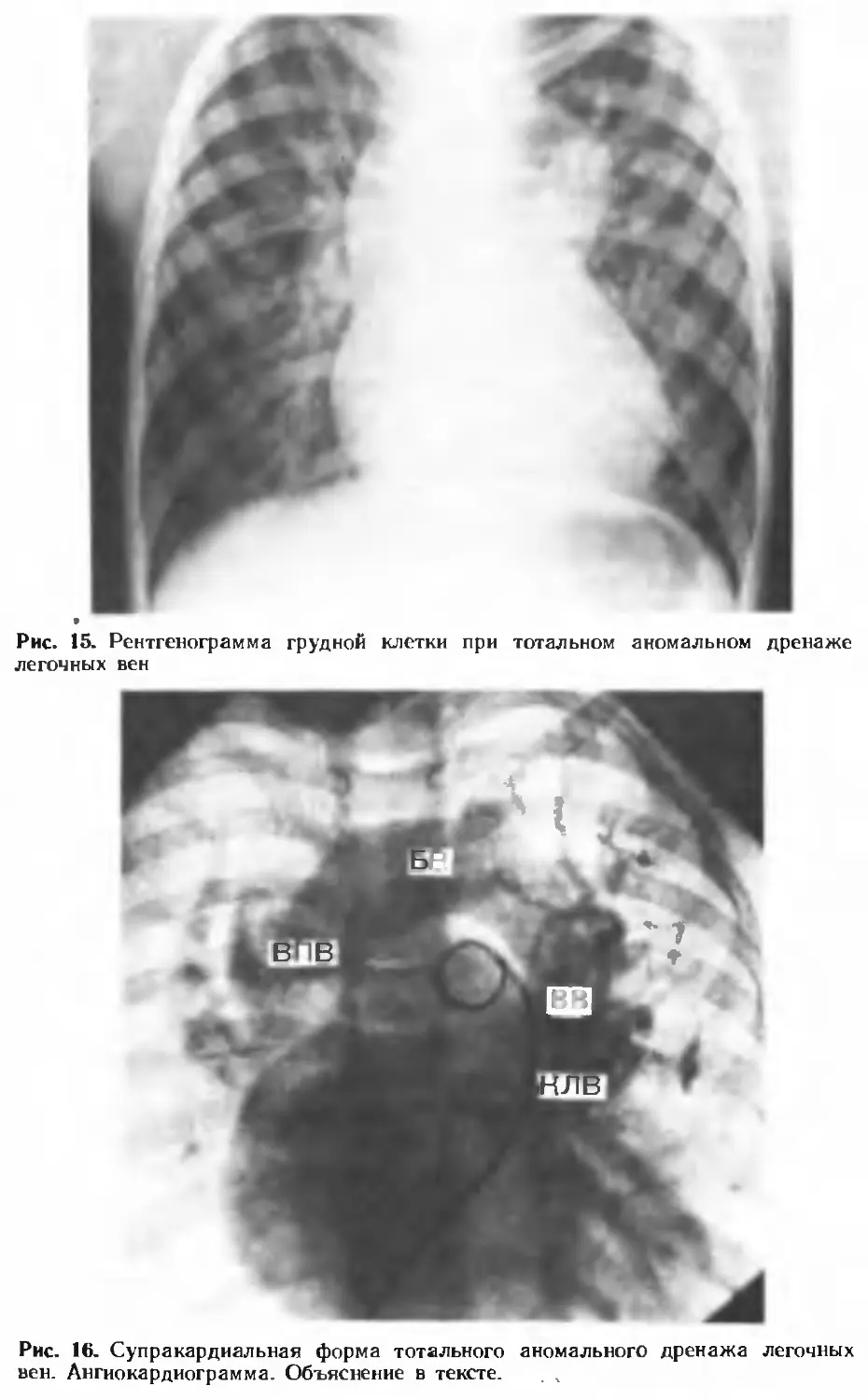
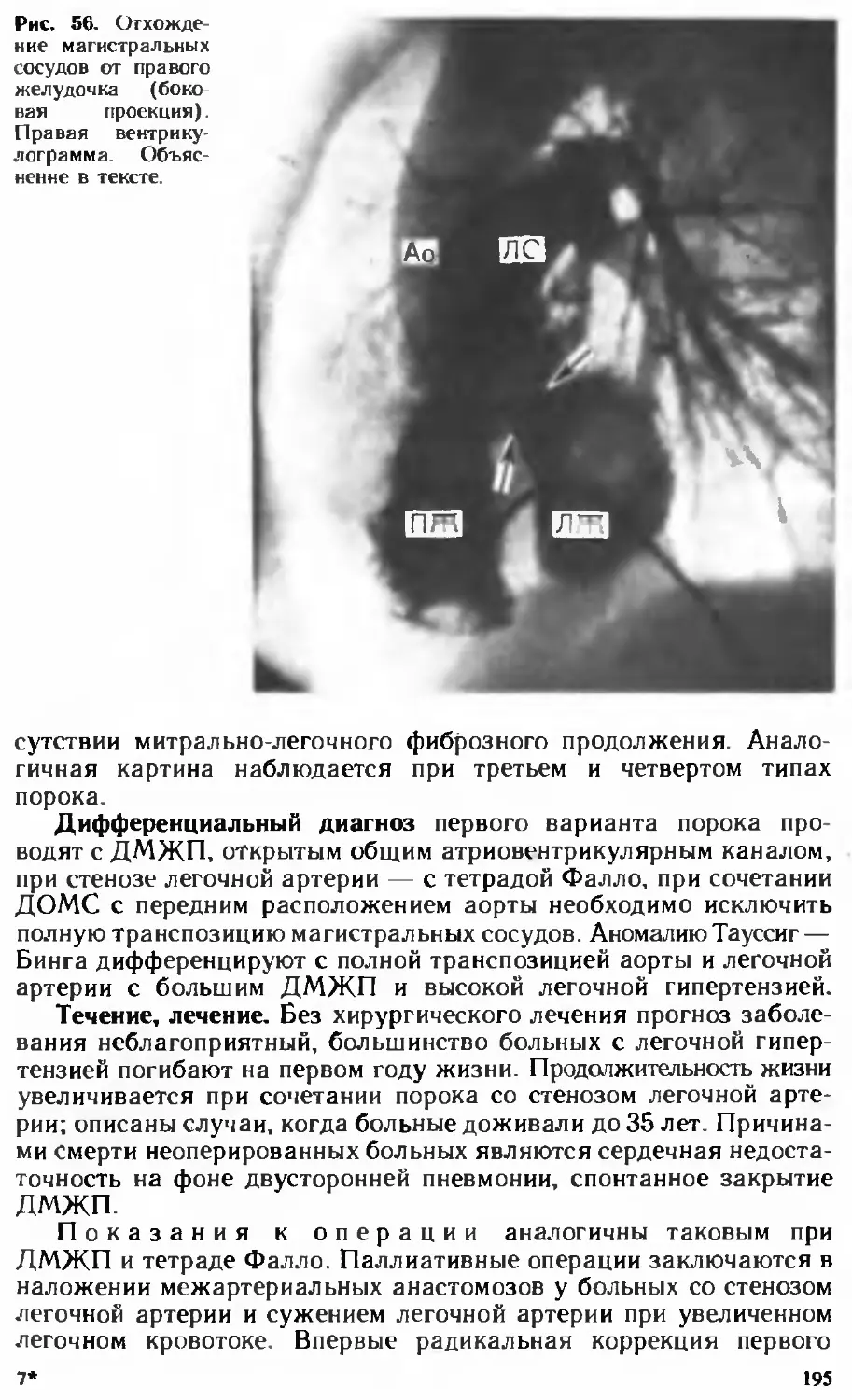
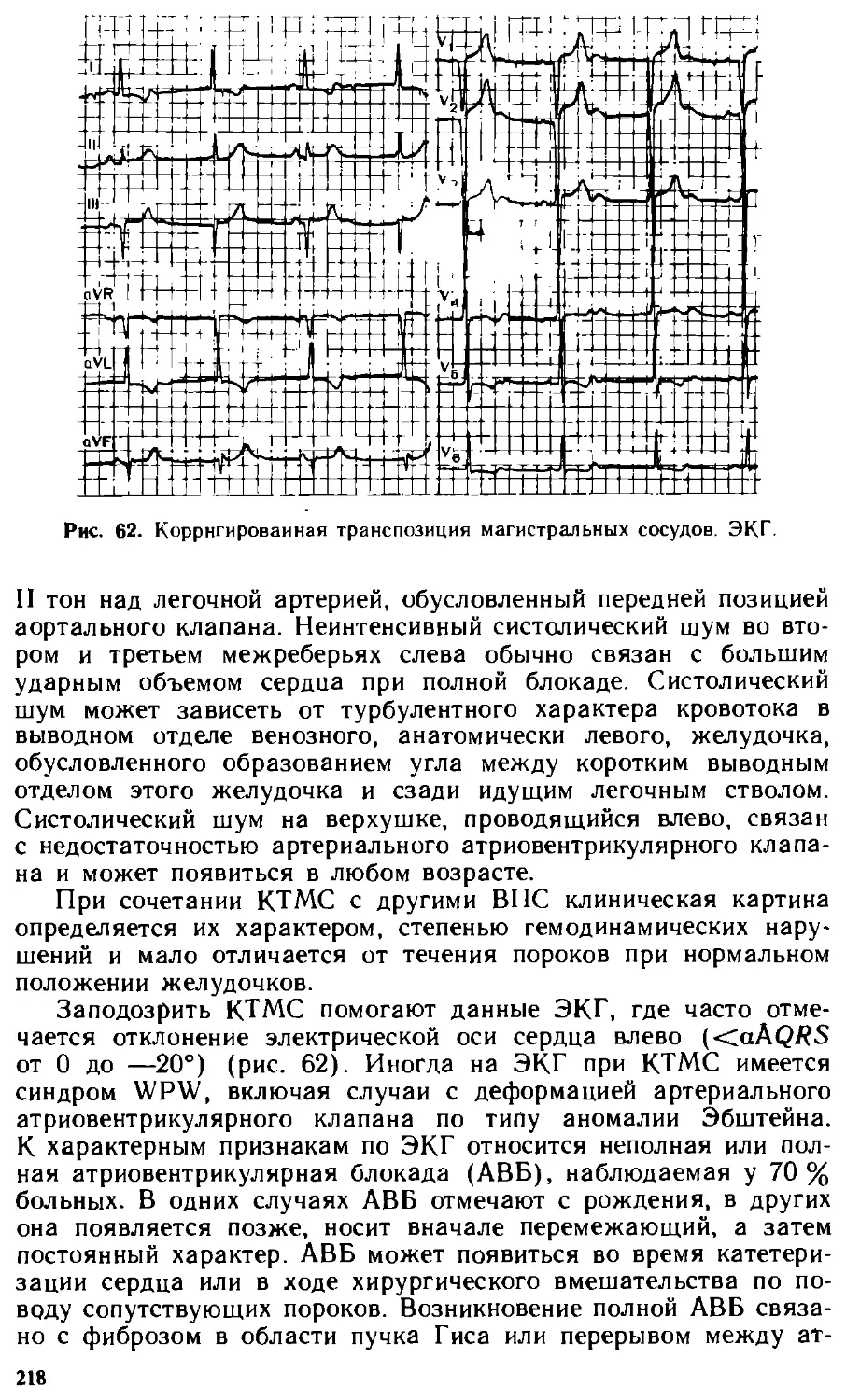
Author: Белоконь Н.А. Подзолков В.П.
Tags: патология сердечно-сосудистой системы сердечно-сосудистые заболевания педиатрия медицина кардиология детские болезни
ISBN: 5—225—01150—0
Year: 1991
Text
ИБЛИОТЕКА
РАКТИЧЕСКОГО
РАЧА
Н. А. БЕЛОКОНЬ, В. П. ПОДЗОЛ КОВ .
ВРОЖДЕННЫЕ
ПОРОКИ
СЕРДЦА
МОСКВА-ИЗДАТЕЛЬСТВО «МЕДИЦИНА»
БИБЛИОТЕКА ПРАКТИЧЕСКОГО ВРАЧА
ЗАБОЛЕВАНИЯ ДЕТСКОГО ВОЗРАСТА
Н. А. БЕЛОКОНЬ, В. П. ПОДЗОЛКОВ
ВРОЖДЕННЫЕ
ПОРОКИ
СЕРДЦА
МОСКВА «МЕДИЦИНА» 1991
ББК 57.33
Б43
УДК 616.12-007.1-053.1
Рецензент М. Л. СЕМЕНОВСКИЙ, доктор мед. наук. проф.
Белоконь Н. А., Подзолков В. П.
Б43 Врожденные пороки сердца. — М.: Медицина, 1990. —
352 с. — (Б-ка практического врача. Заболевания детского
возраста).
ISBN 5—225—01150—0.
Книга посвящена клинике, диагностике, хирургическому лечению врож-
денных пороков сердца. Освещены особенности их течения у новорожден-
ных н детей грудного возраста, тактика врача прн осложнениях (сердечная
недостаточность, бактериальный эндокардит, приступы одышки и цнаноза,
аритмни, анемня, гипотрофия, пневмония). Изложены вопросы тактики
диспансерного наблюдения за больными.
Для педнатров, терапевтов.
4108170000—164
Б 191—90
039(01)—91
ББК 57.33
ISBN 5—225—01150—0
© Н. А. Белоконь, В. П. Подзолков,
1991
СПИСОК СОКРАЩЕНИЙ
АВК — атриовентрикулярный канал
АДЛВ — аномальный дренаж легочных вен
Ао — аорта
АТК — атрезня трехстворчатого клапана
БА — бронхиальная артерия
БВ — безымянная вена
ВВ — вертикальная вена
ВЖ — венозный, анатомически левый желудочек
ВПВ — верхняя полая вена
ВПС — врожденный порок сердца
ВТПЖ — выводной тракт правого желудочка
ДМЖП — дефект межжелудочковой перегородки
ДМПП — дефект межпредсердной перегородки
ДФН — дозированная физическая нагрузка
ЕЖ — единственный желудочек
КА — коронарная артерия
КЛВ — коллектор легочных вен
КОС — кислотно-основное состояние
КТМС — корригированная транспозиция магистральных сосудов
ЛА — легочная артерия
ЛВ — легочная вена
ЛЖ — левый желудочек
ЛЛА — левая ветвь легочной артерии
ЛП — левое предсердие
ЛС — легочный ствол
МЖП — межжелудочковая перегородка
МК — митральный клапан
МКК — малый круг кровообращения
МПП — межпредсердная перегородка
НПВ — нижняя полая вена
ОАП — открытый артериальный проток
ОПС -г- общепериферическое сопротивление
ПЖ — правый желудочек
ПЖВО — выводной отдел правого желудочка
ПЛА — правая ветвь легочной артернн
ПМК — пролапс митрального клапана
ПП — правое предсердие
СГЛЖ — синдром гипоплазии левого желудочка
ТК — трехстворчатый клапан
ТМС — транспозиция магистральных сосудов
ЧСС — частота сердечных сокращений
ПРЕДИСЛОВИЕ
Прошло немногим более 100 лет со дня выхода в свет книги
К- Рокитанского «Дефекты сердечных перегородок», заложившей
по существу научные основы изучения врожденных пороков серд-
ца. За этот период накопился огромный практический опыт по
клинической диагностике пороков развития сердца, разработаны
различные инструментальные методы обследования больных
(электрокардиография, фонокардиография, рентгенокардиогра-
фия, катетеризация полостей сердца и ангиокардиография,
допплеркарднография и др.). К решению вопросов, касающихся
врожденных пороков сердца, постоянно привлекаются не только
кардиохирурги и педиатры, но и специалисты самых различных
направлений (анестезиологи, патофизиологи, гематологи, гене-
тики, кибернетики и др.), что указывает на значимость проблемы
и позволяет решить ряд важных задач для науки и практики.
Авторы монографии педиатр-кардиолог и кардиохирург
написали настоящую книгу с целью максимально расширить
представления практических врачей о состоянии проблемы врож-
денных пороков сердца.
В монографии последовательно и доступно изложены клини-
ко-диагностические подходы к распознаванию врожденных поро-
ков сердца на основе богатого научного и практического опыта
в этой сложной области клинической медицины,, накопленного
как у нас в стране, так и за рубежом. В книге также можно
найти сведения об основах хирургической .тактики при врожден-
ных пороках сердца в объеме, необходимом для практических
врачей.
Авторы отдают себе отчет в том, что написание настоящей
книги было возможным лишь при активном участии их коллег
и сотрудников, за что приносят им благодарность и признатель-
ность.
Глава 1. ЭТИОЛОГИЯ, РАСПРОСТРАНЕННОСТЬ,
КЛАССИФИКАЦИЯ ВРОЖДЕННЫХ ПОРОКОВ СЕРДЦА
Этиология. Среди причин врожденных пороков сердца можно
выделить следующие: 1) хромосомные нарушения — 5 %; 2) му-
тация одного гена — 2—3%; 3) факторы среды (алкоголизм
родителей, краснуха, лекарственные препараты и др.) — 1—2 %;
4) полигенно-мультифакториальное наследование — 90 %.
При различных хромосомных аберрациях возни-
кают количественные и структурные мутации хромосом. Абер-
рации крупных и средних хромосом в большинстве своем не
совместимы с жизнью. Аберрации, совместимые с жизнью, прояв-
ляются различными клиническими синдромами множественных
аномалий хромосом, которые включают в себя и врожденные
пороки сердца (ВПС). Пороки сердца, ассоциирующиеся с хро-
мосомными аномалиями, всегда являются частью синдрома
полисистемных пороков развития, а не изолированными дефекта-
ми. Скрининг больных с ВПС на хромосомные аномалии не имеет
особого значения, если поражение сердца не сочетается с други-
ми пороками развития. При трисомии аутосом дефекты перего-
родок (дефект межпредсердной и межжелудочковой перегородок,
их сочетание) оказываются самыми частыми. ВПС при анома-
лиях половых хромосом бывают значительно реже, чем при три-
сомиях аутосом. Только 10—16% женщин с кариотипом 45Х
имеют порок развития сердечно-сосудистой системы, чаще все-
го— коарктацию аорты илн дефект межжелудочковой перего-
родки (ДМЖП).
Около 2 % ВПС обусловлены мутациями единичных
генов. Так же как в случаях аномалий хромосом, большинство
ВПС, связанных с мутациями единичных генов, сочетается с ано-
малиями развития других органов. При многих формах патоло-
гии, наследуемых в соответствии с простыми менделевскими
закономерностями, пороки развития сердечно-сосудистой системы
являются частью синдрома с аутосомно-доминантным (синдромы
Холта—Орама, Нунана, Крузона, Марфана и др.), аутосомно-
рецессивным (синдромы Гурлер, Картагенера, Карпентера,
Эллиса-ван-Кревельда, Робертса и др.) типами наследования
или сцепленных с Х-хромосомой (синдромы Аазе, Элерса—Данло
V типа, Гольтца, мукополисахаридоз II типа — синдром Гун-
тера и др.). Необходимо подчеркнуть ряд общих принципов для
5
этих синдромов. Во-первых, большинству синдромов свойственна
вариабельная экспрессивность: поражение сердечно-сосудистой
системы у индивидуумов с данным'синдромом может варьировать
от легкой до тяжелой степени. Как правило, вариабельность
экспрессии гена у представителей одной родословной выражена
в меньшей степени, чем межсемейная. Во-вторых, у некоторых
индивидуумов, почти наверняка имеющих соответствующий ге-
нотип, сколько-нибудь выраженных фенотипических аномалий
может не быть (т. е. непенетрантность). Степень пенетрантности
мутантного гена зависит также от критериев, на которые
опираются при поиске признаков присутствия данного гена.
К повреждающим факторам внешней сре-
д ы, способствующим формированию ВПС, относятся воздействие
рентгеновского излучения на организм женщины в первом три-
местре беременности, ионизирующей радиации, некоторых лекар-
ственных препаратов, инфекционных и вирусных агентов, алкого-
ля и др. [Бочков Н. П., 1989]. Образующиеся в результате
пороки в органах по рекомендации Международной рабочей
группы кардиологов следует обозначать эмбриопатией [Spran-
ger J. et al., 1982]. Так, у женщин с ревматизмом в 25 % случаев
рождались дети с ВПС [Зайченко С. И. и др., 1989]. Согласно
основным принципам тератологии оценка тератогенного эффекта
различных повреждающих факторов проводится с учетом меха-
низма воздействия, времени совпадения тератогенного воздей-
ствия с периодами интенсивного формирования органов и систем
плода. Необходимо учитывать также эффект дозы, генетическую
предрасположенность индивидуумов к неблагоприятным реакци-
ям на пусковое воздействие среды (иногда именно на определен-
ный препарат) и к формированию пороков развития вообще
и сердечно-сосудистой системы в частности.
Существенная опасность нарушения органогенеза н форми-
рования врожденных пороков развития доказана лишь для не-
большого числа лекарств. Тератогенным действием на сердечно-
сосудистую систему обладают: алкоголь (чаще формируются
ДМЖП, открытый артериальный проток, дефект межпредсердной
перегородки), амфетамины (образуются ДМЖП, транспозиция
магистральных сосудов), противосудорожные препараты — ги-
дантоин (формируются стеноз легочной артерии и аорты, коарк-
тация аорты, открытый артериальный проток) и триметадион
(транспозиция магистральных сосудов, тетрада Фалло, гипопла-
зия левого сердца), литий (аномалия Эбштейна, атрезия
трехстворчатого клапана, дефект межпредсердной перегородки),
прогестагены (тетрада Фалло, сложные ВПС) [Sipek А., 1989].
Среди токсических веществ, способствующих возникновению
ВПС, этиловому спирту принадлежит ведущая роль. Воздействие
алкоголя на плод приводит к рождению ребенка с эмбриофеталь-
ным алкогольным синдромом. В последние годы интерес к изуче-
нию этого синдрома усилился в связи с учащением случаев
хронического алкоголизма среди женщин. В США из 800 —
6
2400 новорожденных один имеет эмбриофетальный алкогольный
синдром, в некоторых европейских странах — один из 200—
600 новорожденных. У матерей, страдающих алкоголизмом,
поражается 30 % детей, из них ВПС встречаются в 30—49 %
случаев [Таболин В. А., Урывчиков Г. А., 1986]. Алкоголь явля-
ется причиной ВПС в 1% случаев [Kramer Н. et al., 1987].
Особо выраженное тератогенное действие на сердечно-сосуди-
стую систему он оказывает в период интенсивного формирования
органов (критический период развития) — в первые 3 мес бере-
менности.
Одним из факторов среды, приводящим к рождению ребенка
с ВПС, является перенесенная во время беременности краснуха
[Парийская Т. В., Гикавый В. И., 1989]. Частота врожденной
краснухи как причины ВПС составляет 1,3 [Kramer Н. et al.,
1987] —2,4 % [Emerit J. et. al., 1967]. Классический синдром
врожденной краснухи включает триаду наиболее часто встре-
чающихся аномалий развития — катаракту или глаукому, пороки
сердца и глухоту. Кроме этого, имеются пороки развития нервной
системы (микроцефалия), нарушение развития скелета, черепа,
многие дети отстают в физическом и умственном развитии.
Из неонатальных проявлений врожденной краснухи следует
помнить о тромбоцитопенической пурпуре, гепатоспленомегалии,
гепатите, гемолитической анемии, пневмонии, поражении трубча-
тых костей. Из ВПС у живорожденных детей с врожденной
краснухой находят открытый артериальный проток (ОАП),
транспозицию магистральных сосудов (ТМС), общий артериаль-
ный ствол, атрезию или пороки развития атриовентрикулярных
и полулунных клапанов, открытый атриовентрикулярный канал
(АВК), тетраду Фалло (5—10% всех ВПС), ДМЖП (5%),
стеноз легочной артерии.
Чаще всего для объяснения типа наследования при ВПС
прибегают к полигенно-мультифакториальной
модели, основными признаками которой являются: 1) риск по-
вторного поражения возрастает с увеличением числа больных
среди родственников I степени; 2) если популяционные данные
свидетельствуют о половых различиях частоты нарушения,
родственники реже болеющего пола чаще оказываются поражен-
ными: 3) чем более тяжелый порок, тем выше риск его повто-
рения; 4) риск повторения порока у родственников I степени
больного индивидуума равен, примерно, корню квадратному
из частоты патологии в популяции [Edwards J. Н., 1960].
Экспериментальные данные свидетельствуют о том, что распро-
страненные ВПС имеют генетическую основу, которая не являет-
ся результатом мутаций единичных генов, а согласуется с муль-
тифакториальным наследованием. Тем не менее, несомненно,
существует генетическая гетерогенность, и определенные формы
ВПС, вероятно, обусловлены мутациями единичных генов.
Помимо этиологических факторов, следует выделять фак-
торы риска рождения ребенка с ВПС, которыми являются
7
возраст матери, эндокринные нарушения у супругов, токсикозы
в I триместре и угрозы прерывания беременности, мертворожде-
ния в анамнезе, наличие других детей с врожденными пороками
развития, прием женщиной эндокринных препаратов для сохра-
нения беременности н др.
Дать количественную оценку риска рождения ребенка с ВПС
может только генетик, но оценить качественно риск как значи-
тельный, умеренный или малый должен уметь каждый врач.
При медико-генетическом консультирова-
нии по поводу хромосомных аномалий, ассоциирующихся
с ВПС, необходимо учитывать, что повышенная вероятность
иметь потомство с хромосомной аномалией характерна для сле-
дующих ситуаций: 1) пожилой возраст матери; 2) сбалансиро-
ванная транслокация, инверсия или другая аномалия хромосом
у одного из родителей; 3) наличие в семье ребенка с хромосом-
ной аномалией, особенно с трисомией аутосом. Таким образом,
когда ВПС сочетается с аномалиями хромосом, при последующих
беременностях надо ставить вопрос об амниоцентезе с целью
пренатальной диагностики. Если у пробанда диагностирована
трисомия, риск развития ВПС у ребенка равен 1 %, при наличии
у родителя сбалансированной транслокации — 2—10%, но в
случае патологии у пробанда, возникшей de novo, риск, по-види-
мому, не увеличен [Элиас Ш., Янаги Р., 1985].
При медико-генетическом консультировании по поводу менде-
лирующих нарушений супружеским парам, относящимся к группе
риска, необходимо сообщить об относительно высокой вероят-
ности наследования мутантного гена: 50 % для аутосомно-доми-
нантных нарушений (наличие ВПС у родственников 1 степени —
родители, братья, сестры) и 25 % для аутосомно-рецессивных
(ВПС у родственников II степени — дед, бабка, дяди и тетки),
при наличии ВПС у родственников III степени (двоюродные
братья и сестры) вероятность составляет 13%. Однако из-за
вариабельности экспрессии и пенетрантности вероятность рож-
дения ребенка с клинически выраженной патологией часто не-
сколько ниже. При возможности следует предлагать родителям
проведение пренатальной диагностики.
При мультифакториальных ВПС шанс рождения здорового
ребенка в семье, где уже есть ребенок с ВПС, составляет 97 %.
При медико-генетическом консультировании необходимо учиты-
вать риск возникновения ВПС у сибса: при тетраде Фалло он
составляет 2,5%, при ТМС — 2 %, при общем артериальном
стволе — 1 %, при ДМЖП — 3 %, при коарктации аорты — 2 %.
При этом риск развития патологии выше, если пороком страдает
мать, а не отец ребенка.
Распространенность ВПС у детей достаточно высока и состав-
ляет 30 % от числа всех врожденных пороков развития. При этом
ВПС могут быть: основной причиной смерти; фактором, усугуб-
ляющим течение основного заболевания; случайной находкой
на аутопсии, не влиявшей на танатогенез. Частота выявления
8
ВПС, по данным различных авторов, колеблется от 3,23 до 8 на
1000 живорожденных детей [McMahon et al., 1953; Kerrebyjn В.,
1966]. Показано, что основное число детей с ВПС умирает на
первом году жизни (50—90 %) и большинство из них — в период
новорожденное™ (20—43%) или в первые б месяцев жизни
(до 80 %) [Бураковский В. И., Константинов Б. А., 1970; Черно-
ва М. П., 1973; Бураковский В. И. и др., 1989; Keth J.,1978],
После первого года жизни смертность от ВПС резко снижается,
и в возрасте от 1 года до 15 лет погибает не более 5% детей
[ВОЗ, 1971].
Представляет интерес характер ВПС, от которых умирают
дети в различном возрасте [Boughman J. A. et al., 1987]. Так,
на аутопсии у детей первой недели жизни преобладают синдром
гипоплазии левого желудочка, ТМС, тетрада Фалло, стеноз и ат-
резия легочной артерии, коарктация аорты, ДМЖП. Частота
таких ВПС, как ДМЖП, дефект межпредсердной перегородки
(ДМПП), в этом возрасте относительно небольшая. На аутопсии
у детей в возрасте от 1 мес до 1 года наиболее часто встречались
ДМЖП, ТМС, АВК, коарктация аорты, тетрада Фалло, пороки
с обструкцией левого желудочка. В группе детей первого года
жизни из-за большей распространенности тяжелых ВПС реже
встречаются ОАП, стеноз легочной артерии, стеноз аорты. С уве-
личением возраста меньше остается в живых детей со сложными
и комбинированными ВПС. Структура ВПС у подростков и
взрослых имеет свои особенности, именно в этом возрасте удает-
ся проследить естественное течение многих ВПС. Как правило,
это умеренные клапанные дефекты, небольших или средних
размеров ДМЖП, ДМПП, ОАП, коарктация аорты. К другим
ВПС относятся корригированная ТМС, аномалия Эбштейна,
тетрада Фалло и ВПС с высокой легочной гипертензией, которые
не были устранены хирургическим путем в детстве до развития
такого серьезного осложнения. Примерно у 23 -30% детей
с ВПС имеются сопутствующие аномалии желудочно-кишечного
тракта, мочеполовой и костной систем, ЦНС [Menashe V. et al.,
1967; Moller J., Neal W., 1981]. Наиболее высокая частота
экстракардиальных пороков развития отмечается у больных
с комбинированными септальными дефектами (74%), ОАП
(59%), ДМЖП (58%), наиболее низкая — при фиброэластозе
и ТМС [Landtman В., 1971].
Классификация. Создание единой классификации ВПС имеет
определенные трудности в связи с огромным количеством разно-
видностей пороков (по М. Lev — более 200), разных принципов,
которые могут быть положены в ее основу. В Институте сердеч-
но-сосудистой хирургии им. А. Н. Бакулева АМН СССР разра-
ботана классификация, в которой ВПС распределены с учетом
анатомических особенностей и гемодинамических нарушений.
Классификация более удобна для кардиохирургов и менее —
для практических врачей, которые не всегда имеют возможность
оценить топическую ситуацию.
9
Не считая некоторых различий в отдельных классификациях,
клинически значимые формы ВПС в зависимости от гемодина-
мических нарушений можно подразделить на следующие группы:
1) пороки сердца с неизмененным или малоизмененным легочным
кровотоком; 2)пороки с гиперволемией малого круга кровообра-
щения; 3) пороки с гиповолемией малого круга; 4) комбиниро-
ванные пороки сердца.
В. С. Morgan (1978) предлагает классификацию, основанную
на доступных инструментальных и клинических методах иссле-
дования. Первоначально врач определяет наличие цианоза, что
можно выявить как при осмотре больного в покое или при на-
грузке в случае невыраженного цианоза (плач, физическая
нагрузка), так и с помощью определения РаО2 и/или гематокри-
та. Далее уточняется состояние малого круга кровообращения
(гипо- или гиперволемия) с помощью аускультации (характер II
тона над легочной артерией) и рентгенографии сердца. Эти
данные сопоставляются с результатами электрокардиографиче-
ского обследования, выявляющего характер гипертрофии и пере-
грузки камер сердца.
I. Пороки сердца с цианозом
1. Уменьшенный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (тяжелый стеноз легочной артерии,
атрезия легочной артерии с или без ДМЖП);
б) гипертрофия левого желудочка (атрезия трехстворчатого клапана, атре-
зия легочной артерии с гипоплазией правого желудочка);
в) комбинированная гипертрофия правого и левого желудочков (ТМС со
стенозом легочной артерии, общий артериальный ствол с гипоплазией легочных
артерий).
2. Увеличенный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (ДМПП, все пороки с левоправым
шунтом с легочной гипертензией — ОАП, ДМЖП, ДМПП);
б) гипертрофия левого желудочка (ОАП, ДМЖП, артериовенозная фи-
стула).
II Пороки сердца без цианоза
1. Нормальный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (коарктация аорты, стеноз митрального
клапана);
б) гипертрофия левого желудочка (коарктация аорты, стеноз аорты, фибро-
эластоз эндокарда).
2. Увеличенный кровоток в малом круге кровообращения:
а) гипертрофия правого желудочка (атрезия аорты, синдром гипоплазии
левого желудочка, тотальный аномальный дренаж легочных вен, ТМС);
б) комбинированная гипертрофия правого и левого желудочков (ТМС, еди-
ный желудочек, атрезия трехстворчатого клапана с ТМС).
В практической деятельности врачам удобно пользоваться
простым делением ВПС на 3 группы: 1) ВПС бледного типа
с артериовенозным шунтом (ДМЖП, ДМПП, ОАП); 2) ВПС си-
него типа с веноартериальным сбросом (ТМС, тетрада Фалло,
атрезия трехстворчатого клапана); 3) ВПС без сброса, но с
препятствием к выбросу крови из желудочков (стенозы легочной
артерии и аорты, коарктация аорты). Такое деление охватывает
9 наиболее распространенных ВПС.
ю
Не случайно большинство предложенных классификаций ВПС
содержит оценку состояния легочного кровотока, так как пробле-
ма легочной гипертензии в учении о ВПС имеет огромное само-
стоятельное значение. В клинике легочная гипертензия опреде-
ляет выраженность таких симптомов, как одышка, недостаточ-
ность кровообращения, гипотрофия, склонность к рецидивирую-
щим пневмониям. Неумение врача увидеть, правильно и своев-
ременно оценить выраженность легочной гипертензии нередко
стоит жизни больному.
Началом развития легочной гипертензии является повышение
систолического давления в легочной артерии более 30 мм рт. ст.
В зависимости от того, в каком участке сосудистого русла легких
наблюдается первоначальный подъем давления, различают пре-
капиллярную (артериальную) гипертензию — увеличение сопро-
тивления в артериолах и мелких артериях — и посткапиллярную
(венозную) — при повышении давления в левом предсердии
и легочных венах. У больных с ВПС и артериовенозным сбросом
наблюдается артериальная прекапиллярная легочная гипертен-
зия, у больных с миокардитами, кардиомиопатиями и стенозом
аорты — посткапиллярная.
Существует много классификаций легочной гипертензии. На
практике оказалась наиболее удачной классификация, разрабо-
танная в Институте сердечно-сосудистой хирургии им. А. Н. Ба-
кулева [Бураковский В. И. и др., 1975], которая основана на
величине давления в легочной артерии, сброса крови и общеле-
гочного сопротивления в соотношении с показателями большого
круга кровообращения (табл. 1). Согласно этой классификации
больных с легочной гипертензией делят на четыре группы. Боль-
ные 1а подгруппы не имеют выраженных нарушений гемодинами-
ки, нуждаются в наблюдении кардиоревматолога. В отношении
больных 16 подгруппы и II группы уже должен ставиться вопрос
о хирургическом лечении. Легочная гипертензия в этих группах
носит в основном функциональный характер. В III группе мор-
фологические изменения настолько выражены, что после коррек-
ции порока давление в легочной артерии не снижается до нор-
Таблица 1. Классификация легочной гипертензии
(Бураковский В. И. и др., 1975]
Группа Гн- пертенэин Отношение систоличе- ского давления в ле- гочной артерии к си- стемному артериально- му давлению, % Сброс крови по отно- шению к минутному объему МКК. % Отношение общелегоч- иого сосудистого со- противления к систем- ному, %
1а До 30 Менее 30 До 30
16 До 30 Более 30
П До 70 В среднем 50—60 До 30
Ша Более 70 Более 40 Менее 60
1П6 Менее 100 Менее 40 Более 60
IV 100 Справа налево Более 100
11
Рис. 1. Стадии легочной гипертензии по D. Heath, J. Edwards (1958)
а - гипертрофия медии артерии иа уровне респираторной бронхиолы (I стадия) ;
Окраска по ван-Гнзону с докраской фукселином. Ув. 100, б — клеточная пролиферация
интимы артерии на уровне альвеолярного хода (II стадия); в — гиперплазия и фиброз
интимы (III стадия);
PVic. 1. Продолжение.
г — ангмоматозные структуры в просветах сосудов (IV стадия); д — истонченная
медия (V стадия).
мального уровня; это указывает на преобладание органического
компонента. В IV группе гипертензия в основном обусловлена
изменениями структуры легочных сосудов и носит необратимый
характер, хирургическое вмешательство в связи с этим не пока-
зано. В. И. Бураковский и соавт. (1975) предлагают выделять
легочную гипертензию трех степеней: I степени — начальная —
давление в легочной артерии составляет 30—50 % от аорталь-
ного, II степень — умеренная — 51—70%, III степень — высо-
кая — свыше 70 %.
Легочная гипертензия проходит 3 фазы. 1. Гиперволемиче-
ская — результат несоответствия сосудистого русла объему про-
текающей крови, она встречается у детей первых месяцев н лет
жизни. При этом сосуды легких переполнены кровью, но не воз-
никает защитный рефлекс в виде спазма, чем и объясняются
тяжелое клиническое течение, большая величина сброса. Давле-
13
ние в легочной артерии может быть нормальным или умеренно
повышенным, общелегочное сопротивление не изменено. 2. Сме-
шанная фаза - возникает спазм сосудов в ответ на гиперволе-
мию (защитный рефлекс) — сопровождается повышением как
давления в легочной артерии, так и легочного сопротивления,
что способствует уменьшению левоправого сброса. У детей до
2 лет фактор вазоконстрикции легочных сосудов имеет решающее
значение в патогенезе легочной гипертензии, у детей старше
3 лет больше роль органических обструктивных изменений
в легочных сосудах. 3. Склеротическая фаза — длительный
спазм и гиперволемия вызывают необратимые склеротические
изменения в сосудах легких. Существует мнение, что эта фаза
может проявить себя сразу после рождения ребенка и пред-
ставляет собой следствие задержанного фетального развития
сосудов легкого, сохраняющих внутриутробный тип строения.
Для прогноза и показаний к операции имеет значение оценка
морфологической структуры легочных сосудов, которая доступна
при жизни благодаря биопсии легкого-D. Heath, J. Edwards
(1958) выделили 5 стадий изменений легочных сосудов (рис. 1):
I стадия — толщина медии (ее гипертрофия) достигает 25 %
общего диаметра сосудов; II стадия — гиперплазия интимы;
III стадия — гиперплазия и фиброз интимы с обструкцией многих
мелких легочных сосудов; IV стадия — в просветах сосудов
развиваются ангиоматозные структуры; V стадия — просвет со-
судов увеличивается, медия истончается. В результате таких
изменений легочный кровоток значительно уменьшается, увели-
чивается сброс в аорту, постепенно развивается цианоз.
Глава 2. ОБСЛЕДОВАНИЕ БОЛЬНЫХ
С ВРОЖДЕННЫМИ ПОРОКАМИ СЕРДЦА
АНАМНЕЗ
Несмотря на большие современные технические возможности
в обследовании больных с ВПС, анамнезу принадлежит большое
значение, так как только анамнез помогает установить время
начала заболевания, оценить тяжесть течения сердечной патоло-
гии, возникающие осложнения и предположить этиологический
фактор. Анамнез остается основным, а иногда единственным
методом для выявления наследственного характера заболевания.
Незыблемых правил сбора анамнеза не существует, однако есть
ряд вопросов, которые не должны быть упущены при беседе
с родителями больных или больными ВПС. Прежде всего следует
выяснить, когда заболел ребенок и какими были первые признаки
заболевания (цианоз, одышка, тахи- или брадикардия, шум
и др.).
Одним из ярких клинических симптомов ВПС, нередко заме-
чаемым впервые родителями, является цианоз. Важно выяснить,
как и при каких обстоятельствах он был обнаружен и какой имел
14
характер: возник ли сразу же после рождения, в роддоме, какова
была его интенсивность, проходил ли после дачи кислорода,
возникал ли только при физическом напряжении (крик, кашель,
плач), распространенность (вокруг рта, ногтевые фаланги,
кончик носа, щеки, слизистые оболочки и др.), оттенок (бледный,
вишнево-красный и др.).
Одышка также может быть первым признаком заболевания
сердечно-сосудистой системы, при этом родители могут прояс-
нить, существует ли она в покое или появляется, усиливается при
нагрузке (крик, плач, кормление, ходьба и др.), выражена в
положении лежа и уменьшается в положении сидя (ортопноэ).
Врач задает вопрос, были или нет у больного приступы одышки
с цианозом, чем они провоцировались и чем купировались, с ка-
кого времени они существуют и какова их клиническая динамика
с возрастом.
Первым признаком ВПС, особенно протекающих без цианоза,
является шум грубого тембра, настораживающий педиатра на
наличие органического поражения сердца. Шум при ВПС имеет
различную динамику: иногда он отсутствует у новорожденных
и становится грубым к 6—12 мес жизни и, наоборот, из отчетли-
вого «машинного» систолодиастолического шума при ОАП. или
систолического шума при ДМЖП становится еле слышимым
при развитии синдрома Эйзенменгера или спонтанном закрытии
дефекта. Иногда появление систолодиастолического шума связа-
но с внезапным резким ухудшением состояния больных, как это
наблюдается при прорыве врожденной аневризмы синуса Валь-
сальвы.
Необходимо выяснить, наблюдались ли в анамнезе отеки,
где они локализовались, их стойкость и динамику (под влиянием
каких факторов они уменьшились или увеличились), имеются ли
сведения о размерах печени и сочетании ее увеличения с отечным
синдромом.
Определенную информацию могут дать сведения о процедуре
кормления ребенка грудного возраста. Затруднения при кормле-
нии связаны с быстрой утомляемостью. Дети первых месяцев
жизни с ВПС едят медленно, с перерывами, за одно и то же
время по сравнению со здоровыми они получают меньшей объем
пищи и потому остаются голодными, беспокойными. Одышка при
кормлении является признаком сердечной недостаточности или
гипоксемии (при ВПС синего типа). У детей с сосудистым коль-
цом отмечается дисфагия — трудности при глотании.
При сборе анамнеза уточняется вопрос о состоянии перспи-
рации (потливости). У детей первых лет жизни с ВПС отмеча-
ется повышенная потливость как во время сна, так и при нагруз-
ке, что отражает вегетативную дисфункцию на фоне сердечной
недостаточности (гиперкатехоламинемия) и часто сопутствую-
щих изменений в ЦНС.
Необходимо уточнить характер физического и моторного раз-
вития больного. Дети с ВПС нередко недостаточно прибавляют
15
в массе с рождения, позже начинают ходить и сидеть в отличие
от больных с приобретенными заболеваниями сердца (например,
миокардиты), при которых дети развиваются нормально до мо-
мента начала заболевания. Врач должен задать вопрос, не
присаживается ли ребенок на корточки во время подвижных
игр или ходьбы.
Жаловаться на боли в сердце могут дети старше 3—4 лет
с такими ВПС, как стеноз и коарктация аорты, аномальное
отхождение левой коронарной артерии от легочной. При ано-
малиях коронарных артерий приступы внезапного беспокойства,
крика появляются уже с первых лет жизни, в более старшем
возрасте и у подростков боли в сердце возникают чаще на
высоте физической нагрузки. Больные с различными ВПС в пре-
и пубертатном периоде могут иметь кардиалгии, в основе кото-
рых лежат психоэмоциональные особенности («боль не отделима
от личности»).
Большое внимание при сборе анамнеза уделяется выяснению
нервно-психических особенностей ребенка, которые определяются
генетическими факторами, степенью перинатального поражения
ЦНС, а также вариантом сопутствующих синдромов (ВПС —
нередко лишь составная часть генетически детерминированного
заболевания с нарушением психики), определенное влияние
оказывают обстановка в семье, стиль воспитания, длительные
госпитализации. Необходимо выяснить наличие синкопальных
состояний (при повышенной температуре или без нее), их кли-
нические особенности.
Учитывая, что ВПС могут сопровождаться инфекционным
эндокардитом (см. главу 22), необходимо уточнить, бывают ли
подъемы температуры, какова их причина. Немотивированные
подъемы температуры без озноба и других подтверждений эндо-
кардита могут свидетельствовать о нарушении терморегуляции
(неинфекционный фебрилитет) как еще одного клинического
симптома поражения ЦНС или психических отклонений. Субфеб-
рилитеты особенно характерны для больных ВПС синего типа.
По получении информации о перенесенных заболеваниях
необходимо помнить, что для больных ВПС с увеличенным
легочным кровотоком характерны повторные, рефрактерные к ле-
чению пневмонии. При наличии хрипов, протекающих без темпе-
ратурной реакции и катаральных явлений, можно думать о за-
стойных явлениях в легких.
Стридор и осиплость голоса (кардиовокальный синдром)
могут указывать на наличие сосудистого кольца, а также на
сдавление возвратного нерва увеличенным левым предсердием.
С целью выяснения хотя бы ориентировочно причины ВПС
у каждого больного уточняются возраст родителей, профессия,
наличие производственных вредностей, данные о родстве роди-
телей или их происхождении из одной местности, о перенесенных
во время беременности матерью острых заболеваниях (краснуха,
ОРВИ) или обострениях хронических (пиелонефрит, ревматизм
16
и др.), прием лекарственных препаратов, алкоголя. Необходимо
задать вопрос о том, желанная или нежеланная беременность,
так как в последнем случае можно предположить прием медика-
ментов с целью прерывания беременности, который женщина
нередко скрывает. При угрозе выкидыша с целью сохранения
беременности женщина может принимать гормональные препа-
раты, также способствующие рождению ребенка с врожденными
пороками развития. Наконец, подробно собирается семейный
анамнез, уточняются характер сердечно-сосудистых заболеваний
у родственников, наличие у них не только ВПС, но и других
пороков развития, примерное соотношение полов среди больных
родственников — все это способствует характеристике общего ге-
нетического фона в семье.
ФИЗИЧЕСКОЕ ОБСЛЕДОВАНИЕ
Больные с ВПС часто имеют другие большие экстракардиаль-
ные пороки, малые аномалии развития, проявления различных
наследственных хромосомных синдромов, эмбриопатий. Врач
должен знать проявления наиболее часто встречаемых синдро-
мов, чтобы увидеть их у больного, а при необходимости шире
прибегать к консультации врача-генетика.
Сочетание ВПС с большими пороками развития
встречаются не часто (около 7%), но процент увеличивается
при проведении урографии. Большие экстракардиальные пороки
развития встречаются гораздо чаще при тетраде Фалло, ДМПП,
чем при других ВПС, обычно они касаются костно-мышечной
системы (расщепление губы и твердого неба, птоз, деформация
грудной клетки, полидактилия, расщепление костей кисти и др.),
желудочно-кишечного (атрезия ануса и пищевода, стеноз при-
вратника, инверсия внутренних органов и др.) и респираторного
(атрезия хоан, стеноз бронхов) трактов, мочеполовой системы
(гипоспадия, атрезия уретры, гипоплазия мошонки и др.), ЦНС.
Частота малых аномалий развития (МАР) у де-
тей с ВПС составляет более 40 %, при этом все дети с большими
пороками развития имеют и МАР. Стигмы или МАР — это
небольшие отклонения, которые существенно не сказываются на
функции органа и не уродуют внешность субъекта, название
подчеркивает связь МАР с онтогенезом [Ходос X. Г., 1984].
Популяционные исследования Н. Kramer и соавт. (1987) пока-
зали, что наличие более 2—3 МАР свидетельствует о множе-
ственных МАР и нарушениях эмбриогенеза.
Врач должен знать наиболее распространенные МАР, это
поможет при проведении дифференциального диагноза между
миокардитом и ВПС. Для первого не характерно сочетание
с МАР, для второго — типично. Наличие МАР у новорожден-
ного должно настроить врача на поиск более серьезной патоло-
гии. Сочетание отдельных МАР требует исключения хромосомных
синдромов, но нельзя говорить оГЦ$кадФичности МАР для како-
2 Зак. № 976
17
го-либо большого врожденного нарушения. Вероятно, МАР во-
зникают под влиянием тех же причин, что и грубые пороки
развития, являются результатом дизэмбриогенеза, но этиологи-
ческий фактор обладает меньшей патогенностью или действует
в более благоприятный для плода период.
Особенности внешнего вида имеют дети с ВПС и эмбриофе-
тальным алкогольным синдромом: они отстают в росте, характе-
рен лицевой дисморфизм (микрофтальмия, плоская кожная
складка или ее отсутствие между носом и серединой верхней
губы, гипоплазия верхней и нижней челюсти, гипертелоризм,
эпикант, широкая, западающая переносица, высокое готическое
небо), общая диспластичность телосложения, ушные и скелетные
аномалии. Эти изменения в сочетании с отставанием в психо-
моторном, особенно речевом развитии, гипервозбудимостью и
двигательной расторможенностью должны насторожить врача на
наличие алкогольного эмбриофетального синдрома.
Микроцефалия, катаракта, глухота, низкая масса подозри-
тельны на врожденную краснуху.
При осмотре больного с ВПС необходимо оценить физи-
ческое развитие. При некоторых ВПС оно практически
не страдает, при других — выражено значительно. Большая
часть детей с ВПС рождается с нормальными весо-ростовыми
показателями, но вскоре появляются признаки дисгармоническо-
го развития, при этом отставание в массе выражено больше,
чем в росте. Факторами, вызывающими гипотрофию на первом
году жизни и отставание в более старшем возрасте, являются
сердечная недостаточность, значительный левоправый сброс кро-
ви, приводящий к гиповолемии большого круга кровообраще-
ния, недоедание из-за быстрой утомляемости (алиментарный
фактор), гипоксия и гипоксемия, поражение ЦНС, повторные
ОРВИ и пневмонии [Sabzer Н. R. et al., 1989]. Стойкое снижение
в массе на фоне проводимой терапии является показанием
к хирургическому вмешательству. У детей старшего возраста и
подростков отставание в физическом развитии выражено меньше.
Кожные покровы следует внимательно осмотреть для
выявления кровоизлияний и гнойничковых образований. У детей
старшего возраста и взрослых из-за хронических акне может
развиться кожный сепсис [Somervill J., 1986]. Бледность боль-
ного с ВПС бывает связана с сопутствующей анемией, низким
сердечным выбросом при стенозе аорты и сердечной недоста-
точностью (следствие вазоконстрикции).
Цианоз может быть периферическим и центральным.
Периферический цианоз виден на кончиках пальцев рук и ног
(акроцианоз), на губах и отражает замедленный кровоток
в капиллярах. Он может быть как у здоровых грудных детей
на холоде (проходит при согревании), так и при сердечной
недостаточности (на фоне низкого сердечного выброса), сепсисе,
надпочечниковой недостаточности. Однако периферический циа-
ноз непостоянный и проходит при исчезновении причины, вызвав-
18
шей сосудистую дисфункцию, РО2 при нем нормальное. Цен-
тральный цианоз более генерализованный, вовлекает кожные по-
кровы, слизистые оболочки, кончики пальцев и отражает изме-
нение транспорта О2, вызванное патологией сердца, легких или
нарушением структуры гемоглобина. Для возникновения цианоза
при ВПС необходимо наличие: 1) праволевого (веноартериаль-
ного) шунта, что бывает при внутрисердечном и внутридукталь-
ном сообщении и стенозе легочной артерии (например, тетрада
Фалло); 2) единой камеры, в которой будет смешиваться систем-
ный и легочный кровоток (например, единственный желудочек);
3) выраженного венозного застоя в легких при левожелудочко-
вой недостаточности из-за обструктивных пороков левого сердца
(митральный стеноз, стеноз аорты).
Цианоз может иметь различные оттенки, которые определяют-
ся количественным соотношением артериальной и венозной кро-
ви, адекватностью легочного кровотока: голубоватый оттенок —
при тетраде Фалло и единственном желудочке, малиновый
(бывает при менее выраженном недонасыщении артериальной
крови О2) — при стенозе легочной артерии и аномалии Эбштейна,
фиолетовый — при ТМС, синдроме Эйзенменгера, в первые дни
жизни такой цианоз возможен при несердечном заболевании
(синдроме Вильсона — Микити, диафрагмальной грыже, лобар-
ной эмфиземе).
Необходимо осматривать все 4 конечности больного для
исключения дифференцированного цианоза: наличие цианоза на
ногах и отсутствие на руках бывает при предуктальной коаркта-
ции аорты, гипоплазии левого желудочка; наличие цианоза на
руках и отсутствие на ногах характерно для ТМС в сочетании
с гипоплазией или перерывом дуги аорты; если цианотична
одна конечность, можно думать об обструкции венозного крово-
тока.
Следует помнить, что центральный цианоз может быть связан
с патологией легких и респираторного тракта: атрезия хоан,
дистресс-синдром и болезнь гиалиновых мембран у новорожден-
ных, первичная легочная гипертензия и болезнь Хаммена — Ри-
ча, пневмонии, ателектазы и др. Дети с родовой травмой в силу
дизрегуляции сосудистого тонуса, снижения альвеолярной венти-
ляции, низкого альвеолярного насыщения О2, увеличения РСО2
могут иметь достаточно выраженный цианоз и 0ез ВПС, который
уменьшается при целенаправленном лечении. Более редкой при-
чиной центрального цианоза является метгемоглобинемия, при
которой РО2 нормальное. Установить причину генерализованного
цианоза в первые дни осмотра ребенка бывает достаточно слож-
но. Для дифференциального диагноза используют пробу с вдыха-
нием 100% кислорода (гипероксический тест): у больных с ВПС
не будет значительно повышаться содержание РО2, тогда как
у детей с легочной патологией с поражением ЦНС увеличивается
насыщение крови кислородом.
Появление цианоза при ВПС отражает снижение РО2 ниже
19
75—85%, так как известно, что цианоз становится видимым,
когда капиллярная кровь содержит более 50 г/л восстановлен-
ного гемоглобина. Нередко цианоз в покое выражен слабо
и появляется только при дополнительной нагрузке (латентный
цианоз). Интенсивность цианоза определяется также количе-
ством гемоглобина, поэтому может быть снижена при анемии.
Большое влияние на интенсивность цианоза оказывает состояние
легочных сосудов, склероз которых приводит к значительному
снижению насыщения крови Ог. Косвенным подтверждением
цианоза являются утолщение концевых фаланг пальцев рук и
ног, симптомы часовых стекол и барабанных палочек, а также
полицитемия, повышение гематокрита.
При осмотре следует обратить внимание на наличие отеч-
ности кожи и подкожной клетчатки: размеры, локализация,
окраска кожи в области отека. Сердечные отеки видны на ногах,
затем развиваются на лице (особенно на веках), наружных
половых органах и др. Если отеки локализуются на веках, а в
других частях тела отсутствуют, то они скорее всего вызваны
патологией почек. Труднее отличить аллергические отеки, кото-
рые могут иметь различную локализацию. Застойные сердечные
отеки сопровождаются бледной или чаще бледно-синюшной
окраской кожи; при почечных отеках кожа всегда бледная.
Отличительными признаками микседемоподобных отеков являют-
ся локализация их на лице, тыльной поверхности рук и ног,
сочетание-с характерным видом больного.
Одышка является важным и нередко первым симптомом
ВПС. Она может быть выражена по типу диспное (глубокое ды-
хание с нормальной или несколько увеличенной частотой) или
тахипное (частое поверхностное дыхание). Наличие одышки ста-
вит вопрос о ее происхождении: сердечная, легочная, нервно-
рефлекторная. Подтверждением ВПС синего типа являются
о д ы ш е ч н о-ц ианотические приступы, при которых
имеется глубокое судорожное дыхание, бради- или тахикардия,
потеря сознания и др.
Обязательным при подозрении на ВПС является измерение
артериального давления (АД) на обеих руках и од-
ной ноге, так как коарктация аорты может быть самостоятель-
ным пороком или сопутствовать многим бледным и синим ВПС.
Перед измерением АД необходимо определить наличие пульса
на руках (в локтевых сгибах) и ногах (на бедренной артерии
в паху), что важно для своевременной диагностики коарктации
аорты.
Особое внимание необходимо уделять осмотру грудной
клетки. Диагностическое значение при ВПС приобретает
деформация грудной клетки по типу «сердечного горба», послед-
ний свидетельствует о раннем поражении сердца, ибо чем старше
ребенок, тем медленнее развивается изменение скелета. При ВПС
с шунтами, когда увеличиваются правые и левые отделы сердца,
сердечный горб носит парастернальный характер, при пороках
20
с высокой легочной гипертензией и увеличением правых отде-
лов — больше выражен справа, при левосторонних ВПС, кардио-
миопатиях — слева.
Пальпация грудной клетки — важный этап в об-
следовании больного с ВПС. Прежде всего отмечают локали-
зацию верхушечного толчка, так как она дает представление
о размерах сердца. При ВПС происходит смещение толчка и
увеличение его площади. При пальпации можно определить
дрожание в супрастернальной области (при ОАП, стенозе аорты
и легочной артерии), вдоль левого края грудины по межреберьям
(при ДМЖП, ОАП, АВК).
Важными являются определение размеров печени, ее конси-
стенция, чувствительность. Увеличенная печень является ранним
симптомом сердечной недостаточности, при этом важно следить
за ее размерами в динамике. Сохранение увеличенных размеров
печени на фоне интенсивного кардиального лечения в сочетании
с повышенными биохимическими показателями и наличием
HBS-антигена указывает на самостоятельное заболевание (ге-
патит) .
Селезенка у здоровых детей пальпаторно не определяется, ее
увеличение может быть связано с сердечной недостаточностью,
текущим септическим процессом или другим сопутствующим
заболеванием. При ВПС может иметь место инверсия внутренних
органов, которую выявляют пальпаторно.
Перкуссия остается важным методом физического обсле-
дования сердца, при этом вначале определяют границы относи-
тельной, а затем абсолютной тупости. На границы сердца оказы-
вает влияние высота стояния диафрагмы.
Аускультация является наиболее важным и информа-
тивным методом физического обследования больных с ВПС.
Необходимо проводить динамическую аускультацию (лежа,
стоя), у детей раннего возраста желательно во сне, при беспокой-
стве ребенка — на руках у матери (можно даже через одежду).
Аускультация позволяет выявить аритмии (см. электрокардиог-
рафия) . При выслушивании сердца определяются два тона.
Первый тон обусловлен захлопыванием митрального
и трехстворчатого клапанов, отражает начало систолы желудоч-
ков, лучше всего выслушивается над верхушкой сердца (закры-
тие митрального клапана). Усиление I тона у детей имеет боль-
шое семиологическое значение и встречается при следующих
патологических состояниях: 1) когда имеется повышенный-крово-
ток через атриовентрикулярные клапаны (ОАП, ДМЖП, ми-
тральная недостаточность, ДМПП и тотальный аномальный
дренаж легочных вен); 2) при стенозе левого венозного отвер-
стия; 3) при укороченном интервале Р—R; 4) при ВПС с повы-
шенным сердечным выбросом. Снижение интенсивности I тона
наблюдается при: 1) замедлении атриовентрикулярной прово-
димости (удлинение интервала Р—Р); 2) поражении миокарда
(миокардиты, кардиомиопатии); следует помнить, что для ВПС
21
не характерна приглушенность тонов, поэтому наличие последней
требует исключения сопутствующего миокардита, фиброэластоза
или кардиомиопатии.
Второй тон возникает при асинхронном закрытии кла-
панов аорты и легочной артерии, лучше выслушивается во вто-
ром и третьем межреберье слева. В норме II тон имеет 2 компо-
нента и небольшое расщепление, последнее варьирует и связано
с различными фазами дыхания. Нерасщепленный II тон — приз-
нак патологического состояния — аномалии полулунных клапа-
нов (один клапан, стеноз или атрезия одного из клапанов).
Так, атрезия или резкий стеноз клапанов легочной артерии
и тетрада Фалло характеризуются единым II тоном за счет
аортального компонента, при стенозе или атрезии аорты единый
II той связан с легочным компонентом.
Третий тон возникает в фазу диастолы, он обусловлен
расширением стенок желудочков под влиянием первой порции
крови, поступающей из предсердий, и максимально выслушивает-
ся на верхушке сердца. Более отчетливый III тон определяется
при повышенном кровотоке через атриовентрикулярные клапаны
(левоправый шунт, митральная или трикуспидальная недоста-
точность), в некоторых случаях он может восприниматься как
мезодиастолический.
При аускультации следует обратить внимание на такой неред-
ко встречающийся звуковой феномен, как «клик»—короткий
щелкающий звук высокого тона, выслушиваемый в период
систолы. Клики изгнания встречаются при определенных состоя-
ниях: дилатация (чаще постстеиотическая) магистральных сосу-
дов — аорты, легочной артерии. Клики различают по звуковым
оттенкам и месту выслушивания. Аортальные клики систоли-
ческого изгнания лучше всего слышны над верхушкой сердца
и нередко слева на спине. Более яркими они становятся в поло-
жении лежа, с актом дыхания не связаны. Клики легочного
систолического изгнания лучше слышны над областью легочной
артерии, изменяются при дыхании и становятся более громкими
в положении стоя. Аортальные клики у детей раннего возраста
чаще всего обнаруживаются при наличии общего артериального
ствола, крайней форме тетрады Фалло, аортальном стенозе,
а легочные систолические клики обычно указывают на легочный
стеноз и, реже, — на легочную гипертензию. От кликов изгнания
следует отличать клики при пролапсе митрального клапана,
которые выслушиваются над верхушкой сердца, в середине или
конце систолы.
Сердечные шумы при ВПС обусловлены различными
поражениями клапанов, дефектами перегородок. Отношение к
фазам сердечного цикла позволяет разделить систолические шу-
мы на шумы изгнания (возникают при суженном выходе из же-
лудочков) и пансистолические. Диастолические шумы делятся
на прото-, мезо- или позднедиастолические. Протодиастоли-
ческий шум начинается сразу после II тона, мезодиастолический
22
следует за ним, позднесистолический возникает в конце диасто-
лы. Систолодиастолические шумы указывают на коммуникацию
между аортой и легочной артерией или правыми камерами
сердца. Классический систолодиастолический шум — шум при
ОАП. При синих ВПС такой шум может быть связан с развитием
бронхолегочных коллатералей.
Определение места выслушивания имеет диагностическое зна-
чение. Поэтому на грудной клетке выделены 4 основные области
аускультации: аортальная, легочная, трикуспидальная и ми-
тральная. Максимальное звучание шума справа от грудины
может косвенно свидетельствовать о праворасположенном
сердце.
Интенсивность шума выражается дробью, в которой числи-
тель отражает громкость шума, а знаменатель — максимальную
его интенсивность (*/б, 3/е и т. д.). Интенсивность шума не всег-
да коррелирует с тяжестью состояния. При некоторых пороках
(например, при тетраде Фалло) интенсивность шума находится
в обратной связи с тяжестью стеноза.
Иррадиация шума дает ценную диагностическую информа-
цию. Шумы стеноза аорты проводятся на каротидные артерии,
шумы легочного стеноза — влево вверх на спину. Шум при
митральной недостаточности иррадиирует в левую подмышечную
область, при коарктации аорты — на спину.
Аускультативное обследование обязательно включает легкие.
Наличие хрипов может быть связано как с пневмонией, так
и с сердечной недостаточностью, при последней влажные хрипы
могут сочетаться с сухими из-за вторичного бронхоспазма; поло-
жительный эффект отмечается при назначении сердечных
гликозидов и диуретиков.
Пока еще педиатры и кардиологи уделяют недостаточное
внимание состоянию центральной нервной системы, психологи-
ческим и психическим особенностям [Shampaine Е. L. et al.,
1989] больных ВПС до и после операции, хотя они во многом
определяют характер клинического течения заболевания, частоту
интеркуррентных и аллергических осложнений, психическое и
умственное развитие больного, его социальную адаптацию, вно-
сят свой вклад в возникновение различных нарушений сердечно-
го ритма (экстрасистолия, пароксизмальная тахикардия). При-
меняя комплексное лечение психо- и вегетотропными препара-
тами, нередко удается прекратить приступы пароксизмальной
тахикардии, устранить хроническую непароксизмальную тахикар-
дию при аномалии Эбштейна, ДМПП и др., несмотря на сохра-
няющиеся дополнительные пути проведения импульса [Бело-
конь Н. А., Кубергер М. Б., 1987].
Осложнения со стороны ЦНС включают тромбоз мозговых
сосудов (при выраженной полицитемии, бактериальном эндо-
кардите, парадоксальной эмболии после операции на желудочно-
кишечном тракте), абсцессы мозга, гемиплегию из-за эмболи-
ческого или ишемического инфаркта мозга.
23
ЭЛЕКТРОКАРДИОГРАФИЯ
Электрокардиография является одним из основных неинва-
зивных методов обследования больных с ВПС. По изменению
электрокардиограммы (ЭКГ) более точно, чем по данным рентге-
нологического обследования, можно судить о гипертрофии пра-
вого предсердия, правого и левого желудочков, тогда как рентге-
нограмма лучше отражает увеличение левого предсердия, дила-
тацию других полостей сердца. Нередко признаки перегрузки
различных отделов сердца не являются специфичными для како-
го-либо порока, хотя в сочетании с клиническими данными
могут формировать более или менее характерные симптомо-
комплексы; ЭКГ помогает также оценить тяжесть ВПС, вид
нарушений ритма и проводимости.
Анализ и особенности ЭКГ в различные возрастные периоды
представлены в монографиях М. Б Кубергера (1983), М. К. Ос-
колковой, О. О. Куприяновой (1986), Н. А. Белоконь и М. Б. Ку-
бергера (1987). В настоящей книге мы осветим лишь те вопросы,
которые помогут практическому врачу в распознавании ВПС
по данным ЭКГ-
Оценку ЭКГ начинают с характеристики формы зубцов Р,
которая свидетельствует об источнике водителя ритма (синусо-
вый, атриовентрикулярный, желудочковый), изменении положе-
ния сердца. У детей с полиспленией Z. аР отклонен влево, при
асплении — вправо [Moller J. Н., Neal W. А., 1981]. Интервал
PR, отражающий время прохождения импульса по атриовентри-
кулярному узлу, может быть укорочен (при синусовой тахикар-
дии и преждевременном возбуждении желудочков) или удлинен
(генетически детерминированная особенность ЭКГ, врожденный
порок развития проводящей системы сердца, вагртония, миокар-
дит). Для дифференциального диагноза между функциональным
и органическим генезом атриовентрикулярной блокады показана
проба с атропином (0,02 мг/кг внутривенно или подкожно);
при ваготонин блокада исчезает.
Электрическая ось сердца у больных с ВПС может быть
отклонена влево (гипертрофия миокарда левого желудочка,
блокада передней левой ветви пучка Гиса, как дефект или осо-
бенность внутрижелудочковой проводимости) или вправо (ги-
пертрофия правого желудочка, блокада правой ножки пучка Ги-
са). О нарушении внутрижелудочковой проводимости свидетель-
ствует расширение комплекса QRS более 0,08 с у детей первого
года жизни и более 0,11 су детей старшего возраста.
Признаками гипертрофии миокарда левого
предсердия являются: двугорбость зубцов Р в отведениях
I, aVL, Vs, Ve, увеличенная отрицательная фаза в отведениях
V, и V$r, продолжительность зубца увеличивается до 0,08 с и бо-
лее у новорожденных и детей первого года жизни и до 0,12 с и
более у детей старше года (Р mitrale), индекс Макруза (отно-
шение продолжительности зубца Р к продолжительности интер-
вала PR) более 1,6.
24
Признаками гипертрофии миокарда правого
предсердия являются смещение Z.аР вправо, высокий
остроконечный зубец Рн. ш. evr (более 2—3 мм) при нормаль-
ной продолжительности (Р pulmonale), увеличение положи-
тельной фазы в отведениях Vi, V«r.
О гипертрофии обоих предсердий свидетель-
ствуют: 1) двухфазный Pv„ амплитуда инициального отклонения
более 1,5 мм, терминального— 1 мм и более. Ширина отрица-
тельной волны Pv, составляет 0,03—0,04 с; 2) высокий расши-
ренный и расщепленный Р в прекардиальных отведениях и от-
ведениях от конечностей; в отведениях II, III, aVF, V2, V3 он
остроконечный, высокий (активация правого предсердия), в отве-
дениях I, II, aVL и левых прекардиальных расширенный и
расщепленный (активация левого предсердия); 3) увеличенная
амплитуда (2—3 мм и более) зубца Р в отведениях от конечно-
стей при его расширении в этих же отведениях до 0,12 с и более;
4) индекс Макруза равен 1 и 1,6 при одновременном расширении
зубца Р и удлинении интервала PR.
Признаки гипертрофии миокарда левого желудочка [Gomi-
rato Sandrucei М., Воппо G., 1966] у детей до 6 мес: 1) отсут-
ствие соответствующего возрасту отклонения электрической оси
сердца вправо; 2) амплитуда Ravi. больше 7 мм; 3) амплитуда
Rva больше 20 мм; 4) глубина Qv5,6 больше 3 мм при /?v56 больше
16 мм; 5) амплитуда Sv, больше 20 мм; 6) время внутреннего
отклонения в Vs.6 более 0,04 с; у детей от 6 мес до 2 лет: 1) от-
сутствие сооветствующего данному возрасту отклонения электри-
ческой оси сердца вправо; 2) амплитуда Ravi. больше 7 мм;
3) амплитуда /?v6 больше 22 мм; 4) глубина Qv5,6 больше 3 мм
при Rva больше 16 мм; 5) глубина Sv, больше 24 мм; 6) время
внутреннего отклонения в Vs.6 больше 0,04 с; у детей от 2 до
12 лет: 1) отклонение электрической оси сердца влево; 2) Ravi.
больше 8 мм (при горизонтальном положении оси сердца) и
Rav? больше 8 мм (при вертикальном положении); 3) амплитуда
Rva больше 25 мм; 4) глубина зубца Qv56 больше 4 мм, при этом
/?v6 больше 20 мм; 5) время внутреннего отклонения в Vs,6 боль-
ше 0,045 с; 6) 7"v56 уплощен или отрицательный. Смещение
сегмента ST ниже изолинии и отрицательный зубец Т в левых
или правых грудных отведениях свидетельствуют о напряжении
и гипертрофии миокарда соответствующего желудочка («strain»).
Признаки гипертрофии миокарда правого
желудочка:
у детей до 6 мес: 1) Rbvr более 6 мм; 2) Rvb более 8 мм;
3) Rvt + Sv5 более 10 мм; 4) R/S в Vi более 6,5; 5) qR в V1.2;
6) время внутреннего отклонения в V1.2 более 0,04 с; 7) отклоне-
ние электрической оси сердца вправо более 4-140°;
у детей от 6 мес до 2 лет: 1) зубец Rbvr более 5 мм;
2) Rv, 4-Sv5 более 10 мм; 3) R/S в Vi более 5; -4) форма qR в
V1.2; 5) время внутреннего отклонения в V1.2 более 0,04 с; 6) от-
клонение электрической оси сердца вправо более 4-140°;
25
у детей 2—12 лет: 1) /?avR более 4 мм; 2) 7?v, более 17 мм;
3) R/S в Vi более 4; 5) форма qR в V1.2; 6) время внутреннего
отклонения в V1.2 более 0,03 с; 7) отклонение электрической оси
сердца вправо более 4-110°; у новорожденных — высокий зубец
TVi после 3—4-го дня жизни.
Признаки комбинированной гипертрофии
миокарда желудочков [Krovetz L. et al., 1979]. При-
знаки гипертрофии миокарда правого желудочка и один из при-
знаков гипертрофии миокарда левого желудочка: 1) доминант-
ные зубцы Rv56 (вольтаж может быть нормальным) с высоким
положительным Ту^; 2) зубец Q в V5.6 больше 3 мм; 3) откло-
нение электрической оси сердца влево. Признаки гипертрофии
миокарда левого желудочка и наличие одного из следующих
признаков гипертрофии правого желудочка: 1) доминантные
зубцы R или R1 в правых грудных отведениях (вольтаж может
быть нормальным); 2) R>Q в aVR; 3) S>R в Ve. Другими
признаками могут быть высокие (> 70 мм) эквифазные RS ком-
плексы в средних прекардиальных отведениях, отрицательные
зубцы Туь.
Большое значение при ВПС имеет оценка процесса реполяри-
зации. В случаях отрицательных зубцов Tv4 6 при нормальных
по форме, амплитуде и продолжительности комплексах QRS
можно думать о первичных изменениях в миокарде (миокардиты,
кардиомиопатии, дефицит коронарного кровотока при значитель-
ной гипертрофии миокарда, аномалии коронарных артерий,
функциональные изменения в связи с гиперчувствительностью
рецепторов миокарда к катехоламинам или абсолютным увели-
чением их числа). Для отличия органических нарушений от
функциональных в миокарде левого желудочка показано прове-
дение калий-обзидановой пробы — хлористый калий 0,05 г/кг и
обзидан (анаприлин) 0,3—0,5 мг/кг. Если комплекс QRS уши-
рен, деформирован (блокада ветвей пучка Гиса, синдром Воль-
фа— Паркинсона—Уайта), речь идет о вторичном характере
ST — Т нарушений. Изменение амплитуды зубцов Т может быть
связано также с гипокалиемией (снижение амплитуды)) или
гиперкалиемией (высокие, заостренные зубцы).
Интервалы QT и QTc отражают время реполяризации, за-
медление его более чем на 0,05—0,07 с является фактором
риска возникновения жизнеугрожаемых аритмий. Удлинение ин-
тервала QT может быть проявлением кардионейропатии (чаще
вирусного генеза), поражения миокарда, повреждения ЦНС,
следствием приема лекарств (хинидин, новокаинамид и др.),
электролитных нарушений (гипокальциемия, гипомагниемия).
Большое влияние на величину интервала QT оказывают кате-
холамины и симпатическая нервная система [Белоконь Н. А.,
Кубергер М. Б., 1987]. Мы наблюдали детей с ДМПП и ДМЖП,
у них сочетание ВПС с удлинением интервала QT и атриовентри-
кулярной блокадой являлось следствием внутриутробной вирус-
ной инфекции.
26
ЭКГ позволяет уточнить характер нарушений сердеч-
ного ритма и проводимости. Причинами аритмий
у больных с ВПС являются: 1) врожденное нарушение строения
проводящей системы сердца; 2) длительное нарушение гемоди-
намики; 3) наличие дополнительных путей проведения импульса
(не всегда это порок развития); 4) поражение ЦНС и вегета-
тивная дисфункция; 5) поражение миокарда: кардиосклероз,
ишемия, воспалительные, метаболические и электролитные
нарушения; 6) грубые манипуляции при катетеризации полостей
сердца; 7) хирургическая травма.
У новорожденных возникновению аритмий способствуют не-
сколько факторов: 1) изменение гемодинамики при переходе на
взрослый тип циркуляции; 2) особенности вегетативной регуля-
ции с созревшей парасимпатической (как более древней) и раз-
вивающейся симпатической иннервацией; 3) различная степень
зрелости проводящей системы сердца, так как развитие послед-
ней продолжается и постнатально. Существует связь между
аритмиями и кардиомегалией при ВПС, после операции с умень-
шением размеров сердца аритмия исчезает. Дополнительные
пути, способствующие возникновению аритмий с механизмом
риентри (reentry) (пароксизмальная и непароксизмальная
тахикардия, экстрасистолия), могут быть выявлены при электро-
физиологическом исследовании (ЭФИ) (см. ниже); отрицатель-
ные результаты при ЭФИ не исключают наличие дополнительных
путей.
Синусовая тахикардия при ВПС может быть связана с сопут-
ствующим заболеванием, повышением температуры тела, сердеч-
ной недостаточностью, поражением ЦНС, анемией, гипока-
лиемией. Синусовая брадикардия бывает проявлением ваготонин
(иногда наследственного характера), поражения собственно си-
нусового узла, сопровождает апное (у детей первого года жиз-
ни). Экстрасистолия у детей с ВПС чаше носит суправентри-
кулярный характер. Наличие экстрасистолии с широким комплек-
сом QPS далеко не всегда свидетельствует о ее желудочковом
происхождении; при суправентрикулярной локализации это имеет
место в случаях сопутствующей блокады ветвей пучка Гиса
или проводимости по дополнительному пути. Провести диффе-
ренциальный диагноз между желудочковой экстрасистолой и
суправентрикулярной с широким комплексом Q/?5 при отсут-
ствии перед ним зубца Р (они наслаиваются друг на друга)
поможет пищеводная электрокардиография.
Феномен Вольфа — Паркинсона — Уайта (WPW) нередко об-
наруживается на ЭКГ у новорожденных, в дальнейшем он ста-
новится транзиторным или исчезает; наличие дополнительных
путей проведения импульса как причины предвозбуждения,
предрасполагает к аритмиям. Сочетание феномена WPW на ЭКГ
и аритмий называется синдромом WPW. Сохранению функцио-
нирования дополнительных путей после рождения способствует
ваготонин из-за повреждения ЦНС [Белоконь Н. А., Барино-
27
ва В. С., 1986]. Электрокардиографическими признаками фено-
мена WPW являются: укорочение интервала PR, уширение комп-
лекса QRS, дельта-волна на восходящем колене зубца R. Парок-
сизмальная тахикардия на ЭКГ при синдроме WPW может быть
с узким комплексом QRS (ортодромная) — при антеградном
распространении импульса по нормальному пути и ретроград-
ном— через пучок Кента и с широким (антидромная) —при
антеградном ходе импульса через пучок Кента и ретроградном
через атриовентрикулярное соединение. Длительные приступы
пароксизмальной тахикардии у детей первого года жизни с ВПС
способствуют развитию сердечной недостаточности.
Желудочковые тахикардии у больных с ВПС возникают
редко, чаще после операции, и всегда свидетельствуют о серьез-
ном прогнозе, плохом состоянии миокарда.
Атриовентрикулярные блокады различной степени при ВПС,
как правило, связаны с пороком развития или дегенеративными
изменениями в проводящей системе сердца (несоединение мио-
карда предсердий с атриовентрикулярным узлом, узла с пучком
Гиса). Комплексы QRS при этом могут быть узкими (локали-
зация блокады на уровне атриовентрикулярного узла) и широ-
кими (при более низком уровне блока).
Следует помнить, что при некоторых ВПС более часто встре-
чаются те или иные виды нарушений ритма сердца и проводи-
мости. Так, при ДМПП до коррекции порока наиболее часто
имеют место синусовая аритмия [Finley J. et al., 1989], мерцание
и трепетание предсердий (следствие дилатации полостей пред-
сердий, дистрофических изменений в миокарде, наличия допол-
нительных внутрипредсердных проводящих путей), дисфункция
или синдром слабости синусового узла, что проявляется в виде
стойкой брадикардии, синоаурикулярной блокады, периодах уз-
лового замещающего ритма или сокращений, синдрома тахи-
брадикардии, эктопической тахикардии. При подозрении на синд-
ром слабости синусового узла в сочетании с клиническими
проявлениями (приступы головокружений, обмороки) следует
проводить пробы с атропином, физической нагрузкой, суточное
(холтеровское) мониторирование, электрофизиологическое иссле-
дование.
Нарушения ритма при ДМЖП и тетраде Фалло встречаются
нечасто и обычно исчезают самостоятельно после коррекции
порока (миграция водителя ритма, единичные экстрасистолы,
атриовентрикулярные блокады). Отсутствие нарушений ритма
в дооперационном периоде и появление после операции экстра-
систол высоких градаций по Лауну, желудочковых тахикардий
является прогностически неблагоприятным признаком.
При аномалии Эбштейна наиболее часто встречаются надже-
лудочковые пароксизмальные тахикардии, мерцание и трепета-
ние предсердий, узловая и предсердная экстрасистолия, атрио-
вентрикулярная блокада I степени, внутрижелудочковые блока-
ды. Это связано с перегрузкой предсердий, трикуспидальной
28
недостаточностью, а также врожденными особенностями прово-
дящей системы сердца.
При корригированной транспозиции магистральных сосудов
чаще встречаются нарушения проводимости, наджелудочковые
пароксизмальные тахикардии с механизмом риентри, что связано
с аномалией проводящей системы сердца. У многих больных
с возрастом по этой же причине развивается полная атриовен-
трикулярная блокада.
У больных с ВПС может быть использован метод суточ-
ного (холтеровского) мониторирования — запись ЭКГ
на магнитную ленту с помощью портативного кардиомонитора
с последующей дешифровкой. Показаниями к проведению холте-
ровского мониторирования у больных с ВПС являются: 1) нали-
чие пароксизмальных и непароксизмальных тахикардий, экстра-
систолий, удлинение интервала QT на обычной ЭКГ, сочетание
с пролапсом митрального клапана, синдромом WPW, синдромом
слабости синусового узла; 2) наличие атриовентрикулярной
блокады высокой степени; 3) необходимость оценки эффектив-
ности медикаментозного или хирургического лечения нарушений
ритма; 4) аритмогенной природы жалобы на сердцебиение,
головокружение, боли в сердце, синкопе; 5) оценка работы искус-
ственного водителя ритма.
ДОЗИРОВАННАЯ ФИЗИЧЕСКАЯ НАГРУЗКА
Для кардиолога и кардиохирурга важно не только правильно
диагностировать ВПС, но и объективно оценить функциональное
состояние и резервы аппарата кровообращения, выявить латент-
но протекающие сердечную недостаточность и аритмии. Наряду
с традиционными методами исследования в этом помогают пробы
с дозированной физической нагрузкой (ДФН). Основными пока-
заниями для проведения ДФН при ВПС являются: 1) определе-
ние функциональных возможностей сердечно-сосудистой системы
до и после операции; 2) оценка степени риска оперативного
вмешательства; 3) наличие кардиалгий неясного генеза; 4) оцен-
ка эффективности хирургической коррекции ВПС; 5) определение
тактики послеоперационного ведения больных, характера и объе-
ма двигательного режима, путей и эффективности реабилита-
ции. Противопоказаниями к пробам с ДФН являются: 1) пороки
сердца с резким стенозом выходных отделов левого и правого
желудочков; 2) сердечная недостаточность, требующая терапии
сердечными гликозидами; 3) сложные нарушения ритма и прово-
димости (мерцание и трепетание предсердий, желудочковые
аритмии высоких градаций по Лауну, атриовентрикулярные
блокады III степени с ЧСС менее 50 в мин, тяжелые внутри-
желудочковые блокады); 4) острые инфекционные заболевания
с лихорадкой; 5) активный воспалительный процесс в сердечной
мышце; 6) артериальная гипертензия у детей младше 11 лет
160/80 мм рт. ст., старше 11 лет— 180/100 мм рт. ст.; 7) хирур-
29
гические и другие осложнения, возникшие после операции;
8) срок менее 3 мес после бактериального эндокардита и менее
6 мес после гепатита [Кассирский Г. И. и др., 1979J.
У детей с ВПС до и после операции чаще используют вело-
эргометрию, степ-тест [Петрунина Л. В. и др., 1979J, пробу с
тредмилом. При ВПС факторами, ограничивающими работо-
способность и толерантность к ДФН, являются тип и тяжесть
порока, выраженность артериальной гипоксемии и ацидоза,
быстрое и значительное увеличение частоты сердечных сокраще-
ний или, наоборот, малый прирост ее, появление аритмий, гипер-
тензия большого и малого кругов кровообращения. Велоэрго-
метрию у больных с ВПС проводят с помощью субмаксимальных
(PWCim) и максимальных (PWCi?o) тестов. Рекомендуется пре-
рывистая ступенеобразно возрастающая нагрузка с длитель-
ностью каждой ступени от 3 до 5 мин, при этом первая нагрузка
составляет не более 0,5 Вт/кг. Для ориентировочной оценки
можно всем больным проводить одноступенчатую пробу 1 вт/кг
в течение 1 — 2 мин с подсчетом прироста ЧСС.
Нагрузка должна быть прекращена до достижения намечен-
ной ЧСС, если появляются признаки плохой ее переносимости,
в таких случаях речь идет о пороговой нагрузке, к признакам
которой у кардиохирургических больных относятся: 1) изменения
на ЭКГ, свидетельствующие о коронарной недостаточности,
нарушениях ритма и проводимости (косовосходящее, косонисхо-
дящее, корытообразное или горизонтальное смещение интервала
ST ниже или выше изолинии на 2 мм и более, появление частых
экстрасистол, пароксизмальной тахикардии, желудочковой арит-
мии); 2) снижение систолического и диастолического АД на
20—30 % от исходного, величина пульсового давления менее
20 мм рт. ст.; 3) повышение АД до 200—220/100—120 мм рт. ст.
и более; 4) одышка с частотой дыхания более 40 в 1 мин у
взрослых и более 60 в 1 мин у детей; 5) появление болей
в области сердца даже при отсутствии изменений на ЭКГ;
6) большая усталость, головокружение, цианоз или бледность,
тенденция к обмороку, появление холодного пота; 7) отказ боль-
ного от дальнейшего исследования в связи с дискомфортом,
страхом, слабостью.
У больных с тетрадой Фалло, атрезией трехстворчатого
клапана, транспозицией магистральных сосудов до и после опе-
рации обращают внимание достоверно более низкая исходная
ЧСС по сравнению со здоровыми, снижение показателей физи-
ческой работоспособности (особенно у больных с атрезией трех-
створчатого клапана), у некоторых детей на ЭКГ появляются
ишемические нарушения [Bruce S. et al., 1986). Несмотря на
клиническое улучшение, тесты с ДФН свидетельствуют о сниже-
нии после операции адаптационных возможностей сердечно-со-
судистой системы у больных с ВПС синего типа [Perrault Н.
et al., 1989].
Вне зависимости от способа ДФН на ЭКГ происходят опре-
зо
деленные изменения зубцов и интервалов. При нагрузке пропор-
ционально ЧСС увеличивается амплитуда зубца Р, укорачива-
ется интервал PR, продолжительность комплекса QRS не меня-
ется, электрическая ось сердца отклоняется вправо, но не более
чем на 30 % от исходного значения. Амплитуда зубца R на
ЭКГ в период нагрузки отражает объем левого желудочка.
В связи с этим увеличение данного показателя в левых грудных
отведениях (Vs.e) должно расцениваться как неспособность
сердца изометрически справиться с повышенной нагрузкой, что
приводит к увеличению конечно-систолического объема левого
желудочка. Уменьшение амплитуды зубца RvSfi свидетельствует
об уменьшении полости левого желудочка и адаптационном
ответе. В норме при нагрузке зубец Т не меняется или несколько
снижается. У больных с ВПС до и после операции снижение
или появление отрицательных зубцов Т в левых грудных отве-
дениях, а также высоких положительных в правых грудных
может быть связано как с ишемией миокарда, так и быть ложно-
положительной реакцией (отражает изменения в миокарде на
фоне гипервентиляции). При подозрении на ишемию показано
проведение нагрузочной пробы со сцинтиграфическим контролем
с помощью 20|Т1. Большую информацию о гемодинамических
нарушениях, состоянии сократительной и насосной функции мио-
карда можно получить при ДФН во время катетеризации поло-
стей сердца, в том числе с использованием радионуклидной
ангиокардиографии.
ФОНОКАРДИОГРАФИЯ
Фонокардиография — метод объективной графической реги-
страции звуковых феноменов сердца (тонов и шумов), факти-
чески при этом воспроизводятся данные аускультации и тем
самым фонокардиограмма (ФКГ) объективизирует ее.
I тон на ФКГ состоит из нескольких осцилляций и в об-
щем занимает 0,1 с (от 0,07 до 0,15 с), он начинается низко-
частотными колебаниями спустя 0,03 с после зубца Q (R) на
ЭКГ. Уменьшение амплитуды I тона бывает при сердечной
недостаточности, удлиненном интервале PR, увеличение — при
укороченном интервале PR, гиперкинетическом синдроме,
стенозе митрального клапана. Раздвоение I тона характерно
для сопутствующего поражения миокарда. II тон обуслов-
лен звуковыми феноменами, возникающими при закрытии
клапанов аорты и легочной артерии, он соответствует располо-
жению конца нисходящего колена зубца Т ЭКГ или следует
вскоре за ним, продолжительность — 0,06 с. У большинства здо-
ровых детей имеется небольшое расщепление II тона. Фиксиро-
ванное расщепление (раздвоение) II тона — патологический
признак (например, при ДМПП). III тон начинается спустя
0,12—0,16 с после первой осцилляции II тона и регистрируется
правее верхушки сердца. Патологический III тон может указы-
31
вать на ваготонию, тяжелую митральную недостаточность, сер-
дечную декомпенсацию и др. IV тон регистрируется спустя
0,1 с после зубца Р ЭКГ и совместно с клиническими данными
указывает на выраженную гипертрофию миокарда левого желу-
дочка.
Патологические шумы при ВПС имеют различную форму:
веретенообразную (при ДМПП), ромбовидную (при стенозах
аорты и легочной артерии), с убывающей (decrescendo — при
недостаточности полулунных клапанов), нарастающей (crescen-
do — при митральном стенозе) или равномерной амплитудой.
Шумы различают по частотной характеристике: низко-, средне-
и высокочастотные, что обусловлено степенью сужения отвер-
стия, скоростью кровотока, градиентом давления по обе стороны
суженного отверстия. Для ВПС более характерны высокочастот-
ные шумы, для приобретенных пороков — средне- и низкоча-
стотные.
ЭХОКАРДИОГРАФИЯ
Эхокардиография является высокоинформативным неинвазив-
ным методом исследования сердца с помощью отраженных
ультразвуковых волн, она позволяет в настоящее время диагно-
стировать широкий спектр патологических и физиологических
состояний, провести неинвазивную оценку морфологических об-
разований сердца, характера их движений, исследовать состоя-
ние гемодинамики, сократимости и расслабления миокарда.
Несмотря на огромные возможности, метод информативен только
в руках опытного специалиста, требует сопоставлений с данными
клинико-инструментальных и других методов обследования
[Мухарлямов Н. М., 1988].
При одномерной эхокардиографии изучение
движения элементов сердца проводится из одной точки с исполь-
зованием разных углов наклона датчика из 4 основных стандарт-
ных позиций по Н. Feigenbaum (рис. 2). В I позиции последова-
тельно визуализируют небольшую часть правого желудочка,
межжелудочковую перегородку, полость левого желудочка на
уровне сухожильных нитей митрального клапана. В данной пози-
ции определяют размеры полости левого и правого желудочков,
проводят оценку толщины и характера движения межжелудочко-
вой перегородки и задней стенки левого желудочка. Во II пози-
ции ультразвуковой луч проходит через правый желудочек,
межжелудочковую перегородку, переднюю и заднюю створки
митрального клапана и заднюю стенку левого желудочка. Дан-
ная позиция используется для определения анатомического
строения и характера движения митральных створок. В норме
на эхокардиограмме митральный клапан имеет характерную
форму, напоминающую букву М. III стандартная позиция (см.
рис. 2) образуется при направлении луча через основание перед-
ней створки митрального клапана, при этом в зону локации
32
4
Рис. 2. Прохождение ультразвукового луча через структуры сердца в зависи-
мости от ориентировки датчика.
I, 2, 3, 4 — стандартные позиции датчика по Н. Feiqenbaum Д — датчик; ПС, ЗС —
передняя и задняя створки митрального клапана; ЗСЛЖ задняя стенка левого же-
। удочка.
попадает сегмент левого желудочка в области выходного тракта
и часть полости левого предсердия. IV стандартная позиция
образуется при прохождении луча через выходной тракт правого
желудочка, корень аорты, аортальные клапаны и полость левого
предсердия. III и IV позиции обладают высокой информатив-
ностью в диагностике стеноза устья аорты, субаортального
стеноза, патологии аортальных клапанов. Для выявления взаи-
моотношения структурных элементов сердца осуществляют не-
прерывное перемещение датчика от основания сердца к верхуш-
ке — так называемое М-сканирование (от motion — движение).
При перемещении датчика от I к IV позиции в норме выявляются
септально-аортальное и митрально-полулунное продолжения, что
позволяет оценивать взаимоотношение магистральных сосудов
с камерами сердца.
Двухмерная эхокардиография существенно до-
2—976
зз
полняет и уточняет информацию о характере поражения сердца,
полученную при одномерной методике. Исследование сердца
проводится в стандартных плоскостях по длинной, короткой оси
и в плоскости 4 камер, используя парастернальную (наиболее
часто), супрастернальную, апикальную, субкостальную проек-
ции. Двухмерная эхокардиография позволяет охарактеризовать
морфологически правый (наличие септопариетальных мышечных
пучков и атриовентрикулярного клапана, расположенного ближе
к верхушке) и левый (гладкая поверхность перегородки, две
папиллярные мышцы и атриовентрикулярный клапан, располо-
женный дальше от верхушки) желудочки, выявить патологию
атриовентрикулярных клапанов, размеры и расположения дефек-
та межжелудочковой перегородки (невизуализированными могут
остаться только небольшие дефекты в мышечной части), обструк-
цию выводного тракта левого желудочка (мембранозная, мышеч-
ная), патологию полулунных клапанов, магистральных сосудов
и их ветвей (стеноз устья правой ветви легочной артерии, ее
гипоплазию, левая ветвь визуализируется плохо), правую и ле-
вую коронарные артерии. Использование двухмерной эхокардиог-
рафии позволяет многим детям избежать ангиокардиографии
и катетеризации перед операцией, особенно это важно для ново-
рожденных и детей первого года жизни.
Современная эхокардиография имеет ряд разновидностей.
Использование ультразвуковых индикаторов привело к возникно-
вению метода контрастной эхокардиографии, который основан на
феномене эхоконтрастирования при введении в циркуляторное
русло эхоконтрастных веществ, приводящих к возникновению
микропузырьков в исследуемых камерах сердца. В местах сопри-
косновения микропузырьков газа и крови образуются сильные
эхосигналы, регистрируемые М-способом либо двухмерной эхо-
локацией. В качестве эхоконтрастных веществ большинство
исследователей используют изотонический раствор хлорида
натрия, 5—10% раствор глюкозы либо рентгеноконтрастные
вещества, содержащие йод. Обычно вводится от 5 до 10 мл
(новорожденным не более 2 мл) физиологического раствора
либо 5—10% раствора глюкозы со скоростью введения 10 мл/с,
что создает достаточное количество микропузырьков и хорошее
эхоконтрастирование. В зависимости от диагностических задач
эхоконтрастное исследование обычно проводится во время кате-
теризации полостей сердца, при этом выраженность контрастиро-
вания больше, чем при периферическом введении [Berwing К-,
Schlepper М., 1988].
Наиболее часто эхоконтрастное исследование применяется
для диагностики септальных дефектов, клапанной регургитации,
необходимости идентификации отделов сердца и сосудов (право-
го желудочка и предсердия, легочной артерии, эндокардиальной
поверхности сердца).
Большим достижением является внедрение в обследование
больных с ВПС допплерэхокардиографии; метод
34
основан на анализе изменений частот возвращающегося ультра-
звука по сравнению с посылаемым. Существует две модификации
допплерэхокардиографии: непрерывный и импульсный. Метод
непрерывной допплерэхокардиографии более точен для измере-
ния очень высоких скоростей движения крови (более 4 м/с),
например, при определении потока крови за местом сужения сосу-
да. Импульсная допплерэхокардиография позволяет оценить
потоки меньшей скорости в определенном заданном контрольном
объеме. Если допплерэхокардиография проводится во время
двухмерной эхокардиографии, она дополняет это обследование
оценкой клапанных градиентов, сердечного выброса, величины
сброса на уровне дефектов перегородок и клапанов сердца,
величины, скорости и характера (турбулентный или ламинарный)
кровотока. В последнее время сообщается о постановке диагноза
врожденных коронарных свищей при помощи двухмерной и доп-
плеровской эхокардиографии. Большое значение этот метод име-
ет для оценки легочной гипертензии, признаками которой явля-
ются пролабирование створок клапана легочной артерии в вы-
водной тракт правого желудочка, легочная и трикуспидальная
регургитация, изменение потоков крови в стволе легочной арте-
рии и выносящем тракте правого желудочка. Существуют ап-
параты с цветной кодировкой кровотока.
В последнее десятилетие применяется компьютерный
анализ эхокардиограмм, позволяющий точно и объективно
оценить функцию левого желудочка; при этом получают скорост-
ные параметры, которые не могут быть определены по обычной
эхокардиограмме [Лауцявичюс А. А. и др., 1989].
Учитывая, что число детей, рождающихся с ВПС, не умень-
шается, большое значение приобретает пренатальная диагности-
ка с ВПС с помощью фетальной эхографии, которая
является единственным методом, позволяющим диагностировать
врожденные пороки развития. Своевременное выявление патоло-
гии плода, множественных уродств, несовместимых с жизнью,
позволит прервать беременность по медицинским показаниям, что
приведет к снижению перинатальной заболеваемости и смертно-
сти. Пренатальная диагностика врожденных пороков развития,
в том числе и ВПС, осуществляется в основном во II и III три-
местрах беременности. Косвенными признаками наличия пороков
развития плода являются гидрамнион (что бывает и при хромо-
сомной патологии), маловодие (свидетельствует о внутриутроб-
ной задержке развития плода).
Принимая во внимание, что фетальная эхокардиография —
дорогостоящее обследование, оно в первую очередь показано
женщинам, страдающим ВПС, диабетом или имевшим детей
с ВПС или другими пороками развития, если во время беремен-
ности они принимали лекарственные препараты (дифенин, ли-
тий и др.), перенесли краснуху, тяжелые ОРВИ в первый три-
местр беременности, при многоводии, в случаях сохранения
беременности с применением гормонального лечения.
35
РЕНТГЕНОСКОПИЯ И РЕНТГЕНОКАРДИОГРАФИЯ
Рентгенография органов грудной клетки позволяет оценить:
1) легочный рисунок, который отражает артериальный и/или
венозный застой или, наоборот, свидетельствует о снижении
кровенаполнения малого круга кровообращения; 2) размер от-
дельных камер сердца, магистральных сосудов; 3) положение
и форму сердечной тени, которая при многих ВПС имеет харак-
терные особенности; 4) состояние вилочковой железы, наличие
или отсутствие пневмонии, плеврита, гидроторакса, определяет
ход ребер, кровоток по межреберным артериям (имеет диагности-
ческую ценность при коарктации аорты, тетраде Фалло), состоя-
ние позвоночника; 5) изменения со стороны несердечных струк-
тур (легкие, плевра, позвоночник).
При обследовании новорожденных и детей первых месяцев
жизни желательно использовать специальные приспособления,
позволяющие фиксировать больного и снимать рентгенограммы
в любом положении. Рентгеновский снимок делается во фрон-
тальной (переднезадней, прямой), боковой, в переднелевой
(П косое положение) и переднеправой (I косое положение)
проекциях. Рентгенография проводится обязательно с контрасти-
рованием пищевода барием, что позволяет более точно опреде-
лить увеличение отдельных полостей сердца.
Рентгеноскопия грудной клетки является первым эта-
пом рентгенологического обследования ребенка, во время которо-
го намечается план дальнейшего изучения сердца. Исследование
начинается с определения подвижности и высоты стояния диаф-
рагмы, затем обращается внимание на положение, форму и вели-
чину сердца, его смещаемость, размеры отдельных камер,
амплитуду пульсации аорты и легочной артерии, корней легких,
миокарда желудочков, состояние легких и плевры.
Рентгенокар диогр аф ия у детей первых лет жизни
нередко выявляет расширенную тень сосудистого пучка, обычно
больше с правой стороны за счет тени вилочковой железы.
Для подтверждения этого делается рентгеновский снимок во II
косой (левопередней) проекции.
При осмотре легочного рисунка прежде всего необходимо
решить, нормальный он или аномальный; если аномальный, то
усилен он или обеднен; если усилен, то за счет артериального
или венозного русла.
Далее обращают внимание на расположение желудка (газо-
вый пузырь при правильном положении сердца виден слева от
позвоночника, тень печени — справа) и верхушки сердца. В за-
висимости от их соотношения выделяют нормальное расположе-
ние сердца (верхушка над диафрагмой слева, органы
брюшной полости видны в обычной позиции) или аномальное
(см. главу 21).
Праворасположенный желудок, срединное расположение тени
печени с левосторонними дугой аорты и верхушкой сердца ука-
зе
Рис. 3. Рентгенограмма грудной клетки в различных проекциях.
а передняя прямая: б правая передняя косая; в левая передняя косая; г — ле-
вая передняя косая с увеличением полости левого желудочка
зывают на синдром полисплении. Смещение сердца на рентгено-
грамме может быть связано с патологией легких, диафрагмы,
скелета.
Определенную информацию можно получить при оценке фор-
мы сердца. Так, для транспозиции магистральных сосудов ти-
пична большая тень сердца овоидной конфигурации («яйцо, ле-
жащее на боку»), для тетрады Фалло — небольшое сердце типа'
«башмачка» с обедненным легочным рисунком; сердце типа
«снежной бабы» (восьмерки) свидетельствует о тотальном ано-
мальном дренаже легочных вен.
Далее переходят к оценке состояния отдельных камер сердца,
для чего нужно знать места их проекции в прямом и косых по-
ложениях (рис. 3.).
Левое предсердие расположено несколько выше пра-
вого. На фронтальном снимке ушко левого предсердия занимает
небольшой участок между контуром левого желудочка и легоч-
ной артерией (ом. рис. 3, а). В I косой проекции левое предсер-
дие располагается в средней части заднего контура сердца (см.
рис. 3, б), тесно прилежит к пищевому и левому главному брон-
ху. Во II косой проекции оно расположено тотчас ниже левого
бронха (см. рис. 3, в).
37
Увеличению полости левого предсердия соответствуют следу-
ющие признаки: 1) подъем и закругление контура левого главно-
го бронха во II косой проекции; 2) увеличение дуги левого пред-
сердия или его ушка на фронтальном снимке; 3) отклонение
пищевода, контрастированного барием, вправо и кзади в I косой
проекции; 4) двойной правый контур на фронтальном снимке.
Правое предсердие формирует правый контур серд-
ца на фронтальном снимке, оно определяет расположение пра-
вого атриовазального угла, который смещается вверх при увели-
чении камеры. В 1 косой проекции правое предсердие занимает
нижнюю часть заднего контура сердца (см. рис. 3, б). Во II ко-
сой проекции (см. рис. 3, в) оно выполняет средний сегмент на
переднем крае сердечно-сосудистого контура, имеет несколько
уплощенную форму и отделяется от аорты небольшой выемкой.
На рентгенограмме увеличению правого предсердия соответ-
ствуют: 1) выбухание и закругление правого контура на фрон-
тальном снимке; 2) приподнятое положение над диафрагмой
и выступание вперед переднего правого контура во II косой
проекции (см. рис. 3, в).
Об увеличении правого желудочка на фронтальном
снимке будет свидетельствовать большая выпуклость нижнего
правого контура тени сердца. Левый желудочек в такой ситуации
смещается влево, вверх и кзади, поэтому можно ошибочно сде-
лать заключение об увеличении левых отделов. Чтобы этого
не произошло, надо проанализировать данные косых проекций.
Одновременно необходимо оценить состояние легочной артерии,
так как расширение ее ствола подтверждает дилатацию правого
желудочка. Дилатация выводного тракта правого желудочка хо-
рошо определяется в I косой проекции. В боковой проекции об
увеличении полости правого желудочка будет свидетельствовать
сужение ретростернального пространства. Гипертрофия (концент-
рическая) правого желудочка не дает увеличения сердечного
силуэта, косвенно об этом может свидетельствовать закругле-
ние правого контура (без выбухания) и смещение влево левого
желудочка.
Левый желудочек формирует левый контур сердца
на фронтальном снимке и нижний задний в боковом положении
и II косой проекции. При дилатации полости левого желудочка
верхушка сердца принимает вытянутую форму, погружается в
диафрагму, иногда доходя до реберного края. Во II косой про-
екции тень левого желудочка удлинена, закруглена, находит на
позвоночник. При гипертрофии миокарда левого желудочка на
фронтальном снимке верхушка сердца закруглена и приподнята
над диафрагмой, талия выражена.
Очень важно определить по рентгенограмме состояние маги-
стральных сосудов — аорты и легочной артерии. Восхо-
дящая аорта у детей старшего возраста на прямом снимке фор-
мирует правый верхний контур сердца (у маленьких эта выпук-
лость часто образована тенью вилочковой железы); во II косой
38
проекции она расположена в верхнепереднем отделе сердечного
силуэта. Выбухание этого контура может быть вариантом нормы
или свидетельствовать о дилатации восходящей аорты у больных
с синдромом Марфана, клапанным стенозом аорты, открытым ар-
териальным протоком, общим артериальным стволом, с большим
праволевым сбросом, при ВПС с праворасположенной дугой аор-
ты (общий артериальный ствол, тетрада Фалло).
Тень ствола легочной артерии на фронтальном снимке распо-
ложена между контуром ушка левого предсердия и аортой (вто-
рая дуга) (см. рис. 3, а), в I косой проекции она формирует
верхнюю часть сердечного силуэта (см. рис. 3, б). Расширение
ствола легочной артерии бывает при стенозе легочной артерии
(постстенотическое расширение), увеличении легочного кровото-
ка в случаях большого левоправого сброса, легочной гипертен-
зии.
Оценка легочного рисунка в сочетании с клиниче-
скими и другими данными значительно помогает в диагностике
сердечной патологии. Усиление легочного рисунка может быть
связано с переполнением артериального (левоправный сброс) или
венозного (заболевание миокарда, митральный стеноз) русла,
реже за счет увеличения бронхиального кровотока (компенса-
торного при тетраде Фалло). Рентгенологическими признаками
легочной гипертензии являются: резкое расширение корней лег-
ких с круглыми тенями ортогонально направленных расширен-
ных артериальных легочных ветвей; увеличение в 2 раза и более
ширины корней легких; выраженный венозный застой в легких
(признак большого возврата крови из легких в левое предсердие,
его перегрузка с возникновением «относительного стеноза» мит-
рального клапана); аневризматическое расширение легочной ар-
терии.
При анализе рентгенограммы можно использовать рентгено-
кардиометрию. Большой вклад в разработку этого метода внесли
проф. И. X. Рабкин, доктор медицинских наук Р. Р. Голонзко.
Расширение легочной артерии оценивается индексом Мура, по-
казателем Шведеля, размеры сердца — кардиоторакальным ин-
дексом и показателями объемов сердца. Расчет кардиометри-
ческих показателей приведен в монографии Н. А. Белоконь,
М. Б. Кубергера (1987).
КАТЕТЕРИЗАЦИЯ ПОДОСТЕИ СЕРДЦА
И АНГИОКАРДИОГРАФИЯ
Катетеризация (зондирование) полостей сердца представля-
ет собой исследование, при котором через периферическую вену
или артерию вводят катетер (из дакрона, поливинила, полиэти-
лена, длиной 5—150 см, диаметром 1—4 мм) для проведения его
в различные полости сердца и магистральные сосуды. Катетери-
зация полостей сердца используется в настоящее время не толь-
ко с диагностической целью, но и для лечения нарушений ритма
39
сердца, некоторых ВПС (закрытие ОАП, ДМПП, баллонная ат-
риосептотомия, ангиопластика при сужении клапанов аорты
и легочной артерии), заболеваний системных и легочных арте-
рий (дилатация, реканализация и др.).
С диагностической целью катетеризация полостей сердца и
ангиокардиография показаны в следующих случаях: 1) при по-
дозрении на ВПС для уточнения его вида, если имеются пока-
зания к хирургическому вмешательству (сердечная недостаточ-
ность, прогрессирующая легочная гипертензия и др.); 2) для
уточнения морфологических особенностей и гемодинамических
проявлений уже известного порока сердца перед операцией;
3) для оценки результатов операций или определения показаний
к повторной операции; 4) при наличии цианоза у детей раннего
возраста и в более старшем возрасте, включая случаи цианоза
неизвестного происхождения. Зондирование полостей сердца про-
тивопоказано при лихорадочных состояниях, пневмонии, рефрак-
терной сердечной недостаточности ПБ — III стадии, обострении
бактериального эндокардита.
При катетеризации берется кровь из всех полостей сердца
и магистральных сосудов для определения pH и РСОг, измеряют
также сердечный выброс, системный и легочный кровоток, их
соотношение, величину шунта и его направление. Важным мо-
ментом при катетеризации является определение легочного (об-
щего и артериолярного) и общепериферического сопротивления,
их соотношения, для чего необходимо иметь данные о давлении
в желудочках сердца и магистральных сосудах.
Ангиокардиография показана для определения размеров по-
лостей сердца, степени гипертрофии миокарда, уровня, направ-
ления и величины сброса, аномального отхождения магистраль-
ных и коронарных сосудов, выраженности клапанной недостаточ-
ности или стеноза, оценки насосной, сократительной и диастоли-
ческой функции миокарда.
Введение контрастного вещества должно быть селективным,
для этого ориентируются на предполагаемый топический диагноз
порока. В крупных кардиохирургических клиниках проводятся
более полные обследования, при этом объем ангиокардиографи-
ческого исследования продолжает увеличиваться соответственно
возрастанию сложности и улучшению качества выполняемых
операций.
Получаемое изображение сердца в стандартных рентгено-
логических проекциях не всегда позволяет четко судить о деталях
порока. В связи с этим в последние годы широкое распростране-
ние получили так называемые аксиальные проекции, воспроиз-
водимые посредством смещения тела больного в различных
плоскостях; этим достигают расположения интересующих сердеч-
ных структур в плоскости, дающей возможность получить опти-
мальное их изображение и устранить проекционное искажение.
Используют три проекции: «сидячее положение» или положение
«легочного ствола» с приподнятым на 45° туловищем; проек-
40
ция «четырех камер» или «печеночно-ключичная проекция»; про-
екция «длинной оси».
В последнее время все большее распространение получает
числовая (дигитальная) субтракционная ангиография, этот ме-
тод позволяет усиливать рентгеновское изображение с помощью
Субтракции и применения компьютера. Преимуществом метода
является возможность получения качественного изображения
левых отделов сердца и артериальной системы при внутривенном
введении малых доз контрастного вещества, что особенно важно
в диагностике сложных ВПС, так как дает возможность без рис-
ка выполнять многоразовые исследования.
Осложнения при катетеризации полостей сердца чаще возни-
кают у новорожденных и детей первых месяцев жизни. Следует
выделять большие и малые осложнения. К большим осложнени-
ям относятся: смерть через 24 часа после катетеризации; арит-
мии, сопровождающиеся гипотензией и требующие медикамен-
тозного вмешательства (асистолия, желудочковые тахикардия
и фибрилляция, мерцание и трепетание предсердий, синусовая
брадикардия, атриовентрикулярная блокада I1-III степени);
прогрессирующая гипотония; сосудистые нарушения с ишемией
конечности, требующие хирургического вмешательства; перфора-
ция сердца и сосудов контрастным веществом или катетером с
тампонадой или без нее; проблемы, связанные с качеством кате-
тера; инфекционные осложнения (посткатетеризационные эндо-
кардиты и септицемия, тромбофлебит и др.); серьезные аллерги-
ческие реакции на контрастное вещество, препараты, вводимые
для премедикации и анестезии; трансфузионные реакции, гипер-
термии; эмболии (легочные, церебральные, другие); сердечные
осложнения (инфаркт миокарда, острый отек легкого, гипокси-
ческие приступы); серьезные кровотечения; пневмоторакс; про-
чие (гипотермия у новорожденных и младенцев, гемоглобину-
рия, поражение ЦНС).
К малым осложнениям относят: аритмии (суправентрикуляр-
ные тахикардии, брадикардия, атриовентрикулярная блокада,
преходящая блокада левой ножки и др.), не сопровождающиеся
гипотонией, не требующие лечения и преждевременного прек-
ращения зондирования; сосудистые нарушения (слабый пульс
или его отсутствие после катетеризации с теплой конечностью
и хорошим капиллярным наполнением); поражение миокарда с
преходящими нарушениями зубца Т и сегментами ST на ЭКГ или
без них, но без перфорации; поверхностные инфекции; аллерги-
ческие реакции в виде сыпи; кровотечения, не требующие транс-
фузий крови и ее препаратов; прочие (аспирационные пневмонии,
транзиторная гематурия, венозный стаз конечности).
БИОПСИЯ СЕРДЦА И ЛЕГКОГО
Большую помощь в оценке морфологических изменений в
сердце при жизни больного оказывает изучение биопсийного
41
материала. Последний может состоять из субэпикардиальных
(получают при чрескожной и интраоперационной биопсии) и
субэндокардиальных отделов миокарда. Наибольшая информа-
ция получается при исследовании биоптата из субэндокардиаль-
ных отделов миокарда, полученных при помощи биотома Конна.
Последний вводится в правые или левые отделы во время рутин-
ной катетеризации полостей сердца, при этом желательно брать
биопсию из 3—5 разных участков. При подозрении на сопут-
ствующее воспаление в миокарде, кардиомиопатию наиболее
информативна биопсия миокарда левого желудочка; при ВПС,
учитывая гемодинамическую нагрузку, в некоторых случаях бы-
вает показана биопсия правого желудочка. В биоптатах сердца
до операции при ДМПП находят гипертрофию и дегенерацию
миокарда, при ДМЖП — фиброз и дегенерацию, при ОАП и тет-
раде Фалло — гипертрофию, фиброз, дегенерацию, воспаление.
При этом имеется корреляция между гистологическими изменени-
ями и величиной сброса при ОАП; гематокритом и фиброзом,
возрастом и гипертрофией при тетраде Фалло. В послеоперацион-
ных биоптатах наиболее выраженные изменения совпадали с
длительностью искусственного кровообращения и аноксической
остановкой сердца (anoxic arrest).
Изменения в легочных сосудах, приводящие к легочной ги-
пертензии, у детей с ВПС — ведущий фактор, определяющий
тяжесть и исход ВПС. в том числе — послеоперационный.
Как правило, это серьезное осложнение при больших септальных
дефектах. Перед операцией при наличии признаков высокой ле-
гочной гипертензии необходимо решить вопрос, насколько обра-
тимы изменения в легочных сосудах, в противном случае трудно
рассчитывать на хороший послеоперационный результат. Извест-
но, что регресс сосудистых изменений возможен, если в сосудах
имеется гипертрофия медии и неокклюзивная интимальная ги-
перплазия (I-I1I стадии по D. Heath, J. Edwards). Биопсия
легкого в качестве завершающего этапа обследования показана
больным с высокой легочной гипертензией, у которых на основа-
нии клинико-инструментальных исследований невозможно с уве-
ренностью высказаться о характере гипертензии (гиперволе-
мическая или склеротическая). Получить прижизненную инфор-
мацию о состоянии легочных сосудов можно с помощью откры-
той биопсии легкого, а также взяв биопсию легкого во время
операции (перевязка ОАП, резекция коарктации аорты). Биоп-
тат берется из верхней доли правого легкого, желательно из
нескольких мест, оценивается согласно классификации D. He-
ath, J. Edwards, и М. Rabinowitsh (см. главу 1). Изучение
биоптата проводится с помощью световой, электронной и скани-
рующей микроскопии. Наиболее тяжелыми являются обструктив-
ные изменения в легочных сосудах, (IV стадия по D. Heath,
J. Edwards). При гистологическом исследовании можно уви-
деть, что с увеличением степени интимального фиброза медиа
утончается, наружный диаметр сосудов у детей старше 2 лет
42
увеличивается, а число их уменьшается, так же как вели-
чина шунта. Изменения в легочных сосудах бывают менее тяже-
лыми у детей с увеличенным легочным кровотоком и небольшим
увеличением давления в легочной артерии. Гипертрофия медии,
сужение просвета сосудов и снижение их плотности значительно
увеличивают давление в легочной артерии и сосудистое сопро-
тивление; эти параметры сопряжены с величиной сброса, в мень-
шей степени с возрастом больного. Иногда выраженные измене-
ния в виде плексиформных образований можно обнаружить у де-
тей первых недель жизни, что подтверждает наличие врожденной
легочной гипертензии у некоторых больных с ВПС по аналогии с
первичной легочной гипертензией. Взятие нескольких участков
легкого при биопсии позволяет оценить распространенность пора-
жения легочных сосудов, что определяет исход операции.
ЭЛЕКТРОФИЗИОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
На практике известно, что многие ВПС сопровождаются
нарушениями сердечного ритма и проводимости, которые способ-
ствуют более раннему появлению сердечной недостаточности,
ухудшают прогноз и затрудняют хирургическую коррекцию ВПС,
а нередко являются причиной смерти больных. Выявление ме-
ханизма аритмий, возможности их возникновения при ВПС
должно стать неотъемлемой частью дооперационного обследова-
ния больного и, помимо электрокардиографического исследова-
ния, проведения нагрузочных проб и суточного (холтеровского)
мониторирования, требует в ряде случаев электрофизиологиче-
ского исследования (ЭФИ). Последнее выполняется во время ка-
тетеризации полостей сердца и не несет в себе дополнительной
травматизации.
ЭФИ показано: 1) больным с аномалией Эбштейна, пролап-
сом митрального клапана в дооперационном периоде; 2) при со-
четании ВПС с непароксизмальной или пароксизмальной тахи-
кардией, синдромом слабости синусового узла, желудочковой
экстрасистолией и тахикардией, атривентрикулярной блокадой
II—III степени, редким выскальзывающим ритмом с широким
комплексом QRS; 3) больным с ВПС, страдающим синкопаль-
ными или предсинкопальными состояниями, которые могут быть
результатом скрыто протекающих жизнеугрожаемых аритмий, в
том числе при отсутствии последних во время проведения на-
грузочных тестов и холтеровского мониторирования; 4) для под-
бора антиаритмической терапии; 5) при возникновении аритмии
в послеоперационном периоде.
ЭФИ включает: а) регистрацию эндокардиальной электро-
граммы от различных отделов сердца (правого предсердия, ко-
ронарного синуса, пучка Гиса, правого и левого желудочков);
б) программированную электростимуляцию сердца. Исследова-
ние проводится в условиях двухпроекционной рентгеноскопии.
Одновременно с записью электрограммы регистрируется несколь-
43
ко отведений обычной ЭКГ (1, II, III, Vi, Ve). В период иссле-
дования ведется постоянный контроль за всеми отведениями
электрограммы с помощью осциллоскопа. Электростимуляция
сердца осуществляется с помощью программированного стимуля-
то, ... генерирующего импульсы постоянного тока, сила, напря-
жение и частота которых точно регулируются, так же как вели-
чина задержки или продолжительность интервала между нормаль-
ным или предшествующим и последующим искусственным сти-
мулом. Частота стимуляции постепенно возрастает и достигает
800 импульсов в 1 мин и более, при этом могут возникать арит-
мии. Через катетер возможно введение различных препаратов
для вегетативной блокады синусового узла (атропин, обзидан)
или для подбора дозы и оценки эффективности антиаритмиче-
ских средств (кордарон, лидокаин, новокаинамид).
ЭФИ у больных с ВПС позволяет: 1) определить автомати-
ческую функцию синусового узла и время синоатриального про-
ведения; 2) установить наличие и локализацию дополнительных
путей проведения импульса, изучить их электрофизиологические
свойства: антеградное, ретроградное, двустороннее проведение
возбуждения, продолжительность рефрактерного периода, учас-
тие в механизме тахикардии; 3) выяснить вид и механизм арит-
мии; 4) локализовать эктопический очаг.
Уточнение механизма нарушения ритма, локализация эктопи-
ческого очага позволяют обосновать объем и тактику терапев-
тического и хирургического вмешательства (необходимость пере-
сечения дополнительных путей, деструкция эктопического фокуса
и др.). В последние годы советскими кардиохирургами разрабо-
таны и проводятся одновременно такие операции, как протезиро-
вание митрального клапана и устранение тахикардии типа «пи-
руэт», пластика трикуспидального клапана при аномалии Эб-
штейна и устранение нодовентрикулярного тракта и др. Если
во время ЭФИ у больных ВПС устанавливается локализация
полной атриовентрикулярной блокады внутри или ниже пучка
Гиса, а при синдроме слабости синусового узла выявляется
время его восстановления, превышающее 2 с, это является по-
казанием к применению кардиостимулятора.
ДРУГИЕ ИНСТРУМЕНТА/ЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Все нижеперечисленные методы обследования могут быть
применены, если различные варианты эхокардиографии не про-
ливают свет на диагноз ВПС.
Компьютерная томография. Метод основан на
возможности в широком диапазоне и с большой степенью точ-
ности определять «рентгенологическую плотность» тканей и
структур организма на различной глубине и проекции среза.
С помощью компьютерной томографии возможно выявление
структур сердца за счет регистрации изменений плотностных
характеристик после внутривенного введения малых доз конт-
44
растного вещества. ВПС диагностируются главным образом на
основании данных динамического сканирования [Рабкин И. X. и
др., 1985]. Оцениваются размеры и соотношение отдельных ка-
мер сердца, изменения миокарда, а также положение и состоя-
ние магистральных сосудов, что позволяет диагностировать
большинство ВПС. Компьютерная томография в отличие от
эхокардиографии является более эффективной в диагностике
коарктации аорты, открытого артериального протока, гипоплазии
легочной артерии и небольших дефектов межжелудочковой
перегородки. На основании скорости и характера продвижения
контрастированной крови по полостям сердца можно оценить
состояние миокарда, основные показатели гемодинамики отдель-
ных камер сердца, в том числе и при поражениях клапанного
аппарата. Компьютерная томография позволяет диагностировать
аневризмы, тромбы, микрокальциноз клапанов, у больных с
ВПС помогает оценить расположение внутренних органов,
выявить situs inversus, аномалии полых вен, анатомию желудоч-
ков, аорты и ее арки. Остаются нерешенными вопросы значения
рентгеновского облучения, длительности обследования.
Ядерный магнитный резонанс — томография, ос-
нованная на принципе ядерно-магнитного резонанса (ЯМР-
томография), позволяет исследовать различные органы человека.
ЯМР-томография осуществляется путем воздействия на чело-
века трех полей — однородного статического магнитного поля,
необходимого для ориентации ядер (наиболее широко использу-
ются протоны водорода), высокочастотного магнитного поля,
необходимого для возбуждения (изменения энергетического сос-
тояния) ядер, и градиента магнитного поля, который позволяет
выделить в объекте исследуемый слой.
С помощью ЯМР-томографии (в последовательности спин-
эхо) при синхронизации регистрируемых эхосигналов с ЭКГ
возможна количественная оценка размеров левого и правого желу-
дочков, толщины их стенок, выявление створок клапанов сердца
и сосочковых мышц, что находит свое применение в диагностике
ВПС и легочной гипертензии, в том числе у новорожден-
ных [Livolsi A. et al., 1989]. Оценка состояния легочной ар-
терии помогает в диагностике ее атрезии и некоторых вариантов
общего артериального ствола. ЯМР-томография помогает выя-
вить экстракардиальные пороки (аномалии развития дуги и
брюшной аорты, коарктацию аорты), которые плохо определяют-
ся методом эхокардиографии. ЯМР-томографшя позволяет полу-
чать дифференцированное изображение движущейся крови и со-
судистой стенки, в связи с чем этот метод используется для
диагностики патологических изменений сосудов и скорости кро-
вотока в них. ЯМР-томография помогает в диагностике пора-
жений перикарда (утолщения, спайки, кисты) [Underwood S. R.
et al., 1989], в определении участков ишемии и инфаркта мио-
карда.
Несмотря на большие возможности, применение ЯМР-то-
45
мографии в кардиохирургических клиниках ограничено в связи
с неблагоприятными воздействиями высокочастотных элект-
рических полей и веществ, обладающих парамагнитными свой-
ствами, на сердечно-сосудистую систему, особенно у лиц, стра-
дающих аритмиями и имеющих трансплантаты и сердце, ме-
таллические протезы и сосудистые скрепки, сделанные из магнит-
ных материалов, кардиостимуляторы [Jacobson Н. G., 1988].
Радионуклидная диагностика. Высокая чувстви-
тельность методов радиоиндикации и расширившийся выбор
радиофармакологических препаратов существенно повысили их
значимость в диагностике сердечно-сосудистых заболеваний.
Современная радионуклидная диагностика характеризуется при-
менением высокочувствительных гамма-камер, эмиссионных
компьютерных томографов, современных средств вычислительной
техники. Основное направление радионуклидной диагностики —
выявление нарушений перфузии миокарда различной этиологии.
На сцинтиграммах с 201Т1 это проявляется наличием «дефектов
перфузии» (холодный очаг) миокарда. Являясь биологическим
аналогом ионов калия, 20 TI активно аккумулируется только
здоровыми кардиомиоцитами.
Другим важным направлением является использование ра-
дионуклидной вентрикулографии, которая проводится в основном
с помощью меченных технецием ("Тс) эритроцитов или альбу--
мина сыворотки человека. Методики радионуклидной вентрику-
лографии (в том числе плоскостная томовентрикулография),
особенно выполняемые в комплексе с нагрузочными пробами,
позволяют получать количественные характеристики общей и ре-
гиональной сократительной функции левого желудочка, выявлять
локальные зоны асинергии, диагностировать инфрадиафрагмаль-
ную форму тотального аномального дренажа легочных вен.
У больных с ВПС может быть использована радионуклид-
ная сцинтиграфия легких, которая позволяет определить степень
легочной гипертензии, выявить структурные изменения в легоч-
ных сосудах. Сканирование печени и почек проводится больным
при подозрении на самостоятельное заболевание.
ЛАБОРАТОРНЫЕ ИССЛЕДОВАНИЯ
Общий анализ крови с подсчетом эритроцитов, оп-
ределением гемоглобина и цветового показателя — необходимый
элемент диагностического обследования. Так, например, у боль-
ных с ВПС синего типа увеличение содержания гемоглобина
и эритроцитов отражает компенсацию артериальной гипоксемии;
выраженная полицитемия способствует повышению вязкости кро-
ви, тромбозу и эмболии, повышенной кровоточивости. Релятив-
ная (относительная) анемия у детей первых лет жизни с ВПС
синего тона является причиной одышечно-цианотических присту-
пов и поздней диагностики ВПС в силу невыраженности цианоза.
При ВПС синего типа с выраженной полицитемией, а также
46
при сердечной недостаточности ПБ-П1 стадии, несмотря на ин-
фекционное заболевание, показатели СОЭ могут быть нормаль-
ными,.
В диагностике бактериального эндокардита у больных с ВПС
могут\быть использованы следующие тесты: функциональная
активность циркулирующих гранулоцитов, активность щелочной
фосфатазы (значительно повышается в острой фазе гнойно-
септического процесса), миелопероксидазная активность нейтро-
филов и содержание в них катионных белков (снижается при
тяжелом септическом процессе), положительный НСТ-тест, опре-
деление общего белка и его фракций.
Кислотно - основное состояние (КОС) — это оп-
ределенное соотношение водородных (Н4) и гидроксильных
(ОН ) ионов во внутренней среде организма, в первую очередь
в крови. Первичные расстройства кислотно-основного состояния
могут происходить как в сторону дыхательного, так и метаболи-
ческого компонентов. При этом различают ацидоз (дыхательный,
метаболический), который характеризуется абсолютным или от-
носительным преобладанием кислот, и алкалоз (дыхательный,
метаболический) — сдвиг КОС в сторону абсолютного или отно-
сительного преобладания оснований. Ацидоз и алкалоз могут
быть компенсированными, субкомпенсированными и декомпен-
сированными. Если pH крови удерживается в пределах нормы,
то нарушение КОС считается компенсированным. При субком-
пенсированной форме pH достигает крайних значений нормы,
при декомпенсированной — выходит за пределы нормальных гра-
ниц.
Метаболический ацидоз (ВЕ<— 2,5 ммоль/л) развивается
при накоплении в организме кислых продуктов, образующихся
в процессе обмена веществ или при избыточном выведении
из организма оснований. У детей с заболеваниями сердечно-
сосудистой системы метаболический ацидоз отмечается при
недостаточности кровообращения, цианозе и компенсируется
усилением дыхательного алкалоза (гипервентиляция).
Метаболический алкалоз возникает вследствие отрицательного
баланса водородных ионов, при этом образуется избыток осно-
ваний (BE > +2,5 ммоль/л). У детей с заболеваниями сердечно-
сосудистой системы причинами метаболического алкалоза могут
быть: недостаток калия (в том числе в результате приема
диуретиков, кортикостероидных препаратов), частые рвоты, со-
провождающиеся большими потерями соляной кислоты и калия,
длительный прием салицилатов, избыточное поступление ще-
лочных растворов при инфузии или с пищей. Метаболический
алкалоз частично компенсируется дыхательным ацидозом.
Дыхательный ацидоз возникает при положительном балансе
водородных ионов, вызванном недостаточностью легочной венти-
ляции для выведения угольной кислоты (Рсо2>40 мм рт. ст.).
Дыхательный ацидоз возникает у больных в послеоперационном
периоде при сопутствующей дыхательной недостаточности, на-
47
рушениях мозгового кровообращения; компенсация дыхательного
ацидоза происходит за счет метаболического компонента. /
Дыхательный алкалоз развивается вследствие легочной ги-
первентиляции, приводящей к отрицательному балансу/водо-
родных ионов относительно продукции угольной кислоты (Рсо2 <
<30 мм рт. ст.), отмечается у больных при искусственной
вентиляции легких, сопутствует нейротоксическому сийдрому,
аортальным порокам и ВПС с праволевым шунтом, частично
компенсируется метаболическими механизмами. /
Исследование свертывающей системы /крови
и фибринолиза имеет большое клиническое значение
у больных с ВПС синего типа. Для определения общей коа-
гулянтной активности используют показатели времени свертыва-
емости крови по Ли—Уайту, Бюркеру и др. (в норме 8—10 мин);
времени рекальцификации плазмы (в норме 80 — 120 с); теста
толерантности плазмы к гепарину (в норме 120—180 с); про-
тромбинового индекса (в норме 85—100 %); содержания фибри-
ногена плазмы (в норме 2—4 г/л); оценивается ферментативная
и неферментативная фибринолитическая активность плазмы и др.
В большинстве случаев нарушение равновесия в сторону гипер-
коагуляции связано с ослаблением фибринолиза. В условиях
хронической гипоксии у больных, страдающих застойной сердеч-
ной недостаточностью или ВПС синего типа, обнаружено сниже-
ние фибринолитической активности, связанное с истощением
активатора плазминогена в клетке эндотелия, что предраспола-
гает к возникновению тромботических осложнений. У детей с
ВПС синего типа нередко наблюдаются гипофибриногенемия,
нарушение образования протромбина, дефицит VIII фактора свер-
тывания крови.
В обследовании больных с ВПС все шире используются
иммунологические методы, дающие представление
об устойчивости к инфекциям и постоянстве антигенного гомео-
стаза. Иммунологическая недостаточность, как правило, выявля-
ется на уровне Т- и В-лимфоцитов, продукции иммуноглобули-
нов, отдельных субпопуляций лимфоцитов, макрофагов, лимфо-
кинов, отражающих состояние в основном неспецифической за-
щитной реакции организма. В то же время при заболеваниях,
вызванных определенным возбудителем (стафилококк, стрепто-
кокк и др.), имеет значение состояние специфической иммуноло
гической защиты (например, уровень стафилококкового анти
токсина). В целом оценка иммунной реакции организма должна
быть интегральной, при этом большее значение имеет не абсо-
лютная величина того или иного показателя, а соотношение,
сбалансированность всех факторов, динамика показателей. Изу-
чение иммунного статуса требуется не только до операции, но и
после нее, так как иммунная система резко реагирует на
стресс, каким является оперативное вмешательство.
У всех больных с ВПС и сердечной недостаточностью, уве-
личенными размерами печени желательно определять HBS-
48
антиген для исключения скрыто протекающего гепатита. При
наличии хронических очагов инфекции необходимо иметь сведе-
ния О титре стрептококковых антител. При подозрении на врож-
денную краснуху у детей первых месяцев жизни определяется
уровень антител к вирусу краснухи, в более позднем возрасте
результаты, как правило, отрицательные.
Цитогенетические исследования показаны при
подозрении на известный хромосомный синдром, а также детям
с множественными пороками развития и/или умственной от-
сталостью.
В анализах мочи у больных с ВПС могут быть раз-
личные изменения (протеинурия, лейко- и эритроцитурия), свя-
занные с хронической гипоксией, нарушением гемодинамики,
сопутствующими врожденными пороками развития почек и пие-
лонефритом; для исключения последних показаны ультразвуко-
вое исследование и урография.
Глава 3. ОТКРЫТЫЙ АРТЕРИАЛЬНЫЙ ПРОТОК
Открытый артериальный проток (dustus arteriosus, боталлов
проток) — сосуд, соединяющий аорту и легочную артерию, «со-
хранивший нормальную для плода структуру после истечения
срока его закрытия» [Bankl G., 1980]. Порок описан Галеном
во II веке, но первое сообщение принадлежит G. Aranzio (1564).
Название дано в честь итальянского врача Л. Боталло, описав-
шего порок немного позже.
Открытый артериальный проток (ОАП) является одним из
наиболее распространенных пороков: по клиническим данным
частота его составляет 10—18 % от всех ВПС, по патологоанато-
мическим данным — 3 % от всех ВПС, среди популяции —
0,3 % [Bankle G., 1980]. Частота ОАП у недоношенных ново-
рожденных составляет 15—80 %; при массе менее 1000 г макси-
мальная частота 80 %, при 1500—2000 г— 10—15 % [Si-
kes С., 1986]
Анатомия. ОАП располагается в верхнем отделе переднего
средостения и прикрыт листком париетальной плевры. Проток
отходит от аорты на уровне левой подключичной артерии и в
большинстве случаев впадает в ствол легочной артерии в месте
его деления на две ветви или в начальную часть левой ветви;
реже встречается право- или двусторонний проток. Он может
быть изолированным или в 5—10 % сочетаться с другими ВПС
(ДМЖП, коарктация аорты, ДМПП, недостаточность митраль-
ного клапана), нередко проток выполняет функцию компенси-
рующего сообщения при так называемых «дуктусзависимых поро-
ках» (атрезия легочной артерии, крайняя форма тетрады Фалло,
атрезия аорты и др.), при которых если ОАП закрывается,
жизнь во внеутробном периоде становится невозможной. ОАП
имеют в течение нескольких месяцев жизни 50 % детей, рож-
денных с массой менее 1700 г; у 20 % он остается незакрытым
4 Зак. .V? 97 В
49
в течение 1—2 лет. Практически не закрывается проток у ново-
рожденных с синдромом острых дыхательных расстройств (фун-
кционирует в 80 % случаев), что значительно утяжеляет течение
основного заболевания и иногда заставляет прибегать к срочно-
му хирургическому вмешательству. Проток может быть длинным,
узким и извилистым или коротким и широким, диаметр его
составляет от 2—3 до 30 мм, чаще 3—15 мм, длина 3—25 мм.
Систолодиастолический шум слышен, если диаметр протока
превышает 4 мм. В зависимости от формы протока существуют
различные анатомические типы порока: цилиндрический, во-
ронкообразный, окончатый, аневризматический. При длитель-
ном существовании протока может возникать его кальциноз
с переходом на аорту. На аутопсии в 15 % случаев обнаружива-
ют сопутствующие пороки развития внутренних органов (же-
лудочно-кишечного тракта, мочеполовой системы и др.).
Гемодинамика (рис. 4). В период внутриутробного развития
основное количество крови у плода из правого желудочка (4) и
легочного ствола поступает через артериальный проток в аорту
После рождения, с первым вдохом легочное сопротивление па-
дает и поднимается давление в аорте, что способствует воз-
никновению обратного сброса (из аорты в легочную арте-
рию). Высокое насыщение крови кислородом после включения
легочного дыхания вызывает спазм протока; шум исчезает в
течение 15—20 ч (функциональное закрытие); у недоношенных
детей боталлов проток остается открытым более длительно
из-за снижения чувствительности к кислороду констрикторного
рефлекса. Окончательная облитерация и превращение протока
в ligamentum arteriosum происходит в период от 2-й до 10-й не-
дели внеутробной жизни. Артериальный проток считается ано-
малией, если по клиническим данным он функционирует спустя
1—2 нед после рождения. Закрытие протока начинается в месте
его отхождения от легочной артерии, где имеется большое
количество гладкомышечных клеток. Возможно, что незакрытие
артериального протока связано, с дефицитом или недоразвитием
гладкомышечных клеток или эластических волокон в его стенке.
Увеличенное насыщение крови кислородом является главным
стимулом для сокращения гладкомышечных клеток. Выделяю-
щиеся при этом брадикинин и ацетилхолин способствуют со-
кращению протока, тогда как простагландин Е поддерживает
его в состоянии дилатации. В тех случаях, когда проток не
закрывается, эластическая ткань стенки замещается мышечной.
При ОАП (9) происходит сброс оксигенированной крови из
аорты (2) в легочную артерию (1), поэтому это порок бледного ти-
па. Сброс из аорты происходит и во время систолы, и в период
диастолы, так как в обе эти фазы давление в аорте превышает
таковое в легочной артерии. У детей первых месяцев жизни часто
отсутствует диастолический градиент давления между аортой и
легочной артерией, поэтому сброс происходит только в систолу.
Отсутствие в первые недели жизни большой разницы в давле-
50
Рис. 4. Схема открытого артериаль-
ного протока.
нии между малым и большим
кругами кровообращения при-
водит к тому, что при крике,
ОРВИ или пневмонии возника-
ет обратный (веноартериаль-
ный) сброс крови через ОАП,
появляется цианоз [Бураков-
ский В. И., Константинов Б. А.,
1970]. Клинически тяжесть те-
чения порока определяется сле-
дующими факторами: 1) раз-
мерами протока; 2) углом от-
хождения его (более благо-
приятно, если он отходит от
аорты под острым углом, ху-
же — если под тупым, поскольку это способствует большему
сбросу); 3) величиной общелегочного сопротивления. При боль-
шом протоке значительное количество крови поступает в легочную
артерию, затем в левые отделы (3, 5), вызывая их объемную пере-
грузку. Кроме того, давление в аорте передается непосредственно
через проток в легочную артерию, что способствует раннему
развитию легочной гипертензии. В таких случаях, если сопро-
тивление в малом круге кровообращения будет превышать тако-
вое в большом, возникает обратный веноартериальный сброс и
появляется цианоз. Гемодинамические нарушения при артериаль-
ном протоке обусловливают расширение преимущественно левых
отделов сердца, но при развитии легочной гипертензии, особенно
в ее склеротической стадии, преобладает дилатация и гипертро-
фия правого желудочка.
Клиника, диагностика. ОАП чаще встречается у девочек, чем
у мальчиков (2—3:1), что свидетельствует о его мультифактори-
альном наследовании. Описаны семейные случаи порока. При
сборе анамнеза следует обратить внимание на заболевание
матери краснухой (см. главу 1) во время беременности, не-
доношенность, повторные пневмонии. Течение порока может быть
различным: от бессимптомного до появления крайне тяжелых
форм. При больших размерах протока (относительно диаметра
аорты) он проявляет себя уже с первых дней и месяцев жизни.
Клиническая картина включает признаки сердечной недоста-
точности (одышка, тахикардия, гепатоспленомегалия), отставание
в физическом и моторном развитии (см. главу 2), снижение
толерантности к физической нагрузке (при кормлении, ходьбе,
беге). При небольших и средних размерах протока течение
порока длительно может быть бессимптомным. Подростки и
взрослые больные с ОАП часто не отстают от сверстников
в физическом развитии. Ухудшение возникает в пубертатный
51
период или позже (после родов, значительных физических пере-
грузок на работе, в спорте). Постепенно увеличиваются размеры
сердца, появляется цианоз вначале при нагрузке, затем в
покое (признак веноартериального сброса и высокой легоч-
ной гипертензии), медленно развивается сердечная недоста-
точность.
Крайне тяжелое течение порока типично для недоношенных.
Дети с фетальным возрастом до 30 нед имеют небольшое со-
противление в легочных сосудах и поэтому сброс бывает значи-
тельным. ОАП у них не сокращается и долго сохраняет большие
размеры. Изучение мозгового кровотока у новорожденных с
широким ОАП показало его замедление, что способствует ги-
поксии ЦНС.
Со стороны сердечно-сосудистой системы при боталловом про-
токе с кардиомегалией рано развивается парастернальный серде-
чный горб. Верхушечный толчок приподнимающийся, разлитой,
смещен книзу. При пальпации определяется дрожание у основа-
ния сердца слева: оно отсутствует или исчезает у больных с
небольшим протоком или при развитии высокой легочной гипер-
тензии. Сразу после рождения ребенка шум отсутствует. К концу
первой недели жизни появляется систолический шум, так как
разница в давлении между большим и малым кругами крово-
обращения в этот период небольшая, и перекрестный сброс
происходит только в период систолы. В дальнейшем шум стано-
вится типичным систолодиастолическим (шум «мельничного ко-
леса», «машинный шум») и лучше выслушивается во втором
межреберье слева у грудины и на спине. Иногда у детей
первых месяцев жизни он определяется ниже, в третьем-четвер-
том межреберье, и тогда он трудно отличим от дефекта меж-
желудочковой перегородки и аортолегочного свища. При тяже-
лом течении ОАП у новорожденных систолодиастолический
шум может появиться только после назначения сердечных
гликозидов. У взрослых больных интенсивность шума меньше.
Над верхушкой сердца может выслушиваться шум недостаточно-
сти митрального клапана (митрализация порока, свидетельствую-
щая о дилатации левого желудочка), тогда как мезодиастоличес-
кий шум определяется редко даже при большом левоправом сбро-
се. II тон над легочной артерией усилен, может быть расщеплен
или заглушен шумом. Следует помнить, что при повышении дав-
ления в системе легочной артерии диастолический компонент
шума уменьшается, а затем вовсе исчезает. В таких случаях
аускультативная картина ОАП состоит из короткого систоли-
ческого шума во втором межреберье слева у грудины и резкого
акцента II тона над легочной артерией. В дальнейшем при
выравнивании систолического и диастолического давлений в аорте
и легочной артерии может исчезнуть и систолический шум.
В это время появляется цианоз, вначале только при физиче-
ской нагрузке, а затем постоянный. Цианоз в большей мере
выражен на нижних конечностях, чем на лице и верхних конеч-
52
ностях. Все это свидетельствует о высокой легочной гипертензии
и невозможности оперативной коррекции порока.
Для ОАП характерен высокий, быстрый пульс. При этом
определяется нормальное или несколько повышенное систоли
ческое и низкое диастолическое (до 30—40 мм рт. ст.) АД
вплоть до появления феномена нулевого диастолического давле-
ния, что приводит к увеличению пульсового давления. Послед-
нее не изменено при небольших размерах протока, а также при
высокой легочной гипертензии. Определение пульса на бедренных
артериях, измерение АД на ногах является обязательным из-за
частого сочетания открытого артериального протока с коаркта-
цией аорты.
Признаком большого левоправого сброса через проток явля-
ется сердечная недостаточность, как правило, смешанного ха-
рактера (лево- и правожелудочковая): стойкая тахикардия, та-
хипноэ, увеличение печени и селезенки. Следует подчеркнуть,
что спленомегалия у детей первых месяцев и лет жизни при
сердечной недостаточности встречается часто и не обязательно
является признаком другой патологии, например сепсиса. По-
явление сердечной недостаточности у взрослых больных с
боталловым протоком — прогностически неблагоприятный при-
знак.
Осмотр и аускультация больных с ОАП требуют внимания
также и потому, что он нередко сочетается с другими ВПС
бледного типа или маскируют пороки с цианозом (например,
в случаях резкого стеноза или атрезии легочной артерии). При
сочетании боталлова протока с дефектом межжелудочковой пере-
городки дополнительно прослушивается грубый систолический
шум в третьем — четвертом межреберье слева у грудины; при вы-
соких дефектах систолический шум может перекрывать систо-
лодиастолический шум боталлова протока (особенно при не-
больших его размерах). Более затруднено выявление двух по-
роков при больших их размерах и легочной гипертензии,
которая изменяет аускультативную картину обоих ВПС. В та-
ких случаях выслушивается только средней интенсивности систо-
лический шум и в диагностике решающее значение имеют доп-
плер-эхокардиография и рентгенохирургическое обследование.
Заподозрить наличие коарктации аорты помогает снижение
или отсутствие пульсации и АД на бедренных артериях, высокое
АД на руках, грубый систолический шум на основании сердца
и спине. При предуктальной коарктации аорты может наблю-
даться симптом «дифференцированного цианоза» — наличие его
на нижних конечностях и отсутствие на верхних. Подтвердить
стеноз аорты при ОАП помогают систолическое дрожание и
самостоятельный грубый систолический шум во втором межре-
берье справа у грудины, эхокардиография. ОАП нередко являет-
ся причиной относительно благоприятного течения выраженного
стеноза легочной артерии, восполняя сниженный легочный кро-
воток; заподозрить компенсирующее значение протока позволяют
53
данные рентгенографии и ЭКГ, когда ведущим является увели-
чение правого желудочка, тогда как при изолированном ОАП
увеличивается левый желудочек. У больных с синдромом врож-
денной краснухи боталлов проток может сочетаться с перифери-
ческим стенозом легочной артерии. Необходимо помнить о воз-
можности сочетания ОАП с недостаточностью митрального кла-
пана разного генеза. При больших размерах протока появление
шума недостаточности митрального клапана связано с дилатаци-
ей полости левого желудочка и кольца митрального клапана;
в таких случаях после операции устранения протока этот шум
уменьшается, а затем и вовсе исчезает. В случаях врожденной
недостаточности митрального клапана систолический шум на
верхушке и дилатация левых отделов сердца сохраняются, в
дальнейшем может потребоваться пластика створок митрального
клапана. Редко, но возможно при этом развитие фиброэластоза
эндокарда, для подтверждения этого показана биопсия сердца
(см. главу 2); подтвердить дефект створок митрального клапана
помогает эхокардиография.
Одним из возможных осложнений при ОАП является бак-
териальный эндокардит, точнее эндартериит, который встречает-
ся с частотой 3,3 случая на 1000 больных, чаще при небольших
размерах протока. Вегетации находят в просвете протока со
стороны легочной артерии, поэтому возможна эмболия в нее.
Клиника бактериального боталлита включает подъем температу-
ры, нередко с ознобом, ухудшение общего состояния и появление
признаков интоксикации, болей в сердце, возможны проявления
тромбоэмболического синдрома в большом круге кровообраще-
ния (при распространении процесса на митральный и аорталь-
ный клапаны). Как правило, имеются ярко выраженные лабора-
торные показатели. Входными воротами инфекции являются
полость рта (заболевание зубов, их удаление, ангины), отиты,
гайморит. Возможны латентные формы эндартериита.
Другим осложнением могут быть развитие аневризмы протока
и ее разрыв. В одних случаях это связано с особенностями
анатомического строения, в других — с легочной гипертензией
или бактериальным эндартериитом (тогда аневризма является
микотической, т. е. септической, по происхождению); в редких
случаях аневризма протока — составная часть синдрома Марфа-
на, тогда расслоение стенки артериального протока происходит
вследствие повышенного содержания гликозамингликанов.
У взрослых с ОАП может развиться аневризма легочной ар-
терии.
Нормальная ЭКГ регистрируется у '/з больных с ОАП.
Электрическая ось сердца чаще расположена нормально, реже
отклонена вправо (при высокой легочной гипертензии) или вле-
во. На ЭКГ ведущими являются признаки гипертрофии миокарда
левого желудочка (рис. 5). Увеличение левого предсердия
встречается в 5—10% случаев. По мере увеличения сброса и
повышения давления в легочной артерии появляются, а затем
54
Рис. 5. ЭКГ и ФКГ при открытом артериальном протоке без легочной гипер-
тензии.
могут стать ведущими признаками гипертрофии миокарда право-
го желудочка. При большом сбросе зубцы Т в левых грудных
отведениях могут быть отрицательными и интервал ST смещен
вниз — признак перегрузки миокарда левого желудочка («stra-
in»); реже зубцы 7v5.6 высокие, пикообразные. При интерпрета-
ции ЭКГ недоношенных детей следует учитывать гестационный
и хронологический возраст ребенка, так как у них больше выра-
жены признаки перегрузки левого желудочка, чем у доношенных
детей. У взрослых больных с ОАП может появиться мерца-
тельная аритмия (при дилатации полости левого предсердия).
При ОАП на ФКГ во втором-третьем межреберье слева часто
фиксируется «классический» шум (см. рис. 5): сразу или через
небольшой промежуток от I тона определяется систолический
шум, нарастающий ко II тону, перекрывающий его и постепенно
убывающий в диастоле. Над верхушкой сердца у */з детей с
большим сбросом через проток регистрируется ромбовидной фор-
мы голосистолический шум средней амплитуды. При повышении
давления в легочной артерии на ФКГ полностью исчезает диа-
столическая часть шума, нет раздвоения II тона, который вы-
глядит единым и резко увеличенным, может появиться диасто-
лический шум над легочной артерией (шум Грехема—Стилла),
систолический тон изгнания, который фиксируется в начале си-
столы и является следствием удара струи крови о стенку расши-
ренной и уплотненной легочной артерии [Кассирский Г. И.,
1982].
При ОАП на рентгенограмме отмечаются усиление легочного
рисунка, соответствующее величине артериовенозного сброса,
55
расширение или выбухание ствола легочной артерии с увеличе-
нием диаметра лобарных и сегментарных сосудов легкого, увели-
чение тени сердца от незначительного до резкого (кардиотора-
кальный индекс составляет 55—60 %) за счет вначале левого,
а затем обоих желудочков и левого предсердия. С возрастом
отмечается расширение восходящей аорты. При отсутствии лего-
чной гипертензии изменения на рентгенограмме могут отсутство-
вать. Признаками легочной гипертензии является так называе-
мый «обрубленный» (ослабление его на периферии) или асим-
метричный легочный рисунок в сочетании с выбуханием дуги
легочной артерии. Если легочная гипертензия при этом носит
«сбросовый» характер, объем сердца увеличен значительно; при
высоком общелегочном сопротивлении из-за развития склеро-
тических изменений в легочных сосудах и снижения сброса
объем сердца уменьшается [Голонзко Р. Р., 1975]. У взрослых
больных на рентгенограмме бывает видна кальцификация
протока.
Специфических признаков ОАП на эхокардиограмме нет,
поэтому используются косвенные. Так, характерно увеличение
полости левого желудочка и изменение отношения размера лево-
го предсердия к диаметру аорты. В норме размер левого пред-
сердия равен диаметру аорты или несколько меньше его. При
ОАП отношение этих параметров может составить 1,2 и более.
Как проявление объемной перегрузки левого желудочка отмечено
увеличение скорости движения передней створки митрального
клапана в период диастолы. С. В. Савельев и соавт. (1988) пи-
шут о возможности диагностики ОАП с помощью двухмерной
и допплер-эхокардиографии. У новорожденных ОАП может быть
диагностирован при помощи контрастной эхокардиографии: при
введении контраста в пупочную артерию видно поступление
его из аорты в легочную артерию.
Как правило, диагноз открытого артериального (боталлова)
протока можно с уверенностью поставить по клиническим симп-
томам, и только в сомнительных случаях следует прибегать к
рентгенохирургическому обследованию. При зондировании пра-
вых отделов сердца косвенным признаком порока может быть
повышение насыщения крови кислородом на уровне легочной
артерии, увеличение давления в ней. Наиболее достоверным
является проведение катетера из легочной артерии в аорту,
когда он описывает своеобразную кривую в виде греческой
буквы «ф» (рис. 6, б). Во время удаления катетера регистри-
руется кривая аортального, затем легочного давления. При
аортографии виден сброс контрастированной крови из аорты в
легочную артерию (рис. 6, а) и можно оценить размеры протока.
Для диагностики ОАП высокоинформативной является дигиталь-
ная субтракционная ангиография, которая менее травматична и
может быть выполнена в амбулаторных условиях (см. главу 2).
В случаях высокой легочной гипертензии при катетеризации
сердца выявляют систолическое давление в легочной артерии,
56
Рис. 6. Аортограмма при открытом артериальном протоке.
а — контрастное вещество из аорт^ через артериальный проток (указан стрелкой)
поступает в легочный ствол; б — типичное положение катетера при введении его через
открытый артериальный проток: катетер через правое предсердие, правый желудочек
и легочный ствол, через артериальный проток проведен в нисходящие отделы аорты.
равное или превышающее давление в аорте, констатируют пе-
рекрестный сброс крови или сброс крови справа налево.
Дифференциальный диагноз боталлова протока следует про-
водить с функциональным систолодиастолическим шумом «волч-
ка» на сосудах шеи, вызывающим особые трудности в распозна-
вании порока при локализации слева; в таких случаях интенсив-
ность функционального шума меняется при перемене положения
тела и при дыхании. Иногда возникают трудности при диф-
ференциации с дефектом межжелудочковой перегородки с аор-
тальной недостаточностью, легочными артериовенозными свища-
ми, дефектом аортолегочной перегородки, разрывом аневризмы
синуса Вальсальвы, коронарной фистулы с легочным стволом
или выводным отделом правого желудочка.
Течение, лечение. Представляют интерес данные о естествен-
ном течении ОАП. У взрослых порок встречается реже, чем у
детей, что связано с оперативным и самопроизвольным закры-
тием протока (ежегодно спонтанно закрывается 0,6 % ОАП),
летальностью в первые годы жизни при тяжелом течении. Сред-
няя продолжительность жизни больных с ОАП составляет
39 лет: к 30 годам умирает 20 % больных, к 45 годам — 42 %,
к 60 годам — 60 %. Описаны единичные случаи, когда больные
доживали до 70—79 лет (диаметр протока у них не превышал
3 мм). Больные, которым проводилось хирургическое закрытие
порока, имеют большую продолжительность жизни и лучшие по-
казатели гемодинамики. Следовательно, ОАП даже небольших
размеров ведет к преждевременной смерти, что связано со
снижением компенсаторных возможностей миокарда и сосудов
малого круга кровообращения, присоединением различных
осложнений (пневмония, легочная гипертензия, бактериальный
эндартериит, сердечная недостаточность, разрыв аневризмы
и др.) чаще в возрасте после 40 лет.
Показаниями к хирургическому лечению
порока в раннем возрасте являются сердечная недостаточность,
не купирующаяся медикаментозно, гипотрофия, прогрессирую-
щая легочная гипертензия, рецидивирующие пневмонии. У детей
старше 6—12 мес установление диагноза ОАП — показание к
операции. У взрослых больных возраст не должен служить про-
тивопоказанием к хирургическому лечению, хотя у них оно со-
пряжено с большим риском и технически сложнее (проток
часто истончен, инфицирован, склерозирован).
В случаях тяжелого течения ОАП показано назначение ди-
гоксина, мочегонных препаратов (см. главу 22). У недоношенных
детей незакрытию протока способствуют недоразвитие мышечно-
го слоя в легочной артерии, снижение чувствительности к кисло-
роду, гипоксия (анемия, ацидоз), требующая коррекции, а также
незрелая констрикторная реакция со стороны ОАП. Общее коли-
чество вводимой жидкости таким детям не должно превышать
70—100 мш/(кг-сут). Показано переливание крови для под-
держания уровня гемоглобина не менее 120 г/л, гематокрита —
58
40—45 %. Оксигенотерапия способствует поддержанию РО2 от
60 до 85 %; более низкое насыщение крови кислородом препят-
ствует закрытию протока, более высокое способствует развитию
ретролентальной фиброплазии.
В последние годы появилось много работ о закрытии ОАП
у новорожденных детей с помощью индометацина, который
является ингибитором простагландинов Е2 и 12, способствует
спазму протока с последующей его облитерацией. Индометацин
назначают в дозе 0,1 мг/кг 3—4 раза в день внутривенно.
Эффект тем лучше, чем меньше возраст ребенка (желательно
проводить лечение в первые 8—14 дней жизни). Иногда у детей
с низкой массой тела при рождении после применения индомета-
цина вновь отмечается функционирование ОАП. Это можно
объяснить различиями в продукции и клиренсе простагландинов
или в чувствительности протока к действию простагландинов у
детей с рецидивами и со стойкой констрикцией протока. Ослож-
нениями при лечении индометацином являются транзиторная ре-
нальная дисфункция, гипонатриемия, снижение агрегации тром-
боцитов, гастроинтестинальные и внутричерепные кровотечения.
Если у недоношенных, несмотря на проведенные медикаментоз-
ные вмешательства, ОАП протекает с сердечной недостаточ-
ностью [Sikes, 1986], показано хирургическое лечение.
В СССР первую операцию перевязки ОАП произвел в 1948 г.
академик АМН СССР А. Н. Бакулев Закрытие протока произ-
водится различными методами. Чаще проводят перевязку ОАП
2 3 шелковыми лигатурами, реже— пересечением с ушиванием
аортального и легочного концов. Особого внимания заслуживают
случаи, когда ОАП сочетается с легочной гипертензией. При
этом наблюдается высокая операционная и послеоперационная
летальность, а нередко и прогрессирование легочной гипертен-
зии в послеоперационном периоде, остановить которую не пред-
ставляется возможным. При легочной гипертензии в целях про-
филактики прорезывания лигатур или неполной перевязки про-
тока, ведущей к реканализации, применяют управляемую систе-
мную гипотензию (снижение АД до 80 мм рт. ст.). При наличии
двунаправленного сброса операция возможна только, если пре-
валирующим является левоправый сброс, а при пробном пере-
жатии протока происходит хотя бы незначительное снижение
давления в легочной артерии; летальность в этой группе больных
составляет 25 % [Королев Б. А. и др., 1975]. Вместе с тем благо-
приятный прогноз с точки зрения нормализации давления в
легочной артерии у этой группы больных сомнителен. Больным
со стойким праволевым сбросом на уровне протока оперативное
лечение не показано, так как проток в этих условиях гемоди-
намики выполняет роль разгрузочного клапана для правого
сердца.
Хирургическое лечение ОАП, сочетающегося с другими ВПС,
определяется размерами протока (т. е. долей его участия в нару-
шениях гемодинамики), вариантом и степенью тяжести сопут-
59
ствующего порока, а также квалификацией хирургов в кардио-
хирургической клинике. Коррекция пороков может быть выполне-
на одномоментно или двухэтапно. Не вызывает сомнений воз-
можность одновременной ликвидации ОАП и коарктации аорты,
выполняемой с использованием бокового левостороннего до-
ступа. Методом выбора коррекции ОАП, сочетающегося с аор-
тальным стенозом, ДМЖП, ДМПП или митральной недоста-
точностью, также является их одномоментное устранение. В тех
случаях, когда ведущим в нарушениях гемодинамики является
ОАП, а также у детей раннего возраста, у которых могут
иметься ограничения технических возможностей коррекции по-
роков, операция может быть выполнена в 2 этапа: первым этапом
производят закрытие протока, вторым коррекцию сопутствую-
щих ВПС (в определенные сроки при наличии показаний).
Бактериальный эндартериит не является противопоказанием
к хирургическому лечению, к тому же полное излечение от эндо-
кардита невозможно без закрытия протока. Перед операцией
необходимо провести 3—4-недельный курс консервативного ле-
чения. Длительная медикаментозная терапия при боталлите мо-
жет снизить активность процесса, но не вызвать полного из-
лечения; прогрессирование процесса ухудшает и послеопера-
ционный прогноз. Поэтому в таких случаях не рекомендуется
затягивать хирургическое лечение в надежде на эффективность
антибактериальной терапии.
Отдаленные результаты при хирургическом лечении ОАП в
большинстве случаев хорошие. Эффективность его определяется
выраженностью легочной гипертензии, которая зависит от исход-
ного состояния сосудов малого круга кровообращения, поэтому
оперативное вмешательство должно быть проведено как можно
раньше. Хирургическая летальность при ОАП небольшая.
В Горьковском межобластном кардиохирургическом центре
на 2500 операций по поводу ОАП у больных в возрасте от 3 мес
до 48 лет летальность составила 1,1 %, причем у лиц без легоч-
ной гипертензии летальных исходов не было, а при легочной ги-
пертензии I — III степени она составила 2.3 % [Королев Б. А.,
Романов Э. М., 1984]. Реканализация протока после операции,
как правило, связана с неполной его перевязкой либо ослабле-
нием лигатур в результате воздействия на них системной гипер-
тензии, нередко возникающей в послеоперационном периоде
после перевязки широких протоков.
Все больные I—II гемодинамических групп по величине ле-
гочной гипертензии (см. главу 1) после операции через 2—4 года
ведут обычный образ жизни, занимаются физкультурой без огра-
ничения. Изучение эволюции легочной гипертензии после опе-
рации у больных с ОАП II 1а гемодинамической группы показало
нормализацию гемодинамики и обратное развитие патологиче-
ского процесса в системе сосудов легочной артерии в тех случа-
ях, когда преобладал функциональный компонент гипертензии.
Сохранение повышенного давления в легочной артерии из-за
60
высокого общелегочного сопротивления или еще большее его
увеличение в отдаленные сроки после операции у больных III6
группы обусловлено необратимыми изменениями в легочных
сосудах, причем этот процесс прогрессирует, несмотря на устра-
нение порока. Через 3 6 лет у этих болных сохраняется от-
ставание в физическом развитии, снижение Толерантности к
нагрузкам. Обратное развитие электрокардиографических и рент-
генологических признаков гипертрофии и дилатации миокарда
желудочков происходит медленно, иногда в течение нескольких
лет. Если давление в легочной артерии и общелегочное сопротивле-
ние остаются повышенными, изменения на ЭКГ и рентгенограмме
в виде гипертрофии миокарда правого желудочка сохраняются,
несмотря на клиническое улучшение и положительные сдвиги
в гемодинамике. У больных II16 гемодинамической группы су-
щественых изменений гемодинамики и данных клинико-инстру-
ментальных методов исследования не наступает, что указывает
на неэффективность оперативного вмешательства [Махкамо-
ва М. Н., 1977].
Учитывая, что хирургическое лечение ОАП связано с торако-
томией, кровопотерей и эндотрахеальным наркозом, в настоящее
время все шире используется эндоваскулярная окклюзия, осно-
ванная на введении в сосуд через катетер различных материалов,
временно или постоянно обтурирующих просвет сосуда. В 1967 г.
W. Porstmann и соавт. впервые осуществили обтурацию ОАП с
помощью эндоваскулярной катетерной техники. В нашей стране
эндоваскулярная окклюзия протока по этой методике выполнена
в 1981 г. Ю. Ф. Неклассовым. А в 1988 г. С. В. Савельевым
предложена модификация метода эндоваскулярная окклюзия
чрескожным трансвенозным доступом без торакотомии, когда
производится закрытие ОАП боталлоокклюдером, состоящим из
пенистого полиуретана, армированного металлическим каркасом
с фиксаторами. Подобранный соответственно размерам протока
боталлоокклюдер устанавливается в нем через катетер, который
вводится в правые отделы сердца, легочную артерию, боталлов
проток бедренным трансвенозным доступом. Показаниями к про-
ведению эндоваскулярной окклюзии являются: наличие изоли-
рованного ОАП или комбинированных ВПС, при которых ботал-
лов проток требует дополнительного этапа хирургического вме-
шательства. Противопоказаниями к проведению этого метода
могут быть состояние гемодинамики (легочная гипертензия с
перекрестным сбросом крови или сбросом справа налево) и
особенности рентгеноанатомии порока: если наименьший диаметр
протока более 1 см, то использование катетера большого
диаметра (более 8 мм) повышает риск катетеризации из-за опас-
ности повреждения бедренной вены и клапанов сердца; если
наименьший диаметр протока менее 0,2 см; если соустье между
аортой и легочной артерией короткий проток нс позволяет
прочно фиксировать боталлоокклюдер, то существует опасность
миграции его в легочную артерию; если имеется аневризма про-
61
тока; если диагностирован септический боталлит. Отдаленные
результаты (в течение 1—5 лет) подтверждают эффективность
предложенного метода, если соблюдены показания и противо-
показания и он находится в руках опытного хирурга [Са-
вельев С. В., 1988].
Глава 4. ДЕФЕКТ АОРТОЛЕГОЧНОЙ ПЕРЕГОРОДКИ
Дефект аортолегочной перегородки представляет собой порок,
при котором имеется сообщение между прилегающими частями
восходящей аорты и стволом легочной артерии. Он относится
к редким ВПС. Синонимы: аортопульмональный или аортальный
септальный дефект, частичный артериальный ствол, аорто-
легочная фенестрация, свищ или окно и др. Порок впервые
описан J. Elliotson (1830). Частота порока по клиническим дан-
ным составляет 0,3 %, по результатам аутопсий — I % [Bankl Н.,
1980]. К 1983 г. в литературе описано около 260 случаев этого
ВПС.
Анатомия, классификация. Дефект аортолегочной перегород-
ки представляет собой округлое или овальное отверстие (типа
«окна»), чаще больших размеров (I 3 см), расположенное
внутриперикардиально между левой стороной восходящей аорты
и правой стенкой ствола легочной артерии кпереди от места
отхождения правой ее ветви. Нормально сформированные ле-
гочный и аортальный клапаны, выводные тракты обоих желу-
дочков отличают этот порок от общего артериального ствола.
Почти в половине случаев дефект аортолегочной перегородки
сочетается с другими ВПС: ОАП, ДМЖП, коарктацией аорты,
тетрадой Фалло, подклапанным мембранозным стенозом аорты,
идиопатическим гипертрофическим субаортальным стенозом, сте-
нозом правой легочной артерии, аномалией отхождения коронар-
ных артерий. При полном отсутствии аортолегочной перегородки
возникают трудности в дифференциальной диагностике со II ти-
пом общего артериального ствола. Главным отличием является
наличие двух фиброзных клапанных колец аорты и легочной
артерии, тогда как при общем артериальном стволе всегда
имеется лишь одно фиброзное кольцо, т. е. эти два ВПС имеют
разные механизмы развития. Локализация и выраженность гипер-
трофии миокарда зависят от величины дефекта и состояния сосу-
дов малого круга кровообращения; как правило, имеется гипер-
трофия миокарда обоих желудочков, при высокой легочной
гипертензии — больше правого.
В зависимости от степени резорбции артериальной перего-
родки и уровня локализации дифференцируют большое число
анатомических типов дефекта аортолегочной перегородки, что
является причиной множества различных классификаций.
В. И. Бураковский и соавт. (1987) предлагают выделять сле-
дующие пять типов дефекта аортолегочной перегородки (рис. 7):
62
Рис. 7. Анатомические типы дефектов аортолегочной перегородки. Объяснение
в тексте.
I тип — сообщение между восходящей аортой и легочным ство-
лом располагается в средней части аортолегочной перегородки
на достаточном расстоянии от синусов Вальсальвы; имеет про-
тяженность в виде протока с хорошо выраженными верхним
и нижним полюсами его. Правая и левая легочные артерии от-
ходят нормально и дистальнее верхнего края дефекта; II тип —
сообщение между заднемедиальной стенкой восходящей аорты и
легочным стволом имеет вид «окна», располагается в прокси-
мальной части аортолегочной перегородки сразу над уровнем
синусов Вальсальвы. Дистальная часть аортолегочной перего-
родки частично сформирована, магистральные сосуды разделены
перегородкой ближе к бифуркации легочного ствола. Правая и
левая легочные артерии отходят нормально и выше верхнего
края дефекта; III тип — сообщение между заднемедиальной стен-
63
кой восходящей аорты и легочным стволом имеет вид «окна»,
располагается в дистальной части аортолегочной перегородки на
достаточном расстоянии от синусов Вальсальвы, поскольку про-
ксимальная часть перегородки частично сформирована, дефект
доходит верхним краем до начальной части дуги аорты, при
этом правая и левая легочные артерии отходят в области верши-
ны дефекта; IV тип — сообщение имеет вид «окна» и распола-
гается в дистальной части аортолегочной перегородки между
заднемедиальной стенкой восходящей аорты и местом отхождения
правой легочной артерии от легочного ствола. Дефект захваты-
вает устье правой легочной артерии так, что восходящая аорта
сообщается непосредственно как с проксимальным отделом пра-
вой легочной артерии, так и с легочным стволом; V тип —
полностью отсутствует аортолегочная перегородка, имеется
лишь трункальная перегородка, разделяющая два анатомически
самостоятельных фиброзных кольца аорты и легочной артерии с
клапанным аппаратом, правая и левая легочные артерии берут
начало от задней поверхности общего магистрального сосуда,
отходящего от основания сердца.
Наиболее часто встречаются дефекты II анатомического ти-
па, которые многие авторы называют классическими дефектами
аортолегочной перегородки.
Гемодинамика. Выраженность гемодинамических нарушений
при дефекте аортолегочной перегородки определяется его разме-
ром, местом расположения, соотношением общелегочнаго и
общепериферического сопротивления, величиной и направлением
сброса крови. Во время систолы кровь из восходящей аорты
поступает под высоким давлением непосредственно в легочную
артерию, так как больших размеров дефект не оказывает сопро-
тивления току крови. При этом левоправый сброс, как и при
ОАП, происходит и в систолу, и в диастолу. Все это способ-
ствует очень раннему развитию высокой легочной гипертензии,
которая отсутствует лишь у больных с небольшими размерами
аортолегочного дефекта. Правый желудочек в отличие от левого
не подвергается перегрузке увеличенным объемом крови, по-
скольку сброс крови осуществляется на уровне магистральных
сосудов, т. е. дистальнее правого желудочка. Однако последний
нагнетает кровь в сосуд с высоким давлением, в силу чего имеет-
ся его систолическая перегрузка. Дилатация левого желудочка
отражает его работу в условиях диастолической перегрузки.
Гемодинамика при больших дефектах аортолегочной перего-
родки имеет ряд закономерностей, аналогичных другим ВПС
с левоправым сбросом. Сразу после рождения из-за небольшой
разницы в давлении между аортой и легочной артерией отме-
чается перекрестный или небольшой левоправый (артериовеноз-
ный) сброс. Постепенно давление в легочной артерии падает,
происходит физиологическая инволюция в строении легочных
сосудов с уменьшением общелегочного сопротивления, что спо-
собствует увеличению сброса в малый круг кровообращения.
64
Легочная гипертензия в этот период носит гиперкинетический
(«сбросовый») характер. Длительно существующий порок спо-
собствует склеротическим изменениям в легочных сосудах.
Когда сопротивление в малом круге становится равным таковому
в большом, появляется перекрестный, а затем праволевый (ве-
ноартериальный) сброс, приводящий к цианозу. Реальная угроза
такого осложнения при аортолегочных дефектах возникает чаще
в пубертатном периоде, однако описаны ранние (в первые ме-
сяцы жизни) и даже врожденные (отсутствие физиологической
инволюции в строении легочных артерий) случаи развития скле-
ротической формы легочной гипертензии. Многочисленные на-
блюдения показывают, что гиперволемическая и склеротическая
формы легочной гипертензии наблюдаются во всех возрастных
группах; это свидетельствует об отсутствии зависимости степени
нарушения гемодинамики от возраста больных.
Клиника, диагностика. У детей раннего возраста первым
симптомом порока является одышка по типу тахипноэ, затем
присоединяется отставание в физическом развитии, развитие
повторных пневмоний, которые не характерны для больных со
склеротической формой легочной гипертензии. Цианоз может
возникать у детей первых недель жизни, затем по мере сниже-
ния давления в легочной артерии он исчезает, и появление его
вновь свидетельствует уже о высокой степени легочной гипертен-
зии склеротического характера, что чаще встречается в старшем
возрасте и у взрослых. У 70 % больных определяется парастер-
нальный сердечный горб. Верхушечный толчок разлитой, смещен
вниз до шестого межреберья (увеличение левого желудочка).
Над областью сердца в третьем межреберье слева определяется
систолическое дрожание, которое отсутствует при высокой ле-
гочной гипертензии и небольших размерах дефекта. Границы
сердечной тупости расширены в обе стороны. При аускультации
шум может быть грубым систолическим (пансистолическим) с
небольшим диастолическим компонентом. Классический «машин-
ный» систолодиастолический шум при дефекте аортолегочной
перегородки встречается в 9—15 % случаев при небольших
размерах дефекта, максимальное звучание шума приходится на
второе—третье межреберье слева у грудины, т. е. несколько ни-
же, чем при открытом артериальном протоке. При большом
левоправом сбросе на верхушке определяется III тон и мезодиа-
столический шум (относительный стеноз митрального клапана).
В случаях высокой легочной гипертензии при небольшой разнице
давления между аортой и легочной артерией систолический шум
становится коротким, средней интенсивности, сочетается с выра-
женным акцентом И тона над легочной артерией; во втором
межреберье слева у грудины может выслушиваться диастоли-
ческий шум недостаточности клапанов легочной артерии (шум
Грехема—Стилла). У '/з больных с дефектом аортолегочной
перегородки обращает на себя внимание пульс «celer et altus»
с соответствующим АД (повышенным систолическим и понижен-
65
3—976
ным диастолическим); данный признак отсутствует у больных с
высоким общелегочным сопротивлением или небольшим артерио-
венозным сбросом. Частым симптомом является сердечная не-
достаточность, левожелудочковая или бивентрикулярная; при
высоком легочно-сосудистом сопротивлении преобладает право-
желудочковая недостаточность. Таким образом, при небольшом
дефекте этот порок напоминает по клинике ОАП, при большом —
большой дефект межжелудочковой перегородки.
На ЭКГ может не быть отклонений от нормы или имеются
признаки небольшой перегрузки (гипертрофии) миокарда левого
желудочка, электрическая ось сердца расположена нормально.
При легочной гипертензии в II 1а гемодинамической группе
(см. главу 1) регистрируются признаки перегрузки предсердий,
желудочков, возможны отрицательные зубцы Т в отведениях
V4 6 (перегрузка типа «strain»). При высокой легочной гипер-
тензии (II16 и IV гемодинамические группы) наблюдаются при-
знаки, идентичные при всех ВПС с праволевыми шунтами —
отклонение электрической оси сердца вправо, гипертрофия пре-
имущественно правого желудочка.
На ФКГ при небольших размерах дефекта во втором—треть-
ем межреберьях слева определяется систолодиастолический шум
(как при боталловом протоке); при умеренной легочной гипертен-
зии фиксируется систолический шум ромбовидной формы; II тон
над легочной артерией усилен, расщеплен. Расщепление II тона
помогает отличить дефект аортолегочной перегородки от ОАП,
при котором тон всегда единый. При выраженной легочной
гипертензии шум короткий или отсутствует, часто регистрируется
единый II тон, систолический тон изгнания (см. главу 2).
Рентгенологическое исследование при дефекте аортолегочной
перегородки более информативно для оценки степени нарушения
гемодинамики, чем для диагностики самого порока. Легочный
рисунок значительно усилен за счет переполнения артериального
русла, дуга легочной артерии часто выбухает. Тень сердца
умеренно увеличена больше влево у больных I—II гемодинами-
ческих групп и значительно возрастает в Ша—II16 группах.
Из функциональных признаков отмечается увеличение амплиту-
ды пульсации левого желудочка и расширенной восходящей
аорты. В косых проекциях видно, что сердце увеличено за счет
полости левого или обоих желудочков, левого предсердия; при
высокой легочной гипертензии преобладает увеличение правого
желудочка, легочная артерия аневризматически расширена,
легочный рисунок на периферии обеднен.
Дефект аортолегочной перегородки трудно диагностировать
с помощью эхокардиографии. Наиболее информативной явля-
ется высокая парастернальная проекция длинной оси (рис. 8),
позволяющая определить аортолегочную перегородку; а наличие
в ней перерыва соответствующей локализации может указывать
на анатомический тип порока.
Данные катетеризации полостей сердца при дефекте аорто-
66
Рис. 8. Эхокардиограмма при дефекте аортолегочной перегородки в проекции
длинной (а) и короткой (б) оси из левого высокого парастернального доступа
Стрелками обозначен дефект аортолегочной перегородки.
легочной перегородки аналогичны таковым при открытом арте-
риальном протоке (см. главу 3). Дифференциально-диагности-
ческое значение имеет проведение катетера из легочной артерии
в восходящую аорту (реже он приходит в дугу аорты, левую
или правую сонные артерии). Отличить дефект аортолегочной
перегородки от дефекта межжелудочковой перегородки помогает
запись давления: при выведении катетера из аорты регистри-
руются кривые давления в легочной артерии, а затем — в пра-
вом желудочке. При ретроградной катетеризации аорты катетер
удается провести в легочный ствол, а затем — в правый же-
лудочек, чего нельзя сделать при дефекте межжелудочковой
перегородки. При ангиокардиографии методом выбора следует
считать ретроградную аортографию, во время которой контраст-
ное вещество из восходящей аорты непосредственно посту-
пает в ствол легочной артерии над полулунными клапанами
аорты.
Дифференциальный диагноз порока следует проводить с
ДМЖП. ОАП, общим артериальным стволом, двойным отхож-
дением магистральных сосудов от правого желудочка, аномалией
Тауссиг Бинга. Значительную помощь при этом оказывают
эхокардиография и рентгенохирургическое обследование.
Течение, лечение. Учитывая возможность раннего развития
высокой легочной гипертензии и летального исхода при больших
размерах дефекта, кардиомегалии, гипотрофии, сердечной недо-
статочности, рецидивирующих пневмоний, хирургическое лечение
з* 67
показано больным в возрасте до 2 лет. В целом оно эффективно
у больных I —111а групп. По данным В. Gasul и соавт. (1966),
25—30 % больных с этим пороком погибают в течение первого
года жизни, около 15 % — в школьном возрасте, остальные
живут несколько больше. При естественном течении порока про-
должительность жизни больных с дефектом аортолегочной пере-
городки колеблется от нескольких месяцев до 52 лет [Goerttler К-,
1963]. Средняя продолжительность жизни, по данным Н. Meisner
и соавт. (1968), составляет 14 лет, что значительно меньше, чем
при боталловом протоке; это связано с большими размерами со-
общения при дефекте аортолегочной перегородки. Если больные
доживают до 20 —30 лет, они имеют выраженные признаки ле-
гочной гипертензии и цианоз. Случаев спонтанного закрытия
дефекта не описано.
Причинами смерти больных с дефектом аортолегочной пере-
городки являются сердечная недостаточность, разрыв аневризма-
тически расширенной легочной артерии в полость перикарда с
развитием тампонады сердца, тромбоэмболии, реже — бактери-
альный эндокардит.
Все методы коррекции дефекта аортолегочной перегородки
связаны с большими техническими трудностями. Существуют
закрытые и открытые хирургические методы устранения дефекта
аортолегочной перегородки. К закрытым методам относят: 1) пере-
вязку дефекта двумя шелковыми лигатурами (выполнима лишь
при дефектах I типа и отсутствии аномалий коронарных артерий);
2) рассечение дефекта между зажимами с последующим ушива-
нием его аортального и легочного концов.
В настоящее время отдается предпочтение устранению дефек-
тов на открытом сердце в условиях искусственного кровообраще-
ния и гипотермии трансаортальным доступом с использованием
синтетической заплаты. Летальность после коррекции больших
дефектов аортолегочной перегородки в условиях искусственного
кровообращения остается до настоящего времени высокой и колеб-
лется от 14,8 до 37,5 % [Бураковский В. И. и др., 1987].
При невозможности выполнения радикальной операции в
случаях легочной гипертензии прибегают к двухэтапному лечению:
I этап — сужение легочной артерии или легочного ствола,
II этап — радикальная операция с предварительным снятием су-
живающей манжетки.
Отдаленные результаты показывают, что у больных без легоч-
ной гипертензии оперативное вмешательство во всех случаях при-
водит к хорошим результатам. При наличии легочной гипертензии
исход и прогноз после операции определяются состоянием сосудис-
того русла легких. Нормализация или значительное улучшение
внутрилегочной гемодинамики (снижение давления в легочной ар-
терии на 50 % и более от системного уровня, уменьшение
общелегочного сопротивления) наступают у больных с общелегоч-
ным сопротивлением, не превышающим 10 ед. (основная причина
гипертензии — спазм сосудов). Уровень общелегочного сопротив-
68
ления более 10 ед. обычно связан со склеротическими изменениями
в сосудах, поэтому после операции полной нормализации гемоди-
намических показателей не происходит. При удлинении сроков
наблюдения за больными не отмечается нормализации давления
в легочной артерии у тех, у кого оно осталось повышенным
непосредственно после операции, т. е. основные изменения внутри-
легочной гемодинамики происходят сразу после закрытия де-
фекта. У больных 1П6 гемодинамической группы результаты опе-
ративного лечения неудовлетворительные.
Глава 5. ПОРОКИ РАЗВИТИЯ МЕЖПРЕДСЕРДНОЙ
ПЕРЕГОРОДКИ И АНОМАЛИИ ВПАДЕНИЯ ЛЕГОЧНЫХ ВЕН
ДЕФЕКТ МЕЖПРЕДСЕРДНОЙ ПЕРЕГОРОДКИ
Дефект межпредсердной перегородки (ДМПП) —сообщение
между двумя предсердиями — является результатом ненормально-
го развития первичной и вторичной межпредсердных перегородок и
эндокардиальных валиков. Это распространенный ВПС, частота его
по клиническим данным составляет 5- 15 %, по патологоанато-
мическим — 3,7 — Ю % всех ВПС [Bankl Н., 1980]. У детей стар-
шего возраста и взрослых порок встречается чаще, чем у детей
первых месяцев и лет жизни, у которых более распространены
тяжелые редкие грроки, приводящие к раннему летальному исхо-
ду. Поданным ИССХ им А. Н. Бакулева, у детей первых 3 лет жиз-
ни ДМПП имел место в 2,5 % случаев, старше 3 лет — в 11 %.
Анатомия, классификация. Н. Bankl (1980) предлагает сле-
дующую анатомическую классификацию ДМПП.
1. Дефект овальной ямки или центральный дефект (вторичный ДМПП) —
стенка межпредсердной перегородки полностью окружает дефект (около 66 %
всех случаев).
2. Дефект венозного синуса (дефект верхней полой вены, высокий дефект) —
обычно 2—3 см в диаметре, лежит непосредственно ниже устья верхней полой
вены и в стороне от овальной ямки (около 5 %). Верхней и часто задней границ
нет, дефекту обычно сопутствует частичный аномальный дренаж правых легочных
вей.
3. Дефект у нижней полой вены (около I %), расположен у основания
перегородки предсердия, так что нижний край перегородки нависает над отверсти-
ем нижней полой вены, которая сообщается больше с левым предсердием, дефект
обычно большой (2 -3 см); при отсутствии заднего края одна или несколько пра-
вых легочных вен могут дренироваться больше в правое предсердие, чем в левое, —
так называемый ложный аномальный дренаж легочных вен.
4. ДМПП в сочетании с левой верхней полой веной, впадающей в левое пред-
сердие (около 1 %), дефект располагается в том месте, где в норме имеется
коронарной синус.
5. Общее предсердие (около 1 %) — полное отсутствие межпредсердной пере-
городки или наличие только рудиментарных элементов ее, атриовентрикулярные
клапаны чаше расщеплены, реже сформированы нормально, межжелудочковая
перегородка интактна, нередко сочетается с аспленией.
6. Дефекты, захватывающие область атриовентрикулярного канала (около
26 %): а) первичный дефект (6%) в изолированном виде встречается крайне
редко, обычно сочетается с расщеплением атриовентрикулярных клапанов;
69
б) открытый общий атриовентрикулярный канал — около 26 % (см, главу 9); со-
четание первичного ДМПП с пороками атриовентрикулярных клапанов, что
связано с нх общим происхождением нз эндокардиальных валиков.
Частота встречаемости различных вариантов ДМПП меняется
с возрастом. Первичный ДМПП в виде открытого общего атрио-
вентрикулярного канала (см. главу 7) преобладает у детей ран-
него возраста, многие из них рано погибают. До старшего возра-
ста доживают дети со вторичным ДМПП. Нередко одновременно
имеется несколько вторичных дефектов или вторичный сочетается
с первичным. ДМПП может быть изолированным ВПС или состав-
ной частью таких пороков, как транспозиция магистральных
сосудов, аномальный дренаж легочных вен, болезнь Эбштейна,
синдромы гипоплазии правых и левых отделов и др. При вторичном
дефекте отмечается расширение легочной артерии, увеличение
полости правого предсердия и желудочка, левый желудочек —
нормальных размеров или уменьшен.
На аутопсии у детей с легочной патологией, различными ВПС
или без них, при сердечной недостаточности можно увидеть сохра-
нившимся открытое овальное окно. Последнее часто
носит компенсаторный характер, помогая в разгрузке правых от-
делов сердца. Важно помнить, что открытое овальное окно не сле-
дует причислять к разновидностям ДМПП. При истинном дефекте
перегородки имеется недостаточность ткани, при открытом оваль-
ном окне сообщение осуществляется благодаря клапану, который
открывается при особых обстоятельствах. Нарушений гемодина-
мики открытое овальное окно не вызывает, хирургическое лече-
ние не показано. Открытое овальное окно может быть причиной
парадоксальных эмболий (из правых отделов) в ЦНС при первич-
ной и вторичной легочной гипертензии, поражении трехстворчатого
клапана и др. Иногда возникает преждевременное закрытие оваль-
ного окна из-за прилипания клапана к стенке межпредсердной
перегородки во внутриутробный период. В такой ситуации правые
отделы сердца увеличиваются, а левые становятся гипопластич-
ными, смерть наступает либо внутриутробно, либо сразу или через
некоторое время после рождения.
Настоящая глава посвящена особенностям течения вторичного
ДМПП, клиника и диагностика первичного ДМПП изложены в
главе 7.
Гемодинамика при ДМПП определяется размерами дефекта,
величиной и направлением сброса, состоянием сосудов малого
круга кровообращения и миокарда правого желудочка, возрастом
больных и др. Суть гемодинамических нарушений — это артерио-
венозный сброс из левого в правое предсердие, что приводит к
гиперволемии малого круга кровообращения, диастолической
перегрузке и дилатации полости правого желудочка (рис. 9).
При интактной межпредсердной перегородке в норме давление в
левом предсердии (5) больше, чем в правом (6), на 5—6 мм рт. ст.
Градиент давления сохраняется и оказывает влияние на величину
сброса лишь при небольших размерах дефекта. При больших де-
70
Рис. 9. Схема вторичного
предсердной перегородки
кой).
дефекта меж-
(указан стрел-
крови и его
не
в
фектах объем сброса
направление определяются
столько разностью давления
предсердиях (она практически ис-
чезает), сколько относительной
растяжимостью (комплайнс) обо-
их желудочков (3,4) во время диа-
столы, соотношением конечно-диа-
столического давления в их поло-
стях. У детей первых месяцев
жизни сп*особность обоих желу-
дочков к растяжению определяет-
ся толщиной их стенок, которая
однакова или почти одинакова, в результате
порок остается бессимптомным. После рождения ребенка легоч-
сброс небольшой и
ное сопротивление падает, соответственно уменьшается гипертро-
фия миокарда правого желудочка, он делается более податли-
вым; одновременно с возрастом увеличивается системное сопро-
тивление, стенка левого желудочка (3) утолщается, способность к
диастолическому расслаблению уменьшается. Эти изменения
приводят к увеличению левоправого сброса на уровне предсердий.
Из-за особенностей сброса основная нагрузка при этом пороке
приходится на правые отделы. Левое предсердие увеличивается
редко, так как дефект обычно расположен близко к правым ле-
гочным венам (10) и кровь из них шунтируется непосредственно в
правое предсердие.
Несмотря на большой сброс крови на уровне предсердий,
существует ряд факторов, способствующих длительному отсут-
ствию легочной гипертензии при ДМПП: отсутствие непосредст-
венного влияния на сосуды легких высокого давления левого
желудочка (при дефекте межжелудочковой перегородки и откры-
том артериальном протоке последнее непосредственно передается
на сосуды малого круга кровообращения); передача давления из
правого желудочка в легочную (9) артерию (обычно нормальное
или слегка повышенное); значительная растяжимость правых от-
делов сердца; резервная емкость легочных сосудов и их низкое со-
противление. Отличием ДМПП от других ВПС является меньшее
значение спазма легочных сосудов в генезе легочной гипертензии,
поэтому повышение давления в легочной артерии и общелегочного
сопротивления при ДМПП связано с органическими изменениями
в сосудах легкого. Обычно склеротическая фаза возникает после
25 —30 лет, поэтому легочная гипертензия при ДМПП, если она
уже развивается, имеет худший прогноз. Крайне редко, но и при
ДМПП, легочная гипертензия может носить врожденный характер
(отсутствие физиологической инволюции в строении легочных
сосудов).
71
Склеротические изменения в легочных сосудах и легочная
гипертензия дополняют диастолическую перегрузку правого же-
лудочка систолической, в результате чего возрастает гипертрофия
его миокарда, ухудшается комплайнс (растяжимость), повыша-
ется конечно-диастолическое давление в правом желудочке и
среднее давление в правом предсердии, сброс крови на уровне
предсердий уменьшается и становится обратным. В этой стадии
возникает недостаточность клапанов легочной артерии и трех-
створчатого клапана. Поражение миокарда правого желудочка
(дистрофия, склероз) у взрослых больных с ДМПП способствует
развитию сердечной недостаточности и уменьшению артерио-
венозного сброса.
При общем предсердии происходит полное смешение венозной
и артериальной крови.
Клиника, диагностика. Порок обнаруживается в 2—3 раза
чаще у женщин, чем у мужчин. Известны семейные случаи ДМПП
в сочетании с атриовентрикулярной блокадой или без нее.
Большинство детей с ДМПП ведут нормальный образ жизни,
некоторые даже могут заниматься спортом. С возрастом выявля-
ется большая утомляемость, одышка при физической нагрузке по
сравнению со здоровыми сверстниками. Цианоза не бывает; при
его наличии следует заподозрить наличие общего предсердия, со-
четание ДМПП с гипоплазией правого желудочка, болезнью
Эбштейна или впадением левой верхней полой вены в левое пред-
сердие. Исключение составляют новорожденные с ДМПП, у ко-
торых при крике иногда появляется слабый цианоз, свидетель-
ствующий о праволевом сбросе. Почти у 2/3 больных в анамнезе
отмечаются повторные бронхиты, пневмонии возникают реже,
чем при больших ДМЖП и ОАП. В физическом развитии отстают
дети со значительным артериовенозным сбросом и сердечной не-
достаточностью, остальные больные развиваются нормально.
Изредка у детей первых месяцев и лет жизни отмечается тя-
желое течение порока с одышкой, тахикардией, отставанием в
физическом развитии, гепатомегалией.
Корреляция между тяжестью состояния ребенка и величиной
дефекта в раннем возрасте существует не всегда. После 2—3 лет
самочувствие детей улучшается, признаки сердечной недостаточ-
ности исчезают. Ухудшение состояния, жалобы на утомляемость,
одышку у большинства больных появляются после 20 лет. Тогда же
впервые могут возникнуть цианоз (признак склеротической фазы
легочной гипертензии и обратного веноартериального сброса),
нарушения сердечного ритма (жалобы на перебои, неравномерное
или учащенное сердцебиение, замирание сердца).
Систолическое дрожание при вторичном ДМПП определяется
редко, его наличие может быть признаком сопутствующего ВПС
(стеноз легочной артерии, ДМЖП). Верхушечный толчок ослаб-
лен, неразлитой. Границы относительной сердечной тупости нор-
мальные или расширены в обе стороны, но за счет правых отделов;
левая — из-за смещения влево увеличенным правым желудочком
72
левого, вправо — за счет правого предсердия. Сердечный горб
встречается нечасто, обычно в более старшем возрасте у детей
первых лет жизни с кардиомегалией.
При аускультации обращают на себя внимание усиленный I
тон в области трехстворчатого клапана и стойкое расщепление
II тона над легочной артерией (более позднее закрытие клапанов
легочной артерии по сравнению с аортальными). Основным при-
знаком, по которому можно заподозрить ДМПП, является си-
столический шум. Однако он средней интенсивности, не очень
грубый, без выраженной проводимости, с локализацией во вто-
ром-третьем межреберье слева у грудины, лучше выслушива-
ется в положении лежа, чем стоя. Такой шум напоминает функ-
циональный, особенно у детей первых лет жизни, что способ-
ствует поздней диагностике порока. С возрастом (обычно к 5—7
годам) интенсивность шума усиливается, нередко присоединяется
короткий мезодиастолический шум во втором-третьем межре-
берье слева и установление диагноза облегчается. Мезодиасто-
лический шум свидетельствует об умеренном или большом дефек-
те, его наличие учитывается как показание к хирургическому
вмешательству. Генез шума до конца не ясен. Возможно, он свя-
зан с относительной недостаточностью клапанов легочной арте-
рии либо является результатом быстрого кровотока через от-
носительно стенозированный трехстворчатый клапан. О проис-
хождении систолического шума существует единое мнение, что
он связан с функциональным стенозом легочной артерии, возни-
кающим из-за увеличенного кровотока при неизмененном фиброз-
ном кольце легочного клапана.
У больных с ДМПП на верхушке могут выслушиваться кли-
ки и поздний систолический шум — признаки пролапса митраль-
ного клапана. Такое сочетание не случайно. Пролапс митраль-
ного клапана является результатом микроаномалий развития
створок и дисплазии соединительной ткани, т. е. имеет ’общие
с ДМПП механизмы возникновения. Степень пролабирования
обычно небольшая, не имеет гемодинамического значения; с воз-
растом, однако, возможно возникновение недостаточности мит-
рального клапана (см. главу 18), что выражается в появлении
голосистолического шума на верхушке. После операции устра-
нения ДМПП пролапс митрального клапана остается и даже не-
редко прогрессирует.
Наличие диастолического шума на верхушке с резким акцен-
том I тона требует исключения синдрома Лютембаше — соче-
тание вторичного ДМПП и стеноза митрального клапана (см.
главу 18).
Сердечная недостаточность по правожелудочковому типу
встречается при вторичном ДМПП нечасто, в основном у детей
раннего возраста и после 20—30 лет. Причиной сердечной не-
достаточности являются большие размеры ДМПП или множест-
венные дефекты со значительным сбросом крови, дополнительные
ВПС (аномальный дренаж легочных вен), легочная гипертензия.
73
Бактериальный эндокардит как осложнение ДМПП пред-
ставляет чрезвычайную редкость, так как кровоток идет в обла-
сти низкого давления и повреждение интимы менее значитель-
ное, чем при ДМЖП или ОАП. При длительном существова-
нии порока возможно возникновение мерцательной аритмии, ко-
торая при сочетании с бактериальным эндокардитом способст-
вует появлению тромбоэмболии сосудов головного мозга. Со
временем у больных с ДМПП развивается артериальная гипер-
тензия: сниженный сердечный выброс приводит к повышению
общепериферического сопротивления, в свою очередь способству-
ющего повышению АД; артериальная гипертензия вызывает из-
менения ЭКГ (гипертрофия левого желудочка) и рентгенологи-
ческие отклонения.
Наиболее типичными изменениями ЭКГ при вторичном де-
фекте следует считать отклонение электрической оси сердца
вправо (Z_aAQRS = -|-90 4- -)-150°), признаки перегрузки право-
го желудочка (увеличение амплитуды зубца 7?V|, aVR, отноше-
ние R/S в Vi более 1, уменьшение амплитуды зубцов Rv.„ и
увеличение Sv5„)- неполной блокады правой ножки пучка Гиса
типа RSR', rsR' bVi —85 % всех случаев порока (рис. 10), ши-
рина комплекса QRS при этом 0,10 с и более (редко имеет место
полная блокада правой ветви). Неполная блокада правой ножки
пучка Гиса при диастолической перегрузке правого желудочка
является следствием локальной гипертрофии наджелудочкового
гребня, специфичной для ДМПП. После операции форма непол-
ной блокады изменяется на более физиологичную (типа RsR' или
rS). По мере увеличения давления в легочной артерии и гипер-
трофии правого желудочка амплитуда зубца Rv, нарастает и
форма блокады меняется на qR или R с высотой до 12—15 мм
и более, появляется смещение ниже изолинии интервала ST в
отведении Vi—2 с глубокими отрицательными зубцами Т в тех
же отведениях, а иногда вплоть до отведений Vs,6- В 1 /4 случа-
ев имеются признаки перегрузки правого предсердия (остроко-
нечные и увеличенные по амплитуде зубца Рн, v,), возможно за-
медление атриовентрикулярной проводимости в виде увеличения
интервала PR до 0,24 с. Нарушения ритма (пароксизмальная
и непароксизмальная хроническая тахикардия, трепетание и
мерцание предсердий, предсердная экстрасистолия) обнаружива-
ются чаще у больных в пубертатном периоде и после 20 лет,
имеющих легочную гипертензию.
На ФКГ при вторичном ДМПП I тон имеет нормальную или
увеличенную амплитуду. При повышении давления в правом
желудочке отмечается расщепление I тона и увеличение его ам-
плитуды за счет трикуспидального компонента (результат уси-
ленного закрытия трикуспидального клапана). II тон над ле-
гочной артерией широко и стойко расщеплен (на 0,03—0,07 с),
амплитуда легочного компонента увеличена. В отличие от других
ВПС степень расщепления II тона на вдохе и выдохе не меня-
ется, т. е. оно фиксировано и определяется в основном постоян-
74
Рис. 10. ЭКГ при вторичном дефекте межпредсердной перегородки.
ством объема сбрасываемой крови. При легочной гипертензии
расщепление исчезает и фиксируется единый увеличенный II тон.
Сочетание последнего с увеличенной амплитудой трикуспидаль-
ного компонента I тона при ДМПП — признак легочной гипер-
тензии (Шб и IV гемодинамические группы). На ФКГ у боль-
ных с вторичным ДМПП IV тон встречается чаще, чем III тон,
особенно по мере повышения давления в легочной артерии.
Во втором межреберье слева фиксируется максимум систоли-
ческого шума средней или низкой амплитуды, имеющего форму
веретена или ромба; реже он может быть высокоамплитудным,
пансистолическим или имеет пресистолическое усиление (при
большом сбросе). Мезодиастолический шум лучше регистриру-
ется в третьем межреберье у грудины.
Легочный рисунок и размеры сердца на рентгенограмме оп-
ределяются величиной сброса через дефект и состоянием сосудов
малого круга кровообращения. В большинстве случаев признаки
легочной гипертензии отсутствуют или выражены умеренно в
виде расширенных долевых, сегментарных и даже перифери-
ческих артерий; это сочетается с небольшими размерами серд-
ца. При большом левоправом сбросе легочный рисунок значи-
тельно усилен за счет артериального русла, определяются рас-
ширенные тени корней легких и ветвей легочной артерии, дила-
тация выводного тракта правого желудочка и ствола легочной
артерии, сердце расширено в поперечнике за счет правых отде-
лов. Увеличение левых отделов сердца у взрослых может быть
результатом миокардиодистрофии, ИБС и гипертонической бо-
лезни. При высокой легочной гипертензии отмечаются резкое
усиление легочного рисунка, аневризматическое расширение
ствола легочной артерии, кардиомегалия с шаровидной формой
сердца; правый желудочек настолько дилатирован, что образует
75
Рис. II. Эхокардиограмма при вторичном дефекте межпредсердной перегородки
в проекции 4 камер с верхушки, виден перерыв эхосигнала от перегородки
(указано стрелкой).
верхушку сердца. Если при легочной гипертензии развивается
концентрическая гипертрофия миокарда правого желудочка, раз-
меры сердца уменьшаются параллельно с расширением ствола
легочной артерии. Из функциональных признаков при ДМПП
имеются усиленная пульсация корней легких, легочной артерии,
преобладание амплитуды пульсации миокарда правого желудо-
чка над левым. Аорта узкая, гипопластичная, пульсация ее сни-
жена.
При одномерной эхокардиографии косвенными признаками
порока являются увеличение полости правого желудочка при
уменьшении левого, объемная перегрузка правого желудочка,
аномальное (парадоксальное) движение межжелудочковой пе-
регородки. Другими эхокардиографическими признаками явля-
ются уменьшение амплитуды и скорости движения обеих ство-
рок митрального клапана, увеличенная экскурсия задней стенки
правого предсердия и трехстворчатого клапана вследствие лево-
правого сброса. При вторичном ДМПП на эхокардиограмме
часто выявляется пролапс митрального или трикуспидального
клапана. Перечисленные эхокардиографические признаки ДМПП
(особенно парадоксальное движение межжелудочковой перего-
родки) могут отсутствовать при небольшом сбросе крови и вы-
раженной легочной гипертензии.
Двухмерная эхокардиография позволяет непосредственно
визуализировать межпредсердную перегородку на всем протяже-
нии в парастернальной позиции по длинной и коротким осям
сканирования, а также в проекции 4 камер с верхушки (рис.
11). Вторичные дефекты межпредсердной перегородки подтвер-
ждаются по наличию перерыва эхосигнала в дистальной от атри-
овентрикулярных клапанов части, при этом видны два свобод-
ных края дефекта. Исключение составляют вторичные дефек-
ты в области fossa oval is, где перегородка в норме истончается.
В таких случаях помошь в диагностике оказывает контраст-
ная эхокардиография, выявляющая левоправый шунт, либо доп-
плер-эхокардиография.
76
Катетеризация полостей сердца позволяет выявить сброс
крови на уровне предсердий; проведение катетера из правого
предсердия в левое подтверждает наличие дефекта межпред-
сердной перегородки. Давление в легочной артерии бывает нор-
мальным или умеренно повышенным. Только у 5 % детей с изо-
лированным вторичным ДМПП давление в легочной артерии
превышает 50 мм рт. ст., поэтому легочная гипертензия чаще
свидетельствует о сопутствующих дефектах (ДМЖП, аномаль-
ный дренаж легочных вен и др.); тенденция к нарастанию дав-
ления в легочной артерии отмечается после 20—30 лет. Как пра-
вило, при ДМПП определяется небольшой градиент давления
между правым желудочком и легочной артерией, не превыша-
ющий 20—30 мм рт. ст. (функциональный стеноз легочной арте-
рии, обусловленный несоответствием между увеличенным объе-
мом крови, выбрасываемым правым желудочком, и фиксирован-
ным диаметром устья легочной артерии). Увеличение насыщения
крови кислородом начинается на уровне правого предсердия, что
является признаком левоправого сброса. В отличие от ДМПП
при открытом овальном окне отмечается незначительное повыше-
ние насыщения крови кислородом (менее чем на 10 %).
Контрастное вещество для диагностики ДМПП лучше, вво-
дить в легочную артерию. В фазу левограммы видно контрас-
тирование левого предсердия, правого предсердия, затем право-
го желудочка и легочного ствола. Кроме того, такое введение
контраста помогает исключить аномальный дренаж легочных
вен.
Дифференциальная диагностика при вторичном ДМПП преж-
де всего проводится с функциональным систолическим шумом,
выслушиваемым на основании сердца; последний ослабевает в
положении стоя, расщепление II тона связано с актом дыха-
ния, нет увеличения правых отделов сердца, нет характерной
блокады правой ножки пучка Гиса типа rSR'. Другие ВПС,
с которыми проводится дифференциальная диагностика, — это
изолированный стеноз легочной артерии, триада Фалло, ОАП,
ДМЖП, болезнь Эбштейна, аномальный дренаж легочных вен
(см. ниже).
Течение, лечение. Вторичный ДМПП имеет благоприятное
естественное течение в первые две-три декады жизни. Средняя
продолжительность жизни составляет 36—40 лет; имеется много
наблюдений за больными, прожившими 70 лет и более, но боль-
шинство из них становятся тяжелыми инвалидами в возрасте
старше 50 лет.
ДМПП может закрыться спонтанно. М. Mody (1978) описал
закрытие ДМПП у 11 из 40 детей по данным повторного зонди-
рования полостей сердца. J. Keith (1978) из 445 детей с ДМПП
спонтанное закрытие отметил у 15 (3%), причем 8 из них име-
ли в раннем возрасте кардиомегалию, на ЭКГ — признаки ги-
пертрофии правого желудочка. Спонтанное закрытие дефекта
происходит, как правило, в первые 5 лет жизни в результате от-
77
носительного уменьшения размеров дефекта с возрастом на фоне
увеличения сердца (возникает сначала функциональное, а затем
анатомическое его закрытие), возможно также закрытие благо-
даря образованию аневризмы перегородки. Если к 5—6-летне-
му возрасту не наступает спонтанного закрытия дефекта, пока-
зана консультация кардиохирурга для определения сроков
оперативного вмешательства. Оптимальным является возраст
5—10 лет, лучше сделать операцию до поступления ребенка в
школу.
При недостаточности кровообращения у детей раннего воз-
раста с ДМПП показано назначение сердечных гликозидов и
мочегонных препаратов (см. главу 22). Как правило, эффект
от лечения хороший, что в сочетании с возрастным улучшением
течения порока позволяет отложить хирургическое вмешательст-
во. Длительность назначения дигоксина определяется индиви-
дуально и, как правило, потребность в нем сохраняется в те-
чение 10—12 мес.
Показания к операции. Если медикаментозная те-
рапия оказывается неэффективной и остаются признаки сер-
дечной недостаточности, то показана хирургическая коррекция
порока. Другими показаниями к хирургическому лечению явля-
ются значительный артериовенозный сброс (когда легочный кро-
воток соотносится с системным как 2,5:1 и более или сброс со-
ставляет более 40 % от минутного объема малого круга крово-
обращения), отставание в физическом развитии, признаки ле-
гочной гипертензии. Противопоказанием к операции служит вено-
артериальный сброс крови. После 40 лет определяющим факто-
ром в решении вопроса о хирургической коррекции порока дол-
жен быть не возраст больного, а тяжесть его состояния, состоя-
ние миокарда и легочных сосудов.
При оценке риска хирургического вмешательства у больных
с ДМПП необходимо учитывать возраст, наличие или отсутствие
сопутствующих ВПС, сердечной недостаточности, размер дефекта
и объем сброса, давление в легочной артерии и показатель обще-
легочного сопротивления. Оперативное лечение сопровождается
наибольшим риском у детей первых лет жизни и взрослых с явле-
ниями сердечной недостаточности и легочной гипертензии. При-
чиной смерти больных с ДМПП (без операции) является право-
желудочковая сердечная недостаточность, реже — тромбоз ле-
гочной артерии, аритмии, парадоксальная эмболия сосудов го-
ловного мозга, у детей раннего возраста — ОРВИ и пневмония.
Закрытие ДМПП выполняется в условиях гипотермии и
искусственного кровообращения. При больших дефектах накла-
дывается заплата из аутоперикарда или синтетической ткани,
небольшие дефекты ушиваются.
Хирургическая тактика при сочетании ДМПП с другими
ВПС определяется видом пороков. При необходимости их устра-
нения в условиях искусственного кровообращения может быть
использована продольная стернотомия, посредством которой мо-
78
жет быть закрыт и ДМПП. При планировании операции обыч-
но ориентируются на сопутствующий порок (дефект межжелу-
дочковой перегородки, аномальный дренаж легочных вен и т. д.),
чем на ДМПП, закрытие которого обычно технических трудно-
стей не представляет.
К послеоперационным осложнением относятся сердечно-со-
судистая (в частности, левожелудочковая) и дыхательная недо-
статочность, нарушения ритма (результат повреждения области
атриовентрикулярного узла) и проводимости (атриовентрикуляр-
ные блокады, полная блокада правой ножки пучка Гиса), изме-
нения со стороны ЦНС (воздушная эмболия), реже — бактери-
альный эндокардит, остаточный сброс (негерметичные ушивание
или пластика дефекта).
Летальность после операции закрытия вторичного ДМПП
колеблется от 1,4 до 2% [Бухарин В. А., Подзолков В. П.,
1982; De Leval М., Stark J., 1983).
Очень хорошие отдаленные результаты получены у больных
без легочной гипертензии, у них в течение 2 -3 лет полностью
нормализуются гемодинамические показатели, данные электро-
и рентгенокардиографии. У других больных отмечается значи-
тельное улучшение, но в течение многих лет сохраняются прояв-
ления легочной гипертензии (перегрузка правого желудочка,
изменение легочного рисунка на рентгенограмме). У некоторых
больных через 5—10 лет после операции возникает рецидив
субъективной симптоматики (жалобы на одышку при физиче-
ской нагрузке, утомляемость) из-за прогрессирующей легочной
гипертензии, что еще раз подчеркивает необходимость ранней
коррекции порока.
АНОМАЛЬНЫЙ ДРЕНАЖ ЛЕГОЧНЫХ ВЕН
Аномальный дренаж легочных вен (АДЛВ) — порок, при ко-
тором все (тотальный) или отдельные (частичный) легочные
вены впадают в правое предсердие или полые вены, ведущие
к нему. Первое описание порока принадлежит J. В. Winslow
(1739) и J. G. Wilson (1798). Частота АДЛВ составляет 0,5—
2 % от всех ВПС (Bankl Н., 1980).
Частичный аномальный дренаж легочных вен
Частичный АДЛВ составляет '/3 всех случаев данного по-
рока, частота его среди других ВПС — 0,7—9,4 %, при аутопсии
он встречается в 0,5 % (1 на 200 случаев всех ВПС] в сочета-
нии с ДМПП в 10—15 % [Bankl Н., 1980]. Вероятно, значи-
тельное число случаев частичного АДЛВ остается недиагности-
рованным из-за отсутствия клинических проявлений.
Анатомия, классификация. Чаще встречается аномальный
дренаж вен правого легкого. Можно выделить следующие вари-
анты АДЛВ (рис. 12): 1) супракардиальный уровень — легоч-
79
Рис. 12. Схема наиболее распространенных вариантов частичного аномального
дренажа правых легочных вен.
а — супракардиальный уровень: аномальный дренаж ЛВ в ВПВ; б — кардиальный
уровень: аномальный дренаж ЛВ в ПП; в инфракардиальный уровень: аномальный
дренаж ЛВ в НПВ; 1 - дефект межпредсердной перегородки.
ные вены впадают в девую безымянную, верхнюю подую вены
иди одну из их ветвей; 2) кардиадьный уровень — дренирование
всех иди части дегочных вен в полость правого предсердия или
коронарного синуса; 3) инфракардиальный — часть легочных
вен впадает в венозный сосуд, расположенный ниже сердца;
4) смешанный.
У большинства больных имеются сопутствующий вторичный
ДМПП (нередко дефект венозного синуса), открытое овальное
окно. На аутопсии видны увеличенные полости правого предсер-
дия и желудочка, дилатированные легочные артерии и полые
вены; левые камеры сердца и аорта не изменены. Обычно в мес-
тах впадения имеется несколько устьев легочных вен, иногда
они собираются в один ствол и открываются общим устьем.
В 20 % случаев встречаются другие ВПС (ДМЖП, транспози-
ция аорты и легочной артерии, тетрада Фалло, единственный
желудочек, стеноз легочной артерии, декстрокардия).
Гемодинамика. При частичном АДЛВ нарушения гемодина-
мики аналогичны нарушениям при ДМПП и определяются чис-
лом аномально дренирующихся вен, величиной левоправого
шунта и размерами ДМПП, сопутствующими ВПС. Если дрени-
руется одна легочная вена и нет ДМПП, порок остается
бессимптомным. Давление в легочной артерии при частичном
АДЛВ длительное время остается нормальным, так как сброс
крови происходит на уровне предсердий и отсутствует фактор
«передаточного давления» (из левого желудочка и аорты в пра-
вый желудочек и легочную артерию, как при ДМЖП и ОАП).
Клиника, диагностика. При частичном АДЛВ клинические
проявления могут длительно отсутствовать или напоминать та-
ковые при вторичном ДМПП. Основные симптомы порока не ти-
80
пичны: утомляемость, боли в сердце, одышка при нагрузке, воз-
можны повторные пневмонии, отставание в физическом развитии.
С возрастом появляется сердечный горб, границы сердечной ту-
пости расширяются больше вправо. Аускультативная картина
аналогична таковой при вторичном ДМПП: негрубый систоли-
ческий шум в месте проекции легочной артерии, расщепление
II тона. Сердечная недостаточность у детей развивается редко,
обычно в случаях, если аномально дренируется более 50 % легоч-
ных вен; у взрослых ухудшение общего состояния появляется
раньше, чем в случаях изолированного ДМПП.
На ЭКГ при частичном АДЛВ нет характерных симптомов,
электрическая ось сердца расположена нормально или отклонена
вправо, есть признаки перегрузки правых отделов (иногда более
выраженные, чем при изолированном ДМПП), неполной бло-
кады правой ножки пучка Гиса (rSR' в отведении V(), возмож-
но удлинение интервала PR.
При рентгенологическом исследовании органов грудной клет-
ки состояние легочного рисунка определяется величиной арте-
риовенозного сброса. При частичном АДЛВ он в большей сте-
пени усилен по артериальному руслу, если сброс составляет
более 50 % минутного объема малого круга крообращения.
В этих же случаях возможны выбухание ствола легочной арте-
рии и усиленная пульсация корней легких. Тень сердца увеличе-
на за счет правых отделов; правое предсердие дилатировано в
большей степени, чем при изолированном ДМПП. При АДЛВ в
верхнюю полую вену видно ее расширение. Овальная тень от
правых легочных вен, идущая к нижней полой вене вдоль пра-
вой границы сердца («саблевидный синдром» или картина «ту-
рецкой сабли»), является достоверным признаком порока в слу-
чаях аномального впадения правых легочных вен в нижнюю
полую вену.
До настоящего времени отсутствуют убедительные эхокарди-
ографические критерии, позволяющие диагностировать частич-
ный аномальный дренаж легочных вен. Косвенными (гемоди-
намическими) проявлениями его являются: дилатация правого
желудочка, парадоксальное движение межжелудочковой перего-
родки, малые размеры левого предсердия и желудочка, увели-
чение экскурсии трикуспидального клапана. При двухмерной
эхокардиографии частичный АДЛВ следует заподозрить при не-
соответствии анатомического дефекта перегородки гемодинами-
ческим проявлением артериовенозного сброса крови.
При катетеризации полостей сердца зонд из правого пред-
сердия поступает в одну из полых вен и оттуда в свободное ле-
гочное поле. Необходимо производить поэтапное исследование
полых вен и правого предсердия, что позволяет установить
уровень впадения легочных вен и их количество. Когда зонд
из правого предсердия попадает в ствол легочной вены, он в
промежутке между устьями полой и легочной вен имеет поло-
гий ход, отклоняясь вправо от средней линии, или проходит не-
81
посредственно по краю тени правого предсердия. В некоторых
случаях зонд может пройти в ствол легочной вены через ДМПП
и полость левого предсердия. О связи легочных вен с полы-
ми венами свидетельствует повышение насыщения крови кисло-
родом на уровнях левой безымянной, верхней или нижней по-
лых вен.
При аномальном дренаже в правое предсердие отмечается ар-
териализация крови в этой полости, что характерно и для изоли-
рованного ДМПП. Давление в камерах сердца может быть нор-
мальным.
Наиболее ценным диагностическим приемом следует считать
селективную ангиокардиографию с введением контрастного ве-
щества в ствол легочной артерии или селективно в правые или
левые ветви ее. После тугого и быстрого заполнения контраст-
ным веществом легочной артерии видна капиллярная фаза,
затем выявляются ход и место впадения всех легочных вен,
полные вены, правое предсердие и желудочек, левые отделы
сердца.
Лечение. При коррекции частичного АДЛВ применяются
разнообразные операции в зависимости от вида порока (уровня
дренирования, величины и расположения ДМПП). При аномаль-
ном дренаже части легочных вен в верхнюю полую вену или ее
устье используется следующая тактика: а) создание с помощью
заплаты туннеля, соединяющего устья аномально дренирую-
щихся легочных вен с левым предсердием через дефект пере-
городки; б) создание двух туннелей из ствола верхней полой
вены для образования раздельных — системного и легочного —
кровотоков и отведения крови легочных вен. непосредственно в
левое предсердие через ДМПП; в) подшивание нижнего края
дефекта к задней стенке полой вены над устьями аномально дре-
нирующихся легочных вен. При аномальном дренаже легочных
вен в полость правого предсердия выполняется операция с по-
мощью заплаты. При небольшом ДМПП производят его расши-
рение в целях создания адекватного тоннеля, не препятствую-
щего поступлению крови из легочных вен в левое предсердие.
При изолированном аномальном дренаже легочных вен в верх-
нюю полую вену или правое предсердие рекомендуется создание
искусственного дефекта межпредсердной перегородки с последу-
ющей коррекцией порока. При аномальном дренаже легочных вен
в нижнюю полую вену используют одну из вышеуказанных мето-
дик либо производят отсечение коллектора легочных вен и им-
плантацию его в левое предсердие. При аномальном дренаже
левых легочных вен в левую вертикальную вену производят пе-
ревязку этой вены, отсечение левых легочных вен и имплантацию
их в ушко левого предсердия.
Результаты операции хорошие. Хирургическая летальность
не превышает 2—3%. Из осложнений возможны частичное су-
жение верхней полой вены, нарушение дренажа легочных вен,
повреждение синусового или атриовентрикулярного узлов.
82
Частота тотального АДЛВ по клиническим данным составля-
ет 1,6—7,7 % [Парийская Т. В., Вениаминова Г. Н., 1986J, по
патологоанатомическим — около 2% [Bankl Н., 1980).
Анатомия, классификация. При тотальном АДЛВ сообщение
между легочными венами и левым предсердием вообще отсут-
ствует, вся кровь из малого круга кровообращения поступает
в правое предсердие или идущие к нему сосуды, в них происходит
смешение артериальной и венозной крови. Жизнь больного воз-
можна только при наличии сопутствующего ДМПП. Если ДМПП
нет, а имеется только открытый артериальный проток, больные
погибают в раннем возрасте, так как при этом левые отделы
сердца не участвуют в кровообращении; смерть наступает и в
случаях преждевременного (до или вскоре после рождения) за-
крытия овального окна. Существует много разновидностей этого
сложного ВПС, в связи с этим предложены различные его клас-
сификации. Наиболее проста классификация R. Darling и соавт.
(1957), они различают четыре типа порока: 1 тип — супракар-
диальный — впадение всех легочных вен общим стволом (кол-
лектором) через аномальную вену в верхнюю полую, через вер-
тикальную вену — в левую безымянную, через аномальную ве-
ну — в непарную (47 %); II тип — кардиальный — впадение всех
легочных вен в правое предсердие или коронарный синус (30 %);
III тип — инфракардиальный — впадение всех легочных вен в во-
ротную или нижнюю полую вену (18 %); IV тип — смешанный —
различные сочетания указанных трех типов (5%) (рис. 13). Пе-
ред впадением в сердце или идущий к нему сосуд легочные ве-
ны собираются в единую камеру — коллектор, который затем
соединяется с системной циркуляцией на разных уровнях. При
этой разновидности АДЛВ отмечаются дилатации правых камер,
ствола легочной артерии, тогда как левые отделы сердца обычно
нормальные.
При тотальном АДЛВ могут иметь место анатомические при-
чины обструкции в легочном венозном дренаже: чаще всего
это связано с сужением устий аномально дренирующихся легоч-
ных вен или отверстия коллектора, реже имеется внешнее дав-
ление на аномальную вену (в месте прохождения через диафраг-
му, между левой легочной артерией и левым главным бронхом).
В 80 % случаев обструкция легочных вен сопутствует инфра-
диафрагмальному варианту АДЛВ.
Наиболее частыми сопутствующими ВПС при тотальном
АДЛВ бывают общее предсердие, единственный желудочек, ги-
поплазия левых отделов, транспозиция магистральных сосудов
(при этом сочетании создается функциональная коррекция поро-
ка). В 25—30 % случаев встречаются экстра кардиальные поро-
ки развития желудочно-кишечного тракта (неправильный пово-
рот кишечника, дивертикулы, пупочная грыжа), селезенки (аге-
незия, множественные дополнительные селезенки), мочеполовой
83
Рис. 13. Схема наиболее распространенных вариантов тотального аномального
дренажа легочных вен.
1 —супракардиальный уровень; 2—кардиальный уровень (впадение всех легочных
вен в коронарный синус); 3 — инфракардиальной уровень.
(врожденные кисты почек, гидронефроз) и костно-мышечной
систем.
Гемодинамика. При тотальном АДЛВ в правое предсердие
поступает кровь из обоих кругов кровообращения, величина и на-
правление сброса определяются соотношением сопротивлений
большого и малого кругов кровообращения и диастолическим рас-
слаблением желудочков. Большое количество артериальной крови
поступает в правое предсердие из коллектора, в который впадают
легочные вены. В предсердии артериальная кровь смешивается
с венозной, отсюда через ДМПП часть крови (меньшая) по-
ступает в левое предсердие и далее в большой круг кровообра-
щения; большее количество крови направляется в малый круг,
способствуя уменьшению левых отделов сердца и развитию ле-
гочной гипертензии. Если ДМПП достигает значительных разме-
ров и сброс крови в большой круг кровообращения достаточ-
ный, то левый желудочек не гипоплазируется, легочная гипертен-
зия не превышает I—II ст. и больные могут дожить до зрелого’
возраста. В случаях обструкции легочных вен развивается ве-
нозная легочная гипертензия; при отсутствии физиологической
инволюции в строении легочных сосудов возможна и врожден-
ная легочная гипертензия. Таким образом, для тотального АДЛВ
характерны циркуляция смешанной крови с незначительным сни-
жением содержания кислорода в большом круге кровообраще-
ния, перегрузка правых отделов сердца, легочная гипертензия
(артериальная, венозная, врожденная).
Клиника, диагностика. Клиническое течение тотального
АДЛВ определяется анатомо-гемодинамическими особенностями
порока, в частности уровнем общелегочного сопротивления,
степенью легочной венозной обструкции, размером межпредсерд-
ного сообщения, состоянием миокарда правого желудочка. Пер-
вые признаки этой разновидности порока появляются нередко
с первых дней и месяцев жизни, отмечаются проявления сердеч-
84
Рис. 14. ЭКГ (V = 25 мм/с) при тотальном дренаже легочных вен.
ной недостаточности, повторные пневмонии и ОРВИ, кашель,
отставание в физическом развитии. Цианоз может появиться в
любом возрасте, нередко к концу первого года жизни. Как пра-
вило, он незначительный и заметен только при крике; выра-
женный цианоз с первых дней жизни характерен для легочной
венозной обструкции. Сердечный горб (преимущественно право-
сторонний) появляется раньше, чем при изолированном ДМПП.
Систолическое дрожание обычно отсутствует. При аускультации
I тон в области трехстворчатого клапана усилен (признак уве-
личенного кровотока через него). II тон над легочной артерией
акцентирован, расщеплен, часто имеется III тон; во втором меж-
реберье слева выслушивается средней интенсивности систоличе-
ский шум (как при ДМПП), у нижнего края грудины слева
возможен мезодиастолический шум. Если коллектор впадает в
верхнюю полую вену и имеется легочная венозная обструкция,
то над ключицей справа или слева можно слышать продолжи-
тельный систолический шум.
У взрослых больных с тотальным АДЛВ и легочной гипер-
тензией во втором межреберье слева выслушивается систоли-
ческий тон изгнания (см. главу 2). Правожелудочковая недо-
статочность в сочетании с клиническими симптомами ДМПП
и умеренным цианозом помогает заподозрить тотальный АДЛВ
у детей. У взрослых больных с этим пороком клиническая кар-
тина не отличима от ДМПП.
На ЭКГ (рис. 14) регистрируются значительное отклонение
электрической оси сердца- вправо (zLaAQRS от + 90 до + 210°),
увеличение правого предсердия (высокий зубец Pn.v,), правого
желудочка (в Vir и Vi форма qR', rR', rSR', в левых грудных
отведениях зубцы R низкие, зубцы S — глубокие; эти призна-
ки особенно выражены при высокой легочной гипертензии фор-
85
ма R в Vi). Может наблюдаться синдром IFPIF типа В. С уве-
личением нагрузки на правый желудочек появляется смеще-
ние интервала ST ниже изолинии с глубокими отрицательными
зубцами Т в отведениях II, III, aVF, V,—V6.
Фонокардиография подтверждает данные аускультации и
имеет все признаки ДМПП.
На рентгенограмме при тотальном АДЛВ легочный рисунок
значительно усилен как по артериальному, так и по венозному
руслу, отмечается умеренная или значительная кардиомегалия,
вызванная увеличением правых камер, левые отделы нормаль-
ных размеров, иногда видна расширенная тень верхней полой
вены. Для супракардиальной формы порока типичной является
сердечная тень в виде «восьмерки» или «снежной бабы», где
нижняя часть — само сердце, а дополнительное образование
вверху справа представляет собой коллектор, собирающий кровь
из всех легочных вен и открывающийся в левую или правую
полую или безымянную вены (рис. 15). Последние дилатированы,
так как вмещают большой объем легочного кровотока. Иногда
форма сердца имитирует увеличенную вилочковую железу. При
впадении легочных вен в коронарный синус или нижнюю полую
вену характерные рентгенологические проявления порока отсут-
ствуют.
М-эхокардиография не позволяет выявить порок; косвенными
признаками являются относительно малые размеры левого пред-
сердия и левого желудочка, дилатация правого предсердия и же-
лудочка, парадоксальное движение межжелудочковой перего-
родки. При впадении легочных вен в коронарный синус двухмер-
ная эхокардиография позволяет определить за тенью сердца
пространство, образованное венозным коллектором, что подтвер-
ждается при внутривенном введении ультразвукового контраста.
Зондирование полостей сердца при тотальном АДЛВ выяв-
ляет высокое насыщение крови кислородом во всех отделах сердца
(90—96 %); в легочной артерии насыщение иногда такое же, как
в аорте. Наиболее высокое насыщение наблюдается в правом
предсердии или в той вене, куда дренируется коллектор легоч-
ных вен. Давление в легочной артерии может быть повышено
из-за изменений (фетальные, склеротические) в легочных арте-
риолах, увеличенного легочного кровотока, обструкции лего-
чных вен (одновременно повышается и легочное капиллярное
давление). Давление в предсердиях одинаковое или в правом
выше, чем в левом. В таких случаях наблюдаются небольших
размеров ДМПП и тяжелое течение заболевания с первых дней.
Нередко показана срочная атриосептостомия (процедура Раш-
кинда) во время катетеризации.
Введение контрастного вещества в легочную артерию позво-
ляет сразу поставить правильный диагноз (рис. 16). Контраст-
ное вещество обнаруживается в коллекторе легочных вен (КЛВ),
через вертикальную вену (ВВ) попадает в левую безымянную
вену (БВ), затем в верхнюю полую вену и правое предсердие.
86
Рис. 15. Рентгенограмма грудной клетки при тотальном аномальном дренаже
легочных вен
Рис. 16. Супракардиальная форма тотального аномального дренажа легочных
вен. Ангиокардиограмма. Объяснение в тексте. . х
В случае впадения коллектора в коронарный синус последний
вырисовывается в виде яйцевидного образования в нижней части
правого предсердия (лучше видно в боковой проекции). При
впадении легочных вен в нижнюю полую вену контрастное ве-
щество после капиллярной фазы заполняет коллектор, дрениру-
ющийся в этот сосуд выше или ниже диафрагмы.
Дифференциальный диагноз. У новорожденных и детей пер-
вых месяцев жизни этот порок дифференцируют с митральной
или аортальной атрезией, митральным стенозом, трехпредсерд-
ным сердцем, стенозом легочных вен, транспозицией магистраль-
ных сосудов, лимфангиоэктазией; в более старшем возрасте —
с ДМЖП.
Течение, лечение. Около 80 % детей с тотальным АДЛВ уми-
рают в первые годы жизни; Особенно это касается инфракар-
диальных (инфрадиафрагмальных) и других вариантов порока
с легочной венозной обструкцией. Основные причины смерти
больных: сердечная недостаточность, пневмония, преждевремен-
ное закрытие овального окна. Чем позже появляются первые
симптомы заболевания, тем лучше прогноз. Описаны наблюде-
ния, когда больные доживали до 30 лет; в таких случаях имеет
место хорошее смешение крови на уровне предсердий благодаря
достаточному размеру ДМПП, отсутствует венозная обструкция,
уровень давления и общелегочного сопротивления низкие, состо-
яние миокарда правого желудочка удовлетворительное. При на-
личии сердечной недостаточности показано назначение сердечных
гликозидов и мочегонных (см. главу 22) средств. Эффективная
медикаментозная терапия позволяет отложить хирургическое
лечение до более старшего возраста, так как коррекция поро-
ка в раннем возрасте сопровождается летальностью от 35 до
50 % [Фальковский Г. Э. и др., 1986; Clarke D. et al., 1977].
При тотальном АДЛВ в правое предсердие (кардиальная
форма) операция проводится с использованием искусственного
кровообращения и гипотермии и заключается в увеличении меж-
предсердного дефекта и наложении заплаты таким образом, что-
бы направить кровоток из устьев легочных вен через дефект
в левое предсердие. В случаях, когда коллектор дренируется
через коронарный синус, для создания адекватного дренажа ис-
секается часть перегородки, расположенной между коронарным
синусом и овальным окном, надсекается задневерхняя стенка ко-
ронарного синуса, заплата смещает стенку и коронарный синус
в левое предсердие. При супракардиальном и инфракардиаль-
ном типах порока накладывают анастомоз между коллектором
легочных вен и левым предсердием [Бураковский В. И. и др.,
1989].
При выраженной гипоплазии левого желудочка используют
коррекцию ДМПП перфорированной заплатой или двухэтап-
ное хирургическое лечение, включающее: 1 этап — анастомоз
между коллектором и левым предсердием (позволяет разрабо-
тать левые отделы сердца), II этап—перевязка вертикальной
88
вены, посредством которой легочные вены дренируются в правую
верхнюю полую вену.
Летальность после операции у детей до 6 лет, по данным
A. Galloway и др. (1985), составила 10%. Она выше при инфра-
кардиальной форме, дренаже легочных вен в верхнюю полую ве-
ну, особенно в правую (чем при их впадении в коронарный си-
нус или прямо в правое предсердие), при легочной гипертензии,
гипоплазированных левом желудочке и левом предсердии.
При выполнении операции в детском возрасте отдаленные
результаты, как правило, хорошие, так как не успевают развить-
ся склеротические изменения в сосудах малого круга кровообра-
щения и в миокарде желудочков сердца. Если анастомоз имеет
признаки функциональной обструкции, показана повторная опе-
рация.
ТРЕХПРЕДСЕРДНОЕ СЕРДЦЕ
Анатомия. Трехпредсердное сердце (левое) представляет
собой редкий ВПС, когда в левом предсердии имеется фиброз-
но-мышечная диафрагма, разделяющая его полость на две части:
задневерхнюю, дополнительную полость, принимающую легочные
вены, и передненижнюю — собственно полость левого предсер-
дия, сообщающуюся с ушком левого предсердия и митраль-
ным клапаном. Частота порока составляет 0,1—0,4 % от всех
ВПС [Bankl Н„ 1980). На 1981 г. описано около 200 случаев.
Как видно на рис. 17, дополнительная камера предсердия
может принимать все легочные вены и сообщаться с левым
предсердием (рис. 17, а) или не соединяться с ним (интактная
диафрагма) (рис. 17, б), в таких случаях сообщение существует
между дополнительной камерой и правым предсердием. Еще два
варианта представляют разновидность субтотального трехпред-
сердного сердца: имеется дополнительная камера, в которую впа-
дает часть легочных вен и которая сообщается с левым (рис.
17, в) или с правым (рис. 17, г) предсердиями (речь идет о со-
четании с частичным АДЛВ). Отверстие, соединяющее допол-
нительную камеру с левым предсердием, в большинстве случаев
единственное, иногда кальцифицированное; его диаметр состав-
ляет 2—5 мм, реже — до 10 мм, иногда отверстие вообще отсутст-
вует. Межпредсердная перегородка интактна в половине случаев,
при наличии дефекта он открывается в полость левого предсер-
дия. Изменения в легочных сосудах отражают венозную гипер-
тензию, реже они аналогичны таковым при первичной легоч-
ной гипертензии. На аутопсии обнаруживают увеличение правых
отделов сердца, выраженный отек легкого, нормальный митра-
льный клапан. Наличие фиброзного тяжа в левом предсердии —
пример неполной формы трех предсердного сердца. Из сопутству-
ющих пороков встречаются тетрада Фалло, атрезия трехствор-
чатого клапана, D-транспозиция магистральных сосудов, отсут-
ствие перикарда.
89
Рис. 17. Схема левого трехпредсердного сердца [Bancle G., 1980]. Объяснение
в тексте.
Гемодинамика. Гемодинамические изменения определяются
величиной отверстия, соединяющего две камеры левого предсер-
дия. Узкое сообщение приводит к рано возникающим застой-
ным явлениям в малом круге кровообращения, развивается ве-
нозная легочная гипертензия с правожелудочковой недостаточ-
ностью.
Клиника, диагностика. Время появления первых признаков
порока зависит от степени стенозирования. При небольшом
отверстии они возникают почти с рождения: повторные, респира-
торные инфекции и пневмонии, периферический цианоз, отставание
в физическом развитии, навязчивый кашель, одышка, хрипы в
легких (рефрактерные к сердечным гликозидам и диуретикам),
редко, но возможно, кровохарканье, затем появляются гепатоме-
галия, отеки на лице и ногах. При больших размерах сообщения
первые проявления порока возможны в школьном возрасте и
90
Рис. 18. Трехпредсердное сердце. Эхокардиограмма. Стрелкой обозначена мем-
брана, подразделяющая левое предсердие на две камеры.
позже. В таких случаях создается ложное впечатление
приобретенного сердечного заболевания.
При аускультации выслушивается акцентированный, незна-
чительно расщепленный или единый II тон. В пятом межреберье
слева у грудины выслушивается систолический шум недоста-
точности трехстворчатого клапана, диастолический шум обычно
отсутствует; реже шума нет или имеется продолжительный систо-
лический шум из-за выраженной обструкции и большого градиен-
та давления через отверстие, возможны систолические клики во
втором межреберье слева у грудины.
На ЭКГ имеется крайнее отклонение электрической оси серд-
ца вправо (Z-aAQRS = 4- 120 4- 4- 160°), зубец Р увеличенной
амплитуды во II и Vi отведениях, признаки резкой гипертрофии
правого желудочка с формой qP в отведении Vi; глубокие от-
рицательные зубцы Т в правых грудных отведениях, реже во II,
III, aVF — признаки субэндокардиальной ишемии миокарда пра-
вого желудочка при высоком давлении в нем. Возможно, но не
всегда, появление признаков гипертрофии левого предсердия. У
взрослых больных с большим размером отверстия признаки пе-
регрузки правого желудочка выражены меньше..
На рентгенограмме тень сердца незначительно или умерен-
но увеличена в размерах, у взрослых она почти нормальная. В
косых проекциях видно увеличение правых отделов сердца. Ле-
гочный рисунок усилен по венозному руслу, иногда наблюда-
ется картина отека легкого, ствол легочной артерии расширен.
Ушко левого предсердия дилатировано, но само левое предсердие
увеличено не всегда.
На эхокардиограмме идентифицируется фиброзно-мышечная
перегородка внутри левого предсердия, разделенного на две не-
равные части (рис. 18). В противоположность такому пороку,
как надклапанное митральное кольцо, при трехпредсердном серд-
це движение створок митрального клапана не изменено. Одно-
91
временно определяются эхокардиографические признаки легочной
гипертензии.
При катетеризации полостей сердца обнаруживают повыше-
ние давления в правом желудочке и легочной артерии. Харак-
терным является наличие градиента между легочно-капилляр-
ным давлением (оно значительно повышено и достигает 16—40
мм рт. ст.) и конечно-диастолическим давлением в левом желу-
дочке (оно нормальное). В норме эти показатели равны. Если
катетер удается провести через овальное окно или ДМПП в ка-
меру, примыкающую к митральному клапану, в ней обнаружива-
ется нормальное давление — это дисбаланс давления характе-
рен для трехпредсердного сердца. Однако овальное окно име-
ется только у г/3- '/г больных с этим пороком. Контрастное ве-
щество необходимо вводить селективно в ствол легочной арте-
рии; в фазу левограммы в прямой проекции может быть виден
линейный дефект наполнения внутри левого предсердия, однако
мембрана определяется при этом не всегда. В неясных случаях
показана левопредсердная транссептальная катетеризация [Shaf-
fer Е. М. et al., 1987], которая позволяет определить повышен-
ное давление в дополнительной камере (оно равно легочно-ка-.
пиллярному давлению); при введении в эту камеру контрастного
вещества отчетливо видна внутрипредсердная мембрана. Если
дополнительная камера сообщается с правым предсердием, дав-
ление в ней нормальное.
Дифференциальный диагноз проводится с заболеваниями
легких, респираторным дистресс-синдромом новорожденных, пер-
вичной легочной гипертензией, врожденным кардитом с малень-
кой полостью левого желудочка, тотальным аномальным дре-
нажем легочных вен с венозной обструкцией, врожденным
митральным стенозом, опухолью левого предсердия (миксо-
ма); у взрослых в первую очередь исключаются заболевания
легких.
Прогноз определяется размером сообщения между двумя ка-
мерами левого предсердия. Если оно менее 3 мм, смерть наступа-
ет в первые месяцы жизни от сердечно-легочной недостаточно-
сти. При размерах более 5—7 мм продолжительность жизни
увеличивается до нескольких лет, но 80 % больных с трехпред-
сердным сердцем погибают в возрасте до 20 лет [Mesnildrey Р.
et al., 1982]. В то же время при ранней диагностике хирурги-
ческое лечение (удаление мембранозной перегородки, закрытие
ДМПП) дает хорошие результаты. Если при зондировании
удается провести катетер в левое предсердие через допол-
нительную камеру, возможна баллонная дилатация суженного
отверстия.
Глава. 6 ДЕФЕКТ И АНЕВРИЗМА
МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
ДЕФЕКТ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Дефект межжелудочковой перегородки (ДМЖП) является
одним из самых распространенных ВПС. Частота его колеблет-
ся от 11 до 23,7 % [Бураковский В. И., Иваницкий А. В., 1982;
Bankl Н., 1980). По данным Т. В Парийской, В. И. Чикавого
(1989), частота ДМЖП у детей составила 48 %. Впервые порок
описан П. Толочиновым (1874) и Н. Roger (1879).
Анатомия, классификация. S. Milo и соавт. (1980) предла-
гают следующие варианты ДМЖП: 1) перимембранозный де-
фект — приточный, трабекулярный, инфундибулярный; 2) ин-
фундибулярный дефект (мышечный, субартериальный); 3) мы-
шечный дефект (приточный, трабекулярный). Варианты ДМЖП
по R. Anderson, J. Becker (1983) представлены на рис. 19.
Размер ДМЖП составляют от 1 до 30 мм и более. Дефект
имеет различную форму (круглый, эллипсовидный), края его
мягкие или фиброзно изменены, на них можно встретить веге-
тации при осложнении бактериальным эндокардитом. Выделяют
большой ДМЖП — его величина сходна с диаметром аорты
или превышает его, и небольшой или средних размеров — мень-
ше диаметра аорты, обычно 0,5—1,5 см.
Кроме ДМЖП, имеются гипертрофия миокарда и дилатация
полостей обоих желудочков, предсердий, расширение ствола ле-
гочной артерии, иногда значительное, аорта нормальных разме-
ров или гипопластична. Напротив дефекта в стенке правого
желудочка и иногда на трикуспидальном клапане выявляется
фиброзное утолщение как реакция на травму от струи крови,
бьющей через дефект. Почти в 2/3 случаев находят сопутствую-
щие аномалии: ДМПП (20%), ОАП (20%), коарктация аорты
(12%), врожденная недостаточность митрального клапана
(2%), стенозы аорты (5%) и легочной артерии.
Особое место занимает сочетание ДМЖП с ао рта л fa-
ной недостаточностью, Которая встречается у 2,5—
6% детей и у 12 % взрослых с ДМЖП [Ahumala G., 1987].
Дефект расположен субаортально (чаще над наджелудочковым
гребнем, реже — в нем или ниже его). Обычно эта часть пере-
городки играет роль опоры для синусов Вальсальвы, поэтому
ее отсутствие способствует провисанию створок. Однако это не
единственная причина. Большая роль в возникновении такого
сочетания принадлежит аномальному строению собственно аор-
тальных створок (слабость соединительной ткани, дислокация),
комиссур (их расширение), иногда обнаруживается двуствор-
чатый клапан аорты. Поэтому некоторые авторы рассматрива-
ют данную патологию как сочетание двух ВПС: ДМЖП и аор-
тальной недостаточности. Провисание правой коронарной (и/
или некоронарной) створки в дефект вызывает удлинение ее сво-
93
Рис. 19. Варианты дефектов межжелудочковой перегородки [Anderson R., Be-
cker J., 1983].
1 - перимембранозный приточный (типа АВК); 2 перимембранозный приточный
субтрикуспидальный трабекулярный; 3 - перимембранозный отточный субаортальный
инфундибулярный; 4 — подаортальноподлегочный инфундибулярный; 5 перимембра-
нозный отточный подлегочный; 6 отточный надгребешковый инфундибулярный; 7 —
центральный, приточный, трабекулярный; 8 верхушечный, трабекулярный, а — мембра-
нозная перегородка; б — приточная часть перегородки; в трабекулярная перегородка:
г— отточная часть перегородки.
бедного края с развитием аортальной недостаточности, постепен-
но края створок утолщаются, деформируются, срединная часть
истончается. Одновременно отмечаются углубление и расширение
соответствующих синусов Вальсальвы аорты, дилатация восходя-
щей аорты и полости левого желудочка. На измененных створках
развивается бактериальный эндокардит, что выражается в раз-
витии перфорации створок, их сращении.
Большое значение для прогноза, показаний к операции при
ДМЖП имеет степень легочной гипертензии. Субаортальная ло-
кализация ДМЖП в сочетании со склеротическими измене-
ниями в легочных сосудах, дилатацией ствола легочной артерии,
гипертрофией миокарда преимущественно правого желудочка
представляет собой синдром Эйзенменгера. В литера-
туре он впервые описан Dalrymple в 1847 г., затем в 1897 г.
Эйзенменгером. Раньше полагали, что обязательным признаком
синдрома Эйзенменгера является «верхом сидящая» над ДМЖП
декстропонированная аорта. Морфологическое изучение показа-
ло, что этот синдром является вариантом высокого ДМЖП и
смещение аорты вправо представляется вторичным по отношению
к субаортальному дефекту; искусственное создание ДМЖП в
этой области нормального сердца приводит к «декстропозиции»
аорты. Склеротическая фаза легочной гипертензии при другой
локализации дефекта называется реакцией Эйзенменге-
Р а.
При гистологическом изучении легочных сосудов обнаружи-
ваются их перекалибровка, перестройка артериол по типу мел-
94
ких артерий, увеличение резервных капилляров, гиперэластоз
артерий эластического типа, гипертрофия медии мелких мышеч-
ных артерий, гиперплазия интимы и ее фиброз с сужением про-
света мелких сосудов, истончение стенки и дилатация сосудов
выше места сужения, видно образование ангиоматозных и плек-
сиформных структур, утолщение межальвеолярных перегородок
(см. рис. 1).
Гемодинамика. Во внутриутробном периоде ДМЖП не ока-
зывает влияния на кровообращение. После рождения ребенка
направление сброса определяется размером дефекта, разницей
давления в левом и правом желудочках, соотношением общеле-
гочного и общепериферического сопротивлений. В первые дни
жизни сброс может быть перекрестным; но вскоре изменяется
структура легочных сосудов, падает легочное сопротивление, в
результате чего давление в большом круге кровообращения на-
много превышает таковое в малом. Артериальная кровь сбра-
сывается из левого в правый желудочек и легочную артерию,
откуда возвращается в левые отделы сердца. Давление в пра-
вых отделах и легочной артерии определяется величиной сброса
и общелегочным сопротивлением. Развитию легочной гипертен-
зии могут препятствовать провисающие створки аортального или
трикуспидального клапанов, аномально прикрепляющиеся, или
дополнительные хорды, инфундибулярный стеноз легочной арте-
рии.
Особенности развития гипертензии в малом круге кровооб-
ращения при ДМЖП такие же, как и при других «сбросовых»
пороках. Сразу после рождения отмечается перекрестный или не-
большой левоправый (артериовенозный) сброс крови через
ДМЖП (имеется небольшая разница между давлением в аорте
и легочной артерии). По мере физиологической инволюции стро-
ения легочных сосудов давление в легочной артерии падает,
сброс в малый круг кровообращения увеличивается. Компенса-
торно возникающий спазм легочных сосудов препятствует их
переполнению кровью и легочная гипертензия в этот период но-
сит «сбросовый» характер. При длительном существовании поро-
ка формируется склеротическая фаза легочной гипертензии. Ес-
ли физиологической инволюции в строении легочных сосудов не
происходит, с рождения существует и прогрессирует врожденная
легочная гипертензия как самостоятельная патология.
При малых дефектах выявляется большой градиент давления
между желудочками и незначительный артериовенозный сброс;
при аускультации этому соответствует средней интенсивности си-
столический шум, занимающий почти всю систолу, так как вы-
равнивания давления почти не происходит и левоправый сброс
продолжается на протяжении всей систолы.
Большие дефекты не создают препятствия левоправому сбро-
су крови, который происходит как в систолу, так и в диастолу.
Однако сброс в диастолу небольшой, поэтому он не формирует
диастолического шума. Основным фактором, способным умень-
95
шить сброс, является повышение общелегочного сопротивле-
ния, которое может быть следствием спазма или склеротиче-
ских изменений в сосудах легких. Если общелегочное сопротив-
ление нормальное или повышено, но составляет менее половины
сопротивления большого круга кровообращения, то происходит
большой сброс крови, легочный кровоток в 2 раза и более пре-
вышает системный, выслушивается продолжительный систоли-
ческий шум. В случаях, если общелегочное сопротивление соста-
вляет половину общепериферического и больше, то объем сбро-
са (а следовательно, и продолжительность шума) уменьшается,
но он остается левоправым. Реакция Эйзенменгера характери-
зуется тяжелой легочной гипертензией (склеротической ее фа-
зой) и высоким общелегочным сопротивлением, в результате
чего возникает перекрестный, а затем и праволевый (веноарте-
риальный) сброс, систолический шум становится коротким, а со
временем вовсе исчезает, а появляется диастолический шум Гре-
хема — Стилла. Сброс в легкие, а следовательно, и возврат
крови в левые отделы сердца уменьшается, так же как объем-
ная перегрузка правого и левого желудочков, при этом увели-
чивается объем крови, поступающей в аорту. Такая реакция ле-
гочных сосудов (реакция Эйзенменгера) может быть при дефек-
тах различной локализации и других ВПС, поэтому это поня-
тие не следует отождествлять с синдромом Эйзенменгера, для
которого характерен только субаортальный дефект.
Представляет интерес нарушение гемодинамики при ДМЖП
в сочетании с аортальной недостаточностью. М. Н. Люде (1972)
выделяет 4 стадии течения этой разновидности ДМЖП: I ста-
дия — створка аортального клапана умеренно изменена и прови-
сает в левый желудочек, сброс крови через ДМЖП значитель-
ный, аортальная недостаточность минимальная; II стадия —
изменения створки аортального клапана значительно выражены,
она провисает в левый желудочек и частично прикрывает
ДМЖП, сброс крови через дефект составляет 50—60 % от ми-
нутного объема малого круга кровообращения, превалирует
аортальная недостаточность с диастолическим давлением в аор-
те 30—50 мм рт. ст.; III стадия — створка аортального клапана
резко изменена, увеличена и почти полностью закрывает дефект,
величина артериовенозного сброса менее 50 %, диастолическое
давление в аорте — 30—50 мм рт. ст.; IV стадия — выраженная
аортальная недостаточность со снижением диастолического дав-
ления до 0—30 мм рт. ст., артериовенозного сброса — от 0 до
50 % минутного объема малого круга кровообращения. Струя
регургитации обычно направлена в оба желудочка, иногда пре-
имущественно в правый. Если створка провисает в полость
правого желудочка, она может вызывать обструкцию его вывод-
ного тракта.
С возрастом у больных с ДМЖП часто отмечается поло-
жительная динамика процесса (уменьшается сердечная недоста-
точность, легочная гипертензия, заболеваемость пневмониями).
96
Это связано с тем, что, кроме тенденции к спонтанному частич-
ному или полному закрытию дефекта (см. ниже), происходит
уменьшение его размеров относительно увеличения массы сердца.
Клиника, диагностика. Время появления первых признаков
порока определяется размером дефекта, величиной и направле-
нием сброса. При больших дефектах, как правило, заболевание
проявляется не сразу после рождения, а спустя 12 мес. Родители
обращают внимание на трудности при кормлении: появляется
одышка, ребенок делает паузы, вдохи, в результате чего оста-
ется голодным, становится беспокойным. Дети с ДМЖП рожда-
ются чаще с нормальной массой, но вскоре начинают отставать
в физическом развитии. Причинами гипотрофии I—III ст. явля-
ются постоянное недоедание (алиментарный фактор) и наруше-
ние гемодинамики (из-за левоправого сброса развивается гипо-
волемия большого круга кровообращения). Характерны выражен-
ная потливость (результат гиперсимпатикотонии), бледность,
мраморность кожных покровов с небольшим периферическим
цианозом. ДМЖП — это ВПС бледного типа, для него не харак-
терен центральный цианоз; но у детей первых месяцев жизни
с присущим им высоким давлением в легочной артерии цианоз
может появляться при крике, что свидетельствует о возникающем
в этот период веноартериальном сбросе. Появление цианоза в
более старшем возрасте (вначале при нагрузке, затем по-
стоянно) свидетельствует о высокой легочной гипертензии, пере-
крестном, а затем и постоянном веноартериальном сбросе. Не-
смотря на развитие реакции Эйзенменгера, у взрослых больных
в течение определенного времени состояние может быть относи-
тельно компенсированным.
Одним из ведущих симптомов больших ДМЖП является
одышка по типу тахипноэ с участием вспомогательной мускула-
туры. Нередко возникает навязчивый кашель, усиливающийся
при перемене положения тела. ДМЖП с большим артериовеноз-
ным сбросом сопровождается повторными, трудно поддающимися
лечению пневмониями, которые не позволяют своевременно про-
вести хирургическое вмешательство.
При осмотре обращает на себя внимание рано развивающийся
парастернальный сердечный горб, иногда значительных размеров
(«грудь Девиса»), Верхушечный толчок смещен влево и вниз;
сердечный толчок усилен, приподнимающийся. При пальпации
улавливается систолическое дрожание в третьем и четвертом
межреберьях слева, что свидетельствует о сбросе крови в правый
желудочек. Отсутствие дрожания при ДМЖП — признак исход-
но небольшого артериовенозного сброса или его уменьшения
в связи с высокой легочной гипертензией. Границы сердечной
тупости расширены в обе стороны, особенно влево.
Большую диагностическую информацию при этом пороке не-
сут данные аускультации: выслушивается связанный с I тоном
грубый систолический шум в третьем — четвертом межреберьях
слева (реже во втором — третьем—при расположении дефекта
4—976
97
над наджелудочковым гребнем), продолжительный при большом
градиенте давления в желудочках и короткий при высокой легоч-
ной гипертензии. Одновременно на верхушке сердца определяет-
ся мезодиастолический шум — признак большого левоправого
сброса. При повышенном легочном сопротивлении и уменьшении
сброса в малый круг кровообращения мезодиастолический шум
исчезает. Генез этого шума обусловлен возникновением отно-
сительного стеноза митрального клапана на фоне возврата
большого количества крови из легких в левое предсердие. Сис-
толический шум на верхушке с проводимостью в левую аксил-
лярную область — признак относительной недостаточности мит-
рального клапана из-за дилатации полости левого желудочка.
При сопутствующем пролапсе митрального клапана на верхушке
выслушиваются щелчки; после хирургического закрытия ДМЖП
аускультативные проявления пролапса митрального клапана оста-
ются и могут прогрессировать. У некоторых больных во втором
и третьем межреберьях слева .со временем появляется протоди-
астолический шум недостаточности аортальных клапанов, что
является следствием гемодинамических нарушений и поврежде-
ния створок клапанов аорты струей крови. Над легочной арте-
рией определяется акцентированный, чаще расщепленный II тон;
здесь же при легочной гипертензии могут выслушиваться клики,
короткий протодиастолический шум недостаточности клапанов
легочной артерии (Грехема — Стилла).
В большинстве случаев с первых дней или месяцев жизни в
клинической картине выражены признаки тотальной сердечной
недостаточности: увеличение печени, селезенки (у детей первых
лет жизни при декомпенсации она увеличивается-содружественно
с печенью), одышка, тахикардия, отечный синдром, застойные
влажные хрипы в легких. Хрипы особенно долго сохраняются
с левой стороны сзади (сдавление нижней левой доли легкого
увеличенным сердцем).
Описанная клиническая картина характерна для средних и
больших дефектов в мембранозной части межжелудочковой
перегородки у детей раннего возраста. В более старшем возрасте
основные клинические проявления порока сохраняются, но дети
начинают жаловаться на боли в сердце, сердцебиение и по-преж-
нему отстают в физическом развитии. Состояние и самочувствие
многих детей с возрастом улучшается, что связано с уменьшени-
ем размеров ДМЖП по отношению к возросшему общему
объему сердца, прикрытием дефекта аортальной створкой. Недо-
статочность кровообращения встречается реже (42 %), чем у мла-
денцев (79%) [Бураковский В. И. и др., 1975].
При дефекте мышечной части межжелудочковой перегородки
(болезнь Толочинова — Роже) жалоб нет, клинические проявле-
ния порока отсутствуют, за исключением скребущего систоли-
ческого шума средней интенсивности («много шума из ничего»)
в четвертом — пятом межреберьях, шум не иррадиирует, его ин-
тенсивность может уменьшаться в положении стоя. Легочная
98
гипертензия не развивается, характерна склонность к спонтанно-
му закрытию дефекта.
Осложненное течение ДМЖП, кроме сердечной недостаточно-
сти, характеризуется легочной гипертензией, бактериальным эн-
докардитом, недостаточностью аортальных клапанов.
Легочная гипертензия развивается у больных со средними и
большими дефектами, чаще у детей первых лет жизни; до взрос-
лого возраста доживают немногие из таких больных. Крайним
выражением легочной гипертензии является реакция Эйзенменге-
ра. В результате высокого давления в малом круге крообраще-
ния в правом желудочке возникает веноартериальный сброс, у
больного появляется цианоз щек, губ, кончиков пальцев, сначала
едва заметный, затем малинового оттенка (признак умеренного
недонасыщения артериальной крови кислородом) и, наконец, он
становится синим или фиолетовым. Постепенно развивается
симптом «барабанных палочек» и «часовых стекол». Могут быть
носовые кровотечения, сердцебиение, боли в сердце. Систоли-
ческий шум исчезает, но появляется резкий акцент II тона над
легочной артерией, иногда в сочетании с протодиастолическим
шумом недостаточности клапанов легочной артерии. Одновре-
менно уменьшаются размеры сердца (снижение сброса вызывает
уменьшение дилатации полостей, а повышение давления в легоч-
ной артерии способствует развитию гипертрофии миокарда
правого желудочка) и печени (правый желудочек разгружается в
результате беспрепятственного сброса крови в аорту).' Нередко
дети перестают болеть пневмониями. Такая динамика (уменьше-
ние шума, сердечной недостаточности, границ сердца, появление
«малиновых» щек) вводит педиатров и родителей в заблуждение,
состояние расценивается как улучшение. В действительности
больной становится иноперабельным. На ЭКГ при синдроме Эй-
зенменгера определяется гипертрофия миокарда правых отделов
сердца, на рентгенограмме — обеднение легочного рисунка по
периферии, его усиление в прикорневой зоне (симптом «обрублен-
ного дерева»), резкое выбухание дуги легочной артерии.
В анализах крови отмечается вначале умеренное, а затем выра-
женное увеличение числа эритроцитов и гемоглобина. В даль-
нейшем постепенно размеры сердца увеличиваются, появляется
рефрактерная к лечению сердечная недостаточность, могут воз-
никать тромбоз легочной артерии, легочные кровотечения, бакте-
риальный эндокардит, аритмии, абсцесс мозга.
Бактериальный эндокардит обычно возникает у детей старше-
го возраста и взрослых (на второй — третьей декаде жизни) и
чаще в случаях небольших дефектов, что связано с травмой
эндокарда при высокой скорости кровотока. К эндокардиту пред-
располагает сочетание ДМЖП с аортальной недостаточностью.
Аневризма мембранозной части перегородки, образовавшаяся
вследствие спонтанного закрытия ДМЖП, также является locus
minoris resistenta для эндокардита. Последний может возник-
нуть и в различные сроки после хирургической коррекции поро-
4* 99
ка. Обычно эндокардит провоцируется стоматологическими про-
цедурами, гнойными поражениями кожи и др. Воспалительный
процесс локализуется по краям дефекта, распространяясь на
трикуспидальный и аортальный клапаны, или в стенке правого
желудочка напротив дефекта (повреждение эндотелия струей
крови).
Недостаточность аортальных клапанов при ДМЖП имеет
прогрессирующее течение, чаще встречается у мальчиков в воз-
расте от 3 до 8 лет, а у взрослых от 16 до 43 лет [Чачава Т. М.,
1983]. Тяжесть состояния больного нарастает параллельно уве-
личению недостаточности полулунных клапанов (дефект неболь-
ших размеров, так как прикрыт аортальной створкой) и объяс-
няется декомпенсацией левого желудочка или присоединением
эндокардита. Ведущими являются жалобы на одышку, боли в
сердце. При пальпации выявляется характерный пульс («celer et
altus»). Снижение диастолического и увеличение пульсового
АД отражает значительную степень провисания аортальной
створки. При аускультации вдоль левого края грудины выслуши-
вается протодиастолический шум (максимальный во втором меж-
реберье), отделенный от систолического шума дефекта вторым
тоном, что отличает этот шум от сплошного систолодиастоли-
ческого при боталловом протоке.
ЭКГ при ДМЖП отражает систолическую и диастолическую
перегрузку желудочков, степень легочной гипертензии. При не-
больших дефектах ЭКГ нормальная либо с признаками увеличен-
ной активности миокарда левого желудочка. По мере повышения
давления в легочной артерии электрическая ось сердца смещает-
ся вправо, к гипертрофии миокарда левого желудочка присое-
диняются признаки перегрузки правого желудочка и предсердий.
При диастолической перегрузке правого желудочка с легочной
гипертензией комплекс QRS в отведении Vi принимает форму
rS/?1, г/?1, при систолической — R. Сочетание этих призна-
ков с формой qRS в левых грудных отведениях свидетельствует
о недавнем присоединении легочной гипертензии, так как еще
сохраняются признаки гипертрофии левого желудочка. Аритмии
в виде экстрасистолии, мерцания предсердий встречаются не-
часто, обычно у взрослых больных. Нарушения проводимости
не характерны для ДМЖП, но могут выражаться в блокаде пра-
вой ножки пучка Гиса, синдроме WPW. Длительная перегрузка
миокарда левого желудочка (форма qRv5fi и глубокие зубцы
SV1) с высокими заостренными (ишемическими) или глубокими
отрицательными зубцами Т в отведениях V5-6 в сочетании со
смещением интервала ST ниже изолинии характерны для ДМЖП
с аортальной недостаточностью (отражают дефицит коронарного
кровотока).
На ФКГ (рис. 20) при ДМЖП фиксируется высокочастотный
систолический шум, связанный с I тоном, занимающий 2/з или
всю систолу, его максимум определяется в третьем — четвертом
межреберье слева у грудины. Осцилляции шума увеличиваются
100
Рис* 20. Дефект межжелудочковой перегородки. ФКГ. Объяснение в тексте.
к середине систолы по мере нарастания давления в левом желу-
дочке и возрастания кровотока через дефект, затем уменьшаются
ко II тону, иногда сливаясь с ним. Большая амплитуда шума со-
ответствует большому сбросу, его укорочение в сочетании с увели-
чением амплитуды II тона над легочной артерией свидетель-
ствует о развитии легочной гипертензии. Характерно расщепле-
ние II тона над легочной артерией (запаздывание захлопывания
101
Рис. 21. Дефект межжелудочковой перегородки. Эхокардиограмма. В проекции.
4-х камер с верхушки виден перерыв эхосигнала от перегородки (указан стрел-
кой).
ее клапанов из-за повышенного давления). При выраженной ле-
гочной гипертензии расщепление II тона уменьшается, легочный
и аортальный компоненты сливаются, в результате на ФКГ фик-
сируется единый резко усиленный II тон [Кассирский Г И.,
1982]. Одновременно при этом может присутствовать систоличе-
ский тон изгнания на легочной артерии, который при аускульта-
ции воспринимается как клик после I тона —- признак высокой
легочной гипертензии. Кроме того, могут определяться III тон
(признак объемной перегрузки левого желудочка), мезодиасто-
лический шум на верхушке, диастолический шум недостаточности
клапанов легочной артерии (шум Грехема — Стилла).
Одномерная эхокардиография в большинстве случаев не по-
зволяет непосредственно определить дефект перегородки, однако
его можно заподозрить по характеру нарушений гемодинамики.
При значительном легочном кровотоке происходит увеличение
диаметра левого желудочка и предсердия; возникновение легоч-
ной гипертензии сопровождается дилатацией правого желудочка.
При двухмерной эхокардиографии проводят прямое определение
размеров и расположения дефекта. В зависимости от локализа-
ции дефекта в мышечной и мембранозной частях используют
различные проекции сканирования (рис. 21). При реакции Эй-
зенменгера имеются умеренное увеличение конечно-систолическо-
го и конечно-диастолического размеров приносящего и выводного
отделов правого желудочка, гипертрофия его миокарда, умень-
шение размеров левого желудочка пропорционально снижению
минутного объема большого круга кровообращения.
При рентгенографии органов грудной клетки у больных с не-
большими размерами ДМЖП отклонений нет. При средних и
больших дефектах легочный рисунок усилен по артериальному
руслу, ствол и ветви легочной артерии расширены, дуга выбу-
хает, иногда аневризматически, отмечается усиленная пульсация
корней легких, аорта не изменена или гипопластична (рис. 22).
Ослабление легочного рисунка по периферии указывает на реак-
цию Эйзенменгера (склеротическая фаза легочной гипертензии).
102
Рис. 22. Рентгеногрвмма груд-
ной клетки. Дефект меж-
желудочковой перегородки с
реакцией Эйзенменгера.
Определяются признаки
высокой легочной гипертен-
зии: эмфизематозность легоч-
ных полей, обеднение легоч-
ного рисунка на периферии,
симптом «ампутации» корней
легких, значительное выбуха-
ние дуги легочной артерии.
Форма сердца при ДМЖП неспецифична. При умеренном лево-
правом сбросе и отсутствии повышения общелегочного сопротив-
ления отмечается увеличение левого желудочка. В .дальнейшем
по мере повышения давления в сосудах малого круга кровооб-
ращения появляется дилатация обоих желудочков или больше
правого.
При ДМЖП с аортальной недостаточностью усиление легоч-
ного рисунка по артериальному руслу незначительно, более
характерен венозный застой как признак левожелудочковой
недостаточности, имеют место дилатация и увеличение амплиту-
ды пульсации восходящей аорты. Ведущим признаком является
значительная дилатация полости левого желудочка.
С возрастом размеры и форма сердца при ДМЖП претерпе-
вают изменения. Так, сокращение размеров сердца может указы-
вать на уменьшение размера или спонтанное закрытие дефекта,
при сочетании с выбуханием ствола легочной артерии — на
развитие высокой легочной гипертензии, при появлении выражен-
ной талии сердца — на развитие инфундибулярного стеноза.
Катетеризация полостей сердца и ангиокардиография показа-
ны больным с ДМЖП при сердечной недостаточности, призна-
ках легочной гипертензии, подозрении на сопутствующие ВПС.
Если при зондировании правых отделов удается провести катетер
в аорту, то диагноз ДМЖП становится бесспорным. Он под-
тверждается также повышенной оксигенацией венозной крови в
правом желудочке (уровень «кислородного скачка»), увеличени-
ем давления в нем. Выявление градиента давления между пра-
вым желудочком и легочной артерией (20—40 мм рт. ст. н более)
указывает на развитие инфундибулярного стеноза легочной арте-
рии в отличие от картины, наблюдаемой при ДМПП, где такой
градиент давления свидетельствует о функциональном легочном
стенозе. При легочной гипертензии давление в правом желудочке
юз
и малом круге кровообращения повышено и может быть равным
давлению в большом круге кровообращения.
Наличие ДМЖП подтверждается введением контрастного ве-
щества в легочную артерию: в фазу левограммы (после прохож-
дения малого круга кровообращения) наблюдается контрастиро-
вание правого желудочка и далее — повторное контрастирование
легочной артерии. Аортография показана для исключения со-
путствующих ВПС: коарктации аорты, аортальной недостаточно-
сти, открытого артериального протока, дефекта аортолегочной
перегородки.
Несвоевременная диагностика может привести к серьезным
осложнениям во время операции.
Определение размеров и локализации ДМЖП возможно с по-
мощью ЯМР-диагностики. В условиях высокой легочной гипер-
тензии и разноречивых данных клинико-инструментального об-
следования для решения вопроса об операбельности больного
показана открытая биопсия легких (см. главу 2).
Дифференциальный диагноз ДМЖП необходимо проводить
со всеми пороками, которые могут осложняться высокой легоч-
ной гипертензией: с открытым общим атриовентрикулярным ка-
налом, общим артериальным стволом, дефектом аортолегочной
перегородки, отхождением магистральных сосудов от правого
желудочка, а также с изолированным стенозом легочной арте-
рии, врожденной недостаточностью митрального клапана, стено-
зом аорты.
Течение, лечение. Средняя продолжительность жизни больных
при естественном течении ДМЖП составляет 23—27 лет, при
небольших размерах дефекта — около 60 лет. В литературе описа-
ны случаи продолжительности жизни до 50 лет больных с
ДМЖП и синдромом (реакцией) Эйзенменгера.
Можно выделить следующие варианты течения ДМЖП:
1. Спонтанное закрытие дефекта. Оно происходит в 15—60 %
случаев [Alpert В. et al., 1979; Zielinsky Р. et al., 1986]. Неболь-
шие дефекты закрываются, как правило, к 5—6 годам. По на-
блюдениям Л. В. Колосковой (1976), ДМЖП без легочной ги-
пертензии и недостаточности крообращения в раннем детском
возрасте спонтанно закрывается у 43,5 % детей (чаще к 4 годам),
при наличии осложнений — в 13,8 % случаев. Спонтанное закры-
тие ДМЖП может осуществляться следующими основными меха-
низмами: прикрытие дефекта дополнительной тканью трикуспи-
дального клапана с формированием псевдоаневризмы (85%);
образование истинной аневризмы мембранозной перегородки;
пролабирование аортальной створки; относительное уменьшение
размера дефекта с ростом сердца, развитие фиброза краев де-
фекта; трабекулярные дефекты могут закрываться благодаря
росту мышечной ткани [Anderson R. Н. et al., 1983]. Больные со
спонтанным закрытием ДМЖП нуждаются в диспансерном на-
блюдении, так как у них в дальнейшем могут возникать различ-
ные осложнения — поражение проводящей системы сердца (пе-
104
редний левый гемиблок, блокада правой ножки пучка Гиса, пол-
ная атриовентрикулярная блокада), недостаточность трикуспи-
дального клапана, мерцание предсердий.
2. Развитие легочной гипертензии и реакции Эйзенменгера
(см. выше).
3. Переход ДМЖП в «бледную форму» тетрады Фалло.
В связи с турбулентностью тока крови при сбросе через дефект
со временем возникает инфундибулярный (подклапанный) сте-
ноз легочной артерии, в результате чего формируется «приобре-
тенная» форма тетрады Фалло. Развитие инфундибулярного
стеноза носит защитный характер, предотвращая развитие высо-
кой легочной гипертензий, но выраженная степень обструкции
вызывает формирование ВПС синего типа. Клиническая картина
порока меняется: дети перестают болеть пневмониями, так как
стеноз уменьшает сброс крови,.-появляется цианоз (вначале толь-
ко при крике, затем постоянный), уменьшаются размеры сердца
и признаки сердечной недостаточности, присоединяется второй
шум (шум стеноза легочной артерии) в третьем межреберье
слева, который со временем становится доминирующим, умень-
шается акцент II тона над легочной артерией. На рентгенограмме
сердце меняет свою конфигурацию (форма «башмачка»), так как
западает дуга легочной артерии, легочный рисунок становится
обедненным. На ЭКГ электрическая ось сердца постепенно
отклоняется вправо, появляются признаки гипертрофии правого
желудочка.
Наибольший процент летальности при больших ДМЖП при-
ходится на ранний детский возраст: более 50 % детей умирают
в возрасте до года, из них 3/4 — до 6 мес [Бураковский В. И.,
Константинов Б. А, 1970; Гарибян В. А., Бобраков Э Э., 1978].
Поэтому в этот критический возрастной период от педиатра
требуется пристальное внимание и интенсивное лечение, так как,
если ребенок переживает этот срок, в дальнейшем нередко насту-
пает улучшение.
Причинами смерти больных с ДМЖП, которым не проводи-
лось оперативное лечение, являются: сердечная недостаточность
чаще в сочетании с пневмонией или бактериальным эндокарди-
том; парадоксальная эмболия в сосуды мозга; тромбоз легочной
артерии, разрыв ее аневризмы.
Показаниями к оперативной коррекции
ДМЖП у детей первых лет жизни являются: раннее развитие
легочной гипертензии, рефрактерная сердечная недостаточность,
рецидивирующие пневмонии, гипотрофия II—III степени. До опе-
рации при сердечной недостаточности назначают дигоксин, моче-
гонные препараты, кокарбоксилазу, витамины В6 и С, проводят
лечение сопутствующих заболеваний (см. главу 22).
Благоприятное течение порока без нарушений гемодинамики
требует наблюдения за ребенком. При небольших размерах
дефекта, отсутствии признаков сердечной недостаточности и ле-
гочной гипертензии, нормальном физическом развитии можно
105
воздержаться от хирургического вмешательства в раннем возра-
сте в надежде на спонтанное закрытие ДМЖП.
У детей старше 3 лет и взрослых показаниями к операции
следует считать жалобы на ограничение в физической нагрузке,
повышенную утомляемость, частые ОРВИ, осложняемые пневмо-
нией, типичную клиническую картину порока со сбросом крови
более 40 %, сердечную недостаточность.
Хирургическое лечение противопоказано, когда систолическое
давление в легочной артерии равно системному и артериовеноз-
ный сброс крови составляет менее 40 % от минутного объема
малого круга кровообращения (П1б — IV гемодинамические груп-
пы); ДМЖП в этих случаях играет роль туннеля для разгрузки
правого желудочка и его закрытие приводит к острой сердеч-
ной недостаточности.
В настоящее время у нас в стране и за рубежом выполняют
раннее радикальное вмешательство в виде пластики ДМЖП в
условиях искусственного кровообращения. У детей, оперирован-
ных в возрасте до 2 лет, лучше происходит обратное развитие
гипертрофии миокарда и изменений в легочных сосудах.
Существуют две методики закрытия ДМЖП: ушивание его
отдельными П-образными швами, укрепленными прокладками
(при диаметре дефекта до 0,5 см), и пластическое закрытие
заплатой (из синтетической или биологической ткани), которая
фиксируется отдельными П-образными швами или непрерывным
швом (при диаметре дефекта более 0,5 см). В целях избежания
вскрытия правого желудочка и, следовательно, травмы его мио-
карда все типы дефекта, за исключением находящихся в выводном
отделе или верхушечной части, целесообразно закрывать
доступом через правое предсердие. При сопутствующих ВПС
чаще применяется правая вентрикулотомия. При аортальной не-
достаточности коррекцию ее производят трансаортальным досту-
пом посредством «пликации» вальвулопластики, укорочения ство-
рок и аннулопластики [Бураковский В. И. и др., 1986; Зиньков-
ский М Ф. и др., 1986]. Только грубые изменения створок требу-
ют замены клапана на искусственный протез. При сопутствую-
щем клапанном стенозе легочной артерии производят рассечение
стеноза по комиссурам, при подклапанном — резекцию фиброз-
но-мышечной ткани в инфундибулярном отделе правого желу-
дочка.
При рецидивирующем бактериальном эндокардите выполне-
ние операции в острой стадии, видимо, лишено смысла из-за
возможности инфицирования заплаты и прорезывания фикси-
рующих ее швов. Операцию целесообразно производить в латент-
ной фазе под прикрытием больших доз антибиотиков, к которым
чувствительна микрофлора. В методическом плане целесообразно
избегать применения синтетических прокладок и осуществлять
закрытие дефекта непрерывным швом.
В настоящее время риск операции в условиях искусственного
кровообращения у детей первых месяцев и лет жизни пока оста-
106
ется высоким, поэтому в центрах, не располагающих достаточ-
ным опытом оперативного лечения грудных детей и детей в
возрасте до 3 мес с глубокой гипотрофией, при множественных и
мышечных ДМЖП, следует проводить сужение легочной артерии
(операция Мюллера — Альберта). В дальнейшем таким больным
показана повторная операция — закрытие ДМЖП с предвари-
тельным устранением искусственного стеноза легочной артерии.
У 60 % детей после операции Мюллера — Альберта успевает
развиться и инфундибулярный стеноз легочной артерии, который
также требует коррекции.
Летальность при закрытии небольших ДМЖП составляет
около 1 % [Blackstone Е. Н. et al., 1976], при высокой легочной
гипертензии у детей раннего возраста она повышается от 2,4 до
10 % [Фальковский Г. Э. и др., 1982; Алекси-Месхишвили В. В.
и др., 1986; de Leval М., Stark J., 1983]. При сопутствующих
пороках летальность повышается незначительно. Госпитальная
летальность у детей раннего возраста после операции сужения
легочной артерии, по данным А. С. Шарыкина (1986), составила
55,5 %; в связи с этим, несмотря на ранний возраст, при ДМЖП
более предпочтительной является радикальная коррекция порока.
Осложнения и летальные исходы обычно связаны с оставшей-
ся высокой легочной гипертензией, негерметичным закрытием
дефекта, развитием полной атриовентрикулярной блокады, недо-
статочности аортального и трехстворчатого клапанов.
При изолированном ДМЖП отдаленные результаты, как пра-
вило, хорошие, толерантность к физической нагрузке прибли-
жается к норме. В различных гемодинамических группах резуль-
таты обследования больных аналогичны данным, полученным при
обследовании пациентов с открытым артериальным протоком
(см. главу 3). Ухудшение состояния и летальные исходы в отда-
ленные сроки после операции (около 2,5 %) связаны с прогрес-
сированием изменений в легочных сосудах, нарушениями сердеч-
ного ритма, развитием полной поперечной блокады сердца.
Если у больных в дооперационном периоде отмечалась высо-
кая легочная гипертензия, то, несмотря на относительную нор-
мализацию показателей гемодинамики после закрытия дефекта,
повышение толерантности к физической нагрузке, улучшение об-
щего самочувствия, показателей развития, рентгенологические и
электрокардиографические признаки порока подвергаются обрат-
ному развитию в более длительные сроки, чем у больных без
легочной гипертензии. Продолжительный период реабилитации
обусловлен остающимися изменениями в легочных сосудах и
миокарда (его гипертрофия). М. Cullen и соавт. (1986) сообща-
ют об успешном применении экстракорпоральной мембранной
оксигенации для предотвращения прогрессирования высокой ле-
гочной гипертензии, так как медикаментозное лечение часто бы-
вает неэффективно.
Неблагоприятные отдаленные результаты могут быть связаны
с рекацализацией дефекта, в результате этого типичные про-
ЦП
явления порока сохраняются, прогрессируют склеротические из-
менения в легочных сосудах, возможно развитие полной атрио-
вентрикулярной блокады.
Нарушения со стороны проводящей системы сердца — до-
вольно частое осложнение после закрытия ДМЖП. Обычно
возникает блокада правой ножки пучка Гиса (нередко полная),
что связано со вскрытием правого желудочка для закрытия
дефекта. Если при чрезжелудочковом доступе блокада правой
ножки пучка Гиса встречается почти в 80 %, то при доступе
через правое предсердие — в 34 % [Rein J. et al., 1977]. Блокада
переднелевой ножки пучка Гиса встречается в 8—17 % случаев;
она опасна в прогностическом отношении из-за возможности
возникновения полной поперечной блокады сердца.
В отдаленные сроки после коррекции ДМЖП с аортальной
недостаточностью у всех больных, как правило, сохраняется
диастолический шум на аорте. Хорошие и удовлетворительные
результаты отмечаются у 71,4 % больных, плохие, требующие
имплантации искусственного аортального клапана — у 28,6 %
[Чиаурели М. Р., 1986]. Причиной прогрессирования аорталь-
ной недостаточности чаще всего является присоединение бакте-
риального эндокардита, имеют значение и гемодинамические
факторы.
АНЕВРИЗМА МЕМБРАНОЗНОЙ ЧАСТИ
МЕЖЖЕЛУДОЧКОВОЙ перегородки
Порок впервые описан R. Laennec в 1826 г. К 1976 г. в литера-
туре приводится более 150 сообщений о нем, в отечественной
литературе наибольшее число наблюдений представлено
В. А. Бухариным и соавт. (1976).
Аневризма мембранозной части межжелудочковой перегород-
ки относится к редкой врожденной патологии, она может быть
изолированной или сочетаться с другими ВПС (ДМЖП, аорталь-
ной недостаточностью, открытым атриовентрикулярным каналом,
боталловым протоком, коарктацией и кинкингом аорты и др.).
В силу разности давления в желудочках аневризма пролаби-
рует в полость правого желудочка. Она обычно находится под
септальной створкой трикуспидального клапана или может вы-
ступать непосредственно в его основание, полость правого пред-
сердия, выходной отдел правого желудочка. Величина аневризмы
обычно 1—2 см, реже она достигает 6—10 см в диаметре.
При неосложненном течении порока аневризма межжелудоч-
ковой перегородки клинически не проявляется и может быть слу-
чайной находкой при эхокардиографии, ангиокардиографии, ау-
топсии. Иногда заподозрить аневризму можно по раннему систо-
лическому тону и кликам, выслушиваемым слева внизу у груди-
ны. На ФКГ клики фиксируются через 100—130 мс после зубца
Q ЭКГ. В аневризме может быть дефект (с рцждения или в
результате ее разрыва) с левоправым сбросом крови, чаще не-
108
значительным, при этом выслушивается грубый систолический
шум в четвертом межреберье слева. Осложненное течение ха-
рактеризуется развитием аортальной или трикуспидальной недо-
статочности, стенозом легочной артерии, появлением нарушений
сердечного ритма и проводимости.
Поставить диагноз аневризмы мембранозной части межжелу-
дочковой перегородки можно при эхокардиографическом иссле-
довании. При одномерной эхокардиографии у больных с аневриз-
мой межжелудочковой перегородки регистрируются множествен-
ные фрагментированные эхосигналы от перегородки, обращенные
выпуклостью кпереди в область выводного тракта правого желу-
дочка, исчезающие в фазе диастолы. Аневризма межжелудочко-
вой перегородки, образовавшаяся после спонтанного закрытия
дефекта, может давать аналогичное эхокардиографическое изо-
бражение, но чаще расположенное ниже (в полости правого
желудочка). С помощью двухмерной эхокардиографии аневризма
межжелудочковой перегородки легко выявляется в проекции
длинной оси и коротких сечениях левого желудочка по выбуха-
нию контура перегородки в сторону правого желудочка. Стенки
аневризмы, как правило, истончены, выбухание усиливается в си-
столу. Наряду с этим эхокардиография позволяет выявить на-
рушение функции трикуспидального клапана либо обструкцию
правого желудочка, вызванную аневризмой.
При катетеризации полостей сердца повышение давления в
правых отделах наблюдается крайне редко и обычно связано с
сопутствующими пороками. Аневризма хорошо определяется при
левой вентрикулографии в боковой проекции, так как в большин-
стве случаев она располагается под правой коронарной створкой.
Хирургическое лечение показано, если имеются гемодинамиче-
ские нарушения при сочетании с ДМЖП, сужением выводного
отдела правого желудочка, аортальной или трикуспидальной не-
достаточностью. Оно заключается в коррекции сопутствующего
порока и «пликации» аневризмы отдельными швами, укреплен-
ными прокладками.
Глава 7. ОТКРЫТЫЙ АТРИОВЕНТРИКУЛЯРНЫЙ КАНАЛ
Открытый атриовентрикулярный канал (АВК) — это комби-
нированный ВПС, при котором имеется сообщение между пред-
сердиями и желудочками, обусловленное дефектом межпредсерд-
ной (ДМПП) и межжелудочковой перегородок (ДМЖП), а так-
же расщеплением створок митрального и трикуспидального кла-
панов. Синонимы: дефекты эндокардиальных валиков (подуше-
чек), персистирующее общее атриовентрикулярное отверстие,
предсердно-желудочковое сообщение и др.
Различные варианты порока составляют 2—3 % всех ВПС
[Bankl Н., 1980].
Анатомически выделяют 4 основные формы открытого АВК:
109
1) частично открытый АВК (неполная форма); 2) косой атрио-
вентрикулярный канал — левожелудочково-правопредсердное со-
общение; 3) общий открытый АВК (полная форма); 4) общее
предсердие.
ЧАСТИЧНО ОТКРЫТЫЙ атриовентрикулярный канал
Частично открытый атриовентрикулярный канал представляет
собой первичный ДМПП с расщеплением передней митральной
створки, в редких случаях — перегородочной трикуспидальной
створки; имеются два разделенных атриовентрикулярных кольца.
Синонимы: неполная форма АВК; промежуточный вариант пер-
систирующего АВК; дефект эндокардиальных подушечек, сте-
пень II.
Первое сообщение об этом пороке принадлежит Т. В. Peacock
(1846). Частота его составляет 1,2 % всех ВПС [Bankl Н., 1980].
Анатомия, классификация. При патологоанатомическом ис-
следовании обращают на себя внимание отсутствие нижней части
межпредсердной перегородки (первичный ДМПП) и расщепле-
ние пристеночных створок атриовентрикулярных клапанов (рис. 23).
В. И. Бураковский и соавт. (1974) выделяют в этой форме
открытого АВК два типа порока: с ДМПП и с ДМЖП. При каж-
дом из этих типов могут иметь место аномалии створок митраль-
ного, трикуспидального или обоих клапанов одновременно. Атри-
овентрикулярные кольца сформированы правильно.
ДМПП расположен над створками. Атриовентрикулярные
клапаны сформированы и прикрепляются на одном уровне к
верхнему краю межжелудочковой перегородки, который обычно
имеет небольшую выемку. Передняя створка митрального клапа-
на расщеплена. Расщепление может быть полным (до основания
створки), неполным и в виде диастаза. Низкое крепление перед-
ней створки приводит к сужению выводного тракта левого же-
лудочка, однако градиент давления возникает крайне редко.
Изолированный первичный ДМПП без расщепления створки
митрального клапана встречается казуистически редко.
При наличии ДМЖП он локализуется в мембранозной части
межжелудочковой перегородки под основанием септальной створ-
ки трикуспидального клапана. Передняя створка митрального
клапана расщеплена. Кольцо трикуспидального клапана форми-
рует край дефекта и его створка может быть также расщеплена.
Нередко края створок митрального клапана подвернуты и
утолщены. Расщепленная створка может быть фиксирована до-
полнительными хордами, идущими от межжелудочковой перего-
родки; иногда имеется аномальное крепление и папиллярных
мышц. Расщепление септальной створки трикуспидального кла-
пана обычно незначительное (всегда сочетается с выраженным
расщеплением створки митрального клапана) и редко имеет
функциональное значение, поскольку компенсируется другими
створками.
по
Рис. 23. Схема частично открытого
атриовентрикулярного канала.
А
В 15—20 % случаев
Исследования проводя-
щей системы сердца обнару-
жили следующие изменения:
смещение кзади атриовен-
трикулярного узла и пучка
Гиса из-за дефекта эндокар-
диальных подушечек, ран-
нее отхождение левой ножки
и смещение к задним отде-
лам межжелудочковой пере-
городки дистальных ее раз-
ветвлений, гипоплазию пе-
редней левой ветви.
Наиболее частыми сопут-
ствующими ВПС являются
аномалии полых вен, ботал-
лов проток, изолированная
левокардия, двойной митральный клапан,
имеют место аномалии селезенки (аспления, полиспления); не-
редко порок сочетается с синдромами Дауна и трисомии 13.
Гемодинамика. Артериовенозный сброс крови при неполной
форме открытого АВК происходит на уровне предсердий и,
одновременно, через расщепленную створку митрального клапана
поток крови направлен из левого желудочка в левое предсердие
(митральная недостаточность), следовательно, имеет место объ-
емная перегрузка обоих желудочков (см. рис. 23). В большин-
стве случаев первичный ДМПП достаточно велик, поэтому дав-
ление в предсердиях уравновешено; при малых размерах ДМПП
возможно повышение давления в левом предсердии, легочных
капиллярах и формирование в дальнейшем умеренной легочной
гипертензии (венозная, посткапиллярная). В связи с тем что
дополнительное количество крови при регургитации поступает
больше в правое предсердие, левое предсердие может быть лишь
умеренно дилатировано. В то же время левый желудочек бывает
резко расширенным, конечно-диастолическое давление в нем не-
редко повышено. Трикуспидальная недостаточность, если таковая
имеется, не определяет состояние гемодинамики. Несмотря на
то что имеется левоправый сброс крови на уровне предсердий,
высокой артериальной легочной гипертензии при неполной форме
АВК, как правило, не бывает.
Клиника, диагностика. Частично открытый АВК почти в 3 ра-
за чаще встречается у лиц женского пола. Клинические прояв-
ления порока зависят как от величины ДМПП, так и от степени
выраженности недостаточности митрального клапана. При уме-
ренной степени недостаточности .митрального клапана течение
заболевания приближается к таковому при изолированном
И)
Рис. 24. Частично открытый атриовентрикулярный канал. ЭКГ.
Электрическая ось сердца отклонена влево (Z.a =—58°). блокада передней левой
и правой ветвей пучка Гиса, комплекс QRS в Vi типа rSR1, гипертрофия миокарда
обоих желудочков.
ДМПП (см. главу 5), тогда как при значительной регургитации
с первых дней и месяцев жизни состояние больных тяжелое,
отмечаются отставание в физическом и моторном развитии, по-
вторные ОРВИ, признаки сердечной недостаточности как по лево-,
так и по правожелудочковому типу с застойными влажными
хрипами в легких, рано развивается сердечный горб.
При пальпации верхушечный толчок усилен, на верхушке сле-
ва у ’/4 больных определяется систолическое дрожание, при аус-
культации выслушиЬаются два разных по тембру и локализации
шума: на верхушке — систолический шум недостаточности мит-
рального клапана с проводимостью в левую аксиллярную об-
ласть; во втором и третьем межреберье слева — систолический
шум ДМПП. Если из-за особенностей расщепления митрального
клапана сброс крови направлен больше в правое, чем в левое,
предсердие, систолический шум недостаточности митрального
клапана иррадиирует преимущественно на основание сердца.
Систолический шум недостаточности трехстворчатого клапана,
связанный- с расщеплением его створки, или мезодиастоличе-
ский шум относительного его ’теноза (увеличенный кровоток)
нередко не определяются, так как перекрываются другими более
интенсивными шумами. II тон над легочной артерией расщеплен;
единый II тон, как признак высокой легочной гипертензии, встре-
чается редко.
ЭКГ значительно помогает в установлении диагноза АВК
(рис. 24). В первую очередь это касается отклонения электри-
ческой оси сердца влево, которое отмечается у 60—70 % больных
с неполной формой АВК и связано с аномалией проводящей
системы сердца; Z.aAQRS от —20 до —60°, реже до —130°.
Сочетание митральной недостаточности с такой левограммой
указывает на наличие открытого АВК. В редких случаях электри-
112
ческая ось отклонена вправо. Другой особенностью является
перегрузка правого желудочка, что выражается увеличением
амплитуды зубцов R{>t формой QRS в виде rSR', rR', возможны
признаки перегрузки левого предсердия, левого желудочка
(у больных с преобладающей недостаточностью митрального
клапана без легочной гипертензии); удлинение интервала PR.
При легочной гипертензии на ЭКГ появляются признаки систоли-
ческой перегрузки правого желудочка. У взрослых больных воз-
можны приступы пароксизмальной тахикардии.
На ФКГ II тон над легочной артерией расщеплен (0,03—
0,06 с), легочный компонент его усилен, фиксируются III и IV
тоны сердца. Во втором и третьем межреберье определяется
ромбовидный или веретенообразный систолический шум, зани-
мающий 2/з или всю систолу (шум ДМПП); на верхушке — сис-
толический шум недостаточности митрального клапана, связан-
ный с I тоном (убывающий или лентообразный). У половины
больных на верхушке сердца регистрируются мезодиастоличе-
ский или пресистолический шум небольшой амплитуды.
На рентгенограмме при частично открытом АВК легочный
рисунок усилен как по артериальному, так и по венозному руслу
(признак левожелудочковой недостаточности при значительной
митральной регургитации). Дуга легочной артерии умеренно вы-
бухает. Форма сердца может быть различной в зависимости от
размера дефекта и выраженности митральной недостаточности.
При небольшом ДМПП преобладают проявления митральной не-
достаточности, отмечается увеличение левого предсердия, левого
желудочка, в связи с чем верхушка сердца погружена в диаф-
рагму, возможна кардиомегалия (форма сердца напоминает та-
ковую при дилатационной кардиомиопатии). Для большого
ДМПП характерно увеличение правого предсердия.
При эхокардиографическом исследовании у детей с частично
открытым АВК обнаруживаются признаки первичного ДМПП
(перерыв эхосигнала от перегородки); аномалии митрального
клапана (сближение фиброзного кольца клапана и межжелудоч-
ковой перегородки, эхо от передней створки прослеживается
до передней стенки аорты, дополнительные эхосигналы от ано-
мально прикрепленных к межжелудочковой перегородке хорд
расщепленной передней митральной створки, характерная форма
движения передней створки — во время диастолы она как бы
«прилипает» к межжелудочковой перегородке); признаки изме-
нения трикуспидального клапана (начало систолического сегмен-
та кривой клапана непосредственно над межжелудочковой пе-
регородкой); признаки объемной перегрузки правого желудочка.
Дополнительными признаками порока являются сужение вывод-
ного тракта левого желудочка, дилатация правых отделов серд-
ца, парадоксальное движение межжелудочковой перегородки.
При двухмерном эхокардиографическом исследовании в проекции
4 камер с верхушки выявляется первичный дефект межпред-
сердной перегородки, межжелудочковая перегородка и трикуспи-
111
Рис. 25. Частично открытый атриовентрикулярный канал. Левая ве
грамма. Контрастное вещество, введенное в ЛЖ, поступает в Ао, о
также коитрастированне ЛП
дальний клапан не изменены. В коротком сечении левог
дочка на уровне клапана определяется расщепление г
митральной створки.
При введении катетера в правый желудочек во врем:
рования полостей сердца он легко проходит из правого
дия через ДМПП в левое предсердие и левый желудоче!
шенное насыщение крови кислородом отмечается на ypoi
вого предсердия и увеличивается дальше в правом желч
легочной артерии (признак сброса на двух уровнях). Г
тичном открытом АВК показатели давления в легочной
и общелегочного сопротивления нормальные или умерс
вышены, обнаруживается градиент давления между лего1
терией и правым желудочком, как при ДМПП (функцио
легочный стеноз).
Особое диагностическое значение имеет левосторонн:
рикулография (рис. 25), выявляющая типичный призна!
того АВК — сужение и деформацию путей оттока из ле!
лудочка («симптом гусиной шеи»), свидетельствующий о
лении створки митрального клапана (на рис. указаш
кой). Из левого желудочка контрастное вещество noci
правое и левое предсердия.
114
Дифференциальный диагноз частично открытого АВК следует
проводить со вторичным ДМПП, врожденной митральной недо-
статочностью, хроническим миокардитом и кардиомиопатией,
ОАП с митрализацией.
Течение, лечение. Естественное течение порока определяется
размерами ДМПП и выраженностью митральной недостаточности.
Тяжелые формы проявляют себя в первые месяцы и годы жизни
и требуют ранней хирургической коррекции. При легких формах
порока жалобы могут отсутствовать, а заболевание проявляться
только аускультативной симптоматикой; больные доживают до
взрослого возраста и сохраняют работоспособность аналогично
тому, как это наблюдается при вторичных ДМПП Описаны еди-
ничные случаи, когда больные доживали до 60 и более лет. Одна-
ко большинство больных без операции умирают до 20—30-летне-
го возраста от сердечной недостаточности, легочной гипертензии,
бактериального эндокардита, нарушений сердечного ритма.
Показания к операции. В связи с тем что легочная
гипертензия при частично открытом АВК наблюдается редко,
корригирующую операцию целесообразно проводить в 6—10 лет,
когда можно получить оптимальные результаты функционально-
го состояния митрального клапана в отдаленные сроки. Противо-
показанием к операции является острый бактериальный эндокар-
дит.
Операция заключается в восстановлении целостности перед-
ней створки митрального клапана, что достигается наложением
отдельных швов; первичный ДМПП закрывается заплатой. При
необходимости может быть выполнена пластическая операция и
на трикуспидальном клапане. Потребность в протезировании
митрального клапана возникает довольно редко и обусловлена
чаще всего сопутствующей патологией — двойным митральным
клапаном.
Хирургическая летальность колеблется от 3,7 до 6,7 % при
изолированной форме порока [Бухарин В. А., Подзолков В. П.,
1982; Фальковский Г. Э., Бузинова Л. А., 1986; Бураковский В. И.
и др., 1989] и 14 % при сочетании с другими ВПС [Studer М. et
al., 1982]. Летальные исходы чаще отмечаются у детей раннего
возраста с малой массой тела, имеющих тяжелую митральную
недостаточность и кардиомегалию. Среди осложнений, ведущих к
летальному исходу, можно выделить сердечную недостаточность
из-за неадекватной коррекции митрального клапана, сужения в
субаортальном тракте, полную атриовентрикулярную блокаду,
протезирование клапана у младенцев, нарушения сердечного
ритма.
Отдаленные результаты операции при частично открытом
АВК, несмотря на сохранение у многих больных остаточного
шума недостаточности митрального клапана, как правило, хоро-
шие. Выживаемость больных через 20 лет после операции состав-
ляет 94 %, и лишь 5 % из них требуют повторного вмешатель-
ства на митральном клапане [McMullan М. et al., 1973].
115
При этом варианте порока имеются сливающиеся первичный
ДМПП и высоко расположенный ДМЖП, отсутствует деление
на правое и левое венозные отверстия и полностью расщеплены
передне-медиальная митральная и септальная трикуспидальная
створки (рис. 26). Синонимы: полный общий АВК; дефект эндо-
кардиальных подушечек, степень III.
Частота этого ВПС по патологоанатомическим данным сос-
тавляет от 4,7 до 6,5 % [Bankl Н., 1980], нередко он сочетается
с болезнью Дауна.
Анатомия, классификация. При этом пороке фактически в
центре сердца имеется отверстие, через которое сообщаются
все четыре его камеры. Оно состоит из дефектов межпредсерд-
ной и межжелудочковой перегородок, аномального атриовентри-
кулярного клапана, общего для обоих желудочков и образован-
ного передней и задней створками, связанными с перегородкой,
и двумя латеральными створками, каждая из которых связана
со стенкой одного из желудочков.
Из других ВПС можно отметить левую верхнюю полую вену,
клапанный стеноз легочной артерии, аномальный дренаж легоч-
ных и системных вен.
Гемодинамика. При общем открытом АВК все четыре камеры
сообщаются между собой. Гемодинамика сочетает в себе измене-
ния, имеющиеся при большом межпредсердном дефекте (см. гла-
ву 5), большом межжелудочковом дефекте (см. главу 6), и до-
полняется недостаточностью атриовентрикулярных клапанов.
В конечном счете имеется выраженная объемная перегрузка
правых отделов из-за большого левоправого сброса, направляю-
щегося в результате в легочную артерию. Очень рано возникает
и быстро прогрессирует легочная гипертензия с развитием реак-
ции Эйзенменгера (см. главу 6). Течение порока более благопри-
ятное, если имеется сопутствующий стеноз легочной артерии.
Клиника, диагностика. С первых же дней после рождения
наблюдается тяжелое клиническое течение. Отставание в физи-
ческом развитии, повторные пневмонии, снижение аппетита,
утомляемость при кормлении, раннее развитие сердечного горба,
признаки сердечной недостаточности в виде тахипноэ, тахикар-
дии, застойных хрипов в легких, увеличения печени являются
характерными для детей с открытым общим АВК в первые дни
и месяцы жизни. Сердечная недостаточность при общем откры-
том АВК у детей и взрослых отличается рефрактерностью к про-
водимой терапии. Цианоз при этой форме АВК указывает на
праволевый (веноартериальный) сброс крови на уровне общего
отверстия, он возникает в случаях высокой легочной гипертен-
зии (реакция Эйзенменгера) или сопутствующего стеноза легоч-
ной артерии. Наличие последнего делает течение порока более
благоприятным, так как предотвращает развитие легочной гипер-
тензии.
116
Рис. 26. Схема общего открытого ат-
риовентрикулярного канала.
При кардиомегалии рано
развивается сердечный горб.
Систолическое дрожание опре-
деляется в четвертом межре-
берье и/или над верхушкой
сердца. При аускультации I
тон усилен в позиции трехст-
ворчатого клапана, II тон ак-
центирован и стойко расщеп-
лен, при легочной гипертензии
выслушивается единый усилен-
ный II тон. В случаях общего
открытого АВК вдоль левого
края грудины выслушивается
грубый широко иррадиирую-
щий продолжительный систо-
лический шум ДМЖП с максимумом в третьем и четвертом меж-
реберьях. Систолический шум недостаточности митрального кла-
пана выслушивается на верхушке сердца, проводится в левую
аксиллярную область, но может перекрываться шумом ДМЖП.
На верхушке часто выслушивается мезодиастолический шум
(показатель большого артериовенозного сброса). При сопут-
ствующем стенозе легочной артерии во втором и третьем межре-
берьях слева определяется грубый систолический шум, II тон
над легочной артерией ослаблен.
На ЭКГ почти у всех больных отмечается характерное
отклонение электрической оси сердца влево, причем Z.AQRS
чаще превышает —90 ° (рис. 27). Вольтаж комплексов QRS вы-
сокий, имеются признаки перегрузки левого предсердия (расши-
ренные, двугорбые зубцы Ра, vs с, увеличенная отрицательная
волна зубца Pvt, левого желудочка (высокие зубцы Rv-^ с фор-
мой комплекса QRS типа qR), неполной блокады правой ножки
пучка Гиса; при развитии легочной гипертензии преобладают
признаки перегрузки правых отделов сердца, но всегда сохраня-
ются проявления гипертрофии левого желудочка. Почти у поло-
вины больных имеется замедление атриовентрикулярной проводи-
мости. У взрослых появляются аритмии (мерцание предсердий,
экстрасистолия).
Несмотря на яркую аускультативную симптоматику, ФКГ
при общем открытом АВК имеет вспомогательное значение. Фик-
сирующийся на ФКГ шум является результатом слияния шума
ДМЖП, недостаточности митрального клапана и относительного
стеноза легочной артерии. II тон над легочной артерией всегда
расщеплен, легочный компонент его увеличен (исключение со-
ставляют случаи с сопутствующим стенозом легочной артерии,
когда он ослаблен). При высокой легочной гипертензии расщеп-
117
ление II тона исчезает, он становится единым, высок
тудным.
На рентгенограмме при открытом общем АВК легоч
сунок значительно усилен по артериальному и венозном
имеются признаки высокой легочной гипертензии. Тень
резко увеличена в размерах за счет всех четырех камер, с
левого предсердия и правых отделов. Несмотря на нали»
ральной недостаточности, левый желудочек может быть у
умеренно. При сочетании со стенозом легочной артерии
ния в малом круге кровообращения незначительны, сер/
ренно увеличено в размерах, верхушка закруглена, при
над диафрагмой, талия западает (напоминает форму
при тетраде Фалло).
Одномерная эхокардиография при данном пороке пс
выявить несколько вариантов движения атриовентрию
клапанов. При первом типе передняя митральная створк
при частично открытом АВК, приближается («прилип
межжелудочковой перегородке; при втором типе общая п
атриовентрикулярная створка пересекает межжелудочке
регородку; при третьем видно раздельное диастолическо<
тие митрального и трикуспидального клапанов, которые
ляются одновременно; при четвертом регистрируется
контур митральной створки в диастолу. Косвенными прог
ми порока являются сужение выводного тракта левого я
118
Рис. 28. Открытый общий атриовентрикулярный канал. Эхокардиограмма.
ка, парадоксальное движение межжелудочковой перегородки,
дилатация правого желудочка и левого предсердия.
Двухмерная эхокардиография позволяет непосредственно оп-
ределить морфологическую и гемодинамическую характеристики
порока. В проекции 4 камер с верхушки выявляются дефект
нижней части межпредсердной перегородки в области соединения
с атриовентрикулярными клапанами, дефект межжелудочковой
перегородки, наличие двух или одного (общего.) атриовентрику-
лярного клапана (рис. 28).
Общий открытый АВК может сочетаться с единым предсерди-
ем. При одномерном эхокардиографическом обследовании выяв-
ляется симптоматика объемной перегрузки правых отделов, в
более тяжелых случаях - легочная гипертензия. Двухмерная
эхокардиография из апикального доступа позволяет определить
большую предсердную полость без разделяющей перегородки, а
также сопутствующие аномалии атриовентрикулярных клапанов.
При зондировании полостей сердца катетер легко попадает
во все камеры. Давление в легочной артерии и общелегочное
сопротивление часто значительно повышены. Насыщение крови
кислородом одинаково высокое, начиная с правого предсердия
(кислородный «скачок» не идентифицирует другие уровни сбро-
са). При высокой легочной гипертензии констатируется пере-
крестный или праволевый сброс (см. главу 6). Основное
диагностическое значение имеет левая вентрикулография и ско-
ростная рентгенокинематография в прямой и боковой проекциях,
позволяющие увидеть симптом «гусиной шеи» (см. рис. 25),
митральную недостаточность, ДМЖП и сброс артериальной кро-
ви в правые отделы сердца.
Дифференциальный диагноз общего открытого АВК следует
проводить с ДМЖП, кардиомиопатией, единственным желудоч-
ком, двухкамерным сердцем.
Течение, лечение. При естественном течении порока, по дан-
ным Т. Berger и соавт. (1978), 65 % больных умирают на первом
году жизни, 85 % — к концу второго года жизни и 96 % —
к 5 годам. Описаны единичные случаи, когда больные жили дли-
тельно, но были тяжелыми инвалидами. Учитывая, что легочная
119
гипертензия при общем открытом АВК рано осложняется склеро-
тическими измененими в легочных сосудах, методом выбора
следует считать раннее хирургическое вмешательство.
Коррекция открытого общего АВК является одной из слож-
нейших проблем кардиохирургии [Бураковский В. И. и др.,
1989]. При больших ДМЖП применяется операция G. Rastelli
и соавт. Она заключается в разделении общих передней и задней
створок на митральную и трикуспидальную части, закрытии
ДМЖП заплатой, создании перегородочных митральной и три-
куспидальной створок с помощью сшивания передней и задней
частей, закрытии заплатой первичного ДМПП. Для закрытия
дефектов может применяться одна или две заплаты. Летальность
после такой операции составляет 25—50 %.
При недостаточной квалификации хирургов для выцолнения
радикальной операции у детей раннего возраста показана опе-
рация Мюллера — Альберта (сужение легочной артерии).
Особые трудности встречаются при коррекции открытого об-
щего АВК, сочетающегося со стенозом легочной артерии, так
как коррекция стеноза часто должна включать вскрытие и рас-
ширение заплатой выводного отдела правого желудочка.
Послеоперационная летальность у детей первых лет жизни
колеблется от 13 до 32 % [Фальковский Г. Э., Бузинова Л. А.,
1986; Mair J. et al., 1977; Cooper T. et al., 1979]; в старшей
возрастной группе она снижается до 10 % [Stark J., de Leval Н.,
1983]. Осложнения и летальные исходы после операции обычно
связаны с легочной или сердечной недостаточностью (из-за
оставшегося высокого давления в легочной артерии, полной бло-
кады, неполной коррекции порока — оставшейся митральной не-
достаточности), присоединением инфекционного процесса.
При адекватно выполненной операции отдаленные результаты
хорошие. Практически у всех пациентов наблюдается остаточный
шум на митральном клапане, функциональное состояние которо-
го в основном и определяет результаты операции. Необходи-
мость повторных операций в отдаленном периоде чаще всего свя-
зана также с выраженной дисфункцией митрального клапана.
Описаны случаи внезапной смерти.
ЛЕВОЖЕЛУДОЧКОВО-ПРАВОПРЕДСЕРДНОЕ СООБЩЕНИЕ
Врожденное левожелудочково-правопредсердное сообщение в
литературе описывается под различными названиями: двойное
трикуспидальное отверстие, изолированный ДМЖП по типу пер-
систирующего АВК. Термин «косой АВК» предложен А. А. Виш-
невским и Н. К- Таланкиным в 1962 г. Первое описание принад-
лежит J. Thurnam (1838) и В. Buhl (1857). Частота этого по-
рока составляет менее 1 % всех ВПС по данным аутопсий.
В. И. Бураковский и соавт. (1974), М. Robert и соавт. (1964)
относят левожелудочково-правопредсердное сообщение к откры-
тому АВК, так как порок является одним из вариантов дефекта
120
Рис. 29. Схема взаимоотно-
шений мембранозной перего-
родки с атриовентрикулярны-
ми клапанами в норме (а) и
при различных типах левоже-
лудочково-правопредсердного
сообщения (б).
1 — мембранозная перего-
родка; 2 — ее атриовентрику-
лярная часть; 3 — ее межже-
лудочковая часть; 4 — створка
митрального клапана; 5 —
створка трикуспидального кла-
пана.
атриовентрикулярной перегородки, включая аномалии атриовен-
трикулярных клапанов. Однако не все авторы согласны с вклю-
чением этого порока в структуру АВК.
Анатомия, классификация. Левожелудочково-правопредсерд-
ное сообщение представляет собой один из вариантов дефектов
атриовентрикулярной перегородки, под которой подразумевается
атриовентрикулярная часть мембранозной межжелудочковой пе-
регородки; в формировании последней принимают участие атрио-
вентрикулярные эндокардиальные подушечки. В связи с тем что
трикуспидальный клапан в норме расположен ниже уровня мит-
рального, атриовентрикулярная перегородка отделяет левый же-
лудочек от правого предсердия (рис. 29).
По характеру сообщения порок разделяется на две основные
формы: с надклапанными и подклапанными (инфравальвулярны-
ми) дефектами; возможны их сочетания. Надклапанные дефекты
локализуются в атриовентрикулярной перегородке непосредствен-
но над перегородочной створкой трикуспидального клапана. Под-
клапанные дефекты косого канала обязательно сочетаются с от-
верстием в септальной створке трикуспидального клапана. Это
может быть обусловлено четырьмя причинами: перфорацией, рас-
щеплением, недоразвитием створки, расширением передней или
задней комиссуры септальной створки. Митральный клапан и
межпредсердная перегородка при этом сформированы правильно.
Дефект при подклапанном косом канале может быть; 1) пе-
редним — непосредственно в мембранозной части межжелудочко-
вой перегородки под передней частью септальной створки; 2)
центральным — в мембранозной части перегородки и прилежа-
щей мышечной части перегородки под септальной створкой;
3) дефект типа общего атриовентрикулярного канала, занимаю-
щий основание межжелудочковой перегородки.
Почти в */з случаев имеются сопутствующие ВПС: ДМПП,
подклапанный стеноз аорты, двустворчатый аортальный клапан,
ДМЖП.
121
Рис. 30. Левожелудочково-правопредсердное сообщение. Эхокардиограмма.
Гемодинамика. При всех формах левожелудочково-право-
предсердного сообщения струя крови из левого желудочка непо-
средственно направлена в правое предсердие, что приводит к
объемной перегрузке правого желудочка, расширению ствола ле-
гочной артерии. Высокая легочная гипертензия практически не
развивается.
Клиника, диагностика. Клинические проявления при косом
канале напоминают таковые при ДМПП (см. главу 5) с отчет-
ливыми признаками большого сброса. При аускультации же
выслушивается систолический шум ДМЖП, но максимум шума
располагается вдоль правого края грудины.
На ЭКГ электрическая ось сердца расположена нормально
или вертикально, реже отклонена влево и не бывает в «немом»
секторе. Одним из характерных признаков является перегрузка
правого предсердия (увеличение амплитуды зубца Рп и положи-
тельной фазы PV1), особенно при инфравальвулярной форме.
Атриовентрикулярная проводимость не изменена. У большинства
больных имеются проявления неполной блокады правой ножки
пучка Гиса (форма QRS в отведении Vi типа rsR'S', rSR' и др.,
т.е. признаки диастолической перегрузки правого желудочка),
признаки гипертрофии правого и левого желудочков (преимуще-
ственно при инфравальвулярной форме). ФКГ не имеет диагно-
стического значения.
На рентгенограмме при косом канале имеются признаки уве-
личения правого предсердия и обоих желудочков. Обращают на
себя внимание признаки, характерные для ДМЖП, но со значи-
тельной правой атриомегалией.
На эхокардиограмме в двухмерном режиме видны ДМЖП,
аномалии (расщепление) трехстворчатого клапана, левожелу-
дочково-правопредсердное сообщение (рис. 30). В проекции 4
камер с верхушки видно сообщение между ДЖ и ПП (на рис. 30
указано стрелкой), которое проходит над перегородочной створ-
кой тк.
При катетеризации сердца увеличение давления в легочной
артерии отмечается довольно редко. Повышение насыщения кро-
ви кислородом начинается с уровня правого предсердия из-за
122
Рис. 31. Левожелудочково-лравопредсердниг сообщение. Левая вентрикулограм-
ма.
прямого сброса артериальной крови в него из левого желудочка.
При левой вентрикулографии четко выявляется поступление
контрастного вещества непосредственно из левого желудочка в
правое предсердие, симптом «гусиной шеи» отсутствует (рис. 31).
Дифференциальный диагноз косого канала следует проводить
с ДМПП, ДМЖП, аномальным дренажем легочных вен, частич-
но открытым АВК-
Течение, лечение. Больные с косым каналом имеют относи-
тельно благоприятный прогноз, могут доживать до взрослого воз-
раста, однако всем им на том или ином этапе показано хирур-
гическое лечение.
Показания к операции определяются жалобами больных на
частые респираторные инфекции и ограничения в физических
нагрузках, явлениями кардиомегалии, легочной гипертензии и на-
рушениями кровообращения. Крайне редко требуется операция
в раннем детском возрасте. Оптимальным возрастом для опера-
тивного лечения, очевидно, следует считать 6 10 лет. Коррек-
ция порока заключается в закрытии (отдельными швами или
заплатой) сообщения между левым желудочком и правым пред-
сердием и пластической операции на трикуспидальном канале
(ликвидация расщепления перегородочной створки или широкой
комиссуральной поверхности). Поскольку порок редко осложня-
ется легочной гипертензией, то хирургическое лечение сопро-
123
вождается обычно низкой летальностью. Анализ отдаленных ре-
зультатов свидетельствует о практически полном выздоровлении
пациентов.
Глава 8. ПОРОКИ РАЗВИТИЯ ЛЕГОЧНОЙ АРТЕРИИ
ИЗОЛИРОВАННЫЙ СТЕНОЗ ЛЕГОЧНОЙ АРТЕРИИ
Изолированный стеноз легочной артерии (ИСЛА) относится
к числу распространенных ВПС и встречается в 6,8—9 % всех
пороков [Бураковский В. И., Иваницкий А. В., 1982; Bankl Н.,
1980] одинаково часто у мальчиков и девочек. Первое описание
принадлежит S. De Senae (1749) и G. В. Morgagni (1761).
Анатомия, классификация. Морфологически ИСЛА неодноро-
ден. Н. Bankl (1980) предлагает выделять следующие его вари-
анты.
1. Стеноз клапанов легочной артерии (ЛА) с интактной межжелудочковой
перегородкой (рис. 32). Сужение расположено в области клапанов легочной
артерии и чаще представлено диафрагмой с центральным или эксцентричным
отверстием диаметром от 1 до 10 мм. Клапанное кольцо гипоплазировано.
У 2 % больных имеется двустворчатый клапан ЛА. При тяжелых стенозах чаще
у взрослых больных возможно отложение кальция в створках. В других случаях
ИСЛА является результатом дисплазии створок легочной артерии, они ригидны,
неподвижны, резко утолщены. Выявляют отклонения и в структуре клапанного
кольца, которое полностью отсутствует, и створки отходят непосредственно от
легочного ствола, иногда в кольце отмечают значительное увеличение миксома-
тозной ткани. Выше места стеноза отмечают постстенотическое расширение ствола
легочной артерии, реже он гипоплазирован.
2. Инфундибулярный стеноз с интактной межжелудочковой перегородкой
может образовываться за счет фиброзно-мышечной полосы у места соединения
полости правого желудочка и инфундибулума либо за счет гипертрофированных
мышц, формирующих суженный выход из правого желудочка и располагающихся
непосредственно под клапанами ЛА или ниже, в выводном тракте. Инфундибу-
лярный стеноз может сочетаться с клапанным.
3. Суправальвулярный (надклапанный) стеноз легочной артерии и ее ветвей
(может сочетаться с клапанным).
4. Стеноз выходного отдела правого желудочка вследствие аномалии
мышц. Синонимы: двухкамерный правый желудочек, двойной правый желудочек,
трехжелудочковое сердце. В этом случае имеется субинфундибулярная мышеч-
ная преграда, разделяющая желудочек на проксимальную камеру с высоким
давлением и дистальную — с низким. Этот вариант порока обычно сочетается с
ДМЖП.
5. Атрезия ЛА с интактной межжелудочковой перегородкой (см. главу 16).
6. Отсутствие 6-й дуги аорты приводит к атрезии или отсутствию ее про-
изводных (ствола и ветвей легочной артерии, артериального протока); лег-
кие снабжаются кровью через крупные бронхиальные артерии, всегда имеется
ДМЖП.
Кроме анатомического варианта стеноза, необходимо выде-
лять случаи с наличием или отсутствием ДМПП или открытого
овального окна (около 10 % всех больных с ИСЛА), через кото-
рые разгружается правое предсердие и чем объясняются особен-
ности цианоза. В отечественной литературе такое, сочетание
иногда называют триадой Фалло.
Миокард правого желудочка, межжелудочковой перегородки,
124
Рис. 32. Схема клапанного стеноза ле-
гочной артерии.
папиллярных мышц при ИСЛА
гипертрофирован соответствен-
но выраженности стеноза, опи-
саны случаи сопутствующей
кардиомиопатии как проявле-
ние врожденной дисплазии ми-
окарда; при выраженном сте-
нозе миокард плотный из-за
диффузного кардиосклероза,
возможны изменения по типу
инфаркта миокарда, что явля-
ется следствием дефицита ко-
ронарного кровотока. Именно
состояние миокарда при ИСЛА
во многом определяет продолжительность жизни, время появле-
ния сердечной недостаточности, характер послеоперационного
течения. Полость правого желудочка уменьшена, а при выра-
женном стенозе может быть дилатирована, увеличена полость
правого предсердия. Трехстворчатый клапан часто имеет призна-
ки дисплазии, что способствует возникновению его недостаточно-
сти и кальцификации. Аорта и левый желудочек не изменены.
Гемодинамика. Если есть препятствие к выбросу крови из
правого желудочка, то систолическое давление в нем значитель-
но повышается (до 200 мм рт. ст.). В результате этого образу-
ется систолический градиент давления между правым желудоч-
ком и легочной артерией, что обеспечивает сохранность сердеч-
ного выброса. У больных с тяжелой формой ИСЛА давление
в правом предсердии повышается. На фоне повышенного давле-
ния в правом предсердии при наличии ДМПП или открытого
овального окна возникает веноартериальный сброс, при меньшей
степени стеноза сброс может быть артериовенозным. Величина
сброса крови наряду с выраженностью стеноза определяет
клинические особенности цианоза (от малинового до темно-
синего). Следует заметить, что степень стеноза с возрастом
увеличивается, так как измененный поток крови через суженное
отверстие усугубляет клапанную деформацию.
Клиника, диагностика. Клинические особенности ИСЛА цели-
ком зависят от степени стеноза. При «бледных» вариантах ИСЛА
дети хорошо развиваются, жалобы незначительные и в основном
сводятся к одышке при нагрузке; нередко кончики пальцев, нос,
щеки имеют малиновый оттенок. Единственными проявлениями
порока являются систолическое дрожание и грубый систоличес-
кий шум типа изгнания во втором межреберье слева у грудины
в сочетании с ослабленным II тоном (клапанный стеноз). Интен-
сивность и продолжительность шума прямо пропорциональны
степени стеноза. У детей с инфундибулярным или комбиниро-
125
ванным стенозом систолическое дрожание и шум определяются
в третьем и четвертом межреберьях слева. На основании серд-
ца могут выслушиваться систолический тон изгнания (сразу за
I тоном) и клики — результат пролабирования диафрагмы легоч-
ных клапанов. Признаки сердечной недостаточности отсутствуют
или не превышают ПБ степени по правожелудочковому типу;
реже у больных с «бледными» вариантами ИСЛА отмечается
декомпенсация III степени.
При резком стенозе обращают на себя внимание цианоз, ин-
тенсивность которого нарастает с возрастом, симптомы «часовых
стекол» и «барабанных палочек». Больные предъявляют жалобы
на одышку при малейшей физической нагрузке и боль в об-
ласти сердца (дефицит коронарного кровотока на фоне резкой
гипертрофии миокарда правого желудочка). Дети с выраженной
гипоксемией, как правило, отстают в физическом развитии. Ино-
гда у больных отмечаются головокружения и синкопальные сос-
тояния, которые носят аритмогенный характер, в силу чего могут
расцениваться как предвестники внезапной смерти. Таким боль-
ным показано холтеровское мониторирование. Правожелудоч-
ковая сердечная недостаточность (одышка, гепатомегалия, отеч-
ный синдром) часто носит рефрактерный характер и, раз возник-
нув, имеет прогрессирующее течение. Данная картина обычно
наблюдается при резком стенозе с выраженной трикуспидальной
недостаточностью.
У большинства детей образуется правосторонний сердечный
горб. Определяется усиленный сердечный толчок (признак
гипертрофии миокарда правого желудочка). Систолическое дро-
жание во втором и третьем межреберьях слева выражено не-
значительно. В большинстве случаев вдоль левого края грудины
определяется грубый, продолжительный шум клапанного стеноза
легочной артерии с максимумом во втором межреберье. При
выраженной сердечной недостаточности давление в правом же-
лудочке падает, шум ослабевает. Локальный систолический шум
в пятом межреберье слева свидетельствует о недостаточности
трехстворчатого клапана.
На ЭКГ у больных с ИСЛА имеются признаки гипертрофии
правого предсердия (зубец Р высокий, заостренный в отведениях
II, III, Vi), резкое отклонение электрической оси сердца вправо
(/LaAQRS до +210°), выраженная гипертрофия миокарда пра-
вого желудочка (форма R или qR в Vi, глубокий зубец S в Ve)
(рис. 33). Сегмент ST часто смещен на 2 -5 мин ниже изолинии
с отрицательным глубоким зубцом Г в отведениях от Vi—V4,
что отражает снижение коронарного кровотока и выраженные
обменные нарушения в миокарде [Замыслов В. Л., 1989].
На ФКГ систолический шум имеет ромбовидную форму, зани-
мает почти всю систолу, пик шума расположен- тем позже, чем
больше степень стеноза, легочный компонент II тона снижен и от-
стоит на 0,06 0,1 с от аортального.
На рентгенограмме отмечается резкое обеднение легочного
126
рисунка. Размеры сердца зависят от степени стеноза, величины
праволевого сброса на уровне предсердий и выраженности не-
достаточности трехстворчатого клапана. При резком стенозе
без шунта сердце может быть нормальных размеров, но имеются
расширение ствола ЛА, приподнятая над диафрагмой верхушка
сердца (смещение правым желудочком влево и вверх левого)
(рис. 34, а). Степень выбухания дуги ЛА определяется направле-
нием струи крови, врожденными особенностями строения соеди-
нительной ткани сосудистой стенки и не всегда отражает степень
стеноза. Резкий стеноз, сопровождаемый значительной недоста-
точностью трикуспидального клапана, может приводить к выра-
женной кардиомегалии, когда размеры сердца и его форма (ша-
ровидная) становятся аналогичными таковым при аномалии
Эбштейна (рис. 34,6).
М-эхокардиографическая диагностика клапанного стеноза ЛА
основана главным образом на выявлении аномалий движения
127
Рис. 34. Изолированный стеноз легочной артерии. Рентгенограмма грудной
клетки.
а — обеднение легочного рисунка, небольшая тень сердца, гостстенотическое выбу-
хание легочной артерии; б — обеднение легочного рисунка, кардномегалия в результате
дилатации правых отделов.
створки клапана. При тяжелых формах стеноза это проявляется
углублением a-волны на задней створке (градиент давления
между правым желудочком и легочной артерией превышает'
50 мм рт. ст.) либо ее исчезновением при умеренном стенози-
ровании. Одновременно определяются гипертрофия правого же-
лудочка и межжелудочковой перегородки при нормальном дви-
128
жении последней, увеличение экскурсии трикуспидального клапа-
на и задержка его закрытия, голосистолический пролапс его
створок. Двухмерная эхокардиография в проекции короткой оси
на уровне сосудов позволяет выявить нарушенное открытие
клапана, во время систолы створки дугообразно выбухают в
просвет сосуда. Импульсная допплер-эхокардиография позволяет
определить выраженное турбулентное течение крови в области
клапана ЛА.
При катетеризации полостей сердца обнаруживается высокое
систолическое давление в правом желудочке. Если катетер, несмотря
на стеноз, удается провести в ЛА, то измеряют величину систо-
лического градиента давлений между ней и правым желудочком,
отражающую степень стеноза. Этого достигают непрерывной
записью кривой давления на всем пути выведения катетера из
легочной артерии в правый желудочек и далее в правое пред-
сердие. Выявление градиента давления на уровне клапанов ЛА,
выше или ниже их позволяет диагностировать соответственно
уровень стеноза: клапанный, надклапанный, инфундибулярный и
сочетанный. По уровню давления можно выделять варианты
с давлением ниже (до 100 мм рт. ст.) и выше системного, при
последних особенно страдает коронарный кровоток. Определение
степени насыщения крови кислородом в предсердиях при нали-
чии ДМПП позволяет оценить направленность и величину сбро-
са.
Правая вентрикулография в двух проекциях выявляет полость
правого желудочка с выраженной гипертрофией миокарда и
трабекулярностью, локализацию, характер и степень стеноза,
состояние кольца, ствола и ветвей ЛА. Полость правого желу-
дочка может быть нормальных или уменьшенных размеров с
нормальной или увеличенной фракцией выброса. Дилатация
полости чаще свидетельствует о выраженных изменениях в мио-
карде, что подтверждается уменьшением фракции выброса, сни-
жением систолического давления в ЛА, подъемом конечно-диас-
толического давления в правом желудочке. Если последний
признак имеется при уменьшенной полости правого желудочка,
он отражает ухудшение диастолического расслабления (ком-
плайнс), тогда как сократительная функция миокарда может
быть сохранена. При подозрении на ДМПП контрастное ве-
щество вводится в правое предсердие.
Дифференциальный диагноз ИСЛА следует проводить с
ДМПП, ДМЖП, тетрадой Фалло, аномалией Эбштейна.
Течение, лечение. Сведения об естественном течении ИСЛА
немногочисленны. Тяжелые формы порока (резкий стеноз) про-
являются рано и требуют хирургической коррекции, так как
стеноз быстро прогрессирует. Менее тяжелые формы характери-
зуются относительно благополучным течением, удовлетворитель-
ной переносимостью физических нагрузок до 20 —30 лет, затем
появляются признаки сердечной недостаточности, резко снижает-
ся трудоспособность, к 50 годам остаются живыми только 12 %
5—976
129
больных. Средняя продолжительность жизни при ИСЛА равняет-
ся 24,5 годам. Основными причинами смерти кооперированных
больных являются сердечная недостаточность и бактериальный
эндокардит. Возможна внезапная смерть. Лишь 14 % новоро-
жденных с ИСЛА умирают в течение первого месяца жизни.
Если порок обнаруживают у детей раннего возраста, то только
в 40 % случаев можно отметить легкую степень стеноза, в 47 % —
умеренную, а в 14 %—тяжелую [Wennevold A., Jacobsen J.,
1978].
Показаниями к хирургическому лечению
И С Л А в раннем возрасте являются выраженный цианоз, кардиоме-
галия, сердечная недостаточность, увеличение градиента давления
между правым желудочком и ЛА до 40—50 мм рт. ст. и более,
давления в правом желудочке — до 70—75 мм рт. ст. и выше.
Многие кардиохирурги предпочитают оперировать больных в
возрасте до 16 лет, так как более поздние вмешательства увели-
чивают риск развития необратимых изменений в миокарде
правого желудочка.
Операция выполняется на открытом сердце в условиях уме-
ренной гипотермии или искусственного кровообращения и заклю-
чается в рассечении стеноза по комиссурам. При развившемся
подклапанном стенозе этим доступом производят его иссечение, а в
некоторых случаях для устранения требуется вскрытие выводного
отдела правого желудочка. При наличии ДМПП следует его
закрыть в ходе операции.
В последние годы в лечении больных клапанным стенозом ЛА
используется транслюминальная чрескожная баллонная вальву-
лопластика, впервые предложенная Y. Rubio и R. Limon-Lason
в 1954 г. Через бедренную вену вводят 1 или 2 баллонных ка-
тетера диаметром 6—20 мм, производят их надувание на уровне
или ниже клапанов ЛА, делают несколько тракций, в результате
чего происходит разрыв по коммиссурам, и градиент давления
уменьшается. Чрескожная вальвулопластика не показана боль-
ным с диспластичным клапаном ЛА, определяемым по двухмер-
ной эхокардиограмме. В большинстве случаев возникает незначи-
тельная недостаточность клапанов ЛА, которая не всегда опре-
деляется аускультативно; она, как правило, не имеет гемодина-
мического значения [Rey С. et al., 1985]. Инфундибулярный
стеноз, сохраняющийся после устранения клапанного, со време-
нем может уменьшаться .[Robertson М. et al., 1987].
Летальность после хирургического устранения ИСЛА не пре-
вышает 3 %. Однако она резко увеличивается при выраженной
кардиомегалии, обусловленной не только гипертрофией, но и ди-
латацией правых полостей сердца, т. е. когда имеется поражение
сократительного миокарда.
Осложнением оперативного вмешательства может быть ост-
рая сердечная недостаточность, чаще всего обусловленная не-
полным устранением стеноза.
Отдаленные результаты, как правило, хорошие и находятся
130
в прямой зависимости от возраста больного, в котором сделана
операция, и исходной тяжести стеноза. Повторная операция
клапанного рестеноза или прогрессирования подклапанного сте-
ноза может быть показана больным, оперированным в раннем
детском возрасте.
ПЕРИФЕРИЧЕСКИЕ СТЕНОЗЫ ЛЕГОЧНЫХ АРТЕРИЙ
Эта патология включает стенозирующие поражения легочных
артерий, располагающиеся дистальнее ствола ЛА. Для обозначе-
ния аномалии используются синонимы: коарктация легочных арте-
рий, стеноз легочных артерий, атрезия и гипоплазия легочных
артерий, периферический стеноз ЛА, множественные перифери-
ческие стенозы ЛА и др. Первое анатомическое описание этого
ВПС принадлежит Е. Oppenheimer (1938).
В СССР наибольшим опытом диагностики и лечения больных
с данной патологией (69 наблюдений) располагают Институт
сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР
[Подзолков В. П. и др., 1981] и Киевский научно-исследователь-
ский институт сердечно-сосудистой хирургии Минздрава УССР.
Частота стенозирующих поражений ЛА, по данным В. Wein-
berg и соавт. (1964), составляет 4 % всех ВПС.
Анатомия, классификация. Стенозирующие поражения легоч-
ных артерий могут встречаться в любой части легочного
артериального дерева дистальнее ствола ЛА. Стенозы могут
локализоваться в центральных или периферических отделах пра-
вой или левой ЛА, во вторичных, третичных и небольших
ветвях ЛА, но чаще всего они встречаются в месте отхождения
главных легочных артерий от легочного ствола или в месте на-
чала сегментарных и периферических легочных ветвей. Стенозы
могут быть в виде локального сужения, сужения на протяжении
или гипоплазии вплоть до полной атрезии, быть одно- или
двусторонними, единственными или множественными, в виде
комбинации различных форм сужения. Место сужения образует-
ся за счет фиброзного утолщения интимы, в меньшей степени —
медии. При протяженном сужении или гипоплазии постстено-
тическая дилатация сосуда обычно отсутствует. При множествен-
ных стенозах сегментарная или периферическая ветвь ЛА может
оканчиваться «слепым мешком» или аневризмой, имеющей круг-
лую или овоидную форму. При атрезии наблюдается ампутация
одной из ЛА. Кровоснабжение легкого в таких случаях осущест-
вляется за счет ОАП, больших аорто-легочных коллатералей,
бронхиальных артерий, внутренней грудной артерии или ано-
мальных ветвей, отходящих от подключичной артерии.
R. Franch, В. Gay (1963) выделили 4 типа сужений: ство-
ла, центральное, бифуркационные, множественные перифери-
ческие, возможны и комбинированные сужения (центральные
и периферические).
В зависимости от тяжести стенозирующей патологии легочных
5*
131
артерий наблюдается та или иная степень гипертрофии правого
желудочка и правого предсердия. В 60 % случаев стенозирующие
поражения легочных артерий комбинируются с другими ВПС
(клапанный стеноз ЛА, ДМПП, ДМЖП, тетрада Фалло, откры-
тый артериальный проток и др.).
Гемодинамика. Нарушения гемодинамики обусловлены пре-
пятствием к выбросу крови из правого желудочка, которое может
располагаться на любом уровне легочно-артериального дерева.
Степень выраженности препятствия определяет уровень повыше-
ния давления в правом желудочке. Если у пациента с односто-
ронним локальным сужением проксимального отдела одной из
ЛА или легким двусторонним сужением может наблюдаться
нормальная величина давления в правом желудочке, то при
выраженном двустороннем сужении давление, как правило,
повышено соответственно тяжести стеноза.
Клиника, диагностика. Клиническая картина определяется
тяжестью стеноза. У пациентов с односторонним поражением
проксимального отдела одной из ЛА или легким двусторонним
сужением жалобы и клинические симптомы заболевания нередко
отсутствуют. При тяжелых и множественных периферических
стенозах больные предъявляют жалобы на одышку при физичес-
кой нагрузке, повышенную утомляемость. Цианоз, как правило,
отсутствует и появляется лишь при выраженной сердечной
недостаточности или связан с сопутствующим ВПС. При тяже-
лых стенозах, приводящих к выраженной гипертрофии правого
желудочка, над областью сердца определяется сердечный горб.
Границы сердца обычно нормальные или умеренно расширены.
В отличие от клапанного стеноза ЛА систолическое дрожание
над областью сердца отсутствует.
При аускультации на основании сердца выслушивается стено-
тический систолический шум. При одностороннем сужении прок-
симального отдела одной из ЛА шум локализуется на стороне
поражения и нередко проводится в подмышечную область и на
спину. При двустороннем сужении систолический шум выслуши-
вается с обеих сторон. В отличие от клапанного стеноза ЛА II тон
над ней сохранен. При атрезии одной из ЛА аускультативная
картина обычно обусловлена сопутствующими ВПС. При мно-
жественных периферических стенозах ЛА определяется акцент II
тона над ЛА и негромкий систолический шум на основании
сердца. Дополнительной диагностической находкой являются
продолжительные систолодиастолические шумы, выслушиваемые
над всеми легочными полями («шумят легкие»), максимально
определяемые во втором и третьем межреберьях справа и сзади
у края лопатки; эти шумы отражают продолжающийся вихревой
ток крови в периферические отделы ЛА во время диастолы или
увеличенный бронхиальный кровоток в постстенотической зоне.
ЭКГ при односторонних или легких стенозах может быть
практически нормальной; при тяжелой стенозирующей патологии
регистрируются признаки гипертрофии правого желудочка и пра-
132
Рис. 35. Множественные периферические стенозы легочной артерии. Легочная
артериограмма.
вого предсердия, отклонение электрической оси сердца вправо,
возможна блокада правой ножки пучка Гиса.
При рентгенологическом исследовании размеры сердца обыч-
но нормальные или умеренно увеличены за счет правого желу-
дочка. В отличие от клапанного стеноза легочной артерии дуга
легочной артерии, как правило, не выбухает. Легочный рисунок
нормально выражен или слегка обеднен, в случаях атрезии одной
из ЛА можно отметить асимметрию легочного рисунка.
При катетеризации сердца с целью определения степени и
возможных уровней сужения ЛА запись давления следует про-
изводить в течение всего периода медленного выведения катетера
из периферических отделов легочной артерии, вплоть до правого
желудочка. При прохождении кончика катетера через место
стеноза регистрируется подъем систолического давления. При
множественных стенозах можно отметить ступенчатый подъем
давления, иногда кривая давления в ЛА похожа на таковую при
первичной легочной гипертензии (высокое диастолическое давле-
ние). Систолическое давление в правом желудочке повышено, но
в отличие от легочной гипертензии при «сбросовых» пороках
это повышение имеет «стволовой» тип — с градиентом на уровне
периферических стенозов [Мезенцев Г. П. и др., 1985].
Ангиокардиографическое исследование (рис. 35) позволяет
установить локализцию, протяженность и степень тяжести пато-
логии. При отсутствии других ВПС контрастное вещество пред-
133
почтительно вводить в легочный ствол (ЛС). Постстенотическое
расширение легочных артерий наблюдается при сужении их прок-
симальных отделов (на рис. 35 указано стрелкой). Сужению дис-
тальных отделов легочных артерий часто сопутствует их гипопла-
зия на всем протяжении. При множественных периферических
стенозах ЛА контрастное вещество проходит через многочислен-
ные, чаще двусторонние, сужения, которые локализуются в месте,
начала сегментарных и периферических легочных ветвей и имеют
последующие постстенотические расширения. При атрезии одной
из ЛА наблюдается контрастирование ствола и легочной арте-
рии на противоположной стороне. Это подтверждается при ска-
нировании легких, когда обнаруживается полное отсутствие кро-
вотока в одном из легких.
Дифференциальный диагноз проводится с ДМПП, стенозом
ЛА и аорты, первичной легочной гипертензией, легочной гипер-
тензией, осложняющей дефекты перегородок сердца.
Течение, лечение определяются тяжестью стеноза, выражен-
ностью правожелудочковой недостаточности и легочной гипертен-
зии. Если стеноз выражен умеренно, он может длительное время
не сказываться на состоянии больных, в то время как тяжелый
стеноз или стеноз, сочетающийся с другими ВПС, рано приво-
дит больных в кардиохирургическую клинику. В литературе
представлены случаи смертельных легочных кровотечений, воз-
никновение которых связано с постстенотической аневризмати-
ческой дилатацией легочных артерий и их склонностью к разры-
ву при присоединении инфекции. Своевременно не распознан-
ные сужения легочных артерий утяжеляют послеоперационный
период и ухудшают прогноз.
Показаниями к хирургическому лечению
являются сужение артерии более чем наполовину ее диаметра и
градиент давления, превышающий 30 мм рт. ст. При сочетании
стенозов легочных артерий с дефектами перегородок сердца,
сопровождающихся сбросом крови слева направо, показанием
к устранению сужения является градиент давления между ле-
гочным стволом и легочными артериями не менее 50 мм рт. ст.
Множественные периферические стенозы легочных артерий хи-
рургическому лечению не подлежат.
Устранение стеноза достигается рассечением суженного
участка и расширением просвета сосуда лоскутом из аутопери-
карда.
Операцию выполняют в условиях искусственного кровообра-
щения. При тяжелом стенозе одной из легочных артерий с эле-
ментами гипоплазии может возникнуть необходимость в обход-
ном шунтировании с помощью сосудистого протеза, вшиваемого
между легочным стволом и легочной артерией дистальнее места
сужения.
В нашей стране первая успешная операция пластики ДМЖП
с одновременным восстановлением магистрального кровотока в
правой ЛА путем соединения ее с помощью сосудистого про-
134
теза со стволом легочной артерии выполнена В. А. Бухариным
в 1978 г.
Непосредственные и отдаленные результаты обычно благопри-
ятные; даже при небольшом сохранившемся градиенте давлений
(до 20 мм рт. ст.) состояние больных обычно удовлетворительное.
Ю. С. Петросян и соавт. (1986) приводят одно из первых
сообщений в мире об уменьшении степени периферических сте-
нозов ЛА у больного 9 лет с помощью баллонной дилатации
(размер баллона должен втрое и более превышать диаметр со-
суда в месте сужения). Эта процедура хотя и не приносит ра-
дикальных изменений, но обеспечивает стойкий гемодинамиче-
ский эффект. Баллонная дилатация может проводиться повторно.
АТРЕЗИЯ ЛЕГОЧНОЙ АРТЕРИИ
С ДЕФЕКТОМ МЕЖЖЕЛУДОЧКОВОЙ ПЕРЕГОРОДКИ
Этот вид атрезии относится к порокам конотрункуса. В ли-
тературе сочетание атрезии ЛА с ДМЖП нередко определяется
как «крайняя форма» тетрады Фалло, «ложный» общий артери-
альный ствол. В связи с тем, что от сердца отходит одна маги-
стральная артерия, длительное время этот порок рассматривался
в группе ВПС с общим артериальным стволом; в настоящее вре-
мя доказана самостоятельная нозологическая сущность порока.
Частота легочной атрезии с ДМЖП составляет 1—3 % всех
ВПС [Gasul В. М. et al., 1966; Keith S. et. al., 1978].
Анатомия, классификация. Анатомически порок включает 5
следующих компонентов: 1) атрезию легочного ствола, ведущую
к нарушению сообщения правого желудочка с легочно-артери-
альным руслом; 2) окклюзию выводного отдела правого желу-
дочка; 3) большой ДМЖП; 4) наличие какого-либо источника
коллатерального кровоснабжения легких; 5) декстропозицию
корня аорты.
Атрезия может локализоваться на уровне легочного клапа-
на, выводного отдела правого желудочка, проксимального отде-
ла легочного ствола, касаться всего легочного ствола, который
представлен в таких случаях узким тяжем, и захватывать прок-
симальные отделы правой и левой легочных артерий, ведя к от-
сутствию сообщений между ними. В ряде случаев можно отме-
тить гипоплазию легочных артерий или их локальные сужения.
Специфическим компонентом порока, отличающим его от общего
артериального ствола, является слепо оканчивающийся выводной
отдел правого желудочка.
Большой ДМЖП, как правило, расположен ниже наджелу-
дочкового гребня в подаортальной области и аналогичен дефекту,
наблюдаемому при тетраде Фалло, реже он виден выше надже-
лудочкового гребня, соответствуя топографии дефекта, наблюдае-
мого при общем артериальном стволе.
Наибольшее распространение в клинической практике получи-
ла классификация J. Somerville (1970), основанная на степе-
135
Рис. 36. Схема атрезии легочной артерии с дефектом межжелудочковой пере-
городки (указан стрелкой).
ни сохранности легочных артерий, в которой выделяется 4 типа
порока (рис. 36): I—атрезия легочного клапана; сохранены
легочный ствол, правая и левая легочные артерии; II — атрезия
легочного клапана и легочного ствола; сохранены правая и ле-
вая легочные артерии, которые могут быть соединены и разъеди-
нены между собой; III — атрезия легочного клапана, ствола и
одной легочной артерии; сохранена другая легочная артерия;
IV — атрезия легочного клапана, ствола и обеих легочных арте-
рий; легкие кровоснабжаются за счет коллатеральных систем-
ных артерий.
Во всех случаях можно отметить декстропозицию всегда
значительно расширенной аорты. Аортальный клапан обычно со-
держит три створки, реже он может быть дву- или четырехствор-
чатым. Во всех случаях легочный атрезии отмечается гипертро-
фия правого желудочка и умеренная гипоплазия левого желудоч-
ка (40 % случаев).
Среди источников кровоснабжения легких у больных с легоч-
ной атрезией и ДМЖП отмечают: 1) большие аортолегочные
коллатеральные артерии, отходящие от нисходящего отдела
грудной аорты или дуги аорты; 2) открытый артериальный про-
ток (ОАП); 3) бронхиальные коллатеральные артерии; 4) боль-
шие медиастинальные коллатеральные артерии; 5) фистулу меж-
ду коронарной и легочной артериями; 6) смешанные формы
[Кирклин Д. В. и др., 1981].
Гемодинамика. Нарушения гемодинамики определяются нали-
чием единственной магистральной артерии — аорты, в которую
благодаря ДМЖП поступает кровь из правого и левого желудоч-
ков. Условия, в которых функционируют оба желудочка, прибли-
зительно равны, в них регистрируется одинаковое систолическое
давление, равное аортальному. Поскольку в аорте смешиваются
136
потоки артериальной и венозной крови, в большой и малый круг
кровообращения поступает кровь одинакового газового состава
и практически у всех больных определяется артериальная гипо-
ксемия, степень которой зависит от величины легочного крово-
тока.
У подавляющего большинства больных отмечается небольшое
аортолегочное сообщение, ведущее к резкому обеднению легоч-
ного кровотока, в силу чего в левый желудочек и аорту возвра-
щается уменьшенный объем артериальной крови. У этих больных
определяется выраженная артериальная гипоксемия. При ОАП
или больших системных коллатеральных артериях легочный кро-
воток может быть нормальным и даже увеличенным. У таких
больных уровень артериальной гипоксемии может быть умерен-
ным или минимальным. В редких случаях (при большом ОАП)
может наблюдаться легочная гипертензия со склеротическими
изменениями легочных сосудов.
Клиника, диагностика. В клинической картине легочной атре-
зии с ДМЖП преобладают признаки гипоксемии. Этот порок
отличается от тетрады Фалло отсутствием одышечно-цианотичес-
ких приступов. Наряду с общим цианозом, существующим с рож-
дения больного, определяются симптомы «барабанных палочек» и
«часовых стекол». Слева от грудины может определяться дефор-
мация грудной клетки в виде сердечного горба. При аускульта-
ции определяется акцент II тона (проводной с аорты) на основа-
нии сердца и систолодиастолический шум во втором и третьем
межреберьях справа или слева от грудины (в зависимости от
состояния коллатерального кровообращения), проводящийся на
спину.
ЭКГ характеризуется отклонением электрической оси сердца
вправо, признаками гипертрофии правого желудочка и правого
предсердия.
При рентгенологическом исследовании (рис. 37) легочный
рисунок обеднен, корни легких отчетливо не определяются.
Усиление легочного рисунка обычно связано с атипичными те-
нями коллатеральных сосудов. У отдельных больных может
наблюдаться усиление легочного рисунка с одной стороны и
обеднение — с другой. Тень сердца умеренно увеличена в попе-
речнике или нормальных размеров, напоминает по форме сердце
при тетраде Фалло. Тень восходящей аорты расширена, ампли-
туда ее пульсации увеличена.
При эхокардиографическом исследовании лоцируется расши-
ренная восходящая аорта и большой ДМЖП. При I типе поро-
ка [Somerville J., 1970] имеется резко гипоплазированный
легочный ствол (рис. 38), а при II—IV типах эхосигнал от легоч-
ного ствола отсутствует.
При катетеризации правых отделов сердца обычно удается
провести катетер из правого желудочка через ДМЖП в восходя-
щую аорту. Систолическое давление в обоих желудочках и
аорте одинаковое. Насыщение артериальной крови кислородом,
137
Рис. 37. Атрезия легочной артерии с дефектом межжелудочковой перегородки.
Рентгенограмма грудной клетки.
как правило, снижено. Провести катетер в легочный ствол воз-
можно лишь при ОАП.
Ангиокардиографическое исследование следует начинать с
введения контрастного вещества в правый желудочек. Контрас-
тируется окклюзированный выводной отдел и контрастное ве-
щество через ДМЖП поступает в левый желудочек и в восходя-
щий отдел аорты. Для установления источника кровоснабжения
легких производится аортография с введением контрастного ве-
щества в нисходящий отдел аорты и селективная артериография,
при которой контрастное вещество вводится непосредственно в
коллатеральную артерию. Эти исследования позволяют устано-
вить вариант порока.
Течение, лечение. Летальность в первые дни и недели жизни
больных легочной атрезией с ДМЖП связана с закрытием ОАП
или прогрессирующим сужением больших аортолегочных колла-
теральных артерий; причина смерти — нарастающая гипоксемия.
Вместе с тем больные с ОАП и большими аортолегочными колла-
теральными артериями могут в течение длительного времени на-
ходиться в состоянии компенсации. По данным A. Schmaltz и
соавт. (1985), в возрасте до 2 лет погибают 68 % больных.
При данном пороке выполняются 2 типа операций: паллиатив-
ная и радикальная, показания к которым различны. У больных
с I и II типом порока (по классификации J. Somerville) необ-
138
Рис. 38. Атрезия легочной артерии с дефектом межжелудочковой перегородки.
Эхокар диогр ам м а.
а парастернальная проекция длинной оси левого желудочка; видны декстро позиция
аорты и большой подаортальный дефект межжелудочковой перегородки (указан стрел-
кой), б - парастернальная проекция длинной оси выводного тракта правого желудочка;
видеи резко суженный выводной отдел правого желудочка, атрезия клапанов легочной
артерии (указано стрелкой), ствол и ветви легочной артернн гипоплазировдны; в—
парастернальная проекция короткой оси на уровне корня аорты. Виден слепо заканчи-
вающийся резко суженный выводной отдел правого желудочка (ПЖВО — указан
стрелкой).
ходимость паллиативной операции в раннем детском возрасте
обусловлена прогрессирующим цианозом и небольшими размера-
ми легочных артерий. Основная цель паллиативной операции сос-
тоит в увеличении легочного кровотока посредством выполнения
аортолегочного анастомоза, создающего предпосылки для роста
истинных легочных артерий, и при возможности — в перевязке
аортолегочных коллатеральных сосудов. У больных с III типом
порока паллиативная операция является единственно возможным
методом лечения, при этом предпочтение отдается подключично-
легочному анастомозу Блелока — Тауссиг.
Поскольку у большинства больных выполнение радикальной
операции возможно лишь с применением искусственного ствола
и клапанов легочной артерии, ее желательно выполнять больным
старше 5 лет.
Первая успешная радикальная операция при данном пороке
выполнена J. Kirklin в 1965 г., причем для соединения правого
желудочка с легочными артериями была использована создан-
ная на операционном столе трубка из аутоперикарда [Rastelli G.
et al., 1965]. В нашей стране при легочной атрезии с гипоплазией
легочных артерий первая успешная операция по соединению
правого желудочка с легочными артериями с помощью трубки
из аутоперикарда, без закрытия ДМЖП выполнена В. П. Под-
золковым в 1984 г.
Тактика хирургического лечения больных с данным пороком,
разработанная J. Kirklin и соавт. (1981), включает полное ангио-
кардиографическое обследование при первом же поступлении в
клинику. Поскольку в раннем детском возрасте, как правило,
наблюдается гипоплазия легочных артерий, этим больным даже
при умеренной выраженности цианоза показаны выполнение ана-
стомоза Блелока — Тауссиг и перевязка больших аортолегочных
коллатералей, кроме тех, которые идут к бронхолегочным сегмен-
там. Сразу после операции больной переводится в кабинет ан-
гиокардиографии, где после введения контрастного вещества в
подключичную артерию убеждаются в том, что кровь поступает
во все отделы легкого. Если этого не происходит, больного воз-
вращают в операционную и лигатуру с коллатеральной артерии
снимают. В отдаленные сроки после операции, приблизительно
в возрасте 5—10 лет, проводится повторное полное ангиокардио-
графическое обследование. Если после наложения анастомоза
легочные артерии развиваются нормально, выполняют радикаль-
ную операцию; если их развитие недостаточное, следует выпол-
нить еще одну паллиативную операцию — вшивание между пра-
вым желудочком и легочными артериями бесклапанного или кла-
пансодержащего протеза без закрытия ДМЖП. Если повторная
паллиативная операция способствовала развитию легочных арте-
рий, в последующем производится закрытие ДМЖП.
У больных с хорошо развитыми легочными артериями воз-
можна радикальная операция, которую выполняют в условиях
гипотермического искусственного кровообращения и кардиопле-
140
гии, при этом перевязывают аортолегочные коллатеральные арте-
рии или — если он есть — анастомоз Блелока — Тауссиг; затем
заплатой закрывают ДМЖП. Далее при I типе порока (по
J. Somerville) подшиванием заплаты расширяют суженные отде-
лы и создают сообщение между правым желудочком и ЛА; в
53—60 % случаев легочной атрезии это можно сделать лишь с
применением бесклапанного или клапансодержащего протеза.
Паллиативная операция — реконструкция путей оттока из
правого желудочка без закрытия ДМЖП выполняется у больных
с гипоплазией легочных артерий. Отличие от вышеописанной
радикальной операции состоит в том, что ДМЖП не закрывают,
а у маленьких детей для соединения легочных артерий с правым
желудочком используют созданную во время операции трубку из
аутоперикарда [Подзолков В. П. и др., 1987; Alfiery J. et al.,
1978]. Послеоперационная летальность составляет 9,7—16 %
[Olin С. L. et al., 1976; Alfiery J. et al., 1978].
Больные, перенесшие операцию, как правило, чувствуют се-
бя хорошо и относятся к I или II функциональному классу по
NYHA. В отдаленном послеоперационном периоде наиболее частой
причиной смерти является хроническая сердечная недоста-
точность, обусловленная оставшимся высоким давлением в пра-
вом желудочке [Alfiery J. et al., 1978].
ИДИОПАТИЧЕСКОЕ РАСШИРЕНИЕ ТЕРОЧНОЙ АРТЕРИИ
Идиопатическое расширение легочной артерии (ЛА) характе-
ризуется врожденным расширением ствола ЛА, иногда и ее вет-
вей при отсутствии порока сердца и патологии легких. Впервые
патология описана Н. Wessler, L. Jaches (1923). Существуют две
теории, объясняющие эту аномалию. Согласно первой теории
ствол ЛА расширен из-за врожденной неполноценности соедини-
тельной ткани, что подтверждается сочетанием этой патологии
с синдромом Марфана и пролапсом митрального клапана. Вто-
рая теория объясняет аномалию неравномерным делением трун-
куса; это означает, что аорта должна быть гипопластична,
в то время как она обычно нормальная.
Идиопатическое расширение ЛА выявляется, как правило,
случайно при очередном рентгенологическом обследовании. Жа-
лобы у таких больных, связанные с дилатацией ствола ЛА,
отсутствуют. У взрослых лиц с резко выраженной аневризмой
возможны загрудинные боли. Аускультативно определяется сред-
ней интенсивности систолический шум на основании сердца,
уменьшающийся в положении стоя; II тон над легочной артерией
обычный, может быть расщеплен, что заставляет исключать
ДМПП. На основании сердца может выслушиваться систоли-
ческий тон изгнания (вскоре за I тоном), на верхушке опреде-
ляются среднесистолические щелчки и шум (в случаях сочетания
с пролапсом митрального клапана). ЭКГ не изменена. На рент-
генограмме сердце нормальных или уменьшенных размеров, дуга
141
Рис. 39. Идиопатическое расширение легочной артерии. Рентгенограмма грудной
клетки.
ЛА , выбухает, индекс Мура составляет 30- 40 % и более
(рис. 39). Других отклонений не обнаруживается. В случаях,
где для исключения сопутствующих ВПС производились катете-
ризация пол-остей сердца и ангиокардиография, никаких отклоне-
ний не выявлено, за исключением небольшого градиента давле-
ния между правым желудочком и ЛА. При эхокардиографичес-
ком исследовании регистрируется широкая ЛА с нормальным ха-
рактером движения ее клапанов. При допплер-эхокардиографии
в выносящем тракте правого желудочка, несмотря на нормаль-
ное давление в ЛА, отмечаются треугольные, круглые и проме-
жуточные типы потока. Одновременно выявляется среднесистоли-
ческая выемка, связанная с тем, что отраженный фронт волны
давления доходит до клапана раньше и вызывает его раннее
закрытие; кроме того, в расширенном стволе ЛА вокруг клапана
образуются добавочные вихревые потоки, что также способствует
его раннему закрытию [Али Садек Али и др., 1987].
Дифференциальный диагноз. Расширение ствола ЛА может
быть симптомом при первичной легочной гипертензии, врожден-
ных и приобретенных пороках сердца, результатом атеросклеро-
тического и воспалительного поражения сосудистой стенки.
Естественное течение этой аномалии развития благоприятное,
ограничений в физической нагрузке нет. Развитие клапанной
недостаточности как осложнения идиопатического расширения
142
ЛА вызывает сомнение, скорее всего клапанная недостаточность
возникает из-за аномалии створок ЛА, которая всегда сочетает-
ся с расширением ствола ЛА, или из-за органического пораже-
ния сосудистой стенки. В. Н. Саперов и соавт. (1984) описали
случаи гигантской врожденной аневризмы ЛА у мужчины 41 го-
да, осложненной пристеночным тромбозом, множественными мел-
кими тромбоэмболиями сосудов малого круга кровообращения,
что привело к развитию высокой легочной гипертензии и деком-
пенсации легочного сердца со смертельным исходом. Лица с
идиопатическим расширением ЛА требуют динамического рентге-
нологического или эхокардиографического контроля (1 раз в 2—
3 года); в лечении они не нуждаются [Бураковский В. И. и др.,
1989].
ВРОЖДЕННАЯ НЕДОСТАТОЧНОСТЬ КЛАПАНОВ
ТЕРОЧНОЙ АРТЕРИИ
Недостаточность клапанов легочной артерии (ЛА) обусловле-
на врожденной структурной особенностью, наблюдается редко и
составляет 0,2 % всех ВПС [Bankl Н., 1980]. Синонимы: от-
сутствие клапана ЛА, агенезия клапанов ЛА, врожденная бес-
клапанная ЛА.
Первое описание принадлежит J. Champton (1830), к настоя-
щему времени описано более 450 наблюдений.
Анатомия. Выделяют полное и частичное (рис. 40) отсутст-
вие или гипоплазию клапанов ЛА. Аномалия редко бывает изоли-
рованной, обычно она сочетается с инфундибулярным стенозом
ЛА и ДМЖП («вариант тетрады Фалло»), может сопровождать-
ся открытым артериальным протоком, ДМПП, двойным отхожде-
нием сосудов от правого желудочка, синдромом Марфана. Одно-
временно имеются гипоплазия легочного кольца, аневризматичес-
кое расширение легочного ствола и ЛА. На месте створок может
быть небольшой валикообразный выступ толщиной 1—2 мм, слег-
ка утолщенный фиброзный валик с выступающими маленькими
фиброзными узелками или рудиментарные створки — гипоплас-
тичные с признаками синусов Вальсальвы; при этом рудиментар-
ными могут быть все три створки; может отсутствовать одна
створка, а две другие быть рудиментарными или почти нормаль-
ными. Инфундибулярный стеноз представлен фиброзно-мышеч-
ным валиком, ДМЖП обычно высокий, большой, располагается
ниже наджелудочкового гребня. Полость правого желудочка рас-
ширена, стенка его гипертрофирована.
Гемодинамика. Основной особенностью гемодинамики являет-
ся обратное поступление крови из ЛА в правый желудочек, что
приводит к его объемной перегрузке, дилатации полости и гиг
пертрофии миокарда. Инфундибулярный стеноз препятствует
прохождению крови через легочное кольцо в систолу и диастолу,
повышая давление в правом желудочке. Легкая степень недо-
143
Рис. 40. Изолированное частичное врожденное отсутствие клапана легочной
артерии. Двумерная и допплерэхокардиограмма.
На верхнем снимке на эхокардиограмме видиа одна нормальная створка и рудимент
другой (указано стрелкой); внизу на допплерэхокардиограмме выявляются антеградный
систолический (направлен вниз) и ретроградный диастолический (направлен вверх)
потоки на уровне легочного кольца; КЛА створки легочного клапана; J1A — легочная
артерия.
статочности клапанов ЛА может не нарушать гемодинамику,
отсутствие же клапанов приводит к рано возникающей и быстро
прогрессирующей сердечной недостаточности.
Клиника, диагностика. Заболевание несколько чаще встреча-
ется у лиц мужского пола. Многие авторы выделяют острую и
хроническую формы порока. Острая форма проявляет себя в пер-
вые месяцы и годы жизни больного из-за наличия сопутствую-
щего ДМЖП, отсутствия стеноза ЛА и выраженной регургита-
ции через легочный клапан. Кроме признаков правожелудочковой
недостаточности, характерны выраженные респираторные нару-
шения, связанные со сдавлением трахеи и бронхов аневризма-
тически расширенными ветвями ЛА. Заметно, что такие больные
лучше чувствуют себя при положении на животе, а при пово-
роте на спину состояние их значительно ухудшается. Хроничес-
кое течение возникает при инфундибулярном стенозе, который
ограничивает как сброс через ДМЖП, так и величину регурги-
тации. Характерны жалобы на сердцебиение, боли в сердце,
одышку при физической нагрузке. Физическое развитие больных
144
нормальное, возможен цианоз (при веноартериальном сбросе
через ДМЖП). Систолическое дрожание и сердечный гроб могут
встречаться при сопутствующих ВПС и расширении сердца. Наи-
более характерным проявлением недостаточности клапанов ЛА
является протодиастолический шум, связанный со II тоном, оп-
ределяемый вдоль левого края грудины, максимально во втором
и третьем межреберьях слева. При наличии ДМЖП и инфунди-
булярного стеноза выслушиваются соответственно разного тембра
систолические шумы.
На ЭКГ электрическая ось сердца отклонена вправо, имеются
признаки гипертрофии правого желудочка и предсердия, непол-
ная блокада правой ветви пучка Гиса как проявление объемной
перегрузки правого желудочка, у взрослых больных после 20—
30 лет возможны аритмии.
Рентгенологическая картина во многом определяется сопут-
ствующими ДМЖП или инфундибулярным стенозом ЛА. Обра-
щают на себя внимание выбухание дуги ЛА, резкое расширение
ее ветвей, усиленная пульсация. У больных в возрасте до 1 года
часто встречаются ателектазы, эмфизема, гипервентиляция долей
в зависимости от того, какой бронх сдавливается расширенными
легочными ветвями, это можно подтвердить бронхоскопией,
компьютерной томографией. Размеры сердца чаще нормальные
или увеличены за счет правых отделов.
При врожденной недостаточности или отсутствии клапанов
ЛА с помощью одномерной эхокардиографии выявляются ди-
латация полости, парадоксальное движение межжелудочковой
перегородки, трепетание передней створки трикуспидального кла-
пана, отсутствие локации легочного клапана с аномальными
линейными эхосигналами на уровне легочного кольца. При двух-
мерной эхокардиографии (см. рис. 40) из левого парастерналь-
ного доступа в проекции длинной оси клапаны представлены ва-
ликом или рудиментарной тканью; в проекции короткой оси у
основания сердца в случаях агенезии створок видна широкая
ЛА без клапанов; одновременно выявляется подаортальный
ДМЖП, инфундибулярный стеноз. Допплерэхокардиография
подтверждает наличие недостаточности клапанов ЛА по возник-
новению турбулентного тока в выходном тракте правого желу-
дочка (см. рис. 40).
При катетеризации сердца систолическое давление в правом
желудочке может быть нормальным (при небольшой регургита-
ции) и повышенным (при инфундибулярном стенозе и ДМЖП),
в ЛА обнаруживают нередко снижение диастолического давле-
ния до 2—6 мм рт. ст., градиент давления между правым
желудочком и ЛА подтверждает сопутствующий стеноз ЛА. Ди-
агностическое значение имеет правая вентрикулография, обнару-
живающая расширенный ствол ЛА, ее ветви, инфундибулярный
стеноз; синусы Вальсальвы не видны ни в систолу, ни в диастолу,
определяется регургитация контрастированной крови из ЛА в
правый желудочек.
145
Дифференциальный диагноз требует исключения недостаточ-
ности клапанов аорты, идиопатического расширения ЛА и легоч-
ной гипертензии как причин недостаточности клапанов ЛА.
Течение, лечение. Естественное течение порока различно.
При острых формах, манифестирующих себя с первых дней жиз-
ни, требуется раннее хирургическое вмешательство, которое
сопровождается смертностью в 50—80 % случаев [Karl Т. et al.,
1985]. При изолированном пороке или сочетании с умеренным
стенозом ЛА больные длительно остаются компенсированными и
доживают до 40—57 лет.
Если клапаны деформированы, но гемодинамика практически
не нарушена, хирургического вмешательства не требуется. Все
операции при этом пороке можно разделить на паллиативные и
радикальные. К паллиативным у детей первого года жизни отно-
сятся такие операции, как наложение системно-легочного анас-
томоза (при выраженном стенозе), а также операции, уменьша-
ющие сдавление бронхов (пневмонэктомия, лобэктомия, аневрИз-
морафия, кавопульмональный анастомоз, разъединение правой
легочной артерии и ее реимплантация в ствол ЛА с помощью
трубчатого сосудистого протеза над верхней полой веной, закры-
тие ДМЖП и сужение ЛА по Мюллеру). Радикальная операция
включает протезирование клапанов ЛА, устранение сопутствую-
щих ВПС. Первая в мире успешная операция протезирования
клапанов ЛА при его отсутствии выполнена академиком АМН
СССР В. И. Бураковским в 1962 г. В качестве материала
для протезирования используются ксеноклапан из перикарда,
гомоклапан и механические клапаны, реже — клапансодержащие
кондуиты: возможно проводить вшивание заплаты, содержащей
ксеноперикардиальную моностворку, и одновременную пликацию
ствола ЛА в случаях его значительной дилатации. Послеопера-
ционная летальность, по данным ИССХ им. А. Н. Бакулева,
составляет около 15 % [Бураковский В. И. и др., 1989]. Протези-
рование клапанов ЛА дает отличные и хорошие отдаленные ре-
зультаты. Основными осложнениями являются бактериальный
эндокардит, стеноз и кальциноз гомо- и ксеноклапана, ведущие
к его дисфункции, особенно у больных, оперированных в возрасте
до 10—15 лет.
Глава 9. ПОРОКИ РАЗВИТИЯ АОРТЫ
СТЕНОЗ АОРТЫ
Стеноз аорты — врожденный порок сердца, сопровождающий-
ся деформацией створок клапана и/или сужением клапанного,
надклапанного или подклапанного отверстия. В данном разделе
описаны все виды стеноза, за исключением идиопатического ги-
пертрофического, относящегося к кардиомиопатиям. Первым
клапанный стеноз аорты описал С. Rayger в 1672 г., а подкла-
панный — N. Chevers в 1842 г. Различные варианты стеноза аор-
146
Рис. 41. Схематическое изображение ва-
риантов врожденного стеноза аорты.
а - надклапанный; б - клапанный; в -
подклапанный (дискретный, мембранозный);
г - идиопатический гипертрофический.
ты составляют 2—7 % всех ВПС [Gasul В. et al., 1966; Keith J.
et al., 1978].
Анатомия, классификация. Сужение аорты может включать
неправильное развитие створок, комиссур, кольца и ствола. В
зависимости от места расположения (рис. 41) выделяют клапан-
ный (65-70 %), надклапанный (10%) и подклапанный (дис-
кретный) (20—25 %) стенозы [Rey С., 1985].
Наиболее распространен клапанный стеноз. Клапан может
быть образован одной створкой с центральным или эксцентрич-
ным расположением отверстия. Одностворчатый аортальный кла-
пан чаще вызывает тяжелые формы порока и гибель детей на
первом году жизни. Как правило, это куполообразный стеноти-
ческий аортальный клапан с отверстием типа восклицательного
знака. При двустворчатом аортальном клапане имеются правая и
левая створки с передней и задней комиссурами, видна третья
борозда или ложная комиссура; такой клапан в систолу открыва-
ется неполно и недостаточно смыкается в диастолу, со временем
отмечается повышенная кальцификация створок. Двустворчатый
и ненормально сформированный трехстворчатый клапаны аорты
с рождения могут не вызывать стеноза, но со временем в ответ
на гемодинамический стресс створки утолщаются, кальцифици-
руются и возникает стеноз.
Подклапанный стеноз может быть трех видов: 1) тонкая
фиброзная мембрана расположена сразу под клапанами аорты,
размеры отверстия мембраны составляют 0,5—1,5 см; 2) на 1 см
ниже клапанов имеется фиброзное или фиброзно-мышечное коль-
цо, нередко значительно суживающее выводной тракт (дискрет-
ный стеноз); 3) имеется диффузное сужение выводного тракта —
туннельный вариант стеноза. Вихревые потоки крови при стенозе
способствуют возникновению недостаточности собственно аор-
тальных клапанов почти у всех больных. Дискретный стеноз
может сочетаться с клапанным.
Намного реже встречается надклапанный стеноз — различной
степени сужение восходящей аорты сразу над синусами Валь-
147
сальвы. Чаще восходящая аорта имеет вид песочных часов с рас-
пространенным ее сужением. Гистологически стенка аорты имеет
повышенное содержание коллагеновых волокон, дезорганизацию
медии с отложением кальция. При этом отмечается поражение
других ветвей аорты и легочной артерии в виде их гипоплазии,
что подтверждает системную дезорганизацию соединительной
ткани при этом виде стеноза. В 10 % случаев имеется фиброзная
мембрана с центрально расположенным отверстием. Возможен
так называемый гипопластический вариант надклапанного стено-
за в виде гипоплазии ствола восходящей аорты.
При стенозах аорты имеет место гипертрофия миокарда лево-
го желудочка с нормальной или дилатированной его полостью.
При клапанном и дискретном стенозах аорты может развиться
вторичный подклапанный мышечный стеноз. У детей первых ме-
сяцев жизни полость левого желудочка гипоплазирована, эндо-
кард его утолщен за счет фиброэластоза. Нередко увеличены
левое предсердие и правый желудочек, что облегчает функциони-
рование левого желудочка. Их увеличение косвенно отражает
степень клапанного стеноза. Одновременно с гипертрофией часто
имеется распространенный фиброз миокарда — результат дефи-
цита коронарного кровотока на фоне аортального стеноза. В
случаях выраженного стеноза возможно возникновение аневриз-
мы левого желудочка, некроза папиллярной мышцы со вторичной
недостаточностью митрального клапана. Фиброэластоз эндомио-
карда является также результатом гипоксии максимально нагру-
женных субэндокардиальных отделов миокарда и эндокарда ле-
вого желудочка. Четкой зависимости между степенью стеноза и
выраженностью фиброэластоза эндомиокарда не отмечается. При
клапанном стенозе всегда обнаруживается постстенотическая ди-
латация восходящей аорты, как следствие турбулентного крово-
тока сразу после прохождения суженной части; строгого соответ-
ствия между расширением ствола аорты и степенью стеноза нет.
В других случаях обнаруживается гипоплазия восходящей
аорты.
Почти в 20 % случаев стенозы аорты сочетаются с другими
ВПС: открытым артериальным протоком, коарктацией аорты,
ДМЖП, периферическими стенозами легочной артерии.
Гемодинамика. При аортальном стенозе в аорту поступает
меньше крови. Миокард левого желудочка работает с повышен-
ной нагрузкой из-за препятствия к выбросу крови в аорту. Раз-
вивающаяся гипертрофия миокарда делает желудочек ригидным
при наполнении, возникает компенсаторный подъем конечно-
диастолического давления в нем, уменьшается относительный
коронарный кровоток, в том числе субэндокардиальный. Одно-
временно повышается давление в левом предсердии, легочных
венах, легочной артерии. Стеноз считается критическим для де-
тей, если площадь отверстия менее 0,5 см2, для взрослых — менее
1 см2.
На направление кровотока при врожденных стенозах аорты
148
оказывает влияние ориентация полулунных клапанов аорты, ко-
торая может быть направлена вниз, горизонтально и вверх в
зависимости от вида стеноза и его выраженности. Патологичес-
кое отклонение дна полулунных клапанов, значительно нару-
шая топографоанатомическое соотношение осей левого желудоч-
ка и аорты, вызывает резкое изменение направления кровотока
через суженное отверстие и создает условия для непосредствен-
ного воздействия движущегося потока крови на стенку восхо-
дящей аорты, область аортальных синусов и створок аортального
клапана. У 34,6 % больных с патологической ориентацией дна
полулунного клапана это ведет к развитию постстенотического
расширения аорты и недостаточности аортальных клапанов.
Клиника, диагностика. Стеноз аорты в 2—3 раза чаще встре-
чается у мужчин. Большинство детей со стенозом аорты долго не
предъявляют жалоб, нормально развиваются. В случаях вы-
раженного стеноза, его сочетания с фиброэластозом или другими
пороками признаки заболевания появляются на первом году
жизни в виде бледности кожных покровов, одышки, тахикардии,
могут быть приступы внезапного беспокойства, сердечная недос-
таточность. В старшем возрасте после длительного «благопо-
лучия» появляются жалобы на ангинозные боли, приступы серд-
цебиения, одышку, синкопе. Синкопе — признак тяжелого стено-
за с градиентом давления между аортой и левым желудочком
более 50 мм рт.ст. Причиной кратковременной потери сознания
являются сниженный сердечный выброс и аритмии.
Почти 30 % детей с надклапанным стенозом аорты имеют
своеобразную внешность — лицо «эльфа» (синдром Вильям-
са— Бойрена): утолщенные кожные складки над верхними ве-
ками, эпикант, косоглазие, вывернутые ноздри, толстые губы,
полуоткрытый рот. Одновременно отмечаются разница в АД на
руках более чем на 10 мм рт.ст., отклонения в развитии скелета,
грыжи, разболтанность суставов, плоскостопие, мышечная гипо-
тония, олигофрения. В 60-е годы многие авторы относили этот
вид стеноза аорты к идиопатической гиперкальцификации на фо-
не гипервитаминоза D, хотя уровень кальция в большинстве слу-
чаев нормальный. В настоящее время его считают лишь одним из
симптомов наследственного заболевания соединительной ткани.
Тип наследования аутосомно-доминантный, описаны и споради-
ческие случаи. Надклапанный стеноз аорты встречается также у
детей с ксантоматозами и семейной гиперхолестеринемией.
У лиц с наследственными вариантами подклапанного стеноза
аорты также может быть характерный внешний вид: плоское ли-
цо, высокий и выпуклый лоб, гипертелоризм; интеллект сохранен
или снижен незначительно.
Сердечный горб при стенозе аорты, как правило, отсутствует,
так как сердце долгое время остается неувеличенным. Разви-
вающаяся гипертрофия миокарда левого желудочка уменьшает
объем камеры. В случаях кардиомегалии с рождения к 6—12 мес
развивается выраженный сердечный горб. При аускультации
149
I тон громкий при всех видах аортального стеноза, за исключе-
нием случаев с резкой гипертрофией миокарда и выраженным
фиброэластозом эндомиокарда. При пальпации часто определяет-
ся систолическое дрожание во втором межреберье справа при
клапанном и надклапанном стенозе, а при подклапанном — в
третьем и четвертом межреберьях слева. Грубый систолический
шум, связанный с I тоном, стенотического тембра, выслушивает-’
ся во втором межреберье справа при клапанном и надклапанном
стенозе, при подклапанном стенозе — в третьем и четвертом меж-
реберьях слева, хорошо проводится на сосуды шеи справа. Здесь
же при пальпации определяется систолическое дрожание. Интен-
сивность шума, как правило, прямо пропорциональна степени
стеноза. Систолический клик выслушивается на верхушке сердца
и вдоль левого края грудины, интенсивность его не связана с
актом дыхания. Клик отсутствует при выраженном стенозе и им-
мобильном клапане, а также при над- и подклапанных стенозах.
Во втором и третьем межреберьях слева нередко со временем по-
является короткий протодиастолический шум недостаточности
аортальных клапанов, причина которого — гемодинамическое по-
вреждение створок струей крови, однако при этом необходимо ис-
ключать бактериальный эндокардит.
При стенозах аорты пульс на ногах и руках пониженного на-
полнения, АД на нижней границе нормы. К осложнениям стеноза
аорты относятся кальциноз и недостаточность аортальных кла-
панов, бактериальный эндокардит, который особенно поражает
двустворчатый аортальный клапан. Клинические проявления эн-
докардита могут быть от ярких до малозаметных, когда первым
симптомом является протодиастолический шум вдоль левого края
грудины с максимумом во втором и третьем межреберьях слева
у грудины; гепато- и спленомегалия часто отсутствует.
Сердечная недостаточность, преимущественно левожелудочко-
вая, осложняет течение порока у детей раннего возраста и затем
уже у взрослых. В обоих случаях этот признак указывает на вы-
раженность стеноза и миокардиальную недостаточность, свиде-
тельствует о плохом прогнозе. Иногда обращает на себя внимание
несоответствие между клиническими данными порока и значитель-
но увеличенными размерами сердца перкуторно и на рентгено-
грамме, что в сочетании с рефрактерной к лечению сердечной не-
достаточностью свидетельствует в пользу фиброэластоза эндо-
миокарда [Белоконь Н. А., Кубергер М. Б., 1987].
Внезапная смерть при стенозах аорты чаще возникает на фо-
не или вскоре после физической нагрузки и связана с возникно-
вением аритмий и асистолии, возникающих из-за резкого дефици-
та коронарного кровотока. От 4 до 18 % детей с врожденным сте-
нозом аорты умирают внезапно, что составляет ‘/s всех внезапно
умерших детей [Lambert Е. et al., 1974]. У взрослых больных до
30 лет частота внезапной смерти составляет 0,4 % в год, затем
она еще больше увеличивается; стеноз при этом значительный,
хотя жалобы могут отсутствовать и на ЭКГ в покое имеются не-
150
Рис. 42. ЭКГ при умеренном (а) и выраженном (б) стенозе аорты. Объяснения
в тексте.
значительные изменения. Синкопе и боли в сердце при нагрузке
у детей со стенозом аорты служат показанием к хирургическому
вмешательству, так как сочетание этих двух клинических сим-
птомов указывает на возможность внезапной смерти.
На ЭКГ при легких степенях стеноза изменения отсутствуют
или имеются признаки гипертрофии миокарда левого желудочка
(глубокий зубец Sv, и высокий (рис. 42, а). При выраженном
стенозе и гипертрофии миокарда на ЭКГ регистрируются измене-
ния типа «strain» — снижение сегмента ST ниже изолинии на
2 мм и более с отрицательным зубцом Т в отведениях Vs в (рис.
42, б), отражающие систолическую перегрузку миокарда левого
желудочка, снижение субэндокардиального кровотока, ухудше-
ние диастолического расслабления миокарда из-за его гипертро-
фии. Зубцы QvS6 часто расширены и увеличены. Можно отметить
определенную положительную связь между выраженностью гра-
диента давления левый желудочек — аорта и изменениями в
миокарде на ЭКГ. Однако следует помнить, что изменения на
ЭКГ не всегда отражают выраженность стеноза (особенно у
взрослых больных), поэтому их необходимо коррелировать с ре-
зультатами других методов обследования, в частности — аускуль-
тацией.
На ФКГ при клапанном стенозе аорты фиксируются достаточ-
ной амплитуды I тон на верхушке, высокоамплитудный ромбовид-
ной формы систолический шум с максимумом на аорте, который
заканчивается перед аортальным компонентом II тона; одновре-
менно имеется систолический клик. При над- и подклапанном
151
Рис. 43. Клапанный стеноз аорты. Рентгенограмма грудной клетки. Объяснение
в тексте.
стенозах аорты клик отсутствует, аортальный компонент Итона
значительно снижен на верхушке и на основании сердца. При
стенозе аорты в силу замедленного закрытия клапанов на ФКГ
легочный компонент II тона может располагаться перед аорталь-
ным — парадоксальное расщепление Итона.
На рентгенограммах легочный рисунок нормальный; его уси-
ление по венозному руслу бывает при значительном стенозе. Кон-
фигурация тени сердца характерная: резко выражена талия, за-
кругленная, приподнятая над диафрагмой верхушка образует
острый угол с диафрагмой (рис. 43). В косых проекциях опреде-
ляются признаки гипертрофии миокарда левого желудочка.
Сердце в большинстве случаев долго не увеличивается, если нет
сердечной недостаточности, сопутствующих врожденных пороков,
фиброэластоза эндомиокарда. Типичным признаком клапанного
стеноза следует считать расширение восходящей аорты. При над-
клапанном стенозе аорты может не определяться типичная форма
сердца, чаще оно увеличено более значительно, постстенотичес-
кое расширение аорты отсутствует, западение на правом контуре
сердечной тени обусловлено сужением аорты выше ее клапанов.
В случаях дискретного (мембранозного) стеноза может быть
кардиомегалии с первых лет жизни, поскольку одновременно с
гипертрофией миокарда имеется дилатация полости; расширение
восходящей аорты отсутствует, так как основной удар струи кро-
152
ви приходится на клапаны, а не на стенку аорты. У взрослых
больных при рентгенотелевизионном обследовании выявляется
кальциноз клапанов аорты.
При врожденном стенозе аорты на эхокардиограмме часто об-
наруживается двустворчатый клапан аорты, при легких вариан-
тах стеноза створки деформированы незначительно. В силу ма-
лой чувствительности одномерной эхокардиографии в таких слу-
чаях обращают внимание на вторичные проявления порока:
уменьшение выводного отдела левого желудочка, гипертрофия
его стенок, уменьшение наклона EF передней митральной створки.
При двухмерной эхокардиографии определяется характерный
симптом порока: створки дугообразно выбухают в просвет сосуда,
отмечается их движение в виде «колебания маятника». При доп-
плер-эхокардиографическом исследовании регистрируется турбу-
лентный поток на уровне клапана и в надклапанном простран-
стве, возможно неинвазивно оценить чресклапанный градиент
давления. При двухмерной эхокардиографии следует обращать
внимание на размеры фиброзного кольца и восходящей аорты;
узкую аорту также надо относить к группе стенозов. При этой
патологии следует ограничивать физические нагрузки.
При дискретном подклапанном стенозе аорты с помощью
М-эхокардиографии иногда удается увидеть подклапанную мем-
брану как тонкую полоску эхо в выводном тракте левого желу-
дочка.
Секторное сканирование в проекции длинной парастернальной
оси левого желудочка и короткой оси на уровне выводного тракта
позволяет непосредственно определить подклапанную мембрану,
суживающую выводной тракт левого желудочка. В ряде случаев
при дискретном стенозе аорты выявляется сочетанный тип фиб-
розно-мышечной обструкции выводного тракта левого желудочка,
при этом имеет место сужение подаортальной области в виде
длинного туннеля.
При надклапанном аортальном стенозе одномерная эхокар-
диография не позволяет определить точную локализацию и сте-
пень сужения. Двухмерная эхокардиография в проекции длинной
оси левого желудочка и коротких парастернальных проекциях на
уровне аорты дает непосредственную информацию о характере
обструкции просвета сосуда. В большинстве случаев секторное
сканирование позволяет дифференцировать тип анатомической
обструкции. При наиболее распространенной локализованной фор-
ме надклапанного стеноза типа «песочных часов» выявляются
суживающие просвет сосуда эхосигналы на уровне верхней гра-
ницы синусов Вальсальвы.
Характерным признаком стеноза аорты при катетеризации по-
лостей сердца следует считать систолический градиент давлений
между левым желудочком и аортой; наряду с увеличением сис-
толического давления в левом желудочке повышается и конеч-
но-диастолическое давление до 30 мм рт. ст., одновременно ока-
зывается умеренно увеличенным давление в легочных капилля-
153
pax, реже — в легочной артерии. Непрерывная регистрация дав-
ления при переходе катетера из аорты в левый желудочек поз-
воляет определить уровень стеноза. Фракция выброса и сердечный
индекс обычно нормальные или увеличены, их снижение — приз-
нак миокардиальной недостаточности. При левой вентрикулогра-
фии в передней и боковой проекциях отмечается узкая струя
контрастного вещества, поступающего в аорту, видны размеры
полости левого желудочка, гипертрофия его миокарда, нередко
выявляется сопутствующая митральная недостаточность. Пост-
стенотическая дилатация восходящей аорты чаще наблюдается
при клапанном характере стеноза. В случаях надклапанного сте-
ноза аорты сужение расположено над синусами Вальсальвы (вид
«песочных часов»), при дискретном стенозе видна диафрагма в
взводном тракте левого желудочка. У большинства больных со
стенозом аорты выявляется локальная или тотальная гипокине-
зия миокарда левого желудочка [Волынский Ю. Д. и др., 1989].
Аортография помогает исключить сочетание стеноза аорты с
открытым артериальным протоком и коарктацией аорты, оценить
степень сопутствующей аортальной недостаточности.
Дифференциальный диагноз проводят между различными
вариантами стеноза, включая ревматическое поражение клапанов,
идиопатический гипертрофический субаортальный стеноз, а также
с ДМЖП, коарктацией аорты, стенозом легочной артерии.
Наибольшие трудности вызывает дифференциальный диагноз
врожденного и ревматического стеноза аорты. Раннее обнаруже-
ние систолического шума (в первые годы жизни), отсутствие рев-
матического анамнеза, изолированный характер стеноза (без со-
четания с аортальной недостаточностью и с поражением митраль-
ного клапана), данные эхокардиографии (двустворчатый клапан,
аномалия развития створок, кольца) позволяют с уверенностью
диагностировать врожденный стеноз аорты. Следует помнить, что
появление аортальной недостаточности при врожденном стенозе
аорты может быть связано с деформацией створок из-за постоян-
ного гемодинамического воздействия вследствие повышенного
давления в левом желудочке и не обязательно означает присое-
динение ревматизма или бактериального эндокардита.
Течение, лечение. Течение и прогноз при стенозе аорты опре-
деляются его локализацией и выраженностью, сопутствующим
поражением миокарда, сочетанием с другими пороками сердца и
фиброэластозом. При естественном течении порока почти 25 %
больных умирают на первом году жизни, 60 % — в возрасте до
40 лет. С возрастом степень стеноза увеличивается, присоеди-
няются кальцификация клапанов, диффузный склероз миокарда,
резкая его гипертрофия.
Следует помнить, что больным со стенозом аорты противопо-
казаны занятия спортом, физкультура в школе должна прово-
диться только по спецпрограмме. Не диагностированный своевре-
менно стеноз аорты — одна из основных причин внезапной смерти
молодых спортсменов.
154
С целью профилактики эндокардита все хирургические мани-
пуляции (тонзиллэктомия, экстракция зуба и др.) желательно
проводить на фоне антибактериальной терапии.
При сердечной недостаточности на первом году жизни пока-
заны умеренные дозы (0,03—0,05 мг/кг) сердечных гликозидов
и мочегонных средств, препараты, улучшающие обменные процес-
сы в миокарде, коронаролитики (см. главу 22).
Причины смерти неоперированных больных — сердечная недо-
статочность, бактериальный эндокардит, аритмии, асистолия
при физической нагрузке.
Показаниями к хирургическому лечению
являются прогрессирующая сердечная недостаточность, синкопе,
боли в сердце при нагрузке, электрокардиографические признаки
гипертрофии и ишемии миокарда (снижение амплитуды или от-
рицательные зубцы 7v5. е>), градиент давления между левым желу-
дочком н аортой более 50 мм рт. ст. Группу риска по неудовлет-
ворительным результатам операции составляют больные с резким
стенозом, значительной массой миокарда, изменениями в миокар-
де на ЭКГ по типу «strain». Выраженный характер аортального
стеноза, ведущий к быстрому ухудшению состояния, так называе-
мый «критический стеноз», требует неотложного оперативного
вмешательства у новорожденных и детей первых месяцев жизни.
Успешную аортальную вальвулотомию у детей в возрасте 1,5—
2,5 мес выполнил академик АМН СССР В. И. Бураковский в
1981 г. с использованием срединной стернотомии и охлаждением
больных до 29 °C.
В настоящее время при коррекции порока применяется искус-
ственное кровообращение, позволяющее на более длительный
период безопасно выключать сердце из кровообращения. При
клапанном стенозе операция состоит в рассечении сросшихся
створок клапана строго по комиссурам. В тех случаях, когда по-
рок осложняется деформацией, утолщением и кальцинозом ство-
рок, и после разделения комиссур нельзя ожидать восстановления
запирательной функции клапана, створки иссекают и на их
место имплантируют протез.
В последнее время все большее распространение получает бал-
лонная дилатация клапанного стеноза аорты [Петросян Ю. С. и
др., 1986J.
При подклапанных стенозах аорты применяют трансоарталь-
ный доступ; мембрану, располагающуюся ниже фиброзного коль-
ца, захватывают зажимами и иссекают по всему периметру ее
основания. Эту процедуру следует выполнять осторожно, тщатель-
но, чтобы не повредить створки аортального клапана, митраль-
ный клапан и проводящую систему сердца.
Для устранения диффузного подклапанного стеноза аорты,
который обычно сопровождается гипоплазией устья аорты, приме-
няются две принципиально различные методики операций. Пер-
вая из них, предложенная S. Коппо и соавт. (1975) и получившая
название аорто-вентрикулопластики, заключается в расширении
155
выводного отдела левого желудочка и устья аорты с одновремен-
ным протезированием аортального клапана. По второй методике,
предложенной W. Wernhard и соавт. (1975) и D. Cooley и соавт.
(1976), достигается обходное шунтирование стеноза вшиванием
клапансодержащего трубчатого протеза между верхушкой левого
желудочка и восходящей аортой.
При надклапанном стенозе аорты объем хирургического вме-
шательства определяется типом патологии и уровнем располо-
жения препятствия. В редких случаях, при нормальном диаметре
аорты и локальном характере стеноза, обусловленном гребнем,
вдающимся в просвет аорты, операция может быть ограничена
аортотомией и иссечением суживающего гребня. В подавляющем
большинстве случаев наряду с иссечением мембраны возникает
необходимость в расширении восходящей аорты с помощью зап-
латы, вшиваемой в разрез на аорте. Оптимальный, но более об-
ширный вариант аортопластики разработан D. Doty и соавт.
(1977), согласно которому расширение восходящей аорты дости-
гается вшиванием заплаты в форме «штанишек». При диффузной
форме надклапанного стеноза аорты, при котором эффективная
аортопластика невозможна, J. Keane и соавт. (1976) предложи-
ли методику экстракардиального шунтирования стеноза по-
средством вшивания клапансодержащего трубчатого протеза
между верхушкой левого желудочка и нисходящим отделом
аорты.
Хирургическая летальность колеблется от 4,2 до 18 % [Доло-
тов В. К-, 1985; Kirklin J., Barratt-Boyes В., 1986]. Она сравни-
тельно низка при клапанном и дискретном подклапанном стенозе
аорты и повышается у детей раннего возраста при суправальву-
лярной форме порока и протезировании аортального клапа-
на. Наибольшая летальность наблюдается у младенцев с кри-
тическими стенозами, требующими экстренных операций, и ко-
леблется от 25 до 52 % [Keune J. et al., 1976; Sandor G. et al.,
1980].
Из операционных осложнений следует отметить острую сер-
дечную недостаточность, которая чаще всего обусловлена тяже-
лым исходным состоянием больного, развитием аортальной не-
достаточности, повреждением проводящей системы сердца.
Отдаленные результаты хирургического лечения аортального
стеноза вполне благоприятные. Основной причиной неудовлет-
ворительных результатов является недостаточность аортального
клапана, или рестеноз. У больных с клапанным стенозом аорты
(I и II классы в дооперационном периоде по классификзщ
NYHA) 15-летняя выживаемость после операции еоставляет 90 %
тогда как в тех случаях, когда исходное состояние расценивается
как IV или V классы, 15-летняя выживаемость составляет только
27 % [Bernhard W. F. и соавт., 1973; Ankeney J. и соавт., 1983].
Повторные операции, как правило, предпринимаются по поводу
рестеноза или аортальной недостаточности [Ситар Л. Л. и Игна-
тов П. И., 1987].
156
ВРОЖДЕННАЯ НЕДОСТАТОЧНОСТЬ АОРТАЛЬНЫХ КЛАПАНОВ
Эта врожденная аномалия является одной из самых редких и
малоизученных. Первое описание этой патологии принадлежит
N. Osler (1880). Врожденная недостаточность клапанов аорты,
как правило, сочетается с другими врожденными пороками: кла-
панным и подклапанным стенозами аорты, коарктацией аорты,
ДМЖП и фиброэластозом эндокарда. При врожденных стенозах
аорты и двустворчатом аортальном клапане недостаточность явля-
ется следствием гемодинамических нарушений; при коарктации
аорты провисанию двустворчатого клапана способствует повы-
шенное артериальное давление. Недостаточность аортальных кла-
панов может сочетаться с аневризмой аортального синуса, быть
следствием расширения восходящей аорты при идиопатических
ее вариантах и синдроме Марфана.
Н. Bankl (1980) выделяет несколько различных анатомичес-
ких типов врожденной изолированной недостаточности аорталь-
ных клапанов: 1) врожденный двустворчатый аортальный клапан,
в котором одна створка больше другой; при провисании большой
створки в период диастолы возникает аортальная недостаточ-
ность; 2) одностворчатый клапан; 3) врожденная фенестрация
аортальных клапанов, представленная одним или несколькими
крошечными отверстиями в одной или более створках, иногда
расположенных вблизи комиссур, аортальная недостаточность
усиливается при разрыве фенестрации; 4) гипоплазия или диспла-
зия одной створки клапана, в результате две другие прилежа-
щие створки остаются разделенными, что вызывает аортальную
регургитацию.
Основным гемодинамическим нарушением при этой аномалии
является •поступление крови из аорты в левый желудочек в период
диастолы. Как правило, врожденная недостаточность клапанов
аорты бывает незначительной и не вызывает существенных гемо-
динамических нарушений; последние связаны с сопутствующими
ВПС. С возрастом возможно прогрессирующее течение порока.
Единственным признаком, позволяющим поставить диагноз
этого порока, является диастолический шум вдоль левого края
грудины с максимумом во втором межреберье слева, шум непро-
должительный, связан со II тоном. АД обычно нормальное, может
быть тенденция к снижению диастолического АД. Неожиданное
обнаружение шума недостаточности клапанов аорты требует ис-
ключения ревматизма и бактериального эндокардита. При отсут-
ствии иммунологических и лабораторных подтверждений единст-
венным методом, позволяющим провести дифференциальный
диагноз в этих трудных случаях, является эхокардиография.
При одномерной эхокардиографии прямым признаком недос-
таточности является диастолическое несмыкание створок аорты.
Косвенными признаками аортальной недостаточности являются
диастолическое высококачественное трепетание створок митраль-
ного клапана, гиперкинезия межжелудочковой перегородки и зад-
157
ней стенки левого желудочка, инцизура на перегородке. В отличие
от врожденной при ревматической недостаточности клапанов аор-
ты эхо-сигналы от створок аорты широкие, высокой акустической
плотности, клапаны рыхлые, отечные, при длительном течении
деформированы и уплотнены, створок, как правило, три, имеются
изменения со стороны объема левого желудочка. Вегетации на
створках, быстрая динамика процесса, отсутствие признаков сте-
ноза устья аорты указывают на недостаточность аортального кла-
пана при бактериальном эндокардите. При синдроме Марфана
расширение восходящей аорты начинается непосредственно в об-
ласти прикрепления створок аортального клапана к фиброзному
кольцу аорты и далее распространяется на восходящую часть
аорты; створки клапанов тонкие, нежные, систолическое расхож-
дение их увеличено пропорционально степени расширения фиб-
розного кольца, при сопутствующей расслаивающей аневризме
виден двойной контур стенки аорты. При аневризме синуса Валь-
сальвы выявляется выбухание стенки аорты в сторону правого
желудочка на 10—13 мм. Двухмерная эхокардиография является
информативным методом в диагностике врожденных форм, позво-
ляет определить структуру створок, их количество. Доп-
плер-эхокардиография обнаруживает диастолический поток крови
в выводном тракте левого желудочка и самой полости. При
врожденных формах диастолическая турбулентность выявляется
только в выносящем тракте левого желудочка.
Тактика ведения больных с врожденной недостаточностью аор-
тального клапана не отличается от таковой при двустворчатом
клапане аорты, с которым она нередко сочетается.
ДВУСТВОРЧАТЫЙ КЛАПАН АОРТЫ
В 1886 г. W. Osler отметил, что двустворчатый клапан аорты
является довольно частой находкой на аутопсии, гораздо более
распространенной, чем другие ВПС. Двустворчатый клапан имеет
одну створку спереди, другую сзади и две комиссуры. Эта анома-
лия развития сопутствует другим врожденным порокам: коарк-
тации аорты, дефекту межжелудочковой перегородки, над- и под-
клапанному стенозу аорты, перерыву дуги аорты и др., а также
наследственным синдромам (синдром Тернера, Марфана, три-
сомия 18). По данным М. Silver (1973), частота встречаемости
двустворчатого клапана аорты в общей популяции составляет 1 %.
Несмотря на доброкачественное течение порока, возможны
следующие осложнения: прогрессивное утолщение створок и раз-
витие стеноза с возрастом, присоединение эндокардита
(10—15%), кальцификация створок, недостаточность клапанов.
У детей створки могут быть не изменены, и такой клапан функцио-
нирует как нормальный трехстворчатый. Однако у взрослых
двустворчатый клапан становится частой причиной стеноза
аорты. Если створки имеют недостаточные размеры, то полное их
открытие исключается, и таким образом возникает эффект сте-
158
ноза. Слишком удлиненные створки пролабируют и способствуют
развитию со временем недостаточности клапанов, что часто
сопутствует артериальной гипертензии.
Диагностировать двустворчатый клапан аорты помогает сред-
ней интенсивности, но грубоватый по тембру систолический шум
во втором межреберье справа, иногда в сочетании со слабым
коротким диастолическим шумом, связанным со II тоном. По-
следний лучше выслушивается у лежащего ребенка и исчезает
в положении стоя. Клики выслушиваются на основании сердца,
но реже, чем при стенозе аорты.
Подтвердить диагноз двустворчатого аортального клапана
помогает только эхокардиография [Делягин В. М., 1989]. При
одномерной эхокардиографии двустворчатый аортальный клапан
диагностируют на основании индекса эксцентричности, равного
1,3 и более (индекс рассчитывается как отношение половины
ширины просвета аорты к расстоянию от одной аортальной створ-
ки до ближайшей стенки аорты в начале диастолы). Этот при-
знак не имеет строгой специфичности и может наблюдаться
при поражении трехстворчатого клапана аорты, нарушении ориен-
тации ультразвукового луча. Косвенным эхокардиографическим
признаком двустворчатого аортального клапана является множе-
ственность диастолического эхосигнала от створок, более широкая
и акустически более плотная диастолическая линия смыкания
аортального клапана (фиброз свободного края створок). Часто
при данной аномалии определяется диастолическое трепетание
передней митральной створки. Двухмерная эхокардиография поз-
воляет непосредственно определить количество аортальных ство-
рок в проекции короткой оси из парастернального доступа. При
двустворчатом клапане выявляются две неравнозначные по раз-
меру, иногда выбухающие створки, линия их смыкания эксцен-
трична, расположена горизонтально. Одномерная эхокардиогра-
фия выявляет двустворчатый аортальный клапан в 75 % случаев,
двухмерная — в 95 %. Двустворчатый клапан аорты нередко
сочетается с пролапсом митрального клапана.
Пациенты с двустворчатым клапаном аорты нуждаются в регу-
лярном (1 раз в год) эхокардиографическом обследовании, хирур-
гические манипуляции (удаление зубов, миндалин, рентгеноуро-
логическое обследование и др.) у них желательно проводить
под прикрытием антибиотиков. В случае прогрессирующего тече-
ния заболевания должны быть ограничены занятия спортом.
КОАРКТАЦИЯ АОРТЫ
Коарктация аорты представляет собой врожденное сужение
или полный перерыв аорты в области перешейка ее дуги, иногда
в грудной или брюшной части. Частота порока составляет от 6,3
до 15% всех ВПС. Первое его описание принадлежит J. Meckel
(1750).
Анатомия, классификация. Обычно коарктацию аорты обнару-
159
Рис. 44. Схема вариантов ко-
арктации аорты.
а — постдуктальная; б — пре-
дуктальная с локальным сужением;
в — гтредуктальная с сужением на
протяжении; 1 — коарктация аор-
ты; 2 — открытый артериальный
проток
живают в «типичном» месте при переходе дуги в нисходящую
часть аорты, так как здесь и в норме имеется сужение (оба отдела
образуются из разных эмбриональных зачатков). J. Е. Edwards
и соавт. (1948) выделили «взрослый» и «детский» (инфантиль-
ный) типы коарктации аорты. При первом имеется сегментарное
сужение просвета аорты дистальнее отхождения левой подклю-
чичной артерии; при втором типе видна гипоплазия аорты в этом
же месте. Сужение перешейка аорты может быть значительным
вплоть до облитерации.
По анатомическим особенностям можно выделить три варианта
коарктации аорты: 1) изолированная коарктация; 2) коарктация
в сочетании с открытым артериальным протоком (ОАП): постдук-
тальная (расположена ниже отхождения ОАП), юкстадуктальная
(проток открывается на уровне сужения), предуктальная (арте-
риальный проток отходит ниже коарктации) (рис. 44); 3) коаркта-
ция в сочетании с другими ВПС (ДМЖП, ДМПП, стеноз аорты,
аневризма синуса Вальсальвы, транспозиция магистральных сосу-
дов и др.) [Покровский А В., 1979}. ОАП обнаруживается более
чем у 60 % детей первого года жизни с коарктацией аорты, при
этом он может превышать диаметр аорты. Изолированная коаркта-
ция чаще встречается у детей старшего возраста. Нередко на-
ходят двустворчатый клапан аорты, деформацию митрального
клапана, поэтому могут быть клинические признаки аортальной
и митральной регургитации.
Дистально от коарктации аорты стенка истончается, просвет
аорты расширяется (иногда аневризматически — результат турбу-
лентного воздействия тока крови после прохода места сужения).
В более старшем возрасте аневризматические изменения касаются
и восходящей аорты.
К атипичной относится локализация коарктации в грудной
или брюшной аорте, возможны множественные сужения. «Псевдо-
коарктация» или «кинкинг» аорты — деформация аорты, анало-
гичная классической коарктации, но препятствие кровотоку не-
значительное или вовсе отсутствует, так как имеется простое
удлинение и извилистость аорты.
160
На аутопсии у детей раннего возраста с коарктацией аорты
часто находят фиброэластоз эндомиокарда, локализующийся пре-
имущественно в выносящем тракте левого желудочка и на меж-
желудочковой перегородке.
Гемодинамика. При коарктации аорты имеется систолическая
перегрузка левого желудочка и существуют два гемодинами-
ческих режима: гипертонический (выше места коарктации —
верхняя половина туловища) и гипотонический (ниже сужения —
брюшная полость, нижние конечности). При постдуктальной ко-
арктации кровь из аорты под высоким давлением сбрасывается
через ОАП в легочную артерию, при этом может рано развиться
легочная гипертензия. При предуктальном варианте направление
сброса через артериальный проток будет.'определяться разницей
давлений между легочной артерией и нисходящей аортой ниже
места коарктации; сброс может быть артериовенозным и вено-
артериальным. Последний объясняет дифференцированный цианоз
(он есть на ногах и нет на руках) как клинический признак
предуктальной коарктации.
Тяжесть течения порока во многом определяется состоянием
коллатеральных сосудов между верхней и нижней половинами
туловища. Они выглядят дилатированными, извитыми, увеличи-
вают приток крови от восходящей к нисходящей аорте, минуя
коарктацию. Коллатеральный кровоток хуже представлен при пре-
дуктальной коарктации, чем при постдуктальной, что объясняет
более тяжелое ее течение.
Патогенез артериальной гипертензии при коарктации аорты
сложен и до конца не ясен. Механическая обструкция, активация
системы ренин — ангиотензин — альдостерон (на фоне недоста-
точной перфузии почек) и органические изменения в сосудистой
стенке приводят к увеличению общепериферического сопротивле-
ния.
Клиника, диагностика. Коарктация аорты встречается в 3—
5 раз чаще у мальчиков, чем у девочек. Клиническая картина
порока сердца определяется возрастом, анатомическими измене-
ниями, сочетанием с другими ВПС. У детей раннего возраста
коарктация аорты нередко сопровождается повторными пневмо-
ниями, явлениями легочно-сердечной недостаточности с первых
дней жизни, отмечаются резкая бледность кожных покровов,
выраженная одышка, возможны застойные хрипы в легких, ими-
тирующие пневмонию. Дети нередко отстают в физическом раз-
витии, имеется гипотрофия I—III ст. Границы сердца умеренно
и резко расширены (при сочетании с фиброэластозом эндомиокар-
да), верхушечный толчок усилен, приподнимающийся.
Систолический шум грубого тембра шума изгнания различной
продолжительности лучше выслушивается на основании сердца
или сзади в межлопаточной области слева (место проекции
перешейка аорты). При ОАП во втором межреберье слева опре-
деляется систолодиастолический шум, однако диастолический ком-
понент его может практически отсутствовать. II тон над легочной
6—976
161
артерией и аортой усилен. Кроме систолического шума коаркта-
ции аорты при аускультации можно заподозрить двустворчатый
аортальный клапан (негрубый систолический шум во втором
межреберье справа) или его недостаточность (протодиастоли-
ческий шум во втором и третьем межреберьях слева у грудины),
недостаточность митрального клапана (систолический шум на вер-
хушке с иррадиацией в левую аксиллярную область).
Решающее значение в диагностике имеет определение харак-
тера пульса на руках и ногах: отсутствие или резкое ослабление
пульса на бедренных артериях и напряженный пульс на кубиталь-
ной артерии (в локтевых сгибах). При предуктальной коарктации
с веноартериальным сбросом пульс на ногах будет определяться
одновременно с дифференцированным цианозом.
АД на руках у детей с изолированной резко выраженной
коарктацией аорты достигает высоких цифр — до 190—200/90—
100 мм рт. ст., при сочетании с другими ВПС АД 130—
170/80—90 мм рт. ст., в редких случаях оно бывает нормаль-
ным, что затрудняет постановку диагноза. На ногах давление
не определяется или резко снижено. Следует помнить, что у детей
с коарктацией аорты надо измерять АД на обеих руках. При соче-
тании коарктации аорты с аномальным отхождением подключич-
ных артерий (правой подключичной от нисходящей аорты, обеих
подключичных артерий от места сужения и др.) или сужением
устья одной из них возможна разница АД на руках. После
операции в случаях пластики места сужения из левой подключич-
ной артерии АД определяется только на правой руке, на левой
оно отсутствует.
Сердечная недостаточность у детей первых лет жизни носит
бивентрикулярный характер, она может быть рефрактерна к ме-
дикаментозному лечению, особенно при сочетании с фиброэласто-
зом.
У детей старшего возраста и взрослых при отсутствии жалоб
повышенное АД обнаруживают случайно, иногда больные наблю-
даются с диагнозом «артериальная гипертензия неясного генеза»
(эссенциальная). Больные жалуются на головокружения, тяжесть
и боли в голове, повышенную утомляемость, носовые кровотечения,
возможны боли в сердце. Одновременно отмечаются жалобы на
слабость и боли в ногах, судороги в мышцах ног, зябкость
стоп, иногда эти проявления напоминают синдром- перемежа-
ющейся хромоты. У женщин возможны нарушения менструаль-
ного цикла, бесплодие. При осмотре отмечается хорошее физи-
ческое развитие с диспропорцией мышечной системы: мышцы
верхней половины гипертрофированы при относительной гипотро-
фии мышц таза и нижних конечностей, ноги на ощупь холодные.
При пальпации межреберных артерий (больного наклоняют вперед
с опущенными руками) отмечается их повышенная пульсация.
Систолическое АД на ногах на 50—60 мм рт. ст. ниже, чем
на руках (в норме наблюдается обратное соотношение), при нор-
мальном диастолическом АД, т. е. имеется небольшое пульсовое
162
Рис. 45. Коарктация аорты у детей младшего (а) и старшего (б) возраста.
ЭКГ. Объяснение в тексте.
давление на ногах — признак коарктации аорты. Нередко АД
на ногах вообще не определяется, а на руках обнаруживается
высокая гипертензия систолодиастолического характера, которая
может стать причиной внезапного кровоизлияния в мозг.
У детей старшего возраста с коарктацией аорты, как пра-
вило, не бывает сердечной недостаточности, она возникает после
20—30 лет и является прогностически неблагоприятным призна-
ком.
Осложнениями коарктации аорты являются бактериальный эн-
докардит, неврологические изменения (церебральные сосудистые
кризы, инсульт, гемипарезы), разрыв аорты и аневризмы сину-
са Вальсальвы.
Бактериальный эндокардит перешейка аорты часто бывает
рефрактерным к антибиотикотерапии. В случаях непрерывнореци-
дивирующего течения эндокардита показано срочное хирургиче-
ское лечение. Иногда в процесс одновременно вовлекаются кла-
паны аорты, что эхокардиографически диагностируют по наличию
вегетаций на створках.
При умеренной коарктации аорты ЭКГ мало отличается от
нормальной. У детей первых лет жизни при сочетании с ОАП
и ДМЖП электрическая ось сердца отклонена вправо или рас-
положена вертикально, имеются признаки гипертрофии миокарда
обоих желудочков, больше правого (рис. 45, а), возможно сме-
шение интервала ST ниже изолинии с отрицательным зубцом Т
в отведениях I, II, aVL, V5.6. Для детей старшего возраста
типична изолированная гипертрофия Миокарда левого желудочка
с высокими положительными зубцами (рис. 45,6).
6*
163
ФКГ при этом пороке не имеет специфических изменений.
Как правило, фиксируется среднеамплитудный ромбовидный сис-
толический шум в I и V точках и на спине, при наличии ОАП
диастолический компонент шума выражен нечетко.
Тест с дозированной физической нагрузкой на велоэргометре
или тредмиле у детей с коарктацией аорты показан при умеренной
артериальной гипертензии (до 150—160/90—100 мм рт. ст.) для
определения объема двигательного режима. Если систолическое
АД при субмаксимальной нагрузке повышается более 190—200 мм
рт. ст., то рекомендуется ограничение физической активности
(освобождение от занятий спортом, физкультурой). Это обследо-
вание показано также больным после хирургического лечения,
при этом желательно до и сразу после пробы измерять АД на руках
и ногах с оценкой градиента давления между ними. У больных,
перенесших резекцию коарктации аорты и имеющих в покое
нормальное АД, нередко при субмаксимальной нагрузке обнару-
живают его значительное повышение на руках (на ногах АД прак-
тически не изменяется). Эта «артериальная гипертензия напря-
жения» может быть связана с остаточной обструкцией или из-
менениями сосудистой стенки, ведущими к повышению обще-
периферического сопротивления. Если при нагрузке систолическое
АД поднимается выше 200 мм рт. ст., показаны повторная катете-
ризация, проведение усиленной гипотензивной терапии.
На рентгенограмме легочный рисунок нормальный или усилен
по артериальному руслу (при постдуктальной коарктации и в со-
четании с ДМЖП), сердце имеет шаровидную конфигурацию
с приподнятой верхушкой и расширенной восходящей аортой.
У детей старшего возраста сердце имеет нормальные размеры или
несколько увеличено влево, определяется узурация нижних краев
ребер из-за давления резко расширенных и извитых межреберных
артерий (рис. 46). Кардиомегалия с ослабленной пульсацией
миокарда левого желудочка у маленьких детей свидетельствует
о сопутствующем фиброэластозе эндомиокарда.
Одномерная эхокардиография не позволяет выявить коаркта-
цию аорты. Косвенными признаками порока являются гипертро-
фия миокарда левого желудочка с увеличением его массы и при-
знаками перегрузки давлением, увеличение левого предсердия и
корня аорты, гиперкинезия задней стенки. При двухмерном сектор-
ном сканировании из супрастернального доступа коарктация аор-
ты обнаруживается в виде ярких эхо в просвете аорты, одновремен-
но можно судить о наличии дискретной сегментарной коарктации
или полного перерыва.
Допплер-эхокардиография позволяет выявить у больных с ко-
арктацией аорты турбулентный ускоренный поток крови за местом
стеноза, косвенно определить градиент давления. ЯМР-обсле-
дование в сагиттальной и левой косой проекциях также помогает
установить место коарктации и анатомию дуги аорты. Эти методы
используются для оценки эффективности баллонной дилатацион-
ной ангиопластики и выявления рестеноза.
164
Рис. 46. Рентгенограмма грудной клетки больного 8 лет с коарктацией аорты.
Сердце небольших размеров, расширение восходящей аорты, верхушка сердца за-
круглена, видна узурация нижних ребер
Диагноз коарктации подтверждается при катетеризации аорты
и аортографии, когда определяют величину градиента давления
между восходящей и нисходящей аортой, место сужения, гипо-
плазию горизонтальной аорты (причина артериальной гипертензии
после операции), выраженность аневризматических изменений
аорты. Однако необходимость в применении данного метода возни-
кает довольно редко, так как в большинстве случаев возможно
установление точного диагноза на основании данных неинвазив-
ных методов обследования.
У больных с фиброэластозом эндомиокарда показатели зонди-
рования полостей сердца свидетельствуют о значительном сниже-
нии сократительной способности миокарда левого желудочка, от-
мечается повышение конечно-диастолического давления в нем, ле-
гочно-капиллярного давления, систолического давления в легоч-
ной артерии. Левая вентрикулография выявляет резко расширен-
ную полость левого желудочка со сниженной амплитудой
пульсации его миокарда, одновременно бывают увеличены правый
желудочек и левое предсердие.
Дифференциальный диагноз следует проводить с врожденным
миокардитом, кардиомиопатиями, вторичной (симптоматической)
и эссенциальной артериальной гипертензией, ДМЖП, стенозом
аорты.
165
Течение, лечение. Согласно литературным данным средняя
продолжительность жизни больных при естественном течении ко-
арктации аорты составляет 35 лет. Поданным М. Campbell (1956),
смертность среди 716 больных составила 25 % в возрасте до
20 лет, до 32 лет — 50 %, до 46 лет — 75 % и до 58 лет — 90 %.
Основные причины смерти неоперированных больных с коарк-
тацией аорты: сердечная недостаточность, бактериальный эндо-
кардит, внезапная смерть при разрыве аорты или ее аневризмы,
инсульт.
Показания к операции. Операция показана больным,
у которых систолический градиент давления на верхних и нижних
конечностях превышает 50 мм рт. ст. У новорожденных и детей
первого года жизни выраженная артериальная гипертензия и де-
компенсация сердечной деятельности могут явиться основанием
для проведения срочной операции, с предварительным медика-
ментозным лечением. При сравнительно благоприятном течении
операцию целесообразно отложить до 5—6-летнего возраста боль-
ного, когда можно будет выполнить широкий анастомоз и из-
бежать рецидива порока. Операцию проводят и в более поздние
сроки, но функциональный эффект может быть хуже из-за воз-
можности сохранения или периодического появления гипертензи-
онного синдрома.
Впервые оперативное лечение коарктации аорты было пред-
принято С. Crafoord в 1944 г., затем R. Gross в 1945 г. и проф.
Е. Н. Мешалкиным в 1955 г.
Существует несколько методов устранения коарктации аорты,
выбор которых в основном определяется возрастом больных, т. е.
исходным диаметром аорты. У новорожденных и детей раннего
возраста широкое распространение получила операция аортоплас-
тики с помощью подключичной артерии. Если вначале операция
включала пересечение подключичной артерии, ведущее к недоста-
точному росту левой руки, то в последнее время М. Meier и соавт.
(1986) предложили новую методику для устранения коарктации
аорты посредством использования левой подключичной артерии
с сохранением кровотока по левой руке. В этом случае произ-
водят максимальное выделение левой подключичной артерии и от-
ходящих от нее ветвей. Подключичную артерию отсекают от
дуги аорты и ушивают рану на аорте. Продольным разрезом
вскрывают аорту выше и ниже места сужения и соединяют
разрезы между собой, открывая место сужения. Далее подключич-
ную артерию вскрывают в продольном направлении, но ниже уров-
ня отхождения ветвей, низводят вниз и, подшивая непрерывным
швом к краям разреза на аорте, устраняют сужение. Авторы
данной методики оперировали больных в возрасте от 2 мес до
25 лет, но считают, что предпочтительнее ее выполнение у детей
раннего возраста.
У больных старше 5—6 лет наибольшее распространение имеет
методика резекции коарктации аорты с наложением анастомоза
конец в конец. В то же время данных операций стараются избе-
166
гать у детей раннего возраста из-за частого развития рекоаркта-
ции в отдаленные послеоперационные сроки.
В качестве первичной операции ограниченное применение имеет
обходное шунтирование коарктации аорты с помощью сосудистого
протеза, данная методика значительно чаще используется при
рекоарктации аорты.
В последние годы для устранения рекоарктации и коарктации
аорты у детей раннего возраста применяется и баллонная дила-
тация сужения.
Летальность при устранении коарктации аорты в старшей
возрастной группе колеблется от 3 до 0 % и увеличивается
у детей раннего возраста от 10 до 15,4 % [Шарыкин А. С., 1986].
Летальность также увеличивается при сочетании коарктации аор-
ты с другими пороками. J. Stark и М. de Leval (1983) сообщают
о летальности 6 % при устранении изолированной коарктации
аорты и 20 % при ее сочетании с другими ВПС.
Отдаленные послеоперационные результаты, как правило, хо-
рошие. Выживаемость больных через 15 лет после операции
колеблется от 83 до 89%. При изолированной коарктации аорты
выживаемость составляет 92%, при сочетании ее с ДМЖП —
81 % и при сочетании со сложными ВПС — 41 % к третьему
году после операции [Kirklin J., Barratt-Boyes В., 1986].
Наибольшее число рекоарктаций, требующих повторных опе-
ративных вмешательств, образуется при выполнении в раннем
детском возрасте анастомоза конец в конец. Среди признаков
рекоарктации аорты следует отметить повышение АД на руках и
снижение его на ногах (систолический градиент свыше 50 мм
рт. ст.).
По данным S. Geudeau и соавт. (1977), хорошие послеопера-
ционные результаты наблюдались в 81 %, если больной был
оперирован в возрасте до 10 лет, и в 43 % при проведении опера-
ции после 30 лет; в старшем возрасте чаще отмечаются ослож-
нения и послеоперационная летальность, что связано с развитием
к этому времени выраженной гипертрофии миокарда левого же-
лудочка, атеросклеротического и дегенеративного поражения аор-
ты и мозговых сосудов, расширением коллатералей, появлением
сердечной недостаточности.
После резекции коарктации АД снижается вскоре после опера-
ции, но у 10—60 % больных остается артериальная гипертензия
в течение 2—3 лет и более; она может быть связана с оста-
точной обструкцией. Другими причинами повышения АД являются
изменения в сосудистой стенке, сохраняющаяся тубулярная гипо-
плазия перешейка аорты, значительная дилатация нисходящей
аорты, нарушения комплайнес в месте операции, нарушение баро-
рецепторной функции, в меньшей степени имеет значение актива-
ция системы ренин-альдостерон. Резидуальная гипертензия возни-
кает у больных, оперированных в первом году жизни или после
16—20 лет, и требует назначения гипотензивных препаратов
(включая обзидан, диуретики, вазодилататоры — нифедипин).
167
ДВОЙНАЯ ДУГА АОРТЫ
Двойная дуга аорты (ДДА) является одной из аномалий, обра-
зующей сосудистое кольцо и вызывающей компрессию трахеи и
пищевода. Порок впервые описан W. Hommel в 1773 г.
ДДА представляет собой одновременное существование правой
и левой аортальных дуг (рис. 47). Восходящая аорта расположена
впереди трахеи, она разделяется на две дуги, которые затем
проходят по обе стороны трахеи и пищевода. От каждой дуги
отходят общая сонная и подключичная артерия; позади пище-
вода дуги соединяются с нисходящей аортой, которая спускается
в грудную клетку справа или слева от срединной линии. Чаще
правая (задняя) дуга проходит сзади трахеи и пищевода, а левая
(передняя) дуга — спереди. Наиболее часто при ДДА обе дуги
не заращены, правая дуга шире и находится выше левой, открытый
артериальный проток (или артериальная связка) и нисходящая
аорта расположены слева (реже справа); другой вариант: одна ду-
га не заращена, вторая (левая) атрезирована [Bankl Н., 1980].
ДДА обычно существует как изолированная аномалия, но мо-
жет сочетаться с тетрадой Фалло, правосторонней нисходящей
аортой, ДМЖП, ДМПП, коарктацией аорты, транспозицией ма-
гистральных сосудов.
Клинические проявления порока разнообразны. При незначи-
тельном давлении на пищевод и трахею единственным прояв-
лением порока могут быть тупые боли за грудиной, некоторое
затруднение при дыхании и глотании твердой пищи, в связи с чем
возникает подозрение на опухоль пищевода. У грудных детей
основным проявлением сосудистого кольца является стридорозное
дыхание с момента рождения или вскоре после него. Другими
причинами стридорозного дыхания могут быть ларингомаляция,
предшествующая интубация, атрезия хоан, инфекция, родовая
травма. Обычно у детей без ДДА стридорозное дыхание про-
ходит через 2—3 мес, а при наличии ДДА клинические проявле-
ния его сохраняются и прогрессируют. Одновременно наблюда-
ются одышка, кашель, приступы удушья, апноэ, цианоза, рециди-
вирующие бронхопневмонии (из-за аспирации пищи), срыгивание,
рвота, дисфагия, снижение массы тела. Дети принимают вынуж-
денное положение на боку с запрокинутой назад головой (улуч-
шается проходимость трахеи). Дыхательная недостаточность
со временем прогрессирует и угрожает жизни больного [Крив-
ченя Д. Ю., 1985]. При объективном обследовании изменений
со стороны сердца нет, тоны громкие, шум отсутствует, за ис-
ключением случаев с сопутствующими ВПС.
Определить ДДА по обычной рентгенограмме нельзя, но ее
иногда можно заподозрить по дополнительному образованию,
напоминающему праворасположенную дугу аорты. В боковой про-
екции видно сужение трахеи на уровне дуги аорты.
Д. Ю. Кривченя (1985), наблюдая и успешно оперируя та-
ких детей, считает наиболее высокоинформативным диагности-
168
Рис. 47. Схема анатоми-
ческого расположения
аорты, пищевода и тра-
хеи при двойной дуге
аорты.
П — пищевод; Тр — тра-
хея.
ческим методом эзофагографию с введением через зонд водо-
растворимого контрастного вещества (15—20 мл) в пищевод.
Использование жировых и барийсодержащих растворов имеет не-
которую опасность из-за возможности их аспирации и развития
асфиксии. На эзофагограммах в боковой проекции определяются
типичные для порока компрессионные деформации тени пище-
вода. При бронхоскопии обнаруживаются сужение просвета и
пульсация надбифуркационного сегмента трахеи. При трахеогра-
фии с водорастворимым контрастным веществом в боковой проек-
ции выявляются деформация и сужение надбифуркационной части
трахеи. После исследования контрастное вещество надо тщатель-
но отсосать.
Аортография, как метод обследования, остается в резерве,
так как она не всегда информативна, например, в случае, если
сосуды накладываются друг на друга или одна из дуг атрезиро-
вана.
В настоящее время для выявления сосудистого кольца ис-
пользуется двухмерная эхокардиография. J. Huhta и соавт. (1986)
обследовали 22 ребенка первого года жизни со стридором и в 35 %
причиной стридора было сосудистое кольцо.
Авторы считают, что двухмерная эхокардиография должна
быть первым методом обследования детей со стридором и респи-
раторными нарушениями.
Хирургическое лечение показано только в случаях, когда име-
ются клинические проявления сдавления пищевода или трахеи.
Цель операции — восстановление нормальной функции этих орга-
нов. При операции выделяют и пересекают артериальную связку
или открытый артериальный проток и оставляют длинную культю
на его левой дуге. Меньшую по диаметру (левую) дугу пере-
вязывают, прошивают и фиксируют с помощью культи боталлова
протока к грудине, тем самым вызывая декомпрессию трахеи
и пищевода [Кривченя Д. Ю., 1985].
169
Врожденная аневризма синуса Вальсальвы (АСВ) — мешот-
чатое или пальцеобразное расширение либо выпячивание аорталь-
ной стенки синуса, нередко сопровождающееся прорывом в пред-
лежащие полости сердца. Первое описание этой патологии при-
надлежит J. Норе (1839), а в отечественной литературе —
Ф. М. Опенховскому (1894).
Частота врожденной АСВ составляет 0,1—3,5 % всех ВПС
[Некласов Ю. Ф. и др., 1975; Королев Б. А. и др., 1979; Meyer J.
et al., 1975]. Если к концу 1975 г. в литературе содержались све-
дения о 220 таких наблюдениях, то к концу 1985 г. было описано
уже около 350.
Анатомия. Отличительной особенностью врожденных АСВ яв-
ляется их мешотчатая или пальцеобразная форма и выпячивание
в смежные отделы сердца. Чаще всего аневризма заканчивается
одним или несколькими перфорационными отверстиями, приводя-
щими к сообщению корня аорты с соответствующей камерой серд-
ца. Размеры аневризматического мешка бывают в пределах от 0,8
до 3 см, диаметр перфорационного отверстия — от 0,2 до 1,8 см.
Аневризма может исходить из любого синуса Вальсальвы,
однако наиболее часто (75—95%) — из правого коронарного
синуса. Частота локализации аневризмы в некоронарном синусе
составляет 5—25 %. Исключительную редкость представляют
аневризмы, исходящие из левого коронарного синуса.
Существует закономерность разрыва аневризм в определенные
полости сердца. Аневризмы, исходящие из левой или центральной
части правого коронарного синуса, обычно разрываются в вывод-
ной отдел правого желудочка. Если аневризма расположена
в правой части правого коронарного синуса, то в '/4 случаев
она прорывается в приточный отдел правого желудочка и видна
сразу же ниже септальной створки трикуспидального клапана,
а в 3/4 случаев разрыв происходит в полость правого предсердия.
Аневризма, исходящая из некоронарного синуса, как правило, раз-
рывается в полость правого предсердия и лишь иногда — в полость
правого желудочка. Аневризмы левого коронарного синуса, пред-
ставляющие исключительную редкость, могут прорываться в поло-
сти правого предсердия, правого желудочка и экстракардиаль-
но.
Среди сопутствующих ВПС следует отметить ДМЖП, который
обычно встречается при аневризмах правого коронарного синуса;
дефект располагается выше наджелудочкового гребня и ниже
клапана легочной артерии. Частота ДМЖП при врожденных
АСВ составляет 40—50 %. Реже встречаются ДМПП, ОАП, коар-
ктация аорты, аортальная недостаточность, стеноз легочной
артерии.
Гемодинамика. Неразорвавшаяся АСВ протекает без гемо-
динамических нарушений. Однако в ряде случаев, выбухая в вы-
водной отдел правого желудочка, она может создавать препят-
170
ствие току крови в ствол легочной артерии и крайне редко,
сдавливая проводящие пути сердца, вызывает различного харак-
тера нарушения ритма.
Нарушения гемодинамики при прорыве аневризмы обуслов-
лены сбросом крови из аорты в ту или иную камеру сердца, но
чаще всего — в правый желудочек или правое предсердие. Кровь
из аорты поступает постоянно, на протяжении всего сердечного
цикла, так как систолическое и диастолическое давление в ней
значительно выше, чем в правых отделах сердца. Объем сброса
крови зависит как от диаметра перфорационного отверстия, так
и от легочно-сосудистого сопротивления.
Сброс крови слева направо приводит к увеличению не только
легочного кровотока, но и возврата крови в левое предсердие
и левый желудочек, следовательно, возникает объемная перегруз-
ка как правых, так и левых отделов сердца. Давление в малом
круге кровообращения обычно составляет менее 70 % от систем-
ного. Если вскоре после прорыва аневризмы развивается высо-
кая легочная гипертензия и быстро прогрессирующая сердечная
недостаточность, то промедление с операцией может привести
к летальному исходу.
Клиника, диагностика. Большинство (70—80%) больных
с врожденной АСВ — лица мужского пола. Прорыв аневризмы
чаще всего происходит в возрасте 25—40 лет, однако возможен
и у детей раннего возраста. Чаще всего прорыв аневризмы
наступает при резком физическом напряжении, хотя возможен
и в состоянии покоя. К предрасполагающим факторам следует
отнести бактериальный эндокардит.
АСВ без фистулы между аортой и полостью сердца обычно
ничем себя не проявляет и ее обнаруживают случайно при ан-
гиографии или во время операции по поводу какого-либо другого
сопутствующего порока сердца или на аутопсии.
Если после разрыва аневризмы сообщение между аортой и
правыми отделами сердца большое, то развивается и быстро
прогрессирует сердечная недостаточность; при небольших раз-
мерах отверстия она отсутствует или купируется медикаментоз-
ным лечением. По характеру клинического течения всех больных
можно разделить на две группы: а) с постепенным ухудшением
состояния (при сочетании АСВ с другими ВПС, когда с рожде-
ния имели место нарушения гемодинамики, но ухудшение на-
ступает при разрыве АСВ); б) с внезапным ухудшением состоя-
ния (обычно наступает при изолированной форме порока на фоне
разрыва) [Бураковский В. И. и др., 1987J. В момент разрыва
аневризмы появляются боли в области сердца, одышка и сердце-
биение. Нередко больные могут отметить не только день, но и час
начала заболевания, реже начало бывает бессимптомным. Одыш-
ка обусловлена внезапно увеличивающимся легочным кровото-
ком. а тахикардия и боли в области сердца — уменьшением коро-
нарного кровотока и минутного объема большого круга крово-
обращения из-за сброса крови в правые отделы сердца.
171
Одновременно с появлением одышки и болей в области серд-
ца впервые выслушивается продолжительный, машинообразный
систолодиастолический шум над областью сердца. В отличие от
ОАП при АСВ шум локализуется во втором и четвертом меж-
реберьях, слева у грудины — при прорыве в правый желудочек
и над центром или справа от грудины в третьем и четвертом
межреберьях - при прорыве в правое предсердие; шум более
поверхностный и часто сопровождается дрожанием над грудной
клеткой, определяемым при пальпации. Наблюдается умеренное
снижение диастолического АД (в среднем до 40 мм рт. ст.) и по-
вышение пульсового давления (в среднем до 80 мм рт. ст.).
ЭКГ не имеет специфических изменений, определяются приз-
наки гипертрофии миокарда обоих желудочков (больше левого)
и левого предсердия. Иногда обнаруживаются проявления пол-
ной или неполной атриовентрикулярной блокады, узловой ритм,
блокады правой ножки пучка Гиса как результат механического
сдавления этих отделов проводящей системы сердца. Описаны
случаи желудочковой и наджелудочковой тахикардии и синко-
пальных состояний на их фоне.
На ФКГ фиксируется высокоамплитудный систолодиастоличе-
ский шум, реже — только диастолический. При рентгенологиче-
ском исследовании легочный рисунок усилен за счет артериаль-
ного русла, определяется выраженная кардиомегалия, обуслов-
ленная увеличением правых и левых отделов сердца.
Большое значение в обследовании больных с разрывом АСВ
имеет эхокардиография. Одномерная эхокардиография не выяв-
ляет специфических изменений, имеют место синдром объемной
перегрузки левых отделов сердца, увеличение полости правого
желудочка, тенденция к расширению основания аорты. При двух-
мерной эхокардиографии (рис. 48) можно непосредственно уви-
деть аневризму и место ее прорыва — видны хаотичные плотные
эхосигналы в полости правого желудочка, перерыв эхосигнала
в области фистулы. Определяется выпячивание правого коро-
нарного синуса Вальсальвы в полость ПЖ, на вершине, анев-
ризмы — место прорыва (указано стрелкой на рис. 48, а). В фазе
диастолы видны сомкнутые створки аортального клапана; анев-
ризматически расширенный правый коронарный синус Вальсальвы
выбухает в полость правого желудочка, на вершине его видно
отверстие (указано стрелкой на рис. 48,6). В фазе систолы
определяются открытые створки аортального клапана, утолщение
правой коронарной створки, аневризматическое выпячивание
правого коронарного синуса (рис. 48,в). В выводном отделе
ПЖ непосредственно под створками легочного клапана видна
верхняя часть аневризмы (рис. 48, г).
При допплер-кардиографии определяется турбулентный си-
столический и диастолический поток крови в той камере, в ко-
торую произошел разрыв аневризмы.
При катетеризации полостей сердца обычно выявляются уме-
ренная степень легочной гипертензии, высокие показатели насы-
172
Рис. 48. Прорыв аневризмы синуса Вальсальвы в правый желудочек. Эхокар
диограмма.
а — парастернальная проекция длинной оси левого желудочка; б, в— парастерналь-
ная проекция короткой оси на уровне корня аорты; г — парастернальная проекция
длинной оси выводного тракта правого желудочка
щения крови кислородом в правом желудочке или правом пред-
сердии, т, е. в полости, куда произошел прорыв аневризмы. При
выбухании аневризмы в выводной отдел правого желудочка
определяется систолический градиент давления между правым
желудочком и стволом легочной артерии до 10—40 мм рт. ст.
Среди различных методов ангиокардиографического исследо-
вания предпочтение отдается ретроградной аортографии. При
введении контрастного вещества в корень аорты контрастируется
мешкообразное аневризматическое выпячивание, пролабирующее
в выводной отдел правого желудочка или правое предсердие,
через которое контрастное вещество поступает в соответству-
ющий отдел сердца. У ряда больных провисают створки аорталь-
ного клапана, что обусловливает поступление контрастного ве-
щества в полость левого желудочка; это свидетельствует о со-
путствующей аортальной недостаточности.
Дифференциальный диагноз проводится с ОАП, ДМЖП
с аортальной недостаточностью, дефектом аортолегочной перего-
родки, коронарной артериовенозной фистулой.
Течение, лечение. Как правило, больные с АСВ нуждаются
в хирургическом лечении, так как средняя продолжительность
жизни после рызрыва составляет 1—2 года. Описаны случаи
внезапной смерти на фоне разрыва и случаи, когда больные
прожили после разрыва до 17 лет [Королев Б. А. и др., 1979].
Показаниями к операции служат нарушения гемодинамики, обу-
словленные сбросом крови слева направо. При быстро прогресси-
рующей сердечной недостаточности следует прибегать к сроч-
ному хирургическому вмешательству, не дожидаясь эффекта от
медикаментозного лечения.
Первые операции по поводу АСВ проведены С. W. Lillehei
(1957), у нас в стране — В. И. Бураковским (1963).
Операции по устранению АСВ выполняются в условиях ис-
кусственного кровообращения и умеренной гипотермии. Основ-
ные принципы хирургической коррекции порока: резекция анев-
ризматического мешка и устранение образовавшегося отверстия,
соединение медии аорты с фиброзным кольцом аортального кла-
пана, коррекция сопутствующих ВПС. Подходы могут быть через
полость, в которую произошел разрыв аневризмы, или трансаор-
тально. Доступом через правый желудочек или правое пред-
сердие выполняют резекцию аневризматического мешка с после-
дующим ушиванием образовавшегося отверстия отдельными
швами, укрепленными прокладками, или закрытие его заплатой.
Доступом через аорту в зависимости от диаметра отверстия,
ведущего в аневризму, его закрывают отдельными швами или
заплатой. Осуществляют ревизию аортального клапана и при
необходимости выполняют восстановительную операцию (плика-
ция створок) или протезирование.
Летальность после коррекции порока составляет 2,2—11,7%
[Meyer J. et. al., 1975; Pan Chin et al., 1981]. Летальные исходы
обычно связаны с тяжелым состоянием больных, оперированных
174
на фоне быстро прогрессирующей сердечной недостаточности,
развитием бактериального эндокардита, реже они возникают при
протезировании аортального клапана у детей. В Институте
сердечно-сосудистой хирургии им. А. Н. Бакулева АМН СССР
на 1 мая 1985 г. прооперировано 25 больных, из них два леталь-
ных исхода [Бураковский В. И. и др., 1986].
Отдаленные результаты, как правило, благоприятные. В ряде
случаев развитие или обострение бактериального эндокардита
может приводить к аортальной недостаточности, требующей за-
мены аортального клапана протезом.
АОРТО-ЛЕВОЖЕЛУДОЧКОВЫЙ ТУННЕЛЬ
Аорто-левожелудочковый туннель представляет собой ВПС,
при котором между аортой и левым желудочком имеется
аномальное сообщение, начинающееся в восходящей аорте (над
устьем правой коронарной артерии) и заканчивающееся в левом
желудочке (ниже правой аортальной створки), оно проходит по-
зади инфундибулума правого желудочка и через межжелудоч-
ковую перегородку. Этот порок впервые описан К. Hart (1905)
и J. Edwards (1961).
У детей первых лет жизни диагноз ставят на основе наличия
гемодинамических нарушений, сходных с клиникой тяжелой аор-
тальной недостаточности. Подтверждением диагноза служит гру-
бый протодиастолический шум, выслушиваемый вдоль левого
края грудины в первые месяцы жизни ребенка, чаще у маль-
чиков; отмечается сердечная недостаточность; в редких случаях
порок асимптоматичен.
На ЭКГ фиксируются признаки гипертрофии миокарда левого
желудочка, нередко с проявлениями его ишемии (смещение ниже
изолинии сегмента ST с отрицательными зубцами Т в отведениях
I, П. aVL, V-.fi).
На рентгенограмме органов грудной клетки видны значитель-
ная дилатация восходящей аорты, увеличение, полости левого
желудочка, возможно определение расширенного правого синуса
аорты (рис. 49).
Двухмерная эхокардиография и допплер-кардиография позво-
ляют поставить правильный диагноз аорто-левожелудочкового
туннеля и провести дифференциальный диагноз с недостаточ-
ностью аортального клапана.
Всем больным с подозрением на аорто-левожелудочковый
туннель показана аортография, при которой обнаруживается рез-
ко расширенный правый коронарный синус Вальсальвы, внутри-
желудочковая часть туннеля определяется неотчетливо. Аорталь-
ное кольцо дилатировано, видна недостаточность аортальных
клапанов.
Дифференциальный диагноз следует проводить с ДМЖП
с аортальной недостаточностью, ОАП, врожденной аортальной
недостаточностью с двустворчатым клапаном, разрывом аневриз-
175
Рис. 49. Аорто-левожелудочковый туннель. Рентгенограмма грудной клетки,
а — прямая проекция, б — вторая косая проекция.
мы синуса Вальсальвы, коронарными фистулами, врожденной
недостаточностью клапанов легочной артерии.
У больных с аорто-левожелудочковым туннелем уже в мла-
денческом возрасте развивается тяжелая сердечная недостаточ-
ность, ведущая к летальному исходу в первые месяцы жизни
(Okoroma Е. et. al., 1982), поэтому операция обычно произво-
дится крайне тяжелым больным и нередко по срочным показа-
ниям. Во время операции доступом через аорту закрывают тун-
нель отдельными швами или заплатой. В более старшем воз-
расте, до которого доживают единичные больные, нередко от-
мечается выраженная недостаточность аортального клапана, по-
этому требуется имплантация искусственного протеза..
Хирургическая летальность высокая и составляет около 40 %
(Perez-Martinez V. et al., 1973). В СССР первые успешные
операции по поводу аорто-левожелудочкового туннеля выполне-
ны В. И. Бураковским и Г. Э. Фальковским. В отдаленные сроки
после операции отмечают появление или прогрессирование недо-
статочности аортального клапана, что нередко приводит к не-
обходимости имплантации искусственного протеза.
Глава 10. ТЕТРАДА ФАЛЛО
Тетрада Фалло относится к наиболее распространенным поро-
кам сердца синего типа. Частота порока у новорожденных со-
ставляет 5—8 %, а в старшем возрасте — 12—14 % всех ВПС и
50—75 % синих пороков (Gasnl В. et. al., 1966; Keith J. et al.,
1978; Bankl H., 1980). Первые описания этого ВПС принад-
лежат М. Stensen (1673) и A. Fallot (1883).
Анатомия. При классическом варианте тетрады Фалло обна-
руживают 4 признака: стеноз выводного отдела правого желу-
дочка на различных уровнях, дефект межжелудочковой пере-
городки (ДМЖП), гипертрофия миокарда правого желудочка и
декстропозиция аорты (вторичная, связана с субаортальной лока-
лизацией ДМЖП).
Стеноз легочной артерии при тетраде Фалло обязательно
инфундибулярный (низкий, высокий или в виде диффузной гипо-
плазии), нередко он сочетается с клапанным стенозом, гипо-
плазией кольца (60 %) и ствола легочной артерии (около 70 %).
При сочетании клапанного и инфундибулярного стенозов вывод-
ной тракт между ними может расширяться, образуя выходной
карман — так называемый «третий желудочек». С возрастом сте-
пень стеноза выводного тракта (фибромышечное образование)
увеличивается, т. е. порок имеет прогрессирующее течение. Край-
нюю форму обструкции представляет собой атрезия клапанов
легочной артерии (20%). Нередко встречаются гипоплазия и
стеноз ветвей легочной артерии, возможна атрезия левой ветви.
ОАП функционирует, как правило, у детей первых месяцев
жизни и его закрытие приводит к ухудшению состояния больных.
177
При атрезии клапанов легочной артерии легочный кровоток осу-
ществляется за счет ОАП или аортолегочных коллатеральных
сосудов, которые обычно дилатированы.
ДМЖП при тетраде Фалло всегда большой, располагается
ниже наджелудочкового гребня под корнем аорты.
Гипертрофия миокарда правого желудочка сочетается с нор-
мальными по размеру левыми камерами сердца. При резко вы-
раженном легочном стенозе полость левого желудочка может
быть уменьшена.
При тетраде Фалло имеются выраженные морфологические
изменения сосудов малого круга кровообращения. В начальной
стадии они незначительны и заключаются в разрастании интимы,
затем периферические сосуды значительно сужаются, появляются
«многоствольные» сосуды, ангиоматозные структуры, артерии за-
мыкающего типа и артериовенозные анастомозы. В 10—15 лет-
нем возрасте и позже отмечается выраженная наклонность
к тромбообразованию в легочных сосудах. Такие изменения во
многом объясняют случаи неудовлетворительных исходов опера-
ции.
При тетраде Фалло почти в 40 % случаев имеются сопут-
ствующие ВПС: правосторонняя дуга аорты (в 20—25 % слу-
чаев, чаще при гипоплазии или атрезии легочной артерии), со-
судистое кольцо, вторичный ДМПП, ОАП, открытый общий ат-
риовентрикулярный канал, добавочная левосторонняя верхняя
полая вена, частичный аномальный дренаж легочных вен.
Можно выделить три клинико-анатомических варианта поро-
ка: 1) тетрада Фалло с атрезией устья легочной артерии;
2) классическая форма с различной степенью стеноза; 3) блед-
ная форма тетрады Фалло.
Гемодинамика. Особенности гемодинамики при тетраде Фалло
определяются размером ДМЖП и выраженностью стеноза легоч-
ной артерии. При значительном стенозе и больших размерах
дефекта (наиболее частая анатомическая ситуация) во время
систолы кровь из обоих желудочков поступает в аорту и в мень-
шей степени в легочную артерию (рис. 50). Минутный объем
большого круга кровообращения обычно увеличен. Выражен-
ность артериальной гипоксемии и тяжесть состояния больных
коррелируют с величиной стеноза. Расположение аорты «верхом»
на межжелудочковой перегородке приводит к беспрепятствен-
ному выбросу в нее крови из правого желудочка, в силу чего
при тетраде Фалло обычно не развивается правожелудочковая
сердечная недостаточность. Из-за большого ДМЖП в обоих
желудочках устанавливается равное давление. У больных с край-
ней формой тетрады Фалло кровь из аорты поступает в малый
круг кровообращения через ОАП либо через коллатерали.
В случаях умеренного стеноза, когда сопротивление выбросу
крови в легкие ниже, чем в аорту, имеется левоправый сброс, что
клинически проявляется в виде бледной (ацианотичной) формы
тетрады Фалло. Она чаще встречается у детей первых лет жизни
178
Рис. 50. Тетрада Фалло (схема).
и взрослых. По мере увеличе-
ния выраженности стеноза воз-
никает перекрестный, а затем
стабильно праволевый (вено-
артериальный) сброс крови, в
клинике это означает переход в
цианотическую форму порока.
Левые отделы сердца при
тетраде Фалло функционально
недогружены, что является
причиной относительной гипо-
плазии левого желудочка; у
взрослых больных с выражен-
ным коллатеральным кровооб-
ращением левый желудочек
имеет достаточные размеры.
Клиника, диагностика. У де-
тей первых дней жизни выяв-
ляются наиболее тяжелые фор-
мы тетрады Фалло. Диагноз чаще устанавливается в первые
6 мес по грубому систолическому шуму, одышке, цианозу.
Цианоз — один из главных симптомов тетрады Фалло. Время
его появления и выраженность определяются степенью стеноза
легочной артерии. С рождения он наблюдается приблизительно
в 40 % случаев, чаще становится явным к 6—12 мес жизни по
мере увеличения активности ребенка. Почти у половины больных
на первом году жизни цианоз выражен слабо или умеренно,
что отчасти обусловлено сопутствующей анемией; резкий цианоз
отмечается в 13,8 % случаев. Симптом «часовых стекол» и «ба-
рабанных палочек» появляется в зависимости от степени гипоксе-
мии на 1—2-м году жизни. Толерантность к физической нагрузке
у детей с тетрадой Фалло, как правило, снижена, они часто
присаживаются на корточки или лежат в постели с приведенны-
ми к животу ногами, облегчая тем самым свое состояние из-за
уменьшения венозного притока крови к сердцу.
Основным симптомом тетрады Фалло, обусловливающим тя-
жесть состояния и развитие осложнений со стороны ЦНС, явля-
ются одышечно-цианотические приступы. Они отсутствуют у де-
тей первых 3 мес жизни и возникают, протекая наиболее тяжело
в возрасте от 6 до 24 мес, на фоне абсолютной относитель-
ной (релятивной) анемии без высокого уровня гематокрита. При-
ступ начинается внезапно, ребенок становится беспокойным, уси-
ливается одышка, цианоз, уменьшается интенсивность шума, за-
тем возможны апноэ, потеря сознания (гипоксическая кома),
судороги с последующим появлением гемипареза. Клиническая
картина приступов полиморфна, иногда бывают лишь их экви-
валенты. Тяжесть течения приступа не всегда соответствует сте-
179
пени легочного стеноза: больные с поражениями ЦНС, умерен-
ным стенозом, но плохой компенсацией артериальной гипоксе-
мии страдают тяжелейшими одышечно-цианотическими присту-
пами. Возникновение приступов связано со спазмом инфундибу-
лярного отдела правого желудочка, в результате чего вся веноз-
ная кровь через ДМЖП поступает в аорту и вызывает или
усиливает гипоксию ЦНС.
При сочетании тетрады Фалло у больного с сосудистым коль-
цом отмечаются стридорозное дыхание и признаки сдавления
пищевода и трахеи (см. главу 9).
Значительный дефицит массы не характерен для этого ВПС,
отставание в массе у детей с тетрадой Фалло (гипотрофия II —
III степени) встречается в 36,7 % случаев, что связано с отсут-
ствием гиповолемии большого круга кровообращения и удовлет-
ворительной компенсацией артериальной гипоксемии. Однако
в более старшем возрасте и у взрослых нередко отмечается
отставание в физическом развитии. У детей первого и второго го-
да жизни отмечаются резкий цианоз и задержка моторного
развития. Для больных с тетрадой Фалло характерны повтор-
ные ОРВИ, кариес зубов, хронический тонзиллит, гайморит.
Рецидивирующие пневмонии встречаются редко.
У взрослых больных цианоз может быть как выраженным, так
и незначительным, так как длительно живут больные с умерен-
ным стенозом легочной артерии. С возрастом толерантность
к физической нагрузке снижается, появляются жалобы на серд-
цебиение, боли в области сердца, описаны случаи заболевания
туберкулезом.
При тетраде Фалло одышка йыражена по типу диспноэ —
углубленное, аритмичное дыхание, меньше меняется частота ды-
хания. Сердечный горб чаще отсутствует, так как сердце не-
большое; иногда отмечают систолическое дрожание. При аус-
культации определяется громкий I тон, выслушивается грубый
систолический шум изгнания с максимумом в третьем и чет-
вертом межреберьях слева (при инфундибулярном стенозе) или
во втором межреберье (при сочетании с клапанным). Шум
ДМЖП отсутствует, так как давление в желудочках одинаковое.
Над легочной артерией II тон ослаблен; если он сохранен или
даже усилен, на ФКГ видно, что он в основном представлен
аортальным компонентом. При выраженности коллатерального
кровообращения на спине над легочными полями может выслу-
шиваться систолический или систолодиастолический шум.
Сердечная недостаточность по правожелудочковому типу ие
характерна для тетрады Фалло, а тахикардия и одышка связаны
с гипоксемией. Однако мы наблюдали декомпенсацию у 8 %
больных на фоне абсолютной и релятивной анемии и инток-
сикации в сочетании с резким стенозом легочной артерии, а так-
же у больных с еще сохранившимся сбросом крови слева на-
право на уровне желудочков из-за небольшой степени инфун-
дибулярного стеноза (бледная форма тетрады Фалло). Наличие
180
недостаточности кровообращения у больного синим пороком
сердца в первые месяцы жизни не исключает диагноз тетрады
Фалло, но ставит его под сомнение. У взрослых больных по-
явление сердечной недостаточности при тетраде Фалло прогно-
стически плохой признак, указывающий на резкий стеноз и рас-
пространенный кардиосклероз.
Дети с крайней формой тетрады Фалло — наиболее тяжелые
больные. С рождения у них отмечают резкий цианоз, одышку,
тахикардию (рефрактерная к медикаментозному лечению), сни-
жение массы тела, малоподвижность, гипоксические приступы,
рано деформируются ногтевые фаланги, возможны проявления
правожелудочковой сердечной недостаточности. При аускульта-
ции систолический шум не обнаруживается, может выслуши-
ваться систолодиастолический шум во втором межреберье слева
(ОАП) или на спине (шум коллатералей).
У больных раннего возраста с тетрадой Фалло можно вы-
делить 3 клинические фазы порока ( (Белоконь Н. А., 1971):
1) фаза относительного клинического благополучия (с рождения
до 6 мес), нет отставания в физическом развитии, состояние
вполне удовлетворительное, приступы чаще отсутствуют; 2) фаза
одышечно-цианотических приступов (от 6 до 24 мес), имеется
наибольшее число осложнений со стороны ЦНС и летальных
исходов, так как происходят возрастная перестройка эритропоэза
и становление других компенсаторных механизмов, одновременно
увеличивается гемодинамический эффект стеноза; 3) переходная
фаза, когда клиническая картина порока начинает приобретать
черты, характерные для детей старшего возраста, несмотря на
нарастание цианоза, исчезают приступы (или они предотвра-
щаются изменением положения тела — на корточках), уменьша-
ются одышка и тахикардия, в крови развиваются полицитемия и
полиглобулия, в легких — коллатеральное кровообращение.
Неврологический статус, интеллектуальное и умственное раз-
витие больных тетрадой Фалло определяются генетическими фак-
торами, степенью внутриутробного и постнатального поврежде-
ния ЦНС. Длительно существующая и выраженная артериаль-
ная гипоксемия способствует задержке умственного развития,
усугублению органического поражения ЦНС. На психологические
особенности личности больных большое влияние оказывают сам
факт болезни, длительные госпитализации, ограниченные контак-
ты со сверстниками, отношение родителей к заболеванию (гипер-
и гипоопека). До и после операции желательно включать в план
обследования больных консультацию невропатолога, психолога
и при наличии изменений подбирать соответствующую лекар-
ственную коррекцию.
Одним из осложнений при тетраде Фалло может быть абсцесс
мозга, который образуется путем перехода гнойного процесса
из внутреннего уха, придаточных пазух носа на головной мозг;
возможны также посттравматические и метастатические абсцес-
сы (при бактериальном эндокардите, после экстракции зуба, уда-
181
ления миндалин и др.), нагноение старых очагов инфаркта иди
размягчение мозга. Это осложнение чаще встречается у больных
от 2 до 20 лет, крайне редко — у детей первого года жизни.
Основными признаками являются медленно, исподволь нараста-
ющее недомогание, головная боль, нередко со рвотой и бради-
кардией, гипертензионно-гидроцефальный синдром, психиче-
ские отклонения, появляется очаговая симптоматика, возможны
судорожные припадки. Для подтверждения диагноза следует
произвести общий анализ крови (изменения могут отсутство-
вать), эхо- и электроэнцефалографию, церебральную ангиогра-
фию, пневмоэнцефалографию, компьютерную томографию.
Бактериальный эндокардит при тетраде Фалло до операции
встречается нечасто. Источником его могут быть гнойные за-
болевания кожи, кариозные зубы, хронический тонзиллит и гаймо-
рит. Место локализации эндокардита — клапаны легочной арте-
рии, выводной тракт правого желудочка (возможно резкое его
сужение разросшимися вегетациями), трехстворчатый клапан,
реже — края ДМЖП. Течение эндокардита может быть класси-
ческим и малосимптомным. Следует заметить, что у детей с ВПС
синего типа часто отмечают немотивированные подъемы темпе-
ратуры в течение многих месяцев, что служит основанием для по-
становки диагноза бактериального эндокардита, больным назна-
чаются длительно и в большом количестве антибиотики, которые
не оказывают эффекта. Последнее связано с тем, что подъемы
температуры обусловлены нарушением терморегуляции из-за
хронической гипоксии ЦНС, в частности наиболее чувствитель-
ного к дефициту кислорода лимбико-ретикулярного комплекса.
В пользу неинфекционных гипертермий свидетельствуют отсут-
ствие ознобов, подъема температуры в ночное время, связь со
стрессовыми ситуациями, удовлетворительная переносимость
высокой температуры и самопроизвольное ее снижение, отрица-
тельная амидопириновая проба, отсутствие воспалительных
изменений в общих и биохимических анализах крови, рефрактер-
ность к антибиотикотерапии; все это сочетается с астенонев-
ротическими проявлениями, признаками органического пораже-
ния ЦНС и вегетативной дисфункции, наличием субдепрессивных
состояний. На эхокардиограмме также нет данных за эндокар-
дит клапанов.
На ЭКГ обнаруживаются отклонение электрической оси серд-
ца вправо (Z- аА QRS от + 100 до +180°), признаки гипер-
трофии миокарда правого желудочка. Неполная блокада правой
ножки пучка Гиса определяется у '/5 больных. Признаки гипер-
трофии миокарда левого желудочка отсутствуют и могут быть
только при сопутствующем большом артериальном протоке или
развитых бронхиальных сосудах, это более характерно для взрос-
лых больных с тетрадой Фалло. У них же нередко появляются
нарушения ритма (экстрасистолия), признаки гипертрофии пра-
вого предсердия. При «бледной» форме порока на ЭКГ возможна
перегрузка обоих желудочков, но больше правого.
182
Рис. 51. Тетрада Фалло. Рентгенограмма грудной клетки. Объяснение в тексте.
На ФКГ регистрируется ромбовидной формы систолический
шум с пиком в первую половину систолы, легочный компонент
II тона значительно ослаблен или отсутствует (при резком сте-
нозе), систолодиастолический шум или коллатералей обычно
не фиксируется.
На рентгенограммах органов грудной клетки (рис. 51) легоч-
ный рисунок обеднен, мелко- или крупнопетлистый, реже усилен
за счет коллатералей. Крайне тяжелое состояние больных на
фоне развившихся коллатералей свидетельствует о том, что они
лишь частично компенсируют кислородную недостаточность. Раз-
витие коллатералей увеличивается с возрастом и наиболее выра-
жено у детей старшего возраста и взрослых. Форма сердца
обычно типичная — в виде «деревянного башмачка», за счет за-
кругленной, приподнятой над диафрагмой верхушкой и западе-
ния дуги легочной артерии; тень сердца небольшая, увеличение
может иметь место при атрезии легочной артерии. Другим рент-
генологическим признаком является гипертрофия миокарда пра-
вого желудочка, левый желудочек небольшой, виден в виде ша-
почки во II косой проекции; по левому контуру сердца часто
имеется выбухание («третий желудочек»), справа видна право-
расположенная дуга аорты; возможно увеличение правого пред-
сердия, расширение восходящей аорты. При бледной (ациано-
тичной) форме тетрады Фалло на рентгенограмме имеются при-
знаки, характерные как для изолированного ДМЖП, так и для
тетрады Фалло, некоторое усиление легочного рисунка по арте-
183
Рис. 52. Тетрада Фалло. Эхокардиограмма.
риальному руслу, умеренное увеличение левых отделов сердца,
западение дуги легочной артерии и гипертрофия правого же-
лудочка делают форму сердца, похожую на «башмачок».
Наиболее характерным признаком тетрады Фалло на М-ска-
нограмме является отсутствие взаимного перехода передней стен-
ки аорты в межжелудочковую перегородку, при этом широкая
аорта расположена над дефектом. К второстепенным эхокардио-
графическим признакам тетрады Фалло относятся: утолщение
стенки правого желудочка и межжелудочковой перегородки, ко-
торое иногда ведет к диспропорциональной ее гипертрофии по
отношению к свободной стенке левого желудочка, сужение вы-
водного тракта правого желудочка, уменьшение левого предсер-
дия, расширение корня аорты.
Двухмерная эхокардиография (рис. 52) позволяет непосредст-
венно определить величину смещения аорты, ДМЖП, степень ле-
гочного стеноза и гипертрофию правого желудочка. В проекции
длинной оси левого желудочка из парастернального доступа
определяются дилатированная аорта, пересекающая межжелу-
дочковую перегородку, большой межжелудочковый дефект и ми-
трально-аортальное продолжение. В проекции короткой оси из
левого парастернального доступа на уровне магистральных со-
судов выявляются гипоплазированный выводной тракт правого
желудочка, маленький клапан легочной артерии с нормальными
ее ветвями и бифуркацией. Стеноз легочной артерии подтвержда-
ется допплер-эхокардиографией.
При катетеризации полостей сердца обнаруживается высо-
кое давление в правом желудочке, равное системному градиенту
давления между правым желудочком и легочной артерией.
Низкое давление в последней отражает степень стеноза. Давле-
ние в правом предсердии чаще нормальное. Насыщение арте-
риальной крови кислородом составляет в среднем около 70 %,
при атрезии легочной артерии оно меньше. Прохождение катете-
ра из правого желудочка в аорту является характерным призна-
184
Рис. 53. Тетрада Фалло. Правая вентрикулограмма.
ком тетрады Фалло. При рентгеноконтрастном исследовании
аорта и легочная артерия заполняются контрастом одновременно
(рис. 53). При атрезии легочной артерии определяется отсут-
ствие поступления контрастного вещества из правого желудочка
в легочную артерию, и после контрастирования дуги и нисходя-
щего отдела аорты видно слабое контрастирование внутрилегоч-
ных разветвлений или ветвей легочных артерий (через колла-
теральные сосуды или ОАП).. Аортография и легочная артерио-
графия выявляют коллатеральный кровоток, ОАП, патологию
ствола легочной артерии и ее ветвей. По показаниям произ-
водят ретроградную катетеризацию аорты и левого желудочка,
левую вентрикулографию, селективную коронарографию и арте-
риографию с введением контраста в коллатеральные сосуды.
В анализах крови у детей имеется абсолютная (гемоглобин
меньше 107 г/л) или релятивная (относительная) анемия с гемо-
глобином меньше 160 г/л; количество ретикулоцитов и гемато-
крит повышены. С возрастом развиваются полицитемия и поли-
глобулия, способствующие увеличению кислородной емкости
крови.
Дифференциальный диагноз следует проводить с транспози-
цией аорты и легочной артерии, двойным отхождением магист-
ральных сосудов от правого желудочка, единственным желудоч-
ком, двухкамерным сердцем со стенозом легочной артерии.
185
Течение, лечение. Средняя продолжительность жизни коопе-
рированных больных — около 12 лет. Однако примерно 10 %
из них достигают 20-летнего возраста, около 1 % — 30-летнего
и более, в редких случаях больные доживают до 75 лет. Причины
смерти неоперированных больных: нарушения гемо-, ликвороди-
намики, гипоксия, эмболия сосудов мозга, инсульт, абсцессы
головного мозга, сердечная недостаточность, бактериальный
(септический) эндокардит.
Известно, что одышечно-цианотические приступы до опера-
ции — временный эпизод в течении тетрады Фалло, они, как
правило, проходят после 3-го года жизни больного. Педиатр,
должен учесть все моменты, провоцирующие приступы у данного
пациента, чтобы избежать по возможности паллиативной опера-
ции. Для этого необходимо активное лечение сопутствующих
заболеваний (анемия, рахит и др.) (см. главу 22), проведение
дегидратации диакарбом наряду с достаточным введением
жидкости (ие менее 1 —1,5 л/сут), назначение седативной тера-
пии, p-адреноблокаторов (обзидан, анаприлин по 1 мг/кг-сут).
Во время приступа парентерально назначают кордиамин и про-
медол. При купировании приступов у детей следует воздержи-
ваться от назначения сердечных гликозидов; повышая инотроп-
ную функцию миокарда, они увеличивают склонность инфун-
дибулярного стеноза к спазму.
При отсутствии эффекта от проводимой терапии, если приступ
продолжается и возникает потеря сознания, т. е. развивается
гипоксическая кома, производят внутривенное струйное или ка-
пельное введение жидкости: 4 или 5 % раствор бикарбоната
натрия (под контролем кислотно-щелочного равновесия), 5%
раствор глюкозы, раствор Рингера, реополиглюкина, в капельни-
цу добавляют эуфиллин, инсулин, витамины. Если с помощью
проведенных мероприятий больного не удается вывести из
приступа или выведение кратковременно и приступы вновь
повторяются, показана экстренная операция наложения аорто-
легочного анастомоза.
При подготовке больных к операции за 2—4 нед до нее
рекомендуется провести курс лечения ибупрофеном (бруфен)
по 20 мг/(кг-сут) для улучшения микроциркуляции и реоло-
гических свойств крови, учитывая дезагрегаитное действие пре-
парата [Мурашко В. В. и др., 1986].
При наличии значительных отклонений со стороны нервно-
психического статуса у детей в лечение необходимо включить
психо- и вегетотропные препараты, церебропротекторы (см. гла-
ву 22).
Хирургическое лечение показано всем больным с тетрадой
Фалло. Вид операции в основном определяется тяжестью клини-
ческого течения, анатомо-гемодинамическим вариантом порока
и возрастом больных. Методом выбора следует считать радикаль-
ную коррекцию порока. Вместе с тем у новорожденных и детей
раннего возраста с резким цианозом и частыми одышечно-циано-
186
тическими приступами, а также у больных старшего возраста с
гипоплазией легочных артерий показано выполнение паллиатив-
ных операций. Быстро ухудшающееся состояние больного может
быть показанием к срочной операции. Паллиативные операции
должны позволить больным дожить до возраста 5—6 лет, когда
с меньшей степенью риска можно выполнить радикальную
коррекцию порока.
Среди различных типов паллиативных вмешательств наиболь-
шее распространение получили системно-легочные или межарте-
риальные анастомозы Блелока — Тауссиг (подключично-легоч-
ный анастомоз), Ватерстоуна — Кули (внутриперикардиальный
анастомоз между восходящей аортой и правой легочной артери-
ей), соединение данных сосудов с помощью биологических
(анастомоз Вишневского — Донецкого) или синтетических про-
тезов и в меньшей степени анастомоз Поттса — Смита
(анастомоз между нисходящей аортой и левой легочной арте-
рией) .
Летальность после шунтирующих операций колеблется от
1,6 до 15,6 % в зависимости от вида анастомоза и возраста
больных [Мешалкин Е. Н. и др., 1977; Королев Б. А. и др.,
1980; Фальковский Г. Э. и др., 1980; Бухарин В. А. и др., 1981]
и чаще всего связана с кровотечением и нарушением функции
анастомоза, а также с исходно тяжелым состоянием больных,
вследствие чего развивается острая сердечная недостаточность.
Среди осложнений отдаленного периода следует отметить гипо-
функцию и тромбоз анастомоза, гиперфункцию и развитие
легочной гипертензии, перегиб, сужение и полный перерыв
легочной артерии на стороне анастомоза.
Изучение отдаленных результатов шунтирующих операций
свидетельствует о различной длительности функциональной пол-
ноценности анастомозов. Для анастомоза Блелока—Тауссиг и
анастомозов, выполняемых с помощью протезов, характерно бо-
лее быстрое наступление функциональной недостаточности и
тромбоза, чем для анастомоза Ватерстоуна — Кули и ососбенно
Поттса — Смита, при которых чаще наблюдается развитие легоч-
ной гипертензии. Следует отметить, что при любых видах анастомо-
зов в отдаленные сроки после операции состояние больных
ухудшается, причем при адекватной функции анастомоза ухуд-
шение чаще всего связано с прогрессированием стеноза путей
оттока из правого желудочка.
В последнее время у больных с тетрадой Фалло и гипоплазией
легочных артерий, у которых исчерпаны возможности традицион-
ных системно-легочных анастомозов и нельзя сделать радикаль-
ную операцию, стала применяться операция реконструкции путей
оттока из правого желудочка без закрытия ДМЖП [Подзол-
ков В. П. и др., 1987].
Радикальная коррекция тетрады Фалло предложена С. Lil-
lehei и R. Varco (1954), а в условиях искусственного
кровообращения впервые выполнена J. Kirklin в 1955 г. Опера-
187
ция заключается в закрытии ДМЖП и устранении стеноза легоч-
ной артерии. Поскольку при данном пороке ДМЖП всегда
большой, то для закрытия требуется применение синтетических
или биологических заплат. При устранении стеноза легочной
артерии объем вмешательства зависит от типа инфундибуляр-
ного стеноза выводного отдела правого желудочка, диаметра
ствола, состояния кольца и клапанов легочной артерии и состоя-
ния ветвей легочной артерии. В последнее время при необходи-
мости пластического расширения выводного отдела правого
желудочка, легочного кольца и ствола ЛА применяется ксено-
перикардиальная заплата, содержащая моностворку. В ходе ра-
дикальной операции также должны быть устранены ранее вы-
полненные межартериальные анастомозы.
Результаты радикальной коррекции тетрады Фалло отличны
в различных хирургических клиниках и зависят от возраста,
исходного клинического состояния больных, анатомического ва-
рианта порока и сопутствующих аномалий. Вместе с тем в по-
следние годы отмечается тенденция к снижению послеоперацион-
ной летальности. Н. М. Амосов и М. Ф. Зиньковский (1982)
сообщают о ее снижении до 15 % в 1981 г., В. И. Бураковский
и соавт. (1988) —до 9,2 % в 1986 г. В большинстве зарубежных
клиник летальность в среднем колеблется от 9,3 до 16,9 %
[Seybold-Epting W. et al., 1980; Asano К. et al., 1985]. В. П. Под-
золков и соавт. (1986) отметили сравнительно низкую леталь-
ность (5,5 %) в группе больных после операций наложения
системно-легочных анастомозов.
Радикальные операции у детей раннего возраста с тетрадой
Фалло успешно выполняются лишь в отдельных хирургических
клиниках. Среди 92 больных в возрасте до 1 года, оперированных
радикально A. Castaneda и W. Norwood (1983), летальность
составила 7,6 %. В нашей стране первые успешные операции у
больных в возрасте до 3 лет выполнены в Институте сердечно-
сосудистой хирургии им. А. Н. Бакулева АМН СССР академиком
В. И. Бураковским. Радикальную коррекцию тетрады Фалло в
раннем возрасте следует проводить больным, у которых стеноз
выводного отдела правого желудочка обусловлен главным обра-
зом смещением и гипертрофией конусной перегородки при доста-
точно широком легочном стволе и артериях. У этого контингента
больных послеоперационная летальность составляет 37 % [Фаль-
ковский Г. Э., Бузинова Л. А., 1986]. Радикальную операцию
при тетраде Фалло после выполненного в раннем возрасте анас-
томоза по Блелоку — Тауссиг целесообразно производить спустя
1—3 года, желательно до достижения ребенком школьного
возраста. Одним из важнейших показаний к выполнению опера-
ции Блелока — Тауссиг у детей раннего возраста следует считать
отсутствие благоприятных анатомических предпосылок для вы-
полнения радикальной коррекции порока.
Отдаленные результаты радикального лечения неосложненных
форм тетрады Фалло, как правило, хорошие; через 10 лет после
188
операции 95 % пациентов ведут практически нормальный образ
жизни. 93—96 % пациентов, выписанных из клиники, живут
более 10 лет, а 91 % — более 20 лет. Вместе с тем выживаемость
больных через 10 лет после операции меньше, чем у здорового
населения [Fuster V. et al., 1980; Katz N. et al., 1982]. Ухудше-
ние состояния пациентов в отдаленные сроки наблюдения может
быть связано с оставшимся в той или иной степени стенозом
легочной артерии, легочной недостаточностью, реканализацией
ДМЖП, аневризмой правого желудочка, нарушениями ритма
сердца.
Нарушения ритма обычно обусловлены травмированием про-
водящих путей сердца во время операции, остаточным высоким
давлением в правом желудочке, выраженной кардиомегалией
из-за реканализации ДМЖП или развития аневризмы правого
желудочка. Именно аритмии являются причиной внезапной смер-
ти больных в различные сроки после операции. Выявляемость
аритмий увеличивается при холтеровском мониторировании.
Крайне редко источник нарушений ритма может локализоваться
в области рубца миокарда правого желудочка, в таких случаях
показана операция иссечения рубца с последующим подшивани-
ем заплаты [Harken A. et al., 1980]. При углублении нарушений
проводимости и возникновении полной поперечной блокады пока-
зано подшивание электрокардиостимулятора. При оставшихся
пороках, ведущих к выраженным нарушениям гемодинамики,
показана повторная операция для их коррекции.
Глава 11. ОТХОЖДЕНИЕ МАГИСТРАЛЬНЫХ СОСУДОВ
ОТ ОДНОГО ЖЕЛУДОЧКА
Согласно классификации R. Н. Anderson и соавт. (1979),
отхождение магистральных сосудов от одного желудочка может
быть трех видов: отхождение аорты и легочной артерии от
правого желудочка, от левого желудочка, от единого желудочка
с неопределенной морфологией.
ОТХОЖДЕНИЕ АОРТЫ И ЛЕГОЧНОЙ АРТЕРИИ
ОТ ПРАВОГО ЖЕЛУДОЧКА
Отхождение магистральных сосудов от правого желудочка от-
носится к редким порокам сердца, частота его не превышает 1 %
всех ВПС [Gasul В. et al., 1966]. Порок впервые описан
Т. В. Peacock (1866). Существует несколько названий этого по-
рока: частичная транспозиция, двойной выход из правого желу-
дочка, аномалия Тауссиг — Бинга, двойное отхождение маги-
стральных сосудов (ДОМС) от правого желудочка.
Анатомия, классификация. Основными признаками ДОМС от
правого желудочка является: а) полное отхождение аорты и ле-
гочной артерии от правого желудочка; б) наличие двух конусов
189
Рис. 54. Варианты топографии дефекта межжелудочковой перегородки при от-
хождении магистральных сосудов от правого желудочка. Объяснение в тексте.
в правом желудочке, образующих отдельные выводные отделы
для аорты и легочной артерии; в) отсутствие фиброзного продол-
жения между полулунными и атриовентрикулярными клапанами;
г) опорожнение левого желудочка только через дефект межже-
лудочковой перегородки (ДМЖП), который может располагать-
ся под клапанами аорты или легочной артерии; д) расположение
клапанов аорты и легочной артерии на одном уровне.
Согласно классификации М. Lev и соавт. (1972) при ДОМС
от правого желудочка выделяются 4 типа локализации ДМЖП:
190
а) подаортальный, б) подлегочный, в) под обоими магистраль-
ными сосудами, г) несообщающийся или отдаленный от магист-
ральных сосудов (рис. 54).
Следует остановиться на таком признаке ДОМС, как отсут-
ствие полулунно-атриовентрикулярного фиброзного продолже-
ния. В норме фиброзное основание передней створки митрального
клапана переходит непосредственно в фиброзное основание зад-
ней (некоронарной) и левой коронарной створок аортального
клапана в области их соприкосновения с мембранозной частью
межжелудочковой перегородки. Вследствие этого передняя створ-
ка митрального клапана и задняя створка аортального клапана
имеют общую точку прикрепления и пути притока и оттока ле-
вого желудочка разделены только передней створкой митрально-
го клапана. В нормальном сердце трикуспидальный и легочный
клапаны всегда разобщены париетальной ножкой наджелудоч-
кового гребня. Отсутствие резорбции бульбарно-вентрикулярного
гребня в процессе эмбриогенеза приводит к отхождению аорты
от правого желудочка и отсутствию митрально-аортального фиб-
розного продолжения. При этом отсутствует и легочно-трикус-
пидальное продолжение, т. е. оба полулунных клапана отделены
от атриовентрикулярных мышечной тканью.
При первом классическом варианте порока (по М. Lev и со-
авт., 1972) ДМЖП обычно большой, расположен кзади и под
септальной ножкой наджелудочкового гребня, со стороны левого
желудочка он занимает мембранную часть межжелудочковой
перегородки. Расположение магистральных сосудов вариабельно
и может быть таким же, как при полной корригированной транс-
позиции аорты и легочной артерии. Второй вариант порока (ано-
малия Тауссиг—Бинга) отличается от первого расположением
ДМЖП, который находится кпереди от септальной ножки надже-
лудочкового гребня и над ней. При третьем варианте ДМЖП
расположен высоко под обоими магистральными сосудами. При
четвертом, наиболее сложном варианте порока, ДМЖП находит-
ся в трабекулярной части перегородки в стороне от магистраль-
ных сосудов.
Почти в 60 % случаев ДОМС сочетается с другими ВПС —
стенозом легочной артерии, аномалиями коронарных артерий,
открытым общим атриовентрикулярным каналом и др.
Гемодинамика обусловлена анатомической формой порока и
состоянием легочного кровотока. При первом варианте порока
венозная кровь из правого желудочка в виде отдельного потока
поступает в легочную артерию, в то время как из левого желу-
дочка благодаря подаортальной локализации ДМЖП артериаль-
ная кровь преимущественно направляется в аорту (см. рис. 54).
Поскольку в большой круг кровообращения поступает в основ-
ном артериальная кровь, артериальная гипоксемия, как правило,
отсутствует. Такие условия гемодинамики обычно наблюдаются
у больных без стеноза легочной артерии. У них с рождения опре-
деляются гиперволемия малого круга кровообращения и легоч-
191
ная гипертензия. Лишь с повышением легочного сосудистого
сопротивления, которое превышает периферическое сопротивле-
ние, правому желудочку становится легче нагнетать кровь в аор-
ту, чем в легочную артерию; происходит уменьшение легочного
кровотока — все это обусловливает появление артериальной
гипоксемии.
Однако в ряде случаев, несмотря на отсутствие органи-
ческих изменений в малом круге кровообращения и «благоприят-
ное, физиологическое» направление потоков крови, может на-
блюдаться частичное смешивание потоков крови в полости пра-
вого желудочка. Следствием этого являются поступление части
венозной крови в аорту и легкая артериальная гипоксемия.
При втором варианте порока в аорту нагнетается венозная
кровь из правого желудочка, а в легочную артерию, в силу под-
легочного расположения ДМЖП, поступает преимущественно
артериальная кровь из левого желудочка (см. рис. 54). У таких
больных наряду с гиперволемией малого круга кровообращения
и легочной гипертензией наблюдается выраженная артериаль-
ная гипоксемия. В разной степени артериальная гипоксемия
присутствует и при других вариантах порока.
При стенозе легочной артерии вследствие уменьшения легоч-
ного кровотока в аорту поступает венозная кровь, объем которой
зависит от сопротивления стеноза, вследствие этого возникает
артериальная гипоксемия.
Клиника, диагностика. Клиническая картина первого вариан-
та порока без стеноза легочной артерии сходна с таковой при
ДМЖП (см. главу 6) с легочной гипертензией и большим арте-
риовенозным сбросом: рано развивается гипотрофия II—III сте-
пени, характерны рецидивирующие пневмонии, рефрактерная к
лечению сердечная недостаточность. В первые месяцы жизни у
больных в связи с повышенным общелегочным сопротивлением
может наблюдаться цианоз. Появление его у взрослых больных
указывает на развитие склероза легочных сосудов. При наличии
стеноза легочной артерии клиническая картина напоминает симп-
томатику тетрады Фалло (см. главу 10); возможно возникнове-
ние одышечно-цианотических приступов.
При втором варианте порока (аномалии Тауссиг — Бинга)
клиническая картина аналогична той, которую наблюдают при
полной транспозиции аорты и легочной артерии (см. главу 12):
наряду с признаками легочной гипертензии обычно определяются
цианоз и сердечная недостаточность. Степень цианоза может
быть различной — от незначительной до резко выраженной. При
стенозе легочной артерии состояние больных менее тяжелое.
Клиническая картина третьего и четвертого вариантов порока
также определяется наличием или отсутствием легочного стеноза
и характером легочной гипертензии.
На ЭКГ при первом варианте порока без стеноза легочной ар-
терии отмечаются отклонение электрической оси сердца как вле-
во, так и вправо, признаки выраженной гипертрофии миокарда
192
правого и в меньшей степени левого желудочка, замедление ат-
риовентрикулярной проводимости. Изолированная гипертрофия
левого желудочка при этом варианте порока не описана. Прояв-
ления значительной гипертрофии левого предсердия и желудочка
наблюдаются при небольшом ДМЖП, создающем значительнее
препятствия для опорожнения левого желудочка. Изолированная
гипертрофия миокарда правого желудочка может указывать на
увеличенный легочный кровоток. При сочетании со стенозом ле-
гочной артерии отмечаются отклонение электрической оси сердца
вправо, гипертрофия правого предсердия и желудочка (ЭКГ ана-
логична таковой при тетраде Фалло); признаки гипертрофии ле-
вого желудочка в этой ситуации свидетельствуют о небольшом
ДМЖП. При аномалии Тауссиг — Бинга на ЭКГ отмечаются
отклонение электрической оси сердца вправо, признаки гипертро-
фии правого предсердия и желудочка; гипертрофия левого желу-
дочка наблюдается у детей раннего возраста и при сопутствую-
щих ВПС (коарктация аорты, гипоплазия или атрезия аорты).
ФКГ у больных без стеноза легочной артерии напоминает
таковую при изолированном ДМЖП, при наличии стеноза —
идентична тетраде Фалло.
Рентгенологическая картина неспецифична; при первом ва-
рианте порока без стеноза легочной артерии изменения такие же,
как при изолированном ДМЖП с легочной гипертензией. В тех
случаях, когда размеры сердца не увеличены, можно думать о
развитии склеротических изменений в легочных сосудах. У боль-
ных с аномалией Тауссиг — Бинга наряду с усилением легочного
рисунка и кардиомегалией определяется резкое выбухание ство-
ла легочной артерии. При стенозе легочной артерии рентгеноло-
гические изменения такие же, как при тетраде Фалло.
Характерными признаками двойного отхождения магистраль-
ных сосудов от правого желудочка при одновременной эхокар-
диографии являются отсутствие заднего митрально-полулунного
продолжения (смещение вперед задней стенки аорты по отноше-
нию к передней створке митрального клапана) и гипоплазия
левого желудочка. Двухмерная эхокардиография позволяет непо-
средственно определить место отхождения аорты, при этом в про-
екции длинной оси сосуды лежат параллельно, образуя отдель-
ные выходы из правого желудочка без фиброзного продолжения
между полулунными и атриовентрикулярными клапанами. В
проекции короткой оси выявляются две округлые тени сосудов,
при этом клапаны аорты и легочной артерии находятся на
одном уровне. В продольных и коротких сечениях определяется
локализация ДМЖП. На рис. 55 (верхушечная проекция, про-
дольное сечение) видна аорта, отходящая от полости ПЖ, хоро-
шо выражена бульбовентрикулярная складка; стрелкой указан
подаортальный, дефект межжелудочковой перегородки.
При катетеризации полостей сердца выявляется свободное
прохождение катетера из правого желудочка в аорту, одинако-
вое давление в аорте, легочной артерии и обоих желудочках.
193
7—976
Рис. 55. Отхождение магистральных сосудов от правого желудочка с подаорталь-
иым дефектом межжелудочковой перегородки. Эхокардиограмма.
Наличие систолического градиента между левым желудочком,
с одной стороны, и аортой и правым желудочком — с другой,
может указывать на относительно маленькие размеры ДМЖП.
При выраженном стенозе легочной артерии данные зондирования
не позволяют отличить ДОМС от тетрады Фалло. У больных
с аномалией Тауссиг — Бинга характерным признаком является
более высокое насыщение крови кислородом в легочной артерии,
чем в аорте, вследствие преимущественного кровотока из левого
желудочка в легочную артерию.
Ангиокардиография является основным методом диагностики.
Первый вариант порока характеризуется следующими признака-
ми (рис. 56): 1) одновременное контрастирование из правого же-
лудочка аорты и легочной артерии, причем вследствие преиму-
щественного поступления неконтрастированной крови из левого
желудочка в аорту последняя контрастируется слабее легочной
артерии; 2) расположение в прямой проекции клапанов аорты и
легочной артерии в одной горизонтальной плоскости, аортальный
клапан — справа от легочного, иногда чуть выше или ниже его;
в боковой проекции — декстропозиция аорты; 3) двойной конус
в правом желудочке, образующий отдельные выходные отделы
для аорты и легочной артерии, а также языкообразный дефект
наполнения между клапанами аорты и легочной артерии; 4) рас-
положение ДМЖП под клапанами аорты, он является единствен-
ным выходом из левого желудочка; 5) в боковой проекции —
дефект наполнения между митральным и аортальным клапаном,
свидетельствующий об отсутствии митрально-аортального фиб-
розного продолжения (основной признак ДОМС), через подаор-
тальный дефект межжелудочковой перегородки (указан стрелка-
ми на рис. 56) контрастируется ЛЖ.
При втором варианте аорта контрастируется раньше и плотнее
легочного ствола, последний резко расширен, ДМЖП располагает-
ся под клапанами легочной артерии кзади и левее наджелудочкового
гребня. В боковой проекции отмечается дефект наполнения между
митральными и легочными клапанами, свидетельствующий об от-
194
Рис. 56. Отхожде-
ние магистральных
сосудов от правого
желудочка (боко-
вая проекция).
Правая вентрику-
лограмма. Объяс-
нение в тексте.
сутствии митрально-легочного фиброзного продолжения. Анало-
гичная картина наблюдается при третьем и четвертом типах
порока.
Дифференциальный диагноз первого варианта порока про-
водят с ДМЖП, открытым общим атриовентрикулярным каналом,
при стенозе легочной артерии с тетрадой Фалло, при сочетании
ДОМС с передним расположением аорты необходимо исключить
полную транспозицию магистральных сосудов. Аномалию Тауссиг —
Бинга дифференцируют с полной транспозицией аорты и легочной
артерии с большим ДМЖП и высокой легочной гипертензией.
Течение, лечение. Без хирургического лечения прогноз заболе-
вания неблагоприятный, большинство больных с легочной гипер-
тензией погибают на первом году жизни. Продолжительность жизни
увеличивается при сочетании порока со стенозом легочной арте-
рии; описаны случаи, когда больные доживали до 35 лет. Причина-
ми смерти неоперированных больных являются сердечная недоста-
точность на фоне двусторонней пневмонии, спонтанное закрытие
ДМЖП.
Показания к операции аналогичны таковым при
ДМЖП и тетраде Фалло. Паллиативные операции заключаются в
наложении межартериальных анастомозов у больных со стенозом
легочной артерии и сужением легочной артерии при увеличенном
легочном кровотоке. Впервые радикальная коррекция первого
7*
195
варианта порока выполнена J. Kirklin в 1961 г. Основным принци-
пом радикальной коррекции является создание адекватного сооб-
щения между левым желудочком и большим кругом кровообраще-
ния с помощью заплаты, вшиваемой внутри полости правого
желудочка и соединяющей в виде туннеля дефект межжелудочко-
вой перегородки с устьем аорты. При маленьких размерах
дефекта, когда он меньше устья аорты, производят расширение
дефекта, иссекая передневерхний край его, так называемую под-
аортальную кональную мышцу. Стеноз легочной артерии устраня-
ют обычным путем. В тех случаях, когда не представляется воз-
можным адекватное устранение стеноза легочной артерии, выпол-
няют операцию Растелли — экстракардиальное создание
сообщения между правым желудочком и легочной артерией с
помощью трубчатого протеза («кондуита»), т. е. создают ис-
кусственную легочную артерию.
В связи с тем что при аномалии Тауссиг — Бинга трудно создать
прямое сообщение между левым желудочком и аортой в силу отда-
ленности межжелудочкового дефекта от устья аорты, вначале ус-
танавливают с помощью заплаты сообщение левого желудочка с
устьем легочной артерии, создавая таким образом функциональ-
ную полную транспозицию аорты и легочной артерии, затем произ-
водят коррекцию транспозиции по методу W. Mustard. В 1968 г.
D. L. Patrie и D. С. McGoon предложили оригинальную операцию
внутрижелудочковой коррекции аномалии Тауссиг—Бинга, при
которой сформированный из синтетической ткани туннель в поло-
сти правого желудочка направляет артериальную кровь из левого
желудочка в аорту, не создавая препятствия для выброса крови
из правого желудочка в легочную артерию.
При сложных формах порока, обусловленных локализацией
ДМЖП или множественными ДМЖП типа «швейцарского сыра»
и сочетающихся со стенозом легочной артерии, для избежания
высокого риска радикальной операции может быть применена
операция гемодинамической коррекции с использованием принци-
па Фонтена [Бураковский В. И. и др., 1988J.
Операция состоит в выключении из кровообращения правого
желудочка посредством закрытия трикуспидального и легочного
отверстий и соединений правого предсердия с легочной артерией.
Учитывая плохие результаты операции с повышенным
общелегочным сопротивлением, некоторые авторы считают
нецелесообразным проводить операцию больным, у которых об-
щелегочное сопротивление превышает 10 ед/м2. У детей раннего
возраста рекомендуют выполнять операцию сужения легочной
артерии (летальность около 50%), а вторым этапом в возрасте
4—5 лет — радикальную коррекцию. По данным Г. Э. Фальковско-
го и Л. А. Бузиновой (1986), из 10 детей первых лет жизни с
ДОМС от правого желудочка после радикальной операции (созда-
ние внутрисердечного туннеля, соединяющего дефект с устьем
аорты с помощью синтетической или ксеноперикардиальной за-
платы) умерло двое (20%).
196
Радикальная коррекция ДОМС от правого желудочка сопрово-
ждается высокой летальностью (около 30%) [Harvey J. et al.,
1977; Stark J., de Leval M., 1983J. Наибольшее число неблагопри-
ятных исходов приходится на подлегочную и мышечную локализа-
цию ДМЖП, ранний детский возраст, сочетание ДОМС от правого
желудочка с другими пороками.
В нашей стране самым большим опытом радикальной коррек-
ции располагают В. И. Бураковский исоавт. (1988); ими проопери-
ровано 55 болных, летальность — 14,5%.
Причиной послеоперационной летальности чаще всего являет-
ся сердечная недостаточность. Среди осложнений отмечают ре-
канализацию ДМЖП, полную поперечную блокаду, развитие
субаортального стеноза.
Отдаленные послеоперационные результаты при ДМЖП, рас-
полагающемся под аортой или под обоими магистральными сосу-
дами, как правило, хорошие. Пациенты активны и хорошо перено-
сят физические нагрузки. Значительно хуже результаты при
других локализациях ДМЖП.
По данным R. Stewart и соавт. (1979), выживаемость после
коррекции неосложненных форм ДОМС от правого желудочка (с суб-
аортальной локализацией ДМЖП) составила 86 % к 7 годам после
операции, тогда как после коррекции ДОМС с подлегочной лока-
лизацией ДМЖП — только 38 % к 6 годам. Из осложнений в отда-
ленном периоде отмечают нарушения ритма сердца и прогрессиро-
вание изменений легочных сосудов. Повторные операции обычно
связаны с отхождением заплаты, образующей туннель, и остаточ-
ным стенозом легочной артерии.
ОТХОЖДЕНИЕ АОРТЫ И ЛЕГОЧНОЙ АРТЕРИИ
ОТ ЛЕВОГО ЖЕЛУДОЧКА
Первые описания случаев двойного отхождения магистральных
сосудов (ДОМС) от левого желудочка принадлежат S. Sakakibara
и соавт. (1967), М. Paul и соавт. (1970), а в отечественной
литературе — А. В. Иваницкому и соавт. (1985). Порок встреча-
ется редко, по данным О. Е. Soto и соавт. (1979), он составляет
0,23 % среди всех ВПС. К 1981 г. D. A. Murphy и соавт.
нашли в литературе описания всего 84 случаев этой патологии.
Анатомия. Анатомические критерии ДОМС от левого желудоч-
ка до настоящего времени точно не установлены. М. Н. Paul и со-
авт. (1970) и A. R. Kerr и соавт. (1971) относят к данному пороку
случаи отсутствия подаортального и подлегочного мышечного ко-
нусов с наличием фиброзного продолжения или контакта между
митральным и полулунным клапанами. При этом они считают, что
аорта и легочный ствол должны располагаться бок о бок, полно-
стью отходить от левого желудочка, их клапаны находятся на од-
ном уровне и единственным выходом из правого желудочка должен
быть дефект межжелудочковой перегородки (ДМЖП) (рис. 57).
197
Рис. 57. Схема отхождения магистральных
сосудов от левого желудочка
В других работах ДОМС от левого желудочка рассматривается
как одна из форм желудочково-артериальной связи, при которой
обе магистральные артерии полностью или одна из них целиком, а
другая более чем на 50 % находится над левым желудочком. Нали-
чию или отсутствию фиброзного митрально-полулунного продол-
жения или контакта не придается существенного значения. В 5
наблюдениях ИССХ им. А. Н. Бакулева выявлены только мит-
рально-аортальные контакты, тогда как митрально-легочные от-
сутствовали [Подзолков В. П. и др., 1986]. Именно наличие
митрально-аортального контакта определяло диагноз, так как во
всех случаях «верхом сидящим» сосудом на ДМЖП была аорта,
которая в четырех случаях на 75 %, а в одном — на 90 % отходила
от левого желудочка.
ДМЖП, положение которого влияет на условия гемодинамики,
может быть подаортальным (встречается чаще), подлегочным или
располагаться под обоими магистральными сосудами. Взаимоот-
ношения магистральных сосудов также могут быть различными.
Наиболее часто встречается декстропозиция аорты, которая распо-
лагается бок о бок, спереди или сзади ствола легочной артерии. Ре-
же наблюдается левопозиция аорты, причем при данном типе
взаимоотношения она, как правило, располагается спереди от ле-
гочного ствола. Наиболее частым сопутствующим пороком являет-
ся легочный стеноз, который может носить клапанный, подклапан-
ный и комбинированный характер. При отсутствии легочного
стеноза, что встречается исключительно редко, у больных с рожде-
ния отмечается высокая легочная гипертензия.
Среди аномалий трикуспидального клапана, довольно часто
встречающихся при ДОМС от левого желудочка, можно отметить
его стеноз, гипоплазию или атрезию, «верхом сидящий» над меж-
желудочковой перегородкой трикуспидальный клапан и др.
Гемодинамика. Нарушения гемодинамики определяются в ос-
198
новном размером и локализацией ДМЖП, наличием или отсутст-
вием легочного стеноза. При ДОМС от левого желудочка значи-
тельно чаще встречается подаортальная локализация ДМЖП. Это
приводит к тому, что венозная кровь из правого желудочка посту-
пает через ДМЖП преимущественно в восходящую аорту и возни-
кающие нарушения гемодинамики аналогичны наблюдающимся
при полной транспозиции магистральных сосудов (ТМС).
При подлегочном расположении ДМЖП венозная кровь из пра-
вого желудочка поступает через дефект преимущественно в легоч-
ный ствол. Поскольку данным условиям часто сопутствует легоч-
ный стеноз, то нарушения гемодинамики аналогичны встречаю-
щимся при тетраде Фалло. Величина легочного кровотока опреде-
ляется сопротивлением легочного стеноза и артериальных сосудов
малого круга кровообращения. При отсутствии стеноза имеется
высокая легочная гипертензия. Первоначально кровоток в малом
круге кровообращения резко увеличен; по мере развития склероти-
ческих изменений в легочных сосудах общелегочное сопротивление
возрастает, кровоток уменьшается. При небольшом размере
ДМЖП независимо от его локализации наблюдается различной
выраженности препятствие оттоку крови из правого желудочка с
соответствующим повышением давления, которое будет превышать
давление в левом желудочке.
Клиника, диагностика. Специфических клинических признаков
этого порока, имеющих абсолютное диагностическое значение, нет.
В редких случаях отсутствия легочного стеноза у больных с
рождения имеются явления легочной гипертензии, которые и обус-
ловливают соответствующее клиническое течение.
Значительно чаще при ДОМС от левого желудочка имеется ле-
гочный стеноз. Симптоматика заболевания у пациентов с восходя-
щей аортой, располагающейся справа от легочного ствола,
по клиническому течению напоминает тетраду Фалло, а больным с
восходящей аортой, Лежащей слева от легочного ствола, нередко
ставят ошибочный диагноз полной ТМС с ДМЖП и легочным сте-
нозом.
В клинической картине преобладают признаки хронической ки-
слородной недостаточности в виде цианоза с рождения, положи-
тельных симптомов «барабанных палочек» .и «часовых стекол», в
анализах крови — увеличение числа эритроцитов и уровня гемо-
глобина. Над областью сердца выслушивается систолический
шум с максимумом вдоль левого края грудины, II тон на основании
сердца ослаблен. В ряде случаев громкий II тон связан с хорошим
проведением на грудную клетку тона закрытия аортальных клапа-
нов.
На ЭКГ обычно определяются отклонение электрической
оси сердца вправо, признаки гипертрофии правого желудочка.
Данные рентгенологического исследования не имеют характерных
для этой патологии признаков и в основном отражают состояние
легочного кровотока.
Важную информацию дает эхокардиография. При исслсдова-
199
нии в продольной оси удается выявить параллельный ход маги-
стральных сосудов, расположение их над полостью левого желудо-
чка, установить наличие или отсутствие митрально-полулунного
и септально-полулунного контактов, а также локализацию
ДМЖП.
Решающее значение в диагностике порока принадлежит кате-
теризации сердца и ангиокардиографии. У большинства больных
давление в правом и левом желудочке равное. Если давление в
правом желудочке выше, чем в левом, то это признак затрудненно-
го выброса крови из правого желудочка, обусловленного неболь-
шим размером ДМЖП. Давление в легочной артерии зависит от
наличия или отсутствия сопутствующего легочного стеноза. Как
правило, наблюдается в разной степени выраженная артериальная
гипоксемия, причем в большей степени она выражена у больных с
легочным стенозом.
Программа ангиокардиографического исследования включает
правую и левую вентрикулографию, аортографию и по возможнос-
ти легочную артериографию. При контрастировании правого желу-
дочка отмечается симптом отсутствия прямого выхода в легочную
артерию и поступление контрастного вещества через ДМЖП в
левый желудочек и далее в магистральные сосуды. Левая вентри-
кулография подтверждает расположение обоих магистральных
сосудов над левым желудочком, позволяет получить более четкое
представление об их взаимоотношении, наличии или отсутствии
легочного стеноза и в ряде случаев — о состоянии митрально-
полулунного контакта.
Течение, лечение. Если не проводится хирургическая коррек-
ция порока, то прогноз заболевания неблагоприятный. Наличие с
рождния высокой легочной гипертензии рано приводит к структур-
ным изменениям в легочно-артериальном русле, а у больных с
сопутствующим легочным стенозом летальность связана с дефици-
том легочного кровотока и прогрессирующей артериальной гипо-
ксемией.
Показания к операции определяются имеющимися
нарушениями гемодинамики и возрастом больных. У новорожден-
ных детей раннего возраста предпочтение отдается паллиативным
вмешательствам, тип которых зависит от характера легочного кро-
вотока. При отсутствии легочного стеноза в связи с увеличенным
легочным кровотоком и высокой легочной гипертензией показано
сужение легочной артерии, которое будет способствовать предот-
вращению обструктивных изменений в сосудах легких и уменьше-
нию сердечной недостаточности. Больным с выраженным легочным
стенозом и артериальной гипоксемией рекомендуется наложение
системно-легочного анастомоза.
Первое сообщение о радикальной операции при ДОМС от лево-
го желудочка представлено S. Sakakibara и соавт. в 1967 г. В на-
шей стране первая успешная радикальная коррекция выполнена
В. П. Подзолковым в 1983 г.
Радикальная операция показана больным в возрасте старше
200
5—6 лет. Это связано с тем, что в большинстве случаев для
выполнения операции необходимо применение клапансодержаще-
го протеза. В настоящее время радикальная коррекция, основным
элементом которой является создание путей оттока из правого
желудочка в легочный ствол, может быть осуществлена по двум
различным методикам: первая — внутрижелудочковая — посред-
ством создания с помощью заплаты туннеля, ведущего правого
желудочка в легочный ствол, вторая — экстракардиальная — по-
средством соединения правого желудочка с легочным стволом
с помощью бесклапанного или клапансодержащего протеза.
Использование метода внутрижелудочковой коррекции, пред-
ложенного D. С. McGoon (1972) для полной ТМС с ДМЖП, позво-
ляет выполнить внутрижелудочковую коррекцию у ряда больных с
ДОМС от левого желудочка при подаортальной локализации
ДМЖП. Однако в клинической практике значительно чаще встре-
чается ДОМС с подаортальным ДМЖП и легочным стенозом, что
требует экстракардиального соединения правого желудочка и ле-
гочного ствола при помощи бесклапанного или клапансодержа-
щего протеза.
По данным J. Kirklin, В. Baratt-Boyes (1986), из 22 ради-
кальных операций 5 кончились летальным исходом. Наибольшая
смертность была отмечена в группе больных с большим объемом
операции (внутрижелудочковая коррекция в сочетании с экстра-
кардиальным кондуитом) и у больных в возрасте до 4 лет. В отда-
ленные сроки после операции возникают проблемы, связанные с
обструкцией клапансодержащего протеза или необходимостью его
замены на протез большего диаметра, если он был имплантирован
в раннем детском возрасте. В нашей стране о первых двух
успешных операциях сообщают В. П. Подзолков и соавт. (1986),
причем у обоих больных операция заключалась во внутрижелудоч-
ковой коррекции и подшивании между первым желудочком и лего-
чным стволом бесклапанного кондуита.
Отдаленные послеоперационные результаты, как правило, хо-
рошие и определяются сроками оптимальной функции кондуита.
При стенозировании последнего показана повторная операция по
его замене.
Глава 12. ПОЛНАЯ ТРАНСПОЗИЦИЯ АОРТЫ
И ЛЕГОЧНОЙ АРТЕРИИ
Полная транспозиция аорты и легочной артерии представляет
собой синий ВПС, при котором аорта отходит от правого желудоч-
ка и несет неоксигенированную кровь, а легочная артерия — от ле-
вого желудочка и несет оксигенированную кровь; атриовентрику-
лярные клапаны и желудочки сердца сформированы правильно.
Впервые определение пороку дал М. Abbott (1927), первое его опи-
сание принадлежит М. Baillie (1797). Синонимы: цианотическая
транспозиция магистральных сосудов (ТМС), некорригированная
ТМС, истинная ТМС, Д — ТМС.
201
Частота полной ТМС среди всех ВПС по клиническим данным
составляет 4,5 6,2 % [Gasul В. et al., 1966; Nadas A. S.,
1963], по патоморфологическим — 15,7-21 % в зависимости от
возраста [Keith J. et aL, 1978]. Частота порока по данным
катетеризации полостей сердца у детей первого месяца жизни сос-
тавила 27 %, в возрасте от 1 до 3 мес — 16,7 %, от 3 до 6 мес —
9,4 %, от 6 до 12 мес -- 4 %, от 1 года до 2 лет — 1,2 % и стар-
ше 2 лет — 0,5 % [Бураковский В. И. и др., 1971]. Эти различия
обусловлены высокой смертностью больных с полной ТМС в ран-
нем возрасте.
Анатомия, классификация. При полной ТМС полые и легоч-
ные вены соединяются, как обычно, с правым и левым предсер-
дием, которые через трикуспидальный и митральный клапаны со-
общаются с соответствующими желудочками. Однако выводные
отделы обоих желудочков не пересекаются и аорта отходит от
правого, а легочная артерия — от левого желудочка. В контакте
с митральным клапаном при ТМС находятся легочные клапаны,
а не аортальные. Восходящая аорта располагается спереди и
чаще справа по отношению к легочной артерии (D-транспози-
ция); реже аорта лежит прямо перед легочным стволом (О-
транспозиция) или слева от него (L-транспозиция). Ствол легоч-
ной артерии всегда прикрыт аортой на 1/» — 2/з его диаметра.
Оба магистральных сосуда имеют параллельный ход, не пере-
крещиваются, как в норме, уровень аортальных клапанов нахо-
дится несколько выше легочных.
В связи с тем что правый желудочек, нагнетая кровь в аор-
ту, работает в условиях гиперфункции, направленной на прео-
доление общепериферического сопротивления (ОПС), наблюда-
ется резкая гипертрофия его миокарда. Менее значительно выра-
жена гипертрофия левого желудочка, так как он функционирует
в условиях нагрузки увеличенным объемом крови; наличие сте-
ноза легочной артерии или склеротических изменений в сосудах
легких приводит к его резкой гипертрофии.
Жизнь при полной ТМС невозможна без компенсирующих
дефектов. Открытое овальное окно встречается у 33 % больных,
ДМПП — у 5,7 %, ОАП у 8,5 %, ДМЖП — У 61 % больных.
Диаметр ДМЖП чаще всего более 1 см, он локализуется ниже
наджелудочкового гребня в заднем отделе мембранозной части
перегородки. ОАП при ТМС широко открыт у детей, умерших
на первой неделе жизни, позже он нередко закрывается, что
приводит к ухудшению состояния больных; ОАП очень редко бы-
вает единственным сообщением при ТМС.
Из сопутствующих ВПС чаще всего, обычно при наличии
ДМЖП, встречается стеноз легочной артерии (14 23%). При-
мерно в '/2 случаев стеноз носит клапанный характер, нередко
имеется двустворчатый клапан, отмечается также гипоплазия
кольца с постстенотическим расширением ствола. Подклапан-
ный стеноз образован фиброзно-мышечной тканью на протяже-
нии выводного отдела левого желудочка (стеноз «туннельного»
592
Рис. 58. Полная транспозиция магистральных
сосудов (схема).
Стрелкой обозначено межпредсердное сообщение.
типа). В ряде случаев стеноз обусловлен фиброзной мембраной.
Подклапанное мышечное сужение может образовываться выбу-
ханием гипертрофированной межжелудочковой перегородки, в
основном средней ее части, в полость левого желудочка.
С меньшей частотой при полной ТМС встречаются коаркта-
ция и атрезия аорты, юкстапозиция предсердных ушек, добавоч-
ная верхняя полая вена, аномальный дренаж легочных вен,
сообщение между левым желудочком и правым предсердием,
аномалия Эбштейна и др.
Предложено много классификаций ТМС в зависимости от
анатомических особенностей и характера внутрисердечной гемо-
динамики.
Разработанная в ИССХ им. А. Н. Бакулева [Евтеев Ю. В.
и др., 1963] классификация делит ТМС на 2 группы: 1) прос-
тая ТМС: а) с усиленным легочным кровотоком, б) с ослаблен-
ным легочным кровотоком; 2) сложная ТМС: а) с усиленным
легочным кровотоком, б) с ослабленным легочным кровотоком.
R. Van Praagh и соавт. (1967) выделяют 3 группы: 1) с интакт-
ной межжелудочковой перегородкой; 2) с ДМЖП; 3) с ДМЖП
и стенозом легочной артерии. Клинические особенности полной
ТМС отражает классификация J. A. Noonan и соавт. (1960):
1) с интактной межжелудочковой перегородкой; 2) с ДМЖП:
а) с легочным стенозом, б) с обструкцией — склерозом — ле-
гочных сосудов, в) с большим объемом легочного кровотока.
Гемодинамика. Кровоток при ТМС осуществляется по двум
разобщенным кругам кровообращения (рис. 58). Венозная кровь
поступает из правого желудочка в аорту и, пройдя большой круг
кровообращения, через полые вены и правое предсердие вновь
возвращается в правый желудочек. Артериальная кровь посту-
пает из левого желудочка в легочную артерию и, пройдя малый
круг кровообращения, через легочные вены и левое предсердие
вновь возвращается в левый желудочек, т. е. в легких циркули-
рует кровь с высоким содержанием кислорода.
203
Существование порока существенно не сказывается на раз-
витии плода, но после рождения смешение крови двух кругов
кровообращения возможно лишь при наличии коммуникаций,
размер которых определяет выраженность гипоксемии и эффек-
тивность легочного кровотока (объем крови, поступающей из
правого предсердия и желудочка в левые отделы и легочную
артерию). Сброс крови на уровне коммуникации всегда осущест-
вляется в двух направлениях, так как односторонний его харак-
тер привел бы к полному опорожнению одного из кругов.
У новорожденных с началом дыхания происходит увеличе-
ние сосудистого русла легких и падение легочно-сосудистого соп-
ротивления ниже системного, что приводит к веноартериальному
(праволевому) сбросу крови из аорты в легочную артерию через
ОАП и бронхиальные сосуды, а также на уровне предсердий.
В результате этого увеличиваются объемы циркулирующей крови
в малом круге кровообращения и возвращающейся из него в ле-
вое предсердие; среднее давление в левом предсердии возраста-
ет, превышает уровень в правом предсердии, что приводит к
сбросу крови слева направо через межпредсердное сообщение.
При небольшом и среднем ДМЖП сброс крови справа налево
происходит во время систолы, слева направо — во время диасто-
лы; при большом ДМЖП из-за быстро развивающейся легочной
гипертензии с высоким общелегочным сопротивлением, а также
при выраженном стенозе легочной артерии сброс крови справа
налево происходит в диастолу, слева направо •— в систолу. При
одновременном существовании нескольких коммуникаций обмен
крови через них осуществляется в противоположных направле.-
ниях.
Клиника, диагностика. ВПС синего типа в большинстве слу-
чаев диагностируют у больных с ТМС уже в роддоме на
основании цианоза (у 100% больных), одышки (у 100% боль-
ных), реже — шума в сердце (у 26,8 % больных) [Мусато-
ва Т. И., 1973]. Выраженность цианоза определяется размером
шунта и бывает максимальной при открытом овальном окне и
маленьком ДМЖП, при крике ребенка цианоз принимает фиоле-
товый оттенок. Дифференцированный цианоз наблюдается у
больных с сопутствующей предуктальной коарктацией аорты и
ОАП: цианоз в большей степени выражен на верхней половине
туловища, чем на нижней.
Ребенок с ТМС часто имеет нормальную или даже увели-
ченную массу тела при рождении, но в возрасте 1—3 мес, как
правило, отмечается гипотрофия, что связано с трудностями при
кормлении из-за гипоксемии и сердечной недостаточности. Отста-
вание в моторном развитии приводит к тому, что дети позже
начинают сидеть, ходить. Нередко наблюдается отставание и в
умственном развитии. Гипоксические приступы возникают при
ТМС нечасто, обычно в случаях с резким цианозом; при мышеч-
ном подклапанном стенозе легочной артерии их патогенез такой
же, как при тетраде Фалло (см. главу 10).
204
Клиническая картина во многом определяется состоянием
легочного кровотока. При простой форме ТМС (с изолированным
межпредсердным сообщением) с рождения преобладают выра-
женные артериальная гипоксемия и ацидоз, состояние ребенка
прогрессивно ухудшается, что связано с закрытием ОАП и от-
крытого овального окна. Если поместить младенца с ТМС в кис-
лородную палатку, состояние его не улучшится, РаО2 практи-
чески не меняется. У всех больных с рождения отмечаются поли-
цитемия, высокий гематокрит.
У больных с увеличенным легочным кровотоком (ДМЖП)
отмечаются одышка до 60—80 в 1 мин, но цианоз и ацидоз выра-
жены нерезко, так как происходит адекватное смешение кровй.
Начиная со 2—4-й недели жизни основным проявлением порока
является бивентрикулярная, рефрактерная к медикаментозному
лечению, сердечная недостаточность (одышка, тахикардия, ге-
патомегалия, хрипы в легких), характерны повторные ОРВИ,
пневмонии.'
Размеры сердца на первой неделе жизни могут быть нор-
мальными или слегка увеличенными, в дальнейшем быстро раз-
вивается кардиомегалии, что объясняет иногда раннее появление
сердечного горба.
При аускультации II тон над легочной артерией акцентиро-
ван, что связано с усиленным закрытием аортальных клапанов
(аортальный щелчок захлопывания) или легочной гипертензией.
Усиление I тона и диастолический шум на верхушке обусловлены
увеличенным кровотоком через митральный клапан. У больных
с открытым овальным окном шум отсутствует, реже во втором
и третьем межреберье слева у грудины слабый систолический
шум. При большом ДМЖП с высокой легочной гипертензией
шумы могут не выслушиваться. При небольшом ДМЖП систоли-
ческий шум громкий, грубого тембра, выслушивается он в
третьем и четвертом межреберье слева от грудины.
На ЭКГ отмечаются отклонение электрической оси сердца
вправо, гипертрофия правого желудочка и правого предсердия.
При большом ДМЖП или ОАП со значительно увеличенным
легочным кровотоком могут быть нормальное положение электри-
ческой оси сердца и признаки гипертрофии миокарда обоих
желудочков. У детей первых недель жизни единственным приз-
наком правожелудочковой гипертрофии может быть положитель-
ный зубец Т в отведениях Vsr и Vi.
Данные ФКГ отражают аускультативные находки: шум отсут-
ствует или фиксируется систолический шум ДМЖП; шум ОАП
обычно зарегистрировать не удается.
На рентгенограмме органов грудной клетки легочный рису-
нок бывает нормальным (при небольших размерах коммуни-
каций), при ДМЖП и ОАП — в разной степени усиленным.
Для ТМС характерна прогрессирующая в течение нескольких
недель кардиомегалии. Сердечная тень имеет типичную конфи-
гурацию («яйцо, лежащее на боку») (рис. 59). Сердце увеличено
205
Рис. 59. Полная транспозиция магистральных сосудов. Рентгенограмма грудной
клетки. Объяснение в тексте.
за счет обоих желудочков, с возрастом оно принимает шаро-
видную конфигурацию, размеры его тем больше, чем больше
ДМЖП и сердечная недостаточность. Ширина сосудистого пуч-
ка на рентгенограмме зависит от пространственного расположе-
ния магистральных сосудов. В тех случаях, когда аорта распо-
ложена спереди и справа от легочной артерии, тень сосудистого
пучка в передней проекции широкая, во второй косой проекции —
узкая. Если аорта располагается непосредственно спереди от ле-
гочной артерии, то тень сосудистого пучка в передней проек-
ции узкая, в косой проекции — широкая {Голонзко Р. Р.,
1975]'.
У больных с сопутствующим стенозом легочной артерии
одышка выражена несколько меньше, чем в случаях увеличенно-
го легочного кровотока, а полицитемия иногда больше. В проти-
воположность больным с тетрадой Фалло при ТМС одышечно-
цианотические приступы наблюдаются редко. Во втором и треть-
ем межреберьях слева выслушивается грубый систолический шум
изгнания и акцент II тона, связанный с увеличенным крово-
током через расположенные спереди аортальные клапаны. Приз-
206
наки сердечной недостаточности умеренно выражены или отсут-
ствуют.
На ЭКГ отмечаются отклонение электрической оси сердца
вправо, признаки гипертрофии правого желудочка и правого
предсердия; лишь в редких случаях может наблюдаться откло-
нение электрической оси сердца влево.
При рентгенологическом исследовании легочный рисунок обе-
днен соответственно тяжести стеноза легочной артерии и особен-
но в случаях атрезии последней. Тень сердца умеренно увеличе-
на, в основном за счет правых его отделов, по левому кон-
туру сердца западает дуга легочной артерии. Увеличение разме-
ров сердца выражено в меньшей степени, чем у больных преды-
дущей группы, но в большей степени, чем при тетраде Фал-
ло.
Взрослые больные с ТМС обычно являются инвалидами, у
них выражены все проявления артериальной гипоксемии, сердеч-
ная недостаточность, резко снижена толерантность к физиче-
ской нагрузке.
Эхокардиографическая диагностика ТМС основана на иден-
тификации желудочков и главных сосудов, определении их прост-
ранственного взаиморасположения и отношения к желудочкам.
При одномерной эхокардиографии из одной позиции датчика
одноврменно определяется два полулунных клапана, при этом
аорта лежит кпереди от легочной артерии и сосуды имеют парал-
лельный ход. Косвенными эхокардиографическими признаками
являются дилатация и гипертрофия правого желудочка, увели-
чение экскурсии передней створки трикуспидального клапана.
При двухмерном исследовании в парастернальной проекции ко-
роткой оси иа уровне основания сердца аорта видна спереди
и справа (D-транспозиция) или спереди и слева (L-транс-
позиция) от легочной артерии. В проекции длинной оси левого
желудочка видна параллельная ориентация выводных трактов
обоих желудочков и обоих магистральных сосудов; причем легоч-
ная артерия отходит от левого желудочка и имеется митрально-
полулунное продолжение.
Катетеризация сердца и ангиокардиография наряду с эхо-
кардиографией являются наиболее информативными методами ди-
агностики полной ТМС. Катетер следует вводить в вену доста-
точно большого диаметра так, чтобы в дальнейшем через него
можно было провести катетер с баллончиком. При ТМС в пра-
вых отделах сердца и аорте обнаруживаются низкие цифры
насыщения крови кислородом (SaO2), в левых отделах сердца
и легочной артерии — более высокие. Повышение SaO2 проис-
ходит на уровне желудочков (при ДМЖП), при интактной
межжелудочковой перегородке — на уровне предсердий. В пра-
вом желудочке всегда регистрируется высокое давление, равное
системному (при простой форме ТМС оно выше, чем в левом
желудочке), из его полости нередко удается провести катетер в
восходящую аорту. При измерении давления в левом желудочке
207
Рис. 60. Полная транспо-
зиция магистральных со-
судов. Ангиокардиограм-
ма.
оно нормальное или в 2—4 раза ниже, чем в правом (за исклю-
чением случаев с высокой легочной гипертензией и стенозом
легочной артерии). Градиент давления между левым и правым
предсердиями свидетельствует о небольшом межпредсердном
сообщении. У больных с небольшим размером ДМПП резко
выражена артериальная гипоксемия, SAO2 колеблется от 20 до
208
Рис. 60. Продолжение.
а, в—- прямая проекция.
б, г боковая.
ьн
ДМЖП систолическое давление в обоих
отмечается повышение давления в левом
60 %. При большом
желудочках равное,
предсердии; при маленьком ДМЖП систолическое давление в ле-
вом желудочке небольшое. Артериальная гипоксемия при ТМС с
ДМЖП выражена в меньшей степени; SaOs — 30—70 %.
При проведении зондирования наиболее важной и трудной
209
является катетеризация легочной артерии. Особенно важно про-
хождение катетера в легочную артерию у больных с высокой
легочной гипертензией для решения вопроса об операбельности,
У новорожденных в критическом состоянии это обследование
проводить не обязательно. При наличии стеноза легочной ар-
терии определяется градиент давления между ней и левым желу-
дочком; артериальная гипоксемия примерно такая же или более
выражена, чем при изолированном ДМЖП.
Селективная ангиокардиография в двух стандартных проек-
циях имеет решающее значение, она выявляет ТМС, компенси-
рующие и сопутствующие пороки. При введении контрастного
вещества в полость правого желудочка оно попадает преиму-
щественно в аорту (рис. 60, а, б), видно переднее располо-
жение восходящей аорты и заднее — ствола легочной артерии,
сосуды имеют параллельный ход, аортальные клапаны располо-
жены выше уровня легочных. При введении контрастного ве-
щества в левый желудочек (через межпредсердное сообще-
ние) выявляется нормальной конфигурации его полость и легоч-
ная артерия (рис. 60, в, г). Одним из основных критериев
ТМС является обнаружение митрально-легочного контакта, а не
митрально-аортального, как в норме. Далее выполняют аор-
тографию восходящего отдела.
Дифференциальный диагноз полной ТМС следует проводить
с тетрадой Фалло, атрезией трехстворчатого клапана, атрезией
клапанов легочной артерии, единственным желудочком сердца,
общим артериальным стволом, отхождением обоих магистраль-
ных сосудов от правого желудочка, комплексом Эйзенменгера,
аномалией Эбштейна, другими состояниями, протекающими с
цианозом.
Течение, лечение. По наблюдениям J. Liebman и соавт.
(1969), 28,7 % детей, родившихся с полной ТМС, умирают в пер-
вую неделю жизни, 51,6% — в первый месяц; 89,3 % — к концу
первого года, 7 % — в возрасте до 5 лет, 2 % — до 10 лет. Сред-
няя продолжительность жизни, по данным этих же авторов, за-
висит от компенсирующих и сопутствующих пороков и состав-
ляет при небольших межпредсердных и межжелудочковых сооб-
щениях от 0,11 до 0,28 года, при большом ДМПП — 0,81 года,
при больших ДМЖП со склеротическими изменениями в легоч-
ных сосудах — 2 года, при ДМЖП в сочетании со стенозом
легочной артерии — 4,85 года. Описаны редкие случаи, когда
больные доживали до 18—44 лет.
Причиной смерти кооперированных больных являются тяже-
лая гипоксемия, сердечная недостаточность, сопутствующие за-
болевания (пневмония, ОРВИ, сепсис).
Лечение больных ТМС только хирургическое и по воз-
можности оно должно быть ранним. К настоящему времени пред-
ложено свыше 50 методов хирургического лечения, которые
могут быть разделены на два основных вида: паллиативные
и корригирующие.
210
Паллиативные операции проводят больным, находящимся в
тяжелом состоянии и пациентам раннего детского возраста, ког-
да проведение искусственного кровообращения для выполнения
полной коррекции представляет неоправданно большой риск.
Паллиативные операции должны отвечать следующим требова-
ниям: 1) уменьшать гипоксемию за счет улучшения обмена кро-
ви между большим и малым кругом кровообращения; 2) создать
оптимальные условия для функционирования малого круга крово-
обращения; 3) быть, по возможности, технически простыми и
не мешать проведению в будущем корригирующей операции.
Этим требованиям отвечают различные методики расширения
или создания ДМПП,
В настоящее время широкой популярностью продолжает
пользоваться закрытая баллонная атриосептостомия, предложен-
ная W. J. Rashkind и W. W. Miller в 1966 г. Эта процедура
показана всем новорожденным с полной ТМС при первом зон-
дировании; эффективность процедуры Рашкинда ниже у больных
первого месяца жизни, а у детей старше 3 мес она вообще не
эффективна, так как межпредсердная перегородка становится
малоподатливой. При быстром нарастании одышки, цианоза и
сердечной недостаточности закрытую атриосептостомию следует
производить срочно. В нашей стране процедура Рашкинда впер-
вые выполнена проф. Ю. С. Петросяном в 1967 г.
Закрытая баллонная атриосептостомия производится в рент-
генологической операционной (возможно под контролем эхокар-
диографии), где после ангиокардиографического подтверждения
диагноза, под рентгенологическим контролем через бедренную
вену (у новорожденных через пупочную вену) в правое пред-
сердие и далее через открытое овальное окно в левое пред-
сердие вводится катетер, на конце которого имеется баллончик.
Последний, наполняется разведенным контрастным веществом и
катетер коротким рывком выводится из левого предсердия до
устья нижней полой вены, производя разрыв межпредсердной
перегородки в области овального окна. С целью получения
больших размеров ДМПП тракции повторяются несколько раз
с постепенным увеличением объема баллончика до 1—4 мл.
Важное преимущество процедуры Рашкинда — это отсутствие
вскрытия грудной клетки, которое обычно утяжеляет состояние
больных и приводит к спаечному процессу, затрудняющему
торакотомию и выделение сердца в последующем при производ-
стве радикальной операции. По данным Ю. С. Петросяна и
соавт. (1986), летальность после процедуры Рашкинда составила
2,8%. Из возможных осложнений следует отметить нарушения
ритма вплоть до полной блокады сердца, перфорацию предсер-
дия с тампонадой сердца или пневмоперикардом, кровотечение
из бедренной или подвздошной вены, рызрыв баллончика, повре-
ждение трикуспидального клапана. Об эффективности процедуры
судят по величине SaO2 и РаО2 в системной артерии и правом
предсердии, уменьшению цианоза и градиента давления между
211
предсердиями. В ближайшем послеоперационном периоде отлич-
ные и хорошие результаты достигают в 92 % случаев [Гари-
бян В. А., 1972]. Высокий прирост РаО2 и SaO2 после баллонной
атриосептостомии является прогностически благоприятным приз-
наком. В то же время только 30 % больных с остающейся тяже-
лой гипоксемией (РаО2 менее 25 мм рт. ст.) доживают до 6 мес,
почти 70 % больных с РаО2 25—35 мм рт. ст. и SaO2 выше 30 %
пережили этот срок [Петросян Ю. С. и др., 1986]. В ряде слу-
чаев временное улучшение состояния после закрытой атриоСеп-
тосомии может быть обусловлено растяжением открытого оваль-
ного окна, а не его разрывом. Это является основной при-
чиной ухудшения состояния больных вскоре после операции, в
этих случаях требуется повторное хирургическое, вмешательство.
Отдаленные результаты после закрытой баллонной атрио-
септостомии ухудшаются прямо пропорционально сроку, про-
шедшему после операции. Несмотря на первоначальный положи-
тельный эффект операции, лишь половина больных доживает до
2'/2 лет. Летальность в отдаленном послеоперационном периоде
обусловлена сердечной недостаточностью из-за неадекватных
размеров созданного ДМПП, тяжелой легочной гипертензии;
возможна внезапная смерть.
К другим паллиативным вмешательствам относится метод
ножевой атриосептостомии по Парку [Park S. et al., 1978].
Больным с ДМЖП и высокой легочной гипертензией показана
операция сужения легочной артерии. Больным с сопутствующим
тяжелым стенозом легочной артерии и небольшим эффектом
после закрытой баллонной атриосептостомии рекомендуется на-
ложение аортолегочного анастомоза Блелока — Тауссиг.
Если еще совсем недавно паллиативная операция — атрио-
септэктомия являлась методом выбора у больных с полной
ТМС в возрасте до 2—4 лет, то в настоящее время показа-
ния к ее выполнению ограничены. Это обусловлено, с одной сто-
роны, широким распространением закрытой атриосептостомии и,
с другой — расширением показаний к выполнению корригирую-
щей операции. Хирургическое создание ДМПП показано при не-
удавшейся атриосептостомии у детей первых недель и месяцев
жизни, в более старшем возрасте — при отсутствии техниче-
ских возможностей проведения корригирующей операции. Среди
различных методик хирургического создания ДМПП наибольшее
распространение получила операция, предложенная и впервые
выполненная A. Blalock и С. Hanlon (1950), которая не сопро-
вождается выключением сердца из кровообращения; при этом
делаются разрезы на правом и левом предсердиях, вытяже-
ние и иссечение межпредсердной перегородки. По наблюдениям
отделения экстренной хирургии детей первого года жизни
ИСХХ им. А. Н. Бакулева площадь иссечения перегородки около
1 см3 оказывается достаточной для адекватного смещения крови
на уровне предсердий, при удалении большего участка возможна
травма проводящих путей сердца.
212
Летальность после операции Блелока — Ханлона, по данным
ИССХ им. А. Н. Бакулева, составляет 25 % (Шарыкин А. С.,
1986). Из осложнений следует отметить геморрагический отек
легких, кровотечение, прогрессирующую сердечную недостаточ-
ность, нарушения ритма сердца.
Корригирующая операция должна исправить нарушенную ге-
модинамику и устранить компенсирующие и сопутствующие по-
роки. В 1959 г. A. Senning предложил операцию с перемещением
системных и легочных вен на уровне предсердий, которая в
настоящее время применяется с большим успехом, с леталь-
ностью 1,3% [Lemoine G. at al., 1986]; в нашей стране первая
успешная операция выполнена В. В. Алекси-Месхишвили.
Первоначальная идея Н. Albert о возможности внутрипред-
сердного перемещения потоков артериальной и венозной крови
с помощью заплаты была также успешно реализована группой
хирургов из Торонто во главе с W. Mustard в 1964 г. и с тех пор
вошла в литературу под названием операция Мастарда (атрио-
септопластика). В нашей стране аналогичные операции впервые
выполнены академиком АМН СССР Б. И. Бураковским (1976),
проф. Б. А. Константиновым, академиком АМН УССР
Н. М. Амосовым, проф. Г. Э. Фальковским. В настоящее
время многие авторы считают возраст больных 6—12 мес опти-
мальным для выполнения операции Мастарда. Без предваритель-
ной паллиативной операции атриосептопластика может быть вы-
полнена больным первого года жизни с большим ДМПП, при
благоприятных анатомических взаимоотношениях больным с
ДМЖП и стенозом легочной артерии, но в более старшем воз-
расте (4—5 лет).
Операцию выполняют в условиях искусственного кровообра-
щения и поверхностной или глубокой гипотермии. Заплату
выкраивают из аутоперикарда по принципу Брома в виде брюк.
Межпредсердная перегородка иссекается, создается общее пред-
сердие. Далее производится атриосептопластика: заплата подши-
вается таким образом, что кровь из легочных вен и коронарного
синуса дренируется через трикуспидальный клапан в правый
желудочек, а кровь полых вен — через митральный клапан в ле-
вый желудочек, т. е. полная ТМС переводится в корригирован-
ную. Если имеется ДМЖП, то он закрывается, так же как
устраняется стеноз легочной артерии.
Наилучшие результаты получаются при коррекции полной
ТМС с ДМПП, летальность составляет 5—9 % [Trusler G. et al.,
1980; Stark J. et al.,.1980; Klautz R. et al., 1989]. По данным
Г. Э. Фальковского и соавт. (1985), летальность детей первых
лет жизни в ближайшем периоде после операции Мастарда
составила 20,6 %. Причиной неблагоприятных исходов обычно
являются острая сердечная и легочная недостаточность, крово-
течения. В генезе легочной недостаточности основную роль игра-
ет нарушение оттока крови из легочных вен.
Отдаленные результаты в большинстве случаев свидетель-
213
ствуют об эффективности операции. Наблюдения D. A. Fyfe и
соавт. (1986) за 128 больными с ТМС после операции Мастарда
в течение 10—20 лет показали, что умерли 36 человек (28%),
пережили 10 лет — 75 %, 15 лет — 70 %. Основными причинами
смерти являлись тяжелая легочная гипертензия, сердечная не-
достаточность; внезапно умерли 11 человек. При благоприятном
исходе операции у больных прекращались ОРВИ, пневмонии,
исчезали цианоз и сердечная недостаточность, уменьшались раз-
меры сердца, дети начинали прибавлять в массе тела, росте,
принимали активное участие в детских играх. Вместе с тем толе-
рантность к нагрузкам оставалась сниженной (50 % от нормы).
К осложнениям и причинам летального исхода в отдаленном
послеоперационном периоде относятся нарушения сердечного
ритма, затруднения оттока крови из легочных и полых вен, три-
куспидальная недостаточность, прогрессирующие склеротические
изменения в легочных сосудах. Нарушения сердечного ритма и
проводимости включают различные проявления синдрома слабос-
ти синусового узла (редкий узловой ритм, атриовентрикулярную
диссоциацию, мерцательную аритмию, синоаурикулярную блока-
ду), возможны пароксизмальная тахикардия, атриовентрикуляр-
ная блокада высоких степеней. Причины аритмий — поврежде-
ние синусового (при наложении швов) и атриовентрикулярного
(при иссечении межпредсердной перегородки) узлов, коронар-
ных артерий. Показаниями к подшиванию пейсмекера после опе-
рации Мастарда являются брадикардия с синкопе или пресин-
копальными состояниями, а также частота сердечных сокраще-
ний менее 40 в 1 мин, синдром тахикардии — брадикардии,
повторные приступы желудочковых аритмий, регистрируемые при
холтеровском мониторировании или на обычной ЭКГ. Именно
нарушения сердечного ритма — причина частоты внезапной смер-
ти в отдаленном послеоперационном периоде.
Большие трудности представляет коррекция ТМС с клапан-
ным и подклапанным стенозом легочной артерии. С этой целью
G. С. Rastelli и соавт. (1969) предложили принципиально новую
методику корригирующей операции с применением «кондуита»,
она показана в возрасте 3—5 лет. Коррекция порока включает
3 основных этапа: создание внутрисердечного «тоннеля» для
оттока крови из левого желудочка в аорту, разъединение легоч-
ного ствола и левого желудочка и имплантацию кондуита между
правым желудочком и легочным стволом. Резекция подклапан-
ного стеноза легочной артерии в этих условиях не производится.
Возможно использование дакронового трансплантата с имплан-
тированным ксеноклапаном или гомоаортального трансплантата
с клапаном. Первая в мире операция по данной методике у
больного с полной транспозицией магистральных сосудов,
ДМЖП и стенозом легочной артерии выполнена R. Wallace
[Rastelli G. et al., 1969], а в нашей стране — В. И. Бураковским
в 1981 г. Среди осложнений отмечают кровотечение, острую
сердечную недостаточность, обусловленную субаортальным сте-
214
нозом или оставшимся высоким давлением в правом желудочке,
раневую или общую инфекцию. По данным J. Kirklin и В. Ваг-
ratt-Boyes (1986), 91 % обследованных пациентов в отдаленные
сроки после операции были отнесены к I и II функциональным
классам по классификации NYHA. Среди осложнений отдален-
ного периода следует отметить нарушения функции кондуита,
требующие повторной операции по его реимплантации.
Глава 13. КОРРИГИРОВАННАЯ ТРАНСПОЗИЦИЯ
МАГИСТРАЛЬНЫХ СОСУДОВ
Корригированная транспозиция магистральных сосудов
(КТМС) представляет собой ВПС, характеризующийся пред-
сердно-желудочковой и желудочково-артериальной дискордант-
ностью, при этом кровоток имеет физиологическое направление,
т. е. в легочную артерию поступает венозная кровь, а в аорту —
артериальная. Первое описание порока принадлежит С. Roki-
tansky (1875).
Частота КТМС по патологоанатомическим данным [Fonta-
na R. S., Edwards J. Е., 1962] составляет 1,4 %. Однако клини-
ческие отклонения при КТМС могут быть минимальными и во
многих случаях порок остается недиагностированным.
Анатомия, классификация. КТМС может встречаться при нор-
мальном и аномальном положении сердца (рис. 61). Полые вены,
как в норме, соединяются с правым предсердием, которое через
двустворчатый клапан (по структуре и распределению хордаль-
ного аппарата аналогичный нормальному митральному клапану)
сообщается с венозным желудочком, имеющим морфологичес-
кую характеристику левого желудочка: он треугольной формы, с
гладкими внутренними контурами, особенно в области перегород-
ки. От венозного желудочка отходит ствол легочной артерии,
располагающийся сзади и медиально. Фиброзное кольцо легочно-
го ствола находится в такой же связи с септальной створкой
венозного, анатомически митрального, клапана, как аорталь-
ное кольцо с септальной створкой митрального клапана в
нормальном сердце. Легочные вены соединяются с нормально
расположенным левым предсердием, которое сообщается по-
средством трехстворчатого клапана с артериальным желудоч-
ком. Последний по своему анатомическому строению яв-
ляется правым желудочком: содержит наджелудочковый гребень,
подразделяющий его полость на приточный и выводной отделы,
в миокарде — резко выражена трабекулярность. От артериального
желудочка отходит аорта, занимающая переднелевую позицию
по отношению к легочному стволу. Оба магистральных сосуда
идут параллельно, не перекрещиваются, как в норме, и аорталь-
ные клапаны расположены несколько выше легочных. Дуга аор-
ты обычно находится слева, нисходящий отдел ее имеет нормаль-
ный ход. Значительно реже аорта образует правостороннюю
215
Рис. 61. Варианты корригированной транспозиции магистральных сосудов при
различных типах расположении сердца (схема).
а — при нормальном положении сердца; б — при правосформированном правораспо-
ложенном сердце; в — прн левосформированном праворасположенном сердце; г при
левосформированном леворасположенном сердце.
дугу, но аортальный клапан сохраняет левостороннюю позицию
по отношению к легочному.
Топографические взаимоотношения венозного и артериально-
го желудочков приближаются к нормальным: венозный желу-
дочек лежит спереди и справа, выводной отдел его направлен
кзади; артериальный желудочек расположен слева и несколько
кзади, выводной отдел занимает переднее положение. В связи
с этим выводные отделы желудочков пересекаются и это явля-
ется отличительной особенностью КТМС от полной ТМС. Ин-
версия желудочков ведет к нарушению топографии межжелудоч-
ковой перегородки, которая подходит к предсердиям несколько
левее межпредсердной перегородки (в норме — правее), так что
участок левого предсердия непосредственно соприкасается с ве-
нозным. анатомически левым, желудочком. Изменения в топогра-
фии межжелудочковой перегородки оказывают влияние на распо-
216
ложение проводящей системы сердца (ПСС). При КТМС су-
ществует пространственно перевернутое соответственно инверсии
желудочков положение желудочковой части ПСС, что является
причиной электрокардиографических отклонений.
Сопутствующие пороки сердца встречаются в большинстве
случаев КТМС и довольно рано приводят больных в кардиохи-
рургическую клинику. Наиболее часто выявляют ДМЖП, кото-
рый может располагаться как выше, так и ниже наджелудочко-
вого гребня, редко — в мышечной части перегородки. Диаметр
дефекта колеблется от 2 до 3,5 см, так что при отсутствии легоч-
ного стеноза наблюдается легочная гипертензия. У 70 % больных
наряду с ДМЖП определяется легочный стеноз; реже последний
встречается в изолированном виде. Стеноз чаще подклапанный
в виде фиброзной мембраны или мышечного стеноза, реже
клапанный. Следующим по частоте сопутствующим ВПС явля-
ется недостаточность артериального, анатомически трикуспи-
дального, клапана, работающего в условиях системного давле-
ния; недостаточность обусловлена аномальным прикреплением,
расщеплением и деформацией створок, расширением кольца,
иногда по типу аномалии Эбштейна.
К другим сопутствующим ВПС относятся стеноз и атрезия
артериального, анатомически трикуспидального, клапана, «вер-
хом сидящие» над ДМЖП атриовентрикулярные клапаны,
ДМПП, аномалии полых вен, ОАП, коарктация аорты, дискрет-
ный субаортальный стеноз в морфологически правом желудочке.
На основании клинико-анатомических особенностей можно
выделить 3 вида КТМС: 1) при нормальном положении сердца
без сопутствующих ВПС; 2) при нормальном положении с други-
ми ВПС; 3) при аномалиях положения сердца (правосформиро-
ванном праворасположенном, левосформированном правораспо-
ложенном, левосформированном леворасположенном сердце).
Гемодинамика. КТМС в изолированном виде долго не приво-
дит к нарушению гемодинамики, выраженность и характер
которой определяются сопутствующими ВПС. При ДМЖП нару-
шения гемодинамики такие же, как при изолированном пороке, а
при сочетании ДМЖП с легочным стенозом — аналогичны тетра-
де Фалло. Нарушения гемодинамики при недостаточности ство-
рок артериального атриовентрикулярного клапана соответствуют
митральной недостаточности при нормальном расположении ма-
гистральных сосудов.
Клиника, диагностика. Клиническое течение КТМС без со-
путствующих пороков сердца обычно длительно бессимптомное,
отсутствуют какие-либо жалобы, физическое развитие нормаль-
ное. Чаше всего больные обращаются к кардиологу в связи
с нарушениями ритма или наличием шума в области сердца.
Приступы пароксизмальной тахикардии и обнаруживаемую
атриовентрикулярную блокаду нередко считают последствиями
перенесенного миокардита.
При аускультации выслушивается громкий, нерасщепленный
217
Рис. 62. Корригированная транспозиция магистральных сосудов. ЭКГ.
II тон над легочной артерией, обусловленный передней позицией
аортального клапана. Неинтенсивный систолический шум во вто-
ром и третьем межреберьях слева обычно связан с большим
ударным объемом сердца при полной блокаде. Систолический
шум может зависеть от турбулентного характера кровотока в
выводном отделе венозного, анатомически левого, желудочка,
обусловленного образованием угла между коротким выводным
отделом этого желудочка и сзади идущим легочным стволом.
Систолический шум на верхушке, проводящийся влево, связан
с недостаточностью артериального атриовентрикулярного клапа-
на и может появиться в любом возрасте.
При сочетании КТМС с другими ВПС клиническая картина
определяется их характером, степенью гемодинамических нару-
шений и мало отличается от течения пороков при нормальном
положении желудочков.
Заподозрить КТМС помогают данные ЭКГ, где часто отме-
чается отклонение электрической оси сердца влево (<аАQRS
от 0 до —20°) (рис. 62). Иногда на ЭК.Г при КТМС имеется
синдром WPW, включая случаи с деформацией артериального
атриовентрикулярного клапана по типу аномалии Эбштейна.
К характерным признакам по ЭКГ относится неполная или пол-
ная атриовентрикулярная блокада (АВБ), наблюдаемая у 70 %
больных. В одних случаях АВБ отмечают с рождения, в других
она появляется позже, носит вначале перемежающий, а затем
постоянный характер. АВБ может появиться во время катетери-
зации сердца или в ходе хирургического вмешательства по по-
воду сопутствующих пороков. Возникновение полной АВБ связа-
но с фиброзом в области пучка Гиса или перерывом между ат-
218
Рис. 63. Корригированная транспозиция магистральных сосудов. Рентгенограмма
грудной клетки. Объяснение в тексте.
риовентрикулярным узлом и пучком Гиса, что подтверждено
гистологически. Детям с идиопатическими АВБ показано эхокар-
диографическое обследование для исключения КТМС как причи-
ны блокады. Еще одним признаком КТМС на ЭКГ является на-
личие зубцов Q в отведениях II, III, aVF, V1.2 (форма QRS пика
QS) и отсутствие их в I, aVL и левых грудных отведениях, а
также положительный зубец Т во всех грудных отведениях.
Эти изменения отражают инверсию желудочков. Из нарушений
ритма бывают атриовентрикулярная диссоциация, пароксизмаль-
ная тахикардия. Наличие ВПС с нарушениями гемодинамики,
аномалии положения сердца меняют структуру ЭКГ.
На рентгенограмме органов грудной клетки тень сердца
имеет шаровидную форму. В связи с левосторонним расположе-
ние аорты левый контур сосудистого пучка представлен сплош-
ной, слегка наклонной линией, первая и вторая дуги не диффе-
ренцируются (рис. 63). У больных с дефектами перегородок
и увеличенным легочным кровотоком левый контур сердца также
прямой или слегка вогнутый, т. е. возникает парадоксальная
картина из-за несоответствия между признаками усиления легоч-
ного рисунка и отсутствием выбухания второй дуги. Это обычно
указывает на аномальное положение легочного ствола и позволя-
ет заподозрить КТМС. Поскольку легочный ствол располагается
медиально и дорсально, при резком расширении он вызывает
заметное вдавление на контрастированном пищеводе, располо-
женное ниже выемки дуги аорты. Выпуклый характер сплошной
линии на левом верхнем контуре сердца, представленный восхо-
219
дящим отделом аорты, особенно в сочетании с обедненным ле-
гочным рисунком, свидетельствует о выраженном легочном сте-
нозе в комбинации с ДМЖП.
При М-сканировании характерным признаком КТМС являет-
ся наличие перехода заднего магистрального сосуда (легочной
артерии) в переднюю створку правостороннего (митрального)
атриовентрикулярного клапана; передняя и задняя створки этого
клапана имеют свободную экскурсию, у них нет контакта с
межжелудочковой перегородкой. Другим характерным проявлени-
ем КТМС являются 6qk о бок расположенные желудочки. Такое
расположение не позволяет определить из стандартных позиций
датчика типичную картину двух желудочков с разделяющей их
межжелудочковой перегородкой. Передняя створка заднего
(трикуспидального) клапана имеет большую экскурсию и про-
должается в передний магистральный сосуд — аорту. Трикуспи-
дальный клапан закрывается раньше, чем митральный.
При двухмерном сканировании определяется расположенный
впереди и слева магистральный сосуд (аорта), отходящий от пе-
редней левой стенки расположенного слева желудочка и не про-
должающийся в левый атриовентрикулярный клапан. В проек-
ции короткой парастернальной оси правый желудочек опреде-
ляется слева по большому числу трабекул, тогда как левый
(виден справа) имеет более гладкую эндокардиальную поверх-
ность; можно увидеть три створки трикуспидального клапана,
приобретающего в диастолу форму треугольника, тогда как се-
чение митрального клапана похоже на рыбий рот [Feigenba-
um Н., 1981].
При зондировании полостей сердца возникают трудности при
проведении катетера в легочную артерию, обусловленные близо-
стью правого атриовентрикулярного и легочного клапанов, воз-
можны тяжелые нарушения ритма. При прохождении катетера
в легочный ствол фиксируется необычное его положение, обус-
ловленное соотношением приточного и выводного отделов веноз-
ного, анатомически левого, желудочка. Венозный атриовентрику-
лярный клапан, в противоположность нормальной анатомичес-
кой картине, находится в тесном соприкосновении с легочным
клапаном, а последний в свою очередь расположен медиально,
ниже и кзади. Поэтому при проведении катетера в легочный
ствол он отклоняется от нормального пути и круто под острым
углом заворачивает медиально кверху и кзади, что фиксируется
в прямой и боковой проекциях.
Ангиокардиографическое исследование имеет наибольшую
диагностическую ценность. Контрастное вещество лучше вводить
в полость венозного желудочка, откуда оно поступает в легоч-
ный ствол. В прямой проекции контрастированный венозный
желудочек обнаруживает гладкие внутренние контуры и из-за
отсутствия инфундибулярного отдела образует «хвостообразный»
выступ по направлению к верхушке сердца, т. е. изменения,
типичные для левого желудочка (рис. 64, а).
220
Рис. 64. Корригированная
транспозиция магистраль-
ных сосудов с дефектом
межжелудочковой перего-
родки. Ангиокардиограм-
мы.
а — правая вентрикуло-
грамма; контрастное веще-
ство из венозного анатомн-
ческн левого желудочка
(ВЖ) поступает в легочный
ствол (ЛС); б — левая вен-
трикулограмма: контрастное
вещество нз артериального
анатомически правого желу
дочка (ЛЖ) поступает в
ворту (Ао) н через дефект
межжелудочковой перего-
родки в венозный желудок
(ВЖ) и легочный ствол
(ЯС).
Обязательным является введение контрастного вещества в ар-
териальный желудочек (рис. 64, б) для выявления недостаточ-
ности артериального атриовентрикулярного клапана. В прямой
проекции выявляется «грушеподобная» форма артериального
желудочка с грубой трабекулярностью внутренней поверхности,
наличие инфундибулярного отдела и наджелудочкового гребня,
т. е. признаки, характеризующие правый желудочек. Из артери-
ального желудочка контрастируется восходящая аорта, зани-
мающая крайне левое положение. Оба магистральных сосуда
идут параллельно, не перекрещиваясь. Легочный клапан нахо-
дится ниже аортального.
Дифференциальный диагноз при КТМС определяется нали-
221
чием сопутствующих ВПС. Важно, что у детей с атриовентри-
кулярными блокадами, отклонением электрической оси сердца
влево, аритмиями, шумом недостаточности «митрального» клапа-
на необходимо исключить КТМС с помощью эхокардиографии.
Течение, лечение. Изолированная КТМС может длительное
время оставаться асимптоматичной. Так, J. Edwards (1954) и
G. Nagle и соавт. (1971) сообщили о пациентах, которые
дожили соответственно до 60 и 45 лет. A. D. Lieberson и соавт.
(1969) наблюдали больного, который в молодом возрасте был
призван на военную службу, а умер в возрасте 73 лет; на аутоп-
сии была обнаружена выраженная недостаточность артериаль-
ного атриовентрикулярного и аортального клапанов.
J. С. Huhta и соавт. (1985) проследили естественное течение
порока у 107 больных с КТМС. Средний возраст установления
диагноза составил 12,7 лет (с рождения до 56 лет). Продолжи-
тельность жизни снижалась при недостаточности артериального
атриовентрикулярного клапана, полной АВБ, легочной гипер-
тензии.
Несмотря на длительное бессимптомное течение (при отсут-
ствии ВПС), эту аномалию вряд ли следует относить к ва-
рианту нормального развития, что подтверждается частым воз-
никновением с возрастом атриовентрикулярных блокад, аритмий,
недостаточности артериального (анатомически трикуспидально-
го) атриовентрикулярного клапана. Эти осложнения обычно
являются основной причиной ухудшения состояния и смерти
больных с КТМС. Полная АВБ, по-видимому, хорошо перено-
сится в детском возрасте, особенно, если она носит врожденный
характер. Внезапное ее возникновение в юношеском и более
старшем возрасте может быстро приводить к сердечной недоста-
точности и требует операции — имплантации искусственного во-
дителя ритма.
Стенокардические боли иногда наблюдаются у взрослых
больных с КТМС и симулируют ишемическую болезнь сердца.
Боли могут быть связаны с невозможностью правой коронарной
артерии длительное время обеспечить адекватное кровоснабже-
ние правого желудочка, функционирующего как системный же-
лудочек. У больных с КТМС и сопутствующим ВПС естествен-
ное течение и прогноз, как правило, определяются характером
пороков и степенью гемодинамических расстройств.
Хирургическое лечение пороков, сопутствующих КТМС, нача-
то в 1956 г. W. Walker, который впервые успешно закрыл
ДМЖП [Walker W. et al., 1958]. В нашей стране первая
успешная подобная операция выполнена В. И. Бураковским в
1963 г. При изолированной КТМС необходимость в хирурги-
ческом лечении возникает только при развитии полной АВБ.
Показаниями к имплантации электрокардиостимулятора являют-
ся приступы Морганьи — Адамса — Стокса и сердечная недоста-
точность.
Показания к хирургическому лечению сопутствующих ВПС те
222
же, что и у больных с нормальным сердцем. В зависимости от
типа порока, тяжести исходного состояния и возраста больных
выполняются паллиативные или радикальные операции. Среди
паллиативных операций у детей раннего возраста практическое
значение имеет сужение ствола легочной артерии при больших
ДМЖП с прогрессирующей сердечной недостаточностью; нало-
жение межартериальных анастомозов показано при сочетании
ДМЖП с легочным стенозом и резкой гипоксемией, для ра-
дикальной коррекции требуется применение клапансодержащего
протеза.
Показания к закрытию ДМЖП определяются формой легоч-
ной гипертензии: оперативному лечению подлежат больные, от-
носящиеся к П1а гемодинамической группе [Бураковский В. И.
и др., 1975]. У больных с .ДМЖП и тяжелой недостаточностью
артериального атриовентрикулярного клапана быстро прогресси-
рующие кардиомегалия, легочная гипертензия и сердечная не-
достаточность иногда требуют радикальной коррекции уже в дет-
ском возрасте. Поскольку у больных с ДМЖП и легочным сте-
нозом радикальная операция должна включать обходное шунти-
рование стеноза, ее предпочтительно выполнять в возрасте
старше 5—6 лет.
Для коррекции недостаточности артериального (трехстворча-
того) клапана применяют протезирование и аннулопластику.
В нашей стране первая операция протезирования клапана
при данной патологии выполнена в 1968 г. В. А. Бухариным, а
аннулопластика — Ю. И. Бондаревым в 1979 г.
Наиболее частыми интра- и послеоперационными осложне-
ниями являются повреждения коронарных артерий, неадекват-
ное устранение легочного стеноза, нарушения ритма сердца,
нераспознанная и нескорригированная недостаточность артери-
ального атриовентрикулярного клапана, ведущие к острой сер-
дечной недостаточности.
В связи с особенностями анатомических взаимоотношений
хирургическое лечение ВПС при КТМС сопровождается значи-
тельно большей летальностью, чем после таких же операций при
нормальном сердце. Лишь в последние годы имеется снижение
послеоперационной летальности: по данным G. Westerman и
соавт. (1982) —до 9 %, под данным G. D*anielson (1983) —
до 13 %, причем удовлетворительные результаты отмечены у
80 % выживших больных. D. D. Mair (1986) проследил отдален-
ные результаты (1 —18 лет) у 40 больных’с КТМС, у которых
имелись ДМЖП, ДМЖП со стенозом легочной артерии, недос-
таточность левого атриовентрикулярного клапана изолированная
и в сочетании с ДМЖП; 10 человек (25%) умерли, причина-
ми поздней смерти были прогрессирующая миокардиальная не-
достаточность, обструктивное поражение легочных сосудов, арит-
мии. Остальные больные, за исключением 3 человек, чувствуют
себя хорошо, включая лиц с имплантированным искусственным
водителем ритма.
223
Глава 14. ОБЩИЙ АРТЕРИАЛЬНЫЙ СТВОЛ
Общий артериальный ствол — ВПС, при котором один круп-
ный сосуд отходит от основания сердца через единый полулун-
ный клапан и обеспечивает коронарное, легочное и системное
кровообращение [Bankl Н., 1980]. Другие названия: общий
ствол, общий аортопульмональный ствол, персистирующий ар-
териальный ствол (persistent truncus arteriosus). Первое описа-
ние порока принадлежит A. Buchanan (1864). Этот порок со-
ставляет 3,9 % всех ВПС по результатам патологоанатомичес-
ких исследований [McNamara J. J., Gross R. Е., 1969] и 0,8—
1,7 % — по клиническим данным [Gasul В. М. et al., 1966;
Kidd В., 1978].
Анатомия, классификация. Анатомическими критериями об-
щего артериального ствола являются: отхождение от основания
сердца одного сосуда, обеспечивающего системное, коронарное и
легочное кровоснабжение; легочные артерии отходят от восходя-
щей части ствола; имеется единое клапанное кольцо ствола.
Термин «псевдотрункус» относится к аномалиям, при которых
легочная артерия или аорта атрезированы и представлены
фиброзными пучками. R. W. Collett и J. Е. Edwards (1949) выде-
ляют 4 типа общего артериального ствола (рис. 65): 1 —единый
ствол легочной артерии и восходящая аорта отходят от общего
ствола, правая и левая легочные артерии — от короткого ле-
гочного ствола; II — левая и правая легочные артерии располо-
жены рядом и отходят каждая от задней стенки трункуса;
III — отхождение правой, левой или обеих легочных артерий от
боковых стенок трункуса; IV — отсутствие легочных артерий,
из-за чего кровоснабжение легких осуществляется через бронхи-
альные артерии, отходящие от нисходящей аорты. Этот вариант
в настоящее время не признается как тип истинного общего
артериального ствола, при котором хотя бы одна ветвь легоч-
ной артерии должна отходить от трункуса. Таким образом,
можно говорить в основном о двух типах пороков: I и II—III.
При I типе общего артериального ствола длина общего ство-
ла легочной артерии составляет 0,4—2 см, возможны аномалии
развития легочной артерии: отсутствие правой или левой ветви,
стеноз устья общего ствола. При II варианте размеры легочных
артерий равны и составляют 2—8 мм, иногда одно меньше
другого. Клапан общего артериального ствола может быть одно-
(4 %), двух- (32 %), трех- (49 %) и четырехстворчатым (15 %).
F. Butto и соавт. (1986) впервые описали клапан с одной
комиссурой при общем артериальном стволе, который, как и при
стенозе аорты, создает стенотический гемодинамический эффект.
Створки могут быть нормальными, утолщенными (22 %) (по
краю видны мелкие узелки, миксоматозные изменения), дисплас-
тичными (50 %). Такое строение створок предрасполагает к кла-
панной недостаточности. С возрастом деформация створок увели-
чивается, у детей старшего возраста возможно развитие каль-
224
ПЛА
ЛЛА
ба
ба
Рис. 65. Варианты общего артериального ствола (схема).
циноза. Створки клапана общего ствола фиброзно связаны с
митральным клапаном, поэтому считается, что он в основном
аортальный.
Место расположения трункуса над желудочками имеет зна-
чение при отборе больных на радикальную коррекцию порока.
В наблюдениях F. Butto и соавт. (1986) в 42 % он располагался
в равной мере над обоими желудочками, в 42 % — преимущест-
венно над правым и в 16 % — преимущественно над левым желу-
дочком. В этих случаях выходом из желудочка, не соединяюще-
гося со стволом, служит ДМЖП.. По другим наблюдениям, от-
хождение трункуса от правого желудочка встречается в 80 %
случаев, при этом закрытие ДМЖП во время операции приводит
к субаортальной обструкции.
ДМЖП всегда имеется при общем артериальном стволе, он
не имеет верхнего края, лежит непосредственно под клапанами
и сливается с устьем ствола, инфундибулярная перегородка
отсутствует.
Этот порок часто сочетается с аномалиями дуги аорты:
перерыв, атрезия, праворасположенная дуга, сосудистое кольцо,
коарктация.
Другими сопутствующими ВПС бывают открытый общий ат-
8—976
225
риовентрикулярный канал, единственный желудочек, единая ле-
гочная артерия, аномальный дренаж легочных вен. Из экстра-
кардиальных пороков встречаются аномалии желудочно-кишеч-
ного тракта, урогенитальные и скелетные аномалии.
Гемодинамика. Кровь из правого и левого желудочков по-
падает в единый сосуд через ДМЖП; давление в обоих желу-
дочках, трункусе и ветвях легочной артерии равное, что объяс-
няет раннее развитие легочной гипертензии; исключение состав-
ляют случаи со стенозом устья легочной артерии и ее ветвей или
малым их диаметром. Правый желудочек при общем артериаль-
ном стволе преодолевает системное сопротивление, что вызывает
гипертрофию его миокарда, дилатацию полости. Гемодинамичес-
кие особенности порока определяются во многом состоянием кро-
вообращения в малом круге. Можно выделить следующие ва-
рианты.
1. Повышенный легочный кровоток с низким сопротивлением в сосудах лег-
кого, давление в легочных артериях равно системному, что свидетельствует
о высокой легочной гипертензии. Чаще встречается у детей раннего возраста,
сопровождается сердечной недостаточностью, резистентной к терапии. Цианоза
может не быть, поскольку большое количество крови оксигенируется в легких
и смешивается в желудочках из-за большого размера ДМЖП. Большой сброс
в общий ствол, особенно при многостворчатом клапане, способствует появлению
со временем клапанной недостаточности, которая еще более усугубляет тяжесть
клинического течения заболевания.
2. Нормальный или слабо увеличенный легочный кровоток вследствие повы-
шенного сопротивления в сосудах малого круга, предотвращающий большой
сброс крови в общий ствол. Сердечная недостаточность отсутствует, при нагруз-
ке появляется цианоз.
3. Сниженный легочный кровоток (гиповолемия) может возникнуть при су-
жении устья ствола или ветвей легочной артерии или при прогрессирующем
склерозе легочных сосудов. Постоянно отмечается выраженный цианоз, так как
в легких оксигенируется незначительная часть крови.
Сердечная недостаточность носит бивентрикулярный харак-
тер; выраженная недостаточность левого желудочка объясняет-
ся большим возвратом крови в его полость и нередко имеющим-
ся препятствием к выбросу при преимущественном отхождении
общего ствола от правого желудочка. При развитии высокой ле-
гочной гипертензии, ее склеротической фазы, состояние больных
улучшается, уменьшаются размеры сердца и проявления сердеч-
ной недостаточности, но увеличивается выраженность цианоза.
Учитывая анатомическое строение створок клапана ствола, воз-
можно развитие их недостаточности и/или стеноза.
Клиника, диагностика. По клиническим проявлениям дети с
этим пороком напоминают больных с большим ДМЖП. Веду-
щим признаком следует считать одышку по типу тахипноэ до
50—100 в минуту. В случаях уменьшенного легочного кровотока
одышка выражена значительно меньше. Цианоз при общем
артериальном стволе различен: он минимальный или отсутствует
при увеличенном легочном кровотоке, выражен при склеротичес-
ких изменениях в легочных сосудах (реакция Эйзенменгера)
или стенозе легочной артерии. В последних случаях он сопро-
226
вождается развитием симптомов «часовых стекол» и «барабан-
ных палочек», полицитемией. При кардиомегалии появляется
сердечный горб. Тоны сердца громкие, II тон над легочной ар-
терией акцентирован, может быть единым и расщепленным при
наличии более трех створок. Часто определяется апикальный
систолический клик. Грубый, продолжительный шум ДМЖП
определяется в третьем и четвертом межреберьях слева у гру-
дины, на верхушке может быть мезодиастолический шум отно-
сительного стеноза митрального клапана — признак гиперволе-
мии малого круга кровообращения. Если структура створок вы-
зывает стенотический эффект во втором и третьем межреберьях,
слева или справа выслушивается систолический шум типа
изгнания. При развитии недостаточности клапанов ствола вдоль
левого края грудины появляется протодиастолический шум.
Сердечная недостаточность выражена по право- и левожелудоч-
ковому типу вплоть до картины отека легкого; она меньше или
отсутствует при гиповолемии малого круга кровообращения и
склеротических изменениях в легочных сосудах.
Специфических электрокардиографических характеристик по-
рока нет. Электрическая ось сердца расположена нормально или
отклонена вправо (от +60 до +120°). У половины больных
увеличены правое предсердие, правый желудочек (в отведении
комплекс QRS типа R или qR), реже оба желудочка. При легочной
гипертензии на ЭКГ появляются признаки перегрузки по типу
„strain” в правых грудных отведениях (снижение интерва-
ла ST на 0,3—0,8 см, отрицательные зубцы Т в отведениях
V, з).
На ФКГ видны обычной амплитуды тоны на верхушке, во
втором межреберье фиксируются аортальные клики; II тон чаще
единый, но может быть широким и состоять из нескольких
высокоамплитудных компонентов; фиксируется пансистолический
шум, иногда высокочастотный с максимумом в третьем и четвертом
межреберьях слева и протодиастолический шум — признак кла-
панной недостаточности.
На рентгенограмме органов грудной клетки легочный рису-
нок обычно усилен, при стенозе устья легочной артерии обеднен
с двух сторон, при стенозе или атрезии одной из ветвей — с
одной, при склеротической фазе легочной гипертензии — обед-
нен преимущественно по периферии и усилен в прикорневой
зоне. Сердце чаще умеренно увеличено (кардиоторакальное от-
ношение— от 52 до 80%), может стать яйцевидным с узким
сосудистым пучком, что напоминает транспозицию магистраль-
ных сосудов, но с более прямым верхним левым краем. Увели-
чены, как правило, оба желудочка. Иногда сердце похоже по
форме на таковое при тетраде Фалло, имеется характерное
широкое основание сосуда с S-образным ходом. Правостороннее
расположение дуги аорты находят у ’/з больных, что в сочетании
с усилением легочного кровотока и цианозом должно вызвать
подозрение на общий артериальный ствол. Определенное диаг-
*И 227
ностическое значение может иметь высокое положение левой
легочной артерии.
Характерным М-эхокардиографическим признаком порока яв-
ляется отсутствие непрерывного септально-аортального (передне-
го) продолжения, при этом широкий сосуд «верхом сидит» над
ДМЖП. При преимущественном отхождении общего ствола от
левого желудочка заднее (митрально-полулунное) продолжение
сохранено. При сообщении артериального ствола преимущест-
венно с правым желудочком регистрируется нарушение перед-
него и заднего непрерывного продолжений. Другими М-эхокар-
диографическими признаками порока являются: невозможность
определения второго полулунного клапана; диастолическое
трепетание передней створки митрального клапана из-за недоста-
точности полулунного клапана общего артериального ствола;
дилатация левого предсердия.
При двухмерном эхокардиографическом обследовании в про-
екции длинной оси левого желудочка определяется широкий
магистральный сосуд, пересекающий («верхом сидящий») пере-
городку, большой ДМЖП, заднее продолжение сохранено.
В короткой проекции на уровне основания сердца провожелу-
дочковый выводной тракт и клапан легочной артерии не иден-
тифицируются. Из супрастернального доступа в ряде случаев
возможно определить место отхождения легочной артерии или ее
ветвей от трункуса.
Катетеризация полостей сердца и ангиокардиография имеют
решающее значение в диагностике. Венозный катетер входит в
правый желудочек, где давление равно системному, но в сочета-
нии с повышением насыщения крови кислородом свидетельствует
о ДМЖП. Далее катетер свободно проводится в трункус, где
давление оказывается такое же, как в желудочках. Насыщение
крови кислородом в общем артериальном стволе обычно ко-
леблется в пределах 90—96 % в случаях с гиперволемией.
Разница в насыщении кислородом крови легочной артерии и
трункуса не превышает 10 %. Снижение насыщения крови кисло-
родом до 80 % свидетельствует о склеротических изменениях
в легочных сосудах и неоперабельности больных. При введении
контрастного вещества в правый желудочек виден (лучше в
боковой проекции) общий артериальный ствол, от которого от-
ходят коронарные сосуды и легочная артерия (или ее ветви).
Аортография позволяет окончательно подтвердить отхождение
истинных легочных артерий непосредственно от ствола, детали-
зировать тип порока и определить степень недостаточности кла-
пана трункуса (рис. 66).
Дифференциальный диагноз следует проводить в случаях без
цианоза с ДМЖП, при цианозе — с тетрадой Фалло (особенно
при атрезии легочной артерии), транспозицией магистральных
сосудов, синдромом Эйзенменгера.
Течение, лечение. Течение порока тяжелое с первых дней
жизни больного из-за выраженной сердечной недостаточности и
228
Рис. 66. Общий ар-
териальный ствол
(прямая проекция),
1 тип. Аорто?рамма
(трункограмма).
Контрастное ве-
щество. введенное в
аорту, поступает в
легочный ствол.
легочной гиперволемии; при цианозе тяжесть состояния пациен-
та определяется степенью гипоксемии. Большинство детей уми-
рают в первые месяцы жизни и только '/s их переживает первый
год, а 10% доживают до 1—3-го десятилетия [Calder L. et al.,
1976]; известны случаи, когда пациенты доживали до 40—56 лет.
В основном это были больные со склеротическими изменениями
в легочных сосудах или со стенозом легочных ветвей.
Дигоксин и мочегонные препараты (см. главу 22) дают не-
значительный эффект при общем артериальном стволе, особенно
при клапанной недостаточности
Методом выбора хирургического лечения у больных с общим
артериальным стволом следует считать радикальную операцию
по методу G. Rastelli и соавт. (1967) (см. главу 11). У новорож-
денных и младенцев с нарастающими признаками сердечной
недостаточности, несмотря на медикаментозное лечение, может
встать вопрос о срочном хирургическом вмешательстве. В возра-
сте до 3 мес таким больным чаще всего выполняли операцию
сужения легочного ствола или обеих легочных артерий. Посколь-
ку данная операция у больных с общим артериальным стволом
сопровождается довольно высокой летальностью (в среднем
51 %), а у некоторых больных она не предотвращает развитие
обструктивных изменений в легочных сосудах и нередко создает
условия, в значительной степени затрудняющие выполнение в по-
следующем радикальной коррекции, то операцию сужения легоч-
229
ного ствола следует выполнять лишь как вынужденное хирурги-
ческое вмешательство. J. Stark и соавт. (1978) предпочитают
производить корригирующую операцию у больных в возрасте
до 1 года, так как риск выполнения в последующем повторной
операции из-за небольшого диаметра первично имплантируемого
кондуита будет небольшим.
Радикальная операция заключается в закрытии ДМЖП,
разъединении легочных артерий от ствола и соединении их с пра-
вым желудочком с помощью клапансодержащего трубчатого
протеза (кондуита). Первая в мире успешная операция по дан-
ной методике выполнена D. McGoon и соавт. (1968), а в нашей
стране В. И. Бураковским и соавт. (1981). Следует отметить,
что лишь единичные кардиохирургические клиники в мире рас-
полагают опытом коррекции общего артериального ствола.
A. Appelbaum и соавт. (1976) представили результаты хирур-
гического лечения 22 больных с летальностью 41 %, которая
была выше у детей в возрасте до 2 лет и составила 80 %, тогда
как в более старшей группе — 8 %. С. Marcelletti и соавт. (1977)
среди 92 оперированных больных летальный исход отметили у 23
(25%) и 8 больных (12%) умерли в поздние сроки.
Учитывая, что наиболее частой причиной летальных исходов
является раннее развитие органических изменений в артериаль-
ном русле легких, в последнее время коррекцию порока произ-
водят в младенческом возрасте. Наилучшие результаты получены
Р. Ebert и соавт. (1981 —1984), которые прооперировали 112 де-
тей в возрасте до 1 года с летальностью 11,6%, причем
у 84 больных в возрасте до 6 мес летальность была меньше
и составила 9,5%, тогда как у больных в возрасте от 6 до
12 мес — 17,8 %. В нашей стране наибольшим опытом хирургиче-
ского лечения располагают В. И. Бураковский и соавт. (1986),
которые оперировали 9 больных с двумя летальными исходами
(22,2%).
Среди осложнений радикальной операции следует отметить
кровотечение, сдавление протеза грудиной, острую сердечную
недостаточность, обусловленную оставшимся высоким давлением
в артериальном русле легких из-за обструктивной формы легоч-
ной гипертензии. Большую опасность после операции из-за воз-
можности аррозивного кровотечения представляет гнойный меди-
астенит, поскольку в средостении размещается больших размеров
инородный материал, а операцию выполняют у ослабленных,
отстающих в развитии младенцев и детей с явлениями тяжелой
недостаточности кровообращения.
Отдаленные результаты благоприятные. Однако большому
числу больных, оперированных в раннем возрасте, требуется
повторная операция по замене кондуита. Среди больных, опери-
рованных Р. Ebert и соавт. (1984) в возрасте до 6 мес, повторная
операция потребовалась в течение 4 лет 55 из 86 человек. Ухуд-
шение состояния в отдаленнее сроки может быть также связано
с прогрессированием склеротических изменений в легочных сосу-
230
дах. Примером могут служить данные R. DiDonato и соавт.
(1983), согласно которым среди больных, оперированных в воз-
расте от 6 до 9 лет, выживаемость к 13 годам после операции
составила 68%.
Глава 15. АНОМАЛИЯ ЭБШТЕЙНА
Аномалия Эбштейна — врожденный порок сердца, характери-
зующийся дисплазией и смещением створок трикуспидального
клапана в полость правого желудочка. Впервые порок описан
W. Ebstein (1866). Встречается он редко и составляет 0,5—1 %
от всех ВПС [Schiebler G. L. et al., 1968; Gasul В. et al., 1966].
Анатомия. Основная анатомическая особенность порока зак-
лючается в смещении трехстворчатого клапана в полость пра-
вого желудочка по направлению к верхушке сердца, обычно до
места соединения приточной и трабекулярной его частей
(рис. 67). Степень дисплазии, деформации створок, их структур
варьируют в широких пределах. Во всех случаях в полость
желудочка оказывается смещенной задняя створка и довольно
часто — перегородочная, местом наибольшего смещения являет-
ся комиссура между ними. Смещенные створки чаще резко
деформированы, истончены, хорды их укорочены, папиллярные
мышцы гипоплазированы. Нередко створки распластаны и при-
ращены к эндокарду правого желудочка или межжелудочковой
перегородке, пересекая в некоторых случаях выводной тракт
правого желудочка. К фиброзному кольцу прикрепляется только
малоизмененная передняя створка, являющаяся чаще всего
единственной функционирующей створкой трикуспидального кла-
пана, она значительно увеличена в размерах, нередко является
парусоподобной, иногда свободный ее край прикрепляется в вы-
водном отделе правого желудочка и вызывает стенозирование
путей оттока. Патология трехстворчатого клапана сопровожда-
ется расширением фиброзного кольца, что приводит к выражен-
ной недостаточности клапана.
В результате смещения створок по направлению к верхушке
сердца полость правого желудочка оказывается разделенной на
2 части: верхняя часть, расположенная над смещенным клапа-
ном, является «атриализованной» частью правого желудочка
и образует с правым предсердием общую, большую по объему
полость. Меньшая, нижняя, часть располагается под смещенным
клапаном и вместе с трабекулярным (или верхушечным) и
выводным отделом функционирует в качестве правого желу-
дочка.
Стенка правого предсердия гипертрофирована, утолщена, в то
время как стенка «атриализованного» отдела правого желудочка
резко истончена, аневризматически выбухает, толщина ее состав-
ляет 1—3 мм. Нормальная или несколько утолщенная стенка
определяется в дистальной камере правого желудочка. В 80—85 %
231
Рис. 67. Аномалия Эбштейна (схема).
I — левый желудочек, 2 — уменьшенный правый
желудочек, 3 — «атриализованная» часть правого
желудочка, 4 — правое предсердие, 5 — дефект меж-
предсердной перегородки, 6 — левое предсердие, 7 —
легочная артерия.
случаев наблюдается межпредсердное сообщение, которое часто
обусловлено растяжением краев овального отверстия, реже —
существованием вторичного дефекта межпредсердной перегород-
ки (ДМПП). В 15—20 % случаев аномалии Эбштейна встре-
чаются дополнительные атрио- и нодовентрикулярные пути, чаще
правосторонние.
В миокарде правого желудочка обнаруживают значительные
изменения: гипертрофия и атрофия кардиомиоцитов, миомаля-
ции, склероз [Махмудов М. М., 1985].
Сопутствующие пороки встречаются в 5% всех случаев ано-
малии Эбштейна [Подзолков В. П. и др., 1983]. Среди "Них отме-
чают ДМЖП, клапанный, над- и подклапанный стеноз легочной
артерии, ОАП, пороки левого сердца — стеноз или недостаточ-
ность митрального клапана, двустворчатый клапан и атрезия
аорты.
Гемодинамика. При небольшом смещении трехстворчатого
клапана нарушения гемодинамики минимальны. Более значитель-
ные изменения приводят к дефициту легочного кровотока, недо-
статочности трехстворчатого клапана, сбросу крови справа на-
лево через межпредсердное сообщение. Уменьшение легочного
кровотока обусловлено тем, что функционирующий правый желу-
дочек, расположенный дистальнее смещенного трехстворчатого
клапана, имеет небольшую полость и выбрасывает соответствен-
но меньший, чем в норме, ударный объем крови. Кроме этого,
ограничение притока крови в дистальный отдел правого желу-
дочка существует и в диастолу: во время систолы правого пред-
сердия «атриализованная» камера правого желудочка находится
в фазе диастолы, из-за чего продвижение крови в дистальную
232
камеру правого желудочка задерживается и эффективность
систолы предсердия снижается. Наряду с этим деформация
смещенных створок трикуспидального клапана в сочетании с рас-
ширенным фиброзным кольцом часто приводит к недостаточно-
сти, реже — к стенозу этого клапана. Если существование сте-
ноза трехстворчатого клапана ограничивает приток крови к ди-
стальной камере, то наличие недостаточности и парадоксального
сокращения «атриализованной» части правого желудочка приво-
дит к возвращению во время систолы желудочка большого
объема венозной крови вновь в правое предсердие; все это обу-
словливает его дилатацию и гипертрофию. При выраженных
изменениях возникает неспособность правого предсердия к даль-
нейшему расширению, что создает препятствие оттоку крови из
полых вен; наступают венозный застой в большом круге крово-
обращения и значительное повышение давления в правом пред-
сердии, что при наличии межпредсердного сообщения вызывает
сброс венозной крови в левое предсердие, т. е. артериальную
гипоксемию, степень которой определяется величиной градиента
давления между предсердиями и размерами межпредсердного
сообщения. Следовательно, разгружая правое предсердие и за-
держивая развитие системной венозной недостаточности, сброс
крови справа налево носит компенсаторный характер.
Наиболее тяжелые гемодинамические нарушения встречаются
при значительном смещении и дисплазии створок трикуспидаль-
ного клапана и отсутствии или небольшом размере межпредсерд-
ного сообщения. В этих случаях наблюдается резкое расширение
правого предсердия, которое вместе с «атриализованной» частью
правого желудочка образует огромную полость, вмещающую
иногда до 2—2,5 л крови.
Клиника, диагностика. Аномалия Эбштейна диагностируется
в роддоме или в первые недели и месяцы жизни ребенка при
выраженных клинических проявлениях: благоприятный вариант
порока может долго оставаться бессимптомным и его выявляют
при рентгено- или эхокардиографии. Физическое и моторное раз-
витие больных соответствует возрасту. Основные жалобы вклю-
чают боли в сердце, одышку, снижение толерантности к физи-
ческой нагрузке, возможны приступы сердцебиений (пароксиз-
мальная тахикардия), нередко затяжные, сопровождающиеся
потерей сознания. Для купирования приступа используют изоп-
тин, аймалин, кордарон (см. главу 12).
При объективном исследовании у 75—85 % больных опреде-
ляется цианоз, время появления которого может быть различ-
ным. Почти у 2/з больных цианоз отмечается с рождения, реже
появляется между 3-м и 12-м годом жизни. Выраженность циа-
ноза увеличивается по мере того, как нарастают давление в пра-
вом предсердии и веноартериальный сброс, оттенок его меняется
от малинового до синюшного. У некоторых детей цианоза нет
(в случаях отсутствия межпредсердного сообщения). Иногда
отмечается акроцианоз как проявление сердечной недостаточно-
233
сти и нарушения функции внешнего дыхания. У цианотических
больных в анализах крови наблюдается полицитемия, высокие
цифры гематокрита. Нередко можно отметить набухание вен шеи,
хотя систолическая пульсация их встречается обычно в терми-
нальных стадиях. У больных с цианозом наблюдается изменение
концевых фаланг пальцев рук и ног в виде «барабанных пало-
чек» и «часовых стекол». При сочетании порока со стенозом
легочной артерии проявления артериальной гипоксемии выраже-
ны значительно, больные присаживаются на корточки, как при
тетраде Фалло.
У ‘/г больных определяется «сердечный горб», который цели-
ком обусловлен гигантскими размерами правого предсердия
и «атриализованной части правого желудочка». Верхушечный
толчок пальпируется в пятом и шестом межреберьях по передне-
подмышечной линии, что зависит от смещения левого желудочка
резко увеличенными правыми отделами сердца. Границы сердеч-
ной тупости значительно расширены влево и вправо.
При аускультации определяются глухие, ослабленные тоны
(к передней грудной клетке прилежит большое правое пред-
сердие), включая II тон над легочной артерией, ритм «галопа» —
трех- или четырехчленный ритм, обусловленный раздвоением
I и II тонов сердца или наличием дополнительных III и IV тонов.
Шум может отсутствовать, но у большинства больных в четвер-
том и пятом межреберьях слева у грудины выслушивается систо-
лический шум мягкого тембра, связанный с недостаточностью
трехстворчатого клапана. Появление там же диастолического
шума обычно свидетельствует о трикуспидальном стенозе. Ин-
тенсивность шумов нарастает в фазу вдоха, что свидетельствует
о их связи с поражением трехстворчатого клапана. При сопут-
ствующем стенозе легочной артерии выслушивается грубый
систолический шум типа изгнания.
Сердечная недостаточность при аномалии Эбштейна является
правожелудочковой (одышка, тахикардия, гапатомегалия, пуль-
сация шейных вен), возникает иногда с первых месяцев жизни,
но может впервые появиться и очень поздно. Декомпенсация
преобладает у больных с обструкцией трикуспидального клапана,
легочным стенозом, атриомегалией, прогностически она всегда
неблагоприятна, продолжительность жизни после ее появле-
ния — около 2 лет.
Таким образом, для аномалии- Эбштейна характерно отсутст-
вие параллелизма между кардиомегалией, незначительными жа-
лобами и скудными аускультативными данными.
Электрокардиографическая картина при аномалии Эбштейна
очень различна, но часто значительно помогает в диагностике.
Обычно (рис. 68) электрическая ось сердца отклонена вправо, в
отведении V| имеется низкоамплитудный полифазный (причудливо
деформированный) комплекс QRS, признаки неполной и полной бло-
кады правой ножки пучка Гиса также с небольшой амплитудой
зубцов R и S. Такая необычная комбинация признаков на ЭКГ
234
Рис. 68. Аномалия Эбштейна. ЭКГ (а) и ФКГ (б). Объяснение в тексте.
требует исключения аномалии Эбштейна. Зубец Р увеличен по
амплитуде и продолжительности, особенно в отведениях II и Vi,
иногда высота зубца Р превышает амплитуду зубца R, в таких
случаях прогноз заболевания плохой; интервал PR часто удли-
нен; возможны синдром WPW (чаще тип В), трепетание и мер-
цание предсердий, приступы пароксизмальной тахикардии (осо-
бенно при сочетании с синдромом WPW). При сочетании со сте-
нозом легочной артерии на ЭКГ появляются признаки гипер-
трофии миокарда правого желудочка, отсутствует полиморфность
комплекса QRS. Всем больным с аномалией Эбштейна при воз-
можности показано холтеровское мониторирование.
На ФКГ: широкое расщепление I тона на верхушке, что свя-
зано с замедленным закрытием увеличенной передней створки
трехстворчатого клапана; большой амплитуды III и IV тон;
II тон во втором межреберье слева стойко раздвоен, легочный
компонент его снижен; низкоамплитудный систолический шум
в четвертом и пятом межреберьях слева (см. рис. 68).
На рентгенограмме органов грудной клетки легочный рисунок
обеднен. Сердце редко нормальных размеров, чаще отмечается
кардиомегалия с шаровидной формой или в виде «перевернутой
чаши». Правый атриовазальный угол смещен вверх за счет уве-
личения правого предсердия и атриализованной части правого
желудочка, правый диафрагмальный контур «срезан» (умень-
шенный правый желудочек) (рис. 69). Сосудистый пучок узкий,
левые отделы сердца не увеличены. При сочетании аномалии
Эбштейна со стенозом легочной артерии сердце напоминает
таковое при тетраде Фалло.
Эхокардиография в настоящее время позволяет поставить
правильный диагноз в большинстве случаев и тем самым избе-
жать рентгенохирургического обследования. Характерным М-эхо-
кардиографическим признаком порока является смещение ство-
рок трикуспидального клапана в сторону верхушки правого же-
лудочка. Закрытие трикуспидального клапана через 0,03 с и бо-
лее после закрытия митрального клапана, специфичный признак
235
Рис. 69. Аномалия Эбштейна Рентгенограмма грудной клетки. Объяснение в
тексте.
аномалии Эбштейна; повышение этого показателя до 0,065 с
и более — дифференциально-диагностический признак этого по-
рока; исключение составляют случаи с синдромом WPW, при
котором оба атриовентрикулярных клапана закрываются одно-
временно. К другим признакам относятся одновременная реги-
страция передних створок обоих атриовентрикулярных клапанов
с большой диастолической экскурсией трикуспидальной створки,
превышающей экскурсию митральной створки; регистрация пе-
редней створки трикуспидального клапана слева от среднеклю-
чичной линии; увеличение амплитуды движения и снижение ско-
рости раннего диастолического закрытия передней створки; де-
формация эхосигнала от створок клапана; эхопризнаки объемной
дилатации правого предсердия и «атриализованной» части пра-
вого желудочка, парадоксальное движение межжелудочковой пе-
регородки. Диастолический наклон трикуспидальной створки
зависит от наличия недостаточности или стеноза трикуспидаль-
ного клапана. При двухмерной эхокардиографии (рис. 70)
видны большая подвижная передняя створка трикуспидального
клапана, дистальная и «атриализованная» части правого же-
лудочка, аномальное прикрепление септальной трикуспидаль-
ной створки, дефект МПП, большое ПП. Степень смещения три-
236
Рис. 70. Аномалия Эбштейна Эхокардиограмма.
куспидального клапана в полость правого желудочка оценива-
ется в проекции 4 камер с верхушки.
Катетеризацию полостей сердца следует проводить с большой
осторожностью, поскольку у больных с аномалией Эбштейна
из-за тяжелого исходного состояния нередко развиваются опас-
ные для жизни нарушения сердечного ритма. У всех больных
выявляются повышенное давление в правом предсердии, высокие
волны а (усиленное сокращение гипертрофированного правого
предсердия) и V (обусловлена недостаточностью трехстворчато-
го клапана). При прохождении катетера в выводной отдел пра-
вого желудочка нередко регистрируется диастолический гра-
диент, связанный со смещением, дисплазией трехстворчатого
клапана или с относительным стенозированием его отверстия
по сравнению с резко расширенным правым предсердием. Систо-
лическое давление в правом желудочке и легочной артерии обыч-
но нормальное или несколько снижено, так же как сократитель-
ная функция выводного отдела правого желудочка. Газовый
состав крови выявляет низкие цифры насыщения кислородом
в правых отделах сердца, большую артериовенозную разницу
и артериальную гипоксемию, степень которой зависит от объема
сброса крови справа налево на уровне предсердий и редко быва-
ет ниже 85—80 %.
При ангиокардиографическом исследовании наиболее инфор-
мативной является правая атриография: контрастируется гигант-
ская, резко расширенная полость с плотным контрастированием.
Недостаточность трех створчатого клапана и парадоксальная
пульсация «атриализованной» части правого желудочка приво-
дят к позднему, более слабому контрастированию дистального
отдела правого желудочка й легочной артерии; последняя нор-
мальной величины или слегка гипопластична.
При наличии межпредсердного сообщения на ангиокардио-
граммах определяется поступление контрастного вещества
в левые отделы сердца и аорту; последняя расположена нор-
мально. При введении контрастного вещества в дистальный от-
237
дел правого желудочка отмечаются смещение влево и необычные
его контуры, трикуспидальная недостаточность.
Дифференциальный диагноз аномалии Эбштейна следует про
водить с кардиомиопатией, неревматическим кардитом, хрони-
ческим экссудативным перикардитом, тетрадой Фалло, транспо-
зицией магистральных сосудов.
Течение, лечение. При значительном смещении и дисплазии
створок трикуспидального клапана уже в раннем детском воз-
расте наблюдаются выраженные проявления порока, которые
могут привести к смерти больного от сердечной недостаточности.
У неоперированных больных старшего возраста обычно причиной
смерти являются медленно прогрессирующая сердечная недоста-
точность и нарушения ритма, последние приводят к внезапной
смерти. В. М. Gasul и соавт. (1966), проведя анализ 120 секцион-
ных случаев, установили, что 6,5 % больных с аномалией Эб
штейна умирают к 1 году жизни, 14% — к 5 годам, 33 % —
к 10 годам, 59 % — к 20 годам, 79 % — к 30 годам и 87 % —
к 40-летнему возрасту. Следовательно, при данном пороке сердца
относительно редко наблюдается ранняя детская смертность,
а основная масса больных умирает к 20 и особенно к 30-летнему
возрасту. Обычно, начиная с юношеского возраста, наступает
ухудшение состояния, появляются признаки сердечной недоста-
точности. В литературе представлены лишь единичные наблю-
дения доживания больных с аномалией Эбштейна до 60—80 лет,
что связано с небольшим смещением трехстворчатого клапана.
Прогностически неблагоприятными являются кардиомегалия,
сердечная недостаточность, аритмии.
Показаниями к операции являются насыщение ка-
пиллярной крови кислородом менее 80%, прогрессирующая кар-
диомегалия, нарушения ритма и сердечная недостаточность,
рефрактерные к медикаментозному лечению. Оптимальным для
операции является возраст 15 лет и старше. При показаниях
клапансохраняющие операции могут быть выполнены и в воз-
расте от 6 до 15 лет, так как риск смерти при естественном
течении порока у них превышает риск операции. Больные старше
17 лет имеют наихудший прогноз — у них независимо от выра-
женности цианоза и кардиомегалии наблюдается высокая смерт-
ность, поэтому им показана хирургическая коррекция [Махму-
дов М. М., 1985].
Выбор метода операции определяется характером патологии
трехстворчатого клапана, величиной «атрнализованной» и полез-
но функционирующей частей правого желудочка, а также воз-
растом больных. В настоящее время при аномалии Эбштейна
применяются 2 типа радикальных операций: предпочтение отда-
ется пластической реконструкции трехстворчатого клапана, а при
невозможности ее выполнения производят протезирование клапа-
на. Кроме этого, по показаниям производятся пликация «атриа-
лизованной» части правого желудочка, закрытие межпредсерд-
ного сообщения, деструкция дополнительных проводящих путей,
238
устранение сопутствующих ВПС (ДМЖП, стеноз легочной арте-
рии), резекция дилатированной стенки правого предсердия,
уменьшение аннулярного кольца трикуспидального клапана.
Методика клапансохраняющих операций разработана S. Hun-
ter, С. Lillehei (1958), К- Hardy и соавт. (1964) и в дальнейшем
усовершенствована G. Danielson и соавт. (1979). В нашей стране
первый опыт выполнения пластических операций представлен
И. К- Охотиным (1978). Первая успешная операция протезиро-
вания трехстворчатого клапана при аномалии Эбштейна выпол-
нена С. Bernard и V. Schrire (1963), в нашей стране — Г. М. Со-
ловьевым (1964).
Пластические клапансохраняющие операции обычно выполня-
ются при выраженной трикуспидальной недостаточности, когда
наблюдаются достаточные размеры полезно функционирующей
части правого желудочка. Операция заключается в создании од-
ностворчатого клапана. Запирательную функцию при этом вы-
полняет увеличенная по площади и нормально расположенная
передняя створка; одновременно производятся задняя трикуспи-
дальная аннулопластика, пликация «атриализованной» части
правого желудочка, уменьшение правого предсердия.
При сочетании аномалии Эбштейна с синдромом WPW одно-
моментно выполняются операции на трикуспидальном клапане
и деструкция дополнительных путей проведения импульса [Бре-
дикис Ю. Ю. и соавт., 1981; Бокерия Л. А., 1989]. После уста-
новления локализации дополнительных проводящих путей их уст-
раняют криодеструкцией при температуре —60 °C в течение
2 мин или электродеструкцией силой тока в 100 Дж [Боке-
рия Л. А., 1989].
Операция протезирования трехстворчатого клапана показана
при выраженных анатомических изменениях всех трех или перед-
ней створки (ее недоразвитие, фенестрация), что не позволяет
выполнить пластическую коррекцию, а также в случаях неболь-
шой функционирующей части правого желудочка; она включает
иссечение деформированного клапана, подшивание искусственно-
го протеза. В качестве искусственного протеза может быть исполь-
зован полушаровой, шариковый и дисковый протезы, в послед-
нее время предпочтение отдается ксеноперикардиальным биопро-
тезам [Бураковский В. И. и соавт., 1989].
Летальность после пластических реконструктивных операций
составляет 7,8 % [Danielson G., 1983], а после протезирования
трехстворчатого клапана колеблется от 20 до 34 % [Амосов Н. М.
и соавт., 1978, 1983; Бураковский В. И. и соавт., 1981, 1984;
Соловьев Г. М. и соавт., 1983], причем она была наибольшей
в период освоения хирургической техники; в последние годы
послеоперационная летальность значительно снижена или прак-
тически отсутствует.
Летальность при одномоментном устранении дополнительных
проводящих путей и коррекции трехстворчатого клапана при
аномалии Эбштейна колеблется в широких пределах — от 0 до
239
30 % [Бокерия Л. А., 1989; Бураковский В. И. и др., 1984;
Danielson G., 1983].
Основными причинами летальных исходов обычно являются
тяжелое состояние больного до операции, обусловленное резчай-
шей кардиомегалией, злокачественные нарушения ритма сердца,
возникающие в послеоперационном периоде, ошибки в процессе
операции.
Отдаленные результаты у 85—92 % больных расцениваются
как хорошие и удовлетворительные; летальность составляет
5,5—8,6 % и обычно обусловлена нарушениями ритма сердца,
тромбоэмболическими осложнениями при применении механиче-
ских клапанных протезов [Сидаренко Л. Н. и др., 1978; Буха-'
рин В. А. и др., 1985].
По данным ИССХ им. А. Н. Бакулева, в 91,6% случаев
состояние имплантированных ксеноклапанов в сроки до 14 лет
остается без значительных изменений, обеспечивая хорошие и
удовлетворительные результаты операций. Если сравнить выжи-
ваемость больных при естественном течении аномалии Эбштейна
и после операции (через 5 лет — 70,8 и 83,2 % соответственно,
через 10 лет — 34,3 и 77,6 % соответственно), то видно неоспори-
мое преимущество хирургической коррекции в продлении жизни
больных с аномалией Эбштейна [Махмудов М. М., 1985].
Глава 16. СИНДРОМЫ ГИПОПЛАЗИИ ЛЕВОГО
И ПРАВОГО ЖЕЛУДОЧКОВ СЕРДЦА
СИНДРОМ ГИПОПЛАЗИИ ЛЕВОГО ЖЕЛУДОЧКА
Синдром гипоплазии левого желудочка (СГЛЖ) относится
к редким ВПС и включает уменьшенную полость левого желудоч-
ка, пороки аортального и митрального клапана (стеноз, гипо-
плазия, атрезия), СГДЖ встречается с частотой от 0,5 до 7,8 %.
У новорожденных с пороками сердца эта аномалия является
одной из самых частых причин смерти — 25 %. Первое описание
порока принадлежит К. А. Раухфусу (1869). Детальное изучение
клиники и диагностики СГЛЖ в нашей стране проведено доктором
мед. наук М. П. Черновой (1983). Большинство больных с СГЛЖ
погибают вскоре после рождения в родильных домах или отделе-
ниях новорожденных и диагноз ВПС им не ставится.
Другие названия порока: врожденная атрезия аорты, един-
ственный легочный ствол, левосторонний стеноз сердца, врож-
денная митральная атрезия. S. N. Sinha и соавт. (1968) впервые
использовали наименование «синдром гипоплазии левого желу-
дочка», которое получило наибольшее распространение.
Анатомия, классификация. На основании изучения данных
вскрытия у 26 детей с СГЛЖ в возрасте от I до 45 дней мы
выделяем 2 варианта порока [Чернова М. П. и др., 1976]: I —
СГЛЖ с атрезией устья аорты в сочетании: а) с атрезией или
240
б) стенозом митрального клапана; полость левого желудочка при
атрезии обоих клапанов минимальна (щелевидная); II — СГЛЖ
со стенозом и гипоплазией устья аорты в сочетании со стенозом
митрального клапана, гипоплазия полости менее значительная,
почти всегда имеется фиброэластоз эндокарда.
Наиболее тяжелой формой СГЛЖ является атрезия аорты,
которая часто сочетается с гипоплазией или атрезией МК, по-
лость левого желудочка имеет вид слепого мешка, иногда ее
можно увидеть только при микроскопическом исследовании. Од-
нако известны случаи, при которых атрезия аорты сочетается
с нормальным левым желудочком. Обычно верхушка сердца
при СГЛЖ сформирована правым желудочком, а гипоплази-
рованный щелевидный левый желудочек располагается на верх-
незадней поверхности правого желудочка. Объем левого желу-
дочка не превышает 1 см3, толщина его миокарда при атрезии
аорты и МК (1а вариант) незначительна, эндокард тонкий;
в случаях 16 варианта порока толщина стенки левого желудочка
составляет 12—14 мм, часто имеется фиброэластоз эндокарда.
Левое предсердие гипоплазировано и сообщается с правым
через открытое овальное окно. На месте атрезированного МК
имеегся углубление в виде воронки с рудиментами клапана;
в случаях 16 варианта створки МК недоразвиты, утолщены,
сухожильные нити укорочены, часто аномально прикреплены.
К СГЛЖ следует относить не все варианты атрезии МК, а только
те, которые сочетаются со стенозом или атрезией устья аорты
и гипоплазией восходящей аорты. При I варианте СГЛЖ пери-
метр восходящей аорты значительно сужен, выглядит как тон-
кий фиброзный тяж, клапаны аорты полностью отсутствуют.
Самой распространенной формой СГЛЖ является сочетание
стенозов аорты и МК (П вариант). Гипоплазия левого желудоч-
ка выражена в меньшей степени (объем его 0,5—4,5 см3), но
все равно он в 3-+4 раза меньше правого желудочка. Миокард
левого желудочка гипертрофирован до 6—15 мм, у многих
больных имеется фиброэластоз эндокарда. В этой группе МК
умеренно гипоплазирован, створки утолщены, ригидны, иногда
может быть одна створка. Восходящая аорта гипоплазирована
меньше, чем при I варианте, аортальный клапан обычно
имеет две утолщенные створки, реже стеноз представлен мем-
браной.
При обоих вариантах СГЛЖ всегда имеются широкий откры-
тый артериальный проток (ОАП), открытое овальное окно, рас-
ширенные правые отделы и легочная артерия, гипертрофия
миокарда правого желудочка. Иногда СГЛЖ сочетается с тран-
спозицией магистральных сосудов, стенозом или атрезией легоч-
ной артерии, ДМЖП, при этом отсутствует гипоплазия аорты,
возможны экстракардиальные пороки развития со стороны
мочеполовой, костномышечной и нервной систем.
Гемодинамика. В основе гемодинамических изменений при
СГЛЖ (рис. 71) лежат следующие факторы: легочная гипер-
241
Рис. 71. Синдром гипоплазии
левого желудочка (I вари
ант, митрально-аортальная
атрезии). Схема гемодинами-
ки. Объяснение в тексте.
тензия из-за неадекватных размеров левого желудочка (1), обес-
печение правым желудочком кровообращения по большому
и малому кругу. Как видно из схемы, артериальная кровь из
левого предсердия (4) из-за препятствия на уровне митрального
клапана через открытое овальное окно поступает в правое пред-
сердие, правый желудочек (6), затем в легочную артерию (5)
и через открытый артериальный проток (3) в нисходящую аорту;
небольшое количество крови ретроградно поступает в гипоплази-
рованную восходящую аорту (2) и коронарные сосуды. По суще-
ству восходящая аорта при атрезии аортального отверстия функ-
ционирует как «общая коронарная артерия». Таким образом,
в большом круге кровообращения при СГЛЖ циркулирует
смешанная кровь, что приводит чаще к умеренной артериальной
гипоксемии. Другими особенностями гемодинамики являются
сниженный кровоток по большому кругу кровообращения (про-
является множеством ишемических некрозов во внутренних орга-
нах, головном мозгу) и коронарным артериям, легочная ве-
нозная и артериальная гипертензия, гипертрофия миокарда пра-
вого желудочка с расширением его полости и ранней деком-
пенсацией.
Клиника, диагностика. Порок чаще встречается у мальчиков,
клинические его проявления во многом сходны при двух вариан-
тах СГЛЖ. Первые признаки патологии, возникающие внезапно
вскоре после рождения, напоминают респираторный дистресс-
242
синдром, поражение ЦНС или шок. Бледно-серый цвет кожных
покровов, адинамия, выраженная одышка до 80 100 дыхатель-
ных движений в минуту (тахипноэ) с втяжением уступчивых
мест грудной клетки, влажные хрипы в легких (как проявление
лсвожелудочковой недостаточности) имеются у всех детей.
С рождения цианоз выражен умеренно, резкий цианоз не харак-
терен для СГЛЖ; возможен дифференцированный цианоз —
его нет на руках, но есть на ногах из-за праволевого сброса
через ОАП в нисходящую аорту. У больных с транспозицией
магистральных сосудов, стенозом легочной артерии цианоз
с рождения бывает значительным, возможны одышечно-цианоти-
ческие приступы, одышка в покое менее значительная, чем у
больных с I и II вариантами СГЛЖ.
Важным клинико-диагностическим критерием при СГЛЖ яв-
ляется слабый, едва ощутимый пульс на ногах и руках в сочета-
нии с усиленным сердечным толчком и видимой эпигастральной
пульсацией. Систолическое АД не превышает 60—80 мм рт. ст.,
в результате чего пульсовое АД составляет 20—25 мм рт. ст.
Характерным проявлением СГЛЖ является наличие более слабо-
го пульса на руках, чем на ногах, что обусловлено резкой гипо-
плазией дуги аорты. Более слабый пульс на ногах, чем на ру-
ках, — признак сопутствующей коарктации аорты.
Дрожания над областью сердца нет. Границы сердечной ту-
пости резко раширены, особенно влево. При аускультации опре-
деляется тахикардия до 160 200 уд/мин, тоны сердца приглу-
шены (особенно при сочетании с фиброэластозом), систоличе-
ский шум негрубый, непродолжительный или отсутствует. Не-
смотря на стеноз МК, пресистолический шум и хлопающий I тон
на верхушке не определяются, что связано с малыми размерами
левого желудочка. II тон над легочной артерией акцентирован.
Ведущим симптомом СГЛЖ является прогрессирующая сердеч-
ная недостаточность, печень, как правило, очень большая,
у 1/з детей в терминальной стадии развивается отечный синдром.
Время появления сердечной недостаточности при СГЛЖ опреде-
ляется величиной полости левого желудочка, поэтому декомпен-
сация в первые дни жизни характерна для больных с атрезией
аорты (1а вариант). В то же время у больных с сопутствующими
ВПС (стенозом легочной артерии, транспозицией магистральных
сосудов) сердечная недостаточность развивается позже и бывает
менее тяжелой.
У всех больных, переживших первый месяц жизни, развива-
ются гипотрофия II—III степени, сердечный горб.
На ЭКГ у большинства больных отмечаются низкий вольтаж
комплексов QRS, отклонение электрической оси сердца вправо
(Z.a AQRS от +107 до +131°), у больных со II вариантом
возможно нормальное положение оси (признак умеренной гипо-
плазии левого желудочка). Обращают на себя внимание при-
знаки гипертрофии обоих предсердий, больше правого (высокий,
заостренный Рп) и резкой гипертрофии правого желудочка, при
243
этом амплитуда зубца Rvt невысокая, зубцы Svi отсутствуют, но
имеются глубокие зубцы Sv66 при сниженной или нормальной
величине зубцов RvS6. Гипертрофия миокарда левого желудочка
встречается в единичных случаях (QRS типа R в отведениях
V5.6 и только у больных со II вариантом (со стенозом аорты
и фиброэластозом эндомиокарда) или при сопутствующих ВПС.
У всех обследованных больных на ЭКГ отсутствуют зубцы Q
в левых грудных отведениях.
При рентгенографии органов грудной клетки отмечается уси-
ление легочного рисунка за счет переполнения венозного, в мень-
шей степени — артериального русла. Венозный застой (вплоть
до картины отека легкого) более выражен в случаях атрезии
аорты и митрального клапана и небольшого овального окна.
Кардиомегалия возникает с 4—6-го дня жизни (кардиоторакаль-
ный индекс более 60—65 %), она характерна для всех вариантов
СГЛЖ, особенно для больных со II вариантом, и связана с дила-
тацией правых отделов. Конфигурация тени сердца приближа-
ется к шаровидной. При сопутствующем стенозе легочной арте-
рии сердце увеличено менее значительно. Для СГЛЖ характер-
ным является отсутствие тени восходящей аорты по правому
контуру сердца из-за резкой ее гипоплазии, видна необычная
угловатость контура в месте соединения верхней полой вены
с правым предсердием, в связи с чем правый контур сердца
приобретает форму перевернутой цифры «5»; этот признак «ост-
рого угла» не встречается при других ВПС.
При одномерной эхокардиографии определяются выраженная
дилатация правого желудочка, симптомы легочной гипертензии,
маленькая (щелевидная) полость левого желудочка, асимметрич-
ная гипертрофия межжелудочковой перегородки, отсутствие или
маленький митральный клапан с аномальной формой движения,
гипоплазия восходящей аорты, скорость закрытия передней
створки трикуспидального клапана увеличена. Двухмерная эхо-
кардиография в проекции длинной оси из парастернального
доступа выявляет атрезию или гипоплазию устья аорты. В корот-
ких сечениях левого желудочка определяют отсутствие эхосиг-
налов от МК (его атрезия) (рис. 72) либо имеются признаки
гипоплазии МК со стенозом. В проекции 4 камер с верхушки
видны гипоплазированные ЛП и ЛЖ, резко расширенные ПП
и ПЖ. Сообщение между ЛП и ЛЖ отсутствует (указано стрел-
кой на рис. 72).
Важную диагностическую информацию имеют зондирование
полостей сердца и ангиокардиография, хотя они и не всегда
безопасны для детей с СГЛЖ, находящихся обычно в очень тя-
желом состоянии. Характерным признаком СГЛЖ является пре-
обладание давления в легочной артерии над давлением в арте-
риях большого круга. При небольшом межпредсердном сообще-
нии определяется градиент давления между правым и левым
предсердием; в таких случаях показана закрытая атриосепто-
стомия по Рашкинду. Насыщение артериальной крови кислоро-
244
Рис. 72. Синдром гипоплазии левого желудочка. Эхокардиограмма.
дом колеблется от 45 до 90%. причем гипоксемия более выра-
жена при сопутствующем стенозе легочной артерии [Черно-
ва М. П., 1983]. Наиболее ценными являются ретроградная
аортография (баллонная окклюзионная аортография), дающая
представление о состоянии аорты, видна гипоплазированная
восходящая аорта, ее дуга, брахеоцефальные сосуды, а также
ангиография из левого предсердия, при которой обнаруживаются
уменьшенные размеры последнего, большой сброс крови в правое
предсердие. При отсутствии атрезии МК можно выявить гипо-
плазированный левый желудочек. Однако чаще удается выпол-
нить правостороннюю ветрикулографию, при которой кровь из
правого желудочка поступает в широкую легочную артерию и
через ОАП в нисходящую аорту; иногда виден заброс контр-
астированной крови в гипоплазированную восходящую аорту.
Дифференциальный диагноз СГЛЖ необходимо проводить с
респираторным дистресс-синдромом, пневмонией, врожденным
кардитом, ОАП, сепсисом, родовой травмой с дыхательными
нарушениями, рабдомиомой.
Течение, лечение. Прогноз при СГЛЖ очень плохой, без
хирургической коррекции продолжительность жизни больных
составляет от 2,8 дня до 3 мес, около 80 % больных с СГЛЖ
умирают на первой неделе жизни, остальные в течение 1—2 мес,
лишь в единичных случаях больные живут несколько месяцев.
Наименьшая продолжительность жизни характерна для больных с
атрезией аорты—11 дней, для больных со II вариантом
СГЛЖ — от 2 дней до 11 мес [Чернова М. П., 1983]. Причины
смерти больных с СГЛЖ—прогрессирующая сердечная недо-
статочность, пневмония, гипоксия.
Хирургическое лечение СГЛЖ включает различные палли-
ативные операции, направленные на: 1) увеличение межпред-
сердного сообщения для декомпрессии левого предсердия мето-
дом закрытой атриосептостомии по Рашкинду или хирургической
атриосептоэктомии по Блелоку — Ханлону; 2) создание постоян-
ного сообщения между легочной артерией и правым желудочком
245
и аортой (из-за возможности спонтанного закрытия ОАП) путем
наложения межартериального анастомоза по Блелоку или с по-
мощью протеза между легочным стволом и правым желудочком и
нисходящей аортой; 3) предупреждение развития высокой легоч-
ной гипертензии методом сужения правой и левой легочных
артерий дистальнее ОАП; 4) пластику гипоплазированной аорты
для улучшения коронарного кровотока.
Анатомическая коррекция порока не разработана W. J. Nor-
wood и соавт. (1980—1983) предложили двухэтапное лечение
данной патологии. На первом этапе суживают или перевязы-
вают ОАП, суживают легочную артерию и с помощью клапан-
содержащего протеза соединяют правый желудочек с нисходя-
щей аортой. Во время второго этапа полностью перевязывают
(ранее суженный) проксимальный отдел Легочного ствола, иссе-
кают межпредсердную перегородку и с помощью заплаты созда-
ют новую межпредсердную перегородку и помещают ее таким
образом, что трикуспидальный клапан оказывается перемещен-
ным в левое предсердие. Далее вторым клапансодержащим
протезом соединяют правое предсердие с дистальным отделом
легочного ствола. Таким образом, для завершающего этапа авто-
ры использовали принцип операции Фонтена.
Летальность после паллиативных операций крайне высокая
(60—75 %) [Lang Р., Norwood W., 1983; Kirklin J., Barratt-
Boyes В., 1986].
Завершающий второй этап лечения выполнен только у 4 боль-
ных с 2 летальными исходами [Lang Р„ Norwood W., 1983].
Больные, перенесшие операцию в течение 1 года, чувствуют себя
хорошо. Таким образом, СГЛЖ следует считать одним из самых
сложных ВПС, хирургическое лечение которого ограничено еди-
ничными наблюдениями, сопровождается высокой летальностью.
Альтернативой двухэтапному лечению со временем может стать
пересадка сердца.
СИНДРОМ ГИПОПЛАЗИИ ПРАВОГО ЖЕЛУДОЧКА
Синдром гопоплазии правого желудочка (СГПЖ) включает
группу тесно связанных между собой аномалий сердца, основ-
ными характеристиками которых являются недоразвитие право-
го желудочка, атрезия или стеноз устья легочной артерии и/или
атрезия трикуспидального клапана. Первое описание принадле-
жит D. М. Finlay (1879), затем Н. В. Taussig (1936) и соавт.
В отечественной литературе наиболее полное описание и введение
наименования «синдром гипоплазии правого желудочка» принад-
лежит В. А. Бухарину и соавт. (1974, 1977).
Синонимы: гипопластическое правое сердце, недоразвитие
правого желудочка, врожденный стеноз легочного и трехствор-
чатого клапана, комплекс трикуспидального стеноза или атрезия,
комплекс гипоплазии правого сердца.
Размеры полости правого желудочка при СГПЖ варьируют
246
от резкой гипоплазии до почти нормального объема. В. А. Буха-
рин и соавт. (1977) предлагают считать правый желудочек
гипоплазированным, если отношение длин приточного и вывод-
ного отделов правого желудочка не превышает 0,8, причем оно
уменьшается за счет укорочения путей притока. Одним из морфо-
логических проявлений СГПЖ является гипоплазия трехствор-
чатого клапана, при этом отношение периметра правого атрио-
вентрикулярного отверстия к левому — менее 0,76.
В. А. Бухарин и соавт. (1978) выделяют 4 формы СГПЖ в
зависимости от степени гипоплазии правого желудочка и состоя-
ния трикуспидального клапана. I. Умеренная гипоплазия правого
желудочка и атриовентрикулярного отверстия: 1) изолирован-
ная, 2) в комбинации с сопутствующими ВПС. II. Резкая гипо-
плазия правого желудочка и атриовентрикулярного отверстия:
1) изолированная, 2) в комбинации с сопутствующими ВПС.
III. Атрезия трехстворчатого клапана: 1) со стенозом легочной
артерии, 2) без стеноза легочной артерии; а) с увеличенным
легочным кровотоком, б) с уменьшенным легочным кровотоком.
IV. «Верхом сидящий» трехстворчатый клапан.
В настоящее время с клинической точки зрения целесообразно
выделить следующие варианты СГПЖ: изолированная гипопла-
зия правого желудочка, стеноз легочной артерии с интактной
межжелудочковой перегородкой (ИМЖП), атрезию легочной ар-
терии с ИМЖП, атрезию трехстворчатого клапана, «верхом
сидящий» трехстворчатый клапан.
Изолированная гипоплазия правого желудочка. Это редкий
ВПС, впервые описан D. Cooley и соавт. (1950). На аутопсии
левый желудочек увеличен относительно маленького правого
желудочка, в последнем имеется недоразвитие синусной части
желудочка. Степень гипоплазии правого желудочка значительна
у больных, имевших клинические проявления порока в раннем
возрасте, и менее выражена у детей старшего возраста и взрос-
лых. Створки легочной артерии и трикуспидального клапана
нормальные, отверстие последнего уменьшено. Эндокард правого
желудочка утолщен за счет фиброэластоза. Правое предсердие
дилатировано, миокард его гипертрофирован, имеется межпред-
сердное сообщение. Уменьшенные правый желудочек и правое
атриовентрикулярное отверстие ведут к ограничению кровенапол-
нения желудочка и сниженному легочному кровотоку. Право-
левый сброс на уровне предсердий объясняет артериальную
гипоксемию и цианоз.
Цианоз появляется с рождения или спустя несколько лет, вы-
ражен он слабо (при небольших размерах межпредсердного со-
общения и объемах праволевого сброса) или умеренно; харак-
терны одышка в покое и при физической нагрузке, боли в сердце,
гипоксические приступы; с возрастом развивается симптом «ча-
совых стекол» и «барабанных палочек». Область сердца не
изменена, дрожание не определяется. Шум над областью сердца
отсутствует или выслушивается небольшой интенсивности систо-
247
лический шум во втором и третьем межреберьях слева у грудины,
возможен диастолический шум на верхушке. С рождения или в
дальнейшем появляются признаки правожелудочковой сердечной
недостаточности.
На ЭКГ электрическая ось сердца отклонена влево, возможно
нормальное или горизонтальное ее положение, имеются признаки
увеличения правого предсердия (или обоих при большом меж-
предсердном сообщении), левого желудочка (глубокие зубцы
Svi2, причем Sv2 больше SvH уменьшение зубцов Rv,), возможно
удлинение интервала PR, наличие зубцов q в отведениях aVF и
III [Бухарин В. А. и др., 1981]. На рентгенограмме органов груд-
ной клетки легочный рисунок обеднен, реже — нормальный или
представлен коллатералями. Дуга легочной артерии выражена
обычно или западает. Тень сердца нормальных размеров или
умеренно увеличена (кардиоторакальный индекс составляет
46—57 %) за счет правого предсердия, левого желудочка,
реже — левого предсердия (при большом межпредсердном со-
общении). Во II косой проекции возможен симптом «скошенно-
сти» правого желудочка. На эхокардиограмме определяется сни-
жение амплитуды открытия и скорости раннего диастолического
прикрытия передней створки трикуспидального клапана — при-
знаки стеноза или гипоплазии кольца трехстворчатого клапана,
размеры правого желудочка уменьшены.
При катетеризации полостей сердца выявляется повышение
давления в правом предсердии с высокой волной «а», возможен
градиент давления между правым и левым предсердием, систо-
лическое давление в правом желудочке и легочной артерии нор-
мальное. При выведении катетера из правого желудочка в правое
предсердие нередко определяется градиент диастолического дав-
ления. Насыщение крови кислородом подтверждает праволевый
сброс на уровне предсердий, выраженную в различной степени
артериальную гипоксемию (насыщение крови кислородом в аорте
66-88%).
При подозрении на изолированную гипоплазию правого
желудочка показано селективное введение в него контрастного
вещества, при этом видны уменьшение путей притока правого
желудочка и гипоплазированная его полость, смещение вывод-
ного отдела правого желудочка и ствола легочной артерии
вправо, так что они занимают срединное положение. При правой
атриографии полость предсердия увеличена, виден сбоос из
правого в левое предсердие. В отличие от атрезии легочной
артерии контрастное вещество раньше появляется в легочной
артерии, чем в аорте [Бухарин В. А. и др., 1981; Махачев О. М.,
1983].
Большинство больных (62,5%) с изолированной гипоплазией
правого желудочка умирают от сердечной недостаточности,
причем половина из них в возрасте до 1 года. Описаны случаи,
когда больные с этим пороком доживали до 9—46 лет.
Хирургическая тактика в основном определяется размерами
248
Рис. 73. Атрезия легочной
артерии с интактной меж-
желудочковой перегород-
кой (схема).
правого желудочка. В. А. Бухарин и соавт. (1981) при резкой
гипоплазии рекомендуют выполнение системно-легочного анасто-
моза. При умеренной форме гипоплазии должен ставиться
вопрос о закрытии ДМГШ. Операция дает высокую вы-
живаемость и хорошие отдаленные результаты. У больных с рез-
кой гипоплазией правого желудочка и положительным эффектом
от системно-легочного анастомоза может ставиться вопрос о
последующей гемодинамической коррекции порока по методу
Фонтена.
Атрезия легочной артерии с интактной межжелудочковой пе-
регородкой. Этот порок характеризуется отсутствием сообщения
м^жду стволом ЛА и правым желудочком. Частота составляет
0,4—1 % всех ВПС [Алекси-Месхишвили В. В., Беришвили И. И.,
1986] и 8,4 % среди ВПС у новорожденных [Чернова М. П.,
1983].
Анатомическими признаками порока являются полная об-
струкция выхода из правого желудочка вследствие атрезии кла-
панов легочной артерии и интактная межжелудочковая перего-
родка (ИМЖП); выживание больных возможно только при нали-
чии сопутствующих сообщений — открытого овального окна,
ДМПП, ОАП (рис. 73). Полость правого желудочка может быть:
а) резко гипоплазирована до объема 1—2 мл (80—85%) или
б) иметь нормальную конфигурацию и объем (15—20%). При
гипоплазии правого желудочка сердце имеет шаровидную форму,
верхушка его образована левым желудочком. Сосуды отходят
нормально, впереди расположен более узкий легочный ствол,
сзади и справа — расширенная аорта. Инфундибулярный отдел
249
правого желудочка в большинстве случаев сужен и имеет вид
конуса, резко суживающегося к устью легочного ствола, где он
слепо заканчивается. Нередко эндокард в полости правого желу-
дочка утолщен за счет фиброэластоза, миокард в случаях резкой
гипоплазии полости значительно гипертрофирован. Ствол легоч-
ной артерии чаще гипоплазирован. Легочный клапан обычно
имеет вид диафрагмы, состоящей из слившихся створок с тремя
небольшими углублениями. Легочное кольцо гипоплазировано.
Легочная артерия делится на нормальные по размеру левую и
правую ветви. Трикуспидальный клапан обычно гипопластичный
и вызывает стеноз.
Если при атрезии легочной артерии с ИМЖП полость пра-
вого желудочка нормальных рэвмеров, то гипертрофия его мио-
карда нерезкая, конусная часть сужена, синусная — хорошо
сформирована. Правое предсердие увеличено, особенно при соче-
тании с недостаточностью трехстворчатого клапана. В межпред-
сердной перегородке имеется различных размеров открытое
овальное окно, реже ДМПП. Левый желудочек и аорта несколь-
ко дилатированы. ОАП открыт у плода и может закрываться на
первом месяце жизни ребенка.
В основе гемодинамических нарушений при атрезии легочной
артерии с ИМЖП лежит отсутствие сообщения между правым
желудочком и легочной артерией, в силу чего кровь из правого
желудочка поступает обратно в правое предсердие через, как
правило, некомпетентный трикуспидальный клапан и далее через
межпредсердное сообщение — в левое предсердие. При гипопла-
зии правого желудочка во время систолы кровь частично посту-
пает через миокардиальные синусоиды в систему коронарного
кровотока. В легкие кровь поступает через ОАП, размеры кото-
рого определяют величину легочного кровотока; закрытие ОАП
сопровождается резким ухудшением состояния больного и не-
редко является причиной его смерти. Нагнетательная функция
в оба круга кровообращения выполняется одним левым желудоч-
ком, аорта расширена. После рождения ребенка с возрастанием
легочного кровотока давление в левом предсердии увеличивается,
что затрудняет опорожнение правого предсердия, все это приво-
дит к правожелудочковой сердечной недостаточности.
По клиническим проявлениям нельзя определить анатомиче-
ский вариант порока. Основными симптомами атрезии легочной
артерии с ИМЖП являются нарастающий с рождения цианоз,
выраженная правожелудочковая сердечная недостаточность,
рефрактерная к медикаментозной 'Терапии, ранняя смерть.
Интенсивность цианоза обратно пропорциональна размерам
ОАП, при его закрытии цианоз значительно увеличивается; если
же ОАП открыт и имеет большие размеры, то цианоз умеренный.
К 6—12 мес развивается симптом «часовых стекол» и «барабан-
ных» палочек. Одышка отражает неадекватность легочного
кровотока и выражена меньше, чем при синдроме гипоплазии
левого желудочка. У некоторых больных возможны гипоксиче-
250
ские приступы (признак закрывающегося или закрывшегося
ОАП) в виде внезапного беспокойства, нарастания цианоза,
вялости, иногда потери сознания, они возникают при резкой арте-
риальной гипоксемии с насыщением крови кислородом 12—
25%; после появления приступов продолжительность жизни
не превышает 2—4 нед. Правожелудочковая сердечная недоста-
точность проявляется умеренной одышкой, гепатомегалией,
отечным синдромом.
Кардиомегалия имеется с рождения и особенно выражена при
недостаточности трехстворчатого клапана. Дрожание над обла-
стью сердца при пальпации отсутствует. II тон над легочной
артерией усилен (аортальный компонент), никогда не расщеплен
(подтверждается на ФКГ). При аускультации в 20 % случаев
шум отсутствует или можно выявить три его разновидности:
1) шум выброса выслушивается во втором и третьем межре-
берьях слева, он негрубый, непродолжительный, связан с увели-
ченным кровотоком через аортальный клапан; 2) негрубый
систолический шум внизу у грудины слева, отражает недостаточ-
ность трикуспидального клапана, встречается обычно при нор-
мальных размерах правого желудочка; 3) систолодиастоличе-
ский шум ОАП свидетельствует о достаточных его размерах
(диаметр более 5 мм).
На ЭКГ в случаях резкой гипоплазии полости правого
желудочка преобладает нормальное положение электрической
оси сердца или она отклонена влево; всегда имеются признаки
увеличения правого предсердия (высокий Рц.у,), гипертрофии
левого или обоих желудочков. При нормальных размерах пра-
вого желудочка фиксируются отклонение электрической оси
сердца вправо, признаки гипертрофии миокарда правого желудо-
чка (изолированно или в сочетании с гипертрофией левого же-
лудочка); при этом варианте порока чем меньше возраст ребенка,
тем больше выражены проявления гипертрофии левого желу-
дочка.
На рентгенограмме органов грудной клетки имеется обеднен-
ный легочный рисунок или он усилен за счет ОАП или коллате-
рального кровотока. Общие размеры тени сердца в большинстве
случаев увеличены значительно, особенно у больных с нормаль-
ными размерами правого желудочка. Конфигурация тени сердца
приближается к овоидной или колбообразной за счет значитель-
ного увеличения правого предсердия, левого желудочка и уме-
ренной гипоплазии правого желудочка. Диагностическое значе-
ние имеет «скошенность» переднего контура сердца во II косом
положении. При нормальной полости правого желудочка запа-
дение дуги ЛА отсутствует, нет признака «скошенности» пра-
вого желудочка [Голонзко Р. Р., Беришвили И. И., 1985].
На эхокардиограммах продольного сечения выявляются
уменьшение полости правого желудочка с гипертрофией его мио-
карда, увеличение правого предсердия и левого желудочка,
гипертрофия межжелудочковой перегородки, открытое овальное
251
Рис. 74. Атрезия легочной артерии с интактной межжелудочковой перегородкой.
Эхокардиограмма
а — проекция 4-х камер с верхушки; б — проекция длинной оси из низкого парастре
нального доступа; ВТПЖ выводной тракт правого желудочка.
окно. Размеры трикуспидального клапана в двухмерном режиме
уменьшены, но подвижность его створок сохранена; из пара-
стернального или супрастернального подхода можно увидеть
легочную артерию без клапанов (рис. 74).
Катетеризация полостей сердца выявляет повышение давле-
ния в правом предсердии.с увеличением волны «а», особенно у
больных с гипоплазией правого желудочка. Градиент давления
между правым и левым предсердием свидетельствует о неболь-
ших размерах межпредсердного сообщения; в таких случаях
показана закрытая атриосептостомия (процедура Рашкинда).
Давление в гипоплазированном правом желудочке увеличено
до 100—150 мм рт. ст. Насыщение крови кислородом указывает
на праволевый сброс на уровне предсердий, в аорте оно снижено
(30—80%) в зависимости от величины легочного кровотока.
При правой вентрикулографии контрастируется полость пра-
вого желудочка и его окклюзированная часть (указано стрелкой
252
Рис. 75. Атрезия легочной артерии с интактной межжелудочковой перегородкой.
Ангиокардиограммы.
а — прямая проекция; б — боковая проекция
на рис. 75), видно, как через синусоиды наполняются кровью
коронарные артерии. Из правого желудочка контрастное веще-
ство забрасывается в увеличенную полость правого предсердия,
затем через овальное окно в левое предсердие, далее в левый
желудочек, аорту и только после этого через ОАП контрастиру-
ется ствол и ветви легочной артерии (рис. 75). Вторым исследо-
ванием должна быть аортография, позволяющая определить
ОАП и проксимальные отделы легочного артериального дерева.
Течение. Прогноз при естественном течении атрезии легочной
артерии с ИМЖП плохой: 50 % новорожденных умирают к концу
первого месяца жизни, 77 % — к концу 1-го года; средняя про-
253
должительность жизни около 3,5 мес [Чернова М. П., 1983;
Алекси-Месхишвили В. В., Беришвили Й. И.. 1986[. Как пра-
вило, остаются живыми больные, имеющие адекватное межпред-
сердное сообщение или ОАП. Продолжительность жизни больше
у больных с нормальным правым желудочком. По наблюдениям
М. П. Черновой (1983), она определяется также размерами
ОАП: у большинства больных, умерших в возрасте до 1 мес,
диаметр ОАП был не более 2 мм, у всех проживших более 6 нед
ширина ОАП была более 4 мм. Причины смерти кооперирован-
ных больных — артериальная гипоксемия и рефрактерная сер-
дечная недостаточность.
Показаниями к экстренному хирургиче-
скому вмешательству являются выраженный цианоз,
рецидивирующие гипоксические приступы (при закрывающемся
ОАП), прогрессирующая сердечная недостаточность с некорри-
гируемым ацидозом). Всем больным сразу после рождения пока-
зано медикаментозное лечение, включающее введение проста-
гландина Е2, в целях предупреждения закрытия ОАП (см. гла-
ву 22).
В раннем детском возрасте производят паллиативную опера-
цию. Если правый желудочек состоит, как и в норме, из трех
отделов (приточный, трабекулярный, выводной), выполняют ле-
гочную вальвулотомию, направленную на восстановление путей
оттока из правого желудочка в легочную артерию. Если правый
желудочек состоит из двух отделов (приточный, выводной),
легочную вальвулотомию предваряют наложением системно-
легочного анастомоза типа Блелока — Тауссиг. В последующем
в зависимости от состояния правого желудочка и легочных
артерий может быть необходима повторная паллиативная опера-
ция по реконструкции путей оттока из правого желудочка.
J. К. Hamilton и соавт. (1987) рекомендуют в некоторых слу-
чаях выполнять баллонное расширение легочной артерии. При
достаточных размерах правого желудочка и легочных артерий
показано закрытие ДМПП. Если в правом желудочке функцио-
нально полноценен лишь приточный отдел, выполняется один из
типов системно-легочного анастомоза. В последующем радикаль-
ная операция у этих больных невозможна. При достаточном раз-
витии легочных артерий возможно выполнение гемодинамической
коррекции по методу Фонтена. Последняя заключается в закры-
тии заплатой трикуспидального клапана, межпредсердного
сообщения и выполнении предсердно-легочного соустья.
Хирургическое лечение легочной атрезии без ДМЖП сопро-
вождается высокой летальностью, которая после паллиативных
операций колеблется от 9 до 55 %, после радикальной коррекции
от 25 до 34,4 % и после гемодинамической коррекции по методу
Фонтена от 20 до 40 % [de Leval М. et al., 1982, 1985; Kirklin J.,
Barratt-Boyes B., 1986; Alboliras E. et al., 1987].
Отдаленные результаты полностью не изучены.
Атрезия трехстворчатого клапана (см. главу 17).
254
«Верхом сидящий» трехстворчатый клапан — это редкий
ВПС, впервые описан J. Harris и S. Faber (1939). Обязатель-
ным компонентом порока является ДМЖП и смещение правого
фиброзного кольца и/или подклапанного аппарата в полость
левого желудочка.
S. Bharati и соавт. (1979) различают следующие анатомиче-
ские формы порока: 1) полная форма — фиброзное кольцо и
поддерживающий аппарат клапана «сидят верхом» на ДМЖП и
сообщаются с обоими желудочками; 2) аннулярная форма —
кольцо трехстворчатого клапана находится в обоих желудочках;
3) периферическая форма — периферический (хордально-папил-
лярный) отдел клапана находится в обоих желудочках. В. А. Бу-
харин и соавт. (1977) выделяют две разновидности перифериче-
ской формы порока: частичная форма — часть хорд или все
хорды только от перегородочной створки прикрепляются в поло-
сти левого желудочка; полная форма — все створки трикуспи-
дального клапана прикрепляются в полости левого желудочка.
Полость правого желудочка уменьшена за счет синусной части,
что дало основание В. А. Бухарину и соавт. (1977) отнести
«верхом сидящий» трехстворчатый клапан к СГПЖ- Магистраль-
ные сосуды редко отходят нормально, чаще имеется их транспо-
зиция.
Особенности гемодинамики заключаются в том, что венозная
кровь из правого предсердия через «верхом сидящий» клапан и
ДМЖП поступает одновременно в оба желудочка, чем и объ-
ясняется артериальная гипоксемия. На уровне желудочков суще-
ствует перекрестный сброс крови, часть крови из левого желудоч-
ка через ДМЖП поступает в правый желудочек и легочную
артерию, что приводит к легочной гипертензии.
У больных с нормальным положением магистральных сосу-
дов с первых дней или месяцев жизни имеются цианоз, одышка,
утомляемость при физической нагрузке. Цианоз отмечается у
всех больных со стенозом легочной артерии, так как в левый
желудочек поступает меньшее количество артериализованной
крови; в этих случаях возможны одышечно-цианотические при-
ступы такого же патогенеза, как и при тетраде Фалло (см.
главу 10).
Для порока характерны также отставание в физическом
развитии, сердечная недостаточность. Последняя связана с
гипоплазией правого желудочка и/или легочной гиперволемией
из-за большого левоправого сброса на уровне желудочков, раз-
витию декомпенсации способствует собственно недостаточность
«верхом сидящего» трикуспидального клапана. Легочная гипер-
тензия особенно выражена и встречается с большой частотой у
больных с инверсией желудочков и атриовентрикулярных клапа-
нов без стеноза легочной артерии. Артериальная гипоксемия у
больных с легочной гипертензией не отражает склеротические
изменения в легочных сосудах, а связана с поступлением веноз-
ной крови из правого предсердия в левый желудочек.
255
Границы сердца умеренно расширены в обе стороны, при со-
четании со стенозом легочной артерии они почти нормальные.
Тоны сердца по звучности не изменены, II тон над легочной арте-
рией усилен и расщеплен при легочной гипертензии и ослаблен
при сопутствующем стенозе легочной артерии. При аускультации
в третьем и четвертом межреберьях слева у грудины выслушива-
ется пансистолический шум ДМЖП или систолический шум сте-
ноза легочной артерии.
На ЭКГ в большинстве случаев имеются отклонения электри-
ческой оси сердца влево, реже — вправо (при стенозе легочной ар-
терии и инверсии желудочков), гипертрофия правого предсердия
(особенно значительная при небольшом межпредсердном сооб-
щении, выраженной гипоплазии правого желудочка и недоста-
точности трикуспидального клапана), левого (при выраженной
гипоплазии правого желудочка) или обоих желудочков. От
атрезии трехстворчатого клапана данный порок отличает непо-
стоянство левограммы и иногда имеющаяся гипертрофия пра-
вого желудочка. При сочетании с корригированной транспози-
цией магистральных сосудов на ЭКГ могут быть зубцы Q в пра-
вых грудных отведениях при их отсутствии с левых (см. гла-
ву 13).
На рентгенограмме легочный рисунок усилен по артериаль-
ному руслу или обеднен (при стенозе легочной артерии). Увели-
чение размеров сердца за счет правого предсердия в сочетании с
симптомом «скошенности» переднего контура сердца во II косой
проекции позволяет заподозрить СГПЖ- Для «верхом сидящего»
трикуспидального клапана характерно увеличение левого желу-
дочка за счет его объемной перегрузки.
На эхокардиограмме в одномерном режиме видно, что три-
куспидальный клапан в закрытом положении находится кзади от
межжелудочковой перегородки. При открытии трикуспидального
клапана во время диастолы передняя створка пересекает меж-
желудочковую перегородку и как бы «сидит на ней верхом»,
иногда эта створка полностью обнаруживается в полости левого
желудочка. При двухмерной эхокардиографии определяется
гипоплазированная полость правого желудочка, из верхушечной
проекции видна степень смещения правого атриовентрикуляр-
ного кольца относительно межжелудочковой перегородки.
При катетеризации сердца подозрение на «верхом сидящий»
трехстворчатый клапан возникает при проведении катетера из
правого предсердия, минуя левое, в левый Желудочек; в таких
случаях проводится дифференциальный диагноз с открытым об-
щим атриовентрикулярным каналом. Во всех случаях имеется
различно выраженная артериальная гипоксемия. При селектив-
ной правой атриографии можно увидеть разделенные потоки
контрастного вещества, направляющиеся из правого предсердия
в оба желудочка без предварительного контрастирования левого
предсердия. При левой вентрикулографии в косых проекциях на
фоне контрастированных желудочков можно увидеть неконтрас-
256
тированное трикуспидальное отверстие и оценить его отношение
к межжелудочковой перегородке.
В раннем детском возрасте могут быть показания к сужению
легочной артерии, а у больных с сопутствующим легочным сте-
нозом — к выполнению системно-легочных анастомозов. В стар-
шем возрасте хирургическая тактика определяется как степенью
гипоплазии правого желудочка, так и формой «верхом сидя-
щего» трехстворчатого клапана. У больных с легочной гипер-
тензией следует оценить состояние артериального русла легких.
У больных с прикреплением структур трехстворчатого кла-
пана к краям ДМЖП для его закрытия используется обычная
хирургическая техника. При прикреплении структур трехствор-
чатого клапана к перегородке Со стороны левого желудочка
требуется смещение заплаты в его полость. Это в свою очередь
создает высокий риск прямой травмы проводящей системы серд-
ца швами и поэтому более перспективной в данных условиях
следует считать операцию иссечения трехстворчатого клапана,
закрытия ДМЖП и имплантации в правое атриовентрикулярное
отверстие искусственного клапана. У больных с сопутствующим
стенозом легочной артерии, а также признаками уменьшения
отверстия трехстворчатого клапана, очевидно, предпочтительнее
выполнение гемодинамической коррекции по методу Фонтена.
Глава 17. АТРЕЗИЯ ТРЕХСТВОРЧАТОГО КЛАПАНА
Атрезия трехстворчатого клапана (АТК) характеризуется
отсутствием сообщения между правым предсердием и правым
желудочком. Впервые порок описан Kreysig (1817) и Е. Sievek-
ing (1854). Частота по клиническим данным составляет 2,4 %
[Gasul В. et al., 1966], по патологоанатомическим — 2,6—5,3 %
[Bankl Н., 1970; Donzelot Е., D’Allaines F., 1954], занимает тре-
тье место по распространенности среди пороков цианотического
типа после тетрады Фалло и транспозиции магистральных сосудов
(ТМС).
Анатомия, классификация. Основной анатомической характе-
ристикой порока является отсутствие сообщения между правым
предсердием и правым желудочком, наличие межпредсердного
сообщения, гипоплазия или отсутствие правого желудочка, рас-
ширение полости левого желудочка. Частым элементом порока
является ДМЖП. При его отсутствии сообщение между большим
и малым кругом кровообращения осуществляется через открытый
артериальный проток (ОАП) или через большие системные кол-
латеральные артерии (рис. 76).
Можно выделить следующие морфологические варианты
трикуспидальной атрезии: мышечную, мембранозную, клапанную,
атрезию типа аномалии Эбштейна и атрезию атриовентрикуляр-
ного канала [Фальковский Г. Э. и др., 1981].
При всех вариантах АТК полость правого предсердия рас-
9—976
257
Рис. 76. Наиболее распространенные варианты атрезии трехстворчатого клапана
(схема).
а — нормальное расположение магистральных сосудов, ДМЖП; б - нормальное
расположение магистральных сосудов с открытым артериальным протоком без ДМЖП;
в — транспозиция магистральных сосудов, ДМЖП.
ширена, стенка его гипертрофирована. Степень этих изменений
зависит от величины межпредсердного сообщения, без которого
жизнь при АТК невозможна; чаще всего оно представлено де-
фектом в области овального окна или вторичным ДМПП, реже
можно встретить первичный дефект или полное отсутствие пе-
регородки. Правый желудочек, как правило, гипоплазирован за
счет отсутствия приточного отдела и представлен инфундибуляр-
ной камерой, обеспечивает доставку крови в оба круга крово-
обращения, стенка его несколько утолщена. Левое предсердие
т левый желудочек расширены, миокард их гипертрофирован.
Митральное отверстие всегда расширено. Левый желудочек
посредством ДМЖП сообщается с гипоплазированным правым
желудочком. При нормальном расположении магистральных
сосудов от последнего отходит легочный ствол и в 80 % случаев
258
определяется его сужение, обусловленное клапанным, надкла-
панным стенозом или небольшими размерами ДМЖП; при
□ транспозиции сосудов стеноз встречается реже; аорта отходит
от левого желудочка в обычном месте. При атрезии легочного
клапана и отсутствии ДМЖП полость правого желудочка не
определяется или представлена щелевидным слепым карманом;
в таких случаях отмечаются ОАП или большие системные кол-
латеральные артерии.
При ТМС от левого желудочка отходит легочный ствол, а от
гипоплазированного правого желудочка — аорта; полость пра-
вого желудочка и ДМЖП несколько больших размеров, чем
при нормальном расположении магистральных сосудов. В 30—
60 % случаев наблюдается легочный стеноз, в остальных случаях
стеноз отсутствует и отмечаются признаки легочной гипертензии.
Отсутствие ДМЖП при ТМС ведет к атрезии устья аорты.
В этих условиях жизнь возможна только при наличии ОАП,
через который кровь поступает из легочного ствола в большой
круг кровообращения.
При корригированной ТМС от гипоплазированного правого
желудочка отходит аорта, расположенная слева и спереди от
легочного ствола, который отходит непосредственно от левого
желудочка. Поскольку инверсия распространяется и на атриовен-
трикулярные клапаны, то в левом атриовентрикулярном отвер-
стии находится трехстворчатый клапан.
Предлагаемая классификация учитывает состояние легочного
кровотока, тип расположения магистральных сосудов и характер
сопутствующих пороков сердца:
1) трикуспидальная атрезия с увеличенным легочным кровотоком: а) с нор-
мальным расположением магистральных сосудов без легочного стеноза, б) с нор-
мальным расположением магистральных сосудов, легочной атрезией и большим
ОАП, в) с ТМС без легочного стеноза, г) с ТМЗ, атрезией устья аорты и боль-
шим ОАП, д) с инверсионной ТМЗ, небольшим ДМЖП; 2) трикуспидальная
атрезия с нормальным или уменьшенным легочным кровотоком: а) с нормальным
расположением магистральных сосудов и клапанным или подклапанным легоч-
ным стенозом, б) с нормальным расположением магистральных сосудов, отсут-
ствием ДМЖП, легочной атрезией и небольшим ОАП, в) с ТМС и клапанным
или подклапанным легочным стенозом, г) с инверсионной ТМС и клапанным
или подклапанным легочным стенозом. Самым распространенным вариантом
порока является сочетание АТК с нормальным расположением сосудов и не-
большим ДМЖП.
Гемодинамика (см. рис. 76). Если во внутриутробном периоде
порок существенно не влияет на развитие плода, то вскоре пос-
ле рождения ребенок может умереть. Это связано с небольшими
размерами или закрытием овального окна (или ОАП), что делает
невозможным опорожнение системной венозной крови. Гемоди-
намические проявления порока при всех его анатомических ва-
риантах имеют общие черты. Венозная кровь, поступающая в
правое предсердие по полым венам, через межпредсердное сооб-
щение направляется в левое предсердие, где она смешивается
с оксигенированной кровью, притекающей из легочных вен.
9»
259
При небольшом ДМПП правое предсердие расширяется, стенка
его гипертрофируется, систолическое и среднее давление в нем
больше таковых в левом предсердии, объем крови, нагоняемой
правым предсердием, мал, что приводит к венозному застою,
сердечной недостаточности. При больших размерах межпред-
сердного сообщения градиент давления между предсердиями
минимальный, правое предсердие обычных размеров, а левое
значительно увеличено.
Из левого предсердия смешанная кровь поступает в левый
желудочек, далее через ДМЖП — в гипоплазированный правый
желудочек и из них — в магистральные сосуды. Поскольку в
легочном стволе и аорте циркулирует смешанная кровь, то у
большинства больных выявляется артериальная гипоксемия, сте-
пень которой зависит от объема легочного кровотока и величины
межпредсердного сообщения.
При большом ДМЖП (без стеноза легочной артерии), неза-
висимо от типа взаимоотношения магистральных сосудов, дав-
ление в обоих желудочках равное и с рождения существует
гипертензия малого круга кровообращения; в связи со значитель-
ным легочным кровотоком увеличивается объем оксигенирован-
ной крови, притекающей в левое предсердие, где происходит
смешение большого объема артериальной крови с меньшим
объемом венозной. Цианоз в таких случаях минимальный, ио он
усиливается при уменьшении легочного кровотока из-за разви-
тия склеротических изменений в сосудистом русле легких.
Состояние гемодинамики у больных с АТК без ДМЖП зави-
сит от величины ОАП, а при его отсутствии — от калибра систем-
ных коллатеральных артерий. При большом ОАП может даже
отмечаться легочная гипертензия, но чаще он небольшой, что
ведет к дефициту легочного кровотока.
Наиболее тяжелым вариантом порока, при котором с момента
рождения больного существ\'ет легочная гипертензия, является
АТК с ТМС, отсутствием ДМ КП и атрезией устья аорты. В этих
условиях основную функцию по снабжению кровью обоих кругов
кровообращения осуществляет легочная артерия.
У больных с АТК и сопутствующим легочным стенозом,
независимо от характера расположения магистральных сосудов,
наблюдаются дефицит легочного кровотока, гипоксемия, цианоз.
Клиника, диагностика. Клиническая картина трикуспидальной
атрезии зависит в основном от величины ДМПП и состояния
кровотока в малом круге кровообращения. При АТК с
уменьшенным легочным кровотоком у 75—85 %
больных сразу после рождения отмечают цианоз, усиливающий-
ся при нагрузке, крике и с возрастом. Одышечно-цианотические
приступы, как и при тетраде Фалло, отмечаются у 10—15%
больных и связаны со спазмом выводного отдела правого желу-
дочка при наличии подклапанного легочного стеноза; многие
больные присаживаются на корточки, предотвращая появление
приступов.
260
Рис. 77. Атрезия трехстворчатого клапана и стеноз легочной артерии. ЭКГ.
У большинства больных отмечаются отставание в физическом
развитии, одышка в покое, симптомы «барабанных палочек» и
«часовых стекол». При наличии небольшого межпредсердного
сообщения можно наблюдать набухание шейных вен и их пуль-
сацию. У большинства больных имеется полицитемия, увеличи-
вающаяся с возрастом.
При осмотре верхушечный толчок, образованный левым желу-
дочком, усилен, разлитой, сердечный толчок ослаблен. При пер-
куссии сердце несколько увеличено или нормальное. Сердечного
горба обычно нет. При аускультации выслушивается нормальный
I тон и ослабленный II тон над легочной артерией. У подавляю-
щего большинства больных вдоль левого края грудины выслуши-
вается грубый систолический шум, связанный с ДМЖП или
легочным стенозом. Отсутствие систолического шума и непрерыв-
ный систолодиастолический шум во втором межреберье слева
или справа у грудины наблюдается у больных с легочной атре-
зией и зависит от компенсирующего ОАП или системных колла-
теральных артерий.
ЭКГ дает важнейшую диагностическую информацию
(рис. 77). Отклонение электрической оси сердца влево (от 0 до
—90°) встречается в 80—85 % всех случаев, что связано с ано-
малией проводящей системы сердца (раннее отхождение перед-
261
ней левой ветви пучка Гиса, удлинение правой ветви). Этот
признак у больного с цианозом следует считать типичным для
данного порока. В грудных отведениях имеются признаки гипер-
трофии миокарда левого желудочка, часто с отрицательным зуб-
цом 7v5_g. Зубцы Pi.ii,v, увеличены и обратно пропорциональны
размеру межпредсердного сообщения, возможно укорочение ин-
тервала PR.
На рентгенограмме органов грудной клетки имеются узкий
сосудистый пучок, обеднение легочного рисунка. Тень сердца
нормальных размеров или слегка увеличена, атриовентрикуляр-
ный угол смещен вверх за счет увеличения правого предсердия.
Левый контур сердца закруглен, верхушка приподнята над диа-
фрагмой, талия сердца подчеркнута. В косых проекциях определя-
ется увеличение правого предсердия и левого желудочка, а также
«срезанный» передний контур сердца (во втором косом положе-
нии) в месте проекции правого желудочка.
АТК с увеличенным легочным кровотоком
встречается значительно реже, клиническая картина отличается
от представленной выше. Ранняя смертность в этой клинической
группе объясняется существующей с рождения легочной гипер-
тензией; последняя приводит к повышению давления в левом
предсердии и частичному закрытию овального окна, что затруд-
няет опорожнение правого предсердия. Смерть обычно наступает
от сердечной недостаточности, лишь небольшое число больных
переживают возраст 1—2 года. Цианоз в раннем детском возрас-
те часто отсутствует или выражен нерезко. Нарастание цианоза
у детей старшего возраста обычно связано с прогрессирующим
уменьшением легочного кровотока при развитии склеротических
изменений в сосудах легкого. Основными симптомами являются
признаки сердечной недостаточности (одышка, гепатомегалия,
тахикардия). Сердце увеличено в размерах. При аускультации
определяется грубый систолический шум ДМЖП и акцент II то-
на над легочной артерией. На верхушке иногда выслушивается
диастолический шум, обусловленный увеличенным кровотоком
через митральный клапан.
ЭКГ такая же, как в предыдущей группе, но чаще регистри-
руется высокий и расширенный зубец Pi.ii.aVL.v5,6, что свидетель-
ствует о гипертрофии левого предсердия. На рентгенограмме
органов грудной клетки имеются усиление легочного рисунка по
артериальному и венозному руслу, пульсация корней легких.
Тень сердца значительно увеличена, преимущественно за счет
левых его отделов. При нормальном расположении магистраль-
ных сосудов по левому контуру сердца определяется выбухание
дуги легочной артерии.
При одномерной эхокардиографии АТК всегда следует запо-
дозрить у больного с цианозом и дилатированным левым желу-
дочком при отсутствии эхосигналов от трехстворчатого клапана.
При секторном сканировании постановка диагноза не представ-
ляет существенных трудностей. Правый желудочек, как правило,
262
Рис. 78. Атрезия
трехстворчатого
клапана. Ангио-
кардиограмма.
гипоплазирован, левый желудочек дилатирован и гипертрофиро-
ван, сообщение между правым предсердием и желудочком, эхо-
сигналы от трехстворчатого клапана отсутствуют. Предсердия
увеличены, при этом определяется вторичный ДМПП либо
открытое овальное окно. Одновременно определяются сопут-
ствующие пороки: ТМС, ДМЖП, стеноз легочной артерии.
При катетеризации полостей сердца провести катетер из пра-
вого предсердия в правый желудочек не удается, он проникает в
левое предсердие и далее — в левый желудочек. Систолическое и
среднее давление в правом предсердии повышены, имеется гра-
диент давления между правым и левым предсердиями, величина
которого определяется размерами межпредсердного сообщения.
В левом желудочке регистрируется давление, равное системному.
Анализ газового состава крови выявляет снижение насыщения
крови кислородом в левом предсердии из-за сброса в него веноз-
ной крови и одинаковую степень гипоксемии в левом желудочке
и системной артерии. У больных с увеличенным легочным крово-
током степень гипоксемии минимальная и значительно возрастает
при склерозе легочных сосудов.
Ангиокардиография имеет решающее значение в диагностике
(рис. 78). При правой атриографии контрастное вещество, минуя
правый желудочек, поступает в полость левого предсердия, в
его ушко (У) и далее — в левый желудочек,, аорту, легочный
ствол. При этом в переднезадней проекции непосредственно над
диафрагмой между контрастированными правым предсердием и
левым желудочком выявляется неконтрастированный участок
треугольной формы (на рис. 78 обозначен стрелками), распо-
263
ложенный в месте приточной части правого желудочка — так
называемое «окно правого желудочка», характерный признак
АТК.
Для выбора метода хирургического лечения важную инфор-
мацию представляет левая вентрикулография. При нормальном
положении сосудов из гипоплазированного правого желудочка
всегда контрастируется легочная артерия, при ТМС соотноше-
ние обратное. При инверсионной транспозиции разница лишь в
том, что аорта, отходящая от гипоплазированного правого желу-
дочка, располагается слева и спереди от легочного ствола, кото-
рый начинается непосредственно от левого желудочка.
Дифференциальный диагноз следует проводить с единствен-
ным желудочком, легочной атрезией с гипоплазией трехствор-
чатого клапана и правого желудочка, транспозицией магистраль-
ных сосудов.
Течение, лечение. Прогноз при этом пороке очень серьезный,
течение прогрессирующее, с возрастом увеличиваются гипоксия
и признаки сердечной недостаточности. Большинство детей с
АТК умирают в течение первого года жизни, так как закрытие
открытого овального окна или ОАП делает их нежизнеспособ-
ными. По данным R. Sade, A. Castaneda (1976), 49,5 % больных
умерли в течение первых 6 мес жизни и только 10 % прожили
более 10 лет. Известны единичные случаи доживания больных
до 30 и даже 60 лет, когда АТК сочеталась с небольшим легоч-
ным стенозом, имелись большие ДМЖП и ДМПП. До взрослого
возраста доживают также больные, которым в детстве были
произведены паллиативные операции.
Хирургическое лечение включает паллиативные и радикаль-
ную операции. Показания к паллиативным операциям опреде-
ляется размером межпредсердного сообщения, состоянием легоч-
ного кровотока, возрастом больных и др. У новорожденных и
младенцев с АТК и небольшим ДМПП для избежания системной
венозной недостаточности показана декомпрессия правого пред-
сердия, которая достигается расширением межпредсердного
сообщения с помощью процедур Рашкинда и Парка (см. гла-
ву 12). После успешного проведения атриосептостомии, в зави-
симости от состояния легочного кровотока, выполняется одна из
паллиативных операций. При увеличенном легочном кровотоке —
сужение легочного ствола. У больных с дефицитом легочного
кровотока в раннем возрасте выполняется один из видов сис-
темно-легочных анастомозов, которые, увеличивая приток крови
в легкие, уменьшают степень гипоксемии. Среди них предпочте-
ние отдается подключично-легочному анастомозу по методу
Блелока — Тауссиг. Хорошие результаты у больных старше 10—
12 лет можно получить при применении кава-пульмонального
анастомоза, который не создает добавочной нагрузки на левый
желудочек и увеличивает эффективный легочный кровоток, он
применим у больных с любыми размерами межпредсердного
сообщения.
264
Начало корригирующим операциям при АТК положено в
1971 г. сообщением F. Fontan и Е. Baudet, которые описали ори-
гинальную методику коррекции порока в виде закрытия меж-
предсердного сообщения, соединения правого предсердия с легоч-
ным стволом с помощью аортального гомопротеза, имплантации
гомоклапана в устье нижней полой вены и создания кава-пуль-
монального анастомоза, следовательно, при этой операции ана-
томические изменения не ликвидируются, но благодаря разобще-
нию малого и большого кругов кровообращения устраняются
нарушения гемодинамики, поэтому методика операции получила
название гемодинамической коррекции или «операции Фонтена».
В нашей стране первая операция по методу Фонтена выполнена
В. А. Бухариным (1974). Показания к гемодинами-
ческой коррекции порока сформулированы A. Choussat
и соавт. (1977): 1) минимальный возраст больного — 4 года;
2) наличие синусового ритма на ЭКГ; 3) нормальное впадение
полых вен; 4) нормальный объем правого предсердия; 5) сред-
нее давление в легочном стволе не более 15 мм рт. ст.; 6) легоч-
но-сосудистое сопротивление не должно превышать 4 ед/м2;
7) соотношение диаметров легочного ствола и аорты — не менее
0,75; 8) нормальная функция левого желудочка с фракцией
выброса не менее 0,6; 9) функция митрального клапана не на-
рушена; 10) отсутствие повреждений от предшествующих меж-
сосудистых анастомозов.
В зависимости от анатомических особенностей порока в
основном применяют 2 методики операции: соединение правого
предсердия с правым желудочком и с легочным стволом. Первая
методика применяется при хорошо развитом выводном отделе
правого желудочка и отсутствии клапанного легочного стеноза.
Методика операции включает вскрытие правого предсердия, за-
крытие межпредсердного сообщения и ДМЖП. Между правым
предсердием и правым желудочком вшивают кондуит. Учитывая
трудности имплантации и размещение кондуита у детей, а также
возможность сужения его просвета в отдаленные сроки после
операции, в последнее время предпочтение отдают методике
прямого соединения правого предсердия с правым желудочком,
предложенной V. Bjork и соавт. (1979).
Вторую методику — соединение правого предсердия с легоч-
ным стволом применяют при сопутствующей ТМС, гипоплазии
или атрезии устья легочного ствола и небольшой полости правого
желудочка.
В последнее время предпочтение отдают созданию прямых
сообщений [Подзолков В. П. и др., 1985; Doty D. et al., 1981],
причем нередко возникает необходимость в расширении созда-
ваемого соустья перикардиальной заплатой.
Соединение правого предсердия с инфундибулярным отделом
правого желудочка, включающим легочный ствол с клапаном,
применяется при маленькой полости гипоплазированного право-
265
го желудочка, но при нормальном диаметре легочного ствола и
отсутствии клапанного стеноза.
Госпитальная летальность после гемодинамической коррек-
ции трикуспидальной атрезии колеблется от 5 до 20 % [Bouman F.
и соавт., 1978; Fontan F. и соавт., 1983|.
В. П. Подзолков и соавт. (1986) отметили летальность в
5 % случаев при соблюдении критериев операбельности по
A. Choussat и в 14,3% — при превышении показаний. У многих
больных в ближайшие 1 —2 нед наблюдаются увеличение пе-
чени, асцит, гидроторакс, у 1 /з больных — явления острой почеч-
ной недостаточности.
В отдаленные сроки после операции 84 % пациентов отно-
сятся к I и II функциональным классам. Они ведут активный
образ жизни, довольно хорошо переносят физические нагрузки,
цианоз у них отсутствует. Отдаленные результаты находятся в
прямой зависимости от функционального состояния миокарда
левого желудочка до операции. Причиной летальных исходов в
отдаленные сроки после операции чаще всего является хрониче-
ская сердечная недостаточность [Подзолков В. П. и др., 1988].
Глава 18. ВРОЖДЕННЫЕ ПОРОКИ
И АНОМАЛИИ МИТРАЛЬНОГО КЛАПАНА
Аппарат митрального клапана (МК) включает кольцо, две
створки (переднемедиальную и заднелатеральную) и множест-
венные хорды, соединяющие створки с соответствующими папил-
лярными мышцами. Пороки развития МК могут приводить к
недостаточности, стенозу, атрезии или смещению клапана. Как
изолированные, дефекты МК встречаются только в 10%, т. е.
в большинстве случаев имеется сочетание с другими пороками
сердца и сосудов.
ВРОЖДЕННАЯ НЕДОСТАТОЧНОСТЬ МИТРАЛЬНОГО КЛАПАНА
Врожденная недостаточность митрального клапана (ВНМК)
как изолированный порок развития составляет 0,6 % всех
ВПС (Casul В. et al., 1966). Значительно чаще она являет-
ся составной частью открытого атриовентрикулярного канала,
корригированной транспозиции магистральных сосудов, со-
провождает аномалии коронарных сосудов, болезнь Марфана
и т. д.
Впервые недостаточность митрального клапана (НМК) опи-
сана J. N. Corvisart (1813). Еще 20 лет тому назад причиной
НМК считали только ревматизм. В настоящее время с внедрени-
ем эхокардиографии, особенно двухмерной, ангиокардиографии
интерес привлекает большая группа состояний, при которых име-
ется НМК неревматической этиологии.
Анатомия. ВНМК может быть результатом отклонений от
2ос
нормы со стороны всех составных компонентов МК- створок, ко-
миссур, сухожильных хорд, папиллярных мышц, левого предсер-
дия и желудочка. Суммируя наиболее частые анатомические на-
ходки, можно выделить следующие варианты ВНМК.
1. Расщепление переднемедиальной створкн, ее недоразвитие, фиброзное
кольцо при этом чаще структурно неполноценно, расширено; расщепление
может локализоваться в задней створке, быть множественным. Возможны так-
же 4-й и 5-й створочный клапан, гипоплазия или агенезия одной створкн, не-
равномерная их толщина, изменения по типу аномалии Эбштейна. Нередко со-
четание с ОАП, ДМЖП, вторичным ДМПП, бактериальным эндокардитом.
2. Аномальное прикрепление и строение сухожильных нитей и папиллярных
мышц. Выделяют различные варианты аномального положения хорд: от одной
к другой стенке желудочка, от папиллярной мышцы к стенке желудочка, от
одной группы папиллярных мышц к другой, от створок МК непосредственно
к стенке желудочка и др. Плотное прикрепление задней створки к стенке же-
лудочка. образование гемодинамнческн обусловленного фиброзного спаяння
препятствуют смыканию обеих створок в систолу.
3. Пролапс МК (см. ниже).
4. «Болтающийся» МК («floppy mitral valve») задняя (реже обе или толь-
ко передняя) створка МК увеличена, утолщена, с узелками по краю, хорды
удлинены (возможен их разрыв), кольцо расширено, во время систолы створ-
ка выбухает в левое предсердие, имеет вид купола, возможна кальцификация
кольца. Створки и хорды при этой патологии гипермобильны, оказывают ме-
ханическое воздействие на эндокард межжелудочковой перегородки и задней
стенки левого желудочка, в результате чего образуется фиброзная ткань и хор-
ды подпаиваются к задней стенке левого желудочка.
5. Добавочный МК чаще расположен в задней (реже в передней) створ-
ке, имеет свои створки, хорды и папиллярные мышцы. Регургитация через
добавочный МК может отсутствовать и такие больные живут длительно, умирая
от других (несердечиых) причин.
6. Аркадный МК.
7. Изолированное увеличение кольца МК как причина ВНМК возможно,
но многими авторами подвергается сомнению; в большинстве случаев ВНМК
фиброзное кольцо расширено, истончено.
Гемодинамика. Суть нарушения гемодинамики заключается в
постоянном обратном токе крови в систолу из левого желудочка
в левое предсердие, полости которых расширены соответственно
выраженности НМК- Хроническая регургитация крови приводит
к постепенной дилатации левого предсердия, задняя стенка ко-
торого смещается ‘кзади и книзу, натягивая заднюю створку
МК, т. е. по мере расширения левого предсердия наблюдается
функциональное укорочение створки, еще более усиливающее
НМК. Таким образом, по выражению J. Edwards и Н. Burchell
(1958), митральная недостаточность порождает митральную не-
достаточность, т. е. этот ВПС имеет с возрастом прогрессирую-
щее течение. Основная нагрузка при ВНМК длительно прихо-
дится на левые отделы, затем возникает застой в малом круге
кровообращения и к левожелудочковой недостаточности присое-
диняется правожелудочковая (гепатомегалия, отеки).
Клиника, диагностика. Клинические особенности ВНМК за-
висят от степени деформации клапанного аппарата. Единст-
венным проявлением незначительного дефекта створок МК (ча-
ще задней) будет грубый систолический шум на верхушке серд-
267
ца с проведением в левую аксиллярную область. Однако с пер-
вых месяцев и лет жизни больного возможно тяжелое течение
порока с нарастанием признаков легочной гипертензии и сердеч-
ной недостаточности, отставанием в физическом развитии (чаще
это бывает при расщеплении передней створки и слабости
хордо-папиллярного аппарата, нарушающей функцию обеих
створок). Дети болеют повторными ОРВИ, пневмониями. При
осмотре отмечается выраженный сердечный горб, верхушечный
толчок разлитой, смещен в пятое и шестое межреберья; здесь
же возможно систолическое дрожание. Левая граница сердеч-
ной тупости соответствует передней подмышечной линии. Систо-
лический шум грубого тембра на верхушке сочетается с III то-
ном и мезодиастолическим шумом. При наличии аномально
расположенных хорд систолический шум имеет еще и музыкаль-
ный (вибрационный) тембр, лучше определяется на верхушке
сердца или вдоль левого края грудины ближе к основанию серд-
ца. При гепатомегалии в четвертом и пятом межреберье слева
у грудины выслушивается систолический шум недостаточности
трехстворчатого клапана. Акцент II тона над легочной артерией
подтверждает высокую легочную гипертензию. Сердечная недо-
статочность носит бивентрикулярный характер. Осложненное те-
чение порока характеризуется тромбоэмболическим синдромом.
ВНМК может сочетаться с ОАП и ДМЖП. В таких слу-
чаях, кроме аускультативной симптоматики, характерной для
этих ВПС, имеется самостоятельный систолический шум НМК
на верхушке. Необходимо дифференцировать врожденную НМК
от относительной (митрализация порока при больших размерах
ОАП или ДМЖП). Заподозрить ВНМК помогают признаки зна-
чительной дилатации полости левого желудочка при небольших
размерах сопутствующих пороков. Известно, что при вторичном
ДМПП полость левого желудочка небольшая, поэтому ее дила-
тация требует исключения ВНМК-
На ЭКГ электрическая ось сердца не отклонена (0 ±90°),
имеются перегрузка левого желудочка, в меньшей степени —
правого, значительное увеличение левого предсердия, амплитуда
зубцов Т в левых грудных отведениях чаще сохранена, но при
выраженной НМК они могут быть отрицательными. Отклонение
электрической оси сердца влево при ВНМК бывает при сочета-
нии порока с первичным ДМПП. Длительное течение заболевания
и большие размеры левого предсердия предрасполагают к по-
явлению мерцания и трепетания предсердий, пароксизмальной
тахикардии.
На ФКГ амплитуда I тона на верхушке часто снижена,
высокочастотный систолический шум, связанный с I тоном, зани-
мает большую часть систолы, имеет форму затухающих от I то-
на неравномерных колебаний. III тон выражен и нередко сопро-
вождается мезодиастолическим шумом. При патологии хордаль-
ного аппарата форма шума приближается к ромбовидной, ме-
няется от цикла к циклу; в таких случаях систолический шум не
268
связан с I тоном, имеет средне- и низкочастотный характер.
Данные рентгенограммы отражают степень нарушения гемо-
динамики. Легочный рисунок усилен по венозному руслу, сердце
может быть нормальных размеров или незначительно увеличе-
но влево. При выраженной ВНМК оно увеличено значитель-
но с митральной конфигурацией. При рентгеноскопии отмечает-
ся усиленная пульсация левого предсердия («коромыслоподоб-
ные движения»), амплитуда систолодиастолических колебаний
миокарда левого желудочка долго сохранена. При длительном
существования НМК возможны признаки легочной гипертензии,
кальцификация фиброзного кольца и створок МК-
Одновременная эхокардиография позволяет выявить гемоди-
намические проявления митральной недостаточности: дилата-
цию левого предсердия и желудочка, в тяжелых случаях — ле-
гочную гипертензию. Косвенными признаками порока являются
увеличение экскурсии передней митральной створки и скорости
диастолического закрытия клапана (наклон EF). При двухмер-
ной эхокардиографии выявляются дилатация атриовентрикуляр-
ного фиброзного кольца в короткой оси сканирования на уровне
клапана, увеличение площади створок и их голосистолическое
пролабирование. Изолированное расщепление передней митраль-
ной створки регистрируется в парастернальной проекции корот-
кой оси в виде перерыва эхосигнала, разделяющего переднюю
створку на две части; задняя створка МК может быть утолще-
на, подвижность ее снижена. Добавочный атриовентрикулярный
клапан определяется по длинным и коротким осям сканирования,
при этом на одной из створок видны дополнительные эхосигна-
лы, совершающие циклическое движение. Двухмерная эхокардио-
графия позволяет выявить различные варианты аномального
крепления хорд к створкам. Бактериальный эндокардит подтвер-
ждают вегетации на створках МК.
При зондировании сердца в случаях незначительной ВНМК
давление в полостях будет нормальным. В связи с тем что
ВНМК — динамический (прогрессирующий) порок, при длитель-
ном его существовании большое значение будет иметь функци-
ональное состояние миокардал левого желудочка, уровень легоч-
ной гипертензии. При левой вентрикулографии видно поступле-
ние контрастного вещества из левого желудочка в левое предсер-
дие, по объему струи оценивают выраженность НМК как +. + + •
+++, + + + + • При выявлении двух сбросовых потоков в ле-
вое предсердие можно думать о двойном МК. Для исключения
ВНМК левая вентрикулография показана больным с ДМПП,
ОАП и ДМЖП в случаях значительной дилатации полости ле-
вого желудочка.
Дифференциальный диагноз. Следует помнить о других при-
чинах НМК, кроме ревматической и врожденной, к которым от-
носят пролапс МК (см. ниже), разрыв хорд, патологию соеди-
нительной ткани при синдроме Марфана, дилатационную и ги-
пертрофическую кардиомиопатии, хронический миокардит, бакте-
269
риальный эндокардит, миксому, травму сердца, кальцифика-
цию МК (у пожилых лиц), хроническую ишемическую болезнь
сердца, инфаркт миокарда.
Против ревматической этиологии НМК будут свидетельство-
вать данные анамнеза (обнаружение шума в первые месяцы
или годы жизни), отсутствие других проявлений ревматизма,
включая лабораторные показатели.
Разрыв хорд МК необходимо дифференцировать с ВНМК.
Чаще он возникает у мужчин после 45 лет при болезни Марфа-
на, а также в связи с перенесенным ревматизмом, бактериаль-
ным эндокардитом, ИБС, инфарктом миокарда. Выделяют идио-
патический разрыв хорд МК — «синдром изолированного разры-
ва хорд», причиной которого, вероятно, является миксоматоз-
ная дегенерация соединительной ткани; нередко эта патология
сочетается с ПМК- В отличие от ВНМК при разрыве хорд име-
ется картина острой НМК, когда внезапно резко ухудшается
общее состояние, появляются боли в сердце, одышка (вплоть
до клинических симпотомов отека легких), тахикардия, грубый
пансистолический шум на верхушке сердца. Диагноз подтвер-
ждается эхокардиографией.
ВНМК бывает трудно отличить от относительной НМК при
длительно, исподволь текущих заболеваниях миокарда (хрони-
ческом миокардите, дилатационной кардиомиопатии), когда пер-
вым признаком патологии является грубый систолический шум
на верхушке сердца. НМК при дилатации полости левого желу-
дочка может быть связана с расширением фиброзного кольца
(редко), но чаще с дисфункцией папиллярных мышц, латераль-
ным смещением папиллярной мышцы, фиброзом хорд и папил-
лярных мышц. Отличить врожденную НМК от относительной
помогает эхокардиография, где выявляются врожденные дефекты
структурных компонентов МК, тогда как при дилатационной
кардиомиопатии имеется значительное расширение полости лево-
го желудочка, смещение МК кзади с изменениями по типу «ры-
бьего зева».
ВНМК может быть при такой патологии, как фиброэластоз
эндомиокарда, причина ее — дилатация полости левого желу-
дочка, склероз папиллярных мышц, гемодинамическая краевая
деформация створок. Для такого сочетания характерен ранний
возраст больного (первые месяцы и годы жизни), тяжелое тече-
ние с сердечной недостаточностью почти с рождения, отставание
в физическом развитии, выраженные ST—Т нарушения в левых
грудных отведениях на ЭКГ, отсутствие данных за врожденные
аномалии собственно клапанного аппарата.
При гипертрофической обструктивной кардиомиопатии в свя-
зи с гипертрофией межжелудочковой перегородки происходит
смещение вверх места крепления передней папиллярной мышцы,
что также вызывает НМК- Помогают в диагностике семейный
анамнез (случаи кардиомиопатий и внезапной смерти в семьях),
изменения на ЭКГ (отклонение электрической оси сердца вле-
270
во, признаки гипертрофии межжелудочковой перегородки, ише-
мические нарушения в миокарде), данные эхокардиографии.
Поражение структур МК при бактериальном эндокардите
(перфорация и деформация створок, разрыв хорд) может ими-
тировать ВНМК- При этом учитываются анамнез с клинически-
ми проявлениями эндокардита, «приобретенный» характер систо-
лического шума, данные эхокардиографии. Следует помнить, что
бактериальный эндокардит может присоединиться к ВНМК,
при этом, если нет вегетаций на МК, отличить изменения, свя-
занные с ВНМК, от вызванных бактериальным эндокардитом
по эхокардиограммам трудно; помогают анамнез, подъемы тем-
пературы с ознобом, суставной синдром, изменения в общих,
биохимических и иммунологических анализах крови; нередко со-
четание ВНМК с бактериальным эндокардитом устанавливается
только на операции.
ПРОЛАПС МИТРАЛЬНОГО КЛАПАНА
У детей ПМК обнаруживается с большой частотой (от 2,2
до 14%) при проведении популяционных исследований [Perloff
J. К- et al., 1987). ПМК диагностируют в стационаре у 10—30 %
кардиологических больных. В настоящее время показана неодно-
родность ПМК [Белоконь Н. А. и др., 1989].
Внедрение в обследование детского населения эхокардиогра-
фии способствовало выявлению ПМК даже в случаях отсутствия
характерных аускультативных изменений, тем самым повсемест-
но резко увеличилось число детей с данным феноменом, состоя-
щих на учете у педиатра и кардиоревматолога. Наметившаяся
в последние годы отнотипная тактика в отношении ведения де-
тей с ПМК, независимо от его особенностей, содержит потенци-
альную опасность роста ятрогенных заболеваний, поскольку де-
ти освобождаются от занятий физкультурой, получают непока-
занное им лечение.
Термин «пролапс (пролабирование) митрального клапана»
обозначает прогибание, выбухание, створок клапана в полость
левого предсердия во время систолы левого желудочка. Сущест-
вуют другие названия этой патологии: синдром «мезосистоли-
ческого щелчка и позднего систолического шума», синдром Энг-
ла, синдром позднего систолического шума и аномальной Т-волны,
«синдром хлопающего клапана» и др.
Все варианты ПМК можно подразделить на врожденные и
приобретенные, первичные (изолированные, идиопатические) и
вторичные, возникающие как осложнения при ревматизме и не-
ревматическом кардите или являющиеся сопутствующим симпто-
мом основного заболевания — врожденных пороков сердца
(ДМПП, болезнь Эбштейна, ДМЖП), перикардитов, гипертро-
фических кардиомиопатий, нарушений сердечного ритма, наслед-
ственных заболеваний соединительной ткани (болезнь Марфана,
Элерса — Данло). Среди детей с изолированным ПМК необходи-
271
мо выделять две формы: аускультативную (систолические щелчки
и/или позднесистолический шум) и немую (ПМК выявляется
только при эхокардиографии, «псевдо-ПМК») •
Пролабирование створок митрального клапана могут вызвать
следующие причины: а) нарушенная структура МК в виде мик-
соматозного поражения (при синдроме Марфана и др.) или на-
личие незначительных аномалий (расширение кольца, увеличе-
ние площади створок, удлинение хорд); б) аномалия клапанного
(«избыточность» створок) и подклапанного аппарата (непра-
вильное прикрепление, удлинение хордальных нитей, отклонения
в структуре папиллярных мышц); в) регионарные нарушения
сократимости и релаксации миокарда левого желудочка (нижне-
базальная гипокинезия, аномальное сокращение по типу «йога
балерины», преждевременная релаксация передней стенки и др.),
связанные как с его повреждением (воспаление, дегенерация,
гипертрофия), так и нарушенной вегетативной иннервацией и
проведением импульса — ПМК при миокардитах, экстрасисто-
лии, синдроме Вольфа — Паркинсона — Уайта и др.; г) наличие
клапанно-желудочковой диспропорции, когда митральный клапан
является слишком большим для желудочка или желудочек —
слишком маленьким для клапана; д) соматическая реализация
аффективных проявлений — нарушение вегетативной иннервации
створок и подклапанного аппарата на фоне вегетативно-сосу-
дистой дистонии и психоэмоциональных отклонений (психосома-
тическая патология): неврозы, истерия, нервная анорексия и др.
В возникновении изолированного (идиопатического) ПМК
у детей имеют значение одновременно несколько перечисленных
факторов, но основными из них при аускультативной форме яв-
ляются неполноценность соединительнотканных структур и ма-
лые аномалии клапанного аппарата.
Изолированный ПМК обычно диагностируется у детей в
возрасте 7—15 лет, однако может быть выявлен у новорожден-
ных и детей первого года жизни. Аускультативная форма изоли-
рованного (идиопатического) ПМК в 5—6 раз чаще обнаружи-
вается у девочек. При осмотре детей обращают внимание на при-
знаки диспластического физического развития: астеническое те-
лосложение с плоской грудной клеткой, высокорослость, слабое
развитие мускулатуры, повышенная подвижность в мелких суста-
вах, многие девочки светловолосые и голубоглазые; определя-
ются также готическое небо, плоскостопие, сандалевидная щель,
миопия и др.
Более 2/з детей с изолированным ПМК предъявляют много-
численные жалобы на боли в грудной клетке, сердцебиение и
ощущение перебоев в сердце, одышку, головокружение, слабость,
головные боли, обмороки. Боли в сердце дети характеризуют
как «колющие», «давящие», «ноющие» и ощущают в левой поло-
вине грудной клетки без какой-либо иррадиации. У большин-
ства детей они кратковременные, проходят самопроизвольно или
после приема настойки валерианы, валокордина и не купиру-
272
ются валидолом. Такие кардиалгии, как правило, не характерны
для ишемии миокарда и могут быть расценены как проявление
симпаталгий, связанных с психоэмоциональными особенностями
детей с ПМК («боль в сердце неотделима от личности»), однако
в некоторых случаях нельзя исключить спазм неизменных коро-
нарных артерий. Обмороки у детей могут быть проявлением ор-
тостатической гипотонии. Одышка, утомляемость не соответству-
ют выраженности гемодинамических нарушений и связаны с
вегетативной дисфункцией. У '/з детей ПМК протекает бессимп-
томно.
Границы сердца перкуторно не расширены. Решающее зна-
чение в диагностике ПМК имеет аускультация; необходимо вы-
слушать пациента в положении лежа на спине и левом боку,
стоя, сидя, а также сразу после небольшой физической нагруз-
ки. Характерными диагностическими признаками при изолиро-
ванном ПМК являются щелчки (клики), выслушиваемые в сред-
нюю или позднюю части систолы в сочетании с позднесистоли-
ческим шумом либо без него; изолированный позднесистоличе-
ский шум; редко изолированный голосистолический шум; звуко-
вой феномен «писка хорд». Последний признак не является само-
стоятельным аускультативным феноменом и определяется при
сочетании щелчков с позднесистолическим шумом либо при позд-
несистолическом шуме. Интенсивность щелчков нарастает в вер-
тикальном положении тела и при физической нагрузке, ослабе-
вает в горизонтальном положении. Щелчки выслушиваются чаще
в V точке или над верхушкой сердца. Возникновение щелчков
связано с чрезмерным натяжением хорд митрального клапана
во время максимального прогибания створок в полость левого
предсердия. Возможно наличие несколько щелчков в связи с
неодновременным выбуханием различных участков митрального
клапана.
У половины детей определяется сочетание среднесистоли-
ческих щелчков с позднесистолическим шумом, который связан
с недостаточностью митрального клапана, обычно носит постоян-
ный характер, имеет «скребущий» оттенок и слышен как в гори-
зонтальном, так и вертикальном положении, лежа на левом боку.
«Хордальные писки» слышны в положении стоя, носят музыкаль-
ный характер. В редких наблюдениях при аускультативной фор-
ме ПМК может определяться голосистолический шум; в таких
случаях должна быть обязательно исключена недостаточность
митрального клапана другой этиологии. Наличие щелчков в пя-
том межреберье слева у грудины характерно для пролапса трех-
створчатого клапана. С возрастом возможно прогрессирова-
ние звуковой симптоматики: изолированные щелчки сменяются
поздне- или голосистолическим шумом.
У большинства детей с ПМК отмечаются психические расст-
ройства в виде субдепрессивных состояний с ипохондрическими
опасениями, тревогой, астеническими проявлениями, сенестопа-
273
тиями. Такие психовегетативные отклонения способствуют гемо-
динамической дисрегуляции и пролабированию створок.
ЭКГ при ПМК регистрируют в положении лежа и стоя. У
большинства детей имеется вертикальное направление электри-
ческой оси сердца, в '/з случаев фиксируется неполная блока-
да правой ветви пучка Гиса, характерно нарушение процесса
реполяризации на фоне синусовой тахикардии (снижение ампли-
туды зубца Т в 1, II, III, aVF, V5—6 отведениях). При регист-
рации ЭКГ в ортостазе частота таких нарушений у детей, с аус-
культативной формой ПМК увеличивается почти в 2 раза, при
этом усиливается их выраженность и у '/5 детей возникает ин-
версия зубца Т в левых грудных отведениях. В отличие от орга-
нических ST — Т нарушения при ПМК носяз транзиторный ха-
рактер и могут полностью исчезать в течение дня и на несколько
недель.
Иногда на ЭКГ имеет место синдром ранней реполяриза-
ции миокарда желудочков. Увеличение интервала QT у детей
с ПМК предрасполагает к возникновению аритмий, в том числе
желудочковых, поэтому такие дети требуют более частого осмот-
ра кардиоревматологом.
Для уточнения генеза нарушения процесса реполяризации
проводится фармакологическая проба с обзиданом (0,5 1чг/кг
массы), происходит положительная динамика со стороны зубцов
Т, что подтверждает симпатикозависимый характер нарушения
процесса реполяризации у детей с ПМК-
На ЭКГ в состоянии покоя иногда определяются суправент-
рикулярные экстрасистолы экстракардиального происхождения,
связанные с вегетативной дизрегуляцией. Число детей с ПМК,
имеющих аритмию, увеличивается при длительной регистрации
ЭКГ (холтеровское мониторирование), которое показано при на-
личии обмороков, удлинении интервала QT. Сопоставление дан-
ных холтеровского мониторирования с клинико-инструмен-
тальными показателями позволило установить, что возникнове-
ние аритмий при ПМК является феноменом, зависящим от воз-
раста и степени вегетативной дисфункции, что риск возникнове-
ния аритмии увеличивается при наличии митральной регургита-
ции и нарушений процесса реполяризации.
На ФКГ в аускультативном и высокочастотном диапазонах
регистрируются средне- или позднесистолические щелчки в виде
небольшого количества осцилляций, не превышающих по ампли-
туде II тон. Систолический щелчок при ПМК не следует путать
с расщеплением I тона, систолическим тоном изгнания аорты
(при аортальных пороках) или легочной артерии (при ее расши-
рении и легочной гипертензии). Позднесистолический шум опре-
деляется после щелчков, имеет различную форму, чаще — типа
крешендо.
На рентгенограмме грудной клетки у 2/з детей с аускульта-
тивной формой ПМК выявляется уменьшение размеров сердца
в поперечнике и выбухание дуги легочной артерии; последний
274
признак является подтверждением неполноценности соедини-
тельной ткани в структуре сосудистой стенки.
При ангиокардиографии легко выявляется ПМК как у детей с
врожденными пороками сердца, так и без них. Однако проведе-
ние этого инвазивного исследования оказывает стрессовое воз-
действие на миокард, способствует получению ложноположи-
тельных результатов и поэтому не может считаться адекват-
ной диагностической методикой.
Двухмерная экокардиография имеет основное значение для
выявления пролабирования. Характерными являются следу-
ющие изменения: нормальные размеры левого предсердия и ле-
вого желудочка, умеренное увеличение скорости раннего диасто-
лического прикрытия и амплитуды открытия передней створки
МК, увеличение систолической экскурсии атриовентрикулярного
кольца, в большинстве случаев отмечается позднесистолическое
(выгибание створок в последнюю треть систолы левого желу-
дочка), реже голосистолическое (прогибание створок на протя-
жении всей систолы с максимальным выбуханием в среднюю или
позднюю часть ее) пролабирование створок. При исследовании
с помощью одномерной эхокардиографии (М-режим) чаще вы-
является пролапс задней створки, при двухмерном сканировании
нередко обнаруживается пролапс обеих створок. За эхокардио-
графический критерий ПМК необходимо считать смещение ство-
рок митрального клапана не менее чем на 3 мм от линии их смы-
кания. По выраженности прогибания можно выделить 3 степени
ПМК: I—от 3 до 6 мм; II — от 6 до 9 мм; III — более 9 мм.
При изолированных щелчках глубина ПМК не превышает 6 мм,
при сочетании позднего систолического шума со щелчком — ко-
леблется от 4 до 10 мм. Повышенная систолическая экскурсия
межжелудочковой перегородки и задней стенки левого желу-
дочка обусловливает избыточную подвижность папиллярных
мышц, хорд, клапана. У половины детей с аускультативной фор-
мой ПМК обнаруживают множественные эхосигналы от створок
митрального клапана в систолу, утолщенность и «лохматость»
створок. В пользу митральной регургитации, которая наблюда-
ется при глубине пролапса более 5 мм, свидетельствуют увели-
чение амплитуды открытия передней створки и скорости ее при-
крытия, увеличение экскурсии межжелудочковой перегородки.
Следует помнить, что с возрастом на фоне гемодинамических
нарушений анатомические изменения со стороны собственных
створок МК, подклапанного аппарата усугубляются и НМК ста-
новится более выраженной.
К осложнениям ПМК относят отрыв (разрыв) хорд, чаще
прикрепляющихся к среднему сегменту (scallop) задней створки,
а также спаяние утолщенного пристеночного эндокарда левого
желудочка с хордой задней створки (в результате трения друг
о друга), которая укорачивается, движение створки ограничено;
утолщение эндокарда может быть связано с кальцификацией и
бактериальным эндокардитом. Выраженная НМК при ПМК —
275
всегда признак тяжелого течения, она является фактором риска
внезапной смерти и требует хирургической коррекции.
Дифференциальный диагноз при ПМК следует проводить с
недостаточностью митрального клапана различной этиологии
(врожденная, ревматическая вследствие инфекционного эндо-
кардита). С выраженной митральной недостаточностью диффе-
ренцировать ПМК несложно, так как при этом определяются
левая атриомегалия, характерные изменения клапанов на эхо-
кардиограмме, сердечная недостаточность и др. Следует помнить,
что при ПМК может возникнуть тяжелая митральная регургита-
ция вследствие отрыва хорд; диагноз может быть установлен
на основании внезапно появившихся признаков клапанной недо-
статочности, на эхокардиограмме обнаруживается выворачива-
ние створок в полость левого предсердия. Отличить ПМК от под-
остро протекающего ревматического поражения митрального
клапана помогают тщательно собранный анамнез, а также эхо-
кардиографические признаки ревматического вальвулита. Значи-
тельные трудности возникают в диагностике вялотекущего инфек-
ционного эндокардита как самостоятельного заболевания или
осложнившего течения ПМК, что связано с небольшими разме-
рами вегетаций.
Дети с идиопатическим ПМК должны находиться на учете
у кардиоревматолога по форме № 30. Дети с «немыми» вариан-
тами ПМК наблюдаются как здоровые или как пациенты с веге-
тативной дисфункцией; дети со вторичными формами ПМК на-
блюдаются по форме № 30 по основному заболеванию.
В большинстве случаев дети с ПМК вообще не нуждаются
в лечении. Освобождаются от занятий физкультурой в общей
группе и спортом дети, имеющие митральную регургитацию, же-
лудочковые аритмии, увеличение интервала QT, нарушение про-
цесса реполяризации, обморочные состояния. Антибактериаль-
ная профилактика инфекционного эндокардита показана детям,
имеющим изолированный позднесистолический или голосистоли-
ческий шум, при удалении зубов, аденотонзиллэктомии и других
операциях.
Немедикаментозная (психо-, физиотерапия, массаж, реф-
лексотерапия) и медикаментозная терапия назначается диффе-
ренцированно. Терапевтические мероприятия направлены на
улучшение обменных процессов в миокарде, лечение вегетатив-
ной дисфункции, сопутствующих заболеваний и осложнений и
включают панангин, оротат калия, инъекции рибофлавина мо-
нонуклеотида, липоевую кислоту, витамин В|5, глутамевит или
квадевит в течение 1 мес. При психоэмоциональной лабильности,
невротических реакциях могут быть назначены транквилизаторы
с седативным эффектом (мепробамат, седуксен, феназепам, фе-
нибут).
При постоянной тревоге, страхах, стойком кардиалгичес-
ком синдроме в лечение включают френолон, антидепрессан-
ты (азафен).
276
врожденный стеноз митрального клапана
Врожденный стеноз МК редко составляет изолированную
патологию и чаще является составной частью синдрома гипо-
плазии левого сердца (см. главу 16). Частота встречаемости
этого порока 0,2—0,4 % по клиническим данным (Gasul В. et al.,
1966; Collins-Nakai R. et al., 1977).
Анатомия. При врожденном стенозе МК чаще бывают изме-
нены все структурные компоненты клапана: фиброзное кольцо
уменьшено, створки утолщены, хорды и папиллярные мыщцы
укорочены, последние гипертрофированы. Митральный стеноз
может быть клапанным, над- и подклапанным, т. е. обструкция
локализуется на любом участке от легочных вен до полости ле-
вого желудочка.
R. Van Praagh классифицирует данную патологию следующим образом:
1) «типичный» врожденный митральный стеноз с укороченными хордами, об-
литерацией межхордового пространства фиброзной тканью и различной сте-
пенью уменьшения межпапиллярного расстояния; 2) гипопластический врожден-
ный стеноз МК, который почти всегда сочетается с синдромом гипоплазии ле-
вого сердца; 3) надклапанное кольцо; 4) парашютообразный МК.
При типичном клапанном стенозе он может иметь вид диаф-
рагмы (комиссуры отсутствуют или слабо сформированы, сухо-
жильные нити и папиллярные мышцы укорочены, спаяны между
собой) или воронки (верхушка конуса простирается в полость ле-
вого желудочка, края комиссур сращены, подклапанный аппарат
деформирован).
При надклапанном стенозе собственно МК сформирован пра-
вильно, но к основанию створок с предсердной стороны ниже
уровня левого ушка прикреплен соединительнотканный валик
(редко мембрана), выбухающий в митральное отверстие; эта
аномалия может сочетаться с парашютообразным и аркадным
МК, предрасполагает к тромбоэмболии. К надклапанному сте-
нозу относится трехпредсердное сердце (см. главу 5).
При парашютообразном МК створки нормальные (или умень-
шенные) и комиссуры тесно сближены из-за укороченных и
спаянных сухожильных нитей, которые сходятся в одной точке и
соединяются с единой (или группой) задней папиллярной
мышцей, могут быть две папиллярные мышцы, но расположены
близко друг к другу. Отверстие митрального клапана уменьшено,
подвижность створок ограничена, доступ к левому желудочку
обеспечивается через межхордальные щелевидные пространства.
Из сопутствующих ВПС при врожденном стенозе МК обыч-
но имеются стеноз и коарктация аорты, ОАП, ДМЖП, реже
тетрада Фалло, транспозиция магистральных сосудов, единствен-
ный желудочек. Синдром Лютембаше (сочетание митрального
стеноза со вторичным ДМПП) встречается редко, при этом сте-
ноз может быть как врожденный, так и ревматический по про:
исхождению.
277
Гемодинамика. При врожденном стенозе МК нагрузка долго
падает на левое предсердие. Сужение клапана («первый барь-
ер») препятствует поступлению крови в левый желудочек, давле-
ние в левом предсердии повышается, возникает гипертрофия
его миокарда. Эти компенсаторные механизмы облегчают про-
хождение крови через суженное митральное отверстие. Нараста-
ние давления в левом предсердии приводит к ретроградному
повышению давления д легочных венах и капиллярах (венозная,
посткапиллярная легочная гипертензия). Рефлекс Китаева (спазм
артериол легочной артерии в ответ на повышение давления в
левом предсердии — функциональный «второй барьер») сначала
защитный (предохраняет легочные капилляры, от чрезмерного
повышения давления) приводит в дальнейшем к значительному
повышению давления в легочной артерии — развивается арте-
риальная или прекапиллярная легочная гипертензия. Результа-
том этого становятся морфологические изменения в сосудах лег-
кого, их склероз (органический «второй барьер»), стойкая ле-
гочная гипертензия и дилатация правых отделов сердца, право-
желудочковая недостаточность (увеличение печени, отеки на но-
гах, асцит).
Клиника, диагностика. Врожденный стеноз МК чаше встре-
чается у лиц мужского пола. Редкость порока определяет /труд-
ности в диагностике, недостаточную ее разработанность. Веду-
щим признаком порока является одышка, усиливающаяся при
нагрузке. Время ее появления определяется степенью стеноза и
сопутствующими ВПС. Цианоз не характерен для врожденного
стеноза МК, он появляется при легочной гипертензии и имеет
красноватый оттенок. Чаще больные отстают в физическом раз-
витии. С возрастом возникают жалобы на сердцебиение, боли
в области сердца, редко — кровохарканье и легочные кровотече-
ния (разрыв варикозно расширенных сосудов в зоне анастомо-
зов между легочными и бронхиальными венами).
Сердечный горб длительно отсутствует, отмечается усиленная
пульсация правого желудочка, границы сердца расширены преи-
мущественно вправо. Большую помощь оказывает аускультация,
при которой определяется мезодиастолический (с интервалом
от П тона) шум на верхушке (лучше выслушивается в поло-
жении на левом боку), имеющий пресистолическое усиление,
громкий хлопающий I тон, возможен систолический шум отно-
сительной недостаточности трикуспидального клапана в пятом
межреберье слева у грудины (усиливается при вдохе, появ-
ляется при гепатомегалии), П тон над легочной артерией
усилен.
На ЭКГ электрическая ось сердца расположена нормально
или отклонена вправо, имеются признаки перегрузки обоих пред-
сердий. При длительном течении может появиться мерцатель-
ная аритмия, предрасполагающая к тромбозу и тромбоэмболии.
На рентгенограмме органов грудной клетки сердце может быть
нормальных размеров, но имеются признаки венозного застоя;
278
постепенно присоединяются проявления артериальной легочной
гипертензии, линии Керли В, кардиомегалия за счет левого пред-
сердия и правых отделов.
На ФКГ амплитуда I тона на верхушке значительно увели-
чена, здесь же фиксируются мезодиастолический шум с преси-
столическим усилением, при выраженном стенозе уменьшается
интервал II—QS (II тон — тон открытия МК) и увеличивается
интервал Q—I тон до 0,07- 0,1 с (в норме 0,04—0,05 с), что
отражает повышение давления в левом предсердии и косвенно
выраженность стеноза.
При одномерном эхокардиографическом исследовании выяв-
ляются утолщение митральных створок, переднее движение зад-
ней створки во время диастолы, уменьшение амплитуды откры-
тия клапана, увеличение наклонов открытия и закрытия перед-
ней створки, исчезновение волны предсердной контрактации, ди-
латация левого предсердия, в тяжелых случаях легочная ги-
пертензия.
При двухмерной эхокардиографии видны: гипоплазия атрио-
вентрикулярного фиброзного кольца и створок, спаяние створок
по комиссурам, аномально короткие сухожильные нити, утол-
щенные и укороченные папиллярные мышцы, приводящие к
иммобилизации створок. При парашютообразном митральном
клапане в поперечном сечении на уровне левого желудочка вы-
является одна гипертрофированная, чаще задняя, папилляр-
ная мышца, от которой отходят хорды к обеим створкам.
При катетеризации сердца выявляется диастолический гради-
ент через МК (между легочно-капиллярным давлением и дав-
лением в левом желудочке). Градиент будет выше, если митраль-
ный стеноз сочетается с большим левоправым сбросом (ДМЖП,
ДМПП), ниже—при сопутствующем легочном стенозе. Отме-
чается также повышение давления в правых отделах, легочной
артерии, легочных капиллярах.
При ангиокардиографии контрастирование левого желудоч-
ка замедлено, так как кровь небольшой струей поступает в него
из левого предсердия; видны утолщенные створки МК, умень-
шение подвижности передней створки во время диастолы, неболь-
шая полость левого желудочка. При парашютообразном МК
в латеральной и косой проекциях обнаруживают дефект напол-
нения типа «egg-timer»: задневерхняя часть дефекта образована
митральными створками и хордами, передненижняя — единствен-
ной большой задней папиллярной мышцей.
Дифференциальный диагноз врожденного стеноза МК про-
водят у детей первых лет жизни со стенозом устьев легочных
вен, трехпредсердным сердцем, аномальным дренажем легочных
вен, опухолью предсердий, гипертрофической кардиомиопатией.
У детей старшего возраста и взрослых необходимо исключать
ревматический митральный стеноз. Обычно между началом забо-
левания ревматизмом и появлением клинических симптомов
проходит не менее 5 лет.
279
Больным с врожденным митральным стенозом и застойными
явлениями в легких назначаются диета с ограничением соли,
мочегонные препараты (см. главу 22) под контролем массы тела
и диуреза; сердечные гликозиды при правожелудочковой сер-
дечной недостаточности, препараты, улучшающие микроциркуля-
цию; при значительной тахикардии показано назначение 0-адре-
ноблокаторов — обзидан, анаприлин по 1—2 мг/кг/сут, блокато-
ров кальциевого тока — верапамил по 1—3 мг/кг/сут, при мер-
цании предсердий назначают сердечные гликозиды изолиро-
ванно или в сочетании с обзиданом, изоптином, хинидином, по
показаниям проводится дефибрилляция, электрическая стиму-
ляция.
При ВНМК, осложненной сердечной недостаточностью, для
улучшения функционального состояния миокарда левого желу-
дочка назначают сердечные гликозиды, диуретики, вазодила-
таторы (нитропруссид натрия, гидралазин).
Учитывая незначительную распространенность врожденных
пороков развития МК, опыт хирургического лечения в мире пока
невелик.
Показания кхирургическому вмешательст-
в у при митральном стенозе; выраженные застойные явления
в малом круге кровообращения, легочная гипертензия, трикуспи-
дальная недостаточность. Показаниями для хирургической кор-
рекции ВНМК являются увеличение размеров сердца, сердечная
недостаточность I — ПА — Б стадии (оперативное вмешательст-
во при более выраженной декомпенсации имеет плохой прог-
ноз) , присоединение бактериального эндокардита, рефрактерно-
го к медикаментозному лечению. В тех случаях, когда ВНМК
у детей не приводит к повышению давления в легочной артерии
и декомпенсации, операцию можно отложить до более старшего
возраста. Это обусловлено тем, что операция может закончиться
протезированием митрального клапана и всегда желательно им-
плантировать максимально большой протез, чтобы в последую-
щем избежать его смены. Не вызывает сомнений целесообраз-
ность раннего выполнения корригирующей операции при появ-
лении нарушений ритма сердца. При пролапсе МК оператив-
ное лечение показано в случаях выраженной недостаточности
клапана, нарушениях сердечного ритма, присоединении бактери-
ального эндокардита.
Характер корригирующей операции при ВНМК определяет-
ся типом патологии. Операция может быть направлена на восста-
новление запирательной функции собственно митрального клапа-
на либо замену его на протез. Приоритет в разработке ме-
тодов пластических операций принадлежит A. Carpentier (1977—
1983).
При расширении фиброзного кольца МК может быть выполне-
на аннулопластика с помощью полукисетных швов, накладывае-
280
мых вдоль периметра кольца, или подшиванием опорных колец
Карпантье, которые фиксируют отдельными швами. Расщепление
створки МК (чаще это передняя створка) ликвидируют посред-
ством наложения отдельных узловых швов. Отверстия в створ-
ках, широкая комиссуральная поверхность могут быть ликвиди-
рованы посредством вшивания заплат из аутоперикарда. В тех
случаях, когда ограничения в подвижности створок вызваны на-
личием вторичных хорд или укорочением истинных хорд, опера-
ция заключается в иссечении вторичных хорд и удлинении ис-
тинных хорд за счет дозированного рассечения папиллярных
мышц, ведущего к расширению межхордального пространства.
При выраженном пролабировании створки в левое предсердие
из-за удлинения хорд производят рассечение соответствующей
папиллярной мышцы с последующим погружением избыточного
участка в отверстие разреза и фиксацией обвивными швами. При
удлинении папиллярных мышц производят их клиновидную ре-
зекцию или выполняют укорочение «сваривающими», швами. При
добавочном отверстии МК его можно ушить, если оставшееся
отверстие имеет достаточные размеры; в противном случае пока-
зано протезирование клапана. В ряде случаев добавочное от-
верстие МК не приводит к нарушениям гемодинамики и не тре-
бует коррекции.
Устранение клапанной формы митрального стеноза достигают
рассечением по комиссурам, надклапанной формы (чаще всего
это фиброзная мембрана) — иссечением мембраны. Подклапан-
ная форма стеноза может быть результатом сращения папил-
лярных мыши со стенкой левого желудочка и межжелудочковой
перегородкой. Разъединением этих структур стеноз может быть
устранен, хотя нередко требуется операция по укорочению или,
наоборот, удлинению хорд и папиллярных мышц (Carpentier А.,
1983).
Описанные восстановительные операции на МК целесооб-
разно дополнять подшиванием опорного кольца Каопанье В тех
случаях, когда не удается достигнуть удовлетворительной замы-
кательной функции МК из-за тяжести патологии, следует вы-
полнить операцию по замене клапана искусственным протезом.
Одновременно должен быть ликвидирован, если имеется, сопут-
ствующий ВПС.
Пластические операции при ВНМК у детей сопровождают-
ся низкой летальностью (2%), при протезировании МК ле-
тальность увеличивается до 30%. Аналогичная картина наблю-
дается и в отдаленные сроки после операции: после протезирова-
ния у 20 % больных отмечаются летальные исходы, у 10 % —
тромбоэмболии. Напротив, 86 % пациентов после пластической
операции относят к I функциональному классу NYHA (Carpen-
tier А., 1984). В нашей стране наибольшим опытом по хирурги-
ческой коррекции ВНМК располагают В. А. Бухарин и соавт.
(1986).
281
Глава 19. ЕДИНСТВЕННЫЙ ЖЕЛУДОЧЕК СЕРДЦА
Единственный или общий желудочек сердца представляет
собой единственную желудочковую камеру, которая через мит-
ральный и трикуспидальный клайан сообщается с левым и пра-
вым предсердием, т. е. имеется трехкамерное сердце. Первое опи-
сание порока принадлежит Farre (1814) и A. Holmes (1824).
Для обозначения порока используются различные термины;
общий желудочек, примитивный желудочек, трехкамерное сердце
с двумя предсердиями, трехкамерное сердце с единственным
желудочком, единственный желудочек с рудиментарной выводной
камерой, одножелудочковое сердце; наиболее распространен
термин «единственный желудочек» сердца. Не противопоставляя
термины «единственный желудочек» и «общий желудочек», при-
нято пользоваться первым термином в широком смысле слова,
когда сердце имеет одну желудочковую камеру и вторым — вари-
ант единственного желудочка, когда его внутренняя поверхность
характеризуется признаками, свойственными правому и левому
желудочкам. М. Abbott (1936) впервые предложил наименование
«сердце Холмса», описывая единственный желудочек с нормаль-
ным (без транспозиции) отхождением крупных сосудов и легоч-
ным стенозом.
Частота единственного желудочка составляет по клиническим
данным 1—3,2 % (Gasul В. et al., 1966; Rahimtoola S. et al.,
1966), по патологоанатомическим — 1,5% (Bankl H., 1980).
Анатомия, классификация. Многообразием анатомических ва-
риантов единственного желудочка (ЕЖ) и сопутствующих ему
ВПС объясняют большое число предложенных классификаций.
Наибольшее применение получила классификация порока R. Van
Praagh и соавт. (1964), в основу которой положены анатоми-
ческое строение желудочковой камеры и характер взаимоот-
ношения магистральных сосудов. Согласно этой классификации
выделяют 4 типа (А, В, С, D). При типе А (78 %) единствен-
ный желудочек представлен миокардом левого желудочка (тол-
стая стенка с множеством тонких трабекул), приточный отдел
правого желудочка отсутствует, но имеется небольшая рудимен-
тарная камера выводного тракта (миокард инфундибулярного
отдела) правого желудочка — «выпускник» (В). Последний со-
общается с единственным желудочком через бульбовентрикуляр-
ное отверстие; в полость предсердий выпускник выхода не имеет.
Папиллярные мышцы обоих атриовентрикулярных клапанов рас-
полагаются на одной стороне желудочка. При типе В (5%) весь
миокард имеет строение правого желудочка (тонкий миокард и
несколько грубых трабекул), выпускника нет. Тип С (7%) —
миокард имеет строение как правого, так и левого желудочка
(общий желудочек), но межжелудочковая перегородка отсутст-
вует или имеется ее рудимент. Последний тип D (10%) не имеет
дифференцировки миокарда (неопределенная структура), нет ни
выпускника, ни межжелудочковой перегородки.
282
Каждый из анатомических типов порока сопровождается
нормальным (I тип), D (декстро)-транспозиционным (II тип —
сосуды расположены как при полной транспозиции), L (лево)-
транспозиционным (III тип — сосуды расположены как при кор-
ригированной траспозиции) положением аорты относительно
легочного ствола. Наиболее распространенным (74—79%) ти-
пом порока является единственный желудочек с «выпускником»
для аорты и L-транспозиционным положением магистральных
сосудов (тип А III). Все варианты могут встречаться в условиях
нормального, обратного и неопределенного расположения внут-
реннего расположения внутренних органов.
При А типе порока выпускник представляет собой гладко-
стенную, варьирующую в размерах камеру, от 1,5X1 до 3,5Х
Х2,5 см, расположенную на передней поверхности сердца, от
которой отходят один или оба магистральных сосуда. Мощный
мышечный тяж, отделяющий выпускник от полости желудочка,
вероятно, следует считать неправильно расположенной межже-
лудочковой перегородкой, так как в его толще проходит пучок
Гиса. Выпускник обычно рассматривается как часть выводного
тракта единственного желудочка, а не как отдельный желудо-
чек: кровь в выпускник поступает из полости желудочка, а не
предсердия. Небольшие размеры отверстия, ведущего в выпуск-
ник, могут уменьшать объем протекающей через него крови и,
таким образом, играть роль подклапанного стеноза. Атриовент-
рикулярные клапаны обычно не сообщаются с выпускником.
Существует определенная закономерность в отхождении от
выпускника аорты или легочной артерии в зависимости от их
положения. При нормальном расположении магистральных со-
судов от выпускника отходит легочная артерия (или оба сосуда),
при транспозиции — аорта (или оба сосуда). При D-транспози-
ции аорты выпускник занимает переднеправое положение, а
при L-транспозиции — переднелевое положение.
Поскольку имеется два открытых атриовентрикулярных кла-
пана, определение единственного желудочка исключает атрезию
одного из них. Иногда отверстия митрального и трикуспидаль-
ного клапанов сливаются и образуют общий атриовентрикуляр-
ный клапан. При инверсии магистральных сосудов нередко от-
мечается и инверсия атриовентрикулярных клапанов. Приведен-
ная классификация имеет скорее теоретический интерес. В кли-
нической же практике чаще встречаются анатомические ва-
рианты ЕЖ, представленные на рис. 79.
Из сопутствующих пороков следует отметить стеноз легочной
артерии (64%), ДМПП (40%), аномалии расположения серд-
ца (14%). Реже встречаются открытый артериальный проток,
коарктация аорты, аномальный дренаж легочных вен.
Гемодинамика. Особенность гемодинамики при единственном
желудочке заключается в смешивании потоков артериальной
и венозной крови в единственной камере. Аорта и легочная ар-
терия, отходящие непосредственно от желудочковой полости или
283
Рис. 79. Единственный желудочек сердца. Схема наиболее распространенных
вариантов.
а — единственный (общий) неразделенный желудочек с нормальным расположением
магистральных сосудов; б. в, г — единственный левый желудочек с выпускником для
легочного ствола (6) или аорты (в, г).
от выпускника, имеют одинаковое системное давление, при от-
сутствии стеноза легочной артерии с рождения существует ги-
пертензия малого круга кровообращения. Начальное низкое со-
противление легочных сосудов приводит к значительной гипер-
волемии малого круга кровообращения. В связи с увеличением
минутного объема малого круга кровообращения возрастает объ-
ем крови, поступающей из левого предсердия в желудочек, ко-
торый превосходит объем венозной крови, поступающей из пра-
вого предсердия, в желудочке происходит смешивание большо-
го объема оксигенированной крови с меньшим объемом веноз-
ной крови. У таких больных отсутствует артериальная гипоксе-
мия или она минимальна. При склеротических изменениях в
легочных сосудах уровень гипоксемии возрастает.
284
Наличие стеноза легочной артерии вызывает дефицит легоч-
ного кровотока, в результате чего в желудочке смешиваются
относительно небольшие объемы артериальной крови с большими
объемами венозной, насыщение артериальной крови кислородом
значительно снижается, имеется выраженный цианоз. Стеноз
легочной артерии встречается в половине случаев при L-транс-
позиции сосудов, течение порока более благоприятное и напо-
минает тетраду Фалло.
В ряде случаев степень артериальной гипоксемии зависит
и от внутрижелудочкового разделения потоков крови и от типа
расположения магистральных сосудов: большая степень арте-
риальной гипоксемии наблюдается при D-транспозиции, чем при
L-транспозиции, так как струя крови из легочных вен направ-
ляется преимущественно в аорту, расположенную слева, а кровь
из полых вен — в легочную артерию.
Клиника, диагностика. Единственный желудочек чаще диаг-
ностируют вскоре после рождения и у 2/з больных в течение
первых 6 мес жизни. Порок встречается чаще (в 2—4 раза) у
мальчиков. При отсутствии стеноза легочной артерии сразу пос-
ле рождения, когда давление в легочной артерии падает, зна-
чительно возрастает легочный кровоток, появляются повторные
пневмонии, отставание в физическом развитии, одышка, застой-
ные хрипы в легких, тахикардия, увеличение печени, т. е. кли-
ническая картина похожа на ДМЖП с большим левоправым
сбросом.
Более чем у 2/з больных выявляется цианоз, который бывает
сразу после рождения или появляется в возрасте 1—2 лет. Циа-
ноз, как правило, выражен нерезко, имеет голубой оттенок,
локализуется на губах, кончиках пальцев, усиливается при кри-
ке и физической нагрузке. Артериальную гипоксемию подтверж-
дают положительный симптом «часовых стекол» и «барабанных
палочек», снижение насыщения капиллярной крови кислородом.
Цианоз более выражен при сопутствующем стенозе легочной ар-
терии. Следует помнить, что у детей первых лет жизни с анемией
цианоз может быть едва заметным и нарастает на фоне пере-
ливания крови. Взрослые больные значительно отстают в физи-
ческом развитии, имеют выраженный цианоз, предъявляют жа-
лобы на одышку, при небольшой нагрузке боли в сердце.
Сердечный горб определяется у 1 /3 больных. Сердечный тол-
чок разлитой, приподнимающийся, границы сердца расширены
в обе стороны, возможно систолическое дрожание (локализация
выпускника). Следует помнить о частом сочетании порока с
декстро- и левокардией. При аускультации выслушивается гром-
кий 1 тон, II тон над легочной артерией усилен (легочная гипер-
тензия или левопозиция аорты), единый или слабо расщеплен,
пансистолический шум (прохождение крови через выпускник)
определяется в сочетании с III тоном и мезодиастолическим
шумом вдоль левого края грудины и на верхушке (отражает
повышенный кровоток через митральный клапан). На верхушке
285
может выслушиваться систолический шум недостаточности мит-
рального клапана. При сочетании со стенозом легочной артерии
в третьем межреберье слева имеется грубый систолический
шум типа изгнания.
Полиморфизм изменений на ЭКГ при единственном желудоч-
ке связан с большим количеством анатомо-гемодинамических
особенностей. Общими для всех вариантов порока являются вы-
сокий вольтаж комплексов QRS в стандартных и грудных отве-
дениях, стереотипные rS, RS или RS во всех грудных отведениях,
несоответствие между типом гипертрофии желудочка и характе-
ром отклонения электрической оси сердца [Вахидова Л. Р.,
1986]. Кроме перечисленных признаков, для типа А порока
(единственный левый желудочек) характерна гипертрофия мио-
карда обоих желудочков, электрическая ось сердца отклонена
влево, нерезко вправо или имеет горизонтальное положение, воз-
можна перегрузка обоих предсердий. При сопутствующем сте-
нозе легочной артерии электрическая ось сердца расположена
нормально (Za A QRS около 4-40°), при нормальном положе-
нии аорты и D-транспозиции преобладают признаки гипертро-
фии левого, при L-транспозиции — правого желудочков. При ти-
пе В порока (единственный правый желудочек) на ЭКГ имеется
резкое преобладание гипертрофии правого желудочка. Для боль-
ных с единственным желудочком характерны различного *вида
нарушения ритма, атриовентрикулярные блокады. ФКГ не имеет
самостоятельного диагностического значения.
В большинстве случаев рентгенологическое исследование ока-
зывается полезным лишь для оценки степени кардиомегалии,
состояния легочного кровотока и выявления аномалий располо-
жения сердца. У всех больных, особенно при увеличенном ле-
гочном кровотоке, отмечается увеличение сердца за счет «пра-
вого» желудочка и предсердия, реже — за счет «левого» желу-
дочка. Сосудистый пучок при D-транспозиции чаще бывает уз-
ким. При L-транспозиции левый контур сосудистого пучка пред-
ставлен одной уплощенной дугой — контуром восходящей аорты,
переходящей в небольшое выбухание, образованное «выпускни-
ком», ниже него расположена дуга желудочка [Бураков-
ский В. И., Иваницкий А. В., 1982]. При стенозе легочной ар-
терии рисунок обеднен, тень сердца небольшая, напоминает та-
ковую при тетраде Фалло. Однако одновременно имеется вы-
бухание восходящей аорты по верхнему левому краю сердечной
тени.
Эхокардиография позволяет диагностировать порок по сле-
дующим симптомам: I) два атриовентрикулярных клапана про-
слеживаются одновременно, во время диастолы соприкасаются
и не разделены межжелудочковой перегородкой, реже опре-
деляется единственный клапан; 2) межжелудочковая перего-
родка отсутствует; 3) определяется большой диастолический
размер общего желудочка, но с уверенностью высказаться о
морфологическом строении желудочковой камеры не предстанля-
286
ется возможным; 4) у многих больных над желудочковой поло-
стью лоцируется дополнительная камера, не содержащая атрио-
вентрикулярного клапана,— полость выпускника [Митина И. Н.
и др., 1983]; 5) уточняется характер отхождения магистраль-
ных сосудов, чаще обнаруживается заднерасположенный сосуд.
При нормальном расположении магистральных сосудов опреде-
ляется митрально-аортальный, а при их транспозиции — мит-
рально-легочный контакт. Двухмерная эхокардиография в проек-
ции 4 камер с верхушки позволяет идентифицировать общую
камеру с одним или двумя атриовентрикулярными клапанами и
полость выпускника, транспозицию магистральных сосудов.
При зондировании полостей сердца катетер проводится че-
рез нижнюю полую вену в правое предсердие и входит в боль-
шую камеру через трехстворчатый клапан, далее в аорту и с
определенными трудностями — в легочную артерию. В случаях
ДМПП катетер проникает в ту же полость через двустворчатый
клапан. В переднезадней проекции у больных с [.-транспозици-
ей магистральных сосудов аорта локализуется вдоль левого
стернального края кпереди от легочной артерии. В большинстве
случаев обнаруживается равное давление в аорте, легочной ар-
терии (при отсутствии стеноза) и общей камере. Характерно
умеренное повышение оксигенации крови в полости желудочка
по сравнению с правым предсердием (на 5—25%), отличие по-
казателей насыщения крови кислородом в отдельных пробах,
взятых из желудочковой камеры, доходящее до 10—17%, сни-
жение насыщения кислородом артериальной крови, одинаковое
в полости желудочка и аорте.
При введении контрастного вещества в единственный желу-
дочек (рис. 80) выявляется расширенная желудочковая по-
лость, занимающая большую часть сердечной тени как в пря-
мой, так и боковой проекции. Чаще единственный желудочек
обнаруживает гладкие внутренние контуры и треугольную фор-
му, т. е. внутреннюю архитектонику левого желудочка, реже —
грубую трабекулярность, свойственную правому желудочку.
Важное диагностическое значение имеет контрастирование
из полости единственного желудочка выпускника (на рис. 80
указан стрелкой). В прямой проекции у больных с нормальным
расположением магистральных сосудов и L-транспозицией вы-
пускник располагается на переднелевой поверхности сердца;
в первом случае от него отходит легочная артерия, во втором —
аорта. У сольных с D-транспозицией выпускник контрастируется
на переднеправой поверхности сердца, от него отходит аорта.
Введение контрастного вещества в «выпускник» позволяет до-
казать отсутствие сообщения его с предсердиями (отличие от
второго желудочка).
Дифференциальный диагноз. Единственный желудочек следу-
ет дифференцировать с ДМЖП, открытым общим атриовентри-
кулярным каналом, полной и корригированной транспозицией
аорты и легочной артерии.
287
Рис. 80. Единственный
желудочек. Ангиокар-
диограмма.
а — прямая проекция,
б — боковая проекция.
Течение, лечение. Почти 75 % больных с единственным же-
лудочком погибают на первом году жизни [В. И. Бураковский
и Б. А. Константинов, 1970]. В литературе встречаются описа-
ния единичных больных, которые дожили до 56 и более лет.
Средняя длительность жизни больных с единственным желу-
288
дочком сердца, по данным J. Liebman и соавт. (1969), состав-
ляет всего 6, 7 лет. Более высокая смертность наблюдается
в группе больных с легочной гипертензией, чем с легочным
стенозом. Наиболее частыми причинами смерти без операции яв-
ляются нарушения сердечного ритма, сердечная недостаточность
на фоне пневмонии, прогрессирующая гипоксемия.
Показания к хирургическому лечению диктуются тяжестью
течения заболевания и совершенной бесперспективностью прог-
ноза при естественном течении порока. Больным с Единственным
желудочком выполняются паллиативные операции, возможна
радикальная коррекция порока. Первая успешная операция по
разделению единственного желудочка выполнена J. Kirklin в
1956 г., в нашей стране создание межжелудочковой перегородки
у больной с общим или неразделенным желудочком произведе-
но В. А. Бухариным в 1975 г., а единственного левого желу-
дочка с левотранспозицией аорты В. П. Подзолковым и соавт.
(1988).
Паллиативные операции показаны больным при сопутствую-
щих пороках, которые не позволяют осуществить радикальную
коррекцию, и у детей раннего возраста. Выбор паллиативной
операции определяется состоянием кровотока в малом круге кро-
вообращения. При резко увеличенном легочном кровотоке и вы-
сокой легочной гипертензии показана операция сужения легоч-
ной артерии, она способствует уменьшению сердечной недоста-
точности и защищает малый круг от развития склеротической
формы легочной гипертензии. У больных с тяжелым стенозом
легочной артерии и выраженной артериальной гипоксемией по-
казано наложение аортолегочного анастомоза по Блелоку—Таус-
сиг.
Показания к радикальной операции создания межжелудоч-
ковой перегородки находятся в стадии разработки, поскольку
число этих операций крайне мало и они сопровождаются пока
высокой летальностью. Необходимым условием для успешного
проведения операции являются достаточно большие размеры
единственной желудочковой полости и правильно сформирован-
ные атриовентрикулярные клапаны. В настоящее время хирурги-
ческое разделение желудочка возможно при единственном ле-
вом желудочке с L-транспозицией аорты по отношению к легоч-
ному стволу и при общем желудочке с нормальным располо-
жением магистральных сосудов. Разделение желудочка плани-
руется таким образом, чтобы образовались две камеры, имею-
щие достаточные объемы для обеспечения кровью обоих кругов
кровообращения. Важный вопрос — выбор материала для запла-
ты. В. П. Подзолков и соавт. (1988) предлагают использовать
заплату, представляющую собой дубликатуру из ксеноперикарда
и синтетической ткани, которая менее податлива к выбуханию
в полость вновь образованного венозного желудочка, а ксено-
перикардиальный ее фрагмент, обращенный в полость артери-
ального желудочка, исключает ее проницаемость.
10—976
289
Если невозможно выполнить радикальную коррекцию, то
предпочтение отдается гемодинамической коррекции порока [Бу-
харин В. А., Подзолков В. П., 1977, 1979; Gale A. et al., 1979].
Идея операции состоит в том, что функцию нагнетания всей ве-
нозной крови в малый круг кровообращения должно выполнять
правое предсердие, а циркуляция оксигенированной крови в
большом круге должна осуществляться единственным желудоч-
ком. Показания к операции Фонтена сформулированы A. Chous-
sat (1978) (см. главу 17). Смысл операции заключается в том,
чтобы венозную кровь, поступающую по полым венам, напра-
вить из правого предсердия, минуя желудочек, в легочный
ствол, а артериальную кровь, поступающую из левого предсер-
дия,—в желудочек и аорту. Из правого предсердия закрывают
заплатой правое атриовентрикулярное отверстие, перевязывают
проксимальную часть легочного ствола и формируют предсердно-
легочное соустье. При невозможности выполнения прямого со-
устья между правым предсердием и легочным стволом может
быть вшит клапансодержащий или бесклапанный протез.
После операции создания межжелудочковой перегородки наи-
более частым осложнением является острая сердечная недоста-
точность, связанная с исходной тяжестью больных, техническими
трудностями коррекции порока, ведущими к развитию прлной
поперечной блокады. Из осложнений гемодинамической коррек-
ции единственного желудочка сердца, сочетающегося с легоч-
ным стенозом, отмечают острую сердечную недостаточность,
обусловленную недостаточной нагнетательной функцией правого
предсердия и почечно-печеночную недостаточность.
В силу технических трудностей радикальное хирургическое
лечение порока развивается крайне медленно и сопровождается
высокой летальностью. R. f'eldt и соавт. (1981) на 45 радикаль-
ных операций отметили 21 летальный исход в раннем после-
операционном периоде (47%) и 8 — в отдаленном периоде
(18%). В. П. Подзолков и соавт. (1988) сообщают о 3 опера-
циях с 1 летальным исходом (33%). Летальные исходы чаще
всего наблюдались в тех случаях, где требовалось расширение
отверстия, ведущего в выпускник, и тогда, когда предваритель-
но была выполнена паллиативная операция или отмечены сопут-
ствующие пороки. Среди осложнений, наблюдающихся в отда-
ленном периоде, отмечают частичное отхождение заплаты, раз-
деляющей желудочек, с возникновением сброса крови слева на-
право, нарушения ритма сердца.
Гемодинамическая коррекция единственного желудочка так-
же сопровождается высокой летальностью (до 30 %) [Gale А.
et al., 1979; Stefanelli Y. et al., 1984]. Наибольшим опытом
лечения данного порока располагает G. Danielson (1983), кото-
рый отмечает, что при соблюдении всех показаний к операции,
которые разработаны A. Choussat и соавт. (1977), смертность
можно снизить до 5—10%. В нашей стране наибольшим опы-
том располагает Институт сердечно-сосудистой хирургии им.
290
A. H. Бакулева АМН СССР, в котором на 1 мая 1987 г. выпол-
нено 14 операций с двумя летальными исходами—14% [Под-
золков В. П. и др., 1988].
Отдаленные результаты операции Фонтена при единственном
желудочке сердца благоприятные. Пациенты становятся актив-
ными, повышается толерантность к нагрузке, исчезает цианоз,
насыщение артериальной крови кислородом составляет 90—
96%. Некоторые пациенты периодически продолжают получать
дигоксин и диуретики.
Глава 20. АНОМАЛИИ РАЗВИТИЯ КОРОНАРНЫХ
АРТЕРИЙ
Порокам развития КА принадлежит большое место в. генезе
коронарной гипоперфузии и инфаркта миокарда у детей. Ано-
малии КА приводят не только к острой, но и хронической коро-
нарной недостаточности, которая на аутопсии проявляется рас-
пространенными некротическими и рубцовыми изменениями мио-
карда. Клинические проявления коронарной недостаточности лю-
бой этиологии сходны, в основном это приступы внезапного
беспокойства у маленьких детей и типичный ангинозный статус
у старших. Нередко сразу возникает кардиогенный шок у вроде
бы здорового ребенка. При появлении сердечной недостаточнос-
ти возникают такие симптомы, как одышка, цианоз, кашель, рво-
та, тошнота и диарея.
Рентгенография грудной клетки не помогает в установлении
диагноза порока коронарных сосудов и выявляет обычно в раз-
ной степени увеличенное сердце. При хроническом течении кос-
венным подтверждением может быть аневризма левого же-
лудочка.
Ишемию или инфаркт миокарда можно достоверно диагности-
ровать только на ЭКГ. Ведущим признаком острого инфаркта
миокарда на ЭКГ является подъем выше изолинии сегмента
ST и слияние его с зубцом Т. Для трансмурального инфаркта
характерно исчезновение зубца R, в связи с чем комплекс QRS
принимает форму QS. Типичный признак интрамурального ин-
фаркта миокарда — патологический зубец Q при сохранении зуб-
ца R, хотя амплитуда последнего может быть снижена, одновре-
менно выявляются глубокие отрицательные зубцы Т. При ин-
фаркте боковой стенки левого желудочка и верхушки изменения
фиксируются в. отведениях I, 11, aVL, Vs 6, при инфаркте перед-
ней стенки и передней части перегородки — в правых грудных
отведениях (Vi—V4), задней стенки левого желудочка — во II.
Ill, aVF отведениях. Следует помнить, что при многих аномалиях
КА благодаря компенсаторным сосудистым изменениям откло-
нения на ЭКГ отсутствуют или минимальные.
В последнее время для диагностики инфаркта миокарда и
косвенно аномалий КА применяют обследование с радионукли-
10*
291
Рис. 81. Аномальное отхождение левой коронарной артерии от легочного ствола.
Перфузионная сцннтнфотограмма миокарда. Объяснение в тексте.
ПК А — правая коронарная артерия; ПМЖВ передняя межжелудочковая ветвь,
ОВ — огибающая ветвь. ANT передняя проекция, LAO левая передняя косая про-
екция, LAT — левая боковая проекция.
дами. Эти методы получили название «определение очага некро-
за миокарда». В организм вводят вещества с повышенной троп-
ностью к некротизированной (обычно используют радионуклид
технеция SST1). Для последних целей применяют препарат 20|Т1
(рис. 81). На перфузионной сцинтифотограмме миокарда с
20|Т1 определяется аномальное отхождение левой коронарной
артерии от легочного ствола, передневерхушечная аневризма
левого желудочка. Определяются дефекты перфузии переднебо-
ковой и передневерхушечной области левого желудочка (штри-
хованные участки на рис. 81). Общая площадь поражения мио-
карда составляет 30—35%; в области аневризмы—10—15%
от площади левого желудочка.
Нарушение сократимости миокарда, зоны гипо- и акинезии
можно выявить с помощью эхокардиографии, особенно двух-
мерной. При выраженной гипокинезии контур систолы по эхо-
кардиограмме в месте поражения очень близко подходит к кон-
туру диастолы; при акинезии стенка левого желудочка в сис-
толу и диастолу будет иметь на каком-то участке общий контур.
КА легче увидеть у больных со снижением миокардиальной
контрактильности, что уменьшает движение аорты; устье правой
КА выявляется труднее, чем левой.
Для диагностики поражения КА информативна коронарогра-
фия, она показана при стойкой, рецидивирующей боли в области
292
сердца, признаках старых и свежих инфарктов миокарда на ЭКГ,
ишемических изменениях и опасных для жизни аритмиях в покое
и при пробе с дозированной физической нагрузкой (после вклю-
чения миокардита, кардиомиопатии и др.), а также тогда, когда
радионуклидные методы выявляют область аваскуляризации.
Аномалии КА у детей могут встречаться в изолированном
виде и сочетании с ВПС (стеноз и коарктация аорты, тетрада
Фалло, транспозиция магистральных сосудов и др.). Частота
различных типов аномалий КА составляет 0,3 % от общего
числа невыборочных аутопсий и 1,1 на 1000 случаев ВПС [Bankl
Н., 1980]. Аномалии могут быть гемодинамически незначимыми
(малые аномалии) (единая КА от аорты, аномалии устьев, доба-
вочные КА и др.) и значимыми (большие аномалии) (коронар-
ные фистулы, отхождение КА от легочной артерии, отхождение
левой КА от правого синуса Вальсальвы и др.). Малые анома-
лии доброкачественные, большие вызывают нарушение сердечной
деятельности, сердечную недостаточность с возможным леталь-
ным исходом.
Аномалии устьев могут быть представлены их смещением по-
отношению к синусам Вальсальвы и друг к другу; возможно вы-
сокое расположение одной из артерий, смещение ее к краю кла-
пана, отхождение обеих артерий одним широким устьем. Ано-
малии числа КА выражаются в его увеличении до 3—4 или
уменьшении до одной венечной артерии. Единая КА встречалась
с частотой 3 на 1056 человек [Hillestad L., Eie Н., 1971], 1 на
7000 [Kimbris D. et al., 1978] без других ВПС. Обычно это по-
рок с доброкачественным течением, исключение составляют слу-
чаи, когда основной ствол расположен между аортой и легочной
артерией. J. Megesh и соавт. (1986) при обследовании 20 детей
первого года жизни с гипертрофической кардиомиопатией в
40 % случаев нашли единую КА.
На основании данных литературы и собственных исследова-
ний А. В. Смольянников и Т. А. Наддачина (1964) выделили
следующие аномалии: 1) единственная КА; 2) добавочные КА;
3) отхождение левой (реже обеих) КА от легочной артерии;
4) отхождение левой КА от правого синуса Вальсальвы; 5) вы-
сокое расположение устья одной из КА; 6) отщепление дисталь-
ного отдела одной из КА в коронарной борозде; 7) агенезия пе-
риферического участка одной из КА; 8) врожденные аневризмы
КА. На рис. 82 представлены основные варианты аномалий КА,
имеющих значение для практического врача.
Аномальное отхождение левой коронарной артерии от легоч-
ной артерии (синдром Бланда—Уайта—Гарленда). Первое опи-
сание аномального отхождения левой коронарной артерии
(ЛКА) от легочной артерии (АОЛКА от ЛА) (см. рис. 82) при-
надлежит Н. Brooks (1985) и М. Abbott (1908). В отечественной
литературе АОЛКА от ЛА впервые описано А. И. Абрикосовым
в 1911 г. у 3-месячного ребенка. В 1933 г. Е. Bland, Р. White и
S. Garland приводят классические клинико-электрокардиографи-
293
ЯНА
Рис. 82. Варианты наиболее распространенных аномалий коронарных артерий.
а - нормальный ход; б — аномальное отхождение левой коронарной артерии от
правого коронарного синуса; в — аномальное отхождение правой коронарной артерии
(ПКА) от левого коронарного сннуса; г аномальное отхождение левой коронарной
артерии от легочной; Лин — левая передняя нисходящая, Ло -левая огибающая.
ческие признаки этого порока сердца, в связи с чем его назы-
вают синдромом Бланда—Уайта Гарленда.
АОЛКА от ЛА составляет 0,25—0,5 % от всех ВПС [Gasul
М. et al., 1966]. При патологоанатомическом исследовании об-
наруживают резко увеличенное, шарообразное сердце с дилати-
рованным преимущественно левым желудочком; как правило, в
нем имеется выраженный фиброэластоз эндокарда. Папиллярные
мышцы гипертрофированы и деформированы в результате скле-
роза. Более чем в половине случаев мы наблюдали аневризму
на переднебоковой стенке левого желудочка или в области вер-
хушки, т. е. в местах, кровоснабжающихся из левой КА. Не-
редко обнаруживаются свежие субэндокардиальные или транс-
муральные инфаркты миокарда левого желудочка. Левая КА
чаще отходит от левого синуса Вальсальвы легочной артерии,
значительно дилатирована; устье правой КА находится в правом
коронарном синусе аорты, она выглядит расширенной и изви-
той. На передней поверхности сердца видна широкая сеть меж-
коронарных анастомозов. При наполнении КА определяется
как достаточное их количество, так и значительное уменьше-
ние, особенно в зоне инфаркта.
Вопросы гемодинамики при АОЛКА от ЛА до сих пор оста-
ются спорными. В настоящее время с помощью коронарогра-
фии показано, что кровь в левую КА поступает не из легочной
артерии, а через межкоронарные анастомозы из правой КА,
отходящей от аорты, т. е. идет левоправый сброс из области
высокого давления (аорта, правая КА) в область более низкого
давления (левая КА, легочная артерия). В связи с этим выжи-
вание больных с АОЛКА от ЛА определяют коллатеральный
кровоток в миокарде на момент рождения и дг льнейшая его
294
динамика. Количество коллатералей, с которыми рождается ребе-
нок, предопределено во многом генетически. Однако градиент
давления между правой и левой КА и гипоксия миокарда могут
служить стимулом для их развития. Показано, что анастомозы
хорошо развиты во всех отделах сердца, кроме передней стенки
левого желудочка. Определенное значение имеет тип кровоснаб-
жения миокарда. При правом типе кровообращения течение
АОЛКА от ЛА бывает более благоприятным. Ишемия миокарда
может быть вторичной по отношению к низкому перфузионному
давлению в результате ухода крови через коллатерали из правой
в левую КА и'далее в легочную (коронарный steal-синдром),
чем и объясняются стенокардические приступы у детей. При
выраженном «синдроме обкрадывания» особенно страдает суб-
эндокардиальный кровоток. Это является одной из причин фиб-
роэластоза эндомиокарда при АОЛКА от ЛА.
Многие авторы неоднократно пытались классифицировать
варианты клинического течения порока. Так, D. Cooley (1950),
М. Aguston (1962) впервые выделили 2 варианта АОЛКА от
ЛА: «детский» (с малым количеством межкоронарных анасто-
мозов) и «взрослый» (большое количество межкоронарных ана-
стомозов, обеспечивающих длительное выживание), различные
по клинико-инструментальным показателям и прогнозу. Позже
J. Edwards (1964) и другие авторы выделили «промежуточный»
тип и описали их не как варианты, а как три гемодинамические
фазы этого порока. В дальнейшем была определена четвертая
фаза, когда кровоток в миокарде вновь уменьшается из-за раз-
вития steal-синдрома («синдром обкрадывания»). Придержи-
ваясь функционального подхода к оценке состояния больного
с этой патологией, в течении АОЛКА от ЛА можно также вы-
делить три стадии: декомпенсированную, субкомпенсированную
и компенсированную.
У большинства больных с АОЛКА от ЛА заболевание мани-
фестирует в первые 3 мес жизни, реже—во втором полугодии.
Первыми признаками являются нарушение общего состояния,
вялость, бледность кожных покровов, повышенная потливость
рвота, срыгивания, одышка, тахикардия. У половины больных от-
мечаются приступы внезапного резкого беспокойства с усилени-
ем одышки, бледности, потливости, которые иногда становятся
первым признаком болезни. Приступы беспокойства возникают
обычно после или во время кормления и длятся несколько ми-
нут. В это время выражение лица ребенка страдальческое, он
пронзительно кричит, вытягивает ноги, пульс становится ните-
видным. Иногда приступы сопровождаются повышением темпера-
туры до 38 °C, вскоре после приступа она нормализуется. Можно
думать, что повышение температуры при приступе связано с на-
рушением терморегуляции при остро возникшей гипоксии ЦНС.
Между приступами ребенок выглядит спокойным и только одыш-
ка выдает заболевание сердца. Эти приступы названы в лите-
ратуре “angina pectoris” из-за сходства с клиникой стенокар-
295
дии у взрослых. Общность явлений подтверждается и данными
аутопсии (признаки старых и свежих инфарктов миокарда).
Почти у '/з—'/г детей с АОЛ КА от ЛА в анамнезе отмечен
жидкий стул, у многих из них периоды его появления совпадали
с приступами одышки и беспокойства. Посевы кала для вы-
явления патологической флоры давали отрицательные результа-
ты. A. Matsumoto и соавт. (1976) также указывают, что одним
из первых симптомов при АОЛКА от ЛА были одышка и диарея.
Можно предположить рефлекторный характер нарушений со сто-
роны желудочно-кишечного тракта, как это бывает при стено-
кардии и инфаркте миокарда.
Многие дети в стадии декомпенсации заболевания отстают в
физическом развитии. У них рано развивается левосторонний
сердечный горб. Верхушечный толчок разлитой, ослабленный,
смещенный в шестое межреберье. Границы сердца расширены
преимущественно влево и свидетельствуют о кардиомегалии. То-
ны сердца чаще приглушены, нередко выслушивается систоли-
ческий шум недостаточности митрального клапана, причинами
которой могут быть хроническая ишемия или инфаркт папилляр-
ных мышц (чаще передней), дилатация полости левого желу-
дочка, деформация створок митрального клапана. Продолжи-
тельный негрубый систолический шум, максимально во втором
межреберье слева, напоминающий шум при ОАП и отражаю-
щий сброс крови из левой КА в легочную, чаще начинает вы-
слушиваться на 2—3-м году жизни. Сердечная недостаточность
выражена больше по левожелудочковому типу.
В стадии субкомпенсации самочувствие больных приближа-
ется к удовлетворительному, приступы отсутствуют и появляются
жалобы на боли в сердце. Размеры сердца увеличены умеренно
влево, сердечная недостаточность соответствует ПА стадии.
В стадии компенсации («взрослый» тип) жалоб нет, при аускуль-
тации выслушивается шум недостаточности митрального клапана
и/или систолодиастолический шум. Эта стадия в одних случаях
формируется постепенно, имея в начале проявления выражен-
ной декомпенсации, в других — с рождения ребенка состояние
остается стабильным, жалоб нет, из-за чего заболевание сердца
долго не диагностируется. В таких случаях внезапно среди
«полного здоровья», в различном возрасте (от 3 до 25 лет и поз-
же) появляются одышка, загрудинная боль при нагрузке, затем
в покое, реже приступы стенокардии, возможна внезапная
смерть.
Основное диагностическое значение при АОЛКА от ЛА имеет
электрокардиографическое обследование. Почти в половине
случаев обнаруживается выраженное отклонение электрической
оси сердца влево из-за блокады передней левой ветви пучка
Гиса. Характерный симптом на ЭКГ — глубокий, уширенный зу-
бец Q в отведениях I, aVL, Vs 6, максимально в aVL. В стадии
декоменсации такие изменения нередко сочетаются с подъемом
сегмента ST выше изолинии на 3—6 мм и уменьшением ампли-
296
Рис. 83. Аномальное отхождение левой коронарной артерии от легочной. ЭКГ
больного 3 мес.
туды зубца R, что соответствует картине острого инфаркта мио-
карда (рис. 83). В то же время у детей с застывшими глубокими
зубцами Q, но без подъема сегмента ST на аутопсии отмечаются
следы ранее перенесенного инфаркта миокарда, распространен-
ный кардиосклероз и гипертрофия межжелудочковой перегород-
ки. Диагностическую значимость при АОЛКА от ЛА имеет «про-
вал» амплитуды зубца R в отведениях V3 и V4 (морфология
комплекса становится в виде rS, QS, Qr), свидетельствующий
о перенесенном инфаркте миокарда. В стадии субкомпенсации
и компенсации сохраняются признаки гипертрофии миокарда
297
левого желудочка с субэндокардиальной ишемией (смешение на
2 -4 мм ниже изолинии сегмента STi,a\/L.vS6r отрицательные
зубцы Т), зубец Q остается глубоким в отведении aVL, реже
1, V5.6.
На рентгенограмме органов грудной клетки обнаруживается
кардиомегалия (увеличены преимущественно левые отделы).
Иногда из-за аневризмы видно выбухание левого контура сердца.
В стадии компенсации сердце может быть почти нормальных
размеров.
В последнее время в диагностике АОЛКА от ЛА все шире
используется эхокардиография. Одномерная эхокардиография не
позволяет дифференцировать АОЛКА от ЛА от застойной кар-
диомиопатии: регистрируется дилатированная полость со слабой
сократительной способностью миокарда левого желудочка, сме-
щение митрального клапана к задней стенке левого желудочка,
избыточная экскурсия межжелудочковой перегородки, уменьше-
ние экскурсии задней стенки левого желудочка, дилатация ле-
вого предсердия, усиление эхосигнала от эндокарда. Двухмерная
эхокардиография позволяет установить только предположитель-
ный диагноз, поскольку не во всех случаях удается определить
устья КА. Заподозрить порок можно по наличию в коротком
сечении аорты на уровне коронарных устьев расширенной пра-
вой коронарной артерии, при этом устье левой коронарной ар-
терии отсутствует. При выведении клапанов легочной артерии
сразу над ними можно увидеть левую КА. Допплер-эхокардио-
графия легочной артерии в месте отхождения левой КА показы-
вает ламинарный кровоток во время систолы и турбулентный —
в диастолу.
При зондировании полостей сердца отмечают увеличение
давления в легочной артерии и повышение насыщения крови
в ней кислородом: сброс крови из левой КА в легочную состав-
ляет 10—35 % минутного объема большого круга кровообраще-
ния. При селективной коронарографии контрастное вещество
вводится в расширенный ствол правой КА, из нее видно ретро-
градное заполнение системы левой КА через межкоронарные
анастомозы с последующим контрастированием легочной артерии
(рис. 84). При левой вентрикулографии имеется дилатация по-
лости левого желудочка, возможна его аневризма (рис. 85).
Тактика ведения детей с АОЛКА от ЛА заключается в ле-
чении сердечной недостаточности (дигоксин, диуретики), назна-
чении препаратов, улучшающих обменные процессы в миокарде
(кокарбоксилаза, солкосерил, цитохром С, оротат калия, ретабо-
лил, рибоксин, витамин В6), антикоагулянтов (ацетилсалицило-
вая кислота, курантил), анальгетиков, препаратов, улучшающих
микроциркуляцию (пармидин, трентал), транквилизаторов и се-
дативных средств (см. главу 22). Далее решается вопрос о хи-
рургической коррекции — перевязка левой КА, которая пресле-
дует цель ликвидировать steal-синдром, улучшить коронарное
кровообращение путем повышения перфузионного давления. Од-
298
Рис. 84. Аномальное отхождение левой коронарной артерии от легочной Селек-
тивная коронарограмма.
Рис. 85. Аномальное отхождение левой коронарной артерии от легочной Левая
вентрикулограмма.
нако эта операция превращает коронарную систему сердца
в систему единой коронарной артерии с сохранением риска вне-
запной смерти. Неудовлетворительные исходы операции мы
наблюдали у детей первых месяцев жизни. Это согласуется
с данными литературы о неэффективности оперативного лечения
у детей до 2 лет из-за неадекватного количества межкоронарных
анастомозов {Фальковский Г. Э. и др., 1980; Laborde F. et al.,
1981]. Если больные переживают критический период жизни
(1—2 года) на медикаментозном лечении, то затем у одних
детей состояние стабилизируется: уменьшаются одышка, тахи-
кардия, исчезают признаки сердечной недостаточности, дети
хорошо прибавляют в массе и к 4—6 годам не отличаются по
развитию от сверстников, размеры сердца сокращаются в ре-
зультате компенсаторной гипертрофии миокарда и коллатера-
лей. У других детей также наступает клиническое улучшение,
несмотря на сохраняющуюся кардиомегалию. Дети старше 2 лет
хорошо переносят перевязку левой КА. Положительная динами-
ка в клиническом статусе после операции в этом возрасте сви-
детельствует о большом значении steal-синдрома в ишемии мио-
карда. Однако в отдаленные сроки могут вновь появиться яв-
ления ишемии миокарда. Радикальная операция при АОЛКА
от ЛА заключается в пересадке левой КА, создании подключич-
но-коронарного анастомоза и аорто-коронарного шунтирования.
Эти операции более физиологичны, так как сохраняют двукоро-
нарную систему кровоснабжения сердца. Однако из-за айатоми-
ческих особенностей эти операции не всегда выполнимы у ма-
леньких детей.
В связи с этим в раннем детском возрасте перспективной
представляется методика внутрилегочного соединения восходя-
щей аорты с устьем левой коронарной артерии посредством
создания внутрилегочного туннеля [Hamilton D. et al., 1979;
Takeuchi S. et al., 1979].
В СССР данная методика операции впервые успешно при-
менена В. И. Бураковским (1989).
Хирургическая летальность в раннем детском возрасте высо-
кая и колеблется от 25 до 37 % [Фальковский Г. Э. и др., 1984;
Сабистон Д., Лоу Дж., 1984; Kirklin J., Barratt-Boyes В., 1986].
Причиной летальных исходов обычно является сердечная не-
достаточность, а у больных с перевязкой или ушиванием устья
левой коронарной артерии — слабо развитые межкоронарные
коллатерали. Напротив, летальность у больных школьного воз-
раста минимальна.
Отдаленные результаты радикальной операции (реваскуляри-
зации) благоприятные: исчезает сердечная недостаточность,
уменьшаются размеры сердца и признаки ишемии миокарда.
Прогноз при АОЛКА от ЛА без операции в большинстве
случаев неблагоприятный. Продолжительность жизни определя-
ется выраженностью межкоронарных анастомозов, steal-синдро-
ма, кардиосклероза и фиброэластоза, гемодинамической значи-
зоо
мостью митральной недостаточности. Почти 2/з больных без ле-
чения умирают на первом году жизни, 12—15% доживают до
старшего возраста, из них в дальнейшем половина умирает
внезапно после физической нагрузки или психической травмы.
Аномальное отхождение правой коронарной артерии от ле-
гочной артерии. Это редкая форма аномалии развития КА, ча-
ще гемодинамически незначимая, совместимая с жизнью. Впер-
вые описана Н. Brooks (1886). Правая КА отходит от правого
легочного синуса, следует, как обычно, в правой атриовентри-
кулярной борозде и дает нормальное разветвление. Ее стенки
тонкие, напоминают венозный канал. Гемодинамика: кровь из
нормально отходящей левой КА через межкоронарные анастомо-
зы поступает в правую КА и далее в легочную артерию. При
значительном левоправом шунте (steal-синдром) может возник-
нуть ишемия миокарда правого желудочка с увеличением в нем
конечно-диастолического давления, изменения меньше касаются
левого желудочка. При наличии steal-синдрома со временем мо-
жет развиться сердечная недостаточность. Порок будет иметь
неблагоприятное течение при правом типе кровообращения, ког-
да правая КА снабжает кровью миокард правого желудочка,
заднюю часть межжелудочковой перегородки и левого желудоч-
ка; в таких случаях возможно развитие фиброэластоза в пра-
вом и левом желудочке. В случаях более раннего атеросклеро-
тического поражения нормально отходящей левой КА возможна
внезапная смерть в молодом и зрелом возрасте. Больным с этим
пороком показано оперативное лечение, перемещение или реим-
плантация правой КА в восходящую аорту. В СССР первые
операции при этой аномалии выполнены В. И. Бураковским в
1986 и 1987 гг. Ближайшие и отдаленные результаты операции
благоприятные.
Аномальное отхождение единой коронарной артерии от ле-
гочной артерии. Этот порок встречается гораздо реже, чем
АОЛКА от ЛА. На аутопсии обнаруживают инфаркт миокарда,
распространенный кардиосклероз; единая КА вскоре после от-
хождения делится на правую и левую. Миокард при этом снаб-
жается плохо оксигенированной кровью из легочной артерии, к
тому же кровь поступает в КА под низким давлением, что рано
приводит к ишемии миокарда. Аномальное отхождение единст-
венной КА от легочной артерии несовместимо с жизнью, если
нет сопутствующего порока сердца (ДМЖП, ОАП). В таких слу-
чаях кровь в КА поступает под более высоким давлением, сос-
тояние детей менее тяжелое и аномалия сосудов является слу-
чайной находкой на операции. Коррекция сопутствующего по-
рока, устраняющая причину гипертензии в легочной артерии,
ведет к падению перфузионного давления в КА и быстрому ле-
тальному исходу. В случаях прижизненной диагностики воз-
можна операция иссечения устья единственной КА и пересадки
его в аорту.
Аномальное отхождение левой коронарной артерии от правого
301
(переднего) синуса Вальсальвы (см. рис. 82). Эта патология
является причиной внезапной смерти и острой коронарной не-
достаточности у детей и юношей, особенно занимающихся спор-
том, и в сочетании с АОЛКА от ЛА составляет основную часть
гемодинамически значимых аномалий КА. Левая КА распола-
гается между стволом легочной артерии и аорты под острым уг-
лом, в силу чего просвет ее сужен. Особенно ухудшается коро-
нарный кровоток во время физической нагрузки, когда давление
в аорте и легочной артерии повышается, что увеличивает сдав-
ление левой КА вплоть до ее окклюзии. М. Luther и соавт.
(1980) описывают внезапно умершего 14-летнего мальчика, у ко-
торого на секции обнаружено, что обе КА отходили от правого
синуса Вальсальвы, одновременно отмечено сужение на 75 %
ствола левой КА. В настоящее время описано более 35 случаев
этой аномалии, из них около 20 % больных умерло внезапно.
Менее опасно и реже встречается аномальное отхожде-
ние правой КА от левого коронарного синуса
(см. рис. 82). При остром угле между аортой и правой КА
и сдавлении последней магистральными сосудами также воз-
можна внезапная смерть из-за коронарной гипоперфузии. В кли-
нике у детей могут быть боль в сердце, аритмии в покое или
при физической нагрузке. „
Стеноз и атрезия устья коронарных артерий. Эта редкая
врожденная аномалия чаще касается левой КА [Koh Е. et. al.,
1989]. G. El-Said и соавт. (1973) описали 14-летнего мальчика
с атрезией устья левой КА, предъявляющего жалобы на боль в
сердце, утомляемость при нагрузке, синкопе; у него выслуши-
вался систолический шум на верхушке, на ЭКГ периодически
возникали желудочковые экстрасистолы, при велоэргометрии от-
мечено смещение ниже изолинии на 3 мм сегмента ST. При ко-
ронарографии выявлено ретроградное наполнение левой КА че-
рез коллатерали. Произведена операция наложения протеза из
v. saphena, соединяющего восходящую аорту с основным стволом
левой КА. Сходство клинической симптоматики и данных ЭКГ
у таких больных с фиброэластозом эндомиокарда является пово-
дом для диагностики изолированного фиброэластоза или АОЛКА
от ЛА. N. Molander (1982) описывает 19-летнего юношу, кото-
рый с 4 лет наблюдался по поводу недостаточности митрального
клапана; катетеризация (без коронарографии) не пролила свет
на этиологию страдания. Больной умер внезапно; на аутопсии:
старый и свежий инфаркт миокарда, выраженный стеноз ле-
вой КА. Данная патология может быть результатом внутриутроб-
ного воспаления, фибромышечной дисплазии, врожденного поро-
ка развития.
Ныряющие артерии (myocardial «bridges»). Распространяясь
субэпикардиально, КА местами погружаются в толщу миокарда,
а потом вновь появляются на его поверхности. Чаще «мураль-
ной» является левая передняя нисходящая ветвь. Эта аномалия
обнаруживается как у младенцев, так и у людей пожилого воз-
302
раста. Во время физической нагрузки погруженная часть КА
суживается, что и становится причиной острой коронарной недо-
статочности и внезапной смерти.
Коронарные фистулы (свищи). Первое описание данной ано-
малии принадлежит W. Krause (1865). Ее суть состоит в сооб-
щении КА с камерами сердца (предсердиями, желудочками),
реже — стволом легочной артерии. Частота составляет 0,13—
0,4 % среди больных с ВПС [McNamara J., Gross R., 1969;
Gilleberi С. и др., 1986]. Несколько чаще с полостями сердца
сообщается правая, чем левая КА, и фистула КА с правыми от-
делами обнаруживается во много раз постояннее, чем с левыми.
Н. Bank) (1980) выделяет следующие варианты коронарных фистул:
I) анастомоз КА с правыми отделами сердца (артериовенозная фистула)
(около 90 %): а) с правым желудочком; б) с правым предсердием; в) с коро-
нарным синусом; г) с легочной артерией; 2) анастомоз КА с левыми отделами
(артерио-артериальная фистула) (около 10 %): а) с левым предсердием; б) с ле-
вым желудочком.
При патоморфологическом изучении и на операции КА, имею-
щая фистулу, выглядит расширенной, нередко аневризматически
извитой, особенно при сообщении с полостью желудочков. С точ-
ки зрения гемодинамики этот порок представляет собой шунт с
синдромом «обкрадывания», что и является причиной возникаю-
щей при этом ишемии.
Клинические проявления коронарных свищей колеблются от
бессимптомных до выраженной сердечной недостаточности, ино-
гда с раннего возраста. Жалобы детей включают слабость,
вялость, боль в сердце, одышку при физической нагрузке. Одна-
ко ангинозный статус встречается при этой аномалии нечасто.
В связи с характером шума нередко таким детям ставят диагноз
ОАП, ДМЖП с аортальной недостаточностью, аортолегочного
свища, разрыва аневризмы синуса Вальсальвы, артериовенозных
свищей легких. С этими пороками и следует проводить дифферен-
циальную диагностику.
Систолическое дрожание при коронарной фистуле локализу-
ется чаще над областью правого желудочка. При аускультации
выслушивается продолжительный систолический шум с резко вы-
раженным диастолическим компонентом, больше во втором—чет-
вертом межреберье слева у грудины, реже на верхушке сердца
и справа по парастернальной линии. Существует определенная
связь между аускультативными проявлениями и местом впадения
фистулы: если свищ открывается в правое или левое предсердие,
то преобладает систолический компонент шума со среднесистоли-
ческим усилением; при впадении в левый желудочек имеется
громкий диастолический компонент (сброс крови идет преиму-
щественно в диастолу, так как в систолу отверстие фистулы час-
тично или полностью закрывается); при соединении фистулы с
правым желудочком имеются две фазы шума (систолическая и
диастолическая) одинаковой интенсивности. АД при коронарных
фистулах нормальное или увеличено пульсовое давление за счет
Зоз
Рис. 86. Врожденная фистула огибающей левой коронарной артерии с правым
предсердием. ЭКГ больного 2 лет 8 мес.
снижения диастолического. На ФКГ можно отличить систолодиа-
столический шум при ОАП и коронарной фистуле по следующим
критериям: при артериальном протоке систолический шум носит
крещендный (нарастающий) характер ко II тону, а диастоличе-
ский — декрещендный (убывающий) к I; при коронарной фисту-
ле — диастолический шум крещендный к I тону и систоличе-
ский— декрещендный ко II.
На ЭКГ при коронарной фистуле отклонений может не быть,
при большом сбросе появляются признаки гипертрофии миокарда
желудочков (рис. 86), ишемические изменения (в покое или при
велоэргометрии).
На рис. 87 представлена ЭКГ больного 45 лет с врожденной фистулой правой
коронарной артерии с правым желудочком и ретроградным заполнением дисталь-
ного сегмента правой КА через переднюю межжелудочковую ветвь левой КА
(стил - синдром). Объем артериовенозного сброса по фистуле — 45 %. Электро-
кардиографические признаки ишемии миокарда передней и переднебоковой стен-
ки ЛЖ. На рентгенограмме грудной клетки изменения появляются при выра-
женном шунте в виде кардиомегалии за счет дилатации той полости сердца,
в которую идет шунтирование крови.
Диагноз коронарной фистулы ставится только после корона-
рографии (рис. 88), зондирование полостей сердца не выявляет
порока, а указывает только на наличие левоправого шунта (при
фистулах в правые отделы). В последние годы появляются опи-
сания успешной диагностики коронарных свищей с помощью
двухмерной и допплер-эхокардиографии.
Показания к хирургической коррекции коро-
нарных свищей до конца не разработаны. Многие хирурги реко-
мендуют раннее оперативное вмешательство, сразу после уста-
304
новления диагноза, учитывая риск возможных осложнений и ми-
нимальную опасность самой операции. J. Tyrrell (1982) сообща-
ет об успешной операции закрытия коронарной фистулы у
5-дневного ребенка с тяжелой сердечной недостаточностью. Дру-
гие хирурги рекомендуют избирательный подход при показаниях
к хирургическому вмешательству в детстве в связи с возмож-
ностью спонтанного закрытия фистулы.
К осложнениям, возникающим у неоперированных больных с
коронарными фистулами, относятся бактериальный эндокардит,
легочная гипертензия, коронарная недостаточность (вплоть до
развития инфаркта миокарда), разрыв аневризмы. Естественное
течение коронарных свищей изучено недостаточно. Описано спон-
танное закрытие фистулы в 5 и 14 лет [Mahoney L. et al., 1982;
Shubrooks S., Naguar C., 1978]. Однако с возрастом наступают
расширение, удлинение вовлеченной в процесс КА, дилатация
камеры, в которую идет сброс; именно в этой артерии в дальней-
шем развивается атеросклеротическое повреждение (другие со-
суды остаются почти интактными), приводящее к раннему ин-
305
Рис. 88. Врожденная фистула передней межжелудочковой ветви левой коронар-
ной артерии с правым желудочком. Констрастируется резко дилатированная,
извитая передняя межжелудочковая ветвь со сбросом контрастного вещества
в правый желудочек.
фаркту миокарда. Сказанное свидетельствует о том, что ребенок
с коронарной фистулой нуждается в индивидуальном подходе,
регулярном наблюдении педиатром и кардиохирургом, периоди-
ческом обследовании с применением дозированной физической
нагрузки для выявления скрытой ишемии миокарда.
В СССР первое успешное закрытие коронарной фистулы в
условиях искусственного кровообращения произведено в 1964 г.
академиком АМН СССР В. И. Бураковским. Существуют раз-
личные методы закрытия фистулы. При одном отверстии, свя-
занном с ветвью КА второго порядка, возможно простое лиги-
рование непосредственно у места впадения КА. Закрытие фисту-
лы производится также путем наложения множественных мат-
рацных швов по задней поверхности артерии и передней стенке
желудочка. При фистуле с левым желудочком она закрывается
со стороны эндокарда левого желудочка либо из просвета КА.
В случае аневризмы КА производят аневризморрафию, так как
возможны ее тромбоз, разрыв, кальцинирование [Бухарин В. А.
и соавт., 1983]. Е. Rittenhouse и соавт. (1975), обобщив опыт,
представленный в английской литературе, нашли, что более чем
на 170 операций летальность составила 2 %, а частота после-
операционных инфарктов миокарда — 3,6%. Низкую хирургиче-
306
скую летальность отмечали также В. А. Бухарин и соавт. (1980).
Новым в лечении фистул коронарных артерий является их
транслюминальная эмболизация, которая впервые в мире выпол-
нена Ю. С. Петросяном в 1982 г.
J. Low и соавт. (1981), изучив отдаленные послеоперацион-
ные результаты у 22 пациентов в сроки до 10 лет, не нашли ни
случаев реканализации фистул, ни случаев летальных исходов.
Почти все пациенты отнесены к I функциональному классу.
Глава 21. АНОМАЛИИ ВНУТРИГРУДНОГО
РАСПОЛОЖЕНИЯ СЕРДЦА
Аномалии внутригрудного расположения сердца (АВРС)
включают в себя нарушения расположения верхушки сердца,
ее соответствия с характером расположения органов брюшной
полости и случаи неправильного формирования сердца в виде
обратного или неопределенного расположения эмбриональных за-
кладок правого и левого предсердий. Частота АВРС составляет
1,5% среди всех ВПС. Первые сообщения об АВРС касались
правостороннего положения сердца при обратном расположении
внутренних органов [М. Leccius, 1964; Riolan, 1952]. Правосто-
роннее расположение сердца как изолированная аномалия, т. е.
с нормальным расположением внутренних органов, было описа-
но значительно позже [Grunmaeh Е., 1890].
Само по себе существование аномального положения сердца
не сопровождается расстройствами гемодинамики и лишь нали-
чие сопутствующего порока сердца приводит больных в кардио-
хирургическую клинику.
Раньше АВРС диагностировали только по аномальной пози-
ции его верхушки. Затем к ней стали относить случаи с наруше-
нием соотношения между стороной расположения верхушки серд-
ца и формированием органов брюшной полости, в частности
печени. В норме локализация верхушки противоположна месту
расположения больщой доли печени, а согласно Forgacs (1947),
последняя развивается на той же стороне, что и правое пред-
сердие.
Классификация. С учетом основных принципов деления
АВРС, разработанных Б. А. Константиновым и Г. И. Астрахан-
цевой (1965), В. П. Подзолковым и соавт. (1974) предложена
классификация, содержащая данные о локализации основных
отделов сердца. Авторы считают, что в зависимости от стороны
формирования, а следовательно, от расположения правого пред-
сердия и печени, сердце может быть определено как право- (пе-
чень справа) или левосформированное (печень слева), а локали-
зация верхушки сердца по отношению к средней линии тела ха-
рактеризует сердце как право- или леворасположенное. Исходя
из этого, нормальное сердце — это правосформированное лево-
расположенное. Авторы предлагают выделять следующие ва-
рианты АВРС.
307
I. Правосформированное праворасположенное сердце (с нормальным распо-
ложением органов брюшной полости).
2. Правосформированное срединнорасположенное сердце (с нормальным
расположением органов брюшной полости).
3. Правосформированное леворасположенное сердце (с обратным распо-
ложением органjb брюшной полости).
4. Левосформированное праворасположенное сердце (с обратным располо-
жением органов брюшной полости).
5. Левосформированное леворасположенное сердце (с обратным располо-
жением органов брюшной полости).
6. Неопределенносформированное лево-, право- или срединнорасположен-
ное сердце (с абдоминальной гетеротаксией).
Обследование больных с АВРС имеет ряд особенностей.
В первую очередь нужно установить тип положения сердца,
определить, есть ли ВПС и его анатомическую структуру, харак-
тер гемодинамики, расположение внутренних органов. О локали-
зации предсердий можно судить по положению печени и газового
пузыря желудка (правое предсердие расположено с той же сто-
роны, где и печень), а также по направлению зубца Р\ на ЭКГ.
О положении желудочков судят по морфологии комплексов QRS
в грудных отведениях: над анатомически правым желудочком
регистрируются комплексы rS, RS, над анатомически левым —
R, qRS, qR. При ангиокардиографии уточняют особенности внут-
ренней архитектоники каждой камеры. Локализация верхушки
сердца устанавливается с помощью пальпации, рентгено- и ан-
гиокардиографии. ЭКГ больным с праворасположенным сердцем
записывают с дополнительными отведениями: а) стандартные —
от правой и левой руки (IR), от левой руки и правой ноги (IIR),
от правой руки и правой ноги (IIIR); б) однополюсные — от ле-
вой руки (aVRR—aVL), от правой руки (aVL2—aVR), от правой
ноги (aVF); в) записывают V<r—Vbr.
На обзорной рентгенограмме обращают внимание на локали-
зацию тени печени и воздушного пузыря желудка. Срединнорас-
положенная печень свидетельствует о неопределенносформиро-
ванном сердце. Абдоминальная гетеротаксия подтверждается ис-
следованием желудочно-кишечного тракта с барием. Решающее
значение в установлении топики порока принадлежит катетери-
зации полостей сердца и ангиокардиографии.
Правосформированное праворасположенное сердце. Синони-
мы: декстроверсия, изолированная декстрокардия. Частота поро-
ка составляет 54 % среди больных с правосторонним расположе-
нием сердца [Подзолков В. П. и др., 1974] и 0,012—2,4 % всех
ВПС [Gasul В. et al., 1966; Band G., 1980] (рис. 89, a).
Ротация сердца вправо оказывает влияние преимущественно
на расположение желудочков, которые R. Grant (1958) сравни-
вал с «переворачиванием страницы книги». Полые вены и правое
предсердие располагаются справа, но более медиально, чем
обычно. Правое предсердие через трикуспидальный клапан сооб-
щается с правым желудочком. Левое предсердие, нормальным
образом соединяясь с легочными венами, находится несколько
308
Рис. 89. Анатомические взаимоотношения при различных вариантах аномалий
внутригрудного расположения сердца.
а — правосформированное праворасположенное сердце; б — правосформнрованное
срединнорасположенное сердце; в - левосформированное праворасположенное сердце;
г — левосформированное леворасположенное сердце. 1—правое предсердие; 2 — левое
предсердие; 3 — правый желудочек; 4 — левый желудочек; 5 — легочная артерия; 6 —
аорта; 7 — верхняя полая вена; 8 — нижняя полая вена; 9 — дуга аорты; 10 — легочные
вены; П — печень, Ж — желудок.
кпереди по отношению к правому предсердию и через митральный
клапан сообщается с левым желудочком, который лежит справа
и кпереди от левого предсердия. Правый желудочек располага-
ется справа, выше и несколько кзади по отношению к левому
желудочку. Магистральные сосуды отходят от соответствующих
желудочков, но из-за ротации вправо увеличивается окно между
восходящей И нисходящей аортой. Ствол легочной артерии рас-
309
положен более медиально, чем обычно, и кпереди от аорты;
последняя проходит над левым главным бронхом, дуга аорты ча-
ще левосторонняя. Верхушка сердца располагается справа от
грудины и направлена вперед и вниз. Таким образом, при этой
аномалии изменены пространственные взаимоотношения правых
и левых отделов и сохраняется нормальное их строение.
Расположение других органов грудной клетки и топография
органов брюшной полости сохраняются нормальными. В ряде
случаев могут наблюдаться признаки висцеральной симметрии:
оба легких содержат равное количество долей, отмечается сре-
динная печень, общая брыжейка для тонкого и толстого кишеч-
ника, аспления или полиспления.
У больных с правосформированным праворасположенным
сердцем в 90—98 % случаев встречаются ВПС в основном мно-
жественные. Чаще всего встречаются корригированная ТМС с
ДМЖП и стенозом легочной артерии. ДМПП с аномальным
дренажем легочных вен, ДМЖП, синдром гипоплазии правого
желудочка сердца, единственный желудочек сердца, атрезия ле-
гочной артерии, тетрада Фалло, ОАП и др. Гемодинамические
нарушения отмечаются в тех случаях, когда правосформирован-
ному праворасположенному сердцу сопутствуют ВПС.
При клиническом обследовании можно заподозрить наличие
правосформированного праворасположенного сердца в тоц слу-
чае, если верхушечный толчок и сердечная тупость определяются
справа от грудины, а органы брюшной полости располагаются
нормально, т. е. печеночная тупость определяется справа, а же-
лудочный тимпанит — слева. При наличии ВПС клиническая
картина определяется их характером и степенью гемодинамиче-
ских расстройств, шумы сердца соответствуют ВПС и также
имеют правостороннюю локализацию.
На ЭКГ характерен положительный зубец Р в I, aVL, aVF,
Vi-6 отведениях, что объясняется обычным распространением
предсердной деполяризации благодаря нормальному расположе-
нию предсердий. В грудных отведениях вольтаж комплексов
QRS прогрессивно увеличивается от V6R до Vi- 2 и далее снижа-
ется к Уб, указывая на правостороннее расположение сердца,
при этом потенциалы правого желудочка в форме комплексов
rS или 7?S регистрируются в отведениях от V6R до V2.3, левого —
в виде qR или qRS — в Уз 6-
При обычной рентгеноскопии выявляется тень сердца, распо-
ложенная преимущественно в правой половине грудной клетки,
тогда как тень печени и газовый пузырь желудка определяются
в обычных местах. Верхушка сердца ориентирована вправо, об-
ращает на себя внимание более низкое расположение правого
купола диафрагмы, чем левого. На переднезадних рентгено-
граммах на левом контуре сердца определяются 2 дуги: верхняя
представлена часто наблюдаемой левосторонней дугой аорты и
участком нисходящей аорты, нижняя образована выходящим
на левый контур левым предсердием. Дуга легочной артерии
310
отсутствует. Правый контур сердца представлен сплошной вы-
пуклой линией, простирающейся от диафрагмы до основания
сердца. Эта линия образована правым предсердием вверху и
правым желудочком внизу.
Катетеризация сердца и ангиокардиографическое исследова-
ние позволяют уточнить правостороннее расположение полых вен
и правого предсердия, которое почти полностью прикрывается
тенью контрастированного правого желудочка, за исключением
верхне-латеральной части. При поступлении контрастного веще-
ства в левые отделы сердца определяется левое предсердие,
образующее левый латеральный край сердца и левый желудочек,
смещенный вниз и вправо. Верхушка сердца определяется спра-
ва от средней линии тела и часто образована правым желудоч-
ком. В боковой проекции тени контрастированных желудочков
часто накладываются друг на друга. Магистральные сосуды
отходят от соответствующих желудочков, дуга аорты располо-
жена слева.
Хирургическое лечение предпринимается по поводу сопутст-
вующих ВПС, при их отсутствии прогноз благоприятный. Выбор
того или иного метода радикального или паллиативного вмеша-
тельства, как и в обычных условиях, определяется анатомо-
гемодинамическим вариантом порока.
Правосформированное срединнорасположенное сердце. Сино-
нимы: мезокардия, мезоверсия, неполная декстроверсия. Этот
порок составляет 9 % от всех АВРС (Бухарин В. А. и Подзол-
ков В. П., 1979] и обычно является случайной находкой, если не
сочетается с другими ВПС (рис. 89, б).
В отличие от правосформированного праворасположенного
сердца ротация вправо в данных условиях не так значительна
и продольная ось сердца вместе с межжелудочковой перегород-
кой располагаются по среднесагиттальной оси грудной клетки,
в результате чего сердце занимает срединное положение. Полые
вены и правое предсердие расположены справа, причем правое
предсердие лежит в одной плоскости с левым предсердием или
несколько кпереди, т. е. их взаимоотношения приближаются к
нормальным. Правый и левый желудочки лежат справа и слева
от средней линии тела, так что отсутствует их условное деление
на «передний» и «задний». Верхушка сердца располагается в
подложечной области, ориентирована вперед и может быть раз-
двоена. В таком «двухверхушечном» сердце правая верхушка
образована правым желудочком, левая — левым желудочком.
Магистральные сосуды отходят от соответствующих желудочков,
дуга аорты слева. Расположение органов брюшной полости нор-
мальное.
Среди сопутствующих ВПС чаще всего встречаются тетрада
Фалло, ДМЖП, открытый атриовентрикулярный канал (АВК),
корригированная ТМС.
Смещение сердечной тупости вправо обычно расценивается
как «увеличение правых отделов сердца», а верхушечный толчок.
311
пальпируемый в подложечной области, можно принять за «пуль-
сацию гипертрофированного правого желудочка». Чаще сердеч-
ные шумы выслушиваются одинаково хорошо справа и слева от
грудины, реже — только слева или справа. При перкуссии пече-
ночная тупость и желудочный тимпанит определяются в обыч-
ных местах.
На ЭКГ фиксируется положительный зубец Р в I и aVP от-
ведениях, отрицательный — в отведении aVR. В отведении aVL
зубец Р может иметь различное направление. В I стандартном
и в отведении aVL глубокий зубец Q и отрицательный зубец Т
встречаются с такой же частотой или несколько реже, чем при
правосформированном праворасположенном сердце. В грудных
отведениях потенциалы правого желудочка в виде комплексов
rS и RS записываются справа от средней линии тела, а потен-
циалы левого желудочка в виде комплексов qR или qRS регист-
рируются слева.
При рентгенологическом исследовании в прямой проекции
выявляется тень сердца, занимающая срединное положение и
имеющая шаровидную форму в виде «дождевой капли». Поворот
пациента в правую переднюю косую проекцию на 15° обычно
обнаруживает нормальную конфигурацию сердца. В прямой про-
екции верхушка сердца не определяется. Тень печени локали-
зуется под правым куполом диафрагмы, причем как правый,
так и левый куполы диафрагмы располагаются на одном
уровне.
Катетеризация сердца и ангиокардиографическое исследова-
ние уточняют правостороннее расположение полых вен и правого
предсердия. При поступлении контрастного вещества в левое
предсердие и левый желудочек определяется их левостороннее
положение. Тень контрастированного левого желудочка находит-
ся слева от средней линии тела и частично прикрывает собой
левое предсердие. Межжелудочковая перегородка локализуется
по средней линии тела. В боковой проекции тени желудочков
накладываются друг на друга и вследствие этого нельзя выска-
заться о «переднем» или «заднем» их положении. Магистраль-
ные сосуды контрастируются из соответствующих желудочков.
Хирургическое вмешательство определяется топикой ВПС,
обычно выполняется с использованием тех же доступов, что и
при нормальном положении сердца.
Правосформированное леворасположенное сердце с обратным
расположением органов брюшной полости или абдоминальной
гетеротаксией. Синонимы: левокардия, левокардия с транспози-
цией брюшных органов, изолированная инверсия брюшных ор-
ганов, левокардия, situs solitus.
Нарушения соответствия между расположением верхушки
сердца, с одной стороны, и правым предсердием и печенью,
с другой стороны, явились основанием для отнесения правосфор-
мированного леворасположенного сердца с обратным расположе-
нием органов брюшной полости или абдоминальной гетеротакси-
312
ей в разряд аномалий расположения сердца [Константинов Б. А.,
1967; Подзолков В. П. и др., 1974].
Расположение сердца и взаимоотношение его камер и ма-
гистральных сосудов относительно друг друга нормальное. Ха-
рактерно наличие аномалий нижней полой вены: в одних случаях
она располагается слева от позвоночника, затем на уровне пе-
чени круто изменяет свой ход и, пересекая среднюю линию тела,
направляется косо кверху до соединения с обычно расположен-
ным правым предсердием; в других случаях наблюдается отсут-
ствие печеночного сегмента нижней полой вены, причем отток
венозной крови из нижней половины тела осуществляется по не-
парной или полунепарной вене, впадающей в верхнюю полую
вену. Крайне редко нижняя полая вена находится справа.
Положение органов брюшной полости характеризуется зер-
кальной топографией, т. е. печень располагается слева, а желудо-
чек и селезенка — справа. Нередко можно отметить признаки
абдоминальной гетеротаксии, выражающиеся в увеличении пра-
вой доли печени, неполной ротации кишечника (общая брыжей-
ка) и полисплении.
Отсутствие ВПС отмечается приблизительно у 1 /з пациентов.
У оставшихся 2/з больных обычно встречаются тяжелые и мно-
жественные пороки типа пентады Фалло, ТМС, единственного
желудочка сердца.
Данные объективного обследования и результаты рентгеноло-
гического исследования позволяют установить лишь левораспо-
ложенное сердце с обратным расположением органов брюшной
полости или абдоминальной гетеротаксией без специфических
указаний о характере его формирования. На рентгенограмме об-
наруживается обычно расположенное сердце, тень печени опре-
деляется под левым куполом диафрагмы, а газовый пузырь —
под правым, конфигурация сердца определяется сопутствующим
ВПС. Сведения о локализации правого предсердия получают
при анализе ЭКГ, регистрирующей положительный зубец Р в
I стандартном отведении, катетеризации сердца, выявляющей
аномалию системных вен, дренирующихся в правое предсердие,
и с помощью ангиокардиографического исследования, при кото-
ром устанавливаются нормальное анатомическое строение и то-
пография сердечных камер. Диагноз сопутствующих ВПС ста-
вится на основании учета общепринятых диагностических кри-
териев.
Хирургическая тактика и техника зависят от анатомо-гемоди-
намического варианта сопутствующего ВПС, причем при плани-
ровании хирургического вмешательства в условиях искусствен-
ного кровообращения должны учитываться аномалии нижней по-
лой вены.
Левосформнрованное праворасположенное сердце. Синонимы:
зеркальная декстрокардия, истинная декстрокардия. Частота по-
рока составляет 33 % от всех больных с правосторонним положе-
нием сердца [Бухарин В. А., Подзолков В. П., 1979]. В отличие
313
от правосформированного праворасположенного сердца при
данной аномалии левосторонние полые вены соединяются с пра-
вым предсердием, расположенным также слева и несколько
кпереди от правостороннего левого предсердия (рис. 89, в). Пра-
вое предсердие отделено трехстворчатым клапаном от правого
желудочка. Выводной отдел его направлен вправо, вверх, кзади
и от него начинается легочный ствол, располагающййся справа
от средней линии тела. Легочные вены соединяются с правосто-
ронним левым предсердием, которое посредством митрального
клапана сообщается с левым желудочком. Последний располо-
жен справа и сзади по отношению к правому желудочку и об-
разует правостороннюю верхушку сердца. От левого желудочка
отходит аорта, восходящий отдел которой лежит слева и сзади
по отношению к легочному стволу.
Таким образом, левосформированное праворасположенное
сердце представляет точную зеркальную копию нормального
сердца. За редким исключением, левосформированное праворас-
положенное сердце является составной частью полного обрат-
ного расположения внутренних органов. Левое легкое состоит из
3 долей, правое — из 2, зеркальной анатомией характеризуется
и трахеобронхиальное дерево. В левой половине располагаются
печень и желчный пузырь, причем левая доля печени значительно
больших размеров, чем правая; здесь также лежат восходящий
отдел толстой кишки, слепая кишка и червеобразный отросток.
В правой половине брюшной полости можно отметить селезенку,
желудок и нисходящий отдел толстой кишки. В литературе опи-
саны единичные случаи аномалии с нормальным расположе-
нием органов брюшной полости.
По наблюдениям многих авторов, у 16,5—25 % пациентов
встречается триада М. Kartagener (1933), которая включает
полное обратное расположение внутренних органов с левосфор-
мированным праворасположенным сердцем, бронхоэктазы и па-
раназальный синусит.
ВПС при левосформированном праворасположенном сердце
по сравнению с другими аномалиями расположения сердца на-
блюдаются значительно реже, но чаше, чем при обычном поло-
жении сердца. Частота их составляет от 4 до 8 % (Константи-
нов Б. А., Астраханцева Г. И., 1965; Keith J. et al., 1958]. ВПС в
94 % носят множественный характер и в 70 % сопровождаются
цианозом; чаще всего встречаются тетрада Фалло, единственный
желудочек сердца, корригированная ТМС, открытый АВК, стеноз
аорты и др.
Состояние больных с данной аномалией без сопутствующих
пороков сердца обычно благоприятное, жалобы отсутствуют, они
нормально физически развиты и доживают до глубокой старости.
Границы сердечной тупости и верхушка сердца определяются
справа от грудины, здесь же лучше прослушиваются тоны сердца
и при ВПС — сердечные шумы. Печеночная тупость определя-
ется слева, желудочный тимпанит — справа.
314
На ЭКГ имеется отрицательный зубец Р в I, aVL, V5.6 отве-
дении, отражающий расположение синусового узла в левосторон-
нем предсердии, положительный Pn.in.v,, отрицательные комплек-
сы QRSi.aVR, увеличение их вольтажа от Vi до VeR и уменьшение
от Vi до Уб, отрицательные Ti,avL.v5.6- Обычная съемка ЭКГ ре-
гистрирует в I стандартном отведении зубцы, имеющие направ-
ление, противоположное обычному: II стандартное отведение со-
ответствует нормальному III и, наоборот, III стандартное отведе-
ние — второму, отведение aVL отражает отведение aVR и, на-
оборот, aVR—aVL, отведение Vi равноценно Vzr, Уз—Узи,
У|—Уж, Vs—Vsr, Vs—VeR. Отведение aVF не изменяется.
Если поменять местами электроды правой и левой руки и
наложить грудные электроды таким образом, что их положение
будет являться зеркальным отображением нормального, то ЭКГ
можно анализировать, как при нормальном расположении
сердца.
При рентгенологическом исследовании в переднезадней проек-
ции тень сердца и его верхушка определяются в правой поло-
вине грудной клетки (рис. 90). в связи с этим правое легочное
поле уже, чем левое, а правый купол диафрагмы стоит ниже,
чем левый. Сердечный силуэт представляет собой зеркальную
копию нормально расположенного сердца. Тень печени видна
под левым куполом диафрагмы, газового пузыря — под правым.
С помощью катетеризации сердца и ангиокардиографическо-
го исследования уточняется левостороннее положение полых вен,
топография сердечных полостей и магистральных сосудов, яв-
ляющихся зеркальной копией нормального сердца, выявляются
сопутствующие пороки сердца.
Хирургическому лечению подлежат лишь сопутствующие по-
роки сердца.
«Левосформированное леворасположенное сердце. Синонимы:
левокардия с транспозицией брюшных органов, изолированная
левокардия, левоверсия сердца, синистроверсия сердца, сини-
строкардия, цианотическая левокардия, смешанная левокардия
с инверсией предсердий (рис. 89, г). При этой аномалии сердце
расположено слева, там же имеются печень и правое предсер-
дие. Это один из редких вариантов аномального положения серд-
ца. По статистике J. Keith и соавт. (1958), аномалия встречается
примерно в 10 раз реже, чем левосформированное пра,нераспо-
ложенное сердце, и составляет 0,8—1,0% среди всех ВПС и
10% среди АВРС.
При левосформированном леворасположенном сердце полые
вены находятся более медиально и кзади, чем в условиях лево-
сформированного праворасположенного сердца, и соединяются с
правым предсердием, расположенным также слева. Последнее
посредством трикуспидального клапана сообщается с правым
желудочком, который лежит кпереди от правого предсердия.
Выводной отдел его направлен медиально, вверх, назад и дает
начало, легочной артерии. Легочные вены соединяются с право-
315
Рис. 90. Левосформи-
рованное правораспо-
ложенное сердце (зер-
кальная декстракар-
дия). Рентгенограм м а
грудной клетки.
а — прямая проекция;
б — первая косая проек-
ция (соответствует нор-
мальной второй).
сторонним левым предсердием, которое находится несколько кпе-
реди, чем левостороннее правое предсердие. Через митральный
клапан левое предсердие сообщается с левым желудочком, ле-
жащим спереди и слева по отношению к левому предсердию,
справа и спереди от правого желудочка. Восходящая аорта рас-
полагается слева и кзади от легочного ствола. Дуга и нисходя-
щая аорта также локализуются справа. Верхушка сердца на-
правлена влево, вперед и вниз.
Левосформнрованное леворасположенное сердце сопровожда-
316
Рис. 90. Продолжение.
в — вторая косая
проекция (соответствует
нормальной первой).
ется обратным расположением внутренних органов, т. е. двухдо-
левым строением правого легкого и трехдолевым левого, печень
располагается под левым куполом диафрагмы, желудок — под
правым и т. д. Однако в данных условиях чаще, чем при ранее
описанных типах положения сердца, наблюдаются признаки вис-
церальной симметрии.
В литературе описан только один подтвержденный аутопсией
случай левосформированного леворасположенного сердца без
ВПС. В подавляющем большинстве случаев данная аномалия
сочетается с тяжелыми цианотическими ВПС, среди которых
чаще встречается единственный желудочек сердца с инверсион-
ной ТМС, стенозом легочной артерии, корригированная ТМС с
открытым общим АВК и стенозом легочной артерии, двухкамер-
ное сердце.
При объективном обследовании определяется левостороннее
положение верхушечного толчка и сердечной тупости, тогда как
печеночная тупость находится слева, а желудочный тимпанит
справа. При сопутствующих пороках сердца клиническая карти-
на определяется анатомо-гемодинамическим вариантом порока.
Тяжесть сопутствующих ВПС приводит к тому, что 75 % больных
не доживают до 1 года и только 6 % живут после 5-летнего воз-
раста. «
Электрокардиографическим признаком порока являются отри-
цательные зубцы Р в I и aVL отведениях, свидетельствующие о
левостороннем положении правого предсердия. В грудных отве-
зи
дениях увеличивается вольтаж комплексов QRS от V6 к V| и да-
лее снижается к VeR.
На рентгенограмме органов грудной клетки видно нормальное
положение тени сердца, тень печени определяется под левым
куполом диафрагмы, а газовый пузырь желудка — под правым.
Левый купол диафрагмы находится ниже, чем правый. Однако
с помошью рентгенологического исследования установить тип
формирования сердца не представляется возможным.
При катетеризации и ангиокардиографии устанавливается
левостороннее положение полых вен и правого предсердия. Пра-
вое предсердие на значительном протяжении прикрывается тенью
контрастированного венозного, анатомически левого желудочка,
образующего верхушку сердца. При получении фазы левограммы
выявляется левое предсердие, образующее правый латеральный
контур сердца и далее — артериальный, анатомически правый
желудочек, расположенный справа и ниже по отношению к ве-
нозному желудочку. Из артериального желудочка контрастиру-
ется восходящая аорта, занимающая позицию справа от легоч-
ной, артерии. Ангиокардиографическое исследование, как прави-
ло, выявляет стеноз легочной артерии и другие ВПС, часто мно-
жественные, для их установления нередко требуются повторные
введения контрастного вещества в различные отделы сердца.
Частое существование тяжелого комплексного ВПС ограничи-
вает возможности хирургической помощи таким больным.
Неопределенно-сформированное сердце представляет собой
комплексное поражение сердечно-сосудистой системы, при кото-
ром даже детальное анатомическое изучение предсердной поло-
сти, расположения полых и легочных вен не позволяет выска-
заться о характере формирования сердца, обычно имеются тя-
желые ВПС.
Синонимы: неопределенный situs сердца, изомерия предсер-
дий, синдром висцеральной гетеротаксии, синдром висцеральной
симметрии. Частота аномалии составляет 11 % среди больных
с АВРС.
Аномалия обычно протекает в виде 2 патологических синдро-
мов [Подзолков В. П. и соавт., 1974], общим для них являются
единое предсердие, пороки атриовентрикулярных клапанов (рас-
щепление створок, единое кольцо), аномалии формирования и
расположения полых вен, аномальный дренаж легочных вен.
Сердце и его верхушка чаще расположены справа. Печень мо-
жет быть расположена срединно, реже справа или слева. Для
первого из них характерно: 1) общее предсердие; 2) добавочная
верхняя полая вена, впадающая в левую половину общего пред-
сердия; отсутствие печеночного сегмента нижней полой вены;
3) частичный или полный аномальный дренаж легочных вен,
симметрично впадающих в правую и левую стороны общего пред-
сердия; 4) расщепление септальных створок атриовентрикуляр-
ных клапанов; 5) часто праворасположенное сердце; 6) часто по
2 доли в каждом легком; 7) абдоминальная гетеротаксия: тен-
318
денция к срединному расположению печени, общая брыжейка;
8) полиспления.
Для второго патологического синдрома характерны откры-
тый общий атриовентрикулярный канал или двухкамерное сердце
со следующим строением: 1) общее предсердие; 2) открытый
общий атриовентрикулярный канал или общий атриовентрику-
лярный клапан; 3) ДМЖП или единственный желудочек сердца;
4) добавочная верхняя полая вена, впадающая в левую сторону
общего предсердия; две нижние полые вены или отсутствие пе-
ченочного сегмента нижней полой вены; 5) полный аномальный
дренаж легочных вен в верхнюю полую вену, в общее предсердие
или в портальную венозную систему; 6) часто транспозиция ма-
гистральных сосудов; 7) стеноз или атрезия легочной артерии;
8) часто праворасположенное сердце; 9) часто по 3 доли в каж-
дом легком; 10) абдоминальная гетеротаксия; срединная сим-
метричная печень, общая брыжейка; 11) аспления.
Независимо от места впадения системных легочных вен по-
токи венозной и артериальной крови направляются в полость
общего предсердия, где происходит их смешивание, поэтому у
больных с рождения наблюдается артериальная гипоксемия, ко-
торая в большей степени выражена при сопутствующем стенозе
легочной артерии. Существование аномалии атриовентрикуляр-
ных клапанов сопровождается выраженной их недостаточностью,
что в значительной степени ухудшает условия гемодинамики и
рано приводит к дилатации предсердий и желудочков.
Оба синдрома характеризуются тяжелым клиническим тече-
нием и ранней смертностью: 85,5—95 % этих больных умирают
в течение первого года жизни. Основной причиной смерти явля-
ется пневмония или сердечная недостаточность.
У всех больных с рождения наблюдаются выраженный циа-
ноз, одышка и другие признаки цианотического порока сердца.
Верхушечный толчок и сердечная тупость могут определяться
в правой или левой половине грудной клетки. Вдоль левого или
правого края грудины обычно выслушивается систолический
шум. У больных без межжелудочкового дефекта (первый пато-
логический синдром) он негромкий и зависит от относительного,
вторичного стеноза легочной артерии и недостаточности атрио-
вентрикулярных клапанов. При наличии стеноза легочной арте-
рии, наблюдаемого при втором патологическом синдроме, систо-
лический шум грубого тембра и лучше выслушивается на осно-
вании сердца.
На ЭКГ зубец Pi.aVL — отрицательный или изоэлектричный,
нередки аритмии в виде левопредсердного ритма или ритма коро-
нарного синуса. Отклонение электрической оси сердца влево или
ее расположение в «немом» секторе наряду с «5» или «/?£»
типом ЭКГ и признаками «комбинированной» гипертрофии пред-
сердий и желудочков позволяют предполагать открытый общий
АВК, двух- или трехкамерное сердце.
При рентгенологическом исследовании брюшной полости вы-
319
является симметричное, срединное расположение тени печени,
что является специфическим, рентгенологическим симптомом
данной аномалии. Контрастное исследование желудочно-кишеч-
ного тракта подтверждает сторону расположения желудка и
устанавливает неполную ротацию кишечника, включающую об-
щую брыжейку. На холецистограмме желчный пузырь смещен
к средней линии тела.
На рентгенограммах грудной клетки в переднезадней проек-
ции тень сердца умеренно увеличена в поперечнике и часто рас-
полагается в правой половине грудной клетки. При леворасполо-
женном сердце левый его контур представлен желудочковой по-
верхностью, а правый — предсердной и, наоборот, при право-
расположенном сердце правый его контур образован желудочко-
вой поверхностью, левый — предсердной. Дуга легочной артерии
обычно не определяется (второй патологический синдром).
Важный диагностический признак представляют суперэкспо-
нированные рентгенограммы грудной клетки, на которых просле-
живается симметричная топография трахеобронхиального дере-
ва, с большой точностью указывающая на неопределенно-сфор-
мированное сердце.
Катетеризация сердца и анриокардиографическое исследова-
ние подтверждают аномалии впадения полых вен, из которых
контрастное вещество поступает в округлой формы предсердную
полость, занимающую предполагаемую область обоих предсер-
дий, что свидетельствует о наличии общего предсердия.
Радикальное хирургическое лечение возможно у больных с
первым, реже — со вторым патологическим синдромом, у кото-
рых могут выполняться межсосудистые анастомозы и в отдель-
ных случаях гемодинамическая коррекция по методу Фонтена.
Глава 22. ОСЛОЖНЕНИЯ ПРИ ВРОЖДЕННЫХ
ПОРОКАХ СЕРДЦА И ИХ ЛЕЧЕНИЕ
СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
У больных с ВПС чаще имеется комбинированная сердечная
недостаточность. Однако при некоторых ВПС бывает преиму-
щественно правожелудочковая (изолированный стеноз легочной
артерии, транспозиция магистральных сосудов и др.) или лево-
желудочковая (стеноз и коартация аорты) декомпенсация. Наи-
большее значение в лечении сердечной недостаточности принад-
лежит сердечным гликозидам.
При острой сердечной недостаточности предпочтение отда-
ется строфантину и коргликону в дозах, соответствующих воз-
расту больного. Возможно внутривенное введение дигоксина в
дозе насыщения 0,03—0,05 мг/кг массы равномерно в 2—3 дня
по 3 раза в день (чем выше масса, тем меньше доза насыщения
на 1 кг, и наоборот). Затем переходят на поддерживающую дозу
320
сердечных гликозидов, которая равняется 1 /4—1 /6 от дозы насы-
щения и дается в 2 приема в сутки. Противопоказаниями к на-
значению гликозидов являются брадикардия, атриовентрикуляр-
ные блокады, желудочковая тахикардия, их назначают осторож-
но при септическом эндокардите, анурии, при таких ВПС, как
коарктация и стеноз аорты. Одновременно назначаются лазикс
или фуросемид внутривенно в дозе 2—5 мг/(кг-сут), сразу
можно ввести 1 /2 дозы. При симптомах отека легкого и сердеч-
ной астмы хороший эффект наблюдается после введения смеси
аминазина, пипольфена, промедола (каждый по 0,1 мл на год
жизни) внутривенно вместе с реополиглюкином.
Большое значение имеет устранение психомоторного возбуж-
дения, беспокойства введением седуксена (0,1—0,2 мл/год жиз-
ни), наркотических анальгетиков (фентанил 0,001 мг/кг, про-
медол) и нейролептиков (дроперидол 0,25—0,5 мг/кг). Для сни-
жения проницаемости альвеолярно-капиллярных мембран и борь-
бы с гипотонией внутривенно вводят глюкокортикоиды — пред-
низолон 3—5 мг/(кг-сут), первоначально вводимая доза может
составить половину суточной.
При острой сердечной недостаточности с явлениями шока
показано введение изопротеренола — прямой р-адренергический
антагонист, увеличивающий частоту сердечных сокращений и со-
кратимость миокарда (сердечный выброс); осторожно назнача-
ется при значительной тахикардии, может вызвать желудочко-
вые аритмии. Доза препарата при внутривенном введении 0,05—
0,5 мг/кг-мин. В зависимости от состояния периферического
кровообращения н уровня АД вводятся сосудистые препараты:
при повышении АД — папаверин, пентамин, дроперидол, при
гипотонии — допамин, мезатон внутривенно медленно.
При одышечно-цианотических приступах у детей с синими
врожденными пороками сердца показано введение подкожно
кордиамина, промедола, перорально дается обзидан (анаприлин,
индерал) в дозе 0,5—1 мг/(кг-сут), внутривенно вводится
4 % раствор гидрокарбоната натрия, показаны переливание кро-
ви, глюкозы, седативных препаратов (седуксен), постоянная дача
кислорода. При некупирующемся приступе н развитии гипокси-
ческой комы показана срочная операция — наложение аортоле-
гочного анастомоза (см. главу 10).
Основу современной терапии хронической сердечной недоста-
точности при ВПС составляют сердечные гликозиды, причем
строфантин и коргликон применяют редко, только в случаях обо-
стрения, при отеке легкого. Предпочтение отдается дигоксину.
При выборе дозы насыщения учитывают вид ВПС (необходимо
помнить об осторожном назначении дигоксина при фиксирован-
ных стенозах аорты и легочной артерии, высокой легочной ги-
пертензии), состояние миокарда (выраженность кардиосклероза,
вид аритмии), почек и печени (при олиго- и анурии в начале
назначаются диуретики), электролитные нарушения (гипокалие-
мия предрасполагает к аритмии, гиперкальциемия способствует
321
11—976
побочным действиям гликозидов). Доза насыщения дигоксина
составляет 0,03—0,075 мг/кг и вводится в 2 дня; в случаях вы-
раженной кардиомегалии и плохой сократительной функции мио-
карда дозу насыщения при ВПС можно вводить в 3 дня. У детей
с массой тела более 16 кг доза не должна превышать 0,02—
0,03 мг/кг, практически доза насыщения составляет по 1 /4—1 /з—
‘/г таблетки (в одной таблетке 0,25 мг) 3 раза в день либо
внутримышечно по 0,3—0,5 мл (1 мл содержит 0,25 мг). Для
новорожденных доза насыщения составляет 0,03—0,05 мг/кг.
Аналогично рассчитывается доза изоланида. При дозировке лан-
тозида в каплях исходят из того, что 1 капля лантозида соот-
ветствует 0,01 мг дигоксина. Если эффекта от такой дозы гли-
козида нет, то можно продолжить трехкратное введение еще
1—2 дня. В случаях эффекта (уменьшение ЧСС и одышки,
сокращение печени, положительный диурез) переходят на под-
держивающую дозу, которая составляет '/ц— ‘/е дозы насыщения
(обычно это 1 /«—1 /5 таблетки у детей 2—5 лет, 1 /«—1 /3—‘/г таб-
летки — у детей старшего возраста) и вводится в сутки в 2 при-
ема. Следует помнить, что в случаях выраженных застойных
явлений в большом круге кровообращения или при отклонениях
со стороны желудочно-кишечного тракта дигоксин надо вводить
внутримышечно, ибо всасывание его резко снижено.
Больной с ВПС и хронической сердечной недостаточностью
выписывается домой с назначением Дигоксина в поддерживаю-
щей дозе, в связи с этим педиатр и кардиоревматолог должны
контролировать ее эффективность. Иногда доза оказывается не-
достаточной, тогда возникает декомпенсация. В других случаях
прежняя доза гликозида может стать токсичной. Эффективность
принимаемой амбулаторно дозы определяют по жалобам, часто-
те сердечных сокращений, одышке, размерам печени, данных
ЭКГ.
Диуретикам отводится важное место в лечении хронической
сердечной недостаточности. Наибольшее распространение на
практике получил мощный диуретик—.фуросемид, который на-
значается при Пб—III стадии сердечной недостаточности. До-
зы— 1—3 мг/(кг-сут) внутрь (в одной таблетке 40 мг), внутри-
мышечно или внутривенно (2 мл 1 % раствора) (обязательно
при отеке легких), лучше вводить в 3—4 приема. Действие пре-
парата после приема внутрь начинается через 30—60 мин и про-
должается 4—8 ч, при внутривенном введении эффект наступает
через 5—15 мин и длится до 3 ч. При сопутствующей хрониче-
ской почечной недостаточности дозы фуросемида можно увели-
чить до 5 мг/(кг-сут). Хорошо назначать фуросемид в сочета-
нии с калийсберегающими препаратами (триампур, верошпирон).
Следует помнить, что при сочетании фуросемида с цефалоспори-
нами, гентамицином возможно повреждение почечных канальцев.
К побочным действиям относятся гипокалиемия, гиперурикемия.
Калий вводят с пищей (картофель, морковь, чернослив), для его
восполнения назначают панангин, но не хлорид калия (способ-
322
ствует образованию эрозий и язв на слизистой оболочке же-
лудка и кишечника).
Этакриновая кислота (урегит) применяется в тех же случаях,
что и фуросемид, и особенно у детей, длительно получавших
фуросемид с развитием рефрактерности. Дозу 1—2 мг/кг можно
назначить 1 раз утром (1 таблетка содержит 0,05 и 0,1 г) внутрь.
Дети хуже переносят урегит, чем фуросемид, из-за побочного
действия на желудочно-кишечный тракт, органы слуха (нежела-
тельно сочетание с аминогликозидами).
К слабым диуретикам относятся калийсберегающие (веро-
шпирон, триамтерен, триампур). Их можно назначать самостоя-
тельно при I—ПА стадии сердечной недостаточности. В случаях
более выраженной декомпенсации их вводят в комбинации с
фуросемидом, урегитом.
Начинать лечение диуретиками целесообразно с меньших доз
с постепенным их увеличением. С одной стороны, это позволяет
индивидуально подобрать минимальную эффективную дозу,
с другой — не вызывает быстрого схождения отеков с выведени-
ем сразу большого количества жидкости (влечет за собой зна-
чительные электролитные нарушения, гипотензию и даже шок).
Сгущение крови и повышение ее вязкости после обильного моче-
отделения могут, кроме того, вызвать тромбозы (особенно у боль-
ных с синими ВПС). При даче диуретиков желательно оцени-
вать динамику массы тела, контролировать количество вводимой
жидкости (не менее 0,8—1 л). При стабилизации состояния пере-
ходят на прерывистые курсы лечения (прием 2—3 раза в неделю
или длительный прием небольших доз). Эффективность диуре-
тиков повышается при соблюдении больными диеты с ограниче-
нием поваренной соли. При резистентности к диуретикам на фоне
длительного их применения увеличивают дозу препарата, добав-
ляют еще один либо заменяют диуретик.
В последние годы в лечении сердечной недостаточности все
шире используются вазодилататоры. Последние не действуют
непосредственно на миокард, а улучшают периферическое крово-
обращение и тем самым облегчают работу сердца как насоса.
Уменьшение периферического сосудистого сопротивления (пост-
нагрузка) достигается через артериальную вазодилатацию,
уменьшение преднагрузки (величина давления наполнения лево-
го желудочка в конце диастолы) — через венодилатацию; суще-
ствуют препараты, обладающие комбинированным эффектом
(табл. 2). При митральной недостаточности артериальные вазо-
дилататоры уменьшают периферическое сопротивление и увели-
чивают сброс в аорту, уменьшая регургитацию в левое предсер-
дие. Венодилататоры увеличивают депонирование крови на пери-
ферии, в результате чего уменьшаются венозный возврат к пра-
вым отделам и в левый желудочек, объем регургитации через
митральный клапан. При ВПС с левоправым сбросом примене-
ние артериальных вазодилататоров приводит к снижению пост-
нагрузки и уменьшению сброса крови в легочные сосуды.
II* 323
Таблица 2. Вазодилататоры, применяемые при сердечной недостаточности
у больных с врожденными пороками сердца
Препарат Продол- житель- ность дей- ствия, способ введения Механизм действия Место прило- жения Доза
вены арте- риолы
Нитропруссид (Sodium nit- roprusside, Nipride) Внутри- венно Прямой вазоди- лататор + + + + + + 0,5 — 0,8 мг/(кг-мин)
Празозин (Prazosin, Minipress) 6 -10 ч, внутрь а-Адре- ноблока- тор + + + + + + 0,005 — 0,025 мг/кг через 6-10 ч
Каптоприл (Captopril, Capoten) 4 - 8 ч, внутрь Ингиби- тор анги- отензин- превра- щающего фермента + + + + Детям до одного года 0,5—6 мг/(кг-сут) че- рез 6 -24 ч; старше го- да 12,5 мг через 8—24 ч; новорожденным 0,1 — 0,4 мг/кг через 6—24 ч
Гидралазин (Hydralazi- ne, Apresoli- ne 8—12 ч, внутри- венно, внутрь Прямой вазоди- лататор + + + + 0,1—0,5 мг/кг через 6 ч (в/в), 0,5—2 мг/ (кг-сут) через 6- 8 ч максимально 4 мг/ (кг-сут) внутрь
Миноксидил (Minoxidil, Loniten) 8 12 ч, внутрь Прямой вазоди- лататор + + + 0,25 — 1 мг/(кг-сут)
Коринфар (Corinfar, Nifedipine) Внутрь (под язык) Блокатор кальцие- вого тока + + + + 1—2 мг/(кг-сут) через 6 -8 ч
Вазодилататоры бывают показаны больным с ВПС при выра-
женной регургитации через атриовентрикулярные клапаны (мит-
ральная недостаточность, транспозиция магистральных сосудов
с недостаточностью трехстворчатого клапана, включая случаи
после операции Мастарда), при аортальной недостаточности,
больших внутрисердечных левоправых сбросах (недоношенные
с ДМЖП и др.), постоперационная сердечная недостаточность
с дисфункцией левого желудочка при тетраде Фалло, аномаль-
ном отхождении левой коронарной артерии от легочного ствола,
коарктации аорты, открытом атриовентрикулярном канале.
Больным с левожелудочковой недостаточностью, застойными
явлениями в легких (митральная и аортальная недостаточность,
в послеоперационном периоде при низком сердечном выбросе)
назначают венодилататоры — нитраты, улучшающие преднагруз-
ку; при низком сердечном выбросе показаны препараты, пони-
жающие периферическое артериальное сопротивление — постна-
грузку (гидралазин, миноксидил). Больным, у которых сочетают-
ся застойные явления в легких й низкий сердечный выброс, на-
324
значают препараты, действующие на пред- и постнагрузку —
празозин, каптоприл или гидралазин с нитратами (см. табл. 2).
Как правило, вазодилататоры назначают при сердечной недоста-
точности, рефрактерной к обычной комплексной терапии, так как
они нередко обладают побочными действиями в виде ортостати-
ческой гипотензии (празозин, гидралазин), тахикардии (гидра-
лазин), появления желудочно-кишечных симптомов (тошнота,
снижение аппетита) (гидралазин), нейтропении (каптоприл, гид-
ралазин), протеинурии (каптоприл), головных болей (нитраты)
и др.
При хронической сердечной недостаточности в большинстве
случаев положительный эффект дают анаболические стероидные
(ретаболил, нероболил, метила ндростендиол) и нестероидные
(инозин, рибоксин, оротат калия, карнитин) препараты. В комп-
лексное лечение включают препараты, улучшающие обменные
процессы: кокарбоксилаза (5—7 мг/кг, 15 инъекций на курс),
панангин, витамин Bi2 с фолиевой кислотой, пангамат кальция
(витамин Bib), пантотенат кальция (витамин ВБ), пиридоксаль-
фосфат (витамин Вб), витамин Е, солкосерил, сульфокамфокаин.
Положительный эффект наблюдается при назначении рибофла-
вина-мононуклеотида или флавината (внутримышечно по 10—
15 инъекций) в сочетании с липоевой кислотой, витамином Bis,
эссенциале.
Простагландины применяются у новорожденных с сердечной
недостаточностью при некоторых ВПС, когда ОАП обеспечивает
жизнь в течение короткого периода времени, который должен
быть использован для хирургического вмешательства. К «дуктус-
зависимым» порокам относятся атрезия легочной артерии с ин-
тактной межжелудочковой перегородкой или без нее, крайняя
форма тетрады Фалло, трикуспидальная атрезия, атрезия и кри-
тический стеноз аорты, транспозиция магистральных сосудов
(случаи с неэффективной атриосептостомией или без внутрисер-
дечных коммуникаций между легочным и системным кровооб-
ращением). В последние годы с целью поддержания ОАП от-
крытым применяют простагландин Еь а позже Е2 (простин);
простагландины 12 и Ё2о почти неэффективны. Применение про-
стагландина обычно показано во время физиологического за-
крытия протока — в первые 24—48 ч. Позже, когда начинается
морфологическая облитерация протока, рассчитывать на эффект
труднее, хотя он тоже возможен. В начале простагландин Е2
вводили с помощью катетера в непосредственной близости к
артериальному протоку, затем оно было заменено постоянным
внутривенным введением. Обычно применение простагландина Ё2
необходимо в течение нескольких дней до тех пор, пока не уста-
новлен точный диагноз, а затем выполняется хирургическое ле-
чение. Дозировки простагландина Е2 у новорожденных следую-
щие: 1) начало лечения — 0,1 мкг/(кг-мин), постоянная внут-
ривенная инфузия; 2) обычное кратковременное внутривенное
лечение (в течение 1—3 дней), уменьшение начальной дозы на-
325
половину (0,05 мкг/кг-мин) после появления эффекта (возник-
новение шума в области протока, РаО2Х30%), но максимум
через 30 мин, дальнейшее уменьшение дозы до 0,025 мкг/(кг-мин)
или меньше в зависимости от стабильного напряжения кислоро-
да РаО2>35%; 3) длительное лечение — прием препарата
внутрь: а) 30—40 мкг/кг каждый час, при необходимости уве-
личение дозы до 90 мкг/кг (РаОг<35%); б) каждые 4 ч
125 мкг/кг.
По мнению И. Бартель, Б. Гелднер (1986), длительность
применения простагландина Е2 и дозировки определяются на-
пряжением кислорода в артериях и появлением побочных дей-
ствий. Наиболее опасными являются приступы апноэ и дизрит-
мий с брадикардией, поэтому начало лечения простагландинами
необходимо проводить в условиях отделений интенсивной тера-
пии. К другим побочным действиям относятся повышение темпе-
ратуры, подергивание мышц, нарушения ритма сердца, арте-
риальная гипотензия и тахикардия, диарея, некротизирующий
энтероколит.
Наиболее показано применение простагландинов при обед-
ненном легочном кровотоке, когда имеется критически низкое
(менее 30%) насыщение кислородом, а легочный кровоток
целиком определяется размером протока. Применение проста-
гландинов у новорожденных с полной транспозицией магист-
ральных сосудов полезно только в комбинации с септостомией.
У больных с атрезией аорты, пре- или юкстадуктальной коарк-
тацией аорты, перерывом дуги аорты применение простаглан-
дина Е2 показано для обеспечения временного шунта справа на-
лево с помощью ОАП, но только, если возможно вскоре экстрен-
ное хирургическое вмешательство. При невозможности выпол-
нения операции прогноз безнадежный и поэтому применение
простагландина не показано.
БАКТЕРИАГЪНЫЙ [ИНФЕКЦИОННЫЙ] ЭНДОКАРДИТ
Из всех ВПС эндокардит наиболее часто возникает при тет-
раде Фалло. Дефект межжелудочковой перегородки (ДМЖП)
сопровождается эндокардитом обычно у детей старшего возраста
и в случаях небольших размеров, что связано с травмой эндокар-
да на фоне высокой скорости кровотока. Сочетание ДМЖП с
аортальной недостаточностью предрасполагает к эндокардиту
(23 на 1000). Аневризма мембранозной части перегородки, обра-
зовавшаяся вследствие спонтанного закрытия ДМЖП, также
является locus minoris resistenta для эндокардита. Дети с от-
крытым артериальным протоком (ОАП) имеют высокий риск
(3,3 на 1000) заболевания эндокардитом, особенно при неболь-
ших размерах протока. Особое место занимают все разновид-
ности стенозов аорты (клапанный, над- и подклапанный). Кла-
панный стеноз и двустворчатый клапан аорты обнаруживаются
326
у 10—12 % детей с бактериальным эндокардитом. Коарктация
аорты в любом возрасте может стать местом воспаления. Как
крайняя редкость эндокардит описан при изолированном стенозе
легочной артерии (только в случаях выраженной обструкции —
0,2 на 1000), вторичном ДМПП (низкая скорость кровотока).
При первичном ДМПП, который сочетается с дефектом створок
митрального и/или трикуспидального клапанов, эндокардит воз-
никает нередко.
По данным Е. L. Kaplan (1986), из 266 детей с эндокардитом
у 24 % была тетрада Фалло, у 16 % — ДМЖП, у 7 % — ОАП,
у 26 % — другие ВПС, у 22 % — приобретенные пороки.
Большинство авторов указывают на сохраняющуюся ведущую
роль зеленящего стрептококка в возникновении заболевания при
подостром течении, стафилококка — в острых случаях (особенно
у больных после операции на открытом сердце). В сумме на них
приходится 80—90 % всех эндокардитов у детей. Особое место
сегодня среди Streptococcus viridans имеют его L-формы, обла-
дающие устойчивостью к пенициллину. Следует отметить отно-
сительную редкость выделения грамотрицательных микроорга-
низмов при эндокардите у детей (Escherichia coli, Klebsiella),
хотя по сравнению с предыдущими двумя десятилетиями их роль
в развитии эндокардита возросла. Грибковые эндокардиты (кан-
дида, гистоплазма и др.) чаще встречаются при длительной анти-
бактериальной терапии, в послеоперационном периоде, при дли-
тельно стоящих венозных катетерах.
В 30—60 % случаев у взрослых и в 12—20 % у детей этио-
логия эндокардита остается неизвестной в связи со стерильными
гемокультурами («абактериальные формы»). Причем частота
этих форм в последние десятилетия не уменьшается, несмотря
на совершенствование методик высевания. Причинами стериль-
ности гемокультур могут быть достационарное применение анти-
биотиков, локализация эндокардита в правых отделах, длитель-
ное течение заболевания (безбактериальная фаза), небактери-
альные возбудители (вирусы, грибы, выявляемые специальными
диагностическими методиками), неадекватная техника взятия
крови и культивирования бактерий; имеет значение количество
микроорганизмов (для высева их должно быть более 100 в 1 мл).
Методы лабораторной диагностики эндокардита изложены в
главе 2.
При ВПС бактериальные вегетации локализуются в месте
порока и области наиболее выраженного турбулентного тока,
удара струи регургитации (повреждение эндотелия, ухудшение
кровоснабжения). Так, при ДМЖП они обнаруживаются в вы-
водном тракте правого желудочка, на трехстворчатом клапане
и клапанах легочной артерии; у больных с ОАП — на легочном
конце протока, при коарктации аорты — в месте порока или
постстенотическом отделе аорты, при стенозе аорты — в самих
клапанах. В. И. Францев, В. Т. Селиваненко (1986) выделяют
следующие морфологические стадии эндокардита: начальная
327
(мукоидный эндокардит), стадия микросимптомов (бородавча-
тый эндокардит), стадия септических проявлений (тромбоязвен-
ный эндокардит).
Симптомам эндокардита обычно предшествуют фурункулез,
ангины, отит, гайморит, стоматиты, заболевания зубов или опера-
тивные вмешательства в полости рта, различные обследования
мочеполовой системы, кожные инфекции, катетеризация полостей
сердца, внутривенные вливания. Эндокардит после дентальных
процедур вызывает стрептококк или стафилококк; об этом сле-
дует помнить у детей с ВПС синего типа, часто имеющих много
кариозных зубов и периодонтиты, чему способствует гипоксемия.
Клинические проявления эндокардита включают классические
симптомы. Лихорадка постоянная, интермиттирующая или гекти-
ческая; возможны длительные субфебрильные подъемы или по-
вышение температуры в необычные часы. Поэтому при подозре-
нии на бактериальный эндокардит показана дробная термомет-
рия/ Озноб или познабливание характерны для острого течения
и менее обычны при подостром. Приступы потоотделения с па-
дением температуры в сочетании с симптомами интоксикации
должны наводить врача на мысль об эндокардите. Кожные по-
кровы бледно-серые, землистые либо имеют оттенок «кофе с мо-
локом», могут быть различные высыпания (петехии, геморра-
гическая сыпь). Возможно появление артралгий, полиартритов.
Спленомегалия сопутствует септическим вариантам эндокар-
дита. Эндокардит может впервые проявить себя гемипарезами,
болями в животе и сердце из-за тромбоэмболического синдрома.
Острому характеру течения соответствуют ярко выраженные
показатели лабораторных исследований (см. главу 2). О вовлече-
нии в процесс почек свидетельствуют гематурия, протеинурия,
лейкоцитурия и др. Необходимо определить состояние печени
(см. главу 2). Выделение гемокультуры является одним из ос-
новных критериев достоверной диагностики бактериального эндо-
кардита. Рекомендуется взять не менее пяти проб для посева,
желательно на фоне подъема температуры, озноба и до начала
медикаментозного лечения.
При подостром начале болезнь развивается исподволь, появ-
ляется субфебрильная температура, утомляемость, недомогание,
больной худеет. Затем могут возникнуть перечисленные выше
симптомы, но выраженные не очень ярко. При таком затяжном
варианте (может продолжаться несколько месяцев или лет) эн-
докардит вызывается маловирулентным возбудителем, посевы
крови чаще отрицательные, биохимические и общий анализы
крови без отклонений. Заподозрить присоединение эндокардита
у больного с ВПС кроме общеклинических симптомов помогает
вновь появившийся шум клапанного порока. Обычно это лью-
щийся протодиастолический шум недостаточности митрального
клапана, реже — систолический шум недостаточности митраль-
ного клапана. Шумы сразу довольно выражены при прободении
или отрыве створок клапанов и менее значительны при изъязв-
328
лении краев. О сопутствующем миокардите свидетельствуют та-
хикардия, приглушенные или глухие тоны сердца, изменения
на ЭКГ (нарушения ритма, атриовентрикулярные и внутрижелу-
дочковые блокады, снижение амплитуды зубцов Т), недостаточ-
ность кровообращения.
В диагностике эндокардита помогает эхокардиография, при
этом двух- и одномерные методики имеют свои преимущества
и ограничения и их следует применять вместе. Вегетации на кла-
панах выявляются не ранее чем через 6—8 нед от начала заболе-
вания, визуализация возможна при размере более 2 мм. Неболь-
шие вегетации неподвижны и представляют собой утолщение
аортальной или митральной створок. Подвижность вегетаций
можно определить лишь при секторальном сканировании. Боль-
шие вегетации (более 5 мм), как правило, отличаются повышен-
ной подвижностью. Такая эхокардиографическая находка побуж-
дает консультировать больных с кардиохирургами по поводу
оперативного вмешательства, поскольку им угрожают отрыв ве-
гетаций и тромбоэмболический синдром.
Приблизительно у 30—40 % больных эндокардитом основным
симптомом поражения сердца является сердечная недостаточ-
ность — стойкая, прогрессирующая, не поддающаяся терапии
сердечными гликозидами и мочегонными препаратами, но умень-
шающаяся при интенсивном лечении антибиотиками [Селива-
ненко В. Т., Нефедов Е. П., 1989]. При тетраде Фалло и хро-
ническом течении эндокардита разросшиеся вегетации могут
сужать выводной тракт правого желудочка вплоть до полной об-
струкции, что приводит к резкому нарастанию гипоксемии. Ана-
логичные изменения возникают при тромбозе на почве эндокар-
дита аортального анастомоза у больных с тетрадой Фалло,
транспозицией магистральных сосудов. При стенозах аорты по-
явление болей в сердце, синкопе, сердечной недостаточности мо-
жет быть связано с резко уменьшившимся сердечным выбросом
из-за обструкции клапана. Сочетание клинических проявлений
эндокардита у больного с ДМЖП с исчезновением шума свиде-
тельствует о «спонтанном» закрытии дефекта разросшимися веге-
тациями.
К осложнениям бактериального (септического) эндокардита
относится тромбоэмболический синдром, проявляющийся геми-
парезами, кратковременной потерей сознания, пневмонией в ре-
зультате эмболии в легочную артерию, инфарктом миокарда при
эмболии в коронарные сосуды. Эндокардит может осложниться
бактериальным шоком, асептическим или гнойным менингитом,
реже менингоэнцефалитом с острой мозговой симптоматикой,
абсцессом мозга.
При эндокардите отмечают вовлечение в процесс почек в виде
инфарктов, гломерулонефрита, нефротического синдрома и по-
чечной недостаточности, которые во многом определяют прогноз
заболевания.
Операции на сердце привели к появлению еще двух разно-
329
видностей бактериального эндокардита — «эндокардита протези-
рованного клапана» и «оперированного сердца». Ранний эндо-
кардит (первые два месяца после операции) протекает по типу
острого сепсиса, он стафилококковый, грибковый, грамотрица-
тельной бактериальной природы с инфицированием из раны, от
шовного материала, легких или мочевых путей; нередко имеются
распад клапана, медиастинит; летальность большая, показана
замена клапана. Поздний эндокардит возникает через любое вре-
мя после операции, проявляется гипертермией или субфебрили-
тетом, сердечной недостаточностью, новыми аускультативными
феноменами, имеет стафилококковую или стрептококковую этио-
логию, его течение менее тяжелое, летальность около 40 %. Дру-
гие осложнения при эндокардите протезированного клапана: эм-
болия, абсцесс кольца клапана, аневризма желудочков. Нару-
шение функции клапанного протеза даже без клинических и
лабораторных симптомов может свидетельствовать об эндокар-
дите.
Е. L. Kaplan (1986) у 23 больных с бактериальным эндокар-
дитом после операции обнаружил в 65 % случаев аортолегочные
анастомозы (при тетраде Фалло, транспозиции магистральных
сосудов с легочным стенозом, трикуспидальной атрезией) и в
23 % были больные с вмешательством на аорте (коарктация,
стенозы); по мнению автора, именно эти больные представляют
группу риска по эндокардиту досле операции.
В последние годы появилась еще одна группа больных с эндо-
кардитом — ранее излеченные пациенты с повторным заболева-
нием. Частота этой формы у детей меньше, чем у взрослых
(около 5%). Смертность при данном варианте эндокардита в
2 раза выше (30—40%), чем среди первично заболевших
(15-25%).
Лечение бактериального эндокардита может быть медикамен-
тозным и хирургическим. Основной частью медикаментозной
терапии являются антибиотики: пенициллин, оксациллин, ампи-
циллин, карбенициллин, цефалоспорины и аминогликозиды (ген-
тамицин, тобрамицин, амикоцин). Остальные антибиотики (пен-
трексил, рифадин, сизомицин, цефамизин, фузидин) обычно оста-
ются в резерве. Наиболее эффективными являются препараты
пенициллинового ряда в сочетании с аминогликозидами. Такая
комбинация антибиотиков приводит к устранению инфекции из
вегетаций за относительно короткий срок (4—6 нед). Пеницил-
лин вводят в дозе 150 000—250 000 ЕД/(кг-сут) (5—20 млн)
в 6 приемов внутривенно капельно или внутримышечно в течение
4—6 нед, гентамицин по 1,5—3 мг/кг в 3 приема до 2 нед. При
отсутствии эффекта или аллергических реакциях, встречающих-
ся в 1 —10 % случаев, переходят на метициллин (12—16 г/сут),
ванкомицин (250—500 мг каждые 6 ч в течение 4—6 нед), цефа
лотин по 100—150 мг/(кг*сут) каждые 4 ч, аскорбинат эритро
мицина (0,5—1,0 г 3 раза в сутки внутривенно капельно ни
изотоническом растворе хлорида натрия или 5 % растворе глю
ззо
козы). При стафилококковых эндокардитах применяют нафциллин
(8—12 г/сут), оксациллин (8—12 r/сут), метициллин (12—
16 г/сут), в комбинации с аминогликозидами — гентамицином
или тобрамицином по 3—5 мг/(кг-сут), фузидином, возможно
сочетание пенициллина с цепорином. Общая длительность анти-
биотикотерапии индивидуальная и колеблется от 2 до 10 мес.
Энтерококк наиболее чувствителен к аминогликозидам, эри-
тромицину. При энтерококковых эндокардитах эффективнее всего
сочетание ампициллина по 300 мг/(кг-сут) с гентамицином по
3—5 мг/(кг- сут), полимиксина или хлорамфеникола с гентами-
цином. Длительность лечение 6—8 нед и более.
Наиболее трудным для лечения является грибковый эндо-
кардит, рекомендуется назначение амфотерицина В по 0,25—
1 мг/(кг-сут) внутривенно ежедневно или через день, несколько
недель и даже месяцев. С амфотерицином В сочетают 5-флюоро-
цитозин в дозе 75—100 мг/(кг-сут) внутрь в 4 приема.
В случаях эндокардита, вызванного клебсиеллой, применяют
цефазолин, гентамицин, амикоцин, сизомицин; при протее — ам-
пициллин, гентамицин, канамицин, карбенициллин; при синегной-
ной палочке — гентамицин, сизомицин, карбенициллин, поли-
миксин В; при неизвестном возбудителе — цефазолил+гентами-
цин + пенициллин + гентамицин, карбенициллин -|- тобрамицин,
ампициллин-|-гентамицин. Если при антибактериальной терапии
состояние ухудшается, то необходимо изменить комбинацию ан-
тибиотиков или повысить дозу.
В тяжелых случаях при отсутствии эффекта от антибакте-
риальной терапии можно провести лечение левамизолом в дозе
2—2,5 мг/кг массы тела по схеме (3 дня в неделю, 4 нед подряд,
затем 2 нед перерыв и еще один курс).
Большинство авторов очень осторожно относятся к назначе-
нию преднизолона при стрептококковых и стафилококковых эндо-
кардитах с септическим течением, поскольку он способствует
персистенции инфекции или даже активирует ее. Мы также счи-
таем, что включение глюкокортикоидов в терапию тяжелых эн-
докардитов нежелательно или доза их не должна превышать
0,5 мг/(кг-сут).
При сопутствующих миокардите, нефрите, полиартрите к ле-
чению можно добавить негормональные антивоспалительные пре-
параты: вольтарен (ортофен) 2—3 мг/(кг- сут), индометацин
2—2,5 мг/(кг-сут). В острых случаях стафилококковых эндо-
кардитов показаны переливание стафилококковой плазмы, у-гло-
булина, при подострых и хронических — стафилококкового ана-
токсина, антифагина, аутовакцины. Появляется все больше кли-
нических и экспериментальных данных об отрицательном эффек-
те антикоагулянтов при лечении эндокардитов.
Сердечные гликозиды при затяжном эндокардите не дают
должного эффекта, так как сердечная недостаточность при этом
больше гемодинамическая, чем миокардиальная. Кроме того,
повышение тонуса миокарда может способствовать отрыву веге-
331
таций с последующей тромбоэмболией. Поэтому можно рекомен-
довать лишь небольшие поддерживающие дозы дигоксина
внутрь.
В настоящее время успешно разрабатываются вопросы хирур-
гической коррекции эндокардита [Arvay A. et al., 1989]. Опера-
тивное вмешательство лучше проводить в период относительной
стабилизации состояния. Показания к хирургическому лечению
при эндокардите: 1) рефрактерная сердечная недостаточность,
отражающая тяжесть гемодинамических нарушений из-за по-
вреждения клапанов; 2) тромбоэмболический синдром; 3) сохра-
няющаяся активность инфекционного процесса; 4) паравальву-
лярный абсцесс; 5) дисфункция и инфицирование клапанного
протеза, заплаты, шовного материала. Не определены сроки и
показанность оперативного вмешательства в случаях обнаруже-
ния при эхокардиографии больших вегетаций на клапанах,
потенциально опасных в смысле эмболии и как постоянные источ-
ники инфекции. В каждом случае показана консультация кардио-
хирурга.
Профилактика эндокардита сводится к предупреждению стой-
кой бактериемии у детей с ВПС, составляющих группу риска
по этому заболеванию: 1) больные с синими ВПС и плохим со-
стоянием полости рта (кариозные зубы, хронический тонзиллит,
болезни периодонта), воспалительными изменениями в мочепо-
ловой системе и т. д.; 2) дети с аускультативной формой про-
лапса митрального клапана и митральной недостаточностью,
имеющие на эхокардиограмме признаки неполноценности соеди-
нительнотканной структуры, расщепление створок; 3) больные с
такими ВПС, как небольшой ДМЖП, открытый артериальный
проток, различные варианты стенозов аорты, двустворчатый
аортальный клапан, коарктация аорты; 4) больные, оперирован-
ные по поводу ВПС с протезированием клапанов, наложением
искусственных кондуитов и заплат из синтетических тканей, а
также с неблагоприятным течением послеоперационного периода
(нагноение раны, медиастинит), у которых эндокардит может
проявиться спустя несколько месяцев и лет после операции;
5) дети с ВПС, излеченные от эндокардита. Санация очагов
хронической инфекции у данного контингента детей должна про-
водиться 1 раз в 3—6 мес.
Все «малые» хирургические вмешательства должны прово-
диться строго по показаниям и под защитой антибиотиков. По-
казаны общеукрепляющие мероприятия.
НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА
И ВНЕЗАПНАЯ СМЕРТЬ
Аритмии возникают у больных с различными ВПС как до, так
и после операции (см. главу 2). Частота выявляемое™ аритмий
определяется методом регистрации и значительно увеличивается
при дозированной физической нагрузке и холтеровском монито-
332
рировании (по сравнению с ЭКГ покоя). В генезе аритмий при
ВПС имеют значение как кардиальные (наличие дополнительных
путей проведения импульса, перегрузка камер сердца давлением
и объемом, дистрофические, ишемические изменения в миокар-
де), так и экстракардиальные (повреждение центральной и веге-
тативной нервной систем) факторы. Возникновению вегетативной
дисфункции у детей с ВПС способствуют различные повреждаю-
щие воздействия в период беременности матери, быстрые (стре-
мительные) или продолжительные роды, характериологические
особенности личности ребенка и психоэмоциональное напряже-
ние, острые и хронические инфекционные и соматические забо-
левания, очаги инфекции, гормональный дисбаланс. Следует
помнить, что к стрессирующим факторам у больных с ВПС от-
носятся наличие серьезного заболевания сердца, повторные гос-
питализации, разлука с родными и сверстниками, предстоящая
операция и др.
Формирование аритмий после операций с искусственным кро-
вообращением связано с характером операционного доступа,
нарушением внутрипредсердной и внутрижелудочковой проводи-
мости, постоперационными изменениями в ЦНС. В возникнове-
нии аритмий имеет значение риэнтри и триггерный механизм
[Kugler J. et al., 1983; Garson A. C., 1984].
Лечение аритмий (экстрасистолии, пароксизмальные и непа-
роксизмальные тахикардии) должно быть комплексным, состоять
из немедикаментозного и медикаментозного подхода. Физиоте-
рапия включает ультразвук, электросон, синусоидальные модули-
рованные токи, индуктотермию, электросон, гальванизацию по
рефлекторно-сегментарной методике или методом общего воздей-
ствия, электрофорез лекарственных веществ по Вермилю или во-
ротниковой методике 5 % раствора бромистого натрия, 4 % рас-
твора сульфата магния и др.
Если одним из этиологических факторов вегетативной дисто-
нии являются личностные особенности больного, показана рацио-
нальная и групповая психотерапия, направленные на коррекцию
личности, смещение акцентов в системе отношений в сторону
максимальной социализации, воспитание адекватных реакций.
Перед операцией детей различного возраста желательно госйи-
тализировать в стационар вместе с матерью, в этом тоже содер-
жатся элементы психопрофилактики. Кардиологи и терапевты
должны проводить беседы с детьми старшего возраста и взрос-
лыми больными, родителями детей грудного возраста о перспек-
тивах, которые раскроются перед ними после устранения ВПС,
что направлено' на уменьшение эмоционального напряжения,
тревоги, депрессии.
При назначении медикаментозного лечения должно быть ис-
пользовано наименьшее число индивидуально подобранных пре-
паратов. Психофармакотерапия включает седативные средства
(препараты валерианы, боярышника, пустырника; сбор трав:
валериана, пустырник, боярышник, шалфей, богульник, зверо-
ззз
бой, пассит), а также транквилизаторы, антидепрессанты, нейро-
лептики. При назначении транквилизаторов необходимо учиты-
вать характеристику стеничности (гипер- или гипостеническое
состояние). При гиперстенической симптоматике (раздражитель-
ность, аффективные реакции, психомоторная возбудимость, тре-
вога, страх) показаны транквилизаторы с седативным эффек-
том, назначают равномерно 3 раза в течение суток или днем и
вечером: мепробамат, седуксен, феназепам, тазепам. При гипо-
стеническом невротическом состоянии (утомляемость, вялость,
слабость, подавленность, апатия, снижение работоспособности),
артериальной гипотонии назначают препараты с умеренным акти-
вирующим действием — дневные транквилизаторы; даются в
2 приема утром и днем: грандаксин, триоксазин, седуксен в ма-
лых дозах, рудотель. С учетом исходного вегетативного тонуса
при симпатикотонии показаны седуксен, тазепам, феназепам;
при ваготонин— амизил (таблетки по 1 мг и 2 мг); при смешан-
ном характере вегетативной дисфункции — беллоид, белласпон,
триоксазин, мепробамат, фенибут, грандаксин.
Нейрометаболические стимуляторы (церебропротекторы) по-
казаны детям с выраженными проявлениями вегетативной дис-
функции, функциональной соматической патологией (дискинезии
желчевыводящих путей, кишечника) и резидуально-органиче-
скими изменениями в ЦНС: ноотропил (пирацетам), аминолон,
энцефабол (пиридитол), пантогам. Возможно назначение глута-
миновой кислоты, особенно при сочетании с сердечной недоста-
точностью, церебролизина по 0,5—1 мл по 10— 15 инъекций. По
показаниям лечение церебропротекторами следует продолжить
в послеоперационном периоде. При внутричерепной гипертензии
показаны курсы диакарба, триампура, глицерола, мочегонных
трав, рассасывающая терапия — лидаза, бийохинол. Для улуч-
шения микроциркуляции назначают трентал, кавинтон, парми-
дин.
Надо ли назначать антиаритмические препараты при экстра-
систолии? При бессимптомных редких (до 10—15 в мин) супра-
вентрикулярных, правожелудочковых экстрасистолах антиарит-
мические препараты не нужны. Они показаны при жалобах
больных на тягостные ощущения аритмии, жизнеугрожаемых
(по Б. Лауну) желудочковых, групповых и политопных экстра-
систолах, когда существует опасность возникновения пароксиз-
мальной тахикардии или мерцания — трепетания предсердий и
желудочков, синкопальных состояний. На практике выбор препа-
рата чаще происходит эмпирически, используя метод «перебо-
ра». При наджелудочковых экстрасистолиях назначают изоптин
по 1 — 3 мг/(кг-сут) в 3—4 приема (таблетки по 40 мг), неже-
лательно применять при синдроме WPW; обзидан (анаприлин)
по 1 2 мг/(кг-сут) в 4 приема (таблетки по 40 мг), противопо-
казания: бронхиальная астма, брадикардия, гипотония; кордарон
по 0,2—0,4 г/сут в 2—3 приема, затем поддерживающая доза
0,1—0,2 г/сут (таблетки по 0,2 г), побочные действия: гипо- и
334
гипертиреоз, нейроретинопатия, блокады сердца, аллергия; этмо-
зин по 3 мг/(кг-сут) в 3—4 приема (в 1 таблетке 0,025 г). При
желудочковых экстрасистолиях наибольший эффект дают корда-
рон, этмозин, аймалин по 2—3 мг/(кг-сут) в 3—4 приема (таб-
летки по 0,05 г). При снижении порога судорожной готовности,
выраженных изменениях со стороны гипоталамических и стволо-
вых структур на ЭЭГ показано сочетание с финлепсином 0,2—
0,6 г в сутки.
При возникновении пароксизмальной тахикардии (ПТ) у лиц
старшего возраста следует попытаться купировать приступ реф-
лекторными воздействиями, усиливающими тонус блуждающего
нерва: надавливание у верхнего внутреннего края глазных яблок
(проба Ашнера), натуживание при зажатом носе (проба Валь-
сальвы), рвотный рефлекс (раздражение корня языка), можно
положить на область сонной артерии ватный шарик, смоченный
эфиром. Иглорефлексотерапия также может купировать приступ.
При неэффективности указанных методов переходят к медика-
ментозному лечению. В зависимости от состояния больного мож-
но начать давать препараты внутрь или сразу вводить внутри-
венно. При неугрожаемом состоянии назначают внутрь седуксен
или феназепам, настойку валерианы с пустырником, изоптин
(1 мг/кг) или кордарон (5—7 мг/кг), финлепсин. В случаях
стойкого продолжения приступа ПТ внутривенно вводят 0,5—
1 мл 1 % раствора АТФ (быстро без разведения) или изоптин
(верапамил) в дозе 0,1—0,15 мг/кг в сочетании с 2—5 мл панан-
гина, седуксеном (0,1 мг на год жизни); препарат лучше вводить
при ПТ с узким комплексом QRS на ЭКГ в приступе. Можно
вводить также дигоксин 0,03—0,05 мг/(кг-сут) с равномерной
дачей в 3 приема за сутки или сразу можно ввести половину
суточной дозы; дигоксин можно сочетать с изоптином и обзида-
ном. При ПТ с аберрантными комплексами QRS на ЭКГ лучше
вводить аймалин (гилуритмал) медленно 1 мг/кг на 15—20 мл
изотонического раствора хлорида натрия, через 2 ч можно по-
вторить введение в дозе 0,5 мг/кг. Новокаинамид менее жела-
телен, так как при внутривенном введении оказывает больше
побочных действий (резкая гипотония, блокады), особенно при
сердечной недостаточности. Доза новокаинамида 0,15—0,2 мл/кг
в виде 10 % раствора (не более 10 мл), лучше мезатоном (0,1 мл
на год жизни); внутрь дают по 0,01—0,03 г/(кг-сут) (таблетки
по 0,25 г) в 4- 6 приемов. Если приступ продолжается длитель-
но, то необходимо добавить мочегонные препараты [лазикс или
фуросемид 1—2 мг/(кг-сут)]. При желудочковой ПТ показано
введение лидокаина. При неэффективности медикаментозного ле-
чения, рецидивирующих приступах ПТ, представляющих угрозу
для жизни, необходимо решить вопрос о хирургическом лечении.
Лечение хронических непароксизмальных тахикардий вклю-
чает препараты для улучшения обменных процессов в ЦНС (при
этом эффективно сочетание энцефабола с глутаминовой кисло-
той, затем курсы аминолона и ноотропила по 2—3 мес), седатив-
335
ные средства, дегидратационную терапию, в сочетании с фин-
лепсином, беллатаминалом или дифенином. Из антиаритмиче-
ских препаратов эффективен кордарон 5—10 мг/(кг-сут).
Внезапная сердечная смерть (ВСС) больных с ВПС до и пос-
ле операции представляет малоизученный аспект кардиологии.
К группам риска по ВСС относятся больные с такими ВПС, как
стеноз аорты, аномалии коронарных артерий, пороки с выра-
женным цианозом, высокой легочной гипертензией и обструктив-
ным заболеванием легочных сосудов, сочетание ВПС с врожден-
ной атриовентрикулярной блокадой и удлинением интервала QT.
Представляют интерес обстоятельства возникновения ВСС: около
20 % молодых лиц умирают во время занятий спортом, 50 % —
при различных обстоятельствах в период бодрствования, около
30 % — в период сна.
Основным механизмом ВСС является аритмогенный — фиб-
рилляция желудочков (80%), реже—брадикардия или асисто-
лия (20%). В танатогенезе ВСС у больных с ВПС имеют значе-
ние как собственно изменения в миокарде, проводящей системе
сердца, так и повреждение центральной и вегетативной нервной
системы.
К предикторам ВСС можно отнести следующие отклонения.
1. Синкопальные состояния, не связанные с заболеванием ЦНС,
вазодепрессорными механизмами, возникающие при эмоциональ-
ной и физической нагрузке, могут быть результатом жизнеугро-
жаемых аритмий. 2. Боли в сердце во время физической нагруз-
ки, сопровождающиеся бледностью, одышкой, ухудшением обще-
го состояния. 3. На ЭКГ к факторам риска ВСС относятся удли-
нение интервала QT, желудочковые аритмии, альтернация зуб-
цов Т (от высокого заостренного до отрицательного), двухпуч-
ковые блокады (в том числе возникшие после операции на серд-
це), стойкий синдром WPW с аритмиями. Все эти изменения осо-
бенно хорошо выявляются при холтеровском мониторировании
и отражают электрическую нестабильность миокарда. Холтеров-
ское мониторирование желательно проводить больным с перечис-
ленными выше ВПС, а также всем после радикальной операции
по поводу сложных ВПС, особенно при тетраде Фалло, транспо-
зиции магистральных сосудов, открытом общем атриовентрику-
лярном канале.
ЛЕГОЧНАЯ ГИПЕРТЕНЗИЯ
Исход операции и послеоперационное течение во многом опре-
деляются состоянием легочных сосудов, уровнем легочной гипер-
тензии (ЛГ). Первичный стимул к вазоконстрикции легочных
сосудов при ЛГ не всегда бывает ясным, вероятно, у многих
больных с ВПС сброс крови в малый круг кровообращения не
единственный и часто не решающий фактор склеротических по-
ражений, а обструктивное заболевание легочных сосудов явля»
ется самостоятельной патологией (по аналогии с первичной ле-
336
точной гипертензией). В связи с этим в послеоперационном пе-
риоде показано назначение терапии, направленной на предотвра-
щение прогрессирования ЛГ. Положительное действие оказы-
вают а-адреноблокаторы толазолин и фентоламин по 0,025 г
3—4 раза в сутки после еды в течение 4—6 нед, перерыв 1—2 нед
и повторный курс [Heinrich U. et al., 1983]. Основное действие
препаратов заключается в снижении давления в легочной арте-
рии не в покое, а при нагрузке. В последнее время большое
внимание уделяется применению вазодилататоров нитропруссида
натрия, гидролазина, диазоксида, а также простациклина (про-
стагландин 12). При первичной легочной гипертензии обнадежи-
вающие результаты получены при применении антагонистов
кальция (верапамил, коринфар), которые предотвращают легоч-
ную вазоконстрикцию в ответ на гипоксию, снижают давление
в легочной артерии. С целью нормализации показателей гемо-
коагуляции рекомендуются малые дозы ацетилсалициловой кис-
лоты 1—3 мг/(кг-сут) однократно утром, курантил, пармидин
длительно. М. Cullen и соавт. (1986) для лечения легочной ги-
пертензии после коррекции ДМЖП с успехом применяли экс-
тракорпоральную оксигенацию мембран.
ПОСТПЕРИКАРДОТОМНЫЙ СИНДРОМ
В послеоперационном периоде через 1—3 нед может развить-
ся постперикардотомный синдром как проявление асептического
перикардита, который связан со вскрытием перикарда при опе-
рациях у больных с ВПС. Клинические проявления синдрома
включают подъем температуры, боли в сердце, шум трения пери-
карда (ослабевает при большом количестве жидкости в полости
перикарда), может быть плевральный выпот (лево- или двусто-
ронний); на ЭКГ характерны признаки перикардита, включая
сглаженные или отрицательные зубцы Ti,h,v56; возможно появле-
ние лейкоцитоза и ускоренной СОЭ. Нераспознанная тампонада
сердца может быть причиной остановки сердца и смерти
[Engle М. А., 1986]. Всем больным показана эхокардиография.
Постперикардотомный синдром имеет аутоиммунную природу.
Его результатом являются слипчивые перикардиты, которые воз-
никают у многих больных, перенесших операцию на открытом
сердце. По наблюдениям М. A. Engle (1986), частота синдрома
составила 35 % у детей до 2 лет, 36 % — у детей старшего воз-
раста, 29 % — у больных от 21 года до 40 лет, 20 % — у больных
41—60 лет, 12 % — у больных старше 60 лет. Лечение включает
назначение кортикостероидов: преднизолон 2 мг/(кг-сут) в
3 приема в течение одной недели, половину дозы — одну неделю,
1 /4 дозы — в течение еще 1—3 нед. При менее тяжелых проявле-
ниях можно ограничиться назначением нестероидных противовос-
палительных препаратов — индометацин, вольтарен (ортофен)
на 2—3 нед.
337
ТРАХЕОБРОНХИТЫ, ПНЕВМОНИИ
Известно, что дети с ВПС часто болеют повторными ОРВИ,
осложняющимися трахеобронхитами, пневмонией; к этому пред-
располагают парциальные иммунодефицитные состояния, застой-
ные явления в сосудах легких, гипоксические изменения слизис-
той дыхательных путей, снижение защитных свойств миндалин
(хронические тонзиллиты), сопутствующие рахит, гипотрофия’.
Вирусные поражения верхних дыхательных путей необходимо
отличать от аллергических ларингитов и трахеобронхитов, кото-
рые характеризуются приступами сухого, надсадного, навязчиво-
го, иногда грубого «лающего» кашля, чаще в ночное время,
При инфекционных трахеобронхитах необходимо уложить
больного в постель, показано проветривание помещений (но без
сквозняков). Назначают теплое питье, настой малины, калины,
липового цвета, мед, щелочные воды, отхаркивающие средства
(нашатырно-анисовые капли, корень алтея, сбор грудной № 1,3,
мукалтин, настой из листа подорожника большого, мать-и-маче-
хи, трава багульника, корни девясила, пертуссин и др), банки,
горчичники, горячие ножные ванны; при высокой температуре
анальгин с амидопирином. При рецидивирующем или затянув-
шемся бронхите показаны антибиотики (пенициллин, эритроми-
цин), антигистаминные препараты (глюконат кальция, димед-
рол, пипольфен), УВЧ или диатермия на грудную клетку, сана-
ция носоглотки, придаточных пазух. Лечение респираторных ал-
лергенов включает устранение контакта с причиннозначимым
аллергеном, специфическую гипосенсибилизацию, теплые щелоч-
ные ингаляции и питье, отвлекающие теплые ножные ванны,
банки, отвар багульника, антигистаминные препараты.
Для лечения пневмоний любой этиологии применяют антибио-
тики; пенициллин внутримышечно 50 000—100 000 ЕД/(кг-сут)
на 3—4 инъекции; ампициллин (пентрексил) внутрь 100—
200 мг/(кг-сут) на 4 приема, внутримышечно по 0,25 г 3—4 ра-
за в сутки; оксациллин (детям дошкольного возраста 1—2 г,
старше 7 лет — 2—3 г/сут на 4 приема), метициллин (внутри-
мышечно 200 мг/(кг-сут) на 3—4 приема детям первых 10 лет
жизни) ; при тяжелом течении эти антибиотики назначают вместе
с аминогликозидами (канамицином, гентамицином), которые
противопоказаны при патологии почек и органов слуха. Длитель-
ность курса лечения антибиотиками 10—14 дней. Назначают так-
же нистатин, антигистаминные препараты, витамины Вь В6, С.
Для улучшения бронхиальной проходимости, дренажной функции
бронхов — ингаляции с растворами натрия гидрокарбоната, про-
теолитическими ферментами (трипсин, химопсин), ацетилцистеи-
ном, разжижающими мокроту; отхаркивающие средства внутрь
(см. выше); показаны оксигено- и аэротерапия. С целью дезин-
токсикации проводится инфузионная терапия: 10 % раствор глю-
козы, кокарбоксилаза, 1—5 мл 5 % раствора витамина С, эуфил-
лин (0,15—1 мл 2,4 % раствора), сульфокамфокаин. При деком-
338
пенсированном ацидозе необходимо введение раствора натрия
гидрокарбоната. При токсических пневмониях показаны гормо-
ны преднизолон внутривенно или внутримышечно 1-5 мг/(кг-сут).
При астматическом компоненте назначают эфедрин, теофедрин,
глицерин, эуфиллин, банки, горячие ножные ванны. При затяж-
ных и сливных пневмониях производят прямое переливание крови
(от матери или отца) 3—5 раз с интервалом 2—4 дня, назначают
декарис. Физиотерапевтические мероприятия: горчичные обвер-
тывания или горчичники. С 5-го дня можно назначать УВЧ,
индуктотерапию, электрофорез с раствором хлорида кальция и
аскорбиновой кислоты в зависимости от фазы развития пневмо-
нии. Целесообразно применение стимулирующих средств (пен-
токсил, комплекс витаминов). После выписки из стационара
дети с ВПС находятся под диспансерным наблюдением у пе-
диатра и кардиолога.
ИЗМЕНЕНИЯ СО СТОРОНЫ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
И ПЕЧЕНИ
У детей с ВПС нередко можно отметить сниженный аппетит
на фоне артериальной гипоксемии, сердечной недостаточности,
постгипоксической энцефалопатии, лихорадочных состояний, со-
путствующих острых инфекций и обострения хронических очагов
инфекции, глистной инвазии, анемии. Лечение должно быть на-
правлено на соблюдение всех правил питания ребенка (объем,
качество пищи, часы кормления). Для повышения аппетита боль-
ным назначают желудочный сок, соляную кислоту с пепсином,
поливитамины, препараты железа, апилак, карнитин, витами-
ны В6 (пиридоксин, пиридоксальфосфат), С (аскорбиновая кис-
лота), В2 (рибофлавин) или рибофлавин-мононуклеотид (внут-
римышечно по 10—15 инъекций) с липоевой кислотой.
Одной из жалоб детей с ВПС являются запоры, среди кото-
рых выделяют гипотоническую (гипокинетическую) форму с вя-
лой перистальтикой, гипотоническим расширением толстого ки-
шечника и спастическую, при которой доминирует блуждающий
нерв, кишечник спазмирован, стул в виде круглых, спрессован-
ных шариков. При спастических запорах в рационе не должно
содержаться много шлаковых веществ, а при гипотонических
формах, наоборот, показана фруктово-овощная диета. Необхо-
димо приучать ребенка к дефекации в строго определенное время
(утро). Клизмы разрешаются в тяжелых случаях и только в на-
чале лечения, ибо злоупотребление ими способствует закрепле-
нию запоров. Целесообразна лечебная физкультура (при отсут-
ствии сердечной недостаточности), осторожно — массаж живота.
Назначают парафиновое и облепиховое масло внутрь, сок алоэ,
плод аниса (в виде настоя), плод фенхеля (в виде укропной
воды), витамины В1 и В6; при спастических запорах показаны
препараты белладоны, при гипотонических — дигидроэрготомин,
ацетилхолин.
339
Оценка состояния печени у больных с ВПС до и после опера-
ции имеет большое значение. Нарушения функции печени у боль-
ных с ВПС и сердечной недостаточностью чаще рассматривают-
ся только как результат гемодинамических нарушений, при этом
не распознаются самостоятельные поражения собственно печени
(активный хронический гепатит, лекарственные поражения, би-
лиарный цирроз и др.). При решении вопроса об операциях на
сердце необходимо больных с гепатомегалией подразделять на
следующие группы [Логинов А. С. и др., 1986]: 1) нарушение
функции печени обусловлено гемодинамическими сдвигами, опе-
рация является методом выбора; 2) больные с сочетанными по-
ражениями печени, обусловленными кардиоваскулярными нару-
шениями и самостоятельными заболеваниями печени, но при ве-
дущей роли гемодинамических отклонений, оперативное лечение
обосновано, так как устраняется одна из причин гепатомегалии,
в этих случаях показана тщательная предоперационная подго-
товка с применением гепатопротективных препаратов; 3) боль-
ные с самостоятельными заболеваниями печени, при этом, как
правило, отсутствует параллелизм между степенью гемодинами-
ческих расстройств и функциональным состоянием печени. Хи-
рургическое лечение в этих случаях не показано, так как опера-
ция может привести к печеночной коме.
При гепатомегалии у больных с ВПС в комплексное лечение
сердечной недостаточности рекомендуется включать следующие
препараты: эссенциале («эссенциальные» — необходимые — фос-
фолипиды) внутривенно или перорально в капсулах, липоевую
кислоту внутримыщечно или перорально, витамин Bis, никотино-
вую кислоту, сирепар или витогепат на 20 25 дней.
У детей с ВПС часто имеют место различные проявления
дисбактериоза, причиной которого являются раннее и длительное
назначение антибиотиков, сопутствующее поражению ЦНС.
В клинике преобладают неустойчивость аппетита, запоры, метео-
ризм, приходящее учащение стула, неравномерная окраска кало-
вых масс.
Для подтверждения диагноза определяют микрофлору ки-
шечника. Лечение дисбактериоза включает правильную орга-
низацию питания, желательно с использованием кислых смесей
(ацидофильные, кефир). Из биопрепаратов у детей первого года
жизни наиболее целесообразно применять бифидумбактерин, би-
фикол, лактобактерии, бактисубтил, которые в зависимости от
клиники назначают от 5 до 10 доз в сутки в течение 10—14 дней
и более.
Одновременно показаны полиферментные препараты (пан-
зинорм, панкурмен и др.). Коррекция нарушений аэробной
флоры осуществляется направленными фагами (протейный, ко-
липротейный, стафилококковый) в 2—3 повторных курса. При
значительном повышении стафилококка в фекалиях можно при-
менять хлорофиллипт внутрь, при грибах рода Candida назна-
чают противогрибковые препараты.
340
АНЕМИИ
У детей раннего и дошкольного возраста с ВПС выделяют
группу анемических синдромов, которые проявляют себя сни-
женным аппетитом, недостаточной прибавкой в массе, задержкой
физического развития, бледностью, общей слабостью. При вы-
раженной анемии усиливаются и так существующие проявления
сердечной недостаточности (одышка, тахикардия), систолический
шум над областью сердца. У детей с ВПС бледного и синего типа
чаще имеются железодефицитные анемии, связанные с однооб-
разным характером вводимой пищи, кишечным инфантилизмом,
повторными ОРВИ и пневмониями. Гемоглобин менее 9,93 ммоль/л
у детей с синими ВПС свидетельствует об относительной ане-
мии. Количество гемоглобина и эритроцитов при железодефи-
цитной анемии понижено, содержание гемосидерина в костном
мозге и железа в сыворотке крови значительно снижено, железо-
связывающая способность крови повышена.
Лечение анемий сводится к правильной организации питания,
назначению препаратов железа: сироп алоэ с железом (по
15—30 капель 3 раза в сутки детям до 1 года, по 1 /2—1 чайной
ложке детям старше 1 года): таблетки «гемостимулин» по 1 /2—
1 таблетке 2 раза в день с аскорбиновой кислотой, а также
ферроплекс, конферон, феррокаль. При нарушениях всасывания
и желудочно-кишечных заболеваниях препараты железа вводят
парентерально: 0,25—2,5 мл ферковена 1 раз в день внутривенно;
0,5—1 мл фербитола внутримышечно детям до 2 лет, старше
2 лет — 1—2 мл 1 раз в день, 10—15 инъекций; назначают также
гематоген жидкий по 1 /2 чайной— 1 десертной ложке 2—3 раза
в сутки, внутримышечно по 0,25—1 мл витогепата по 10—20 инъ-
екций на курс лечения, сульфат меди (по 5—15 капель 1 % рас-
твора в молоке 2—3 раза в сутки во время еды), показаны ви-
тамины С, В2 (рибофлавин). В тяжелых случаях проводят пере-
ливания крови, эритроцитной массы.
СПИСОК ЛИТЕРАТУРЫ
Алекси-Месхишвили В. В., Николюк А. П., Чуркин В. М. и др. Глубокая гипотер-
мия со снижением объемной скорости перфузии для коррекции больших
ДМЖП у грудных детей//Неотложная хирургия врожденных пороков сердца
у детей раннего возраста. — М., 1986. — С. 134 - 146.
Амосов Н. М., Зиньковский М. Ф. Хирургическое лечение тетрады Фалло. —
Киев: Здоров’я, 1982. — 151 с.
Бартель И., Гелднер Б. Применение простагландина Е? у новорожденных с врож-
денными пороками сердца/Неотложная хирургия врожденных пороков серд-
ца у детей раннего возраста. —М.: Медицина, 1986. — С. 128 133.
Банкл Г. Врожденные пороки сердца и крупных сосудов: Пер. с англ. — М.: Меди-
цина, 1980. — 312 с.
Белоконь Н. А., Белозеров Ю. М., Осокина Г. Г. и др. Клиническое значение
проблемы пролапса митрального клапана у детей. — Педиатрия, 1989. № 2.
с. 71—76.
Белоконь Н. А., Кубергер М. Б. Болезни сердца и сосудов у детей: Руководство
для врачей. — В 2-х томах. — М.: Медицина, 1987. — 918 с.
Бокерия Л. А. Нарушения ритма сердца. В кн.: Сердечно-сосудистая хирургия./
Под ред. В. И. Бураковского, Л. А. Бокерия. — М.: Медицина, 1989. —
С. 471 524.
Бочков А. П. Наследственность человека и мутагены внешней среды. — М.: Меди-
цина, 1989. - 269 с.
Бураковский В. И., Бухарин В. А., Плотникова Л. Р. Легочная гипертензия при
врожденных пороках сердца. — М.: Медицина, 1975. — 247 с.
Бураковский В. И.. Подзолков В. П., Рагимов Ф. Р. Дефект аортолегочной пере-
городки. М.: Медицина, 1987. — 146 с.
Бураковский В. И., Бухарин В. А., Подзолков В. П. и др. Врожденные пороки
сердца. В кн.: Сердечно-сосудистая хирургия/Под ред. В. И. Бураковского,
Л. А. Бокерия. М.: Медицина, 1989. С. 45 -382.
Бухарин В. А., Бондарев Ю. И., Иваницкий А. В. и др. Изолированная гипо-
плазия правого желудочка сердца//Грудная хир. — 1981. — № 2. — С. 16 —
23.
Волынский К). Д.. Голома В. В., Курочкина А. И. Асинергии миокарда левого
желудочка у больных со стенозом устья аорты//Кардиология. — 1989,
№ 8. — С. 53—57.
Делягин В. М. Двух- и четырехстворчатый клапаи аорты//Педиатрия. — 1989,
№ 8. — С. 38 -43.
Замыслов В. Л. Электро- и фонокардиографические признаки различных форм
стеноза легочной артерии с интактной межжелудочковой перегородкон//Пе-
диатрия. — 1989, № 8. — С. 58—64.
Иваницкий А. В. Роль рентгенологического исследования в диагностике пороков
сердца у детей//Педиатрия. — 1985. — № 8. — Т. 7. — С. 55—57.
Кассирский Г. И. Фонокардиография//Руководство по кардиологии/Под ред.
Е. И. Чазова. — М.: Медицина, 1982. — Т. 2. — С. 91 —101.
Константинов Б. А., Микаелян А. Л., Ткаченко В. М. и др. Сократительная функ-
ция миокарда левого желудочка у больных врожденным стенозом устья
аорты//Кардиология. — 1987. - № 4. — С. 61—64.
Константинов Б. А., Алексеева Л. А., Кулагина Т. И. и др. Днсплазня митраль-
342
ного клапана как кардиохнрургическая проблема//Кардиология. — 1987. —
№ 6. — С. 19—24.
Королев Б. А., Романов Э.И. Пороки сердца. — Горький: Горьк. мед. ин-т,
1984. — 65 с.
Лауцявичюс А. А., Бартусявичене А. С.. Палющинская Н. А. и др. Место
компьютерного анализа двухмерных эхокардиограмм в предоперационной
оценке функционального состояния левого желудочка у больных с аорталь-
ными пороками//Сог et vasa. — 1989, № 4. — С. 273 -281.
Михайлов С. С. Клиническая анатомия сердца. — М.: Медицина, 1987. — 287 с.
Парийская Т. В., Гикавый В.'И Врожденные пороки сердца у детей и их фарма-
котерапия. Кишинев: Штипнуа, 1989.
Петросян Ю. С., Гарибян В. А., Мусатова Т. И. и др. Процедура Рашкинда
н Парка и судьба больных в отдаленные сроки//Неотложная хирургия
врожденных пороков сердца у детей раннего возраста. — М., 1986. — С.
89—96.
Петросян Ю. С.. Иваницкий А. В., Кужукбаев X. Баллонная дилатация пери-
ферических стенозов легочной артерии//Грудная хнр. — 1986. — № 1.—
С. 18—22.
Подзолков В. П., Бондарев Ю. И., Махачев О. М. и др. Радикальная коррекция
единственного левого желудочка сердца с синистротраиспозицией аорты//
Грудная хнр. — 1988. — № 3. — С. 89 —92.
Подзолков В. П., Чиаурели М. Р., Алекян Б. Г. и др. Отдаленные результаты
гемодинамической коррекции сложных врожденных пороков по методу Фон-
тена//Грудиая хир. — 1988.—№ 4. — С. 11-19.
Подзолков В. П., Махачев О. М., Дадабаев М. X. и др. Современный подход
к хирургическому лечению единственного желудочка сердца//Грудная хир. -
1988. — № 4. - С. 80 -81.
Савельев С. В. Отдаленные результаты лечения больных с открытым артериаль-
ным протоком методом эндоваскулярной окклюзии.//Кардиология. 1988. —
№ 4. - С. 77—80.
Селиваненко В. Т., Нефедов Е. П. Изменения сократительной способности миокар-
да при различных его состояниях у больных врожденными пороками сердца
после операции//Кардиология, — 1989; № 8. — С. 57—61.
Фальковский Г. Э.. Ильин В. И., Бузинова Л. А., Крамер В. С. Хирургическое
устранение транспозиции магистральных сосудов//Грудная хир. — 1985. --
№ 4. - С. 53—57.
Фальковский Г. Э., Бузинова Л. А. Хирургическое лечение сложных врожденных
пороков сердца в раннем возрасте//Неотложная хирургия врожденных поро-
ков сердца у детей раннего возраста. — М., 1986. — С. 147—154.
Францев В. И., Селиваненко В. Т. Бактериальный эндокардит при врожденных
пороках сердца. — М.: Медицина, 1986. — 142 с.
Чернова М. П., Белоконь И. А., Акаева Ф. Ю. О частоте выявления синдрома
гипоплазии левого желудочка у новорожденных детей и его отношение
к первичному фиброэластозу эндокарда у детей//Педиатрия. — 1976. -
№ 6. — С. 43—49.
Шарыкин А. С. Хирургическое лечение врожденных пороков сердца у детей
первых трех месяцев жизии//Неотложная хирургия врожденных пороков
сердца у детей раннего возраста. — М., 1986. —С. 155 -163.
Элиас Ш., Янагес Р. М. Пороки развития сердечно-сосудистой системы//Наслед-
ствеииые болезни при беремеиности/Под ред. Дж. Шульмана, Дж. Симпсо-
на. — М.:Медицина, 1985. — С. 224-- 257.
Ahumada G. G. Congenital heart disease//Cardiovascular pathophysiology. —
Oxford: University Press, 1987. — P. 232— 260.
Areias J. C., Valente J. Congenital heart malformations associated with dilated
cardiomyopathy//Int. J. Cardiol. — 1987. — Vol. 17. — P. 83— 88.
Arvay A., Lengyel M., Цукерман Г. И. и др. Хирургическое лечение клапанного
эндокардита в активной стадии заболевания//Сог et vasa. — 1989, № 1. —
С. 27—36.
Boughman J. A., Berg К- A., Astemborski 1. A. et al Familial risks of congenital
heart defect assessed in a populationbased epidemiologic study//Amer. J. Med.
Genet. — 1987. — Vol. 26. — P. 839 -849.
343
Butto F., Lucas R. V., Edwards J. E. Persistent truncus arterious: pathologic ana-
tomy in 54 cases//Pediat. Cardiol. — 1986. — Vol. 7. — P. 95—101.
Castaneda A. R., Norwood 117. J. Fallots tetralogy//.). Stark, M. de Leval (eds.):
Surgery tor Congenital Heart Defects. — London: Grune Stratton, 1983.
Clark E. B. Mechanisms in the pathogenesis of congenital heart defects//Pier-
pont ME, Moller J. M. (ed.) The Genetics of Cardiovascular disease.—
Boston: Martinus-Nijoff, 1986. — P. 3—ll.
Cohn H. E., Freed M. D., Hellenbrand 117. F., Fyler, D. C. Complications and
mortality associated with cardiac catheterization in infants under one year.
A prospective study//Pediat. Cardiol. — 1985.—Vol. 6. — P. 123—131.
Cullen M., Splittgerber F., Sweezer 117. et al. Pulmonary hypertension postventri-
cular septal defect repair treated by extracorporeal membrane oxygenation//
J. Pediat. Surg. — 1986. — Vol. 21. — P. 675—677.
De Leval M., Bull C., Hopkins R. el al. Dessison making in the definitive repair
of the heart with a small right ventricle//Circulation. — 1985. — Vol. 72,
Suppl. 11—P. Il—52. — P. 11—60.
Di Donato R. M., Fyfe D. A., Puga F. У. et al. Fifteen-year experience with sur-
gical repair of truncus arteriosus//J. Thorac. Cardiovasc. Surg—1985.—
Vol. 89. — P. 414—420.
Ferencz C., Rubin J. D., McCarter R. J. et al. Congenital heart disease: prevalence
at live birth//Amer. J. Epidem. — 1985. —Vol. 121. — P. 31—36.
Finley L, Nugent S. T., Hellenbrand 117. et al. Sinus arrhythmia in children with
atrial septal defect: an analysis of heart rate variability before and after
surgical repair//Br. Heart J. — 1989. —Vol. 61. — P. 280—284.
Fisher R. G„ Moodie D. S., Sterba R. et al. Patenl ductus arteriosus in adults:
Natural history versus surgery therapy//Pediatric Cardiology/E. F. Doyle,
M. A. Engle, W. M. Gersony et. al. (eds.) — Springer—Verlag, 1986. —
P. 1145—1147.
Fried R., Falkovsky G., Newburger J. et al. Pulmonary artery changes in patients
with ventricular septal defects and severe pulmonary hypertension//Pediat.
Cardiol. — 1986. — Vol. 7. — P. 147—154.
Galloway A. C., Campbell D. N., Clarke D. The value of early repair for total
anomalous pulmonary venous draihage//Pediat. Cardiol. — 1985. — Vol. 6. —
P. 77—82.
Gikonyo В. M., Lucas R. V., Edwards J. E. Anatomic features of congenital
pulmonary valvar stenosis//Pediat. Cardiol. — 1987. — Vol. 8. — P. 109—115.
Gillebert C., Van Hoof R., Van de Werf J. et al. Coronary artery fistulas in an
adult population//Europ. Heart. J. — 1986. — Vol. 7. — P. 437—443.
Gorlin R: Natural history, medical therapy and indications for surgery in mitral
valve disease//Mitral valve disease. Diagnosis and Treatment/Ed. by M. lo-
nescu, L. Cohn. — Butterworths, 1985. — P. 105—127-
Hamilton J. R. L., Fonseka S. F., Wilson N. et al. Operative balloon dilatation for
pulmonary atresia with intact ventricular septum//Brit. Heart J. — 1987. —
Vol. 58. — P. 374—377.
Jacobson H. G. Magnetic resonance imaging of the cardiovascular system. Pre-
sent state of the art. and future potential//.). Amer. Med. Ass.— 1988.—
Vol. 259. — P. 253—259.
Kirklin J. 117., Barratt-Boyed B. G. Cardiac Surgery. A Wiley Medical Publica-
tion. — New York; Toronto; Sungapore, 1986.
Klautz R. J.. Ottenkamp I., Guaegebeur I. M. et al. Anatomic correction for trans-
position of the great arteries: first follow-up (38 patients)//Pediatr. Cardi-
ol. — 1989. — Vol. 10. — P. 1—9.
Kleinman C. S., Copel J. A. Fetal echocardiography: a 7-year experience//Pediat-
ric Cardiology./E. F. Doyle, M. A. Engle, W. M. Gersony et al. (eds.) —
Springer-Verlag, 1986. — P. 21—25.
Koh E., Nakagawa M., Hamaoka K- et al. Congenital atresia of the left coronary
ostium: diagnosis and surgical treatment//Pediatr. Cardiol. — 1989. —
Vol. 10. — P. 159—163.
Kramer H. H., Majewski F., Trampisch H. S. et al. Malformation patterns in
children with congenital heart disease//Amer. J. Dis. Childh.— 1987.—
Vol. 141. — P. 789—795.
344
Leung M. P., Lau К- C. Demonstration of ascending aorta in hypoplastic left heart
syndrome with aortic atresia by balloon occlusion aortography//Pediat.
Cardiol. — 1987. — Vol. 17. — P. 370—372.
Livolsi A., Kastler B., Dietmann J. et al. Apport de limagerie par risonance mag-
netigue dans le diagnostic neonatal des cardiopathies congenitales//Arch. Fr.
Pediatr. — 1989. — Vol. 46. — P. 89—94.
Mohr-Kahaly S., Erbel R., Zotz R. et al. Left ventricular contrast echocardiography
using an oxypolygelatine solution//Z. Kardiol. — 1987. — Bd 7. — S. 699—705.
Moller J. H., Patton C., Varco R., Lillehei C. Postoperative ventricular septal de-
fect: twenty—four—to—thirty year follow-up of 245 patients//Pediatric Cardi-
ology./E. F. Doyle et al. (eds.)—Springer—Verlag, 1986.—P. 1278—1279.
Moodie D. S., Fyfe D., Gill C. G. et al. Anomalous origin of the left coronary arte-
ry from the pulmonary artery (Bland—White Garland syndrome) in adult
patients: long-term follow-up after surgery//Amer. Heart J. — 1983.—
Vol. 106. — P. 381—386.
Nora J. J., Nora A. H. The genetic contribution to congenital heart diseases//Nora
J. J., Takao A. (eds.). Congenital heart disease: causes and process. — New
York: Futura, 1984. — P. 3—13.
Oliver J. M., Lopez de Ca E., Dominguez F. et al. Congenital right coronary artery
to left atrium fistula detected by two-dimensional and Doppler echocardio-
graphy//Amer. Heart J. — 1987. — Vol. 114. — P. 165—166.
Perrault H., Drblik S. P., Montigny M. et al. Comprison the cardiovascular adjust-
ments of exercise to adolescents 8 to 15 years of age after correction of Tetra-
logy of Fallot, Ventricular Septal Defect of Atrial septal defect//Amer. J.
Cardiol. — 1989. — Vol. 64. — P. 213—218.
Rey C., Marache P., Motina D.. Mouly A. Valvuloplastie transluminale percutanee
des stenoses pulmonaires. A propos 24 cas//Arch. Malad. Coeur. — 1985. —
Vol. 78. — P. 703—710.
Salzer H. R., Haschke F., Wimmer M. Et al. Growth and nutritional intake winh
congenital heart disease//Pediatr. Cardiol.— 1989. — Vol. 10. — P. 17—23.
Sanchez-Cascos A. Riesgo genetico pars los hijos de madres con cardiopatias
congenitas//An Esp. Pediat. — 1987. — Vol. 26. — P. 81—83.
Sechtem U., Pflugfelder P., Cassidy M. et al. Ventricular septal defect: visualiza-
tion of shunt flow and determination of shunt size by cine MR imaging//
AJR. — 1987. — Vol. 149. — P. 689—692.
Shaffer E. M., Rocchini A. P., Dick M., Rosenthal A. Transseptal left heart cathe-
terization as an aid in the diagnosis of cor triatriatum//Pediat. Cardiol. —
1987. — Vol. 8. — P. 123—125.
Shampaine E. L., Nadelman L„ Rosenthal A. et al. Logitudinal psychological
assessment in Tetralogy of Fallot//Pediatr. Cardiol. — 1989. — Vol. 10. —
P. 135—141.
Sipek А. Литий и аномалия Эбштейна//Сог et vasa. — 1989. — N 2. — C. 150—
157.
Somerville J. Congenital heart disease in adults and adolescents//Brit. heart. J. —
1986. — Vol. 56. — P. 395—397.
Tahimoto T., Tsuchiya T., Kamiya T. et al. Histologic findings of biopsied right
ventricular myocardia in congenital heart disease before and after heart sur-
gery//Pediatric Cardiology/E. F. Doyle, M. A. Engle, W. M. Gersony et al.
(Ed.). — Springer-Verlag, 1986. — P. 1053—1057.
Van Rossum A. C., Visser F. C., Van Einige M. Y. et al. Magnetic resonance ima-
ging of the heart for determination of ejection fraction//Int. J. Cardiol. —
1988. — Vol. 18. — P. 53—63.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Алкалоз 47
Анамнез 14
Анастомоз Блелока — Тауссиг 187
- Ватерстоуна — Кули 187
— Поттса Смита 187
Ангиография 40
Аневризма мембранозной части межже-
лудочковой перегородки 108
— синуса Вальсальвы врожденная 170
- - — - — анатомия 170
_ — — гемодинамика 170
— — — — диагноз 171
— — — - клиника 171
- — — лечение 174
— — — _ течение 174
Анемии 341
Аномалня(н) впадения легочных вен 69
— клапана митрального 266
— — — недостаточность врожденная 266
— — — пролапс 271
— — — стеноз 277
— развития артерий коронарных 291
— Эбштейна 231
— — анатомия 231
— — гемодинамика 232
— — диагноз 233
— — клиника 233
— — лечение 238
---ФКГ 235
---ЭКГ 235
— — эхокардиография 235
Аорта, дуга двойная 168
— клапан двустворчатый 159
— коарктация 159
— пороки развития 146
— — — аневризма синуса Вальсальвы
врожденная 170
— - — двойная дуга аорты 168
— — — двустворчатый клапан 158
— — — коарктация 159
— — — недостаточность аортальных кла-
панов врожденная 157
__ — туннель аорто-левожелудочко-
вый 175
Аорто-левожелудочковый туннель 175
Аортолегочная перегородка, дефект 62
— — — анатомия 62
— — — гемодинамика 64
— — — диагностика 65
— — — классификация 62
— — — клиника 65
— — — лечение 67
— — - тип I 62
---------11 63
---------Ill 63
---------IV 64
---7-----V 64
Аритмии у новорожденных 27
Артериальное давление при ВПС 20
Артериальный проток открытый 49 .
- анатомия 49
— — — аортография 56
— — — гемодинамика 50
- — — диагноз 51
— — — клиника 51
— — — лечение 58
— — — осложнения 54
— — — рентгенограмма 55
--------ФКГ 55
--------ЭКГ 54
— — — эхокардиограмма 56
— ствол общин 224
— — — анатомия 224
— — — гемодинамика 226
— — — диагноз 226
— — — классификация 226
— — — клиника 226
— — — лечение 228
— — — течение 228
Артерня(н) коронарная(ые), аномалин
развития 291
— — единая, аномальное отхождение от
легочной артерии 301
— — левая, аномальное отхождение от
легочной артерии 293
— — — — - от правого синуса Валь-
сальвы 302
— — правая, аномальное отхождение от
легочной артерии 301
— — устье, стеноз н атрезия 302
— легочная, атрезия с дефектом меж-
желудочковой перегородки 135
— — — с интактной межжелудочковой
перегородкой 249
— — недостаточность клапанов врожден-
ная 143
— — — — — анатомия 143
— — — — — гемодинамика 143
— — — — — диагноз 144
— - — — — классификация 143
— - — — — клиника 144
— - — — — лечение 146
— — пороки развития 124
— — расширение идиопатическое 141
— — — — диагноз дифференциальный
142
346
— — — — рентгенограмма 142
— — стеноз(ы) изолированный 124
— — — периферические 131
— ныряющие 302
Атрезня артерии легочной с дефектом
межжелудочковой перегородки 135
— — — с интактной межжелудочковой
перегородкой 249
-- — - — — - - вмешательство хирур-
гическое экстренное 254
— трехстворчатого клапана 257
— — — анатомия 257
- — — гемодинамика 259
- — - диагноз 260
— — — классификация 257
- — — клиника 260
— — — ангиокардиография 263
— — — — рентгенографии 262
----------- фКГ 268
----------ЭКГ 261
— — — — эхокардиография 262
— — — лечение 264
Атриовентрикулярный канал открытый 109
— — — общий 116
.. — анатомия 116
— — — - диагностика 116
- — — - классификация 116
— — - клиника 116
— — - лечение 119
— - частично 110
— - - — анатомия 110
— - — гемодинамика 111
— -- - -- диагностика 111
— — — — классификация 110
— - — клиника 111
-- — — — лечение 115
Аускультация 21
Ацидоз 47
Биопсия легкого 41
— сердца 41
Блокады атриовентрикулярные 28
Боталлов проток см. Артериальный про-
ток
Брадикардия синусовая 27
Вольфа — Паркинсона — Уайта феномен
27
Гипертензия легочная 11
Гипертрофия миокарда желудочка(ов)
комбинированная 28
— — — левого 25
— — — правого 25
— — предсердия (й) левого 25
— — — обоих 25
— — — правого 25
Гипоплазия желудочка правого изолиро-
ванная 247
Дефект перегородки аортолегочной 62
— — межжелудочков'ой 93
- — - анатомия 93
— — - гемодинамика 95
- — диагностика 97
— — — классификация 93
- — — клиника 97
— — — лечение 104
— — межпредсердной 69
— — анатомия 69
- - — — вторичный 71
-------- ФКГ 74
------ЭКГ 74
— — эхокардиограмма 76
- — гемодинамика 70
- — диагностика 72
— - - классификация 69
— — — клиника 72
— — — лечение 77
Допплерэхокардиография 34
Дренаж вен легочных аномальный 79
— — — — частичный 79
— — — анатомия 79
— ... _ — гемодинамика 80
- — — - — днагностнка 80
-- — — классификация 79
— - - --- — лечение 82
- — — тотальный 83
- — анатомия 83
— — - -- гемодинамика 84
-- — — — диагностика 84
- — классификация 83
— - - - — клиника 84
- — — лечение 88
Дуга аорты двойная 168
Желудочек сердца единственный 282
-- — анатомия 282
- — гемодинамика 283
— - диагноз 285
— — - классификация 282
- — — клиника 285
- — — зондирование 287
— - рентгенограмма 286
----------- фКГ 286
----------ЭКГ 286
- — эхокардиография 286
... ... _ лечение 288
— — — течение 288
— — правый, гипоплазия изолированная
247
Зондирование см. Катетеризация
Исследование (я) иммунологическое (не) 48
кислотно-основного состояния 47
— кровн 46
— мочн 49
— свертывающей системы кровн 48
— физическое 17
- цитогенетические 49
— электрофизиологическое 43
Канал атриовентрикулярный открытый
частично 110
- — — общий 116
Катетеризация полостей сердца 39
Клапан (ы) аортальный (ые), недостаточ-
ность врожденная 157
аорты двустворчатый 158
- митральный, аномалии 266
- - — недостаточность врожденная 266
— — пороки врожденные 266
— — пролапс 271
— стеноз врожденный 277
— трехстворчатый, атрезня 257
- «верхом сидящий» 255
Коарктация аорты 159
- - анатомия 160
— - гемодинамика 161
диагноз 161
347
— — классификация 160
— — клиника 161
— — лечение 166
— — течение 166
Кожные покровы при ВПС 18
Консультирование медико-генетическое 8
Коронарные свищи 303
Левожелудочково-правопредсердное сооб-
щение 120
— — анатомия 121
— — гемодинамика 122
— — диагноз 122
— — классификация 121
— — клиника 122
— — лечение 123
Легкое, биопсия 41
Легочный рисунок, оценки 39
Межпредсердная перегородка, дефект 69,
93
— — пороки развития 69
Мониторирование суточное 29
Нагрузка физическая дозированная 29
Нарушения сердечного ритма н внезапная
смерть 332
Недостаточность клапана(ов) аортальных
врожденная 157
— — легочной артерии врожденная 143
— — митрального врожденная 266
— — — — анатомия 266
— — — — гемодинамика 267
— — — — диагноз 267
— — — клиника 267
— сердечная острая 320
— — хроническая 321
Обследование больных 14
Одышка 20
Отхождение аорты и легочной артерии от
желудочка левого 197
— — — — — правого 189
Пальпация грудной клетки 21
Перегородка межжелудочковая, аневриз-
ма 108
— — дефект 93
Перкуссия 21
Пневмония при ВПС 338
Пороки развития аорты 146
— — перегородки межпредсердной 69
— — — — дефект 69
— — — — дренаж легочных вен 79, 83
— — — — сердце трехпредсердное 89
— сердца, аномалии большие 17
— — — малые 17
— — врожденные, классификация 9
— осложнения 320
— — — — анемнн 340
— — — -г- внезапная смерть 332
— — — — гипертензия легочная 336
— — — — дисбактериоз 340
— — — — изменения желудочно-ки-
шечного тракта 339
— — — — — печени 339
— — — — нарушения сердечного ритма
339
— — — — пневмонии 338
— — — — сердечная недостаточность
320
— — — — синдром постперикардотом-
ный 337
— — — — трахеобронхиты 338
— — — — эндокардит бактериальный
326
— — — причины 5
— — — распространенность 8
— — — сочетание с аномалиями разви-
тия 17
— — — факторы риска 7
— — — этиология 5
Приступы одышечно-цианотические 321
Пролапс клапана митрального 271
Радионуклидная диагностика 46
Расширение артерии легочной- идиопати-
ческое 141
Реакция Эйзенменгера 94
Рентгеиокарднография 36
Рентгеноскопия грудной клетки 36
Свертывающая система крови, исследова-
ние 48
Сердце, биопсия 41
— левосформированное леворасположен-
иое 315
— — праворасположеиное 313
— неопределенно-сформированное 318
— пороки, аномалии большие 17
— — — малые 17
— — врожденные, классификация 9
— — — осложнения 320
— — — — анемии 340
— — — — внезапная смерть 332
— — — гипертензия легочная 336
— — — дисбактериоз 340
— — — изменения желудочно-кишечного
тракта 339
— — — — печени 339
— — — нарушения сердечного ритма 339
— — — пневмонии 338
— — — сердечная недостаточность 320
— — — синдром постперикардотомный
337
— — — — трахеобронхиты 338
— — — — эндокардит бактериальный
326
— правосформированиое леворасполо-
жениое 312
— — праворасположеиное 308
— — срединнорасположенное 311
— расположение внутригрудное, анома-
лии 307
— — — — классификация 307
— трехпредсердное 89
— — анатомия 89
— — гемодинамика 90
— — диагностика 90
— — клиника 90
— — прогноз 92
Синдром Бланда — Уайта — Гарленда 293
— гипоплазии желудочка левого 240
— — — — анатомия 240
— — — — гемодинамика 241
— — — — диагноз 242
— — — — — дифференциальный 245
— — — — классификация 240
— — — — клиника 242
— — — — лечение 245
- — — — — хирургическое 245
348
— — — — рентгенография 244
-----------ЭКГ 243
- — — — эхокардиография 244
- — — правого 246
— Эйзенменгера 94
Синус Вальсальвы, аневризма врожденная
170
Сообщение левожелудочково-правопред-
сердиое 120
Состояние кислотно-основное 47
— послеоперационное, легочная гипертен-
зия 336
— — синдром постперикардотомиый 337
Сосуды магистральные, отхождение от
одного желудочка 189
— — транспозиция корригированная 215
— — — — анатомия 215
— — — — гемодинамика 217
— — — — диагноз 217
— — — — классификация 215
— — — — клиника 217
— — — — лечение 222
Стеноз(ы) аорты 146
— — анатомия 147
— — гемодинамика 148
— — диагноз 149
— — классификация 147
— — клиника 149
— — лечение 154
— артерии(н) легочной(ых) изолирован-
ный 124
— — — — анатомия 124
— — — — гемодинамика 125
— — — — диагноз 124
— — — — классификация 124
— — — — клиника 125
— — — — лечение 129
— — — периферические 131
— — — — анатомия 131
— — — — гемодинамика 133
— — — — диагноз 132
— — — — классификация 131
— — — — клиника 132
— — — — лечение 134
— клапана митрального 277
— — — анатомия 277
— — — гемодинамика 278
— — диагноз 278
— — — клиника 278
— — — лечение 280
— — — — хирургическое, показания 280
Трахеобронхиты при ВПС 338
Тахикардия желудочковая 28
— синусовая 27
Тетрада Фалло 177
— — анатомия 177
— — гемодинамика 178
— — диагноз 179
— — клиника 179
— — лечение 186
— — осложнения 181
— — рентгенограмма 183
— — течение 186
---ФКГ 183
— — форма бледная 105
— — ЭКГ 182
— -- эхокардиограмма 184
Томография компьютерная 44
— основанная на я/юрно-магннтном резо-
нансе 45
Транспозиция аорты н легочной артернн
полная 201
— — — — — анатомия 202
— — — — — гемодинамика 203
— — _ _ _ диагноз 204
— — _ _ _ клиника 204
— — — — — лечение 210
Туннель аорто-левожелудочковый 175
Факторы риска врожденных пороков серд-
ца 7
Фалло тетрада см. Тетрада Фалло
Фибринолиз, исследование 48
Физическое развитие больных с ВПС 18
Фонокардиография 31
Цианоз 18
Цитогенетическое исследование 49
Шум(ы) Грехема — Стнлла 65
— сердечные 22
Эбштейна аномалия 28, 231
Эйзенменгера реакция 94
— синдром 94
Электрокардиограмма, гипертрофия мио-
карда желудочка левого 25
— — — — правого 25
— — — желудочков 26
— — — обоих предсердий 25
— — — предсердия левого 24
— — — — правого 25
— нарушения проводимости 27
— — сердечного ритма 27
— феномен Вольфа - Паркинсона — Уай-
та 27
Эндокардит бактериальный 326
— инфекционный см. Эндокардит бакте-
риальный
— септический см. Эндокардит бакте-
риальный
Эхокардиограмма, анализ компьютерный
35
Эхокардиография 32
— двухмерная 33
— одномерная 32
Эхография фетальная 35
ЯМР-томография 45
349
ОГЛАВЛЕНИЕ
Предисловие . . ...... 4
Глааа 1. Этиология, распространенность, классификация врожденных
пороков сердца....................................................... 5
Глааа 2. Обследование больных с врожденными пороками сердца . 14
Анамнез......................................................... 14
Физическое, обследование 17
Электрокардиография............................................. 24
Дозированная физическая нагрузка . 29
Фонокардиография ... 31
Эхокардиография................................................. 32
Рентгеноскопия н реитгенокардиография........................... 36
Катетеризация полостей сердца и ангиокардиография . 39
Биопсия сердца и легкого ... .... 41
Электрофизиологическое исследование............................. 43
Другие инструментальные методы исследования 44
Лабораторные исследования . 46
Глааа 3. Открытый артериальный проток ... . 49
Глава 4. Дефект аортолегочной перегородки........................... 62
Глааа 5. Пороки 'развития межпредсердной перегородки и аномалии
впадения легочных вен ...... 69
Дефект межпредсердной перегородки 69
Аномальный дренаж легочных вен.................................. 79
Частичный аномальный дренаж легочных вен 79
Тотальный аномальный дренаж легочных вен . 83
Трехпредсердное сердце. . . 89
Глава 6. Дефект и аневризма межжелудочковой перегородки . 93
Дефект межжелудочковой перегородки.............................. 93
Аневризма мембранозной части межжелудочковой перегородки 108
Глава 7. Открытый атриовентрикулярный канал . . 109
Частично открытый атриовентрикулярный канал . 110
Общий открытый атриовентрикулярный канал . . 116
Левожелудочково-правопредсердное сообщение . . 120
Глава 8. Пороки развития легочной артерии ... 124
Изолированный стеноз легочной артерии.................... .... 124
Периферические стенозы легочных артерий........................ 131
Атрезия легочной артерии с дефектом межжелудочковой перего-
родки ......................................................... 135
Идиопатическое расширение легочной артерии..................... 141
Врожденная недостаточность клапанов легочной артерии . 143
Глава 9. Пороки развития аорты 14g
Стеноз аорты.................................. 146
Врожденная недостаточность аортальных клапанов . 157
350
Двустворчатый клапан аорты . 158
Коарктация аорты . . 159
Двойная дуга аорты............................................. 168
Врожденная аневризма синуса Вальсальвы . 170
Аорто-левожелудочковый туннель 175
Глава 10. Тетрада Фалло............................................ 177
Глава 11. Отхождение магистральных сосудов от одного желудочка . 189
Отхождение аорты и легочной артерии от правого желудочка . 189
Отхождение аорты и легочной артерии от левого желудочка . 197
Глава 12. Полная транспозиция аорты и легочной артерии 201
Глава 13. Корригированная транспозиция магистральных сосудов . 215
Глава. 14. Общий артериальный ствол . 224
Глава 15. Аномалия Эбштейна........................................ 231
Глава 16. Синдромы гипоплазии левого и правого желудочков сердца 240
Синдром гипоплазии левого желудочка . 240
Синдром гипоплазии правого желудочка . 246
Глава 17. Атрезия трехстворчатого клапана.......................... 257
Глава 18. Врожденные пороки и аномалии митрального клапана . 266
Врожденная недостаточность митрального клапана . 266
Пролапс митрального клапана.......... . ,. 271
Врожденный стеноз митрального клапана . 277
Медикаментозное и хирургическое лечение 280
Глава 19. Единственный желудочек сердца . . . 282
Глава 20. Аномалии развития коронарных артерий . 291
Глава 21. Аномалии внутригрудного расположения сердца 307
Глава 22. Осложнения при врожденных пороках сердца и их лече-
ние ............................................................... 320
Сердечная недостаточность ..................................... 320
Бактериальный (инфекционный) эндокардит . . . 326
Нарушения сердечного ритма и внезапная смерть . 332
Легочная гипертензия........................................... 336
Постперйкардотомный синдром 337
Трахеобронхиты, пневмонии ..................................... 338
Изменения со стороны желудочно-кишечного тракта и печени . 339
Анемии . 341
Список литературы 342
Предметный указатель . 346