Author: Саркисов Д.С. Перов Ю.Л.
Tags: фармакология общая терапия токсикология семиология симптоматология признаки и симптомы заболеваний исследование диагностика пропедевтика биологические науки медицина оптика оптические приборы
ISBN: 5-225-02820-9
Year: 1996
РОССИЙСКАЯ АКАДЕМИЯ МЕДИЦИНСКИХ НАУК
МИКРОСКОПИЧЕСКАЯ
ТЕХНИКА
РУКОВОДСТВО
ДЛЯ ВРАЧЕЙ И ЛАБОРАНТОВ
Под редакцией Д.С. Саркисова и Ю.Л. Перова
МОСКВА «МЕДИЦИНА» 1996
ББК 28. 86
М59
УДК 615. 471:616-076. 4(035)
Издание одобрено и рекомендовано к печати
редакционно-издательским советом при президиуме
Российской академии медицинских наук
Микроскопическая техника: Руководство/Под ред. Д.С. Сар-
М59 кисова и Ю.Л. Перова.- М.: Медицина, 1996.- 544 с: ил.
15ВЫ 5-225-02820-9
В руководстве представлены сведения по применению современных
микроскопических методов исследования в патоморфологических
лабораториях. Изложены вопросы организации работы лабораторий, описаны
различные этапы и методы обработки тканей и органов для последующего
микроскопического исследования, способы выявления их различных
структурных и химических компонентов. Большое внимание уделено
особенностям работы с материалом эндоскопических, пункционных и других
биопсий. Специальные разделы руководства посвящены методикам
цитологического исследования и основам электронной микроскопии, которые
все шире используют в диагностической практике. Впервые в
отечественной литературе с практических позиций рассмотрены современные иммуно-
морфологические методы.
Для патологоанатомов, судебных медиков, специалистов по
лабораторной диагностике
М 4^000000-75 Без объявл ББК 28 86
039(01 )-96
15ВЫ 5-225-02820-9
© Коллектив авторов, 1996
ПРЕДИСЛОВИЕ
Общение с широким кругом специалистов, использующих в
своей профессиональной деятельности микроскопические
методы, убеждает в том, что давно назрела необходимость в
современном руководстве по микроскопической технике.
Переведенные на русский язык в 50 —60-х годах работы Б. Ромейса,
Э. Пирса, Р. Лилли и других известных авторов давно стали
библиографической редкостью и в чем-то устарели. В
значительной мере это относится и к руководствам, написанным
С.С. Вайлем и Г.А. Меркуловым, сослужившим хорошую
службу не одному поколению патоморфо логов и гистологов. Со
времени последнего, 5-го, издания руководства Г.А. Меркулова
прошло более 25 лет, и молодые врачи, научные работники и
лаборанты практически лишены возможности им пользоваться.
Настоящее руководство, подготовленное большим авторским
коллективом, должно восполнить этот пробел и служить
специалистам, применяющим в своей работе микроскопические
методы, справочным пособием, отражающим современные
достижения микроскопической техники. Составители и редакторы
руководства стремились к тому, чтобы включенные в него
материалы при сохранении авторского стиля изложения были
максимально доступны специалистам, имеющим разные подготовку и
опыт работы.
Список литературы включает основные руководства,
монографии и обзоры.
При составлении руководства использован опыт работы па-
то логоанатомических отделений и бюро, а также научных
лабораторий Москвы, Санкт-Петербурга, Львова, Чернигова,
Ташкента, Вильнюса и др., а также Института патологии
Берлинского университета им. Гумбольдта и других зарубежных пато-
морфологических лабораторий.
Редакторы приносят глубокую благодарность всем коллегам,
предоставившим необходимую информацию для настоящего
руководства или поделившимся своим опытом.
Академик РАМН Д. С. САРКИСОВ,
профессор Ю.Л. ПЕРО В
3
ГЛАВА 1
ОРГАНИЗАЦИЯ И ОСНАЩЕНИЕ
ПАТОГИСТОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
Гистологическая (патоморфологическая) лаборатория
размещается в типовом или специально приспособленном помещении.
Она должна быть оснащена необходимыми оборудованием,
инструментами, лабораторной посудой и химическими
реактивами.
Рабочие помещения лаборатории — комната, в которой
производят вырезку секционного, биопсийного или
экспериментального материала; рабочая комната лаборантов; комната для
размещения аппаратуры и моечная.
Рабочие помещения должны быть оснащены приточно-вы-
тяжной вентиляцией.
В лаборатории необходимо строго соблюдать правила
противопожарной безопасности и работы с летучими и токсичными
веществами.
В рабочей комнате лаборанта должны быть вытяжной шкаф,
химический и физический столы, шкаф и сейф для хранения
химических реактивов. Лабораторная мебель, выполненная из
древесины, малопригодна для работы с многими токсичными
веществами, используемыми в патоморфологии, поскольку
затруднена ее последующая санитарная обработка, поэтому
предпочтение следует отдавать специальной лабораторной мебели из
металла и пластика, которая снабжена выдвижными частями,
подводкой воды, вакуума, воздуха и газа. Рабочий стул должен
иметь регулируемую высоту сиденья и спинки и легко
перемещаться по полу.
Перечень необходимого оборудования лаборатории включает
технические и аналитические весы, рН-метр, микротомы
(санные, ротационные, замораживающие), криостат или криокит,
водяную баню, столик для расплавления парафиновых срезов,
комплекты автоматических пипеток, термостаты,
холодильники, микроскопы, автоматы для проводки материала и др.
ЛАБОРАТОРНОЕ СТЕКЛО, ПОСУДА, ИНСТРУМЕНТЫ
Бесперебойная работа любой гистологической лаборатории
возможна лишь при наличии достаточного набора лабораторного
стекла и посуды. Наиболее часто используют чашки Петри,
4
банки с притертыми пробками, бюксы, кюветы, химические
стаканчики, предметные и покровные стекла.
Чашки Петри — плоские, широкие стеклянные чашки с
крышками — используют для вырезки биопсийного материала,
в них можно окрашивать «свободно плавающие» срезы, ставить
гистоэнзиматические реакции в термостате и т.д.
Банки с притертыми пробками вместимостью 1—3 л чаще
используют для приготовления музейных макропрепаратов,
хранения и фиксации кусочков тканей, обезжиривания
предметных стекол в смеси Никифорова или кислотах. Большие
банки можно применять для хранения летучих веществ. Банки
вместимостью 50 — 200 мл чаще используют для хранения
летучих химических реактивов, а также для подготовки кусочков
тканей к заливке (в такой посуде проводят материал,
полученный при гастро- и бронхобиопсии, а также пункционных
биопсиях).
Бюксы — стаканчики различной вместимости (чаще 10 —
100 мл) с притертой пробкой, которые используют для
проведения гистологических окрасок и гистохимических реакций. Для
постановки реакции на целлоидиновых и замороженных срезах
применяют плоские бюксы диаметром около 50 мм.
Кюветы — прямоугольные стаканчики различной высоты с
крышками — используют при проведении гистологических,
гистохимических, ферментохимических реакций для
одновременной окраски нескольких срезов, наклеенных на предметные
стекла.
Химические стаканчики вместимостью 50—100 мл
используют для проведения гистохимических и ферментохимических
реакций.
Предметные стекла размером 76 х 26 мм и толщиной 2 мм
служат для приготовления гистологических препаратов. Для
проведения гистохимических, в том числе гистоэнзиматических,
реакций желательно использовать стекла толщиной 1 мм.
Покровные стекла — тонкие и хрупкие стеклянные
пластинки толщиной 0,15 — 0,2 мм. Чаще используют покровные стекла
размером 18 х 18 и 24 х 24 мм.
В лаборатории должны быть также воронки разных
размеров, фарфоровые стаканчики, ступки и мерная посуда (колбы,
стаканы, цилиндры и мензурки).
Колбы из термостойкого стекла позволяют готовить
реактивы, требующие нагревания. Большие колбы, как правило,
служат для проточной и дистиллированной воды, а маленькие с
притертыми пробками пригодны для хранения химических
реактивов.
В патогистологических лабораториях применяют простые и
гРадуированные пипетки. Вместимость последних составляет
обычно от 0,1 до 100 мл; их используют при постановке
гистохимических реакций и приготовлении реактивов.
^
Вся используемая лабораторная посуда должна быть
снабжена этикетками и рационально размещена, что позволяет
избежать ошибок при ее применении.
В набор используемых в гистологической лаборатории
инструментов входят пинцеты (хирургические, анатомические и
глазные), ножницы (анатомические, хирургические и глазные),
скальпели, препаровальные иглы, шпатели — прямые и
изогнутые металлические лопатки (чаще применяют при
приготовлении срезов на замораживающем микротоме и целлоидиновых
срезов), хирургические ножи для вырезки материала и ножи с
двойным лезвием для получения тонких срезов ткани мозга.
Для вырезки мелких объектов используют лезвия безопасной
бритвы.
УЧЕТНАЯ ДОКУМЕНТАЦИЯ И ЕЕ ВЕДЕНИЕ
Правильное ведение учетной документации позволяет
сотрудникам патогистологической лаборатории эффективно
использовать рабочее время и облегчает работу с архивным материалом.
К документации, ведение которой является обязательным,
относятся: алфавитный журнал для регистрации биопсийного и
операционного материала; журнал регистрации выдачи
биопсийного и журнал регистрации секционного материала;
направления на патогистологическое исследование.
Кроме того, у старшей сестры (старшего лаборанта) должны
быть книги учета спирта, ядовитых химических реактивов,
драгоценных металлов, медикаментов и каталог учета химических
реактивов, по которому легко находят нужный для работы
реактив.
ГЛАВА 2
ВЗЯТИЕ И ФИКСАЦИЯ МАТЕРИАЛА
Важнейшими условиями получения высококачественных
гистологических препаратов являются возможно более раннее
получение материала, минимальное травмирование ткани и
адекватная фиксация. Эти условия относительно просто выполнимы
при работе с биопсийным, операционным и экспериментальным
материалом, тогда как при секционном исследовании часто
наблюдаются явления аутолиза.
ТЕХНИКА ВЫРЕЗКИ МАТЕРИАЛА
Оптимальная площадь кусочков ткани 2 — 3 см2, толщина 5 —
7 мм. Если возможна повторная вырезка материала (например,
при секционных исследованиях), то кусочки могут быть
большего размера.
Вырезанные кусочки ткани непосредственно с лезвия ножа
погружают в фиксатор и смачивают в холодном изотоническом
растворе хлорида натрия, что позволяет избежать высыхания
материала. Недопустимы сдавливание кусочков, промывание их
водой, а также очистка поверхности органа, особенно слизистой
оболочки, инструментами, пальцами и т.д. После погружения
кусочков в сосуд с фиксатором туда же опускают этикетку с
номером (шифром), написанным карандашом или тушью на
матовой поверхности фотобумаги. В тех случаях, когда возникает
необходимость маркировки каждого кусочка, его вместе с
этикеткой завязывают в марлевый мешочек. Возможно также
нанизывание кусочков на нитку: сначала 2 — 3 раза прошивают
этикетку первого кусочка, затем сам кусочек, потом следующую
этикетку и так далее до 10—15 кусочков.
При наличии патологически измененных участков тканей и
органов кусочки вырезают на границе с нормальной тканью.
Кусочки полых органов вырезают таким образом, чтобы в
препарате были видны все слои стенки. Для изучения стенки сосуда
на большом протяжении его разрезают вдоль, свертывают в виде
рулона и прошивают посередине. Кусочки стенки полого органа
удобно предварительно распластывать на фотобумаге.
Для исследования рыхлой соединительной ткани готовят
пленчатые препараты: после осторожной препаровки соедини-
7
тельнотканную пленку натягивают пинцетом на обезжиренное
предметное стекло и фиксируют.
ОБЩИЕ ПРИНЦИПЫ ФИКСАЦИИ
Фиксация обеспечивает стабилизацию тканевых структур и их
уплотнение. Механизм действия фиксаторов основан на
коагуляции белков и стабилизации липидов.
Фиксация всегда приводит к большим или меньшим
изменениям структуры и объема ткани, степень выраженности
которых зависит от рН фиксатора, его концентрации, температуры,
продолжительности воздействия и других факторов.
Концентрация ионов водорода фиксатора должна соответствовать
таковой в тканях, поэтому фиксатор должен иметь рН, близкий к
нейтральному. Увеличение температуры фиксатора ускоряет
процесс, но вызывает еще большие изменения в тканях.
Слишком продолжительная фиксация приводит к значительному
уплотнению материала, что в дальнейшем затрудняет его
обработку. Для каждого конкретного вида исследования подбирают
наиболее приемлемый фиксатор.
Полноценная фиксация материала обеспечивается при
соблюдении ряда требований.
1. После вырезки кусочка ткани его немедленно погружают в
фиксатор.
2. Объем фиксатора должен превышать объем фиксируемого
материала в 10 — 20 раз, так как тканевая жидкость может
существенно изменить концентрацию фиксатора.
3. В том случае, если цвет фиксатора изменяется после
погружения в него кусочков ткани, фиксатор необходимо
немедленно сменить.
4. Недопустимо повторное использование фиксаторов.
5. Для каждого фиксатора следует соблюдать установленное
время фиксации. Длительное пребывание материала возможно
лишь в некоторых фиксаторах, например 10 % нейтральном
формалине, жидкости Буэна.
Для фиксации лучше использовать емкости с широким
горлом, чтобы не возникло проблем с извлечением фиксированного
материала. Равномерность фиксации некоторых рыхлых
тканей, например легочной, достигается помещением их на дно
банки, а поверх них — прокладки из слоя марли или ваты.
Чаще материал фиксируют при комнатной температуре, но
для некоторых видов исследования (гистохимических,
электронно-микроскопических и др.) необходимо проводить
фиксацию при 4 °С. Материал срочных биопсий фиксируют при
повышенной температуре фиксатора.
В экспериментальных исследованиях применяют также
прижизненный перфузионный метод фиксации и его сочетание с
обычным погружением в фиксирующую жидкость.
8
ПРОСТЫЕ ФИКСИРУЮЩИЕ ЖИДКОСТИ
Формалин. Основным, широко применяемым фиксатором
служит формалин, представляющий собой 40 % раствор
формальдегида. Из него готовят нейтральный (забуференный до рН
7,0) 10—12 % формалин. Для этого в банку с 40 % формалином
засыпают карбонат кальция или магния либо смесь этих
солей — доломит из расчета 100 г на 1 л формалина. Для
получения 10 % нейтрального формалина через 24 ч к 1 части 40 %
нейтрального формалина добавляют 9 частей водопроводной
воды. Продолжительность фиксации 24 —48 ч при 20 °С.
Универсальным фиксатором, пригодным для
гистологических и большинства гистохимических исследований, является
нейтральный формалин по Лилли.
А. 100 мл 40 % формалина + 900 мл дистиллированной воды.
Б. 4 г дигидроортофосфата натрия моногидрата (однозамещенного
фосфата натрия).
В. 6,5 г гидроортофосфата натрия (двузамещенного фосфата натрия).
Если на дне банки с 40 % формалином образовался осадок
белого цвета (параформальдегид), то его можно растворить,
подогрев до 70 — 80 °С (в вытяжном шкафу!), и использовать для
фиксации. Очищенный коммерческий параформальдегид
применяют как составную часть многих фиксаторов для
гистохимических и электронно-микроскопических исследований.
Этиловый спирт (80 %, 90 %, 96 % и 100 %). Его применяют
в качестве фиксатора для выявления гликогена, железа,
амилоида, но он растворяет липиды. Механизм действия основан
на осаждении белков, при этом происходит обезвоживание
объектов, что значительно ускоряет проводку. Продолжительность
фиксации от 2 ч до 1 сут. Увеличение длительности фиксации,
особенно в 100 % спирте1, нежелательно, так как материал
значительно уплотняется и происходит его пересушивание.
Оптимальная температура для фиксации материала в спирте +4 °С,
но ее можно проводить и при комнатной температуре. Если
после спиртовой фиксации предстоит резать ткань на
замораживающем микротоме или криостате, то кусочки промывают в
течение 1 —2 ч до их полного погружения на дно банки, при этом
происходит насыщение ткани водой.
Ацетон (его действие подобно действию спирта). Ацетон
используют для увеличения скорости фиксации. Применяют
100 % ацетон, для получения которого в коммерческий ацетон
засыпают прокаленный сульфат меди (медный купорос) или
силикате ль. В ацетоне фиксируют кусочки толщиной 3 — 4 мм в
течение 2 ч при 20 °С или 30 мин— 1 ч в термостате при 60 °С в
Здесь и далее термином «спирт» обозначается этиловый спирт (этанол).
9
плотно закрытой посуде. Ацетон значительно уплотняет ткань и
при увеличении продолжительности фиксации возможно
сморщивание объектов. Чаще ацетон применяют для обработки
материала срочных биопсий при его заливке в парафин.
Сулема (дихлорид ртути). Сулему применяют в качестве
фиксатора с начала развития гистологии. Готовят насыщенный
раствор: 10 г сулемы на 100 мл дистиллированной воды или
изотонического раствора хлорида натрия доводят до кипения,
охлаждают, фильтруют. Продолжительность фиксации
кусочков толщиной 3 мм 6—12 ч при 20 °С. При фиксации сулемой
возможно появление в тканях кристаллического осадка,
который удаляют путем обработки срезов йодированным 70 %
спиртом (на 50 мл 70 % спирта — 5—10 капель 5 % спиртового
раствора йода до появления оранжевого цвета). По мере
обесцвечивания йодированного спирта со срезами его заменяют свежей
порцией вплоть до полной потери цвета, затем срезы
промывают в 3—4 сменах 70 % спирта.
СЛОЖНЫЕ ФИКСАТОРЫ
Составными частями сложных фиксаторов являются простые.
Существует множество вариантов фиксирующих смесей. Ниже
приведены наиболее распространенные.
Спирт-формол по Шафферу — 10 % нейтральный
формалин, который готовят из 1 части нейтрального 40 % формалина
и 2 — 3 частей 96 % спирта.
Продолжительность фиксации 24 —48 ч. Дальнейшая
промывка в воде не требуется, и материал сразу же помещают в 96 %
спирт.
Солевой формол
Нейтральный 40 % формалин 100 мл
Хлорид натрия 8,5 г
Водопроводная вода 900 мл
Продолжительность фиксации 48 ч при 20 °С с последующей
промывкой в проточной воде в течение б —12 ч.
Жидкость Буэна — классический фиксатор для
экспериментальных исследований.
Насыщенный раствор пикриновой кислоты 75 мл
Нейтральный 40 % формалин 25 мл
Ледяная уксусная кислота 5 мл
Продолжительность фиксации 1 — 24 ч при 20 °С.
Насыщенный раствор пикриновой кислоты готовят заранее
из расчета 3 г кристаллической пикриновой кислоты на 1 л
горячей дистиллированной воды. После фиксации кусочки
отмывают от избытка пикриновой кислоты в 70 % спирте, затем
заливают в парафин.
10
Кальций-формол по Бейкеру используют для фиксации
лили дов.
А. 10 мл 40 % формалина + 90 мл дистиллированной воды.
Б. 1 г хлорида кальция.
Растворы А и Б смешивают.
Продолжительность фиксации 24 —48 ч при 20 °С.
Для гистохимических исследований с успехом применяют
фиксатор Бейкера, приготовленный из параформальдегида.
А. К 50 г параформальдегида и 500 мл дистиллированной воды добавляют
с одновременным встряхиванием несколько капель 1 н. гидроксида натрия до
исчезновения осадка.
Б. 10 г хлорида кальция + 500 мл дистиллированной воды.
Растворы А и Б смешивают, добавляют 0,5 г активированного угля. Перед
использованием фильтруют.
Продолжительность фиксации 24 —48 ч при 20 °С.
Жидкость Карнуа — универсальный фиксатор для
большинства гистологических и гистохимических исследований
(кроме выявления липидов).
Спирт 100 % или 96 % 60 мл
Хлороформ 30 мл
Ледяная уксусная кислота 10 мл
Продолжительность фиксации 2 —4 ч при 4 °С или 1 —2 ч
при 20 °С. Затем материал помещают в 100 % спирт. Если
материал не сразу подлежит проводке, то его можно перенести в
96 % спирт и держать в нем до 3 сут.
Используется также фиксатор Карнуа I, в состав которого
входят 75 мл 100 % спирта и 25 мл ледяной уксусной кислоты.
Условия фиксации те же.
В случае отсутствия этилового спирта вместо жидкости
Карнуа можно использовать смесь следующего состава.
Изопропиловый спирт 60 мл
Пропионовая кислота 30 мл
Ацетон 10 мл
Диоксан 10 мл
Продолжительность фиксации 12 — 24 ч при 20 °С; для
промывки и обезвоживания применяют изопропиловый спирт.
Жидкость Ценкера — сулемовая смесь.
Жидкость
Бихромат калия 2,5 г
Сульфат натрия 1 г , Мюллера
Дистиллированная вода 100 мл )
Сулема 5 г
Ледяная уксусная кислота 5 мл
11
Ледяную уксусную кислоту можно заменить нейтральным
10 % формалином (фиксатор Максимова, ценкер-формол).
Продолжительность фиксации 1—24 ч при 20 °С. После
фиксации материал в течение 12 — 24 ч отмывают в проточной воде и
помещают в йодированный 70 % спирт для удаления остатков
сулемы. При добавлении 10 мл 2 % раствора тетраоксида осмия
хорошо фиксируются и окрашиваются липиды.
В последнее время для гистологических исследований часто
применяют глутаровый альдегид, параформальдегид,
фиксаторы Ито, Замбони и др., особенно в тех случаях, когда материал
предназначается одновременно для нескольких видов
исследования (иммуноморфологического,
электронно-микроскопического), а его количество ограничено, например при пункционных
биопсиях.
ПРАВИЛА РАБОТЫ С ФИКСАТОРАМИ
Практически все фиксаторы относятся к токсичным веществам
(альдегиды, ацетоны, спирты), некоторые ядовиты (сулема,
тетраоксид осмия, метанол), поэтому необходимо соблюдать
правила техники безопасности при работе с реактивами,
которые используют в гистологической практике.
Фиксацию и вырезку материала необходимо производить в
вытяжном шкафу. Материал, извлеченный из фиксатора,
содержащего формалин, желательно в течение нескольких минут промыть
в проточной воде, так как пары формалина оказывают
раздражающее действие на слизистые оболочки глаз и органов дыхания.
БЫСТРАЯ ФИКСАЦИЯ МАТЕРИАЛА СРОЧНЫХ БИОПСИЙ
Доставленный в лабораторию материал в случае необходимости
вырезают или разрезают на несколько кусочков и фиксируют с
помощью одного из способов быстрой фиксации. Если
возможно, то следует часть материала сохранить для изготовления
постоянных препаратов.
1. Материал помещают в металлический сосуд с ручкой и
заливают теплым 10 % нейтральным формалином, доводят до
кипения, затем промывают проточной водой в течение 2 — 5 мин и
режут на замораживающем микротоме или криостате.
2. Кусочки фиксируют в 100 % ацетоне в термостате при
56 °С в течение 15 мин, затем помещают в хлороформ или
ксилол для последующей заливки в парафин.
3. Материал фиксируют в смеси 10 % нейтрального
формалина и 96 % спирта (1:1) в течение 15 мин при 56 °С, затем
промывают в 96 % спирте и обезвоживают в 100 % спирте.
4. М. Утс1 и соавт. (1990) предложили метод фиксации
кусочков ткани объемом 0,5—1 см3 с применением микроволновой
техники. Материал в растворе альдегида помещают на 20 с в
12
микроволновую печь (2,5 Гц/500 В), а затем оставляют на 10 —
30 мин при комнатной температуре в том же фиксаторе.
Микроволновое излучение способствует быстрому проникновению
альдегидов в клетки и ткани, в результате чего улучшается
качество фиксации. Этот способ позволяет проводить не только
обычные гистологические, но и ультраструктурные цитохимические,
иммуноморфологические исследования, а также
рентгенологический микроанализ.
ВОЗМОЖНЫЕ АРТЕФАКТЫ, СВЯЗАННЫЕ С ФИКСАЦИЕЙ,
И ИХ УСТРАНЕНИЕ
При фиксации формалином, особенно кислым, возможно
появление в срезах темно-коричневого пигмента в виде зернышек
или глыбок (результат реакции формалина с гемоглобином
ткани). Пигмент удаляют, помещая срезы на 15 — 20 мин в 1 — 5 %
раствор аммиака или 70 % спирт. После промывания водой
препарат можно окрашивать. Хорошо удаляется пигмент в
растворе 1 % гидроксида калия в 80 % спирте (1:25): после
10-минутной экспозиции препарат промывают в проточной воде в
течение 5 мин.
В случаях значительного уплотнения ткани в результате
слишком продолжительной фиксации кусочки помещают на 1 —
2 ч в 10 % раствор лимонной кислоты, в результате чего
материал становится более мягким и пригодным для исследования.
Кристаллический осадок, образующийся после фиксации с
применением сулемы, удаляют из кусочков или лучше срезов с
помощью йодированного 70 % спирта.
ГЛАВА 3
ОБЕЗВОЖИВАНИЕ И ЗАЛИВКА МАТЕРИАЛА
После фиксации, для которой применялся формалин, кусочки
промывают в течение 6, 12 или 24 ч в проточной воде: на
водопроводный кран надевают резиновую трубку, конец которой
опускают в широкогорлую банку, закрытую марлей. Для промывки
удобно использовать эксикаторы разных размеров, снабженные
краном: в отверстие крышки эксикатора опускают шланг, по
которому подают воду, а через кран эксикатора ее сливают.
В том случае, если в состав фиксатора входила пикриновая
кислота, материал следует промыть в нескольких сменах 70 %
спирта, после фиксации с использованием сулемы — в
йодированном 70 % спирте. Материал, фиксированный для
некоторых гистохимических реакций, электронно-микроскопического
и иммуноцитохимического исследований, отмывают от
фиксаторов в различных буферных смесях.
В случае необходимости кусочки тканей перед
обезвоживанием можно уменьшить, подровнять. Если материал после
фиксации не сразу подлежит проводке, то его можно оставить в
70-80 % спирте.
СПОСОБЫ ОБЕЗВОЖИВАНИЯ ТКАНЕЙ
Перед заливкой материала в парафин или целлоидин его
необходимо обезводить. Существует несколько традиционных
способов обезвоживания. Самым распространенным является
обезвоживание в спиртах восходящей концентрации, начиная с
70 %. Обычно применяют батарею спиртов, состоящую из двух
порций 96 % и двух — 100 % спирта. Продолжительность
процесса обезволшвания в спиртах в среднем 48 ч в зависимости от
качества материала (содержания жира в ткани) и размера
кусочков, а также от их количества. При использовании автомата
для заливки количество спиртов увеличивают, а при
проведении кусочков по спиртовой батарее вручную их осторожно
промокают фильтровальной бумагой или салфеткой из марли, что
позволяет реже менять спирты в батарее.
Процесс обезвоживания можно ускорить, периодически
встряхивая кусочки в банках со спиртами или поместив их в
термостат при 37 °С. Спирты в батарее необходимо своевремен-
14
но заменять. Контролировать пригодность спирта позволяет
проба с водой. В отлитое из банки небольшое количество спирта
добавляют 1 каплю воды. Помутнение раствора свидетельствует
о необходимости замены спирта в батарее.
Абсолютный спирт можно приготовить из 96 %. Для этого
применяют сульфат меди, который помещают в ступку и
прокаливают на спиртовке или в термостате, периодически растирая и
размешивая до консистенции пыли и бледно-голубого цвета. Затем
сульфат меди (1 часть) засыпают в банку с 96 % спиртом (4 или
6 частей), плотно закрывают ее крышкой, взбалтывают и
оставляют на несколько дней, периодически встряхивая. Сульфат меди
адсорбирует воду из спирта и вновь приобретает синюю окраску.
Перед использованием абсолютного спирта проводят его контроль
спиртометром или в пробирку с небольшим количеством ксилола
(4 — 5 мл) добавляют каплю приготовленного спирта (раствор
мутнеет, если спирт недостаточно обезвожен). Хорошим
адсорбентом воды из спирта является также силикагель после
предварительного просушивания его в термостате.
При отсутствии 100 % спирта в батарею включают еще одну
порцию 96 % спирта. Однако в этом случае всегда есть
опасность недостаточного обезвоживания и возникновения
трудностей при получении срезов.
С целью ускорения обезвоживания применяют ацетон без
примесей (ЧДА), предварительно добавив в него силикагель
для удаления остатков воды или дистиллированный ацетон.
Обезвоживание проводят в 2 — 3 сменах ацетона от нескольких
часов до 1 сут в зависимости от величины объектов
Обезвоживание тканей возможно с помощью 99 % изопропи-
лового спирта, который непосредственно смешивается с
парафином без промежуточных растворителей (ксилол, хлороформ
и др.). Таким же свойством обладает диоксан, однако в связи с
высокой токсичностью он не нашел широкого применения в па-
тогистологической технике
Для обезвоживания глицерином [Беккер Г.М., 1958; \МоН ].,
1939, и др.] кусочки ткани последовательно помещают в 60 %,
80 % и 100 % глицерин на 3 — 4 ч, а затем в смесь, состоящую из
равных частей 100 % глицерина и ксилола.
Выраженное влияние на скорость обезвоживания оказывает
микроволновое излучение. Объекты в 70 % спирте помещают на
20 с в микроволновую печь (2,5 Гц/500 В), а затем дообезво-
живают в абсолютном спирте в течение 30 — 60 мин.
Секционный и биопсийный материал часто обезвоживают в
аппаратах типа АТ-5 и др. с последующим пропитыванием
толуолом, хлороформом или их смесью с парафином. При этом
применяют две порции 96 % спирта и две — 100 %. Общая
продолжительность обезвоживания 48 ч. Преимущество использования
аппаратов состоит в том, что в них материал постоянно
перемешивается и находится во взвешенном состоянии. Однако аппа-
15
рат не включается автоматически после внезапного перепада
напряжения в электрической сети, что может привести к
пересушиванию большого количества материала.
ЗАЛИВОЧНЫЕ СРЕДЫ
Для получения тонких (до 6 мкм) гистологических срезов
необходимо фиксированный и промытый материал залить в
плотную среду, предварительно пропитав ею кусочки тканей. В
зависимости от способа растворения все заливочные среды
разделяют на растворимые в органических растворителях и
водорастворимые. К первым относятся парафин, пластические
полимеры на основе парафина, целлоидин, ко вторым — желатин,
полиэтиленгликоли, полиэфиры, некоторые метакрилаты и т.д.
Заливка ткани в парафин
Парафин — смесь высокомолекулярных предельных
углеводородов, продукт перегонки нефти; растворяется в анилине,
бензоле, бергамотном масле, целлозольве, хлороформе, декалине,
диоксане, бутаноле, пропаноле, толуоле, трихлорэтилене,
ксилоле. Каждый из этих растворителей можно использовать в
качестве промежуточной среды между спиртом и парафином.
Температура плавления различных парафинов от 27 до 62 °С. В
гистологической технике применяют парафин с температурой
плавления 56 °С. Зарубежные фирмы производят специальный
парафин для гистологических исследований, содержащий
различные пластические полимеры, такие как диметилсульфоксид.
Их коммерческие названия «Парапласт», «Парапласт плюс»,
«Гистопласт С», «Гистозес».
Важнейшим условием успешной заливки материала является
своевременная смена реактивов в процессе их загрязнения, а
также соблюдение рекомендуемых временных и температурных
параметров. Кроме того, нужно стремиться к тому, чтобы
одновременно заливать одинаковые по толщине и плотности кусочки
ткани.
Схема Меркулова
Фиксация:
формалин 10 %
спирт-формол
жидкость Карнуа
спирт 96-100 %
промывание в проточной воде
Обезвоживание:
спирт 96 % I
спирт 96 %П
спирт 100 % I
спирт 100 % II
24 ч
24 ч
2-4ч
12-24ч
12-24ч
24 ч
2ч
24 ч
2ч
16
Заливка в парафин:
спирт+хлороформ (1:1)
или спирт+ксилол (1:1)
или хлороформ
или ксилол
хлороформ+парафин (1:1 —
или ксилол+парафин (1:1 —
парафин I 56 °С
парафин II 56 °С
«каша») 37 °С
«каша») 37 °С
6-12ч
1-Зч
6-12ч
1-6ч
2-Зч
1-2ч
2ч
1 ч
Схема Волковой—Елецкого
Обезвоживание
спирт 50 % 2 —4 ч
спирт 60 % 2 —4 ч
спирт 70 % 12-24ч
спирт 96 %1 12 ч
спирт 96 % II 12 ч
спирт 100 %1 1-12ч
спирт 100 % II 12 ч
Заливка в парафин:
спирт 100 % + хлороформ (1:1) 2 —3 ч
хлороформ I 1,5 ч
хлороформ II 0,5 ч
хлороформ III 0,5 ч
хлороформ+парафин (1:1) 37 °С 3 —6 ч
хлороформ+парафин (1:1) 56 °С 0,5—1 ч
парафин I 56 °С 2 ч
парафин II 56 °С 2 ч
парафин III 56 °С 1ч
Заливка по Ромейсу ручным способом
I вариант
Фиксация в 10 % формалине 12 ч
Промывание в проточной воде 3 ч
Спирт 50 % 2 ч
Спирт 70 % 3 ч
Спирт 96 % 4 ч
Спирт 100 % I 4 ч
Спирт 100% II 4 ч
Метилбензоат I 2 ч
Метилбензоат II 2 ч
Бензол 2 ч
Бензол+парафин (1:1) 1ч
Парафин 60 °С 8 ч
Продолжительность 47 ч
II вариант
Фиксация в 10 % формалине 12 ч
Промывание в проточной воде 3 ч
Изопропиловый спирт 50 % 2 ч
Изопропиловый спирт 75 % 3 ч
Изопропиловый спирт 90 % 6 ч
17
Изопропиловый спирт 100 % 1 4 ч
Изопропиловый спирт 100 % II 4 ч
Изопропиловый спирт+парафин (1:1) 60 °С 12 ч
Парафин 60 °С 8 ч
Продолжительность 54 ч
Заливка в парапласт с помощью автомата
Фиксация в 5 % формалине 2 ч
Спирт 70 % I 2 ч
Спирт 70 % II 1ч
Спирт 96 % I 1ч
Спирт 96 % II 1ч
Спирт 100 % I 1ч
Спирт 100 % II 1ч
Спирт 100 % III 1 ч
Хлороформ I (бензол) 1 ч
Хлороформ II (бензол) 1 ч
Парапласт I 60 °С 2 ч
Парапласт II 60 °С 3 ч
Продолжительность 17 ч
Заливка в парапласт с помощью вакуум-автомата
5 мин
12 мин
12 мин
12 мин
12 мин
12 мин
12 мин
15 мин
15 мин
15 мин
25 мин
Продолжительность 12 ч 27 мин
Быстрая заливка биопсийного материала в парапласт
с помощью автомата
Фиксация в 5 % формалине при 60 °С 10 мин
Ацетон I 30 мин
Ацетон II 30 мин
Ацетон III 30 мин
Ацетон IV 30 мин
Ацетон-ксилол (1:1) 10 мин
Ксилол 10 мин
Парапласт плюс 60 °С 30 мин
Продолжительность 3 ч
Наиболее быстрым, простым, не требующим применения
специальной аппаратуры методом заливки материала является
Спирт 70 % I
Спирт 70 % II
Спирт 96 % I
Спирт 96 % II
Спирт 100 % I
Спирт 100 % II
Спирт 100 % III
Бензол I
Бензол II
Парапласт плюс
Парапласт плюс
160°С
II 60 °С
18
способ, разработанный Н.Н. Золотых в патологоанатомическом
отделе Института хирургии им. А.В. Вишневского.
Фиксация в 96 % спирте 15 мин
Спирт 100 % 15 мин
Хлороформ 15 мин
Хлороформ-парафин при 56 °С 15 мин
Парафин при 56 °С, энергично встряхивая 1 мин
Парафин при 56 °С 45 мин
Продолжительность 2 ч 30 мин
Особенности заливки в парафин крупных объектов
Заливка в парафин позволяет получать гистологические срезы
больших размеров (гистотопографические срезы), например
срезы всего органа (матка, почка) или его значительной части
(доля легкого). Заливку проводят вручную, и для нее требуется
дополнительное время на всех этапах. Для приготовления таких
срезов из ткани головного мозга с помощью мозгового ножа
делают срез свежей ткани толщиной около 1 см и закладывают в
ванну с фиксатором. Для того чтобы сохранить плоскую
конфигурацию среза, его кладут между двумя проволочными сетками,
которые притягивают друг к другу резиновыми кольцами.
Продолжительность фиксации 48 ч. После промывки в проточной
воде (3 — 4 ч) следует обезвоживание в 70 %, 96 % и 100 %
спирте (по 2 смены) в течение 48 ч. Для обезвоживания можно
применить изопропиловый спирт, обеспечивая частую его смену и
температуру 45 °С (в термостате). Это позволяет избежать
получения чрезмерно жестких препаратов. В качестве
промежуточной среды используют метилбензоат или хлороформ —
3 смены по 3 дня. Объекты заливают в парафин или парапласт,
имеющие температуру плавления 56 — 58 °С.
Приготовление парафиновых блоков
Пропитанные парафином кусочки ткани выкладывают в
специальные формочки и заливают расплавленным в термостате или
на водяной бане при 60 °С парафином, в который добавлено 1 —
3 % воска.
Для получения парафиновых блоков нужной формы
используют различные приспособления. К ним относятся
изготовляемые самим лаборантом бумажные коробочки, на дно которых
выкладывают кусочки, а рядом к боковой стенке ставят
этикетку номером кнаружи; металлические Г-образные угольники или
разъемные формочки, которые перед употреблением смазывают
глицерином и помещают на нагретую металлическую
пластинку, выполняющую роль дна формочек. Применяют также
различные пластмассовые коробочки и формы, в частности исполь-
19
зуемые в микробиологии, особенно при заливке мелких
объектов, таких как материал пункционных биопсий.
Специальные импортные аппараты для заливки в парафин
(так называемые заливочные центры) снабжены набором
различных формочек (кассет) и пинцетов. В них обеспечивается
автоматическая подача дробных доз парафина оптимальной
температуры.
Раскладывание кусочков в формочки и их ориентирование
нужно проводить быстро теплым пинцетом. Если материала для
заливки много и он быстро остывает, то можно использовать
парафин, подогретый на водяной бане до 60 °С. Для охлаждения
формочки с материалом рекомендуют помещать в воду при 10— 18 °С,
но не погружать в нее. При застывании парафина поверхность
блока стягивается, и в нем образуется кратерообразное
углубление. Это нужно учитывать при заливке кусочков и в дальнейшей
работе с блоками. Парафин должен на 3 — 4 мм выступать над
поверхностью блока, если предстоит монтировать его на деревянную
колодку. Возможны также заливка блока большим количеством
парафина и резка без использования деревянных колодок, с
успехом применяемая даже на санном микротоме.
В большинстве руководств рекомендуют после
подравнивания и удаления лишнего парафина наклеивать блоки на
деревянные бруски с помощью подогретого на спиртовке
металлического шпателя или скальпеля. Затем для обеспечения более
прочного приклеивания основания блок оплавляют с четырех
боковых сторон тем же горячим шпателем или скальпелем.
Заливка ткани в целлоидин
Целлоидин — хорошо растворяющаяся в эфире
нитроклетчатка. В гистологической практике применяют 2 %, 4 % и 8 %
растворы целлоидина, которые готовят из целлоидиновых пластин
или отмытой от эмульсии и высушенной рентгеновской пленки.
Для приготовления 500 мл 2 % раствора целлоидина 10 г
сухого целлоидина заливают 250 мл 100 % спирта и оставляют
на 1 сут, затем добавляют 250 мл безводного эфира, который
растворяет набухший в спирте целлоидин. Для приготовления
4 % и 8 % растворов количество целлоидина увеличивают
соответственно в 2 и 4 раза. Растворы хранят в плотно закрытой
посуде.
Заливка ткани в целлоидин стала в настоящее время менее
популярной, чем парафиновая, и ее применяют главным
образом для обработки труднорежущихся тканей и объектов
больших размеров, с которых трудно получить хорошие
парафиновые срезы. Целлоидиновую заливку используют также в тех
случаях, когда необходимо избежать воздействия на
исследуемый материал высоких температур. Кроме того, заливка
материалов в целлоидин позволяет получить лучшие результаты при
20
наличии в объектах больших полостей, лакун и слоев
различной консистенции.
Эфир и сухой целлоидин огнеопасны, поэтому при работе с
ними необходима осторожность.
Обезвоженный материал помещают в смесь 100 % спирта с
эфиром (1:1) на 4 —6ч, переносят в 2 % раствор целлоидина на
2--3 дня, затем в 4 % и 8 % растворы на 5 —7 дней в каждый.
Пропитанный кусочек заливают свежим 8 % целлоидином и
уплотняют в парах хлороформа (в эксикаторе). Уплотненный
таким образом материал заливают 70 % спиртом для хранения.
Вырезанные блоки наклеивают густым целлоидином на
деревянные колодки на 1 сут перед резкой.
Заливка в целлоидин по Меркулову
Фиксация:
Формалин 10 % 24 ч
Жидкость Карнуа 2 —4 ч
Спирт 96% 12 ч
Промывание в воде после формалина 24 — 48 ч
Обезвоживание:
Спирт 96 % 24 ч
Спирт 100 % 24 ч
Заливка в целлоидин
Спирт 100 % + эфир (1:1) 6-24 ч
Целлоидин 2 % 2 — 4 дня
Целлоидин 4 % 2 — 4 дня
Целлоидин 8 — 10 % 1—2 дня
Хлороформ 2 — 3 дня
Спирт 70 % хранение
Заливка в целлоидин по Ромейсу
Спирт-эфир (1:1)
Целлоидин 2 %
Целлоидин 4 %
Целлоидин 8 %
Целлоидин 16 %
Спирт 70
4-6ч
2 дня
2 дня
8 дней
уплотнение в
эксикаторе до образования
поверхностной корочки в
парах хлороформа
хранение
Особенности заливки в целлоидин крупных объектов
Целлоидиновая заливка, так же как и заливка в парафин,
позволяет получать гистотопографические срезы.
Пластины ткани органа толщиной 1 см кладут между двумя
проволочными сетками (как для заливки в парафин), фиксиру-
21
ют, промывают и обезвоживают. Общая продолжительность
процесса заливки в целлоидин крупных объектов 2 — 2,5 мес. С
помощью целлоидиновой заливки можно получить гистотопо-
графические срезы толщиной около 20 мкм.
Схема заливки в целлоидин материала для гистотопограмм
по Меркулову
Формалин 10—15 % 1— 2 нед
Промывание в проточной воде 1 сут
Спирт 70% 1-2 дня
Спирт 96 %1 1-2 дня
Спирт 96 % II 3 — 4 дня
Спирт 96 % III 5 дней
Спирт 100 % 2 дня
Спирт 100 % + эфир (1:1) 4-5 дней
Целлоидин 2 % 2 — 3 нед
Целлоидин 8 % 7—10 дней
Хлороформ (уплотнение блоков) 4 — 7 дней
Спирт 70 % хранение
Заливка в целлоидин-парафин
Этот метод рекомендуется для обработки объектов, которые
легко сжимаются при парафиновой заливке, например органов
кроветворения, мезенхимной ткани, а также органов и тканей,
имеющих многослойное строение (трахея, кожа и др.).
Фиксация в 10 % формалине 24 ч
Промывание в проточной воде 6— 12 ч
Обезвоживание в спиртах 2 — 3 дня
Спирт 100 % + эфир (1:1) 3-6 ч
Целлоидин 2 % 1—2 дня
Хлороформ 6—18 ч
Хлороформ + парафин (1:1) при 37 °С 2 —3 ч
Парафин I при 56 °С 1 — 2 ч
Парафин II при 56 °С 1 — 2 ч
Используют также смесь целлоидина с касторовым маслом
(1:1), пребывание в которой объектов в течение 1—2 дней
улучшает их пропитывание. Затем для удаления касторового масла
материал промывают в трех порциях хлороформа.
Заливка в желатин
Для исследования липидов в рыхлых тканях и органах, а также
при изучении эмбриональных объектов с успехом применяют
заливку в водорастворимый биополимер желатин. Используют
кристаллический прозрачный пищевой желатин, из которого
готовят 25% и 12,5% растворы.
К 25 г желатина добавляют 75 мл 1 % водного раствора
фенола (карболовая вода) и помещают в термостат при 37 °С. Же-
22
латин набухает, и после перемешивания образуется густой 25 %
раствор. Из него при разбавлении теплой (37 °С) карболовой
водой в 2 раза получают 12,5 % раствор желатина.
Приготовленные растворы разливают в чистые сухие
пробирки для однократного использования и закрывают пробкой.
В застывшем состоянии желатин можно долго хранить в темном
прохладном месте.
Схема заливки в желатин по Волковой—Елецкому
Фиксация в 10 % формалине 24 — 48 ч
Промывание в проточной воде 18 — 24 ч
Желатин 12,5 % при 37 °С в закрытой посуде 3 —20 ч (в зависимости
от величины объекта)
Желатин 25 % при 37 °С 3-20 ч
Заливка свежим 25 % желатином в формочки
Застывание в формочках в холодильнике
Формалин 20 — 25 % (уплотнение блоков) 24 ч
Формалин 10 % хранение
Залитый в желатин материал режут на замораживающем
микротоме. Из полученных срезов удаляют желатин, чтобы
избежать окрашивания фона. Для этого срезы помещают на 30
мин в 10 % раствор гидроксида калия при 37 °С. Затем их
промывают в водопроводной воде и окрашивают. Окрашенные
срезы заключают в поливиниловый спирт или
глицерин-желатин.
Приготовление поливинилового спирта: порошок
поливинилового спирта отмывают в 96 % спирте (2 смены), эфире (3
смены) и высушивают. К 16 г отмытого порошка добавляют 100 мл
дистиллированной воды, оставляют на 12 ч для набухания.
Полученную массу нагревают в течение 20 — 30 мин на кипящей
водяной бане. На поверхности густой мутноватой жидкости
образуется пленка с пузырями, которую удаляют, а раствор
фильтруют через 4 слоя марли. Поливиниловый спирт можно
использовать как промежуточную среду для получения постоянных
препаратов после резки на замораживающем микротоме.
Сначала на срез, расправленный на стекле, наносят поливиниловый
спирт, затем после образования тонкой пленки (через 6—12 ч)
препарат заключают в полистирол или бальзам.
Приготовление глицерин-желатина: к 7 г желатина
добавляют 41 мл дистиллированной воды и оставляют для набухания
3 —4 ч. Затем добавляют 50 мл глицерина и 1 г фенола. Смесь
нагревают на водяной бане, постоянно помешивая. Раствор
фильтруют через крупнопористый фильтр, разливают по
пробиркам, закрывают пробками и хранят в холодильнике.
Срезы ткани, залитой в желатин, полученные на
замораживающем микротоме, можно обезводить в спиртах, просветлить в
карбол-ксилоле и заключить в бальзам или полистирол.
23
В других схемах рекомендуют иные концентрации желатина
и продолжительность пребывания в нем объектов.
Схема заливки в желатин Гаскелла-Граффа
Фиксация в 10 % формалине 48 ч
Промывание в водопроводной воде 2 —6 ч
Желатин 10 % при 37 °С 2 —6 ч
Желатин 20 % при 37 °С 2 —б ч
Заливка в свежую порцию 10 % желатина при 37 °С
Застывание формочек с кусочками в холодильнике
Вырезка блоков
Уплотнение блоков в 10 % формалине
Заливка в водорастворимые пластмассы
Для целей гистохимии, особенно для выявления липидов и
ферментов, хорошо себя зарекомендовала заливка ткани в
синтетические водорастворимые пластмассы — полиэтиленгликоль,
поливакс, метилметакрилат и др.
Заливка в полиэтиленгликоль различной молекулярной
массы по Ринерхарту—Абуль-Хею
Вариант I
Фиксация в 5 % формалине 24 — 48 ч
Промывание в проточной воде 12 ч
Полиэтиленгликоль-400 + дистиллированная вода (1:1) 30 мин
Полиэтиленгликоль-400 + дистиллированная вода (3:1) 30 мин
Полиэтиленгликоль-400 30 мин
Полиэтиленгликоль-1000 при 40 °С 30 мин
Заливка смесью полиэтиленгликоль-1550 + полиэтилен-
гликоль-4000 (1:9) при 58 °С 30 мин
Вариант II
Фиксация в 5 % формалине 24 — 48 ч
Промывание в проточной воде 12 ч
Заливка смесью полиэтиленгликоль-1550 + полиэтилен-
гликоль-4000 (1:9) при 58 °С 1 -3 ч
Заливка свежей порцией смеси при 58 °С 30 мин
Заливка смесью при 58 °С
Срезы с залитых в полиэтиленгликоль блоков готовят на
замораживающем микротоме, окрашивают, помещают на
предметное стекло и заключают в смесь глицерина и желатина или
раствор диэтиленгликоля (диэтиленгликоля — 4 части,
дистиллированной воды — 5 частей, 40 % формалина — 1 часть).
Заливка в поливакс по Стидмену
Поливакс (полиэстервакс) представляет собой смесь полиэтилен-
гликоля-400-дистеарата и ацетил алкоголя в соотношении 9:1.
24
Фиксация в 5 % формалине 6 — 24 ч
Промывание в проточной воде 6— 12 ч
Обезвоживание в 70 % и 96 % спиртах 24 ч
Спирт 96 % + поливакс (1:1) 2 ч
Поливакс при 40 °С 3 ч
Свежая порция поливакса при 40 °С 3 ч
Заливка в поливакс при 40 °С
Застывание блоков при комнатной температуре
Заливка в метилметакрилат по Хиршу—Болларду
Смола имеет сложный состав и состоит из четырех
компонентов, которые смешивают в определенной последовательности:
10 мл метилметакрилата (А) + 5 мл полиэталенгликоля (Б) +
3 мл дибутилфталата (В) + 0,2 г бензоилпероксида (Г).
Фиксация в 5 % формалине 6— 12 ч
Промывание в 70 % спирте 10 мин
Ополаскивание в 96 % спирте 2 мин
Спирт 96 % 2 ч
Метилметакрилат 2 ч
Смесь (А+Б+В+Г) при 50 °С 2 ч
Свежая порция этой смеси при 50 —60 °С 6— 10 ч
Затем материал выдерживают при комнатной температуре в течение 1 сут
ГЛАВА 4
ПРИГОТОВЛЕНИЕ ГИСТОЛОГИЧЕСКИХ СРЕЗОВ
Для получения гистологических срезов применяют специальные
микротомные ножи, различающиеся по форме, длине и углу
сечения лезвия. По форме они представляют собой сложный
стальной клин, у которого режущий край имеет
дополнительную клиновидную заточку. Длина ножа может составлять от 8
до 50 см.
По конфигурации лезвия различают три группы
микротомных ножей: А, В и С. У микротомных ножей, относящихся к
группе А, одна поверхность ровная, а другая вогнутая (их
называют плоско-вогнутыми с большой кривизной вогнутой
поверхности). Эти ножи чаще всего изготовлены из мягкой или
относительно мягкой стали и предназначены для резки
объектов, залитых в целлоидин.
Ножи, относящиеся к группе В, называются
плоско-вогнутыми, но кривизна вогнутой поверхности у них значительно
меньше, чем у ножей группы А. Они изготовлены из более твердой
стали, используют их для приготовления целлоидиновых и
целлоидин-парафиновых срезов.
У ножей, относящихся к группе С, обе поверхности клинка
плоские. Их изготавливают из твердой стали и применяют для
резки объектов, залитых в парафин, а также для получения
срезов на замораживающем микротоме.
Кроме того, для приготовления парафиновых и полутонких
срезов на микротомах и ультратомах используют металлические
магнитные лезвия и стеклянные ножи. Металлическое
магнитное лезвие (одноразовый нож) позволяет получить срезы с 50 —
60 парафиновых блоков, затем лезвие меняют. Изготовление и
применение стеклянных ножей — см. главу 12.
ЗАТОЧКА МИКРОТОМНЫХ НОЖЕЙ
Получить качественные гистологические срезы при
целлоидиновой, целлоидин-парафиновой и парафиновой заливке материала
можно с помощью микротомного ножа, толщина лезвия
которого должна быть от 3 до 5 мкм. Для работы на замораживающем
микротоме необходимо иметь острый нож без зазубрин на
лезвии. Нож необходимо своевременно точить, а перед каждой рез-
26
кой объектов править. Микротомные ножи затачивают с
помощью специальных аппаратов, например «5акига» (Япония).
Однако до сих пор не потеряла актуальности и применяется во
многих лабораториях ручная заточка ножей. Вручную
микротомные ножи точат на камне, имеющем форму бруска. Желтый,
так называемый бельгийский камень используют для заточки
первым, затем продолжают заточку на белом камне (арканза-
се), который имеет более мелкую зернистость. Можно
использовать природный аспидный камень, который также имеет
крупнозернистую и мелкозернистую поверхность.
Перед заточкой на поверхность камня наносят машинное
масло или керосин, глицерин, разведенный 70 % спиртом (1:1),
мыльную воду. На спинку ножа надевают специальный обушок
(желательно постоянно используемый для заточки одних и тех
же ножей — это определяет угол заточки), а в стержень или
отверстие в торцевой части ножа вкручивают ручку. Затем нож
кладут обушком на камень, по которому скользит и лезвие под
действием собственной тяжести. Нож проводят по камню с
одного конца на другой, а затем, поворачивая через обушок,
осуществляют движение в обратном направлении.
Продолжительность процесса зависит от квалификации
лаборанта и состояния режущей кромки ножа. В среднем она
составляет от 30 мин до 1 ч. Периодически контролируют
качество заточки, осторожно укладывая нож на предметный столик
микроскопа и перемещая его так, чтобы режущая кромка
проходила через поле зрения при малом увеличении. Затем нож
правят на широком ремне, натянутом на деревянную колодку.
Правку проводят так же, как и заточку (через обушок).
МИКРОТОМЫ И ОСОБЕННОСТИ РАБОТЫ НА НИХ
Микротомы — это приборы, с помощью которых получают
срезы тканей, залитых в различные среды, а также
замороженных и нефиксированных. Микротомы позволяют получать
гистологические срезы различной толщины. По принципу действия
различают санные, ротационные, замораживающие микротомы,
а также криостаты и вибратомы.
Санные микротомы характеризуются
горизонтальным движением ножа и вертикальным подъемом блокодержате-
ля. Их с успехом используют для резки объектов, залитых в
целлоидин, целлоидин-парафин и парафин. Основные части
микротома располагаются на специальных салазках, отсюда
происходит его название. Принцип работы санного микротома
заключается в том, что при обратном ходе ножа ножевые
салазки толкают стержень со шкалой регулятора подачи, вызывая
его перемещение. Движение стержня передается на тягу,
которая с помощью «собачки» поворачивает храповик. Вращение
27
храповика передается микровинту, который с помощью
разъемной гайки перемещает салазки с блоком вверх. С каждым
срезом блок поднимается все выше на расстояние, соответствующее
толщине среза. После того как блокодержатель достигнет
высшей точки, с помощью разъемной гайки надо опустить салазки с
механизмом в крайнее нижнее положение. Существуют другие
разновидности санных микротомов с различными вариантами
способов подачи, зажимов для ножей и т.д.
Ротационные микротомы предназначены для
резки парафиновых блоков, с их помощью можно получать
серийные срезы. Важнейшая часть ротационного микротома —
механизм микроподачи, который включает в себя храповик,
дифференциальный механизм, микровинт, лимб, косозубую
передачу и кулачок. Приводной механизм при повороте вала с
помощью «собачки» поворачивает на заданное количество
зубьев храповик, на оси которого находится зубчатое колесо,
передающее через шестерню вращение микровинту. Винт
перемещает каретку подачи объектодержателя. Толщина срезов
устанавливается поворотом лимба.
Объектодержатель ротационного микротома — винтовой
зажим, вмонтированный в шаровую оправу каретки подачи.
Шарнирный механизм позволяет подать блок под любым углом.
Объектодержатель фиксируется в зажиме специальной
рукояткой.
Держатель для ножа — массивная подставка с двумя
вертикальными стойками, в которые вмонтированы двигающиеся
держатели, приспособленные для установки ножа под нужным
углом. Фиксация ножа осуществляется винтами. В переднезад-
нем направлении нож перемещается по специальным
направляющим с помощью винта. Постепенно приближая нож к объекту
и одновременно поворачивая колесо подачи, подравнивают
площадь резания, а затем нож фиксируют.
Ротационные микротомы снабжены специальной
транспортной лентой, на которую с ножа попадает полоска (серия)
срезов. На ленте их разделяют препаровальными иглами и
производят дальнейшие манипуляции. Снимать срезы с ножа
ротационного микротома можно кисточкой или препаровальной иглой.
Замораживающие микротомы используют для
резки не залитых, но фиксированных объектов, материала,
залитого в желатин и водорастворимые пластмассы. Особенно
широко применяются замораживающие микротомы для
изготовления препаратов при исследовании материала срочных
биопсий. По своей конструкции замораживающие микротомы
относятся к микротомам санного типа, но в их устройстве есть
некоторые особенности. Станина имеет приспособление для
крепления к столу. Нож устанавливают под нужным углом в
подвижной ручке с помощью одного или двух зажимов.
Автоматическая подача осуществляется при каждом размахе ручки с ножом
28
через систему рычагов. Замораживающий столик снабжен
приспособлением для подачи углекислоты или охлаждается
термоэлектрически с помощью полупроводниковых элементов.
Криостаты, вибратомы. С развитием гистохимии
ферментов и иммуноморфологии возникла необходимость в
обработке нефиксированного материала, которая была
реализована с помощью специальных приборов — криостатов. Позднее
появились криокиты и вибратомы.
Криостат — специализированная холодильная камера с
установленным в ней микротомом, в которой имеются отверстия
для рук, люминесцентная лампа и смотровое стекло. Надежная
изоляция позволяет поддерживать в криостате температуру от
-5 до -25 °С. Отрицательными моментами при работе с крио-
статом являются значительное переохлаждение рук оператора,
недостаточная освещенность рабочего поля, а также
невозможность ориентировать объект относительно кромки ножа. Эти
недостатки практически устранены в криокитах зарубежного
производства, управление которыми вынесено за пределы
морозильной камеры. В них можно отдельно регулировать
температуру объекта и ножа. Через 3 — 5 мин после включения
прибора достигается низкая температура, причем охлаждение
возможно до -65 °С, что предотвращает образование кристаллов в
тканях.
Уход за микротомами и микротомными
ножами. Все скользящие поверхности микротомов должны
быть чистыми и смазаны тонким слоем машинного или
вазелинового масла. При постоянной работе на микротоме все
скользящие поверхности необходимо один раз в неделю протирать
тряпочкой, смоченной бензином или толуолом, и смазывать.
После окончания работы на микротоме объектодержатель и
станину очищают от остатков парафина, предварительно вынув
микротомный нож и убрав его в футляр. Микротомные ножи
никогда не оставляют в микротоме или на рабочем столе!
Замораживающие микротомы и криостаты через 30 мин после
выключения вытирают насухо и винтовую подачу смазывают
вазелиновым маслом.
РЕЗАНИЕ ПАРАФИНОВЫХ БЛОКОВ НА САННОМ МИКРОТОМЕ
Парафиновый блок, наклеенный на деревянную колодку или
без нее (с большим слоем парафина), зажимают в
объектодержатель. Установив нужный угол наклона ножа (оптимальный
13—15°) в зависимости от плотности ткани, медленно подводят
нож к блоку, регулируют его высоту до соприкосновения с
ножом. Сначала выравнивают поверхность блока, установив
микрометрическую шкалу на получение толстых (20 — 25 мкм)
срезов, затем шкалу переводят на 6 —8 мкм и приступают к ре-
29
занию материала. Как правило, нож располагается
перпендикулярно, но возможно также получение срезов (особенно с более
плотных объектов) ножом, который установлен под углом к
станине микротома.
Срезы с блока осторожно снимают с помощью сухой или
смоченной в спирте кисточки, используют также изогнутую
препаровальную иглу или скальпель. Срезы обычно переносят в
коробку, дно которой выстлано бумагой черного цвета, и
укладывают матовой стороной вверх. После получения нужного
количества срезов рядом с ними кладут блок или этикетку с
номером. Удобнее сразу обработать 20 — 30 блоков, а затем
приступить к монтированию срезов на предметные стекла.
Часто срезы наклеивают на предметное стекло
непосредственно с ножа. Для этого их переносят в склянку с теплой (35 —
40 °С) дистиллированной или кипяченой водой, а затем
вылавливают на предметные стекла, которые предварительно
обезжиривают и натирают белком с глицерином. Срезы приклеивают
на предметное стекло блестящей, обращенной к ножу стороной.
Небольшие складочки на срезе можно расправить, осторожно
дотрагиваясь до них углом согнутой препаровальной иглы.
Можно расправлять срезы непосредственно на стекле с
помощью специального приспособления для сушки и
расправления парафиновых срезов. Для этого на предметное стекло
пипеткой наносят каплю воды и в нее опускают срез. Стекло со
срезом помещают на нагреваемый столик прибора, где срез
постепенно расправляется. После удаления избытка воды
пипеткой или фильтровальной бумагой стекло со срезом
подсушивают и одновременно срез плотно фиксируется на предметном
стекле. На нагреваемом столике прибора помещается
одновременно 45 предметных стекол, при его использовании не
требуется дальнейшего просушивания стекол со срезами в термостате.
Имеются специальные импортные ванночки для расправления
срезов и переноса их на стекло. В них постоянно
поддерживается оптимальная температура воды 38 °С.
Продолжительность просушивания срезов в термостате при
37 °С 6— 12 ч. В случае необходимости проведения срочной
окраски срезы можно поместить на 10—15 мин в термостат при
56 °С до начала плавления парафина, что способствует лучшей
фиксации среза на предметном стекле. Однако при этом
несколько затрудняется депарафинирование: требуется
применение дополнительной порции ксилола и увеличение
продолжительности депарафинирования.
Существует сухой способ приклеивания срезов к стеклу,
который пригоден только для срезов отличного качества. На
предметное стекло, смазанное тонким слоем белка с глицерином,
помещают срез, аккуратно расправляют его препаровальной иглой
или скальпелем и слегка подогревают на спиртовке или
нагреваемом столике.
30
ПРИГОТОВЛЕНИЕ ЦЕЛЛОИДИНОВЫХ СРЕЗОВ
Для приготовления целлоидиновых срезов используют ножи
типа А и Б. Целлоидиновые блоки закрепляют так же, как и
парафиновые. После установки ножа в микротом к нему
пододвигают объектодержатель с укрепленным в нем блоком.
Выравнивают поверхность блока до тех пор, пока полностью не
обнажится ткань кусочка, а затем приступают к приготовлению
срезов желаемой толщины. Во время резания нож и объект
обильно смачивают 70 % или 80 % спиртом, пользуясь
кисточкой. Нож по салазкам микротома ведут плавно, без давления.
Полученный срез расправляют на ноже с помощью кисточки,
после чего срез снимают с ножа на подушечку указательного
пальца, подложенного под нож. Срезы кладут в склянки с 70 %
спиртом.
ОСОБЕННОСТИ РАБОТЫ НА РОТАЦИОННОМ МИКРОТОМЕ
Парафиновый блок приклеивают к металлическому блокодер-
жателю и оплавляют горячим скальпелем с четырех сторон.
Затем блокодержатель с объектом закрепляют в винтовой
зажим и переводят в среднее положение (на уровне лезвия
ножа). Нож, закрепленный под углом 7 — 9°, подводят до
соприкосновения с объектом. После этого микрометрическую шкалу
устанавливают на 20 мкм и выравнивают поверхность блока,
затем переводят шкалу на 6 —7 мкм. Первые срезы, как
правило, не используют, а последующие получают в виде серии при
нескольких круговых поворотах рукоятки микротома. Серию
срезов (4 — 6) осторожно отделяют от лезвия ножа и с помощью
кисточки и препаровальной иглы переносят в коробочку с
черной бумагой для дальнейшего разъединения и выбора лучших
срезов.
После получения срезов парафиновые блоки снимают с бло-
кодержателя с помощью скальпеля и убирают в архив. Р. Лил-
ли (1969) рекомендует обрабатывать поверхность блока
горячим парафином, что предохраняет ткань от высушивания и
загрязнения.
ПРИЧИНЫ ОШИБОК, ВСТРЕЧАЮЩИХСЯ ПРИ РЕЗАНИИ
МАТЕРИАЛА, ЗАЛИТОГО В ПАРАФИН, И ИХ УСТРАНЕНИЕ
1. Парафин крошится: 1) он слишком тверд, 2) медленно
охлаждался при заливке, 3) низкая температура окружающей
среды, 4) большой угол наклона ножа.
Устранение: 1) перед получением среза подышать на блок,
2) изменить угол наклона ножа, 3) перезалить объект.
31
2. Ткань отделяется от парафина: 1) заливка проводилась
холодным парафином, 2) плохая пропитка материала, 3) при
проводке остались следы спирта.
Устранение: перезалить блок, предварительно поместив его в
промежуточную среду (для удаления спирта).
3. Материал плохо режется, ткань белесого цвета, срезы
сморщенные, плохо расправляются: недостаточное
обезвоживание ткани.
Устранение: блок расплавляют в термостате и пропускают по
батарее в обратном порядке до 100 % спирта, затем снова
заливают по схеме.
4. Нож как бы подскакивает, не срезая ткань или на срезах
образуются поперечные полосы: переуплотнение или
пересушивание материала при фиксации или обезвоживании.
Устранение: резать материал, поместив на него кусочек
льда; если срезы не получаются, то из архива надо вырезать
новый кусочек, обезводить по схеме и перезалить.
5. Срезы сморщенные, прилипают к поверхности ножа,
закручиваются: 1) недостаточный угол наклона ножа, 2) высокая
температура в помещении, 3) материал залит в легкоплавкий
парафин.
Устранение; 1) изменить угол наклона ножа, 2) перед
получением срезов поместить материал в холодильник, 3)
перезалить в более тугоплавкий парафин.
6. Срезы покрыты полосами и легко разрываются: 1) плохое
качество ножа (зазубрины), 2) загрязнение парафина (плотные
соринки), 3) наличие в ткани солей кальция.
Устранение: 1) передвинуть нож или сменить его на хорошо
заточенный, 2) декальцинировать объект или воспользоваться
микротомом-пилой со специальными ножами,
предназначенными для плотных тканей, керамики, синтетики и др.
7. Срез прилипает к ножу (электризация).
Устранение: перед получением среза надо подышать на блок.
ОСОБЕННОСТИ РАБОТЫ НА ЗАМОРАЖИВАЮЩЕМ МИКРОТОМЕ
Материал, залитый в формалин или спирт, тщательно
промывают в воде, затем вырезают кусочек толщиной 3 — 5 мм и
смачивают его водой, а также смачивают водой кусочек
фильтровальной бумаги площадью 2 — 3 мм . Сначала на столик
микротома кладут фильтровальную бумагу, а на нее — кусочек
ткани, после чего, слегка придерживая его пальцем, начинают
замораживание. Для этого открывают вентиль баллона, затем,
то открывая, то закрывая кран у столика микротома,
выпускают углекислоту небольшими порциями. Для лучшего и*
экономичного замораживания кусочка часто используют маленький
стаканчик или металлический колпачок, входящий в набор
32
микротома, которым накрывают кусочек. Углекислота
скапливается под стаканчиком, что способствует быстрому
замораживанию кусочка. Кусочек начинает белеть, т.е. замораживаться,
снизу.
После полного замораживания столик вместе с кусочком
осторожно подводят под нож и медленными движениями углом
ножа ровняют поверхность объекта. Столик подают рукой до
тех пор, пока вся поверхность кусочка не станет ровной. Затем
прекращают подачу столика вручную и передвигают нож так,
чтобы его середина проходила над объектом. Устанавливают
нужный угол наклона ножа и регулируют подачу (до 5 — 6
мкм), переходя на автоматическую резку. Срезы с
микротомного ножа снимают подушечкой указательного пальца и переносят
в воду. Перемороженная ткань может крошиться; для
устранения этого недостатка поверхность кусочка «подогревают»
пальцем. Если на ноже образуется соскоб ткани, то для получения
качественных срезов ткань следует слегка подморозить.
Замороженные срезы обычно хранят в 5— 12 % формалине или 70 %
либо 96 % спирте.
ОСОБЕННОСТИ ПОЛУЧЕНИЯ СРЕЗОВ С КРУПНЫХ ОБЪЕКТОВ
(ГИСТОТОПОГРАММ)
Срезы с крупных объектов можно получить на
замораживающем, санном и ротационном микротомах. На последних можно
резать блоки диаметром до 60 мм, для резания более крупных
объектов применяют специальные большие микротомы со
сменными столиками диаметром 75—160 мм. Фирмы «М1сгот»
(Германия), «5сЬапс1оп» (Великобритания), «ЬКВ» (Швеция)
и др. выпускают микротомы, предназначенные для резания
крупных объектов, в частности твердых тканей, например неде-
кальцинированной костной ткани.
На замораживающем микротоме фиксированные в 10 %
формалине и отмытые в воде пластины органа или ткани толщиной
1 — 1,5 см обильно поливают водой и замораживают
углекислотой или термопарой. Срезы с ножа перекладывают в большой
бюкс с водой, обезжиривают и окрашивают. Окрашивание и
заключение крупных срезов проводят по обычной схеме с
использованием посуды большей вместимости и предметных стекол
соответствующих размеров в зависимости от величины объекта.
После осторожного расправления на предметном стекле (им
может быть отмытая от эмульсии фотопластинка) срезы
заключают в водную или синтетическую среду и покрывают отмытой
от эмульсии и высушенной рентгеновской пленкой. Для топо-
графоанатомических исследований срезы можно заключить
между двумя предметными стеклами.
33
ПОДГОТОВКА ПРЕДМЕТНЫХ СТЕКОЛ
Предметные стекла, применяемые для получения
гистологических препаратов, необходимо предварительно подготовить.
Исключение составляют готовые к использованию и специально
упакованные импортные предметные стекла.
Предметные стекла моют в теплой мыльной воде или
кипятят в 2 — 3 % растворе гидрокарбоната натрия, затем
ополаскивают горячей водой и промывают в течение нескольких часов в
проточной воде. Вымытые стекла протирают чистой
хлопчатобумажной тканью и на несколько дней помещают в смесь
Никифорова: 96 % спирт и эфир (1:1). Обезжиренные стекла
извлекают пинцетом из этой смеси, протирают чистой тканью и
складывают в коробочку.
Для обезжиривания предметных стекол используют также
хромовую смесь, в состав которой входят 100 г бихромата
калия, концентрированной серной кислоты и 1000 мл горячей
воды. Бихромат калия растворяют сначала в горячей воде,
затем раствор охлаждают и после этого по стеклянной палочке
осторожно по каплям добавляют серную кислоту. Стекла
выдерживают в хромовой смеси 2 — 3 дня, а затем тщательно
промывают в проточной воде в течение 1 — 2 дней.
Предметные стекла также хорошо обезжириваются в
крепком растворе соляной кислоты. Через несколько суток их
промывают проточной водой и высушивают.
Качество обезжиривания можно проверить, капнув на
предметное стекло воду из пипетки: по обезжиренному стеклу вода
растекается тонким слоем, а не собирается в каплю.
Для лучшей фиксации срезов на стекле его предварительно
смазывают смесью белка с глицерином. Свежий яичный белок
взбивают и фильтруют через крупнопористый фильтр,
смоченный дистиллированной водой, затем размешивают с равным
объемом глицерина и добавляют несколько кристаллов
тимола. Смесь хранится в течение нескольких месяцев.
Применяют также смесь, в состав которой входят 15 мл сыворотки
крови, 5 мл дистиллированной воды и б мл 5 % формалина.
После фильтрации смесь готова к нанесению на предметные
стекла. Ее использование дает лучшие результаты, чем
применение яичного белка, так как при окрашивании не образуется
фон.
Для нанесения белка на обезжиренные предметные стекла в
одну руку берут 5 — 6 стекол в виде веера, а в другую — чистую
стеклянную палочку, которой наносят белок, прикасаясь к
каждому стеклу. Затем белок растирают обезжиренным спиртом
пальцем по поверхности стекла до его середины, прилагая
небольшое усилие. Некоторые авторы рекомендуют натертые
белком стекла прогревать в термостате, но опыт показывает, что
это излишне так как после переноса срезов на стекла их поме-
34
щают в термостат или на специальный столик для
просушивания, где одновременно происходит коагуляция белка.
Разработан способ фиксации среза к предметному стеклу без
предварительного натирания последнего белком с глицерином.
В ванночку с теплой дистиллированной водой капают несколько
капель жидкого казеинового клея и перемешивают. В
полученную мутноватую жидкость опускают срезы, расправляют
препаровальной иглой и вылавливают на чистое обезжиренное
стекло. Этот способ дает неизменно хороший эффект и вокруг среза
отсутствует окрашенный фон, как это часто бывает при
применении белка.
ГЛАВА 5
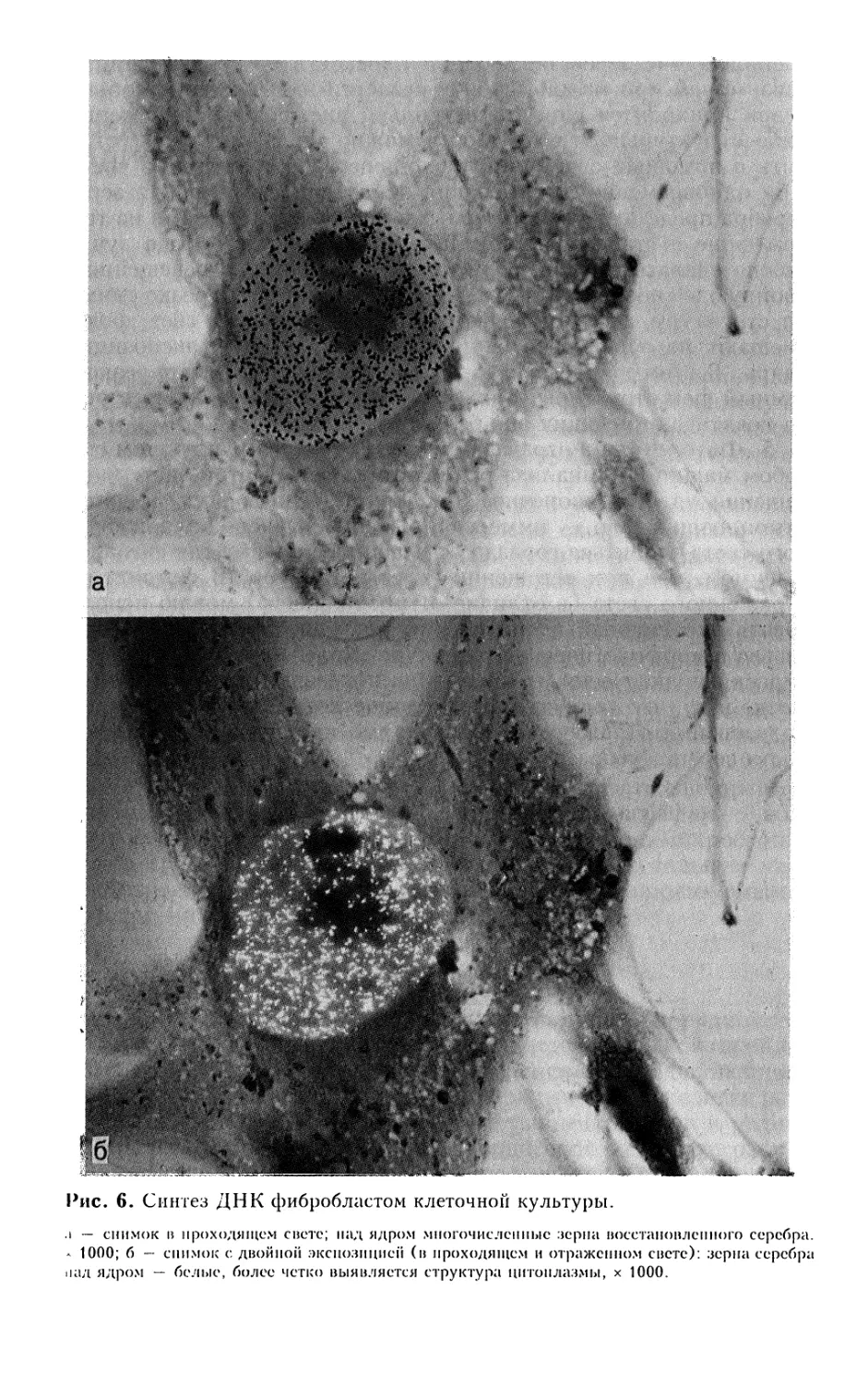
ОБЩИЕ ПРИНЦИПЫ И МЕТОДЫ ОКРАШИВАНИЯ
ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
В основе окрашивания клеток и тканей лежат
физико-химические процессы (диффузия, адсорбция, абсорбция, растворимость
и др.), происходящие как в красителе, так и в
микроструктурах. Большое значение имеют плотность ткани и дисперсность
красителя, которые определяют последовательность и скорость
окрашивания.
Целью окрашивания является более отчетливое выявление
различных компонентов клеток и тканей. Некоторые красители
обеспечивают этот эффект, растворяясь в выявляемых
компонентах, например нейтральных жирах. Другие красители
вызывают химическую реакцию, например выявление железа с
образованием берлинской лазури в кислой среде. Во многих случаях
процесс окрашивания возможен только при наличии протравы,
например гематоксилин окрашивает ткань в присутствии солей
металлов.
В гистологической практике применяют основные,
кислотные и нейтральные красители.
Основные, или ядерные, красители — это основания или их
соли, которые окрашивают структуры кислой природы
(хроматин ядер, ядрышко и др.) и называются базофильными. К ним
относятся гематоксилин, тионин, кармин, метиловый зеленый и
др.
Кислотные красители — это кислоты или их соли, с
помощью которых выявляют вещества и структуры основной
природы (цитоплазматические структуры клеток, эритроциты и т.д.).
Таковыми являются эозин, кислый фуксин, конго красный
(конгорот), эритрозин.
Нейтральные красители: судан III, судан IV, метиленовый
синий.
Процесс гистологического окрашивания условно
подразделяют на прогрессивный и регрессивный, прямой и непрямой,
простой и сложный. При прогрессивном типе окрашивания процесс
идет до тех пор, пока не достигается интенсивное
проникновение красителя в ткань. Регрессивный тип основан на
первоначальном перекрашивании структур с последующей дифферен-
цировкой до нужного уровня. Если раствор красителя
непосредственно действует на ткань, то говорят о прямом окрашива-
36
нии. Окрашивание после предварительной подготовки ткани
(протравливания) называется непрямым. Окрашивание одним
красителем — простое, а при использовании нескольких
красителей — сложное.
Для получения оптимальных результатов окрашивания
гистологических препаратов нужно использовать растворы,
приготовленные в точном соответствии с рекомендуемой
прописью. Перед приготовлением нужно внимательно осмотреть
реактивы, так как возможны изменение цвета, окисление,
кристаллизация и т.п. По мере инактивации, разбавления и
изменения концентрации растворов красителя при длительном
использовании его необходимо своевременно заменять свежим.
Для хранения красителей и проведения окраски применяют
химически чистую маркированную посуду. После
приготовления новых порций красителя, особенно при использовании
различных партий реактивов окраску нужно контролировать
под микроскопом. Продолжительность окрашивания
реактивами различных фирм варьирует.
ПРЕДВАРИТЕЛЬНАЯ ПОДГОТОВКА СРЕЗОВ К ОКРАШИВАНИЮ
Депарафинирование срезов
Парафиновые или целлоидин-парафиновые срезы перед
окрашиванием освобождают от парафина с помощью любого его
растворителя — бензола, толуола, ксилола, бензина. Особенно
тщательно удаляют парафин перед исследованием ткани в
поляризационном микроскопе, так как парафин обладает двоякопре-
ломляющим свойством. Депарафинирование осуществляют по
следующей схеме.
Ксилол I 10—15 мин (можно в
термостате при 37 °С)
Ксилол II 3 — 5 мин
Спирт 100 % I 1-2 мин
Спирт 100 % II ополоснуть
Спирт 96 % I »
Спирт 96 % II »
Дистиллированная вода 2 смены
После депарафинирования 100—150 препаратов реактивы
нужно менять. Депарафинированные препараты готовы к
окрашиванию сразу же после промывания в дистиллированной воде,
но во избежание отклеивания срезов, особенно при окраске по
Ван-Гизону, их лучше подсушить на воздухе. Если
окрашивание производят не сразу, то депарафинированные и
высушенные препараты аккуратно, чтобы не повредить срезы,
складывают в коробки и окрашивают по мере необходимости.
37
Подготовка целлоидиновых срезов
и срезов ткани, залитой в желатин
Для получения хороших результатов окраски препаратов
ткани, залитой в целлоидин, не требуется специальная
подготовка срезов. Их переносят из 70 % спирта в 50 %, а затем в
дистиллированную воду.
В тех случаях, когда применяемый краситель окрашивает
целлоидин, его можно удалить из ткани. Для этого
целлоидиновые срезы наклеивают на покрытые белком с глицерином
предметные стекла, плотно прижимают фильтровальной
бумагой, смоченной в 70 % спирте, и заливают гвоздичным маслом;
через 1 мин срез на стекле обрабатывают ацетоном или
абсолютным спиртом. После удаления целлоидина срез со стекла
переносят в склянку с 70 % спиртом, а затем — в
дистиллированную воду.
Желатин невозможно удалить из срезов, если блоки
уплотнялись в формалине. Желатиновые срезы, не обработанные в
формалине, наклеивают на стекло, покрытое белком с
глицерином, подсушивают, заливают 2 —4 % раствором уксусной
кислоты и помещают на 10—15 мин в термостат при 37 °С. Затем
срезы промывают в дистиллированной воде и окрашивают.
ЗАМЕЧАНИЯ ПО ТЕХНИКЕ ОКРАШИВАНИЯ
При окраске водными красителями срезы переносят в краситель
из дистиллированной воды, а при окраске спиртовыми — из
соответствующего раствора спирта. После того как препарат
приобретает интенсивную окраску, его промывают в воде или
спирте для удаления избытка красителя (дифференцировка),
контролируя этот процесс под микроскопом.
Срезы тканей после целлоидиновой и парафиновой заливки,
а также полученные на замораживающем микротоме
окрашивают в широкогорлых бюксах или на часовых стеклах.
Одновременно окрашивают несколько срезов, но промывают,
дифференцируют и т.д. каждый срез отдельно.
Препараты можно помещать в красящий раствор в
специальных контейнерах, предназначенных для одновременного
окрашивания большого количества стекол. Если препаратов
немного, то рациональнее краситель наносить непосредственно на
срез по каплям с помощью пипетки. Остатки красителя можно
слить в склянку и использовать повторно. Д. Кисели (1962)
предлагал накрывать при этом срезы стеклянным колпаком, а
для увлажнения среды оставлять под колпаком смоченную
водой вату.
38
ПРОСВЕТЛЕНИЕ И ЗАКЛЮЧЕНИЕ СРЕЗОВ
Одним из основных условий, определяющих пригодность
гистологических препаратов к микроскопическому исследованию,
является их прозрачность. Кроме того, препараты должны быть
защищены от высыхания и загрязнения. Все это обеспечивается
просветлением и заключением в специальные среды, которые
можно подразделить на смешивающиеся с водой (глицерин,
гуммиарабик, поливиниловый спирт, желатин) и не
смешивающиеся с водой (ксилол, толуол, их смеси с фенолом, эфирные
масла).
Смешивающиеся с водой просветляющие вещества
одновременно являются средой для заключения и приготовления
постоянных препаратов.
Заключение в среды, смешивающиеся с водой
Из этих сред чаще применяют глицерин-желатин. Используют
также чистый глицерин, однако этот метод не позволяет
приготовлять постоянные препараты.
Р. Л ил ли рекомендует для этих целей гумми-сироп Апати:
чистый гуммиарабик 50 г
сахар-рафинад 50 г
дистиллированная вода 50 мл
Смесь растворяют на водяной бане при постоянном
помешивании, затем добавляют 500 мг тимола. Используют также
поливиниловый спирт.
Среды, смешивающиеся с водой (кроме глицерина),
предварительно нагревают на водяной бане, капают нагретой
стеклянной палочкой или пипеткой на расправленный срез, слегка
подсушивают и покрывают чистым и сухим покровным стеклом.
Чистой стеклянной палочкой или обезжиренным пальцем
слегка прижимают покровное стекло. При этом излишки среды
выдавливаются и их аккуратно удаляют чистой тканью.
Для длительного хранения препаратов, чтобы избежать их
высыхания, многие авторы рекомендуют окантовывать
покровное стекло тонким слоем парафина или целлоидина. Однако
опыт показывает, что заключенные в глицерин-желатин
препараты и без окантовки хорошо сохраняются свыше 10 лет.
Просветление препаратов и заключение в среды,
не смешивающиеся с водой
Срезы или наклеенные на стекло препараты тщательно
обезвоживают в спиртах (70 %, 96 % и 100 %), а затем помещают в
любые из просветляющих веществ. Установлено, что для раз-
39
ных исследований предпочтительнее то или иное
просветляющее вещество. Так, при окраске по Нисслю и методу Грама —
Вейгерта лучшим просветляющим и одновременно
дифференцирующим средством является анилиновое масло, но для
просветления препаратов при окраске по Ван-Гизону использование его
недопустимо. Наиболее распространенными и
индифферентными по отношению к красителям веществами являются толуол и
ксилол, а также их смеси с фенолом (кристаллический фенол
расплавляют в термостате при 56 °С и смешивают с ксилолом в
пропорции 1:4 или 1:6).
Хорошо обезвоженные в спиртах и просветленные в карбол-
ксилоле, а затем в чистом ксилоле препараты готовы к
заключению в специальные смолы. С этой целью применяют смолы
растительного происхождения — бальзамы (канадский, пихтовый
и сибирский кедровый). Все они хорошо растворяются в
толуоле и ксилоле.
Метод растворения: в склянку с сухой смолой заливают
толуол, который постепенно растворяет верхние слои смолы.
Процесс можно ускорить, если склянку поместить в термостат
при 37 — 40 °С. Полученный густой раствор сливают в другую
банку и добавляют новую порцию толуола, одновременно
перемешивая раствор и доводя до консистенции жидкого меда.
Слишком жидкий раствор по мере испарения толуола вновь
загустевает. Приготовленный бальзам хранят в плотно, закрытой
посуде.
В практической патоморфологии широко используют
синтетическую пластмассу — полистирол. Способ применения этого
пластического материала предложен Д.С. Саркисовым и
подробно изложен в руководстве Г.А. Меркулова «Курс патолого-
гистологической техники» (1969). Полистирол хорошо
растворяется в ксилоле и толуоле, прозрачен и быстро затвердевает
под предметным стеклом, образуя тончайшую пленку. Метод
растворения тот же, что и для смол растительного
происхождения. Однако со временем полистирол становится хрупким, в
пленке появляются трещины, что затрудняет микроскопическое
исследование и совершенно неприемлемо для микросъемки.
Для предотвращения этих недостатков в 30 % раствор
полистирола в ксилоле добавляют пластификатор, придающий пленке
эластичность и гибкость, устраняя все недостатки полистирола.
В настоящее время в качестве пластификатора используют ди-
бутилфталат, широко применяемый в электронной
микроскопии. Существует несколько вариантов приготовления
полистирола для заключения препаратов:
1) 94 мл 30 % раствора полистирола в ксилоле смешивают с
6 мл дибутилфталата;
2) смесь, состоящую из 100 г полистирола, 100 мл ксилола и
12 мл дибутилфталата, растворяют при 22 °С или в термостате
при 37 °С, периодически перемешивая.
40
Готовую синтетическую смолу хранят в плотно закрытой
посуде. Технология заключения срезов та же, что и при
применении водорастворимых сред.
ЯДЕРНЫЕ КРАСИТЕЛИ И ИХ ПРИГОТОВЛЕНИЕ
Окрашивание ядер клеток обусловлено двумя механизмами
химического взаимодействия: 1) основные красители, например
анилиновые, образуют соли в присутствии ДНК и РНК; 2)
образуются комплексы с ионами металлов при применении
протравы. В практической работе чаще используют протравные
красители. К ним относятся гематоксилин, кармин, сафранин,
галлоцианин, ализарин. Хорошо окрашивают ядра такие
красители, как янус зеленый, основной коричневый, оксазиновые
красители (крезиловый фиолетовый, нильский голубой), тиа-
нин, азуры, метиленовый синий, основной фуксин, метиловый
зеленый и др. Следует упомянуть о хороших результатах
окраски ядер соком черники, которая предложена М.Д. Лавдовским
еще в 1887 г.
Гематоксилин и способы его приготовления
Гематоксилин имеет растительное происхождение: его получают
из эфирного экстракта кампешевого дерева. Гематоксилин
хорошо растворяется в спирте и плохо в воде. Красящими
свойствами обладает продукт окисления гематоксилина — гематеин,
поэтому краситель становится пригодным только после
созревания — окисления, на которое требуется от 10 дней до 2 — 3 нед.
Созревание можно ускорить с помощью солей алюминия,
хрома, железа и др.
Гематоксилин Эрлиха
Гематоксилин кристаллический 2 г
Спирт 96% 100 мл
Дистиллированная вода 100 мл
Глицерин 100 мл
Алюмокалиевые или алюмоаммонийные квасцы 3 г
Ледяная уксусная кислота 10 мл
Гематоксилин растворяют в спирте, а квасцы — в
дистиллированной воде, смешивают оба раствора и затем добавляют
остальные компоненты. Раствор периодически перемешивают.
Через 10—14 дней он приобретает темно-вишневый цвет, что
свидетельствует о готовности красителя. Продолжительность
окрашивания гематоксилином Эрлиха 4 — 6 мин. Затем следуют
промывание в дистиллированной, потом в водопроводной воде,
дифференцировка в 1 % солянокислом спирте, восстановление в
41
аммиачной воде и окончательное промывание в
дистиллированной воде.
Для приготовления солянокислого спирта к 100 мл 70 %
спирта добавляют 1 мл концентрированной соляной кислоты;
для приготовления аммиачной воды к 50 мл дистиллированной
воды добавляют 2 капли крепкого аммиака.
Результат: ядра клеток (оболочка, хроматин) темно-синие,
ядерный матрикс бледно-голубой или прозрачный.
Гематоксилин Делафильда
Гематоксилин кристаллический 4 г
Спирт 96 % 25 мл
Алюмокалиевые или алюмоаммонийные квасцы 40 г
Дистиллированная вода 400 мл
Растворенный в спирте гематоксилин смешивают с раствором
квасцов, смесь держат на свету 3 — 4 дня, периодически
перемешивая, затем фильтруют и добавляют 100 мл глицерина и 100 мл
метилового спирта. Раствор оставляют на свету 3 — 4 дня,
фильтруют, хранят в банке с притертой пробкой. Перед
применением краситель разбавляют в 2 раза дистиллированной водой
или слабым 2 % раствором алюмокалиевых квасцов.
Продолжительность окрашивания 4 — 6 мин, затем следуют
промывание в дистиллированной воде, дифференцировка в
солянокислом спирте, восстановление в аммиачной воде и
окончательное промывание в дистиллированной воде.
Результат: хроматин и кариолемма ярко-синие.
Гематоксилин Гарриса
Гематоксилин кристаллический
Спирт 96 %
Алюмоаммонийные квасцы
Дистиллированная вода
Смешивают растворы I и II, затем добавляют 60 мл
глицерина и 2,5 г оксида ртути (красной или желтой). Раствор
нагревают до 100 °С, остужают, фильтруют. Перед использованием к
100 мл раствора добавляют 2 мл ледяной уксусной кислоты.
Преимуществами гематоксилина Гарриса являются быстрота
приготовления и четкость окраски ядер.
Продолжительность окрашивания 3 — 4 мин. Затем следуют
промывание и дифференцировка, восстановление в аммиачной
воде и окончательное промывание в дистиллированной воде.
Результат: ядра ярко-синие.
Гематоксилин Гарриса в модификации Кисели
Д. Кисели исключил из прописи квасцы, считая, что для
окисления гематоксилина достаточно желтого оксида ртути.
Зо'мл ) Раствор 1
1000Гмл I Раств°Р П
42
Гематоксилин кристаллический 1 г ] „
Спирт 96% 10 мл | раст»»Р1
Гематоксилин кристаллический 20 г 1 „ тт
Дистиллированная вода (теплая) 200 мл \
Растворы I и II смешивают и доводят до кипения, в кипящую
смесь добавляют 500 мг желтого оксида ртути. Полученный
раствор охлаждают, фильтруют. Он сразу пригоден к применению.
Продолжительность окрашивания 4 — 6 мин. Затем следуют
те же процедуры, что и при окрашивании гематоксилином
других модификаций.
Результат: ядра ярко-синие.
Гематоксилин Ганзена
Гематоксилин кристаллический 1 г 1 „ т
Спирт 100% 10 мл | РЛС**°Р1
Алюмокалиевые квасцы 20 г
Дистиллированная вода 100 мл
Раствор II
Растворы I и II смешивают и добавляют 3 мл насыщенного
раствора перманганата калия. Смесь нагревают до кипения,
охлаждают, фильтруют. Раствор сразу готов к применению.
Продолжительность окрашивания 3 — 4 мин. Затем следуют
те же процедуры, что и при окрашивании гематоксилином
других модификаций.
Результат: ядра красно-фиолетовые.
Гематоксилин Маллори (водный)
Гематоксилин кристаллический 2,5 г
Алюмоаммонийные квасцы 50 г
Дистиллированная вода 1000 мл
Раствор выдерживают 10 сут при 25 °С, добавляют 440 мг
перманганата калия и 2,5 г тимола. Перемешивают несколько
раз, перед окрашиванием фильтруют.
Продолжительность окрашивания 3 — 4 мин. Затем следуют
те же процедуры, что и при окрашивании гематоксилином
других модификаций.
Результат: ядра синие.
Кислый гемалаун Майера (водный)
Гематоксилин кристаллический 1 г
Алюмоаммонийные квасцы 50 г
Дистиллированная вода 1000 мл
Йодат натрия 200 мг
Хлоралгидрат 50 г
Лимонная кислота 1 г
43
Квасцы растворяют в воде без нагревания, затем добавляют
и растворяют гематоксилин, йодат натрия, лимонную кислоту и
последним — хлоралгидрат. После растворения всех
компонентов краску фильтруют, и она готова к применению.
Продолжительность окрашивания 4 — 6 мин.
Результат: ядра красно-фиолетовые.
Гематоксилин Кораци (водный)
Гематоксилин кристаллический 0,1 г
Йодат калия 2 — 3 кристалла
Алюмокалиевые квасцы 5 г
Дистиллированная вода (теплая) 100 мл
Смесь перемешивают до полного растворения и добавляют
25 мл глицерина. Раствор перед использованием фильтруют.
Продолжительность окрашивания 1—2 мин.
Результат: ядра ярко-синие.
Железный гематоксилин Гейденгайна
Гематоксилин кристаллический 1 г
Спирт 96% 10 мл
Дистиллированная вода 90 мл
Краситель созревает 4 нед. Добавление 100 мг йодата натрия
ускоряет «созревание» — он готов к использованию уже через
1 ч после приготовления. Окрашивание проводят разведенным
в 2 раза раствором.
Продолжительность окрашивания 1 — 36 ч.
Методика окрашивания
1. Препарат помещают в 2,5 % раствор железоаммонийных
квасцов на 2 — 12 ч.
2. Ополаскивают в дистиллированной воде.
3. Окрашивают гематоксилином Гейденгайна 1 — 36 ч.
4. Промывают в водопроводной воде — 3 смены по 10 мин,
затем обезвоживают, просветляют, заключают.
Результат: ядра и цитоплазматические структуры черные и
синевато-черные.
Железный гематоксилин Брусси
Гематоксилин кристаллический 1 г 1 раствор \
Дистиллированная вода при 40 °С 100 мл )
Железоаммонийные квасцы 8 г 1
Дистиллированная вода при 40 °С 100 мл } РаствоР п
Растворы I и II смешивают, фильтруют.
44
Продолжительность окрашивания 30 с—1 мин. Затем
промывают в водопроводной воде, обезвоживают, просветляют и
заключают.
Результат: ядра синевато-черные.
Железный гематоксилин Вейгерта
Гематоксилин кристаллический 1 г
Спирт 96% 100 мл
Раствор трихлорида железа гексагидрата 50 % 4 мл
Дистиллированная вода 95 мл
Концентрированная соляная кислота 1 мл
Раствор А
Раствор Б
Растворы хранят в отдельных склянках с притертыми
пробками. Перед использованием нужное для окрашивания
количество краски получают путем смешивания растворов А и Б в
пропорции 1:1.
Продолжительность окрашивания 1—2 мин, затем
промывают в водопроводной воде.
Результат: ядра черно-синие.
Другие ядерные красители
Кармин
Кармин
Дистиллированная вода
1 г
100 мл
Раствор кипятят 15 мин, охлаждают, фильтруют, добавляют
10 мл 40 % формалина.
Продолжительность окрашивания 30 мин —24 ч. Затем
следуют промывание в дистиллированной воде, дифференцировка
в солянокислом спирте, обезвоживание, просветление и
заключение.
Результат: ядра ярко-красные.
Сафранин
Обеспечивает получение хороших результатов после
фиксации ткани в тетраоксиде осмия и особенно после применения
фиксаторов, содержащих хром.
Сафранин 10 г
Спирт 96% 155 мл
Дистиллированная вода 145 мл
Основной раствор 20 мл
Спирт 50 % 80 мл
Основной
раствор
Краситель
Продолжительность окрашивания 24 ч. Затем следуют
промывание дистиллированной водой, дифференцировка в соляно-
45
кислом спирте, дистиллированная вода, обезвоживание,
просветление и заключение.
Результат: хроматин ядер и кариолемма ярко-красные.
Галлоцианин
Рекомендуется для окрашивания тканей, залитых в желатин.
Галлоцианин 100 г
Хромовые квасцы 5 г
Дистиллированная вода 100 мл
Сначала растворяют квасцы, затем добавляют галлоцианин,
раствор кипятят при постоянном помешивании, охлаждают,
фильтруют. Срок годности красителя 1 мес.
Продолжительность окрашивания 24 — 48 ч. Затем следуют
промывание в 2 сменах дистиллированной воды,
обезвоживание, просветление и заключение.
Результат: хроматин и тигроидное вещество
синевато-черные.
Сок черники
Свежие чистые ягоды черники разминают в фарфоровой
ступке, смешивают с равным объемом 96 % спирта, настаивают 1 —
2 сут и фильтруют. Перед окрашиванием часть раствора
разводят равным количеством 2 % водного раствора алюмокалиевых
квасцов и добавляют 2 — 3 кристаллика тимола.
Продолжительность окрашивания 5 — 7 мин. Затем следуют
промывание в дистиллированной воде, дифференцировка в
солянокислом спирте, промывание в дистиллированной воде,
обезвоживание, просветление и заключение.
Результат: ядра темно-фиолетовые.
ЦИТОПЛАЗМАТИЧЕСКИЕ КРАСИТЕЛИ
Окрашивание цитоплазмы клеток происходит в результате
связывания оснований и белков кислотными красителями. В
группу диффузных (кислых) красителей входят карбоновые и суль-
фоновые кислоты, нитро-, азокрасители и др. В
гистологической практике постоянно применяют эозины, пикриновую
кислоту, оранжевый Г, кислый фуксин, конго красный (конгорот),
азокармин, эритрозин. Чаще используют 1 % водные растворы
этих красителей, но можно применять и 1 % спиртовой раствор.
Продолжительность окрашивания колеблется от 5 с до 3 — 5
мин в зависимости от сорта и серии красителя. Если препарат
перекрашивается, то излишек краски легко удаляется при
ополаскивании в дистиллированной воде и последующем
обезвоживании препарата или среза в спиртах.
46
Смесь кислого фуксина и пикриновой кислоты (пикрофук-
син) готовят из насыщенного водного раствора пикриновой
кислоты и 1 % водного раствора кислого фуксина (см. главу 22).
МЕТОДЫ, ПРИМЕНЯЕМЫЕ В ПАТОМОРФОЛОГИЧЕСКОЙ
ПРАКТИКЕ
В арсенале патоморфологической лаборатории должны быть
отработаны и в любой момент применены следующие методики:
окраска гематоксилином и эозином, резорцин-фуксином, по
Ван-Гизону, методы окраски, предназначенные для выявления
амилоида, фибрина, кератина и слизи по Крейбергу, извести по
Косее, железа по Перлсу, липидов Суданом III и Суданом
черным.
Методика окраски гематоксилином и эозином
Процедура окрашивания срезов, полученных на
замораживающем микротоме, после парафиновой или целлоидиновой
заливки различается лишь по техническим приемам, а порядок
проведения окраски одинаков.
Дистиллированная вода ополоснуть
Раствор гематоксилина 1 — 20 мин
Дистиллированная вода ополоснуть
Солянокислый спирт дифференцировка
Аммиачная вода срезы синеют (контроль
под микроскопом)
Проточная вода 5—10 мин
Дистиллированная вода ополоснуть
Раствор эозина 10 с —3 мин
Спирт 96 %, карбол-ксилол, заключение.
Результат: ядра синие, цитоплазма и межклеточное вещество
розовые.
Методы выявления амилоида
Окраска генциановым или метиловым фиолетовым
по Варшавскому и Проскурневой
Окрашивают срезы, полученные на замораживающем
микротоме или после заливки в парафин, но не приклеенные на
предметное стекло.
Генциановый фиолетовый (1 % водный раствор) 2—15 мин
Водопроводная вода ополоснуть
Уксусная кислота (2 % раствор) до
красновато-фиолетового оттенка
Водопроводная вода ополоснуть
47
Срезы, полученные на замораживающем микротоме,
извлекают на предметное стекло и переносят в 50 % водный раствор
ацетата калия. Применение глицерин-желатина приводит к
исчезновению метахроматического (розово-фиолетового)
окрашивания.
Плавающие парафиновые срезы вылавливают на предметное
стекло и высушивают в течение 2 —3 ч в термостате при 37 °С,
затем депарафинируют в ксилоле и заключают в бальзам.
Результат: амилоид красновато-фиолетового цвета, прочие
ткани синего.
Окраска конго красным
Конго красный (1 % водный раствор) 1 —3 мин
Водопроводная вода ополоснуть
Спирт 70 % или 80 % дифференцировка до
бледно-розового цвета
Водопроводная вода ополоснуть
Квасцовый гематоксилин для докраски ядер 2 — 3 мин
Водопроводная вода ополоснуть
Затем обезвоживают, просветляют, заключают в смолу.
Результат: амилоид красного цвета, ядра синеватые.
Можно вначале окрасить ядра гематоксилином,
отдифференцировать в солянокислом спирте, а затем окрашивать конго
красным.
Элективный метод выявления фибрина
[Зербино Д.Д. и др., 1983]
Методика пикро-Маллори
1. Срезы помещают в гематоксилин Гарриса на 4 —6 мин.
2. Промывают в дистиллированной воде в течение 10 мин.
3. Переносят в пикрофуксиновый раствор (0,2 г пикриновой
кислоты + 0,8 г кислого фуксина + 2мл ледяной уксусной
кислоты + 98 мл дистиллированной воды) на 5 мин.
4. Промывают в 2 % растворе ледяной уксусной кислоты и
переносят на 5 мин в дифференцирующий раствор. Его готовят
из основного раствора (25 г фосфорно-вольфрамовой кислоты +
2,5 г пикриновой кислоты + 100 мл 96 % спирта), к 40 мл
которого добавляют 60 мл дистиллированной воды.
5. Ополаскивают в проточной воде и переносят на 5— 10 мин
в 1 % раствор анилинового голубого.
6. Промывают в 2 % растворе уксусной кислоты и переносят
на 2 —5 мин в дифференцирующий раствор (10 мл основного
раствора + 90 мл дистиллированной воды).
7. Промывают в 2 % растворе ледяной уксусной кислоты.
8. Обезвоживают, просветляют, заключают в бальзам.
48
Методика пикро-Маллори для быстрой окраски
1. Срезы помещают в гематеин Майера на 4 —6 мин.
2. Ополаскивают в дистиллированной воде.
3. Переносят в раствор пикро-Маллори (к 98 мл
дистиллированной воды последовательно добавляют 0,2 г пикриновой
кислоты, 1 г кислого фуксина, 2 г анилинового голубого, 1 г фос-
форно-вольфрамовой кислоты; смесь доводят до кипения и
охлаждают, затем добавляют 2 мл ледяной уксусной кислоты и
фильтруют на 5 мин.
4. Промывают в 2 % растворе уксусной кислоты.
5. Переносят в дифференцирующий раствор (10 мл
основного раствора + 90 мл дистиллированной воды) на 2 —5 мин.
6. Промывают в 2 % растворе уксусной кислоты.
7. Обезвоживают, просветляют, заключают в бальзам.
Результат: «молодой» и «зрелый» фибрин окрашиваются в
красный цвет, «старый» фибрин в синий, эритроциты в
оранжевый, мышечная ткань в фиолетовый, соединительная ткань в
голубой.
Выявление кератина и слизи по Крейбергу
Фиксированный в 10 % растворе формалина материал заливают
в целлоидин или парафин. Для окрашивания готовят алыдиано-
вый синий, сафранин и эритрозин.
1. Альциановый синий: 50 мл 1 % водного раствора альциа-
нового синего + 50 мл 1 % раствора уксусной кислоты + 10 мг
тимола.
2. Сафранин: 5 г сафранина смешивают в термостойкой
посуде со 100 мл 100 % спирта, затем кипятят на водяной бане 1 ч.
Полученный раствор сливают в бутылку и к осадку добавляют
еще 100 мл 100 % спирта. Вновь кипятят, повторяя эту
процедуру не менее 5 раз. Полученный экстракт (700 мл раствора
позволяют окрасить 1000 срезов) фильтруют и хранят в
тщательно закрытой посуде.
3. Эритрозин: на водяной бане готовят 1 % водный раствор
эритрозина, затем фильтруют и добавляют 10 мг тимола.
Методика окраски
1. Депарафинированные срезы ополаскивают в
дистиллированной воде.
2. Ядра окрашивают любым гематоксилином без длительной
дифференцировки.
3. Очень быстро дифференцируют в 0,5 % растворе соляной
кислоты.
4. Тщательно просушивают фильтровальной бумагой.
49
5. Переносят в раствор эритрозина на 5 мин.
6. Очень быстро ополаскивают в дистиллированной воде, 96 %
спирте, дистиллированной воде.
7. Переносят в раствор альцианового синего на 3 — 5 мин.
8. Быстро обезвоживают в 96 % спирте.
9. Погружают в раствор сафранина — 5 мин.
10. Ополаскивают в 2 сменах 100 % спирта.
11. Просветляют и заключают по любой методике.
Результат: ядра клеток темно-синие, кислые гликозамино-
гликаны голубые, клетки красные, прочие ткани розовые и
фиолетовые.
ГЛАВА б
ОСНОВНЫЕ ГИСТОХИМИЧЕСКИЕ РЕАКЦИИ
Цель гистохимии как раздела гистологии и цитологии —
микроскопическая локализация химических соединений в клетке и
тканях при сохранении их структуры, а также изучение
механизмов и специфичности реакций, используемых с этой целью.
Результат гистохимического анализа в равной мере зависит
от качества проведения гистохимической реакции и подготовки
материала. Процесс подготовки включает взятие образца ткани,
фиксацию, промывание, обезвоживание, заливку в парафин
или синтетические смолы и приготовление срезов, мазков или
отпечатков. На каждом из этих этапов важно правильно
выбрать конкретную методику, обеспечивающую наилучшую
сохранность исследуемых веществ при одновременной
сохранности, насколько это возможно, прижизненной структуры клеток и
тканей. Для последующего гистохимического анализа наиболее
важен выбор метода фиксации.
ФИКСАЦИЯ
Целью фиксации биологического материала для
гистохимического анализа является перевод живого вещества из лабильного
состояния в стабильное, т.е. прекращение процессов аутолиза и
стабилизация веществ и структур клетки в такой мере, при
которой их локализация, целостность и взаимное расположение
практически не изменяются при последующем обезвоживании,
заливке в парафин или в смолу, приготовлении срезов, а также
под воздействием пучка электронов, если проводится
ультрацитохимический анализ. Для достижения этой цели возможны три
подхода: высушивание, замораживание и химическая
фиксация.
Наиболее часто как в гистологической, так и
гистохимической практике используют метод химической фиксации. На его
результаты влияют время, прошедшее после взятия материала,
продолжительность фиксации, рН и изотоничность
фиксирующей среды, температура и химические свойства выбранного
фиксирующего реагента. Очень важное значение имеет время,
прошедшее от прижизненного взятия материала из организма
До начала фиксации. Этот срок должен быть максимально со-
51
кращен, желательно до нескольких минут, хотя неплохая
морфологическая сохранность, достаточная для идентификации
ткани, клеток и веществ с целью патоморфологической
диагностики, может быть обеспечена при фиксации материала через
30 — 90 мин после операции.
Температура фиксирующего раствора для гистохимических
целей в большинстве случаев устанавливается от 0 до 4 °С для
замедления аутолитических процессов и для снижения скорости
возможной диффузии исследуемого вещества. Фиксация на
холоду особенно рекомендуется для энзимогистохимических и
ультрацитохимических исследований.
В химической фиксации для гистохимических целей
используют в первую очередь альдегиды (формальдегид, глутаровый
альдегид и др.), тетраоксид осмия, хромовую кислоту и ее
соли, спирты (этанол, метанол и др.), ацетон, соли ртути
(например, сулема), уранилацетат и кислоты (например, уксусная,
трихлоруксусная, пикриновая, азотная и др.).
Формальдегид и смеси с формальдегидом
Фиксатор, наиболее широко используемый как в гистологии,
так и в гистохимии,— формальдегид. Это газ, растворимый в
воде до концентрации 40 % по массе; именно в такой
концентрации он и поступает в продажу под названием «формалин».
В гистологической практике обычно используют 10 %
раствор формалина, что соответствует 4 % раствору
формальдегида.
В водных незабуференных растворах формальдегид со
временем превращается в муравьиную кислоту, метиловый спирт и
ацетон, которые существенно ухудшают качество фиксации,
особенно для гистохимии, электронной микроскопии. К
недостаткам формальдегида относится также его довольно высокая
способность к полимеризации и выпадению белого осадка пара-
формальдегида. В результате этих процессов точную
концентрацию формальдегида в растворах формалина установить не
представляется возможным.
Формальдегид и смеси с формальдегидом можно
использовать в большинстве гистохимических исследований. Особенно
хорошо зарекомендовали себя при выявлении ферментов,
главным образом гидролитических и липидов, кальций-формол по
Бейкеру, а для выявления нуклеиновых кислот фиксатор ФСУ
(формалин — спирт — уксусная кислота).
Фиксатор Лилли для кислых гликозаминогликанов:
нитрат свинца 8 г
40 % раствор формальдегида 10 мл
вода 10 мл
этанол 80 мл
52
Продолжительность фиксации 24 ч при комнатной
температуре, 2 — 3 дня при 4 °С, 10—14 дней при -25 °С.
Для фиксации гликогена наряду с известным фиксатором
Буэна используют раствор Жандра, в котором к формалину,
помимо пикриновой и уксусной кислот, добавлен этанол.
Фиксатор Жандра для гликогена:
пикриновая кислота (насыщенный раствор в 96 % спирте) 85 частей
раствор формальдегида 40% 10 частей
ледяная уксусная кислота 5 частей
В рутинной электронной микроскопии и
электронно-микроскопической гистохимии формальдегидные фиксирующие смеси
проявили себя вначале не с лучшей стороны, что было
обусловлено наличием в формальдегиде вредных примесей, главным
образом метанола (до 16 %). Свободный от метанола формалин,
полученный из параформальдегида, обеспечивает практически
такую же ультраструктурную сохранность клеток, как и глута-
ровый альдегид, поэтому его с успехом применяют для многих
гистохимических реакций.
Метод приготовления свободного от метанола 4 % раствора
формальдегида из параформальдегида по Гайеру: 2 г
параформальдегида в 50 мл 0,1 М фосфатного буфера (рН 7,4 — 7,6)
нагревают, помешивая, до 70 °С до просветления раствора, а
затем охлаждают и фильтруют; 4 % раствор формальдегида в
0,1 М фосфатном буфере имеет рН 7,3 — 7,5.
Метод приготовления свободного от метанола 40 %
раствора формальдегида из параформальдегида по Глауэрт: готовят
40 % раствор параформальдегида, растворяя 40 г порошка
формальдегида в 100 мл дважды дистиллированной воды при
нагревании до 65 °С, постоянно помешивая. Добавляют
несколько капель 40 % гидроксида натрия до просветления
раствора. Полученный раствор 40 % параформальдегида
охлаждают перед смешиванием с другими компонентами фиксирующей
смеси.
Состав фиксирующей смеси из 2 % формальдегида и 2,5 %
глутарового альдегида по Карновски:
0,1 М фосфатный или какодилатный буфер (рН 7,2 — 7,4) 40 мл
4 % раствор формальдегида на 0,1 М фосфатном или како-
дилатном буфере (рН 7,2 — 7,4) 50 мл
25 % раствор глутарового альдегида 10 мл
Главным преимуществом формальдегида по сравнению с глу-
таровым альдегидом и тетраоксидом осмия является его более
высокая проникающая способность. Однако его взаимодействие
с белками идет медленно и, что не следует забывать, процесс
обратим. Следовательно, длительное отмывание кусочков от
формальдегидного фиксатора нежелательно.
53
Глутаровый альдегид
Глутаровый альдегид обеспечивает наилучшую
морфологическую сохранность и стабилизацию многих ферментов, поэтому
его наиболее часто используют в электронной микроскопии и
ультрацитохимических исследованиях ферментов.
Состав фиксирующей смеси с глутаровым альдегидом:
0,2 М фосфатный или какодилатный буфер (рН 7,2 — 7,4) 50 мл
дистиллированная вода 40 мл
25 % глутаровый альдегид 10 мл
сахароза 8,5 г
Глутаровый альдегид не защищает липиды от последующего
вымывания, и если не провести дофиксации в тетраоксиде
осмия, то до 95 % липидов вымывается спиртами и /или
ацетоном в процессе обезвоживания материала.
Некоторые авторы рекомендуют использовать лишь свежие
фиксирующие альдегидные смеси, хотя из практики известно,
что они хорошо сохраняются в холодильнике в течение
нескольких месяцев; в таких случаях необходимо лишь контролировать
рН раствора.
Тетраоксид осмия
Тетраоксид осмия — дорогой реагент. Он поступает в продажу
в запаянных стеклянных ампулах по 0,5 — 2 г. Для получения
водных растворов тетраоксида осмия чисто вымытую ампулу
обертывают чистой плотной бумагой, раздавливают щипцами
или молотком, вместе с осколками стекла помещают в
дистиллированную воду нужного объема и выдерживают не менее
24 ч, так как он плохо растворяется в воде. Соблюдение
чистоты при этой операции и хранение в чистой посуде позволяют
сохранить водные 1—4 % растворы в течение многих месяцев
даже при комнатной температуре. При этом флакон с раствором
необходимо закрыть хорошо притертой пробкой и хранить в
темноте. Для первичной фиксации липидов используют 1 %
раствор тетраоксида осмия на 0,1 М фосфатном буфере, а также в
смеси с хромовой или уксусной кислотой.
Состав смеси для вторичной фиксации:
2 % раствор тетраоксида осмия в дистиллированной воде 5 мл
сахароза 850 мг
0,2 М фосфатный или какодилатный буфер (рН 7,2 — 7,4) 5 мл
Раствор тетраоксида осмия 2 % готовят не менее чем за 1 сут;
для лучшей сохранности липидов добавляют хлорид кальция
или магния до конечной концентрации 1—3 ммоль. Если смесь
используют для первичной фиксации, то вместо сахарозы
добавляют хлорид натрия.
54
Раствор Флемминга:
2 % раствор тетраоксида осмия на дистиллированной воде 2 мл
1 % раствор хромовой кислоты на дистиллированной воде 7,5 мл
ледяная уксусная кислота 0,5 мл
В этом растворе можно фиксировать блоки тканей толщиной
не более 2 мм в течение 12 — 24 ч. Промывают 12 ч в воде и
перед обезвоживанием выдерживают в течение нескольких
часов в 70 % спирте. Смешивать три компонента раствора Флем-
минга следует непосредственно перед использованием.
Для приготовления фиксирующего раствора 2 части
жидкости Марчи (2,5 г бихромата калия, 1 г сульфата натрия и 100 мл
дистиллированной воды), приготовленной непосредственно
перед использованием, смешивают с 1 частью 1 % раствора
тетраоксида осмия.
Прекрасная морфологическая сохранность клеток при
осмиевой фиксации, в том числе и на ультраструктурном уровне,
объясняется главным образом воздействием на белки, которые
при этом не коагулируют, а желатинизируются, что
практически не сопровождается сморщиванием ткани.
Тетраоксид осмия реагирует не только с аминогруппами,
главным образом триптофана, цистеина и гистидина, но и с
этиленовыми группами ненасыщенных липидов, которые
восстанавливают его с образованием осмиевой черни. Благодаря этому
тетраоксид осмия действует не только как фиксатор, но и как
контрастирующее вещество, в связи с чем он нашел широкое
применение в электронной микроскопии. Это свойство в
последние годы стало играть большую роль в электронной гистохимии
при использовании 3,3'-диаминобензидина, превращающегося в
гистохимических реакциях в процессе окислительной
полимеризации в избирательно осмирующийся продукт.
В электронной микроскопии тетраоксид осмия используют
преимущественно для вторичной фиксации (или
постфиксации) после первичной фиксации (или префиксации) в
растворах альдегидов. Осмиевая постфиксация уменьшает потери
липидов при последующих обезвоживании и заливке в смолы.
При этом не только липидные структуры, но также клеточный
матрикс, митохондрии и клеточные мембраны лучше контрас-
тируются.
Хорошего контрастирования клеточных структур можно
достичь также путем постфиксации в 1 % растворе тетраоксида
осмия с 1,5 % гексацианоферратом (феррицианидом) калия на
0,1 М фосфатном буфере:
4 % раствор тетраоксида осмия на дистиллированной воде 0,5 мл
6 % раствор гексацианоферрата калия на
дистиллированной воде 0,5 мл
0,2 М фосфатный буфер (рН 7,2) 1 мл
55
Продолжительность постфиксации 2 ч при комнатной
температуре.
Этот вариант постфиксации рекомендуется как для
морфологических, так и особенно для электронно-микроскопических
гистохимических исследований, поскольку достигаемый при
этом «мягкий» контраст не маскирует продукт гистохимической
реакции и позволяет не проводить дополнительное
контрастирование цитратом свинца по Рейнольдсу.
Хромовая кислота и хроматы
Хроматы дают нерастворимые соединения с белками и липида-
ми, образуют комплексы с водой. Такие комплексы, подобно
формальдегиду, могут образовывать связи с реакционноспособ-
ными группами белков, что и оказывает фиксирующий эффект.
Хроматы могут быть также использованы для стабилизации ли-
пидов благодаря их способности окислять ненасыщенные
жирные кислоты. Их можно применять для фиксации гликогена и
нуклеиновых кислот.
Наиболее часто используют фиксатор Элфтмана (бихромат-
сулема), содержащий 2,5 % бихромат калия и 5 % сулему:
сулема 5 г
бихромат калия 2,5 г
дистиллированная вода 100 мл
Продолжительность фиксации 3 дня при комнатной
температуре.
Уранилацетат
Уранилацетат обычно используют в электронной микроскопии
как третий фиксатор после фиксации в альдегиде и тетраоксиде
осмия и одновременно как контрастер. Он особенно хорошо
выявляет мембраны благодаря стабилизации фосфолипидов, хотя
при этом другие компоненты, например гликоген, могут
исчезать или терять способность окрашиваться.
Уранилацетат применяют в концентрации 0,25 — 2 % в воде,
в 50 — 70 % спирте, в веронал-ацетатном или натрий-малеатном
буфере (рН 5,0) в процессе обезвоживания и при
контрастировании срезов. Фосфатный и какодилатный буферы нельзя
использовать из-за образования осадков, а ткани, фиксированные
тетраоксидом осмия на этих буферных смесях, подлежат
длительной промывке (от нескольких часов до 1 сут и более) перед
фиксацией в урани л ацетате. Со временем красящие свойства
уранилацетатных растворов ослабевают и возможно
образование осадков. Эти растворы обычно хранят в темноте при
комнатной температуре. Можно, однако, насыщенный раствор ура-
56
нилацетата в 50 % спирте (продолжительность окрашивания
8 мин) хранить в течение многих лет в холодильнике и
пользоваться им без фильтрования, если образующиеся после
контрастирования игольчатые кристаллы уранилацетата на
ультратонких срезах непродолжительно отмывать в 50 % спирте
подогретом до 31 — 35 °С.
В гистохимических исследованиях имеют значение не только
фиксирующие свойства уранилацетата, но и его красящие
свойства при выявлении нуклеопротеидов методом
дифференциального контрастирования по Бернару. Уранилацетат используют
также для стабилизации ДНК и других компонентов клетки.
Кислоты
Чистые кислоты для фиксации биологических объектов
используются реже. Однако благодаря своему более быстрому
проникновению в ткань по сравнению с другими компонентами
фиксирующей смеси они оказывают смягчающее действие и таким
образом препятствуют сморщиванию ткани, воздействуя в
процессе гидролиза на гетерополярные валентные связи и ослабляя
состояние гидратации.
Кислоты (пикриновая, уксусная, трихлоруксусная, азотная)
входят в различных сочетаниях с формальдегидом и спиртом во
многие известные фиксирующие смеси (по Буэну, Жандру,
Карнуа, Лилли, Ценкеру, Бродскому и др.), используемые для
фиксации нуклеопротеидов, полисахаридов, а также
простейших и сперматозоидов. Кроме того, азотная, муравьиная и
трихлоруксусная кислоты входят в различные сочетания с
формальдегидом и спиртом в состав декальцинирующих смесей.
5. Но и М.^ Кагпоузку (1968) получили более полную
сохранность химических компонентов и антигенных структур,
используя смеси формальдегида и глутарового альдегида с пикриновой
кислотой (тринитрофенол) и другими соединениями с тремя
иитрогруппами.
Спирты и ацетон
Спирты и ацетон наиболее часто используют для осаждения
белков. Они одновременно обезвоживают и уплотняют ткань.
При длительном выдерживании ткани в абсолютных спиртах и
ацетоне ткань становится настолько плотной, что приготовление
срезов практически невозможно. Спирты и ацетон обеспечивают
хорошую морфологическую сохранность бактерий, фибрина,
эластических волокон и мазков клеток.
В гистохимии, как и в гистологии, .спирты и ацетон
используют не только как фиксирующие, но и как обезвоживающие
агенты. В гистохимических исследованиях их применяют в
чистом виде при фиксации многих окислительно-восстановитель-
57
ных ферментов, однако при этом подавляется активность ряда
фосфогидролаз. Спирты и ацетон используют также в
различных сочетаниях с кислотами, солями металлов и альдегидами
для фиксации нуклеопротеидов и полисахаридов. Фиксация
0,65 % раствором хлорида магния в безводном ацетоне
обеспечивает хорошую сохранность фосфолипидов [Бухвалов И.Б.,
1969].
Фиксация и одновременное обезвоживание проводятся при
комнатной температуре в двух сменах фиксатора по 60 мин.
ГИСТОХИМИЯ БЕЛКОВ
Белки принимают участие в построении практически всех
структур клеток и тканей. Для гистохимии представляет
интерес не подтверждение наличия белков в тех или иных
клеточных и тканевых структурах, а оценка его содержания или усуа-
новление класса белка.
Гистохимические методы выявления белка берут начало от
классических реакций аналитической, органической и
биологической химии. К ним относятся: реакция Миллона на тирозин;
диазониевая реакция на тирозин, триптофан и гистидин; ксан-
топротеиновая реакция на фенольные производные; реакция
Сакагуши на аргинин; нитропруссидная реакция на сульфгид-
рильные группы; нингидриновая реакция на свободные МНЬ-
группы; реакция сулема —бромфеноловый синий; реакция ди-
нитрофторбензола с ароматической группой тирозина по Сэнге-
РУ и др.
Строго говоря, эти реакции позволяют в большей или
меньшей мере установить наличие только определенных
аминокислот, однако положительную реакцию можно также считать
доказательством присутствия белка в целом, поскольку в
гистологических и цитологических препаратах свободные
аминокислоты не встречаются.
Для цитоспектрофотометрической оценки содержания белка в
гистологических срезах и цитологических препаратах можно
рекомендовать окраску на гистоны прочным зеленым РСР по Ол-
ферту и Гешвинду и окраску нафтоловым желтым 5 при рН 2,8 на
основные группы лизина, аргинина и гистидина по Дейтчу.
Общие реакции на белок
Окраска суммарного белка бромфеноловым синим
по Бонхегу
1. Материал фиксируют в 1 % формалине, жидкости Карнуа,
заливают в парафин или получают криостатные срезы.
2. Доводят парафиновые срезы до воды.
58
3. Окрашивают в течение 2 ч при комнатной температуре в
2 % водном растворе уксусной кислоты с 1 % раствором сулемы
и 0,05 % раствором бромфенолового синего.
4. Промывают срезы в течение 5 мин в 0,5 % уксусной кислоте.
5. Переносят непосредственно в трет-бутанол.
6. Просветляют в ксилоле и заключают в бальзам или
синтетическую среду.
Результат: белки окрашиваются в темно-синий цвет.
Диазониевая реакция Паули и методы тетразониевого
сочетания по Даниелли
В 1904 г. РаиН предложил использовать в качестве реагента на
тирозин и гистидиндиазобензолсульфокислоту, которая
относится к классу диазосоединений, содержащих диазогруппу.
Изомер диазогруппы, состоящий из трех- и пятивалентного
атомов азота, называемый диазонием, определяет высокую
реактивность диазосоединений.
Диазосоединения вступают в реакцию азосочетания с
ароматическими аминами, фенолами и нафтолами с образованием
азокрасителя, и их широко применяют в промышленном
производстве красителей.
Диазобензосульфокислота в щелочных растворах
взаимодействует с фенольной группой тирозина, индольной группой
триптофана и гетероциклической имидазольной группой гистидина с
образованием окрашенных продуктов реакции. Применив эту
реакцию в гистологических исследованиях, ОашеШ (1947)
нашел ее недостаточно интенсивной, поэтому он в качестве
индикатора вместо диазосоединений использовал тетразосоедине-
ния, т.е. соединения, содержащие две диазогруппы. В качестве
таковых он применил двойные диазониевые соли — тетразоти-
рованный бензидин или его диметоксипроизводное — тетразо-
тированный о-дианизидин (прочный синий В). Этот широко
используемый в гистохимии метод тетразониевого сочетания по
Даниелли основан на взаимодействии аминокислот, в частности
тирозина, триптофана и гистидина, с тетразотированным бензи-
дином и последующем сочетании оставшейся свободной
диазогруппы с (3-нафтолом или Н-кислотой.
Реакция тетразониевого сочетания по Даниелли
в модификации Кисели
Готовят 40 % раствор параформальдегида, растворяя 40 г
порошка формальдегида в 100 мл дважды дистиллированной воды
при нагревании до 65 °С с постоянным помешиванием.
1. Материал фиксируют в 1 % формалине, спирте, с
помощью лиофильной сушки, наиболее пригодна фиксация по Кар-
59
нуа. Заливают в парафин. Полученные срезы толщиной 5 — 7
мкм депарафинируют, промывают в дистиллированной воде и
веронал-ацетатном буфере (рН, 9,2).
2. Обрабатывают свежететразотированным бензидином на
ледяной бане в течение 20 мин. Тетразотированный бензидин
готовят следующим образом: 18 мг бензидина растворяют с
добавлением 0,83 мл концентрированной соляной кислоты в 50 мл
дистиллированной воды. Раствор охлаждают на ледяной бане,
затем добавляют 14 мг нитрита натрия, растворенного в 1 мл
дистиллированной воды, и в течение 10 мин часто помешивают,
затем подщелачивают 10 — 20 % раствором гидроксида натрия
или калия до рН 9,0. В процессе подщелачивания раствор
приобретает коричневый цвет. Срезы помещают в щелочной
раствор тетразотированного бензидина. Этот раствор нестоек, и его
следует использовать сразу после приготовления. Вместо него
можно использовать 0,2 % водный раствор прочного синего В в
трис-НС1-буфере (рН 9,2); инкубировать 5 мин при комнатной
температуре.
3. Промывают дистиллированной водой, затем охлажденной
0,1 н. соляной кислотой и вновь дистиллированной водой.
4. Проводят реакцию азосочетания в веронал-ацетатном
буфере (рН 9,2), насыщенном р-нафтолом или Н-кислотой в
течение 15 мин.
5. Промывают дистиллированной водой, затем 1 % уксусной
кислотой и вновь дистиллированной водой.
6. Обезвоживают в спиртах, просветляют в ксилоле,
заключают в бальзам или дистрен-дибутилфталат ксилол.
Результат: белки тканей окрашиваются в различные оттенки
красновато-коричневого цвета.
При использовании (3-нафтола обезвоживание следует
проводить быстро. После фиксации в формалине интенсивность
реакции немного уменьшается, так как атомы водорода
ароматических колец тирозина, триптофана, гистидина и фенилаланина
необратимо блокируются формальдегидом.
Реакция с динитрофторбензолом для выявления
общего белка по Даниелли
2,4-Динитрофторбензол (ДНФБ) реагирует количественно со
свободными аминогруппами белков, 1-группами лизина, фе-
нольными ОН-группами тирозина, имидазольными группами
гистидина. Соединения с тирозином и гистидином бесцветны, а
соединения со свободными аминогруппами имеют слабо-желтую
окраску. ДНФБ может также реагировать с 5Н-группами, но
эта реакция, по-видимому, не стехиометрична. ДНФБ можно
использовать как блокирующий агент для всех указанных
реактивных групп.
60
Реакция с динитрофторбензолом для выявления
общего белка по Даниелли в модификации Берстона
1. Материал фиксируют в спирте, ацетоне, формальдегиде,
заливают в парафин.
2. Промывают депарафинированные срезы в спирте.
3. Обрабатывают 1 % раствором ДНФБ в 90 % спирте,
содержащем 0,01 н. (0,04 %) гидроксида натрия, при комнатной
температуре 20 — 24 ч.
4. Промывают в четырех сменах 90 % спирта.
5. Промывают в дистиллированной воде.
6. Восстанавливают 5 % дитионитом натрия 40 мин при 45 —
60 °С (при этом желтая окраска обесцвечивается; при
комнатной температуре продолжительность восстановления нитро-
групп больше).
7. Для диазотирования помещают срезы на 5 мин при
температуре от 0 до 4 °С в следующий раствор: 3 мл 10 % серной
кислоты доводят до 50 мл 5 % нитритом натрия (растворы перед
сливанием следует охладить до 4 °С).
8. Промывают в дистиллированной воде.
9. Обрабатывают холодным (4 °С) веронал-ацетатным
буфером (рН 9,2), насыщенным Н-кислотой или р-нафтолом,
15 мин.
10. Промывают в дистиллированной воде и 70 % спирте,
содержащем 1 % соляную кислоту.
11. Обезвоживают, просветляют в ксилоле и заключают в
синтетическую среду.
Результат: положительная реакция выражается в
образовании комплекса азокрасителя красновато-оранжевого цвета.
Поскольку выявляемые группы встречаются повсюду,
окрашивание наблюдается во всем срезе. Интенсивно окрашиваются
эластические, коллагеновые волокна и эритроциты.
Реакции на аминогруппы
Реакция нингидрин-Шифф
Под действием нингидрина происходит окислительное дезами-
нирование аминокислоты белков с образованием углекислоты,
альдегида и красителя. Этот краситель
голубовато-фиолетового цвета легко подвержен диффузии, легко распадается и не
удовлетворяет современным гистохимическим требованиям.
Однако можно использовать окислительные свойства
нингидрина и выявить образующиеся альдегидные группы с помощью
реактива Шиффа. Наряду с нингидрином можно использовать
аллоксан и другие окислители, например гипохлорит натрия и
хлорамин Т.
61
Нингидрин-Шифф(аллоксан-Шифф)-реакция
для выявления МН2-групп по Яшуме и Ичикаве
1. Материал фиксируют в жидкостях Карнуа, Ценкера,
этиловом спирте с 5 % уксусной кислотой, заливают в парафин.
2. Депарафинируют срезы и промывают в 2 сменах 100 %
спирта.
3. Обрабатывают 0,5 % нингидрином или 1 % раствором ал-
локсана в 100 % спирте (16 — 20 ч при 37 °С).
4. Промывают проточной водой 2 — 5 мин.
5. Переносят в реактив Шиффа на 30 мин при комнатной
температуре.
6. Промывают в 3 — 4 сменах смеси, состоящей из 200 мл
дистиллированной воды, 10 мл 10 % гидросульфита натрия и 10 мл
1 н. соляной кислоты 2 мин.
7. Промывают проточной водой 10 мин.
8. Обезвоживают в спиртах, просветляют в ксилоле;
заключают в бальзам.
Результат: ЫЬЬ-группы, связанные с белком, приобретают
окраску от красной до красно-фиолетовой.
Примечание. П. 6 можно опустить. После п. 7 можно
провести докрашивание ядер, например гемалауном. Поскольку
МН2-группы широко представлены в белках, реакции с
нингидрином или аллоксаном можно использовать также для
ориентировочного изучения распределения белков.
Этот методический подход с использованием образующихся
на промежуточном этапе альдегидных групп широко применяют
в гистохимии, например при выявлении ДНК, полисахаридов и
ряда ферментов, катализируюших реакции с образованием
альдегидов.
Гистохимическое выявление тирозина:
реакция Миллона в модификации Бейкера
1. Материал фиксируют в формальдегиде, заливают в
парафин или целлоидин.
2. Депарафинированные срезы проводят через 50 % спирт до
дистиллированной воды. Целлоидиновые срезы толщиной 20 —
30 мкм проводят так же.
3. Помещают в стеклянный сосуд с реактивом Миллона: к
100 мл 10 % раствора серной кислоты добавляют 10 г сульфата
ртути (II), при нагревании растворяют; раствор охлаждают и
доводят дистиллированной водой до 200 мл; к 5 мл этого
раствора перед использованием добавляют 0,5 мл 0,25 % раствора
нитрита натрия и нагревают до кипения.
4. Охлаждают до комнатной температуры в течение
нескольких минут.
5. Промывают в 3 сменах дистиллированной воды по 2 мин.
62
6. Заключают в глицерин-желатин или обезвоживают в
спирте и заключают в бальзам через ксилол.
Результат: положительная реакция проявляется красным или
желтовато-красным окрашиванием, интенсивность которого
зависит от количества тирозина в структурах, содержащих белок.
Гистохимическое выявление триптофана: реакция
с диметил-аминобензальдегид-нитритом по Адамсу
1. Материал фиксируют в 4 — 10 % формалине 4 — 12 ч; в 80 %
спирте с 1 % трихлоруксусной кислотой 24 ч, заливают в
парафин.
2. Депарафинированные в ксилоле срезы проводят через 100 %
спирт, просушивают при температуре 30 — 40 °С.
3. Обрабатывают 50 % п-диметиламинобензальдегидом в
концентрированной соляной кислоте 1 мин.
4. Помещают в 1 % нитрит натрия в концентрированной
соляной кислоте на 1 мин.
5. Промывают срезы в проточной воде 30 с.
6. Быстро промывают в 1 % солянокислом спирте.
7. Обезвоживают в спиртах возрастающей концентрации,
просветляют в ксилоле, заключают в бальзам.
Результат: белки, содержащие триптофан, окрашиваются в
темно-синий цвет различной интенсивности; интенсивно
окрашиваются гранулы клеток Панета, гранулы пепсиногена в
главных клетках желез желудка, зимогенные гранулы экзокринных
клеток поджелудочной железы, мышцы, фибрин, фибриноген,
нейрокератин, чехлы волосяных луковиц.
Примечание. Вп.2 вместо высушивания можно после
удаления спирта покрывать срезы тонкой пленкой целлоидина
(0,25 % раствор целлоидина в смеси спирта с эфиром в
соотношении 1:1). Для приклеивания срезов более пригоден хромат-
желатин, чем белок-глицерин.
Гистохимическое выявление аргинина:
реакция Сакагучи для выявления аргинина
в модификации Бейкера
1. Материал фиксируют в жидкостях Ценкера, Буэна, Кар-
нуа, «Суза» (допустима также фиксация в нейтральном
формалине), заливают в парафин.
2. Депарафинированные в ксилоле или толуоле срезы после
обработки 100 % спиртом покрывают тонкой пленкой
целлоидина (1 % раствор целлоидина в смеси спирта с эфиром 1:1) и
уплотняют в 70 % спирте.
3. Доводят через 50 % спирт до дистиллированной воды и
тщательно промывают.
63
4. Извлеченные из воды срезы высушивают на воздухе.
5. Обрабатывают 15 мин раствором сс-нафтол-гипохлорита
натрия, который готовят непосредственно перед
использованием: к 4 мл 1 % гидрооксида натрия добавляют 4 капли 1 %
а-нафтола на 70% спирте и 8 капель 1 % гипохлорита натрия.
Реакция окрашивания развивается в реакционной смеси
постепенно.
6. Сливают реактив с предметного стекла, препараты
осторожно просушивают фильтровальной бумагой и помещают на
3 мин в смесь высушенного пиридина и безводного
хлороформа.
7. Заключают под покровное стекло в смесь пиридина с
хлороформом или в безводный пиридин. Поскольку сохранность
таких срезов непродолжительна, рекомендуют просматривать и
фотографировать их сразу после приготовления.
Результат: белки, содержащие аргинин, окрашиваются в
оранжевый цвет разных оттенков.
Примечание. При интерпретации результатов реакции
следует учитывать, что: а) стабильность окраски низка; б) для
проявления окрашивания требуется гипохлорит, который,
однако, мешает реакции образования красителя; в) щелочная
реакционная среда оказывает разрушающее действие на ткань; г)
точная локализация реакции затруднена из-за возможной
диффузии продукта.
Реакции на связанные с белками
дисульфидные (цистин) и сульфгидрильные (цистеин)
группы
Значение гистохимического выявления сульфгидрильных
(5Н=) и дисульфидных (-§=3-) групп определяется наличием
в белковых молекулах цистина и цистеина. Свободные
сульфгидрильные группы в тканях легко окисляются, частично под
влиянием гистологической фиксации, поэтому количественно
оценивать их содержание следует с осторожностью.
Гистохимическое выявление серосодержащих аминокислот
возможно только для цистина и цистеина, связанных с
белковыми молекулами и присутствующих в достаточно высокой
концентрации. Свободный цистин и цистеин, а также глутатион
гистохимически не выявляются, так как они присутствуют в
очень низких концентрациях и вымываются из тканей в
процессе их обработки.
Гистохимические реакции, направленные на определение
сульфгидрильных групп, могут быть применены в случае
дисульфидных групп, но при этом последние перед проведением
гистохимической реакции должны быть восстановлены до
сульфгидрильных групп.
64
Совместное и раздельное выявление сульфгидрильных и ди-
сульфидных групп возможно с помощью диоксидинафтилди-
сульфид-реакции (ДДД-реакции) на трех параллельных
препаратах (срезах): на первом выявляются свободные реактивные
сульфгидрильные группы; на втором дисульфидные группы
восстанавливаются до сульфгидрильных (например, тиоглико-
латом натрия, цианидом калия, сульфидом аммония,
аскорбиновой кислотой и др.), и выявляют их вместе; на третьем
свободные сульфгидрильные группы блокируют (например, ацети-
лиодидом или М-этилмалеимидом), а дисульфидные группы
восстанавливают до сульфгидрильных в условиях сохранения
блокирования имеющихся свободных сульфгидрильных групп.
Сопоставление таких препаратов дает представление о
локализации сульфгидрильных и дисульфидных групп.
Метод выявления сульфгидрильных групп Баррнетта—Зе-
лигмана основан на том, что в щелочной среде дисульфиды
избирательно окисляют только тиоловые группы в белках. Ди-
сульфидный реагент — 2,2'-диокси-6,б'-динафтилдисульфид
специфически реагирует с сульфгидрильными группами
фиксированных белков при рН 8,5 с образованием комплекса, не
растворимого в воде и органических растворителях. После
тщательного отмывания непрореагировавшего реагента и побочных
продуктов (6-тио-2-нафтол) образовавшийся комплекс
преобразуют в азокраситель путем сочетания с солью диазония,
например тетразотированным диортоанизидином (прочным синим В).
ДДД-реакция для выявления связанных с белком
сульфгидрильных групп по Баррнетту—Зелигману
1. Материал фиксируют 24 ч в смеси трихлоруксусной
кислоты и спирта (1 % трихлоруксусная кислота в 80 % спирте),
жидкости Карнуа, формалине.
2. Быстро заливают в парафин (лучше в вакуумном
сушильном шкафу); парафиновые срезы прикрепляют небольшим
количеством смеси белка и глицерина на предметное стекло.
3. Срезы депарафинируют и через спирт понижающейся
концентрации доводят до дистиллированной воды.
Варианты: срезы, депарафинированные в ксилоле,
промывают в 100 % спирте и покрывают 0,5 % целлоидином (0,5 г
целлоидина растворяют в 100 мл смеси 100 % спирта с эфиром в
соотношении 1:1). Тонкую пленку целлоидина на срезах
просушивают, уплотняют в 70 % спирте, переносят срезы в
дистиллированную воду.
4. Срезы обрабатывают (в кювете) ДДД-реагентом (50 мг 2,2-
диокси-6,6-динафтилдисульфида + 30 мл 100 % спирта + 70 мл
натрий-веронального буфера, рН 8,5) при 50 °С 1 ч.
5. Кювету со срезами охлаждают при комнатной температуре
+10 мин.
65
6. Быстро промывают срезы в дистиллированной воде, затем
промывают 10 мин в дважды сменяемой дистиллированной
воде, подкисленной до рН 4,0 — 4,5 уксусной кислотой.
7. После проведения через ряд спиртов возрастающей
концентрации промывают срезы в двух сменах 100 % эфира 5 мин.
8. Доводят через спирт до дистиллированной воды и
ополаскивают в ней.
9. Срезы при комнатной температуре помещают на 2 мин в
свежеприготовленный 0,1 % раствор тетразотированного диор-
тоанизидина (соль прочного синего В) на 0,1 М фосфатном
буфере Серенсена (рН 7,4).
10. Промывают в проточной воде, а затем в дистиллированной.
И. Монтируют в глицерин-желатин или проводят через
серию спиртов возрастающей концентрации и ксилол,
заключают в бальзам.
Результат: структуры с большим количеством активных
сульфгидрильных групп окрашиваются в синий цвет, при
меньшем количестве более рассеянных 5Н-групп возникает красное
окрашивание.
Примечание. Для прохождения реакции имеет
значение оптимальная концентрация используемой соли диазония;
более высокие концентрации ведут к получению непостоянных
результатов. Вместо прочного синего В можно использовать
другие соли диазония: прочный красный КС, прочный синий
КК, прочный черный К. ДДД-реакция допускает проведение
микроспектрофотометрической количественной оценки
содержания сульфгидрильных групп в срезах тканей. ДДД реагент
можно также использовать для химического определения
сульфгидрильных групп в белках.
Практически из всех аминокислот, встречающихся в тканях
человека, положительную реакцию Сакагучи дает только
аргинин, гуанидин, креатинин и мочевина дают отрицательную
реакцию. По существу почти все клеточные белки содержат
аргинин, но реакция Сакагучи идет только в тех случаях, когда
аргинин содержится в значительных концентрациях, как,
например, в основных белках, в частности в гистонах, поэтому
реакция Сакагучи имеет важное значение для выявления основных
белков в тканях.
Метод окисления надмуравьиной кислотой
для выявления дисульфидина по Пирсу
1. Материал фиксируют в кальций-формоле, формалине,
заливают в парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. Обрабатывают 10 — 30 мин раствором надмуравьиной
кислоты (к 40 мл 98 % муравьиной кислоты добавляют 4 мл 30 %
66
свежей перекиси водорода и 0,5 мл концентрированной серной
кислоты; смесь готовят за 1 ч до использования и применяют не
более 24 ч).
4. Срезы промывают в дистиллированной воде.
5. Помещают на 30 — 60 мин в реактив Шиффа (особенно
пригодны реактивы Шиффа, приготовленные по Де Томасси
или Итакаве).
6. Промывают в проточной слегка теплой воде 10 мин.
7. Обезвоживают в спиртах возрастающей концентрации,
проводят через ксилол, заключают в бальзам.
Результат: структуры, содержащие цистин, в зависимости от
его количества окрашиваются в цвета от розового до темно-
красного. Особенно интенсивно окрашиваются кератинсодержа-
щие структуры. Четкую реакцию дают нейромедиаторы,
содержащие дисульфидные группы, а также базофильные клетки
передней доли гипофиза.
Вариант. После окисления надмуравьиной кислотой
срезы окрашивают 10—15 мин 0,0005 М метиленовым синим
(молекулярная масса 319,8) в 0,1 М веронал-ацетатном или
глициновом буфере (рН 2,6 — 2,8) вместо реактива Шиффа,
затем промывают дистиллированной водой и накрывают
покровным стеклом для непосредственного микроскопирования
или быстро обезвоживают в спиртах и т.д.
Блокирование и превращение реакционноспособных
групп в белках
Реакции блокирования и превращения реакционноспособных
групп аминокислот могут служить не только контролем на
специфичность гистохимической методики, но и, как это видно при
рассмотрении некоторых реакций гистохимии белков, быть
одновременно решающим этапом при гистохимическом
выявлении реактивных групп (например, окислительное дезаминиро-
вание, реакция с динитрофторбензолом). В табл. 1
представлены наиболее часто используемые реакции подобного рода.
ГИСТОХИМИЯ НУКЛЕОПРОТЕИДОВ
В связи с исключительно важной биологической ролью нуклео-
протеидов в белковом синтезе и генетических механизмах
необходимо их отдельное рассмотрение. Нуклеопротеиды состоят из
белкового компонента, в котором преобладают основные белки
типа гистонов и протаминов, и небелкового компонента, или
простетической группы — нуклеиновой кислоты.
В тканях животных и растений, а также в микроорганизмах
встречаются два типа нуклеиновых кислот — дезоксирибонук-
леиновая кислота (ДНК) и рибонуклеиновая кислота (РНК),
67
Таблица 1. Блокирование и превращение реакционноспособных групп в
белках [1_ирре, 1980]
Метод
Дезаминирование
Динитрофенилирование
Анилирование
Нитробензоплирование
Метилирование
в «мягких» условиях
в «жестких» условиях
Деметилирование
Окисление надмуравьиной кислотой
Окисление надуксусной кислотой
Окисление персульфатом
Йодирование
Окисление йодом
Карбоксиалкилирование
Блокирование малеинимидом
Блокирование меркаптидом*
а) хлоридом ртути
б) хлоридом фенилртути
Восстановление тиогликолатом
Блокирование группы
или аминокислоты
-ын2
N1^2-, фенольные, имидазольные,
5Н-группы
КН2-, окси-, фенольные и 5Н-группы
ЫН2-, тирозил-ОН
соон-
СООН-, КГН2-
Этерифицированные кислые группы
вновь высвобождаются
Триптофан, цистин
То же
Триптофан
Тирозин (триптофан)
-5Н
-5Н
-5Н
-5Н
-5Н
-5-5- |
представляющие собой высокополимерные молекулы полинук-
леидов, образованные из мононуклеотидов. Каждый мононук-
леотид состоит из пентозы (дезоксирибозы или рибозы), орто-
фосфорной кислоты и пуринового или пиримидинового
основания. Пентоза связана диэфирной связью с фосфорной кислотой
и гликозидной — с основанием. Мононуклеотиды объединены в
полинуклеотидную цепочку через фосфатную группу.
В ДНК пентоза представлена дезоксирибозой, пуриновые
основания — аденином и гуанидином, а пиримидиновые
основания — тимином и цитозином. В РНК пентоза находится в виде
рибозы, а тимин замещен урацилом. Различия по тимину и ура-
цилу позволяют проводить дифференцированное
радиоавтографическое изучение ДНК и РНК с соответствующим
радиоактивным предшественником тимидином для ДНК и уридином для
РНК. Другое важное различие — спиральная двухцепочечная
структура и значительно большая молекулярная масса (1 —
8 млн) у ДНК по сравнению с РНК, имеющей, как правило,
одиночную цепь и существенно меньшую степень
полимеризации,— обусловливает их различное окрашивание основными
красителями — метиловым зеленым и пиронином.
68
Гистохимическое выявление нуклеиновой кислоты можег быть
направлено на любой из трех ее компонентов: 1) пуриновые и пи-
римидиновые основания выявляют по поглощению ультраоиоле-
тового излучения; 2) углеводный компонент определяют пс
образующимся в результате кислотного гидролиза альдегидным
группам с помощью реактива Шиффа или его аналогов; 3)
фосфорную кислоту выявляют по сродству к основным красителям.
Кроме того, разработаны и обоснованы методы ферментатизной и
химической экстракции нуклеиновых кислот, повышающие
надежность и специфичность гистохимических методов.
Выявление пуриновых и пиримидиновых оснований
Гетероциклические кольца пуриновых и пиримидиновых
оснований ДНК и РНК специфически поглощают ультрафиолетовое
излучение при длине волны 260 нм. Количественную оценку
содержания нуклеиновых кислот проводят по оптической
плотности при указанной длине волны. Дифференцированное
выявление ДНК и РНК на основании различий в поглощении
ультрафиолетового излучения осуществляют с помощью
специфического экстрагирования ДНК- и РНК-азой.
Выявление углеводного компонента ДНК по Фельгену
Принцип этого метода выявления ДНК заключается в том, что в
результате мягкого гидролиза под влиянием 1 н. соляной
кислоты в фиксированных препаратах происходит специфическое
отщепление от ДНК пуриновых оснований (аденина и гуаниди-
на), связанных с С-атомом дезоксирибозы. Удаление
пуриновых оснований раскрывает потенциальные альдегидные
группы, которые после этого способны реагировать с реактивом
Шиффа и образовывать кислотостойкий краситель
красно-фиолетового цвета. Образовавшийся окрашенный комплекс очень
стабилен. Фуксин может быть экстрагирован из соединения
только после обработки горячими кислотами или щелочами.
Метод Фельгена прост и надежен, но условия кислотного
гидролиза играют в нем решающую роль. Продолжительный
гидролиз приводит к ослаблению окрашивания, причиной
которого может быть деполимеризация и экстрагирование ДНК, а
также химические изменения. Оптимальная продолжительность
кислотного гидролиза 1 н. соляной кислотой при 60 °С
определяется выбором фиксатора.
Нейтральный 10 % формалин 8 мин
Жидкость Карнуа 8 мин
Спирт 80 % 5 мин
Формалин-спирт-уксусная кислота 7 мин
Жидкость Буэна 22 мин
Жидкость Ценкера 5 мин
69
При обследовании указанных условий гидролиза РНК
практически полностью вымывается из срезов, поэтому не
происходит образования альдегидов из рибозы и при правильном
проведении реакции Фельгена РНК всегда остается неокрашенной.
Стандартная реакция Фельгена
1. Материал фиксируют одним из перечисленных
фиксаторов, заливают в парафин или готовят мазки суспензированных
клеток.
2. Срезы депарафинируют и через ряд спиртов убывающей
концентрации доводят до воды.
3. Быстро промывают в холодной 1 н. соляной кислоте.
4. Помещают при 60 °С в 1 н. соляную кислоту на
оптимальное время гидролиза (от 8 до 22 мин). Хорошие результаты
дает также гидролиз в 5 н. соляной кислоте при 37 °С.
5. Быстро промывают в 1 н. соляной кислоте, затем в
дистиллированной воде.
6. Переносят в реактив Шиффа на 45 мин.
7. Промывают в 3 сменах свежей смеси, состоящей из 5 мл
10 % пиросульфита калия, 5 мл 1 н. соляной кислоты,
дистиллированной воды до 100 мл) по 2 мин в каждой.
8. Промывают в дистиллированной воде 2 мин.
9. Возможна докраска 1 % водным раствором
светло-зеленого (1 мин) или 0,5 % спиртовым раствором прочного зеленого
1 мин.
10. Обезвоживают в спиртах возрастающей концентрации,
проводят через ксилол, заключают в бальзам.
Результат: структуры, содержащие ДНК, окрашиваются в
красно-лиловый цвет. После обработки дезоксирибонуклеазой
реакция отрицательна.
Приготовление реактива Шиффа. Существуют различные
способы приготовления реактива Шиффа. Состав реактива
(содержание фуксина, кислотность, насыщение сернистым газом)
оказывает выраженное влияние на реакцию с альдегидами,
причем не все партии фуксина удовлетворительного качества.
Готовый реактив следует хранить в холодильнике в полностью
заполненном сосуде с хорошо притертой пробкой. Реактив может
сохраняться в течение нескольких месяцев и внезапно терять
красящие свойства. Слабая розовая окраска реактива не влияет
на его специфичность и может быть устранена с помощью
активированного угля.
1. Метод ди Томаси. Растворяют 1 г основного
фуксина в 200 мл кипящей дистиллированной воды. Охлаждают до
52 °С. Фильтруют и добавляют 1 г пиросульфита натрия или
калия. После выдерживания раствора в темноте 16 — 24 ч,
добавляют 2 г активированного угля, встряхивают и фильтруют в
сосуд для хранения.
70
2. Метод Итакавы и О г у р ы. Растворяют 1 г
основного фуксина в 200 мл кипящей воды. Охлаждают и
фильтруют через пористый стеклянный фильтр, в раствор
пропускают сернистый ангидрид (свежегенерированный или из газового
баллона). После того как красный раствор станет прозрачным,
сосуд закрывают пробкой и оставляют на ночь при комнатной
температуре. Добавляют 500 мг активированного угля, хорошо
встряхивают и фильтруют.
3. Метод Элфтмана (модификация «холодного»
метода Лилли). Добавляют 1 г основного фуксина и 2 г
гидросульфита натрия к 100 мл 0,2 н. соляной кислоты в колбу на
150 мл. Встряхивают 2 ч, добавляют 500 мг активированного
угля, хорошо встряхивают и фильтруют.
Окрашенные по методу Фельгена препараты можно хранить
бесконечно долго, выцветание их незначительное: согласно
результатам цитоспектрофотометрии, 3 — 4 % за 1-й год хранения.
Продукт реакции Фельгена удовлетворяет требованиям закона
Ламберта—Бера, что позволяет проводить цитоспектрофотомет-
рический анализ препаратов. Абсорбционный максимум
красителя составляет 585 нм.
Несмотря на сравнительную простоту метода Фельгена и
надежность современной техники для цитоспектрофотометрии,
могут быть получены ошибочные данные об уменьшении
содержания ДНК в ядрах клеток опухолей вплоть до появления
гаплоидного класса клеток. Такие ошибки исключаются при цито-
фотометрировании не гистологического препарата, а мазков из
суспензированной ткани.
Реакция выявления фосфорной кислоты
основными красителями
Основные, или катионные, красители обладают свойством более
или менее избирательно связываться с отрицательно
заряженными кислотными группами. Эти реакции не строгоспецифичны
к фосфатным группам нуклеиновых кислот, поэтому необходим
контроль (блокирование, а также химическая или
ферментативная экстракция).
В гистохимии нуклеиновых кислот используют красители ти-
азинового или оксазинового ряда, например тионин. Для тиози-
новых красителей характерно наличие тиазониевого катиона с
выровненными связями (заряд равномерно распределен между
атомами серы и азота), поэтому цвет катиона тиозиновых
красителей от голубого до синего. Широко известный метиленовый
синий является тетраметильным производным тионина. При рН
от 3,0 до 5,0 он окрашивает не только нуклеиновые кислоты, но
и кислые гликозаминогликаны. Их можно дифференцировать в
контрольных опытах с нуклеазами. К тиазиновым красителям
71
относятся толуидиновыи синий, который связывается с ДНК
при рН 4,0 — 6,0 в стехиометрических соотношениях, и крезило-
вый фиолетовый, связывающийся с РНК при рН 4,2 стехиомет-
рически, поэтому может быть использован для цитофотометри-
ческого определения содержания РНК.
Окраска комплексом галлоцианин-хромовые квасцы
Принадлежащий к оксазиновым красителям галлоцианин в
водных растворах существует в виде катиона и может образовывать
комплексы с металлами (в частности, с хромом), специфически
связывающиеся с нуклеиновыми кислотами.
С помощью цитофотометрических исследований
установлено, что при выявлении РНК и ДНК каждый их мононуклеотид
через фосфатную группу связывается с одним катионом
красителя. В результате этой реакции РНК и ДНК окрашиваются в
серо-голубой цвет. При рН от 1,5 до 1,7 специфичность
связывания красителя с нуклеиновыми кислотами довольно высока.
Поскольку краситель связывается с субстратом в
стехиометрических соотношениях, этот метод может быть использован в
количественных цитофотометрических исследованиях.
Выявление ДНК и РНК смесью галлоцианина
и хромовых квасцов
1. Маленькие кусочки ткани фиксируют в жидкости Карнуа
или спирте в течение 2 —4 ч при температуре 2 —4 °С и
заливают в парафин.
2. Депарафинированные срезы проводят через спирты
убывающей концентрации до воды.
3. Помещают на 24 — 48 ч при комнатной температуре в
раствор смеси галлоцианина и хромовых квасцов.
0,15 г галлоцианина кипятят в 10 мл 5 % раствора хромовых
квасцов; после охлаждения фильтруют и доводят
дистиллированной водой до 100 мл; рН красящего раствора доводят до 1,64
(можно 1 н. соляной кислотой).
4. Дифференцируют в дистиллированной воде, спиртах
возрастающей концентрации, заключают в бальзам.
Результат: ядра и цитоплазматические структуры,
содержащие РНК (например, тельца Ниссля в нервных клетках),
окрашиваются в темно-синий или черный цвет.
Примечание. Продолжительность окрашивания можно
уменьшить (правда, при одновременном усилении
неспецифического окрашивания) путем повышения температуры (44 —
56 °С) до 4 ч. Смесь галлоцианина с хромовыми квасцами
можно также использовать для докрашивания ядер при
радиоавтографии.
72
Окраска ДНК и РНК метиловым зеленым-пиронином
по Браше в модификации Курника
1. Материал фиксируют в 10 % нейтральном формальдегиде
4—12 ч или жидкости Карнуа 4 —24 ч при 4 °С; заливают в
парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. Окрашивают срезы в смеси метилового зеленого-пирони-
на (12,5 мл 2 % пиронина С5 + 7,5 мл 2 % метилового
зеленого + 30 мл дистиллированной воды) б мин при температуре
18-24 °С.
4. Просушивают фильтровальной бумагой.
5. Дифференцируют в 2 сменах н-бутанола по 5 мин.
6. Просветляют в 3 сменах ксилола по 5 мин.
7. Заключают в бальзам.
Результат: структуры, содержащие ДНК, окрашиваются в
голубовато-зеленый цвет, а содержащие РНК — в красный.
Контроль. Предварительная обработка срезов рибонук-
леазой или деоксирибонуклеазой; в зависимости от фермента
остаются неокрашенными участки, в которых локализуются
РНК или ДНК.
Примечание. Метиловый зеленый обычно содержит
примесь метилового фиолетового, который перед
использованием рекомендуется удалять с помощью экстракции в
хлороформе, лучше всего путем встряхивания в делительной воронке.
При оценке содержания РНК в клетке следует учитывать, что
пиронин частично экстрагируется из срезов при промывании и
обезвоживании.
Метод регрессивного контрастирования
рибонуклеопротеидов по Бернару
В основе этого метода лежит дифференцирование с помощью
комплексообразователей — ЭДТА или цитрата. Согласно
К. Вегпаг, ультратонкие срезы для электронной микроскопии
контрастируют водным раствором уранилацетата, а затем
обрабатывают в ЭДТА или цитратном буфере, в результате чего
ионы уранила вымываются из хроматина гораздо быстрее, чем
из рибонуклеопротеинов (РНП). В предварительных опытах
отрабатывают такую продолжительность дифференцирования в
ЭДТА, чтобы РНП в отличие от хроматина еще сохранили бы
связанные ионы уранила и могли бы быть контрастированы
цитратом свинца. Материал, фиксированный тетраоксидом
осмия, для этой цели непригоден.
73
Регрессивное контрастирование рибонуклепротеидов
по Бернару в модификации Бурглена
Для приготовления раствора ЭДТА 7,44 г динатриевой соли
ЭДТА помещают в 50 мл дистиллированной воды и ставят на
магнитную мешалку. Медленно, по каплям, добавляют
свежеприготовленный 1 н. гидроксид натрия до полного
просветления раствора и доводят рН до 7,0. Добавляют
дистиллированной воды до 100 мл. Раствор оставляют в течение 4 дней при
4 °С. Его можно использовать в течение нескольких месяцев.
1. Ультратонкие срезы материала, фиксированного в
альдегидных растворах и залитого в гликольметакрилат или эпон, на
медных сеточках контрастируют 30 мин 5 % водным раствором
уранилацетата при 37 °С.
2. Осторожно промывают дистиллированной водой.
3. Переносят в раствор ЭДТА на 5—15 мин.
4. Осторожно промывают дистиллированной водой.
5. Контрастируют цитратом свинца 5—10 мин.
6. Промывают дистиллированной водой.
Специфичность метода Бернара по отношению к РНП может
быть повышена при использовании его в сочетании с
экстракцией нуклеазами. Однако в большинстве случаев в этом нет
необходимости, так как метод применяют главным образом для
изучения РНП в ядре, где другие структуры, выявляемые этим
способом, отсутствуют.
Ферментативный и химический гидролиз нуклеопротеидов
Дальнейший анализ нуклеиновых кислот осуществляют
посредством ферментативной или химической экстракции.
Преимуществом нуклеаз по сравнению с другими агентами является
высокая специфичность, однако эффективность их использования
зависит от способа фиксации, заливочной среды и других
факторов. Наиболее эффективно действие ДНК- и РНКазы на
ткани, фиксированные в формальдегиде. После фиксации тет-
раоксидом осмия возможно переваривание РНКазой, но не
ДНКазой. Ферментативное расщепление лучше проводить на
замороженных срезах, но можно и в кусочках ткани, и на депа-
рафинированных срезах. Для электронно-микроскопической
гистохимии лучше использовать заливку в гликольметакрилат
после фиксации в формальдегиде: при этом сохраняется как
структура, так и чувствительность к действию РНК- и ДНКазы.
Для химического гидролиза ДНК и РНК используют
хлорную, трихлоруксусную и соляную кислоты. Все нуклеиновые
кислоты удаляют из срезов ткани путем обработки 5—10 %
трихлоруксусной кислотой при 90 °С в течение 10 мин или 10 %
перхлоруксусной кислотой при 70 °С в течение 20 — 30 мин. Для
экстракции РНК рекомендуется использовать холодную 10 %
74
хлорную кислоту (18 ч при 4 °С). Успех химической
экстракции, особенно на ультратонких срезах, также зависит от
способа фиксации, заливочной среды, толщины среза и т.д., поэтому
в каждом случае следует находить оптимальные условия в
предварительных опытах.
ГИСТОХИМИЯ УГЛЕВОДОВ
Биологическая роль углеводов многообразна. В организме они
выполняют опорные и энергетические функции, некоторые
углеводы являются составными частями биологически важных
соединений (АТФ, циклической АМФ, нуклеиновых кислот,
гепарина, витамина С и др.). Гликопротеиды как специфический
компонент иммуноглобулинов играют важную роль в иммунных
механизмах, определяя антигенную активность сывороточных и
клеточных факторов. Кроме того, продукты расщепления
углеводов используются для синтеза практически всех классов
соединений в живой клетке.
Классификация углеводов
В живой клетке углеводы существуют в форме моно-, олиго- и
полисахаридов. В гистологических препаратах они сохраняются
практически только в виде полисахаридов: во всяком случае
только полисахариды могут быть с достоверностью выявлены
гистохимически. Правда, возможно также гистохимическое
выявление глюкозы и витамина С.
Общепринятой классификации полисахаридов не
существует. Для практических гистохимических целей достаточно
разделить полисахариды на гомо- и гетерополисахариды.
Гомополисахариды построены из остатков молекул
моносахаридов, главным образом пентозы и гексозы, соединенных
между собой кислотными мостиками. Гомополисахаридами
являются крахмал, инулин, клетчатка, гликоген. К ним с
определенными оговорками можно также отнести хитин и полигалак-
туроновую кислоту.
Гетерополисахариды разделяют на гликозаминогликаны
(ГАГ) и гликопротеины. К кислым гликозаминогликанам ГАГ
относят гиалуроновую кислоту, молекула которой построена из
остатков глюкуроновой и уксусной кислот и гексозамина; хонд-
роинин-4-сульфат, хондроитин-6-сульфат, дерматан-сульфат,
кератан-сульфат, гепаритин-сульфат, гепарин, молекулы
которых содержат остатки гексозамина, глюкуроновой или уроно-
вой кислот, серной и уксусной кислот в различных сочетаниях.
В тканях кислые ГАГ, кроме гепарина, находятся в соединении
с белками. Такие комплексы, в которых к белковому стержню
присоединены полисахаридные цепи, носят название «протео-
75
гликаны». Все эти соединения входят в состав матрикса
соединительной ткани, крови, синовиальной жидкости, слизи.
Гликопротеины являются белками, к молекуле которых ко-
валентно присоединены олигосахариды: гексозы, гексозамины,
сиаловые кислоты, фу козы и др. Такие соединения являются
составной частью клеточных мембран, слизистых секретов
желез, сывороточных белков, ферментов, гормонов, «неколла-
геновых белков» соединительной ткани и т.д.
Гистохимическая идентификация углеводов
Выявление углеводов основано, как правило, на методах
общего анализа химических групп. Используются методы
окисления, метахроматическое окрашивание основными красителями,
реакции связывания коллоидных металлов, выявление базофи-
лии, окрашивание кармином, реакции блокирования и
превращения реакционноспособных групп, методы ферментативного
гидролиза, радиоавтографию, иммуногистохимию.
Методы окисления 1,2-гликолей до альдегидов
Реакция Шифф-йодной кислотой (ШИК-реакция)
Метайодная кислота селективно окисляет и расщепляет -С=С-
связи не только в 1,2-окси-, но также в 1-окси-2-амино-1-окси-2-
алкиламино- и 1-окси-2-кетогруппах. В результате этого
образуется одна кетогруппа или две альдегидные группы, как,
например, в глюкозе. Альдегидные группы реагируют с реактивом
Шиффа (фуксин-сернистой кислотой) точно так же, как и в
реакции Фельгена. С помощью этого метода выявляют все
соединения, содержащие оксигруппы, которые в результате
окисления метайодной кислоты могут превращаться в альдегидные
группы. Однако в гистологических срезах практически лишь
гликоген и гликопротеины, сохраняющиеся в достаточных
количествах, могут быть выявлены с помощью ШИК-реакции.
Гликоген можно дифференцировать от гликопротеинов путем
переваривания в амилазе или диастазе.
Для окисления -С-С-связей в полисахаридах
предпринимались попытки использовать, помимо одной кислоты, другие
окислители — хромовую кислоту, перманганат калия, тетрааце-
тат натрия и т.д. Наиболее удачной является модификация
ШИК-реакции, предложенная А.Л. Шабадашем (1949).
1. Материал фиксируют в 10 % формалине, жидкостях Кар-
нуа, Ценкера, заливают в парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. При комнатной температуре срезы окисляют 0,5—1 %
водным раствором орто- или метайодной кислоты в течение 2 —
76
10 мин. Окисление можно также проводить по Шабадашу в
0,001—0,01 М метаперйодате калия или натрия в течение 7 — 25
мин. Раствор хранят в темноте. Рабочую концентрацию этого
раствора и продолжительность инкубации в ней подбирают в
зависимости от объекта. ,
4. Промывают в дистиллированной воде 1<Ншн.
5. Помещают срезы в реактив Шиффа на 10 — 30 мин при
комнатной температуре в темноте. Реактив Шиффа по Грауман-
ну: 0,5 г парарозанилина (парафуксин, свободный от акридина,
стандартный) полностью растворяют в 15 мл 1 н. соляной
кислоты без нагревания при помешивании и доводят до 85 мл
дистиллированной водой с растворенными в ней 0,5 г пиросульфи-
та калия; прозрачный интенсивно-красный раствор,
помещенный в темноту в сосуде с плотно прилегающей пробкой, в
течение 24 ч приобретает желтоватый оттенок, его встряхивают
2 мин с013 г активированного угля (порошок) и затем дважды
фильтруют. Такой раствор готов к использованию и его можно
хранить в сосудах коричневого цвета с пришлифованной
пробкой по крайней мере в течение 2 мес.
6. Срезы промывают сернистой водой (600 мл
дистиллированной воды + 30 мл 10 % пиросульфита калия + 30 мл 1 н.
соляной кислоты) три раза по 2 мин. Сернистую воду можно
также готовить (непосредственно до проведения реакции) по
рекомендации А.Л. Шабадаша следующим образом: к 200 мл
дистиллированной воды добавить 10 мл 10 % раствора натрия
гидросульфита и 10 мл 1 н. соляной кислоты.
7. Тщательно промывают в проточной и дистиллированной
воде, ядра можно докрасить 0,5 % светлым зеленым или
кислым гемалауном.
8. Обезвоживают в спиртах возрастающей концентрации,
заключают в бальзам.
Результат: углеводы, содержащие гексозу, окрашиваются в
красно-лиловый цвет, гликоген — в более интенсивный темно-
красный.
Контроль: расщепление гликогена амилазой или диастазой,
реакция ацетилирования для блокирования гидроксильных
групп.
Примечание: необходимо пользоваться химически чистой
посудой, стеклянными палочками; нельзя работать с
металлическими крючками или иголками; окрашивание срезов в реактиве
Шиффа следует проводить в темноте.
Метахроматическое окрашивание кислых
гликозаминогликанов
Метахромазия — это изменение спектров поглощения
используемых красителей. Метахромазию можно получить при
использовании очень широкого набора красителей (табл. 2).
77
Таблица 2. Спектры поглощения красителей, дающих метахромазию [Ке1-
1у, 1956]
Краситель
Толуидиновый синий
Азур А
Метиленовый синий
Крезиловый синий
Кристаллический фиолетовый
Основной фуксин
Тионин
Максимум поглощения, им
ортохроматический
630
620
665
625
590
543
597
мсгахроматический
480-540
480-530
570
530
510
510
557
Пригодность красителя для выявления метахромазии
определяется тем, насколько ортохроматический и метахроматичес-
кий максимумы поглощения отдалены друг от друга.
В гистохимии под метахромазией подразумевают
практически только явления, наблюдающиеся при использовании
красителей тиазиновой группы, а именно те изменения окраски от
синего через фиолетовый до красного, которые происходят при
окрашивании тканей разбавленными водными растворами
красителей названной группы.
Типичным примером метахромазии служит окрашивание ти-
азиновыми красителями (тионин, толуидиновый синий и т.п.)
лаброцитов (тучных клеток), при котором гранулы этих клеток
окрашиваются в фиолетово-красный цвет, тогда как другие
структуры воспринимают оригинальный синий цвет красителя.
Метахроматическое окрашивание не связано ни с
определенной химической структурой, ни с определенным химическим
соединением, а обусловлено плотностью анионов на поверхности
молекулы субстрата, а также степенью ионизации. Наличие
метахромазии свидетельствует только о наличии некоторой
минимальной плотности свободных отрицательных поверхностных
зарядов на молекулах субстрата. В животной ткани метахрома-
тически окрашиваются главным образом кислые ГАГ,
характеризующиеся высокой молекулярной массой и большим
количеством свободных анионных групп (К=0=50"з, К~0=НРО-з,
К=СОО).
Все приемы подготовки срезов и следующей за
окрашиванием обработки влияют на метахромазию, поэтому
предпочтительнее использовать криостатные срезы с непродолжительной
последующей фиксацией. Окрашенные срезы перед
обезвоживанием и заключением в бальзам рекомендуется предварительно
просматривать в дистиллированной воде под покровным
стеклом. Существуют также методы сохранения метахромазии в
постоянных препаратах [Кутах Г.Н., Шубич М.Г., 1965].
78
Реакции связывания коллоидных металлов
Подобно основным (катионным) красителям, катионы
некоторых металлов также образуют соединения с анионами кислых
ГАГ. С этой целью используют коллоидные растворы золота,
тория, платины, железа, а также ионы бария и висмута. Торий,
платину, барий и висмут применяют главным образом для
контрастирования кислых ГАГ в электронно-микроскопической
гистохимии.
В светооптической гистохимии применяется в первую
очередь метод Хэйла, основанный на связывании в кислой среде
(рН < 2) коллоидных мицелл гидроксида железа (III) с
карбоксильными и сульфоновыми группами кислых ГАГ и
последующем выявлении связанного железа с помощью гексацианофер-
рата (ферроцианида) калия в реакции берлинской лазури.
Нуклеиновые кислоты и белки также могут связывать коллоидный
гидроксид железа, но при более высоких значениях рН.
Выявление кислых гликозаминогликанов с помощью
коллоидного железа (модификация реакции Хэйла
по Грауманну—Клаусу)
1. Материал фиксируют в забуференном 10 % формалине,
жидкостях Карнуа, Жандра, спирт-формоле (лучше
пользоваться безводными фиксаторами) и заливают в парафин;
возможна обработка срезов без фиксации или криостатных срезов.
2. Срезы депарафинируют и через ряд спиртов убывающей
концентрации доводят до дистиллированной воды. Обработку
свежих криостатных срезов начинают с п. 3. Фиксированные
срезы хорошо промывают в дистиллированной воде.
3. Помещают срезы на 10 мин в раствор коллоидного железа,
подкисленного уксусной кислотой (маточного раствора 10
частей, 96 — 99 % уксусной кислоты 4 части). Маточный раствор:
750 мл дистиллированной воды доводят до кипения и
добавляют 12 мл 32 % раствора трихлорида железа. Образовавшийся
гидроксид железа можно хранить в течение 1 мес.
4. Промывают в 2 сменах 5 % уксусной кислоты по 5 мин в
каждой.
5. Срезы помещают в свежеприготовленный раствор,
включающий 30 мл 2 % гексацианоферрата калия + 60 мл 1 %
соляной кислоты на 10 мин.
6. Срезы проводят через 2 смены дистиллированной воды по
2 мин.
7. Обезвоживают в ряду спиртов возрастающей
концентрации, проводят через ксилол, заключают в бальзам.
Результат: структуры, в которых содержатся кислые ГАГ,
окрашиваются в синий цвет.
79
Реакция Хэйла специфична для выявления свободных
кислотных групп, например эфиров серной и фосфорной кислот,
свободных гидроксильных групп уроновой и моноаминодикарбоновой
кислот белков. Специфичность метода Хэйла для выявления
кислых мукоидных веществ следует контролировать с помощью
вспомогательных реакций. Ложную положительную реакцию,
обусловленную присутствием железа в тканях, можно исключить
путем обработки контрольных срезов в растворе гексацианофер-
рата калия и соляной кислоты (5-й этап данного метода).
Реакцию связывания железа можно комбинировать с ШИК-
реакцией. В этом случае после п. 6 следует окисление метайод-
ной кислотой. В результате этого кислые ГАГ окрашиваются в
темно-синий цвет, белковые структуры — в светло-синий, а
нейтральные гликопротеины — в красный цвет различных
оттенков. Эта комбинация двух методов позволяет получить
контрастную гистологическую картину при исследовании ткани
почек и кожи.
Окраска альциановым синим
В гистохимической практике используют несколько фталоциа-
ниновых красителей: альциановые синие — 8 СХ, 8 ЗХ, 8 С8,
8 СИ, 5 СХ, 150,альциановые зеленые — 2 СХ, 3 ВХ, люксоло-
вый прочный синий, астрасиний и др. Альциановый синий
обладает большими преимуществами по сравнению с другими
красителями кислых мукоидных веществ, прежде всего быстротой
окрашивания и простотой применения. Прослеживается
параллель между окрашиванием альциановым синим и метахрома-
зией при изменении рН и концентрации красителя. На
соответствующих объектах могут быть получены хорошие результаты в
случае прижизненного окрашивания альциановым синим.
Окраска альциановым синим при рН 2,5
1. Материал фиксируют в формалине, формалин-этаноле,
смесях Ценкера, Буэна, Карнуа и заливают в парафин (можно
использовать криостатные срезы).
2. Депарафинированные срезы окрашивают в свежеотфильт-
рованном 1 % растворе альцианового синего 8 СХ в 3 %
уксусной кислоте (рН 2,5) в течение 30 мин.
3. Промывают в проточной воде в течение 5 мин.
4. Обезвоживают в ряду спиртов возрастающей
концентрации, проводят через ксилол, заключают в бальзам.
Результат: слабокислые сульфатированные ГАГ (гиалуроно-
вая кислота) и сиалогликопротеины приобретают темно-синюю
окраску. Сильнокислые сульфатированные ГАГ окрашиваются
слабо или совсем не окрашиваются.
80
Окраска альциановым синим при рН 1,0
1. Срезы помещают в дистиллированную воду.
2. Окрашивают в 1 % растворе альцианового синего 8 ОХ в
0,1 н. соляной кислоте (рН 1,0) в течение 30 мин.
3. Просушивают фильтровальной бумагой.
4. Обезвоживают в этаноле, проводят через ксилол,
заключают в бальзам.
Результат: окрашиваются только сульфатированные ГАГ.
Примечание. Вместо альцианового синего 8 ОХ можно
использовать альциановый синий 8 ОМ, альциановый зеленый
3 ВХ или альциановый зеленый 2 ОХ. Для окрашивания очень
кислых мукоидных веществ рекомендуется модификация
окраски альциановым синим по Гомори.
Окраска метиленовым синим
Тиазиновый краситель метиленовый синий позволяет отделить
кислые ГАГ от нейтральных гликопротеинов и
дифференцировать сульфатные, фосфатные и карбоксильные группы путем
выявления их базофилии при различных рН. Степень базофи-
лии определяется наличием свободных анионов полисахаридов.
По мере снижения рН интенсивность окрашивания отдельных
структур снижается. Это явление носит название «экстинкция»
(от лат. ехИпсио — гашение).
Окрашивание анионных групп метиленовым синим
при различных значениях рН (экстинкция метиленового синего)
рН Окрашиваемые группы или вещества
1,5 504
2,8 Р04(504)* кислые ГАГ
4,0 СООН(Р04, 504)*
5,0 Все кислые группы
> 5,0 Нейтральные гликопротеины
В присутствии электролитов, таких как соляная кислота,
хлорид натрия и калия, окрашивание альциановым синим
усиливается. При концентрациях хлорида магния ниже 0,3 М
альциановый синий связывается кислыми ГАГ, содержащими
сульфатированные и карбоксильные группы, а при концентрациях
хлорида магния 0,8 М и выше окрашиваются исключительно
вещества, содержащие 504-группы. Эти факты свидетельствуют о
Труппы, указанные в скобках, ионизированы, поэтому также дают
окрашивание.
81
ведущей роли электростатических сил при связывании альциа-
нового синего с субстратом.
Для определения экстинкции метиленового синего можно
использовать растворы 0,0005 — 0,005 М (приблизительно 0,1 —
0,01 %) метиленового синего в веронал ацетатном буфере или
ацетатном буфере Михаэлиса при различных рН (от 2,6 до
8,0 с интервалами 0,5).
Наибольший интерес представляют значения рН ниже 4,0,
так как анионные группы белков, прежде всего карбоксильные
группы, значительно осложняющие интерпретацию
результатов, теряют свой заряд. При рН 3,0 метиленовый синий
связывается также нуклеиновыми кислотами, но для них характерна
другая локализация, и их можно дифференцировать с помощью
специфических реакций. Кроме того, их окрашивание можно
ослабить путем добавления хлорида магния к раствору
красителя. Вместо метиленового синего можно использовать растворы
(0,02 %) азура А в НСЬфосфатном или фосфат-цитратном
буфере.
К.С. Митин (1966) показал, что коллагеновые волокна не
окрашиваются мети леновым синим при рН 5,0 —6,0,а основное
вещество средней оболочки аорты, построенное из хондроитин-
сульфатов, обладает метахромазией при рН 2,5 — 3,0, интима
обесцвечивается при рН 4,0, а лаброциты (тучные клетки) и
нейроны окрашиваются в фиолетовый цвет при рН 1,5 — 2,0.
Окраска рутениевым красным
Рутениевый красный давно используют в световой микроскопии
для окрашивания пектина, растительных муцинов, целлюлозы,
крахмала, инулина и лигнина, гранул лаброцитов, основного
вещества хряща и т.д. Специфичность этого окрашивания
невысока, однако благодаря методу контрастирования рутениевым
красным по Лафту значительно дополнены сведения о гликокалик-
се — слое мукоидов, окружающих плазмалемму. При
использовании этого метода на первом этапе образуется связь между
катионом рутениевого красного и анионными группами кислых ГАГ,
при этом субстрат окрашивается в красный цвет. Электронно-
микроскопическое контрастирование происходит при
последующей обработке тетраоксидом осмия в
окислительно-восстановительной реакции, катализируемой рутениевым красным, при
которой низшие окислы осмия осаждаются на окисленном
субстрате. Поскольку рутениевый красный плохо проникает в ткани, его
рекомендуется добавлять прямо в фиксирующую смесь.
Контрастирование рутениевым красным по Лафту
1. Кусочки ткани фиксируют в растворе глутарового
альдегида и рутениевого красного (0,5 мл 3,6 % глутарового альдеги-
82
да + 0,5 мл 0,5 М какодилатного буфера рН 7,3 + 0,5 мл 0,15 —
0,3 % водного раствора рутениевого красного) в течение 1 ч при
4°С.
2. Промывают в 0,15 М какодилатном буфере 3 раза по
3 мин.
3. Дополнительно фиксируют в течение 3 ч при 20 °С в
следу ющем растворе: 0,5 мл 5 % тетраоксида осмия + 0,5 мл 0,2 М
какодилатного буфера рН 7,3 + 0,5 мл 0,15 — 0,3 % раствора
рутениевого красного.
4. Быстро промывают в буферном растворе, обезвоживают в
спиртах, заливают в эпоксидную смолу.
Результат: контрастируются полианионы с умеренной и
высокой плотностью заряда, представленные в тканях главным
образом внеклеточными кислыми ГАГ.
Для очистки рутениевого красного рекристаллизацией 1 г
рутениевого красного помещают в 10 мл 0,5 н. раствора
аммиака при 60 °С. Нерастворимый остаток отделяют от горячего
раствора центрифугированием. Надосад очную жидкость остужают
до 0 °С. Образующийся при этом осадок промывают водой,
охлажденной до 0 °С, спиртом и диэтиловым эфиром, а затем
высушивают на воздухе при комнатной температуре.
Окраска кармином по Бесту
Классическая ШИК-реакция и различные ее модификации,
направленные на выявление гликогена, не могут быть
рекомендованы для всех случаев, особенно если ткань содержит вещества,
имеющие ту же локализацию, что и гликоген, дающие
положительную ШИК-реакцию: мукопротеиды, гликопротеиды и
ненасыщенные липиды. В таких случаях лучшие результаты может
дать карминовый метод Беста, хотя применение этого чисто
эмпирического метода трудно «примирить» со строгими
гистохимическими требованиями.
Действующим началом природного кармина является
карминовая кислота. Ее способность окрашивать гликоген зависит от
ряда не до конца понятых физических и стереохимических
факторов. Для лучшей сохранности гликогена в первоначальных
прописях рекомендовалась заливка в целлоидин, однако можно
использовать и парафиновые срезы, если перед перенесением в
раствор Беста покрыть их тонким слоем целлоидина. Целлоиди-
рования срезов можно избежать, фиксируя ткань в жидкости
Марчи в течение 12 — 20 ч при 4 °С, промывая затем при 4 °С в
течение 10—12 мин в 30 % спирте, инкубируя также при 4 °С в
красящем растворе кармина и после дифференцирования
быстро обезвоживая в двух сменах абсолютного ацетона.
При использовании этого метода необходимо проводить
контрольные реакции с перевариванием гликогена амилазой, диа-
стазой или слюной.
83
1. Материал фиксируют по Лилли, Жандру, Россману, Кар-
нуа, Шабадашу, Буэну или в 100 % спирте; заливают в
парафин; можно также использовать целлоидиновые или
замороженные срезы.
2. Депарафинированные срезы доводят до абсолютного
спирта.
3. Целлоидируют срезы в 1 % растворе целлоидина (в смеси
равных частей спирта и эфира) в течение 2 мин.
4. Просушивают срезы на воздухе, уплотняют в 70 % спирте
и помещают в дистиллированную воду.
5. Проводят интенсивное окрашивание ядер в гемалауне по
Майеру или в гематоксилине по Эрлиху.
6. Промывают в дистиллированной воде, в случае
необходимости дифференцируют в солянокислом спирте и снова
промывают в воде.
7. Окрашивают в растворе кармина в течение 10 — 30 мин.
Маточный раствор кармина: 2 г кармина, 1 г карбоната калия и
5 г хлорида калия растворяют в 60 мл дистиллированной воды
и кипятят несколько минут на слабом огне. Раствор после
охлаждения фильтруют и добавляют в него 20 мл раствора
аммиака (плотность 0,880). Раствор готов к непосредственному
применению, его можно хранить в темной колбе в течение
нескольких недель, в холодильнике — до 3 мес. Красящий раствор
кармина: 20 мл профильтрованного маточного раствора кармина +
30 мл раствора аммиака + 30 мл метанола (сохранность
несколько дней).
8. Переносят срезы непосредственно в смесь для
дифференцирования (40 мл метанола + 50 мл абсолютного этанола + 100 мл
дистиллированной воды). Дифференцируют в двух порциях до
тех пор, пока видимые глазом следы красителя перестанут
выходить из среза в раствор — от нескольких секунд до нескольких
минут.
9. Промывают в 80 % спирте, обезвоживают в абсолютном
спирте, проводят через ксилол, заключают в бальзам.
Результат: гликоген окрашивается в интенсивный красный
цвет, ядра — в темно-синий.
Контрольные реакции в гистохимии углеводов
Описанные методы выявления углеводов являются в основном
лишь реакциями на химические группы. Для установления
специфичности проведенной реакции и для дифференциальной
локализации полисахаридов используют методы блокирования ре-
акционноспособных групп и ферментативного гидролиза.
Кислые группы (карбоксильные, фосфатные и сульфатные)
можно блокировать метилированием в растворах метанол-НС1,
метанол-тионилхлорида и метанол-метилиодида. В результате
этого ослабляются базофилия и метахромазия элементов ткани.
84
Метилирование по Белло—Гайеру
1. Депарафинированные срезы промывают в двух сменах
абсолютного спирта, а затем в двух сменах абсолютного метанола.
2. Помещают срезы при 24 °С на 4 —б ч в следующий
раствор: 1 мл тионилхлорида медленно добавляют в 50 мл
абсолютного метанола (перед использованием раствор можно
хранить в течение ночи). Контрольные срезы — без обработки тио-
нилхлоридом.
3. Промывают в 70 % спирте и дистиллированной воде.
4. Проводят соответствующее окрашивание.
Результат: 6-часовая обработка полностью устраняет базофи-
лию ткани. Базофилия цитоплазмы, обусловленная СООН-
группами и РНК, снимается через 30 мин, а базофилия,
обусловленная присутствием сульфатированных ГАГ,— через 4 ч.
Для дифференциации кислых ГАГ и нейтральных гликопро-
теинов обычно используют переваривание гиалуронидазой и
нейраминидазой.
Гиалуронидаза В, выделенная из культур пневмококков,
стрептококков, стафилококков и СЛозЫсНит \уе1сЬи,
расщепляет гиалуроновую кислоту, а гиалуронидаза А, полученная из
семенников быка, гидролизует, помимо гиалуроновои кислоты,
еще и хондроитинсульфаты А и С.
Удаление кислых гликозаминогликанов путем
ферментативного гидролиза с гиалуронидазой
1. Материал фиксируют в одной из смесей,
рекомендованных для фиксации полисахаридов, заливают в парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды через ряд спиртов убывающей концентрации.
3. Обрабатывают срезы в течение 4 —6 ч при 37 °С
следующим раствором: 0,3 — 0,6 мг/мл гиалуронидазы из семенников
в 0,1 н. фосфатном или ацетатном буфере (рН 6,0).
Контрольные срезы инкубируют в буфере в таких же условиях.
4. Окрашивают контрольные срезы и срезы, обработанные в
растворе гиалуронидазы, 0,1 % раствором толуидинового синего
в течение 1 — 2 ч.
5. Тщательно промывают в дистиллированной воде.
6. Заключают в глицерин-желатин или после обезвоживания
и просветления в ксилоле в бальзам.
Результат: метахроматическое окрашивание в контрольных
срезах и отсутствие его в срезах, обработанных
гиалуронидазой, свидетельствуют о наличии гиалуроновои кислоты или
хондроитинсульфатов А и С.
Нейраминидаза (сиалидаза, выделенная из культуральных
сред С1оз<:пс1шт рег{гт§епз и У1Ъпо сЬо1егае, а также из
противогриппозной вакцины) селективно удаляет из гистологических
85
срезов сиаловую кислоту, уменьшая окраску ШИК-позитивных
гликопротеинов, а также ослабляя метахромазию.
Следует учитывать, что буферный раствор, не содержащий
нейраминидазы, может переводить в раствор значительную часть
связанной нейраминовой кислоты в составе сиаломукоидов.
Ферментативное переваривание гликогена на
гистологических срезах проводят с помощью диастазы, амилазы или слюны.
Обычно используют диастазу солода по Лилли, которая
катализирует гидролиз гликогена, главным образом до дисахарида
мальтозы.
Ферментативный гидролиз диастазой для удаления
гликогена по Лилли
1. Деиарафинированные срезы доводят до
дистиллированной воды.
2. Обрабатывают в 0,1 — 1 % растворе диастазы солода на
изотоническом растворе хлорида натрия при комнатной
температуре в течение 2 ч или при 37 °С 30 — 40 мин.
3. Промывают в дистиллированной воде и проводят
окрашивание на гликоген (ШИК-реакция или окрашивание кармином
по Бесту).
Результат: вещества, которые в прямом опыте окрашиваются
при ШИК-реакции или кармином по Бесту, но исчезают из
среза после обработки диастазой, следует считать гликогеном.
Примечание. Различия между молекулами гликогена с
разветвленными и неразветвленными цепями могут быть
выявлены в срезах путем их обработки 0,5 % р-амилазой в 0,004 М
ацетатном буфере (рН 5,0) вместо ос-амилазы. р-Амилаза
расщепляет только молекулы с разветвленными цепями.
ГИСТОХИМИЯ ЛИПИДОВ
Собирательный термин «липиды» охватывает жиры (т.е. три-
глицериды) и жироподобные вещества растительного и
животного происхождения. Это преимущественно неполярные
соединения, основным компонентом которых являются жирные
кислоты. Липиды нерастворимы или плохо растворимы в воде, но
хорошо растворяются в типичных жирорастворителях: бензине,
хлороформе, четыреххлористом углероде, ацетоне, эфире, пет-
ролейном эфире, горячем спирте и т.п. Не все липиды
растворимы в указанных растворителях одинаково, на этом основаны
дифференциальная экстракция липидов и выявление их с
помощью жирорастворимых красителей.
С учетом гистохимических свойств и химической структуры
липиды делят на простые (нейтральные жиры, воски, стериды)
и сложные (фосфолипиды, цереброзиды, ганглиозиды, сульфо-
липиды).
86
Гистохимическая идентификация липидов
Гистохимическое выявление липидов возможно с помощью
физических и химических методов. К физическим относятся
методы экстракции, поляризационная микроскопия и окрашивание
жирорастворимыми красителями, к химическим —
подавляющее большинство гистохимических методов выявления липидов,
направленных главным образом на определение активных
функциональных групп.
Экстракция липидов
В основе методов экстракции липидов лежат законы
растворимости, известные из аналитической органической химии. Их
необходимо также учитывать при подготовке тканей для
проведения гистохимического анализа липидов. Первые потери
водорастворимых липидов происходят уже при фиксации в
альдегидах или тетраоксиде осмия и продолжаются в процессе
обезвоживания и заливки. После первичной фиксации в тетраоксиде
осмия вымываются главным образом насыщенные липиды.
Особенно велики суммарные потери липидов в тканях,
фиксированных в альдегидах. После двойной фиксации в альдегидах и
тетраоксиде осмия достигается хорошая стабилизация структур,
содержащих ненасыщенные липиды. Наибольшие потери
липидов наблюдаются во время пропитки ткани парафином и
эпоксидными смолами, но их можно уменьшить путем более
быстрого обезвоживания и замены этанола на ацетон. Стабилизация
липидов может быть значительно усилена путем добавления к
альдегидной фиксирующей смеси хлорида кальция, как,
например, в кальций-формоле по Бейкеру или при использовании
хроматов, способных окислять ненасыщенные липиды, как в
фиксаторе Элфтмана, содержащем бихромат калия и сулему.
Хорошо сохраняются фосфолипиды при фиксации с
одновременным обезвоживанием в ацетоне с 0,65 % хлоридом магния.
Управляя процессом экстрагирования липидов и применяя
его в сочетании с методами окрашивания, гистохимия
обеспечивает контроль специфичности окрашивания и
дифференцированно выявляет различные липидные фракции.
Экстракция липидов по Кейлигу позволяет провести
разделение четырех фракций липидов, при этом тонкие,
нефиксированные кусочки ткани обрабатывают четырьмя растворителями:
а) холодным ацетоном (удаляет глицериды, холестерин, холес-
териды и кетостероиды); б) горячим ацетоном (удаляет цереб-
розиды); в) горячим эфиром (удаляет лецитины и кефалины) ;
г) горячим метанол-хлороформом (удаляет все липиды).
Применяют по три порции каждого растворителя, сменяя их
соответственно через 3, 3 и 12 ч. Для горячих растворителей
можно использовать аппарат Сокслета или более простой при-
87
бор. После экстракции кусочки ткани промывают водой, и кри-
остатные срезы окрашивают раствором Судана черного В в 70 %
спирте. Следует помнить, что при использовании этого метода
не удается полностью исключить диффузию, что затрудняет
точную локализацию липидов, однако все же они остаются в
срезе и окрашиваются Суданом.
Экстракция пиридином по Бейкеру обеспечивает удаление
всех липидов. Ее проводят на тонких кусочках ткани,
фиксированных слабым раствором фиксатора Буэна в течение 20 ч.
После фиксации их следует промыть в спирте для удаления
пикриновой кислоты, обработать пиридином сначала при
комнатной температуре 30 мин, затем при 60 °С 20 ч, промыть в
проточной воде в течение 2 ч, перенести в бихромат-кальциевый
раствор (5 % бихромат калия и 1 % хлорид кальция на
дистиллированной воде) и окрасить материал Суданом и черным В или
любым другим жировым красителем.
Разработаны приемы липидной экстракции, обеспечивающие
хорошую ультраструктурную сохранность ткани для целей
электронно-микроскопической гистохимии.
Поляризационная микроскопия липидов
В нативном состоянии большинство нейтральных липидов
находится в жидком состоянии и не дает двойного лучепреломления
в поляризованном свете; это свидетельствует об их аморфном
(изотропном) состоянии. Однако при охлаждении нейтральные
липиды переходят в анизотропное состояние и могут
образовывать двоякопреломляющие кристаллы. При поворачивании
предметного столика поляризационного микроскопа с
исследуемым препаратом на 360° можно отметить четыре положения,
при которых интенсивность пришедшего света минимальна.
Подобным образом ведут себя все липиды. Если же в препарате
выявляется анизотропный эффект мальтийского креста, то
можно сделать вывод о присутствии фосфатидов, цереброзидов
или эфиров холестерина. В целом же возможности этого метода
ограничены.
Флюоресцентная микроскопия липидов
Небольшая часть липидов обладает собственной, или
первичной, флюоресценцией в ультрафиолетовом свете. Липопигмен-
ты светятся желтым или желто-зеленым светом, липиды с
растворенным каротином дают зеленую флюоресценцию, так же
как и стероидные гормоны, но зеленая флюоресценция
последних меняется во времени. Практическое значение имеет
выявление витамина А.
Методы вторичной флюоресценции, в основе которых лежит
растворение флюоресцирующих веществ (флюорохромов) в ли-
88
пидах тканей, позволяют устанавливать присутствие липидов в
клетках и тканях точнее, чем многие другие методы. С этой
целью использовали ряд флюоресцирующих красителей, в том
числе метиленовый синий, тиоф лавин, родамин В, бенгальский
розовый, фосфин ЗК, бензпирен и др. Возможность применения
водных растворов таких красителей обеспечивает сохранность
самых мелких капелек жира. С помощью этого метода
выявляют липиды и липопротеиды в очень низких концентрациях.
Особенно это относится к флюорохромированию бензпиреном.
Этот высокочувствительный метод позволяет выявлять липиды
в тонких структурах, входящих в состав липопротеидных
комплексов или тонкодисперсных образований.
Выявление бензпиреном по Бергу
1. Материал фиксируют в формалине или кальций-формоле.
Срезы толщиной 10 мкм получают на замораживающем
микротоме.
2. Обрабатывают срезы в течение 20 мин раствором бензпи-
рен-кофеина (к 100 мл насыщенного отфильтрованного 1,5 %
раствора кофеина в воде добавляют 0,002 г 3,4 бензпирена;
раствор выдерживают 2 дня при 37 °С, отфильтровывают и
разводят равным объемом дистиллированной воды. Оставляют на 2 ч
и вновь фильтруют. Колбу с раствором плотно закрывают и
помещают в темное место; в таком виде его можно хранить
несколько месяцев).
3. Срезы быстро промывают в дистиллированной воде.
4. Заключают под покровное стекло с водой и сразу же
исследуют под флюоресцентным микроскопом.
Результат: липиды выделяются своей синей или бело-синей
флюоресценцией.
Примечание. Этот метод не позволяет
дифференцировать липиды разных классов; цвет флюоресценции — от сине-
зеленой до бело-синей и бело-желтой, по-видимому, зависит от
концентрации липидов.
Флюорохромирование Липидов фосфином ЗП
по Фольку—Попперу
Флюорохром — фосфин ЗК — обусловливает яркую серебристо-
белую флюоресценцию, которую легко отличить от
естественной флюоресценции тканей, даже не пользуясь контрольными
препаратами сравнения.
1. Материал фиксируют в кальций-формоле. Срезы
толщиной 10 мкм готовят на замораживающем микротоме.
2. Срезы помещают в дистиллированную воду, затем
обрабатывают 0,1 % водным раствором фосфина ЗК.
3. Быстро промывают в дистиллированной воде.
89
4. Заключают в 90 % глицерин или дистиллированную воду,
исследуют под флюоресцентным микроскопом.
Результат: липиды, включая эфиры холестерина, дают
серебристо-белую флюоресценцию. Исключение составляют
жирные мыла и холестерин.
Окраска жирорастворимыми красителями
Для всех жировых красителей единственным общим признаком
является отсутствие солюбилизирующих сульфогрупп (-ЗОзН)
или карбоксильных (-СООН)-групп. Это диазокрасители, в
основном красного цвета.
Судан черный В обладает более выраженными, чем суданы
III и IV, красящими свойствами, хотя он может давать и
гораздо более слабое окрашивание белков и кислых ГАГ.
Окраска Суданом черным по Лизону
1. Материал фиксируют в кальций-формоле, готовят срезы
на замораживающем микротоме или заливают в поливакс.
2. Промывают срезы в 70 % спирте.
3. Окрашивают Суданом черным (насыщенный раствор
Судана В в 70 % спирте, профильтрованный перед использованием)
20 — 30 мин.
4. Промывают в 70 % спирте 30 с.
5. Быстро промывают в дистиллированной воде.
6. Окрашивают 1 % ядерным прочным красным 1 мин.
7. Быстро промывают в дистиллированной воде и заключают
в глицерин-желатин или глицерин.
Результат: липиды окрашиваются в цвета от черного до
темно-синего, ядра — в красный цвет; окраску воспринимают
также фосфолипиды.
Для контроля неспецифического окрашивания за счет
адсорбции используют экстракцию ацетоном или этанолом.
Окраска масляным красным О в изопропаноле
по Лилли
1. Материал фиксируют в кальций-формоле, срезы
получают на замораживающем микротоме.
2. Срезы переносят в дистиллированную воду и быстро
промывают в 60 % изопропаноле.
3. Срезы окрашивают 10 — 20 мин в растворе масляного
красного О (0,05 г масляного красного О растворяют в 100 мл 98 %
изопропанола, перед использованием разводят дистиллированной
водой в пропорции 6:4, выдерживают 24 ч и затем фильтруют).
4. Быстро дифференцируют в 60 % изопропаноле или сразу
же промывают в дистиллированной воде.
90
5. Промывают в проточной воде 10 мин.
6. Срезы заключают в глицерин-желатин.
Результат: нейтральные жиры окрашиваются в красный
цвет, ядра — в синий.
Примечание. Масляный красный О можно также
использовать в виде насыщенного отфильтрованного раствора в
70 % спирте. Вместо масляного красного О можно применять
масляный красный 7В, который окрашивает липиды в ярко-
красный цвет. В качестве растворителей для жировых
красителей используют 55 — 70 % спирт, 65 — 98 % изопропанол, пропи-
ленгликоль, а также смесь Герксхаймера, состоящую из равных
частей 70 % спирта и ацетона.
Гистохимическое выявление фосфолипидов
Для гистохимического выявления фосфолипидов наиболее
пригодны методы с использованием кислого гематеина. По
методу Бейкера ткани после фиксации в кальций-формоле
подвергают длительному хромированию в бихромат-кальциевой смеси,
в результате чего фосфолипиды образуют нерастворимые
комплексы с хромом. Эти комплексы реагируют с кислым гематеи-
ном, который получают при окислении гематоксилина метайо-
датом натрия. Связанный с фосфолипидами хром,
взаимодействуя с кислым гематеином, образует соединение хром-гематеин
темно-синего цвета.
Окраска фосфолипидов кислым гематеином Бейкера
в модификации Бухвалова
1. Кусочки размером 2 — 4 мм фиксируют в 2 сменах ацетона
с 0,65 % раствором хлорида магния по 60 мин.
2. Помещают в ксилол — 2 смены по 5—10 мин.
3. Переносят в горячий парафин — 2 смены по 30 мин.
4. Заливают в парафин и получают срезы.
5. Срезы проводят через ксилол — 2 смены по 5 мин.
6. Помещают в ацетон с 0,65 % раствором хлорида магния —
2 смены по 5 мин.
7. Переносят в дистиллированную воду — 2 смены по 1 мин.
8. Помещают срезы в 5 % раствор бихромата калия при 60 °С
на 4 ч.
9. Промывают в нескольких сменах дистиллированной
воды.
10. Помещают срезы при температуре 37 °С на 0,5-5 ч в
раствор кислого гематеина (50 мг кристаллического
гематоксилина растворяют в 50 мл 0,1 % раствора метайодата натрия при
нагревании до кипения, охлаждают и добавляют 1 мл ледяной
уксусной кислоты).
11. Промывают в дистиллированной воде.
91
12. Дифференцируют при комнатной температуре в 0,25 %
водных растворах дибората натрия, декагидрата и гексациано-
феррата калия 18 ч.
13. Промывают в дистиллированной воде.
14. Обезвоживают в 2 сменах ацетона с 0,65 % хлоридом
магния по 5 мин.
15. Проводят через 2 смены ксилола по 5 мин и заключают в
бальзам.
Результат: фосфолипиды окрашиваются в черно-синие тона.
Окраска железным гематоксилином по Элледеру и Лойде
для выявления фосфолипидов
1. Срезы получают на замораживающем микротоме.
2. Срез А в сухом состоянии обрабатывают 10 мин при
температуре от 0 до 4 °С абсолютным ацетоном и высушивают на
воздухе.
Срез Б при комнатной температуре обрабатывают 10 мин
смесью хлороформа с метанолом, а затем быстро промывают в
ацетоне и дистиллированной воде.
3. Срезы А и Б фиксируют в кальций-формоле (5—10 мин),
а затем промывают в дистиллированной воде.
4. Оба среза окрашивают смесью растворов I (3 части) и II
(1 часть) 6 — 8 мин.
Раствор I: 298 мл дистиллированной воды + 2мл
концентрированной соляной кислоты + 2,5 г дихлорида железа гексагид-
рата + 4,5 г сульфата железа гептагидрата.
Раствор II: 1 г гематоксилина растворяют при слабом
нагревании в 100 мл дистиллированной воды.
5. Промывают в дистиллированной воде, затем несколько
раз в 0,2 % растворе соляной кислоты.
6. Хорошо промывают в проточной воде.
7. Заключают под покровное стекло в глицерин-желатин или
после обезвоживания в ацетоне и просветления в ксилоле — в
бальзам.
Результат: фосфолипиды окрашиваются в темно-синий цвет.
Их можно идентифицировать, лишь сравнив с окрашиванием
срезов, обработанных ацетоном и смесью хлороформа с
метанолом; последние не должны давать окрашивания,
обусловленного присутствием липидов.
Можно использовать также замороженные срезы тканей,
фиксированных в формалине. Перед экстракцией ацетоном
такие срезы следует подсушить. Продолжительность
экстракции в смеси хлороформа с метанолом после фиксации в
формалине должна составлять 1 — 2 ч. С помощью обработки срезов
гидроксидом натрия после экстракции ацетоном удается
выявить сфингомиелин. Плазмалогены можно удалять с помощью
гидролиза в 1 % водном или солянокислом (1 н.) растворе суле-
92
мы в течение 10 мин. Преимуществом этого метода являются
быстрота и надежность.
Выявление ненасыщенных липидов
Для гистохимического выявления важна легкая окисляемость
ненасыщенных липидов. Продуктом окисления непредельных
связей липидов, проводимого с помощью надмуравьиной или
надуксусной кислоты, в большинстве случаев являются
альдегидные группы, которые могут быть выявлены с помощью
реактива Шиффа.
Непредельные связи в липидах ответственны также за
восстановление тетраоксида осмия и за превращение его в диоксид
осмия (осмиевую чернь).
На связывание тетраоксида осмия, по-видимому, влияет
также ориентация липидных молекул в тканях. На этом
принципе основан тест Марчи с тетраоксидом осмия на дегенериро-
ванный миелин. Механизм реакции Марчи был детально изучен
АсЗашз (1959), который разработал метод одновременного
выявления нормального и дегенерированного миелина с помощью
тетраоксида осмия и а-нафтиламина. По АсЬтз, гидрофобные
липиды дегенерированного миелина окрашиваются в черный
цвет в результате восстановления оксида осмия до его
тетраоксида. Гидрофильные липиды нормального миелина
окрашиваются в красный цвет в связи с образованием хелата осмий-а-на-
фтиламина. Таким образом, этот метод позволяет различать три
типа липидов: ненасыщенные гидрофобные (черный цвет),
ненасыщенные гидрофильные (красный цвет) и насыщенные
(бесцветные). К первому типу относятся олеиновая кислота, трио-
леин и олеат холестерина, ко второму — лецитин, кефалин,
сфингомиелин и цереброзид, к третьему — стеариновая
кислота, тристеарин, стеарат холестерина и холестерин.
Если перед реакцией по Адамсу провести гидролиз в 2 н.
гидроксида натрия при 37 °С в течение 1 ч, то окрашиваются
только устойчивые к щелочному гидролизу липиды, из которых
наиболее важным в биологическом отношении является
сфингомиелин; также, по-видимому, окрашивается кефалин В.
Окраска с применением тетраоксида осмия
и а-нафтиламина по Адамсу
1. Материал фиксируют в кальций-формоле, срезы
толщиной 10—15 мкм получают на замораживающем микротоме.
2. Обрабатывают свободноплавающие срезы 18 мин в смеси,
в состав которой входят 1 часть 1 % тетраоксида осмия и 3 части
1 % перхлората калия.
3. Промывают в дистиллированной воде 10 мин.
4. Срезы монтируют на покровные стекла.
93
5. Обрабатывают 10 — 20 мин при 37 °С насыщенным водным
раствором а-нафтиламина (готовят путем добавления а-нафтил-
амина к дистиллированной воде и последующего фильтрования
после нагревания до 40 °С).
6. Промывают в дистиллированной воде 5 мин.
7. Окрашивают 2 % альциановым синим в 5 % уксусной
кислоте от 15 до 60 с (под контролем микроскопии).
8. Заключают в глицерин-желатин.
Результат: фосфолипиды окрашиваются в
оранжево-красный цвет, эфиры холестерина и триглицериды — в черный.
Примечание. Гидрофобные липиды, окрашенные в
черный цвет, во многих случаях могут маскировать имеющиеся
в тканях фосфолипиды. В результате гидролиза
свободноплавающих срезов в 2 н. растворе гидроксида натрия в течение 1 ч
при 37 °С глицерофосфолипиды вымываются, а устойчивые к
действию щелочи сфингомиелины сохраняются и окрашиваются
в оранжевый цвет. Этот метод выявления надежен лишь при
условии предварительной фиксации срезов в абсолютном ацетоне.
Выявление холестерина
Для гистохимического выявления холестерина применяют
метод Адамса с хлорной кислотой и нафтохиноном, а также
метод Шультца. В основе последнего лежит окисление
холестерина до оксихолестерина под действием ультрафиолетового
излучения (в первоначальном варианте) или аммонийных
квасцов. Хотя с помощью реакции Шультца выявляют не только
холестерин и его эфиры, метод можно считать достаточно
специфичным .
Модифицированная реакция Шультца для выявления
холестерина и его эфиров
1. Материал фиксируют в кальций-формоле 2 — 3 дня в
холодильнике. Срезы толщиной 20 — 30 мкм получают на
замораживающем микротоме.
2. Свободноплавающие срезы промывают в нескольких
сменах дистиллированной воды 24 ч.
3. Срезы помещают на 7 дней при 37 °С в забуференный
раствор железоаммонийных квасцов [2,5 % раствор железоаммо-
нийных квасцов (фиолетовые кристаллы) в 0,2 М ацетатном
буфере, рН 3,0; окончательная величина рН раствора около 2,0].
4. Срезы промывают в 0,2 М ацетатном буфере — 3 смены
по 1 ч.
5. Промывают в дистиллированной воде.
6. Переносят в 5 % раствор формалина на 10 мин, а затем
монтируют на предметные стекла, осторожно давая жидкости
стечь, просушивают фильтровальной бумагой.
94
7. На покровное стекло наносят одну каплю смеси равных
частей химически чистых уксусной и серной кислот (серную
кислоту осторожно, по каплям, добавляют к уксусной кислоте,
при этом колбу лучше охлаждать на ледяной бане).
Перевернутое предметное стекло со срезом осторожно кладут на
покровное и слегка прижимают так, чтобы жидкость равномерно
распределилась по срезу.
8. Препарат сразу же исследуют под микроскопом.
Результат: холестерин и его эфиры через несколько секунд
приобретают сине-зеленое окрашивание, через 30 — 60 мин цвет
меняется на синий.
Свободный холестерин и другие Зр-оксистерины могут быть
выявлены также на ультраструктурном уровне благодаря их
способности образовывать нерастворимые в воде соединения с
дигитоксином. Эту реакцию проводят одновременно с
альдегидной фиксацией или после нее.
Выявление плазмалогенов
Плазмалогены, или ацетальфосфатиды, — это
модифицированные глицерофосфатиды, содержащие ненасыщенный ацеталь с
альдегидом. Природа этих альдегидных групп, которые
высвобождаются из плазмалогенов под действием сулемы или
мягкого кислотного гидролиза, точно неизвестна. В основе метода
Фельгена и Фойта лежит выявление реактивом Шиффа высших
альдегидов, высвобождаемых из плазмалогенов после
непродолжительного воздействия сулемы. Этот же принцип реакции
использован в реакции Хайеса.
Плазмалевая реакция по Хайесу
. 1. Материал фиксируют в кальций-формоле 3 —6 ч. Срезы
получают на замораживающем микротоме.
2. Срезы прикрепляют к предметному стеклу.
3. Обрабатывают в 1 — 5 % растворе сулемы 10 мин.
4. Промывают в 3 сменах дистиллированной воды.
5. Помещают срезы в реактив Шиффа на 20 мин.
6. Промывают срезы в 3 сменах сернистой воды по 1 мин.
7. Промывают в проточной воде 20 мин.
8. Заключают под покровное стекло в глицерин-желатин.
Результат: в срезах, обработанных сулемой, плазмалогены
окрашиваются в красно-фиолетовый цвет. Контрольные срезы
после п. 2 переносят непосредственно в реактив Шиффа; эти
срезы, не обработанные раствором сулемы, должны оставаться
неокрашенными.
Примечание. Появление красноватого окрашивания —
признак псевдоплазмалевой реакции, обусловленной окислением
ненасыщенных липидов. Высвобождаемые в результате гидроли-
95
за липиды блокируются с помощью соответствующих реакций
сочетания. Реактив Шиффа можно заменить фенилгидразином.
От плазмалевой реакции следует отличать псевдоплазмале-
вую реакцию тканевых и клеточных компонентов,
окрашиваемых реактивом Шиффа при различных условиях. Химическая
природа соединений, дающих псевдоплазмалевую реакцию,
неизвестна. Ызоп (1953) выделяет две группы таких соединений.
К первой относятся соединения, окрашиваемые реактивом
Шиффа без предварительной обработки, содержащиеся в элас-
тиновых волокнах, миелине, некоторых клетках гипофиза,
цитоплазме яйцеклеток и нервных волокнах. Во вторую группу
входят соединения, реагирующие с реактивом Шиффа после
предварительной обработки. В первую очередь это липиды,
легко окисляемые йодной кислотой и некоторыми другими
слабыми окислителями.
Обычная формалиновая фиксация подавляет плазмалевую
реакцию. Интенсивность последней, наоборот, увеличивается
при продолжительной фиксации формалином.
Выявление жирных кислот и триглицеридов
Для гистохимического выявления жирных кислот существуют
два подхода: образование солей красителя в реакциях жирных
кислот с некоторыми основными красителями и омыление
жирных кислот солями металлов. Более интенсивно
разрабатывается второй подход.
В методе Хольцингера ионы меди, связываемые жирными
кислотами, выявляются рубеановодородной кислотой, которая
образует с ними окрашенное комплексное соединение.
Выявление жирных кислот по Хольцингеру
1. Срезы нефиксированного материала получают на
замораживающем микротоме.
2. Обрабатывают 0,05 % водным раствором ацетата меди 3 —
5 ч.
3. Промывают в 2 сменах 0,1 % раствора динатриевой соли
ЭДТАпри рН 7,1 по 10 с.
4. Промывают в дистиллированной воде.
5. Обрабатывают в течение 10 мин в 0,1 % растворе
рубеановодородной кислоты в 70 % спирте (100 мл рубеановодородной
кислоты растворяют в 70 мл абсолютного спирта при легком
нагревании, после охлаждения раствор доводят до 100 мл
дистиллированной водой).
6. Промывают несколько минут в 70 % спирте, а затем в
дистиллированной воде.
7. Окрашивают (в случае необходимости) ядерным прочным
красным.
96
8. Заключают в глицерин-желатин. Можно обезводить в
спиртах возрастающей концентрации, провести через ксилол и
заключить в бальзам.
Результат: жирные кислоты окрашиваются в
зеленовато-черный цвет.
Реакция омыления лежит также в основе метода Адамса для
выявления жирных кислот триглицеридов. При этом эфирные
связи триглицеридов сначала расщепляются липазой, а затем
высвободившиеся жирные кислоты переводятся в осадок в виде
нерастворимых кальциевых мыл. С целью
электронно-микроскопического выявления проводят обмен оснований с
образованием свинцовых мыл. Для обнаружения продуктов
гистохимической реакции в световой микроскопии препарат обрабатывают
раствором сульфида аммония с образованием коричневого
осадка сульфида свинца. Специфичность этой реакции может быть
проконтролирована с помощью ингибиторов липазы: 0,01 М
растворов цинка, свинца, меди и ЭДТА.
Выявление триглицеридов по Адамсу
1. Маленькие кусочки ткани фиксируют в течение 4 ч при
4 °С в 3 % глутаровом альдегиде на 0,067 М какодилатном
буфере (рН 7,4).
2. Промывают в 7,5 % сахарозе на буфере в течение 18 ч.
3. Срезы толщиной 50 мкм получают на замораживающем
микротоме.
4. Срезы инкубируют в течение 30 мин в среде, в состав
которой входят 50 мг панкреатической липазы, 10 мл 2 %
раствора хлорида кальция, 15 мл 0,2 М трис-буфера (рН 7,0) и 25 мл
дистиллированной воды.
5. Тщательно промывают в дистиллированной воде.
6. Помещают срезы на 15 мин в 1 % раствор нитрита свинца.
7. Промывают в дистиллированной воде.
8. Дополнительно фиксируют в 1 % растворе тетраоксида
осмия в течение 18 ч.
9. Обезвоживают, заключают.
Результат: в участках прохождения реакции выявляются
оптически плотные игольчатые кристаллы свинцового мыла.
ГИСТОХИМИЯ БИОГЕННЫХ АМИНОВ
Биогенные амины — низкомолекулярные органические
основания — образуются в процессе декарбоксилирования и
последующих ферментативных превращений аминокислот. С помощью
гистохимических методов выявляют две группы биогенных
аминов — катехол амины и индол амины. Их концентрация в
большинстве органов низкая, поэтому для гистохимического
выявления пригодны лишь высокочувствительные реакции.
97
Биогенные амины в тканях. выявляют с помощью хромаф-
финной и аргентаффинной реакции, реакций окрашивания и
конденсации и других методических подходов, которые
подробно изложены в главе 21.
ГИСТОХИМИЯ ПИГМЕНТОВ
Термин «пигменты» охватывает группу веществ, поглощающих
свет в видимом спектре и наблюдаемых в неокрашенных
клетках и тканях. Под это определение подходят вещества
различного происхождения, состава и функционального назначения.
По происхождению пигменты можно разделить на экзогенные
(в частности, угольная или известковая пыль, отложения
металлов, химиотерапевтических веществ и др.) и эндогенные.
Эндогенные пигменты разделяют на гематогенные (например,
гемоглобин и его производные) и негематогенные, или аутогенные
(например, меланин и жировые пигменты — липофусцины и
каротиноиды).
В гистохимическом отношении пигменты мало различаются.
Несмотря на то что химический состав ряда пигментов выяснен
не до конца, гистохимически их можно выявить с достаточно
высокой степенью надежности, тем более что большинство из
них имеет характерную тканевую локализацию.
Выявление гемосидерина и гемоглобина
Гемосидерин — железосодержащий пигмент, образующийся из
гемоглобина в результате внутриклеточных превращений. Для
выявления гемоглобина пригодна реакция псевдопероксидазы с
бензидином, а идентификация гемосидерина основана на
определении содержащегося в нем железа с помощью реакции Перл-
са с кислым ферроцианидом. Кроме того, гемосидерин дает
положительную ШИК-реакцию, обусловленную его нахождением
в белково-полисахаридном комплексе. Резко положительна
реакция этого комплекса с тетразолием после бензотирования.
Выявление гемоглобина бензидином по Пикворту
1. Материал фиксируют в формалине, заливают в парафин.
2. Депарафинированные срезы доводят до воды.
3. Промывают в метаноле.
4. Перевернутое стекло со срезом помещают в раствор
бензидина (0,2 г бензидина и маленький кристаллик нитропруссида
натрия растворяют в 15 мл метанола, добавляют 4 капли
ледяной уксусной кислоты и встряхивают) в чашке для
окрашивания на 5— 10 мин.
5. Смывают бензидин озонированным эфиром (50 мл 3 %
перекиси водорода, 100 мл метанола и 50 мл эфира).
98
6. Помещают срез на 10 мин в свежую порцию
озонированного эфира.
7. Промывают в проточной воде 10—15 мин.
8. Докрашивают ядра в 1 % водном растворе нейтрального
красного 3 мин.
9. Промывают, обезвоживают в спиртах, просветляют в
ксилоле и заключают в дистрен-дибутил-ксилол.
Результат: гемоглобин и некоторые «оксидазные» гранулы
лейкоцитов окрашиваются в темно-синий цвет, ядра — в
красный.
Трехцветный метод выявления билирубина,
гемосидерина и липофусцина по Гленнеру
1. Срезы толщиной 10 мкм готовят в криостате, наклеивают
на стекла и подсушивают при комнатной температуре.
2. Погружают на 5 мин в 2 % раствор гексацианоферрата
калия.
3. Обрабатывают 20 мин свежеприготовленной смесью
равных частей 2 % гексацианоферрата калия и 5 % уксусной
кислоты.
4. Ополаскивают в проточной воде и обрабатывают в течение
15 мин 3 % раствором бихромата калия с рН 2,2.
5. Промывают в воде.
6. Окрашивают свежепрофильтрованным раствором
жирового красного О в изопропаноле 20 мин.
7. Промывают в проточной воде в течение 5 мин.
8. Заключают в сироп Апати.
Результат: липофусцины окрашиваются в оранжево-красный
цвет, гемосидерин — в синий, билирубин — в темный
изумрудно-зеленый.
Примечание. Гемосидерин растворяется в кислотах,
поэтому для его выявления не следует применять кислые
фиксаторы.
Выявление желчных пигментов
Желчные пигменты, как и гемосидерин, являются продуктом
разложения гемоглобина и других железосодержащих белков.
Основные желчные пигменты — билирубин и биливердин —
обладают кислотными свойствами и образуют со
щелочноземельными металлами соли, не растворимые в воде. Их
идентификация возможна с помощью окраски метиленовым синим,
реакций Гмелина и Штейна. Реакция Гмелина основана на
окислении билирубина азотной кислотой, а реакция Штейна — на
окислении его йодом. Метод Штейна позволяет выявить все
желчные пигменты.
99
Реакция с йодом на желчные пигменты по Штейну
1. Материал фиксируют в формалине или спирте, заливают
в парафин.
2. Депарафинированные срезы доводят до воды.
3. Обрабатывают 12—18 ч йодным реактивом (2 части
раствора Люголя и 1 часть 10 % раствора йода на 96 % спирте).
4. Промывают в проточной воде 5 мин.
5. Обесцвечивают 5 % раствором тиосульфата натрия 30 с.
6. Промывают и докрашивают квасцовым кармином Майера
3-18ч.
7. Промывают в воде, обезвоживают абсолютным ацетоном,
просветляют в ксилоле и заключают в бальзам.
Результат: желчные пигменты окрашиваются в
темно-зеленый цвет, ядра — в красный.
Выявление меланина
Меланин имеет сложную полимерную структуру и обычно
окрашен в черно-коричневый цвет, хотя имеются и другие
оттенки — до желтого и даже фиолетового. Как правило, он
встречается в форме гранул — меланосом — в клетках тканей
эктодерма льного происхождения — в эпидермисе, волосах, волосяных
фолликулах, меланомах кожи, пигментном эпителии радужки,
сетчатке. В нервной системе присутствует разновидность
меланина — нейромеланин. Меланин синтезируется в промеланосо-
мах через окисление тирозина до ДОФА при участии тирозина-
зы и пероксидазы. На этом основаны методы специфического
контрастирования и электронно-микроскопического
гистохимического выявления промеланосом по положительной реакции на
тирозиназу.
Выявление меланина основано на его способности
образовывать комплексы с ионами двухвалентного железа, которые
легко обнаруживаются гексацианоферратом калия в реакции
турнбулевой сини. На этом принципе основан метод Ли л ли.
«Железный» метод выявления меланина по Лилли
1. Материал фиксируют в различных смесях, заливают в
парафин.
2. Депарафинированные срезы доводят до воды.
3. Помещают в 2,5 % раствор сульфата железа гептагидрата
на 60 мин.
4. Промывают в 4 сменах дистиллированной воды по 5 мин.
5. Помещают в 1 % раствор гексацианоферрита (III) калия в
1 % уксусной кислоте на 30 мин.
6. Промывают в 1 % уксусной кислоте.
7. При желании докрашивают пикрофуксином по Ван-Гизону.
100
8. Проводят через спирт возрастающей концентрации и
ксилол, заключают в бальзам.
Результат: меланин окрашивается в темно-зеленый цвет на
бесцветном фоне; такой же цвет имеет гемосидерин.
Меланин, как и липофусцин, обладает способностью
восстанавливать раствор аммиачного серебра. На этом основан
принцип электронно-микроскопического гистохимического
выявления промеланосом и меланосом по Мисиме. Раздельное
выявление меланина и липофусцина возможно по их разному
окрашиванию нильским синим. Кроме того, липофусцин в отличие от
меланина дает видимую собственную флюоресценцию в
ультрафиолетовом свете.
Импрегнация серебром промеланосом
и меланосом по Мисиме
1. Маленькие кусочки ткани фиксируют в 10 %
формальдегиде на фосфатном буфере (рН 7,4) в течение 1 ч при 4 °С.
2. Тщательно промывают в дистиллированной воде.
3. Инкубируют в растворе аммиачного серебра 40 — 60 мин
при 58 °С.
4. Промывают в нескольких сменах дистиллированной воды.
5. Кусочки ткани помещают на 1 — 2 мин в раствор трихлори-
да золота (5 мл 6 % тиосульфата натрия смешивают с 5 мл 6 %
тиоцианата аммония и добавляют по каплям 2 % раствор трих-
лорида золота до образования розовато-красного осадка).
6. Кусочки ткани помещают сразу в 0,6 % раствор
тиосульфата натрия на 8 мин.
7. Тщательно промывают в дистиллированной воде.
8. Дополнительно фиксируют в 0,6 % забуференном
растворе перманганата калия или в 1 % забуференном растворе тетра-
оксида осмия (рН 7,4) 1 ч при 4 °С.
9. Обезвоживают и заливают.
Результат: серебрятся меланосомы и премеланосомы.
Гранулярные отложения металлического серебра выявляются и в тех пре-
меланосомах, в которых меланин не образуется (у альбиносов).
Выявление липофусцина и меланина с применением
нильского синего по Лилли
1. Материал фиксируют в любом фиксаторе, заливают в
парафин.
2. Депарафинированные среды доводят до воды.
3. Окрашивают в течение 20 мин 0,05 % раствором нильского
синего А в 1 % серной кислоте.
4. Промывают в проточной воде 10 — 20 мин.
5. Можно также быстро ополоснуть в 1 % растворе серной
кислоты и обезводить в 4 порциях абсолютного ацетона.
101
6. Заключают после п. 3 в глицерин-желатин или после п. 4
проводят через ксилол и заключают в синтетическую среду.
Результат: если обработка включала пп. 4 и 6, то
липофусцины окрашиваются в темно-синий или зеленый цвет, меланин —
в темно-зеленый; при обработке с включением пп. 5 и 6 меланин
окрашивается в темно-зеленый цвет, а липофусцины сохраняют
свою первоначальную окраску.
Метод дифференцировки меланина
от липофусцина по Хужу
1. Материал фиксируют в любом фиксаторе, заливают в
парафин.
2. Депарафинированные срезы помещают в
дистиллированную воду.
3. Срезы окрашивают свежеприготовленным насыщенным
водным раствором нильского синего 30 мин.
4. Промывают в дистиллированной воде.
5. Обесцвечивают 10 % перекисью водорода 24 ч.
6. Промывают в проточной воде.
7. Заключают в глицерин-желатин.
Результат: липофусцин окрашивается в синий цвет, меланин
в результате обработки перекисью водорода обесцвечивается.
Выявление жировых пигментов
Наряду с липофусцином к жировым пигментам относятся гемо-
фусцин, цероид, псевдомеланин, железосодержащие липопиг-
менты и каротиноиды.
Липофусцин обладает выраженной базофилией и сильной
восстанавливающей способностью, на чем основана реакция
Шморля — основная реакция на липофусцин. Липофусцин
окрашивается также нильским синим.
Выявление кислотоустойчивых липофусцинов
по Цилю—Нильсену
1. Материал фиксируют в различных смесях, заливают в
парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. Окрашивают срезы в течение 3 ч при 60 °С в растворе кар-
бол-фуксина (10 г основного фуксина + 50 г фенола + 100 мл
спирта + 1000 мл дистиллированной воды).
4. Промывают в проточной воде.
5. Дифференцируют в 1 % солянокислом спирте до тех пор,
пока эритроциты не станут розовыми.
6. Промывают в дистиллированной воде.
102
7. Докрашивают в железных квасцах или 0,5 % растворе то-
луидинового синего.
8. Промывают в проточной воде.
9. Обезвоживают в спиртах возрастающей концентрации,
проводят через ксилол, заключают в бальзам.
Результат: кислотоустойчивые липофусцины
окрашиваются в ярко-красный цвет, а липопротеиды приобретают
красноватый оттенок; ядра окрашиваются в темно-синий или синий
цвет.
Примечание. Из-за базофилии липофусцинов
слишком сильная докраска обусловливает развитие темно-красного
окрашивания. В присутствии фенола растворимость красителей
в липидах повышается.
Метод Шморля для выявления липофусцина
1. Материал фиксируют в формалине, заливают в парафин
или получают срезы на замораживающем микротоме.
2. Срезы промывают в дистиллированной воде.
3. Помещают срезы на 5 — 20 мин в реакционную смесь [3
части 1 % раствора дихлорида железа смешивают с 1 частью 1 %
раствора гексацианоферрата (III) калия; смесь используют в
течение 30 мин после приготовления].
4. Срезы хорошо промывают в проточной воде. В особенно
важных случаях рекомендуется проводить микроскопию срезов,
заключенных в воду.
5. Быстро обезвоживают в спиртах возрастающей
концентрации, проводят через ксилол, заключают в бальзам.
Результат: липофусцин и меланин окрашиваются в темно-
синий цвет. Кроме того, положительную реакцию дают арген-
таффинные гранулы, а также ткани, содержащие активные 5Н-
группы.
Примечание. После п. 4 можно провести окрашивание
ядер 1 % нейтральным красным в течение 3 мин.
ГИСТОХИМИЯ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ
Гистохимическое выявление неорганических веществ
сопряжено с трудностями, обусловленными прежде всего их легкой
растворимостью и тем, что концентрация их в клетках редко
бывает достаточно высокой для определения гистохимическими
методами. В связи с этим для локализации неорганических
элементов предпочтение следует отдавать гистофизическим
методам, используемым в растровой (сканирующей)
электронной микроскопии,— дифракции электронов и электронного
зонда.
Из гистохимических методов выявления неорганических
веществ ограничимся рассмотрением наиболее надежных и до-
103
ступных — реакций выявления железа, калия, натрия, группы
тяжелых металлов и хлора.
Выявление железа
Выявляется только свободное железо. Определить железо,
входящее в состав органических молекул (например, гемоглобина,
цитохрома, ферритина), можно только после его
высвобождения из органических связей.
Выявление двухвалентного железа (ферро-иона) по Тирману
и Шмельцеру основано на образовании турнбулевой сини в
результате реакции ионов железа (II) тканей с гексацианоферра-
том калия.
Выявление железа (II) по образованию турнбулевой сини
1. Материал фиксируют в формалине, заливают в парафин
или получают срезы на замораживающем микротоме.
2. Депарафинированные срезы доводят до
дистиллированной воды (если срезы дополнительно обработать 10 %
раствором сульфида аммония в течение 1 — 24 ч, то выявляется также
трехвалентное железо).
3. Тщательно промытые в дистиллированной воде срезы
обрабатывают свежеприготовленным раствором, состоящим из
равных частей 20 % водного раствора гексацианоферрата (III)
калия и 1 % соляной кислоты, в течение 10 — 20 мин.
4. Срезы тщательно промывают в дистиллированной воде.
5. При желании ядра можно докрасить ядерным прочным
красным.
6. Промывают в дистиллированной воде.
7. Проводят через спирты возрастающей концентрации и
ксилол заключают в бальзам.
Результат: соединения железа (II) окрашиваются в темно-
синий цвет.
Примечание. Надежность этого метода можно
повысить путем контрольной экстракции железа. С этой целью ткань
фиксируют в 80 % спирте, насыщенном сероводородом, в
течение 24 ч при 4 °С обрабатывают при комнатной температуре в
следующем растворе: 1 г 1,10-фенантролинийхлорида + 100 мл
дистиллированной воды. Этот раствор сменяют несколько раз
до исчезновения красного окрашивания, после чего срезы
промывают в дистиллированной воде. Проводят реакцию
выявления железа.
Выявление иона трехвалентного железа (ферри-иона) по
Перлсу основано на образовании берлинской лазури (ферроци-
анида) в результате реакции ионов железа (III) с гексациано-
ферратом калия тригидридом в кислом растворе.
104
Метод Перлса для выявления железа (III)
с помощью реакции берлинской лазури по Лизону
1. Материал фиксируют в формалине (применение кислых
фиксаторов и смеси с хромом недопустимо), заливают в
парафин (замороженные срезы менее пригодны).
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. Срезы помещают в свежеприготовленный раствор,
состоящий из равных частей 2 % гексацианоферрата (II) калия три-
гидрата и 2 % соляной кислоты, на 30 — 60 мин (новый раствор
использовать спустя 30 мин).
4. Промывают в дистиллированной воде.
5. В случае необходимости ядра окрашивают ядерным
прочным красным, после этого промывают дистиллированной
водой.
6. Проводят через спирты возрастающей концентрации и
ксилол, заключают в бальзам.
Результат: соединения железа (III) окрашиваются в темно-
синий цвет.
Примечание. Следует избегать контакта срезов с
металлическими инструментами. Возможно проведение
контрольной реакции с экстракцией железа
Выявление кальция
В тканях животных нерастворимый кальций присутствует
большей частью в виде фосфатов и карбонатов. Метод Даля основан
на образовании комплексов ализариновых красителей с
металлами, окраска которых зависит от величины рН. При рН 4,1 —
4,3 комплекс с кальцием избирательно окрашивается в
оранжево-красный цвет.
Выявление кальция по Далю в модификации
Мак Ги—Рассела
1. Материал фиксируют в формалине или
формалин-этаноле, заливают в парафин (кислые или металлосодержащие
фиксирующие среды менее пригодны).
2. Депарафинированные срезы помещают в 50 % спирт.
3. Быстро промывают дистиллированной водой.
4. Под контролем микроскопии окрашивают ализариновым
красным 5 (в 2 % раствор ализаринового красного 5
добавляют слабый раствор аммиака — 1:100, доводя рН до 4,1—4,3)
30 с — 5 мин.
5. Срезы без промывания подсушивают фильтровальной
бумагой.
6. Помещают в абсолютный ацетон на 10 — 20 с.
105
7. Проводят через ацетон-ксилол (1:1) 10 —20 с, ксилол и
заключают в бальзам.
Результат: отложения кальция окрашиваются в оранжево-
красный цвет, неорганическое железо — в пурпурный,
остальные структуры — в розовый.
Примечание. При изменении рН могут окрашиваться
другие неорганические соединения.
Выявление калия
В тканях животных калий находится преимущественно в
ионизированной растворенной форме, поэтому основные процедуры
проводят при низкой температуре и предпочтение отдают работе
с лиофилизированными срезами. Современные приемы
гистохимического выявления калия основаны на методе Макаллума:
срезы обрабатывают нитритом кобальта-натрия, который
образует с калием микрокристаллический осадок тройной соли —
кобальта калия нитрит. В некоторых модификациях этот осадок
желтовато-коричневого цвета преобразуют в сульфид кобальта.
Выявление калия по Макаллуму в модификации
Краута и Дженнингса
1. Материал замораживают, высушивают и заливают в
парафин.
2. Лиофилизированные парафиновые срезы толщиной 10
мкм переносят для депарафинирования непосредственно в пет-
ролейный эфир (срезы к предметному стеклу не прикреплять!).
3. Свободноплавающие срезы помещают в новую смену пет-
ролейного эфира.
4. Срезы прикрепляют к предметному стеклу (без покрытия
стекол белком с глицерином) и высушивают на воздухе, после
чего слегка прижимают их фильтровальной бумагой.
5. Обрабатывают раствором нитрита кобальта (25 г нитрита
кобальта растворяют в 7 мл воды, добавляют 12,5 мл уксусной
кислоты; 120 г нитрита натрия растворяют в 180 мл
дистиллированной воды; к первому раствору добавляют 210 мл второго.
Смесь охлаждают на воздухе 1 — 2 ч для удаления диоксидеазо-
та, затем в холодильнике и фильтруют перед применением на
холоду).
6. Просушивают фильтровальной бумагой, промывают в
трех сменах дистиллированной воды, охлажденной на льду, по
15 с в каждой (пока не перестанут отделяться желтоватые
облачка красителя).
7. Проводят через спирты возрастающей концентрации и
ксилол, заключают в бальзам.
Результат: кобальта калия нитрит выпадает в осадок в виде
желтовато-коричневых кристаллов.
106
Выявление тяжелых металлов
Тяжелые металлы присутствуют в тканях обычно в виде
легкорастворимых солей. Методы гистохимического выявления
основаны прежде всего на их обработке сероводородной водой или
растворами сульфидов для перевода в нерастворимые
сульфиды данного металла. Некоторые авторы в эксперименте
прибегают к перфузии органов раствором сульфида после
непродолжительной перфузии альдегидного фиксатора или объединяют
процессы фиксации и образования сульфида, используя в
качестве фиксатора раствор альдегида, насыщенный сероводородом.
Для лучшего выявления осадка Т1тт (1958) рекомендовал
осаждение на нем металлического серебра из
восстанавливающей среды, содержащей нитрит серебра. Эти приемы
используют и для определения в ткани тяжелых металлов в электронно-
микроскопической гистохимии.
Выявление тяжелых металлов с помощью
сульфида серебра по Тимму
Необходимые растворы:
а) раствор гуммиарабика: 20 или 40 г неизмельченного
гуммиарабика растворяют в 100 мл дистиллированной воды,
оставив раствор стоять 7 — 14 дней (100 мл);
б) свежеприготовленный 10 % водный раствор нитрата
серебра (1 мл);
в) восстанавливающая среда: 5 г лимонной кислоты и 2 г
гидрохинона растворяют в 100 мл бидистиллированной воды
(100 мл). Растворы а, б и в (проявляющий раствор) смешивают
непосредственно перед применением.
1. Маленькие кусочки ткани фиксируют в 70 % спирте,
насыщенном сероводородом (добавить 2 капли концентрированного
аммиака к 100 мл) в течение 10 — 12 ч, заливают в парафин.
2. Срезы толщиной 6 — 8 мкм, прикрепленные к предметным
стеклам без приклеивающего вещества, доводят через ксилол и
спирт убывающей концентрации до дистиллированной воды.
3. Срезы, прикрепленные к предметным стеклам, помещают
в плоские чашки, осторожно заливают проявляющим раствором
и проявляют в темноте при 20 °С до тех пор, пока они не
приобретут светло-коричневый цвет, обычно в течение 20 — 60 мин,
максимально 6 ч
4. Промывают в дистиллированной воде.
5. Ядра докрашивают ядерным красным или гемалауном.
6. Промывают в дистиллированной или проточной воде.
7. Проводят через спирты и ксилол, заключают в бальзам.
Результат: тяжелые металлы окрашиваются в
темно-коричневый цвет, ядра — в синий (гемалауном) или в красный
(ядерный прочный красный).
107
Примечание. Специфичность реакции можно
повысить, используя контроли. Образование осадка в процессе
окрашивания можно уменьшить с помощью бидистиллированной
воды и кварцевого стекла.
Выявление тяжелых металлов с помощью сульфида серебра
для криостатных срезов по Брунку и Шеельду
1. Из свежей ткани вырезают тонкие кусочки (максимальная
толщина 2 мм).
2. Обрабатывают во влажной камере при 20 °С парами
сероводорода в течение 20 мин.
3. Криостатные срезы толщиной 6 — 8 мкм прикрепляют на
предметные стекла.
4. Дальнейшую обработку проводят по стандартному методу
Тимма, начиная с п. 3.
Выявление натрия
Натрий, как и калий, присутствует в тканях в легко диффузи-
руемой, чаще всего ионизированной, форме Однако ионы
натрия могут быть стабилизированы для
электронно-микроскопического исследования уже в процессе фиксации путем его
осаждения гексагидроксоантимонатом калия по Комнику. С этой
целью можно использовать также пироантимонат калия.
Осадок гексагидроксоантимоната натрия малорастворим и
хорошо выдерживает последующую обработку тканей для
электронной микроскопии. Осадок обладает высокой электронной
плотностью.
Специфичность этого метода, однако, невысока. Помимо
гексагидроксоантимоната натрия в осадок могут выпадать соли
некоторых других металлов; может также вступать в реакцию
гликоген.
Выявление хлора
Для гистохимического обнаружения хлора в настоящее время
применяют исключительно методы серебрения.
Использовавшиеся ранее растворы перманганата калия и нитрата серебра не
позволяли надежно установить локализацию легко диффунди-
руемых ионов хлора, так как эти соли серебра, являющиеся
сильными осадителями белков, проникают в ткань медленно и
на небольшую глубину. Лучше проявили себя ацетат и лактат
серебра. Осаждение хлора проводят в процессе фиксации
ткани, при этом принимают меры против смешения ионов
хлора.
108
Электронно-микроскопическое выявление хлора
по Комнику
Принцип метода заключается в осаждении хлора ацетатом или
лактатом серебра.
1. Маленькие кусочки ткани фиксируют, постоянно
помешивая (1 ч), в темноте или при слабом красном свете в течение 2 ч.
Фиксирующая смесь: 1,5 % тетраоксидосмия, 1 % лактат
серебра в 0,05 — 0,1 М какодилат уксусном буфере (рН 6,4 — 6,6).
2. Кусочки ткани переносят в темноте или при слабом
красном свете в 10 % и 30 % ацетон на 5 мин в каждый.
3. Дифференцируют в 2 сменах 0,1 н. азотной кислоты в 50 %
ацетоне по 5 мин.
4. Обезвоживают в 2 сменах (70 % и 90 %) ацетона по 5 мин
и в 3 сменах абсолютного ацетона по 10 мин.
5. Заливают в эпоксидные смолы и полиэфиры.
Результат: хлорид серебра выпадает в виде
электронно-плотного мелкозернистого осадка.
ГИСТОХИМИЯ ФЕРМЕНТОВ
В настоящее время известно около 1000 ферментов, но лишь
около 100 из них доступны гистохимическому изучению. Вместе
с тем информация, получаемая с помощью гистохимических
методов, гораздо более ценная, чем это может показаться на
первый взгляд. Во-первых, при изучении обмена веществ в
конкретном типе клеток или ткани необязательно анализировать
все или большинство ферментов, достаточно выявить ключевой
фермент исследуемого цикла. Во-вторых, энзимогистохимичес-
кие методы позволяют исследовать ферменты в тканях и
клетках т 81(Л1, не подвергая их разрушению, связанному
гомогенизацией, аутолизом, элюцией и резорбцией в процессе
выделения, что может привести к ошибочной интерпретации
результатов. С помощью гистохимических подходов удается
обнаруживать ферменты не только на тканевом, но также часто на
клеточном и субклеточном уровнях.
Основные принципы гистохимического
выявления ферментов
В основе энзимогистохимических методов лежит выявление
продукта ферментативной реакции. При этом, строго говоря,
определяется не сам фермент, а его активность.
Гистохимическая реакция выявления ферментативной
активности состоит из двух этапов — собственно ферментативной
реакции и одновременной или последовательной реакции
«захвата» с образованием окрашенного конечного продукта гистохи-
109
мической реакции (нерастворимого хромогена) по следующей
схеме: субстрат -> первичный продукт реакции -> реакция
«захвата» -> конечный продукт реакции (нерастворимый
хромоген).
Все известные гистохимические реакции определения
ферментативной активности можно разделить на реакции
осаждения ионами металлов, окислительно-восстановительные
реакции, индигогенные методы, реакции азосочетания, реакции со
вспомогательными ферментами и реакции синтеза.
Реакции осаждения ионами металлов
Реакция Гомори
Реакция Гомори (определение активности кислой фосфатазы) —
самая простая и одна из наиболее демонстративных. Обычно в
этой реакции используют натриевую соль р-глицерофосфата. Для
осуществления одновременной реакции «захвата» в
инкубационную среду в качестве осаждающего агента вводят ионы свинца.
Образующийся осадок фосфата свинца имеет белый цвет и
обнаруживается при световой микроскопии. Для его выявления в
новой среде проводят реакцию превращения: белый осадок
фосфата свинца переводят в темно-коричневый осадок сульфида
свинца путем обработки срезов раствором сульфида аммония или
натрия. Для электронно-микроскопической гистохимии третий
этап (реакция превращения) необязателен, так как осадок
фосфата свинца имеет высокую электронную плотность и прекрасно
виден в электронном микроскопе.
Реакция Карновски—Рутса
Реакция Карновски — Рутса является модифицированной
реакцией Гомори, которую применяют для определения активности
холинэстеразы. В ней в качестве осаждающего агента
используют ионы трехвалентного железа (гексацианоферрат калия).
Феррицианид под действием образующегося в ферментативной
реакции тиохолина восстанавливается в ходе реакции
превращения до ферроцианида, который в свою очередь,
взаимодействуя затем в реакции «захвата» с ионами меди, образует
нерастворимый ферроцианид меди (так называемый коричневый
пигмент Хэтчетта).
Окислительно-восстановительные реакции
Индикаторы — акцепторы электронов (водорода)
В гистохимических реакциях, используемых для определения
активности окислительно-восстановительных ферментов, в
капо
честве индикаторов, которые, принимая на себя водород,
меняют окраску и выпадают в осадок, применяют соли тетразолия
Пригодность солей тетразолия для гистохимических целей
определяется прежде всего их окисляющей способностью, или
окислительно-восстановительным потенциалом, т.е.
готовностью принимать на себя водород (электроны), который, проходя
через систему переносчиков в дыхательной цепи, соединяется с
молекулярным кислородом.
Наряду с солями тетразолия способностью «снимать»
электроны с дыхательной цепи обладает феррицианид, который
взаимодействует с дыхательной цепью на участке дегидрогеназы и
цитохрома С. В условиях гистохимической реакции
феррицианид восстанавливается преимущественно или исключительно де-
гидрогеназой.
Индикаторы — донаторы электронов (водорода)
В 1885 г. П. Эр лих открыл индофеноловую реакцию, которая
затем получила название «НАДИ-реакция» по первым двум
буквам участвующих в ней реагентов — нафтола и диамина.
Впоследствии было установлено, что в НАДИ-реакции выявляется не ци-
тохромоксидаза, а ее субстрат — цитохром С, причем в
окисленной форме однако участие цитохромоксидазы в этой реакции
обязательно. Запас окисленного цитохрома С в ткани ограничен, и
реакция возможна лишь при постоянном окислении цитохромок-
сидазой цитохрома С, восстанавливаемого в индофенолоксидаз-
ной реакции. Таким образом, речь идет о «непрямом»
гистохимическом выявлении цитохромоксидазы, основанном на
способности ароматических аминов восстанавливать цитохром С.
Принципиальная схема индофенолоксидазной реакции Эр-
лиха лежит в основе ряда других гистохимических реакций
выявления оксиредуктаз, из которых наибольшее значение имеет
реакция с 3,3-диаминобензидином (ДАБ) для выявления перок-
сидазы по Карновски — Грэхему и цитохромоксидазы по Зелиг-
ману и соавт. ДАБ, так же как и НАДИ-реагенты, является
донатором электронов для цитохромоксидазы и других
терминальных оксидаз.
Индигогенные методы
Многие растения, например разновидности индигофера,
содержат глюкозид индикан, который при кислотном или
ферментативном гидролизе распадается на глюкозу и индоксил.
Важнейшей особенностью последнего является его легкая окисляемость
под действием кислорода воздуха, особенно в щелочных
растворах. Окисление идет недостаточно быстро для того, чтобы
исключить диффузию молекул индоксила от места локализации
фермента, поэтому для увеличения скорости образование конеч-
111
ного окрашенного продукта — индиго в инкубационную среду
добавляют окисляющий агент — феррицианид, феназинмето-
сульфат или соль тетразолия.
Азосочетание (одновременное и последовательное)
Азосочетанием называется взаимодействие ароматических диа-
зосоединений, содержащих диазогруппу (-К=М-), с
веществами, имеющими способный к замещению атом водорода,
связанный с атомом углерода. Изомер диазогруппы, состоящий из
трехвалентного и пятивалентного атомов азота, который
называется диазонием (=№=Ю, определяет высокую реактивность
диазосоединений. Наибольшее практическое значение в
гистохимии имеет азосочетание с производными нафтолов, нафтила-
мина и индолиламина.
В качестве сочетающихся агентов могут быть использованы
соединения не только с одной, но и с двумя азогруппами, т.е.
тетразотированные производные, и с тремя азогруппами — гек-
сазотированные производные. В продажу эти соединения
поступают в стабильной (прочной) форме в виде диазониевых солей,
поэтому в их названии присутствует слово «прочный». Другая
составляющая их названия — «синий», красный» или
«гранатовый» — характеризует цвет азокрасителя, образующегося после
реакции азосочетания. В гистохимической практике наибольшее
значение имеют следующие соли диазония: прочный синий В,
прочный синий КК, прочный красный ТК, прочный гранатовый
ВС, прочный синий УВ, гексазотированный парарозанилин и
гексазотированный новый фуксин.
Если реакции ферментативного расщепления и сочетания
проводят одновременно в одной среде, то их называют
реакциями одновременного азосочетания. Если же эти реакции
осуществляют в разное время и в двух разных средах, то их называют
реакциями последовательного азосочетания. В реакциях
последовательного азосочетания растворимые субстраты после их
ферментативного гидролиза превращаются в менее растворимые
продукты и концентрируются в местах локализации фермента.
Для выявления гидролизованного субстрата в новой среде
проводят реакцию сочетания с солью диазония. При этом не
исключается возможность артефактов вследствие диффузии
продуктов первичной (ферментативной) реакции. Обычно к методу
последовательного сочетания прибегают для выявления
ферментов, активность которых подавляется диазониевыми солями,
как, например, в случае гетерогалактозидазы.
Реакции с вспомогательными ферментами
В тех случаях, когда конечный продукт ферментативной
реакции не поддается гистохимическому выявлению, его можно из-
112
менить с помощью вспомогательного фермента и сделать
доступным для обнаружения. Так поступают при выявлении окси-
даз, таких как моноаминооксидаза и глюкооксидаза. Одним из
конечных продуктов реакции в этих случаях является перекись
водорода, локализация которой может быть установлена во
вспомогательной реакции с экзогенной пероксидазой и донором
электронов, например ДАБ.
Реакция синтеза
В тех случаях, когда из низкомолекулярного субстрата под
действием фермента синтезируется высокомолекулярный
нерастворимый продукт, последний может быть локализован с
помощью обычных гистохимических методик в новой среде.
Этот принцип используют для определения активности глико-
зилтрансфераз. Ее выявление проводят в две стадии в разных
средах.
1. Стадия синтеза: фермент отщепляет О-глюкозу от
растворимого субстрата (О-глюкозо-1-фосфата, уридиндифосфатглю-
козы) и образует из нее полигликан, характеризующийся
значительно меньшей растворимостью, чем субстрат.
2. Стадия гистохимического окрашивания: синтезированный
полигликан визуализируется с помощью раствора Люголя или
ШИК-реакции.
Особенности заливки и фиксации ткани
при гистохимическом выявлении ферментов
В обычной патоморфологической (диагностической)
лаборатории специфические требования гистохимии ферментов и
соответствующей обработки материала могут быть удовлетворены
лишь в ограниченной степени. Тем не менее параллельно с
получением постоянных гистологических препаратов можно
проводить выявление ряда ферментов (кислая и щелочная фосфа-
тазы, пептид азы, глюкоамилазы, эстераза и др.) с помощью
быстрой заливки в парафин.
Для этого материал фиксируют в альдегидах в течение 2 — 3 ч
при 4 °С, промывают дважды по 60 мин в буферном растворе, 5 %
сахарозе или изотоническом растворе хлорида натрия при 4 °С,
обезвоживают 30 — 45 мин при 4 °С в 50 % ацетоне, а затем в 3
сменах 100 % ацетона 3 —24 ч. В последней смене ацетона материал
оставляют на 1 — 2 ч при комнатной температуре. Затем тканевые
блоки просветляют в 3 сменах (по 10 мин каждая) бензола,
толуола или ксилола, промокают фильтровальной бумагой, помещают
в парафин на 30 — 45 мин при 56 °С и переносят в контейнеры для
заливки в новой смене парафина.
113
Выявление неспецифических кислых фосфатаз
по Гомори
1. Кусочки ткани фиксируют в холодном кальций-формоле
по Бейкеру. Получают срезы на замораживающем микротоме
или криостатные срезы с постфиксацией в холодном кальций-
формоле в течение 10—15 мин или в холодном ацетоне в
течение 15 — 30 мин.
2. Срезы инкубируют до 30 мин при 37 °С в
свежеприготовленном растворе субстрата:
0,05 М ацетатный буфер (рН 5,3) 50 мл
3 % р-глицерофосфат натрия 5 мл
ацетат или нитрат свинца 80 мг
3. Срезы промывают в 4 сменах дистиллированной воды
всего в течение 1—2 мин.
4. Обрабатывают 0,5—1 % раствором сульфида аммония
около 1 — 2 мин.
5. Срезы тщательно промывают в нескольких сменах
дистиллированной воды.
6. Заключают в глицерин-желатин или обезвоживают в
спиртах, просветляют в ксилоле и заключают в бальзам.
Результат: активность фермента проявляется коричневато-
черным окрашиванием в местах выпадения осадка сульфида
свинца. В контроле после инкубации без субстрата или после
добавления 0,01 М фторида натрия в инкубационную среду
реакция должна быть отрицательной.
Примечание. Наиболее надежные результаты
получают на свободноплавающих срезах. При фиксации ацетоном с
последующей заливкой в парафин под вакуумом
продолжительность инкубации в зависимости от исследуемой ткани следует
увеличивать до 4 ч. Обезвоживание срезов и заключение через
ксилол в бальзам или другие синтетические заливочные среды
приводят к небольшим потерям осадка сульфида свинца,
указывающего на локализацию ферментативной активности.
Кусочки ткани, фиксированные в холодном формалине,
хранят в 0,88 М сахарозе или 1 % гуммиакации (4 °С) несколько
недель без значительных потерь ферментативной активности.
Выраженных посмертных изменений в локализации кислой
фосфатазы в первые 6 ч не наблюдается.
Выявление щелочной фосфатазы методом
азосочетания по Гомори в модификации Берстона
1. Фиксацию образцов тканей проводят различными
способами (так же как в аналогичном методе с солями металлов).
Можно также использовать криостатные срезы
нефиксированной ткани, монтированные на предметных стеклах. Вегз1:оп
114
(1965) рекомендует такие срезы фиксировать в течение
нескольких минут в ацетоне. Особенно четко щелочная фосфатаза
выявляется в срезах тканей, залитых в парафин после
фиксации и обезвоживания в холодном ацетоне (без использования
спирта), или после лиофильной сушки.
2. Промывают в 3 сменах 8,5 % сахарозы по 5, 10 и 30 мин
или в течение ночи при -4 °С. Допустимо промывание в
изотоническом растворе хлорида натрия или проточной воде
продолжительностью не более 2 ч.
3. Инкубируют при комнатной температуре или 37 °С в
течение 5 — 30 мин или более в зависимости от уровня активности
фермента в среде следующего состава: приблизительно 10 мг
натриевой соли р-нафтилфосфата растворяют в нескольких
миллилитрах дистиллированной воды, добавляют 2 —4 мл 5 %
раствора тетрабората натрия, 40 мл холодной
дистиллированной воды, несколько капель 10 % раствора хлорида или
сульфата магния, 20 — 50 мг соли диазония (прочный синий В, УВ или
КК, прочный красный КС, О или др.), раствор встряхивают и
фильтруют; рекомендуется встряхивать сосуд в процессе
инкубации.
4. Промывают в растворе сахарозы, изотоническом растворе
хлорида натрия или проточной воде.
5. В случае необходимости докрашивают ядерным
красителем и дифференцируют в подкисленном 70 — 80 % спирте.
6. Промывают и заключают в глицерин-желатин или
обезвоживают и заключают в бальзам, если краситель нерастворим в
органических растворителях. Азокраситель, образованный (3-на-
фтолом и тетразотированным о-дианизидином (прочным синим
В), нерастворим в спиртах и ксилоле, по растворим в их смеси,
поэтому срезы перед переносом из последнего спирта в ксилол
следует осторожно промокнуть фильтровальной бумагой.
Большинство других азокрасителей более или менее растворимы в
абсолютном спирте и особенно в ксилоле.
Примечание. Вместо (3-нафтилфосфата в качестве
субстрата можно использовать фосфаты нафтолов А5-МХ, А5-Аг\[,
А5-С1, А5-КВ, А5-ТК, А5-В1, А5-Е и др. В этом случае
инкубационную среду готовят следующим образом
субстрат (фосфат нафтола А5) 5 мг
(растворить в 0,25 мл диметилформамида
или диметилсульфоксида)
дистиллированная вода 25 мл
0,2 М трис-НС1-буфер (рН 8,3-9,3) 25 мл
Соль диазония (прочный синий В или др ) 30 мг
Раствор встряхивают и фильтруют. Срезы инкубируют от 5
мин до нескольких часов. Промывают в проточной воде и
заключают в глицерин-желатин или обезвоживают и заключают в
бальзам либо смолу. Особенно высокое оптическое качество
115
препаратов получают при обезвоживании 80 % спиртом и
заключении в раствор поливини л ацетата в 80 % спирте.
Можно использовать стабильный основной раствор,
содержащий субстрат и буфер. Для этого 50 мг субстрата растворяют
в 20 мл ММ-диметилформамида. Добавляют 20 мл воды и
доводят до рН 8,0 с помощью 1 М раствора карбоната натрия
(требуется 0,5— 1 мл раствора; рН на этой стадии нельзя проверять
по индикаторной бумаге). Добавляют 600 мл дистиллированной
воды и доводят до 1 л 0,2 М трис-НС1-буфером (рН 8,3 — 8,6).
После добавления буфера раствор обычно становится опалесци-
рующим: Основной раствор устойчив при комнатной
температуре в течение нескольких месяцев. Для гистохимического
применения к 50 мл основного раствора добавляют соль диазония,
встряхивают и фильтруют в сосуд Коплина.
Выявление неспецифической кислой фосфатазы
с нафтолом А5-В1-фосфатом и гексазотированным
парарозанилином по Лойде
1. Маленькие кусочки ткани фиксируют в кальций-формоле
по Бейкеру при 4 °Св течение 12 — 24 ч; срезы получают на
замораживающем микротоме или используют криостатные срезы.
Постфиксацию свежих замороженных срезов проводят в
холодном кальций-формоле в течение 15 — 60 мин; промывают в
холодной воде 5 мин.
2. Инкубацию осуществляют в течение 30 — 90 мин при
комнатной температуре (при 37 °С продолжительность инкубации
уменьшается) или в холодильнике (несколько часов) в
следующем растворе:
фосфат нафтола А5-В1 5 мг (свежерастворенный в
0,25 мл диметилформамида)
0,1 М ацетатный буфер (рН 5,0 — 5,5) 10 мл (добавляют сразу)
5 % хлорид магния 1 — 2 капли
гексазотированный парарозанилин 0,3 — 0,9 мл
Проверить и, если необходимо, установить нужную величину рН;
раствор профильтровать!
Для приготовления гексазотированного парарозанилина
равные части холодного 4 % парарозанилина в 2 н. соляной
кислоте и холодного 4 % водного нитрата натрия сливают при
постоянном помешивании на ледяной бане, пока раствор не
приобретет бледно-желтый цвет (около 1 — 2 мин); 1 н. гидроксид
натрия добавляют по каплям до рН 6,0 (из-за быстрого испарения
жидкости проверку рН следует проводить быстро!).
3. Срезы промывают в дистиллированной и проточной воде.
4. Заключают в глицерин-желатин.
116
Результат: активность неспецифической кислой фосфатазы
проявляется выпадением осадка светло-красного красителя.
Контроль — как в методе Гомори.
Примечание. Перед приготовлением замороженных
или криостатных срезов рекомендуется промывать кусочки
ткани, фиксированные в кальций-формоле в течение 3 —4 ч или
дольше в холодном 7,5 % растворе сахарозы. Светло-желтое
окрашивание раствора гексазотированного парарозанилина не
мешает реакции. Загрязнение красителя, а также неполное гекса-
зотирование иногда приводят к сильному неспецифическому
окрашиванию.
Выявление АТФазной активности с солями свинца
по Гомори в модификации Бухвалова
1. Маленькие кусочки ткани фиксируют при 4 °С в кальций-
формоле по Бейкеру или в 2 % формальдегиде,
свежеприготовленном из параформальдегида, на 0,1 М фосфатном буфере
(рН 7,2 — 7,4) 2 — 24 ч или в смеси такого же формальдегида и
0,2 % глутарового альдегида 1—4 ч.
2. Промывают при 4 °С в 3 сменах 8,5 % сахарозы в течение
2 ч и в случае необходимости хранят при 4 °С в 8,5 % сахарозе
от 1 до нескольких суток.
3. Готовят в криостате или на вибратоме срезы ткани
толщиной 10 мкм (для световой микроскопии) или 50 мкм (для
электронной микроскопии). Для световой микроскопии можно
использовать свежезамороженные нефиксированные срезы.
4. Инкубируют в течение 30 — 60 мин при 37 °С в среде
следующего состава (в скобках указана конечная концентрация):
АТФ (натриевая соль) 12 мг (2 мМ)
дистиллированная вода 5,6 мл
0,2 М трис-малеатный буфер 4 (80 мМ)
4,3 % ацетат магния или 4,9 % сульфат магния 0,1 мл (2 мМ)
сахароза 850 мг (0,25 мМ)
2 % нитрат или ацетат свинца 0,3 мл (2 мМ)
Раствор соли свинца (II) добавляют в последнюю очередь по
каплям при интенсивном помешивании.
5. Дальнейшая обработка срезов: а) для световой
микроскопии промывают в дистиллированной воде, помещают в 1 %
сульфид аммония или сульфид натрия на 1 мин, промывают в
дистиллированной воде и заключают под покровное стекло в
глицерин-желатин; б) для электронной микроскопии
промывают срезы в 8,5 % сахарозе, контрастируют в 1 % тетраоксида
осмия, гексацианоферратом калия на 0,1 М фосфатном буфере
(рН 7,0 — 7,4) в течение 1 —2 ч, помещают в 70 % спирт на ночь
при 4 °С, обезвоживают и заливают в эпон, аралдит или весто-
117
пал, готовят ультратонкие срезы и желательно без
дополнительного контрастирования, просматривают в электронном
микроскопе Возможно также осмирование в стандартном растворе
тетраоксида осмия и контрастирование у ранил ацетатом, а также
цитратом свинца, если последний не будет маскировать продукт
гистохимической реакции.
Результат: локализацию ферментативной активности
определяют по коричнево-черному осадку сульфида свинца в световом
микроскопе или электронно-плотным гранулам фосфата свинца
в электронном микроскопе
Примечание. При электронно-гистохимическом
изучении локализации активности АТФазы и других нуклеозид-фос-
фатаз в суспензиях клеток оптимальные результаты получают
при фиксации клеток в 2 % формальдегиде,
свежеприготовленном из параформальдегида, в течение 1 ч и хранении в 8,5 %
сахарозе при 4 °С в течение 18 — 24 ч.
Выявление фосфогидролаз на основе свинцового
метода Гомори в модификациии Бухвалова
1. Первые четыре этапа обработки материала соответствуют
пунктам 1—4 предыдущего метода. Можно также использовать
и нефиксированные суспензии клеток и субклеточных фракций
в 0,25 М сахарозе, содержащей ионы М§ (3 ммоля), или срезы
нефиксированной ткани, приготовленные на вибратоме без
замораживания. В этом случае альдегидную фиксацию
осуществляют после инкубации в соответствующей среде с субстратом.
2. Инкубация в течение 30 — 60 мин при 37 °С в
соответствующей исследуемому ферменту среде с субстратом (табл. 3).
3. После инкубации материал обрабатывают соответственно
п. 5 предыдущей методики.
Результат: локализацию ферментативной активности
определяют по коричнево-черному осадку сульфида свинца в световом
микроскопе или электронно-плотным гранулам фосфата свинца в
электронном микроскопе. В контроле (инкубация в среде без
субстрата; сравнение результатов гистохимической реакции с
различными субстратами в аналогичных инкубационных средах;
добавление в инкубационную среду инкубатора — 0,01 М фторида
натрия для кислой фосфатазы, 2,5 М п-хлоромеркурибензоата для
Са-активируемой АТФазы и 0,05 М Ь-фенилаланина для
щелочной фосфатазы) указанные продукты должны отсутствовать.
Выявление неспецифической эстеразы
по Дэвису—Орнштейну
1. Маленькие кусочки ткани фиксируют в кальций-формоле
по Бейкеру или в 2 — 3 % глутаровом альдегиде при 4 °С; гото-
118
Таблица 3. Состав унифицированной среды для выявления активности
АТФазы, 5'-нуклеотидазы, глкжозо-6-фосфатазы и неспецифической фосфа-
тазы
Компонент среды
Субстрат
Дистиллированная вода
0,2 М трис-малеатный буфер
0,2 М трис-НС1-буфер
0,2 М ацетат магния (4,3 %)
или сульфат магния (4,9 %)
Сахароза
Ацетат или нитрат свинца 2 %
АТФаза
12 мг АТФ
5,6 мл
4 мл
(рН 7,2)
0,1 мл
850 мг
0,3 мл
5'-Нук;1со-
тидаза
7.5 мг
5'-АМФ
5.6 мл
4 мл
(рН 7,2)
0,1 мл
850 мг
0,3 мл
Глюко ю-6-
фосфагага
20 МГ
5,6 мл
4 мл
(рН 6,7)
850 мг
0,3 мл
Нес исцифическая
фосфата за
5 мг р-глице-
рофосфата
5,6 мл
4 мл
(рН 5,0, или
6,0, или 7,2)
4 мл
(рН 9,0)
0,1 мл
850 мг
0,3 мл 1
вят замороженные или криостатные срезы толщиной 10 — 15
мкм; нефиксированные замороженные или криостатные срезы
дофиксируют в течение 10—15 мин.
2. Срезы промывают в дистиллированной воде и инкубируют
при комнатной температуре в течение 10—15 мин.
Инкубационная среда: 15 мг р-нафтилацетата на водяной
бане расплавляют при температуре до 50 — 55 °С при
энергичном встряхивании (до помутнения), добавляют 2 — 3 мл
дистиллированной воды и доводят объем 0,2 М гидроортофосфатом
натрия до 25 мл. К этому раствору добавляют диазолированный
парарозанилин (4 % парарозанилин в 2 н. соляной кислоте + 8
капель 4 % нитрата натрия при помешивании на ледяной бане);
рН инкубационной смеси доводят 0,2 М дигидроортофосфатом
натрия от 8,0 — 8,5 до 7,0 — 7,1.
3. Срезы промывают в дистиллированной воде и заключают
в глицерин-желатин.
Результат: эстеразная активность проявляется
красно-коричневым окрашиванием.
Контроль — инкубация без субстрата, после которой
тщательно промыть срезы в дистиллированной воде. Указанное
окрашивание не выявляется.
Выявление ацетилхолинэстеразы
с ацетилхолиниодидом по Гомори
1. Материал фиксируют в холодном кальций-формоле по
Бейкеру. Замороженные или криостатные срезы дофиксируют в
холодном кальций-формоле по Бейкеру (10—15 мин) с после-
119
дующим тщательным промыванием в дистиллированной воде.
Можно использовать нефиксированный материал.
2. Инкубируют свободноплавающие срезы либо срезы,
прикрепленные на покровные или предметные стекла при 37 °С в
свежеприготовленном инкубационном растворе в течение 10 —
60 мин. Инкубационный раствор готовят следующим образом.
А Маточный раствор*
сульфат меди пентагидрат 0,3 г
глицин 0,375 г
хлорид магния гексагидрат 1 г
малеиновая кислота 1,75 г
гидрокснд натрия 4 % 30 мл
сульфат натрия 40 %
(насыщенный при подогреве, рН 6,0) 170 мл
Б. Инкубационный раствор 20 мл ацетилхолиниодида растворяют в
нескольких каплях дистилированной воды и добавляют 10 мл маточного
раствора
3. Промывают в 3 сменах насыщенного раствора сульфата
натрия.
4. Помещают срезы в раствор сульфила аммония на 2 мин.
5. Быстро промывают в проточной и дистиллированной воде
и заключают в глицерин-желатин.
Результат: активность ацетилхолинэстеразы проявляется
окрашиванием различных оттенков — от коричневого до черного.
Контроль — инкубация без субстрата; инкубация с 10 М эзери-
ном (физостигмина салицилат) в инкубационной среде без
субстрата (предварительная инкубация), в среде с субстратом
(основная инкубация для подавления ацетилхолинэстеразной и
холинэстеразной активности).
Примечание. Реакция дает надежные результаты и
пригодна как для проведения исследования, так и в практической
работе. Для выявления холинэстеразной активности вместо ацетил-
тиохолиниодида можно использовать бутирилтиохолиниодид.
Выявление ацетилхолинэстеразы с использованием
тиохолина и ферроцианида меди по Карновски—Рутсу
(для электронной микроскопии)
1. Фиксация: а) фиксация перфузией 3 % глутаровым
альдегидом на фосфатном буфере (рН 7,6) в течение 15 — 30 мин, с
последующей фиксацией погружением на 2 — 4 ч при
температуре 2—4 °С; б) маленькие кусочки ткани фиксируют в 4 %
формалине на 0,75 М фосфатном буфере (рН 7,6) с добавлением
0,44 М сахарозы в течение 2 —4 ч при температуре 2 — 4 °С.
2. Фиксированную ткань просушивают фильтровальной
бумагой и промывают в 0,44 М сахарозе в течение 16 ч при
температуре 2 — 4 °С.
120
3. Срезы толщиной 50 — 80 мкм готовят на резаке или
толщиной 50 мкм на замораживающем микротоме и помещают в 0,44 М
сахарозу при температуре 2 — 4 °С.
4. Предварительную инкубацию срезов проводят с
ингибитором в 0,1 М натрий-малеатном буфере (рН 6,0) в течение 1 ч
при температуре 2 — 4 °С. Ингибитор — 10 М изо-ОМФА
(ингибитор холинэстеразы).
5. Инкубируют в течение 15—120 мин при 0 °С (ледяная
баня) в среде следующего состава:
ацетилхолиниодид 5 мг
0,1 М натрий-малеатный буфер (рН 6,0) 6,5 мл
0,1 М цитрат натрия 0,5 мл
30 мМ сульфат меди 1 мл
ингибитор 10 М изо-ОМФА 1 мл
5 мМ гексацианоферрат калия 1 мл
сахароза 1,5 г
Рекомендуется прежде всего растворитель в буфере
ацетилхолиниодид, после чего добавить все остальные компоненты
инкубационной среды в указанном порядке. Растворы для
инкубационной среды готовят накануне; используют
дистиллированную воду, перегнанную в стеклянной посуде.
6. Дважды промывают срезы в холодной 0,44 М сахарозе по
4 мин.
7. Дофиксируют в 1 % тетраоксиде осмия на коллидиновом
буфере (рН 7,2), возможна дофиксация в тетраоксиде осмия на
фосфатном буфере.
8. Обезвоживают, заливают в эпон или микропал (весто-
пал), контрастируют в нитрате свинца по Рейнолдсу в течение
10— 15 мин.
Результат: активность ацетил холинэстеразы, считающаяся
специфичной после подавления холинэстеразы с помощью изо-
ОМФА, определяют по осадку ферроцианида меди. Для
выявления неспецифической холинэстеразной активности вместо
ацетилхолиниодида можно использовать бутирилтиохолинио-
дид, а в качестве специфического ингибитора ацетилхолинэсте-
разы -ЮМ ВШ284 С 51.
Выявление сукцинатдегидрогеназы
1. Готовят нефиксированные замороженные или криостатные
срезы толщиной 5—10 мкм.
2. Срезы подсушивают и инкубируют в течение 10 — 60 мин в
среде следующего состава:
2,5 М динатрий-сукцинат 1 мл
(6,75 г в 10 мл, нейтрализовать
121
1 н соляной кислотой)
нитросиний тетразолий (4 мг/мл) 2,5 мл
0,2 М трис-НС1 буфер (рН 7,4) 5,5 мл
5 мМ хлорид магния 1 мл
дистиллированная вода 3 мл
100 мМ цианид калия (65,1 мг в 10 мл) 1 мл
Проверяют рН и, если необходимо, доводят с помощью
маточного раствора триса или 1 н. соляной кислоты до рН 7,0 —
7,1.
3. Инкубационную смесь стряхивают со срезов и фиксируют
их в 10 % нейтральном формалине в течение 15 — 30 мин.
4. Промывают в проточной воде 2 мин, затем в
дистиллированной.
5. Заключают в глицерин-желатин или обезвоживают в
спиртах возрастающей концентрации, проводят через ксилол,
заключают в бальзам.
Результат: места сукцинатдегидрогеназной активности
маркируются кристаллами формазана красного или синего цвета.
Контроль — инкубация без субстрата.
Примечания. Вместо нитросинего тетразолия можно
использовать нерастворимый в липидах тринитросиний
тетразолий в той же концентрации. Ингибирование системы цитохро-
мов с помощью цианида калия усиливает реакцию, поскольку
на восстановление соли тетразолия остается больше водорода.
Непродолжительная фиксация маленьких кусочков ткани
формальдегидом или глутаровым альдегидом способствует
сохранению локализации фермента; однако она приводит к его
частичной инактивации и затрудняет определение истинной
ферментативной активности. Согласно Апйегзоп Ноег (1973), хорошая
локализация фермента т зки без потерь достигается с помощью
фиксации в 1 % забуференном, свободном от метанола
формальдегиде, приготовленном из параформальдегида (рН 7,2
устанавливается 0,2 М фосфатным буфером).
Продолжительность фиксации 5 мин при температуре от 0 до 4 °С. Кусочки
ткани следует вырезать быстро, толщина их должна быть не
более 1 — 2 мм. Такая фиксация способствует проникновению
нитросинего тетразолия в ткань и повышает субстантивность
формазана.
Выявление пероксидазы с использованием
диаминобензидина по Грэхему—Карновски
1. Кусочки ткани толщиной 3 — 4 мм фиксируют в смеси
формалина и глутарового альдегида (буфер рН 7,2) в течение 5 ч
при комнатной температуре.
2. Кусочки промывают в течение ночи в 0,1 М какодилатном
буфере (рН 7,2).
122
3. Готовят замороженные или криостатные срезы толщиной
10 — 40 мкм; срезы, приготовленные на резаке, могут иметь
толщину 50 мкм.
4. Инкубируют в течение 3—10 мин при комнатной
температуре в среде следующего состава: 5 мг 3,3-диаминобензидинтет-
рагидрохлорида растворить в 10 мл 0,05 М трис-НС1-буфера
(рН 7,6) и добавить 0,2 мл 1 % перекиси водорода
(свежеприготовленной из 30 % раствора). Сохранность инкубационной
среды около 1 ч.
5. Срезы промывают в 3 сменах дистиллированной воды.
Для световой микроскопии заключают в глицерин-желатин.
6. Для электронной микроскопии срезы следует дофиксиро-
вать в 1 — 2 % тетраоксида осмия на 0,2 М фосфатном или кол-
лидиновом буфере (рН 7,2 — 7,4) в течение 90 мин.
7. Обезвоживают в спиртах возрастающей концентрации и
заливают в эпон.
8. Срезы толщиной 0,5—1 мкм для световой микроскопии
подвергают непродолжительному окрашиванию толуидиновым
синим. Ультратонкие срезы контрастируют растворами
свинца.
Результат: в световом микроскопе места ферментативной
активности (пероксидаза, каталаза) после п. 5 окрашиваются в
коричневый цвет. При электронно-микроскопическом
гистохимическом исследовании продукт реакции представляет собой
гомогенный электронно-плотный осадок.
Выявление пероксидазы с использованием
З-амино-9-этилкарбазола
по Грэхему—Ландхолму—Карновски
1. Маленькие кусочки ткани фиксируют при 0 °С в забуфе-
ренном растворе формалина и сахарозы в течение 18 ч с
последующим промыванием в холодном 8,5 % растворе сахарозы в
течение 24 ч.
2. Криостатные срезы толщиной 5—10 мкм наносят на
покрытые желатином покровные или предметные стекла и
подсушивают на воздухе.
3. Срезы инкубируют при комнатной температуре в среде
следующего состава: 2 мг З-амино-9-этилкарбазола растворить
в 0,5 мл диметилформамида и добавить 9,5 мл 50 мМ
ацетатного или трис-НС1-буфера (рН 5,0). Непосредственно
перед употреблением добавить 1—2 капли 30 % перекиси
водорода.
4. Срезы промывают в дистиллированной воде и заключают
в глицерин-желатин.
Результат: пероксидазную активность выявляют по красному
цвету продукта реакции.
123
Выявление монооксидазы с использованием
тетразолия по Гленнеру
1. Нефиксированные замороженные или криостатные срезы
толщиной 10 — 40 мкм помещают на покровное или предметное
стекло и быстро просушивают.
2. Инкубируют 30 — 45 мин при 37 °С в среде следующего
состава:
триптамина гидрохлорид 25 мг
сульфат натрия 4 мг
3. Промывают в дистиллированной воде и заключают в
глицерин-желатин .
ГЛАВА 7
СОВРЕМЕННЫЕ ИММУНОМОРФОЛОГИЧЕСКИЕ
МЕТОДЫ
Иммуноцитохимические методы основаны на
высокоспецифическом взаимодействии антигена с антителом, что при наличии
соответствующих меченых антител позволяет выявить
практически любой тканевый или клеточный антиген. В качестве
такого антигена могут выступать как целые фракции (митохондри-
альная, ядерная и др.), так и отдельные химические соединения
(белки, пептиды и др.).
В первые годы развития иммуноцитохимии гистологи были
вынуждены либо сами, либо совместно с иммунологами и
биохимиками получать антитела к интересующему их антигену. В
настоящее время производят коммерческие поли- и монокло-
нальные антитела к широкому спектру антигенов (Са1ЫосЬет,
З^та, ВюзоЛ и др.). Тем не менее проблема выработки
антител к некоторым, в основном нестандартным, антигенам в
лабораторных условиях до сих пор достаточно актуальна. Этому
вопросу посвящены многие руководства [Ро1ак ]., Уап №югс!еп
5., 1986; Са<±у Э., 1988].
Антитела образуются в ответ на введение в организм
чужеродного антигена В-лимфоцитами, на поверхности которых
расположены иммуноглобулиновые рецепторы к антигену, точнее,
к его антигенным детерминантам. Сами антитела являются
иммуноглобулинами, образованными четырьмя полипептидными
цепями — двумя тяжелыми и двумя легкими с общей
молекулярной массой около 150 000. Молекула антитела
бифункциональна. На изменяющемся М-конце молекулы, образованном
тяжелой и легкой цепью, имеются два участка, где происходит
связывание антигена. Относительно постоянный С-концевой
участок молекулы обеспечивает связывание комплемента (С1д,
С4) и клеточных Рс-рецепторов [Са1±у В., 1988].
Поликлональные антисыворотки, получаемые при
иммунизации животных, обычно кроликов, коз или овец, содержат
антитела к различным эпитопам иммуногена. Наиболее важным
преимуществом поликлональной антисыворотки является то, что
она образует крупные нерастворимые интенсивно
окрашиваемые при иммуногистохимическом исследовании комплексы с
антигеном благодаря одновременному связыванию антител с
многими эпитопами антигена. Высокая гетерогенность
поликлональной антисыворотки, обусловленная одновременной выра-
125
боткой антител к различным эпитопам иммуногена,
обусловливает и ее недостатки. Так, например, плазма животного,
иммунизированного комплексом гаптен —белок —носитель, включает
в себя антитела к различным фрагментам не только молекулы
гаптена, но и белка носителя. В связи с этим необходимо
использовать дополнительные подходы для повышения
специфичности антисыворотки: в приведенном примере наиболее
эффективным приемом является преабсорбция антисыворотки
очищенным белком-носителем [СаНу В., 1988].
Недостатки поликлональных антисывороток удалось
устранить О. КоЫег и С. МИз^ет (1975), которые предложили метод
с использованием моноклональных антител. В основе метода
лежит создание гибридомы путем слияния В-лимфоцитов
селезенки иммунизированного животного (обычно мыши или
крысы) и культуры клеток миеломы, полученных из
плазматических клеток опухоли того же животного. Эти гибридомы
обладают, с одной стороны, способностью В-лимфоцитов
синтезировать однородные антитела к одному из эпитопов антигена, а с
другой — свойством клеток миеломы расти и пролиферировать
неопределенно длительное время в культуре ткани. Каждая
гибридная клетка дает начало клону клеток, продуцирующих
однородные антитела. С помощью последующего скрининга культу-
ральной среды каждого клона и ее анализа на содержание
антител с применением радиоиммунологического метода, ЕЫ5А-
теста или иммуногистохимии выделяют клон или клоны клеток,
которые далее будут использованы для получения
моноклональных антител.
Важным преимуществом моноклональных антител,
продуцирующихся в большом количестве одиночными клонами клеток
гибридомы, является то, что они идентичны по молекулярной
организации, специфичности и сродству к антигену. Однако
специфичность к определенному эпитопу антигена не исключает
перекрестные реакции, так как структура эпитопа иммуногена
может быть характерна также для других известных и
неизвестных соединений.
Недостатками моноклональных антител по сравнению с
поликлональными антисыворотками является то, что: а) они
связываются только с одним участком молекулы антигена, и это
обусловливает низкую чувствительность метода,
проявляющуюся в слабом иммуноокрашивании на срезах; б) при
единственном эпитопе высока вероятность того, что фиксатор сделает его
недоступным для антител, в результате чего не произойдет им-
муноокрашивания. Указанные трудности можно отчасти
преодолеть, если для выявления антигена использовать смесь
моноклональных антител, выработанных к различным эпитопам
одного и того же иммуногена, а для иммунизации —
«фиксированный» антиген [Ро1ак ^ , Уап Ыоогскп 3., 1987; Са11у Э.,
1988].
126
СВЕТООПТИЧЕСКАЯ ИММУНОЦИТОХИМИЯ
Иммуноцитохимия в настоящее время представляет собой
группу методов, позволяющих идентифицировать тканевые
компоненты т зИи благодаря специфической реакции антиген —
антитело, продукт которой при определенных условиях становится
видимым в световом и/или электронном микроскопе.
Существует несколько классификаций иммуногистохимических
методов: по метке антител— иммунофлюоресцентный, иммунофер-
ментный, иммуноизотопный и др.; в зависимости от выявления
антигена до или после заключения ткани в заливочную среду —
«пре-имбеддинг» и «пост-имбеддинг» [Угрюмов М.В., 1991]. В
основу наиболее распространенной классификации, которая
приведена ниже, положен принцип либо непосредственного
взаимодействия меченого антитела с антигеном, либо
опосредованного — через немеченые антитела [Ро1ак ]., Уап №югс1еп §.,
1986].
Первичная обработка ткани
Обработка ткани, предшествующая иммунологическому
выявлению антигена, преследует две цели — с одной стороны,
обеспечить удовлетворительную сохранность самой ткани, а с
другой — иммобилизовать антиген т зИи, обеспечив при этом
максимальную сохранность его антигенной активности. Важнейшим
этапом обработки материала до получения срезов является
фиксация, хотя изредка иммуноцитохимическую реакцию проводят
и на замороженных срезах нефиксированной ткани. В
экспериментальной и клинической практике чаще всего используют
химическую фиксацию свежей ткани, к которой предъявляют
определенные требования. Так, «мягкая» фиксация —
непродолжительная при низкой концентрации фиксирующего агента, как
правило, не обеспечивает удовлетворительной сохранности
ткани, в то время как «жесткая» приводит к значительной
потере антигенной активности. Это означает а рпоп, что идеальный
результат не может быть получен, а оптимальный является
компромиссом. Таким образом, залогом успешного использования
иммуногистохимических методов является подбор адекватного
фиксатора для конкретных тканей и антигенов.
Фиксация
Как в фундаментальных — биологических, так и в прикладных
медицинских иммуноцитохимических исследованиях на светооп-
тическом уровне чаще всего используют фиксаторы,
приготовленные на основе формалина/параформальдегида: 4 % парафор-
мальдегид, фиксатор Замбони, жидкость Буэна, формол-солевой,
формол-уксусный, формол-ртутный фиксаторы и др.
127
Параформальдегидный 4 % фиксатор. Для приготовления
100 мл фиксатора:
1) 4 г порошка параформальдегида насыпают в 50 мл
дистиллированной воды и, помешивая, нагревают до 60 — 70 °С на
водяной бане;
2) продолжая помешивать, добавляют 1 — 2 капли 1 н. гид-
роксида натрия до просветления раствора, фильтруют и
охлаждают до комнатной температуры;
3) добавляют 50 мл 0,2 М фосфатного буфера (рН 7,2 — 7,4)
и проверяют рН конечного раствора, который должен
сохраниться в том же диапазоне.
Фиксатор Замбони. Для приготовления 100 мл фиксатора:
1) 2 г порошка параформальдегида насыпают в 15 мл
насыщенной профильтрованной кислоты и, помешивая, нагревают
до 60 — 70 °С на водяной бане;
2) продолжая помешивать, добавляют по 1 — 2 капли 1 н.
гидроксида натрия до просветления раствора и охлаждают до
комнатной температуры;
3) добавляют 85 мл 0,1 М фосфатного буфера (рН 7,2 —
7,4). В случае необходимости рН можно довести 1 н. соляной
кислотой.
Модифицированный фиксатор Замбони
для электронн о-м икроскопической иммуно-
цитохимии. Для приготовления 100 мл фиксатора:
1) 4 г параформальдегида насыпают в 99,6 мл 0,2 М
фосфатного буфера (рН 7,2 — 7,4), нагревают до 60 °С при постоянном
помешивании;
2) добавляют несколько капель гидроксида натрия до
просветления раствора и охлаждают до комнатной температуры;
3) в полученный раствор добавляют 0,4 мл 25 %
коммерческого глутарового альдегида;
4) растворяют 50 мг порошка пикриновой кислоты и
фильтруют. Проверяют рН и в случае необходимости доводят 1 н.
соляной кислотой.
Формол-солевой 10 % фиксатор. Для приготовления 100
мл фиксатора 850 мг хлорида натрия растворяют в 10 мл
формалина и добавляют 90 мл дистиллированной воды.
Формол-уксусный 2,5 % фиксатор. Для приготовления
100 мл фиксатора к 10 мл формалина добавляют 90 мл
дистиллированной воды и растворяют 4 г дигидроортофосфата
натрия моногидрата и 6,5 г гидроортофосфата натрия, к
полученному раствору добавляют 5 % раствор ледяной уксусной
кислоты.
Формол-сулемовый фиксатор. Для приготовления 100 мл
фиксатора смешивают 90 мл насыщенного раствора дихлорида
ртути и 10 мл формалина.
Жидкость Буэна. Для приготовления 100 мл фиксатора к
75 мл насыщенного и профильтрованного раствора пикрино-
128
вой кислоты добавляют 25 мл формалина и 5 мл ледяной
уксусной кислоты.
Входящие в состав этих фиксаторов параформальдегид и
формалин обеспечивают иммобилизацию тканевых антигенов. В
случае легкодиффундируемых антигенов, например коротких
пептидов, в фиксатор дополнительно вводят химически более
активные альдегиды — глутаровый альдегид или акролеин [Ко-
гЬшзЫ С, №1ауег С, 1983]. Другие компоненты фиксаторов,
такие как пикриновая кислота, вызывают преципитацию белков
с образованием пикратов, а уксусная кислота обеспечивает
хорошую сохранность антигенной активности [^опез Е., Сге§огу ].,
1988]. Продолжительность фиксации устанавливают
эмпирически в зависимости от используемого фиксатора, фиксируемой
ткани и выявляемого антигена. При этом необходимо
учитывать, что недофиксированный материал плохо сохраняется, а в
перефиксированной ткани альдегидные группы настолько
сильно «сшивают» белковые молекулы, что нередко затрудняют
доступ антител к антигену [Уап №югс1еп 5., 1986]. Значительно
реже для решения специальных задач используют и другие
методы фиксации.
В экспериментальных исследованиях наиболее часто в
качестве фиксатора используют 4 % параформальдегид,
модифицированный фиксатор Замбони (рН 7,2 — 7,4), а также жидкость
Буэна, которые особенно эффективны при фиксации
железистой и нервной тканей. Фиксации, как правило, предшествует
перфузия наркотизированных животных в течение 3 — 5 мин
изотоническим раствором хлорида натрия или 2 М фосфатным
буфером (рН 7,2 — 7,4), приготовленном на изотоническом
растворе хлорида натрия (ПБС) при 37 °С, в состав которого
включают антикоагулянт (гепарин) и/или вазодилататор
(0,1 % нитрит натрия). Для перфузии используют специальную
систему по типу системы для переливания крови, но с меньшей
производительностью, или перистальтическую помпу,
подающую жидкость с регулируемой скоростью. Конец канюли, по
которой протекает раствор, вводят в левый желудочек сердца и
оставляют там или продвигают дальше — в восходящую часть
аорты. Одновременно вскрывают правое предсердие для
свободного оттока крови. Отмывание крови особенно важно при
последующем использовании антител, меченных пероксидазой,
так как форменные элементы крови богаты эндогенной
пероксидазой. Затем в течение 15 мин животное продолжает перфузи-
ровать охлажденным фиксатором. После этого вырезают
интересующую ткань и дофиксируют в том же растворе при 4 °С в
течение 2 —48 ч, а иногда и дольше. Очевидно, что в
определенных условиях, особенно при использовании секционного или
биопсийного материала, отмывание ткани от крови и фиксация
с помощью перфузии неосуществимы. После фиксации
материал тщательно отмывают от фиксатора в течение 2 —48 ч.
129
Приготовление срезов
Иммуноцитохимической реакции предшествует приготовление
срезов, обычно вибратомных, замороженных и парафиновых.
Техника получения этих срезов и необходимая предварительная
подготовка материала для резки существенно различаются,
поэтому рассматриваются раздельно.
Вибратомные срезы
Важнейшим преимуществом вибратомных срезов является то,
что их готовят сразу после фиксации. Тем самым, с одной
стороны, ускоряют иммуногистохимический процесс в целом, а с
другой — исключают негативные влияния на антиген в процессе
дополнительной физической (высокая температура) или
химической (органические растворители) обработки материала перед
резкой. Таким образом, с помощью вибратомных срезов можно
добиться максимальной сохранности антигенной активности.
Вибратомные срезы, толщина которых обычно 50 мкм,
инкубируют свободноплавающими в соответствующих растворах,
что способствует наилучшему проникновению антител и других
реагентов к антигенам. При этом иммуногистохимическая
реакция проходит по всей толще среза, что позволяет использовать
вибратомные срезы для объемных реконструкций. Наряду с
достоинствами имеются и определенные недостатки: а) фиксация
материала должна быть достаточно «жесткой», чтобы кусочек
не деформировался в процессе резки; б) качество срезов
ухудшается по мере увеличения их площади; в) обычно достаточно
трудно, а при некоторых вариантах фиксации невозможно
получить срезы толщиной менее 50 мкм, вследствие чего
уменьшается разрешающая способность метода.
Основной принцип работы вибратома — обеспечение вибрации
режущего лезвия в горизонтальной плоскости с частотой 50 Гц,
что позволяет приготавливать срезы из свежефиксированного, не
залитого в синтетическую среду материала. Прибор
полуавтоматический. В нем задаются такие параметры, как амплитуда,
скорость поступательного движения лезвия, т.е. скорость резки, и
угол наклона ножа. Толщину среза регулируют вертикальной
подачей держателя с блоком, теоретически с точностью до 1 мкм.
Неудобство в работе с прибором заключается в том, что подъем
^столика перед началом приготовления каждого нового среза
осуществляют вручную. Указанные параметры резки подбирают
эмпирически с учетом характера фиксации и вида ткани. В случае
необходимости, например при недостаточно «жесткой» фиксации
или слишком большой площади срезов, качество срезов можно
несколько улучшить, увеличивая амплитуду ножа и уменьшая
скорость резания. С этой же целью кусочки материала можно
покрывать желатиновой или агаровой капсулой [Угрюмов М.В , 1991].
130
Практические рекомендации. Режущее лезвие (ЗсЫск 5и-
рег СЬготшт или какое-либо другое) вставляют в держатель
чаще всего под углом 15 — 20°. Блок ткани размером не более
8x8x8 мм подсушивают фильтровальной бумагой. На
поверхность металлического столика наносят каплю специального циа-
нолитного клея (5ирег С1ие, Еаз1:тап 910 и др.) и выжидают
2 — 3 мин, пока он немного подсохнет. После этого наклеивают
блок ткани на поверхность столика. В ванночку заливают
охлажденный до 4 °С ПБС до погружения в него кромки лезвия,
одновременно в раствор должен полностью погрузиться блок
ткани. Столик с блоком поднимают до уровня кромки лезвия и
делают первые срезы, подбирая оптимальные параметры резки.
Амплитуду можно регулировать, обычно она колеблется от 0,5
до 1 мм. Далее можно начать приготовление стандартных
срезов толщиной 50 мкм, которые хранят в охлажденном до 4 °С
ПБС до последующей обработки.
Мягкий блок покрывают агаровой капсулой. Для этого
предварительно приготавливают 2 — 3 % агар в дистиллированной
воде, который хранят в термостате при 56 °С. Агар капают на
приклеенный к столику блок ткани до образования капсулы,
охлаждают в течение нескольких минут при 4 °С и помещают в
вибратом.
Криостатные срезы
Техника приготовления криостатных срезов для иммуноцитохи-
мических исследований мало отличается от техники их
получения для других морфологических исследований.
Парафиновые срезы
В отличие от вибратомных и криостатных парафиновые срезы
могут быть подготовлены для иммуногистохимических
исследований только после дегидратации кусочка ткани в спиртах
возрастающей концентрации, его просветления в ксилоле или
хлороформе и заливки в парафин при довольно высокой
температуре (45 — 56 °С). Очевидно, что в процессе проводки
значительно снижается антигенная активность. С учетом этого
обстоятельства для просветления ткани предпочитают применять
хлороформ. Кроме того, для заливки необходимо использовать
парафин с наименьшей точкой плавления, который при
комнатной температуре остается все же достаточно твердым для
приготовления тонких (5 — 7 мкм) срезов.
В климатических условиях нашей страны наиболее
пригодным является парафин с точкой плавления 56 °С, а в северных
районах, вероятно, может быть использован и парафин с точкой
плавления 45 °С. Температура парафина с тканью ни в коем
случае не должна превышать 60 °С, поскольку при этой темпе-
131
ратуре начинается полимеризация некоторых синтетических
примесей парафина, которые впоследствии практически
невозможно удалить из срезов.
Приготовленные на микротоме срезы монтируют на стекла,
высушивают, депарафинируют и регидратируют. После этого
срезы считаются подготовленными для последующих
инкубации, предшествующих иммуномечению.
Практические рекомендации. Кусочки фиксированной
ткани последовательно инкубируют в 70 % спирте 2 ч, 90 %
спирте — 2 ч, 100 % спирте — в двух сменах по 2 ч в каждой, в
хлороформе — 16 ч, парафине — в трех сменах по 3 ч в
каждой. После этого их помещают в ванночки со свежим
расплавленным парафином и охлаждают. С полученных таким образом
блоков на микротоме приготавливают срезы толщиной 3 —
7 мкм. Следует отметить, что даже незначительные
механические повреждения срезов из-за дефектов на ноже в дальнейшем
могут привести к локальному неспецифическому окрашиванию.
Срезы снимают в ванночку на воду, температура которой
должна быть несколько ниже точки плавления парафина, и затем
монтируют на чистые стекла или стекла, предварительно
обработанные белком, желатином либо поли-Ь-лизином. Затем
срезы на стеклах сушат в термостате при 37 °С в течение ночи и
охлаждают до комнатной температуры. В процессе дальнейшей
обработки срезов — их депарафинирования и регидратации —
стекла помещают в постоянно перемешиваемый ксилол на 1 —
2 мин. Иногда для полного депарафинирования срезов этого
недостаточно и в этом случае стекла со срезами, предварительно
нагретые до 60 °С, помещают в ксилол не более чем на 1 мин
(в противном случае значительно снижается антигенная
активность). После обработки в ксилоле срезы быстро ополаскивают
абсолютным спиртом и помещают в ванночку с постоянно
перемешиваемым абсолютным спиртом на 1 мин. Далее срезы
промывают в проточной воде или в нескольких сменах ПБС.
Подготовка срезов к иммуномечению
Для успешного проведения иммуноцитохимической реакции
необходимо создать определенные оптимальные условия,
которые, с одной стороны, повысили бы эффективность
взаимодействия антигена с антителом, а с другой — свели бы к минимуму
неспецифическое окрашивание (фон). С этой целью применяют
комплекс приемов обработки срезов перед их инкубацией с
первыми (специфическими) антителами, причем их применение
должно быть обусловлено особенностями каждой ткани и
выявляемого антигена. Другими словами, вопрос о целесообразности
той или иной предварительной обработки срезов нужно решать
эмпирически.
132
Протеолитические ферменты
Как отмечалось выше, альдегидные фиксаторы способствуют
«сшиванию» белковых молекул и образованию
внутримолекулярных связей, часто затрудняющих доступ антитела к
антигену. Общепринято, что разрушение этих связей
протеолитическими ферментами, такими как трипсин, протеиназа, пепсин и
др., облегчает взаимодействие антитела с антигеном. Однако
следует иметь в виду, что наряду с благоприятным действием
протеолитические ферменты могут, с одной стороны,
повреждать структуру самого антигена, а с другой — расщеплять
молекулу предшественника с образованием антигеноподобной
структуры. В том и другом случае в результате иммуноцитохимичес-
кой реакции проявится неспецифическое окрашивание. Кроме
того, инкубация с протеолитическими ферментами ухудшает
общую сохранность ткани. При этом наиболее щадящее и легко
контролируемое действие оказывает трипсин [Ро1ак ]., Уап
№югс!еп 5., 1986; ^пез Е., Сге^огу ]., 1988].
Практические рекомендации, а) Приготовить 0,1 % раствор
трипсина Ш^со) и 0,1 % хлорида кальция на ТБС (0,05 М
трис-НС1-буфер в изотоническом растворе хлорида натрия,
рН 7,6). б) Инкубировать срезы в среде «а» при 37 °С в течение
30 мин при постоянном медленном перемешивании среды.
Концентрация трипсина и время инкубации срезов должны быть
подобраны эмпирически.
Помимо трипсина, можно использовать протеазу, которая
является более активным протеолитическим ферментом.
Согласно протоколу [Лопез Е., Сге^огу ]., 1988], срезы
инкубируют в 0,05 % растворе протеазы (51§та: тип XXIV) на трис-НС1-
буфере (рН 7,4) в течение 30 — 60 мин при 37 °С.
Детергенты
Уже в начале развития иммуноцитохимии было очевидно, что
проникновение таких высокомолекулярных соединений, как
антитела (иммуноглобулины), через мембраны, а
следовательно, и их доступ к внутриклеточным антигенам весьма
ограничены. С целью увеличения проницаемости мембран в настоящее
время широко применяют такие вещества-детергенты, как
тритон Х-100 или сапонин, повреждающие липидную компоненту
мембран. Изредка с этой целью используют и другие приемы,
например осмотический шок мембран, вызываемый
дегидратацией срезов в спиртах возрастающей концентрации и ксилоле с
последующей их регидратацией [Вегой А. е! а1., 1981; Ро1ак ].,
Vап Ыоогйеп 3., 1986, и др.]. Однако при увеличении
проницаемости мембран, особенно в случае использования детергентов,
появляется вероятность диффузии антигена. Следует отметить,
что упомянутые выше детергенты не только влияют на проница-
133
емость мембран, но и отчасти предотвращают неспецифическую
адсорбцию белков на срезах, снижая таким образом
неспецифический фон реакции.
Практические рекомендации. При использовании тритона в
качестве детергента срезы инкубируют в 0,1 —0,3 % тритоне Х-100
на ПБС в течение 20 — 30 мин при комнатной температуре.
Коммерческий (100 %) тритон (51§та и др.) обладает высокой
вязкостью, вследствие чего он неудобен в работе, поэтому сначала
целесообразно приготовить 10 % водный (маточный) раствор тритона,
который можно хранить длительное время при 4 °С.
Неиммунная сыворотка
Трудности в использовании иммуноцитохимических методов
связаны с появлением при определенных обстоятельствах
высокого неспецифического фона, т.е. окрашивания, не
обусловленного реакцией антиген —антитело. Наиболее частой причиной
возникновения такого фона является наличие в ткани
высокозаряженных неантигенных молекул, с которыми и связываются
антитела за счет ионных сил.
Наиболее эффективный способ снижения такого фона —
предшествующая иммунологической реакции инкубация срезов
с неиммунной сывороткой животных, у которых получены
вторые антитела. Эта сыворотка в концентрации 2 —5 % блокирует
высокозаряженные участки ткани, оставляя, однако,
свободными антигены для связывания со специфическими антителами.
Фон может быть также несколько снижен путем разведения
первой антисыворотки. При использовании моноклональных
антител нет необходимости в преинкубации с неиммунной
сывороткой, так как при их оптимальном разведении фон
практически отсутствует.
Практические рекомендации. Учитывая то, что вторые
антитела обычно вырабатываются у козы или овцы, используют
неиммунную сыворотку этих же животных. Срезы инкубируют
в 2 —5 % неиммунной сыворотке, приготовленной на ПБС, при
комнатной температуре в течение 10 — 30 мин.
Ингибирование эндогенных ферментов
При использовании ферментов в качестве маркеров антител
существует опасность появления неспецифического фона в связи с
наличием в ткани таких же эндогенных ферментов.
Наиболее часто в качестве маркера антител используют пе-
роксидазу, которая в большом количестве содержится в
некоторых клетках, например клетках крови. Ингибирование
эндогенной пероксидазы обеспечивают путем инкубации срезов с
перекисью водорода, метанолом, соляной кислотой, боргидридом
натрия, йодноватой кислотой и т.д. Однако следует отметить,
134
что подавление эндогенной пероксидазной активности на криос-
татных срезах нередко приводит к снижению их антигенной
активности. В связи с этим ингибирование эндогенной пероксида-
зы рекомендуют проводить после инкубации криостатных
срезов с первыми антителами, т.е. после образования т зИи недиф-
фундируемого комплекса антиген —антитело.
В качестве маркера антител также довольно широко
используют щелочную фосфатазу, содержание которой особенно
велико в желудочно-кишечном тракте. Этот эндогенный фермент
блокируется левамизолом [Ропйег В., \УПкт5 М., 1981].
При использовании авидин-биотинового метода источником
фона может явиться эндогенный биотин, которым особенно
богаты печень и почки. Эндогенный биотин можно заблокировать
свободным авидином с последующим насыщением его связей
немеченым биотином. Поскольку молекула биотина обладает
только одной связью с авидином, описанные выше
манипуляции приводят к устранению или по крайней мере к
значительному снижению фона.
Практические рекомендации. Для ингибирования эндогенной
пероксидазы срезы чаще всего инкубируют с 0,2—1,0 %
перекисью водорода на ПБС в течение 30 мин при комнатной
температуре. С этой целью используют и другие растворы: а) 1 % перекись
водорода на метаноле в течение 10 мин при комнатной
температуре; б) 2 % соляную кислоту на метаноле в течение 30 мин; в) 1 %
нитроферроцианид натрия и 0 2 % уксусную кислоту на метаноле;
г) 2 % йодноватую кислоту в течение 10 мин. В последнем случае
необходима дополнительная постинкубация в водном растворе бо-
рогидрида натрия (0,1 мг/мл) в течение 10 мин для уменьшения
образования альдегидов.
Для блокирования эндогенной активности биотина срезы
необходимо последовательно инкубировать с авидином (1 мг/мл)
20 мин и биотином (0,1 мг/мл) 20 мин. После каждой из этих
двух инкубации срезы промывают ПБС или ТБС по 5 мин.
Иммуномечение
Прямой метод
Прямой метод явился первым и наиболее простым иммуноцито-
химическим подходом, основанным на непосредственном
выявлении антигена в ткани с помощью меченых антител.
В качестве метки антител чаще всего используют
флюоресцирующие красители, реже — пероксидазу хрена. Независимо от
модификации иммуноцитохимического метода у препаратов с
флюоресцентной и пероксидазной меткой имеются
определенные недостатки и достоинства. Так, на приготовление
препаратов с пероксидазной меткой затрачивают больше времени из-за
дополнительных операций — подавления активности эндоген-
135
ной пероксидазы и гистохимического выявления фермента с
помощью широкого круга хромогенов. Меченные пероксидазой
препараты можно дегидратировать, заключать в синтетическую
среду и таким образом хранить в течение длительного периода
времени, используя для анализа обычный световой микроскоп.
Препараты с флюоресцентной меткой, наоборот, короткоживу-
щие, и для их анализа должен быть использован специальный
флюоресцентный микроскоп. Наиболее важным преимуществом
антител, меченных пероксидазой, является возможность
использования полученного материала не только на светооптичес-
ком, но и на электронно-микроскопическом уровне. В целом же
прямой метод наименее чувствителен по сравнению с
остальными модификациями, однако чрезвычайно прост, поэтому его до
сих пор часто используют при экспресс-анализе [Ро1ак }.у Уап
Ыоогёеп 5., 1986].
Одним из наиболее важных условий успешного проведения
любой иммуноцитохимической реакции является подбор
оптимального разведения первых (специфических) антител. Этот
параметр зависит от ряда факторов: температуры, при которой
осуществляют инкубацию срезов; длительности инкубации; типа
срезов (вибратомные, замороженные или парафиновые);
длительности фиксации; типа фиксации; предшествующей обработки
срезов (протеолитическими ферментами, тритоном и др.).
Практические рекомендации. Подбор оптимального
разведения первых антител проводят эмпирически по результатам
инкубации срезов с удваивающимся разведением
антисыворотки (1:5, 1:10, ..., 1:320, ...). Инкубация с первой
антисывороткой может продолжаться 30 — 60 мин при комнатной
температуре или 12 — 48 ч при 4 °С. В первом случае необходимо
использовать более концентрированную антисыворотку, обычно с
разведением 1:50—1:300, а во втором — с большим разведением —
1:100—1:30 000. При оптимальном разведении антисыворотки
наблюдается максимальная разница в окрашивании срезов
между сигналом и фоном. Эта разница, как правило, больше
при длительной инкубации срезов в сильно разведенной
антисыворотке на холоду, чем при кратковременной инкубации в
концентрированной антисыворотке при комнатной температуре.
При особенно длительной инкубации срезов в первую
антисыворотку следует добавлять бактериостатики — азид натрия
(0,01—0,1 %) или мертиолат (0,01 %). Применение азида
натрия для консервации антител, меченных пероксидазой хрена,
полностью исключается, так как этот бактериостатик ингибиру-
ет активность пероксидазы. После иммунологической реакции
срезы отмывают в 3 — 5 сменах ПБС по 30 мин в каждой для
удаления избытка первых меченых антител [Ро1ак ]., Уап 1Моог-
с!еп 5., 1986; ^пез Е., Сге^огу ]., 1988].
Следует отметить, что независимо от модификации иммуно-
цитохимического метода инкубацию плавающих срезов осу-
136
ществляют в небольшом объеме антисывороток (0,5—1,5 мл) —
в маленьких бюксах или пенициллиновых пузырьках, причем
для лучшего доступа антисывороток к ткани количество срезов
не должно превышать 10—15 в одном пузырьке. От
антисывороток срезы отмывают в гораздо большем объеме ПБС (30 —
50 мл) — в стеклянных кристаллизаторах. В случае
применения антисывороток и промывочного ПБС растворы необходимо
постоянно перемешивать путем медленной ротации сосудов или
их плавного покачивания.
В том случае, если срезы наклеены на предметные стекла,
инкубацию с антисыворотками осуществляют на самих стеклах.
Для этого края стекол, влажных после промывания срезов в
ПБС, протирают насухо краем фильтровальной бумаги, в
результате чего создается несмачиваемая краевая зона. После
этого на слегка увлажненные ПБС срезы из автоматической
микропипетки капают антисыворотку, обычно около 100 — 200 мкл на
стекло, а при определенном навыке и меньше. Стекла помещают
в горизонтальном положении во влажную камеру —
пластмассовую коробку с вмонтированным штативом для стекол, дно
которой покрыто пропитанной дистиллированной водой
фильтровальной бумагой. Находясь в холодильнике в таком состоянии,
срезы не подсыхают в течение 2 — 3 дней. После инкубации
антисыворотки аккуратно собирают со срезов пипеткой, а
стекла со срезами помещают в специальные штативы и отмывают в
ванночках, заполненных ПБС.
Метод гистохимического выявления пероксидазы хрена —
см. раздел «Метод немеченых антител».
Непрямой метод
В случае применения непрямого метода первичные
(специфические) немеченые антитела выявляют с помощью меченых
вторичных антител к иммуноглобулинам животного, у которого
выработаны первичные антитела. Это означает, например, что
кроличьи антитела к тканевому антигену в свою очередь
выступают в роли иммуноглобулина антигена для вторичного
меченого антитела, выработанного в любом другом животном, чаще
всего в овце или козе. В качестве метки вторых антител
используют флюоресцентные красители, пероксидазу хрена и др.
Наибольшей чувствительностью обладает модификация метода с
использованием связанных с биотином вторых антител, которые
выявляют с помощью авидина, меченного пероксидазои или
флюоресцентным красителем [С1 С. еЬ а1., 1986].
Преимущества непрямого метода по сравнению с прямым
заключаются в том, что: а) антисыворотка к иммуноглобулинам
чрезвычайно гипериммунна и обладает высоким сродством к
ним; 6) с каждой молекулой первичного антитела связываются
две молекулы вторичных антител, в результате чего значитель-
137
но повышается чувствительность метода и можно использовать
первую антисыворотку в большем разведении; в) все первые
антитела, выработанные у одного и того же вида животного к
различным антигенам, могут быть выявлены с помощью одних
и тех же меченых антител [Ро1ак ]., Уап Ькюгйеп 5., 1986].
Недостатки метода — большие затраты времени и возникновение
дополнительной опасности неспецифических реакций.
Практические рекомендации. В случае применения
непрямого метода необходимо эмпирически подбирать разведения не
только первой, но и второй антисыворотки, например по схеме,
предложенной в 1988 г. Е. ,1опе5 и ]. Сге§огу (табл. 4).
Таблица 4 Схема подбора оптимального разведения антисывороток для
непрямого метода
Первые антитела
1/50 1/200 1/500 1/1000
Вторые антитела
1/50
1/100
1/200
При использовании коммерческих антисывороток первичная
информация об их разведении может быть получена из
сопроводительного описания.
Как упоминалось выше, иммуноцитохимический процесс при
использовании непрямого метода двухэтапный: 1) обычно
инкубацию с первыми антителами проводят в таких же условиях,
как и в случае применения прямого метода: 30 — 60 мин при
комнатной температуре или 12 — 48 ч при 4 °С, однако
разведение первых антител в обоих случаях должно быть выше. После
этого срезы отмывают в трех сменах ПБС по 30 мин в каждой;
2) инкубацию со вторыми мечеными антителами в подобранном
разведении (обычно 1/30 — 1/100) проводят в течение 30 —
60 мин при комнатной температуре с последующим отмыванием
срезов в трех сменах ПБС по 30 мин в каждой.
Метод немеченых антител
Если непрямой метод является «двухслойным», то метод
немеченых антител, предложенный Ь.А. 51:егпЬег§ег и соавт. (1970),
«трехслойный». Первый слой, как и в предыдущих
модификациях, образован немечеными антителами (обычно кроличьими)
к тканевому антигену, второй — немечеными антителами
(обычно овцы или козы) к иммуноглобулинам животного, у
которого выработаны первые (специфические) антитела, третий
138
слой представляет собой антитела к метке, выработанные в
животном того же вида, в котором получены антитела к тканевому
антигену (обычно кролик). Таким образом, в третьем слое
антитела связаны с меткой иммунологически. Следует отметить, что
вторые антитела способны выполнять функцию мостика между
первыми и третьими только при условии их избыточной
концентрации по отношению к первым антителам. В этом случае
лишь один РаЬ-фрагмент второго антитела связывается с
первым антителом, а второй РаЬ-фрагмент сохраняется свободным
для связи с третьим антителом. Метод немеченых антител,
наиболее широко применяемый в настоящее время в иммуноцито-
химии, имеет несколько модификаций в зависимости от
используемой метки третьего уровня и характера ее связи с третьими
антителами.
Пероксидаза-антипероксидазный метод
В начале 70-х годов Ь. 51егпЬег§ег и соавт. предложили
использовать в качестве третьего уровня в технике немеченых антител
пероксидаза-антипероксидазный (ПАП) комплекс, который
образован молекулами пероксидазы, связанными с антителами к
пероксидазе, выработанными в животном того же вида, которое
было использовано для получения первых антител (обычно
кролик).
Этот метод характеризуется чрезвычайно высокой
чувствительностью, так как на каждую молекулу первого антитела
приходится три молекулы пероксидазы, причем при
иммунологическом образовании ПАП-комплекса активность пероксидазы
полностью сохраняется. В то же время такая высокая
концентрация пероксидазной метки позволяет значительно увеличить
разведение первой антисыворотки, что в свою очередь приводит
к резкому снижению концентрации побочных антител
(например, антител к примесям иммуногена) и падению фона. Низкий
фон при использовании ПАП-метода также обусловлен высокой
очисткой коммерческого ПАП-комплекса и блокированием
потенциальных мест его неспецифического связывания тканью
путем предварительной инкубации материала с нормальной
сывороткой животного того вида, у которого были выработаны
вторые антитела. Единственными недостатками ПАП-метода
являются его относительная трудоемкость и расходование некоторых
дополните 1ьных реактивов [Ро1ок ]., Уап Моогйеп 5., 1986].
Конечный этап иммуноцитохимической реакции —
выявление маркерного фермента — пероксидазы хрена (ПХ) с
помощью субстрата ферментативной реакции — перекиси воздуха и
хромогена. В процессе реакции образуется комплекс
пероксидазы с перекисью водорода, взаимодействующий с донором
электронов, в результате чего образуется нерастворимый
окрашенный продукт реакции и вода.
139
В качестве донора электрона чаще всего используют ДАБ —
3,3'-диамино6ензидинтетрагидрохлорид (§1§та),
обеспечивающий образование темно-коричневого нерастворимого осадка в
месте реакции. Нерастворимый осадок дает также п-фениленди-
аминдигидрохлорид/пирокатехол (Напкег —Уа1ез), однако
реакция с его участием довольно плохо воспроизводима. Для
выявления пероксидазы используют и другие хромогены: 3-амино-
9-этилкарбазол и 4-хлоро-1 -нафтол, образующие
соответственно красный и синий депозиты. Серьезным недостатком обоих
хромогенов является растворимость в спиртах продукта их
реакции, т.е. невозможность приготовления долгоживущих
(постоянных) препаратов.
Важным преимуществом ПАП-метода с последующим
выявлением ДАБ-продукта гистохимической реакции является
возможность увеличения его оптической плотности — в основном
за счет осаждения в местах реакции таких металлов, как
кобальт, никель, серебро, золото, осмий и др. Такого рода
интенсификация позволяет, с одной стороны, существенно увеличить
разрешающую способность иммуноцитохимического метода, а с
другой — использовать его для «двойного» мечения.
Практические рекомендации. Обработку материала при
использовании метода немеченых антител проводят в такой
последовательности.
1. Инкубация отмытых в ПБС срезов с первой
антисывороткой в тех же условиях, что и в случае применения других
методов, однако обычно при большом ее разведении. После
инкубации срезы отмывают в трех сменах ПБС по 30 мин в каждой.
2. Инкубация со второй антисывороткой (МогсНс, З^та),
обычно в разведении 1/100, в течение 2 ч при комнатной
температуре с последующей стандартной отмывкой в ПБС.
3. Инкубация с ПАП-комплексом (51§та, Бакораиз), обычно
в разведении 1/200, в течение 1 ч при комнатной температуре.
На этом этапе особенно важно тщательно отмыть избыток ПАП-
комплекса в нескольких сменах ПБС в течение нескольких часов.
Желательно перед выявлением пероксидазы в ПБС оставить
материал на ночь в холодильнике. В том случае, когда
исследователь имеет дело с совершенно незнакомыми ему тканью и
антигеном, рекомендуется подбирать оптимальные разведения второй и
третьей антисывороток по схеме, предложенной в 1988 г. Е. ^пез
и ]. Сгедогу (табл. 5).
4. Выявление пероксидазы хрена. Поскольку пероксидаза
оказалась универсальным маркером антител, был разработан
ряд методов ее выявления и интенсификации первичного
продукта гистохимической реакции. В большинстве рутинных им-
муноцитохимических исследований для выявления пероксидазы
срезы инкубируют в среде, содержащей 0,01—0,06 % ДАБ и
0,01—0,03 % перекись водорода на 0,05 М трис-НС1-6уфере
(рН 7,6) или ПБС (рН 7,2), в течение 5 — 20 мин. Реакцию кон-
140
Таблица 5. Схема выбора оптимального разведения второй
антисыворотки и ПАП-комплекса
ПАП-комплекс
1/50 1/100 1/200
Вторые антитела
1/50
1/100
1/200
тролируют под бинокулярной лупой или световым
микроскопом, однако при минимальном освещении реакционной среды
ввиду ее нестабильности. Несмотря на то что представления о
канцерогенном эффекте диаминобензидина существенно
пересмотрены, все же необходимо соблюдать определенную технику
безопасности — работать с ДАБ в резиновых перчатках в
вытяжном шкафу.
Помимо ДАБ, окрашивающего продукт реакции в
коричневый цвет, для выявления пероксидазы используют и другие
хромогены, окрашивающие его в другие цвета: З-амино-9-этилкар-
базол — в красный, 4-хлоро-1-нафтол — в синий, п-фениленди-
аминдигидрохлорид/пирокатехол, о-дианизидин ди-НС1 — в
зеленый, а-нафтол с пиронином — в красный. Протоколы
приготовления инкубационной среды для выявления пероксидазы с
наиболее широко применяемыми хромогенами приведены в
Приложении.
Интенсификация ДА Б-п родукта реакции.
1. В самом простом варианте оптическую плотность ДАБ-про-
дукта можно несколько увеличить при добавлении в
инкубационную среду обычного состава на ПБС (рН 7,0) 10 мМ имида-
зола (51§та) [51гаиз \У., 1982].
2. Более эффективной является модификация реакционной
среды с добавлением в нее п-кризола. Состав среды: 0,07 %
(объемных) п-кризола + 0,01 % перекиси водорода + 0,01 %
ДАБ на 0,05 М лимонной кислоты — 6,2 М ацетата аммония
(рН 6,5).
3. Наиболее эффективной, но в такой же степени трудоемкой
и несколько «капризной» является интенсификация ДАБ-про-
дукта серебром и золотом. После окончания ДАБ-реакции среды:
а) отмывают в двух сменах 2 % ацетата натрия по 15 мин в
каждой при комнатной температуре;
б) инкубируют в водном растворе 10 % тиогликолевой
кислоты (Пика) в течение 6—12 ч при 4 °С, что предотвращает не-
специфическое связывание тканью серебра. Тиогликолевая
кислота чрезвычайно токсична, поэтому с ней необходимо работать
в резиновых перчатках в вытяжном шкафу;
141
в) отмывают в четырех сменах 2 % ацетата натрия по 15 мин
в каждой при комнатной температуре;
г) проявляют в течение 5—15 мин в свежеприготовленном
«физическом проявителе» при комнатной температуре.
Реакцию осуществляют в идеально чистых, без механических
дефектов стекла кристаллизаторах вместимостью 20 — 50 мл.
Проявление необходимо проводить в темноте, однако время от
времени контролируя его под бинокулярной лупой или микроскопом.
Реакцию доводят до отчетливого почернения ДАБ-иммунопози-
тивных структур и появления небольшого сероватого фона;
д) инкубируют в 1 % растворе уксусной кислоты в течение 5
мин при комнатной температуре с целью остановки процесса
интенсификации серебром;
е) отмывают в 2 % ацетате натрия в течение 5 мин при
комнатной температуре;
ж) инкубируют в 0,05 % водном растворе золотохлористоводо-
родной кислоты в течение 8—10 мин при 4 °С, что обеспечивает
еще большее увеличение оптической плотности ДАБ-продукта;
з) снова отмывают в 2 % ацетате натрия в течение 5 мин при
комнатной температуре;
и) инкубируют в двух сменах 3 % водного раствора
тиосульфата натрия по 10 мин в каждой при комнатной температуре
для удаления неспецифически адсорбированного на срезах
серебра;
к) отмывают сначала в двух сменах 2 % ацетата натрия по
5 мин в каждой, а затем в ПБС еще в течение 10 мин.
Существуют и другие менее трудоемкие способы
интенсификации ДАБ-продукта.
4. Интенсификация осмием. После ДАБ срезы инкубируют в
1 % водном растворе тетраоксида осмия. Реакцию
контролируют под световым микроскопом.
5. Интенсификация хлоридом кобальта. К 100 мл ДАБ-рас-
твора добавляют, помешивая, 2 мл 1 % хлорида кобальта.
Среды инкубируют в этом растворе в течение 6 мин, после чего
добавляют в него необходимое количество перекиси водорода
[Нзи §., 5оЬап Е., 1982].
6. Интенсификация никелем. Проявление срезов после
инкубации с ПАП-комплексом осуществляют в среде, состоящей из
0,035 % ДАБ, 2,5 % никеля-аммония сульфата, 0,01 % раствора
перекиси водорода в 0,1 М ацетатном буфере (рН 6,0).
Авидин-биотиновый метод
По чувствительности авидин-биотиновый (АБС) метод
превосходит даже ПАП-метод и в последнее время все больше
вытесняет его из экспериментальной практики [Нзи 5. еЬ а1., 1981;
С1 С. е1 а1., 1986]. В основе АБС-метода лежит способность
к прочному связыванию высокомолекулярного гликопротеи-
142
на — авидина, получаемого из яичного белка, с
низкомолекулярным витамином — биотином, входящим в состав яичного
желтка. Кроме того, биотин способен связываться в высокой
пропорции с высокомолекулярными соединениями, такими как
антитела (иммуноглобулины) и пероксидаза хрена. Так, с
одной молекулой антитела связывается до 150 молекул биотина.
Авидин также может образовывать комплексы с различными
маркерами, включая ферменты (пероксидаза, фосфатаза, р-га-
лактозидаза), флюоресцентные красители (родамин, флюорес-
цеин), коллоидное золото, ферритин и др.
Важной особенностью третичной структуры молекулы
авидина является наличие на его поверхности четырех
гидрофобных «карманов», обеспечивающих специфическое связывание
четырех молекул биотина.
Однако авидин не лишен некоторых недостатков, поскольку
его молекула характеризуется высокой изоэлектрической
точкой (10,5) и наличием олигосахаридных фрагментов. С
помощью этих фрагментов авидин может связываться с лектинопо-
добными эндогенными белками и некоторыми другими
соединениями, в то время как при нейтральном рН весьма вероятно
связывание авидина отрицательно заряженными участками
ткани, например клеточными мембранами и ядрами, что в
целом приводит к появлению фона. Эти трудности можно
преодолеть, заменив авидин на стрептавидин —
высокомолекулярный белок, получаемый из культуральной среды 51;гер{;отусе5
аУ1сНш. Как и молекула авидина, молекула стрептавидина
обладает четырьмя субъединицами с сильным сродством к
молекулам биотина. В то же время молекула стрептавидина
характеризуется наличием нейтральной изоэлектрической точки и
отсутствием олигосахаридных фрагментов. Все это в совокупности
приводит к значительному уменьшению вероятности ее
неспецифического связывания тканью [С1 О. еЬ а1., 1986].
Указанные выше особенности авидина (стрептавидина) и
биотина позволяют использовать их в различных комбинациях
практически во всех модификациях иммуноцитохимического
метода. Наибольшее признание получил непрямой метод с
использованием коммерческого авидин-биотин-пероксидазного
комплекса (АБС-метод), с помощью которого выявляют биоти-
нилированные лектины, гормоны, молекулярные зонды
нуклеиновых кислот и др.
Особенностью всех иммуноцитохимических методов, в
основе которых лежит взаимодействие авидина и биотина, является
использование биотинилированных антител: первых антител в
случае применения прямого метода и вторых — при
использовании непрямого метода. В свою очередь биотинилированные
антитела выявляют с помощью: а) меченого авидина; б)
авидина, выполняющего роль мостика между антителами и биотини-
лированным ферментом; в) АБС-метода.
143
Наиболее широко используемый АБС-метод, как и ПАП-
метод, состоит из трех неидентичных этапов: а) связывание
первых (специфических) антител (обычно кроличьих) с тканевым
антигеном; б) взаимодействие вторых антител (обычно козы
против иммуноглобулинов кролика), связанных с биотином, с
первыми антителами; в) взаимодействие биотина вторых
антител с авидином авидин-биотин-пероксидазного комплекса.
Третий слой в эгом «сэндвиче» — комплекс авидина и биотина,
связанного с иероксидазой. Взаимодействие авидина и меченого
биотина осуществляется в такой пропорции, при которой часть
потенциальных связей биотина на молекуле авидина остается
свободной. За счет именно этих связей на третьем этапе имму-
ногистохимической реакции взаимодействуют биотин,
связанный со вторыми антителами, и авидин
авидин-биотин-пероксидазного комплекса. В конечном счете на каждую молекулу
антигена приходится много молекул пероксидазы, что
обусловливает высокую чувствительность метода [Нзи 5. е1: а1., 1981;
Со8§1 О. е* а1., 1986; Ро1ак ]., Уап №югс1еп 5., 1986].
Помимо авидин-биотин-пероксидазного комплекса, в
световой иммуноцитохимии применяют, хотя и крайне редко, ави-
дин-биотиновые комплексы, меченные радионуклидами или
коллоидным золотом.
Практические рекомендации. 1. Прямой АБС-метод:
а) инкубация срезов с сильно разведенными биотинилиро-
ванными первыми антителами 0,5 — 2 ч при комнатной
температуре или в течение ночи при 4 °С;
б) отмывание в ПБС или ТБС — три смены по 5 мин в
каждой при комнатной температуре;
в) инкубация с авидином, меченным флюоресцентным
красителем (например, флюоресцеин-изотиоционатом или тетраме-
тилродамин-изотиоцианатом) или пероксидазой в течение 30 мин
при комнатной температуре;
г) отмывание в ПБС или ТБС;
д) выявление пероксидазы.
2. Непрямой метод с помощью меченого авидина:
а) инкубация с сильно разведенной немеченой первой
антисывороткой 0,5 — 2 ч при комнатной температуре или в течение
ночи при 4 °С;
б) отмывание в трех сменах ПБС или ТБС по 5 мин в
каждой при комнатной температуре;
в) инкубация со вторыми биотинилированными антителами
(Уес1:ог) 30 мин при комнатной температуре; далее в случае
флюоресцентной или пероксидазной метки те же манипуляции,
что и при использовании прямого метода (см. «в», «г», «д»).
В случае же применения авидина или стрептавидина,
меченного коллоидным золотом, инкубации срезов с первыми
антителами предшествует преинкубация их в трех сменах ПБС или
ТБС, содержащем 2,5 % хлорид натрия и 0,5 % Твин 80 (Т^ееп
144
80), по 5 мин в каждой. Этот же раствор используют для
отмывания срезов после антисывороток. Этапы «а» и «6» повторяют
без изменений, после чего следуют:
в) инкубация с 1 % бычьим сывороточным альбумином на
ПБС или ТБС (рН 8,2) в течение 5 мин;
г) инкубация со стрептавидином, меченным золотом, на ПБС
или ТБС в течение 30 мин при комнатной температуре;
д) повторение этапа «д»;
е) повторение преинкубации;
ж) отмывание в трех сменах дистиллированной воды по
5 мин в каждой. На этом этапе коллоидное золото можно
интенсифицировать серебром. С этой целью следует:
а) проявить срезы в специальном растворе в течение 5 мин в
темноте;
б) остановить проявление в фотографическом фиксаже,
разведенном в 4 раза, в течение 2 мин;
в) промыть срезы в проточной воде в течение 5 мин.
3. Непрямой метод с помощью авидин-биотин-пероксидазно-
го комплекса:
а) до пункта «в» повторить все действия, как при
использовании предыдущего (непрямого) метода;
б) инкубация авидин-биотин-пероксидазным комплексом,
приготовленным за 30 мин до ее начала, или с комплексом
стрептавидин — биотинилированная пероксидаза в разведении
1:200 (АтегзЬат) в течение 30 мин при комнатной температуре;
в) стандартная отмывка в ПБС или ТБС;
г) выявление пероксидазы.
Неспецифическое окрашивание (фон)
Как уже отмечалось, несмотря на высокую специфичность
реакции антиген —антитело, иммуногистохимики часто
сталкиваются с проблемой неспецифического окрашивания — фона,
который может быть диффузным или иметь вид избирательно
окрашенных структур или участков ткани. Существует ряд причин
возникновения фона, которые при определенных условиях
могут быть устранены.
1. Материал, используемый для иммуногистохимических
исследований, особенно криостатные срезы, обладает
рецепторами к Рс-фрагменту иммуноглобулинов, что приводит к
неспецифическому связыванию антител. Как отмечалось ранее, этого
можно избежать, добавляя в антисыворотки и промывочные
буферы нормальную, обычно 1 %, сыворотку того вида
животного, у которого получены вторые антитела. При этом тканевые
рецепторы к Рс связываются по конкурентному принципу
иммуноглобулинами нормальной сыворотки и становятся, таким
образом, недоступными для первых антител. В свою очередь
вторые антитела не будут связываться с этими иммуноглобулина-
145
ми, поскольку они получены у одного и того же вида
животного. С этой же целью иногда используют гомогенаты печени.
2. Иммуноглобулины также могут связываться
неспецифически с тканью, особенно с ее заряженными участками, с помощью
гидрофобных или электростатических сил. Таким же образом с
тканью может взаимодействовать комплемент, что также
приводит к неспецифическому связыванию иммуноглобулинов, которое
можно предотвратить: а) как можно большим разведением первой
и второй антисывороток; б) инактивацией комплемента всех
сывороток при нагревании до 56 °С в течение 30 мин; в) увеличением
ионной силы антисывороток или промывочных буферов путем
повышения концентрации хлорида натрия в этих растворах до 2,5 %
или использования трис-НС1-6уфера, обладающего большей
ионной силой по сравнению с фосфатным буфером. Иногда с этой же
целью в растворы антисывороток и промывочные буферы
добавляют тритон Х-100 [Ро1ак ]., Уап Ккюгскп 5., 1986].
3. Причиной появления фона может послужить и то, что
антитела к иммуноглобулинам одного вида животных окажутся
реактивными и по отношению к иммуноглобулинам других
видов. Это означает, что вторые антитела могут связываться с
тканью, хотя и специфически, но не с комплексом антиген —
первое антитело. Эту проблему можно решить, добавив ко
второй антисыворотке 5 % нормальную сыворотку того животного,
у которого выявляется антиген.
4. В случае фиксации материала параформальдегидом или
глутаровым альдегидом источником фона могут быть свободные
альдегидные группы, связывающие иммуноглобулины, в
частности антитела. Это особенно отчетливо проявляется при
недостаточно тщательном отмывании ткани от фиксатора. Такого
рода фон можно снизить путем связывания свободных
альдегидных групп борогидридом калия или натрия.
5. При использовании пероксидазной метки постоянно
существует опасность появления фона, обусловленного эндогенной
пероксидазой. В этом случае необходимо использовать
фармакологические подходы, обеспечивающие инактивацию этого
фермента. В некоторых случаях, например при работе с криос-
татными срезами, ингибирование пероксидазной активности
можно проводить только после инкубации материала с первой
антисывороткой, т.е. после образования недиффундируемого
комплекса антиген —антитело.
6. В состав поликлональной антисыворотки входят не только
антитела к выявляемому антигену, но также антитела к
макромолекуле, с которой он связан (в случае низкомолекулярных
антигенов), некоторым компонентом ткани, примесям в имму-
ногене и т.д. При высоком титре антител фон может быть
значительно снижен за счет высокого разведения антисыворотки.
Полностью устранить такой фон можно только при
использовании моноклональных антител.
146
Методы контроля специфичности иммуноокрашивания
Помимо специальных иммунологических тестов, для
определения специфичности антител существуют методы контроля
специфичности имммуноокрашивания на срезах. К ним в первую
очередь относятся позитивный и негативный контроль,
контроль с преабсорбцией.
Позитивный контроль. Идея позитивного контроля состоит
в выявлении антигена при обычной иммуноцитохимической
проводке в биологическом тест-объекте, т.е. в той ткани, в
которой он заведомо содержится. Желательно, чтобы содержание
антигена в биологическом тест-объекте было невелико, так как в
противном случае антиген будет выявляться даже при
малоэффективных антисыворотках и других реагентах [Ро1ак ]., Уап
№югс!еп 5., 1986].
Негативный контроль. Существуют две разновидности
негативного контроля. В одном случае при обычной
иммуноцитохимической проводке используют ткани, в которых антиген
заведомо отсутствует. В другом случае при выявлении антигена в
ткани, в которой он есть или может быть, в процессе обычной
иммуноцитохимической проводки исключают один из
принципиально важных этапов, например инкубацию с первыми
(специфическими) антителами, или заменяют ее инкубацией с
антителами к другому антигену, а также с неиммунной сывороткой.
Во всех приведенных случаях должна отсутствовать иммунопо-
зитивная реакция.
Контроль с преабсорбцией. Он основан на потере иммуно-
реактивности антител в результате их предварительной преаб-
сорбции с избытком антигена, к которому они выработаны. При
этом иммунореактивность антител не должна снижаться после
преабсорбции антисыворотки аналогичным количеством
веществ, по структуре похожих на антиген. В контроле с
преабсорбцией желательно использовать синтетический антиген,
исключающий реакцию с антителами, выработанными на
возможные примеси в антигене. Контроль с преабсорбцией
целесообразно использовать в случае новых антител. При этом важно
оценить количество антигена, необходимое для инактивации
антисыворотки при оптимальном ее разведении. Для этого в
равные порции антисыворотки добавляют антиген в постепенно
снижающейся концентрации, обычно от 10 до 0,001 нМ/мл.
Как правило, иммунореактивность полностью нивелируется
антигеном в концентрации 10 — 0,1 нМ/мл, тогда как при
меньшей концентрации (0,01—0,001 нМ/мл) этот эффект
проявляется лишь частично. Такого рода количественная оценка
позволяет сравнить реакцию антител одного вида на разные антигены
или, наоборот, реакцию различных антител на один и тот же
антиген.
147
Гистологическое окрашивание и заключение срезов
После проведения иммуноцитохимической реакции срезы
можно подкрасить и заключить. Характер соответствующих
процедур зависит от того, в какой степени растворим продукт
иммуноцитохимической реакции или первичная метка. Если
продукт реакции или метка нерастворима в воде и спиртах
(например, ДАБ-продукт), то срезы можно дегидратировать в
спиртах, просветлить в ксилолах и заключить в бальзам, пермо-
унт и другие среды, обеспечивающие длительное хранение
препаратов. Напротив, если продукт реакции или метка
растворимы (флюоресцентные красители, хлоронафтолпродукт и др.),
то срезы можно заключить только в водорастворимые среды
(например, глицерин с различным содержанием ПБС), которые
не обеспечивают сохранность срезов в течение длительного
периода времени.
Двойное иммуномечение
Перед исследователями нередко встает задача выявить на одном
и том же срезе два или более антигенов, содержащихся как в
разных клетках, так и в пределах одной и той же клетки.
Классическим примером являются нейросекреторные нейроны,
продуцирующие одновременно несколько физиологически
активных веществ — пептидов и/или моноаминов. С помощью
двойного иммуноцитохимического мечения можно решить и многие
другие задачи, например определить природу иннервации
нейронов строго определенной эргичности и др. [Угрюмов М.В.,
1989].
Для решения этих задач используют несколько стандартных
методических приемов.
Двойное мечение на серийных срезах
Наиболее простой способ идентифицировать два антигена в
одной и той же структуре — выявить их иммуноцитохимически
на двух последовательных срезах. Если размеры интересующей
структуры, например клетки, соизмеримы с толщиной среза, то
антигены необходимо выявлять на «зеркальных» срезах. Для
этого один из двух последовательных срезов переворачивают
таким образом, чтобы одна и та же пересеченная ножом
структура была на поверхности обоих срезов. После этого на первом
срезе выявляют один антиген, а на втором — другой. Далее
срезы фотографируют и производят наложение изображения
одного среза на изображение другого, идентифицируя таким
образом структуры, содержащие оба антигена.
148
Двойное мечение прямым методом
В этом случае два антигена выявляют с помощью двух первых
антител, меченных различными флюорофорами, например
флюоресцеином и родамином. Дальнейшее использование
соответствующих красителям фильтров позволяет различить метки
и таким образом локализовать оба антигена на срезах. Этот
метод, однако, малоэффективен в случае значительного
преобладания внутри клетки одного антигена над другим, так как при
этом одна метка маскирует другую.
Двойное мечение непрямым методом
Непрямой метод предполагает использование двух видов
первых антител соответственно к двум разным антигенам. Первые
антитела выявляются вторыми антителами с различной меткой.
Необходимым условием применения этого метода является
использование первых антител, полученных у разных видов
животных, и отсутствие перекрестной реакции у вторых, меченых,
антител. В качестве первых антител можно также использовать
моноклональные антитела, относящиеся к разным классам
иммуноглобулинов .
Двойное иммунопероксидазное мечение с элюированием
Этот метод предполагает последовательное использование
первых антител, выработанных к разным антигенам у одного и того
же вида животного. Пероксидазная метка вторых антител
выявляется при этом с помощью различных хромогенов (ДАБ, а-на-
фтол, пиронин), обеспечивающих образование продукта
реакции разной окраски (коричневый, красный). Перед выявлением
второго антигена всю цепочку предыдущей иммуноцитохими-
ческой реакции, начиная с первых антител, вымывают (элюиру-
ют) путем длительной инкубации в кислом буфере (например, в
глицин-НС1-буфере). Окрашенный продукт реакции
сохраняется при этом т зИ;и.
Этап элюирования является принципиально важным в
процессе двойного мечения, так как при этом: а) устраняется пе-
роксидаза, сохранившая свою активность после выявления
первого антигена; б) исключается возможность связывания первых
антител, выработанных против второго антигена, с вторыми
антителами первой иммуноцитохимической реакции. Элюирова-
ние в кислом буфере малоэффективно лишь в случае высокого
сродства антител к антигену. В этом случае диссоциация
комплекса антиген — первое антитело обеспечивается путем
короткого окисления перманганатом калия.
Несмотря на то что теоретически с помощью такого метода
можно выявить несколько антигенов на одном и том же срезе, в
149
настоящее время мало кто использует данный подход. Это
объясняется тем, что он требует большого количества довольно
трудоемких методов контроля. Так, перед выявлением каждого
последующего антигена необходимо быть уверенным в том, что
продукт предыдущей иммунологической реакции — комплекс
антитело —антиген, действительно полностью элюирован. В
противном случае неизбежны перекрестная реакция между
первыми антителами и /или выявление остаточной активности пе-
роксидазной метки. Кроме того, в реальных условиях довольно
трудно определить оптимальную концентрацию элюирующего
раствора для каждого антигена.
Двойное мечение без элюирования
Проблема перекрещивания двух последовательных иммуноци-
тохимических реакций с целью выявления двух антигенов на
одном и том же срезе эмпирически успешно решена Ь. 31:егпЬег-
§ег и Р. ^зерЬ (1979). Они установили, что интенсивное
проявление пероксидазы первой реакции блокирует (маскирует)
реактивные участки на всем срезе, предотвращая таким образом
неспецифическое связывание компонентов последующей имму-
ноцитохимической реакции. Если для выявления пероксидазы
первой реакции в качестве хромогена обычно используют ДАБ,
то во второй реакции проявление пероксидазы проводят в
присутствии 4-хлоро-1-нафтола. Как упоминалось выше, продукты
реакции этих хромогенов резко различаются по цвету.
Существенным недостатком этого варианта двойного мечения является
то, что продукт реакции, образующийся в присутствии 4-хлоро-
1-нафтола и большинства других хромогенов, за исключением
ДАБ, растворяется в воде и спирте, т.е. в этой ситуации срезы
нельзя дегидратировать и заключить в стойкую среду.
Упомянутого выше недостатка лишен иммунопероксидазный
метод без элюирования, предложенный венгерскими
исследователями [Ыроз^з 2. еЬ а1., 1983]. Первый антиген выявляют
классическим ПАП-методом с получением конечного продукта
ДАБ-реакции, который затем интенсифицируют серебром и
золотом. Потенциальные места неспецифического связывания в
процессе последующей иммуноцитохимической реакции
блокируются не только интенсивным проявлением пероксидазы, но и
довольно длительной (2 —б ч) инкубацией в тиогликолевой
кислоте, предшествующей интенсификации. Однако следует иметь
в виду, что эти же процедуры приводят к значительному
снижению активности второго антигена, поэтому важно первым
выявлять антиген с низкой активностью, а вторым — с высокой.
После окончания интенсификации срезы тщательно промывают
и затем полностью повторяют цикл иммуноцитохимической
реакции с целью выявления второго антигена. Этот процесс
заканчивается ДАБ-реакцией второго антигена. В результате
двойного
го мечения продукт гистохимической реакции,
соответствующий локализации первого антигена, окрашивается в интенсивно
черный цвет, в то время как продукт гистохимической реакции
второго антигена — в коричневый.
Практические рекомендации. 1. Фиксация, срезы:
а) перфузия крысы под наркозом ПБС (80— 150 мл),
фиксатором — 4 % параформальдегидом сначала при рН 6,5 (150 мл),
а затем при рН 10,5—10,8 (150 мл) при комнатной температуре;
б) фиксация мозга иммерсией в щелочном параформальдеги-
де в течение 2 — 3 дней при 4 °С;
в) приготовление вибратомных срезов толщиной 40 мкм и
отмывание их в восьми сменах ПБС по 15 мин в каждой.
2. Выявление первого антигена:
г) инкубация срезов с 0,2 % тритоном Х-100 на ПБС в
течение 20 мин при комнатной температуре и отмывание в трех
сменах ПБС по 5 мин в каждой;
д) инкубация в 2 % нормальной (неиммунной) сыворотке
козы на ПБС 30 — 60 мин при комнатной температуре;
е) инкубация с первой антисывороткой (кролика против ти-
розингидроксилазы) на ПБС, включающем 1 % нормальную
сыворотку козы и 0,1 % азид натрия, 36 — 48 ч при 4 °С и
промывать в восьми сменах ПБС по 15 мин в каждой;
ж) инкубация со вторыми антителами (козы против
иммуноглобулинов кролика) в разведении 1:100 в течение 1,5 ч
при комнатной температуре и промывание срезов ПБС в
течение 1 ч;
з) инкубация с ПАП-комплексом в разведении 1:100 в
течение 1,5 ч при комнатной температуре и последующее
промывание в ПБС в течение 2 ч;
и) выявление пероксидазы ПАП-комплекса с помощью
метода, разработанного Р. З^гек, ]. КеиЫ (1977), в инкубационной
среде следующего состава: 0,01 % ДАБ, 0,0024 % перекись
водорода, 0,075 % п-крезол на 0,1 М буфере, содержащем лимонную
кислоту и ацетат аммония (рН 5,1), в течение 5 — 20 мин под
контролем светового микроскопа и отмывание срезов в ПБС.
3. Интенсификация ДАБ-продукта первого антигена:
к) инкубация в водном 10 % растворе тиогликолевой
кислоты («Пика», Швейцария) в течение 2 ч при 4 °С и отмывание
срезов в 2 % ацетате натрия в течение 2 ч;
л) проявление срезов в физическом проявителе под
контролем светового микроскопа или бинокулярной лупы в течение
5— 15 мин;
м) остановка проявления в 1 % растворе уксусной кислоты
в течение 5 мин и промывание в 2 % ацетате натрия в течение
10 мин;
н) инкубация в 0,05 % растворе золотохлористоводородной
кислоты в течение 10 мин при 4 °С и отмывание в 2 % ацетате
натрия в течение 10 мин;
151
о) инкубация в 3 % растворе тиосульфата натрия в течение
10 мин при комнатной температуре и промывание ПБС в
течение такого же периода времени.
4. Выявление второго антигена:
п) инкубация с 2 % нормальной (неиммунной) сывороткой
козы на ПБС в течение 10 мин при комнатной температуре;
р) инкубация с первой антисывороткой против второго
антигена (антисыворотка кролика против кортиколиберина в
разведении 1:2000) в течение 36 — 48 ч при 4 °С.
Далее повторить «ж», «з», «и».
5. Приготовление препаратов для световой микроскопии:
с) поместить срезы на предметные стекла и высушить их в
течение нескольких часов при 37 °С;
т) дегидратировать в спиртах возрастающей концентрации,
просветлить в ксилолах;
у) заключить в бальзам, пермоунт или любую другую среду.
Модификация метода, разработанного 2з. Ыроз^з и соавт.
(1984), предложенная японскими и отечественными
исследователями [0§гитоу М. еЬ а1., 1989], преследует цель улучшить
сохранность второго антигена и таким образом увеличить
разрешающую способность метода в целом. С этой целью
предлагают: а) уменьшить продолжительность инкубации с первыми
антителами с 36 — 48 до 6 ч и таким образом уменьшить
вероятность диффузии второго антигена; 6) уменьшить длительность
обработки срезов тиогликолевой кислотой с 2 — 6 ч до 30 мин,
обеспечив лучшую сохранность второго антигена; в) увеличить
продолжительность инкубации со вторыми (биотинилированны-
ми) антителами с 1,5 до 12 ч при выявлении второго антигена;
г) использовать вместо ПАП-комплекса АБС-комплекс,
позволяющий повысить чувствительность метода. Однако наиболее
принципиальное значение имеет изменение последовательности
обработки срезов. Так, после выявления ДАБ-продукта реакции
первого антигена срезы тщательно отмывают и инкубируют с
первыми антителами против второго антигена, а далее — со
вторыми биотинилированными антителами. Только после того,
когда комплекс второй антиген — антитело уже иммобилизован т
зИи, осуществляют интенсификацию ДАБ-продукта реакции
первого антигена. Вслед за этим срезы инкубируют с АБС-ком-
плексом и выявляют пероксидазную метку второго антигена.
Существенно ограничивает применение всех модификаций
иммунопероксидазного метода без элюирования то
обстоятельство, что они пригодны только для выявления антигенов,
содержащихся в разных клетках. Это объясняется тем, что продукт
первой иммуноцитохимической реакции настолько интенсивно
окрашен, что маскирует близлежащий продукт второй реакции.
Еще одна модификация метода двойного меченпя без
элюирования предложена Е. ДУап§ и Ь. Ьагззоп (1985). Как и в
предыдущих случаях, два антигена выявляют путем последова-
152
тельных иммуноцитохимических реакций с использованием
первых антител, выработанных у животных одного и того же
вида. Для последующего определения первых антител обычно
используют антитела, меченные различными красителями и
коллоидным золотом. В этой модификации места
потенциального неспецифического связывания иммуноглобулинов,
сохранившиеся после первой иммуноцитохимической реакции,
блокируют парами формальдегида перед инкубацией срезов с первыми
антителами ко второму антигену.
Двойное иммуноферментное мечение без элюирования
Этот метод существенно отличается от предыдущих тем, что
срезы инкубируют одновременно с первыми антителами к двум
разным антигенам. Эти поликлональные антитела должны быть
выработаны у животных разных видов, например у кролика и
мыши. Возможно также использование моноклональных
антител, выработанных у животных одного вида, но
принадлежащих двум разным подклассам иммуноглобулинов. Вторые
антитела должны быть выработаны против иммуноглобулинов
животных, у которых получены первые антитела, например
антитела козы против иммуноглобулинов кролика и антитела козы
против иммуноглобулинов мыши. При использовании в
качестве первых моноклональных антител вторые антитела должны
быть выработаны против соответствующих им (первым
антителам) подклассов иммуноглобулинов.
Ферментная метка, например пероксидаза и щелочная фос-
фатаза, могут быть связаны как со вторыми, так и с третьими
антителами в зависимости от характера используемого иммуно-
цитохимического метода Далее два разных фермента
проявляют отдельно с образованием по-разному окрашенного продукта
реакции, например в коричневый цвет в случае применения пе-
роксидазы и синий — в случае использования щелочной фосфа-
тазы. С этой же целью с успехом было применено сочетание
ПАП-комплекса (коричневое окрашивание) и глюкозооксидаза-
антиглюкозоксидазного комплекса (синее окрашивание). Если
оба антигена находятся в соизмеримой концентрации в одной и
той же клетке, то наложение продуктов реакции приводит к
окрашиванию в фиолетово-серый цвет. Однако если концентрация
одного антигена существенно ниже концентрации другого, то
соответствующая ему окраска может быть вообще не различима
на фоне окрашивания второго антигена.
Комбинирование иммуноцитохимии с другими
гистологическими (гистохимическими) методами
Использование комбинации иммуноцитохимии с другими
гистологическими и физиологическими подходами позволяет решить
153
многие принципиально важные проблемы фундаментальной и
прикладной науки. Например, комбинацию иммуноцитохимии с
гистофлюоресцентным или радиоавтографическим выявлением
моноаминов широко используют для двойного мечения пептид- и
моноаминергических структур мозга с целью изучения их
структурно-функциональных взаимоотношений [Угрюмов М.В., 1989].
Радиоавтография
Сочетание радиоавтографии с иммуноцитохимией в
экспериментальной практике сопровождается взаимопроникновением или
чередованием специфических этапов, характерных для обоих
методов [Во51ег О. е1 а1., 1986]. Как правило, эксперимент
начинают с введения животному (или в культуру клеток)
соответствующего радиоактивно меченного соединения, например 3Н-
тимидина при изучении митотически делящихся клеток, 3Н-мо-
ноаминов при изучении моноаминергических структур нервной
ткани, 3Н-аминокислот при использовании их в качестве
маркеров цито(аксо)плазматического транспорта и т.д.
Через определенный промежуток времени после введения
радиоактивно меченного вещества животное фиксируют
перфузией, а затем вырезают интересующую ткань и дофиксируют ее
иммерсией. Состав фиксатора определяется тем, что, с одной
стороны, он должен обеспечить максимальную иммобилизацию
радиоактивно меченного соединения т 5И:и, а с другой —
минимально снизить активность антигена, предназначенного для
последующего иммуноцитохимического выявления. Так,
например, при использовании 3Н-тимидина можно ограничиться
непродолжительной (минимум 1 —2 ч) фиксацией параформаль-
дегидом невысокой концентрации (2 — 4 %). В случае легко
диффундируемых моноаминов фиксация, наоборот, должна
быть более продолжительной (минимум 3 ч) и в фиксатор
необходимо ввести активные альдегиды (глутаровый, акриловый и
т.д.) в высокой концентрации, с тем чтобы «пришить»
моноамины альдегидными мостиками к клеточным белкам. Однако
следует иметь в виду, что добавка к фиксатору глутарового
альдегида даже в невысокой концентрации (0,1 — 0,5 %) приводит к
резкому снижению антигенной активности.
После фиксации чаще всего проводят полный иммуноцито-
химический цикл на вибратомных срезах с помощью ПАП- или
лучше АВС-метода. Интенсифицировать ДАБ-продукт реакции
каким-либо образом (особенно серебром и золотом) не
рекомендуют, так как это приводит к маскировке последующей
радиоавтографической реакции. Иммуноцитохимическую реакцию,
предшествующую радиоавтографии, можно также проводить на
замороженных и парафиновых срезах.
В случае «плавающих» (вибратомных или замороженных)
срезов после иммуноцитохимической реакции они должны быть
154
дегидратированы, пропитаны эпоксидной смолой и залиты в эту
же смолу. С полученных блоков на ультрамикротоме
приготавливают так называемые полутонкие срезы — толщиной 1 —
3 мкм и монтируют их на предметные стекла. В случае
парафиновой заливки срезы толщиной 5 — 6 мкм приготавливают на
микротоме, монтируют на предметные стекла, депарафинируют,
регидратируют, после чего проводят иммуноцитохимическую
реакцию. В таком виде срезы готовы для последующей
рутинной радиоавтографической обработки.
В литературе приводятся другие комбинации иммуноцитохи-
мического и классических гистохимических методов, например
сочетание гистофлюоресценции с иммуноцитохимией для
одновременного выявления нейропептидов и моноаминов и т.д.
ИММУНОЦИТОХИМИЯ
НА ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКОМ УРОВНЕ
Несмотря на то что иммуноцитохимия на светооптическом
уровне чрезвычайно обогатила биологию и теоретическую медицину,
а также предоставила прецизионный подход к оценке
патологических процессов в клинической медицине, ее разрешающая
способность оказалась недостаточной для исследования
биологических процессов на субклеточном и молекулярном уровнях.
Этот пробел был восполнен путем разработки и внедрения
электронно-микроскопической иммуноцитохимии.
Электронно-плотные маркеры
Для решения определенной цитологической или молекулярно-
биологической задачи прежде всего необходимо выбрать
адекватный маркер антител. Согласно М. НопзЪегдег (1984),
электронно-плотные маркеры по их основным характеристикам
разделяют на: а) маркеры, применяемые для решения широкого
круга проблем (коллоидное золото, ферритин, ПАП- и АВС-
комплексы) или узкоспециализированных задач (гликозилиро-
ванные ферритин и пероксидаза); б) диффузные маркеры
(пероксидаза) или имеющие вид частиц (ферритин, коллоидное
золото); в) маркеры, соединенные с антителами нековалентными
связями (коллоидное золото), ковалентными связями
(ферритин, пероксидаза) или путем специфических взаимодействий
(ПАП- и АБС-комплексы). Кроме того, устанавливают
пригодность маркеров для одно- или многоэтапного маркирования,
использования не только в просвечивающей, но и сканирующей
электронной микроскопии, а также для количественной оценки
результатов.
155
Ферритин
Основным источником коммерческого ферритина является
селезенка лошади. Молекула ферритина (молекулярная масса
750 000) образована белковой оболочкой с внешним диаметром
12 нм, окружающей мицеллу гидроокиси железа диаметром
5,5 — 6 нм. На каждую молекулу ферритина приходится около
2000 атомов железа. Ферритин связывается ковалентно с
антителами с помощью таких химических агентов-мостиков, как глу-
таровый альдегид, мета-ксилендиизоцианат или толуен-2,4-ди-
изоцианат. Разрешающая способность
электронно-микроскопической иммуноцитохимии с использованием ферритина в
качестве маркера приближается к 30 нм.
К недостаткам использования ферритина относятся: а)
снижение активности антител в процессе связывания ферритина;
б) низкий контраст частиц ферритина на неконтрастированных
ультратонких срезах; в) неспецифическая адсорбция ферритина
тканью при проведении иммуноцитохимической реакции на
ультратонких срезах за счет отрицательного заряда молекулы
ферритина при нейтральном рН. Для преодоления указанных
трудностей для мечения рекомендуют антисыворотку с высоким
титром антител или, что еще лучше, очищенные с помощью
аффинной хроматографии или другими способами антитела.
Некоторые недостатки, обусловленные химическим связыванием
ферритина с антителами, удалось также преодолеть с помощью
«гибридных» антител.
Коллоидное золото
Применение коллоидного золота в качестве маркера основано на
адсорбции макромолекул на поверхности частиц золота при
строго определенных значениях рН, концентрации реагента и ионной
силы раствора. При этом практически не происходит химического
связывания и не теряется биологическая активность антител.
Исключением является только каталаза. В результате адсорбции
макромолекул на поверхности гидрофобных отрицательно
заряженных частиц золота сами частицы стабилизируются, будучи
защищенными от последующей агрегации электролитами.
Достоинствами коллоидного золота как маркера является его
высокая электронная плотность, четкая гранулированная форма
и градация размеров частиц от 5 до 150 нм, что обеспечивает
высокую эффективность использования этого маркера в
просвечивающей и сканирующей электронной микроскопии, для
количественного анализа и двойного мечения. Важной
характеристикой является также и незначительное неспецифическое
связывание антител, меченных золотом.
Недостатком меченных золотом макромолекул является их
низкая стабильность. При недостаточно плотном покрытии час-
156
тицы золота макромолекулами существует опасность агрегации
этих комплексов электролитами, что является недостатком
использования коллоидного золота в качестве маркера [Кота-
по Е., Котапо М., 1984]
Коллоидное золото применяли в качестве маркера
поверхностных клеточных антигенов, вирусов, бактерий, а также для
выявления внутриклеточных антигенов. С этой целью
коллоидное золото связывали с иммуноглобулинами, антигенами, лек-
тинами и стафилококковым белком А. Последний вариант мече-
ния нашел особенно широкое применение в экспериментальной
практике. Этот метод основан на способности белка А
связываться с Рс-фрагментом иммуноглобулинов многих видов
животных. Наиболее прочные связи образуются с большинством
подклассов иммуноглобулинов человека, кролика, морской
свинки и собаки. Менее прочно белок А связывается с
иммуноглобулинами коровы, мыши, лошади и совсем слабо — с
иммуноглобулинами овцы, козы, крысы и цыплят. Потенциальные
возможности комплекса коллоидное золото — белок А в
значительной степени определяются его важнейшими
физико-химическими характеристиками: а) молекулярная масса 42 000;
б) белок А имеет вытянутую форму; в) коэффициент экстинк-
ции 1 % раствора равен 1,65 при длине волны 275 нм; г) изо-
электрическая точка белка А равна 5,1. Это означает, что для
получения стабильных комплексов растворы белка А и
коллоидного золота должны смешиваться в диапазоне рН 4,6 — 5,6,
т.е. как можно ближе к изоэлектрической точке; д) белок А,
выделенный из интактного 51:арЬу1ососси5 аигеиз, обладает
четырьмя потенциальными связями с Рс-фрагментами
иммуноглобулинов, в то время как этот же белок, выделенный из
оболочки бактерии, имеет только две связи, т.е. бивалентен.
Пероксидаза хрена
Пероксидазную метку наиболее широко используют в
современной биологии и медицине. Это объясняется такими
специфическими положительными характеристиками пероксидазы, как
стабильность, относительно небольшая молекулярная масса
(40 000), обеспечивающая проникновение в ткани, не очень
большая потеря активности при химическом связывании с
антителами, возможность параллельного исследования в световом и
электронном микроскопах. Для выявления пероксидазы на
электронно-микроскопическом уровне, как правило,
используют ДАБ, который обладает достаточно высокой электронной
плотностью вследствие повышенной осмиофильности. ДАБ-про-
дукт распределяется несколько диффузно и по сравнению с
коллоидным золотом приводит, с одной стороны, к увеличению
чувствительности метода, с другой — к снижению его
разрешающей способности.
157
Наряду с упомянутыми в качестве маркера в электронно-
микроскопических иммуноцитохимических исследованиях
применяют радионуклиды, тяжелые металлы (железо, уран, ртуть
и др.), полиэтиленамин и др.
Методы электронно-микроскопической
иммуноцитохимии
Предложено множество методов иммунохимического выявления
тканевого антигена на электронно-микроскопическом уровне,
которые различаются по используемому маркеру, характеру
фиксации, заливочной среде и т.д. Одной из наиболее важных
характеристик метода является момент выявления антигена по
отношению к остальным этапам гистологической обработки
материала. По этому принципу методы
электронно-микроскопической иммуноцитохимии подразделяют на нонимбеддинг (без
заливки), преимбеддинг (до заливки) и постимбеддинг (после
заливки).
Нонимбеддинг-метод
В основе методов этой группы лежит выявление антигена на
замороженных ультратонких срезах префиксированной ткани. После
«мягкой» фиксации ткань обрабатывают криопротектором и
мгновенно замораживают. Из замороженной ткани
приготавливают ультратонкие срезы и монтируют их на напыленные углем
медные сеточки. Затем на сеточках осуществляется иммуноцитохими-
ческая реакция. Этот подход особенно важен при выявлении
антигена, который экстрагируется из ткани в процессе
гистологической проводки или теряет активность при нагревании.
Практические рекомендации. 1. Ткань фиксируют парафор-
мальдегидом и/или глутаровым альдегидом.
2. Блоки ткани объемом около 0,5 мм3 инкубируют с
криопротектором, чаще всего 0,6 — 2,3 М сахарозой.
3. Ткань замораживают обычно в изопентане, охлажденном
жидким азотом.
4. Готовят замороженные ультратонкие срезы и высушивают
их на сеточках.
5. Отмывают срезы от сахарозы, помещая сеточки срезами
вниз на поверхность влажной пластины — 0,3 % агарозы и
0,01-0,02 М глицина.
6. «Желатинизацию» срезов проводят, помещая сеточки
срезами вниз на каплю 2 % желатина в ПБС на 10 мин.
7. Промывают срезы в ПБС в течение 10 мин и затем
инкубируют в 1 % свежеприготовленном борогидриде натрия на ПБС в
течение 10 мин.
8. Отмывают срезы в ПБС и инкубируют с первыми
антителами (оптимальные температуру, длительность инкубации и
158
разведение антисыворотки подбирают эмпирически для каждой
антисыворотки и каждого антигена).
9. Отмывают срезы в ПБС и инкубируют их со вторыми
антителами, меченными золотом (параметры инкубации, как и в
случае первых антител, подбирают эмпирически).
10. Отмывают в ПБС и постфиксируют 2 % глутаровым
альдегидом на дистиллированной воде в течение 5 мин.
11. Отмывают в дистиллированной воде и контрастируют.
Преимбеддинг-метод
Иммуноцитохимическую реакцию осуществляют на
относительно толстых, не заключенных в какую-либо среду, обычно виб-
ратомных срезах. После завершения иммуноцитохимической
реакции толстые срезы постфиксируют тетраоксидом осмия,
что, с одной стороны, способствует лучшей сохранности ткани
на ультраструктурном уровне при дальнейшей проводке срезов
через органические растворители, с другой стороны, в случае
пероксидазной метки, повышает электронную плотность ДАБ-
продукта гистохимической реакции. После дегидратации и
пропитывания срезы заливают в синтетическую среду. Только
после этого становится возможным приготовление ультратонких
срезов для электронно-микроскопического исследования.
Основным преимуществом преимбеддинг-метода является то,
что иммуномечение предшествует дегидратации, постфиксации
тетраоксидом осмия и заливке толстых срезов в синтетическую
среду, как правило, при повышенной температуре. Все эти
процедуры и применяемые химические агенты, особенно тетраок-
сид осмия, и такой физический фактор, как высокая
температура полимеризации синтетической среды, приводят к резкому
снижению антигенной активности. Это означает, что
преимбеддинг-метод особенно целесообразно использовать при низкой
концентрации тканевого антигена и его высокой
чувствительности к заливке.
Преимбеддинг-метод характеризуется строго определенной
последовательностью принципиально важных этапов: фиксация
ткани -» приготовление толстых срезов -> иммуноокрашивание
-> постфиксация тетраоксида осмия -» заключение в
синтетическую среду -> приготовление ультратонких срезов ->
исследование в электронном микроскопе.
Фиксация ткани
Как и в случае световой иммуноцитохимии, значение фиксации
в преимбеддинг-методе заключается, с одной стороны, в
иммобилизации антигена т зИи, а с другой — в обеспечении
хорошей сохранности ультраструктуры клеток. Однако «жесткая»
фиксация концентрированным фиксатором в течение длитель-
159
ного периода времени приводит к плохой сохранности
антигенной активности, и, наоборот, «мягкая» фиксация обеспечивает
хорошую сохранность антигенной активности при плохой
сохранности ткани. Возможно, отрицательное влияние фиксатора
на выявление антигена заключается не в снижении самой
антигенной активности, а в затруднении доступа антител к антигену.
Таким образом, подбор оптимального фиксатора должен быть
компромиссом.
На практике в качестве фиксатора в преимбеддинг-методе
используют параформальдегид или смесь параформальдегида и
глутарового альдегида. Считают, что оптимальной формальде-
гидной фиксации можно добиться с помощью 4 %
параформальдегида, сначала фиксируя материал при рН, близком к
нейтральному (рН 5,6), а затем сдвинув рН в щелочную сторону
(рН 11,0). Такое комбинирование рН растворов фиксатора, по
мнению А. Вагой и соавт. (1981), обеспечивает быстрое и
равномерное проникновение фиксатора в ткани без видимого
повреждения мембран.
В современных исследованиях наиболее часто используют
смешанные фиксаторы — 4 % параформальдегид и 0,05 — 0,5 %
глутаровый альдегид при нейтральном рН (7,2 — 7,4). Точный
состав фиксатора подбирают эмпирически с учетом конкретных
антигена и антител. В некоторых случаях необходима гораздо
более высокая концентрация глутарового альдегида, например
для выявления допамина — 5 % раствор. Однако повышение
концентрации глутарового альдегида не только оказывает
негативное действие на антигенную сохранность, но и приводит к
возрастанию фона. Антигенная активность после такой
фиксации может быть частично восстановлена путем инкубации
срезов с борогидридом натрия.
В электронно-микроскопической иммуноцитохимии
используют и другие фиксаторы: акролеин, перйодат-лизин-параформаль-
дегид, модифицированный фиксатор Замбони, состоящий из
пикриновой кислоты, параформальдегида и глутарового альдегида.
Таким образом, в начале каждого исследования следует
подобрать оптимальный фиксатор, контролируя иммуноцитохими-
ческую реакцию на светооптическом уровне. Необходимым
требованием к любому фиксатору является его быстрое и
равномерное проникновение в ткани. Помимо оптимального
химического состава фиксатора, этому способствует перфузия
животного фиксатором, предшествующая фиксации вырезанной ткани
путем иммерсии [РпезИеу ]., 1984].
Приготовление вибратомных срезов
и их предварительная подготовка
В большей части работ, выполненных преимбеддинг-методом,
использовали вибратомные срезы, которые обеспечивают впол-
160
не удовлетворительную сохранность ткани. Изредка с этой же
целью применяли замороженные срезы, однако даже при
наличии криопротектора сохранность ультраструктуры клеток, как
правило, была неудовлетворительной.
Существенным недостатком вибратомных срезов префикси-
рованной ткани, особенно в тех случаях, когда в состав
фиксатора входит глутаровый альдегид или акролеин, является
плохое проникновение антител и других химических ингредиентов
в глубь среза, иногда не более чем на 10 мкм. С целью
увеличения проницаемости ткани для антител используют детергенты, в
частности тритон Х-100, что, однако, ухудшает сохранность
мембран. Гораздо менее травматичным для мембран является
применение другого детергента — сапонина. В ряде случаев
вообще отказываются от применения детергентов, ограничивая
таким образом зону и интенсивность иммуноцитохимической
реакции, но обеспечивая при этом хорошую сохранность ткани.
В некоторых работах использован принципиально иной
подход с целью увеличения проницаемости антител. Блоки ткани,
предварительно обработанные криопротектором, быстро
замораживают и затем оттаивают. Предполагают, что такое
воздействие приводит к возникновению микроповреждений мембран,
которые, однако, остаются невидимыми в электронном
микроскопе. Еще один способ увеличения проницаемости ткани для
антител заключается в дегидратации и последующей регидрата-
ции вибратомных срезов перед проведением
иммуноцитохимической реакции. Однако в этом случае мембраны сохранены
наихудшим образом.
Иммуномечение
При использовании ПАП-метода в электронной микроскопии им-
муноцитохимические процедуры — инкубация срезов с первыми
и вторыми антителами, ПАП-комплексом и выявление пероксида-
зы, мало отличаются от таковых в световой микроскопии. Тем не
менее в электронно-микроскопической иммуноцитохимии все
этапы сокращены до минимума для обеспечения лучшей
сохранности ткани на ультраструктурном уровне. С этой же целью
практически исключается введение детергентов в антисыворотки и
промывочные буферные растворы. Для лучшего проникновения
антител и химических реагентов в ткани осуществляют
постоянное перемешивание инкубационных сред. Из многочисленных
хромогенов только ДАБ может быть использован в электронной
микроскопии, так как продукт гистохимической реакции с
другими хромогенами либо растворим в спиртах и ацетонах, либо
недостаточно хорошо локализован в местах реакции. С целью более
эффективной иммобилизации ДАБ-продукта т зки рекомендуют
перед дегидратацией срезов постфиксировать их в глутаровом
альдегиде довольно высокой концентрации — 2,5 %.
161
Постфиксация, обезвоживание и заливка
После выявления антигена срезы подвергают рутинной
обработке для электронно-микроскопического исследования, т.е. пост-
фиксируют тетраоксидом осмия, дегидратируют в спиртах или
ацетонах возрастающей концентрации, пропитывают смолой и
заливают в нее. Естественно, продолжительность проводки виб-
ратомных срезов значительно меньше по сравнению с
длительностью проводки блоков ткани размером 1 — 2 мкм3, которые
обычно используют в рутинной просвечивающей электронной
микроскопии. В начале процесса дегидратации, на уровне 70 %
спирта или ацетона, срезы можно дополнительно
контрастировать уранилацетатом.
Для лучшей ориентации в залитом материале нередко
используют двухэтапный процесс плоскопараллельной заливки,
что позволяет предварительно оценить реакцию на светоопти-
ческом уровне и выбрать наиболее интересные участки для
последующего электронно-микроскопического анализа.
При приготовлении ультратонких срезов следует иметь в
виду, что обычно поверхностная зона вибратомного среза (2 —
3 мкм) характеризуется интенсивной иммунной реакцией, но
большими деструктивными изменениями, далее следует зона
толщиной 5—10 мкм с отчетливой реакцией и
удовлетворительной сохранностью ткани, наконец, в более глубоко
расположенном отделе сохранность ткани идеальная, однако реакция
практически отсутствует. Это означает, что средний слой является
наиболее приемлемым для электронно-микроскопической имму-
ноцитохимии. При интерпретации полученных
микрофотографий необходимо учитывать, что во время фиксации возможна
диффузия антигена, а во время электронно-микроскопической
проводки — ДАБ-продукта.
Практические рекомендации. Как и во всех других методах
иммуногистохимии, протокол преимбеддинг-метода подбирают
эмпирически для каждой ткани, каждого антигена и первых
антител. В качестве примера приведен сводный протокол,
использованный ]. РпезИеу (1984) и М. ^гитоу (1989) в
основном для выявления нейропептидов и ключевых ферментов
специфических синтезов в ЦНС у крыс с помощью ПАП-метода.
В скобках указаны некоторые детали и модификации. В тех
случаях, когда возможно использование принципиально разных
промежуточных этапов исследования, под буквенными
обозначениями приводят наиболее распространенные из них.
Первый день. 1. Фиксация с помощью перфузии:
крысе под наркозом проводят перфузию через левый желудочек
сердца сначала ПБС, раствором Тироде или раствором Креб-
са —Рингера при 37 °С в течение 2 — 5 мин (50 — 70 мл), а затем
фиксатором смесью 4 % параформальдегида и 0,05 — 0,2 % глу-
тарового альдегида на 0,1 М фосфатном буфере (рН 7,2 — 7,4)
162
при 4 °С (200 — 300 мл). В случае поверхностного
расположения в ткани интересующей области пункт 1 можно опустить.
2. Фиксация с помощью иммерсии: вырезают кусочки и до-
фиксируют в том же фиксаторе, которым проводили перфузию,
при 4 °С обычно в течение 2 —4 ч, а иногда до 12 ч и более.
3. Увеличение проницаемости ткани для реагентов:
а) ткань помещают в ПБС, содержащий 30 % сахарозу, на
6 — 8 ч. Затем быстро замораживают блоки в жидком азоте
или, лучше, в изопентане, охлажденном жидким азотом.
«Оттаивают» блоки в первоначальном буфере с сахарозой и ткань
переносят в фосфатный или трис-НС1-буфер. В электронно-
микроскопической иммуноцитохимии предпочтение отдают
трис-НС1-буферу на изотоническом растворе хлорида натрия
(ТБС).
Модификации «б» и «в», используемые с той же целью —
обеспечить доступ реагентов к внутриклеточным антигенам,
реализуют после пункта 5 (см. ниже),
б) вибратомные срезы инкубируют в течение 20 мин в 0,1 %
тритоне Х-100 на ПБС/ТБС при комнатной температуре;
в) вибратомные срезы никак не обрабатывают с целью
увеличения проницаемости ткани.
4. Приготовление толстых срезов. Чаще всего срезы
толщиной 30 — 50 мкм приготавливают на вибратоме в охлажденном
ПБС/ТБС.
5. Подавление эндогенной пероксидазной активности: при
использовании пероксидазы в качестве маркера антител и при
наличии в изучаемой ткани эндогенной пероксидазы
необходимо подавить ее активность, инкубируя срезы с 0,1 % перекисью
водорода в течение 20 мин при комнатной температуре борогид-
ридом натрия и желатином.
6. Блокирование неспецифического связывания
иммуноглобулинов: вибратомные срезы инкубируют с 10 % нормальной
сывороткой животного, у которого выработаны вторые антитела
(например, козы), в течение 30 мин при комнатной
температуре. Далее срезы отмывают в ПБС/ТБС в течение 1 ч при
комнатной температуре.
7. Инкубация с первыми (специфическими) антителами.
Срезы инкубируют с первой антисывороткой (например,
выработанной у кролика) обычно в разведении 1:300—1:5000 на
ПБС/ТБС с добавлением 1 % нормальной сыворотки
животного, у которого выработаны вторые антитела, в течение ночи
при 4 °С.
Второй день. 1. Промывание срезов в трех сменах
ПБС/ТБС с 1 % нормальной сывороткой по 15 мин в каждой.
Далее инкубация срезов со второй антисывороткой (например,
выработанной у козы против иммуноглобулинов кролика) в
разведении 1:10—1:100 в течение 1 — 2 при комнатной
температуре.
163
2. Стандартное промывание срезов (см. п. 1) и инкубация с
ПАП-комплексом в разведении 1:50—1:200 в течение 1 — 1,5 ч
при комнатной температуре.
3. Тщательное отмывание срезов минимум в трех сменах
ПБС/ТБС по 30 мин в каждой. Выявление пероксидазной
метки путем инкубации срезов в среде, содержащей 0,03 —
0,06 % ДАБ и 0,01 % перекись водорода на ТБС (рН 7,6), в
течение 5—15 мин. В отличие от световой иммуноцитохимии
срезы нужно проявлять до получения максимальной
специфической реакции независимо от появления и нарастания фона.
Это возможно потому, что даже ярко выраженный при светооп-
тическом анализе фон на толстых (вибратомных) срезах
практически нивелируется на ультратонких срезах из-за их
небольшой толщины. Реакцию останавливают, перенося срезы в
фосфатный буфер и тщательно промывая их в нем.
4. Постфиксация. После ДАБ-реакции срезы постфиксируют
сначала в 2,5 % глутаровом альдегиде, а затем в 1 —2 % тетраок-
сиде осмия на 0,1 М фосфатном буфере (рН 7,2 — 7,4) по 30 —
60 мин в каждом при 4 °С. Постфиксацию глутаровым
альдегидом используют крайне редко, хотя она способствует
стабилизации ДАБ-продукта.
5. Дегидратация и контрастирование. Дегидратацию
проводят в спиртах или ацетонах возрастающей концентрации:
50 % — две смены по 5 мин, 70 % — две смены по 5 мин, но
можно оставить на более длительный срок, 80 % — две смены
по 5 мин, 96 % — две смены по 10 мин, 100 %
(дегидратированный силикагелем или хлоридом кальция) — три смены по
10 мин. Преимуществом ацетонов является растворимость в
них эпоксидных смол, используемых для заливки. По ходу
дегидратации срезы могут быть контрастированы путем их
инкубации в 0,5 % уранилацетате на 70 % ацетоне в течение 2— 12 ч
при 4 °С.
6. Пропитывание смолой и заливка. Срезы помещают в смесь
100 % ацетона с заливочной смолой (со всеми компонентами)
сначала в соотношении 2:1, а затем 1:2 на 1 ч в каждую, а затем
переносят в чистую смолу минимум на 3 ч при комнатной
температуре. В случае необходимости срезы в смоле можно оставить
при 4 °С на ночь. После пропитывания срезы заливают в смолу
и осуществляют полимеризацию блоков. С этой целью
используют два способа:
а) из вибратомных срезов под контролем бинокулярной
лупы вырезают небольшие участки ткани с удовлетворительной
реакцией, переносят их в небольшой капле смолы на кончике
препаровальной иглы на чистое предметное стекло и накрывают
желатиновой капсулой, предварительно наполненной смолой. В
таком виде блоки полимеризуют в термостате при 56 °С в
течение 2 — 5 сут. Блоки необходимо отделить от стекол в самом
термостате, пока они не охладились. Если блоки успели охла-
164
диться, то для отделения от стекол их следует слегка нагреть,
например, на спиртовке;
б) согласно второму способу, вибратомный срез, пропитанный
смолой, переносят на предметное стекло с ограниченной каким-
либо валиком ячейкой высотой 2 — 3 мм. Ячейку заливают смолой
и производят ее полимеризацию. После полимеризации такой
срез можно изучать в световом микроскопе и даже
фотографировать. После того как под световым микроскопом найдена
интересующая зона, ее аккуратно вырезают лезвием и наклеивают на
верхушку эпоксидного блока смолой или цианолитным клеем. С
этого участка готовят ультратонкие срезы, которые далее
анализируют в электронном микроскопе [РпезИеу ]., 1984].
Модификация «а» проще, однако может быть использована в
основном при интенсивной иммуноцитохимической реакции в
однородной ткани, в то время как модификация «б» чрезвычайно
важна при низкой антигенной активности в неоднородной ткани.
7. Приготовление ультратонких срезов. При проведении
последнего этапа электронно-микроскопического иммуноцитохими-
ческого исследования залогом успеха является приготовление
серийных ультратонких срезов высокого качества с вибратом-
ных срезов на глубине 3—10 мкм. Такие срезы можно получить
при определенном навыке с помощью специального ножа с
алмазной кромкой. На обычных (стеклянных) ножах довольно
быстро возникают дефекты режущей кромки, в том числе под
воздействием твердого ДАБ-продукта. Ультратонкие срезы
дополнительно контрастируют цитратом свинца и в случае
необходимости уранилацетатом.
Постимбеддинг-метод
В отличие от предимбеддинг-метода этот метод характеризуется
иммунохимическим выявлением антигена после того, как
материал залит в смолу — на ультратонких срезах. Необходимость
в разработке метода была обусловлена в основном стремлением
преодолеть такие недостатки преимбеддинг-метода, как
неудовлетворительная фиксация ткани вследствие длительной
инкубации в антисыворотках и использования детергентов, плохая
проницаемость клеточных мембран для антител и
высокомолекулярных маркеров. Теоретически постимбеддинг-метод лишен
таких недостатков, так как в плоскости ультратонкого среза
находятся пересеченные и таким образом доступные для
антисывороток антигены. Что касается сохранности ткани, то до
заливки осуществляют лишь ее минимальную обработку — фиксацию
и дегидратацию. Более того, в постимбеддинг-методе нередко
используют водорастворимые смолы, что позволяет свести
дегидратацию материала к минимуму. Несмотря на теоретические
преимущества постимбеддинг-метода, в практической работе
возникают значительные трудности.
165
Фиксация ткани
Как в любой иммуноцитохимической реакции, при
использовании постимбеддинг-метода фиксация приводит к снижению
антигенной активности. Особенно выраженное отрицательное
влияние на нее оказывает осмиевый фиксатор, что вынуждает
полностью исключить его из проводки. Это в свою очередь
приводит к повышенной экстракции некоторых веществ, особенно
липидов, в процессе дегидратации и заливки и, следовательно,
значительному ухудшению сохранности ткани. Для того чтобы
свести к минимуму экстракцию веществ в отсутствие осмия,
необходимо использовать более «жесткую» альдегидную
фиксацию — наиболее реактивными альдегидами в высокой
концентрации в течение длительного периода времени. Так, например,
фиксация 1 — 2 % глутаровым альдегидом в течение 3 — 4 ч
обеспечивает гораздо лучшую сохранность, чем фиксация парафор-
мальдегидом такой же концентрации. «Жесткая» фиксация
также дает побочные негативные эффекты, поскольку
альдегиды «сшивают» белки, делая при этом антигены
малодоступными для антител. К альдегидному фиксатору рекомендуют
добавлять пикриновую кислоту, которая способствует преципитации
белков, обеспечивая таким образом лучшую сохранность
мембран и цитозоля и практически не влияя на антигенную
активность. Таким образом, для фиксации материала с высокой
антигенной активностью целесообразно использовать параформаль-
дегид-глутаральдегидный фиксатор, в то время как при низкой
антигенной активности — смесь глутарового альдегида с
пикриновой кислотой. Желательно, чтобы фиксации иммерсией
предшествовала фиксация перфузией.
Практические рекомендации. Обычно для фиксации ткани
перфузией и /или иммерсией используют глутаровый альдегид
в концентрации 0,5 — 4 %, смесь параформальдегида (2 — 4 %) с
глутаровым альдегидом (0,1—2 %), смесь 1 % глутарового
альдегида и 0,2 % пикриновой кислоты. Фиксаторы обычно
приготавливают на 0,1 М фосфатном буфере (рН 7,3). Размер
блоков ткани, фиксирующихся иммерсией, не должен превышать
1 — 2 мм3. Если наблюдается сжатие (сморщивание) ткани, то
концентрацию буфера снижают до 0,05 М. Продолжительность
фиксации колеблется от 30 мин до 4 ч [Иедутап С, ^заш В.,
1984].
Дегидратация и заливка
Существует большой арсенал сред, в которые можно заключать
ткани для иммуноцитохимического выявления
внутриклеточных антигенов на ультратонких срезах. В зависимости от
заливочной среды в той или иной степени происходит дегидратация
ткани. При подборе реагентов, используемых в указанных про-
166
цессах, необходимо отчетливо представлять себе их основные
физико-химические характеристики и учитывать возможное
влияние на сохранность ткани и антигенную активность.
Дегидратирующие (спирты, ацетон) и просветляющие
(ксилолы) реагенты, как и эпоксидные, и полиэстеровые смолы,
очень липофильны, следствием чего является плохая
сохранность мембран и клеточных органелл. Полиэстеровые и
эпоксидные смолы (аралдит, эпон, спурр) практически
непроницаемы для водных растворов при нейтральном рН. Это
обусловливает необходимость «разрыхления» залитой ткани, для того
чтобы сделать внутриклеточные антигены доступными для
антител. Отчасти этого можно достичь путем обработки
ультратонких срезов 10 % перекисью водорода в течение нескольких
минут. Существенным недостатком использования эпоксидных
смол является также то, что их полимеризация происходит в
течение довольно длительного периода времени (18 — 24 ч) при
высокой температуре (60 °С), что оказывает пагубное влияние
на сохранность антигенной активности, особенно
термолабильных антигенов (вазоактивный интестинальный пептид и др.).
Эти трудности отчасти можно преодолеть, используя
ультрафиолетовое излучение, в условиях которого полимеризация
проходит при комнатной температуре в течение 10 — 21 сут [Уагпс1е11 Ь.,
Ро1а1и., 1986].
Попытки использовать вместо эпоксидных смол метакрила-
ты пока не увенчались успехом, так как при этом возникли
качественно иные проблемы — плохая сохранность ткани в
результате нестабильной полимеризации и недостаточная
устойчивость ультратонких срезов к действию электронного пучка в
микроскопе. Кроме того, использование метакрилатов все же не
исключает необходимости «разрыхления» ткани ультратонких
срезов перед иммуноцитохимической реакцией [№\\гтап С,
1азаш В., 1984].
В последние годы появились новые заливочные среды — ак-
рилы, например «ловикрил» (Ьо\У1сгу1) и ЛР-уайт (Ь.К. \УЫ1;е,
ЬопсЬп Кезт Сотрапу, Вазт§з1;оке, Нап^з., II.К.),
обладающие важными преимуществами по сравнению с эпоксидными и
полиэстеровыми смолами. Полимеризация смолы «ловикрил»
происходит при температуре 30 °С или даже ниже, что сводит к
минимуму денатурацию и экстракцию белков. Эти смолы
гидрофильны, что гарантирует проникновение в них водных
растворов и позволяет осуществлять лишь частичную дегидратацию
ткани. Практически это означает, что можно ограничиться
дегидратацией в 70 % спирте и таким образом существенно
улучшить сохранность антигенной активности. Растворимость липи-
дов в смолах крайне незначительна, что является залогом
хорошей сохранности внутриклеточных структур и особенно их
мембранных компонентов даже без дополнительной фиксации тет-
раоксидом осмия. Смолы, с одной стороны, не обладают специ-
167
фическим сродством к антителам, а с другой — не
препятствуют их связыванию с тканевыми антигенами, поэтому перед им-
муноцитохимической реакцией не требуется какой-либо
дополнительной обработки, «разрыхляющей» ткани
(гидролитическими ферментами и др.). Ультратонкие срезы, залитые в эти
смолы, устойчивы к действию электронного пучка. При этом
нет необходимости в использовании подложки, следовательно,
иммуноцитохимическую реакцию можно проводить с обеих
сторон среза.
Практические рекомендации. 1. Дегидратация.
Дегидратацию можно начинать с 70 % спирта, причем в этой среде в
течение 1 — 2 ч из ткани вымываются активные пикраты и
свободные альдегиды. Если эта процедура приводит к сжатию
(сморщиванию) ткани, то перед применением 70 % спирта материал
нужно поместить на 15 мин в 50 % спирт. Если в состав
фиксатора входят только альдегиды, то перед дегидратацией
материал можно отмыть в буфере/ПБС, что позволит в дальнейшем
уменьшить продолжительность проводки по спиртам. При
наличии в фиксаторе пикриновой кислоты материал из фиксатора
переносят сразу же в спирты, как указано выше.
2. Заливка в водорастворимую смолу (ЛР-уайт). Из 70 %
спирта материал переносят в первую порцию ЛР-уайта. Если
эта процедура приводит к сжатию ткани, то в промежутке ее
необходимо поместить в смесь 70 % спирта и смолы (1:2). После
первой порции смолы материал помещают во вторую порцию и
оставляют на ночь на медленно вращающейся «вертушке».
Далее материал переносят на 1 ч в третью порцию смолы и
после этого осуществляется его заливка. Теоретически
полимеризация должна проходить в анаэробных условиях, однако при
использовании неповрежденных и плотно закрывающихся,
например, желатиновых капсул, в этом практически нет
необходимости. Для того чтобы снизить побочные негативные
эффекты — денатурацию белков, полимеризацию проводят при как
можно более низкой температуре. Так, удовлетворительную
полимеризацию ЛР-уайта можно получить при температуре
50 °С в течение 24 ч.
Иммуномечение
Для иммуномечения в постимбеддинг-методе используют в
основном иммунокомплексы с пероксидазой (ПАП, АБС и др.)
или тяжелыми металлами (железо, золото и др.). Как правило,
иммунопероксидазные комплексы характеризуются меньшими
размером и массой, что обусловливает их относительно хорошее
проникновение в ткани, особенно залитые в водорастворимые
смолы. Иммунопероксидазные методы обладают большей
чувствительностью, но меньшей разрешающей способностью по
сравнению с методами, в которых используют иммунокомплексы с
168
тяжелыми металлами. В свою очередь высокая
чувствительность пероксидазного метода позволяет использовать первые
антитела в большом разведении, обычно в диапазоне от 1:100 до
1:100 000. При выявлении пероксидазы электронную плотность
ДАБ-продукта реакции можно увеличить не путем осмирования
материала, а с помощью 0,1 % хлорида золота, который
обладает большей электронной плотностью при менее выраженном
фоне.
Иммунопероксидазные методы. В постимбед-
динг-методе широко применяют иммунопероксидазные ПАП- и
АБС-комплексы, подробно описанные выше.
«И ммунозолотые» методы. Широкое применение
в электронно-микроскопической иммуноцитохимии нашли
методы, основанные на использовании в качестве метки частиц
коллоидного золота строго определенного размера в комплексе со
стабилизирующими белками-«носителями» (белок А или
иммуноглобулины).
Разработаны точные количественные и качественные [Ое
Мау ]., 1986] реакции определения минимального количества
белка, необходимого для стабилизации в растворе коллоидного
золота, по существу эквивалентного количеству белка, которое
может связаться с определенным количеством коллоидного
золота. «Иммунозолотые» методы обладают более высокой
разрешающей способностью, но меньшей чувствительностью по
сравнению с иммунопероксидазными. Кроме того, в отличие от им-
мунопероксидазных методов мечение коллоидным золотом
используют в основном в электронной микроскопии. Существует
несколько модификаций этого метода [УагпйеП Ь., Ро1ак ].,
1984].
1. Прямое иммуномечение. В этой реакции,
чувствительность которой невелика, используют первые антитела,
меченные коллоидным золотом.
2. Непрямое иммуномечение. Антиген, высокоочищенный
или синтетический, связывается с частицами коллоидного
золота. Срез обрабатывают антителами, выработанными против
антигена, а затем комплексом антиген — коллоидное золото.
Поскольку антитела бивалентны, они образуют связь, с одной
стороны, с тканевым антигеном, а с другой — с выделенным или
синтезированным антигеном, меченным золотом.
3. Непрямое иммуномечение с помощью комплекса белок А —
коллоидное золото. Метод основан на чрезвычайно высоком
сродстве белка А, выделяемого из 51арЬу1ососсиз аигеиз, к
иммуноглобулинам большинства видов млекопитающих.
Таким образом, для выявления первых антител, связанных
на срезе с антигеном, используют белок А, меченный частицами
коллоидного золота разного размера. Недостатком метода
является то, что нельзя использовать иммуноглобулины,
блокирующие места неспецифического связывания.
169
Практические рекомендации. 1. Непрямое иммуномечение
на срезах ткани, залитой в смолу [УагпёеП Ь., Ро1ак ]., 1984]:
а) приготавливают ультратонкие срезы, серебристые или
серебристо-серые в отраженном свете, монтируют их на
никелевые или золотые сеточки с подложкой или без нее и
высушивают при 20 — 35 °С в течение 2 — 24 ч;
б) в случае необходимости «разрыхляют» поверхность
среза, помещая сеточки срезами вниз на каплю одного из
окисляющих растворов: 10 % перекиси водорода на 10 мин, 1 %
йодноватой кислоты на 1 мин, 1 % метоксид натрия в абсолютном
этаноле на 10 — 30 мин. После этого срезы необходимо хорошо
промыть сначала в соответствующем растворителе, а затем в ПБС
или ТБС при рН 7,2 — 7,6;
в) блокируют реактивные альдегидные группы (-СНО),
которые образуются в процессе фиксации и «разрыхления»
срезов. С этой целью сеточки помещают на/в раствор,
блокирующий эти связи, на 10 — 60 мин при комнатной температуре. В
качестве такого раствора обычно используют: 0,1 М трис-глицино-
вый буфер (рН 7,2), свежеприготовленный 1 % борогидрид
натрия, 1 — 10 % сывороточный альбумин, яичный белок или
неиммунную сыворотку того же вида животного, у которого
получена вторая антисыворотка. Следует помнить, что для
блокирования неспецифического связывания нельзя использовать
глобулины, так как они активно реагируют с белком А. После этой
процедуры сеточки аккуратно промокают фильтровальной
бумагой, но не высушивают;
г) срезы инкубируют с первой антисывороткой на ТБС (рН
7,2), в которую добавляют 0,1 % сывороточный альбумин быка
(очищенный от глобулинов) и 0,01 % азид натрия. Разведение
антисыворотки, продолжительность инкубации и температуру
подбирают эмпирически;
д) тщательно промывают в ТБС/ПБС;
е) инкубируют с белком А, связанным с коллоидным
золотом. Оптимальное разведение, время и температуру подбирают
эмпирически;
ж) промывают в ТБС/ПБС;
з) промывают в дистиллированной воде;
и) в случае необходимости срезы дополнительно
контрастируют [Уагпс1е11 Ь., Ро1ак ]., 1984].
2. Непрямое иммуномечение на замороженных ультратонких
срезах [5Ы; ]., Сеиге Н., 1984]. Для иммуноцитохимической
реакции используют замороженные срезы ткани, предварительно
фиксированной глутаровым альдегидом и/или параформальде-
гидом и обработанной криопротектором (2,3 М сахароза). Эти
срезы монтируют на напыленные углеродом сеточки и далее в
процессе иммуноцитохимической реакции помещают их на каплю
соответствующего раствора при комнатной температуре:
а) 2 % желатин на ПБС — 10 мин;
170
б) 0,02 М глицин на ПБС — 10 мин. Вместо глицина может
быть использован 1 % борогидрат на ПБС;
в) специфические иммуноглобулины, желательно высоко-
очищенные, в концентрации примерно 25 мкг/мл (для
инкубации достаточно 1 капли объемом 4 мкл) — 30 мин;
г) ПБС — 4 смены по 1 мин в каждой;
д) комплексы белок А или иммуноглобулины —золото,
разведенные непосредственно перед инкубацией ПБС и
содержащие 1 % сывороточный альбумин быка (для инкубации
достаточна капля объемом 5 мкл) — 30 мин;
е) ПБС — 4 смены по 5 мин;
ж) дистиллированная вода — 3 смены по нескольку секунд в
каждой;
з) 2 % уранилацетат на 0,15 % щавелевой кислоты,
доведенной до рН 7,5 % МН4ОН, - 10 мин;
и) дистиллированная вода — 3 смены по нескольку секунд в
каждой;
к) 2 —4 % уранилацетат — 10 мин;
л) дистиллированная вода — 1 с;
м) водный раствор 1,5 % метилцеллюлозы (Ту1озе МН 300
или Ме1Ьосе1 МС 400,сР, фирма «Р1ика» Швейцария);
н) сеточку удаляют из метилцеллюлозы, аккуратно
промокают фильтровальной бумагой и высушивают на воздухе.
Двойное мечение
Преимбеддинг-метод
Первоначально для двойного иммуномечения использовали
сочетание антител, меченных радиоактивно и пероксидазой. При
этом пероксидазу выявляли на вибратомных срезах до их
дегидратации и заливки в смолу, в то время как радиоактивную
метку определяли радиоавтографически — на ультратонких
срезах, покрытых жидкой эмульсией фирмы «Шогй Ь4»
(Франция) или «Койак» (США). В последнее время наиболее
распространено двойное иммуномечение по методу, предложенному
2з. Ыроз^з и соавт. (1983), или по более поздней и более
чувствительной модификации этого метода [и^штоу М. еЬ а1.,
1989]. В обоих вариантах используют первые немеченые
антитела к двум различным антигенам, выработанные у одного и того
же животного, обычно у кролика. Первые антитела выявляют
ПАП- или АБС-методами. Продукт ДАБ-реакции,
соответствующий локализации первого антигена, интенсифицируют
серебром и золотом, что и дает возможность отличить его от неин-
тенсифицированного ДАБ-продукта, соответствующего
локализации второго антигена.
Практические рекомендации. Модифицированный
протокол оригинального метода [11§гитоу М. е! а1., 1989].
171
1. Фиксация, срезы:
а) перфузия крысы под наркозом сначала ПБС (раствором
Тироде, изотоническим раствором хлорида натрия и др.) в
течение 2 — 3 мин при комнатной температуре, а затем охлажденным
модифицированным фиксатором Замбони (4 % параформальде-
гид, 0,1 % глутаровый альдегид, 0,05 % пикриновая кислота на
0,1 М фосфатном буфере, рН 7,3). В случае поверхностного
расположения интересующих участков ткани перфузию можно
не проводить и начать с «б»;
б) фиксация вырезанного кусочка ткани иммерсией
модифицированным фиксатором Замбони в течение 3,5 — 6 ч при 4 °С и
отмывание в ПБС в течение 2 ч;
в) приготовление вибратомных срезов толщиной 40 — 50 мкм.
2. Начало выявления первого антигена:
г) инкубация срезов с 0,1 % перекисью водорода на ПБС в
течение 20 мин при комнатной температуре и тщательное
промывание в 2 — 3 сменах ПБС в общей сложности в течение 1,5 ч;
д) инкубация срезов с 0,1 % тритоном Х-100 на ПБС в
течение 30 мин при комнатной температуре;
е) инкубация с первыми антителами (кролика) против
первого антигена (например, люлиберина) в разведении 1:2000 в
ПБС с 1 % нормальной сывороткой козы или экстрактами
печени и отмывание в 3 сменах ПБС по 15 мин в каждой;
ж) инкубация с биотинилированными вторыми антителами
(козы против иммуноглобулинов кролика) в ПБС в течение
1,5 ч при комнатной температуре. Приготовление: одну каплю
компонента «В» (Уес^азЪет АВС КИз Уес1;ог ЬаЬога1огу, ВигП-
§ате, СА) растворяют в 1 мл ПБС. Отмывание в 3 сменах ПБС
по 15 мин в каждой;
з) инкубация с авидин-биотин-пероксидазным комплексом в
течение 1,5 ч при комнатной температуре. Приготовление: одну
каплю компонента «АВС» (Уес*;а51ет АВС Ккз Уес<:ог ЬаЬога-
*;огу, ВигП§ате, СА) растворяют в 1 мл ПБС. Отмывание в 3
сменах ПБС по 30 мин в каждой;
и) инкубация в 0,03 % ДАБ и 0,01 % перекиси водорода на
трис-НС1-буфере в течение 5—15 мин при комнатной
температуре и тщательное отмывание в четырех сменах ПБС по 30 мин
в каждой.
3. Начало выявления второго антигена:
к) инкубация с первыми антителами (кролика) против
второго антигена (например, тирозингидроксилазы) в разведении
1:2000 в ПБС с 1 % нормальной сывороткой козы или
экстрактами печени в течение 38 ч при 4 °С и промывание в 3 сменах
ПБС по 15 мин в каждой;
л) инкубация с биотинилированными вторыми антителами
(козы против иммуноглобулинов кролика) в течение 12 ч при
комнатной температуре и промывание в 3 сменах ПБС по 15 мин
в каждой.
172
4. Окончательное выявление первого антигена
(интенсификация ДАБ-продукта):
м) инкубация в водном 10 % растворе тиогликолевой
кислоты («Пика», Швейцария) в течение 1 ч при 4 °С и отмывание
срезов в 2 % ацетате натрия в течение 2 ч;
н) проявление срезов в физическом проявителе под
контролем светового микроскопа или бинокулярной лупы в течение
5—15 мин;
о) остановка проявления в водном 1 % растворе уксусной
кислоты в течение 5 мин и промывание в 2 % ацетате натрия в
течение 10 мин;
п) инкубация в водном 0,05 % растворе золотохлористоводо-
родной кислоты в течение 10 мин при 4 °С и промывание в 2 %
ацетате натрия в течение 10 мин;
р) инкубация в водном 3 % растворе тиосульфата натрия в
течение 10 мин при комнатной температуре и промывание ПБС
в течение такого же времени.
5. Окончательное выявление второго антигена:
с) инкубация с авидин-биотин-пероксидазным комплексом в
течение 1,5 ч при комнатной температуре. Приготовление: одну
каплю компонента «АВС» (Уес1аз1:ет АВС КИз Уес^ог ЬаЬога-
1огу, ВигП^ате, СА) растворяют в 1 мл ПБС. Промывание в 3
сменах ПБС по 30 мин в каждой;
т) инкубация в 0,03 % ДАБ и 0,01 % перекиси водорода на
трис-НС1-буфере в течение 5 — 15 мин при 32 °С в течение 10 —
20 мин и тщательное отмывание в четырех сменах ПБС по
30 мин в каждой.
6. Постфиксация, дегидратация, заливка:
у) постфиксация сначала в 2,5 % глутаровом альдегиде, а
затем в 1 — 2 % тетраоксиде осмия на 0,1 М фосфатном буфере
(рН 7,2 — 7,4) при 4 °С по 30 — 60 мин в каждом.
Остальные этапы (постфиксация, контрастирование урани -
лацетатом в блоках, дегидратация, заливка и приготовление
ультратонких срезов для электронно-микроскопического
анализа) описаны выше.
Постимбеддинг-метод
Существует несколько вариантов двойного мечения на
электронно-микроскопическом уровне с использованием этого
метода.
1. Выявление двух антигенов на соседних срезах. Этот метод
позволяет определить два антигена в субклеточных структурах,
больших или соизмеримых по размеру с толщиной
ультратонких срезов.
2. Выявление двух антигенов на противоположных сторонах
среза. Как показали специальные исследования, иммуномече-
ние осуществляется только в самом поверхностном слое ультра-
173
тонкого среза, т.е. полностью исключается перекрест реакций
антител, выявляющих антиген на противоположных сторонах
одного и того же среза. Для двойного мечения ультратонкие
срезы монтируют на сеточку без подложки.
В качестве метки используют белок А в комплексе с
частицами коллоидного золота различного размера, например 4 и
12 нм. Для выявления первого антигена сеточку помещают на
каплю первой антисыворотки. При этом с ней соприкасается
только одна поверхность срезов. Таким же образом
осуществляется последующее связывание первыми антителами комплекса
белок А — частицы золота строго определенного размера
(например, 4 нм). Далее выявляют второй антиген, но при этом
меняют поверхность сеточки (среза), которая соприкасается с
антисывороткой, и используют белок А, меченный частицами
золота другого размера — 12 нм.
«Прилипание» ультратонких срезов к сеточке можно
улучшить путем предварительной обработки сеточек 20 % уксусной
кислотой в течение нескольких секунд, после чего сеточки
промывают 90 % спиртом и дистиллированной водой.
3. Выявление двух антигенов на одной и той же поверхности
среза [УагпйеП Ь., Ро1ак ]., 1984]. Этот метод предполагает
последовательное выявление двух антигенов на одной и той же
поверхности ультратонкого среза с использованием первых
антител, а в качестве маркера — комплекса белка А с частицами
золота различного размера. Необходимым условием метода
является то, что после выявления первого антигена с помощью
первых антител и комплекса белок А —частицы золота
определенного размера срезы инкубируют с избыточной
концентрацией первых антител против второго антигена. Последние, с
одной стороны, связываются со вторым антигеном на срезе, а с
другой — блокируют свободные связи белка А с
иммуноглобулинами.
Возможной причиной перекрестной реакции, однако, можс!
быть то обстоятельство, что первые антитела против второго
антигена, связанные с белком А первого антигена, могут также
связываться с комплексом белок А — золото, используемое для
мечения второго антигена.
Практические рекомендации. 1. Фиксация, проводка,
заливка, срезы
а) фиксация кусочков ткани иммерсией в смеси 1 % парафор-
мальдегида и 2,5 % глутарового альдегида на 0,1 М фосфатном
буфере (рН 7,2) в течение 2 ч при 4 °С;
б) отмывание материала в фосфатном буфере с 0,1 %
сахарозой в течение 30 — 60 мин и постфиксация 1 % тетраоксидом осмия
на фосфатном буфере (рН 7,2) в течение 1 ч при 4 °С. На этом
этапе можно ограничиться промыванием материала в буфере;
в) дегидратация и заливка материала в аралдит, эпон или
спурр. Полимеризацию проводят при комнатной температуре в
174
условиях постоянного ультрафиолетового освещения в течение
10 — 21 дня. Возможна также заливка в акриловые смолы;
г) нанесение ультратонких срезов ткани, не обработанной
тетраоксидом осмия, на никелевые или золотые сеточки с 300
ячейками и высушивание на воздухе в течение ночи. Все
последующие инкубации проводят в ячейках специальных пластин
объемом 15 — 20 мкл.
2. Иммуномечение:
д) обработка срезов 10 % перекисью водорода в течение 10
мин при комнатной температуре и промывание в
дистиллированной воде;
е) инкубация в 3,3 % нормальной сыворотке козы в течение
30 мин при комнатной температуре и подсушивание срезов
фильтровальной бумагой;
ж) инкубация с двумя первыми антисыворотками,
выработанными у разных животных (например, кролика и морской
свинки) в течение 1 ч при комнатной температуре. Антисыворотки в
оптимальной для них концентрации разводят в ПБС,
содержащем 0,1 % сывороточный альбумин быка («51§та», V фракция,
очищенная от глобулинов) и 0,01 % азид натрия;
з) последовательное промывание срезов в 50 мМ трис-НС1-
буфере (рН 7,2) — три смены по 15 мин, в 50 мМ трис-НС1-бу-
фере, содержащем 0,2 % сывороточный альбумин быка,— три
смены по 15 мин; в трис-НС1-буфере (рН 8,2), содержащем 1 %
сывороточный альбумин быка,— 5 мин;
и) инкубация в смеси двух вторых антител (козы против
иммуноглобулинов морской свинки и кролика), меченных
коллоидным золотом с частицами размером соответственно 20 и 10
или 40 нм. Коллоидное золото перед использованием разводят
трис-НС1-буфером (рН 8,2) с 1 % сывороточным альбумином
быка и центрифугируют при 2000 об/мин в течение 20 мин с
целью удаления микроагрегатов коллоидного золота;
к) последовательное промывание трис-НС1-6уфером с 0,2 %
сывороточным альбумином быка, чистым трис-НС1-буфером и,
наконец, дистиллированной водой (в трех сменах каждого
раствора по 15 мин);
л) высушивание срезов фильтровальной бумагой и
дополнительное контрастирование тяжелыми металлами.
2. Контроли специфичности иммунной реакции:
а) вместо инкубации с первыми антителами проводят
инкубацию с нормальной неиммунной сывороткой кролика и/или
морской свинки;
б) инкубация с первыми антисыворотками, преабсорбиро-
ванными с соответствующими антигенами, их молекулярными
Фрагментами или гомологичными молекулами;
в) исключение одной или обеих первых антисывороток из
проводки;
г) дополнительное мономечение антигена на соседнем срезе.
175
Комбинированные методы
Двойное мечение можно получить с помощью комбинации пре-
и постимбеддинг-метода, а также сочетания иммуноцитохимиче-
ских и других методов — гистохимических,
радиоавтографических и т.д.
Сочетание пре- и постимбеддин г-м е т о д о в.
Первый антиген выявляют преимбеддинг-методом — на вибра-
томных срезах, обычно с использованием пероксидазы в
качестве маркера. После этого вибратомные срезы обрабатывают по
протоколу постимбеддинг-метода и второй антиген выявляют на
ультратонких срезах, обычно с помощью комплекса белок А —
коллоидное золото. Этот вариант двойного иммуномечения
особенно показан в том случае, когда первый антиген, например
некоторые ферменты синтеза катехоламинов, невозможно
выявить постимбеддинг-методом, так как их антигенная
активность резко снижается в процессе постфиксации и заливки в
смолу.
ПРИЛОЖЕНИЕ
Растворы для выявления пероксидазы хрена
и интенсификации ДАБ-продукта
3,3-Диаминобензидинтетрагидрохлорид (ДАБ). В состав
инкубационной среды входят: 0,01—0,06 % 3,3-диаминобензи-
динтетрагидрохлорид и 0,01 — 0,03 % перекись водорода на 0,05
М трис-НС1-буфере (рН 7,6) или ПБС (рН 7,2).
Приготовление:
а) в 100 мл 0,05 М трис-НС1-6уфера или ПБС растворяют
10 — 60 мг ДАБ и полученный раствор фильтруют. Этот
раствор можно разлить на аликвоты, например по 10 мл, и
хранить в течение длительного периода времени в темноте при
-20 °С;
б) перед применением к 10 мл ДАБ-раствора добавляют 33 —
100 мкл 3 % перекиси водорода. Наибольшей растворимостью
обладает ДАБ производства фирмы «§1§та» (Германия). После
добавления перекиси водорода среда сохраняет стабильность в
течение 45 мин.
З-амино-9-этилкарбазол 0,4 %. Маточный раствор
(стабильный при комнатной температуре): 0,4 % З-амино-9-этилкар-
базол в диметилформамиде. Инкубационная среда: 0,5 мл
маточного раствора + 9,5 М ацетатного буфера (рН 5,0) + 0,15 мл
3 % перекиси водорода, раствор профильтровать.
4-хлор-1 -нафтол:
а) растворяют 3 мг 4-хлор-1-нафтола в 0,1 мл абсолютного
спирта;
176
б) раствор «а» прилить к 10 мл 0,05 М трис-НС1-6уфера (рН
7,6) при постоянном помешивании;
в) добавить в раствор «6» 0,1 мл перекиси водорода;
г) профильтровать, удалив при этом белый осадок.
п-Фенилендиаминдигидрохлорид/пирокатехол («Нап-
кег —Уа1ез», Германия):
а) смешивают 5 мг п-фенилендиаминдигидрохлорида с 10 мг
пирокатехола;
б) полученную смесь растворяют в 10 мл 0,05 М трис-НС1-
буфера (рН 7,6);
в) к раствору «а» добавляют 1 мл 3 % перекиси водорода.
Среда для выявления пероксидазы с использованием п-кре-
зола:
а) 100 мл 0,1 М цитратно-ацетатного буфера (рН 5,1)
нагревают до 40 — 50 °С;
б) при постоянном помешивании в растворе «а» растворяют
10 мг ДАБ и 75 мкл п-крезола («Мегск», Германия);
в) раствор «6» фильтруют и охлаждают до комнатной
температуры;
г) перед использованием добавляют 8 мкл 30 % перекиси
водорода.
Раствор никеля-аммония сульфата гексагидрата 2,5 %:
а) 18 мг ДАБ растворяют в 25 мл 0,1 М ацетатного буфера
(рН 6,0) и фильтруют;
б) 1,25 г никеля-аммония сульфата гексагидрата растворяют
в 25 мл 0,1 М ацетатного буфера СрН 6,0) и фильтруют;
в) сливают растворы «а» и «б», добавляют 50 мкл 9 %
перекиси водорода.
Физический проявитель для интенсификации ДАБ-продукта
серебром и золотом [Ырозйз 2з. еЬ а1., 1984]. Проявитель
состоит из двух маточных растворов — А и Б. Раствор А — 5 %
карбонат натрия в дистиллированной воде. Для приготовления
100 мл раствора Б необходимо в 100 мл дистиллированной воды
последовательно и тщательно растворить 200 мг нитрата
аммония, 200 мг нитрата серебра, 1 г кремниевовольфрамовой
кислоты и 0,35—0,5 мл 35 % формальдегида.
Для получения готового проявителя растворы «А» и «Б»
смешивают в пропорции 1:1 непосредственно перед
использованием. При этом раствор А медленно вливают в раствор «Б» при
постоянном помешивании. Для успешного приготовления
проявителя необходимо использовать тщательно вымытую посуду,
деионизированную воду и светонепроницаемые колбочки для
приготовления и хранения растворов А и особенно Б. Сразу
после приготовления проявителя необходимо убедиться с
помощью бинокулярной лупы, что в нем не происходит
преципитация серебра.
177
АБС-комплекс [Содд1 С. е* а1., 1986]
За 30 мин до инкубации смешивают 1,3 мл раствора авидина
(концентрация 1 мг/мл) с 1 мл биотинилированной пероксида-
зы (концентрация 33 мг/мл). Полученный раствор разводят
ПБС в пропорции 1:20.
Интенсификация коллоидного золота,
связанного с авидином и серебром
Растворяют 850 мг гидрохинона в 85 мл цитратного буфера (рН
3,5 — 3,9) и НО мг лактата серебра в 15 мл дистиллированной
воды, после чего смешивают оба раствора. Раствор готовят
непосредственно перед инкубацией.
ГЛАВА 8
ПОЛЯРИЗАЦИОННАЯ МИКРОСКОПИЯ
Поляризационная микроскопия — один из высокоэффективных
методов морфологического исследования, обладающий широкими
возможностями идентификации биологических структур, что в
сочетании с доступностью и относительной простотой
обусловливает его высокую ценность. Метод позволяет познавать не только
тонкости гистологического строения объекта, но и некоторые его
гистохимические параметры, а в некоторых аспектах — и
ультраструктурные особенности. Недаром в 40 —50-х годах XX в.
поляризационную микроскопию относили к ультраструктурным
методам.
Поляризационная микроскопия предназначена для изучения
свойств гистологических структур, обладающих способностью
двоякого лучепреломления (анизотропия) — раздвоения
светового луча при прохождении его через анизотропную среду.
Световая волна в анизотропной среде распадается на две волны с
взаимно перпендикулярными плоскостями колебаний
электромагнитных волн. Эти плоскости называются плоскостями
поляризации. Поляризованный свет отличается от обычного (неполяризо-
ванного) тем, что в последнем колебания световых волн
происходят в различных плоскостях, а в поляризованном свете — лишь в
определенной плоскости.
Для создания эффекта поляризации в поляризационном
микроскопе имеются два поляризационных фильтра, один из
которых, помещаемый между источником освещения и
гистологическим объектом, называется поляризатором, а другой,
находящийся между гистологическим объектом и глазом
исследователя,— анализатором. И поляризатор, и анализатор в
оптическом отношении представляют собой совершенно одинаковые
поляризационные фильтры, поэтому их можно менять местами.
Ранее для поляризационной микроскопии применяли
изготавливаемые из исландского шпата призмы Николя, Аренса или
Томсона. У этих призм ограничен угол преломления света. В
настоящее время вместо них используют плоские
поляризационные фильтры, продуцирующие широкопольный
поляризованный свет.
В создании поляризованного света определяющую роль
играет взаимное расположение поляризатора и анализатора
относительно оптической оси микроскопа. Если они ориентированы
179
Рис. 1. Расположение поляризационных фильтров в поляризационном
микроскопе.
а — совпадение плоскостей поляризации поляризатора и анализатора (светлое поле зрения);
б — перпендикулярное расположение плоскостей поляризации поляризатора и анализатора
(темное поле зрения). ПП — плоскость поляризации поляризатора, АА — плоскость
поляризации анализатора. ОО — оптическая ось микроскопа.
таким образом, что тот и другой пропускают поляризованный
свет в одной и той же плоскости, т.е. при совпадении их
плоскостей поляризации, оба поляризационных фильтра способны
пропускать поляризованный свет; поле зрения микроскопа при
этом светлое (рис. 1,а). Если же плоскости поляризации
поляризационных фильтров взаимно перпендикулярны (этого
достигают путем поворота анализатора на 90° вокруг оптической
оси микроскопа), то поляризованный свет не проходит и
исследователь видит темное поле зрения (рис. 1,6). При повороте
поляризатора на 360° в процессе его вращения поле зрения
дважды полностью затемнено и дважды полностью просветлено.
В прошлом применяли фильтры Бернауэра, при использовании
которых затемненное поле зрения имеет красноватый оттенок.
При применении черных зеркальных фильтров затемненное
поле зрения выглядит не полностью темным, а слабо
подсвеченным .
В тех случаях, когда при скрещенном положении
поляризационных фильтров (т.е. в темном поле зрения) на пути
поляризованного света встречаются анизотропные субстанции,
содержащиеся, например, в гистологическом препарате, эти
субстанции, точно так же, как и поляризационные фильтры,
расщепляют поляризованный свет на два луча с взаимно
перпендикулярными плоскостями колебаний световых волн. Световые лучи с
плоскостью колебаний, совпадающей с плоскостью
поляризации, проходят через анализатор, а с перпендикулярной —
абсорбируются, вследствие чего интенсивность светового потока,
попадающего в глаз исследователя, составляет лишь половину
180
интенсивности исходного светового пучка. В результате
описанных процессов анизотропные субстанции, находящиеся между
двумя скрещенными поляризаторами, видны на темном фоне в
виде светлых светящихся объектов. При этом изотропные
структуры, не обладающие способностью двоякого
лучепреломления, остаются темными. В биологических тканях имеется
достаточное количество структур, дающих эффект двоякого
лучепреломления,— это элементы сократительного аппарата мышц,
коллагеновые образования, некоторые липиды, ряд кристаллов
и др.
Расщепленные в анизотропном объекте и проходящие через
анализатор световые лучи характеризуются неодинаковой
скоростью распространения волн. В зависимости от величины этой
разницы (ее еще называют величиной задержки светового луча)
и от различий абсорбции света в анализаторе свечение
анизотропных объектов может быть белым или цветным. В последнем
случае речь идет о феномене дихроизма (двойная абсорбция).
Цветовые эффекты при исследовании в поле поляризации дают,
например, многие кристаллы.
Процесс двоякого лучепреломления может быть значительно
усилен путем применения определенных красителей, молекулы
которых обладают способностью ориентированно откладываться
на анизотропных структурах. Гистохимические реакции, в
результате которых возникает эффект анизотропии, были названы
О. КотЬапу1 топооптическими реакциями. Различают две
разновидности таких реакций — аддитивные и инверсивные. При
аддитивных реакциях задержка светового луча увеличивается, что
называют положительной анизотропией, при инверсивных
реакциях она уменьшается — отрицательная анизотропия.
АППАРАТУРА И ОБОРУДОВАНИЕ
Поляризационную микроскопию проводят с помощью
специальных поляризационных микроскопов. В качестве примера можно
назвать отечественные микроскопы МП-1, МП-2, МПД-1.
Большинство современных световых микроскопов оснащено
приспособлениями, позволяющими проводить поляризационную
микроскопию.
Для поляризационной микроскопии можно приспособить
любой световой микроскоп. Достаточно иметь два
поляризационных фильтра, один из которых, выполняющий функцию
поляризатора, помещают между источником света и препаратом, а
другой, играющий роль анализатора,— между препаратом и
глазом исследователя. Поляризатор обычно вставляют под
конденсор микроскопа в оправу светофильтра, а анализатор — в
окуляр. В бинокулярных микроскопах анализатор размещают
над объективом. При использовании монокулярных и биноку-
181
11
10-
4
Рис. 2. Поляризационный микроскоп
(схема).
I — источник света; 2 — зеркало; 3 —
поляризатор; 4 — конденсор; 5 — предметный столик;
6 — гистологический препарат; 7 — объектив;
8 — тубус; 9 — компенсатор; 10 — анализатор;
II — окуляр.
^
]
лярных микроскопов с
наклонным тубусом следует иметь в
виду, что поляризующие
свойства поляризатора могут
нейтрализоваться эффектом отражения в
призме. Для того чтобы
устранить этот побочный эффект,
нужно повернуть поляризатор в
условиях затемненного поля
зрения таким образом, чтобы
красноватый оттенок поля зрения
сменился зеленоватым. В этой
позиции достигается
максимальное гашение отраженного света.
Влияние призмы можно
полностью устранить, если разместить
анализатор непосредственно над
объективом под призмой.
На рис. 2 представлена
принципиальная схема поляризационного микроскопа. Помимо
общих для всех световых микроскопов компонентов, в
поляризационном микроскопе имеется два поляризационных фильтра
(поляризатор, размещаемый обычно под конденсором, и
анализатор, находящийся в окуляре), а также компенсатор. Один из
поляризационных фильтров должен обязательно вращаться,
причем для определения степени вращения необходима
соответствующая градуированная шкала.
В поляризационном микроскопе используется источник
освещения, обеспечивающий высокую плотность светового пучка. В
качестве такого источника рекомендуют применять лампу
мощностью 100 Вт при напряжении 12 В. Для некоторых видов
исследования требуется монохроматический свет. С этой целью
используют металлический интерференционный фильтр,
который лучше поместить над зеркалом [ЗсЬеипег С, Ни^зсЬепге-
Нет ]., 1972]. Рассеивающее свет матовое стекло помещают
перед поляризатором, т.е. между ним и источником освещения,
но ни в коем случае не после поляризатора, так как при этом
нарушается функция поляризационного фильтра.
В поляризационном микроскопе используют только
ахроматические, а не апохроматические объективы и не флюоритные
182
стекла. Апохроматические объективы можно применять лишь в
тех случаях, когда требуется нормальная цветопередача при
микрофотографировании [АрреИ; Н., 1955].
Поляризационные микроскопы оснащены вращающимся
предметным столиком, положение которого относительно
оптической оси можно менять. Угол поворота столика измеряют с
помощью градусной шкалы, нанесенной по его окружности.
Одним из обязательных условий, обеспечивающих
эффективное применение поляризационной микроскопии, является
тщательная центровка вращающегося предметного столика с
помощью центровочных винтов.
Важным элементом поляризационного микроскопа является
компенсатор, помещаемый между объективом и анализатором,
обычно в тубусе микроскопа. Компенсатор представляет собой
пластинку, изготавливаемую из особых сортов гипса, кварца
или слюды. Он позволяет измерять разницу хода
расщепленных световых лучей, выражающуюся в нанометрах.
Функционирование компенсатора обеспечивается его способностью
изменять разницу хода световых лучей, низводя ее до нуля либо
увеличивая до максимума. Это достигается вращением
компенсатора вокруг оптической оси.
Микрофотосъемка препаратов при поляризационной
микроскопии имеет некоторые особенности. В качестве негативного
материала используют ортопанхроматические фотопленки.
Чрезмерной контрастности негативов можно избежать,
используя фильтр ВС 7, пропускающий свет с короткой длиной волны
(460 — 470 нм), однако при этом нужно применять
апохроматические объективы. Цветную съемку с целью получения слайдов
проводят на обратимую фотопленку для дневного света. Для
того чтобы устранить желто-коричневый фон на цветном
изображении, спектр искусственного света приближают к спектру
дневного, используя фильтр ВО 34 или Ад^а 69. Эти фильтры
заменяют применявшийся раньше с этой целью раствор
сульфата меди.
МЕТОДИКА МИКРОСКОПИИ В ПОЛЯРИЗОВАННОМ СВЕТЕ
Поляризационную микроскопию удобнее проводить в
затемненном помещении, так как интенсивность светового потока,
попадающего в глаз исследователя, уменьшается в 2 раза по
сравнению с исходной. После включения осветителя микроскопа
вначале добиваются максимально яркого освещения поля зрения
путем вращения поляризатора или анализатора. Такое
положение поляризационных фильтров соответствует совпадению их
плоскостей поляризации. Препарат помещают на предметный
столик и изучают его сначала в светлом поле. Затем путем
вращения поляризатора (или анализатора) максимально затемняют
183
поле зрения; эта позиция фильтра соответствует
перпендикулярному расположению плоскостей поляризации. Для того
чтобы выявить эффект анизотропии, нужно совместить
плоскость поляризации анизотропного объекта с плоскостью
поляризованного света. Эмпирически этого добиваются путем
вращения предметного столика вокруг оптической оси. Если для
поляризационной микроскопии используют световой
микроскоп, не оборудованный вращающимся столиком, то
приходится вращать гистологический препарат вручную. Это допустимо,
однако в таком случае нельзя проводить отдельные виды
поляризационной микроскопии, требующие количественной оценки
(определение знака двоякого лучепреломления, величины
разницы хода световых лучей).
В том случае, если анизотропные объекты в исследуемом
препарате расположены упорядоченно (например,
анизотропные диски поперечнополосатых мышечных волокон), их удобно
изучать в фиксированном положении предметного столика, при
котором эти объекты дают максимальное свечение на темном
фоне. Если же анизотропные структуры располагаются в
препарате хаотично (например, кристаллы), то при их
исследовании приходится постоянно вращать предметный столик,
добиваясь свечения той или иной группы объектов.
Для проведения более углубленного анализа и оценки топо-
оптических реакций необходимо знать методику определения
относительного знака двоякого лучепреломления, величины
разницы хода лучей и индекса (коэффициента)
лучепреломления.
Знак двоякого лучепреломления характеризует степень и
направление смещения хода световых лучей, проходящих через
анализатор. Это смещение вызывается топооптическими
красителями, и в том случае, если оно направлено в сторону
уменьшения разницы хода лучей, говорят об отрицательном знаке
двоякого лучепреломления (отрицательная анизотропия), если
же оно способствует увеличению разницы хода лучей, то
констатируют положительный знак двоякого лучепреломления
(положительная анизотропия). Если разница хода лучей исчезает,
то эффект анизотропии нивелируется.
Знак двоякого лучепреломления определяют с помощью
компенсатора. Процедура его применения заключается в
следующем. Исследуемый объект помещают в положение, при котором
в темном поле зрения достигается максимальное свечение
анизотропных структур. Пластинку КЬкомпенсатора поворачивают
вокруг оптической оси под углом +45° по отношению к
плоскости поляризации анализатора. Объект в зависимости от разницы
хода световых лучей, которая может колебаться от 20 до 200
нм, приобретает либо голубую, либо желтую окраску. В первом
случае знак двоякого лучепреломления положительный, во
втором — отрицательный. Следует иметь в виду, что в том случае,
184
когда компенсатор расположен под углом +45°, общий фон
затемненного поля зрения имеет красный оттенок.
Можно использовать также компенсатор Х/А. Процедура его
применения такая же, только поле зрения имеет не красный, а
серый оттенок, и объект при положительном знаке
лучепреломления светится, а при отрицательном — затемнен.
Количественное определение разницы хода световых лучей,
выражаемой в нанометрах, осуществляют с помощью
компенсатора Брака Келера. Для этого используют формулу:
Г = ГА, • з1п2ф,
где X — константа, проставляемая на компенсаторе
заводом-изготовителем, ф— угол поворота компенсатора относительно
плоскости поляризации анализатора.
Индекс лучепреломления анизотропного объекта определяют
путем его сопоставления (под микроскопом) с тест-объектом,
помещаемым рядом. В качестве тест-объектов используют
стандартные жидкости с известным индексом лучепреломления.
Объект и образец помещают рядом на предметном столике. При
несовпадении их коэффициентов преломления между объектом
и образцом видна светлая линия, называемая линией Бека.
Подъем тубуса микроскопа относительно сфокусированного
положения вызывает смещение линии Бека в сторону среды, дающей
более выраженный эффект лучепреломления. При совпадении
коэффициентов лучепреломления объекта и образца линия
Бека исчезает. Обычно коэффициент лучепреломления
определяют в монохроматическом свете для натриевой линии спектра
(при длине волны 589 нм и температуре 20 °С).
Лучепреломление следует определять для двух взаимно перпендикулярных
плоскостей поляризации. С этой целью снимают анализатор и
регистрируют лучепреломление объекта в его двух взаимно
перпендикулярных положениях. Разница между обоими
показателями лучепреломления (пй—Пк) характеризует силу
лучепреломления.
ОСОБЕННОСТИ ОБРАБОТКИ МАТЕРИАЛА
И ПРИГОТОВЛЕНИЯ ПРЕПАРАТОВ
Фиксация материала для поляризационной микроскопии в
кислом формалине нежелательна, так как формалиновый пигмент,
образующийся при взаимодействии гемоглобина тканей с
кислым формальдегидом, обладает анизотропными свойствами и
затрудняет изучение препаратов в поляризованном свете. О. ЗсЬеи-
пег и ]. Ни1:зсЬепге1{ег (1972) рекомендуют использовать с этой
целью 10 % нейтральный формалин, раствор кальций-формола
по Бейкеру, жидкость Карнуа.
185
Продолжительность фиксации в 10 % нейтральном
формалине 24 — 72 ч при 4 °С, в растворе кальций-формола по Бейкеру —
16 —24 ч при 4 °С. Фиксация в кальций-формоле особенно
предпочтительна при исследовании липидно-белковых соединений.
Жидкость Карнуа быстро пропитывает ткани. Кусочки
толщиной 1 — 2 мм бывают профилированы уже через 1 ч при
температуре 4 °С. Для исследования липидов фиксация в жидкости
Карнуа непригодна. Кроме того, применяют жидкость Ценкера,
особенно при импрегнации солями золота и серебра. После
обработки смесью жидкости Ценкера и уксусной кислоты
эритроциты приобретают способность к двоякому лучепреломлению.
При исследовании в поляризационном микроскопе плотных
тканей (кости, зубы), помимо кислотной декальцинации,
необходима дополнительная обработка для удаления коллагеновых
волокон. С этой целью шлифы таких тканей в течение нескольких
минут варят в смеси глицерина и гидроксида калия (10 мл
глицерина и 2 крупинки гидроксида калия) до полного побеления,
затем осторожно сливают щелочь, шлиф промывают в воде и
переносят с помощью пинцета на предметный столик микроскопа.
Для поляризационной микроскопии используют
парафиновые, замороженные и криостатные срезы. Неокрашенные
замороженные срезы для изучения в поляризованном свете
заключают в глицерин. Нефиксированные криостатные срезы пригодны
для поляризационно-микроскопического анализа сразу после
приготовления. В связи с их высокой чувствительностью к
повреждающему действию различных факторов внешней среды
эти срезы все же рекомендуют фиксировать в 10 % нейтральном
формалине или растворе кальций-формола.
На результаты поляризационной микроскопии оказывает
влияние толщина гистологических срезов. При исследовании
толстых срезов создаются условия для наложения разных
анизотропных структур друг на друга. Кроме того, при разной толщине
срезов могут меняться анизотропные свойства изучаемых
структур, поэтому очень важно, особенно при сравнительных
исследованиях, обеспечивать постоянную толщину срезов.
Рекомендуемая максимальная толщина срезов не должна превышать 10 мкм.
Еще одним обязательным условием является тщательное де-
парафинирование срезов, так как неудаленные остатки
парафина дают выраженный эффект анизотропии, затрудняя
исследование. Парафин особенно долго задерживается на эритроцитах
и ядрах клеток. Для того чтобы полностью удалить парафин из
срезов, рекомендуют провести их следующую обработку.
Ксилол 30 мин
Спирт 100% 5 мин
Смесь метанола и хлороформа (11) при 50 °С 24 ч
Спирт 100% 5 мин
Спирт 70% 10 мин
Вода
186
Следует также иметь в виду, что срезы, которые подвергают
поляризационной микроскопии, не должны вступать в контакт с
фенолами (например, их нельзя просветлять в карбол-ксилоле).
ПОЛЯРИЗАЦИОННАЯ МИКРОСКОПИЯ ОТДЕЛЬНЫХ ТКАНЕЙ
И БИОЛОГИЧЕСКИХ СТРУКТУР
Амилоид
Умеренная первичная анизотропия амилоида значительно
усиливается при применении красителей — раствора Люголя и конго
красного (конгорот). Окраску конго красным, обусловливающую
зеленое свечение амилоида в поляризованном свете (дихроизм),
рекомендуют для его специфического выявления в тканях.
Окраска амилоида по Беннхольду. 1. Депарафинирован-
ные, обработанные в течение 24 ч в смеси метанола и
хлороформа (1.1) при 50 °С и доведенные до воды срезы окрашивают в
1 % водном растворе конго красного 15 — 20 мин (замороженные
срезы — 20 с).
2. Помещают на 15 с в насыщенный водный раствор
карбоната лития.
3. Обесцвечивают в 80 % спирте, затем ополаскивают в воде
(при неравномерном обесцвечивании повторно проводят через
раствор карбоната лития, обесцвечивают в 80 % спирте и
ополаскивают в воде).
4. Промывают в воде 15 мин, проводят через спирты
возрастающей концентрации и заключают в бальзам.
В поле поляризации амилоидные массы, окрашенные конго
красным, дают зеленое свечение. Для того чтобы
дифференцировать их от коллагеновых структур, также дающих
зеленоватое свечение, О. КошЬ^пу1 (1971) предложил заключать
препараты в гуммиарабик: при этом анизотропия коллагеновых
образований исчезает, а амилоида сохраняется.
Б. Ромейс рекомендует следующую методику заключения
препаратов в гуммиарабик с целью поляризационно-микроско-
пического выявления амилоида.
1. Фиксация материала в жидкости Карнуа.
2. Заливка в парафин, изготовление парафиновых срезов.
3. Тщательное депарафинирование с доведением препаратов
до дистиллированной воды.
4. Окрашивание в 2 % водном растворе конго красного 10 —
20 мин (замороженные срезы — 20 —30 с).
5. Ополаскивание в дистиллированной воде.
6. Заключение в гуммиарабик.
После заключения в гуммиарабик массы амилоида,
окрашенные конго красным, дают в поляризованном свете
желто-зеленое свечение.
187
Н.Р. М155таЫ и М. Наг1^1§ (1954) применили для
дифференциации амилоида и соединительнотканных волокон,
особенно при небольших амилоидных отложениях, окрашивание поли-
хромовым мети леновым синим, при котором амилоидные
субстанции в поляризованном свете дают ярко-красное свечение (а
при применении компенсатора — желто-красное), а не
содержащие амилоид образования — синее.
М. \\/Ытап (1975) предложил выявлять амилоид поляри-
зационно-микроскопически с использованием окрашивания то-
луидиновым синим. Эта реакция менее чувствительна, чем с
конго красным, однако, как считает автор, более специфична.
В связи с меньшей чувствительностью реакции ее рекомендуют
использовать для идентификации больших скоплений
амилоида.
Следует иметь в виду, что в сенильных бляшках головного
мозга (при болезни Альцгеймера) амилоид не всегда проявляет
анизотропные свойства.
Соединительная ткань
Коллаген
В неокрашенных срезах коллаген обладает анизотропией,
которая усиливается и сопровождается эффектом дихроизма при
использовании топооптических красителей или импрегнации
препаратов металлами — золотом, медью, серебром. При
импрегнации солями золота и серебра Б. Ромейс рекомендует
фиксировать материал в жидкости Ценкера без уксусной кислоты.
Тщательно депарафинированные срезы помещают на 30 мин в
1 — 2 % раствор нитрата серебра или трихлорида золота на
дистиллированной воде, в которую добавляют гидразингидрат
(1 каплю на 100 мл воды). После промывания в
дистиллированной воде срезы проводят через спирты восходящей
концентрации и заключают.
Незрелый коллаген, фибриллы которого более гидратирова-
ны и менее упорядочены, чем в зрелом, характеризуется более
слабой анизотропией по сравнению с ним. Интенсивность
анизотропии коллагена увеличивается с возрастом. При нагревании
анизотропия быстрее исчезает у незрелого коллагена. В
заживающей ране изменение выраженности анизотропии коллагена
происходит в течение нескольких дней. Двойное
лучепреломление коллагена, отчетливо проявляющееся при заключении
препаратов в смолы или капрат целлюлозы, может полностью
исчезать при заключении их в глицерин-желатин.
Для идентификации коллагеновых структур в
поляризованном свете чаще всего используют фенольную реакцию, реакции
с пикросириусом красным и солофениловым красным, сумахо-
вую реакцию.
188
Фенольная реакция. Отложение фенола и его производных
на коллагеновых волокнах вызывает изменение знака двоякого
лучепреломления на отрицательный. Такую инверсивную
реакцию вызывает не только фенол, но и фенольные соединения —
резорцин, бензальдегид, пикриновая кислота. Степень
выраженности этой реакции зависит от концентрации применяемых
веществ.
С. ЗсЬеипег и ]. Ни^зсЬепгеНег (1972) предлагают
следующие прописи фенольных реакций.
Фенольная реакция в парафиновых
срезах. 1. Срезы обрабатывают смесью метанола и хлороформа
(1:1) при50°С 24 ч.
2. Переносят в ксилол на 10 мин.
3. После подсушивания заключают в смесь фенола и
бальзама (10 г фенола в 10 мл бальзама).
Для качественного исследования препараты пригодны через
30 мин, для количественной оценки — через 2 — 10 дней.
Фенольная реакция в замороженных
срезах. 1. Подсушивают фиксированные в формалине и
ополоснутые в воде замороженные срезы.
2. Заключают, в 80 % раствор фенола (80 г фенола в 20 мл
воды при комнатной температуре).
Для качественного исследования препараты готовы через
30 мин. Для количественной оценки необходимо хранить
препараты в течение 2—10 дней в плотно закрытых чашках Петри,
в которые можно добавлять немного воды по мере ее испарения.
Качественную оценку коллагеновых структур осуществляют
путем регистрации отрицательного знака двоякого
лучепреломления с помощью компенсатора. Для количественной оценки
рассчитывают коэффициент фенольной реакции на основе
различий в показателях двоякого лучепреломления до и после
реакции. Если коэффициент (при заключении срезов в смесь фенола
и бальзама) ниже 3, то это свидетельствует о наличии в
препарате коллагеновых волокон с относительно большим количеством
свободных гидрофильных групп, что в нормальных тканях
характерно прежде всего для незрелого коллагена. В зрелых
коллагеновых волокнах коэффициент фенольной реакции выше 3.
Коэффициенты фенольной реакции в замороженных срезах
ниже, чем в парафиновых, что объясняется разной степенью
набухания тканей. Если при проведении фенольной реакции не
принимать в расчет липиды, то замороженные срезы можно
полностью высушить в эксикаторе и заключить в смесь фенола
и бальзама (как и парафиновые срезы). Обработанные фенолом
коллагеновые волокна после вымывания фенола растворителем
вновь приобретают положительную анизотропию.
Фенольная реакция позволяет идентифицировать коллаген
среди других гистологических структур. Однако следует иметь
в виду, что при определенных условиях другие фибриллярные
189
белки (эластин, фибрин, спонгин и др.) могут вызывать
изменение знака анизотропии после осаждения на них фенолов. С
помощью фенольной реакции целесообразно выявлять коллаген в
тех тканях, в которых его с трудом обнаруживают с помощью
других методов, например в гиалиновом хряще, фибриноиде,
базальных мембранах эпителия. С помощью фенольной
реакции удобно различать обызвествленную и необызвествленную
ткань костей и зубов на шлифах. В обызвеств ленных участках
фенольная реакция не проявляется. Следует также учитывать,
что интенсивность фенольной реакции ниже в коллагене,
заключенном в межуточную субстанцию, богатую кислыми глико-
заминогликанами, например в хряще, синовиальной оболочке
при ревматоидном артрите.
Реакция с пикросириусом красным. Пикросириус красный —
двухкомпонентныи краситель, в состав которого входят сириус
красный РЗВА и пикриновая кислота. Основным красящим
компонентом является сириус красный — анионный краситель,
вступающий в реакцию с основными группами молекул
коллагена, при этом молекула красителя ориентируется так, что ее
продольная ось параллельна оси коллагенового волокна.
Материал фиксируют в 10 % растворе формалина, ценкер-
формоле, жидкостях Карнуа, Буэна, Ромейса или Кайзерлинга.
При фиксации в глутаровом альдегиде интенсивность
анизотропии коллагена уменьшается на 40 % по сравнению с таковой при
фиксации в формалине [^ип^ие^^а Ь.С.У. е! а1., 1979]. Однако
после длительной (в течение нескольких месяцев) фиксации в
формалине интенсивность реакции ослабевает.
Окраска пикросириусом красным по
методу, предложенному Н. Ри сЫ:1 ег и соавт.
(1973). 1. Депарафинированные срезы доводят до воды. В
случае необходимости удаляют формалиновый пигмент с помощью
насыщенного раствора пикриновой кислоты в спирте.
Промывают срезы в проточной воде 10 мин.
2. Окрашивают раствором пикросириуса красного (0,1 %
раствор сириуса красного РЗВА в насыщенном растворе
пикриновой кислоты) 30 мин.
3. Быстро обезвоживают в трех порциях абсолютного
спирта, просветляют в ксилоле и заключают в пермаунт или
аналогичную синтетическую среду.
Растворы сириуса красного и пикриновой кислоты
рекомендуют готовить заранее, смешивая перед применением 10 мл
сириуса красного РЗВА и 90 мл насыщенного раствора
пикриновой кислоты.
Окраска пикросириусом красным прочна; не отмечено
выцветания препаратов при хранении их в течение 10 лет.
Окраска пикросириусом красным по О.
О а у а п и соавт. (1989). 1. Депарафинированные срезы
доводят до дистиллированной воды.
190
2. Инкубируют срезы в растворе пикросириуса красного при
комнатной температуре в течение 1 ч.
3. Помещают в 1 % раствор уксусной кислоты на 30 мин.
4. Ополаскивают в 3 сменах дистиллированной воды по 10 с
в каждой.
5. Окрашивают в гематоксилине Майера 5 мин.
6. Дифференцируют в 1 % растворе соляной кислоты в 70 %
спирте в течение нескольких секунд.
7. Промывают в проточной водопроводной воде 10 мин.
8. Обезвоживают в спиртах восходящей концентрации и
заключают в меркоглас.
На результаты поляризационной микроскопии коллагена
при окрашивании пикросириусом красным влияет толщина кол-
лагеновых волокон: чем толще коллагеновые волокна, тем
больше сдвиг цвета поляризации в сторону длинных волн, т.е. от
зеленого через желтый в сторону красного цвета [^ип^ие^^а Ь.С.У.
еЬ а1., 1982; Эауап Э. е^ а1., 1989]. Коллаген I типа формирует
толстые волокна, состоящие из плотно упакованных толстых
фибрилл, поэтому в поляризованном свете дает свечение в
спектре от желтого до красного цвета. Из коллагена III типа
образуются тонкие ретикулярные волокна, состоящие из рыхло
упакованных тонких фибрилл, поэтому он дает слабое свечение
зеленоватого оттенка. Коллаген II типа, присутствующий в гиа-
лине и эластическом хряще, не формирует волокон, а его очень
тонкие фибриллы образуют рыхлую сеть, тесно связанную с
межуточной субстанцией. Этот тип коллагена характеризуется
слабой анизотропией и различным свечением в поляризованном
свете.
По данным Б. Бауап и соавт. (1989), поляризованный цвет
тонких коллагеновых волокон (толщиной 0,8 мкм и менее)
различного типа колеблется от зеленого до желто-зеленого. Толстые
волокна (толщиной 1,6 — 2,4 мкм) имеют различные цветовые
характеристики в зависимости от типа. Красное и оранжевое
свечение дает коллаген III и V типов, а также коллаген I типа,
экстрагированный 0,1 М уксусной кислотой из кожи теленка. Коллаген
I типа, экстрагированный 0,15 М хлоридом натрия, чаще дает
желто-зеленое свечение. Для нерастворимого коллагена I типа из
бычьего пяточного сухожилия характерно желто-оранжевое
свечение. Проколлаген I типа характеризуется желто-зеленым
свечением. Тот же спектр имеет проколлаген III типа. Коллаген III
типа дает красно-оранжевое свечение, а II типа — желтое и
желто-оранжевое. Растворимый коллаген V типа из плаценты
человека характеризуется красно-оранжевым свечением.
Таким образом, к оценке типов коллагена по результатам
поляризационной микроскопии с применением окрашивания
пикросириусом красным нужно подходить осторожно.
Для изучения коллагена хряща с помощью этого красителя
срезы предварительно обрабатывают в 0,5 % растворе папаина в
191
течение 90 мин при 37 °С. Раствор папаина готовят на 0,02 М
фосфатном буфере при рН 4,7, содержащем 0,005 М
гидросульфита натрия и 0,0005 М ЭДТА. На этом этапе удаляют протео-
гликаны, связанные с коллагеном, и его анизотропия
возрастает.
Определение типов коллагена с помощью солофенилового
красного. 1. Депарафинированные срезы ополаскивают в 70 %
спирте.
2. Окрашивают в резорцин-фуксине (по Вейгерту),
разбавленном (1:1) 1 % солянокислым спиртом 24 ч при комнатной
температуре.
3. Тщательно отмывают в 70 % спирте до тех пор, пока не
прекратит отделяться краситель, и ополаскивают в
дистиллированной воде.
4. Окрашивают целестиновым синим (2,5 г железоаммоний-
ных квасцов растворяют в 50 мл дистиллированной воды,
добавляют 0,25 г целестинового синего В и кипятят 3 мин;
охлаждают, фильтруют и добавляют 7 мл глицерина) 5 мин при
комнатной температуре.
5. Тщательно промывают в проточной воде и ополаскивают в
дистиллированной воде.
6. Окрашивают раствором гемалауна Майера при комнатной
температуре 5 мин.
7. Промывают в водопроводной воде.
8. Быстро дифференцируют в 70 % кислом спирте.
9. Подсинивают в водопроводной воде 2 мин.
10. Ополаскивают в дистиллированной воде.
11. Окрашивают 60 мин раствором солофенилового красного
(0,1 г солофенилового красного ЗВЬ в 100 мл насыщенного
водного раствора пикриновой кислоты при рН 1,25 — рН
устанавливают, добавляя по каплям 5 н. соляную кислоту или 0,1 н.
гидроксид натрия.
12. Ополаскивают в двух смесях 0,01 н. соляной кислоты, в
каждой по 30 с.
13. Обезвоживают в спиртовой батарее, просветляют в
ксилоле и заключают в ЕикШ.
Результат: в поляризованном свете коллагеновые структуры,
состоящие из коллагена I типа, дают оранжевое свечение, III
типа — зеленое свечение.
Окрашивание резорцин-фуксином проводят для выявления
эластических волокон, гемалауном Майера — для выявления
ядер.
Сумаховая реакция. Сумах — разновидность
кустарниковых растений, из которого выделяют краситель с одноименным
названием, относящийся к группе пирогаллоловых. Он
обладает способностью менять знак двоякого лучепреломления
коллагена, давая эффект, сравнимый с таковым фенольной реакции,
однако более специфичный.
192
1. Замороженные (фиксированные или нефиксированные)
либо парафиновые срезы, обработанные в течение 24 ч при 50 °С
смесью метанола и хлороформа (1:1), проводят через спирты
уменьшающейся концентрации до воды в течение 15 мин.
2. Помещают в водный экстракт из листьев сумаха на 48 ч.
3. Промывают в воде 5 мин.
4. В течение 30 мин проводят через 70 % спирт, а затем
дважды через абсолютный, просветляют в ксилоле и заключают в
бальзам.
Результат: положительный знак анизотропии коллагена
меняется на отрицательный.
Ретикулярные волокна
Ретикулярные волокна, так же как и коллагеновые, обладают
анизотропией, но отличаются от последних тем, что после
обработки глицерином меняют знак лучепреломления с
положительного на отрицательный. После отмывания глицерина
положительный знак двоякого лучепреломления восстанавливается.
Предварительная обработка срезов спиртом высокой
концентрации (ацетоном, эфиром, хлороформом, ксилолом) приводит к
тому, что эффект воздействия глицерина на лучепреломляющие
свойства исчезает [5сЬт1сИ У/.]., 1958]. С учетом этих свойств
ретикулярных волокон для их дифференциации от коллагено-
вых предлагают заключать срезы в глицерин-желатин, при этом
положительный знак двоякого лучепреломления ретикулярных
волокон меняется на отрицательный. Реакцию считают
специфичной для данных волокнистых образований.
Анизотропные свойства базальных мембран, которые по
многим параметрам близки к ретикулярным волокнам,
непостоянны. Так, базальные мембраны кишечного эпителия, почечных
канальцев, амниона и хориона не обладают двояким
лучепреломлением, однако оно появляется под влиянием фенольной
реакции (инверсивная фенольная реакция). В то же время
базальные мембраны других органов (капилляров подслизистой
основы, плаценты) таким свойством не обладают. Это означает, что
базальные мембраны, которые отделяют эпителий от мезенхим-
ных элементов, содержат коллагеновые фибриллы,
ориентированные перпендикулярно длиннику мембраны [ЗсЬеипег О.,
Ни1зсЬепгеИег ]., 1972].
Эластические волокна
Эластические волокна обычно изотропны и приобретают двояко-
преломляющие свойства лишь при растягивании. Для поляриза-
ционно-микроскопической идентификации эластических волокон
используют две инверсивные топооптические реакции: реакцию с
толуидиновым синим и феррицианидом и анилиновую реакцию.
193
Обработка препаратов, содержащих эластические и коллаге-
новые волокна, забуференными растворами толуидинового
синего при рН 2,6 — 7,0 с последующей обработкой 5 % раствором
гексацианоферрата калия показала, что эластические волокна
дают инверсивную топооптическую реакцию при рН ниже 4,1, а
коллагеновые — при рН выше 4,1. Эта реакция связана с
адсорбцией красителя кислыми ГАГ, входящими в состав волокна.
Предварительная обработка срезов перманганатом калия
способствует значительному усилению эффекта анизотропии. В
поляризованном свете при окрашивании толуидиновым синим
эластические структуры дают сине-зеленое свечение. Степень
его можно оценивать количественно, например в
поляризационном микроскопе, оснащенном компенсатором с красным
фильтром. Это позволяет измерять эластолитическую активность.
Анилиновая реакция. Используют замороженные срезы и
парафиновые из материала, фиксированного в формалине.
Срезы извлекают из воды, переносят на предметный столик
микроскопа, промокают фильтровальной бумагой, после
обработки спиртом просветляют в терпеновом масле и заключают в
смесь терпенового масла и анилина, используя разные
концентрации последнего (от 10 до 80 %) вплоть до чистого анилина.
При необходимости получения срезов для длительного
хранения их заключают в бальзам. Для этого депарафинированные
срезы обрабатывают в ксилоле и ксилол-анилиновой смеси при
разных концентрациях анилина.
При анилиновой реакции эластические волокна дают
интенсивное отрицательное двоякое лучепреломление. По мере
возрастания концентрации анилина анизотропия возрастает.
Коллагеновые волокна при этом изотропны, лишь отдельные
волокна как исключение дают слабое двоякое лучепреломление.
Кислые гликозаминогликаны
Для поляризационно-микроскопической идентификации кислых
ГАГ используют топооптические реакции с тиазиновыми
красителями (толуидиновый синий, азур А) и с флюорохромами,
производными акридина (этакридина лактат, акридиновый оранжевый,
корифосфин О, трипафлавин). Эти красители обладают
способностью изменять лучепреломление, соединяясь с кислыми ГАГ.
Окраска кислых гликозаминогликанов тиазиновыми
красителями. 1. Материал фиксируют в смеси из 4 частей
абсолютного спирта и 1 части 40 % формальдегида.
2. Заливают в парафин.
3. Тщательно депарафинированные срезы доводят до
дистиллированной воды.
4. Окрашивают в 0,01 — 0,1 % растворе толуидинового синего
или азура А в ацетатном буфере при рН 4,1.
5. Промокают срезы фильтровальной бумагой.
194
6. Фиксируют в смеси из 6 —7 частей 2 % водного раствора
йодида калия и 1 части 2 % водного раствора гексацианоферра-
та калия несколько минут.
7. Срезы обезвоживают и заключают.
При поляризационно-микроскопическом исследовании
наблюдается анизотропная метахроматическая окраска ГАГ в
красный цвет.
Окраска кислых гликозаминогликанов акридиновыми
производными. 1. Парафиновые срезы из материала,
фиксированного в формалине, помещают на 30 мин в ксилол, затем на
5 мин в абсолютный спирт.
2. Переносят в смесь метанола и хлороформа (1:1) при 50 °С
на 24 ч.
3. Если реакция оценивается на качественном уровне, то
препарат обсушивают, заключают в нефлюоресцирующее
парафиновое масло и через 60 мин определяют разницу хода лучей в
объекте. При количественной оценке фиксируют координаты
препарата на предметном столике.
4. Осторожно удаляют покровное стекло с помощью ксилола
и через 96 % и 70 % спирты (по 10 мин) доводят до воды.
5. Обрабатывают 0,01 М раствором акридиновых солей
(акридиновый оранжевый N. этакридина лактат, корифосфин О,
трипафлавин) в буферной смеси (фосфатно-цитратный буфер)
при разных значениях рН 10 мин.
6. Ополаскивают в буферном растворе с тем же значением
рН, что и в растворе красителя.
7. Осторожно промокают фильтровальной бумагой и
высушивают на воздухе.
8. Покрывают нефлюоресцирующим парафиновым маслом.
9. Через 60 мин измеряют разницу хода лучей и определяют
знак двоякого лучепреломления.
В тех случаях, когда используют замороженные срезы, их 30
мин промывают в проточной воде, затем 10 мин — в
дистиллированной (ткань фиксирована в формалине или не
фиксирована). Для качественной оценки обсушивают, заключают в
нефлюоресцирующее парафиновое масло. Для количественной
оценки следует зафиксировать положение препарата,
обработать его ксилолом и далее, начиная с п. 4, обрабатывать так же,
как парафиновые срезы.
При количественной оценке содержания кислых ГАГ
рассчитывают коэффициент (2 по формуле:
Г^Гд
г0
где Го — разница хода лучей перед обработкой акридиновым
красителем; Га — тот же показатель после обработки.
Если |Г0|<|Га1 и знак Гс и ГА одинаков, то используют
формулу:
195
0 = ^А
г()
Коэффициент (} характеризует количество кислых ГЛГ. Если
Го = Га, то (^ = 0, что свидетельствует об отсутствии кислых
ГАГ.
Определяют значение рН, при котором знак двоякого
лучепреломления меняется на противоположный. При этом
значении рН выявляют интересующие исследователя разновидности
кислых ГАГ. Так, сульфатированные кислые ГАГ (хондроитин-
сульфаты А, В, С) определяются при рН 2,6 и ниже,
фосфорсодержащие кислые группы идентифицируют при рН 3,0 — 4,6,
карбоксильные при рН 3,6 — 7,0.
При окраске акридиновыми производными кислых ГАГ дают
в поляризованном свете оранжево-красное свечение.
Мышечная ткань
Двояким лучепреломлением обладают и поперечнополосатые, и
гладкомышечные клетки, однако в последних анизотропия
выражена гораздо слабее. Сокращение усиливает анизотропные
свойства лейомиоцитов, в результате чего сокращенные гладко-
мышечные клетки в стенке артерий дают более сильное
свечение в поляризованном свете, чем релаксированные. Двоякое
лучепреломление гладкомышечных клеток выражено непостоянно
и во многом зависит от среды, в которую заключен препарат.
Лейомиоциты приобретают анизотропные свойства при
заключении препарата в среды с низким показателем
лучепреломления, например в раствор капрата целлюлозы в ксилоле.
Попытки дифференцировать лейомиомы и лейомиосаркомы от фиб-
робластических опухолей на основании выявления слабой
анизотропии гладкомышечных клеток не увенчались успехом.
Вместе с тем есть данные об успешной идентификации миоблас-
тов в опухоли Вильмса с помощью поляризационной
микроскопии [^Уо1тап М., 1975].
Наиболее широко применяют поляризационно-микроскопи-
ческие исследования поперечнополосатых мышечных волокон.
Для выявления в них эффекта двоякого лучепреломления
волокна должны быть ориентированы вдоль плоскости
гистологического среза. Поперечно срезанные волокна для такого
исследования непригодны. Эффект анизотропии дают так
называемые анизотропные диски — А-диски, которые характеризуются
свечением, чередуясь с темными изотропными дисками — 1-дис-
ками (рис. 3). А-диски представляют собой участки мышечного
волокна, на которых толстые миозиновые и тонкие актиновые
миофиламенты располагаются параллельно друг другу. В
местах локализации 1-дисков находятся только актиновые фила-
менты, а также 2-полосы, к которым они прикрепляются.
196
Рис. 3. Структура поперечнополосатых мышечных волокон миокарда в
поляризованном свете Чередование светящихся А-дисков с темными 1-дисками
Неокрашенный криостатный срез х 400
С помощью поляризационной микроскопии удобно выявлять
наиболее универсальные повреждения мышечных волокон
миокарда и скелетных мышц — контрактурные повреждения [Цел-
лариус Ю.Г., Семенова Л.А., 1977]. Принято выделять 3 стадии
этих повреждений. В I стадии усиливается анизотропия на
отдельных участках мышечных волокон. Во II стадии А-диски с
повышенной анизотропией сближаются, вследствие чего
толщина 1-дисков уменьшается (рис. 4). В III стадии А-диски
сливаются в сплошной анизотропный конгломерат (рис. 5).
Наряду с контрактурными повреждениями поляризационная
микроскопия позволяет идентифицировать еще один тип
поражения поперечнополосатых мышечных волокон —
гиперрелаксацию саркомеров, свойственную в большой мере ишемии
миокарда [Кактурский Л. В., 1981].
Нервная ткань
В нервной ткани эффект анизотропии дают миелиновые
оболочки, специфические гранулы нейросекреторных клеток и
отростки астроцитов. Миелиновые оболочки нервных волокон на
поперечных срезах в поляризованном свете дают характерное
анизотропное свечение. При дегенеративных неврологических
заболеваниях (лейкодистрофия, рассеянный склероз) и при других
видах патологии нервной системы отмечается распад миелино-
вых оболочек, что отчетливо определяется при поляризацион-
197
41111111111!.
Рис. 4. Контрактурные повреждения II степени, сочетающиеся с участками
гиперрелаксации саркомеров, в поляризованном свете: сближение А-дисков с
уменьшением толщины 1-дисков в местах контрактурных повреждений и
расхождение А-дисков с увеличением 1-дисков в местах гиперрелаксации
саркомеров. Неокрашенный криостатный срез, х 400.
Рис. 5. Контрактурные повреждения III степени в поляризованном свете:
слияние А-дисков в сплошной анизотропный конгломерат. Неокрашенный
криостатный срез, х 280.
ной микроскопии. Для исследования используют замороженные
и криостатные срезы.
Анизотропными свойствами обладают специфические
гранулы нейросекреторных клеток. Для их поляризационно-микро-
скопического выявления предлагают проводить обработку
препаратов перманганатом калия с последующей окраской псевдо-
цианиновыми красителями.
Отростки астроцитов обладают анизотропией и дают эффект
дихроизма после окраски трипановым синим, конго красным,
генциановым фиолетовым, метиловым фиолетовым,
импрегнации золотом. Для усиления эффекта дихроизма предлагают
смещать анализатор на 10° по отношению к оптической оси.
Таким способом удается, например, отчетливо
дифференцировать глиобластому [^УЫтап М., 1975].
Жиры и липиды
Для исследования используются замороженные срезы из
нефиксированного или фиксированного в формалине материала.
Нельзя применять фиксаторы, содержащие растворители липи-
дов. Срезы заключают в глицерин.
Эффектом анизотропии обладают холестерин и его эстеры,
фосфатиды, цереброзиды, миелины. Нейтральные жиры, жирные
кислоты, мыла характеризуются отсутствием лучепреломляющих
свойств. Г.А. Меркулов (1969) предложил выделять две группы
оптически активных жировых субстанций: 1) вещества,
анизотропия которых исчезает при нагревании и вновь появляется при
охлаждении; 2) вещества, анизотропные свойства которых при
нагревании не исчезают. К первой группе относятся холестерин и
его эстеры, ко второй — цереброзиды, фосфатиды и миелины.
Для того чтобы выявить названные свойства жировых
субстанций, установив факт анизотропии, изучаемый препарат
нагревают на спиртовке и снова просматривают в поляризованном
свете. Если анизотропия при нагревании исчезла, а затем при
охлаждении восстановилась, то это служит доказательством
принадлежности идентифицируемого вещества к холестерину и
холестеринэстерам. Холестерин в свободном виде имеет форму
анизотропных ромбовидных пластинок, в срезах — игольчатых
кристаллов. Холестеринэстеры имеют кристаллическую форму
(игольчатую и глыбчатую) либо существуют в паракристалли-
ческом состоянии в виде двоякопреломляющих капель, дающих
в поляризованном свете свечение в виде поляризационного
креста. Переходу в плотные кристаллы способствует
охлаждение после нагревания, а также фиксация формалином.
Триглицериды существуют в организме в виде жидких
оптически изотропных капель. Однако при охлаждении
гистологического препарата на замораживающем микротоме или
непосредственно на предметном столике микроскопа (в последнем
199
случае предоставляется возможность зафиксировать точку
плавления) происходит их кристаллизация, при этом часто
появляются отрицательно анизотропные игольчатые кристаллы.
Лучше всего кристаллизуются благодаря высокой точке
плавления смеси с высоким содержанием стеариновой и
пальмитиновой кислот, хуже — масляной кислоты [ЗсЬппсИ; V*/.]., 1958].
Холестерин и холестеринэстеры обнаруживают в большом
количестве в атеросклеротических бляшках. Поляризационная
микроскопия эффективна при идентификации холестериновых
эмболов в органах. Анизотропные холестерин-триглицеридные
смеси обнаруживают при различных ксантоматозных
процессах: кожном ксантоматозе, болезни Хенда —Шюллера —Крисче-
на, ксантогранулематозе и др. При гиперлипопротеинемии II
типа ксантомные клетки в начале заболевания обладают
выраженной анизотропией, по мере прогрессирования болезни ли-
пидные отложения трансформируются в хромолипидные
(пигментные) гранулы, которые теряют анизотропию.
Гидрофильные липоиды, особенно фосфолипиды (в
частности, лецитин) в присутствии воды образуют так называемые мие-
линовые фигуры, дающие двоякое лучепреломление с
радиальным полем поляризации, что вызывает свечение в форме
поляризационного креста. Обработка тетраоксидом осмия приводит
к изменению знака двоякого лучепреломления.
Анизотропные жироподобные вещества можно подвергать
поляризационной микроскопии, используя замороженные
срезы, окрашенные Суданом III и заключенные в глицерин. В
этом случае они дают ярко-золотистое свечение.
Кристаллы
Кристаллы — наиболее благодатный объект для поляризацион-
но-микроскопического исследования, что связано с их
выраженным свойством двоякого лучепреломления. Поляризационная
микроскопия во многом обязана своим развитием
кристаллографии, давно взявшей на вооружение этот метод.
Выше была дана характеристика поляризационно-оптических
свойств липидных кристаллических образований. При различных
патологических процессах у человека важное значение имеют
также кристаллические структуры минерального происхождения.
Наиболее часто встречаются кристаллы в осадке мочи и почечной
ткани. Анизотропные кристаллические осадки можно
идентифицировать не только по их форме, но и по чувствительности к
различным растворителям (табл. 6), которую можно определить
непосредственно в поляризационном микроскопе.
Чаще встречаются кристаллы оксалата кальция, которые
образуются при многих заболеваниях почек. Особенно
массивными бывают их отложения при первичном и вторичном оксалозе.
При цистинозе в интерстиции почек обнаруживают гексагональ-
200
Таблица 6 Растворимость кристаллических осадков мочи [ТМогп 1_., 1975].
Кристаллы
Оксалат кальция
Цистин
Тирозин
Мочевая кислота
Ураты
Растворимость
в щелочах
+
+
+
+
в минеральных кислотах
+
+
+
+
в уксусной кислоте
+ I + I I
ные вытянутые кристаллы цистина, рядом с которыми могут
откладываться мелкие сгруппированные кристаллы тирозина.
Двоякопреломляющие кристаллы мочевой кислоты и ураты
встречаются при подагре, мочекислом инфаркте у
новорожденных, лейкозах [ТаиЬег! С, 1977].
Поляризационно-микроскопическое исследование
синовиальной жидкости и синовиальной оболочки информативно для
дифференциальной диагностики подагры и суставного хондро-
кальциноза (пирофосфатной артропатии, или псевдоподагры).
Кристаллы выявляют экстра- и интрацеллюлярно в сегменто-
ядерных лейкоцитах — так называемые подагрические и
псевдоподагрические клетки. Большинство встречающихся при
подагре кристаллов игольчатой формы и характеризуются
отрицательным двояким лучепреломлением. В противоположность
этому кристаллы пирофосфата кальция, выявляемые при
псевдоподагре, более мелкие и обладают свойством положительного
двоякого лучепреломления. Кристаллы уратов из-за их
способности растворяться в воде в гистологических срезах обычно не
выявляют, в то время как кристаллы пирофосфата кальция из
срезов не вымываются.
Следует учитывать возможность образования в тканях арти-
фициальных кристаллических осадков. Так, при фиксации
почечной ткани в результате реакции мочевины и формалина
образуется кристаллический осадок диформолмочевины. Эти
кристаллы внешне похожи на кристаллы оксалата кальция, но
их можно отличить от них по способности растворяться в
разбавленной соляной кислоте (оксалаты растворяются в
концентрированной соляной кислоте).
Анизотропные включения встречаются в гигантских клетках
инородных тел, что позволяет дифференцировать их от других
клеток. При саркоидозе обнаруживают анизотропные
включения карбоната кальция в гигантских клетках Лангханса.
Похожие включения в гигантских клетках гранулем при бериллиозе
не дают эффекта анизотропии. Двоякопреломляющие
кристаллы выявляют в тканях при силикозе. Кристаллические
включения в тканях могут быть обусловлены применением сульфанил-
201
амидных препаратов, парентеральным введением талька,
крахмала (у наркоманов). Тальк и крахмал могут попасть в ткани с
резиновых перчаток хирурга, вызывая развитие грану лематоз-
ных реакций.
Другие объекты
Возможности поляризационной микроскопии очень
многообразны. Так, информативно изучение костей, в которых
анизотропией обладают и органический матрикс, и кристаллы апатита.
Таким образом, анизотропный эффект можно изучать и на
дека льцинированных, и на недекальцинированных срезах [\^о1-
тап М., 1975]. Зрелый необызвествленный остеоид также
обладает выраженной анизотропией. В недекальцинированных
срезах основным анизотропным компонентом является коллаген.
Заживление переломов костей сопровождается
прогрессирующим усилением анизотропии новообразованного коллагена. В
костях старых животных выраженность анизотропии костной
ткани выше, чем у молодых. То же относится к дентину зубов.
Резко выраженной анизотропией по сравнению с дентином и
цементом обладает эмаль. Кариес и флюороз вызывают
уменьшение анизотропных свойств эмали. Двояким лучепреломлением
обладают кератин и волосы. При аспирации амниотической
жидкости у младенцев или при эмболии околоплодными водами
сосудов матери в легких выявляют анизотропные чешуйки.
Анизотропные субстанции обнаруживают в органах и тканях
при болезнях накопления. При болезни Нимана — Пика
найдены анизотропные кристаллы в вилочковой железе, костном
мозге, лимфатических узлах, а в нейронах встречаются сферо-
кристаллы, имеющие вид поляризационного (мальтийского)
креста. При болезни Тея —Сакса (амавротическая идиотия)
анизотропный материал выявляют в нейронах, при сульфатид-
ном липидозе (метахроматическая лейкодистрофия) — в
клетках нервной системы и других органов, при болезни Фабри — в
эндотелии, мышечных клетках и некоторых видах
эпителиальных клеток, а также в осадке мочи.
Заслуживают внимания методики выявления нуклеиновых
кислот в ядрах и цитоплазме клеток с использованием топоопти-
ческих красителей. О. КотЬ4пу1 (1967) предложил окраску толу-
идиновым синим с последующей обработкой феррицианидом для
поляризационно-оптического выявления ядерного хроматина. Он
показал, что интерфазные ядра могут выявляться только после
предварительного триптического переваривания гистонов.
0. ЗсЬеипег и ]. Ни^зсЬепгеНег (1972) предлагают
следующую методику выявления РНК.
1. Готовят замороженные срезы из ткани, фиксированной в
10 % нейтральном формалине (24 — 72 ч при 4 °С) и залитой в
парафин.
202
2. Промывают в воде 30 мин.
3. Окрашивают в 0,1 % растворе риванола на 0,6 М растворе
хлорида натрия 10 мин.
4. Подсушивают, ополаскивают в дистиллированной воде.
5. Наносят на препарат с помощью пипетки 2 % водный
раствор гексацианоферрата калия, и через 1 мин промокают
фильтровальной бумагой.
6. Заключают в тонкий слой гумми-сиропа (50 г по
возможности бесцветного гуммиарабика и 50 г глюкозы), растворяют в
50 мл дистиллированной воды в термостате и добавляют 0,15 г
гексацианоферрата калия и 1 мл 40 % формальдегида).
Результат: в поляризованном свете РНК дает
желто-оранжевое свечение. Необходимо использовать контрольные
препараты, обработанные рибонуклеазой.
Полезной представляется рекомендация использовать
поляризационную микроскопию для оценки результатов гистофер-
ментохимических реакций, в которых в качестве восстановителя
используют неотетразолий; оценка основана на определении
анизотропии кристаллов формазана [ЗсЬеипег С, Ни1зсЬепге-
Нет]., 1972].
ГЛАВА 9
ПРИНЦИПЫ ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКОГО
ИССЛЕДОВАНИЯ И ОРГАНИЗАЦИЯ РАБОТЫ
ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКОЙ ЛАБОРАТОРИИ
Достоинство электронной микроскопии — ее высокая
разрешающая способность. Электронный микроскоп принципиально
не отличается от светооптического. Если в последнем
используется поток световых лучей и формирование изображения
зависит от степени поглощения света в различных участках объекта,
то в электронном микроскопе оно определяется рассеиванием
электронов. Основное отличие состоит в том, что разрешающая
способность светооптических микроскопов ограничена длиной
волны светового пучка, а в электронных микроскопах
благодаря очень малой величине длины волны электронов достигается
высокое разрешение
ОСОБЕННОСТИ РАЗМЕЩЕНИЯ
ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКОЙ ЛАБОРАТОРИИ
В такой лаборатории отдельное помещение предназначается для
электронного микроскопа. Фирмы, изготавливающие
электронные микроскопы, как правило, снабжают заказчиков
подробными инструкциями об условиях размещения и эксплуатации
приборов. Несмотря на то что микроскопы разных систем
различаются по чувствительности к вибрации, большинство
изготовителей рекомендуют устанавливать их на прочном фундаменте на
нижнем этаже. Особенно следует избегать соседства с лифтами
и рентгеновскими установками. Необходимо обеспечить
подведение воды для охлаждения микроскопа. Последние модели
микроскопов имеют автономное охлаждение замкнутого цикла.
Это отдельные установки с встроенными холодильником и
насосом, подающим охлажденную жидкость в колонку в заданном
режиме. Предусматривается наличие двух дополнительных
электросхем с автоматическими выключателями (напряжение
сети 210 — 220 В, мощность 5 кВт) и отдельного контура
заземления, так как прибор имеет очень высокое выходное
напряжение (100—150 кВ). Помещение, в котором установлен
электронный микроскоп, должно быть обеспечено принудительной
вентиляцией, так как при работе прибора выделяется большое
количество тепла и паров от вакуумных насосов.
204
Фотокомната должна примыкать к помещению, в котором
установлен микроскоп. В фотокомнате необходимо иметь
большую раковину для проявления, вмещающую по крайней мере
четыре кюветы размером 28 х 36 см каждая. Рядом с раковиной
размещают бачок с отдельным краном для промывания в
проточной воде фотопластинок и отпечатков. Желательно
использовать два фотоувеличителя (один для печати с пластинок,
другой — для фоторабот с пленками) и сменные фотообъективы —
короткофокусный для 6—12-кратного и длиннофокусный для
2 —б-кратного увеличений.
Отдельное помещение предназначается для фиксации
материала, его обезвоживания, проводки через смолы и заключения
в блоки. В нем должен быть вытяжной шкаф и обеспечена
хорошая вентиляция, так как часто используемые материалы, в
первую очередь эпоксидные смолы, катализаторы, отвердители,
растворители типа ацетона, диоксана и др., токсичны.
В том случае, если в лаборатории проводятся
радиоавтографические исследования с применением светового и
электронного микроскопов, необходимо выделить помещение для работы с
радиоактивными веществами и комнату для фотографических
работ. Первое оборудуется принудительной вентиляцией, а
специальное покрытие стен и пола должно обеспечивать
возможность их мытья и обработки. В этом помещении необходимо
иметь вытяжной шкаф, подводку холодной и горячей воды,
холодильник для хранения сред и нестабильных радиоактивных
предшественников, фиксации материала при пониженной
температуре, термостат для инкубации культур, пропитывания и
полимеризации образцов, лабораторный стол с легко моющейся
поверхностью, сейф для хранения радиоактивных
предшественников и отходов, шкаф для лабораторной посуды и
инструментов. На использование такого помещения нужно получить
разрешение центра санитарно-эпидемиологического надзора.
Персонал лаборатории должен пройти инструктаж по работе с
радиоактивными веществами.
Комната для фотографических работ должна быть снабжена
светонепроницаемыми шторами, обеспечивающими полную
темноту. К обязательному оборудованию такого помещения
относятся проводка холодной и горячей воды, холодильник для
хранения эмульсий и экспонируемых препаратов, водяная баня для
расплавления эмульсии и работы с ней, лабораторный фонарь
со сменными светофильтрами (№ 117 и № 118). Пригодность
фильтра и расстояние от него до рабочего места проверяют
путем сравнения фона пробных препаратов (необлученных и
облученных) через испытуемый фильтр. В фотокомнате также
должны быть стол и шкафы для хранения реактивов, посуды и
инструментов.
205
НЕОБХОДИМЫЕ ПРИБОРЫ И ОБОРУДОВАНИЕ
С помощью электронной микроскопии изучают в основном те
же объекты, что и в световом микроскопе, поэтому лаборатория
электронной микроскопии должна быть оснащена тем же
оборудованием, аппаратурой и химическими реактивами, которые
используют в обычных гистологических лабораториях.
Специальным оборудованием для лаборатории электронной
микроскопии, кроме электронных микроскопов, являются
ультрамикротомы, прибор для нарезки стеклянных ножей,
специальные ванночки и пинцеты; вакуумная установка для
контрастирования и напыления образцов, триммерное устройство для
заточки блоков, ультратермостат и специальные кассеты для
блоков; установка для замораживания и высушивания образцов
для сканирующей электронной микроскопии, а также световые
микроскопы для просмотра окрашенных полутонких срезов,
холодильник и электронагреватель. Желательно иметь в
лаборатории компьютер типа «Видиоплан» для морфометрических
исследований фотоизображений клеточных органелл.
Для фотокомнаты необходимы стационарные
фотоувеличители типа «Беларусь-2», «Азов-3», фотоаппарат, часы-реле
типа «Янтарь», электрический глянцеватель для фотоотпечатков,
негатоскоп, бачки для проявления фотопленки и пластинок,
фотоэкспонометр и кинокамера. В лаборатории желательно иметь
настольный токарный станок и набор инструментов.
ГЛАВА 10
ПОДГОТОВКА МАТЕРИАЛА К ИССЛЕДОВАНИЮ
В ТРАНСМИССИОННОМ ЭЛЕКТРОННОМ
МИКРОСКОПЕ
ВЗЯТИЕ МАТЕРИАЛА
К забору материала для электронно-микроскопических
исследований предъявляются более строгие требования, чем это
принято в обычной гистологической технике. Одним из важных
моментов является уменьшение продолжительности периода
между забоем животного и взятием материала. Наиболее
чувствительны к процессам аутолиза нервные клетки, а также клетки
эпителия кишечника и гепатоциты. Наименее выраженные
изменения наблюдаются в мышечных и соединительнотканных
клетках [Райхлин Н.Т. и др., 1981].
По возможности фиксацию начинают еще до взятия кусочков
ткани, вводя фиксатор в орган т зИ;и. Затем ткань быстро
иссекают, переносят в каплю свежего фиксирующего раствора и
помещают на предметное стекло. После этого ткань режут на кусочки
размером не более 1—2 мм3, которые помещают в бюксы с
фиксирующей жидкостью. Переносить кусочки ткани удобнее с
помощью широкой пастеровской пипетки.
Перфузионный метод фиксации создает наиболее
благоприятные условия для сохранения ультраструктуры клеток, его
рекомендуют использовать при работе с клетками мозга и
миокарда. В качестве перфузнойного раствора применяют 2,5 %
раствор глутарового альдегида на 0,2 М фосфатном буфере рН 7,4.
Для выравнивания осмолярности фиксирующего раствора
используют сахарозу. Наркотизированное животное (крысу)
фиксируют на предметном столике, после чего на передней
поверхности грудобрюшной стенки делают «окно». Затем через
надрез левого желудочка сердца в аорту вводят иглу,
соединенную с перфузионной системой, и фиксируют на аорте
лигатурой. Для оттока крови и жидкости одновременно надрезают
ушко правого предсердия. После непродолжительного
промывания кровеносной системы изотоническим раствором хлорида
натрия (50 — 70 мл) приступают к предварительной перфузионной
фиксации. Количество перфузионного раствора составляет
около 200 мл, продолжительность перфузии — 25 мин. Этот метод
забора с предварительной фиксацией рекомендуют
использовать при исследовании клеток миокарда, мозга,
периферической нервной системы и почек [ЗаЬаиш Э., Вашей К., 1972].
207
СПОСОБЫ ФИКСАЦИИ
Кусочки органа или ткани сразу же после иссечения у
животного помещают на пробку или фильтровальную бумагу,
смоченную фиксатором. С помощью пинцета и лезвия нужно из
небольших кусочков аккуратно нарезать для фиксации кусочки
размером 1 — 1,5 см3 и поместить их в фиксирующую жидкость.
Прямоугольная форма кусочков способствует более быстрому
проникновению в ткань фиксатора и облегчает последующую
ориентацию при заключении в смолы.
Фиксирующая жидкость должна обладать определенными
свойствами: 1) очень быстро проникать в глубь объекта,
предупреждая действие протеолитических ферментов; 2)
способствовать сохранению внутриклеточных структур; 3) исключать
перемещение структур и макромолекул в клетках в результате
осмотических явлений; 4) обеспечивать максимальную
сохранность внутриклеточных включений (липиды, углеводы) и
образований (микропили, микровакуоли и т.д.). Вопрос о
максимальном сохранении в клетках легко растворимых веществ
наиболее трудный и актуальный.
Идеальный фиксатор не должен вызывать сморщивания
клетки и ее набухания, т.е. по отношению к клетке он должен
быть изотоническим. В связи с этим состав большинства
наиболее распространенных фиксаторов подбирают таким образом,
чтобы концентрация веществ в среде соответствовала 0,3 М.
Осмиевые фиксаторы
Наибольшее распространение получили фиксаторы, в состав
которых входит тетраоксид осмия или глутаровый альдегид.
Раствор тетраоксида осмия очень медленно проникает в ткань —
скорость его проникновения 0,75 мм/ч, поэтому
продолжительность фиксации кусочка ткани размером 1 мм3 составляет 60 —
90 мин. Оптимальную продолжительность фиксации
устанавливают опытным путем в зависимости от типа ткани, размера
кусочка, концентрации фиксатора, используемого буферного
раствора. Осмиевый фиксатор прежде всего взаимодействует с ли-
пидами и белками по месту двойных связей. Нуклеиновые
кислоты и углеводы почти не взаимодействуют с тетраоксидом
осмия, если они не связаны с белками. При длительной
фиксации в тетраоксиде осмия продукты реакций многих белков и ли-
пидов легко растворяются в воде и могут быть удалены,
поэтому целесообразно фиксировать образцы в течение
непродолжительного периода времени.
В 1963 г. Э. ЗаЪаНш и соавт. предложили метод фиксации
биологических объектов в глутаровом альдегиде. Вначале
предполагали, что глутаровый альдегид, являясь
низкомолекулярным веществом, проникает в ткань быстрее, чем тетраоксид
208
осмия, и продолжительность фиксации в нем должна
составлять 30 мин — 2 ч в зависимости от величины и особенностей
объекта. Однако в дальнейшем было установлено, что
оптимальная продолжительность фиксации в глутаровом альдегиде
2 —3 ч. В глутаровом альдегиде лучше сохраняются цитоплазма
и другие мембранные структуры клетки, более полной является
фиксация белков и углеводов. Он является наилучшим
фиксатором для сохранения тонких клеточных структур. Липидные
молекулы при этом не стабилизируются, для их сохранения
требуется дополнительная фиксация в тетраоксиде осмия. В связи
с этим в настоящее время наиболее распространена двойная
фиксация: вначале в глутаровом альдегиде, а затем в растворе
тетраоксида осмия (см. ниже).
Фиксация в растворе тетраоксида осмия. Для
исследования применяют рабочие растворы А и Б.
Раствор А — 0,1 М веронал-ацетатный буфер (рН 7,6);
5,5-диэтилбарбитурат натрия 14,7 г
ацетат натрия 9,7 г
бидистиллированная вода 500 мл
Раствор Б — 2 % раствор тетраоксида осмия
В химически чистую темную стеклянную посуду наливают
необходимое количество бидистиллированной воды. Ее объем
устанавливают в зависимости от содержания в ампуле по массе
кристаллического тетраоксида осмия. Тщательно отмывают
стеклянную ампулу с кристаллами осмия, делают на ампуле
надрез, помещают в посуду с отмеренным количеством воды,
разбивают ампулу и размешивают раствор стеклянной
палочкой. Осмий растворяется в течение 24 ч. Готовый раствор
должен быть прозрачным и слегка желтоватым. Его можно хранить
в холодильнике в течение длительного периода времени. Для
лучшей сохранности раствора в него необходимо добавить три-
оксид хрома из расчета 10 мг на 100 мл раствора. Можно также
разлить раствор в ампулы, запаять и хранить в холодильнике.
Состав фиксирующего раствора:
0,1 веронал-ацетатный буфер (рН 7,6) 5 мл
0,1 М раствор соляной кислоты 5 мл
бидистиллированная вода 2,5 мл
2 % раствор тетраоксида осмия 12,5 мл
Фиксатор должен иметь рН 7,4. Если рН сдвигается в
кислую сторону, то необходимо добавить несколько капель 5 %
раствора диэтилбарбитурата натрия, если в щелочную —
несколько капель 0,1 М раствора соляной кислоты.
Для повышения осмотического давления в фиксатор
добавляют 4,5 % раствор сахарозы. С целью выравнивания
осмотического давления фиксатора и фиксируемой ткани можно
ввести растворы солей натрия, калия и кальция. Однако введение
209
этих солеи может привести к вымыванию некоторых веществ из
тканей. Для приготовления такого раствора (фиксатора)
используют основные растворы А и Б.
Раствор А*
ацетат натрия 9,7 г
5,5-диэтилбарбитурат натрия 14,7 г
бидистиллированная вода до 500 мл
Раствор Б'
хлорид натрия 40,3 г
хлорид калия 2,1 г
хлорид кальция безводный 0,9 г
бидистиллированная вода до 500 мл
Состав фиксирующего раствора:
раствор А 5 мл
раствор Б 1,7 мл
0,1 М раствор соляной кислоты 5,5 мл
бидистиллированная вода 0,3 мл
2 % раствор тетраоксида осмия 12,5 мл
рН фиксатора должен быть в пределах 7,2. Для подкис л ения
применяют 0,1 М раствор соляной кислоты, а для подщелачива-
ния — 0,28 М раствор 5,5-диэтилбарбитурата натрия (14,7 г в
500 мл воды).
Возможности применения данного фиксатора несколько
ограничены в связи с использованием веронал-ацетатного буфера,
что не позволяет сохранить в тканях многие важные включения
и образования. В связи с этим можно использовать осмиевый
фиксатор на фосфатном буфере. Этот буфер нетоксичен, имеет
более приемлемое для тканей значение рН в пределах 7,4 и
характеризуется высокой буферной емкостью. Применение
осмиевого фиксатора на фосфатном буфере предотвращает
вымывание белков, сохраняет гликоген и фибриллярные структуры,
обеспечивает более равномерную фиксацию всей ткани.
Продолжительность фиксации 60 — 90 мин. Для составления
рабочего раствора используют основные растворы А, Б, В, Г:
раствор А — 5,1 % раствор дигидроортофосфата натрия
моногидрата, раствор Б — 5,5 % раствор гидроксида натрия (растворы
А и Б можно хранить в течение 10 дней и более), раствор В —
5,4 % раствор глюкозы (быстро портится даже при 4 °С),
раствор Г — 49,5 мл раствора А и 10,8 мл раствора Б.
Состав фиксирующего раствора:
раствор Г 20 мл
раствор В 5 мл
2 % раствор тетраоксида осмия 25 мл
Раствор фиксатора должен иметь рН 7,3 и при хранении в
холодильнике оставаться стабильным в течение нескольких не-
210
дель. Этот фиксатор наиболее распространен в практике
электронно-микроскопических исследований.
Фиксатор Колфида для растительных клеток:
веронал-ацетатный буфер (рН 7,6) 5 мл
0,1 М раствор соляной кислоты 5 мл
дистиллированная вода 2,5 мл
4,5 % раствор сахарозы 4 мл
2 % раствор тетраоксида осмия 12,5 мл
Глутаральдегидные фиксаторы
Фиксация глутаровым альдегидом характеризуется быстрым
проникновением его в ткани и ровной стабилизацией мембран в
клетках. Растворы (25 % и 50 %) специально
стабилизированного глутарового альдегида для электронной микроскопии
поставляют во флаконах вместимостью 25 мл. Хранить их необходимо
при 4 °С. Продолжительность фиксации — от 2 до 4 ч в
зависимости от размеров и свойств ткани. Фиксацию лучше проводить
при комнатной температуре, так как понижение ее до 0 °С хотя
и сводит к минимуму посмертные изменения ткани и
экстрагирование тканевых компонентов, однако при этом уменьшается
скорость проникновения фиксатора в ткань Для получения
удовлетворительных результатов важное значение имеют
чистота и рН рабочих растворов глутарового альдегида. В
концентрации 25 % и выше глутаровый альдегид может окисляться
кислородом воздуха и выпадать в осадок. Продукты этих реакций
оказывают отрицательное влияние на качество фиксатора, а в
результате накопления глутаровой кислоты снижается рН
раствора альдегида, поэтому 25 % раствор глутарового альдегида
предварительно нейтрализуют карбонатом бария. Для этого
необходимо раствор глутарового альдегида на 1<з объема
заполнить карбонатом бария и оставить в холодильнике на 2 сут.
После нейтрализации раствор годен к использованию.
С целью очистки глутарового альдегида от примесей,
образующихся при полимеризации, нужно многократно встряхивать
раствор с активированным углем или же произвести перегонку
под вакуумом. Для адсорбции на активированном угле
необходимо 200 мл раствора глутарового альдегида смешать с 40 г
активированного угля и профильтровать под вакуумом.
Процедуру повторяют трижды, добавляя каждый раз по V-* порции
активированного угля. Выход чистого реактива составляет 10—15 %.
Перегонка под вакуумом позволяет получать глутаровый
альдегид лучшего качества и с большим выходом, чем при адсорбции
на активированном угле. В круглодонной колбе на 500 мл при
пониженном давлении (2 кПа) и температуре 60 — 65 °С
перегоняют 250 мл глутарового альдегида. Первые 20 мл дистиллята
отбрасывают, к оставшейся части после снятия вакуума медлен-
211
но приливают равный объем дистиллированной воды (при 70 —
75 °С). Растворы смешивают на магнитной мешалке в
атмосфере азота. Полученный раствор разливают в ампулы по 5 мл,
предварительно заполненные парами азота. Ампулы следует
хранить в светонепроницаемом контейнере при 3 — 4 °С.
Для приготовления фиксатора на фосфатном буфере
используют растворы А и Б: раствор А — 0,1 М раствор гидроорто-
фосфата натрия, раствор Б — 0,1 М раствор дигидроортофос-
фата калия. Смешивают 70 мл раствора А и 30 мл раствора Б и
доводят рН до 7,2 — 7,4.
Состав фиксирующего раствора:
25 % раствор глутарового альдегида 2 мл
фосфатный буфер (рН 7,2 —7,4) 23 мл
Приготовленный фиксатор можно хранить в течение 10—12
дней при 4 °С.
Глутаральдегидный фиксатор Миллонинга на фосфатном
буфере:
25 % раствор глутарового альдегида 8 мл
5,1 % раствор дигидроортофосфата натрия дигидрата 32 мл
дистиллированная вода до 50 мл
рН доводят до 7,3 — 7,4 5,5 % раствором гидроксида натрия.
Глутаральдегидный фиксатор на какодилатном буфере
(табл. 7):
25 % раствор глутарового альдегида 4 мл
0,2 М раствор какодилата натрия 25 мл
дистиллированная вода до 50 мл
рН доводят до 7,3 — 7,4 1 М раствором соляной кислоты.
Для промывания тканей после фиксации можно
использовать 0,3 М какодилатный буфер (см. табл. 7).
Таблица 7. Состав какодилатного буфера
Компонент
Какодилат натрия
Соляная кислота
Сахароза
Вода
Молярность, М
0,2
0,1
2
-
Объем, мл
50
8
4,2
37,8
Молярная
концентрация после
разведения до 100 мл
0,20
0,016
0,084
-
В последнее время благодаря своей универсальности и
стабильности при хранении получил распространение осмиевый
фиксатор на 5-коллидиновом буфере.
Буферный раствор:
212
5-коллидин 2,67 мл
0,1 М раствор соляной кислоты 9 мл
дистиллированная вода до 100 мл
При этом получается стойкий 0,2 М буферный раствор с рН
7,4 — 7,5. Этот раствор можно хранить довольно долго и
использовать для приготовления осмиевых, перманганатных и глута-
ральдегидных фиксаторов. Однако он имеет свойство
сравнительно быстро восстанавливать осмий, поэтому такой фиксатор
нужно использовать в течение 3 — 4 дней после приготовления.
Состав фиксирующего раствора:
5-коллидиновый буфер 1 часть
2 % раствор тетраоксида осмия 2 части
В результате получается 1,33 % раствор тетраоксида осмия в
0,067 М буферном растворе.
Перманганатные фиксаторы
Перманганатные фиксаторы широко применяют для фиксации
растительных тканей и в меньшей степени для фиксации
животных тканей. Химические процессы, лежащие в основе фиксации
перманганатом калия, пока еще не совсем ясны. Результаты
экспериментов т уИго свидетельствуют о том, что если тетраок-
сид осмия связывает молекулу белков и стабилизирует их, то
перманганат калия растворяет одни белки и резко изменяет
другие. Некоторое количество ДНК сохраняется, но скопления
хроматина в ядре неразличимы. Плохо видны рибосомы.
Однако фосфолипидные мембраны сохраняются очень хорошо,
поэтому перманганатные фиксаторы играют важную роль при
исследовании мембранных структур в растительных клетках.
Веронал-ацетатный буфер:
5,5-диэтилбарбитурат натрия 14,7 г
ацетат натрия 9,7 г
дистиллированная вода до 500 мл
Приготовленный 2 % раствор перманганата калия хранят во
флаконе темного цвета с притертой пробкой при 4 °С.
Состав перманганатного фиксатора:
2 % раствор перманганата калия 12,5 мл
веронал-ацетатный буфер 5 мл
0,1 М раствор соляной кислоты 5 мл
дистиллированная вода 2,5 мл
рН раствора доводят до 7,3 — 7,4 соляной кислотой.
Конечная концентрация перманганата калия составляет 0,6 %. Более
высокие концентрации могут привести к повреждению клеток.
Продолжительность фиксации не более 1 ч.
213
Двойная фиксация
В настоящее время наиболее распространенным методом
консервации и сохранения ткани является двойная фиксация, т.е.
первичная фиксация в растворе глутарового альдегида с
последующей дополнительной фиксацией в растворе тетраоксида
осмия. Этот метод сочетает в себе преимущества обоих
фиксаторов: сохраняется больше белков, чем при фиксации только в
тетраоксиде осмия, а последний в свою очередь стабилизирует
некоторые нейтральные липиды и большую часть фосфолипи-
дов. Кроме того, тетраоксид осмия не рекомендуется применять
для перфузии, так как это вещество вызывает спазм
кровеносных капилляров и фиксатор почти не проникает в клетки.
ХАРАКТЕРИСТИКА БУФЕРНЫХ РАСТВОРОВ
Верона л-а цетатный буфер в начале проведения
электронно-микроскопических исследований был единственным
буфером для приготовления осмиевых фиксаторов. Однако он
непригоден для альдегидных фиксаторов, так как реакция,
происходящая между фиксатором и буфером, лишает последний
буферных свойств. Кроме того, этот буферный раствор плохо
сохраняется.
Фосфатные буферы применяют как с осмиевыми, так и с
глутаральдегидными фиксаторами. Они представляют собой
так называемые физиологические буферы, поскольку имеют
сходные компоненты с тканевыми жидкостями, нетоксичны,
имеют рН 7,4 и характеризуются очень высокой буферной
емкостью. Для приготовления осмиевых фиксаторов особенно
удобно использовать фосфатный буфер Миллонинга, так как он
предотвращает вымывание белков и других веществ в процессе
фиксации.
Какодилатный буфер особенно широко
применяют при элекронно-гистохимических исследованиях. Его
используют для приготовления как осмиевых, так и альдегидных
фиксаторов.
5-к оллидиновый буфер получил распространение
сравнительно недавно. Его преимущество по сравнению с
другими буферными растворами состоит в том, что он остается
стабильным и не подвергается разрушению в течение длительного
периода времени. Отмечено также, что применение этого
буферного раствора облегчает получение срезов, так как блоки после
пропитывания им становятся более эластичными.
Следует добавить, что, как показывает практика, при
двойной фиксации целесообразнее использовать один буфер для
обоих фиксаторов.
214
ОБЕЗВОЖИВАНИЕ МАТЕРИАЛА
Обезвоживание имеет важное значение для проведения
качественной полимеризации смолы в биологических объектах.
Большая часть смол, используемых для заключения материала, не
смешивается с водой. Следовательно, для того чтобы ткани
полностью пропитались заливочной средой, воды в них должно
быть как можно меньше или она должна быть замещена такой
средой, которая способна смешиваться с заливочной массой. С
этой целью использовали различные обезвоживающие
растворы, в том числе ацетон и метанол, однако.практика показала,
что удаляет воду из ткани и при этом вызывает ее наименее
выраженные повреждения этиловый спирт. Однако спирт
растворяет липиды, поэтому обезвоживание необходимо проводить
быстро. Если материал сразу же перевести из фиксатора в
100 % спирт, то могут возникнуть механические повреждения
вследствие изменения поверхностного натяжения и воздействия
образующихся при смешивании этих жидкостей токов. В связи
с этим материал проводят через батарею спиртов возрастающей
концентрации - 50 %, 70 %, 90 %, 100 %.
Особенно тщательно необходимо обезвоживать объекты на
заключительном этапе — в 100 % спирте (кусочки выдерживают
в трех его порциях по 10 мин). На заключительном этапе
можно использовать абсолютный ацетон, предварительно
обезвоженный прокаленным сульфатом меди, однако при этом
имеется риск растворения липидных компонентов.
Если заливочная масса смешивается со спиртом, то сразу
после обезвоживания кусочки ткани можно перенести в
приготовленную заливочную среду. В остальных случаях ткань
нужно обработать такой жидкостью, которая смешивается как с
этанолом, так и с заливочной средой. Так, для заливки в
эпоксидные смолы в качестве такой промежуточной жидкости
используют окись пропилена (2 смены по 5 мин).
Затем ткань переносят в небольшой бюкс или флакон,
содержащий неполимеризованную заливочную смолу. В ней кусочки
должны находиться до полного пропитывания (при комнатной
температуре для этого обычно достаточно нескольких часов).
Фиксатор или обезвоживающую жидкость необходимо
каждый раз сливать из флаконов, следя за тем, чтобы не смыть
кусочки ткани.
ЗАЛИВКА МАТЕРИАЛА В ПОЛИМЕРЫ
От правильно проведенной заливки и полимеризации зависит
получение качественных тонких срезов, поэтому большое
внимание уделяют выбору компонентов заливочных смол (отверди-
тель, ускоритель, пластификатор, катализатор). Используемые
215
с этой целью реактивы должны в мономерном состоянии иметь
достаточно низкую вязкость, необходимую для свободного
пропитывания препарата; полностью смешиваться с раствором, в
котором ведется обезвоживание образца (ацетон, этиловый
спирт); иметь постоянный объем до и после полимеризации;
быть удобными для изготовления ультратонких срезов из поли-
меризованного материала с заключенным в нем объектом; не
влиять на качество изображения; быть устойчивыми к действию
электронного пучка и не плавиться в полимеризованном
состоянии.
Оптимальными средами для заливки биологических
материалов являются эпоксидные смолы (аралдит и эпон),
полиэфирная смола вестопал и водорастворимые среды (аквон, гликоль-
метакрилат и др.).
Краткая характеристика заливочных смол
Применение эпоксидных смол (аралдит и эпон) позволило
решить ряд проблем, которые возникали при заливке в метакри-
латы. В значительной степени уменьшилось сморщивание и
повреждение ткани при полимеризации, перестало быть
проблемой образование воздушных пузырьков внутри блока.
Подвижка и испарение эпоксидных смол под воздействием
электронного пучка очень незначительны. Срезы тканей, заключенных в
эпоксидные смолы, достаточно прочны, и их можно
монтировать на сетки или бленды без опорной пленки-подложки из
формвара. В настоящее время в качестве заливочных сред в
большинстве лабораторий применяют аралдит и эпон. Особенно
хорошее качество блоков достигается при использовании смеси
этих смол.
Полиэфирные смолы обладают почти теми же свойствами,
что и эпоксидные. Полимеризация их протекает однородно,
разбухание тканей и нарушение клеточных органелл
незначительно. Широкое применение в электронно-микроскопических
исследованиях получил в основном вестопал ^. Эту смолу
используют чаще всего в тех случаях, когда необходимо получить
высокое разрешение. Поскольку прочность срезов,
приготовленных из материала, залитого в эту смолу, высокая, а скорость
ее испарения под действием электронного пучка низкая, то
деформация клеточных компонентов, возникающая в результате
лиофилизации материала, сводится к минимуму. Однако
изготовленные из вестопала блоки режутся довольно трудно и
требуется определенный навык в приготовлении ножей.
Водорастворимые смолы (аквон, гликольметакрилат, дурку-
пан) легко растворимы в воде, поэтому нет необходимости в
обезвоживании. Обычно достаточно обезвоживания,
происходящего при проведении ткани по заливочным средам
возрастающей концентрации. При этом ткань хорошо окрашивается гисто-
216
логическими красителями, возможно проведение
гистохимических реакций, которые исключаются при заливке в эпоксидные
смолы.
Заливка в аралдит
Перед проводкой материал обезвоживают в спиртах
возрастающей концентрации. Затем во флакон с материалом доливают
окись пропилена, которая является проводником заливочной
среды в объект, дважды сменяя ее и постепенно изменяя
соотношение окись пропилена — аралдит в сторону увеличения
последнего.
Первая смесь для пропитывания:
аралдит 50 % 1 часть
уплотнитель НУ 964 1 часть
окись пропилена 2 части
Смесь нужно тщательно перемешивать в течение 1 ч и
контролировать отсутствие в ней пузырьков. Для перемешивания
лучше использовать магнитную мешалку при 50 °С.
Приготовленный раствор хорошо сохраняется в течение 2 нед. При
пропитывании объекта температуру необходимо поддерживать в
пределах 60 °С. Продолжительность пропитывания мягких
объектов 2 —3 ч, твердых — до 24 ч.
После этого объекты необходимо провести при комнатной
температуре через 2 смены окончательной заливочной массы.
В ее состав на 20 мл входят по 1 части аралдита М и
уплотнителя НУ 964, 0,4 мл катализатора ДУ 064 и 0,6 мл
пластификатора.
Смесь с добавлением катализатора и пластификатора готовят
при комнатной температуре. Степень ее полимеризации зависит
от тщательности перемешивания составных компонентов и
точного соблюдения указанных пропорций. Бюкс с заливочной
средой помещают на магнитную мешалку и перемешивают в течение
2 ч. Затем в вакуумном термостате отсасывают имеющиеся в
смеси пузырьки воздуха (10—15 мин при давлении 98 кПа).
Кусочки ткани извлекают из бюкса с заливочной массой и
помещают в капсулы конусообразной формы, чтобы сразу
ориентировать блоки для резания. Заполненные заливочной массой
капсулы ставят в специальные пластмассовые штативы.
Полимеризацию осуществляют в ультратермостате с реле времени при
начальной температуре 48 °С, затем при 60 °С — до 1 сут.
Описанная методика позволяет получать блоки средней
твердости. Плотность блока регулируют, добавляя большее или
меньшее количество пластификатора и изменяя
продолжительность полимеризации.
Заливка в аралдит рыхлых объектов. После обезвоживания
в этиловом спирте ткань проводят через раствор окиси пропиле-
217
на в течение 2 —б ч и помещают в смесь для заливки на 2 — 6 ч
при комнатной температуре, а после пропитывания — в свежую
заливочную смесь для полимеризации на 24 ч при 60 °С.
Первый вариант заливки. Предварительная
смесь представляет собой раствор равных объемов аралдита М
и уплотнителя. Раствор тщательно перемешивают при 50 °С,
затем помещают в вакуумный термостат с целью удаления
пузырьков.
Заливочная смесь:
аралдит М 10 мл
уплотнитель НУ 964 10 мл
катализатор ДУ 064 0,4 мл
пластификатор 0,5 мл
Эта смесь легко проникает в объект, а блоки имеют
твердость вышсЧредней.
Второй вариант заливки. Предварительный
раствор состоит из 10 частей аралдита М и 7 частей уплотнителя
НУ 964. Для приготовления заливочной среды необходимо в
этот раствор добавить 1,5 — 2 % катализатора ДУ 064. Второй
вариант заливки также позволяет получать блоки средней
твердости. Путем изменения количества уплотнителя в
предварительной смеси можно приготовить более мягкий или более
твердый блок.
Заливка в эпон
Довольно высокая гигроскопичность эпона затрудняет резание
приготовленных из него блоков. Для того чтобы избежать
попадания влаги из воздуха в запасные растворы эпона, их следует
хранить в плотно закупоренных флаконах. С этой же целью
следует закрывать флаконы при пропитывании и заливке
ткани.
Наиболее часто для заливки биологических объектов
применяют следующий способ.
1. Кусочки из последних порций абсолютного спирта
переносят в две смены безводного ацетона — на 20 мин в каждую.
2. Готовят предварительный раствор эпона: на 100 мл смолы
эпон 812 добавляют 89 мл уплотнителя НМА (ИМА) или 136 мл
уплотнителя ДДСА фОЗА).
3. Помещают объекты в смесь ацетона с предварительным
раствором (1:1) и выдерживают 1—3 ч.
4. Готовят заливочный раствор эпона, добавляя к
предварительному 1,5 — 2 % катализатора ДМП-30 (ДМР-30); смесь
тщательно перемешивают.
5. В капсулы с заливочным эпоном помещают кусочки ткани
и ориентируют их на дно капсул.
218
6. Полимеризацию проводят по следующей схеме:
а) помещенные в термостат капсулы выдерживают в течение
12 ч при 35 °С (капсулы обязательно должны быть закрытыми);
б) на протяжении следующих 12 ч — при 45 °С;
в) в течение еще 12 ч — при 60 °С.
Полученные таким образом блоки средней твердости можно
резать через 2 — 3 сут. Различной твердости блоков добиваются,
подбирая дозу уплотнителей опытным путем. При
использовании в качестве уплотнителя ДДСА получают мягкие блоки, а
НМА — очень плотные, поэтому предлагается готовить два
запасных раствора. Первый из них состоит из эпона и
уплотнителя ДДСА, второй — из эпона и уплотнителя НМА. Блок
средней твердости получается при смешивании 7 частей первого
раствора и 3 частей второго. К каждым 10 мл такой смеси
добавляют 0,2 мл катализатора ДМП-30.
Оставшуюся заливочную среду можно хранить в
морозильной камере холодильника или при глубоком замораживании: в
этих условиях смесь не полимеризуется в течение 7—10 дней.
Заливка в смесь эпона и аралдита
Многие исследователи считают заливку материалов в эту смесь
более удобной и универсальной. Эпон значительно быстрее
проникает в ткань, чем аралдит. Аралдит лучше сохраняет
ультраструктуру клеток, и блоки легче поддаются резке. Кусочки
ткани после обезвоживания и проводки через окись пропилена
хорошо пропитываются смолами при комнатной температуре.
Предложены два варианта смеси эпона и аралдита.
Первый вариант:
эпон 812 100 г
аралдит 502 55 г
уплотнитель ДДСА или НУ 964 180 г
катализатор ВДМА или ДУ 064 10 г
После пропитывания в этой смеси ткань помещают в свежую
заливочную среду, подогретую до 60 °С. Качество аралдита и
эпона в зависимости от хранения может быть различным,
поэтому возможна коррекция с помощью уплотнителей.
Второй вариант:
аралдит М 20 мл
эпон 812 25 мл
уплотнитель ДДСА (НУ 964) 60 мл
катализатор ДМР-30 1,5 — 2,5 % (4 — 8 капель)
После пропитывания ткань помещают в капсулы и полиме-
ризуют при 60 °С. Полученные блоки имеют среднюю
твердость.
219
Заливка в вестопал У\1
Эту полиэфирную заливочную среду рекомендуют использовать
для заливки твердых тканей. При этом следует учитывать, что
получаемые блоки очень твердые и резать их лучше с помощью
алмазных ножей или специальных стекол.
Для приготовления заливочной смеси к вестопалу ДУ
добавляют 1 % трет-бутилпарабензоата (инициатор) и 0,5 % нафтена-
та кобальта (активатор). Инициатор и активатор нельзя
смешивать непосредственно друг с другом, так как смесь их
взрывоопасна, поэтому после добавления каждого реактива смесь
тщательно перемешивают.
Вестопал XV не растворяется в этиловом спирте, поэтому
материал обезвоживают в растворах ацетона возрастающей
концентрации: в 30 %, 50 % и 75 % ацетон — по 15 мин, 90 % — 30 мин,
100 % - 30 мин.
Затем материал постепенно пропитывают в смеси безводного
ацетона и вестопала XV вначале в соотношении 3:1, затем 1:1 и
1:3. После этого материал помещают в капсулы с вестопалом XV и
переносят в термостат для полимеризации при 60 °С на 14 — 24 ч.
Заливка в водорастворимые среды
Ультратонкие срезы, приготовленные из материала, залитого в
эпоксидные смолы, почти непригодны для гистохимических
исследований. Не увенчалась успехом попытка введения
красителя в ткань вместе с фиксатором. Для того чтобы облегчить
проникновение красителей в клетку, были использованы
водорастворимые среды (дуркупан, гликольметакрилат и др.). При
заливке в гликольметакрилат не следует использовать осмиевый
фиксатор, а также старые смолы, в которых происходит
спонтанная полимеризация.
После фиксации в 2 % глутаровом альдегиде материал
обезвоживают, постепенно повышая при этом концентрацию
гликольметакрилата: 80 % раствор мономера гликольметакрилата
на дистиллированной воде — 2 порции по 10 мин, 97 % раствор
мономера гликольметакрилата на дистиллированной воде —
2 порции по 20 мин.
Затем материал пропитывают в течение 20 мин в непреполи-
меризованной заливочной смеси:
95 % раствор мономера
гликольметакрилата на дистиллированной воде 7 частей
бутилметакрилат 3 части
перекись бензоила 10—12 мл
Преполимеризованную заливочную смесь можно приготовить
несколькими способами. Наиболее приемлемым является следую-
220
щий: в коническую колбу тонким слоем (примерно 1 см)
заливают готовую смесь и нагревают до 80 — 90 °С (температура
кипения). В начале кипения колбу немедленно переносят в ледяную
баню и содержимое перемешивают до исчезновения пузырьков. В
обработанную таким образом смесь помещают материал на ночь.
Затем кусочки ткани переносят в свежую преполимеризован-
ную смесь, залитую в предварительно высушенные
желатиновые капсулы. Капсулы оставляют открытыми на 30 мин, чтобы
удалить пузырьки воздуха. Закрытые капсулы помещают в
камеры. Полимеризацию проводят с помощью ртутно-кварцевой
лампы в течение 1—3 сут при комнатной температуре. Между
капсулами и лампой должно быть расстояние 2 — 3 см.
Рабочая пропись полного цикла обработки материала:
фиксация, проводка, полимеризация
Предлагаемая схема обработки материала дает наилучшие
результаты при исследовании ткани печени, миокарда и
некоторых других тканей.
1. Фиксация: кусочки ткани помещают в 2 % раствор глута-
рового альдегида на фосфатном буфере.
2. Промывание: глутаровый альдегид отмывают в растворе
фосфатного буфера — 2 смены по 20 мин.
3. Дофиксация: после отмывки материал помещают в 1 %
раствор тетраоксида осмия на 2 ч.
4. Материал отмывают в растворе фосфатного буфера —
2 смены по 20 мин.
5. Обезвоживание:
50 % спирт 15 мин,
70 % спирт (2 смены) по 20 мин,
96 % спирт (2 смены) по 20 мин,
100 % спирт (2 смены) по 30 мин.
Затем материал переносят в раствор окиси пропилена —
2 смены по 10 мин.
6. Пропитывание:
окись пропилена — смесь смол (2:1) 60 мин,
окись пропилена — смесь смол (1:1) 60 мин,
окись пропилена — смесь смол (1:2) 30 мин.
Смесь смол включает 10 мл аралдита М, 12 мл эпона 812, 30
мл уплотнителя ДДСА и 8— 12 капель катализатора ДМП.
7. Заливка: кусочки ткани помещают в капсулы,
заполненные свежей смесью эпоксидных смол. Затем эти капсулы с
открытыми крышками размещают в специальных пластмассовых
штативах, чтобы материал осел на дно капсул. Капсулы
переносят в термостат на 1 ч при 50 °С для удаления пузырьков и
паров остатков окиси пропилена. После этого капсулы
накрывают крышками и оставляют в термостате на 24 ч при 60 °С.
221
Полученные таким образом блоки выдерживают 1 сут при
комнатной температуре, затем производят заточку и получают
ультратонкие срезы. Срезы помещают на сетки с подложкой и
окрашивают водным раствором уранилацетата и цитратом свинца.
Меры предосторожности при работе
в электронно-микроскопической лаборатории
Многие реактивы, используемые в электронной микроскопии
для обработки тканей, токсичны, и при обращении с ними
необходимо соблюдать правила безопасности.
1. Пары тетраоксида осмия раздражают дыхательные пути и
могут обусловить тяжелые поражения глаз. Раствор этого
реактива вызывает ожоги. Работать с раствором следует только в
вытяжном шкафу, так как его пары очень летучи и токсичны.
Если раствор попал на кожу рук, необходимо немедленно
смыть его проточной водой.
2. Окись пропилена также токсична и очень летуча. Работать
с ней следует только в вытяжном шкафу. Кроме того, это
вещество легко воспламеняется и может взорваться при работе в
помещении с открытым огнем. Окись пропилена хранят в бутылях
с притертой пробкой и в холодильнике.
3. Глутаровый альдегид не столь токсичен и летуч, как тетра-
оксид осмия, однако вдыхать пары этого вещества не
рекомендуется При попадании на кожу глутаровый альдегид может
вызвать дерматит.
4. Эпоксидные смолы, применяемые для заливки (эпон,
аралдит, метакрилаты, катализаторы и пластификаторы)
токсичны и обладают канцерогенными свойствами. При попадании
на кожу вызывают стойкий дерматит, поэтому при работе с
этими реактивами рекомендуется надевать резиновые перчатки.
Проводку и предварительную полимеризацию осуществляют в
вытяжном шкафу.
5. Амилацетат используют в качестве растворителя формва-
ра и коллодия при изготовлении подложек на сетках.
Амилацетат обладает наркотическими свойствами, и работать с ним
нужно в хорошо проветриваемой комнате или в вытяжном
шкафу. При длительном вдыхании паров амилацетата
возможны поражения печени.
6. Свинец, содержащийся в «электронных» красителях,
способен проникать через неповрежденную кожу и вызывать
неврологические расстройства. Свинец вместе с пылью попадает в
дыхательные пути, если растворы свинцовых красителей
разливаются и высыхают, поэтому необходимо вытирать стол и мыть
руки до и после работы с красителями.
7. Ацетон и ксилол легко воспламеняются. При длительном
вдыхании эти вещества могут вызвать поражение печени. С
этими растворами следует работать в вытяжном шкафу.
222
Рентгеновское излучение может достичь опасного уровня в
том случае, когда электронный микроскоп используется без
диафрагмы конденсорной линзы и на экран отбрасывается
большой пучок электронов. Для защиты оператора электронного
микроскопа от рентгеновского излучения проводят надежное
экранирование колонны, а в смотровые люки вставляют
освинцованные стекла. В электронных микроскопах последних
моделей, особенно зарубежных, обеспечивается надежное
экранирование и защита от рентгеновского излучения, поэтому опасности
этого воздействия практически не существует. Для того чтобы
не сомневаться в надежности экранирования микроскопа,
следует проверить вновь смонтированный микроскоп с помощью
дозиметра и рекомендовать персоналу в течение первых 100 ч
работы использовать индивидуальные индикаторы излучения.
ГЛАВА 11
ПРИГОТОВЛЕНИЕ ПОЛУТОНКИХ СРЕЗОВ
И ИХ ОКРАШИВАНИЕ
Полутонкими называют срезы, которые по толщине занимают
промежуточное положение между толстыми срезами (5—10 мкм),
приготовляемыми с помощью микротома с блоков, залитых в
парафин или целлоидин, и тонкими (ультратонкими) срезами
(50— 100 нм), которые получают с помощью ультрамикротома с
блоков, залитых в эпоксидные смолы. Полутонкие срезы
готовят, как и тонкие, в ультрамикротоме из материала, залитого в
эпоксидные смолы. Толщина полутонких срезов от 0,5 до 2 мкм
(обычно 1 мкм). Приготовление полутонких срезов имеет много
общего с ультратомией, хотя оно, конечно, проще.
Изучение полутонких срезов — чрезвычайно полезный, а в
некоторых случаях незаменимый прием морфологического
анализа. Для того чтобы электронно-микроскопическое
исследование достигло своей цели, почти всегда необходим
предварительный просмотр полутонкого среза. Это позволяет оценить
топографию исследуемого объекта на тканевом и клеточном уровне,
расширить область исследования, применить цветное
окрашивание, рационально и точно выбрать участок для ультратомии,
установить корреляцию данных, полученных с помощью
электронно-микроскопических и светомикроскопических
исследований. Кроме достижения такой прикладной цели, как бы
расширяющей и облегчающей электронно-микроскопическое
исследование, анализ полутонких срезов может решать и
самостоятельные задачи. На полутонких срезах можно проводить многие
гистохимические [Ьетз Р., Кш§Ы; ^., 1977] и иммуноцитохи-
мические исследования, в том числе с применением метода
флюоресценции в проходящем и, что еще более важно, в
отраженном свете [Шеёег С, Во^зег 3., 1987].
При заливке в смолу клеточные компоненты сохраняются
лучше, чем при заливке в парафин, так как изображение
мелких деталей в полутонком срезе толщиной 1 мкм в 5 раз меньше
«размывается» перекрывающими деталями, чем в парафиновом
срезе толщиной 5 мкм, поэтому изображение в полутонком
срезе более четкое. Таким образом, исследование полутонких
срезов вполне может быть применено как самостоятельный
морфологический метод, даже в тех случаях, когда не
предусматривается последующее изучение материала в электронном
микроскопе.
224
ПРИГОТОВЛЕНИЕ СРЕЗОВ
В том случае, если материал подвергался обычной заливке для
электронно-микроскопического исследования, полутонкие
срезы, как правило, делают с таким расчетом, чтобы они
включали всю площадь залитого кусочка, т.е. они гораздо шире, чем
ультратонкие. Заточку блока производят в принципе так же,
как для ультратомии, но с большим размером пирамидки.
Желательно в отличие от тонких срезов, чтобы между тканью и
краем полутонкого среза со всех сторон была зона смолы. При
таком условии полутонкий срез отражает морфологию не
только глубоких, но и самых поверхностных зон кусочка.
Последние могут отличаться от первых в связи с более интенсивным
воздействием на них фиксирующих веществ, растворителей,
контрастирующих и других реагентов. Кроме того, край из
«пустой» смолы позволяет захватывать срез пинцетом, не
повреждая ту его часть, в которой находится образец. Наиболее
удобная форма среза — полутрапеция, т.е. четырехугольник с
двумя прямыми углами, одним острым и одним тупым. При
такой форме среза разные углы служат удобными ориентирами,
позволяющими легко и достаточно точно находить выбранный в
срезе участок на лицевой поверхности блока для прицельной
ультратомии.
Полутонкие срезы режут с низкой скоростью, а чаще
вручную сухим стеклянным ножом, но можно резать и в водяную
ванночку. Резка сухим ножом обычно оказывается более
эффективной при толщине срезов 1 мкм и более. Срез толщиной
1 мкм при рабочем ходе штанги обычно остается на ноже в
более или менее смятом виде. Тем не менее при осторожном
обращении срез обычно удается зацепить за край пинцетом, не
прикасаясь при этом к режущему краю ножа. В таком виде срез
переносят в каплю воды на предметном стекле. Как правило,
поверхностное натяжение воды обеспечивает полное
расправление всех складок среза (процесс контролируют под стереомик-
роскопом ультрамикротома). Если полного расправления не
происходит, то режут новый срез. Для лучшего расправления
можно помещать срез на каплю 100 % спирта. С той же целью
на режущий край ножа можно помещать каплю глицерина.
В этом случае срез, распространяясь по мере срезания по
поверхности глицерина, вообще не мнется, но могут возникнуть
трудности с удержанием капли в нужном положении.
В том случае, если перечисленные приемы не позволяют
добиться расправления срезов, следует заменить сухой нож на
нож с ванночкой. К этому приему прибегают и в случае
необходимости получить срезы толщиной менее 1 мкм. Из ванночки
срезы извлекают проволочной петлей либо сразу
перекладывают на предметное стекло, погружая угол стекла в ванночку и
подправляя срезы пинцетом. Предметные стекла с каплей воды
225
и срезом или ленточкой срезов на ее поверхности помещают на
20 — 30 мин в термостат или на плиту при 80 °С. После полного
испарения воды срез оказывается прочно приклеенным к
поверхности стекла и, как правило, удерживается на ней при
любых дальнейших манипуляциях. В большинстве случаев
полутонкие срезы можно рассматривать и фотографировать как
с сухими, так и с иммерсионными объектами без заключения и
применения покровного стекла. При удалении иммерсионного
масла ватным тампоном со спиртом не происходит повреждения
и обесцвечивания среза.
ОКРАШИВАНИЕ СРЕЗОВ
Полутонкие срезы можно окрашивать, не удаляя пластмассу.
Эти методы окрашивания более просты и обеспечивают
окраску, вполне достаточную для изучения многих видов
биологического материала. Самый распространенный и простой прием —
это окрашивание среза путем нанесения на его поверхность
капли 1 % раствора метиленового или толуидинового синего.
В зависимости от свойств ткани, пластмассы и толщины среза
окрашивание может продолжаться от нескольких секунд до 1 ч.
Плохо воспринимающий краситель материал можно окрашивать
с прогревом на спиртовке или в термостате или предварительно
в течение нескольких минут обработать 3—10 % раствором
перекиси водорода. Заключенные в эпоксидную смолу ткани
окрашивают 1 % раствором основного фуксина в 50 % ацетоне.
Можно применять двойной краситель: 1 % толуидиновый синий
и 1 % азур II в 1 % растворе тетрабората натрия.
Предложено несколько методов многоцветного окрашивания
полутонких срезов без удаления смолы [Науа!: М., 1986].
Одним из наиболее простых является следующий.
Раствор А*
метиленовый синий 0,13 г
азур II 0,02 г
глицерин 10 мл
метанол 10 мл
фосфатный буфер (рН 7,0) 30 мл
вода 50 мл
Раствор Б.
основной фуксин 0,1 г
50 % спирт 10 мл
вода 90 мл
Срезы сначала окрашивают 20 — 30 мин в растворе А с
нагревом до 65 °С, затем промывают водой и докрашивают 1 — 3 мин
в растворе Б с последующим промыванием водой.
226
После удаления смолы можно применять разнообразные
методы окрашивания, в том числе гистохимические. Однако
прибегать к методам, связанным с удалением смолы, следует лишь
в тех случаях, когда иначе цель не может быть достигнута.
Удаление смолы может оказать заметное влияние на морфологию
образца. Для удаления смолы рекомендуют использовать
несколько способов, наиболее простой из которых — обработка в
течение 10 мин в 2 % гидроксиде натрия на 100 % спирте [Вегко-
Шг Ь. ека!., 1968].
ГЛАВА 12
ПРИГОТОВЛЕНИЕ УЛЬТРАТОНКИХ СРЕЗОВ
И ИХ ОКРАШИВАНИЕ
Приготовление ультратонких срезов, т.е. срезов, пригодных
для исследования в трансмиссионном электронном микроскопе,
называют ультратомией. Ультратомия необходима по двум
причинам: 1) электронный пучок трансмиссионного электронного
микроскопа, работающего при ускоряющем напряжении 50 —
80 кВ, не проникает сквозь срезы, толщина которых
значительно превышает 100 нм; 2) в толстом срезе клеточные компоненты
перекрывают друг друга и видны менее четко. Этим
объясняется понижение разрешающей способности с увеличением
толщины среза. Разрешающая способность среза — это наименьшая
величина объекта, различимого в срезе. Обычно разрешающая
способность среза заметно ниже разрешающей способности
электронного микроскопа, поскольку возможности ультратомии
отстают от возможностей современных электронных
микроскопов. При оптимальных условиях заливки и выполнения
ультратомии не удается получить срезы тоньше 30 нм. Обычная же
толщина ультратонких срезов 50—100 нм. Однако для
приготовления даже таких срезов требуются не только знания и
опыт, но и искусство.
НОЖ ДЛЯ УЛЬТРАТОМИИ
Непременным условием получения качественных ультратонких
срезов является хороший нож. Материал, залитый в
эпоксидные смолы, режут стеклянным или алмазным ножом. Для
изготовления стеклянных ножей можно использовать специальные
приборы — найфмейкеры, предлагаемые некоторыми
зарубежными фирмами, но можно изготовить отличные ножи и
вручную с помощью стеклореза и специальных щипцов или даже
приспособленных плоскогубцев. В качестве материала для
изготовления ножей удобно использовать полоски специального
стекла. В отсутствие их нарезают полоски зеркального стекла
шириной 2,5 см и толщиной около б мм. Окончательное
заключение о пригодности стекла для ультратомии можно сделать
только после получения пробной серии срезов.
Предназначенные для изготовления ножей полоски стекла
тщательно моют и высушивают, но не вытирают, в противопо-
228
ложном случае стекло электризуется, к нему прочно прилипают
срезы и пыль. Сначала из полосок нарезают квадратные
кусочки со стороной 2,5 см. Для изготовления ножа по диагонали
такого квадратика, отступя от угла 2 — 3 мм, проводят царапину
стеклорезом. Направление царапины должно чуть-чуть не
соответствовать идеальной диагонали квадрата, чтобы в случае
проведения царапины без отступа она была бы смещена от угла на
0,5 мм. Плавным нажатием щипцов квадратик разламывают на
две половины треугольной формы. При разломе того же угла
квадрата, от которого отступала царапина, на одной из
половинок (той, в сторону которой царапина была смешена от
диагонали) образуется острый режущий край — он и является режущей
кромкой ножа. Естественно, если царапина расположена
одинаково по отношению к обоим противоположным углам квадрата,
из него получатся два ножа.
В стеклянном ноже принято различать переднюю
поверхность, т.е. одну из сторон бывшего стеклянного квадрата (во
время резания она обращена к блоку), и заднюю поверхность,
образованную при разломе по диагонали (во время резания она
обращена к исследователю и образует дно ванночки). По задней
поверхности ножа проходит в виде небольшого возвышения
кривая линия напряжения (линия слома), начинающаяся в
одном из углов режущего края и постепенно исчезающая около
противоположной этому углу боковой стороны ножа.
Качество ножа проверяют с помощью бинокулярного стерео-
микроскопа, смонтированного на ультрамикротоме. Некоторые
ультрамикротомы оборудованы специальным осветителем,
позволяющим сфокусировать свет. В таких приборах узкий пучок
света направляют на край установленного сухого ножа так,
чтобы он высвечивался в виде узкой полосы на темном фоне.
При таком освещении четко видна ровная часть края ножа в
виде сплошной светлой черты, начинающейся от угла, из
которого исходит линия слома, и продолжающейся на !/3 или даже
45 длины режущего края. Чем длиннее эта ровная часть, тем
лучше нож, так как для ультратомии используют только эту
часть края. Остальная часть в сфокусированном свете выглядит
в виде ряда ярких точек, поскольку содержит множество
зазубрин.
В ультрамикротомах, не имеющих специального осветителя
для ножа, последний можно осматривать, не закрепляя его в
приборе, а поворачивая в руках под нужным углом к свету.
Конечно, в этом случае определение длины ровной части
режущего края не столь точно. Опытные специалисты, пользующиеся
приборами без сфокусированного осветителя, вообще не
прибегают к специальному исследованию качества ножа. При работе
с одной партией стекла и применении отработанной техники
изготовления ножей они получаются достаточно стандартными.
Необходимо соблюдать определенные меры предосторожности,
229
чтобы случайно не испортить нож, в частности не прикасаться к
режущему краю, хранить нож в закрытой емкости не более
нескольких часов. При соблюдении этих условий почти половина
режущего края, как правило, бывает пригодна для ультрато-
мии. Если в ней при резании обнаружат какие-либо дефекты, то
режущий край (точнее, участок, соприкасающийся с блоком)
меняют.
ВЫБОР И ПОДГОТОВКА УЧАСТКА БЛОКА ДЛЯ ПОЛУЧЕНИЯ
УЛЬТРАТОНКИХ СРЕЗОВ
Для того чтобы блок для ультратомии заточить правильно с
технической точки зрения и рационально с научной, нужно
предварительно получить с этого блока полутонкий срез и
рассмотреть его. Полутонкий срез можно сделать с
неподготовленного блока либо с блока, заточенного для приготовления
полутонкого среза. В последнем случае при заточке с блока снимают
только излишек заливочного материала и срезу придают
желаемую форму. Ультратомия почти всегда прицельная, т.е. ее
проводят с таким расчетом, чтобы в ультратонком срезе была
представлена не случайная зона залитого кусочка, а зона, имеющая
наибольший интерес для исследования. Такую зону выбирают
по результатам просмотра полутонкого среза.
Задача заключается в том, чтобы при ультратомии не
«промахнуться» и резать именно тот участок, который был намечен
при просмотре полутонкого среза. Для этого выбранный в срезе
участок нужно найти на лицевой поверхности блока. На этой
поверхности в большинстве случаев не видны детали строения
клеток и тканей, различить можно только ткань и «пустую»
пластмассу. Ориентировка основывается на идентичности
внешнего контура среза и лицевой поверхности блока.
Для того чтобы внешние очертания среза и лицевой
поверхности блока могли служить ориентирами при выборе участка
для ультратомии, лицевая поверхность не должна быть
квадратной, так как в этом случае из-за того, что все углы и стороны
среза и лицевой поверхности блока одинаковые, невозможно
использовать эти углы и стороны в качестве ориентиров. Лучше
блок для полутонкого среза затачивать так, чтобы последний
имел форму полутрапеции, т.е. четырехугольника с двумя
прямыми, одним тупым и одним острым углами. Дополнительными
ориентирами при выборе участка для ультратомии могут быть
нередко оставляемые ножом царапины, хорошо видимые и на
срезе, и на блоке.
После просмотра полутонкого среза под микроскопом и
выбора участка для прицельной ультратомии проводят
перезаточку блока для получения ультратонких срезов (тримминг). Для
этого с помощью бритвы, ультрамикротома или специального
(триммерного) устройства формируют четырехгранную пирами-
230
ду с плоской вершиной. Эта вершина представляет собой
лицевую поверхность блока, подлежащего ультратонкому резанию.
При тримминге нужно учитывать, что чем меньше лицевая
поверхность блока, тем легче получить особо тонкие срезы; чем
шире основание пирамиды и меньше ее высота, тем полнее
устраняется вибрация блока при давлении его на нож и
соответственно срезы получаются ровнее. Если материал не был
диспергирован в виде отдельных клеток или суспензии, а представляет
собой кусочек, то вся лицевая поверхность должна быть занята
тканью, т.е. не содержать «пустой смолы», в противном случае
из-за неоднородности консистенции блока ухудшается качество
срезов.
Форма лицевой поверхности в принципе может быть
произвольной, но для получения ровной ленточки пирамиду
затачивают таким образом, чтобы срез имел форму трапеции,
полутрапеции, прямоугольника или квадрата. Иными словами, две
перпендикулярные направлению резания стороны обязательно
должны быть параллельны друг другу и режущему краю ножа.
Наиболее предпочтительна форма трапеции, ориентированной
так, чтобы первое соприкосновение с ножом происходило по
широкому основанию. Узкая вершина позволяет последующему
срезу легче отодвинуть от края ножа предыдущий срез. Кроме
того, такая форма в отличие, например, от прямоугольной
показывает направление резания и позволяет определить
последовательность серийных срезов.
ВАННОЧКА ДЛЯ НОЖА
Ультратонкие срезы невозможно сделать сухим ножом. Для
того чтобы срез по мере его образования отрывался от края
ножа и расправлялся, используют силу поверхностного
натяжения жидкости. С этой целью на задней стороне ножа монтируют
ванночку из металла, пластмассы или изоляционной ленты.
Металлическая и пластмассовая ванночка удерживается на ноже
пружинящими боковыми стенками, ванночку из ленты
приклеивают. Герметизацию ванночек проводят расплавленным воском.
Для блоков, залитых в эпоксидные смолы, наиболее
подходящей жидкостью для заполнения ванночки является чистая
дистиллированная вода. Для других заливочных материалов могут
оказаться более удобными другие жидкости, например 10 — 20 %
водный раствор спирта или ацетона.
Ванночку заполняют с помощью пипетки с резиновой грушей
или шприца, которые позволяют легко добавлять или удалять
небольшие количества воды. Обычно вначале ванночку
заполняют с некоторым избытком так, чтобы мениск был выпуклым и
полностью смочился режущий край ножа. Затем некоторое
количество жидкости удаляют с таким расчетом, чтобы
оставшаяся жидкость образовала плоскую поверхность на одном уровне
231
с краем ножа. Регулировкой света и уровня жидкости
добиваются такого состояния, чтобы серебристо-белесая зона
отражения от поверхности воды была максимальной по величине и
обязательно в том месте, где будет формироваться ленточка
срезов. Только при соблюдении этого условия можно определить
толщину срезов по цвету интерференции и своевременно
изменить условия резания при отклонении толщины срезов от
желаемой величины.
ПОСЛЕДОВАТЕЛЬНОСТЬ ОПЕРАЦИЙ УЛЬТРАТОМИИ
1. Рукоятки грубой и тонкой подводки устанавливают в
исходное положение.
2. Штангу образца закрепляют в средней точке рабочего хода.
3. Вставляют и закрепляют блокодержатель с блоком.
4. Устанавливают нож с ванночкой (пустой или содержащей
жидкость ниже нормального уровня). Высота режущего края
ножа должна точно соответствовать отметке на приборе.
5. Устанавливают угол наклона передней поверхности ножа
и лицевой поверхности блока. Его величина зависит от
твердости заливочной среды и обычно составляет 2 — 5°.
6. Устанавливают середину высоты лицевой поверхности
блока на уровне режущего края ножа. В приборах фирмы
«ЬКВ» (Швеция) этого достигают путем изменения положения
блокодержателя, в приборах фирмы «КешЫег» (Австрия)
центр среза переводят в среднюю точку рабочего хода штанги с
помощью специального устройства.
7. Направляют свет на лицевую поверхность блока и
получают изображение ее в стереомикроскопе.
8. Подводят нож так, чтобы видеть режущий край вместе с
блоком.
9. Направляют свет на нож и блок так, чтобы при
подведении ножа на достаточно близкое расстояние на лицевой
поверхности блока появилось отражение ножа.
10. Поворачивая блокодержатель и нож, добиваются того,
чтобы отражение было параллельно режущему краю, а также
верхней и нижней границам среза; лицевая поверхность блока
должна быть параллельна режущему краю ножа.
11. Боковым смещением ножа устанавливают напротив
лицевой поверхности выбранный участок режущего края.
12. Подводят нож так близко, чтобы между его краем и
отражением на блоке осталась узкая щель.
13. Доводят уровень воды в ванночке до нормы.
14. Включают движения штанги. Между одиночными
рабочими циклами прибора продолжают подведение ножа
рукояткой тонкой подводки по 1 мкм.
15. Получают первый срез. Он, как правило, бывает
слишком толстым по меркам электронной микроскопии, поэтому его
232
следует отстранить ресничкой от края ножа. К этому,
бракованному, срезу можно прикасаться ресничкой и даже вынимать ею
срез из ванночки. С теми же срезами, которые предназначены
для просмотра, манипулируют следующим образом: действуя
ресничкой как веслом, создают в ванночке движение воды с
таким расчетом, чтобы оно обеспечивало перемещение срезов в
нужном направлении.
16. Устанавливают желаемую скорость резания, можно
начать с 2 — 3 мм/с. Включают автоматическое движение штанги
и автоматическую подачу.
17. После появления первых ультратонких срезов
регулируют их толщину, которую определяют (конечно,
приблизительно) по цвету интерференции срезов в ванночке [КеМ N.. 1974].
При использовании сред с показателем преломления около 1,5
(эпоксидные смолы, метакрилат) срезы толщиной менее 60 нм
имеют серый цвет, 60 — 90 нм — серебристый, 90—150 нм —
золотистый, 150—190 нм — красный, 190 —240 нм — голубой.
18. Проверяют качество срезов (ровность ленточки,
равномерность толщины, отсутствие царапин от ножа). Если для его
улучшения нужно изменить скорость резания, то это можно
сделать только во время возвратного (не рабочего) хода штанги.
19. После получения достаточного количества срезов
выключают движения штанги и автоматическую подачу, отстраняют
ленточку срезов от режущего края и стенок ванночки.
20. Расправляют срезы хлороформом. Для этого полоску
фильтровальной бумаги, смоченную хлороформом, держат
несколько секунд над срезами.
21. Опускают на срезы сетку или бленду.
22. Высушивают срезы, прикасаясь краем сетки к
фильтровальной бумаге, и помещают в кассету или чашку Петри
«лицом» вверх.
Для смены режущего участка ножа его отводят немного
назад, отключают подачу, блок закрепляют в среднем
положении. Боковым смещением устанавливают напротив блока
выбранный участок режущего края. Понижают уровень воды в
ванночке, для того чтобы получить отражение ножа на лицевой
поверхности блока. Дальнейшие операции осуществляют в
описанной выше последовательности.
ТРУДНОСТИ, ВОЗНИКАЮЩИЕ ПРИ УЛЬТРАТОМИИ,
ИХ ПРИЧИНЫ И СПОСОБЫ ПРЕОДОЛЕНИЯ
Ультратонкие срезы получаются только после более или менее
продолжительного периода неудач начинающего ультратомиста.
Приведенное ниже описание возникающих трудностей и
способов их преодоления направлено на уменьшение
продолжительности этого периода.
233
I. Включена автоматическая подача, штанга совершает
рабочие движения, а срезов нет. Возможные причины: 1) «лицо»
блока трется о переднюю поверхность ножа; 2) нож, блок,
держатель ножа или держатель блока плохо закреплены; 3)
вибрация и/или изменения температуры; 4) исчерпана возможность
механизма подачи; 5) затупился режущий край; 6) лицевая
поверхность блока отдалена от режущего края.
Способы устранения: 1) увеличить угол наклона ножа, 2)
закрепить, туго затянуть все винты; 3) устранить причину
вибраций и изменений температуры (укрепить и утяжелить стол,
прекратить работу моторов по соседству, не ходить во время
работы прибора, устранить сквозняки, отдалить нагревательные
приборы); 4) установить исходное положение механизма; 5)
сменить участок режущего края или нож; 6) подвести нож к блоку.
II. Срезы разной толщины. Возможные причины: 1) нож,
держатель ножа или блока не закреплены; 2) срезы слишком
велики; 3) неправильный угол клиренса; 4) высока скорость
резания; 5) тупой режущий край; 6) слишком уменьшена подача
из-за стремления получить очень тонкие срезы; 7)
нестандартны циклы ультрамикротома; 8) вибрации, сквозняки; 9)
слишком мягкий блок; 10) дефектный механизм или неправильная
установка прибора.
Способы устранения: 1) закрепить; 2) уменьшить размер
пирамидки; 3) изменить угол; 4) уменьшить скорость; 5) сменить
участок края и нож; 6) увеличить подачу, а потом попытаться
снова уменьшить ее; 7) отрегулировать прибор; 8) устранить
причину; 9) провести дополнительную полимеризацию при 60 —
80 °С в течение 24 ч. Сменить блок; 10) починить, установить
правильно.
III. Неравномерная толщина срезов. Возможные причины:
1) тупой нож (граница между зонами разной толщины
перпендикулярна режущему краю); 2) неоднородная консистенция
блока (есть «пустая» пластмасса); 3) вибрация (граница между
зонами разной толщины параллельна режущему краю); 4)
увлажнение отвердителя; 5) неправильное расположение ножа
и/или блока по высоте.
Способы устранения: 1) сменить участок режущего края или
нож; 2) изменить пирамидку, освободиться от «пустой» смолы;
3) устранить; 4) сменить отвердите ль; 5) правильно
расположить нож и блок.
IV. Срез остается на блоке. Возможные причины: 1) высокий
мениск; 2) мал угол наклона ножа; 3) грязь на блоке или ноже;
4) капля жидкости на лицевой поверхности блока; 5) капля
жидкости на передней поверхности ножа; 6) слишком мягкий блок;
7) лицевая поверхность блока наэлектризована; 8) не закреплены
блок и /или нож.
Способы устранения: 1) понизить уровень воды в ванночке;
2) увеличить наклон ножа вперед; 3) очистить блок бумагой
234
для оптики, заменить нож; 4), 5) удалить воду фильтровальной
бумагой; 6) прогреть при температуре 60 — 80 °С в течение 24 ч,
сменить блок; 7) прикоснуться влажной бумагой к лицевой
поверхности блока, увеличить влажность в комнате; 8) закрепить
нож и блок.
V. Лицевая поверхность блока увлажняется. Возможные
причины: 1) капля жидкости на передней поверхности ножа;
2) высокий уровень воды в ванночке; 3) низкая скорость
резания; 4) грязь на режущем крае.
Способы устранения: 1) удалить каплю бумагой; 2) понизить
уровень воды; 3) увеличить скорость; 4) очистить нож
фильтровальной бумагой, смоченной спиртом либо ацетоном, или сухой,
сменить нож
VI. Ленточка не образуется. Возможные причины: 1)
высокий мениск и ранний отрыв срезов от режущего края; 2)
верхняя и нижняя границы среза непараллельны; 3) верхняя и
нижняя границы среза непрямые; 4) низкая скорость резания;
5) блок или нож наэлектризованы; 6) нестабильны циклы
ультрамикротома; 7) верхняя граница среза не параллельна
режущему краю; 8) ведущий конец ленточки уперся в стенку
ванночки; 9) грязь на режущем крае.
Способы устранения: 1) понизить уровень воды; 2), 3)
перезаточить пирамидку; 4) увеличить скорость; 5) коснуться блока
влажной бумагой, чтобы снять заряд, увеличить влажность в
комнате; 6) починить, отрегулировать прибор; 7)
переориентировать или перезаточить пирамидку; 8) укоротить или
сцентрировать ленточку; 9) очистить или сменить нож.
VII. Ленточка кривая. Возможные причины: 1) верхняя и
нижняя границы среза непараллельны; 2) верхняя и нижняя
границы среза непрямые; 3) в различных зонах режущего
участка нож неодинаково острый; 4) верхняя и нижняя
границы среза не параллельны режущему краю.
Способы устранения: 1), 2) перезаточить пирамидку; 3)
сменить режущий участок или нож; 4) переориентировать блок.
VIII. Срезы плохо видны. Возможные причины: 1) много
воды в ванночке; 2) неправильный угол освещения.
Способы устранения: 1) понизить уровень воды; 2)
отрегулировать свет.
IX. Срезы с царапинами. Возможные причины: 1) мелкие
зазубрины на режущем крае; 2) грязный режущий край; 3)
твердые частицы в материале.
Способы устранения: 1) сменить участок режущего края или
нож; 2) очистить режущий край или сменить нож; 3)
перезаточить блок, использовать алмазный нож.
X. Срезы мнутся или прилипают к режущему краю.
Возможные причины: 1) низкий мениск, сухой режущий край; 2)
грязный режущий край; 3) тупой режущий край; 4) мал угол
наклона ножа.
235
Способы устранения: 1) поднять уровень воды; 2) очистить
или сменить нож; 3) сменить участок режущего края или нож;
4) увеличить угол наклона ножа.
XI. На срезах складки. Возможные причины: 1) плохое
пропитывание; 2) тупой нож; 3) срез большого размера; 4) не
закреплен нож, блок.
Способы устранения: 1) дополимеризовать блок 24 ч при 60 —
80 °С, сменить блок; 2) сменить участок режущего края или
сменить нож; 3) уменьшить размер среза; 4) закрепить нож и блок.
XII. В срезах дыры. Возможные причины: 1) пузырьки
воздуха в смоле; 2) грязный режущий край; 3) кусочек твердого
материала в образце.
Способы устранения: 1) перезаточить пирамидку, срезать на
некоторую глубину лицевую сторону блока, сменить блок;
2) очистить, сменить участок режущего края и сменить нож;
3) использовать более плотную заливку, соответствующую
наиболее плотной порции образца.
XIII. Образец (ткань) мнется и выкрашивается из среза.
Возможная причина: плохое пропитывание.
Способ устранения: увеличить продолжительность
пропитывания, уменьшить размер кусочков, использовать шейкер,
пропитывать последней порцией смолы в вакууме.
XIV. Четтер — равномерные колебания толщины среза с
«длиной волны» меньше 1 мкм (виден только в электронном
микроскопе). Возможные причины: 1) тупой нож; 2) твердый блок;
3) частые или неритмичные циклы ультрамикротома; 4) велик
угол наклона ножа; 5) неправильно выбрана скорость резания;
б) слишком высокая пирамидка; 7) срез больших размеров.
Способы устранения: 1) сменить участок режущего края или
нож; 2) изменить соотношение компонентов смолы с целью
уменьшения твердости блока; 3) снизить частоту циклов,
отрегулировать прибор; 4) уменьшить угол наклона ножа; 5) подобрать
оптимальную скорость; 6) перезаточить блок, сделать пирамидку
низкой с широким основанием; 7) уменьшить площадь среза.
XV. Блок ломкий. Возможная причина: избыток отвердителя.
Способ устранения: уменьшить содержание отвердите ля,
включить в смесь дибутилфталат или увеличить его
содержание.
XVI. Блок бесцветный. Возможная причина: старый
катализатор.
Способ устранения: сменить катализатор.
XVII. Блок мягкий. Возможные причины: 1) неполная
полимеризация; 2) мало катализатора; 3) неправильно подобраны
компоненты смеси.
Способы устранения: 1) дополимеризовать при 60 — 80 °С;
2) увеличить содержание катализатора; 3) с помощью метода
проб имеющейся партии компонентов смолы найти их
оптимальное соотношение.
236
ОКРАШИВАНИЕ УЛЬТРАТОНКИХ СРЕЗОВ
Термин «окрашивание» по отношению к ультратонким срезам
нельзя считать точным, поскольку изображение их черно-белое.
Однако он широко распространен наряду с более точным
термином «контрастирование». Различают негативное и позитивное
контрастирование. Первое используют для изучения
субклеточных частиц, вирусов, бактерий, находящихся не в срезах, а в
свободном виде. Для изучения срезов применяют только
позитивное контрастирование, описанное ниже.
Электронно-микроскопическое изображение создается
благодаря рассеиванию образцом пучка электронов. Рассеивание
увеличивается пропорционально массе элемента. Биологические образцы
состоят главным образом из элементов с низким атомным числом:
углерода, водорода, кислорода, азота. Исключение составляют,
пожалуй, только эршроциты, содержащие тяжелый элемент —
железо. Используемые для пропитывания и получения
ультратонких срезов эпоксидные смолы — органические вещества,
следовательно, они состоят из перечисленных легких элементов. В связи
с этим различия в отклонении электронов образцом и смолой, а
также отдельными компонентами образца невелики и изображения
в трансмиссионном электронном микроскопе малоконтрастны.
Для усиления рассеивания электронов в образец вводят
атомы тяжелых металлов: осмия, вольфрама, рутения, урана,
свинца. Таким образом, изображение в электронном
микроскопе представляет собой картину, отражающую распределение
атомов тяжелых металлов в различных структурах образца.
Структуры, связавшие большее количество этих атомов,
сильнее отклоняют электроны и представляются более темными на
экране и позитиве и более светлыми на негативе.
Соединения тяжелых металлов (контрастные вещества) в
образец вводят: 1) при фиксации (осмий, рутений), 2) при
дегидратации (у рани л ацетат, фосфорно-вольфрамовая кислота), 3) в
заточенный блок (спиртовые растворы у рани л ацетата и фос-
форновольфрамовой кислоты), 4) в ультратонкие срезы.
Контрастирование тетраоксидом осмия при фиксации описано
в главе 10. Для исследования внеклеточного матрикса и бактерий
в раствор тетраоксида осмия можно добавлять 0,1 % раствор
рутениевого красного (продолжительность окрашивания 2 ч). После
фиксации и отмывания кусочков буфером в них можно вводить
уранилацетат, выдерживая его в 0,5 — 2 % водном растворе 10 —
60 мин. В процессе дегидратации часто вводят 1 — 2 % раствор ура-
ни л ацетата в 50 %, 70 % или 95 % спирте. В той же концентрации в
95 % спирт может быть введена фосфорно-вольфрамовая кислота
[РеШ Т., Ье ВоиШНег ]. 1990]. Уранилацетат и
фосфорно-вольфрамовая кислота в спиртовых растворах способны проникать в
ткань, залитую в эпоксидную смолу, на глубину около 15 мкм
[Ьоске М., КпзЬпап К., 1971], поэтому 2 % растворы этих веществ
237
в 95 % спирте применяют для контрастирования образцов в
блоках. Заточенный блок обрабатывают в таком растворе 12 — 24 ч
при 60 °С. Проникновение веществ на глубину 15 мкм позволяет
сделать с такого блока десятки контрастных ультратонких срезов.
Наиболее распространено контрастирование путем введения
контрастных веществ в срезы. Основные трудности,
возникающие при контрастировании — низкая специфичность и
образование осадков. Специфичность можно повысить путем подбора
оптимальных концентраций веществ, рН, продолжительности
обработки. Обычно рекомендуют использовать свежие растворы
контрастных веществ, но для этого нужны большие количества
дефицитных веществ, причем такие расходы не всегда-оправданны,
так как хранившиеся по крайней мере несколько недель растворы
«красят» не хуже. Вообще в контрастировании, как и в ультрато-
мии, много от искусства, и в связи с этим рекомендации не стоит
воспринимать как директиву. Перед применением как свежих,
так и старых растворов их следует фильтровать (хотя иногда и
нефильтрованные растворы контрастируют хорошо и без
осадков), а контрастированные срезы тщательно отмывать. Если,
несмотря на все предосторожности, осадок на срезах все же
образовался, его можно удалить путем обработки 10 % уксусной
кислотой в течение 1 — 5 мин. После такой обработки контрастность
значительно ослабляется и приходится красить снова.
Описано много способов контрастирования срезов с
использованием различных, обычно несложных, приспособлений.
Часто срезы контрастируют на сетках или блендах в чашках
Петри. В пластиковые чашки можно непосредственно вносить
капли контрастирующих веществ. По поверхности стекла капли
растекаются, поэтому в стеклянные чашки сначала наливают
слой парафина и после его остывания капают растворы на
парафин. Иногда в парафине делают лунки для капель.
Уранилацетат в фиксированных образцах избирательно
контрастирует структуры, содержащие нуклеиновые кислоты. Кроме
того, он является фиксатором для нуклеиновых кислот и фосфо-
липидов, уменьшая их вымывание в процессе подготовки
материала для электронной микроскопии. Для окрашивания уранил-
ацетатом капли раствора помещают в чашку Петри и на эти капли
срезами вниз опускают сетки. В качестве исходного режима
окрашивания можно рекомендовать применение насыщенного водного
раствора уранилацетата в течение 5 — 20 мин при комнатной
температуре. Однако могут оказаться более подходящими
разбавленные (0,5—1 %) водные растворы либо растворы в метиленовом
или этиловом спирте. Продолжительность и температура
обработки также могут быть другими. Все эти условия подбирают для
исследуемого материала эмпирически. После контрастирования
сетки со срезами промывают. Если применяли спиртовые
растворы уранилацетата, то сначала промывают чистым растворителем,
а затем дистиллированной водой. Растворы уранилацетата разру-
238
шаются на свету, поэтому хранить их и контрастировать ими
нужно в светонепроницаемых емкостях. У ранил ацетат может
быть использован в качестве единственного контрастного
вещества или в сочетании со свинцом [БасМоху Ь., 1983].
Свинец контрастирует многие клеточные компоненты.
Окрашивание им будет более интенсивным, если его производят
после обработки срезов уранилацетатом. По-видимому, свинец
связывается с уранил ацетатом; возможно также, что усиление
окраски после обработки уранилацетатом связано с тем, что
последний фиксирует некоторые субстанции и защищает их от
вымывания растворами свинца. Растворы свинца образуют с
углекислым газом осадок карбоната свинца, поэтому нужно
исключить этот газ из контрастирующих и промывных жидкостей.
Воду от него освобождают кипячением в течение 10 мин. Для
связывания углекислого газа воздуха в чашки Петри,
используемые для контрастирования свинцом, кладут гранулы гидрок-
сида натрия за несколько минут до помещения туда сеток со
срезами. Контрастирование производят так же, как
уранилацетатом, т.е. на каплях соответствующих растворов. Если после
уранилацетата предполагается контрастирование свинцом, то
срезы нужно промывать в воде без углекислого газа.
Наиболее популярно контрастирование раствором свинца,
приготовленным по методу, предложенному Е. КеупоЫз (1963).
В мерной колбе вместимостью 50 мл смешивают 1,33 г нитрата
свинца, 1,76 г цитрата натрия и 30 мл дистиллированной воды,
не содержащей углекислый газ. Смесь энергично встряхивают в
течение 30 мин. Превращение нитрата свинца в цитрат
проявляется образованием равномерной однородной молочной суспензии.
К ней добавляют 8мл1н.(4%) гидроксида натрия. Объем
доводят дистиллированной водой до 50 мл и смешивают до полного
растворения цитрата свинца и просветления суспензии (рН 12,0).
Для контрастирования используют цельный раствор или
разбавляют его в 5— 100 раз 0,01 н. (0,04 %) гидроксида натрия в
зависимости от материала и необходимой контрастности.
Продолжительность контрастирования 5 — 30 мин. Растворы можно хранить
в плотно закупоренных емкостях в течение нескольких недель.
Образование осадка свидетельствует о непригодности раствора.
Для контрастирования можно использовать готовый цитрат
свинца. К 10 мл не содержащей углекислого газа
дистиллированной воды, находящейся в центрифужной пробирке,
добавляют 0,01—0,04 г цитрата свинца и 0,1 мл 10 н. гидроксида
натрия. Пробирку плотно закрывают и энергично встряхивают до
полного растворения соли. Перед использованием
центрифугируют. Продолжительность контрастирования от 10 с до 5 мин.
Раствор хорошо сохраняется.
При всех описанных способах результаты контрастирования
можно улучшить, если предварительно обработать
ультратонкие срезы 10 % перекисью водорода в течение 1 мин.
239
ГЛАВА 13
ПОДГОТОВКА МАТЕРИАЛА К ИССЛЕДОВАНИЮ
В СКАНИРУЮЩЕМ ЭЛЕКТРОННОМ МИКРОСКОПЕ
Общие требования к исследуемому материалу в сканирующей
(растровой) электронной микроскопии (СЭМ, РЭМ) по сути те
же, что и в трансмиссионной электронной микроскопии. Однако
при последней важна сохранность архитектоники самого
объекта и его внутриклеточных органелл, а при РЭМ все внимание
обращено на поверхность изучаемого объекта и ее сохранность
при специальной обработке. Кстати, количество применяемых
видов обработки и фиксаций в РЭМ значительно больше, чем в
трансмиссионной. По способу обработки поверхности объекты
исследования в РЭМ можно условно разделить на две
категории. К первой относится материал с более или менее твердой
поверхностью, специальная обработка и фиксация которого
практически не требуются. Это всевозможные кристаллические
образования, кости, эмаль зубов, волосы и ногти, чешуя рыб,
насекомые с твердым хитиновым покровом, листья и пыльца
растений, известковые образования и т.д. Вторая категория —
это ткани и клетки животного происхождения, имеющие
нежные, чувствительные к внешним воздействиям поверхностные
мембраны с различными морфологическими образованиями:
клетки крови и костного мозга, культивируемые т уИго клетки
асцитных опухолей, одноклеточных организмов, бактерии. К этой
категории относятся также ассоциации клеток, наружные
покровы тканей и органов, эндотелиальные, эпителиальные и ме-
зоэндотелиальные выстилки.
Предварительная подготовка биологического объекта
заключается в очистке поверхности, покрытой слизью или плазмой
крови, под которой могут скрываться различные поверхностные
образования. Это относится к эпителию кишечника,
дыхательных путей, легких, а также эндотелию кровеносных сосудов.
Поверхность таких объектов осторожно промывают путем
орошения слабой струей специального раствора. Промывание
отдельных клеток непосредственно перед фиксацией исключает
возможность осаждения на их поверхности сывороточного
белка культуральной среды.
Для промывания тканей и клеток животных применяют забу-
ференные солевые растворы, рН которых составляет 7,3 — 7,4, а
температура — 37 — 38 °С. Недостаточную относительную
плотность безбелковых промывочных растворов можно сбалансировать
240
путем добавления сахарозы или декстрана, доведя ее до значений,
соответствующих таковым в тканевой или сывороточной среде.
Любые многократные воздействия на клетки могут вызвать
артефакты, маскирующие изменения поверхностных мембран
клеток. Это в первую очередь нужно учитывать при обработке
культур клеток. Иногда можно ограничиться легким
прополаскиванием культуры клеток в первой смене фиксатора.
Осторожного кратковременного промывания материала подогретым
раствором Хенкса или средой № 199 бывает вполне достаточно для
сохранения и выявления нежных поверхностных образований
клеток. К специальным видам предварительной обработки
биологических объектов относятся также перфузия ткани
гипертоническим раствором сахарозы с целью увеличения размеров
межклеточных промежутков, а также помещение объектов в
специальные растворы, разъединяющие клеточные контакты.
ФИКСАЦИЯ
Выбор метода фиксации зависит от объекта исследования. Если
это отдельные клетки, например эритроциты, то
продолжительность процедур и количество фиксирующих растворов
значительно уменьшаются. В биологических исследованиях для
фиксации материала применяют главным образом два вида
фиксаторов: растворы солей металлов, действие которых основано на
реакции окисления, и растворы альдегидов (формальдегид,
глутаровый альдегид и др.), в основе действия которых лежат
восстановительные реакции. Чаше используют 1—2 % раствор
тетраоксида осмия и 2 % раствор глутарового альдегида.
Различают три способа фиксации: простую — посредством
реакции окисления или восстановления, комбинированную —
одновременное окисление и восстановление, двойную —
окисление после восстановления.
Действие фиксаторов условно сводится к образованию
связей между молекулами клеточных мембран и мембран органелл
в прочную единую сеть. Альдегиды в основном активно
«сшивают» клеточные белки. Фиксация в растворе глутарового
альдегида происходит намного быстрее, чем в других фиксаторах.
Для фиксации с применением формальдегида требуется
довольно много времени — до 1 сут. Кроме того, глутаровый альдегид
обеспечивает лучшую сохранность морфологических
образований в поверхностном слое клеток, а также тонких
внутриклеточных структур, поэтому является наиболее распространенным
фиксатором для целей РЭМ.
В отличие от белков ненасыщенные липидные и фосфоли-
пидные компоненты клетки, по-видимому, не стабилизируются
альдегидами, поэтому фиксацию этих компонентов
осуществляют с помощью тетраоксида осмия. Анализ состояния клеточных
компонентов показал, что осмиевые фиксаторы следует исполь-
241
зовать после хотя бы кратковременной фиксации альдегидами.
Осмиевые фиксаторы связывают белки, но менее эффективно,
чем альдегиды. В связи с этим многие исследователи
используют для фиксации глутаровый альдегид или смесь его с
формальдегидом, поскольку такое сочетание дает положительные
результаты и без применения дополнительной осмиевой
фиксации, при этом только увеличивается продолжительность
фиксации. Однако постфиксация тетраоксидом осмия является
необходимым этапом в подготовке таких тканей, как эпителий
желудка, эндотелий сосудов и других многоклеточных
образований. Следует учитывать, что при альдегидной фиксации, во-
первых, вымываются липиды, а во-вторых, клетки сохраняют
свойства осмометра и утрачивают их лишь после постфиксации
тетраоксидом осмия. При фиксации тканей животного
происхождения нужно тщательно выбрать рН, осмотическое
давление, температуру и продолжительность фиксации. Фосфатный
или веронал-ацетатный буферные растворы применяют
главным образом для того, чтобы варьировать значение рН, тогда
как сахарозу используют с целью регулирования осмотического
давления. Для дегидратации применяют растворы ацетона и
спирта, причем первый обладает более выраженными дегидра-
тационными свойствами. С целью обезвоживания применяли и
другие дегидратационные агенты, но в литературе нет сведений
о каких-либо эффективных заменителях. Необходимо отметить,
что полная дегидратация может способствовать повышению
влажности объекта при напылении в вакууме, что в свою
очередь приводит к деформации поверхности образца. Кроме того,
при использовании некоторых способов обезвоживания явление
«вредного сжатия» наблюдается сразу же после того, как
образец удаляется из раствора.
Особенности фиксации различных биологических
объектов
При препарировании различных биологических тканей чаще
применяют двойную фиксацию (предварительная фиксация
раствором глутарового альдегида и постфиксация в растворе
тетраоксида осмия), так как она позволяет более стабильно
получать хорошие результаты. Двойную фиксацию осуществляют
следующим образом.
1. Вырезают тонкий кусочек поверхности ткани или органа и
ополаскивают в изотоническом растворе хлорида натрия.
2. Поверхность кусочка осторожно очищают от крови и
слизи также в изотоническом растворе.
3. Очищенный кусочек ткани помещают в бюкс с 2 %
раствором глутарового альдегида на 0,1 М фосфатном буфере при рН
7,2 на 1—3 ч в зависимости от плотности объекта.
Фиксирующий раствор в процессе фиксации 2 — 4 раза обновляют.
242
4. После предварительной фиксации ткань тщательно
прополаскивают в изотоническом растворе хлорида натрия или
фосфатном буфере (0,1 М при рН 7,2).
5. После промывания кусочек ткани помещают в 1 % раствор
тетраоксида осмия на фосфатном буфере на 2 — 4 ч.
6. Кусочек ткани вновь тщательно отмывают в фосфатном
буфере до полного удаления фиксирующего раствора.
7. Отмытый образец ткани обезвоживают в растворах
ацетона возрастающей концентрации (60 %, 70 %, 80 %, 90 %, 100 %)
в течение 5—10 мин в каждой порции ацетона.
8. Образцы извлекают из 100 % раствора ацетона и
просушивают в струе теплого воздуха (около 45 °С) или вакууме.
Приготовленные таким образом объекты пригодны для
контрастирования или нанесения электропроводящего слоя.
Для свободно изолированных клеток проникающая
способность фиксаторов в некоторой степени отличается от
проницаемости тканей В этих случаях применяют в основном простую
фиксацию с использованием альдегидов, чаще 1 —4 % растворов
глутарового альдегида на фосфатном или какодилатном
буфере. Буферный раствор должен быть изотоническим (не менее
0,3 осмоля), при этом условии достигается оптимальная
сохранность морфологических образований в поверхностном слое
клеток. При использовании гипертонического раствора
альдегидного фиксатора (1 осмоль) происходит значительное уплощение
клеток, а при применении гипотонического фиксатора уже в
первые 10 мин фиксации появляются выбухания на
поверхности клеток. Для достижения изотоничности раствора глутарового
альдегида рекомендуется его готовить на 0,15 М фосфатном и
какодилатном буферных растворах, которые являются
изотоническими. Можно использовать и 0,1 М буферный раствор,
возмещая недостающую осмотичность добавлением сахарозы. рН
альдегидного фиксатора 7,2 или 7,4. В кислой среде на
поверхности мембран могут образоваться складки. Температура
применяемого альдегидного фиксатора должна быть близка к
«физиологической» (37 — 38 °С) и ее следует поддерживать по крайней
мере на протяжении первых 5 — 8 мин от начала фиксации,
дальнейшую фиксацию можно проводить при комнатной
температуре. Если возникает необходимость продления фиксации на 1 сут
и более, то можно перенести клетки в том же фиксаторе в
холодильник и сохранить их при 5 — 6 °С. Продолжительность
фиксации глутаровым альдегидом определяют опытным путем в
зависимости от размеров и вида клеток, степени плотности и
морфологических особенностей их поверхности. Например, для
клеток из культуры 1—3-часовая фиксация является вполне
достаточной, однако в случае необходимости объект может находиться
в 2 % растворе глутарового альдегида в течение 1 сут и более.
Фиксацию отдельных клеток в глутаровом альдегиде
осуществляют следующим образом.
243
1. В пробирку со взвесью свободных отмытых клеток
добавляют 1 % раствор глутарового альдегида на 0,1 М фосфатном
буфере (рН 7,4), содержимое пробирки несколько раз
встряхивают и фиксацию проводят при 37 °С в течение 10 — 30 мин.
2. Отделяют клетки от фиксирующего раствора путем
центрифугирования при 1500 об /мин, над осадочную жидкость сливают.
3. В пробирку с осажденными свободными клетками
доливают 0,1 М фосфатный буфер (рЫ 7,4). Несколько раз
взбалтывают содержимое, затем взвесь клеток промывают несколькими
порциями буферного раствора для удаления остатков
фиксатора. Затем жидкость со взвесью клеток снова центрифугируют
до получения осадка. Процедуру можно повторить 2 — 3 раза.
4. После слива надосадочной жидкости изолированные
клетки в осадке обезвоживают в растворах ацетона возрастающей
концентрации (60 %, 70 %, 80 %, 90 %, 100 %) по 10 мин в
каждой порции.
5. Взбалтывают взвесь свободных клеток в 100 % ацетоне,
затем пипеткой набирают взвесь клеток и каплю наносят на объ-
ектодержатель для просушивания. Приготовленные образцы
напыляют углеродом или металлом в вакууме.
РЭМ широко применяют для изучения клеток крови.
Установлено, что очень чувствительны к различным патологическим
воздействиям эритроциты, которые реагируют на них
изменениями размеров и формы, в том числе характерными для
некоторых заболеваний крови и различных состояний. С целью
быстрого проведения анализа состояния мембран и формы
эритроцитов крови больных разработана модификация метода
фиксации материала для исследования в растровом электронном
микроскопе [Втюрин Б.В., Каем Р.И., 1982]. Средняя скорость
проникновения фиксирующих растворов в биологический
материал — около 60 мкм/ч. С учетом того, что толщина
эритроцита 1—2 мкм и диаметр 7 — 8 мкм, можно соответственно
уменьшить продолжительность фиксации и обезвоживания.
В кровь после взятия добавляют гепарин, встряхивают
несколько раз в пробирке и центрифугируют 10 мин. Затем каплю
осадка тонкой пипеткой наносят на полированную поверхность
металлической подложки-держателя сканирующей приставки
электронного микроскопа. Полученный таким образом ровный
слой мазка помещают на 10 мин в бюкс с 4 % раствором
глутарового альдегида на 0,1 какодилатном буфере при рН 7,4.
Зафиксированные мазки обезвоживают в растворах ацетона
возрастающей концентрации по 10 мин в каждой порции.
Обезвоженный материал на подложке-держателе помещают в
вакуумный пост, закрепив на вращающемся столике, и напыляют
вначале углерод, а затем медь.
Несколько иные условия фиксации применяют для
исследования дрожжевых клеток, патогенных грибов типа кокцидий и
бактерий.
244
1. Клетки выращивают в пробирке на специальных средах в
течение суток при 25 °С.
2. Забор клеток производят платиновой петлей и смывают в
пробцрку с раствором 0,1 М фосфатного буфера при рН 7,2.
Затем взвесь клеток центрифугируют, надосадочную жидкость
сливают. Промывание можно повторить 2 — 3 раза при скорости
центрифугирования 1500 об/мин.
3. Фиксацию осажденных клеток проводят в 6 % растворе
глутарового альдегида на фосфатном буфере (0,1 М при рН
7,2), содержащем 7,5 % сахарозы. Продолжительность
фиксации от 5 до 20 ч в зависимости от вида клеток.
4. Удаляют фиксирующий раствор путем
центрифугирования при 1500 об/мин. Надосадочную жидкость сливают.
5. В осадок добавляют дистиллированную воду и несколько
раз ополаскивают. Если осадок рыхлый и при промывании
образуется суспензия клеток, то вновь прибегают к
центрифугированию.
6. После отмывки фиксатора материал помещают в 2 %
раствор перманганата калия для дофиксации и оставляют на 48 ч в
холодильнике со сменой раствора через 24 ч.
7. После окончательной фиксации взвесь клеток осаждают
центрифугированием. Надосадочную жидкость сливают.
8. В пробирку с осадком добавляют дистиллированную воду
и материал несколько раз промывают до исчезновения розовой
окраски, обусловленной перманганатом калия.
9. Обезвоживание проводят в растворах ацетона
возрастающей концентрации по 10 мин в каждой порции.
10. Из 100 % раствора ацетона материал набирают пипеткой,
каплю его наносят на подложку объектодержателя и высушивают.
ВЫСУШИВАНИЕ БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
После обезвоживания в ацетоне или спирте фиксированный
материал высушивают на воздухе или в вакууме. Однако у
клеток, фиксированных в суспензии и характеризующихся
микрорельефом наружной мембраны, при этом происходит
сглаживание морфологических образований. При высушивании на
воздухе в процессе испарения жидкости граница раздела жидкость —
газ проходит через объект и тонкие выросты на поверхности
клеток подвергаются механическому разрушению, иногда
весьма значительному. Замена водных растворов органическими
растворителями с более низким поверхностным натяжением
(спирт, ацетон и др.) не дает эффекта. При этом происходит
сжатие клетки (до 35 — 45 % от первоначального объема). В
результате этого отдельные клетки сферической формы при
высушивании на воздухе становятся плоскими. Близко
расположенные к поверхности вакуоли спадаются и на их месте образуются
245
провалы, а некоторые внутриклеточные структуры (ядра,
митохондрии) выбухают и создают видимость поверхностных
образований. Наиболее выраженные изменения поверхностных
образований отмечены в тех клетках, которые имеют
специфические морфологические выросты в виде микроворсинок или
псевдоподий (эпителий кишечника, фибробласты и т.д.).
Артефакты, возникающие в результате действия
поверхностного натяжения, не ограничиваются только поверхностью
клеток. Поверхностное натяжение может резко изменить форму
фиксированной клетки в целом. При этом не только исчезают
тонкие поверхностные образования клеточной мембраны, но и
формируются новые, не свойственные данной клетке
структуры. Механизм формирования этих псевдоструктур,
имитирующих истинные прижизненные образования, прослежен Ю.А. Ро-
венским. Показано, что клетки, фиксированные в суспензии и
осевшие на подложку после обезвоживания в ацетоне,
сохраняют свою сферическую форму и микрорельеф клеточной
поверхности лишь в том случае, если их высушивают с помощью
метода перехода критической точки.
Высушивание с помощью метода перехода
критической точки
Сущность этого метода заключается в том, что помещенный в
замкнутую камеру биологический объект, находящийся в среде
сжиженного газа, подвергается под давлением нагреву до
температуры выше критической для данной среды. При этом
происходит ее переход в газообразное состояние, который не
задерживается действием поверхностного натяжения. Высушивание с
помощью метода перехода критической точки осуществляют в
специальных приборах. Общей и основной их деталью является
металлическая герметическая камера с впускным и выпускным
клапанами, снабженная устройством для охлаждения и
подогрева.
Биологический материал, находящийся в 100 % ацетоне или
другой обезвоживающей жидкости, извлекают пипеткой из
пробирки и помещают в специальные патрончики, которые вносят в
предварительно охлажденную камеру, куда затем впускают
сжиженный углекислый газ из баллона. Поступая под
давлением около 6-106 Па в охлажденную камеру, углекислый газ
частично начинает испаряться. Для того чтобы избавиться от
примеси ацетона в камере, несколько раз проводят «стравливание»
через выпускной клапан. После удаления остатков ацетона
камеру заполняют сжиженным углекислым газом с таким
расчетом, чтобы жидкость полностью покрывала патрончики с
материалом Впускной и выпускной клапаны плотно закрывают и
нагревают жидкость до температуры выше критической точки
(примерно до 42 °С). С повышением температуры возрастает и
246
давление в камере до 6 — 810е Па. Нагревание нужно проводить
постепенно, так как давление в камере повышается гораздо
быстрее, чем температура, до требуемого значения. По
достижении критической точки углекислый газ переходит в
газообразное состояние. Пока это состояние сохраняется, происходит
высушивание объекта без действия сил поверхностного
натяжения. Затем газ из камеры выпускают и извлекают высушенный
материал. Качество сушки зависит от выполнения ряда важных
условий.
1. Помещаемый в камеру материал должен быть полностью
погружен в обезвоживающую жидкость, которая затем
смешивается со сжиженным углекислым газом. Необходимо, чтобы
ацетон был полностью удален из камеры. В противном случае
критическая точка смеси уже не будет соответствовать
критической точке чистой переходной жидкости и, когда она перейдет
в газообразное состояние, произойдет конденсация
промежуточной или обезвоживающей жидкости. Образование из газовой
смеси конденсата вызовет повреждение объекта под действием
поверхностного натяжения. Для того чтобы предотвратить
конденсацию, необходимо вывести остатки обезвоживающей
жидкости из камеры через выпускной клапан. Образование
конденсата зависит от применяемой переходной жидкости и остатка
обезвоживающей жидкости. Так, например, объемное
содержание ацетона в смеси ацетон — углекислый газ не должно
превышать 0,4 % в камере, в смеси фреон 113 —фреон содержание
фреона 113 должно быть не выше 2,4 %. Из этого следует, что
при использовании комбинации ацетон — углекислый газ
количество необходимых «стравливаний» должно быть больше, чем
при применении смеси фреон 113 —фреон. Количество
необходимых «стравливаний» возрастает также с увеличением
количества объектов в камере.
2. При каждом «стравливании» необходимо следить за тем,
чтобы уровень жидкости в камере был выше поверхности объекта.
3. Перед нагреванием следует убедиться в том, что камера с
биологическим объектом целиком заполнена переходной
жидкостью. При частичном заполнении камера содержит
двухфазную систему (жидкость —газ), температура и давление которой
при нагревании возрастают до критической точки
неравномерно Прежде чем эта точка будет достигнута, жидкость при
нагревании будет кипеть, в связи с чем существует опасность
повреждения ультраструктуры мембран под воздействием
поверхностного натяжения. Для того чтобы исключить кипение, в
камере перед нагреванием должна находиться только жидкость,
поэтому передачу углекислого газа необходимо проводить через
охлажденную камеру. В этом случае при нагревании давление
возрастает гораздо быстрее, чем это наблюдается при наличии в
камере не только переходной жидкости, но и газа. Поскольку
давление превысит критическое значение раньше, чем подымет-
247
ся температура, необходимо с помощью выпускного клапана
поддерживать достигнутый сверхкритический уровень давления
до того момента, пока температура тоже не превысит
критическую. К этому времени в камере в основном находится газ,
который постепенно выпускают. Таким путем можно избежать
прохождения через критическую точку и связанного с ним кипения
переходной жидкости, которая превращается в газ без
образования конденсата.
4. Не следует допускать перегрева камеры, который ведет к
появлению деформаций в виде пузырьков и разрывов на
биологических мембранах.
5. По окончании высушивания газ из камеры выпускают
постепенно, небольшими порциями. Пока давление в камере
высокое, быстрый выпуск газа может обусловить быстрое снижение
температуры до субкритической. На последних этапах сушки
быстрый выпуск газа может вызвать образование разрывов и
трещин в биологическом объекте в связи с резкими перепадами
давления.
Приготовленный и высушенный биологический материал
очень хрупок и гигроскопичен, его нельзя хранить на открытом
воздухе вблизи влажных воздушных потоков, поэтому образцы
после сушки рекомендуется сохранять в эксикаторе с силикаге-
лем.
Метод замораживания—высушивания
Этот метод, как и описанный выше, позволяет предотвратить
образование границы жидкость — газ и связанное с ней действие
поверхностного натяжения. Замораживание объекта часто
используют не только для последующего высушивания, но и для
других целей, например для получения реплик путем скола
замороженного биологического материала, непосредственного
осмотра поверхности замороженного объекта в растровом
электронном микроскопе, уплотнения клеток и сохранения их
внутриклеточных структур. При замораживании материала
свободная вода кристаллизуется в виде включений различной
величины в цитоплазме клеток и межклеточных пространствах. При
этом возникают повреждения органелл, особенно если материал
не фиксирован предварительно в растворе глутарового
альдегида, поэтому перед замораживанием необходимо провести
фиксацию материала. Наилучшие результаты замораживания
биологического материала без повреждения тонких структур
достигаются путем увеличения скорости замораживания и применения
криопротекторов. В условиях быстрого замораживания клеток
не успевают сформироваться крупные кристаллы льда и не
разрушаются органеллы. При низкой температуре (-80 °С)
молекулы охлаждаемой жидкости становятся неактивными, связи
между ними не возникают и кристаллы не образуются. Высокая
248
скорость охлаждения может быть достигнута путем уменьшения
размеров образца или применения низкотемпературного агента.
Обычно материал замораживают с помощью сухого льда,
спирта, в жидком азоте или фреоне. Материал быстро погружают в
сосуд с фреоном (-155 °С), где происходит практически
мгновенное замораживание. При использовании жидкого азота
нужно учитывать, что при погружении в него материала происходит
кипение — объект оказывается облепленным пузырьками,
создающими изоляционный слой, в результате чего снижается
скорость замораживания.
Одним из способов защиты от вредной кристаллизации
является предварительное замещение воды в биологическом
материале различными криопротекторами, уменьшающими размеры
образующихся кристаллов льда. В качестве таковых чаще
используют ацетон, спирт и др. Образование кристаллов при
замораживании биологических объектов резко снижается, если
материал предварительно поместить в спирт. Замещение воды в
материале перед его замораживанием различными
криопротекторами имеет и другие преимущества: значительно ускоряется
процедура последующего высушивания, замороженный объект
в дальнейшем может быть подвергнут высушиванию не только
лиофилизацией в вакууме, но и с помощью метода перехода
критической точки. При замораживании живых клеток не
рекомендуется использовать этиленгликоль или глицерин, так как
после высушивания в вакууме эти вещества остаются в объекте
и могут сглаживать морфологические образования, изменяя их
конфигурацию, а также явиться причиной загрязнения
вакуумной системы колонны микроскопа.
Метод высушивания
Замороженные образцы ткани, находящиеся в металлических
капсулах, помещают в специальную герметично закрытую
камеру, предварительно охлажденную до -60 °С. Камеру плотно
закрывают и создают вакуум порядка 106 Па. При замораживании
богатых водой биологических объектов длительность
высушивания составляет 2 —3 ч. Если материал (изолированные клетки)
был предварительно пропитан органическими растворителями,
то продолжительность высушивания уменьшается в 10 раз.
По окончании сушки камере дают постепенно нагреться до
комнатной температуры, а затем ненадолго нагревают ее до
30 °С, и только потом впускают в камеру воздух. Этот прием
позволяет предотвратить конденсацию на объекте воды из
воздуха. Нужно учитывать также, что высушенный биологический
материал приобретает высокую гигроскопичность, поэтому
последующую его обработку и перенос в камеру необходимо
проводить быстро. Высушенные объекты рекомендуется хранить в
эксикаторе с силикате л ем.
249
НАПЫЛЕНИЕ НА БИОЛОГИЧЕСКИЕ ОБЪЕКТЫ В ВАКУУМЕ
Почти все биологические объекты обладают низкой
электропроводностью. С целью исключения накапливания зарядов и
получения достаточно контрастной картины на поверхность образца
напыляют металл. Для напыления используют различные
металлы, характеризующиеся низкой степенью окисления, и их
сплавы (золото, платина, медь, алюминий). Напыленная
пленка этих металлов накапливает вторичные электроны,
предохраняет объект от нагревания и более устойчива к процессам
окисления.
Напыление производят в специальной вакуумной камере
путем нагрева и испарения металла в вакууме или «выбивания»
атомов металла в результате действия ионов инертного газа.
Металл, предназначенный для покрытия, закрепляют в
специальном вольфрамовом испарителе. Под действием
пропускаемого электрического тока в условиях вакуума испаритель
нагревается до красного цвета, а помешенный в его воронку металл
начинает плавиться. Атомы испаряющегося металла покрывают
тонкой пленкой поверхность образца. Для того чтобы пленка
равномерно покрывала все неровности поверхности, столик с
объектом вращается. Для исключения перегрева образца в
момент напыления используют различные экраны.
Если объект сложной конфигурации и металл не проникает
во все углубления, контрастирование производят путем
напыления углерода. Благодаря способности к рассеиванию в вакууме
атомы углерода тончайшей пленкой равномерно покрывают все
неровности. Ровный слой углеродного покрытия укрепляет
поверхность объекта, защищает ее от атмосферной влаги и
является удобной подложкой для покрытия металлом.
В последнее время получил распространение метод
напыления путем ионной бомбардировки металла [Ровенский Ю.А.,
1979]. Мишень из металла подвергается бомбардировке ионами
инертного газа в вакууме. Таким образом «выбиваются» атомы
металла, которые образуют пленку. При этом создается более
прочное и равномерное покрытие. Поскольку весь процесс
ионного напыления осуществляется при относительно высоком
давлении, то рассеивание атомов металла происходит более
интенсивно и столкновение способствует изменению траектории их
полета, что позволяет осуществить тонкое покрытие объекта
самой сложной конфигурации и без вращения
столика-держателя.
Описанные методы напыления поверхности биологических
объектов имеют ряд недостатков: при обработке материала с
неровной и пористой поверхностью не всегда удается получить
равномерное покрытие; слой металлического покрытия может
сгладить нежные морфологические образования; при
длительном напылении происходит нагрев объекта и поверхность его
250
деформируется. В связи с этим некоторые исследователи
предлагают способы покрытия поверхности без применения
металла. Например, используют пары тетраоксида осмия или
предварительно обрабатывают материал таниновой кислотой, а затем
парами осмия. Таниновая кислота способствует лучшему
проникновению тетраоксида осмия в биологический объект.
СПЕЦИАЛЬНЫЕ МЕТОДЫ ОБРАБОТКИ
БИОЛОГИЧЕСКИХ ОБЪЕКТОВ
Кроме изучения свободной поверхности клеток, для
морфологов представляет интерес исследование скрытой поверхности
клеток в местах их соединений, а также строение и
расположение органелл. Исследования, проводимые с целью их изучения,
с одной стороны, углубляют представления о механизме
клеточных соединений, а с другой — расширяют возможности
расшифровки внутриклеточных связей между ядром и органелла-
ми при различных воздействиях.
Применяются различные способы разъединения и
препарирования клеток, которые разделяют на механические и
химические.
К механическим методам относится метод раскола и
разрыва. Сущность его состоит в том, что вначале биологический
объект фиксируют и уплотняют путем заключения в
эпоксидные смолы. Полученные твердые блоки раскалывают и
обнаженные поверхности напыляют. Другим вариантом является
быстрое замораживание объекта с последующим его
раскалыванием с помощью тонких щипцов, скальпеля и легкого
молоточка. Полученные поверхности раскола затем обрабатывают с
целью получения реплик либо предварительно высушивают и
напыляют для исследования в растровом электронном
микроскопе.
Химические методы предусматривают обработку материала
химическими агентами, в частности энзимами, с целью
удаления определенных компонентов объекта. Так, для обнажения
поверхности клеток поперечнополосатой мышечной ткани,
покрытой тонкой пленкой коллагена, проводят предфиксацион-
ную обработку коллагеназой.
Для изучения мелких сосудов можно рекомендовать метод
инъекционных реплик [Гусев С.А., 1981]. После перфузии
сосудов отмывают сосудистое русло от крови изотоническим
раствором хлорида натрия или раствором Хенкса с добавлением
гепарина при 37 °С в течение 5—10 мин. В качестве
инъекционных масс при заполнении сосудов используют эпоксидные
смолы типа «Мегсох» или «Ва1зоп-17». Полимеризация
происходит в течение 1 ч. Полученные реплики очищают от тканей
путем коррозии в 25 % растворе гидроксида натрия или калия в
течение 1 —2 ч, затем промывают в дистиллированной воде, вы-
251
сушивают на воздуха и напыляют по принятой методике. Этот
метод позволяет четко выявлять внутреннюю поверхность
сосудов.
СОЧЕТАНИЕ РАСТРОВОЙ ЭЛЕКТРОННОЙ
МИКРОСКОПИИ И РАДИОАВТОГРАФИИ
С самого начала применения РЭМ было чрезвычайно заманчиво
соединить возможности электронной микроскопии и
радиоавтографии. Такой синтетический метод позволил бы определять не
только изменения морфологических образований в
поверхностном слое различных клеток, но и уровень содержания в них
ферментов при различных состояниях. Теоретические расчеты
позволяют надеяться на возможность одновременного
исследования радиоавтограммы и микрорельефа поверхности клеток в
режиме РЭМ. Разрабатываются различные способы,
позволяющие сохранять ультраструктуру поверхности клеток и участки
реакции проявленных автографов.
В этом отношении перспективным является метод, в котором
сочетаются возможности РЭМ и радиоавтографии при изучении
локализации различных ферментов в биологических мембранах
[Надточий В.В., Бродский Р.А., 1982]. В качестве модели
локализации меченного тритием мономера на поверхности
биологического объекта используют способ введения 3Н-лейцина в энте-
роциты тонкой кишки крысы. После обычной обработки и
фиксации высушенные кусочки ткани ориентируют на объектодер-
жателе, затем прикрепляют к столику с помощью
электропроводящего клея и помещают в вакуумный пост, где образец
напыляют тонким слоем углерода. На покрытый углеродом образец
наносят фотоэмульсионный слой — фотоимульсии типа М или
ПР-2. После экспонирования препараты помещают в
проявитель Д-19 в темной камере в течение 1—2 мес.
Исследование образцов с проявленными зернами серебра в
местах расположения радионуклида проводят в режиме
детектирования вторичных электронов. Микроскопию
радиоавтограммы осуществляют без удаления проявленной
фотоэмульсии. При таком режиме сканирования проявленные зерна
серебра (автографы) выглядят как светлые контрастные пятна на
поверхности клеток эпителия кишечника на фоне темных
микроворсинок.
ГЛАВА 14
СВЕТОМИКРОСКОПИЧЕСКАЯ РАДИОАВТОГРАФ И Я
Радиоавтография — разновидность метода меченых атомов.
Принцип его заключается в том, что, заменяя один из атомов
изучаемого вещества соответствующим радионуклидом, тем
самым метят данное вещество и получают возможность
проследить за его превращениями в организме с помощью различных
способов обнаружения радиоактивности. В отличие от
биохимического анализа, при котором судьбу меченого соединения
определяют по содержанию радиоактивности в различных
химических компонентах и фракциях живых тканей, радиоавтография
позволяет установить присутствие радиоактивности в
определенных структурах, т.е. представляет собой один из методов
морфологического анализа.
Для создания радиоавтографического препарата —
радиоавтографа в исследуемый материал тем или иным способом
вводят радиоактивное вещество, затем из этого материала готовят
срез, мазок, отпечаток, слой культивируемых клеток. В
радиоавтографии используют фотографический способ регистрации
радиоактивности. С этой целью на препарат наносят
фотослой — фотопленку или фотоэмульсию. Излучение
радиоактивного вещества, содержащегося в морфологическом препарате,
активирует кристаллы галогенида серебра фотослоя —
вызывает образование центров скрытого изображения. В процессе
проявления кристалл, содержащий центр скрытого изображения,
превращается в зерно восстановленного серебра. Значительное
скопление таких зерен над участками, содержащими
радиоактивное вещество, обнаруживается визуально как потемнение
При небольшом количестве зерен определить присутствие
радиоактивного вещества можно только с помощью светового или
электронного микроскопа.
ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
Многие операции по приготовлению радиоавтографического
препарата тесно связаны с такими важнейшими
характеристиками метода, как его чувствительность, разрешающая способность
и фон.
253
Чувствительность
Чувствительность (или эффективность) метода определяется
минимальной концентрацией радиоактивных атомов, которая
может быть обнаружена в исследуемом материале; чем ниже эта
концентрация, тем выше чувствительность. Так, выраженное
влияние на чувствительность метода оказывает пропорция
включенной радиоактивности, но этот показатель резко
меняется в зависимости от изучаемого процесса, объекта
исследования, способа введения радионуклида, времени его присутствия
в материале и т.д. В связи с этим на практике важно четко
представлять, какие условия и каким образом влияют на
чувствительность метода, чтобы, подбирая и варьируя эти условия,
добиваться нужного результата. Конкретную величину
чувствительности надежнее всего определять по результатам
эксперимента. Для этого нужно сопоставить введенную активность и
зарегистрированное радиоавтографом количество зерен серебра и
выразить его в процентах от количества радиоактивных
распадов, произошедших в объекте за время экспонирования.
В радиоавтографии регистрируют не каждый радиоактивный
распад, произошедший в образце, а лишь меньшую часть этих
распадов. Это объясняется прежде всего тем, что излучение
может быть направлено в любую сторону от каждого
распадающегося атома, и если взято много таких атомов, то излучение
направляется во все стороны одинаково, а в радиоавтографе
регистрируются только те распады, которые испустили частицу в
сторону фотослоя. Кроме того, не каждая частица, достигшая
фотослоя, образует центр скрытого изображения. Часть
образовавшихся в кристаллах галогенида серебра центров скрытого
изображения не сохраняется до момента проявления, а
подвергается обратному развитию — регрессии и, следовательно, не
дает при проявлении видимых зерен восстановленного серебра.
Наконец, эффективность проявления никогда не составляет
100 %, т.е. не все центры скрытого изображения,
сохранившиеся к моменту проявления, образуют в результате его проведения
зерно восстановленного серебра.
Чувствительность метода снижается из-за самопоглощения
радиоактивного излучения самим материалом. Взаимодействуя
с атомами материала, излучение тормозится и может не
достигнуть фотослоя. Значение самопоглощения значительно
возрастает с уменьшением энергии излучения, а как раз такие
источники в основном используют в радиоавтографии. Например, из-
за низкой энергии распада трития пробег (3-частиц трития в
пропитанном эпоксидной смолой биологическом материале в
среднем не превышает 1 мкм. Таким образом, если данный
радиоавтографический препарат приготовлен на основе среза
толщиной 5 мкм, то в образовании радиоавтографии будет
участвовать только х/ъ (по толщине) этого среза, т.е. слой толщиной
254
1 мкм, лежащий непосредственно под фотоэмульсией.
Излучение остальных 4/5 среза заторможено из-за самопоглощения,
следовательно, эффективность этой большей доли препарата
равна нулю. В связи с этим светомикроскопической
радиоавтографии при работе с тритием следует стремиться к
использованию самых тонких по меркам световой микроскопии срезов,
например 1 мкм. В этих условиях качество изображения
улучшается без какого-либо ущерба для чувствительности метода.
Снижение чувствительности вследствие самопоглощения
может иметь принципиальное значение при работе с мазками и
препаратами культуры клеток. В таких препаратах меченые
структуры могут постоянно перекрываться немечеными,
например содержащие 3Н-тимидин ядра всегда отделены от эмульсии
слоем немеченой цитоплазмы. Если толщина последнего
превышает 1 мкм, то чувствительность метода снижается до нуля и
содержащие 3Н-тимидин ядра в препарате представляются
немечеными. Перекрывание ядра цитоплазмой возможно и в срезе (это
явление непостоянно). При работе с источниками большей
энергии излучения (14С, 355, 32Р) уровень самопоглощения
снижается. Слой биологического материала толщиной 1 — 2 мкм
поглощает лишь небольшую долю р-частиц, а не тормозит излучение
полностью, как при работе с тритием. В этих условиях в
образовании автографа участвует не только самый верхний слой
гистологического среза, но и весь срез толщиной 5—10 мкм. С
увеличением толщины среза повышается и чувствительность метода.
Важное практическое значение имеет влияние на
чувствительность метода толщины слоя эмульсии. Поглощение частиц в
эмульсии происходит в принципе так же, как в биологическом
материале, но еще значительнее, так как плотность эмульсии,
содержащей высокий процент серебра, примерно в 3 раза выше
плотности биологического материала. Для характеризующегося
низкой энергией распада трития толщина слоя эмульсии
существенного значения не имеет. р-Частицы трития обычно
поглощаются самым нижним, лежащим непосредственно на срезе,
рядом кристаллов галогенида серебра. Очень немногие р-части-
цы трития обладают энергией, достаточной для того, чтобы,
пройдя один кристалл и образовав в нем скрытое изображение,
поразить еще и второй кристалл галогенида серебра также с
созданием скрытого изображения. При любой толщине слоя
эмульсии излучение трития выявляется в виде отдельных зерен
серебра, а не треков (путей), которые создаются р-частицами
высоких энергий и предстают в виде нескольких
расположенных друг за другом зерен серебра, обозначающих путь р-части-
цы в фотослое.
Практически важно, что при нанесении жидкой эмульсии
образуется фотослой неодинаковой толщины, но над любым
участком препарата при правильно выбранном разведении
эмульсии он бывает толще 1 — 2 мкм, т.е. достаточным для того,
255
чтобы полностью поглотить излучение трития. Таким образом,
фотослой, образованный путем нанесения жидкой эмульсии, в
работе с тритием позволяет осуществлять количественные
радиоавтографические исследования, поскольку неравномерная
толщина фотослоя не отражается на плотности зерен серебра.
(З-Частицы с энергией, большей, чем у трития, могут
образовывать в фотослое больше одного зерна серебра или даже трек.
Чувствительность метода при работе с источниками таких р-час-
тиц возрастает с увеличением толщины слоя эмульсии (если
чувствительность оценивать по плотности зерен серебра). В
данном случае количественные исследования возможны лишь при
использовании метода съемных эмульсий [Ко^егз А., 1973],
обеспечивающего равномерную толщину фотослоя, либо
создании толстых слоев эмульсии и определения в последних не
плотности зерен, а количества треков, каждый из которых
(независимо от количества составляющих трек зерен) является
результатом одного р-распада (трековая радиоавтография).
Перечисленные физические и фотохимические факторы
имеют, безусловно, важное, но все же второстепенное значение
для чувствительности метода по сравнению с биологическими
факторами. В исследованиях синтеза макромолекул к
важнейшим биологическим факторам относят величину
внутриклеточного пула предшественника, его специфичность, скорость
синтеза биополимера, количество биополимера в клетке. Так, в
исследованиях синтеза нуклеиновых кислот клетками
млекопитающих чувствительность метода радиоавтографии при работе с
предшественником ДНК *Н-тимидином оказывается в 20 — 25
выше, чем чувствительность при работе с предшественником
РНК 3Н-уридином. В исследованиях синтеза нуклеиновых
кислот бактериями соотношение почти обратное, по крайней мере
для мечения РНК требуются гораздо меньшие дозы 3Н-уриди-
на, чем дозы 3Н-тимидина, необходимые для мечения ДНК.
Разрешающая способность
Под разрешающей способностью (разрешением) метода
радиоавтографии понимают степень точности, с которой можно
определить локализацию в препарате радиоактивного вещества.
Проблема заключается в том, что сам радиоактивный атом
невидим, а о его расположении в срезе судят по локализации зерна
серебра в фотослое над срезом. Возникающая при этом
погрешность имеет особенно большое значение в
электронно-микроскопической радиоавтографии. Погрешность имеет две
составляющие — геометрическую ошибку и фотоошибку. Первая
возникает из-за того, что излучение распадающегося атома может быть
направлено под любым углом к плоскости фотослоя.
Соответственно этому зерно серебра в фотослое может быть расположено
не точно над радиоактивным атомом, а быть больше или меньше
256
смещенным в сторону в зависимости от величины угла между
плоскостью фотослоя и направлением частицы, толщины среза
(точнее, расстояния между распадающимся атомом и
фотослоем), длины пробега частицы. Фотоошибка возникает в связи с
тем, что зерно серебра, состоящее из многих тысяч атомов
металла, намного больше радиоактивного атома, т.е. о
локализации маленького объекта приходится судить по расположению
большого объекта.
Несмотря на погрешность, вносимую геометрической
ошибкой и фотоошибкой, техника современной радиоавтографии
такова, что при работе с тритием разрешение радиоавтографа
практически не уступает максимально возможному разрешению
светового микроскопа. Первым обстоятельством,
обусловливающим это положение, является низкая энергия распада трития,
не позволяющая р-частицам проникать в материал более чем на
1 мкм от распадающегося атома. При таком пробеге даже в
самом толстом срезе и при самом невыгодном направлении
частицы зерно не может быть удалено от распавшегося атома более
чем на 1 мкм, т.е. величину, близкую к пределу разрешения
светового микроскопа.
Вторым важным фактором повышения разрешающей
способности радиоавтографии является использование
мелкозернистых эмульсии. Современные эмульсии позволяют даже с
обычными проявителями получать зерно диаметром 0,3 — 0,5 мкм.
Применение специальных проявителей дает возможность
уменьшить размер зерна до оптимальной величины, т.е. можно
подобрать режим проявления, который обеспечит образование
зерен, находящихся на пределе видимости при самых
благоприятных условиях наблюдения.
Использование для метки трития, мелкозернистой эмульсии
и специального проявителя позволяет вполне надежно отличать
в радиоавтографах меченые бактерии от рядом расположенных
немеченых, т.е. успешно проводить анализ мелких по меркам
световой микроскопии объектов [Пальцын А.А. и др., 1988].
Применение радионуклидов с энергией распада большей,
чем у трития, и, следовательно, большим пробегом частиц
снижает разрешающую способность радиоавтографии. В этом
случае она в той или иной степени уступает разрешению светового
микроскопа, и, естественно, при использовании модификаций
метода могут быть решены только задачи, более примитивные в
смысле точности локализации источника излучения, например
различение меченых и немеченых клеток или даже меченых и
немеченых клеточных слоев, зон и т.д.
Фон радиоавтографа
В любых фотоматериалах, в том числе и в используемых для
радиоавтографии эмульсиях, образование скрытого изображе-
257
ния и последующее появление зерен восстановленного серебра
может быть обусловлено не только облучением р-частицами, но
и влиянием видимого света, космического излучения,
химическими и механическими воздействиями. Вследствие этого само
по себе обнаружение в проявленном препарате зерна серебра
еще не свидетельствует о содержании в срезе радиоактивного
вещества. Это зерно может отражать фон радиоавтографа, т.е.
быть обусловлено перечисленными побочными факторами.
Полностью избавиться от фона в радиоавтографах не удается,
однако в правильно приготовленных препаратах фон состоит из
одиночных зерен серебра, расположенных на большом
расстоянии друг от друга. Чем реже встречаются эти зерна, тем выше
качество радиоавтографа и больше точность получаемых
результатов.
Фон может оказаться причиной ошибочного «выявления»
радиоактивности там, где она отсутствует. Для того чтобы
избежать этого, можно использовать несколько приемов. Важное
свидетельство действительного выявления метки — это
концентрация зерен серебра над определенными структурами —
избирательность мечения. Фон, как правило, со структурой
препарата не связан, поэтому если на единицу площади какой-то
структуры приходится большее количество зерен, чем на такую
же площадь других структур (плотность метки над структурой
повышена), то это является серьезным основанием
предполагать наличие специфического включения радионуклида в
данную структуру. Как правило, в биологическом материале много
одноименных структур, и, если метка не артефакт, ее обычно
выявляют по крайней мере в нескольких одноименных
структурах. Однако избирательная концентрация зерен серебра над
определенной структурой — не абсолютный критерий
действительного сосредоточения радиоактивности в ней. В некоторых
случаях механические напряжения в слое эмульсии
обусловливаются рельефом лежащего под ним среза. Эти механические
напряжения обусловливают активизацию кристаллов галогени-
да серебра и массовое возникновение фоновых зерен над
структурами с определенным рельефом: волосяными фолликулами,
сосудами и т.п. При просмотре такого препарата создается
достаточно убедительная иллюзия концентрации метки в
волосяных фолликулах или сосудах. Препараты с таким фоном
следует отбраковывать, даже если в них наряду с фоном
обнаруживают действительную метку. Вообще следует исключать из
анализа все партии препаратов, в которых наблюдается повышенная
чувствительность фотослоя к механическим воздействиям.
Последняя проявляется скоплением зерен над неровностями
препарата: царапинами от ножа, границами среза, границами
долек, ацинусов, протоков желез и любых других полых
образований. Наиболее частой причиной этого бывает
пересушивание фотослоя.
258
Лучшим способом дифференциации метки от фона является
так называемый холодный контроль. Это точно такой же
материал, как и в основном эксперименте, прошедший точно такую
же обработку, но без введения радиоактивности. Фон эмульсии
в опыте и холодном контроле бывает одинаковым, поэтому если
плотность зерен в исследуемом материале достоверно
превышает плотность зерен в холодном контроле, это свидетельствует о
присутствии в материале радиоактивного вещества.
НИЗКОМОЛЕКУЛЯРНЫЕ ПРЕДШЕСТВЕННИКИ,
ИСПОЛЬЗУЕМЫЕ В РАДИОАВТОГРАФИИ
Радиоавтография осуществляется только с помощью атомов,
испускающих при распаде частицу (а- и р-частицы, позитрон)
или производящих электронный захват. Элементы,
испускающие у-лучи и рентгеновское излучение, для радиоавтографии
непригодны, так как эти излучения отличаются высокой
проникающей способностью и соответственно слабым
взаимодействием с материалом, в котором они распространяются. ос-Частицу
испускают обычно тяжелые элементы, поэтому они имеют
небольшое значение для биологии и используются главным
образом в токсикологических исследованиях. Наибольший интерес
представляют элементы с низкой средней энергией распада
(табл. 8), поскольку частицы с высокой энергией снижают
разрешение метода и, кроме того, могут понижать его
чувствительность, так как проходят тонкие слои эмульсии без
взаимодействия с кристаллами галогенида серебра. Вследствие этого
радионуклиды со средней энергией выше 0,5 МэВ практически
непригодны для радиоавтографии.
Кроме энергии распада, важным показателем возможности
применения радионуклида в радиоавтографии является период
Таблица 8. Радионуклиды, используемые в радиоавтографии
т,, Характеристика
Радионуклид | %ас""Да
Тритий
мс
Зад
125!
55ре
32р
Р-Частица
р-Частица
Р-Частица
Электронный захват
Электронный захват
Р-Частица
Средняя энергия,
МэВ
0,018
0,159
0,167
*
*
1,71
Период полураспада
12,26 года
5760 лет
87,2 дня
60 дней
2,7 года
14,3 дня
*Распад с электронным захватом отличается низкой энергией и обеспечивает разрешение по
крайней мерс не хуже, чем у трития.
259
полураспада. Чем короче этот период, тем выше может быть
удельная активность предшественника и, следовательно, легче
обнаружить даже небольшие количества исследуемого
вещества. В то же время при слишком коротком периоде полураспада,
измеряемом несколькими днями и часами, проведение
радиоавтографических экспериментов затрудняется и даже
становится невозможным, поскольку дни и недели уходят на то, чтобы
организовать и провести эксперимент, фиксировать и залить
материал, приготовить достаточное количество срезов, залить их
эмульсией и экспонировать в течение необходимого срока в
темноте.
При выборе радионуклида для эксперимента, конечно,
приходится учитывать его стоимость, и в этом отношении первое
место остается за тритием: меченные им соединения наиболее
дешевы. Будучи тяжелым изотопом водорода, тритий легко
замещает его при обработке соответствующих веществ тритиевым
газом, поэтому тритием можно пометить любое органическое
соединение далее с неизвестной структурой*.
Наиболее широко и успешно метод радиоавтографии
используют для исследования синтеза ДНК и процессов
пролиферации клеток. В значительной мере это связано с доступностью
высокоспецифичного предшественника ДНК *Н-тимидина,
меченного в 6-м положении. Для изучения синтеза РНК чаще
применяют 5-*Н-уридин. Ценность этого предшественника
обусловлена тем, что при превращении уридина в тимидин метка из 5-го
положения теряется. Следовательно, хотя указанное
превращение в клетках может происходить, оно не влияет на
специфическое мечение РНК 5-3Н-уридином. В исследованиях синтеза
полисахаридов в качестве предшественников используют
моносахариды. В качестве предшественника липидов можно
использовать меченый глицерин. Белки можно метить различными
предшественниками, чаще всего для этого используют
аминокислоты. Однако можно применять и сахара как
предшественники сахарных остатков гликопротеинов. Все перечисленные
предшественники в радиоавтографических исследованиях
удобнее метить тритием. В некоторых случаях целесообразнее
использовать другие элементы, например 125Ыа — для тиреоглобу-
лина, 55Ре — для гемопротеина и 353 — для сульфатированных
ГАГ.
Тех, кто недостаточно знаком с техникой радиоавтографии,
обычно удивляет, почему радиохимические фирмы в паспортах
* Действительная технология приготовления меченых веществ, конечно,
гораздо сложнее, так как тритий должен заместить не любой атом водорода, а
только связанный с углеродом стабильной связью. Лишь в этом случае с
помощью трития можно проследить за «судьбой» меченой молекулы. Если же
тритий попадает в группы —ОН, — СООН, — ЫШ, — ЗН и т.д., то он очень
быстро переходит в другие молекулы и правильная трактовка автографов
становится невозможной.
260
на меченые вещества указывают срок хранения намного меньше
периода полураспада того элемента, которым помечено данное
вещество. Например, срок хранения меченных тритием нуклео-
зидов обычно не превышает б мес, тогда как период
полураспада трития 12,26 года. Это объясняется тем, что при хранении
меченых веществ происходит их разрушение под действием
собственного радиоактивного излучения (радиолиз). В результате
радиолиза появляются соединения, отличающиеся от исходного
предшественника по химической структуре, а следовательно, и
по поведению в организме. Скорость разрушения в
значительной степени зависит от удельной активности. Чем последняя
выше, тем больше скорость разрушения и возможность
перемещения трития в меченой молекуле из стабильных положений в
активные. Поскольку даже небольшое количество подобных
продуктов может исказить результаты эксперимента, в
радиоавтографических исследованиях следует пользоваться только
свежими предшественниками высокой радиохимической
чистоты.
С учетом достоинств и недостатков высокой удельной
активности предшественника, т.е. возможности обнаружить
небольшое количество вещества и ускоренного радиолиза, следует
стремиться к использованию в работе веществ с минимальной
удельной активностью, однако достаточной для надежного
выявления меченого продукта. Для уменьшения радио лиза при
хранении предшественника в лаборатории можно
рекомендовать следующие приемы 1) разбавлять предшественник до
минимальной концентрации, необходимой для проведения работы;
2) хранить в холодильнике; 3) добавлять реагенты, снижающие
активность свободных радикалов, обычно это бензиловый или
этиловый спирт. Радиохимические фирмы поставляют многие
предшественники в спиртовых растворах. Их можно
использовать только в виде сильно разбавленных растворов. Если же по
условиям эксперимента разбавление невозможно, то спирт
перед использованием препарата нужно выпаривать, а затем
разводить сухой предшественник в жидкости, подходящей для
введения в исследуемую систему.
ВВЕДЕНИЕ МЕТКИ
Путь введения предшественников определяется прежде всего
объектом изучения, а иногда и изучаемым процессом. В работах
с культурами клеток радионуклиды вводят в питательную
среду.
Для исследования клеток и тканей человека с помощью
радиоавтографии образцы инкубируют в течение некоторого
времени при температуре тела в питательной среде, содержащей
меченое вещество. Таким образом можно изучать и ткани
животных (особенно более крупных, чем, например, мышь), если
261
постановка эксперимента на целом животном оказывается
слишком дорогой. В экспериментах на животных метку чаще всего
вводят в кровь, хотя может оказаться более эффективным и
дешевым местное применение препарата. Так, введение метки в
желудочки мозга позволяет преодолеть гематоэнцефалический
барьер и требует очень небольших доз препаратов. Введение в
аорту может быть наиболее подходящим для исследования
почек.
Путь введения иногда приходится подбирать в соответствии
с изучаемым процессом. Так, для изучения синтеза ДНК в
печени 3Н-тимидин можно ввести в брюшную полость и при этом
получить равномерное мечение всех клеток органа,
синтезирующих ДНК. Если же для исследования синтеза РНК в печени
внутрибрюшинно ввести 3Н-уридин, то обнаруживается резко
выраженная неравномерность мечения клеток печени: клетки на
поверхности органа метятся очень сильно, а в глубине —
намного слабее или же метка не обнаруживается. Причина такого
различия понятна. Синтез РНК в отличие от ДНК совершается
практически постоянно во всех живых клетках, поэтому
огромное количество клеток, интенсивно синтезирующих РНК на
поверхности такого крупного органа, как печень, которая при
внутрибрюшинном введении раствора 3Н-уридина по существу
погружается в него, очень быстро включает значительную часть
введенной дозы. Лишь небольшая ее доля успевает проникнуть
в кровь и, конечно, намного слабее метит все остальные клетки.
В отличие от этого 3Н-тимидин включается лишь очень
небольшим количеством клеток и соответственно медленно
поглощается ими из внутрибрюшинной жидкости, поэтому большая часть
введенного вещества успевает проникнуть в кровь и равномерно
пометить все клетки, синтезирующие ДНК.
Таким образом, при любом радиоавтографическом
эксперименте, особенно поставленном на животных, нужно тщательно
выбирать подходящий метод введения метки. В случае
необходимости с этой целью стоит провести специальные эксперименты.
Доза меченого вещества зависит от особенностей
исследуемого объекта или процесса, условий эксперимента, удельной
активности и специфичности предшественника. Проще всего
указать дозу тимидина в связи с его высокой специфичностью и с
тем, что репликативный синтез ДНК в клетке либо не идет,
либо идет очень стандартно в разных видах клеток. Поэтому
если эксперимент проводится с целью выявить клетки,
синтезирующие в данный момент ДНК, то для светомикроскопической
радиоавтографии с парафиновыми и с полутонкими срезами, а
также с культурами клеток достаточна доза 0,5—1 мкКи на 1 г
массы животного или на 1 мл инкубационной среды. Для более
сложных исследований ДНК могут потребоваться другие дозы
3Н-тимидина. Так, для выявления репаративного синтеза ДНК
5. Ре1е и соавт. (1972) вводили 3Н-тимидин в дозе 3 мкКи/г.
262
Длительность присутствия в исследуемой системе
предшественника определяется биологической или медицинской задачей
эксперимента. Так, если исследуется место синтеза или
связывания какого-то вещества, то это время должно быть как можно
более коротким (так называемое пульсовое мечение), поскольку
многие вещества могут перемещаться из мест синтеза или
первичного накопления. В тех случаях, когда исследуются и
участки синтеза, и пути перемещения веществ, анализу подвергаются
препараты с несколькими сроками присутствия
предшественника в изучаемой системе. Это позволяет отразить отдельные
этапы процесса. При изучении миграции веществ бывает
полезным прекратить включение предшественника на какой-то
стадии, чтобы получить более четкую картину перемещения, не
затушеванную продолжающимся синтезом. С этой целью
используют следующий прием. После короткого, измеряемого
минутами, «пульса» вводят предшественник, не содержащий
радиоактивный элемент в концентрации, примерно в 10 раз
превышающей концентрацию предшественника с радиоактивным
элементом. Избыток немеченого предшественника практически
прекращает включение меченого, и миграция вновь
синтезированного вещества более демонстративна.
ПРИГОТОВЛЕНИЕ И АНАЛИЗ РАДИОАВТОГРАФОВ
Получение и обработка срезов
Фиксация, обезвоживание и заливка материала для
радиоавтографии имеют те же цели и осуществляются теми же способами,
какими фиксируют и обрабатывают ткань для обычного
морфологического исследования. Только следует учитывать, что при
радиоавтографии должны выполняться еще 3 условия: 1)
сохраняться исследуемое макромолекулярное вещество или
вещества и структуры, специфически связывающие введенную
метку; 2) обеспечиваться вымывание невключившегося
предшественника или не связанной специфически метки; 3) не
оказываться химическое воздействие на фотослой. Практически
большинство широко используемых в морфологии фиксирующих
веществ может быть применено в радиоавтографии и выбирают
прежде всего то, которое обеспечивает наилучшую
морфологическую картину объекта и, конечно, соответствует упомянутым
трем условиям. Успешно могут применяться даже вещества,
энергично воздействующие на эмульсию, например формалин,
дающий очень плотный хемавтограф (фон, обусловленный
химическим воздействием). Нужно лишь после фиксации
тщательно отмыть формалин из кусочков и депарафинированных
срезов.
Многие красители, так же как формалин, создают хемавто-
графы, поэтому радиоавтографические препараты обычно окра-
263
шивают после проявления фотослоя. Конечно, могут быть
особые случаи, например окрашивание со значительным
нагреванием (слабый нагрев фотослой выдерживает) или применением
концентрированных кислот и щелочей, когда окрашивание
может повредить фотослой и приходится проводить окраску до
нанесения эмульсии.
Выбор и нанесение эмульсии
Наиболее доступны два вида ядерных, т.е. предназначенных
для исследования элементарных частиц, фотоэмульсий: М и Р.
Выбор одной из них определяется задачей эксперимента и
спецификой объекта исследования и должен рассматриваться в
комплексе с такими особенностями работы, как
чувствительность метода, необходимое разрешение, экспозиция,
характеристика проявителя, способ анализа препаратов и регистрации
результатов эксперимента.
Средний размер кристаллов галогенида серебра в эмульсии
М — 0,12 — 0,14 мкм, в эмульсии Р кристаллы галогенида
серебра приблизительно в 2 раза крупнее. В связи с этим
эмульсия М позволяет получить большее разрешение, однако менее
чувствительна и, следовательно, при прочих равных условиях
«требует» больших доз радиоактивности и больших
экспозиций. Зерна эмульсии М меньше закрывают морфологические
структуры, но и менее заметны в проходящем свете, поэтому
при ее использовании для рассматривания и фотографирования
применяют объективы с большим увеличением. Подсчет зерен
эмульсии М возможен только с иммерсионными объективами.
Эти объективы необходимы в большинстве случаев и для
фотографирования препаратов, и лишь очень многочисленные и
плотные скопления зерен эмульсии М могут быть четко отсняты
с помощью сухих объективов. Если необходимо
продемонстрировать распространенность какого-то процесса и приходится
снимать обширные участки ткани под малым увеличением,
лучше пользоваться эмульсией Р. При этом меченые объекты
отчетливо видны в микроскоп и на фотографии даже при 10-кратном
увеличении. Конечно, исходные качества эмульсий можно
корректировать путем подбора доз, условий экспонирования и
проявления.
Обе эмульсии наносят в жидком виде. Работу с ядерными
эмульсиями проводят с использованием красного или
желто-зеленого светофильтра. В стеклянный стаканчик с
дистиллированной водой или 0,02 % раствором бромида калия добавляют
кусочками холодную желеобразную эмульсию в соотношении
1:3—1:10 в зависимости от желаемой толщины фотослоя. Для
уменьшения фона, обусловленного быстрым высыханием
фотослоя, можно добавлять до 1 % глицерина. Стаканчик
помещают на водяную баню при 42 °С. После расплавления эмульсии
264
ее тщательно размешивают стеклянной палочкой (медленными
движениями) и фильтруют через бумажный фильтр. В течение
всего времени нанесения стаканчик с эмульсией остается на
водяной бане. Предметные стекла со срезами погружают в
стаканчик, затем вынимают из него. Сторону стекла, не несущую срез,
вытирают чистой марлей и стекло помещают на горизонтальную
поверхность срезом вверх для высушивания. Предметные
стекла, используемые для радиоавтографии, должны быть
максимально чистыми. Если далее при соблюдении этого условия
эмульсия не растекается равномерно по поверхности стекла, то
можно в жидкую эмульсию добавить 1 — 2 капли какого-либо
поверхностно-активного вещества. После высыхания слоя
эмульсии стекла укладывают в светонепроницаемые коробки и
хранят при 2 — 4 °С. В случаях с короткой экспозицией (3—10
дней) можно хранить препараты и при комнатной температуре.
Срок экспонирования зависит от дозы радиоактивного
вещества, чувствительности применяемой методики и желаемой
плотности расположения зерен серебра. Этот срок определяется
путем периодического (по мере увеличения экспозиции)
проявления и просмотра препаратов, специально предназначенных
для установления времени экспонирования и приготовленных
так же, как препараты основной серии. В зависимости от
условий эксперимента экспозиция составляет от нескольких часов
до нескольких месяцев.
Проявление
Проявление препаратов — один из наиболее важных моментов
радиоавтографии. При проявлении можно влиять на
разрешающую способность, чувствительность, фон, размер зерен и даже
на способы качественного, количественного анализов и
фотографирования радиоавтографов. Наиболее эффективен
проявитель Д-19: 2,2 г, метола, 96 г сульфита натрия безводного, 8,8 г
гидрохинона, 20 г карбоната натрия, 5 г бромида калия, 1000 мл
воды. Этот проявитель можно хранить до 3 мес. В качестве
основного приема можно рекомендовать разбавление указанного
раствора перед применением двукратным объемом
дистиллированной воды и проявление препаратов при 20 °С в течение
3 мин. При желании снизить фон, уменьшить или увеличить
размер зерен, увеличить чувствительность и т.д. можно
изменять условия проявления, варьируя температуру,
продолжительность проявления, темп перемешивания и степень
разбавления проявителя. Все эти условия подбирают эмпирически
соответственно объекту и задачам исследования. В каждом впервые
выполняемом радиоавтографическом эксперименте, кроме
биологического и температурного «холодного» контроля, следует
иметь еще одну группу препаратов, составляющих
фотографический контроль. По этим препаратам методом проб и ошибок
265
(разные экспозиция и условия проявления) подбирают
подходящий режим фотографической обработки материала. Главные
преимущества проявителя Д-19 по сравнению с другими —
стабильность результатов и высокая эффективность (большее
количество зерен при одинаковой концентрации метки).
По нашему мнению, с помощью проявителя Д-19 можно
решить все основные задачи светомикроскопической
радиоавтографии. Пожалуй, только действие парафенилендиаминового
проявителя не удается заменить никакими вариациями условий
применения проявителя Д-19. Парафенилендиаминовый
проявитель (8,1 г сульфита натрия безводного, 1,35 г парафенилен-
диамина, 135 мл воды) используют для работ, при которых
требуется наивысший уровень разрешения. Этот проявитель
значительно уступает проявителю Д-19 в эффективности и
стабильности результатов, однако дает очень мелкое и очень
компактное зерно, позволяющее метить такие мелкие объекты, как
бактерия. Проявляя в нем препараты при 30 °С от 1 до 4 мин,
можно менять размер зерен и уровень фона. Как правило,
выбирают такую длительность проявления (1—2 мин), при
которой из-за малой величины зерна оно почти невидимо в
проходящем свете, но очень хорошо заметно и может быть
сфотографировано в отраженном свете.
Закрепление радиоавтографических препаратов проводят в
20 — 25 % растворе тиосульфата натрия (продолжительность,
как и в обычной фотографии, равна удвоенному времени
просветления эмульсионного слоя). После промывания проточной
водой препараты можно окрашивать и исследовать в световом
микроскопе.
Анализ радиоавтографов
Прежде всего следует убедиться в том, что анализу
подвергается действительно радиоавтограф, а не артефакт. Основной
прием на этом этапе — сравнение распределения зерен серебра
в исследуемом препарате и в «холодном» контроле.
Если цель эксперимента заключается в количественном
исследовании какого-то процесса, то для успешного его
осуществления необходимо соблюдать несколько условий. В
радиоавтографии используют количественные исследования двух видов:
1) определение содержания меченого вещества; 2) определение
содержания меченых элементов или структур. Результаты
исследования первого вида могут быть выражены абсолютными и
относительными величинами. Получение абсолютных данных
(концентрация меченого вещества в изучаемом объекте) редко
бывает целью радиоавтографического исследования. Для этого
необходимо знание ряда условий, например эффективности
метода, точное определение которых затруднено, поэтому обычно
количественные радиоавтографические исследования первого
266
вида проводят путем сравнения плотности (концентрации)
зерен серебра над исследуемым объектом и контролем, при этом
контрольные данные принимают за 1, или 100 %. В таких
работах исследуемый объект и контроль должны получать строго
одинаковую дозу радиоактивности и обрабатываться в
одинаковых условиях. Заливку сравниваемых препаратов необходимо
осуществлять из одного разведения эмульсии. Для проявления
те и другие препараты следует помещать в одну коробку и
проявлять их одновременно, а не последовательно друг за другом.
При применении описанного метода жидких эмульсий
толщина фотослоя не бывает постоянной, поэтому количественные
исследования возможны только с тритием для 1251 при
обязательном контроле толщины слоя эмульсии (она должна быть не
менее 2 мкм). Для определения толщины фотослоя препарат
после заливки и высыхания эмульсии исследуют под
микроскопом. Наиболее простой и доступный метод измерения толщины
фотослоя — определение величины поворота микровинта
микроскопа при смещении фокуса с верхней поверхности
эмульсионного слоя на нижнюю. Наблюдение ведут с помощью 100-
кратного иммерсионного объектива в фазовом контрасте, при
котором достаточно хорошо различимы кристаллы галогенида
серебра. Толщину следует определять над срезом, где она
значительно больше, чем над поверхностью стекла. Плотность
зерен серебра выражается количеством зерен на единицу
площади исследуемой структуры, поэтому радиоавтографический
анализ, кроме визуального или машинного подсчета количества
зерен, всегда включает тот или иной способ определения
площадей. Последнее желательно проводить с помощью современных
приборов для анализа изображений. Можно использовать
также любой известный в морфометрии способ вычисления
площадей.
Второй вид количественных исследований — определение
содержания меченых элементов или структур, является
уникальной особенностью метода радиоавтографии. При этом
получают абсолютные величины, например процент меченных :зН-ти-
мидином клеток в какой-то клеточной популяции. К меченым
относятся клетки независимо от количества зерен серебра над
ними, но, конечно, при условии, что это количество выше фона.
Требования к единообразию условий проведения экспериментов
в таких исследованиях гораздо менее строгие. Здесь не имеют
решающего значения доза, особенности фотослоя, экспозиция,
метод проявления. Даже в тех случаях, когда эти параметры
различны и, более того, исследования проведены в разных
лабораториях, результаты работ на одном и том же объекте могут
и должны быть сходны, конечно, при условии, что работы
выполнены технически грамотно.
Все виды анализа радиоавтографов возможны путем
обычной микроскопии в проходящем свете и путем наблюдения и ре-
267
гистрации в отраженном свете. Последний прием имеет особое,
хотя еще не всеми специалистами признанное, значение в
радиоавтографии. В отраженном свете удобно рассматривать,
фотографировать и фотометрировать зерна серебра. Прием
осуществляется с любым микроскопом, оборудованным оптической
системой (например, предназначенной для исследования
флюоресценции), которая позволяет направить свет на препарат
сверху через объектив. Если в таком микроскопе радиоавтограф
осветить одновременно проходящим светом через
расположенный под препаратом конденсор и сверху через объектив, то при
достаточной яркости падающего через объектив света зерна
серебра интенсивно отражают его и кажутся светящимися точками
на фоне структур препарата,- Яркий ореол вокруг каждого зерна
позволяет увидеть очень мелкие зерна, в том числе и такие,
которые не видны в проходящем свете. При выключении
подходящего света зерна серебра кажутся яркими точками на темном
фоне (картина напоминает звездное небо). Этот эффект
наиболее выражен при использовании иммерсионных объективов, так
как масло уменьшает рассеяние света. Еще больший контраст
между темным фоном и светящимися зернами удается получить
при сочетании иммерсионных объективов и поляризованного
света. Одинаково пригодны иммерсионные объективы с
большим и средним увеличением.
Система анализа радиоавтографов в отраженном свете
обладает настолько существенными достоинствами, что может быть
признана необходимой в каждой радиоавтографической
лаборатории. Достоинства этой системы заключаются в следующем.
1. Облегчается поиск редких меченых объектов. Даже при
достаточно быстром перемещении препарата, освещенного
только падающим светом, меченный хотя бы несколькими зернами
серебра объект бросается в глаза, как любой яркий предмет на
темном фоне.
2. Использование отраженного света позволяет увидеть все
зерна серебра в фотослое, даже самые мелкие, и потому точнее,
чем при наблюдении в проходящем свете, определить уровень
фона и уровень метки.
3. В отраженном свете зерна серебра практически
невозможно спутать с глыбками хроматина, осадками красителя,
бактериями и некоторыми другими объектами, которые иногда
непросто отличить от зерен, в том случае, если используют
освещение через конденсор.
4. Сложная задача фотографирования радиоавтографов
значительно облегчается при использовании отраженного света.
Две основные причины затрудняют четкую передачу
радиоавтографов в фотоснимках, сделанных в проходящем свете. Первая
состоит в снижении контрастности из-за того, что черные зерна
серебра располагаются, как правило, на фоне достаточно
темных структур, например на фоне хроматина. Вторая причина —
268
>'* А
Рис. 6. Синтез ДНК фибробластом клеточной культуры.
| — снимок в проходящем свете; над ядром многочисленные зерна восстановленного серебра.
* 1000; б - снимок с двойной экспозицией (в проходящем и отраженном свете): зерна серебра
над ядром — белые, более четко выявляется структура цитоплазмы, х 1000.
расположение зерен не в одной плоскости со структурами, в
связи с чем при малой глубине резкости иммерсионных
объективов приходится снимать несколько вне фокуса либо зерна,
либо структуры. Эти трудности можно уменьшить или
устранить с помощью сочетания проходящего и отраженного света.
При одновременном применении обоих видов освещения зерна
серебра предстают уже не черными, а светлыми точками на
темном фоне и становятся заметнее на фотографиях. Еще лучше
можно сделать снимок, если применить оба вида освещения и
двойную экспозицию. Сначала в проходящем свете резко
снимают структуру, затем включают только отраженный свет, фокус
смещают на зерна серебра и производят вторую экспозицию
кадра. В этом варианте и зерна, и структуру снимают резко и
темный фон структуры лишь увеличивает контрастность зерен,
на позитивах имеющих вид белых точек (рис. 6).
5. Фотометрия в отраженном свете является наилучшим
способом машинного анализа радиоавтографов. В этой системе
освещения удается (конечно, при использовании всех приемов,
затемняющих фон,— иммерсионных объективов,
поляризованного света) добиться гораздо большей разницы между сигналом
и шумом, чем при освещении через конденсор. В фотометрии
отраженного света (в отличие от проходящего) можно
использовать окрашенный препарат, что позволяет легко
ориентироваться в морфологической структуре. Колебания интенсивности
окраски практически не влияют на показания прибора. Важно
также и то, что величина фотометрического показателя при
использовании отраженного света прямо пропорциональна
плотности зерен серебра.
ГЛАВА 15
ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКАЯ
РАДИОАВТОГРАФИЯ
Электронно-микроскопическая радиоавтография является
модификацией метода радиоавтографии, направленной на
получение максимального разрешения, которое бы позволило
подвергнуть радиоавтографическому анализу структуры, наблюдаемые
в электронном микроскопе.
Методы электронно-микроскопической и
светомикроскопической радиоавтографии принципиально сходны, однако
первый отличается значительно большей технической сложностью
и трудоемкостью. Поводом для разработки этого сложного
метода и причиной все более широкого его распространения
является большая разрешающая способность
электронно-микроскопического радиоавтографа по сравнению со светомикроскопи-
ческим. Если наивысшее разрешение светомикроскопической
радиоавтографии при использовании трития равно 1 мкм, то
разрешение электронно-микроскопической радиоавтографии
может достигать 0,1 — 0,2 мкм, т.е. больше первого в 5— 10 раз.
Кроме увеличения разрешающей способности, есть еще
преимущество электронно-микроскопической радиоавтографии —
возможность получить радиоавтограф над
электронно-микроскопическим срезом, представляющим гораздо более детальную
картину строения клетки по сравнению со срезом, используемым в
световой микроскопии.
РАЗРЕШАЮЩАЯ СПОСОБНОСТЬ
Уже по самой идее электронно-микроскопической
радиоавтографии разрешающая способность является основной
проблемой метода. Кроме того, если в современных модификациях
светомикроскопической радиоавтографии нет выраженных
различий между разрешающей способностью микроскопа и
радиоавтографа, то в электронно-микроскопической радиоавтографии
эти различия велики. Даже при использовании в качестве
образца срезов ткани разрешение электронного микроскопа по
крайней мере не ниже нескольких нанометров, а в
радиоавтографах оно в лучшем случае составляет 100 — 200 нм, т.е. в 10 —
100 раз ниже
271
Эти различия между разрешением ультратонкого среза и
радиоавтографа, приготовленного на основе данного среза,
обусловлены тем, что в определение радиоавтографического
разрешения вносятся две погрешности, называемые геометрической
ошибкой и фотоошибкой. Источники этих ошибок указаны в
главе 14, однако следует их рассмотреть подробнее в связи с
особенностями приготовления
электронно-радиоавтографического препарата. В таком препарате далее при использовании
трития источником излучения оказывается вся толща среза, а не
только его верхний слой, как это бывает в светомикроскопичес-
кой радиоавтографии. Ведь даже наиболее толстые электронно-
микроскопические срезы (100— 150 нм) проницаемы для р-час-
тиц. В создании радиоавтографа участвуют только те р-части-
цы, которые направлены в сторону эмульсии перпендикулярно
или под некоторым острым углом к ее плоскости. Последние
создают геометрическую ошибку радиоавтографа, так как
вызывают образование скрытого изображения не строго над
источником излучения. При одинаковом угле направления частицы это
отклонение в сторону тем меньше, чем меньше расстояние от
источника излучения до эмульсии. Поскольку в
электронно-микроскопической радиоавтографии расстояние от источника
излучения до эмульсии в основном определяется толщиной среза,
при ее уменьшении соответственно уменьшается геометрическая
ошибка и увеличивается разрешение. Теми же
закономерностями определяется и роль толщины фотослоя в величине
геометрической ошибки и соответственно разрешающей способности.
При увеличении толщины фотослоя отклонение частиц при том
же угле вылета больше, геометрическая ошибка возрастает, а
разрешение снижается.
Фотоошибка обусловливается особенностями
фотографического процесса. Кристалл галогенида серебра только в том
случае способен служить детектором излучения, если в нем есть
какие-то нарушения идеальной структуры — так называемые
центры чувствительности. Активация кристалла проходящей
через него р-частицей выражается образованием скрытого
изображения — восстановлением нескольких ионов серебра до
атомов металлического серебра. Для проблемы
радиоавтографического разрешения важно то, что скрытое изображение
формируется не на пути частицы через кристалл, а в центре
чувствительности. Так в определении пути частицы уже возникает ошибка,
максимальная величина которой равна диаметру кристалла. Эта
ошибка увеличивается при проявлении. Последнее вызывает
рост числа атомов металлического серебра в центрах скрытого
изображения (невидимых даже в электронном микроскопе) и
превращение этих скоплений серебра в видимые в микроскопе
зерна. В зерне невозможно определить, где был центр скрытого
изображения. Наиболее рационально считать, что он находится
в центре круга, описанного вокруг зерна. Однако и при таком
272
допущении возникает ошибка, максимальная величина которой
равна радиус)' окружности, описанной вокруг зерна. Таким
образом, максимальная величина фотоошибки равна сумме
диаметра кристалла галогенида серебра и радиуса зерна. Очевидно,
что для повышения разрешающей способности следует
использовать эмульсии с минимальным диаметром кристаллов и
проявители, дающие самое мелкое зерно. То и другое снижает
величину фотоошибки.
К сожалению, движение по обозначенным выше путям
повышения разрешающей способности
электронно-радиоавтографического метода возможно только в ограниченных пределах.
Ограничение создается тем, что эти пути ведут к снижению
чувствительности метода и приходится останавливаться в какой-то
точке, выбранной как компромисс между стремлениями
увеличить разрешающую способность и сохранить необходимый для
осуществления работы уровень чувствительности.
ЧУВСТВИТЕЛЬНОСТЬ
При использовании в качестве основы радиоавтографа
ультратонкого среза значительно снижается чувствительность
электронно-микроскопической радиоавтографии. В таком срезе
вообще мала масса клеточного материала, только часть этого
материала, часто совсем небольшую, составляет исследуемый макро-
молекулярный полимер. В последнем в свою очередь далеко не
каждый мономер содержит метку. Все это приводит к тому, что
чувствительность электронно-микроскопической
радиоавтографии в среднем примерно в 10 раз ниже чувствительности свето-
микроскопической радиоавтографии.
В связи с этим следует крайне осторожно и продуманно
относиться ко всем мерам, направленным на повышение
разрешающей способности, чтобы они не привели к снижению
чувствительности ниже порога, необходимого для выполнения
работы.
При уменьшении толщины срезов уменьшается не только
величина геометрической ошибки, но и содержание меченого
вещества, поэтому в электронно-микроскопической радиоавтографии
часто используют более толстые срезы (порядка 100—120 нм),
чем в обычной электронной микроскопии.
Стремясь повысить разрешающую способность электронно-
микроскопической радиоавтографии, исследователи используют
эмульсии с минимальным размером кристаллов галогенида
серебра. Однако при уменьшении кристалла снижается его
чувствительность к воздействию р-частицы. Интенсивность
взаимодействия р-частицы с кристаллом прямо зависит от длины
пройденного ею пути внутри кристалла, поэтому в небольшом
кристалле меньше вероятность образования скрытого изображения.
Наименьший диаметр кристаллов галогенида серебра имеет
273
эмульсия «Кос1ак КГГЕ», выпускаемая фирмой «Коёак» (США),
специально предназначенная для электронно-микроскопической
радиоавтографии с высоким разрешением (30 — 55 нм).
Чувствительность этой эмульсии примерно в 4 раза ниже
чувствительности наиболее популярной в
электронно-микроскопической радиоавтографии эмульсии «]Нот(1 Ь4» (размер кристаллов
120—140 нм), производимой фирмой «Л1Ъгс1» (Франция),
поэтому дальнейшее уменьшение диаметра кристалла не имеет
смысла.
Сходные противоречия возникают при попытках уменьшить
фотоошибку и соответственно повысить разрешающую
способность путем уменьшения размера проявленного зерна. При
использовании одного и того же проявителя уменьшения размера
зерна достигают снижением его температуры, уменьшением
продолжительности проявления или разбавлением раствора
проявителя (т.е. недопроявлением). Во всех этих случаях
уменьшение величины зерен неизбежно сопровождается и
уменьшением их количества, т.е. снижением чувствительности
метода. Использование различных по составу проявителей
также, как правило, позволяет увеличить разрешающую
способность лишь за счет уменьшения чувствительности.
РАДИОАКТИВНЫЕ ПРЕДШЕСТВЕННИКИ
Приведенные выше сведения о разрешении и чувствительности
электронно-микроскопической радиоавтографии объясняют тот
факт, что количество радиоактивных атомов, пригодных для
использования, меньше, чем в светомикроскопической
радиоавтографии. В электронно-микроскопической радиоавтографии
необходимы элементы с минимальной энергией распада, что
способствует повышению и разрешения (короткий пробег), и
чувствительности (так как частицы с низкой энергией сильнее
взаимодействуют с кристаллами галогенида серебра, а не
проходят их насквозь). Кроме низкой энергии, элементы должны
иметь сравнительно короткий период полураспада, чтобы
обеспечить удельную активность, достаточную для выявления
исследуемого процесса с помощью чувствительного метода
электронно-микроскопической радиоавтографии. На практике
используют почти исключительно третий, хотя вполне пригодны
125| и 55ре> однако исследований с этими элементами известно
немного [^трЫ АУ. е1 а1., 1977; Нал* 5., ЗсЬткН; ].у 1978].
Опубликованы результаты электронно-радиоавтографического
исследования с 355 [Уоип§ К., 1973]. Вследствие низкой
чувствительности электронно-микроскопической радиоавтографии
приходится применять предшественники с более высокой
удельной активностью и в больших дозах, чем в
светомикроскопической радиоавтографии. В исследованиях биосинтез
макромолекул, выполняемых с помощью электронно-микроскопической
274
радиоавтографии, дозы вводимых меченых предшественников
обычно в 10 — 40 раз выше, чем при использовании светомикро-
скопической радиоавтографии.
ФИКСАЦИЯ МАТЕРИАЛА И УДАЛЕНИЕ
НЕВКЛЮЧИВШЕГОСЯ НИЗКОМОЛЕКУЛЯРНОГО
ПРЕДШЕСТВЕННИКА
Фиксацию материала осуществляют так же, как для обычного
электронно-микроскопического исследования. Единственной ее
особенностью для электронно-микроскопической
радиоавтографии является требование провести эту операцию так, чтобы в
процессе фиксации и последующей обработки невключившийся
в макромолекулы предшественник был удален из ткани. Между
тем с применением предшественников с высокой удельной
активностью и в высоких дозах увеличивается опасность
неспецифического связывания предшественника, т.е. абсорбции его
структурами клетки и сохранения при фиксации, дегидратации
и заливке. В таком случае при анализе радиоавтографа участок
абсорбции, в котором низкомолекулярный предшественник
присутствует в мономерной форме, может быть ошибочно принят за
место синтеза макромолекулярного полимера.
В светомикроскопической радиоавтографии проблема
удаления невключившегося предшественника не столь остра, потому
что, во-первых, его применяют в меньших дозах, во-вторых,
предшественник можно удалять не только на стадии фиксации
материала, но также из депарафинированных срезов перед
заливкой эмульсией, обрабатывая их водой или 5 % раствором
трихлоруксусной кислоты. Обрабатывать таким же образом
электронно-микроскопические срезы, залитые в не растворимые
в воде эпоксидные смолы, не имеет смысла, поэтому усилия по
удалению предшественника должны быть сосредоточены на
этапе фиксации.
Для удаления предшественника перед фиксацией кусочки
промывают при 4 °С по 10 мин в 2 сменах питательной среды
или буфера, используемого для растворения глутарового
альдегида. Затем проводят обычную фиксацию глутаровым
альдегидом, а после нее кусочки отмывают при 4 °С в течение 1 сут не
менее чем в 5 сменах буфера с сахарозой.
Описанную манипуляцию не следует рассматривать как
прием, гарантирующий полное удаление невключившегося
предшественника. Степень неспецифического связывания
предшественника необходимо контролировать в каждом электронно-
радиоавтографическом исследовании независимо от методики
фиксации. С этой целью применяют несколько методов.
1. Фиксированные кусочки ткани могут быть подвергнуты
биохимическому анализу с определением радиоактивности
низкомолекулярной и макромолекулярной фракции. Сопоставле-
275
ние этих данных с результатами радиоавтографического
исследования позволяет определить степень абсорбции
предшественника.
2 Другой метод контроля — применение ингибиторов
синтеза макромолекул (актиномицин О, пуромицин и др.). При
введении достаточно высоких доз ингибиторов синтез
макромолекул должен значительно уменьшиться или вообще
отсутствовать, и наличие метки в таких препаратах отражает,
по-видимому, неспецифическое связывание предшественника.
3. Популярным способом контроля является обработка
материала ферментами, расщепляющими макромолекулы.
Специфическая метка при этом утрачивается, а абсорбция
предшественника сохраняется. Если условия эксперимента позволяют, то
лучше обрабатывать свежую ткань. В исследовании включения
3Н-уридина в РНК можно применять расщепление рибонуклеа-
зой кусочков размером менее 1 мм3 после фиксации глутаровым
альдегидом и отмывания буфером. После инкубации кусочков с
ферментом в концентрации 2 мг/мл при 37 °С в течение 5 ч
метка над срезами существенно не превышает фон, тогда как в
основном опыте (материал инкубируют в буферном растворе
без рибонуклеазы) отмечается явно выраженная концентрация
метки в ядрах.
4. Возможные погрешности методики, в том числе и
неспецифическое связывание, можно и нужно контролировать с
помощью параллельного исследования материала с применением
электронно-микроскопической и светомикроскопической
радиоавтографии. Способы обработки материала, используемые в
этих двух видах радиоавтографического анализа, различаются,
поэтому исследование двумя методами позволяет обнаружить
как абсорбцию предшественника, так и другие артефакты,
связанные с цитологической техникой. Для сравнения результатов
электронно-радиоавтографического исследования и
светомикроскопической радиоавтографии их следует выражать в
сопоставимой форме, т.е. без подробностей распределения зерен по
ультраструктурам. Если представленные в такой форме
результаты двух исследований не совпадают, то это служит признаком
погрешности, вносимой одним из методов. Параллельное
изучение образцов с помощью светомикроскопической
радиоавтографии позволяет также установить распространенность процесса в
органе и применить соответствующие гистохимические пробы.
НАНЕСЕНИЕ ЭМУЛЬСИИ
НА ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКИЕ СРЕЗЫ
С учетом условий получения максимального разрешения и
чувствительности электронно-микроскопической радиоавтографии
могут быть сформулированы требования к строению
эмульсионного слоя в препарате. Этот слой должен быть предельно тон-
276
ким, чтобы обеспечить максимальное разрешение, и не иметь
промежутков между кристаллами галогенида серебра,
поскольку при наличии промежутков снижаются и разрешение, и
чувствительность Больше всего указанным требованиям
соответствует так называемый монослой эмульсии, представляющий собой
один ряд кристаллов галогенида серебра, плотно уложенных
друг около друга. Создать идеальный монослой, лишенный
промежутков между кристаллами, в настоящее время не
удается, так как все эмульсии, кроме кристаллов, содержат желатин,
располагающийся в пространстве между кристаллами. Желатин
можно удалить из эмульсии, однако это сопряжено со
значительным ухудшением ее фотохимических свойств, поскольку
желатин не только является механическим разбавителем, но
также участвует в образовании скрытого изображения и
предотвращает проявление соприкасающихся кристаллов.
Создание монослоя и нанесение его на срезы считают одним
из наиболее трудных и ответственных моментов электронно-
микроскопической радиоавтографии. Предложено несколько
способов получения монослоя [Ко^егз А., 1973]. Выбор того
или иного из них определяется главным образом типом
эмульсии, а также опытом исследователя.
Для создания монослоя мелкозернистых (с диаметром
кристаллов менее 120 нм) эмульсий чаще используют различные
варианты способа, основанного на том, что разбавленная в
определенной степени эмульсия, растекаясь по большой плоской
поверхности, образует достаточно тонкие и однородные слои
[5а1ре1ег М., ВасЬтап Ь., 1965]. Предварительно для каждой
партии эмульсии подбирают нужное разведение. С этой целью
готовят несколько разведений расплавленной эмульсии в воде и
погружают в них предметные стекла, покрытые слоем
коллодия. После извлечения стекол из эмульсии и ее высыхания в
воде со стекла снимают пленку коллодия вместе с
образовавшимся фотослоем. Ориентировочно толщина фотослоя может
быть определена по цвету интерференции. Однако для
окончательного суждения о его толщине и структуре пленку коллодия
с непроявленной эмульсией помещают на сетки и
просматривают в электронном микроскопе. Таким путем выбирают
разведение эмульсии и зону предметного стекла, над которой
образуется оптимальный монослой Для приготовления
радиоавтографического препарата ультратонкие срезы помещают на покрытые
коллодием предметные стекла в ту зону, которая оказалась
наиболее подходящей. В темной комнате стекла погружают в
соответствующим образом разбавленную эмульсию. Данный метод
предусматривает не только точный выбор разведения эмульсии,
но и определенную скорость извлечения стекол из нее.
Препараты экспонируют и проявляют на предметных стеклах.
После проявления пленку коллодия со срезами снимают со
стекол и под срезы подводят сетки.
277
Сравнительно крупнозернистую эмульсию <^1Гогс1 Ь4» чаще
наносят на срезы в виде пленки, образующейся в проволочной
петле. Этот способ используют и для создания монослоя
эмульсии М [Саркисов Д.С. и др., 1975]. Эмульсию разводят водой
(см. главу 14) в соотношении 1:8—1:12. Концентрацию
подбирают по результатам просмотра контрольного непроявленного
слоя в микроскопе. Для того чтобы обеспечить устойчивость
пленки в петле, в эмульсию после фильтрования добавляют по
каплям смачивающее вещество 1019 или другое поверхностно-
активное вещество. Через 5—10 мин проверяют прочность
пленки.
Процесс нанесения эмульсии удается ускорить путем
применения не одной, а четырех проволочных петель. Петли после
извлечения из стаканчика с расплавленной эмульсией
развешивают на крючках до желатинизации и высыхания слоя. Важно,
чтобы пленка удерживалась в петле, пусть даже в высохшем и
сморщенном состоянии. Если такую пленку поместить на
темном фоне перед лабораторным фонарем на расстоянии около
1 м от него и повернуть так, чтобы свет фонаря падал на
плоскость пленки под острым углом, то на пленке можно увидеть
цвета интерференции. Осторожно подышав на сморщенную
пленку, можно ее полностью расправить и обнаружить в ней
зону красной интерференции. В этой зоне эмульсия М
представляет собой сравнительно однородный монослой. Петлю
следует опускать на закрепленную в пинцете сетку или бленду так,
чтобы срезы оказались покрытыми зоной красного цвета (при
верно подобранном разведении ширина такой зоны составляет
несколько миллиметров). От дыхания пленка эмульсии
увлажняется и прочно прилипает к поверхности срезов.
После нанесения эмульсии бленду или сетку закрепляют в
разрезанной продольно жесткой полиэтиленовой трубке
(диаметр 3 — 5 мм). Края разреза, стремящиеся в силу эластичности
сомкнуться, достаточно прочно удерживают 10—12 сеток, т.е.
среднее количество препаратов с двух блоков. В таких трубках
удобно проводить экспонирование и проявление препаратов.
Для экспонирования пригодны завинчивающиеся
пластмассовые контейнеры, остающиеся после использования меченных
тритием соединений. На дно контейнера насыпают
прокаленный силикате ль, в который, как в песок, погружают трубки с
блендами. После завинчивания крышки образуется герметичная
светонепроницаемая полость с небольшим содержанием влаги,
что обеспечивает хорошее сохранение скрытого изображения.
С целью увеличения чувствительности метода эмульсию
можно наносить с обеих сторон среза. Для этого ленточку
срезов помешают на бленду. Предварительно на нее наносят
пленку, приготовленную из 0,6 % раствора формвара в дихлорэтане.
Это обеспечивает механическую прочность пленки,
позволяющую сохранить ее целость при многочисленных манипуляциях,
278
связанных с электронно-радиоавтографической обработкой.
В то же время пленка формвара достаточно тонка и проницаема
для р-частиц. Кроме повышения чувствительности, как бы
побочным, но не менее важным результатом нанесения эмульсии с
двух сторон является увеличение точности метода, что
обусловлено использованием для двустороннего нанесения эмульсии
бленд, а не сеток. Бленды в свою очередь не только позволяют,
но, можно сказать, вынуждают исследовать серийные срезы,
поскольку разрозненные срезы на них нанести трудно. Эти
срезы на бленде полностью открыты для просмотра, никакая
часть их не загораживается переплетом, как это бывает при
использовании сеток. В таких условиях появляется возможность
сравнивать распределение зерен серебра в соседних срезах, что
обусловливает более высокую достоверность полученных
данных, чем основанных на просмотре единичных срезов [Сарки-
сов Д.С. и др., 1980].
ЭКСПОНИРОВАНИЕ И ПРОЯВЛЕНИЕ
ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКИХ РАДИОАВТОГРАФОВ
Экспозиция электронно-микроскопических радиоавтографов
зависит от многих условий: специфичности, дозы и удельной
активности предшественника; скорости синтеза макромолекул,
степени их сохранения при обработке, толщины срезов,
чувствительности эмульсии, условий экспозиции. В однотипных
экспериментах электронно-радиоавтографические препараты
экспонируют, как правило, гораздо дольше, чем светомикроскопи-
ческие. В большинстве случаев экспонирование продолжается
от нескольких недель до нескольких месяцев.
Наиболее важным условием экспонирования, влияющим на
чувствительность метода в целом, является содержание влаги и
кислорода в контейнерах с препаратами. Влажность и кислород
способствуют тому, что атомы восстановленного серебра в
центрах скрытого изображения вновь окисляются и таким образом
происходит регрессия скрытого изображения в кристаллах га-
логенида серебра. Этот процесс в электронно-микроскопической
радиоавтографии имеет гораздо большее значение, чем в свето-
микроскопической, в связи с большей продолжительностью
экспозиции и с тем, что в мелкозернистых эмульсиях регрессия
скрытого изображения происходит значительно быстрее. Для
сохранения скрытого изображения в коробки с хранящимися
препаратами помещают поглотители влаги: хлорид кальция, си-
ликагель, пятиокись фосфора. Для одновременного устранения
влаги и кислорода препараты экспонируют в герметичных
контейнерах, заполненных азотом, гелием, углекислым газом, или
в вакууме.
Проявлять электронно-радиоавтографические препараты
можно теми же проявителями, которые описаны в главе 14. В каче-
279
стве исходного режима молено рекомендовать экспозицию в
проявителе Д-19 или парафеиилендиаминовом в течение 2 мин.
В этих условиях первый обеспечивает гораздо большую
чувствительность, но довольно крупное зерно, порядка 0,3 мкм;
второй проявитель уменьшает размер зерен в 2 — 3 раза, но и
существенно уменьшает их количество. Путем подбора режима
можно изменить результаты проявления.
Кроме упомянутых проявителей, следует остановиться на
проявлении метолом и аскорбиновой кислотой после латенси-
фикации (повышения чувствительности) скрытого изображения
тиоцианатом золота. Оно обеспечивает сочетание очень мелкого
зерна (примерно такого же, как кристалл галогенида серебра) с
чувствительностью, превышающей ту, которую обеспечивает
проявитель Д-19 [Корп\уа В., 1975]. Используемые в этом
способе проявления растворы готовят на кипяченой и охлажденной
перед растворением дистиллированной воде. Для латенсифика-
ции готовят 2 % запасной раствор трихлорида золота, который
можно длительно хранить в пластиковой бутылке в
холодильнике. Перед использованием 1 мл этого раствора разбавляют
100 мл воды, доводят рН до 7,0 добавлением по каплям 0,5 и.
раствора гидроксида натрия; затем растворяют 0,25 г тиоциана-
та калия и 0,3 г бромида калия, объем раствора доводят водой
до 500 мл. Для приготовления проявителя в 150 мл воды
последовательно растворяют 0,45 г метола, 1,5 г аскорбиновой
кислоты, 2,5 г тетрабората натрия, 0,5 г бромида калия, 7,5 г
сульфита натрия; объем раствора доводят водой до 500 мл. Латенсифи-
кацию и проявление осуществляют при 20 °С по следующей
схеме: латенсификация раствором тиоцианата золота — 5 мин,
промывание, проявление — 4 мин, закрепление тиосульфатом
натрия — 1 мин, промывание в 3 сменах воды по 30 с.
Закрепление препаратов лучше проводить 20 — 25 %
раствором тиосульфата натрия без каких-либо ускоряющих или
дубящих фотослой добавок. После закрепления, в процессе
которого удаляются кристаллы галогенида серебра, в фотослое
остаются зерна восстановленного серебра и желатин. В светомикро-
скопической радиоавтографии желатиновый слой, хотя и более
толстый, незаметен и совершенно не мешает окраске и
наблюдению радиоавтографов. В электронно-микроскопической
радиоавтографии остающийся слой желатина часто снижает
контрастность изображений, затрудняет просмотр и фотографирование
препаратов. Если срезы контрастируют после проявления
фотослоя, то желатин, как и прочие белки, связывает соли
тяжелых металлов, темнеет и становится заметным препятствием для
электронного пучка. По нашему мнению, лучший способ
преодолеть эту трудность — контрастирование срезов до нанесения
фотослоя. В этом случае желатин, будучи неконтрастирован-
ным, более проницаем для электронного пучка и почти
незаметен при исследовании радиоавтографов в электронном микро-
280
сколе Контрастирование перед нанесением эмульсии имеет еще
одно достоинство. При насыщении среза солями тяжелых
металлов повышается плотность материала и вследствие этого
уменьшается пробег (3-частиц и соответственно повышается
разрешение [5а1ре1;ег М. еЬ а1., 1977]. Если по каким-либо
причинам контрастирование радиоавтографов проводят после
проявления, то для повышения качества
электронно-микроскопических изображений желатин приходится удалять, например,
ну чем обработки 0,05 % раствором проназы в течение 1 ч при
37 °С. С этой же целью применяют обработку 0,2 % раствором
пепсина или трипсина 0,05 — 0,2 н. раствором гидроксида
натрия, 0,1—0,2 н раствором уксусной кислоты, электронным
пучком в микроскопе Свойства желатина нестандартны, они
могут различаться в эмульсиях разных изготовителей и даже в
отдельных партиях одной и той же эмульсии. Иногда для
удаления желатина вообще не требуется каких то специальных
усилий* он растворяется щелочными растворами при
контрастировании. Каким бы способом ни проводили удаление желатина,
следует иметь в виду, что это всегда опасная процедура,
которая может привести к смещению и даже полному удалению
зерен серебра.
КОЛИЧЕСТВЕННЫЙ АНАЛИЗ РЕЗУЛЬТАТОВ
ЭЛЕКТРОННО-РАДИОАВТОГРАФИЧЕСКОГО ИССЛЕДОВАНИЯ
Один из пионеров электронно-микроскопической
радиоавтографии Р ОгапЬои1ап (1963) считал ее пригодной только для
определения качественных особенностей материала. Однако с тех
пор метод был значительно усовершенствован и
стандартизован, что повысило воспроизводимость результатов. Еще
большее значение для внедрения метода в область количественных
исследований имело установление причин и объяснение
некоторых ошибок, возникающих при трактовке
электронно-микроскопических радиоавтографов. В 60 —70-х годах проведено
большое количество работ, посвященных количественному
анализу результатов электронно-радиоавтографического
исследования. Детальное изложение достаточно разработанных
приемов такого анализа с учетом разрешения метода [ДУПНатз М.,
1977] слишком объемно, поэтому ограничимся лишь
замечаниями о технических требованиях к препаратам, используемым для
количественного анализа.
Главным источником ошибок, несомненно, является
зависимость плотности зерен серебра электронно-микроскопического
радиоавтографа от толщины среза. При одинаковой
концентрации радиоактивного вещества в ткани более интенсивный
автограф выявляется над более толстым срезом, т.е различия в
толщине срезов обусловливают ошибку при определении
относительной концентрации исследуемого вещества.
281
Таким образом, точность определения концентрации
радиоактивного вещества в электронно-микроскопической
радиоавтографии пропорциональна точности определения толщины среза.
Обычно толщину электронно-микроскопических срезов
устанавливают по цвету их интерференции. Однако одинаковые «на
глаз» срезы могут различаться по толщине. В специальном
исследовании было установлено, что такое определение вносит
ошибку порядка 10—15 %. При увеличении количества
наблюдений в опыте и контроле величина этой основной ошибки
электронно-микроскопической радиоавтографии снижается.
В светомикроскопическом радиоавтографе глубина
расположения структуры в срезе оказывает выраженное влияние на
плотность метки над ней. В электронно-микроскопической
радиоавтографии ошибки, связанной с различной глубиной
расположения структур в срезе, по существу нет: все структуры,
которые видны в ультратонком срезе, образуют автограф
(конечно, если они содержат радиоактивное вещество). Ошибка,
связанная с различной плотностью структур в
электронно-микроскопической радиоавтографии, также значительно меньше. Эта
ошибка возрастает с увеличением длины пробега р-частиц в
структурах, различающихся по плотности. В ультратонком
срезе пробег короткий и влияние разной плотности структур
невелико, что является преимуществом этого метода, позволяющим
более точно, чем в светомикроскопической радиоавтографии,
определять пути и скорости перемещения радиоактивных
веществ из одних структур в другие.
Важным преимуществом количественной
электронно-микроскопической радиоавтографии по сравнению со
светомикроскопической является то, что при большой глубине резкости
электронного микроскопа одновременно хорошо виден срез и все
зерна автографа, поэтому при аккуратном подсчете невозможно
пропустить или дважды учесть одно и то же зерно. В
светомикроскопической радиоавтографии такие ошибки вполне
вероятны, так как зерна, составляющие автограф, лежат в разных
плоскостях и не могут быть хорошо видны одновременно.
В 1969 г. Р. РШпеу описал способ, позволяющий
осуществлять абсолютные количественные измерения радиоактивности
с помощью электронно-микроскопической радиоавтографии.
Способ заключается в том, что в полимеризованном электронно-
микроскопическом блоке делают разрез, проникающий в
кусочек ткани на некоторую глубину. В разрез вносят каплю среды,
использованной для заливки, но содержащей известное
количество трития. После вторичной полимеризации блок режут, как
обычно. В приготовленных из такого блока срезах находится
внутренний эталон точно такой же толщины, как и остальной
срез. Сравнение автографа над тканью с автографом над
эталоном позволяет, по мнению автора, определять абсолютный
уровень радиоактивности ткани. По нашему мнению, абсолютные
282
данные, полученные таким способом, требуют поправки, так
как содержащиеся в срезе атомы тяжелых металлов могут
снизить «выход» зерен над тканью вследствие торможения р-час-
тиц. Однако несомненно, что такой «внутренний контроль»
позволяет проводить весьма точные относительные измерения
радиоактивности. Конечно, описанный способ может быть
применен для точных количественных исследований с помощью све-
томикроскопической радиоавтографии на полутонких срезах.
Для вычисления абсолютной радиоактивности нужно знать
чувствительность метода и толщину среза. Первая может быть
установлена путем определения плотности зерен над срезом
эпоксидной смолы по описанному выше способу. Сопоставив
количество зерен с количеством р-распадов, произошедших в
срезе за время экспозиции, устанавливают чувствительность
для среза смолы. Чувствительность для среза ткани несколько
ниже из-за торможения (3-частиц атомами тяжелых металлов.
По данным М. 5а1ре1ег (1973), «потеря» чувствительности в
биологических препаратах, залитых в эпон, составляет около
7 %. Толщину срезов определяют в интерференционном
микроскопе отраженного света (срезы расположены на предметном
стекле) или проходящего света (срезы расположены на сетке
или бленде). Определив чувствительность метода и толщину
среза, вычисляют абсолютную радиоактивность структуры по
следующей схеме. Допустим, над структурой, занимающей
площадь 400 мкм2, обнаружено 80 зерен серебра, чувствительность
метода оказалась равной 1/10 (10 распадов на одно зерно). В
80 х 10 ~ Л ,
таком случае плотность распадов = I распада на 1 мкм2;
при толщине среза 100 нм это составляет 20 распадов на 1 мкм3
структуры за все время экспозиции или, если экспозиция
продолжалась 30 дней, 7716 распадов на 1 см3 структуры в 1 с, т.е.
0,21 мкКи/см3.
Завершая описание методики электронно-микроскопической
радиоавтографии, следует отметить, что эти исследования (в
особенности количественные) чрезвычайно трудоемки. В связи
с этим их, как правило, не применяют и не должны применять
на «пустом месте», т.е. в ситуациях, когда нет предварительных
данных, касающихся изучаемого вопроса. Наиболее
целесообразно предпринимать электронно-радиоавтографические
эксперименты в тех случаях, когда методами обычной морфологии,
электронной микроскопии, светомикроскопической
радиоавтографии, биохимии произведена соответствующая «разведка» и
наметились узловые пункты, где необходимо и возможно
применение уникальных особенностей
электронно-микроскопической радиоавтографии.
ГЛАВА 16
ПРИНЦИПЫ ЦИТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ,
СПОСОБЫ ПОЛУЧЕНИЯ МАТЕРИАЛА И ТЕХНИКА
ПРИГОТОВЛЕНИЯ ЦИТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
Клиническая цитология основана на изучении и оценке
клеточного материала, полученного различными способами из
патологического очага. Привлекает простота цитологического
исследования, его быстрота и возможность легко повторить. Последнее
позволяет применять цитологический анализ для изучения
динамики морфологических изменений, в том числе в процессе
лечения, а также использовать метод как в условиях
поликлиники, так и для проведения профилактических осмотров.
Известно, что цитологическая картина отражает
гистологическое строение ткани и гистологические критерии во многом
подходят для оценки цитологических препаратов. При этом для
описания результатов цитологического исследования
используют диагностические, а не количественные термины.
Ранее клиническая цитология была преимущественно эксфо-
лиативпой. проводили исследование жидкостей (экссудаты,
промывание воды), выделений (мокрота, моча), мазков с шейки
матки и поверхности опухоли. В настоящее время преобладает
пункционная цитология. Материал получают в основном
посредством пункции опухолевых образований тонкой иглой,
пункции под контролем ультразвукового и рентгенологического
исследования, компьютерной томографии. Значительную долю
составляют исследования мазков с кусочков, полученных при
трепанобиопсии, мазков-отпечатков операционного и биопсий-
ного материала, мазков щеточкой и соскобов, взятых при
эндоскопических исследованиях.
Основным диагностическим направлением в клинической
цитологии является онкоцитология. В процессе
дифференциальной диагностики определяют характер патологического
процесса и выявляют воспалительные, реактивные, пролиферативные
или предраковые поражения, а также доброкачественные
опухоли.
Выбор способа взятия материала определяется характером
поражения, его локализацией, возможностью проведения
инструментальных исследований. Желательно исполь'зовать весь
комплекс доступных методов взятия материала. Так, при
поражениях мочевого пузыря может быть проведено цитологическое
исследование нативной мочи (эффективность цитологической
284
диагностики 40 — 45 %), спиртового смыва (60 — 65 %), мазков-
отпечатков с кусочков опухоли, полученных при цистоскопии
(около 90 %). При комплексном обследовании эффективность
цитологической диагностики около 100 %.
Развитие эндоскопической техники и ультразвуковых
методов исследования в немалой степени способствовало широкому
внедрению цитологического анализа в диагностику
новообразований практически всех тканей организма, в том числе
недоступных ранее внеоперационпому морфологическому анализу.
При распознавании так называемых ранних раков
цитологический метод нередко имеет преимущества перед другими
способами исследования.
Опыт показывает, что цитологическое исследование
позволяет с достаточно высокой степенью достоверности не только
констатировать наличие злокачественного новообразования, но
также в большинстве случаев определить гистогенез и степень
дифферепцировки опухоли. Последнее важно для клиники, так
как известно, что чувствительность к различным химиотерапев-
тическим и лучевым воздействиям во многом определяется
степенью дифференцировки новообразования. Кроме того,
уровень дифферепцировки опухоли может быть использован в
качестве важного прогностического показателя.
Материал для цитологического исследования (моча,
содержимое кист, промывные воды, экссудат, мокрота и т.п.)
доставляются в лабораторию в ближайшее время после получения.
Мазки, высушенные на воздухе, можно хранить. Флаконы с
материалом и мазки должны быть маркированы (указана
фамилия больного).
В сопровождающем материал направлении указывают:
фамилию, имя и отчество, пол и возраст больного; каким образом
и откуда получен материал, в каком виде направляется
(жидкость, мазки), количество; краткий анамнез, в который
обязательно должны быть включены сведения о вредных
воздействиях предшествующего лечения (особенно гормональной, лучевой
терапии и химиотерапии), результаты других исследований
(рентгенологического, эндоскопического и др.), при
подозрении на системные заболевания (гемобластозы) — анализа
крови; клинический диагноз.
В эксфолиативной цитологии исследованию подвергают
отделяемое различных органов (молочная железа, бронхи и др.).
Для приготовления препарата каплю отделяемого наносят на
предметное стекло и готовят мазок. Можно также сделать
отпечатки с того места, откуда идут выделения (сосок молочной
железы, выходное отверстие свища). Отделяемое бронхов, обычно
в виде мокроты, собирают в сосуд.
Жидкости и содержимое кист получают путем пункции
полостей (брюшной, плевральной и др.) и кист. Если материала
мало, то его наносят на стекла и распределяют в виде тонкого
285
мазка. В случае получения значительного количества жидкости
ее предварительно центрифугируют, а затем готовят мазки из
осадка. Таким же образом обрабатывают промывные воды.
Отпечатки со слизистых оболочек и кожи, если они
доступны, можно сделать непосредственно на стекло. В других
случаях мазки готовят из соскобов шпателем, с тампонов.
Пункцию опухолевых образований производят, как правило,
тонкой иглой. Для получения полноценного материала
необходимо соблюдать определенные условия. В частности, игла и
шприц для пункции должны быть сухими. Не следует
проводить предварительную местную анестезию. Для пункции богато
васкуляризированных образований (щитовидная железа,
сосудистые опухоли и др.) необходимо использовать иглу с мандре-
ном. Его извлекают после введения иглы в то место, из
которого предполагают получить материал. Таким же образом,
используя специальные приспособления, осуществляют пункции
под рентгенологическим и ультразвуковым контролем или
контролем компьютерной томографии.
В современных эндоскопических приборах имеются
специальные приспособления, позволяющие получить материал для
морфологического исследования. При эндоскопии могут быть
получены, в частности, мазки щеточкой, промывные воды,
мазки тампоном, мазки-отпечатки щипковых биопсий.
Использование для цитологического исследования мазков-
отпечатков с биопсийного и операционного материала
значительно повышает эффективность цитологической диагностики.
Кроме того, заключение по мазкам-отпечаткам может быть
получено значительно раньше, чем гистологическое. Следует
отметить исключительную ценность параллельных
цитологических и гистологических исследований, что позволяет проводить
цитогистологические сопоставления.
Для приготовления препарата соскоб со среза биоптата или
операционного материала распределяют тонким мазком на
стекле. Отпечатки со среза биоптата или кусочка удаленной во
время операции ткани наносят прикосновением поверхности
среза к стеклу. Если отпечатки делают с ткани, богатой кровью
(печень, селезенка и др.), то необходимо удалить кровь с
поверхности среза фильтровальной бумагой и лишь затем
производить отпечатки.
ТЕХНИКА ПРИГОТОВЛЕНИЯ ЦИТОЛОГИЧЕСКИХ
ПРЕПАРАТОВ
Предметные стекла для цитологических препаратов готовят так
же, как для гистологических препаратов (см. главу 4).
Для обеспечения надежной маркировки стекол используют
механический и химический способы «матирования» края
поверхности стекла. Механический способ основан на обработке
286
предметного стекла абразивным камнем на станке. При
использовании второго способа в пластмассовый сосуд вместимостью
около 300 мл помещают 50 г фторида аммония и 50 мл
концентрированной соляной кислоты. Смесь тщательно перемешивают
до кашицеобразной консистенции (в вытяжном шкафу). Высота
слоя смеси в сосуде не должна превышать 1,5 см. Чистые
предметные стекла устанавливают вдоль стенок сосуда таким
образом, чтобы один конец стекла был погружен в смесь. В сосуде
последовательно размещают 20 — 25 предметных стекол. Через
1 мин стекла переносят на 10—15 мин в пластмассовое ведро с
большим количеством воды. Затем воду сливают и стекла
обрабатывают слабым раствором серной кислоты (5 мл
концентрированной кислоты на 8—10 л воды) для их обезжиривания.
После этого стекла тщательно промывают водой и просушивают
(можно с помощью вентилятора). Всю работу по подготовке
предметных стекол выполняют в резиновых перчатках. Смесь
фторида аммония и концентрированной соляной кислоты
можно использовать многократно, добавляя небольшое
количество кислоты. Маркировать стекла можно также, подписывая
один край стекла тушью.
Фиксация материала
Как правило, фиксируют высушенные мазки. Лучшим
фиксатором для цитологических препаратов является метанол.
Фиксацию в нем проводят в течение 3—10 мин. Кроме того, для
фиксации может быть использован 100 % этиловый спирт.
Продолжительность фиксации в нем 10 — 30 мин. В качестве фиксатора
можно использовать смесь Никифорова, продолжительность
фиксации в ней от 15 мин до 1 — 2 ч.
Приготовление мазков
Возможности диагностики не всегда определяются количеством
полученного материала: иногда очень небольшого количества
материала достаточно для установления диагноза. Часто
помехой для цитологического исследования является большое
количество крови. В этих случаях мазки необходимо готовить как
можно быстрее, так как из-за наступающего свертывания крови
исследование затрудняется. Материал наносят на предметное
стекло и аккуратно делают мазки, так как клетки очень
ранимы, а наличие большого количества разрушенных клеток
затрудняет диагностику.
Из жидких пунктатов мазки готовят подобно мазкам крови.
Если получена плотная или комковатая масса, то, помимо
мазков, можно приготовить отпечатки на стекле. Метод отпечатков
имеет определенные преимущества. Во-первых, клетки
значительно меньше деформируются; во-вторых, есть возможность
287
расположить клетки пластами, что помогает оценить
соотношение клеток. Если материал содержит много крови, то его
вначале наносят на стекло, а затем выбирают беленькие крупинки и
ими делают мазки.
Во время операции или биопсии цитологический метод
может быть использован как самостоятельно, так и параллельно
с гистологическим исследованием. В этих случаях получают
отпечатки с удаленных или обнаженных органов, прикасаясь
предметным стеклом к исследуемой ткани. Так же можно
готовить препараты при получении материала методом соскоба.
Жидкости, полученные при пункции, сразу же
центрифугируют, а из осадка готовят мазки, которые подвергают
цитологическому исследованию.
Методика получения материала
из шейки матки с помощью поролоновых кубиков
С этой целью применяют кубики из поролона-пенополиуретана,
предназначенные для одноразового использования.
Относительно большой кусок поролона моют горячей водой с мылом,
тщательно промывают 5 — 6 раз и просушивают на воздухе. Затем
ножницами вырезают кубики размерами 0,4x0,4 см, помещают
их в чистую стеклянную банку с притертой пробкой
(вместимость 0,5 - 1 л) или чашки Петри; стерилизуют в сухожаровом
шкафу при 180 °С в течение 1 ч.
Во время профилактического осмотра для получения
материала у одной обследуемой необходимо 2 кубика. (Материал
получают в самом начале гинекологического осмотра до любых
других манипуляций ) Первый кубик захватывают корнцангом
и берут материал из влагалищной части канала шейки матки —
производят энергичное круговое движение шариком.
Полученный при этом материал продольным движением
переносят на чистое обезжиренное предметное стекло.
Благодаря низкой дегидратационной способности и структуре поролона
он не впитывает материал и большая его часть переносится на
предметное стекло.
Второй кубик захватывают тем же корнцангом и получают
материал из внутренней части канала шейки матки, погружая
кубик на максимально возможную без травмы глубину.
Материал круговым движением переносят на то же или другое
предметное стекло. Наиболее рационально размещать материал
влагалищной и внутренней частей канала шейки матки на одном
предметном стекле.
ГЛАВА 17
ОСНОВНЫЕ МЕТОДЫ ОКРАШИВАНИЯ
ЦИТОЛОГИЧЕСКИХ ПРЕПАРАТОВ
С целью окрашивания цитологических препаратов наиболее
часто применяют красители, используемые для
гематологических исследований, в частности краски Романовского —Гимзы,
Лейшмана, Мая —Грюнвальда.
Качество окрашивания зависит от вида и состава
красителя — его концентрации, которая не всегда определяет
красящую способность; продолжительности окрашивания; времени
изготовления препарата (большинство препаратов, от момента
приготовления которых до окрашивания прошло от 6 ч до
нескольких дней, утрачивают мелкие структурные детали); рН
среды; температуры воздуха в процессе окрашивания, что
связано с испарением красящего раствора.
ОКРАСКА ПО ГИМЗЕ И ЕЕ МОДИФИКАЦИИ
Стандартный раствор Гимзы:
азур I 3,772 г
эозин 2,165 г
метиленовый синий 1,563 г
метиловый спирт 750 мл
глицерин 256 мл
Методика окраски
Препарат, полученный б ч — 2 — 3 дня назад, фиксируют 3 мин
в метиловом спирте и переносят на 30 мин в красящую
жидкость, состоящую из 5 мл стандартного раствора Гимзы и 20 мл
дистиллированной воды (рН 6,8 — 7,2). После этого
ополаскивают водопроводной водой и высушивают на воздухе.
Окраска по Романовскому—Гимзе
Сухие мазки фиксируют в метиловом спирте (5 мин) или смеси
Никифорова (15 мин). Затем погружают в рабочий раствор
(разведение 1:4) готового красителя Романовского — Гимзы на
5 — 7 мин, после чего промывают дистиллированной водой и
высушивают.
289
Окраска по Паппенгейму
Предварительная фиксация мазков не требуется. На подсохшие
на воздухе мазки наливают краску-фиксатор Мая — Грюнвальда
на 3 мин. Не сливая краску, к ней добавляют такое же
количество дистиллированной воды. Через 1 мин краску с мазка
сливают и, не ополаскивая его, наливают профильтрованный
рабочий раствор (разведение 1:4) готовой краски Романовского —
Гимзы (при рН 6,8) на 5 мин. После окрашивания препараты
промывают дистиллированной водой и высушивают на воздухе,
устанавливая вертикально в специальной сушке.
Для приготовления краски-фиксатора Мая — Грюнвальда
250 мг порошка Мая —Грюнвальда растворяют в 100 мл
метилового спирта. Раствор подогревают при 70 °С на водяной бане до
полного растворения порошка, фильтруют и хранят в бутылке с
притертой пробкой.
Модификация метода Паппенгейма
Готовят 0,3 % раствор красителя Мая —Грюнвальда (300 мг
порошка красителя растворяют в 100 мл метилового спирта; раствор
созревает 3 дня); раствор азура II (1 г растворяют в 1000 мл
кипящей воды); раствор эозина калия или натрия (1 г эозина калия
или 0,5 г эозина натрия растворяют в 1000 мл кипящей воды).
Методика окраски
1. Высушенные мазки фиксируют в метиловом спирте 3 мин.
2. Окрашивают 0,3 % раствором Мая —Грюнвальда, на 1
часть которого добавлено 4 части фосфатного буфера (рН 6,8 —
7,2) 10 мин.
3. Докрашивают азур-эозином (1 часть раствора азура + 1
часть раствора эозина + 5 частей фосфатного буфера при рН
6,8-7,2) 20 мин.
4. Смывают краситель проточной водой.
5. Высушивают мазки на воздухе.
ОКРАСКА МАЗКОВ ПО ЛЕЙШМАНУ
Готовят краску Лейшмана (2,5 г сухого красителя на 1 л
метилового спирта; краситель созревает 3 — 4 дня); азур (1 г сухого
красителя азур на 1 л дистиллированной воды, краситель
созревает 3 — 4 нед); эозин (1 г сухого красителя эозин на 1 л
дистиллированной воды; краситель созревает 3 — 4 нед).
Методика окраски
1. Высушенный на воздухе мазок переносят на 3 мин в
краситель Лейшмана.
290
2. Промывают в водопроводной воде.
3. Удаляют (стряхивают) избыток воды и заливают
красителем, в состав которого входят 40 мл азура, 30 мл эозина и 70 мл
дистиллированной воды. Краситель готовят перед работой.
Мазки окрашивают 30 — 40 мин.
4. Промывают водопроводной водой.
5. Высушивают на воздухе или промокают фильтровальной
бумагой.
СРОЧНАЯ ОКРАСКА ПО АЛЕКСЕЕВУ
1. Тонкие мазки фиксируют в подогретом до 35 — 40 °С
растворе Мая —Грюнвальда 30 с.
2. Ополаскивают в воде.
3. Окрашивают в 0,1 % растворе азур-эозина (2:1) 2 мин.
4. Ополаскивают в воде.
5. Высушивают, промокая.
ОКРАСКА ПО ПАПАНИКОЛАУ И ЕЕ МОДИФИКАЦИИ
1. Влажный препарат фиксируют в смеси Никифорова в
течение 30 мин. Если после фиксации его залить глицерином на
2 ч, то потом препарат можно хранить до 14 дней.
2. Перед окрашиванием препарат проводят через спирты
нисходящей концентрации (100 %, 95 %, 80 %, 50 %) и
дистиллированную воду (в каждом стаканчике держат по 2 мин).
3. Окрашивают гематоксилином в течение 10 мин (перед
использованием раствор красителя необходимо фильтровать).
4. Промывают в 3 сменах дистиллированной воды.
5. Переносят в смесь из 97 мл 70 % спирта и 3 мл
концентрированного раствора аммиака (препарат становится синим). В
этой смеси препарат необходимо ополоснуть несколько раз.
6. Опускают в 70 % спирт и затем промывают в проточной
воде.
7. Опускают в раствор карбоната лития на 1 мин (3 капли
насыщенного водного раствора на 100 мл дистиллированной
воды).
8. Промывают в проточной воде 5 мин.
9. Обезвоживают (дистиллированная вода и спирты
восходящей концентрации - 50 %, 70 %, 80 %, 100 %).
10. Докрашивают в течение 4 мин в оранжевом Г (готовый
раствор).
И. Ополаскивают в 2 сменах 95 % спирта.
12. Опускают в краситель Папаниколау на 1 —2 мин.
13. Ополаскивают в 3 сменах 95 % и 2 сменах 100 % спирта
(в последней смене держат 5 мин).
14. Просветляют в ксилоле, заключают в бальзам.
291
Приготовление красителей. Раствор I: 1 г
кристаллического гематоксилина растворяют в 10 мл 100 % спирта.
Раствор II: 20 г алюмокалиевых квасцов при
нагревании растворить в 200 мл дистиллированной воды.
Через 24 ч растворы I и II смешивают и добавляют 0,5 г
оксида ртути (красного), нагревают до кипения и охлаждают на
водяной бане. Через 24 ч отфильтрованный раствор может быть
использован. Каждый раз перед применением его следует
фильтровать.
Краситель Папаниколау. Смешивают 45 мл 1,5 %
раствора светлого зеленого (лихтгрюн) в 95 % спирте, 10 мл 0,5 %
раствора основного коричневого (бисмаркбраун) в 95 % спирте,
45 мл 0,5 % раствора эозина в 85 % спирте, 0,2 г фосфорно-молиб-
деновой кислоты и добавляют 1 каплю насыщенного водного
раствора карбоната лития (1 г на 100 мл дистиллированной воды).
Отечественными цитологами предложена модификация
метода, в которой светлый зеленый заменен на более доступный
бриллиантовый зеленый.
Окраска по Папаниколау в модификации Куницы
I. Оранжевый Г: смешивают раствор 0,5 г оранжа О на 100 мл
96 % спирта и 0,015 г фосфорно-молибденовой кислоты.
Полученный раствор оставляют на 1 сут, после чего он годен для
использования.
С целью приготовления промежуточного красителя и
бриллиантового зеленого необходимо за 1 сут приготовить
следующие водные растворы:
1) основного коричневого — 0,1 г на 1 л дистиллированной
воды;
2) эозина (желтоватый или обычный) — 0,1 г на 1 мл
дистиллированной воды;
3) бриллиантового зеленого — 0,05 г на 1 мл
дистиллированной воды +1 мл 96 % спирта. Эти растворы необходимо плотно
закрыть на 1 сут в термостате при 37 °С. Далее на них готовят
спиртовые растворы красителей.
II. Промежуточные красители: основной коричневый — 1 мл
водного раствора на 200 мл 96 % спирта (если эозин
обычный — 1 мл водного раствора на 260 мл 96 % спирта).
Для получения промежуточного красителя, представляющего
собой смесь, берут следующие количества вещества для 100 мл
смеси: 16 мл спиртового раствора основного коричневого, 84 мл
спиртового раствора эозина (желтоватого или обычного), 0,17 г
фосфорно-молибденовой кислоты и добавляют 1 каплю
насыщенного раствора карбоната лития. Красители фильтруют перед
смешиванием, остаток хранят непрофильтрованным.
III. Бриллиантовый зеленый — 0,5 мл водно-спиртового
раствора на 180 мл 96 % спирта.
292
Методика окраски
1. Препарат фиксируют в смеси Никифорова (минимальная
продолжительность фиксации 30 мин).
2. Промывают в 96 % спирте, а затем в дистиллированной
воде.
3. Окрашивают гематоксилином 2 — 3 мин, промывают в
воде.
4. Дифференцируют 0,5 % раствором соляной кислоты до
покраснения в течение 2 — 3 мин, сливают, промывают в воде.
Контролируют под микроскопом окраску ядер.
5. Опускают на 1 мин в слабый раствор карбоната лития
(3 капли насыщенного водного раствора лития на 100 мл
дистиллированной воды), промывают в воде.
6. Тщательно обезвоживают мазок 96 % спиртом.
7. Окрашивают оранжем О в течение 1 мин, наливая
краситель на стекло. Сливают краситель и хорошо промывают
спиртом до удаления его избытка.
8. Красят промежуточным красителем 1 мин, сливают,
промывают в спирте.
9. Окрашивают бриллиантовым зеленым 1 — 2 мин, сливают,
промывают спиртом, промокают.
10. Проводят через ксилол, заключают в бальзам.
Окраска по Папаниколау в модификации Руденко
Вначале готовят водные растворы цитоплазматических красок:
по 0,1 г светлого зеленого, эозина желтоватого
водорастворимого и основного коричневого растворяют отдельно в 1 мл воды.
Водные растворы, хорошо закрыв, оставляют на 1 сут в
термостате при 37 °С. Затем из водных растворов готовят спиртовые
растворы красителей:
1) светлый зеленый — 1 мл водного раствора на 200 мл 96 %
спирта;
2) эозин желтоватый водорастворимый — 1 мл водного
раствора на 200 мл 96 % спирта;
3) основной коричневый — 0,25 мл водного раствора на 200 мл
96 % спирта.
После этого готовят смесь, которую Г. Папаниколау назвал
ЕА-36. Она состоит из смеси спиртовых растворов красителей:
200 мл светлого зеленого, 168 мл эозина желтоватого и 32 мл
основного коричневого, которые перед смешиванием
фильтруют. К смеси добавляют 0,68 — 0,8 г фосфорно-молибденовой
кислоты и 4 капли насыщенного водного раствора
карбоната лития. В растворе красителя образуется небольшое
количество устойчивого осадка, не мешающего работе. Полной
готовности краска достигает через 3—12 дней при комнатной
температуре.
293
Для приготовления оранжа О 0,5 г сухого вещества
растворяют в 100 мл 96 % спирта и добавляют 0,02 — 0,05 г фосфорно-
молибденовой кислоты. Полученный насыщенный раствор
готов к применению на следующий день. После того как
использован весь раствор красителя, в эту же посуду с осадком можно
добавить 100 мл 96 % спирта и указанное количество фосфорно-
молибденовой кислоты. Оставшиеся количества спиртовых
растворов эозина желтоватого и основного коричневого хранят и
используют для приготовления красителя 3 — 6 мес.
Методика окраска
1. Мазки фиксируют в жидкости Никифорова 30 мин.
2. Промывают 96 % спиртом 1 мин.
3. Промывают в дистиллированной воде 2 — 3 мин.
4. Окрашивают в растворе гематоксилина 3 — 8 мин.
5. Ополаскивают в проточной воде 3 — 5 мин.
6. Проводят через 0,5 % раствор соляной кислоты 1 мин.
7. Промывают 2 — 3 мин в дистиллированной воде и 3 —
5 мин — в проточной, контролируя процесс под микроскопом.
8. Переносят в 0,1 % раствор карбоната лития 1 мин.
9. Ополаскивают в дистиллированной воде и 96 % спирте.
10. Переносят в 100 % спирт 1 мин.
11. Окрашивают в растворе оранж О 1 — 3 мин.
12. Проводят через 96 % спирт в течение 2 мин, контролируя
процесс под микроскопом.
13. Окрашивают в светлом зеленом (смесь ЕА-36) 2 — 5 мин.
14. Проводят через 96 % спирт 1 — 3 мин.
15. Промокают фильтровальной бумагой, проводят через
ксилол и заключают в бальзам.
ВАРИАНТ ОКРАСКИ ГЕМАТОКСИЛИНОМ
И ЭОЗИНОМ ДЛЯ МАЗКОВ
Для приготовления красителя 50 г алюмокалиевых квасцов
растворяют в 500 мл дистиллированной воды, доводят до кипения
и высыпают в горячий раствор 1 г гематоксилина. Затем
добавляют 500 мл дистиллированной воды и доводят до кипения (но
не кипятят). Раствор остужают до комнатной температуры и
добавляют йодат калия. Горло сосуда завязывают марлей и
оставляют созревать на свету 5 нед. Затем сосуд с красителем
закупоривают и убирают в темное место. Перед использованием
краситель фильтруют.
Методика окраски
1. Мазки фиксируют в смеси равных частей эфира и 96 %
спирта или в 96 % спирте 7—10 мин.
2. Окрашивают в гематоксилине 5 мин.
294
3. Промывают в проточной воде 1 — 2 мин.
4. Окрашивают в 0,3 % спиртовом растворе желтоватого
эозина 1 мин.
5. Промывают в проточной воде 1 — 2 мин.
6. Высушивают.
НЕКОТОРЫЕ ГИСТОХИМИЧЕСКИЕ МЕТОДЫ,
ПРИМЕНЯЕМЫЕ В ЦИТОЛОГИЧЕСКИХ ИССЛЕДОВАНИЯХ
Гистохимические методы с успехом используют в
цитологических исследованиях. Реактивы и их приготовление
соответствуют приведенным в главе 6 настоящего руководства. Небольшие
отличия имеются в проведении самих реакций.
Выявление гемосидерина по Перлсу
1. Препарат обесцвечивают метанолом или солянокислым
спиртом.
2. Ополаскивают в дистиллированной воде.
3. Заливают 1 н. соляной кислотой на 30 мин.
4. Добавляют в кислоту равное количество 2 % раствора гек-
сацианоферрата тригидрата, перемешивают и окрашивают в
течение 10 мин.
5. Ополаскивают в дистиллированной воде.
6. Высушивают.
Выявление ДНК по Фельгену
1. Препарат фиксируют в метаноле 15 мин.
2. Опускают в подогретый до 37 °С раствор 3 н. соляной
кислоты и помещают в термостат при 37 °С на 20 — 25 мин.
3. Промывают в отработанном реактиве Шиффа из
холодильника.
4. Помещают в чистый реактив Шиффа при 37 °С на 45 —
50 мин.
5. Промывают в сернистой воде 3 раза по 3 мин.
6. Промывают в дистиллированной воде.
7. Высушивают на воздухе и заключают в бальзам.
Выявление слизи муцикармином
1. Препарат фиксируют в метаноле 3 мин.
2. Переносят в эфир на несколько секунд.
3. Заливают муцикармином на 10 мин.
4. Смывают дистиллированной водой.
5. Докрашивают гематоксилином Эрлиха 5 мин.
6. Смывают водопроводной водой.
7. Высушивают.
295
Выявление РНК по Браше
1. Препарат фиксируют в метаноле 20 мин.
2. Ополаскивают дистиллированной водой 5 с.
3. Окрашивают метиловым зеленым-пиронином 2 ч при
комнатной температуре.
4. Промывают в дистиллированной воде 3 раза по 5 с.
5. Высушивают.
Выявление ядрышек метиленовым синим
1. Препарат фиксируют в метаноле 5 мин.
2. Переносят в эфир на несколько секунд.
3. Окрашивают 0,1 % раствором метиленового синего с
кратковременным подогреванием до легкого парообразования 5 —
10 мин.
4. Смывают краску и высушивают мазок.
5. Помещают в цитратный буфер (рН 4,9) на 30 — 60 с.
6. Высушивают.
Реакция на гликоген с контролем амилазой
1. Промывают мазок проточной водой 16 мин.
2. Переносят в эфир на несколько секунд.
3. Инкубируют с 0,1 % раствором амилазы (рН 7,0) при 37 °С
15 — 30 мин.
4. Промывают в дистиллированной воде 20 мин.
5. Переносят в йодную кислоту на 3 мин.
6. Промывают в дистиллированной воде 3 раза по 3 мин.
7. Помещают в реактив Шиффа (в темном месте) на 40 мин.
8. Промывают в сернистой воде 3 раза по 3 мин.
9. Промывают в дистиллированной воде 3 мин.
10. Докрашивают гематоксилином 20 мин.
11. Промывают в водопроводной воде.
12. Высушивают.
Выявление липидов Суданом черным
1. Препарат фиксируют в парах формалина 3 мин.
2. Ополаскивают дистиллированной водой 5 с.
3. Окрашивают Суданом черным В при 37 °С 1 ч (сухой
краситель растворяют в 96 % спирте; нагревают и готовят
насыщенный раствор — до появления на дне колбы кристаллов судана;
перед использованием фильтруют).
4. Ополаскивают в спиртах нисходящей концентрации (70 %,
50% и 40%).
5. Ополаскивают в дистиллированной воде.
6. Докрашивают ядра кармином 1 сут.
7. Ополаскивают дистиллированной водой и высушивают.
296
Реакция на пероксидазу с бензидином
1. Мазок фиксируют в спирт-формалине 30 с.
2. Переносят в эфир на несколько секунд.
3. Инкубируют при 22 °С (в темном месте) 10 мин.
Инкубационную среду готовят перед работой. В ее состав
входят 5 —7 мл 40 % спирта, 2 капли 2 % перекиси водорода и
несколько кристаллов бензидина, которые смешивают и фильтруют.
4. Промывают в водопроводной воде и высушивают.
Выявление неспецифической эстеразы по Хейко
1. Мазок фиксируют в парах 10 % формалина 3 мин.
2. Переносят в эфир на несколько секунд.
3. Инкубируют при 22 °С 2 ч.
Инкубационную среду готовят перед работой. В ее состав
входят 5 мг а-нафтилацетата, 2 капли ацетона, 20 мл 0,1 М
трис-НС1-буфера и 25 мг синего прочного В, или РР, или
прочного красного, которые растворяют и фильтруют.
4. Промывают в проточной воде и высушивают.
Выявление щелочной фосфатазы по Хейко
1. Мазок фиксируют в парах 10 % формалина 3 мин.
2. Опускают на несколько секунд в эфир.
3. Инкубируют при 22 °С (в темном месте) 3 ч.
Инкубационную среду готовят перед работой. В ее состав
входят 1 мг фосфата нафтола А5-ТК. (предварительно
растворяют в 2 каплях диметилформамида) и 1 мл 0,08 М трис-НС1-6у-
фера (рН 9,2), которые смешивают и фильтруют.
4. Промывают в водопроводной, а затем в дистиллированной
воде.
5. Докрашивают 1 % водным раствором метилового зеленого
несколько секунд.
6. Промывают в водопроводной воде и высушивают.
Выявление кислой фосфатазы по Барку
1. Мазок фиксируют в парах 10 % нейтрального формалина
3 мин.
2. Переносят в эфир на несколько секунд.
3. Инкубируют при 37 °С 4,5 — 5 ч.
Инкубационную среду готовят перед работой. Раствор «А»:
10 мг фосфата нафтола А5-ВР или А5-МХ растворяют в 2
каплях диметилформамида, смешивают с 25 мл 0,05 М ацетатного
буфера (рН 5,5). Раствор Б: 4 капли 4 % раствора нитрита
натрия смешивают с 4 каплями гексазотированного парарозанили-
на. После приготовления растворов их смешивают.
4. Промывают в проточной и дистиллированной воде.
297
ИССЛЕДОВАНИЕ ПОЛОВОГО ХРОМАТИНА
Соскоб со слизистой оболочки ротовой полости получают с
внутренней поверхности щеки. Сначала утром натощак
шпателем снимают поверхностный слой эпителия, непригодный для
исследования, а затем другим краем шпателя получают клетки
из среднего слоя слизистой оболочки и аккуратно размазывают
материал на стекле.
Методика окраски
1. Мазок фиксируют в смеси спирта и эфира (1:1) 24 ч.
2. Проводят через 70 % и 50 % спирты по 1 мин.
3. Ополаскивают в дистиллированной воде.
4. Переносят в 5 н. соляную кислоту.
5. Промывают в дистиллированной воде — 2 смены по 10 с.
6. Окрашивают 5—15 с, промывают в проточной воде,
высушивают.
Для приготовления красителя смешивают 9,7 г ацетата
натрия, 14,7 г веронала, 500 мл дистиллированной воды, 32 мл 1
н. раствора соляной кислоты, 40 мл 50 % спирта, 1 г толуидино-
вого синего. Полученный раствор фильтруют (рН красителя
5,7).
ГЛАВА 18
ВЫЯВЛЕНИЕ ПРОСТЕЙШИХ, БАКТЕРИЙ,
ВИРУСОВ И ГРИБОВ
В диагностике инфекционных болезней бактериоскопия мазков,
отпечатков и срезов тканей служит ориентировочным методом
установления этиологии заболевания. В практике
патологоанатома инфекционных стационаров бактериоскопия обязательна
при исследовании как секционного материала, так и
полученных прижизненно, так как важно полное выявление в тканях
возбудителей, определение их состояния и взаимоотношений с
клетками и тканями макроорганизма. Выявление возбудителя
осуществляют в мазках и срезах ткани, преимущественно
парафиновых.
В настоящее время классическую бактериоскопию с
окрашиванием микробов различными красителями дополняют
получившими широкое распространение иммуноцитохимическими
методами с применением меченых антител. Эти методы позволяют
во многих случаях провести высокоспецифичный
экспресс-анализ, особенно если применяют препараты моноклональных
антител против поверхностных антигенов возбудителя.
Нередко наиболее доступными для исследования с целью
идентификации возбудителя являются экссудаты, выделения,
обработанные в центрифуге, кровь, пунктаты паренхиматозных
органов, мазки и отпечатки тканей.
Для обнаружения возбудителей в зависимости от их формы
и размеров, а также способности к окрашиванию используют
различные методы и группы методов.
1. Методы выявления кислых ГАГ с помощью ШИК-реак-
ции. Наилучшие результаты получают при выявлении
простейших, в частности пневмоцист и токсоплазм, микоплазм, хлами-
дий; некоторых грибов, особенно рода СапсНёа, и капсулообра-
зующих бактерий.
2. Методы с использованием основного фуксина, азура, тио-
нина и метиленового синего (окраски по Пфейферу, Леффле-
ру, Николя и др.), которые в небольших концентрациях
позволяют выявить разную, в основном бактериальную флору.
Наиболее эффективны способы окраски по Цилю — Нильсену для
выявления спирто- и кислотоустойчивых бактерий, в частности
семейства МусоЪас1;епасеае (микобактерий туберкулеза, лепры
и др.) и некоторых простейших (криптоспоридий); основным
299
фуксином и метиленовым синим, позволяющими выявить,
помимо бактериальной флоры, фуксинофильные
внутриклеточные включения, характерные для некоторых вирусных,
особенно респираторных, инфекций; азуром и эозином для выявления
различной бактериальной микрофлоры, особенно грамположи-
тельной, и некоторых простейших, в частности плазмодия
малярии.
3. Методы, основанные на использовании анилинового
фиолетового (окраска по Граму и ее модификации), позволяющие
выявлять грамположительные бактерии и некоторые грибы, в
первую очередь рода СапсИс1а. Следует, однако, иметь в виду,
что наиболее интенсивно окрашиваются молодые формы.
Погибшие или погибающие микроорганизмы утрачивают
способность окрашиваться этими методами. В то же время часть грам-
отрицательных возбудителей, по крайней мере эшерихий, в
случае их гибели становятся грамположительными или
окрашиваются полихромно.
4. Методы, основанные на импрегнации кусочков тканей или
срезов нитратом серебра, направлены на выявление разной, в
основном бактериальной, флоры, поиски которой облегчаются в
связи с тем, что импрегнированные серебром микроорганизмы
немного увеличиваются в размерах.
Следует отметить, что некоторые микроорганизмы, особенно
ДНК-вирусы (семейств Негрезушёае и Аскпоутйае) и многие
грибы (классов Азсошусе^ез и РЬусошусе^ез), вполне
удовлетворительно окрашиваются гематоксилином, и использование
дополнительных способов окраски из числа перечисленных
излишне.
Осторожно следует подходить к интерпретации находок при
бактериоскопии секционного материала, особенно при поздних
вскрытиях, поскольку происходит постмортальная инвазия, а
размножение многих видов бактерий происходит даже в пред-
агональном периоде, на что указывают многие авторы.
ОКРАШИВАНИЕ МИКРООРГАНИЗМОВ В МАЗКАХ
Окраска метиленовым синим по Леффлеру
Смешивают 30 мл насыщенного спиртового раствора метилено-
вого синего со 100 мл 0,01 % раствора гидроксида калия. В этом
красителе мазки окрашивают в течение 3 — 5 мин, ополаскивают
в проточной воде, дифференцируют 3 с в 0,5 % растворе
уксусной кислоты и ополаскивают в проточной воде. Проводят через
спирты, просветляют в ксилоле и заключают в бальзам.
Препараты можно изучать при масляной иммерсии без заключения
в бальзам, но в этом случае они хранятся недолго.
Результат: бактерии окрашиваются в густо-синий цвет.
300
Окраска генциановым или метиловым фиолетовым
Смешивают 10 мл насыщенного спиртового раствора генциано-
вого фиолетового со 100 мл 2,5 % раствора фенола (смесь
хранится долго). Мазки окрашивают в течение 2 — 5 мин,
промывают в проточной воде, сушат и исследуют при масляной
иммерсии.
Результат: бактерии окрашиваются в густо-фиолетовый цвет.
Окраска основным фуксином по Пфейферу
1 г основного фуксина растворяют в 10—15 мл этилового
спирта и смешивают со 100 мл 5 % раствора фенола. Затем 3 капли
полученного раствора добавляют к 10 мл дистиллированной
воды и этой смесью окрашивают мазки в течение 30 — 40 мин.
После этого ополаскивают водой, дифференцируют 0,1 %
раствором соляной кислоты в абсолютном спирте, ополаскивают в
абсолютном спирте и заключают в бальзам.
Результат: бактерии окрашиваются в малиново-красный
цвет.
Окраска по Романовскому—Гимзе
Готовый жидкий краситель перед окрашиванием мазков
разводят из расчета 1—2 капли красителя на 1 мл дистиллированной
воды. Мазки окрашивают 20 — 25 мин при 37 °С во влажной
камере (закрытая чашка Петри с увлажненным фильтром на дне).
После окрашивания мазки промывают в проточной воде, сушат
на воздухе и исследуют при масляной иммерсии.
Красящую смесь Романовского — Гимзы в виде порошка
(коммерческий краситель) растворяют в смеси равных объемов
метилового спирта и глицерина (800 мг красителя на 100 мл
растворителя). Краситель растворяется плохо, поэтому лучше
его растереть с растворителем в количестве 300 мг на 100 мл, а
затем, помешивая, добавлять краситель до получения нужной
концентрации. Приготовление красителя часто занимает
несколько дней. Важно в качестве растворителей использовать
химически чистый метиловый спирт и глицерин, так как примеси
ухудшают свойства красителя. Вместо метилового спирта
можно применять 100 % этиловый спирт. Приготовленную
красящую смесь хранят в сухом прохладном месте в плотно
закрытом сосуде.
Методика окраски
1. Мазки, фиксированные в метиловом спирте, окрашивают
раствором (1 мл готовой жидкой краски + 2 мл основного
буферного раствора + 47 мл дистиллированной воды) в течение
40—120 мин (продолжительность окрашивания подбирают эм-
301
пирически) Пользуются фосфатным буфером, но рН буфера
зависит от вида мазка: для мазка костного мозга — 5,8 — 6,0,
для мазка крови — 6,4 — 6,5, для выявления простейших — 6,8,
малярийного плазмодия — 7,0 — 7,2.
2. Ополаскивают в дистиллированной воде, высушивают и
исследуют при иммерсии.
Окрашивание толстой капли.
Нефиксированную толстую каплю сушат в течение 1 ч на воздухе и
окрашивают 2—10 мин смесью из 4 мл раствора Гимзы, 3 мл ацетона,
2 мл буферного раствора (рН 6,5) и 31 мл дистиллированной
воды. Осторожно промывают в дистиллированной воде,
высушивают и исследуют при иммерсии. Для сохранения препаратов
можно закрыть толстую каплю покровным стеклом, которое
кладут на водный раствор поливинилового спирта или раствор
желатина.
Толстую каплю (например, для выявления плазмодиев
малярии) не фиксируют. На высохшую каплю наливают краситель
Гимзы, разведенный, как описано выше, и окрашивают 30 —
50 мин. Осторожно ополаскивают в воде (лучше в стакане),
просушивают окрашенный мазок в вертикальном положении и
исследуют при иммерсии.
Результат: бактерии окрашиваются в фиолетово-красный
цвет, цитоплазма клеток — в голубой, ядра — в красный.
Окраска карболовым тионином Николя
Смешивают 1 часть насыщенного спиртового раствора тионина с
10 частями 1 % водного раствора фенола, мазки окрашивают
3 — 5 мин, ополаскивают в проточной воде, дифференцируют
30 с в 96 % спирте, снова ополаскивают в воде и высушивают.
Препарат изучают при масляной иммерсии.
Результат: бактерии окрашиваются в темно-синий цвет.
Окраска акридиновым оранжевым по Дарту—Тернеру
1. Мазки фиксируют в смеси равных частей диэтилового
эфира и 95 % этилового спирта в течение 1 ч.
2. Проводят через спирты нисходящей концентрации (80 %,
70 %, 50 %) и дистиллированную воду, окуная мазок по 5 раз в
каждую порцию.
3. Окунают 4 раза в 1 % уксусную кислоту.
4. Переносят в дистиллированную воду на 2 мин.
5. Помещают на 3 мин в ацетатный буфер (рН 3,8).
6. Переносят в 0,01 % забуференный раствор акридинового
оранжевого на 3 мин.
7. Дифференцируют 4 мин в ацетатном буфере (рН 3,8).
8. Протирают концы предметных стекол, а затем осторожно
удаляют избыток буферного раствора фильтровальной бумагой.
302
9. Заключают под покровное стекло в буферный раствор и
оставляют на 2 мин. Препарат исследуют с помощью
флюоресцентного микроскопа сразу либо, если мазок оставляют
надолго, держат в темноте и парафинируют края покровного стекла.
Флюоресценция сохраняется в течение 3 мес.
Результат: бактерии, дрожжи, грибы рода СапсНёа
окрашиваются в красный цвет, паразиты — в красный с желтыми
ядрами; лейкоциты — ярко-зеленые.
Окраска по Граму для мазков
1. Мазки крови, цереброспинальной жидкости, экссудатов
фиксируют над пламенем горелки (быстро проводят 3 раза над
пламенем мазком вниз), затем высушивают. Кроме фиксации
над огнем, для мазков применима фиксация в метиловом спирте
(5 мин) или в парах формалина (в сосуде Коплина) в течение
15 мин.
2. Мазки окрашивают кристаллическим фиолетовым в
течение 1—2 мин (иногда при этом предметное стекло прогревают
3 — 4 с над огнем или нагревают краситель до 60 — 80 °С).
3. Краситель сливают, стекло промывают водой, мазок
заливают на 1 мин раствором Люголя или другим йодистым
раствором, например по Граму (2 г йодида калия растворяют в
2 — 3 мл дистиллированной воды, добавляют 1 г
кристаллического йода, доливают до 300 мл, а по Вейгерту до 100 мл
дистиллированной воды), раствор сливают, мазок промывают
водой.
4. Дифференцируют в 96 % этиловом спирте 2 — 3 раза до тех
пор, пока не перестанет отходить краситель, а мазок не
обесцветится. Если вместо спирта использовать ацетон, то промывание
продолжается 30 с. Можно дифференцировать смесью спирта и
ацетона (1:1) 30 с.
5. Промывают стекла в проточной или дистиллированной
воде 1—2 мин. Докрашивают растворами фуксина, сафранина
(0,2— 0,5 % водный раствор или 0,25 % раствор в 10 % спирте)
основного коричневого либо пиронина ^ или В 2 —5 мин.
Промывают в проточной воде 5 с и высушивают.
Результат: грамположительные микробы окрашиваются в ис-
синя-черный цвет, грамотрицательные — в красный или
коричневый в зависимости от красителя; ядра клеток —
ярко-красные, цитоплазма — розовая.
Красящие растворы. Раствор кристаллического
фиолетового по Эр лиху: 1,2 г кристаллического фиолетового растворяют
в 12 мл 96 % спирта и добавляют 100 мл свежеприготовленной
анилиновой воды, полученной при смешивании 2 мл анилина со
100 мл воды. Эта красящая смесь может храниться 2 нед.
Вместо кристаллического фиолетового можно использовать
метиловый фиолетовый.
303
Красящие смеси для грамположительных бактерий:
1) 10 г кристаллического фиолетового + 100 мл спирта;
2) 10 г генцианового фиолетового +100 мл спирта;
3) 10 г метилового фиолетового +100 мл спирта;
4) 1 мл насыщенного спиртового раствора кристаллического
фиолетового + 10 мл дистиллированной воды;
5) 0,25 мл насыщенного спиртового раствора
кристаллического фиолетового +100 мл 5 % раствора уксусной кислоты;
6) 8 —9 г метиленового синего +100 мл спирта;
7) 30 мл насыщенного раствора метиленового синего в
спирте + 1 г гидроксида калия + 99 мл дистиллированной воды.
Красящие смеси для грамотрицательных бактерий:
1) 8 —9 г основного фуксина +100 мл 96 % спирта;
2) 1 мл насыщенного спиртового раствора основного
фуксина + 10 мл дистиллированной воды;
3) 1 г основного фуксина +1 г фенола + 0,5 мл глицерина +
10 мл 96 % спирта +100 мл дистиллированной воды;
4) 0,2 — 0,5 % водный раствор сафранина либо 0,25 %
раствор сафранина в 10 % спирте.
Дифференцированная окраска кислотоустойчивых
бактерий (микобактерии туберкулеза и лепры)
Кислотоустойчивыми называют бактерии, которые после
окрашивания фуксином не обесцвечиваются под действием
концентрированных минеральных кислот и спиртов. Особенностью
этой группы бактерий является их невосприимчивость к
красителям, поэтому для их окрашивания применяют подогретые
концентрированные красители. Наиболее распространен метод
Ци ля — Нильсена.
Окраска мазков по Цилю—Нильсену
Фиксированный мазок окрашивают карболовым фуксином над
огнем до появления паров (3 — 5 мин), затем дают стеклу
остыть, сливают краситель, ополаскивают в проточной воде и
дифференцируют в 5 % растворе серной кислоты или смеси 10
частей спирта и 1 части соляной кислоты до тех пор, пока мазок
не обесцветится. Тщательно промывают проточной водой.
Докрашивают раствором любого красителя, например
метиленового синего.
Результат: микобактерии окрашиваются в красный цвет.
Для приготовления раствора карболового фуксина 1 г
основного фуксина растворяют в 2 мл глицерина и доливают до
100 мл 5 % раствором фенола. Р. Лилли (1969) рекомендует
следующую пропись: в 50 мл спирта растворить 25 г фенола, а
затем 5 г основного фуксина и долить дистиллированной водой
до 500 мл.
304
Серебрение бактерий в мазках — метод Фонтана
1. Мазки, фиксированные нагреванием (или в парах
формалина, спирте, формоловых смесях, жидкости Карнуа),
ополаскивают в воде.
2. Нагревают 10 мин в растворе Люголя до появления паров,
просветляют 2 мин в 5 % растворе тиосульфата натрия.
3. Ополаскивают дистиллированной водой 30 с.
4. Нагревают до появления паров в растворе аммиачного
серебра 30 с.
5. Промывают в дистиллированной воде, высушивают и
заключают в бальзам.
Выявление жгутиков и ресничек
Метод Леффлера
1. Мазок кладут на 0,5—1 мин в слегка нагретую протраву
(100 мл 12 % водного раствора танина + 50 мл насыщенного на
холоде раствора сульфата железа + 50 мл спиртового раствора
фуксина).
2. Хорошо промывают мазок водой и ополаскивают в спирте.
3. Окрашивают насыщенным раствором фуксина в
анилиновой воде, к которому по каплям добавляют 1 % гидроксида
натрия до тех пор, пока раствор не станет мутным и не начнет
выпадать осадок красителя. Раствор красителя наливают на часовое
стекло, мазок пускают плавать, подогревая краситель на
спиртовке до появления паров. Окрашивают в течение 1 — 2 мин.
4. Промывают в воде, сушат и исследуют при иммерсии или
заключают в бальзам.
Метод Лайфзона
Смешивают равные объемы 1,5 % хлорида натрия, 3 %
таниновой кислоты и 0,9 г парарозанилина ацетата + 0,3 г парарозани-
лина гидрохлорида + 100 мл 96 % спирта. Хорошо
размешивают, рН смеси должен быть от 4,8 до 5,2. При 4 °С краску можно
хранить до 2 мес, при комнатной температуре — несколько
дней, а при -10 °С — неопределенно долго.
Мазки с культур или из жидкостей не фиксируют на огне,
можно пользоваться другими методами фиксации.
Методика окраски
1. На мазок наливают светлую надосадочную жидкость
красителя.
2. Окрашивают 8—15 мин до появления на стекле
металлического оттенка.
3. Промывают в воде, высушивают и изучают при иммерсии.
Результат: бактерии и жгутики — красные.
305
Выявление капсул бактерий
Метод Клетта
Мазки окрашивают разбавленным в 10 раз насыщенным
спиртовым раствором метиленового синего, подогревая краску на огне
до кипения. Затем промывают в воде и окрашивают в течение
5 с 10 % спиртовым раствором фуксина, разбавленным водой в
10 раз. Промывают водой, сушат и изучают при масляной
иммерсии.
Результат: бактерии окрашиваются в синий цвет, а их
капсулы — в красный.
Метод Джоне
Фиксированные над огнем мазки окрашивают при подогревании
до появления паров в течение 2 мин 20 % водным раствором ген-
цианового фиолетового. Затем промывают в воде и окунают на
8—10св2% раствор уксусной кислоты. Далее снова
промывают водой, сушат и изучают при масляной иммерсии.
Результат: бактерии темно-синие, капсулы светло-синие.
Метод Фридлендера (для срезов)
Депарафинированные срезы окрашивают в течение нескольких
часов смесью 5 частей насыщенного спиртового раствора генци-
анового фиолетового, 10 частей дистиллированной воды и
1 части ледяной уксусной кислоты (срезы можно оставить на
ночь). Дифференцируют окраску 10— 15 с в 0,1 % растворе
уксусной кислоты. Промывают срез водой, быстро обезвоживают
в спиртах, проводят через ксилол и заключают в бальзам.
Результат: бактерии темно-синие, капсулы светло-синие.
Метод Бурри
На конец предметного стекла наносят каплю туши и петлей —
исследуемый материал. Смесь тщательно перемешивают петлей,
делают мазок и высушивают его, не фиксируя. Исследуют при
масляной иммерсии.
Результат: фон препарата окрашен в дымчато-темный цвет, на
котором хорошо видны бесцветные микробные тела и их капсулы.
Метод Гинса
Негативно окрашенный препарат, приготовленный по методу
Бурри, фиксируют любым способом, промывают водой и
окрашивают карболовым фуксином, разведенным в соотношении
1:3. Промывают водой, высушивают и изучают при иммерсии.
306
Выявление спор бактерий
Окрашивание спор удается только в мазках.
Метод Вайсера—Хьюппе
1. Мазки окрашивают в растворе карболового фуксина или
фуксина на анилиновой воде в термостате при 37 °С в закрытой
посуде в течение нескольких часов.
2. Обесцвечивают 25 % раствором серной кислоты в течение
3 — 5 с и споласкивают 96 % спиртом, пока не перестанут
отходить облачка красителя.
3. Докрашивают мети леновым синим 3 — 5 мин.
4. Ополаскивают в проточной воде, сушат на воздухе и
изучают при масляной иммерсии.
Можно окрашивать карболовым фуксином, подогревая на
огне мазок с красителем до появления паров 5 — 8 мин, но тогда
дифференцировать следует 2,5 % серной кислотой в течение
10-20 с.
Результат: споры окрашиваются в красный цвет, бактерии в
синий.
Метод Меллера
1. Фиксированные мазки помещают на 2 мин в хлороформ.
2. Переносят в 5 % водный раствор хромовой кислоты на 2 —
10 мин.
3. Промывают в проточной воде и окрашивают карболовым
фуксином 1 мин (стекло при этом подогревают на горелке до
появления паров).
4. Дифференцируют в 5 % серной кислоте 5 с.
5. Хорошо промывают в проточной воде и подкрашивают
водным раствором метиленового синего 3 мин.
6. Промывают в проточной воде, сушат и изучают при
иммерсии.
Результат: споры окрашиваются в красный цвет, бактерии —
в синий.
Окраска малахитовым зеленым Шеффера—Фултона
1. Мазки, фиксированные над огнем, окрашивают 5 %
водным раствором малахитового зеленого 5—10 мин.
2. Промывают в проточной воде.
3. Докрашивают 1 % водным раствором сафранина 30 с.
4. Промывают водой, сушат и изучают при масляной
иммерсии.
Результат: споры окрашиваются в зеленый цвет, бактерии —
в красный.
307
Метод Ожешки
На нефиксированный мазок наливают 0,5 % раствор соляной
кислоты и подогревают над огнем 1 — 2 мин. С препарата
сливают кислоту, тщательно промывают проточной водой,
высушивают и после высыхания фиксируют на пламени. Фиксированный
препарат окрашивают по методу Циля —Нильсена.
Результат: тела бактерий окрашиваются в синий цвет,
споры — в красный.
Метод Биттера
Нефиксированный мазок обрабатывают 10 % формалином
10 мин, промывают проточной водой и высушивают.
Окрашивают 3 мин аммиачным мети леновым синим (20 мл
насыщенного спиртового раствора метиленового синего + 3 мл 98 %
раствора аммиака + 80 мл дистиллированной воды), нагревая
стекло над огнем до закипания красителя. Промывают
проточной водой, докрашивают 0,5 % раствором сафранина 3 — 5 мин,
промывают водой, высушивают и изучают при масляной
иммерсии.
Результат: бактерии красные, споры синие.
ОКРАШИВАНИЕ МИКРООРГАНИЗМОВ В СРЕЗАХ
Для окрашивания бактерий в срезах используют парафиновую
или парафин-целлоидиновую заливку тканей, менее надежные
результаты получают на замороженных срезах и срезах
нефиксированных тканей. Для выявления бактерий и их
идентификации пригодны лишь тонкие или даже полутонкие (1 — 2 мкм)
срезы. Лучший фиксатор для бактерий — 96—100 % спирт,
применяют также формалиновые и сулемовые фиксаторы. Де-
парафинируют срезы обычным способом, проводят через
ксилол и ряд спиртов.
Из универсальных методов для выявления бактерий в срезах
применяют окраску по Граму в модификации Вейгерта, окраску
метиленовым синим Леффлера, карболовым тионином Николя,
карболовым фуксином Циля, серебрят спирохеты и некоторые
другие возбудители, иногда окрашивают толуидиновым синим,
красителем Лейшмана, красителем Гимзы.
Окраска бактерий по Граму—Вейгерту
1. Депарафинированные срезы доводят до воды.
2. Окрашивают 20 мин в 1 % растворе парарозанилина или
основного фуксина в 1 % уксусной кислоте (раствор красителя
нагревают до кипения, охлаждают и фильтруют).
3. Промывают в 3 сменах дистиллированной воды.
308
4. Окрашивают 5 мин в 1 % кристаллического фиолетового в
дистиллированной воде.
5. Быстро ополаскивают в 1 % растворе хлорида натрия.
6. Обрабатывают 30 с в смеси: 1 часть йода + 2 части йодида
калия +100 частей дистиллированной воды.
7. Промокают фильтровальной бумагой.
8. Дифференцируют, нанося на срез смесь равных объемов
анилина и ксилола (1—2 мл); растворы сливают до тех пор,
пока облачка красителя не перестанут отходить от среза.
9. Проводят через 3 смены ксилола.
10. Заключают в бальзам или любую смолу, растворенную в
ксилоле.
Результат: грамположительные бактерии сине-черные,
фибрин фиолетовый, ядра красные; грамотрицательная флора не
окрашивается.
Метод Гимзы
Кусочки ткани должны быть фиксированы в смесях,
содержащих хромовые соли (Хелли, Ценкера). Если материал
фиксирован в формалине, то можно рекомендовать дополнительное
хромирование срезов в 5 % растворе бихромата калия в течение 2
сут или в термостате при 37 °С в течение б ч. Затем срезы
хорошо промывают водой, переносят в 1 % раствор сулемы на 3 ч,
снова промывают водой, обсушивают фильтровальной бумагой
и переносят в краситель Гимзы.
1. Тонкие тщательно депарафинированные срезы на
предметных стеклах после ополаскивания водой заливают только что
приготовленным раствором коммерческого красителя Гимзы из
расчета 1—2 капли на 10 мл дистиллированной воды, помещают
во влажную камеру в термостат на 1 ч при 37 °С (можно
окрашивать и дольше, но нужно следить, чтобы краска на срезе не
высохла).
2. Срезы быстро ополаскивают дистиллированной водой,
подсушивают фильтровальной бумагой.
3. Обезвоживают в химически чистом ацетоне 30 с.
4. Проводят через 2 — 3 порции чистого ксилола и заключают
в бальзам.
Результат: бактерии окрашиваются в пурпурный или синий
цвет; цитоплазма паразитов голубая, ядра пурпурные.
Метод Вольбаха для выявления риккетсий
с помощью красящей смеси Гимзы
Материал фиксируют в жидкости Ценкера или Мюллера 24 —
48 ч.
1. Тонкие депарафинированные срезы окрашивают 1 ч при
комнатной температуре смесью 1 мл коммерческой краски
309
Гимзы +1,25 мл метилового спирта + 0,1 мл 0,5 % карбоната
натрия и 40 мл дистиллированной воды.
2. Смесь сливают и заливают срезы ее свежей порцией на
1 ч. В третьей порции смеси срезы оставляют на ночь, помещая
их во влажную камеру в чашку Петри, чтобы предохранить от
высыхания.
3. Дифференцируют в 95 % спирте с несколькими каплями
10 % спиртового раствора канифоли.
4. Обезвоживают в 100 % спирте, просветляют в ксилоле и
заключают в кедровое масло.
Результат: риккетсии окрашиваются в интенсивно-красный
цвет; ядра темно-синие, цитоплазма голубая.
Метод Леффлера
При этом методе возможна любая фиксация ткани.
1. Депарафинированные срезы окрашивают красителем
Леффлера при комнатной температуре в течение 5—10 мин.
2. Хорошо промывают проточной водой.
3. Дифференцируют в 0,5 % растворе уксусной кислоты 3 —
5 с.
4. Ополаскивают в проточной воде, контролируя под
микроскопом качество дифференцировки. Ядра клеток должны четко
выступать, а фон должен быть совершенно светлым.
5. Быстро проводят через 96 % и 100 % спирты, ксилолы и
заключают в бальзам.
Результат: бактерии окрашиваются в синий цвет.
Окраска карболовым тионином Николя
Возможна любая фиксация.
1. Депарафинированные срезы окрашивают в карболовом ти-
онине 5—10 мин (можно и дольше).
2. Ополаскивают в проточной воде.
3. Дифференцируют в 96 % спирте 1 — 2 мин.
4. Быстро проводят через 100 % спирт, ксилолы и заключают
в бальзам.
Результат: бактерии окрашиваются в темно-синий цвет, так
же как и ядра клеток.
Метод Левадити
Этот метод обычно применяют для выявления спирохет, однако
он трудно воспроизводим.
1. Кусочки ткани толщиной не более 1—2 мм фиксируют в
10 % формалине 1 — 2 дня.
2. Промывают в воде и выдерживают в 96 % спирте
1 су т.
310
3. Выдерживают в дистиллированной воде до тех пор, пока
кусочек не опустится на дно.
4. Помещают в 2 % раствор нитрата серебра при 37 °С на
4 сут, ежедневно меняя раствор.
5. Промывают в дистиллированной воде.
6. Восстанавливают в смеси, содержащей 3 г пирогаллола,
5 мл 40 % формалина и 100 мл дистиллированной воды.
7. Промывают в 3 — 4 сменах дистиллированной воды.
8. Обезвоживают в ряде спиртов, просветляют в кедровом
масле и заливают в парафин. Готовят тонкие срезы, депарафи-
нируют и заключают в бальзам.
Результат: ткани приобретают разные оттенки желтого и
коричневого цвета, спирохеты окрашиваются в черный цвет.
Метод Вартина для выявления спирохет
и кампилобактера
Материал фиксируют в формалине и заливают в парафин.
1. Депарафинированные срезы доводят до воды.
2. Промывают 0,01 М ацетатным буфером (рН 3,6 — 3,8).
3. Помещают в сосуд Коплина или во влажную камеру
(чашка Петри) в 1 % раствор нитрата серебра, приготовленный
на том же буфере (рН 3,6 — 3,8), на 45 мин при 37 °С.
4. За время инкубации готовят и ставят в термостат при
33 °С раствор проявителя. Заранее готовят основной (5 %)
раствор желатина в буфере (рН 3,6 — 3,8), который нагревают в
термостате при 37 °С. В качестве консерванта добавляют 1
каплю мертиолата. Раствор желатина хранят в холодильнике.
Перед работой желатин расплавляют, отливают 15 мл и нагревают
до 60 °С; 3 мл 2 % раствора нитрата серебра на ацетатном
буфере также нагревают до 60 °С, добавляют в него желатин, затем
1 мл свежеприготовленного 3 % раствора гидрохинона на 0,01 М
ацетатном буфере.
5. Укладывают предметные стекла со срезами на стеклянные
палочки и заливают теплым проявителем. Когда срезы станут
золотисто-коричневыми или серовато-желтыми, а проявитель —
коричнево-черным, последний сливают и стекла промывают
сначала теплой водопроводной водой при температуре около
60 °С, а затем — дистиллированной.
6. Тонируют 0,2 % раствором трихлорида золота в течение
3 мин.
7. Промывают в воде и докрашивают гематоксилином и
эозином или сафранином либо вообще не докрашивают.
8. Обезвоживают в спиртах, просветляют в ксилоле и
заключают в бальзам.
Результат: фон желто-коричневый, спирохеты или другие
микробы черные.
311
Окраска по Брауну—Бренну в модификации
Хмельницкого
1. Срез помещают в железный гематоксилин Вейгерта на 2 —
4 мин.
2. Ополаскивают в воде.
3. Дифференцируют в 1 % растворе соляной кислоты.
4. Помещают в воду на 3 мин.
5. Окрашивают карболовым анилиновым фиолетовым (в
маленькой бутылочке смешивают 5 капель 5 % гидрокарбоната
натрия, содержащего 0,5 % фенола, и 0,75 мл 1 % водного
раствора анилинового фиолетового) 5—10 мин.
6. Смывают водой.
7. Наливают на срез раствор Люголя на 1 мин.
8. Смывают 96 % спиртом.
9. Дифференцируют в смеси анилина и 96 % спирта (1:1),
смывают 96 % спиртом.
10. Промывают водой.
11. Окрашивают очень быстро раствором основного фуксина
(5 мл нормального раствора основного фуксина) + 100 мл
дистиллированной воды).
12. Смывают 96 % спиртом.
13. Дифференцируют 1 % спиртовым раствором пикриновой
кислоты до тех пор, пока не перестанет отходить краситель.
14. Заключают в бальзам.
Результат: ядра клеток окрашиваются в черно-коричневый
цвет, цитоплазма — в желтый, грамположительные грибы и
бактерии — в сине-л иловый, почти черный, грам отрицательные
в красно-лиловый.
Окраска азур-эозином
1. Срез помещают в краситель (свежеприготовленная смесь
0,1 % растворов азура II и водорастворимого эозина) на 18— 24 ч
при комнатной температуре (или на 20 — 30 мин при 37 °С).
2. Быстро дифференцируют слабым раствором уксусной
кислоты (1 мл 1 % раствора уксусной кислоты на 100 мл воды).
3. Заключают в бальзам.
Результат: ядра клеток окрашиваются в темно-синий цвет,
цитоплазма — розовая, эритроциты — оранжевые, микрофлора, в
основном бактериальная, — синего цвета разной интенсивности.
Окраска эозиновокислым метиленовым синим
с докраской азур-эозином (по Паппенгейму)
1. На срез наносят 20 — 30 капель красителя Мая —Грюн-
вальда (0,25 г сухого красителя — эозиновокислого метилено-
вого синего — растворяют в 100 мл коммерческого метанола
312
при легком нагревании на водяной бане при 60 °С; в случае
необходимости приготовления сухого красителя 1 г эозина и 1 г
метиленового синего растворяют в 1 л дистиллированной воды,
образующийся при этом темноокрашенный осадок — после
отсасывания отстоя через несколько суток — промывают
холодной дистиллированной водой и высушивают 1—3 мин.
2. Добавляют такое же количество дистиллированной воды
на 1 мин.
3. Сливают, не смывая.
4. Докрашивают азур-эозином (10 мл 0,1 % раствора эозина +
14 мл 0,1 % раствора азура + 0,7 мл 0,2 М раствора уксусной
кислоты + 0,4 мл 0,2 М раствора ацетата натрия + 5 мл ацетона +
20 мл дистиллированной воды) 35 мин при 37 °С.
5. Промывают водой.
6. Заключают в бальзам.
Окраска с использованием реактива Шиффа
(ШИК-реакция)
Фуксинсернистая кислота (реактив Шиффа) образует
соединение лилово-красного цвета при взаимодействии с альдегидными
группами. Последние возникают при окислении полисахаридов
возбудителей, в частности дрожжеподобных грибов и
простейших.
Окисление можно проводить с помощью метайодной
кислоты (окраска по Хочкиссу — Мак-Манусу), однако из-за того, что
она быстро разлагается, лучше применять метайодат калия или
натрия (окраска по Шабадашу).
1. Срез промывают дистиллированной водой.
2. Помещают в раствор метайодата (400 мг метайодата калия
или натрия + 10 мл 0,2 н. раствора уксусной кислоты; на дне
всегда остается осадок) на 5— 10 мин.
3. Ополаскивают в дистиллированной воде 3 — 10 мин.
4. Помещают на 10 мин в фуксин-сернистую кислоту
(приготовление — см. главу 10).
5. Промывают в дистиллированной воде.
6. Хорошо промывают в сернистой воде (200 мл
водопроводной воды + 10 мл 10 % пиросульфита калия или безводного
гидросульфита натрия +10 мл 1 н. соляной кислоты; сернистой
водой при хранении ее в плотно закрытой посуде можно
пользоваться повторно).
7. Окрашивают гематоксилином, например гематоксилином
Гарриса, с последующей дифференцировкой 1 % водным
раствором соляной кислоты и промыванием в щелочной воде до
восстановления синеватой окраски ядер.
8. Заключают в бальзам.
Результат: препараты, полученные с помощью этой
методики, несколько напоминают окрашенные гематоксилином и эози-
313
ном. Ядра клеток — темного синевато-серого цвета,
цитоплазма — бледно-фиолетовая; микоплазмы, грибы рода СапсНс1а,
пневмоцисты, токсоплазмы, а также слизь —
красно-фиолетовые; плесневые грибы и некапсульные бактерии окрашиваются
только гематоксилином.
Окраска орсеином по Шикате
(для диагностики вирусного гепатита В)
1. Срез помещают на 10 мин в раствор (9,5 мл 5 % перманга-
ната калия + 5 мл 3 % серной кислоты + 85 мл
дистиллированной воды).
2. Переносят в 2 % щавелевую кислоту на 10 мин.
3. Промывают в проточной воде — 5 мин, затем в 2 сменах
дистиллированной воды и в 2 сменах 70 % спирта.
4. На срез наливают краситель (1 г орсеина, 100 мл 70 %
спирта, 2 мл концентрированной соляной кислоты) на 4 ч.
5. Промывают в проточной воде 10 мин.
6. Дифференцируют солянокислым спиртом.
7. Заключают в бальзам.
Результат: на светло-коричневом фоне органа в цитоплазме
гепатоцитов выявляются крупные округлые темно-коричневые
включения однородного строения; аналогично окрашиваются
ядра лимфоцитов в перипортальных инфильтратах.
ВЫЯВЛЕНИЕ ВОЗБУДИТЕЛЕЙ ИММУНОФЕРМЕНТНЫМ
МЕТОДОМ
1. Срез депарафинируют после ксилола в химически чистом
ацетоне.
2. Обрабатывают 1,5 — 2 % раствором перекиси водорода для
устранения возможного побочного окрашивания эндогенных пе-
роксидаз и псевдопероксидаз 10 мин.
3. Наносят сыворотку (в рабочем разведении, указанном в
инструкции к данной сыворотке), содержащую антитела к
выявляемому возбудителю, с последующей инкубацией срезов во
влажной камере при 37 °С 45 мин.
4. Промывают в фосфатном буфере (рН 7,2) дважды по
1 мин.
5. Наносят антивидовую сыворотку, меченную пероксидазой
(в рабочем разведении, указанном в инструкции к данной
сыворотке), с последующей инкубацией во влажной камере при
37 °С 45 мин.
6. Промывают фосфатным буфером (рН 7,2) дважды по
10 мин.
7. Обрабатывают раствором диаминобензидина (5 мг на 10 мл
0,1 М трис-НС1-буфера с добавлением 3 — 4 капель 3 % раствора
перекиси водорода) 4 мин.
314
8. Быстро промывают фосфатным буфером (рН 7,2).
9. Обрабатывают 0,1 % раствором тетраоксида осмия для
более четкого контрастирования 3 — 4 мин.
10. Промывают изотоническим раствором хлорида натрия,
затем дистиллированной водой.
11. Окрашивают гематоксилином или другим ядерным
красителем (в случае необходимости).
12. Заключают в бальзам.
Результат: выявляемый возбудитель — коричневого цвета
разной интенсивности, фон — синеватый.
ВЫЯВЛЕНИЕ ВОЗБУДИТЕЛЕЙ С ПОМОЩЬЮ
ЛЮМИНЕСЦЕНТНОЙ МИКРОСКОПИИ
Наибольшее значение для выявления возбудителей имеет имму-
нофлюоресцентный метод. Рациональнее проводить
исследование мазков, а не срезов. Особенно это относится к обнаружению
возбудителей вирусных инфекций, в том числе респираторных.
В связи с внутриклеточным расположением возбудителя
наилучшего результата достигают при исследовании мазков,
приготовленных из соскоба с поверхности органа или его разреза.
Это объясняется тем, что в мазок попадает несравненно больше
пораженных клеток органа, чем в отпечаток, что значительно
ускоряет исследование и делает его результаты более
надежными. При бактериальных инфекциях, вызываемых
возбудителями, для которых также характерно внеклеточное расположение,
оптимальным является приготовление отпечатков или
исследование срезов, в том числе парафиновых.
1. Сухую люминесцентную сыворотку растворяют в
указанном на этикетке ампулы объеме дистиллированной воды.
2. После растворения сыворотку желательно отцентрифуги-
ровать 30 мин при 3000 — 6000 об/мин; разведенную сыворотку
можно длительное время хранить в пробирке с резиновой
пробкой или запаянной ампуле при 4—10 °С.
3. Непосредственно перед нанесением сыворотки на
препарат ее нужно развести 0,15 М хлоридом натрия (рН 7,2 — 7,4),
рабочие разведения готовят с помощью нескольких двукратных
разведений.
4. Для окраски на срез наносят несколько капель сыворотки,
окраску проводят во влажной камере (чашке Петри, на дно
которой кладут увлажненную фильтровальную бумагу) 15 —
30 мин при комнатной температуре.
5. Промывают мазок в 0,15 М хлорида натрия дважды по
10 мин.
6. Мазок подсушивают на воздухе.
Препараты изучают при водной или масляной иммерсии
(необходимо пользоваться специальным нефлюоресцирующим им-
315
мерсионным маслом или его заменителем, например диметил-
фталатом)
Результат: участки, содержащие антиген, при применении
сыворотки изотиоцианата флюоресцеина — ярко-зеленые, фон —
темный, участки клеток, подвергшиеся некрозу, темно-желтые.
Аналогично обрабатывают криостатные, а также
парафиновые срезы тканей. Последние нецелесообразно применять для
выявления антигенов вирусов без специальной заливки,
например по Санта-Мари. Это объясняется исчезновением антигена в
процессе обработки тканей. Кроме того, при исследовании
парафиновых срезов отмечается диффузное неспецифическое
свечение, резко затрудняющее выявление антигена, особенно
вирусов.
Заливка в парафин по Санта-Мари.
1. Фиксируют кусочек толщиной до 5 мм в 96 % спирте,
охлажденном до 4 °С (50 мл на 1 г ткани) в закрытом сосуде при
4 °С 1 ч.
2. Подрезают кусочек до толщины 2 — 4 мм.
3. Продолжают фиксацию при 4 °С 15 — 24 ч.
4. Переносят в 100 % спирт при 4 °С (4 порции по 1—2 ч в
каждой).
5. Помещают в ксилол при 4 °С (3 порции по 1 — 2 ч в каждой),
после третьей смены оставляют при комнатной температуре.
6. Переносят в парафин при 56 °С (4 смены по 1 — 2 ч).
7. Полученные срезы высушивают при 37 °С 30 мин (их
можно хранить при 2 °С до нескольких недель).
8. Депарафинируют в холодном ксилоле при 4 °С (2 смены
по 10-15 с).
9. Удаляют ксилол осторожным движением вверх —вниз в
96 % спирте при 4 °С (3 смены по 10—15 с).
10. Удаляют спирт в фосфатном буфере (рН 7,2) при 4 °С
(3 смены по 1 мин).
11. Обрабатывают флюоресцирующей сывороткой.
СПЕЦИАЛЬНЫЕ МЕТОДЫ
Выявление микобактерий туберкулеза и лепры
Микобактерии являются кислотоустойчивыми, поэтому после
окраски не обесцвечиваются под действием концентрированных
минеральных кислот. Наиболее распространен метод Циля —
Нильсена (см. стр. 304).
Метод Френкеля
Окрашивают мазок с нагреванием на пламени горелки
раствором фуксина или генцианового фиолетового на анилиновой
воде и затем обесцвечивают 1—2 мин смесью (50 мл спирта +
316
20 мл 15 % азотной кислоты + 30 мл воды). В этой смеси
растворяют до насыщения метиленовый синий или основной
коричневый. Затем мазок промывают в проточной воде, сушат и
изучают при иммерсии.
Результат: микобактерии окрашиваются в красный цвет (при
окраске фуксином) или в фиолетовый (при окраске генциано-
вым фиолетовым).
Флюоресцентное окрашивание мазков мокроты
(метод Хагеманна)
Фиксированные нагреванием мазки окрашивают в течение 8 —
10 мин при комнатной температуре в растворе аурамина (1 г ау-
рамина в 100 мл 5 % фенола). Тщательно промывают проточной
водой, дифференцируют в 2 сменах 2 % солянокислого спирта
по 2 мин. Затем снова хорошо промывают в проточной воде,
обрабатывают 0,1 % раствором перманганата натрия 20 с, снова
промывают в воде, сушат и исследуют при иммерсии (2 мл
концентрированной соляной кислоты на 98 мл спирта).
Результат: микобактерии имеют вид ярко-желтых палочек.
Метод Киньуна (для срезов)
1. Депарафинированные срезы доводят до воды.
2. Окрашивают любым карбол-фуксином при 70 °С 10 мин,
при 55 °С — 30 мин, при 37 °С — 2 мин или при 20 — 25 °С 4 —
16 мин.
3. Промывают в воде.
4. Обесцвечивают в смеси 2 мл концентрированной соляной
кислоты и 98 мл 95 — 70 % спирта от 20 с до нескольких минут
(до обесцвечивания).
5. Докрашивают кислым квасцовым гематоксилином 2 — 5 мин
или 1 % раствором метиленового синего либо януса зеленого В в
1 % уксусной кислоте и 20 % спирте 3 мин (два последних
красителя пригодны и для мазков).
6. Промывают в проточной воде.
7. Обезвоживают, просветляют (не следует пользоваться
карбол-ксилолом, который обесцвечивает почти все
микобактерии) и заключают в полистирол, капрат целлюлозы или депекс,
но не в бальзам.
Результат: кислотоустойчивые микробы и цероид
окрашиваются в красный цвет, ядра клеток — в синий или зеленый,
гранулы лаброцитов (тучных клеток) при окрашивании метилено-
вым синим приобретают сине-фиолетовый цвет, но не
окрашиваются гематоксилином. В материале, фиксированном
формалином, эритроциты часто окрашиваются в розовый цвет, а
стержни волос и кератогиалин — в красный различных
оттенков.
317
Метод Файта (для срезов)
1. Депарафинированные срезы доводят до воды и
окрашивают 30 — 60 мин при комнатной температуре смесью, в состав
которой входят 5 г фенола, 10 мл этилового или метилового
спирта и 1 г основного фуксина (растворить и долить до 100 мл
дистиллированной воды).
2. Переносят срезы в концентрированный раствор
формалина на 5 мин.
3. Дифференцируют почти до полного обесцвечивания в 2 %
солянокислом спирте.
4. Переносят в концентрированный раствор формалина на
несколько секунд и промывают в воде.
5. Докрашивают пикрофуксином Ван-Гизона и
гематоксилином 10—15 мин, промывают в воде.
6. Дифференцируют и просветляют в спиртах возрастающей
концентрации (от 95 % до 100 %), спирт-ксилоле и двух сменах
ксилола, заключают в полистирол или пермаунт.
Результат: кислотоустойчивые микобактерии окрашиваются
в фиолетовый цвет.
Выявление коринебактерий дифтерии
Лучше всего они выявляются в мазках из зева. Мазки
фиксируют над пламенем горелки и окрашивают либо щелочным мети-
леновым синим Леффлера, либо ацетатом толуидинового
синего, либо ацетатом кристаллического или метилового
фиолетового. Коринебактерия грамотрицательна, ложнодифтерийные
палочки при окраске по Граму обладают гораздо большей
устойчивостью, чем возбудители дифтерии.
Возбудитель идентифицируют по характерным структурным
особенностям: палочки имеют колбообразные вздутия на
концах, что придает бактерии вид булавы. В мазке наряду с
длинными, тонкими, прямыми и слегка изогнутыми палочками
можно обнаружить короткие и толстые. Характерным
признаком бактерий дифтерии являются включения зерен волютина,
находящихся на концах палочки. Ложнодифтерийные палочки
значительно грубее, короче возбудителей дифтерии и не
содержат зерен волютина. Зерна волютина окрашивают 10— 15 с
смесью, в состав которой входят 0,1 мл метиленового синего,
0,2 мл 96 % спирта, 5 мл ледяной уксусной кислоты, 100 мл
дистиллированной воды. После окрашивания мазки
ополаскивают водой, докрашивают 10—15св0,2% водном растворе
основного коричневого; снова ополаскивают водой, высушивают и
изучают при иммерсии.
Бактериоскопическая идентификация возбудителя дифтерии
является ориентировочной, поэтому требуется подтверждение с
помощью классического бактериологического метода. Более бы-
318
стрым и достаточно специфичным методом идентификации
дифтерийной палочки является непрямая иммунофлюоресцен-
ция с препаратом антител против О- и К-антигенов коринебак-
терии дифтерии. Кроме того, разработана иммуноферментная
тест-система для выявления дифтерийного токсина, которая
пригодна для определения токсинообразующих коринебактерий
в мазках.
Выявление стрептококков
В мазках гноя и осадка жидкости, полученной при лаваже
бронхов, в ткани эндокарда, взятой при биопсии или на вскрытии,
стрептококки выявляются при окраске по Граму: они грамполо-
жительны. Однако более ярко стрептококки окрашиваются
анилиновыми красителями — синькой Леффлера и др. Характерно
расположение стрептококков в виде цепочек, при этом
делящиеся формы лежат перпендикулярно оси цепочки, что позволяет
довольно точно идентифицировать эти микроорганизмы в
мазках и срезах.
Выявление стафилококков
Так же как и стрептококки, стафилококки являются грамполо-
жительными микроорганизмами, но прекрасно воспринимают
анилиновые красители типа метиленового синего, синьки
Леффлера и др. Характер микроколоний стафилококков в тканях и
выделениях морфологически хорошо идентифицируется — это
округлые образования со значительным количеством делящихся
форм в виде тетрад.
Выявление пневмококков
В мазках цереброспинальной жидкости, мазках осадка
промывных вод, в легочной ткани, полученной на вскрытии, можно
выявить грамположительные диплококки, располагающиеся
цепочкой, или одиночные, покрытые капсулой. Эти
микроорганизмы хорошо окрашиваются по Граму или анилиновыми
красителями типа метиленового синего, в срезах — с большим
трудом. В связи с наличием капсулы требуется специальное
окрашивание.
Выявление менингококков
Менингококки, представляющие собой диплококки без
капсулы, грамотрицательны. Их выявляют в мазках
цереброспинальной жидкости, нейтрофилах крови и свободно в крови, гное с
оболочек мозга. Менингококки хорошо окрашиваются
анилиновыми красителями типа метиленового синего. Мазки клиничес-
319
кого материала нужно исследовать либо сразу, либо
фиксировать и затем окрашивать спустя любое время. Для
идентификации менингококков применяют также метод иммунофлюоре-
сценции, но для этого необходимо наличие иммуноферментной
тест-системы.
Выявление гонококков
Гонококки, имеющие вид диплококка с капсулой, грамотрица-
тельные, окрашиваются метиленовым синим по Леффлеру. В
срезах гонококки окрашиваются с трудом. Эти микроорганизмы
можно идентифицировать с помощью коммерческих иммуно-
флюоресцентных наборов.
Выявление возбудителей чумы
Возбудитель чумы грамотрицателен. В мазках патологического
материала он имеет характерный вид палочек оксидной формы,
концы которых окрашиваются метиленовым синим более
интенсивно, чем середина. Палочки часто собраны в цепочки.
Созданы коммерческие иммунофлюоресцирующие препараты для
идентификации возбудителей чумы и иммуноферментные тест-
системы на чумные антигены, пригодные для идентификации
возбудителя в мазках и тканях.
Выявление анаэробных спорообразующих бактерий
группы клостридий
Клостридии — крупные грамположительные палочки, все они
могут образовывать споры. У возбудителя столбняка спора
располагается на конце палочки, что придает ему вид барабанной
палочки. Иногда споры могут находиться в центре клетки. У
большинства видов есть перитрихиальные жгутики.
Окрашивают клостридии карбол-фуксином либо по методу Ожешки для
выявления спор.
Возбудители ботулизма (С1. Ьо1иПпит). Их выявляют с
помощью биологической пробы на присутствие ботулинического
токсина. Бактериоскопию не проводят.
Возбудители газовой гангрены (С1. реНтт^епз) и другие
клостридии. При окраске мазков гнойного отделяемого из ран
по Граму выявляют крупные грамположительные палочки,
окруженные капсулой. Для окрашивания капсул на стекло
наносят каплю туши и рядом петлей размазывают исследуемый
материал. Смесь материала и туши тщательно перемешивают,
делают тонкий мазок, высушивают, фиксируют любым способом.
После фиксации мазок промывают проточной водой,
окрашивают карболфуксином Циля, разведенным в соотношении 1:3, в
течение 3 — 5 мин, промывают водой, высушивают и изучают
320
при иммерсии. Выявление грубых или полиморфных палочек,
имеющих капсулу, позволяет заподозрить наличие в
исследуемом материале возбудителя газовой гангрены.
Выявление возбудителей сибирской язвы
Мазки из мокроты при подозрении на легочную форму
сибирской язвы, мазки из содержимого карбункула (при кожной
форме) или мазки из кала, фиксированные любым способом,
окрашивают по Граму. Окраску капсул проводят так же, как
при выявлении возбудителей газовой гангрены. Обнаружение
крупных грубых грамположительных палочек, имеющих
капсулу и расположенных в виде коротких цепочек, является
основанием для установления предварительного диагноза сибирской
язвы.
Выявление возбудителей кишечной инфекции
Возбудители кишечных инфекций относятся к нескольким
семействам, все представители которых являются
грамотрицательными, неспорообразующими палочками, имеют сходную
морфологию и с трудом различаются бактериоскопически,
поэтому они хорошо окрашиваются анилиновыми красителями.
Идентификацию этих возбудителей лучше всего проводить им-
муноцитохимически либо с помощью иммунолюминесцентного
или иммуноферментного метода. Холерные вибрионы выявляют
как с помощью анилиновых красителей типа метиленового
синего, так и иммунолюминесцентным способом с препаратами лю-
минесцирующих антихолерных антител.
Выявление спирохет и других спиралевидных бактерий
Для выявления возбудителя сифилиса (Тгеропета раШйит)
используют темное поле или иммунофлюоресцентную окраску.
Они плохо окрашиваются анилиновыми красителями, но имп-
регнируются по методу Левадити в тканях.
Выявление возбудителей возвратного тифа
Возбудители возвратного тифа (ВоггеНа гесиггепиз) хорошо
окрашиваются всеми анилиновыми красителями, а также по
методу Гимзы и Райта. Фуксином они окрашиваются в розовый,
краской Гимзы — в фиолетово-розовый цвет.
Выявление лептоспир
Лептоспиры плохо окрашиваются анилиновыми красителями,
поэтому их обычно выявляют в бактериологических лаборато-
321
риях с помощью живых возбудителей в темном поле — в
толстой капле крови или в экссудатах из паренхиматозных
органов.
Выявление возбудителей сыпного тифа
и других риккетсий
Выявление риккетсий в мазках (метод Маккиавелло)
1. Тонкие мазки фиксируют над пламенем (3 раза).
2. Окрашивают в предварительно профильтрованной смеси,
состоящей из 0,5 г основного фуксина (насыщенного), 3,6 мл
0,1 М гидроортофосфата натрия, 1,4 мл 0,1 М дигидроортофос-
фата натрия и 95 мл дистиллированной воды (рН 7,2) 5 мин.
3. Окунают на 5 с в 0,5 % водный раствор лимонной
кислоты.
4. Тщательно промывают в водопроводной воде.
5. Докрашивают 0,1 % водным раствором метиленового
синего 1 —2 мин или 1 % раствором 10 с.
6. Ополаскивают в воде, высушивают и исследуют при
иммерсии.
Результат: риккетсий окрашиваются в красный цвет, клетки
и бактерии — в синий различных оттенков.
Часто используют также красящую смесь Гимзы. Ею можно
окрашивать при рН 7,2 — 7,4, а затем дифференцировать в
подкисленной воде до тех пор, пока эритроциты не станут
розовыми, или при рН 6,5 — 6,0 с последующим промыванием и
высушиванием мазков.
Выявление риккетсий в срезах (метод Ника)
Материал фиксируют 10 % нейтральным формалином,
заливают в парафин, депарафинированные срезы доводят до воды.
1. Окрашивают водным раствором метилового фиолетового
(1:10 000) 30-60 мин.
2. Дифференцируют в слабой уксусной кислоте (две капли
ледяной уксусной кислоты на 100 мл дистиллированной воды)
до тех пор, пока цитоплазма не обесцветится.
3. Докрашивают водным раствором метилового желтого
(1:10 000) несколько секунд.
4. Обезвоживают и просветляют в ацетоне и ксилоле.
5. Заключают в синтетическую смолу.
Результат: риккетсий пурпурно-фиолетовые, ядра клеток
желтые.
ГЛАВА 19
КУЛЬТИВИРОВАНИЕ КЛЕТОК И ТКАНЕЙ
Клеточные культуры находят все более широкое применение в
разных областях биологии и медицины. Их используют при
решении таких общебиологических проблем, как выяснение
механизмов дифференцировки и пролиферации, взаимодействия
клеток со средой, адаптации, старения, биологической
подвижности, злокачественной трансформации и др. Важную роль
играют клеточные культуры в биотехнологии при производстве
вакцин и биологически' активных веществ. Культуры клеток
применяют для диагностики и лечения наследственных
заболеваний, в качестве тест-объектов при испытании новых
фармакологических веществ.
Использование культивируемых клеток вне организма для
диагностики болезней является логическим продолжением
метода биопсии, при которой изъятый из организма фрагмент ткани
подвергают немедленному (преимущественно
морфологическому) исследованию. Однако благодаря культивированию
возможности исследования и диагностики расширяются
практически беспредельно, так как имеется возможность оценки не
только морфологических и биохимических изменений, но также
изменений в поведении клеток, их реакций на различные агенты,
в том числе на лекарственные воздействия. Воспроизведение
культивируемыми клетками в ряду поколений какого-либо
дефекта или изменения, свойственного клеткам т у1уо,
свидетельствует о наследственной природе этого дефекта или изменения.
Именно благодаря этому обстоятельству культивируемые
клетки являются ценным объектом физиологической генетики. В
последнее время возрос интерес к работе с культивируемыми
клетками, особенно у специалистов по применению монокло-
нальных антител, получаемых методами гибридомной
технологии.
ОРГАНИЗАЦИЯ ЛАБОРАТОРИИ КУЛЬТУРЫ ТКАНИ
Технические средства, предназначенные для лаборатории
культуры клеток и тканей, должны образовывать определенную
систему. При подборе оборудования полезно составлять так
называемые номенклатурные перечни. При этом все технические
средства группируют по их месту в процессе работ с клеточны-
323
ми культурами: 1) приборы и устройства, обеспечивающие
работу с клеточными культурами; 2) приборы и устройства для
культивирования клеток; 3) микроскопы; 4) устройства для
криоконсервации и хранения клеточных культур.
Приборы
Для получения сверхчистой и обще лабораторной воды,
используемой для приготовления питательных сред, мытья посуды,
предназначенной для выращивания культур тканей и других
целей, применяют установки ОВ-1, ОВ-2, ОВ-3. Установка
ОВ-1 представляет собой последовательно соединенные
установки ОВ-2 и ОВ-3.
В практике работ с клеточными культурами часто возникает
необходимость в массовом дозировании, отборе проб или
разведении биологически активных жидкостей. Величина единичной
дозы в большинстве случаев находится в диапазоне от 1 мкл до
10 мл. Жесткие требования предъявляют также к точности и
воспроизводимости разовой дозы. Значительно облегчает
проведение этой технологической операции использование
автоматических или полуавтоматических устройств, которые в разных
источниках называют дозаторами-дилюторами,
автоматическими пипетками и т.п.
Пипетки лабораторные ПЛ-01 позволяют осуществлять
полуавтоматическое дозирование биологически активных
жидкостей. Конструкция пипеток исключает возможность контакта
разливаемых жидкостей с рабочим элементом пипетки.
Дозируемую жидкость набирают в специальный сменный наконечник
конической формы. В поставляемый набор входят пипетки трех
видов: ПЛ-01-20 (величина дозы в диапазоне от 2 до 20 мкл,
основная погрешность дозирования ±0,2 мкл, сходимость
дозирования ±0,4 мкл), ПЛ-01-200 (соответственно 20 — 200 мкл,
±1 мкл, ±2 мкл), ПЛ-01-1000 (соответственно 200—1000 мкл,
±5 мкл, ±10 мкл). Сменные наконечники можно подвергнуть
паровой стерилизации при ПО °С и повторно использовать.
Комплект дозаторов пипеточных типа КДП-1 для
полуавтоматического дозирования биологически активных жидкостей,
набираемых в сменные наконечники, состоит из 8 моделей,
каждая из которых обеспечивает выдачу двух фиксированных доз
(5 и 10, 20 и 25, 50 и 75, 50 и 100, 75 и 150, 200 и 300, 250 и
300, 600 и 1000 мкл). Сменные наконечники можно подвергнуть
паровой стерилизации при 121 °С и повторно использовать.
Пипетки, входящие в комплект, различаются цветной
маркировкой.
За рубежом широко применяют устройства, относящиеся к
малой лабораторной технике, не являющиеся по своей сути
дозаторами, но значительно облегчающие этот процесс и
делающие его более безопасным для оператора. Речь идет о так назы-
324
ваемых приборах «Р1рес1-А1с1», которые предназначены для
отбора проб и выдачи дозы при работе с пастеровскими
пипетками и любыми градуированными пипетками емкостью до 75 мл.
Пипетку вставляют в специальный держатель, соединенный с
малогабаритным вакуумным насосом. Отбор проб и
дозирование проводят путем создания вакуума или избыточного
давления в пипетке. Оператор управляет работой прибора с помощью
кнопок, размещенных на держателе. Скорость набора и выдачи
дозы регулируют с помощью установки производительности
насоса или силой нажатия соответствующих кнопок управления.
В данных приборах предусмотрена защита от попадания
дозируемой жидкости в прибор, а также имеются воздушные
фильтры, исключающие загрязнение дозируемой жидкости при
выдаче дозы.
Устройства для приготовления питательных сред
Одним из основных требований к жидким питательным средам
для клеточных культур является их стерильность, достигаемая,
в частности, с помощью так называемой стерилизующей
фильтрации, освобождающей питательные среды от примесей,
бактерий и коллоидов.
Различают микро- и ультрафильтрацию сред. При
микрофильтрации из жидкости удаляют частицы примесей и бактерии
размером от 0,25 до 10 мкм. Ультрафильтрация позволяет
извлечь из раствора очень мелкие частицы и коллоиды, а также
молекулы растворенных веществ с молекулярной массой от
1000 до 1 000 000.
Мембранные фильтры, пригодные для очистки питательных
сред, производят ряд фирм. Наиболее широкое применение в
практике нашли миллипоровые фильтры. Размеры мембранных
фильтров (13, 25, 47, 90, 142 и 293 мм) стали в какой-то мере
стандартными.
Для фильтрации средних по объему количеств питательных
сред (25 — 50 л) наиболее удобны установки с мембранными
фильтрами диаметром 90 и 142 мм. В общем случае установка
для стерилизующей фильтрации состоит из системы,
предназначенной для создания избыточного давления на фильтруемую
жидкость, стерилизуемого держателя фильтра, фильтрующей
мембраны, трубопроводов и сосудов для размещения
фильтруемой жидкости и фильтрата.
При подборе и расчете фильтрующей системы рекомендуется
предварительно сформулировать задачу (вид среды,
подлежащей фильтрации, ее температура, вязкость, химический состав,
размер частиц, подлежащих фильтрации, режим фильтрации —
непрерывный или порционный и т.п.) и подобрать
соответствующие мембрану и держатель, а также определить величину
избыточного давления, необходимого для фильтрации.
325
Приборы и устройства для культивирования клеток
Стерильность при работе с культурами клеток обычно
достигается путем проведения исследования в так называемом
боксовом помещении. Для создания боксовых помещений, как
правило, необходимы значительные затраты. Альтернативой в этом
случае является использование так называемых ламинар-бок-
сов, или стерильных рабочих мест: в любом помещении может
быть создан локальный стерильный объем, необходимый для
работы и создающий биологическую защиту пользователей.
Технически задачу решают путем постоянного обдува места
проведения работ (например, стола) ламинарным потоком
воздуха, в 1 дм3 которого содержится не более 4 частиц
загрязнителей величиной 0,3 — 0,5 мкм. Избыточное давление воздуха в
рабочем объеме и специальные конструктивные меры
исключают возможность попадания воздуха из помещения в то место,
где расположен биологический материал. Ламинар-бокс с
горизонтальным потоком обеспыленного воздуха типа УО-БГ
(установка обеспыливания биологическая с горизонтальным
потоком) обеспечивает очистку воздуха, подаваемого в рабочую
зону, до необходимого уровня. Очистку производят с помощью
фильтров грубой и тонкой очистки, встроенных в прибор.
Ламинар-бокс типа БП-4-004 («Бокс-Р»), предназначенный
для работ с потенциально патогенными культурами,
обеспечивает подачу в рабочую зону ламинарного потока воздуха, в
1 дм3 которого содержится не более 3 — 4 частиц размером более
0,3 мкм. В приборе предусмотрена так называемая
рециркуляция воздушного потока, заключающаяся в том, что воздух из
рабочего объема попадает на специальный фильтр тонкой
очистки, откуда часть его выходит в окружающее пространство,
а остальной поток повторно проходит через фильтр тонкой
очистки и вновь поступает в рабочий объем. Благодаря этому
исключается вынос обрабатываемого материала в помещение.
Возможность попадания выходящего воздуха на оператора
предотвращают путем создания зоны подсоса на открытой
стороне рабочего объема бокса. Перечисленные ламинар-боксы
предназначены для размещения в любых производственных
помещениях, имеющих приточную вентиляцию с предварительной
грубой очисткой воздуха.
Лабораторные термостаты для культивирования клеток
должны отвечать определенным требованиям: обеспечивать
высокую стабильность заданной температуры, создавать
минимальный градиент температуры по полезному объему, иметь
систему быстрого восстановления температуры после
кратковременного охлаждения. Внутренняя поверхность термостатов
должна быть изготовлена из биологически пассивных
материалов, т.е. не влияющих на жизнедеятельность клеток и стойких к
воздействию компонентов питательных сред. Материалы, из ко-
326
торых изготавливают внутренние и наружные части термостата,
и покрытия должны выдерживать деконтаминацию водными
растворами спирта-ректификата и стерилизацию УФ-излучени-
ем.
Современные модели этих приборов имеют полезный объем
от 20 до 1400 л. Полезный объем образуется полированными
пластинами из нержавеющей стали или меди (у дорогих
моделей). Как правило, термостаты имеют наружную и внутреннюю
двери. Последнюю изготавливают из прозрачного материала,
что позволяет наблюдать за содержимым термостата без
нарушения температурного режима. Многие модели подобных
приборов имеют секционную внутреннюю дверь, обеспечивающую
доступ в термостат с минимальным нарушением теплового
режима в полезном объеме.
Температуру в рабочей камере термостатов обычно можно
задавать в диапазоне от превышающей комнатную на 5 °С до
80 °С. В некоторых моделях термостатов имеется встроенная
холодильная установка, позволяющая задавать температуру в
диапазоне от -10 до 80 °С и поддерживать ее при помещении в
полезный объем приборов, выделяющих дополнительное тепло,
например роллерных установок, встряхивателей и т.п.
В связи с необходимостью поддержания постоянного рН
питательной среды и ее минимального испарения в период
инкубации клеток были созданы специальные приборы,
предназначенные для этой цели,— так называемые углекислотные
инкубаторы. По своей конструкции и основным параметрам они
полностью соответствуют описанным выше термостатам. Основным
отличием является наличие систем создания и поддержания
определенного состава газовой среды в полезном объеме и высокой
относительной влажности в нем.
В газовой среде камер углекислотного инкубатора повышена
концентрация кислорода и углекислого газа, в большинстве
случаев только углекислого газа; концентрацию задают в
зависимости от условий культивирования и поддерживают
автоматически с точностью до ±0,1 %. Современные модели этих
приборов позволяют регулировать количество кислорода и
углекислого газа в диапазоне от 1 до 95 об.%.
Известно, что принудительное перемешивание питательных
сред с помещенными в них культурами клеток обеспечивает
лучший газообмен и, следовательно, повышает эффективность
культивирования. Во многих случаях этот эффект возрастает
при сочетании перемешивания и поддержания температуры,
оптимальной для данной культуры. Приборы, осуществляющие
эту операцию, называются лабораторными встряхивателями.
Конструктивно они состоят из платформы, на которой крепят
сосуды, заполненные суспензией, и приводного механизма,
обеспечивающего вращательное или возвратно-поступательное
движение платформы. В случае необходимости платформу по-
327
мещают в воздушный термостат или водяную баню. Эти
приборы относятся к сложным и дорогим техническим устройствам,
что связано со специальными требованиями к их работе,
основным из которых является строгое плоско-параллельное
перемещение платформы без толчков и вибрации. Кроме того, при
вращательном движении диаметр этого перемещения должен
быть одинаков в любой точке платформы. Заданные параметры
встряхивания (перемешивания), например радиус вращения,
должнц быть постоянными. Платформу приводят в движение с
помощью электродвигателя через систему кинематических
передач или путем приложения к платформе магнитного поля.
Большинство современных приборов этого вида имеет
следующие характеристики: частота возвратно-поступательных
движений платформы 10 — 300 колебаний в 1 мин, частота
вращательных движений платформы 40 — 400 об/мин, радиус
вращения 20— 25 мм, ход возвратно-поступательного движения
10 — 40 мм, стабильность поддержания заданных параметров не
менее ±1 % от заданной величины.
Большинство моделей встряхивателей позволяет
осуществлять перемешивание в одном режиме — вращательном или
возвратно-поступательном. Наиболее современные модели
являются универсальными, т.е. могут работать в любом из
приведенных режимов перемешивания.
Микроскопы
Для оперативного получения качественной информации о
состоянии культивируемых клеток используют специальные
инвертированные микроскопы. Принцип инвертированности
(перевернутости) заключается в том, что объект наблюдения освещается
сверху, а наблюдение ведется через объективы, расположенные
под объектом. Это позволяет наблюдать за живыми клетками в
культуре, т.е. непосредственно в сосудах, где происходит
процесс их роста. В микроскопах с обычной оптической схемой
исключается возможность помещения таких сосудов между
столиком и объективом из-за недостаточности этого расстояния.
Происхождение и характеристика клеток
Перечень типов клеток, которые в настоящее время можно
культивировать, достаточно велик. Это элементы
соединительной ткани (фибробласты), скелетные ткани (кость и хрящи),
скелетные, сердечная и гладкие мышцы, эпителиальные ткани
(печень, легкие, молочная железа, кожа, мочевой пузырь,
почки), клетки нервной системы (глиальные клетки и нейроны,
хотя последние лишены способности к пролиферации),
эндокринные клетки (надпочечники, гипофиз, клетки островков
Лангерганса), меланоциты и различные типы опухолевых кле-
328
ток. Для того чтобы клетки пролиферировали, они должны
происходить скорее от недифференцированных
клеток-предшественников, чем от полностью дифференцированных клеток,
способность которых к пролиферации в норме утрачивается.
Однако популяция необязательно должна быть гомогенной и
обладать фиксированным фенотипом. Некоторые культуры,
например кератиноциты эпидермиса, содержат стволовые клетки,
клетки-предшественники и кератинизированные чешуйчатые
клетки. В такой культуре происходят постоянное обновление за
счет стволовых клеток, пролиферация и созревание клеток-
предшественников, терминальная необратимая дифференциров-
ка, сопровождающаяся «слущиванием» чешуйчатых клеток в
культуральную среду. Культуры других клеток, например фиб-
робластов, представляют собой относительно однородную
популяцию пролиферирующих клеток при низкой плотности
монослоя (~104 клеток на 1 см2) и столь же однородную популяцию
более дифференцированных, непролиферирующих клеток при
высокой плотности монослоя (105 клеток на 1 см2). Эта
популяция фиброцитоподобных клеток при высокой плотности
монослоя способна к возвращению в клеточный цикл в результате
трипсинизации, снижающей плотность клеток в монослое, или
соскабливания части клеток, приводящего к появлению
свободного края монослоя.
Дифференцировка и пролиферация клеток регулируются не
только плотностью монослоя, но и питательными факторами
среды (сыворотка, Са2+), гормонами, взаимодействием с
внеклеточным матриксом.
Дифференцировка
Ведение клеточных линий требует постоянного увеличения
количества клеток, поэтому выбор условий культивирования
направлен на обеспечение максимальной скорости клеточной
пролиферации. Эти условия, как правило, неблагоприятны для
дифференцировки клеток, при которой их рост существенно
ограничивается или полностью подавляется. К условиям,
способствующим размножению клеток, относятся их низкая
плотность, невысокая концентрация Са2+, присутствие ростовых
факторов, таких как фактор роста эпидермиса, фактор роста
фибробластов и фактор роста, синтезируемый тромбоцитами.
Высокая плотность клеток (выше 105 клеток на 1 см2) и
концентрация Са2+ (300—1500 мкмоль), присутствие индукторов
дифференцировки (гормоны, например гидрокортизон, фактор
созревания глии, фактор роста нервов, ретиноиды и полярные
растворители, в частности диметилсульфоксид) способствуют
прекращению клеточного деления и индуцируют дифференци-
ровку клеток. Низкие концентрации сыворотки способствуют
дифференцировке олигодендроцитов, но для дифференцировки
329
бронхиального эпителия в ороговевающий используют высокие
концентрации сыворотки.
Большое значение, особенно для эпителия, имеет
установление правильной полярности клеток и их формы. Клетки,
растущие на взвеси коллагенового геля, смываются питательной
средой со всех сторон, и это позволяет устанавливать правильную
полярность относительно базальной мембраны, а также
поддерживать правильную форму клеток благодаря субстрату.
Органная культура клеток
Исходно тканевыми культурами называли эксплантаты целых
фрагментов тканей, полагая, что в этих фрагментах, по крайней
мере частично, поддерживается гистологическая целостность. В
настоящее время «культура ткани» превратилась в общее
понятие, включающее в себя как органную культуру, в которой
небольшие фрагменты ткани или целые эмбриональные органы
эксплантируются с сохранением тканевой архитектоники, так и
культуру клеток, в которой ткани диспергируются
механически, ферментативно или путем спонтанной миграции клеток из
эксплантации и клетки размножаются в виде суспензии или
монослоя, прикрепившегося к субстрату клеток.
При выборе того или иного типа культуры следует
принимать во внимание следующее. Органная культура сохраняет
межклеточные взаимодействия, в течение долгого периода
времени поддерживает гистологическую и биохимическую диффе-
ренцировку и после начальной травмы эксплантации и ряда
центральных некрозов остается, как правило, в нерастущем
равновесном состоянии в течение нескольких дней и даже
недель.
Культуры клеток, наоборот, как правило, лишены
структурной организации, теряют характерную гистиотипическую
архитектонику и связанные с ней биохимические признаки и обычно
не достигают равновесного состояния в отсутствие
определенных условий. Клетки в культурах размножаются, что
обеспечивает получение большой массы клеток и их разделение на
идентичные параллели. Культивируемые клетки могут быть
охарактеризованы, и определенная клеточная популяция может быть
сохранена путем замораживания. Клетки идентифицируют по
фенотипическим признакам, путем выращивания в селективной
среде, физического отбора, клонирования или генотипически
для получения относительно однородной линии клеток.
Источник ткани
Культуры, полученные из эмбриональных тканей, как правило,
характеризуются лучшей выживаемостью и более активным
ростом по сравнению с культурами из соответствующих «взрос-
330
лых» тканей. Это отражает, по-видимому, более низкий
уровень специализации и наличие реплицирующихся
клеток-предшественников или стволовых клеток в эмбрионах. «Взрослые»
ткани, как правило, характеризуются пониженным пролифера-
тивным пулом и более высоким содержанием неделящихся
специализированных клеток, часто ассоциированных с более
структурированным и слабо дезагрегирующим внеклеточным
матриксом. Получение первичных культур клеток «взрослых»
тканей и их размножение являются более сложной задачей, и
продолжительность жизни таких культур, как правило,
невелика.
В качестве примеров широко используемых линий
эмбриональных клеток можно привести различные линии ЗТЗ
(мышиные эмбриональные фибробласты), линию МКС-5 и другие
линии эмбриональных легочных фибробластов человека.
Клетки мезодермального происхождения (фибробласты, клетки
эндотелия, миобласты) легче культивировать, чем эпителиальные
клетки, нейроны и клетки эндокринных тканей.
Нормальные клетки, как правило, дают начало культурам с
ограниченной продолжительностью жизни, тогда как культуры
клеток, полученных из опухолей, способны пролиферировать
неограниченно долго. Известно, однако, несколько линий
неограниченно пролиферирующих клеток (клетки почки собаки,
фибробласты ЗТЗ), которые не прививаются при введении
животным, т.е. не являются опухолеродными.
Нормальные клетки обычно растут как
недифференцированные стволовые клетки или клетки-предшественники, и
наступление дифференцировки в такой культуре часто
сопровождается полным прекращением пролиферации клеток. Некоторые
нормальные клетки, например фибробласты и клетки
эндотелия, способны дифференцироваться, затем дедифференциро-
ваться, возобновлять пролиферацию и вновь
дифференцироваться. Другие, например клетки ороговевающего эпителия и
многие кроветворные клетки, после инициации
дифференцировки не способны к возобновлению пролиферации.
В культурах клеток, полученных из опухолей, возможна
дифференцировка, по крайней мере частичная, при
сохранении способности к пролиферации. Опухолевые ткани часто
могут пассироваться на сингенных хозяевах, и это
обеспечивает простое и дешевое получение большого количества клеток,
хотя полученные популяции могут быть недостаточно
гомогенны. В случае отсутствия природных хозяев опухоли можно
пассировать на бестимусных мышах. Многие другие различия
между нормальными и злокачественными клетками
аналогичны различиям между ограниченными и постоянными линиями
клеток; имеются данные о важности приобретения
«бессмертия» в неопластической трансформации клеток [Ьапс! Н.,
1983].
331
Субкультивирование
Свежевыделенные культуры носят название «первичные» до
начала пассирования или субкультивирования. Клетки
первичной культуры обычно гетерогенны и характеризуются малым
пролиферативным пулом, но в них наиболее полно
представлены типы клеток той ткани, откуда они были получены, а также
четко обнаруживается экспрессия ряда свойств, присущих
данной ткани. Субкультивирование обеспечивает возможность
продления существования культуры (в результате
субкультивирования получают линии клеток), возможность клонирования,
исследования и сохранения клеток, а также получения более
однородных популяций. При этом во многих случаях
субкультивирование приводит к потере специализированных клеток и
дифференцировочных признаков.
Основным преимуществом получения клеточных линий из
первичных культур является наработка большого количества
стабильного материала, пригодного для продолжительного
использования.
ВЫБОР СРЕДЫ
Среду, к сожалению, часто выбирают чисто эмпирически. Это
не столь важно для постоянных линий клеток, но при работе со
специализированными клетками, с первичными культурами,
при выращивании клеток в отсутствие сыворотки выбор среды
может иметь принципиальное значение.
Использование более сложных сред в отсутствие сыворотки
имеет два преимущества: такие среды могут быть селективными
для определенного типа клеток, а отсутствие сыворотки
облегчает выделение из среды требуемых продуктов клеточного
метаболизма. Тем не менее культивирование в присутствии
сыворотки проще и, как ни странно, часто оказывается не более
дорогим, хотя, конечно, труднее контролируется. Две основные
причины все еще ограничивают применение бессывороточных сред:
1) очень медленно увеличивается выпуск коммерческих
ингредиентов таких сред (не многие исследователи способны
изготовлять среды собственными силами); 2) потребности в
бессывороточной среде в большей степени зависят от типа используемых
клеток. Сыворотка нивелирует многие недостатки среды,
которые могут проявляться в ее отсутствие. Проблема может стать
особенно острой при культивировании опухолевых клеток; для
клеточных линий, происходящих из разных опухолей, может
требоваться модификация культуральной среды.
ГАЗОВАЯ ФАЗА
Состав газовой фазы определяется тремя факторами: 1) типом
среды; 2) использованием открытых (чашки Петри, многолу-
332
ночные чашки) или закупоренных (флаконы, бутылки) культу-
ральных сосудов; 3) требуемой буферной емкостью. Некоторые
параметры культивирования могут варьировать, но необходимо
соблюдать одно главное правило — концентрация
гидрокарбоната и парциальное давление углекислого газа должны
находиться в равновесии.
СУБСТРАТ
Природа субстрата зависит в основном от типа используемых
клеток и характера проводимых исследований. Почти повсеместное
распространение получил полистирол, обработанный таким
образом, чтобы увеличить смачиваемость и придать поверхности
отрицательный заряд. В особых случаях (культуры нейронов,
мышечных клеток и некоторые культуры эпителиальных клеток)
пластиковую поверхность покрывают желатином, коллагеном или
полилизином для придания ей положительного заряда. Может
быть использована и стеклянная посуда, но она должна быть
тщательно вымыта с применением нетоксичных детергентов.
Культуральные сосуды различаются по размеру — от
многолуночных пластинок Тераски (площадь поверхности - 1 мм2,
объем среды 5—10 мкл) и микротитровальных пластинок (~30
мм3/100 — 200 мкл) до набора чашек и флаконов с площадью
поверхности до 180 см2 и вращающихся бутылей.
Определяющими факторами при выборе культуральной посуды являются
требуемое количество клеток (максимальная плотность
большинства трансформированных культур 5-Ю4 —5-Ю5 клеток/см2).
Чашки с 24 лунками удобны при большом количестве
параллелей и одновременном отборе образцов, но в тех случаях, когда
отбор образцов проводят в разное время, предпочтительнее
использовать индивидуальные флаконы или бутыли. Чашки
Петри дешевле флаконов и достаточно удобны для
последующей обработки клеток, например окрашивания или экстракции.
Флаконы могут быть герметично закрыты, при этом не
требуется инкубатор с продувкой углекислым газом, кроме того, при
использовании флаконов снижается опасность заражения
культур. В случае суспензионных культур определяющим фактором
является объем сосуда. При увеличении объема может быть
затруднено перемешивание и ухудшиться аэрация культур.
ПОДГОТОВКА
Во многих лабораториях для культур тканей используют
пластмассовую посуду одноразового применения. Эти сосуды
оптически прозрачны и подготовлены для использования при
культивировании тканей путем модификации пластика,
увеличивающей его смачиваемость и облегчающей прикрепление клеток.
Некоторые культуральные сосуды выпускают уже стерилизо-
333
ванными. В целом пластмассовую посуду удобно применять и в
процессе выращивания клеток, и для решения
экспериментальных задач, однако одноразовая культуральная посуда дорогая.
Мытье стеклянной культуральной посуды
Для пассирования постоянных и многих ограниченных линий
клеток подходит стеклянная культуральная посуда, если есть
условия для мытья посуды и возможность контроля его
качества. Посуду нужно выдержать в растворе нетоксичного
детергента, предпочтительно в течение ночи, и после этого тщательно
промыть проточной, а затем деионизованной или
дистиллированной водой.
Стерилизация стеклянной посуды
Пластиковая посуда поступает стерильной, а стеклянную куль-
туральную посуду перед использованием необходимо простери-
лизовать. Во многих лабораториях проводят массовую
стерилизацию всей посуды независимо от ее непосредственного
использования для культивирования, что позволяет избежать ошибок
при выборе посуды.
Стерилизацию лучше проводить в сухожаровом
стерилизаторе (160 °С в течение 1 ч), помещая посуду в контейнеры или
заворачивая в фольгу. Завинчивающиеся крышки сосудов
стерилизуют отдельно. /
Качество посуды, процесс ее мытья и выбор детергента
следует периодически контролировать. Для этого промывают
посуду обычным образом, оценивают чистоту визуально,
высушивают, стерилизуют и используют для клонирования клеток в
монослое, предпочтительно при низкой концентрации сыворотки
(2 — 5 %) или в ее отсутствие.
Первичная культура
Первичная культура лишена многих клеток, присутствующих в
исходной ткани, поскольку не все клетки способны
прикрепиться к субстрату и выжить в условиях т уИхо. При пролиферации
культивируемых клеток происходит относительное обеднение
культуры неделящимися или медленно делящимися клетками,
поэтому может оказаться необходимым отбор специфических
типов клеток путем клонирования, селективного
культивирования или физического разделения клеток.
На первом этапе получения первичной культуры удаляют
фрагмент ткани животного в стерильных условиях и
подвергают его механической или ферментативной дезагрегации. Ткань
может быть просто измельчена до кусочков объемом около
1 мм3, которые прикрепляются к поверхности чашки благодаря
334
собственней адгезивности, наличию насечек на чашке или с
помощью сгустка плазмы. В этих случаях происходит рост клеток
из фрагментов и клетки, мигрирующие из эксплантатов, могут
быть исподьзованы для пассирования. Фрагменты ткани
(эксплантаты ^ожно переносить в новые чашки) и мигрирующие
клетки можно удалить путем трипсинизации, а, остающийся
эксплантат образует новые выросты. Трипсинизированные
клетки пересевают в новые сосуды, и они становятся вторичной
культурой. По формальным признакам такую культуру
называют «линией клеток».
Первичные культуры могут быть также получены путем
дезагрегации тканей ферментами, например трипсином (0,25 %
неочищенный или 0,01 — 0,05 % очищенный) или коллагеназой
(200 — 2000 ЕД/мл, неочищенная). Клетки образующейся при
этом суспензии оседают, прикрепляются к поверхности стекла
или пластика и распластываются на ней. Такой способ
получения культуры обеспечивает более высокий выход клеток; хотя
он кажется более селективным, поскольку только определенные
клетки переживают диссоциацию. На практике успешное
получение первичных культур из многих тканей, особенно из
эпителия, связано с использованием коллагеназы, при этом размер
эксплантата уменьшается до небольшого кластера клеток,
который затем прикрепляется к субстрату и разрастается.
Субкультивирование
Монослойная культура может быть перенесена во второй куль-
туральный сосуд после диссоциации клеток монослоя
трипсином и разведения. В случае субкультивирования суспензионных
культур достаточно разведения. Диссоциация клеток монослой -
ной культуры лучше всего достигается путем промывания
монослоя фосфатным солевым буфером (ФСБ) или ФСБ с 1 мМ
ЭДТА и последующей инкубации с холодным раствором
трипсина (0,25 % неочищенный или 0,01—0,05 % очищенный) в
течение 30 с. После этого трипсин удаляют, клетки
дополнительно инкубируют в течение 15 мин. Затем клетки суспензируют в
среде, определяют их количество и рассевают в новые флаконы.
Кривая роста
После посева клеток во флакон они входят в лаг-период
продолжительностью 2 — 24 ч, сменяющийся периодом
экспоненциального роста (логарифмическая фаза). В конце этого периода
клетки достигают плотного монослоя и входят в период
медленного роста или покоя (фаза плато). Эти фазы характерны для
всех клеточных линий и позволяют получить воспроизводимые
характеристики клеточных линий: продолжительность
лаг-периода, время удвоения популяции в середине логарифмической
335
фазы и насыщающую плотность клеток в моносл|ое в фазе
плато. Воспроизводимость этих характеристик возможна только
при постоянстве условий культивирования. 1
Определение параметров ростового цикла важно для
пассирования культуры и проведения экспериментов на культурах.
Поведение и биохимические свойства клеток заметно
различаются в разные фазы роста культуры, так что важно
контролировать стадию ростового цикла, в которой в культуру добавляют
различные препараты либо реагенты или проводят сбор клеток
для пересева. Форма кривой роста позволяет также получить
информацию о репродуктивном потенциале культуры. Не
вызывает сомнения тот факт, что клональный анализ прост и
позволяет сделать более однозначные и правильные выводы.
ЗАРАЖЕНИЕ КУЛЬТУРЫ КЛЕТОК
Опасность микробного заражения культур в значительной мере
снижается благодаря использованию антибиотиков и
ламинарных боксов. Однако следует по мере возможности избегать
культивирования клеток с антибиотиками, поскольку проблема
хронического латентного заражения все еще остается острой.
Следует как можно чаще проводить визуальную оценку
микробного заражения культуры по быстрому изменению рН. Как
правило, заражение сопровождается снижением рН, хотя
некоторые грибы могут индуцировать увеличение рН. Заражение
может привести также к помутнению среды, появлению
межклеточного грануляционного материала, обнаруживаемого при
микроскопическом исследовании, и взвешенного в среде неиден-
тифицированного материала. Во всех этих случаях культураль-
ные сосуды изолируют, не вынимая пробки, и автоклавируют.
Источником заражения микоплазмой при культивировании
клеток могут быть культура л ьная среда, сыворотка, трипсин
или сам исследователь. Заражение не выявляется визуально, и,
поскольку оно не приводит к изменению роста культуры,
заражение микоплазмой часто остается незамеченным. Следует
регулярно (один раз в 1 —3 мес) проверять культуры на наличие в
них микоплазм, поскольку такое заражение значительно
изменяет биохимию клеток, их антигенные свойства и параметры
роста культуры. Предложено несколько методов выявления
микоплазм, но наибольшее распространение получил метод
флюоресцентного окрашивания ДНК по методу Чена.
ПОЛУЧЕНИЕ И КУЛЬТИВИРОВАНИЕ ЭПИДЕРМОЦИТОВ
1. Полученный дерматомный срез помещают в пробирку,
содержащую среду Игла + пенициллин (25 000 ЕД/мл) +
стрептомицин (25 000 ЕД/мл) + фунгизон (50 ЕД/мл),— до 24 ч
при комнатной температуре.
336
2. Отмывают в среде Игла до тех пор, пока среда не станет
прозрачной.
3. Помещают ЭДТА на 20 мин при комнатной температуре.
4. Переносят в трипсин (0,05 % или 0,25 %) на 18 ч при
+4 °С.
5. Фермент сливают и добавляют сыворотку для
нейтрализации фермента.
6. Выделяют эпидермоциты в чашке Петри в сыворотке.
7. Центрифугируют при 1000 об/мин 5 мин.
8. Осадок ресуспендируют в среде Игла (без Са2+).
9. Суспензию клеток вносят в пластмассовые, покрытые
коллагеном или гидрофильные чашки (из расчета не менее 70 000 —
100 000 на 1 см2).
10. Сменяют среду 2 раза в неделю до формирования
монослоя.
ПОЛУЧЕНИЕ И КУЛЬТИВИРОВАНИЕ ФИБРОБЛАСТОВ
1. Дерму после удаления эпидермиса путем трипсинизации
измельчают ножницами в пенициллиновый флакон.
2. К гомогенату добавляют раствор коллагеназы (готовят на
среде, активность коллагеназы от 0,28 до 630 ЕД/мл) и
инкубируют в нем.
3. Фермент нейтрализуют путем добавления среды с 10 %
сыворотки.
4. Центрифугируют при 1000 об/мин 5 мин.
5. Осадок ресуспендируют в среде (Игла и др. с обычными
добавками).
6. Подсчитывают клетки в камере Горяева (20 000 клеток на
1 см2).
7. Суспензию клеток переносят в культуральные чашки.
8. Сменяют среду на следующий день.
9. Проводят дальнейшее культивирование до формирования
монослоя.
ВЫДЕЛЕНИЕ КОЛЛАГЕНА И ПОКРЫТИЕ ИМ ПОВЕРХНОСТИ
КЛЕТОК ДЛЯ УСКОРЕНИЯ ИХ РОСТА
Коллаген I типа может быть получен с помощью метода,
предложенного 5. 51:гот и соавт. (1982), из сухожилий, связанных с
позвонками хвоста крыс.
1. Разрезают свежевыделенные или замороженные и
оттаявшие хвосты продольно от основания до конца.
2. Удаляют кожу и кровеносные сосуды.
3. Берут белые коллагеновые волокна и стерилизуют их с
помощью ультрафиолетового излучения.
337
4. Помещают 1 г коллагеновых волокон (из 3 — 4 хвостов) в
300 мл 0,1 М уксусной кислоты и оставляют перемешиваться
при 4 °С в течение 48 ч.
5. Фильтруют раствор через 2 — 3 слоя стерильной марли.
6. Разводят полученный раствор в 20 раз бидистиллирован-
ной водой.
7. Покрывают раствором дно пластиковой чашки и
высушивают на воздухе (1—2 дня при температуре, не превышающей
37 °С). Чашки можно хранить во влажной атмосфере при 4 °С в
течение нескольких месяцев.
Исходный маточный раствор коллагена может быть также
нейтрализован и разведен культуральной средой. В этом случае
коллаген образует гель благодаря повышению рН и
концентрации солей. Денатурированный (высушенный на воздухе)
коллаген облегчает прикрепление клеток (например, клеток
эндотелия и скелетных мышц), а нативный (неденатурированный)
коллаген может оказаться необходимым для правильной фено-
типической экспрессии.
ОБРАБОТКА ПОВЕРХНОСТИ КЛЕТОК ФИБРОНЕКТИНОМ
ДЛЯ УСКОРЕНИЯ ИХ РОСТА
Фибронектин может быть получен с помощью метода,
предложенного В. ОЬппк (1982), из свежей плазмы человека, не
обработанной гепарином, в условиях подавления протеолитической
активности фенилметилсульфонилфторидом. Можно
использовать также коммерческие препараты фибронектина.
Фибронектин применяют в количестве 1 — 5 мкг на 1 см2 поверхности
культуральной посуды.
1. Растворяют при осторожном помешивании 20 мкг лиофи-
лизованного фибронектина в 1 мл бидистиллированной воды.
2. Покрывают полученным раствором дно чашки диаметром
35 мм и высушивают на воздухе при 40 °С.
3. Тщательно промывают чашки дистиллированной водой и
вновь высушивают на воздухе. Готовые чашки можно хранить
при комнатной температуре в течение нескольких месяцев.
ГЛАВА 20
ОКРАШИВАНИЕ НЕРВНОЙ ТКАНИ
При морфологических исследованиях нервной ткани на свето-
оптическом уровне применяют большое количество методов
окрашивания, многие из которых модифицированы. Чаще всего
это избирательные (элективные) методы, используемые для
выявления одного или двух элементов. С определенной целью
применяют комбинированные методы.
В настоящей главе представлены четыре группы методов
окрашивания: нервных клеток, нервных волокон, глиальных
элементов и комбинированные методы для выявления нескольких
элементов нервной системы.
ФИКСАЦИЯ
Основные принципы и приемы фиксации изложены в главе 2.
При изучении нервной ткани из простых фиксаторов наиболее
часто используют 10 — 20 % раствор формальдегида и 96 % и
100 % спирт, из фиксирующих смесей — сулему и пиридин.
Существуют также специфические фиксаторы, применяющиеся
только при исследовании элементов нервной ткани.
Фиксирующая смесь Рамон-и-Кахаля (для выявления
глии):
нейтральный формалин 15 мл
бромид аммония 20 г
дистиллированная вода 85 мл
Смесь применяют для серебрения глии по Рамон-и-Каха-
лю —Хортеге. Продолжительность фиксации тонких (до 1,5 см)
кусочков материала 2 — 15 дней. Промывание в проточной
воде.
Фиксирующая смесь Рамон-и-Кахаля (для выявления нейро-
фибрилл):
пиридин 40 мл
96 % спирт 30 мл
Продолжительность фиксации 2 ч. Промывание в проточной
воде в течение 1 ч.
339
ОБЕЗВОЖИВАНИЕ
Особенностью обработки нервной ткани является ее тщательное
обезвоживание. Для обезвоживания кусочков толщиной 5 —6 мм
используют следующую схему:
50 % спирт 2 ч
70 % спирт б ч
80 % спирт б ч
96 % спирт 6 ч
100 % спирт I 6 ч
100% спирт II 6 ч
Продолжительность обезвоживания 32 ч
НЕКОТОРЫЕ ОСОБЕННОСТИ ЗАЛИВКИ
НЕРВНОЙ ТКАНИ
Нервную ткань для гистологического исследования заливают в
парафин, целлоидин и желатин. Методика заливки в парафин и
целлоидин изложена в главе 3. Никаких особенностей
обработки нервной ткани на этой стадии нет.
Заливка в желатин по Снесареву
Метод пригоден для эмбриологических исследований.
Преимущество его заключается в том, что он не вызывает сморщивания
материала. Рекомендуется для выявления тонкой межклеточной
структуры соединительной ткани, а также для некоторых
цитологических исследований.
Для заливки берут бесцветный прозрачный пищевой
желатин и вначале из него готовят 25 % раствор. Для этого мелко
нарезают нужное количество желатина, насыпают в широкогор-
лую банку и ставят в термостат при 37 °С до растворения.
После этого часть приготовленного желатина разводят пополам
теплым 1 % раствором фенола (карболовой кислоты) и таким
образом получают 12,5 % раствор. Растворы желатина лучше
готовить в небольших количествах по мере надобности.
После фиксации тщательно промытый материал переносят в
12,5 % раствор желатина, где держат в зависимости от
величины кусочков от 1-2 ч до 1-2 сут, затем на такое же время
переносят в 25 % раствор желатина при 37 °С. После заливки
следуют быстрое охлаждение в холодильнике и уплотнение в
5— 10 % формалине. Блоки режут только на замораживающем
микротоме.
ОКРАШИВАНИЕ НЕЙРОНОВ
Окрашивание метиленовым синим, которое Ниссль [№зз1 Р.,
1894] положил в основу изучения эквивалентной картины нерв-
340
ных клеток, основано на перекрашивании фиксированных в
спирте срезов основным анилиновым красителем с
последующим отмыванием его избытка спиртом. При этом составные
части клеток сильнее удерживают краситель, чем масса
волокон, которая дифференцируется быстрее. В результате
интенсивно окрашенный клеточный материал резко выделяется на
бесцветном фоне. В окрашивании клеток участвуют как
ядерные структуры, так и вещества, находящиеся в цитоплазме
нервных клеток,— тигроидные глыбки; глыбки, или вещество
Нисс ля.
Под эквивалентной картиной клетки Р. №зз1 понимал
«картину микроскопической структуры имеющихся в ткани нервных
клеток животного, убитого определенным образом, которая
может быть закономерно воспроизведена при определенной
микротехнике обработки нервной ткани, находящейся в
определенных экспериментальных условиях».
Со временем метод Ниссля был упрощен. Даже основное
требование Р. №зз1 — фиксация препаратов этиловым
спиртом — выполняют частично, поскольку метод часто применяют
для обработки материала, фиксированного в формалине.
Однако в ответственных случаях следует рекомендовать по
возможности проводить окрашивание материала, который был
фиксирован по прописи в спирте. Что же касается указаний Р. №зз1 о
резании и окрашивании, то их вполне можно заменить без
ущерба для результата обычным спирт-целлоидиновым методом
и более контрастным окрашиванием толуидиновым синим или
тионином.
Метод Ниссля
Фиксация. Острыми ножницами вырезают кусочки ткани мозга
в форме кубиков и сразу, без соприкосновения с водой,
помещают в большое количество 96 % спирта. Кусочки не должны быть
ни слишком большими, ни слишком маленькими (длина сторон
не менее 1 см). Важно, чтобы кусочек ткани со всех сторон
омывался спиртом (положить на вату), который в 1-й день
нужно сменить по крайней мере 1 раз, в дальнейшем обновлять
каждые 2 дня.
Получение срезов. Через 5 дней блок обычно достигает
необходимой консистенции. Его сторону, предназначенную для
наклейки, ровно срезают острой бритвой так, чтобы толщина
блока не была более 6 — 8 мм, размер плоскости среза может
быть любым. На ровную поверхность деревянной колодки,
служащую для наклейки, наносят раствор гуммиарабика
консистенции меда. Поверхность кусочка мозга промокают
фильтровальной бумагой и легким нажимом вдавливают в раствор
гуммиарабика так, чтобы он всюду хорошо прилегал к деревянной
колодке. Затем блок переносят обратно в 96 % спирт, где гум-
341
миарабик белеет и быстро уплотняется. Через несколько минут
блок можно резать.
Блок режут косо поставленным ножом, смоченным спиртом,
причем стараются срезы толщиной 10—15 мкм по возможности
полностью расправить с помощью смоченной спиртом кисточки.
Срезы собирают в чашку с 96 % спиртом. Долго хранить их в
спирте нельзя, следует сразу же подготовить к окрашиванию.
Блок, наоборот, можно хранить в спирте довольно долго: для
этого его нужно снять с деревянной колодки.
Окрашивание срезов. Срезы окрашивают в часовом стекле с
красящим раствором, в состав которого входят 3,75 г метилено-
вого синего В, 1,75 г наскобленного венецианского мыла, 1 л
дистиллированной воды. Красящий раствор осторожно
подогревают до появления паров. Затем расправленные срезы
переносят для дифференцировки в свежеприготовленную смесь из
10 мл совершенно прозрачного анилинового масла и 90 мл 96 %
спирта. Дифференцируют до прекращения отхождения
крупных облачков краски. Затем срез помещают на предметное
стекло, просушивают гладкой фильтровальной бумагой, быстро
покрывают кайепутовым маслом, снова просушивают, поливают
бензином (не давать подсохнуть!) и покрывают канифолью с
ксилолом (насыщенный раствор канифоли в ксилоле).
Предметное стекло осторожно подогревают до испарения ксилола,
после чего на еще горячий слой канифоли накладывают
подогретое покровное стекло. Красящий раствор перед
использованием взбалтывают и фильтруют. Свежеприготовленный
красящий раствор должен созревать не менее 3 мес. Этот метод
является основной высокоспецифической методикой окрашивания
нервных клеток для изучения в них выраженных
патологических и структурно-функциональных изменений в световом
микроскопе. Основу его составляет способность выявлять с
помощью основных красителей специфичный для нейронов нуклео-
протеидный комплекс (тигроид), содержащейся в цитоплазме и
дендритах, а также другие комплексы РНК и основных белков
(ядрышко, хроматин ядра).
Упрощенный метод Ниссля
Фиксированный в спирте материал заливают в
спирт-целлоидин. Срезы собирают в 70 % спирт, где их можно хранить
долгое время.
Методика окраски
1. Расправленные срезы помещают в 0,1 % раствор толуиди-
нового синего или тионина, который после этого дважды
нагревают до появления паров.
2. После охлаждения ополаскивают в воде и 70 % спирте.
3. Дифференцируют в 96 % спирте.
342
4. Проводят через 100 % спирт, ксилол, бальзам или
окрашивают, как указано выше; дифференцируют в анилиновом масле
со спиртом.
5. Извлекают срезы на предметное стекло, просушивают
фильтровальной бумагой.
6. Просветляют кайепутовым маслом, затем масло сливают.
7. Просушивают, проводят через ксилол и заключают в
бальзам.
Результат: глыбки тигроида, ядерная оболочка и ядрышки
интенсивно синие или фиолетовые, цитоплазма ганглиозных и
глиальных клеток бледно-синяя, волокнистое нервное вещество
не окрашено.
Метод Ниссля в модификации Снесарева
Одновременно с нервными клетками на препаратах,
окрашенных по Нисслю, выявляются клеточные элементы мягкой
мозговой оболочки и ее сосудов, внутримозговых сосудов, ядра глии
и инфильтративные клетки, липофусцин, зеленый пигмент, 6а-
зофильные коагуляты в сосудах, протоплазменная реакция аст-
роцитов. Метод Ниссля также может быть использован для
предварительной диагностики нейроэктодермальных опухолей
и паразитарных поражений мозга.
Срезы материала, залитого в целлоидин, получают на
санном микротоме. Толщина срезов 8—10 мкм. Их хранят в 96 %
спирте.
Методика окраски
1. Срезы в 96 % спирте подогревают на водяной бане до
появления пузырьков и охлаждают.
2. Переносят в 0,2 % раствор тионина, подогревают до
появления паров и охлаждают.
3. Промывают в 2 сменах дистиллированной воды; проводят
через 2 смены 96 % спирта (до побледнения срезов) по 30 — 40 с
в каждой.
4. При недостаточной дифференцировке тионина в спиртах
проводят через эвкалиптовый спирт (10 мл 96 % спирта +
1 капля эвкалиптового масла) 3 — 5 с; тщательно ополаскивают
в 3 сменах 96 % спирта, проводят через спирт-ксилол (2 части
ксилола и 1 часть 96 % спирта), 100 % спирт-ксилол, ксилол.
5. Переносят на предметное стекло и заключают в бальзам.
6. Готовые препараты укладывают на доски и держат на
свету до просветления фона (контроль под микроскопом).
Раствор тионина готовят из 1 г тионина и 500 мл
дистиллированной воды. Тионин растирают в ступке в течение 45 —
60 мин, добавляя по каплям подогретую дистиллированную
воду. Затем доливают оставшуюся дистиллированную воду,
подогревают, доводят до кипения и фильтруют через 6 фильтров.
343
Перед использованием приготовленного раствора тионина его
также следует профильтровать. Использованный краситель
сливают в отдельный сосуд, так как он может быть вновь
использован.
Результаты: на светлом фоне выявляются нервные клетки
сине-фиолетового цвета различных оттенков.
Метод Ниссля отличается постоянством и большой
надежностью результатов. Основой его успешного использования
являются правильная фиксация материала и, что особенно важно,
тщательное обезвоживание в спиртах восходящей концентрации
при заливке в целлоидин или парафин. При несоблюдении этих
условий препараты дают неотчетливое изображение, имеют
зеленый оттенок и быстро обесцвечиваются.
ОКРАШИВАНИЕ НЕРВНЫХ ВОЛОКОН
Методика выявления миелиновой оболочки
по Шпильмейеру
Данная методика предназначена для элективного окрашивания
миелиновых оболочек нервных волокон. Одновременно в белом
веществе выявляется дренажная олигодендроглия.
Кусочки хранят в 10 % формалине, режут на
замораживающем микротоме (толщина срезов 15 — 20 мкм). Срезы можно
хранить также в 10 % формалине.
Методика окраски
1. Срезы промывают в 3 сменах дистиллированной воды.
2. Переносят на предметное стекло, смазанное смесью белка
с глицерином, и подсушивают на воздухе.
3. Погружают в 2,5 % раствор железоаммонийных квасцов
на 2 сут (можно дольше) и держат в темном месте.
4. Промывают в 3 сменах дистиллированной воды и
обезжиривают в 96 % спирте 15 — 30 мин.
5. Помещают в гематоксилин (15 мл гематоксилина Бемера и
85 мл дистиллированной воды) на 1 сут и держат на свету.
6. Промывают в 3 сменах дистиллированной воды и
дифференцируют в 2,5 % растворе железоаммонийных квасцов
(контролируя процесс под микроскопом).
7. Промывают в дистиллированной воде, затем оставляют на
30 мин в проточной воде.
8. Просушивают на воздухе, проводят через ксилол и
заключают в бальзам.
Гематоксилин Бемера готовят из двух растворов. Первый
раствор: 1 г гематоксилина в 10 мл абсолютного спирта; второй:
8 г алюмокалиевых квасцов растворяют при нагревании в
200 мл дистиллированной воды, после чего раствор остужают и
344
фильтруют. Через 1 сут после приготовления растворы
смешивают и дают смеси созреть на свету в широкогорлом открытом
сосуде 10—14 сут, после чего фильтруют и добавляют
несколько кристаллов тимола.
Раствор железоаммонийных квасцов: 2,5 г
железоаммонийных квасцов и 100 мл дистиллированной воды размешать и
профильтровать.
Результаты: на светлом слегка желтоватом фоне миелиновые
волокна темно-серо-синеватого оттенка; ядра дренажной олиго-
дендроглии в белом веществе того же оттенка.
В одном препарате редко удается одновременно выявить
касательные (тангенциальные) и проекционные волокна, потому
что для выявления миелиновых волокон разных систем (интра-
кортикальные, проекционные и спаечные) требуется различная
длительность дифференцировки срезов в железоаммонийных
квасцах. В связи с этим одно стекло со срезом, окрашенным
гематоксилином, с тем чтобы получить четкую архитектонику
волокон, а также тонкую структуру миелиновой оболочки
проекционных волокон, нужно более длительно дифференцировать
в 2,5 % растворе железоаммонийных квасцов, тогда как для
выявления архитектоники волокон и структуры миелиновой
оболочки касательных (тангенциальных) волокон другое стекло
со срезом, окрашенным гематоксилином, погружают в 2,5 %
раствор железоаммонийных квасцов на более короткий срок.
В процессе окрашивания могут появляться артефактные
контрастные белые пятна неокрашенной ткани. В таких случаях
срезы нужно более длительное время обезжиривать в 96 %
спирте.
Метод Шпильмейера в модификации Соколянского
Данный метод применяют для выявления миелиновых оболочек
нервных волокон. С его помощью более четко определяется
волоконная архитектоника и структура волокна, но хуже
окрашивается миелин. Одновременно окрашивается дренажная олиго-
дендроглия в белом веществе (при окраске головного мозга
крыс лучше применять модификацию Соколянского).
Материал фиксируют в формалине. Срезы толщиной 10 —
15 мкм получают на замораживающем микротоме.
Методика окраски
1. Срезы промывают в 3 сменах дистиллированной воды.
2. Переносят на смазанное белком покровное стекло и
подсушивают.
3. Помещают в насыщенный раствор бихромата калия на 24 ч
(можно на несколько суток) и держат на свету.
4. Ополаскивают в дистиллированной воде.
345
5. Переносят в 2,5 % раствор железоаммонийных квасцов и
держат в темноте 24 ч (можно дольше).
6. Ополаскивают в дистиллированной воде (необязательно).
7. Окрашивают в течение 24 ч (можно дольше) на свету в
гематоксилине (15 мл гематоксилина Бемера + 85 мл
дистиллированной воды).
8. Промывают в нескольких сменах дистиллированной воды.
9. Дифференцируют в 2,5 % растворе железоаммонийных
квасцов.
10. Промывают в дистиллированной и проточной воде,
проводят через 96 % спирт, карбол-ксилол, ксилол и заключают в
бальзам.
Результат: на сероватом фоне миелиновая оболочка
центральных нервных волокон сиреневая; ядра дренажной олиго-
дендроглии в белом веществе такого же оттенка.
Выявление миелиновой и нейрокератиновой оболочек
по Авцыну
Материал фиксируют в формалине, заливают в желатин. Срезы
толщиной до 10 мкм отмывают от формалина в 2 сменах
дистиллированной воды, затем помещают в спиртовой раствор пиридина
(чистый пиридин + 96 % спирт в соотношении 1:1) на 1 сут.
Методика окраски
1. Срезы промывают в 3 — 5 сменах дистиллированной воды
и помещают в 0,5 % раствор нитрата серебра.
2. Ополаскивают в 3 сменах дистиллированной воды.
3. Переносят в 10 % нейтральный формалин (3 порции, в
каждой по 3 мин).
4. Ополаскивают в 3 сменах дистиллированной воды.
5. Опускают в фосфорно-молибденовое серебро на 30 с.
6. Быстро ополаскивают в 2 сменах дистиллированной
воды.
7. Переносят в 10 % нейтральный формалин на 2 мин.
8. Погружают в дистиллированную воду, контролируя
процесс под микроскопом.
9. Переносят в фосфорно-молибденовое серебро (в той же
банке).
10. Помещают в 10 % нейтральный формалин на 2 мин.
И. Ополаскивают в дистиллированной воде.
12. Переносят в фосфорно-молибденовое серебро (так до 3 —
4 раз, а для выявления тангенциальных волокон — до 7 раз).
13. Переносят в дистиллированную воду, контролируя
процесс под микроскопом.
14. Осторожно натягивают на предметное стекло, смазанное
смесью белка с глицерином.
346
15. Подсушивают на воздухе 8—10 мин, проводят через
ксилол и заключают в бальзам.
Для приготовления фосфорно-молибденового серебра берут
4 мл 20 % раствора нитрата серебра и 1 мл 1 % раствора фос-
форно-молибденовой кислоты, добавляют по каплям 25 %
раствор аммиака до растворения осадка, доливают до 15 мл
дистиллированной воды.
Результат: на светло-сиреневом фоне определяются нейроке-
ратиновая и миелиновая оболочки нервных волокон черного
цвета; в сосудах выявляются эритроциты черного цвета.
Для получения этих результатов требуется тщательное
соблюдение методических рекомендаций: свежий, прозрачный
раствор фосфорно-молибденового серебра, соответствующей
толщины срезы, химически чистая посуда. В противном случае
фон становится интенсивно коричневым, а серебро,
применяемое для выявления нервных волокон, выпадает в осадок в виде
зерен черного цвета.
Выявление оболочек нервных волокон
по Хеквисту
Материал (кусочки ткани размером до 3 см) фиксируют в
формалине, продолжительность фиксации не ограничена. После
фиксации кусочек промывают до исчезновения запаха
формалина. Затем кусочки помещают в 5 % раствор бихромата калия на
14 дней, промывают в проточной воде 24 ч, проводят через
спирты (70 %, 96 % и 100 %) и заливают в парафин.
Методика окраски
1. Срезы проводят через 100 %, 96 %, 80 %, 70 % спирты и
дистиллированную воду.
2. Переносят в 0,5 % раствор фосфорно-молибденовой
кислоты на ночь. Одновременно готовят краситель (35 мл 1 %
водного раствора метиленового синего + 35 мл 1 % водного
раствора желтого или красного эозина, через 1 сут после
приготовления растворы сливают и добавляют 120 мл воды).
3. Срезы быстро ополаскивают в дистиллированной воде и
переносят на ночь в краситель.
4. Ополаскивают в воде, быстро проводят через спирты и
ксилол, заключают в бальзам.
Результаты: на синем фоне ткани миелиновая оболочка
нервных волокон приобретает окраску от розовой до ярко-красной,
осевые цилиндры окрашиваются в темно-синий цвет.
Рисунок миелинового волокна может иметь размытый фон
при задержке ополаскивания в воде.
347
ВЫЯВЛЕНИЕ ГАНГЛИЕВ И ИХ ОТРОСТКОВ
Среди методов импрегнации металлами первое место занимают
методы импрегнации серебром Гольджи. Они основаны на
образовании соединений серебра, которые осаждаются на отдельных
ганглиозных клетках и их отростках, а также часто на глиаль-
ных клетках, сосудах и других образованиях. Наиболее
распространен так называемый быстрый метод Гольджи. Во многих
случаях вместо него можно использовать простой метод
серебрения Шультце. Недостатком, но в то же время и достоинством
метода Гольджи является то, что импрегнация никогда не
распространяется на все клетки, ограничиваясь отдельными
элементами. Благодаря этому получается картина, хотя и не
полная, но более ясная, чем если бы были выявлены все клетки.
Метод Гольджи имеет большое значение не только для
импрегнации нервных клеток, но и для выявления нервных
окончаний, секреторных капилляров, железистых ходов, границ
клеток и т.п. Хотя метод Гольджи позволяет получить лишь
теневую картину, в соответствующих случаях с его помощью с
успехом выявляют разнообразные тканевые элементы. При его
использовании, конечно, нужно постоянно сознавать, что
выявление структур основано на образовании осадка, который при
известных обстоятельствах может дать картину не существующих
в действительности структур. Нужно также учитывать, что
выявленные клетки или структуры могут оказаться неполно имп-
регнированными. Какие именно образования будут импрегниро-
ваны, является в известной степени делом случая, так как
условия, при которых происходит образование осадка, к
сожалению, еще недостаточно известны. В связи с этим для
правильной оценки полученных результатов требуются знания и опыт.
Ускоренный метод Гольджи
1. Кусочки ткани, по возможности свежей, помещают в смесь
из 40 мл 2,5 % (до 3,5 % по Кахалю) бихромата калия и 10 мл 4 %
тетраоксида осмия при 20 — 25 °С в коричневую склянку на
стеклянную вату так, чтобы жидкость проникала со всех сторон.
Указанного количества, жидкости достаточно для 5 — 6 кусочков.
Кусочки не должны быть слишком большими или слишком
маленькими (толщина 2 — 3 мм, площадь поверхности 5—10 мм2).
Продолжительность воздействия заранее нельзя указать, так
как для каждого объекта она различна, поэтому всегда кладут в
смесь большое количество кусочков и вынимают их из раствора
в течение 2 — 7 дней с промежутками около 12 ч.
2. Кусочки обсушивают фильтровальной бумагой и
погружают в небольшое количество 0,75 % раствора нитрата серебра,
который в случае необходимости несколько раз меняют до
прекращения образования осадка, затем помещают на 1 — 2 дня (на
348
1 — 6 дней по Рамон-и-Кахалю) в 100 мл 0,75 % раствора
нитрата серебра при комнатной температуре или 35 °С (не выше),
лучше в темноте.
3. Промывают в 40 % спирте (1 — 2 ч), сменяя его несколько
раз. Переносят в 80 % и 96 % спирты. Затем кусочки зажимают
в уплотненную печень или проклеивают гуммиарабиком и
режут бритвой или на микротоме, смачивая спиртом (толщина
срезов 20—100 мкм). Если кусочки после уплотнения в спирте
перенести обратно в воду, то их можно резать и на
замораживающем микротоме. Кусочки можно также быстро залить в
целлоидин, для чего их обезвоживают в 100 % спирте 12 ч, спирт-
эфире 2 —4 ч, 4 % целлоидине 1 — 2 дня, накладывают на
деревянный или лучше стабилитовый блок, обливают густым
раствором целлоидина и уплотняют на воздухе или в 80 % спирте.
Если ткань при резке сильно крошится, то блок после каждого
среза смазывают жидким раствором целлоидина.
Кусочки также можно поместить на1— 4чв100% спирт, на
1 ч в смесь 100 % спирта и эфира (1:1), а затем на несколько
часов в жидкий целлоидин (в сосуд со свободно сидящей
пробкой). После этого объект уплотняют в парах хлороформа и
режут в 96 % спирте.
Срезы тщательно промывают в 80 % спирте для удаления
избытка серебра, обезвоживают в абсолютном спирте,
просветляют в креозоте, а затем в скипидаре.
После этого срезы переносят на покровное стекло,
осторожно отсасывают масло и наносят каплю густого бальзама,
которую распространяют по всему препарату. В таком виде
препарат оставляют на несколько дней сохнуть в месте,
защищенном от пыли, и, наконец, укрепляют покровное стекло срезом
вниз на продырявленном предметном стекле или деревянной
дощечке. Таким образом, препарат не следует заключать между
предметным и покровным стеклами, так как в этом случае
импрегнация разрушается в короткий срок.
Результат: при удавшейся импрегнации на светлом фоне
выделяются отдельные темно-черные ганглиозные клетки вместе с
отростками.
Наиболее легко удается импрегнация ганглиозных клеток на
материале, взятом от молодых животных (поздние эмбрионы,
1 —10-дневные животные). Особенно благоприятными
объектами являются головной и спинной мозг птенцов голубя.
Выраженное влияние на результаты оказывает
продолжительность хромирования. Точные рекомендации, к сожалению, дать
невозможно, так как для каждого объекта она различна и зависит
от состояния препарата, температуры, концентрации, количества
жидкости и др. Сроки устанавливают чисто эмпирически: для
ганглиозных клеток ЦНС обычно 3 — 5 дней, для глии 2 — 3 дня,
для нервных волокон 5 — 7 дней. При слишком кратковременном
хромировании появляется лишь диффузный осадок хромата се-
349
ребра, при слишком длительном находят только резко
отграниченные кристаллы, импрегнация же отсутствует.
Кусочки ткани обычно окружены толстым слоем осадка
серебра, который может затруднять наблюдение, особенно в
случае тонких препаратов мембран, так как покрывает большую
часть препарата. В связи с этим перед помещением кусочков в
раствор нитрата серебра целесообразно несколько раз быстро
погрузить их в 10 % раствор желатина, т.е. окружить
желатиновой оболочкой. После серебрения от желатина освобождаются
путем быстрого погружения кусочков в теплую воду,
насыщенную хроматом серебра.
Объекты, находившиеся слишком долго в растворах,
содержащих хром, еще могут быть пригодны для импрегнации по
Гольджи, если их обрабатывать в течение 1 — 14 дней в часто
сменяемой смеси равных частей 2 — 3 % раствора бихромата
калия и 4 —5 % раствора сульфата меди; из этой смеси объект
переносят в ванну с нитратом серебра.
Надежность метода Гольджи повышается при 2- или
3-кратном импрегнировании по Кахалю. Благодаря этому часто
можно «спасти» импрегнацию, оказавшуюся в первый раз
неудачной.
При повторном импрегнировании поступают так, как при
использовании метода Гольджи (быстрого). Обсушивают кусочек
на фильтровальной бумаге и помещают в ранее
использовавшуюся смесь бихромата калия и тетраоксида осмия, а затем на
1 сут в раствор нитрата серебра, применявшийся ранее.
Ополаскивают дистиллированной водой, обсушивают фильтровальной
бумагой. Погружают на 1 — 2 мин в 96 % спирт, обсушивают
фильтровальной бумагой. Делают блок с помощью
гуммиарабика или парафина и режут, смачивая 96 % спиртом. Толщина
срезов 80—100 мкм; срезы промывают в 96 % спирте,
сменяемом 5 — 6 раз, в общей сложности не дольше 30 мин. Переносят
на предметное стекло, прижимают фильтровальной бумагой и
заключают (по методу Гольджи). Приведенные выше
процедуры можно повторить и в 3-й раз.
Медленный метод Гольджи
Маленькие кусочки органов помещают в жидкость Мюллера
или 3 % раствор бихромата калия, концентрацию которого
постепенно повышают до 5 % (в сосуде из коричневого стекла).
Через 4 — 6 нед проводят первую пробу; для этого один кусочек
обсушивают фильтровальной бумагой, ополаскивают в 0,75 %
растворе нитрата серебра, а затем кладут в такой же раствор на
24 ч. Если на сделанных бритвой срезах с материала не
обнаруживают никакой импрегнации, то пробу повторяют через 8 дней.
После того как наступит импрегнация, материал обрабатывают
по методу Гольджи, начиная с пункта 3.
350
Специальные методики импрегнации нервных клеток
с отростками и контактным аппаратом
Оригинальная методика Гольджи
Данная методика является основной в изучении тонких
структурных особенностей дендритов, шипиков и аксонной системы
нейронов, позволяет более полно выявить морфологические
особенности нейронов и межнейрональных связей.
1. Кусочки ткани мозга фиксируют в 10 % формалине от 1 до
15 дней. Увеличение продолжительности фиксации в
формалине ухудшает качество импрегнации. Толщина кусочков не
должна превышать 3 — 3,5 мм.
2. Фиксированные в 10 % формалине кусочки переносят (без
промывания) на 3 сут в жидкость Мюллера в термостат.
3. Помещают (без промывания) в фиксатор, состоящий из 5 мл
1 % тетраоксида осмия и 25 мл 3 % бихромата калия, который
готовят непосредственно перед использованием, ставят бюкс с
притертой крышкой на 2 дня в термостат при температуре 37 °С. Для
фиксации одного кусочка требуется не менее 30 мл указанной
смеси.
4. Промывают кусочки в 2 сменах 1 % раствора нитрата
серебра, приготовленного на 20 % растворе глюкозы.
5. Кусочки переносят в баночки из темного стекла на
стеклянную вату и осторожно наливают раствор нитрата серебра на
глюкозе (на 1 кусочек примерно 40 — 50 мл раствора).
Обращаться с кусочками следует с большой осторожностью: брать их
можно только пластмассовой или стеклянной лопаточкой, не
следует пользоваться металлическим шпателем. Импрегнацию
кусочков проводят в течение 14 — 20 дней в теплом месте.
6. Проводят по спиртам восходящей концентрации:
70 % спирт I 15 мин
70 % спирт II 15 мин
96 % спирт I 30 мин
96 % спирт II 30 мин
96 % спирт II 30 мин
100 % спирт I 1 ч
100 % спирт II 1 ч
100 % спирт с эфиром 30 мин
целлоидин жидкий (4 —5 %) 1,5 ч
целлоидин средний (6 —7 %) 1ч
целлоидин густой (10—11%) на ночь
Заливку в целлоидин проводят в течение 2 сут. Кусочки
вырезают и наклеивают на блоки. Для более полного
использования кусочков рекомендуется сделать на блоке подкладку из
целлоидина, на которую кладут кусочек и заливают густым
целлоидином. Кусочки подсушивают в парах хлороформа и помещают
в 70 % спирт. Проводку по спиртам и заливку в целлоидин осу-
351
ществляют в темноте, для этого баночки с кусочками следует
покрыть колпачками из черной бумаги.
7. Режут кусочки на санном микротоме (толщина срезов
90—120 мкм). Серии срезов снимают с ножа кисточкой и
помещают в 96 % спирт в чашки Петри, расправляя срезы
кисточкой.
8. Каждый срез ополаскивают отдельно в 96 % спирте, затем
переносят последовательно в две порции абсолютного спирта —
в каждую на 30 мин.
9. Из 100 % спирта срезы переносят кисточкой на большие
(60 х 90 или 32 х 40 мм) покровные стекла. Укладывают срезы
в порядке серии. Стекла со срезами помещают в чашки Петри и
осторожно заливают профильтрованным эвкалиптовым маслом.
Если срезы при этом всплывают на поверхность, то их следует
кисточкой вновь опустить на покровное стекло, помещенное на
дно чашки Петри. В эвкалиптовом масле срезы должны
находиться до просветления в течение 24 ч в темном месте.
Эвкалиптовое масло можно использовать несколько раз (после
фильтрации) до тех пор, пока оно не потемнеет.
Перед заключением в бальзам масло сливают, промокают
срезы на покровных стеклах фильтровальной бумагой и
заливают ровным слоем густого бальзама. После того как бальзам
подсохнет (примерно в течение 3 сут), по краям покровного стекла
со стороны бальзама приклеивают стеклянные, парафиновые
или спичечные ножки.
Для приготовления жидкости Мюллера 3 г бихромата калия
растворяют в 100 мл дистиллированной воды, можно подогреть,
затем остудить и добавить 1 г сульфата натрия. Фильтровать
раствор не нужно. Раствор хранят в темной стеклянной банке.
Результаты: на светло-желтом фоне выявляются нейроны с
дендритами и аксонной системой, интенсивно импрегнирован-
ные в черный цвет.
Метод Гольджи—Дейнеки (для выявления синапсов)
1. Материал фиксируют в свежем растворе АФА (состоит из
равных частей 96 % спирта, 20 % нейтрального формалина и
насыщенного раствора мышьяковистой кислоты) до 3 ч.
2. Промывают в 1 % растворе нитрата серебра и оставляют в
этом растворе на срок от 18 дней до 2,5 мес.
3. Промывают в дистиллированной воде 3 — 4 мин.
4. Переносят в восстановительную смесь, в состав которой
входят 2 г гидрохинона, 0,5 г сульфита натрия, 5 мл 40 %
нейтрального формалина и 100 мл дистиллированной воды, на
1 сут.
5. Промывают в дистиллированной воде.
6. Проводят через 70 %, 80 %, 96 % спирты по 3 ч в каждом и
оставляют в 100 % спирте на ночь.
352
7. Переносят в 6 % целлоидин на 2 — 3 сут, затем в 8 %
целлоидин на 2 сут (лучше только в 6 % целлоидин на 2 — 3 сут).
8. После заливки на блоках готовят срезы толщиной от 15 до
30 мкм и переносят их в 70 % спирт.
9. Промывают срезы в дистиллированной воде и погружают
до почернения в вираж (1,5 г тиосульфата натрия, 1,5 г тиоциа-
ната аммония, 50 мл дистиллированной воды, на каждые 10 мл
виража 1 мл 1 % трихлорида золота).
10. Промывают 10 — 30 мин водопроводной, затем
дистиллированной водой.
11. Дифференцируют до просветления в растворе перманга-
ната калия (2 — 3 кристалла на 50 мл дистиллированной воды +
1 капля серной кислоты).
12. Не промывая срезы, погружают их в 1 % раствор
щавелевой кислоты на 1—3 мин (щавелевая кислота отмывает перман-
ганат калия).
13. Промывают дистиллированной водой и переносят в спирты
восходящей концентрации (50 %, 70 %, 96 %, 100 %) по 2 —3 мин.
14. Проводят через карбол-ксилол 1 — 2 мин, 2 — 3 порции
ксилола и заключают.
Результат: фон препаратов светлый, тела нейронов и дендри-
ты светло-серого цвета. Аксонные синаптические окончания
импрегнируются интенсивно, дендриты — более интенсивно.
Метод Гольджи в модификации Блиновой
1. Материал фиксируют в 10 % формалине от 1 мес до 1 года
(получены удовлетворительные результаты при фиксации в
формалине более 1 года).
2. Кусочки ткани переносят в 2 % раствор бихромата калия
(готовят на дистиллированной воде) на 2 сут в термостат при
25-30 °С.
3. Промывают в двух сменах 4 % раствора нитрата серебра,
приготовленного на 20 % растворе глюкозы.
4. Помещают в такой же раствор нитрата серебра на 4— 5 сут
при комнатной температуре в темном месте.
5. Не меняя раствор нитрата серебра, баночки с кусочками
ткани переносят в термостат при 24 — 30 °С на 1 сут (более
продолжительная импрегнация кусочков ткани в термостате
ухудшает качество препаратов)
6. Кусочки ткани переносят в дистиллированную воду и
получают срезы толщиной 40 — 50 мкм на замораживающем
микротоме.
7. Обезвоживают срезы в спиртах восходящей концентрации
(70 %, 80 %, 96 %) и в 2 порциях 100 % спирта, проводят через
ксилол, заключают в бальзам под покровное стекло.
Для приготовления 4 % раствора нитрата серебра на 20 %
растворе глюкозы растворяют 20 г глюкозы (можно заменить
353
сахарозой) в 100 мл дистиллированной воды. В этот раствор
добавляют 4 г нитрата серебра. В случае выпадения осадка
раствору дают отстояться непосредственно перед применением.
Подобным образом готовят и 1 % раствор нитрата серебра на 20 %
растворе глюкозы.
Результат: на светло-желтом или почти бесцветном фоне
нейроны с дендритами и шипиками на них окрашены в
интенсивно-черный цвет.
Метод Гольджи—Кокса (для животных)
1. Животное анестезируют нембуталом (эфир применять
нельзя) в летальных дозах, затем берут кусочки головного
мозга, быстро ополаскивают в теплом изотоническом растворе
хлорида натрия и помещают в 50 мл следующей смеси: 20 мл 5 %
раствора бихромата калия, 20 мл 5 % раствора сулемы, 40 мл
дистиллированной воды. К этой смеси при постоянном
помешивании добавляют 8 мл 5 % раствора бихромата калия. Кусочки в
этом растворе помещают на стеклянную вату. Банки хранят в
темном месте при комнатной температуре (не перемешивая) в
течение 8 нед. Для коры головного мозга кошки, котенка и
крысы этот срок меньше.
2. Кусочки без промывания ополаскивают в смеси равных
количеств ацетона и 100 % спирта, затем помещают в такую же
смесь на 24 ч в закрытой посуде.
3. Переносят в смесь равных количеств 100 % спирта и
эфира на 4 ч.
4. Помещают в 5 % целлоидин на 24 ч, затем в 12 %
целлоидин на 12 ч. Заливают на блоки и укрепляют хлороформом.
5. Срезы толщиной 100—120 мкм режут на микротоме в 70 %
спирт.
6. Доводят до дистиллированной воды.
7. Осуществляют редукцию в 5 % растворе сульфата калия
(к большому объему раствора добавляют несколько капель 5 %
раствора щавелевой кислоты) для просветления фона и его
обесцвечивания.
8. Промывают в дистиллированной воде в течение 5 мин.
Проводят в смеси равных количеств спирта и хлороформа и
наклеивают на предметное стекло 1 % раствором целлоидина.
9. Стекла со срезами проводят через смесь равных количеств
абсолютного спирта и хлороформа.
10. Просветляют в скипидаре и заливают в бальзам.
Метод Глисса в модификации Владимировой
1. Небольшой кусочек ткани головного мозга погружают в
жидкость Бодиана (5 мл формалина, 5 мл ледяной уксусной
кислоты и 90 мл 80 % спирта) на 3 — 4 дня.
354
2. Промывают в проточной воде в течение 24 ч.
3. Срезы толщиной 12—15 мкм получают на
замораживающем микротоме, ополаскивают в дистиллированной воде и
помещают на 24 ч в 50 % спирт, добавив в него 10 капель крепкого
аммиака.
4. Ополаскивают в дистиллированной воде и помещают в 10 %
раствор нитрата серебра на срок от нескольких часов до 5 дней
(пока срез не станет коричневым).
5. Не ополаскивая, переносят в 10 % формалин, меняя его
несколько раз, пока не исчезнет муть.
6. Ополаскивают в проточной воде.
7. Погружают на 30 с (можно до 1 мин) в смесь, состоящую
из 10 мл 100 % спирта и 10 мл 20 % раствора нитрата серебра
(выпадающий осадок растворяют аммиаком, прибавляя его по
каплям).
8. Переносят в 10 % формалин, меняя несколько раз до
исчезновения мути.
9. Промывают в дистиллированной воде и помещают в 1 %
раствор хлорного золота до появления стального цвета.
10. Переносят в 5 % раствор тиосульфата натрия.
11. Промывают в дистиллированной воде.
12. Переносят на предметное стекло, подсушивают на
воздухе, затем проводят через ацетон, ксилол, заключают в
бальзам.
Результат: на сером фоне видны темные нервные клетки,
ядра, нейрофибриллы в нервных клетках и синаптических
волокнах, синаптические окончания.
Методы Бильшовского
Предварительной обработкой материала для выявления нейро-
фибрилл, по Бильшовскому, служит фиксация нейтральным
формалином. Оптимальная ее продолжительность — 3 — 6 нед
после помещения в формалин, однако материал, лежавший в
формалине несколько лет, также дает удовлетворительные
результаты, особенно после обработки пиридином. Проводят
окраску срезов (импрегнация срезов) или кусочков (тотальная
импрегнация). Для получения хороших результатов
необходимы точное соблюдение прописей (инструменты только
стеклянные!) и применение чистых реактивов.
Импрегнация срезов
Материал фиксируют в растворе формалина (1:9) не менее 14
дней (максимальная толщина кусочков 1 см); промывают в
проточной воде 2 —3 ч, затем в дистиллированной воде 1—2 дня;
нарезают на замораживающем микротоме срезы толщиной .5 —
10 мкм и собирают в дистиллированную воду. Хорошие срезы
355
вылавливают и промывают 1—2 раза в дистиллированной воде,
которую меняют 3 — 4 раза.
Импрегнация:
1) срезы помещают в 2 % раствор нитрата серебра на 24 ч;
2) быстро (2 — 3 с) проводят через дистиллированную воду,
сменяя стеклянные палочки;
3) помещают в свежеприготовленный раствор аммиачного
серебра: к 10 мл 10 % раствора нитрата серебра добавляют 5
капель 40 % раствора гидроксида натрия — образуется коричнево-
черный осадок окиси серебра. После этого при постоянном
взбалтывании к раствору серебра по каплям добавляют раствор
аммиака (молекулярная масса 0,875 — 0,910) до тех пор, пока от
растворяющегося осадка останется лишь несколько крупинок.
После каждой капли выжидают 10 — 20 с, прежде чем добавить
следующую каплю. Необходимо избегать избытка аммиака.
Раствор разводят до 20 мл дистиллированной водой. В раствор
аммиачного серебра срезы помещают на 10 — 20 мин, в нем они
должны приобрести желтоватый оттенок;
4) быстро проводят через 2 — 3 порции дистиллированной
воды;
5) восстанавливают в растворе формалина (1:4), не
содержащем кислоты в течение 10 мин, — срезы быстро окрашиваются в
темно-серый цвет;
6) промывают в воде 15 мин;
7) золотят в разбавленном растворе трихлорида золота (3 —
5 капель 1 % раствора желтого трихлорида золота на 10 мл
дистиллированной воды) до тех пор, пока коричневый тон не
перейдет в серый или серо-фиолетовый;
8) фиксируют 1—2 мин в 5 % растворе тиосульфата натрия;
9) тщательно промывают в обычной воде (1—2 ч); проводят
через спирты, карбол-ксилол, ксилол (не дольше, чем нужно) и
заключают в бальзам.
На хорошо импрегнированных препаратах нейрофибриллы и
перицеллюлярные сетчатые структуры ганглиозных клеток
черного цвета выделяются на светлом фоне, так же отчетливо
видны тончайшие осевые цилиндры.
К восстанавливающему 4 % раствору формалина можно
добавить 1 % цитрат натрия в соотношении 1:9. В этом случае
картина, получающаяся в результате серебрения, очень
равномерная и более контрастная.
Метод серебрения с предварительной
обработкой пиридином
В тех случаях, когда материал предназначается главным
образом для выявления осевых цилиндров, а не внутриклеточных
нейрофибрилл, М. Бильшовский рекомендует предварительно
обработать его пиридином (благодаря этому сильно подавляется
356
подкраска глии и соединительной ткани). Фиксацию и
предварительную подготовку материала проводят по методу Билыиов-
ского. Замороженные срезы промывают в дистиллированной
воде 1 — 2 ч и переносят в неразведенный пиридин на 24— 48 ч.
Затем срезы тщательно освобождают от пиридина, промывая их
в часто сменяемой дистиллированной воде до тех пор, пока не
исчезнет специфический запах пиридина. После этого
переносят в 2 % раствор нитрата серебра на 24 ч и далее обрабатывают
по методу Бильшовского.
Тотальная импрегнация
Импрегнацию целого кусочка проводят с предварительной
обработкой пиридином или без нее. В последнем случае кусочки
ткани размером не более 1 см3 фиксируют в формалине и без
промывания переносят в 2 % раствор нитрата серебра на 1 —
8 дней (в зависимости от величины). Затем перекладывают на
0,5 — 6 ч в раствор аммиачного серебра, быстро проводят через
дистиллированную воду и помещают в 20 % раствор формалина
на 12 — 24 ч. После этого материал как можно быстрее заливают
в парафин.
Более надежной является тотальная импрегнация с
пиридином по Бильшовскому.
1. Органы, фиксированные не менее 1 нед в нейтральном
формалине (от 1:4 до 1:9), разрезают на кусочки толщиной не
более 0,5 см и на 3 — 4 дня помещают в чистый неразведенный
пиридин при комнатной температуре.
2. Промывают 12 — 24 ч в проточной воде и столько же в
часто сменяемой дистиллированной воде.
3. Пропитывают в 3 % растворе нитрата серебра при 36 °С
3 — 5 дней.
4. Быстро ополаскивают в дистиллированной воде.
5. Помещают на 24 ч в раствор аммиачного серебра (готовят
так же, как для импрегнации срезов, но доливают
дистиллированной водой до 100 мл).
6. Промывают в часто сменяемой воде (по Бильшовскому, до
1 ч в зависимости от толщины блока, по Буке, 2 ч).
7. Восстанавливают в нейтральном формалине (1:9) 10 —
12 ч.
8. Ополаскивают в дистиллированной воде, быстро проводят
через спирты, заливают в парафин; золочение и фиксацию
проводят на срезах.
При тотальной импрегнации с применением пиридина можно
использовать материал, находившийся в формалине в течение
нескольких лет. При этом методе глия и соединительная ткань
обычно отступают на задний план или выделяются благодаря
иному тону окраски. Фибриллярные структуры ганглиозных
клеток выявляются менее четко, чем при использовании ориги-
357
нального метода, моторные и чувствительные концевые
образования нервов, наоборот, видны отчетливо.
Нередко импрегнация протекает хорошо не во всем кусочке,
а лишь в его определенных зонах. Более благоприятные
результаты наблюдаются в эмбриональных тканях, которые легче
пропитываются.
М. Бильшовский рекомендует использовать для
восстановления серебра не формалин, а смесь, состоящую из 75 мл 30 %
раствора фруктозы, 75 мл 10 % раствора сегнетовой соли, 20 мл
10 % раствора карбоната калия и 5 мл чистого формалина. Имп-
регнированные блоки помещают в эту смесь на 24 ч при 50 °С.
Затем следуют промывание в дистиллированной воде,
обезвоживание и заливка.
Смесь может быть применена и для восстановления импрег-
нированных срезов. В этом случае срезы после пропитывания в
растворе аммиачного серебра быстро ополаскивают и переносят
на 1—2 мин в указанный раствор, подогретый до 50 °С. Затем
следуют промывание, золочение и т.п.
С помощью восстанавливающей смеси по Билыповскому
особенно хорошо выявляются перицеллюлярные концевые
образования в ЦНС.
Метод Адэра и Витгилию
(для выявления нейрофибрилл и синапсов)
Головной мозг кошки фиксируют в дважды сменяемом ацетоне
по 24 ч в каждом. Заливают в парафин в течение 18 — 24 ч.
Срезы толщиной 15 — 20 мкм депарафинируют, промывают в
100 % спирте и опускают на б ч в 1 % раствор аммиака на
абсолютном спирте. Затем погружают на 6 ч в пиридин. Промывают
в дистиллированной воде и переносят в 2 % раствор нитрата
серебра на 12 ч при температуре 30 °С, затем промывают в 100 %
спирте. Восстанавливают серебро в растворе пирогалловой
кислоты с формалином (95 мл 95 % спирта, 3 г пирогалловой
кислоты и 8 мл формалина).
Далее проводят через дважды сменяемый спирт, промывают
несколько раз в дистиллированной воде и обрабатывают 1 %
трихлоридом золота до обесцвечивания. Промывают в 6 —8
порциях дистиллированной воды.
Для усиления окраски срезы обрабатывают 3 — 4 мин в 1 %
растворе щавелевой кислоты. Снова промывают в б —8 порциях
дистиллированной воды и погружают на 5—10 мин в 10 %
раствор тиосульфата натрия. Далее промывают, обезвоживают в
спиртах, просветляют в ксилолах и заключают в бальзам.
Результат: хорошо выражены нейрофибриллы черного
цвета, видны конечные колечки и колбочки.
358
Методы Рамон-и-Кахаля
Методы импрегнации нейрофибрилл, предложенные 5. Катоп
у Са]а1, применяют преимущественно в форме тотальной
импрегнации. Принцип методов основан на том, что свежевзятые
кусочки ткани сразу или после фиксации спиртом пропитывают
раствором нитрата серебра, а образовавшиеся при этом
соединения серебра восстанавливают при последующей обработке пиро-
галловой кислотой или гидрохиноном.
Недостаток методов состоит в том, что в импрегнированном
кусочке пригодной для исследования обычно оказывается лишь
средняя зона, так как раствор серебра не проникает в глубокие
слои. Наружная зона не может быть исследована вследствие
сильного зачернения. Кроме того, часто происходит
значительное сжатие ткани, в связи с чем общая сохранность препарата
во многих случаях оказывается не очень хорошей. В новых
модификациях метода импрегнации на срезах эти недостатки
устраняются.
В растворах серебра препараты должны находиться все
время в отсутствие света (коричневые склянки с
пришлифованными пробками, обертки из картона и т.п.). Кусочки ткани не
должны быть толще 3 мм.
Метод I. Пригоден для исследования головного мозга
мелких животных, а также эмбрионов и новорожденных крупных
животных, позволяет выявить пирамидные клетки большого
мозга и клетки-зерна мозжечка.
1. Свежевзятые кусочки ткани помещают на 3 — 5 дней в
0,75 — 3 % раствор нитрата серебра при 35 °С до появления та-
бачно-коричневой окраски кусочков.
2. Ополаскивают дистиллированной водой 1 мин.
3. Восстанавливают 24 ч в смеси, состоящей из 1—2 г пиро-
галловой кислоты или гидрохинона, 5 мл нейтрального
формалина и 100 мл дистиллированной воды.
4. Ополаскивают в дистиллированной воде 5 мин.
5. Заливают в целлоидин или парафин. Обезвоживать
следует по возможности быстро, около 5 —6 ч.
Для обработки материала, взятого у новорожденных и
эмбрионов, берут 0,75 % раствор нитрата серебра, у взрослых
млекопитающих — 3 %, у беспозвоночных — 6 % раствор. На 2 — 3
кусочка расходуют 80— 100 мл раствора.
Метод II. Пригоден для выявления мякотных и безмякот-
ных нервных волокон, перицеллюлярных разветвлений,
больших и средних нервных клеток, особенно головного мозга,
мозжечка, спинного мозга и, кроме того, двигательных и
чувствительных нервных окончаний и регенерационных стадий.
1. Материал фиксируют в 96 % или 100 % спирте 24 ч.
2. Разрезают на кусочки толщиной 2,5 — 3 мм, импрегнируют
5 — 7 дней в 1 — 1,5 % растворе нитрата серебра при 30 — 35 °С.
359
3. Ополаскивают дистиллированной водой 1 мин.
4. Восстанавливают 24 ч в смеси, состоящей из 1—2 г пиро-
галловой кислоты или гидрохинона, 5 мл нейтрального
формалина и 100 мл дистиллированной воды.
5. Ополаскивают дистиллированной водой 5 мин.
6. Заливают в парафин или целлоидин; обезвоживать
следует по возможности быстрее (примерно 5 —6 ч).
В том случае, если импрегнация слишком светлая, срезы 5 —
10 мин обрабатывают в смеси, состоящей из 3 г тиоцианата
аммония. 3 г тиосульфата натрия, 100 мл дистиллированной воды
и нескольких капель 1 % раствора трихлорида золота. Если к
спирту, используемому для фиксации, добавить веронал,
хлоралгидрат и т.п. (на 50 мл 1 г), то для импрегнации в растворе
нитрата серебра потребуется только 5 дней. Это делает метод
более надежным и он может быть применен на материале,
долгое время лежавшем в спирте.
Метод III. Особенно показан для выявления нейрофибрилл
спинного мозга, чувствительных симпатических ганглиев
человека, кошки, собаки, кролика.
Материал фиксируют 24 ч в смеси 50 мл 96 % или 100 %
спирта и 1 — 12 капель (для большого мозга 1—3 капли,
мозжечка — 4, спинного и продолговатого мозга — 8—12,
периферических окончаний — 2 — 3) раствора аммиака (молекулярная
масса 0,910). Если аммиака добавлено слишком много, то
импрегнация получается бледная. Сжатие можно уменьшить, если
объект вначале поместить на 6 ч в 70 % спирт, затем на 2 — 4 ч в
85 % спирт и лишь после этого перенести в аммиачный спирт.
После обсушивания фильтровальной бумагой обработку
проводят так же, как при использовании метода II.
Метод IV. Пригоден для выявления безмякотных волокон
ЦНС, перицеллюлярных разветвлений, моховидных волокон
мозжечка.
Материал фиксируют в смеси 15 мл формалина и 85 мл
воды; промывают в проточной воде 6—12 ч; помещают на 24 ч в
50 мл 96 % спирта, к которому добавлено 5 капель раствора
аммиака; обсушивают фильтровальной бумагой; далее обработку
проводят так же, как при использовании метода П.
Метод V. Хорошие результаты получают на эмбрионах, а у
взрослых прежде всего при изучении нейрофибрилл, нервных
окончаний и процесса регенерации нервов (за исключением
первых стадий).
Материал фиксируют 24 ч в 70 % пиридине или смеси,
состоящей из 40 частей пиридина и 30 частей 95 % спирта;
промывают в проточной воде до исчезновения запаха 12 — 24 ч;
.переносят на 6— 12чв95% спирт; далее обработку ведут так же, как
при использовании метода П.
Метод VI. Пригоден для изучения двигательных концевых
пластинок, перицеллюлярных разветвлений, мозжечка.
360
Материал фиксируют 24 ч в смеси, состоящей из 5 г
хлоралгидрата, 25 мл 100 % спирта и 75 мл дистиллированной воды;
ополаскивают в дистиллированной воде 1 мин; помещают на
24 ч в 50 мл 100 % спирта, в который добавлено 4 капли
раствора аммиака; промывают 12 — 24 ч в проточной воде и 2 — 5 ч в
часто сменяемой дистиллированной воде; далее обработку ведут
так же, как при использовании метода II.
Импрегнация замороженных срезов. Метод пригоден для
исследования большого мозга, мозжечка, двигательных концевых
пластинок, чувствительного эпителия.
1. Материал фиксируют в формалине (1:4) 3 дня или
дольше.
2. Замороженные срезы толщиной 30 — 40 мкм собирают в
формалин.
3. После быстрого (несколько минут) промывания в
дистиллированной воде помещают в смесь, состоящую из 12 мл 2 %
раствора нитрата серебра, 7—10 капель пиридина и 5 — 6 мл
97 % спирта, в которой срезы за 4 — 6 ч должны стать
светло-коричневыми; если этого не происходит, то следует в течение
нескольких минут подогреть над пламенем.
4. Отдельные срезы на 2 —4 с погружают в 100 % спирт.
5. Восстанавливают 1—3 мин в смеси, в состав которой
входят 0,3 г гидрохинона, 70 мл дистиллированной воды, 20 мл
формалина и 15 мл ацетона.
6. Основательно промывают в воде, золотят и фиксируют
как обычно.
7. Промывают, извлекают на предметное стекло,
обсушивают фильтровальной бумагой.
8. Проводят через 100 % спирт, гвоздичное масло, ксилол,
заключают в бальзам.
В том случае, если с помощью этого метода не удается
выявить мякотные волокна белого вещества, то перед серебряной
ванной замороженные срезы 2 ч обрабатывают в смеси,
состоящей из 10 мл 100 % спирта, 10 мл дистиллированной воды и 8 —
10 капель аммиака. Затем промывают, помещают в раствор
нитрата серебра с пиридином и т.д.
Метод Рамона—Лермитта
(выявление дегенерированных синапсов)
Материал фиксируют в 10 % нейтральном формалине в течение
1 — 2 нед или дольше. Затем его переносят на 1 ч в 40 %
формалин, 2 ч промывают в проточной воде и 2 ч — в
дистиллированной. Срезы толщиной 15 — 20 мкм получают на
замораживающем микротоме. Из дистиллированной воды их переносят в
20 % раствор нитрата серебра при температуре 50 — 53 °С
(продолжительность пребывания в этом растворе срезов спинного
мозга — 50 мин, продолговатого мозга и коры головного моз-
361
га — 60 мин, мозжечка и таламуса — 80 мин). После
импрегнации срезы должны быть табачного цвета.
1. Срезы ополаскивают в дистиллированной воде, на 5 —
10 мин переносят в раствор аммиачного серебра (в 20 % раствор
нитрата серебра добавлять по каплям 25 % раствор аммиака до
растворения осадка в мерном стаканчике, а затем добавляют
столько же раствора аммиака).
2. Промывают в дистиллированной воде.
3. Восстанавливают в формалине (1 часть формалина, 2
части водопроводной воды и 2 части дистиллированной воды)
15 мин, срезы должны стать коричнево-черными.
4. Переносят в 0,5 % раствор трихлорида, золота и держат
до тех пор, пока срезы не станут серыми.
5. Закрепляют в 3 % растворе тиосульфата натрия 5 мин.
6. Промывают в дистиллированной воде (2 — 3 смены)
7. Обезвоживают в 40 % и 96 % спирте по 10 мин.
8. Просветляют в 10 % карбол-ксилоле и 2 смесях ксилола по
10 мин, заключают в бальзам.
Методика Бильшовского (выявление внутриклеточных
нейрофибрилл, осевых цилиндров нервных волокон и
сенильных бляшек)
Служит наиболее адекватной методикой для микроскопической
диагностики болезни Альцгеймера и старческого слабоумия.
Материал фиксируют в 10 % формалине не менее 2 нед.
Срезы толщиной 8—10 мкм получают на замораживающем
микротоме, хранят в 10 % формалине, перед окраской промывают в
3 сменах дистиллированной воды.
1. Переносят срезы на 24 ч в 2 % раствор нитрата серебра.
2. Ополаскивают в 2 сменах дистиллированной воды.
3. Переносят в аммиачное серебро на 25 — 30 с.
4. Тщательно ополаскивают в 2 сменах дистиллированной
воды.
5. Помещают в 20 % нейтральный формалин на 4 —5 с до
приобретения темно-коричневой окраски.
6. Ополаскивают в дистиллированной воде.
7. Переносят 1—3 среза в 0,5 % раствор трихлорида золота
(они должны приобрести светло-серый, мышиный, цвет без
коричневых пятен).
8. Переносят в дистиллированную воду (если на срезах
появятся коричневые пятна, то вновь помещают в раствор
трихлорида золота до их исчезновения).
9. Переносят в 5 % раствор тиосульфата натрия на 1 мин.
Стеклянную палочку после погружения со срезом в
тиосульфат натрия следует тщательно промыть в дистиллированной
воде, протереть чистой тканью. Переносить срезы из
тиосульфата натрия в трихлорид золота не следует, так как последний
362
в этом случае темнеет и становится непригодным для
использования.
10. Срезы промывают в дистиллированной воде, наклеивают
на стекло, смазанное смесью белка с глицерином, затем ставят
на ребро для просушки на 8—10 мин.
11. Просветляют в одной порции ксилола и заключают в
бальзам под покровное стекло. Если препарат просветлен не
полностью, т.е. имеются мутные пятна, то его следует погрузить
на 2 — 3 с в ацетон, а затем вновь поместить в ксилол. Эту
процедуру повторяют до полного просветления срезов.
Результат: на светлом фоне импрегнируются контуры
нейронов, их ядер; в телах нейронов выявляются тонкие волокна ней-
рофибрилл или их патология. Между клетками видна тонкая
сеть аксонов и их коллатералей. Аксосоматические терминали
на поверхности тел нервных клеток выявляют изредка и
частично, поэтому о количестве их говорить нельзя. Иногда в белом
веществе обнаруживают волокнистые астроциты.
При правильной предварительной фиксации материала с
помощью этого метода постоянно получают хорошие результаты.
Засорение срезов осадками серебра происходит при
использовании плохо обработанной посуды и недоброкачественного
раствора серебра. При недостаточной дифференцировке в растворе
трихлорида золота структуры выглядят грубо импрегнирован-
ными с коричневым оттенком, в срезе определяются
коричневые пятна.
МЕТОДЫ ОКРАШИВАНИЯ ГЛИИ
Методика Снесарева (выявление волокнистой,
астроцитарной глии и глиальных волокон)
Методика высокоизбирательна, позволяет выявить астроциты
белого вещества ЦНС, глиальные волокна, а в нервных
клетках — феномен центральной тинкториальной ацидофилии
(ЦТА) и одновременно бета-зернистость [Снесарев П.Е., 1950].
Преимущество методики Снесарева перед методикой Рамон-и-
Кахаля заключается в получении дифференцированной окраски
органелл астроцитов (цитоплазма, ядро, отростки).
Дополнительно выявляют эритроциты в сосудах и дренажную снесарев-
скую олигодендроглию.
Материал фиксируют в 10 % формалине. Срезы толщиной
8— 10 мкм получают на замораживающем микротоме.
1. Ополаскивают срезы в 2 сменах дистиллированной воды и
помещают в профильтрованный 1 % водный раствор эритрозина
(1 г эритрозина на 100 мл дистиллированной воды) на 20 — 30 с
(в зависимости от восприимчивости красителя).
2. Срезы тщательно промывают в 2 и более сменах
дистиллированной воды до прекращения отхождения краски.
363
3. Переносят в 0,5 % раствор фосфорно-молибденовой
кислоты на 35 —40 с.
4. Быстро промывают в дистиллированной воде, переносят
на предметное стекло, смазанное смесью белка и глицерина,
тщательно протирают мягкой тканью стекло вокруг среза,
промокают сложенной в 4 раза фильтровальной бумагой, а затем
смоченной метилхлороформом (1 часть метилового спирта + 2
части хлороформа).
5. Стекла со срезами помещают в раствор Мая —Грюнвальда
на 3 — 5 с.
6. Промывают в водопроводной воде в течение 3 — 5 с до
удаления излишка красителя, протирают стекло тканью и
промокают фильтровальной бумагой.
7. Обезвоживают в ацетоне, просветляют в ксилоле и
заключают в бальзам под покровное стекло.
Для приготовления 0,5 % раствора фосфорно-молибденовой
кислоты на 200 мл дистиллированной воды берут 1 г фосфорно-
молибденовой кислоты, взбалтывают. В полученном растворе
имеется осадок. Раствор помещают на 2 — 3 ч в термостат при
37 — 40 °С, пока осадок не растворится (раствор должен быть
абсолютно прозрачным).
Результат: на нежно-голубовато-синеватом фоне
определяются такого же оттенка астроциты (ядро, цитоплазма,
отростки). Вследствие патологических изменений астроцитарная
клетка может настолько измениться, что патоморфоз в виде
амебоидного астроцита бывает не всегда ясен. Ядра дренажной олиго-
дендроглии в белом веществе также имеют светло-синеватую
окраску, иногда с розоватым оттенком (метахромазия). Феномен
центральной тинкториальной ацидофилии принадлежит к
гистохимическим реакциям, при этом центральная часть клетки —
ядро и прилежащая цитоплазма, — становится розовой: от
яркого цвета до едва заметного розоватого оттенка. Эритроциты в
сосудах розового цвета.
Следует иметь в виду, что фосфорно-молибденовая кислота
и метилхлороформ могут пережечь ткань (появляется дырча-
тость), излишек эритрозина обусловливает появление розовых
пятен, при излишке раствора Мая — Грюнвальда и чрезмерной
толщине срезов (более 8—10 мкм) срез становится грубым и
тонкая структура астроцитов плохо дифференцируется.
Методика Рамон-и-Кахаля
(выявление волокнистой и астроцитарной глии)
Материал фиксируют в 10 % формалине. Срезы толщиной 8 —
10 мкм получают на замораживающем микротоме, хранят в
свежем 10 % кислом формалине.
1. Срезы промывают в 3 сменах дистиллированной воды и
переносят на 2 сут в свежий бромистый фиксатор (14 мл ней-
364
трального формалина, 2 г бромида аммония и 100 мл
дистиллированной воды).
2. Тщательно промывают в 3 сменах дистиллированной воды
и переносят в раствор трихлорида золота с сулемой (8 мл 5 %
прозрачного раствора сулемы, 10 мл 1 % раствора трихлорида
золота и 60 мл дистиллированной воды) на 1 сут в темное
место.
3. Промывают в 3 сменах дистиллированной воды и
помещают в 5 % раствор тиосульфата натрия на 1 мин.
4. Переносят в дистиллированную воду, затем наклеивают на
предметное стекло, смазанное смесью белка с глицерином,
подсушивают на воздухе до полного высыхания.
5. Просветляют в ксилоле и заключают в бальзам под
покровное стекло.
Результат: в белом веществе на сиреневом фоне (разной
интенсивности) четко определяются черновато-фиолетовые
фиброзные астроциты, а в сером веществе — более светлые.
Методика Мийагавы в модификации Александровской
(выявление мезенхимной глии)
Методику используют для выявления клеток микроглии,
перицитов (гематогенных гистиоцитов), а также клеток олигоденд-
роглии (плотных и дренажных). Одновременно обнаруживают
зернистые шары и дельта-зернистость; в мягкой мозговой
оболочке окрашиваются пигментные клетки (хроматофоры), могут
выявляться фиброзные астроциты.
Материал фиксируют в 10 % формалине не менее 12 дней,
затем промывают проточной водой в течение 2 сут и заливают в
желатин. Вырезанные из желатина кусочки помещают в 10 %
кислый формалин на 1 сут (в нем их можно длительно
хранить). Перед резкой на замораживающем микротоме
желательно промыть кусочки в проточной воде около 1 —2 ч (материал
лучше режется). Толщина срезов 15 — 20 мкм. Срезы хранят в
10 % кислом формалине.
1. Срезы промывают в 2 сменах дистиллированной воды и
помещают в 10 % кислый формалин на 20 мин (можно до 3 ч).
2. Переносят без промывания в щелочной раствор (1 капля
гидроокиси натрия на 10 мл дистиллированной воды) на 40 — 60 с.
3. Промывают в 2 сменах дистиллированной воды.
.4. Импрегнируют в растворе аммиачного серебра 1 —2 мин.
5. Переносят в горячий 10 % кислый формалин, который
подогревают под вытяжкой на спиртовке. В случае помутнения
формалина его следует заменить. В горячем формалине срезы
приобретают золотистый цвет.
6. Помещают в холодный 10 % кислый формалин (в нем их
можно оставить до следующего дня).
365
7. Промывают в 2 — 3 сменах водопроводной воды,
наклеивают на предметное стекло, смазанное смесью белка с глицерином
и дают просохнуть на воздухе.
8. Просветляют в ксилоле (если на препарате видны мутные
пятна, то его опускают на 2 — 3 с в ацетон и вновь переносят в
ксилол до просветления), заключают в бальзам под покровное
стекло.
В случае недостаточного выявления микроглии, особенно
олигодендроглии, желатиновые срезы следует перенести из
формалина, в котором их хранят, в смесь Дубранского (срезы
перед этим промывают в 2 — 3 сменах дистиллированной воды)
на срок от 2 — 3 сут до 2 — 3 нед, обязательно меняя смесь через
2 — 3 дня.
Для приготовления смеси Дубранского в 100 мл нагретой до
кипения дистиллированной воды осторожно всыпают 6 г
гидрокарбоната натрия, еще раз доводят до кипения, охлаждают,
фильтруют. В полученный раствор добавляют б мл неразведен-
ного нейтрального формалина и 6 капель 25 % аммиака.
Результат: на светло-янтарном фоне видны ветвистые клетки
микроглии, перициты, плотные и дренажные клетки
олигодендроглии, имеющие цвет от светло-коричневого до
темно-коричневого. Дренажные клетки в белом веществе ткани головного
мозга светло-коричневые, часто светло-желтые. Хроматофоры в
мягкой мозговой оболочке, изредка в сосудах вещества мозга —
черного цвета. Иногда в белом веществе коры и подкорковых
образованиях одновременно выявляют волокнистые астроциты
светло-коричневого цвета. Старческие бляшки имеют цвет от
светло- до темно-коричневого.
Метод Хорнеца (выявление фиброзных астроцитов)
Материал фиксируют в 10 % кислом формалине, срезы
получают на замораживающем микротоме. Хорошие результаты
удается получить также на материале, заключенном в парафин.
1. Срезы переносят в дистиллированную воду, на 100 мл
которой добавлено 15 капель раствора аммиака (недолго).
2. Помещают в 5 % раствор бромисто-водородной кислоты на
1 ч при температуре 37 °С.
3. Промывают в 3 сменах дистиллированной воды, а затем в
дистиллированной воде, к которой добавлено несколько капель
уксусной кислоты.
4. Переносят на 15 —24 ч в раствор, состоящий из 1 г трихло-
рида золота в 75 мл дистиллированной воды + 25 мл 2 %
сулемы + 18 мл дистиллированной воды + 15 капель уксусной
кислоты, препараты приобретают темно-коричневую или красно-
коричневую окраску.
5. Помещают в 5 % раствор щавелевой кислоты (до
приобретения ими серой окраски).
366
6. Ополаскивают в дистиллированной воде, переносят в 5 %
раствор тиосульфата натрия с несколькими каплями раствора
аммиака; быстро ополаскивают и заключают.
Результат, на сиреневом фоне выявляются темно-синие
фиброзные астроциты с отростками, видны капилляры и красные
эритроциты в их просвете.
Возможные осложнения: при использовании старого
раствора бромисто-водородной кислоты и передержке в ней препарата
выпадают артефактные синие глыбки неправильной формы.
КОМБИНИРОВАННЫЕ МЕТОДЫ ОКРАШИВАНИЯ
Ускоренный метод окрашивания миелиновых волокон
и нервных клеток по Викторову
Депарафинированные срезы окрашивают в течение 1 — 2 ч в
0,01 % кислом спиртовом растворе люксолевого синего
прочного, дифференцируют в 0,1 % растворе тетрабората натрия
(буры) и докрашивают крезиловым фиолетовым прочным по
Нисслю.
Растворы красителей и их изготовление. Раствор I: 1 г
люксолевого синего прочного, 5 мл ледяной уксусной кислоты, до
100 мл 96 % спирта. Для приготовления рабочего 0,01 % раствора
1 мл основного раствора красителя смешивают со 100 мл 96 %
спирта. Рабочий раствор красителя можно использовать повторно.
Раствор II: 250 — 500 мг крезилового фиолетового прочного,
130 мг ацетата натрия, 1,2 мл ледяной уксусной кислоты,
100 мл дистиллированной воды. Забуференный раствор
крезилового фиолетового прочного для подкрашивания по Нисслю
можно использовать неоднократно.
Методика окраски
1. Наклеенные на стекла парафиновые срезы толщиной
10 — 20 мкм депарафинируют в ксилоле и промывают в 100 % и
96 % спиртах.
2. Окрашивают в 0,01 % спиртовом растворе люксолевого
синего прочного 1 — 2 ч при 56 — 60 °С.
3. Промывают срезы последовательно в 96 % и 70 % спиртах
и дистиллированной воде.
4. Дифференцируют в 0,1 % растворе тетрабората натрия,
контролируя процесс под микроскопом (краситель постоянно
удаляется из среза, а миелиновые волокна сохраняют яркую
сине-зеленую окраску).
5. Ополаскивают в 5 % растворе уксусной кислоты.
6. Окрашивают крезиловым фиолетовым прочным в течение
2 — 5 мин.
7. Промывают в дистиллированной воде.
367
8. Обезвоживают в спиртах восходящей концентрации (70 %,
96 %, 100 %), просветляют в ксилоле и заключают в бальзам.
Результат: миелин ярко-синего цвета; вещество Ниссля, ядра
нейронов, глиоцитов, клеток сосудов и оболочек мозга
фиолетовые.
Метод избирательной импрегнации дегенерированных
нервных волокон и окончаний
Фиксацию мозга лабораторных животных проводят методом
прижизненной перфузии 10 % раствором нейтрального формалина на
изотоническом растворе хлорида натрия через левый желудочек
сердца. После перфузии мозг дополнительно фиксируют в
течение 10—14 дней в 10 % растворе нейтрального формалина, а за
1 — 2 дня перед резкой помещают в 30 % раствор сахарозы, что
предупреждает повреждение ткани при замораживании. В
растворе формалин-сахарозы мозг может храниться долго.
Срезы толщиной 25 — 40 мкм, полученные на
замораживающем микротоме, собирают в 10 % раствор формалина, в котором
и хранят до последующей обработки.
Растворы и их приготовление. А. Кислый раствор соли
пятивалентного ванадия: навеску в 1,2 г метаванадата аммония
(аммоний ванадиевокислый) растворяют в 150 — 200 мл горячей
дистиллированной воды, после охлаждения раствора к нему
добавляют 5 мл концентрированной серной кислоты и доводят его
объем до 1000 мл. Удобно готовить также концентрированный
раствор: 12 г метаванадата аммония растворяют в 500 мл горячей
дистиллированной воды. К полученному раствору после
охлаждения небольшими порциями добавляют 50 мл
концентрированной серной кислоты и доводят его объем до 1000 мл. Если при
добавлении серной кислоты выпадает бурый осадок пятиокиси
ванадия, то его растворяют при нагревании. Перед применением к
1 части концентрированного раствора добавляют 9 частей
дистиллированной воды. Кислый раствор метаванадата аммония может
храниться в течение длительного времени.
Б. Раствор нитрата серебра 3 %.
В. Аммиачно-натриевый раствор: в 100 мл 25 % водного
раствора аммиака растворяют 1,25—1,5 г гидроксида натрия.
Раствор хранят в плотно закрытой склянке с полиэтиленовой
пробкой.
Г. Раствор аммиачного серебра (готовят перед
использованием): к 50 мл 3 % аммиачного серебра добавляют 6 мл аммиачно-
натриевого раствора.
Д. Редуцирующий раствор: 27 мл 10 % формалина, 87 мл 1 %
лимонной кислоты, 90 мл 96 % спирта, до 1000 мл
дистиллированной воды.
Е. Смесь равных объемов 1 % раствора тиосульфата натрия
и 1 % раствора сульфита натрия.
368
Импрегнация срезов
1. Срезы промывают в течение 5 мин в 2 сменах
дистиллированной воды.
2. Помещают в кислый раствор метаванадата аммония на
10— 15 мин.
3. Промывают в 2 сменах дистиллированной воды 5 мин.
4. Переносят на 25 — 30 мин в 3 % раствор нитрата серебра
(срезы приобретают светло-коричневый цвет). Далее каждый
срез обрабатывают отдельно.
5. Ополаскивают в дистиллированной воде (5—10 смен).
6. Помещают на 1 —2 мин в раствор аммиачного серебра.
7. Без предварительного промывания проводят через 2
смены редуцирующего раствора (1-я смена — 1 мин, 2-я смена —
2 — 3 мин).
8. Промывают 1—2 мин в дистиллированной воде.
9. Помещают на 1—2 мин в смесь равных объемов 1 %
растворов тиосульфата натрия и сульфита натрия.
10. Тщательно промывают в 2 сменах дистиллированной
воды в течение 10—15 мин.
11. Промытые срезы наклеивают на предметные стекла
спиртовым раствором желатина и хромовых квасцов (в 200 мл 0,5 %
раствора желатина растворяют 100 мг хромовых квасцов;
чистые предметные стекла погружают в этот раствор, вынимают и
сушат в вертикальном положении). Наклеенные и хорошо
просушенные срезы обезвоживают спиртом, просветляют в ксилоле
и заключают в бальзам.
Примечания. 1. Продолжительность обработки срезов,
описанной в пунктах 2, 4, б, определяют опытным путем для
каждой серии срезов.
2. Качество препаратов значительно улучшается, если срезы,
наклеенные на предметные стекла, докрасить растворами крези-
лового фиолетового прочного или толуидинового синего.
Результат: фон препаратов светло-желтый, реже
коричневый; дегенерированные волокна — черные; в местах окончания
дегенерированных волокон выявляют тела нервных клеток и
ядра нейроглии, имеющие различные оттенки фиолетового
цвета.
Методика дифференцированного выявления нейронов
и глии на парафиновых срезах
Гистохимические методы, в частности методы определения
белковых веществ, не позволяют дифференцировать типы глии,
поскольку обычно у глиальных клеток различимы только
структуры ядра. Ставя задачу разработать метод
дифференцированного определения нейронов и глиальных элементов на
гистохимических препаратах, авторы попытались объединить метод Альц-
369
геймера, предназначенный для выявления митохондрий, нейро-
сом, телец Ниссля и астроцитарной глии, и гистохимический
метод определения общего белка с применением амидо черного
10Б. Метод Альцгеймера основан на различном сродстве
органоидов клетки к красителям: в нейронах митохондрии и нейро-
сомы окрашиваются в ярко-красный цвет, вещество Ниссля — в
зеленый, а тела амебовидных клеток — в зеленоватый, глиаль-
ные и соединительнотканные волокна — в красный. Метод с
применением амидо черного 10Б позволяет обнаружить общий и
суммарный белок в ткани мозга по окрашиванию его скоплений
в зеленый цвет. В результате исследования разработана
следующая схема.
Кусочки ткани мозга после фиксации в жидкости Карнуа
проводят по обезвоживающим средам и заключают в парафин.
Срезы толщиной 5—10 мкм приклеивают белком на предметные
стекла.
1. Срезы депарафинируют и через спирты нисходящей
концентрации доводят до воды.
2. Переносят в 0,03 % раствор амидо черного 10Б на
ацетатном буфере (рН 5,32) при комнатной температуре на 20 мин.
3. Промывают в дистиллированной воде.
4. Инкубируют в насыщенном водном растворе кислого
фуксина при 56 °С 30 мин.
5. После охлаждения до комнатной температуры
ополаскивают в дистиллированной воде.
6. Дифференцируют в пикриновой кислоте (15 мл
насыщенного спиртового раствора пикриновой кислоты и 30 мл
дистиллированной воды) 15 с.
7. Ополаскивают в дистиллированной воде и обсушивают
фильтровальной бумагой.
8. Дифференцируют в 100 % спирте около 2,5 с.
9. Просветляют в ксилоле и заключают в бальзам.
Результат: отчетливо выявляются белки в телах и
митохондриях нейронов, а также в ядрах глиальных клеток. Последние
значительно различаются по интенсивности окраски в
зависимости от принадлежности к тому или иному типу глии:
кариоплазма и хроматиновые структуры ядер олигодендроглиоцитов
интенсивно-красного цвета, а у астроцитов в красный цвет
окрашены ядрышко и небольшое количество зерен хроматина.
Метод Герлаха
Для выявления грубых отростков ганглиозных клеток и более
крупных тяжей волокон рекомендуется метод Герлаха. При
этом важно, чтобы препараты до окрашивания кармином не
соприкасались со спиртом.
Материал фиксируют в жидкости Мюллера или 3 — 5 %
растворе бихромата калия. Продолжительность фиксации мозга
370
птиц и лягушек составляет несколько недель, головного и
спинного мозга человека — несколько месяцев и даже лет. Срезы
получают на замораживающем микротоме и в течение
нескольких часов промывают в воде. Окрашивают в разбавленном
растворе аммиачного кармина 24 — 48 ч. Очень важно правильно
приготовить раствор: растирают 1 г кармина, приливают 100 мл
дистиллированной воды и добавляют по каплям 26 % раствор
аммиака (нашатырный спирт) в таком количестве, чтобы
краситель полностью растворился. После этого раствор должен
созреть в открытом сосуде до полного исчезновения запаха
аммиака. К употреблению годны лишь растворы, стоявшие в течение
длительного времени. Перед использованием основной раствор
разбавляют дистиллированной водой настолько, чтобы для
окрашивания срезов потребовалось 24 — 48 ч. Раствор кармина
можно использовать повторно (со временем он даже становится
лучше). Срезы дифференцируют в слабо подкисленной
уксусной кислотой воде 1—2 ч; промывают, проводят через спирты
возрастающей концентрации, ксилол и заключают в бальзам.
Результат: ганглиозные клетки с отростками интенсивно-
красные; осевые цилиндры нервных волокон и ядра клеток
красные; волокна глии розовые; мякотные оболочки остаются
неокрашенными. Если срез предварительно окрасить
гематоксилином, то ядра окрашиваются контрастно в синий цвет.
Метод аксонального электрофореза солей кобальта
для исследования мозга млекопитающих
Создание метода заполнения нервных структур солями
кобальта (Со-метод) у позвоночных животных [Ри11ег Р.М., Рпог
и.]., 1975] открыло широкие возможности для избирательного
окрашивания определенных систем нервных клеток и волокон,
напоминающего импрегнацию по методу Гольджи.
Метод отрабатывали на корешках тройничного, языкогло-
точного и блуждающего нервов взрослых крыс и латеральном
обонятельном тракте котов при пропускании тока 5 — 50 мкА и
длительности электрофореза 2 —24 ч.
1. Животное умерщвляют внутрибрюшинным введением
наркотических веществ. Все дальнейшие процедуры до окончания
эксперимента обязательно проводят на холоде и используют
холодные растворы (4 °С). Мозг перфузируют через сердце 200 мл
трис-НС1-буфера (рН 7,4), содержащего 154 мМ хлорида натрия,
5,6 мМ хлорида калия, 2,3 мМ хлорида кальция и 0,25 М
сахарозы, быстро и осторожно достают из черепной коробки и помещают
в фарфоровую чашку с таким же раствором.
2. Аксональный электрофорез солей кобальта: корешок
черепного нерва перерезают острым скальпелем, центральный
конец корешка или тракта помещают в полиэтиленовую трубку,
диаметр которой немного больше диаметра корешка или тракта.
371
Этот конец фиксируют к стенке клеем МК-6 или вазелином,
который одновременно герметически закупоривает трубку с этого
конца. С противоположной стороны трубки наливают 130 мМ
раствор дихлорида кобальта. Составляют электрическую цепь,
в которую последовательно включают батарею постоянного тока
(100-АМЦГ-У-190), микроамперметр, реостат и электроды.
Один платиновый электрод (плюс) помещают в раствор
дихлорида кобальта, другой (минус) — в раствор, омывающий мозг.
Пропускают постоянный электрический ток силой 40 мкА в
течение б ч. В процессе эксперимента через каждый час
полностью меняют раствор, омывающий мозг.
3. Осаждение солей кобальта: по окончании эксперимента
вырезают подлежащий изучению участок мозга (размером
20 х 10 х 5 мм), который для одновременного осаждения Со2+ и
фиксирования нервной ткани помещают на 10 ч в смесь,
состоящую из 2 мл 10 % сульфида натрия и 100 мл 70 % спирта. При
удачном заполнении корешка нерва или тракта почернение его
наступает уже через 10 с.
4. Получение гистологических препаратов: после
кратковременного промывания в 70 % спирте (10 мин) кусочек мозга
обезвоживают в спиртах: 96% — 1 ч, в 100 % — 1 ч, в 100 % —
2 ч; помещают последовательно в смесь 100 % спирта и
хлороформа (1:1) и хлороформ до тех пор, пока он не опустится в
каждом из этих растворов на дно сосуда, затем обычным
способом заливают в парафин. Мозг режут на непрерывные
серийные срезы толщиной 20 — 25 мкм, наклеиваемые белком на
стекла. Срезы на стеклах депарафинируют в ксилоле и проводят по
спиртам нисходящей концентрации до воды.
5. Усиление осадка сульфида кобальта: для выявления
малых количеств кобальта в нервной ткани используют
физический проявитель. Срезы на стеклах помещают в чашку Петри,
заливают проявителем и ставят в термостат при 37 °С на 20 —
30 мин. Необходимо избегать попадания прямого солнечного
света. Окрашивание можно контролировать визуально и
прекращать при появлении слабо-желтого или коричневого фона на
стороне введения кобальта путем промывания срезов водой
(несколько смен по 5 мин). Затем срезы обезвоживают в спиртах
возрастающей концентрации, просветляют в ксилоле и
заключают в бальзам.
6. С целью выявления не содержащих кобальт и поэтому не
окрашенных нервных элементов срезы можно докрашивать
0,15 % галлоцианином по Ромейсу или 0,2 % крезиловым
фиолетовым по Викторову.
7. Все растворы готовят на дистиллированной воде,
реактивы должны быть химически чистыми.
Физический проявитель состоит из раствора А — 25 %
гуммиарабик, раствора В — 2 % гидрохинон в 5 % растворе
лимонной кислоты, раствора С — 10 % раствор нитрата серебра. Рас-
372
творы А, В и С можно хранить в темном прохладном месте в
течение 2 нед. Рабочий раствор готовят непосредственно при
проявлении срезов, последовательно смешивая 10 частей А, 10
частей В и 0,2 части С. Гуммиарабик в растворе А можно заменить
4 % раствором желатина и рабочий раствор тогда составляют из
8 частей А, 3 частей В и 0,1 части С.
Результат: сенсорные волокна и их терминальные ветвления
заполнены кобальтом и имеют четкие контуры; окрашенные
нервные клетки и их аксоны легко отличимы от заметных
иногда на препарате в виде теней не заполненных кобальтом
нервных элементов, дендриты можно проследить на расстоянии
100— 150 мкм от тела клетки; набухания и фрагментации
волокон, изменения формы и объема нейронов не наблюдается. Весь
препарат имеет слабо-желтый фон, окрашенные волокна и
клетки черного цвета.
Методика фотооксидации флюоресцентных препаратов
секционного материала мозга человека для световой
и электронной микроскопии
Для системного выявления нейронов и проводящих путей мозга
человека применяют внутриклеточное введение люциферового
желтого (ЛЖ) и мембранный транспорт карбоцианиновых
красителей, в основном 1,1-диоктадецил-3,3,3',3'-тетраметилиндо-
карбоцианин перхлорит (ДИЛ).
1. В секционном материале мозга человека, взятом спустя
7— 16 ч после смерти, через микроэлектрод вводят Л Ж в
пирамидные нейроны зрительной, фронтальной коры и
непирамидные нейроны гиппокампа, а карбоцианиновые красители (в
основном ДИЛ) — в белое вещество или различные слои
зрительной коры.
2. Вибратомные срезы (толщиной 75—150 мкм),
окрашенные Л Ж или ДИЛ, помещают в чашку Петри и прижимают к ее
дну металлическим грузом; наливают раствор, состоящий из
1 мг/мл 3,3'-диаминобензидииа-4 (ДАБ) и 1 мг/мл цианида
калия на 0,1 М фосфатном буфере (рН 7,4).
3. Для фотооксидации чашку Петри со срезами помещают
под флюоресцентный микроскоп. Используют эпифлюоресцен-
цию через объективы с увеличением в 6,3 или 10 раз и
соответствующие светофильтры: для Л Ж — максимум возбуждения
470 нм, для ДИЛ — 546 нм.
4. Через 1 — 2 ч (время колеблется в зависимости от
плотности освещения, толщины препаратов и флюоресцентного
вещества) срезы мозга промывают 3 раза фосфатным буфером. Можно
проводить несколько процедур фотооксидации на одном и том
же срезе, каждый раз меняя раствор.
5. Для проведения световой микроскопии срезы помещают
на предметные стекла, смазанные белком, высушивают, обезво-
373
живают в спиртах восходящей концентрации, просветляют в
ксилоле и заключают в бальзам
6. Для осуществления электронной микроскопии срезы
помещают на 7—10 мин в 0,5 % раствор тетраоксида осмия на
фосфатном буфере, промывают 3 раза тем же буфером,
обезвоживают в спиртах восходящей концентрации и заключают между
двумя целлофановыми листочками.
7. Срезы, окрашенные ЛЖ, дополнительно контрастируют в
у ранил ацетате. Срезы, окрашенные ДИЛ, этой процедуре не
подвергают, так как в этом случае на
электронно-микроскопическом уровне невозможно отличить мембраны, окрашенные
ДИЛ, от мембран, контрастированных уранилацетатом.
Результат* выявляются пучки аксонов с коллатералями и
бусинками по ходу, очень четко окрашиваются также отдельные
терминальные волокна с бусинками по ходу или шипикоподоб-
ными образованиями; нейроны выявляются со всеми деталями.
На электронограммах нейроны и дендриты, окрашенные ЛЖ,
имеют более темный профиль.
Использование метода фотооксидации позволяет
преобразовать флюоресцентные препараты в световые, которые также
годны для электронной микроскопии.
ГЛАВА 21
ОКРАШИВАНИЕ ТКАНИ ЭНДОКРИННЫХ ЖЕЛЕЗ
И ЭЛЕМЕНТОВ АПУД-СИСТЕМЫ
Эндокринная система организма состоит из компактно
организованных эндокринных желез, а также из совокупности
эндокринных клеток, поодиночке или группами локализованных в
слизистой оболочке желудочно-кишечного тракта, бронхов, органов
мочеполовой системы, в сердце, печени, почках, желчном пузыре и
других органах. Вырабатывая различные биологически активные
вещества, эндокринные клетки обладают биохимическими,
цитохимическими и ультраструктурными признаками, которые
позволяют отличить их от клеток других видов.
В практике патоморфологического анализа
структурно-функциональной организации эндокринных клеток применяют
комплекс чувствительных объективных методов исследования: гисто-
и иммуногистохимия, электронная микроскопия,
радиоавтография. Вместе с тем не потеряли своей актуальности многие
традиционные гистологические методы окрашивания ткани эндокринных
желез, которые достаточно просты по технике выполнения и дают
хорошие результаты даже в отсутствие особых навыков в работе.
ШИШКОВИДНОЕ ТЕЛО (ЭПИФИЗ)
Выявление пинеалоцитов
с помощью метода Рио-Хортега
Материал фиксируют в 10 % нейтральном формалине не менее
2 сут. Срезы получают на замораживающем микротоме,
тщательно промывают в нескольких сменах воды и помещают в 2 %
раствор нитрата серебра, на 10 мл которого добавляют 3 капли
чистого пиридина. В этом растворе срезы нагревают в течение 5 —
10 мин до 50 °С и затем оставляют на несколько часов в
термостате при 37 °С (в некоторых случаях вместо этого срезы помещают
в раствор нитрата серебра на 24 ч при комнатной температуре).
Срезы должны приобрести темный охряно-коричневый оттенок.
1. Срезы промывают в дистиллированной воде, добавляя на
каждые 10 мл воды 2 капли пиридина.
2. Импрегнируют в аммиачном растворе карбоната серебра,
на 10 мл которого добавляют 3 капли пиридина, подогретого до
50 °С, до тех пор, пока срезы не приобретут коричневую
окраску (обычно несколько минут).
375
3. Промывают в дистиллированной воде.
4. Восстанавливают в формалине (1:10) 1 мин.
5. Тщательно промывают в дистиллированной воде.
6. Тонируют в 0,2 % растворе трихлорида золота несколько
минут до появления серой окраски срезов; раствор слегка
подогревают для усиления окраски и получения фиолетовых тонов.
7. Фиксируют в 5 % растворе тиосульфата натрия 1 мин.
8. Промывают, обезвоживают, проводят через ксилол,
заключают в бальзам.
Приготовление раствора карбоната серебра: к 5 мл 10 %
раствора нитрата серебра добавляют 20 мл 5 % раствора карбоната
натрия (используют безводный карбонат натрия). После этого
добавляют по каплям такое количество аммиака, какое
требуется для растворения слегка желтоватого осадка. При добавлении
аммиака после каждой капли необходимо выждать некоторое
время, прежде чем капать следующую. Маленькие капли
дозируют тонко оттянутой пипеткой. В случае необходимости можно
добавить 1—3 капли раствора нитрата серебра. Затем доливают
дистиллированной водой до 45 мл.
Результат: избирательно импрегнируются пинеалоциты с их
характерными отростками.
ГИПОФИЗ
Метод Берблингера—Бургдорфа
Материал фиксируют в 10 % нейтральном формалине или
спирт-формалине, заливают в парафин.
1. Депарафинированные срезы окрашивают от 2 до 48 ч в
спиртовом растворе крезофуксина, затем промывают в 96 %
спирте, контролируя процесс под микроскопом.
2. Промывают дистиллированной водой в течение
нескольких минут и окрашивают ядра квасцовым кармином 3 ч.
3. Ополаскивают дистиллированной водой и окрашивают
5 мин в растворе следующего состава: 2 г оранжевого О, 1 г фос-
форно-молибденовой кислоты, 100 мл дистиллированной воды.
4. Быстро ополаскивают дистиллированной водой,
обсушивают срезы фильтровальной бумагой и окрашивают 10 — 20 мин
в растворе анилинового синего.
5. Ополаскивают водой и дифференцируют в 75 % спирте до
прекращения отдачи облачков краски.
6. Обезвоживают в 96 % и 100 % спиртах, просветляют в
ксилоле и заключают в бальзам.
Для приготовления раствора анилинового синего к 100 мл
дистиллированной воды добавляют 0,5 г анилинового синего и
8 мл ледяной уксусной кислоты. Смесь кипятят и после
охлаждения фильтруют. Стойкий основной раствор перед
окрашиванием разбавляют 2 частями дистиллированной воды.
376
Результат: ядра красные, гранулы эозинофильных клеток
оранжево-желтые, гранулы базофильных клеток красно-синие,
остальные — темно-синие; главные клетки бледно-синие или
серые; соединительная ткань синяя.
Метод Ландинга—Холла (выявление клеток
передней доли гипофиза)
Материал фиксируют в 10 % нейтральном формалине,
обезвоживают, заливают в парафин.
1. Депарафинированные срезы ополаскивают
веронал-ацетатным буфером (рН 9,2).
2. Окрашивают 0,1 % раствором прочного синего В в
веронал-ацетатном буфере (рН 9,2) в течение 15 мин при 0 °С.
3. Ополаскивают буфером.
4. Проводят реакцию последовательного сочетания с 2 %
раствором 8-амино-1-нафтол-3,6-дисульфокислоты (Н-кислоты) в
буфере (рН 9,2) в течение 15 — 30 с.
5. Промывают в проточной воде 2 мин.
6. Обрабатывают в течение 10 мин при 20 —25 °С 1 %
раствором мезоперйодата натрия в 0,5 % азотной кислоте
(равноценным является 0,8 % раствор ортойодной кислоты).
7. Промывают в проточной воде 5 мин.
8. Обрабатывают в течение 2 ч реактивом ван-Дейна.
9. Проводят через спирты, ксилол и заключают в
синтетическую смолу.
Приготовление реактива ван-Дейна: 0,5 г тионина
растворяют в 250 мл дистиллированной воды, кипятят 5 мин, охлаждают,
доводят объем до прежнего уровня, добавляют 250 мл трет-бу-
танола ({;„., 25 °С); не фильтруя, переносят в сосуд с пробкой,
добавляют 75 мл 1 н. соляной кислоты и сразу 5 г пиросульфита
(метабисульфита) натрия; закрывают пробкой, встряхивают,
оставляют на 1 сут при 25 °С и затем на 48 ч при 4 °С. Перед
применением порцию основного раствора фильтруют.
Использованную смесь соединяют с основным раствором и хранят в
закрытом сосуде при 4 °С. Реактив сохраняется в течение б нед, считая
с момента приготовления смеси; его нельзя применять, прежде
чем он не будет выдержан, как указано в методике.
Результат: базофильные клетки синие, ацидофильные
клетки коричневые; хромофобные клетки не окрашиваются.
Метод Кереньи—Тейлора
Материал фиксируют в формалине, обезвоживают и заливают в
парафин. Срезы толщиной 5 мкм депарафинируют и доводят до
воды.
1. Окрашивают 1 % водным раствором бензо-чисто-синего
2 мин.
377
2. Промывают в водопроводной воде или нескольких сменах
дистиллированной воды 1 мин.
3. Помещают на 1 мин в квасцовый гематоксилин (по Гарри-
су или смесь сходного состава).
4. Дифференцируют под контролем микроскопа в растворе
0,125 н. соляной кислоты в 70 % спирте.
5. Подсинивают в 1 % растворе гидроортофосфата или
ацетата натрия и ополаскивают водой.
6. Докрашивают эозином 10—15 с.
7. Ополаскивают, обезвоживают, просветляют и заключают
в синтетическую смолу или бальзам.
Результат: гранулы р-клеток без эозина ярко-синие, с
эозином сине-пурпурные; гранулы а-к леток с эозином красные, без
эозина не окрашиваются; цитоплазма хромофобных клеток с
эозином розовая, без эозина не окрашивается; ядра сине-черные.
Метод Северингхауза
А. Предварительная обработка.
1. Маленькие кусочки ткани фиксируют 24 ч в смеси,
состоящей из 1 части 2 % тетраоксида осмия, 2 частей 3 % бихромата
калия, 1 части 1 % хромовой кислоты.
2. Промывают в нескольких сменах дистиллированной воды
30 мин.
3. Помещают на 18 —24 ч в смесь, состоящую из 1 части
древесного уксуса и 2 частей 1 % хромовой кислоты.
4. Промывают в нескольких сменах дистиллированной воды
30 мин.
5. Помещают на 3 — 6 дней в 3 % бихромат калия.
6. Промывают в проточной воде 24 ч.
7. В течение 6 ч проводят по спиртам до 96 %.
8. Материал заключают в парафин по следующей схеме:
100 % спирт 1 ч
100 % спирт с кедровым маслом (1:1) 12 —24 ч
кедровое масло 24 ч
кедровое масло с ксилолом (1:1) 1ч
ксилол 1 ч
ксилол с парафином (1:1) 6 ч
мягкий парафин (45 °С) 48 ч
заливка через 4 — 5 порций парафина
(60 — 62 °С), в каждой по 20 мин
9. Получают серийные срезы толщиной 3 мкм при
охлаждении парафина.
Б. Окрашивание.
1. Депарафинированные срезы доводят до
дистиллированной воды и покрывают 20 % раствором кислого фуксина на
анилиновой воде, 2 — 3 раза подогревают до появления паров.
378
2. Промывают в дистиллированной воде и наносят каплями
разбавленную пикриновую кислоту (1 часть насыщенного
раствора пикриновой кислоты на 100 % спирте и 7 частей 20 %
спирта), дифференцируют под контролем микроскопа 15 — 60 с.
3. Ополаскивают дистиллированной водой и помещают на
1 мин в фосфорно-молибденовую кислоту.
4. Основательно промывают и окрашивают 30 — 60 с в смеси
из 7 частей 1 % раствора метилового зеленого, 5 частей 1 %
раствора кислотного фиолетового и 5 частей 50 % спирта.
5. Промывают дистиллированной водой и обсушивают.
6. Помещают на 5 с в 95 % спирт, дифференцируют в смеси,
состоящей из 1 части абсолютного спирта и 3 частей
гвоздичного масла.
7. Обсушивают, быстро проводят через 100 % спирт и ксилол
и заключают в бальзам.
Результат: эозинофильные гранулы красные; базофильные
синие; митохондрии яркие фуксиново-красные; ядрышки
красные; эритроциты оранжево-желтые.
В том случае, если необходимо выявить пластинчатый
комплекс (комплекс Гольджи), то материал после фиксации
промывают 24 ч в проточной воде, ополаскивают в
дистиллированной воде и затем помещают в 2 % тетраоксид осмия на 8—10 ч
при 40 °С, а на последующие 4 — 6 дней при 35 °С. После этого
промывают в проточной воде, проводят по спиртам и т.д. Перед
окрашиванием срезы помещают в 0,1 % раствор перманганата
калия на 1 мин и после промывания также на 1 мин в 1 %
щавелевую кислоту.
Окраска крезазаном по Ромейсу
1. Материал фиксируют в жидкости «Суза» (смесь сулемы,
формалина и ледяной уксусной кислоты) или формалине.
Проводят через смесь спирта с эфиром и заливают в целлоидин-
парафин. Толщина срезов не более 5 мкм.
Целлоидин-парафиновые срезы после растворения парафина должны быть
обычным путем освобождены от целлоидина смесью спирта с
эфиром. Срезы фиксируют с применением сулемы, обрабатывают,
как обычно, спиртом с йодом.
2. Депарафинированные срезы тщательно промывают
дистиллированной водой, 80 % спиртом, помещают в резорцин-
фуксин до появления интенсивной черно-синей или
черно-коричневой окраски р-клеток. Продолжительность окрашивания
варьирует в зависимости от фиксации препаратов и зрелости
красящего раствора. Как правило, достаточно 1 ч, иногда
продолжительность должна быть увеличена на несколько часов или
препараты оставляют в красящем растворе на ночь. Для
контроля окрашивания срезы ополаскивают 96 % спиртом и изучают
под микроскопом. Следует избегать слишком длительного окра-
379
шивания, так как при этом остальные клетки также принимают
серый оттенок и последующее окрашивание получается
нечетким. То же самое происходит и при несоответствующей
фиксации. Раствор резорцин-фуксина готовят следующим способом.
Раствор А: 0,5 г фуксина (некислого) и 1 г химически
чистого резорцина растворяют в 50 мл дистиллированной воды,
нагревают в эрленмейеровской колбе вместимостью 200 мл.
Раствор Б: 2 г кристаллического трихлорида железа
растворяют в колбочке в 10 мл дистиллированной воды.
Раствор А нагревают до кипения, прибавляют раствор Б и на
небольшом пламени кипятят еще 5 мин при многократном
встряхивании. После охлаждения при комнатной температуре
осадок собирают на маленький фильтр; затем его вместе с
фильтром помещают обратно в эрленмейеровскую колбу,
заливают 70—100 мл 96 % спирта и осторожно подогревают на
водяной бане: осадок растворяется. Остудив, прибавляют 0,7 мл
концентрированной соляной кислоты (плотность 1,19) и
фильтруют. Раствор резорцин-фуксина должен быть по возможности
свежим и для данной цели им можно пользоваться не более 2 —
3 нед.
3. Дифференцируют в 3 сменах 96 % спирта до
обесцвечивания фона и четкого выделения р-клеток. В последней чистой
порции спирта срезы оставляют на 15 мин.
4. Помещают в анилиновый спирт (0,1 мл анилинового масла
на 100 мл 90 % спирта) на 15 мин.
5. Окрашивают азокармином О в течение 45 — 60 мин при 58 °С
в закрытом сосуде.
6. Остужают в течение 30 мин и затем дифференцируют в
анилиновом спирте до четкого выявления а-клеток и
обесцвечивания соединительной ткани.
7. Быстро (30 с) смывают анилин уксуснокислым спиртом
(1 мл ледяной уксусной кислоты на 100 мл 96 % спирта).
8. Промывают в дистиллированной воде.
9. Помещают на 4 мин в 5 % фосфорно-молибденовую
кислоту.
10. Обсушивают фильтровальной бумагой.
И. Помещают в раствор анилинового синего (0,5 г
водорастворимого анилинового синего на 100 мл дистиллированной
воды и 8 мл ледяной уксусной кислоты; смесь кипятят и после
охлаждения фильтруют; стойкий основной раствор перед
окрашиванием разбавляют 2 частями дистиллированной воды) на 40 мин.
12. Быстро ополаскивают дистиллированной водой и
дифференцируют в 96 % спирте до прекращения отдачи крупных
облачков краски.
13. Проводят через абсолютный спирт и ксилол, заключают
в бальзам.
Приготовление раствора азокармина О: 0,1 г азокармина О
добавляют к 100 мл дистиллированной воды, недолго кипятят и
380
после охлаждения до комнатной температуры фильтруют через
нежесткий фильтр. При этом часть нерастворившихся очень
мелких кристалликов красителя проходит через фильтр,
причем именно в таком количестве, которое растворяется при
последующем нагревании в термостате. На 100 мл
профильтрованного раствора добавляют 1 мл ледяной уксусной кислоты.
Результат: а-клетки ярко-красные; р-клетки от интенсивно-
коричневато-фиолетовых до сине-фиолетовых; у-клетки светло-
фиолетовые; 8-клетки кобальтово-синие; соединительная ткань
синяя; коллоид синий и красный.
Окраска толуидиновым синим по Валльраффу
Материал фиксируют в жидкости Буэна, заливают в парафин.
1. Депарафинированные срезы толщиной 5 мкм после
отмывания пикриновой кислоты в дистиллированной воде помещают
на 2 — 3 мин в раствор танина по Салазару (в смеси из 2 частей
дистиллированной воды и 1 части ледяной уксусной кислоты
растворяют танин в таком количестве, чтобы раствор принял
янтарно-коричневую окраску).
2. Ополаскивают дистиллированной водой и помещают на
30 с в 3 — 4 % раствор железоаммиачных квасцов.
3. Ополаскивают дистиллированной водой и
дифференцируют в солянокислом спирте (0,5 мл концентрированной соляной
кислоты, разведенной водой в соотношении 1:2, на 100 мл 70 %
спирта).
4. Промывают 70 % спиртом.
5. Окрашивают азокармином В (в бюксе) в течение 30 —
45 мин в термостате при 56 — 60 °С, затем на 5— 10 мин
оставляют охлаждаться при комнатной температуре.
6. Ополаскивают в дистиллированной воде и
дифференцируют в анилиновом спирте до тех пор, пока ядра не выступят
отчетливо благодаря окрашиванию остальной ткани.
7. Быстро (30 — 60 с) смывают анилин уксуснокислым
спиртом.
8. Проводят через 96 % и 70 % спирты до дистиллированной
воды.
9. Окрашивают в течение 1—3 мин 0,2—1 % водным
раствором толуидииового синего.
10. Дифференцируют 24 ч в 96 % спирте.
11. Проводят через абсолютный спирт и ксилол, заключают
в бальзам.
Результат: базофильные клеточные гранулы и коллоид
темно-синие: остальные клетки серые и без различимой
зернистости; ядра ярко-красные: соединительная ткань черно-синяя.
Если уменьшить продолжительность окрашивания в толуидино-
вом синем и соответственно дифференцировки в 96 % спирте, то
остаются окрашенными и гранулы эозинофильных клеток.
381
Окраска клеток передней доли гипофиза
на полутонких срезах по Ричарду—Оливиеру
Наркотизированных крыс перфузируют через сердце 2 % глута-
ровым альдегидом на 0,01 М фосфатном буфере (рН 7,2).
Маленькие кусочки быстро извлеченного гипофиза помещают на
ночь в 4 % раствор параформальдегида на 0,01 М фосфатном
буфере (рН 7,2), затем промывают фосфатным буфером.
Обезвоживают, заключают в эпон, нарезают полутонкие срезы
толщиной 1,5 мкм и помещают на стекла.
1. Для удаления заливочной среды со срезов стекла
помещают на 30 — 60 мин в раствор метилата натрия — 10 г метилата
натрия на 100 мл смеси метанола с бензолом (1:1). Срезы
промывают в течение 15 мин в смеси метанола с бензолом, в двух
сменах ацетона (в каждой по 5 мин) и затем в проточной воде
по крайней мере 1 ч.
2. Помещают в 95 % спирт.
3. Окрашивают раствором люксолевого прочного синего в
течение 5 мин при 60 °С (0,1 г люксолевого прочного синего МВ5,
100 мл 95 % спирта и 0,5 мл уксусной кислоты). При комнатной
температуре раствор стабилен не менее 1 мес.
4. Ополаскивают в 95 % спирте.
5. Промывают в проточной воде.
6. Помещают на 10 мин в 0,01 % раствор карбоната лития.
7. Дифференцируют в 70 % спирте до обесцвечивания срезов
(около 10 с).
8. Промывают в дистиллированной воде.
9. Окрашивают раствором эритрозина в течение 10 мин (2 г
эритрозина, 100 мл дистиллированной воды и 2 капли уксусной
кислоты, рН 6,42).
10. Промывают в дистиллированной воде.
11. Дифференцируют в 0,1 % спиртовом растворе фосфорно-
молибденовой кислоты около 30 с.
12. Обезвоживают, просветляют, заключают в ЭРХ.
Результат: гранулы пролактинпродуцирующих клеток ярко-
красные; гранулы соматотропных клеток фиолетовые или
темно-синие; цитоплазма других типов клеток окрашена в
бледно-голубой цвет; митохондрии, ядрышки и клеточные
мембраны имеют бирюзовый оттенок.
ЩИТОВИДНАЯ ЖЕЛЕЗА
Окраска коллоида по Краусу
Свежий материал фиксируют в формалине (1:9) при 37 °С.
Тщательно заливают в парафин. Получают срезы толщиной 3 — 5 мкм.
1. Депарафинированные срезы помещают на 6 мин в поли-
хромный метиловый спирт (1 г метилового синего растворяют в
382
100 мл дистиллированной воды и к 20 мл 96 % спирта
добавляют 1 г карбоната калия; медленно выпаривают на водяной бане
до 100 мл).
2. Ополаскивают в дистиллированной воде и
дифференцируют в 25 % растворе танина до тех пор, пока не прекратится
отделение облачков красителя.
3. Окрашивают раствором кислого фуксина с танином до
появления интенсивно-синей окраски клеточных ядер и красной
окраски соединительной ткани.
4. Тщательно промывают в дистиллированной воде.
5. Дополнительно окрашивают в течение 1 мин 2 % водным
раствором кислого фуксина.
6. Быстро ополаскивают водой и помещают на 30 с в 1 %
фосфорно-молибденовую кислоту.
7. Промывают водой, обсушивают и быстро проводят через
абсолютный спирт в ксилол и заключают в бальзам.
Раствор кислого фуксина с танином по Френкелю состоит из
смеси равных частей 0,5 % водного раствора кислого фуксина,
33 % раствора танина и глицериново-эфирной смеси. Глицери-
ново-эфирная смесь представляет собой глицериновый эфир,
разведенный в 5—10 раз дистиллированной водой. Для
приготовления глицеринового эфира 50 мл чистого глицерина и 10 г
сухого хлорида кальция помещают в колбу для перегонки и
собирают фракции, перегоняющиеся при 120 — 220 °С.
Полученную коричневую жидкость смешивают с углем и еще раз
перегоняют, при этом получается светло-желтоватый дистиллят,
который перегоняют уже при температуре 100 °С. Если видна
небольшая муть, то ее можно устранить прибавлением следов
100 % спирта.
Результат: таниноустойчивый коллоид от бледного
красновато-фиолетового до темного фиалково-синего цвета; фуксино-
фильный коллоид красновато-желтый или желто-красный; фук-
синофобный коллоид ярко-синий.
ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА
Тотальная окраска островков Лангерганса по Бенсли
Животное забивают путем кровопускания и через аорту перфу-
зируют раствором Рингера, подогретого до температуры тела, к
которому добавлены нейтральный красный (1:15 000) или янус
зеленый (1:30 000). Сосуды, не относящиеся к исследуемой
области, перед началом перфузии перевязывают.
Вскоре после начала инъецирования раствора с нейтральным
красным поджелудочная железа окрашивается в красный цвет.
Когда интенсивность окраски становится достаточной, кусочек
железы помещают под микроскоп: островки, интенсивно
окрашенные в желто-красный цвет, отчетливо выделяются среди
383
красноватой экзокринной ткани. Вскоре экзокринная ткань
обесцвечивается, тогда как островки остаются окрашенными.
При перекрашивании достаточно ненадолго накрыть препарат
покровным стеклом, чтобы привести к обесцвечиванию.
При использовании януса зеленого поступают так же.
Промывают до тех пор, пока вся железа не станет интенсивно сине-
зеленой. Затем железу прикрывают кусочком брыжейки, после
чего экзокринная ткань вследствие восстановления красителя
краснеет, тогда как островки остаются зелеными. Обычно через
15 — 20 мин восстановление необходимо прервать. Для этого
орган или выставляют на воздух, или заливают 5 % раствором
молибдата аммония. Если этого не сделать, то восстановление
может захватить и островки.
Дифференцированное окрашивание клеток островков
Лангерганса по Бенсли в модификации Лилли
1. Тонкие кусочки ткани рекомендуют фиксировать 24 ч в
смеси тетраоксида осмия, уксусной кислоты и бихромата калия
(по Бенсли: 2 мл 4 % тетраоксида осмия, 8 мл 2,5 % бихромата
калия и одна капля ледяной уксусной кислоты; по Лилли: 2 мл
4 % тетраоксида осмия, 5 мл 4 % бихромата калия и 3 мл 0,5 %
уксусной кислоты) или в смеси жидкости Ценкера с
формалином. После фиксации (независимо от способа) материал
промывают в проточной воде в течение ночи и заливают в парафин.
Толщина срезов не более 5 мкм.
2. Срезы проводят через ксилол и спирты до воды. Материал,
фиксированный сулемой, обрабатывают в течение 5 мин 0,5 %
раствором йода, приготовленным на 70 % спирте, и 1 мин 5 %
раствором тиосульфата натрия.
3. Окрашивают в течение 30 мин раствором следующего
состава:
1 % сафранин О 2 мл
1 % эриоцианин А 2 мл
0,1 М лимонная кислота 1,3 мл
0,2 М гидроортофосфат натрия 0,7 мл
дистиллированная вода 34 мл
4. Ополаскивают водой, обезвоживают ацетоном,
просветляют в смеси ацетона с ксилолом и в 2 сменах ксилола, заключают
в полистирол или в другую синтетическую смолу.
Результат: ядра и р-клетки красные; эритроциты и сс-клетки
синие. Достаточно хорошее окрашивание достигается уже через
10 мин, а результаты 60-минутного окрашивания ненамного
лучше результатов 30-минутного. По-видимому, можно
применять ацетатный буфер с рН 3,8. Вместо буфера для дифферен-
цировки можно использовать смесь Бенсли, состоящую из
гвоздичного масла и 100 % спирта в соотношении 3:1.
384
Окраска анилиновым синим и оранжевым Г
по Маллори
1. Тонкие срезы свежей ткани фиксируют в смеси жидкости
Ценкера с формалином (модификация Шпулера—Максимова)
в течение 4 — 24 ч. Парафиновые срезы через ксилол и спирты
доводят до воды; при этом осуществляют обычную обработку
йодом и тиосульфатом натрия.
2. Тщательно промывают в воде.
3. Промокают воду вокруг срезов и окрашивают в течение
10 мин смесью анилина с кислотным фуксином по Альтману
(10 мл профильтрованного 5 % водного раствора анилина и 1,5 г
кислотного фуксина; перед использованием время от времени
взбалтывают в течение 24 ч). Сначала на срезы наносят толстый
слой красящего раствора, затем нагревают над маленьким
пламенем до появления паров, дают остыть и продолжают
окрашивание.
4. Быстро промывают в предварительно прокипяченной и
охлажденной воде.
5. Помещают на 10 мин в 1 % водный раствор фосфорно-мо-
либденовой кислоты.
6. Подсушивают и окрашивают в течение 1 ч или менее в
растворе, состоящем из 0,5 г анилинового синего, 2 г оранжевого Г
и 100 мл дистиллированной воды.
7. Подсушивают и дифференцируют в 95 % спирте до тех
пор, пока от среза не перестанут отделяться густо окрашенные
облачка.
8. Обезвоживают 100 % спиртом, просветляют ксилолом и
заключают в бальзам.
Результат: гранулы а-клеток оранжево-красные; гранулы
Р~клеток голубоватые; клетки концевых отделов
поджелудочной железы голубовато-фиолетовые, иногда с оранжевыми зи-
могеновыми гранулами; эритроциты красные.
Окраска хромовым гематоксилином и флоксином
по Гомори
1. Материал фиксируют в жидкости Буэна.или смеси
жидкости Ценкера с формалином. Готовят парафиновые срезы
толщиной 2 — 4 мкм.
2. Срезы через ксилол и спирты доводят до воды и рефикси-
руют в жидкости Буэна в течение 12 — 24 ч.
3. Тщательно промывают в водопроводной воде для
удаления пикриновой кислоты.
4. Помещают на 1 мин в раствор, содержащий 0,3 % перман-
ганата калия и 0,3 % серной кислоты.
5. Обесцвечивают 2 —5 % раствором гидросульфита натрия и
промывают.
385
6. Окрашивают под контролем микроскопа в растворе
гематоксилина до тех пор (около 10—15 мин), пока р-клетки не
приобретут темно-синюю окраску.
7. Дифференцируют примерно 1 мин в 1 % (0,125 н.)
спиртовом растворе соляной кислоты.
8. Промывают водопроводной водой до тех пор, пока срезы
не приобретут ярко-синий цвет.
9. Докрашивают в 0,5 % водном растворе флоксина в течение
5 мин и ополаскивают.
10. Помещают на 1 мин в 5 % раствор фосфорно-вольфрамо-
вой кислоты.
И. В течение 5 мин промывают водопроводной водой, при
этом срезы вновь должны приобрести красную окраску.
12. Дифференцируют в 95 % спирте. Если срезы остаются
слишком красными и а-клетки различаются недостаточно
четко, то срезы погружают на 15 —20 с в 80 % спирт.
13. Проводят через 100 % спирт и ксилол, заключают в
бальзам.
Для приготовления красящего раствора смешивают равные
части 1 % водного раствора гематоксилина и 3 % раствора
хромовых квасцов; на каждые 100 мл смеси добавляют 2 мл 5 %
раствора бихромата калия и 2 мл 0,5 н. серной кислоты. Смесь
созревает через 48 ч; ее можно использовать до тех пор, пока на
поверхности после однодневного выдерживания в сосуде Коп-
лина не перестанет образовываться пленка, имеющая
металлический блеск (около 4 — 8 нед). Перед использованием
красящий раствор фильтруют.
Результат: р-клетки синие; а-клетки красные; 8-клетки от
розовых до красных и не отличаются от ос-клеток; гранулы зи-
могена в ацинарных клетках поджелудочной железы красного
цвета или же не окрашены; ядра от красно-пурпурных до
фиолетовых; эритроциты ярко-розовые.
НАДПОЧЕЧНИКИ. ПАРАГАНГЛИИ
Йодатный метод выявления норадреналина
по Хилларпу—Хекфельту
1. Тонкие кусочки (0,5 мм) мозгового вещества
надпочечника помещают в 10 % раствор йодата калия на 16 —48 ч при
комнатной температуре.
2. Фиксируют в течение 24 ч 10 % раствором формалина.
3. Срезы толщиной 10 — 20 мкм готовят на замораживающем
микротоме.
4. Тщательно промывают в дистиллированной воде (в случае
необходимости ядра можно докрасить в красный цвет).
5. Обезвоживают, просветляют и заключают в бальзам.
386
Результат: клетки, содержащие норадреналин, диффузно
окрашены в коричневый цвет; на докрашенных препаратах
окрашены как ядра, так и цитоплазма.
Хромаффинная реакция для выявления адреналина
и норадреналина по Хилларпу—Хекфельту
1. Свежие тонкие кусочки ткани помещают на 24 —48 ч в
раствор, состоящий из 90 мл 5 % бихромата калия и 10 мл 5 %
хромата калия (рН 5,6).
2. Промывают в дистиллированной воде в течение 30 — 60 мин,
трижды сменяя воду.
3. Срезы получают на замораживающем микротоме,
помещают на чистые предметные стекла, промывают дистиллированной
водой и заключают в глицерин-желатин (срезы можно
обезводить, просветлить в ксилоле и заключить в бальзам).
Результат: клетки, содержащие адреналин, окрашиваются в
темно-коричневый цвет; клетки, содержащие норадреналин,
приобретают более светлые желтоватые или
желтовато-коричневые тона.
Предварительная фиксация глутаровым альдегидом
позволяет выявить только те клетки, в которых содержится
норадреналин.
Метод Севки
1. Свежие тонкие кусочки ткани помещают на 48 ч в форма-
лин-бихроматную смесь:
40 % формальдегид 12 мл
5 % водный раствор бихромата калия 50 мл
1 М ацетат натрия 20 мл
дистиллированная вода до 100 мл
2. Промывают дистиллированной водой в течение 1,5 — 2 ч.
3. Срезы толщиной 10 мкм получают на замораживающем
микротоме.
4. Окрашивают разведенным красителем Гимзы (1 капля на
1 мл дистиллированной воды) в течение 24 — 48 ч.
5. Промывают дистиллированной водой (30 мин) и
дифференцируют в 0,2 % растворе уксусной кислоты.
6. Обезвоживают в 96 % и 100 % спиртах, проводят через
ксилол и заключают в бальзам.
Результат: клетки, содержащие адреналин, окрашиваются в
желто-зеленый цвет; клетки, содержащие норадреналин, —
сине-зеленые; энтерохромаффинные клетки — оранжевые;
тучные клетки (лаброциты) — пурпурно-красные.
387
Реакция Вульпиана по Чиаччио
При погружении свежей ткани надпбчечника в разбавленный
раствор трихлорида железа хромаффинные клетки мозгового
вещества окрашиваются в зеленый цвет. Очень тонкие кусочки
ткани фиксируют в 5 % спиртовом растворе трихлорида железа
(100 % спирт) около 10 мин, переносят в смесь 28 % раствора
аммиака и 100 % спирта (1:10) и затем уплотняют в 100 %
спирте (спирт проникает в ткань плохо, всего на 100 мкм).
Результат: в клетках мозгового вещества и в стенках вен
обнаруживают гранулы, окрашенные в цвета от фиолетового до
коричневого.
ИДЕНТИФИКАЦИЯ КЛЕТОК АПУД-СИСТЕМЫ
(АПУДОЦИТОВ)
В настоящее время известно более 40 типов эндокринных
клеток, включенных в АПУД-систему (диффузную эндокринную
систему). Апудоциты — зрелые дифференцированные клетки,
которые по своим функциональным, морфологическим,
гистохимическим , иммуногистохимическим и ультраструктурным
признакам могут быть отнесены к АПУД-системе,
располагаются в шишковидном теле, гипофизе, желудочно-кишечном
тракте, мочеполовых органах, поджелудочной железе, органах
дыхания, щитовидной железе, печени, надпочечниках, коже, лйм-
фоидных и других органах.
В клетках АПУД-системы экспериментально установлено
наличие ряда общих биохимических и цитохимических свойств,
сходных механизмов синтеза, накопления и секреции
биологически активных веществ. Апудоциты содержат биогенные
амины и /или способны поглощать предшественники биогенных
аминов (диоксифенилаланин и 5-гидрокситриптофан) и декар-
боксилировать их с образованием соответственно дофамина и
серотонина. Синтезируемые апудоцитами биогенные амины и
пептидные гормоны накапливаются в секреторных гранулах,
имеющих характерную форму, размеры и электронную
плотность осмиофильного содержимого в разных типах
эндокринных клеток. В секреторных гранулах обнаруживают высокое
содержание карбоксильных групп боковых цепей белков и аде-
ниннуклеотидов. В цитоплазме апудоцитов выявляют высокую
активность ряда ферментов: Ь-ДОФА-декарбоксилазы, нейрон-
специфической энолазы (уу-форма гликолитической энолазы),
а-глицерофосфат-дегидрогеназы, неспецифических эстераз
и /или холинэстеразы.
При окрашивании с помощью обычных гистологических
методов апудоциты можно различить, лишь имея определенный
опыт. Они несколько больших размеров, чем клетки паренхимы
388
тех органов, в которых располагаются, имеют округлую или
треугольную форму (чаще всего лежат в основании слизистых
оболочек желез или крипт), цитоплазма их эозинофильна, ядро
сдвинуто в апикальную часть клетки.
В практической работе для выявления апудоцитов на
гистологических срезах рекомендуется использовать
гистохимические реакции, позволяющие селективно окрасить секреторные
гранулы: импрегнацию серебром (аргентаффинные и аргиро-
фильные реакции), окрашивание свинцовым гематоксилином,
выявление скрытой метахромазии, флюоресцентные методы
выявления биогенных аминов, хромаффинную реакцию и др.
Некоторые из этих методов (например, импрегнация серебром и
окрашивание свинцовым гематоксилином) благодаря простоте и
хорошей воспроизводимости результатов широко используют
для количественных подсчетов.
Аргентаффинные реакции
Аргентаффинные реакции основаны на наличии в клетке
химических веществ, способных самостоятельно восстанавливать ионы
серебра из аммиачного раствора до металлического серебра.
Метод Массона в модификации Гамперля
1. Материал фиксируют в формалине, заливают в парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды и тщательно промывают в течение 2 —3 ч.
3. Помещают в раствор Фонтана на 24 ч в темноте.
Стаканчик для окраски должен быть хорошо закрыт.
4. Обильно ополаскивают дистиллированной водой.
5. Помещают в 5 % раствор тиосульфата натрия на 3 — 5 мин.
6. Промывают в проточной воде 15 мин. Окрашивают ядра
квасцовым кармином или ядерным прочным красным.
7. Проводят через спирты, просветляют в ксилоле,
заключают в бальзам.
Раствор Фонтана: к 5 % раствору нитрата серебра приливают
по каплям 28 % раствор аммиака (все время взбалтывая) до тех
пор, пока образующийся при этом осадок вновь не растворится.
Затем осторожно добавляют каплю за каплей 5 % раствор
нитрата серебра до появления неисчезающей мути. Готовая
жидкость не должна пахнуть аммиаком, перед использованием ее
взбалтывают.
Результат: аргентаффинные вещества, темно-коричневые
(иногда разных оттенков) на желтом фоне, ядра красные.
Метод позволяет интенсивно окрасить серебром энтерохро-
маффинные клетки. В ЕС-клетках аргентаффинную реакцию
дает продукт конденсации между серотонином и
формальдегидом — производное р-карболина.
389
Метод Лилли
1. Материал фиксируют в формалине, заливают в парафин.
2. Тонкие срезы депарафинируют, доводят до воды,
тщательно промывают в дистиллированной воде.
3. Обрабатывают раствором аммиачного серебра в закрытом
химически чистом сосуде Коплина в темноте в течение 8 —24 ч
при 25 °С.
4. Осадок серебра осторожно удаляют небольшим
количеством концентрированной азотной кислоты, затем промывают
несколько раз дистиллированной водой.
5. Промывают в дистиллированной воде и фиксируют в 0,2 М
(5 %) растворе тиосульфата натрия.
6. Промывают 10 мин в проточной воде, обезвоживают в
спиртах, просветляют в ксилоле и заключают в раствор капрата
целлюлозы в ксилоле.
Аммиачное серебро: к 2 мл 28 % раствора аммиака
(молекулярная масса 0,900) добавляют приблизительно 35 —40 мл 5 %
нитрата серебра; первые порции прибавляют довольно быстро,
встряхивая каждый раз, чтобы растворить коричневый осадок
окиси серебра. По мере того, как продолжительность
растворения осадка начинает увеличиваться, нитрат серебра прибавляют
все меньшими порциями и прекращают, когда появится легкая,
но отчетливая и неисчезающая муть.
Результат: при экспозиции препаратов в растворе аммиачного
серебра в течение 8 — 24 ч «вычерниваются» энтерохромаффин-
ные клетки, липофусцины, гематоидин и желчные пигменты.
Метод Гомори—Бартнера
1. Депарафинированные срезы обрабатывают йодным
раствором Вейгерта в течение 10 мин.
2. Помещают на 2 мин в 5 % раствор тиосульфата натрия.
3. Промывают в течение 10 мин проточной водой.
4. Ополаскивают в 2 сменах дистиллированной воды.
5. Срезы помещают в химически чистые сосуды Коплина,
содержащие предварительно подогретый забуференный раствор
метенамина серебра, и оставляют в термостате при 60 °С на 2 —
3 ч. Предварительное нагревание до 60 С позволяет сократить
длительность импрегнации на 0,5— 1 ч.
6. Ополаскивают в дистиллированной воде.
7. Тонируют 10 мин в 0,1 % растворе золотохлористоводо-
родной кислоты.
8. Ополаскивают в дистиллированной воде.
9. Переносят на 2 мин в 5 % водный раствор тиосульфата
натрия.
10. Промывают в течение 5 мин проточной водой.
11. Докрашивают 0,1 % раствором сафранина О в 0,1 %
уксусной кислоте 5 мин.
390
12. Обезвоживают ацетоном, просветляют в ксилоле и
заключают.
Раствор Вейгерта: 1 г йода, 2 г йодида калия, 100 мл
дистиллированной воды. Для приготовления раствора сначала
растворяют йодид калия в воде, количество которой в 1 — 2 раза (по
массе) превышает количество соли (в таком концентрированном
растворе йод легко растворяется). Когда йод растворится,
добавляют дистиллированную воду до нужного объема.
Основной раствор метенамина серебра: 3 г метенамина (гекса-
метилентетрамина) растворяют в 100 мл дистиллированной воды,
добавляют 5 мл 5 % водного раствора нитрата серебра. Этот
раствор можно хранить в прохладном темном месте в течение 1 мес.
Рабочий раствор: к 30 мл исходного раствора метенамина
серебра добавляют 8 мл боратного буфера Холмса с рН 7,8 (16 мл
0,2 М ортоборной кислоты и 4 мл 0,05 М тетрабората натрия).
Результат: за 2 — 3 ч импрегнации «вычерниваются» все арген-
таффинные клетки. Если на 3-й стадии (п. 3) ввести обработку
1 % трихлоридом железа (10 мин) или 5 % хромовой кислотой
(1 ч), то серебрение энтерохромаффинных клеток ингибируется.
Аргирофильные реакции
Клетки, дающие аргирофильные реакции, обладают
способностью накапливать ионы серебра из раствора, однако
металлическое серебро появляется только после добавления внешнего
восстановителя. Продукт аргирофильной реакции откладывается в
цитоплазме в виде мелких коричнево-черных зерен.
Метод Гримелиуса
1. Кусочки ткани фиксируют в забуференном формалине
(10 % формалин на фосфатном буфере, рН 7,2) или жидкости
Буэна.
2. Тщательно отмывают и заливают в парафин.
3. Депарафинированные срезы пропитывают 0,1 М
ацетатным буфером (рН 5,6).
4. Срезы импрегнируют 0,03 — 0,05 % свежеприготовленным
раствором нитрата серебра на ацетатном буфере (рН 5,6) в
темноте в течение 24 ч при 37 °С или 3 ч при 60 °С. Раствор серебра
(0,03 %) готовят путем смешивания 10 мл 0,2 М ацетатного
буфера с 87 мл бидистиллированной воды и 3 мл
свежеприготовленного 1 % водного раствора нитрата серебра.
5. Избыток раствора серебра удаляют со стекол (но не со
срезов) фильтровальной бумагой; срезы проявляются в 1 %
гидрохиноне на 5 % растворе сульфита натрия в течение 1 мин при
температуре 40 — 45 °С.
6. Срезы промывают дистиллированной водой,
обезвоживают в спиртах, просветляют в ксилоле и заключают в бальзам.
391
Аргирофильную реакцию эндокринных клеток можно
усилить, если увеличить концентрацию нитрата серебра с 0,03 до
0,07 %, а температуру восстанавливающего раствора повысить
до 55 °С. Кроме того, слабую аргирофильную реакцию можно
усилить путем реимпрегнации. Для этого после 5-го этапа (п. 5)
срезы нужно ополоснуть дистиллированной водой и погрузить в
5 % водный раствор тиосульфата натрия на 5 мин. Затем срезы
промывают бидистиллированной водой и помещают в
свежеприготовленный раствор нитрата серебра (как описано в п. 4) на
10 мин при комнатной температуре и проявляют в
свежеприготовленном растворе восстановителя (как в п. 5) в течение 1 мин
при 55 °С.
Рекомендуется использовать свежеприготовленные
растворы, предназначенные как для импрегнации, так и для
восстановления металлического серебра. Для того чтобы избежать
осаждения серебра на срезы, для приготовления растворов
необходимо использовать бидистиллированную воду с очисткой ее
в стеклянных сосудах. Посуда должна быть химически чистой.
Метод Бильшовского—Грос
1. Материал фиксируют в формалине не менее 4 нед.
Используют замороженные или парафиновые срезы. Доводят до
дистиллированной воды и выдерживают в ней 5 — 10 мин.
Замороженные срезы наклеивают на предметные стекла:
стекла дважды смазывают смесью белка с глицерином,
высушивают над пламенем горелки, вылавливают на них срезы и
плотно промокают фильтровальной бумагой. Фиксируют 1—2
каплями 40 % формалина, предварительно отфильтрованного через
фильтр Беркефельда; в процессе фиксации срез все время
сильно прижимают фильтровальной бумагой. Через 15 — 20 мин он
прикрепляется к стеклу.
2. Фиксируют 3 — 4 нед в кислом 40 % формалине
3. Промывают в 5 % формалине. Промокают сложенной в
несколько слоев фильтровальной бумагой (в дистиллированной
воде не промывать!).
4. Обрабатывают 20 % раствором нитрата серебра в темноте
в течение 1 ч при 25 — 30 °С (ставят на термостат, нагретый до
45 — 50 °С). Промокают сложенной в несколько слоев
фильтровальной бумагой.
5. Обрабатывают аммиачным серебром в течение 5 мин (к 20 %
раствору нитрата серебра добавляют по каплям 28 % раствор
аммиака до полного растворения осадка); оставляют на 1 — 2 ч;
непосредственно перед использованием добавляют еще 0,6 мл 28 %
раствора аммиака на каждые 10 мл раствора.
6. Препараты вынимают и кладут срезами вверх. К раствору
аммиачного серебра добавляют 20 % раствор формалина, в 100 мл
которого содержится 1 мл 85 % муравьиной кислоты (0,02 —
392
0,05 мл смеси на каждые 10 мл раствора нитрата серебра);
перемешивают.
7. Переносят срезы в приготовленную смесь и импрегнируют
в течение нескольких минут под контролем микроскопа. Для
этого срезы вынимают, промывают разбавленным раствором
аммиака (п. 8), стекла вытирают досуха. После наблюдения срезы
вновь помещают в этот же раствор.
8. Когда импрегнация окажется достаточной, срезы
промокают и переносят на 1 — 2 мин в 5 % раствор аммиака, для того
чтобы остановить импрегнацию.
9. Промокают и переносят для нейтрализации аммиака в 1 %
раствор соляной кислоты на 1 мин.
10. Промокают или ополаскивают в дистиллированной воде.
11. Тонируют в 0,1 % растворе золотохлористоводородной
кислоты до тех пор, пока срезы не станут равномерно серыми
(около 15 мин).
12. Промокают или ополаскивают в дистиллированной
воде.
13. Помещают на 1 мин в 2,5 % раствор тиосульфата натрия.
14. Промывают в течение 20 мин в нескольких сменах
водопроводной воды.
15. Докрашивают в квасцовом кармине или гематоксилине
Эрлиха (1 мин).
16. Быстро проводят через спирт, терпинеол, ксилол и
заключают в бальзам.
Метод Севье—Мунгера
Запасные растворы:
I. Раствор нитрата серебра в дистиллированной воде 10 %.
II. Раствор нитрата серебра в дистиллированной воде 20 %.
III. Раствор кислого формалина в водопроводной воде (2 мл
40 % формалина и 98 мл воды) 2 %
IV. Раствор карбоната натрия: 8 г карбоната натрия декагид-
рата и 30 мл дистиллированной воды.
V. Аммиачный раствор серебра:
1) к 50 мл 10 % раствора нитрата серебра добавляют по
каплям свежий холодный 28 — 30 % раствор аммиака (между
каплями энергично встряхивать!) до тех пор, пока образующийся
темно-коричневый осадок почти не исчезнет (избегать полного
обесцвечивания!). Добавление аммиака прекращают, когда
появится легкая, но отчетливая и неисчезающая муть. Раствор
можно приготовить в темном стеклянном плотно
закрывающемся флаконе с делениями вместимостью 100 мл или в колбе Эр-
ленмейера;
2) к полученному раствору добавляют 0,5 мл раствора IV
(карбоната натрия). Тщательно перемешивают путем
взбалтывания;
393
3) добавляют 25 капель аммиака и тщательно перемешивают.
Раствор должен стать кристально прозрачным.
Отфильтровывают в колбу Эрленмейера вместимостью 125 мл. Плотно
закрывают.
Для приготовления растворов серебра используют
химически чистую темную стеклянную посуду, тщательно промытую в
нескольких сменах дистиллированной воды. Для того чтобы
предотвратить контактирование металла с растворами серебра,
пинцеты покрывают тонким слоем парафина или целлоидина.
Концентрированный раствор аммиака хранят в холодильнике.
Для каждой группы препаратов используют свежие порции
растворов.
1. Материал фиксируют забуференным формалином или
жидкостью Буэна (фиксаторы, содержащие этиловый спирт,
сулему, бихроматы и осмий, снижают интенсивность аргирофиль-
ной реакции или вызывают осаждение серебра) и заливают в
парафин.
2. В чистый сухой сосуд Коплина наливают 40 мл
отфильтрованного 20 % раствора нитрата серебра (раствор II); ставят
на 15 мин на термостат, нагретый до 60 °С. Стекла с тщательно
депарафинированными срезами помещают в подогретый
раствор серебра и вновь ставят на термостат на 15 мин.
3. Тщательно промывают в проточной воде, слегка
обсушивают и помещают в чистый сосуд Коплина.
4. К аммиачному раствору серебра (раствор V) добавляют 10
капель 2 % формалина (раствор III); при добавлении
формалина раствор осторожно перемешивают. Быстро выливают в сосуд
Коплина поверх стекол (чтобы избежать осаждения серебра на
срезы, целесообразно использовать препараты, покрытые 1 %
целлоидином).
5. Проявляют в течение 3 — 30 мин при постоянном
осторожном перемешивании раствора до тех пор, пока срезы не
станут золотисто-коричневыми. Для определения
оптимального времени проявления стекла можно вынимать из раствора
для контроля под микроскопом и вновь помещать в раствор
(не промывать!) либо проявлять контрольные препараты в
чашке Петри под микроскопом (раствор осторожно
перемешивать!).
6. Тщательно промывают в нескольких сменах проточной
воды.
7. Помещают на 2 мин в 5 % раствор тиосульфата натрия.
8. Промывают в воде.
9. Обезвоживают в 95 % и 100 % спиртах, просветляют в
ксилоле, заключают.
Результат: на золотисто-желтом фоне эндокринные клетки и
нервные волокна черные, эритроциты темно-коричневые, 6а-
зальные мембраны коричневые, ядра очень слабо окрашены в
серый или черный цвет.
394
Метод Дэвенпорта в модификации Хеллерстрема
и Хельмана
1. Материал фиксируют в жидкости Буэна, заливают в
парафин.
2. Срезы тщательно депарафинируют и рефиксируют в
жидкости Буэна в течение 2 ч при 37 °С.
3. Промывают в проточной воде в течение 1 ч.
4. Обезвоживают в спиртах возрастающей концентрации,
включая 95 % спирт, и импрегнируют в спиртовом растворе
нитрата серебра в темноте в течение 12 — 18 ч при 37 °С или 3 ч при
60 °С.
5. Быстро (максимум 10 с) промывают 95 % этанолом.
6. Проявляют под контролем микроскопа (около 1 мин) в
растворе: 100 мл 95 % спирта, 5 г пирогалловой кислоты, 5 мл
концентрированного формалина. Для того чтобы избежать
выпадения осадка, препараты необходимо все время покачивать
7. Промывают в течение 1 мин в 3 сменах 95 % спирта.
8. В случае необходимости можно окрасить ядра клеток. Для
этого срезы доводят до дистиллированной воды и окрашивают
ядерными красителями в течение 15 мин.
9. Обезвоживают, просветляют в ксилоле, заключают в
бальзам.
Спиртовой раствор нитрата серебра: 10 г нитрата серебра
растворяют в 10 мл дистиллированной воды, затем добавляют
90 мл 95 % спирта и 0,1 мл 1 н. азотной кислоты. Перед
использованием рН раствора доводят до 5,2 путем добавления
нескольких капель концентрированного аммиака.
Результат: интенсивную аргирофильную реакцию дают
эндокринные клетки, продуцирующие соматостатин.
Особенности применения аргирофильных методов
для выявления отдельных типов апудоцитов
Из большого количества аргирофильных методов и их
модификаций для выявления эндокринных клеток наиболее часто
применяют импрегнацию серебром по Гримелиусу, Севье —
Мунгеру и Дэвенпорту. Эти методы хорошо изучены и
позволяют получать воспроизводимые, но не одинаковые результаты
(табл. 9).
По Гримелиусу положительную аргирофильную реакцию
дает большинство известных эндокринных клеток желудочно-
кишечного тракта (кроме клеток, вырабатывающих холецисто-
кинин и соматостатин) и клетки островков поджелудочной
железы, содержащие глюкагон и панкреатический пептид, а также
С-клетки щитовидной железы. Аргирофильные клетки
выявляются в гипофизе, паращитовидных железах, мозговом веществе
надпочечников и параганглиях.
395
Таблица 9. Идентификация эндокринных клеток желудочно-кишечного
тракта и поджелудочной железы человека с помощью методов импрегнации
серебром
Тин
клеток
А (а)
в(р)
О (8)
Э1 (50
ЕС1
ЕС2
ЕСЬ
С
I
К
Ь
N
Р
РР
5
X
Продуцируемые
гормоны
Глюкагон
Инсулин
Соматостатин
?*
Серотонин
Вещество Р
Серотонин
Мотилин
?**
Гастрин
Холецистокинин
ГИП
Энтероглюкагон
Нейротензин
Бомбезин
ПП
Секретин
?
Массоиу
-
-
-
-
+++
+++
-
-
-
-
-
-
-
-
-
-
Метод импрегнации по
Гримслиусу
+++
-
-
-
+++
+++
+++
+
-
+++
++
+
+
+
+
+
Ссвьс —Мупгсру
±
-
-
-
+++
+++
+++
±
±
+++
±
-
+
+
±
(+)
Ддвси порту
-
-
+++
±
"
~
-
-
-
-
-
-
-
-
-
1
Примем а н п я.
1. ГИП — гаетроиигибирующий пептид; ПП — панкреатический пептид; ? —
гормональный профиль окончательно не установлен.
2. Интенсивность реакций: +++ сильная; ++ достаточно сильная; + слабая; ± иногда слабая,
иногда отсутствует; (+) практически отсутствует; - клетки не окрашиваются.
* У некоторых видов, возможно, содержат вазоактивный интсстииальиый пептид (ВИП).
** У грызунов содержат гнетам и и.
С помощью метода Севье — Мунгера интенсивно
окрашиваются ЕС- и ЕСЬ-клетки; клетки, синтезирующие
гаетроиигибирующий пептид; Э^клетки поджелудочной железы и С-клетки
щитовидной железы.
Метод Дэвенпорта особенно информативен при выявлении
Э-клеток, вырабатывающих соматостатин.
Другие методы идентификации апудоцитов
Методы конденсации для флюоресцентного выявления
биогенных аминов
Для топохимического выявления биогенных аминов
разработаны высокочувствительные флюоресцентные методы с
применением обработки тканей парами формальдегида, глиоксиловой
кислоты и ортофталевого альдегида. Флюоресцентные методы
основаны на способности биогенных аминов конденсироваться с
396
указанными веществами и образовывать флюорофоры. Так, при
обработке лиофилизированных или высушенных криостатных
срезов парами формальдегида происходит конденсация кате-
холаминов и серотонина, с образованием интенсивно
флюоресцирующих продуктов (катехоламины -> тетрагидрохинолин; се-
ротонин -» тетра-(5-карболин). Различие спектров
флюоресценции продуктов конденсации позволяет дифференцировать
амины: катехоламины (дофамин, адреналин и норадреналин)
дают зеленую флюоресценцию, серотонин — желтую. С
помощью этого метода хорошо выявляются ЕС-клетки
пищеварительного тракта, моноаминсодержащие клетки гипофиза и
клетки мозгового вещества надпочечников.
Некоторые соединения, не выявляющиеся с помощью
формальдегида: Ы-ацетилированные индол амины (например, мелато-
нин) и метоксилироваиные катехоламины (например, 3-мето-
кситирамин) можно идентифицировать с помощью метода
конденсации с глиоксиловой кислотой. Для выявления гистамина
используют ортофталевый альдегид.
Конденсация с формальдегидом
(выявление биогенных аминов)
1. Свежие кусочки ткани замораживают на сухом льду или в
изопентане (предварительно охлаждают жидким азотом).
2. Криостатные срезы толщиной 15 — 20 мкм помещают на
покровное стекло и высушивают в плотно закрытой кювете над
фосфорным ангидридом при -20 °С (лучше в криостате).
3. Срезы обрабатывают параформальдегидом 2 ч при 80 °С в
эксикаторе (необходимо соблюдать меры предосторожности,
так как при температуре 80 °С образуются токсичные пары
параформальдегида). Для установления постоянного уровня
влажности 50 г параформальдегида выдерживают не менее 7 сут
над 25 % серной кислотой в плотно закрытом эксикаторе.
4. Заключают в парафиновое масло и исследуют с помощью
флюоресцентного микроскопа.
Результат: катехоламины дают флюоресценцию от зеленого
до желто-зеленого цвета (максимум спектра возбуждения
410 нм, максимум спектра флюоресценции — 480 нм).
Серотонин дает флюоресценцию от желтого до оранжевого цвета
(410- 525 нм).
Конденсация с глиоксиловой кислотой
1. Наркотизированных крыс перфузируют через аорту
охлажденным на льду 2 % раствором глиоксиловой кислоты
(50 мл) на гидрокарбонатном буфере Кребса — Рингера (рН
буфера доводят до 7,0 с помощью гидроксида натрия) в течение
3 — 5 мин.
397
2. Кусочки быстро извлеченной ткани помещают в холодный
буфер.
3. Готовят на вибратоме срезы толщиной 20 — 50 мкм (при
изготовлении срезов кусочки ткани следует заливать
гидрокарбонатным буфером Кребса—Рингера, рН 7,0).
4. Сразу или после 5 мин обработки в перфузионной среде с
глиоксиловой кислотой, охлажденной на льду, переносят срезы
на предметное стекло.
5. Удаляют избыток буфера фильтровальной бумагой.
6. В течение 15 мин высушивают срезы в потоке теплого
воздуха.
7. Помещают на ночь в эксикатор с фосфорным ангидридом
под вакуумом.
8. Проводят конденсацию с глиоксиловой кислотой. С этой
целью срезы подвергают следующей обработке: 3 г
глиоксиловой кислоты (высушенной над фосфорным ангидридом в
течение 24 ч) нагревают при 100 °С в течение 1 ч в закрытом сосуде,
соединенном с реакционным сосудом. После этого из
реакционного сосуда с помощью вакуумного насоса откачивают воздух
до тех пор, пока давление не уменьшится до 300 мм рт.ст.; в
сосуд впускают горячий, насыщенный глиоксиловой кислотой
воздух, а затем теплый воздух до восстановления нормального
атмосферного давления. Температура на протяжении всей
реакции 100 °С.
9. Заключают срезы в жидкий парафин и исследуют их под
флюоресцентным микроскопом.
Результат: при использовании светофильтров ВС 12/44 + 47
(фирма «5сЬои/2е153», Германия) катехоламины дают
голубовато-зеленую флюоресценцию, индоламины — коричневато-
желтую. В качестве контроля служат неперфузированные срезы
ткани, не обработанные глиоксиловой кислотой.
Конденсация с ортофталевым альдегидом
1. Тщательно высушивают криостатные срезы (в потоке
воздуха или в закрытой кювете со свежим фосфорным
ангидридом).
2. Для проведения реакции подготавливают два сосуда. В
первый помещают ортофталевый альдегид, во второй наливают
несколько миллилитров дистиллированной воды. Оба сосуда
плотно закрывают и ставят на 10 мин в термостат при
температуре 100 °С для образования паров.
3. Высушенные срезы помещают на 10 с в сосуд с
ортофталевым альдегидом, сосуд плотно закрывают.
4. Стекла быстро переносят в сосуд с водой, плотно
закрывают и оставляют на 1 мин.
5. Срезы высушивают в термостате при 80 °С.
6. Заключают в полистирол.
398
Для выявления флюоресценции продуктов конденсации гис-
т!амина используют светофильтр с длиной волны 520 нм.
При анализе материала следует учитывать, что обработка
сЬезов ортофталевым альдегидом индуцирует флюоресценцию
нЬ только продуктов конденсации гистамина, но также белков с
Ы^-терминальным гистидином и некоторых других соединений.
Ферри-феррицианидный метод Лилли
1. Кусочки ткани фиксируют в течение 1 — 15 дней в 10 %
формалине, заливают в парафин.
2. Срезы толщиной 5—10 мкм депарафинируют, доводят до
воды и осуществляют реакцию блокирования сульфгидрильных
групп. Для этого их обрабатывают б % водным раствором
сулемы и 1 % спиртовым раствором хлорпикрина в течение 1 ч.
3. Промывают в воде и помещают на 10 мин при 20 — 30 °С в
раствор реактива, в состав которого входят 4 мл
свежеприготовленного раствора 1 % гексацианоферрата (феррицианида)
калия, 30 мл 1 % трихлорида железа и 6 мл дистиллированной
воды (смесь готовят непосредственно перед использованием).
4. Промывают в 1 % водном растворе уксусной кислоты.
5. Докрашивают в разбавленном (1:5000) растворе нового
фуксина или фуксина в 1 % уксусной кислоте 10 мин.
6. Ополаскивают 1 % уксусной кислотой.
7. Обезвоживают, проводят через 95 % и 100 % спирты,
смесь спирта с ксилолом и ксилол; заключают в синтетическую
смолу, полистирол или минеральное масло. Недокрашенные
срезы заключают в капрат целлюлозы.
Результат: энтерохромаффинные клетки окрашиваются в
синий цвет; фон бледно-розовый или светло-зеленый, ядра от
розового до красного или светлые зеленовато-желтые, если
докрашивание не производили. Следует учитывать, что реакция
свидетельствует о наличии веществ, способных восстанавливать
феррицианид в ферроцианид. Данное свойство характерно для
меланинов, липофусцинов и других веществ.
В тканях, фиксированных смесями с бихроматом, с
помощью этого метода выявляют хромаффинные гранулы в клетках
мозгового вещества надпочечников.
Окраска свинцовым гематоксилином по Солциа
1. Кусочки ткани фиксируют в 6 % формальдегиде, глутаро-
вом альдегиде или смеси формальдегида и глутарового
альдегида на 0,2 М фосфатном буфере Соренсена (рН 7,0), заливают в
парафин.
2. Депарафинированные срезы доводят до воды и помещают
в краситель на 2 — 3 ч при 37 °С или на 1 — 2 ч при 45 °С.
3. Промывают, обезвоживают, заключают.
399
Приготовление красителя: 5 % раствор нитрата свинца в
дистиллированной воде добавляют к равному объему насыщенного
водного раствора ацетата аммония. Смесь фильтруют. К 100 м|л
фильтрата добавляют 2 мл 40 % формальдегида. Запасной
«стабилизированный» раствор свинца можно хранить в течение
нескольких недель при комнатной температуре. |
Для приготовления свинцового гематоксилина 200 мг
гематоксилина растворяют в 1,5 мл 95 % этанола. Спиртовой раствор
гематоксилина добавляют к 10 мл «стабилизированного»
раствора свинца и разводят 10 мл дистиллированной воды. Смесь
тщательно перемешивают. Через 30 мин раствор свинцового
гематоксилина фильтруют, доводят по объему до 75 мл
дистиллированной водой и используют для окрашивания.
Результат: в сине-черный цвет окрашиваются секреторные
гранулы а- и 8-клеток островков поджелудочной железы, ЕС-,
С- и Х-клеток желудочно-кишечного тракта, клеток гипофиза,
продуцирующих адренокортикотропный и меланоцитстимули-
рующий гормоны, клеток мозгового вещества надпочечников и
хеморецепторных клеток каротидного тела. В темно-синий цвет
окрашиваются также ядрышки, ядерный хроматин, кератогиа-
линовые гранулы, трихогиалин, отложения солей кальция,
нервные и мышечные волокна.
Окраска толуидиновым синим после гидролиза
соляной кислотой (реакция «скрытой» метахромазии)
1. Свежие кусочки ткани фиксируют в течение 24 — 48 ч в
формалине, жидкости Буэна или смеси ГПА (1 часть 25 %
водного раствора глутарового альдегида, 3 части насыщенного
раствора пикриновой кислоты и 1 % ацетата натрия).
2. Тщательно промывают в 5 —б сменах 0,01 М фосфатного
буфера с 0,85 % хлоридом натрия (рН 7,1), обезвоживают в
спиртах, проводят через ксилол и заключают в парафин.
3. Срезы помещают на стекла, покрытые альбумином, и
высушивают.
4. Тщательно депарафинируют, доводят до воды.
5. Осуществляют гидролиз в 0,2 н. соляной кислоты в
течение 5 —18 ч при 60 °С (для повышения толерантности ткани к
различным условиям гидролиза, уменьшения
продолжительности обработки соляной кислотой и усиления метахромазии к
гидролизной смеси рекомендуется добавлять 20 % СагЬошах 20М —
инертный полимер с молекулярной массой около 200 000).
6. Осторожно (чтобы избежать отклеивания срезов после
длительного гидролиза) промывают в 4 — 5 сменах
дистиллированной воды.
7. Окрашивают 2 — 3 мин 0,05 % раствором толуидинового
синего в 0,02 М фосфатном буфере (рН 5,5) или 1 ч 0,01 %
толуидиновым синим на 0,2 М ацетатном буфере (рН 5,0).
400
1 8. Промывают в буфере, заключают в каплю буфера или 70 %
сорбит.
1 Результат: «скрытую» метахромазию дают эндокринные
клетки островков поджелудочной железы, ЕС- и некоторые
другие клетки желудочно-кишечного тракта, С-к летки
щитовидной железы, базофильные клетки гипофиза и адреналинсодер-
жашие клетки мозгового вещества надпочечников.
Реакция азосочетания
Реакция диазосочетания для выявления
аргентаффинных гранул
1. Материал фиксируют в формалине, заливают в парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. Обрабатывают разведенным раствором (1 мг/мл)
стабилизированного диазотата 5-нитроанизидина (прочный красный
В) в 0,1 М веронал-ацетатном буфере (рН 9,2) в течение 30 с.
4. Тщательно промывают в проточной воде.
5. Окрашивают ядра в железоаммонийных квасцах по Майе-
ру в течение 6—10 мин.
6. Промывают-в проточной воде в течение 30 мин.
7. Обезвоживают в спиртах, просветляют в ксилоле и
заключают в дистрен-дибутилфталат-ксилол или бальзам.
Результат, аргентаффинные гранулы в энтерохромаффин-
ных клетках окрашиваются в оранжево-красный цвет, ядра — в
синий.
Кислая диазониевая реакция
1. Материал фиксируют в формалине, заливают в парафин.
2. Депарафинированные срезы доводят до
дистиллированной воды.
3. Помещают на 20 — 40 мин в 0,5 М ацетатный буфер (рН
5,2), содержащий 1 мг/мл диазотированного М-нитроанилина.
4. Промывают в проточной воде.
5. Докрашивают ядра в железных квасцах по Майеру 3 мин.
6. Промывают в проточной воде 30 мин.
7. Обезвоживают в спиртах, просветляют в ксилоле,
заключают.
Результат, аргентаффинные гранулы энтерохромаффинных
клеток окрашиваются в оранжево-красный цвет.
Метод Джиббса
1. Материал фиксируют в формалине (избегать солей
ртути), заливают в парафин.
401
2. Тонкие (5 мкм) срезы доводят до воды.
3. Помещают в 0,1 % красящий раствор Джиббса в веронало-
вом буфере (рН 9,2) на 15 мин. Для приготовления красящего
раствора 20 мг 2,6-дихлорхинонхлоримида (реактив Джиббса)
растворяют в 20 мл веронал-ацетатного буфера (рН 9,2) при
подогревании до 70 °С и встряхивании. Перед применением
раствор охлаждают и фильтруют.
4. Тщательно промывают в проточной воде (около 5 мин).
5. Докрашивают в течение 3 мин 0,5 % сафранином или 1 %
нейтральным красным.
6. Обезвоживают и дифференцируют ядерную окраску
быстрой проводкой через 70 % и 100 % спирты до ксилола.
7. Заключают в синтетическую смолу или дистрен-дибутил-
фталат-ксилол.
Результат: аргентаффинные гранулы окрашиваются в цвета
от темного серо-синего до черного; ядра красные.
Окраска гематоксилином по Лилли
(модифицированный метод Клара)
1. Парафиновые срезы толщиной 5 мкм доводят через
ксилол и спирты до дистиллированной воды.
2. Помещают в красящую смесь при 22 — 25 °С на 24 — 48 ч.
Для приготовления красящей смеси 35,6 мг гематоксилина
растворяют в смеси следующего состава:
0,1 М дигидроортофосфат калия 5,2 мл
0,1 М гидроортофосфат натрия 4,8 мл
дистиллированная вода 90 мл
3. Ополаскивают в дистиллированной воде, проводят через
спирты и ксилол, заключают в капрат целлюлозы.
Результат: гранулы энтерохромаффинных клеток и эозино-
фильных лейкоцитов окрашивают в цвета от синего до черного;
кератогиалин темно-синий.
Иммуногистохимическая идентификация апудоцитов
Получение новых данных об АПУД-системе во многом
обусловлено появлением принципиально нового методического подхода
в практике гистологических исследований — иммуногистохи-
мии. Получение антисывороток к пептидным гормонам и
биогенным аминам из крови иммунизированных животных, а также
возможность маркировать антитела флюоресцентными
красителями, ферментами или металлами без изменения их иммуноре-
активности открыли широкие перспективы для изучения
функционального состояния эндокринных клеток.
По сравнению с классическими гистологическими и
гистохимическими методами окрашивания приемы иммуногистохимии
402
позволяют выявлять и локализовать в тканях, клетках и
внутриклеточных структурах молекулярные компоненты,
обладающие антигенными свойствами, с высокой избирательностью и
специфичностью.
(Методы иммуногистохимического анализа характеризуются
очень высокой специфичностью. Однако в связи с
возникновением некоторых трудностей (получение «нужных» антител,
наличие перекрестных реакций, неспецифическая сорбция
антител;, необходимость сохранения в ткани антигена, без изменения
его иммунореактивности и т.д.) необходимо критически
оценивать результаты для их объективной трактовки.
Получение антител к пептидным гормонам
и биогенным аминам
Для того чтобы химическое соединение могло вызвать
образование антител в организме, это соединение должно быть для
данного организма чужеродным. Кроме того, на способность
вещества вызывать появление антител (иммуногенность) оказывают
влияние и некоторые другие его особенности. Во-первых,
размер молекул. Многие химические соединения (например,
маленькие пептиды, стероиды и лекарства) с молекулярной
массой менее 1000, как правило, не обладают иммуногенностью,
хотя могут связывать специфические антитела. Обычно
хорошими иммуногенами являются высокомолекулярные
соединения и комплексы. Во-вторых, химический состав. Большинство
природных белков с различной последовательностью
аминокислот вызывает интенсивное антителообразование, в то время как
гомополимеры аминокислот и другие макромолекулы с
повторяющимся химическим составом таким свойством не обладают.
В-третьих, третичная структура. Иммуногенные детерминанты
соединения должны быть доступны для поверхностных
рецепторов клеток иммунной системы.
Биогенные амины и большинство пептидных гормонов
слишком малы, чтобы вызвать образование антител. Кроме того,
биогенные амины являются постоянным компонентом многих видов
и не могут служить чужеродным материалом для иммунного
аппарата. Однако такие маленькие молекулы представляют
иммуногенные детерминанты, если их химическим путем
присоединить к большой молекуле-носителю. Обычно маленькую
молекулу в качестве гаптена ковалентно связывают с помощью
формальдегида, глутарового альдегида или карбодиимида с белковой
молекулой-носителем (например, с бычьим сывороточным
альбумином, яичным альбумином или тиреоглобулином).
Полученный комплекс хорошо стимулирует образование антител.
Специальные приемы иммунизации позволяют усилить
антителообразование. С этой целью широко применяют, например,
адъювант Фрейнда, в состав которого входит смесь минерально-
403
го масла, эмульсионного вещества и убитых микобактерий. Для
первичной иммунизации животным подкожно или внутрикожно
инъецируют смесь антигена и адъюванта. Из такой стабильной
водно-масляной эмульсии иммуноген высвобождается
медленно, в течение длительного периода времени. Это обеспечивает
максимальную длительность воздействия иммуногенного
комплекса на клетки иммунной системы и, кроме того, замедляет
локальную деструкцию комплекса фагоцитирующими
клетками. Липополисахариды, присутствующие в убитых микобакте-
риях, активируют В-лимфоциты и стимулируют иммунную
систему в целом. Через определенный период времени животным
повторно инъецируют иммунный комплекс, а затем берут кровь
для проверки наличия антител в сыворотке.
При иммунизации животных в плазме крови появляются
антитела, которые принадлежат в основном к классу у-глобули-
нов. Известно, что если даже иммуногеном служит высокоочи-
щенное или синтетическое вещество, полученные сыворотки
содержат спектр антител, распознающих различные антигенные
детерминанты в различных концентрациях, с разной
специфичностью и сродством к ним.
Комплекс гаптен — носитель стимулирует образование смеси
антител, способных реагировать с различными участками гапте-
на и белковой молекулы-носителя, но лишь одну субпопуляцию
антител можно использовать для иммуногистохимического
тестирования пептидного гормона или биогенного амина. К тому
же в сыворотке животного-донора обычно присутствуют
естественные иммуноглобулины, которые могут неспецифически
связываться благодаря гидрофобным или электростатическим
взаимодействиям с компонентами исследуемой ткани.
Наличие в сыворотке специфических антител к пептидному
гормону или биогенному амину можно проверить Лп уИто на
чистом антигене с помощью ферментного иммуносорбентного
метода или путем радиоиммунологического анализа. Однако
целесообразнее применять иммуногистохимическое тестирование,
т.е. окрашивание ткани, заведомо содержащей исследуемый
антиген. Этот способ позволяет оценить силу связывания
антител с антигеном (авидность антител). Для иммуногистохимичес-
ких исследований необходимо применять антитела с высокой
авидностью, иначе их можно вымыть из срезов ткани в процессе
иммуноокрашивания. На известном позитивном контроле
можно определить и оптимальное разведение антисыворотки,
т.е. такое разведение, при котором наблюдается оптимальное
специфическое окрашивание при минимальном фоне.
Чистую фракцию антител обычно получают путем аффинной
очистки на твердофазном иммуносорбенте, например на
гранулах сефарозы, покрытых антигеном. Антисыворотку,
содержащую смесь антител, пропускают через колонку с иммуносорбен-
том. Специфические антитела, «узнающие» детерминанты анти-
404
геца, прочно прикрепляются к сорбенту и не отделяются в
процессе промывания стандартным буфером, в то время как
загрязняющие антитела практически полностью удаляются с
растворов • Связанные антитела элюируют с сорбента при низком или
высоком рН буфера. К сожалению, при такой очистке теряется
мнбго антител с высокой авидностью, особенно пригодных для
иммуногистохимических исследований.
О. КаЫег и М. МПз^еш (1975) предложили принципиально
новый способ получения чистых антител даже при иммунизации
целой молекулой. Этот способ получил название «метод моно-
клональных антител». После слияния лимфоцитов селезенки
иммунизированных мышей с культивируемыми клетками
мышиной миеломы (клетки опухоли иммунной системы) удается
получить разнообразные гибридные клетки, которые обладают
способностью, с одной стороны, непрерывно размножаться, с
другой — синтезировать антитела. Одна клетка и ее потомки
продуцируют только один вид антител, антигенсвязывающие
участки которых обладают уникальной последовательностью
аминокислот и высокой специфичностью взаимодействия с
антигеном. Соответствующие методы отбора нужных клонов
позволяют получить линию гибридных клеток, секретирующих
одинаковые моноспецифичные (моноклональные) антитела.
В последние годы выделены клоны, которые вырабатывают
моноклональные антитела ко многим антигенам, в том числе к
пептидным гормонам и биогенным аминам.
Подготовка тканей к иммуногистохимическим
исследованиям
Специфичность иммуногистохимических реакций во многом
зависит от правильной подготовки ткани. В идеальном случае в
процессе обработки ткани концентрация биогенных аминов и
пептидных гормонов, а также их антигенность не должны
изменяться. В реальных условиях добиться этого сложно.
Большинство иммуногистохимических реакций невозможно провести без
фиксации, которая в той или иной степени влияет на
химическую структуру изучаемого соединения. Фиксация необходима
прежде всего для того, чтобы перевести антиген в
нерастворимую форму и предотвратить его вымывание при иммуноокраши-
вании. Кроме того, без соответствующей сохранности
морфологических структур сложно идентифицировать иммунореактив-
ную клетку.
При традиционных способах фиксации альдегидами из-за
жесткой поперечной сшивки белковых молекул антигенные
детерминанты пептидных гормонов могут изменить свою
пространственную структуру и стать недоступными для антител.
Однако при уменьшении продолжительности обработки и
снижении концентрации фиксирующих веществ, таких как фор-
405
мальдегид и глутаровыи альдегид, эндокринные клетки дают
удовлетворительную иммунопозитивную реакцию.
Выбор метода фиксации тканей для выявления биогенных
аминов часто зависит от способа приготовления иммуногена.
Если структура амина изменилась в процессе приготовления
иммуногена, то соответствующее изменение, внесенное в ткань
при фиксации, может стать предпосылкой для получения
позитивного иммуноокрашивания. Так, если биогенный амин
сшивают с альбумином с помощью формальдегида, то и фиксация
ткани жидкостями, содержащими формалин, способствует
лучшему выявлению моноамина. Это объясняется тем, что,
согласно предположению, при фиксации биогенные амины
соединяются с белками ткани аналогично связыванию гаптена с белковым
носителем.
Для иммуногистохимии пептидных гормонов разработаны
специальные слабосшивающие фиксаторы, такие как диэтилпи-
рокарбонат и парабензохинон. Эти реагенты хорошо сохраняют
морфологические детали ткани и практически не изменяют им-
мунореактивность пептидов.
От правильного выбора метода подготовки ткани зависит
конечный результат иммуногистохимической реакции. В
некоторых случаях материал можно фиксировать забуференными
жидкостями, содержащими формальдегид или парабензохинон,
путем погружения или перфузии и заключать в парафин.
Большинство пептидных гормонов хорошо сохраняется на
парафиновых срезах ткани, предварительно высушенной из
замороженного состояния и фиксированной в парах формальдегида,
диэтилпирокарбоната или парабензохинона. Если при
пропитывании ткани горячим парафином антигенность пептидов
снижается, то иммуноокрашивание следует проводить на криостатных
срезах.
Иногда антигенные участки в «перефиксированной»
альдегидом ткани удается' восстановить путем обработки депарафини-
рованных срезов протеолитическими ферментами.
Предполагают, что антигенные детерминанты высвобождаются вследствие
разрушения сшивок, образованных фиксатором.
В настоящее время «оптимального» фиксатора для иммуно-
гистохимических исследований нет. Многие авторы
предпочитают использовать 2 — 4 % параформальдегид (иногда с
добавлением 0,5 % глутарового альдегида) на фосфатном буфере (рН
7,1 — 7,4), забуференную жидкость Буэна или 0,4 % раствор
парабензохинона.
Необходимо учитывать, что стандартного депарафинирования
в течение 10 мин может быть недостаточно для удаления среды, в
которую заключали срезы. Это в свою очередь может привести к
выраженному окрашиванию фона. Для удаления всех следов
этой среды достаточно подогреть стекла чуть выше точки
плавления парафина и депарафинировать срезы в ксилоле.
406
Фиксация забуференной жидкостью Буэна
по Стефанини—де Мартино—Замбони
Для приготовления фиксатора 20 г параформальдегида
смешивают с 150 мл дважды фильтрованного насыщенного водного
раствора пикриновой кислоты и растворяют при нагревании до
60 °С, добавляя по каплям 2,5 % раствор гидроксида натрия.
Прозрачный раствор фильтруют, охлаждают до комнатной
температуры и доливают до 1000 мл фосфатным буфером (3,31 г
дигидроортофосфата натрия моногидрата, 33,77 г гидроорто-
фосфата натрия гептагидрата в 1 л дистиллированной воды).
Фиксирующая смесь имеет рН 7,3 и осмолярность 900 мосмоль.
Смесь стабильна в течение 1 года при комнатной температуре.
1. Маленькие кусочки свежей ткани фиксируют от 30 мин до
2 ч для электронно-микроскопической иммуноцитохимии, 12 —
24 ч — для световой иммуногистохимии.
2. Тщательно промывают в нескольких сменах буферного
раствора.
Фиксация в растворе бензохинона, по Полаку—Блуму
Готовят 0,4 % раствор рекристаллизованного бензохинона на
физиологическом растворе Кунса (ФРК), забуференном 0,01 М
фосфатным буфером рН 7,1 — 7,4 (ФРК — 8,1 г хлорида
натрия, 1,28 г гидроортофосфата натрия, 0,16 г
дигидроортофосфата натрия и до 1 л дистиллированной воды).
Кристаллы бензохинона, залитые ФРК, следует
перемешивать до полного растворения. Раствор бензохинона готовят не
ранее чем за 20 мин до использования. Готовый раствор должен
иметь светло-желтую окраску (раствор коричневого цвета не
применяют!). Кристаллы хранят в темноте в прохладном сухом
месте, иначе они приобретают коричневый цвет и не могут быть
применены.
1. Свежие кусочки ткани фиксируют в растворе бензохинона
от 30 мин до 2 ч в зависимости от размеров (отношение объема
ткани к объему раствора приблизительно 1:10).
2. После фиксации кусочки ткани погружают в ФРК,
содержащий 7 % сахарозы и 0,01 % азида натрия.
3. Промывают в растворе ФРК-сахарозы в течение
нескольких часов при 4 °С.
4. Кусочки ткани замораживают и готовят криостатные срезы.
Интерпретация результатов иммуноокрашивания
Для точной идентификации клеток АПУД-системы с
установлением типа продуцируемого гормона используют различные
приемы иммуногистохимического анализа. Наряду с
флюоресцентными красителями для маркировки антител применяют фермен-
407
ты и металлы: пероксидазу, щелочную фосфатазу, глюкозоок-
сидазу и коллоидное золото. При использовалии антителофер-
ментных конъюгатов связанный с антителом фермент выявляют
на заключительном этапе проведения реакции антиген —
антитело. Образующиеся в результате специальных
гистохимических реакций нерастворимые полимерные красители дают
интенсивно окрашенный продукт, который можно наблюдать в
обычном световом микроскопе. Кроме того, продукт
ферментативных реакций можно сделать электронно-плотным и,
следовательно, использовать его для выявления антигенов на
ультраструктурном уровне. Применение в качестве
электронно-плотного маркера коллоидного золота позволяет не только изучать
одновременно локализацию нескольких гормонов в одной
клетке, но и дифференцировать их по гранулам.
Широко применяют непрямой иммунофлюоресцентный
метод с флюоресцеинизотиоционатом (ФИТЦ) в качестве флюо-
рохрома. Реакцию взаимодействия антиген — антитело
наблюдают благодаря характерной флюоресценции красителя, конъ-
югированного с антителами, в ультрафиолетовом свете. При
возбуждении ФИТЦ светом с длиной волны 490 нм наблюдается
флюоресценция желто-зеленого цвета. В качестве флюорохро-
мов применяют и другие красители, например красный
флюоресцентный краситель — тетраметилродаминизотиоционат.
Иммунофлюоресцентные методы сравнительно просты и
обладают выраженной разрешающей способностью. Однако
результаты реакции не всегда стабильны (со временем
флюоресценция меченых антител снижается), в связи с чем требуется
фотодокументация сразу после обработки материала. Для
визуализации реакции необходима специальная
микрофлюоресцентная техника, поскольку проводят ультрафиолетовую
микроскопию с исследованием объектов в люминесцентном свете. Иногда
затруднена гистологическая интерпретация нефлюоресцирую-
щих структур на срезе, а в некоторых случаях, наоборот,
выявление позитивной реакции затруднено из-за аутофлюоресцен-
ции ткани.
Особое внимание следует обратить на возможность
появления неспецифических реакций. Так, при использовании имму-
нопероксидазного метода существенной помехой может служить
высокий уровень эндогенной пероксидазы. При иммуноокраши-
вании эндокринных клеток желудочно-кишечного тракта и
поджелудочной железы возможно неспецифическое связывание
иммуноглобулинов сыворотки через Сц-фракцию комплемента.
В случае применения непрямого метода увеличивается
вероятность фонового загрязнения вследствие неспецифической
сорбции у-глобулинов второй антисыворотки на компонентах
ткани.
С целью преодоления этих методических трудностей
используют несколько простых способов. Для того чтобы блокировать
408
эндогенную пероксидазу, обычно достаточно обработать срезы
тканей 0,3 % раствором перекиси водорода в буфере, метаноле
или этаноле. Для удаления комплемента сыворотку прогревают
в течение 30 мин при 56 °С. Некоторые неспецифические
реакции можно частично блокировать путем обработки срезов
инертным белком или неконъюгированной неиммунной
сывороткой животного — донора вторых антител до нанесения
первых антител. При блокировании участков неспецифической
сорбции образующиеся связи не препятствуют взаимодействию
специфических антител с антигеном. Необходимость
блокирования нормальной сывороткой отпадает, если применять антитела
после аффинной очистки, моноклональные антитела или
белок А. (Белок А представляет собой линейный тетравалентный
протеин, выделенный из стенки бактерии 51арЬу1ососсиз аигеиз.
Посредством так называемой псевдоиммунной реакции этот
белок прикрепляется к Рс-фрагменту молекулы
иммуноглобулина многих видов млекопитающих: интенсивно связывается с
иммуноглобулинами человека, кролика и собаки; слабо
взаимодействует с Рс-рецепторами у-глобулинов мышей и крыс. Белок А,
меченный ФИТЦ, пероксидазой или коллоидным золотом,
можно использовать вместо второго слоя антител в непрямом
методе. Комплекс белок А — коллоидное золото находит все
более широкое применение в ультраструктурной иммуноцитохи-
мии.)
Одно из требований, предъявляемых к антисывороткам,
высокий титр (концентрация) специфических антител. При
высоком титре путем сильного разведения антисыворотки можно
добиться значительного снижения активности неспецифических
реакций, возникающих из-за гетерогенности антител.
Нежелательные побочные реакции, в том числе гидрофобные и
электростатические взаимодействия иммуноглобулинов
сыворотки с компонентами ткани на срезе, можно предотвратить
путем добавления к антисыворотке альбумина либо адсорбцией
антисыворотки гомогенатами или порошком «инертной» ткани,
не содержащей исследуемого антигена, например порошком из
печени, высушенной ацетоном, того животного, ткань которого
предстоит исследовать.
Следует помнить, что даже при использовании высокоочи-
щенных антител возможны перекрестные реакции,
обусловленные наличием в некоторых пептидах антигенных детерминант с
одинаковой последовательностью аминокислот. Так, у бомбези-
на и вещества Р последовательность аминокислотных остатков
на С-конце одинакова. Если при иммунизации животных
комплексом бомбезин — носитель образовались антитела к С-тер-
минальному фрагменту бомбезина, то при иммуногистохимичес-
ких исследованиях одновременно будут выявлены и бомбезин,
и вещество Р. (Одинаковые фрагменты определенной
последовательности аминокислот имеют такие пептидные гормоны, как
409
гастрин и холецистокинин, а также секретин, глюкагон, гастро-
ингибирующий пептид и вазоактивный интестинальный
пептид.) В связи с этим для точной идентификации гормона иногда
приходится работать с антителами, специфически
взаимодействующими с разными участками пептида (1Ч-концом, средней
частью и С-концевым фрагментом).
В связи с возможным неспецифическим связыванием
антител независимо от метода иммуноокрашивания для оценки
результатов и подтверждения специфичности иммуногистохими-
ческой реакции необходимо проводить контрольные
иммунологические и неиммунологические реакции, основными из
которых являются: 1) окрашивание заведомо «положительной» и
заведомо «отрицательной» ткани на содержание
соответствующего гормона; 2) замена специфической первой антисыворотки
на нормальную неиммунную сыворотку от того же вида
животных; 3) замена специфической антисыворотки на
антисыворотку к другому гормону (родственному по признаку перекрестной
реакции); 4) истощение антисыворотки избытком
специфического антигена до полной нейтрализации антител; 5) адсорбция
антисыворотки родственным антигеном (если отсутствует
перекрестная реакция, то результат должен быть положительным;.
Непрямой иммунопероксидазный метод выявления
биогенных аминов и пептидных гормонов
1. Срезы ткани, заключенной в парафин, тщательно депара-
финируют и доводят до воды. Криостатные с'резы для лучевой
адгезии помещают на предметные стекла, предварительно
покрытые пленкой из поли-Ь-лизина. В случае необходимости
можно удалить пигменты путем обработки срезов йодом и
тиосульфатом натрия.
2. Промывают срезы физиологическим раствором Кунса, за-
буференным 0,01 М фосфатным буфером, рН 7,2 (ФРК).
3. Для блокирования эндогенной пероксидазы помещают
срезы в 0,3 % раствор перекиси водорода на ФРК.
4. Промывают в ФРК (для снижения окрашивания фона в
промывающий буфер можно добавить 0,2—1 % тритона Х-100).
5. Для блокирования участков неспецифического
связывания на срезы наносят нормальную сыворотку животного —
донора вторых антител, разбавленную от 1:5 до 1:30 и
инкубируют 10 — 30 мин при комнатной температуре.
6. Не промывая срезы, пипеткой или фильтровальной
бумагой удаляют избыток сыворотки, оставив влажной ту часть, где
находятся срезы. Стекла помещают во влажную камеру
(например, в чашку Петри с мокрой фильтровальной бумагой).
7. На срезы наносят первую антисыворотку, содержащую
специфические антитела к выявляемому гормону (оптимальное
разведение определяют заранее, обычно от 1:20 до 1:200). При
410
высоком разведении инкубируют до 48 ч при 4 °С, при
низком — от 15 мин до 1 ч при комнатной температуре.
8. Промывают в трех сменах ФРК (по 5 мин в каждой) и
осушивают стекла (кроме зон, где находятся срезы!).
9. Наносят на срезы раствор вторых антител, конъюгирован-
ных с пероксидазой, в ФРК. (Коммерческие препараты козьих
антител к иммуноглобулинам кролика обычно разводят 1:20,
овечьи антитела к кроличьему 1дО после аффинной очистки
применяют в концентрации 1 мкг/мл.) Инкубируют при
комнатной температуре 15 — 60 мин.
10. Промывают в 3 сменах ФРК (по 5 мин в каждой).
11. Проявляют пероксидазу модифицированным методом
Грэхема—Карновского. Инкубационная смесь: 0,025 — 0,05 %
раствор тетрагидрохлорида диаминобензидина в 0,015 — 0,03 %
перекиси водорода на ФРК или трис-буфере (следует соблюдать
меры предосторожности, так как диаминобензидин —
потенциальный канцероген!). Раствор готовят и фильтруют
непосредственно перед использованием. Срезы инкубируют до 10 мин при
комнатной температуре, контролируя окраску под микроскопом.
12. Промывают срезы сначала в ФРК, затем в
дистиллированной воде. Ядра можно слегка окрасить гематоксилином или
метиловым зеленым.
13. Обезвоживают в спиртах, просветляют в ксилоле,
заключают.
Контрольные реакции заключаются в следующем.
1. Для проверки эндогенной пероксидазной активности
окрашивание начинают с п. 11, исключив п. 5— 10.
2. В п. 7 заменяют специфическую антисыворотку
нормальной сывороткой (например, если применяют кроличьи антитела
к гормону, то для контроля наносят неиммунную кроличью
сыворотку). Результат должен быть отрицательным.
3. В п. 7 заменяют специфическую антисыворотку на
антисыворотку к родственному гормону. Результат должен быть
отрицательным.
4. Для выявления неспецифического связывания антител
второго слоя с компонентами ткани окрашивание проводят
после п. 9, исключив п. 7.
5. Истощают антитела первой антисыворотки избытком
гормона. Результат должен быть отрицательным.
В раствор первых антител можно внести 0,1 % бычьего
сывороточного альбумина и 0,01 % азида натрия. В раствор вторых
антител азид натрия не добавляют. Оптимальное разведение
первых антител целесообразно определять на криостатных
срезах. Если при одинаковом разведении антисыворотки криостат-
ные срезы дают позитивную реакцию, а парафиновые —
негативную, то, возможно, заливка в парафин снижает или
разрушает антигенность. В этом случае первые антитела следует
применять в большей концентрации. Если реакция продолжает ос-
411
таваться негативной, то необходимо использовать только криос-
татные срезы
Метод пероксидазы—антипероксидазы (ПАП-метод)
Первые этапы обработки материала такие же, как описанные
выше при непрямом иммунопероксидазном методе (пп. 1—8).
Однако при работе с ПАП-комплексом разведение первой
антисыворотки обычно в 10 раз выше, чем в непрямом методе.
9. На срезы наносят раствор неконъюгированных вторых
антител в ФРК (например, овечьи или козьи антитела к 1§С
кролика, если применяют кроличьи антитела к гормону и
кроличий ПАП-комплекс) в разведении 1:20, инкубируют 30 мин
при комнатной температуре.
10. Промывают 3 раза в ФРК, в каждой смене по 5 мин.
11. Наносят ПАП-комплекс, разведенный в ФРК (без азида
натрия) от 1:35 до 1:70, согласно протоколу для коммерческого
препарата, инкубируют 30 мин при комнатной температуре.
12. Промывают 3 раза в ФРК.
13. Проявляют пероксидазу так же, как в п. 11 непрямого
метода.
14. Промывают (можно подкрасить ядра), обезвоживают,
заключают.
Контрольные реакции состоят в следующем.
1. Исключить первую антисыворотку (п. 7).
2. Первую антисыворотку истощить очищенным гормоном и
продолжить последовательность операций.
3. Первую антисыворотку заменить неиммунной сывороткой.
4. Специфическую антисыворотку в п. 7 заменить
антисывороткой к родственному гормону.
5. Пропустить п. 9 (неконъюгированные вторые антитела).
Если на известном позитивном материале получен
положительный результат, а во всех контролях — отрицательный, то
разведение первой антисыворотки (обычно 1:1000) можно
использовать для анализа неизвестного материала. Однако чаще
предпочтение отдают более высоким разведениям. Если
получены отрицательные результаты на позитивном контроле, то
разведение первой антисыворотки нужно снизить с 1:500 до 1:100.
Если результаты остаются отрицательными, то необходимо
изучить влияние разных фиксаторов на сохранность биогенных
аминов пептидных гормонов.
Электронно-микроскопическая верификация
секреторных гранул в эндокринных клетках
Такие морфологические признаки клеток АПУД-системы, как
их размеры и форма (округлая, треугольная, наличие
отростков), ультраструктура ядра, ядрышек, эндоплазматической
412
сети, пластинчатого комплекса (комплекс Гольджи) и др., не
являются достаточно специфичными для всей популяции апудо-
цитов в целом. Указанные признаки зависят от локализации
этих клеток и их функционального состояния.
Основным характерным признаком клеток АПУД-системы
служит наличие в цитоплазме секреторных гранул, которые
являются окончательным местом образования и хранения
пептидных гормонов и биогенных аминов.
Согласно существующим представлениям, процесс
биосинтеза и секреции пептидных гормонов проходит несколько
последовательных стадий. Пептиды синтезируются на полисомах
гранулярной эндоплазматической сети в виде
крупномолекулярного белка-предшественника (прогормона). После отщепления
гидрофобной МН2-терминальной сигнальной
последовательности, необходимой для переноса пептида через мембрану,
предшественник попадает в полость цистерн эндоплазматической сети.
Под действием ферментов прогормон-процессинга
крупномолекулярный белок претерпевает некоторые изменения, в
результате которых в зоне пластинчатого комплекса формируются про-
тогранулы. По мере продвижения к клеточной мембране
происходит структурное «созревание» гранул: их размеры
увеличиваются, а матрикс уплотняется. Одновременно прогормон
подвергается протеолитическому расщеплению с участием эндопепти-
даз, карбоксипептидаз и аминопептидаз. В результате из
инертного белка-предшественника образуется высокоактивная
молекула пептидного гормона. Биогенные амины образуются в цито-
золе клетки и накапливаются в созревающих гранулах. При эк-
зоцитозе мембрана секреторной гранулы сливается с мембраной
клетки, а содержимое гранулы высвобождается. Некоторые
этапы этих процессов достаточно хорошо прослеживаются с
помощью электронного микроскопа.
Зрелые секреторные гранулы представляют собой
многокомпонентные структуры. Помимо пептидных гормонов и биогенных
аминов, в гранулах содержатся предшественники пептидов и
крупные белковые молекулы, АТФ, ионы металлов (Са2+, М§2+).
Этот сложный многокомпонентный состав определяет размеры,
форму и внутреннее строение секреторных гранул,
идентифицированных на ультраструктурном уровне, а также возможность
применения различных гисто- и иммуногистохимических методов
исследования. Специфичность строения гранул, а также их
способность к осмиофилии, аргентаффинность и аргирофилия могут
служить в качестве ультраструктурных диагностических
признаков многих типов эндокринных клеток (табл. 10).
При ультраструктурной диагностике апудоцитов могут
возникать ошибки, обусловленные тем, что традиционные способы
электронно-микроскопического анализа не позволяют
дифференцировать эндокринные гранулы от эндокриноподобных
гранул другой химической природы.
413
Таблица 10. Номенклатура (буквенное обозначение типа клеток),
продуцируемые гормоны и ультраструктурные характеристики секреторных гранул
эндокринных клеток желудочно-кишечного тракта и поджелудочной железы
человека
Тип
клеток
А
в
р
р1
ЕС,
ЕС2
ЕСЬ
С
I
К
ь
N
Р
РР
5
X
Гормоны
Глюкагон
Инсулин
Соматостатин
?
Серотонин
Вещество П
Серотонин
Мотилин
?
Гастрин
Холецистокинин
Гастроингибиру-
ющий пептид
Энтероглюкагон
Нейротензин -
Бомбезин
Панкреатический
пептид
Секретин
?
Размер
гранул, им
[250
300
260-370
180-200
300
350
450
200-400
250
350
260
300
90-100
150-170
200
250
Ультраструктурпыс характеристики гранул
Круглые, матрикс осмиофильный с
высокой электронной плотностью, между мат-
риксом и мембраной узкий светлый
ободок («Ьа1о»); аргирофильны
Круглые, овальные, матрикс
полиморфный осмиофильный, часто имеет кристал-
лоидную форму, довольно широкий «Ьа-
1о»
Круглые, матрикс мелкозернистый,
умеренно осмиофильный
Круглые, электронно-плотные
Полиморфные, часто бобовидной формы,
электронно-плотные, аргентаффинны
Полиморфные, часто бобовидной формы,
электронно-плотные, аргентаффинны
Круглые, матрикс полиморфный,
аргирофильны
Круглые, матрикс варьирует от
электронно-прозрачного до электронно-плотного с
«па1о»
Круглые, электронно-плотные
Форма варьирует от круглой до
неправильной, часто каплевидной, электронно-
плотные
Круглые, электронно-плотные
Круглые, электронно-плотные 1
Круглые, электронно-плотные
Овальные, электронно-плотные
Форма варьирует от круглой до
неправильной, электронно-плотные
Круглые, электронно-плотные
Примечание. ? — гормональный профиль окончательно не установлен.
В 1977 г. ,1.0. ШсЬагёз и М. Эа Ргийа предложили
ультраструктурный цитохимический метод, так называемый метод
уранаффинной реакции, для выявления аденин-нуклеотидов в
органе л л ах, содержащих биогенные амины. Установлено, что
при соблюдении определенных условий (фиксация ткани глута-
414
ровым альдегидом и окрашивание 4 % водным раствором ура-
нилацетата при рН 3,9) ярко выраженную уранаффинную
реакцию дают структуры, содержащие большие количества 5-фос-
фонуклеотидов: ядра, ядрышки, рибосомы и эндокринные
гранулы. Селективность окрашивания объясняется тем, что при рН
3,9 положительно заряженные ионы уранила находятся
преимущественно в некомплексированной форме \]022+ и
накапливаются в местах концентрации отрицательных зарядов фосфатных
групп нуклеотидов.
Метод уранаффинной реакции
1. Маленькие кусочки ткани фиксируют 3 % глутаровым
альдегидом на 0,1 М какодилатном или фосфатном буфере (рН
7,2) в течение 90 мин.
2. После фиксации кусочки измельчают на блоки размером
около 1 мм и промывают 3 раза в 0,9 % растворе хлорида
натрия, каждая промывка по 15 мин (при использовании
фосфатного буфера или хранении кусочков ткани после фиксации в
охлажденном буфере с добавлением сахарозы отмывают в 0,9 %
растворе хлорида натрия в течение 72 ч при 4 °С).
3. Блоки ткани помещают в 4 % водный раствор урани л
ацетата (рН 3,9) на 18-48 ч при 4 °С.
4. Промывают в 3 сменах 0,9 % раствора хлорида натрия (по
15 мин в каждой), обезвоживают в спиртах и заключают в
эпоксидную смолу (эпон или спурр).
5. В электронном микроскопе исследуют ультратонкие срезы
(дополнительно не контрастировать!). Для предварительного
изучения материала и ориентировки блока целесообразно
сделать полутонкий срез и окрасить его толуидиновым синим.
Результат: избирательно контрастируются секреторные
гранулы эндокринных клеток, ядерный хроматин, ядрышки и
рибосомы. Не окрашиваются лизосомы, липофусциновые, лакт-
альбуминовые и зимогенные гранулы.
Непрямой метод выявления пептидных гормонов
на ультратонких срезах с помощью антител,
меченных золотом
1. Кусочки ткани фиксируют забуференной жидкостью
Буэна, глутаровым альдегидом или его смесью с
формальдегидом на 0,05 — 0,1 М фосфатном буфере (рН 7,2) в течение 2 ч
при 4 °С (если гормоны резистентны к осмированию, то
дополнительно фиксируют стандартным раствором тетраоксида
осмия); обезвоживают и заливают в эпоксидную смолу. Для
предварительного изучения гистологических структур
рекомендуется изготовить полутонкие (1 — 1,5 мкм) срезы и окрасить их
толуидиновым синим.
415
2. Ультратонкие (60—100 нм) срезы помещают на
никелевые или золотые сеточки без подложки, высушивают в течение
ночи.
3. Обрабатывают 10 % раствором перекиси водорода в
течение 15 мин (протравливание перекисью водорода особенно
рекомендуется для осмированной ткани).
4. Промывают профильтрованной дистиллированной водой,
удаляют избыток жидкости с сеточки.
5. Сеточку со срезами помещают на 30 мин в каплю 3 —5 %
нормальной сыворотки того вида животных, который был
донором вторых антител, на ФРК, содержащий 0,1 % бычьего
сывороточного альбумина (БСА).
6. Удаляют избыток нормальной сыворотки и помещают
сеточку в раствор первых антител на ФРК, содержащий 0,1 %
БСА. Оптимальное разведение антител и продолжительность
инкубации определяют экспериментально. Рекомендуется
выбрать фиксированное время (например, 1 ч при комнатной
температуре или 48 ч при 4 °С) и для него подобрать оптимальное
разведение.
7. Тщательно промывают в 0,05 М трис-буфере (рН 7,2).
8. Промывают в 3 сменах (по 15 мин в каждой с
перемешиванием) 0,05 М трис-буфера (рН 7,2), содержащего 0,2 % БСА.
9. Помещают на 5 мин в каплю 0,05 М трис-буфера (рН 8,2)
с 1 % БСА.
10. Сеточку переносят в каплю раствора вторых антител,
меченных коллоидным золотом, в 0,05 М трис-буфера (рН 8,2) с
1 % БСА и инкубируют в течение 1 ч при комнатной
температуре. Оптимальное разведение вторых антител определяют
экспериментально. Раствор вторых антител перед использованием
центрифугируют в течение 20 мин при 2000 об/мин для
удаления микроагрегатов частиц золота.
11. Тщательно промывают сначала в 0,05 М трис-буфере
(рН 7,2) с 0,2 % БСА, затем в буфере без БСА и
дистиллированной воде.
12. Сеточки осушивают адсорбционной бумагой,
контрастируют уранилацетатом и цитратом свинца.
Перед использованием все буферы и растворы необходимо
профильтровать через миллипоровые фильтры с диаметром пор
0,45 нм.
На всех этапах иммуноокрашивания нельзя допускать
полного высушивания сеток. Инкубировать сетки со срезами
удобно в ячейках (объемом 15 — 20 мкл) пластинок для
микротестовых анализов. Для переноса сеток и погружения их в ячейки
обычно используют два тонких пинцета. Если сеток немного, то
их лучше промывать каждую отдельно из шприца с
микрофильтром. При большом количестве сеток удобно использовать
специальную кассету с перфорированным дном и отверстиями в
крышке над каждой ячейкой; в которую вкладывают сеточку со
416
срезами. Закрытую кассету с сетками помещают в бюкс с
промывающим буфером и осторожно покачивают. Такая процедура
промывания достаточно эффективна и в то же время «мягкая».
Методологические рекомендации по последовательному
применению гистохимических, иммуногистохимических
и электронно-микроскопических методов при изучении
функциональной морфологии АПУД-системы в норме
и при патологии
Комплексный анализ изучения функциональной морфологии
апудоцитов основан на поэтапном применении гисто- и
иммуногистохимических методов, общих и специальных методов,
применяемых в электронной микроскопии.
На первом этапе целесообразно установить принадлежность
клеток к АПУД-системе и изучить популяцию эндокринных
клеток в целом. С этой целью используют в основном три
группы методов.
1. Гистохимические методы: аргирофильные реакции по
Гриме лиусу и Севье —Мунгеру, окрашивание свинцовым
гематоксилином и выявление «скрытой» метахромазии — позволяют
выявить большую часть эндокринных клеток, относящихся к
АПУД-системе.
2. Иммуногистохимическое тестирование на наличие в
эндокринных клетках уу-формы гликолитической энолазы (нейрон-
специфической энолазы).
3. Метод, основанный на свойстве апудоцитов поглощать и
декарбоксилировать предшественники биогенных аминов с
образованием моноаминов,— так называемый ФИФ —ДОФА-ме-
тод (флюоресценция, индуцированная формальдегидом после
экзогенного введения диоксифенилаланина). Через 1 — 2 ч
после инъекции животным Ь-ДОФА (200 мг/кг) на срезах
ткани, обработанных формальдегидом, наблюдается
интенсивная зеленая дофаминовая флюоресценция апудоцитов.
(Помимо апудоцитов, некоторые экзокринные клетки: ацинарные
клетки поджелудочной и слюнных желез, главные клетки
желудка и клетки Панета, также могут образовывать дофамин
после введения диоксифенилаланина, однако период
«полужизни» дофамина в экзокринных клетках гораздо короче, чем у
большинства апудоцитов.) Радиоавтографический анализ
накопления меченных тритием или 14С предшественников
моноаминов представляет определенную ценность при изучении
функциональной активности апудоцитов.
Основную роль в установлении типа продуцируемого
гормона и точной идентификации апудоцита играет иммуногистохи-
мия. Вместе с тем некоторые гистохимические (например,
импрегнация серебром по Массону —Гамперлю и Дэвенпорту) и
417
флюоресцентные методы конденсации можно с успехом
применять для выявления отдельных типов эндокринных клеток.
Усовершенствованные способы подготовки тканей,
применение очищенных и моноклональных антител, введение в
практику иммуноцитохимии электронно-плотных меток позволяют с
высокой точностью локализовать пептидные гормоны и
биогенные амины на субклеточном уровне. Для ультраструктурной
локализации лабильных антигенов разработаны иммуноцитохими-
ческие способы на основе криоультрамикротомии.
Все же методы электронно-микроскопической
иммуноцитохимии остаются достаточно трудоемкими и сложными для
повседневной работы. В связи с этим особый вклад в
классификацию апудоцитов по секреторному продукту и виду эндокринных
гранул внес простой и надежный способ серийных полутонких-
ультратонких срезов, при котором тип гормона
идентифицируют с помощью иммуногистохимического метода на полутонком
срезе, а эндокринную клетку изучают на соответствующем
серийном ультратонком срезе. На полутонких срезах удобно
проводить радиоавтографические исследования, а после удаления
заливочной среды удается провести многие гистохимические
реакции. Большинство известных эндокринных клеток
идентифицировано в исследованиях, в которых применяли гисто-, имму-
ногистохимические и ультраструктурные методы анализа.
Комплексное применение различных методов исследования
позволяет не только изучать функциональное состояние
популяции клеток АПУД-системы как в норме, так и при патологии,
проанализировать эндокринную функцию той или иной клетки,
определить тип и гормональный профиль апудоцита, но также
изучать кооперацию апудоцитов с другими клетками для
совместной регуляции функций организма.
ГЛАВА 22
ОКРАШИВАНИЕ СОЕДИНИТЕЛЬНОЙ
И МЫШЕЧНОЙ ТКАНЕЙ
Соединительная ткань составляет более 50 % массы тела,
образуя опорный каркас (кости, хрящ и сухожилия) и наружные
покровы (кожа), являясь составной частью всех органов и
тканей (строма, сосуды, клетчатка). Она состоит из клеточных
элементов и межклеточного матрикса, который в свою очередь
включает волокна (коллагеновые, ретикулярные,
эластические), протеогликаны и гликопротеины. Различают рыхлую
неоформленную и плотную оформленную соединительную ткань.
В условиях патологии образуются грануляционная и фиброзно-
рубцовая ткань, костная мозоль, гиалин, фибриноид. Все эти
виды различаются лишь количественным соотношением
основных компонентов и их архитектоникой.
Клеточные элементы соединительной ткани (фибробласты,
макрофаги, лимфоциты) окрашивают с помощью
общепринятых методов, для характеристики их функционального
состояния применяют различные гистохимические методы [Серов В.В.,
Шехтер А.Б., 1981]. Для выявления плазматических клеток
используют окраску пиронином-метиловым зеленым по Браше, а
тучные клетки (лаброциты), гранулы которых содержат
гепарин, хорошо выявляются с помощью гистохимических реакций
на кислые гликозаминогликаны (ГАГ). Из обзорных
гистологических методов для обнаружения лаброцитов следует
использовать окраску азур-эозином, гранулы хорошо выявляются при
окраске альдегид-фуксином или резорцин-фуксином.
Коллагеновые волокна по объему и массе составляют
основную часть межклеточного матрикса, поэтому определяют
главным образом тинкториальные особенности соединительной
ткани. Эти волокна представляют собой многокомпонентную
структуру, состоящую из белка коллагена (точнее коллагенов
разных типов), трехспиральные молекулы которого,
соединяясь между собой, образуют коллагеновые фибриллы,
характеризующиеся поперечной исчерченностью. Фибриллы с
помощью межфибриллярного цементирующего вещества,
содержащего протеогликаны и гликопротеины, формируют волокна и
пучки волокон, тинкториальные свойства которых
определяются их сложным химическим составом и микроструктурой.
В настоящее время выделено 14 типов коллагеновых белков,
различающихся молекулярной и надмолекулярной структурой.
419
Наибольшее значение имеют: 1) коллаген I типа, из которого в
основном состоят зрелые коллагеновые волокна большинства
тканей; 2) коллаген II типа, из которого образованы волокна
хряща и клапанов сердца (наряду с коллагенами IX —XII
типов); 3) коллаген III типа, из которого состоят ретикулярные
волокна и который в относительно большом количестве
содержится в незрелых коллагеновых волокнах развивающейся
соединительной ткани (эмбриональной, грануляционной и т.д.);
4) коллаген IV типа, не формирующий волокна и
содержащийся в базальных мембранах сосудов и эпителия вместе с
коллагеном XIII типа и гликопротеинами (фибронектин, ламенин) и
кислыми ГАГ; 5) коллагены V и VI типов, образующие очень
тонкие микрофиламенты без поперечной исчерченности.
Большинство этих типов коллагенов можно выявить в ткани
с помощью иммуноморфологических методов (см. главу 7) с мо-
ноклональными и поликлональными антителами и к коллагенам
соответствующих типов [\У1ск О. еЬ а1., 1976; Оау 3. еЬ а1.,
1982]. Гистологические окраски позволяют выявить раздельно
коллагеновые и ретикулиновые волокна, однако достоверных
способов окраски разных типов коллагена пока не существует.
Метод окрашивания срезов пикросириусом красным с
последующей поляризационной микроскопией (см. главу 8),
который, как полагали ранее, дает возможность раздельно выявлять
коллагены I и III типов, позволяет различать коллагеновые
волокна больше по толщине и структуре, чем по химическим
признакам. В частности, зеленую окраску приобретают не только
ретикулярные волокна, состоящие из коллагена III типа, но и
тонкие коллагеновые волокна, содержащие коллаген I типа.
Ретикулярные волокна, в большом количестве содержащиеся
в строме печени и других паренхиматозных органов, хорошо
выявляются при импрегнации серебром. Однако их следует
отличать от других аргирофильных структур — незрелых
коллагеновых волокон растущей ткани, которые ранее назывались
преколлагеновыми. Их общим признаком является повышенное
содержание «ответственных» за аргирофилию углеводных
групп. Следует отметить, что ретикулярные волокна во многих
работах обозначают как «ретикулиновые», так как ранее
считали, что в их основе лежит особый белок — ретикулин. Однако в
настоящее время установлено, что эти волокна являются двух-
компонентной системой, состоящей из коллагена III типа и гли-
копротеинов (в частности, фибронектина).
Эластические волокна также состоят из двух компонентов:
белка эластина и гликопротеиновых микрофибрилл. Их тинкто-
риальные свойства определяются в основном аморфным эласти-
новым компонентом.
Протеогликаны, составляющие основу цементирующего
вещества, заполняющего пространство между фибриллами,
волокнами и пучками волокон, являются сложным комплексом бел-
420
ков и кислых ГАГ (устаревшее название — кислые мукополиса-
хариды). Среди последних различают гиалуроновую кислоту,
хондроитинсульфаты, гепарин, кератан-, дерматан- и гепаран-
сульфаты. В тканевых срезах кислые ГАГ выявляются
благодаря комплексу гистохимических методов (окраска толуидино-
вым, альциановым синим и другими красителями при разных
рН) с энзиматическим контролем.
Гликопротеины (устаревшие названия — нейтральные муко-
полисахариды, гликопротеиды) — это белки, к молекуле
которых ковалентно присоединены олигосахариды: гексозы, гексо-
замины, сиаловые кислоты и др. В тканях их выявляют с
помощью ШИК-реакции (см. главу 6). Принадлежащий к этому
классу соединений фибронектин может быть обнаружен
посредством иммуноморфологической реакции с антителами к фибро-
нектину.
Мышечную ткань (гладкие и поперечнополосатые мышцы)
обычно выявляют при использовании тех же красочных
методов, что и соединительную ткань. С этой целью применяют
двух- и трехцветные методы, при которых контрастно
окрашиваются коллагеновые волокна и мышцы, а также окраску
железным гематоксилином. При исследовании мышечной ткани
используют также различные гистохимические, в том числе гис-
тоферментативные, методы, фазовоконтрастную,
поляризационную и люминесцентную микроскопию,
иммуноморфологический метод выявления мышечных белков и т.д.
ОБЗОРНЫЕ МЕТОДЫ ОКРАШИВАНИЯ СОЕДИНИТЕЛЬНОЙ
И МЫШЕЧНОЙ ТКАНЕЙ, КОЛЛАГЕНОВЫХ ВОЛОКОН
К обзорным относятся такие способы окраски, с помощью
которых контрастно окрашиваются клетки, коллагеновые волокна и
мышечная ткань. Существуют два основных принципа
окрашивания коллагеновых структур: анионовыми (кислыми)
красителями и фосфорно-вольфрамовым или фосфорно-молибденовым
гематоксилином. Больше распространены кислые красители.
Методов, основанных на их использовании, очень много, но все
их можно разделить на две основные группы. В методиках
первой группы, прототипом которых служит метод Ван-Гизона,
применяют смесь двух кислых красителей, один из которых
проявляет сродство к коллагену, а другой — к цитоплазме
клеток, включая мышечные волокна и эритроциты. Во вторую
группу входят различные трехцветные (трихромные) методы, в
которых два, три или четыре кислых красителя используют в
сочетании с фосфорно-вольфрамовой или фосфорно-молибде-
новой кислотой. Коллаген, цитоплазма клеток и мышц,
эритроциты, хрящ, кератин, фибрин, секреторные гранулы
окрашиваются в разные цвета.
421
В обеих группах методов используют отмывание срезов от
красителя (дифференцировка). При извлечении красителя с
более крупными молекулами он медленнее диффундирует из
структур, характеризующихся высокой концентрацией белка
(например, коллагеновые волокна), поэтому они остаются
окрашенными им, в то время как менее плотные структуры (мышцы
и др.) окрашиваются другим красителем, имеющим менее
крупную анионовую молекулу [НогоНп К., Р1етт§ Ь., 1988].
Метод Ван-Гизона и другие двухцветные окраски
В этой группе методов используют смесь кислых красителей
(кислый фуксин, анилиновый синий, метиленовый синий, инди-
гокармин, пищевой) с пикриновой кислотой, которая служит
как для подкис л ения, так и для докрашивания мышц,
цитоплазмы клеток и др. Избирательное (но не специфическое)
окрашивание коллагена связано, по-видимому, с его сродством к этим
кислым красителям в кислой среде (рН 1,0 — 2,0). Химические
основы такой избирательности не вполне ясны. Связывание
красителя не является результатом ионного взаимодействия
[РисЬИег Н. ек а1., 1988]. Присоединение кислого фуксина и
других красителей к гидроксильным группам некоторых
аминокислот коллагена осуществляется благодаря водородным
связям между ними и аминогруппами красителей. Возможна также
адсорбция красителя за счет гидрофобных связей и сил Ван-
дер-Ваальса.
Следует отметить, что интенсивность окраски коллагеновых
волокон зависит от плотности соединительной ткани и зрелости
волокон. В зрелых волокнах плотность расположения молекул
коллагена в протофибриллах и фибриллах, а фибрилл в
волокнах выше, чем в незрелых. Вследствие этого создается более
высокая концентрация химических групп белка,
обеспечивающих связь с красителем, и уменьшается его диффузия.
Незрелые волокна, богатые содержащим углевод цементирующим
веществом, не окрашиваются. Беспорядочное расположение
фибрилл и содержание большого количества протеогликанов также
способствуют снижению интенсивности окрашивания
(например, хрящевая ткань). Денатурация коллагена, ведущая к
разворачиванию спиральной структуры молекулы, как в желатине,
также ослабляет окраску. В связи с этим участки
соединительной ткани, где отмечается фибриноидная или другая
дезорганизация, имеют слабую окраску, а при окрашивании по Ван-Гизо-
ну становятся пикринофильными.
Окраска по Ван-Гизону
Для окрашивания ядер используют железный гематоксилин
Вейгерта, который готовят по мере необходимости путем сме-
422
шения двух растворов. Рабочий раствор можно хранить в
холодильнике не более 2 нед. Правильно приготовленный
гематоксилин должен иметь темно-фиолетовый цвет и быть
стойким, при побурении или позеленении он непригоден.
Окрашивание ядер в бурый цвет вместо черного считают дефектом
метода.
Пикрофуксин по Меркулову готовят путем смешивания 1 %
водного раствора кислого (не основного!) фуксина и
насыщенного при комнатной температуре водного раствора пикриновой
кислоты в соотношении 1:10. По прописи ]. Уап СНезоп
красящую смесь готовят, смешивая 5 мл 1 % раствора кислого
фуксина и 95 мл насыщенного раствора пикриновой кислоты.
Добавляя к этой смеси 0,25 мл концентрированной соляной кислоты,
получают более контрастные препараты: мышцы окрашиваются
в ярко-желтый цвет, а коллаген — в более яркий красный
[Лилли Р., 1969].
Успех окрашивания во многом зависит от качества кислого
фуксина. Если красная окраска коллагеновых волокон слаба
(розовый цвет), то к красящей смеси необходимо добавить фуксин;
если же окраска срезов слишком красная (когда даже мышцы
красные), то следует добавить пикриновую кислоту или
концентрированную соляную кислоту (0,5 мл на 100 мл раствора).
Методика окраски
1. Срезы ополаскивают водой и окрашивают в железном
гематоксилине Вейгерта в течение 3 — 5 мин (если рабочий
раствор хранился несколько дней, то продолжительность
окрашивания увеличивают до 10 мин).
2. Промывают в 2 — 3 порциях водопроводной воды.
3. Окрашивают в пикрофуксине 2 — 5 мин.
4. Быстро ополаскивают в воде, обезвоживают и
дифференцируют окраску волокон, проводя срезы через несколько смесей
96 % и 100 % спиртов.
5. Просветляют в карбол-ксилоле, ксилоле, заключают в
бальзам или синтетическую среду.
Результат: ядра черные или темно-коричневые, коллагено-
вые волокна красные, цитоплазма (особенно гладких и
поперечно исчерченных мышц), а также кератин и эритроциты
желтые.
Для проведения окрашивания по Ван-Гизону требуется
определенный навык. Необходимо контролировать под
микроскопом хотя бы первые препараты. Если остаются темные участки
с плохо отмытым гематоксилином, то следует дольше (до 10 —
15 мин) выдерживать срезы в пикрофуксине, который
ослабляет окраску гематоксилином, или дифференцировать
гематоксилин 1 % солянокислым спиртом (в этом случае в пикрофуксине
кра'сить не более 1 мин). При слишком сильном окрашивании
423
срезов в красный цвет фуксином следует увеличить
продолжительность ополаскивания в воде, но этот этап можно вообще
опустить, если окраска сразу достаточно избирательна. К
сожалению, окраска пикрофуксином нестойка и быстро выцветает
(за 2 — 3 мес).
Окраска пикро-индигокармином
Пикро-индигокармин был предложен еще раньше, чем
краситель Ван-Гизона, и его до сих пор применяют в некоторых
лабораториях. Готовят 0,25 % раствор индигокармина на
насыщенном растворе пикриновой кислоты и помещают в него срезы
после окрашивания ядер кармином или железным
гематоксилином. Коллаген окрашивается в синий или сине-зеленый цвет,
мышцы — в желтый.
Окраска пикро-анилиновым синим
Срезы вначале окрашивают 5 мин железным гематоксилином,
затем промывают водой, окрашивают 5 мин смесью анилинового
или метиленового синего и пикриновой кислоты (0,1 г
красителя на 100 мл насыщенной пикриновой кислоты), быстро
дифференцируют в 1 % уксусной кислоте и 96 % спирте, проводят
через 100 % спирт и ксилол. В синий цвет окрашиваются не
только коллагеновые, но также ретикулярные волокна и базаль-
ные мембраны.
Если между окрашиванием гематоксилином и
пикро-анилиновым синим провести ШИК-реакцию, то базальные мембраны
и некоторые секреторные продукты окрашиваются в
ярко-розовый или фиолетовый цвет, коллагеновые и ретикулиновые
волокна — в синий, мышцы — в зеленовато-желтый. Эта окраска
носит название «аллохромный метод Лилли».
Окраска пикро-пунцовым С
Окраска пикро-пунцовым С позволяет получить очень хорошие
результаты. Краситель готовят из пунцового С: 10 мл 1 %
водного раствора пунцового С; 86 мл насыщенного раствора
пикриновой кислоты, 4 мл 1 % раствора уксусной кислоты.
Методика окраски
1. Окрашивают препарат железным гематоксилином 5 мин.
2. Тщательно промывают в нескольких сменах
водопроводной воды.
3. Окрашивают в пикро-пунцовом С 3 — 5 мин (при
перекрашивании в гематоксилине время можно увеличить; можно
контролировать под микроскопом после ополаскивания в воде.
424
4. Дифференцируют в солянокислом спирте и обезвоживают
в 70 %, 96 % (две смены) и 100 % спиртах, просветляют в
ксилоле, заключают в бальзам.
Результат: ядра черно-коричневые; коллагеновые и
ретикулярные волокна красные; мышцы, эритроциты, эластические
волокна желтые. В отличие от способа Ван-Гизона окраска
волокон не выцветает.
Трехцветные методы окраски с использованием
фосфорно-вольфрамовой
и фосфорно-молибденовой кислот
Под термином «трехцветные методы» обычно понимают
способы окраски соединительной и другой ткани, в которых
используют два и более кислотных красителей в сочетании с
фосфорно-вольфрамовой и фосфорно-молибденовой кислотами. В
одних методах протравливание этими кислотами проводят
предварительно до окраски, в других их используют в смеси с
красителями. Избирательность методов этой группы основана на
связывании кислот с реактивными группами белков (наибольшую
роль играют аминогруппы лизина) с последующим
присоединением к свободным анионным группам кислот молекул
анилиновых красителей аминотрифенилметанового ряда с помощью их
аминогрупп [РисЫег Н. е! а1., 1988].
Гетерополикислоты, каковыми являются фосфорно-вольфра-
мовая и фосфорно-молибденовая кислоты, соединяются при рН
1,5 с белками и аминокислотами, но не с углеводами. Связь
этих кислот с коллагеновыми волокнами значительно сильнее,
чем с цитоплазмой клеток и мышечных волокон. Имеется и
другое представление о механизме окрашивания [Еуеге!: М., МП-
1ег ^., 1974]: гетерополикислоты связываются с цитоплазмой
посредством электровалентных сил, блокируя последующие
связи с красителями. Соединение же с коллагеном не имеет
ионного характера, поэтому не препятствует его связям с
кислотными красителями.
Из многих методов и их модификаций приведем несколько
основных трехцветных окрасок, преимуществом которых перед
способом Ван-Гизона является лучшее окрашивание тонких
коллагеновых и ретикулярных волокон, базальных мембран, а
также фибрина, гиалина, фибриноида, слизи, нервных
структур.
Следует отметить, что лучшие результаты получают при
фиксации ткани в хромово-сулемовых фиксаторах: жидкости
Ценкера, ценкер-формоле. Если материал фиксировали другим
способом, то рекомендуется срезы перед окрашиванием
протравить в насыщенном растворе сулемы или 3 % растворе бихрома-
та калия в течение 30 мин.
425
Метод Маллори
1. Срезы промывают в водопроводной воде.
2. Обрабатывают раствором Люголя или тиосульфата натрия
(этот этап необязателен).
3. Окрашивают в 0,5 % водном растворе кислого фуксина в
течение 2 — 3 мин и быстро ополаскивают в воде.
4. Обрабатывают 1 % водным раствором фосфорно-молибде-
новой (можно и фосфорно-вольфрамовой) кислоты в течение
2 — 5 мин (нельзя пользоваться металлическими
инструментами) и быстро ополаскивают в воде.
5. Окрашивают 1 — 2 мин (до 15 мин) в красящем растворе
следующего состава: 0,5 г анилинового синего, 2 г оранжа О, 100 мл
дистиллированной воды. В некоторых модификациях смесь
нагревают до кипячения, охлаждают и фильтруют.
6. Промывают 0,5 — 2 мин в дистиллированной воде.
7. Дифференцируют под контролем микроскопа в 96 %
спирте до отчетливого выявления волокон, обычно 3 — 5 мин.
8. Переносят в 100 % спирт, ксилол, заключают в бальзам.
Результат: ядра, эластические волокна, глия, фибрин, фибри-
ноид, хитин красные; коллагеновые волокна темно-синие;
ретикулярные волокна, хрящ, гиалин, амилоид, слизь голубые; мышцы,
цитоплазма клеток, эритроциты оранжевые; миелин желтый.
Ядра можно предварительно окрашивать литиевым кармином.
Окраска азаном по Гейденгайну
Это модификация метода Маллори, которая дает более четкие
результаты. Материал должен быть хорошо отмыт от фиксатора.
Приготовление раствора азокармина: 0,1 г азокармина С
растворяют в 100 мл дистиллированной воды, нагревают до
кипения, охлаждают и фильтруют, затем добавляют 1 мл ледяной
уксусной кислоты.
Приготовление красящей смеси: 0,5 г анилинового синего и
2 г оранжа О растворяют в 100 мл дистиллированной воды,
добавляют 8 мл ледяной уксусной кислоты. Смесь кипятят,
охлаждают, фильтруют. Раствор хорошо хранится. Для
окрашивания его можно развести в 2 — 3 раза дистиллированной водой.
Методика окраски
1. После промывания срезов дистиллированной водой их
окрашивают в растворе азокармина в термостате при 56 °С в
течение 1—2 ч, а в предварительно прогретом растворе азокармина
до 30 мин. Окрашивание проводят в высоких хорошо закрытых
стаканчиках.
2. После охлаждения до комнатной температуры срезы
ополаскивают в дистиллированной воде и дифференцируют в ани-
426
линовом спирте (1 мл анилинового масла в 10 мл 96 % спирта),
до четкого выявления ядер и значительного уменьшения
красной окраски среза, контролируя этот процесс под микроскопом.
Этап длится обычно 10 — 30 мин в зависимости от толщины
срезов и характера ткани.
3. Промывают в течение 30 с — 1 мин в 1 % уксуснокислом
спирте (96 %) и ополаскивают в дистиллированной воде.
4. Обрабатывают 5 % водным раствором фосфорно-вольфра-
мовой кислоты в течение 2 — 3 ч
5. Быстро ополаскивают в дистиллированной воде и
окрашивают в растворе анилинового синего с оранжем О в течение 1 — 3 ч.
6. Быстро ополаскивают в дистиллированной воде и
дифференцируют в 96 % спирте до выявления синих коллагеновых
волокон, контролируя этот процесс под микроскопом (как в
методе Маллори)
7. Проводят через 100 % абсолютный спирт, ксилол,
заключают в бальзам или другие среды.
Результат: ядра клеток красные, коллагеновые и
ретикулярные волокна темно-синие, мышцы оранжевые или красные,
эритроциты красные, слизь голубая, нейроглия красноватая,
фибрин красный.
Часто применяют упрощенную модификацию трехцветного
метода окраски по Слинченко:
1. После ополаскивания в дистиллированной воде срезы
держат 1 мин в красителе следующего состава: в 100 мл
дистиллированной воды растворяют 0,2 г хромотропа 2В и 0,5 г
йодноватой кислоты. Затем среды быстро ополаскивают в
дистиллированной воде.
2. Протравливают в 5 <% растворе фосфорно-вольфрамовой
кислоты в течение 2 — 5 мин, после чего ополаскивают в
дистиллированной воде.
3. Окрашивание проводят в течение 5—10 мин в растворе
следующего состава: 0,2 г водного голубого и 0,1 г йодноватой
кислоты в 100 мл дистиллированной воды.
4. Среды дифференцируют в 96 % спирте под контролем
микроскопа
5. Проводят через 100 % спирт, ксилол, заключают в бальзам.
Результат: коллагеновые волокна синие; ядра клеток, мышцы,
фибрин красные; гиалин разных оттенков голубого и красного.
Метод Массона
1. Окрашивают ядра железным гематоксилином Вейгерта в
течение 5 — 7 мин.
2. Дифференцируют в 0,5 % солянокислом спирте 15 — 30 с
(можно обойтись без дифференцировки, если окрашивать в
гематоксилине 1 — 2 мин).
. 3. Промывают в водопроводной воде 10 — 20 мин.
427
4. Окрашивают 2 — 5 мин в красящем растворе 1 г кислого
фуксина, 1 мл ледяной уксусной кислоты, 200 мл
дистиллированной воды.
5. После быстрого ополаскивания в дистиллированной воде
обрабатывают в 1 % фосфорно-молибденовой или фосфорно-
вольфрамовой кислоте в течение 5—15 мин до обесцвечивания
соединительной ткани (контроль под микроскопом).
6. Не ополаскивая, срезы окрашивают 1 — 2 мин в растворе
анилинового синего (2 г анилинового синего растворяют в 100 мл
кипящей воды, добавляют 2,5 мл ледяной уксусной кислоты,
охлаждают, фильтруют).
7. Ополаскивают в водопроводной воде и дифференцируют в
1 % водном растворе уксусной кислоты 10 — 30 мин,
контролируя этот процесс под микроскопом.
8. Проводят через 96 % и 100 % спирты, ксилол, заключают
в бальзам.
Результат: ядра черные, остальные структуры окрашиваются
так же, как при использовании других трехцветных методов.
Как видно из описания трехцветных методов, сложность их
состоит в длительности и многоступенчатости окрашивания,
поэтому постоянно предлагаются упрощенные, «быстрые»
методы. В зарубежных лабораториях в последние годы
предпочитают одноступенчатые методы, также дающие хорошие
результаты. Они основаны на одновременном «протравливании» и
окраске. Одним из этих способов является метод Касона.
Трехцветный одномоментный метод Касона
Приготовление красящего раствора: в 200 мл дистиллированной
воды последовательно растворяют 1 г фосфорно-молибденовой
кислоты, 2 г оранжа О, 1 г анилинового синего и 3 г кислого
фуксина. Этот раствор хранится до 1 года.
Методика окраски
1. Срезы промывают в воде и окрашивают ядра в железном
гематоксилине Вейгерта 5 мин.
2. Промывают в воде 5—10 мин и переносят на 5 мин в
красящий раствор.
3. Промывают в проточной воде 3 — 5 с, высушивают
фильтровальной бумагой.
4. Проводят через 3 смены 100 % спирта, ксилол, заключают
в бальзам или другие среды.
Результат: ядра черные или коричневые; коллагеновые и
ретикулярные волокна синие; мышцы и цитоплазма клеток,
эритроциты, кератин красные или оранжевые; фибрин красный;
слизь, амилоид, гиалин — синие разных оттенков; эластические
волокна бледно-розовые или желтые. Можно не окрашивать
428
срезы гематоксилином Вейгерта, тогда ядра клеток
приобретают красный цвет.
Окраска коллагена фосфорно-вольфрамовым
гематоксилином
Метод основан на том, что коллагеновые волокна при
протравливании гетерополикислотами становятся восприимчивыми не
только к кислотным, но и к основным красителям. Для
исследования пригоден только материал, фиксированный в жидкостях,
содержащих сулему. Если для фиксации применялся другой
способ, то срезы нужно протравливать насыщенным водным
раствором сулемы в течение 3 ч при 57 °С.
По методу Маллори фосфорно-вольфрамовый гематоксилин
готовят следующим образом: 0,1 г гематоксилина и 2 г фосфор-
но-вольфрамовой кислоты растворяют в 100 мл
дистиллированной воды; краситель созревает несколько недель.
Методика окраски
1. Срезы обрабатывают 5 мин 0,5 % раствором йода на 96 %
спирте.
2. Переносят на 5 мин в 0,5 % раствор тиосульфата натрия
(или на 1 мин в 5 % раствор).
3. После промывания водой переносят на 5 мин в 0,25 %
раствор перманганата калия, снова промывают водопроводной
водой.
4. Обесцвечивают в 5 % растворе щавелевой кислоты 10 —
15 мин и хорошо промывают в воде.
5. Окрашивают фосфорно-вольфрамовым гематоксилином в
течение 12 —24 ч.
6. Дифференцируют в 96 % спирте до полного выхождения
красителя из срезов (обычно несколько секунд).
7. Переносят в 100 % абсолютный спирт, проводят через
ксилол, заключают.
Результат: коллагеновые, ретикулярные и эластические
волокна красно-коричневые или желтоватые; ядра клеток,
фибрин, нейроглия и контрактальные элементы мышц синие.
Существуют другие способы приготовления фосфорно-
вольфрамового и фосфорно-молибденового гематоксилинов
[Коте15 В., 1989], но они не имеют преимуществ перед
описанными выше. Интерес представляет только более быстрый метод
окраски, предложенный Н. РисЬЫег и соавт. (1963).
1. После ополаскивания в воде срезы 10 мин окисляют
раствором, содержащим 0,5 % йода и 1 % йодида калия, т.е.
разведенным в 4 раза раствором Люголя.
2. Переносят на 5 мин в 5 % раствор тиосульфата натрия.
• 3. Отмывают 5 мин в проточной воде.
429
4. Окрашивают 1 ч в фосфорно-вольфрамовом
гематоксилине Маллори при 60 °С.
5. Отмывают в двух сменах 96 % спирта, переносят в 100 %
спирт, проводят через ксилол, заключают в бальзам.
Результат такой же, как при окраске по Маллори.
ВЫЯВЛЕНИЕ БАЗАЛЬНЫХ МЕМБРАН,
РЕТИКУЛЯРНЫХ И НЕЗРЕЛЫХ КОЛЛАГЕНОВЫХ ВОЛОКОН
С ПОМОЩЬЮ ИМПРЕГНАЦИИ СЕРЕБРОМ
Как указано выше, ретикулярные волокна состоят из коллагена
III типа и структурных гликопротеинов, в том числе фибронекти-
на. Незрелые коллагеновые волокна (так называемые преколлаге-
новые) развивающейся ткани состоят из коллагенов I и III типов,
а в межфибриллярном пространстве их содержатся протеоглика-
ны, структурные гликопротеины, коллагены V, VI и VII типов.
Общим признаком ретикулярных и незрелых коллагеновых
волокон, а также базальных мембран сосудов и эпителия является
высокое содержание углеводных остатков (гексоз), которые
«ответственны» за ШИК-позитивность этих структур и их способность к
импрегнации серебром (аргирофилию). Углеводные группы
находятся в основном в гликопротеинах, в большом количестве
содержащихся в этих структурах. При окраске по Ван-Гизону ни
ретикулярные, ни незрелые коллагеновые волокна не
окрашиваются в красный цвет: отрицательная фуксинофилия, по-видимому,
связана с меньшей плотностью упаковки фибрилл в волокне, чем
в зрелых коллагеновых волокнах. С помощью трехцветных
методов они окрашиваются относительно слабо.
Наиболее распространенный метод выявления этих волокон,
а также базальных мембран — импрегнация серебром.
Гистохимическая основа этой группы методов, по данным Р. Лилли
(1969), С. Vе1^сап и О. Х^еПсап (1970) и других авторов,
состоит в том, что гидроксильные группы гексоз окисляются до
альдегидов перманганатом калия или йодноватистой кислотой.
После восстановления щавелевой кислотой следует
«сенсибилизация» железистыми, серебряными или ураниловыми солями
(не во всех методах), в результате чего в последующем
активизируется осаждение металлического серебра из аммиачного
серебра. Серебро восстанавливается формальдегидом, при этом
происходит процесс, аналогичный фотографическому
проявлению После тонирования растворами солей золота срезы
фиксируют в растворе тиосульфата натрия.
В принципе зрелые коллагеновые волокна также обладают
способностью восстанавливать серебро [Зпойдгазз М., 1977],
однако интенсивность реакции вследствие меньшего
содержания гексоз в цементирующем веществе волокон сравнительно
низка, что и обусловливает их коричневую, а не черную
окраску при импрегнации. Следует отметить, что при деструкции
430
коллагеновых волокон в очагах фибриноидного набухания и
некроза аргирофилия их резко усиливается, по-видимому, в
результате демаскировки углеводных групп.
В основе всех способов импрегнации серебром лежит метод
Билыиовского. Результаты окрашивания с использованием
этого метода, как и многих его модификаций, зависят не только
от способа, но и от выполнения ряда общих условий.
1. Стеклянная пбсуда и палочки при работе с
замороженными срезами должны быть химически чистыми (обработаны
хромовой смесью) и многократно промыты дистиллированной
водой. Нельзя пользоваться металлическими инструментами.
2. Все реактивы должны быть химически чистыми, нитрат
серебра — белым, а не серым или розовым. Для приготовления
растворов серебра необходимо пользоваться свежей, дважды
дистиллированной водой, к которой можно добавить 0,5 %
раствор перманганата калия (1 — 2 капли на 1 л воды). Остальные
растворы готовят на дистиллированной воде.
3. Одновременно следует импрегнировать небольшое
количество срезов, контролируя окраску под микроскопом и меняя
продолжительность отдельных процедур, так как результаты
зависят от качества реактивов, толщины срезов, плотности
ткани и других факторов.
4. Лучшие результаты дает фиксация тканей в нейтральном
формалине, но можно использовать спирт-формол, жидкости
Ценкера или Орта, спирт. Импрегнировать целесообразно
парафиновые и замороженные срезы, импрегнация целлоидиновых
срезов дает худшие результаты.
5. Следует тщательно приклеивать срезы белком с
глицерином, так как они могут отклеиваться в процессе окрашивания.
Необходимо отметить, что даже при соблюдении этих
условий импрегнация серебром остается сложным методом,
требующим большого навыка. При правильном окрашивании
ретикулярные и незрелые коллагеновые волокна, а также базальные
мембраны сосудов и эпителия приобретают черный цвет, зрелые
коллагеновые волокна при золочении — красно-коричневый, а
в отсутствие золочения — коричневый или серовато-черный,
остальная ткань — бледно-желтый цвет. Ядра клеток не должны
импрегнироваться серебром, но иногда они окрашиваются.
Плохими результатами импрегнации являются интенсивная темная
окраска коллагеновых волокон, грубая зернистость и осадок
серебра на всех структурах ткани. В нашей стране чаще
используют импрегнацию серебром по Футу, а в лабораториях США и
Великобритании — метод Гордона —Свитса.
Метод Фута
Приготовление раствора аммиачного серебра: к 20 мл 10 %
раствора нитрата серебра добавляют 20 капель 40 % раствора гид-
431
роксида натрия. Образующийся коричневый осадок
растворяют, добавляя по каплям (медленно и при постоянном
встряхивании) аммиачную воду (28 % раствор аммиака), оставляя
несколько нерастворимых гранул (аммиак нельзя
передозировать). Разводят дистиллированной водой до 80 мл и
фильтруют. Используют однократно.
Г.А. Меркулов (1969) приводит другую пропись: к 5 мл
10 % раствора нитрата серебра добавляют 4 — 5 капель 40 %
водного раствора аммиака, осадок растворяют, добавляя по
каплям аммиачную воду и разводят дистиллированной водой
до 20 мл.
Методика импрегнации
1. После депарафинирования срезы помещают на 5—10 мин
в 0,25 % водный раствор перманганата калия.
2. Ополаскивают в воде.
3. Помещают в 5 % раствор щавелевой кислоты на 15 — 30 мин
до отбеливания срезов.
4. Основательно (20 — 30 мин) промывают в 3 сменах
дистиллированной воды.
5. Держат в 2 % растворе нитрата серебра в течение 48 ч в
темноте («сенсибилизация»).
6. Быстро ополаскивают в дистиллированной воде.
7. Переносят в свежий раствор нитрата серебра на 15 — 30 мин.
Срезы принимают коричневатый тон.
8. Ополаскивают в дистиллированной воде 5—15 с. Это
ответственный момент во всех методиках импрегнации, так как
слишком быстрое ополаскивание приведет в последующем к
получению темных препаратов или образованию осадка, а при
излишнем промывании плохо окрашиваются волокна. В связи с
этим в каждом случае следует установить продолжительность
промывания в зависимости от материала, проводя по одному
срезу через формалин и контролируя под микроскопом. Иногда
следует увеличить продолжительность промывания до 1 мин и
более или ополаскивать менее 5 с.
9. Срезы помещают для восстановления в 5 % нейтральный
формалин на 15 — 30 мин. Опыт показывает, что иногда лучше
пользоваться слабыми растворами: 10—15 капель формалина
на 100 мл воды.
10. Тщательно отмывают в водопроводной воде.
И. Тонируют в 0,5 — 1 % растворе трихлорида золота
(хлорное золото) в течение 5—10 мин. Можно использовать тетра-
гидрат золотохлористоводороднои кислоты или ее натриевую
соль.
12. Промывают в водопроводной воде 10—15 мин.
13. Обрабатывают в 5 % растворе тиосульфата натрия в
течение 5 мин.
432
14. Тщательно промывают водопроводной водой, ядра
можно докрасить квасцовым кармином; проводят через спирты
и ксилол, заключают в бальзам или синтетические среды.
Импрегнацию серебром можно сочетать с окраской
гематоксилином и эозином, по Ван-Гизону, орсеином на эластические
волокна; в этом случае после импрегнации нужно длительно, до
1 сут, промывать срезы в водопроводной воде.
Метод Гордона—Свитса
Приготовление аммиачного серебра. Аммиачную воду
добавляют по капле к 10 мл 10 % раствора нитрата серебра до
появления, а затем почти полного растворения осадка. Добавляют
7,5 мл 4 % гидроксида натрия и вновь по капле аммиачную воду
до тех пор, пока опять не растворится осадок. Добавляют
дистиллированную воду до 100 мл.
На 1-й стадии импрегнации используют 1 % раствор перман-
ганата калия, к 100 мл которого добавляют 5 мл 3 % раствора
серной кислоты. Держат срезы 1 мин. Далее их обрабатывают,
как в методике Фута, но на 5-й стадии сенсибилизацию
проводят 2 % раствором железоаммонийных квасцов или 4 % трихло-
рида железа в течение 10 мин. Продолжительность
импрегнации в аммиачном серебре (7-я стадия) обычно 5—10 с (можно
до 1 мин). При ополаскивании после нее следует учитывать
замечания к аналогичному этапу метода Фута. Восстановление
(9-я стадия) проводят в нейтральном свежеприготовленном
10 % растворе формалина в течение 30 мин.
После отмывания срезы можно просмотреть под
микроскопом и, если они перекрашены, снова начать с 5-й стадии.
Тонирование золотом (11-я стадия) проводят в течение 2 мин 0,2 %
раствором золотохлористоводородного натрия или 0,5 % три-
хлорида золота. Вместо него можно использовать 0,05 %
калиевую соль гексахлорпалладиевой кислоты в течение 10 мин. Пал-
ладиевое тонирование [КпкеНз Н., 5тИ:Ь А., 1988] не дает
красно-коричневого общего тона и полученные с его помощью
препараты более удобны для фотографирования. Фиксацию
(13-я стадия) проводят 5 % тиосульфатом натрия 3 мин.
Для целлоидиновых срезов Д. Кисели (1962) рекомендует
модифицированный метод Рио-Хортега. После обработки
щавелевой кислотой и промывания срезы помещают на 5 — 30 мин в
1 % спиртовой раствор танина в термостат при 56 °С. Затем
быстро ополаскивают в воде — продолжительность определяют
эмпирически в зависимости от материала. После этого
импрегнацию проводят в трех сосудах, содержащих по 9 мл
дистиллированной воды и 1 мл аммиачного серебра, в каждом сосуде
срезы держат до появления над ними желтого облака, в
последнем' сосуде они окрашиваются в желтый цвет. После каждого
433
среза раствор в первом сосуде меняют и передвигают сосуды
таким образом, что первый становится третьим. После быстрого
ополаскивания в дистиллированной воде срезы
восстанавливают в сильно разведенном растворе нейтрального формалина
(10—15 капель на 100 мл дистиллированной воды). Затем
следуют промывание, золочение, обработка в 10 % растворе
тиосульфата натрия в течение 5—10 мин.
ОКРАШИВАНИЕ ЭЛАСТИЧЕСКИХ ВОЛОКОН
Эластические волокна соединительной ткани и эластические
мембраны сосудов состоят из белка эластина и микрофибрилл
гликопротеиновой природы, образующих каркас волокон.
Микрофибриллярный компонент виден только в электронном
микроскопе, а при световой микроскопии эластические волокна
выглядят как гомогенные структуры. Эластин отличается от
коллагена аминокислотным составом (отсутствие триптофана, цис-
тина и метионина, низкий уровень оксипролина, высокая
концентрация валина и аланина, наличие специфических
гетероциклических структур — десмозина и изодесмозина), а также
третичной молекулярной структурой. Эти различия и
обусловливают, по-видимому, тинкториальные и гистохимические
особенности волокон.
На гистологических срезах эластические образования
выявляются в виде ветвящихся волокон толщиной от 0,2 до 5 мкм
благодаря специфике их тинкториальных свойств —
окрашиванию резорцин-фуксином, альдегид-фуксином, орсеином,
железным гематоксилином Верхгофа. Несмотря на длительное
изучение, химические основы взаимодействия эластической ткани с
этими красителями до сих пор неясны [Вап§а ]., 1966; Лилли Р.,
1969; КеШ1 В. е* а1., 1977; НогоЫп К., 1988]. Считают, что
молекулы красителей, содержащих пятичленное ароматическое
кольцо, присоединяются к молекуле эластина благодаря
водородным связям и силам Ван-дер-Ваальса. Следует помнить об
относительной специфичности методов окраски. Так, резорцин-
фуксин и орсеин окрашивают коллагеновые волокна,
подвергающиеся «эластоидной дегенерации» при возрастных или
патологических изменениях кожи, в атеросклеротических бляшках
и др.
Гистохимические реакции на углеводные компоненты
(ШИК-реакция, альциановый синий), а также способность к
импрегнации серебром характерны для ранних стадий
созревания эластических волокон, когда в них преобладает гликопроте-
иновый микрофибриллярный компонент, и исчезают при
созревании, маскируясь эластином [31топе-5ап1:аго ]., 1971; Йапоуз Р.
еЬ а1., 1974]. В то же время незрелые волокна плохо или совсем не
окрашиваются красителями, особенно гематоксилином Верхгофа.
434
Последний, возможно, наиболее специфичен для эластина в
отличие от микрофибрилл, что подтверждают данные об оксита-
лановых и элауниновых волокнах.
Окситалановые волокна, обнаруженные Н. Ри11тег (1958) и
другими исследователями в коже, сухожилиях, сосудах, перио-
донте и других тканях, отличаются от обычных эластических
волокон тем, что они устойчивы к эластазе, совсем не
окрашиваются гематоксилином Верхгофа, а другими красителями —
только при предварительном окислении надуксуснои кислотой в
течение 10 — 30 мин.
Позднее были выявлены так называемые элауниновые
волокна — тонкие волоконца, которые упомянутыми красителями
окрашиваются без окисления, но остаются невосприимчивыми к
гематоксилину Верхгофа. В настоящее время показано, что
окситалановые волокна состоят почти из одного
микрофибриллярного компонента, тогда как элауниновые содержат 30 — 40 %
эластина, а зрелые волокна — более 90 % [Со1±а-Реге1га О. е!
а1., 1976]. Способность микрофибриллярного компонента
окрашиваться орсеином, резорцин- или альдегид-фуксином, а также
альциановым синим в 0,8 М хлориде магния после окисления
надуксуснои кислотой или тиосульфатом натрия объясняется
высокой концентрацией дисульфидных групп аминокислоты —
цистина [Коте15 В., 1989].
Окраска резорцин-фуксином (фукселином)
по Вейгерту
Приготовление резорцин-фуксина: в фарфоровой чашке 2 г
основного фуксина (не кислого!) и 4 г резорцина растворяют в
200 мл воды, нагревают до кипения, добавляют 25 мл офици-
нального раствора трихлорида железа (РеСЬ), кипятят,
помешивая, еще 5 мин, затем охлаждают и фильтруют. Фильтр с
осадком после подсыхания кладут в чашку, наливают 200 мл
96 % спирта и осторожно нагревают до кипения на водяной
бане. Вынимают фильтр, соскабливая с него остатки красителя,
охлаждают, фильтруют, доводят до 200 мл 96 % спиртом и
добавляют 4 мл крепкой (плотность 1,15—1,19) соляной кислоты.
Хранят 1,5 — 2 мес.
Методика окраски
1. Ядра окрашивают в литиевом кармине Орта 10—15 мин
(необязательно).
2. Дифференцируют в 1 % солянокислом спирте в течение
5 — 15 мин.
3. Ополаскивают в 70 % спирте.
4. Окрашивают профильтрованным фукселином 20 — 30 мин
(длительно хранившимся красителем — до 2 — 3 ч).
435
5. Обезвоживают в 70 % спирте в течение 1—2 мин или
подсушивают фильтровальной бумагой.
6. Дифференцируют в 1 % солянокислом спирте (при
сильном перекрашивании) или 96 % спирте под контролем
микроскопа до тех пор, пока отчетливо не выступят эластические
волокна и не просветлится фон (обычно в течение нескольких
минут).
7. Проводят через спирты и ксилол, заключают в бальзам.
Результат: ядра клеток красные, эластические волокна и
гранулы тучных клеток (лаброцитов) темно-синие или
фиолетовые. Фиксация ткани лучше всего спиртовая, но можно
использовать и другие фиксаторы.
Хорошие результаты дает и модификация этой окраски по
Харту: окрашивают не чистым фукселином, а
профильтрованным 5 % раствором его на 1 % солянокислом спирте (жидкость
Харта) в течение 18 — 24 ч. Эластические волокна при этом
часто не требуют дифференцировки, поэтому срезы сразу
промывают и обезвоживают.
Окраска альдегид-фуксином по Гомори
Приготовление красителя: растворяют 0,5 г основного фуксина
или парарозанилина в 100 мл 70 % спирта (можно нагреть,
потом охладить), добавляют 1 мл концентрированной соляной
кислоты и 1 мл паральдегида. Через 24 ч смесь становится
темно-фиолетовой и считается готовой. Хранить ее следует в
холодильнике.
Методика окраски
1. Препарат держат 10 — 60 мин в 0,5 % растворе йода.
2. Обесцвечивают в течение 30 с 0,5 % раствором
гидросульфида натрия
3. Промывают в воде 2 мин.
4. Обезвоживают в 70 % спирте 1 — 2 мин.
5. Окрашивают альдегид-фуксином 5—10 мин под
контролем микроскопа, ополаскивая 70 % спиртом.
6. Промывают в нескольких сменах 70 % спирта.
7. Докрашивают ядра гематоксилином или прочным
зеленым.
8. Проводят через спирты и ксилол, заключают в бальзам
или другие среды.
Результат: эластические волокна красные или фиолетовые.
Окрашиваются также тучные клетки (лаброциты), р-клетки
островков Лангерганса (окраска до 30 мин) и р-клетки
гипофиза (окраска до 2 ч). При докрашивании по Маллори — Гейден-
гайну окрашиваются также а- и у-клетки гипофиза.
436
Окраска орсеином по методу Унны—Тенцера
Этот метод наиболее простой, но окрашивание эластических
волокон менее интенсивное, чем другими красителями.
Приготовление красителя: 1 г орсеина растворяют в 100 мл
96 % или 100 % спирта и добавляют 1 мл крепкой
(молекулярная масса 1,15—1,19) соляной кислоты. Краситель можно
хранить 1—2 мес.
]. Юегпап (1990) рекомендует другой способ приготовления,
дающий более надежные результаты: 1 г орсеина на 100 мл 70 %
спирта нагревают до 60 °С, после охлаждения добавляют 1 мл
крепкой соляной кислоты и фильтруют.
Методика окраски
1. Ополаскивают в 70 % спирте.
2. Окрашивают орсеином в течение 30 — 60 мин при 37 °С (в
термостате) или 18 — 24 ч при комнатной температуре.
3. Дифференцируют в 1 % солянокислом спирте (под
контролем микроскопа) до просветления фона и выявления
эластических волокон, обычно от нескольких секунд до 2 — 3 мин.
4. Промывают водой, проводят через спирты и ксилол.
Результат: эластические волокна буро-красные, коричневые.
Можно докрасить ядра гематоксилином, метиленовым или то-
луидиновым синим после 3-й стадии или окрасить их литиевым
кармином Орта до окраски в орсеине.
Иногда коллагеновые волокна окрашиваются слишком
интенсивно, а при дифференцировке ослабляется окраска
эластических волокон. В этих случаях следует уменьшить
концентрацию орсеина (растворяют до 0,4 г на 100 мл спирта) и рН
раствора путем добавления нескольких капель соляной кислоты,
что, по данным Н. Багго^ (1952), позволяет усилить
избирательность окрашивания.
Окраска гематоксилином Верхгофа
Метод основан на перекрашивании срезов смесью
гематоксилина, йода и трихлорида железа с последующей дифференциров-
кой в растворе трихлорида железа. Н. РисЬЫег и Р. \Уа1с1гор
(1979) считают, что ионы йода служат лигандами для
связывания атомов железа и присоединения их к молекуле
гематоксилина, что способствует связыванию последних с десмозинами
эластина посредством сил Ван-дер-Ваальса. Достоинством
метода является интенсивное и очень стойкое окрашивание
эластических волокон и ядер клеток.
Приготовление красящего раствора: растворяют 1 г
гематоксилина в 20 мл горячего 100 % спирта, добавляют 8 мл 10 %
раствора трихлорида железа, перемешивают и добавляют 8 мл
437
раствора Люголя, содержащего 2 % йода и 4 % йодида калия.
Применяют свежеприготовленный раствор.
Лучше приготовить три раствора по Мусто: а) 2 г
гематоксилина на 100 мл 96° спирта; б) 12,4 г трихлорида железа +
495 мл воды и 5 мл крепкой (плотность 1,15—1,19) соляной
кислоты; в) раствор Люголя. Эти растворы можно хранить до
1 года, а перед окраской смешать в соотношении 3:2:1. Смесь
используют 1 раз.
Методика окраски
Срезы окрашивают в рабочем растворе 15 — 45 мин до полного
почернения, затем дифференцируют в 2 % растворе
трихлорида железа несколько секунд под контролем микроскопа. В
случае передифференцировки повторяют окраску. Затем
промывают водой 96° спиртом и снова водой до полного
отмывания избытка йода, после этого проводят через спирты и
ксилол.
Результат: эластические волокна черные, ядра клеток и
миелин фиолетовые, коллагеновые волокна красноватые.
В некоторых руководствах [Нутазоп С, 1972; Коте1з В.,
1989] рекомендуется окраска эластических волокон орсином и
новым фуксином по Фуллмеру. Красящую смесь готовят
следующим образом: 2 г нового фуксина и 4 г орсина (орсинола)
растворяют в 200 мл дистиллированной воды, кипятят 5 мин,
добавляют 25 мл 29 % официнального раствора трихлорида
железа (или растворяют 15,5 г трихлорида железа, добавив воды до
25 мл) и снова кипятят 5 мин, охлаждают, фильтруют, осадок
на фильтре растворяют в 100 мл 96 % спирта. Окрашивание
продолжается 15 мин при 37 °С. Срезы дифференцируют в трех
сменах 70 % спирта по 5 мин в каждой, обезвоживают и
просветляют, как обычно. Эластические волокна окрашиваются в
темно-фиолетовый цвет, можно докрасить ядра
гематоксилином, сафранином.
При флюоресцентной микроскопии эластические волокна
выявляются благодаря более интенсивной первичной
флюоресценции в неокрашенных или окрашенных гематоксилином и
эозином срезах, чем у коллагеновых волокон. Для усиления
флюоресценции срезы окрашивают 3 мин 1 % раствором акри-
флавина в 96 % спирте или данзилгидразином [Ке^Ь ^., 1977].
Хорошие результаты дает и поляризационная микроскопия по
Ромхани [КотЬапу С, 1962; Вапда ]., 1966], основанная на
отрицательном двойном лучепреломлении эластических волокон
при анилиновой реакции. При этом анилин реагирует не с
белком эластином, а с микрофибриллярным компонентом волокон.
Наиболее сильная реакция — с незрелыми эластическими
волокнами.
138
КОМБИНИРОВАННЫЕ СПОСОБЫ ОКРАШИВАНИЯ
ВОЛОКОН СОЕДИНИТЕЛЬНОЙ ТКАНИ
Одновременное окрашивание коллагеновых, эластических и
ретикулярных волокон позволяет изучить их взаиморасположение
и количественное соотношение в тканях. При этом нельзя
пренебрегать и приведенными выше методами, так как с помощью
комбинированных способов не всегда удается отчетливо
выявить все структуры.
Одним из наиболее распространенных методов
одновременного выявления коллагеновых и эластических волокон является
комбинированная окраска резорцин-фуксином и пикрофукси-
ном: после окрашивания фукселином по Вейгерту и дифферен-
цировки в солянокислом спирте срезы промывают в 70 % спирте
и воде, а затем окрашивают по Ван-Гизону. Р. Лилли (1969)
рекомендует свою модификацию этого способа с использованием
раствора фукселина, разведенного в 1 % солянокислом спирте
(1:9). После окрашивания в течение 24 ч срезы ополаскивают в
солянокислом спирте, переносят на 1—3 мин в 96 % спирт,
окрашивают 7—10 мин одним из квасцовых гематоксилинов,
ополаскивают водой, дифференцируют в спирте, промывают водой,
погружают на 30 — 60 с в смесь фосфорно-вольфрамовой и фос-
форно-молибденовой кислот (по 1 г каждой на 80 мл
дистиллированной воды), ополаскивают водой, докрашивают в течение
2 — 5 мин пикрофуксиновой смесью Ван-Гизона, ополаскивают
водой, обезвоживают, просветляют и заключают.
Окраску фукселином комбинируют также с методом
Маллори — Гейденгайна [Уо1ктап Р., 51гаи$з Э.К., 1934]. При этом
коллагеновые волокна окрашиваются в синий, а
эластические — в фиолетовый цвет. Окраску эластина
альдегид-фуксином можно комбинировать с трехцветными методами Массона
или Маллори —Гейденгайна, особенно если вместо анилинового
синего использовать прочный зеленый РСР или световой
зеленый 5Р.
Окраску гематоксилином Верхгофа иногда сочетают с
окраской по Ван-Гизону, при этом эластические волокна приобретают
черный, а коллагеновые — красный цвет. О. Нитазоп (1972)
рекомендует после гематоксилина Верхгофа докрашивать
коллагеновые волокна пикропунцовым С в течение 1 мин и
дифференцировать в спирте.
Неплохие результаты дает также метод Френкеля: после
окрашивания орсеином и дифференцировки в 70 % солянокислом
спирте срезы окрашивают 10—15 мин в 0,25 % растворе индиго-
кармина на насыщенном растворе пикриновой кислоты,
ополаскивают в 3,5 % растворе уксусной кислоты, обезвоживают в
спиртах, просветляют ксилолом. При этом эластические
волокна окрашиваются в темно-коричневый, коллаген — в
сине-зеленый, а мышцы — в зеленовато-желтый цвет.
439
Существуют также методы одновременного выявления арги-
рофильных (ретикулярных и незрелых коллагеновых волокон)
и зрелых коллагеновых волокон, иногда вместе с эластическими
волокнами. С этой целью используют комбинацию импрегнации
серебром с одной из окрасок коллагеновых или эластических
волокон. Так, Р. Л ил ли (1966) предлагает после импрегнации,
тонирования трихлоридом золота и фиксации в тиосульфате
натрия промыть срезы водопроводной водой, докрасить
квасцовым гематоксилином (2 мин) и пикрофуксином Ван-Гизона,
дифференцировать 96 % спиртом, обезводить, просветлить.
Можно после импрегнации серебром ретикулярных волокон
окрасить эластические волокна резорцин-фуксином, а после этого
докрасить по Ван-Гизону. Для увеличения контрастности лучше
вместо основного фуксина в красящей смеси с резорцином
использовать 1 % раствор кристаллического фиолетового (можно
добавить 1 г декстрина). Тогда эластические волокна
приобретают зеленый, аргирофильные волокна — черный, а коллагено-
вые — красный цвет. О. Нитазоп (1969) описала
комбинированную окраску ретикулярных, эластических и коллагеновых
волокон с помощью импрегнации использования орсеина и
анилинового синего, а в другой методике она заменила анилиновый
синий сириусом супрасиним (Зтиз зирга Ыие РОЬ-ОР).
ИСПОЛЬЗОВАНИЕ ПРОТЕОЛИТИЧЕСКИХ ФЕРМЕНТОВ
ДЛЯ ИЗУЧЕНИЯ СОЕДИНИТЕЛЬНОЙ ТКАНИ
В гистологической практике иногда применяют ферментное
переваривание различных структур соединительной ткани.
Чаще для этого используют ферменты, воздействующие на
углеводные компоненты межклеточного матрикса (гиалуронида-
за, сиалидаза, диастаза и др.), позволяющие
дифференцировать различные кислые ГАГ, нейтральные гликопротеины и
другие вещества.
Коллагеназы
Коллагеназы — группа ферментов, специфически
расщепляющих молекулу коллагена. Они относятся к классу металлопро-
теиназ, для проявления активности которых необходимы ионы
цинка, кальция, магния и железа. В гистологической практике
чаще используют бактериальную коллагеназу из С1. Ыз1:о1Шсит
или С1. регЫпдепз, которая расщепляет молекулу на множество
фрагментов в области пролин-глициновой последовательности.
Тканевая коллагеназа позвоночных животных, содержащаяся в
разных тканях, расщепляет молекулу коллагена на два
неравных фрагмента, которые при температуре тела теряют
спиральную конфигурацию и становятся чувствительными к действию
440
неспецифических пептидов и протеиназ. Еще одну группу
составляют менее специфичные коллагенолитические ферменты
беспозвоночных, например, выделенные из печени крабов.
Ряд фирм выпускает препараты бактериальных коллагеназ
(главным образом для работ с культурами тканей). Следует
отметить, что эти препараты содержат примесь других пептидаз и
избирательность их действия на коллагеновые волокна
относительна. Необходимо учитывать также, что коллагеновые
волокна — это многокомпонентные системы, состоящие из коллагено-
вых фибрилл и межфибриллярных белково-углеводных
комплексов, поэтому высокоочищенная коллагеназа действует на
них только в относительно высокой концентрации, так как ее
непосредственный контакт с молекулами коллагена затруднен.
В связи с этим нецелесообразно использовать препараты колла-
геназы в световой микроскопии для идентификации коллагено-
вых волокон на тканевых срезах.
В условиях патологии (ревматические заболевания,
воспалительные процессы, опухоли и др.) коллагеназу можно
использовать для выявления участков дезорганизации коллагеновых
структур, которые становятся менее устойчивыми к
воздействию фермента. Предварительно устанавливают «оптимальную»
концентрацию фермента, т.е. самую высокую концентрацию, в
которой он еще не действует на неизмененные коллагеновые
волокна нормальных тканей. С этой целью используют серийные
срезы кожи, синовиальной оболочки и других тканей
одинаковой толщины, инкубируя их в растворах фермента разной
концентрации (готовят на фосфатном буфере или трис-буфере с рН
7,6 при 37 °С в течение 5 —б ч в закрытых стаканчиках). Когда
«оптимальная» концентрация установлена, в ферменте этой
концентрации инкубируют срезы (той же толщины) изучаемой
патологически измененной ткани. После инкубации срезы
тщательно промывают в нескольких порциях дистиллированной
воды и окрашивают по Ван-Гизону или одним из трехцветных
методов. Степень ослабления окраски коллагеновых волокон
соответствует степени их дезорганизации. Эти срезы
обязательно сравнивают с соседними серийными срезами, которые не
подвергались ферментной обработке.
Эластаза
Эластические волокна весьма устойчивы практически ко всем
тканевым протеазам, за исключением специфического фермента
эластазы — панкреатопептидазы Е. Получены эластолитичес-
кие ферменты из нейтрофильных лейкоцитов, макрофагов,
тромбоцитов. Все эти ферменты не строго специфичны и
воздействуют не только на эластин, но и на гликопротеины.
Некоторые фирмы производят препарат панкреатической
эластазы, которая в зависимости от концентрации полностью
441
или частично разрушает эластические волокна. Концентрацию
фермента устанавливают опытным путем, при этом критерием
является отсутствие окраски (орсеином, резорцин-фуксином и
др.) эластических волокон здоровой ткани при неизмененной
окраске коллагеновых волокон по Ван-Гизону или трехцветным
методом. Срезы обрабатывают 0,01 — 0,03 % раствором
фермента в 0,1 М вероналовом или 0,3 М боратном буфере при рН 9,0
в течение 5 —б ч при 37 °С в закрытых стаканчиках.
Необходимо сравнение с соседними необработанными эластазой, но
окрашенными срезами. Можно установить наивысшую
концентрацию фермента, в которой он еще не разрушает эластические
волокна (отдельно для тонких и толстых волокон), а затем
воздействовать энзимом в этой концентрации на срезы
патологически измененной ткани.
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА
ВОЛОКОН СОЕДИНИТЕЛЬНОЙ ТКАНИ
В табл. 11 суммированы основные тинкториальные свойства
всех волокнистых компонентов соединительной ткани, что
необходимо для их идентификации в тканевых срезах. С этой целью
можно использовать также различную способность волокон к
двойному лучепреломлению в поляризованном свете. Коллаге-
новые и ретикулярные волокна в поляризационном микроскопе
обладают анизотропией, хотя и более слабой, чем у
кристаллических структур.
При обработке срезов фенолом и его соединениями
происходит изменение положительного знака двойного
лучепреломления на отрицательный, что лежит в основе методов
количественного определения коллагена в тканях. По коэффициенту фе-
нольной реакции при поляризационной микроскопии различают
зрелые и незрелые коллагеновые волокна, а по реакции на
глицерин — коллагеновые и ретикулярные волокна. После
импрегнации серебром анизотропные свойства ретикулярных волокон
исчезают, а коллагеновых — сохраняются. Обработка диаста-
зой усиливает двойное лучепреломление ретикулярных
волокон, так как при этом разрушается углеводный компонент,
«маскирующий» анизотропию волокон [<1е Сатроз V., 1988]. С
различным содержанием углеводов и разной структурой связана,
по-видимому, и возможность различения коллагеновых и
ретикулярных волокон в поляризационном микроскопе при окраске
срезов сириусом красным или близкими к нему красителями.
Эластические волокна изотропны, однако они приобретают
анизотропию при анилиновой реакции по методу Ромхани, в то
время как коллагеновые волокна становятся изотропными.
Эластические волокна в отличие от коллагеновых и
ретикулярных обладают также большой резистентностью к воздействию
442
Таблица 11 Тинкториальные свойства волокон соединительной и мышечной тканей
Метод
Окраска по Ван-Гизону
Трехцветные методы окраски
Окраска фосфорно-вольфра-
мовым гематоксилином
Импрегнация серебром
Окраска резорцин- или
альдегид-фуксином
Окраска орсеином
Окраска гематоксилином
Верхгофа
Анизотропия при
поляризации
Окраска пикросириусом
красным + поляризация
Реакция с коллагеназой
Реакция с эластазой
Волокна соединительной ткани
зрелые
коллагеновые
Красные
Синие
Красно-
коричневые
+
-
-
-
+
Желто-
красные
+
-
незрелые
коллагеновые
-
Голубые
Красно-
коричневые
+++
-
-
-
+
Желто-
зеленые
+
-
ретикулярные
-
Голубые
Красно-
коричневые
+++
-
-
-
+
Зеленые
+-
-
эластические
-
-
Желто-
коричневые
-
+
+
+
-
-
-
+ ,
окситалановые
-
-
-
-
+ после
окисления
То же
-
-
-
-
-
эуланиновые
-
-
-
-
+
+
-
-
-
-
+-
Мышечная
ткань
Желтые
Красные
Синие
-
-
-
-
+-
-
-
-
высокой температуры, кислот и щелочей. Кипячение ткани в
слабых кислотах и щелочах освобождает ее от всех
компонентов, кроме эластических волокон, и, как показывает опыт,
позволяет изучать архитектонику последних в сканирующем
электронном микроскопе. Возможность отличить эластические
волокна от коллагеновых дает также разная устойчивость их к
воздействию протеолитических ферментов. Коллагеновые и
ретикулярные волокна перевариваются коллагеназами, пепсином;
на их структурную стабильность и тинкториальные свойства
действуют папаин, катепсин Э и ряд других протеиназ.
Эластические волокна устойчивы к этим ферментам, но подвергаются
воздействию эластазы.
ИССЛЕДОВАНИЕ МЫШЕЧНОЙ ТКАНИ
Гладкомышечные клетки и волокна произвольной
(поперечнополосатой) мускулатуры хорошо выявляются с помощью
многих обзорных методов, особенно трехцветных, которые
обеспечивают контрастную окраску с коллагеновыми волокнами. Для
выявления гладких мышц также лучше использовать
трехцветные методы: по Маллори, азаном или др. В. Коте1з (1989)
рекомендует для окрашивания гладких мышц метод Найберта с
ализариновым синим.
Красящий раствор готовят путем смешивания 80 мл 2,5 %
раствора ализаринового синего на дистиллированной воде и
20 мл 10 % раствора сульфата алюминия на дистиллированной
воде. Через 15 мин интенсивного помешивания раствор
фильтруют. Окрашивание продолжается 5 — 30 мин. Срезы
дифференцируют в 5 % фосфорно-вольфрамовой кислоте под
контролем микроскопа, ополаскивают в воде и держат 5 — 30 мин в 5 %
растворе ацетата меди, затем промывают, обезвоживают и
заключают.
Результат: гладкие мышцы окрашиваются в синий цвет.
Для выявления миофибриллярных структур в гладких
мышцах, миоэпителиальных клетках, миоидных клетках и миофиб-
робластах В. Коте1з (1989) предложил метод окрашивания ле-
ванолом.
Красящий раствор: 6 г леванола (1еуапо1 ^аз^суашп 5КЮ
растворяют в 90 мл метилового спирта и оставляют на 24 ч.
Перед применением к 45 мл раствора добавляют 5 мл ледяной
уксусной кислоты и оставляют на 20 мин. Ткань лучше
фиксировать в жидкости Карнуа.
Методика окраски
1. Срезы окрашивают 5—10 мин профильтрованным
раствором ядерного красного (0,1 г) в 100 мл 5 % раствора сульфата
алюминия.
444
2. Ополаскивают в 3 сменах дистиллированной воды.
3. Переносят на 10 мин в 5 % раствор таниновой кислоты.
4. Ополаскивают в 3 сменах дистиллированной воды.
5. Помещают на 10 мин в свежеприготовленный 1 % раствор
фосфорно-молибденовой кислоты.
6. Ополаскивают в 3 сменах дистиллированной воды.
7. Переносят на 5 мин в красящий раствор леванола.
8. Быстро отмывают в 2 сменах смеси метилового спирта с
ледяной уксусной кислотой (9:1).
9. Проводят через метанол и ксилол, заключают.
Результат: ядра красные; миофибриллы, фибрин и эластин
синие.
Для выявления тончайшей поперечной исчерченности
волокон произвольных мышц материал следует фиксировать в
фиксаторах, содержащих трихлоруксусную кислоту, или в ценкер-
формоле, после чего срезы окрашивают железным
гематоксилином Гейденгайна. Можно использовать окраску фосфорно-
вольфрамовым гематоксилином Маллори, который хорошо
окрашивает не только коллагеновые и ретикулярные волокна, но
и контракта л ьные элементы поперечнополосатых мышц.
Окрашивание в 1 % растворе тионина или метилового синего в
течение 1 ч с последующей дифференцировкой в спиртах также
хорошо выявляет поперечную исчерченность мышц, особенно
после фиксации в трихлоруксусной кислоте.
ГЛАВА 23
ОСОБЕННОСТИ ИССЛЕДОВАНИЯ КОСТНОЙ ТКАНИ
В большинстве пособий и руководств недостаточно внимания
уделяется вопросам исследования костной ткани, в том числе
изучению состояния скелета при вскрытии трупа. В связи с
этим представляется необходимым привести основные сведения
по технике исследования костно-суставной системы.
Следует отметить, что эту систему редко подвергают
исследованию при вскрытии трупа, особенно если отсутствуют
клинические данные о наличии патологических изменений скелета.
Однако установлено, что в костной ткани и костном мозге
«находят морфологическое отражение» многие заболевания. В тех
случаях, когда возникает необходимость в специальном
исследовании скелета, прозектор, не обладающий навыками в этой
области, может оказаться в весьма сложном положении. Между
тем практически при любом вскрытии имеется возможность, не
прибегая к специальным приемам, иногда значительно
увеличивающим продолжительность самого вскрытия и требующим
больших физических усилий, отметить ряд изменений
позволяющих довольно точно оценить состояние костно-суставной
системы умершего.
С этой целью измеряют длину трупа сантиметровой лентой
(рулеткой) или деревянной планкой с нанесенными на ней
делениями. А.В. Русаков (1959) рекомендовал пользоваться особым
ростомером, который подробно описан в многотомном
«Руководстве по патологической анатомии» (1959).
При анализе состояния опорно-двигательного аппарата имеет
значение также длина трубчатых костей, а в некоторых случаях
и длина позвоночника. При этом достаточно измерить длину
плечевой и бедренной костей, изъятых из трупа и отделенных
от мягких тканей, и сопоставить с длиной тела умершего. При
заметном искривлении позвоночника (кифоз, сколиоз) следует
определить его длину в выпрямленном состоянии. Для этого
тонкой металлической лентой или мягкой проволокой измеряют
расстояние от верхнего края первого крестцового позвонка до
нижнего края шейного отдела позвоночника, при этом ленту
или проволоку ведут по средней линии тел позвонков. Слишком
малые или слишком большие размеры тела являются
свидетельством патологических изменений в костной системе. На это же
указывает явная диспропорция между длиной рук и ног, с
446
одной стороны, и длиной тела — с другой. При осмотре трупа
следует также обращать внимание на правильность
телосложения и форму черепа.
Для исследования костно-суставной системы используют
стандартный секционный набор, включающий все инструменты,
необходимые для извлечения любой кости, распила черепа и
позвоночника. Существуют и специальные инструменты, которые
значительно облегчают работу прозектора и уменьшают
продолжительность вскрытия. К ним, в частности, относятся двойная
пила Люэра и рахиотом. Пила Люэра состоит из двух
параллельных листовых пил, раздвигающихся на различную ширину,
и служит для перепиливания дужек позвонков при извлечении
позвоночника или вскрытии спинномозгового канала.
Рахиотом — клювовидные щипцы (кусачки) Гелли — предназначены
для перекусывания дужек позвонков, особенно при вскрытии
спинномозгового канала при искривлениях позвоночника. Во
время вскрытия допустимо также использование дисковой
электрической пилы при наличии специального защитного
устройства и практического навыка работы.
Исследование различных частей скелета проводят на
протяжении всего вскрытия. После вскрытия черепа оценивают
состояние его костей, после извлечения органов грудной клетки,
полости живота и малого таза можно осмотреть ребра, грудину,
ключицы, позвоночник и кости таза. Отдельные кости подробно
исследуют в случае травм, опухолевых поражений костной
ткани, остеомиелита, костно-суставного туберкулеза, общих
заболеваний скелета (рахит, остеомалятический синдром,
системный остеопороз, несовершенный остеогенез). Кроме того,
рентгенография выделенных костей, еще не подвергшихся
мацерации, позволяет получить изображение, наиболее близкое к
результатам прижизненного рентгенологического исследования.
Кость выделяют целиком, осуществляя вычленение в суставах.
При вскрытии можно изъять практически все трубчатые кости,
кроме пальцев, все плоские кости и даже позвоночник, не
нарушая значительно форму тела умершего. На место изъятых
костей вставляют деревянные «протезы» соответствующих
размеров.
Распил черепа, произведенный любым способом, позволяет
определить толщину кости, гладкость ее поверхности,
состояние черепных швов и легкость отделения твердой мозговой
оболочки.
Во время вскрытия очень важно быстро оценить состояние
всей костной системы как структуры, реагирующей на
изменение обмена веществ. Наиболее ярко такая реакция проявляется
в ребрах, поэтому их надлежит обследовать в первую очередь.
Это можно сделать, определив степень их ломкости и изучив
внутреннюю структуру. Патологические изменения,
возникающие при системных заболеваниях костей, особенно выражены в
447
местах соединения костных и хрящевых частей ребер. Разрез
при этом начинают от хряща, оставшегося на ребре после
вскрытия грудной клетки, отрезая реберным ножом верхние и
нижние края ребра вдоль его длинной оси на протяжении
нескольких сантиметров.
Обязательно производят распил грудины и осмотр ее
структуры. Пользуясь очень простым приемом, можно осмотреть
позвоночник, не извлекая его из трупа. Для этого рассекают тела
позвонков ударами молотка по реберному ножу или широкому
долоту, приставленному к их передней поверхности во
фронтальной плоскости. Этот прием применяют для определения
состояния межпозвоночных дисков и выявления метастазов
опухоли в телах позвонков. Осмотр ребер, грудины и позвонков
можно осуществить, выбивая костный мозг из извлеченных
препаратов или их фрагментов сильной струей воды.
Осмотр трубчатых костей позволяет одновременно оценить
состояние костномозгового канала (атрофия или избыточное
развитие костного вещества) и самого костного мозга. С этой
целью производят длинный разрез по наружной поверхности
бедра, бедренную кость освобождают от мышц, делают два
поперечных надпила на половину ее диаметра на расстоянии
нескольких сантиметров друг от друга, затем долотом сбивают
фрагмент кортикальной пластинки. Этот прием позволяет
одновременно взять для гистологического исследования кусочек
бедренной кости.
Если распил костей черепа производят практически при
каждом вскрытии, так как он необходим для извлечения и
исследования головного мозга, то полное вскрытие позвоночника
(собственно вскрытие спинномозгового канала) осуществляют
редко. Чаще всего его проводят в случае необходимости
исследовать не только костные структуры позвоночника, но и спинной
мозг, например, при его поражениях.
Распиливание позвоночника по Шминке производят на
месте. Сначала разрезают лонное сочленение и отделяют мягкие
ткани промежности от костей. После этого распиливают
позвоночник, кроме его шейного отдела, по сагиттальной линии
насквозь до задней поверхности, разводят ребра в стороны,
раздвигают и осматривают распиленные тела позвонков. Для
вскрытия межпозвоночных суставов делают сагиттальные
распилы, отступя 1 — 1,5 см в стороны от средней линии. Шейный
отдел позвоночника распиливают сзади: из кожного разреза на
задней стороне шеи пересекают позвоночник на границе
шейного и грудного отделов, приподнимают шейную часть вверх и
распиливают по длине от Суп до Сь
При использовании метода Шморля позвоночник
предварительно извлекают из трупа, для чего делают распилы по средней
линии через тела позвонков, боковые распилы через
межпозвоночные суставы и поперечные — через межпозвоночные диски.
448
Для вскрытия спинномозгового канала и одновременного
исследования тел позвонков И. И. Медведев (1969) рекомендует
способ, предложенный И.А. Цыбанем (1952): производят два
параллельных распила по длине позвоночника, сходящихся в
его глубине так, чтобы можно было вынуть клиновидную
«ленту» (трехгранную призму).
Суставы вскрывают при обнаружении каких-либо изменений
их конфигурации или явной деформации. Патологические
изменения чаще всего обнаруживают в коленном и локтевом
суставах, поэтому вскрывать следует именно эти наиболее доступные
суставы. Плечевой, тазобедренный и голеностопный суставы
обычно без необходимости не вскрывают. Для вскрытия
локтевого и коленного суставов используют распространенные
хирургические доступы. Методика вскрытия отдельных суставов,
а также приемы, применяемые для исследования сосудов
конечностей, подробно описаны в специальных руководствах по
технике патологоанатомических вскрытий [Абрикосов А. И.,
1939,1948; Медведев И.И., 1969]. Необходимо помнить, что в
норме синовиальной жидкости в полостях суставов очень мало,
при вскрытии она никогда не вытекает по каплям. Если при
вскрытии суставной полости появляются капли вязкой
жидкости, то это служит прямым свидетельством патологии. После
вскрытия сустава можно осмотреть суставные поверхности
сочленяющихся костей, обращая внимание на состояние
суставного хряща и синовиальной оболочки.
РАЗЛИЧНЫЕ ТИПЫ «НАБОРОВ» СЕКЦИОННОГО МАТЕРИАЛА
ДЛЯ ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ КОСТЕЙ
Нормальное гистологическое строение отдельных костей с
учетом их возрастных изменений удается определить благодаря
тому, что материал для приготовления гистологических
препаратов берут при вскрытии каждый раз из одного и того же
отдела кости в одном и том же сечении.
Основываясь на огромном практическом опыте, А.В.
Русаков рекомендует использовать для гистологического
исследования костей один из трех «наборов» секционного материала в
зависимости от цели исследования в каждом конкретном случае и
технических возможностей, которыми располагает патологоана-
томическое отделение или лаборатория.
Большой костный набор. 1. Ребро в области соединения
хрящевой и костной частей на продольном разрезе длиной 3 — 4 см (в препарат
должна попасть часть хряща длиной 2 — 2,5 см).
2. Ребро в поперечном сечении на расстоянии 3 — 4 см от хряща.
3. Кусочки лобной и затылочной костей.
4. Пластинка, выпиленная из средней части тела позвонка, в сагиттальной
плоскости.
449
5. Межпозвоночный диск с половинками костных частей двух соседних
позвонков.
6. Кусочек грудины.
7. Поперечная пластинка бедренной кости толщиной 2 — 3 мм из средней
части ее диафиза.
8. Фронтальная пластинка толщиной 3 — 4 мм из средней части головки
бедренной кости.
9. Такая же пластинка из верхнего метафизарного отдела этой кости.
10. Такая же пластинка из нижнего эпифиза бедренной кости.
11. Поперечная пластинка средней части диафиза плечевой кости.
12. Фронтальная пластинка средней части головки этой кости.
13. Кусочек реберного хряща на поперечном разрезе шириной 3 — 4 см.
Детский, или подростковый, костный набор. 1.
Кусочек ребра на продольном разрезе у места соединения кости с хрящом
длиной 3 — 4 см с участком хрящевой ткани длиной 2 — 2,5 см.
2. Кусочки лобной и затылочной костей.
3. Межпозвоночный диск с половинками костных частей двух соседних
позвонков.
4. Поперечная пластинка бедренной кости по средней части ее диафиза.
5. Пластинка головки бедренной кости.
6. Пластинка метафиза бедренной кости.
7. Пластинка эпифиза бедренной кости.
Малый костный набор. 1. Продольная пластинка ребра.
2. Кусочек затылочной или лобной кости.
3. Поперечная пластинка средней части бедренной кости.
Костный набор, который рекомендует использовать при
гистологическом исследовании костей П.Ф. Калитеевский (1987),
по сути является лишь несколько расширенным «малым
набором» Русакова. Его можно рекомендовать как вполне
достаточный и доступный при любых технических возможностях.
МЕТОДЫ ПРИГОТОВЛЕНИЯ СУХИХ ПРЕПАРАТОВ КОСТИ
Для детального исследования костей, особенно с целью
документального подтверждения научных выводов и демонстрации
на клинико-анатомических конференциях, иногда необходимо
сохранить на длительное время костные препараты, изъятые
при вскрытии. Хранение в формалине костей свода черепа,
длинных трубчатых и плоских костей затруднительно, так как
для этого требуется специальная посуда больших размеров
(бачки, закрывающиеся герметически). Кроме того, фиксиро-
ванные в формалине препараты малопригодны для
демонстрации. В этих случаях возникает необходимость в приготовлении
специальных сухих препаратов кости.
Существует два вида сухих препаратов кости: учебные, или
музейные, пригодные для создания учебной коллекции, и
рабочие — патологоанатомические. Приготовление первых основано
главным образом на бактериальной мацерации костей, для
которой необходимы много времени, соответствующая материальная
база и обученный персонал. Приготовление сухих препаратов
450
кости детально описано в руководстве Б.М. Ярославцева
«Анатомическая техника» (1961).
Патологоанатомические сухие препараты кости можно
получить через максимально короткий период времени после
вскрытия с помощью метода, предложенного А.В. Русаковым (1959).
Он основан на том, что денатурированный кипячением белок
подвергается гниению гораздо быстрее, чем нативный. Этот
способ является своеобразной модификацией бактериальной
мацерации и включает выполнение следующих процедур.
1. Непродолжительная предварительная фиксация
препарата в растворе формалина с последующим тщательным
промыванием в проточной воде. Такая фиксация необходима, так как
при кипячении разрушаются примитивные и тонкие структуры
патологической кости, а под воздействием формалина клейдаю-
щие вещества кости становятся нерастворимыми при
нагревании.
2. Кипячение кости в течение 3 —5 ч до полного размягчения
мышечной ткани.
3. Очистка препарата от остатков мягких тканей.
4. Мацерация препарата в течение 3 — 5 сут в специальном
бачке, который помещают в термостат при 38 — 40 °С. За это
время растворяются все ткани, подверженные гниению.
5. Окончательная очистка препарата от мягких тканей водой
и механическим путем.
6. Отбеливание перекисью водорода или 10 % раствором
хлорной извести.
7. Высушивание при комнатной температуре и хранение в
специальных коробках или закрытых витринах.
ВЫРЕЗКА КОСТНОГО МАТЕРИАЛА
Кость — наиболее плотная (твердая) ткань организма, что
обусловливает особенности взятия материала для гистологического
исследования и необходимость такого важного его этапа, как
декальцинация.
Гистологическому исследованию подвергают костную ткань,
полученную при вскрытии трупа; операционные препараты
опухолей и опухолеподобных образований костей, материал
открытых и пункционных биопсий; экспериментальный материал, в
основном длинные трубчатые кости лабораторных животных
(крыса, кролик, собака и т.д.).
Основным инструментом для взятия костного материала при
вскрытии до сих пор является пила из стандартного
секционного набора (в виде широкого полотна или лучковая с узким
полотном). Большая скорость вращения диска электрической
пилы не позволяет аккуратно выпилить фрагмент кости, а
высокая температура, возникающая при трении, создает артефакты,
451
которые заметно снижают качество гистологических
препаратов. Аккуратно распилить операционный препарат,
представляющий собой опухоль кости, с помощью дисковой
электрической пилы можно, только предварительно уплотнив опухоль
путем замораживания в холодильнике. Обычно опухоли костей
имеют, более мягкую консистенцию, чем сама кость, даже если
они содержат костные включения (кроме некоторых видов осте-
огенных сарком и паростальной саркомы). Следует
подчеркнуть, что для проведения полноценного исследования
необходимо распилить (или разрезать) не только опухоль, но и
прилежащий к ней фрагмент кости, а чаще всю кость.
Исследование операционного препарата опухоли кости
начинают с разреза опухоли обычно по ее длиннику, который чаще
совпадает с длинной осью трубчатой кости. Затем фрагмент
кости, свободный от опухоли, зажимают в тиски и, используя
пилу из секционного набора, производят распил. Распилить
длинную трубчатую кость с опухолью вдоль оси практически
невозможно без использования тисков. Для работы пригодны
обычные слесарные тиски больших размеров, надежно
прикрепленные к рабочему столу или массивной тумбочке. Желательно,
чтобы стол или тумбочка были фиксированы к полу или стене.
Поверхность стола под тисками должна быть покрыта
линолеумом или любым легко моющимся пластиком.
Операционный препарат распиливают в плоскости,
перпендикулярной к поверхности стола. Трубчатую кость, имеющую
на поперечном распиле округлую форму, очень трудно надежно
фиксировать в тисках. Кроме того, полотно пилы по мере
приближения к поверхности тисков зажимается в щели распила,
перемещается с большим трудом, сдвигая весь препарат.
Попытки плотнее фиксировать его в тисках приводят к тому, что
движения пилы еще более затрудняются, и приходится
отказаться от тисков и закончить распил оставшейся части кости на
специальной доске с упором. Распиливание длинной трубчатой
кости облегчается, если в зажимающих поверхностях тисков
высверлить на всю их глубину полукруглые желобки
различного диаметра. При зажиме кости в тисках эти желобки
сближаются и образуют канал, в котором надежно фиксируется
обрабатываемая кость. Опухоли костей таза, лопатки, позвоночника
и ребер удобно распиливать на специальной доске, имеющей
упор в виде угла или щели. Поверхность этой доски и рабочего
стола должна быть покрыта легко моющимся материалом.
Для отпиливания мелких или мельчайших фрагментов
компактной и трубчатой кости, а также трубчатых костей
экспериментальных животных лучше использовать пилу по металлу
любой конструкции, имеющую более мелкие зубчики, чем у
секционной пилы, или подобие лобзика с пилкой по металлу.
Можно применить обычный лобзик, однако он удобен только
для таких распилов, когда его дуга (соответственно и пилка)
452
располагается перпендикулярно к поверхности рабочего стола.
Важно правильно ориентировать зажимаемую в креплениях
лобзика пилку: ее зубчики должны быть направлены острием в
сторону, противоположную ручке инструмента, т.е. обращены к
кости, которую пилят. Костный препарат небольших размеров
при использовании пилы по металлу или лобзика обычно
достаточно прижать свободной от инструмента рукой к поверхности
рабочего стола. При этом следует избегать соприкосновения
препарата с деревянной поверхностью, так как в распил (щель
распила) во время работы неизбежно попадают мельчайшие
опилки дерева, которые «загоняются» даже в костномозговые
пространства. Это один из самых частых артефактов в
гистологических препаратах, приготовленных из кусочка кости без
соблюдения указанных предосторожностей. Удобно использовать
небольшой столик или просто деревянную дощечку, покрытую
линолеумом или пластиком, а также кусок фторопласта,
которые даже при их повреждении (пропиливании) не дают опилок,
подобных деревянным.
ФИКСАЦИЯ КОСТНОГО МАТЕРИАЛА
ДЛЯ ГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ
Первый этап обработки кусочков кости — фиксация, цель
которой: 1) закрепить структуру костной ткани в том состоянии,
в каком она находилась в момент ее погружения в
фиксирующую жидкость; 2) предохранить ее от дальнейшего разрушения;
3) подготовить костную ткань к последующей обработке.
Для фиксации костной ткани наиболее пригодны
фиксирующие жидкости, содержащие формалин, так как при
последующей декальцинации меньше набухает ткань, содержащая
коллаген. С целью выявления извести (солей кальция) в костной
ткани в качестве фиксатора чаще всего используют этиловый
спирт. Формалин, смеси с пикриновой кислотой и фиксаторы,
содержащие трихлоруксусную и уксусную кислоты, обладают
с лабовыраженными декальциниру ющими свойствами, что
важно учитывать при фиксации кусочков костной ткани.
Продолжительность фиксации в каждом фиксаторе можно
указать только примерно. Надрезая острой бритвой толстые
куски фиксируемой ткани, по изменению окраски и плотности
ткани можно удостовериться, полностью ли проник фиксатор в
ткань. Не следует передерживать объекты в фиксаторах.
Только в 10 % формалине и смеси Буэна кусочки костной ткани
можно хранить неограниченно долго.
При работе с любыми фиксирующими жидкостями
необходимо соблюдать общие правила фиксации, изложенные в главе 2.
Для фиксации костного материала используют формалин,
этиловый спирт, спирт-формол, жидкости Карнуа, Буэна и др.
453
Формалин. Обычно используют: а) 10 % раствор
формалина, состоящий из 10 мл 40 % раствора формальдегида и 90 мл
водопроводной воды; б) концентрированный нейтральный
формалин, состоящий из 100 мл формалина и 10 г мела или
карбоната магния основного; в) 10 % нейтральный формалин,
состоящий из 10 мл концентрированного нейтрального формалина и
90 мл водопроводной воды; г) хорошо зарекомендовал себя 5 %
раствор формальдегида на изотоническом растворе хлорида
натрия.
Кусочки костной ткани фиксируют в течение 24 — 48 ч в
хорошо укупоренной банке (материал в формалине может
сохраняться годами), затем промывают в проточной воде
(лучше 2 сут) и проводят через спирты возрастающей
концентрации.
Этиловый спирт. Применяют как абсолютный, так и 96 %
спирт. Абсолютный спирт обладает преимуществом: благодаря
резко выраженному коагулирующему действию менее
деформирует клеточные элементы. Но спирт имеет меньшую
проникающую способность, чем формалин, поэтому кусочки костной
ткани должны быть толщиной не более 0,5 см. Спиртовая
фиксация, как правило, применяется в специальных случаях,
например для различных гистохимических методов и при
исследовании на соли кальция. Объект помещают в спирт на 12 —24 ч,
который за это время нужно 2 — 3 раза сменить.
Спирт с формалином (спирт-формол). Смесь готовят перед
применением: 1 часть 10 % нейтрального формалина + 9 частей
96 % этилового спирта.
Кусочки кости фиксируют в течение 24 ч, а затем помещают
в 96 % или 100 % спирт.
Жидкость Карнуа. Смесь содержит 6 частей 100 % спирта,
3 части хлороформа и 1 часть ледяной уксусной кислоты.
Применение этой жидкости показано в тех случаях, когда
необходимо ускорить исследование. Соединительная ткань при
фиксации слегка сморщивается. Кусочки костной ткани толщиной от
2 до 4 мм фиксируют от 2 до 3 — 4 ч, а затем переносят в 100 %
спирт.
Жидкость Буэна. Смесь готовят из насыщенного раствора
пикриновой кислоты (15 частей), 40 % раствора формальдегида
(5 частей) и ледяной уксусной кислоты (1 часть). Жидкость
быстро проникает в фиксируемые объекты, вызывая
незначительное сморщивание соединительной ткани. Фиксацию
проводят в течение 1 сут, затем кусочки тщательно промывают в
проточной воде (не менее 24 ч) и проводят через спирты
возрастающей концентрации, которые повторно меняют, чтобы, по
возможности, устранить желтую окраску ткани.
Смесь сулемы с формалином. Эту фиксирующую смесь
готовят из 9 частей насыщенного водного раствора сулемы и
1 части 40 % формальдегида. Смесь считается очень хорошим
454
фиксатором для органов, богатых соединительной тканью.
Продолжительность фиксации в жидкостях 2 — 24 ч. При фиксации
в жидкостях, содержащих сулему, в препаратах обычно
образуются кристаллические или аморфные преципитаты. Для их
удаления к 70 —80 % спирту, служащему для промывания кусочков
сразу же после фиксации, добавляют несколько капель 3 %
спиртового раствора йодата калия. Материал выдерживают в
этом растворе 24 ч — ткань должна приобрести коричневый
оттенок. Если кусочки обесцвечиваются, нужно увеличить в
растворе концентрацию йода. Затем из материала удаляют йод при
помощи 0,25 % раствора тиосульфата натрия и промывают в
дистиллированной воде.
Фиксирующая смесь «Суза» по Гейденгайну. Вначале
4,5 г сулемы и 0,5 г хлорида натрия растворяют при
нагревании в 80 мл дистиллированной воды, затем к раствору
добавляют 2 г трихлоруксусной кислоты, 4 мл ледяной уксусной
кислоты и 20 мл 40 % формальдегида. Это одна из лучших
фиксирующих смесей, одновременно обладающая декальцини-
рующим эффектом. Кусочки костной ткани, фиксируемой в
смеси «Суза», должны быть не более 1 см. Фиксация
продолжается от 3 до 24 ч в зависимости от величины исследуемого
материала. Промывают материал в 96 % или 100 % спирте.
Применение спирта меньшей концентрации нежелательно, так
как при этом возможно чрезмерное набухание соединительной
ткани. Далее кусочки обрабатывают в спиртовом йодо-йодок-
алиевом растворе.
Фиксирующая смесь «Супиформейс» по Пфулю. Смесь
состоит из 40 мл концентрированного водного раствора сулемы,
20 мл 40 % формальдегида, 5 мл ледяной уксусной кислоты и
40 мл насыщенного раствора пикриновой кислоты. Эта смесь
обладает очень хорошими фиксирующими свойствами,
применение ее не вызывает сморщивания исследуемого материала.
Продолжительность фиксации кусочков костной ткани 12 — 24 ч.
Затем следуют промывание в 80 % спирте и обработка в
спиртовом йодо-йодокалиевом растворе.
Жидкость Гелли (ценкер-формол). Непосредственно перед
применением к исходному раствору Ценкера вместо ледяной
уксусной кислоты добавляют 5 мл формалина. Кусочки костной
ткани фиксируют от нескольких до 24 ч, затем промывают в
проточной воде в течение 24 ч.
Фиксирующая смесь «Саномия». Смесь состоит из 3 г
сульфосалициловой кислоты, 5 мл ледяной уксусной кислоты и
100 мл 100 % спирта. Является очень хорошим общим
фиксатором, не вызывающим сморщивание материала. Смесь
приготавливают непосредственно перед использованием. Фиксацию
необходимо проводить в темноте в течение 3—12 ч, материал
промывают в 100 % спирте.
455
ДЕКАЛЬЦИНАЦИЯ КОСТНОГО МАТЕРИАЛА
В период становления гистологической техники для
демонстрации применяли шлифованные распилы кости. Однако этот
метод оказался малопригодным для гистологических
исследований, так как в этих очень толстых срезах была плохо различима
структура костной ткани и при шлифовании разрушались
клеточные элементы. Для получения гистологических срезов
костной ткани необходимо растворить соли кальция, т.е. декальци-
нировать материал, сохранив клеточные элементы и
органический матрикс кости.
Декальцинацию проводят после полной фиксации ткани,
обычно в некислых фиксаторах. После декальцинации в
кислотах необходимо проводить деацидификацию с помощью
щелочных растворов или по крайней мере путем промывания в двух
сменах спирта. Нельзя допускать длительного промывания в
проточной воде, так как это способствует набуханию коллагено-
вых волокон, особенно если промывание проводится сразу
после обработки в кислых растворах.
При проведении декальцинации надо учитывать следующие
положения.
1. Продолжительность декальцинации в кислотах должна быть
по возможности уменьшена, так как при длительном воздействии
кислоты ухудшается способность тканей окрашиваться. В связи с
этим декальцинации подвергают небольшие и тонкие кусочки
костной ткани (толщиной 0,5—1 см).
2. С целью уменьшения продолжительности декальцинации
необходимо брать большое количество декальцинирующей
жидкости (ее объем должен в 25 — 50 раз превосходить объем всех
вместе взятых декальцинируемых кусочков костной ткани),
чаще менять ее (каждые 24 — 48 ч) и встряхивать сосуд, в
котором протекает реакция:
3. Продолжительность декальцинации не может быть
установлена заранее, так как содержание солей кальция в декальци-
нируемой ткани может колебаться в очень широких пределах.
Критерии окончания декальцинации — см. ниже.
4. Если декальцинацию проводили с помощью трихлоуксус-
ной и пикриновой кислот, то кусочки промывают 80 — 90 %
спиртом, после декальцинации неорганическими кислотами их
промывают водой. В последнем случае во избежание набухания
соединительной ткани перед промыванием объект необходимо
на 24 ч поместить в жидкость, уменьшающую набухание,
например в 5 % раствор алюмокалиевых квасцов. Затем следует
тщательно промыть материал в проточной воде в течение 24 —48 ч.
5. Если декальцинируемая ткань содержит много жира
(костный мозг), то ее необходимо предварительно обезжирить,
выдерживая объект несколько дней в 96 % и 100 % спиртах,
лучше в термостате при 37 °С.
456
6. Объекты небольших размеров или такие, в которых
костная ткань имеет тонкую структуру, можно предварительно
залить в целлоидин.
7. Процесс декальцинации протекает быстрее в термостате при
37 °С, однако кислотная декальцинация в этих условиях обычно
сопровождается возникновением различных артефактов.
8. После декальцинации кусочки кости можно резать на
замораживающем микротоме или залить в парафин или
целлоидин.
В зависимости от используемых реагентов различают
кислотную и бескислотную декальцинацию.
Кислотная декальцинация
Минеральный компонент костной ткани в основном представлен
кристаллами нерастворимого гидроксиапатита. С тем чтобы
удалить это вещество из кости, его переводят в растворимое
состояние в декальцинирующих растворах, обладающих высокой
кислотностью. Используются азотная, сернистая, муравьиная,
трихлоруксусная, пикриновая кислоты и жидкости различного
состава.
Азотная кислота. Для декальцинации применяют 5 — 7,5 %
водный раствор азотной кислоты. Для его приготовления в
мензурку с притертой пробкой наливают 5 — 7,5 мл химически
чистой концентрированной азотной кислоты (плотность 1,40) и
добавляют до 100 мл дистиллированную воду. В оптимальных
условиях небольшие кусочки самой плотной кости декальциниру-
ются в растворе азотной кислоты уже через 10 ч. После
декальцинации для подавления набухания соединительной ткани
кусочки кости на 24 ч подвешивают в 5 % растворе сульфата
натрия или лития и лишь после этого промывают в течение 24 —
48 ч в проточной воде.
Не рекомендуется применять растворы азотной кислоты как
более низкой, так и более высокой концентрации: в первом случае
происходит набухание, во втором — повреждение клеточных
структур. При этом в более концентрированном растворе кислоты
вряд ли значительно усиливается ее декальцинирующее действие.
Сернистая кислота. Под воздействием сернистой кислоты
нерастворимый в воде третичный фосфат кальция переходит в
легко растворяющийся в воде первичный фосфат кальция. Для
декальцинации используют насыщенный 5 % водный раствор
сернистой кислоты. Предварительную фиксацию кусочков
кости лучше проводить формалином, а не растворами,
содержащими сулему. Сернистая кислота обеспечивает быструю и
равномерную декальцинацию в течение 5 — 8 дней.
Муравьиная кислота. Для декальцинации применяют
концентрированную муравьиную кислоту, разбавленную равным
количеством 70 % спирта или 10—15 % раствором формалина.
457
Материал перед этим должен быть хорошо фиксирован в
формалине. После декальцинации, кусочки кости промывают в
течение нескольких дней в часто сменяемом 70 % спирте или 10 —
15 % растворе формалина, что позволяет избежать сильного
набухания тканей. Муравьиную кислоту особенно рекомендуют
использовать для декальцинации зубов. Она мало влияет на ок-
рашиваемость срезов костной ткани.
Трихлоруксусная кислота. Обычно применяют 5— 10 %
водный раствор этой кислоты, который одновременно фиксирует
материал. К этому раствору целесообразно добавлять 10 — 20 %
раствор формалина. Декальцинацию в трихлоруксусной
кислоте рекомендуется проводить после предварительной фиксации в
формалине, жидкости Буэна. Для декальцинации небольших
кусочков достаточно 1 — 4 дней. Материал промывают в 96 %
спирте в течение 3 — 4 дней при ежедневной его смене. Для
промывания ни в коем случае нельзя использовать воду, что
приводит к очень сильному набуханию соединительной ткани.
Пикриновая кислота. Концентрированный водный раствор
кислоты применяют для декальцинации эмбриональных
объектов и костей мелких животных, поскольку процесс
декальцинации в ней проходит очень медленно (от одного до нескольких
месяцев). Материал промывают в 70 — 80 % спирте во
избежание набухания соединительной ткани, а также потому, что
образующиеся под воздействием пикриновой кислоты осадки
большей частью нерастворимы в воде. Клеточные структуры ткани и
способность окрашиваться сохраняются очень хорошо.
Жидкость Виленсона (кислотно-формалино-солевой
раствор). Эта жидкость состоит из 10 % раствора азотной кислоты,
приготовленного на 5 % формалине с добавлением ацетата
калия из расчета 5 г на каждые 100 мл декальцинирующего
раствора. Продолжительность декальцинации в этом растворе
значительно меньше, чем в других реагентах, при этом способность
тканей окрашиваться не ухудшается.
Жидкость ван-Эбнера. Она имеет следующий состав: 10 —
15 г хлорида натрия, 2 мл соляной кислоты (плотность 1,19) и
100 мл дистиллированной воды. Декальцинирующее действие
оказывает соляная кислота. Хлорид натрия главным образом
противодействует разбуханию коллагеновых волокон. Кусочки
кости оставляют в этой жидкости на несколько недель и даже
месяцев, в течение которых нужно ежедневно добавлять 1 —
2 мл соляной кислоты для сохранения первоначальной
концентрации или ежедневно менять декальцинирующую жидкость. По
окончании декальцинации кусочки промывают в проточной
воде, затем переносят для нейтрализации в ежедневно
сменяемый 10—15 % раствор хлорида натрия.
Жидкость Рихмана—Гельфанда—Хилла. Данную смесь
готовят из следующих компонентов: 90 % муравьиной кислоты
(100 мл), 38,8 % соляной кислоты (плотность 1,19 — 80 мл), дис-
458
тиллированной воды (820 мл). Кусочки костной ткани декальци-
нируют в этой смеси 1 — 5 дней при 20 °С и за 6 — 24 ч при 37 °С.
Жидкость Гудинга—Стеварта. Эта смесь состоит из 25 мл
концентрированной муравьиной кислоты, 75 мл
дистиллированной воды и 5 мл 40 % формальдегида. Декальцинация в этой
смеси продолжается от 1 до 7 сут.
Флороглуциназотная кислота. Эта жидкость позволяет
проводить быструю декальцинацию — в течение нескольких часов.
Однако для тонких гистологических исследований
предпочтительнее декальцинация в жидкости Гудинга—Стеварта.
Кусочки костной ткани помещают в большой объем декальцинирую-
щей жидкости, которую готовят следующим образом: в
фарфоровой чашке к 1 г флороглуцина медленно добавляют 10 мл
концентрированной азотной кислоты. После прекращения
кипения в чашку добавляют еще 100 мл 10 % азотной кислоты.
Первоначально декальцинирующая жидкость имеет темно-красный
цвет, но через несколько дней после приготовления становится
желтой, что не свидетельствует о снижении ее эффективности.
Флороглуцин защищает ткань от набухания и мацерации,
которые наблюдаются при действии кислот.
Жидкость Дженкинса. Смесь состоит из 4 мл
концентрированной соляной кислоты, 3 мл ледяной уксусной кислоты,
10 мл дистиллированной воды, 73 мл 100 % спирта и 10 мл
хлороформа. Кусочки костной ткани декальцинируют в этом
растворе 2 — 4 сут при 20 °С. После декальцинации материал
промывают в двух сменах 100 % спирта по 4 ч в каждой. Перед
заливкой в парафин или целлоидин спирт удаляют в двух сменах
хлороформа по 3 мин в каждой. После декальцинации в этом
растворе не происходит набухания коллагеновых волокон,
срезы костной ткани хорошо окрашиваются.
При проведении декальцинации в кислотных растворах
крышку банки, в которой находится декальцинирующая жидкость,
необходимо держать слегка приоткрытой, что способствует
улетучиванию углекислого газа. Удалять образцы из кислотных
растворов необходимо сразу после прекращения формирования в
жидкости пузырьков углекислоты. Чрезмерно длительное
пребывание образцов костной ткани в кислотных растворах
нежелательно, так как при этом ухудшается качество окраски срезов.
Бескислотная декальцинация
Бескислотные методы декальцинации возникли как альтернатива
кислотной декальцинации, которая имеет ряд недостатков:
повреждающее действие кислотных растворов на клеточные
структуры, особенно при передержке в них материала; набухание
межклеточного матрикса, в частности коллагеновых волокон;
инактивация многих ферментов, в связи с чем почти невозможно
проводить гистохимические и гистоэнзиматические исследования.
459
Бескислотная декальцинация солями
этилендиаминотетрауксусной кислоты (ЭДТА)
Бескислотная декальцинация рекомендуется в случае
необходимости проведения гистохимических исследований костных
образцов. ЭДТА и ее натриевые соли (версен, секвестрен, трилон
Б, комплексон-Ш и др.) относятся к хелатообразующим
агентам и имеют замечательное свойство: их растворы в комбинации
с ионами кальция формируют легко растворимые отрицательно
заряженные комплексы кальция. При декальцинации в
растворах ЭДТА не образуются пузыри газа, вследствие чего не
повреждаются ткани. Использование ЭДТА и ее солей
предотвращает нарушение окрашивания срезов декальцинированных
костных образцов.
ЭДТА и ее соли рекомендуют использовать для
декальцинации зубов и костей. Они с успехом могут быть применены для
изучения щелочной фосфатазы и других ферментов (которые
разрушаются в кислой среде при декальцинации), так как
ЭДТА можно использовать при нейтральном рН.
ЭДТА и ее соли обычно используют в виде 5 — 10 % водного
раствора. Декальцинация проходит быстрее при ежедневной
смене раствора. Щелочные растворы в некоторой степени
гидролизу ют белки, поэтому рекомендуется применять растворы
ЭДТА и ее солей в пределах рН 6,5 — 7,5. Губчатая кость в этих
растворах декальцинируется в течение 3 — 7 сут, компактная
кость — намного дольше. На 1 г ткани необходимо брать
приблизительно 100 мл декальцинирующей жидкости. После
декальцинации кусочки тщательно промывают в проточной воде.
Завершенность декальцинации чаще всего оценивают с
помощью иголочного теста.
Приводим несколько известных методов бескислотной
декальцинации хелатообразующими агентами.
Декальцинация версеном по Хиллеману—Ли. Смесь
состоит из 5,5 % раствора версена, приготовленного на 10 % растворе
формалина. Перед декальцинацией образцы в течение 24 ч
фиксируют в нейтральном формалине. Декальцинирующий раствор
обновляют каждые 10 сут. По наблюдению авторов,
декальцинация большеберцовой кости крысы занимает в среднем 4 нед.
Декальцинация ЭДТА по Фрейману. Декальцинирующая
жидкость представляет собой 5 % водный раствор ЭДТА, рН
которого доведен с помощью гидроксида натрия до 6,0 — 6,5.
Материал фиксируют в 80 % спирте в течение 24 ч при 4 °С, затем
промывают проточной водой. Декальцинацию в первые 24 ч проводят
при 4 °С, затем раствор заменяют и декальцинация продолжается
при комнатной температуре в течение 2 — 21 сут. Раствор
рекомендуют менять через равные промежутки времени.
Декальцинация трилоном Б. Декальцинирующий раствор
состоит из 250 г трилона Б, 50 мл 40 % раствора гидроксида на-
460
трия и 1000 мл дистиллированной воды. В процессе
приготовления раствора соблюдают следующую последовательность: 250 г
три лона Б высыпают в огнеупорную стеклянную колбу,
добавляют 200 мл дистиллированной воды, ставят колбу на пламя
газовой горелки, добавляют 50 мл 40 % раствора гидроксила
натрия, тщательно размешивают. Затем, не прекращая
размешивания, добавляют 750 — 800 мл дистиллированной воды. С
помощью 40 % раствора гидроксида натрия доводят рН до 7,4.
Подогревание прекращают после полного растворения трилона Б.
Повторно измеряют рН, добавляя при необходимости 40 %
раствор гидроксида натрия.
Декальцинацию нежных образцов ткани, таких как улитка
костного лабиринта пирамиды височной кости, желательно
проводить после их заливки в целлоидин. Целлоидиновые блоки
помещают в 3 — 5 % раствор азотной кислоты. После
завершения декальцинации образцы в течение 24 ч обрабатывают 5 %
водным раствором сульфата лития или натрия. Затем материал
в течение 24 ч промывают в проточной воде с последующим
обезвоживанием в спирте восходящих концентраций.
Критериями хорошей декальцинации костной ткани
являются: 1) полное удаление солей кальция; 2) отсутствие в
изучаемых срезах признаков разрушения клеток и
соединительнотканных волокон; 3) отсутствие отрицательного влияния
декальцинации на процессы окрашивания срезов костной ткани.
Факторы, влияющие на продолжительность
декальцинации
На продолжительность действия декальцинирующих растворов
влияют несколько факторов. Два из них являются бесспорными
и важными: 1) концентрация и пригодность активного агента;
2) температура, при которой протекает процесс декальцинации.
Концентрация активного агента. Применение различных
добавок, особенно буферов, защищающих ткани от
повреждения, приводит к увеличению продолжительности
декальцинации. В пределах определенных ограничений более
концентрированные растворы реагентов (особенно водные растворы кислот)
действуют быстрее, но более вредны для обрабатываемых
тканей. Известно, что в 4 н. растворе муравьиной кислоты
декальцинация происходит вдвое быстрее, чем в 1 н. растворе, но 1 н.
растворы соляной и трихлоруксусной кислот более
эффективны, чем 4 н. Установление оптимальной концентрации
активных реагентов является компромиссом, позволяющим добиться
баланса между желаемым результатом декальцинации и
нежелательным повреждающим действием на ткани.
Во всех случаях необходимо исключить значительное
истощение активного декальцинирующего агента при его
взаимодействии с кальцием. Поэтому важно, чтобы соотношение объемов
461
декальцинирующей жидкости и обрабатываемой ткани ;было не
менее чем 20:1, причем жидкость необходимо периодически
менять. Некоторые авторы рекомендуют другое соотношение —
100 мл реагента на 1 г ткани при необязательной смене
декальцинирующей жидкости. Но некоторое истощение
декальцинирующей жидкости тем не менее происходит, поэтому следует
проводить смену сильных кислот 2 — 3 раза в течение 24 ч,
слабых кислот — ежедневно, а ЭДТА — 1 раз в неделю.
Температура. При увеличении температуры ускоряются
многие химические реакции, включая декальцинацию костного
материала, но при этом усиливается воздействие кислот на
обрабатываемую ткань. Так, при температуре 60 °С кость может
полностью мацерироваться почти так же быстро, как декальци-
нироваться.
Оптимальная температура для кислотной декальцинации не
установлена. Однако в большинстве случаев декальцинацию
проводят при температуре рабочей лаборатории, хотя
некоторые авторы предлагают считать стандартной температуру 25 °С.
В то же время при низкой температуре реакции замедляются, в
связи с чем материал, декальцинируемый в конце рабочей
недели, можно оставить в кислоте при 4 °С на 2-3 дня. Особенно
это полезно при использовании муравьиной кислоты.
Увеличение температуры также ускоряет декальцинацию,
проводимую с помощью ЭДТА, но без риска мацерации.
Обычно не определяются повреждения материала, декальцинирован-
ного с помощью ЭДТА при 60 °С при условии, что ткань была
хорошо фиксирована.
Размешивание декальцинирующей жидкости. Вопрос о
влиянии размешивания декальцинирующей жидкости на
декальцинацию костной ткани спорный. В проведенных
исследованиях не удалось подтвердить влияние этого фактора на
продолжительность декальцинации костной ткани. Вместе с тем
большинство авторов рекомендуют перемешивать декальцини-
рующий раствор 1 — 2 раза в день.
Подвешивание декальцинируемого материала. Декальци-
нирующая жидкость должна свободно соприкасаться со всеми
поверхностями ткани. Дно посуды, в которой находится декаль-
цинирующий раствор, обычно покрывают стеклянной ватой или
любым другим инертным абсорбирующим материалом. Кусочки
ткани подвешивают на нитке, что обеспечивает смачивание
объекта декальцинирующей жидкостью со всех сторон.
Желательно выполнять эту процедуру, так как даже при небольшом
количестве образцов может стать невозможным проход между
ними декальцинирующей жидкости, в результате чего
увеличится продолжительность декальцинации.
Ионообменные смолы. Ь.ДУ. ОоШ и соавт. (1951) описали
метод использования ионообменных смол для ускорения
декальцинации костной ткани, основанный на удалении из раство-
462
ра свободного кальция. Результаты сравнивались с данными,
полученными при использовании 13 % раствора цитрата натрия
в 45 % муравьиной кислоте. Установлено, что декальцинация с
помощьк) ионообменной смолы происходит быстрее, чем в
контроле. При этом обеспечивается высокая сохранность ткани и
клеточных деталей (кроме случаев, когда концентрация
муравьиной кислоты превышала 50 %). Однако ].М. 1п^оос1 (1958)
не обнаружил каких-либо различий в длительности
декальцинации или сохранности ткани при сравнении действия кислот
эквивалентных концентраций с добавлением и без добавления
ионообменной смолы.
Электролиз. С целью ускорения декальцинации 1.М. ШсЬ-
тап и соавт. (1947) разработали электролитический метод. При
этом кость прикрепляют к аноду, электрический ток, проходя
через раствор электролита, способствует миграции ионов
кальция к катоду и тем самым вызывает деминерализацию кости.
В качестве электролитов были испытаны разные растворы.
Наиболее эффективной оказалась смесь 8 % соляной и 10 %
муравьиной кислот (они сами по себе обладают выраженным де-
кальцинирующим свойством), декальцинирующая костные
образцы в течение 2 —6 ч. Декальцинацию проводили при
температуре от 30 до 45 °С, но на аноде она была определенно выше.
Другие авторы, используя подобную аппаратуру и схожие
растворы, обнаружили, что продолжительность декальцинации
костных образцов составляет 15 — 20 ч. Более того, Е.С. С1ау-
ёеп (1952) показал, что электролитический метод способствует
незначительному ускорению декальцинации. Существенным
недостатком этого метода декальцинации является риск
повреждения (ожог, набухание или гидролиз) или деструкции ткани при
ее контакте с электродом.
Ультразвук. Е.^ ТЬогре и соавт. (1963) предложили
использовать для декальцинации кости ультразвуковой генератор. Они
сообщили о десятикратном увеличении скорости декальцинации
без ущерба для структуры ткани и ее окраски в результате
применения генератора с частотой 10,25 кГц и 7,5 % раствора уксусной
кислоты. Однако другим авторам, повторившим подобные
эксперименты, не удалось подтвердить эти данные. В среде,
подвергающейся воздействию ультразвука, температура повышается до
56 °С, что, вероятно, является единственным фактором,
ускоряющим процесс декальцинации [Раде К.М., 1977]. Кроме того,
ультразвук дает деструктивный эффект и вряд ли может быть широко
использован как метод декальцинации.
Завершение декальцинации
При наиболее оптимальном варианте ткань необходимо
извлекать из декальцинирующей жидкости немедленно после того,
как из кости удалены последние следы минералов. Для этого
463
необходимо постоянно наблюдать за ходом декальцинации.
В отдельных случаях допускается некоторая
передекальцинация материала. При этом материал окрашивают так ке, как и
костный образец, в котором сохраняются последние остатки
минералов. I
Контроль за ходом декальцинации осуществляют в
сочетании с заменой декальцинирующей жидкости. При
использовании в качестве декальцинаторов слабых кислот тестирование на
завершение декальцинации обычно проводят ежедневно, при
проведении декальцинации с помощью ЭДТА — еженедельно.
Тестирование образцов костной ткани с небольшим
содержанием минералов, декальцинацию которых осуществляют с
помощью сильных кислот, проводится однократно для оценки
полной декальцинации материала. В тех случаях, когда обработку
материала осуществляют в условиях значительного дефицита
времени, допускается его неполная декальцинация.
Для контроля за завершением декальцинации используют
различные тесты. Наиболее простыми являются сгибание или
сжимание кусочков пальцами, пробный надрез, прокалывание
кусочка препаровальной иглой. Для выполнения этих тестов
требуется большой практический опыт, и ни один из них не
может быть признан удовлетворительным, так как возможно
повреждение материала, в частности при прокалывании
кусочков иглой [Виноградова Т.П., 1964].
Химические тесты основаны на определении содержания
кальция в декальцинирующей жидкости. Кальций-оксалатный
метод позволяет обнаруживать в ней кальций за счет
преципитации нерастворимых гидроокиси и оксалата кальция. Для
проведения этого теста берут приблизительно 3 мл использованной
декальцинирующей жидкости, опускают в нее маленький
кусочек лакмусовой бумаги и добавляют по каплям
концентрированный аммоний до тех пор, пока раствор не станет нейтральным
(взбалтывают после добавления каждой капли). Затем
добавляют примерно 5 мл насыщенного раствора оксалата аммония,
хорошо взбалтывают и оставляют на 30 мин.
Образование преципитата после добавления оксалата
аммония свидетельствует о том, что в декальцинирующей жидкости
имеется значительное количество кальция. Преципитация,
поступающая после добавления оксалата аммония, также
позволяет сделать вывод о наличии кальция в декальцинирующей
жидкости, но в меньшем количестве. Если исследуемая жидкость
остается прозрачной в течение 30 мин, то это означает, что
декальцинация завершена.
Этот метод не применяют в тех случаях, когда декальцинирую-
щая жидкость содержит свыше 10 % кислот. Однако такая
жидкость может быть разведена или ее рН увеличен до 4,5
посредством добавления раствора гидроксида натрия непосредственно
перед началом выполнения теста, но при этом снижается чувстви-
464
тельность теста. Растворы муравьиной кислоты, концентрация
которых выше 10 %, имеют тенденцию становиться мутными при
проведении теста и обычно маскируют его результаты.
Процесс декальцинации кислотными жидкостями
сопровождается образованием диоксида углерода, покрывающим
поверхность ткайи слоем пузырьков. Они рассеиваются при
встряхивании и образуются вновь до тех пор, пока в ткани присутствует
карбонат кальция. Предлагалось использовать этот показатель
для оценки степени декальцинации, однако карбонат кальция
составляет только 4 — 5 % от общего количества всех минералов
кости, поэтому прекращение образования пузырьков углекислого
газа не может быть надежным признаком полной декальцинации.
Несомненно, наиболее эффективным методом обнаружения
кальция в ткани является рентгенография. С помощью
стандартной клинической рентгенологической установки можно
одномоментно исследовать несколько образцов.
Подрезание декальцинированного материала
Особым (завершающим) этапом декальцинации является так
называемое подрезание материала, т.е. окончательное
моделирование кусочка кости перед его заливкой в избранную среду.
Необходимость в этом этапе бывает вызвана тем, что на
поверхности кусочка кости (особенно губчатой) после пребывания
его в кислотном декальцинаторе образуется слой (налет) жира
костного мозга, содержащий костные крошки и нередко
деревянные опилки. Налет жира удаляют, но при этом кусочек
уменьшается в размерах, что нужно иметь в виду еще при
выпиливании образца. При работе с крупным фрагментом кости
(изготовление гистотопограмм) моделирование позволяет
одновременно проверить полноту и качество декальцинации, избежать
порчи микротомного ножа и получить качественные срезы. В
случае неполной декальцинации ее приходится продолжить,
таким образом, подрезание может быть неоднократным.
Проводят моделирование любым остро заточенным лезвием.
Для этой цели пригодны и скальпель, и малый секционный
нож, однако лучше использовать опасную бритву или лезвие
безопасной бритвы, фиксированное в хирургическом
иглодержателе. Опасная бритва имеет наиболее подходящий (не
клиновидный, как у ножа или скальпеля) профиль и легко может
быть заточен на специальном мягком бруске или
мелкозернистой наждачной бумаге. С помощью опасной бритвы можно
получить очень ровную поверхность, подлежащую резке на
микротоме, и не раскрошить при этом кость.
Следует заметить, что для качественного подрезания
необходимо иметь используемый только для этой цели инструмент.
Его нужно постоянно затачивать (особенно, если это нож или
скальпель) и тщательно мыть после работы, так как металли-
465
ческое лезвие портится от действия кислот (при кислотной
декальцинации), следы которых сохраняются в кусочке кости
даже после тщательного промывания. ,
ПОСЛЕДУЮЩАЯ ОБРАБОТКА МАТЕРИАЛА
В большинстве случаев в кусочках ткани, прошедших
кислотную декальцинацию, всегда содержится то или иное количество
кислоты. Перед переносом кусочков во вторичный фиксатор
или первую дегидратирующую жидкость остатки кислоты
обычно удаляют путем быстрого ополаскивания в проточной воде
или с помощью промокания. После кислотной декальцинации
целесообразнее использовать различные нейтрализующие
средства, включая промывание в проточной воде или других более
щелочных растворах, что предотвращает загрязнение
дегидратирующей жидкости. Перед дегидратацией также
рекомендуется промывание материала в 2 сменах 70 % спирта в течение 12 —
18 ч.
Для получения замороженных срезов декальцинированную
ткань предварительно промывают в воде или хранят в растворе
формалина, что исключает коррозию металла, из которого
изготовлен нож, под воздействием кислоты, которая обычно
остается в ткани.
Декальцинированные в концентрированном нейтральном
растворе ЭДТА ткани не помещают в 70 % этиловый спирт, так
как это вызывает образование преципитатов в виде
кристаллической корки из остатков ЭДТА и спирта. Для предотвращения
этого дефекта декальцинированные кусочки ткани после ЭДТА
на ночь помещают в раствор формалина.
При наличии не полностью обызвествленной ткани или в тех
случаях, когда минеральные включения в ткани препятствуют
получению удовлетворительных срезов, проводят
поверхностную декальцинацию. Минеральные включения выявляют после
грубой (предварительной) резки ткани. В этих случаях залитый
в парафин кусочек обычно помещают на 15 — 60 мин в 1 %
соляную кислоту так, чтобы кислота соприкасалась только с той
поверхностью блока, которую предстоит резать. Поскольку
проникновение кислоты внутрь образца незначительное, блок
должен быть тщательно ориентирован в микротоме во избежание
потери декальцинированных срезов.
ЗАЛИВКА ДЕКАЛЫДИНИРОВАННОГО МАТЕРИАЛА
Для приготовления гистологических препаратов декальциниро-
ванной костной ткани объект необходимо заключить в
пластическую массу, способную полностью пропитать его и обеспечить
консистенцию, позволяющую получать тонкие срезы. С этой целью
используют заливку в парафин, целлоидин, целлоидин-парафин.
т
Заливка в парафин
Для маленьких кусочков декальцинированной костной ткани
вполне пригодна обычная заливка в парафин по общепринятой
методике. В качестве просветляющего агента используют
хлороформ, который хорошо растворяет парафин (поэтому его
применяют как промежуточную среду между обезвоживанием и
заливкой ткани). С целью более качественного пропитывания
костной ткани парафином заливку желательно осуществлять в
вакууме. Для этого образцы костной ткани, лежащие в смеси
парафина с воском (3:1), помещают в вакуумную камеру
(вакуумный термостат) при температуре 37 °С. Давление в
вакуумной камере снижают очень медленно до 400 — 500 мм рт. ст.
Продолжительность парафиновой заливки в вакууме обычно
составляет ХА — х/1 времени, необходимого для заливки таких же
костных образцов при атмосферном давлении. В заключение
процедуры давление в вакуумной камере медленно повышают
до тех пор, пока оно не сравняется с атмосферным. Костные
образцы больших размеров вакуумируют 2 — 3 раза, каждый раз
помещая их в новую порцию парафина. При вакуумной заливке
значительно ускоряется замещение хлороформа парафином.
Т.П. Виноградова (1973) предложила метод ускоренной
парафиновой заливки, используемый в отдельных случаях для
материала, полученного при аспирации или пункции.
1. Материал фиксируют в 10 % нейтральном формалине 1 —
Зч.
2. В случае необходимости проводят декальцинацию от 1 —
2 ч до 1 сут с последующим промыванием.
3. Переносят в 95 % этиловый спирт — 2 смены по 30 мин.
4. Проводят через 100 % спирт — 2 смены по 30 мин.
5. Помещают в бензол на 30 мин.
6. Заливают в парафин при 52 — 58 °С на 30 мин.
Метод двойной целлоидин-парафиновой заливки
Этот метод обладает достоинствами парафиновой и
целлоидиновой заливок. В срезах образцов, залитых с помощью этого метода,
ткани различной плотности (кость, хрящ и прилежащие мягкие
ткани) удерживаются вместе лучше, чем при заливке в парафин.
Методика заливки
1. Сухой целлоидин (10 г) растворяют в 1000 мл метилбензо-
ла в закрытой колбе, которую необходимо встряхивать и
переворачивать 1 — 2 раза в день, 1 — 2 нед, иногда дольше.
2. Обезвоженные кусочки костной ткани помещают в
полученный раствор, который меняют через 24 или 48 ч, а при
обработке крупных объектов — через 72 ч. В результате образцы
становятся прозрачными.
467
3. Кусочки переносят в бензол (3 смены по 5 — 7 ч в
каждой), после чего проводят по общепринятой методике через
смесь, состоящую из равных частей бензол-парафина и чистого
парафина.
Заливка в целлоидин
Целлоидиновая заливка незаменима при изготовлении
гистологических препаратов костной ткани. Целлоидин лучше
связывает друг с другом ткани разной консистенции, чем парафин, и
предотвращает их разделение во время резки. Этот способ
заливки незаменим при получении гистологических срезов с
больших блоков кости (гистотопограмм) и кости с прилежащими
мягкими тканями. В целлоидине кость становится более гибкой
и близкой по плотности к заливочной среде. Корковое вещество
кости меньше твердеет, чем при заливке в парафин. Для
целлоидиновых срезов более пригодны некоторые методы окраски
(например, метод выявления канальцев), кроме того,
отдельные компоненты кости, такие как линии склеивания,
выявляются несколько лучше.
Целлоидиновая заливка имеет и недостатки. Так, из-за
относительно большой толщины получаемых срезов (10 — 20 мкм)
затруднено изучение деталей клеток; возникают сложности при
изготовлении больших и серийных срезов, их наклеивании на
стекла; вследствие значительной продолжительности получения
целлоидиновых срезов не всегда возможно их использование
при исследованиях, проводимых с диагностической целью.
Заменителем целлоидина может быть ацетилцеллюлоза,
получаемая из негорючей кинопленки и рентгеновской пленки.
Обработку и заливку кости в целлоидин проводят так же, как и
мягких тканей, но заливочная среда должна быть более
твердой. Некоторые исследователи предпочитают целлоидину
низковязкую нитроцеллюлозу, увеличивая тем самым твердость
заливочной среды.
ПРИГОТОВЛЕНИЕ ГИСТОТОПОГРАФИЧЕСКИХ ПРЕПАРАТОВ
В практической и научной работе исследователей,
специализирующихся в области костной патологии, часто возникает
необходимость в сопоставлении тех или иных особенностей
структуры костной ткани в отдаленных друг от друга участках. Эту
возможность предоставляют гистотопографические (кристелле-
ровские) обзорные препараты. С их помощью можно оценить
распространенность и выраженность патологического процесса
в пределах всего или большей части органа [Смольянников А.В.,
Саркисов Д.С, 1994], в связи с чем легче сопоставить патомор-
фологические и клинические проявления болезни.
468
Для приготовления гистотопографических срезов вырезают
сравнительно тонкие (0,7 — 1 см) пластинки кости. Их
последующая обработка включает:
1) фиксацию в нейтральном формалине — 4 — 6 сут;
2) декальцинацию — 4 — 5 сут;
3) подрезание материала, обычно с последующей дофикса-
цией в растворе формалина — 2 сут и дополнительной
декальцинацией — 1—2 сут;
4) промывание в проточной воде — 1 сут;
5) проводку по спиртам восходящей концентрации (70 %,
80 %, 96 %, 100 %) — в каждом спирте не менее 3 сут;
6) проводку через смесь спирта с эфиром (1:1) — 3 — 5 сут.
Две смены жидкого целлоидина (в 1-й не менее 10 сут, во 2-й —
не менее 5 сут), густой целлоидин — не менее 5 сут.
Пропитанный целлоидином материал наклеивают на
большие деревянные блоки. Срезы готовят на санном микротоме,
окрашивают обычными способами.
ПОЛУЧЕНИЕ ГИСТОЛОГИЧЕСКИХ СРЕЗОВ
ДЕКАЛЬЦИНИРОВАННОЙ КОСТИ
Срезы с небольших кусочков декальцинированной костной ткани
можно получить с помощью любого санного или ротационного
микротома. Более крупные образцы, залитые в целлоидин,
необходимо резать на санном микротоме. Для обработки больших и
плотных блоков используются микротомы специальной
конструкции. Применяют более толстые и жесткие микротомные ножи,
относящиеся к группам В и С, имеющие размеры 240 х 36 х 13 мм.
При этом плосковогнутые ножи группы В чаще предназначены
для резки объектов, залитых в целлоидин, плоские ножи группы
С — преимущественно в парафин [Меркулов Г.А., 1961].
Срезы недекальцинированной кости могут быть получены
только с помощью специального оборудования. Однако в связи со
значительными технологическими трудностями этот метод нельзя
рекомендовать для применения в повседневной практике.
Кусочки кости легче резать вдоль структуры ткани. В
некоторых случаях процесс получения срезов облегчается при
охлаждении ткани. С этой целью к режущейся поверхности блока
прикладывают на 5 —7 мин кусочки льда.
Оптимальная толщина срезов костной ткани обычно немного
больше, чем толщина срезов мягких тканей, и составляет 7 мкм.
При охлаждении костной ткани льдом толщину срезов можно
уменьшить до 5 —6 мкм. Однако в таких срезах
микроскопически часто определяются пустоты.
Даже при использовании совершенно чистых предметных
стекол срезы кости плохо приклеиваются к ним, поэтому стекла
предварительно обрабатывают желатином, дихроматом калия
или амилопектином.
469
Большинство срезов хорошо обработанной ткани,
нарезанных острым ножом, выравнивают и высушивают без
специальной обработки. В отдельных случаях вследствие разной степени
расширения парафина и залитой в него костной или хрящевой
ткани плавающие на поверхности воды срезы могут
образовывать складки. Срезы можно расправить путем повышения
температуры, но не выше точки плавления парафина.
ОКРАШИВАНИЕ СРЕЗОВ ДЕКАЛЬЦИНИРОВАННОЙ КОСТИ
Для окрашивания срезов декальцинированной костной ткани
применимо большинство методик окраски срезов мягких
тканей. Несколько ограничено использование некоторых
красителей лишь при кислотной декальцинации.
Окраска гематоксилином и эозином
Для окрашивания декальцинированной ткани можно
использовать стандартную методику. Ткани, длительное время
находившиеся в кислотном декальцинирующем растворе, окрашивают в
течение нескольких часов или даже подвергают ночной
инкубации в стандартном растворе гематоксилина, разведенном
дистиллированной водой (1:10), с последующей окраской 0,1 —
0,5 % раствором эозина как обычно. Концентрацию красителей
и продолжительность окрашивания можно изменять в
зависимости от степени воздействия кислоты на ткани.
Некоторые авторы отдают предпочтение гематоксилину Эр-
лиха как более специфическому ядерному красителю,
обладающему способностью выявлять хрящевые элементы
(окрашиваются в голубой или пурпурный цвет), контрастирующие с кол-
лагеновой тканью (окрашивается в розовый цвет). С помощью
гематоксилина Эрлиха можно определять линии склеивания,
особенно при болезни Педжета, а также в кости, которая
быстро образуется или ремоделируется. Эта особенность менее
выражена после кислотной декальцинации, но может быть усилена
с помощью пролонгированного окрашивания. Линии
склеивания зрелой кости хорошо видны в срезах залитой в
нитроцеллюлозу декальцинированной кости, обработанной ЭДТА и
окрашенной гематоксилином Эрлиха. Недостатком данной
окраски является нечеткость деталей ядер, которые иногда бывают
тусклыми, особенно в хрящевой ткани, поэтому целесообразнее
использовать квасцовый (кислый) гематоксилин Майера.
Окраска коллагеновых волокон
Выявление зрелых и тонких незрелых коллагеновых волокон
необходимо, в частности, при некоторых опухолях. С этой
470
целью целесообразнее применять трехцветные методы,
особенно при заливке материала в нитроцеллюлозу. В результате
окрашивания зрелая костная ткань выглядит как поля голубого
или зеленого и ярко-красного цвета. Неправильное
окрашивание возможно вследствие неадекватного проникновения красок
и реагентов внутрь срезов, а также в связи с нагреванием срезов
для их расправления.
Окраска по Ван-Гизону пригодна для выявления
микроструктуры костной ткани, особенно после заливки материала в
нитроцеллюлозу. Однако при этом тонкие волокна могут
окрашиваться в неопределенные цвета.
Импрегнация серебром является ценным методом
распознавания опухолей кости и метастазов опухолей в кости. Ее
результат не зависит от метода декальцинации. Особое внимание
необходимо уделять прикреплению срезов к предметным
стеклам перед использованием раствора аммиачного серебра.
Окраска хрящевой ткани и кислых
гликозаминогликанов
Элементы хряща хорошо выявляются с помощью метахроматич-
ного окрашивания. Более точная идентификация кислых
гликозаминогликанов возможна с помощью 0,05 % раствора альци-
анового голубого в ацетатном буфере (рН 5,8), дающего при
добавлении хлорида магния 0,4 — 0,5 М. Метод специфичен для
хрящевой ткани.
ШИК-реакция может быть использована для выявления
новообразованной кости и обызвествляющегося хряща благодаря
содержанию в этих тканях кислых гликозаминогликанов. Молодые
остеобласты содержат гликоген, поэтому являются ШИК-пози-
тивными. Эта реакция особенно показана для выявления
гликогена в некоторых первичных опухолях кости и муцина в метастазах
некоторых опухолей кости. Результаты ШИК-реакции не зависят
от метода декальцинации, но следует избегать пролонгированной
обработки костной ткани сильными кислотами.
Специальные методы окраски
Остеоциты и их лакуны достаточно велики для того, чтобы их
можно было легко идентифицировать в большинстве
препаратов, включая парафиновые срезы декальцинированной кости,
окрашенные гематоксилином и эозином. Тонкие канальцы,
идущие в радиальном направлении, выявляются частично в тонких
целлоидиновых срезах, окрашенных гематоксилином, или в де-
кальцинированном материале, импрегнированном серебром.
Один из методов выявления костных канальцев — их
заполнение какой-либо субстанцией, которая приобретает темную
окраску, контрастирующую со светлым или неокрашенным
471
фоном. К таким методам относится простой способ «воздушной
инъекции» [Са1епЪу ].В., 1934]. Недекальцинированные срезы
высушивают и заливают в бальзам, который расплавляется при
нагревании, и при попадании воздуха внутрь костных
канальцев они выявляются как черные нити на общем неокрашенном
фоне.
Пикротиониновый метод Шморля [5сЬтог1 С, 1934]
основан на отложении тионинового преципитата внутри лакун и
канальцев. При этом рекомендуется использовать замороженные
или нитроцеллюлозные срезы, поскольку в них канальцы
меньше сморщиваются, чем в парафиновых, и преципитат краски
лучше проникает внутрь образцов. Однако длительно
хранившиеся в этиловом спирте нитроцеллюлозные срезы могут
окрашиваться неудовлетворительно.
С. 5сЬтог1 (1934) применял насыщенный раствор тионина
в 50 % этиловом спирте. Другие авторы рекомендуют
использовать наполовину насыщенный водный раствор тионина.
О §сЬтог1 считал предпочтительным щелочной раствор и
добавлял непосредственно перед использованием 1—2 капли
концентрированного раствора аммиака на 10 мл раствора
красителя. Позднее было установлено, что разные партии тионина
различаются по пригодности для окрашивания этим методом,
поэтому необходимо подбирать концентрацию аммиака (она
может доходить до 1 капли на 100 мл красящего раствора).
В практической работе вместо тионина может быть с успехом
использован азур А.
Фиксацию осуществляют с помощью любых фиксаторов,
кроме тех, которые содержат дихлорид ртути. Декальцинацию
проводят в любом декальцинирующем растворе. Основным
является 25 % водный раствор тионина, из которого готовят
рабочий раствор (отфильтрованный основной раствор, разведенный
эквивалентным объемом дистиллированной воды с добавлением
раствора аммиака непосредственно перед использованием).
Методика окраски
1. Срезы промывают дистиллированной водой 10 мин.
2. Окрашивают в рабочем растворе тионина 5—10 мин и
более.
3. Промывают дистиллированной водой.
4. Обрабатывают насыщенным водным раствором
пикриновой кислоты 30 — 60 с.
5. Промывают дистиллированной водой.
6. Дифференцируют в 70 % этиловом спирте до тех пор, пока
перестанут образовываться голубовато-синие скопления
красителя 5—10 мин или более.
7. Быстро обезвоживают, просветляют в ксилоле и
заключают.
472
Срезы обрабатывают осторожно в 3 —6-й стадиях процесса.
Это особенно важно в 6-й стадии, когда раствор может
нуждаться в обновлении. Если костный матрикс обесцвечивается во
время дифференцировки, то желтый цвет можно восстановить,
опустив срез на несколько секунд в раствор пикриновой
кислоты перед дегидратацией.
Результат: лакуны и канальцы темные, коричнево-черные;
костный матрикс желтый или коричнево-желтый, клетки
красные.
Схожий метод рекомендован С. 8сЬтог1 для исследования
костной ткани у детей: используют полу насыщенный раствор
тионина, пикриновую кислоту заменяют фосфорно-вольфрамо-
вой или фосфорно-молибденовой. СР. СиШп§ (1974)
предложил проводить окрашивание щелочным тионином (1 капля
раствора аммиака на 100 мл красящего раствора), но в течение
более длительного периода времени; несколько секунд срезы
обрабатывают в кислоте. С помощью этого метода канальцы и
лакуны выявляются как сине-черные на небесно-голубом фоне.
НЕДЕКАЛЬЦИНИРОВАННЫЕ СРЕЗЫ КОСТИ
Соединения кальция и фосфора в форме гидроксиапатита
являются основными компонентами скелета, обусловливающими
очень важные свойства костной ткани. В связи с этим ее
целесообразно изучать с помощью таких методов, которые позволяют
наблюдать распределение минералов в костной ткани при
различных патологических состояниях. Это особенно важно при
исследовании биопсийного и операционного материала у
больных с метаболическими заболеваниями скелета. Так, основной
проблемой при генерализованной деминерализации скелета (ос-
теопении) является проведение дифференциальной диагностики
с остеопорозом — уменьшением массы нормально
минерализованной кости и остеомаляцией — увеличением
неминерализованного костного матрикса вследствие уменьшения скорости
минерализации. Необходимым условием для решения подобных
проблем является возможность различать в гистологических
препаратах минерализованную и неминерализованную (остео-
идную) костную ткань, что осуществимо лишь на недекальцини-
рованных срезах. Более того, неминерализованный костный
матрикс рентгенонегативен, поэтому рентгенологически обычно
невозможно различить остеопороз и остеомаляцию. С
развитием гистологической техники и появлением возможности
изучения недекальцинированных срезов патологоанатом становится
центральной фигурой в диагностике метаболических
заболеваний скелета и оценке эффективности их лечения. Следует
также подчеркнуть, что только на недекальцинированных
срезах проводят достоверные количественные гистоморфометри-
473
ческие исследования статических и динамических параметров
объема, ремоделирования и минерализации костной ткани.
Биопсийный материал для получения срезов недекальцини-
рованной кости обычно берут из гребня подвздошной кости.
При фиксации материала необходимо избегать использования
кислых фиксаторов, так как они удаляют минералы из костной
ткани. Обычно применяют раствор формалина,
нейтрализованный карбонатом кальция или фосфатным буфером. Если био-
птаты достаточно большого размера, то их можно разделить на
две части: одну часть использовать для заливки в плотный
пластический материал, другую — для приготовления обычных
парафиновых или целлоидиновых срезов костной ткани после
ее декальцинации.
Парафин как мягкая заливочная среда непригоден для
заливки недекальцинированной кости. В связи с этим используют
двойную заливку в целлоидин-парафин и заливку в пластмассу.
Двойная заливка недекальцинированой кости
в целлоидин-парафин
Этот метод приемлем только для образцов губчатой кости
величиной не более 5 мм. Материал фиксируют в 5 % растворе
формалина или 2 % формальдегиде на верональном буфере при рН
7,2, обезвоживают в этиловом спирте. Образцы помещают в
приготовленный на метилбензоле 3 % раствор слабовязкой
нитроцеллюлозы (2 смены по 2 — 3 ч в каждой), затем — в 20 %
раствор нитроцеллюлозы на 18 ч. Вместо нитроцеллюлозы
можно использовать целлоидин. Осторожно удалив избыток
нитроцеллюлозы, образцы в течение 2 ч проводят через 3 смены
бензола. Кусочки ткани помещают в смесь равных частей
бензола и парафина, чистый парафин и заливают в парафин по
общепринятой методике.
Для получения срезов недекальцинированной костной ткани
желательно использовать тяжелый санный микротом. С целью
предотвращения фрагментации и волнистости срезов перед
получением каждого из них к поверхности блока прикрепляют
кусочек адгезивной пленки. Затем пленку вместе с одним или
несколькими срезами фиксируют на покрытых альбумином
предметных стеклах. Удаляют адгезивную пленку в ксилоле: в него
помещают стекла со срезами, обычно на ночь. Срезы
недекальцинированной кости через спирты доводят до
дистиллированной воды и окрашивают.
Заливка недекальцинированной кости
в синтетические смолы
Для получения хороших срезов недекальцинированной кости
получаемые объекты необходимо заливать в субстанцию, плот-
474
ность которой соизмерима с плотностью костной ткани. В
последнее время для заливки костных образцов используют
различные типы синтетических пластмасс и смол. Наиболее
распространен метод заливки недекальцинированной кости в
мети лметакри латы. Этот метод относительно прост, и получаемые
в конечном итоге блоки могут быть использованы как для
получения срезов, так и для распиливания с последующей
шлифовкой.
Метилметакрилат — прозрачная бесцветная жидкость с
резким запахом. При полимеризации она становится твердой
прозрачной смолой. Мономер метилметакрилата стабилизируется
гидрохиноном, который предотвращает спонтанную
полимеризацию.
Для того чтобы получить хорошо импрегнированные,
свободные от пузырьков воздуха блоки, на заключительных
стадиях заливки необходимо удалить стабилизатор и вызвать
частичную, а затем полную полимеризацию мономера
метилметакрилата. Гидрохинон удаляют с помощью отмывания в растворе
гидроксида натрия, затем добавляют катализатор (перекись
бензоила). Частичной полимеризации достигают путем
нагревания или добавления полимера, который растворяется в
мономере. Полимеризация посредством нагревания является
рискованным методом, так как без тщательного контроля за
температурой возможен сильный перегрев, что отрицательно сказывается
на результатах. Кроме того, быстрое охлаждение может
привести к увеличению вязкости смолы.
Заливка в метилметакрилат по Джауси
Кусочки костной ткани помещают на 24 ч в 70 % этиловый
спирт, являющийся одновременно фиксирующим и
дегидратирующим агентом, ина12чв100% спирт. С целью удаления
жира образцы переносят на 24 ч в смесь равных частей эфира и
ацетона при комнатной температуре. Для удаления из образцов
смеси эфира и ацетона, растворяющей заливочную среду,
кусочки костной ткани помещают в 100 % спирт на 12 ч (замена
свежей порцией спирта через 6 ч).
После завершения обезвоживания образцы переносят на 24 ч
в неполимеризованныи промытый мономер метилметакрилата, к
которому затем добавляют катализатор. После этого образцы
готовы к заливке. Необходимо использовать вакуумную
заливку, позволяющую удалить пузырьки воздуха и ускорить
пропитывание костной ткани метилметакрилатом.
Заливочная среда — метилметакрилат — должна быть
приготовлена заранее. Мономер метилметакрилата содержит
гидрохинон — ингибитор, предотвращающий полимеризацию. Его
необходимо удалить путем промывания мономера
метилметакрилата с гидроксидом натрия. Эту процедуру проводят в вы-
475
тяжном шкафу, так как выделяющиеся вещества токсичны и
обладают неприятным запахом. Смешивают 520 мл мономера ме-
тилметакрилата и 100 мл 5 % раствора гидроксида натрия в
сепараторной воронке, которую необходимо интенсивно
встряхивать. Полученный раствор фильтруют, образующийся на дне
воронки темно-коричневый осадок удаляют. Промывание
повторяют 4 — 5 раз до тех пор, пока гидроксид натрия не перестанет
окрашиваться в коричневый цвет. Затем гидроксид натрия
вымывают из мономера дистиллированной водой (100 мл),
повторяя процедуру 4 — 5 раз до окончательного устранения
щелочности воды. Промытый мономер метилметакрилата высушивают
путем его фильтрования через обезвоживающие агенты, такие
как хлорид или сульфат кальция. К концу процедуры из
первоначально взятых 520 мл обычно остается приблизительно
500 мл мономера метилметакрилата.
С целью полимеризации мономера метилметакрилата к нему
добавляют катализатор (0,5 г на 100 мл мономера) — безводную
перекись бензоила, которую необходимо хранить в эксикаторе с
обезвоживающими веществами. После этого мономер можно
использовать для инфильтрации костной ткани до заливки.
Мономер с добавленным катализатором хранят в холодильнике.
Для окончательной заливки костных образцов применяют не
жидкий, а полуполимеризованный мономер. Это необходимо
для ускорения процесса полимеризации метилметакрилата и
уменьшения его потерь вследствие испарения во время заливки.
В процессе полимеризации жидкий мономер сгущается и
затвердевает. Если полимеризация протекает слишком быстро, то
образуется избыточное количество тепла и формируются
пузырьки воздуха.
Полуполимеризованный мономер готовят следующим образом.
Мономер с катализатором помещают в колбу, которую погружают
в ванну с кипящей водой до тех пор, пока мономер не загустеет
(на 30 мин). При этом мономер необходимо постоянно
перемешивать с целью предупреждения локального перегрева. Температура
мономера не должна достигать 95 °С. Если она приближается к
этой отметке, то колбу следует немедленно охладить в ванне со
льдом. Полуполимеризованный мономер по вязкости должен
напоминать сироп, медленно вытекающий из колбы в охлажденном
состоянии. Хранят полуполимеризованный мономер
метилметакрилата в холодильнике в закрытой колбе.
Кусочки недекальцинированной костной ткани, взятые из
мономера метилметакрилата, помещают в боксы из картона или
фольги размером 2 х 3 см, и заливают полуполимеризованным
метилметакрилатом. В больших боксах часто происходит
перегревание метилметакрилата и образуются пузырьки воздуха.
Внутреннюю поверхность боксов покрывают раствором
силиката натрия, предотвращающего прилипание метилметакрилата.
Затем боксы помещаются в термостат при 35 °С приблизительно
476
на 2 сут. При этом полностью завершается полимеризация
мети лметакрилата, и он приобретает высокую твердость.
Заливка в метилметакрилат по Диффорду
Необходимое количество мономера метилметакрилата
помещают в разделительную воронку и добавляют равный объем 5 %
раствора гидроксида натрия, размешивают, дают отстояться
(при этом метакрилат образует верхний слой). Эту процедуру
повторяют еще 2 раза, а затем промывают в 3 сменах
дистиллированной воды. Добавляют 1 г перекиси бензоила на каждые
100 мл мономера метилметакрилата, и фильтруют через хлорид
кальция. Полученный основной катализируемый мономер
хранят при 4 °С в герметично закупоренном сосуде. Смешивание
100 мл основного катализируемого мономера и 40 г полиметил-
метакрилата во вращающемся смесителе при комнатной
температуре в течение 24 ч позволяет получить полимер-мономерза-
ливочную среду, которую хранят в плотно закрытых
контейнерах при 4 °С, но в течение короткого периода времени.
Перед использованием как основной катализируемый
мономер, так и полимер-мономерзаливочную среду держат при
комнатной температуре для предотвращения попадания в
заливочную среду паров конденсаторной воды.
Методика заливки
1. Обезвоживают образцы недекальцинированной костной
ткани в 70 %, 90 % и 3 сменах 100 % спирта по 24 ч в каждой.
2. Пропитывают смесью равных частей неотмытого
метилметакрилата и 100 % спирта в течение 24 ч.
3. Пропитывают в 3 сменах неотмытого метилметакрилата по
24 ч в каждой.
4. Пропитывают полимер-мономерзаливочной средой 24 ч
при 4 °С.
5. Пропитывают кусочки, помещенные в тонкостенные с
ровным основанием контейнеры подходящей глубины
(приблизительно на */5 их объема), свежей порцией
полимер-мономерзаливочной среды.
6. Выдерживают в течение 1 — 3 сут при 37 °С,
предпочтительно на водяной бане. Хранят блоки сухими.
Описанная методика подходит для губчатой кости толщиной
5—10 мм. Заливка компактной кости должна быть более
длительной, хотя тонкие блоки могут быть обработаны быстрее.
Если метилметакрилатные блоки становятся слишком мелкими
во время их приготовления, то можно добавить больше
заливочной среды. Рекомендуются заливочные* формы глубиной
приблизительно 50 мм, так как метилметакрилатные блоки затем
должны быть с помощью зажима установлены в микротом или
477
тиски для резки или распиливания. Для заливки следует
использовать тонкостенные контейнеры, так как они не позволяют
образующемуся при экзотермической полимеризационной
реакции теплу перегревать залитые в смолу кусочки ткани. После
затвердения блоки выравнивают с помощью пилы
(предпочтительнее ленточной) так, чтобы стороны были параллельными и
подходили для зажима микротома.
Получение срезов недекальцинированной кости
Существует два метода получения срезов
недекальцинированной кости, залитой в метакрилат: первый — с помощью
распиливания и шлифования, второй — с помощью микротома. Ни
один из них не идеален. Распиливание и шлифование приводят
к потере многих важных деталей ткани, кроме того,
невозможно отшлифовать срезы толщиной менее 20 мкм без
фрагментации. С помощью микротома нельзя получить срезы
кортикального вещества, за исключением очень маленьких кусочков или
дефицита минералов в кортикальной кости. Кроме того, таким
способом невозможно получить толстые срезы для
микрорадиографии. В связи с этим в случае необходимости проведения
широкого спектра исследований нужно использовать оба метода.
С залитыми в метилметакрилат блоками можно проводить
следующие процедуры: удаление поверхностного метакрилата,
отпиливание одного тонкого слоя и взятие следующего слоя для
шлифования и микрорадиографии. Затем остаток блока может
быть порезан на микротоме. Если тканевый блок очень тонкий и
только один слой материала получен с помощью пилы, то этот
блок можно отшлифовать и использовать для
микрорадиографии, а затем более тонко отшлифовать для окрашивания.
Распиливание образцов
В случае отсутствия специального прибора для шлифования и
резки кости, залитой в метакрилат, адекватные препараты
можно получить с помощью распиливания и шлифования
вручную. Блок хорошо укрепляют в тисках и распиливают
ювелирной пилой, в результате удается получить довольно толстые и
неровные образцы. Путем их осторожного шлифования можно
создать довольно тонкие препараты, которые подходят для
окрашивания и исследования в световом микроскопе.
Более тонкие препараты можно получить с помощью
инструментов, предназначенных для резки металла. Это могут быть
как небольшие приборы, используемые в металлургических
лабораториях, так и индустриальные фрезерные станки. Их
циркулярные ножи с зубчатыми или абразивными режущими
лезвиями, имеют различную толщину, которая увеличивается с
увеличением диаметра ножа. Так, лезвие диаметром 5 см имеет
478
толщину 500 мкм, а лезвие диаметром 10 см — 800 мкм.
Соответственно увеличивается и толщина получаемого среза,
поэтому целесообразнее использовать лезвие как можно меньшего
диаметра. С помощью различных приборов можно получить
срез кости толщиной около 150 мкм, а последующее его
шлифование с целью удаления царапин и шероховатостей позволяет
добиться требуемой толщины среза.
Шлифование образцов
Инструменты, применяемые при шлифовании
металлургических или геологических образцов, могут быть адаптированы для
шлифования образцов кости. Однако в случае заливки в мета-
крилат шлифование с помощью этих инструментов имеет
небольшие преимущества перед ручным шлифованием. Его можно
использовать для шлифования незалитой кортикальной кости.
Для ручного шлифования необходимо твердое стекло
квадратной формы толщиной 20 — 30 мм (основная пластина), меньшая
полоска такого стекла или одна половина чашки Петри,
силиконовый карбидный абразив с частицами размером 60 — 70 мкм,
прибор для измерения толщины.
Стеклянные пластины обрабатывают абразивом таким
образом, чтобы они приобрели шлифующие свойства. Для этого
основную пластину посыпают небольшим количеством абразива,
смачивают водой и с помощью меньшей пластины
циркулярными движениями растирают абразив между стекол до тех пор,
пока они не станут матовыми (манипуляция обычно занимает не
более 1 мин). Затем отмывают с пластины все следы абразива,
помещают между ними образец кости, смачивают 70 % спиртом
и шлифуют круговыми движениями. Время от времени образец
поворачивают и контролируют его толщину с помощью
измерительного прибора. В случае необходимости, если пластины
потеряли свои шлифующие свойства, проводят их повторную
обработку абразивом.
С помощью этого метода можно уменьшить толщину
шлифуемого образца от 150 до 70 мкм в течение нескольких минут.
Срезы хранят сухими, что достигается помещением их между
двумя стеклянными пластинами, скрепленными адгезивной или
эластичной лентой.
Микротомные срезы
Тонкие (менее 20 мкм) срезы минерализованной кости могут
быть приготовлены с помощью очень устойчивого микротома,
прочного и острого ножа. Одним из приборов, который режет
материалы, по плотности схожие с костью, является микротом
<иип§' К.» (фирма «Ке1сЬегЬ>, Германия), снабженный
мотором. Это тяжелый санный микротом, в котором объект движет-
479
ся относительно фиксированного ножа. С помощью мотора,
имеющего редуктор, регулируют скорость движения образца.
Автоматической подачей устанавливают толщину срезов в
пределах от 1 до 30 мкм. В данном микротоме используют тяжелые
прочные ножи, изготовленные из специальной стали
(некоторые из них имеют особо прочные вольфрамово-карбидные
лезвия). Угол наклона ножа составляет приблизительно 45° к
режущей поверхности блока.
Срезы получают по возможности при наиболее низкой
скорости резания. Оптимальная скорость перемещения блока равна
приблизительно 2 мм/с. Для предотвращения сворачивания
срезов (после заливки метилметакрилатом) рекомендуется
перед получением каждого среза наносить на поверхность блока
слой густого целлоидина, который должен слегка подсохнуть.
С этой же целью блок и соприкасающуюся с ним поверхность
ножа смачивают 70 % спиртом. Полученные срезы выравнивают
на поверхности ножа с помощью кисточки и затем переносят в
разбавленный спирт, в котором их можно хранить. Для
растворения целлоидина, покрывающего поверхность срезов, их
переносят в смесь 100 % спирта и эфира (2:1). Эта смесь также
способствует расправлению срезов.
Методы окрашивания срезов
недекальцинированной кости
Расправленные срезы для окрашивания наклеивают на
предметные стекла или помещают непосредственно в раствор
красителя. Предметные стекла перед этим хорошо обезжиривают.
Поверх расправленного среза кладут полоску фильтровальной
бумаги и второе предметное стекло, на которое устанавливают
груз, или сжимают стекла зажимом и помещают на ночь в
термостат при 37— 40 °С. В результате этого срез плотно
приклеивается к поверхности стекла.
Некоторые исследователи после прикрепления срезов
недекальцинированной кости к стеклу перед их окраской удаляют
или размягчают заливочную среду. Полимеризованный метил-
метакрилат удаляют путем погружения срезов в мономер метил-
метакрилата, который растворяет пластмассу. Обычно срезы
выдерживают в трех порциях мономера метилметакрилата по
20 — 30 мин в каждой. Затем препараты помещают в две смены
бензола на 10 мин в каждую.
Однако опыт показывает, что при заливке кости в метилме-
такрилат велик риск потери срезов, поэтому их лучше
окрашивать свободно плавающими на поверхности жидкости в
небольших сосудах (плошках, блюдцах).
Срезы, монтируемые на стекло неокрашенными, могут быть
использованы для изучения в поляризационном свете с целью
исследования внутрикостных пучков коллагена. Окрашивание
480
срезов недекальцинированной кости обычно занимает больше
времени, чем окрашивание парафиновых срезов. Необходим
определенный опыт в адаптации различных методов окраски депа-
рафинированных или целлоидиновых срезов при окрашивании
недекальцинированных препаратов.
Полимеризованный метилметакрилат растворяется во многих
органических растворителях, поэтому обезвоживание и
просветление срезов необходимо проводить с осторожностью. Срезы
обезвоживают, проводя через батарею спиртов. Для просветления
обычно используют изопропанол, затем срезы переносят в ксилол
и заключают в бальзам или синтетическую смолу.
Для приготовления обзорных препаратов недекальциниро-
ванные срезы лучше окрашивать гематоксилином и эозином.
Эта окраска позволяет не только хорошо выявлять ядра клеток
и другие компоненты ткани, но и дифференцировать
минерализованную часть кости и остеоид.
Окраска гематоксилином и эозином по Валлингтону
1. Срезы проводят через дистиллированную воду.
2. Окрашивают в свежеприготовленном гематоксилине Коле
60 мин.
3. Промывают в щелочной проточной воде.
4. Окрашивают в 1 % водном растворе эозина 30 мин.
5. Промывают в проточной воде.
6. Обезвоживают, просветляют и наклеивают на предметные
стекла.
Результат: остеоидная ткань розовая; минерализованная кость
темно-красная или коричневая, ядра клеток голубые или синие.
Окраска солохромом цианина
Этот метод используют как дифференцирующее окрашивание для
демонстрации остеоид а и его связи с минерализованной костью.
Некоторые авторы используют 1 % раствор красителя в 2 %
растворе уксусной кислоты. Чаще применяют следующий метод
окраски: готовят раствор солохрома цианина К (1 г) в
концентрированной сернистой кислоте (2,5 мл). Смесь хорошо перемешивают
до консистенции кашицы, добавляют 500 мл 0,5 % водного
раствора железоаммонийных квасцов, размешивают и фильтруют.
Методика окраски
1. Срезы проводят через дистиллированную воду.
2. Окрашивают в растворе солохрома цианина 60 мин.
3. Дифференцируют в теплой щелочной проточной воде до
тех пор, пока минерализованные поля не станут голубыми, а
другие поля — светло-красными (под микроскопическим кон-
481
тролем, так как в случаях передержки в дифференцирующем
растворе весь срез станет голубым).
4. Обезвоживают, просветляют, наклеивают на предметные
стекла.
Результат: минерализованная кость светло-голубая; фронт
кальцификации темно-синий; остеоид светлый
красно-оранжевый; ядра голубые.
Окраска костного минерала
Классическим методом выявления кальция и других солей в
тканях служит метод Косса. Костный минерал становится
черным вследствие отложения серебра, а остеоид остается
восприимчивым к контрастному окрашиванию.
Методика окраски
1. Срезы проводят через дистиллированную воду.
2. Помещают в 1 % водный раствор нитрата серебра и
освещают с помощью сильного источника света 10 — 60 мин.
3. Промывают в 3 сменах дистиллированной воды.
4. Обрабатывают 2,5 % раствором тиосульфата натрия 5 мин.
5. Хорошо промывают в дистиллированной воде.
6. Окрашивают для создания контраста 1 % раствором
сафранина О или пикрофуксином Ван-Гизона.
7. Обезвоживают, просветляют, заключают в бальзам или
синтетическую смолу.
Результат: минерализованная кость темная,
коричнево-черная в виде грубых гранул; остеоид красный.
Для освещения срезов лучше использовать длинноволновый
ультрафиолетовый, например солнечный, свет или свет от квар-
цево-галогеновой лампы — реакция проходит быстрее.
Оптимальную продолжительность светового воздействия
устанавливают макроскопически по почернению образцов.
Ускоренный метод приготовления препаратов
недекальцинированной кости, залитой
в метилметакрилат по Меллечу
Важным преимуществом этого метода является значительное
уменьшение времени, необходимого для приготовления
препаратов: недекальцинированные срезы кости можно получить в
течение 16 — 20 ч (при использовании общепринятой техники
для изготовления срезов необходимо от 1 до 4 нед). Эффект
достигается за счет электромагнитного микроволнового
излучения, благодаря применению которого значительно уменьшается
продолжительность фиксации и обезвоживания костной ткани,
заливки материала в пластмассу, приклеивания срезов к стеклу
и их окрашивания.
482
Фиксация. Кусочки костной ткани размером
приблизительно 0,5 — 3 см помещают в сосуд, наполненный 4000 мл 100 %
спирта при -10 °С. Костные образцы в подвешенном состоянии
должны располагаться в жидкости как можно глубже, но
расстояние до дна сосуда должно^составлять не менее 1 см. Сосуд
помещают на 10 мин в микроволновую печь при мощности
излучения 600 Вт. Воздействие проводят повторно, если размеры
кусочков костной ткани превышают приведенные выше.
Обезвоживание. Фиксированные костные образцы
переносят в сосуд, содержащий 1800 мл 100 % спирта при 20 °С. Затем
сосуд помещают на 20 мин в микроволновую печь при мощности
получения 24 Вт. После этого кусочки костной ткани
перекладывают в другой сосуд с 1800 мл 100 % этилового спирта и
подвергают обработке в микроволновой печи в том же режиме
(20 мин, мощность излучения 24 Вт). Эту процедуру повторяют
б-кратно, используя каждый раз новый этиловый спирт. Через
1800 мл 100 % спирта может быть проведено не более 25
костных образцов стандартного размера.
Для обезвоживания больших кусочков костной ткани
можно использовать метод высушивания в замороженном
состоянии. Фиксированные кусочки помещают в лиофилизируемую
колбу, содержащую 300 мл 100 % спирта при -5 °С.
Продолжительность высушивания в замороженном состоянии 1 — 1,5 ч
при начальной температуре -50 °С и давлении в камере от 400
до 1000 мм рт. ст.
Заливка материала в пластмассу. Фиксированные и
обезвоженные кусочки костной ткани помещают в сосуд, содержащий
500 мл равных частей 100 % спирта и метилметакрилата. В
течение 45 мин содержимое сосуда активно перемешивают с
помощью магнитной мешалки. Затем костные образцы переносят в
другой сосуд с 500 мл чистого мономера метилметакрилата,
который помещают на 5 мин в микроволновую печь при мощности
излучения 24 Вт. Эту процедуру повторяют 2 раза, перемещая
кусочки в новую порцию чистого метилметакрилата (500 мл).
Температура метилметакрилата вблизи костных образцов к
моменту окончания 5-минутного воздействия электромагнитных
микроволн не должна превышать 36 °С. На следующем этапе
костные образцы помещают в сосуд с 10—15 мл полимеризую-
щегося раствора, состоящего из 500 мл мономера
метилметакрилата, 15 мг безводной перекиси бензоила и 125 мл пластоида и
выдерживают в холодильнике до 8 ч. За это время происходит
их оптимальное пропитывание полимеризующимся раствором.
Затем кусочки костной ткани кладут в маленькие стеклянные
пузырьки, наполненные 10—15 мл полимеризующегося
раствора. Эти пузырьки помещают в водяную баню при 48 — 50 °С.
Процесс полимеризации при повышенной температуре
значительно ускоряется. Полностью завершается полимеризация
пластмассы за 4 — 8 ч. Затем стеклянные пузырьки переносят на
483
5 мин в холодильник, разбивают и получают пластмассовые
блоки, содержащие фиксированный и обезвоженный материал
недекальцинированной костной ткани.
Приклеивание срезов к предметным стеклам. Для
получения срезов недекальцинированнсщ кости, залитой в пластмассу,
необходимо использовать тяжелый микротом <^ип§ К.»,
снабженный специальными сверхпрочными ножами с вольфрамово-
карбидными лезвиями. Полученные срезы помещают на
предметные стекла, покрытые желатином. Добавление одной или
нескольких капель 70 % спирта или бутоксиэтанола способствует
лучшему расправлению срезов на стекле. Затем к предметным
стеклам с находящимися на них срезами с помощью полосок
клейкой ленты прикрепляют маленькие (4 х 2,5 см) кусочки
полиэтилена. В таком виде накладывают друг на друга 2 — 6
предметных стекол и осторожно зажимают в маленьких тисках
для удаления пузырьков воздуха, которые могут оставаться
между залитыми в пластмассу срезами и предметным стеклом.
Зажатые в тисках предметные стекла помещают в термостат при
36 °С на 30 — 60 мин, затем на 2 — 3 мин на холод, после чего
стекла со срезами вынимают из тисков. Если между
предметными стеклами и покрывающими их кусочками полиэтилена
определяются остатки жидкости, то стекла переносят в
микроволновую печь на 3 мин при мощности излучения 480 Вт.
Удаление пластмассы. С предметных стекол снимают
полиэтиленовую пленку и приступают к растворению пластмассы,
что необходимо для обеспечения оптимального окрашивания
срезов костной ткани. Стекла помещают в баночки для окраски,
содержащие 2-метоксиэтилацетат. Растворение пластмассы
ускоряет обработка в микроволновой печи в течение 15 с при
мощности излучения 600 Вт. Эту процедуру повторяют 3 раза,
причем каждый раз предметные стекла обрабатывают в новой
баночке со свежим 2-метоксиэтилацетатом.
Окрашивание срезов. Перед окрашиванием предметные
стекла со срезами обрабатывают в 3 сменах (по 2 — 3 мин в
каждой) 100 % спирта при комнатной температуре.
Предпочтительнее трехцветная окраска по Массону —Гольднеру, позволяющая
дифференцировать остеоидную и кальцифицированную части
костной ткани, а также хорошо выявляющая различные детали
клеток. Продолжительность окрашивания срезов можно
значительно уменьшить путем обработки помещенных в красящие
растворы срезов электромагнитными микроволнами.
Окрашивание проводят при комнатной температуре.
Методика окраски
1. Срезы окрашивают гематоксилином Вейгерта 10 с.
2. Ополаскивают в 100 % спирте.
3. Ополаскивают в дистиллированной воде.
484
4. Дифференцируют в 1 % водном растворе соляной кислоты.
5. Промывают в проточной воде (4 раза).
6. Обрабатывают предметные стекла со срезами в баночках с
проточной водой при комнатной температуре в микроволновой
печи в течение 20 с при мощности излучения 600 Вт.
7. Промывают в дистиллированной воде.
8. Погружают в 1 % раствор ледяной уксусной кислоты.
9. Обрабатывают срезы в растворе ксилиденового пунцового
при комнатной температуре в микроволновой печи в течение
20 с при мощности излучения 600 Вт.
10. Промывают в дистиллированной воде.
11. Погружают в 1 % раствор ледяной уксусной кислоты.
12. Дифференцируют в 5 % растворе фосфорно-молибдено-
вой кислоты до тех пор, пока не исчезнет пунцово-красная
окраска трабекулярной кости (2 — 5 мин).
13. Ополаскивают в дистиллированной воде.
14. Погружают в 1 % раствор ледяной уксусной кислоты.
15. Обрабатывают в микроволновой печи в растворе
анилинового голубого при комнатной температуре в течение 6 —8 с
при мощности излучения 600 Вт.
16. Отмывают срезы от анилинового голубого в 1 % растворе
ледяной уксусной кислоты.
17. Обезвоживают в 100 % спирте (3 смены по 1 мин).
18. Ополаскивают в 3 сменах ксилола (в каждой по 1 мин).
19. Заключают срезы в бальзам или синтетическую смолу.
Метод окраски недекальцинированных срезов
обызвествленного хряща по Аарону
Изучение процессов энхондрального обызвествления и оссифи-
кации представляет значительный интерес в биологии развития
и роста, а также при заживлении переломов. Гистологическое
исследование кальцинирующегося хряща при энхондральном
формировании костной ткани обычно не проводят в связи с
методическими трудностями, включающими подбор заливочной
среды для резки довольно твердой ткани и красителей,
позволяющих окрашивать обызвествленный и необызвествленный хрящ
при одновременном выявлении деталей клеток. С помощью
предлагаемого метода удается получить относительно тонкие и
окрашенные срезы обызвествленной ткани с хорошо
сохранившимися гистологическими деталями хондроцитов.
Фиксация, заливка, окрашивание. 1. Образцы фиксируют
в 10 % формальдегиде, приготовленном на 0,1 М какодилате
натрия при рН 7,2 в течение 24 ч при 4 °С.
2. Обезвоживают в спирте возрастающих концентраций (30 %,
70 %, 85 % и двух сменах 100 % спирта) по 1 ч в каждой.
3. Помещают в смесь 100 % спирта и целлозольва (этоксиэта-
нола) в соотношении 1:1 на 1 ч и затем в целлозольв на ночь.
485
4. Переносят в свежеприготовленный метилметакрилат,
содержащий 15 % дибутилфталата и 2,5 % перекиси бензоила, и
помещают в вакуум при комнатной температуре на 30 мин
(процесс повторяют 3 раза).
5. Оставляют на ночь при 4 °С.
6. Помещают в частично полимеризованный
метилметакрилат при 4 °С на 24 ч, а затем оставляют полимеризоваться при
комнатной температуре в течение 2 дней.
Частично полимеризованный метилметакрилат готовят
следующим образом. Свежеприготовленную заливочную среду
частично полимеризуют при нагревании до 85 — 90 °С и постоянном
помешивании. Когда появляются маленькие пузырьки, которые
не вызваны помешиванием, смолу помещают в холодную воду,
снижая температуру до 40 — 45 °С. Процесс повторяют до тех
пор, пока вязкость метилметакрилата немного увеличится.
Срезы обызвествленного хряща получают на тяжелом
микротоме <^ип§ К.» с помощью вольфрамово-карбидных ножей,
режущую поверхность которых смачивают 40 % спиртом.
Обычно получают срезы толщиной 5 мкм. Срезы в 95 % спирте
помещают на предметные стекла, которые предварительно
обрабатывают 0,4 % желатином и придавливают грузом. Весь процесс
занимает б дней.
Методика окраски
1. Срезы помещают в целлозольв при 60 °С для удаления
метилметакрилата .
2. Проводят через 80 % и 40 % спирты, а затем через
дистиллированную воду.
3. Помещают в 5 % раствор нитрата серебра на 30 мин в
темноте.
4. Тщательно промывают в дистиллированной воде и
переносят в раствор формол-карбората для редуцирования нитрата
серебра на 2 мин.
5. Промывают в проточной воде 10 мин.
6. Окрашивают гематоксилином 3 — 5 мин.
7. Промывают в проточной воде.
8. Окрашивают 0,2 % сафранином О при 50 °С 45 с.
9. Промывают в дистиллированной воде.
10. Переносят в 0,5 % раствор уксусной кислоты на 10— 15 с.
11. Промывают в дистиллированной воде, при этом
сафранин О-позитивный материал должен быть слегка перекрашен.
12. Контрастируют 0,2 % раствором прочного зеленого 10 —
15 мин.
13. Промывают в дистиллированной воде.
14. Обезвоживают, просветляют и заключают в бальзам.
Результат: ядра интенсивно-голубые; хрящевой матрикс,
содержащий кислые гликозаминогликаны, окрашивается саф-
486
ранином О в оранжевый цвет; недекальцинированный остеоид-
ный матрикс зеленый, а кальцинированный хрящ и кость
черные.
Приготовление недекальцинированных срезов кости
и имплантированных в нее биоматериалов по Стефлику
Методика позволяет оценить взаимоотношение
имплантируемых биоматериалов, в том числе алюмоксидной керамики, с
костной тканью. С помощью этого метода можно приготовить
тканевый блок, состоящий из кости с имплантированным
материалом и прилегающими мягкими тканями, и получить
относительно тонкие гистологические срезы.
1. Костный фрагмент, содержащий имплантат, получают с
помощью пилы из секционного набора.
2. Тканевый блок фиксируют в 10 % растворе нейтрального
формалина не менее 24 ч; объем формалина должен превышать
объем образца не менее чем в 10 раз.
3. Блок подравнивают пилой, имеющей алмазное напыление,
с целью удаления излишнего объема ткани для лучшего
пропитывания образца дегидратирующими жидкостями и метилмета-
крилатом.
4. Обезвоживают в 70 %, 90 % и 2 сменах 100 % спирта по 24 ч
в каждой.
5. Обезвоживают в абсолютном ацетоне в вакуумном
сушильном шкафу 24 ч.
6. Выдерживают в смеси ацетона и мономера метилметакри-
лата (1:1) в вакуумном сушильном шкафу 24 ч.
7. Выдерживают в чистом мономере метилметакрилата под
вакуумом 24 ч.
8. Выдерживают в полуполимеризованном полиметилмета-
крилате в холодильнике 24 ч.
9. Выдерживают в свежей порции полуполимеризованного
полиметилметакрилата при 37 °С в течение 3 — 5 сут; для
предотвращения образования пузырьков воздуха необходимо
соблюдать строгий температурный режим (37 °С), а при малейшем
сжатии образца добавлять необходимое количество заливочной
среды.
10. Образцы разрезают на фрезерном станке, а затем
подравнивают блоки с помощью ручной зубоврачебной машины.
И. Получают срезы толщиной 100—130 мкм с помощью
циркулярной низкоскоростной пилы с лезвием, имеющим алмазное
напыление.
12. Окрашивают парагоном 1301 в течение 2 — 6 мин.
Краситель нагревают до 50 °С на горячей пластине в 40-миллилитро-
вой колбе, и срезы погружают в теплый краситель до получения
желаемого окрашивания. Затем срезы промывают в двух сменах
дистиллированной воды, обезвоживают в 95 % спирте и двух
487
сменах 100 % спирта, проводят через две смены ксилола и
заключают в бальзам.
Полуполимеризованный полиметилметакрилат готовят
следующим образом: 250 мл мономера метилметакрилата
смешивают с 2,5 г перекиси бензоила, к этому раствору, который
постоянно размешивают магнитной мешалкой, при 25 °С добавляют
по 10 г полиметилметакрилата в гранулах за 1 ч (всего 100 г).
Вся процедура занимает приблизительно 10—15 ч, а
получаемый раствор должен быть прозрачным и не содержать
преципитаты.
Приготовление криостатных срезов
недекальцинированной кости по Хиллу
Полученные с помощью этого метода срезы
недекальцинированной кости можно применять не только для окраски
общепринятыми способами, но и для гистохимических и иммуноцитохими-
ческих исследований, а также для визуализации
флюоресцентной метки. Описываемая техника приготовления недекальцини-
рованных срезов кости является модификацией метода Аарона
и включает перфузию полимера поливинилпирролидона (ПВП)
в исследуемый образец с целью сохранения целости
недекальцинированной кости во время получения криостатных срезов.
Метод рекомендуется использовать для получения криостатных
срезов недекальцинированной кости у экспериментальных
животных.
1. Анестезированным животным (крысам) транскардиально
проводят перфузию 250 мл холодного изотонического раствора
хлорида натрия с последующей перфузией 750 мл фиксатора,
состоящего из 2,5 % параформальдегида и 15 % пикриновой
кислоты в 0,1 М фосфатном буфере (рН 7,3) в течение 10 —
20 мин.
2. Животному перфузируют 100 — 200 мл 10 % раствора ПВП
в 0,1 М фосфатном буфере (рН 7,3) с 5 % сахарозой (10 %
раствор ПВП состоит из смеси 25 % ПВП-10 и 25 % ПВП-360 в
дистиллированной воде).
3. У животных извлекают неповрежденный костный
материал с окружающими мягкими тканями и помещают в забуферен-
ный ПВП с сахарозой при 4 °С на 1 —14 сут.
4. Костный материал подравнивают, полученные блоки
заливаются в трагант.
5. Блоки для частичного замораживания опускают в жидкий
азот, а затем погружают в измельченный сухой лед до полного
замораживания.
6. Переносят в криостат, снабженный мотором с редуктором,
при -24 °С за 20 мин до начала резания.
7. С помощью микротомного ножа типа С готовят срезы
толщиной 5 — 30 мкм. Резание образца с наименьшей скоростью
488
обычно позволяет получить срезы лучшего качества. Перед
получением срезов к поверхности блока прикладывают
кусочек бумаги, предварительно погруженной в ПВП (смесь 25 %
ПВП-10 и 25 % ПВП-360 в дистиллированной воде),
разведенный водой в соотношении 1:2, выравнивают его холодной
стеклянной палочкой и приступают к резанию блока.
8. Получаемые срезы помещают тканевой стороной вниз на
холодные стекла (температура криостата), покрытые адгезивом
и желатином, и прижимают их к стеклу стеклянной палочкой.
9. Стекла с образцами подвергают оттаиванию на теплых
пластинах (27 — 32 °С) до тех пор, пока они полностью не
подсохнут.
Стекла хранят при -20 °С в плотно закрытых стеклянных
коробках; в коробку с образцами, предназначенными для имму-
ногистохимических исследований, дополнительно помещают
высушивающее вещество. Полученные срезы могут быть
использованы для окрашивания любым методом. Перед
окрашиванием бумагу и ПВП размачивают дистиллированной водой
(обычные окраски) или фосфатным буфером (ферментная
гистохимия или иммуногистохимия) в течение 5 — 30 мин при
комнатной температуре.
Микрорентгенография (гисторентгенография)
недекальцинированных срезов кости
Метод применяют для изучения плотности костного минерала и
его расположения при определении степени кальцификации на
различных этапах остеогенеза и при различных патологических
состояниях кости. Метод основан на том, что рентгеновское
излучение по-разному поглощается различными веществами. При
микрорентгенографии используют мягкое монохроматическое
рентгеновское излучение.
Недекальцинированную кость заливают в метилметакрилат и
изготавливают среды толщиной 70 мкм. При большей толщине
срезов изображение бывает смазанным, более тонкие срезы
становятся слишком прозрачными для рентгеновского излучения.
Полученные гисторентгенограммы можно оценивать не только
визуально, но и денситометрически, т.е. возможна
количественная оценка плотности различных участков.
Исследование срезов недекальцинированной
костной ткани с использованием флюоресцирующих
антибиотиков
Гистологическое исследование недекальцинированных срезов
кости позволяет дифференцировать остеомаляцию и остеопо-
роз. Однако избыточное накопление остеоида (гиперостеоидоз)
может быть следствием уменьшения скорости минерализации
489
остеоида (остеомаляция) или его ускоренного синтеза. Оба типа
гиперостеоидоза при обычной окраске недекальцинированных
срезов создают одинаковую картину. Эти формы можно
различить лишь при измерении кинетики минерализации костной
ткани.
Скорость синтеза костного матрикса может быть
количественно измерена на гистологических срезах. Для этого
используют флюоресцирующий антибиотик тетрациклин, поглощаемый
т у1уо отложениями минералов в незрелой кости — остеоиде,
при этом выявляется пласт минерализуемой ткани (фронт каль-
цификации). Двукратное, разделенное во времени, введение
тетрациклина вызывает появление двух параллельных
флюоресцирующих полос (меток) на участках минерализации кости.
В отличие от статических параметров, отражающих
процессы ремоделирования костной ткани только в момент проведения
биопсии, динамические параметры, полученные на
недекальцинированных срезах с помощью двойной тетрациклиновой
метки, позволяют производить прямые измерения скорости
минерализации костной ткани в период между двумя курсами
введения тетрациклина.
С целью получения максимальной флюоресценции костную
ткань фиксируют в спирте (максимальное разведение — 70 %) и
без декальцинации заливают в синтетическую смолу (метилме-
такрилат). Срезы монтируют на предметные стекла
неокрашенными и изучают в люминесцентном микроскопе при
ультрафиолетовом излучении с длиной волны приблизительно 400 нм.
ОСОБЕННОСТИ РАБОТЫ С ТКАНЬЮ ЗУБОВ
Поскольку основная масса зуба состоит из очень плотного
материала, продолжительность обработки ткани зубов на всех
этапах увеличивается. Это особенно важно учитывать при заливке
материала в синтетические смолы или нитроцеллюлозу.
Обработка ткани зубов в основном схожа с обработкой
костной ткани. После фиксации и декальцинации для получения
тонких срезов можно использовать заливку в парафин или
двойную целлоидин-парафиновую заливку. Заливку в
нитроцеллюлозу применяют для изучения зуба или зубов т зИи
внутри кости. Для выявления элементов нервной ткани используют
замороженные срезы декальцинированных зубов и дентального
материала. Недекальцинированные срезы применяют при
исследовании минеральных компонентов зуба.
Зубы обычно фиксируют в растворе нейтрального
формалина: зубы взрослых до 4 сут, зубы детей 24 ч.
В качестве декальцинатора рекомендуют применять 5 %
трихлоруксусную кислоту, хотя могут быть использованы и
другие декальцинирующие жидкости. Наиболее эффективным
490
методом оценки завершенности декальцинации является
рентгенологический.
Методика получения срезов зубов и способы их окрашивания
такие же, как и применяемые при исследовании костной ткани.
АРТЕФАКТЫ, ВОЗНИКАЮЩИЕ ПРИ ИЗГОТОВЛЕНИИ
ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ КОСТИ
При исследовании кости и хряща необходимо знать артефакты,
с которыми можно встретиться, изучая гистологические
препараты этих тканей.
1. Качество гистологических препаратов кости зависит
прежде всего от качества фиксации исходного материала. Формалин
или любой другой фиксатор должен полностью зафиксировать
коллаген костной ткани. Если этого не происходит, то
неизбежно возникновение артефакта — гомогенизации структуры кости
и затушеванности ее фибриллярной основы, вызванных
разбуханием при декальцинации и дальнейшей обработке
препаратов.
2. В гаверсовых каналах (каналы остеона) компактной кости
и костномозговых пространствах губчатой кости часто
обнаруживаются мелкие крошковидные костные фрагменты
неправильной формы с неровными очертаниями (своего рода
«костная крошка»). Фрагменты располагаются хаотично, какая-либо
видимая реакция окружающих тканей отсутствует. Это —
костные опилки, которые образуются при выпиливании выбранного
для исследования кусочка и вдавливаются в него. Если
исследуемый препарат кости содержит хрящ (суставной, реберный,
элементы хрящевой ростковой пластинки), то среди костных
опилок можно встретить и хрящевые элементы. Иногда в
глубину костных структур заносятся обрывки соединительной и
мышечной тканей. При выпиливании нужного для исследования
кусочка кости на деревянной дощечке или столе, покрытом
пластиком, помимо костных опилок, в костномозговых
пространствах и гаверсовых каналах можно видеть мельчайшие
опилки пластического материала, а также разволокненные
древесные опилки.
Избежать этого артефакта можно, используя пилу с зубцами
небольшого размера, специальные пилы по металлу и пилки
для лобзика по металлу, которые меньше повреждают кость при
распиливании и дают меньшее количество опилок. Для
окончательного устранения этого артефакта необходимо подрезать
поверхность костного кусочка после декальцинации, уменьшая его
толщину с опиленных сторон как минимум на 1 — 2 мм (см.
раздел «Подрезание декальцинированного материала»).
3. При слишком длительном пребывании исследуемого
костного кусочка в декальцинирующей жидкости (обычно в кисло-
491
те) ядра клеток, в частности остеоцитов, могут плохо
воспринимать краситель. В этих случаях вместо остеоцитов видны лишь
пустоты, в которых они помещались. Встретившись с этим
явлением, необходимо установить причину слабой окраски или ее
полного отсутствия. Ядра остеоцитов могут подвергаться
прижизненному растворению, в то же время отсутствие окраски
может быть следствием слишком длительной декальцинации.
Свидетельством последней (передекальцинации) является
плохая окрашиваемость ядер остеоцитов и ядер других клеток:
жирового и кроветворного костного мозга, сосудов,
соединительной ткани. Если ядра клеток перечисленных тканей
окрашиваются хорошо, а ядра остеоцитов слабо или совсем не
окрашиваются, следует думать о прижизненном некрозе остеоцитов. При
этом необходимо помнить, что у лиц пожилого возраста часто в
отсутствие патологического процесса и каких-либо видимых
причин в кортикальном слое кости встречаются участки,
лишенные остеоцитов. Обычно они располагаются в интерстициаль-
ных пластинах, находящихся между остеонами кортикального
слоя [Виноградова Т.П., 1964]. При слишком длительной
декальцинации костная ткань лучше окрашивается железным
гематоксилином. Если гистологический препарат кости,
окрашенный обычным гематоксилином (гематоксилином Эрлиха),
непригоден для исследования, а другого препарата нет, то можно
обесцветить его 1 % солянокислым спиртом, хорошо промыть
обычной водой, а затем вновь окрасить уже железным
гематоксилином.
Избежать появления этого артефакта можно, только зная
длительность декальцинации, которая при наиболее
распространенной методике (12—15 % раствор азотной кислоты)
зависит главным образом от величины костного кусочка и типа
строения кости (губчатая, компактная, резко уплотненная, так
называемая слоновая кость при некоторых видах остеогенной
саркомы). Оптимальная продолжительность декальцинации,
достаточная для резки препарата без риска испортить
микротомный нож или получить очень толстые срезы и в то же время
столь небольшая, чтобы не передекальцинировать материал, в
конечном счете определяется практическими навыками. К
сожалению, не существует точно установленных правил, можно
лишь привести некоторые общие рекомендации:
а) для исследования нельзя использовать крупные кусочки
кости. В случае необходимости изготовления гистотопограммы
больших размеров лучше разделить препарат на несколько
частей, после чего смонтировать его на одном стекле или
пронумеровать отдельные препараты меньших размеров;
б) декальцинирующую жидкость следует брать в количестве,
в 50 раз превышающем объем обрабатываемого кусочка.
Равномерное пропитывание препарата кислотой достигается
подвешиванием его на нитке, прикрепленной к краю банки;
492
в) необходимо тщательно следить за процессом
декальцинации, в случае необходимости проверяя ее полноту несколько
раз. Губчатая кость может быть декальцинирована в среднем за
1—3 сут, компактная — за 3 — 5 сут, при обязательном
ежедневном контроле и частой смене декальцинирующей жидкости;
г) необходимо любыми средствами избегать длительного
воздействия кислоты на тканевые структуры, так как при этом
ядра клеток теряют способность воспринимать основные
красители, а промежуточное вещество кости и хряща изменяет свои
тинкториальные свойства;
д) нельзя исключать из арсенала методов, уменьшающих
риск передекальцинации, промежуточное подрезание, стараясь
моделировать препарат таким образом, чтобы он был как можно
тоньше. Например, препарат головки бедренной кости должен
быть толщиной не более 0,5 см;
в) не следует пытаться искусственно ускорять процесс
декальцинации, например подогревая раствор кислоты. Опыт
показывает, что это не только не приводит к желаемой цели, но
также служит причиной неравномерной декальцинации костной
ткани, следствием чего является другой артефакт.
4. Довольно часто в костных препаратах, подвергшихся
декальцинации, встречаются единичные или множественные
шаровидные базофильные образования, рассеянные без какого-
либо порядка. Их можно видеть в костных структурах,
костномозговых пространствах, сосудистых каналах. Эти
образования, вероятно, появляются вследствие неравномерно
проходящего процесса декальцинации. Об этом свидетельствует тот
факт, что особенно часто (почти регулярно) эти образования
портят хорошие в других отношениях гистологические
препараты после попытки ускорить процесс декальцинации. Один из
общедоступных способов ускорения декальцинации,
используемый в некоторых лабораториях,— помещение сосуда с
раствором кислоты в термостат. Указанный способ является «грубым»
и явно недопустимым, так как заведомо вызывает
неравномерную декальцинацию препарата.
5. В гистологических препаратах даже небольшого кусочка
губчатой кости часто выявляют выраженную базофильную
окраску и отсутствие четкой структуры части костных балок. Ба-
зофилия всех костных балок часто встречается при изучении
препаратов из материала трепанобиопсий, при наличии
незамеченных крошковидных костных включений, когда материал не
подвергался декальцинации и тем не менее из него были
приготовлены срезы. Гораздо чаще этот артефакт встречается при
неполной или несовершенной декальцинации (в глубине
препарата), когда отдельные костные балки или часть одной и той же
балки выглядят плотными и базофильными, т.е. декальциниро-
ваны не полностью. Описываемый артефакт в отличие от уже
перечисленных «опасен», так как, встретив его в первый раз,
493
недостаточно опытный исследователь может ошибиться, приняв
плотные базофильные костные балки за проявление атипизма
формирования костных структур. Уродливые базофильные
костные структуры, как правило, встречаются в
злокачественных опухолях костей, в том числе в остеосаркомах. Опасность
ошибки такого рода особенно велика, если учесть, что артефакт
часто встречается при исследовании материала трепанобиопсий.
При малейших сомнениях относительно содержания костных
включений в материале, подлежащем гистологическому
исследованию, его необходимо поместить на 1 — 2 ч в стандартный
раствор азотной кислоты. Помимо этого, всегда следует добиваться
полной и равномерной декальцинации исследуемого материала.
6. При подсыхании мелких кусочков губчатой кости или мяг-
котканных кусочков, содержащих костные включения (до
фиксации формалином), более плотные волокнистые структуры
жирового костного мозга кажутся приближенными друг к
другу, а более рыхлые, наоборот, разреженными. Этот
артефакт можно обнаружить в препаратах из подсохших или
неправильно фиксированных кусочков губчатой кости, когда
жировой костный мозг выглядит совершенно необычно, в результате
чего часто создается впечатление о наличии в межкостных
пространствах мелких и крупных кист. Предупредить
возникновение этого артефакта просто: сразу же после вырезки следует
фиксировать материал в формалине или любой избранной
фиксирующей жидкости, не допуская его подсыхания. Если
материал доставлен для исследования не сразу после операции или
биопсии и подсох вследствие неправильного хранения, то его
следует до фиксации поместить на несколько часов в 20 %
раствор антиформина (смесь равных количеств 15 — 20 % раствора
хлорной извести и 15 % раствора едкой щелочи) — желтоватую
жидкость с запахом хлора. Раствор антиформина нестоек при
хранении, обладает способностью растворять белки и другие
органические вещества.
КРАТКИЕ СВЕДЕНИЯ О МЕТОДИКЕ «ЧТЕНИЯ»
ГИСТОЛОГИЧЕСКИХ ПРЕПАРАТОВ КОСТИ
В практической работе большинства прозектур больниц и
других лечебных учреждений редко возникает необходимость
приготовления и изучения гистологических препаратов кости. При
этом, как правило, препараты невысокого качества и содержат
множество артефактов, так как почти повсеместно для их
приготовления используют заливку материала в парафин, хотя она
возможна лишь в исключительных случаях и только для очень
маленьких кусочков.
Практически случается так, что препараты кости, имеющие
многочисленные недостатки, пытаются изучать специалисты, не
494
владеющие методикой их «чтения». Создается ситуация, при
которой нет условий для грамотного описания препаратов и тем
более диагностики по ним каких-либо патологических процессов.
Основной гистологический анализ состояния кости и хряща
рекомендуется проводить по препаратам, хорошо окрашенным
гематоксилином и эозином, а также гематоксилином и пикро-
фуксином. При этом имеется в виду заливка образцов в
целлоидин, обеспечивающая лучшее качество препаратов. Для
изучения цитологических деталей и гистохимических особенностей
кости и хряща необходимо использовать маленькие кусочки
ткани, залитые в парафин.
1. В процессе костеобразования условно выделяют четыре
взаимосвязанные стадии: пролиферацию остеоб ластических
клеток, образование коллагеновых волокон, образование
склеивающего их аморфного межуточного вещества, импрегнацию
его минеральными солями. Фазы образования белковой основы
кости и последующего выпадения минеральных солей при
формировании зрелой пластинчатой костной ткани следуют одна за
другой так быстро, что при микроскопическом исследовании по
отдельности не улавливаются. В других условиях, например
при развитии грубоволокнистой кости, коллагенообразование
может значительно опережать процесс минерализации. В
патологических условиях отдельные фазы костеобразования могут
быть отделены друг от друга значительным промежутком
времени. Этот феномен встречается в остеосаркомах, когда в разных
участках одной и той же опухоли можно видеть различные
фазы формирования костного вещества.
Костные структуры могут быть незрелыми и зрелыми.
Незрелые, т.е. примитивные, структуры построены из так
называемой грубоволокнистой, или пучковой [Русаков А.В., 1959],
сетчато-волокнистой, параллельно-волокнистой ткани. Обычно
они содержат большое количество остеоцитов, расположенных
беспорядочно, нередко в виде небольших скоплений. Зрелые
костные структуры построены из пластинчатой костной ткани,
остеоцитов в ней немного и располагаются они более
упорядочение.
2. При оценке состояния исследуемой компактной
кортикальной кости обращают внимание на размеры гаверсовых
каналов. Они могут быть увеличены вследствие рассасывания
костной ткани или уменьшены в результате напластования
новых масс костного вещества на их стенки. Расширение и
сужение гаверсовых каналов нехарактерны для какого-либо
патологического процесса, поэтому их следует оценивать вместе с
деталями строения остеонов и состоянием ткани внутри
каналов. Значительное расширение большого количества
гаверсовых каналов приводит к рарефикации кортикального слоя
кости, т.е. к его спонгизации. Высокая степень рарефикации
характерна для остеопороза. При исследовании губчатой кости от-
495
мечают состояние костных балок: регулярность расположения,
истончение или утолщение. Истончение наблюдается при лити-
ческих процессах различного происхождения, утолщение
происходит при увеличении механической нагрузки на кость, а
также при различных реактивных процессах.
3. Помимо особенностей архитектоники компактного и
губчатого вещества кости, следует обращать внимание на строение
самих костных структур. В норме остеоны зрелой пластинчатой
кости компактного строения расположены упорядоченно.
Каждый остеон отграничен от соседнего линией склеивания, базо-
фильной при окраске гематоксилином и эозином. Она не
содержит коллагеновых волокон и построена из аморфного костного
вещества. Оппозиционные линии склеивания образуются в
периоды временного прекращения отложения костного вещества,
а резорбционные — по границе его рассасывания. При
возобновлении костеобразования новое костное вещество
наслаивается на линии склеивания, при очередном прекращении процесса
появляется новая линия и так далее. Таким образом, костное
вещество одной генерации отделено от вещества следующей
генерации четкой базофильной линией. По рисунку этих линий
можно в известной мере судить о процессе костеобразования в
данной структуре, «читать ее прошлое». Каждый фрагмент этой
мозаики представляет собой костное вещество, образованное в
том или ином возрастном периоде. Рисунок линий склеивания
позволяет судить о происходивших на данном участке
перестройках костных структур. При этом оппозиционные линии
склеивания представляются более или менее ровными (угловатыми
или прямыми), а резорбционные — неровными, зазубренными.
Губчатая кость состоит из костных балок, образующих
единую замкнутую сеть. На отдельных гистологических срезах и в
отдельных препаратах встречаются как бы изолированные, не
соединенные друг с другом балки. Однако при изучении
серийных срезов устанавливают, что такая изолированность балок
лишь кажущаяся. Раздельное расположение костных балок
наблюдается только в патологических условиях, например при
фиброзной дисплазии, и свидетельствует об афункциональном
строении костных структур. Костные балки губчатой кости
обычно неостеонного строения. Только при развитии массивных
балок, например при остеосклерозе, в них могут появляться
отдельные остеоны. Все эти сведения необходимы для правильной
оценки картин, которые можно встретить при регенерации и
трансплантации кости, для того чтобы отличить старые, предсу-
ществовавшие структуры от новообразованных.
4. Термин «костное вещество» практически относится к
межуточному веществу, так как именно оно составляет основную
массу кости. Необызвествленное костное вещество называется
остеоидом. В норме его можно обнаружить лишь в виде узких
зон, окаймляющих стенки гаверсовых каналов или края кост-
496
ных балок. Ширина этих зон не превышает ширины отдельной
пластинки зрелой пластинчатой костной ткани. Наличие
больших масс остеоида всегда свидетельствует о патологии кости.
Оно наблюдается при бурных регенераторных процессах,
развивающихся в кости при ее переломах и патологическом
торможении процесса костеобразования (рахит, остеомалятический
синдром). Остеоид, возникающий при регенерации кости,
содержит много клеток (остеоцитов), при торможении
костеобразования остеоид включает в свой состав всегда намного меньшее
количество клеток, чем в норме. Различия такого рода могут
служить дифференциальными признаками, помогающими при
гистологическом анализе патологического процесса. Следует
иметь в виду, что остеоид — незрелая кость, а не субстанция,
уже бывшая в обызвествленном состоянии, а затем потерявшая
известь. Известковые соли костного вещества никогда не
исчезают из кости сами по себе, без разрушения органической
основы костной субстанции. При нормальном состоянии костной
структуры ее края гладкие, окрашены слегка базофильно,
около нее нет никаких особых клеточных форм, которые можно
было бы рассматривать как камбиальные элементы. С началом
костеобразования или разрушения (рассасывания) кости около
костных структур обнаруживают разное количество пролифери-
рующих клеток, которые принимают участие как в
рассасывании костного вещества, так и в его образовании, поэтому при
гистологическом анализе необходимо изучать состояние
околокостной ткани, ее состав. На основе результатов такого анализа
можно составить суждение о характере патологического
процесса и его направленности.
5. Различают три формы морфологических признаков
рассасывания костных структур: гладкое, остеокластическое (лаку-
нарное) и пазушное рассасывание. В основе всех этих форм, по-
видимому, лежит одно и то же явление — аутолитический
распад костного вещества, однако морфологическое выражение
этого феномена различно, что обусловлено разными темпами и
разной интенсивностью процесса. При гладком рассасывании
наблюдается постепенное исчезновение, «таяние» костных
балок или кортикальной кости. В последнем случае костное
вещество убывает как со стороны гаверсовых каналов, которые
заметно расширяются, так и с периостальной и эндостальной
поверхности кортикального слоя. Наиболее отчетливо этот вид
рассасывания проявляется в костных балках губчатой кости:
они заметно истончаются, иногда неравномерно, около них не
удается выявить ни клеточной реакции, ни усиления
кровоснабжения. Гладкое рассасывание наблюдается в случаях
медленного растворения (разрушения) костного вещества, например при
старческом остеопорозе.
Остеокластическое (лакунарное) рассасывание выражается
появлением около костных структур крупных многоядерных
497
клеток — остеокластов, которые обычно находятся в мелких
или глубоких выемках (лакунах) по краям костных балок или
компактной кости кортикального слоя.
Пазушное рассасывание выражается в массивном аутолизе
костного вещества, которое на ограниченном участке
превращается в плазмоподобную жидкостъ («жидкую кость»). Очертания
костных структур в первое время остаются прежними, так как
разжиженное костное вещество удерживается на прежнем месте
листком эндоста. Затем в пазухи проникают эритроциты и клетки
костномозговых пространств, около пазух появляются
остеокласты, содержимое пазух поступает в окружающие тканевые щели, а
отсюда в сосуды. Пазушное рассасывание обычно наблюдается
при процессах интенсивного растворения (разрушения) костного
вещества, происходящих быстро и захватывающих обширные
зоны костных структур, например при воспалительных
процессах и по периферии злокачественных опухолей костей.
При рассасывании костных структур наиболее медленно
протекающий процесс — гладкая резорбция, самый быстрый —
пазушное рассасывание, остеокластическое (лакунарное)
рассасывание занимает как бы промежуточное положение между ними.
При анализе разрушения костных структур следует
обращать внимание на то обстоятельство, что резорбции легко
подвергается лишь обызвествленное костное вещество. Массы ос-
теоида, как правило, не подвергаются рассасыванию, однако с
началом минерализации сразу появляются признаки резорбции.
Обменная функция костей осуществляется в значительной
степени посредством частичного или полного рассасывания
костного вещества (той или иной структуры) и образования его
новых порций, т.е. посредством перестройки. Рассасывание и
новообразование костного вещества — явления, казалось бы,
прямо противоположные — протекают одновременно и
направлены к одной цели — моделированию архитектоники кости и
являются, таким образом единым процессом. Усиленная
перестройка костных структур может составлять основную черту
патологического процесса, например при паратиреоидной остеоди-
строфии, в других случаях она сопровождает различные
местные патологические процессы (воспалительные, опухолевые) и
не имеет самостоятельного значения в диагностике.
6. При изучении операционного и биопсийного материала, а
также материала, взятого для гистологического исследования во
время вскрытия, следует помнить, что в препарате можно
обнаружить три вида костной ткани: 1) предсуществующую (предсуще-
ствовавшую) функциональную ткань компактного или губчатого
строения, обычно зрелого пластинчатого характера; 2) ткань,
характеризующую патологический процесс, обычно опухолевого
характера; 3) реактивные костные структуры.
Общий признак опухолевой костной ткани — это атипизм ее
структуры и архитектоники. Атипизм может заключаться в при-
498
митивности строения: отсутствии зрелого костного вещества,
нерегулярности его обызвествления, наличии неравномерно,
беспорядочно расположенных остеоидных скоплений и зон по
краям примитивных костных балок, нерегулярности и узости
сосудистых каналов. Архитектоника опухолевых костных
структур беспорядочна, т.е. не имеет функционального
характера. Костное вещество опухолевого происхождения имеет
патологический характер, фазы костеобразования в нем могут быть
отделены друг от друга значительным промежутком времени,
что создает причудливые картины, не имеющие аналога при
нормальном костеобразовании.
Реактивные костные структуры обычно представляют собой
незрелые пучковые или тонковолокнистые балочки, лежащие
изолированно или образующие нерегулярную сеть. Выраженное
реактивное костеобразование наблюдается прежде всего при
травматических воздействиях на кость, в частности при макро-
и микропереломах. Следует помнить, что переломы могут
возникать и на почве деструкции кости опухолью. При этом
костеобразование может носить характер костной или
костно-хрящевой мозоли. Знание элементов костно-хрящевой мозоли имеет
не только диагностическое значение. Любому специалисту,
изучающему кости, необходим минимум сведений о
морфологических проявлениях процесса репаративной регенерации кости для
правильной оценки результатов исследований, проводимых на
экспериментальных животных.
7. Помимо хрящевой ткани, относящейся к костно-хрящевой
мозоли, при гистологическом исследовании костного материала
она может оказаться частью эпифизарной ростковой пластинки.
В этом случае легко установить характерное для нее строение с
чередующимися зонами гипертрофических, столбчатых и
покоящихся клеток, а также элементами так называемой первичной
спонгиозы. Суставной хрящ и хрящевые части межпозвоночных
дисков обычно определяют уже при макроскопическом
изучении препарата или специально берут для гистологического
исследования. Они также имеют характерное строение, знание
которого помогает исследователю. При исключении упомянутых
видов хряща наличие хрящевой ткани в гистологическом
препарате может быть обусловлено диспластическим процессом
(хондроматозом костей и суставов, костно-хрящевым
экзостозом) или какой-либо разновидностью хрящевой опухоли.
Изложенные сведения о методике «чтения» гистологических
препаратов кости, разумеется, не являются даже кратким
«руководством к действию». Они представляют собой лишь
некоторые опорные пункты, которые помогут исследователю
правильно описать гистологические препараты кости.
ГЛАВА 24
ОСОБЕННОСТИ ОБРАБОТКИ БИОПСИЙНОГО
И ОПЕРАЦИОННОГО МАТЕРИАЛА
Морфологический метод исследования значительно расширил
диагностические возможности клиницистов и сделал
патологоанатома неотъемлемым участником диагностического процесса.
Неуклонно растет доля биопсийных исследований в общем
объеме работы врача-патологоанатома, причем это связано не
столько с повсеместной отчетливой тенденцией к снижению
количества аутопсий, сколько со все более возрастающей ролью
исследований биопсийного материала в процессах диагностики
и лечения.
Морфологические исследования тканей и органов могут
быть проведены на всех этапах пребывания больного в
стационаре, в том числе в до-, интра- и послеоперационном периодах.
Конкретными целями патогистологических (в сочетании с
цитологическими) исследований являются уточнение клинического
диагноза или установление его в неясных случаях, выявление
начальных стадий заболевания, распознавание воспалительных,
гиперпластических и опухолевых процессов, определение
степени злокачественности новообразований и динамики изменений
под влиянием проводимого лечения. Совместно с клиницистами
морфологи участвуют в определении объема оперативного
вмешательства, установлении активности процесса и тяжести
поражения органа, оценивают эффективность лечения и т.п.
Биопсия нередко позволяет установить более реальную картину
патологического процесса, чем многочисленные
функциональные пробы, так как последние часто оказываются нормальными
при резко выраженных поражениях, например печени
[Логинов А.С, Аруин Л.И., 1985]. Не случайно в современной
патологической анатомии все большее место занимает клиническая
патология — понятие близкое к «5иг§1са1 ра1:Ьо1о§у» в
англоязычной литературе и обозначающее тот раздел науки, который
занимается прижизненной диагностикой на основании
результатов изучения материала, получаемого при биопсиях.
Патологоанатом, таким образом, все больше становится клиническим
патологом .
Биоптаты даже столь малого объема, который обычно
получают при пункционной или эндоскопической биопсии, для
500
опытного патоморфолога являются полноценным источником
важной диагностической информации. Ушли в прошлое
недоуменные вопросы о том, можно ли по небольшому пунктату
диаметром 1 мм или эндоскопическому биоптату диаметром
2 мм судить о распространенной патологии того или иного
органа. Многолетняя клиническая и патологоанатомическая
практика показала, что это вполне возможно.
Разумеется, при работе с биоптатами, особенно пункционны-
ми и эндоскопическими, существуют определенные
ограничения, связанные главным образом с небольшим объемом
материала и степенью его информативности. Существует
минимальный объем биоптата, за пределами которого надежность
диагностического заключения резко снижается. Это относится и к
количеству кусочков, взятых из того или иного органа. Так,
идеальной считается пункционная биопсия почки, в результате
которой во взятом столбике ткани содержится 25 клубочков, а
сам столбик проходит через все отделы коркового вещества и
содержит часть хотя бы наружной зоны мозгового вещества.
Вместе с тем о природе почечной патологии можно судить и по
пунктату, который включает 5 клубочков, особенно если
гистологический срез прошел не через их периферию, а через
сосудистый полюс.
При гастробиопсиях желательно получение биоптата, в
котором представлена слизистая оболочка на всю ее толщину, так
как только в этом случае можно с уверенностью судить,
например, о степени атрофических процессов. Кроме того,
поверхностно взятый гастробиоптат может содержать лишь шеечные
отделы фундальных желез, обладающие значительной мито-
тической активностью, высоким ядерно-цитоплазматическим
соотношением и другими признаками, симулирующими диспла-
зию, хотя на самом деле подобные картины являются нормой
для этой «стартовой» зоны слизистой оболочки желудка. Не
менее важно и достаточное количество взятых кусочков.
Оптимальным считается получение 4 — 5 кусочков из краев и
середины участков поражения (лучше, если их берут по одной
стандартной схеме). При меньшем количестве кусочков вероятность
правильной идентификации процесса существенно
уменьшается.
При пункционной биопсии печени информативным считается
биоптат, содержащий не менее 3 — 4 портальных трактов. В
случаях пункционной биопсии синовиальной оболочки коленного
сустава при ревматоидном артрите обязательно наличие в пунк-
тате ворсин синовиальной оболочки.
Другие возможности и ограничения, связанные со
спецификой биопсийного материала, рассматриваются в литературе,
посвященной патологии различных органов и тканей.
501
ВИДЫ БИОПСИЙ И ПОРЯДОК
ПОСТУПЛЕНИЯ БИОПСИЙНОГО МАТЕРИАЛА
НА ГИСТОЛОГИЧЕСКОЕ ИССЛЕДОВАНИЕ
В клинике используют несколько способов взятия биопсийного
материала: открытый, пункционный, аспирационный,
эндоскопический, трепанобиопсия. Кроме того, важное значение имеет
цитологический метод (мазки, отпечатки и т.д.), связанный с
минимальной травмой при взятии материала и возможностью
проведения исследования в экстренном порядке.
Гистологические и цитологические методы взаимно дополняют друг друга.
Существует сложившийся порядок поступления биопсийного
материала в патогистологическую лабораторию.
1. Материал, предназначенный для гистологического
исследования, должен иметь четкую маркировку и сопровождаться
направлением. Материал от одного больного должен быть
помещен в отдельную посуду. Этикетку из плотной, неразмокающей
в воде бумаги (лучше фотобумаги) прикрепляют к объекту.
Надписи делают только мягким простым карандашом.
2. Фиксацию производят в предоперационной, куда заранее
доставляют в достаточном количестве 10 % нейтральный
формалин.
3. Стандартный бланк направления на патогистологическое
исследование заполняет и подписывает лечащий врач. При этом
в направлении отражают такие клинические данные, как
продолжительность заболевания, характер проведенного лечения,
результаты предыдущих исследований, если они проводились.
При наличии опухоли необходимо указать ее точную
локализацию, темпы роста, размеры, консистенцию, отношение к
окружающим тканям, наличие метастазов и других опухолевых
узлов, специальное лечение и клинический диагноз. Если в
направлении отсутствуют необходимые данные, заведующий пато-
логоанатомическим отделением ставит об этом в известность
заведующего того отделения, откуда была прислана биопсия, а
при повторных случаях сообщает администрации.
5. При приеме материала в направление и журнал
поступлений вписывают порядковый номер патогистологического
исследования каждого объекта и время поступления материала, а
также указывают характер биопсии — диагностическая,
срочная, операционный материал, количество кусочков, методики
окраски.
6. Материал диагностической биопсии запрещается делить
на части и посылать их в разные патогистологические
лаборатории, то же самое относится и к материалу для цитологического
исследования.
7. Ответственность за качество доставленного в лабораторию
материала несет врач, назначивший данное исследование.
Подсохший, загнивший, замороженный, нефиксированный матери-
502
ал не принимают в патогистологическое отделение и о таких
фактах сообщают администрации лечебного учреждения.
8. Если по условиям работы невозможно сразу отправить из
операционной материал в патогистологическую лабораторию, то
хирург, проводивший операцию, обеспечивает правильную
фиксацию материала и его сохранность.
После регистрации из присланного на исследование объекта
вырезают необходимое количество кусочков. Материал,
полученный методом соскоба, в том числе при гинекологическом
исследовании, аспирационных и других биопсиях, а также трепа-
нобиопсии исследуют целиком.
Совершенствование методов диагностики и развитие
гистологической техники направлены на уменьшение
продолжительности приготовления качественных препаратов с целью
обеспечения быстрого и точного установления диагноза. Если раньше
результаты микроскопического исследования и ответ на
биопсию можно было получить через 4 — 5 сут от момента
поступления материала, то теперь продолжительность исследования
уменьшилась до 1 сут, а при четко организованной работе и
наличии современного оснащения весь процесс можно завершить
за несколько часов.
Заключение подписывают патологоанатом и лаборант. Все
заключения, основанные на данных срочных биопсий, чаще всего
носят предварительный характер, поэтому должны быть
подтверждены после заливки оставшегося операционного материала с
изготовлением достаточного количества срезов, по результатам
исследования которых дают окончательное заключение.
ОСОБЕННОСТИ ОБРАБОТКИ МАТЕРИАЛА
БИОПСИЙ РАЗНЫХ ОРГАНОВ
Основные приемы взятия образцов ткани, с помощью которых
можно получить максимум информации о структуре органа и ее
изменениях, изложены в руководствах по гистологической
технике и в монографиях, посвященных патологии различных
органов и тканей, а также в некоторых главах настоящего
руководства. В связи с этим целесообразно остановиться лишь на
некоторых основных особенностях взятия наиболее часто
исследуемого материала и его обработки с применением ускоренных
методик.
Прежде всего следует упомянуть о правильном иссечении
кусочков из органов, которое производят острыми инструментами:
скальпелем, лезвием бритвы, малыми глазными ножницами и
др. Недопустимы деформация и механическое повреждение
ткани, поэтому кусочки губчатой кости не следует откусывать
кусачками, а рекомендуется использовать пилящие
инструменты. Если ткань компактна и структуры распределены в органе
503
относительно равномерно, то кусочек вырезают из любого
отдела вместе с капсулой (печень, селезенка, поджелудочная железа
и др.). Кусочки из почек и надпочечников вырезают так, чтобы
на срезе имелось и корковое, и мозговое вещество. Полые
органы исследуют на поперечных сечениях, проходящих через все
слои стенки. Если при макроскопическом исследовании в ткани
обнаружены патологические изменения (опухоли, эрозии,
инфильтраты), то кусочки обязательно иссекают на границе с
нормальным участком ткани. Особенно важно место перехода
нормальной ткани в опухолевую.
В том случае, если для исследования прислан достаточно
крупный объект, его следует разрезать на пластины толщиной
до 5 мм и изучать с помощью бинокулярной лупы или стерео-
микроскопа для ориентировочной дифференциации дисгормо-
нальных диспластических процессов в железистых органах
(сохранение дольчатости, наличие узлов, однородность
мелкозернистой структуры) и опухолей (фокусы уплотнения,
«стекловидные» поля, сосочковые структуры, псаммомные тельца,
очаги некроза, обызвествления). Кроме того, благодаря этому
исследованию можно правильно сориентировать мелкие
кусочки биоптатов на блоке.
Вырезанные кусочки ткани должны иметь размер не более
1,5x1x0, 5 см, оптимальный для быстрой фиксации и
проводки материала. В случае необходимости свежий материал можно
промыть в изотоническом растворе хлорида натрия, а затем
фиксировать. Промывание в воде нефиксированного материала
недопустимо.
При эндоскопических и пункционных биопсиях желудка или
прямой кишки, когда количество материала ограничено,
следует разрезать цилиндрический кусочек на 2 части так, чтобы на
срезе была слизистая оболочка и подслизистая основа. При
биопсии почки кусочек надо ориентировать так, чтобы на срезе
было корковое и мозговое вещество. Одну часть пунктата
заливают в парафин для гистологических и гистохимических
исследований, другую используют для
электронно-микроскопического исследования и/или флюоресцентной микроскопии.
Кожа. Лучшим фиксатором для биоптатов кожи является
жидкость Карнуа [Левер У.Ф., 1958; Мордовцев В.Н., Цветко-
ва Г.Н., 1993]. Продолжительность фиксации 2 ч при 4 °С. Для
того чтобы избежать пересушивания, в качестве промежуточной
среды лучше использовать хлороформ. Продольные кусочки
кожи заливают в боковом положении, чтобы срез проходил
через все слои эпидермиса и дермы. При получении срезов с
парафиновых блоков часто применяют охлаждение объекта
кубиком льда. Помимо окраски гематоксилином и эозином, кожу
обязательно окрашивают по Ван-Гизону, импрегнируют по Го-
мори и выявляют кислые гликозаминогликаны толуидиновым
синим, т.е. исследуют с помощью методик, применяемых при
504
изучении соединительной ткани. В случае наличия участка
кожи с пигментным новообразованием вырезают от 2 до 6
кусочков ткани толщиной 3 — 4 мм. На срезе должен быть и
неизмененный участок кожи. При изучении пигментного невуса
обычно применяют реакцию Перлса, ДОПА-реакцию и метод
Фонтана — Массона.
Молочная железа. Возможны три типа образцов тканей
молочной железы: 1) кусочки, полученные при диагностических
биопсиях; 2) участки ткани после секторальной резекции с
удаленными подмышечными лимфатическими узлами или без них;
3) железа после радикальной мастэктомии. После тщательной
пальпации присланного материала выявляют более плотные
участки, которые иссекают и нумеруют. Часть железы после
секторальной резекции или орган после радикальной
мастэктомии рассекают в плоскости хода протоков, патологически
измененные участки вырезают и фиксируют в 10 % нейтральном
формалине.
Органы желудочно-кишечного тракта. При изучении
патологии пищеварительной системы следует учитывать
гистологическое строение исследуемого отдела и соответственно этому
правильно ориентировать материал. Например, слюнные
железы располагают так, чтобы в срез попали выводные протоки.
При изучении пищевода продольно иссеченные полоски ткани
должны включать макроскопически неизмененную слизистую
оболочку и край новообразования или язвы.
Эндоскопические гастробиоптаты часто имеют небольшие
размеры, поэтому их проводят в 2 —3-слойном марлевом
мешочке и заливают в один блок. Л.И. Аруин и соавт. (1993)
рекомендуют приклеивать биоптаты на полоску печеночной ткани
или помещать их в небольшой разрез кусочка печени с
последующим смыканием края разреза. Размещение кусочков
слизистой оболочки, полученных от одного больного из различных ее
участков или от разных больных, на печени позволяет
проводить достоверное сопоставление различных объектов и при мик-
роскопировании идентифицировать кусочки, относящиеся к
разным отделам.
Операционный материал может быть представлен
иссеченным новообразованием, удаленным желудком или его частью
вместе с опухолью. Макроскопическое исследование желудка
В.А. Самсонов (1989) рекомендует производить до фиксации,
при которой происходит деформация органа. После
продольного рассечения желудка вне опухоли измеряют размеры его по
малой и большой кривизне, затем рассекают всю стенку
желудка через опухоль. При язвенном дефекте вырезают либо
продольную пластинку ткани через весь дефект, либо производят
крестообразное иссечение материала, что позволяет исследовать
края язвы с четырех сторон. При наличии полипозного
образования срез проводят через ножку полипа. Если имеется не-
505
сколько полипов, то необходимо брать материал из каждого.
Существует определенный набор методик, рекомендуемых для
изучения материала биопсий желудка: окраски гематоксилином
и эозином, пикрофуксином по Ван-Гизону, кармином, альциа-
новым синим, применяют также ШИК-реакцию. Особенно
информативна методика, сочетающая ШИК-реакцию с обработкой
срезов реактивом Романовского —Гимзы.
При исследовании резецированной толстой кишки материал
вырезают через ножку полипа или середину язвы, чтобы эти
изменения попали на срез.
Червеобразный отросток вскрывают острым ножом по
длине либо делают поперечные срезы. Если макроскопически
изменения отростка распределены неравномерно, то вырезают
участки с наибольшими и наименьшими изменениями [Калите-
евский П.В., 1993], уделяя особое внимание перфорациям и
дивертикулам. Освободив отросток от содержимого,
описывают обнаруженные при этом инородные тела, паразиты и др.,
затем осматривают его слизистую оболочку. При аппендиците
она набухшая, полнокровная часто с кровоизлияниями и
неглубокими язвами.
Вырезанные и фиксированные в 10 % нейтральном
формалине кусочки отростка режут на замораживающем микротоме или
заливают в парафин, окрашивают обычно только
гематоксилином и эозином.
Желчный пузырь необходимо фиксировать сразу же после
его удаления. Орган разрезают вдоль, удаляют желчь и
растягивают пузырь на картоне слизистой оболочкой вверх. Иногда
желчь из полости пузыря извлекают шприцем, а затем
заполняют его фиксирующей жидкостью. При наличии на внутренней
поверхности язвенных дефектов или опухолевых разрастаний
необходимо их подробно описать, измерить, отмечая
локализацию и отношение к различным слоям стенки пузыря. Вырезают
кусочки из участков с наибольшими и наименьшими
изменениями органа. По данным Г.Г. Автандилова (1994), качество срезов
повышается при заливке кусочков ткани желчного пузыря в
целлоидин-парафин.
Поджелудочную железу рекомендуют фиксировать сразу же
после удаления, так как ткань органа быстро подвергается ауто-
лизу. Разрезы делают по ходу протоков. Помимо рутинных
методов окраски, используют окрашивание препаратов по Малло-
ри, Гомори, альдегид-фуксином.
Биоптаты печени фиксируют в 10 % забуференном
формалине, а если предполагается выявление гликогена, то используют
фиксатор Карнуа. При этом продолжительность фиксации
мелких биоптатов должна быть не более 30 мин, что не всегда
возможно. После заливки в парафин с каждого блока готовят 25 —
30 срезов и помещают их на 4 —5 предметных стекол.
Используют окраски гематоксилином и эозином, по Ван-Гизону, иногда
506
импрегнацию по Гомори и выявление железа по Перлсу. Кроме
того, при исследовании материала биопсий печени очень важно
выявление поверхностного антигена гепатита В по методу,
предложенному Т. 5Ыка1:а и соавт. (1973).
1. После депарафинирования срезы помещают на 10 мин в
смесь 5 % перманганата калия (9,5 мл), 3 % серной кислоты
(5 мл), дистиллированной воды до 100 мл.
2. Обесцвечивают в течение 10 мин в 2 % щавелевой кислоте.
3. Промывают в проточной воде.
4. Окрашивают 4 ч при 22 °С в смеси, состоящей из 1 г ор-
сеина, 100 мл 70 % спирта и 2 мл концентрированной соляной
кислоты (рН 1,0 — 2,0).
5. Дифференцируют в 1 % соляной кислоте на 70 % спирте
5 мин. Промывают в проточной воде, обезвоживают, заключают
в бальзам.
Результат: НВз-антиген, эластические волокна и белковые
комплексы окрашиваются в коричневый цвет1.
Органы дыхания. Гистологическому исследованию
подвергают чаще всего кусочки из полости носа, синусов гортани,
бронхов, легкого. Кусочки из резецированной гортани иссекают
вертикальными разрезами, проходящими через опухоль и
голосовые складки. Биоптаты, полученные при бронхоскопии,
фиксируют в нейтральном 10 % формалине и компактно, в одном
блоке, заливают в парафин. Наибольшей информативностью
для эндоскопических бронхобиопсий обладает
электронно-микроскопический метод исследования в комбинации с изучением
полутонких срезов [Непомнящих Г.И., 1978]. При вырезке
ткани легкого для гистологического исследования учитывают
сегментарное строение органа. Срез должен проходить
продольно через бронх и его ветви. С тканью легкого рекомендуется
работать после хорошей фиксации материала в 10 % нейтральном
формалине, так как работа с этим органом на замораживающем
микротоме и в криостате связана с риском инфицирования
туберкулезом и другими инфекциями. Плевру изучают на срезах,
идущих перпендикулярно к ее поверхности. Из
гистологических методов чаще всего применяют окраску гематоксилином и
эозином в сочетании с предварительно проводимой реакцией
Перлса на железо и окраску пикрофуксином по Ван-Гизону в
комбинации с резорцин-фуксином, окрашивающим
эластический каркас легкого; используют также методы, позволяющие
выявить слизь и кератин.
Мочеполовая система. Почку после нефрэктомии или ее
удаленную часть разрезают от наружной поверхности
продольно по направлению к воротам, затем иссекают кусочки тре-
1 Более подробно обработка пункционных биопсий печени описана в
монографии А.С. Логинова, Л.И. Аруина «Клиническая морфология печени».—
М.: Медицина, 1985.
507
угольной формы, включающие корковое и мозговое вещество.
Материал, полученный в результате пункционной биопсии
почки, фиксируют в 10 % нейтральном формалине и заливают в
парафин. Срезы толщиной 4 — 6 мкм окрашивают
гематоксилином и эозином, пикрофуксином по Ван-Гизону, азаном по Гей-
денгайну, конго красным, проводят ШИК-реакцию. Для
дифференциальной диагностики используют также иммуногистохи-
мический метод Кунса с применением моноспецифических
сывороток.
При исследовании резецированного мочевого пузыря
вырезают кусочки измененной ткани и прилежащие к ней
неизмененные участки. Материал фиксируют в 10 % нейтральном
формалине и окрашивают гематоксилином и эозином, по Ван-Гизону и
резорцин-фуксином1.
Патологию мочеточника изучают на поперечных срезах,
применяя стандартный набор общепринятых методов
гистологического исследования.
Предстательную железу (после вырезки и фиксации)
изучают на горизонтальных срезах органа, которые окрашивают
гематоксилином и эозином и по Ван-Гизону. Эндоуретальные и
игловые биоптаты предстательной железы обрабатывают так
же, как и материал других пункционных биопсий: проводят в
мешочках из нескольких слоев марли по ускоренному методу
для мелких объектов, заливают в парафин в один блок, режут
практически весь материал и помещают срезы на 5 —6
предметных стекол, часть из которых окрашивают тремя основными
методами, остальные хранят в архиве.
Яичко, поступившее на гистологическое исследование,
рассекают по длинному диаметру и вырезают до фиксации. В случае
необходимости до фиксации проводят забор материала для
бактериологического исследования. Фиксировать этот орган лучше
в жидкости Карнуа, но можно использовать и 10 %
нейтральный формалин.
Половой член и мошонку исследуют на продольных
разрезах, проводка, фиксация и методы окраски обычные.
При обработке материала биопсий вульвы срезы должны
проходить перпендикулярно поверхности препарата в направлении
его длинной оси. Материал биопсии рекомендуют фиксировать в
10 % нейтральном формалине. Эндоцервикальные соскобы часто
содержат кровь и слизь. Материал исследуют полностью после
предварительного промывания в изотоническом растворе хлорида
натрия на фильтровальной бумаге.
Для исследования конических биопсий шейки матки
требуется четкая пространственная ориентация очага поражения
*А И. Романенко и Н Т Райхлин (1976) для дифференциальной
диагностики опухолей мочевого пузыря предлагают проведение комплексного
гистохимического и гистоэнзиматического исследования
508
[Хмельницкий О.К., 1994]. Для этого рекомендуют прошить
участок шейки матки в точке, соответствующей 12 часам
циферблата. Интраэпителиальная опухоль шейки матки часто
обнаруживается в зоне перехода плоского эпителия в железистый.
Материал конической биопсии рассекают в зоне 3 часов
циферблата, где опухолевый рост наименее вероятен. Раскрытую шейку
прикрепляют булавками к пробковой основе и фиксируют в
течение 3 ч. Вырезку производят серийно и блоки помещают в
отдельные кассеты.
Соскобы эндометрия (весь материал, включая небольшое
количество свертков крови) помещают в двухслойный марлевый
мешочек, фиксируют, промывают, обезвоживают и заливают в
парафин. Общая продолжительность проводки 2 — 3 ч.
Получать срезы на замораживающем микротоме не рекомендуют.
Препараты окрашивают гематоксилином и эозином, по Ван-Ги-
зону, муцикармином или альциановым синим.
Операционный материал, полученный при тотальной и
радикальной вульвэктомии, должен быть расправлен, фиксирован, а
затем рассечен с интервалом 0,5 см. Влагалище следует
вскрывать продольно по стороне, противоположной опухоли; берут
также кусочки из краев операционного разреза и всех
лимфатических узлов, обнаруженных в удаленных мягких тканях.
Полость матки вскрывают перед фиксацией с помощью
Т-образного разреза, производимого по передней стенке. В дальнейшем
разрезы выполняют по правилам, принятым в прозекторской
практике. Не следует расчленять материал на куски. Яичники,
удаленные во время гистерэктомии, взвешивают и измеряют, а
затем разрезают сагиттально в направлении наибольшего
диаметра с включением в срез области ворот. При наличии кист
вырезают участки утолщения стенки кисты. Гистологические
препараты окрашивают гематоксилином и эозином и по Ван-Ги-
зону.
Щитовидная железа. Особенность обработки ткани
щитовидной железы связана с выраженным сморщиванием тиреоид-
ной ткани при фиксации и заливке в парафин, поэтому
Н.Н. Гольдбурт (1993) рекомендует пользоваться
замороженными срезами. Предварительно ткань изучают с помощью сте-
реомикроскопа и из подозрительных участков вырезают
кусочки, которые помещают на столик микротома в виде единого
блока так, чтобы в полученном срезе была максимально
представлена капсула узла.
Надпочечник. Его рассекают по длинной оси, хромаффин-
ную ткань исследуют полностью.
Трепанобиопсии. Материал поступает в виде трепанатов
костного мозга и кусочков губчатой кости. После фиксации в 10 %
нейтральном формалине или ценкер-формоле и промывания в
проточной воде материал декальцинируют в 50 % растворе
муравьиной кислоты, разбавленной 70 % спиртом; продолжитель-
509
ность декальцинации от 12 до 24 ч в зависимости от величины
кусочков. Быстро хорошие результаты дает декальцинация в
трилоне Б. От кислоты материал отмывают в нескольких
порциях 70 % спирта, затем обезвоживают и обезжиривают в 2 сменах
96 % и 100 % спирта, заливают в парафин через хлороформ (1 —
2 ч), хлороформ-парафин при 37 °С (1 — 2 ч), парафин при 56 °С
(1—2 ч). Г.А. Меркулов (1969) рекомендует для этого
материала заливку в целлоидин-парафин. Наряду с обзорными
окрасками при изучении материала трепанобиопсий применяют реакции
на пероксидазу, липиды с Суданом черным, гликоген с помощью
ШИК-реакции, неспецифическую эстеразу, кислую фосфатазу.
Селезенка и лимфатические узлы. Селезенку разрезают по
большему диаметру, вырезают 3 — 4 кусочка и фиксируют в
10 % нейтральном формалине. Препараты окрашивают
гематоксилином и эозином и по Ван-Гизону. Особое внимание
требуется при исследовании лимфатических узлов, являющихся как
органами иммуногенеза, так и коллекторами метастазов
злокачественных опухолей. Их измеряют, взвешивают, а затем после
рассечения по малому диаметру погружают в фиксатор (10 %
нейтральный формалин или жидкость Карнуа).
Кость. Особенности обработки этого материала приведены в
главе 23.
Особенности обработки височной кости
Пирамида височной кости, заключающая в себе перепончатый
лабиринт (улитку, преддверие и полукружные каналы),—
самая плотная костная ткань, а для исследования структур
перепончатого лабиринта требуется высокое качество
гистологических препаратов. Это обстоятельство определяет ряд
особенностей гистологической техники на разных этапах обработки
височной кости, начиная со способов ее выделения при
проведении вскрытия.
Непременным условием при извлечении височных костей на
вскрытии является предотвращение аутолитических процессов в
перепончатом лабиринте, что достигается охлаждением трупа.
Благодаря этому можно сохранить структуры среднего и
внутреннего уха для световой микроскопии в течение 24 ч от
момента наступления смерти. Для специальных исследований во
внутреннее ухо вводят соответствующий фиксатор.
Существует несколько способов выделения височной кости.
Наиболее распространен метод получения костного образца в
форме блока, ограниченного пределами пирамиды и среднего
уха [ЗсЬикпесМ Н., 1968], с помощью остеотома и молотка,
однако удобнее пользоваться электрическими циркулярной или
вибрационной пилой. С помощью острого ножа на твердой
мозговой оболочке делают 4 контурных разреза. Два разреза
проводят перпендикулярно длинной оси пирамиды (один — через
510
верхушку пирамиды, второй — вблизи латеральной стенки
средней черепной ямки параллельно чешуйчатой части
височной кости), два других направлены от наружных углов
каменистой части параллельно длиннику пирамиды. Затем
соответственно обозначенным контурам производят 3 вертикальных (на
глубину 2,5 — 3 см) и один горизонтальный (внизу каменистой
части пирамиды примерно на 2,5 см ниже линии прикрепления
мозжечкового намета) распилы. Выпиленный костный блок
захватывают большими костными щипцами и мягкими
раскачивающими движениями освобождают от связывающих его костных
структур, а с помощью ножа — от мягких тканей на нижней
поверхности. Перед отсечением внутренней сонной артерии на нее
накладывают лигатуру. Правильно выделенный блок размером
приблизительно 2,6x3x2,6 см должен включать барабанную
перепонку, среднее ухо, перепончатый лабиринт и каменистую
порцию VII и VIII черепных нервов.
Перед помещением в фиксатор с помощью ножа и кусачек с
полученного образца удаляют лишние мягкие ткани и костные
структуры. Затем препарат височной кости (каждой в
отдельности) немедленно погружают в 300 мл фиксирующего раствора
Гейденгайна — «Суза», находящегося в стеклянном сосуде
емкостью 500 мл с притертой крышкой. Фиксатор готовят ех
1:етроге путем смешивания 60 мл 40 % раствора формальдегида
и 240 мл маточного раствора. В состав последнего входят:
сулема 45 г
хлорид натрия 5 г
дистиллированная вода 800 мл
трихлоруксусная кислота 20 г
ледяная уксусная кислота 40 мл
Продолжительность фиксации 48 ч при температуре около
3 °С. Дважды в день сосуд встряхивают для лучшего
проникновения фиксатора в ткани. Уменьшение продолжительности
фиксации чревато неполной фиксацией, а ее увеличение приводит к
выпадению в ткани солей ртути. Препарат височной кости
можно также фиксировать в 10 % растворе формалина на
изотоническом растворе хлорида натрия (объем фиксатора 300 мл) в
течение 3 нед на холоду. Перед погружением в этот раствор
фиксатор вводят с помощью шприца в полость среднего уха.
После фиксации в формалине препарат протравливают в том же
объеме жидкости Мюллера в течение 2 нед, промывают в
проточной воде (на ночь). С помощью этого метода удается
получить препараты вполне удовлетворительного качества для
световой микроскопии.
Препарат височной кости извлекают из фиксирующей
жидкости, промывают в проточной воде и помещают в 300 мл 5 %
раствора трихлоруксусной кислоты, находящегося в сосуде
вместимостью 500 мл. Раствор трихлоруксусной кислоты обновляют
511
3 раза в неделю на протяжении 6 нед. Эту процедуру, как и все
последующие, проводят при комнатной температуре. По ходу
декальцинации 1 раз в неделю лезвием бритвы или другим схожим
инструментом с образца срезают ненужные ткани; удаляют также
серу и эпителиальный детрит, которые могут находиться в
наружном слуховом проходе. Декальцинированная кость
становится мягкой, легко режется. Полноту декальцинации можно
проверить с помощью рентгенографии или химического теста. Для
проведения последнего 2 мл декальцинирующей жидкости,
омывающей образец, смешивают с 1 мл 5 % раствора оксалата
аммония и 1 мл 5 % раствора гидроксида аммония. Образование
белого осадка свидетельствует о неполной декальцинации. После
завершения декальцинации без ущерба для тканей образцы
некоторое время могут находиться в трихлоруксусной кислоте.
Декальцинацию можно проводить также в муравьиной кислоте
по Фридману. В состав декальцинирующей жидкости входят:
муравьиная кислота 400 мл
натриевая соль муравьиной кислоты 86 г
водопроводная вода 2000 мл
Продолжительность декальцинации 6 — 8 нед, жидкость
меняют каждые 2 — 3 дня в первые 2 нед, затем 1 раз в неделю.
Полноту декальцинации контролируют рентгенологически.
Для обработки небольших костных препаратов (слуховых
косточек, улитки экспериментальных животных, фрагментов
отосклеротической кости) используют методы быстрой
декальцинации, из которых лучшую сохранность гистологических
структур обеспечивает декальцинация в ЭДТА. Методы
быстрой декальцинации непригодны для электронной
микроскопии внутреннего уха, так как при этом значительно нарушается
ультраструктура нейроэпителиальных сенсорных клеток. В
ряде лабораторий для декальцинации височной кости используют
метод электролитической диссоциации.
После фиксации в муравьиной кислоте для нейтрализации
достаточно промыть препарат в течение 48 ч проточной водой.
После фиксации в трихлоруксусной кислоте его в течение 1 сут
промывают проточной водой, затем погружают в 300 мл 5 %
раствора сульфата натрия на 8 — 24 ч.
Обезвоживание
50 % спирт
70 % спирт
80 % спирт
96 % спирт
96 % спирт
100 % спирт I
100 % спирт II
спирт-эфир (1:1) I
спирт-эфир (1:1) II
проводят по следующей схеме:
24 ч
24 ч
72 ч
24 ч
24 ч
24 ч
24 ч
8ч
72 ч
512
Заключение в целлоидин осуществляют в течение 12 нед
путем последовательного помещения препаратов в жидкий
целлоидин (в сосудах с притертыми крышками, смазанными
вазелином) по схеме:
1,5 % целлоидин 1 нед
3 % целлоидин 3 нед
6 % целлоидин 4 нед
12 % целлоидин 4 нед
Основными опознавательными точками для ориентации
препарата на блоке при резке являются отверстия наружного и
внутреннего слуховых проходов. Для получения
горизонтальных срезов улитки препарат укладывают на блок нижней
поверхностью височной кости. Положение блока в зажиме
микротома следует отрегулировать таким образом, чтобы при резке
ампула верхнего полукружного канала срезалась одновременно
с верхней поверхностью молоточка и наковальни.
В течение резки одной височной кости полагается несколько
раз править микротомный нож. Поскольку целлоидиновые
срезы обычно имеют толщину около 20 мк, удается получить
400 серийных срезов, которые следует нумеровать в порядке их
получения; каждый 10-й срез окрашивают гематоксилином и
эозином. Полученные срезы можно окрашивать с помощью всех
методов, пригодных для целлоидиновых препаратов, включая
обзорные, специальные и импрегнационные.
Поскольку необходимость декальцинации височной кости
является основным препятствием, ограничивающим
применение современных тонких методов морфологического
исследования (гистохимических, иммуногистохимических,
электронно-микроскопических и др.), разработаны способы обработки
структур внутреннего уха без декальцинации. Так, резать не-
декальцинированную кость позволяют специальные
микротомы и микротомные ножи, однако на практике использовать их
можно только для получения срезов височных костей молодых
животных.
Особенности обработки офтальмологического
материала
Операционный и биопсийный офтальмологический материал
включает глазное яблоко, придаточный аппарат глаза, ткани
глазницы и прилегающие участки кожи. Чаще на исследование
поступает энуклеированное глазное яблоко, которое сразу же
надо правильно ориентировать. Фиксируют глазное яблоко
целиком. Наилучший способ фиксации — перфузия через сонную
артерию сначала изотоническим раствором хлорида натрия,
затем фиксатором, содержащим сулему, жидкостью Буэна или
Карнуа. Хорошие результаты обеспечивает использование сме-
513
си (1:1) 1 % глутарового альдегида и 10 % нейтрального
формалина на фосфатном буфере (рН 7,2). Широко применяют также
10 % нейтральный формалин, но при этом происходит
набухание стекловидного тела и как следствие — сдавление сетчатки и
хориоидеи. Кроме того, возможно появление в срезах
формалинового пигмента, что может затруднить изучение пигментных
образований глаза. При погружении глазного яблока в
фиксирующую жидкость рекомендуют также ввести фиксатор в
стекловидное тело с помощью шприца, прокалывая глазное яблоко
в области экватора.
Минимальная продолжительность фиксации 24 ч. После
промывания глазного яблока в проточной воде в течение 30 мин
его переносят в 70 % спирт. При фиксации в жидкости Ценкера
материал промывают в течение 24 ч в проточной воде, а затем
переносят в йодированный спирт. Если применялся фиксатор
Карнуа, то орган сразу же переносят в 100 % спирт, уменьшая
продолжительность заливки материала.
Вырезку материала производят после уплотнения глазного
яблока в 96 % или 100 % спирте. Рекомендуется класть глазное
яблоко роговицей вниз и слегка придавливать его к доске, на
которой вырезают материал. При этом хрусталик, лежащий на
радужке, плотно прилежит к роговице и не выскальзывает при
резании. Чаще глазное яблоко разрезают в горизонтальной
плоскости на 3 части таким образом, чтобы в центральном
кусочке оказались диск зрительного нерва, желтое пятно и центр
роговицы. Первый разрез следует делать осторожно, не
наклоняясь низко над материалом, так как из полости может
выбивать струя крепкого спирта. Иногда возникает необходимость
разрезать глазное яблоко в иной плоскости, например, если
клинически на глазном дне определялась грибовидная опухоль
хориоидеи (в этом случае разрез должен пройти через
основание опухоли). При язве роговицы глазное яблоко ориентируют
так, чтобы измененная часть попала в срез. В атрофичном
глазном яблоке, при хронических воспалительных процессах могут
встретиться кальцинаты и реже инородные тела. В этих случаях
прибегают к декальцинации в ЭДТА. Зрительный нерв (кроме
его внутриглазной части) разрезают на несколько поперечных
кусочков, предварительно сделав небольшой продольный
надрез для его правильной дальнейшей ориентации на срезе.
После вырезки материал вновь помещают в 96 % спирт,
затем в две смены 100 % спирта и начинают пропитку в
зависимости от способа заливки. Чаще применяют парафиновую
заливку, но лучшие результаты получаются при использовании
целлоидин-парафина.
Схема Хорошиловой —Масловой для заливки центрального
кусочка глазного яблока с применением автомата:
96 % спирт 2 ч
100 % спирт I 1,5 ч
514
100% спирт II 2,5 ч
100 % спирт + ксилол (11) 30 мин
ксилол I 1 ч
ксилол II 1 ч
ксилол + парафин (11) 1ч
парафин I 2 ч
парафин II 2 ч
Схема заливки в парафин по Архангельскому:
96 % спирт 24 ч
100 % спирт I 24 ч
100 % спирт II 24 ч
100 % спирт + ксилол (1*1) 1—Зч
ксилол I 3 ч
ксилол II 3 ч
ксилол + парафин (11) при 37 °С 2 ч
парафин I при 56 °С 1,5 —2 ч
парафин II при 56 °С 1 — 1,5 ч
Схема заливки в целлоидин-парафин по Янковски:
фиксация глазного яблока 24 ч
промывание в проточной воде 24 ч
60 % спирт 24 ч
70 % спирт 24 ч
80 % спирт 24 ч
вырезка кусочков глазного яблока
96% спирт 12 ч
100 % спирт I 12 ч
100% спирт II 12 ч
2 % целлоидин 48 ч
4 % целлоидин 24 ч
6 % целлоидин 24 ч
хлороформ I 3 —6 ч
хлороформ II 3 ч
парафин I при 56 °С 1 — 2 ч
парафин II при 56 °С 1 — 2 ч
СОВРЕМЕННЫЕ ТЕНДЕНЦИИ В РАБОТЕ
С МАТЕРИАЛОМ БИОПСИЙ
Рассматривая особенности работы с биопсийным и
операционным материалом, необходимо остановиться на новых
технологиях его обработки, которые позволяют значительно повысить
производительность труда лаборантов при одновременном
достижении высоких стандартов качества1.
Одним из основных моментов подобных нововведений
является все более широкое использование специальных систем об-
*В этой части главы использованы материалы И Б Извозчикова, за что
автор выражает ему искреннюю благодарность
515
работки ткани, например установки для заливки в парафин.
В подобных системах применяют пластмассовые кассеты,
которые одновременно служат контейнерами для кусочков ткани в
ходе ее обработки и держателями блоков при микротомии, а
также металлические формы для заливки и аппарат для
формирования парафиновых блоков. Специальные зажимы в
микротомах последних моделей, адаптированные к названным
приспособлениям, позволяют значительно быстрее менять блок при
микротомии.
Карусельные аппараты для обезвоживания ткани и
подготовки ее непосредственно к заливке — хорошо знакомые
отечественным морфологам АТ-4, АТ-4М, АТ-5 и различные
зарубежные модели — действуют по принципу переноса образцов из
одной ванны в другую. Эти аппараты достаточно надежны и
привычны для персонала, однако само по себе наличие
большого количества ванн не позволяет в полной мере использовать
некоторые дополнительные воздействия, существенно
ускоряющие и улучшающие качество обезвоживания и пропитывания,
прежде всего вакуум и повышенное давление, а также
изменяющуюся температуру растворов.
Работа аппаратов для обезвоживания и пропитывания
нового поколения основана на совершенно ином принципе: кусочки
ткани находятся в одной и той же герметично закрытой
камере, а обезвоживающие жидкости, растворители и парафин
последовательно подают в нее из специальных резервуаров.
Благодаря этому на всех этапах обезвоживания и пропитывания
материала можно изменять давление и температуру по
контролируемой с помощью электроники специальной программе, что
позволяет уменьшить продолжительность обработки ткани при
его высоком качестве. Примером такого прибора является
аппарат «Нурегсеп1:ег ХР» фирмы «5Ьапс1оп» (Великобритания;
рис. 7).
Обычный рабочий цикл таких аппаратов для крупных
образцов ткани составляет 16—18 ч, что позволяет получить
пропитанные кусочки на следующий день после поступления
материала и при соответствующей организации дальнейшей работы дать
диагностическое заключение через 24 ч. Эффективность
использования приборов этого типа можно значительно повысить, если
использовать интервал между выходом пропитанных крупных
образцов (7 — 8 часов утра) и загрузкой их следующей партии
(2 — 3 часа дня) для обработки материала эндоскопических и
пункционных биопсий, на которую уходит лишь несколько
часов.
Перспективными дополнительными воздействиями при
обработке биопсийного материала считают ультразвук и СВЧ-из-
лучение, однако в настоящее время режимы этих воздействий
еще недостаточно отработаны, что не позволяет рекомендовать
широкое применение соответствующего оборудования.
516
Для обработки материала биопсий гораздо большее
значение, чем при обработке секционного материала, имеет микрото-
мия, поскольку именно она в конечном счете определяет
качество гистологических срезов. Санные микротомы привычны для
лаборантов и позволяют поддерживать высокий темп работы
при приемлемом качестве. В настоящее время они значительно
модернизированы, однако, с точки зрения внедрения всего
комплекса новейших достижений микротомии в работу с биопсий-
ным и операционным материалом, гораздо более
перспективными, безусловно, являются ротационные микротомы. Кроме
обычных механических ротационных микротомов с
минимальным набором функций, выпускают многоцелевые микротомы с
электронной системой подачи и механическим приводом, а
также специальные микротомы (для работы с твердыми
образцами) с электронным управлением и моторным приводом. На
рис. 8 представлен один из современных универсальных
ротационных микротомов — НМ-360 фирмы «Мкгот» (Германия),
который можно использовать для получения парафиновых
срезов, полутонких препаратов и твердых образцов. Одной из
наиболее интересных и перспективных новейших разработок в
области микротомии, позволяющих получать срезы толщиной 2 —
3 мкм, является приспособление для щадящего переноса таких
тонких срезов на наклонный ламинарный термостатированный
поток жидкости — модель НМ-340 Е фирмы «Мюгот» (рис. 9).
При этом срезы в расправленном состоянии сразу попадают в
ванночку, и их можно монтировать на предметное стекло.
Одной из современных тенденций в развитии микротехники
является обеспечение безопасности и комфортности работы
лаборанта, особенно с инфицированным материалом. Для этих
целей служат автоматы для окрашивания препаратов, например
многопрограммный автомат «Уапз1:ат XV» с встроенной
вытяжной системой (рис. 10), изготовляемый фирмой «ЗЬапсЬп»
(Великобритания). Этот прибор одновременно окрашивает
66 препаратов по любой из 20 программ, обеспечивает подогрев
растворов, имея закрытый контур, предохраняющий рабочее
помещение от испарений.
Имеются также полностью автоматизированные приборы для
заключения и сушки препаратов, однако они требуют
использования тонких, стандартных по толщине предметных стекол, а
также крупных покровных стекол размером 24 х 48 мм.
Для цитологических исследований разработаны приборы,
предполагающие получение препаратов по «замкнутому
циклу». Так, малогабаритная центрифуга «Су1озрт 3» фирмы
«ЗЬапйоп» (рис. И) позволяет приготавливать в безопасных
условиях стандартные мазки в виде монослоя клеток и цитобло-
ки из фрагментированного операционного материала.
Окрашивание мазков крови также проводят с помощью автоматов для
окраски гистологических препаратов.
517
Заключительным этапом в гистологической технике является
микроскопирование и микросъемка. В последние годы созданы
и усовершенствованы оптические приборы, предназначенные
для гистологических целей. Фирма «Каг1 2е153 ^па ОтЬХ»
(Германия) разработала новое поколение микроскопов с
современным дизайном, удобных в работе и обладающих высокими
оптическими свойствами: «Ахю1аЪ» — микроскоп,
предназначенный для исследований и врачебной практики (рис. 12, а),
«Ахюзкор» — прибор для люминесцентной и фазово-контраст-
ной микроскопии (рис. 12, 6), «АхюрЬо!» — фотомикроскоп,
используемый в медицине и биологии (рис. 12, в).
ГЛАВА 25
ОСОБЕННОСТИ РАБОТЫ
С ЭКСПЕРИМЕНТАЛЬНЫМ МАТЕРИАЛОМ
Экспериментальные исследования являются составной частью
многих научных работ во всех областях медицины и биологии.
Современные фармакология и токсикология, достижения в
хирургии и терапии базируются на эксперименте. Большая часть
экспериментов — это уникальные многоплановые
исследования, позволяющие использовать широкий спектр методов
фиксации, применять различные гисто- и цитохимические
методики, электронную микроскопию, гисторадиоавтографию,
культуры тканей.
Основными объектами экспериментальных исследований в
отечественных лабораториях являются млекопитающие: мыши,
крысы, морские свинки, хомяки, кролики, кошки, собаки.
Особенности содержания этих животных и работы с ними описаны
в ряде руководств и монографий [Гиндце В.К., 1937;
Ковалевский К.Л., 1948, 1951; Гамбарян П.П., 1955; Западнюк И.П. и
др., 1974; Лоскутова З.Ф., 1980; Е. Рапзз, 1942], а также в
периодических изданиях, например в журнале «Ветеринария».
ВЫВЕДЕНИЕ ЛАБОРАТОРНЫХ ЖИВОТНЫХ
ИЗ ЭКСПЕРИМЕНТА, ВСКРЫТИЕ И ВЗЯТИЕ МАТЕРИАЛА
Морфологи чаще всего начинают работу с лабораторными
животными во время выведения их из эксперимента, поэтому
необходимо знать Международные правила гуманного отношения к
животным. Они отражены в Санитарных правилах по
оборудованию и содержанию экспериментально-биологических клиник
(вивариев).
Перед выведением из эксперимента (за 12 ч) животных
прекращают кормить. Умерщвление животного нельзя производить
в присутствии других животных. Наиболее приемлемым
способом эйтаназии признана передозировка наркотических средств
(летальная доза). В остром опыте животное необходимо
умерщвлять до прекращения наркоза.
Мелких животных (мыши, крысы, птицы, лягушки)
допускается подвергать эйтаназии методом декапитации в том случае,
если для исследования необходимо взять артериальную кровь, а
519
также с помощью ингаляционного наркоза без
предварительного введения других анестетиков. Пригодными для этих целей
считают хлороформ и эфир. Животное помещают в эксикатор,
через отверстие в крышке которого дробными дозами подают
наркотическое вещество. Установлено, что эфир лучше
применять для умерщвления крыс, а хлороформ — кошек и птиц
[Кисели Д., 1962].
Более крупным животным вначале вводят гексенал или тио-
пентал-натрий, а затем производят воздушную эмболию
(морским свинкам в сердце, а кроликам в ушную вену). Для того
чтобы было легче попасть иглой в сосуд, у кроликов
предварительно выщипывают волосы с участка уха, а затем
подготовленную область протирают ксилолом для усиления кровотока.
Самым крупным животным (собаки, свиньи, телята) вначале
вводят миорелаксанты, а затем — анестетики. Если не нужно
исследовать ткань мозга животного, то эйтаназию производят с
помощью электрического тока — электроды вводят в область
продолговатого мозга и крестца [Лоскутова З.Ф., 1980].
С целью получения материала для некоторых видов
морфологического исследования (электронная микроскопия, иммуно-
цитохимия) у мелких животных применяют сочетание
эйтаназии с прижизненной фиксацией органов и тканей.
Мелких лабораторных животных вскрывают на пробковых
или пенопластовых пластинах, помещенных в кювету.
Животных фиксируют, прикалывая кожу к пластинам с помощью
препаровальных игл, или привязывают за лапки к крючкам в
торцевой части пенопластовых пластин.
Для вскрытия кроликов и кошек используют покрытые
пластиком деревянные станки. Крупных животных вскрывают на
специальных металлических секционных столах.
Техника вскрытия всех лабораторных животных одинакова.
Особенностью ее является наличие у большинства из них
выраженного шерстного покрова, поэтому во избежание попадания
фрагментов волос на внутренние органы на коже
предварительно выбривают участок, где будет произведен разрез. Затем
нижнюю часть стенки живота приподнимают пинцетом по средней
линии, прорезают ножницами (очищенными от волос) и
разрезают брюшную стенку снизу вверх до грудины, стараясь не
повредить внутренние органы. Вскрытие грудной полости
производят двумя разрезами через реберные хрящи по обе стороны от
грудины снизу вверх, костно-хрящевой лоскут удаляют.
В том случае, если по условиям эксперимента
предполагается изучение одного или нескольких органов, вскрывают ту
часть тела животного, где он (или они) располагается. Орган
иссекают, вырезают кусочки необходимого размера и
фиксируют в заранее выбранном для данного исследования фиксаторе.
При многоплановых токсикологических исследованиях,
проводимых, как правило, на крысах и мышах и предполагающих
520
выполнение серии экспериментов с большим количеством
животных, к вскрытию необходимо привлекать самих
экспериментаторов и хорошо обученных лаборантов, которые должны
работать под руководством опытного морфолога.
На каждое животное необходимо оформить протокол
вскрытия, в котором дают оценку состоянию внутренних органов,
отмечают наличие интеркуррентных, не связанных с изучаемым
веществом или воздействием, заболеваний. У животных как опытных,
так и контрольных групп часто встречаются глистные инвазии,
воспалительные или опухолевые поражения. Животных, у
которых обнаружены подобные изменения, необходимо
отбраковывать на этапе вскрытия или после сопоставления с результатами
биохимических и других лабораторных исследований.
В некоторых экспериментах, таких как изучение нового
лекарственного препарата, у подопытного животного (чаще всего
крысы) извлекают около 20 органов, которые до фиксации
необходимо взвесить. Порядок вскрытия при этом следующий:
вначале выделяют тимус (лежит на трахее), затем — органы
грудной полости; в брюшной полости первыми извлекают
печень и селезенку, обнаруживают и выделяют надпочечники,
почки и элементы мочеполовой системы; последними выделяют
и промывают в изотоническом растворе хлорида натрия части
желудочно-кишечного тракта. Одновременно другой
препаратор извлекает головной мозг: у крыс — кусачками, а у
кроликов и собак с помощью пилы из секционного набора
выпиливают достаточно крупный треугольник в лобной части черепа
(после предварительного освобождения его от кожи), а затем с
помощью анатомического пинцета и лопаточек мозг аккуратно
извлекают, взвешивают и фиксируют.
Во избежание высыхания и быстро начинающихся
изменений, особенно в железистой ткани, извлеченные органы перед
взвешиванием накрывают марлевой салфеткой, хорошо
смоченной изотоническим раствором хлорида натрия. После
взвешивания мелкие органы (надпочечники, лимфатические узлы)
целиком и кусочки, вырезанные из более крупных органов,
складывают в марлевую салфетку, помещают туда же бирку из
фотобумаги, на неглянцевой поверхности которой мягким простым
карандашом четко записывают номер животного или шифр.
Мешочек завязывают таким образом, чтобы органы не слипались и
располагались свободно, и опускают в банку с 10 %
нейтральным формалином или другим фиксатором.
ПРОВОДКА И ЗАЛИВКА ЭКСПЕРИМЕНТАЛЬНОГО
МАТЕРИАЛА
Тактика проводки и заливки экспериментального материала
практически не отличается от таковой при обработке
клинического (биопсийного) материала. После фиксации и промывания
521
кусочки в случае необходимости подравнивают и уменьшают в
размерах. В одних лабораториях предпочитают перед
проводкой нанизывать кусочки на нитку, снабдив ее этикеткой, в
других обезвоживание и пропитывание проводят в марлевых
мешочках. Ниже приведена одна из апробированных схем
проводки и заливки органов мышей и крыс.
Материал фиксируют в 10 % нейтральном формалине не
менее 48 ч, после вырезки кусочков проводят их дофиксацию в
течение 1 ч в термостате при 37 °С:
проточная вода
70 % спирт
96 % спирт
100 % спирт I
100 % спирт II
хлороформ I
хлороформ II
хлороформ + параф]
парафин I 56 °С
парафин II 56 °С
Продолжительность
ин (11) при 56 °С
без фиксации
2ч
30 мин
30 мин
1 ч
1 ч
30 мин
1 ч
1 ч
30 мин
30 мин
8 ч 30 мин
В том случае, если нет возможности за 1 рабочий день
полностью провести и залить материал, рекомендуется довести
проводку до смеси хлороформа с парафином и оставить в ней
материал при комнатной температуре на ночь.
После фиксации материала в жидкости Карнуа (в течение 2 ч
при 4 °С) кусочки помещают в 2 смены 100 % спирта на 30 мин в
каждую, далее — по приведенной выше схеме. Общая
продолжительность фиксации, проводки и заливки материала 7 ч.
При большом количестве экспериментального материала с
целью экономии времени и материальных затрат на
изготовление одного препарата можно заливать в один блок по 3 — 4
кусочка от одного животного с учетом плотности и особенностей
ткани. Так, хорошо режутся залитые вместе почка, легкое и
мозг; различные отделы желудочно-кишечного тракта;
семенник, тимус и легкое; сердце, селезенка и печень. Не всегда
получаются стандартно хорошие препараты печени, что может быть
связано с различным кровенаполнением органа в зависимости от
вида забоя животного. Необходимо следить за тем, чтобы
кусочки печеночной ткани были хорошо фиксированы, и не допускать
пересушивания материала при обезвоживании и пропитывании.
РЕКОМЕНДАЦИИ ПРИ РАБОТЕ
С ЭКСПЕРИМЕНТАЛЬНЫМ МАТЕРИАЛОМ
Во-первых, для каждого эксперимента необходим адекватный,
хорошо продуманный и согласованный с морфологом контроль.
522
Чаще всего контролей несколько, в том числе интактные
животные, содержащиеся в таких же условиях, как и опытные.
Во-вторых, если экспериментальная работа оказалась
перспективной и ожидается получение важных, далеко идущих
выводов, необходимо повторить эксперимент с учетом
выраженных сезонных изменений, имеющихся у большинства
лабораторных животных.
В-третьих, в экспериментальной лаборатории, кроме
протоколов вскрытия животных, должна быть тетрадь учета
поступающего материала по годам. В ней после фамилии
экспериментатора фиксируют время поступления материала, его шифр или
номер, особенности эксперимента, перечень органов и
количество кусочков каждого органа с пометкой об особенностях их
ориентирования при заливке. Кроме того, указывают способ
фиксации и методы окрашивания препаратов. При длительном
(иногда до 3 лет) эксперименте следует вносить в тетрадь данные о
том, в каком виде остается архив и где он находится.
Архив нужно хранить как можно дольше, минимум 10 лет,
так как иногда из незначительного, на первый взгляд,
эксперимента в последующем вырастает новое научное направление.
Кроме того, при испытании некоторых препаратов сначала не
обнаруживают признаков токсического воздействия, а
проявляются они лишь во втором и третьем поколениях животных.
Примером может служить тератогенный эффект диэтилстильб-
эстрола — синтетического аналога синэстрола. В данном случае
важным научным аргументом явились препараты первичного
эксперимента, хранившиеся в лаборатории около 20 лет.
В-четвертых, необходимо знать, что морфологическое
исследование является неотъемлемой составной частью любой
экспериментально-клинической работы. При получении результатов,
имеющих важное практическое, в том числе коммерческое,
значение или являющихся предметом изобретения или открытия,
морфолог — полноправный участник творческого
коллектива — может использовать результаты эксперимента в
собственной научной работе.
ГЛАВА 26
ХРАНЕНИЕ МАТЕРИАЛОВ ГИСТОЛОГИЧЕСКОГО
(ПАТОМОРФОЛОГИЧЕСКОГО) ИССЛЕДОВАНИЯ,
ИХ АНАЛИЗ И РАБОТА С АРХИВОМ
В связи со спецификой работы патологоанатомического
отделения или любой другой патоморфологической лаборатории, в
которой проводят исследования клинического, а не
экспериментального материала, необходимо хранить фрагменты органов и
тканей, блоки и срезы в течение определенного периода
времени после выдачи диагностических заключений.
Органы и ткани, а также их фрагменты, оставшиеся после
вырезки и заливки материала («сырой» архив, или
макроархив), хранят в 10 % растворе формалина в больших банках,
чанах или бидонах с плотно закрывающимися крышками.
Необходимо следить за уровнем формалина в емкостях и не
допускать высыхания архива. Каждый объект завязывают в марлю
вместе с биркой из фотобумаги или любой другой плотной
бумаги, на которой указаны год и номер исследования. Бирку
помещают таким образом, чтобы обозначения на ней можно было
рассмотреть, не развязывая марлю, или же аналогичную бирку
укрепляют снаружи марлевого «контейнера».
Существует и более современный способ хранения
материала: его вместе с этикеткой помещают в плотный, прозрачный и
прочный полиэтиленовый пакет, затем в него наливают немного
формалина и склеивают с помощью специального аппарата.
Этот пакет помещают в другой пакет большего размера для
полной герметизации. Размеры пакетов могут быть различными,
этикетка и сам материал должны быть четко видны. Такие
двойные или даже тройные пакеты с заключенным в них материалом
размещают на стеллажах. Этот способ широко применяют в
гистологических лабораториях США.
В тех лабораториях, в которых до настоящего времени
работают с целлоидином, целлоидиновые блоки хранят в плотно
закрытых банках с 70 % спиртом, маркированных
соответствующим образом (с указанием года и номеров исследований). Для
длительного хранения залитого в целлоидин материала его
снимают с деревянных колодок, нанизывают на нитку и вместе с
биркой, на которой указаны год и номера исследований,
помещают в емкости с 70 % спиртом. Парафиновые блоки хранят в
коробках или завязанными в марлю на специальных
маркированных стеллажах.
524
Гистологические препараты (стекла) предпочтительнее
хранить в вертикальном положении в прорезях специальных шка-
ф(Ьв или стеллажей. В случае их отсутствия препараты хранят
завернутыми в бумагу «по случаям» с указанием их номеров и
гоДа исследования в любых пригодных для этой цели шкафах.
Жестких правил, строго регламентирующих определенные
сроки хранения того или иного материала, в настоящее время не
существует. Однако опыт, традиции, а также некоторые
положения, приведенные в нормативных документах,
разработанных в предшествующие десятилетия, позволяют дать
следующие рекомендации.
«Сырой» архив секционного материала хранят до 3 мес, а
если площади помещений не позволяют, то не хранят вовсе.
Такой же архив обычного операционного материала
(червеобразные отростки, желчные пузыри, грыжевые мешки,
миндалины, соскобы из полости матки после неполного аборта и т.д.),
если площади не позволяют обеспечить его длительную
сохранность, обычно хранят не более 2 нед или по крайней мере до
момента выдачи диагностического заключения. Макропрепараты
опухолей и их отдельные фрагменты, а также материал,
полученный в случаях, когда имеются подозрения в отношении
новообразований, ткани и органы, природу патологических
изменений в которых, возможно, потребуется уточнить,
рекомендуют хранить в течение 1 года. Кусочки опухолей некоторых
локализаций и гистогенеза, новообразования головного мозга,
злокачественные опухоли мягких тканей, некоторые другие
редко встречающиеся злокачественные новообразования, а
также органы и ткани с неясной патологией рекомендуют
хранить пожизненно [Автандилов Г.Г., 1994].
Гистологические препараты новообразований в большинстве
стран принято сохранять пожизненно, а иногда и дольше, в
течение всего периода существования патологоанатомического
отделения или лаборатории. Вместе с тем приходится принимать
во внимание объемы (площади) помещений
патологоанатомического отделения, при недостатке которых длительность
хранения препаратов может быть ограничена. В любом случае
нужно стараться сохранять их как можно дольше.
Гистологические препараты материала, полученного от больных с часто
встречающимися патологическими процессами, обычно хранят в
течение 1 года, затем стекла смывают.
Независимо от способа хранения гистологических и особенно
гистохимических препаратов необходимо исключить
воздействие на них солнечного и даже просто яркого дневного света во
избежание обесцвечивания. Следует также помнить, что
обесцвечивание гистологических и гистохимических препаратов при
их длительном хранении может быть связано с диффузией
красителей, особенно хорошо растворимых, в материал,
используемый для заключения срезов (окраска по Ван-Гизону, реакция с
525
толуидиновым синим и др.). В еще большей мере это относится
к полутонким срезам, особенностями которых являются
сравнительно слабое (поверхностное) связывание красителя со
структурами ткани и соответственно более быстрый переход его'в
среду для заключения с одновременным снижением
интенсивности окраски срезов. В связи с этим полутонкие срезы
предпочитают исследовать и затем хранить без заключения под
покровное стекло, помещая их в хорошо закрываемые,
защищенные от пыли коробки.
Копии заключений по результатам исследования материалов
биопсий необходимо хранить в течение всего времени
существования патологоанатомического отделения или лаборатории.
Желательно столь же долго хранить и протоколы вскрытий,
однако если такой возможности нет, то их хранят не менее 25 лет.
Копии этих документов подшивают по годам и затем
переплетают в виде книг, которые соответственно нумеруют. Эта
документация, так же как книги записи поступления биопсийного и
операционного материала, хранят под присмотром, их нельзя
выносить из отделения.
В хорошо оснащенных крупных патологоанатомических
отделениях и бюро со временем накапливается значительное
количество фотодокументов, отражающих наиболее важные и
демонстративные макро- и микроскопические изменения органов.
Все негативы, позитивы и фотоотпечатки хранят по правилам,
принятым при хранении документации такого рода.
В последнее время для учета и последующего анализа
результатов исследований биопсийного и секционного материала
все шире применяют компьютерную технику с соответствующим
программным обеспечением. Увеличение количества биопсий в
сочетании с возрастающей трудоемкостью обработки и анализа
результатов исследований, централизация и укрупнение
подразделений патологоанатомической службы и особенно создание
патологоанатомических бюро, проведение в таких учреждениях
значительно большего объема работы по изучению не только
биопсийного, но и секционного материала приводят к
накоплению значительных объемов информации. При современном
оперативном статистическом анализе этой информации, крайне
необходимом практическому здравоохранению и медицинской
науке, методом выбора является использование с этой целью
персональных ЭВМ с их практически неограниченными
возможностями хранения результатов патоморфологических
исследований и их последующего анализа.
Отечественному пользователю доступна автоматизированная
информационно-справочная система (АИСС) «Биопсия»,
достаточная для хранения и анализа биопсийного материала в
отделениях, в которых в год проводят исследования материалов
нескольких десятков тысяч биопсий. После введения в систему
всех необходимых данных, в том числе и неформализованного
526
текста заключения патологоанатома, сделанного им на
основании результатов исследования материала биопсии, система
выло лняет следующие функции: оперативный поиск нужной
информации; оформление необходимой документации; ведение
архива документов; выполнение статистического анализа
разного вида; ведение автоматизированного учета лиц с теми или
ирыми заболеваниями; ведение автоматизированного учета и
акализа количества выполненных исследований по отрезкам
времени, отдельным сотрудникам отделения, прикрепленным
учреждениям и т.д.; организация связи и взаимодействия с
клиническими и другими отделениями больницы и
администрацией, если подобные локальные или объединенные в сеть
системы имеются в данном лечебном учреждении [Трибунов Ю.П. и
др., 1990].
Примером подобного эффективного использования
персональных ЭВМ для автоматизированного учета и анализа
результатов вскрытия служит информационно-поисковая система
(ИПС) «Аутопсия», предназначенная для создания годового
отчета патологоанатомического отделения или бюро, отчетов по
секционной работе для каждого из обслуживаемых
лечебно-профилактических учреждений, накопления и обработки архивных
данных для последующей научной работы, получения справок,
подготовки сообщений, докладов и т.д. [Константинов Г.С.,
Кошкина Н.Г., Готманова В.Н., 1990]. О возможностях
системы можно судить, например, по тому, что годовой отчет для
областной больницы с анализом результатов примерно 900
вскрытий на 13 таблицах составляют за 39 мин. Как и в случае
применения АИСС «Биопсия», данные, заложенные в память
компьютера, можно использовать в каких угодно комбинациях и
вариантах для самых разнообразных целей. Если же
предварительно разработать соответствующие стандартные формы, то
информацию с заданным анализом можно получить за
считанные минуты. Примеры эффективного использования
вычислительной техники для учета и анализа онкоморфологического
материала и решения ряда других задач можно найти в работах
Н.К. Пермякова и соавт. (1980), О.Н. Ратнера и С.Ж.-П. Бо-
сенко (1990), Г. Г. Автандилова (1994), Е). КоЬег^з^опез,
]. МсСЫге (1985), К.У. З^еИепЬат и соавт. (1982) и др.
Использование ЭВМ непосредственно для целей
диагностики (задача «распознавания образов»), несмотря на некоторый
прогресс в этой области, еще не вышло за рамки
экспериментальных научных разработок.
ПРИЛОЖЕНИЕ
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ
В ПАТОМОРФОЛОГИЧЕСКОЙ ЛАБОРАТОРИИ
К работе в патоморфологической лаборатории могут быть
допущены лица, прошедшие соответствующий инструктаж по
технике безопасности и производственной санитарии. Очередной
повторный инструктаж проводят не реже 1 раза в год.
В лаборатории запрещается:
1) проводить работы, связанные с перегонкой,
экстрагированием вредных веществ при неисправной вентиляции;
2) при работе в вытяжном шкафу держать голову под тягой,
пробовать на вкус и вдыхать неизвестные вещества;
3) хранить и применять реактивы, находящиеся в посуде без
этикеток;
4) хранить запасы ядовитых и сильнодействующих, огне- и
взрывоопасных веществ и растворов на рабочих столах и
стеллажах;
5) хранить и принимать пищу, а также курить;
6) захламлять и загромождать проходы, коридоры,
лестничные клетки, а также подходы к средствам пожаротушения.
При эксплуатации аппаратов, приборов и оборудования
необходимо строго руководствоваться правилами
(инструкциями), изложенными в техническом паспорте
завода-изготовителя.
Металлические корпуса всех электроприборов должны быть
заземлены. Категорически воспрещается работать на
неисправном оборудовании.
При эксплуатации термостата запрещается:
1) ставить в термостат легко воспламеняющиеся вещества;
2) снимать предохранительные колпачки с регулирующих
устройств;
3) производить уборку термостата до отключения его от
электросети.
Электрические плитки и другие нагревательные приборы
(бани, микротермостаты и др.) обязательно устанавливают на
огнеупорном покрытии. Не следует допускать попадания на
электроприборы кислот, щелочей, растворов солей, парафина.
528
Баллоны с углекислотой должны иметь предохранительные
колпаки. Их хранят в специальном помещении в вертикальном
положении (закрепляют специальными ремнями, хомутами или
цепочками) на расстоянии не менее 1 м от радиаторов
отопления] укрытые от попадания прямых солнечных лучей. Баллоны
не должны соприкасаться с электрическими проводами.
Помещение для хранения баллонов должно быть оснащено
средствами пожаротушения.
П|ри работе со спиртовой горелкой (спиртовкой) нельзя
доливать в нее спирт, предварительно не потушив ее. Горелка
обязательно должна быть снабжена нержавой металлической
трубкой й шайбой для фитиля. Работу со спиртом, эфиром и
другими горючими летучими веществами необходимо проводить в
удалении от источников открытого огня; отгонку, перегонку
спиртов и эфиров необходимо осуществлять только в вытяжном
шкафу при опущенном смотровом стекле с помощью водяной
бани или плитки с закрытой спиралью.
Токсичные органические растворители (хлороформ, ксилол,
ацетон и т.д.) разливают из больших емкостей с помощью
шланга и груши, при работе с ними нужно пользоваться
сифонами, механическими пипетками, шприцами. Желательно все
манипуляции проводить в вытяжном шкафу, а выпаривание и
возгонку этих веществ только в вытяжном шкафу при
опущенном смотровом стекле.
Ядовитые, сильнодействующие, едкие, взрыво- и
огнеопасные средства и растворы необходимо хранить в отдельной
комнате, в опломбированных металлических шкафах или сейфах
под замком; концентрированные растворы кислот хранят в
бутылях из толстого стекла с притертой пробкой, закрытой
притертым стеклянным колпачком. Щелочи хранят в
стеклянной таре темного стекла, закрытой корковыми или
стеклянными (притертыми) пробками, сверху залитыми слоем
парафина.
Горючие и взрывоопасные вещества необходимо хранить в
хорошо закупоренных толстостенных емкостях, которые
помещают в железные ящики, выложенные асбестом и удаленные от
источников тепла. Совместное хранение легко
воспламеняющихся и огне- и взрывоопасных веществ с кислотами и
щелочами категорически воспрещается. Емкости, в которых находятся
все перечисленные реагенты, должны быть четко подписаны с
указанием количества вещества, так как подлежат предметно-
количественному учету (по соответствующей форме) в
отдельных книгах, пронумерованных, прошнурованных, скрепленных
печатью и подписями материально ответственного лица и
руководителя подразделения. Работу с ядами можно доверять
работникам только после специального инструктажа.
При доставке в лабораторию всех этих веществ необходимо
принять меры предосторожности. Так, бутыли с кислотами, ще-
529
лочами и другими едкими веществами следует переносить
вдвоем в специальных корзинах со стружками (в оплетке) и
перевозить на специальной тележке, работать с ними нужно в
резиновых перчатках и защитных очках. ,
Расфасовку, измельчение, отвешивание и отмеривание,
ядовитых и сильнодействующих веществ проводят только в
вытяжном шкафу с помощью специально выделенной для этих целей
посуды и приборов (цилиндры, ступки, воронки, весы и т.д.).
Нагревание ядовитых веществ разрешается только в круглодон-
ных колбах на закрытом огне.
При работе с кислотами и щелочами для мелкой расфасовки
следует использовать пипетки с резиновыми грушами или
пипетки-автоматы. Насасывать жидкость в пипетку ртом
категорически воспрещается. При разбавлении крепких кислот их
понемногу добавляют в воду, а не наоборот.
Приготовление рабочих растворов кислот и щелочей из
концентрированных растворов, выпаривание растворов,
содержащих кислоты и щелочи, производят в вытяжном шкафу; нельзя
закрывать посуду пробкой или крышкой при нагревании и
кипячении растворов. При нагревании сосуда с кислотой или
щелочью нужно держать его отверстием в сторону от себя и
сотрудников.
При попадании крепких растворов кислот или щелочей на
кожу необходимо сначала смыть их водой, затем
нейтрализовать. В случае попадания кислоты участок обрабатывают 2 %
раствором гидрокарбоната натрия (пищевая сода), при ожоге
щелочью — 1 % раствором уксусной или лимонной кислоты.
Эти растворы постоянно хранят в аптечке. Использованные в
процессе работы кислоты и щелочи собирают отдельно, затем
сильно разводят водой и выливают в раковину.
Работу с легковоспламеняющимися веществами и горючими
жидкостями выполняют в вытяжном шкафу при работающей
вентиляции и выключенных газовых горелках и
электроприборах. На рабочем месте разрешается иметь огнеопасные вещества
в тех минимальных количествах, которые необходимы для
осуществления конкретной работы.
Запрещается слив в канализацию отработанных горючих
жидкостей. Их собирают в специальную герметическую тару
и передают для централизованного уничтожения или
регенерации. Лабораторную посуду после работы с этими
веществами следует мыть в резиновых перчатках и резиновом
фартуке. Стеклянную посуду погружают в раствор соды,
смешанный с мылом, после чего хорошо ополаскивают в проточной
воде.
Согласно правилам противопожарной безопасности, в
лаборатории в доступном месте необходимо иметь огнетушители,
ящик с сухим песком, асбестовое одеяло, лопату.
530
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ ПРОВЕДЕНИИ РАБОТ И БАКТЕРИОЛОГИЧЕСКИХ
ИССЛЕДОВАНИЙ С ИНФЕКЦИОННЫМ МАТЕРИАЛОМ
Перёд работой нужно проверить целость стеклянной посуды,
проходимость игл и поршней у шприцев, наличие необходимых
для работы инструментов, так как прикасаться руками к
исследуемому материалу категорически запрещается. Посев
инфекционного материала проводят в боксе около горящей горелки с
обжиганием петли, шпателя и краев пробирки. На пробирках,
чашках Петри, колбах, флаконах и другой посуде делают
надписи с указанием названия материала, номера анализа, даты
посева. Посуду с посевами помещают в кюветы или на подносы, а
пробирки — в штативы. Не допускается размещение чашек с
посевами непосредственно на столах.
После окончания работы с инфекционным материалом
необходимо провести дезинфекцию предметных стекол, пинцетов,
шпателей и др. Их погружают на 1 сут в дезинфицирующий
раствор, затем моют и кипятят. Посуду автоклавиру ют,
обрабатывают дезинфицирующим раствором или подвергают
длительному кипячению. Трупы зараженных животных помещают в
сосуд с дезинфицирующим раствором, а затем сжигают в
специальных печах или автоклавируют в течение 1 ч при температуре
120 °С. Поверхность рабочих столов обрабатывают
дезинфицирующим раствором и по возможности обжигают спиртом.
Стены, двери, пол боксов обтирают дезинфицирующим
раствором и включают бактерицидную лампу. Во время перерыва в
работе и по ее окончании перчатки и руки моют
дезинфицирующим раствором, а затем теплой водой с мылом.
При работе с риккетсиями и вирусами необходимо надевать
защитные очки, маски-респираторы, резиновые перчатки,
нарукавники и клеенчатые фартуки. Рабочий стол застилают 3 — 4
слоями марли, смоченной в дезинфицирующем растворе. В него
же опускают руки в перчатках после каждой манипуляции с
инфицированным материалом.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Абрамов М.Г. Клиническая цитология — М : Медицина, 1974 — 334 с
Абрикосов А.И. Техника патологоанатомических вскрытий трупов.— М.: Мед-
гиз, 1948.- 166 с
Архангельский В.Н. Практическое руководство по патологогисто логической
технике для офтальмологов — М : Медгиз, 1957 — 110 с
Белецкий В.К. Техника микроскопического исследования* Руководство по
неврологии — М * Медгиз, 1942 — Т. 2.— 389 с
Бухвалов И.Б Гистохимия — Учебное пособие — М.* Высшая школа, 1993 —
227 с.
Вайль С.С Руководство по патологогистологической технике — Л : Медгиз,
1947 - 236 с.
Винников Я.А., Титова Л.К. Кортиев орган Гистофизиология и гистохимия —
М -Л Изд. АН СССР, 1961.- 260 с
Втюрин Б. В , ПалъцынА А. Современные методы и приемы
электронно-микроскопических исследований биологических объектов
(электронно-микроскопическая радиоавтография и растровая электронная микроскопия) — М
Радио и связь, 1985 — 48 с
Епифанова О.И., Терских В.В., Захаров А.Ф. Радиоавтография — М *
Высшая школа, 1977.— 246 с.
Кветной И М. АПУД-система (структурно-функциональная организация,
биологическое значение в норме и патологии)//Успехи физиол наук.—
1987 - № 1.- С. 84-102
Крымский Л.Д., Нестайко Г.В., Рыбалов А.Г. Растровая электронная
микроскопия сосудов крови — М ' Медицина, 1976 — 160 с
Культура животных клеток* Пер. с англ — М.: Мир, 1989 — 312 с.
Луцик А.Д., Детюк Е.С., Луцик Д.М. Лектины в гистохимии Львов* Вища
школа, 1989.— 227 с
Медведев ИИ. Основы патологоанатомической техники — М.: Медицина,
1969 - 3-еизд - 288 с.
Меркулов Г.А. Курс патологогистологической техники — Л * Медицина,
1969 - 5-е изд - 645 с.
Методы культивирования клеток.— Л. Наука, 1987 — 322 с
Ровенских Ю.А. Растровая электронная микроскопия нормальных и
опухолевых клеток — М : Медицина, 1979 — 150 с.
Современные методы морфологических исследований мозга.— М.: Изд. Ин-та
мозга, 1969 - 110 с.
Соколовский В.В. Гистохимические исследования в токсикологии.— Л :
Медицина, 1971 - 168 с.
Угрюмое М.В. Современные методы иммуноцитохимии и гистохимии. Итоги
науки и техники. Серия «Морфология человека и животных».— М :
ВИНИТИ, 1991.- Т. 15.- 117 с.
Хмельницкий О. К. Гистологическая диагностика поверхностных и глубоких
микозов — Л.* Медицина, 1973 — 239 с
Хруст Ю.Р , Литинская Л.Л., Оглобина Т.А. Основы количественной
цитохимии.— М Изд. Московского ун-та, 1978 — 226 с
532
Хрущов Н.Г. Функциональная цитохимия рыхлой соединительной ткани. — М.:
Наука, 1969.- 139 с.
Целлариус Ю.Г., Семенова Л. А. Применение поляризационной микроскопии
для гистологической диагностики ранних стадий ишемических и
метаболических повреждений миокарда//Cor et vasa.— 1977.— Vol. 19, № 1.—
P. 28-33.
Цинзерлинг А. В. Обработка и окраска мазков и срезов микроорганиз-
мов//Арх. пат.- 1992.- N° 5.- С. 35-40.
Aaron J. Е., Carter D.H. Rapid preparation of fresh-frozen undecalcified bone for
histological and histochemical analysis//J. Histochem. Cytochem.—
1987.- Vol.35.- P. 361-367.
Baker J.R.J. Autoradiography. A Compehensive Overiew,— London: Oxford.—
1983.- 423 p.
Bosler O., Beaudet A., Picket V. Characterization of chemically defined neurons
and their cellular relationships by combined immunocytochemistry and ra-
dioautographic localization of transmitter uptake sites//J. Electron. Micro-
scop. Technique.- 1986.- N4.- P. 21-39.
Catty D. Properties of antibodies and antigens//Antibodies, Vol.1. A practical
approach/Ed. D. Catty.- Oxford, 1988.- P. 7-18.
Causton B.E. The choice of resins for electron immunocytochemistry//Immunola-
belling for Electron Microscopy/Eds. J.M. Polak, l.M. Varndell.—
Amsterdam, 1984.- P. 29-38.
Coggi G., Dell'Orto O., Viale G. Avidin-biotin methods//Immunicytochemis-
try. Modern Methods and Applications//Eds. J.M. Polak, S. Van Noor-
den.- Bristol, 1986.- P. 54-70.
Daddow L. A double lead stain method for enchancing contrast of ultrathin
sections in electron microscopy: a modified multiple staining technique//J. Mi-
croscop.-1983.- Vol. 129, N2.- P. 147-153.
Friedman T. Pathology of the Ear.— Oxford — Lordon —Edinburg.: Blackwell Sci.
Publ.- 1974.- 608 p.
Grimelius L., Wilander E. Silver stains in the study of endocrine cells of the gut
and pancreas//Invest. Cell Pathol.- 1980.- Vol. 3.- P. 3-12.
Hill E.L., Elde R. An improved method for preparing cryostat sections of
undecalcified bone for multiple uses//J. of Histochem. Cytochem.— 1990.— Vol.
38.- P. 443-448.
Horisberger M. Electron-opaque markers: a review//Immunolabelling for
Electron Microscopy/Eds. J.M. Polak, l.M. Varndell.— Amsterdam, 1984.—
P. 17-26.
Humason G.L. Animal Tissue Techniques. —S. Francisco: Freeman and Company,
1972.- 3ed.- 641 p.
Immunocytochemistry. Modern Methods and Applications/Eds. J.M. Polak,
S. Van Noorden.- Bristol: Wright, 1986.- 703 p.
Immunolabling for Electron Microscopy//Eds. J.M. Polak, J.M. Varndell.—
Amsterdam, 1984.- 250 p.
Kiernan J.A. Histological, Histochemical Methods: Theory and Practice.— New
York: Pergamon Press, 1990.— 2ed.— 433 p.
Kopriwa B.M. A comparison of various procedures for fine grain development in
electron microscopic radioautography//Histochemistry.— 1975.— Vol. 44,
N3.- P. 201-224.
Lewis P.R., Knight D.P. Staining methods for sectioned material//Practical
methods in electron microscopy/Ed. A.M. Glauert.— New York
—Amsterdam-Oxford, 1977.- Vol. 5.-P. 1-311.
533
Лилли Р. Патогистологическая техника и практическая гистохимия: Пер. с
англ.- М.: Мир, 1969.- 845 с.
Liposits Zs., Gores Т., Torok A. et al. Simultaneous localization of two different
tissue antigens based on the silver intensified PAP —DAB and on the
traditional PAP-DAB method//Acta Morphol. Hung.- 1983.- Vol. 31.-
P. 365.
Mason D. Y., Woolston R.-E. Double immunoenzymatic labelling//Techniques in
Immunocvtochemistry/Eds. R.G.R. Bullock, P. Petrusz. — New York,
1982.- Vol. 1.- P. 135-152.
Pearce A.G.E. Histochemistry, Theoretical and Applied.— London: Churchil
LTD, 1972.- Vol. 1.- Ed. 3d.- 1518 p.
Пирс Э. Гистохимия теоретическая и прикладная: Пер. с англ.— М.:
Иностранная литература, 1962.— 3-е изд.— 926 с.
Reynolds E.S. The use of lead nitrate at high pH as an electron opaque stain in
electron microscopy//J. Cell. Biol.- 1963.- Vol. 17, N 1.- P. 208-212.
Romhanyi G. Submicroscopic structure of elastic fibers as observed in the
polarization microscope//Nature,- 1958.- Vol. 182.- N4640.- P. 61-62.
Ромейс Б. Микроскопическая техника: Пер. с нем.— М.: Иностранная
литература, 1953.— 12-е изд.— 720 с.
Romeis В. Mikroskopische Technik//Munchen: Urban urd Schwarzenberg,
1989.- 17 Aufl.- 697 S.
Sabatini D.D., Barnett R. Cytochemistry and electron microscopy — the
preservation of cellular ultrastructure and enzymatic activity by aldehyde
fixation//^ Cell. Biol.- 1972.- P. 19-28*.
Schmidt W.J. Anwendung der Polarisationsmikroskopie in der Histo-
chemie//Handbich der Histochemie/Hrsg. von W. Graumann, K.
Neumann.- Stuttgart: Gustav Fischer Verlag, 1958.- Bd 1.- Т.1.- S. 171 —
191.
Schuknecht H.F. Pathology of the Ear.— Cambridge, Massachusetts: Harvard
University Press, 1974.— 503 p.
Shikata T. Australia antigen in liver tissue//Jap. J. exp. Med.— 1973.— Vol.
43.- P. 231-245.
Sundler F., Hakanson R. Fluorescence histochemical methods for the study of
peptide hormone-producing cells//Brain Res. Bull.— 1982.— Vol. 9.—
P. 107-116.
Tramu G., Pillez A., Leonardelli J. An efficient method of antibody elution for the
aucessive or simultaneous localization of two antigens by immunocytochemis-
try//J. Histochem. Cytochem.- 1978.- Vol. 26.- P. 322-324.
Ugrumov M.V., Hisano S., Daikoku S. Topographic relations between tyrosine
hydroxylase- and luteinizing hormone releasing hormone immunoreactive
fibers in the median eminence of adult rats//Neurosci. Lett.— 1989a.— Vol.
102.- P. 159-164.
Ugrumov M.V., Taxi /., Tixier-Vidul A. et al. Ontogenesis of tyrosine hydroxy-
lase-immunopositive structures in the rat hypothalamus. An atlas of neuronal
cell bodies//Neuroscience. - 1989b.- Vol. 29.- P. 136-156.
Uhi G.R. An approach to in situ hybridization using oligonucleotide cDNA
probes//Molecular Neuroanatomy/Eds. F.W. Van Leeuwen et al.—
Amsterdam, 1988.- P. 25-41.
Уикли Б. Электронная микроскопия для начинающих: Пер. с англ.— М.: Мир,
1975.- 310 с.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
АБС-комплекс 178
Авидин 135, 142
Азокармин 381, 426
Азосочетание 112
Азур А 78
- 1289
- II 290
Аквон 216
Акрифлавин 438
Акролеин 160
Ализариновый красный 105
Альдегид глутаровый 52, 54
Альдегид-фуксин 434, 436
Алыдиановый синий 49, 80, 434, 509
Алюминия сульфат 444
Амилоид, окраска по Беннхольду 187
З-Амино-9-этилкарбазол 0,4 % 176
Анилин 194
Анилиновый синий 385, 426
АПУД-система 375
Аралдит 217
Ацетон 9, 57
- абсолютный 105
- горячий 87
- холодный 87
Бактериоскопия 299
Бальзам 60
Бензидин тетразотированный 59
Бензин 37
Бензол 37
Бензохинон 407
Бензо-чисто-синий 377
Бензпирен 89
Биотин 135, 142
Бриллиантовый зеленый 292
Бромфеноловый синий 58
Буфер ацетатный 114, 142
- веронал-ацетатный 56, 60, 209, 213
- какод и латный 53, 122, 214
- состав 212
- коллидиновый 123
- 5-коллидиновый 213, 214
- Кребса—Рингера
гидрокарбонатный 398
- натрий-малеатный 56, 121
- трис-малеатный 117
- трис-НС1 122, 140
- фосфатный 53, 120, 122 212, 407
- Серенсена 66, 399
Введение метки 261
Вестопал \У 216
Взятие материала для
трансмиссионной электронной микроскопии 207
Вибратомы 29
Водный голубой 427
Вырезка материалов 7
Выявление адреналина и норадрена-
лина по Хилларпу — Хекфельту 387
- АТФазы с солями свинца по Гомо-
ри в модификации Бухвалова 117
- ацетилхолинэстеразы по Карнов-
ски —Рутсу 120
- с ацетилхолиниодидом по Гомори
119
- бактерий группы клостридий 320
- чумы 320
- билирубина, гемосидерина и
липофусцина по Гленнеру 99
- вируса гепатита В по Шикате 314
- возбудителей возвратного тифа 321
- иммуноферментным методом 314
- кишечной инфекции 321
- сибирской язвы 321
- с помощью люминесцентной
микроскопии 315
- ганглиев и их отростков методом
Гольджи ускоренным 348
медленным 350
- гемоглобина 98
- гемосидерина 98
- гистохимическое аргинина 63
- дисульфидина 66
- сульфгидрильных групп 65
- тирозина 62
- триптофана 63
- цистина и цистеина 64
- гонококков 320
- ДНК по Фельгену 69
- и РНК смесью галлоцианина и
хромовых квасцов 72
- жгутиков и ресничек методом
Лайфзона 305
Леффлера 305
- железа (II) 104
- (III) 105
- калия 106
- кальция 105
- капсул бактерий методом Бурри 306
Гинса 306
Джоне 306
Клетта 306
Фридлендера 306
- кератина и слизи по Крейбергу 49
- кислот(ы) жирных 96
- фосфорной основными
красителями 71
- коринебактерий дифтерии 318
- лептоспир 321
535
- липидов бензпиреном по Бергу 89
- красителями жирорастворимыми
90
- масляным красным О 90
- ненасыщенных по Адамсу 93
- Суданом черным 90
- фосфином ЗК по Фольгу — Поппе-
РУ89
- липофусцина по Цилю — Нильсену
102
- по Шморлю 103
- меланина 100—102
- менингококков 319
- металлов тяжелых 107
- микобактерий туберкулеза и лепры
методом Киньуна 317
Френкеля 316
- монооксидазы по Гленнеру 124
- натрия 108
- нейрофибрилл и сенильных
бляшек, методика Бильшовского 362
синапсов методом Адэра и Витги-
лию 358
- методами (I—VI) Рамон-и-Кахаля
359
- нервных клеток методами
Бильшовского 355
импрегнация срезов 355
тотальная 357
серебрением с
предварительной обработкой пиридином 356
методом Глисса в модификации
Владимировой 354
Гольджи — Кокса 354
- норадреналина йодатным методом
по Хилларпу — Хекфельту 386
- оболочек миелиновой и нейрокера-
тиновой по Авцыну 346
- нервных волокон по Хеквисту 347
- оболочки миелиновой по Шпиль-
мейеру 344
в модификации Соколянского
345
- пероксидазы по Грэхему — Карнов-
ски 122
- по Грэхему — Ландхолм —Карнов-
ски 123
- пигментов желчных 99
- жировых 102
- плазмалогенов 95
- пневмококков 319
- пуриновых и пиримидиновых
оснований 69
- риккетсий в мазках 322
срезах 322
- методом Вольбаха 309
- синапсов дегенерированных
методом Рамона —Лермитта 361
- методом Гольджи — Дейнеки 352
- спирохет методом Левадити 310
- и других спиралевидных бактерий
321
кампилобактера методом Варти-
наЗП
- спор бактерий методом Биттера 308
Вайсера —Хьюппе 307
Меллера 307
Ожешки 308
- стафилококков 319
- стрептококков 319
- сукцинатдегидрогеназы 121
- триглицеридов по Адамсу 96
- хлора 108
- холестерина 94
- фосфатазы неспецифической
кислой по Гомори 114
Лойде 116
- щелочной методом азосочетания
по Гомори в модификации Берстона
114
- фосфогидролаз 118
- фосфолипидов гистохимическое 91,
92
- эстеразы неспецифической 118
Галлоцианин 46, 72
Гексацианоферрат калия 399
Гемалаун кислый Майера (водный) 43
Гематеин кислый 91
Гематоксилин 36, 41
- Ганзена 43
- Гарриса 42
- в модификации Кисели 42
- Делафильда 42
- железный 92
- Брусси 44
- Вейгерта 45, 427
- Верхгофа 434
- Гейденгайна 44
- Кораци (водный) 44
- Маллори (водный) 43
- свинцовый 399
- фосфорно-вольфрамовый 429
- по Маллори 429
- Эрлиха 41
Генциановый фиолетовый 47
Гиалуронидаза 85
Гидролиз нуклеопротеидов 74
Гистохимия аминов биогенных 97
- белков 58
- липидов 86
- неорганических веществ 103
- нуклеопротеидов 67
- пигментов 98
- углеводов 67, 75
- реакции контрольные 84 — 86
- ферментов 109
- методы индигогенные 111
536
- реакции
окислительно-восстановительные 110
Гликольметакрилат 216, 220
Глицерин 15
Глицерин-желатин 39
Р-Глицерофосфат натрия 114
Глицин-НС1-буфер 149
Гуммиарабик 39
Данзилгидразин 438
Детергенты 133
Диазобензосульфокислота 59
3,3-Д иаминобензидинтетрагидрохло-
рид(ДАБ) 176
Диастаза 86
Дибутилфталат 25, 40
Динитрофторбензол 60
ДНК 67
Дуркупан 216, 220
Желатин 38
Железо коллоидное 79
Жидкость(и) Буэна 10, 128
- Карнуа 11, 58, 510
- Мюллера 511
- фиксирующие простые 9
- Ценкера 11
Заключение срезов 39
Заливка в парапласт 18
- парафин 16, 19
- целлоидин 20
- рыхлых объектов в аралдит 217
- ткани в аралдит 217
вестопал ^ 220
водорастворимые среды 220
желатин 22
пластмассы водорастворимые 24
смесь эпона и аралдита 219
целлоидин 20
целлоидин-парафин 22
эпон 218
Заражение культуры клеток 336
Зеленый РСР прочный 58, 70
- светлый 70
Золото коллоидное 156
Идентификация клеток АПУД-систе-
мы иммунохимическая 402
методы 396
реакции аргентаффинные 389
метод Массона —Гамперля 389
Лилли 390
Гомори — Бартнера 390
аргирофильные 391
метод Гримелиуса 391
Бильшовского —Грос 392
:— Севье —Мунгера 393
- углеводов гистохимическая 76
Иммуномечение 161
- двойное 148
- метод непрямой 137
- прямой 135
Иммуноцитохимия, маркеры
электронно-плотные 155
- метод авидин-биотиновый 142
- пероксидаза-антипероксидазный
139
- мечение двойное без элюирования
150
иммунопероксидазное с элюиро-
ванием 149
методом непрямым 149
прямым 149
на серийных срезах 148
- нонимбеддинг-метод 158
- обработка ткани первичная 127
- окрашивание неспецифическое 145
- преимбеддинг-метод 159
- постимбеддинг-метод 165
- светооптическая 127
- срезы криостатные 131
- парафиновые 131
Импрегнация нервных клеток с
отростками и контактным аппаратом
по оригинальной методике Гольджи
351
- серебром базальных мембран,
ретикулярных и незрелых коллагено-
вых волокон 430
Ингибирование эндогенных
ферментов 134
Индигокармин 424
Индикаторы - акцепторы водорода
110
Индикаторы - донаторы электронов
(водорода) 111
Инструменты 6
Исследование в СЭМ 240
- цитологическое 284
- электронно-радиографическое,
анализ результатов количественный
281
Источник ткани 330
Кальций-формол 66, 89
- по Бейкеру 11, 52
холодный 119
Кармин 45, 83
Квасцы алюмокалиевые 41
- галлоицианин-хромовые 72
- железоаммонийные 44
- хромовые 46, 72
Кислота(ы) 57
- азотная 57
- глиоксиловая 397
- дезоксирибонуклеиновая (ДНК) 67
- золотохлористоводородная 151
537
- йодноватая 427
- лимонная 107
- метайодная 76
- муравьиная 57, 510
- по Фридману 512
- надмуравьиная 66
- пикриновая 53, 57
- рибонуклеиновая 67
- тиогликолевая 151
- трихлоруксусная 57, 63
- уксусная 57
- формалин-спирт-уксусная 69
- фосфорно-вольфрамовая 237, 426
- фосфорно-молибденовая 426
- хромовая 52, 56
- Шифф-йодная 76
- щавелевая 429
Классификация углеводов 75
Клетки культивируемые 323
Коллагеназа 440
Конго красный 48
Контрастирование рибонуклеопротеи-
дов регрессированное 73, 74
Красители 36
- жирорастворимые 90
- кислотные 36
- нейтральные 36
- основные 71
- фталоцианиновые 80
- цитоплазматические 46
- ядерные 36, 41, 45
- приготовление 41
Красный прочный КС 66
Крезазан 379
Крезиловый синий 78
- фиолетовый прочный 367
Криостаты 29
Кристаллический фиолетовый 78
Ксилол 37
Культура(ы) клеток органная 330
- клеток и тканей 323
- монослойная 335
- первичная 332, 334
- получение 335
- тканей, выделение коллагена 337
Лаборатория
электронно-микроскопическая 204
- оборудование 206
- размещение 205
Линии клеточные, дифференцировка
329
Люксолевый синий прочный 367
Мазки, приготовление 287
- фиксация 287
Масло терпеновое 194
Масляный красный О 90
Материал биопсийный 502
— особенности обработки 503
— способы взятия 502
Метанол-хлороформ горячий 87
Метахромазия 77
Метиленовый синий 36, 78
Метилметакрилат 25
Метиловый зеленый-пиронин 73
Метод(ы) выявления амилоида 47
— контроля специфичности иммуно-
окрашивания 147
— Маккиавелло см. Выявление рик-
кетсий в мазках
— немеченых антител 138
— Ника см. Выявление риккетсий в
срезах
— окрашивания глии Мийагавы в
модификации Александровской 365
Рамон-и-Кахаля 364
Снесарева 363
Хорнеца 366
— нервных клеток и волокон 367 —
374
— Хагеманна см. Окрашивание
флюоресцентное мазков мокроты
— элективный выявления фибрина 48
— электронно-микроскопической им-
муноцитохимии 158
Методика окраски гематоксилином и
эозином 47
Мечение двойное 171
— иммуноферментное без элюирова-
ния 153
Микроскоп(ы) 179
— инвертированные для культуры
тканей 328
Микроскопия поляризационная 179,
182
— амилоида 187
— волокон коллагеновых 188
определение типов пикросириу-
сом 192
реакция с пикросириусом
красным 190
су маховая 192
фенольная 189
ретикулярных 193
эластических 193
реакция анилиновая 194
— гликозаминогликанов кислых 194
окраска акридиновыми
производными 195
окраска тиазиновыми
красителями 194
— жиров и липидов 199
— кристаллов 200
— липидов 88
— ткани мышечной 196
— ткани нервной 197
соединительной 188
538
- флюоресцентная липидов 88
Микротомы 27 — 29
- замораживающие 28
- ротационные 28
- санные 27
Натрия гидросульфид 436
- дитионит 61
р-Нафтол 60
Нафтоловый желтый 5 58
Нингидрин-Шифф 61
Нитрат серебра, приготовление 350,
375, 431
Н-кислота 59, 377
Нож для ультратомии, приготовление
228-230
Обезвоживание тканей 14
Обработка поверхности клеток фиб-
ронектином 338
Окраска альдегид-фуксином по Гомо-
ри 436
- альциановым синим 80
- бактерий кислотоустойчивых 304
- волокон коллагеновых, методы
обзорные 421
- нервных 344
- эластических 434
альдегид-фуксином по Гомори
436
гематоксилином Верхгофа 437
резорцин-фуксином по Вейгерту
435
- гематоксилином и эозином для
мазков 294
- ДНК и РНК метиловым зеленым-
пиронином по Браше 73
- кармином по Бесту 83
- клеток нервных методом Гольджи в
модификации Блиновой 353
- метиленовым синим 81
- микобактерий по Цилю — Нильсену
304
- микроорганизмов акридиновым
оранжевым по Дарту — Тернеру 302
- в срезах азур-эозином 312
орсеином по Шикате 314
методом Гимзы 309
по Брауну —Бренну в
модификации Хмельницкого 312
Граму — Вейгерту 308
Паппенгейму 312
реактивом Шиффа 313
- карболовым тионином Николя 302
- метиленовым синим по Леффлеру
300
- основным фуксином по Пфейффе-
РУ 301
- по Граму 303
Романовскому—Гимзе 301
— нейронов 340
— методом Ниссля 341 —343
— орсеином по методу Унны — Тенце-
ра437
— резорцин-фуксином по Вейгерту 435
— рутениевым красным 82
по Л афту 82
— спор бактерий малахитовым
зеленым Шеффера — Фултона 307
— ткани гипофиза 376
— железы поджелудочной 383
щитовидной 382
— карболовым тионином Николя 310
— методом Леффлера 310
— мышечной 449
— надпочечников 386
— параганглиев 386
— соединительной 419
азаном по Гейденгайну 426
методы двухцветные 422
обзорные 421
трехцветные 425
пикро-анилиновым синим 424
пикро-индигокармином 424
пикро-пунцовым С 424
по Ван-Гизону 422
Кассону 428
Маллори 426
Массону 427
способы комбинированные 439
— шишковидного тела (эпифиз) 375
— флюоресцентное мазков мокроты
317
Оранж О 426
Оранжевый Г 385
Организация лаборатории культуры
клеток и тканей 323
Орсеин 434
Осмия тетраоксид 109
Парафин 15
Параформальдегид 59
Пероксидаза хрена 157
Пиридин 355, 356
Пиронин О 73
Поливакс 24
Полистирол 40
Полиэтиленгликоль 24
Получение и культивирование фиб-
робластов 337
эпидермоцитов 336
Посуда культуральная стеклянная 334
мытье 334
стерилизация 334
— лабораторная 5
Предшественники радиоактивные 259,
274
Препарат(ы) цитологический 286
539
- выявление гемосидерина по Перл-
су 295
ДНК по Фельгену 295
липидов Суданом черным 296
РНК по Браше 296
слизи муцикармином 295
фосфатазы кислой по Барку 297
щелочной по Хейко 297
эстеразы неспецифической по
Хейко 297
ядрышек метиленовым синим 296
- исследование полового хроматина .
298
- окраска по Алексееву срочная 291
Гимзе289
Лейшману 290
Папаниколау 291
в модификации Куницы 292
Руденко 293
Паппенгейму 290
Романовскому — Гимзе 289
- реакция на гликоген с контролем
амилазой 296
пероксидазу с бензидином 297
Приборы и устройства для
культивирования клеток 326
Просветление срезов 39
Проявитель физический 177
Пунцовый С 424
Радиоавтограф(ы), анализ 253, 266
- обработка срезов 263
- получение 263
- приготовление 263
- проявление 265
- фон 257
- электронно-микроскопические 280
- экспонирование 279
Радиоавтография 154
- светомикроскопическая 253
- электронно-микроскопическая 271
- эмульсии 264
Раствор никеля-аммония сульфата
гексагидрата 2,5 % 177
- пикро-Маллори 48
- Флемминга 55
- ЭДТА 74
Растворы буферные 214
Реактив Шиффа 61, 70
- приготовление 70
Реакции блокирования белков 67, 68
- на аминогруппы 61
- общие на белок 58
- связывания коллоидных металлов
79
Реакция Гомори ПО
- Карновски — Рутса 110
- Хэйла 79
Резорцин-фуксин 434
РНК 67
Рутениевый красный 82
Сафранин 45, 49
- О 384, 486
Силикагель 15
Синий прочный В 59, 65
- КК65
Сириус красный РЗВА 190
Сироп Апати 99
Смесь(и) Никифорова 291
- «Саномия» 455
- «Суза» 455, 511
- сулемовая 11
- «Супиформайс» 455
- с формальдегидом 52
Смолы заливочные 216
Сок черники 46
Спирт анилиновый 381
- изопропиловый 15
- поливиниловый 39
- приготовление 23
- солянокислый 63
- уксуснокислый 381
- этиловый 9, 14
Солохром цианина К 481
Соль р-глицерофосфата 110
Среда(ы) Игла 336
- заливочные 16
Срезы вибратомные 130
- кости недекальцинированной 473
заливка 474, 477, 483
получение 478, 487, 488
методы окрашивания 480, 485
- декальцинированной окрашивание
470
специальные методы 471
- культуральные и субстраты 332, 333
- полутонкие 224
- окрашивание 226
- приготовление 225
- ультратонкие 228
- окрашивание 237
- электронно-микроскопические,
нанесение эмульсии 276
Стекла предметные 34
Субкультивирование 332, 335
Судан III 36
- IV 36
- черный 90
Сулема 10
Сульфид серебра 108
Сыворотка неиммунная 134
Сочетание РЭМ и радиоавтографии
252
СЭМ, Биологические объекты 240
- высушивание ткани 245
с помощью метода перехода
критической точки 246
540
- метод(ы) высушивания ткани 249
- замораживания-высушивания
ткани 248
- обработки ткани специальные 251
- напыление на биологические
объекты в вакууме 250
- особенности фиксации ткани 242
Танин 381
Тетразолий нитросиний 122
- тринитросиний 122
Тетраоксид осмия 54, 209
ТионинЗб, 71, 78, 377
Тиохолин 120
Ткань нервная 340
- заливка в желатин по Снесареву 340
- обезвоживание 340
- фиксация 339
- костная 446
- вырезка 451
- декальцинация 456
- заливка 466
бескислотная 459
кислотная 457
- фиксация 453
Толуидиновый синий 78, 381, 400
Толуол 37
Трансмиссионная электронная
микроскопия, заливка материала 215
Трилон В 510
Ультратомия 228
- последовательность операций 232
Уранилацетат 56, 237
Устройства для приготовления
питательных средств 325
п-Фени ленд иаминд игидрох лорид /
пирокатехол 177
Ферменты протеолитические 133
Ферритин 156
Ферроцианид меди 120
Фибронектин 338
Фиксатор(ы) 8
- глутаральдегидные 211
- Жандра 53
- Замбони 128, 160
- Лилли 52
- Мая —Грюнвальда, приготовление
290
- осмиевые 208
- параформальдегидный 4 % 128
- перманганатные 213
- Рамон-и-Кахаля 339
- сложные 8
- «Суза»63, 109, 455
- формол-солевой 10 % 128
- формол уксусный 2,5 % 128
- ФСУ52
- Элфтмана 56
Фиксация для гистохимических
реакций 51
- общие принципы 8
Фильтры поляризационные 180
Формалин 9, 52, 66
- нейтральный 12, 69
Формалин-этанол 105
Формальдегид 52, 101
- приготовление смесей 53
Формол солевой 10
Фосфаты нафтолов 115
Фосфин ЗК 89
Фуксин 70
- основной 78, 435
Хлорамин Т 61
4-Хлор-1-нафтол 176
Хлороформ 522
Хроматы 56
Хромотроп 2В 427
Целлоидин 20
Цитология, взятие материала 285, 286
Черный прочный К 65
ШИК-реакция 76
ЭДТА512
Экстракция липидов 87
Эластаза 441
Эозин водорастворимый 46, 292
- спиртовой 46, 292
Эпон 74, 216
Эриоцианин А 384
Эритрозин 46
- приготовление 49
Эфир горячий 87
Ядерный красный 444
ОГЛАВЛЕНИЕ
Предисловие 3
Глава 1. Организация и оснащение патогистологической
лаборатории. Л. В. Лысенко, З.П. Милованова 4
Глава 2. Взятие и фиксация материала. З.П. Милованова 7
Глава 3. Обезвоживание и заливка материала. З.П. Милованова .... 14
Глава 4. Приготовление гистологических срезов. З.П. Милованова,
Л. В. Лысенко 26
Глава 5. Общие принципы и методы окрашивания гистологических
препаратов. З.П. Милованова, Л.В. Лысенко 36
Глава 6. Основные гистохимические реакции. И.Б. Бухвалов 51
Глава 7. Современные иммуноморфологические методы. М.В.
Угрюмое 125
Глава 8. Поляризационная микроскопия. Л.В. Кактурский 179
Глава 9. Принципы электронно-микроскопического исследования и
организация работы электронно-микроскопической
лаборатории. Б.В. Втюрин, А.А. Пальцын 204
Глава 10. Подготовка материала к исследованию в трансмиссионном
электронном микроскопе. Б.В. Втюрин, А.А. Пальцын 207
Глава 11. Приготовление полутонких срезов и их окрашивание.
Б.В. Втюрин, А.А. Пальцын 224
Глава 12. Приготовление ультратонких срезов и их окрашивание.
Б. В. Втюрин А.А. Пальцын 228
Глава 13. Подготовка материала к исследованию в сканирующем
электронном микроскопе. Б.В. Втюрин, А.А. Пальцын 240
Глава 14. Светомикроскопическая радиоавтография. А.А. Пальцын . . . 253
Глава 15. Электронно-микроскопическая радиоавтография. А.А.
Пальцын 271
Глава 16. Принципы цитологического исследования, способы
получения материала и техника приготовления цитологических
препаратов. А. С. Петрова, Н.Ю. Полонская 284
Глава 17. Основные методы окрашивания цитологических препаратов.
А.С. Петрова, Н.Ю. Полонская 289
Глава 18. Выявление простейших, бактерий, вирусов и грибов.
\А.В. Цинзерлинг\, Н.Б. Шалыгина 299
Глава 19. Культивирование клеток и тканей. В.П. Туманов 323
542
Глава 20. Окрашивание нервной ткани. Г.Н. Кривицкая 339
Глава 21. Окрашивание ткани эндокринных желез и элементов АПУД-
системы. И.М. Кветной, В. В. Южаков 375
Глава 22. Окрашивание соединительной и мышечной тканей.
Л. Б. Шехтер 419
Глава 23. Особенности исследования костной ткани. Г.Н. Берченко,
СМ. Липкин 446
Глава 24. Особенности обработки биопсийного и операционного
материала. Ю.Л. Перов, В.П. Быкова, М.Н. Сорокина 500
Глава 25. Особенности работы с экспериментальным материалом.
З.П. Милованова 519
Глава 26. Хранение материалов гистологического (патом о рф о
логического) исследования, их анализ и работа с архивом.
Ю.Л. Перов 524
Приложение 528
Рекомендуемая литература 532
Предметный указатель 535
Руководство
МИКРОСКОПИЧЕСКАЯ ТЕХНИКА
Зав. редакцией А.К. Владимирова
Научный редактор М.Н. Ланцман
Редактор издательства Н.В. Кирсанова
Редактор Н.Д. Карцева
Художественный редактор СМ. Лымина
Художник В.С. Сергеева
Технический редактор Н.М. Гаранкина
Корректор Т.Г. Ганина
ЛР № 010215 от 11.03.92. Сдано в набор 19.07.96. Подписано к печати 25.09.96. Формат
бумаги 60х90,/1Н. Бумага офс. № 1. Гарнитура Петербург. Печать офсетная. Усл.печ.л. 34,25.
Усл.кр.-отт. 35,25. Уч.-изд.л. 34,24. Тираж 3000 экз. Заказ № 640 «С» 075.
Ордена Трудового Красного Знамени издательство «Медицина». 101000, Москва, Петровериг-
ский пер., 6/8.
Диапозитивы изготовлены в фирме «Литан». Москва, Кронштадтский б-р, 37-Б.
Отпечатано с готовых диапозитивов в типографии ВО «Внешторгиздат». 127576, Москва,
ул. Илимская, 7.
К стр. 516.
Рис. 7. Аппарат «Нурегсеп1:ег ХР» для проводки материалов пункциоиных и
эндоскопических биопсий с одномоментной загрузкой 200 кусочков.
К стр. 517.
Рис. 8-. Универсальный автоматизированный ротационный микротом НМ-360
со сменными лезвиями, укрепленными в специальном держателе. Одним
лезвием производят резку до 60 блоков.
К стр. 517.
Рис. 9. Ротационный
микротом НМ-340 Е.
а — общий вид; 6 ~
увеличенная деталь микротома:
срезы расправляются па потоке
подогретой дистиллированной
воды и поступают в ваппочку.
!» ч • • С С- **?**»*•
• А •*> * • * * * * * » % % *
• ••**%!**%***«
• ••**«**.* **«*
«*«* №***««««<
*»*••*******
»*•■****■**»■■*«
К стр. 517.
Рис. 10. Многопрограммный автомат «Уап$г.ат ХУ»
Рис. 11. Малогабаритная центрифуга «Суг,озрт» для безопасного
изолированного приготовления стандартных цитологических мазков.
К стр. 518.
Рис. 12. Некоторые современные микроскопы фирмы «Каг1 2е135 ^па СтЬХ»
(Германия).
а — микроскоп для лабораторий и врачебной практики «АхЫаЬ»; б — прибор для
люминесцентной и фазовоконтрастной микроскопии «Ах'ювкор»; в — современный исследовательский
фотомикроскоп «Ахюрпо!:», применяемый в медицине и биологии.