Text
ш
КОРРОЗИЯ УР/1НЛ
И ЕГО СПЛАВОВ
АТ0МИЗДАГ1965
в. В. ГЕРАСИМОВ
КОРРОЗИЯ УРАНА
И ЕГО СВААВОВ
УДК 546.791 : 620.193.01
В книге на современном научном уровне рассмат-
ривается коррозионное поведение урана и его сплавов
в средах, представляющих интерес для атомной про-
мышленности. Приводятся данные по влиянию соста-
ва сплавов и коррозионной среды, термической обра-
ботки. покрытии и других факторов на стойкость ура-
на и его сплавов.
Книга рассчитана на инженеров и исследователей,
работающих в атомной промышленности.
ВВЕДЕНИЕ
Уран — основное ядерное горючее и основной мате-
риал для Получения ядерного горючего, используемого
в реакторах. Надежная работа атомного реактора су-
щественно зависит от целостности его тепловыделяю-
щих элементов. Разрушение тепловыделяющего элемен-
та и попадание ядерного горючего и продуктов деления
в теплоноситель могут привести к активации первого
контура со всеми вытекающими отсюда последствиями.
Ядерное горючее в тепловыделяющих элементах обыч-
но покрывается металлической оболочкой, препятствую-
щей контакту его с теплоносителем. Однако в процессе
эксплуатации полностью не исключаются случаи нару-
шения целостности оболочки тепловыделяющего элемен-
та. При этом теплоноситель вступает в контакт с ядер-
ным горючим и вызывает коррозию последнего. Знание
коррозионной стойкости ядерного горючего и механиз-
ма коррозионных процессов позволит наиболее рацио-
нально подойти к выбору топливных композиций, усло-
вий термической обработки и водного режима первого
контура.
Следует заметить, что вода в настоящее время —
наиболее распространенный теплоноситель в ядерных
реакторах. Вследствие этого в предлагаемой читателю
монографии основное внимание уделено коррозионной
стойкости урана и его сплавов в воде. В процессе полу-
чения, обработки и эксплуатации уран подвергается воз-
3
действию воздуха, кислот, расплавленных солей, раз-
личных газов, воды, пара, жидких металлов и других
сред, что вызывает его коррозию. В связи с этим в мо-
нографии широко использованы имеющиеся в литерату-
ре данные по стойкости урана и его сплавов в различ-
ных средах. Рассматриваются также возможные пути
повышения стойкости урана: легирование, термическая
обработка, применение ингибиторов, покрытие и т. д.
Глава I
ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА УРАНА
И ПРОДУКТОВ КОРРОЗИИ УРАНА
Уран — элемент VI группы периодической системы,
подгруппы хрома. Порядковый номер его 92, атомный
вес 238. Известен ряд изотопов урана. Плотность урана
19 г/сл13, температура плавления 1133°. Существуют три
кристаллические формы металлического урана. До тем-
пературы 660° устойчив а-уран, кристаллизующийся в
ромбической системе с параметрами решетки а = 2,854 А,
Ь = 5,867 А, с = 4,957 А. При 660—760° устойчива те-
трагональная p-модификация с параметрами решетки
а = b — 10,590 А, с = 5,634 А. Элементарная ячейка со-
держит 30 атомов.
От 760° до температуры плавления уран кристалли-
зуется в у-форме с объемноцентрированной решеткой
с параметром а = 3,474 А.
Металлический уран — весьма реакционноспособный
элемент. Он легко реагирует со всеми неметаллами и об-
разует интерметаллические соединения. Даже в ваку«
уме при комнатной температуре на поверхности ура-
на образуется окисная пленка. Уран является доста-
точно электроотрицательным металлом и в ряду напря-
жений стоит между бериллием и алюминием. В табл. 1
приводятся стандартные электродные потенциалы урана
и потенциалы окислительно-восстановительных реакций
урана и его соединений. Следует заметить, что данные
различных авторов зачастую разнятся между собой.
В своих соединениях уран имеет валентность от
+2 до +6.
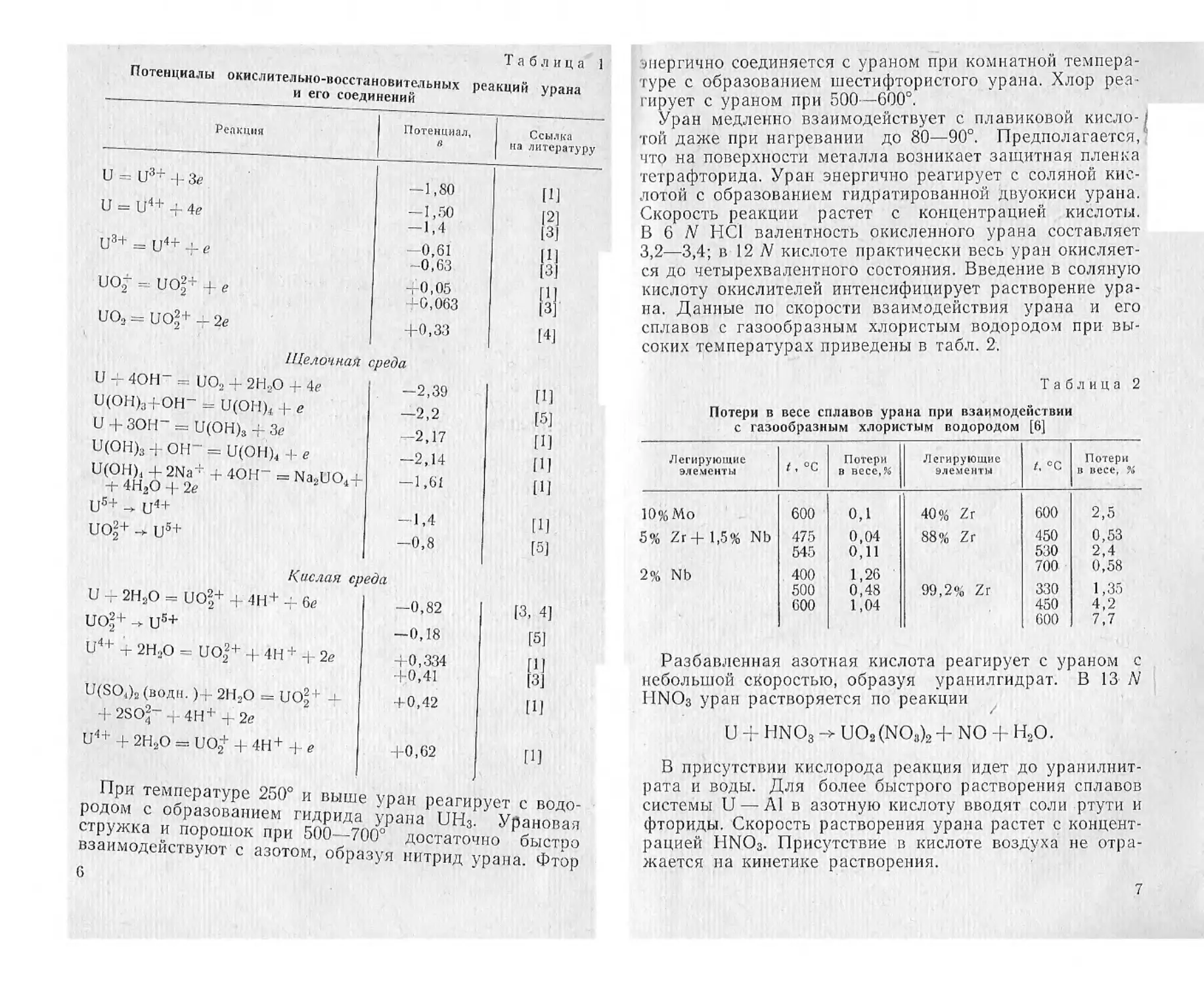
Таблица
Потенциалы окислительно-восстановительных реакций урана
и его соединений
Реакция Потенциал, Ссылка на литературу
и- = flj3? + Зё . -1,80 m
U = U4+ + 4е -1,50 |2] 13]
(j3+ __ Д_ е -0,61 -0,63 11!
UOJ- = UO|+ 4- е +0,05 +0,063 11!
UO2 = UO1+ + 2е +0,33 [4]
Щелочная среда
U + 4ОН" = UO2 + 2Н2О + 4е -2,39 [И
U(OH)3+OH- = U(OH)< + е —2,2 [5]
U + ЗОН" = U(OH)3 + Зе -2,17 (П
U(OH)3 ОН- = U(OH)4 -1- е -2,14 П1
U(OH)4 + 2Na+ + 4ОН- = Na2UO4+ + 4Н2О + 2е -1,61 [И
и5+ -> и4+ —1 4 [1]
UO|+ -> us+ -0,8 (5)
Кислая среда
U - 2Н3О = UO|+ + 4Н+ + бе -0,82 (3, 4]
ио|+ - и5+ -0,18 [51
U4+ + 2Н2О = ио22+ + 4Н+ -|- 2е +0,334 +.0,41 [И [3]
U(SO4)2 (води.) г 2Н3О = ио|+ + +0,42 [1]
+ 2SO2- + 4Н+ + 2е U4+ + 2Н2О = UO^ + 4Н+ + е +0,62 [1]
При температуре 250° и выше уран реагирует с водо-
родом с образованием гидрида урана UH3. Урановая
стружка и порошок при 500—700° достаточно быстро
взаимодействуют с азотом, образуя нитрид урана. Фтор
6
энергично соединяется с ураном при комнатной темпера-
туре с образованием шести фтор истого урана. Хлор реа-
гирует с ураном при 500—600°.
Уран медленно взаимодействует с плавиковой кисло-1
той даже при нагревании до 80—90°. Предполагается, •
что на поверхности металла возникает защитная пленка
тетрафторида. Уран энергично реагирует с соляной кис-
лотой с образованием гидратированной двуокиси урана.
Скорость реакции растет с концентрацией кислоты.
В 6 W HCI валентность окисленного урана составляет
3,2—3,4; в 12 N кислоте практически весь уран окисляет-
ся до четырехвалентного состояния. Введение в соляную
кислоту окислителей интенсифицирует растворение ура-
на. Данные по скорости взаимодействия урана и его
сплавов с газообразным хлористым водородом при вы-
соких температурах приведены в табл. 2.
Таблица 2
Потери в весе сплавов урана при взаимодействии
с газообразным хлористым водородом [6]
Легирующие 0„ Потери
элементы
Потери
в весе, %
10%Мо 600 0,1
5% Zr + 1,5% Nb 475 0,04
545 0,11
2% Nb . 400 1,26
500 0,48
600 1,04
40% Zr
88% Zr
99,2% Zr
600
450
530
700
330
450
600
2,5
0,53
2,4
0,58
4^2°
Разбавленная азотная кислота реагирует с ураном с
небольшой скоростью, образуя уранилгидрат. В 13 N
HNO3 уран растворяется по реакции
U + HNO3 UO2 (NO3)2 + NO -Ь Н2О.
В присутствии кислорода реакция идет до уранилнит-
рата и воды. Для более быстрого растворения сплавов
системы U — А1 в азотную кислоту вводят соли ртути и
фториды. Скорость растворения урана растет с концент-
рацией HNO3. Присутствие в кислоте воздуха не отра-
жается на кинетике растворения.
Таблица <
Влияние легирующих элементов на скорость растворения урана
в азотной кислоте [6)
Легирующий элемент Концентрация кислоты, А' Скорость растворе- ния сплава
11 I9
0,5% А1 11 1,23
11 + 10~3 М Mg2T 1,25
2,5% Сг 11 з
2,5% Zr 11 Незначительная
11 -F-(lll': HNO,=-1 : 24) 2,05
11 . F~ (HF : HNO3=1 : 12) 1.26
1% Мо 9 0,45
5,3 0,98
0,1% Si 11 0,5
5 1,1
Легирование урана в значительных количествах мо-
либденом, ниобием, цирконием существенно замедляет
растворение сплавов в азотной кислоте (табл. 3). Для
ускорения процесса растворения сплава урана с 10% Мо
в кислоту вводят добавки, например 6 г/л азотнокислого
железа или 20,5—40 г,1л фосфорной кислоты. Такие до-
бавки могут давать комплексы с молибденом и препят-
ствовать образованию молибденовой кислоты. Во избе-
жание образования гремучей смеси растворение ведут в
атмосфере азота. Тройной сплав урана с 5% Zr и 1,5%
Nb целесообразно растворять в 3—15 N азотной кислоте
с добавкой 0,01—0,1 N плавиковой кислоты. Отношение
содержания фтора к цирконию должно быть равно 4 и
концентрация урана в кислоте — меньше 12 г/л. В смеси
6 М фторида аммония с 0,5 М нитрата аммония ско-
рость растворения сплава урана с 9% Zr составляет в
течение первых 9 ч 0,6 г/см2 ч. В расплаве 3ZrCl< • 2РоС13
при 360е скорость растворения сплава урана с 95% Zr
составляет 6 мг/см2 • мин.
Уран не реагирует с 6 A' H2SO4. Скорость растворе-
ния урана в кипящей серной кислоте такая же, как и в
воде. Горячая концентрированная серная кислота мед-
ленно реагирует с ураном с образованием бисульфата
8
урана. Окислители и анодная поляризация ускоряют
растворение урана в серной кислоте. Холодная 85%-ная
фосфорная кислота медленно взаимодействует с ураном.
При нагревании этот процесс интенсифицируется. В бо-
лее концентрированной кислоте при длительном нагре-
вании реакция идёт быстро с образованием фосфата
четырехвалентного урана. Разбавленная хлорная кисло-
та практически не взаимодействует с ураном; 90%-ная
Рис. 1. Коррозия урана в кислотах [6]:
1 — 12/V НС1; 2 — 50-85%-ная Н3РО4 и 2—
38%-ная НС1, уран анодирован при U — 12 в,
3 — 36 NH1SO,. Уран анодирован при
и- 12 в; 4-6 N на,- 5- 12 Л' HNО,;
C-6/VHNO,.
кислота реагирует с ним бурно. Муравьиная, уксусная,
пропионовая, масляная кислоты, как разбавленные, так
и безводные, не реагируют с ураном. Данные по скоро-
сти растворения урана в различных кислотах приведены
на рис. 1.
Щелочи слабо действуют на уран. Введение в щелочи
окислителей ускоряет растворение в них урана. В кис-
лых средах нерастворимые продукты коррозии на по-
верхности урана не образуются. Образующиеся в нейт-
ральных средах продукты коррозии удаляются с урана
либо в 20°/о-ной азотной кислоте, либо в кипящем рас-
творе, содержащем 25 г/л хромового ангидрида и
35 мл/л ортофосфорной кислоты с удельным весом 1,7.
Окисная пленка, возникающая при анодировании ура-
на, снимается в 1—10%-ной лимонной кислоте при тем-
пературе 20° и анодной поляризации с плотностью тока
0,3 а/дм".
Наиболее устойчивой валентной формой является ше-
стивалентный уран. В кислых и нейтральных средах он
существует в виде иона уранила иОг+> в щелочных сре-
дах — в виде иона диуранита (U2O7)2-. В зоне радиации
валентность ионов урана может изменяться.
Азотнокислый уранил UCMNOah— желтовато-зеле-
ная соль, расплывающаяся во влажном и выветриваю-
щаяся в сухом воздухе. Соль хорошо растворима в воде:
при 21° растворимость составляет 56%. Разлагается при
температуре свыше 200°. Сернокислый уранил UO2SO4 —
зеленого цвета. В воде при 15° растворяется до 14,82%
соли, в серной кислоте труднорастворима. Гидрат окиси
уранила кирпично-красного цвета; плохо растворим в
воде. Произведения растворимости UO2(OH)2, ЩОН)з,
U(ОН) 4 составляют соответственно 2 • 10_|®, 10-19, 10-45.
Растворы солей уранила обычно окрашены в желтый
цвет. Растворы солей четырехвалентного урана — темно-
зеленые, трехвалентного урана — пурпурно-красные.
Уранил гидролизуется по уравнению
2UO2+ +Н2О = й2ф + 2Н+-
с константой гидролиза 1,1 • 10-6. В свою очередь U2Os+
гидролизуется по уравнению
U2Os+ + UO1+ + Н,0 = U3Os+ + 2Н+
с константой гидролиза 5 • 10—9, a U3Os+ —по уравне-
нию
и,о;+ + н,о = иао,он+ + н+
с константой 2,8 • 10~4.
При взаимодействии урана с водой, паром, кислоро-
дом, углекислым газом и другими средами на поверхно-
сти металла образуются продукты коррозии в виде окис-
лов, гидридов, карбидов. Так, при коррозии в воде на
поверхности урана образуется темно-коричневая мелко-
зернистая пленка двуокиси урана UO2. Некоторые свой-
ства двуокиси урана приведены в табл. 4. Двуокись ура-
на, возникшая в процессе коррозии, имеет меньшую
10
юйства окислов урана [2, 7, 8]
плотность, чем двуокись, полученная другими способа-
ми. Давление паров двуокиси урана довольно велико'
уже при температурах значительно ниже точки ее плав-
ления. Двуокись урана испаряется в виде UO2, в то вре-
мя как другие окисли урана при испарении разлагают-
ся. Зависимость давления паров двуокиси урана от тем-
пературы в интервале 1600—2700° выражается уравне-
нием
Igp = 13 34 - 3’737’10‘ 3,67-1О6 + 2,4638-Ю9
Упругость диссоциации двуокиси урана зависит от со-
держания в ней кислорода. Так, при 1000° для UCh.ise и
U02,oi8 1g pOi равен соответственно —6 и —9 [7].
Электропроводность двуокиси урана стехиометриче-
ского состава при 100° составляет 0,02 ом~'-см~х, при
500° равна 0,1 ом~' - см При 500° ионная электропро-
водность равна 9,6- 10-11 ом~' ‘СМ~'.
Двуокись урана — полупроводник p-типа. Электропро-
водность окисла, зависит от содержания в нем кислоро-
да. Чистая двуокись урана без избыточного кислорода
имеет минимальную электропроводность.
Порошок двуокиси урана окисляется на воздухе. Ес-
ли размеры частиц составляют 0,1 мк, процесс сопро-
вождается интенсивным нагреванием. При этом проис-
ходит частичное превращение двуокиси урана в закись-
окись. Двуокись урана не реагирует с деаэрированной
водой и ее парами до температуры 300°. Вода, содержа-
щая кислород, окисляет двуокись урана до UO3 • 0,8Н2О.
Свойства ее при этом также не изменяются. Двуокись
урана нерастворима в соляной кислоте, щелочи и рас-
творяется в концентрированной азотной кислоте, царской
водке, смеси азотной и плавиковой кислот. При раство-
рении двуокиси урана в перекиси натрия образуется
Na2UO4. Скорость растворения двуокиси урана в азот-
ной кислоте связана с температурой уравнением Арре-
ниуса. В 14 N HNO3 скорость растворения двуокиси ура-
на при 20 и 95° составляет 0,3 и 20 мг/см2 • мин соответ-
ственно [9].
Гидроокись урана U(OH)4, или UO2-2H2O, может де-
гидратироваться при нагревании в воде до температур
свыше 285°. Энергия активации окисления двуокиси ура-
на в парах воды равна 5—10 ккал/моль. Гидроокись
12
урана выпадает в растворе при коррозии урана в среде
с рН>4. В нейтральной среде продукты коррозии ура-
на состоят в основном из коллоидальной гидроокиси
UO2 • 2Н2О.
В случае окисления урана на воздухе при температуре
свыше 250°, а также при коррозии в кипящей воде под
вакуумом или в воде с перекисью водорода на поверх-
I пости металла образуется закись-окись ОзОв, а также
UO3 и UO4. В зависимости от условий образования цвет
ее изменяется от зеленого до черного. Закись-окись
урана электропроводка и обладает полупроводниковыми
свойствами. Она не растворяется в воде и разбавленных
кислотах, но медленно растворяется в концентрирован-
ных минеральных кислотах с образованием смеси солей
урана и уранила.
Трехокись урана ПОз существует в одной аморфной
и пяти кристаллических формах. Упругость диссоциации
трехокиси стехиометрического состава при 1873° состав-
ляет 10-4 ат и зависит от содержания кислорода в окис-
ле. Электропроводность UO3 до 300° крайне мала и уве-
личивается при 350—490°. Трехокись урана растворяется
во всех минеральных кислотах и в растворах солей ще-
лочных металлов.
При действии облучения на растворы солей урана об-
разуется черный гидрат двуокиси урана UO2 • 2Н2О.
Влажный аморфный гидрат двуокиси урана окисляется
на воздухе до UO3 • Н2О. Окисление происходит медлен-
но на холоду и быстро при нагревании. Кристаллический
гидрат двуокиси урана устойчив на воздухе при ком-
натной температуре. При нагревании он превращается в
зеленую закись-окись урана.
Гидрат закиси-окиси ПзОз • хН2О на воздухе легко
окисляется до гидрата трехокиси урана. Гидраты трех-
окиси значительно устойчивее гидратов двуокиси и за-
киси-окиси урана. Потенциал платинового электрода, по-
крытого двуокисью, закисыо-окисью или гидратом трех-
окиси урана, составляет от —0,770 до —0,86 в. Содер-
жание урана и воды в различных окислах урана приве-
дено в табл. 4. В двуокиси урана, образовавшейся в
результате коррозии, содержание урана меньше стехио-
метрического.
При взаимодействии урана с водой и водяным паром
образуется гидрид урана UH3. Он представляет собой
13
коричневато-черный или коричневато-серый пирофорный
порошок. Гидрид урана имеет две модификации с куби-
ческой кристаллической решеткой. Удельное сопротив-
ление гидрида урана равно 0,47 ом • см. Зависимость уп-
ругости диссоциации гидрида урана от температуры в
интервале 300—400° выражается уравнением
рп. ст.) = -!^1 -6,0146lgT+28,92.
При температуре 200—300° гидрид урана медленно
реагирует с парами воды с образованием двуокиси ура-
на. Гидрид урана растворяется в 6—12 /V НО, хлорно-
ватой и концентрированной фосфорной кислотах. В по-
следнем случае образуется фосфат четырехвалентного
урана. Гидрид урана легко восстанавливает 6 .V или
концентрированную азотную, кислоту до двуокиси азота.
При взаимодействии гидрида урана с горячей концентри-
рованной серной кислотой образуется сульфат четырех-
валентного урана. Гидрид не взаимодействует с щелоча-
ми. Растворимость гидрида урана в т-уране составляет
(1,5—1,7) • 10-3 % и в а-уране 2 • 10-4%.
В результате взаимодействия урана с углекислотой
при высокой температуре образуются карбиды UC,
U2C3, UC2. На воздухе при 400° карбиды окисляются до
закиси-окиси урана и углекислого газа. Карбиды разру-
шаются водой при температуре 80° и выше с выделени-
ем водорода. Нормальный потенциал UC равен 0,32 в.
Карбиды урана разлагаются разбавленными растворами
серной, соляной, азотной кислот с образованием солей
уранила. Концентрированные кислоты и щелочи при
комнатной температуре практически не действуют на
карбиды урана и энергично растворяют их при высокой
температуре.
Глава П
КОРРОЗИЯ УРАНА В ВОДНЫХ СРЕДАХ
В ряде работ [10] принимается, что коррозия урана
происходит в результате химического взаимодействия
урана с водой по реакциям:
U -I- 2Н.0 -> UO2 Н- 2Н3;
U 4- 3'2HS -> UH3;
UH3 + 2H2O->UO2 + 7/2Н2.
Делались попытки объяснить изменение скорости кор-
розии урана под влиянием растворенного в воде водоро-
да с точки зрения влияния последнего на свойства за-
щитной окисной пленки, образующейся на поверхности
металла. Между тем ряд обстоятельств свидетельству-
ет о том, что взаимодействие урана с водой представляет
собой электрохимический процесс. Так, с увеличением
потенциала урана и сплава урана с 5% Zr скорость кор-
розии металла и анодного процесса снижается (рис. 2)
[11]. Такое явление наблюдается при наступлении пас-
сивности. Под пассивностью обычно понимают резкое
уменьшение скорости растворения металла в условиях,
когда он термодинамически нестоек вследствие тормо-
жения анодного процесса, обусловленного образованием
адсорбционных или фазовых защитных слоев.
При отсутствии пассивности металлы в большинстве
практически важных случаев растворяются в активном
15
состоянии. Скорость анодного процесса I в этом случае
зависит от потенциала по уравнению
1 Rr
где К, р — постоянные; п— валентность металла; F —
число Фарадея; <р — потенциал металла; R — универ-
сальная газовая постоянная; Т — температура, °К.
Рис. 2. Зависимость скорости коррозии от потенциа-
ла в деаэрированном 0,1 N растворе KsSO4 (pH =
= 5,4, продолжительность взаимодействия 150 мин):
1 — уран; 2 —сплав урана с 5% Zr.
В активном состоянии могут протекать следующие
анодные реакции:
U + 2OH-->UO(OH) \ 2е\
U + 2О2~ -> UO8 + 4е;
UO (ОН) + ОН- -> UO (ОН)2 + е.
Наиболее медленной стадией, определяющей скорость
процесса перехода ион-атомов металла из кристалличе-
ской решетки в раствор, является стадия ионизации ме-
талла.
На анодной поляризационной кривой растворению
металла в активном состоянии отвечает участок АВ
16
(рис. 3). При достижении определенного потейЙЖда*
<рФл (см. рис. 3), называемого фляде-гуэтепЗйшчв^на
поверхности металла начинается обр^зрвдрие адсорб-
ционных, или фазовых, пасмрИчНИтц^^тлоев. Металл
при этом переходит в пассивное состояние и остается в
нем до потенциала перепассивации <рп.п- В пассивном со-
стоянии (участок CD кривой) скорость анодного процес-
са растворения металла не зависит от потенциала. При
потенциалах, более
положительных, чем
Фл.п, скорость анод-
ного процесса ра-
стет с потенциалом
и металл растворяет-
ся в области пе-
репассивации (уча-
сток DE кривой). С
варьированием сос-
тава среды изме-
няется положение
характерных точек и
участков анодной по-
ляризационной кри-
вой.
С увеличением
pH среды скорость
растворения -----
металлов в
ной области , ,
постоянном потенциале) возрастает. Предполагают, что
гидроксил-ионы образуют с поверхностными атомами ра-
створяющегося металла комплексы (МОН). Концентра-
ция комплексов, или заполнение ими поверхности, мо-
жет быть оценена при помощи уравнения Нернст.а
[МОН]=К'<гон_ехр-й-.
ряда рис з Анодная поляризационная кри-
актив- вая пассивирующегося металла.
(при
При этом предполагается, что реакция
Н2О;±Н+ + ОН-
в поверхностном слое сдвигается вправо. В силу этого
поверхностная концентрация гидрокеил-иона может зна-
чительно превышать объемную. Комплекс МОН образу-,
2 В. В. Герасимов 17
др- ет Q соседними атомами металла и гидроксил-ион а мп
промежуточное соединение, которое впоследствии раз-
лагается с регенерацией комплекса, являющегося в дан-
ном процессе как бы катализатором. Скорость анодного
процесса при этом выражается уравнением
". = /Г [МОН] аон_ехр “Р
Из этого уравнения, подтвержденного эксперименталь-
но, следует, что с ростом концентрации гидроксил-иона
скорость анодного процесса растворения металла в ак-
тивном состоянии возрастает. Так, гидроокись натрия в
концентрации 0,01 N увеличивает общую коррозию ура-
на, но вместе с тем подавляет развитие язв. Однако из
этого не следует, что во всех случаях скорость коррозии
растет с увеличением pH. Фляде-потенциал отвечает по-
тенциалу адсорбционно-химического взаимодействия по-
верхностных ионов металла с гидроксил-ионом или, как
иногда говорят, с кислородом воды. Потенциал этот,
естественно, зависит от pH и смещается в отрицатель-
ную сторону на 0,059 в с увеличением концентрации гид-
роксил-иона в 10 раз, В связи с этим при достаточно вы-
соких pH стационарный потенциал металла будет боль-
ше, чем фляде-потенциал, и металл будет находиться в
пассивном состоянии.
Следует отметить, что величина 1g i мако (см. рис. 3),
при достижении которой начинается пассивация метал-
ла, уменьшается с ростом pH. Скорость, анодного процес-*
са в пассивном состоянии также зависит от pH. Количе-
ство ионов гидроксила, адсорбированных на поверхно-j
сти (си), пропорционально концентрации гидроксил-ио-
нов в среде и связано экспоненциальной зависимостью с
потенциалом
Скорость анодного процесса
г, , fyiFv
i. = Kc'expJ^,
гае с' — количество ион-атомов на 1 см2 поверхности ме-
талла, принимающих участие в анодном процессе. В пер-
18
вом приближении можно принять, что с' обратно пропор-'
ционально сп. Комбинируя последние два уравнения, по-
лучаем
В тех случаях, когда величина р близка к рь скорость
анодного процесса в пассивном состоянии не зависит от
потенциала и обратно пропорциональна концентрации
гидроксил-иона.
Выход металла в перепассивацию связан с наруше-
нием пассивного состояния. Если пассивность обуслов-
лена адсорбцией гидроксил-иона, то выход в перепасси-
вацию происходит при достижении потенциала кисло-
родного электрода, когда протекает реакция
40Н-->02 + 2НйО + 4е.
В этом случае потенциал перепассивации <р„. п (см.
рис. 3) отвечает значению равног-.есного кислородного
[электрода и уменьшается на 0,059 в с увеличением pH
на единицу.
При потенциалах пассивной области и особенно при
достижении потенциала кислородного электрода, когда
па электроде выделяется кислород, на поверхности ряда
металлов образуется окисная пассивирующая пленка.
В этом случае потенциал перепассивации больше, чем
потенциал кислородного электрода. Псрепассивация на-
I ступает при потенциале образования растворимых ионов
высшей валентности. В ряде случаев этот потенциал
близок к потенциалу кислородного электрода.
Возникающая в процессе коррозии урана окисная
пленка способствует пассивации металла. Двуокись ура-
на достаточно хорошо сцеплена с металлом. Между кри-
сталлическими решетками двуокиси урана и урана
имеется структурное соответствие. Так, кристаллографи-
ческая плоскость (НО) двуокиси урана параллельна
плоскости (100) сплава урана с ниобием. В присутствии
кислорода в воде образуется более плотная пленка про-
дуктов коррозии с более высокими защитными свойства-
ми [12]. При непрерывном барботаже кислорода через
кипящую воду поверхность урана, быстро покрывается
черной защитной пленкой. Пленка окисла, полученная;
2* 19)
при анодировании в 0,1 Л' растворе КОН, увеличивает
стойкость сплава урана с 4—6°/о Zr. При анодной поля-
ризации на поверхности урана возникает фазовая окис-
1ная пленка, состоящая из двуокиси урана. Толщина ее
J растет с увеличением потенциала и при напряжении на
клеммах 70 в может достигать 3000 А. Нагрев анодиро-
ванного урана на воздухе при 120° практически не из-
меняет цвета и толщины окисной пленки.
Поскольку уран принадлежит к числу пассивирую-
щихся металлов, его анодная поляризационная кривая
сходна с кривой, приведенной на рис. 3. Стационарный
потенциал металла <рст отвечает равенству скоростей
анодного и катодного процессов (пересечение прямых
АВ и /</< на рис. 3). В активном состоянии устанавли-
вается стационарный потенциал фст.а-
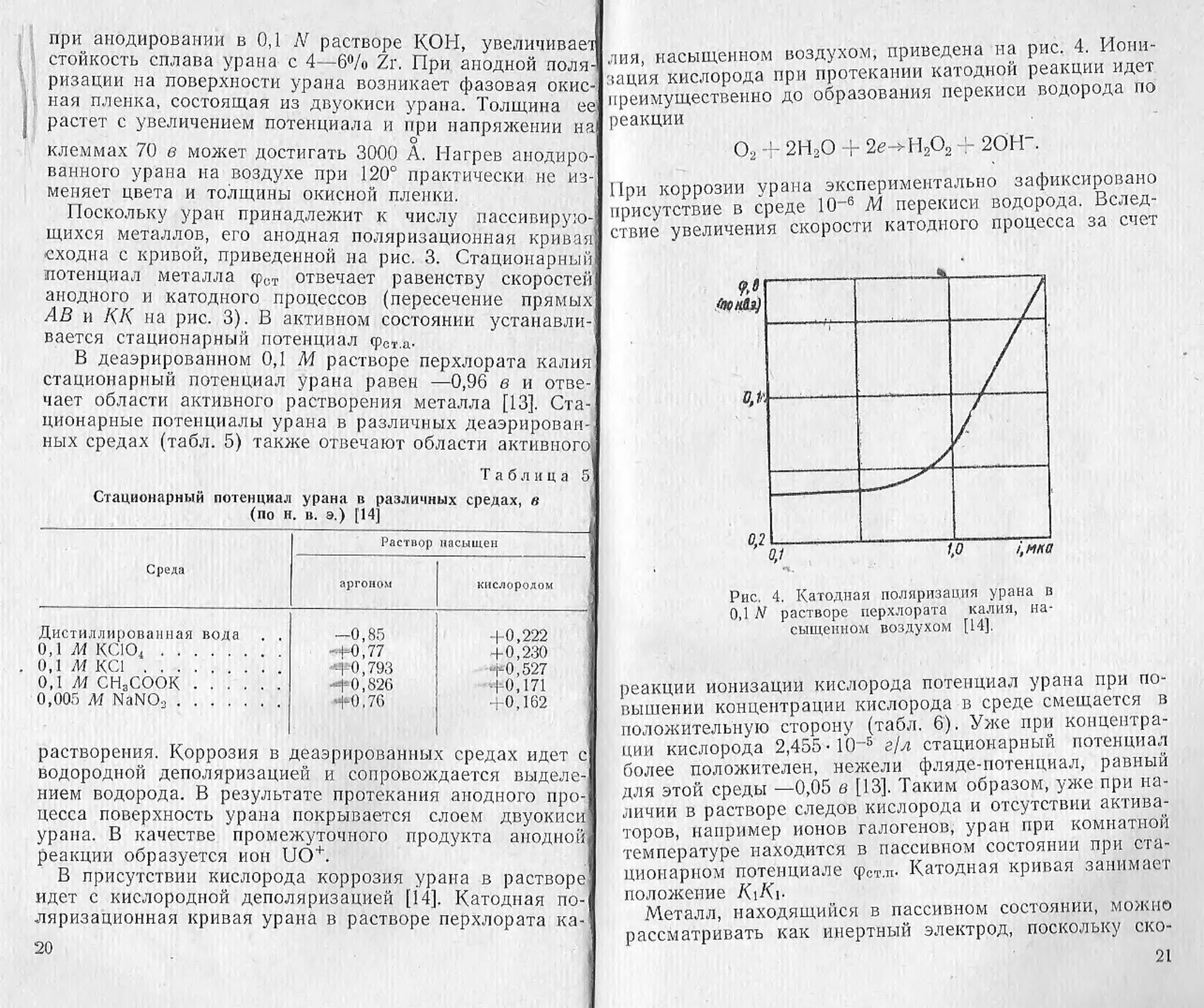
В деаэрированном 0,1 М растворе перхлората калия
стационарный потенциал урана равен —0,96 в и отве-
чает области активного растворения металла [13]. Ста-
ционарные потенциалы урана в различных деаэрирован-
ных средах (табл. 5) также отвечают области активного;
Таблица 5
Стационарный потенциал урана в различных средах, в
(по н. в. э.) [14]
Среда Раствор насыщен
аргоном кислородом
Дистиллированная вода . . —0,85 4-0,222
одл/ксю., -Н»,77 --1-0,793 +0,230
O.lAfKCl •+0,527
0,1 м сн3соок -|«0,826 1 0,171
0,005 М NaNO3 +0,76 +0,162
растворения. Коррозия в деаэрированных средах идет с
водородной деполяризацией и сопровождается выделе-
нием водорода. В результате протекания анодного про-
цесса поверхность урана покрывается слоем двуокиси
урана. В качестве промежуточного продукта анодной
реакции образуется ион UO+.
В присутствии кислорода коррозия урана в растворе
идет с кислородной деполяризацией [14]. Катодная по-
ляризационная кривая урана в растворе перхлората ка-
20
лия, насыщенном воздухом, приведена на рис. 4. Иони-
зация кислорода при протекании катодной реакции идет
преимущественно до образования перекиси водорода по
1 реакции
О2 4- 2Н,0 + 2<?->Н2О, J- 2ОН“.
| При коррозии урана экспериментально зафиксировано
I присутствие в среде 10-6 М перекиси водорода. Вслед-
Iствие увеличения скорости катодного процесса за счет
Рис. 4. Катодная поляризация урана в
0,1 N растворе перхлората калия, на-
сыщенном воздухом [14].
реакции ионизации кислорода потенциал урана при по-
вышении концентрации кислорода в среде смещается в
положительную сторону (табл. 6). Уже при концентра-
ции кислорода 2,455-IO-5 г/л стационарный потенциал
более положителен, нежели фляде-потенциал, равный
для этой среды —0,05 в [13]. Таким образом, уже при на-
личии в растворе следов кислорода и отсутствии актива-
торов, например ионов галогенов, уран при комнатной
температуре находится в пассивном состоянии при ста-
ционарном потенциале <рст.п. Катодная кривая занимает
положение KiKi-
Металл, находящийся в пассивном состоянии, можно
рассматривать как инертный электрод, поскольку ско-
21
Таблица 61
Стационарный потенциал урана в 0,1 N растворе в зависимости от содержания кислорода перхлората калия среде [13]
Концентрация кислорода, Потенциал, (ПО II. в. э.)
измеренный расчетный
2,445-IO.-2 0,3862 0,3862
5,2 -10“3 0,3660 0,3627
2,455-10“3 0,3537 0,3557
7,365-10““ 0,3392 0,3404
2,455-10““ 0,3223 0,3252
2,455-Ю-5 0,2830 0,2946
рость его саморастворения крайне мала. Потенциал же
инертного электрода определяется равновесием окисли-
тельно-восстановительных реакций, реализующихся на
его поверхности.
Потенциал урана, находящегося в пассивном состоя-
нии, определяется окислительно-восстановительной
реакцией ионизации кислорода до перекиси водорода.
Равновесный потенциал этой реакции, подсчитанный по
уравнению Нернста из экспериментально определенных
концентраций кислорода и перекиси водорода, удовлет-
ворительно согласуется со значениями экспериментально
измеренных потенциалов (см. табл. 6). Скорость анод-
ного процесса растворения урана в пассивном состоянии
составляет (5—10) • 10-8 а/см2. Максимальная величина
плотности тока в активной области, при которой начи-
нается пассивация урана, составляет 2,2-10—6 а/см2 [13].
Присутствие в растворе окислителей смещает стацио-
нарный потенциал урана в положительную сторону
(табл. 7). При малых концентрациях окислителя ста-
ционарный потенциал урана остается в пределах актив-
ной области. Так, перекись водорода в концентрации
1.0-s N не изменяет скорости коррозии урана в воде при
57—90° [12]. При достаточно высокой концентрации окис-
лителя, например в 0,5 N NaNO3, уран находится в пас-
сивном состоянии. Нитрат натрия существенно увеличи-
вает потенциал урана уже при концентрации 0,1 N. При
концентрации нитрита натрия менее 0,05 N, хро-
22
Таблица 7
Стационарный потенциал урана в растворах окислителей J13]
Среда Концентрация, Л' Стационарный потенциал, в (по и. в. э.)
ксю4 0,1 -0,852
NaNO3 0,0005 -0,797
NaNO> 0,005 0,697
NaNO2 0,05 -0,297
NaNO2 0,5 от -0,133 до +0,133
NaNOs 0,1 -1 0,246
Na2CrO4 0,066 -0,417
Na3MoO, 0,001 —0,597
Na2WO4 0,001 -0,577
мата —менее 0,066 N, вольфрамата или молибдата —
менее 0,001 N стационарный потенциал урана также сме-
щается в положительную сторону, но остается при этом
в пределах активной области. Приведенные данные поз-
воляют понять, почему присутствие кислорода в среде
снижает скорость коррозии урана (табл. 8). При ком-
Таблица 8
Коррозия урана в иоде, насыщенной различными газами [14]
Водород ...............
Кислород .............
Воздух ................
Гелий .................
Азот..................
Скорость коррозии. яИсм*-ч
воды* 06* испытаний, ч
50 24,5 0,066
70 24 0,35
90 22 .1,0
50 766 0,036
70 45 0,003
90 49 1,0 0,0005
50 823
70 42 0,01
70 18 0,21
70 48 0,25
ватной температуре в аэрированной дистиллированной
воде уран находится в пассивном состоянии и скорость
коррозии его достаточна мала —0,063 мг/см7-ч [15].
23
В воде, насыщенной кислородом, стационарный потен-
циал урана при комнатной температуре отличается от
потенциала выхода в. область перепассивации на 0,4 в'.
С повышением температуры до 50—90° эта разница
уменьшается. Отдельные участки поверхности металла!
вследствие флуктуации потенциала могут на некоторое
время переходить в состояние перепассивации. При этом]
скорость растворения урана на этих участках возрастает,।
что приводит к развитию язвенной коррозии. При заме-1
не кислорода в воде воздухом разность между стацио-
нарным потенциалом и потенциалом выхода в область]
перепассивации увеличивается и вероятность возникно-i
вения язвенной коррозии уменьшается. Эксперименталь-
ные данные подтверждают более интенсивное развитие:
язвенной коррозии в воде, насыщенной кислородом, по*
сравнению с водой, насыщенной воздухом [16].
Ряд исследователей считает, что кислород и другие!
окислители обладают специфическими пассивирующими
свойствами. По их мнению, с одной стороны, окислите-
ли, будучи хорошими деполяризаторами, увеличивают i
скорость катодного процесса и являются активаторами,
с другой — тормозят скорость анодного процесса и явля-
ются пассиваторами.
Многочисленные работы советских и иностранных уче-
ных показали, что кислород и другие окислители не из-
меняют кинетики анодного процесса. Такие характерные
величины, как фляде-потенциал, скорость анодного про-
цесса в пассивном состоянии, а в большинстве случаев
и потенциал выхода металла в область перепассивации,
не изменяются при введении в раствор окислителей. Сле-
довательно, окислители не обладают специфическим пас-
сивирующим действием. Для наступления пассивного со-
стояния стационарный потенциал металла должен быть
сдвинут в положительную сторону до величин, больших,
чем фляде-потепциал. Естественно, что наиболее эффек-
тивно будут способствовать увеличению стационарного
потенциала окислители. Однако не все окислители яв-
ляются пассиваторами. Такие, казалось бы, эффектив-
ные окислители, как перекись водорода, персульфат ам-
мония, ионы трехвалентного железа, не являются пасси-
ваторами. Если придерживаться теории, утверждающей,
что пассивность обусловлена адсорбцией гидроксил-ио-
на, то пассиваторами должны являться окислители, ко-
24
горне, восстанавливаясь в ходе катодного процесса, да-
ют достаточное количество гидроксил-ионов. Такими
окислителями являются, например, хроматы, нитриты;
это широко известные пассиваторы.
В результате восстановления хромата и нитрита по
реакциям
СгО*" 4- 4Н2О + Зе 6ОН" Сг (ОН)»
2NO2" + 2Н2О 4- 4е 4ОН" + N2O2“
образуется гидроксил-ион, который, адсорбируясь на по-
верхности, пассивирует ее.
В кислых средах концентрация гидроксил-иона слиш-
ком мала и пассиваторы типа хроматов и нитритов при
низких pH мало эффективны. Следует заметить, что нит-
рат-ион также может участвовать в катодном процессе
но реакции
NOF + Н2О -1- 2е МОГ Ь2ОН “
также с образованием гидроксил-иона. Нитрит, образу-
ющийся при этом, сам по себе является пассиватором.
Изложенное позволяет понять, почему нитрат является
пассиватором по отношению к урану. В 0,001 М растворе
нитрита при 70° за 350 ч испытаний поверхность урана
покрылась лишь цветами побежалости. Отмечалась так-
же точечная коррозия,, которая могла быть связана с
недостатком ингибитора. С ограниченным успехом для
защиты урана от коррозии могут применяться хроматы,
молибдаты, вольфраматы в концентрации 10~5—10~3 М.
В воде при температуре свыше 100° уран при стацио-
нарном потенциале находится в активной области. Вве-
дение в воду при 183° 1% бихромата натрия увеличивает
потенциал металла, но в пределах активной области.
При этом скорость коррозии металла возрастает [16].
Перекись водорода является сильным окислителем.
Смещая стационарный потенциал в пассивную область,
где уран пассивируется и в отсутствие пассиваторов, пе-
рекись водорода при концентрации 10-5УУ снижает ско-
рость коррозии урана в дистиллированной воде при тем-
пературах 20—90°. При наличии в воде перекиси водо-
рода повышается температура, при которой резко уве-
личивается скорость коррозии урана и коррозия из ме-
-стной переходит в общую. В дистиллированной воде, не
-содержащей перекиси водорода, увеличение скорости
коррозии урана происходит при 70—80°. В воде, содер-
жащей 10-5N перекиси водорода, скорость коррозии силь-
но возрастает при 80—90°.
Введение в кипящую дистиллированную воду 0,1%
.дигидротиоортотолуидина снижает скорость коррозии
урана в первые 24 ч в 7 раз. Однако при более длитель-
ных экспозициях дигидротиоортотолуидин разлагается
[16]. Присутствие в воде хлоридов, бромидов и других
галогенов приводит к нарушению пассивного состояния
и увеличению скорости коррозии металла. Механизм ак-
тивирующего действия хлоридов на сегодняшний день
полностью не раскрыт.
Некоторые исследователи полагают, что хлор-ион об-
разует с ион-атомами металла промежуточный комп-
лекс, который в дальнейшем распадается, но тем не ме-
нее облегчает переход ион-атомов металла в раствор.
Оставаясь в рамках пассивирующего действия гидрок-
сил-иона, можно полагать, что вещества, способные
взаимодействовать с гидроксил-ионом, адсорбированным
на поверхности запассивированного металла при потен-
циалах, меньших, чем потенциал кислородного электро-
да, будут являться активаторами и выводить металл из
пассивного состояния. Действительно, анионы, участ-
вующие в реакциях
<р, в при pH —14
S’- + 6011- > SOs“ + ЗНаО + бе -0,61
S01_+20H-j*S0’- + HaO+« -
SaoT + ЗОН . 2SO»“ + 2H,O + e, -1,4
уменьшают-величину пассивной области за счет сдвига
потенциала пробоя в отрицательную сторону. Напомним,
что при pH = 14 потенциал кислородного электрода ра-
вен 0,401 в. После коррозионных испытаний в хлоридах
в растворе обнаруживаются кислородсодержащие ионы!
хлора. Это обстоятельство позволяет полагать, что хлор-
ион реагирует с адсорбированным на поверхности метал-
ла гидроксил-ионом по реакции
6О1-Г + СГ^СЮз" -|- ЗН2О бе.
:26
В свою очередь ион С Юз также реагирует с гидроксил-
ионом но реакции
2ОН" 4- С107 С10Г + Н2О + 2е.
В результате этих реакций гидроксил-ион десорби-
руется с поверхности металла и последний выходит из
пассивного состояния. Пассивная область при этом су-
жается за счет уменьшения потенциала выхода в область
перепассивации. При достаточной концентрации хлори-
дов металл при стационарном потенциале в насыщен-
ном воздухом растворе находится в области перепасси-
вации.
Хлор-ион интенсифицирует коррозию металлов и в том’
случае, когда пассивность обусловлена образованием
фазовых окислов.
Хлор-ион адсорбируется на поверхности металла и тем
самым препятствует взаимодействию поверхностных ион-
атомов металла с молекулами воды, в результате чего
не образуется фазовая пассивирующая пленка. Речь в
данном случае идет о реакциях, равновесный потенци-
ал которых ниже потенциала кислородного электрода.
Заметим также, что при наличии в среде хлор-иона по-
тенциал выхода металла в область перепассивации ни-
же потенциала кислородного электрода и при этом
потенциале на электроде образуется не кислород, а кис-
лородсодержащие ионы галоидов. Даже если концентра-
ция хлоридов мала и потенциал выхода в область
перепассивации отвечает потенциалу кислородного элек-
трода, присутствие в среде хлор-ионов препятствует вы-
делению кислорода [17]. Естественно, эти обстоятельства
препятствуют образованию окисла и наступлению пас-
сивности. В деаэрированном и насыщенном кислородом
растворе хлоридов стационарный потенциал урана отве-
чает активной области (см. табл. 5).
Из сказанного выше становится понятным, почему
присутствие в воде хлоридов, бромидов и других гало-
генов интенсифицирует коррозию урана. При 70° ско-
рость коррозии урана в речной, воде в 8—10 раз выше,
чем в дистиллированной [12]. Зафиксировано усиление
язвенной коррозии урана в насыщенной воздухом воде,
содержащей 0,001 N КС1. Существенного изменения об-
щей скорости коррозии урана при этом не отмечено [16].
27
Фосфат и сульфат натрия в полтора раза снижают ско
рость коррозии урана в воде при 70°.
Присутствие в воде ряда катионов может отразиться
на скорости коррозии урана. Так, введение в воду суль-
фата никеля и солей платины в количестве 50 мг/л не-
сколько снижает скорость коррозии сплава урана с 12°/<
Мо. Определенное количество ионов никеля и платинь
восстанавливается, и никель и платина высаживаются
на поверхности сплава. Перенапряжение водорода н<
никеле и платине мало. Вследствие этого скорость ка
тодного процесса возрастает. Не исключена возмож
ность, что с увеличением вследствие этого потенциал;
сплава стационарный потенциал урана попадает на иис
ходящую ветвь анодной поляризационной кривой в а-к
тивной области, что должно сопровождаться снижение.1)
коррозии.
В кипящей дистиллированной воде уран при стацио
парном потенциале находится в активном состоянии
Присутствие в воде солей меди повышает скорость ка
тодного процесса вследствие высаживания меди на по
верхности урана. Интенсификация катодного процесс;
разряда ионов водорода приводит к увеличению стацио
парного потенциала и возрастанию скорости растворе
ния урана в активном состоянии в 1,5—2 раза [12]. Пр)
температуре 50—70° высаживание на поверхность уран;
меди и связанное с этим увеличение потенциала не пн
тенсифицирует коррозии, так как способствует пассива
ции металла.
В пассивном состоянии увеличение толщины окисно!
пленки на уране со временем происходит по параболиче
скому закону. В активной области при потенциалах о-
—0,3 до —0,4 в первые 100 ч коррозия также идет п<
параболическому закону. Затем зависимость роста плен
ки от времени описывается двумя пересекающимися при
мыми. Коррозия в этом случае идет с ускорением в<
времени [11]. Предполагается, что выделяющийся в про
цессе коррозии водород может влиять на свойства дву
окиси урана, в частности на ее электропроводность
В работе [11] сопоставляются константы скорости корро
зйи урана и активность водорода на поверхности раздел;
окись — раствор. В частности, изменение сопротивлени:
урана с потенциалом связывается с изменением диэлек
трических свойств окисла, являющегося полупроводни
28
ком, в результате взаимодействия с водородом. Посколь-
ку двуокись урана достаточно электропроводка, катод-
ные реакции могут протекать1 на поверхности пленки.
Анодные же реакции протекают либо в порах, либо в.ре-
зультате диффузии через пленку кислорода и гидрок-
гсил-иона.
Следует иметь в виду, что с увеличением потенциала
скорость катодной реакции разряда нона водорода сни-
жается. При уменьшении потенциала возрастают ско-
рость водородной деполяризации и соответственно коли-
чество выделившегося водорода. Считают [18], что обра-
зовавшиеся при этом на поверхности раздела уран—
двуокись урана гидриды способствуют разрушению
окисной пленки и интенсификации коррозии.
При комнатной температуре в воде, насыщенной воз-
духом, коррозия идет преимущественно с кислородной
деполяризацией, и металл находится в пассивном со-
стоянии. В воде, насыщенной водородом, стационарный
потенциал урана отвечает активной области и, естест-
венно, скорость коррозии при этом велика (рис. 5).
С увеличением температуры скорость водородной депо-
ляризации возрастает, а пассивация урана затрудняется,
растворимость же кислорода при этом уменьшается.
При 100° вода практически не содержит растворимого
кислорода. Коррозия урана даже в специально неде-
29
аэрированной воде идет при 100° с водородной деполя-
ризацией. При этом скорости коррозии урана в воде, на-
сыщенной кислородом и водородом, выравниваются (см.
рис. 5). В кипящей дистиллированной воде стационар-
ный потенциал урана равен —0,95 в и отвечает области
растворения металла в активном состоянии.
Насыщение воды водородом не сказывается на скоро-
сти коррозии сплава урана с 12% Мо при 360°. В воде,
насыщенной водородом, аргоном или азотом, скорость
коррозии практически одинакова. Насыщение воды кис-
лородом снижает скорость коррозии на 15—20%. Мож-
но полагать, что при 360° в деаэрированной воде кор-
розия идет с водородной деполяризацией и металл на-
ходится в активном состоянии. Кислород способствует
образованию окисной пленки, которая несколько тор-
мозит коррозию. Количество водорода, поглощенного
сплавом урана в процерсе коррозии в деаэрированной
воде, насыщенной аргоном или водородом, одинаково.
Это позволяет утверждать, что скорость водородной де-
поляризации не зависит от присутствия в среде молеку-
лярного водорода. Насыщение воды кислородом снижа-
ет количество поглощенного сплавом водорода в три
раза. И в этом случае увеличение потенциала металла
за счет эффективного протекания процесса кислородной
деполяризации уменьшает скорость разряда ионов во-
дорода.
В окисной пленке продуктов коррозии присутствовали
частицы урана. В целом отношение кислорода к урану
в продуктах коррозии составляло 2,4. Пленка состояла
из tJC>2,2. После выдержки на воздухе при комнатной
температуре состав ее приближался к UOg^. Про-
дукты коррозии урана были отделены фильтра-
цией от воды, в которой проводилось испытание об-
разцов. В продуктах коррозии содержание урана. со-
ставляло 16%. Спектральным анализом в продуктах
коррозии обнаружены также кальций, магний и хром,
присутствовавшие в металлическом уране. После 50 су-
ток испытаний при 60° содержание урана в воде состав-
ляло 5-10“5 М. Эта величина превышает растворимость
U(OH)< в воде. По-видимому, часть урана связывалась
в комплекс [18].
Защитные свойства окисной пленки, полученной при
окислении урана на воздухе, были подтверждены сле-
30
дующими экспериментами. Уран предварительно окис-
лялся в течение 2 ч при температуре 100—700° в среде
кислорода с давлением 5 • 10_5—10-3 мм рт. ст. Затем в
кипящей воде определялась скорость коррозии хаких
предварительно окисленных образцов. С повышением
температуры предварительного окисления скорость кор-
розии урана снижалась (табл. 9). Если предварительно
Таблица 9
Влияние предварительного окисления на скорость коррозии урана
в кипящей воде [18]
Длительность Скорость коррозии, .нг,'сл«2.ч
.«.и pm. cm.
100 5-10“Б 4 2,93
100 5-10~5 4 3,04
200 5-10-° 4 3,26
200 5-10-° 4 3,34
300 5-10“5 4 2,78
300 5-Ю-5 4 3,01
-100 5-10-5 4 3,00
400 5-10-° 4 2,71
500 5-Ю-5 4 1,56
500 5-10~5 4 2,16
000 5-10~5 4 0,68
600 5-Ю-5 4 1,20
600 5-10— 4 1,24
600 5 10-5* 4 3,10
600 5-10“5 4 1,77
600 5-Ю-5* 4 3,12
600 5-Ю-4 4 —
600 5-Ю-4 4 —
600 5-Ю-4 4 —
600 5-Ю-4 4 —
650 5-Ю-4 21 0,06
650 5-10“4 21 0,10
650 5-Ю-4 21 0,09
600 1 • ю-3 21 0,16
600 1-Ю-3 21 0,28
600 1-10-3 21 0,21
пленка удалена электрополировкой.
31
созданная окисная пленка снималась электрополиров-
кой, скорость коррозии возрастала до величины, харак-
терной для образцов без защитной окисной пленки. ।
Окисная пленка, полученная при температуре, превы-
шающей температуру структурного превращения а-ура-
на в p-уран, не обладала защитными свойствами. Пред-
лагается следующее объяснение этому явлению [18]: в
окисной пленке имеются значительные механические на-
пряжения, обусловленные различными термическими
коэффициентами линейного расширения окисла и метал-’
ла; структурное превращение увеличивает эти напряже-
ния и приводит к появлению трещин в окисной пленке;
после этого окисная пленка не защищает уран от кор-
розии.
Наличие механических напряжений в окисной пленке
подтверждается следующим экспериментом. Урановая'
лента, свернутая в спираль, подвергалась коррозии в. во-(
де при высокой температуре. На поверхности металла
возникала пленка двуокиси урана. Под влиянием меха-
нических напряжений, имеющихся в окисной пленке,
спираль раскручивалась.
Между кристаллическими решетками двуокиси урана
и урана может быть структурное соответствие. Так, от-
мечено структурное соответствие между плоскостью
(110) в сплаве урана с 10% Nb и плоскостью (011) в
двуокиси урана. Аналогичное явление имеет место меж-
ду плоскостями (ИО) сплава и (100) двуокиси урана.
В другом эксперименте на поверхности урана путем
кратковременной катодной поляризации в 5%-ной азот-
ной кислоте создавался слой гидридов, состоящий из
гидрида урана в a-модификации или смеси а- и р-моди-
фикаций. Коррозионные испытания показали, что при-
сутствие на поверхности урана гидридов не отразилось
на скорости коррозии. Очевидно, лишь гидриды, образо-
вавшиеся на границе раздела металл — окись в процессе
коррозии при высоких температурах, влияют на сплош-
ность и свойства окисной пленки и на стойкость урана.
Таким образом, можно полагать, что окисная пленка,
полученная при. окислении урана на воздухе, обладает
большими защитными свойствами, чем окисная пленка,
образовавшаяся в процессе коррозии в воде при 100°.
Состояние поверхности может существенно сказывать-
ся на стойкости урана (табл. 10). Длительное пребыва-
32
line на воздухе не отражается на скорости коррозии.
Окисная пленка образуется в первые же часы контакта
урана с воздухом. Нагрев в азоте или аргоне при 400°
приводит к интенсификации коррозии (табл. 11). Мож-
но полагать, что различие в термических коэффициентах
линейного расширения окисла и металла приводит по-
’явлению трещин в двуокиси урана и тем самым к ин-
тенсификации коррозии.
Таблица 10
Влияние состояния поверхности на скорость коррозии и потенциал урана [12]
Характер обработки поверхности Срела Темпера- тура, °C Скорость коррозии, лг;с.иг ч Потенциал, в (по н.в.э.)
Полировка:
топкая Дистиллят 70 0,32 —0,111
средней чистоты . . » 70 0,46 —0,258
грубая Полировка средней » 70 0,40 -0,162
чистоты Пар 178 109 —
Полировка и травле-
ние в HNO-, .... » 178 105
Поверхность, покрытая
окисной пленкой . . 178 205 Та лица 11
Коррозия урана, легированного 5% Zr, л кипящей
дистиллированной воде (длительность испытаний 24 ч) [19]
Характер обработки поверхности
Без обработки 4,87
28 суток на воздуху при комнатной тёмпера-
ТУ ре 4,75
24 ч в потоке аргона при 400° 18,0
24 ч в потоке азота при 400° 14,6
21 ч откачка в вакууме (0,13 мм рт. ст.)
при 409° 0,74
Причины уменьшения коррозии урана после пребыва-
ния его в вакууме при высокой температуре неясны.
Предварительное травление в азотной кислоте не влия-
3 В. В. Герасимов 33
ет на скорость коррозии урана. Изменение времени
травления в азотной кислоте от 1,5 до 30 мин также на
отражается на скорости коррозии урана [14]. Чистота
механической обработки существенно не сказывается на
стойкости урана. Все же тонкая полировка поверхносп
несколько снижает скорость коррозии урана в воде пр)
70° (см. табл. 10). Изменяется при этом и стационарны)'
потенциал металла.
В паре при 178° полированный и травленый уран бо
лее стоек, чем металл, покрытый окисной пленкой (см
табл. 10).
В условиях эксплуатации различные участки поверх
иости одной и той же детали могут находиться в кон
такте с водой, .содержащей различные количества кис
порода. Например, потенциал участков металла, омы цирконием в кипящей дистиллированной воде и в воде
ваемых потоком насыщенной воздухом воды, отличаете) с ю-< М перекиси водорода. Следует напомнить, что пе-
от потенциала металла в застойной зоне. При этом воз 1
пикает так называемая пара дифференциальной аэрация
На уране плотность тока пары дифференциальной аэра
ции может достигать 50 мка/см2. Поверхность урана
омываемая водой с более высоким содержанием кисло
рода, служит катодом. Потенциал этих участков отве
чает пассивной области. Участки же поверхности урана
контактирующие с водой с низким содержанием кисло
рода, находятся в активном состоянии и интенсивно рас1
творяются. На поверхности участков металла, являю
щихся катодами в паре дифференциальной аэрации, про
дукты коррозии состоят из UO3-2H2O и U(OH).(. Н<
образце, погруженном в раствор с недостатком кислоро р11Ды, вступающие^ дальнейшем в реакцию "с водой с
да, продукты коррозии состоят из двуокиси урана. По- образованием двуокиси урана.
скольку Хлориды способствуют активации урана, в при ~ °
сутствии ионов хлора в воде пары дифференциально)'
аэрации работают более эффективно, чем, например, i
перхлорате.
Наличие щелей и зазоров может .отразиться на стой;
кости урана. Поступление кислорода в раствор, наха
дящийся в щели, затруднен. В результате протекай»
коррозионного процесса кислород в щели израсходуется
При этом, естественно, стационарный потенциал уран;
будет уменьшаться и может сместиться в активную об
.часть. Скорость коррозии урана в щели при этом возра
стет. В щели, образованной при контакте урана со стек
лом, коррозия интенсифицируется и идет с водородно!
31
|| деполяризацией. Существенного изменения скорости
|| коррозии урана за счет контакта с другими металлами
Дожидать, по-видимому, не следует. Отмечено, напри-
мер, что в процессе испытаний электрически^ контакт
Между соприкасающимися урановыми и алюминиевыми
образцами нарушался, очевидно,, вследствие образова-
ния на поверхности урана пленки двуокиси урана.
В этом эксперименте контакт с алюминием не изменил
скорости, коррозии урана [16]. Если же. контакт с алю-
минием, являющимся в этой паре анодом, сохраняется,
скорость коррозии урана возрастает [12]. В паре с не-
ржавеющей сталью уран является анодом [16].
По другим данным контакт с нержавеющей сталью и
алюминием снижает скорость коррозии сплава урана с,
10-4 М перекиси водорода. Следует напомнить, что пе-
рекись водорода сама по себе снижает скорость корро-
зии урана [12]. Щели, образующиеся при контакте с не-
ржавеющей сталью и алюминием, забиваются продукта-
ми коррозии урана.
При наличии неплотностей в оболочке тепловыделяю-
щих элементов вздутие, а затем и разрушение оболоч-
ки являются следствием механических напряжений,
обусловленных накоплением продуктов коррозии. Раз-
рушение оболочки не всегда происходит точно на тех
участках, где герметичность ее была нарушена. Щеле-
вая коррозия, как считают Франк и Рокбук [20], идет в
дне стадии. На первой, по их мнению, образуются гид-
Стойкость урана, выплавленного в дуговой и индук-
ционной печах, практически одинакова. После закалки
и воду с 900° более стоек уран, выплавленный в дуговой
' Термическая обработка влияет на коррозионную стой'?
Кость урана. Так, нагрев в у-области с последующей за-
калкой в воду или охлаждением вместе с печью увели-
чивает скорость коррозии урана в кипящей дистиллиро-
ванной воде [16]. Влияние термической обработки на.
скорость коррозии урана зависит от чистоты металла,,
длительности нагрева, скорости охлаждения, размера,
icpna и других факторов. Окислы, . карбиды, нитриды:
Практически нерастворимы в уране при низких и высо-
ких температурах. Анодные и катодные процессы и
включениях этих соединений не идут и присутствие и
в уране практически не сказывается на скорости коррс
зии. В одних случаях медленное охлаждение с печью
высоких температур или старение может увеличит
стойкость урана, в других —уменьшить ее.
В зависимости от чистоты металла и термической of
работки скорость коррозии урана может изменяться бс
лее чем в 2 раза.
Скорость коррозии урана высокой чистоты практичс
ски не зависит от характера термической обработк;
В этом случае на стойкость урана не влияет и длитеЛ!
ный нагрев при 1000°, который снижает стойкость м<
.нее чистого металла. Следует отметить, что уран, зак-
ленный с 1000°, менее коррозионностоек, чем охлажде;
ный вместе с печыо с этой температуры. Последующи
отжиг урана в течение часа при 600° нивелирует влю
ние предыдущего высокотемпературного нагрева.
Одним из наиболее часто присутствующих загрязш
ний в уране является железо. Оно способно в опред<
ленной степени растворяться в уране и давать с ним и»
терметаллические соединения. Скорость коррозии ур;
на, загрязненного железом, зависит от того, в како
виде это железо находится (в твердом растворе или
интер мет алл и де). Растворимость железа в у-уране зн:
чительно выше, чем в а-уране [21]. Можно полагать, чп
присутствующее в виде отдельной фазы соединение ж
леза (после отжига урана в a-области) является эффе;
тивным катодом, который увеличивает скорость като,
ного процесса водородной деполяризации и смещас
стационарный потенциал в положительную сторон
Поскольку в кипящей дистиллированной воде стащи
парный потенциал отвечает активной области, повыш
ние его интенсифицирует коррозию. При нагреве в у-о
ласти соединение железа растворяется в уране; при это
скорость катодного процесса и стационарный потенциг
уменьшаются, что приводит к снижению скорости ко;
розии урана. Так, уран, содержащий значительное кол]
чество углерода и железа, наиболее стоек после терм
ческой обработки в у-фазе (табл. 12). Влияние разли
ных видов термической обработки на скорость корроз,
урана в кипящей дистиллированной воде приведено
табл. 13.
36
Таблица 12
Скорость коррозии урана в кипящей дистиллированной воде
после различной термической обработки [6]
Испытуемый Содержание в металле, Скорость коррозии. лг:с.«'г • ч
углерода железа «-фазе нагрев в 1-фазе закалка из
Обычно применя- емый в реакто- рах Средней чистоты Высокой чистоты 0,025— 0,027 0,005 0,002— 0,0025 0,01 0,005 0,0005 4,9 2?6 3,1 2,5 3,2 2,5
Таблица 13
Влияние термической обработки на скорость коррозии урана
в кипящей дистиллированной воде [12]
Термическая обработка Длительность испытаний, ч Скорость ко^ро-
Без термической обработки . 7769 2,7
64 ч при 100 , з. в 308 о’, 78 1,55-2,04
2 ч при 900°, з. в 113
96 ч при 900°, з. в 26-96
64 ч при 850°, з. в 308 1,8
2 ч при 725', з. в 413 1,16
2 ч при 600°, з. в 98 217
2 ч при 900°, о. п 98 1,17
96 ч при 900°, о. и 24-97 0,94-1,10
2 ч при 725”, о. п 484 1,68
2 ч при 600°, о. и 96 2,13
96 ч при 900° 1 , 2 ч при 600° / з.в., -0. п. . 24-98 0,66 - 244
Медленное охлаждение и деформирование 310 0,77
Примечание, з. в. — закал ка в воду; о. п. — клаждение с печью.
Известно, что увеличение температуры коррозионной
среды способствует активации металла. При этом ско-
рость коррозии урана в дистиллированной воде возра-
стает (рис. 6). Особенно это заметно при увеличении
температуры выше 80°. D широком интервале темпера-
37
тур зависимость между скоростью коррозии урана в во-3
де, насыщенной водородом, и температурой описывает!
ся уравнением Аррениуса (см. рис. 5):
1g К (.«г'см2= + 10,34.
При температуре 100° коррозия урана идет в основном
с водородной деполяризацией [18]. Отношение скоростей;
водородной и кислородной .деполяризации равно 10. |
Продолжительность испытания, сутки
Рис. 6. Коррозия урана. в насыщенной воздухом
дистиллированной воде [6].
При температуре 50 и 70° наличие в воде воздуха или
кислорода снижает скорость коррозии урана по сравне-
нию с водой, насыщенной водородом, азотом, гелием
(см. табл. 8). В этом случае введение в воду кислорода
увеличивает скорость катодного процесса и сдвигает
потенциал до значений, отвечающих пассивной области.
При 90—100° скорость водородной деполяризации вели-
ка. Растворимость же кислорода при этих температурах
мала. В связи с этим кислород в этих условиях сущест-
венно не изменяет скорости катодного процесса, потен-
циала металла, а следовательно, и скорости его раство-
рения в активном состоянии (см. табл. 8). Однако соот-
ношение водорода и кислорода в воде влияет на ско-
рость коррозионного процесса сплавов урана, например
с 5% Zr, при 97° (табл. 14).
38
Влияние соотношения водорода и кислорода в воде
на коррозию сплава урана с 5% Zr при 97° [19]
Отношение водорода к кислороду в воде Скорость коррозии, .иг/сл2 за 168 ч Отношение водорода к кислороду в воде Скорость кор- розии, мг1см^ за 168^р
2 : 1 0,08 35:1 34
15: 1 0,04 35:1 79
20:1 0,11 230 : 1 14,8
35:1 0,11
При достаточном количестве кислорода в воде ста-
ционарный потенциал металла в этих условиях отвеча-
ет пассивной области, и скорость коррозии мала. Пас-
сивность сплава урана с 5% Zr в воде при 97° имеет ме-
сто при отношении водорода к кислороду от 2:1 до
20:1. При величине этого отношения 35:1 стационар-
ный потенциал находится на границе активной и пассив-
ной областей. Флуктуация потенциала приводит к тому,
что металл может в одних случаях находиться в пассив-
ной области, в других — в активной. В соответствии с
этим при соотношении водорода к кислороду 35: 1 мо-
жет наблюдаться и низкая, и высокая скорость коррозии
(см. табл. 14). В деаэрированной воде скорость корро-
зии мало изменяется во времени. При температуре 178°
силикат в количестве 0,01—0,03% замедляет коррозию
урана.
Глава Ш
КОРРОЗИЯ СПЛАВОВ УРАНА В ВОДНЫХ СРЕДАХ
Коррозионная стойкость урана в воде и паре в усло-
виях работы первого контура ядерных реакторов низка.
Весьма заманчивой является перспектива повышения
коррозионной стойкости урана путем легирования. В на-
стоящее время исследовано влияние па стойкость урана
значительного числа элементов. Стойкость урана прак-
тически не изменяется при введении в него от 2 до 12%
следующих элементов: сурьмы, бария, бериллия, висму-
та, бора, кадмия, углерода, церия, хрома, меди, гадоли-
ния, золота, лантана, свинца, лития, азота, кислорода,
селена, серебра, стронция, тория, олова, вольфрама,
иттрия, цинка. Термическая обработка не повышает
стойкости сплавов урана с этими элементами [22].
Стойкость урана несколько возрастает при легирова-
нии его алюминием, кобальтом, германием, железом,
марганцем? палладием,’ платиной,’ танталом, таллием,
ванадием. Однако даже 'самые стойкие сплавы этой
группы значительно разрушаются после 672-часовой экс-
позиции в кипящей дистиллированной воде. Наивысшую
стойкость показали сплавы урана с гафнием, нике-
лем, ниобием, титаном, цирконием, молибденом, крем-
нием.
Наилучшие из этих сплавов могут эксплуатироваться в
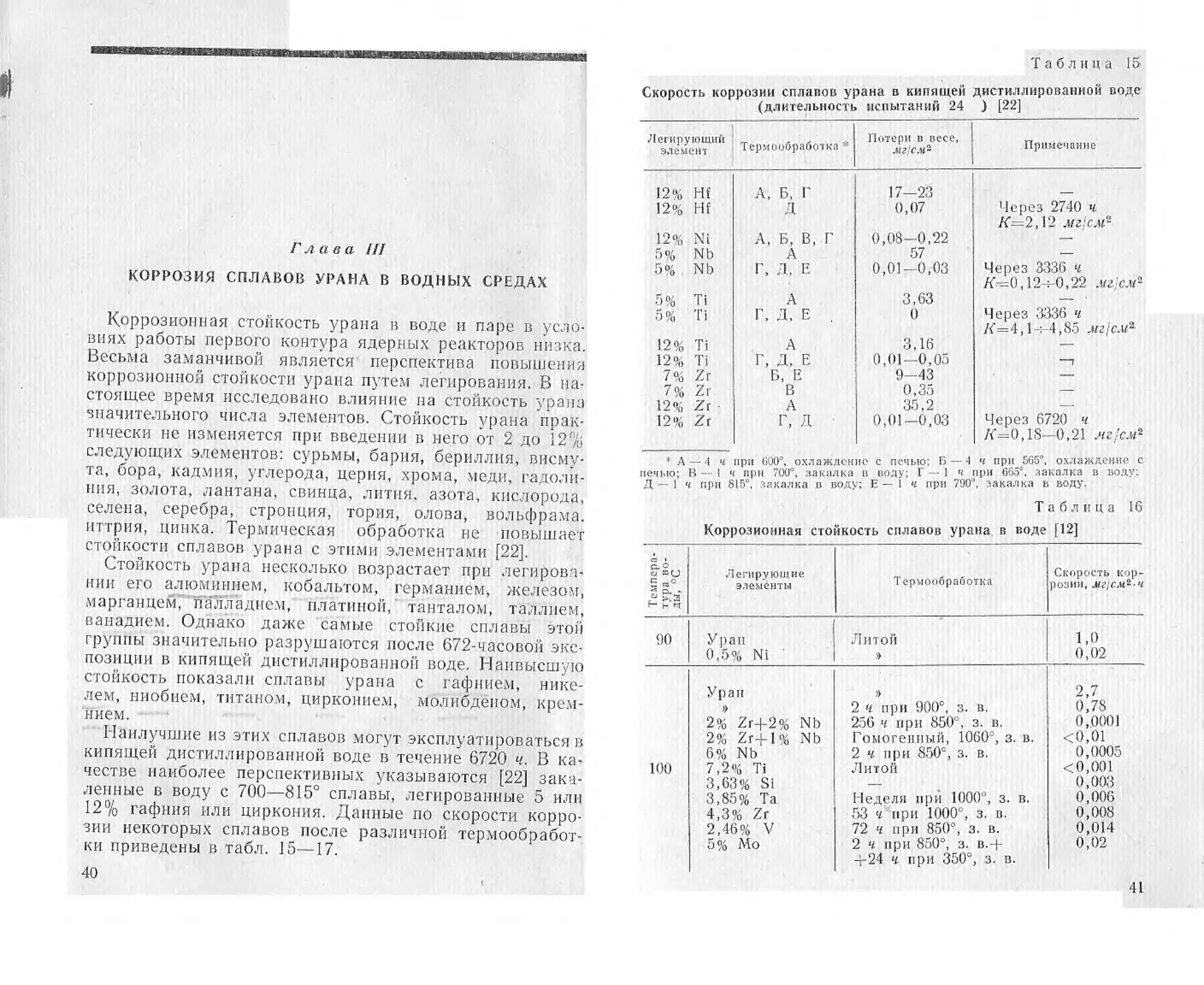
кипящей дистиллированной воде в течение 6720 ч. В ка-
честве наиболее перспективных указываются [22] зака-
ленные в воду с 700—815° сплавы, легированные 5 или
12% гафния или циркония. Данные по скорости корро-
зии некоторых сплавов после различной термообработ-
ки приведены в табл. 15—17.
40
Таблица 15
Скорость коррозии сплавов урана в кипящей дистиллированной воде
(длительность испытаний 24 ) [22]
Легирующий ' . , Потерн и иесе, _
элемент Термообработка мнем- Примечание
12% Hf А, Б, Г 17-23
12% Hf Л 0,07 Через 2740 ч
/<=2,12 мг:см-
12% Ni А, Б, В, Г 0,08-0,22 —
5% Nb д 57 —
5% Nb Г, Д, Е 0,01-0,03 Через 3336 ч
/6=0,12 :-0,22 мг ел-
5% Ti д 3,63 —
5% Ti Г, Д, Е . 0 Через 3336 ч
/<=4,1 : 4,85 мгс.и*
12% Ti д 3,16 —
12% Ti Г, Д, Е 0,01-0,05 —,
7% Zr Б, Е 9-43 —
7% Zr В 0,35
12% Zr • А 35,2
12% Zr г, д 0,01-0,03 Через 6720 ч
/<=0,18-0,21 мг'см*
♦ A — .| ц при 600’, охлаждение с печыо; Б — -1 ч при 565", охлаждение с
Д — 1 ч при 815 , закалка в воду; Е — 1 ч при 790 закалка в воду.
Таблица 16
Коррозионная стойкость сплавов урана в воде [12]
с. 6 Е 3 >.з Легирующие элементы Термообработка Скорость кор- розии,
90 Уран 0,5% Ni Литой 1,0 0,02
100 Уран 2% Zr+2% Nb 2% Zr-Ь 1 % Nb 6% Nb 7,2% Ti 3,63% Si 3,8o % Fa 4,3% Zr 2,46% V 5% Mo 2 ч при 900°, з. в, 256 ч при 850е. з. в. Гомогенный, 1060°, з. в. 2 ч при 850°, з. в. Литой Неделя при 1000", з. в. 53 ч при 1000°, з. в. 72 ч при 850°, з. в. 2 ч при 850°, з. в.-Ь -т-24 ч при 350°, ,з. в. 2,7 0,78 0,0001 <0,01 0,0005 <0,001 0,003 0,006 0,008 0,014 0,02
41
Продолжение табл. 16
о »О 12.°- Легирующие элементы Термообработка Скорость коррозии. жг/сл»><
Уран Литой 115
178 2% Zr-|-2%Nb 0,0007
6% Nb 2 ч при 850°, з. в. 0,004
3,63% Si 0,009
7,56% Ti 5,9
Примечание, з. в. — закалка в вода-.
Таблица 17 Коррозионная стойкость термически не обработанных
сплавов урана в воде [12]
Легирующий элемент Температура, °C Скорость коррозии, Добавка H.,OS в полу, Л'
0,07-2,9% Си 90 0,2-0,9 3-10~5
96 % Си 90 0,007 3-Ю”5
0,5% Аи 100 2 ЗЮ-5
0,9-4,4% Pb 90 Разрушение 3-10“5
0,15-0,3% Мо ICO 2,95—4,35 3-10-5
0,61-3,09%Мо 100 0,97-1,77 3-10-5
6,31% Мо 100 0,145 3-10-5
6,31% Мо 135 15 3-10-°
0,25-3,13% Ni 90 0,02—0,6
1,8% Rh 100 0,78-1,06
4-4,6% Rh 100 8,1 11,8
2,2% Ru mo 3,9-5,4
2-3,4% Si 70 0,006-0,008 —
0,03-1,3% Si 90 0,3-0,9 4-10-5
0,94% Si 100 0,43 4-10-5
1,7-4,96% Si 100 0,05-0,26 4-Ю-5
2,2% Si 100 0,01- -0,03 4-Ю-6
2,9-3,67% Si 125 0,26 0,83
3,77% Si 187 0,01
3,77% Si 225 0,18
0,017% Ag 100 4
<0,006% Sr 100 2,2 -3,2
0,4 0,44% Ta 100 3,6-4,5
4,5% Ta 100 1,63
42
Сплавы урана, стойкие в деаэрированной воде при
300—350°, можно в первом приближении разбить на три
группы:
1) сплавы со структурой у-твердого раствора;
2) сплавы со структурой пересыщенного а-твердого
раствора мартенситного типа;
3) сплавы на основе интерметаллических соедине-
ний.
К первой группе принадлежит, в частности, ряд спла-
вов системы U—Мо. Максимальная растворимость мо-
либдена в у-фазе урана при 605° равна 20%. Наиболь-
ший практический интерес представляют сплавы с 10—
15% Мо. Начиная примерно с 13% Мо при комнатной
температуре может быть зафиксирована у-фаза урана.
Она метастабильна и испытывает эвтектоидные превра
щения при температурах ниже 600°.
Превращение у-фазы урана в a-фазу может идти по
двум механизмам: диффузионному, когда превращение
происходит путем зарождения центров и их роста, иля
сдвиговому, мартенситному. По мере повышения содер-
жания молибдена увеличивается устойчивость у-фазы.
В сплавах с высоким содержанием молибдена скорость
уa-превращения невелика и в ряде случаев даже ох-
лаждение сплава с печью с температур выше 774° при-
водит к сохранению у-фазы при комнатной температуре.
Сплавы со структурой у-фазы наиболее устойчивы. Не-
сколько уступают им, но сохраняют достаточно высокую
стойкость сплавы со структурой пресыщенного а-твер-
дого раствора мартенситного типа. Сплавы со структу-
рой а + д, полученные в результате диффузионного пре-
вращения при медленном охлаждении, имеют низкую
коррозионную стойкость. В кипящей воде скорость кор
розни сплава с 4,6% Мо, закаленного на у-фазу, состав-
ляет 0,02 мг!см2 ч, а сплава со структурой а-фазы -
[0,18 мг/см2-ч [12].
Сплав с 5% Мо обладает максимальной стойкостью в
кипящей воде (в 135 раз большей, чем нелегированный
уран) после следующей термической обработки: нагрев
2 ч при 880° и закалка в воду, далее выдержка в тече-
ние 1 суток при 350° и закалка в воду. При этой термо-
обработке сплав наиболее стабилен и a-фаза тонко дис-
пергирована в d-фазе. В воде при 178° стойкость сплава
И этом же состоянии лишь в 16 раз превосходит стой-
43
кость чистого урана. В кипящей воде скорость коррозии
сплавов U—Мо снижается с ростом содержания молиб-
дена и при 6,31% Мо составляет 0,145 мг/см2-ч.
В сплаве с 6% Мо углерод в количестве. 0,03% не
влияет на скорость коррозии; 0,05% С уже сказываются i
на стойкости сплава. Стойкость сплава с 8% Мо в воде;
при 343° может быть увеличена введением третьего эле-
мента и соответствующей термообработкой. Это наблю-
дается при легировании сплава 0,3% Ti и закалке его
на у-твердый раствор или при дополнительном легирова
нии 1% Pt и семидневном отжиге при 400°. Ванадий,
алюминий, железо, марганец увеличивают стойкость ря-
да литых уран-молибденовых сплавов. Закалка из у-об-
ласти при легировании этими компонентами ухудшает
стойкость сплавов.
При воде при 300° наиболее стойки сплавы с 10—
12% Мо после закалки из у-области [23]. Коррозия этих
сплавов равномерная. Сплаве 11,5% Мо полностью раз-
рушился в воде при 300° после испытаний длительно-
стью 35 суток. Наибольшую стойкость этот сплав пока-
зал после отжига в течение 35 суток при 400°. После та-
кой термообработки он разрушился в воде при 300"
лишь через 105 суток. Чем более однородны сплавы ура-
на с молибденом и чем равномернее распределение за-
грязнений,, тем более стойки эти сплавы. Скорость кор-
розии сплава с 12% Мо в воде при 343° в первые 20 су-
ток составляет 0,28 мг/см2 ч и растет с дальнейшим уве-
личением времени выдержки.
Сплав с 13% Мо разрушается из-за растрескивания,
обусловленного, вероятно, образованием гидридов, в во-
де при 300° через 30—40 суток, хотя начальная скорость
коррозии его мала. Для сплавов урана с 9—13,5% Мо
наблюдается значительный разброс результатов коррози-
онных испытаний в воде при 343°. При содержании мо-
либдена 9; 10,5; 12 и 13,5% время до разрушения образ-
цов составляет соответственно 99—199; 56—176; 49—
268 и 273—343 суток. Время до разрушения образцов в
воде и паровой фазе при температурах 360 и 400° мень-
ше и разброс данных сохраняется [24].
Сплавы с 28—29% Мо в воде при 300° разрушаются в]
основном за счет раскрошивания. Это обстоятельству
связывается [24] с внутренним образованием гидридов,;
которые и обусловливают хрупкость сплавов. На по-
44
верхности сплава с 20% Мо в воде при 300° образуются
язвы.
Зависимость скорости коррозии сплавов урана, леги-
рованных 7—15% Мо, от температуры выражается урав-
нением Аррениуса. Энергия активации при этом со-
ставляет 21 ккал/моль. Скорость коррозии возрастает с
температурой. Для сплавов, закаленных из у-фазы, ско-
рость коррозии составляет при 316, 360 и 400° соответ-
ственно 0,1; 0,3 и 0,8 мг/см2 • ч.
Оптимальные режимы термообработки сплавов U—
Мо, обеспечивающие их максимальную стойкость, при-
ведены в табл. 18.
Таблица 18
Оптимальный режим термообработки сплавов U—Мо,
обеспечивающий их максимальную коррозионную стойкость [6]
Содержание Мо, Температура отжига, Длительность отжига,
Q 300 >7
<) 343 49
11 5 400 35
12 400 35
14 500 7
15 500 7
Дополнительное легирование ниобием сплавов урана
с молибденом повышает их стойкость. Так, в воде при
340° сплавы урана с 8—12% Мо разрушались через
25 суток. Сплавы же, содержащие 8—12% Мо и 8—
12% Nb, разрушались после испытаний в течение 30—
56 суток. Более значительной стойкостью в этих усло-
виях обладал сплав урана, легированный 12% Мо и
0,5—2% Nb, после отжига в течение 7 суток при 400°.
Такую же высокую стойкость показал сплав с 9% Мо
и 1,4% Nb после отжига в течение 21—35 суток. Авторы
работы [23] указывают, что молибден и ниобий стабили-
зируют у-фазу.
Сплавы урана с 5,2—14,8 ат. % Мо и 3,4—3,6 ат. % Сг
разрушались в воде при 100° после испытаний в течение
100 ч. То же произошло со сплавом урана с 1,98 ат. %
Сг. В воде при 200° разрушаются сплавы урана с 19—
45
21,2 ат. % Мо и 3,9—4,6 ат. % Сг. Сплавы с 23—24,5 ат.
% Мо и 2,3—3,8 ат. % Сг разрушались через 100 ч ис-
пытаний в воде при 350°. Сплавы с 27,7—29,5 ат. % Мо
и 1,9 ат. % Сг разрушались в тех же условиях после
200 ч испытаний [25].
Введение 0,5% Zr в сплав урана с 10,5—12% Мо пред-
отвращает выпадение гидридов урана.
Длительность испытаний в воде при 343° до разруше-
ния сплава с 12% Мо при дополнительном легировании
сплава 1% Al, Si или Си возрастает. Введение 4,8% Pt
увеличивает время до разрушения отожженного сплава
с 15% Мо до 280 суток и закаленного на у-фазу—
308 суток. Платина в этих сплавах катализирует молиза-
цию водорода.
В воде при 343° максимальной стойкостью обладают
сплавы тройной системы U—Мо—Nb, содержащие 3,5%
Nb, а также ниобия и молибдена соответственно (в %):
14—0; 8—4; 8—8; 12—8; 20—4. После недельного отжи-
га при 400° наиболее стоек сплав с 12% Мо и 0,5—
2% Nb. В закаленном на у-фазу состоянии наиболее
стоек сплав с 9% Мо и 1,4% Nb. Скорость его коррозии
в воде при 343° равна 0,08 мг/см2-ч после испытаний
длительностью 168 суток. При более длительных испыта-
ниях сплав разрушается.
Стабилизация у-фазы способствует снижению скоро-
сти коррозии под облучением сплавов с 9—13,5% Мо.
Следует заметить, что облучение практически не изменя-
ло скорости коррозии в воде при 343°, но снижало дли-
тельность испытаний до разрушения образцов с 60 до
1—7 суток. Рост содержания молибдена в отожженных
сплавах увеличивает стойкость металла под облучени-
ем. Чем более длительное время сплав, закаленный в
у-области, подвергался облучению, тем быстрее он раз-
рушался в процессе коррозионных испытаний.
Сплавы с 9—13,5% Мо и 10% Nb достаточно корро-
зионностойки в воде при 340°. Однако использование их
при высокой температуре ограничено вследствие распу-
хания [24].
Выше указывалось, что a-фаза урана менее стойка,
чем у-фаза. Альфа-фаза образуется и в результате ста-
рения сплава при длительных выдержках в области вы-
соких температур. В связи с этим сплавы урана, зака-
ленные из у-области и представляющие собой Пересы-
46
щенный твердый раствор, могут быть использованы толь-
ко при низких температурах. Метастабильная а-фаза,
образовавшаяся при мартенситном превращении, более
стойка, чем стабильная a-фаза. Путем длительного от-
жига при температуре 350—400° можно увеличить кор-
розионную стойкость сплава, закаленного из у-области.
Сущность этого явления, неизвестна. Фазовых превра-
щений при этом не происходит. Возможно, что при та-
кой термообработке происходит растворение и перерас-
пределение примесей в сплаве, что приводит к образо-
ванию мелкозернистой квазиизотропной структуры
[26—28].
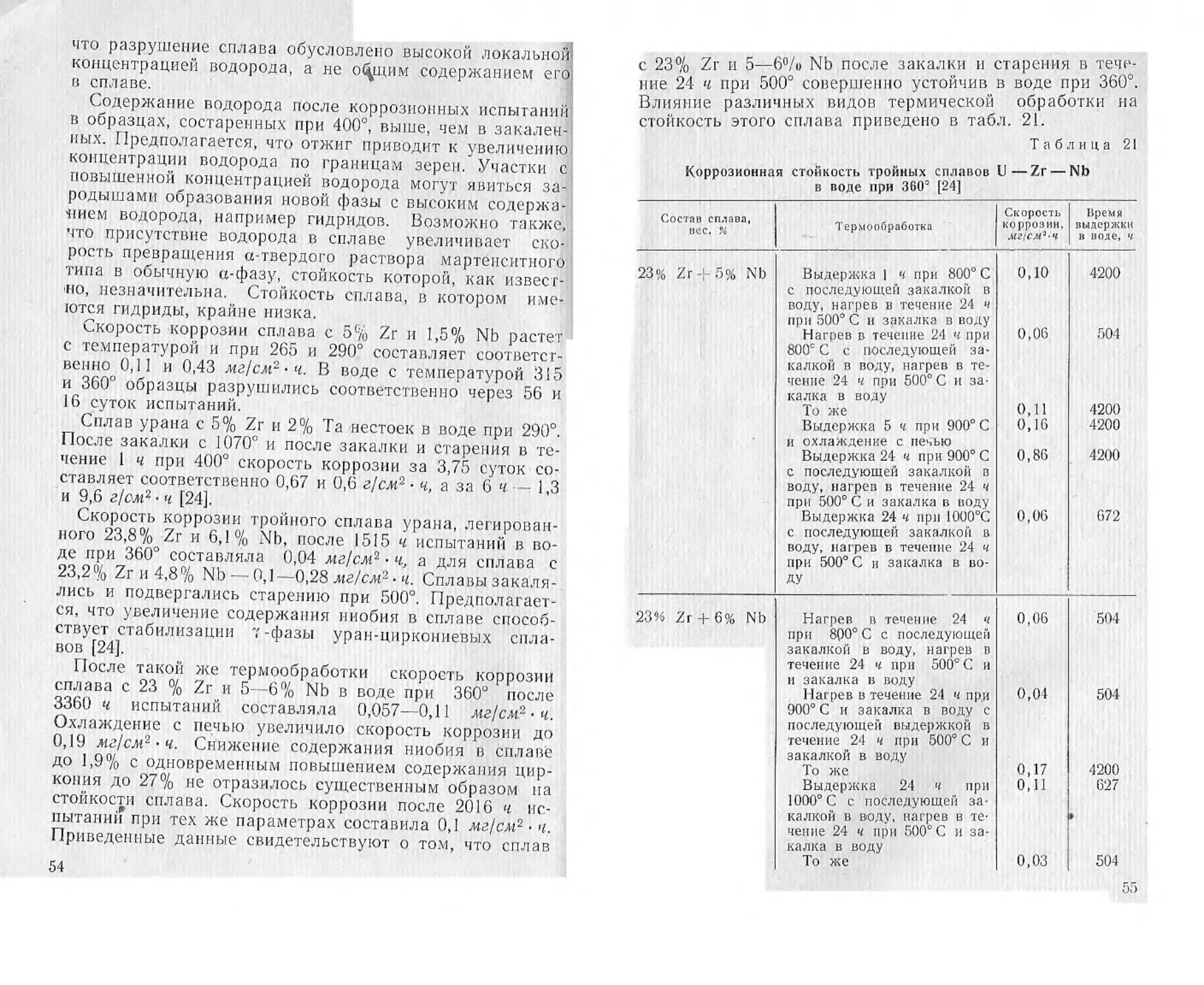
Гамма-фазы урана и циркония обладают полной
взаимной растворимостью при высоких температурах.
При 693° наблюдается моноэвтектоидный распад у-фа-
зы. Бета-фаза претерпевает эвтектоидный распад при
662°. Закалка сплавов с 2—3% Zr с 800° в воду способ-
ствует образованию тонкой игольчатой структуры. От-
пуск сплавов при достаточно высоких температурах со-
провождается коагуляцией составляющих и снижением
твердости. Для полной сфероидизации частиц необходи-
ма выдержка в течение нескольких недель при темпера-
туре 575—600°.
Легирование цирконием в количестве 2—3% лишь
незначительно снижает скорость коррозии урана
(табл. 19). Дальнейшее увеличение содержания цирко-
ния до 4—5% уже в большей степени снижает скорость
коррозии урана в кипящей дистиллированной воде. Од-
нако лишь сплав с 6% циркония оказывается достаточно
стойким в кипящей воде в течение 3000—7000 ч [20, 22].
Скорость коррозии урана, легированного 5% Zr, суще-
ственно уменьшается со временем. Так, по результатам
65-часовых испытаний скорость коррозии составляет
1,43 мг/см2 • ч (табл. 20), а через 165 ч— 0,02 мг/см2 • ч
(см. табл. 19). Можно полагать, что присутствие'в спла-
ве циркония способствует созданию па поверхности ме-
талла пассивирующей пленки продуктов коррозии. Уве-
личение потенциала облегчает пассивацию. Насыщение
воды кислородом или введение в нее перекиси водорода
увеличивает потенциал сплава урана с 5% Zr на 0,25—
0,35 в [14]. В этом направлении действует и контакт
сплава с нержавеющей сталью. Исходя из этих сообра-
жений, можно заключить, что введение в воду перекиси
47
Таблица 19
Скорость коррозии сплавов U—Zr в кипящей дистиллированной
воде, находящейся в контакте с воздухом |22]
Содержание
Термообработка
Длительность
испытании.
Скорость
1 ч при 600° и закалка в
воду....................
1 ч при 800° и закалка в
волу.............
То же . . ..............
» »
» » ...................
1 ч при 1100° и закалка в
воду....................
То же...................
1 ч при 600° и закалка в
ВОДУ...............• •
1 ч при 800° и закалка в
воду и 24 ч при 600° .
Коррозия сплава урана с 5% Zr в растворах перекиси водорода
при 100° (длительность испытаний 65 ч) [22]
48
водорода и контакт с нержавеющей сталью должны
снижать скорость коррозии сплава; это и подтверждает-
ся данными табл. 20.
По этой же причине в воде, насыщенной воздухом,
скорость коррозии сплава урана с 5% Zr при длительно-
сти экспозиции 500—670 ч в 100 раз меньше, чем в воде,
насыщенной аргоном [20]. После испытаний в воде, на-
сыщенной воздухом, поверхность сплава покрыта равно-
мерной темной окисной пленкой. После испытаний в во-
де, насыщенной аргоном, пленка окисла неравномерная.
При контакте с алюминием сплав- поляризуется катодно
и потенциал его остается в пределах активной области.
В этом случае условия для пассивации отсутствуют и
даже введение в воду перекиси водорода не может уве-
личить потенциал сплава до значений, отвечающих пас-
сивной области. Естественно, что при контакте с алюми-
нием наличие перекиси водорода в воде не снижает
сколько-нибудь существенно скорость коррозии этого
сплава (см. табл. 20).
Продукты коррозии на сплаве U—Zr после коррозии
в перекиси водорода имеют следующий состав, % [22]:
Ag, Be, Bi, Со, Cr, Sb............... <10-3
В, Mn, Mo, Ni, Ti, Zr......... <5-10“3
Al................................. 0,02-0,05
Cu, Fe, Pb......................... IO-2— 2-10-2
Mg............................. 10~2—0,15
Si....................• .... 5-10—2—°>5
Zr............................ 3-5
U.............................. 60-80
Стойкость сплава с 6% Zr в статических и динамических
условиях практически одинакова.
Термическая обработка влияет на стойкость сплавов
урана с 5% Zr. Изотермическая закалка из у-области с
быстрым охлаждением до комнатной температуры дает
металл, содержащий a-фазу в комбинации с мартенсит-
ной структурой. Стойкость сплавов при этом незначи-
тельна. Изотермическая закалка при 660° дает при
комнатной температуре a-фазу в сочетании с остаточной
метастабильной у-фазой. Структура эта также не обла-
дает высокой стойкостью. Наибольшую стойкость сплав
имеет после закалки с 725—1000° в воду или в жидкий
4 в. В. Герасимов
49
сплав Вуда. Время выдержки при температуре закалки
не влияет на стойкость сплава, что указывает на гомо-
генность фазового состава сплава при этих температу-
рах [29]. После закалки сплав имеет мартенситную
структуру. Дальнейшая термообработка, приводящая к
образованию обычной a-фазы, снижает стойкость спла-
вов.
При нагреве образцов под закалку в.вакууме отмече-
но выделение из металла пузырьков водорода. После
испытания в воде при температуре 290° в течение 113 и
J ч содержание водорода в металле составило соответ-
ственно 0,0004 и 0,00076%. Металлом поглощено при
этих испытаниях 0,00007% общего количества водорода,
выделившегося в процессе коррозии [29]. Величина эта
остается постоянной при длительности испытаний от 274
до 642 ч. В процессе испытаний наблюдается появление
в образцах трещин. Предполагается, что трещины обус-
ловлены высокой местной концентрацией водорода, вы-
делившегося при коррозии и поглощенного металлом.
Трещины находятся в той части образца, где содержа-
ние водорода максимально.
Дополнительное легирование сплава с 5% Zr ниобием
в количестве 1,5% благоприятно сказывается на корро-
зионной стойкости. В структуре сплава кроме а-фазы
имеется метастабильная у-фаза. Считают, что в, присут-
ствий ниобия метастабильная у-фаза коагулирует мед-
леннее и тройной сплав более стоек к коррозии в случае
увеличения времени выдержки при старении.
Благоприятное с точки зрения коррозии влияние цир-
кония объясняется следующим образом. Цирконий спо-
собствует образованию более стабильной окисной плен-
ки на поверхности сплава и препятствует диффузии во-
дорода в ней. Параметр решетки двуокиси урана на
сплаве с цирконием меньше, чем на чистом уране. Фа-
за, обогащенная цирконием, более интенсивно поглоща-
ет водород, предотвращая тем самым образование гид-
рида урана; уже 0,5% Zr предотвращает образование
гидрида урана. При большем содержании циркония в
сплаве фазой, обогащенной цирконием, поглощается в
единицу времени водорода больше, чем образуется
в процессе коррозии. Цирконий, кроме того, повышает
стабильность мартенситной фазы сплава, которая, как
известно, обладает большей стойкостью. Сплав урана с
50% Zr разрушается полностью в воде при температуре
315—331° за 200 и более суток испытаний. Скорость кор-
розии в этих условиях сплавов с 60 и 80% Zr составля-
ет соответственно 0,018 и 0,0029 мг/см2-ч.
В двойных сплавах с высоким содержанием циркония
стойкость снижается линейно с уменьшением процента
циркония в них. Особенно резко возрастает скорость
коррозии при уменьшении содержания циркония в спла-
ве ниже 50%. В воде при 360° стойки сплавы с содер-
жанием циркония не ниже 40%. В паре при 315—398°
скорость коррозии сплавов с 65% Zr линейно растет с
температурой.
В практике находит применение композиция на осно-
ве сплава циркония — циркалоя-4, легированного допол-
нительно 2—15% U. Дополнительное легирование таких
сплавов оловом в количестве 0,5—2,5% и ниобием в ко-
личестве 8% повышает стойкость этих материалов. Есте-
ственно, что в такого рода топливных композициях при-
меняется уран, значительно обогащенный изотопом
U235 [30].
Введение в сплав на основе циркалоя-2, содержащий
4% U, дополнительно 0,1 — 1% Fe улучшает стойкость
металла. Легирование сплавов циркония с 4—15% U
оловом в количестве 0,5—2,0% существенно не отра
жается на стойкости сплавов.
Коррозионная стойкость в воде при 301° урана с 40—
60% Zr ухудшается при содержании в сплаве 0,05—2%
никеля, 1—5% алюминия, хрома, железа, молибдена,
ниобия, платины, титана, ванадия или вольфрама, 0,02-
0,05% углерода или азота; 0,5—1,5% олова не влия-
ют на стойкость сплавов, а 0,05—0,2% железа улучша-
ют ее.
Введение 8% Nb в сплав на основе циркалоя-2 с
4°/о U улучшает его стойкость в воде при 300° и несколь-
ко увеличивает коррозию в паре при температуре 400°'
и давлении 100 ат. Легирование этого же сплава 8% Мо
увеличивает скорость коррозии [6].
Скорость перехода урана из сплава циркония с-
3,8% U в воду с температурой 316° составляет
27-10-6 мг/см2-ч. Сплавы на основе циркалоя-3 облада-
ют наилучшей стойкостью после закалки с 950°. Анало-
гичным образом влияет термическая обработка на сплащ
па основе циркалоя-2 с добавкой бора. Тройной сплав
51
урана с бором на основе циркалоя-3 наиболее стоек пос-
ле охлаждения с печью с температуры 550° [24].
Сплавы с 60% Zr, облученные при температурах
вплоть до 370°, при выгорании до 0,5 ат. "/о показали
удовлетворительную коррозионную стойкость при об-
лучении.
Сплавы на основе циркалоя-2 с 7% U при выгорании
1,6% полностью разрушились после 500 ч испытаний в
воде при 360°. Скорость коррозии этого же сплава с 1%
выгорания в воде при 280° составляет 0,06 мг/сл12-ч.
Предполагается [24], что низкая стойкость сплава пос-
ле выгорания 1,6% может быть связана с выделением
кислорода при радиолизе воды и перегревом отдельных
участков образцов вследствие неравномерного отвода
тепла. Коррозионная стойкость сплавов снижается с
увеличением степени выгорания [24].
В тройной сплав при отношении циркония к ниобию
(в ат. %), равном 1 : 1, можно ввести до 8 ат. % U.
При этом наблюдается даже некоторое увеличение стой-
кости сплавов при 400° [25].
Из сплавов на основе циркония с низким содержанием:
урана удовлетворительной стойкостью в паровой фазе
при 400° и давлении 300 ат обладают следующие ком-
позиции: 0,5 ат. % Nb + 2,0 ат. % U; 0,5 ат. % Nb +
-I- 0,5 ат. % Sn + 2,0 ат. % U; 15 ат. % Nb +
+ 2,0 ат. % Sn + 2,0 ат. % Sb + 5,0 ат. % U [25].
Сплав урана с 5°/о Zr и 1 % Nb быстро разрушается в
воде при 300°. Увеличение содержания ниобия до 1,5%.
делает сплав достаточно стойким в воде при 300—350°,
Скорость коррозии сплава в этих случаях составляет.
14—15 лг/сл12- сутки. Однако дальнейшее увеличение col
держания ниобия не повышает стойкости сплава.
Перспективным с точки зрения коррозионной стойко]
сти является сплав урана с 5% Zr и 1,5% Nb. При тем-
пературе выше 677° сплав кристаллизуется в т -фазе*
В температурном интервале 666—677° сплав содержи-?
р- и у-фазы. Ниже 666° структура сплава зависит от тер1
мической- обработки. Сплав, термически обработанный
на «-твердый раствор, нестоек. Быстрое охлаждение из.
Y-области приводит к образованию мартенситной струк!
туры с высокой коррозионной стойкостью. Оптимальной
термической обработкой являются выдержка в течение
52
при 125°. В процессе такой термообработки один обра-
зец был лишь наполовину погружен в сплав Вуда. При
коррозионных испытаниях в воде при 300° часть образца,
не погружавшаяся в сплав Вуда, разрушилась через
3 суток.
Скорость охлаждения при закалке существенно ска-
зывается на стойкости сплава. Серия образцов выдержи-
валась в свинце при 800° и закаливалась в воду, сплав
Вуда, масло и жидкий азот. В первых двух случаях об-
разцы показали удовлетворительную стойкость в воде
при 290°. После закалки в масло и жидкий азот сплав в
тех же условиях испытаний разрушился за 4 суток.
Можно полагать, что скорость охлаждения при закалке
в масло и жидкий азот недостаточна для фиксирования
мартенсита. Возможно, что слой пара изолирует металл
от закалочной среды и препятствует быстрому охлаж-
дению сплава. Длительность выдержки под закалку при
725—1000° не сказывается на стойкости сплава. Одина-
ковая стойкость наблюдается после выдержки продол-
жительностью несколько минут и 5,5 ч.
Старение в течение 2 ч при 400° снижает скорость,
коррозии закаленного из 7 -области образца в течение
первых 15 суток испытаний в воде при 290°. При дли-
тельных испытаниях скорость коррозии закаленных и
состаренных образцов выравнивается. Старение в те-
чение 312 ч при 290° дает тот же эффект, что и старение
в течение 2 ч при 400°. Если старение производится
при 425 и 440°, то хорошая стойкость получается при
длительности старения не свыше 10 и 5 мин соответст-
венно.
Присутствие в сплаве О,ОО35°/о водорода приводит к
существенному снижению стойкости металла. Количест-
во водорода, диффундирующего в металл в процессе
испытаний, прямо пропорционально количеству раство-
рившегося металла. 14з общего количества водорода, вы-
делившегося в процессе коррозии в металл, диффун-
дирует 0,69—1,14%. При коррозии в воде с температу-
рой 290° скорость поступления водорода в сплав состав-
ляет 0,95—1,09 мкг)см2 • сутки, причем величина .эта
практически не зависит от скорости коррозии. В двух
сериях образцов, с высокой стойкостью и разрушив-
шихся в процессе испытаний, содержание водорода прак-
тически было одинаковым. Дралей и др. [31] полагают,
53
что разрушение сплава обусловлено высокой локальной!
концентрацией водорода, а не о^щим содержанием его;
в сплаве.
Содержание водорода после коррозионных испытаний
в образцах, состаренных при 400°, выше, чем в закален-!
ных. Предполагается, что отжиг приводит к увеличению
концентрации водорода по границам зерен. Участки с
повышенной концентрацией водорода могут явиться за-
родышами образования новой фазы с высоким содержа-
нием водорода, например гидридов. Возможно также,;
что присутствие водорода в сплаве увеличивает ско-1
рость превращения a-твердого раствора мартенситного
типа в обычную a-фазу, стойкость которой, как извест-
но, незначительна. Стойкость сплава, в котором име-;
ются гидриды, крайне низка.
Скорость коррозии сплава с 5% Zr и 1,5% Nb растет
с температурой и при 265 и 290° составляет соответст-
венно 0,11 и 0,43 мг/см2-ч. В воде с температурой 315
и 360° образцы разрушились соответственно через 56 и
16 суток испытаний.
Сплав урана с 5% Zr и 2% Та нестоек в воде при 290°.
После закалки с 1070° и после закалки и старения в те-
чение 1 ч при 400° скорость коррозии за 3,75 суток со-
ставляет соответственно 0,67 и 0,6 г!см2 • ч, а за 6 ч 1,3
и 9,6 г/см2 • ч [24].
Скорость коррозии тройного сплава урана, легирован-
ного 23,8% Zr и 6,1% Nb, после 1515 ч испытаний в во-
де при 360° составляла 0,04 мг/см2 ч, а для сплава с
23,2% Zr и 4,8% Nb — 0,1—0,28 мг/см2 • ч. Сплавы закаля-
лись и подвергались старению при 500°. Предполагает-
ся, что увеличение содержания ниобия в сплаве способ-
ствует стабилизации '.'-фазы уран-циркониевых спла-
вов [24].
После такой же термообработки скорость коррозии
сплава с 23 % Zr и 5—6% Nb в воде при 360° после
3360 ч испытаний составляла 0,057—0,11 мг/см2 • ч.
Охлаждение с печью увеличило скорость коррозии до
0,19 мг/см2 • ч. Снижение содержания ниобия в сплаве
до 1,9% с одновременным повышением содержания цир-
кония до 27% не отразилось существенным образом на
стойкости сплава. Скорость коррозии после 2016 ч ис-
пытаний при тех же параметрах составила 0,1 мг/см2 - ч.
Приведенные данные свидетельствуют о том, что сплав
54
с 23% Zr и 5—6°/о Nb после закалки и старения в тече-
ние 24 ч при 500° совершенно устойчив в воде при 360°.
Влияние различных видов термической обработки на
стойкость этого сплава приведено в табл. 21.
Таблица 21
Коррозионная стойкость тройных сплавов U—Zr — Nb
в воде при 360’ [24]
Термообработка Скорость Время
.иг/сл’-ч в воде, ч
2396 Zr-|-5% Nb Выдержка 1 ч при 800° С с последующей закалкой в воду, нагрев в течение 24 ч при 500° С и здкалка в воду Нагрев в течение 24 ч при 800° С с последующей за- калкой в воду, нагрев в те- чение 24 ч при 500° С и за- калка в воду То же Выдержка 5 ч при 900° С и охлаждение с печью Выдержка 24 ч при 900° С с последующей закалкой в воду, нагрев в течение 24 ч при 500° С и закалка в воду Выдержка 24 ч при 1000°С с последующей закалкой в воду, нагрев в течение 24 ч при 500° С и закалка в во- ду 0,10 0,06 0,11 0,16 0,86 0,06 4200 504 4200 4200 4200 672
23% Zr + 696 Nb Нагрев в течение 24 ч при 800° С с последующей закалкой в воду, нагрев в течение 24 ч при 500° С и и закалка в воду Нагрев в течение 24 ч при 900° С и закалка в воду с последующей выдержкой в течение 24 ч при 500° С и закалкой в воду То же Выдержка 24 ч при 1000° С с последующей за- калкой в воду, нагрев в те- чение 24 ч при 500°С и за- калка в воду То же 0,06 0,01 0,17 0,11 0,03 '504 504 4200 627 504
55
Продолжение табл. 21
Состав сплава, Термообработка Скорость 'коррозии, выдержки в воде, ч
15% Zr-J-5% Nb Выдержка 24 ч при 800° С с последующей закалкой в воду, нагрев в течение 24 ч при 500° С и закалка вводу Выдержка 24 ч при 1000° С, охлаждение па воз- духе 0,06 0,05 504 504
10% Zr-|-5% Nb Выдержка 24 ч при 800° С и закалка в воду Выдержка при 900° С Выдержка при 1000° С 0,07 0,10 0,08 672 504 672
10% Zr-!-6% Nb Выдержка при 900° С . Выдержка при 1000° С Выдержка 24 ч при 800° С и охлаждение на воздухе Выдержка при 1000° С 0,10 0,10 0,06 0,04 504 672 672 504
В работе [24] исследовалась стойкость сплавов урана
со структурой a-фазы, легированных 2% Zr и рядом дру-
гих элементов. Количество этих элементов выбиралось
таким образом, чтобы сечение захвата было меньше или
равно сечению захвата сплава с 4% Zr. Сплавы с 2%
Zr, легированные платиной, алюминием, ниобием, а воз-
можно, и рутением, более стойки, чем сплавы с 4°/о Zr.
Легирование третьим компонентом увеличивает дли-
тельность использования в коррозионной среде сплава
с 2% Zr в 2—3 раза. Старение несколько увеличивает
скорость коррозии.
В кипящей воде сплавы с 2—4% Nb стойки лишь пос-
ле термообработки, обеспечивающей получение мартен-
ситной структуры. В литом состоянии скорость коррозии
этих сплавов составляет 0,29 мг/см2-ч. После нагрева в
течение недели при 1000° и последующего отжига в те-
чение 15 суток при 500° скорость коррозии равна
1,7 мг/см2-ч. После закалки с температуры 1000°, при'
которой сплав выдерживался неделю, скорость коррозии
составляет 0,0007 мг/см2-ч. Сплав с 6% Nb стоек после
всех перечисленных термообработок. При содержании в
сплаве 10% Nb скорость коррозии в литом состоянии
равна 0,002 мг!см2-ч. Закалка с температуры 1000° пос-
ле 11 суток выдержки при этой температуре снижает
скорость коррозии до 0,0006 мг/см2-ч.
Сплавы U — Nb после закалки с температур т-области
превосходят по стойкости сплавы U — Мо. При 175°
сплав с 6% Nb теряет за 63 суток 6,5 мг/см2. Для срав-
нения укажем, что потери в весе урана составляют при
этих условиях 2450 мг!см2 за сутки.
I — t - 260°; 2 — t 290'. разрушение за VI суток;
3 — I = ЗвО“.
Присутствие в воде 1% NaCl интенсифицирует кор-
розию всех уран-ниобиевых сплавов. При 185° вода
практически не действует на уран при кратковременных
испытаниях. В отношении сплава с 25% Nb аналогич-
ная картина имеет место в течение 500-часовых испыта-
ний. Данные по стойкости сплавов с 3 и 6% Nb при раз-
личных температурах приведены на рис. 7 и 8.
С повышением температуры стойкость сплавов сни-
жается. Присутствие кислорода в воде несколько уско-
ряет коррозию. Малые добавки ниобия не только спо-
собствуют фиксированию при комнатной температуре
более коррозионностойкой мартенситной структуры, ио
и ведут к образованию т -фазы, обогащенной после об-
разования a-фазы ниобием. Перенапряжение водорода
57
на г -фазе, обогащенной ниобием, мало, что способст
вует удалению водорода.
Стойкость двойных сплавов с ниобием при содержа-
нии урана 10—60% близка к стойкости чистого ниобия.
В воде при 316° уменьшение веса сплавов зафиксирова-
но через 112—126 суток, при 360° — через 98 суток. Об-
разовавшаяся на поверхности сплавов темно-коричневая
окисная пленка отслаивается от металла. До отслаива-
ния пленки привес после недельной экспозиции в воде'
при 316 и 360° составлял соответственно 0,18—0,29 ill
0,28—1,8 мг/см2 [24].
Сплав с 3% Nb является анодом по отношению к цир-
калою-2. В воде при 300° между образцами сплава и
частью урана, находящимися на расстоянии 0,5 см, за-
фиксирован ток 2 ма/см2. Сплав с 1,5% Nb и 5% Zr при
анодной поляризации с плотностью тока 1 ма/см2 пока-
зал скорость коррозии 22 мг/см2 •сутки. При катодной
поляризации с той же плотностью тока на образце вы-
деляется водород и скорость коррозии составляет
31 мг/см2 • сутки. Без поляризации сплав разрушался сея
скоростью 25 мг/см2 • сутки. Такой сплав имеет наиболь-
шую стойкость при закалке на мартенсит. Присутствие в;
структуре сплава а- и 7-фазы снижает его коррозион-i
ную стойкость.
С увеличением длительности коррозионных испытаний;
содержание водорода в сплавах возрастает. Сплавы с
7,125—15% Nb, а также с 10,6% Nb и 4% Zr, закален-
58
ные с 1600°, нестойки в воде при 360°. Кислород, сера,
бериллий по отдельности и железо, бериллий и тантал,
присутствующие вместе, понижают коррозионную стой-
кость сплава в воде при 366°. Олово благоприятно
влияет на коррозионную стойкость. Роль железа и угле-
рода неясна [24].
Гомогенизация сплава при 1000° в течение 24 ч спо-
собствовала уменьшению внутризеренной ликвации, но
ухудшала стойкость в воде при 360°. Увеличение шири-
ны границ зерен в результате термической обработки
приводит к развитию межкристаллитной коррозии. Об-
разцы, не подвергавшиеся термической обработке, Име-
ли более высокую коррозионную стойкость. Но вследст-
вие негомогеннбсти сплава разброс данных был велик.
Сплавы с 7% Nb и 1—2% Zr, с 7% Nb с добавками
0,12—0,74% Сг, 0,9—1,94% Ti, 0,14—0,68% Si, 0,14% Ni,
0,49% Ru, 0,98—2,02% V разрушились через 10 суток в
воде при температуре 360° [24].
Скорость коррозии сплавов U — Si в дистиллирован-
ной воде при 60° вдвое меньше скорости коррозии не-
легированного урана. В воде при 343° скорость коррозии
этих сплавов составляет 16 мг/см2 сутки. С ростом дав-
ления в системе скорость коррозии увеличивается. В па-
ре при температуре 400° и давлении 100 ат сплавы раз-
решаются. Сплавы с 3,4—3,8% Si приобретают макси-
мальную стойкость после 160-часового нагрева при 750’.
Присутствие в сплаве a-фазы урана резко снижает стой-
кость. Наибольшей стойкостью обладает сплав с сум-
марным содержанием кремния 3,63%: 3,40% Si в 6-фазе
и остальное в UsSi. Сплавы с 3,07 и 2,59% Si разруши-
лись после I—3 суток испытаний в воде при 178°. Ско-
рость коррозии сплава с 3,63% Si составила в этих же
условиях 0,0081 мг/см2-ч.
Фаза состава USi2 стойка в кипящей воде ив 1,0 У
растворе гидроокиси натрия, но реагирует с кислотами.
Стойкость сплава урана с 2,26% Si и 1,45% А1 такого
же порядка, что и у сплава с 3,4 % Si.
Длительная выдержка при температуре 850° сплава
урана с 3,8% Si приводит- к образованию б-фазы — U3S1.
Сплавы этого состава достаточно стойки в воде при тем-
пературе 260° (табл. 22). С повышением температуры
до 316° стойкость этих сплавов снижается. Сплавы с
3,8% Si могут применяться при более высоких темпера-
59
Таблица 22
Коррозия сплавов U — Si — С в воде [27]
Термообработка
3,7% Si-j-O,08% С (графит)
3,75% Si—0,05% С (графит)
3,82% Si-| 0,05% С
3 суток при 800°
6 суток при 800°
3 суток при 800°
Скорость коррозии,
маем*'месяц
260° | 316э
0,07 1,95
0,083 1,95
0,042 1,67
турах, чем сплавы со структурой 7 -твердого раствора и
а-мартенсита. Последние две группы сплавов при дли-
тельной выдержке при высоких температурах испытыва-
ют структурные превращения с образованием a-фазы с
низкой коррозионной стойкостью. Рекомендуется, в ча-
стности, сплав следующего состава: 2,63% Si. 1,45% А1,|
остальное уран. Контакты с алюминием, цирконием, не- ]
ржавеющей сталью практически не изменяют стойкости;
сплавов этого типа [12].
Облучение снижает стойкость сплава урана с 3,8% St'
в воде при 343°. Так, облученные образцы разрушились,
после 20 ч испытаний, контрольные образцы — после]
84 суток. При испытаниях с облучением до выгорания в.|
0,085 ат % в деаэрированной воде высокой чистоты при]
260° скорость коррозии сплава с 3,8% Si составила зж
31,4 суток 0,05 мг/см2 • сутки. Однако после 62,8 суток
испытаний в образце образовалась трещина.
Присутствие в сплаве других фаз, кроме UgSi, снижав
ет стойкость металла. С этой точки зрения содержания
кремния в сплаве желательно иметь в пределах 3,9ч-'-|
4%. Оптимальная температурная область образования
U3Si из UsSia и урана считается 785—825° [24].
Увеличение содержания хрома в уране от 0,2 до 1,8%
снижает скорость коррозии сплава в 4- 10-5 N перекиси
водорода при pH = 6 и 90° с 0,7 до 0,03 мг/см2 ч. Имеет
ся указание [26] на высокую коррозионную стойкосп
сплавов урана с 1 — 12% Сг.
Литые сплавы урана с 0,6 и 2,01% W разрушаются в
кипящей воде. Отжиг увеличивает стойкость этих спла
вов. Скорость коррозии сплава с 0,6% W в литом состоя
нии составляла 7 мг/см2 • ч, в отожженном ч
60
1,8 мг/см2 ч. Для сплава с 2,01% W эти значения были
соответственно равны 1,8 и 0,65 мг/см2 • ч.
С увеличением содержания тантала стойкость сплава
проходит через минимум, лежащий при 4—8% Та. Ско-
рость коррозии литых сплавов оптимального состава в
воде при 100° составляет 2—2,5 мг/см2 ч. После недель-
ного отжига при 1000° скорость коррозии сплавов с 4—
8% Та по результатам 972-часовых испытаний в кипя-
щей воде равна 0,002—0,005 мг/см2 • ч.
Легирование урана церием в количестве 0,17% сни-
жает стойкость урана. Скорость коррозии этого сплава
после 72-часового отжига при 850° в кипящей дистилли-
рованной воде составляет 1,3 мг/см2 • сутки после 800 ч
испытаний и 14,7 мг/см2 сутки для сплава с 0,57% Се
после 94-часовых испытаний.
В воде при 100° скорость коррозии урана, легирован-
ного 2,5% V, после испытаний в течение 138, 164 и 306/ ч
составляла 0,016; 0,33 и 0,014 мг/см2-ч соответственно.
Сплав же с 1,1% V корродировал с постоянной скоро-
стью 1,7 мг/см2-ч.
В системе U — А1 наивысшую стойкость имеет сплав
с содержанием 0,02% А1, что приблизительно соответст-
вует максимальной растворимости алюминия в уране.
Скорость коррозии линейно увеличивается с ростом со-
держания алюминия до 6%. Хлориды в количестве
2 мг/л не влияют на стойкость сплавов. При окислении
на воздухе при 150—400° окисная пленка, образующая-
ся на UAh, увеличивает стойкость сплава.
Определенный интерес представляют сплавы алюми-
ния с небольшим содержанием урана. При содержании
урана в сплаве свыше 16,8% сплавы нестойки в потоке
воды, содержащей 2- 10~5;V перекиси водорода, при 70°.
Скорость коррозии при этом составляет 6 мг/см2 ч и вы-
ше. Сплав алюминия с 9% U близок по стойкости в во-
де к сплаву 2 S (1100) [6].
В деаэрированной обессоленной воде при температуре
380° удовлетворительную стойкость показали сплавы
алюминия с 12% Si и 6% U [21]. Сплавы алюминия с
6% U не были стойкими в этих условиях.
В системе U — Be максимальной стойкостью облада-
ет сплав с 0,02% Be. С уменьшением или увеличением
содержания бериллия ниже или выше этого значения
скорость коррозии сплава возрастает. Скорость корро-
61
зии сплава оптимального состава равна 0,3 мг/см2 ч в-
воде, содержащей 3>10-5Л^ перекиси водорода, при
pH = 6 и температуре 90°. Хлориды в количестве 2 мг/Л
не влияют на стойкость сплава.
Рутений в количестве 1—3% снижает температуру
превращения 7-фазы уран-циркониевых и уран-молиб-
деновых сплавов и повышает их коррозионную стой-
кость в воде при 360°.
Введение в уран титана в количестве 0,1% увеличи-
вает стойкость к атмосферной коррозии в 10 раз при
70- и 50%-ной относительной влажности. Закалка из Y -об-
ласти ведет к уменьшению скорости коррозии. При содер-
жании титана 1 % стойкость сплава увеличивается в
50 раз по сравнению с чистым ураном. Для заметного
снижения скорости коррозии урана в воде при 290° в
сплав надо вводить минимум 2,7% Ti. Скорость корро-
зии сплава с 2,7% Ti, закаленного из '.'-фазы, состав-
ляет 1—2 мг/см2 • ч. Однако на отдельных образцах на-
блюдалось расслаивание. При температуре 315° за 3,8—
6,8 суток скорость коррозии сплава составила 3,1 —
5 мг/см2 ч, причем в ряде случаев коррозия была яз-
венной [24].
Сплав с 3% Ti, закаленный из т -области и состарен-
ный в течение 1 ч при 400°, разрушился после нескольких
дней испытаний в воде при 260°. Скорость же коррозии
сплава с 3% Ti и 1,5% Nb, закаленного с 1000°, в воде
при 260° в течение 50 суток составила 0,04 мг/см2 ч.
В течение дальнейших 25 суток испытаний скорость кор-
розии снизилась вдвое. Однако уже после 14 суток ис-
пытаний в образце появились мелкие трещины. Закалка
с 750° и старение в течение 2 ч при 400° сплава, зака-
ленного с 1000°, практически не изменили коррозионной
стойкости.
Стойкость сплава с 3% Ti и 1,5% Nb в воде при 245°
выше, чем сплава с 5% Zr и 1,5% Nb в закаленном со-
стоянии. Следует, однако, иметь в виду, что сплав урана
с титаном имеет более высокое сечение захвата тепло-
вых нейтронов. Сплав с титаном менее стоек при тепло-
сменах. Изменение содержания циркония от 0,5 до 2%
в сплаве с 3% Ti не отражается на скорости коррозии,
которая в воде при 260° составляет в этом случае
0,19 мг/см2 • ч. Скорость коррозии сплава с 7,2—9% Ti
в воде при 100 и 178° составляет 0,001 и 5,9 мг/см2-ч
62
соответственно. Скорость коррозии сплава с 3,2% Ti в
кипящей воде за 500 ч равна 0,2 мг/см2-ч. При 178°
этот сплав разрушается.
При увеличении содержания палладия в сплаве сура-
ном свыше 80 ат. % стойкость сплава снижается до ми-
нимума при 88 ат. % Pel. Эти сплавы в кислых средах
более стойки, чем композиции с высоким содержанием
урана.
Данные по коррозионной стойкости ряда бинарных
сплавов урана приведены в табл. 23 и 24.
Таблица 23
Скорость коррозии сплавов урана в воде и > аре, мг/см- • ч [30]
Легирующий элемент
260° 352° <100°
3,8% Si (U3Si)..............
(9-: 15)% Мо...............
(8+20)% Nb.................
50% Zr .....................
0,15
0,016
0,006
0,005
1,4
0,25
0,05
0,17
0,77
Таблица 24
Длительность коррозионных испытаний (до разрушения образцов)
сплавов урана в воде при 343“ [30]
Длительность испытаний до разрушения образцов, сутки
Легирующие элементы охлаждение с 900е со скоростью 1° в сутки охлаждение с 900° со скоростью 1э в сутки и выдержка при 400- в течение 35 суток
12% Мо..................
15% Мо..................
10% Nb..................
20% Nb..................
50% Zr..................
10
10
133
105
22
3,8% Si.................
12% Mo+ 0,5% Pt.........
15% Mo + 4,8% Pt........
9% Mo + 1,4% Nb.........
>200
>200
63
>308
175
103
>200
90
>294
10
Из исследованных в работе [25] многочисленных ком-
позиций тройной системы U — Th — Zr ни один сплав
не был стоек в воде при 350°.
Излучение ядерного реактора существенным образом
влияет на стойкость металлов и сплавов. Перекись во-
63
дорода, короткоживущие радикалы, образующиеся при
радиолизе воды, увеличивают скорость катодного про!
цесса и соответственно потенциал металла. При этом
скорость анодного процесса и коррозии металла возра-
стает, если величина стационарного потенциала при об-
лучении и без него отвечает активной области. Если же
стационарный потенциал во всех случаях отвечает пас-
сивной области, обусловленной адсорбционными пасси-
вирующими слоями, то облучение не изменяет скорости
анодного процесса и коррозии металла [32]. Для метал-
лов, покрытых окисной пленкой, следует иметь в виду
фото-электрохимическое действие излучения. Поскольку
уран и его сплавы в процессе коррозии покрываются
окисной пленкой, при оценке влияния облучения на их
стойкость всегда следует учитывать возможность уве-,
личения скорости электродных процессов при облучении
за счет фото-электрохимического эффекта. Не следует?
также исключать в разбираемом случае и изменения,
скорости анодного процесса под облучением за счет ра-
диационно-химического эффекта, т. е. изменения состава1
среды за счет радиолиза.
В работе [33] показано, что фото-электрохимический
эффект при облучении металлов, покрытых окисной
пленкой, зависит от характера окисла. Так, для окисных
пленок — полупроводников п-типа — фото-электрохими-
ческий эффект проявляется в основном в анодной обла-
сти, для окислов р-типа — в катодной. Напомним, чта
двуокись урана является полупроводником p-типа. На
основании данных работы [33] можно полагать, что об-
лучение интенсифицирует катодные процессы на уране,
покрытом пленкой, за счет фото-электрохимического;
эффекта. Увеличение же скорости анодного процесса;
при облучении будет обусловлено в основном радиа-
ционно-химическим эффектом. В целом же излучение
интенсифицирует коррозию урана и его сплавов.
Сплавы с 2—5% Zr имеют мартенситную структуру q
высокой коррозионной стойкостью. Однако эти сплавы,
даже будучи легированы дополнительно ниобием, обла-
дают низкой радиационной стойкостью. Лишь сплавы ci
10% Nb удовлетворительно ведут себя в поле облучения.
Если в сплавах при работе в реакторе произошло га-
зовое распухание (свеллинг), то значительная коррозия
наблюдается уже в воде при 76°.
64
Пластины сплава с 5% Zr и 1,5% Nb были покрыты
циркалоем-2. Сплав был закален после 15 мин выдержки
при 850° и состарен в течение 45 мин при 425°. В обо-
лочке из циркалоя-2 были проделаны круглые отверстия
диаметром 0,125 дюйма. В реакторе сплав выдерживался
до выгорания 0,021—0,079 ат. %. Испытания проводи-
лись в деаэрированной воде при 240—275° в течение
58 ч. В конце испытаний отверстия в оболочке были за-
биты продуктами коррозии, но спеллинга не наблюда-
лось. В аналогичных испытаниях в течение 66 ч при
290° оболочка полностью окислилась и разрушилась по
сварному шву. В контрольных испытаниях без облуче-
ния в течение 95 ч при 290° не отмечено сколько-нибудь
существенной коррозии образцов.
Уран-ниобиевый сплав, закаленный из у-области, в во-
де при 260° без облучения показал себя достаточно
стойким. После 2000 ч испытаний скорость коррозии его
составляла 0,18 мг/см2-ч. Когда же испытания проводи-
лись на материале, выгоревшем на 0,1 ат. %, образцы
разрушились через 1 ч. При выгорании материала на
0,04 ат. % через 63 ч испытаний в воде при 260° в образ-
цах возникли трещины. Скорость коррозии при этом со
ставила 1 мг/см2 ч [26].
Облучение также ускоряет появление трещин и разру-
шение сплавов урана с 9% Мо при испытаниях в воде
при высокой температуре. Стойкость сплавов со стаби-
лизированной г-фазой снижается при облучении мень-
ше, чем мартенситных сплавов или соединений UsSi.
При совместном воздействии горячей воды и механи-
ческих напряжений наблюдается растрескивание 7-фазы
сплавов U — Zr [34]. Предполагается, что при образова-
нии трещин определенную роль играют силы сцепления,
возникшие между окисной пленкой и металлом. В ряде
случаев наблюдается структурное соответствие между
кристаллическими решетками окисла урана и сплава.
Поскольку параметры кристаллических решеток раз-
личны, возникают напряжения в решетке металла.
С ростом толщины пленки продуктов коррозии увеличи-
ваются и напряжения в металле. При толщине пленки
1 мк напряжения в металле достигают предела текучести.
Молекулярный объем продуктов коррозии больше, чем
атомный объем металла. Трещины могут развиваться за
счет расклинивающего действия продуктов коррозии.
5 в. В. Герасимоп
Г ла в а IV
КОРРОЗИЯ УРАНА И ЕГО СПЛАВОВ
В НЕВОДНЫХ СРЕДАХ И ЗАЩИТНЫЕ ПОКРЫТИЯ
Металлический уран взаимодействует с воздухом при'
комнатной температуре. Во влажном воздухе металл по-
крывается окисной пленкой темно-коричневого цвета,
состоящей из двуокиси урана. Состав окисла может от-
личаться от стехиометрического в сторону избытка кис-
лорода. Скорость коррозии при комнатной температуре
в сухом воздухе невелика и составляет несколько микрон
в год. В присутствии влаги скорость окисления на воз-
духе существенно возрастает. При высокой влажности
или при температуре свыше 70° окисная пленка не яв-
ляется защитной. В ней образуются и гидраты, напри-
мер UO2 • 2Н2О.
При давлении воздуха менее 10-4 ат и температуре
более 600° на поверхности урана образуется нестабиль-
ная моноокись урана UO, переходящая при снижении
температуры в двуокись урана. При атмосферном дав-
лении и температуре ниже 100° продукты коррозии со-
стоят из двуокиси урана, в интервале температур 100—'
200° — из UO2 и U3O8 [6].
Во влажном воздухе окисли урана, взаимодействуя с
водой, образуют темно-зеленый гидрат окиси урана
UO2-2H2O или желтый гидрат закиси-окиси U3O8-H2O.
При нагреве свыше 185° оба гидрата диссоциируют, а
двуокись урана окисляется при этом до UsO». При ком-
натной температуре отмечено крайне медленное окис-
ление гидрата двуокиси до UO3 • Н2О.
Коррозия урана во влажном воздухе сопровождается
выделением водорода. Увеличение относительной влаж-
66
(пости воздуха до 1% приводит к интенсификации кор-
розии. Для предотвращения коррозии уран целесообраз-
но хранить в герметичной емкости в присутствии погло-
тителей влаги, например силикагеля, перекиси натрия,
сульфата кальция. Коррозия в этом случае в 10—20 раз
меньше, чем в воздухе с 50 %-ной относительной влаж-
ностью. Коррозия урана при комнатной температуре за
100, 700 и 5000 ч составляет 0,51; 2,65 и 11,1 мг/см2 со-
ответственно. По результатам 1000-часовых испытаний
при 75° в воздухе с 50%-ной относительной влажностью
коррозия высокочистого урана, урана с 0,044% Fe, с
0,56% С, с 0,05% Си составила соответственно 3,6; 1,75;
1,8; 1,8 мг/см2. Потери ультравысокочистого урана и
урана, загрязненного 0,053% Ni и 0,05% Si, были рав-
ными и составляли 2,4 мг/см2. В сухом воздухе при 75°
потери в этом случае колебались от 0,053 до
0,075 мг/см2 [6].
Механизм атмосферной коррозии металлов детально
изложен в ряде руководств, например в монографии
И. Л. Розенфельда [35]. Не вдаваясь в детали процесса
атмосферной коррозйи, заметим лишь, что на поверхно-
сти урана, как и любого другого металла, при сопри-
косновении с воздухом образуется адсорбционная, или
фазовая, пленка влаги. Коррозия идет по электрохи-
мическому механизму. В пленке влаги протекают элек-
тродные Процессы, приводящие к развитию атмосфер-
ной коррозии. Атмосферная коррозия в большинстве
случаев идет с кислородной деполяризацией. Конвек-
ционное размешивание, обусловленное испарением вла-
ги из пленки, интенсифицирует доступ кислорода к по-
верхности металла и соответственно ускоряет протека-
ние катодного процесса. Облегчение доступа кислорода
к поверхности металла в процессе атмосферной корро-
зии способствует образованию окисных пленок, влияю-
щих в ряде случаев на кинетику анодного процес-
са.
Увеличение температуры и влажности в большинстве
случаев интенсифицирует' атмосферную коррозию. При
этом скорость коррозии чистого урана значительно боль-
ше зависит от температуры, чем скорость коррозии спла-
вов урана. Во влажном. воздухе при повышенных, темпе-
ратурах коррозия урана и _егр сплавов ..идет,..па...з.акрду,
близкому к линейному.
67
Легированием можно снизить скорость коррозии ураЯ
на в воде при температуре 300° в 105 раз, При атмос!
ферной коррозии легированием можно уменьшить расЛ
творение урана в 100 раз.
На воздухе при относительной влажности 50—75%]
привес урана высокой чистоты за 10 и 10 000 ч состав-]
ляет соответственно 0,05 и 10 мг/см2. Легирование урана
6% Zr снижает коррозию в 10 раз. Если сплав с 6% Zra
закален с 850° в воду, то скорость его коррозии на возду'1
хе в 20—30 раз меньше, чем чистого урана. Легирование'
урана 6% Hf снижает коррозию в тех же условиях в|
первые 1000 ч испытаний в 2—3 раза. При длительных'
испытаниях в течение 10 000 ч коррозия урана и его
сплава с 6% Hf практически одинакова.
С увеличением содержания ниобия в уране коррозия
сплава уменьшается: 4% Nb снижают коррозию в 4—
6 раз, 6 и 8% Nb — в 20 раз. Закалка этих сплавов с
850° еще несколько повышает их стойкость. Предпола-
гается, что в процессе отжига исчезает местное обедне-
ние ниобием.
Сплавы с ниобием имеют структуру а-мартенсита и
у-твердого раствора (36].
Коррозия сплава, легированного 3% Мо и 1% Nb, в,
10 раз меньше, чем в случае чистого урана. В значителъ
но большей степени (в 40—60 раз) тормозит атмосфер;
ную коррозию введение в сплав 5% Мо и 1% Nb. Тако
го же порядка стойкость имеет сплав с 3% Мо, 2°/о NI
и 1 % Zr. Все сплавы с содержанием молибдена до 6П/
в результате 10-месячных испытаний подвергаются бо-
лее интенсивной коррозии, чем литой уран высокой чи-
стоты. Атмосферная коррозия этих сплавов идет с уско-
рением во времени. После 300 ч испытаний на воздухе о
50%-ной влажностью при 75° сплав с 6% Мо сильна
растрескался и затем разрушился. На сплавах с мень:.
шим содержанием молибдена образовались порошкообя
разные слоистые продукты коррозии, толщина которых
в 3 раза превышала толщину прокорродировавшего
металла. В продуктах коррозии был обнаружен гидрид
урана.
Сплавы с 8 и 10% Мо показали хорошую коррозионЯ
ную стойкость. Никаких следов растрескивания не об!
наружено. После 7000 ч коррозия в 70—100 раз мены]
ше, чем чистого урана [36].
68
Сплавы урана с 1 % Ti наиболее стойки после закал-
ки. Коррозия при этом в 10—15 раз меньше, чем чистого
урана. Сплавы с 1% Ti могут оказаться полезными в тех
случаях, когда легирование металла ограничивается
очень малыми добавками.
Продукты атмосферной коррозии урана и его сплавов
состоят в основном из двуокиси урана. Снижение относи-
тельной влажности воздуха с 50 до 1% уменьшает кор-
розию чистого урана при 75° в первые 150 ч в 2—3 раза.
При увеличении экспозиции до 10 000 ч коррозия при от-
носительной влажности 1% возрастает, приближаясь к
значениям, характерным для влажности 50%. Полное
осушение воздуха снижает скорость атмосферной корро-
зии чистого урана в 10—20 раз, т. е. до значений, харак-
теризующих коррозию наиболее стойких сплавов урана
в воздухе при 75° с 50%-ной относительной влажностью.
Скорость атмосферной коррозий урана мало зависит
от чистоты металла. Однако все же наиболее стойким
является уран высокой чистоты.
В последнее время в ряде работ было показано, что
электрическое поле влияет на скорость окисления метал-
лов. Электролитом в данных опытах явилась окисная
пленка, образованная на поверхности металла. Можно
полагать, что электрическое поле в зависимости от на-
правления ускоряет или тормозит движение ионов в
окисле и тем самым сказывается на скорости окисления.
В сухом воздухе при температурах 250—760° и в ат-
мосфере кислорода при 250—400° окисление урана в на-
чальный период идет по параболическому закону. По
истечении некоторого определенного для данной темпе-
ратуры интервала времени окисление начинает проте-
кать по линейному закону. Платиновая проволока, нане-
сенная на поверхность урана перед экспериментом, пос-
ле длительного окисления на воздухе при 350° оказалась
на поверхности окисного слоя. Это свидетельствует о
том, что взаимодействие ион-атомов урана с кислородом
происходит на границе раздела уран — окисная пленка,
а не на границе раздела окисная пленка — газовая фаза.
Сравнение энергии активации объемных самодиф-
фузий урана (90—125 /с/салЛиоль) и кислорода
(29,7 ккпл/жодь) в двуокиси урана, отсутствие рыхлот в
зоне окалины, прилегающей к границе окисел — металл,
опыты с платиновой меткой дают возможность утверж-
G9
дать, что определяющим фактором в окислении урана
является диффузия кислорода через плотный слой ока-1
лины {37].
Коэффициент диффузии кислорода (см2/сек) в двуокиd
си урана стехиометрического состава при 160—350°
D = 5,5 • 10-2 ехр(-26300//?7’).
Для двуокиси нестехиометрического состава U02,oo4 И
том же температурном интервале
D = 7-IO'6 ехр (-29 700/7? 7).
Коэффициент самодиффузии кислорода в двуокиси
урана стехиометрического состава при 80—550° состав-
ляет
О = 1,2-10~3ехр(—65300//??’).
Коэффициент диффузии ион-атомов урана в двуокиси
урана при 1450—1785°
D == 4,3-10-* ехр (-88 000//??').
Окалина на металле подразделяется на два слоя:
внутренний (первичный) —плотный, сплошной, и на-
ружный— пористый, прерывный. Скорость образования
первичного слоя обратно пропорциональна его толщине.
Окисление урана по линейному закону начинается в
тот момент, когда первичный (не пористый) продукт
окисления переходит в пористую модификацию вследст-
вие присоединения дополнительного кислорода. Первич-
ная окисная пленка состоит из двуокиси урана. В случае
окисления урана на воздухе при 260—400° окисли ура-
на распределяются в окалине по следующей схеме:
UMeT aUO2 -> aUO2+.f 3UO2(U4O.,) -> U3O7 -> UO2,67.
Порошкообразный, легко осыпающийся наружный слой
окалины на уране состоит из U3Oe. После удаления
П3О8 с образца, окисленного при 350°, на поверхности
окалины преобладает пористый окисел U3O7. При темпе-
ратурах выше 400—500° окисел U3O7 неустойчив и раз-
лагается с образованием двух фаз: pUO2 и U3O8. При
высокотемпературном окислении урана протекают не
только диффузионные процессы в уже сформировавших-
ся слоях окалины, но и процессы образования и роста
70
зародышей кристаллических решеток новых окисных фаз,
связанных с перестройкой кристаллических решеток
окислов. Последняя осуществляется по принципу ориен-
тационно-размерного соответствия. Окислы UOg и Ь\ОЭ
имеют кубическую решетку. Структура U3O7 получается
путем простого добавления атомов кислорода в решетку
U.|Og. Поэтому взаимные переходы этих окислов осу-
ществляются сравнительно легко. При образовании же
окисла ПзОв или твердых растворов на его основе осу-
ществляется кристаллизация на решетке с резко отлич-
ной структурой [37]. Осыпающийся слой U3O8 легко про-
ницаем для газа-окисилителя. Практически единственным
препятствием на пути реагентов является плотный слой
двуокиси урана. С увеличением толщины слоя UO2 ско-
рость роста его уменьшается, так как затрудняется диф-
фузия реагирующих компонентов через этот слой к месту
взаимодействия. В результате скорости роста первого
слоя и перестройки его во второй слой выравниваются.
При этом толщина первого слоя остается постоянной.
В дальнейшем окисление контролируется диффузией
реагирующих компонентов через окисную пленку по-
стоянной толщины. Этим и объясняется тот факт, что на
последующих этапах окисления процесс описывается ли-
нейным временным законом.
Следует также иметь в виду, что вследствие большой
разности в удельных объемах урана и его окислов (от-
ношение удельных объемов образующихся окислов и ис-
ходного металла равно 1,96—2,6) в окисной пленке,
прочно сцепленной с металлом, возникают значитель-
ные механические напряжения, под действием которых
тонкие образцы из урана могут удлиняться на 20% за
16 и окисления при 650°. Последнее обстоятельство при-
водит к растрескиванию и скалыванию отдельных участ-
ков наружных слоев окалины. В связи с этим, хотя со-
отношение Пиллинга и Бэдворса выполняется и равно,
как указывалось выше, 1,96—2,6, окисная пленка, об-
разующаяся на металле, не является защитной. Ка-
жущаяся энергия активации, найденная в работе [37] и
равная 17—-18 ккал/моль, ниже значения, приведенного
ранее для объемной самодиффузии кислорода в двуоки-
си урана — 29,7 ккал/моль.
В связи с этим можно полагать, что наряду с диффу-
зией кислорода по междоузлиям кристаллической решет-
71
ки существенное значение имеет диффузия по границам
зерен, порам, трещинам в окисной пленке. При окисле-
нии на воздухе с температурой выше 400° кажущаяся
энергия активации снижается до 4,6 ккал/моль. Послед-
нее связывается либо с разложением U3O7 на U4O9 и
и3Ов, которое может протекать при температурах выше
400°, либо с взаимодействием урана с азотом при 420е
и выше [37].
В случае окисления урана на воздухе при температу-
рах 400—600° и давлении воздуха ниже 200 мм рт. ст.
скорость окисления прямо пропорциональна давлению
воздуха. Если же давление воздуха больше 200 мм рт. ст.,
скорость окисления прямо пропорциональна квадратно-
му корню из давления.
Скорость окисления урана в кислороде пропорциональ-
на давлению газа в степени, равной 0,09; 0,18; 0,21; 0,47,
при температурах 125, 150, 200 и 250° соответственно.
С ростом температуры показатель степени возрастает и
приближается к 0,5 [6]. При 300° в интервале давлений
кислорода 6—550 мм рт. ст. скорость окисления урана
прямо пропорциональна корню квадратному из давления
газа [37].
Убыль веса образцов сплава урана с 10% Nb и 4% Zr
при 360° и давлении кислорода 600 мм рт. ст. примерно
в 5 раз больше, чем при давлении кислорода
120 мм рт. ст. [24]. Циркуляция кислорода не влияет на
скорость окисления. Циркуляция воздуха при давлении
его свыше 200 мм рт. ст. незначительно влияет на ско-
рость окисления урана. При давлении воздуха ниже
200 мм рт. ст. циркуляция воздуха интенсифицирует
окисление, причем с ростом температуры этот эффект
возрастает.
Пропорциональность скорости окисления урана квад-
ратному корню из давления газа-окислителя дает осно-
вания полагать, как это делается в работе [37], что про-
цессу диффузии кислорода через плотный слой окалины
предшествует диссоциация его молекул на атомы. Заме-
тим, что кислород, растворенный в двуокиси урана, на-
ходится в атомарном состоянии в междоузлиях решетки
окисла.
Указанные обстоятельства позволяют полагать, что
кислород в основном диффундирует через окалину в
атомарном состоянии.
72
Прямо пропорциональная зависимость скорости окис-
ления урана от давления воздуха при давлениях ниже
200 Л1Л4 рт. ст. связывается с тем, что в этих условиях ли-
митирующей стадией является доставка газа-окислите-
ля из ядра газового потока к наружной поверхности
плотного слоя окисла. Этим же объясняется и влияние
циркуляции воздуха на скорость окисления [37].
Скорость окисления урана растет с температурой. До
400° скорость окисления урана на воздухе и в кислороде
связана с температурой уравнением Аррениуса. Эиер«
гия активации в этом случае равна 17—18 ккал/моль.
При более высоких температурах при окислении в кис-
лороде энергия активации увеличивается, а при окисле-
нии на воздухе уменьшается [37]. Вилкинсон [6] для слу-
чая окисления урана в кислороде при давлении
800 Лья рт. ст. дает следующую зависимость скорости
процесса от температуры:
1В* = 8,5-4-^.
Скорость окисления урйна на воздухе при высокой
температуре велика и составляет, например, при 500е’
72,5 см/год. При меньших температурах (100, 200, 300,
400°) скорость окисления равна соответственно 0,26;
5,04; 1.0,07; 54,3 см/год [6].
На сплавах урана с 50 и 90% Nb после выдержки на
воздухе при 300° в течение 500 ч образовалась плотная
пленка, способствующая увеличению стойкости. Привес
составил 0,40 и 0,28 мг/см2 соответственно. В других экс-
периментах 60-часовая выдержка на воздухе при 350°
привела к убыли веса, равной 2—6 мг/см2 для всех спла-
вов системы U — Nb, кроме сплава с 10% U, который
имел потери 1 мг/см2. Убыль веса сплавов с 50 и 90% Nb
за 60-часовую экспозицию при 400° составила 20 и
12 мг/см2 соответственно. Увеличение температуры с 300
до 500° привело к возрастанию потерь веса с 15,8 до
9600 мг/см2 [24].
Легирующие элементы, нерастворимые в уране и даю-
щие с ним интерметаллические соединения, меньше
влияют на скорость окисления урана, чем элементы, об-
разующие с ним твердые растворы. К первым относятся
натрий, углерод. Термическая обработка урана, загряз-
ненного этими элементами, не сказывается сколько-ни-
73-
будь заметно на стойкости урана на воздухе и в кисло-'
роде. В высокочистом уране отжиг способствует д'иффу!
зии углерода и азота к поверхности металла и образова-
нию там слоя U (С, N), располагающегося под слоем'
окислов. Слой, состоящий из U (С, N), по мнению Вил-
кинсона [6], несколько тормозит окисление урана. От-
жиг загрязненного железом урана вдвое повышает стой-
кость его к окислению. При медленном охлаждении
железо выпадает в виде интерметаллида, достаточно^
коррозионностойкого. Матрица же обедняется железом
и приближается по составу к чистому урану.
В ряде случаев ион-атом легирующего элемента заме-
няет уран в окисной пленке. Если радиус иона легирую-
щего элемента меньше, чем у урана, параметр решетки
окисла уменьшается. Диффузия иона кислорода через
слой окисла в этом случае затрудняется, что приводит к
увеличению стойкости сплава.
Образцы сплава урана с 20 и 40% Nb полностью окис-
лились после суточной выдержки на воздухе при 600°.
В образцах с 80% Nb осталась лишь небольшая часть
неокисленного металла. С ростом температуры от 350 до
400° привес образцов из сплава урана с 20 и 40% Nb
увеличивается в 15 и 30 раз соответственно [24].
Из тройных сплавов U — Zr — Nb наибольшей стой-
костью на воздухе при 400° и длительности испытаний
2500 ч обладают сплавы с 7,5 ат. % U, 46—70 ат. % Zr,
23—46 ат. % Nb.
В сплавах системы U — Мо оптимальной стойкостью
обладает сплав с 17 ат. % Мо. Достаточную стойкость
показал также сплав урана с 17—23 ат. % Мо и 2—-
3 ат. % Zr [25].
Нагрев на воздухе до 700—1000°, а в некоторых слу-
чаях и до 500—700° в зависимости от геометрических
размеров образца, чистоты поверхности, примесей, ско-
рости отвода тепла может привести к загоранию урана.
’На интенсивность окисления в этом случае влияют так-
/же состав газа, размер зерна, величина напряжений в
металле, характер термической обработки, длительность
экспозиции и т. д.
Удобной характеристикой процесса окисления метал-
ла в таких условиях являются так называемые кривые
загорания (рис. 9), характеризующие изменение темпе-
ратуры образца во времени. Температура печи, в кото-
74
рой образец контактирует с окислительной средой, из-
меняется по заданной программе обычно линейно. В мо-
мент загорания наблюдается резкое (за доли минуты)
возрастание температуры. Температура загорания зави-
сит от размеров частиц урана. В кислороде эта темпе-
ратура Т3 в градусах Кельвина связана с величиной
Рис. 9. Кривая загорания урана, зака-
ленного из P-области в кислороде [6],
удельной поверхности П (см2/г) следующей зависи-
мостью:
или
n г й 19,300
/7 = 6-10~6 ехр-----------------------.
В целом уран более пирофорен, нежели цирконий [6].
В насыщенном паре коррозия протекает по электро-
химическому механизму [38]. В связи с этим нет основа-
ний ожидать значительного расхождения в скорости
коррозии урана в воде и насыщенном паре при одина-
ковой температуре. Данные, приведенные па рис. 5, под-
тверждают это положение. С повышением температуры
насыщенного пара до 250—280° скорость коррозии воз-
75
растает в соответствии с зависимостью Аррениуса. При
увеличении температуры выше 280° скорость коррозии
урана в насыщенном паре растет очень мало (табл. 25).
С ростом температуры содержание двуокиси урана в
продуктах коррозии снижается, a UgO8 возрастает.
Таблица 25
Скорость коррозии урана в насыщенном паре [19]
Температура »С Скорость коррозии, Содержание в продуктах коррозии, %
иоа UjOi
150 16-19 100
183 106—5500 — —
200 117 93,8 6,2
250 970 21,2 75,8
300 1120 17,3 82,7
400* 1470 8,3 91,7
* Давление 100 ат.
В перегретом паре скорость коррозии урана зависит
от давления. Так, при температуре 300° уменьшение дав-
ления пара с 87 до 1 ат приводит к снижению скорости
коррозии урана па 2—3 порядка. При давлении пара
1 ат до температуры 880° коррозия идет по линейному
закону. При температурах 880—1060° коррозия урана
в паре идет в первые 1—2 ч по параболическому закону
и затем по линейному. Степень параболы равна 0,5. До
температуры 500° продукты коррозии состоят из рыхло-
го порошкообразного окисла с мелким зерном. Свыше
500° размер частиц окисла возрастает. В результате кор-
розии в паре при температуре выше 880° на поверхности
урана образуется плотная пленка продуктов коррозии,
хорошо сцепленная с металлом и не осыпающаяся после
охлаждения образца. В интервале температур 200—
1400° продукты коррозии состоят из двуокиси урана, в
некоторых случаях отличающейся от стехиометрического
состава, а именно UO 2,24- Лишь после испытаний в паре
при 300° продукты коррозии состоят из UgOg. В продук-
76
тах коррозии наряду с четырехвалентным обнаружен
шестивалентный уран. После испытаний при 930—
1060° продукты коррозии состоят из двух слоев: слоя,
плотно сцепленного с металлом, толщиной 5 лис, и слоя,
;менее плотного, толщиной I лъи. Предпочтительного
окисления границ зерен не обнаружено [39].
Нарушение сплошности окисной пленки имело место
лишь на зернах карбидов и гидридов урана. После испы-
таний в паре-до температуры 200° гидриды в уране от-
сутствуют.
Рассматривая зависимость скорости окисления урана
от температуры, можно отметить два максимума при
300 и 750° и два минимума при 550 и 800—1050° (рис. 10,
табл. 26). Первый максимум связывается [39] с измене-
Таблица 26
Скорость коррозии урана в парах воды при давлении 1 ат [39]
Температура, ’С Показатель параболы при окислении по параболическому
при окислении по линей- ному закону. .«г;'сл<г-лшя
160 0,02
200 0,1—0,08 —
230 0,3—1,6 —
250 1.6 -
77
Продолжение табл. 26
Температура, °C Скорость коррозии при окислении ни линей- ному закону, мг/см^мчн показатель параболы при окислении по параболическому закону
270 1,9
300 2,0 ,—.
330 2,1 л—
350 1,6 —
370 1,9 а—
380 1 6
400 - 1,8
420 1,2-1,8
450 1,1-1.7
500 0,9-1,3
520 1,0
550 1,0
600 1,5-1,7
650 1 4 ——
700 1,3-6
730 6
780 4
820 3 .—
840 3 —
880 0,2 0,52
890 0,3 0,46
930 0,3 0,46
970 0,3 0,50
1000 0,2 0,42
1020 0,2 0,50
1060 0,3 0,49
1200 3,8
1400 4,8 -
нием скорости образования гидридов с температурой.
Вилкинсон [6] считает, что в интервале температур
300—600° протекание структурных превращений в про-
дуктах коррозии затрудняет диффузию газов в двуоки-
си урана и тем самым тормозит коррозионный процесс.
Плоскость (ПО) кристаллической решетки двуокиси
урана, образовавшейся в водяных парах или влажном
водороде с температурой до 400°, параллельна поверх-
ности металла. В решетке же двуокиси урана, образо-
вавшейся на отожженном в вакууме уране, поверхности
металла параллельна плоскость (100). Имеет место
структурное соответствие между кристаллическими ре-
78
тетками двуокиси урана и металлического урана в
Т-фазе, что увеличивает защитные свойства продуктов
коррозии [6].
Следует отметить также, что гидрид урана нестабилен
при температуре свыше 433° и парциальном давлении
водорода 1 ат и что скорость реакции между ураном и
газообразным водородом достигает максимума при
225—250°. Считается, что ниже температуры 450° уран,
реагируя с водяным паром, образует смесь гидрида и
окисла. Далее гидрид медленно реагирует с паром, об-
разуя двуокись урана.
При температуре свыше 500° гидрид не образуется,
коррозия идет с выделением водорода. Изменение ско-
рости коррозии при 500° и выше зависит от изменения
свойств окисной пленки. В частности, при 880—1050° за-
висимость, связывающая скорость окисления со време-
нем, описывается квадратной параболой. Это обстоя-
тельство позволяет полагать, что контролирующим фак-
тором в данном случае является скорость диффузии
реагентов через окисную пленку. В случае линейного
механизма окисления предполагается [39], что либо ве^
личина поверхности металла, на которой протекает ре-
акция, не изменяется во времени, либо скорость реак-
ции ограничивается диффузией через пленку, но толщи-
на пленки не меняется со временем. Считается, что из
всей окисной пленки лишь ее часть, неизменная во вре-
мени, оказывает защитное действие. На скорость корро-
зии может также влиять изменение истинной поверхно
сти металла в процессе окисления.
Зависимость скорости взаимодействия с паром сплава
алюминия с 21,4% урана от температуры в интервале
816—982° выражается уравнением Аррениуса. Энергия
активации равна 45 ккал/моль. С повышением темпера-
туры от 982 до 1038° скорость коррозии сплава в паре
снижается с 0,033 до 0,007 мг/см2 мин [24].
В паровой фазе при температуре 400° и давлении
300 ат удовлетворительной стойкостью обладали спла-
вы на основе циркония с низким содержанием урана
0,5 ат. % Nb + 2 ат. % LJ; 0,5 ат. % Nb 4- 0,5 ат. % Sn -h
-4- 2 ат. % U; 15 ат. % Nb 4- 2 ат. % Sn 4- 2 ат. % Сг 4-
4- 5 ат. % U [25].
При одинаковой температуре коррозия урана в водя-
ном паре более равномерна, чем на воздухе.
79
Скорость взаимодействия расплавленного урана с па-
ром при 1200 и 1400° в первоначальный момент возра-
стает по параболическому закону до значения
37 ,иа/сл12 • мин. Однако затем реакция замедляется и
через 10—20 мин достигается устойчивая величина при-
веса 4—5 мг/см2 • мцр [24].
Уран не взаимодействует с сухим гелием, очищенным
от кислорода, азота, углекислого газа, водорода. Обра-
зовавшиеся при контакте с влажным гелием продукты
коррозии урана плохо сцеплены с металлом. Пленка
продуктов коррозии в этом случае может быть диффе-,
реицирована на два слоя: наружный содержит 84,84%
урана и 8,7% воды, внутренний — 86,22% урана и 5,3%
воды. Во внутреннем слое уран находится в виде дву-
окиси урана. Наружный слой, способный флуоресциро-
вать, содержит, кроме того, и UO3. С течением времени
состав продуктов коррозии изменяется.
Пленка продуктов коррозии пориста. С увеличением
влажности гелия скорость коррозии урана линейно воз-
растает. При 100° и давлении паров воды 50 и
550 лш рт. ст. скорость коррозии составляет соответст-
венно 0,02 и 0,05 мг/см2-ч при длительности испытаний
100 ч. Прокатка и отжиг не изменили интенсивности
коррозии урана при 57° в гелии с 10%-ной относитель-
ной влажностью.
Скорость коррозии в этом случае составляет за 1000 ч
испытаний 0,002—0,005 мг/см2 [6].
Данные по скорости коррозии урана в аргоне, содер-
жащем различное количество кислорода, приведены в
табл. 27.
Таблица 27
Скорость коррозии урана в аргоне, яг:с.и--ч [6]
Температура, °C Скорость коррозии при содержании кислорода н аргоне, мг/кг
10 30 50
300 Коррозии нет 0,14 0,19
600 0,03 0,39 0,64
900 0,04 0,36 0,66
80
Во влажных газах коррозионные процессы протекают
в пленке влаги. Коррозия в этом случае идет по элек-
трохимическому механизму. Загрязнение газов кислоро-
дом может сместить стационарный потенциал до значе-
ний, отвечающих пассивной области, и тем самым сни-
зить коррозию урана [6].
Порошкообразный уран реагирует с водородом при
0°. При комнатной температуре реакция идет со зна-
чительной скоростью и с выделением тепла. Скорость
взаимодействия массивного урана с водородом в первое
время крайне низка. Имеется так называемый индук-
ционный период, величина которого обратно пропорцио-
нальна температуре, и составляет при 105 и 125° соот-
ветственно 410 и 50 мин. С ростом температуры выше
130° величина индукционного периода практически не
изменяется. Длительность индукционного периода зави-
сит также от чистоты водорода и поверхности металла.
Уран с чистой поверхностью немедленно реагирует с во-
дородом. При температуре 225° в результате взаимодей-
ствия с водородом толщина урана может измениться на
0,2—0,3 мм/ч. Продукты реакции состоят при низкой
температуре из а-гидрида урана, при высокой — из
р-гидрида урана. Оба гидрида кристаллизуются в куби-
ческой решетке: первый с параметром 4,16 А, второй - -
6,63 А. Альфа-гидрид урана переходит полностью в
0-форму при 250°. Скорость образования гидрида связа-
на с температурой зависимостью Аррениуса. При 250—
400° взаимодействие урана с водородом идет вначале
по параболическому закону, а затем по линейному. За-
висимость растворимости в уране водорода (с) от дав-
ления его при 290° и давлении водорода 26—
150 мк рт. ст. выражается уравнением
с(см3/г) = 3,3Ур (мк рт. ст.).
Растворимость водО'рода в а-уране при атмосферном дав-
лении его и при температуре превращения а- в 0-уран не
больше 0,0002%. Уран же, закристаллизовавшийся в ат-
мосфере водорода, содержит 0,003% водорода [6].
При температуре выше 300° азот при атмосферном
давлении быстро реагирует с урановой пудрой. При
330° с массивным ураном реагирует влажный, а при
370°—и сухой азот. Скорость взаимодействия станр-
6 в. В. Герасимов 81
вится заметной при 450° и увеличивается с повышением)
температуры. С гидридом урана азот реагирует медлен-
но при 200° и значительно быстрее при 350°. При темпе-
ратур? 700° окисная пленка на поверхности урана не
препятствует взаимодействию металла с азотом. Кон-
центрация нитридов в расплавленном уране, находящем-
ся в атмосфере азота, не превышает 0,03—0,04%. В ин-
тервале температур 350—650° количество азота, погло-
щенного полированным ураном, пропорционально
длительности экспозиции в степени 0,75—0,85. При
650—770° скорость азотирования постоянна. В зависи-
мости от давления азота и температуры образуются ни-
триды урана состава UNbee, UNi,6o и UNj,65- При высо-
ких температурах устойчив первый нитрид, при низких —
два последних [6].
При температуре 500° уран реагирует с окисью угле-
рода с образованием желтой или черной пленки двуоки-
си урана, содержащей до 5% карбида урана. При 600°
скорость взаимодействия урана с окисью углерода зна-
чительно меньше, чем с углекислым газом. При 700°, од-
нако, интенсивность взаимодействия урана с двумя эти-
ми газами практически одинакова. В результате взаи-
модействия с углекислым газом образуется двуокись
урана. В интервале температур 500—900° при давлении
углекислого газа 420 мм рт. ст. в начальной стадии про-
цесса окисление идет по параболическому закону. При
более длительных экспозициях окисление протекает по
линейному закону. Предполагается [40], что в начальной
стадии окисления на поверхности урана образуется плот-
ная защитная окисная пленка. Скорость окисления при
этом определяется эффективностью диффузии окислите-
ля через пленку. Последнее обстоятельство было под-
тверждено в опытах по окислению урана с инертными
метками на его поверхности. При увеличении толщины
окисного слоя сверх определенного предела в пленке
двуокиси урана возникают значительные внутренние
напряжения, приводящие к растрескиванию пленки, об-
разованию в ней большого количества пор. Наряду с
этим происходит укрупнение зерен двуокиси- за'счет ре-
кристаллизации. Окалина в конечном результате со-
стоит из двух слоев: внутреннего плотного и наружного
пористого и достаточно рыхлого. Наружный слой обра-
зуется из внутреннего в процессе окисления. По мере
82
увеличения толщины плотного слоя диффузия реаги-
рующих компонентов через него замедляется и скорость
роста первого слоя выравнивается со скоростью образо-
вания второго слоя за счет первого. С этого момента
толщина плотного слоя остается постоянной и окисле-
ние протекает по линейному закону.
При температуре 700° в интервале давлений 20- -
700 мм рт. ст. скорость окисления урана пропорциональ-
на корню четвертой степени из давления углекислого га-
за и не зависит от циркуляции газа в реакционном про-
странстве.
В работе А. Ф. Бессонова и В. Г. Власова [40] приво-
дятся значения энергии активации окисления урана в
углекислом газе. До температуры 780° эта величина со-
ставляет 17 ккал!моль, свыше 780° — 26 ккал/моль. Вил-
кинсон [6] для интервала температур 440—725° приводит
значение 26—28 ккал/моль. Авторы работы [40], сравни-
вая энергии активации самодиффузии урана (90—
125 ккал/моль) и кислорода (29,7 ккал/моль) в двуоки-
си урана с величиной 17 ккал/моль, считают, что наряду
с диффузией кислорода по междоузлиям окисла проис-
ходит диффузия по границам зерен. Предполагается
при этом, что кислород диффундирует в атомарном со-
стоянии. Атомарный кислород образуется при диссоциа-
ции углекислого газа, адсорбированного на поверхности
окисла. Двуокись урана, по-видимому, катализирует эту
реакцию.
Изменение энергии активации при температуре 780° в
работе [40] связывается со структурным превращением
урана из р- в f -модификацию, сопровождающимся
уменьшением объема металла. При этом увеличиваются
напряжение в окисной пленке, количество пор и трещин
в ней. Последнее обстоятельство сопровождается увели-
чением скорости окисления и даже приводит иногда к
возгоранию массивного урана. Температура возгорания
растет с давлением углекислого газа и не зависит от
присутствия в газе воды.
С повышением температуры до 800—1000° скорость
окисления урана снижается. В работе [40] это объяс-
няется образованием на уране пленки моноокиси урана
UO, так как растворимость кислорода и скорость диф-
фузии его в моноокиси урана малы. В работе [24] счи-
тают; что окисная пленка при этих температурах более
6*
83
пластична, не растрескивается и лучше защищает металл
от окисления.
Скорость окисления зависит от чистоты углекислого
газа. Особенно возрастает скорость окисления с увели-
чением содержания кислорода в углекислом газе свыше
0,0005%. Присутствие в углекислом газе воды в коли-
честве 3% еще более ускоряет окисление урана.
После 50-часовых испытаний в углекислом газе при
316° на сплавах U — Nb образовалась отслаивающаяся
окалина. Изменения веса составили для сплавов с 10 и
20% U 0,20 мг/см2, для других сплавов — 0,35 мг/см2 [24].
Скорость взаимодействия окиси углерода с окисью
урана зависит от геометрии образца и не зависит от тем-
пературы в интервале 500—900°. Вазимодействие пре-
кращается при достижении концентрации углекислого
газа 1% [24].
В парах серы при 500° уран горит с образованием US2
и U2S3. Расплавленная же сера в интервале температур
250—300° слабо взаимодействует с ураном. Фтор окис-
ляет уран при комнатной температуре с образованием
газообразного шестифтористого урана. Диспергирован-
ный уран реагирует с хлором при 150—180° с образова-
нием UCI4, UCI5 и UCIg. Для начала реакции хлора с
ураном в куске нужен нагрев до 500—600°. Газообраз-
ный бром при 650° дает с ураном UBr4 или UBr3- В ре-
зультате взаимодействия с иодом при 350° образуются
Ш3 и Ш4.
Хлороформ, трихлорэтилен с порошком урана могут
реагировать со взрывом, особенно в присутствии гидри-
дов урана, соляной кислоты [6].
Уран достаточно стоек в натрии и в эвтектике Na — К.
Разумеется, жидкие металлы должны быть очищены от
кислорода. Растворимость чистого урана в очищенном
натрии при 97,8 и 300° составляет соответственно 0,01 и
0,005%- Присутствие в натрии кислорода интенсифици-
рует коррозию урана. Урай имеет большее сродство к
кислороду, нежели натрий (табл. 28). В связи с этим
уран восстанавливает окись натрия, окисляясь до дву-
окиси урана. В статических условиях при 750° в натрии
с содержанием кислорода 0,01% скорость коррозии
урана составляет 10 мг/см2 • месяц. В потоке -натрия с
содержанием кислорода 0,005% при 600° скорость кор-
розии урана равна 600 мг/см2 • месяц [41].
184
Таблица 28
Свободная энергия образования соединений урана, ккал [41]
В результате коррозии в натрии, содержащем 0,04%
кислорода, в жидком металле- обнаружено 0,1—0,5%
двуокиси урана. Испытания эти проводились в атмосфе-
ре аргона. Скорость коррозии существенно не измени-
лась при повышении температуры до 400 и 600°. В по-
следнем случае, впрочем, на поверхности урана зафик-
сировано несколько язв. Фильтрация расплавленного
натрия или введение в него кальция снижает содержа-
ние урана в расплаве до 0,01%. Железо и натрий не об-
наружены на поверхности урана после извлечения его из
расплава и промывки спиртом. Растворение в натрии
0,007% урана повышает температуру плавления натрия
на 0,005°.
После 100-часовых испытаний в натрии при. 816° на
поверхности двойных сплавов U — Nb с содержанием
урана 10—60% образовалась тусклая черная окисная
пленка. С увеличением содержания урана в сплавах
стойкость их снижается. Содержание кислорода в спла-
вах, по-видимому, незначительно влияет на скорость
коррозии сплавов урана с ниобием в натрии [41]. Даже
в случае нарушения сплошности оболочки тепловыделяю-
85
щего элемента взаимодействие уранового сердечника с
натрием или эвтектикой Na — К не приводит к серьез-
ному загрязнению теплоносителя [41].
Облучение не сказывается на скорости коррозии урана
в натрии или эвтектике Na — К при температурах до
600°. За 6 суток уран лишь в крайне малой степени реа-
гирует с очищенным литием, находящимся в атмосфере
гелия при 600°. Загрязнение лития никелем не влияет су-
щественно на скорость взаимодействия лития с ураном.
Расплавленные свинец, висмут, галлий слабо взаимо-
действуют с ураном [6].
В дифениле при 400° уран значительно более стоек, чем
в воде при этой температуре. При 260° скорость коррозии
урана в дифениле по результатам 4508-часовых испыта-
ний составляет 4,06 мг/см2-месяц, в то время как для ин-
тервала температур 360—400° и длительности испытаний
263—3562 ч скорость ' коррозии оказалась равной
2,73 мг/см/2-месяц. Выдержка в течение 3357 ч в дифени-
ле при 360° не привела к серьезным поражениям поверх-
ности урана. Однако при дальнейших испытаниях этих
же образцов в течение 2151 ч при 400° они разрушились.
Стойкость урана в органических теплоносителях сильно
зависит от чистоты последних. Этим можно, по-видимо-
му, объяснить расхождения в данных по скорости корро-.
зии, приводимых различными авторами. Так, в работе
[41] приводятся данные по скорости коррозии урана в
очищенном дифениле при 400°. Скорость коррозии в ста-
тических условиях составляет 1 мг/см2-месяц в динами-
ческих — 5 мг/см2 • месяц.
В органических теплоносителях (дифениле, моноизо-
пропилдифениле) скорость гидрирования урана в 8 раз
меньше, чем в сухом водороде. С ростом парциального
давления водорода и содержания воды в дифениле от
0,006 до 0,015% скорость гидрирования возрастает. Кон-
такт урана при нарушении целостности оболочки тепло-
выделяющего элемента с органическими теплоносителя-
ми не приводит к существенному загрязнению последних.
Покрытия на уран наносятся в двух основных случаях:
1) для защиты от коррозии вследствие взаимодействия с
агрессивной средой и 2) в качестве промежуточного слоя
между урановым сердечником и металлической оболоч-
кой тепловыделяющего элемента. Покрытия на уран на-
носятся гальваническим, химическим, диффузионным, го-
86
рячим способами из газовой фазы либо путем создания
защитной окисной или нитридной пленки.
Медное покрытие может быть нанесено из сернокислой
ванны. Покрытие это нестойко и быстро разрушается б
кипящей воде. Гальваническое покрытие, состоящее из
85% Ni и 15% Мо, даже после отжига при 600° разру-
шается в воде при 90°.
Из обычных стандартных ванн на уран могут быть иа
несены никелевое, свинцовое, хромовое, цинковое, ко-
бальтовое и оловянное покрытия [16]. Гальваническое по-
крытие урана алюминием производится в ванне из рас-
' плавленного хлорида алюминия. Это покрытие защищает
от атмосферной коррозии в течение 6 месяцев [42, 43].
Однако практически все гальванические покрытия плохо
сцепляются с ураном. В кипящей воде медное и никеле-
вое покрытия защищают уран ограниченное время. Об-
разцы с никелевым покрытием толщиной 0,025 мм были
термически обработаны при 600° в течение 0,5—1 ч. При
испытаниях в кипящей дистиллированной воде семь об-
разцов разрушились за 1—40 ч, 12 образцов — за >40—
80 ч и лишь три — после 160 ч испытаний. Под металли-'
ческим покрытием после испытаний обнаружены продук-
ты коррозии урана. При толщине никелевого слоя 0,05 мм
среднее время защитного действия покрытия равно 80 ч.
Однако при очень хорошем качестве покрытия этот срок
увеличивается в отдельных случаях до 900 ч. Обжатие
эдэи высокой температуре улучшает сцепление покрытия
с ураном. Скорость коррозии никелевого покрытия в ки-
пящей воде составляет 0,004 мг/см2-ч.
Никелевое покрытие может быть нанесено иа уран и
химическим способом. В этом случае покрытие содержит
фосфиды. После соответствующей термообработки может
быть получено беспористое твердое, но достаточно хруп-
кое покрытие [16]. Эксперименты с ураном, покрытым ни-
обием, бериллием, медью, серебром, кадмием,' не дали
положительного' результата.
Цинковое покрытие, полученное гальваническим мето-
дом из ванн, содержащих ацетат цинка и формамид, об-
ладало "хорошим сцеплением с ураном. Однако после
удаления этого покрытия на поверхности урана обнару-
жена рыжеватая окисная пленка. Цинковые покрытия,
полу^нные из других ванн, имели плохое сцепление с
металлом [43].
87
Основная трудность в нанесении покрытий на уран со-
стоит в качественной очистке поверхности урана "от окис-
лов.
Алюминий может быть нанесен на поверхность урана
гальваническим способом из органической ванны [44].
Толщина покрытия может достигать 300 мк. Наилучшее
сцепление алюминия с ураном достигается при создании
промежуточного слоя из никеля или силумина. Промежу-
точное. никелевое покрытие препятствует диффузии ура-
на в алюминий и образованию хрупких слоев сплава
А1 — U. Толщина промежуточного никелевого слоя долж-
на быть 7—25 мк. Однако и в этом случае покрытие за-
щищает уран в кипящей воде лишь в течение 100 ч. За-
щитные свойства ряда покрытий на уране приведены в
табл. 29.
Диффузионное покрытие может быть получено при
взаимодействии урана со смесью тонко диспергированно-
го порошка металла и окислов кремния и алюминия. По-
следние препятствуют сплавлению частиц металла. Если
покрытие наносится во вращающейся печи, то частицы
окислов кремния и алюминия способствуют удалению
окислов урана с его поверхности. Созданные таким обра-
зом покрытия: кремниевое, хромовое, никелевое, цинко-
вое, алюминиевое, железное, молибденовое, разрушаются
в кипящей воде. Для усиления диффузии в уран ниобия
и циркония в смесь добавляются активаторы: хлориды
аммония и циркония. Однако качество и этих покрытий
невысоко, так же, как и ниобиевого покрытия, образо-
вавшегося при нагревании в порошке ниобия урана с ни-
келевым покрытием [46].
Покрытия, нанесенные методом металлизации и погру-
жения в расплав, не защищают уран в течение длитель-
ного времени от воздействия кипящей воды. Так, алюми-
ниевое покрытие, нанесенное методом металлизации,
разрушилось в этих условиях через сутки. Не дали удов-
летворительных результатов и испытания в кипящей воде
оловянного, цинкового, висмутового покрытий, получен-
ных методом погружения в расплав. После испытаний в
кипящей дистиллированной воде в течение одной-двух
недель разрушилось цинковое покрытие, образованное
при погружении урана в расплав хлористого цинка при
400°, и покрытие сплавом алюминия с 12% Si, нанесен-
ное горячим методом [42, 46].
88
Й 8 s S 8 8 S 8 88
Покрытие на уране может быть образовано при раз-
ложении газообразных галоидных солей в присутствии
водорода. Кремниевое покрытие удовлетворительного
качества получается при разложении газообразного те-
трахлорида кремния. Полученное таким же методом мо-
либденовое покрытие не защищает уран в кипящей во-
де. Ниобиевое покрытие, нанесенное из пентахлорида
ниобия, хорошо защищает уран в течение 96 ч от корро-
зии в кипящей воде [6].
Удовлетворительные результаты дали испытания цир-
кониевых. покрытий толщиной 0,12—0,25 мм, получен-
ных разложением тетраиодида. В кипящей воде это по-
крытие защищало уран в течение 10 суток. Цирконие-
вое покрытие, нанесенное при давлении паров тетра-
иодида циркония 0,1 мм рт. ст., отжигалось при 1050°
для улучшения сцепления с ураном. Такое покрытие
успешно защищало уран в кипящей воде в течение
20 суток. Скорость коррозии циркониевого покрытия в
этих условиях 0,001—0,006 мг/см--ч. Молибденовое по-
крытие, полученное при разложепии-карбонила, облада-
ло низкими защитными свойствами.
В работе [47] указывается, что в принципе путем раз-
ложения в вакууме тетраиодида циркония при .1100°
можно получить на уране беспористое циркониевое по-
крытие. Это покрытие обеспечивает защиту урана, леги-
рованного О,5°/о Zr, в кипящей воде в течение 200 ч и в"
воде при 170° в течение 80 ч.
При осаждении цинка из газовой фазы на поверхно-
сти урана образуется сплав урана с цинком, имеющий
удовлетворительное сцепление с металлом. Такой спо-
соб создания защитной пленки на поверхности урана
считается перспективным, однако на сегодня он недоста-
точно изучен [42].
Никелевое покрытие, полученное разложением карбо-
нила, после отжига при 650° хорошо защищало уран во
влажной атмосфере. В кипящей воде следов коррозии
урана не обнаружено после 170 суток. Па воздухе это
покрытие сохраняло стойкость при температуре 150, 500,
600° в течение 140, 70 и 35 суток соответственно [45]. Тол-
щина никелевого покрытия в этом случае составляла
130 мк. Из газовой фазы на уран могут быть нанесены
покрытия из молибдена, ниобия, ванадия, титана, цир-
кония, бериллия, тантала [46].
90
Покрытия, полученные распылением в вакууме цирко-
ния, ниобия, молибдена, плохо защищали уран в кипя-
щей воде. Хромовое покрытие толщиной 0,05—0,075 л<л,
нанесенное из паровой фазы, после отжига при 650—
750° удовлетворительно защищало уран в кипящей воде
в течение 200 ч.
Окисная пленка, возникшая при нагреве урана в тече-
ние 3 ч при 600° в вакууме при давлении 10-3 мм рт. ст.,
существенно снизила скорость коррозии урана в воде
при 70° в течение трех месяцев. При более высокой тем-
пературе воды окисная пленка разрушалась и корро-
зия урана интенсифицировалась. Так, в кипящей воде
окисная пленка разрушалась после двух суток испыта-
ний.
Нитриды урана сами по себе стойки в воде. Однако по-
крытия, полученные при азотировании в атмосфере азо-
та при 1000° или при цианировании, не увеличивают
стойкость урана. Азотирование в аммиаке неприменимо
вследствие образования гидридов урана [16].
Для визуальной оценки пористости металлических по-
крытий на уране применяется следующий метод [48].
Образцы с покрытием выдерживаются в атмосфере во-
дорода при пониженном давлении при температуре 200°
в течение суток. Если в покрытии имеются поры, то в
них образуется черный осадок гидрида урана. Присут-
ствие в водороде небольших количеств азота, кислоро-
да, водяных паров не мешает испытаниям по этой ме-
тодике.
Уран и его сплавы в тепловыделяющих элементах по-
крываются оболочкой из сплавов алюминия, циркония,
нержавеющей стали и других металлов и сплавов.
В условиях эксплуатации не исключена возможность на-
рушения целостности оболочек тепловыделяющих эле-
ментов. Вода при этом будет вступать в контакт непо-
средственно с ядерным горючим. Рассмотрим случаи
коррозии урйна и его сплавов в этих условиях.
Сплав урана с 2% Zr покрывался оболочкой из цирка-
лоя-2. После покрытия производился диффузионный от-
жиг. В оболочке просверливалось отверстие диаметром
0,127 Л1Л. Существенного разрушения сплава урана не
наблюдалось после испытаний в воде в течение 21,8 су-
ток при 290° и далее в течение 31,7 суток при 350°. Ес-
ли диаметр отверстия увеличивался до 0,405 мм, корро-
91
зия интенсифицировалась. Выгорание до 0,1 ат. % не из-
менило характера коррозии [24].
При контакте с водой в основании дефекта образуется
компактный слой окислов урана. С дальнейшим разви-
тием коррозионного процесса окисли накапливаются и
через 1—2 ч или через более длительное время в зависи-
мости от прочности оболочки происходит ее выпучива-
ние. В ряде опытов распухание при 200° начиналось че-
рез 8 ч, а в воде с температурой 340° — через 24 мин.
Образовавшиеся в этот период окислы урана затрудняли
проникновение воды к урану и тем самым тормозили раз-
витие коррозионного процесса. Продукты деления в за-
метных количествах не попадали в воду первого конту-
ра. По истечении некоторого времени бугорок продук-
тов коррозии начинал разрушаться. Термические цик-
лы интенсифицировали этот процесс. Окислы и продук-
ты деления попадали затем в воду, резко увеличивая ее
активность. Одновременно с этим вода получала сво-
бодный доступ к топливной композиции и процесс кор-
розии проходил с большой скоростью. Если с момента
резкого увеличения активности температура циркули-
рующей воды снижается в течение 30 мин ниже 150°, су-
щественного разрушения тепловыделяющего элемента
не происходит [24].
Сплавы урана с 5% Zr + 1,5% Nb и 3% Nb + 0,5% Sn
с оболочкой из циркалоя-2 испытывались в воде при
290—350° в течение 54 суток. Образцы получались сов-
местным выдавливанием с последующим диффузион-
ным отжигом при 880° в течение 7 ч. В оболочке просвер-
ливались отверстия диаметром 0,125 мм. После испыта-
ний с выгоранием до 0,1 ат. % заметных разрушений
топливной композиции не было обнаружено. При
выгорании 0,16—0,3 ат. % образцы разрушались после
2—2,5 суток испытаний в воде при 260°. Необлучен-
ный сплав при более . высокой температуре (290°) за
то же время показал скорость коррозии 1—2 мг/см2-ч
[24].
Количественные данные по развитию коррозии на об-
разцах сплава урана с 2% Zr, покрытых оболочкой из
циркалоя-2 с искусственными дефектами, получены пу-
тем измерения выделяющегося водорода. Диффузион-
ный отжиг замедляет разрушение топливной компози-
ции, когда коррозия достигла уровня, необходимого для
92
обнаружения, и интенсифицирует разрушение в первые
моменты контакта с водой при 350°.
Сплав урана с 50% Zr, покрытый оболочкой из цирка-
лоя-2 с искусственными дефектами, испытывался в воде
при температуре 360°. После 588 суток катастрофическо-
го разращения топливной композиции не наблюда-
лось [24].
Сплав урана с 3,8% Si стоек без покрытия в воде при
343°, но значительно разрушается в оболочке с дефекта-
ми. Повреждение образцов, покрытых циркалоем-2 путем
совместного выдавливания, наблюдается в этих условиях
через 14 суток. При этом интенсивно разрушается по-
верхность соприкосновения оболочки и топливной компо-
зиции. Вода легко достигает поверхности сплава и обра-
зующийся окисел разрушает оболочку.
В воде при 260° дефекты в оболочке не интенсифици-
ровали разрушение сплава урана с 3,8% Si в течение
46,4 суток до выгорания 0,069 ат. %. При увеличении
экспозиции до 78 суток накопление продуктов коррозии
около дефекта вызвало появление трещин в оболочке
[24].
При коррозии в воде при 340° образцов сплавов цир-
кония с-5,5 % U и 0,113% В с дефектной оболочкой ин-
тенсивное развитие коррозии и дальнейшее разрушение
оболочки произошли после 1 ч испытаний.
Л ИТЕРАТУРА
1. Латимер В. Окислительное состояние элементов и их потен-
циалы в водных растворах. М., Изд-во иностр, лит., 1954.
2. Жук Н. П. Коррозия и защита металлов: Расчеты. М., Машгнз,
1957.
3. Handbook of chemistry and physics, 33 edition. Ohio, 1951.
4. Г л e с с т о и С. Введение в электрохимию. M., Изд-во иностр,
лит., 1951.
5. Handbook of electroch. Const. Lond., 1959.
6. Wilkinson W. D. Uranium metallurgy, v. 2. N. Y„ 1962.
7. Кац Дж., Рабинович E. Химия урана. М., Изд-во иностр,
лит., 1954.
8. Стер лип Я. М. Металлургия урана. М., Госатомиздат, 1962.
9. Taylor R. !'. J. АррГ. Chem., 13, 1, 32 (1963).
10. Todt F. Korrosion und Korrosionschutz. Berlin, 1961.
ll. Lewolyn-Leach J. S., Nehru A. Y. Corrosion of reactor
’materials. Conf. Salzburg. June 1962. Vienna, 1962, v. 1, p. 59.
12. Dr ale у J. E. U.S. Atomic Energy Comm. ANI. 5030 (1953);
ANL 4862 (1953); ANL 5029 (1953).
13. Word J. W., Waber J. J. Electrochem. Soc., 109, 2, 21'
(1962)..
14. Waber J. T. AEC-Euroatom Conference on agueous corrosion of
reactor materials, Brussels, 1959. U. S. Atomic Energy Comm.
_ TID-7587, p. 307.
15. Ядерные реакторы. T. 3, Материалы для ядериых реакторов.
М„ Изд-во иностр, лит., 1956, (Материалы КАЭ США.)
16. Норк in son В. Е. Corros. Technol., 6, 11, 337 (1959).
17. Ri us A. Electrochem. acta, 7, 513 (1962).
18. Schraetter J. B. et al. J. Electrochem. Soc., 106, 6, 486 (1959).
19. Pray H. A. U. S. Atomic Energy Comm. BMI-893 (1957).
20. Frank J. W., Roebuck A. H. U.S. Atomic Energy Comm.
ANL-5380 (1955).
21. Bowden H. C„ Pi 11 on R. L. Corrosion, 17, 7, 9 (1961).
22. Sailer H. A. U. S. Atomic Energy Comm. BMI-971 (1954).
23. Burkart Al. W., McGeary R. K. Proceeding the Second'
nuclear engineering and Sci. conf. 1957, v. 2, p. 197.
24. Ядерно-горючие материалы. Кн. 1. Al., Госатомиздат, 1961. (Ме-
талловедение реакторных материалов. Обзоры ин-та им. Бэттла).
25. Строение и свойства сплавов урана, тория и циркония. Со.
статей. Под ред. О. С. Иванова. М„ Госатомиздат, 1963, стр. 175,
. 185, 246.
94
26. Маху. «Вопросы ядерной энергетики», № 1, 68 (1958); «Атом-
ная техника за рубежом»? № 1, 79 (1957).
2.7. Весkerley J. G. Nuclear fuels. New York — London, 1956.
28. Сергеев Г. Я. и др. Металловедение урана и некоторых реак-
торных материалов. М„ Атомиздат, 1960.
29. Др ей л и Ю. Е., Гринберг С., Родер В. Экспресс-ин-
формация «Коррозия и защита металлов», № 47, реф. 379 (I960)..
30. Janitschek К. Atomkernenergie, 5, 6, 222 (1960).
31. Draley J. E el al. J. Electrochem. Soc., 107, 9, 732 (1960).
32. Герасимов В. В. и др; Коррозия и облучение. М., Госатом-
издат, 1963.
33. Вальков В. Д„ Бялобжесский А. В. В сб. «Коррозия
металлов и сплавов». М., Металлургиздат, 1963, стр. 298.
34. Т рейтер т В. Е. Экспресс-информация «Коррозия и защита
металлов», № 31, реф. 222 (1961).
35. Розенфельд 1-1. Л. Атмосферная коррозия металлов. М.„
Изд-во АН СССР, 1960.
36. Уобер Дж. В кн. «Труды Второй международной конференции
по мирному использованию атомной энергии. Женева, 1958». Из-
бранные доклады иностранных ученых. Т. 6. М„ Атомиздат, 1959,.
стр. 210.
37. Бессонов А. Ф„ Власов В. Г. «Физика металлов и ме-
таловедение», 12, 3. 403 (1961).
38. А ко л ьз нн П. А., Герасимов В. В. Коррозия конструк-
ционных материалов атомных и тепловых энергетических уста-
новок. М., «Высшая школа», 1963.
39. И opkins on В. Е. Electrochem. Soc., 106, 2, 103 (1959).
40. Бессонов А. Ф„ Власов В. Г. «Физика металлов и ме-
талловедение», 12, 5, 775 (1961).
41. Kaufman A. Nuclear reactor fuel elements Metallurgy and fab-
rication. New York — London. 1962.
•42. Corros. Technol., 10, 2, 43 (1963).
43. Metal Ind., 102, 2, 52 (1963).
44. В i g If. ,1. Electrochem. Soc., 106, 8 (1959).
45. Owen L. W„ Less-Common. J. Metals, 4, 1. 35 (1962).
46. Corros. Technol., 8, 1, 2 (1961). '
4/. Rott W. L. J. Electrochem. Soc., 106, 2, 126 (1959).
48. Lora nt M. Electroplat, and Metal Finish., 16. 1, 15 (1963): цит.
по Экспресс-информации- «Коррозия и зашита металлов», № 17,
реф. 160 (1963).
ОГЛАВЛЕНИЕ
Введение .......................................... 3
Глава I. Физико-химические свойства урана и продуктов
коррозии урана.....................................5
Глава II. Коррозия урана в водных средах.......... 15
Глава III. Коррозия сплавов урана в водных средах ... 40
Глава1 IV. Коррозия урана и его'сплавов в неводных сре-
дах и защитные покрытия.......................... 66
Литература ........................................94
Герасимов
Валентин Владимирович
КОРРОЗИЯ УРАНА И ЕГО СПЛАВОВ
Тематический план 1965 г. № 40
Обложка художника /Г.
Техн, редактор Е. И. Мазель
Сдано в набор 19/VIII 1964 г. Подписано в печать 31/Х 1964 г.
Бумага 84Х1О8'/к. Физ. печ. л. 3,0 Привел, п. л. 5,01 Уч.-иэд. л. 4,86
Заказ изд. 1215 Тираж 1700 экз. Т-14892 Цена 24 коп.
Атомиздат, Москва, Центр, ул. Кирова, 18.
Московская типография № 8 Главполиграфпрома
Государственного комитета Совета Министров СССР по печати.
Хохловский пер.. 7. Зак. 1533.
ЗАМЕЧЕННЫЕ ОПЕЧАТКИ
Стр. Строка Напечатано Следует читать
\о Табл. 5, 2-я колонка, 2-5-я строки и 3-я колонка, 3 и 4-я строки +
Зак. 1533