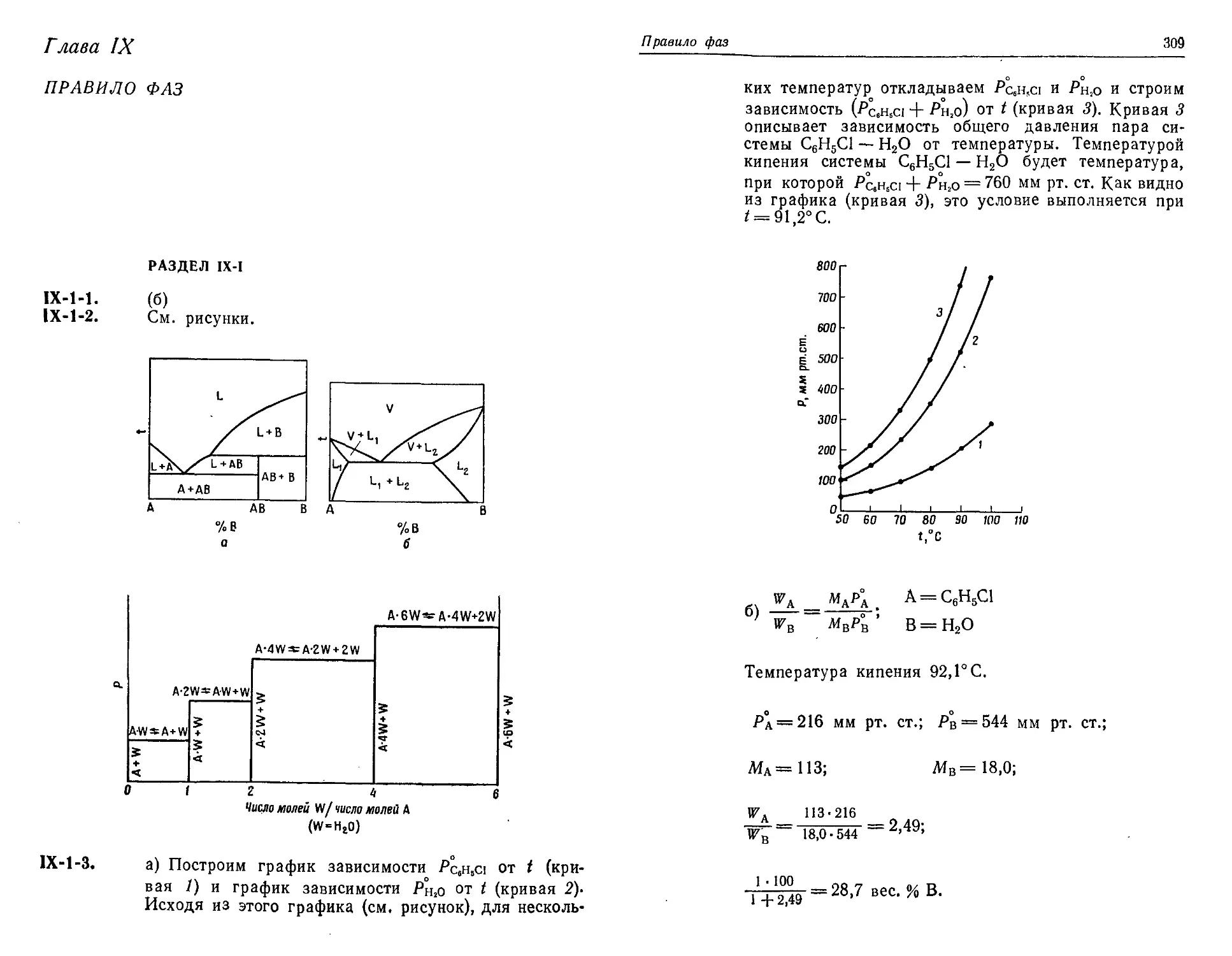
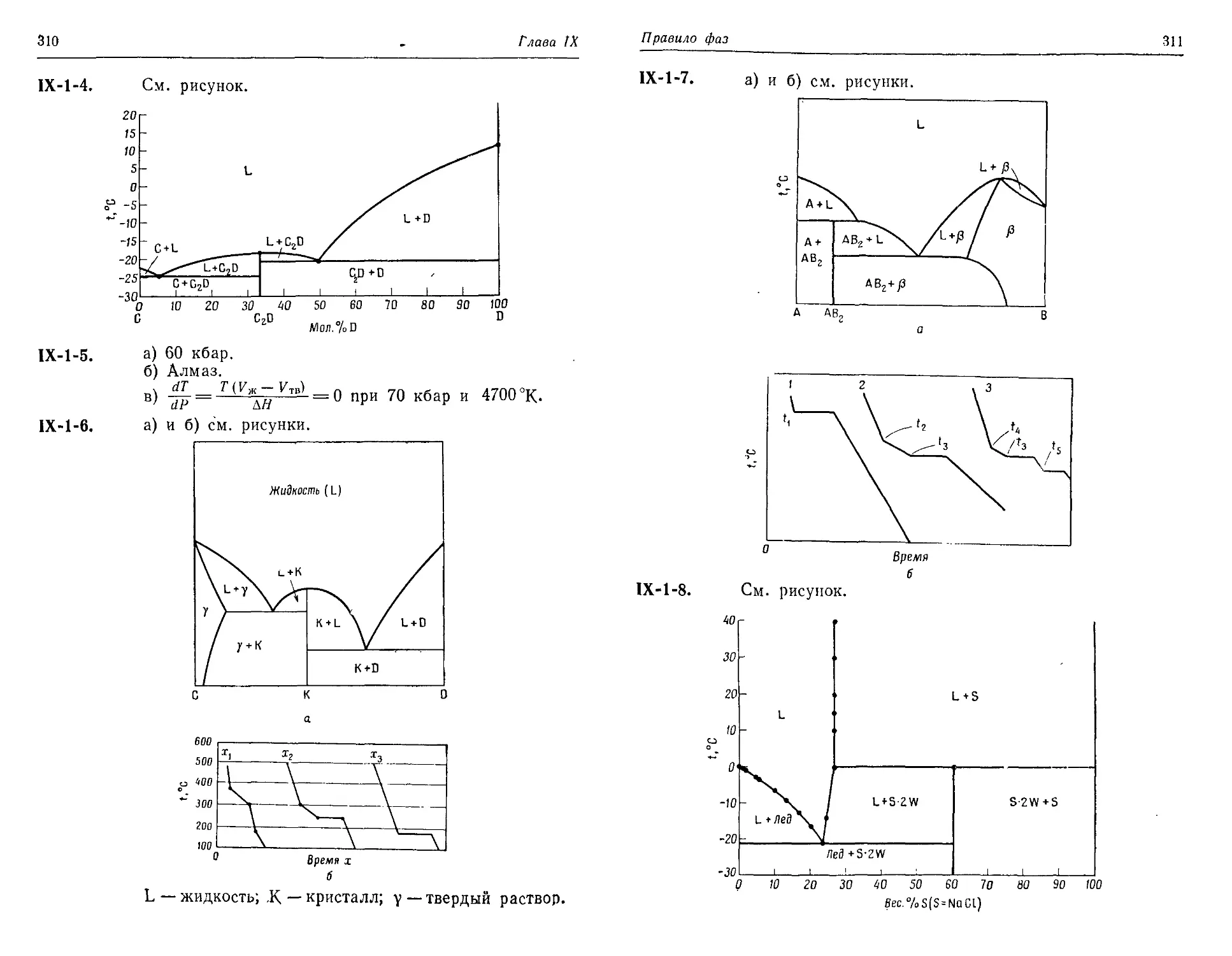
Text
Л.ЛАБОВИЦ
ДЖ АРЕНС
ЗАДАЧИ
ПО
ФИЗИЧЕСКОЕ
ХИМИИ
С РЕШЕНИЯМИ
PROBLEMS
AND SOLUTIONS
PHYSICAL
CHEMISTRY
LEONARD C. LABOWITZ
Stern College for Women, Yeshiva University
JOHN S. ARENTS
The City College
of the City University of New York
ACADEMIC PRESS
NEW YORK LONDON
1969
Л. ЛАБОВИЦ,
Дж. АРЕНС
ЗАДАЧИ
ПО ФИЗИЧЕСКОЙ ХИМИИ
С РЕШЕНИЯМИ
Перевод с английского
канд. хим. наук
В. П. ВЕНДИЛЛО
Под редакцией
Проф. Ю. В. ФИЛИППОВ^
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА, 1972
УДК 541.1(076.5)
В книге собраны задачи по основным разделам физической хи-
мии, причем подавляющее большинство их составлено по оригиналь-
ным литературным данным, что представляет особый интерес. В от-
личие от имеющихся задачников в книге даны подробные решения
всех задач, что обеспечит возможность успешной самостоятельной
подготовки студентов, а также в значительной мере облегчит работу
преподавателей при подборе наиболее интересного материала для
проведения занятий.
Учитывая отсутствие подобных учебных пособий, задачник пред-
назначен прежде всего для студентов и преподавателей высших
учебных заведений. Благодаря очень удачному подбору и изложе-
нию материала книга окажет также большую помощь преподава-
телям смежных дисциплин, научным работникам и инженерам в ов-
ладении основами физической химии.
Редакция литературы по химии
2-5-4
86-72
ПРЕДИСЛОВИЕ
Практическое освоение физической химии требует от изучаю-
щего этот предмет непременного умения решать примеры и за-
дачи. К сожалению, в настоящее время у нас очень мало хороших
сборников задач по физической химии. Данная книга призвана
восполнить этот недостаток, тем более, что в ней приведены задачи
с подробными решениями. Последнее обстоятельство придает осо-
бую ценность книге и делает ее уникальной. Она будет полезной
не только студентам, особенно изучающим физическую химию са-
мостоятельно, но и преподавателям, облегчая им подбор задач
для проведения семинаров.
Задачи, приведенные в книге, практически охватывают все
разделы курса физической химии: это газы, классическая термо-
динамика, электрохимия, кинетика, фотохимия, радиохимия, кол-
лоидные системы, квантовая химия и спектроскопия, статистиче-
ская термодинамика. Подавляющее большинство задач составлено
по оригинальным литературным работам, что представляет осо-
бый интерес.
Материал каждой главы (за исключением гл. XV) разделен на
три категории сложности: от простейших задач, требующих про-
стой подстановки величин в известные формулы, до задач, при
решении которых необходима определенная самостоятельная ра-
бота.
Следует отметить, что распределение материала в книге не все-
гда отвечает современному содержанию физической химии. Так,
задачи гл. I —раздела не первостепенной важности в современной
физической химии — разнообразны и многочисленны, а в то же
время задачи гл. IV по расчету абсолютных энтропий или гл. XI,
в которой речь идет о химической кинетике, либо не отвечают
месту и значению, которое они занимают в физической химии,
либо не охватывают всей проблемы в целом.
Тем не менее можно смело утверждать, что благодаря широте
охвата материала и оригинальности решения многих задач, книга
Л. Лабовица и Дж. Аренса представляет исключительный интерес
и найдет многочисленных читателей.
Ю. Филиппов
ПРЕДИСЛОВИЕ АВТОРОВ
Настоящая книга служит дополнительным источником задач
для студентов и должна помочь им в изучении физической химии.
Материал каждой главы разделен на три категории трудности.
Исключение составляет гл. XV, большинство задач которой после-
довательны по характеру.
Задачи первого раздела относительно легки, второго — средней
трудности, третьего — довольно трудны. Мы надеемся, что задачи
третьего раздела будут стимулировать у студентов интерес к фи-
зической химии; вообще говоря, эти задачи требуют глубокого
понимания, интуиции в физической химии, а также некоторого
«воображения».
Для решения задач второго раздела необходимо достаточно
хорошо знать предмет, чтобы справиться с несколько усложнен-
ными условиями, иметь отличную точку зрения по сравнению с об-
щепринятой, а также понимать материал значительно глубже, чем
просто уметь подставить численные значения величин в соответ-
ствующие формулы.
Задачи первого раздела, в своей основе, классические. Все три
типа задач требуют знаний полного курса физической химии.
Мы использовали буквы с черточкой наверху (v и др.) для
обозначения как мольных, так и парциальных мольных величин;
другие обозначения стандартны или объясняются в тексте. Кон-
станты равновесия даются в виде безразмерных величин, учитывая,
что давление выражено в атмосферах, а концентрация — в молях
ца литр.
Л. Лабовиц
Дж. Аренс
ЗАДАЧИ
Глава /
ГАЗЫ
РАЗДЕЛ 1-1
1-1-1. Пузырек газа с диаметром 1 см, находящийся у дна
озера при температуре 5° С и давлении 3 атм, подни-
мается на поверхность, где температура 25° С и да-
вление 1 атм. Какой будет диаметр пузырька, когда
он достигнет поверхности? (Присутствием в пузырьке
водяного пара можно пренебречь.)
1-1-2. При определении молекулярного веса озона [1] полу-
чены следующие данные: температура 28,2° С; вес
колбы, наполненной озоном, 6,7624 г; вес эвакуиро-
ванной колбы 6,5998 г; давление озона в колбе
274,4 мм рт. ст.; обьем колбы 235,67 см3. Вычислите
молекулярный вес озона.
1-1-3. Молекулярный вес диэтилового эфира определялся
по методу Майера [2]. Получены следующие данные:
вес эфира 0,1023 г; объем вытесненного воздуха
35,33 см3; температура 32,5° С; атмосферное давление
743,95 мм рт. ст. Вычислите молекулярный вес эфира.
1-1-4. Некоторый газ имел следующие плотности при 300°К:
Давление, атм 0,4000 0,8000 1,0000
Плотность, г-л-1 1,512 3,088 3,900
Определите молекулярный вес газа с точностью, кото-
рую могут дать эти данные.
1-1-5. Зависимость плотности газообразного метиламина от
давления исследовалась при температуре 0°С [3]. Были
получены следующие данные:
Давление, атм 0,200 0,500 0,800
Плотность, г-л~' 0,2796 0,7080 1,1476
Определите молекулярный вес этого соединения.
1-1-6. Используя закон Максвелла о распределении моле-
кул по энергиям dn = К ]/е e~e/kr d&, напишите вы-
ражение для доли молекул идеального газа, трансля-
ционная кинетическая энергия которых больше неко-
торой величины ео-
1-1-7. Для определения значения числа Авогадро исследо-
вали под микроскопом распределение коллоидных ча-
стиц гуммигута, суспензированного в воде, как функ-
10
Глава J
цию высоты [4]. В одной из серий измерений полу-
чены следующие данные (при 15° С):
Высота h, мкм 5 35
Среднее относительное число частиц п на 100 47
высоте h за некоторый период времени ,
Плотность частиц 1,206 г-см-3; плотность воды
0,999 г-см*3. Радиус частиц равнялся 0,212 мкм
(1 мкм=10~4 см). Рассчитайте число Авогадро из
этих данных.
1-1-8. Постройте график зависимости функции плотности ве-
роятности f(v) от скорости молекул водорода приО°С.
1-1-9. Вычислите среднюю длину свободного пробега моле-
кул аргона при 25° С и давлении 1 мм рт. ст.; диа-
метр молекулы 2,86 А.
1-1-10. Вычислите число столкновений z молекул азота за 1 с
в одном кубическом сантиметре при 1 мм рт. ст. и
25° С; диаметр молекулы 3,16 А.
1-1-11. Смесь 90 мол. % водорода и 10 мол. % дейтерия вы-
текает через узкое отверстие с сечением 0,30 мм2.
Рассчитайте состав газа, первоначально прошедшего
через отверстие.
1-1-12. Вычислите давление (в атмосферах), создаваемое
2 молями пара хлорбензола, занимающими объем
10 л при 25° С. Используйте: а) закон идеального
газа; б) уравнение Ван-дер-Ваальса (а=25,43 л2Х
Хатм-моль-2, 6=0,1453 л-моль*1).
1-1-13. Коэффициент сжимаемости Z = PVInRT для СО2 при
0° С и 100 атм равен 0,2007. Вычислите объем
0,1 моля газа при 100 атм и 0° С. Используйте:
а) закон идеального газа; б) коэффициент сжимае-
мости.
1-1-14. Коэффициент сжимаемости Z=PV/nRT для азота N2
при —50° С и 800 атм равен 1,95; при 100° С и
200 атм 1,10. Объем некоторого количества азота при
—50° С и 800 атм равен 1 л. Вычислите объем того же
количества азота при 100° С и_200 атм.
1-1-15. Для газа Ван-дер-Ваальса У1ф = ЗЬ, Ркр = а!21Ь2 и
TKp=8a/27bR. Определите из этих критических точек
коэффициент сжимаемости газа.
1-1-16. Температура кипения н-гексана при 760 мм рт. ст. со-
ставляет 68,9° С. Оцените приближенно критическую
температуру этого вещества.
РАЗДЕЛ 1-2
1-2-1. Зависимость коэффициента термического расширения
гелия а от давления приведена ниже [5]. Вычислит^
Гази
И
1-2-2.
1-2-3.
1-2-4.
1-2-5.
температуру (°C), соответствующую абсолютному
нулю.
Р, мм рт. ст. 504,8 520,5 760,1 1102,9 1116,5
а-10° 3658,9 3660,3 3659,1 3658,2 3658,1
Плотность р (г-л_|) некоторого газа при 300,00° К
определяется уравнением р = 2,000/’ + 0.0200Р2, где
Р — давление, выраженное в атмосферах. Вычислите
молекулярный вес газа с точностью до четырех зна-
чащих цифр.
Определение атомного веса хлора проводили методом
измерения предельной плотности газообразного хло-
ристого водорода [6]. В одной из серий измерений
найдено, что в стеклянном сосуде объемом 465,856 см3
содержались следующие весовые количества хлори-
стого водорода (при указанном ниже давлении
и 0°С):
Вес НС1, г 0,76097 0,75731 0,75481 0,75968
Барометрическое да- 756,76 753,38 750,83 755,79
вление, мм рт. ст.
В другой серии опытов получены следующие данные
по зависимости произведения PV (для хлористого во-
дорода) от давления при 0° С:
Р, мм рт. ст. 829,50 604,71 384,13 243,40 157,57
V, см3 66,012 90,815 143,259 226,401 349,978
PV 54757 54917 55030 55106 55146
Отношение предельной плотности к давлению кисло-
рода при 0° С lim р/Р= 1,42762 г-л_|-атм-1. Эти изме-
* р->о
рения были проведены в Лондоне, где ускорение
силы тяжести в 1,000588 раза больше, чем на широте
45°. Во все данные была внесена поправка на адсорб-
цию газа на стенках сосуда. Определите предельную
плотность хлористого водорода и атомный вес хлора.
Термический коэффициент объемного расширения
ртути дается выражением:
а = = 1> 817-10~4 + 5,90-10"9/ + 3,45- 10-IV,
где t — температура (°C) и VQ=V при t=0. Если по-
казания идеального газового и ртутного термометров
совпадают при 0 и 100° С, то какой кажущейся тем-
пературе по ртутной шкале будет соответствовать
50° С по шкале идеального газового термометра?
Каждое из нижеследующих определений (а и б) аб-
солютной температуры (Т) возможно и реально. Опи-
шите кратко, чем каждое определение отличается от
12
Глава 1
1-2-6.
1-2-7.
1-2-8.
официального определения (принятого в 1954 г. Ме-
ждународным комитетом мер и весов), и объясните,
почему каждое из этих определений не имеет общего
применения. Официальное определение имеет вид:
где п — число молей газа, V — объем, Р—давление и
R— постоянная, выбранная так, что 7=273,16° С
в тройной точке воды.
а) 7 = 100 (7—7-) + 273,15,
' \lt> —h 1
где I — высота столба ртути постоянного сечения при
температуре 7; 1ъ и If — высоты того же столба в точ-
ках фазовых переходов (кипения и затвердевания со-
ответственно) воды, насыщенной воздухом под давле-
нием в одну стандартную атмосферу (1,01325Х
ХЮ6 дин-см'2). б) T=PV/nR, где V — объем при од-
ной атмосфере давления п молей чистого кислорода
с изотопным составом, найденным в земной атмосфе-
ре. Один моль определяется как количество кисло-
рода (приблизительно 31,9988 г), которое содержит
то же число молекул, что и число атомов, содержа-
щееся точно в 12 г чистого изотопа 12С; R — постоян-
ная, выбранная так, что 7=273,16° С в тройной точ-
ке воды.
Смесь гелия и аргона весит 5 г и занимает объем
10 л при 25° С и 1 атм. Определите достав смеси в ве-
совых процентах.
Вычислите плотность (г-л-1) воздуха, насыщенного
водяным паром при 25° С. Давление пара воды при
этой температуре равно 23,7 мм рт. ст. Состав сухого,
свободного от СОг, воздуха: 78,1 об.% N2, 21,0 об.%
0.2 и 0,9 об. % Аг.
Давление газа как функция высоты выражается так:
где Ро— давление газа на высоте h0 и Р — давление
газа на высоте h(h > /г0); М — молекулярный вес
газа, §=980,6 см-с'2— ускорение силы тяжести и
R = 8,314-107 эрг-°К~’• моль'1 — газовая постоянная,
а) Рассчитайте атмосферное давление на высоте
300 м, если давление на уровне земли равно 1 атм
при температуре 25° С (турбулентностью и градиен-
том температуры можно пренебречь), б) Объясните,
как можно построить график прямолинейной зависи-
Газы
13
мости высоты от давления воздуха. Кажущийся мо-
лекулярный вес воздуха равен 29.
1-2-9. Выведите барометрическую формулу Р = Poe~MezlRT,
решив дифференциальное уравнение. Для составле-
ния уравнения используйте следующие данные: из-
менение давления (—dP) между высотами z и z 4- dz
равно весу (не массе) газа, приходящегося на еди-
ницу площади слоя толщиной dz. Приравняйте эти
две величины, выразив их через две переменные Р и
z (используйте закон идеальных газов), и решите
уравнение (разделив переменные).
1-2-10. Ускорение силы тяжести g изменяется с увеличением
расстояния г от центра земли в соответствии с фор-
мулой: g—GmE/r2, где G — константа пропорциональ-
ности, называемая постоянной тяготения, и тЕ —
масса земли. Выведите видоизменение барометриче-
ской формулы, приняв во внимание это изменение g
с увеличением высоты от поверхности земли.
1-2-11. В нижней части атмосферы температура воздуха не
одинакова, но линейно уменьшается с высотой со-
гласно уравнению Т — То—az, где а — коэффициент
пропорциональности, z — высота, То — температура
на уровне земли и Т — температура на высоте z. Вы-
ведите видоизменение барометрического уравнения,ко-
торое учитывало бы эту температурную зависимость.
1-2-12. Ответы на следующие вопросы могут быть выражены
через количества веществ, универсальные постоянные
и могут содержать интегралы, которые можно не
брать, а) В идеальном газе при температуре Т ка-
ждая молекула имеет массу т. Определите долю мо-
лекул, имеющих скорость больше f0. б) Определите
эту долю для двухмерного идеального «газа», моле-
кулы которого двигаются в плоскости.
1-2-13. В среднем внешняя поверхность тела человека равна
приблизительно 2 м2. Вычислите число молекул воз-
духа (20 мол.°/о Ог и 80 мол.% N2), ударяющихся за
1 с о поверхность тела человека при 25° С и 1 атм.
1-2-14. Давление паров скандия определено по методу Кнуд-
сена [7]. При этом измерялся вес газа, прошедшего
сквозь маленькое отверстие за известный период вре-
мени. Были получены следующие данные: температу-
ра 1555,4° К; время 110,5 мин; потеря веса 9,57 мг;
диаметр отверстия 0,2965 см. Вычислите давление
(атм) паров скандия при этой температуре (1 динХ
Хсм-2 = 9,87-10~7 атм).
1-2-15. Два идеальных газа А и Б находятся в отдельных
сосудах при температурах Гд и 7 и концентрациях
14
Глава I
1-2-16.
1-2-17.
1-2-18.
1-2-19.
1-2-20.
с а и Сб (моль-л-1') соответственно. У газа А молеку-
лярный вес А4д и диаметр молекул оА; у газа Б—М Б
и Об- Допустим, что молекулы являются твердыми ша-
рами. Вычислите отношение (для газа А по отношению
к газу Б) а) средней кинетической энергии одной моле-
кулы; б) средней скорости молекул; в) длины сред-
него свободного пробега; г) молекулярных столкно-
вений, испытываемых одной молекулой в единицу
времени.
Согласно кинетической теории газов, вязкость газа
пропорциональна величине Г'/2сг2, где а — диаметр
молекулы Объясните, почему вязкость а) увеличи-
вается с возрастанием температуры, б) зависит от
диаметра молекул и в) не зависит от давления при
постоянной температурё; почему эта независимость
нарушается при очень низком давлении?
Предполагают, что межгалактическое пространство
содержит атомы водорода при температуре 7,8-105°К
с концентрацией приблизительно 1 атом на 100 л.
Пусть диаметр соударения атома водорода равен 2 А.
а) Вычислите среднюю длину свободного пробега
атома в межгалактическом пространстве (в световых
годах), б) Определите приблизительно среднее время
(в годах) между столкновениями данного атома.
Температура Бойля Тв для газа — это температура,
при которой [<?(РV)/<5P]t=0, если Р=0. Для каждо-
го из следующих уравнений состояния оцените Тв че-
рез известные постоянные A, b, R, Ркр, Ткр и т. д.:
a) PV=W+((,-_±-)₽;
б) Рй_дг{|+Х(А)(2^)[1-в(-^)!]}.
Оцените температуру Бойля для газа Ван-дер-Вааль-
са через постоянные а, b и R. Окончательное выраже-
ние для Тв должно содержать только а, b и R. Указа-
ние; уравнение Ван-дер-Ваальса трудно преобразует-
ся в вириальную форму, которая позволила бы оце-
пить Тв, поэтому запишите его в виде
р nRT п2а
V -nb V2 '
При умножении на И и при Р = 0 получим
Р(РЮ1 _п
L дР Jr’
Помните, что при Р=0 V=co.
Покажите, что при низких плотностях уравнение Ван-
Газы
15
дер-Ваальса
+ (₽-&) = /??’
и уравнение Дитеричи
р — _^Т e-afRTV
(V-b)
дают по существу одинаковый результат для Р.
Указание: в уравнении Дитеричи разложите в беско-
нечный ряд ех= 1 + к + х2/2! + х3/3! + х4/4! + ... .
1-2-21. Некоторый газ подчиняется уравнению состояния
P^-RT “
V-bT V3 ’
где V — мольный объем, а и b — характеристические
постоянные газа. Покажите, что
где Икр и Ткр — критические постоянные.
1-2-22. Некоторый пеидеальный газ подчиняется^ уравнению
состояния PV—RT + APT — ВР, где V—мольный
объем, А и В — характеристические постоянные газа,
а) Определите температуру Бойля, б) Установите,
имеет ли газ критическую точку. Если газ имеет кри-
тическую точку, то найдите критические постоянные;
если критической точки нет, объясните это.
1-2-23. Гипотетический газ подчиняется уравнению состояния
Р^ & а
V — b V ’
где а и b — постоянные, отличные от нуля. Устано-
вите, имеет ли этот газ критическую точку. Если газ
имеет критическую точку, выразите критические по-
стоянные через а и Ь\ если критической точки нет,
объясните это.
1-2-24. Для газа Дитеричи P(V — b)e^lRTV = RT; PItp = 2b,
Ткр = a/ARb и PKp = a/4e2b2. Напишите уравнение Ди-
теричи в приведенной форме, т. е. через приведенную
температуру 9 = 7’/7’кр, приведенное^ давление л=
= Р/Ркр я приведенный объем ^=И/Икр. В оконча-
тельное уравнение должны входить только перемен-
ные л, ф и 9, а постоянные а, b и R должны отсут-
ствовать.
РАЗДЕЛ 1-3
I-3-J. При заливке трубки барометра ртутью некоторое ко-
личество воздуха осталось в верхней части трубки.
16
Глава 1
1-3-2.
Очевидно, из-за этого прибор показывал давление па
3 мм ниже истинного давления — 720 мм рт. ст. при
комнатной температуре 20° С. Общая длина трубки
барометра, измеренная от нижнего уровня ртути, со-
ставляет 780 мм. Выведите формулу, которая позво-
лит измерить истинное давление с помощью этого ба-
рометра при комнатных условиях. Определите, какие
поправки должны быть внесены в показания прибора.
Стеклянный цилиндр длиной 100 см, запаянный с од-
ного конца и наполненный сухим воздухом при да-
влении 1 атм и 25° С, перевернут в сосуд со ртутью,
причем запаянный конец цили щра находится па од-
ном уровне с поверхностью ртути (см. рисунок). Ба-
- рометрическое давление равно 1 атм.
Определите: а) высоту столба ртути внутри цилинд-
ра; б)'конечное давление воздуха в цилиндре.
1-3-3. J-образпая трубка, показанная на рисунке, запол-
нена сначала воздухом при 1 атм и 25° С, затем в от-
крытый конец была налита жидкая ртуть. Баромет-
рическое давление равно 1 агм. Определите: а) вы-
соту столба ртути в длинной ветви трубки, когда
ртуть достигла краев короткой ветви; б) давление
сжатого воздуха в этой точке.
Газы
17
1-3-4. Каждый из двух пустых сферических сосудов (ем-
кость сосуда 22,4 л) заполнили 1 молем азота при
температуре 25°С и давлении 1 атм. Затем сосуды
соединили тонкой пустой трубкой незначительного
объема. Один шар поместили в термостат при темпе-
ратуре 100° С, а другой — при 0° С. Определите ко-
нечное давление в системе и число молей азота в ка-
ждом шаре.
1-3-5. При попытке вывести формулу РУ=КТ (К — по-
стоянная) с помощью законов Бойля и Шарля (или
Гей-Люссака), была допущена ошибка:
PV = (1) V = k2T (4)
= (2) ^ = k2T (5)
V=^- (3) ^- = k3 = PT или PT = K. (6)
Очевидно, что уравнение (6) неправильно. В чем
ошибка? На какой стадии опа допущена? Сделайте
правильный вывод формулы.
1-3-6. а) Объясните, па какой основе можно построить гра-
фик прямолинейной зависимости, при помощи кото-
рого можно определить состав (мол.%) смеси гелия
и кислорода, отсчитывая плотность (r-л'1) при темпе-
ратуре 25° С и общем давлении 1 атм (газы ведут
себя, как идеальные).
б) Постройте график и используйте его для опреде-
ления состава смеси гелия и кислорода, плотность ко-
торой при определенных условиях равна 0,82 г-л_|.
1-3-7. Три компоненты скорости молекулы газа: vx, vy и vz.
Скорость v = (v?x -4- v2 а) Напишите выраже-
ние для v*x, среднего четвертой степени скорости.
(Этот и последующие ответы можно оставить в виде
неопределенных интегралов. Тем не менее они долж-
ны содержать только массу каждой молекулы т, тем-
пературу Т, универсальные постоянные и переменные
интегрирования.) б) Напишите аналогичное выраже-
ние для о4, в) Если имеется различие между получен-
ными выражениями, помимо замены v на vx, объяс-
ните, как оно возникло.
J-3-8. График представляет изотерму для 1 моля газа, кото-
рый подчиняется уравнению состояния P(V — b) —
= RT, где b > 0. Объясните физический смысл на-
клона прямой и точки пересечения его с осью PV,
18
Г лава 1
1-3-9.
1-3-10.
1-3-11.
1-3-12.
1-3-13.
1-3-14.
Обсудите справедливость этого уравнения состояния
для реального газа при низких давлениях.
Для некоторого гипотетического газа коэффициент
термического расширения определяется так:
_ 1 (dV\ (ср\
а~ v \dT/p—k'\cv)
T(cp/cv)-\
а коэффициент изотермического сжатия —
R____1 /
р~ V \ дР )т Р'
Какому уравнению состояния подчиняется этот газ?
(Примите, что Ср, Cv, k\ и k2 — постоянные.)
Покажите, что для газа Ван-дер-Ваальса ТкР —
—3aj27bR, VKp—3nb и Ркр—а/27Ь2, где Лф—крити-
ческая температура, Икр— критический объем и
Ркр— критическое давление. Уравнение Ван-дер-
Ваальса имеет вид
(P + ^)<y-nb)=nRT.
Газ подчиняется уравнению состояния (Р + аР2)Х
Х(И — b)=RT, где а и b — постоянные. Установите,
имеет ли этот газ критическую точку. Если имеет, на-
пишите уравнение состояния в приведенном виде.
Для газа, описываемого уравнением Бертло.
Р = RT/(V - b) - a/TV2,
выразите а, b и R через критические постоянные и на-
пишите уравнение состояния в приведенных пере-
менных.
Покажите, что критические постоянные Ткр, |/ир и
РКр для газа, который имеет уравнение, состояния
Р = RT p-AIRpliV
V-b
будут иметь вид
7'кр = (ч&^’) ’ и ^кр = Т (46/?) е 2<
Предложено следующее уравнение состояния для не-
идеального газа:
Р = ----AVm,
V — В
где V — мольный объем, А, В н пг — характеристиче-
ские постоянные газа. Если это уравнение можеу
Газы
19
быть применено к реальному газу, то оно должно
предсказать: 1) приближение к идеальному газу при
давлении, равном нулю, или при бесконечном объеме,
т. е. PV/RT —> 1 при V -* оо; 2) существование крити-
ческой точки при положительных У|ф, Ткр и Рьр. Же-
лательно установить, каким условиям должны удо-
влетворять постоянные А, В и т для того, чтобы
уравнение_отвечало этим двум предсказаниям, а) Вы-
разите PVIRT через А, В, т, R, Т и V. б) Если А и
В=А=0, то какие требования необходимы, чтобы
PV/RT-+ 1 при V—► оо? в) Выразите (dP/dV)r и
(д2Р/дУ2)г через Л, В, т, R, Т и V. г) Выразите
критический объем Укр через А, В, т и R. д) Какие
условия должны быть наложены на А, В или т, что-
бы Ркр было положительным? е) Выразите критиче-
скую температуру Гкр через А, В, т и R. ж) Какие
условия должны быть наложены на А, В или т, что-
бы Гкр была положительна? з) Обсудите физический
смысл условий, которым должны удовлетворять А,
Вит.
Глава II
первый закон термодинамики
и термохимия
Таблица П-1
Стандартные энтальпии образования АЯ^ 298 (ккал • моль-1) соединений
и их теплоемкости Ср = а + ЬТ + сТ2 + dT3 + fT~2
(кал • °К-1 • моль-1) а
Соединение 298’ икал-моль”1 а &-103 с-107 d-109 f-10-5 Интервал темпера- тур, °к
С (графит) 0 4,03 1,14 0 0 -2,04 298-2000
СО (г) —26,4157 6,79 0,98 0 0 -0,11 298—2000
СО2 (г) -94,0518 10,57 2,10 0 0 —2,06 298-2000
Н2О (г) Н2О (ж) -57,7979 —68,3174 7,219 2,374 2,67 0 0 298—1500
H2S (г) NH3 (г) -4,815 — 11,04 6,955 3,675 7,40 0 0 298-1500
О2 (г) 0 6,148 3,102 -9,23 0 0 298—1500
so2 (г) —70,96 6,796 11,588 —3,015 2,057 0 298—1500
а Приведенные данные используются в задачах этой главы.
РАЗДЕЛ 1Ы
П-1-1. Покажите, что для процесса нагревания идеального
газа
Д(/ + (P2V2 - P.V.) = пСР (Т2 - Tt).
II-1-2. Используя уравнение (dU/dV)T = Т (dP/dT)v — Р, пока-
жите, что (dUldV)T = 0 для газа, который подчиняется
уравнению состояния PV = RT.
П-1-3. Выведите математическое выражение, включающее
только постоянные и легко измеримые физические па-
раметры, для работы w, совершаемой газом в окру-
жающей среде. Газ подчиняется уравнению состоя-
ния PV = nRT------------------у- и расширяется обратимо от
объема Vt до объема Vf при постоянной температуре.
П-1-4. Найдите^ для 1 моля газа, уравнение состояния кото-
рого PV=RT -|- APT—ВР, работу обратимого изо-
термического расширения от объема Vi до объема V2.
Первый закон термодинамики и термохимия
21
II-1-5.
11-1-6.
V—мольный объем, а Л и В — характеристические
постоянные газа.
Клапан цилиндра, содержавшего 10 л газа при да-
влении 25 атм и температуре 25° С, открыт в атмо-
сферу, давление в которой 760 мм рт. ст., а темпера-
тура 25° С. Считая этот процесс изотермическим, оп-
ределите работу (л-атм) процесса расширения газа.
Один моль одноатомного идеального газа проведен
через обратимый цикл, показанный на рисунке. За-
полните пустые места в таблицах, приведенных ниже.
Точка Р, атм V, л Т, °К
1 1 24,4 298
2 — 24,4 596
3 — 12,2 298
Стадия Характер процесса q, кал w, кал Д СУ, кал ДЯ, кал
1 —> 2 Изохори-
ческий
2 —> 3 Изобари-
ческий
3 —> 1 Изотерми-
ческий
Полный
цикл
II-1-7.
Один моль одноатомного идеального газа проведен
через обратимый цикл, показанный на рисунке. За-
22
Глава II
полните пустые места в таблицах, приведенных ниже.
Точка Р, атм V. Л т, °к
1 1 24,4 300
2 1 48,8 —
3 0,5 48,8 —
Стадия Характер процесса d, кал w, кал AU, кал ЛЯ, кал
1 —> 2 Изобари- — —
ческий
2 —> 3 Изохори- — — — —
ческий
3 —> 1 Изотерми- — —
ческий
Полный цикл — — — —
IM-8.
Один моль одноатомного идеального газа проведен
через обратимый цикл, показанный на рисунке. За-
полните пустые места в таблицах, приведенных ниже.
Первый закон термодинамики и термохимия
23
Точка Р, атм V. л г, °к
1 1 298
2 1 — 596
3 2 — 595
Стадия Характер процесса q, кал w, кал XU, кал Д/7, кал
1 —> 2 Изобари- — — — —
ческий
2 —> 3 Изотерм»- — — — —
ческий
3 —> 1 Изохори- — — —— —»
ческий
Полный —» —» — —
ЦИКЛ
II-1-9.
11-1-10.
II-1-11.
II-1-12.
II-1-13.
Вычислите конечную температуру обратимого адиа-
батического расширения 100 г аргона от 10 до 50 л;
начальная температура 25° С.
Вычислите максимальную работу а) изотермического
и б) адиабатического расширения 2 молей азота от
10 до 20 л (считая его идеальным газом) с началь-
ной температурой 25° С. Примите, что Су=51г%.
Исходя из уравнения цтт=(—1/СР) (дН/дР)т, выве-
дите формулу
Vjt ср [Д dV 4 ( дР )т + дР у
Коэффициент Джоуля— Томсона для кислорода ра-
вен 4-0,366° С атм4. Приняв, что этот коэффициент
не зависит от температуры, определите конечную
температуру газа, когда 10 молей кислорода с исход-
ным давлением 20 атм и температурой 20° С расши-
ряются, как в опыте Джоуля — Томсона, сквозь по-
ристую мембрану до конечного давления 1 атм.
При определении энтальпии сгорания нафталина
(С|оН8) в кислороде в калориметрической бомбе най-
дено [8], что при сгорании 1,1226 г нафталина темпе-
ратура калориметрической системы возросла на
4,0630° С. Средняя температура опыта равна 18° С.
Повышение температуры исправлено с учетом энталь-
пии сгорания запальной проволочки и образования
сажи, окиси углерода и азотной кислоты. Теплоем-
кость калориметрической системы 2660 кал; молеку-
24
Глава ll
п-1-14.
П-1-15.
II-1-16.
лярный вес нафталина 128,11 г-молы-’. Определите
энтальпию сгорания 1 моля нафталина при 18° С.
Калорическая ценность пищевых продуктов (факти-
чески энтальпия сгорания единицы массы пищевых
продуктов) может быть определена измерением теп-
лоты, выделяющейся при горении взвешенного образ-
ца пищи при условии постоянства объема в калори-
метрической бомбе. Выделяющееся тепло при полном
сгорании 1 г (3 10-3 моля) куриного жира в этих
условиях (постоянный объем) составляет 10 ккал при
37° С. Определите калорическую ценность куриного
жира (кал-г-1) при 37° С и постоянном давлении, т. е.
стандартную теплоту сгорания куриного жира при
37° С. Реакция может быть представлена уравнением
С20Н32О2 (тв) + 27О2(г) ->20СО2 (г) 4- 16Н2О (ж).
Определите энтальпию плавления льда (кал-моль-1)
при —10° С из следующих данных; Ср(Н2О, тв) =
= 9 кал-моль-1 -°К-1; Ср(Н2О, ж) = 18 кал-моль-1 X
X °К-1; AZf плавления льда при 0° С 1435 кал-моль-1.
Ниже приведены энтальпии растворения некоторых
соединений типа nCaO-mBa2O3 в 1 н. НС1 при
298,16° К [9]:
Соединение Энтальпия растворения. ккал’моль’”1
ЗСаО • В2О3 Д/Z, = -82,423
2СаО • В2О3 Д#2 = -50,287
СаО • В2О3 Д//3 = -20,259
СаО • 2В2О3 ДЯ4 = -10,080
СаО Д//5 = -46,380
В2О3 Д#6 = —32,86
II-1-17.
II-1-18.
11-1-19.
Вычислите АД для реакции ЗСаО + В20з = ЗСаО-В2Оз.
Для реакции 2А2(тв) + 5В2(г) = 2А2В5(г) АД2э8 =
= 15 000 кал. Определите АДгэв для этой реакции.
Стандартная энтальпия сгорания АЯгов твердого
нафталина (СюНз) равна—1231,6 ккал-моль-1. Про-
дукты сгорания — СО2 и жидкая вода. Найдите стан-
дартную энтальпию образования нафталина при 25° С.
а) Стандартная энтальпия сгорания (А/Др) кРистал-
лической бензойной кислоты (C6HsCOOH) при 25° С
до СОг (г) и НгО (ж) равна —771,72 ккал-моль-1.
Найдите АН0 и АД0 образования бензойной кислоты
цз простых веществ при 25° С. б) Найдите стандарт-
Первый закон термодинамики и термохимия
25
ную энтальпию образования \Н° кристаллической
бензойной кислоты при 100° С. Примите, что в дан-
ном интервале температур теплоемкости приведенных
веществ постоянны:
СбН5СООН (крист) С (графит) Н2(г) О2 (г)
Ср, кал-°К-1 моль-1 35,1 2,0 4,9 5,0
П-1-20.
Оцепите ДЯ° ионизации водных растворов лг-хлорфе-
пола (л«-ХФ) [10] на основе следующих данных:
л/-ХФ (ж) -> л/-ХФ (aq) \Н° — 674 кал • моль-1
лг-ХФ (ж) -4- ОН- (aq) -> 0
, \ । ттгч/ \ ДЯ2 — —7540 кал • моль-1
-»(л«-ХФ) (aq) Ч- Н2О (ж)
Н2О (ж) -> Н+ (aq) + ОН” (aq) ДЯз = 13,5 ккал • моль-1
П-1-21.
П-1-22.
При 298,16° К стандартная энтальпия сгорания цис-
гексагидроиндана (q«c-C9Hie) равна —1351, бОккалХ
X моль-1 [11]. Процесс сгорания может быть представ-
лен уравнением:
quc-C9Hi6 (ж) + 13 О2 (г) -> 9СО2 (г)8Н2О (ж).
а) Вычислите стандартную энтальпию образования
1 моля цис-гексагидроиндана из простых веществ при
298,16° К
б) Какой будет ответ, если за стандартное состояние
углерода принят алмаз вместо графита?
С (алмаз) -» С (графит) ДЯ298 = — 0,45 ккал.
Оцените стандартную энтальпию образования карбида
вольфрама WC (тв) на основе следующих данных
[12]:
С (графит) + О2 (г) -> СО2 (г)
WC (тв) + ®/2О2(г)->
-> WO3 (тв) 4- СО2 (г)
W (тв) + 3/2О2(г) -> WO3(tb)
ДЯ298 == —94,052 ккал
ДЯ298 = — 285,80
ДЯ298 = — 200,16
11-1-23.
Измерена [13] стандартная
циклогексена и бензола и
энтальпия гидрирования
получены следующие ре-
26
Глава ll
11-1-24.
11-1-25.
II-1-26.
11-1-27.
зультаты:
Реакция ДА/0, ккал*моль-1
Н2 Н2
+ Н2 ---> -28,59
£12 ^2
н2 н2
н н2
«нОн+зн‘^ -4мо
н н2
На основании реакции (а) определите стандартную
энтальпию образования бензола и объясните, почему
полученная величина не совпадает с измеренной
(—49,80 ккал-моль-1).
Стандартная энтальпия сгорания борогидрида алюми-
ния А1(ВН4)з (ж) равна —989,1 ккал-моль-1 при
298,2° К [14].
-А1(ВН4)з (ж) + 6О2 (г) ->
-> >/2А120з (крист, корунд)3/2В2О3 (крист)+
+ 6Н2О (ж).
Вычислите стандартную энтальпию образования
А1(ВН4)з (г). Энтальпия испарения А1(ВН4)3 (ж)
7,2 ккал • моль”1, а энтальпии образования необходи-
мых для расчета соединений равны: А120з(крист.
корунд) —399,09 ккал-моль-1; В2О3 (крист)
—303 ккал • моль-1.
При 298,2° С стандартная энтальпия образования
Mg(NO3)2 составляет —188 770 кал-моль-1, стан-
дартная энтальпия растворения —21 530 кал-моль-1,
а стандартная энтальпия образования иона NO3
—49320 кал-(г-ион)-1 [15]. Вычислите стандартную
энтальпию образования иона Mg2+ при этой темпера-
туре.
Стандартная энтальпия сгорания жидкого пиридина
при 298,15° К равна —664,95 ккал-моль-1 [16]. Опреде-
лите стандартную энтальпию образования пиридина
при 298,15° К.
а) Определите \Н° и Д[/° при 25° С для реакции:
4NH3 (г) + ЗО2 (г)->2N2 (г) + 6Н2О (ж).
б) Определите ДН° для реакции (а) при 50° С, при-
няв следующие теплоемкости при постоянном давле-
нии:
Первый закон термодинамики и термохимия
27
Соединение —° O—I 1 Ср кал» к -моль
NH3 О2 n2 Н2О (ж) 8,89 6,97 6,94 18,02
11-1-28. Используя следующие данные:
ДЯ300 образования, ккал-моль""1 —о Ср, кал.°К -моль
А 0 5,00 + 0,002 Т
В -50 7,00
ав2 -80 8,00
а) выведите выражение для зависимости ДЯ° от тем-
пературы для реакции А + 2В^>АВ2. Ваше выраже-
ние должно содержать только численные величины
и Г; б) оцените Д/7° для этой реакции при 1000° К.
11-1-29. Имеются следующие данные:
ДЯ°, ккал (при 18° С)
а) Ре(тв) + 2НС1 (aq)->FeCl2( aq) + Н2(г) —21,0
б) РеС12(тв) + aq->FeCl2(aq) -19,5
в) НС1 (г) + aq-> НС1 (aq) -17,5
г) Н2(г) + С12(г)-^2НС1(г) —44,0
С°р (ккал • °К-1 • моль-1) Fe (тв) С12(г) РеС12(тв)
6 8,2 18,5
Определите для процесса образования твердого FeCl2
а) ЛЯ° при 18° С, б) Д[/° при 18° С и в) ДН° при
118° С.
11-1-30. Используя эмпирические величины энтальпии образо-
вания связей ЬН (см. таблицу), оцените Д/7 —энталь-
28
Глава 11
пию изомеризации этилового спирта в диметиловый
эфир:
СН3СН2ОН (г)-»СНзОСН3 (г).
Связь ДЯ, ккал«моль"’1 (при 25° С)
н—н 104
0—0 33
о—н 111
с—н 99
с—о 84
с—с 83
11-1-31.
11-2-1.
11-2-2.
I1-2-3.
11-2-4.
dU = xy2dx -f- x2ydy\ dW = (sin y)dx + (sin x')dy.
а) Установите, являются ли dU и dW полными диф-
ференциалами. б) Для каждого полного дифференциа-
ла найдите функцию (U или №), в которую переходит
этот дифференциал при интегрировании подходящим
путем. Изобразите графически выбранный путь.
РАЗДЕЛ П-2
Так как по определению Cv = (dU/dT) v, часто пишут
без ограничивающих условий: «dU = CvdT». При ка-
ких условиях действительно dU = CvdT?
Покажите, что работа обратимого адиабатического
расширения 1 моля идеального газа выражается урав-
нением
Дт [1 ( Рг \R/Cd
w — cvTi L—\_дГ) J’
если Су и Ср не зависят от температуры.
При бесконечно малом сжатии жидкости или твер-
дого тела под давлением Р изменения энергии U,
объема V и температуры Т приближенно связаны вы-
ражением dO = CydT-\-{kT— P)dV, где k — харак-
теристическая постоянная вещества. Выведите урав-
нение, связывающее начальный и конечный объемы,
начальную и конечную температуры при равновесном
адиабатическом сжатии жидкости или твердого тела
с постоянной теплоемкостью Су.
Воображаемый, газ подчиняется уравнению состояния
PV2 — n2KT (/( — постоянная), а его теплоемкость Cv
Первый закон термодинамики и термохимия
29
не зависит от температуры и давления. Для этого
газа 0 зависит только от температуры, так же как и
в случае идеального газа, а) Выведите уравнение, ко-
торое связывает начальное и конечное давления с на-
чальной и конечной температурами при обратимом
адиабатическом расширении газа, б) Выразите
(Ср— Cv) для этого газа через Р, Т и К.
11-2-5. Газ _описывается уравнением Ван-дер-Ваальса
(dU/dV)r = a/V2. Выведите уравнение, связывающее
начальную и конечную температуры с начальным и
конечным объемами при обратимом адиабатическом
расширении газа Ван-дер-Ваальса, для которого
Cv — А + ВТ (Л и В — постоянные).
11-2-6. Выведите общую формулу Н.п ~ (ддг j •
11-2-7. Выр азите коэффициент Джоуля — Томсона
1 / дТ\
через a, R, Т и СР для газа, который подчиняется
уравнению состояния V — nRT[P— na!R2T2. Имеет
ли газ температуру инверсии? Объясните.
II-2-8. Коэффициент Джоуля — Томсона для газа Ван-дер-
Ваальса описывается уравнением
_ 1 / 2а , ЗаЬР\
PjT ~ cp\RT ° RZTZ )'
Выведите выражение для температуры инверсии как
функции давления.
11-2-9. Покажите, что
П-2-10. Докажите, что для любого вещества
П-2-11. Покажите, что для особых случаев идеального газа
каждая формула, приведенная ниже, упрощается до
30
Глава II
выражения
СР - Cv = R.
2)сР-сР=-о;/«)г;
3) Ср - Cv =-- TV a2 ft,
где
1 (dV\ а 1 (dV \
а И ( дТ )р и Р И \ дР )г *
II-2-12. а) При экспериментальном определении энтальпии
нейтрализации соляной кислоты едким натром [17]
смешивали растворы НС1 и NaOH в прецизионном ка-
лориметре, причем температура содержимого калори-
метра поднялась на 0,2064° С. Количество воды, вы-
делившееся в результате реакции, равно 3,4075 ммо-
лей. Кроме того, электрические измерения показали,
что удельная теплоемкость калориметра и его содер-
жимого равна 223,9 кал-град-1. Вычислите энтальпию
нейтрализации на 1 моль НС1. Необходимо ввести
поправку (+155 кал) на 1 моль образовавшейся
в конце процесса Н2О к энтальпии смещения рас-
творов НС1 и NaOH до того, как прошла реакция.
б) В другом опыте те же исследователи установили,
что энтальпия нейтрализации НСЮ4 в пределах
ошибки эксперимента та же, что и для НС1. Однако
энтальпия нейтрализации уксусной кислоты едким
натром равна —13,3 ккал-моль*1. Как объяснить тот
факт, что энтальпии нейтрализации НС1 и НСЮ4 оди-
наковы, по отличаются от энтальпии нейтрализации
уксусной кислоты?
II-2-13. Выразите \Н° как функцию температуры для реакции
С (графит) + СО2 (г)-> 2СО (г). (Ответ должен со-
держать только Т и числа.) Укажите интервал тем-
ператур, в котором полученное выражение выпол-
няется.
11-2-14. а) Найдите \Н° и At/0 при 25° С для реакции
H2S (г)+3/2О2 (г)—>Н2О (r) + SO2 (г).
б) Найдите АД° при 1000° К. в) Имеете ли Вы доста-
точное количество сведений для того, чтобы найти
МГ при 2000° К? Объясните.
II-2-15. Для реакции ЗА2 (г, 1 атм) = 2Аз (г, 1 атм) АД°30о
равна —35 ккал. Используя этот факт и данные таб-
Первый закон термодинамики и термохимия
31
лицы, приведенной ниже, выведите основное выраже-
ние для зависимости стандартной энтальпии реакции
от температуры в виде ДА/° = А + ВТ -j- СТ^ -j- DjT,
действительное в интервале температур от 300 до
500° К. Оцените численно все постоянные.
С°р = а + ЬТ + c/Т2 (кал • моль-1 • °К-1)
а Ь-103 с-10-5
А2 (г) 2 2 4
Аз (г) 6 5,5 8
11-2-16.
11-2-17.
II-2-18.
11-2-19.
Найдите Д/7° при 1000° К для реакции 02(г)->20 (г)
Д//298 = И7,04 ккал; CP(O)=&/2R.
Выведите уравнение зависимости ДА/0 от температуры
для приведенной ниже реакции. (Конечное уравнение
должно содержать только Т и числа.)
А (тв) + 2В2 (г) # АВ4 (г) ДА/°оо = 500 ккал
СР (А, тв) = 5 + 3 • 10-37' (кал • моль-1 • °К-1) •
СР (В2, г) = 6 + 4 • 10-37 (кал • моль-1 • °К-1)
СР (АВ4, г) = 7 + 5 • 10-3Г (кал • моль-1 • °К-1)
Для гипотетической реакции 2А(г)->А2(г) ДСР =
= 1 -f- 2-10-3 У кал-°К-1 и Д//298 = —5 ккал. Опреде-
лите для этой реакции температуру, при которой
ДА/0 ±= о при постоянном давлении.
Определите максимально возможную температуру про-
дуктов сгорания 2 объемных частей На (г) и 5 объем-
ных частей воздуха [20 об.% О2 (г) и 80 об.% N2 (г)],
если температура зажигания равна 25° С. Какое за-
ключение можно сделать о полученном выражении
для теплоемкости?
Ср — а + ЬТ (кал • моль-1 • °К—*)
а ь-ю-3
Н2 (г) 6,947 -0,2
О2 (г) 6,095 3,253
N2 (г) 6,449 1,413
Н2о (г) 7,219 2,347
32
Глава II
11-2-20.
На основе приведенных ниже термодинамических дан-
ных [18] оцените энтальпию сгорания /\Нп трнэтилен-
диамипа (тв):
СН2 СН2 СН2
СН2 СН2 СН2
Продукты сгорания — СО2 (г), Н2О (ж) и N2 (г).
а) Энергия связи С—С* 83,1
б) Энергия связи Н—II 104,2
в) Энергия связи С—Н 98,8
г) \H°f СО2 (г) -94,0518
д) MI°f Н2О (ж) —68,3174
е) СН3—СН3 (г) -20,236
ж) Д//С°г (CH3)3N (г) -583,7
з) ДЯсубл N(CH2CH2)3N 14,8
* Все величины даны в ккал«моль
11-2-21.
11-2-22.
Установите, будет ли выражение dz = ху dx + у х2 dy
полным дифференциалом. Если будет, найдите функ-
цию, от которой взят этот дифференциал. Если нет,
найдите два значения dz, полученные двумя различ-
ными путями интегрирования между одними и теми
же точками.
Пусть dz = xy(dx 4- dy).
а) Будет ли dz полным дифференциалом? б) Вычис-
(1,2)
лите J dz, проводя интегрирование двумя различ-
(0, 0)
ними путями от начала координат до точки х— 1,
У = 2.
11-3-1.
РАЗДЕЛ 11-3
а) Для газа_Ван-дер-Ваальса_(<Э(7/дЙ) т == а/Е2. ВьЬ
разите (dZVdV)— через a, R и V для газа, у которого
Су = 3/2R. б) Известно, что газ, описанный в пункте
Первый закон термодинамики и термохимия
33
I1-3-2.
I1-3-3.
11-3-4.
11-3-5.
11-3-6.
11-3-7.
(а), ксенон. 1 моль ксенона адиабатически расши-
ряется в вакуум от начального объема 1 л до конеч-
ного объема 2 л. Для ксенона а = 4,19 л2-атм-моль-2.
Вычислите изменение температуры газа при расши-
рении.
Студент сделал следующий ошибочный вывод в лабо-
раторном журнале по калориметрии в бомбе: «АД =
= АД + РАУ. Поскольку в калориметрической бомбе
процессы идут при постоянном объеме, то AV = 0 и
AL7 = АД.» Объясните, почему этот вывод неправиль-
ный.
Удельная теплоемкость С = dqldT обычно измеряется
при постоянном давлении или при постоянном объеме,
однако могут быть постоянными и другие переменные.
Выразите Сн (при постоянной энтальпии) через неко-
торые (или все) величины: Р, Т, V, Ср, (dV/dT)p и
(д]//дР)Т- Примите, что система закрыта, гомогенна,
имеет только две степени свободы (в данном случае Т
и Н) и не производит никакой иной работы, кроме
работы Р—V.
Докажите, что если (dU/dV)T — 0, то и (dU/dP)T =
= 0.
Докажите, что не обязательно (дН/дУ)т — 0, если
(dU/dV)T = 0.
Из формулы
**jt = с7[7'(_дг)р_,/]
видно, что математическое условие для температуры
инверсии Т{ следующее:
г‘(4г)Р-1/=0-
Это выражение можно переписать в приведенных пе-
ременных л = Р/РКр, Ф = V/VKp и 0 = Т/Тнр. В этом
случае условие инверсии будет иметь вид Qi(d<j>/dQ)n—
— ф = 0. Примените последнее выражение для вывода
приведенного уравнения Ван-дер-Ваальса
(л+ 3/^>2)(3^>- 1) = 80
и покажите, что
д _ 3(30— l)g 9 (20 — 1)
402 ИЛ/
Газ подчиняется уравнению состояния Р(Г— nb)=*a
=> nRT\ (dU/dV)T — 0. Выведите выражения, вклю-
чающие только постоянные (такие, как b или /?) и
2 Зак. 1360
34
Г лава 11
легко измеримые физические параметры (такие, как
Р или V, п, Т, СР и Су) для:
а) коэффициента термического расширения данного
газа а
1 (dV\ .
а V \ дТ )р'
б) работы, выполняемой газом при обратимом изо-
термическом расширении от У^до Vf,
в) функции переменных Т и V для обратимого адиа-
батического расширения, ^аналогичной формуле для
идеального газа Ti/Тг = (V^/Ki)7'1, где у = CP]CV.
Примите, что Ср и Су постоянны;
г) коэффициента Джоуля — Томсона
Глава III
второй закон термодинамики
РАЗДЕЛ 111-1
111-1-1. Для какого из следующих случаев AS — \Н/Т:
а) процесс, при котором Апг = 0;
б) процесс, при котором АСР = 0;
в) процесс при постоянном давлении;
г) адиабатический процесс;
д) изотермический обратимый фазовый переход?
III-1-2. Мольная теплоемкость (кал-град-1-моль-1) некото-
рого металла при 20° К равна b. С помощью какого
из приведенных ниже уравнений можно наилучшим
образом выразить абсолютную энтропию этого ме-
талла при 20° К?
„ г С DdT 20
о
б) 5П</7’ = -|т’3==-|(20)3;
о о
в) графическое интегрирование СР/Т по Г;
т
г) (20)~3 j bT2dT = b/3‘,
о
д) 6(20-0);
е) 1/6(20 — 0)?
III-1-3. Определите AS для изобарического нагревания 1 моля
азота от 300 до 1000° К. СР = 6,4492 + 1,4125-1 О*3 Т—
-0,807-10’7 Р.
111-1-4. 200 г олова [теплоемкость 6,1 кал-(г-атом)-1] с исход-
ной температурой 100° С и 100 г воды (теплоемкость
18 кал-моль-1) с исходной температурой 25° С погру-
жены вместе в калориметр. Приняв, что теплоемкость
постоянна и что тепло не было потеряно или получено
от окружающей среды или калориметра, найдите
а) конечную температуру системы, б) изменение эн-
тропии для олова, для воды и для олова и воды
вместе.
2*
36
Глава III
111-1-5. Вычислите максимальный теоретический коэффициент
полезного действия обратимой тепловой машины, ра-
ботающей между 25 и 100° К-
III-1-6. Коэффициент полезного действия цикла холодильной
установки
„ _ <71 ^1
- w Г2 - П ’
где Г] и Т2— температуры холодильных камер и ок-
ружающей среды соответственно, q\ — теплота, отво-
димая от холодильных камер, w — потребляемая ра-
бота. а) Определите максимальную величину со для
холодильной установки, которая работает между 25
и —5° С. б) Вычислите минимальное количество
работы, которую необходимо затратить для того,
чтобы передать одну калорию от холодильной камеры
при —5° С в окружающую среду с температу-
рой 25° С.
III-1-7. Тепловой насос является в сущности обратным холо-
дильником, т. е. он использует тепло окружающей
среды при низкой температуре Т\ на нагревание си-
стемы при высокой температуре (перекачивает тепло).
Таким образом, этот тепловой насос может использо-
ваться для обогрева помещений путем передачи тепла
от холодного открытого воздуха к теплому внутрен-
нему помещению. Преимущество этого метода перед
обычным методом нагревания состоит в том, что ма-
ксимальный коэффициент полезного действия холо-
дильника намного больше, чем в случае обычных ме-
тодов нагревания. Пусть коэффициент полезного
действия теплового насоса равен
где </1 — количество тепла, передающегося от более
низкой температуры. Рассчитайте q2]w — отношение
полученного тепла при высокой температуре к затра-
ченной работе.
III-1-8. 2 моля идеального одноатомного газа при начальном
давлении 1 атм и 300° К были проведены через сле-
дующий цикл, все стадии которого обратимы: изотер-
мическое сжатие до 2 атм (I); изобарическое нагрева-
ние до 400° К (П), возвращение в начальное состоя-
ние по пути Р — а + ЬТ (а и b — постоянные) (III).
Изобразите цикл на диаграмме Р — Т и вычислите
At/ и AS рабочего тела для каждой стадии цикла.
Второй закон термодинамики
37
III-1-9. Определите AS для смешения 1 моля азота с 3 мо-
лями кислорода при 25° С и общем конечном давле-
нии 1 атм. Начальное давление каждого газа 1 атм.
III-1-10. Какое из следующих утверждений справедливо для
идеального газа (или реального газа при отсутствии
давления): a) f = Р\ б) у = 1; в) fjP = 0; г) ЦР —
= f/Q = оо; д) у = 0?
f — летучесть, Р — давление, у — коэффициент летуче-
сти.
III-1-1I. Оцепите 1п у для _газа, который подчиняется уравне-
нию состояния Р (У— b)= RT.
III-1-12. Нормальная температура кипения бензола равна
80,1°С. Оцените мольную теплоту испарения бензола
при этой температуре.
РАЗДЕЛ II1-2
III-2-1. Процесс 2Н2 (г, 1 атм, 25°С)+О2 (г, 1 атм, 25° С)
—>2Н2О (ж, 1 атм, 25° С) обычно относят к самопро-
извольным (термодинамически возможным) процес-
сам. Возможно ли проведение этого процесса при сле-
дующих условиях: а) в изолированной системе; б) при
постоянных температуре и давлении; в) при постоян-
ных температуре и объеме? Объясните.
II1-2-2. Пусть новая термодинамическая функция ф опреде-
ляется уравнением
ф==Р4- RT,
где F, R и Т имеют свои обычные значения. Дока-
жите, что Лфу, т может быть использована в качестве
основного критерия равновесия, т. е. что Лфу,?- —0
для обратимого процесса и Афу,?- < 0 для самопро-
извольного процесса.
1II-2-3. Напишите математическое выражение изменения эн-
тропии для рабочего тела, участвующего в каждом из
следующих процессов: а) свободное расширение
1 моля идеального газа от объема У) до объема У2;
б) обратимый изотермический фазовый переход; в) об-
ратимое адиабатическое расширение 1 моля идеаль-
ного газа от объема У] до объема У2; г) обратимое
изотермическое расширение 1 моля идеального газа
от объема У] до объема У2.
II1-2-4. Для некоторого газа справедливы следующие соотно-
шения: Cv — а ЬТ -|- сТ2 и P(V — В)= &Т. Выве-
дите выражение для изменения энтропии 1 моля этого
38
Г лава III
111-2-5.
111-2-6.
111-2-7.
111-2-8.
111-2-9.
111-2-10.
газа_при переходе от состояния Г,-, F, к состоянию
Tf,
Определите AS, .АН и AL7 процесса 1 моль Н2О
(ж, 20° С, 1 атм) -> 1_моль Н2О (г, 250° С, 1 атм), имея
следующие данные: СР(ж) 18 кал-град'1 моль-1; СР(г)
8,6 кал-град-1-моль-1. ДЯ испарения воды при 100° С
и 1 атм составляет 9720 кал-моль-1.
а) Найдите ДЯ° при 1000° К для реакции NaCl (тв)—►
—>Na(г) + У2С12 (г); &Н°2д8 — 124,1 ккал и ДСР —
= — 1,585 — 3,82 • 10-3Т — 0,34 • ЮТ-2.
б) Выполняется ли соотношение AS0 = АН°/Т для
(1) приведенной реакции при 25° С; (2) реакции
NaCl (тв)—*NaCl (г) при 25°С; (3) реакции
NaCl (ж)—* NaCl (г) при 1413° С (температура кипе-
ния NaCl)? Объясните каждый случай, предполагая,
что газы идеальные.
ДЯ для процесса _плавления воды при 0° С равна
1436 кал-моль-1. СР для твердой и жидкой воды со-
ставляет соответственно 8,9 и 18,0 кал-град-1-моль-1.
Определите а) ДЯ, б) AS и в) ДС при постоянном
давлении 1 атм для следующего процесса:
Н2О (тв, — 10°С)->Н2О (ж, -10°С).
Для некоторого процесса ДСг98 = В кал-моль-1.
ДЯ° = D + аТ + ЬТ2 сТ3. Выведите выражение для
ДО0 как функции температуры.
Изобразите схематически на диаграмме Т— S сле-
дующий цикл: стадия А — изотермическое расшире-
ние (при Ti) от Pi до Р2; стадия Б — изохорическое
нагревание от Р2, 7\ до /У, Т3, стадия В — изобариче-
ское охлаждение от Р3, Т3 до Pi, Tt.
Цикл Отто состоит из следующих (см. рисунок) четы-
рех стадий; изоэнтропийное сжатие (I); изохорическое
нагревание (II); изоэнтропийное расширение (III);
изохорическое выделение тепла (IV). Покажите, что
коэффициент полезного действия цикла Отто, в кото-
ром рабочим телом является идеальный газ, может
быть представлен в виде
Т]== 1 — г<‘-4
где у= CpjCy и г—степень сжатия (отношение на-
чального объема к конечному объему для процесса
Второй закон терлюдиналшки
39
сжатия). Как влияет увеличение степени сжатия на
коэффициент полезного действия цикла?
II1-2-12.
II1-2-13.
V
Процесс А: 1 моль одноатомного идеального газа рас-
ширяется изотермически в вакуум при 300° К от на-
чального объема 10 л до конечного объема 20 л.
Процесс Б: 1 моль этого газа расширяется изотерми-
чески и обратимо при 300° К от объема 10 л до
объема 20 л. а) Для каждого процесса рассчитайте q,
w, MJ, \П, &F и AG. б) Опишите процесс, благодаря
которому газ мог бы возвратиться в исходное состоя-
ние после каждого из процессов А и Б. Покажите,
как окружающая среда может быть возвращена в ис-
ходное состояние после одного из процессов и по-
чему она не может быть возвращена в исходное со-
стояние после другого процесса. _
1 моль идеального одноатомного газа (Cv = 3/sR)
проведен через следующий обратимый цикл (про-
цесс Л): газ сжимается адиабатически от давления/3!
и температуры Т\ до давления Р2 и температуры Т^Ц);
расширяется изотермически от давления Р2 и темпе-
ратуры Т2 до начального давления Pi (II); охлаж-
дается изобарически (постоянное Р) до начальной
температуры 1\ (III), а) Выразите Р2 через Pi, Tlt Т2
и (если необходимо) через R. б) Выразите q, w, MJ
и AS газа для каждой из трех стадий (I, II, III) и
всего процесса через любые или все величины Pi, Ть
Т2 или R. В процессе Б первая и третья стадии такие
же, как и в процессе А, но вторая стадия проходит
необратимо, позволяя газу расширяться в вакуум и
достичь тех же конечных значений Pi и Т\. Опреде-
лите q, w, MJ и AS газа для второй стадйй й всего
процесса Б.
1 г жидкой воды при 100° С и исходном давлении
1 атм ограничен объемом, в котором отсутствует пар.
111-2-11.
40
Глава 111
Затем был открыт клапан и вода испарилась в эва-
куированное пространство, причем конечное давление
равно 0,10 атм. Вся аппаратура находилась в тепло-
вом резервуаре при 100°С. \Н испарения воды при
100° С составляет 540 кал •г-1. Примите, что пар яв-
ляется идеальным газом и что объем жидкости не-
значителен в сравнении с объемом пара. Найдите q
и AS для а) воды, б) резервуара и в) всей системы,
г) Опишите обратимый процесс, в котором вода мо-
жет быть приведена к тому же конечному состоянию.
Покажите, почему конечное состояние системы после
обратимого процесса будет отличаться от ее состояния
после действительно проведенного процесса.
III-2-14. а) Покажите, что (dV/dS)P — (dT/dP)s.
б) Выразите (dV/dS)P для идеального газа через Р, Т,
СР и универсальные постоянные.
III-2-15. Термодинамическое уравнение состояния (dU/dV)r =
= T(dP/dT)v — Р применимо ко всем веществам. Вы-
ведите его, используя первый и второй законы термо-
динамики, а также необходимые определения и мате-
матические принципы.
III-2-16. Исходя только из определений и математических прин-
ципов, выведите формулу (дН/дР)т — V — T (dV/dT)P.
III-2-17. Оцените AS для обратимого изотермического расши-
рения 1 моля газа от объема 16 до объема V? при
температуре Т. Газ подчиняется уравнению состояния
PV = RT +А. Можно принять, что для этого процесса
AL7 = 0.
II1-2-18.
Покажите, что
( dS\ _ nRV1
\дР)р~~ 2п2а-РГ2
для газа, подчиняющегося уравнению состояния
PV = nRT~-^-.
III-2-19. Оцените AG и АГ для изотермического обратимого
расширения 1 моля газа от объема Vi до объема V2
при температуре Т. Газ подчиняется уравнению со-
стояния PV = RT (1 4- В/Г).
II1-2-20. Покажите, что для газа Ван-дер-Ваальса
/ дт \
\<Э7 /у
III-2-21. а) Покажите, что для газа Ван-дер-Ваальса
ldv\ -Cv(V-b)
I дТ )s RT
Второй закон термодинамики
41
б) Используя полученный результат, выведите урав- нение, связывающее исходную и конечную темпера- туры, исходный и конечный объемы для обратимого адиабатического расширения газа_ Ван-дер-Ваальса. Примите, что Cv не зависит от Т и V.
II1-2-22. Уравнение состояния Дитеричи имеет вид Р = —В-— g—a/RTV V-b Покажите, что для газа Дитеричи 1 dU\ ae~a!IiTV \<эг/г (v-b)v'
II1-2-23. Оцените AG для обратимого изотермического сжатия 1 моля газа от Pi до Рч\ газ подчиняется уравнению состояния + -^ (тУ(»[1 где Ркр и Гкр — критические постоянные.
II1-2-24. Уравнение состояния Бертло имеет вид р РТ а V-b TV2 ’ где а и b — характеристические постоянные газа. Для газа, подчиняющегося этому уравнению, покажите, что а) h-=2—; \dvlr V-b V2T2 б) 1 dU\ — 2а • ' \ dV /т TV2 ’ В) \ dV )т T2V2 \дТ Js Т \ V-b T2V2) ’ А к дТ )р [- RT/(V — &)2] + (2а/ТГ3) ’ е1С -С = -Г{[^/(Г-&)] + [а/(Г~Йг)]}г ' р v - RT/(V - b)2 + [2(j/(7V3)] ж) Для особого случая, когда а = 0 и Cv не зависит от температуры, выведите уравнение, которое свяжет в обратимом адиабатическом расширении газа Бертло
42
Г лава III
начальный и конечный объемы, начальную и конеч-
ную температуры. Покажите, какой результат сле-
дует из одного или большего числа уравнений, при-
веденных выше (а — е).
III-2-25. Для N2O при 0° С коэффициент летучести (активно-
сти) y=f/P составляет 0,9847 при 3 атм и 0,6961 при
60 атм [19]. Оцените AG (кал) для обратимого изо-
термического сжатия 1 моля N2O при 0° С от 3 до
60 атм. а) Примите, что газ идеальный; б) исполь-
зуйте приведенные данные по летучести.
II1-2-26. Некоторый газ подчиняется уравнению состояния
PV = RT + аР'1г -4- ЬР-}~ сР\ Выведите уравнение для
коэффициента летучести этого газа а при постоянной
температуре Т.
II1-2-27. Некоторый газ подчиняется уравнению состояния
V =-^(1 + АР + ВР2),
где А и В — функции только температуры. Опреде-
лите коэффициент летучести y=f/P газа, испвльзуя
некоторые или все величины Р, А, В и универсальные
постоянные
HI-2-28. При давлении 10,3084 атм и —15° С мольный объем
N2O равен 1,8566 л [19]. Определите коэффициент ле-
тучести y=f/P для N2O но этим данным.
II1-2-29. Пусть смесь двух газов X и Y подчиняется уравне-
нию состояния
= (пх + пу) (1 + РР) + a (nxny)'h Р,
где аир зависят от Т, но не зависят от Р, пх или пу.
а) Определите парциальный мольный объем Vx, ис-
пользуя Р, Т, а, р, пх, пу и R. б) Найдите
р2
AGX = j VxdP
р,
для изотермического расширения смеси газов от Pi
до Р2.
II1-2-30. Объем жидкой воды V при t°C и 1 атм свя-
зан с объемом Vo при 0° С и 1 атм следующим со-
отношением: V = Vo (1 — 6,427-10-5i + 8,5053- 10-®i2—
— 6,7900-10-8/3). Это выражение справедливо в ин-
тервале температур от 0 до 33° С. Сжимаемость воды
вблизи 0°С и 1 атм равна 5,25-10-5 атм-1. Найдите
внутреннее давление [dCZ/dV)?-] для жидкой воды
Второй закон термодинамики
43
111-3-1.
111-3-2.
111-3-3.
111-3-4.
II1-3-5.
1П-3-6.
при 1°С и 1 атм. Покажите и объясните заметную
разницу между полученной величиной и внутренним
давлением большинства жидкостей.
РАЗДЕЛ III-3
Является ли орбитальное движение Земли вокруг
Солнца случаем вечного движения и, следовательно,
нарушением законов термодинамики? Объясните.
Является ли непрерывное хаотическое движение мо-
лекул газа случаем вечного движения и, следова-
тельно, нарушением законов термодинамики? Объяс-
ните.
а) Является ли процесс в опыте Джоуля—Томсона
обратимым? Возможно ли возвратить газ в его ис-
ходное состояние тем же путем? б) Остается ли по-
стоянной энтропия газа в опыте Джоуля — Томсона?
Если нет, выразите (dS/dP)H через некоторые или
все переменные Р, V, Т, СР и Cv.
Два тела с различными температурами соединены
проволокой с бесконечно малой теплопроводностью
так, что тепло бесконечно медленно переходит от горя-
чего к холодному телу до тех пор, пока их темпера-
туры не сравнялись. Обратим ли этот процесс? Кратко
поясните.
Человек, имеющий поверхностное представление о
термодинамике, спрашивает о следующей трудно-
сти: «Для реакции 2Н2 + О2—* 2НгО ДЗ, как можно
видеть из таблиц физико-химических величин, отри-
цательна. Энтропия должна увеличиваться в каждом
процессе. Можно ли сделать вывод, что эта реакция
невозможна?» Объясните, что неправильно в этом
предположении и что соответствует правильному ут-
верждению; укажите особые условия, если они
имеются, при которых становятся правильными пер-
воначальное предположение и заключение.
Человек, имеющий поверхностное представление о
термодинамике, спрашивает о следующей трудности:
«Я думаю, что каждый самопроизвольный процесс со-
провождается увеличением энтропии, но, согласно
расчету, изменение энтропии при замерзании 1 моля
переохлажденной воды при —5° С, которое я интуи-
тивно считаю самопроизвольным процессом, равно
— 5,04 кал-0К-1 • моль-1. Почему тогда изменение энтро-
пии не положительная величина?» Объясните, что не-
правильно в этом предположении, а что соответствует
правильному утверждению; укажите особые условия,
44
A
Глава III
I11-3-7.
I11-3-8.
111-3-9.
111-3-10.
111-3-11.
II1-3-12.
если они имеются, благодаря которым исходное пред-
положение и заключение станут правильными.
Опишите условия, при которых приведенные ниже
утверждения справедливы, и покажите (в каждом
случае), каким образом они могут быть видоизмене-
ны для того, чтобы получить более общее и справед-
ливое утверждение.
a) dG = -SdT + VdP.
б) Для процесса, в котором жидкость замерзает,
AS = АН IT.
в) Две фазы (а и р) находятся в равновесии: а,а —
= агр (а,-—активность компонента t).
Для адиабатического процесса <?=0 (по определе-
нию), поэтому qlT=QIT—Q. Почему в этом случае
происходит изменение энтропии (AS > 0) при адиа-
батическом расширении в вакуум?
Твердое тело имеет температуру плавления Гпл, при
которой оно превращается в жидкость; при этом не-
обратимо переносится некоторое количество тепла q.
Правильно ли предположение, что для этого процесса
А5=<7/7’пл? Если это предположение правильное, то
почему и на каком основании был отвергнут тот факт,
что процесс необратим? Если предположение ошибоч-
но, то как можно получить правильное выражение
для AS?
Почему при использовании энтропии в качестве кри-
терия самопроизвольности процесса необходимо пред-
положение, ЧТО А50бщ = А5СИСТемы — AS0Kp. среды, в в
случае свободной энергии Гиббса рассматривают
только
Абсистемы (но не АбОбЩ=Абсистемы — Абокр. среды).
Функции F и G полезны как критерии самопроизволь-
ности процессов, потому что
dFViT = dq — Т dS и dGP,T = dq — Т dS.
Что означает разность (dq — Т dS) в этих выраже-
ниях при указанных ограничениях? Почему нельзя
определить новую функцию X как dX—dq— Т dS без
ограничений относительно Р, V или Г?
а) Приведенный ниже вывод применим только к изо-
термическим процессам и содержит некоторые ошиб-
ки. Отметив эти ошибки, опишите особые условия
(если они имеются), при которых каждое из выраже-
ний будет справедливо.
AS = q/Г; (1) XG — XH — TXS; (3)
^H=q- (2) AG = q-г(^-) = 0. (4)
Второй закон термодинамики
45
б) При соответствующем пересмотре приведенных выше аргументов получим bG = q'- q", где q' и q" — количества тепла, поглощенные систе- мой при переходе от начального к конечному состоя- нию двумя различными путями соответственно. Опи- шите каждый из этих путей.
111-3-13. Используя уравнения dU=TdS — Р dV и Я=(/-|- PV, докажите, что ( dU \ р pl дТ \ \dS)p \dP)s’
I1I-3-14. Докажите, что ~СР \dUhi Г[Ср(Рр-1) + РУа(1-Га)] ’ где а "" V Ur Д и Р V дР ‘
П1-3-15. Докажите, что а) (Я, — 4. / dS\ С.. а б) aTV + 0 ’
II1-3-16. Докажите справедливость каждого из следующих со- отношений: а> 1 dS )р Ср \дТ }р’
111-3-17. Покажите, что для газа, подчиняющегося уравнению состояния ру = ftT — ВР + APT, где Г —мольный объем, А и В — характеристические постоянные газа, сР-ск = /?(1 +4г)2-
111-3-18. Два образца (1 и 2), содержащие по одному молю одинакового идеального газа, занимают равные объе- мы и имеют начальные температуры Ту и Т2 соответ- ственно (Т2 > Ту). Мольная теплоемкость не за-
46
Г лава 111
висит от температуры. Два резервуара, в которых на-
ходились эти газы, приведены в соприкосновение че-
рез газонепроницаемую, но теплопроводящую стенку
до тех пор, пока газы не будут иметь одинаковую
температуру Г3 (объемы газов остались постоянны-
ми). Потери тепла не происходило. Резервуары име-
ли незначительную теплоемкость. Назовем описанный
процесс процессом А.
а) Найдите Т3, используя приведенные в условии ве-
личины.
б) Приведите пример обратимого процесса (про-
цесс Б), при котором газы могут перейти из началь-
ного состояния в то же конечное состояние. (Имеют-
ся по крайней мере два пути, когда температура газа
изменяется обратимо.)
в) Найдите AS для каждого газа, окружающей сре-
ды и общее изменение в каждой стадии процесса Б,
а также для всего процесса.
г) Найдите AS для каждого газа, окружающей сре-
ды и общее изменение в процессе А.
III-3-19. Газ подчиняется уравнению состояния
PV . гф
nRT ~ 1 VT '
а) Покажите, что (при н=1 моль)
\ dV)T ~V' \dv)T~'^2' \ dV )т V2 •
Два одинаковых сосуда (объем каждого сосуда V)
соединены трубкой с запорным краном. Сосуды по-
гружены в термостат, наполненный охладительной
смесью, например смесью воды и льда. Термостат
представлял собой совершенный термический изоля-
тор. Сначала один сосуд был наполнен газом, а дру-
гой был пустой. Запорный кран был открыт на неко-
торое время до установления равновесия. Назовем
описанный процесс процессом А.
б) Приведите пример обратимого процесса (можно
использовать другую аппаратуру), при котором газ
может быть переведен из того же начального в такое
же конечное состояние (процесс Б).
в) Для каждого из процессов найдите q, A.U, w и AS
газа, окружающей среды (включая сосуды, термостат
и любую другую аппаратуру, которая была введена в
процесс Б) и процесса в целом.
III-3-20. Газ-Подчиняется уравнению состояния (Ра/32) X
Х(Г — b)=RT, где а, b и R— постоянные. Выразите
Второй закон термодинамики
47
II1-3-21.
II1-3-22.
II1-3-23.
G — G°, S — S° и II — Н° для этого газа через Р, Т,
а, b и R. G° определяется как lim {G — RT In Р).
р->о
а) Покажите, что для газа Ван-дер-Ваальса
/ dS \ __ nR .
\ dV Jt V — nb ’
I OS \ _ V — nb
\ dP )T (2na/RV3) (И - nb}2 - I ’
/ dU \ _ n2a
V 'JF/t- ~ V2 ’
/ dH \ _ V — nb _1_ I/.
\ dP )T~ (2na/RTV3) (V — nb}2 — 1 + V ’
/ dU \ _ (V - nb}2
\dP )T~ (2/V) (V - nb}2 - (V2RT/na} ’
б ) Оцените AG, AW, &F, AG и AS для изотермическо-
го расширения, в) Выведите выражения для G, f (ле-
тучести) и y—f/P как функций Р или V при постоян-
ной температуре Т.
Два одинаковых сосуда (объем каждого сосуда V)
соединены трубкой с запорным крапом. Материал, из
которого собрана аппаратура, является совершенным
термоизолятором. Сначала п молей одноатомного
газа Ван-дер-Ваальса были помещены в один из со-
судов при температуре То, а другой сосуд оставался
пустым, затем запорный кран был открыт до уста-
новления равновесия. Примите, что газ имел тепло-
емкость (Су=3/2Р), как в случае идеального газа.
Определите q, w, \U, АГ и AS через п, V, То, по-
стоянные Ван-дер-Ваальса а и b и универсальные по-
стоянные.
Выразите для газа Ван-дер-Ваальса
д И /у
через Т, V, R, а, b и Су.
Полученные результаты могут быть использованы
для дальнейшего решения задачи. 1 моль одноатом-
ного газа Ван-дер-Ваальса с исходной температурой
Г] занимает объем Уь Газ может расширяться адиа-
батически а) в эвакуированное пространство, б) об-
ратимо, так что его конечный объем в каждом случае
будет равен У2. Выразите Т2 через Т\, У], У2, R, а и
b для каждого из процессов, в) Найдите Т2 в каждом
48
Глава III
111-3-24.
111-3-25.
111-3-26.
111-3-27.
из процессов, если 7’1 = 300° К, У| = 1 л, Г2=100 л,
а—10 л2-атм-моль'2 и Ь=0.
Для некоторого вещества (дН/дР)г = 0 и (dU/dV)T = 0.
а) Покажите, что это вещество является идеальным
газом (т. е. имеет уравнение состояния PV — kT, где
k — постоянная), б) Определите, достаточно ли одного
из этих уравнений для того, чтобы установить, являет-
ся ли это вещество идеальным газом.
Некоторый гипотетический газ при низком давлении
подчиняется приближенному уравнению состояния
У-гТ/Р2, где V — мольный объем, а) Выразите
мольную свободную энергию G этого газа как функ-
цию Р при фиксированной Т при низком давлении,
б) Определите стандартную мольную свободную энер-
гию G°, летучесть f и коэффициент летучести y—f/P
(так что lim у=1) по пути, аналогичному используе-
Р->0
мому для реального газа. Выведите формулу, по ко-
торой у может быть рассчитано из уравнения со-
стояния.
Мольная намагниченность некоторого_ воображаемого
вещества передается уравнением I = Ci5i?/7’2, где С\ —
постоянная, 3$ — магнитное поле. Покажите, что для
этого вещества
/ дТ \ 2Ci%
Г2 (Со + ЗС^/Т3) ’
где Со — мольная теплоемкость при постоянном да-
влении и магнитном поле, равном нулю.
Полоска резины может быть использована как термо-
динамический аналог некоторого газа. Вытягивание
резины соответствует сжатию газа. Работу, произво-
димую над резиной, можно представить как —dw —
=f dl, где f — сила натяжения при сжатии резины и
I — длина полоски, а) Определите по аналогии
с Гельмгольцем и Гиббсом свободную энергию (F и
G) полоски резины, б) Покажите, что для резины при
постоянной температуре Т —dw dF и что для про-
цесса при постоянных Т и f —dwnoneav^dG. Сфор-
мулируйте определение аусолезн- Укажите основной
термодинамический принцип, с помощью которого Вы
начали доказательство, в) Выведите уравнение для
(dU/д1)т через некоторые или все величины Т, f, I и
их производные, г) Для «идеальной» резины
(dU/dl)r = 0. Покажите, что это выражение может
быть выведено из «уравнения состояния» (связь ме-
жду f, I, Т) для идеальной резины.
Глава IV
третий закон термодинамики
IV-1-1. РАЗДЕЛ IV-1 Теплоемкость металлического урана равна 0,727
IV-1-2. кал-град-1 • моль-1 при 20° К [20]. Рассчитайте стандарт- ную абсолютную энтропию (кал-°К-1) 1 моля этого вещества при 20° К. Оцените энтропию NO при температуре абсолютного нуля.
IV-2-1. РАЗДЕЛ IV-2 Объясните следующие утверждения в статистическом смысле:
1V-2-2. а) изменение энтропии химической реакции обычно приближается к пулю с приближением температуры к 0° К; б) реакция 2С (графит) + О2 (крист.) —>2СО (крист.) является исключением из этого правила. Теплоемкость СР (кал-моль-1 •°К-1) некоторого веще- ства имеет следующие значения: СР (тв) 4,0- 10~5Т’3 0<7’<50°К Ср (тв) 5,00 50 < Т <150° К Ср (ж) 6,00 150 < Г < 400° К
IV-2-3. Температура плавления 150° К; АЯ° для плавления 300 кал-моль-1, а) Вычислите по третьему закону термодинамики мольную энтропию этого вещества в жидком состоянии при 300° К. б) Рассчитайте моль- ную энтальпию плавления, энтропию плавления и сво- бодную энергию плавления Гиббса при 100° К. Какой знак будет иметь AG? На основе следующих данных [21] с помощью графи- ческого интегрирования определите мольную энтро- пию газообразной окиси этилена при температуре ки- пения. Ниже 15° К используйте закон Дебая, по ко- торому теплоемкость пропорциональна Г3.
50
Глава IV
т. °к Ср. кал-моль*"1-°К 1 г, °к кал Ср. моль“1-°К“1 Т, °К CpL кал моль‘-1-°К—1
15 0,60 90 10,76 180 19,55
20 1,43 100 11,43 190 19,49
25 2,31 ПО 12,06 200 19,47
30 3,33 120 12,77 210 19,50
35 4,26 130 13,58 220 19,56
40 5,21 140 14,47 230 19,67
45 6,02 150 15,39 240 19,82
50 6,77 160 16,30 250 20,00
60 8,16 170,65 16,35 260 20,21
70 9,22 160,65 19,80 270 20,46
80 10,06 170 19,66 280 20,67
285 20,77
Температура плавления 160,65° К
Температура кипения 283,66° К
Энтальпия плавления 1236,4 кал-моль-1
Энтальпия парообразования 6101 кал-моль-1 при
1 атм
1V-2-4. Вычислите стандартную мольную энтропию газооб-
разной платины при 1000° К. Предположите, что Pt
является одноатомным идеальным газом, и не прини-
майте во внимание электронное возбуждение ниже
1000° К; используйте следующие данные:
Т, °К ——, кал • моль-1 • °К-1
298,15 —45,96
1000 —49,17
1V-2-5. При измерении константы равновесия реакции
Н20(ж) + СО(г)=рь НСООН(ж) найдено, что стан-
дартная свободная энергия образования муравьи-
ной кислоты из простых веществ равна —85200
кал-моль-1 при 298° К [22], а стандартная свободная
энергия образования муравьиной кислоты из простых
веществ при 298° К, определенная из измерения теп-
лоемкостей, равна —85370 кал-моль-1 [23]. Оба эти
результата можно считать в пределах ошибки экспе-
римента тождественными. Какое значение имеет со-
гласие между двумя экспериментальными результа-
тами для обоснования третьего закона термодина-
мики?
Г лава V
ЖИДКОСТИ И СЖИЖЕНИЕ ГАЗОВ
РАЗДЕЛ V-1
V-1-1. Давление пара некоторой жидкости равно 2 мм рт. ст.
при 300° К и 100 мм рт. ст. при 400° К. Какое будет
давление при 500° К?
V-1-2. Оцените приближенно мольную энтальпию испарения
н-пентана. Его нормальная температура кипения рав-
на 36° С.
V-1-3. Вычислите давление пара чистой жидкости с молеку-
лярным весом 100, которая теряет 1,0000 г веса при
пробулькивании через нее 0,5000 моля N2npn 1,00 атм
и 20° С. Примите, что N2 полностью насыщается па-
ром.
V-1-4. Вязкость OF2 (ж) определена по методу Оствальда
[24]. При калибровке вискозиметра по воде при 20° С
было найдено, что необходимо 363,4 с для вытекания
воды между метками. Вязкость воды при 20° С
1,005 сп; плотность 0,9982 г-см-3. Время, необходимое
для вытекания 0Р2(ж) между метками при—145,8° С,
составило 67,6 с. Плотность 0Р2(ж) при этой тем-
пературе равна 1,523 г-см-3. Определите абсолютную
вязкость 0Р2(ж) при —145,8° С.
V-1-5. Стальной шарик с радиусом 1,00 мм и плотностью
7,87 г-см-3 падает с постоянной скоростью 10,0 см-с-1
в жидкости с плотностью 1,26 г-см-3. Вычислите вяз-
кость жидкости в сантипуазах. Ускорение силы тя-
жести 980,7 см-с-2; закон Стокса y = 2gr2X
X (Ртв Рж)/9т].
V-1-6. Как влияет удвоение площади поперечного сечения
капиллярной трубки на высоту поднятия жидкости
в капилляре?
V-1-7. В опыте по определению поверхностного натяжения
этилацетата методом капиллярного поднятия жидко-
сти студент откалибровал капилляр по бензолу и на-
блюдал высоту поднятия 2,71 см при 20,5° С и плот-
ности бензола 0,878 г-см-3; поверхностное натяжение
28,8 дин-см-1. Этилацетат с плотностью 0,900 г-см-3
поднялся па 2,18 см при той же температуре. Рас-
считайте а) радиус капилляра и б) поверхностное
натяжение при этой температуре. Какое предполо-
жение относительно краевого угла было сделано
в обоих расчетах?
52
Глава V
V-l-8. Из следующих данных для уксусной кислоты (моле- кулярный вес 60,1) определите постоянную k в урав- нении Рамзая — Шилдса и критическую температуру жидкости: t, °C 20,0 75 у, дин-см-1 27,4 22,3 рж, г-см~3 1,049 0,9892 Уравнение Рамзая — Шилдса имеет вид Y^) = k (^кР — t — 6)-
V-l-9. Данные по ортобарической плотности сложного этил- меркаптана приведены ниже. Его критическая тем- пература 225° С. Используя график, определите кри- тическую плотность dltp этого вещества (рПар—плот- ность насыщенного пара). /, °C 100,0 200,0 рж> г-см-3 0,74 0,53 Рпар. г-см-3 0,01 0,1
V-l-10. Для некоторого соединения (молекулярный вес 100) известны следующие данные (рпар — плотность насы- щенного пара): /, °C 0 20,0 40,0 60,0 80,0 100,0 105,0 Рпап, г-см~3 0,01 0,01 0,01 0,04 0,10 0,26 0,34 рж.г-см-3 1,35 1,29 1,23 1,14 1,02 0,80 0,70 Определите критические а) температуру, б) плот- ность и в) мольный объем. РАЗДЕЛ V-2
V-2-1. Скорость изменения давления пара с температурой дается уравнением Клапейрона: дР . дТ Т (7паР - Ёж) ’ где АЛ пар — мольная энтальпия испарения, Упар и Гж— мольные объемы пара и жидкости соответ- ственно. Часто встречается видоизменение этого урав- нения — уравнение Клапейрона — Клаузиуса: 1 dP А^пар Р dT RT1 ' ' 7 а) Покажите, что уравнение (2) может быть полу- чено из уравнения (1); укажите приближения, кото- рые следует сделать, б) Пусть Pi и Рг— давление пара жидкости при температуре Ti и Т% соответствен-
4*
Жидкости и сжижение газов
53
V-2-2.
V-2-3.
нсг_ Используя (2), определите Рг через Ръ Ть Т2,
Лйпар и R-, укажите дальнейшие приближения, кото-
рые необходимо сделать.
Выведите уравнение для зависимости давления пара
жидкости от температуры (аналогичное интегральной
форме уравнения Клапейрона — Клаузиуса), приняв,
что пар подчиняется уравнению состояния PV=
= RT + К, где К — постоянная. (Интегрирование
проводите по частям.)
Покажите, что зависимость давления пара от темпе-
ратуры приближенно может быть выражена форму-
лой
P = fc[l
ЛЯпар
1 / Д//пар 1 / Л^пар \3
г У \ RT / — ’б’ \ RT /
V-2-4.
V-2-5.
V-2-6.
если АЯпар не зависит от температуры.
Согласно некоторым справочным данным, нормаль-
ная температура кипения гликоля (молекулярный
вес 62,1) 197°С и энтальпия парообразования 191
кал •г-1. Определите температуру перегонки вещества
в вакууме под давлением в системе 30 мм рт. ст.
Объясните, почему вязкость жидкости быстро умень-
шается с повышением температуры.
В методе двойного капилляра поверхностное натяже-
ние определяется разностью высот Д/г, на которые
поднялась жидкость в обоих капиллярах, и разностью
между радиусами капилляров. Схема прибора дана
г t
на рисунке. Покажите, что поверхностное натяжение-
жидкости может быть вычислено по формуле
V = 1/2AA(!7^7?)pg;
Д/г = h\ — /г2.
V-2-7.
Получены следующие данные по зависимости поверх-
ностного натяжения бензола от температуры [25]:
t, °C 20,0
у, дни • см-1 28,88
32,5
27,30
41,5
26,08
54,8
24,28
54
Г лава V
V-2-8. 1, °C -у, дин • см-' р, г • см-3 Критическая температура бензола 561,6° С. Покажи- те, что эти данные подтверждают уравнение Блоха y=k(tl!P — t)n, и определите постоянные k и п. Из данных по зависимости поверхностного натяжения двуокиси серы от температуры [26] выбраны следую- щие: —20,3 —10 0,2 9,9 20 30 40 50 30,74 28,29 26,30 24,45 22,75 20,54 18,75 16,73 1,4846 1,4601 1,4350 1,4095 1,3831 1,3556 1,3264 1,2957
Покажите, что эти данные удовлетворяют уравнению Рамзая — Шилдса у(Л4/р)!'5=/г(/[ф— 6—t). Вычис- лите k И /кр-
V-2-9. * V п е/и2
о-Дихлорбензол .и-Дихлорбеизол п-Дихлорбензол 7,47 106 1,5518 1,5'570 2,86 104 1,52101 3,10 1,21
V-2-10.
V-2-1I.
е — диэлектрическая проницаемость, v — частота в
периодах в секунду при измерении в, п — показа-
тель преломления линии натрия с частотой 5,10-1014
пер-с-1, а) Электромагнитная теория света утверждает,
что п2 = в. Объясните противоречие между этим утвер-
ждением и данными, приведенными выше.
б) Какое значение б/и2 для .и-дихлорбензола можно
ожидать из сравнения с соответствующими величи-
нами для орто- и пара-соединений? Объясните.
Сероуглерод CS2, подобно углекислому газу, имеет
линейную молекулу. Он плавится при —109° С и ки-
пит при 46,3° С. Его диэлектрическая проницаемость
при 20° С для частоты 9-103 с-1 равна 2,647. Оцените
показатель преломления при 20° С в видимом или
инфракрасном излучении. Объясните.
Мольная поляризация некоторого полярного вещества
зависит от температуры и значительно отличается от
мольной рефракции. Объясните.
Глава VI
ТВЕРДЫЕ ТЕЛА
РАЗДЕЛ VI-1
VI-1-1. Сколько атомов О и • приходится на элементарную,
кубическую ячейку, показанную на рисунке?
V1-1-2. Индексы Вайса некоторой кристаллической грани
имеют значения ’/2, 2/з, °°- Какими будут соответ-
ствующие индексы Миллера?
VI-1-3. Какие индексы Вайса и индексы Миллера имеет кри-
сталлическая грань, показанная на рисунке.
V1-1-4. Рентгеновские исследования показали [27], что силил-
калия KSiHg (молекулярный вес 70,18) имеет кубиче-
скую структуру типа NaCl с атомами калия в поло-
жениях ООО, 44-0, 0 т? 4-, 4-0 4- и атомами крем-
£ £ £ it £ £
.56
Глава VI
V1-1-5.
VI-1-6.
V1-1-7.
V1-1-8.
Vl-1-9.
VI-1-10.
Vl-1-11,
ния в положениях 00-4, 4-00, OyO, Ребро
элементарной ячейки равно 7,15 А. Все атомы водо-
рода находятся в виде силил-аниона SiHJ" и не со-
здают напряжения в решетке, а) Представьте на
эскизе элементарную ячейку, показывающую относи-
тельные положения атомов калия и кремния, б) Рас-
считайте расстояние (А) между ближайшими атома-
ми К — Si. в) Вычислите плотность кристалла.
Боргидрид натрия NaBH4 имеет гранецентрированную
кубическую структуру, в которой четыре атома нат-
рия занимают положения 0 0 0, 0 -4-4 4о -4, 44 о
и четыре атома бора — 444’ 4^^’
Ребро элементарной ячейки а0 6,15 А [28]. а) На
эскизе элементарной ячейки укажите относительное
расположение атомов натрия и бора, б) Рассчитайте
плотность кристалла.
Бромид цезия кристаллизуется в кубической системе.
В центре его элементарной ячейки находится ион Cs+;
ионы Вг~ находятся в углах ячейки. Плотность бро-
мида цезия равна 4,44 г-см-3. Определите а) ребро
элементарной ячейки и б) расстояние d2oo-
CsI имеет такую же структуру, как и CsCl (двойная,
взаимопроникающая кубическая решетка). Радиусы
ионов Cs+ и I- равны 1,69 и 2,16 А соответственно.
Найдите а) объем элементарной ячейки и б) плот-
ность (г-см-3) кристаллов CsI.
K.CN имеет плотность 1,52 г-см-3 и кристаллизуется
по типу структуры NaCl [29]. Вычислите dioo для эле-
ментарной ячейки.
Рассчитайте плотность серебра, если известно, что
металл кристаллизуется в гранецентрированной ку-
бической форме, а расстояние между ближайшими
соседними атомами равно 2,87 А.
Комплексное соединение перхлората серебра и бензо-
ла AgClOvCgHe (молекулярный вес 285) имеет ром-
бическую структуру с размерами элементарной ячей-
ки а0=7,96, Ьо=8,34 и Со=Н,7А. На каждую эле-
ментарную ячейку приходится четыре молекулы [30].
Определите плотность кристаллов.
Боргидрид лития ЫВН4 в ромбической структуре
имеет четыре молекулы на элементарную ячейку. Раз-
меры ячейки ао=6,81, ft0=4,43 и с0=7,17А [31]. Рас-
считайте плотность этого кристалла.
Твердые тела
57
V1-1-12. Некоторое органическое соединение кристаллизуется
в ромбической системе. Элементарная ячейка имеет
ребра 12,05, 15,05 и 2,69 А. На одну элементарную
ячейку приходится две молекулы. Плотность кристал-
ла равна 1,419 г-см*3. Найдите молекулярный вес
этого соединения.
РАЗДЕЛ VI-2
V1-2-1. Каков физический смысл п («порядок» в рентгенов-
ском излучении) в уравнении Брэгга nX=2d sin 0?
V1-2-2. При изучении кристаллической структуры цианида
калия найдены следующие углы отражения от пло-
скости 100 [29]:
Угол отражения 5° 23' 10° 51' 4° 47' 4° 40'
Порядок отражения 2 4 2 2
Длина волны, А 0,614 0,614 0,545 0,534
Структура кристаллов кубическая. Обозначьте линии:
и укажите тип кубической решетки. Полезно вос-
пользоваться следующей таблицей:
AM А2 + k2 + /2 100 1 ПО 2 111 3 200 4 210 5 211 6 220 8 221 9 300' 9-
hkl 310 311 222 320 321 400
А2 + А2 + /2 10 И 12 13 14 16
V1-2-3.
V1-2-4.
V1-2-5.
LiBr, NaBr, КВг и RbBr имеют одинаковую кристал-
лическую структуру. Однако дифракция рентгенов-
ских лучей показывает, что RbBr имеет простую ку-
бическую решетку, а остальные три соединения.—
гранецентрированную. Объясните.
Объясните, почему кристалл не может иметь ось сим-
метрии больше шестого порядка.
Перечислите элементы симметрии кристалла, показан-
ного на рисунке:
58
Глава VI
VI-2-6.
Перечислите элементы симметрии кристалла, пред-
ставленного на рисунке:
VI-2-7.
Сколько осей симметрии второго порядка будет иметь
кристалл, изображенный на рисунке? Покажите их.
Кристалл представляет собой правильный куб, если
не принимать во внимание скошенные углы.
VI-2-8.
VI-2-9.
VI-2-10.
Покажите, что ось вращения второго порядка (2) эк-
вивалентна плоскости зеркального отражения.
а) Начертите эскиз двухмерной решетки плотной упа-
ковки тождественных кругов. Укажите подходящую
элементарную ячейку, б) Найдите долю площади пу-
стот в этой решетке. [Для треугольника со сторона-
ми а, Ь, с площадь равна [5(5 — a) (s — b)(s —
где $ = fe + c)-]
Три одно-одновалентных ионных кристалла АХ, AY и
AZ составлены из ионов с радиусами (в произволь-
ных единицах):
А+ X’ Y“ Z~
1,00 1,00 2,00 3,00
Твердые тела
59
VI-3-1.
Предположите, что ионы — твердые шары, а) Пред-
скажите, может ли каждый из кристаллов иметь
структуру хлорида натрия или хлорида цезия. Объяс-
ните. б) Приняв, что это утверждение справедливо,
найдите объем элементарной ячейки каждого из трех
кристаллов.
РАЗДЕЛ VI-3
Используя следующие радиусы ионов, найдите долю
объема пустот в a) CsCl, б) NaCl и в) LiCl. При-
мите, что ионы — соприкасающиеся твердые шары.
Ион Радиус, А
Li+ 0,60
Na+ 0,95
Cs+ 1,69
СГ 1,81
Каждый положительный и отрицательный ионы в
CsCl образуют простейшую кубическую решетку.
Ближайшие соседи каждого иона в решетке — восемь
ионов противоположного заряда. Каждый ион в NaCl
и LiCl находится в гранецентрированной кубической
решетке и имеет ближайшими соседями шесть ионов
противоположного заряда.
Глава VII
РАСТВОРЫ
VI1-1-1.
V11-1-2.
VI1-1-3.
V1I-1-4.
V11-1-5.
V11-1-6.
РАЗДЕЛ VI1-1
Объясните, почему даже в неидеальном растворе,
если он достаточно разбавлен, давление насыщенного
пара подчиняется закону Рауля?
Криоскопическая постоянная камфоры равна 40,27° С
(кг камфоры) • (моль растворенного вещества)-1.
0,0113 г фенантрена понизили точку замерзания
0,0961 г камфоры на 27,0° С [32]. Каков молекуляр-
ный вес фенантрена в камфоре?
Криоскопическая постоянная бензола 5,085° С (кг бен-
зола)-(моль растворенного вещества)-1. 0,07734-мо-
ляльный раствор тиоцианата тетраизоамиламмония в
бензоле имел температуру замерзания на 0,01573°С
ниже чистого бензола [33]. Рассчитайте ассоциацию
четвертичной аммониевой соли (т. е. отношение кажу-
щегося молекулярного веса к молекулярному весу)
в бензоле.
Раствор, содержащий 86,52 г сероуглерода и 1,4020 г
антрацена, имеет температуру кипения на 0,220° С
выше, чем чистый сероуглерод при давлении 740,5
мм рт. ст. [34]. Прибавление 1 моля растворенного
вещества на 100 г CS2 поднимает температуру кипения
этого растворителя на 23,7° С. Предполагая, что рас-
твор идеальный, определите молекулярный вес антра-
цена. _
Закон осмотического давления л71 = X2/?7,, где V] —
парциальный мольный объем растворителя, а Хг —
мольная доля растворенного вещества. 10 г веще-
ства В растворено в 100 г растворителя А. Молеку-
лярный вес А равен 100, его плотность 1,00 г-мл-1.
Осмотическое давление при 300° К равно 0,50 атм.
Найдите молекулярный вес вещества В. Укажите
приближения, которые необходимо использовать при
выводе данного уравнения.
Вычислите коэффициент активности брома в растворе
четыреххлористого углерода, над которым парциаль-
ное давление брома составляет 10,27 мм рт. ст. Со-
став раствора в мольных долях: 0,0250 Вг2 и 0,9750
ССК. Давление пара чистого брома при той же тем-
пературе 213 мм рт. ст. За стандартное состояние
брома примите чистый жидкий бром.
Растворы
61
Vll-1-7.
Vll-1-8.
Vll-1-9.
Vll-1-10.
VII-2-1.
VI1-2-2.
Коэффициент абсорбции Бунзена для кислорода
в воде при 19,94° С равен 0,03097 атм*1 [35]. Сколько
молей кислорода воздуха (21 об. % О2 и 79 об. % N2)
при общем давлении 1 а4м должно раствориться в 1 л
воды при этой температуре?
При 30° С 244,0 мл воды растворяют 2,265 мл гелия
(при 30° С и 1 атм) [36]. Определите коэффициент
абсорбции Бунзена а для гелия при этой темпера-
туре.
Коэффициент абсорбции Бунзена для кислорода
в воде при 0 и 10°С равен 0,04889 и 0,03802 атм-1 со-
ответственно. Вычислите энтальпию растворения кис-
лорода в воде.
Если 1,046 г кадмия растворить в 25,23 г ртути, то
давление пара образующейся амальгамы при 32,2°С
будет составлять 0,920 от давления чистой ртути [37].
Какими будут а) активность и б) коэффициент ак-
тивности (в мольных долях) ртути в амальгаме?
РАЗДЕЛ VI1-2
А и В образуют идеальный раствор. Давление пара
чистого А при 25° С равно 100,00 мм рт. ст. Давление
пара чистого В равно пулю. Давление пара раствора,
содержащего 1,00 г В и 10,00 г А, при 25° С равно
95,00 мм рт. ст. Найдите отношение молекулярного
веса В к молекулярному весу А.
Для определения формулы комплекса теллурата нат-
рия в жидком аммиаке (№аТеж или Na2Tex) измеряли
давление пара серии растворов, приготовленных рас-
творением металлического натрия в жидком аммиаке
в присутствии избытка твердого теллура [38]. Резуль-
таты одной из серий измерений приведены ниже.
Давление пара чистого жидкого аммиака при 20°С
равно 6428 мм рт. ст. Вес Na 0,1398 г; t 20° С.
Мольная доля Na «КН
~-------------104
"Na + nNHs
Вес NH3 (ж), г
Изменение давления
пара АР,
мм рт. ст.
38,909 26,5 8,2
28,767 35,9 12,0
20,904 49,3 17,0
15,272 67,3 22,8
11,362 90,6 32,0
62
Глава VI/
VI1-2-3.
VI1-2-4.
VI1-2-5.
На основе этих данных определите формулу ком-
плекса. Объясните.
При выводе формулы для соотношения между кон-
центрацией растворенного вещества и температурой
замерзания соответствующего раствора обычно при-
нимается, что энтальпия плавления растворителя не
изменяется с температурой. Однако в случае воды
это предположение не совсем оправдывается, по-
скольку энтальпия плавления льда изменяется вбли-
зи 0° С примерно на 1,6% при изменении темпера-
туры на один градус. Выведите формулу для мольной
доли растворенного вещества в растворе Х2 как функ-
ции температуры замерзания, использовав эмпириче-
ское уравнение:
ДЯпя(лед) =—6997 + 63,68 Т — 0,1586 Т2 кал-моль-1.
Парциальный мольный объем растворенного веще-
ства (2) в разбавленном растворе некоторого раство-
рителя дается выражением Vi=a bm, где пг — мо-
ляльность растворенного вещества, а и b — констан-
ты. Выразите парциальный мольный объем Vi через
a, b, m и количественные характеристики раствори-
теля.
Давление пара С2Н5ОН и НгО при 20° С над раство-
рами обоих веществ следующее:
С2Н5ОН, вес. % РС2Н-ОН, мм рт. ст. РН2О, мм рт. ст.
0 0 17,5
20,0 12,6 15,9
40,0 20,7 14,7
60,0 25,6 14,1
80,0 31,2 11,3
100 43,6 0
VI1-2-6.
Найдите активность и коэффициент активности каж-
дого компонента в растворе, содержащем 40 вес.%
С2Н5ОН. Для каждого компонента за стандартное со-
стояние примите чистое вещество.
Насыщенный водный раствор А изобутилового спир-
та (74,12 г-моль-1) содержит при 25° С 8,2 вес.%
спирта. Вторая фаза В, находящаяся в равновесии
с раствором, содержит 83,2 вес.% спирта. Найдите
активность спирта в растворе А, приняв за стандарт-
ное состояние чистый спирт. Укажите возможные при-
ближения.
Растворы
63
VI1-2-7.
VI1-2-8.
VI1-2-9.
VI1-2-10.
VI1-2-11.
Состав некоторого жидкого раствора характеризуется
данными весовыми долями z/д и z/в компонентов А
и В. Молекулярный вес компонентов МА и Л4В. Най-
дите а) соотношение между Цд— стандартным хими-
ческим потенциалом А, выраженным в весовых долях
по отношению к чистому А как стандартному состоя-
нию, и Цд—мольной свободной энергией чистого А;
б) отношение между активностью bк компонента А,
выраженной в весовых долях, и активностью аА ком-
понента А, выраженной в мольных долях (в обоих
случаях за стандартное состояние примите чистое ве-
щество); в) соотношение между коэффициентами ак-
тивности при двух способах их выражения; г) коэф-
фициент активности компонента А в весовых долях,
если Уа=Ув=0,50 и при условии, что раствор иде-
альный. Ответы могут содержать любые величины:
«/а, Уъ, МА и Мв.
Пусть у\ и у2— весовые доли растворителя и раство-
ренного вещества соответственно; а, Ь\ и Ь2—актив-
ности, определяемые как lim bifyi — 1. Аналогично
^->1
пусть Х| и х2 — мольные доли, а а\ и а2 — активности,
определяемые так, что limai/x1 = l. Определите от-
ношение Ь2/а2 через количественные характеристики
растворителя и растворенного вещества. Докажите,
что такой же результат можно получить из опреде-
ления активности через химические потенциалы.
Выведите уравнение -^- = —/1 + т:гМ~}, связы-
J у2 р \ 1000 /
вающее коэффициент активности у2, выраженный че-
рез молярность (концентрацию), с коэффициентом ак-
тивности у2, выраженным через моляльность. В урав-
нение входят плотность раствора р, плотность чистого
растворителя ро, моляльность т2 и молекулярный вес.
Коэффициент активности у2, выраженный в мольных
долях растворенного вещества, в некотором разбав-
ленном растворе равен у2 = е 2, где А— константа
при данной температуре. Выведите выражение для
коэффициента активности растворителя yi через А и
Х2 (в мольных долях).
Водолаз имеет 5 л крови и дышит смесью из 20 мол.°/о
О2 и 80 мол. % Не. Вычислите общий объем газа, ко-
торый будет выделяться из крови водолаза, при его
внезапном подъеме с глубины 30 м, где вода имеет
температуру 25° С, на поверхность, где атмосферное
64
Глава VII
VI1-2-12.
VII-2-13.
VI1-2-14.
VII-2-15.
давление составляет 1 атм и температура 25° С. Плот-
ность воды 1 г-см*3. Примите, что коэффициенты аб-
сорбции Бунзена для Не и Ог в плазме крови будут
теми же, что и в воде: 0,00861 для Не и 0,02831 атм*1
для Ог.
Коэффициенты абсорбции Бунзена а для СОг при
различной температуре приведены ниже:
I, °C 30 40 50
а, атм-1 0,665 0,530 0,436
Оцените подходящим графическим методом величи-
ну а для СО2 при 100° С. Используя полученный ре-
зультат, рассчитайте число молей СОг, остающихся
в 1,00 л дистиллированной воды, сначала насыщенной
воздухом (0,03 об.% СОг) при комнатных условиях,
но впоследствии прокипяченной при 100° С для уда-
ления СОг.
На графике представлена интегральная теплота рас-
творения H2SO4 в воде при 18° С. Определите_диффе-
ренциальную теплоту растворения кислоты АН2 для
раствора, содержащего 1 моль H2SO4 в 10 молях
При 25° С интегральная теплота растворения некото-
рой кислоты в воде выражается формулой
АН == 2,00м1/2 + 3,00м8/2 + 4,00 м8/2 (кал),
где Mi — число молей НгО на 1 моль кислоты. Оце-
ните АЯг[т- е. (дДН/дм2)р, т, nJ раствора, содержащего
10 мол.% кислоты.
Ниже приведены данные по интегральным теплотам
растворения NaCl в воде при 2° С [38].
Растворы
65
Число молей
на 1 кг Н2О, m
ЛИ,
кал-моль'
0,0624 1846
0,2001 1780
0,4003 1650
0,7504 1531
1,0058 1439
1,9457 1187
3,1064 946
4,0012 767
4,9966 619
6,0004 454
VII-2-16.
Какое количество тепла будет поглощено при этой
температуре при прибавлении 126 г Н2О к 100 г рас-
твора с 10,0 вес.% NaCl?
Используя данные таблицы, приведенной ниже (со-
единение 1—Н2О, соединение 2 —H2SO4), опреде-
лите а) общее количество выделяющегося тепла при
прибавлении 4 молей Н2О к раствору 6 молей Н2О
и 1 моля H2SO4; б) общее количество тепла, выде-
ляющегося при смешении 3 молей Н2О с 6 молями
H2SO4.
Интегральные и дифференциальные теплоты
растворения 1 моля H2SO,
в воде при 25° С
Число молей Н2О, rtj ДЯ, кал ДЯЬ — 1 кал«моль ДЯ?, каломель”1
0 0 —6750 0
0,50 —3810 —6740 -438
1 —6820 —4730 —2)90
2 —9960 —2320 -5320
3 — 11890 — 1480 —7450
4 -13120 — 1040 —8960
6 — 14740 -570 — 11320
10 — 16240 -233 — 13910
VII-2-17. При исследовании растворимости диметилглиоксима
никеля в воде при нескольких температурах получены
следующие результаты [39]:
3 Зак, 1360
66
Глава VII
t, °C
25,0
30,0
35,0
40,0
45,0
Растворимость* 10 5*
моль*л~*
0,105 + 9%
0,139 + 4%
0,184 + 2%
0,240 + 2%
0,307 + 2%
VII-2-18.
а) Оцените энтальпию растворения диметилглиокси-
ма никеля в воде ДЯ° (ккал • моль-1). б) Что обозна-
чает индекс «°» в ДЯ°?
Если вы проводите опыт по определению энтальпии
растворения металлического нептуния в 1 М НС1, то
какая поправка должна быть сделана на 1 моль
Np (тв) для теплоты, включающей теплоту испаре-
ния воды, которая будет смешана в виде водяного
пара с выделяющимся Н2 [40]? Давление пара чистой
воды при 25° С 23,756 мм рт. ст.; энтальпия парооб-
разования чистой воды при 25° С 582,2 кал-г-1. Реак-
ция имеет вид:
Np (тв) + ЗН+ —>Np (III) Н- 3/2Н2
Н+ + Np (HI) + 7А -> Np (IV) + ‘/2Н2О
Температура и давление постоянны и равны 25° С и
1 атм соответственно.
РАЗДЕЛ VI1-3
VII-3-1. Пусть А и В — жидкости. При температуре Т давле-
ние их паров равно Ра и Рв соответственно, а моль-
ная теплота испарения — ДЯА и ДЯВ соответственно.
Пар — идеальный газ. При смешении А и В получим
идеальный раствор. Пусть Ра и Рв — парциальное
давление паров А и В соответственно над раствором,
содержащим пА молей А и «в молей В. а) Выразите
РА и Рв через пА, пй, Р°А и Рв- б) Следующие про-
цессы выполняются обратимо при постоянной темпе-
ратуре Т. Для каждой стадии и всего процесса най-
дите Дб и ДЯ системы, содержащей пА молей А и пв
молей В (это не тепловой эффект образования иде-
ального раствора):
1) чистые жидкости испаряются отдельно;
2) пары расширяются отдельно до давления РА и Рв;
Растворы
67
VI1-3-2.
VI1-3-3.
VI1-3-4.
3) пары смешиваются так, что их парциальные давле-
ния в смеси будут РА и Рв соответственно;
4) пар конденсируется в жидкий раствор.
в) Выразите AS смешения двух жидкостей через пА
и «в- г) Если пары будут не идеальными, но жидко-
сти образуют идеальный раствор, то как это повлияет
на предыдущий ответ? Объясните.
Кажущийся удельный объем (мл-г-1) компонента 2
в растворе определяется как
V —
где V — объем раствора, v,— удельный объем чи-
стого компонента 1 и w2—вес (г) компонентов 1
и 2 соответственно. Примем, что wt равно 1 г, так что
будет отношением веса компонента 2 к весу ком-
понента 1. а) Выведите уравнение для d$2/dw2 через
плотности раствора р и чистого компонента 1 р°, w2
и dp]dw2. б) Используйте полученное уравнение для
оценки парциального удельного объема глицерина v2
в 50%-ном (по весу) водном растворе, имеющем сле-
дующие плотности:
Глицерин, вес. % 0 49 50
Плотность раствора, 0,9982 1,1236 1,1263
г•мл-1
а) Раствор содержит молей компонента 1 и п2 мо-
лей компонента 2. Их молекулярные веса и М2 со-
ответственно. Выразите парциальный мольный объем
компонента 2 V2 через «ь п2> плотность раствора р,
производную (ые) р по п2 при постоянном nt и моле-
кулярные веса.
б) Пусть Х\ и Х2 — мольные доли 1 и 2 в растворе.
Покажите, что V2 = ——(Mt*t + AJ2X2) •
Р р О Л 2
в) Плотность (г-мл-1) водно-метанольного (СН3ОН)
раствора при 25° С дана уравнением:
р == 0,9971 - 0,28930*2 + 0,29907*1 - 0,60876*2 +
4-0,59438*2-0,20581*2,
где *2 — мольная доля метанола [41]. Определите V2
в водно-метанольном растворе при 25° С и Х2 =
= 0,100.
Давление паров хлороформа СИСК и ацетона
(СН3)2СО над раствором этих компонентов при
35,17° С следующее:
3*
68
Глава VI!
Мольная доля. XCHCI, РСНС1, мм рт. ст. P(CHS),CO. мм рт. ст.
0 0 344,5
0,0588 9,2 323,2
0,1232 20,4 299,3
0,1853 31,9 275,4
0,2970 55,4 230,3
0,5143 117,8 135,0
0,7997 224,4 37,5
0,9175 267,1 13,0
1,0000 293,1 0
V П-3-5.
а) Найдите коэффициенты активностей у для обоих
компонентов в мольных долях, отнесенных к чистому
веществу как стандартному состоянию, в растворе,
содержащем 51,43 мол.% СНС13.
б) Определите постоянную k закона Генри (Р = kx)
для каждого из компонентов настолько приближенно,
насколько это возможно сделать, не прибегая к тща-
тельному анализу данных, в) Найдите коэффициент
активности хлороформа усна, в мольных долях, от-
несенных к бесконечно разбавленному раствору
СНС13 в (СН3)2СО, в растворе, содержащем
51,43 мол. % СНОз (уснсь —* 1 при Хснш, —>0).
г) Вычислите отношение у'/у для каждого компо-
нента. Зависит ли оно от мольной доли? д) Найдите
Дб для процесса смешения 0,5143 моля СНС13
с 0,4857 молями (СН3)2СО при 35,17° С.
Неидеальный раствор содержит пА молей А и «в мо-
лей В. Полная свободная энергия этого раствора при-
ближенно дается уравнением:
л л , С fl Д Mlj
G = «Ацд 4~ пвЦв + RT (nA In Хд + «в In Хв) + ,
где Ха, Хв— мольные доли, а С — постоянная, харак-
теризующая пару А— В.
а) Выведите выражение для химического потенциала
вещества А в этом растворе (|лА или GA) через вели-
чины, входящие в правую часть приведенного выше
уравнения, используя следующие формулы:
д in ХА 1 1 ( д In Хв 1
\ дпА /„в “ «Г ~ «А + «В ’ \ <Э«А /„в «А + «В ’
б) Выведите простое выражение для коэффициента
активности у компонента А. При каких условиях
Ya = 1?
Растворы
69
VI1-3-6.
В некотором растворе коэффициент активности рас-
творенного вещества уг равен 1пуг =—km3/2, где
m — моляльность растворенного вещества, a k — по-
стоянная. а) Выразите In yi через k, tn и молекуляр-
ный вес растворителя, б) Установите степень п в вы-
ражении
VI1-3-7.
V П-3-8.
V П-3-9.
которое не равно нулю или бесконечности. Исполь-
зуйте следующие формулы:
J а^_х dx = х — a In (а + х) + const,
In (1 + х) = х — V2 х2 + 73 х3 — ...
Коэффициент активности Zn (2) в разбавленном рас-
творе Hg (1) при 25° С приближенно дается форму-
лой у2 = 1 — 3,92 Х2. а) Найдите общее выражение
для коэффициента активности Hg yi через Х2 в таком
растворе при 25° С. б) Покажите, что 1 — yi стано-
вится приблизительно пропорциональна Хг при очень
малом Х2, т. е. что lim ~Y1- конечен и отличен от
Х2->0 Х2
нуля.
В некотором растворе коэффициент активности рас-
творенного вещества у2, выраженный через моляль-
ность, дается выражением lny2 = Amp, где ш — мо-
ляльность компонента 2, а А и р — постоянные, а) Вы-
ведите выражение для коэффициента активности рас-
творителя yi (в мольных долях) через ш, А, р и пх
(«1 — число молей на 1 кг растворителя), б) Какое
ограничение следует наложить на возможную вели-
чину р, для того чтобы получить наиболее правиль-
ный ответ?
А и В образуют идеальный раствор. Необходимо вы-
разить его состав через Хв вместо Хв. Попытайтесь
определить активность ав и соответственно цв и ув,
основываясь на Хв в том смысле, что Нтав/Хв = 1
при а) Хв~*1, б) Хв—*0. Покажите связь каждого
Ив с Ив — химическим потенциалом чистого В и вы-
ведите выражение для каждого ув- Объясните труд-
ности, которые могут возникнуть при этих расчетах.
Глава VIII
СВОБОДНАЯ ЭНЕРГИЯ И ХИМИЧЕСКОЕ
РАВНОВЕСИЕ
РАЗДЕЛ VIII-1
VIII-1-1. Исходя из уравнения А 6° = — RT In Kv выведите
уравнение 1пдр = —-------------------j-C,
где С — постоянная интегрирования.
VIII-1-2. Перечислите все условия, при которых будет спра-
ведлива следующая формула:
1 Р2 А//Пар / 1 1 \
1П"рГ= R \Т~г ~
VIII-1-3.
VIII-1-4.
VIII-1-5.
VIII-1-6.
Этилен (С2Н4) может перевозиться в баллонах или
цистернах, а также транспортироваться по трубопро-
воду. Для реакции С2Н4 (г)—► 2С (графит) ф- 2Н2 (г)
при 25° С AG = — 16 ккал, а) Является ли разложе-
ние С2Н4 самопроизвольным? б) Идет ли разложение
при комнатной температуре? в) Объясните кажущееся
противоречие между предыдущими ответами.
Из серии измерений [42] выбраны следующие данные
для равновесия при образовании пара натрия (дав-
ление 10 атм, температура 1482,53° К):
71,30 вес.% мономера натрия (Na, г), 28,70 вес.% ди-
мера натрия (Na2, г). Определите КР для реакции
2Na (r)^Na2 (г) при этих условиях.
По реакции Bi (ж) Д- Bil3 (г) ВИ (г)
приведены данные [43] для нескольких различных со*
четаний равновесных парциальных давлений ВИ3 (г)
и ВИ (г) при некоторой температуре. Логарифмы пар-
циальных давлений 1g Рви были отложены по оси
абсцисс, a 1g Рви, — по оси ординат, а) Обоснуйте
теоретически, почему следует предположить, что гра-
фик будет прямолинейным, б) Определите величину
и физический смысл наклона dyldx.
При 298,2° С стандартная свободная энергия раство-
ра MgC12-6H2O равна —6 180 кал-моль-1 и стандарт-
ные свободные энергии образования MgC12-6H2O, Н2О
и Cl- (aq) равны соответственно —505 410 кал-моль-1,
—56693 кал-моль-1 и —31 340 кал• (г-атом)-1 [44].
Свободная энергия и химическое равновесие
71
Определите стандартную свободную энергию образо-
вания иона магния при этой температуре.
V1II-1-7. Используя приведенные ниже данные, вычислите кон-
станту равновесия при 25 °C для реакции
ЗНС^зСН(г)^*С6Н6 (г)
Ацетилен Бензол
Примите, что газы идеальные. Можно ли рекомендо-
вать этот процесс в качестве практического метода
получения бензола? Объясните.
AGf,
кал • моль-1
С2Н2 50000
С6Н6 29760
VIII-1-8. При 300° К константа равновесия КР для реакции
N2O4 (r)^2NO2 (г) равна 0,174 [45]. Каким будет ка-
жущийся молекулярный вес равновесной смеси Ь12О4
и NO2, полученной при диссоциации чистой N2O4 под
давлением 1 атм при этой температуре?
VIII-1-9. Константа равновесия реакции Fe3O4 (тв) 4~ СО
3FeO (тв)4~СО2 при 600° С равна 1,15 [46]. Смесь
1 моля Fe3O4, 2 молей СО, 0,5 моля FeO и 0,3 моля
СО2 нагрета до 600° С при общем давлении 5 атм. Оп-
ределите количество каждого вещества при равнове-
сии.
VIII-1-10. Для реакции 3 Fe2O3 (тв) ^>2Fe3O4 (тв) 4- у О2(г)
A#298=55,5 ккал и Дб298 = 46,5 ккал.
Рассчитайте константу равновесия Кр для этой реак-
ции а) при 25° С, б) при 125° С и в) укажите исполь-
зованное при расчете приближение.
VIII-1-11. Для реакции CO(r)4-SO3 (г)^*СО2(г) 4-SO2(r)
д/7^=—44,14ккали Дб298 = —44,72 ккал. Определите
а) Дб398 и б) Кр> 398. Предположите, что в интервале
298-398° К ДСр = 0.
VIII-1-12. Константа равновесия Kv реакции 2В5Нц(г)4~
+ 2Н2(г) ^ 2B4Hio (г) 4-В2Н6 (г) при 100° С равна
1,46, а при 140° С — 0,54 [47]. Оцените ДЯ° для этой
реакции в килокалориях.
VIII-1-13. На основании следующих данных [48] по давлению
пара твердого металлического _палладия как функ-
ции температуры определите ДЯ°субл— среднюю Эн-
тальпию сублимации палладия (ккал-моль-1);
72
Глава VIII
T, °K
Р-10»,
мм рт. CT.
1294 2,17
1308 3,19
1322 5,23
1333 6,01
1350 8,22
1396 24,5
1406 29,0
1426 47,8
1459 88,6
1488 168
V1I1-1
VIII-1
VI11-1
VIII-
- 14. Некоторое соединение Y имеет следующее давление
паров в твердом и жидком состояниях:
Давление паров Y
над твердым
соединением
200° К 25 мм рт. ст.
250° К 75 мм рт. ст.
Давление паров Y
над жидким
соединением
300° К 150 мм рт. ст.
400° К 300 мм рт. ст.
Определите энтальпии (кал-моль-1) а) сублимации,
б) парообразования и в) плавления.
- 15. Давление пара бромистого метила при —70° С равно
13 мм рт. ст., а при —36,7°С— 117 мм рт. ст. Опреде-
лите а) мольную энтальпию испарения бромистого
метила и б) давление пара при —50° С.
- 16. Рассчитайте константу равновесия для реакции
4НС1 (г)+ О2 (г)^ 2С12 (г)+ 2Н2О (г) при 25° С, ис-
пользуя следующие данные:
•* при 298,15° к, кал-°К’-1‘.моль"’1 О 1 Hq, ккал«моль
О2 (г) —42,06 0
С12(г) -45,93 '0
Н2о (г) —37,17 —57,107
НС1 (г) —37,72 —22,019
1-17, Определите константу равновесия при 1000° К для
реакции
С2Н4 (г) 4- Н2 (г) С2Н6 (г),
используя следующие данные!
Свободная энергия и химическое равновесие
73
(g°-w°o)/t при 1000° к, кал^К”1 •моль”’1 —° — 1 Hq. ккал’моль
с2нв —61,11 -16,52
С2Н4 —57,29 + 14,52
н2 —32,74 0
VIII-1-18.
VII1-2-1.
VI П-2-2.
VII1-2-3.
VIII-2-4.
Определите константу равновесия для реакции
А (г)ч=ь2В (г) при 600° К, используя следующие дан-
ные:
при 600° к. кал^К"”1 -моль”1 о Я0. ккал-моль 1
А(г) 48,0 —94,000
В(г) 27,0 —27,000
РАЗДЕЛ VIII-2
Выведите формулу
Г д ( \U
[дГ \ Т )]v~ Тг ‘
Определите давление, необходимое для плавления
льда при —ГС. Удельная теплота плавления льда
80 кал •град-1; плотность жидкости 1,00 гем-3; плот-
ность твердого льда 0,92 г-см~3.
При 298,15° К и 1 атм AG для перехода ромбической
серы в моноклинную составляет 18 кал-моль-1. Какое
из двух состояний будет стабильным при этих усло-
виях? Плотность ромбической серы 1,96 г-см-3; плот-
ность моноклинной серы 2,07 г-см*3. Оцените мини-
мальное давление, при котором вторая фаза будет
стабильна при 298,15° К.
Для реакций
РеО(тв) + СО(г)^*Ре(тв) + СО2(г) Kt = Рсо,/Рсо
Fe3O4 (тв) + СО (г) 3FeO (тв) -Г СОг (г) К2 = PcoJPco
получены следующие данные [46]:
/
Глава VIII
t, °C Ki К2
600 0,871 1,15
700 0,678 1,77
800 0,552 2,54
900 . 0,466 3,43
1000 0,403 4,42
VII1-2-5.
VI1I-2-6.
VIII-2-7.
V1II-2-8.
VIII-2-9.
Определите температуру, при которой Fe, FeO, Fe3O4,
CO и СОг будут находиться в равновесии.
Объясните, почему допустимо пренебрежение концен-
трациями чистых твердых веществ и жидкостей при
расчете Кс для гетерогенных реакций.
Чистые окись цинка и окись углерода находятся в со-
прикосновении при 1300° К и общем давлении 1 атм
до тех пор, пока реакция ZhO(tb) + СО (г) Zn(r) +
+ СО2 (г) не достигнет равновесия. Плотность газо-
образной смеси стала равна 0,344 г-л-1. Найдите
а) средний (кажущийся) молекулярный вес газа,
б) мольную долю СО, прореагировавшей с ZnO, и
в) константу равновесия Кр для данной реакции.
В реакции XY2 X 4~ 2Y все вещества являются
идеальными газами. 10-литровый сосуд содержал
0,40 моля XY2. Затем был введен катализатор разло-
жения. После достижения равновесия давление смеси
составило 1,20 атм, температура 300° К. Найдите кон-
станту равновесия Кр для данной реакции.
2SO2 + О2 2SO3.
0,1 моля SO2 и 0,1 моля SO3 смешаны в 2-литровом
сосуде при 27° С. После достижения химического рав-
новесия давление стало равно 2,78 атм. Определите
а) мольную долю Ог при равновесии, б) КР и в), сте-
пень диссоциации SO3 при условии, что сначала сосуд
содержал 0,100 моля SO3 и не содержал Ог или SO2.
Как известно, в газовой фазе уксусная кислота суще-
ствует в виде равновесной смеси мономера НОАс и
димера (НОАс) 2 в соответствии с уравнением
(НОАс)2 (г)^2НОАс (г).
При 51,2° С в сосуде объемом 359,8 мл давление не-
которого количества паров уксусной кислоты соста-
вило 25,98 мм рт. ст. После окончания измерения дав-
ления пар был сконденсирован и жидкость оттитро-
вана стандартным раствором Ва(ОН)2. Для титрова-
ния потребовалось 13,80 мл 0,0568 н. Ва(ОН)2. Вы-
числите а) степень диссоциации димера а при этих
Свободная энергия и химическое равновесие
75
VI11-2-10.
VIII-2-11.
условиях и б) константу равновесия диссоциации ди-
мера К [49].
Кофеин (К) и бензойная кислота (HBz) образуют
растворимый в воде комплекс 1:1 согласно уравнению
К (в растворе) + HBz (в растворе)
з^К-HBz (в растворе).
Для определения константы диссоциации этого ком-
плекса в водном растворе Kc=[HBz][K]/[K-HBz]
была выполнена серия опытов следующего типа [50].
1 г бензойной кислоты и точно взвешенное количество
кофеина помещали в бутыль со стеклянной пробкой.
Затем туда добавляли 50 мл воды и 50 мл «скелле-
зольва-С» (продажный растворитель, который не сме-
шивается с водой). Бутыль, содержащая эти веще-
ства, непрерывно встряхивалась при постоянной тем-
пературе 0° С в течение 2 ч. Затем из каждого слоя
отбирались пробы и титровались спиртовым раство-
ром гидроокиси калия с использованием а-нафтол-
бензоина в качестве индикатора. Концентрация бен-
зойной кислоты (свободной HBz и связанной K-HBz)
в водном слое, исправленная на диссоциацию HBz, со-
ставляла 20,40-10-3 моль-л-1. Общая концентрация
бензойной кислоты (HBz) в слое скеллезольва-С
была равна 28,43 • 10-3 моль • л-1. Коэффициент рас-
пределения Kd бензойной кислоты между водой и скел-
лезольвом-С определялся в специальном опыте:
(HBz)2 (в скеллезольве-С) 2HBz (в воде)
/Q = (в воде)--рг = 5,02 • IO’3.
а [(HBz)2J (в скеллезольве-С)
Заметим, что бензойная кислота находится в виде мо-
номера в водном растворе и в виде димера в рас-
творе скеллезольва-С. Общая концентрация кофеина
(свободного и находящегося в комплексе) в водном
слое равна 2,691 • 10-2 моль-л-1. Кофеин и комплекс
K-HBz не растворимы в скеллезольве-С. Вычислите
Кс
Даны следующие свободные энергии образования
(ккал-моль-1) при 25° С:
СО (г) СО2 (г) Н2О (г) Н2О (ж)
—32,807 —94,260 —54,635 —56,69
а) Найдите Дб°и константу равновесия КР для реак-
ции СО (г) 4- Н2О (г) СО2 (г) 4- Н2 (г) при 25° С.
б) Определите давление пара воды при 25° С.
76
i
Глава VIII
V Ш-2-12.
VIII-2-13.
VIII-2-14.
в) Если смешать СО, СОг и Нг так, что парциальное
давление каждого компонента будет равно 1 атм, и
смесь привести в соприкосновение с избытком жидкой
воды, то каким будет парциальное давление каждого
газа по достижении равновесия при 25° С? Объем по-
стоянный.
В реакции А (г) + 2В (г) С(тв) 4* 2D (г) А, В и
D — идеальные газы; С имеет очень небольшое дав-
ление пара и незначительный объем. Следующие про-
цессы происходят при некоторой температуре: а) А и
В вводятся в резервуар до тех пор, пока парциальное
давление каждого компонента, прежде чем обра-
зуются С и D, достигнет 1 атм. При достижении рав-
новесия при постоянном общем давлении 2 атм 75% А
(от первоначально присутствовавшего) осталось не-
прореагировавшим. Найдите парциальное давление
газа D при равновесии и константу равновесия КР
для данной реакции, б) А и В вводятся в резервуар
с фиксированным объемом до тех пор, пока парциаль-
ное давление каждого компонента, прежде чем обра-
зуются С и D, достигнет 1 атм. Напишите уравнение,
в котором в условиях равновесия неизвестным будет
только парциальное давление газа D. в) В каком из
опытов—(а) или (б) — будет большим равновесное
парциальное давление газа D. Объясните, г) Рассчи-
тайте с точностью до двух значащих цифр парциаль-
ное давление газа D в опыте (б).
а) Чистый бромистый иод вводится в сосуд с по-
стоянным объемом при 25° С до тех пор, пока его пар-
циальное давление (прежде чем начнется реакция)
достигнет 0,5 атм. После достижения равновесия в ре-
акции 21Вг (г)ч=± Ь (тв) 4~ Вг2 (г) при 25° С парциаль-
ное давление брома будет равно 0,17 атм. Найдите
константу равновесия реакции Кр. б) Бромистый иод
находился при 25° С и постоянном общем давлении
0,50 атм до тех пор, пока в процессе его диссоциации
не установилось равновесие. В присутствии твердого
иода парциальное давление паров иода равно
4,0-10"4 атм. Определите парциальное давление брома
в равновесной смеси, приняв, что бром не конденси-
руется в жидкость.
Для реакции Вг2 (ж) 4* С1г (г) 2ВгС1 (г) КР = 2,032
при 25° С. Давление паров Вг2 (ж) при 25° С 0,281 атм.
Чистый ВгС1 (г) вводится в закрытый сосуд регули-
руемого объема. При общем постоянном давлении
1 атм и температуре 25° С Вг2 (ж) находится в рав-
новесии. Найдите долю ВгС1 (от первоначально при-
Свободная энергия и химическое равновесие
77
сутствовавшего количества), превратившегося в Вг2
и С12 при равновесии. Примите, что газы идеальные.
VIII-2-15. PuF4 (тв) + F2 (г) PuF6 (г)
КР = 26,6-10-4 при 300° С.
Газообразный фтор при давлении 1 атм пропускается
через трубку, содержащую 239PuF4 (тв) при 300° С.
Примите, что равновесие достигнуто, а) Каков состав
газа (мол.%), выходящего из трубки? б) Сколько мо-
лей свободного F2 (г) необходимо ввести в трубку для
получения 1 г PuF6 (г) в этих условиях?
У1П-2-16. Для реакции HD (г) + Н2О (г) Н2 (г) + HDO (г)
при 100° С КР — 2,6. Концентрация HD в природном
водороде равна 0,0298 мол.%, а) Вычислите долю ис-
ходного HD, которая останется в потоке смеси, со-
стоящей из 0,50 атм естественного водорода и 0,50 атм
Н2О (г), после достижения равновесия при этой тем-
пературе. б) Если природный водород, обработанный
этим способом, будет возвращен и снова пройдет че-
рез трубку при тех же условиях, то какое количество
от исходных 0,0298 мол.% HD останется теперь?
VIII-2-17. а) Найдите константу равновесия Кр для реакции
С2Н4 (г)з^ Н2 (г) 4- С2Н2 (г) при 1000° К, используя
данные, приведенные ниже.
при 1000° к, кал-°К”1 •моль’”1 О "о- ккал-моль-1
н2 (г) 32,74 0
С2Н4 (г) 57,29 14,52
С2Н2 (г) 52,01 54,73
б) С2Н4 находится при 1000° К и общем давлении
10 атм, пока не начнется указанная выше реакция.
Определите парциальное давление Н2 при равновесии.
V111-2-18. А, В и С — идеальные газы; D — твердое вещество,
занимающее незначительный объем и имеющее незна-
чительное давление пара. Константа равновесия КР
реакции А + 2В С + D (тв) равна 1,0-10~3 (давле-
ние дано в атмосферах). А и В вводились в сосуд до
тех пор, пока парциальное давление каждого компо-
нента (прежде чем началась реакция) не достигло
1 атм. Найдите парциальное давление продукта С
при равновесии: а) когда объем сосуда оставался по-
стоянным; б) когда общее давление в сосуде поддер-
78
Глава VIII
живалось постоянным и составляло 2 атм. Темпера-
тура постоянна в обоих случаях. Выведите для каж-
дого случая уравнение, решение которого дало бы
точное значение Рс', решите это уравнение с подходя-
щим приближением, в) Результат этого расчета Рс не
может быть достаточно точным, чтобы показать раз-
ницу между случаями (а) и (б). Покажите, в каком
из случаев доля реагирующих веществ, превращаю-
щихся в продукты реакции при равновесии, будет
больше. Объясните полученное значение в математи-
ческой и физической формах.
VI1I-2-19. Для реакции 2 H2S (г) 4- 3 О2(г)^±:2 SO2(r)4-2 Н2О (ж)
ДА/298= -1130,5 кДж, А3298=-388,3 Дж-°К-' и ЬѰР=
=74,0 Дж • °К-'. Выразите ДА/°, Д1/°, Дб° и AS
реакции только через Т и численные величины. Сде-
лайте и укажите приемлемые и необходимые прибли-
жения.
VIII-2-20.
СО (г) СО? (г) РЬ (тв) РЬО (тв)
* ДЛ^ 298, ккал • моль-1 -26,42 —94,05 0 -52,40
AGp, 298, ккал • моль-1 —32,81 —94,26 0 -45,25
Ср, кал • °К-1 • моль-1 6,95 8,76 6,34 11,07
Примите, что в интервале температур 25—127° С теп-
лоемкость постоянна.
а) Найдите Д№, Дб° и КР при 25° С для реакции
РЬО (тв) 4* СО (г) Pb (тв) 4- СО2 (г).
б) Выразите ДН° как функцию температуры в интер-
вале 25—127° С. в) Определите Кр при 127° С.
VIII-2-21. Выведите общее математическое выражение для ДО0
как функции температуры для реакции Y2 (г)^ 2Y (г)
при постоянном давлении. Объясните все постоянные.
Выражение должно содержать в качестве переменных
только Дб° и Т.
"зоо- _ ккал-моль 1 —О S300’ 0., — 1 —1 кал* К «моль кал^К^’Моль”1
Y (г) — 150,000 10,00 3,00 + 2,00- 10-2 Т
(г) -250,000 30,00 4,00 +5,00- 10-2 Т
VIII-2-22. а) Для реакции 2Ag (тв) 4-2НС1 (г) ** 2AgCl (тв) 4-
4- Н2 (г) определите Д/7°, Дб° и Kv при 25° С. Исполь-
зуйте следующие данные:
Свободная энергия и химическое равновесие
79
НС1 (г) AgCl <тв»
298 -22,06 -30,36
298 -22,77 -26,22
б) Серебро и хлорид серебра помещены в эвакуиро-
ванный сосуд. Хлористый водород вводился в сосуд
при температуре 25° С до давления 0,50 атм. При рав-
новесии общее давление 0,50 атм и температура 25° С.
Каждое из присутствующих твердых веществ остается
при равновесии и находится в контакте с газом. Най-
дите парциальное давление НО и Нг в равновесной
смеси. Примите, что газы идеальные. (Примечание.'
Примите, "что неизвестные количества должны быть
малы.) в) Приняв, что мольные теплоемкости следую-
щих веществ в интервале 0 — 50° С постоянны, выра-
зите Д/7° как функцию температуры, справедливую
в этом интервале температур:
Ag AgCl н2 НС1
Ср, кал- “К-1 -моль-1 6,01 12,61 6,89 7,0Э
г) Выведите 1g как функцию температуры для
того же интервала температур. Найдите Кр при 50° С.
VIII-2-23. Для реакции 12 (тв) Д- Вг2 (г) = 21Вг (г) при 25° С Кр
равна 0,164. Ниже приведены стандартные энтальпии
образования при 25°С и теплоемкости (при постоян-
ном давлении) для интервала температур 0—125° С:
Ь (тв) Вга (г) IBr (г)
ДЯр ккал • моль-1 0 7,34 9,75
Ср ’ кал • °К ' • моль 13,3 8,8 8,7
а) Вг2 (г) вводится в сосуд, в котором находится из-
быток 12 (тв). Давление и температура поддержи-
ваются постоянными (0,164 атм и 25° С). Определите
парциальное давление IBr при равновесии. Примите,
что давление пара h (тв) гораздо меньше 0,164 атм.
б) Найдите Кр реакции при 125° С. в) Объясните, по-
чему энтальпия образования Вг2 (г), приведенная
80
j
Глава VIII
в таблице, не равна нулю, хотя Вг2 — простое веще-
ство.
VIII-2-24.
При 300° К ДД°, ккал Дб°, ккал
2 (СН2ОН)2 (ж) 4- 5 О2 (г) -> -546,96 —562,94
—>4СО2(г) 4-6Н2О (ж)
С (графит) 4- О2 (г) -> СО2 (г) -94,05 -94,26
2Н2(г) + О2(г)->2Н2О (ж) -136,64 -113,38
С (графит) Н, О» СО, Н,0 (ж) (СН,ОН), (ж)
С°, кал.°К_|-моль-1 2,04 6,84 6,98 8,76 17,98 35,45
VIII-2-25.
VIII-2-26.
Примите, что все газы являются идеальными и что
теплоемкости постоянны в интервале 280—370° К. Для
реакции 2С (графит) 4- ЗН2 + Ог ^(СН2ОН)2 (ж) оп-
ределите а) ДД°, б) Дб°, в) bU°, г) NF° при 300° К-
д) Выразите ДН° как функцию температуры. В каком
интервале температур будет справедливо полученное
выражение, е) Найдите Д/7° при 350° К. ж) Опреде-
лите КР (или 1g К.р) при 300° К. з) Объясните смысл
индекса «°» при Д//°. Укажите и объясните, в каких
из перечисленных выше случаев пропуск этого значка
приведет к серьезной ошибке.
Для некоторого простого вещества теплоемкость
в твердом состоянии равна Ср (тв) = а 4-
4- bТ кал-^К-1 • моль-1, а теплоемкость в жидком со-
стоянии— Ср (ж) =e-\-fT кал-°К-1 моль-1, где а, Ь,
е и f — постоянные. Стандартная теплота плавления
при температуре Л — ДД) кал-моль-1, стандартная
свободная энергия плавления при этой же темпера-
туре— Дб(. Выведите уравнение для зависимости
Дб° от температуры.
Ниже приведены стандартные энтальпии образова-
ния, абсолютные энтропии и стандартные мольные
теплоемкости при 25° С:
О ккал«моль —О sf О., —1 —1 кал* К -моль Ср, о,,_1 .] кал* К *моль
н2 (г) 0 53,29 6,84
НС1 (г) -22,06 44,62 7,07
Na (тв) 0 12,2 6,79
NaCl (тв) —98,23 17,30 12,11
а) Выразите константу равновесия КР (или 1g Кр)
для реакции NaCl (тв)4-5-Нг (r)-+Na (тв)4-_ НС1 (г)
Свободная энергия и химическое равновесие
81
VIII-2-27.
VIII-2-28.
как функцию температуры. Выражение должно содер-
жать только Т и численные величины. Укажите при-
ближение, которое должно быть сделано, б) Найдите
Кр при 25° С. в) Определите парциальное равновес-
ное давление НС1 при 25°С в присутствии Na (тв),
NaCl (тв) и Н2 (г, 4 атм). Примите, что газы являют-
ся идеальными.
При 600° К для реакции 2Hg(r) + О2(г) 4=^2HgO (тв)
А/7° =—71,5 ккал и AS0 = —91,9 кал • °К~‘ • моль-1.
Теплоемкости (кал • °К_| • моль-1) при постоянном дав-
лении равны:
О2(г) 6,31+0,0023 Г
HgO (тв) 6,24+ 0,016 Г
Примите, что газы идеальные, а) Определите СР для
Hg (г), б) Определите константу равновесия для
реакции при 600° К. в) Закрытый сосуд определенного
объема при 600° К содержит Ог под давлением I атм.
Образец HgO (тв) вводится в сосуд без заметного
изменения объема газов. При равновесии присут-
ствует некоторое количество HgO (тв). Определите
давление паров Hg (г) при равновесии, г) Давление
паров Hg (ж) при 600° К равно 400 мм рт. ст. Най-
дите константу равновесия К'р для реакции 2Hg^)+
+ О2 (r)^2HgO (тв) при 600° К. д) Рассчитайте КР
для реакции 2Hg(r)+ О2 (r)^2HgO (тв) при 300° К.
§,
при 27° С, кал.°К-1 -моль-1
при 27° С, кал-°к—1-моль—1
о2 (г) 49,0 7,0
S (тв) 7,6 4,4
Те (тв) 11,9 6,0
Н2О (ж) 16,7 18,0
H2S (г) 48,6 8,3
SO2 (г) 69,2 8,6
ТеО2 (тв) 17,6 13,5 (оценочно)
А/7°(ккал • моль-1) при 27°С для реакций:
S (тв) + О2 (г) -> S О2 (г) -70,96
Те (тв) + О2 (г) -+ ТеО2 (тв) -77,69
2 H2S (г) + 3 О2 (г) -> 2 Н2О (ж) + 2 SO2 (г) -268,92
Приняв, что все газы являются идеальными, рассчи*
тайте с помощью приведенных выше данных;
82
Глава VIII
VIII-2-29.
VIII-2-30.
а) АЯ° при 27° С для реакции
2H2S Н-ТеОг (тв)—>Те (тв)-|- 2S (тв) + 2Н2О (ж);
б) АЯ° и AG° при 77° С для этой реакции; в) равно-
весное давление H2S при 77° С в смеси с жидкой во-
дой и твердыми S, Те, ТеО2.
а) Найдите константу равновесия для реакции
NO (г)+-^О2 (r)=±NO2 (г) при 500° К, используя дан-
ные, приведенные в таблице, б) Без каких-либо дру-
гих данных, кроме тех, которые были использованы
в пункте (а), определите температуру, при которой
для этой реакции Кр = 1.
Примечание. Учтите величины, которые остаются при-
мерно постоянными при изменении температуры и,
следовательно, заранее приближенно известными,
даже если ожидаемая температура неизвестна.
'—О — о\ / о —о _
G —HqJ T при 500 К, Hq (энтальпия образования
кал-°К—1 -моль-1 при 0° К), ккал-моль-1
О2 (г) 45,68 0
NO (г) 46,76 21,48
NO2 (г) 53,60 8,68
На основе следующих данных [51] рассчитайте А/7о
при 298,15°К для реакции NaOH-H2O (тв)=«=ь
|5=t NaOH (тв)+Н2О (г). Давление пара воды над
моногидратом равно 0,15 мм рт. ст.
кал* К *моль
NaOH • Н2О (тв) 11,281
NaOH (тв) 6,995
Н2О (г) 37,17
VIII-2-31. Исходя из следующих данных:
G1000~ Я298 Н°9ал, 1000 ’ ’ 98 -1 о.,—1 _1 ккал-моль кал- К -моль
Си2О О2 СиО —31,48 —40,4 —52,78 0 — 16,09 —37,6
Свободная энергия и химическое равновесие
83
V1II-2-32.
рассчитайте Кр при 1000° К для реакции 2СиО(тв)^>
<-Си2О (тв)+-g О2(г). Оцените температуру, при ко-
торой давление Ог при равновесии с СиО и Сц2О бу-
дет равно 10"6 атм.
Давление паров водно-этанольных растворов при 20° С
следующее:
Спирт, вес. % 0 20 50 80 100
РНг0, мм рт. ст. 17,5 15,9 14,5 11,3 0
РСгН5ОН- ММ РТ- СТ- 0 12,6 23,5 31,2 43,6
Для реакции С2н4 (г) + Н2О (ж)^ С2Н5ОН (ж)
/<=10 при 25° С. Найдите давление СгН4 при 25° С
при равновесии с раствором, содержащим равные
весовые количества НгО и С2Н5ОН. Примите, а) что
раствор идеальный, б) используйте подходящие дан-
ные из условия задачи.
V1II-2-33.
HI (г) Hgzb (тв)
AGf при 25° С, ккал • моль 1 +0,31 —26,60
Д//| при 25° С, ккал • моль-1 +6,20 —28,91
Примите, что теплоемкости веществ постоянны в ин
A iprilViri 1 V, "HU
тервале 25—125° С:
Hg (ж) Н2 (г) Hg2I2 (тв) HI (г)
С°р, кал • °К~1 • моль-1 6,6 6,9 25,0 7,0
Определите Д//°, Д5°, Дб° и Кр при 125° С для реак-
ции 2Н§(ж) + 2Ш (г)—*Hg2l2 (тв)-j- Н2 (г).
РАЗДЕЛ VIII-3
V111-3-1. Чистая жидкость А находится в равновесии со своим
паром. Примите, что пар является идеальным газом.
Два следующих уравнения могут быть выведены из
точных термодинамических обоснований:
а) уравнение Клапейрона
dP _ //пар: //ж
~dT ПИлар-Уж) ’
б) уравнение Вант-Гоффа для реакции
А (ж) А (г)
d in Р d in К //na„ — Н°ж ,
Tr--------3r-------* = '’>
84
Глава VIII
или
_ Р ("пар ~ "ж) __ "napj~ "ж
dT RT2 TVnap *
Почему результаты (а) и (б), одинаково точные, не-
идентачны (если не делать неточного предположения,
что Гж = 0 и Нж = Я°ж) ?
VHI-3-2. Химик, имеющий поверхностное представление о тер-
модинамике, советуется с Вами по поводу следующих
трудностей:
а) «Я считаю, что изменение свободной энергии си-
стемы при равновесии равно нулю. Однако изменение
равновесной свободной энергии реакции N2 -Ь ЗН2
2NH3, согласно учебнику, не равно нулю и состав-
ляет —7,88 ккал при 298° К. Если система находится
в равновесии, то почему изменение свободной энергии
не равно нулю?»
б) «Говорят, что лед и соленая вода находятся в рав-
новесии при —3°С. Активность льда равна 1. Актив-
ность воды в растворе меньше 1. Разве для жидкой и
твердой воды, находящихся в равновесии, нет необ-
ходимости, чтобы их активности были равными?»
Объясните для каждого случая, какие неправильные
предположения были сделаны, как исправить соответ-
ствующие предположения и при каких особых обстоя-
тельствах, если это вообще возможно, первоначаль-
ные предположения и заключения будут правиль-
ными.
VIII-3-3. Идеальный газ А2 подвергается частичной диссоциа-
ции на идеальный газ А: А2 2А. Константа равно-
весия реакции (выраженная через парциальные Дав-
ления) равна К.
а) Покажите, что а = (1 + 4Р/К)~'1г, где а — степень
диссоциации А2 и Р — общее давление А2 и А.
б) Напишите кажущееся уравнение состояния этой
смеси газов, включающее Р, V, Т, К и R, приняв,
(1) что ее молекулярный вес равен А2; (2) что ее мо-
лекулярный вес равен А.
в) Химик, не знакомый с явлением диссоциации, пы-
тается определить коэффициент летучести этого газа
путем расчета на основе наблюдаемых данных
Р — V — Т. Покажите, что он будет иметь успех, если
примет предположение (2), а не (1). Выведите при-
ближенное выражение для у, действительное при
Р К, основываясь на предположении (2). Полез-
Свободная энергия и химическое равновесие
85
VII1-3-4.
V1H-3-5.
VII1-3-6.
ними приближениями являются (1 +х)п « 1 + пх,
|х| «С 1.
[ . dx = -U In (л* ~ Д) + С, а > 0.
J хУ а + Ьх У а \ К а + + Уа /
Растворы веществ А и В идеальные; их пары являют-
ся идеальными газами. В растворах В находится
в виде димера В2, но в парах существует в виде мо-
номера В. Давление пара растворов исследовалось
химиком, который не был знаком с димеризацией и
предположил, что явные отклонения давления пара
от закона Рауля связаны с обычной неидеальностыо.
а) Выразите давления паров Р'А и Р'в веществ А и
В без учета димеризации через пА, пв, Р\ и Р^, где
Пв — число молей В (а не В2), находящихся в рас-
творе.
б) Выразите фактические давления паров РА и Рв ве-
ществ А и В через те же самые переменные. Учтите,
что испарение В влечет за собой химическую реак-
цию.
в) Найдите коэффициенты активности уА и ув, кото-
рые химик определил на основе своих измерений и
предположений. (Он принял чистое вещество за стан-
дартное состояние каждого компонента.) Выразите уА
и ув через пА и пв; в случае разбавленного раствора В
(«в «а) выразите уА и ув через кажущуюся моль-
ную долю Ав (не учитывая димеризации).
Следующие данные относятся к реакции
Вг2(г) 2Вг (г):
Температура, °К 1400 1600
Кр (давление, атм) 0,0303 0,255
а) Вычислите долю Вг2, диссоциирующую на атомы
Вг при 1600° К и общем давлении 0,1 атм. Примите,
что газы идеальные, б) Определите Д/7° реакции,
в) ДЯ° изменяется с температурой. Считаете ли вы,
что ответ на пункт (б) будет точным? Это будет зна-
чение \Н° при 1400° К, при 1600° К или при другой
температуре?
Соединение А при 300° К кристаллическое; простое
вещество В и соединение АВ2 — идеальные газы. Кри-
сталлы В существуют ниже 100° К, однако они субли-
мируются при этой температуре (давление пара
1 атм); энтальпия сублимации равна 2000 кал-моль-1.
Теплоемкость В (крист) ниже 100° К приближенно-
описывается уравнением
86
Глава Vllt
C> = 2,50 • 10"4Г3 - 2,40 • 10~‘°Г6 кал • ° К"' • моль"1-
Для В (г) Ср = 6,00 кал ° К"1 моль"1 около 100° К.
Энтальпии образования и абсолютные энтропии со-
единений при 300° К следующие:
VIII-3-7.
//joq, ккал • моль 1 кал • °К * моль 1
А (крист) —10 15
АВ2 (г) -41 55
а) Определите стандартную абсолютную энтропию
В (г) при 300° С. б) Найдите AG° и КР для реакции
А (крист) + 2В (г) = АВ2 (г), в) По одному молю В
и АВ2 вводятся в сосуд, в котором находится твердое
вещество А. При равновесии 1,10 моля АВ2 присут-
ствуют вместе с остатками твердого А. Давление
пара А незначительно. Определите общее давление
пара при равновесии.
Покажите, чему будет равна функция свободной энер-
гии (Gt — Но)/Т, если энтропия вещества при 0° К
будет иметь величину ст вместо 0.
Глава IX
ПРАВИЛО ФАЗ
РАЗДЕЛ IX-1
IX-1-1. Для воды АН (замерзания) = —80 кал-г-1; Ср(ж)=»
-1,00 кал^К-'-г’1; СР (лед) = 0,49 кал-’К'1 -г"1. Ка-
кой из следующих записей можно выразить Д5СИстемы
для замерзания переохлажденной воды при —10° С:
а) (0,49- 1,00) In
о
80 I /Л лл 1 лл\ t 263
6) 273 + (0>49 — 1 >00) In-273 ,
в) 0;
\ 80 । /л Л Л 1ЛТО1 263
г) 263 + (0’40 1,00) In 273 ;
д) ни одной из этих записей.
IX-1-2.
IX-1-3.
Изобразите схематически:
а) фазовую диаграмму «состав — температура» би-
нарной системы А — В, имеющей одну эвтектическую
точку, одну перитектическую точку (соответствую-
щую инконгруентному плавлению соединения АВ) и
не имеющей твердого раствора. Обозначьте все обла-
сти; б) фазовую диаграмму «состав — температура»
бинарной системы А — В, имеющей газовую фазу и
две частично смешивающиеся жидкие фазы. Примите,
что в системе нет твердых фаз. Обозначьте все обла-
сти; в) фазовую диаграмму «состав — давление» при
данной температуре системы гидрата соли А — W
(А — негидратированная соль; W — вода), имеющей
соединения A, A-W, A-2W, A-4W и A-6W, которые
присутствуют в твердом состоянии в равновесии с па-
рами воды. Примите, что жидкие фазы не образуются.
Обозначьте линии.
Данные по давлению паров чистых хлорбензола и
воды даны в таблице.
88
Глава IX
1, °C рн,о- мм рт. ст. ₽С,Н5С1, мм рт. ст.
50 93 42
60 149 66
70 234 98
80 355 145
90 526 208
100 760 293
НО 1075 403
1Х-1-4.
JX-1-5.
а) Приняв, что хлорбензол и вода в жидком состоя-
нии полностью не смешиваются друг с другом, опре-
делите температуру, при которой хлорбензол будет
перегоняться с паром при общем давлении 1 атм.
б) Каково будет содержание (вес.%) хлорбензола
в дистилляте?
Система, состоящая из четыреххлористого углерода
(С) и диоксана (D), имеет две эвтектические точки:
при 5,2 мол. % D и —24,7° С и при 49,5 мол. % D и
—20,2° С. Имеется одно бинарное соединение C2D
с конгруентной точкой плавления —18,2° С. Темпера-
тура плавления чистого С —22,7° С, температура
плавления чистого D 11,8° С. Постройте фазовую диа-
грамму «состав — температура» этой системы, при-
няв, что твердые растворы не образуются [52].
Фазовая диаграмма «давление — температура» для
углерода показана на рисунке [53] (1 бар =.
= 0,987 атм).
Правило фаз
89
а) Определите давление, необходимое для превраще-
ния графита в алмаз при 2000° К.
б) Какая фаза будет плотнее—графит или алмаз —
при любых температуре и давлении?
в) Если эта диаграмма правильна, то при каких тем-
пературе и давлении графит и расплавленный углерод
будут иметь одинаковую плотность?
IX-1-6. а) Обозначьте на диаграмме области, б) Проведите
кривую охлаждения для составов х2 и х3 от темпе-
ратуры до температуры if.
в) Каким будет максимальный вес чистого D (не за-
грязненного другими твердыми веществами), полу-
ченного кристаллизацией 150 г расплавленной смеси,,
содержащей 90 вес. % D?
1Х-1-7,
На рисунке изображена диаграмма «состав—темпе-
ратура» бинарной системы А —В.
90
Глава IX
а) Обозначьте все области, б) Начертите кривые
охлаждения системы, указанной цифрами 1, 2, 3.
IX-1-8. Используя приведенные ниже данные, постройте диа-
грамму для системы хлористый натрий (S) — вода (W).
Примите, что твердые растворы не образуются. Обо-
значьте все области.
Температура замерзания. °C Состав насыщенного раствора, вес. % NaCi Твердая фаза
0 0 W
-0,4 0,69 W
- 0,8 1,35 W
— 2,86 4,7 W
— 3,42 5,53 W
-6,6 9,90 W
-9,25 13,0 W
- 12,7 16,7 W
- 16,66 20,0 W
— 21,12 (эвтектика) 23,1 (W + S • 2W)
- 14 24,6 S-2W
+ 0,1 (перитектика) 26,3 S • 2W + S
10,0 26,34 S
15,0 * 26,34 S
20,0 26,40 S
30,0 26,52 S
40,0 26,67 S
60,0 27,07 S
80,0 27,55 S
100,0 28,15 S
IX-1-9. Следующие данные получены для температуры замер-
зания (начало замерзания) смесей этиленгликоля (К)
и воды (W) [54]:
Температура замерзания, °C Состав раствора, мол. % К Твердая фаза
0 0 W
-14,1 10,5 W
—20,9 14,1 W
—28,3 18,1 W
—41,8 24,9 W
—51,2 28 W+ K-2W
—49,6 31,8 K-2W
—49,6 34,1 K-2W
-58,6 44,0 K-2W
-63,3 47,5 K-2W +3K‘2W
-54,6 50,2 3K-2W
—40,7 60,9 3K-2W
—49,4 66,0 ЗК • 2W + К
-45,3 67,8 К
-36,4 75,3 К
-22,4 90,1 К
-12,8 100 К
Правило фаз
9t
IX-1-10.
а) Постройте диаграмму «состав — температура»,,
приняв, что твердые растворы не образуются. Обо-
значьте все области, б) Какой состав смеси К и W,
не замерзающей при —10° С? в) Какого состава наи-
более низко замерзающую смесь можно приготовить?
См. рисунок.
IX-1-11.
IX-1-12.
а) Какие фазы находятся в равновесии в области
abc? б) Дайте эмпирическую химическую формулу
любого бинарного или тройного соединения, суще-
ствующего в системе. Молекулярные веса: НгО 18,
Р 25, Q 36. в) Изобразите схематически кривую зави-
симости количества воды в жидкой фазе (вес.%) от
веса испарившейся воды для испарения воды из смеси
исходного состава х.
Тройная система F2—Оз—Ог была исследована для
использования в качестве окислителя в ракетных дви-
гателях [55]. Жидкие О3 и Ог способны только к ча-
стичному смешиванию при 77,4° К; два насыщенных
раствора имеют состав 7 и 84 вес. % О3. Известно, од-
нако, что F2 полностью смешивается с О3 и О2. а) По-
стройте треугольную фазовую диаграмму системы,
б) Проведите на диаграмме несколько линий, осно-
вываясь на предположении, что F2 распределяется
между О3 и Ог так, что его концентрация больше
в фазе, богатой Ог (не известно, справедливо ли это
предположение).
Для системы бензол — уксусная кислота — вода при
25° С получены данные [56], приведенные ниже. В этой
системе две несмешивающиеся жидкости (Li и L2)
«2
Глава IX
находятся в равновесии. По этим данным а) построй-
те треугольную диаграмму и проведите ноды; б) оце-
ните состав в точках смешивания жидкостей; в) опре-
делите равновесные состав и веса фаз, получающихся
при смешивании 30 г СНзСООН с 60 г СвНв и 10 г
воды при данной температуре.
Концентрация, вес. %
Нола L, L,
№
сн,соон С6Нв CHjCOOH CflHg
1 0,46 99,52 9,4 0,18
2 3,1 96,75 28,2 0,53
3 7,0 92,66 43,9 1,5
4 8,9 90,67 49,5 1,93
5 16,3 82,91 61,4 6,1
6 22,8 76,10 65,0 10,0
7 32,8 64,76 65,0 17,8
8 52,8 39,6 52,8 39,6
IX-1-13.
Укажите все ошибки или противоречия, которые
встречаются в следующих фазовых диаграммах. Лю-
бая из диаграмм может содержать 0 или 1 ошибку.
В каждом случае укажите принцип или условие, ко-
торые нарушены, и покажите, как должны выглядеть
правильные диаграммы (L — жидкость).
Правило фаз
93
IX-2-1.
IX-2-2.
IX-2-3.
IX-2-4.
РАЗДЕЛ IX-2
Укажите точно условия, при которых справедлива
формула ft + f=n + 2, где К — число фаз, f — число
степеней свободы и п — число компонентов в системе.
Почему ошибочно применение формулы
. Р2 _ ДЯ / 1 1
п р, ~ R \Тг Т,
к фазовому превращению алмаз — графит?
Докажите, что на диаграмме «давление— темпера-
тура» линия равновесия жидкость — пар (L — V)
в однокомпонентной системе всегда должна иметь по-
ложительный наклон.
Докажите, что для системы, изображенной на рисун-
ке, при равновесии
IX-2-5.
W, — вес фазы 1, П?2 — вес фазы 2, х, — вес. % В
в фазе 1, х2— вес. % В в фазе 2; хг — вес. % В во
всей системе.
Согласно рисунку, покажите соотношение величин
удельной энтропии s и удельного объема и для фаз
вблизи тройной точки 1-2-3.
Глава IX
94
L
IX-2-6.
Некоторое вещество существует в двух твердых фор-
мах Q и R, а также в виде жидкости и пара. В сле-
дующих тройных точках наблюдалось устойчивое рав-
новесие.
Температура, °C Давление, атм Фазы
10 1,0 Q, R, пар
80 10 R, жидкость, пар
50 1000 Q, R, жидкость
IX-2-7.
IX-2-8.
а) Изобразите фазовую диаграмму «давление — тем-
пература» этого вещества. Обозначьте фазу (или
фазы) в каждой области диаграммы, б) Если вы
имеете достаточную информацию для решения, из ка-
ждой следующей пары выберите форму с большей
плотностью вблизи 50° С и 100 атм: Q и R; R и жид-
кость; Q и жидкость. Если не можете решить, объяс-
ните, почему.
Простое вещество X существует в трех твердых алло-
тропных модификациях 1, 2 и 3 соответственно. Вблизи
тройной точки 1-2-3 s2 > S3 > и vs >• >• Vz
(s — удельная энтропия, v — удельный объем). На-
чертите три линии, соответствующие двухфазному рав-
новесию вблизи тройной точки 1-2-3, на диаграмме
«давление — температура», согласующиеся с приве-
денными данными. Обозначьте все линии и области.
В соответствии с рядом условий, приведенных в этой
задаче, простое вещество Y существует в виде пара V,
жидкости L, а в твердом состоянии — в трех алло-
тропных модификациях 1, 2 и 3. Закончите приве-
денную фазовую диаграмму и обозначьте все линии и
области. Система имеет только три тройные точки
1-2-3(/), 2-3-V(2), 3-L-V(3). На диаграмме показано
их расположение.
з
Правило фаз
95
IX-2-9. Некоторое вещество существует в двух твердых мо-
дификациях а и 0, а также в виде жидкости и пара.
Под давлением 1 атм при низкой температуре а
устойчивее, чем 0, а 0 при более высокой температуре
переходит в жидкость; а имеет плотность больше,
а 0 меньше, чем жидкость. Метастабильного равно-
весия не наблюдается. Изобразите фазовую диаграм-
му «давление — температура», указав значение ка-
ждой точки, линии и области. Включите в диаграмму
каждую тройную точку, которая может наблюдаться.
IX-2-10. В исследовании воды при давлениях вплоть до
3000 атм получены следующие тройные точки:
Температура, °C Давление, _ атм Фаза
+ 0,008 -22,0 —34,7 6,1 • 10—3 Пар, жидкость, лед I 2450 Лед I, лед III, жидкость 2100 Лед I, лед И, лед III
IX-2-11.
Под давлением в 1660 атм лед I и лед II находятся
в равновесии При —60° С. Лед II имеет плотность
больше, чем у льда III, который плотнее жидкости,
а) Изобразите схематически фазовую диаграмму
давление — температура для воды в области от —60
до 0° С и от 0 до 3000 атм. Обозначьте каждую об-
ласть. Покажите наклон каждой кривой. Пренебре-
гите кривыми, которые неразличимы в масштабе диа-
граммы.
б) Какая фаза в каждой из перечисленных ниже пар
имеет большую мольную энтальпию: лед I или
лед II; лед I или лед III; лед II или лед III?
Некоторое вещество X имеет нормальную темпера-
туру замерзания 300° К. При 300°К его теплота пла-
вления (ДУУ) равна 3000 кал-моль-1. Теплоемкости
твердого и жидкого X: Ср(тв)=20,0 кал-“К-1 • моль-1,
Ср (ж) =25,0 кал-°К~1-моль-1, а) Какова величина ДО
плавления X при 290° К: положительная, отрицатель-
ная или равна нулю? Объясните. Определите: б) Д/У
при 290° К, в) ДЗ для плавления 1 моля твердого X
при 300° К; г) ДЗ плавления 1 моля твердого X при
290° К; д) ДО плавления 1 моля твердого X при 290° К
[сравните с результатом, полученным в пункте (а)].
96
Глава IX
IX-2-12.
IX-2-13.
IX-2-14.
Давление пара некоторой чистой жидкости Рж описы-
вается уравнением
In Рж — Аж + Вж In Т + CJT.
Давление пара соответствующего твердого тела вы-
ражается как
In Р-гв = Лтв + Втв In Т + Сув/Т.
а) Выразите мольную теплоту испарения жидкости
АЛ/;к и твердого тела Д/Утв через одну или несколь-
ко величин: Д)К, BiK, Cm, Дтв, Втв, Ств и Т. б) Опреде-
лите мольную теплоту плавления через те же вели-
чины. в) Определите разность мольных теплоемко-
стей жидкости и твердого вещества [СР(ж) —СР(тв)].
г) Напишите уравнение для определения температу-
ры плавления вещества, включающее Л)К, Дтв, Вт и
другие известные величины.
При данной температуре давление паров чистых С и
D равно 550 и 250 мм рт. ст. соответственно. С по-
мощью простого графического построения определи-
те: а) общее давление пара над раствором, содер-
жащим 25 мол.% D; б) парциальное давление D
в смеси; в) состав раствора, давление пара которого
равно 500 мм рт. ст. Примите, что раствор идеаль-
ный.
В таблице приведены давления паров воды и ацето-
на, находящихся в равновесии с растворами различ-
ного состава, при 25° С:
Мольная доля ацетона
в жидкости
Парциальное давление паров,
мм рт. ст.
ацетон вода
0 0 24
0,0333 38 23
0,117 105 23
0,236 146 22
0,420 164 22
0,737 192 17
1,00 229 0
а) Постройте фазовую диаграмму, показывающую за-
висимость общего давления пара раствора ацетона
в воде от мольной доли ацетона в жидкости и в паре.
Обозначьте на диаграмме каждую область, указав
фазы, если давление и общий состав системы будут
представлены точкой в этой области, б) Вычислите
(настолько точно, насколько позволяют приведенные
Правило фаз
97
данные) постоянную Генри для ацетона, растворен-
ного в воде, в) Найдите коэффициент активности аце-
тона в растворе, в котором мольная доля ацетона
равна 0,420, 1) приняв чистый ацетон за стандартное
состояние, 2) считая ацетон растворенным веществом
в чистой воде так, что его коэффициент активности
в пределе становится равным 1. В обоих случаях ис-
пользуйте мольную долю для определения состава.
IX-2-15. Фазовая диаграмма системы, состоящей из двух ча-
стично смешивающихся жидкостей А и В, дана на
рисунке. 30 г чистой А смешаны с 70 г чистой В.
вес. % В
а) Определите температуру кипения смеси при 1 атм.
б) Определите состав пара, находящегося в равнове-
сии с жидкостью, когда смесь начинает кипеть при
1 атм. в) Какое максимальное количество чистой В
можно получить при фракционной перегонке?
IX-2-16. Согласно рисунку, определите:
а) при какой температуре начнет кипеть смесь, со-
держащая 50 г А и 150 г В; б) состав равновесного
пара в начале кипения; в) состав смеси, оставшейся
в перегонном кубе, если исходная смесь перегонялась
4 Зак. 1360
98
Глава IX
IX-2-17.
до тех пор, пока ее температура кипения не измени-
лась на пять градусов; определите состав остатка и
вес-дистиллята, собранного при кипении смеси в этом
интервале.
На рисунке представлена фазовая диаграмма «тем-
пература— состав» для двухкомпонентной системы
А—В при Р—\ атм. 200 г смеси А и В кипят сна-
чала при 65° С и перегоняются до тех пор, пока тем-
пература кипения оставшейся смеси не достигнет
75° С.
IX-2-18.
а) Каков состав оставшейся смеси? б) Каков сум-
марный состав дистиллята? в) Каков вес дистиллята?
Фазовая диаграмма «состав — температура» системы
А —В показана на рисунке:
а) При какой температуре начнет кипеть смесь, со-
держащая 25 вес. % А и 75 вес. % В? б) Каков будет
состав остатка, если эта смесь перегоняется до тех
пор, пока температура кипения остатка не подни-
мется на 5 градусов? в) Каков будет общий состав
смеси, если весь дистиллят, полученный после повы-
Правило фаз
99
IX-2-19.
шения температуры на 5 градусов, собрать как одну
фракцию? г) Если полученный дистиллят перегонять,
то каковы будут начальная температура кипения и со-
став первых капель нового дистиллята?
На рисунке представлена диаграмма перегонки сме-
си А — В при Р= 1 атм.
IX-2-20.
Жидкая смесь 60 вес. % А и 40 вес. % В помещена
в закрытый сосуд переменного объема. Давление
в сосуде поддерживалось постоянным (1 атм), а тем-
пература и объем регулировались так, что испари-
лась половина смеси (по весу). Определите темпера-
туру и состав каждой фазы.
Некоторое соединение существует в двух твердых мо-
дификациях аир. На рисунке показаны линии рав-
новесия a-V, p-V, L-V и тройная точка системы a-p-L.
Закончите построение диаграммы (насколько это воз-
можно) и обозначьте все линии и области.
IX-2-21.
4*
Ац РЬ
Температура плавления, °C 1063 327
Инконгруентная точка Ац2РЬ AuPb2
плавления, °C Ат. % РЬ в жидкости 418 254
44 71
100
Глава IX
IX-2-22.
-----------у-------------------------------------
Эвтектическая точка: AuPb2 + РЬ; 215° С; 84 ат. % РЬ.
Твердых растворов система не образует. Постройте
для системы Au — РЬ фазовую диаграмму «темпера-
тура— ат.%». Обозначьте каждую область, пркажите
присутствующую фазу (фазы), если система пред-
ставлена точкой в этой области.
При 30° С и 1 атм сульфаты лития и аммония об-
разуют двойную соль L1NH4SO4. Сульфат лития об-
разует гидрат Li2SO4-H2O. Сульфат аммония гидрата
не имеет. Водные растворы в равновесии с твердой
фазой имеют следующий состав [57]:
Раствор
Твердая фаза --------------—----------------------
LI2SO4, мол. % (NH4)2SO4, мол. %
Li2SO4 • Н2О 5,2 0
Li2SO4 • Н2О + LiNH4SO4 5,3 4,8
LiNH4SO4 + (NH4)2SO4 1,9 9,1
(NH4)2SO4 0 9,6
IX-2-23.
а) Начертите треугольную фазовую диаграмму. Обо-
значьте каждую область, указав, какие фазы при-
сутствуют, когда система имеет общий состав, соот-
ветствующий точке в данной области, б) Опишите
изменение, которое произойдет, если (NH4)2SO4 при-
бавить к незначительному количеству Li2SO4-H2O
при 30° С.
Серная кислота образует три гидрата. Все они пла-
вятся копгруентно и не имеют твердых растворов.
Соединение Температура плавления, °C
H2SO4 (безводная) 10,5
H2SO4 • Н2О 8,6
H2SO4 • 2Н2О - 38,9
H2SO4 • 4Н2О - 24,5
а) Постройте схематически фазовую диаграмму «тем-
пература — мольная доля». Обозначьте каждую об-
ласть, указав, какие фазы присутствуют, когда си-
стема имеет температуру и общий состав, соответ-
ствующий точкам этой области, б) Опишите все из-
менения, которые будут происходить, если серная
кислота добавлена в небольшое количество льда при
постоянной температуре —30°С. Если приведенные
Правило фаз
101
IX-2-24.
IX-2-25.
данные не позволяют в ряде случаев дать правиль-
ный ответ, укажите все возможные ответы и необхо-
димые добавочные данные для выбора правильного
решения.
А и В образуют два твердых соединения. А2В пла-
вится при 800° С; АВ2 разлагается при 700° С на
твердое В и жидкую фазу. Температура плавления А
500, В 1000° С. Твердые растворы соединения не об-
разуют. а) Постройте для системы А—В фазовую
диаграмму «температура—мольная доля». Обозначь-
те каждую область и определите фазу (фазы) в си-
стеме, соответствующей точке в этой области,
б) Жидкий раствор, содержащий 70 мол.% В, охла-
ждается медленно от 1100 до 400° С. Постройте гра-
фик зависимости температуры процесса охлаждения
от времени. Покажите, как каждая характерная точ-
ка кривой охлаждения связана с фазовой диаграм-
мой.
Золото и сурьма образуют соединение AuSb2. Эти
три вещества смешиваются в жидком состоянии во
всех отношениях, но не образуют твердые растворы
Друг с другом. Температуры плавления (°C) следую-
щие:
Au Sb AuSb2
1064 631 460
Получены следующие эвтектические точки [58]:
Au -J- AuSb2 -J- L AuSb2 -J- Sb -J- L
360° C; 35 ат. % Sb 456° C; 72 ат. % Sb
а) Постройте для этой системы фазовую диаграмму
«температура — ат.%». Обозначьте каждую область,
указав сосуществующие фазы системы, представлен-
ные точкой в этой области, б) Жидкий раствор, со-
держащий 20 ат. % Sb и 80 ат. % Au, медленно охла-
ждается от 1100 до 200° С. Начертите кривую зави-
симости температуры процесса охлаждения от вре-
мени. Свяжите каждую характерную особенность
кривой с фазовой диаграммой, в) Имеются два чи-
стых вещества Аи(Х) и AuSb2(Y), причем не извест-
но, что одно из них является соединением, включаю-
щим другое. Допустим, Вы изучаете фазовую диа-
грамму системы X — Y с помощью термического ана-
лиза. Как в этом случае, рассматривая фазовую диа-
грамму, Вы установите, что Y — соединение, содержа-
щее X, а X не является соединением, содержащим Y?
102
Глава IX
IX-2-26.
CaF2 и CaCh полностью смешиваются в жидком со-
стоянии. Следующие данные получены при охлажде-
нии различных жидких растворов CaF2 и СаС12:
Температура
СаС1г, мол. % начала затвердевания,
°C
Температура
при завершении
затвердевания, °C
0 1300 1300
30 1050 737
40 950 737
50 820 737
58 737 644
60 735 644
70 700 644
80 644 644
90 710 644
100 774 774
IX-2-27.
а) Постройте для этой системы фазовую диаграмму
«температура — мол.%». Обозначьте каждую область,
указав фазу (фазы) в системе, представленной точ-
кой в этой области, б) Опишите с помощью кривой
охлаждения изменение температуры со временем,ко-
гда смесь, состоящая из 55 мол.% СаС12 и 45 мол.%
CaF2, охлаждается от 1000 до 600° С. Свяжите каж-
дую характерную особенность кривой с фазовой диа-
граммой.
Приготовлено несколько жидких растворов магния и
меди. Каждый раствор медленно охлаждался, при
этом на диаграмму наносили температуру как функ-
цию времени. Видимый излом или остановку на ка-
ждой кривой охлаждения заносили в следующую таб-
лицу [59]:
Си, вес. % Излом, °C Остановка, °C
0 648
8,57 619 485
16,53 580 485
24.78 531 485
30,10 489 485
34,40 500 485
43,29 540 485
51,60 564,5 485
56,61 567,5 485
56,79 567,5 552
61,70 563 552
Правило фаз
103
Си, вес. % Излом, °C Остановка, °C
65,41 552
73,63 692 552
80,08 793 552
84,43 816 552
84,54 808 722
88,77 753,5 722
90,36 722
96,00 958 722
97,38 1005 722
97,75 1010, 804
98,50 1042, 874
100 1083
IX-2-28.
IX-2-29,
а) Постройте для системы Mg — Си фазовую диа-
грамму «температура—вес.%». Обозначьте области
и укажите фазы системы, представленной точкой
в этой области, б) Если образуются соединения, то
найдите их формулы.
Получены следующие данные для давления паров
жидкого и твердого SnBr4 при различных темпера-
турах [60]:
Твердый SnBr4 Жидкий SnBr4
/, °C 9,8 21,0 30,7 41,4
Р, мм рт. ст. 0,116 0,321 0,764 1,493
Рассчитайте для SnBr4: а) тройную точку, б) моль-
ную энтальпию возгонки и в) мольную энтальпию
плавления. В случаях (б) и (в) найдите энтальпии
алгебраическим и графическим методами.
При изучении правила фаз в жидкой области си-
стемы никотин — вода было открыто необыкновенное
явление [61].
В некоторой области состава по мере того как
исходный гомогенный раствор никотина и воды нагре-
вался и достигал некоторой температуры, происходило
его расслоение на две различные жидкие фазы, на-
ходящиеся в равновесии друг с другом. При даль-
нейшем увеличении температуры соотношение между
жидкими фазами постепенно изменялось до тех пор,
пока температура достигала предела, после которого
одна из фаз совершенно исчезала и система вновь
104 Глава IX
--------------------------1---------------------------------------
становилась гомогенной. За пределами этих концен-
траций система остается гомогенной во всех интерва-
лах температур. Таким образом, при нагревании рас-
творов никотина и воды получены следующие дан-
ные:
Никотин в системе вес. % Температура, при которой появляется вторая фаза. ° Температура, при которой система вновь становится G гомогенной, °C
6,8 94 95
7,8 89 155
10 75
14,8 65 200
32,2 61 210
49,0 64 205
66,8 72 190
80,2 87 170
82,0 129 130
Постройте для этой системы фазовую диаграмму
«температура—состав». Обозначьте все области и
укажите состав всех фаз, находящихся в равновесии
друг с другом при следующих условиях:
Никотин в системе, вес. % Температура, °C
а) 20 45
б) 20 120
в) 20 220
г) 90 120
IX-2-30. Найдено [62], что мышьяк(Ш)’' может быть отделен
количественно от висмута(Ш) и сурьмы(Ш) в 8 н.
растворе НС1 экстракцией бензолом. Коэффициент
распределения мышьяка Снго/Сбензол = 0>05. Висмут и
сурьма фактически не растворимы в бензоле при этих
условиях. Определите число порций по 50 мл чистого
бензола п, необходимое для обработки 50 мл водного
раствора 8 н. НС1, содержащего сначала 0,1000 г
мышьяка(III), для извлечения 0,1 мг мышьяка из вод-
ного слоя.
IX-2-31. На рисунке изображена фазовая диаграмма тройной
системы А—В—Н2О при 25° С. а) Можно ли полу-
чить твердое соединение А-В-2Н2О при этой темпе-
ратуре добавлением В к А-Н2О? Объясните, б) Опре-
делите общий состав системы в точке х, указанной
Правило фаз
105
1Х-2-32.
на диаграмме.
Следующие данные были получены путем определе-
ния мокрого осадка для трехкомпонентной системы
А—В—С (см. рисунок):
Ноды, №
Состав насыщенного
раствора
Состав осадка
а) Проведите в обычном порядке ноды и укажите со-
став чистой сухой твердой фазы, находящейся в рав-
новесии с насыщенным раствором, б) Укажите со-
став системы в точке Lj.
fiec7<
106
Глава IX
IX-2-33. При определении мокрого осадка тройной системы
А—В—С при 25° С получены следующие данные:
В, вес. % С. вес. %
Нода № 1
Насыщенный раствор 16,0 47,0
Мокрый осадок 32,0 37,0
Нода № 2
Насыщенный раствор 17,0 55,0
Мокрый осадок 30,0 42,0
Нанесите все приведенные выше данные на треуголь-
ную диаграмму. Проведите ноды и укажите состав
(вес.%) твердой фазы.
IX-2-34. При исследовании фазового равновесия системы
NH4F — KF — Н2О при 25° С получены следующие
данные [63]:
Насыщенный раствор Мокрый осадок
NH4F, вес % KF, вес. % NH4F, вес. % KF. вес. %
0 48,96
1,70 48,76 0,27 63,08
6,53 48,15 1,41 59,32
8,75 48,44 1,60 62,93
10,08 47,88 2,99 58,65
10,94 47,04 43,46 29,58
11,98 44,88 67,94 16,57
12,92 42,93 61,14 19,50
13,93 40,82 70,00 14,96
14,85 38,63 60,34 18,01
17,07 35,01 60.53 16,4
20,37 29,92 70,48 10,99
26,44 23,76 41,23 18,83
31,59 16,85 76,99 5,43
41,27 4,57 80,74 1,64
44,85 0
Нанесите эти данные на треугольную диаграмму, про-
ведите ноды и приведите формулы всех твердых фаз
в системе.
IX-2-35. Соли А и В имеют общий ион. В системе А—В—Н2О
наблюдается равновесие между следующими насы-
щенными растворами и твердыми фазами:
Правило фаз
107
Твердая фаза Раствор
А, мол. % В, мол. %
а-н2о 25 0
В-2Н2О 0 12
А • Н2О + В • 2Н2О 20 10
а) Постройте треугольную фазовую диаграмму (на-
сколько это возможно из приведенных данных). Обо-
значьте каждую область и перечислите присутствую-
щие фазы системы, представленной точкой в этой об-
ласти. б) Какая дополнительная информация необхо-
дима для того, чтобы отметить все качественные осо-
бенности диаграммы?
РАЗДЕЛ IX-3
IX-3-1. Бесконечно малое изменение поверхностного натяже-
ния у дается уравнением
kdt 2£ (?кр— t — dv
M2/1v/a 3M2/’o'/s ’
где M — молекулярный вес, v — удельный объем, k—
постоянная и /ьр— критическая температура (°C).
Вместо обычных координат, таких, как Р, V, Т, х
и т.п., постройте фазовую диаграмму, используя
в качестве координат поверхностное натяжение и тем-
пературу. Докажите, что это действительно возможно.
IX-3-2. Покажите, что на основании знака наклона можно
указать 8, и только 8, возможных уникальных распо-
ложений линий раздела двух фаз вблизи тройной точ-
ки на однокомпонентной диаграмме «давление — тем-
пература». Изобразите их графически.
IX-3-3. Объясните, почему система КС1 — NaCl'—Н2О долж-
на рассматриваться как трехкомпонентная, тогда как
система КС1 — NaBr — Н2О должна считаться четы-
рехкомпонентной.
IX-3-4. Для каждой из следующих систем установите число
компонентов:
a) NH4C1 (крист), NHt(aq), СГ(ац), Н2О (ж), H3O+(aq),
Н2О(г), NH3(r), OH"(aq), NH4OH(aq);
108 Глава IX
_______________________I.____________________________—------
б) NHiCl (крист), NH3(r), НС1(г), где парциальное
давление NH3 всегда равно парциальному давлению
НС1, как в случае, когда весь газ образует сублими-
рованный NH4CI (крист);
в) NH4CI (крист), NH3(r), НО (г), где парциальное
давление NH3 не обязательно равно парциальному
давлению НС1;
г) CH3COONH4 (крист), СН3СОО” (aq), NHj (aq),
H3O+(aq), NH3(aq), OH“(aq), CH3COOH (aq), Н20(ж),
Н2О(г), учитывая гидролиз;
д) КаО(крист), КВг(крист), K+(aq), Na+(aq),
Cl"(aq), Br~(aq), Н20(ж), Н2О(г);
е) КаО(крист), КСЦкрист), Na+(aq), Cl_(aq),
Н20(ж), Н2О(г);
ж) СаС12-6Н2О(крист), Ca2+(aq), Cl"(aq), Н20(ж),
Н2О(г);
з) СаСО3(крист), СаО(крист), СО2(г), где СаО и
СО2 образуются при распаде СаСО3(крист).
IX-3-5. Соли MX и MY образуют гидраты МХ-2Н2О и
MY-H2O. При 25° С раствор, состоящий из 20 мол.%
MX и 80 мол.% Н2О, насыщен МХ-2Н2О; раствор,со-
стоящий из 30 мол.% MY и 70 мол.% Н2О, насыщен
MY-H2O. Раствор, насыщенный обоими гидратами,
содержит 15 мол.% MX и 20 мол.% MY. Давление
паров воды, находящихся в равновесии с некоторой
смесью, следующее:
Смесь Давление, мм, рт. ст.
МХ + МХ-2Н2О MX • 2Н2О + насыщенный раствор (MY отсутствует) MY + MY • Н2О MY • Н2О + насыщенный раствор (MX отсутствует) MX • 2Н2О + MY • Н2О + насыщенный раствор в отношении обеих солей 13 19 10 17 14
а) Постройте треугольную фазовую диаграмму си-
стемы MX — MY — Н2О при 25° С и 1 атм, выразив
концентрации через мольные доли. Обозначьте ка-
ждую область.
Правило фаз
109
б) Опишите изменения, которые будут происходить
при конденсации фаз, когда водяной пар постепенно
откачивается из раствора, состоящего сначала из
10 мол.% MX, 10 мол.% MY и 80 мол.% Н2О, до тех
пор, пока вся вода не будет удалена. Укажите (на-
сколько это возможно сделать из приведенных дан-
ных) давление водяного пара для каждой стадии про-
цесса откачивания.
Глава X
ЭЛЕКТРОХИМИЯ
РАЗДЕЛ Х-1
Таблица Х-1
Стандартные восстановительные потенциалы
в водных растворах при 25° С
£°, В
Ag+ +е~ —> Ag (тв) +0,7996
Ag(NH3)+ + е~ —> Ag (тв) + 2NH3 (aq) +0,373
С12 (г) + 2е- —> 2С1- +1,358
Си2+ + 2е- —> Си (тв) +0,337
Си+ + е~ —> Си (тв) +0,522
Fe2+ + 2е~ —> Fe (тв) —0,440
Fe3+ + е~ —> Fe2+ +0,771
2Н+ +2е- —> Н2 (г) 0
Hg2+ + 2е~ —> 2Hg (ж) +0,7986
Hg2+ + 2е- —> Hg (ж) +0,854
Hg2Cl2 (тв) + 2е- —> 2Hg (ж) + 2С1" +0,2676
Na+ + e- —> Na (тв) —2,7132
О2 (г) + 4Н++4е- —> 2Н2О +0,1129
РЬ2+ + 2е~ —> РЬ (тв) -0,126
Т1+ + е- —► Т1 (тв) -0,3363
Т13++2е- —> Т1+ +0,125
Zn2+ + 2е- —> Zn (тв) —0,7628
Х-1-1. Для эквивалентной электропроводности амида азот-
ной кислоты, растворенного в воде при 15° С, были
получены следующие данные [64]:
Л, Ом-'• см2 • Г-ЭКВ-1 1,017 1,446 2,052 2,89 4,053
Лн+ = 298; ^Na+= 39,9 и A^aHNjO2=93 Ом-1-см2т-экв-1.
Определите константу равновесия для диссоциации
амида азотной кислоты в соответствии с уравне-
нием H2N2O2^ Н+ + HN2O2.
Электрохимия
111
X-l-2.
Докажите, что для равновесия моста Уинстона
Ri R<
Rz Ri
X-l-3.
Х-1-4.
Х-1-5.
Предельная эквивалентная электропроводность пи-
крата калия при 25°С 103,97 Ом-1 -см2-г-экв-1, по-
движность иона калия 73,58 Ом-1 •см2-г-экв~1 [65]. Вы-
числите подвижность пикрат-иона и его число пере-
носа при бесконечном разбавлении.
Электропроводность йодата калия (КЮ3) была из-
мерена при 25°С [66]. Данные приведены ниже в таб-
лице; с—концентрация йодата калия (г-экв-л-1);
А — эквивалентная электропроводность раствора с по-
правкой на воду. Определите Ао—предельную экви-
валентную электропроводность КЮ3.
0,00018265 113,07
0,00035295 112,61
0,00070430 111,91
0,00099845 111,45
0,0017117 110,55
0,0025362 109,78
0,0032859 109,19
0,0039118 108,78
Растворимость умеренно растворимого ферроцианида
кобальта Co2Fe(CN)6 определялась измерением удель-
ной электропроводности в насыщенном растворе [67].
Найдено, что при 25°С насыщенный раствор имеет
удельную электропроводность 2,06-10~6 Ом-1-см-1,
в то время как удельная электропроводность
используемой воды была 4,1 • 10-7 Ом-’-см'1. Подвиж-
ность иона Со2+ — 43 Ом"1-см2-г-экв-1 и иона
112
Глава X
X-l-6.
Х-1-7.
Х-1-8.
Х-1-9.
Х-1-10.
Fe(CN)^+ 111 Ом-1 -см2-г-экв-1. Определите раство-
римость Co2Fe(CN)6 в воде при 25° С.
Эквивалентная электропроводность (Л) хлората се-
ребра для ряда концентраций с (г-экв-л*1) приведена
ниже [68]:
С Л
0,0010256 123,43
0,0013694 122,94
0,0029782 121,14
0,0032500 120,95
Найдите Ло для этого соединения.
0,1000 М водный раствор LiX имеет удельную элек-
тропроводность 0,009000 Ом-1-см-1 при 25°С. Ионная
электропроводность Li+ 39,5 Ом_1-см2-г-эквч. Най-
дите: а) эквивалентную электропроводность раство-
ра; б) ионную электропроводность X- (настолько точ-
но, насколько позволяют имеющиеся данные).
Раствор сильного электролита АВ подвергался элект-
ролизу в аппарате Гитторфа под током 0,100 А
(ампер) в течение 9650 с. Реакции на электродах:
А-*А+ + е~; А+ 4- е_->А. Раствор имел исходную кон-
центрацию 0,100 моля АВ на 1 кг Н2О. После завер-
шения электролиза в анодном пространстве раствор
состоял из 100 г Н2О и 0,0165 моля АВ. Найдите
число переноса иона А+ в этом растворе.
При определении числа переноса иона Na+ в 0.0200М
NaCl методом подвижной границы при 25° С получе-
ны следующие данные [69]:
/, см (смещение 0 ’ 1,00 6,00 10,00
подвижной границы)
t, с 0 341 2070 3453
Катод Ag| AgCl, анод Cd. Площадь поперечного се-
чения трубы равна 0,1115 см2. Ток 0,0016001 А. Вычис-
лите число переноса иона Na+ в этих условиях.
Определение чисел переноса методом подвижной гра-
ницы было выполнено при 25°С с растворами, содер-
жащими в 1 л 0,100М КС1 внизу трубки и (исходный)
0.0700М NaCl вверху трубки. Числа переноса К+ и
Na+ в этих растворах равны 0,490 и 0,388 соответ-
ственно. Подвижная граница опускалась. Площадь
поперечного сечения трубки 0,100 см2. Было передано
96,5 Кл электричества, а) Как далеко продвинулась
Электрохимия
ИЗ
подвижная граница? б) Какова концентрация NaCl
непосредственно над границей во время протекания
тока?
Х-1-11. Были получены следующие данные по растворимо-
сти S умеренно растворимой трехвалентной соли
[Co(NH3)6]III[Fe(CN)6]111 при 25° С в присутствии
KNO3 [70]:
Концентрация прибавленного KNO8, М S-Ю5, м
0 2,900
0,0005 3,308
0,0010 3,586
0,0020 4,080
Покажите, что эти данные находятся в согласии
с теорией Дебая—Хюккеля, и вычислите средние
коэффициенты активности ионов [Со(КНз)б]3+ и
[Fe(CN)e]3~ для каждой приведенной концентрации.
Х-1-12. Константа диссоциации молочной кислоты при 25° С
равна 1,4-10"4. Буферный раствор приготовлен доба-
влением 1,00 моля молочной кислоты и 0,80 моля мо-
лочнокислого натрия к 1 кг воды. Примем, что коэф-
фициент активности воды равен единице, а коэффи-
циент активности каждого одновалентного иона (во
всех случаях) равен 0,65. Найдите: а) pH (через ак-
тивности) этого раствора при 25° С; б) изменение pH
раствора в результате добавления 0,50 моля гидро-
окиси натрия к количеству раствора, содержащему
1 кг воды; в) изменение pH в результате добавления
0,50 моля гидроокиси натрия к 1 кг чистой воды при
25° С.
Х-1-13. Произведение растворимости CuCl при 25° С равно
2,29-1 О*7. По этим данным и стандартному восстано-
вительному потенциалу, приведенному в табл. Х-1,
вычислите: а) Е° для цепи С1“|СиС1(тв) |Си(тв);
б) стандартную свободную энергию CuCl (тв)
(кал-моль-1).
РАЗДЕЛ Х-2
Х-2-1. Какое заключение может быть сделано о полноте дис-
социации перхлората кадмия в разбавленном водном
растворе при 25° С из приведенных ниже данных по
его эквивалентной электропроводности Л [71]:
114
Глава X
Концентрация, г-экв-л"""1 Л, Ом""1 «см2«Г’ЭКВ 1
0,1 92,64
0,08 94,21
0,06 96,22
0,04 98,93
0,02 103,30
0,01 107,15
0,005 110,45
0,001 115,74
В значения, приведенные в таблице, были внесены
поправки на гидролиз. (Примечание. Постройте гра-
фик зависимости Л от с'11.)
Х-2-2. Опишите путь перехода от уравнения K=kafl к вы-
ражению Л=Ю00й/с (К — электропроводность, с —
концентрация, k — удельная электропроводность, а —
площадь, I — длина, Л — эквивалентная электропро-
водность).
Х-2-3. Раствор, содержащий 0,0250 моля Na2SO4 на 100 г
воды, подвергнут электролизу в аппарате Гитторфа
между инертными электродами. Реакция на аноде:
2Н2О-»4Н+ + О2 + 4е~.
В конце опыта анодное пространство содержало
100 г Н2О и, как установлено титрованием, 0,0100 мо-
ля Н+. Число переноса Na+ в этом растворе равно
0,390. Определите число молей Na+ и SO42- в анодном
пространстве в конце опыта.
Х-2-4. Аппарат Гитторфа заполнен водным раствором AgX,
в котором находится 1,500 г AgX на 101,5 г раствора.
Через раствор пропускался постоянный ток до тех
пор, пока на катоде не осело 1,0787 г серебра. Затем
ток был отключен, раствор удален из катодного про-
странства; он весил 100,5 г и содержал 0,500 г AgX.
Молекулярный вес AgX 150 г-моль-1. Определите чи-
сло переноса Ag+ в растворе AgX.
Х-2-5. Раствор CuSO4 подвергнут электролизу в аппарате
Гитторфа с электродами из РЦинертн). Процессы на
электродах:
2Н2О—>4Н+ + О2 (г)4-4е-
Cu2+ + 2e"->Cu
Исходный раствор был 0,1000м. В конце электролиза
анодное пространство содержало 100,0 г Н2О,
0,00500 моля H2SO4 и 0,00800 моля CuSO4. Примите,
что ионами, присутствовавшими в начале опыта и
Электрохимия
115
Х-2-6.
Х-2-7.
Х-2-8.
покидающими анодное пространство за время опыта,
были Си2+ и SOh а) Определите количество электри-
чества (в фарадеях), прошедшего через цепь, б) Вы-
числите число переноса для иона Си2+ в CuSO4.
в). В конце электролиза катодное пространство со-
держало 100,0 г Н2О. Сколько молей CuSO4 содер-
жалось в катодном пространстве? г) Эквивалентная
электропроводность CuSO4 при бесконечном разведе-
нии равна 133,6 Ом-1 •см2-г-экв'1. Вычислите подвиж-
ность иона Си2+ при бесконечном разведении. Какие
приближения Вы использовали в этом расчете?
Водный раствор K4Fe(CN)e с исходной концентра-
цией 1,000м подвергался электролизу при 25°С в ап-
парате Гитторфа с Pt-электродами до тех пор, пока
через него не прошло 0,0100 фарадея электричества.
Реакция на аноде: Fe(CN)^_-»Fe(CN)^_ -f- е~. После
электролиза раствор, находящийся в анодном про-
странстве, содержал 100,0 г Н2О и 1,015 моля Fe (об-
щее количество), а) Чему равен эквивалент моля
Fe(CN);!- с точки зрения электропроводности (1) и с
точки зрения реакции, протекавшей при электроли-
зе (2)? б) Сколько молейРе(СК)^-прореагировало на
аноде? в) Сколько молей Fe(CN)j!_ поступило в анод-
ное пространство или ушло (и в каком состоянии) из
анодного пространства? г) Вычислите число переноса
Fe(CN)|" в K4Fe(CN)s. д) Вычислите подвижность
иона Fe(CN)^- при бесконечном разбавлении при 25° С,
если для иона К+ она равна 73,52 Ом'Гсм^г-экв"1.
Укажите приближения, которые необходимо сделать
при этом расчете.
Кажущееся число переноса t+ иона Zn2+ в растворе
Znl2 измерено с использованием концентрационной
цепи с переносом и без переноса. Число переноса из-
менялось с изменением m (моляльность Znl2), что
видно из следующих выборочных данных [72]:
m 0,05 0,1 1,0 2,5 4,0 5,0 10,0
t+ 0,382 0,363 0,291 0,115. -0,050 -0,190 -0,550
Как объяснить эти отклонения t+? Может ли t+ быть
отрицательным?
Формула t±=Et!E (Et — потенциал цепи с перено-
сом, Е — потенциал соответствующей цепи без пере-
носа) может быть справедлива для расчета чисел пе-
реноса из данных по ЭДС, только если рассматривать
их независимыми от концентрации. Если числа пере-
116
Глава X
носа изменяются с концентрацией, как, ’ например,
в случае раствора LiCl, то t+ может быть рассчитано
по формуле
dEt=± 2t±~d\na±,
где а± — среднее геометрическое активностей ионов
в одном из растворов. t+ появится, если электроды
обратимы в отношении отрицательных ионов, и на-
оборот. Получено [73] следующее эмпирическое урав-
нение для ЭДС цепи, эквивалентной ячейке с перено-
сом Ag | AgCl | LiCl (ci) | LiCl (c2) |AgCl|Ag:
Et — —43,865 + 45,363 (IgA) — l,4902(lg A)2,
где А в IO4 больше средней ионной активности LiCl
при концентрации ci; Et выражено в мВ, а± при кон-
центрации с2 равно 10~3 (этот выбор устанавливает
только постоянный предел Et). Коэффициент актив-
ности 0.010М раствора LiCl равен 0,905. Вычислите t+
для 0,010М раствора LiCl.
Х-2-9. Средний коэффициент активности электролита в раз-
бавленном растворе дается приближенным уравне-
нием
In у± = — А Ут,
где т — моляльность, А — постоянная. Используя
уравнение Гиббса — Дюгема, выразите коэффициент
активности растворителя у, в разбавленном растворе
через А, т и постоянные, характеризующие раство-
ритель и растворенное вещество. Отметим, что
1П= 1П—= 1п -Г—V- - - —.
1 + ту 1 + mv/n, tii
где v — число ионов в молекуле соединения (напри-
мер, для NaCl v=2) и П\ — число молей раствори-
теля в 1000 г растворителя. Следовательно, все вели-
чины, за исключением yi, которые неизвестны, могут
быть выражены через переменную т.
Х-2-10. Произведение растворимости AgCl при 25°С равно
1,71-10"10.
Определите: а) средний коэффициент активности ио-
нов AgCl, выраженный через моляльности, в насы-
щенном водном растворе при 25° С; б) средний коэф-
фициент активности ионов AgCl в насыщенном вод-
ном растворе при 25°С, выраженный через мольные
доли относительно разбавленного раствора,
Электрохимия
117
Х-2-11. Улучшенный предельный закон Дебая — Хюккеля
дает следующее уравнение для коэффициента актив-
ности отдельного иона М с зарядом гм:
— Az^ УТ
lg YM = — + Zj 5мх(.тХ/,
где А— постоянная Дебая — Хюккеля, I — ионная
сила, сумма всех присутствующих ионов с зарядом,
противоположным заряду М, Вмх,- характеризует
пару MX, и tnxt — моляльность иона X,. Покажите, что
для электролита Mv+Xv- средний коэффициент актив-
ности выражается так:
— ЛI zMzx I К/ V, xi,
Y± — Y+Vf ь X Вмх,т\ +
+ v+ + V_ X Вмх."Ч>
где первая сумма — сумма отрицательных ионов, вто-
рая — сумма положительных ионов.
Х-2-12. Термодинамическая константа диссоциации a-хлор-
пикриновой кислоты при 25° С равна 1,47-Ю-3. Вы-
числите степень диссоциации кислоты в 0,010 м вод-
ном растворе при 25° С. Для определения коэффи-
циентов активности используйте предельный закон
Дебая — Хюккеля.
Х-2-13. Константа диссоциации 2-тиофенкарбоновой кисло-
ты (C4H3SCOOH, или НА) Ка = 3,3-10-4 при 25° С.
а) Найдите стандартный электродный потенциал Е°
для полуреакции
НА (aq) + е" -> A- (aq) + >/2Н2 (г).
б) Определите долю НА, продиссоципровавшую
в 0,200 м водном растворе НА, содержащем, кроме
того, 1,00 м MgCl2. Используйте разумное приближе-
ние при расчете коэффициентов активности, но не до-
пускайте, чтобы они были равны единице.
Х-2-14. Константы диссоциации Н2СОз при 25° С Ki = 4,3X
ХЮ-7 и К2=5,61 • 10*и. Для 0,10 м водного раствора
ИаНСОз при 25° С а) напишите уравнения, необхо-
димые для расчета моляльности всех присутствую-
щих частиц; б) введя упрощения, найдите моляль-
ности Н+ и СО^_ в растворе. Примите, что активности
равны моляльностям.
Примечание. Для задач Х-2-14—Х-2-19 константа
диссоциации воды равна 1,00-10-14.
118
Глава X
Х-2-15. Константа диссоциации кислоты HF равна 3,5-10-4.
Константа диссоциации новокаина (основание) равна
7 10-6. Приготовлен раствор 0,100 моля HF и 0,200 мо-
ля новокаина в 1000 г воды, а) Напишите шесть урав-
нений, в которых неизвестными будут моляльности HF,
новокаина (В), F-, иона новокаина (ВН+), Н+ и ОН-.
Примите, что активности равны моляльностям,
б) Сделав подходящие приближения (о состояниях
частиц), решите эти уравнения для моляльностей
HF и Н+.
Х-2-16. Константы диссоциации никотиновой кислоты и хи-
нолина (основание) при 25° С равны 1,4-10-5 и 8,7Х
ХЮ-6 соответственно. Приготовлен раствор 0,100 мо-
ля хлорида хинолина и 0,050 моля никотината калия
в 1000 г воды при 25° С. а) Напишите все уравнения,
решения которых дадут моляльность каждой химиче-
ской частицы в этом растворе, за исключением воды.
Примите, что активность воды равна единице и коэф-
фициент активности каждого одновалентного иона ра-
вен 0,70. б) Введите упрощающие допущения и най-
дите моляльности Н3О+ и никотиновой кислоты в рас-
творе.
Х-2-17. Хинин (C20H24N2O2)—основание (Q), которое может
принимать два протона. Первая и вторая константы
диссоциации равны Ki = 2,0-10-6 и Кг = 1,35-10-10.
Раствор приготовлен добавлением 0,10 моля хинина
и 0,10 моля НС1 к 1,00 кг воды при 25° С. а) Опреде-
лите ионную силу раствора. Использовав полученный
результат и уравнение Дебая — Хюккеля, найдите
приближенно коэффициент активности каждого иона
в этом растворе, б) Напишите уравнения, решения
которых дадут моляльность каждой химической ча-
стицы в растворе, за исключением воды. Примите, что
активность воды равна единице, в) Сделайте необхо-
димые упрощения для определения моляльности ОН-
и хинина в растворе.
Х-2-18. Константа диссоциации миндальной кислоты в вод-
ном растворе при 25°С 4,29-IO-4; константа диссо-
циации n-анизидина (основание) 5,13-106. Раствор
приготовлен добавлением 0,040 моля миндальной кис-
лоты и 0,060 моля n-анизидина к 1000 г воды при
25° С. (Только одна фаза присутствует при равнове-
сии.) а) Определите ионную силу раствора. Исполь-
зуя полученный результат и уравнение Дебая — Хюк-
келя, найдите коэффициент активности каждого иона
в растворе, б) Составьте уравнения, решения кото-
рых дадут моляльность каждой химической частицы
Электрохимия
119
в растворе за исключением воды. Примите, что ак-
тивность и мольная доля воды равны единице, в) Сде-
лайте подходящие допущения для определения мо-
ляльностей миндальной кислоты и Н+ в растворе.
Х-2-19. Константы диссоциации глицин-иона (кислота)
Н2С--С—ОН
NHJ О
при 25° С следующие: /<i=4,47-10-3 и /<2= 1,66-10_,°.
0,100 моля глицина и 0,040 моля NaOH растворены
в 1000 г воды при 25° С. а) Определите ионную силу
раствора. Используя полученный результат и урав-
нение Дебая — Хюккеля, определите коэффициент ак-
тивности каждого иона в растворе, б) Составьте урав-
нения, решения которых дадут моляльность каждой
частицы в растворе, за исключением воды, в) С по-
мощью подходящих упрощений получите уравнение,
в котором неизвестным будет моляльность глицин-
иона. г) Решите его, введя дальнейшие необходимые
приближения.
Х-2-20. а) Предложите гальваническую ячейку, в которой
происходил бы процесс:.
РЬ(тв) CuBr2(aq; 0,010 м, сильный электролит)->
—>РЬВг2(тв) -)-Си(тв). Изобразите ячейку в услов-
ной системе обозначений, б) Для этой ячейки при
25°С Е = 4-0,442 В. Приняв средний коэффициент ак-
тивности CuBr2^±=0,707= IO*0-150, найдите Е° ячей-
ки. в) Определите произведение растворимости РЬВг2
при 25° С.
Х-2-21. Na(TB)|NaI в СгНбК'НДж) |Na (0,206% в Hg)
Е = 0,8453 В
Na(0,206% в Hg)|NaCl(aq, 0,1005M)|Hg2Cl(TB)|Hg(»)
Е = 2,2676 В
Для 0,1005м NaCl lgy± = —0,1019. Вычислите
стандартный потенциал гипотетической полуцепи
Nh(tb) |Na+(aq). Сравните результат расчета с таблич-
ными данными.
Х-2-22. Следующие данные относятся к цепи
Zn (тв) |ZnSO4(aq,моляльности = m) I РЬВОДтв) IРЬ при
25° С:
m Vm RT i —дг- In пг, В E, В
0,001000 0,03162 -0,17745 0,59714
0,005000 0,07071 -0,13611 0,56598
120
Глава X
а) Напишите химические уравнения для процессов,
протекающих в цепи, б) Напишите уравнение Нерн-
ста для цепи, включающее т и средний коэффициент
активности ZnSO4 у±. Примите, что PbSO4 нераство-
рим. в) Линейной экстраполяцией, графически или
численно определите Е° цепи, г) Определите у±
в 0,005 м растворе с помощью данных по ЭДС.
Х-2-23. а) Для реакции 2Ag(Te)o+РЬ5О4(тв)->РЬ(тв)-ф
+ 2Ag+ (aq) + SO4*(aq) ДД2Э8 = 53,22 ккал, AG298 =
= 53,41 ккал и АСр, 298= — 8,7 кал • °К-1. Вырази-
те константу равновесия К как функцию температу-
ры. Выражение должно содержать только Т и числен-
ные величины. Сделайте необходимые и разумные
приближения, б) Составьте гальваническую цепь (или
комбинацию цепей), которая может быть использо-
вана для определения К приведеннной выше реакции
при одной температуре. Покажите, какие измерения
должны быть проведены и как они могут быть при-
менены к расчету К (проиллюстрируйте это графиче-
ски). Примите, что PbSO4 нерастворим, a Ag2SO4 до-
статочно растворим в воде, в) Покажите, как будет
зависеть К от активностей ионов, выраженных в «ра-
циональной» шкале (мольные доли) вместо «практи-
ческой» шкалы концентраций (моляльность).
Х-2-24. Для гальванической цепи Pt | Н2 (1 aTM)|HBr(aq; с,
моль-л-1) | AgBr(TB) | Ag при 25° С получены следую-
щие обратимые ЭДС:
Раствор е 1 2 3
Ю4с 4,042 8,444 37,19
Е, В 0,47381 0,43636 0,36173
а) Напишите уравнения процессов, протекающих в
цепи, б) Из данных для каждого раствора 1 и 2 (от-
дельно) вычислите Е° цепи на основе предельного за-
кона Дебая — Хюккеля. Примите, что молярности
равны моляльностям, в) Оцените графически дей-
ствительное значение Е°. г) Определите средний ко-
эффициент активности НВг в растворе 3 из экспери-
ментальных данных и из предельного закона Де-
бая — Хюккеля.
Х-2-25. Для цепи Pt | И2(г, 1 атм) | НВг (т) |AgBr|Ag при 25° С
получены следующие потенциалы [74]:
Электрохимия
121
m Ь
0,005125
0,010021
0,015158
0,02533
0,03006
0,34594
0,31265
0,29225
0,26718
0,25901
Х-2-26.
Определите Е° для этой цепи при 25° С.
Вычислите константу диссоциации этилового спирта
при 25° С, т. е. К для реакции С2Н5ОН —* С2Н5О" +
+ Н+, из следующих данных [75]:
Е° при 25° С, В
а) Н21 НС1 (в С2Н5ОН) | Hg2CI2 | Hg -0,0216
б) Hg|Hg2Cl2 |NaCl (в С2Н5ОН)|
Na (2-фазн. амальгама) —1,8562
в) Na (2-фазн. амальгама) | NaOC2H5 0,7458
(в С2Н5ОН) | Н2
Х-2-27.
а) Напишите уравнение суммарной реакции, проте-
кающей в цепи Pt|H2(l атм)|НА, NaA, NaCl, Н2О[
|AgCl|Ag, где НА — слабая кислота, б) Выразите
(Е — Е°) для цепи через Т, универсальные постоян-
ные, моляльности и коэффициенты активностей (сред-
них ионных активностей, где это возможно) НА, NaA
и NaCl. Опишите, как можно экспериментально опре-
делить Е° цепи, в) Перепишите ответы (а) и (б) для
цепи, подобной (а), в которой НА заменена на НО
и NaA отсутствует. Примените полученное в пункте
(б) основное выражение к новой цепи, г) Покажите,
как можно скомбинировать (а) и (в), чтобы сум-
марная реакция комбинированной цепи была сле-
дующая:
НА + Н2О^Н3О+ +А-.
Х-2-28.
д) Выразите константу равновесия К (или 1g Е) этой
реакции через Е° и Е°'. Покажите, каким образом из-
мерения комбинированной цепи могут быть приме-
нены для определения К.
а) Найдите средний коэффициент активности ионов
в 0,00500 м водном растворе ZnCl2 при 25° С, исполь-
зуя уравнение Дебая — Хюккеля. б) ЭДС цепи
Zh(tb) |ZnCl2(aq, 0,00500 м) |Hg2Cl2|Hg(ж) при 25°С
122
Глава X
Х-2-29.
Х-2-30.
Х-2-31.
Х-2-32.
Х-2-33.
равна +1,2272 В. Найдите Е° цепи, приняв, что к пей
приложимо уравнение Дебая — Хюккеля. в) Вычис-
лите Е° с помощью данных, приведенных в табл. Х-1,
и сравните результаты (б) и (в).
В цепи Cd(Xi) в Hg|CdSO4 (раствор) | Cd (Х2) в Hg
электродами являются растворы (амальгамы) кад-
мия в ртути, в которых мольная доля кадмия равна
Xi и Х2 соответственно. Ртуть можно рассматривать
инертной, а) Рассчитайте обратимую ЭДС (какой
знак?) цепи при 25° С и Xi = 1,75-10-2, Х2 =
= 1,75-10-4, приняв, что Cd и Hg образуют идеаль-
ный раствор, б) Наблюдаемая ЭДС цепи равна
0,05926 В. Найдите отношение коэффициентов актив-
ностей (выраженных в мольных долях) кадмия в
обеих амальгамах.
Используя данные таблицы Х-1, рассчитайте ЭДС для
полуреакции 2Hg2+ + 2е~ —> Hg2+.
Оцените Е° полуреакции Fe->Fe3+ + 3e~ по данным
табл. Х-1.
При потенциометрическом титровании 10 мл раствора
урана(III) 0,09064 н. КгСггО? получены [76] следую-
щие данные.-Постройте графики зависимости Е от V
и Л£/ЛУ от V (среднее между последующими объе-
мами) и определите общий объем К2Сг2О7, прибав-
ленного в точках эквивалентности U(IV) и U(VI).
V, мл К2СГ2О7 Е, мВ И, мл К2СГ2О7 Е, мВ
0,0 —570 4,4 по
0,05 —565 6,5 120
0,15 -560 8,7 130
0,2 —530 10,3 140
0,25 —490 10,4 150
0,3 —440 10,5 170
0,35 —70 10,6 350
0,4 50 10,8 370
0,5 65 10,9 390
2,5 90 11,1 420
11,55 440
Укажите условия, при которых справедливо каждое
из следующих уравнений:
а) £ = 0; б) £° = 0;
в) Л = Ло — const • с1г; г) 1g у± = — 0,509
д) /+=тг+д_; е) a3± = 4m3v3±;
u + I и —
Электрохимия
123
ж)с— 1000-Д-; з) ЬН = -п^\Е-Т^\ 1;
До ’ L оТ )Р\
и) ^-=4-
Х-2-34. Некоторое газообразное соединение имеет молекуляр-
ный вес 100,0 г-моль-1. Его плотность постоянна
1,000-10-3 г-см-3, диэлектрическая проницаемость
1,001212 при 200° К и 1,0007575 при 400° К- Опреде-
лите постоянный дипольный момент р, и поляризуе-
мость а молекулы X. Покажите размерности р и а.
РАЗДЕЛ Х-3
Х-3-1. Раствор FeCU был сначала 2,0000 м, затем он был
подвергнут электролизу между электродами из
РЦинерт.) по опыту Гитторфа при 25° С. Реакция на
катоде: Fe3++ е~ -> Fe2+. После электролиза в катод-
ном пространстве содержалось 50,00 г Н2О, 1,5750 м
FeCl3 и 0,500 м FeCl2. а) Какое количество электриче-
ства прошло через цепь? б) Найдите число пере-
носа иона С1_ в растворе, в) Подвижность СГ 76,35
Ом-1-см2-г-экв-1. Определите подвижность Fe3+ при
25° С. Какие приближения необходимо сделать при
расчете?
Х-3-2. Водный раствор, содержащий NaBr и Вг2, использо-
ван в опыте Гитторфа. Единственные реакции на элек-
тродах:
2Вг_ —» Вг2 4- 2е~, Вг2 + 2е_ —> 2Вг~.
После электролиза в анодном пространстве в 100 г
Н2О содержалось 0,1100 моля Вг2 и 0,0920 моля NaBr;
в катодном пространстве в 100 г Н2О содержалось
0,0900 моля Вг2 и 0,1080 моля NaBr. Вг2 оставался
в растворе. Определите числа переноса ионов Na+ и
Вг_ в растворе. {Примечание. Учтите количество Вг2
в начале опыта в каждом отделении.)
Х-3-3. а) Предположим, что средний коэффициент активно-
сти ионов некоторого электролита дается уравнением
1gУ± = — В Vm -f- Cm, где m — моляльность электро-
лита, В и С — постоянные. Выразите коэффициент
активности растворителя yi через В, С, m и количе-
ственные характеристики растворителя и раствора,
б) Из полученной формулы найдите у, в 0,0010 м вод-
ном растворе Na2SO4 при 25° С, приняв, что С = 0, а
В определяется предельным уравнением Дебая — Хюк-
келя. Примите, что моляльности равны молярностям.
Найдите осмотическое давление л в 0,0010м водном
растворе Na2SO4 при 25° С,
124
Глава X
Х-3-4. Теория Дебая — Хюккеля предполагает, что раствор
в целом электронейтрален: По = о. о0=2од,
i
где Ct — концентрация ионов i, выраженная в ионах
на 1 см3, Qi — заряд соответствующего иона, выра-
женный в электростатических единицах на 1 ион. При-
мем более общую теорию, не учитывая этого предпо-
ложения. В таком случае
1 d I ? dU\
г2 dr \Г dr)
__ 4л£о
e
где U — электростатический потенциал на расстоя-
нии г от некоторого иона, b Ct.z^11, е —
\ i /
заряд электрона, 8—диэлектрическая проницаемость
среды, Zi — Qi/e, k и Т имеют обычное значение. Об-
щее решение этого дифференциального уравнения
следующее:
у___ Л ехр (— Ьг) + В exp (Ьг) . 4лсг0
г ' Ь2е ’
где А и В — постоянные интегрирования. Получите
выражение для коэффициента активности (или его ло-
гарифма) для иона с зарядом z на основе общей тео-
рии через b, со, z, е, Т и универсальные постоянные.
Примите, что при бесконечном разбавлении предел для
о0/62 — 0.
Х-3-5. Определите pH для 10-8М раствора НС1 при 25° С.
Х-3-6. Человек, который имеет поверхностное представление
о термодинамике, спрашивает вас о следующей труд-
ности: «ЭДС цепи Pt|Н2 (г) |НС1 (aq)|AgCl|Ag дает-
ся уравнением
ан*асг
---- 1П --Г77--
gr №
1 П2
Но aH+acl-/f$2—константа равновесия реакции
у Н2 + AgCl->Ag + Н++ СГ. Ее значение для лю-
бой температуры, а также Е° можно взять из таб-
лицы. Можно ли заключить, что Е зависит только от
температуры?» Объясните, что неправильно в сделан-
ном предположении, что правильно в утверждении и
при каких особых условиях, (если они имеются) пред-
положение и заключение будут справедливы.
Х-3-7. а) Составьте гальваническую цепь (или комбинацию
цепей), которую можно использовать для опреДеле-
Электрохимия
125
ния AG°процесса Ag(TB) + у Вг2(ж)->А§Вг(тв) при
некоторой температуре. Покажите, как может быть
рассчитан AG° полученной цепи, б) Эксперименталь-
ное значение AG° при 25° С равно —96 кДж. Какое
значение (если оно вообще имеется) имеет константа
равновесия, рассчитанная из этой величины? Объяс-
ните.
Х-3-8. а) Найдите константу равновесия реакции
Ag(NH3)2+5±Ag+ + 2NH3(aq) при 25° С.
б) Опишите цепь (или сочетание цепей), не имеющую
скачка потенциалов в месте соприкосновения жидко-
стей, когда происходит приведенная (или обратная)
реакция. (Примечание. Ag2SO4 среднерастворим
в Н2О, но PbSO4, подобно AgCl, почти нерастворим.)
в) Напишите уравнение Нерпста (Е как функция ак-
тивностей) для описанной выше цепи и покажите, что
Е действительно зависит от средних активностей
ионов, а не от активностей однозарядных ионов.
Х-3-9. Раствор, содержавший сначала 0,10 М Т1+ и 1,0 М
НС1, оставлен на воздухе при температуре 25° С и
общем давлении 1,00 атм до тех пор, пока Т1+ (на-
сколько возможно) окислится в состояние Т13+. Какое
количество (мол.%) присутствовавшего Т1+ останется
неокисленным?
Х-3-10. Вычислите п в формуле Со(КН3)2+ из следующих
данных по ЭДС, полученных при 25° С [77]:
Со10,050М СоС12 + х М NH3|l,00M NaH|HgO|Hg.
Концентрация NH3, М ЭДС цепи, В Давление пара NH3, мм рт. ст.
6 4 3 2 0,715 107,7 0,693 63,4 0,659 44,7 0,620 27,8
Концентрация NH3 изменялась, но общая концентра-
ция кобальта оставалась постоянной. Можно при-
нять, что [Со2+] мала по сравнению с [Co(NH3)2+] и
[Co(NH3)2+] остается, следовательно, постоянной. Та-
ким образом, можно предположить, что концентрация
свободного NH3 в растворе пропорциональна давлению
паров NH3 над раствором.
126
Глава X
Х-3-11. Вообще нельзя складывать интенсивные свойства ча-
стей системы для того, чтобы получить соответствую-
щие свойства всей системы. Так, например, удельный
объем системы (мл-г*1) не является суммой удельных
объемов частей системы. Для того чтобы рассчитать
удельный объем системы V, состоящей из двух частей,
необходимо умножить удельный объем каждой части
на массу этой части, получив общий объем частей
(экстенсивное свойство), а затем сложить эти объемы
и разделить на общую массу:
V . •
тх + т2
Электрический потенциал — интенсивное свойство
(Дж-Кл-1). Однако при простом сложении потенциа-
лов двух полуэлементов получим потенциал всей
цепи, не принимая во внимание размер полуэлемента
и количества веществ, реагирующих в нем. Как отве-
тить на этот парадокс?
Х-3-12. Предположим, что эффективное поле, действующее
на молекулу, дается уравнением F = Е 4--^-Р, где
п — постоянная. (Это уравнение является обобщением
известного уравнения для случая, когда п = 3.) Полу-
чите уравнение (аналогичное уравнению Клаузиуса —
Мосотти) для поляризации а, включающее п, диэлек-
трическую проницаемость е, молекулярный вес, плот-
ность и универсальные постоянные.
Глава XI
КИНЕТИКА
РАЗДЕЛ XI-1
Х1-1-1. Превращение перекиси бензоила в диэтиловый эфир
(реакция первого порядка) при температуре 60°С
прошло за 10 мин на 75,2% [78]. Вычислите кон-
станту скорости реакции.
XI-1-2. При изучении взаимодействия между ионами брома
и хлорноватистой кислоты С10-+ Вг_—* ВгО-Cl-
смешивали 100 мл 0,1 н. раствора хлорноватистокис-
лого натрия, 48 мл 0,5 и. раствора едкого натра и
21 мл дистиллированной воды; смесь помещали в тер-
мостат при 25° С [79]. К смеси добавляли 81 мл
1%-пого раствора бромистого калия также при 25°С.
Через определенные промежутки времени (/) отби-
рали пробы и определяли в них содержание иона
ВгО~. Результаты анализов приведены ниже:
t, мин 0 3,65 7,65 15,05 26,00 47,60 90,60
Концентрация 0 0,0560 0,0953 0,1420 0,1800 0,2117 0,2367
ВгО-,
моль • л-1 • 102
Концентрации NaClO и КВг в реакционной смеси при
t = 0 были равны 0,003230 М и 0,002508 М соответ-
ственно, pH раствора 11,28. Определите порядок реак-
ции и константу скорости.
XI-1-3. Для изучения разложения щавелевой кислоты в кон-
центрированной серной кислоте при 50°С готовили
раствор 'До М щавелевой кислоты в 99,5%-ной сер-
ной кислоте [80]. Через определенные промежутки вре-
мени t из смеси отбирали пробы и определяли объем
раствора перманганата калия и, необходимый для ти-
трования порции в 10 мл. Получены следующие дан-
ные:
t, мин 0 120 240 420 600 900 1440
о, мл 11,45 9,63 8,11 6,22 4,79 2,97 1,44
Определите порядок реакции относительно щавелевой
кислоты и константу скорости.
XI-1-4. Кинетика реакции тиосульфата натрия с н-пропил-
бромидом ЗгОз" 4- RBr —► RSSO3 + Вт” изучалась
при 37,50°С [81]. Концентрацию иона опреде-
ляли через различные интервалы времени t титрова-
128
Глава XI
Xl-1-5.
XI-1-6.
Xl-1-7.
XI-1-8.
нием. Для титрования использовали v мл 0,02572 н.
раствора иода на одну порцию реакционной смеси
(10,02 мл). Начальная концентрация тиосульфата,
присутствующего в избытке, составляла 0,100 М. По-
лучены следующие данные:
/, с 0 1110 2010 3192 5052 7380 11232 78840
V, мл 37,63 35,20 33,63 31,90 29,86 28,04 26,01 22,24
Вычислите константу скорости второго порядка.
Скорость реакции (С2Н5)зК + СН31-♦
-*[(С2Н5)3 — N+— (СН3)]1- в нитробензоле определя-
лась при 25° С [82], причем найдено, что:
t, с 1200 1800 2400 3600 4500 5400
х, моль-Л-1 0.00876 0,01066 0,01208 0,01392 0,01476 0,01538
Здесь t — время, х—количество триэтиламина или
йодистого метила, прореагировавшее за время t. На-
чальные концентрации амина и йодистого алкила рав-
ны 0,0198 моль-л-1. Рассматриваемая реакция — вто-
рого порядка. Определите константу скорости.
Вычислите порядок стадии, определяющей скорость
пиролиза диборана [В2Н6(г)], при 100° С из следующих
данных по скорости увеличения давления в системе
как функции концентрации диборана [83]:
Концентрация В2Не, Скорость увеличения
моль • л-1 • 102 давления, моль • л-1 • ч-1 • 104
2,153 7,4
0,433 0,73
Исследовалась кинетика каталитического распада ам-
миака на простые вещества на вольфрамовой нити,
нагретой до 1100° С [84]. Было найдено, что время, не-
обходимое для разложения половины всего количе-
ства аммиака (причем вначале азот и водород отсут-
ствуют), зависит от начального давления аммиака
следующим образом:
р, мм рт. ст. 265 130 58
1у2, мин 7,6 3,7 1,7
Определите: а) порядок реакции и б) константу ско-
рости.
Кинетика реакции метанола с З.З'-дикарбазилфенил-
метил-ионом (зеленый краситель) в щелочном водно-
ацетоновом растворе при 25° С исследовалась спек-
трофотометрически [85]. Для раствора с 0,25 М исход-
ной концентрацией метанола были найдены следую-
щие разности (Д—Л,») между поглощением раствора
за время t (Д) и поглощением раствора, когда реак-
ция достигла равновесия (Д»)> при 730 нм; концен-
Кинетика
129
Xl-1-9.
XI-1-10.
трация едкого натра поддерживалась равной 2,03 X
X IO"2 М (выборочные данные):
t, мин 2,7 8,7 14,7 21,7 33,7
Л-Лоо 0,562 0,243 0,111 0,045 0,010
Покажите, что это реакция первого порядка относи-
тельно 3,3'-дикарбазилфепилметил-иона, и вычислите
константу скорости.
Пусть Р — интенсивность прошедшего через образец
света, а Ро—интенсивность падающего света. Тогда
р
поглощение ^4 = 1g-• Поглощение прямо пропор-
ционально концентрации абсорбирующего вещества.
Для скорости инверсии тростникового сахара в при-
сутствии соляной кислоты были получены следующие
данные [86]:
Время tt с
Наблюдаемый угол вращения а, град
0 11,20
1 035 10,35
3 113 8,87
4 857 7,64
9 231 5,19
12 834 3,61
18 520 1,60
26 320 —0,16
32 640 -1,10
76 969 —3,26
ОО -3,37
Определите порядок реакции и константу скорости.
Для изучения кинетики реакции
Н2С--СН2 + Н2О —> Н2С—СН2
\/ II
о но он
готовили раствор с исходными концентрациями
0,007574 М хлорной кислоты и 0,12 М окиси этилена.
Ход реакции контролировали дилатометрически (из-
мерение объема раствора как функции времени). При
20° С получены следующие данные:
мин 0 30 60 135 300 ОО
Показания 18,48 18,05 17,62 16,71 15,22 12,29
дилатометра
Определите порядок реакции по этилену и константу
скорости,
5 Зак. 1360
130
Глава XI
Кинетика
131
XI-1-11.
XI-1-12.
XI-1-13.
XI-1-14.
Xl-1-15.
Покажите, что третий порядок реакции 2NO + Н2 -*
—> 2NOH может быть обусловлен любым из механиз-
мов:
a) NO + Н2 NOH2
NOH2 + NO— ->2NOH
б) 2NO^>N2O2
H24-N2O2—-> 2NOH
хотя ни одна из их стадий не является тримолекуляр-
ной.
Покажите, что для реакции
а) первого порядка А -♦ продукты Л/2 = 0,693/й;
б) второго порядка 2Л —> продукты ty2 = l/ka;
в) третьего порядка ЗА -> продукты Г/2 — 3/2ka2.
а — начальная концентрация A; Ь;2— период полурас-
пада.
При изучении кинетики реакции
Co(NH3)5NO2+ + ОН" -> Co(NH3)5OH2+ + NO2
найдена следующая зависимость константы скорости k
„ от ионной силы раствора / [87]:
I 2,34 5,61 8,10 11,22 11,73 16,90
(5-f-lgfe) 1,7640 1,7130 1,6800 1,6467 1,6418 1,5990
Вычислите &0— константу скорости при ионной силе,
равной нулю.
Существует мнение, что скорость обычной химической
реакции удваивается при увеличении температуры на
10 градусов. Определите энергию активации Е реак-
ции, для которой это утверждение приемлемо вблизи
300° к.
Скорость реакции N + О2 -> NO + О в газовой фазе
изучалась [88] при получении атомов азота в проточ-
ной системе в высокочастотном разряде, причем кон-
центрация определялась методом ЭПР. Найдены сле-
дующие константы скорости:
Т, °К 586 910
k, см3 • моль-1 • с-1 (1,63±0,05) • 10«° (1,77±0,08) • 10"
Определите энергию активации реакции. Получите
два значения, соответствующие верхнему и нижнему
пределам, с учетом ошибок, указанных в эксперимен-
тальных данных.
РАЗДЕЛ XI-2
Х1-2-1. Для исследования кинетики реакции
МпО; + Сг3+ -> СгО2" + Мп4+
при 25,1°С измеряли время, необходимое для поддер-
жания различной степени превращения, сначала как
функцию концентрации СгО2~, а затем как функцию
концентрации МпО4 [89]. В серии из трех опытов
получены следующие данные:
№ опыта I II III
Относительная концен- трация MnOJ" 1 2 1
Относительная концен- трация СгО^- 1 1 0,5
Сг2О3 , мл (0,01 н.) t, мин
0,1 23 11 40
0,2 36 18 70
0,4 58 32 113
0,6 77 44 148
В каждом опыте через определенный интервал вре-
мени отбирали 25 мл реакционной смеси и быстро
добавляли к раствору, содержащему 60 мл 1,2 М
H2SO4 и 25 мл 0,5 н. КВг. Немедленно выделялся сво-
бодный бром:
2МпО7 + 10Вг" + 16Н+ -> 2Мп2+ + 5Вгг + 8Н2О,
который экстрагировался сероуглеродом.
Бихромат-ион, образовавшийся по реакции
2СгО2- 4- 2Н+ -> Сг20Г + Н2О,
титровался 0,01н. FeSO4:
Cr2O?_4-6Fe2+4-16H+4-2SOt-> 2Cr3+4-6Fe3+4-2HSO;+
+ 7H2O.
Количество 0,01 н. Cr2O2- (мл), присутствующее в сме-
си в указанное время реакции, дано в таблице. Можно
предположить, что этот объем прямо пропорционален
концентрации СгО2- в реакционной смеси в указанное
время. Каков порядок реакции относительно а) иона
Сг3+; б) иона МпО4?
5*
132
Глава X/
Xi-2-2. Кинетика гидролиза трет-бутилхлорида (СН3)3СС1 +
+ НгО —> (СН3)3СОН + Н+ + С1~ (суммарная реак-
ция) исследовалась при 25° С в концентрационной
цепи типа Ag | AgCl | А || В | AgCl | Ag [90]. При t = 0
оба полуэлемента содержали раствор из 95% воды и
5% ацетона, в котором был также 0,144 М перхлорат
натрия. Кроме того, в ячейку А добавляли 0,001 М
трет-бутилхлорид. Для измерения скорости реакции
в ячейку В быстро добавляли небольшое количество
0,0499 М соляной кислоты (t»nci) и записывали
время t, за которое стрелка гальванометра между
электродами, отклоняющаяся при каждом добавле-
нии, устанавливалась на нуль. В одной из серий та-
ких опытов получены следующие данные:
t, с оНС1, МЛ
30 0,90
44 1,10
62 1,30
83 1,40
111 1,50
оо 1,61
Х1-2-3.
Покажите, что гидролиз — реакция первого порядка,
и определите константу скорости.
При изучении кинетики гидролиза этйлацетата
(ЕЮАс) щелочью проводили следующий опыт [91].
В колбу емкостью 600 мл отмеряли 300 мл воды при
0° С и добавляли 100,00 мл 0,0500 М этилацетата при
той же температуре. Колбу закрывали пробкой и для
достижения термического равновесия погружали
в термостат. Реакцию инициировали добавлением
100,00 мл 0,100 М раствора едкого натра также при
0° С и энергичным встряхиванием. Если принять, что
объемы исходных растворов образуют строго аддитив-
ную смесь, то полученный раствор сначала будет со-
держать 0,0100 М этилацетат и 0,0200 М едкий натр.
Через различные промежутки времени t из реакцион-
k ной смеси отбирали пробы по 50,00 мл, вносили в них
измеренный избыток 0,0200 М НО (dhci) при 0°С и
титровали при той же температуре 0,0200 М раствором
NaOH (t>Naon)- Концентрацию NaOH при равновесии
устанавливали на пробах, оставленных при постоянной
температуре до тех пор, пока нельзя было заметить
дальнейшего изменения состава смеси со временем.
Получены следующие результаты:
t, мин 0
vhci’ мл 60,0
°№ОН. мл 11 >50
15 30 45 60 75 оо
50,0 50,0 50,0 50,0 50,0 50,0
7,35 11,20 13,95 15,95 17,55 24,0
Кинетика
133
Определите порядок реакции и константу скорости.
Х1-2-4. Скорость реакции фотохимического разложения
Кг52О8
K2S2O8 + н2О —2KHSO4 + 72о2
в присутствии 0,1 М K2SO4 и 0,28 М КОН изучалась
титрованием определенных количеств реакционной
смеси, взятых в различное время [92]. Получены сле-
дующие данные:
t, мин 0 150 360 540 720 940 1160 1340
vFeSO4, мл 9,25 8,75 8,24 7,85 7,51 7,07 6,64 5,27
Титрование проводили 0,0500 М раствором FeSO4, ко-
торый реагирует ио уравнению
K2S2O8 + 2FeSO4 -> Fe2(SO4)8 + K2SO4.
Исходная концентрация K2S2O8— 0,100 М. Найдите
порядок реакции по Кг52О8.
Х1-2-5. Хлороформ в метанольном растворе в присутствии
метилата натрия реагирует в соответствии с уравне-
ниями:
СНС13 + ОМе~ ,Бьк:тро:-Л^-1>СС1з + МеОН
СС1з - ^ЛЛСП11о-> СС12 + СГ
СС12^1Р2> Продукты
Считают, что медленная стадия будет лимитирующей
стадией реакции. Для определения порядка медлен-
ной стадии относительно СС1з проводили титрова-
ние хлор-иона, образующегося в момент времени t,
при 59,7° С 0,0100 н. раствором азотнокислого серебра
(v). Результаты были следующими [93]:
t, мин 0 4 9 15 22 30 41 50 оо
V, мл 1,71 3,03 4,49 5,97 7,39 8,87 10,48 11,7 15,98
Исходная концентрация хлороформа 9,95-10-3 М.
Средняя концентрация [NaOMe] в течение реакции
1,10 ±0,01 М (большой, практически постоянный из-
быток). Покажите, что реакция имеет первый поря-
док по СС1з, и определите константу скорости.
Х1-2-6. Кинетика окисления щавелевой кислоты сульфатом
церия исследовалась в концентрационной цепи типа
Pt|Sr II S2|Pt [94].
134
Глава XJ
В начале опыта Si и S2 содержали равные количества
серной кислоты, бисульфата аммония (добавлялся для
получения смеси с постоянной ионной силой 2,0 М) и
сульфата церия. При / = 0 (t — время) титрованный
раствор щавелевой кислоты вводился в Si и равный
объем воды — в S2. Для измерения скорости реакции
в ячейку S2 вводили отмеренный избыток сульфата
железа (uFeS0) и записывали время, за которое стрел-
ка гальванометра, отклоняющаяся при каждом доба-
влении, устанавливалась на нуль. Получены следую-
щие значения для одной серии измерений с использо-
ванием 0,00253 М Ce(SO4)2, 0,00125 М Н2С2О4 и 2,0 М
H2SO4:
t, MHtl
VFeSOr (общий)
0,31 7,00
0,51 9,00
0,65 10,00
0,86 11,00
1,01 11,50
1,15 12,00
1,36 12,50
1,58 13,00
2,19 13,80
ОО 16,50
Покажите, что реакция между щавелевой кислотой
и сульфатом церия имеет второй порядок, и опреде-
лите константу скорости.
XI-2-7. При исследовании [95] термического распада арсина
на стекле 2АзНз (г)-* 2As (тв)ЗНг (г) обнаружено
изменение общего давления в системе со временем
(при 350° С):
t, ч о 4,33 16
Общее давле- 39,2 40,3 43,65
ние, см
25,5 37,66 44,75
45,35 48,05 48,85
Определите порядок реакции и константу скорости.
XI-2-8. При исследовании [96] гидролиза метилтозилата (ме-
тил-и-толуолсульфоната) при 25° С получены следую-
щие спектрофотометрические данные (длина волны
261 нм) для водного раствора с исходной концентра-
цией метилтозилата 1,22-10*3М:
Кинетика
135
Время, ч
Поглощение
(см. задачу XI-1-8)
0 0,791
5,0 0,746
9,0 0,709
18,0 0,645
24,0 0,611
32,0 0,570
44,0 0,526
55,0 0,498
67,0 0,471
290,0 0,420
XI-2-9.
XI-2-10.
XI-2-11.
Учитывая, что при указанной длине волны поглощает
только метилтозилат, покажите, что реакция имеет
первый порядок по метилтозилату, и вычислите кон-
станту скорости (с-1).
Некоторый газ претерпевает мономолекулярное пре-
вращение в смеси с инертным газом. Применив тео-
рию Линдемана, определите скорость реакции через
концентрации реагирующего и инертного газов и кон-
станты скорости элементарных реакций.
Был предложен следующий механизм термического
разложения озона:
О3—о2+о
О + О2 -—О3
О4-О3—-->2О2
а) С помощью метода стационарных концентраций
получите выражение для скорости распада, включаю-
щее константы kit k2 и концентрации О2 и О3.
б) Экспериментально найдено, что реакция имеет вто-
рой порядок по озону и минус первый — по кисло-
роду. Покажите, какое соотношение должно существо-
вать между концентрациями и константами скоростей
для того, чтобы полученное выражение согласовыва-
лось с экспериментальными данными.
Для реакции На (г)+ h (г)-*2HI (г) до 1967 г. яв-
лялся общепринятым следующий механизм (I):
H2+I2—->2Н1.
В 1967 г. было показано [97], что реакция идет, ве-
роятно, по механизму (II):
I8~*2I (1)
136
Глава X!
21 12
21 + Н2—->2Н1
(2)
(3)
. D d [HI]
а) Выведите уравнение для скорости реакции —>
соответствующее каждому из механизмов I и II. Ис-
пользуйте, где возможно, метод стационарных кон-
центраций. б) Выведите уравнение скорости реакции
на основе механизма II в предположении, что реак-
ции (1) и (2) находятся в равновесии, причем К —
константа равновесия реакции 12 =?* 21. При каких
условиях согласуются результаты (а) и (б) для ме-
ханизма II? в) Фотохимическое получение атомов
позволило измерить
иода известной концентрации
константу скорости k3:
Т, °К 417,9 520,1
fe3, л2 • моль-2 • с—1 1.12- 105 40-Ю5
,, d [I2J \ п
(«з определяется как------’ Вычислите энергию
активации Еа реакции (3).
Х1-2-12. Для реакции нитрита натрия с кислородом предло-
жен следующий механизм [98];
NO2 -j- О2—!->NOa -|- О
no2 + о -^>no;
04-0 —о2
а) Покажите, что
фОз]
di
= Mno2’][o2] 1 +
fe2 [no2]
Zs3 [О] 4-fejNOj]
б) Покажите, что уравнение, приведенное в пунк-
те (а), переходит в следующее уравнение:
1I^1 = 2A1[NO2-][O2],
если принять, что реакция (3) гораздо медленнее ре-
акции (2).
Х1-2-13. Разложение амида азотной кислоты в водном рас-
творе
O2NNH2->N2O + H2O
Кинетика
137
имеет первый порядок по амиду. Полагают, что ре-
акция протекает в три стадии:
O2NNH2 + В-> ВН++ O2NNH“ (1)
O2NNH"->N2O + ОН- (2)
ОН" + ВН+ -> В + Н2О, (3)
где В—основание (например, ацетат-ион). Предло-
жены две гипотезы, а) Быстрая обратимая стадия (1)
имеет константу равновесия Л-; стадия (2) медленная,
определяющая скорость реакции; ее константа скоро-
сти k2. б) Стадия (1) является определяющей скорость
и имеет константу скорости Ар, стадия (2) более быст-
рая. Установите, какая гипотеза (или обе) правильно
предсказывают уравнение скорости первого порядка
(примите, что активности равны концентрациям). Если
обе гипотезы согласуются с экспериментальными дан-
ными, предложите дальнейший эксперимент, который
мог бы исключить одну из них.
Х1-2-14. Для инициируемого радиацией распада некоторых не-
органических нитратов при комнатной температуре
предложен следующий механизм [99]:
NO3-—->NO2 + 0 (1)
NO2" + O--^->NO3 (2)
NO3+ 0-^->N02"+ 02 (3)
Символ ф обозначает некоторую дозу радиации и ука-
зывает на то, что была использована ионизирующая
радиация (вместо световой), а) Сделав предположе-
ние о стационарной концентрации атомов О, выве-
дите уравнение для скорости образования N02 •
б) Проинтегрируйте выражение, полученное в пунк-
те (а), предположив, что концентрация N07 по-
стоянна.
Х1-2-15. Предложен следующий механизм для гомогенного пи-
ролиза метана [100]:
сн4-^>сн3 + н
СН4 + СН3—!->с2н6 + н
СН4 + Н-^>СНз4-Н2
Н + СН3 + М-^->СН4 + М
138
Глава XI
Xl-2-16.
X1-3-2.
Xl-3-1.
M—некоторая молекула (возможно, СН4 или С2Н6),
которая отводит энергию рекомбинации Н и СН3. Вы-
ведите уравнение для скорости образования С2Нб на
основе приведенного механизма. Концентрации СН3 и
Н очень малы, поэтому стационарны и не должны
входить в уравнение.
Гипотетическая реакция А->В имеет минус первый
порядок, т. е. —kc~X’ где с = [А].
а) Выведите уравнение для с как функции t, k и ис-
ходной концентрации Cq. б) Выразите время, необхо-
димое для того, чтобы концентрация снизилась на
10% (от исходной), через k и с0. в) Идет ли эта реак-
ция до конца? Идут ли до конца реакции первого по-
рядка? Объясните различие между обоими случаями.
РАЗДЕЛ Х1-3
Для реакции NO2C1 -*NO2 + V2CI2 предположен сле-
дующий механизм:
NO2C1-^NO2 + C1
NO2C1 + Cl —NO2 + Cl2
а) Определите скорость реакции на основе этого ме-
ханизма. Примите, что концентрация С1 мала и по-
стоянна. б) При концентрации NO2C1 ~10-4 моль-л-1
реакция становится реакцией второго порядка по
NO2C1. Измените приведенный выше механизм так,
чтобы он согласовался с уравнением скорости второго
порядка, и объясните, почему это видоизменение не-
обходимо только при низкой концентрации.
Предложен следующий механизм разложения азот-
ной кислоты [101]:
HNO3—>HO + NO2
ho + no2-^->hno3
НО + HNO3—* Н2О + NO3
а) Предположив, что концентрация ОН стационарна,
покажите, что выражение для скорости разложения
азотной кислоты имеет следующий вид:
d [HNO3]__гнмп ,_____________1_________
dt — IHNU3J j + {kb [n02] )/(kc [НЫОз] } .
б) Исчезновение NO2 происходит быстро; как изме-
нится приведенное выше уравнение?
Кинетика
139
Xl-З-З. Сделав предположение о стационарности концентра-
ции НОг, на основании приведенного механизма вос-
становления нептуния(VI) перекисью водорода пока-
жите, что справедливо следующее уравнение для ско-
рости реакции [102]:
d [NpO2+] _ 2Kfei [NpO|+] [H2O2]
dt [H+] {1 + (k3 [NpOj] )/(fe2 [NpO|+] ) '
HO2 + NpO22+ Npp2 + HO2
HO2 + NpO2+ —2-> NpO2 + O2 + H+
HO2 + NpOj —’> NpOi+ + HO2
XI-3-4. Термический распад газообразного N2O5 имеет сле-
дующий механизм:
N2O5—^->NO2 + NO3 (1)
NO2+NO3-^->N2O5 (2)
NO2 + NO3 ——^NO2 + NO + O2 (3)
NO +N2O5—^->3NO2 (4)
а) Применив метод стационарных концентраций
к NO3 и NO, найдите уравнение скорости реакции на
основе этого механизма, б) Предположите, что энер-
гия активации реакции (2) близка к нулю, а энергия
активации реакции (3) составляет 5 ккал. Сделав
разумное упрощение, оцените приближенно отноше-
ние kz/k-i при 320° К. Объясните, чем можно обосно-
вать ваше предположение, в) Покажите, что уравне-
ние, полученное в пункте (а), можно вывести, рассма-
тривая реакции (1) и (2) как равновесные. При каких
условиях это приближение справедливо?
Х1-3-5. Был предложен следующий механизм образования
фосгена (СОС12):
С12—^>2С1
2С1—->С12 . .ГГ11.
. (* лля
С1 + СО—’->С1СО \ д dt )
СОС1—!->С1 + СО
СОС1 + С12 —> СОС12 + С1
140
Глава X!
а) Использовав приближение стационарных концен-
траций, найдите уравнение скорости образования фос-
гена согласно этому механизму. Примите, что концен-
трации СОС1 и С1 малы и стационарны. Уравнение
может содержать некоторые или все константы kit...
..., k5 и концентрацию всех частиц, кроме СОС1 или
С1. б) Примите, что реакции (1) — (4) быстрее реак-
ции (5), и покажите, как может быть упрощено урав-
нение скорости в этом случае, в) Покажите, что ре-
зультат (б) может быть получен также при рассмо-
трении реакций (1), (2) и (3), (4) как равновесных.
Объясните, почему предположения, принятые в (б) и
(в), привели к тождественному результату.
XI-3-6. Две реакции первого порядка протекают последова-
тельно: А — >В —Чс (начиная с А, но не с В или
С). Докажите, что в этом случае концентрация про-
межуточного продукта В достигает максимума, а за-,
тем падает. Определите время, за которое концентра-
ция В достигнет максимума, и максимальную концен-
трацию продукта В. (Примечание. Решение этой за-
дачи, кроме обычных методов расчета, требует неко-
торого знания линейных дифференциальных уравне-
ний. Напомним, что еа1пЬ = Ьа. Случай, когда k\ = k2,
требует особого рассмотрения.)
Глава XII
ФОТОХИМИЯ и спектрофотометрия
РАЗДЕЛ XII-1
X1I-1-1. На основе следующих выборочных данных [103] оце-
ните квантовый выход ф разложения ураиилоксалата
для каждой длины волны:
Длина волны, пм Доля разложившегося оксалата Число разложившихся молекул’Ю-"18 Число поглощенных фотоиовИО-18
365,5 0,0592 5,18 10,58
365,5 0,0498 4,32 8,93
435,8 0,0242 2,10 3,64
435,8 0,0208 1,79 3,10
РАЗДЕЛ XII-2
X1I-2-1. При одновременном спектрофотометрическом опреде-
лении концентрации двух веществ А и В в некотором
растворе получены следующие данные:
[А]. _ МОЛЬ’Л 1 [В]._ МОЛЬ’Л 1 Процент прошедшего света при Л « 400 нм Процент прошедшего
света при Л = = 500 нм
Раствор / 0,001 0 10 60
Раствор 2 0 0,005 80 20
Раствор 3 Неиз- Неиз- 40 50
вестпа вестпа
Определите концентрации веществ А и В в растворе 3.
Х11-2-2. Для определения константы диссоциации К индика-
тора .«-нитрофенола (Н1п) был приготовлен его
6,36-10“4 М раствор и выполнены следующие спектро-
фотометрические измерения этого раствора при 25° С
и 300 нм. В одном из опытов раствор был сильно кис-
лым и его поглощение Ai составляло 0,142. б этих ус-
ловиях все индикаторы принимают форму Шп. В дру-
гом опыте раствор был сильно щелочной и поглоще-
ние Лг составило 0,943. При этих условиях все инди-
каторы принимают форму 1п~. Затем, в серии допол-
нительных опытов, pH раствора индикатора регули-
142
Глава XI!
ровалось буферной смесью с ионной силой / и изме-
рялось поглощение А. (Поглощение определено в за-
даче XI-1-8.) Результаты приведены в следующей
таблице [104]:
I pH А
0,10 8,321 0,527
0,08 8,302 0,518
0,06 8,280 0,505
0,04 8,251 0,493
0,02 8,207 0,470
XI1-2-3.
XI1-2-4.
Определите кажущуюся величину рХ (выраженную
в концентрациях) индикатора для каждой приведен-
ной величины ионной силы.
Процент поглощения (Т, %) серии растворов кислот-
но-основного индикатора бромфенола синего опреде-
лялся при 590 нм; были получены следующие резуль-
таты:
Относительная концентрация Буфер при pH 4,39, Т, % Сильное основание, Г, %
0,8 20,0 5,4
0,6 29,0 11,0
0,4 44,2 22,7
0,2 66,8 46,4
При указанной длине волны основная форма погло-
щала сильно, но поглощение кислой формы было не-
значительным. Определите рКа индикатора.
Предложен следующий механизм фотохимического
распада перекиси водорода в присутствии окиси угле-
рода [105]:
H2O24-Av—>2ОН
он 4-со —^->со2н
со2н + Н2О2 СО2 + Н2О 4- он
Н2О2 + ОН Н2О 4- но2
2НО2 —О2 4-Н2О2
Сделав предположение о стационарности концентра-
ций ОН, СО2Н и НО2, получите уравнение скорости
Фотохимия и спектрофотометрия
143
^[HaOaJ/dt Пусть ф — первичный квант действия для
фотолиза Н2О2, а 1а—поглощение Эйнштейна на 1 л
в секунду.
ХП-2-5. Предложен [105] следующий механизм фотолитиче-
ского распада перекиси водорода в присутствии окиси
углерода:
Н2О2 + hv —-> 2 ОН
ОН4-СО -^->СО2Н
СО2Н + Н2О2 -**> СО2 + Н2О + ОН
2СО2Н — -> Продукты
Сделав предположение о стационарности концентра-
ции ОН и СОгН, определите d [Н2О2]/с?Л как в преды-
дущей задаче.
РАЗДЕЛ XI1-3
XI1-3-1. При каком значении Т (парциальное поглощение)
в спектрофотометрических анализах будет минималь-
ной относительная ошибка в определении концентра-
ции (Дс/с) для данной ошибки измерения Г?
XII-3-2. а) При фотохимической реакции 2Н1-*Нг-|-12 в га-
зовой фазе квантовый выход равен ~2. Определите
количество граммов распавшегося HI на 1 калорию
радиационной энергии, поглощенной HI, при облу-
чении монохроматическим излучением с длиной волны
2070 А.
б) Какой квантовый выход будет наблюдаться при
следующем механизме реакции? Объясните.
HI + hv -+ Н + I
H + HI->H2 + I
(1)
(2)
21-Иг (на стенке или при тройных (3)
столкновениях).
в) Для реакции Нг -ф Cl2-*2НС1, механизм которой
имеет некоторое сходство с предыдущей реакцией, по-
лучен квантовый выход от 104 до 106. Объясните раз-
ницу между квантовыми выходами этих двух реакций,
основываясь на энергии активации, энергии связи или
на других данных. Энергия связи Н—I равна
71 ккал-моль-1, связи I—I 36 ккал-моль-1.
144
Глава XII
С14-Н2->НС14-Н
Н 4- С12->НС14- С!
Н4-Н1-> Н24-1
Энергия активации, ккал
8
2
1,5
ХН-3-3. Фотолиз Оз в растворе жидкого Аг изучался при
87° К [106]. Было использовано излучение с длинами
волн 2537 и 3130 А. Первичный квантовый выход ф
определялся таким образом, что скорость распада Оз
по реакции
О3 4- hv -> О2 4- О*
(Г)
оказывалось равной ф!а (моль-л-1-с-1), где 7а — по-
глощенный эйнштейн па 1 л в секунду, а О* — атом
О в возбужденном электронном состоянии (lD).
Кроме реакции (1), были предложены следующие ре-
акции:
XI1-3-4.
0*4-03->202 (2)
О’^О (3)
О4-О24-М->О3 + М (4)
М — некоторая молекула, которая может отводить
энергию, освобождающуюся в реакции (4). Полный
квантовый выход Ф был найден из суммарной скоро-
сти исчезновения Оз: —с?[Оз]с?^ = Ф1а-
а),На основе приведенного механизма получите вы-
ражение для Ф через константы скорости, ф и концен-
трации стабильных частиц (Ог, 03).
б) По результатам опытов для Ф при 2537 А полу-
чено подходящее уравнение, в котором Ф-' = 0,538 +
4-0,81 [Оз]-1. Определите ф и любые доступные дан-
ные о константах скорости.
Кинетика и механизм фотохлорировапия трифторэти-
лена в паровой фазе
CF2=CFH4-Cl2-^'->CF2Cl—CFHC1 (или TfCl2)
исследованы [107] при комнатной температуре, причем
установлено, что:
1) практически отсутствует темновая реакция;
2) в пределе от 25 до 400 мм рт. ст. скорость реакции
не зависит от давления олефина;
3) если давление хлора равно 90 мм рт. ст., то ско-
рость реакции — dP&Jdt зависит от интенсивности
света /о, как показано в таблице:
Фотохимия и спектрофотометрия
145
/0, произвольные единицы
(-dPci2A«)-io3.
мм рт. ст.-с-1
0,0144 2,2
0,122 6,1
0,421 9,5
1,88 17,2
1,90 18,0
1,90 18,4
1,90 18,4
1,93 19,6
4) если интенсивность света постоянна, то скорость
реакции изменяется с давлением CU, как показано
в таблице:
T>cl , мм рт. CT. (-dPci2/^)-103 ММ рт. CT.’C 1
9,1 22,2 35 45 94 137,2 180,7 1,5 6,98 11,66 17,3 47,5 77,5 101
5) реакция прекращается при добавлении в систему
следов NO.
а) Как следует из данных, приведенных в пункте (3),
при постоянном давлении хлора константа скорости
реакции пропорциональна /о- Оцените п.
б) Как следует из данных, приведенных в пункте (4),
при постоянной интенсивности света скорость реакции
пропорциональна Рсь- Оцените tn.
в) На основе найденных величин (п и т) напишите
эмпирическое уравнение скорости суммарной реакции.
г) Предложен следующий механизм реакции (Tf —
CF2=CFH):
C124-/zv (падающий свет)—>2С1 (1)
C14-Tf->TfCl (2)
TfCl ч-Cl2 —> TfCl2-h Cl (3)
TfCl 4- TfCl -> Продукты (4)
146
Глава XII
Примените приближенный метод стационарных кон-
центраций и покажите, что предложенный механизм
согласуется с эмпирическим уравнением скорости.
Упростите результат насколько возможно.
д) В уравнении (4) продукты не идентифицированы.
При каких условиях можно пренебречь идентифика-
цией продуктов?
е) Как можно показать экспериментально, что реак-
ция (3) необратима?
ж) Какое значение имеет наблюдение (5)?
Глава XIII
РАДИОХИМИЯ
Х111-1-1.
XIII-1-2.
XHI-1-3.
XIII-1-4.
XIII-1-5.
XIII-1-6.
XIII-1-7.
XIH-1-8.
XIII-1-9.
РАЗДЕЛ ХИМ
Период полураспада ИС составляет 5760 лет. За
сколько лет активность образца ИС упадет до 90%
(от исходной величины).
Некоторый изотоп X имеет скорость радиоактивного
распада 1,00-105 атом-с-1-г-1. Скорость распада ра-
дия 3,71-1010 атом-с-1-г-1. Какова активность X, вы-
раженная в миликюри на 1 грамм?
Период полураспада 24Na (Л/2) 14,9 ч, а его атомная
масса 24,0. Вычислите активность 1,000 мкг 24Na в
кюри (Ки).
Образец 24Na (А/2 14,9 ч; атомная масса 24) с актив-
ностью 1,00 мкКи дан больному. Какова была актив-
ность образца, если он стал неэффективным за 5 ч?
Какая масса 24Na (Л/2 14,9 ч; атомная масса 24) бу-
дет иметь такую же активность, как и 1,000 мг 27Mg
(А/, 10,2 мин; атомная масса 27,0)?
Вычислите массу 222Rn (А/2 3,82 сут), находящегося
в длительном равновесии с 1,00 г 226Ra (А/2
1,62-103 лет).
Примите, что 226Ra (6/2 1,6-103 лет) находится в не-
котором минерале в длительном равновесии с 238U
(Л/2 4,5-109 лет). Сколько граммов 226Ra на 1 грамм
238U будет присутствовать в этом минерале?
Имеется 0,100 г образца 226Ra (А/2 1,62-103 лет). Каж-
дые 24 ч откачивается 222Rn (газ), образующийся при
распаде радия. Определите активность 222Rn во время
его откачки. Для 222Rn А. = 0,182 сут-1. Уравнение,
описывающее одновременный радиоактивный распад
двух изотопов А и В при последовательном распаде
ядер А—В—- С следующее:
ЛВ ~ ЛА
где к—постоянная радиоактивного распада (кон-
станта скорости первого порядка).
В радиохимии период жизни образца может быть оп-
ределен при измерении отношения количества про-
дукта распада образца D к количеству исходного об-
148
Глава XIII
XJII-1-10.
XHI-1-11.
XIII-1-12.
XIII-1-13.
XIII-1-14.
XIH-1-15.
разца P. Покажите, что период жизни образца t свя-
зан с отношением продукта распада к исходному об-
разцу DjP следующим образом:
где продукт распада — нерадиоактивпый изотоп,
а X— постоянная радиоактивного распада исходного
изотопа.
В 30 г образца некоторого минерала найдено 450 мг
Rb и 0,90 мг Sr. В Rb было 27 масс.% 87Rb
(X 1,47-10-и лет-1); в Sr 80 масс.% 87Sr. 87Rb при ра-
диоактивном распаде переходит в 87Sr. Вычислите
возраст образца.
Завершите следующие уравнения:
a) i£> + у -> ? + on
б) ®Ве + гНе -> on + ?
Завершите следующие уравнения:
a) 197Au (п, у)?
б) 40Са (п, а)?
в) 24Mg (rf, а)?
г) 3Н (а, п)?
Рассчитайте дефект массы и энергию связи 'вО. Изо-
топная атомная масса 'fO 15,99468 ат. ед. Массы
протона и нейтрона 1,007277 и 1,008657 ат. ед. соот-
ветственно, а масса электрона 0,000549 ат. ед.
Масса покоя р-частицы 0,000549 ат. ед. Определите
эффективную относительную массу, если р-частица
движется со скоростью, равной 0,99 скорости света?
Если пучок нейтронов с плотностью потока ф прохо-
дит сквозь поглощающую среду, то доля изменения
плотности потока йф/ф в некоторой данной точке
среды прямо пропорциональна длине пути dx:
= Nodx. N — число атомов мишени на 1 см3 среды,
а о — микроскопическая площадь поперечного сече-
ния. Покажите, что о может быть определена из гра-
фика зависимости 1п^> от х.
РАЗДЕЛ XIII-2
XIII-2-1. В 4 ч дня 22 августа фармацевт решил приготовить
медикамент, содержащий 198Au (fy2 2,70 сут), который
в 8 ч следующего дня имел бы активность 0,50 мкКи
Радиохимия
149
на 1 г. В 12 ч дня 21 августа, когда материал был
доставлен от изготовителя, он имел активность
3,00 мкКи на 1 г. Сколько нерадиоактивного вещества
должен был использовать фармацевт на 1 г 198Аи, по-
ставленного изготовителем?
РАЗДЕЛ XII1-3
XIII-3-1. Покаж ите, что возраст радиоактивного образца, рас-
падающегося на два нерадиоактивпых вещества, вы-
ражается уравнением
t = lin Г1 + A(.ff + .LY|
х 111L р \ р Л ’
где Р — количество исходного вещества, D[ — коли-
чество первого (1) продукта распада, a D%— количе-
ство второго (2) продукта распада за время t\ к — по-
стоянная радиоактивного распада исходного образца;
Р — D<JD2.
XIII-3-2. Исходный изотоп (1) и его радиоактивный продукт
распада (2) находятся в длительном равновесии друг
с другом. Продукт распадается с образованием ста-
бильного изотопа (3);
(1) —(2) —> (3)
Пусть JVi—число атомов изотопа (1) при t — 0. Выве-
дите уравнение
N2 — л N-\- (е~^ —
л,2 — Л]
для Nz — числа атомов продукта (2) в некоторое дан-
ное время t. Примите, что Xi #= (в случае %i = fa
необходима особая обработка) иА^2 = А^з = 0. (При-
мечания'. для решения этой задачи необходимы допол-
нительные знания о линейных дифференциальных
уравнениях). Эта задача аналогична задаче XI-3-6.
XIII-3-3. Покажите, что среднее время жизни (не период полу-
распада) изотопа дается формулой /сред11 =•= у. Для
решения необходимо взять интеграл типа:
J хеах dx = -yj- (ах — 1) + С.
XII1-3-4. Пусть излучение от точечного источника одинаково
во всех направлениях. Таким образом, точки равной
интенсивности можно изобразить в виде сферической
поверхности с точечным источником в центре. Только
150
Глава XIII
часть такого излучения захватывает счетчик Гейгера.
Доля излучения, которую захватывает счетчик, назы-
вают геометрическим фактором G. G — отношение се-
чения сферической поверхности захвата круглой щели
счетчика к полной площади поверхности шара. Со-
гласно рисунку, покажите, что
q 1 — cos 0 1 / [______h \
~ 2 ~~ 2 \ Vh2+'r2 /
и что для больших расстояний между щелью счетчика
и источником выполняется обратный квадратичный
закон
г ~ —
G ~ 4h2 •
Трубка Гейгера
►—Г'
Щель
h
/О
~~—Источник
Глава XIV
ХИМИЯ ПОВЕРХНОСТИ И КОЛЛОИДЫ
РАЗДЕЛ XIV-1
XIV-1-1. Суспензия 1 г гемоглобина в 1 л воды имеет осмоти-
ческое давление 3,6 -10*4 атм при 25° С. Определите вес
частицы гемоглобина.
XIV-1-2. - При измерении осмотического давления раствора
у-глобулина в 0,15 М NaCl при 37° С получены сле-
дующие данные [108]:
Концентрация у-глобулина с. г на 100 мл Осмотическое давление Р, мм Н2О
19,27 12,35 5,81 453 253 112
Определите молекулярный вес у-глобулина.
XIV-1-3. Установлено [109], что связь между истинной вязко-
стью и молекулярным весом (А1) раствора полиизо-
бутилена при 20° С описывается формулой г] =
= 3,60- 1О-4А10’64. Определите молекулярный вес фрак-
ции полиизобутилена в растворе с истинной вязкостью
1,80 дл-г-1. Истинная вязкость может быть найдена
из уравнения
С->0 ' Ч0С
где т]о — вязкость растворителя, а с—концентрация,
выраженная в граммах на 1 децилитр.
XIV-1-4. Получены [НО] следующие данные в растворе СС14
при 30° С по истинной вязкости полиизобутилена как
функции молекулярного веса (А1). Покажите, что эти
данные согласуются с уравнением [rj] = КМа. Оце-
ните Киа. Истинная вязкость определена в преды-
дущей задаче.
152
Глава XIV
м
СП], длт'
1260000 4,30
463000 2,06
110000 0,78
92700 0,73
48000 0,43
10000 0,15
9550 0,138
7080 0,115
XIV-1-5. Определите графически а и К из формулы [р] — КМа
для бупа А (синтетический каучук), растворенного
в толуоле, по следующим данным:
1л1
25000 0,30
31800 0,35
39500 0,40
57000 0,48
100000 0,71
224000 1,16
380000 1,76
[р] — истинная вязкость, определенная в задаче
XIV-1-3; М — средний молекулярный вес.
XIV-1-6. а) Какова поверхность куба, имеющего ребро 1 см?
б) Какова общая площадь поверхности того же мате-
риала, если он размельчен на кубики коллоидного
размера, имеющие ребро 10-7 см. Выразите резуль-
тат в м2.
XIV-1-7. Адсорбция кислорода на гладком железе исследова-
лась при —183° С [111]. На основе следующих выбо-
рочных данных покажите, что скорость адсорбции
t, с
V, см3
1380
3000
4260
7320
10020
0,167
0,272
0,330
0,408
0,432
Химия поверхности и коллоиды
153
подчиняется кинетике реакции первого порядка, и
оцените константу скорости.
V — объем, адсорбированный па поверхности образца
железа за время t, Ve— объем, адсорбированный при
равновесии и равный 0,451 см3.
XIV-1-8. Объясните качественно различие двух следующих ад-
сорбционных кривых:
a) N2 на Fe при —195° С; б) Вг2 на SiO2 при 79° С,
Pq — давление пара адсорбата.
РАЗДЕЛ XIV-2
XIV-2-1. Поверхностное натяжение у водного раствора масля-
ной кислоты с объемной концентрацией с при 18°С
подчиняется эмпирическому уравнению Yo__Y =
= 29,8 lg(l + 19,64с), где у0 — поверхностное натяже-
ние чистой воды [112]. Применивуравнение адсорбции
Гиббса
~______________ — с dy
RT de ’
вычислите S — избыточную концентрацию растворен-
ного вещества на 1 см2 поверхности, если с = 0,01 М.
Каким будет S при с->оо?
XIV-2-2. Адсорбция азота на древесном угле исследовалась
при —77° С, причем найдено, что 0,0946 г образца
угля адсорбировали следующие количества азота х
при указанном давлении Р [113]:
Р, атм X, г Р, атм х, г
3,5 0,0119 25,7 0,0192
10,0 0,0161 33,5 0,0195
16,7 0,0181 39,2 0,0196
48,6 0,0199
154
Глава XIV
Нанесите на диаграмму эти данные таким образом,
чтобы получить прямую линию в соответствии со сле-
дующими зависимостями, и оцените постоянные. Нет
необходимости строить графики по уравнениям в их
данной форме. Сначала, если необходимо, переведите
уравнения в форму, которая дает прямолинейную за'
висимость; т — вес угля (г).
а’ (x/m) ki ’
б) =
' т
в)
XIV-2-3.
Получены следующие данные по адсорбции на дре-
весном угле уксусной кислоты из водных растворов
(во всех случаях объем раствора с углем был по-
стоянным, 200 мл):
Со, молярность
уксусной кислоты
в растворе до
добавления угля
cgt моляряость
уксусной кислоты,
оставшейся
в растворе
при равновесии
Вес угля mt
г .
0,503 0,434 3,96
0,252 0,202 3,94
0,126 0,0899 4,00
0,0628 0,0347 4,12
0,0314 0,0113 4,04
0,0157 0,00333 4,00
Покажите, что эти данные удовлетворяют изотерме
адсорбции Фрейндлиха
— = kc'Jn,
т е ’
где х — количество граммов адсорбированной уксус-
ной кислоты. Оцените постоянные k и п.
Глава XV
КВАНТОВАЯ ХИМИЯ И СПЕКТРОСКОПИЯ
XV-1. а) Вычислите работу w, необходимую для удаления
двух атомов водорода (каждый с массой 1,7-10-24 г)
от их равновесного расстояния 0,74 А до бесконечно
большого, приняв, что гравитационное притяжение ме-
жду двумя атомами водорода — единственная сила,
которую следует учесть. Универсальная гравитацион-
ная постоянная G = 6,670-Ю-8 дин-см2-г-2. б) Экс-
периментальная энергия связи Н—Н указывает, что
фактически энергия, необходимая для удаления двух
атомов Н, равна 6,7-10-12 эрг. Каков смысл различия
между этими данными и данными, полученными
в пункте (а).
XV-2. Вычислите электростатический заряд (эл. ст. ед.) на
капле масла с плотностью 0,920 г-см-3 и радиусом
1,24-Ю-4 см, находящейся неподвижно на одном уров-
не в воде, к которой приложено электрическое поле
напряженностью 4,5-103 В-см-1. 1 В = 3,34-Ю-3 стат. В.
Плотностью воздуха можно пренебречь.
XV-3. Человек, адаптированный к темноте, может воспри-
нимать желтую часть света, если скорость попадания
случайных фотонов на сетчатку глаза составляет око-
ло 500 фотонов в 1 сек. Определите энергию (Вт),
соответствующую этой скорости попадания, приняв
длину волны 5000 А.
XV-4. Некоторая система имеет четыре уровня энергии Еп,
обозначаемые квантовым числом п, со следующими
энергиями (эрг):
£0 = 0; Е2 = 3,000- 10““;
£1 = 1,000-10“"; £3 = 3,500-10“".
Правило отбора для проходящего света в этой систе-
ме Дп= ±1 (или ±3). .Составьте таблицу разности
энергий, частот и волновых чисел (см-1), соответ-
ствующих всем линиям, которые могут наблюдаться
в спектре поглощения системы.
XV-5. Исходя из закона излучения Планка
8лАс
Рх— Л5(ейс/ш-1) ’
156
Глава XV
выведите уравнение Стефана — Больцмана р=о7’4,
где р — средняя общая энергия излучения от Л=0до
К=со:
ОО
р= J pA,dx = o7’4.
о
(Примечание. Пусть х — hc/% kT. Необходимо взять
интеграл
г х3 dx __ л4 \
J ех- 1 — is •)
о
XV-6. Исходя из закона излучения Планка, выведите закон
смещения Вина лМакс = —7—где Лмакс — длина
волны, когда р максимально при данной температуре.
XV-7. Исходя из закона излучения Планка, выведите урав-
г> тт 8nkT
нение Рэллея — Джинса р^= , которое приме-
нимо только при больших длинах волн.
XV-8. Исходя из закона излучения Планка, выведите урав-
С.е-сЛТ
нение Вина рл =----дё---> которое применимо толь-
ко при малых длинах волн.
XV-9, Предположим, что излучение находится в равновесии
со стенкой (концом) одномерной полости длиной I
при температуре Т. Аналогичную картину можно на-
глядно представить, предположив трехмерную по-
лость в форме прямого цилиндра или призмы, только
вдоль оси которой возможно распространение элек-
тромагнитных волн. Найдите: а) число различных
стоячих электромагнитных волн в этой одномерной
полости с частотами между v и v + dv, б) количество
электромагнитной энергии, соответствующей интерва-
лу частоты v и v + dv в этой полости, согласно тео-
рии Планка.
XV-10. а) Возможная энергия действия электромагнитного
излучения с частотой v равна nbv2, где n=0, 1, 2, ...
и b — постоянная. Использовав это предположение
(вместо предположения Планка о величине энергии
nhv), получите выражение для плотности излучения
с частотой между v и v + dv, находящегося в равно-
весии со стенкой полости при температуре Т. б) Из
полученного результата найдите плотность всей энер-
гии при всех частотах в полости в зависимости от
температуры.
Квантовая химия и спектроскопия
157
XV-11.
XV-12.
XV-13.
XV-14.
XV-15.
XV-16.
Каковы значения п\ и «2 при применении комбина-
ционного принципа Ритца
v
в каждом из следующих случаев: а) расчет v для ли-
нии поглощения, обусловленной полной ионизацией
атома водорода из основного состояния; б) расчет v
для линии поглощения серии Пашепа, обусловленной
переходом электрона в атоме водорода с низшего
уровня этой серии («] = 3) на третий от этого уровень
той же серии.
Вычислите частоту (см'1) третьей линии серии Пфуп-
да (И] = 5) в спектре атома водорода. Постоянная
Ридберга для атома водорода равна 109 677,76 см-1.
На основе принципа запрета Паули покажите, что
максимально возможное число электронов на оболоч-
ке М (п = 3) любого атома равно 18.
Два пучка волн могут быть охарактеризованы функ-
циями ф1 = з1п(ах + 6/) и ip2=sin(ax — bt) соответ-
ственно. а) Для каждой из этих последовательностей
найдите скорость, направление распространения и
длину волны. (Примечание. Определите узловые точ-
ки (где ф=0) каждой последовательности и их дви-
жение.) б) Покажите, что ф+=ф[ + фг и ф-=ф1— фг
представляют стоячие волны. Определите узловые
точки каждой волны.
Постулат квантовой механики гласит, что оператор
энергии следующий: — ("2лг) > где — время,
а) Определите зависимость собственной функции
энергии от времени? (Другими словами, какая функ-
ция является решением уравнения —I -^r-l 1-^- 1=£ф?1
б) Если ф— собственная функция оператора энергии,
то как будет зависеть от времени плотность вероят-
ности |ф|2? Как полученный результат помогает рас-
крыть важность собственной функции энергии, осо-
.бенно в химии?
В классической механике энергия частицы дается
уравнением Е = + V (х), где р — импульс и V—
потенциальная энергия. В квантовой механике опе-
ратор (Н), соответствующий энергии, может быть по-
лучен заменой р на оператор (в одном измерении)
а) Сделав такую замену, получите вы-
158
Глава XV
ражеиие для оператора Н. (Следует отметить, что
квадратный оператор означает действие оператора
дважды.) б) Постулируем (задача XV-15), что эиер-
I h \1 д \ „
гии также соответствует оператор )• С0'
чета я предыдущий результат с этим постулатом, по-
лучите уравнение в частных производных, включаю-
щее зависимость волновой функции ф как от х, так
и от t. в) Заменив в этом дифференциальном уравне-
нии функцию, полученную в задаче XV-15(a), полу-
чите дифференциальное уравнение, не содержащее t.
(Примите, что ф не зависит от у и г.)
XV-17. Ниже приведено независимое от времени одномерное
уравнение Шредингера:
() (4^-) + V (х) ф = Еф,
\ 8л2т } \ дх2 ) 1 ' ' т т
где V — потенциальная энергия. Хорошо известно, что
только изменение V имеет физический смысл; ничего
в сущности ие изменится, если к V прибавить по-
стоянную величину. Покажите, что произойдет с урав-
нением Шредингера при таком изменении V; почему
эффект несуществен?
XV-18. Частица с массой т двигается в одном измерении,
ограниченном по оси х между х=0 и х=а. Потен-
циальная функция
( о,
V(x) =
(ос
О
х < 0 или х > а
а) Получите набор волновых функций ф для этой
частицы, которые ограничены и непрерывны везде,
включая х=0 и х=а, а также удовлетворяют урав-
нению Шредингера
-(«-)(43-)+yw^=£^
Найдите величину Е, соответствующую каждой функ-
ции. б) Установите, будут ли эти функции собствен-
ными функциями оператора момента количества дви-
жения Если это так, то найдите соб-
XV-19.
ственное значение, если нет, то объясните, почему
более одного момента соответствует одной функции.
Частица с массой т заключена в одномерный ящик
с началом координат в центре ящика. Ящик ограни-
Квантовая химия и спектроскопия
159
чей длиной от — у до у. Потенциальная энергия
V(x) =
О,
°°,
XV-20.
XV-21.
XV-22.
XV-23.
а) Напишите уравнение Шредингера для этого слу-
чая, введя отдельные уравнения для частицы внутри и
вне ящика, б) Предположим решение (внутри ящика)
в виде ф(х) = A sin(cx) + В cos(cx). Приведите пра-
вило, которое определяет все возможные с, и для каж-
дого возможного с укажите условия, при которых ip
удовлетворяет уравнению, в) Выразите энергию через с.
Каждая из следующих частиц заключена в одномер-
ный ящик (см. задачу XV-18). Для каждого случая
вычислите: а) энергию (эрг), соответствующую низ-
шему уровню энергии (п=1); б) разность (£2 — £1)
между низшим и ближайшим уровнем энергии; в) ко-
личество уровней с энергией меньше средней тепло-
вой энергии у kT (при 7’=300° К) •
Частица Масса т, г Длина (а)
I) Электрон 9,11-10““ 1 А
2) Молекула Н2 3,35-10“24 1 см
3) Шар 100 1 м
а) Выведите собственную функцию оператора момен-
та количества движения ("^7) с собственным
значением р. б) Покажите, что линейная комбинация
такой функции с собственными значениями У^пгЕ
и — У^тЕ эквивалентна каждой из собственных
функций энергии, найденных в задаче XV-18. Обсу-
дите связь полученного результата с задачей
XV-18(6).
Согласно соотношению де Бройля, р = у, где /? —
импульс и % — длина волны. Проверьте, действитель-
но ли длина волны, полученная из соотношения де
Бройля, является длиной волны, представляемой соб-
ственной функцией ф, полученной в задаче XV-21(a).
Примите 1) разность между двумя возможными мо-
ментами в задаче XV-21 (б) как меру неопределеЦ'.
160
Глава XV
XV-24.
XV-25.
XV-26.
XV-27.
ности момента частицы, \p — 2 У^тЕ', 2) разрешен-
ный интервал а как меру неопределенности положе-
ния, Дх—а. Вычислите Др Дх и сравните результат
с принципом неопределенности Гайзенберга.
Рассмотрите волновую функцию ф для одномерной
задачи. Для того чтобы |ф |2 dx представляло дей-
ствительную вероятность нахождения частицы между
4-00
х и х + dx, | | ф |2dx должен быть равен 1; обычно
—оо
этот интеграл представляет просто вероятность нахо-
ждения частицы в любой точке. Это условие может
быть удовлетворено умножением волновой функции
на подходящую так называемую нормировочную по-
стоянную. Полученная волновая функция называется
нормированной. Преобразуйте волновую функцию,
полученную в задаче XV-18(a), в нормированную
функцию.
Частица с массой т в одномерном пространстве огра-
ничена в положительном направлении оси х потен-
циальной энергией, так что У(х)=О, х > 0; Р(х) =
= <х>, х < 0. а) Найдите набор волновых функций
для этой частицы как собственных функций энергии.
Какие ограничения (если они есть) должны быть на-
ложены на энергию для того, чтобы получить прием-
лемый набор функций? б) Установите, будут ли эти
функции также собственными функциями момента
движения. Интерпретируйте физический смысл полу-
ченного результата.
Дана потенциальная энергия частицы:
V =0, — а х ^а
V — Vi> 0, — Ь^х^ — а или а<х^.Ь (6 = 2а)
V = v2 = 2Vj, х< —& или х>Ь
Изобразите схематически распределение уровней
энергии для частицы. Покажите различия между
большим и малым расстоянием между уровнями.
Объясните Ваше заключение.
Частица с массой т движется по оси х со следую-
щими потенциалами:
Область
1 х < О,
2 0^х<а,
3 х > а,
У = оо;
V = 0;
Квантовая химия и спектроскопия
161
Найдите ограниченную и непрерывную волновую
функцию, удовлетворяющую уравнению Шредингера,
для предельного состояния частицы (Е < Уо). Пер-
вая производная должна быть непрерывна везде, кро-
ме области бесконечно больших V. Функция будет со-
держать параметры, которые должны удовлетворять
некоторым уравнениям. Напишите эти уравнения, осо-
бенно уравнение(ия), которое(ые) определяет (ют)
возможные значения Е (нет необходимости находить
точные значения этих величин).
XV-28. Для жесткого ротатора с вынужденным вращением
в плоскости относительно фиксированной точки, но не
испытывающем действия других сил, энергия равна
L2/2/, где L — угловой момент, / — момент инерции,
L соответствует оператор I ) 1-^-1, где <р — угол
между ротатором и осью х. Найдите: а) оператор,
соответствующий энергии ротатора; б) разрешенные
энергетические уровни и собственные функции энер-
гии этого ротатора. (Помните, что ф должна иметь
единственное значение.)
XV-29. Простой гармонический осциллятор описывается в
квантовой механике дифференциальным уравнением
<>)
где h — постоянная Планка, m — масса колеблю-
щейся частицы, k — постоянная восстанавливающей
силы, х—смещение частицы из равновесного положе-
ния, ф— волновая функция и Е — энергия осцилля-
тора. Покажите прямой подстановкой, что каждая из
следующих функций (а и б) является решением урав-
нения (1) при условии, что постоянная а (или Ь)
имеет некоторое значение. (Функция ф является ре-
шением уравнения (1), если вся левая часть преоб-
разуется в Е, умноженное на ф.) Для каждой функ-
ции выразите а (или Ь) и Е через k, m и h и затем
выразите Е через классическую частоту v, где v =
k/tn. а) ф] = е-0-*’; б) ф2 — хе~Ьх2.
XV-30. Согласно волновой функции гармонического осцилля-
тора ф[ (задача XV-29), частица может находиться
в области между х=—оо и х=оо, но наиболее ве-
роятно вблизи х=0. а) Найдите длину Дх, такую, что
если х — ± уДх, то ф уменьшается на 10% (от ее
величины при х=0). Выразите результат через энер-
6 Зак, 1360
162
Глава XV
гию Е и другие необходимые параметры, б) Согласно
классической механике, импульс колеблющейся части-
цы изменяется между У 2тЕ и — У 2тЕ. (Докажи-
те это утверждение.) В квантовой механике для им-
пульсов так же, как и для положений, нет резких
пределов, но все же правильно принять /Хр = 2У2тЕ
за область, в которой вероятнее всего находится им-
пульс частицы. Вычислите Др Ах и сравните резуль-
тат с принципом неопределенности Гайзенберга.
XV-31. Сделайте серию эскизов, представляющих все воз-
можные колебания молекулы двуокиси углерода (мо-
лекула линейная), и укажите, какие из этих колеба-
ний будут активны в инфракрасной области.
XV-32. Колебательная частота ’Нз5С1 (в волновых числах)
равна 2989 см-1. Изотопный атомный вес 'Н 1,008,
35С1 34,97 ат. ед. (6,023-1023 ат. ед. = 1 г), а) Вырази-
те эту частоту в с-1, б) Вычислите приведенную мас-
су атомов в HCI в ат. ед. и г [см. задачу XV-33(b)].
в) Вычислите силовую постоянную валентных колеба-
ний HCI в дин/А.
XV-33. Колебательная потенциальная энергия двухатомной
молекулы может быть представлена приближенно
функцией Морзе
V = Д(1 -е-в<г-г°)у,
где г — межъядерное расстояние, г0 — равновесное
значение г, А и В— положительные постоянные для
молекулы, а) Покажите, что V имеет минимум при
г=г0. б) Выразите энергию диссоциации D молеку-
лы через А, В и г0. (Энергия диссоциации есть раз-
ность энергий при r = rQ и г=оо без учета кинетиче-
ской энергии.) в) Выразите аналогично колебатель-
ную частоту v. (Отметим, что для гармонического ос-
циллятора У=у^(г —г0)2 и v = где
z т,т,
ц— приведенная масса двух атомов; т ц. т •
Чтобы получить k и, таким образом, v, необходимо
аппроксимировать функцию Морзе к функции гармо-
нического осциллятора вблизи г=г0-) г) Исправьте
рассчитанную выше энергию диссоциации, учитывая,
что минимум энергии молекулы не соответствует г =
=Го, но выше на у hv (нулевая энергия).
XV-34. Для молекулы с симметрией BF3 (плоский равносто-
ронний треугольник) выразите через массы тв, т?
и длину связи г моменты инерции относительно ка-
Квантовая химия и спектроскопия
163
ждой из двух взаимно перпендикулярных осей в пло-
скости молекулы, проходящих через центр массы. По-
кажите, что два момента будут равны.
XV-35. Если атом (или ион) окружен шестью идентичными
отрицательными зарядами в октаэдрическом распо-
ложении вдоль осей координат, то атомная d-орби-
таль расщепляется на два набора орбиталей: 3z2— г2
и х2 — у2 с высшей энергией и ху, yz и xz с низшей
энергией. Предположив, что вместо шести отрица-.
тельных зарядов находится четыре, постройте орби-
тали: а) в прямоугольнике осей х и у\ б) тетраго-
нально во взаимоисключающих углах куба, грани ко-
торого перпендикулярны трем осям. Опишите каче-
ственно уровни энергии d-орбитали в каждом случае.
XV-36. a) 2s- и 2р2-орбитали атома водорода следующие:
ф25 = —т= (%-------— | е-''/’20'»;
4/2л 0 \ aj
, — —1= а~е/г — e~r/2a° cos 0.
г 4/2л 0 а0
(«о — радиус Бора, 0,529 А.) Используя эти орбитали,
объясните выражение для двух диагональных (sp)-
гибридных орбиталей вдоль оси z Z\2 —(-pL^X
Х(ф2., ± ’Ф2Рг)-б) Для каждой (не для обеих) гибридных
функций вычислите плотность вероятности | ф|2 по
оси z при г=а0 и z=—а0 через а0 и другие универ-
сальные постоянные, в) Сделайте тот же расчет от-
дельно для 2s- и 2р2-функций. г) Как полученные ре-
зультаты могут объяснить относительную прочность
связи, образованной s-, р- и sp-орбиталями?
XV-37. Электрон в атоме водорода находится на 2р2-орби-
тали (см. задачу XV-36). Оцените вероятность того,
что этот электрон находится внутри шара радиуса «о
с центром в ядре атома.
XV-38. Сделайте эскиз предполагаемого спектра протонного
магнитного резонанса гипотетической молекулы
Н2С—ОН2 а) содержащей следы кислоты или основа-
ния; б) строго индивидуальной. Примите, что кислот-
ные свойства протонов, связанных с атомом кислоро-
да, такие же, как в случае СНзОН. Перечислите осо-
бенности каждого спектра, в) Оцените различия ме-
жду спектрами в случаях (а) и (б).
6*
Глава XVI
СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
XV1-1-1.
XVI-1-2.
XV1-1-3.
XV1-1-4.
XVI-2-1.
XVI-2-2.
РАЗДЕЛ XVI-1
Оцените предельную высокотемпературную теплоем-
кость Су (кал• моль'1-град-1) нелинейной молекулы
РН3 (фосфин).
а) Для каждого из следующих газов, предполагаемых
идеальными: Не, CF4 (нелинейная молекула), C2F2
(линейная молекула), найдите мольную теплоемкость
при постоянном объеме из приложения законов клас-
сической механики ко всем видам движения ядер,
б) Как отличается фактическая теплоемкость каждо-
го газа при обычных температурах от рассчитанной
выше (больше, равна или меньше)? Объясните.
Почему теплоемкость вещества в твердом или жид-
ком состоянии при одинаковой температуре обычно
больше теплоемкости того же вещества в газообраз-
ном состоянии?
Изменение энергии при 0° К реакции NaCl (г)
Na+(r) ф- С1'(г) Део=8,63-10~12 эрг-молек-1. Вы-
числите отношение константы равновесия реакции
NaCl(aq) Na+(aq) ф- Cl'(aq) и Кс реакции в газо-
вой фазе при 300° К- Предположите, что единствен-
ным различием между реакциями в жидкой и газо-
образной фазах будет Део, деленное на диэлектриче-
скую проницаемость воды (~80).
РАЗДЕЛ XVI-2
Число степеней свободы для колебаний нелинейной
га-атомной молекулы в трех измерениях равно (Зга —
— 6). Рассмотрите воображаемую га-атомную нели-
нейную молекулу, существующую только в двухмер-
ном пространстве (например, в плоскости изображе-
ния). Определите число степеней свободы для коле-
баний такой молекулы. Как будет отличаться ре-
зультат для линейной молекулы?
Большое число частиц находится в поле притяжения
источника с силой, такой, что потенциальная энергия
каждой частицы равна м(г)=г2а (г — расстояние от
источника). Температура равна Т. а) Выведите выра-
жение (содержащее неизвестные константы пропор-
циональности) для числа частиц на единицу площади
Статистическая термодинамика
165
на расстоянии г. б) Выведите аналогичное выраже-
ние для общего числа частиц между расстоянием г и
г -|- dr. в) Оцените среднюю потенциальную энергию
к (г) для группы частиц через приведенные величины
и универсальные постоянные.
XV1-2-3. Рассмотрите набор молекул, каждая с массой т, на-
ходящихся в двух измерениях, но ведущих себя по-
добно молекулам идеального газа. Закон распреде-
ления каждой компоненты скорости имеет вид
dNv л —mv^JzkT ,
а) Выведите закон распределения по скоростям V.
-^- = F(v)dv.
'«общ
Ответ не должен содержать неизвестных констант,
таких, как А. б) Выразите среднюю скорость моле-
кул v через т, Т и универсальные постоянные.
XVI-2-4. Для некоторой гипотетической молекулы функция
распределения равна <7 = 2 -|- fte, где р=1//г7’, а ё —
характеристическая постоянная молекулы. Рассчитай-
те через р, е и универсальные постоянные а) среднюю
энергию и, б) среднюю энтропию S и в) теплоемкость
(дЩдТ\.
XV1-2-5. Некоторая молекула может существовать в любом
синглетном (спины спаренных электронов) или три-
плетном (спины неспаренных электронов) состояниях.
Вырождения синглетного или триплетного уровня бу-
дут 1 и 3 соответственно. Энергия синглетного состоя-
ния в превосходит энергию триплетного состояния,
а) Напишите электронную составляющую функции
распределения этой молекулы. Укажите все прибли-
жения, которые были сделаны, б) Для е=1,38Х
ХЮ"14 эрг и 7’=100°К найдите отношение заселен-
ности синглетного уровня к заселенности триплетного
уровня. Какое предположение следует сделать о вра-
щательных и колебательных энергетических уровнях
молекулы? Если не делать этого приближения, то ка-
кое другое, более общее предположение необходимо
сделать?
XVI-2-6. Разделим возможные состояния молекулы на два
класса А и В. Пусть NA и NB — равновесные числа
молекул в обоих классах, N=NА + NB-, ёл, ёв—
средняя энергия молекул в этих классах. Предполо-
жим, что молекулы образуют идеальный газ и пре-
терпевают переходы между классами А и В. Энергии
166
Глава XVI
XV1-2-7.
XVI-2-8.
XV1-2-9.
XVI-2-10.
измерены от одинакового нулевого уровня для обоих
классов, а) Выразите заселенность Л'д и NB, энергию
ёА и ёв через парциальные функции распределения
qA и qB, приведенные к уровням, относящимся к од-
ному классу. (Этот, а также последующие ответы мо-
гут содержать Т, /V и универсальные постоянные.)
б) Выразите общую энергию системы через
ёЛ и ёв. в) Выразите теплоемкость системы Су через
общую энергию системы. Как изменится ответ, если
переход между двумя классами молекул будет невоз-
можен? г) Используя полученные результаты, пока-
жите, что
с -нс +ЫС I ^.(8л-Мг
а) Для газов Не, CF4 (нелинейная молекула) и C2F2
(линейная молекула), считая их идеальными, найдите
мольную теплоемкость при постоянном объеме из при-
ложения классической механики ко всем видам дви-
жения ядер, б) Будет ли теплоемкость каждого газа
при обычных температурах отличаться от рассчитан-
ной?’ Объясните, в) Второй электронный энергети-
ческий уровень атома гелия на 3,13-10'11 эрг выше
низшего уровня. Определите приближенно самую
высокую температуру, при которой теплоемкость
гелия будет соответствовать рассчитанной выше.
Объясните.
Молекула SO2 нелинейная, а) Найдите мольную теп-
лоемкость Су газообразного SO2 из приложения клас-
сической механики ко всем видам движения ядер,
б) Колебательные частоты SO2 (с-1): 1,57-1013; 3,45Х
ХЮ13 и 4,08-1013. Какова низшая температура_(при-
ближенпо), при которой можно ожидать, что Су га-
зообразного SO2 будет согласоваться с результатом
расчета в пункте (а). Объясните.
Молекула А2В нелинейная. Ее колебательные частоты
(с-1): 1,00-1013; 9,0-1013; 1,00-10’4. а) Определите моль-
ную теплоемкость Су газообразного Л2В при 100
и 1000° К- Объясните, б) Найдите Су при очень высо-
кой температуре, приняв, что молекула не диссоции-
рует и электроны остаются в состоянии с низшей энер-
гией. в) Определите приближенно температуру, выше
которой Су будет иметь величину, найденную в пунк-
тах (б). Объясните.
Колебательные частоты некоторой нелинейной моле-
кулы АВ2: 4,0-IO12, 5,0-J_012 и 7,0-1013 с-1. Определите
мольную теплоемкость Су газообразного АВ2 при 500
Статистическая термодинамика
16?
XV1-2-11.
XV1-2-12.
XVI-3-1.
XV1-3-2.
и 5000° К (предполагая, что молекула не диссоции-
рует). Объясните.
Молекула ацетилена НССН линейная. Колебательные
степени свободы включают три валентные и четыре
деформационные колебания. Наблюдаемая теплоем-
кость Cv 8,0 кал-“К-1 • моль-1. Определите Су для
ацетилена: а) из приложения классической механики
к движению ядер; б) из предположения, что валент-
ные колебания имеют очень высокую частоту (v
kT/h), а деформационные — очень низкую (v С
•С kT/h)\ в) предполагая, что все колебания имеют
очень высокую частоту, г) Объясните связь между
этими предположениями и экспериментальным значе-
нием Су.
Объясните, согласно предположениям, сделанным в
соответствующих теориях, почему:
а) теории теплоемкости твердых тел Эйнштейна и
Дебая утверждают, что lim Су = 0, тогда как по клас-
сической теории Су не зависит от температуры;
б) теория Эйнштейна предсказывает, что Су стремит-
ся к пулю быстрее, чем предполагает теория Дебая.
РАЗДЕЛ XV1-3
М частиц, каждая с массой пг, ограничены в прямо-
угольной плоской области с ребром L, на которое
с внешней стороны не действуют никакие силы,
а) Выразите силу на единицу длины, с которой эти
частицы действуют на границу прямоугольника, че-
рез N, tn, L, среднюю кинетическую энергию частиц ё
и универсальные постоянные, б) Частицы находятся
в равновесии с окружающей средой при температуре
Т. Какова связь между ё и Т? Объясните, в) Выра-
зите среднюю скорость частиц v через Т, ё , m и уни-
версальные постоянные.
Разбавленный мономолекулярный слой на поверхно-
сти жидкости содержит /V одинаковых молекул на
единицу площади. Молекулы двигаются независимо
друг от друга и от молекул растворителя. Масса ка-
ждой молекулы ш. (Ответы должны содержать tn, N,
Т и универсальные постоянные.)
а) Определите нормированную функцию распределе-
ния f(u) по двухмерным скоростям этих молекул, та-
кую, что
со
J f (v)dv = 1.
о
168
Глава XVI
XVI-3-3.
XVI-3-4.
XVI-3-5.
б) Рассчитайте средние v, v2 и v3. в) Определите
число столкновений на единицу длины в единицу вре-
мени с линейным отрезком края поверхностного слоя,
г) Найдите поверхностное давление (т. е. падение по-
верхностного натяжения), оказываемое поверхностной
пленкой на перегородку, отделяющую пленку от сво-
бодной области, д) Определите среднюю кинетиче-
скую энергию молекул, которые проникают сквозь
малую щель в перегородке.
Молекулы, каждая с массой т, ограничены одним из-
мерением, в котором они двигаются (в противопо-
ложных направлениях) по закону случая с распреде-
лением по скоростям, определяемым температурой Т.
Молекулы проницаемы и могут проникать сквозь друг
друга, а) Какова средняя скорость молекул v? б) Вы-
разите среднюю скорость |г>] через т, Т и универ-
сальные постоянные, в) Вычислите среднюю относи-
тельную скорость |г?211 и отношение |г>21 \/\v |.
Некоторая гипотетическая «молекула» может суще-
ствовать только в одном из трех состояний с энер-
гиями 0, е и е (два состояния имеют одинаковую
энергию), а) Найдите функцию по состояниям Q и
мольную теплоемкость Су для 1 моля этих молекул
через е, Т и универсальные постоянные, б) Постройте
график зависимости Су от Т для этих молекул, в) По-
стройте график зависимости Су от температуры для
обычных молекул. Используйте кристалл Дебая как
типичный образец набора обычных молекул, г) Объ-
ясните физический смысл любого характерного раз-
личия между построенными графиками.
Некоторый осциллятор имеет бесконечное число энер-
гетических уровней с расстоянием Ь между ними:
со = 0; Ei = bi, Е2 = 2Ь, ..., Еп = nb. Число разных со-
стояний (вырожденных или мультиплетных), соответ-
ствующее га-му энергетическому уровню, равно Зп:
go=l, gi = 3, g2=9, ..., gn=3n. Если имеется не-
сколько таких осцилляторов, то они не взаимодей-
ствуют. Найдите: а) функцию по состояниям 1 моля
(число Авогадро) этих осцилляторов в виде беско-
нечного ряда, а также в виде конечной функции че-
рез b, Т и универсальные постоянные; б) V, S и Су
вещества, состоящего из этих осцилляторов, учитывая
только колебательные составляющие, в) Возможно
ли, что когда-нибудь будет открыт действительный ос-
циллятор, имеющий эти энергетические уровни и вы-
рождения 1) для всех энергий от нуля до бесконеч-
ности, 2) для низких энергий, с распределением энер-
Статистическая термодинамика
169
гий и вырождением, отличным от вырождения при
высоких энергиях? Объясните поведение набора та-
ких осцилляторов при различных температурах.
XV1-3-6. Обычно физические системы бывают типа I: ряд воз-
можных энергетических уровней от конечного значе-
ния ео до +оо. Некоторые степени свободы принад-
лежат к типу II: конечное число энергетических уров-
ней, ограниченных пределами, например, ео и ет. Те-
перь предположим также два гипотетических типа:
III, —оо <е<е0 и IV, —оо <е< -фоо. а) Обсу-
дите для каждого из четырех типов возможное зна-
чение обратной температуры $=\/kT (положитель-
ное, отрицательное, действительное, мнимое, между
некоторыми пределами и т. д.). Воспользуйтесь всеми
тремя типами статистики, б) Опишите, что произой-
дет, если система типа III находится в тепловом кон-
такте с системой типа I или II.
XVI-3-7. Свободная энергия (и, следовательно, химический по-
тенциал ц) содержит произвольную линейную функ-
цию температуры а-^-ЬТ и, таким образом, зависит
от произвольных постоянных а и Ь.-Если уравнение
а = —n/RT правильно, то две соответствующие про-
извольные постоянные должны появиться в а (а —
параметр закона распределения Больцмана А^ =
= gie~ae~^kT). ea—Q/N, где Q — функция распределе-
ния, a N — число частиц, а) При каком условии (ях)
а и b определены в феноменологической термодина-
мике? б) Обсудите влияние изменения этих произ-
вольных постоянных на уравнения статистической ме-
ханики и опишите условия (может быть, воображае-
мые), при которых эти постоянные обычно опреде-
ляются. Ограничьтесь статистикой Больцмана.
XVI-3-8. Понятие «абсолютная энтропия» имеет значение, при-
сущее квантовой статистической механике, но оно мо-
жет иметь значение и в классической механике или
феноменологической (т. е. эмпирической, нестатисти-
ческой) термодинамике при принятии произвольных
условий. Объясните.
XVI-3-9. Представьте пространство, в котором постоянная
Планка заменена функцией температуры, напри-
мер, h=aTn, где а и га — постоянные. Получите вы-
ражение для энтропии 3 1 моля идентичных (неотли-
чающихся) гармонических осцилляторов в таких ус-
ловиях. Установите, для каких значений га limS = 0
т->о
будет неограничен и для каких значений этот предел
ограничен, но не равен нулю. Используйте минимум
170
Глава XVI
XVI-3-10.
XVI-3-11.
XV1-3-12.
X VI-3-13.
XV1-3-14.
на кривой потенциальной энергии (но не низший энер-
гетический уровень) как пуль энергии. (Заметьте,
что lim7'°= 1 даже когда нуль энергии пе опре-
т-»о
делен.)
а) Закон распределения материальных частиц (с мас-
сой покоя, не равной нулю) дает возможность про-
извольного выбора пулевого уровня энергии. Пока-
жите, каким образом три закона распределения влия-
ют на изменение энергии каждого уровня Де и что
эти законы существенно не меняют этого изменения,
б) Закон распределения фотонов требует, чтобы энер-
гия, которую имеют фотоны, была определена в аб-
солютном значении. Покажите, как закон налагает
такое требование, и объясните его физический смысл.
Полость объемом V при температуре Т содержит фо-
нионы (ложные фотоны), находящиеся в равновесии
со стенками. Ложные фотоны сходны с фотонами тем,
что они — бозоны, каждый с энергией hv, их общая
энергия сохраняется только при условии добавочного
сжатия: сумма квадратов их частот остается по-
стоянной. Получите уравнение, аналогичное закону
распределения Планка, для числа ложных фотонов
с частотой между v и v + dv.
Новый тип частиц (фиктоны} имеет свойство не со-
храняться. Изолированный набор этих частиц имеет
единственное ограничение: их общая энергия сохра-
няется. Фиктоны, таким образом, имеют сходство
с фотонами, которые могут создаваться или разру-
шаться па стенках сосуда, однако отличаются от них
будучи различимыми, а) Получите закон распреде-
ления фиктонов через р = 1/kT, число фиктонов в 1-м
состоянии, когда каждая частица имеет энергию е.
б) Выразите общую энергию и общее число частиц
через р и е;. в) Укажите особенности этого закона.
Известен новый вид частиц — новоны. Для них ха-
рактерно, что результатом взаимообмена двух частиц
является новое состояние. Однако новоны имеют сход-
ство с ферми-ионами в том, что в каждом состоянии
не может быть больше одного повона. а) Выведите
выражение для числа состояний, соответствующих
данному распределению новонов, через вырождение
gt и число заселения V,-. б) Запишите закон распре-
деления этих частиц, в) Укажите и обсудите особен-
ности этого закона.
Предположим, что молекулы могут подвергаться
«спонтанной абсорбции» из состояния п в высшее со-
Статистическая термодинамика
17)
стояние m с вероятностью перехода Апт. (Это воз- можно при условии, что излучение будет иметь мень- шую энергию, чем вакуум.) а) Используя закон рас- пределения Планка, покажите, что Лпт=0- б) Как должен быть видоизменен закон распределения План-
XV1-3-15. ка, если Дпт#=0. Для двухатомной молекулы с идентичными атомами возможная вращательная энергия ₽ - AW+ ’) J 4л2тг2 ’ где h — постоянная Планка, т — масса каждого ато- ма, г — расстояние между ядрами и J = 0, 1, 2, 3, ... . Известны межъядерные расстояния (см): Н2 О2 С12 7,4 • 10-9 1,21-Ю-8 1,99-10-8 а) Вычислите (ё[— e0)/kT при 100° С для каждого газа. б) Обсудите, как с помощью полученного результата можно объяснить приведенные ниже данные по моль- ной теплоемкости при постоянном объеме (кал-°К-1Х Хмоль-1): 0° С 100° С 200° с Н2 4,87 4,93 5,05 О2 4,99 5,05 5,15 С12 5,95 6,3 6,7
XVI-3-16. Примените теорию Дебая к одномерному кристаллу (цепи) из N атомов, в котором каждый атом совер- шает только продольные колебания. Выведите выра- жение для теплоемкости цепи. Преобразуйте резуль- тат в приближенные формы, применимые вблизи 0°К и при высокой температуре.
XVI-3-17 При низкой температуре (^70° К) единственное ко- лебание графита, которое «не заморожено»,— коле- бание, перпендикулярное плоскости бензольных колец графита. Графит можно рассматривать как двухмер- ный кристалл, в котором каждый атом имеет одну степень свободы. Используя приближение Дебая, по- лучите выражение для теплоемкости Cv графита при низкой температуре.
РЕШЕНИЯ ЗАДАЧ
Г лава I
ГАЗЫ
1-1-1. РАЗДЕЛ I-T л У, . т/4 тз. 7, ~~ Т2 ’ V 3'2,)’ 3 - (4л/3) f/2)2 1 • (4л/3) (rf/2)3 . 278 298 ’ 278 298 ’ 1’48 СМ.
1-1-2. Вес озона 1Г = 6,7624— 6,5998 = 0,1626 г. WRT 0,1626-82,06-301,4 М PV (274,4/760) • 235,67 47,3 Г М0ЛЬ '
1-1-3. ,, WRT 0,1023-82,06-305,7 _. 1П М PV (743,95/760) • 35,33 = 74>19г моль •
1-1-4. Введя поправку на относительную влажность, Мак- Инес и Крейлиг получили /И=75,72. Значение, рас- считанное из атомных весов, равно 74,12. Р, атм 0,400 0,8000 1,000 d/P, г-л-1-атм-1 3,780 3,860 3,900
1-1-5- Для идеального газа PM=dRT, т. е. M=dRT/P. Для реального газа Л4 = РГПт(d/P). Построим гра- Р-»0 фик зависимости (d/P) от Р и проведем экстраполя- цию к Р = 0. Из графика видно, что lim (d/P) = Р->0 =3,700 г • л”1 • атм”1. М=0,08206 л-атм-°К_1,моль_,Х Х300° К-3,700 г-л-1 • атм-1 = 91,09 г-моль-1. Построим график зависимости (d/P) от Р и проведем экстраполяцию к Р—0. Р, атм 0,2 0,5 0,8 d/P, г-л-1-атм-’ 1,398 1,416 1,4344 lim(d/P) — 1,3857 (из графика) р-»о М = RT= 1,3857 • 0,08206 • 273,15 = 31,07.
176
Глава I
(Вычисленное теоретически значение равно 31,06.)
| е e,kT Vг dz
1-1-6.
1-1-7. 4г1п77== — hi)(d — d');
8,31 - 107 • 288,2 • 2,303 . 100
•g 47
= 4-л (2,12- IO"5)3 • 981 • (35 — 5) • 10~4-(1,206 - 0,999);
A7 = 7,44- 1023.
(Указание. Используйте для R размерность:
эрг • °К-1 • моль-1.)
Максимум будет иметь место при наиболее вероят-
ной скорости
При этой скорости
f(O) = 4nO2(-^)V^r =
= 4л (1,50 • 105)2 ( 2я.8>314. ю?. 273,2) X
2,016(1,51 105)2
Хехр[ 2 - 8,314-107 - 273,2 J*
f (v) = 5,54- 10“6.
Аналогично можно рассчитать /(о) при различных и.
Полученные значения приведены ниже:
v • 105, см-с-1 0,50 1,00 1,50 2,0 3,0 4,0
f(v)-10e 1,49 4,28 5,54 4,53 1,11 0,89
Газы
177
На графике показана эта зависимость
r PN- Ю-3 _ (1/760)- 1,013- 106- 6,023 1023- 10~3
С RT 8,314- 107 • 298,2 “
= 3,24 • 1013 молек • см-3;
1 ~ V2 ла2 С ~~ /2 л (2,86 • 10-8)2 • 3,24 • 1013 — 8,49 СМ'
. j r /W-10-3_ (1/760) • 1,013 • 106 • 6,023 • 1023-10~3
c RT 8,314- 107 - 298,2 ~
= 3,24 • 1013 молек • см-3;
(8RT\'l2 /8-8,314-Ю7-298,2\'/2 .
y = Ur) ------) =4,75-10<cm-c
Z=¥~naW = ^y-n(3,16- 10~8)2 • (4,75 • 104)X
X (3,24 • 10I3)2= 1,11- Ю17 столк • cm-3 c-1.
1-1-11. Скорость вытекания для водорода равна dtiH.Jdt —
= Пн2анЛ, а для дейтерия — dnQJdt — п.ь^О1А или
dnH,ldt _ пн, 5н, _ 90
dnDJdt nD oDtA nDi ’ 6D> 10 ' 6Dj '
Выражение Грэхэма содержит среднеквадратичные
скорости, но поскольку они пропорциональны сред-
178
Глава I
ним арифметическим скоростям, постоянная пропор- циональности исчезает. Можно записать ,90 ~-1Л^-91/Тбб=12 7 dnDJdt 10 У М112 10 У 2,016 9 V 2,00 12,7. Таким образом, относительная скорость вытекания со- ставляет 12,7 молекул Нг на одну молекулу D2. Сле- довательно, состав проходящего первоначально газа следующий: йкп=т=7’30 мол-0/0 D2; 100 —7,30 = 92,7 мол. % Н2. (Данные о температуре, давлении и площади сечения излишни.)
1-1-12. - п nRT 2-0,08206-298,2 . nn а) Р- v - 10>0 -4,90 атм; ,, n nRT п2а 2-0,08206-298,2 22 - 25,43 . м „ б) Р- v_nb уг ,0.0- 2(0,1453) (10,0)2 ~4’02 а™-
Ы-13. , ,, nRT 0,1-0,08206-273,2 пп . . п-з a) V= р = 100 = 22,4-10 л; х. ZnRT 0,2007-0,1-0,08206-273,2 . .л-з б)У 100 - 4,50-10 л.
1-1-14. 17 — P'V' — 800-1.00- 1,10-373,2 __ 0 77 И2— Р2 ZJ\ ~~ 200-1,95 - 223,2 О»// Л.
М-15. -РкрУкр _ а 3ft_ 4TbR _ 3 Zk₽ ЯТкр ' 27ft2 ~R 8а 8 U’0/0,
М-16. Для многих веществ нормальная температура кипе- ния (°К) приблизительно равна 2/3 критической тем- пературы (°К). Таким образом, | 7кр = 7К = (68,9 + 273,2) = 342,1; 7кр==513°К (принято 507,9°К)> или 240°C.
РАЗДЕЛ 1-2
1-2-1. Постройте график зависимости а от Р. При Р = 0
а = 3660,9- 10-6 (из графика). Согласно закону Гей-
Дюссака, Vt = V0(l + at), где а = • ЕслИ
Газы
179
Р—>0, поведение газа подобно идеальному и закон Гей-Люссака выполняется. Используем значение а приР = 0. Если/ = /0, то У( = 0, а при этих условиях Ц-а/о = О и f0 = -- = - б=“273,16. ° a 3660,9 • 10~ь
1-2-2. р-»о V г > = (2,000 + 0,0200 Р) г • (л-атм)-1; М = RT (2,000) = 0,082056 л-атм • град-1 • моль'1 X X 300,00°К 2,000 г • (л-атм)-1 = 49,23 г • моль-1.
1-2-3. Применяя закон идеальных газов, найдем, что при 0° С и 760 мм рт. ст. (без поправки) вес 1 л НС1 равен • 0,76097 = 1,64053 г. 465,856 756,76 Средняя величина для четырех серий данных равна 1,64016 г-л-1. Поскольку давление измерено в Лондо- не, где ускорение силы тяжести в 1,000588 раза боль- ше, чем на широте 45°, истинное давление будет рав- но Рпабл• 1,000588, а исправленный средний вес одного литра: 1,64016 । 63919 г-л-1 1,000588 ’° у г л Из графика зависимости PV от Р можно найти, что при Р = 0 произведение PV равно Ро/о—55 213; при Р = 760 мм рт. ст. PV=P\ Г1 = 54 803. Пусть у — плот- ность НС1 при 760 мм рт. ст. и 0° С, тогда РоУо 55 213 _ 1,63919 . _ 1 с97а9 _ „-1 PiV1 54803 у > У 1,62702 г-Л . Теперь пусть х — молекулярный вес НС1, тогда 1,62702 х ас . 1,42762 31,9988 И Х ^6,467. Атомный вес хлора 36,467— 1,008=35,459. Атомный вес хлора по шкале атомных весов 1961 г. равен 35,453. Грэй и Барт, используя старую шкалу атомных весов, получили величину, незначительно от- личающуюся от этой.
180
Глава I
1-2-4.
1-2-5.
(^o-ro)Hg .лл,
zng ==7i7—• loo;
s (моо — Ио/Hg
50
V5o Vo = J aVoc?/ =
0
= | 1,817- IO-4/ + 2,95 • 10-9/2 +
+ 1,15- 1О",о/ТУ0 =
= 0,009107V0;
100
Vioo Vo = J aV0 dt =
0
= | 1,817- КГ4/ + 2,95 • I0"9/2 +
+ 1,15- 10_V|o00V0==
= o,oi83i/0;
2 ____ 0,009107Vq 1 nr> . лп oof
/hs “ o;oi83iK" • 100 - 49,8 C.
а) Это определение основано на особых свойствах
ртути; ртутный термометр, калиброванный в соответ-
ствии с идеальным газовым термометром в двух точ-
ках, не будет иметь согласия в других точках. Ме-
ждународная шкала, основанная па свойствах неко-
торого идеального газа (точнее, некоторого реального
газа с давлением, равным в пределе нуля), более
предпочтительна, чем шкала, которая выбрана по ка-
кой-нибудь термометрической среде. Кроме того, эта
шкала имеет фиксированные точки: замерзания и ки-
пения воды (как интернациональная шкала до
1954 г.). Температуры, близкие к 0° К, могут быть
установлены более воспроизводимо, если абсолютный
нуль взят как одна из фиксированных точек, б) При
этом определении Г пропорциональна объему Ог (не-
идеального газа) при постоянном давлении. Интерна-
циональная шкала определяет Г как Т = 1 /nR lim {PV
р->о
для любого газа, и таким образом избегается любая
зависимость от особенностей данного газа. Шкала
идеального газа, определенная таким образом, имеет
решающее преимущество, так как она идентична тер-
модинамической шкале.
Газы
181
1-2-6. Пусть 1Гдг — вес Аг (г); ITне — вес Не (г). Тогда 1Гаг+
+ й7Не = 5. Обозначим парциальное давление аргона
РАг, парциальное давление гелия Рне; общее давле-
ние Р= 1 атм. Тогда
п_п , п RT , RT WArRT , wHeRT
Р Раг + Рне — «Аг у + «Не у — м^у + —
' ___ / ГНе 5 ~ Гне 'I °’082' ’ 298 __
к 4,00 39^9 / Щ0 —’
Й7не = 3,67 г.
100 = 73,4 вес. % Не;
О
100 — 73,4 = 26,6 вес. % Аг.
1-2-7. Число молей НгО «Нго в RT насыщенного воздуха
PV
равно ду =0,0312 моля; РТ=24,47л-атм-моль-1. Об-
щее число молей Ыг + Ог + Аг, содержащееся в
24,47 л насыщенного воздуха, равно 1 — 0,0312 =
=0,9688. Таким образом, общий вес всех газов и па-
ров воды в 24,47 л насыщенного воздуха равен
2-14,0067 + 0,781-0,9688 + 2-15,9994-0,210-0,9688 +
;+ 39,948 • 0,009 • 0,9688 + 0,0312 • 18,02 = 21,18 +
-4-6,51 +0,35 + 0,56=28,60 г.
Плотность воздуха, насыщенного водой при темпера-
туре 25° С и общем давлении 1 атм, будет равна
28,60 . 1С_
— =1,169г-л >.
1-2-8. а) 1п-^ = -^(^.;
. 1 _ 29 - 980,6(300-100 - 0) __пп1 до.
lg Р 2,303 • 8,314 • 107 • 298,2 О.ШЧУ,
1g р = — 0,0149 = 9,9851 - 10;
Р— 0,9935 атм.
б) График зависимости 1g Р от h должен предста-
влять прямую линию, проходящую через точку
lg Р= 1g 1=0 (если Р выражено в атмосферах) при
й = 0, с наклоном Mg/2,303RT.
1-2-9.
—dP = pgdz = —dz (р — плотность);
dP___ Mg dz .
Р ~ RT '
182
Глава I
1-2-10.
ln( P \ Po J . Mg dz RT ’ p == p^-Mgz/RT,
dP Mg dz GmE
~P~ RT ’ ~~ r2 ’
dP MGm^ dz E • z = r — rE\
P RTr2 ’
(rE — радиус Земли).
dP MGm^dz
~P~ = ~Rr(z + rEY’
/ P \ MGm„ f 1 1 \
W V + 'f rE)
dP _ Mg dz ' dP ____ Mg dz
P ~ RT~'’ ~T~~ R(T0-az) *
Пусть To — az — x. Тогда dx =— adz, a dz = — dxja.
X
Xo
p \ _ Mg (Тй — аг\
Po J Ra Ш To Г
1-2-11.
1-2-12.
а) Число молекул co скоростью между v и v-j-dv
равно Ce~mv2/2kTv-dv, где С — некоторая постоянная.
Это выражение пропорционально множителю Больц-
мана и объему 4nu2du области в пространстве ско-
ростей между двумя концентрическими сферами
с радиусами v и v + dv соответственно. Число
молекул, имеющих скорость больше о0> равно
оо
С J e~mv2l2kTv2 dv. Общее число молекул
Vfi
С Г e-m^/2kTv2 dv=C (^LX'2.
J 4 \ m )
о
Доля молекул с v > и0 составит:
4
V0
g-mv2l2kTy2 dv.
e-mv2l2kTv2dy
0
Газы
18!
Этот интеграл не может быть выражен конечным
сочетанием элементарных функций.
б) В двух измерениях число молекул со скоростью
между v и v -4- dv равно Ce~mv2,'ikTv dv. Рассмотрим
область между окружностями с радиусами v и v + dv
соответственно; площадь этой области равна 2iwdv.
Доля молекул с v>v0 равна:
1-2-13.
f e~mvV2kTvdv
J 9 /
Ра _____________ o~mv0pkT
оо •
J e~m^vdv
о
f -mv2 2kT
J vxe Xl dvx _______________ ,_________
Г7~~1__ 0__________________, f 2kT ___, f 2RT
* 00 2 lr,.T 1 Л1п r nAf
f -mvx pkT
J e xl dvx
о
Z соударений • см-2 • c_| = у N молек • см-3 X
X V^RT/rcM см • с-1, где у N — доля молекул, дви-
гающихся к поверхности, и \^2RТ/лМ — объем ци-
линдра с площадью сечения 1 см2, молекулы в кото-
ром будут ударяться о поверхность за 1 с (если они
двигаются к поверхности).
у___ ‘/2 • 1 атм • 6,023 • 1023 молек моль-1 ..
82,06 см3 • атм • град-1 - моль-1 -298 град
, /"2^314 • 10г • 298~ /0,2 0,8 \ __
Х V л Ч /32 "t" /28 /
= 2,885 • 1023 соударений см-2 • с-1.
Д = 2 • 104 см2;
ZA = 2,885 • 1023 • 2 • Ю4 = 5,77 • 1027 соударений • С"1.
1-2-14. Площадь отверстия А = № = 3,14 • (0,29б5/2)2 =
= 0,0692 см2.
»=4№ =2’"85'10-5 г''с''
- 2-м о-5/2-3'’4-8'::./"55--
= 2,80 дин • см-2;
Р= 2,80 9,87 • 10~7 = 2,77 • 10~6 атм.
184
Глава 1
1-2-15.
Ч ГА
а) —
1 Б
б)
ГаМб\‘<
в)
°БСБ .
°2аса ’
г) ( Х1г °АСА
\Ма/ стБсБ
1-2-16.
1-2-17.
а) Вязкость газа — результат бокового перемещения
момента количества движения между слоями, движу-
щимися с различной скоростью. При повышении тем-
пературы молекулы двигаются быстрее и увеличи-
вается перенос момента в единицу времени, б) Боль-
шие молекулы чаще сталкиваются с другими молеку-
лами, уменьшаются длины их свободного пробега и
становится меньше средняя разность моментов между
слоями газа, между которыми перемещаются молеку-
лы за каждый свободный пробег. Следовательно, вяз-
кость уменьшается с увеличением диаметра молекул,
в) С уменьшением давления пропорционально умень-
шается количество молекул, передающих момент ко-
личества движения. Однако средняя длина свобод-
ного пробега молекул изменяется обратно пропорцио-
нально давлению, и таким образом с уменьшением
давления увеличивается способность каждой молеку-
лы к передаче момента между слоями, движущимися
с различными скоростями. Эти два эффекта точно
компенсируются. Однако при очень низких давлениях
средний свободный пробег становится сравнимым
с размером сосуда. Он не может увеличиваться да-
лее, и вязкость приближается к нулю при приближе-
нии давления (и, следовательно, числа молекул)
к нулю.
У"2 лСа2 1^2 л (10~5 атом • см-3) (4 • 10~16 см2)
1 СВ. ГОД сгс\
X п/«Г-1П17-----= 59 св. лет;
9,464 • 1017 см
/8-8,314- 107-7,8- 105 эрг • (г-атом)"1
лМ у л-1,008 г • (г-атом)”1
= 1,64 • 10й эрг • г-1 = 1,28 • 107 см • с'1;
Л 59 св. лет • 9,464 • 1017 см • (св. лет) 1 1 год
~~ v ~ 1,28• 107 см • с-1 ' 3,156- 107 с
= 1,38 • 105 лет.
(Получено приближенное значение, так как среднее
отношение не равно отношению средних чисел.)
Газы
185
1-2-18.
1-2-19.
а) Согласно одному из определений, температура
Бойля — температура, при которой так называемый
«второй вириальный коэффициент» В (Г), или Ь(Т),
равен нулю. При исследовании уравнения видно, что
это условие выполняется при [6 — A/RT3i*]=0, т. е. при
Т=ТВ= (A/bRyia. б) Уравнение может быть преобра-
зовано в уравнение PV2jRT—\ (и, таким образом,
выполнен закон Бойля), если 1—6(7’Кр/7’)2=0, т. е.
при Т =TB=TKV /6.
р nRT п2а
V — nb
Г<5(РИ)1 Г nRT nRTV , .
L дР j/1 \_V — nb (V-nb)2^ V2 J \ дР )т ’
(57/<ЭР)г<0 при всех условиях.
Если [д(РУ)/дР]т—0, как это будет приР=0, Т=ТВ,
тогда выражение в квадратных скобках равно нулю
и, следовательно,
nRT nRTV । п2а __ „
V-nb (V-nb)2 + V2 --U’
nRTV2 (7 - nb) - nRTV3 + n2a (V—nb)2 = 0;
— nRT [V2 (7 - nb) - V3] = n2a (7 - nb)2\
~ RT (V3 — nbV2 - V3) = na(V - nb)2-,
DT a ( V — nb \2 a /. nb \2
~~ b\ V ) — T\ V / ’
В точке Бойля Т—Тв, Р — 0 и 7 = оо, поэтому
= и Тв = -^.
В другом методе поступают следующим образом.
Пусть c = n/V, тогда
р nRT п2а ,
V-nb V2 ’
V--
Если c — n/V, то Р— . — /----ас2 и
' 1 — ОС
Г д (РУ) ] _ Гд(РИ)1 (дс \ _ Г bRT _ 1 \ .
L дР Jy^L дс \т\дР)т~~ n[(l-bc)2 WdRlr'
186
Глава I
/ дс \ _ 1 _
\дР)т~ (дР/дс)т ~
_ Г bcRT RT „I-1 1 п
Ц1 — Ьс)2 + 1 — be аС J °*
I с->0
Следовательно, множитель bRT/(l — be)2 — а,
оцениваемый при с = 0, при температуре Бойля ста-
нет равен нулю:
bRTB-a = y Тв=-^.
1-2-20. Разлагая в уравнении Дитеричи член ех в бесконеч-
ный ряд, получим
р__ RT__________а_____।______а^______
~ (V-b) V (V - b) + 2RTV2 (V - Ь)
При низких плотностях можно принять, что третий
и последующий члены бесконечно малы и что
V (V — b) ~ V2. Таким образом, получим уравнение
р___ Г________
v-b V2 ’
которое аналогично уравнению Ван-дер-Ваальса.
В критической точке
I дР\ RT За
к /г (V-bT)2 Р4
1д2Р\ =_2RT_______12а =0
UvJr (V-ьту Р5
Следовательно,
/?ГКр За 2RTKp 12а
(’7кр-^кр)2=^Г; (^-^KP)3==^V
Разделив второе выражение на первое, получим
-=— -----= b =~;
1\р — ЬТ кр VKp 2Гкр
УкрУкр _
3 (ИКр — ЬТКр)2 3
Газы
187
1-2-22.
PV = RT + APT - BP;
_ ВТ
V -АТ + В
а) ру =------rT Л
\+(B-AT)/V
В - АТ ,
если —=— <С 1.
V
Найдем температуру Бойля:
в-лт\
V I
lim ЦЩ-] =0; В — АТв = 0; Тв = — .
<?(1/Ю]г в в А
1-2-23.
б) m =___^---------------;
!т (V - АТ + ву
/ д2Р\ _ 2RT
k<?V2/r— (V-AT + ВУ '
В критической точке (dP/dV)T = 0 и (d2P/dV2)r = 0.
В данном случае эти производные могут быть равны
нулю только при Т = 0 или если член (V — АТ А~ В)
равен бесконечности. Ни тот, ни другой случай не
соответствует реальной критической точке._
В критической точке (дР/дУ)т = 0 и (d2P/dV2)r — 0.
= _ .JL = 0
\<ЗИ2/г (И-&)2 V2
или
RT а
(V-b)2 V2 ’
/ д2Р\ _ 2RT _ 2а _
\ dV2 !т~ СЙ - ЬУ V3 ~
или
2RT _ 2а
(V - ьу ~ V3 ’
Разделив второе уравнение на первое, получим
2/(V — b)=2/V, откуда 6=0. Следовательно, обе
производные никогда не могут быть равны нулю од-
новременно, если только 6=/=0. Когда а и b одновре-
менно будут отличны от нуля, газ не будет иметь кри-
тической точки.
188
Глава 1
Газы
189
1-2-24.
р = . ,JT____е~а1^фв^рт^;
ФИкр — ъ
«____I -а_____________________\ .
31 4е2&2 ф (2Ь) — Ь р \ РФ2&0а/4/?& ) ’
0
1-3-4.
1-3-1.
1-3-2.
я=е2-2/фв<
20 —- 1
РАЗДЕЛ 1-3
Выберем в качестве единицы объема объем, равный
1 мм, умноженному на площадь поперечного сечения
трубы барометра. В этих единицах объем численно
равен длине трубки, выраженной в миллиметрах; да-
вление выражается в мм рт. ст. Поправка АР отно-
сится к отсчету, равному давлению воздуха, остав-
шемуся в верхней части трубки барометра: АР=
— KTiV, где V = 780 — Рнабл, а К — неизвестная по-
стоянная. Для определения К применим это уравнение
к данным условиям, т. е.
„ УДЯ (780 - 717)-3,0
/\ у.
1-3-5.
293,2 °’"64’
0,64Г
780 Р наб,ч
Пусть Р2—конечное давление (см рт, ст.) остаточного
воздуха, h — конечная высота (см) ртути в цилиндре.
Тогда Р2 = 76 • .
Тогда АР =
Общее число молей N2 во всей системе равно 2. Пусть
п — конечное число молей N2 при 100° С в шаре 1. То-
гда (2 — п) —конечное число молей N2 в шаре 2 при
0°С.
у1 = у2 = 22,4 л;
7’1 = 373°К, 7’2 = 273о К; Р,=Р2;
«ЯП = (2-«)../?r? . (2 _ 273 = 373п.
VI V 2
п = 0,846 моля (число молей в шаре 1).
Г, п 0,846 • 0,08206 • 373,2 .
Р\ = Р2 =--------22/4------=1,16 атм.
2 — п = 2 — 0,846 = 1,154 моля (число молей в шаре 2).
Ошибка содержится при переходе от уравнений (3) и
(4) к уравнению (5). Уравнение (3) выполняется при
постоянной температуре, а не при постоянных объеме
или давлении. Уравнение (4) — при постоянном да-
влении и переменных объеме или температуре. Урав-
нения (3) и (4) должны быть записаны в виде:
V=[ki(T)]/P (З7) и V=k2(P)T (4'), где fei и k2 —
неопределенные функции переменных Т и Р соответ-
ственно. Если теперь приравнять правые части урав-
нений (3') и (4'), то получим следующие уравнения:
b±H = k2(P)T или ^P-==k2(P)P.
(5')
1-3-3.
Кроме того, Р2= 100 — Л + 76; 176 -/г;
/г2 - 276/г + 10000 = 0.
a) /i=42,9; 233 (233 — недействительный корень).
б) Р2= 176 —42,9=133,1.
Пусть Р2 — конечное давление (см рт. ст.) остаточ-
ного воздуха, h — конечная высота (см) столба ртути
в длинной ветви трубки.
Тогда
Р, = 76.
10° = 50 - /г + 76; /г2 - 226/г + 5000 = 0;
1 UU fl
a) h = 25,4, 201 (201 — недействительный корень);
б> ₽>=76-истм = '02-
ЙСТ’ />,-50-/. + 76;
1-3-6.
Левая часть выражения не будет зависеть от Р, а пра-
вая от Т. Но обе части равны для всех Т и Р, следо-
вательно, ни та, ни другая части не зависят от Т или
Р (так как эти величины постоянны):
-^Д = КГ, fe1(T) = Ki7’;
fc2(P)P=K2; k2(P) = -^-.
Таким образом, установлен вид функций ki и k2. Если
подставить их в уравнения (5'),то получим К\ = К2.
Тогда из уравнений (3') или (4') получим V=
= (KiT)/P.
а) Построим график зависимости плотности (г-л-1)
смеси от ее состава (мол.%). Получим прямую с на-
клоном [Р(Л41-Л42)]/100/?7’; при th=O PM2)RT\ ана-
логично при п2=0 PMJRT. Обозначим кажущийся
молекулярный вес смеси — А4; молекулярный вес кис-
190
Г лава I
лорода —Mj; молекулярный вес гелия — М2; количе-
ство (мол.%) кислорода в смеси — ti\\ количество
(мол.%) гелия в смеси —и2; вес смеси—U7 и плот-
ность смеси — d. Тогда
PV=^nRT = ^--,
d И RT ’ М 100 + 100 ’ «2—100 п1>
д.__ М1п1 + М2 (100 — nd _ П1 (М1 — М2) + 100Л12 .
М ~ 100 ~ 100
р ni(Mi — M2)+\ooM2_P(Mi — M2)nt,PM2
а~~ RT 100 — 100/?Г + RT •
Последнее уравнение выражает зависимость, изобра-
женную на графике. Уравнение дает наклон и точку
пересечения при «1 = 0, которые соответствуют пред-
сказанным. Если заменить «, на «2, то получим ана-
логичное уравнение; при «2=0 плотность равна
PMJRT, что также соответствует предсказанному зна-
чению.
б) См. рИСуНОК. ПрИ flj = 100
л _ — 1'32 __ J Qi г . л-1
а~ RT ~ 0,0821 -298 ’
При = 0
d ~ RT = 0,0821 • 298 0’163 г ' л •
Проведя прямую линию между этими двумя точками,
определим, что плотности 0,82 г-л-1 соответствует со-
став смеси, содержащей 57,3 мол.% Ог-
Газы
191
1-3-7.
1-3-8.
00
j t>*exP(-l mv2x!kT^dvx
a) ;
' X OO >
I exp (“ ^m°xlkT) dVx
— OO
j v4e-mv2/2kTv2dv
6) ---------------•
J e-mvV2kTv2dv
0
в) Изменение пределов интегрирования несуществен-
но. Если изменить в интеграле (а) нижний предел ин-
тегрирования от —оо до 0, то результат не изменится.
Значительное различие может быть обусловлено до-
бавочным множителем v2 во втором интеграле (б),
который появляется потому, что молекулы с величи-
нами скоростей между v и v + dv включают все точ-
ки (в пространстве скоростей) сферической оболочки
с объемом 4jw2dw. Аналогично интеграл (б) вычис-
ляется в сферических координатах, когда элементар-
ный объем равен v2 sin 0 dv dQ d<f>. В этом случае ин-
тегралы по dQ d<f> будут одинаковыми в числителе и
знаменателе.
PV—RT + bP-, наклон прямой равен [д(Ру)/дР]т =
— Ь (см. рисунок);
что соответствует достоянной b в уравнении состоя-
ния. При Р=0 PV=RT (идеальный газ при давле-
нии, равном нулю). Для реального газа при b > О
и при температуре выше температуры Бойля уравне-
ние состояния применимо при низких давлениях, по-
скольку вблизи Р=0 наклон положителен.
192
Глава I
1-3-9.
1-3-10.
dV = (^\ dP-± dT.
\дР )t \ dT )p
Из выражения для a:
pyx = klVCp№C^
\ dT )p Cv
Из выражения для 0:
ри\ __ k2V .
\дР)т Р '
dV dP CD ,r ,r . ,
-ft2T + c; т,(ср/си)-1 dr;
lnV = —• k2\nP + TcP/cv + const =
Gj/ Gp
== — fe2ln P + k,TCPlcv 4- const.
Таким образом, уравнение состояния будет иметь вид
Р*2У —&ехр {,kxTCplCv).
Существуют два метода решения этой задачи. Пер-
вый метод состоит в написании уравнения Ван-дер-
Ваальса в кубической форме относительно V в кри-
тической точке и сравнении коэффициентов при V
в уравнении (7— У1ф)3=0. Рассмотрим более под-
робно.
Уравнение Ван-дер-Ваальса имеет вид
(P + ^-yV ~nb) = nRT. (1)
Раскрыв скобки, получим
PV +J^-Pnb ~^ = nRT. (2)
Умножим (2) на V2:
PV3 -f- n2aV — PnbV2 — n3ab = nRTV2. (3)
Разделим (3) на P:
уз + _ nbV2 _ (4)
Преобразуем (4) по степеням V:
V3~^^ + nbjv2-h-~---^- = 0. (5)
Газы
193
Теперь в критической точке все три корня V будут
равны, т. е. = У2 = V3 — Укр — три корня уравне-
ния
(^-^КР)3 = О. (6)
Раскроем скобки в (6):
(И - У кр)3 = _ ЗУкрУ2 + ЗУ2РУ - У3кр = о. (7)
В критической точке
/ nRTK„ \ п2а rfiab
V3-[-^ + nb]V2 + ^V--p-^0. (8)
\ 'кр / Г[<р Г'кр
Сравнивая коэффициенты при V3, И2, У1 и У° в урав-
нениях (7) и (8), получим
V3: 1 = 1; (9)
V2: 3/кр = nRTкр/Ркр + nb; (10)
У’: ЗУ2кр = п2а/Ркр; (11)
У°: УкР = п3ай/Ркр. (12)
Из уравнений (11) и (12) получим
п2«/ЗУкр = паЬ{УкР
или
Укр = 3пй. (13)
Подставим (13) в (11):
р =Л-^-= -”2fl =_£_ (141
кр ЗИ2р 27n2b2 27b2 ' '
Можно было бы подставить (13) в (12), что привело
бы к тому же конечному результату. При подстанов-
ке (13) и (14) в (10) имеем
от/ nRTKp
3^КР р Tib,
~кр
Ркр (ЗУкр — nb) a(9nb — nb) 8а
= nR ~ 27b2nR ~ 27Rb ’
Второй метод состоит в получении двух новых урав-
нений с помощью частного дифференцирования.
Прежде всего запишем уравнение Ван-дер-Ваальса
в виде
р___ nRT п2а
V-nb V2 * ' '
7 Зак. 1360
194
Глава I
1-3-11.
Затем найдем первую производную
(дР \ nRT . 2п2а
'т~ (V-nb)2 -Гр* '
Дифференцируя (2')> получим вторую производную
/ д2Р \ 2nRT (in2 а ,„п
(V-nb)3 V‘ •
В критической точке изотерма, которая представляет
Р как функцию У, имеет перегиб. Так как кривая
в точке перегиба горизонтальна, то (дР/дУ)т=0, и
так как она имеет точку перегиба, (д2Р/дУ2)т=0.
Тогда
RT — 2па . (4'\
(V-nb)2 Р ’ ' '
2RT (та * В
(V-nb)3 ““р-'
Разделив левую часть уравнения (4') на правую
часть уравнения (5') и приведя подобные члены в пра-
вой части, имеем
—и ^кр = 3п6. (6')
Подставив этот результат в (4'), получим
RT _ 2па т 8а
(2пЬ)2 ~ (ЗпЬ)3 И 1 кр — 27Rb ' ' '
И, наконец, из уравнения (1')
р =______§5________— == а (8'1
к₽ 27(b)(2b) (3b)2 27b2 у >
Преимущество первого метода состоит в том, что он
ие требует использования дифференциального исчис-
ления. Однако второй метод более простой и требует
меньшей математической интуиции; он более широко
применяется для решения аналогичных задач.
В критической точке (если она имеется) (дР/дУ)т=0
и (д2Р/дУ2)т — 0. Уравнение может быть решено (как
квадратное уравнение) относительно Р, однако проще
получить первую производную в виде
(дР\ (дТ/дУ)р __ (Р + аР2)
1.7Г/г = (dT/dP)v ~ ~~ (V-b)(l+2aP) ‘
Прежде чем провести вычисление второй производ-
ной (д2Р/дУ2)т, необходимо решить, в каком случае
первая производная будет равна пулю. (дР/дУ)т=0
тогда и только тогда, когда Р аР2=0. Но
Газы
195
1-3-12.
P-j-aP2 = 0 при 7=0, следовательно, газ не будет
иметь критической точки.
RT а
V-b'~ TV2
В критической точке
/ дР \ _ RT 2д
[dVlT (V-b)2 + TV1
I д2Р\ _ 2RT_______6а _
\dV2'r~ (V-b)3 TV* ~
Из уравнений (2) и (3)
(1)
(2)
(3)
(4)
(5)
Подставим а и b в уравнение (1) и упростим:
Из уравнения (2)
а_ ^кр7кр __9^к.Лр
2 (Икр — Ь)2 8
р - ЗДГкр .
КР 8Йкр ’
8РкрИкр
ЗГкр
(6)
Р =
Подставляя R в (5), получим
а = ЗРкрЙ2крГкр. (7)
Теперь можно преобразовать уравнение (1), используя
приведенные переменные л, 9, ф и критические по-
стоянные:
р (3^>крИкр/зГКр)(9ГКр) ЗРкрИкрГкр .
^кр-Up ’
О
1-3-13.
_ 80 3
Л ЗФ - I W ‘
Поступив так же, как при решении задачи 1-3-3
вторым методом, т. е. определив первую и вторую
производные, получим два новых уравнения:
р — _ДГ__ е- airt’I’v (1)
V-ь ’
e-A/RT^V / ________—! 'l • (2)
\dV lT V-b \Ц/1гУ2 V-bJ
7*
196
Глава I
1-3-14.
д’-Р \ (Г А__________________1 1Г 1 4 1
dV4r I L RT"l!V2 V-zdl (V - &)2 + /?Г5/Ф2] +
.____1 Г —24
+ V - ь I яг’/гР3
+ ----11 х RTe~Ai^s/2V.
(V-b)2])
(3)
В критической точке (дР/дУ)г = 0 и 4д2Р/дУ2)г — 0.
В уравнении (2) только один член может быть равен
нулю:
--------------!---= о (4)
*даР Спир-*) u
Следовательно, первый член в правой части выра-
жения (3) равен нулю. Для того чтобы второй член
был равен нулю,
24 . 1
*дар + (^кр-*)2
(5)
Из уравнений (4) и (5) находим 2/VKp = 1/(7кр — Ь),
т. е. 7кр = 26. Подставляя 1/кр = 2Ь в уравнение (4),
получим Укр — A/4bR или _7’кр = (A/4bR)1г. Наконец
подставим выражения для Укр и Ткр в уравнение (1):
. _ *( Л У%-2
к₽"~ b \4bRJ
(6)
а)
PV _ 1_______4Ит+1
RT ~~ 1 - B/V RT
б) Vm+' должно приближаться к нулю, когда У стре-
мится к бесконечности. Для этого необходимо,
чтобы m -f- 1 < 0 или m < — 1.
в) P=-~J~-AVrn- (1)
RT
(V - в)2
- тАУт-''
= —------m(m — 1) АУ‘
(2)
(3)
г) В критической точке (дР/дУ)г — 0 и (д2Р/дУ2)г = 0,
следовательно, можно переписать выражения (2)
и (3) в виде
J?— — mAVm~';
(И —В)2
--2/?Г-. = т {т - 1) ДЙ"1-2
(Г-В)3 х '
(2')
(3')
Газы
197
Разделим (3') на (2'):
__ 2 ___ т — 1
~~ У - В “ ’
77 / т — 1 \ п
(4)
д) Если известно, что т <; —1, тогда т — 1 и т 4- 1
должны быть отрицательными величинами, будет
иметь тот же знак, что и В. Для того чтобы И1;р было
положительным, В должно быть положительным.
[Если не учитывать результат (б), можно считать, что
(т — l)/(m + 1) и В должны иметь одинаковый знак.
Если т < —1 или m > -|-1, то В > 0; если —1 <
< т < 4-1, то В <0. Если же /п =—1, то Гкр беско-
нечно; при т=4~1 Икр=0, независимо от В.]
е) Из выражения (2') имеем
„ (У - В)2тЛЙД-‘
гр __ \ кр / кр
'Кр— R
Из выражения (4) следует, что
V —В =--------т~гВ.
КР т -4-1
Следовательно,
4В2тАУ"г~1 4Bm+lrn (т - l)"1-1 А
___ кр _______
кр— (m + 1)2/? (m + l)"i+l R,
ж) Поскольку т < 0 и В > 0, то Ткр > 0 тогда и толь-
ко тогда, когда А > 0. Это легче видеть в первой фор-
ме результата, чем во второй.
з) В связано с объемом, занимаемым молекулами.
Требование В > 0 говорит только о том, что моле-
кулы должны иметь положительный объем. Член, со-
держащий А и т, должен внести поправку на меж-
молекулярные силы. Если А < 0, то Р должно увели-
чиваться с этими силами, которые должны быть
в этом случае силами отталкивания. Газ, в котором
молекулы только отталкиваются, не будет конденси-
роваться и не будет иметь критической точки. По-
этому реальная критическая точка будет только, если
А > 0, что соответствует притяжению и уменьшению
давления на член AVm. Для того чтобы газ вел себя
как идеальный при низком давлении, силы притяже-
ния должны убывать достаточно быстро по мере того,
как увеличивается расстояние между молекулами,
а следовательно, по мере увеличения V. Условие
т < —1 следует из этого требования.
Глава II
первый закон термодинамики
И ТЕРМОХИМИЯ
РАЗДЕЛ 11-1
11-1-1. KU + (P2V2 - PiVi) = KU + (nRT2 - nRT{) =
= Д6/ + п/?(Г2-Г,) =
= nCv (T2 - Г,) + nR (T2 - Г,) =
= (nCv + nR)(T2-Tl) =
— nCp (T2 T().
11-1-2. PV — RT;
PdV + V dP = RdT;
(dP\ __R_, IdU \ __T R Р.-.РУ P — 0
\dT]v v’ \dVlT V V
11-1-3. PV^nRT
p__ nRT _ n2a .
V "p"’
n Jt/ nRT dV n2a dV
PdV = —--------p~;
vf vf vf
w=fpdV={-^-f^ =
vi Vi vt
= nRT In n2a [~y^- ~ 'у~)'
11-1-4. PV = RT + APT - BP;
RT = P(V - AT 4- B); P = -=—;
' V-AT + B
Vi V, _
w= f PdV = RT f = +
J _J V-AT + B \Vi—AT + B/
v, v,
11-1-5. При нормальных условиях перенос тепла из окру-
жающей среды в цилиндр не будет достаточно
быстрым, так как должно сохраниться условие изо-
термичное™. Предполагая, что при расширении газа
температура остается постоянной и равной 25°С,
поступим следующим образом.
Первый закон термодинамики и термохимия
199
11-1-6.
Известно, что препятствующее давление постоянно
(1 атм), т. е. w — P2{V2 — V\), где Р2 — препятствующее
давление; V, = 10 л.
n.RTi = P1V1 = 25 атм • 10 л = 250 л-атм;
nRT, nRTi 250 л-атм o[-n
2 P2 Pi 1 атм ’
w = 1 • (250 — 10) = 240 л-атм.
Точка / Р, атм 1 2 2 3 2
Стадия q. кал wt кал Д[/, кал АН, кал
1 —► 2 889 0 889 1480
2 —> 3 -1480 -591 -889 — 1480
3 —► 1 411 411 0 0
Полный цикл — 180 -180 0 0
Более подробный расчет приведен ниже:
Стадия 1->2
и, т-
w = J /W = 0; Д(7 = j nCydT =
V , T,
= 1 • у R (596 - 298) = 889 кал;
т,
= J nCPdT = \ • у R (596 - 298) = 1480 кал;
г,
q — \U + w = 889 + 0 = 889 кал.
Стадия 2—*3
Vi
w = j P dV = P (V2-V0 = 2 (12,2-24,4) =
v,
= — 24,4 л-атм;
ta — — 24,4 л-атм «24,22 кал (л-атм)-1 = — 591 кал;
г. _
Д1/= J nCv dT=l • 3/2 R (Т2 - Ti) =
г,
= 1 • 3/2 R (298 - 596) = - 889 кал;
200
Г лава 11
т.
кН — J nCpdT= 1 .5/2/?(Т2- Т,) =
г,
= 1 • 5/2 /? (298 - 596) = —1480 кал.
q = АС/ + w = — 889 -f- (— 591) = — 1480 кал.
Стадия 3-+1
Иг
w — f Р dV = nRT In -р- =
J У1
= 1 • 1,987 • 298 • 2,303 lg 111 = 411 кал;
АС/ = 0 1
__q г (изотермическое расширение идеального газа);
q — kU w = 0 411 = 411 кал.
П-1-7.
Точка / 2 3
Т, °К 300 600 300
Стадия q, кал - w, кал AU, кал Aff, кал
1 — -> 2 1485 591 894 1490
2 — -> 3 -894 0 -894 -1490
3 — -> 1 -413 -413 0 0
Полный цикл 178 178 0 0
Более подробный расчет приведен ниже:
Стадия 1 -+2
Уг
w= J PdV = P(V2-Vi) =
v,
— 1 • (48,8 — 24,4) = 24,4 л • атМ;
w = 24,4 • 24,22 = 591 кал;
т2
АС/ — J nCv dT = 3/2 R (600 - 300) = 894 кал;
т,
тг
А// = J пСР dT = % R (600 — 300) = 1490 кал;
т.
q = Ди w = 894 4- 591 = 1485 кал.
Первый закон термодинамики и термохимия
201
Стадия 2-+3
Иг
w = J PdV = 0;
и,
Тг
ьи = j nCv dT = 3/2 R (300 - 600) = — 894 кал;
т,
Л
ДЯ = J пСР dT = 5/2 R (300 - 600) = — 1490 кал;
г,
q = А£/ + w = — 894 кал.
Стадия 3-+1
Уг
w = j PdV ~ nRT In -у- =
и,
= 1 1,987-300-2,3031g Щ = —413 кал;
At/ = 0; Д/7 = 0 (изотермическое расширение идеаль-
кого газа);
q = /\U 4- w = — 413 кал.
II-1-8.
Точка V, л 1 24,4 2 48,8 3 24,4
Стадия q, кал ну, кал &U, кал ДЯ, кал
1 > 2 1480 591 889 1480
2 —> 3 —822 -822 0 0
3 —> 1 -889 0 —889 -1480
Полный цикл 231 -231 0 0
Более подробный расчет приведен ниже:
Стадия 1 ->2
Уг
= j РdV ~ P(V2 —VJ —
v,
— 1 • (48,8 — 24,4) = 24,4 л • атм;
ш = 24,4 • 24,22 = 591 кал;
Тг
nCvdT = 3/2 R (596 - 298) = 889 кал;
202
Глава II
Т,
кН = J пСр dT = 5/2 R (596 - 298) = 1480 кал;
г,
q — &U + w — 1480 кал.
Стадия 2->3
w = f PdV = nRT\n^- =
J V1
И,
= 1-1,987 • 596 2,303 1g “ — 822 кал;
*10,0
Д[7 —О 1
__0 | (изотермическое сжатие идеального газа);
q — \U -f- w = — 822 кал.
Стадия 3 1
V,
ш= J PdV = O (Vi^Vz)-,
v,
т,
AU «= J nCv dT = 3/2 R (298 - 596) = - 889 кал;-
т,
т2
Д/7 = j пСР dT = 5/2 R (298 - 596) = - 1480 кал;
т,
q — kU-}-w — — 889 кал.
П-1-9. Cv — zl<iR (идеальный одноатомный газ);
3/2/?1п-Ь-=-/?1п^-;
lg7’2=-2/3lg-^ + lg7’1;
lg7’2=-2/3lg5»/10+lg298,2;
1g Г2 = - 0,466 + 2,475 = 2,009;
7’2=102°К.
П-1-10. а) дамакс==п/?Г1п^- =
= 2-1,987 • 298,2 • 2,303 • 1g = 822 кал.
б) -Cvln-^ = /?lny4
-5/2ln^- = ln-^-;
Первый закон термодинамики и термохимия
203
1g 7^2= —2/5lgVT + =
= - % lg+ 1g 2Э8>2 = 2,354;
Т = 226° К.
w = — At/ — — nCv (Т2 — Ту) —
= 2-5/2- 1,987(298, 2- 226) = 717 кал.
П-1-11. H^U + PV',
„ =_______— Г(—+ ] =
Гл дР
______LI7+£_) । (д (PV) \ i
Ср [\dV )г\дР дР JJ-
П-1-12. Н,т = (^)„ = 0,366;
dT = 0,366 dP\ Т2- Ti= 0,366 (1 — 20) = — 6,96° С.
Поскольку pJT > 0, расширенный газ имеет более
низкую температуру, чем до расширения, поэтому
конечная температура равна 13,04° С.
II ю ЛГ7 -2660-4,063-128,11 1ОО. „ Л -1
П-1-13. АГ/=--------гткос---’—= —1231,6 ккал • моль 1
1,1226
\Н = \и +(Лпг)/?Г;
для реакции С10Н8 (тв) + 12О2 -> ЮСО2 + 4Н2О (ж)
Апг = — 2.
А// = — 1231,6-2- 1,987-291,2- 10~3 =
— — 1232,8 ккал • моль-1.
П-1-14. А//° = АГ/° + \ncRT =
= —10 000 + (20-27)- 3- 10"3- 1,987-310,2 =
= -10000- 12,9= - 10012,9 кал.
г,
П-1-15. ЬНТг = ЬНТ, + J АСР dT = 1435 + (18 - 9) (Т2 - Л) =
г,
= 1435 + 9 (263 - 273) = 1435 — 90 =
= 1345 кал • моль-1.
П-1-16. А//^ = 3 А//5 + А/76 — = — 60003 кал.
П-1-17. ДЯ = АС/+(Апг)/?Г=15000 + (2-5)- 1,99-298 =
= 15 000- 1778= 13 222 кал.
204
Глава 11
П-1-18. С10Н8 (тв) + 12О2 (г) -> ЮСО2 (г) + 4Н2О (ж)
х 0 —94,0518 —68,3174
(ккал • моль-1).
Стандартная мольная энтальпия образования каж-
дого вещества может быть записана на основании
формулы. Для данной реакции
Д//° = Ю (- 94,0518) + 4(-68,3174) -х =
= — 1231,6 ккал;
х = 17,8 ккал • моль-1.
П-1-19. а) Уравнение реакции сгорания следующее:
С6Н5СООН (крист) + 'з/2 О2 (г) = 7СО2 (г) + ЗН2О (ж).
х 0 -94,0518 -68,3174
(ккал • моль-1)
Под каждым соединением записаны стандартные
энтальпии образования (из табл. П-1).
Тогда
ДД° = 7 • (- 94,0518) + 3 • (- 68,3174) - х - • 0 =
= — 771,72 ккал.
х — — 91,95 ккал.
Реакцию образования можно записать так:
7С (графит) + ЗН2 (г) + О2 (г) -> С6Н5СООН (крист)
В этой реакции число молей газообразных веществ
уменьшается на 4.
Д[/° = &Н° - RT (- 4) = - 93,96 ккал.
б) Для реакции образования С6Н5СООН
\Ср = 35,1 - 7 • 2 - 3 • 4,9 - 5 = 1,4 кал • °К“';
Д//373 = Д//+ + ЬѰР(373 - 298) ==
= — 91,59 + 75 • 0,0014 = — 91,49 ккал.
11-1-20. м-ХФ (ж) + ОН" (aq) —>.и-ХФ" (aq) + Н2О (ж)
.и-ХФ (ац)->.и-ХФ (ж);
Н2О (ж) -► Н+ (aq) + ОН" (aq)
м-ХФ (aq) -> (.и-ХФ)" (aq) + Н+ (aq)
ДН° = ДЯ2 - Д/Д + ДЯ3’ = - 7540 -674+ 13 500 =
= 5286 кал [на 1 моль м-ХФ (aq)].
Первый закон термодинамики и термохимия
205
11-1-21. a) 9CO2 (г) + 8H2O (ж) ► q«c-C9H16 (ж) + 13O2 (r) (1)
9C (графит) + 9O2 (r) -» ►9CO2 (r) (2)
8H2 (r) + 4O2 (r) -8H2O (ж) (3)
9C (графит) + 8H2 (г) -h ► z{MC-C9H|6 (ж) (4)
Д//4 = + A//2 + A//3 =
=--- 1 (—1351,6) + 9-(—94,0518) + 8-(—68,3174) =
= 1351,60 — 846,4662 — 546,5392 =
= — 41,41 ккал-моль-1.
б) Обычно за стандартное состояние углерода при-
нимается графит, но если вместо него выбран алмаз,
то в этом случае стандартная энтальпия образова-
ния СО2 рассчитывается так:
С (графит) + О2—>СО2 — 94,05 ккал
С (алмаз) ->С (графит) — 0,45 ккал
С (алмаз) + О2-»СО2 — 94,50 ккал
Таким образом, \H°f из алмаза равна — 94,50
ккал моль-1, а для процесса образования цис-
гексагидроиндана будет равна —45,46 ккал - моль-1.
П-1-22. Для реакции W (тв) + С (графит) ->WC (тв)
Д/Д>298= — 94,052 — 200,16 + 285,8 = — 8,41 ккал.
П-1-23. Из реакции (а)
\Н° — — 3 • 28,59 — — 85,77 ккал-моль-1. Разность
(85,77 — 49,80 = 35,97 ккал • моль-1) равна резонанс-
ной энергии бензола. Расчет Д/7 не учитывает дело-
кализации „двойных связей" в бензоле.
11-1-24. Д/Д = ‘/2 • (- 399,09) + 3/2 • (- 303) + 6 - (- 68,3174) -
— (— 989,1) + 7,2 = - 199,55 - 454,5 — 409,9044 +
+ 989,1 +7,2 = —67,7 ккал-моль-1 (по литературным
данным —72,1 ккал-моль-1).
П-1-25. Mg(TB) + N2(r) + 3O2(r)->Mg(NO3)2(TB) — 188,770
Mg(NO3)2 (тв) + aq ->Mg++ (aq) + 2NO3 (aq) — 21,530
2NQ3 (aq)-> N2 (г) + 3O2 (r) + 2e~ -2 (-49,320)
Mg(TB)->Mg++(aq)+2e~ A//f = — 111,660 ккал-(г-ион-1)
П-1-26. C5H5N (ж) + 25/4 O2 (r) ->5CO2 (r) +
+ % H2O (ж) + V2 N2 (r) - 664,95
5CO2 (г) -> 5C (графит) + 5O2 (r) - 5 • (-94,0518)
% H2O (ж) ^5/2 H2 (г) + 5/4 O2 (r) - 5/2 (-68,3174)
206
Глава II
C5H5N (ж) -> 5C (графит) +
+ % H2 (г) + l/2 N2 (г) — 23,90 ккал • моль-1
5С (графит)+ 5/2Н2 (г) +
+ x!z N2 (г) -> C6H5N (ж) + 23,90 ккал • моль-1
11-1-27. а) ДД-гэз = 6-(—68,3174)— 4-(—11,04) =—365,74 ккал;
ДС/^98 = Д^298 - RT • (-5) = - 365,74 + 2,96 =
= — 362,78 ккал.
б) ДСр = 6 • (18,02) + 2 • (6,94) - 4- (8,89) - 3• (6,97) =
= 65,53 кал • °К-1 = 0,06553 ккал • °К-1;
Д%з = Д Д 298 + №°р (323 - 298) =
= — 365,74 + 1,64 = — 364,10 ккал.
П-1-28. а) Д//зоо = — 80,00 — 0 — 2 • (—50) = 20,00 ккал;
ЬСр = 8 - (5 + 0,0020 Т) - 2 • (7,00) =
= - 11 — 0,0020 7’ кал- °К-1;
т
\Н°т = \Нт+ jbC°PdT =
300
т
= 20 000 + | (- 11 - 0,0020 Т) dT =
300
= 20 000 - 11 (Т - 300) - 0,0010 (Г2 - 300)2 =
= 23 390 - 11Т - 0,0010 Т2 кал.
б) Д/Д0оо — 23 390 — 11 • 1000 - 0,0010- 10002 =
= 11 390 кал (11,39 ккал).
II-1-29. Для реакции
Fe (тв) + С12 (г) -> FeCl2 (тв)
а) Д//291 = — 21 — (—19,5) + 2 • (—17,5) — 44 =
= — 80,5 ккал;
б) ДС2°91 = Д^91 - RT (-1) = - 79,9 ккал; ’
в) ДСр = 18,5 — 8,2 — 6 = 4,3 кал • °К~';
ДДз91 = Д/7291 + ДСр (391 - 291) = - 80,1 ккал.
Первый закон термодинамики и термохимия
207
11-1-30. Разрыв связей: О-Н 1 • 111 =+ 111 С-С 1 • 83 = + 83 Образование связей: С-0 1-(—84) = —84 С-Н 1 -(—99)= —99
+ 194 - 183
ДД = + 194- 183= 11 ккал.
11-1-31. a) dU- dW-,
д (sin и) ч—— —COSy, ду
д (sin х) —— = COS X += cos у.
Полный дифференциал Неполный дифференциал
Для отрезка (z) у = 0 первый интеграл равен 0. Для
отрезка (и) х постоянно, а у изменяется от 0 до у,
следовательно,
у
J dU = x21 у dy = J х2у2;
о
U = у х2у2 + const.
РАЗДЕЛ 11-2
П-2-1. Только при условии, что (дШдУ),- = 0 или dV = 0
(постоянный объем). В общем случае:
dU = dT + №£.\ dV.
\ дТ lv \ dV /т
Аналогично dH = CPdT только, если (дН/дР)г — Q
дли dP — Q.
208
Глава II
П-2-2. Для адиабатического процесса dq — О и, следова- тельно, dU = — PdV. Таким образом, CvdT = — dw и w = — CV(T2— Т]). Для адиабатического обрати- мого процесса расширения идеального газа Г2 / Р2\RICP T,~\pJ • поэтому = - Cv [г, (^)WCp - г,] = ад [1 - Ср].
П-2-3. dU = — dw, CvdT + (kT~P)dV = ~PdV; Cv dT + kT dV = 0; C dT _ _ T _ _ -V— = — kdV\ Cv\n^- = -k(V2-Vx). J 11
П-2-4. a)dq = 0, dU = — dw, Cv dT — — PdV. Из уравнения состояния P = (n2KT)/V2, тогда CvdT= = (-n2KTdV)/V2. Cv = nCv. nCv In jr- = n2K (y- — y-j . pin _ 1 ( К \‘< \dT )p~ 2 \PT ) ’ C -c -p(-^} -l^V2 GV P dT )p 2 \ T ) *
П-2-5. dq = 0; dw = -dU- P dV = - Cv dT -^^dV; dV = - (Л + ВТ) dT-~ dV-, \v — b V2 1 V2 dV = — (— + B}dT-, V-b \T ) R In = - A In - В (T2 - T,). Vt — 0 rt
II-2-6. По определению, = Используя общее вы- ражение / ду \ _ (дх/дх)у \дх/г (дг/ду)^ ’
Первый закон термодинамики и термохимия
209
II-2-7.
П-2-8.
П-2-9.
найдем, что
_ (дН!дР)т __ 1 /дН\
~ (дн/дТ)р w )г •
У nRT па
V — —р
/ dV \ nR , 2па
\дТ)р Р~ +
yldV\ ___ nRT , 2па
1 \дТ )Р Р
TldV\ ,7 _____ nRT . 2па nRT .па ____ Зпа
\дТ/р V Р ' R2T2 ~Р г R2T2 R2T2 ’
__ Зпа
UJT — С pR2T2 '
При температуре инверсии (7^) pJT = 0. Это может
быть, только если СР — оо, Т — оо или а = 0. Следо-
вательно, данный газ не имеет температуры инверсии.
При температуре инверсии (Т{^ [iJT = 0. Следова-
тельно,
2а , ЗаЬР п
------О-------к-к- ~ 0.
RTt R2T]
Таким образом, bR^Tj— 2aRT t + ЗаЬР — 0. Решая
это квадратное уравнение относительно Т{, получим:
т _ 2aR ± У 4а2 R2~ \2ab2R2P а + Vа2 - ЗаЬ2Р
7 ‘ — 2bR2 ~ bR
Поскольку мы имеем дело с квадратным уравнением’
должны быть два значения температуры инверсии
при любом данном давлении. Реальный газ действи-
тельно имеет две температуры инверсии при любом
данном давлении.
(дСр\ —Г 5 (dff\ 1 — g2f{ — [ д 1дН} 1
\ дР 7 I dF'-dF'pJT- дР дТ 1'дГ VdP/rJp"’
dT + (-^\ dP;
\ дТ /р ‘ \ дР /у
\ дТ )р \ дР )т \ дТ /и
/дНХ_____( дН \ ( дТ\ __г
\ дР )т~ \дТ)р\дР)И
1дСр\ __ д ( с __________{дСД с
\ дР 1т дТ ( дТ ]р ^р[ дТ /р
210
Глава II
П-2-10. г _ Г д(и + (эи\ _ р ьу~\дт)р \dT)v~ [ дт ]Р \дт)у~ =(» +Рт _(» : \ ОТ /р \ дТ )р \ дТ /у’ dU = (%.\ dT + (^-\ dV; \ дТ )у \ dV /р ( dU \ _ / dU \ . / dU \ / dV \ \дТ )р \ дТ )у \ 5У М дТ )р' m (яР+-
П-2-11. но для идеального газа (dU/dV)T = 0. Таким образом, Поскольку V — RT/P, P(dV\ — JL^—p И\дТ)р Р то Ср — Cv = R. V — ^L. (дУ\ _ —JL v Р ’ \дР )т Р2 ’ \дТ )р~ Р ' Подставляя в последнюю формулу условие, данное в задаче, найдем, что СР —Cv — R. 3) Используя выражения (дУ/дТ)Р и (dVldP)T, как показано в пункте 2, получим: „ _ 1 R _ 1 . о_/ 1 \1 1 V Р Т V )\ Р 1 Р и Ср - Су TV (у)2 P = R.
П-2-12. а) Число молей образовавшейся Н2О ' Поправка ^-^.Э-Ю"3- 0:2064 +0 155==_13 562+0,155= 3,4075 10-3 = — 13,41 ккал-моль-1.
б) НС1 и НСЮ4 — сильные кислоты, они полностью
диссоциируют. Уксусная кислота — слабая кислота,
она только частично диссоциирует. Разница между
Первый закон термодинамики и термохимия
211
наблюдаемыми энтальпиями равна энтальпии диссо-
циации уксусной кислоты.
11-2-13. Л#298 = 41,220 ккал;
ДС₽ = -1,02- 1,28 • 10-3Г + 3,88 • IO5?-2 кал • 'К-1;
Д//г =41,220— 1,02 • 10-3(Г —298) —
-6,4- 10~7(Г2 —2982) —
-3,88 102(1/Г — 1/298) кал.
Это выражение справедливо в интервале температур
298-2000° К.
11-2-14. а) ЛЯ^8=-57,7979-70,96-(-4,815)-0 =
= — 123,94 ккал;
At/298 — 298 — RT (Ли)г =
= - 123,94 - 1,987 10"3 • 298 (- ’/2) =
— — 123,64 ккал.
б) ДСр = -2,162+ 5,634- 10“V-
- 6,100 • 10~7Г2 + 2,057 • 10~9Г3 кал;
1000
Д//1000 = Д//298 + J \CpdT =
298
= - 123,94 - 2,162 • 10“3 • (1000 - 298) +
+ 2,817 • 10~6 • (Ю002 - 2982) -
— 2,033 Ю-10 • (1 0003 — 2983) +
+ 5,14- 10-13 (10004 — 2984) =—122,58 ккал.
Полученные данные применимы только в интервале
температур от 298 до 1500° К. Они не дают сведений
об изменении теплоемкости выше 1500°, следовательно,
нельзя найти ДЯ° при 2000°К.
11-2-15. ДСр = 6 +5- Ю-3? + 4 • 105Г-2;
Тг Т2
\НТг = ^Н°ж + | 6 dT + | 5 • 10_37’d7’ +
300 300
+ Г1#"-.
300
212
Г лава II
^Нтг = - 35 000 + 6 (Г2 - 300) +
+ 7г • 5 • 1О-3(7’2 - 3002) - 4 • 105 (гг1—1/300)=
= —35692 + 6 • Г2 + 2,50 • 10~3Г2-4- Ю+Г1;
ДЯ° = - 35 692 + 6 • Т + 2,50 • 10“3Г2 -
— 4-ЮТ-1 кал • °К-1 • моль-1.
11-2-16. ДСР = 2-4,968-6,148-3,102- 10-37’ +
+ 9,23- 10"7Г2 кал-°К-1.
Для данной реакции
ДД1000 — ДД298 + J \CpdT =
298
= 117,04 + 3,787- 10-3-(1000 —298) —
- 72 • 3,102 • 10-6 • (1000“ - 2982) +
+ 7з-9,23- Ю-10(10003 — 2983) =
= 118,58 ккал.
П-2-17. ДСР = СР (АВ4) - Ср (А) - 2СР (В2) = - 10 - 6 • 10~3Г;
Д/+ = ДДзоо+ \^CPdT =
300
т т
= 500 000+ J (-10) dT-\- J(-6- 10-3) Г d? =
300 300
= 500 000 - 10 • (Т - 300) - 7г• о • 1 о-3 • (Г2-3002) =
= 503 270 — ЮГ — 3 • 10-3Г2.
т2
П-2-18. bHT! — kHTl = | \CpdT-,
г,
т
0-(-5000)= J (1 + 2 • 10-3Г)б/Г =
298
= 1 • (Г - 298) + 1 • 10-3 • (г2 - 2982);
5000= —298+ 1 • Г —89 + 1 • 10-3Г2;
0=1- 10-3Г2+ 1 • Г-5387.
Решая относительно Г и пренебрегая отрицательным
корнем, получим Г = 1880° К.
Первый закон термодинамики и термохимия
213
И-2-19. Для реакции 2Н2 + 02-]- 4N2-»2H2O (г)-ф 4N2
ДЯме = 2 • (—57,8) = — 115,6 ккал.
Таким образом, 115,6 ккал нагревают 2 моля Н2О (г)
и 4 моля N2 (г) от 298,2° К до конечной темпера-
туры Т2.
2СР (Н2О, г) + 4СР (N2, г) = 40,234 -ф 10,4 • 10-37';
тг г,
115 600= J 40,234 dT + [ 10,4 • 10-3Т dT =
298,2 298,2
= 40,234 (Т2 - 298,2) -ф
+ 72- 10,4- 10-3 • [Тг — (298,2)2].
115 600 = 40,234Т2- 11,996 -ф 5,2 • 10-37’2- 462;
0 = 5,2 • Ю-3?2 + 40,234Т2 - 128 058.
Решая квадратное уравнение и пренебрегая отрица-
тельным корнем, получим 7^ = 2425° К. Этот резуль-
тат справедлив, только если уравнение для СР при-
менимо в интервале температур от 298 до 2425° К.
При более высоких температурах результаты будут
ошибочными.
П-2-20. ДДС = — 6в + За + 36 — Зд + 2ж + з =
= — 978,5 ккал-моль-1.
Экспериментальное значение —970,8 ккал-моль-1.
,, . д (1 .г2)
П-2-21. —g^- = x; —-дх - — х. Полный дифференциал.
Хг Уг
j dz = j ху dx -ф J x2 dy =
Xl У,
{У = У\) (x = x2)
= У\ (у X2 - | x?) + 4 x2 (1)2-у^ = 4 X2y2-4 X2y;,
Z = 4 X2y + const.
214
Г лава II
11-2-22. а) ^Ц~ = У> ~ — х^у. Неполный дифференциал,
б) См. рисунок.
ч
г
Путь (а, б)
о о 1 о
(а) (б)
J ydy = ±y2\^-2.
Путь (в, г)
о
11-3-1.
РАЗДЕЛ 11-3
I дТ\ (дй/д7)т _ а _ 2а
~ (dU/dT)- ~ ~ CvV2 3RV2 '
Vi 2 _
б) дГ== f /ЭТХ = =
J \dV /г? 3R J V2 3R\ 1 2/
v, 1
= —тв-(l>0 моль- л_|) =
□К
__ 4.19 л2 • атм • моль-1 • 1,0 моль-л~‘__ 17° С
3-0,0821 л • атм • моль-1 • град-1
Первый закон термодинамики и термохимия 215
11-3-2. Ошибка состоит в применении уравнения, справед- ливого только при постоянном давлении, к процессу, который производится при постоянном объеме. Вообще H = PV + U и \H = \U + Ь(РУ). При по- стоянном давлении ДР = 0 и, следовательно, &Н — = Д174-РДУ, а при постоянном объеме (например, процесс, проходящий в калориметрической бомбе) — ду = 0 и MI = bU +V ЬР.
11-3-3. dH — dU + PdV + VdP = Q-, dq =dU + PdV = -V dP; C = - lz (dHldT}p _ VCp " dT V\dTln V (dff/dP)Tm V — T (dV/dT)p‘
11-3-4. / dU \ _ / dU \ , I dU \ / dV \ \ dP )T \dP )v + \ dV )p\dP h' [dU\ 1 dU \ . / dU \ / dP \ Uv/r \ dv )p + [dp )T' Если (dU/dV)T = 0, тогда ( dU \ (dU\ ( OP \ / dU \ ( dV \ ldU\ Up 4 Un )T ИЛ1Ц <?и \ dP )r ~ Up)/ Следовательно, ж =0. \dP )T \ dP lv \ dP )v u
11-3-5. dH = dU + d(PV); (dH \ _ / dU \ , Г d (Plz) 1 U/j- Uv 'r I Jr’ Если (dU[dV)T = 0, to (dH \ d(PV) \ [д(РЮ1 _n \ <?И )т \ dV )T I dV только если (PV)T = const (закон Бойля). Теперь ясно, почему для полного термодинамического опре- деления идеального газа (газ, для которого внутрен- няя энергия и энтальпия являются функцией только температуры) необходимы закон Бойля и условие (dU/dV)T = 0.
11-3-6. _ 88 3_t П ~ ЗФ - 1 Ф2 ’ (30 — 1) • 8 df) — 86 3 йФ . G , , п U-iy +фз^-0;
216
Глава 11
дФ \ (Зл/<?0)^ / дл \ 240 6
,<?0 /я (дл/ЗФ)е ’ \ дФ /е (30—I)2 Ф3 ’
дФ \ 8 /Г 240 6 "I #
— Зф-1 / 1(30- I)2 ~ ’
0(30— 1)
8
30 - 1 Г 240f
8 [ 30 - 1
24 1_ 3(30-1)
(30—I)2] 4Ф2
3(30-1) 3(30- I)2
402 [ 1 — ЗФ/(ЗФ — 1)] 402 (30 _ । _ 30)
3(30- I)2 .
402 ’
11-3-7.
80;______3_ 6 (30 — 1)___3____180 - 9
30 - 1 02 02 02 02
_ 9(20-1)
02
Газ не является идеальным, поэтому нельзя заме-
нить PV на nRT, чтобы получить в последнем урав-
нении а = 1/7.
б) P = -nRT ; PdV=-!£™V
' V — nb V — nb
vf Vf
f n Г nRT dv
w= PdV = ~—7-.
J J V — nb
vi vi
Проинтегрируем, полагая, что T — постоянная вели-
чина:
Г V. — nb 1
ш = п«Т1п
в) <7 = 0 (адиабатический процесс), поэтому &U =
= <7— ау = О — w — — w. Поскольку Д(7 = —w, то
nCvdT = — PdV, так как (dU/dV)T — Q.
<rr nRTdV . dT nRdV
ncvai —— v_nb , ncv T — v_nb-
После интегрирования получим
т. е.
( т2 _ Г V2 -nbT-R пи т2 _[V2-nbTRICV
krj — 1к,- nb J или г, Lri-«d
Первый закон термодинамики и термохимия
217
СР — Cv = R только для идеального газа, поэтому
в данном случае нельзя заменить R на СР — Cv.
( дУ \ ==R_,
\дТ JP Р '
JT Ср L Р 1 СР1 Р J ср
Глава 1П
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ
РАЗДЕЛ 111-1
III-1-1. Для изотермического обратимого фазового пере-
хода (д).
т
1И-1-2. (20)-3 | ЬТ2 dT— [уравнение (г)]
О
1000 С dT 1000 1000
ПМ-З. Д5 = J { 6,4492-^-4- J 1,4125-10-3dT -
300 300 300
1000
— | 0,807- М)~7Т dT =
300
= 6,4492 • 2,303 lg S + 1,4125- 10“3 (1000 - 300) -
oUU
-0^807 . Ю-7 (10002 — 3002) =
= 7,77 4- 0,99 — 0,04 = 8,72 кал • °K"‘ • моль-1.
Ш-1-4. а) Пусть tf — конечная температура.
2™.. 18 (tf - 25) = -^ • 6,1 (100 - tf)-
tf = 31,9° C
3f0,1 n.C dT 100 330,1
б) Доводы = j —7=---= -j8" 18 • 2,303 lg-298j —
298,2
= 10,21 кал • град-1.
330,1
.о f т? dT __ 200 д । q ooo I,. 330,1 _
А'-’олОВа = J пСр-y | |g 7 • 6,1 • 2,303 lg 3?g,2
373,2
= —1,26 кал • град-1.
Д^общее — ^5ВОДЫ-f-Д5олова — 10,21 1,26 =
= 8,95 кал • град-1.
ш-1-5. f-==1=°’201 (20>1 %)-
Ц2 ^2 <j 0/0
Второй закон термодинамики
219
II1-1-6.
а) ®макс
б) — данин
___. = 268,2 — g 94-
Г2 - Tt 298,2 - 268,2 ’ ’
_ T2 — 7, _ 298,2 — 268,2 . _
Ti di— 268,2 ’ 1
30 nun
= 2682 = 0,1 12 кал.
Ill-1-7.
со = ——
W
Т\
= 7,0;
W = <7, + <72;
<72 = да —<7,;
— <?z _ 7.
---^ = 6.
W
111-1-8.
насос на 1 кал поглощен-
Таким образом, тепловой
ной энергии выработает в шесть раз больше тепла,
чем калорифер с эффективностью 100%.
Процесс представлен на рисунке:
300
\Ui= j nCvdT = 0-,
300
400
ДС/ц = | ncv dT = 2 - 3/2 • 1,99 (400 - 300) = 597 кал;
300
300
Д£/П1 = | dT1 = 2-3/2-1,99(300 — 400) =—597 кал.
400
dw + dU dV nC,7dT nRT dV nC,7dT
dS. =-f-= p_ + -^-==^r- + —
ASi = nR In -у- 4- n.Cv In =
= 2 • 1,99 • 2,3031g 72+0 = -2-1,99- 2,303 • 0,3010=
= — 2,76 кал • °К-1;
220
Глава 1П
Второй закон термодинамики
221
AS,, = nR In ~ + nCv In ~ =
И 1 1 I
= 2 - 1,99 • 2,3031g-^-4-
ouu
+ 2-3/2. l,99-2,3031g^ =
ouu
= 2,86 кал • °K-1.
AS, 4-AS,, 4-AS,,, = 0;
AS,,, = - AS, - AS,, = 2,76 - 2,86 = - 0,10 кал-°K-1.
III-1-9. AS = —/? (X, In X, + X2ln X2),
где X, — мольная доля азота, а Х2 — мольная доля
кислорода.
AS = —- 1,987 • 2,303 (0,2501g 0,250 + 0,750 1g 0,750) =
= -4,58-(-0,2442) = 1,12 кал-°К-1.
Ш-1-10. f = P (а) и у= 1 (б).
Ш-1-11. Для этого газа И = -^-+&;
17 RT L ,11 ,11 I f \ а J П bdP
a = V---p- = b\ d\ny = d\n[^pj = ^-dP = -^r-,
v p
lnY= J dlnY = ^, =
y=l 0
Ш-1-12. Используя правило Трутона АЯпар/Гк11П
«= 21 кал • град-1 • моль-1, получим А/7пар « Гкип • 21 =
= 353-21 = 7400 кал-моль-1. Экспериментальное
значение равно 7220 кал-моль-1.
РАЗДЕЛ 111-2
111-2-1. а) Нет. Продуктом будет пар при более высоких
температурах и давлении.
б) Да. AG <0 и процесс возможен. Именно это усло-
вие учитывают, когда говорят о самопроизвольности
протекания процесса.
в) Нет. Если V и Т поддерживать постоянными,
давление будет падать из-за потери газа.
111-2-2. y = F + RT = U -TS + RT-,
dty — dU -TdS-SdT+ RdT =
— dq~dw~TdS — SdT + RdT —
= dq - P dV - T dS - S dT + RdT-,
dtyTi v=dq — T dS.
Если процесс обратимый, то
dq = TdS, dilj>T, v=0, Афу, y=0.
Если процесс самопроизвольный, то
dq<T dS, ch|v, v<0, A4r, y<0.
. dqo6p dU + dw
a) dS = —— =-------у,--, dU = 0;
. „ PdV Г* nRT dV n. V2
AS= J —= J = „/?lnTr.
V, Vi
„ А^перехола
6) AS =-----у----.
в) AS = 0.
r) dS = -^^-\ dU =^Q;
v. v,
c f PdV Г nRT dV n . V2
AS= J —= J -v^=„/?lnTr.
V, V,
d(/°6p _ dU + dw _ CydT
U rn " rp 1 “ -p
PdV
Вычислим (Cv dT)/T и (PdV)/T;
Tf _ Tf Tf Tf
Г CvdT I a dT (• f T.T
n I —у— = /г I —------n I b dT 4- n j cTdT =
Ti Ti rt Ti
= na\n^- + nb(Tf — T^ -|- n(jj — Tf);
f i
V-b ’ т V-b 1
vt
г PdV , /Vf — b\
т x V V, - & / ’
ASP = tia In-y- 4- nb (Tf — T{) 4-
4_Ц(7’*_г*)4-Я1п(2с2
222
Глава III
III-2-5.
Разобьем процесс на следующие стадии:
1) Нагревание от 20 до 100° С:
— Ср(Т2— Г1)= 18(80) — 1440 кал моль-1;
AS = СР In = 18 In Sri = 4,35 кал • °К-1 • моль-1.
/ I 1 и
2) Испарение при 100°С:
А 77 — 9720 кал • моль-1;
до Л/7— AG 9720 — 0 n„ nn °tz-1 -I
А5 =-----=----—-ото.,: =26,02 кал - К -моль .
/ О/О,1э
3) Нагревание от 100 до 250° С:
А// = СР(Т2 — Г[) = 8,6 (150) = 1290 кал • моль-1;
AS = СР 1п -£- = 8,6 In -|§# = 2,91 кал • °К~‘ моль-1.
/ I о! о, 1Э
AS = 4,35 + 26,02 + 2,91 = 33,28 кал • °К-1 • моль-1.
АТ/ = 1440 + 9720 + 1290 = 12 450 кал • моль-1.
А17 = \Н - A (PV) = \Н-Р А/;
AV = /(г. 523) — К(Ж, 293) == /(г, 523),
если принять, что объем жидкости незначителен
по сравнению с объемом газа.
III-2-6.
Р А/ = PV{r, 523) = рт = 1,987 ——------ 523,15° С =
1 град • моль
= 1040 кал моль-1 (при предположении, что газ
идеальный).
А £7 = 12 450 — 1040 = 11 410 кал • моль-1.
а) АЯ:000 = А^8+ j \CapdT =
298
= 124100 - 1,585(1000 - 298) - • Ю-3 X
X (ЮОО- - 298^) - ——=
= 121,2 ккал.
б) Для любого изотермического процесса
AS° = A//°~ A-G° , a \S° = \H°/T,
только если AG° = 0.
1. Нет. Как видно из эксперимента, для этого не-
обратимого процесса АС0 > 0.
Второй закон термодинамики
223
III-2-7.
2. Нет. Для этого процесса также ДО'0 3> 0. Индекс „о“
показывает, что летучесть NaCl(r) равна 1 атм, а,
как мы знаем, давление насыщенных паров NaCl
значительно меньше 1 атм при 25° С.
3. Да. Летучесть NaCl (и давление паров, поскольку
газ считается идеальным) при температуре кипения
равна 1 атм. Если процесс будет обратимым и изо-
термическим при этом постоянном давлении, то ра-
бота, исключая работу расширения, будет равна
нулю. Следовательно, AG° = 0.
ДСР = СР (ж) — Ср (тв) = 9,1 кал • град-1 • моль-1;
264
а) \Н263 = \Н2П+ J ДСр= 1436 4-9,1 (-10) =
273
= 1345 кал • моль-1.
263
лЪ л с 1 Г л 7- dr 1436 . n . . 263
б) Д$263 = ^*$273 + J ^Р~==’273’"^9, П'273' =
273
= 5,25 — 0,34 = 4,91 кал • °К-1 • моль-1.
(Заметим, что ДС273 = 0, поэтому ДД273 = Д//273/273.
Как будет показано в пункте (в), ДЗ и Д/7 нельзя
определить таки»£ путем при других температурах.)
в) Метод /. \G = \H- Т ДЗ = 1345-263- 4,91 =
= 53 кал • моль-1.
263
Метод II. AG263 = AG273 — j \SdT=0—Д5средн,(—10);
273
ДЗсредн ~ */г • (5,25 + 4,91) = 5,08 кал • °К-1 • моль-1;
ДС263 = 51 кал • моль-1.
_ _ 263 _
Метод III. Г ^-dT =
Zou 21 о J L ч
273
= 0 ~ Д^средн (-273- ~ '263')'•
Д/7средН « 1/2 (1436 — 1345) = 1390 кал • моль-1;
263-1390-10 К1
ДС263 = 973 - 263 = 5 кал'моль •
224
Гмва III
II1-2-8.
Ш-2-9.
|сЦЛ6’7П1 _ Л/Г _ D а .
L дТ ]р Г2 'Г2 Т ° С1’
(ДС7Гг) т т
_[ d(AG°/n = -j
(AG2/Ti) 298 298
Т Т
- \ bdT- J сТ dT',
298 298
AG -^Ossb । rj ________1_\ 1 / Т \
Т 298 ' \ Т 298 ) а Ш \ 298)
— Ь(Т~ 298) - у (Г2 - 2982);
AG° = Т [& ~ ^8 + 2’303а 298+2986 + -f (298)2] +
+ D - 2,303аГ lg Т - ЬТ2 -
См. рисунок. Стадии цикла обозначены А, Б, В.
Стадия А: прямая, параллельная оси S.
Стадия Б:
III-2-10.
НС _dU -_Acvd7\ l^_] _£v_. t^L}
u^v T — T ' \dT!v T ' \ dS ]v Cv ’
( bT\
y’dS/y опРед^яет наклон кривой.
Стадия В;
_ан (CpdT)' idS\ _Ср> 1дТ_\
аБр т — т \ удт]р т ’ \dSlp Ср'
I дТ\
\dS/p определяет наклон кривой.
I. rfS = 0; d<7 = 0(o6p)
u’i = — \U v = — CY (T2 — Г J.
Второй закон термодинамики
225
II. dV = 0', ®ц=0; q^—MJn—Cv (Т3—Т2) (нагревание).
III. dS = O; d<7=0(o6p); wHI=-Д1/1П=-СУ (Г4-Г3).
IV. dV = 0; w = 0; q-yj — \Uiv = — Gy ^4)!
_ _ ~су(Т2-Т1)~Су(Т4~Тз) e
*1- 9 ~ Cy(T3-T2)
“ T2 + Г, - Л + T3 _ (7~з-7'2) + (7'1-Л)
__ _____________________________________ t T,-T4
Гз — Г2 T3 — T2 T3 — T2
Поскольку dS[ = 0, Sj = S2; так как dStu = 0, S3 = S4.
Следовательно, S3 — S2=S4— SP Поэтому
T:
т,
Т3 Ть т Тхт3 .
=г- = -=г- ИЛИ —
1 1 * 1 1 ч.
Ту-Т, - (Г.Гз/Гг) + Т, = ТЛ-Тг/Ъ+У)
Тз —• Т? Тз~ Тг — Тз
= г, (Гг ~ Гз)/Г2 _ _ Т\_.
Тз ~тг Т2'
— 1 _Л
t] 1 .
Для обратимого изоэнтропийного процесса dq = 0 и
dU = — dw.
dV
CvdT = -PdV\ CvdT = -RTy-\
CT V T I v \RICV
Hcin-LL^-in-l- 21= 11) •
R 1П T, V, ’ 72 k Vj
JL^ CJLCv=^.^ 1 =Y - 1-
CY Cv Cv 1 Y С
/ V. iV-l / 1 \Y-1
Cvdl RdV
~Т~— у-
T] = 1 -rl-Y.
Поскольку Ср > Су, то Y > 1 и (1 — у) < 0; по мере
того как увеличивается г, увеличивается и т).
111-2-11. а) Процесс А
?a = Wa = 0.
Процесс Б
q3==Wb== RT In V2/Vt = 1,987 • 300 In 2 = 413 кал.
Любой процесс
= ДГ = ДО = -/?Пп2 = -413 кал.
8 Зак. 1360
226
Глава HI
б) Газ может быть сжат изотермически и обратимо
от 20 до 10 л. Работа, совершенная над газом в этом
процессе, будет равна 413 кал. В процессе Б это
количество работы совершается газом и переходит
в окружающую среду, из которой она может быть
вновь получена настолько полно, насколько это по-
зволит исходное состояние газа. Однако в процессе А
не будет производиться работы и 413 кал при не-
обходимости должны быть получены, например, при
падении веса. Таким образом, окружающая среда
приходит в состояние, отличное от исходного. Если
обратный процесс проводится необратимо, затрачен-
ная работа должна быть больше чем 413 кал и воз-
вращение окружающей среды в исходное состояние,
очевидно, еще более невозможно.
111-2-12. a) Cv = */2R, II СП кэ йэ о!-о — 1 ю II (£Г= (ъу".
Q W ли AS
б) I 0 -3I2R(T2-TA 3/2R(T2-TA 0
II р, /?г21п = RT2\n = 0
= *I2RT2 In = s/2RT2 In = V2/?ln-p- 11
III s/2R(Ti -ТА R(Tt - та 3/2R(T.-TA 6/2/г in 1 2
Весь процесс 72/?[(Л - та + 72/?[(Л -г2) + 0 0
, т . 7г~| + Тг In y-J + Г2 1ПуЛ]
в)
II 0 0 0 6/2/? in 1 1
Весь процесс 7г/? (Г> - ТА 5/2R(Tt - ТА 0 0
111-2-13. а) При постоянном общем объеме
w = 0; q = \U = \H — \(PV) = - RT
= 540— 1,987 • 373 • = 499 кал.
I o,Ux
Для нахождения AS проведем двухстадийный про-
цесс, в котором исходное и конечное состояние воды
будет таким же, как и в данном процессе.
Второй закон термодинамики
227
Испарение газа при 1 атм:
. с ДА/ 540 кал-г-1 , ..а ,
А8 = -¥- =—„A, „ = 1,448 кал • град 1 • г-1.
1 о/ О
Расширение от 1 до 0,10 атм:
AS = rt^nnA = _* . 1>987 In 10 =
i 2 I O,U2
= 0,254 кал • град-1 • г-1.
Общее:
А8Ш = 1,702 кал • град'1.
б) <7г = — qw — — 499 кал;
л о —499 кал , оо- .
А8Г =— -гд. - = — 1,337 кал • град-1.
(Для резервуара ш=0и А(7 — q. Изменение состоя-
ния источника, определяемое только его энергией,
будет тем же самым, независимо от того, будет
теплота отводиться от него обратимо или необратимо.
Поэтому \S = q/T, даже если описываемый процесс
необратим.)
в) <7общ = 0; А80бШ= 1,702 — 1,337 = 0,365 калтрад-1.
г) Вода испаряется обратимо при давлении 1 атм.
Вода испаряется обратимо против внешнего давле-
ния, равного собственному давлению пара. Оба этапа
проводятся изотермически при 100° С.
В обратимом процессе испарение и расширение воды
производит работу. Эта работа, сохранившись
в окружающей среде, будет доступна, если потре-
буется, в обратном процессе. В необратимом про-
цессе вода не будет производить работы и возмож-
ность получения работы от нее будет потеряна. Сле-
довательно, в необратимом процессе от резервуара
отводится меньше тепла.
Ш-2-14. a) dH = Т dS + V dP. Поскольку dH — полный диф-
ференциал, то
ж .
\dS)p \dP/s
(dV\ _(дТ\ (dS/dP)T Т (dV\ RT
б) \dSh~\dPJs~~(dS/dT)p
Ш-2-15. dU — dq — dw (первый закон термодинамики);
dw — PdV (определение работы Р — V);
dU — dq — PdV‘,
, _ ^<7обр , „
dS — —у— (второй закон термодинамики).
В*
228
Глава III
(Так как конечное уравнение применимо только
к равновесным системам, это соотношение можно
использовать.)
dU — TdS — PdV (комбинация первого и второго
законов);
Ж =7^) _р-
\dV )т \dV )т ’
F—U — TS (определение F);
dF — dU—Т dS—S dT = Т dS-Р dV— Т dS~SdT—
== — PdV — SdT.
Применяя соотношение Эйлера к dF, получим
\дТ )v \ )т
Следовательно,
-т(дР\ -р
\ dV )т \ дТ )v
Ш-2-16. H = U + PV;
dH = dU + d(PV)^dq-dw + PdV + V dP =
= TdS + V dP;
G = H - TS = U + PV - TS;
dG— dU -V PdV + V dP—TdS — S dT =
= dq-dw +PdV + V dP-TdS ~ SdT =
— VdP — SdT.
dG является полным дифференциалом, поэтому по
соотношению Эйлера — (dV/dT)P = (dS/dP)T. Следо-
вательно,
\ дР )т \ дТ /р
1П-2-17. dq — dU-\-dw; dU = 0; dq = dw = PdV\
v, v,
AS= j j ж±^)^=(р+4)1П^.
Vi 7,
1П-2-18. dG = V dP - S dT.
Поскольку dG — полный дифференциал, соотношение
Эйлера можно применить к этому уравнению. По-
Второй закон термодинамики
229
лучим (dS/dP)T = — (dV/dT)P. Далее (дУ/дТ)Р можно
вычислить из уравнения состояния
PdV + V dP = nR dT + dV\
Ш-2-19.
Ш-2-20.
dV \ ng
дТ]р (P -2n2a/V2) ’
9S \ _ / dV \ ng ngV2
dP Jr \ dT JP (2n2a/V2) — P 2n2a - PV2 '
PV = RT + dG = VdP-SdT-,
V
dGT = V dP-
PdV + VdP^=~~dV-, VdP=~PdV-^dV-,
' V2 Vt ’
р = < + <£ ydP=lM ?RTBXv
V V2 \V V2 J
\GT = ~ f RT^- J 2RTB^- =
V, V,
= _Rn„^ + 2RrB^_|.
V2 Vi
Afr = -f PdV— RT
V, V1
Кроме того, можно рассчитать AG:
AG = AF + A (PV) = - ЯПп + RTB +
+RrB(i-w)"
= -RT\n^- + 2RTB J-).
V, \V2 vj
/ar\ (du/dv)T /аД\ __т(дР\ p
W Ju ~ (dU/dTJy ’ \dv)T~ \dTJv
p__.
v-ь v3 ’
230
Г лава III
II1-2-21.
/дЦ\ __ а . / дТ\ _ _ а
Uv/r у2 ’ \<3V/y CvV2 '
(dV\ (dS/dT) С
’\dTjs (dS/dV)T Т (дР]дТ)у
р RT_______а .
V-b V2 ’
(дР \ =_R_. / Су (Г-6)
\ дТ ]v V -b' \дТ js RT
б) В этом процессе S постоянна. Тогда
,?7 (dV\ dV ^vdT
\ dT }s 'V-b RT
Ш-2-22.
Ш-2-23.
Ш-2-24.
Второй закон термодинамики
231
. !dV\ (дР/дТ)у - R/(V - b) - a/T2V2
n) ---- =----------=— =---------=-----------=— .
\dT Jp (dP/dV)T - RT/(V - 6)2 + ‘2a/TVi
q\C — C= T (—} I—} - -TlR/^-b} + a/T2^2
p V \ dT /v\dT !p - RT/(V - b)2 + 2a/TV3 '
ж) В обратимом адиабатическом процессе S по-
стоянна:
dF [dV\ С Г R а
----= ----- =------— —----_1 ---—
dT \ дТ Js Т V — b ~ T2V2.
В этом выражении а = О и Cv—постоянная величина,
поэтому
dF -^(F-fe). R dV _ CvdT '
dT = RT ’ V — b~ T ’
n i V2 — b 7? i G
R In ------= — C,, in —.
V, - b r,
P,
Ш-2-25. a) AG == f V dP = RT\n^ = 1,987- 273,2- 2,303 lg?=±
J л j <5
Pi
— 1628 кал.
6) AG = /?ГIn £-==1,987-2,303-273,2 1g —
= 1440 кал.
Ш-2-26. din Y = -^rrfP; a=F—7=-^ + aP-,/a+&+cP,/2;
a = + aP~'!l + b + cP'11 -
In? P
in у — J d In у = j (аР~'/г -|- b + cP'12) dP;
о о
In Y - [2aP'la + bP + j cP3'1}.
Ш-2-27. У==<(Н^ + бП = £ + X +
p v p
ln Y = I “t)dp = / <A + BP>dP = AP + 4
о о
Y = exp^4P +£bp2).
232
Г лава III
Ш-2-28.
Ш-2-29.
Ш-2-30.
V _ *1 _ 0.0821 • 258 _ 9
' идеальч р щ 3] ^,иии,
а = Йнабл - УиДеальн = 1,857-2,056 = -0,199 л;
р
In Y = -Ят f “
К t J
При предположении, что а не зависит от давления
в интервале между 0 и 10,3 атм, получаем
V = 2,303-0,0821 258 (-0,199) (10,3084 - 0) =
==—0,0420; у = 0,908.
а) V = RT + Р(пх + пу) + а(пх пу)’/’];
_ / <?у \ г 1 1 / пи \’/»1
— Г!— г Р1 / 1 1пи\'!Л 1
б) AGx=J )(Р2-Л)].
\dV It \dT lv r (dV/dP)T r'
= Vo(-6,427-10“' -I- 2 • 8,5053 • 10~6/ -
- 3 • 6,79 • 10~¥)= -4,746 • 1O'VO;
Обычно для жидкости или твердого тела (д(7/дУ)т—
большая положительная величина, означающая, что
энергия убывает со сжатием. Однако в данном слу-
чае энергия со сжатием увеличивается, потому что
уменьшение объема может происходить только при
разрыве некоторых водородных связей, которые обу-
словливают открытую структуру воды.
РАЗДЕЛ II1-3
111-3-1. . Нет. Движение не является вечным, однако сила тор-
можения настолько мала по сравнению с моментом
количества движения Земли, что пройдет вечность,
пока станет заметным сколь угодно малое замедление
Второй закон термодинамики
233
движения (скорость замедления равна 1,6-10-10 ча-
стей в год). Если сила торможения близка к нулю,
движение будет как бы постоянным, но это не имеет
ничего общего с вечным движением, поскольку систе-
ма не может так называться, так как она совершает
некоторую работу.
III-3-2. Нет. Не имеет ничего общего с вечным движением
первого рода, так как движущийся объект совершает
некоторую работу (против трения, например). Дви-
гающиеся молекулы часто теряют энергию при столк-
новениях, однако тут же получают ее при других
столкновениях. Трение не уничтожает энергии моле-
кул, но только делает ее более хаотичной. В газе дви-
жение уже случайно настолько, насколько это может
быть. Что касается вечного движения второго рода
(нарушение второго закона), то оно могло бы быть
только, когда неупорядоченное (тепловое) движение
молекул переходит в упорядоченное движение (рабо-
ту), причем этот процесс не должен сопровождаться
никакими другими процессами.
III-3-3. а) Процесс необратим. Возвращение системы по тому
же пути означало бы, что газ должен был бы прохо-
дить сквозь пористую перегородку от меньшего к боль-
шему давлению, что явно невозможно. Газ может воз-
вратиться в исходное состояние только при другом
процессе, включающем разные количества работы и
теплоты.
б) dH — TdS + VdP = 0; =-Х.
111-3-4. Процесс необратим, а) Процесс не может быть про-
веден обратно по тому же пути—тепло не будет пе-
редаваться по проволоке от холодного к горячему
телу.
б) AS всей системы положительно для описываемого
процесса, но мало по величине из-за медленности про-
текания процесса. Обратимые процессы бесконечно
медленны, но бесконечно медленно протекающий про-
цесс не обязательно является обратимым.
111-3-5. , Нет. Энтропия изолированной системы должна возра-
стать в каждом процессе. Если Н2 и О2 реагируют
в изолированной системе, продуктом будет пар при
очень высокой температуре; его энтропия будет боль-
ше, чем энтропия исходных веществ. AS рассчиты-
вается с помощью таблиц энтропий, относящихся
к процессам, в которых исходные вещества и продук-
ты реакции отнесены к начальной температуре. Эти
234
Глава HI
111-3-6.
111-3-7.
процессы в действительности невозможны в изолиро-
ванной системе.
Неправильным предположением является то, что в са-
мопроизвольном процессе энтропия системы, т. е. воды,
должна увеличиваться. Действительный критерий са-
мопроизвольности — увеличение общей энтропии (си-
стемы и окружающей среды). Чтобы учесть окружаю-
щую среду, предположим, что замерзание переохла-
жденной воды протекает на масляной бане, причем
настолько медленно, что при этом температура бани
мало изменяется. Тогда изменение энтропии бани
(окружающей среды) \S = qoap/T. \Н при —5° С, рас-
считанная по формуле Кирхгофа, будет равна
13-76 кал-моль-1, так что А5бани—1376/268=
= 5,14 кал-ОК-1 • моль-'. Поэтому изменение общей эн-
тропии составляет —5,044-5,14=0,10 кал-“К-1 • моль-1,
т. е. процесс действительно сопровождается возраста-
нием энтропии.
а) Выражение dG = —S dP 4- V dP справедливо для
закрытых систем с постоянным давлением, не произ-
водящих никакой другой работы, кроме работы P—V.
В общем случае
dG = - S dT 4- 2 Vt dPi 4- 2 Н/ dti] + ^Fk dxk.
i i k
Второй член в правой части этого уравнения спра-
ведлив при различии давлений в отдельных областях
системы. Он основан на определении: G =F 4-
4- 2 PiVi- Третий член связан с изменением числа
компонентов (в открытой системе). В четвертом чле-
не А — обобщенная координата и Fh — соответствую-
щая обобщенная сила, например,
х F
поверхностный потенциал
электрический поверхностного
заряд натяжения
б) Обычно для изотермических процессов Д5 =
= (АЯ— \G)/T. Если замерзание происходит в точке
плавления, AG = 0 и \S=\H/T. Если затвердевает
переохлажденная жидкость, AG <0 и AS > Д///Г.
в) В общем случае при равновесии Pta=p.i₽;
4- RT In aia = 4- RT In al&.
Если ц°а = ц°3, тогда ata = а,р. Однако обычно P°tt=# р °б.
Например, если i — жидкая вода, а —лед и 0 — вод-
Второй закон термодинамики
235
II1-3-8.
II1-3-9.
HI-3-10.
ный раствор NaCl, то ц£а==ц°а иа( = 1, вто время
как (ц°р — химический потенциал чистой жид-
кой воды при той же температуре) и а1& < 1. Тем не
менее если водный раствор состоит из двух фаз (как,
например, в опыте по осмотическому давлению),
тогда при равновесии = и aia = a^.
Вообще неверно предположение, что \S = q/T. Это
справедливо только для обратимых изотермических
процессов. Обычно AS = j dqoe9IT. Если газ расши-
ряется обратимо к какому-то конечному состоянию, то
AS= j dq0&vIT > 0. Такое обратимое расширение не
может быть адиабатическим; при обратимом адиаба-
тическом расширении конечное состояние не было бы
таким же, как при необратимом адиабатическом рас-
ширении. Газ в конце процесса должен быть слишком
холодным, потому что он должен был бы произвести
работу, большую, чем в случае необратимого расши-
рения.
Для любого изотермического процесса \S~q06p/T,
где </обр — поглощенное тепло в процессе обратимого
перехода системы из начального в конечное состоя-
ние. Будет ли <7 = </обр в описываемом процессе? Ко-
нечно, АД=АДОбр и q = \U 4- w. Вопрос заключается
в том, будет ли w = w06p? В данном случае справед-
ливо предположение, что w = wo6p; для процесса пла-
вления в любом случае это фактически не является
работой и аг/обр — ш может быть даже несколько
больше, чем w. Единственным отличием был бы ре-
зультат расширения (или сжатия) настолько быстро-
го, что атмосфера не успеет прийти в равновесие с
этой системой — слишком незначительный эффект.
Поместим систему в изолированный термостат при
температуре Т и постоянном давлении. Система s и
термостат t вместе составляют изолированную систе-
му, следовательно,
ASs + ASj = ASo6iu > 0.
Теперь единственным взаимодействием термостата
с окружающей средой (системой) является поглоще-
ние и выделение тепла. Термостат переходит в неко-
торое конечное состояние, независимо от того, будет
ли данное количество тепла при постоянной темне-
236
Глава III
ратуре поглощено обратимо или нет; qi=XHt. По- этому AS, Но qs = — q{ и AGS = qs = — XHt, поэтому ДА/. ML ML ASs + ASt =ASs + ~ = ASs ^=-^>0 или AGs < 0. Функция G определена для того, чтобы не было не- обходимости рассматривать окружающую среду, осо- бенно для данного типа процессов при постоянных Т и Р.
111-3-11. Обе величины dq и Т dS не являются полными диф- ференциалами (хотя dS — полный дифференциал). Определенный подобным образом dX также не будет полным дифференциалом. (Возможно, что сумма или разность двух неполных дифференциалов будет пол- ным дифференциалом, но это исключение, например: dU=dq — dw). Другими словами, мы не будем пола- гать, что функция X определяется состояниями систе- мы. Изменение X будет зависеть только от пути, по которому система переходит из старого в новое со- стояние. С другой стороны, общее определение функ- ций F и G таково, что их дифференциалы являются полными: F=U — TS, dF=dU — TdS — S dT=dq — — dw — T dS — S dT. Если V — постоянная величина и нет другой работы, кроме работы расширения, то dw=0\ если Т—постоянная величина, то SdT—0. Тогда dFVtT=dq—Т dS. Эта разность неполных дифференциалов будет полным дифференциалом при указанных ограничениях. Аналогично dG = dF + Р dV + V dP = dq — (dw — PdV)-^ 4 V dP-TdS-SdT', dGP, T = dq — T dS, где P и T постоянны, a dw — PdV.
II1-3-12. a) 1) XS = q/T, если процесс обратим. 2) XH=q, если давление постоянно и производится только ра- бота расширения: w~ 1 PdV (иеэлектрическая ра- V, бота). Совершенно ошибочно уравнение (3). Следова- тельно, заключение (4) применимо, если условия, пе-
Второй закон термодинамики
237
речисленные выше, выполняются. Единственный обыч-
ный процесс, который удовлетворяет этим условиям,—
процесс фазовых переходов (затвердевание, испаре-
ние и т. п.) в условиях равновесия, например затвер-
девание при температуре плавления, но не затверде-
вание переохлажденной жидкости, б) Пусть q' — теп-
ло, поглощенное в процессе, при котором w = P ДИ
(Р постоянно; работа неэлектрическая); тогда q'=
= \Н. Пусть q"— тепло, поглощенное в равновесном
процессе; тогда
q"=T\S.
\G=\H-T\S = q'-q".
Ш-3-13. dU-TdS-PdV-,
dH == dU + V dP + Р dV = Т dS + V dP,
следовательно, (dV/dS)P = (dT/dP)s (соотношение Эй-
лера).
Тогда Ж) .
\ дЪ /р \ дР Js
Ш-8-14. Пусть r=r(>V.
тогда
TdS = X dU + Y dH = dU + P dV-,
dH = (^ dP + CPdT-,
dV=(4Hdp+(4r)P dT=v (- ₽dp+° dpy
Таким образом,
+ 1'(-jJ-)/P+>'Cprf7--
- (4H <" + (4т-)Р‘Я' - ЛР + PVcdT.
Приравнивая коэффициенты при dP a dT, получим
Л^)г+у(4?-),=(Яг-|,'>1'’
Л^)р+гсН-эН.+“р,,:
238
Глава 111
Кроме того,
== V (1 - Та) 4- PK0 - V = V (Р0 - Га);
Ш,=с- -р(тг\,=с-
Следовательно,
[У(РР - Та) - РУр]Сп - (С_ - РУа + РУа)У(1 - Га)
Х У (Рр - Га) Ср — У (1 — Га) (Ср - РУа)
__________~СР
Ср(Рр- 1) + РУа (1 - Га) ’
/ as \ - Ср
\dU 1Н~ Г[Ср(Рр- 1)+РУа(1 - Га)] ’
П1-3-15. а) dH = Т dS + V dP;
\ дР )ц Г
б ) Метод 1
«S = (»/P+(»/r;
/ as \ _ / as \ I дт \ _ сР 1
Vay/р-Гаг/р \ av7p Г” v^’’
Ср = Cv + Г р” (известное уравнение);
/ as \ _ cv а
V ау )р~~ TVa I- Р •
Метод 2 I ds\ ds\ 1 (ayjp \-ау7г "Н /аР) (дУ/дТ){ 1 аг 1у (ау/ар), as\ /дТ\ /дР\ Су 1 ’аг'/и\’ау/р==\аг'/и’^ ~' 70"’ > « г “ ₽ ’
Второй закон термодинамики
239
HI-3-17.
(дУ \ = (дУ_ \ Т 1дУ\
<?S /р \ ЗГ /р \<?S )р Ср \ дТ /р'
‘ \ дН /Р~\дТ)р\ дН )Р ~' Ср ( дТ )Р ’
(дТ\ = __ (дН/дР)т = _ _Jf,. _ !дУ_ \ _
УдР)” (дН/дТ)р Срр Ч<?Г/р]~
___v_ , г /зт\ _ 1Z / дг \ । т(ду\
Ср1~ Ср\дт)р- \df/!p + I [дн)р-
> Г _ Т ( дР\
p-cv-/[ дГ )v[-§r)p>
р __ _ RT____.
V — АТ+ В ’
/ дР\ Р ART
[dT/у V - АТ + В + (V- АТ + В)2
_ RV~-ART + RB + ART R(V~+B)
(V-AT + B)2 ~ (7- АТ+ ВУ ’
V^=~- + AT-В-,
Г
III-3-16.
_ RT (V А- В) (R/P + Д) RT2 (R/P - Л)»
(V-AT+ВУ (RT/Py
=4(4+4-«(1 + тГ-
HI-3-18.
а) Тепло, полученное образцом 1, равно теплу, по-
терянному образцом 2:
cv (т3 -т^Су (Т2 - Гз); Лз = 72(Л + т2).
б) Одним из возможных будет следующий процесс:
пусть газ / сжимается, а газ 2 расширяется адиа-
батически и обратимо так, что каждый принимает
конечную температуру Т3. Найдем и< объемы
(7 и V2 соответственно), используя уравнение
PVv = const = 7'/?7¥’1, где y = CP/Cv = (Cv + R)/Cv.
Для газа 1
Г,!/7-’ = Г37Г',
т>
V-
240
Глава III
Для газа 2
Т2Уу-х = Т.УГ1, -y- = (4)'/(V~".
Проведем расширение газа / от объема V] до объ-
ема V и сжатие газа 2 от объема V2 до V изотер-
мически и обратимо; при этом газы находятся в кон-
такте с тепловым резервуаром при температуре Т3.
в) В адиабатическом процессе энтропия не изме-
няется. Для изотермического процесса имеем:
ASra3! = R In In 77 = Су 1п ;
ASra32 = R ।П -jT~ = Су 1п -=т~ •
К 2 ‘2
Тепло, выделенное (или поглощенное) каждым газом,
поглощается (или выделяется) источником при той же
температуре Т3:
А30кр. среды == (ASraa I 4" ASraa 2) == Су In ==
тз
__С |п 4Г[Гг
cvin (Г1 + т^г ,
А50бщ == 0.
г) В процессе А не происходит изменения состояния
окружающей среды и AS0Kp. средь| = 0. Энтропия газов
изменяется так же, как и в процессе Б, поскольку
исходное и конечное состояния в обоих процессах
одинаковы. Тогда
А50бш = ASraa / 4- ASra3 2 = СИп .
Доказательство того, что эта величина всегда поло-
жительна при Т{^=Т2, является интересным матема-
тическим упражнением.
1П-3-19. а) Р = п-^- —
ру = „/??•_ «311;
(dS \ ( дР \ nR R , . ,
\ ду )т ~ \ дТ )у ~~ V ~~ Р 1 моль);
(dU\ -т(дР\ -Р—М.-
\dV )т \дТ )у r V2 ’
(дН\ =(dU\ = 2№
I дУ )т \ дУ )т I дУ ]г V2 ‘
б) Газ помещен в цилиндр объемом V с герметич-
ным без трения поршнем; цилиндр помещен а тот же
Второй закон термодинамики
241
термостат, что и в процессе А. Газ бесконечно мед-
ленно расширяется от объема V до объема 2V.
'2V 2V
V V
2V 2V
V V
Процесс А
<7 ьи Д5
Газ 2V 0 PR 2V R In 2
Окружаю- PR 0 РР РЛ
щая среда 2Г 2V 2VT
Общее изменение 0 0 0 *(ln2 2Vt}
Процесс Б
Q w Л1/ AS
Газ RT In 2 RT In 2 — || P/? 2V R In 2
Окружаю- щая среда - RT In 2 - RT In 2 + -Ц -И 2V - Rin 2
Общее изменение 0 0 0 0
Ш-3-20.
V-T^ + b^RT^-^j + b-.
dG — VdP-,
a~\vdp = RT\[^--^dP + b\dP-
== РГ[1п Р —- ln(l + аР)] + 6Р + С;
G° = lim (G - PTln P) =
p->o
= lim I- RT In (1 + aP) + bP + C] =
p->o
?=C (постоянная интегрирования).
242
Глава III
G -G° = G - C = RT [In P - In (1 + aP)] + bP.
S-S°=_ [a(^~5o)] =-/?[lnP-ln(l +aP)J.
H - H° = G - G° + T (S - S°) = bP.
III-3-21.
Уравнение Ван-дер-Ваальса может быть записано
в трех формах:
(р + ~Уу-nb)==nRT', (1)
р — nRT _ • (О\
V-nb V2 ’ v '
PV = nR1 _
l-nb/V V '
я\ (dS \ =(£L'\ — llR
7 \dV )r \ dT )v V-nb ’
/ as \ _ / _ay_\
\дР)т \dT)p-
Дифференцируя уравнение (1), имеем
/п , n2a\(dV\ 2п2а ( dV \ ... ,, п
\^+v2)(a7’)p v3 П^’
/ as \ / dv \ _ nR __
\ дР )т [ дТ )р~ (2n2a/V3)(V - nb) — (Р + n2a/V2) ~
______________nR_____________=
(2n2a/V3) (V — nb) — nRT/(V — nb)
__ V — nb
~ {2na/RV3)(V — nb)2 — T ’
I dU \ _~/aS\ p________ n2a
^"аГ/г ~ 1 vW 'т ~~ и ~~v2' ’
— т f 4- v —______________Vj-nb_________. y_
\dPjT \dPIT~ (2na/RTV3)(V-nb)2-\ v ’
(^\ =(M\ _v^Pl^L\
\dP )T \ dP )T \dP )T'
Дифференцируя уравнение (1), получим
Г, 2п2а / aV \ ] ,,, I / г> t п2а \ I dV \ n
I1 -—Ы J - «&)+(p+M =0;
/ an \ _ v-nb
\dP )r~ (2n2a/V3) (V-nb) — nRT/(V - nb)
(V-nb)2
~ nRT [(2na/RTV3) (V - nb)2 — \] ’
p(dV \ _ V-nb_____________________
\dP )T (2nalRT V3) (V - nb)2 - 1
__________na(V-nb)2__________
V2RT [(2na/RTV3) (V - nb)2 - 1] ’
Второй закон термодинамики
243
следовательно,
/ ди \ _______(У — пЬУ______
\ дР )т (2/V)(V ~ nb)2 — V2RT/na ‘
v,
б) ДС/= f = ' у
V,
ДЯ = Д[/4-Д(РУ);
Д (PV) = nRТ (----1Т7т7- - т- п-а (4- - -тМ:
' ’ \l~nb/V2 X—nb/V-t) \ V2 V\)
Ml = 2n2a(±-±.\ + nRT (,--------------:---!—};
\V, V2/ \1 — nb/V2 X—nb/Vi)'
v,
\F = - f PdV — — nRTini-^^-—-} —
J \ Vi — nb /
v,
na\v2 V,)’
= M' + k(PV) = - nRT In -
- 2n2a U------J-UnflT’f-j--—-—1—-V,
\ V2 Vi J \i—nb/V2 l—nb/Vj
AS = f dV = nRIn
J \ dV )T V, — nb
v,
в) Для 1 моля свободную энергию можно записать
так:
°=т-=-«7'|"(т-6)-^- +
RT
(1 — nb/V)
К,
где К — неизвестная постоянная. [Для того чтобы
остались только интенсивные величины, перепишем
(V2 — пЬ)ИУх — nb): (У2/п — bjliVJn — £>)]. Для 1 моля
стандартная свободная энергия определяется сле-
дующим образом:
G°= lim (— -RT\nP}= lim (— - RT\n^-\ =
= lim (— +RT In— \-RT In RT,
V/n^^ \ « П I
так как P = nRT!V в пределе при низком давле-
нии. Но
— + RT\n- = -RT\n
п п
Г V/n — Ь~\ 2па .
L Vjn J У~ +
RT
1 — nb/V
+ к
244
Глава III
2na . RT
V "i" 1 — nb/V
и
lim (— + /?Tln— \ = RT + R = G° + RT \п RT.
У/га->оо \ n n /
Тогда Д = G° + ДТ (In RT — 1), т. e. мы выразили_Д
через более удобную постоянную интегрирования б°.
Таким образом,
°-= G°-ДТ Inf-
ra \ п
- RT(\-\nRT).
Летучесть f определяется как G = G/n = G° -f- RT Inf
или f = exp (G — G°)/RT, отсюда
, RT /1 . 2na \
' У/га — й eXp \ I — nb/V ~ 1 * * * V VRT/’
__ f _ [nRT/(V — nb)]exp [\/(l —nb)/V) — I —2na/VRT] _
Y P nRT/(V — nb) — n2a/V2
__ exp [1/(1 - nb/V) - 1 — 2na/VRT]
1 - [па (V - nb)}/V2RT '
Ш-3-22.
Заметим, что lim у=1, как и должно быть. При
V/n->oo
рассмотрении уравнения Ван-дер-Ваальса V и Т —
более подходящие переменные, чем Р и Т, потому
что Р легче выразить через Т и И, а не И через
Р и Т.
q~0, w — 0, \U = 0.
р__ nRT п2а , / dS \ _______ nR
V-nb Vs’ \dV/т~~ V-nb ’
= CV = W,
1 dT \ (dU/dV)T n2a 2na
\~dV Iц (dU/dT)y V2-3/2-nR — ’
2V 2V
AT f / dT \ _ 2na f dV na
~ J \dV )uaV ~ 3R J V2 ~ 3/?E •
v v
Для определения AS заменим общее расширение
на два пути, ведущих к тому же конечному со-
стоянию.
Изотермическое расширение
2V
V
Второй закон термодинамики
245
Изохорическое охлаждение
Т.+ ЛТ То+ЛГ
ле f п dT 3 г, f dT
&S2 — J Cv —у J у —
To Го
AS - AS, + as, - «Ф + 4 In (1 -
Ш-3-23.
Во-первых, заметим, что
\dV It \ dT lv W
отсюда
dCv\ d2V I d a\
=-=—=----------------=0;
dV )T dV dT \дТ V2 lv
’ dT \ (dU/dV)T a
JVIu~~~ (dU/dT)v ~~ CvV2'
/ dT \ (dS/dV)T (dP/dT)v RT
(dv)s~ (dS/dT)v ~ Cv/T ~ cv(V-b)'
Так как этот газ одноатомный и идеальный, в пределе
при бесконечно_м объеме CV=3I2P.- Кроме того,
известно, что Cv не зависит от объема. Поэтому
Cv—^lzR Для всех объемов.
a) w = 0, <? = 0, поэтому и = 0.
б) В обратимом адиабатическом процессе AS = 0.
rfK =
RT _ __R dV
Cv (v-b)dV’ T Cy V-b'
In^-
Cv V2~b 3 v2~b
ИЛИ
246
Глава 111
в) В первом случае
Г, = 300 4- 3.008206 (foo ~ Тоо)==219’^
III-3-24.
во втором случае
7\ = 300 (-[У/з = 3- 100'/’= 13,9° К.
а) (-^й = V- т(^\ =0;
т ( dV \ ( dinV\ =]
V \ дТ Jp— ’ \ д In Т )р~
In V = In Т 4- In f (Р), где f (Р) — произвольная функ-
ция Р.
v = Tf(py, (1)
да =гда -р=о; 4-да =1; (|да =i,
\ dV }£ \ дТ )у Р \ дТ /у \ д In Т /у
lnP = ln Т + In g (I/),
P=Tg(V). (2)
Из уравнений (1) и (2) получаем
г—W = "ли
Левая часть полученного уравнения зависит только
от Р, правая — только от V. Следовательно, обе части
должны быть постоянны:
pf(P)-vg(V)=k- f(P)=y, g(v)=v-
Таким образом,
Т =-^~ или PV = kT.
k
б) Уравнение (1) требует только одного условия:
V должно быть пропорционально Т; оно не учиты-
вает точную зависимость V от Р. Аналогично урав-
нение (2) требует только, чтобы Р было пропорцио-
нально Т, не устанавливая зависимости Р от V, Та-
ким образом, ни одно уравнение не доказывает, что
вещество является идеальным газом. Например,
V-nb
является уравнением типа (2), но оно описывает не-
идеальный газ.
Второй закон термодинамики
247
III-
-25. a)(-g)r = V, G = G° —-у-,
где G° — постоянная интегрирования.
б) g =j(r-^)dP-4 + c =
= j(p-^)dP+c-4,
о
где С — постоянная интегрирования. Предел интегри-
рования от 0 до Р выбран для сохранения аналогии
с реальным газом. Так как
G°= lim (G +
р->о \ 7
следовательно,
lim
р->о
= С,
G = G°-^ + $[V-^)dP.
О
Последний член является поправкой на „неидеаль-
ность“. Определим f так, что G = G° — rTlf. Тогда
о
III-
-26.
\/Р- J (V/rT- \/P2)dP
О
У-4--^—--------------;
1 -Р j (V/rT - \/P2)dP
lim y= 1.
p->o
т G\w . (dT\ _ 2C^6 . I <Э2П _6C,^.
7-~ T2 - [дт'ж p~ Г3 ’ \dT4ge_p T4 ’
at _ _
СЖ=С,+ J- t[ »=Co+“i* ;
dG = -SdT + V dP- I d№,
(по соотношению Эйлера),
248
Глава 111
f dS\ __ Cgg
\дТ'зе, p r
Тогда
I dT \ (dS/dS^)r_ p _ T / dT\
\дЗ>ё/8,Р (dS/дТУ^р СсуХдТ )зс,Р
_________2С,3^
“ Т3 (Со + ЗС^/Т3} '
III-3-27. a) F = U - TS; G — F — fl.
б) —dw—dU—dq^dU—Т dS=dF (при постоянной Т).
Первый закон
термодинамики
Wu == ЬУполезн = W + j f dl = W ф- f\l
(работа против постоянной силы не входит в выра-
жение ДЛЯ Wfj).
—dwy— — dw ~ f dl^dF — f dl = dG
(при постоянной f).
в) dU-Т dS+f dl, если не имеется работы, кроме f dl,
и эта работа обратима (т. е. f равно равновесной
силе).
dF = -SdT + fdl-,
_(9S\ — (^L\ .
\dl)T \дТ
=1;
\ д In Т )i *’
Inf — In Т + tnC(Z), где С(/) — некоторая функция I.
f—TC(l)', f должна быть прямо пропорциональна Т
при постоянном /.
Глава IV
третий закон термодинамики
РАЗДЕЛ IV-1
IV-1-1. Ср^Су=аТ\
Су 0,727 n пп 1П—5,
tz (20)3 — 9,09 * 10 ,
Cv = 9,09 IO-5/'3;
AS= j ^1 = j 9,09 10-57’2d7' =
т, о
= */3 • 9,09 • 10~5(203- 03) = 0,242 кал-°К-' моль-1.
IV-1-2. В твердом состоянии NO может находиться в двух
ориентациях, которые имеют практически равную воз-
можность существования, — NO NO и NO ON. По-
этому энтропия при0° К равна k \n2N—Nk\n2=R\n2=
= 1,99 • 2,30 0,301 = 1,38 кал • ° К-1 • моль-1, где k—
постоянная Больцмана и N — число Авогадро.
РАЗДЕЛ IV-2
IV-2-1. a) S = /г In W, где W — число элементарных молеку-
лярных состояний, соответствующих данному общему
(макроскопическому) состоянию. Обычно при 0э К F=1
для каждого исходного вещества и продукта реакции,
поэтому S = 0 для каждого исходного вещества и
продукта реакции, следовательно, AS = 0 при 0°К-
б) Для С и О2, как обычно, F = 1 и S = 0. Для СО,
однако, дипольный момент настолько мал, что ориен-
тация молекул (СО или ОС) в кристалле почти слу-
чайна вблизи 0°К. Таким образом, W> 1 и5>0
для СО или AS > 0 для данной реакции.
50 - 50
IV-2-2. a) j -f-dT = j 4,0 • IO-5?2dT =
о
1,0. IO-5-50? . 01z_i
-----5------= 1,67 кал • К
• моль
250
Глава IV
1V-2-3.
150 С
f -+ dT = 5,00 In -^- = 5,00- 1,09861 =
J 1 50
50
= 5,49 кал •0 К-1 • моль-1.
А с 300 кал • моль-1 о лг, отл-1 -1
АЗпл =--------------=2,00 кал • К • моль ;
300 С
[ dT = 6,001п^ = 6,00 0,69315 =
J / 150
150
= 4,16 кал •0 К-1 • моль-1;
S = 1,67 + 5,49 + 2,00 + 4,16 =
= 13,32 кал •0 К-1 • моль-1.
б) ад100 = ад150 + J AcPdT =
150
= 300+1,00(100— 150)=250 кал • моль-1;
AS100 = AS150 + J ^dr=~2,00+l,001n-^ =
= 2,00+ 1,00(0,69315- 1,09861) =
= 1,59 кал • ° К-1 • моль-1.
AG100 = Atf- 100 AS = 250 — 159 =
= 91 кал • моль-1 > 0.
Плавление несамопроизвольно ниже температуры
плавления (150 °К), поэтому AG положительно.
кал • ° К-1 • моль-1
От 0 до 15° К (экстраполяция по Дебаю) 0,20
От 15 до 160, 65° К (графически) 16,55
Плавление; 1236, 4/160, 65 7,70
От 160,65 до 283,66° К (графически) 11,25
Испарение; 6101/283,66 21,51
Энтропия данного газа при температуре 57,21
кипения
В работе [21] введена небольшая поправка — приве*
дено значение 57,38 для соответствующего идеального
газа. Графическое интегрирование можно выполнить,
строя зависимость Ср от 1g Т или СР/Т от Т.
Третий закон термодинамики
251
1V-2-4. Метод I
Цг — Gr _ нт — Н298 _ Gt — //298 .
О у* yi Т ’
G1000 —G298 лп 17 OTZ-1 -1
----loop--= —49,17 кал- К -моль ;
CP = CV + R — 5I2R для идеального
одноатомного газа.
Нт - Я°298 = 5I2R -(Т — 298) = 5/2R 702 =
= 3488 кал моль-1 при Т = 1000° К;
Тг°
0° ''1000 п 298 u 1000 — "298
о юоо— 1000 1000 —
= 3,49 + 49,17 = 52,66 кал • ° К-1 • моль-1.
Метод II
Г» = 45,96;
2Уо
1000 _
Siooo = S°2o8 + J ^dT^45,96+5/2R\n(^-^
298
= 45,96 + 6,01 =51,97 кал - ° К-1 • моль-1.
Расхождение этих двух результатов можно объяснить
электронным возбуждением при высокой температуре.
IV-2-5. Расчет AGf из измерения константы равновесия не
основывается на предположении о справедливости
третьего закона термодинамики, тогда как расчет AGf
из теплоемкостей исходит из этого предположения.
Следовательно, согласие между обоими результатами
является очевидным доказательством того, что при-
менение третьего закона справедливо в последнем
случае.
Глава V
ЖИДКОСТИ И СЖИЖЕНИЕ ГАЗОВ
РАЗДЕЛ V-1
V-1-1. Отложим на графике по осям lg Р и 100/Г (см. рис.). Проведем прямую через две данные точки. Из гра- фика найдем, что при 500°К lgP=3,05 и Р=1120 мм рт. ст. 3Гч X ° X <2- \ 5 X 5 X, О. 1 ~ р| 1 1 —Sj 0,200 0,250 0,300 100/Т Р, мм рт. ст. lg Р Т, °К 1/Т 2 0,30 300 0,00333 100 2,0 400 0,00250 500 0,00200
V-1-2. Правило Трутона: КНДТ 21 кал • ° К-1 • моль”1; A//v = 21 7=21 • 309 = 6500 кал • моль-1 Экспериментально наблюдаемая величина равна 6160 кал • моль-1.
V-1-3. n пхРТ Пх*Т . пхРЪ _ 1 1.00 V (nx + nN,)RT/Pti, nx + nNi 100 0,501 = 0,0200 атм = 3,80 мм рт. ст.
V-1-4. = .Ррр/ог.Яцо д '^3-И.6 ЮТ =0 сП 0F’ Рн,О^Н2О 0,9982-363,4
V-1-5. _ 2.980.7 0.W7.37.-W П_М4(;П.
Жидкости и сжижение газов
253
V-1-6.
V-1-7.
V-1-8.
V-1-9.
Площадь круга равна а — лг2. Для первого капил-
ляра ai = nrf, ri = Уа\/л; для второго капилляра
а2 = 2а1 = лг2, г2 = '02а1/л.
y—-^ghr; h = 2y/gr, где h — высота поднятия
жидкости.
^- = -^ = -U = 0,707.
Л, г2 У 2
Высота поднятия в широкой трубке будет в 0,707
раза меньше, чем в узкой.
_ 2Y 2-28,8 л пол7
Г hpg 2,71-0,878-981 0,0247 СМ.
б) у = 1 hrpg = ‘/2 2,18 - 0,0247 • 0,900 -981 =
= 23,8 дин/см-1.
В пункте (а) было предположено, что краевой угол
равен нулю. В пункте (б) — что краевой угол у бен-
зола такой же, как у этилацетата (но не обязательно
равен нулю).
А А [у (ЛГ/р)2/г] 344 — 407 _ -
Д(/кр—/-6) 26-81 ’ ’
407= 1,15 (/кр — 20 — 6) = 1,15 (^кр — 26); ^кр = 380°С
(экспериментальная величина равна 322° С).
При 100°С средняя плотность = */2(0,74 + 0,01)=0,375;
при 200°С средняя плотность = */2 (0,53 + 0,10)=0,315.
Построим график зависимости средней плотности
от t (см. рис.).
Проведем прямую через две нанесенные на график
точки. Плотность, при которой продолжение линии
достигнет точки / = 225° С, и является критической
плотностью; она равна 0,300 г • см-3.
254
Глава V
V-1-10. Ортобарическая плотность [*/2 (рпар — Рж)] для указан-
ных температур равна соответственно 0,68; 0,65;
0,62; 0,59; 0,56; 0,53; 0,52 г-см-3. Отложим по од-
ной оси реальную и ортобарическую плотности, а по
другой — t (см. рис.).
Проведем кривую через точки реальной плотности
и прямую — через точки ортобарической плотности,
а) В максимуме на кривой, проведенной через реаль-
ные плотности, найдем ^кр=109°С.
б) В точке пересечения кривой и прямой линии най-
дем критическую плотность, равную 0,51 г • см-3.
в) Критический объем равен 100/(0,51 • 103) =
= 0,196 л • моль-1.
РАЗДЕЛ V-2
V-2-1.
а) V пар V ж ' пар> еСЛИ V ж V пар- У пар ~ СС ЛИ
давление настолько мало, что к пару можно при-
менить закон идеального газа
dP Д//пар Р Д//пар 1 dP Д^пар
dT “ T(Vnap-V») № или ~р7т
т,
1 dP din Р . , ( Рг\ f d In Р
б) -p~dT 1ПЫ= J
т,
С А//Пар , Д^пар /1 1 \
= J RT2 dl ~ R
Г1
Жидкости и сжижение газов
255
V-2-2.
если КН нс зависит от температуры.
Р2 = Р\ exp dP _ A^nap /1 1 \ R \t7~ T2)\ nap nap A//nap^*
dT dP Т(Йпар-7ж) ~ nap dT rVnap T(RT + K)
P 1 T (RT + K) ’ _ 1 R
T (RT + /<) KT К (RT + K) ’
dP дяпар dT R.XHliap dT
P KT K(RT + K) ’
In -Z- = nap , —~— In т2 АЛГпар , ЯЪ + Я 1 n
Pl к Ti к RTi + К
1 In -yr- = ^^nap . n T2(RTi+K)
Pi к Ti (RT2 + ^) ‘
V-2-3.
V-2-4.
\пР= — р™~-+С, где С—постоянная интегрирования.
р = е-™аар/ят+с = е-^п^тес = ke"^n^IRT-,
ех = 1 + X + ту + з7 4" • • • ; здесь х= K.Hnap/RT.
р , Л^пар 1 / КНпар \ 1 / Л^пар Y
Г = Я р рт f- у pf— J — у рТ у + • • J -
Температура кипения 197°С (давление пара при
197°С=760 мм рт. ст.). А//Пар=191 '62,1 кал - моль"1;
197° С = 470° К-
Р2 КНпар / 1 1 )
g "Р? = _ 2.303Р \Т\ ~Т\Г
760 _ 191 • 62,1 / 1 1 \
lg 30 —’ 2,303 • 1,987 \ 470 Т J ’
1g 25,3 = -2590^
г, = 375° к = 102° С.
V-2-5. Доля молекул, которые имеют кинетическую энергию
больше данной, увеличивается быстрее, чем возра-
стает температура. Вязкое течение жидкости включает
движение молекул к новым положениям, при этом
молекулы будут проходить через область высоких по-
' тенциальных энергий (когда молекула «протиски-
256
Глава V
V-2-6.
вается» между другими молекулами). Повышение
температуры приводит к увеличению доли молекул,
имеющих достаточную энергию для перехода через
потенциальный барьер, и к увеличению скорости по-
тока.
1 , , 2у
1 2 ’ pgr
— h2 = ДЛ
_ 2у 2у _2у 7 J________1 \ 2у /г2 — rt \ .
Р£П PgTj Pg \ И r2J pg \ г^г ) ’
V = 4 АЛ (тт=7г)
V-2-7.
lgv = lgA + «lg(^P-n.
Построим график, отложив по оси ординат 1g (/кр — t),
а по оси абсцисс 1g у (см. рис.).
t° lg V '8 ('кр-')
20,0 1,4606 2,7337
32,5 1,4362 2,7235
41,5 1,4163 2,7161
54,8 1,3853 2,7048
Наклон прямой = 2,60 = п;
1,3853 = 1g k + 2,60 (2,7048);
/г = 2,2 • IO-6; у=2,2 1O-6(561,5-/)2,60.
Жидкости и сжижение газов
257
V-2-8.
Построим график зависимости у (М/р)1''3 от темпера-
туры t (см. рис.).
t. °C V (М/рЛ' t, °C V (М/рЛ»
—20,3 378 20 294
-10 354 30 270
0,2 332 40 250
9,9 313 50 228
V-2-9.
Наклон прямой =2,27 =/г (в среднем получим 2,134,
однако данные имеют большой разброс и поэтому
точное построение графика затруднено).
Из уравнения
378 = 2,27 (/кр — 6 + 20,3)
/кр =152,2° С (в среднем 157,5).
а) Уравнение п2 = е выполняется, если е и п изме-
рены при одинаковой частоте. Однако е, а также п
изменяется с частотой; мы не можем надеяться, чтое,
измеренное при 104 или 106с-1, будет таким же, как
и п, измеренное при 5,10' 1014с-1. Наиболее важной
причиной зависимости е от частоты является то, что
полярные молекулы могут вытягиваться в линию при
приложении поля низкой частоты (Z ~ 1010с-1), в то
время как эффект ориентации не наблюдается при
высокой частоте. Сильное уменьшение е для о-С6Н4С12
при переходе от 106 к 10,4с_ 1 может быть приписано
такой потере ориентации. Для п-С6Н4С12, молекулы
которого неполярны и, таким образом, не имеют
ориентационного эффекта, зависимость гораздо слабее,
б) Дипольный момент лг-СеН4С12 промежуточен между
дипольным моментом орто- и пара-изомеров. Отноше-
ние е/п2 должно находиться между 1,24 и 3,10.
9 Зак, 1360
258
Глава V
V-2-10.
V-2-11.
(Экспериментальная величина е равна 5,04 в пределе
при частоте, стремящейся к нулю, и п, равном 1,5457;
следовательно, е/п2 —2,11.)
п ~ \' е = У2,647 = 1,63 (что согласуется с экспери-
ментом). Из симметрии молекулы CS2 можно заклю-
чить, что ее дипольный момент равен нулю. Поэтому
ориентационная поляризация, которая проявляется
только при относительно низких частотах (Z ~ 10,0с-1),
отсутствует и возникает поляризация только от иска-
жения молекул. Этот эффект почти не зависит от
частоты в видимой области, так что диэлектрическая
проницаемость в видимой или инфракрасной области
остается примерно такой же, как и при 9-105с-1.
Таким образом, возможно применение соотношения
Максвелла п? = е.
а) Полярные молекулы стремятся ориентироваться
так, чтобы их дипольный момент стал параллелен
электрическому полю. С повышением температуры
степень ориентации уменьшается, потому что при
тепловом движении молекулы стремятся к случайной
ориентации. Ориентация молекул вносит свой вклад
в поляризуемость вещества. Поэтому мольная поля-
ризация (фактически поляризуемость) уменьшается
с повышением температуры.
б) Мольная рефракция равна мольной поляризации,
измеренной при частоте видимого света. При такой
высокой частоте молекулы не могут переориентиро-
ваться, так как поле переменно по направлению,
и поэтому эффект ориентации не вносит вклада
в поляризуемость. Однако мольная поляризация изме-
ряется при низких частотах (обычно 106с-1); в этом
случае молекулы свободно могут переориентиро-
ваться в соответствии с частотой колебаний. Таким
образом, эффект ориентации существен в мольной
поляризации и не имеет значения в мольной реф-
ракции.
Глава VI
ТВЕРДЫЕ ТЕЛА
РАЗДЕЛ Vf-1
VI-1-1. Элементарная ячейка содержит 8 атомов •, а каждый
граничит с 8 элементарными ячейками, поэтому общее
число таких атомов, которые могут принадлежать
элементарной ячейке, равно 8 • */8= 1. Элементарная
ячейка содержит 2 атома О, каждый из которых
граничит с двумя элементарными ячейками, поэтому
общее число атомов О> которые могут принадлежать
элементарной ячейке, равно 2 • l/2 = 1.
VJ-1-2. Для того чтобы определить индекс Миллера, берут
обратную величину индекса Вайса. В данном случае
получим 2/1( 3/2, 0. Чтобы исключить дроби, умножим
эти величины на 2 и получим 4, 3, 0.
VI-1-3. Индексы Вайса —это пересечения плоскости 2, 1, 3.
Для получения индексов Миллера берут обратные
индексы Вайса, т. е. в данном случае ’/2, ’Д, 7з> и
умножают их на 6 для уничтожения дробей. В ре-
зультате получим 3, 6, 2.
VI-1-4. а) См. рисунок: О — К, е —Si, Для ясности грани
100,010 и 011 на рисунке не показаны. Атомы калия
находятся в углах и центрах граней. Атомы Si нахо-
дятся в центре ячейки и центрах ребер.
б) Близлежащие соседи К—Si находятся на расстоя-
нии 7,15/2 = 3,57 А.
в) Объем элементарной ячейки равен (7,15- 10~8)3 =
= 365 • 10-24 см3. Число элементарных ячеек на
1 г-моль KSiH3 = */4 • 6,023 1023. Объем, занимаемый
1 г-молем KSiH3= 74’6,023-1О23-З65- 10-24 = 54,9 см3.
Плотность кристалла =70,18/54,9= 1,28 г • см-3.
9’
260
Глава VI
VI-1-5. а) См. рисунок.
б) Молекулярный вес NaBH4 = 37,8
Число атомов Na в углах = 8 • % = 1
Число атомов Na в центрах граней = 6 •’/2 = 3
На элементарную ячейку приходится 4 атома Na
Число атомов В в центрах ребер = 12 ‘/4 = 3
Число атомов В в центре ячейки = 1-1 = 1
На элементарную ячейку приходится 4 атома В
Объем элементарной ячейки == (б, 15 • 10~8)3 =
= 233 КГ2'1 см3
Объем 1 г-моля элементарных ячеек =‘Д • 6,023 X
X Ю2!- (б,15 - 10-8)3 = 35,1 см*
Плотность кристалла 37,8/35,1 = 1,08 г см~3.
VI-1-6. а) Элементарная ячейка содержит один ион Cs~ и
один ион Вг~.
212,81 г-моль-1 _
4,44 г • см-3 • 6,023 • 1023 (эл. яч.)-моль-1
= 7,97- 10~23 см3 (эл. яч.)-1=е3; е = 1^79,7- Ю~24==
= 1,30 • 10~8 см = 4,30 А.
б) d200 = 4d'°o= ’ 4’30 = 2’15 А-
VI-1-7. а) Если ионы Г соприкасаются по ребру,
6 = 2-2,16 = 4,32 А.
Если ионы Cs+ и Г соприкасаются по диагонали
ячейки,
е /3 = 2 (1,69 + 2,16) = 7,70 А; е = 4,44 А.
Последнее (большее) число должно быть исправлено
Твердые тела
261
(экспериментальное значение е~ 4,562 А при 25° С):
е3 = 4,443 = 87,5 А3 = 8,75 10-23 см3,
б) Плотность =
___________________259,8 г» мол,ь~1_______ _______
6,023 • 1023 (эл. яч.) • моль-1 • 8,75 • 10-23 см3 (эл. яч.)-1
= 4,93 г • см-3
(экспериментальная величина равна 4,510 г • см-3).
VI-1-8. dfoo — объем элементарной ячейки; молекулярный
вес 65,11.
,з _______________ (65,11/1,52) см3-моль-1 _
100 6,023 • 1023 • /< (эл. яч.)-моль~‘
= 284 • 10~24 см3 • моль-1;
d100 = 1^284- 10-24 = 6,57 10-8 см = 6,57 А.
VI-1-9. Элементарная ячейка содержит 4 атома Ag (*/8 • 8+
+ 7г -6 = 4). Ближайший соседний атом обозначен на
рисунке. Из рисунка можно видеть, что 2,87 А —
= 7г- /2 • dIW), поэтому d100 = 2,87/0,707 = 4,06 А.
V = '/4 • 6,023 • 1023 • (4,06 • 10-8)3 =
= 10,08 см3 • (г-атом)-1.
VI-1-10. Объем, занимаемый 1 молем комплекса, равен
7=7,96-8,34- 11,7 (10-8)3 • • 102! = 117 см3.
Масса 1 моля комплекса М = 285 г; плотность =
= M/V = 2,44 г • см-3 (экспериментальное значение
2,4 г • см-3).
VI-1-11. Объем, занимаемый 1 молем ЫВН4, равен
V = */4 • 6,81 4,43 • 7,17 • (10-8)3 • 6,023 • 1023 = 32,6 см3.
262
Глава VI
Масса 1 моля М — 21,76 г; плотность = М/V =
= 0,668 г • см-3.
VI-1-12. Объем одной молекулы — 12,05 • 15,05 • 2,69 = 488
А3-(эл. яч.)-1=244 А3*молек-|=2,44* 10" 22см3* молек
Молекулярный вес = 1,419 г • см-3 • 2,44 • 10-22
см3* молек-1 *6,023* 1023 молек*моль-1 = 209 г - моль-1.
РАЗДЕЛ VI-2
VI-2-1. п („порядок" х-лучей) — число длин волн х-лучей,
укладывающихся между данными атомными плоско-
стями.
VI-2-2. е sin2 0 _ sin2 0/sln (4°40z) ft2+fe2+r hkl
5°23' 0,00881 1,33 = 4/3 4 220
10°5Г 0,03545 5,35 = 16/3 16 400
4°47' 0,00696 1,05 = 3/3 3 111
4°40' 0,00662 1 =3/3 3 111 .
VI-2-3.
Рассчитанные значения hkl все нечетные или все
четные. Следовательно, структура является кубиче-
ской гранецентрированной. Действительно, струк-
тура NaCl включает две взаимопроникающие, гране-
цептрированные кубические решетки. В общем случае
для простой кубической решетки возможны любые
значения h, k, I; для гранецентрированной кубиче-
ской h, k, I все четные или нечетные, включая
нуль; для объемноцентрированной кубической решетки
сумма h + k + I должна быть четной.
Rb+ и Вг~ имеют одинаковое число электронов [36].
Таким образом, они практически эквивалентны при
расчете отражения х-лучей. Кристалл RbBr обра-
зует простой куб, если два рода ионов считать иден-
тичными. В других трех кристаллах два вида ионов
имеют различное число электронов. Каждый вид ионов
занимает гранецентрированную кубическую решетку.
х-Лучи „видят" каждый из этих двух видов решеток
(которые имеют идентичные размеры), и в результате
получается дифракционная картина, характеризующая
гранецентрированную решетку, с различной интен-
сивностью, которая является результатом интерфе-
ренции между отражениями двух решеток. (Для RbBr
эффект такой интерференции дает картину, тожде-
ственную интерференции в случае простой кубической
решетки.)
Твердые тела
263
VI-2-4.
VI-2-5.
VI-2-6.
VI-2-7.
V1-2-8.
Любая ось симметрии должна быть перпендикулярна
к точкам на плоскости решетки. Общая плоскость,
образуемая всеми смежными сериями соответствующих
точек решетки, должна составить вместе правильный
многоугольник. Это возможно только тогда, когда
ось симметрии имеет порядок 3,4 или 6.
Ось симметрии второго порядка (от середины линии ab
до середины линии cd) и четыре оси третьего порядка
(от каждой вершины к средней точке противополож-
ной грани).
Ось 4 (неправильная ось четвертого порядка, ось
вращательной инверсии четвертого порядка) от сред-
ней точки ab до средней точки gh. Ось второго
порядка (собственная ось второго порядка) от средней
точки ab до средней точки gh. Плоскость симметрии,
проходящая через линию ab и середину линии gh, и
плоскость симметрии, проходящая через линию gh
и среднюю точку линии ab.
Три: ab, cd и ef [согласно рисунку (стр. 58)]. Диаго-
наль, проведенная через скошенный угол, не прини-
мается во внимание.
Как можно видеть
двойной оси из ]1| в ]2| можно представить себе
инверсией |2| через точку, показанную на оси 2,
дающей 13| • [з], является зеркальным отражением |2|
в плоскости
бражения.
г
на рисунке, вращение вокруг
пг,
перпендикулярной плоскости изо-
П1
VI-2-9. а). См. рисунок. Подходящая элементарная ячейка —
ABCD.
264
Глава VI
б) Пусть г — радиус круга. Элементарная ячейка,
показанная на рисунке, состоит из двух равносторон-
них треугольников АВС и BCD, каждый со сторо-
ной 2г и s = 3r; площадь элементарной ячейки равна
2 (Зг • г3)7’ = 2г2 / 3.
Элементарная ячейка содержит 7б + 7з + 7б + 7з ==
= 1 круг с площадью яг2. Тогда доля площади пустот
равна
V1-2-10.
-2Т21-<3 яг2 = 0,093.
2г2 У 3
а) АХ AY
-^ = 7? 1 0,5
г>
AZ
0,33
Для АХ R > |73 — 1 =0,732 и поэтому, вероятно,
АХ имеет структуру CsCl. Для AY 0,732 > R > 0,414=
= ^2 — 1, его структура соответствует NaCl.
AZ с R< 0,414, возможно, имеет структуру с еще
меньшим координационным числом, чтобы допустить
связь неодинаковых ионов, но из структур CsCl
и NaCl мы должны выбрать последнюю. Аналогич-
ное положение наблюдается у LiCl, LiBr и Lil; все
эти кристаллы имеют структуру NaCl с соприкасаю-
щимися отрицательными ионами.
б) Пусть I — ребро элементарной ячейки.
АХ. Диагональ ячейки — I уг3=2г+ + 2г_=4; /=2,31;
У = Р = 12,3.
AY. / = 2r++ 2r_ = 2 + 4 = 6; У = 216.
AZ. Здесь отрицательные ионы соприкасаются вдоль
диагонали. _
Диагональ грани = 1 ]/2 = 4г_=12; /=8,48; У =609,8.
РАЗДЕЛ VI-3
VI-3-1. а) CsCl. Рассмотрим ионы С1 , находящиеся в углах
элементарной ячейки, и ион Cs+ в центре ячейки.
Элементарная ячейка содержит lCs+ + 8/80 . Если
ионы С1 соприкасаются по ребру, то ребро будет
иметь длину 1,81 + 1,81 =3,62Д. Если ионы Cs+и СГ
соприкасаются по диагонали ячейки, то диагональ
равна 1,81+2 • 1,69+1,81=7,00 А, а ребро 7,00/|АЗ =
= 4,04 А. Большее из этих чисел должно быть пра-
вильным: е = 4,04А. Объем элементарной ячейки =
= е3 = 65,9А3. Объем ионов = 4/3л (1,813 + 1,-693) =
Твердые тела
265
= 45,1 Л3. Доля объема пустот = (65,9—45,1)/65,9 =
= 0,316.
б) NaCl. Элементарная ячейка содержит 4Na++ 4СГ.
Если Na+ и CI соприкасаются по ребру, то ребро
равно 2 (0,95 + 1,8) = 5,52 А. Если ионы СГ сопри'
касаются по диагонали грани, то эта диагональ
равна 4 • 1,81 = 7,24 Л, а ребро — 7,24/^2 =5,12 А.
Если Na+ и С1 соприкасаются по диагонали ячейки,
эта диагональ равна 2(0,95 + 1,8) = 5,52 Л, а ребро—
5,52/у^ = 3,19 А. Только большая из этих цифр
должна быть правильна: е = 5,52А; е3 = 168 А3. Объем
ионов = 4 • 4/зЯ (0,953 + 1,813) = 114 А. Доля объема
пустот = (168-114)/168 = 0,32.
в) LiCl. Соприкосновение по ребру: е=2 (0,60+1,81) =
= 4,82 А.
Соприкосновение по диагонали грани: е=4> 1,81/1^2 =
= 5,12 А.
Соприкосновение по диагонали ячейки: е = 4,82/^3 =
= 2,78 А.
Правильное значение: е = 5,12 А; е3=134А3.
Объем ионов = 4 • 4/Зл (0,603 + 1,813) = 103 А3.
Доля объема пустот = (134 — 103)/134 = 0,23.
Глава VII
РАСТВОРЫ
РАЗДЕЛ VII-1
VII-1-1. В очень разбавленном растворе -молекулы раствори-
теля обычно находятся рядом с другими молекулами
растворителя. Энергия, которая им необходима для
испарения с поверхности раствора, практически равна
энергии испарения с поверхности чистого раствори-
теля. Давление пара растворителя над раствором
меньше, чем над чистым растворителем, не только
потому, что каждая молекула в растворе сильнее
удерживается, но в основном потому, что в поверх-
ностной пленке находится меньше молекул раствори-
теля. Число молекул растворителя меньше в отно-
шении Ад (мольная доля растворителя), и давление
пара меньше в том же отношении: Рд/Рд = Хд1 (закон
Рауля).
VH-1-2. М2-^-дт^Г=40’27 • 27,6-0,0961 = 177‘
В статье Розенберга и Ушаковой найдено, что
Л42= 173. Величина, полученная из атомных весов,
равна 178.
V11-1-3. т = = =0,00309=кажущаяся моляльность.
Af 5,085 J
Моляльность, определенная из
тт „ молекулярного веса
Число ассоциации =---------Наблюдаемая моляльно^ь-----=
0,07734
0,00309'
25,0.
V11-1-4. Если 1,4020 г антрацена были бы растворены
в 100 г CS2, то температура кипения повысилась бы
на 0,220-(86,52)/100 = 0,190° С. Пусть х — число молей
1ПП r-е -г 23,7° С 0,190° С
антрацена в 100 г CS2. Тогда и
г 1 1 моль х молей
х = 0,00802 моля. Поскольку 1,4020 г = 0,00802 моля,
то 1 моль антрацена — 1,4020/0,00802 = 175 г. Сле-
довательно, молекулярный вес антрацена равен
175 г • моль-1. Рассчитанный из атомных весов моле-
кулярный вес равен 178-
Растворы
267 -
V1I-1-5. Примем, что Vi — мольный объем чистого раство- рителя А; ЮОг-моль-1 "1 =—гбк =т~ = ЮО мл • моль 1 1,00 г • мл-1 — v л71 0,50 атм ♦ 100 мл • моль-1 п »л-з Тогда л о = —=- = j = 2,03 • 10 . RT 82,06 мл • атм • °К • 300 °К Пусть М2 — молекулярный вес В, тогда Y 10/М2 _ 1 . Л2 10ЛИ2+ 1000/100 1 + М2 ’ М2 = -4 1 = 492 г • моль-1. 2 Х2
Vll-1-6. Vll-1-7. — 10'27 _ 1 QO Y 0,0250-213 ’yi5. Число молей О2, растворенных в 1 л воды, равно 0,0?02927:0’21 =0,000290.
V1I-1-8. 273,2 2,265 _ л лло од “ 303,2 244,0 °>°°836.
Vll-1-9. . а2 АН / Тг — \ lg aj 2,3037? \ Т,Т2 J’ . 0,04889 _ Aff / 283,2 — 273,2 \ # g 0,03802 2,303 • 1,987 \ 283,2 • 273,2 ) ’ AH = 3870 кал • (моль O2)-1.
VI1-1-10. a) a = 4r = 0,920. 6) V,- J; -0.920/(25i23/^«'e/1|24]) = 0.9S9. РАЗДЕЛ VI1-2
Vll-2-1. Pa — Pa = X aP\. 100,00 - 95,00 = XB. 100,00; = 0,0500. У wb/mb J . в wa/ma + wb/mb (mbwa/mawb)+' ’ ЛТпШд 1 . . Л4п = - 1 = 19,0; -/= 19,o—=1,90. MAK>B . ma wa
VI1-2-2. AP /[ nNa. \ I £2 1 = 0,48; 0,52; 0,54; 0,53; 0,55 соответ- P°/ \ nNa +«NHs/ ственно. При предположении, что растворенное сое- динение недиссоциировано, число молей соединения, образовавшегося на 1 моль использованного Na, равно отношению (понижение давления насыщенного
268
Глава VII
пара)/(мольная доля Na) ~ l/2. Другими словами, на 1 молекулу приходится два атома Na и, следовательно, правильной формулой будет Na2Tex, а не NaTex.
Vll-2-3. dP _ A// dT _ _ 6997 dT 63,68 dT _ 0,1586 dT . P RT2 RT2 1 RT R ’ 1 P — 6997 1 1 1 \i 63,68. T 0,1586, 1П P° R \ T To ) 1 R П To R '<>)> In (1 - X2) = 3521 + 73,8 lg -f- - 0,0798 (T- Го); X2 ~ 3521 - 73,8 Ig^J- + 0,0798 (T - To). 1 ol I 0
V1I-2-4. y2 — a-\-bm\ dV2=bdm-, «j dVi + n2 dV2 = 0; n.\ — —молекулярный вес растворителя); n2 — пт, Л/ _ «2 лт/ — mMibdm . dl/1~ я, dVi— 1000 ’ V1 — —M2qqq " + С (С — постоянная интегрирования). Когда m — 0, Vi — Vi — С (V) — мольный объем чи- стого растворителя); Vi = V’i 2000 .
VI1-2-5. Молекулярный вес С2Н5ОН равен 46,07; молекуляр- ный вес Н2О равен 18,02. Мольные доли: у 40,0/46,07 ~ 907 • Лс,н5он 40,0/46,07 + 60,0/18,02 ’ ’ у 60,0/18,02 _ п „„о Л Нг0 60,0/18,02 + 40,0/46,07 ’ * Активности: с н он 20,7 асдьоп = = — = 0,475; РСгН5ОН 43’6 РНо 14-7 пн!0 = -^ = — = 0,840. РН,0 17>5 Коэффициенты активности: _ аС2Н5ОН _ °'475 9 оП. Yc2h5oh xCH01I o,2O7 аП2О °’840 , nR унго X 0,793 ,06‘ rijU
Растворы
269
VI1-2-6.
V1I-2-7.
VI1-2-8.
Пусть спирт — компонент 2. Его мольная доля в ра-
створе В равна
у в 83,2/74,12 _____,, едс
Л2 ~ 83,2/74,12+ 16,8/18,02 — ’
Если принять, что летучесть спирта в этом растворе
определяется законом Рауля (грубое приближение
для раствора, содержащего около половины другого
компонента в мольных долях), то тогда активность
а2 = %2 — 0,546. Для двух растворов при равновесии
и при условии, что активности определены через
то же стандартное состояние (чистый спирт),
аА = дв = о,546.
а) цА = Нт (нА — RT In г/А) =
б) НА==НА + ^7’>пйА = НА + /?7,1паЛ; ЬА = аА.
в) _ 6а Хл . *а . . Уа/^л =
Ya’ У а “а Уа (МЛ1л + Ув/Мв)
__________1______
~ Уа + Увма/ми ’
г) у(х) = 1 для идеального раствора;
v<^)=________!_______ =______™.
0,50 + О,5О/ИЛ/Л4В 1 + Л4л/Л4п
Определим стандартные химические потенциалы:
Хг = lim (ц2 — RT 1п Х2);
х,-> 1
р’==11т(н2 — /?Т1п уХ
Когда X] —> 1, //]—>1; следовательно, предел соот-
ветствует тому же состоянию бесконечного разбав-
ления.
ц2 = Х° + RT In а2 — Pj + RT In Ь2;
RT In = 7v°—ц2 ==j'm (н2~RR In Х2—y.2+RT In у2)=
— lim (RT 1п-^-) = RT In him -^-1.
X,-> 1 \ A2 / +,->! Л2 /
270
Глава VII
Используя молекулярный вес М и число молей п, получим: X — Пг — - ”2^2 2 «1 + «2 ’ П1Л1] + Я2М2 ’ Уг _ п2м2 (и, + Яг) _ м2 (1 + И2М1) . Х2 «2 («1 + П2М2) + (п2/«1) Л42’ 1 • У 2 М 2 11ГП -V1 = -тг-. Х,->1 Afi
VI1-2-9. Пусть п — число молей, 'М — молекулярный вес, с — молярность и V — объем, выраженный в литрах, тогда я2 у titMi + riiMz г 1000ря2 2 V’ 1000р г-л-1 n1M1+n2Af2 1000и2 . с2 риМ р . П\М\ ’ М2 П\М} -|- ^2^2 1 + п2М2/п\М\ ’ а2 = |ifn = Pq. V2 ачтч _Ро_Л _|_ . а2 пг-^0\т2) ’ у2 с2а2 р ‘ Выберем «1 так, чтобы — 1000 г. Тогда п2 — т2 и __ Ро / 1 тгМ2 \. у2 р \ Ю00 /
VII-2-10. 1пу2=ЛХ2; dlny2 = 2AX2dX2 = -2A(l -X^dX^, d In у, - - ф- d In y2 = - 1^- [-2A (1 - X,) dX^ Л1 Л1 = -2A (^-2 + X^dXr, 1пу[ = 2Д j — 2 + X;) dXi — i Г 1 21X' = 2Л[1пХ1-2Х1+yX?Ji = = 2A [lnX1-2(X1- 1) + |(X?- 1)]. 1)(X,- 1)==(2-X2)(-X2) = = - 2X2 + X2\ In Yi — 2Л pn (1 — X2) + X2 + у X2].
VIJ-2-11. Давление на глубине 30 м равно 30-100 см. 1г.с^ = 2)90 атм. 1033,7 г-см 2-атм
Растворы
271
Водолаз переходит от 2,90 атм к 1 атм, т. е. раз-
ность давлений составляет 2,90—1,00= 1,90 атм.
= 5 (аНе А/’11е + аОг АРО!) =
=5(0,00861 0,80- 1,90+0,02831 • 0,20 • 1,9)=0,119 л =
= 119 мл при 0°С; 119--^-=130 мл при 25° С. ‘
V11-2-12.
t, °C 30 40 50 100
a 0,665 0,530 0,436
Iga —0,177 -0,276 -0,361
7, °K 303,2 313,2 323,2 373,2
1/7, °K-1 0,00330 0,00319 0,00309 0,00268
Построим график зависимости 1g а от 1/Г (см. рисунок).
При 100°С lga = —0,700 (из графика); a = 0,200.
Число молей СО2 = 0,03 --^- = 0,00027 моля
на 1 л Н2О.
VII-2-13. (См. рисунок в задаче).
А// = АЙг1п1 + ДЛ2п2=—15 300 = —192- 10 +Atf2- 1;
АЯ2 = —13 380 кал.
V11-2-14.
= 9; n2 = 1.
А// = 2,00 (9)'/2 + 3,00(9)’/! + 4,00(9)/: = 1059 кал.
A#i = т п = 1/2 • 2,00пГ‘/! + 3/2 • 3,00и? +
+ 5/2 • 4,OOn? = 1,00 (9)~'/! + 4,50 (9)‘/г +
+ 10,00(9)’л = 284 кал моль-1.
п2А//2 = А Я — п, AZ/f,
272
Глава VII
1 • Д//2 = 1059 — 9 (284) = —1497;
Д//2=—1497 кал-моль-1.
VII-2-15. Число молей Н2О/1 моль NaCl = 889; 280; 139; 73,9;
55,2; 28,5; 17,9; 13,9; 11,1; 9,25 соответственно. По-
строим график зависимости ДТ/ от отношения числа
молей Н2О к 1 молю NaCl (см. рисунок). Проведем
плавную кривую через данные точки.
Число молей Нг0/число молей NaCl
Исходная концентрация раствора=(90/18,0)/(10/58,5)=
=29,2 моля Н2О на 1 моль NaCl. При этой концен-
трации Д7/ = 1195 кал моль-1 (из графика). Конеч-
ная концентрация раствора = (216/18,0)/(10/58,5) —
= 70,3 моля Н2О на 1 моль NaCl. При этой концен-
трации
\Н = 1518 кал • моль-1 (из графика).
Д(Д/7) = ~(1518 - 1195) = 55,2 кал.
V11-2-16. а) Исходный состав раствора = 6 молей Н2О на 1 моль
H2SO4, а состав конечного раствора = 10 молей Н2О
на 1 моль H2SO4.
Д 77 = 16240 — ( — 14740) = 1500 кал.
б) (3 моля Н2О)/(6 молей H2SO4) = 0,5 моля Н2О на
1 моль H2SO4.
Д//] = —6740 кал • моль-1;
Д//2=—438 кал • моль-1;
\Н = Д/Л/г, + Д/72ц2 = —6740 • 3 — 438 • 6 =
= —22848 кал.
Vll-2-17. a) 1g -^ = (у- — , где s — растворимость.
Используя третье и пятое значения s и Т, найдем,
Растворы
273
что Д/7 == 9990 кал • моль'1. Можно построить также
график зависимости lgs от 1/Т и получить из
наклона прямой.
б) Индекс указывает, что исходные вещества и
продукты реакции находятся в соответствующих
стандартных состояниях. Для растворителя стандарт-
ным состоянием является чистое вещество; для ра-
створенного вещества — гипотетическое состояние бе-
сконечного разбавления (более точно для растворен-
ного вещества Н° = lim Н, предел при концентрации,
равной нулю).
VII-2-18. Хи,о = 4|£ =0,031;
Х11г= 1 - Л’НгО = 0,969; 0,969«общ = «цг = 1,500;
Нобт= 1,548; «11,0 = ^11,0 • «Общ = 0,031 • 1,548 = 0,048.
АД = 0,048 582,2 • 18,01 =0,50 ккал.
Экспериментальная величина АД равна 0,4 ккал.
РАЗДЕЛ VII-3
VII-3-1.
И Д О М Г> _
а) /’а = 7Г~^Ра; /’в = ^г-Рв.
«А-Г «в /гл + '!В
б) А/Д = «а АДл + «в АДц; АД2 = АД3 = 0;
А Д4 = — («л АД л + «в АД в); АДобщ — 0.
AG] — = AG4 = 0;
АСобш ~ AG2 ~ In ~o~ “р «В In —5- J =
\ Pi\ PR /
(ti, nn \
П\ In -:---1- «в In-T--I .
«л + ^в «л + «в /
Л/7 rt — AG , / Пк
в) AS = _o6!L------_^1Пл1п------^—+
Т \ «А + «В
-|- «В In -—- ).
«л + "в /
AS одинаково для процессов смешения независимо
от того, происходит ли смешение обычным, необра-
тимым путем (простое смешение) или обратимо,
как описано в пункте (б).
г) Результат должен быть тем же, потому что исход-
ное и конечное состояния будут одинаковыми: две
чистых жидкости и идеальный раствор. А5обШ не бу-
дет изменяться, если процесс в системе (б) будет
проходить через неидеальное вместо идеального ис-
парения, хотя, конечно, AS будет меняться в каждой
отдельной стадии,
274
Глава VII
VI1-3-2.
а)7=1±^; а° = Д_;
P Pl
i /.. \ i i/i i \ i
?2 — — -• I--F 1) —5— = — I-----г1+—;
ffi'2 p \w2 / P,t02 w2 \p pt / p
дФ2 _(1 1 \ / 1 \ 1 <?p / 1
, ° 11 2 I 2 -> I + 1 b
<7^2 \P Pl / \ w2 / P ^2\w2 /
6) V^w^ + vt, v2 = -^ = t2+w2^.
Здесь p — 1,1263 г • мл-1, р/ = 0,9982 г • мл-1 и w2 — 1.
<?р Ар 1,1263 -1,1236 п псп
-т-^- = -Н—= 0,069 г • мл
dw2 Д®2 1—(49/51)
Тогда
</>2 = 0,774 мл'Г-1; -^- = 0,0099 мл • г-1;
'1 dw2
ц2 = 0,774 + 0,0099 = 0,784 мл • г-1.
Vll-3-3.
а) У — Т~ ^2n2 .
; — р
г2=т
\ дп2 /П1 Р
(М,„| + МЛ) +Д+
\ у* _____ tT'i ф / дХ2 \ ___________ Tij *
' 2— п, + п2 ’ \ дп2 + — (п, + п2)2 ’
др \ _ dp (дХг \ П] dp
дп2 /п dX2 \ дп2 )п (ni + п2у dX2 ’
- + -(.-и,х, + ад + .А.
в) Дифференцируя, получаем уравнение для р:
-^-= -0,28930 + 0,59814Х2 - 1,82628X1 +
О Л. 2
+ 2,37752Х2- 1,02905X1
Когда Х = 0,100, р = 0,97061 г • мл-1 и др/дХ2 =
= — 0,24547 г • мл-1.
Подставим эти значения и = 18,016 г • моль-1,
М2=- 32,043 г-моль-1, X] = 0,900 в уравнение, полу-
ченное в пункте (б):
V2 = 37,56 мл • моль-1.
Растворы
275
Vll-3-4.
117,8
------------= 0,782;
0,5143-293,1
135,0
y, == —= ------------------= 0,802.
A XAPA 0,4857 • 344,5
PC 9’2
6> fec=='y7== W588 = 156 MM PT- CT-
Используем Pc и Xc для более разбавленных рас-
творов, для
k
YC = = 156 - 0,5143 = 1,468 •
Рс
а) Ус==ТУ
ЛС?С
РА
которых имеются данные.
13,0
= 07)825 = 158 мм РТ- СТ-
117,8
V1I-3-5.
г)^
Yc
Ya
PCXC Pc
PC kC
344,5
-^- = 2,18.
loo
293,1
-^^=1,88;
100
Ра
Ya kb
Это отношение не зависит
д) AG = 0,5143ис + 0,4857цд - (0,5143цс+0,4857рд) =
= 0,5143 (рс - ц’) + 0,4857 (рА- Ц°А)==0,5143RT In ас+
+ 0,4857 RT In aA = RT [0,5143 In (усХс) +
+ 0,4857 In (удХд)] = 2,3037?Г [0,5143 lg (0,782 • 0,5143)+
+ 0,4857 lg (0,802 • 0,4857)] = 2,303 • 1,987 • 308,32 X
X (—0,4026) =—568 кал.
G = паН1 + «X + RT (nA In Хд + nB In XB) + •
/ dG \
a) HA = kr- =иА + /гТ1пХА +
\ А/„в> 7-, p
от состава раствора.
+ RT \п
в
~(пл + пв) ПВ~"А«В
+ RT 1
nB \ | CnB
«A + «В «a + «bR (/1a + /1b)2
«А
О
= |Гд + Я7’1пХд + СХ2в.
б) РА = и1 + ЯПпаА = рА + ЯПпХд4-ЯПпуА.
276
Глава V/1
При сравнении выражений для цЛ получаем:
/?Г1пуЛ = СХ2; уА = еСХ^1КТ^1,
где Хв = 0 (чиетое вещество /1). С другой стороны,
можно потребовать, чтобы уА -> 1 при An-> 1 (беско-
нечно разбавленный раствор веществ А и В). Тогда
= lim (иА - RT In Ад)= lim (ц° + С№в) = ц°+С;
Ид = и°д' + /?Г In ХА + С(ГВ - 1) = Hl + RT In Хд +
+ /?Т1п уд;
с(хв - О
In у' —--------= 0, если Ав = 1.
КI
VII-3-6.
а) Пусть у2 — а2/пг. Допустим, что
пх = 1000/М,;
nxd In Gj = — md In a2 = — md In (y2m) =
= — tn (—3/2km/2 + dm — fykm1' — 1) dm.
lnXI = -ln(l + — V, n,dlnX,= n}d-\ ах=ухКх.
1 \ «1 / 1 + tn 1 H 1
nxd In Yj = Hjdln (Yi^i) ” njdln =
= (3fem»/8_1\</m+_n^L =
\ 2 ) 1 nt + m
= (---------1- km‘/!) dm.
\ n, + zn 1 2 /
Проводя интегрирование от tn — 0 (у; = 1) до m = m,
получим
। , , п, + m . 3 , 5/,
пх In Y1 — — m + пх In -!-Р — km/2;
11 1 и, 5
, тМх . /,
In Vi — 1000 + In ^1 +
тМх \ 3Mxkmfl
1000 ) “г 5000
б) Разлагая в ряд In (1 +mM|/1000)
первыми двумя членами, получим
Vl 1000 ~ 1000 2 ( 1000 /
о
.. /1пУ|'1 М21
im ( W2 / ~2- 106 ’ п==2-
Для п у£= 2 предел равен нулю или
и ограничиваясь
3Mktn,‘
5000
— оо.
Растворы
277
Vll-3-7. •)*-' 3,92X2; dlnV! Xj^lny, + X2dln y2 = 0 для коэффициентов актив- ности, отнесенных к мольным долям. lnY1 J х, <Лпу2 3’92 f (1-x2)(i-з,92Х2) Хг=0 0 _ 3,92 Г2/ -х2 , 3,92Х2 \ _ 2,92 J \ 1 - X, 1 1 - 3,92Х2 / 2 = |||{-1 + Х2+1п(1 -х2) + + ^2 [! — 3.92Х2 — 1п(1 — Э,92Х2)] = = [3,92 In (1 - Х2) - In (1 - 3,92Х2)[. б) lny1 = ln[l—(1— Yi)l « — (1 — у,), если | 1— у, |< 1, т. е. в достаточно разбавленном растворе. In(1 -Х2)~ -X2-±Xh . при х2 <1; In (1 - 3,92Х2) « - 3,92Х2 - ± (3,92Х2)2 1 -Y1 « - In у, « - [-3,92Х2 -1.3,92Х2 + + 3,92Х2 + |(3,92Х2)2] - 3>92 , 1 । о qn\ у2 3,92 у2 2-2,92 ( 1 + 3,92) Л2— 2 ^2‘
V1I-3-8. a) n,dlna, + n2dlna2 — 0; 1пу2 = Лтр; tiid In Yj + n.\d In Xx + tnd In y2 + md In m = 0; d In y2 = Aptnp~1 dm', In Xi = In tii — In (tii + m); dlnX, = 1 nt + m md\nm — dm. Следовательно, njdlnyj—+ Apmp dm + dm = 0; d In yj = [— -ApnP +--1 dm-, 11 L w n\ J
278
Глава VII
т
lnY1= jdlnY1=ln^±^-^-(-^- + m),
/n=ssO
tn
если интеграл | тр dm существует и равен тр~^/(р-[-1),
о
т
б) Интеграл J mpdm существует только если р > —1.
о
Выражение для In Y1 можно вычислить, используя
это предположение.
V1I-3-9. а) ц° — lim (цв — /?Т1п Х|) = р’.
Хв-»1
Так как раствор является идеальным, то Нв~ Р-в +
+ RT 1п Хв=р.в+/?Г 1п Хв. Активность определяется из
выражения цв = цв + /?Т1пав, следовательно, ав—Хв.
ав 1 .. ,
Тв ТГ х2 х ’ х'тУв ’
л в Лв Лв *в-»1
что и требовалось. Однако существует затруднение,
состоящее в том, что ув в пределе для чистого А при-
ближается к бесконечности.
б) ц° = 1 irn (цв — RT In = lim (цв — 2RT In Хв);
Хв-»о хВ-»°
Нв = (н’в + %Т 1п *в); Нв = lim (ц* — RT In Хв) = оо.
хв-»°
Предела не существует, и такое выражение для
определения активности не может быть использовано.
Попытка его использования может привести к сле-
дующему;
Нв = ^в + ^7’1пав5 ^^1пав = цв —цв = —°°;
On
ав = 0; Yb = —5- = 0,
D 15 V* —
Лв
за исключением Хв = 0. Это выражение для актив-
ности было бы подходящим, если бы В диссоцииро-
вало на 2Bi/2 при бесконечном разбавлении (как
электролит). В таком случае, конечно, раствор не
был бы идеальным в отношении Хв-
Глава VIII
СВОБОДНАЯ ЭНЕРГИЯ И ХИМИЧЕСКОЕ РАВНОВЕСИЕ
РАЗДЕЛ VIП-1
V1I1-1-1. AG°= — RTlnK-,
AG° 1 А0° . ,. „ 1 WAG°\.
ln/< RT R Г ’ R^\ Т )’
, AG° _ bH°dT, 1 (-L\H°dT\_bH°dT.
и. p2 » ОИП/\ I y,2 I RJ,2 >
f , i „ f A//° dT . „ A/7° ,
J din К = J—In к =-----------J^-A-C.
VI1M-2. 1) Пар — идеальный газ;
2) A//nap не зависит от температуры;
3) объем жидкости незначителен по сравнению
с объемом пара;
4) система находится в равновесии.
Vlll-1-3. a) AG < 0, следовательно, реакция самопроизвольная,
б) Нет.
в) „Самопроизвольный" в термодинамике означает
„не невозможный". С точки зрения термодинамики
нет оснований считать, что С2Н4 не может разла-
гаться при 25° С. По некоторым сверхтермодинами-
ческим основаниям (например, высокая энергия акти-
вации) скорость реакции по существу равна нулю.
V1H-1-4. Число молей Na (г) = ~^- = 3,103;
число молей Na2(r) = = 0,624;
общее число молей =3,103 -1- 0,624 = 3,727;
мольная доля Na (г) = = 0,832;
0 624
мольная доль Na2(r) =-уууу = 0,167;
VI11-1-5. а) Поскольку /<₽ = Рвп/Рвп., постоянна при постоян-
ной температуре, то 1g/<р = 1g (Рви) — -у IgUbn.)™
== con§t. Это уравнение — уравнение прямой линии.
280
Глава VIII
6) 0 = d(const) = d (lg PBII) — - d (lg Pbii3); dy 1 о dx ‘/з Физический смысл наклона: отношение коэффициен- тов в химическом уравнении. AG°
V11I-1-6. Mg + С12 + 6Н2 + ЗО2-» -»MgCI2-6H2O —505 410 6Н2О->6Н2+ЗО2 -6 (-56 693) = + 340 158 2СГ (aq) -> С12 + 2е~ — 2 (—31 340) = + 62 680 MgCl2 • 6Н2О + aq-» ->Mg++(aq) + + 2Cl~(aq) + 6Н2О -6180 Mg-»Mg++(aq) + 2е~ — 108 752 кал • (г-ион)-1 По данным оригинальной статьи AG° =—108 760 кал - (г-ион)-1.
Vlll-1-7. AG° = 29 760 - 3 (50 000) = — 120 240 кал; |р-/Т = AG° = —(—120 240) gg 2- iz _ о . 1 n88 lgA 2,303/?Г 2,303-1,987-298,2 ’ ’ Л z • Поскольку константа равновесия так велика, процесс может быть использован для получения бензола.
Vlll-1-8. N2O4#2NO2 (1—а) 2а (число молей при равновесии) Общее число молей при равновесии равно 1+<х, тогда „ _ [2<х/(1 4- а)]2-12 _ а 174. К [(1 — а)/(1+'а)] • 1 °’174’ т-^т = 0,174; а = 0,204. 1 — а2 ’ Мольная доля N2O4 = ANj0< = = 0,661; 2а мольная доля Ь10г = Ano, = = 0,339; кажущийся молекулярный вес = Mn2o< • An,o4 + Mno,X X Ano, = 92,0 • 0,661 +46,0 -0,339 = 76,5.
VlIl-1-9. Fe3O4 + CO++FeO + CO2 l—у 2—у 0,5+3^ 0,3-f-^ (число молей при равновесии»
Свободная энергия и химическое равновесие
281
Общее число молей газа равно 2,3.
Рсо = йу/- -5 атм; РСо. 0,3 + у к = —• 3 атм; 4,0
рсо, (0,3 + z/)/2,3 = 1,15; // = 0,93.
кР = рсо (2 - z/)/2,3
Число молей СО2 при равновесии = 0,3 + // = 1,23
Число молей СО при равновесии = 2 — у = 1,07
Число молей Fe3O4 при равновесии =1 — у = 0,07
Число молей FeO при равновесии = 0,5 + Зу = 3,29
— 46,5
V11H-10. a) AG29S = 46,5 ккал;
< TS -- \G° ---I1',-' п Л 1
1g К п =----------=------------------Zq---------= — 34,1;
р 2,303/?/' 2,303- 1,987- 10 3 • 298,15 ’
КР = 8 • Ю“35.
б) А//298 = 55,5 ккал;
Г,
2-ТО .
1g Ктг 1g Кт, + 2,303/?
~lgAT,+ 2,303/?Т,Г2 ’
ел ____ ол 1 । 55,5* 100
1g гСзэз-----34,1 -|-------------------о--------------
& 2,303- 1,987- 10~3- 298,15 -398,15
= —34,1 + 10,2 = -23,9;
/<398 = 1.3- Ю"24.
в) Сделано предположение, что А//° не зависит
от температуры в интервале 25—125 °C и, следова-
тельно, может быть вынесено за знак интеграла и
равно его значению при 25° С. Равноценно можно
предположить, что АСр 0 или, более точно, что
398
j \CpdT < ЫГ.
298
V1I1-1-11. = =
ОУо 2Уо j л 2
298
~ 298 + 44,14 ^29g—398)=—0,113 ккал- К ,
AG398 = — 45,0 ккал.
\ сг АО° . „ 0,113 о,
б) 1пд„=----------; lg/<„ =----------------^ = 24,7;
Р RT Б р 2,303- 1,987- 10~3
Лр = 5- 1024.
282
Глава VIII
Vlll-1-12.
Kn - / 1 1 \
1 O’ ~ ----------- I----------- I •
ё 2,303/? у 72 Tj’
. 0,54 _ - Atf° / 1 1 \
lg 1,46 ~ 2,303/? \ 413,2 373,2 /’
A/7° — — 7630 кал = — 7,63 ккал.
VHH-13.
(По оригинальным данным: — 7,56 ккал.)
Построим график зависимости lg Р от 1/7' (см. рису-
нок). Наклон прямой — — А/7субч/2,303р. Наклон
прямо|1 = Л<М_„ <1-800 - 0.400>-----------J де. 10<.к
Л(1/7) (6,90 — 7,72) • 10-4
ДЯ°убл = 2,303Р • Наклон = 2,303 • 1,987 • 1,95 • 104 =
= 89200 кал • моль-1 (или 89,2 ккал • моль-1).
2,0
1,8
1,6
14
1,2
/,о
0,8
0,8
0/г
VIH-1-14.
Р2 Л/7субл (Г2 — 71)
lg “рГ== 2,303/?7,72
т~й 1g (75/25). 2,303/?. 250-200) o.nn
ЛЯсубл = ——'—-— = 2190 кал • моль
J ои
Рг А77пар(7,2 — 7J
g "№ 2,303/?7’172 ’
т-77 1g (300/150)-2,303/?-400-300 1сс.
Д//пар = -ь-J—:------------------------= 1654 кал моль ,
VI11-1-15.
^^субл — пл Н- ^1^пар>
кНпл = А//Субл—А//пар=2190—1654=536 кал-моль-1.
а) Построим график зависимости lg Р от 1/Г (см. ри-
сунок). Наклон прямой — — \Haap/2,3Q3R.
Свободная энергия и химическое равновесие
283
и « A(lgP) 2,068—1,114 .„„„
Наклон прямой д (i/y) о,004228—о,004921 1378;
А77пар = 2,303-1,987-1378 = 6300 кал - моль'1.
б) При -50° С Т = 223,2° К и 1/7 = 0,00448° К-1.
Из графика при 1/7 = 0,00448 1g Р = 1,72, следова-
тельно, Р=52 мм рт. ст.
/ G° — Т/g \
V111-1-16. Ц-------jr—= 26,74 кал • °К ;
Д№= —26,138 ккал;_ A (G° — 77о) = 298,15 • 26,74 =
= 7972 кал; AG" = A(G° — Я°о) + Atfg = 7972-26 138 =
= — 18 166 кал;
1 _ — _ 18 166
адОЗЯГ ~ 4,576-298,15 ’ ’
/Ср==2-1013.
AG° A#o
VI11-1-17. — =A(^--------+ =
,, оо-гл I - 16520- 14520
= — 61,11 + 57,29 + 32,74 -|------------------=
= — 2,12 кал • “К”1;
VIII-1-18.
=2 -27,0- 1 -48,0 = 6,0;
— (AG° — АЯ5) = 6,0 • T = 6,0 • 600 = 3600 кал;
АШ = 2 (—27 000) — 1 (—94 000)=40 000 кал;
_ AG° = 3600 — A/7o = 3600—40 000 =
— — 36400 кал;
284
Глава VIII
AG° = 36 400 кал;
. д. ____ — 36 400 _ |
lgAP“ 2,303-1,987-600 — 1Л’М’
Кр = 5,50- 10-14.
РАЗДЕЛ VIII-2
VIII-2-1. dF = — PdV — S dT;
т I д - \F
Г д (М/Т) 1 1 дТ ) _ —T&S — M _ ДС7
[ дТ J Т2 Т2 Т2 '
dP MI 80 _
dT Т ДУ — {273,2 [(0,92- 1,00)/( 1,00 • 0,92)]}
= — 3,4 кал • см-3 • °К-1;
ДР = - 3,4ЬТ = - 3,4 (-1) =
п . _ч 41,3 см3-атм < . . п9
= 3,4 кал • см 3 •-----------=1,4- 102 атм.
’ кал ’
VIII-2-3. Ромбическая сера стабильнее.
d(\G) = bVdP; \G2-\Gl=\V(P2-Pi);
0—18 кал* моль-1 =(х-^= — см3*г-1*32,0г-моль-1Х
\л,м/ 1}УО/
X (^2 — 1) а™ • гг? КзЛ-’> р2~ 858 атм.
' 41,3 см3-атм 2
VIII-2-4. Поскольку условия равновесия имеют одинаковый
вид К — Рсо/Рсо, то имеется только одна темпе-
ратура, при которой обе реакции могут быть в равно-
весии одновременно, — температура, при которой
Свободная энергия и химическое равновесие
285
Построим графики зависимости lgKi от 1/Т
и lg от (см- рисунок).
VHI-2-5.
V1H-2-6.
Точка пересечения дает \/Т — 11,9-10 4, Т = 840° К
(567° С) и 1g К, = 1g = - 0,01; К = 0,98. (По ори-
гинальным данным 1g К = — 0,1, но здесь явная
ошибка.)
Стандартным состоянием твердого тела или жидкости
в чистом виде или в растворе является чистое веще-
ство. р = р° + RT 1п а. Если вещество чистое, то
р = р° и я = 1. Таким образом, в условиях равно-
весия мы заменяем активности каждого чистого
вещества единицей, что равноценно пренебрежению
ими. Если вещество не вполне чистое, то в первом
приближении активности можно заменить мольными
долями (согласно закону Рауля), но не концентра-
циями.
а) М = -^ = 0,344 г • л-‘ • °'08206 л' ат,м ' °К~‘' моль- X
X 1300° к = 36,7 г • моль-1.
б) ZnO + СО <^Zn-|-CO2
п0(1—а) поа поа (число молей при равновесии'.
Иобщ == По \ 1 Ct),
Общий вес газов равен w = п0[(1 —a) - 28,01 +
+ а 65,37 +а-44,01] (числа — молекулярные веса
газов),
w = По (28,01 + 81,37а);
286
Глава VIII
M = -^- = 28,01+ 81,37a = 367; a==o, 194. ^обш * ~Г & B) Pco; = Pzn= -Tf0?--, P —0,162 атм; «0 V т Pco = -"° jl-7.4 p = 0,675 атм; По (1 + a) ft =-.90^.. = 3,89- 10"2 атм. 'co
Vin-2-7. XY2 ^X + 2Y (0,40—г) г 2г (число молей при равновесии) «общ = 0,40 + 2z; • PV 1,20 атм -Юл __ RT 0,08206 л - атм • °К-1 • моль-1 • 300°К = 0,487; 0,40 + 2z = 0,487; z = 0,044. РхРу_ г(2г)2(1,20)2 3 Лр РХУ, (0,40 - г) (0,40 + 2г)2 0,0 и '
VIII-2-8. а) 2SO2 + О2<± 2SO3 (0,100+2;/) w (0.100—2;/) (число молей при равновесии) «общ = 0,200 у, . V 2л = RT 0,08206 л • атм • °К-1 • моль-1 300°К = 0,0812 моль • атм-1; «общ —— 2,78 атм • 0,0812 моль-атм-1 = 0,226 моля; К.' у = 0,026 моля; Хо-“^=й»=0'116' Р2О гг?0 V 0,0482 • 0,0812 б) Кр = -ь S^- = = = 0,32. PsoA, 4оЛо, W 0.1522 - 0,026 в) 2S0g О2 —> 2SO3 2у и (0.100—21?) (число молей при равновесии^ ”80, __ _ °'32 _394. »so,»o, v °,»812 ’ ' <0,100-ЭД’ =3 94. woo-w _15 (2г/)2 у У3 Это уравнение лучше всего решать методом подбора. Возможен следующий прием. Очевидно, что у должен находиться между 0 и 0,050. Теперь найдем среднее в следующих интервалах!
Свободная энергия и химическое равновесие
287
у 10,100 —2у)2/у 0,025 160 у слишком мал 0,040 6,3 у слишком велик 0,036 16,79 j 0,0365 14,99 > интерполяция 0,0363 15,70 J 2t/ q-[0()- = 0,73 (73%) — доля диссоциирующего SO3.
VIII-2-9. Число молей НОАс (100%-ный мономер) = 13,80 X X 10-3 • 0,0568 = 7,84 • 10~4; число молей (НОАс)2 (100%-ный димер) = */2 • 7,84 • 10~4 = 3,92 10-4. Пред- полагая 100%-ный димер, давление идеального газа должно быть равно n nRT 3,92-10“4-82,06-324,4 n nQOn Л v = 359^8 -0,0290 атм = 22,0 мм рт. ст. (НОАс)2(г)^2НОАс(г) (1—а) 2а (число молей при равновесии) Общее число молей равно (1 +а). Pi(1 % а) = Рнабл — 22,0 (1 + а) = 25,98 мм рт. ст.; а = 0,181; „ Т’нодс (2а)2Р К = -р =7: . п х — 3,52 мм рт. ст. Р(НОАс), (1—а)(1+а) н
VIII-2-10. Водный раствор: [HBz] + [К • HBz] = = 20,40 • 10-3 моль • л-1 Скеллезольв-С (Sk): [HBz] = 28,43- 10-3 моль • л-1 Водный раствор: [К] + [К • HBz] = = 26,91 • 10-° моль • л-1 (HBz)2(Sk)^2HBz(aq) 10~3; [(HBz)2]sk [HBz]2at) = 28’43:10~3 . 5,02 - 10"3 = 71,4 • 1О-0; [HBz]aq = 8,45 • 10" моль • л~‘;
288
Глава Vlll
[К • HBz]aq = 20,40 • IO'3 - [HBz]aq = = 20,40' IO-3 — 8,45 IO-3 =11,95 • IO-3; [K]aq = 26,91 • IO-3- 11,95- 10-3 = = 14,96 • 10~'! моль • л-1; K = [KJaq = 8,45 • 10~~3 • 14,96 10~3 = c~ [K-HBz]aq ~ 11,95. KF3 ~ = 1,06 • IO-2.
VIII-2-11. a) CO (г) + H20 (г) C02 (г) + H2 (r), (1) AG)= —6,818 ккал; ]SKr,= 2да. .да, 298,15 =5'<№ 10s- б) H2O (ж)«± H2O (r), AG2 = 2,055 ккал (2) IgKp: 2,303-1,987-298,15 1,506, Рн,о = KPl — 3,12 • 10~2 атм. в) CO (г) + H2O (ж) СО2 (г) + Н2 (г) (3) (1,00—х) (1,00+х) (1,00+х) (атмосфер при равновесии) Рго Рн (1,00 + х)2 Рт 1.00-х -3,12-IO3. (2 — и)2 Пусть у = 1 — х, тогда 1 + х = 2 — у и — = = 3,12- 103. Примем, что у <С 2. — = 3,12 • 103; у= 1,28 • 10-3 атм = = Рсо; Рсо, = Рн, = 2,00 — у = 2,00 атм; Рц2о — = 3,12 • 10~2 атм.
VIII-2-12. а) А (г) + 2В(г) =C(tb) + 2D(t) Число молей в начале реакции п0 п0 0 0 Число молей при равновесии п0(1 — а) п0(1—2а) [поа] п02а Общее число молей газа при равновесии равно п0 (2 — а). Примем, что (1 — а) = 0,750, тогда а = 0,250 и Р = 2 атм. D, Пр (1 — и) р 6. р »о ( 1 — 2и) р _ 4, п0 (2 -а) 7 /7 а™> Ра п0(2-а)е /7атм»
Свободная энергия и химическое равновесие
289
п02а
п0 (2 — а)
Р — *17 атм;
Рр
рЛ
=7/6.
б) А (г) + 2В (г) С (тв) + 2D (г)
Парциальное
давление при
равновесии, атм 1—1— х х
УШ-2-13.
в) В опыте (а) общее давление всегда равно 2 атм.
В опыте (б) при равновесии давление меньше, потому
что, когда реакция протекает слева направо, три
моля газа превращаются в два моля (объем остается
постоянным) н давление должно падать. Увеличение
давления благоприятствует ускорению реакции, и
поэтому увеличения количества продукта D следует
ожидать в опыте (а).
г) Уравнение третьей степени для Кр часто решается
методом подбора. Ищем решение между 0 и 4/7 = 0,57,
получаем х — 0,48 атм = Р&.
а) 21Вг(г)^ 12(тв) + Вг2(г);
0,50 — 2х = 0,16 атм;-х = 0,17 атм (при равновесии);
PRr 0,17
^=-^- =---------г = 6,64.
Р Р?Вг (0Л6)2
б) 21Вг(г)^12(тв) + Вг2(г)
По (I—2а) поа (число молей при равновесии)
Иобщ == П0 (1 Cl),
Рвг, + Лвг = 0,50 — 4 • 10-4 атм = 0,50 атм;
P,Bt=^4r^_0,50—1^-; =
п0(1 —а) 2(1—а) р Р21ВГ
•У 7-<г=6,64; 14,28а2-14,28а+ 3,32 = 0;
(1 — 2a)z ’
а =
Поскольку а < 0,5, подкоренное выражение должно
быть выбрано со знаком минус, т. е. а = 0,368.
п а 0,368 л он
^Вг,— 2(1—а) 2-0,632 — а™’
Ю Зак. 1360
290
Г лава VI1I
VIII-2-14. 2ВгС1 (г)^* Вг2(ж) + С12 (г)
%р ~ 2^32“ = °>4921;
РвгС1 + Ра, = 1,000 - 0,281=0,719 атм.
Пусть п0 — число молей ВгС1 в начале реакции, тогда
при равновесии
ttBrci tto(l па2 по~2 (1 Е5гС1 —> — С12^;
ИВгС1 “1“ rtci2 = по (1 2 а) •
РвгС1 = 7°(1~1а)\ ’ 0,719 а™;
«о (1 —g- aj
Рсь= , -0,719 атм;
п011 — — a j
VIII-2-15.
VHI-2-16.
0,604a2 — 1,208a + 0,354 = 0; a = 0,357.
а) Равновесное давление F2 = (l — Р) атм; равновес-
ное давление PuF6 = P атм.
КР = = TTJ = 26,6 10~4;
Р = 26,5 • Ю-4;
Робщ — Ppuf, + Рр2 = 1 — Р + Р = 1 атм;
Рр/Робщ- 100= 1 —-6’| ~ 10..4 - 100 = 99,7 мол. % F2;
PpuFs/Робщ - 100 = 26,5''10р4'100 = 0,265 мол. % PuF6.
б) Молекулярный вес PuF6 = 353; 1 г PuF6 =
= 1/353 моля = 0,00283 моля.
Пусть nF — необходимое число молей, тогда
0,00265nFj = 0,00283; nFt = 1,07.
а) HD (г) + Н2О (г) Н2 (г) + HDO (г)
(0,000298 • 0,5 — х) (0,5 — х) (0,5 + х) х
РнЮ'Рн,_ (0,5 + х)(х)
р ’ ₽hd-Ph!0 ~ (0,000149-х) (0,5-х)
Свободная энергия и химическое равновесие
291
Поскольку 0,5 » х, то 0,5 + х 0,5 — х 0,5 и можно записать: 00001*49 ~х = 2,6; х= 1,078- 10-4 атм. Доля оставшегося HD = О’ОО%4оооП9°00108 = 0,275. б> 0,0000^^ = 2-6; + = 0,0000296. п un 0,000041-0,000030 п . Доля оставшегося HD = п пломб = 0,074. UjUUU 1 G° - Н°о
VII1-2-17. а) А г-1 =-32,74-52,01 +57,29 = — — 27,46 кал • °К"‘ • моль-1; ДДо = 54,33 — 14,52 = 39,81 ккал • моль-1; „ -1 -1 —у—= 39,81 кал • К -моль ; bG° G° - Н°о ДЯо „ -у- = Л——= 12,35 кал- К моль ; ]„/< _ ~AG° _ 12,35 *ёЛР 2,303/?Г 2,303 -1,987 /<р = 2,0 10“3. б) С2Н4 + н2 + С2Н2 л0 (1—а) лоа поа (число молей при равновесии) Побщ === И0 (I -р Рсгш= . , „ -10 атм; Рн^Р^н, — . , • 10 атм. 1 и 1 “р и Рн * Рс н / Юсе Г 1 ™|_ q 1 _ /С = U—- I = 2,00-10 3; р ^с2н4 \1+а/ [10,0(1—а)] л A А 1 А““4 2 2,00 *10 л /ч/ч f г\“ 1-«2-2.00-Ю ; а- 10002 - 2,00-10 . а =1,41 • 10-2. Р1!,= +014— • 10 = 0,139 атм.
V1II-2-18. А + 2В С + D (тв) п0(1-а) nail— 2а) поа (число молей при равновесии) П0РТ , ——=1 атм. a) PA — n0(l — a) = 1 — а; Рв = п0(1 _2а)-у^-= 1 -2а; D RT РС Г. Рс~поа а; 2 — Кр; * А* В
-----------=10- ю-3
(1-а)(1-2а)2 1,и
292
Глава VIII
Если 2а <С 1, то а =1,0-10 3 атм = Рс или более
точно: 1—а = 0,999; 1—2а = 0,998;
а = 1,0 • 10-3 • 0,999 0,998 = 0,995 • 10-3 атм = Рс.
б) п0бщ = по(1 —а+ 1—2а + а) = п0(2—2а);Р=2атм;
-«) р== f
п0 (2 — 2а) .
атм;
Ра
Рв
Кр
__ гсо(1 —2а) р 1 — 2а . р_______ггоа р______ а .
по (2 — 2а)________________________________________1 — а ’ с по (2 — 2а)_1 — а’
Рг а (1 — а) ,
= —V; —-------------=!• 10-3.
РАР| (1 —2а)*
Если 2а 1, то а = 1 • 10 3 атм Рс- Можно полу-
чить более точный результат [как в пункте (а)]:
„ 1 • 10-3 • 0,9982 _ -3.
а =---099------= 0,997-10 ;
п _ ® ___ 0,997- 10 . л лло 1 п~3
Pc-q^----------ода—= 0,998- 10 .
VIII-2-19.
в) Физический смысл. Реакция сопровождается умень-
шением числа молей газа. Если объем остается по-
стоянным, конечное давление должно быть меньше
2 атм. Таким образом, реакция, идущая влево (по
принципу Ле-Шетелье), более предпочтительна, чем
реакция при постоянном давлении 2,00 атм. Следо-
вательно, можно ожидать увеличения количества
продукта С при постоянном давлении. Математически:
а) аа =/(р(1 — аа)(1 — 2аа)2;
w. Кр(1— 2aft)* aa
б) аь =----j—----; « (1 _ а 2 < L
1 — a#
Т
= J \CpdT= -1130,5+0,0740 (7-298)=
298
= — 1152,6 + 0,0740 Т кДж (при предположении, что
ДС/> не зависит от 7).
AUt = ДЯг - RT \пг = ЬН°Т + 3RT=-1152,6 +
+ 0,0989 Т кДж [при предположении, что газы идеаль-
ные и PV незначительно для Н2О (ж)].
г дс<>
\S°T = AS;98 + / dT = -388,3 + 74,0 In =
298
= —810,0 + 74,0In 7 Дж °К~'-
ДО?* = &НТ — Т =
= -1152,6 + 0,8840 Т - 0,0740 Tin Т кДж.
Свободная энергия и химическое равновесие
293
VI1I-2-20.
.-з
V1II-2-21.
а) ДЯ298=О—94,05—(—52,40)—(—26,42)=—15,23 ккал;
AGm8=0—94,26—(—45,25)—(—32,81)=—16,20 ккал.
1g Д’ = ~—° =-----------------== 11,88;
6 ₽ 2,303/?Г 4,576 • 10-3 • 298
/(р = 7,6- 10“.
б) ЬСр = 6,34 + 8,76-11,07—6,95 =
= —2,92 кал • "К"1 • моль-1;
т
&Нт = Д7/298 + f \C°pdT = -15,23- 2,92- 10-3Х
298
X (Г—298) = — 14,36 — 2,92 • 10-3 Т ккал.
400 , „о
1 р дяг
В) 1g Кр, 400 '=s 1g ^р,298 2,303/? J Тг
298
= 11,88 Н-----—--тХ
4,576-10 3
400 / чч
14,36 2,92- Ю-3\
X] (—----------------т--)dT=
298
11 оо I 1 Г - 14,36(400 - 298)
' 1 1 >ОО Ч~ о I
4,576-10-3 [ 400-298
-2,92- 10~31п^ = 7,32;
Кр — 2,1 • Ю7.
дЯ°зоо = 2 (-150000) - 1 (-250000) = -50000 кал;
AS3oo = 2- 10,00- 1 • 30,00 = -10,00 кал-°К~';
АОзоо == А/'/зоо — 300 ASзоо = —50000 — 300 (— 10s00) —
= — 47000 кал;
NCp = 2 (3,00 + 2,00- 10-2 Г) - (4,00 + 5,00- 10-27) =
= 2,00- 1,00- 10~2 Т.
т,
KHTt = KHTi+ f kCpdT-,
r>
т
\HT = - 50000 + j (2,00 - 1,00 • 10~2 Г) dT =
300
= -50000+2,00(7-300)- 1’09г10~2 (Г _ 3002)=
= - 50000 + 2,007 — 600 - 5,00 • 10~3 72 + 450;
—2
294
Глава VIII
ДЯГ = -50150 + 2,00г - 5,00 • 10~3 Т2 кал.
AG2 , \G| _ г’ AH dT Г’50150 <т ( Р 2,00 dT
г2 Tt J т2 ~ J тг а1 "Г J Т
Ti Ti Ti
Т?
- j 5,00- 1 O'3 df = 50150 (^--^-) +2,00 In
T,
-5,00- 10"3(Г2- Г,).
AG2 . — 47000 cnIKnZ 1 1 \ I ОЛЛ1 r2
Г2 "* 300 50150 U 300) *" 2,00 П 300
-5,00- 10-3(Г2 —300);
-23,408 + 50150 1
AG2
Г2 — , Тг
+ 4,61 1g Г2 — 5,00 • Ю-3 Т2.
Ph‘= 1^+
^=4^ и
MdCl
Пусть ДС2 = AG и T2—T, тогда
AG = -50150 + 23,4087 -4,61 Г 1g Г + 5,00-10-3 Г2 кал.
VIII-2-22. а) Д#298 = 2 (-30,36) — 2 (-22,06) = -16,60 ккал;
AG298 = 2 (—26,22) — 2 (—22,77) = —6,90 ккал.
— AG2q8 6,90 _
1 g Кр =-----— =----------------х-----= 5,06;
р 2,303RT 2,303-1,987-10“3-298
Кр = 1,1 Ю5.
б) 2Ag + 2НС1 #2AgCl + H2
Ло(1—2а) поа (число молей при равновесии)
^общ == TIq (1 — а).
-— • 0,50 атм; Phci = \~ 2и • 0,50 атм.
’’ 1 — а
а (1 — а)
—------— = 1,1 • 105.
- 2а)2 • 0,50
Пусть р= 1 —2а, тогда а=0,5(1 — Р); 1 — а = 0,5 (1+Р);
1 — в2 ч
—р/ =2,2 • 10° и ₽ = 2,1 • 10-3 .
PHCi = --O!02L_ = 2,O9- 10'3 атм;
2-(1 +W
|(1-р)-оло
Рн. = —j-----------= 0,50 атм.
2(1+₽)
Свободная энергия и химическое равновесие
295
в) \ѰР= 2 • 12,61 + 6,80 — 2 • 6,01 - 2 7,09 =
= 5,82 кал • °К-1 • моль-1;
т
&Нт = ЛЯ298 + J ас; dT =
298
==-16,60 + 5,82- 10-3(Г-298)==
= —18,33 + 5,82 • 10-3 Т ккал.
т мГ
Г) 1g Кр, Т ~ 1g Кр, 298 + 2,303/? J ’ d? —
298
V11I-2-23.
= 5,06 н-------!----з [18,33 [-----—1 +
4,576-10~3L (г 298/
+ 5,82- Ю-31П^] =
= — 15,59 + 4,^--°3 + 2,931g Т.
1g КР, 323 = -15,59 + 4’°‘23103- + 2,931g 323 = 4,16;
/Ср, з2з= 1,4 • 104.
а) 12 (тв) + Вг2(г) + 21Вг (г)
ло (1—а) л02а (число молей при равновесий)
^общ П0 (1 “I- а).
р ____ п0 • 2а р_____ 2а • 0,164 ф
^Вг «0 (1 + 1 + Ct *
р . «0(1—а) „ (1-и)-0964 _ ?2Пг .
Вг2 «о (1 +а) г 1 + а > Ар— рВгг >
(2а)2-0,164 л 1ЛЛ 4а2 , л
(1+а)(1-~-а) —0,164; 7^=1; а = 0,447.
п 2-0,447-0,164 л ,п,
PlBr =-----П4+7----= °> 1 ° 1 а™ •
б) АСр = 2-8,7— 13,3 — 8,8=—4,7 • кал • °К-';
Д//298 = 2 • 9,75 — 7,34 == 12,16 ккал = 12160 кал.
т
д//; = Д//;98+ |дс; dr =12160-4,7(7 -298) =
298
= 13560 — 4,77’ кал.
din Кр _ ДН° 1 / 13560 4,7\
dT ~ RT2 ~ ~R [“f2 Т~/
, КР, з9з 1 Т/ 13560 4'7 Ьг
ln Кр, 2W~~ R J \ тг Т 1 dT>
г 298
296
Глава Vlll
Кр, 398 _ 1 / 13560-100 398 X
Кр, 298 ~ к 398 -298 -2,303 ~ 4,7 g W/ = 2’20’
Кр, эм = Кр, • Ю2,20 = 0,164 - 1,59 • 102 = 26,0.
VIII-:
в) Энтальпия образования простых веществ Л7/° при
некоторой температуре в их стандартном состоянии
(стабильное состояние при 1 атм и данной темпера-
туре) принята равной нулю. Для Вг2 стандартным
является жидкое состояние, и для процесса
Вг2 (ж) -> Вг2 (г, 1 атм) АД равно 7,34 ккал.
-24.
АДзоо Дбзоо
2СО2 (г) + ЗН2О (ж) ->
->(СН20Н)2(ж) + |02 (г) 273,48 281,47
2С (графит) + 2О2 (г)
->2СО2 (г) -188,10 —188,52
ЗН2 (г) + |о2 (г)->
->ЗН2О (ж) -204,96 -170,07
а) —119,58ккал б)—77,12ккал
в) Af7o = A//o-/?7An(r)=
= -119,58- 1,987- 10“3 • 300 (-4) =
= —117,20 ккал.
г) ДГ° = AG° —/?ТДПг = —74,74 ккал.
д) ДСр = 35,45 - 2 • 2,04 - 3 • 6,84 - 6,98 =
= 3,87- 10"3 ккал-°К"‘;
т
&Нт — АДзоо + ^kCpdT —
300
= -119,58 + 3,87 • 10"3 (Г - 300) ккал,
280<Г<370°К
е) ДДз5о = —119,58 + 3,87- 10'3 - 50 =-119,39 ккал.
. . „ — &G 77,12 о
ж) 1g Ко —----------------------—-------5-----— 56,2.
₽ 2,ЗОЗЯГ 2,303-1,987-10-3-300
з) Индекс „о“ означает, что идеальный газ, чистые
твердое тело или жидкость находятся под давлением
1,00 атм. U и Н мало зависят от давления или раз-
бавления, т. е. обычно нет большого различия между
Свободная энергия и химическое равновесие
297
U и U° или между Н и Н°. Однако в случае газов
F и G сильно зависят ог давления;
\дР)т ’ \дР)т \дР)т
Таким образом, F° и G° (при 1 атм) значительно
отличаются от F и G (при ином давлении). Для
жидкостей или твердых тел V мал и, таким обра-
зом, F и G мало зависят от давления. Значительное
отличие в этом случае должно быть между G° (или F°)
для чистого вещества и G (или F) для компонента
в растворе.
VIII-2-25. АСРтв^ж = (е - а) + (f - b) • Т кал • °К"’ • моль"1;
4/ДЯ° = ДСР dT-
ЬН° = j (e-a)dT+ j (f-b)TdT =
= (e-a) Т + ^([-Ь)Г + !у .
Вычислим I[. Пусть ЛЯ = ЛЯ1 при T — Tlt тогда
ДЯ? = (е - а) Л + |(f - b) Г? + I, и
Л = ДЯ° - (e - a) 7\ - у (f - b) Ti.
,\G°__-\HedT__~(e-a)TdT {dT^
Я T * T2 T2 T2 T2 9
^^-(e-a)\nT-^f-b)T + -^+J2.
Если T=Tlt to h.G° = &G° и
AGi 1 , Л
l2=^- + (e-a)\nTl + ^(f-b)
AG° = — (e —-a) Tin T-±(f-b) F + h + ItT,
где /] и /2 могут быть вычислены, как показано выше.
Если необходимо, Ц и /2 могут быть исключены из
последнего уравнения, например:
Т ^GOl „Г Т\
AG°=---?-± + дЯ1(1 -77) +
+ (е-а)(Пп^ + Т-7’1)-
-у(Г-Ь)(Т-Т^.
298
Г лава VI f I
VII1-2-26. а) ДЯ298 = 76,16 ккал;
AS298= 12,86 кал • °К-1; АСр = -1,67 кал • °К-1;
\Нт = АЯ298 + АСр (Г-289) = 76170 — 1,67 (7— 298) =
= 76670 — 1,677 кал;
ASy = Л5г98 4* ACpln-^g = 12,9 — 1,67In -^g- =
= 22,4- 1,67 In Г кал • °K-1;
VIH-2-27.
. „ _ - \G° _ 1 / - A//° , „0\
*gAp 2,303RT 2,3037? \ T + Ad j—
= 4^6 + b67 + 22,4 - 1,67 !n Г) =
= ~ 'y76° + 5,26 — 0,840 lg T.
б) Г = 298°К; lgKp = -51,39; Kp = 4,1 • 10-52.
в) NaCl (тв) + у H2 (r)^ Na (тв) + HC1 (r)
= ^Ь4’1-10'2-’ Pf,ci= 8,2 • 10-52 атм.
a) Cp = a/2R = 4,97 кал • °K-1 • моль-1 (для одноатом-
ного идеального газа).
б) АСбоо = А//боо — 7 ASgoo —
=—71,5 — 600(—91,9 • 10-3)= -16,4 ккал;
< — AGfinn 16,4
1 g Кр =----=------------г----= 5,97;
Р 4,5767’ 4,576- 10-3.600
/<р=9,3 105.
в) 2Hg+ O2^2HgO
'2х 14-х (давление (атм) при равновесии]
(2х)2(1-х) = ^- = 1,07-10-6.
FHg • Pq2
Если х <С 1, то (2х)2= 1,07 • Ю-6 и
РНг = 2х= 1,03- 10-3 атм.
г) Кр=т- = КЛ = 9,3- 105р^-? = 2,6- Ю5.
д) АСр = 2(6,24 4-0,016Г)—2-4,97—(6,31 4-0,00237) =
-3,77 4- 0,02977 кал • °К“\
Свободная энергия и химическое равновесие
299
Д/7зоо — А//боо + J \CpdT =
600
= -71,5 — 3,77- Ю':) (300 - 600) +
+ 0,5-2,97- 10"5(3002 - 6002) =
= —74,4 ккал;
зоо
AS300 = ASeoo + С —уД dT =
600
= -91,9+ J ("А—+ о,0297^7’ =
600
= -91,9 — 3,77 In -|§§- + 0,0297 (300 - 600) =
= -98,2 кал • °К-1;
Д(7зоо = Д77зоо — 71 Д5°оо =—74,4—300 (—98,2 • 10'3) =
= —44,9 ккал;
° р~ 2,303/?Г ~ 4,576-10-3-300
/<р= 5- 1032.
V11I-2-28. а)
ДЯзоо, ккал
2SO2->2S + 2O2 +141,92
ТеО2->Те + О2 + 77,69
2H2S + ЗО2 -> 2Н2О + 2SO2 -268,92
2H2S + ТеО2 Те + 2S + 2Н2О - 49,31
б) ДСр = 6,00 + 2 • 4,4 + 2 • 18,0 - 2 • 8,3-13,5 =
= 20,7 кал0 • К-';
ДЯ;50 = Д//;00+ j ДСрй7’=-49,31+20,7- 10~3-50=
300
= — 48,27 ккал;
ДЗзоо = 11,9 + 2 • 7,6 + 2 • 16,7 - 2 • 48,6 - 17,2 =
= —53,9 кал-°К"‘;
ДЗз5о=Д£°оо+ У ^-dT=- 53,9+ 20,7 In ^- =
300
=• — 50,7 кал • °К-1;
300
Глава VIИ
AG350 = А//350 — Т AS350 = — 48,27 —
- 350 (-50,7 • 10-3)= - 30,52 ккал.
. . „ — &G° 30,52 .
в) 1g =-----------=------------:----к-----= 19,1;
₽ 2,303/?7" 2,303-1,987-10-3-350
КР=1- Ю19 =
Ph2s = V/2 = 3- IO-10 атм.
/ G° - Н°
а) Ц-----
V11I-2-29.
V1II-2-30.
— 9,60 кал • °К 1 • моль'
= 2,098;
= - 53,60 + 46,76 + 0,5 • 45,68 =
= 16,00 кал • °К-1 • моль-1;
АЯо = 8,68 — 21,48 = — 12,80 ккал моль-1;
Д/7° —12800 ,
—т~~—кт— = — 25,60 кал °К -моль ;
I эии
AG°
т — т ) т —
. „ — ДО0 __ 9,60
1g Ар — 4,5767" — 2,303-1,987
К, = 125.
б) Если КР=1, то AG° = 0. (AG° — Hq)[T медленно
изменяется с температурой. Предположим, что A[(Go—
— Н^)/т] постоянно и равно 16,00 кал • °К-1 моль-1,
тогда
ДО° ДЯ„ 12 800
— = 16,00 +-т±= 16,00----------— = 0;
Г = 800°К-
NaOH • Н2О (тв) 5* NaOH (тв) + Н2О (г)
^ = РН!о=-—=1,97- 10—4;
- А ---yr-2-J = 6,995 + 37,17 - 11,281 = 32,884;
АОж = -7?Г1пКр =
= — 1,987-298,2-2,303- 1g 1,97- 10-4 = 5057 кал;
о О „ ! G -- НА
kGigg = А/7о 4- т • А —у;
5057 = АЯо - 298,2 • 32,884 = АЯо - 9806;
А//о= 14 863 кал • моль-1 (по литературным
данным 14 890 кал-моль-1)-
Свободная энергия и химическое равновесие
301
VI11-2-31.
а)
G1000 ~ G298
1000
/7298,
кал•°К-1 • моль-1 ккал • моль-1
Си2О -31,48 -40,4
4 °, -26,39 - 0
— 2СиО +32,18 +75,2
-25,69 +34,8
ДО1000 Л ( °1000 — G298 । Д//298 г>к cn t о л о
"1000“ Л \---1000---; + +обб“ = - 25169 + 3418 =
= 9,1 кал • °К~’ • моль-1;
2,303/?Г ~ 4,576 ~ ~ 1,99; Кр=1,0-10 .
б) Р'Ьг — Кр- Если POi=10—6 атм, то Кр=10~3 и
AG° = — 4,5767 lg(10~3)= 13,7287.
Функция свободной энергии (бг — медленно
изменяется с температурой. Предположим, что эта
функция при неизвестной температуре Т будет
такой же, как и при 1000°К- Тогда
ДО° ДЯ,98 34800
-у-= -25,69 + —13,728 = - 25,69 +-у—;
7 = 882° К-
VIH-2-32.
асан5он ==к= 10д где
гсгн4анго
D _ “слон
* СгН< in •
1и“Н2О
а — активность;
а) В идеальном растворе активности равны мольным
долям:
__ у____________1 /46,07______л
«СЛОН — ЛС,Н5ОН— 1/4б,07 + 1/18,02 U’261’
где 46,07 и 18,02 — молекулярные веса С2Н5ОН и Н2О
Соответственно.
П 9Я1
ан2о = Хн2о = 0,719; ^ = = 0,0392 атм.
302
Глава V/il
б) Для каждого компонента а = Р/Р°, где Р — да-
вление паров компонента над раствором, Р° —давле-
ние паров чистого компонента.
асгн5он = = 0,539; пн2о = 444 = 0,828;
40,1) I / ,0
п _____ 0,539 ___л Anri
^>с-н< ~ ~0,828 • 10 = 0,065 ЭТМ-
VIII-2-33. АСр = 25,0 + 6,9 - 2 • 6,6 - 2 • 7,0 = 4,7 кал • °К-1;
АД298= — 28,91 — 2 6,20= — 41,31 ккал;
AG298= - 26,60 - 2 • 0,31 = - 27,22 ккал;
* е° Д^298 ~ Д®298 — *4 090
Аг>298 — т — 298 —
= — 47,2 кал • °К-‘;
398
ДДз98= А7/298 + j hC°PdT = -41,31+4,7 • 10-3 • 100=
298
= — 40,84 ккал.
398 ЛГ°
AS1x = AS;98+ f ~^-dT = - 47,2+ 4,7 In Ц =
J / 2Уо
298
= —45,8 кал • °K-1;
AG°98= АДзэ8 - ТЛ3з98=- 40,84-398 (- 45,8 • 10~3)=
= 22,61 ккал;
РАЗДЕЛ VIII-3
VIII-3-1. Уравнение Клапейрона (а) относится к давлению,
при котором жидкость и пар находятся в равновесии;
обе фазы находятся под давлением Р, равном да-
влению пара жидкости. Уравнение Вант-Гоффа (б)
относится к равновесию между газом (паром), нахо-
дящимся под давлением Р, и жидкостью в ее стан-
дартном состоянии при фиксированном давлении
(обычно 1 атм). Сравните следующие выводы;
Свободная энергия и химическое равновесие
303
а) dGnap— ^пар dT -f- Vпар dP\
dGx=-SMdT + VMdP~,
d (Gn3p — Gjk) = — (S1I3p — S;K) d-T +
+ (Vnap-V»)rfP=0;
dP Snap S>K //пар /Лк
dT Уnap V ж 7'(l/nap — Уж)
б) dGmp= -s^dT + VnaprfP;
dGK = — SxdT. (Л'ж не зависит от фактического
давления в системе.)
d (Gimp — Gjk) = — (Snap — S^dT 4~ l^nap dP = 0;
<“\/„ар-зж япар-7Гж
dT ^nap
VII1-3-2. a) Необходимость различать AG и AG°. Условием
равновесия является AG = 0, а не AG° = 0- AG° = 0,
только если константа равновесия равна 1.
б) Необходимым условием равновесия между двумя
фазами (твердой и жидкой) является ньж = Р1, тв, где
индекс I относится к воде. Это условие может быть
записано в виде
^ж + Л7'1па1>>к = н;тв + /?Ппа1 тв. (1)
Если [л° = ц, тв, тогда, конечно, при равновесии
ai ж~а1 тв- Й° в данном случае рц ж — химический
потенциал чистой жидкой воды, а тв — химический
потенциал чистого льда при 1 атм и —3°С. Эти по-
тенциалы не равны, вернее, ц° тв < ц° ж, и стабиль-
ной формой является лед. Тогда из уравнения (1)
а1,тв > <Л,ж- У° может быть одинаков для Двух фаз
в случае осмотического давления; при этом действи-
тельно активности растворителя в каждой фазе при
равновесии одинаковы.
VIII-3-3. а) А2«±2А;
Число молей А2 при равновесии —п0(1 — а)
Число молей А при равновесии = 2/г0а
Общее число молей при равновесии — п0(1 + а)
р _ (1 — «) п. р = 2”оа р.
М1+а) ’
304
Глава V/If
Р2А 4а2Р 4а2Р
К = /(== (1-а)(1 +а) ’’ /<==Ь^Т;
а ~~ К+ 4Р ' а \ К ) ’
б) V — р = n0 (1 + а) -р-.
1) Предположи,"»!, что имеется п0 молей газа, тогда
i?=v=(l+o)T' М1 +(' +-тГ]"-
2) Предположим, что имеется 2и0 молей газа,
тогда
Г/ = = h д_ n\RL. . (1 _L±tr’/2l^L
V 2n0 U . о) 2P ’ " [1 + (1 + % J J 2P ’
в) Для P <C К a « 1 - 2P/K и
Г. 2P \ PT . o
V « ^2----K~)1^P' где m== 1 или 2-
VI1I-3-4.
Этот интеграл не сходится, кроме случая, когда
2/т — 1=0, т = 2 [предположение (2)]. В этом слу-
чае In у = — 2PjKjn.
а) Р'А = Р°АХА^Р°А-^—;
, О О
РВ = ₽ВХВ = РВЧ-А_
б) —Ц—
"A+"B, „а+1„в
где пВг — фактическое число молей В2 в растворе,
равное половине числа молей вещества В(пв) (кото-
рое химик принимал во внимание).
В2 (ж) # 2В (г)
/< = РвМв,.
Свободная энергия и химическое равновесие
305
VIH-3-5.
Если Хв2 = 1. то Рв = Р°в и К — Рв — (Рв)2.
Рв = (Рв)2 ^в/>
О __1/ _О / Ип. о
Рв — Рв^в2 = Рв (— —) = Рв
\"а + "в2/ -
"а + т"в /
В) у _ ?А _ »а+»В I + nR/nA ~
А РА «Л + 4" "В 1 + "В/2"Л
а) Вг2<^2Вг
1—а 2а (число молей)
Общее число молей равно 1 + а.
р‘”=т^р- р‘-—₽“0-' а™-
?Вг 4а2р Л п1--г
Кр~~Р^' (1-а)(1 +а) -°>255’’
= = 0,64; а2 = 0,39; а = 0,62.
d In К _ Д/Г .
d[l/T) R ’
„ К, boo _ Д//° f 1________1 \ ЛЯ° .
Лноо R \ 1600 1400 1,12-Ю4/? ’
ДЯ° = 1,12" 104Р 1п4^ =
Л1400
= 1,12- 104-4,576 lg4^ =
Л1400
= 1,12- 104-4,576-0,925 =
= 4,74 • 104 кал (47,4 ккал),
306
Глава VIII
в) Это среднее значение А Я0 в интервале 1400 — 1600° К, усреднение проводится относительно пере- менной (1/Г); таким образом, 7=1600 1 Т=1600 АЙ° = j bH°d(X/T) j 7=1400 / 7=1400 Если использовать Т как переменную интегрирова- ния, то необходимо иметь средневзвешенное значе- ние; коэффициент взвешивания будет (1/Г2): 1600 1 1600 АЯ° = J t\H/T2dTI j dT/T2. 1400 / 1400 100 -о
VIH-3-6. . оо Г Ср ЛТ 1 2000 , onnt 300 a) S° J т df+ -^6,00 In 10Q- 0 = Уз • 2,50 10-4 • 1003 - 76 • 2,40 • Ю-10 • ЮО3 + + 20,0 + 6,0-1,099 = 69,9 кал • °К-1 моль-1. б) А (крист) + 2 В # АВ2(г) Язоо —10 0 — 41, ккал • моль-1 S300 15 2 (69,9) 55 кал • °К-1 • моль-1 АЯзоо=—31 ккал • моль-1; AS300 = — 99,8 кал • °К-1 • моль-1; AG300 = А//300 — 300 AS300 = — 1060 кал • моль ; 2,303-1,987-300 0,772, 5,92. в) А (крист) + 2В = АВ2(г) «в = 1 — 2х; пдв2= 1 + х = 1,10 моля; х = 0,10моля; пв = 0,80моля; пОбщ= 1,90 моля. «лв 1,10 п„ 0,80 -^(-^+ = 5,92; P=0,5S атм. Ра 1.90 \0,80Р /
VI1I-3-7. G°r - Н°о _ С°т - Н°т Н°т-Н°0 -о Н°т - Нр Т Т ! т " 1 т
Свободная энергия и химическое равновесие
307
При Т = 0
т с°
—о — О Р V D
So = O,Sr= J ~dT.
Пусть So = о, тогда
Г С°
St — ст J — dT — о St-
о
Видоизмененная функция свободной энергии будет
иметь вид:
ё°г-я°у
7> I ОГ “|“ р
Таким образом, функция свободной энергии умень-
шается на величину ст, если So увеличивается на
эту же величину.
Глава IX
ПРАВИЛО ФАЗ
РАЗДЕЛ IX-I
IX-1-1. (б)
IX-1-2. См. рисунки.
1Х-1-3. а) Построим график зависимости PceHsci от t (кри
вая /) и график зависимости Рн,о от t (кривая 2)
Исходя из этого графика (см. рисунок), для несколь
Правило фаз
309
ких температур откладываем Рс6н,а и Рн,о и строим
зависимость (Pc6h5ci + Рн,о) от t (кривая 3). Кривая 3
описывает зависимость общего давления пара си-
стемы С6Н5С1 — Н2О от температуры. Температурой
кипения системы С6Н5С1 — Н2О будет температура,
при которой Pc6H5ci + Рн2о = 760 мм рт. ст. Как видно
из графика (кривая 3), это условие выполняется при
/ = 91,2° С.
WA мар°а . А = С6Н5С1
V7 — МВРВ ’ В=Н2О
Температура кипения 92,1° С.
Ра = 216 мм рт. ст.; Рв = 544 мм рт. ст.;
Мд =113;
Мв= 18,0;
IF, 113-216
__С_ —____________= 9 AQ'
WB 18,0 • 544 ’
ГОТ = 28,7 вес. о/о В.
310
Г лава (X
IX-1-5. а) 60 кбар.
б) Алмаз.
в) 4^- = —Vt~ = Q при 70 кбар и 4700°К.
7 аР кН г
IX-1-6. а) и б) см. рисунки.
а
600
500
о 400
о
* 300
200
ЮО
° Время х
б
L — жидкость; .К — кристалл; у — твердый раствор.
Правило фаз
311
IX-1-7.
312
Глава IX
1Х-1*9. а) См. рисунок.
б) 9 мол. % этиленгликоля и 91 мол. % воды.
в) 47,5 мол. % этиленгликоля и 52,5 мол. % воды.
IX-1-10. a) L + Р.
б) Число молей Н2О — = 2,78.
КП
Число молей Q —-^- = 1,39.
-g = 2; Q • 2Н2О.
в) См. рисунок.
Вес испарившейся воды
Правило фаз
313
б) Критическая точка растворения (точка, в которой Li
и L2 имеют одинаковый состав): 52,8 вес. % СН3СООН;
39,6 вес. % С6Н6 и 7,6 вес. % Н2О.
в) Точка b лежит на ноде № 5. Lp 16,3 вес. %
СН3СООН; 82,9 вес. % С6Н6 и 0,79 вес. % Н2О.
L2: 61,4 вес. % СН3СООН; 6,1 вес. % С6Н6 и
32,5 вес. % Н2О.
Li Отрезок be 52 .
L2 Отрезок ab 23 ’
314
Глава IX
1-' = 1°()-»ТЙ“69-'1 *
l2= 100 30,6 г.
Исходная диаграмма возможна, однако неправдо-
подобна.
б) Нет ошибок.
в) (В(тв) + С(тв)) следует исправить на (В(тв) +
+ С(тв) + Ь).
РАЗДЕЛ IX-2
1Х-2-1. Формула действительна для систем, находящихся
в равновесии, в которых могут изменяться концен-
трация фаз и два других свойства.
1Х-2-2. При выводе данной формулы сделаны предположе-
ния, что одной из фаз является идеальный газ и что
мольный объем одной из фаз незначителен по сра-
внению с мольным объемом другой фазы. Ни одно
из этих предположений не справедливо для перехода
алмаз — графит.
dP &Н AS Snap — 5Ж
dT l’(V,nap ^ж) V пар — ISk V пар Уж 1
Snap S» И ^пар > Иж.
Поэтому
IX-2-4. Пусть WT — общий вес всей системы. Тогда
WTxT = + W2x2, ГГ = Г, + Г2;
W iXT + Г2хг = + ГгХ2;
Wtxr - W,х, = W2x2 -
WdXr-x^^W^-Xr)-,
х2—хт
W2 ХТ~ Х1
Правило фаз
315
IX-2-5.
IX-2-6.
S2 > $з > Si; v2 > v:> > °i-
t,°C
IX-2-7.
б) Увеличение давления при постоянной температуре
благоприятствует форме с большей плотностью:
Pq > Pr> Рж > Pr* Нельзя рассматривать Q и жидкость,
так как неизвестен наклон линии равновесия между Q
и жидкостью.
См. рисунок.
IX-2-8.
т
См. рисунок. Линия L —V должна иметь положи-
тельный наклон, и плотность газа должна быть
меньше плотности жидкости.
IX-2-9. См. рисунок. Кривые равновесия: QR, а — пар; RS,
Р —пар; SW, жидкость — пар; RU, а—Р; SU, р —
316
Глава IX
жидкость; UX, а — жидкость. Тройные точки: R,
а — 0 — пар; S, 0 — жидкость—пар; U, а—0— жидкость.
Критическая точка: W.
Знак наклона линий RU и SU может быть получен
из уравнения Клапейрона:
dP __ Н3-
dT T(V3-VX) •
Поскольку повышение температуры благоприятствует
формам с большей энтальпией образования, Нж >
> Яр > На, тогда как из плотностей > Vx > Va.
Таким образом, для равновесия а —0 dPfdT>Q, но
для равновесия 0 — жидкость dP/dT < 0; кривые (если
их наклон не изменяет знака) будут пересекаться
в тройной точке U.
Правило фаз
317
б) Увеличению мольной энтальпии способствует уве-
личение температуры при постоянном давлении, сле-
довательно, Н\ > Яц‘, Н[ > Нщ\ Нщ > Нц.
IX-2-11. a) AG > 0; ниже 300° К плавление X не является
самопроизвольным.
б) кСР = СР (ж) — Ср (тв) = 25,0 — 20,0 =
= 5,0 кал °К-1 • моль-1;
^-^290 ЬНзоо -j- J \Ср с1Т ~
300
= 3000-5,0- 10 = 2950 кал • моль"1.
\ ~о Д-/^зоо “ ЛС3оо 3000 — 0 «л отл~1 п
в) AS300— 300 Зоо 10кал- К -моль .
__ ___ АС
г) А$290 = А$зоо+ J -уТ-йТ —
ЗОЭ
= 10 + 5,0 In = 9,83 кал • °К~' • моль-1.
oUU
Д) AG290 ==:^^290 290 AS2go =
= 2950 — 290 • 9,83 = 99 кал • моль-1 > 0, как
показано в пункте (а).
IX-2-12. а) 1пР= А+й1пГ + -^;
\H = RT2^~- = RT2 (^--^) = R(BT-C)-
bHM = R(BxT-CJ-,
bH^R(BTBT -Ctb).
б) ДЯпл=== ^ж Ятв:=: ^пар #тв (^Лтар ^ж)
= АЯТВ - АЯЖ = R [(Втв - Вж) Т - (Ств - Сж)].
в) Ср(ж)-Ср(тв) = ^^^ = ^у^=/?(ВТВ-Вж).
г) 1пРж = 1пРтв;
Аж + Вж1пТ + ^ = Атв + Втв\пТ + ^.
318
Глава IX
1Х-2-13.
IX-2-14.
Из графика:
a) 475 мм рт. ст.;
б) 62,5 мм рт. ст.;
в) 17 вес. % D.
б) k\ — PhlX\. Возьмем величины для наиболее раз-
бавленного раствора:
*А= ода = 1140 мм рт- ст-
В) у =2Л- = —1^—= 1,71; (1)
Л ХЛРА 0,420-229
р 164
Y А = " 0,420 • 1140 = 0,343‘
IX-2-15.
а) 116° С.
б) 36 вес. % В.
Правило фаз
319
в) Лучший дистиллят — 36 вес. % В (эвтектика); луч-
ший остаток — 100 вес. % В. Пусть wd — вес дистил-
лята, wr —вес остатка и wr 4- wd = 100 г. Вес В
в дистилляте 4- вес В в остатке = вес В в определяе-
мой смеси, следовательно,
0,36^D+1,00wr = 70; 0,36(100 — №r) 4-
4- 1 ,00u>r — 70;
0,64u»r = 31; u»R = 48,4r (чистое В).
IX-2-16. a) 74° C.
6) 87 вес. % В.
в) 1) 62 вес. % В.
2) ’/г (87 68) = 77,5 вес. % В (среднее между исход-
ным и конечным составами дистиллята). Пусть
wr — вес остатка, ощ —вес дистиллята и wr4-®d =
= 200. Вес В в остатке 4- вес В в дистилляте = 150 г,
тогда
0,62№r 0,775ищ == 150;
0,62(200 —u»d) + 0,775u»d= 150; .
0,155u»d — 26;
Wd = 168 г.
IX-2-17. а) Остаток —20 вес. % А.
б) Весь дистиллят ~ >/2 (91 + 71) = 81 вес. % А (сред-
нее между исходным и конечным составами пара),
в) Пусть a»R — вес остатка; — вес дистиллята.
В исходной смеси находилось 49 вес. % А.
wd + a»R = 200;
0,20шк 4- 0,8 Iwd = 0,49 • 200
(общее количество А);
0,20(200 — ищ) 4" 0,81 = 98; 0,61 wd = 58; u’D = 95r.
IX-2-18. a) 82° C.
6) 90 вес. % В (87° С).
в) ‘/г (60 4-70) = 65 вес. % В (среднее между исход-
ным и конечным составами дистиллята).
г) 82° С; 60 вес. % В (эвтектика).
IX-2-19. Пусть [или fB(nap)] — весовая доля В в жидкой
(или газообразной) фазе соответственно.
Общий вес В равен
wb = fa (ж) (у w} ^в (пар) (у w) ’
где w— общий вес В в смеси и ’/2w — вес каждой
фазы.
320
Глава IX
Но wqIw = 0,40. Тогда
/В (ж) + Аз (пар) = 2wz/W = 0>80-
Из графика видно, что это условие удовлетворяется
при 77° С, когда few" 0,21 и (пар) = 0,59.
IX-2-20. См. рисунок.
IX-2-21. См. рисунок
llOOl------------
0 10 20 30 40 5 0 60 70 30 90 100
Au Am.%Pb рь
Правило фаз
321
IK-2-22.
б) Пунктирная линия соответствует прибавлению
(NH4)2SO4 к Li2SO4 Н2О. Сначала образуются жидкий
раствор и LiNH4SO4. [(NH4)2SO4 „извлекает" Li2SO4
из гидрата, образуя двойную соль, а освободившаяся
вода растворяет обе соли с образованием раствора.]
В точке А весь гидрат израсходован и существует
только двойная соль и раствор. Эти условия сохра-
няются до точки Б, в которой будет существовать
раствор, насыщенный обеими солями LiNH4SO4 и
(NH4)2SO4. Прибавляемый с этого момента (NH4)2SO4
остается нерастворимым.
IX-2-23.
Мал.°/о h2so4
п Зак. 1360
322
Глава IX
1Х-2-24.
б) Из диаграммы видно, что система при —30° С
(пунктирная линия) проходит через следующие стадии:
лед + раствор; только раствор; H2SO4 • 4Н2О + рас-
твор; только твердый H2SO4 • 4Н2О; H2SO4 • 4Н2О
раствор; только раствор; H2SO4 • Н2О-j-раствор;
только твердый H2SO4 • Н2О; H2SO4 Н2О -)- раствор;
только раствор; твердая H2SO4 раствор. На диа-
грамме видно фактическое положение точек эвте-
ктики. Поскольку они не указаны в условии задачи,
их положение может несколько отличаться. Если бы
фаза Н2О -j- H2SO4 • 4Н2О имела точку эвтектики
выше —30° С, система оставалась бы твердой до тех
пор, пока содержание H2SO4 не будет выше 20 мол. %.
Прибавленная H2SO4 будет соединяться со льдом,
образуя H2SO4 • 4Н2О. Затем, когда эта реакция завер-
шится, будет образовываться H2SO4 • 2Н2О (при пред-
положении, что превращения твердое тело —твер-
дое тело возможны). Аналогично, если бы фаза
H2SO4 • Н2О + H2SO4 имела эвтектику выше —30° С,
то прибавление свыше 50 мол. % H2SO4 было бы
простым добавлением твердой H2SO4 к другой твердой
фазе H2SO4 Н2О; жидкость не появлялась бы.
См. рисунки. Температуры и составы эвтектик вы-
браны произвольно.
1Х-2-25. а) и б) См. рисунки. Следующие процессы соответ-
ствуют условиям пункта (б):
1) охлаждение жидкого расплава;
Правило фаз
323
2) медленное охлаждение, потому что Ан кристал-
лизуется и выделяется теплота плавления;
3) точка эвтектики; температура остается постоянной
до тех пор, пока вся жидкость не превратится в твер-
дую смесь Ан и AuSb2;
4) охлаждение твердой смеси.
в) Прибавление Y к чистому X, как обычно, умень-
шает температуру затвердевания X. Однако начальный
наклон кривой затвердевания равен пулю (в макси-
муме). Это свойство является характеристикой твер-
дого вещества: температура затвердевания чистого со-
единения в присутствии продуктов разложения (Au
и Sb) падает ниже гипотетического значения (пока-
зано пунктиром).
IX-2-26. а) и б) См. рисунки.
324
Глава IX
IX-2-27.
Отрезки кривой для пункта (б) соответствуют сле-
дующим процессам:
1) охлаждение жидкого расплава;
2) выпадение кристаллов CaF2 из расплава;
3) точка перитектики; CaF2, CaF2-CaCl2 и расплав
находятся в равновесии;
4) кристаллизация CaF2 СаС12 из расплава;
5) точка эвтектики; CaF2 • СаС12, СаС12 и расплав
находятся в равновесии;
6) охлаждение твердой смеси CaF2 • СаС12 и СаС12.
а) См. рисунок. С] и С2 — соединения.
б) С], 56,7 вес. % Си:
Д6’3. = 0,892 г-атом Си; Д3’3. = 1,78 г-атом Mg;
63,54 ’ 24,31 °’
4g-=2; CuMg2.
С2, 84,5 вес. % Си:
-——-==1,33 г-атом Си; *5’5, =0,64 г-атом Mg;
63,54 24,31 ’
W=2: С“Л-
Правило фаз
325
IX-2-28.
а) Построим график зависимости lg Р от 1/Г для
твердого SnBr4 и такой же график для жидкости
(см. рисунок).
1/ГЮа
Точка пересечения дает значения lg Р и МТ для трой-
ной точки. Вообще правильнее строить зависимость
lg Р от \/Т, а не Р от Т, потому что зависимость
lg Р от \/Т является прямолинейной и может быть
экстраполирована, тогда как зависимость Р от Т вы-
ражается кривой и две данные точки недостаточны
для построения графика этой функции. Точка пере-
сечения находится при Т = 308° К.
Твердый SnBr4 Жидкий SnBu
t, °C 9,8 21,0 30,7 41,4
т, °к 283,0 294,0 303,9 314,6
1/Г 0,003534 0,003399 0,003291 0,003179
Р, мм рт. ст. 0,116 0,321 0,764 1,493
lg Р —0,9355 —0,4935 -0,1169 +0,1741
б) Алгебраический метод. Интегрируя уравнение
Клаузиуса — Клапейрона, имеем
I Ра — А/7ТВ / 1______1\ ,
lg Рх ~~ 2,303/? \ Т2 TJ'
0,321 - АЯсубл /1 1 \
lg 0,116 “ 2,303-1,987-10~3 \ 294,2 283,0/’
Д//субл=15,0 ккал (по литературным данным
15,13 ккал • моль-1).
326
Глава IX
Графический метод. Из уравнения Клаузиуса — Кла-
пейрона при неопределенном интегрировании получаем
1g Р = - у + const.
Это значит, что зависимость lg Р от 1/Г должна вы-
ражаться прямой с наклоном —&H/R. Таким обра-
зом, наклон линии сублимации — Д//су6л/4,58. Наклон
может быть определен графически, а затем можно
рассчитать ДЯСубл-
в) Рассчитаем ДЯпар так же, как и ДЯсубл, т. е. спо-
собом, описанным выше. Тогда
== Д^субл А//Пар == 15,0
— 11,9 — 3,1 ккал • моль-1;
0,764 _ - АЯпар / 1 1
lg 1,493 ~~ 4,576 • 10-3 \ 303,9 314,6
ДЯпар=11,9 ккал • моль-1.
IX-2-29.
Вычисленные таким образом величины 1/Г, Р, ДЯСубл
и ДЯпар отличаются от значений, полученных в ори-
гинальной статье, потому что в оригинальном иссле-
довании использовано больше экспериментальных
точек.
См. рисунок.
Правило фаз
327
а) Жидкость, 20 вес. % никотина.
б) Жидкость 7,3 вес. % никотина; жидкость L2,
82,0 вес. % никотина.
в) Жидкость, 20 вес. % никотина.
г) Жидкость L2, 90 вес. % никотина.
К — Wl/Vl
' (w — Wi)/v2 ’
где К — постоянная распределения, w — вес раство-
ренного вещества в фазе 1 перед экстракцией,
и»! — вес растворенного вещества в фазе 1 после пер-
вой экстракции; —объем жидкости 1; и2 — объем
жидкости 2.
Kv{(w — Wi) = WiV2-, Wi = W к-^~2
Аналогично вес растворенного вещества в фазе I
после п экстракций будет равен
-^2- = к = 0,05;
г> _ _ _ ' • '
Сс6н5
(2^Г=Ю-3; (-^-Г =103 = 21,0";
\ 52,5 / \ 2,5 /
n lg21,0 = 3,00; 1,32-п = 3,0; /1 = 2,3.
IX-2-31. а) Нет. Прямая, соединяющая В и А • Н2О, не про.
ходит через область, соответствующую А • В • 2Н2О.
б) 60 вес. % А, 30 вес. % В и 10 вес. % Н2О.
IX-2-32. а) См. рисунок. Проведем линии L1->RI, L2->R2 и
L3->R3 и продолжим их до пересечения. Точка пе-
ресечения дает состав твердой фазы (20 вес. % А,
54 вес. % В, 26 вес. % С).
A
б) 50 вес. % А, 44 вес. % В, 6 вес. % С.
IX-2-33. См. рисунок. Твердая фаза имеет следующий состав:
Н20
КГ nh4f
Правило фаз
329
IX-2-35.
б) Если система А-)-А • Н20 имеет давление парр
выше, чем система В + В • 2Н2О, то А • Н2О начнет
дегидратироваться с исчезновением последней капли
раствора (линия I). Когда дегидратируется все А • Н2О
(пунктирная линия II), давление падает до давления
пара системы В + В 2Н2О; затем дегидратируется
В 2Н2О. Наоборот, если система В + В • 2Н2О имеет
давление пара выше, чем система А + А-Н2О, то
сначала дегидратируется В • 2Н2О, затем А • Н2О
(пунктирная линия III). Каждая из этих линий, II
или III (но не обе), относится к диаграмме. Таким
образом, необходимы данные по давлению пара.
РАЗДЕЛ IX-3
IX-3-1. Чтобы фазовая диаграмма была правильной, коорди-
наты свойств должны быть функциями состояния
(т. е. их дифференциалы должны быть полными диф-
ференциалами). Известно, что t является свойством
состояния, но это необходимо доказать и для у. При-
меним правило о равенстве вторых производных
Эйлера к дифференциальному уравнению dy —
— f (t, v) dt g (t, v)dv. Получим
d \ / k \ _ -2k
dv / \ Л/2/’у2/з / 3.'M!,,'3u°/j
j3\ (-2k{tKp-t-&)
dt J\ ЗМ2/,К/з
— 2k
3AfV3 ’
330
Глава IX
Поскольку эти две производные равны, у является
свойством состояния и, следовательно, у и t дейст-
вительно будут координатами фазовой Диаграммы.
IX-3-2. Наклон каждой линии должен быть по величине
положительным (+) или отрицательным (—). Обо-
значим три фазы 1, 2 и 3 и произведем возможные
перестановки знаков следующим образом:
линия равновесия 1—2 + + + — + — — —
линия равновесия 2—3 + + — + — + — —
линия равновесия 1—3 + — + + — — + —
Всего таких перестановок получается восемь. Ниже
приведены соответствующие диаграммы.
- 12
IX-3-3.
Число компонент п = числу возможных компонентов
(составляющих); У — число независимых уравнений Е,
связывающих их концентрации, мольные доли и т. д.
Каждое независимое химическое равновесие, вклю-
чающее составляющие, описывается одним уравне-
нием. Условие, что раствор электронейтрален, также
может быть описано одним уравнением, если рас-
сматривать ионы как составляющие.
КС1—NaCl—Н2О
У = 3(КС1, NaCl, Н2О);
Е = 0;
n = N-£==3-0 = 3.
КС1—NaBr—Н2О
У = 5 (КС1, NaBr, NaCl, KBr, Н2О);
£=1; КС1 + NaBr #КВг + NaCl
n — N — Е — 5— 1=4.
Правило фаз
331
IX-3-4.
а) У=8 (NH4CI, NHJ, СГ, Н20, NH3, NH4OH, Н30+,
ОМ-);
£ = 5 (электронейтральность).
NH4CI NH4+ + СГ
NH3 + Н2О NHf + ОН"
NH3 + Н2О NH4OH
2Н2ОН3О+ + ОН" n — N-£ = 8-5 = 3.
б) У = 3 (NH4C1, NH3, НС1);
£ = 2; NH4C1^NH34-HC1
P.NH, = £hc1!
n = ?V- £ = 3-2= 1.
в) У = 3 (NH4C1, NH3, HC1)
£=1; NH4C1^NH3+ HC1
n = N — £ = 3—1=2.
r) У = 8 (CH„COONH4, СНзСОО", NH4+, H3O+, NH3,
OH", CH3COOH, H2O);
£ = 4 CH3COOH 4- H2O CH3COO- 4- H3O+
CH3COO" 4-H2O CH3COOH 4-OH"
NH4+ 4- H2O NH3 4- H3O+
(электронейтральность)
n = /V-£=8 — 4 = 4.
Уравнение 2H2O H3O+ 4- ОН" не учитывается, так
как оно может быть получено из первых двух урав-
нений.
Д) W=9(NaCl, KBr, КС1, NaBr, К+, Na+, СГ, Вт", Н2О);
£ = 5 NaCl#Na+4-Cl"
KBr К + 4- Вг (электроней-
NaBr^Na+4-Br" ' тральность)
NaCl 4- KBr NaBr 4" КС1
n = N — £ = 9-5 = 4.
e) /V = 6 (NaCl, KC1, K+, Na+, СГ, H2O)
£ = 3 NaCl Na+4-СГ 1
, > (электронеитральность)
КС1т±К+4-СГ j
п = У-£ = 6-3 = 3.
332
Глава IX
IX-3-5.
ж)М=4 (СаС12 • 6Н2О, Са2+, С1 , Н20);
Е = 2 СаС12 • 6Н2О Са2+ + 2С1" -ф 6Н2О (электро-
нейтральность)
n—-N -£=4-2 = 2.
з)М = 3 (СаСОз, СаО, СО2);
£=1 СаСО3 СаО+ СО2
n = N - £ = 3-1=2.
То, что СаО и СО2 присутствуют в стехиометри-
чески равных количествах, в данном случае не при-
нимается во внимание потому, что это не влияет па
состав фазы. Независимо от соотношения СаО и СО2
состав газообразной фазы всегда 100% СО2, а состав
твердой фазы всегда 100% СаО.
а) См. рисунок.
б) При откачивании воды состав изменяется по
вертикальной линии. Эта система проходит через сле-
дующие стадии:
Область Фаза (фазы)
L
MX • 2Н2О + L
MX • 2Н2О + MY. Н2О + Ls
MX - 2Н2О + MX + MY-H2O
MX + MY • H2O + MY
Ненасыщенный раствор > 14
Насыщенный рас- > 14, < 19
твор + MX • 2Н2О
Два гидрата + пасы- 14
щенный этим гид-
ратом раствор
Два гидрата + без- 13
водный MX
Две безводные со- 10
ли + MY > Н2О
Правило фаз
333
Трудность состоит в том, проводить ли линию между
MX и MY • Н2О или между MY и MX • 2Н2О. Когда
исчезнет последняя капля насыщенного двойного рас-
твора Ls, давление должно упасть до давления пара
MX + МХ • 2Н2О 13 мм рт. ст. (а) или MY + MY • Н2О —
10 мм рт. ст. (б). Если предположение (а) справедливо,
то MY • Н2О (стабильное при давлении большем
10 мм рт. ст.) будет существовать до тех пор, пока
весь MX • 2Н2О дегидратируется. Если же справед-
ливо предположение (б), то давление упадет до 10
мм рт. ст. и дегидратироваться будет МХ‘2Ы2О, будучи
нестабильным ниже 13 мм рт. ст. Но это невозможно.
Для удаления воды из MX • 2Ы2О требуется время.
Поэтому неправильно предположение (б). Справедливо
предположение (а). Когда Ls исчезнет, первым де-
гидратируется MX • 2Н2О (при 13 мм рт. ст.) Таким
образом, фазовая диаграмма должна показывать
область, соответствующую MX • 2Н2О, MX и MY • Н2О.
Когда исчезнет весь MX 2Н2О (при 10 мм рт. ст.),
начинает дегидратироваться MY • Н2О.
Глава X
ЭЛЕКТРОХИМИЯ
РАЗДЕЛ Х-1
х-ы. hn2o2 п+ са2 л д = = : а = -тт- > ch2n2o2 1 — а А Ah2o2n2 = 298 + 93 — 39,9 = 351,1. Для с = 0,03 а = 4тт =0,00290; 351,1 ’ у-о.оз =2,5з- ю-7. с 0,03 -0,015 0,0075 0,00375 0,001875 X К 2,53 2,56 2,58 2,55 2,53- 10~7 /(средн = 2,55 • 10~7.
Х-1-2. Е1—ЦР1', E2 — I2R2', Ез~ИР?,’, Еа = ЦР^. 1,К,=1Л-. «.= «; ^- = 4sr- 7| = х •
Х-1-3. Л°=4 + С; У- = Л°-Я°+=103,97—73,58=30,39 Ом”1 • см2 • г-экв"1; Г 30,39 Ло — 103>97 —0,292.
Х-1-4. Построим график зависимости Л от ]/с. Л = Л°, когда Ус =0; Л°= 114,3.
Х-1-5. ло= шоой £ = 2,06- 10-6 —- 4,1 • 10-7 = 1,65 • 10-6; С ’ ’ 10006 1000-1,65-10"6 , 1n-5 -I с = -дб- = 1И +43 = 1,07-10 г-экв-л = = 2,7 • 10~6 моль • л-1. По данным авторов статьи [67], которые использо- вали уравнение Онзагера, с = 1,02 • Ю-0.
Х-1-6. Нанесем на график зависимость Л от с1/г; Л°= 126,62.
Х-1-7. ч * 1000/г 9,000 —I 2 —I а) Л =—— = ^^-=90,00 Ом ’• см2 • г-экв б) = Л—Л+ = 90,00—39,5 = 50,5 Ом-1 • см2 • г-экв~‘.
Электрохимия
335
X-l-8.
____0Л00Л19650£____= 00100
9,65 • 104 Кл • фарадей-1 ’
фарадея;
0,100 моля АВ • 100 г Н2О
1000 г Н2О
= 0,0100 моля АВ.
В анодном пространстве:
исходных
образовалось
присутствовало в конце опыта
перешло
молей А+
0,0100
0,0100
0,0200
0,0165
0,0035
G’GQ35 ___„
0,0100 U,d0‘
Х-1-9.
calSF
t
+ —
, где
Х-1-10.
с — концентрация (г-экв • л-1); а —площадь попереч-
ного сечения трубы; I — смещение подвижной гра-
ницы (см); Q — количество прошедшего электричества
(в фарадеях).
, _ 0,0200-0,1115- 1,00-96 500 _ „ „ ,
+ 344-0,0016001 — 0,оУ1;
, _ 0,0200-0,1115-6,00-96 500
г+ 2070-0,0016001 — и,-эуи;
, _ 0,0200 • 0,1115 • 10,00 • 96 500 _ „
Г+— 3453-0,0016001 — и,о»У.
Среднее значение: t+ — 0,390.
а) Пусть с — концентрация (г-экв • см~3).
ск+ = 1,00 • 10~4 г-экв • см-3; /к+ = 0,490; /Na+ — 0,388.
4- = орЕ-.лЛ-1,00 • 10"3 фарадея.
SF 9,65 • 104 Кл • фарадей 1 ’ 1
Объем трубки, соответствующий передвижению гра-
ницы, равен
/k+Q/^ 0,490-1,00-10-3 фарадея , пп 3
ск+ cNa+ 1,00- 10“4 Г-ЭКВ • СМ-3 ’
336
Глава X
X-l-ll.
г1 « 4,90 см3 л л л
Смещение подвижной границы -Q смт = 49,0 см.
- ZNa+Q/£r 0,388 • 1,00 • 10—3 . пп з
б) --------—-----------------= 4,90 см3;
CNa+ CNa+
cNa+ = 7,92 • IO-'’ г-экв • см-3 =
= 7,92 • 10“2 моль • л-1.
Ионная сила I = Ск\о„ + 9S.
lg SIS, /г Vl -Vi,
0 0,01616 0
0,0572 0,02824 0,01208
0,0922 0,03637 0,02021
0,1483 0,04865 0,03249
См. график. Наклон прямой равен 4,94. Данные ло-
жатся на прямую. Наклон, предсказываемый тео-
рией Дебая — Хюккеля, равен 0,509 • 32 = 4,58.
lg Y+ == — 0,509z_|_z_ УГ
—0,0740 0,843
—0,1294 0,742
—0,1667 0,681
—0,2230 0,598
Электрохимия
337
Х-1-12. а) НА + Н+ + А--
1,0—1,0 х 0,8+х«0,8 \число молей тп при равновесии)
v _lV tn Л tn _
УН+УА~ Н+ А _ „
"'пл ~ ’
•iy^ = 3,3 • 10-4;
х = 4,1-10-4 моль • кг-1 = тн+.
аи+ = ун+ • mH+ = 0,65 • 4,1 • 10-4 = 2,7 • 10—4;
pH = — lg aH+ = 3,57.
6) mI|A — 1,0 — 0,5 = 0,5; mA-= 0,8 + 0,5 = 1,3;
= 3,3 • 10-4; у = 1,3 • 10-4 моль • кг-1 = тн+.
aI1+ = 0,65- 1,3- 10"4 = 8,3- 10-5; pH = 4,08.
в) mOH- = 0,5 моль • кг-1; a0II- = 0,65 • 0,5 = 0,33;
pOH = — lg 0,33 = 0,48; pH=14,00—0,48=13,52.
X-l-13. a) E° = = 0,05915 IgA = 0,05915 (—6,64)=
= —0,393B
E°, В
CuCI (тв)-> Cu+ + СГ —0,393
Cu+ + e~ —>Cu(tb) + 0,522
CuC1(tb)-|- e-—> Cu (tb) + Cl- + 0,129
б) E°, В
Cu(tb)+ СГ ->СиС1(тв)4-е~ -0,129
|C12 (г)+ e~ -+СГ +1,358
Си(тв) + уС12(г)->СиС1(тв) +1,229
AG° = — n&~E° = — 1 фарадей • моль-1 X
X 9,65 • 104 Кл • фарадей-1 X
X 1,229 Дж • Кл-1 • кал • Дж-1 =
—2,83 • 104 кал • моль-’.
338
Глава X
РАЗДЕЛ Х-2
Х-2-1. См. рисунок. Изгиб кривой зависимости А от с'/2 при
низких концентрациях показывает, что диссоциация
не закончена.
о ода 0,10 о,1о о,го о,го о.зо ода
с'/2
Х-2-2. f K=ka;l. Поскольку эквивалентная электропроводность
определяется как электропроводность объема раство-
ра, содержащего 1 г-экв электролита между электро-
дами, находящимися на расстоянии 1 см, то А = kaf\
и а численно равно объему, занимаемому 1 г-экв
раствора, или 1000/с. Следовательно, А== 1000 /г/с.
Х-2-3. Реакция па аноде: Н2О ->2Н+ + у О2 + 2е~. Обра-
зование 0,0100 г-ион Н+ означает, что через цепь
прошло 0,0100 фарадея. 0,005 моля = 0,090 г Н2О,
которая разложилась; этим количеством можно пре-
небречь (по сравнению со 100 г). 0,0100/+ г-экв
(или г-ион) Na+ ушло из анодного пространства;
0,0100/_ г-экв = 0,0050/_ г-пон SC>4+ перешло в анод-
ное пространство.
/+ = 0,39; /_ = 0,61.
В начале опыта в 100 г Н2О:
0,0500 г-иоп Na+ +0,0250 г-ион SOi*.
В конце опыта:
0,0500 -0,0100/+ =0,0461 г-иоп Na+;
0,0250 + 0,00500/_ = 0,0281 г-ион SO<+.
1,0787 г Ag п ninnn ,
Х-2-4. 167,87? Ag фарадей =°’01 000 Ф^адея.
В катодном пространстве (в 100 г Н2О'):
Электрохимия
339
Х-2-5.
в начале опыта 1,500 г AgX
в конце опыта 0,500 г AgX
изменение 1,000 г AgX
1,000 г AgX п А v
-,-^7-7;----—г = 0,00667 моля AgX.
150,0 г • моль-1 ’ ь
0,00667 моля Х~ уходит из катодного пространства:
i- 0,01000 ~' 0.667, t+ 0,333.
а) 0,00500 моля H2SO4, образованных на аноде,
X 2 фарадея X моль-1 = 0,01000 фарадея.
б) 0,01000 моля CuSOt присутствует в начале опыта
в анодном пространстве [0,1000 моля • (кг • Н2О) 'Х
X 0,1000 кг Н,О].
0,00800 моля CuSO4 присутствует в анодном про-
странстве в конце опыта
1 моля CuSO4 теряется в анодном простран-
I стве
0,00200 „ 2+
г• ион уходит из анодного простран-
ства.
0,00400 г-экв Си2+ переходит из анодного простран-
ства
, 0,00400 г-экв Си2+ _„ .
г+ ~ 0,01000 фарадея “ U’4UU- '
(Небольшую поправку следует внести на то, что
в анодном пространстве расходуется 0,00500 моля =
= 0,0901 г Н2О. Следовательно, количество Н2О,
присутствующей в анодном пространстве в начале
опыта, равно 100,0 + 0,09 = 100,1 г. В этом коли-
честве воды содержалось 100, 1/100, 0 • 0,01000 =
= 0,01001 моля CuSO4.)
в) 0,01000 моля CuSO4 (в катодном пространстве
в начале опыта)
— 0,00500 моля Си2+ (выделившихся на катоде)
+ 0,00200 моля Си2+ (перешедших в катодное про-
странство)
0,0070 моля 1 Cu2+ 1 в катодном пространстве
I CuSO4 J в конце опыта.
г) 133,6 Ом-1 • см2 • г-экв-1 • 0,400 =
= 53,4 Ом-1 • см2 • г-экв-1.
Мы приняли, что t+ в 0,1 м растворе равно в ра-
створе при бесконечном разбавлении.
340
Г лава X
Х-2-6. а) 4(1); 1 (2).
б) 0,01 моля.
\ шп л (1,015 — 1,000) моля ллП|- „
в) 100,0 г------юоо И О------= 0,0015 моля Fe посту-
пило в анодное пространство.
(Реакция па аноде не влияет па общее количество Fe.)
, , 4 г-экв • моль-1 0,0015 моля „ „„
г) Г_ = --------77777,7---------= 0,60.
' 0,010 г-экв ’
д) Я°_ = Л°+-^ = 73,52-^=110 Ом-1-см2-г-экв-1.
При расчете мы приняли, что число переноса и, сле-
довательно, отношение эквивалентных электропро-
водностей в 1 м растворе будет тем же, что и при
бесконечном разбавлении.
Х-2-7. Оставшийся Zn[2 образует комплекс с I-. Имеют
место следующие равновесия:
' Zn2+ + I~5±ZnI +
Znl+ + I- 7> Znl2
Znl2 + I- Znir
Znl:7 + T^Znl2-
При повышении концентрации преобладают ионы
ZnI7 и Znl2~, и, таким образом, Zn(II) движется
в направлении, противоположном движению поло-
жительного иона.
Х-2-8. dEt = ±^^-d\na±.
При исследовании ячейки можно заметить, что
с увеличением С) увеличивается Et (лучше поместить
слева анод); следовательно, будет знак +, когда
а± относится к левому (с,) раствору.
а±=10_4Л; 1g а± = — 4 + 1g А;
= 2 • 0,05915(+ = 0,11830*.;
d lg А ’ + ’ +’
Et = -0,043865 + 0,045363• lgА - 0,0014902 (1g Л)2;
= 0,045363 - 0,0029804 1g А;
dig 4 ’ ь
= TOW ifr = »-3834 - °.0252 Л =
= О 3834 -0,0252 1g(0,01 -0,905- 104) = 0,333.
Электрохимия
341
Х-2-9. In Y+ = — Am'1*; d In Yj. = —Am~':* dm-, i v mv . л v v dm . InX^ — ; dlnX,= ; n2 = m. In a2 — In (a^.) = v In (y±m±); In m± = In (const • tn);
Я» d\na2 — v din(Y±m±) = v (d In y± + d In m). Уравнение Гиббса — Дюгема: n, d In at + tn d In a2 — 0; «j (d In y, + d In X,) + mv (d In y± + d In tn) — 0; rtj d In Yi — v dm —^-Avm1'2 dm + v dm = 0; ,, Аут'1г dm rflnY>~ 2rt) •> In Yi = f nt'1* dm = 11 2/ti J 3/ti 0
Х-2-10. a) a+a_/aAgCI = 1,71 • 10~'°. По условию aAgci=l’ Тогда a2± = a+a_= i>7i . io-IO; a±= 1,31 • 10-5. 6) -^7= lim — = —- — 0,018016, где X — мольная a± m->0 tn 1000 доля Ag+ или Cl- и Mj — молекулярный вес H2O. a{*} = 1,31 • Ю-5 • 0,018016 = 2,36 • 10~7.
Х-2-11. Пусть u=^r-. 1 +1/s , v+ lg YM + V_ lg Yx (v+Zm + v-zx) , lgv«- v++v_ - ,++,_ + + V. + v_ li B^im\ + V+ + v_ S T t- T j
342
Глава X
Пусть z+ = zM и z_ = zx. Подставив в первый член
уравнения условия электронейтральности v+z+ -J-
+ v_z_ = 0, получим
lg Y± = U (- z+z_) + £ Вмх mx. +
+ i
+ v+ + v_ S
X-2-12. HA + H2O H3O+ + A"
0,010(1— a) 0,010a 0,010a (моль*кг~1)
Y±«h3o+«a~ = = j а. _ у2±(0,010а2) .
«на ’ ’ 1-a ’
a1 _ К _ 0,147
1-a O.OlOyt y±
X-2-13.
Первое приближение:
Z = 0, Y±=l, a2+0,147a — 0,147 = 0; a = 0,317.
Второе приближение:
Z = 0,01 • 0,317 = 3,17- IO'3; /7 = 5,63- 10-2;
lg Y^_ = 2 lg y± = 2 • 0,509 • 1 - (-I)-5,63- 10~2 =
= -5,73. t0-=; v’t = 0,876; 7^=^-
= 0,168; a = 0,334.
а) HA + e"->A"+ -|h2 E° = ?
-i-H2->H++e~ £2 = 0
HA 5±H+ + A“ E;=(£7’/Sr)lnAa =
О О о
= Ej + E2 — E1
E° = 0,05915 lg (3,3 • 10-4) = —0,206B.
6) z = y(l,00 -22+ 2,00- l2) = 3,00; /7= 1,73.
Пусть
. , , - 0,509 VT
lg Y = lg Yh+ = lg Ya- ~ ; ^7-.....=
0,509- 1,73
2,73
= —0,322;
Y = 0,476.
Электрохимия
343
Х-2-14.
1 к- __ aH+aA_
Yha^1’ «а~ анл
wi.+mA- = Ха = 3,3-IQ-4
'«HA Y:
YzmH + m
---Г — = Ка,
mIIA
0,4762 1.46-10
,-з
НА Н+ + Л~
0,200(1—а) 0,200а 0,200а
0,200а2 । . с* «а^ 1 л~“3 Т7 ।
_ а = 1,46-10 ; j _ а — 7,3 • 10 . Если а <С 1, то
а =7,3 - 10"3 и а = 8,5 • 10"2.
Или с более высокой точностью:
а2 + 7,3 • 10~3а - 7,3 • 10“3 = 0;
а = 8,2- 10'2.
а) Равновесия:
Н2СОз Й+ + НСОГ;
ГПггл.т - и+ HCOq 7 2_ = /<, = 4,30 • 10~7. тп!со3 (1)
НСО3~^Н+ + СО23_;
mu+m 2- н со2 2-= /<2 = 5,61 - 10-11. пг _ z ’ нсо“ (2)
Н2О Н+ + ОН"; ти+тои-==^н2о= 10-14‘ (3)
Баланс зарядов: mNa+ + mfl+ == miICO- + 2mC02- + '"ОН- (4)
Материальный баланс: «H^ + ^i^ + ^cor^0,105 (5)
игХа+ == 0,10. б) Примем, что тн+, тон- mn,cos’ mco2-' (6)
Тогда из (4) и (5) с использованием (6) получим
0’10 = mHCO- + 2mCo2-; (4'}
тн2соа + тнсО- + тсо2- = 0’10- (5/)
О О
344
Глава X
Из (4') и (5'):
/ИС0Г = /ПНгС0, = ДС-
Из (4):
milco3- = 0>1°-2x-
Умножим (1) на (2):
m{l+ = = 2,41 • Ю-'7;
mH+ = 4,9- 10-9 моль-кг-1.
Разделим (1) на (2):
т2
НСОГ _ К. .
т т 9 Кг ’
н2со3 со3~
(О.-Ю-2< = 7 66 . j0з. 0,10-2х = 87 g
X2 X ’
х ~ 1,1 • 10-3 моль • кг-1 = m >—
со3
Х-2-15. а) Равновесия:
т,.лт _
——!_ = 3,5-10-4; (1)
mIIF
-^^^- = 7- 10-6; (2)
шв
тн+тон~ ~ 1,00 ' Ю"14« (3)
Баланс зарядов:
тн+ + пвн+ = тон- + mF~' (4)
Материальный баланс:
miiF + т1.- = 0,100; (5)
mB +твн+ = 0,200. (б)
б) Примем, что m[I+, тон- < ^вн+> mF_*
Тогда
/«BIl+ mF- = Х’
пгИ!? = 0,100 — х; (5')
т& = 0,200 — х. (6')
Электрохимия
345
Умножим (1) на (2): ОТИ-ОТНН + /<11£ = 2 45 . 10-9 mF-mBH+ = 2 45 . 105 ИЛИ (0,100 — х) (0,200 — х) — 2>45 10 • Пусть у = 0,100 — х. Тогда х = 0,100 — // и 0,200 — х = 0,1ОО + У- -^—^^- = 2,45- 105. 1/(0,100 + у) Примем, что у < 0,100, тогда 77=—= 2,45 • 10 ; // = 4,1-10 моль-кг = тнп. О,1ОО(/ Hr mF- = 0,100— // = 0,100 моль-кг-1; m 4 «нг 3,5- IO’4-4,1 • IO"7 m„+ = 3,5 • 10 = —= = H m 0,100 = 1,4 • IO-9 моль-кг-1.
Х-2-16. а) Никотиновая кислота — НА; хинолин — В. Равновесия: 0,702m +т НА^*Н+ + А-, У—— = 1,4-10-5; (1) тНА В+Н,о?± ВН+ + О1П, -°’70 ОТ^Н^—--2 = 8,7• 10-6; (2) н2о?*н+ + он-, 0,702тн+тои- = 1,00 • 10-14. (3) Баланс зарядов: твп+ + тк+ + mil+ = тл- + ша- + тон-. (4) Материальный баланс: тНА + тл-== 0,050; (5) пгв + твн+ = 0,100; (6) шк+ = 0,050; (7) та- = 0,100. (8) б) Примем, что mI1+, mofI_ < твц+, mA-- Тогда mBH++ 0,050 = mA-+ 0,100. (4')
346
Глава X
Пусть x = tnA-t тогда
твн+= 0,050 + x; m11A = 0,050 — х, (5')
тв = 0,100 — /ивн+ = 0,050 — х. (6')
Умножим (I) на (2) и разделим на (3):
0,7°4отн+ОТА-тВН+шОЦ- _ 1,4- 10~5-8,7- 10~6 .
0,702m11A/nBmH+mOH_ 1,00-10~14
—=2,49-104; + $- =2,49-104.
тнАтв (0,050 — х)2
Ясно, что 0,050 — х « 0. Пусть у = 0,050 — х. При-
мем, что у <С 0,050, тогда
х = 0,050 —у « 0,050; 0,050 + х = 0,100 — у ~ 0,100.
0.050.0.100 _
У2
у = 4,5 • 10~4 моль-кг-1 = тНА
(более точно: у = 4,45 • 10-4).
тА_ = 0,050 —у = 0,0496 моль-кг-1.
Из (1):
1,4- 10 ,
тн+- 0,70^ _ = 2’6'10 моль-кг .
А
Х-2-17. a)Q + H+#QH+
mQH+~0,10; тС1- = 0,10; /«0,10; /7 « 0,32.
Пусть Yj = ун+ = Yqh+ = Yci~ “ Yoh_> Y2==YqH2+-
!gYi-- 0’5°9^ =-0,123; Yl =0,753.
lg Y2 = - 0,509,22 КГ. = -0,492; у2 = 0,322.
S Y2 1+|// , > Y2
б) Равновесия:
2
Q + H2O QH+ 4- ОН"; =
mQ
= Л1 = 2,0 • 10"6. (1)
Электрохимия
347
+ 2+ W"Wmon-
QH + Н2О QH2 + ОН"; ---------—--------=
V,mQH +
= /С2= 1,35 • 1О“10. (2)
Н2О Н+-|-ОН-; уХ1+тон- = /<н!о=1>00-10_14- (3)
Баланс зарядов:
mQH+ + 2mQH2+ + mI1+ = mcl- + /ион-. (4)
Материальный баланс:
mQ + mQH+ + mQi12+==0-1°; (5)
ma- = 0,10. (6)
в) Примем, что тн+, топ- < mQ, mQH2+. Тогда
с использованием (6) из (4) и (5) получим-
mQIl+ + ^mQll2+ 0’10’
mQ + ^QH+ + mQHl+=0’10
mQ-mQ^ = 0
Пусть x = mQ = mQH2+. Тогда
Умножим (1) на (2):
2 2
ИУ2 qh+ он QHq
-----------------— = КхК2-
mQmQn+
2 — __ 2,0- 10~6- 1,35- IO-10
m°H- — y?y2 0,7532 • 0,322
mQH+ = 0,10 — 2x.
1,48 • 10"15;
mm- = 3,8 • 10 8 моль • кг
Разделим (1) на (2):
vKh+otoh- . Чн+ K.V2 .
V2",QOTOH2+m0H- K2 ’ mQmnH2+ ’
«^4*2 w1 *2
(0,10 —2x)j |Q3. 0,10 — 2x gl,?.
x— 1,08 • 10 ’ моль • кг 1 —mQ.
348
Глава X
Х-2-18.
а) Миндальная кислота — НА, /г-анизидин — В. При-
мем, что реакция завершена:
0,040 НА + 0,060 В-> 0,-040 ВН+ + 0,040 А" + 0,020 В.
/ « 0,040; УТ ~ 0,20;
. — 0,509z2l<T —0,509-I2-0,20 nnQ,Q
1g у ~------7=— —---------------= —0,0848
1+У/ 1,20
у = 0,823 для любого иона с зарядом ±1.
б) Равновесия:
.Ш
НА^Н+ + А-; --------У—— = 4,29 • 10"4. (1)
тнл 2 ' ’
В + Н2О ВН+ + ОН-; .УИвн+ОТ^~ =5,13 • 10~6.
тв
(2)
Н2О Н+ + ОН"; y2mH+m01I-= 1,00 • 10-14. (3)
Баланс зарядов:
твн+ ”1” тн+ тл~ тои—
Материальный баланс:
m\\\ + тА~ = 0,040;
/ив -j- твн+ = 0,060.
в) Примем, что тн+, пгОн- <С твн+, тА—
Тогда
твн+ = тА-=*;
тНА = 0,40 — х;
тв — 0,60 — х.
Умножим (1) на (2) и разделим на (3):
у4т11+ОТА-ОТВ11+т011- 4,29 - 10~4 • 5,13 • 10-6 .
^НАтвтн+т0Н- ~ 1’°°-1°-П ’
(4)
(5)
(§)
(4')
(5')
(6')
(0,040 — х) (0,060 — х)
Ясно, что 0,040 — х 0. Пусть у = 0,040 — х. Тогда
х = 0,040 — у, 0,060 — х = 0,020 + у,
(0,040 - yY
у (0,020 + у)
= 3,25- 105.
Электрохимия
349
Примем у<СО,О4О. ^|t = 3,25- 105; 0,020г/ у = 2,46 • 10~7 моль • кг-1 = шна! г/<^0,040, как и предполагалось. т.~ = 0,040 — у — 0,040 моль • кг-1. Из (1): 4,29-10 4»гНА „ _j mH+ — j = 3,90 • 10 моль • кг . н у2т __ ’ А
Х-2-19. а) Глицин —НА; глицин-ион — Н2А+. Для завершенной реакции: 0,100 НА + 0,040 Na+ Д- 0,040 ОН- ->0,040 Na+ 4- + 0,040 А- + 0,040 Н2О + 0,060 НА. I « 0,040; //=0,20; , -0,509-I2 УТ ппй.„ 1ст v = т= = —U,0848 к у 1 + Г7 у = 0,823 для любого иопа с зарядом ±1. б) Равновесия: Н2А+Н++ НА; —н+'”н^- = = 4,47 . ю~3. (1) mH,A+ у2т +т _ HATtH+ + A-; S—— = К2=1,66- 10-10. (2) тНА Н2О^Н+ + ОН-; у2тн+тон- = 1,00-10-14. (3) Баланс зарядов: mNa+ Т mH,A+ Т тн+ = т\- ^он-’ (4) Материальный баланс: тнл+ + тнл + тА- = 0,100; (5) mNa+ 0>040. (6) в) Примем, что /пн+, отон-</тгНА+, тл-. Пусть х = тНгл+- ТогДа т\~ ~ 0,040 Т х\ (4') Шна = 0,100 — .г — (0,040 Ь х) = 0,060 — 2х. (5')
350
Глава X
Разделим (1) на (2):
ти + т11А
^тн:.А + т1, + т
тНЛ
2,69- 107;
Л?2
, (0,060 - 2х)2
-= 1,82-107; 1,82 • 107.
тн,А+тА- х (0,040 4-х)
г) Примем, что х<С0,030.
S~ = 1,82- 107;
0,040х * ’
х — 4,95 • 10-9 моль • кг-1 = т[[ Л+.
Х-2-20. a) Pb |PbBr2(TB)|CuBr2(aq, 0,0100м)|Си.
б) т± = (0,0100 • 0,02002)'/з = 0,0100]/4;
1g т± = —2 4- ‘/з 1g 4 = — 1,799;
£ = Е° - — Inf---------Щ =
23^ I 9.crn - /
\ Сц2+ Вг /
„о । 3RT , --,0 . 3RT (. «I х
- Е 4- In а± = Е + (In у± 4- In m±) =
= Е° + 3/2 • 0,05915 (lg у± 4- lg m±) =
= E° 4- 3/2 • 0,05915 (-0,150 - 1,799) =
= E° —0,173;
E° = E 4- 0,173 = 0,442 4- 0,173 = 0,615 B.
в) E°, В
Pb-» Pb2+4-2e- 4-0,126 (из табл. X-l)
Pb Br2 4- Cu -> Pb 4- Cu2+ 4- 2Br- -0,615 [из (6)]
Cu2+4- 2e- -> Cu 4-0,337 (из табл. X-l)
Pb Br2-»Pb2+4- 2Br- -0,152
« = W=-5-W; «-7.2-10-.
X-2-21.
Na (тв) Na+ (в C2H5NH2) + e~ 1
Na+ (в C2H5NH2) 4- e~ Na (в Hg) j
Na(B Hg)—> Na+ (aq) + e~ |
у Hg2Cl2(TB) 4- -* Hg(>K)4-Cl- (aq) J
Na (тв) 4- Hg2Cl2 (тв) Na+ (aq)4~C1~ (aq)-|-Hg (ж)
Е, В
4-0,8453
4-2,2676
4-3,1129
Электрохимия
351
Х-2-22.
Е — Е + -у- 1п (т±/п±)хаС1 =
= 3,1129 + 2 • 0,05915 [-0,1019 + 1g 0,1005] =
= 2,9820 В.
Е°, В
Na (тв) -> Na+ (aq) + е~ —х
| llg2Cl, (тв) + е- -> Нё(ж) + СГ (aq) +0,2676
2,9820
х——2,9820 + 0,2676 = —2,7144 (табличное значе-
ние: —2,7132 В).
a) Zn -> Zn2+ + 2е~
PbSO,j + 2е— -> Pb + SO2-
Zn + PbSO4 -> Pb + Zn2+ + SO2-
6) aZn2+aso2- = (v+m) (y_m) = y2±m2;
E = E° - In (y>2) = E° - in (y±m).
в) Пусть E' = E + y-ln m = E° — In y±;
E°— limE'.
ш->(>
пг У т Е'
0,001000 0,03162 0,41969
0,005000 0,07071 0,42987
Согласно предельному закону Дебая — Хюккеля, In у±
должен быть пропорционален Уm . Таким образом, Е'
должна быть линейной функцией Ут: Е' = Е° +
+ k Ут.
0,41969 = £° + /г (0,03162)
0,42987 = £° + k (0,07071)
0,01018 = k (0,03909)
/г = 0,2604; Е° = 0,4114бВ.
Можно построить график зависимости Е' от У~т и
провести экстраполяцию к Ут — Q. (Приемлемое
352
Глава X
значение 0,41089 В [114], однако необходима поправка
на предельную растворимость PbSO4.)
г) ~ 1пу± = £°-£' = 0,4 П 46 -0,42987=-0,01841;
, 0,01841 п оно п лоо
lg Y±— 0,05915 — °’3113; Y± — °>488.
Х-2-23.
ДО298 - 53,41
а) 1п К298 =-----— =-----------=----= -90,2.
' 298 RT 1,987 • 10 3 • 298
т
ЬНт = ДЯ°298 + J ДСр dT =
298
= +53,22 - 8,7 • 10~3 (7 - 298) =
= 55,8 — 8,7-10-37 ккал (если принять, что
ДСр не зависит от Т}.
т
In /+ = 1п 7^298 + у j bHrlT2dT=*
298
= -90,2 Н--------!----г f - 8,7 •10~3>) dT --
1,987- IO-3 J \ Т2 Т )
298
= —90,2 + 2,81 • 10<( 29g — у) — 4,4 In 298 =
= 28,8 - 2,8у—4 - 4,4 In Т.
б) Пригодна цепь Ag(TB)| Ag2SO4(aq) |РЬ (тв). В этой
цепи процесс
2 Ag(TB)+PbSO4(TB) -> Pb (TB)+2Ag+ (aq) + SO4- (aq)
идет фактически обратимо, поскольку Е < 0 около-
комнатной температуры для любой приемлемой кон-
центрации Ag2SO4. ЭДС цепи:
ln (aAg+aso2-)252“ па±’
Далее, а± = Y±m± — N±V 4m .
Предельный закон Дебая — Хюккеля дает 1п󱫻
« — В ]/т, где В —известная постоянная для дан-
Электрохимия
353
них температуры, растворителя и типа соли. Пусть
Е' = Е 4- (3 In m + In 4 — ЗВ ^пг), тогда
£' = £°--|§^(1пу± + В/т)
и
lim Е' = Е°.
т-»0
Затем измеряем Е (таким образом, и Е') цепи с пос-
ледовательным уменьшением моляльности Ag2SO4m.
Строим график зависимости Е' от tn и проводим
экстраполяцию к т = 0 (см. рисунок). Окончательно
, „ 2&~Е°
1пЕ= —
К х = а<Х)^а(Х)2 ;
Ag+ SO^
0,018.
Ag+ SO^
a(m) mUnW 1000
x)">0
^ = (0,018)4 = 5,83 • 10-6.
l\m
X-2-24. a) j H2 (r) + AgBr (тв) -> H + + Br~ + Ag (тв).
б) E = E° - In (aH+aBr-) = E° - in
= £°-^ln(Y±C);
Е° = Е + In (Y±C) = Е + 0,1183 (lg Y± + lgс).
Предельный закон Дебая ~ Хюккеля:
1g у± 0,5091 j/c.
Пусть Е°' = Е - 0,06023 /Г 4- 0,1183 1g с.
12 Зак. 1360
354
Глава X
Предельный закон предполагает, что Е°' ~ Е°.
в) (1) (2)
Е°', В 0,07110 0,07091 (см. рисунок)
Е° = 0,0713 В.
. Е° — Е — 0,1183 1gс п пола
г) 1g У* =------671183 -0.0248;
у± = 0,944; (1)
lgy± = - 0,5091 |Л37,19* 10-2=—0,0311;
у± = 0,931. (2)
Х-2-25. у Н2 + А^Вг <тв> <тв> + н+ + Вг-;
Е = Е° - In (а~а+) = Е° - In (Y±m)2 =
™ 2RT , 2RT .
= ЕГ-----дг- In у±--— In т.
Так как m->0, Y±-* 1, то —^-1пу±->0 и
Е°= lim ГеIn ml.
/m->0
Построим график зависимости E 4- (2^/^) In m
от У tn и проведем экстраполяцию к |/m=0 (см.
рисунок).
ао«ог
е 0,078 ^аоЛ ♦ 0,874 0,072 0,010 1 *— 1 1 -л t « 1 > 0 орг Ц04 0}К про 0,10 0,12 О,п Ц16 0,18 оро
Электрохимия
355
m
Е + (2ДГ In m
0,005125 0,0749
0,010021 0,0762
0,015158 0,0771
0,02533 0,0782
0,03006 0,0790
Х-2-26.
£” = 0,0722 В (по литературным данным 0,07106 В).
Можно построить также зависимость
Е' == Е ч- In tn 4- In Y±,
где у± вычисляется из предельного уравнения Дебая —
Хюккеля. Этот вариант лучше, так как Е° — Е'=£0.
Только поэтому наблюдается отклонение от предель-
ного закона. В _этом случае строят зависимость
от пг, а ие от \ftn, так как In у' (и, следовательно,
Е° — Е') приблизительно линейно зависит от пг.
Е°, В
-0,0216
-1,8562
4-0,7458
-1,1320
Х-2-27.
12*
Реакции в цепях:
а) 1Н2 4- j Hg2Cl2 Н+ 4- Hg 4- С1-
б) Hg 4- Na+ 4- Cl" -> j Hg2Cl2 4- Na
в) Na 4- C2H5OH -> 4 H2 4- ОДО" 4- Na+
C2H5OH -* H+ 4- C2H5O"
£” = 0,05915 Igtf;
lg К = = —19,138 = 0,862 - 20;
K = 7,28- IO-20.
a) H2 4- A" 4- Ag Cl -> HA 4- Cl" 4- Ag.
~ i mHAmCl"YHAY±NaCI
6)E-E°= —In------------m —-------------
A r±NaA
__i mHAmNaClVHAV±NaCI .
^NaAYjfcNaA
P_L In OTHA^NaCl =
1 & mNaA
Я7 , YHAV±NaCI
Г “ V±NaA *
356
Глава X
Е" может быть рассчитано из измеренных количеств,
если НА достаточно слабая кислота, чтобы тнл
и mNaA могли быть приняты равными общей моляль-
ности. Приготовим серию ячеек с различными мо-
ляльностями NaCl, NaA и НА и построим график зави-
симости Е" от I (от УТ), lim Е" = Е°. Поскольку
/->о
Yha =« 1 и Y±Naci Y±NaA> приближение к Е° будет
в этом случае идти достаточно быстро.
B)4-H2 + AgCl->H+ + Cl-+Ag,
Е' = ln (m±HCiY±nci)2 >
где m'±HCI = = lmHci (тна + mNaci)]'/2-
Пусть Е”' = Е' + In (m'±Hci) = Е°' - In y±hci-
Построим зависимость Е' от /. В этом случае Yi
отложим по оси абсцисс, тогда
lim£"' = £°.
г->о
г) Р1|Н2(1атм)|НС1, NaCl, Н2О|AgCl|Ag|AgCl|НА,
NaA, NaCl, Н2О|Н2(1атм)|Р1.
д) Для цепи (г) стандартной ЭДС является Е° —Е°.
Измеренной ЭДС будет Е' — Е. Комбинируя ответы
(б) и (в), получим
cz п по' I по OT±HClY±HClOTNaAY±NaA
OTHAmNaClYHAY±NaCI .
r-r rv/zz п/ п । 1 m±HCIOTNaA
Пусть Е' - Е - Е + In „нд„ма<;| -
— Б°' —Е° —-g-ln T*"clT;aS4-.
VHAViNaCl
Построим зависимость Е"" от тогда
lim Е"" = Е°' — Е°.
Г->0
Реакция для цепи (г): HA^tH+4-A“ или
НА + NaCl НС1 + NaA.
Соотношение между ее константой равновесия К. и
(£°/ — £°) имеет вид
1ПД цт ' .
Электрохимия
357
Х-2-28.
а) /=‘/2 (0,00500-22 + 0,01000 • 12) = 0,01500;
/7=0,1225;
lgY± = -0-Y^y^l// =—0,1111; Y± = 0,774.
б) m± = ^пгпч+т2сгУ3 — -0,00500.
Zn + Hg2Cl2-> Zn2+ + 2С1- + 2Hg;
£=£-_^1„(02п2Л1.) =
= e° - -§£-111 a± = E° ~ 111 (y±™±)=
= E° - 3/2 • 0,05915 (-0,1111 + 7з lg 4 + lg 0,00500);
1,2272 = E° + 0,1964; E° = 0,0308 В.
в) Zn -> Zn2+ + 2e~
Hg2Cl2 + 2e- -> 2Hg + 2C1-
Zn + Hg2Cl2-> Zn2+ + 2C1- + 2Hg
Х-2-29.
Cd QG) -> Cd2+ + 2e-
+0,7628
+0,2676
E° = l,0304B
Cd2++ 2e~-> Cd (Л2)
Cd (X!) -* Cd (X2)
£ = 7F°-^ln-^ = 0-g,(ln^ + ln^) =
z.£r Uj Zcr \ yi A| /
0,05915 /. y, . . X, \
= —— ig -£- + igy-
* \ у 2 л2 /
а) Для идеального раствора:
, г 0,05915 , / 1,75-10-2 \ nnt-nier,
Y1 = Y2=1 и Е=—-—lg 1’75- io—) = 0,05915 В.
IrrJL— 25 |„ _ 2-0,05926
) g у2 0,05915 g Х2 ~ 0,05915 2
== 2(0’059оо59|0б’05915) = 0-00 37; = 1,0086.
U,(Jo91o у2
Х-2-30.
Для расчета ЭДС полной реакции необходимо сум-
мировать ЭДС полуреакций. Однако такой расчет
справедлив при равном числе электронов в обеих
полуреакциях (задача Х-3-11). В данном случае сло-
жим Дб° или, что проще, — (^G°/^~) = пЕ°:
п Е° пЕ°
2Hg->Hg2+ +2е~ 2 -0,7986 -1,5972
2Hg2+ + 4e~->2Hg 4 . +0,854' +3,416
2Hg2+ + 2е~ -> Hg2+ 2 + 1,819
Е° = -Ь^1 = о,91О В.
358
Глава X
Х-2-31.
Fe-»Fe2+ + 2е~
Fe2+->Fe3+ + е~
Fe->Fe3+ + 3е-
+0,440 • 2 = 0,880
—0,771 • 1 = — 0,771
3£°= 0,109
£°== 0,036 В
Е° — стандартный потенциал новой полуцепи.
Х-2-32. --------------2-----------------------------------------
V V AV Е &.Е ДЕ/ДУ
0 0,025 0,05 -570 5 100
0,05 -565
0,10 0,1 5 50
0,15 0,175 0,05 -560 30 600
0,2 0,225 0,05 -530 40 800
0,25 -490
0,3 0,275 0,05 -440 50 1000
0,325 0,05 370 7400
0,35 0,375 0,05 -70 120 2400
0,4 0,450 0,1 50 15
150
0,5 65
1,500 2,0 25 13
2,5 90
4,4 3,450 1,9 110 20 И
5,450 2,1 10 5
6,5 7,600 120 10 5
2,2
8,7 9,500 130 10 6
1,6
10,3 140
10,4 10,350 0,1 150 10 100
10,5 10,450 0,1 170 20 200
10,550 0,1 180 1800
10,-6 350
10,700 0,2 20 100
10,8 370
10,9 10,850 0,1 390 20 200
Н,1 11,000 0,2 420 30 150
11,325 0,45 20 44
11,5 440
Электрохимия
359
На графиках показаны зависимости £ от И и ДЕ/ДУ
от V.
8000 г
7000
6000 '
5000 -
'МО-
Ч,мв
Х-2-33. а) Равновесие.
б) КР = 1 или Кс = 1 в зависимости от того, как
определялось Е°. Другой ответ: „концентрационная
цепь".
в) Очень разбавленный раствор сильного электро-
лита.
г) Очень разбавленный раствор.
д) Без ограничений.
е) Только для соли 1 :2 или 2:1.
ж) Очень разбавленный раствор.
з) Обратимая реакция в цепи.
и) Е(==ЭДС цепи, обратимой относительно катиона;
Е=ЭДС той же цепи без переноса. Число переноса
зависит от концентрации.
Х-2-34.
е—1 ЗМ , Р
----------- а -4- —.
е + 2 4л#р Т ’
где 0 «= fi2/3k и N — число Авогадро.
ЗМ 3» 100,0 г 1 моль-1________
молек • моль-1 • 1,000 • 10-3 г • см-3
см3 • молек-1;
4nNp 4л-6,023 • 1023
«=3,96- 10-2°
1,212-10~3
3,001
7,575- 10 4 . з QA . 1 Л-20 = а I •
3,001 d,yb 1U ° + 400 ’
360
Глава X
1,60- 10"23 = а+^Ь
1,00 • 10’2! = а +
0,60-10 =₽("200 ~1оо) = 1оо ’
Р = 2,40 • 10-21 град • см3 • молек-1;
а ===== 1,0 - 10 23 —4оо'==4>О- 10-24 см3 • молек-1;
ц2= 3/г(3 = 3 • 1,38 • 10-16 эрг • град-1 • молек-1 X
X 2,40 • 10-21 град • см3 • молек-1 =
= 9,94 • 10-37 эрг • см3 • молек-2
[или (эл. ст. ед.)2 • см2 • молек-2; 1 эрг =
= 1 (эл. ст. ед.)2-см-1];
ц = 1,0 • 10-’8 (эл. ст. ед.) • см-1 • молек-1, или 1,0 D.
Х-3-1.
РАЗДЕЛ Х-3
а) 0,5000 моль • кг-1 • 0,0500 кг = 0,0250 моля Fe2+
(получено или пропущено 0,0250 фарадея).
6) 3-1,5750 + 2-0,5000 = 5,7250 моля СГ
3 • 2,000
= 6,0000 моля С1 1
Х-3-2.
(в конце
опыта)
(в начале
опыта)
0,2750 моля С1-1 (перешло)
0,2750 моль • кг-1 • 0,0500 кг = 0,01375 моля (или
эквивалента) СГ перешло.
; — 0,01375 __ „
0,0250 U>MU.
, , , t + 76,35 • 0,450 со е л _i о i
в) Х+ = Х-+^ = — = 62,5 Ом 1 • см2 • г-экв
Предположим, что /_ (и /+) в 0,5 м растворе равно
числу переноса в бесконечно разбавленном растворе.
Это приближение, вероятно, не применимо для трех-
валентного иона, например, Fe3+, который в концен-
трированном растворе существует в основном в виде
FeCl2+.
Количество Вг2, выделяющееся на аноде, равно коли-
честву Вг2, расходующемуся на катоде. Количество
Вг2, сначала находившегося в каждом пространстве,
Электрохимия
361
равно ‘/2 от общего количества Вг2; оно постоянно:
0,1000 моля. Анодное пространство получает
0,0100 моля, катодное пространство теряет 0,0100 моля.
Вг2 не переходит из одного пространства в другое.
Следовательно, 0,100 моль-2 г-экв • моль-1 = 0,0200 фа-
радея (количество прошедшего электричества). Число
ионов Вг~, присутствующих вначале в каждом про-
странстве, равно ’/2 всех ионов Вг“, присутствующих
в обоих пространствах. Эта величина постоянна:
0,1000 моля.
[Jr . моль Анол К ат о л
В начале опыта 0,1000 0,1000
Образовалось —0,0200 4-0,0200
В конце опыта в отсут- 0,0800 0,1200
ствие перехода
Конечное количество 0,0920 0,1080
Перешло 4-0,0120 —0,0120
х-з-з.
'-=-S-°-600: b-o.'ioo-
а) п{ dpj + n+ dp+ 4- /г_ dp_ = 0.
Если 1 кг растворителя 1 диссоциирует, то n+ = v+m,
п_ = v_m и «! = 1000/Л4!, где Л4, — молекулярный вес
растворителя 1. Введя активности, получим
n,d In а, + пг (y+d In а+ + v-d In а_) = 0;
«[dlnOj + vmdln а± =0, тде v=v+ + v_.
Далее, ai = y,^, а± = у± (v^+v*-)l/vm.
Таким образом,
п, (d In Yj + d In Xj) + vm {d In y± + d In m) = 0.
По условию,
In у± = — В У tn + Cm.
Тогда
d In y± — (—Вт~'1г + dm.
Решим это уравнение:
(Ппу| = — dlnX, — 4-Вт-'/2 + С 4”) dm\
’ * \ 4> Ч’ 1
362
Глава X
In Yj = — j dlnXi —
x,=i
m
— J (-4BV^ + C/n+l)d/n =
m=0
= - In Xi - 1 Вт’1' + ±Cm2 + /n) =
rlj \ u Z /
= _ In —£----A( ' 4.1 Cm2 + ml.
tij + vm nt \ 3 2 )
6) v = 3, «1=55,5;
Y 55,5 _ 1.
Л1 ~’ 55,5 + 0,0030 1 + 0,0030/55,5 ‘
। у 0,0030 ________ r ,< ,л—5
ln%i«-------55j- = ^5,41 • 10 ;
7 = 1(2- l2 + 22)/n = 3m.
In у± = - 0,5091 • 2,303 -1-2 /3m = - 4,06 /m;
В = 4,06.
lnYi = 5,41 • 10_5--l=-[-l^-(0,001),/,4- 0,0011 =
□D,0 L o J
= 2,31 • 10'6; Yi = 1,09000231.
в) л = —
RT In Д1________RT (In + In Yi) __________
Й ~ Vi
82,06 • 298,15 • (- 5,41 + 0,23) • 10~5
18,016/0,997
= 0,070 атм.
Х-3-4.
В — 0 для того, чтобы U (оо) было конечно. В отсут-
ствие других ионов 6 = 0, а0 = 0 и Оо/62->0. Тогда
zg = Л ехр (0) А= ге_.
вг г е
При любых b и сг0
ц___ ге exp (— Ьг) . 4лст0
ег * Ьгв ~
ге геЬ . 4ла0 ге . г,
-----------р = р Cf-
er е &2е ег *•’
г> ___ Zeb । 4na0
$ • b2$
Электрохимия
363
Для переменного заряда Q центрального иона имеем
rt Qb । 4жуо ,
UXS— е Т 62g .
ге ге
Gxs (для 1 иона)= j UxsdQ = / (--^ + ^bQ==
о о
|_.. bz2e2 । 4naoze
nY— 2ekT + b2ekT '
X-3-5. Пусть х=[Н+]. Тогда
[он-]=^=-^.
X X
[н+]=[он-] + [СГ] (в условиях электронейтраль-
ности)
х =+ 10-8; х2- 10-8х — 10-14 = 0;
х= 1,051 • 10“7; pH = 6,978.
Х-3-6. Для цепи, в которой протекает процесс
± Н2 (г) + AgCl (тв)—> Ag (тв) + Н+ (aq) + СГ (aq),
произведение активностей равно
Q = ан+°С1~-.
Таким образом,
£ = £°--^lnQ.
Вообще нельзя говорить, что Q = K; это справедливо
только для цепи, в которой процесс достиг равно-
весия. В этом случае цепь не работает, поэтому
£ = 0 и
£° = ^lnQ = -^lnK.
Если ячейка не вполне разряжена, то Q — перемен-
ная, зависящая от концентрации НС1, давления Н2,
а также от температуры; Е зависит от тех же пере
менных.
364
Глава X
Х-3-7. a) Ag (TB)|Ag+, NOf (aq) | Вг2 (ж) | AgBr (тв) | Pt (тв)
Ag (тв) -> Ag+ + е~
Ag+ + у Вг2 (ж) + е~ -> AgBr (тв)
Ag (тв) + у Вг2 (ж) AgBr (тв)
£ = £° - —ln-^y- = F
«Ag<
так как активности чистых твердого тела и жидкости
равны 1.
AG0 = - ТЕ° = - ТЕ.
Х-3-8.
б) Формально E = e~M°IRT- Однако понятие кон-
станты равновесия непреложимо к реакции, вклю-
чающей только чистые жидкости и твердые тела. Для
реакции, записанной выше, AG = AG° < О, и, следо-
вательно, она будет протекать до тех пор, пока одно
или несколько реагирующих веществ не будут пол-
ностью израсходованы. В течение реакции AG не
изменяется. Активности каждого вещества остаются
равными 1, независимо от того, насколько прошла
реакция, и
aAgaBr2/aAgBr = 1 ft’
Достижение равновесия возможно только, когда актив-
ности изменяются в результате изменения концен-
траций или парциальных давлений.
а) Е°, В (из табл. Х-1)
Ag(NH3)2+ + е- -> Ag + 2NH3 0,373
Ag^Ag++e~ -0,7996
Ag(NH3)2+ Ag+ 4- 2NH3 -0,427
% = 2,303 RT = 0,05915 = ~ 7’22’ == 6>° ’ 10 •
6) Ag|Ag+, SOt|PbSO4|Pb
--- Pb| PbSO41 Ag(NH3)2+ I sot, NH3|Ag.
2Ag->2Ag+ + 2e~ 1
PbSO4 + 2e-Pb + SQ2-(aj) J левая ячейка
Pb + SQ2- (a2) -> PbSO4 + 2e-
2Ag (NH3)2+ + 2e~ 2Ag 4NH3
правая ячейка
Электрохимия
365
Х-3-9.
Х-3-10.
Суммарная реакция:
2Ag(NH3)+ ф SO2- (а2)-> 2Ag+ ф SO2- (aj ф 4NH3.
ЯГ Ад ЯГ al±aNH
в)------------Е = Е°------In AS-—.Н1 = Е°-In —* Н>
2Г а2 ,а2 2Г аз >
Ag(NHs)+ 2 2±
где а1± — средняя ионная активность Ag2SO4, а а2± —
средняя ионная активность [Ag(NH3)2]2SO4.
(из табл. Х-1)
0,1129
-0,125
Е°, В
О2ф4Н+ф4е“^2Н2О
2Т1+ 2Тр+ 4е-
О2 ф 4Н+ ф 2Т1+ -> 2Т13+ ф 2Н2О
-0,012
При равновесии
™ 0,05915 . [Т13+]2
4 lg Р0Дн+]4[Т1+]2 ’
РОг =0,21 • 1,0 = 0,21 атм.
Пусть М — концентрация образовавшегося Т13+ •
(0,10 — М) — концентрация оставшегося Т1+.
М2 _-0,012-4 _ R.9
lg [0,21] [1,0]4 [0,10-Лф ~ 0,05915 —
М2 _ п |
[0,21] (0,10- Лф — и>104>
|0,10-Л.Г-'°’ I64'0.21-3,24. 10-!; ^^. = 0,18-,
М = 0,018 — 0,18М; М = 0,0153; 0,1 - М = 0,0847;
100--^ = 85 мол. % неокисленного Т1+.
Со + nNH3 -* Co(NH3)*+ + 2е~
HgO + Н2О + 2е" -> Hg + 2ОН~
Со -j- nNH3 + HgO ф Н2О -> Co(NH3)*+ ф Hg ф 2ОН~
р_ро W , [Со(МНз)* + ][ОН-]2 _
й 2Г 1П [NH3]n
= const ф In [NH3] = const' ф In Pnh,.
Глава X
Построим график, отложив Pnh, по оси абсцисс и Е
1Т 2,303л/?Г Л tco
по оси ординат. Наклон —— = 0,163;
п = 5,5 6.
В зависимости от того, как построен график, ответ
меняется от 5 до 7.
Х-3-11. Величиной, которую несомненно можно складывать
для двух полуэлементов, является AG — изменение
экстенсивного свойства. Итак, для каждого полуэле-
мента AG = — пУЕ, где п — число фарадеев, про-
шедших через цепь, когда в полуэлементе протекает
реакция. Таким образом, для полной цепи
AG = ДО1 + AG2 = — {niEi + п2£2).
Однако, чтобы сохранялось число электронов, реак-
ции в полуэлементах должны быть записаны так,
чтобы tii— п2 — п. Тогда
AG==-n0’(£1+£2).
Для полной цепи п не равно (nt + п^, но равно п. для
каждого полуэлемента: электроны, полученные на
одном электроде, теряются на другом, и, таким обра-
зом, каждый электрон дважды учитывается. Поэтому
для полной цепи
Е = —+
Размеры полуэлементов не имеют физического
смысла; AG зависит от количеств реагирующих ве-
ществ, но ие от количеств присутствующих веществ.
Х-8-12. Р—^Е; m-»F-«(E+-^-P);
-»(1+-т±)Етг;
i=J-E — «(1 +±=-!-)е-$#;
4л \ п ) М
е— 1 __ / л + е— 1 \ Lp .
“4S п ) М ’
Мл(е—1)
а 4л£р (л + е — 1) *
Глава XI
КИНЕТИКА
РАЗДЕЛ ХМ
Vi 1 1 h 2,303 t I а \ 2,303 . 100 л ооло. л ._
ХМ-1. k lg — ) = — 1g 243 “ 0,2303 lg 0,43 e
= 0,2303-0,606 = 0,140 мин"1.
XI-1-2. Предположим, что реакция имеет второй порядок.
»-INaClO]0 - 0.003230;
Ь = [КВг]0 = 0,002508; а - Ъ = 0,000722.
_ 2,303 . 2,508 • 10~3 (0,003230 - 0,000560) _
3,65 • 7,22 • IO-4 g 3,230 • 10~3 (0,002508 - 0,000560) “
==23,42 л - моль-1 • мин-1.
k =23,42; 23,30; 23,52; 23,90; 23,80; 23,80. Среднее
значение: 23,62 л • моль-1 • мин-1.
Второй порядок (как показывает вычисление кон-
стант k).
XI-1-3. Предположим, что реакция имеет первый порядок.
ft==Tln'r: * = n^te-y^T=0>00144-
t с 120® 9,оЗ
Х1-1-4.
k = 0,00144; 0,00144; 0,00145; 0,00145; 0,00150; 0,00140.
Среднее значение: 0,00145 мин-1.
Для реакции второго порядка
t _ 2,303 , Ь (а — х)
t(a-b) a (b-x) ’
где а —концентрация 820з“ при f = 0;
v • 0,02572 37,62 • 0,02572 Л
а —-----!---= —!- ----— 0,0967м.
v 10,02
S2°2
К моменту времени t = 0 некоторое количество S2O1“
уже было израсходовано, так что концентрация S2O3""
меньше исходной концентрации (0,100М).
Ь — концентрация «-С3Н7Вг при t = 0;
Общее количество тиосульфата, израсходоваииое
, иа H-CsH7Br
О ---------------------------------——---——-—-— а»
°н-С,Н7Вг
~ 137,63-fo,И'°,<g57g =°'0395M.
368
Глава XI
Мы приняли, что при /==78840 с достигнуто равно-
весие.
(Ь — х) — концентрация н-С3Н7Вг в момент времени /;
(а — х) — концентрация S2O3"" в момент времени t.
При /=1110 с;
Количество S2O?—, израсходованное при /=1110 с
(Ь — х) =--------------------------------------------—
ан-С3Н,Вг
(35,20 — 22,24) • 0,02572 _ 12,96 • 0,02572 .
— 10,02 “ 10,02 ’
. . Количество иода, израсходованное при/=1110 с
(а _ х) =-------------------------------------------=
S2°3
35,20 • 0,02572 ,
~ 10,02
Ь(а — х) _ 0,0395 (35,20-0,2572)/10,02 _ 0,0395 • 35,20 _ .
а(Ь — х) ~ 0,0967 (12,96-0,2572)/10,02 ~ 0,0967- 12,96“ 1,1 XU’
а - b = 0,0967 - 0,0395 = 0,0572;
k = 0,0363 • lg 1,110 = 0,0363-0,0453 = 0,001644.
k = 0,001644; 0,001644; 0,001649; 0,001636;
0,001618; 0,001618. Среднее значение: 0,001635 л-
• моль-1 • с-1.
Х1-1-5. Для реакции второго порядка, в которой реагируют
два вещества с одинаковыми концентрациями,
h — х
ta(a — х) ’
, _ 0,00876 _ „
1,200 - 0,0198 - 0,02104 й ’
k = 0,0334; 0,0327; 0,0329; 0,0332; 0,0328; 0,0325.
Среднее значение: 0,0329 л • моль-1 • с-1.
XI-1-6. Для реакции п-го порядка
= lg(-~)=lg* + nlgc.
Таким образом,
lg (— rfc/rf/)| — ig (— rfc/rf/)2 __
igtj —lgc2
Скорость увеличения давления пропорциональна
lg 7,4-lg 0,73 ... 3
П =----5__!____-_’__ sss I 44 j=s — .
* lg 2,153-lg 0,433 ’ 2
Кинетика
369
XI-1-7. При проверке можно видеть, что /у2 прямо пропор- ционально р. Когда р уменьшается в два раза, также уменьшается в два раза. Это предполагает v dx , реакцию нулевого порядка, для которой — = k. В данном случае — -^- = 4; после интегрирования , pi получим k = -~—, где — начальное давление. 2Г‘/2 k— 17,4; 17,6; 17,0. Среднее значение: 17,3(мм рт. ст.) • мин-1.
XI-1-8. А прямо пропорционально концентрации. Построим график зависимости (А-А^У от t. Прямая имеет наклон —0,0563; k = —2,303• (—0,0563) = 0,130 мин-1.
XI-1-9. а„ — а, 11,20—10,35 Доля превращения х аа_^ 11(20_(_3>37) - = 0,0583 при t= 1,035 с. Предположим первый порядок: k = _2303 । >_ = 5 80 . !0-5. t & 1 — X ’ ^средн = 5,80 • 10"5с“! (реакция имеет первый порядок).
Xl-1-10. Предположим первый порядок: а = 18,48 — 12,29 = 6,19; а - х = 18,05 - 12,29 = 5,76; k~ t lga_x“ 30 §5,76~2’40'10 МИН • fe = 2,40; 2,46; 2,49; 2,49. Среднее значение: 2,46 • 10-3 мин-1.
XI-1-11. ах К- tN0H21 . Л (NO] [Н2] ’ d [N°H1 = 2k [NOH2] [NO] = 2kK [NO]2 [H2]. бИ=-^; -Я = 2й' [N2o2][H2] = = 2fe'tf'[NO]2[H2].
XI-1-12. . , 1 . 1 a \ 1IO_ °-693 • a) h — k ln^ a/2 ) k In 2 k , 6) /1/2 k ( a/2 a ) ka ’ . , _ 1 [_J 11 — 3 В) h 2k I (<?/2)2 a2 J 24a2 ’
370
Глава XI
XI-1-13. Построим график зависимости lg k от \^1 и проведем
экстраполяцию к УI =0.
(5 + lg fe) V7
1,7640 1,53
1,7130 2,37
1,6800 2,85
1,6467 3,35
1,6418 3,42
1,5990 4,11
XI-1-14.
Значение, полученное экстраполяцией: 5-f- 1g Лг0 =
= 1,858; k0= 7,21 • 10~4. .
о_ *зо5 _ е~Е1Ж*,
k2№ е—Е/295Д ’
1п9— * Е ( 1 1 Е ( ~ 10 V
1 R \ 305 295 J R \ 305 • 295 ) ’
0,693 ------------г--------; Е = 12,4 ккал • моль-1.
1,987 • 10-3 • 305 • 295
Xl-1 -15. k = Ae~E!RT\ Е = —ln (*a/fel);
1 2 — * 1
2,303-ЯЛТа 4,576-910-586 _ГОЛ .
~~Т2-Т, -----910 - 586 • = 7530 кал • М0ЛЬ :
о ,ГОП1 1,85.10"
£макс — ZooO 1g 158 . Ю1® =
= 8046 кал - моль-1 (активированный комплекс);
£ццн = 7530 lg ‘ = 7549 кал • моль-1.
(По литературным данным для температуры ниже
300° К Е = 7900 ± 200 кал моль-1.)
РАЗДЕЛ XI-2
XI-2-1. Из таблицы можно видеть, что увеличение концент-
рации МпО? в два раза увеличивает скорость реакции
в два раза, в то время как уменьшение концентра-
ции Сг3+ наполовину приводит к аналогичному
уменьшению скорости реакции. Следовательно, реак-
ция имеет первый порядок относительно иона Сг3+
И первый порядок относительно иона МпОГ.
Кинетика
371
XI-2-2.
t, с (°НС1, //°НС1. оо)-100
30 55,9
44 68,3
62 80,8
83 87,0
111 93,2
ОО 100
XI-2-3.
XI-2-4.
fe, = 12,3031g(—2-) = -^ lg^r = 0,0273 c-*.
1 t & \ a — x) 30 & 44,1
6 = 0,0273; 0,0262; 0,0266; 0,0249; 0,0242. Среднее
значение: 0,0258 c-1.
Вычисление константы показывает, что реакция
имеет первый порядок.
EtOAc + NaOH -> EtOH + NaOAc
Предположим второй порядок:
, _ 2,303 . а — 0,0200 = [NaOH]0;
t (а - b) a (b - x) ’ b == 0,0100 = [EtOAc]0.
Для /=15 мин
[NaOH] = [50,0 - 7,35] • 0,0200 • IO-3 моля/0,0500 л =
= 0,01^06 н. = a — x;
x = a - 0,01706 = 0,0200 - 0,01706 = 0,00294;
[EtOAc] = b - x = 0,0100 - 0,00294 = 0,00706.
, 2,303 . 0,0100 • 0,01706 . осл . _.
— 15-0,0100 g 0,0200-0,00706 1,260 Л-МОЛЬ -МИН .
6 = 1,260; 1,136; 1,087; 1,053; 1,039. Среднее значение:
1,097 л • моль-1 • мин-1.
Второй порядок (как показывает вычисление кон-
стант 6).
Приведенные данные не соответствуют первому, вто-
рому и третьему порядкам. Прн построении графика
зависимости vFeS0,> который пропорционален остающе-
муся количеству K2S2O8, от времени можно видеть,
что концентрация K2S2O8 изменяется линейно со вре-
менем. Таким образом, скорость реакции не зависит
от концентрации K2S2O8 и реакция имеет нулевой
порядок. Можно рассчитать количество K2S2O8 и
построить график его зависимости от времени; получим
прямую линию. Порядок реакции зависит от кон-
центрации K2S2O8 и может непрерывно меняться от
372
Глава XI
нуля до единицы. В области данных концентраций
осуществляется нулевой порядок.
XI-2-5. Для решения задачи данные по концентрациям СНС13
и NaOMe не понадобятся.
Метод!. Если построить график зависимости ^(у^—г)
от t, то для реакции первого порядка зависимость
должна быть линейной. Величина k может быть рас-
считана из наклона этой прямой.
Метод 2. Проведем расчет, например для / = 4 мин:
* = —= =0-0243 мин-1.
fe= 0,0248; 0,0241; 0,0236; 0,0231; 0,0231; 0,0233;
0,0241. Среднее значение: 0,0237 мин-1.
Вычисленные константы k показывают, что реакция
имеет первый порядок.
XI-2-6. Ь мин *=(OFeSO4, </°FeSO4, оо)-Ю°
0,31 42,4
0,51 54,6
0,65 60,6
0,86 66,7
1,01 69,7
1,15 72,7
1,36 75,8
1,58 78,8
2,19 83,6
оо 100
XI-2-7.
fe = -^~ , где а—100%; х —процент превра-
щения.
102fe = 2,37; 2,36; 2,36; 2,33; 2,28; 2,32; 2,30; 2,35,
2,33. Среднее значение fe : 2,33 • 10-2 л-моль-1-мин-1.
2AsH3 (г) -> 2As (тв) + ЗН2
До—2х Зх
Пусть Ро=39,2 см — исходное давление (при / = 0);
(Ро — 2х) — парциальное давление AsH3 в момент
времени t. Тогда Зх — парциальное давление Н2
в момент времени t, следовательно, Р0бш = Ро — 2х4-
-(-Зх = Ро-(-х (в момент времени /).
При / = 4,33 ч Робщ = 39,2 + х — 40,3; х = 1,1,
откуда Pash3 = Ро — 2х = 39,2 — 2 (1,1) = 37 см.
t 0 4,33 16 25,5 37,66 44,75
JgPAsIIj 1,593 1,568 1,481 1,430 1,332 1,299
Кинетика
373
Xl-2-8.
XI-2-9.
XI-2-10.
Если реакция имеет первый порядок по AsH3, то
d isH’ ~ ~ ^PasH,- Таким образом, -g--"» = — ц dt.
at *AsH3
После неопределенного интегрирования получаем
In Pash, = — kt + const; 2,303 lgPAsii3 = — kt + const';
lg PAsll3 2 303 COnst .
Это уравнение прямой с наклоном —6/2,303. Построим
график зависимости Ig^AsH, от /; получим прямую
линию. Следовательно, реакция имеет первый порядок.
Наклон - 6/2,303 = 6,58 • 10~3; 6 = 1,52 • 10~V1.
При/==5ч доля оставшегося метилтозилата составит
(0,746 - 0,420),(0,791 - 0,420) = 0,879.
, 2,303 /, 1 \ 1 7 17 1Л-6 -1
5 \ g 0,879 ) 60-60 ° С ’
6ередН=7,77- 10-V1.
Пусть А — реагирующий газ, В — йнертный газ, С и
D — продукты реакции.
а + а^^а’ + а
*-i
fro
A + B^=z±A*+B
ft-2
A* -^>C + D
АШ = k} [а]2 _ [А‘] [А] + 62 [ А] [В] -
- 6_2 [АЧ [В] - 63[А‘] ~ 0;
d[C] _ . г. _ 63(6! [А]2 + feg [А] [В])
dt 3[Aj 6_, [А] + 6-2 [В] + 63 •
а) = kl [О3] - 6_, [О] [О2] - 62 [О] [О3] - 0;
[01=_______^12^_____•
б-i [О2] + 62 [Оз] ’
= - k} [О3] + 6_, [О] [О2] - 62[О][О3] =
____ l го ] 6-161 [Оз] [Ог1 — 6,6г [Оз]2 _
6-, [О2]+62[О3]_____________________________—
- 26,6; [O3]2
б-, ]О2] + 62 [О3]
б) Если 6_, [О2] » 62[О3], то
(Il « — 1
374
Глава Xi
XI-2-11.
XI-2-12.
а) Механизм I:
^- = 2fc[H2][I2].
Механизм II:
= 2k. [I2] - 2k2 [I]2 - 2&3 [ I ]21H2] « 0;
f T12_____^1 [Ы ,
ш ~ k2 + k3 [H2] ’
d [HI] Гт]2ftj 1 - [H2] [Is]
~Л —2*зИ1 lH2J--------------fe2 + fe3[H2] ’
6)-^ = tf; n]2=tf[l2]; ^r- = 2^[H2][i2].
Этот результат согласуется с результатом (а), если
&3[Н2] < k2, т. е. реакция (3) должна быть гораздо
медленнее реакции (2).
в) In k3 = In А — ;
К*
1 ( ft \___ Eg ( '_________ Eg ( ^2 ~~ Л \,
\*3. T, / “ * \ Ti T2)~ R \ T.T2 )'
E _ j /fe3.T,\_
° T2-T.ln\k3Ti)
_ 2,303 • 1,987 - IO-3 • 417,9 • 520,1 . 40-105 _
520,1— 417,9 lg 1.12-105
= 5,38 ккал-моль-1 (активированный ком-
плекс).
а) *^°3-1 = k. [NO2‘] [О2] + k2 [О] [НОГ]; (1)
= k. [NO2-] [O2] - k2 [O] [NO2-] - k3 [Of. (2)
Применяя принцип стационарных концентраций к [О],
из уравнения (2) получим
[О]= MNOrllOJ (3)
1 k3 [О] +k2 [NO2-]
Подставим (3) в (1):
[NOT] [О,1( 1 + )
“ 1 Ч *.101 + *а[М0г У
б) Если реакция (3) гораздо медленнее реакции (1),
то &з[О] < k2 [NOf] и
«= k. [NO2-J [О2] (1 + = 2ki [NO2-] [O2].
rfr \ «21^О2 1/
Кинетика
375
XI-2-13.
. [bh+][o2nnh-] __
> [O2NNH2] [В]
^NNH^L = _ [0 ] = ,^?£[O^H,HB]
1 J [вн+]
— kt [O2NNH2] [В].
dt
d[O2NNH2]
; dt
Оба предположения согласуются с первым порядком
скорости. Гипотезы можно подтвердить при изменении
[ВН+], тогда как [O2NNH2] и [В] остаются постоянными.
Если правильна гипотеза (а), то скорость должна
быть обратно пропорциональна [ВН+]. Если спра-
ведлива гипотеза (б), то скорость должна быть по-
стоянна. [Оказывается, что правильно предположе-
ние (б).]
XI-2-14. a) = krf [NO3"] - k2 [О] [NOr] + k3 [О] [NO3~].
Поскольку $ является начальной дозой (а не погло-
щенной), скорость реакции (1) выражается как
(а не k^) при условии, что поглощена
только небольшая доля начальной радиации. При-
менив принцип стационарных концентраций к ато-
мам О, получим
= kl INO3-] ф - k2 [О] [NOg] - k3 [О] [NOr] = 0;
fQ1 _ fei[NO3-]0
k2 [no2-J + k3 [N07]
и, следовательно,
diNOd , г .
— = &i</>[NO3 ] +
, ~ М2 [NO2-] [NOj-] Ф + fe,fe3 [NO3~]2^
k2 [no2-] + k3 [NO3-]
М2* [NOd [NO'I + k.ty [ Nod2 -
=___________________-М2^О2~][ЦОз~] + Мз[ЦОз~]2*
k2 [no2-| + fe3 [no3-|
__ 2fe1fe3»[NO3-]2
fe2[NO2-]+fe3|NO3-] ‘
б) Преобразовав предыдущее выражение, получим
уравнение
k2 [NO2~] d [NO2-| + k3 [NO3“] d [NO?] = [NOS']2 dt,
376
Глава XI
которое при интегрировании в пределах от 0 до INO2 ] для ]NOrj и от 0 до t для t дает 1 k21NO2"]2 + k3 [ NO3" ] | NO2" ] = [NO3“ ]21. J
XI-2-15. =k, [chj - k2 [ch3] [CH4] + k3 [Н] [ch4] - — fc4 [H] [CH3] [M] = 0; (1) = k, [CH4] + k2 [CH3] [CH41 - k3 [H] [CH4] - -MH][CH3][M] = 0. (2) Складывая эти два выражения, получим мсн4]-мн][сн3] [М] = о. Вычтем из первого выражения второе: - k2 [СН3] [СН4] + k3 [Н] [СН4] = 0; [Н] [СН3] ki [м] , [СНз] ki . Разделим: гги 12 &1&3 fCH4] е 1СНз] [М] ’ rf [С;Нб] , ГС14 1 ГСН 1 ( k\kjk3 [СН4]3 \'1г dt — Л21СН3][СН4]. ММ) ] .
XI-2-16. а) —^ = kc~\ —cdc = kdt-, (cl — с2) = kt-, с = (($ — 2kt),/!. . Co — c2 0,99ca 6) c = O,lco; c2 = 0,01cg; t = = в) c = 0, когда t = c2!2k. Это время, необходимое для завершения реакции. Для реакции первого по- рядка — dcldt = kc. Когда с уменьшается, умень- шается и скорость изменения концентрации (—dcldt). Реакция становится все медленнее и медленнее, не достигая завершения. В то время как при порядке реакции —1, скорость уменьшения с увеличивается по мере того, как с уменьшается, становясь бесконеч- ной при с->0. Реакция ускоряется по мере прибли- жения к завершению и внезапно останавливается, когда совсем исчезнут реагирующие вещества-
Кинетика
377
XI-3-1.
РАЗДЕЛ XI-3
а) АЯ = kl [NO2C1] - k2 [NO2C1] [Cl] « 0;
[С11=ф
-d 1 ~ [NO2C1] - k2 [NO2C1] [Cl] =
= —2MNO2C1].
б) Согласно теории мономолекулярных реакций Лин-
демана, молекула NO2C1 для того, чтобы прореаги-
ровать, должна быть активирована при соударении.
Она может также дезактивироваться при столкнове-
нии. Мы рассматриваем активированную молекулу
NO2C1* как отдельную частицу.
2NO2C1 NO2C1 + NO2C1*
ь_.
fe,
NO2Cr —-> NO2 + Cl
no2ci + Cl no2 + Cl2
Теперь стационарное состояние может быть приме-
нено к обеим частицам — С1 и МО2СГ:
= k\ [NO2C1‘] - k2 [NO2C1] [Cl] ~ 0.
d [Nyr] = k3 [NO2C1]2 - k_3 [NO2C1] [NO2C1‘] -
- k\ [NO2C1’] ~ 0.
[NO2C1‘] = —MNO2CIL
rCn = fei[N°2Cl1 fe[fe3[NO2Cl]
1 J fc2[NO2Cl] k,(fc_3[NO2Cl]*
= - k3 [NO2C1]2 + k-3 [NO2C1] [NO2C1‘] -
— k2 [NO2C1] [Cl] = — k\ [NO2C1‘] - k2 [NO2C1] [Cl] =
—2fe]fe3 [NO2C1 ]2
_ fc_3[NO2Cl] *
При больших концентрациях k-3 [NO2C1] k\ и
rf[NO2Cl] -4k\k3 [NO2C1]
' dt
k—з
378
Глава XI
XI-3-2.
Этот результат находится в согласии с (а) при усло-
вии, что k\ —k'iki/k-з. При малых концентрациях
fe_3[NO2Cl] < k\ и 12^11 = _ 2/г3 [NO2C1]2. В по-
следнем случае активация при соударениях стано-
вится лимитирующей стадией.
. d[HNO3]
а} dt
. d [НО]
dt
- ka [HNO3] + kb [HO] [NO2] -
-MHO][HNO3];
Mhno3]-mho][no2]-
- MHO][HNO3] = 0;
runi _ k° IH№3] .
invj — kb [N02] + kc [HN03] ,
dtH^31=----^a[HNO3] +
, (feb.[NO2] - kc [HNO3]) ka [HNO3]
kb [NO2] + kc [HNO3]
— ka [HNO3] kb [NO2] - kakc [HNO3]S +
_______________+ kg [HNO3] kb [NOal - kgkc [HNO3P _ _
= kb [NO2] + kc [HNO3I
_ -<2.kakc [HNO3F _
kb [NO2] + kc [HNO3]
== — 2ka [HNO3] j + (kb [NOs]/fee [HNO3]) *
б) Если NO2 расходуется очень быстро, то [МО2]*«0;
следовательно,
kb [NO2] „ ।
kc [HNO3]
£JHNO3]s=2fe4HNO3]t l
-fyj « A, [HO2“] [Npoi+] 4- k2 [HO2] [NpOi+] -
-fe3[HO2][NpO2+h
ki [ног] [NpO22+] - k2 [HO2] [Npo!+J -
-fe[HO2][NpO2+]>=0;
rum- ^[ho2-][npo“+]
lHU21“^NpOr]-W3[NpO+p
XI-8-8.
2MHNO3J.
Кинетика
379
= kl [НО2-J[Npoi-Ч + -^[^+J2[HOd
Л *2[NpO*+| + *3[NpO+]
_ M3[HO2~][NpO2+][NpO^+| _
*2[NpOr] + *3[NP°2+]
*1 [H0-] [NpO|+]2 + k3 [NpO2+] [NpO2+] +
___________________+ fe2 [NpO2+]2 - fe3 [NpOj-] [nP02+])
= *2[NpO^+] + *3[NpO2+]
_ fe, [HO2~] 2fe2 [мрО2+]2 _ .
*2[NpO2+] + *3[NpO2+]
__ 2k, [НОГ] [NpOj+]
l+(fe3[NpO2+])/(fe2[NpO2+])'’
[н+Цног]. гно-1 *[H2O2],
K—wT' lH°!1—w
2Kk, [NpO2+][H2O2]
XI-3-4.
d [npo2+] _________________
dt [H+] {1 +(fe3[NpO+])/(fe2[NpO|+])} ’
a) = fe. [N2O5] - fe_. [N02] [N03] -
- fe2[NO2][NO3] « 0;
[мп 1____ fei [N2O5]
INOd— (*_1 + *2)[NO2] ’
= fe2 [NO2] [NO3] - fe3 [NO] [N2O5] ~ 0;
ГЫО1 = [NO;] [NO3] _= fe.fej .
1 J k3 [N2Ob] k3 (fe_. + fe2) ’
= - fe. [N2O5] + fe_. [NO2] [NO3] -
- fe3 [NO] [N2O5] = { - fe. + I[N2O5].
б) Когда NO2 и NO3 сталкиваются с участием ато-
мов N, то будет образовываться (если вообще будет)
N2O5 (т. е. O2NONO2). Когда при столкновении встре-
чаются О из NO2 и О из NO3, должны будут обра-
зоваться NO (из NO2), NO2 (из NO3) и О2 (по одному
атому из каждого соединения). Поскольку в NO2
в два раза больше атомов О, чем N, соударения
первого рода [необходимые для реакции (2)] прибли-
зительно в два раза менее вероятны, чем соударе-
ния второго рода [необходимые для реакцйи (3)].
380
Глава XI
Тогда предэкспоненциальные множители для реак- ций (2) и (3) будут приблизительно относиться как 1:2, т. е. , . -Е_,/8Т „ -о . ft-l _ л-1е 1е - - 1 . 10">/(2,303.1,987.10~3.320)= ki A2e~Ei/RT le-'a,RT 2 = 1,3- 103. в) n,o55±no2 + no3 [NO2] [NO3] _ K _ fei . rNO1 _ kt [NO2] [NO3] _ [N2O5] л fe_, ’ l шо5] k3 • = + {k_t _ [N20s] Это результат тот же, что и в (а), при условии, что k2 <С /г_|, т. е. если наибольшее количество NO2 + NO3 превращается в N2O5. В этом случае реакция (3) может рассматриваться просто как медленная утечка NO3 из равновесной системы. Расчет (б) основан на этом предположении.
XI-3-5. а) = 2А, [С12] - 2k2 [Cl]2 - k3 [Cl] [CO] + + *4[COC!]+MCOC1][C!2] = 0; (1) d tC°^ = k3 [CO] [Cl] - k4 [COCI] - k5 [COCI] [Cl2] = 0. (2) Складываем (1) и (2): 2k' [Cl2] - 2k2 [Cl]2 = 0; [Cl] = Из уравнения (2) имеем [СОСИ = k3 [CI1[CO] = V'MC'd’^CQ] J *4+*5[Cl2] ^(*4 + fe5[Cl2]) * Следовательно, ^-Mcocihcj-^W». (3) а/ к2 + k5 [Cl2]) б) Если 6ДСОС1]» 65[COC1][C12], to уравнение (3) переходит в уравнение rf[COCl2] = k5k3k'f [Cl2f* [CO] dt k'£k4 ‘ ' [CH2 , rpii iz’A rpi iVz. [COC1] -r B) Tci2] Ki’ [C1]’ ’ ‘[ci] [co] [COC1] = [Cl] [CO] = ЯзК'/2 [CI2]'/a [CO]; ^[С^С1а-' = k5 [COCI] [Cl2] = k^'l’ [Cl2]’/l [CO].
Кинетика
381
XI-3-6.
Уравнение (5) согласуется с уравнением (4), если
K\=kjk2 и Дз=63/64. Это хорошо известное соот-
ношение между константой равновесия и константами
скоростей прямой и обратной реакций. Рассмотрение
реакций (1) —(4) как равновесных равноценно ска-
занному в пункте (б): они намного быстрее реакции (5),
и их равновесие не нарушается при относительно
медленном удалении СОС1 и С12 из равновесной
системы.
Пусть а — [А], 6 = [В] и с — [С]. Исходное количе-
ство а (при t — 0) обозначим а(1; а0 предполагается
известным. Уравнения скорости (в системе обозна-
чения а — da/dty.
a — — k\(r, (1)
b — kxa — k2b‘, (2)
с = k2b. (3)
Так как а + b 4- с — а0, или а = а0 — Ь — с, то
b - kt (а0 — b — с) — k2b', (4)
b = kx (— b — с) — k2b.
Используя (3), получим b = k{ (— b — k2b) — k2b или
Ь + (^ + k2)b + k}k2b = 0. (5)
Теперь мы имеем линейное однородное дифферен-
циальное уравнение с переменной Ь. Общее решение
этого уравнения: b — ает<* -(- $emit (6), где аир —
постоянные интегрирования, а и т2 — два различ-
ных корня уравнения т2 -(- (6, 4- k^m 4- k{k2 — Q\
т{ = — kx\ т2 = — k2.
Если k\=k2, то корни не различаются и уравне-
ние (6) не будет общим решением.
Случай I. k{ Ф k2. b = ae~k'1 4- pe_fe<
Если t = 0, то 6 = 0; 0 = а 4- Р> Р = — а.
ft = a(e-^-e-W). (7)
Из (4) b = kx (а0 — b — с) — k2b.
Если / = 0, то 6 = с = 0. Тогда b — kia0. Из (7)
имеем
b = а (— 6,e_fe,e 4" k2e~k2‘).
Если / = 0, то b — a(k2 — и
382
Глава XI
Когда Ъ максимально, 6 = 0 и b < 0.
6 — а (— kte~k,i + — 0;
= fe2e~w;
In kt — kYt = In k2 — k^\
2 __ I*1 (kltki)
‘макс — ki _ k2 •
(Может ли это выражение быть отрицательным?)
b — — + k2) b — k'k2b (из 5);
b = — kik2b<Q, если 6 = 0.
Следовательно, b имеет максимум при t — но
не минимум или точку перегиба.
3=0 J
/ л, ki) Г f tf \(— h+4i)/(*i"Wl
=a т-J p-hr =
. в k2 — k\ \ k2 / \ k2) ° \ k2 ) *
Случай II. kt = k2 = k.
Общее решение для b‘.
b = ае~к<* + fite~ktt.
Если t = 0, to 6 = 0; 0 = a + 0 • 0, a = 0. Тогда
6 = 0fe-*‘, 6 = 0(1 -kt)e-kt.
Как и в случае I,
а = — ka',
— b — с = — k(a0— b — c)\
— b — kb = — k(aQ — b — c).
Если t = 0, to b — c — O и 6=0 = ka0.
Если 6 = 0, то 1 — kt = 0 и /макс = 1/£.
b = — kxk2b < 0; 6макс=0/ма1Ссе_*<““£С== ka^—e-'= aje.
Глава XII
ФОТОХИМИЯ И СПЕКТРОФОТОМЕТРИЯ
XII-1-1. РАЗДЕЛ XII-1 При 365,5 нм , Число разложившихся молекул 5,18» 1018 q ^gg * Число поглощенных фотонов 10,58 • 101а ’ Ф для четырех измерений равно 0,490; 0,483; 0,576 и 0,577 соответственно.
- РАЗДЕЛ XII-2
XII-2-1. А — abc, где А — поглощение, а — поглощающая спо- собность материала, b — толщина образца и с — кон- центрация. Т = 1/1о, A = -\gT.
Раствор 1 При 400 нм А = lgyj-= 1,00, ад = ^= 1,00-103. При 500 нм А = 1g о^ = О,22, ал = ^ = 0,22 • 103. Раствор 2 При 400 нм А = 1g А-= 0,097, ав = ^=19,4. При 500 нм А = lgo^q —0,699, aB = g=140. Раствор 3 При 400 нм 1000сд + 19,4св = 1g = 0,398.
ХП-2-2. При 500 им 220сд+ 140св = Ig-Q^-= 0,301. Решая совместно два последних уравнения, получим св = 0,00156 моль • л-1; сА — 0,000368 моль • л"1. Анщ« 0,142; ан1п == 223; А. - = 0,943; а.- = —= 1483. 1п 6,36 • 10-4
384
Глава XII
Пусть [НIп] — концентрация HIn в растворе с / = 0,02,
a [In ] — концентрация иона In в том же растворе,
тогда [HIn] = 6,36 • 10-4— [In ].
223 [НIn] + 1483 [In ] = 0,470;
223(6,36- 10-4 — [in-]) 4- 1483 [ln~| = 0,470;
0,142 — 223 [In ] 4~ 1483 [In"] = 0,470; 1260 [In-] - 328;
[In] = 2,60- 10"4;
[HIn] = 6,36- 10~4 —2,60- 10-4 = 3,76- 10“4;
pH = 8,207; [H+] = 6,21 • 10-9;
„ = [H+] [In~] = 6,21 • 10~9-2,60- 10~4 = 4 29 . 1 o"9
[HIn] 3,76- 10“4
p/( = 8,368 при / = 0,02.
ХП-2-3.
I 0,10 0,08 0,06 0,04 0,02
pK 8,33 8,36 8,36 8,36 8,37
HIn# H+ 4- In-
[H+][ln~] . J______[HIn] [HIn] 1 .
° [HIn] ’ Ka [H + ][ln“] [In"] ‘ [H+] ’
p^a = lg -щту + pH; A = lg у- (4 — поглощение).
Относительная концентрация А при pH — 4,39 А (сильное основание)
0,8 0,699 1,268
0,6 0,538 0,959
0,4 0,355 0,644
0,2 0,175 0,333
Принимая, что выполняется закон Бера, т. е. что
концентрация основной формы [In ] пропорциональна
поглощению А, можно записать для раствора с от-
носительной концентрацией 0,8 и буфером pH = 4,39:
[HIn] 1,268 - 0,699 ПО1,
[1п~] — 0,699 — 0>814,
рК = 1g 0,814 4- pH = — 0,09 4- 4,39 = 4,30.
Для растворов с концентрациями 0,6; 0,4 и 0,2 р/<
будут равны 4,17; 4,23 и 4,34 соответственно. Сред-
нее значение для четырех растворов 4,26.
Фотохимия и спектрофотометрия
385
ХП-2-4. HIW = _ ф1а _ [H2q2] [СС>2Н] __ [H2Q2j [ОН] +
+ МНО2]2. (1)
- kx [ОН] [СО] + МН2О2][СО2Н] -
—/г3[Н2О2][ОН]==0. (2)
= ki [ОН] [СО] - k2 [Н2О2] [СО2Н] = 0. (3)
-^-2i = fe3[H2O2][OH]-fe4[HO2]2-0. (4)
Преобразуем (4):
МНО2]2=ЫН3О2][ОН]. (5)
Подставим (5) в (1):
= -ф1а- k2 [н2о2] [со2н]. (6)
Преобразуем (3):
МОН][СО] = /?2[Н2О2][СО2Н]. (7)
Подставим (7) в (2):
2^а=/?3[Н2О2][ОН]. (8)
Подставим (7) в (6):
^^- = -</>4-^ [ОН] [СО]. (9)
Преобразуем (8):
1он'=~Вя' (10>
Подставим (10) в (9):
d [Н2О2] jr _ 2fei0/a [СО] <. n
dt ~ ^la k3 [H2O2] • О J
Преобразуем (11)
d = — ф1 (14- -2.MC°] 'I (12)
dt ?Ти3[Н2О2|Г V ’
Уравнение (12) было получено и в оригинальном
исследовании [105].
ХП-2-5. -^^- = -</>/а-/г2[Н2О2][СО2Н]. (1)
= kl [ОН] [со] - k2 [н2о2] [со2н] -
~/г5[СО2Н]2 = 0. (2)
1Д12 Зак. 1360
386
Глава XII
11°Щ. = 2^о-МОН][СО] + + МН2О2][СО2Н] = 0. (3) Сложив (2) и (3), получим 2^>/а — £5[СО2Н]2 = 0; (4) [СО2Н] = -/^. (5) Подставим (5) в (1): d [НаО2] _ k2 [2<t>I <,]''* [Н2О2] . «7 • (6) РАЗДЕЛ ХП-З
ХП-8-1. Поглощение = abc = А, где а — абсорбционная спо- собность, Ь — длина пути в образце и с — концен- трация. у, 1 |Q—а&с 2,303а&с, Iq ' dT = — аЬе~^ЖаЬс de. т-г 1 de -e^abc Пусть р = — -= = т , J r с dT abc где p — относительная ошибка в определении с, деленная на ошибку в определении Т. dp _ —2,ЖаЬё1-ЖаЬс . e2,303abc _ de abc 1 abc2 1 =2W+ ' _0; abe = ^-. c abc2 ’ 2,303 ’ Г = e-2,303abc = e-i — o,368. Ошибка p будет минимальной, когда T = 36,8%.
ХП-3-2. . 2 молекулы v 1 фотон 2,070 10~5 см у 6,625 • 10“27 эрг • с/фотон • 2,998 • 1010 см • с-1 X 4,184 • 10б) 7 эрг • кал-1 • = r 6,023 • 1023 молек = 1,85 10~3 г • кал-1.
б) Каждый фотон разрушает одну молекулу HI, обра-
зуя атом Н, который разрушает вторую молекулу HI,
Фотохимия и спектрофотометрия
387
что соответствует наблюдаемому квантовому выходу,
равному 2.
в) Высокий квантовый выход реакции Н2 + С12
является свойством цепной реакции
С1 + Н2->НС1 + Н (1)
Н + С12->НС1 + С1 (2)
Энергия активации достаточно низкая: £!=8ккал,
£'2 = 2ккал. Таким образом, обе реакции быстрые
и могут осуществляться неоднократно, прежде чем
наступит обрыв цепи благодаря рекомбинации атомов.
Распад HI мог бы идти с таким же высоким кванто-
вым выходом, если была бы возможна следующая
цепная реакция:
Н + Н1->Н2 + 1 (3)
I-j-HI ->12 + Н (4)
£3= 1,5 ккал, т. е. реакция (3) быстрая и может
быть одной из стадий предложенного механизма.
Е4 неизвестна, но нижний предел может быть опре-
делен из энергий связей:
Д£, ккал
Н1->Н + 1 71
21 —> 12 -36
I + Н1->12 + Н +35
Таким образом, Е4^35 ккал; энергия, необходимая
для достижения активированного состояния, не может
быть меньше энергии образования продуктов реак-
ции. Мы показали, что реакция (4) с высокой энер-
гией активации будет медленной, так что цепь не
будет расти и атомы I будут рекомбинировать гораздо
быстрее, чем участвовать в реакции (4).
ХП-З-З. a) = Ф1а - k2 [О*] [О3] - k3 [О*] « 0;
[0*1 —---tl»---.
1 J k2 [О,] + k3
WL = k3[0*] - Л4[О][О2][М] « 0;
’/412*
388
Г лава XII
[01 = -A12J—
1 J kt [02] [MJ •
-</>/« = ^ = - k2 [О*] [Оз]+k< [О] [02] [М] =
= -&а + (*з~ М03])[0*] =
6) (2</>)~‘= 0,538; </> = 0,93.
75^-= 0,81; -^~- = 1>51 моль-л-1.
2ф«2
ХП-3-4. а) Скорость =/г/о;
1g скорости = lg k 4- п 1g/0.
Построим график зависимости 1g (скорости) от 1g/а;
наклон = и = у.
б) Скорость = k'PciA
1g (скорости) = k' + tn lg PC12.
Построим график зависимости 1g (скорости) от lg Pci/,
наклон = т = г12.
в) Скорость = k"Pc\fo = скорость исчезновения С12 =
= скорость появления TfС12.
г) Так .как hv в этом случае относится к падающему
свету (а не к поглощенному), скорость реакции (1)
равна &i/0Pci2, а не kda (при условии, что 1а /0).
— dPC\
——- = Zji/qPci, + fePciAici; (1а)
k^P^Pa,. (16)
Применяя приближенный принцип стационарных кон-
центраций к Cl-иону, получим
k2PciPti = 2kiPciJo + ^зРтгщРс!,- (2)
Применяя приближенный принцип стационарных кон-
центраций к TfCl, получим
^зРпаРсь + ^Ptici = k2PciPrt- (3)
Решая (2) и (3) совместно, получим
kiP^tci = 2kiPaJo (4)
Фотохимия и спектрофотометрия
389
ИЛИ
/’rfCl —
P^ci/oY/2
\ k4 I
(5)
Подставляя (5) в (la), получим
^_wopcl,+fepc„(^_
= kiIoPci2 + k 'Pajo-
(6)
Если реакция (1) идет гораздо медленнее, чем реак-
ции (2), (3) и (4), то значение kJoPcu будет мало и
можно пренебречь им в уравнении (6) по сравнению
с членом k'''Pci/о', тогда (6) примет вид
~ rfPci, _
dt
k"'PW-
(7)
Подставляя (5) в (16), получим
^7*1 fCl, _ 4, г» П ____Urrr О*/г /Va
----~t- = KsHTfCir’ci,— « г-’оио •.
(8)
д) Если их концентрации не влияют на скорость
реакции.
е) Необходимо вывести новое уравнение скорости
с учетом реакции, обратной реакции (3) (в дополне-
ние к другим реакциям), и сравнить это уравнение
с результатами опытов.
ж) Включает свободные радикалы.
13 Зак. 1360
Глава XIII
РАДИОХИМИЯ
РАЗДЕЛ ХИМ
Х111-1-1. ^=2-'Ч; lg = lg 2 = ^0,3010; N о N гч2 тц2 tv 1g (Ю0/90) 5760-0,0458 * 0,3010 0,3010 377 леТ1
XI1I-1-2. Активность 1000 • 3’7° .‘дю =0.00270 мКи.
XI11-1-3. , __ 0,693 _ 0,693 , 0Q .--5 -1. 1 t4 14,9 • 60 • 60 ~" ,29 ' ° С ’ Скорость распада — = = 1,29. 10-5-6,02-1 о23 _ о. 1п|| . . = 24,0. 10’ = 3’24 • 10 С • Мкг ; Активность 37^ JQ10 =8,74 Ки.
XIII-1-4. 1п-^-=—М; ln-^- = M; Na N . 0,693 0,693 . щ-2 -1 л = —,— = —’ „- = 4,65 > 10 ч ; t4i 14,9 lg W = --^J =-0,1010 = 9,8990- 10; z,ouo N = 0,792 мкКи.
XI11-1-5. = ~KN. at Пусть m2,Na — искомая масса 24Na. / dN \ _ - 0,693 6,02-1023. m2,Na \<fthNa 14,9-60 24,0 — — 0.693 6,02- 1023. 10~3 , \ dt A,Mg — 10,2 27,0 m 14,9.60.24,0. 10~3 nn7Qn„ 7O a "^Na = io,2.27^ = °>0780 г = 78>0 “Г-
Радиохимия
391
X1II-1-6. 6,02 • 1023 , пп ™Ra = —226 >00 ат°м°в; , 0,693 0,693 , '"Ra tt/2 1,62-IO3-365 СуТ • Л7 _ 6,02- Ю23 . 0,693 ^Rn 222 mRn’ ^Rn з,82 СуТ ' ^Ra-^V Ra = ^Rn-^ Rn', 0,693 6,02 - 1023 - 1,00 0,693 6,02-Ю23 1,62-IO3-365 226 3,82 222 mRn’ mRn 1,62 • 103 365 • 226 0-34 10 г 6,34 1ИКГ.
ХШ-1-7. A/fflRa __ 1,6 • 103 _ м2йи 4,5-IO9’ m”6Ra 226 1,6 ‘ 1Q3 о . ,n-7 226 D . 238 j . mau . 238 ‘ 4.5-109 3,4 ’ 10 Г Ra на 1 Г U.
ХШ-1-8. 0,693 0,693 )n-6 -i ^Ra f./ 1,62- 103- 365 ’ 7 0 сут . /2 ^Rn = 0,182 сут"1. v —. 1.17-10 6A/a /—! 17,in-6 g-0-182) — Rn " 1,182-l,17.10-6 } 1,17-10-6лЛ R о = oj82~~ (1 “ °’834) = 1 >07 • 1 °" ^A- Активность 0,1 г 226Ra равна 0,1 Ки, следовательно, /VRn = 1,07- IO-8 • 0,1 = 1,07-10-9 Ки=1,07-IO-3 мкКи.
XI1I-1-9. N = Noe-u. Пусть N — остаток исходного элемента Р; No — исходный + полученный элемент = Р + D P = (P + D)e-»-, -^=6-^ In р — W; t— Л In^l + р j.
ХШ-ЫО. /=l’"(1+4) (вывод см. в предыдущей задаче) t — 2'303 ] Л 1 0.90/87 - 0,80 \ _ 1,47 -IO-11 450/87-0,27 / = 1,568- 1011-2,303- lg(l 4-0,0059) = = 1,568 • 10й • 2,303 0,00255 = 3,99 • 108 лет.
392
Г лава XIII
ХШ-1-11. X1II-1-12. а) !Н; б) ‘бС. a) I98Au; б) 37Аг; в) 2?Na; г) 6Li.
X1I1-1-13. Для получения массы ядра масса 8 электронов должна быть вычтена из массы атома О16. Дефект массы 8 (1,007277)4-8 • 1,008657-(15,99468-8 0,000549)= = 0,1372 ат. ед. Энергия связи 931 МэВ • (ат. ед.)~’Х X 0,1372 ат. ед. = 128 МэВ
ХШ-1-14. /и о 0,000549 n „noon / -7 1 т = г. г=0,00389 ат. ед. (в 7,1 У 1 — (о/с)2 У 1—(0,99/1,ОО)2 раза больше массы покоя). Ф, х.
ХШ-1-15. — Na dx-, f -^- = f Na dx\ Ф J Ф J Ф, Xl In </>2 — In </>! = Na (x2 — xj; __ In ф2 — In Ф1 -V(x2—x,) График зависимости ф от х дает наклон, равный Na. РАЗДЕЛ XIII-2
ХШ-2-1. , 0,693 0,693 _ , .. 44 t4i ~ 270 “ 0-257 сут ; /-44ч~24сут. « W Л/ ~ 0,257 • 44/24 « олл _ п тле 1 л. 2,303 “ 2,303 “ 0,204-9,796 10; -^- = 0,625 в 8 ч утра 23 августа. Активность чистого материала в 8 ч утра 22 августа была 0,625 • 3= 1,875 мкКи • г-1. Таким образом, фар- мацевт должен был прибавить 2,75 г растворителя на 1 г поставленного материала. Время, за которое было изготовлено лекарство, не принимается во вни- мание. РАЗДЕЛ XII1-3
ХШ-3-1. ^ = -AJV; dN = _-kdt-, ln-J-=-M; at ’ Wo = P D\ *4* 1П P + Di + D2 ln P
Радиохимия
393
In [1 + 4- (А + од]=М; 1" I1 + тт (1 + 4)] = U; '"['+1тн
XIII-3-2. У t = У ° — У2 — У3; - z2y2 = Zj (у? - у3) - (Ad + м У2; ^3 , дг dt d^N2 л cW3 /а । * \ dN2 , ' dt* dt ^1+Л2) dt = -X1Z2y2-(Z1 + Z2)^; + (*< + К) -^р + z,z2y2 = 0. Это однородное линейное дифференциальное уравне- ние с постоянными коэффициентами. Характеристи- ческим уравнением будет уравнение т2 + (Z, + Z2) tn + 4-Z,X2 = 0 с корнями Ш\ = — и т2 =—Z2. У2= Де-М4- де-M. Если / = 0, то У2=0 = Д + В. = Х,У° = - - Z2B. Решая, получим Л2 Л| N2 — , 1 j, (e-x'f — e~Klt). Aj “ Л|
ХШ-З-З. Для получения среднего времени жизни умножим каждое возможное время жизни t на число частиц, распавшихся к концу этого времени (—dN — XNdf)’, „сложим" (интегрируем) полученный результат для всех величин t в пределах от 0 до оо и делим на число исходных частиц. Передо = / ay dt = j tle-u dt = 0 0 ~и . ,, ..Г 1 — X ( W Io ~ А. ’
394
Г лава XIII
XIII-3-4.
Для нахождения поверхности шарового сегмента, пе-
ресеченного плоской круглой щелью, построим кольца
с окружностью 2nR (R = D sin 8), см. рисунок. Пло-
щадь этих колец
dA — 2nD sin BD dQ = 2nD2 sin 0 dB.
Интегрируем в пределах от 0 до 0:
г Iе
A — 2nD2 sin 0 dG = — 2nD2 cos 0 = 2л£)2(1 — cos0).
Геометрический фактор
Площадь, включающая щель
Площадь шара радиуса D
2nD2 (1 — cos 6) _
4лО2
= у(1 —COS0).
Так как cos 0 = — = -7=^—- ,
D У h2 + г2
то
G= —(1 -
2 k Vh2 + r2)
Для больших расстояний, т. е. когда h г, получаем
1 - h (А2 + г2Г'!г =
г2
Глава XIV
ХИМИЯ ПОВЕРХНОСТИ и коллоиды
РАЗДЕЛ XIV-1
XIV-1-1. М = ^~ = 1 = 6,8 • 104 г • моль-'.
PV 3,6.10-4-1
XIV-1-2. -£- = -4^3 23,5 (мм Н2О)-дл-г-‘.
С 19,26
Для других растворов
-у = 20,5; 19,3 (мм Н2О) • дл • г-1.
Построим график зависимости Р/с от с.
lim (—= 18,6 (мм Н2О) • дл • г-1 =
с->0 \ /
__________18,6 (мм Н2О) * дл • г"1 • 0,100 л« дл"1_ _
13,56 (мм Н2О) • (мм РТ..СТ.)"1 • 760 (мм рт. ст.) • атм-1
= 1,804 • Ю-4 л • атм • г-1.
,, n-rr I Р\ 0,08206 л-атм • °К-1 • моль“‘• 310 °К
М = RT lim — =------------------=т--------п--------—
\ с / 1,804 -10 4 л • атм • г
= 1,41 • 105 г моль-1.
XIV-1-3. 1,80 = 3,60 • 10~4М0'6';
5,00- 1О3 = Л4064; 1g (5,00- 103) = 0,641 g М;
3,6990 = 0,641g Л1; 1g М = 5,78;
М — 6,0 • 105 г • моль-1.
XIV-1-4. Построим график зависимости lg [т|] от 1gЛ4. Получим
прямую линию, показывающую, что данные удовле-
творяют уравнению [т]] — КМа, или lg[rj] = 1 g К +
-j- a IgAl. Пересечение прямой с осью IgM дает^/С
Наклон а = (d lg[T]]/d lgM) = 0,70; lg/C=-— 3,58 =
= 6,42 — 10; К = 2,6 • 10~4 (по литературным данным,
а = 0,68; К = 2,9 • 10-4).
XIV-1-5. Построим график зависимости lg[т|] от lgМ. Наклон
прямой равен а. Если lgM = 0, то 1 g[т]] = 1g К',
/< = 4,14 . Ю-4, a = 0,65.
396
Глава XIV
X1V-1-6.
а) 6 см3; б) Число кубиков —3-= Ю21 кубиков;
каждый кубик имеет поверхность 6 • (10~7)2 см2; сум-
марная поверхность 1021 • 6 • (10-7)2 = 6 • 107 см2 —
= 6 • 103 м2.
X1V-1-7. Построим график зависимости lg(Vg — V) от t; полу-
чим прямую линию с наклоном —k. /= 1380 с;
V = 0,167 см3; (Ve- У) = 0,284 см3; ]g(7e-V) =
=—0,547. Другие четыре случая обрабатываются ана-
логично. k= 1,38 • IO-4 с-1.
XIV-1-8.
Обе изотермы соответствуют физической адсорбции.
В случае (а) первый слой молекул адсорбируется
более сильно, чем другие слои; другими словами,
притяжение между N2 и Fe больше, чем между N2
и N2. Количество адсорбированного вещества быстро
увеличивается с увеличением давления от нуля, затем
после заполнения первого слоя этот процесс проис-
ходит медленнее. В случае (б) Вг2 лучше взаимодей-
ствует с Вг2, чем с SiO2. Количество адсорбирован-
ного вещества с увеличением давления увеличивается
медленнее. В этом случае кривая не имеет специфи-
ческой особенности, соответствующей заполнению
мономолекулярного слоя.
РАЗДЕЛ XIV-2
XIV-2-1. у0- у = 29,8 lg (1 + 19,64 с);
dy _ 0,4343-29,8. 19,64 _ 254
de ~ 1 + 19,64с — 1 + 19,64с ’
Ji__ с dy________ 254с ___
d ~ ~RT ~dc ~~ RT (1 + 19,4с) “
_ 254-0,01
~ 8,31 • 107 • 291 • (1 + 19,64 • 0,01) ’
S = 8,79 10-11 моль см-2;
lim S = = 5-34 • 1О-10
19,64/?r
(экспериментальная величина 5,35- 10~10),
Химия поверхности и коллоиды
397
XIV-2-2. р а) Построим график зависимости от Р. Пере- сечение прямой с осью в точке Р = 0 дает 1/6,; на- клон k.Jki. Р 3,5 10,0 16,7 25,7 33,5 39,2 18,6 Р[(х[т) 27,8 58,8 87,9 126,5 162,7 189,3 230,5 l/Zf! = 12; А;, =0,083; 62/6, = 4,50; 62 = 0,38. б) Построим график зависимости lg(x/m) от lg Р. Пересечение прямой с осью в точке lg Р = 0 дает lg k; наклон l//z. Р 3,5 10,0 16,7 25,7 33,5 39,2 48,6 lg (x/m) —0,900 —0,770 —0,716 —0,693 —0,686 —0,684 —0,677 IgP 0,554 1,000 1,223 1,410 1,526 1,594 1,688 lg6 = - 1,048; 6 = 0,0895; l/n = 0,271; « = 3,69. в) Построим график зависимости lg [(x/m)/P] от x/m; наклон k.
Р (х/т)/Р lg [(x/m)//3] 3,5 10,0 16,7 25,7 33,5 39,2 48,6 0,0360 0,0170 0,0114 0,00790 0,00615 0,00528 0,00434 -1,444 -1,770 -1,943 -2,102 -2,211 -2,277 -2,362
XIV-2-3. k = -7,61. Все построенные кривые показывают отклонение от линейной зависимости при высоких давлениях. Пусть х—число граммов адсорбированной СН3СООН= = (с0 — се) моль • л-1 • 0,200 л • 60,0 г • моль-1. — = kcxJn-, 1g — = lg k + — lg c. m e m 6 1 n 6 e Построим график зависимости lg(x//n) от lgce; полу- чим прямую линию. Пересечение в точке се=1 (1g се = 0) дает 1g 6; наклон 1/и. Со се х Х/’П 'g 'g се 0,503 0,434 0,828 0,209 —0,680 -0,362 В других пяти случаях обработка аналогична. Пере- сечение при 1g се=0 дает —0,552=lg k. lg 6=9,448—10; 6 = 0,28. Наклон 0,355 =!/«; п = 2,82.
1/.13 Зак. 1360
Глава XV
КВАНТОВАЯ химия и СПЕКТРОСКОПИЯ
XV-1. a) w = | F dr — | dr= — G/n2-|-1 = = — Gm2 [— —ztt] = L oo 0,74 • 10 8 J = - 6,670 • IO-8 • (1,7 • 10-24)2 j- = 0,74 • 10 8 = 2,6 • 10-47 эрг. б) Экспериментально полученное значение намного больше значения, рассчитанного из предположения, что только гравитационное притяжение является силой, которую необходимо учитывать. Эта разница показывает, что гравитационное притяжение состав- ляет незначительную часть от силы связи.
XV-2. Когда суспензированная капля масла неподвижна в пространстве, направленная вверх электрическая сила qE равна направленной вниз силе притяжения -у nr3g (р — ро), т. е. qE = у nr3g (р — р0). Для полу- чения q в эл. ст. ед. Е должно быть выражено в стат. В • см-1: £ = 4,50- 103 • 3,34 10-?= 15,0 стат. В • см-1; <7 = л (1,24- 10"4)3- 981 (0,92 - 0) = = 4,81 • 1О~10 эл. ст. ед.
XV-3. Е nhc 500 с~‘ • 6,625 - 10~27 эрг - с ~' Л ~ 5,000-10-5 см . . 2,998-1010 см • с-1 • 1 Вт on 1п-1б„ X — ГК? = 2,0 • 10 Вт. /ч 10'эрг* с 1
XV-4. АЕ АЕ эрг v = — = ; h 6,625 -10 ' эрг • с _ V V с-1 с ~ 2,998-1010 см-с-1 ’
Квантовая химия и спектроскопия
399
Е, эрг Е. с 1 Е, см 1
0 —>1 1,000-10~и 1,51 • io15 5.04-104 0 —> 3 3,500- 10"11 5,28 - 1015 1,76- 105 1 —» 2 2,000- 10"“ 3,02- 1015 1,01 - 105 2—> 3 5,00-10“12 7,55-1014 2.52-104
XV-5. гт he „ , he d'X .. Пусть х = , тогда dx — ' Кроме того, . he he dx ~ ^~~xkTr и = —FkT • Следовательно, , 8лЛс 7 — he dx \ pxax=~ (hc/xkT)3(ex - I) \ x2kT )’ oo 0 0 p = f px d7. = f px dx = f - —__ x r J J J (Лс/xfe?)5 (еЛ — l) z 0 OO OO 0 У 7 — hcdx\ Г 8nx3fe4P dx z'\ x2kT ) J (he)3 (ex — I) OO 8nk4T'' Г x3 < 8nfe47'4 я (he)3 J (ex-\)aX (he)3 15 0 _ 8л W __ 4 15 (he)3 ’ 8n5fe4 ГДе ff 15 (he)3 •
XV-6. dp n T_ „ J» -^- = 0, когда p == рмакс. Найдем и предположим, dp n что == 0- ал dp _ 5 I I (hc/kT) ehclKkT dK X6 ’ I X7 u> hcehc!KkT 5kT{ehc’KkT-\)‘ Если требуемое соотношение должно иметь форму закона смещения Вина, то необходимо принять, что ehdKkT ] Hj следовательно, ehcl,Kkr — 1 ehcl%kT. С учетом этих предположений получаем i hcehc!KkT _ he макс 5kTehclKkT 5kT '
*/213*
400
Глава XV
XV-7. ex — 1 +x + |.t2 + ex — 1 ~~ x, если | x | <C 1. ehc!kkT _ ] t еслн 8rtfte 8nkT P?- %5 (hctKkT) V ’
XV-8. 8nhc PX l5(ehc/^T_ ]) • Когда Z—>0, to ehc,’fM' 1 (так как hcl^kT -> оо) и ^ehciw — —> ghci^kT _ Следовательно, _ 8лйс _ 8nhce~hclKkT PX J&hc/KkT ^5 Ac Пусть 8nhc = ci и — ==c2, тогда для коротких волн _ с,е~с^т Л5
XV-9. а) Длина должна соответствовать целому числу по- луволн: I == —, где п — целое число. с сп 2lv , 21 dv v = -5- — -=г; п = ; ап = . Л 21 ’ с ’ с Между п и n + dn находится dn целых чисел. (хМы предполагали, что п настолько велико, что „беско- нечно малое" приращение все еще включает .множе- ство целых чисел.) Число волн dN —2dn, так как имеется два направления поляризации: dN = 2dn--= _ 4/rfv С б) dE — ё dN\ ё = (независимо от числа е ~ 1 измерений). ,р 4lhv dv -c^lkT_{y
XV-10. а) еге = nbv~. Средняя энергия излучения с частотой лг. 2 е„ exp (— nbv2/kT) bv2 У пуп ё (V) = ( У! exp (— nbv2lkT) У, уп п=0 п=0
Квантовая химия и спектроскопия
401
где г/ = ехр(— bv2jkT). Пусть f (у) = 2 Уп = (1 — у)
п=О
Тогда
оо
/'(£/) = ^nyn-'=(\~yr2-,
п~0
оо
yf' (у) = 2 пуп = у (1 — г/)-2;
п=0
ё (v) = 6v2z/(l — z/)-1 = bv2 [exp (bv2/kT) — I]-1.
Плотность излучения (стоячие волны) с частотой
между v и v + dv в объеме У равна dn — 8лУс~3т2 dv
(этот результат приведен во многих учебниках). Энер-
гия между v и v + dv равна dE=e.(y)div, функция
плотности
р dv = -^г = 8лс~36т4 [exp (bv2/kT) — I]-1 dv.
ОО оо
б) j pdv = -^-j v4[exp(bv2lkt) — I]-1 dv —
о о
co
= 8л&/2£\^ f x^dx_ = const . fy.
c3 \ b I J ex ‘
XV-11. a) n{ = 1, n2= oo.
б) /г, == 3, «2 = 5.
XV-12. ’ = Лн(^--109 677,76 (J,--i)-
= 2673,395 cm-1.
XV-13. Когда осуществляется переход с любой главной обо-
лочки к следующей главной оболочке, то прибав-
ляется новый подуровень. Каждый прибавленный
подуровень содержит на две орбитали больше, чем
предшествующий. Первый главный уровень (К) со-
держит один подуровень, состоящий из одной орби-
тали. Второй главный уровень (L) состоит из двух
подуровней, состоящих из 1 -|- 3 = 4 орбиталей,
а третий главный уровень М — из трех подуровней,
содержащих 1 3 5 == 9 орбиталей. Согласно прин-
ципу запрета Паули, два электрона на одной и той
же орбитали не могут иметь одинакового спина.
Поскольку имеются только два возможных спина
402
Глава XV
XV-14.
( + —£)> это означает, что на любой орбитали
может быть не больше двух электронов. Оболочка М
содержит 9 орбиталей, следовательно, на ней может
быть не более 9-2=18 электронов.
а) -ф] — 0, когда ах + Ы = л/г, где п = 0, ± 1, ±2, ...;
яп — bt
Х =-------.
а
Каждая такая узловая точка двигается вдоль оси х
dx
в отрицательном направлении со скоростью —
Аналогично для ф2 = эти волны рас-
пространяются вдоль оси х в положительном напра-
влении. Длина волны в каждом случае равна удвоен-
ному расстоянию между соседними узловыми точками:
X = 2 (хп+1 — х„) = ~ (см. рисунок).
Н---------л-----------4
6) Ф+ = sin (ах + ^0 + sin (ах — bt) =
= sin ах cos bt + cos ax sin bt -f- sin ax cos bt —
— cos ax sin bt = 2 sin ax cos bt.
- nn ~
Функция имеет узлы при х~—. Эти узлы не из-
меняют свои положения со временем и, следова-
тельно, функция соответствует стоячей волне.
Аналогично ф_ = 2 cos ах sin bt с узлами при
XV-15. а) = А ЗЬф
' 2л1 di т 2лг di
, , — 2niEt , .
In ф =----д----h const;
ф =
б) [Ф |2 = | Фо PI e~2*lEtlh |2 = [ф012,
поскольку | е‘ф | = 1 для любого действительного <}>.
Следовательно, | ф |2 не зависит от времени. Соб-
Квантовая
химия U спектроскопия
403
XV-16.
ственная функция энергии соответствует стабильной
вероятности распределения. Химию интересуют, глав-
ным образом, долгоживущие стабильные молекулы,
в которых распределение электронов остается по-
стоянным во времени. (Отметим, что ф0, оставаясь
постоянной во времени, может зависеть от х, у и г.)
. „ 1 I й д \2 . . Л2 д2 . ... .
а) Н *= 75- 75—г -5— I 4“ V (х) =-g-»-7—9- V (х).
’ 2m \ 2л/ дх ) 1 v ’ 8л2т ox2 1 v ’
б) ____d2^ _i_ у (х)ф =--------—
°' 8n2m dx2 V W ф 2л< dt
в) ф=ф0 (X) e -m e-*iEllh +
+ V (x) ф0 e~2niEilh =
Аф0(-
2m \ h j
h2
8л2 m
^- + 7(х)ф0 = £ф0.
XV-17.
Полученное уравнение — известное, независимое от
времени, уравнение Шредингера.
Пусть V' = V + C, или V = V' — C.
Л2 й2ф
8 л2 m dx2
(У' -С)ф = Еф;
Л2 rf2xp
8л2/п dx2
+ У'Ф = (Е + С)ф.
XV-18.
Таким образом, уравнение может включать V
вместо V, но тогда каждое собственное значение
энергии увеличивается на ту же постоянную С. Пе-
речень энергий определен (относительно некоторого
выбора для начала отсчета V.
а) Для О^х^а имеем следующее уравнение Шре-
дингера: —8n2m~dx^~^' Этому уравнению удовле-
творяют функции типа sin kx, coskx и e‘kx. Для
х<0 или х>0 ооф==Дф и ф = 0
(исключая Е — оо или — Тогда для непре-
рывности функции ф=0 при х = 0 и х — а. Только
sin kx = 0 (а не cos kx или eikx) при х — 0. Чтобы ф — 0
при х=а, ip(a)=sin kx=0; ka=nti, п=0, ±1, ±2, ... .
Тогда фп W = sin j • Однако п = 0 должно быть
404
Глава XV
XV-19.
исключено, так при п = 0 ф = 0. Чтобы получить Еп,
подставим фл в уравнение Шредингера:
d’ibrt / лге \2 . лпх ( лп2 \2
Sln ф„;
h2 d2^n __ 1 / n/г \2
8л2т dx2 8т \ а ) nWn>
Е = _Lp^2.
,г Ът\ а ]
h d'&n h ли лпх , ,
б) -т-2- = -л------COS---- =/= const • lb„.
' 2Л1 dx 2л1 a a
фге не является собственной функцией момента коли-
чества движения. В интервале частица
обладает только кинетической энергией, которая свя-
зана с моментом р: Е = или р= + У2тЕ. Сле-
довательно, для данной энергии возможны два мо-
мента, соответствующие противоположным направле-
ниям движения частицы.
\ П № dZlb С I
а) Внутри ящика: - -$ = Вф.
Вне ящика: —=4—-ф ооф = £ф.
8л2т dx2 1 т т
Тогда вне ящика ф = 0.
б) i|: = Xsin(cx)-|- Bcos(cx).
Для непрерывных функций внутри и вне ящика:
Ф — у) = — я sin-y + В cos -у = 0;
ф(у) = A sin-y + В cos-y- = 0.
2Лэт—= 0.
а
Либо Л = 0, либо sin-y = 0:
-у- = пл, п = ± 1, ± 2, ... ;
2да . . . . 2лпх
с=------; ф = Лз1п----.
а ’ т а
2В cos у = 0.
Либо В = 0, либо cos -у = 0:
у — л, п — 0, ±1, ±2,
Квантовая химия и спектроскопия
405
XV-20.
с = д 1)зт ; ф = В cos |)зтх j.
в) = —с2^; —оД— (— с2ф) = Еф;
' dx2 т ' т/
h2c2 h2i2
/ = 2п или2ц-1 (±1, ±2, ...).
х р _ h2 _ 5,49- 10-51 .
a) 8та2 та2
б> ^-S. = e = 3E,;
в) Е = у kT = у 1,38 • 10-16 300 = 2,07 • 10"14 эрг;
г, г, n2h2 2а V2mE
Е^ Еп — -=—т; п <--------т—.
п 8та2 h
Множеством целых чисел, которые удовлетворяют
этому неравенству, является число уровней с энергией
меньше Е.
а) Еь эрг б) Еч — эрг в) п
1) 6,02- КГ11 1,81 • 10~‘° 0
2) 1,64- 10~3° 4,92- 10~3° 1,12-10“*
3) 5,49- 10~G° 1,65- 10“59 6,15- 10“22
XV-21.
. h dtb । Л d In ib
= ы~аГ- = Р'
In ф — —+ const;
Ф — CeMlpx^h (C— постоянная).
б) Функции, полученные в задаче XV-18 (а), имеют
следующий вид:
е—ikx___e~lkx
фп = sin kx =------—------
, ЯП
k = —
а
Эти функции представляют линейную комбинацию
функций (а), если ikx = ± ‘ZTtipxjh (k= ± 2лр/И) или
± kh
Р 2л~
± nh
2а
± l/2/П^.
Таким образом, функция фге для определенной энер-
гии является линейной комбинацией собственных
функций операторов количества движения, причем
каждый оператор отвечает одному из двух возможных
моментов ± У2тЕп, соответствующих энергии Еп.
406
Глава XV
Эта комбинация не является собственной функцией моментов, но соответствует наблюдаемым моментам У2тЕп и — ]/2тЕп для противоположных направле- ний распространения волн.
XV-22. Л = А; ф (х) = Ce2niPx/h-, ф 4- X) = Ce2nipxlh e2MPK!h=Ce2MPx!h • e2in’ = ф (х), так как e2nl = 1. Таким образом, ф повторяется через интервал Л, который должен быть либо длиной волны, либо целым числом волн. Однако нет целых чисел п (кроме п=1), таких, что ф(хф-А)=ф(х). Я5 = ф (х) e21ti/n — ф (х) только, если «=1,-5-, А z о Следовательно, Л — длина волны.
XV-23. Ар Ах = — a — nh^h. г а
XV-24. C„sin , (Сп — нормировочная фге— постоянная) 0, х < 0 или х > а 00 а Г 12 «2 г , . г лях , „ а 1 J |Ф„|2с?х= | |Cresin а dx=c2n пп 2 2 =1; — оо 0 Сп = (для всех п в этом особом случае) т /~~2 . ЛПХ г. , 1/ —Sin , ООчй Фя = | Г а а 0, х < 0 или х > а
XV-25. а) ф=0 для х < 0; для непрерывности функции ф(0)=0. Уравнение Шредингера имеет следующий вид при х > 0: _ h2 а2ф F 8л2т dx2 ~~ •С'Р’ Как и в задаче XV-18, ф = зт£х, тогда ф (0) = 0, что и требовалось получить. Однако в этом случае нет а, таких, что ф(а) = 0, поэтому только действи-
Квантовая химия и спектроскопия
407
тельные числа (исключая нуль) приемлемы для k.
h2 d2ty h2k2 . r h2k2 c л л
---—77= 02” Ф’> E = тгл—; E может быть любым
8л2т dx2 8л2т т 8л2т
положительным числом.
б> 2^77 = cos/гх#= const -ф.
Следовательно, ф не является собственной функцией
момента количества движения, но, как и в задаче
XV-18, она будет линейной комбинацией собственных
функций моментов с собственными значениями У 2тЕ
и — У^тЕ. Последовательность волн, соответствую-
щая определенному моменту, должна будет отра-
зиться от барьера при х = 0, давая начало другой
последовательности волн, движущихся в противопо-
ложном направлении.
XV-26.
В прямоугольной потенциальной яме по мере увели-
чения энергии уровни находятся на все более широ-
ком расстоянии. Чем шире яма, тем более тесно рас-
положены уровни. Таким образом, в данном случае
уровни будут все более широко расположены по мере
движения из глубины ямы, но при У] промежутки
уменьшатся, потому что яма расширяется. Проме-
жутки снова начнут возрастать до V2 тогда, когда
яма становится бесконечно широкой и уровни обра-
зуют континуум (нулевые промежутки).
XV-27.
Область 1: Ф1 = 0.
Область 2:
й2 d2^2
2m dx2
ф2 == А2 sin с2 х + В cos с2 х;
У2тЕ
С2~ й •
Область 3: - -jf = (Е - Уо) Фз!
ф3 = Л3е-С1* + Взе**;
408
Г лава XV
/2от(У0-£)
(0) = ip2(0) . ’. 0 = В2
Фз (оо) = 0 . •. В3 = 0
ф2 (а) = фз (а) . * • А2 sin с2а = А3е~Сза
т|з' (а) = ip' (а) . *. А2с2 cos с2а = — А3с3е~с=а
(1)
(2)
Разделим (2) на (1):
с2 ctg с2а = — с3;
У 2тЕ аУ 2тЕ _ У2т (Vo — Е) ,
fi Ctg ti Й ’
ctg££2m£=_y< А - 1.
Это трансцендентное уравнение для Е имеет решения,
соответствующие энергетическим уровням. Найденные
уровни будут расположены ниже и ближе друг
к другу, чем в случае Уо= <х> (задача XV-18). Имеется
только ограниченное число связанных состояний.
Уравнение (1) дает
Окончательно А2 или А3 определяется нормировкой:
/ 1Ф21i 2 dx = f I Фз I2 dx = 1;
J A^ sin2 c2x dx + J Л2е“2езХ dx — 1;
sin 2c2a , sin2 c2a \
i2 — a------j—-—-------„ = 1;
\ 2 4c2 1 2ca /
i __/1 sin 2c2a , sin2 c2a \”I/l_____
2 \ 2 a 4c2 + 2ca /
__I a____sin (.2аУ2тЕ!Ь) . sin2 [д У2m (Vp — E)lti\ I
| 2 ~ (4 К2Й£)/Й + (2 (Vo-В)]/» /
Квантовая химия и спектроскопия
409
XV-28. а) £ =
’ 2m дФ ’
L2 _ _ /г2 д2 _ ,,
21 ~~ 8л2/ дФ2 ~ " •
б) =
ф = sin/?</>, cos/?</> или е‘кф.
h2k2
Подстановка любой из этих функций дает -^7- = Е.
Поскольку точки = О, ± 2л, ± 4л, ... в физиче-
ском смысле одинаковы, ф должна быть периодиче-
ской функцией с периодом 2л:
sin кф = sin /?(</> + 2л) = sin cos 2л/г -f- cos кф sin 2л/г;
cos2nft = l, a sin2nft = 0.
Это требует, чтобы /г = 0, ±1, ±2, .... Тот же ре-
зультат получим для ф = соз/г^ или е‘кф.
XV-29. a) = - 2ахе~^-
' dx ’
•d^i- — (4а2х2 — 2а) e~ax‘\
Г—Д;— (4а2х2 — 2а) + 4- /?х21 е~ах? — Ее~ах\
L 8mm ' ' 1 2 J
Члены левой части этого уравнения, содержащие х2,
должны быть равны нулю:
+ 1 ^2 = 0;
л У km г, 2ah2 h / k 1 ,
й=—h~’ £==«T = 17V
6) ^ = (-2ftx2 + \)e~hx‘-,
^ = ^№-bbx)e-bx\
\-=^~ (4Z>2*3 - 6bx) + 4 M e~^ = Exe-bx\
L OJv til & J
Члены этого уравнения, содержащие х3, должны быть
равны нулю:
h2b2x3 ,1,0 А , л У km , .
- '2л5^' + "2 kx — 0; Ь =----h-- <ТаК же> каК и ДЛЯ а>>
с 6bh2 8h f k 3 ,
£ = = =-2 /lv’
410
Глава XV
XV-30.
XV-31.
XV-32.
’ 4>i (0) ~' 1 “°
- ja(Ax)2lge=-1; (Ах)а = у^-; a =
(Ax)2 =-------------—----; \x =—=L=.
4rt2wi£'lge nymElge
6) x = Л sin2nv/;
p = m^t~ = 2nvmA cos2nvt;
Рмакс == ± 2nvffM
(соответственно cos2nW=± 1, x = 0).
£ = 4- + т*х2 = Т^ + °; Л.«с-± /2mE;
— т/ — = 1,37Л.
л V mE ige л ' lg e
Принцип неопределенности требует, чтобы kptxx^h.
у, О* О *О % (р
W3O* *О О— Р2Ь © О ©
Любые колебания, которые сопровождаются измене-
нием дипольного момента молекулы, должны быть
активны в инфракрасной области: v3, v2a и v26. Заме-
тим, что v2a и v2b имеют одинаковую частоту, и по-
этому они являются вырожденными.
а) у = 2989 см-1,
v = y = 2,998 • Ю10 см-с-1 -2989 см~'=
= 8,96 • 10'3с-'.
тхт2 1,008-34,97 nnoi
б) И= -35,98 —Q.981 ат. ед.;
0,981 ат. ед. • 6023.1023 ат_ ед — 1,63-10 г.
в) v==^rVT;
= 4я2(8,96 • 1013)2 с’2-1,63- IO’24 г • ---
108 А 1 г-см-с-1
= 5,17 • 10-3 дин/А.
Квантовая химия и спектроскопия
411
XV-33.
а)= е в(г~г^) Ве~в{г~г'>'1 = 0, когда г = г0
и г = оо.
= 2АВ [(1 — е~в (- В) + Ве~в <г~'•>] е~в
— 2АВ2>0, где г — г0. Поэтому V имеет минимум,
когда г — г0, т. е. V(ro) = O и V > 0, если г#=г0.
Следовательно, V (г0) в этом случае минимально.
б) V(ro) = O, У(оо) = Л;
D = V (oo) - V (г0) = А.
в) Вблизи r — r0 V — ^-k (г — г0)2;
е~в (г-го) = ] _ в (г — г0) + ...;
V - А [1 - 1+ В (г -г0) ~ |в2(г - го)2]2 ~
яа АВ2(г — г0)2 [пренебрегая степенями (г — г0) выше
первой].
k=2AB2
_ 1 / k у/2 _ В / 2А у/г
v 2л (ц) 2л \ ц /
Более просто: = —2АВ2.
\ гч гл It л Bh / 2А \'/s
г) Aicnp — D 2 hv —А 4Jt ( р, ) •
XV-34.
Ix = fflb-r2 + 2mF — -|- mFr2;
412
Глава XV
XV-35. а) Орбиталь х2 — у2 ближе к отрицательным зарядам,
и поэтому электроны этой орбитали должны иметь
наибольшую энергию. Орбиталь ху находится не-
сколько дальше, гх- и i/z-орбитали — еще дальше;
орбиталь Зг2 — г2 самая дальняя (см. рисунок).
х2-уг
ху
yz zx I/2 zx
3z2-r2 3z2-r2 х2-у2
а б
б) Четырехугольная схема рассматривает все оси по-
добными, следовательно, Зг2 — г2 и х2 — у2 имеют
равные энергии. [Имеются три эквивалентные, но
линейно зависимые орбитали: х2 — у2, г2 — х2 иг2 - у2,
любые две из которых могут служить для получения
линейно независимого набора. Обычно выбирают
(г2 — х2) + (г2 — y2) = 2z2 — х2 — y2 = 3z2 — г2.] Такие
две орбитали, которые относятся к гранецентрирован-
ному кубу, более удалены от отрицательного заряда,
чем другие три, которые относятся к ребрам центри-
рованного куба (см. рисунок).
XV-36. a) D,. 2 = (fe ± ф2Рг) = = ~^а0~^ [2 + -Ц- 8 V л L а0 б) Если z=±a0, то х — у = или л, a cos 0 = ± 1. D] = а-3/> Гг + —(— 8 Гл 0 L йо 1°. ± 1)2; |Z).(e = 0)i2 = ^; 1^ (6= л) |2 = 0. 1 ± cos 0)^j e~rl2a>. = 0; тогда г = а0, 0 = 0 1 + 1) e~a<ii2a4 =
Квантовая химия и спектроскопия
413
а-Ъ
в) fe(r=«0) = -^e-7S
11 12 ао'е
1^1 -~32^
йп-’/ге-1/а
+Pz (г = о, е = О или л) = ±
2 4 у 2л
XV-37.
г) При 0 = 0 | Di |2 в два раза больше, чем | ip2s |2 или
|ip2Pz|2. Таким образом, D{ должна более соответство-
вать образованию ковалентной связи с большой
межъядерной электронной плотностью с другим ато-
мом, приближающимся вдоль положительной оси z.
Однако для 0 = л D\ — 0 при г = а0 и I Т>, |2 обычно
незначительна вдоль отрицательной оси z. Таким
образом, D\ не соответствует образованию ковалент-
ной связи с атомом, приближающимся вдоль отри-
цательной оси z. Аналогичные заключения с поло-
жительным и отрицательным обменом применимы
к £>2- Эти результаты, конечно, не применимы коли-
чественно к другим атомам, кроме водорода, но каче-
ственно они справедливы.
Р— | j | |ip2Pz|2r2sin0 dr dQd<l> —
ООО
ao л
= j (re~r/2a‘)2 r2 dr | cos2 0 sin 0 d02n =
о 0
= -f6 a^5 f e~r/a° (“ aori ~ 4aor3 ~ 12aor2| ~
- 24a<r- 24a->)|“°==-^-(-646-*+ 24) = 0,00366.
XV-38.
a ff
14 Зак. 1360
414
Глава XV
в) В случае (б) данный протон в С может иметь любое
из трех различных магнитных окружений, соответ-
ствующее четырем возможным спиновым состояниям
протонов в ОН2: фф, U (второе и третье экви-
валентны). Правило отбора устраняет возможность
перехода между состояниями, отличающимися по
спину другого протона, в С. Таким образом, три
линии протонов СН2 имеют относительную интенсив-
ность 1:2:1. Аналогично имеются три линии для
протонов ОН2 в результате расщепления протонов
СН2. В случае (а) быстрый обмен . протонов ОН2
между различными молекулами усредняется из-за их
магнитного окружения. В первый период радиочастот-
ного излучения каждый протон будет принадлежать
различным молекулам и каждый протон в СН2 будет
иметь соседей в О во всех возможных спиновых
состояниях. Имеется только одна пара энергетических
уровней для протонов СН2 и одна пара — для прото-
нов ОН2, соответствующая такому среднему состоя-
нию, но ориентированная параллельно или антипарал-
лельно приложенному полю.
Глава XVI
СТАТИСТИЧЕСКАЯ ТЕРМОДИНАМИКА
XVI-1-1.
XVI-1-2.
РАЗДЕЛ XV1-1
Степени свободы Вклад в теплоемкость
Поступательная 3 3/2/?
Вращательная 3 3ER
Колебательная 3-4 — 6 = 6 QR
9/?=18 кал • моль-1 •°К—1
а) Не CF4 C2F2
Поступательный 3ER 3hR 3/2R
Вращательный 0 3ER R
Колебательный 0 9R 7R
3hR 12/? 19/2/?
XV1-1-3.
б) Не. Равна. Поступательные энергетические уровни
расположены так близко, что поступательное движе-
ние классически возбуждается при любой температуре
существования газов.
CF4 и C2F2. Меньше. Уровни колебательной энергии
достаточно далеки друг от друга, так что вклад
каждого вида колебаний при комнатной температуре
меньше R. Вклад валентных колебаний с большей
частотой обычно равен 0; вклад деформационных
колебаний от 0 до R.
Молекула газа имеет 3 поступательные и 2 или 3 вра-
щательные степени свободы. Вклад каждой степени
свободы в мольную теплоемкость при температуре,
равной или выше (или даже значительно ниже) ком-
натной, равен УгУ?. В твердом теле эти степени свободы
относятся к колебаниям решетки; вклад каждого
колебания в теплоемкость равен R при такой тем-
пературе, что kT > hv, где v — частота колебаний.
Так как частота колебаний решетки низкая, то это
14*
416
Глава XV/
XV1-1-4.
условие вполне удовлетворяется при комнатной или
более высокой температуре. Таким образом, можно
ожидать, что мольная теплоемкость твердого тела
будет превышать теплоемкость газа приблизительно
на 5/27?, если молекулы линейны, или на 3/?, если
молекулы нелинейны. Подобные рассуждения приме-
нимы и к жидкостям. Добавочная теплоемкость может
быть больше, если имеются сильные межмолекуляр-
ные силы, особенно водородные связи, которые раз-
рываются с поглощением тепла по мере повышения
температуры.
— ^Na+^C1 c-ABn/fer
С '/NaCl ’
где q — функция по состояниям, выраженная в энер-
гиях, измеренных относительно соответствующих ос-
новных состояний. Мы высказали предположение, что
эти функции одинаковы для реакций в газовой фазе
и в растворе.
Де0(Г) =8,63 • 10 12 эрг • молек-1;
. 8,63-10~12
&e0(aq) =-----gg---- эрг • молек *.
(ад)
(г)
= ехр
= ехр
' ~ [Ае0 (ад) ~ Ае0 (г) \
kT г
' 8,63 • 10~12 (1 — 1/80)'
1,38-10-16-300
XV1-2-1.
РАЗДЕЛ XVI-2
В общем молекула имеет 2п степеней свободы (2 для
каждого атома). Имеются 2 поступательные и 1 вра-
щательная степени свободы и, следовательно, (2п—3)
колебательные степени свободы, каждая из которых
соответствует определенному виду колебаний.
Если молекула линейная, то доводы очень про-
сты. В трех измерениях отличие значительно, потому
что когда молекула линейная, одна вращательная
степень свободы переходит в колебательную. Однако
в данном случае эта степень свободы будет соответ-
ствовать движению из плоскости и, следовательно,
будет отсутствовать.
Статистическая термодинамика
417
XVI-2-2.
dN. — Cp-ar2lkT
а) dA
6) dA — 2лг dr;
dN = 2лСе~аг!,кТ r dr.
J ar2e~ar2/kT r dr
в) u (r) = ar2 = -2-^-----------~kT.
f e-arW r dr
о
XVI-2-3.
а) Вероятность нахождения молекулы c vx между
vx и vx + dvx и одновременно с vy между vu и
vy + dvy равна произведению отдельных вероятностей:
dN°x°y (dN°A(dN°A
Л у / Л I ! У |
Nобиз. \ Nобщ. /\№общ /
°х +
2kT
— А2 ехр — m
dvx dvu.
л у
Преобразуя это выражение к полярным координатам
в пространстве скоростей, получим
d^vxv
v -У- = A2e-m^2kT V dv d$.
N06ux
Для того чтобы получить число молекул, имеющих
скорости между v и и •-}- dv, „сложим** (интегрируем)
молекулы для всех значений угла
2л
= J A2e-mv,l2kT vdvd<l> = 2nA2e~m^2kT v dv.
общ o
Это выражение должно дать 1 при интегрировании
по всем скоростям:
f = 2лД2 f v dv = 2лЛ2~ = 1;
J V06m J m
0=0 0
Д2_ m '
. 2nkT *
® s= j С7 = т/АГР'~’“Го!йНт£)'‘-
v=0 0
418
Глава XVI
XVI-2-4.
XVI-2-5.
XV1-2-6.
я\ Й— ________
' dp 2 + ₽e ’
6) S= /г(1пр + р{7) = /г[1п(2 + ре)--^
B\ < _ dU_ W k(p _д_й _kl Ре V
' дТ d$ dT 1 SP \ 2 + P8 / '
а) (2эл = 3 e~e,kT при предположении, что для каж-
дого уровня I с ег > е gie~e^kT е~&!кт.
N, e-W
б) NT ~ 3
1
ехр
( — 1,38- 10-14
V 1,38- IO-16- 100
е~1/з=0,123.
Мы приняли, что вращательный и колебательный
уровни одинаковы, независимо от того будет ли мо-
лекула в синглетном (S) или триплетном (Т) состоя-
нии; т. е. что ее моменты инерции и силовая
постоянная остаются такими же. Если это предполо-
жение не справедливо, необходимо записать, что
М е~&1кт О
IVS е *<вр, к (Г)
3QBP1 к (5)
где QBp, к — функция распределения для вращения и
колебания в молекуле в одном из двух электрон-
ных состояний. Сделанное выше упрощение состоит
в том, что QbP, к (5) = Qbp, к (D- Действительно, только
в этом случае электронный фактор функции рас-
пределения может быть написан раздельно, как
в пункте (а).
а)
1*вЛ /вВ
N А _ Ч А . В _ Чв .
N Ча + Чв' N 4A + qB'
iA^kT2_dln4A_. ^т^Чв
ел dT , ев к/ dT .
б) {/= Мдёл + Мвёд.
в) Cv=NA^+NB^ + eA^ + sB^.
Если переход невозможен, последние два члена
должны быть отброшены.
V 47. — dlr,
Г) ^VA= dT •. С¥В = -^р-
Статистическая термодинамика
419
XV1-2-7.
cv=nacva+nbcvb+
, [(!B(dqA/dT)-qA(dqB/dT)]N(eA-eB)i
+ (dA + dB)2
dC>A __ dAd\n.qA _ qAiA ' dqR _ qвгB .
dT dT kT2 ’ dT kT2 ’
Су = NACVA + NBC- = nacva + nbc 1 qAQB(eA йд) (dA + dBfkr2 1 Na‘^b (ёд ~ ®в)‘ ^(ёд- ёд) —
а) VB “ NkT2
Вклад в теплоемкость
степени свободы поступа- тельный вращательный колеба- тельный общий
Не cf4 C2F2 0 9 7 а/2Я ам а/2Я 0 а/2Я R 0 9/? 7R а/2Я 12/? 19/2я
б) Для He предсказанная величина будет правиль-
ной; включается только поступательное движение, и
уровни поступательной энергии сходятся достаточно
близко для того, чтобы можно было применить клас-
сическую механику. Тоже относится к поступатель-
ному и вращательному движению молекул двух других
газов, но не к их колебаниям. Уровни колебательной
энергии (по крайней мере валентных колебаний) на-
ходятся на таком далеком расстоянии, что при ком-
натной температуре лишь немногие молекулы возбуж-
даются до высших энергетических уровней при
повышении температуры, и, следовательно, эти ко-
лебания вносят меньший вклад в теплоемкость, чем
предсказывает классическая механика, в) Пункты (а)
и (б) подразумевают, что движение электронов
незначительно сказывается на теплоемкости. Это
предположение правильно до тех пор, пока расстоя-
ние ДЕ между низшим и ближайшим к низшему
электронными уровнями велико по сравнению с kT:
kT^\E-, T« — = 3,13'б) * * * 10~‘г = 2,77- 105°К.
k 1,38. 10“Ib
Если это условие не удовлетворено, то Cv > 3/2/?.
В грубом приближении CV = ^R, когда Т ниже
104°К.
420
Глава XVI
XVI-2-8.
XV1-2-9.
а) В данном случае имеются 9 — 6 — 3 колебатель-
ных степеней свободы.
Су = (4 + 4+3)/? = 6/?.
б) Приближенный результат, полученный в (а), при-
меним, если hvIkT < 1, или Т > hv/k. Если это усло-
вие удовлетворяет высшим частотам (v 4,08 1013с“*),
то оно будет удовлетворять и другим частотам.
hv _ 6,625- 10~27-4,08- 1013 = j gg
k 1,381-IO"16
Если Т » 2 • 103°К, то Cv приближенно определяется
выражением, полученным в (а).
а) Вклад каждого вида колебаний в теплоемкость
зависит от отношения расстояния между энергетиче-
скими уровнями (Av) к kT:
hv л on 1Л-Ч v
-т^-= 4,80- 10 -sr
kT ’ I
(v выражена в c~’; T — в °K)
Вид колебаний I 11 ill
Т V 1,00- ю13 9,0- 1013 1,00 - 1014
100 hv 4,80 43,2 48,0
1000 kT 0,480 4,32 4,80
Если hvfkT < 1, то вклад колебаний в если
то вклад колебаний в Cv практически
равен пулю. Второму условию удовлетворяют все
виды колебаний при 100° К; при этой температуре
можно предположить только поступательный и вра-
щательный вклады: Cv = (у + у) R = 3R. При 1000° К
вклад в теплоемкость колебаний II и III будет все
еще очень мал, но для колебаний I hv/kT < I и
ev“(4+4+i)R=«-
б) Имеется три вида колебаний. При высоких темпе-
ратурах вклад каждого вида в Cv равен R:
Статистическая термодинамика
421
в) Если hvIkT < 1 для каждого вида колебаний, то
результат (б) будет правильным. Это условие наибо-
лее трудно удовлетворяется для колебаний с высшей
частотой (III). Когда для этого вида hv/kT=\, то
Т = hvlk = 4,80 10"“ • 1,00 1014 = 4800°К.
X VI-2-10.
XV1-2-11.
Вклад каждого вида колебаний в Cv равен
если hvjkT <1, и ~0, если hv/kT 1.
Вид колебаний 1 11 ш
Т, °к v 4,0-1012 5,0- 1012 7,0 • 1013
500 1 hv Г 0,38 0,48 6,7
5000 J kT 1 0,038 0,048 0,67
500 Вклад в Су R R 0
5000 R R R
При 500°К Су = (4 + 4+2)/? = 5/?;
При 5000°К Су = (4 + 4+ з)/? = 6/?.
а) В данном случае имеем три поступательные и две
вращательные степени свободы; каждой степени сво-
боды соответствует вклад в теплоемкость 'I^R'-
Си = (у + 4 + = -у- R = 18,88 кал-°К"‘ • моль"1.
б) Это предположение подразумевает, что вклад
каждого деформационного колебания в теплоемкость
равен R, а каждого валентного колебания равен
нулю:
Cv = (4 + 4) R ==-у R — 12,92 кал • °К"' • моль"1.
в) В данном случае вклад колебаний равен нулю:
Cv = у R ~ кал ’ °К~' 1 моль"1.
г) Экспериментальное значение находится в интерва-
ле между величинами, полученными в (б) и (в). Таким
образом, оказывается, что валентные колебания
«заморожены», а деформационные колебания воз-
буждены так, что их вклад в Cv составляет
8,0 — 4,97 = 3,0 кал • °К-1 • моль"1,
422
Глава XVI
XV1-2-12. Классическая теория принимает, что расстояние
между энергетическими уровнями равно нулю. В этом
случае применимпринцип распределения Больцмана:
средняя энергия каждого осциллятора (колебание —
единственный вид движения в твердом теле) равна kT,
или NkT для N осцилляторов, и теплоемкость, рав-
ная Nk, не зависит от температуры. Теории Эйн-
штейна и Дебая учитывают квантование энергии:
если частота осциллятора у, то расстояние между
уровнями энергии hv. Если kT hv, то осциллятор
«заморожен»: практически все осцилляторы с этой
частотой находятся в их основном состоянии, они
остаются в этом состоянии и при небольшом повы-
шении температуры и практически не поглощают
энергии. Их вклад в Cv будет равен нулю. Таким
образом, для всех видов колебаний lim Cv = 0.
Г->0'
б) Теория Эйнштейна полагает, что все осцилляторы
имеют одинаковую частоту v0. Если kT hv0, то Cv
практически равно 0. По теории Дебая, осцилляторы
имеют частоты от 0 до максимальной частоты vD.
Для всех частот не существует температур, при
которых kT <С hv. С падением температуры все
меньше осцилляторов вносят заметный вклад в Cv,
но низкочастотные осцилляторы влияют на тепло-
емкость вблизи Т — 0 значительно больше, чем пред-
сказывает теория Эйнштейна.
РАЗДЕЛ XVI-3
XVI-3-1. а) Для одной частицы со скоростью (их, и^) измене,
ние момента количества движения при столкновении
с ребром, параллельным оси у, равно крх — ~2mvx.
Время между столкновениями с ребром M = 2L[vx.
Средняя сила, с которой ребро действует на частицу
Ьрх/Ы — — mv2IL, а частица действует на ребро со
средней силой mv2x/L.
v2 = v2 + v2.
Усредняя по всем частицам, получим
Сила, с которой все Af частиц действуют на ребро,
составляет
A'mv2 Nmv2 Ne,
~L~^~2L~=Z~’
Статистическая термодинамика
423
XVI-3-2.
Сила на единицу длины равна Nil!2.
б) Принцип распределения Больцмана предсказывает,
что средняя кинетическая энергия для каждой степени
свободы равна ~^kT. В этом случае имеется две сте-
пени свободы и ё = kT.
j ve
\ - °
B) v = —-----------------------
| e-4^/KTv dv
0
V rt m
4 (mIZkT)’11 ~kT
nkT
2m /
a) f (v) — Ce~mvl/2kT v,
OO OO
[f(v)dv = C f e~m^2kTvdv = C — = 1; C = ^
J v J m ’ kT
о о
f(v}^^rem^!2kTv.
6) v = ~ J e~mv'1,2kTv2 dv
0
__ ni 1 /2kT V
kT 2 \ tn /
__ 2kT .
tn 9
v2 = ~ [ e-"102^^3 dv
kl J
0
OO
и3___^_ | e-mv2/2kTv4 dv ==-~
в) Рассмотрим молекулы, скорость которых находится
между v и v + dv\ вектор их скорости образует угол
с отрезком линии АВ между 0 и 0 -|- dQ (см. рису-
нок). Эти молекулы будут сталкиваться с отрезком
в течение секунды, если они расположены в парал-
лелограмме ABC D, _гд$_ AD = v. Площадь этого
параллелограмма (ЛВ) (А£>) sin 0 = и sin 0. Число моле-
кул в параллелограмме Wo sin 0; число молекул в дан-
ных областях и и 0:
Nv sin 0 e-w^v dv— = Nm^QdQe
424
Глава XVI
Это выражение дает число соударений молекул
в бесконечно малых областях v и 0. Общее число
соударений можно получить интегрированием этого
выражения в пределах от 0 = 0 до 0 •— л (молекулы,
для которых 0 > л, движутся в противоположных
направлениях) и от v = 0 до v = oo:
Z=-^- [ sin 0 de f e~mv2l2krv2 dv N
2nkJ J J \ 2лт /
г) Когда молекулы соударяются с перегородкой, они
претерпевают изменение момента количества движе-
ния, равное 2mvsine. Сила, с которой молекулы
действуют на перегородку и перегородка — на моле-
кулы, равна изменению момента в единицу времени.
Расчет в этом случае такой же, как и в пункте (в);
однако вместо подсчета соударений в единицу вре-
мени, необходимо «сложить» изменение момента
в единицу времени. Это означает, что перед интегри-
рованием необходимо включить множитель 2masin0.
Длина отрезка равна 1, поэтому давление
Р — -^р=г2т [ sin2 0 de \ e~mv2'2kTv2 dv — NkT.
2nkT J J
Очевидно сходство с законом идеального газа [ср
с задачей XVI-3-1 (а)].
д) Частица, которая «сталкивается» со щелью, «уле-
тучивается». Выше была рассчитана общая кинети-
ческая энергия соударяющихся частиц на единицу
длины в единицу времени. Проведем аналогичный
расчет, включая множитель у tnv2:
f sin0 de f e~mv2'2kTv* dv =
2nkT 2 J J
3N / kT \7»
Кл m \ 2 / '
Статистическая термодинамика
425
Разделив на число соударений частиц, получим сред-
нее значение:
- — Л лл
е— 2 == 2 ’
XV1-3-3. а) и = 0
Г ve~^№T dv ____
j—j- 0 kT/m ,/ 2kT
б) I= ----------------= 1 :-y тйг*
f e-nw’/2kT dv -V{2nkT)/m
e
в) Пусть o21 = v2 — и ^2i = 2"(»i + Ог)- Тогда
D| = V21— — o2, и O2 = ^21 +yW2b
„. + й = 21/«|+10<1.
Определитель Якоби p*? — 1, следовательно,
dv. dv2 — rfP21 dv2i;
4-co 4-00
j" | | v2) | exp [— m (of + w|)/2Zs7'j dvt dv.,
(7 — OO — OO ___
^21 I 4“°o 4-сю
| j' exp [—m(v!t + v^)j2kT\dvi dv2
— OO —oo
4-oo 4" °°
| exp (— mVli/kT) dV2] J | o21 |exp (— mv?2i/4kT) dv2[
"“°0 —oo
4-oo 4-o°
J exp(—mV21/W) dV2i J exp (—то21/4/гГ) rfu2i
—OO —00
Г ve-^I^T dv ____
= о_____________= 2kT/m == 2 kT .
00 1 , у, / V ЯП ’
J e-mv2,'4kT dv yT (4nkT)/m
J.M- = V2.
I v|
XVI-3-4. a) <? = 1 4- 2e-e/ftr; Q = qN = (1 4- 2e~^T)N,
где Af —число Авогардо.
d In Q __ N dq _______N_______2e g_s/fiT.
dt q dr 1 + 2е~*1кт kT2 ’
426
Глава XVI
и == kT2-d{n Q
dT
v dT
2Ns .
eslkT 2 ’
2Ns elkT e _ 2Rx2ex
(eW + 2)2e kT2- (e* + 2)2'
где х — ъ/kT.
б) См. рисунок.
г) Фактически молекулам всегда доступно бесконеч-
ное число возможных состояний с энергией, дости-
гающей бесконечно больших величин (при условии,
конечно, что учитываются состояния, соответствующие
диссоциации). При любой температуре имеются на-
столько высокие уровни энергии, что их заселение
заметно меньше, чем заселение более низких уровней;
когда температура повышается, добавочные моле-
кулы заселяют эти высокие уровни. Такое заселение
соответствует поглощению тепла, так что в действи-
тельности молекулы имеют теплоемкость, не равную
нулю, независимо от того, насколько высока темпе-
ратура. Однако для рассматриваемых гипотетических
молекул заселение трех состояний становится прак-
тически одинаковым при достаточно высокой темпе-
ратуре (kT е). Дальнейшее повышение температуры
может способствовать только переходу малого числа
молекул на высшие уровни; таким образом, при
высоких температурах теплоемкость приближается
Статистическая термодинамика
427
XV1-3-5.
к нулю. Такое поведение наблюдается для некоторых
степеней свободы в физических системах только,
если температура не слишком высока.
ОО ОО со
а ) ч = V - 2 3 V““r « V / =
п==0 п~0 п==0
где х — 3e~b/kT
Q^q" = (l — 3e~b,kT)~N,
где АГ — число Авогадро.
б ) U = kT2 Q = RT2 'n = 3bN ,
7 dT dT ~ eb/kT - 3 ’
S = -^ + k\nQ = -T з) - 7? In (1 - 3e~b^).
p _dU _ 3bNeblkT b __' 3Ry2etJ
V~ dT~ (eb!kT - 3)2 kT2 (ey - 3)2 ’
где tj = b!kT.
XV1-3-6.
в) Ряд для q сходится только, если х_<_1> или
Т < b'(k In 3). Если Т bj[k In 3), то q, U, S n Cv
бесконечны. Маловероятно, чтобы анион можно было
обнаружить в веществе, в котором эти величины
становятся бесконечными при конечной температуре.
Однако если высшие члены ряда имеют различные
классы (случай 2), то расхождение ряда невозможно,
например, вырождение высших уровней может быть
меньше Зп. В этом случае полученный результат
будет применим только к температурам, при которых
эти высшие уровни имеют незначительное заселение:
при Т < b/(k In 3). Могут существовать осцилляторы,
низшие уровни которых имеют данные энергию и
вырождение, но в высших уровнях могут быть изме-
нения. Вырождение уровней этого гипотетического
осциллятора будет сравнимо с вырождением трех-
мерного гармонического осциллятора, для которого
функция распределения равна (1 — e~hvlkT)~3*
а) Согласно закону распределения:
1
еае^‘ -|- у *
428
Г лава XVI
где Ni — заполнение /-го состояния с энергией ez и
•v = 0 для статистики Максвелла — Больцмана; 4-1
для статистики Ферми — Дирака и —1 для стати-
стики Бозе — Эйнштейна.
Для системы типа I при Р < О заселение состояния
увеличивается с увеличением ег; при v = 0 заселение
будет бесконечным, так как бесконечным становится
ег; при v = — 1 бесконечное заселение будет про-
исходить, если есть состояние с ez = — а/p и высшие
энергетические состояния имеют отрицательное засе-
ление; при v = 1 заселение не будет бесконечным,
но становится равным для состояний с высокими
энергиями. При применении всех трех типов стати-
стики отрицательное р будет соответствовать беско-
нечной энергии или абсурдному выводу об отрица-
тельном заселении. То же относится и к Р = 0; все
состояния имеют равное заселение. Таким образом,
для системы типа I р > 0.
Система типа II может иметь Р < 0, однако заселение
должно увеличиваться с увеличением энергии; р = 0
для всех одинаковых заселений. Не возникает труд-
ности при бесконечных энергиях—Р может быть
любым действительным числом.
Система типа III может иметь Р < 0. Заключения
будут теми же, что и для системы типа I, но труд-
ность появляется при бесконечных отрицательных
энергиях, если Р^О.
Система типа IV должна иметь Р > 0, как система
типа I, и в то же время — Р < 0, как система типа III.
Такая система не может иметь любые температуры.
Можно предположить, что р = 0, когда все состояния
имеют равное заселение и бесконечные положитель-
ные энергии одних состояний могут компенсировать
бесконечные отрицательные энергии других состояний,
б) Отметим, что чем меньше р (алгебраически), тем
более возбуждена система. Отрицательная темпера-
тура является более горячей, чем положительная.
Система типа III с Р<0 будет передавать энергию
системе типа II, пока они не будут иметь одинаковые
отрицательные р. Система типа III будет передавать
энергию системе типа I, причем обе стремятся к тем-
пературе р = 0 (Т = оо). Равновесие никогда не будет
достигнуто; система типа III будет приближаться
к все более низким уровням энергии, давая беско-
нечные количества энергии системе типа I. Система
типа III будет разрушать вселенную, так как она
будет стремиться к бесконечной температуре.
Статистическая термодинамика
429
XV1-3-7. а) ц = + а +
О) +b-
\дТ )v \ дТ }v
-S = -S' + Ь.
Таким образом, b — произвольная постоянная, при-
бавляемая к 5. Она обычно определяется при усло-
вии, что 30 = 0 для каждого вещества при 0° К.
Тогда S определяется для любой температуры:
0 (Фазовые переходы)
Аддитивная постоянная а определяется при условии,
что р. = 0 для каждого простого вещества в его стан-
дартном состоянии при одной и той же температуре
(обычно 25° С). Тогда для соединения при той же
температуре (i = AGf -(-7? Tin (активность).
б) a = lnQ-lnA=-i=-^-^-±.
Произвольная постоянная а соответствует возмож-
ности замены начала координат в системе отсчета
энергии. Пусть ег = е' + е0, тогда
Q _ 2 е,е-^т - 2 Sie-'J"e-^a -
i
lnQ = ln Q'->.
Таким образом,
e0 a
k ~ R’
Изменение b соответствует умножению всех вырожде-
ний g. на постоянную: gi — yg'i-
Q-2v^-'/" = vQ";
lnQ = lnQ" + ln4; Inv——-j.
Изменение b отличается от изменения а и соответ-
ствует реальной физической картине: учитывает со-
стояния с данной энергией. Изменение 5 при 0°К
Имеет то же самое значение. Мы приняли Зо = О
потому, что обычно имеется только одно состояние,
достигаемое при этой температуре. Однако можно
430
Г лава XVI
показать, что если имеется два состояния с простым
удвоением каждого уровня, то 36 = Rin 2. Тогда
b = — R In 2 и у = 2.
XVI-3-8. Статистическое определение энтропии: 5 = k In W, где
IF —число детальных (микроскопических, молекуляр-
ных) состояний, соответствующих данному общему
(макроскопическому) состоянию. В классической ме-
ханике IF бесконечно; каждая частица системы может
иметь произвольное количество положений и момен-
тов. Проще всего определить соотношение W2/Wl и,
таким образом, АЗ для двух состояний; иапример,
AS изотермического сжатия идеального газа, содер-
жащего V молекул, правильно рассчитывать из пред-
положения, что W2/Wi = (V2/Vi)n. Однако в квантовой
механике число микросостояний (линейно независи-
мых волновых функций) ограниченной системы, со-
ответствующих данному макросостоянию, ограни-
чено, хотя оно может быть бесконечно большим.
Поэтому выражение 3 = 6 In IF дает абсолютную
величину 3.
-hvl2kT e-avTn~42k
XVI-3-9. q = ] _ ehv!kT = t •
Пусть c = av/k, тогда
1 - e~cT 1
3 = /?1п(?4--^=-1 RcTn~' - R In (1 - +
+ R (1 - n) cTn~’ (j + } =
V есГ
= - 4 RncTn~l - R In (1 - + R{l~ScTn~'
2 ecT -l
~ У У z
Статистическая термодинамика
431
lim Т + 0 X У Z S
п — 1 < 0, П #= 0 — оо 0 0 — оо
п = 0 0 0 0 0
и- 1 =0 -4^ — R In (1 — е~с) 0 -Яу с + 1п(1 -е-с)1
п — 1 > 0 0 ОО /?(1 -п) ОО
Для Z при (п — 1) > 0 и Т ~ О
сГ”-1 сГге-‘ j
eC7-n-‘ ( ~ 1 4. ег«-1 _ 1
Таким образом, lim 5 ограничен, если п=1; равен
т->о
нулю, если /г = 0 (наша вселенная) и бесконечен
в других случаях. Когда /г = 0, па S не влияет учет
или пренебрежение нулевой энергией. Однако, если
п #= 0, нулевая энергия должна быть включена,
поскольку она зависит от температуры. Пренебре-
жение нулевой энергией будет означать измерение
энергии от разных пулевых уровней при различных
температурах.
XVI-3-10. a) -.J* —, v = ± 1 или 0.
е и + v
Пусть ц= — kTa, тогда = ~(е:~ц\/кт--------•
Когда е; заменяется на е< = ег-|-Ае, величина /г.
не должна изменяться, если ц заменить на ц' = ц + Ле
или, что равноценно, a — на a' = a —Ле/АГ. Другими
словами, изменение нулевой энергии требует одина-
кового изменения пулевого уровня химического по-
тенциала ц или изменения температурной зависи-
мости для а.
б) Закон распределения фотонов следующий:
_ gi
П1 г./kT , ’
е ч — 1
В этом уравнении отсутствует параметр а (или ц),
потому что он появляется в результате сохранения
условия, которое отсутствует в данном случае. Любое
изменение е{ приводит к изменению «/. Это можно
понять, если вспомнить, что образование или распад
432
Глава XVI
фотона связаны с передачей определенного количества
энергии (hv) к радиационному полю (или с получе-
нием энергии от него). С другой стороны, до тех пор,
пока сохраняется материя частицы, ее абсолютная
энергия не определена, и любая неопределенная
постоянная может быть прибавлена ко всей энергии.
Однако, когда такие частицы не сохраняются, как, на-
пример, в ядерных реакциях, необходимо объединить
определенное количество энергии тс2/1 — (и2/с2) ~
« тс2 + у tnv2 с энергией каждой частицы, как и
в случае фотонов.
XVI-3-11. Для системы бозонов
lntr-2[(W, + g,)ln(^-+ 1)-g,ln i],
где g/ — число состояний с энергией ez, Nj — число
частиц в этих состояниях и W — число путей,
по которым это распределение может быть осущест-
влено. Необходимо найти максимум для функции
f = In W — hfi S NjVf — у 2 W/v*.
Дифференцируем:
----hfiv.—yv2=ln + 1) — ftP'v — yv2 = 0;
aNj aNj r / 1 / \-Vy / > ’ I '
1 exp (ftPv, + yv2) — 1 ’
Заменим gj и Му на число состояний и число частиц
с частотами между v и •v + dv. Число типов излуче-
ний на единицу объема между v и v 4- dv равно
gty) dv = ~-dv.
Число фонионов в этом ряду:
g(v) dv________8луг dv
ghPv+w1 _ ] — c3 (ghBv+W2 _ J) •
XVI-3-12. а) Для различимых частиц IF =
In Г = ЛП - 2 In АП 2 (ty InWi-ty).
i i
Статистическая термодинамика
433
Пусть </> — In W — ₽ 2 тогда
XVI-;
(Отметим, что нельзя рассматривать W как постоян-
ную дифференцирования. Следует указать также, что
W = 2 ЛГр)
i
б) £=2,Viei=1v2Eie’fj8<;
i i
N^^Ni = N^e-^.
i i
в) Необходимо, чтобы У e-₽e'=l. В случае сохраняю-
i
щихся частиц множитель Лагранжа а может быть
согласован при удовлетворении аналогичных условий,
но в данном случае такой параметр отсутствует. Си-
стема должна иметь только одну температуру р.
:-13-
б) In W = s ki hl gi—gt—(gi— Nt)ln(gz—Nt)+gi—Af/L
i
если gt и Nt 1.
H- In (?( - AU - 1 = ln (gt - ^).
Обычным путем введем множители Лангранжа аир
и потребуем, чтобы для каждого i
—а —рег = О, ln(gj — ЛГг) —а —рег = О,
в) Другие законы распределения выражают nt/gi
только через а, р и ег. Таким образом, в этих обыч-
ных случаях число частиц nt в группе состояний
приблизительно одинаковой энергии пропорционально
числу состояний gt, входящих в группу. Когда уровни
очень близко расположены друг к другу, они могут
434
Г лава XVI
быть произвольно разбиты на группы сходных энер-
гий. Однако в случае новонов
,, a+tle;
________________
gt gt ’
и изменение длины произвольного интервала будет
изменять величину Ntigi. Например, если =
т
то — = 1-------------¥=—• 1акое положение на-
gi 2gi gi
столько нереально, что можно с уверенностью пред-
положить, что повоны не существуют.
XVI-3-14. а) Пусть р — плотность энергии для частоты v==
= гт~1г~- При равновесии Nm(Amn-\- рВтп) =
— N п (Апт -f- рВпт), где Атп и Апт — вероятности
спонтанных самопроизвольных переходов, Втп пВ„т-
вероятности индуцированных переходов, Nm и Nn —
заселенности двух состояний. Согласно закону рас-
пределения Больцмана, = e~M!kT. По общему
принципу квантовой механики Впт — Втп.
___ NтАтп — NпАпт =_= Атп е Апт-
Р NnBnm — Х'тВтп Втп (e'lV^'r 1)
Закон Планка дает
__ 8jt/zv3
Р — c3(eftv/Ar- 1) ‘
Эти два выражения для р согласуются при всех
температурах только, если Апт = 0 и
Атп _ 8л7гу3
Втп с3
б) Закон Планка может быть записан в виде
8лМ>3(1 -yeh'llkT)
Р- c3(e/.v//ir_1) •
Тогда
_ 8л/гу3у
Впт С3
Апт и Впт не будут зависеть от температуры и, таким
образом, у не должна зависеть от температуры.
Поскольку равновесная плотность радиации полости
не зависит от природы стенок, у не должна зависеть
от вида включенных атомов или молекул. Однако у
может зависеть от частоты.
Статистическая термодинамика
435
XVI-3-15. а) е7 = Аг/ (/ +2~ .
’ 7 4л2тг2
А2 (2 — 0) _ AW
81 Б°— 4л2тг2 “ 2л2Л4г2 ’
где ЛГ — число Авогадро и Л4 — атомный вес.
eI-e0 h2N _2,60-10-17
kT 2n.2Mr2kT Mr2
н, 02 Cl,
61 ~ е°- 0,47 0,011 ki 0,0019
XVI-3-16.
б) Когда поступательное и вращательное движения
классически возбуждаются, а колебательное движе-
ние „заморожено", Си=^-|-+-|-^7?=-|-7? =
= 4,97 кал • °К-1 • моль-1. Применим этот результат,
если 1) расстояние между уровнями вращательной
энергии много меньше kT и 2) расстояние между
уровнями колебательной энергии много больше kT.
Расчет показал, что условие (1) хорошо выполняется
для О2 и С12. Эти газы, согласно вышесказанному,
имеют Cv 4,97 кал • °К-1 • моль-1. То, что Cv для О2
незначительно больше и для С12 значительно больше
величины 4,97 кал • °К • моль-1, указывает, что усло-
вие (2) не полностью удовлетворяется и что колеба-
тельные степени свободы вносят некоторый вклад
в теплоемкость. Однако для Н2 расстояние между
двумя низшими вращательными уровнями ~ 'IzkT
и условие (1) не удовлетворяется. Таким образом,
Н2 имеет Cv < 4,97 кал • °К • моль-1 при 100° С.
Распределение степеней свободы колебательного дви-
жения относительно частоты незначительно зависит
от ограничивающих условий в конце цепи. Примем,
что концевые атомы фиксированы. Тогда колебания
вида m могут быть представлены так: Dn=Asin(nmn/N),
где Dn — перемещение n-го атома, Л — амплитуда,
с которой это колебание возбуждается, и ш—\, 2, 3 ....
Сделаем предположение, обычное в теории Дебая,
что колебания всех видов имеют одинаковую фазо
436
Глава XVI
вую скорость, т. е. vA —u = const (v — частота, А —
длина волны и и — скорость). Здесь k~2Nlm для
. Г (и + 2N!m) тп 1_ . nrtm
SlnL W J sin W ’
Тогда v — vlk = tnvl%N или m~2Nvlv. Число видов
колебаний в интервале частот от v, до пропор-
ционально числу целых чисел между соответствую-
щими т: т2 — пц =—— (^2 — vt). Аналогично, для
бесконечно малого интервала dv число видов колеба-
ний между •v и •v -|- dv пропорционально dv и не
зависит от V. (Обычно предполагают, что dv 2А/и,
чему соответствует несколько видов колебаний в ин-
тервале.) Число видов колебаний от 0 до данной
частоты vD равно
| К dv = N, где Д' — постоянная,
о
Kvd=n-,
D
Пусть u = hvlkT и Q — hvD!k, тогда
Nh г — f г kuV‘ -> •
’ Cv~ J " (e“-l)2“V’
о
dv = -^-du.
h
Если •v = vD, то
e/r
_ 0 r _ Nh . kT Г u2e“ , _
U ~ T ’ — kQ ‘ K ’ h J (eu - I)2 aU ~
о
e/r
0
Для T <C 0 имеем
oo
Cv~Nk (-j-) j 1)2 du = const • T.
0
Для T >> 0 необходимо рассматривать только и <С 1:
0/Г
(е“ — I)2 ~ (1 + «- I)2 Cv Nk (т) J dU = Nk’
Статистическая термодинамика
437
XV1-3-17.
В двухмерной системе № : п = Kv2, где п— число
видов колебаний с частотой меньше •v. Этот результат
может быть получен так же, как в трехмерном слу-
чае. Однако здесь имеются многочисленные пары
целых чисел с суммой квадратов меньше некоторой
величины, пропорциональной v. В случае двухмерной
системы площадь квадранта эллипса (вместо объема
октанта эллипсоида) с осями, пропорциональными v,
пропорциональна № (а не •v3). Тогда число видов
колебаний с частотами между v и v + dv равно
dn = 2K,vdv. В 1 моле кристаллов находится N атомов
(число Авогадро). Каждый атом имеет одну степень
свободы (перемещение в плоскости). Если интегри-
ровать по dn при той же максимальной частоте vm,
то получим N:
f dn = 2K J vdv = Ky2m - N;
о 0
.. N , 2Nv dv
K = -k-; dn =----5.
Vх V
vm m
Пусть x = hv/kT и xm — hvm[kT, тогда dn = (2Nx dx)/x2m.
Вклад каждого вида колебаний в теплоемкость соот-
ветствует выражению Эйнштейна (kx2ex)/(ex — I)2.
Необходимо умножить это выражение на dn для
каждой частоты и интегрировать от 0 до хт
хт хт
х f kxV 2Nx dx _ 2R Г xsex dx
V-OJ (e’-i)2> 4 “4 J (e*-ir
0/Г
Пусть 0 = = Txm, тогда Cv = 2R (-g-)2 j
о
Если T <C 0, to
А о n ( ? V Г *3e* dx , T2
Cv~2^eJ j _ 1)2 — const • T .
Приложение
МАТЕМАТИЧЕСКИЕ ПОСТОЯННЫЕ
п = 3,141 592 653 589 793
е = 2,718 281 828 459 045
е-1 =0,367 879 441 171 442
lg(, 10 = In 10 = 2,302 585 092 994 046
log,0 е = lg е = 0,434 294 481 903 252
К? = 1,414 213 562 373 095
УЗ = 1,732 050 807 568 877
ФИЗИЧЕСКИЕ ПОСТОЯННЫЕ
Скорость света в вакууме Заряд электрона с = 2,997 925- Ю10 см-с-1 е= 1,6021 • 10-9 Кл = = 4,8030 • Ю-10 стат. Кл • см^2 г'/2-с-‘
Число Авогадро Н = 6,0225 • 1023 молек X X • моль-1 (ат. ед. • г-1)
Число Фарадея (Фарадей) Постоянная Планка = 9,6487 • 104 Кл • моль-1 h = 6,6256 • 10—27 эрг • с
Радиус атома Бора Газовая постоянная а0 = 5,29167 • 10-9 см /? = 8,314 Дж-°К-1-моль-1= = 1,987 кал-°К-1 -моль-1= = 0,08206 л-атм-Ж-1 X X моль-1 = 62,35 л-(мм рт. ст.)-°К-1-моль-1 R 1п 10 = 4,576 кал • °К-1 • моль-1
Постоянная Больцмана k = 1,3805- 10-18 эрг • °К-1 - молек-1
ПЕРЕХОДНЫЕ МНОЖИТЕЛИ
1 см = 108 А
1 год = 3,1557 • 107 с
1 Дж = 107 эрг
Приложение
439
1 кал = 4,18400 ... Дж
1 л-атм = 101,325 Дж = 24,2173 кал
1 электронвольт (еВ)= 1,6021 • I0-12 эрг
1 ат. ед. = 9,31478- 108 еВ = 931,478 МеВ
1 атм = 760 мм рт. ст. = 1,01325 бар = 1,01325 • 108 дин-см-2
298,16 R In lO/lT" = 0,05915 В • экв • моль-1
Коэффициент уравнения Дебая — Хюккеля = 0,5091 для Н2О при
25° С
ЛИТЕРАТУРА
1. Karrer, Wulf., J. Am. Chem. Soc., 44, 2391 (1922).
2. Maclnnes, Kreiling., J. Am. Chem. Soc., 39, 2350 (1917).
3. Arthur, Felsing, J. Am. Chem. Soc., 68, 1883 (1946).
4. Perrin, Ann. Chim. Phys., 18, 1 (1909).
5. Henning, Heuse, Z. Physik, 5, 285 (1921).
6. Gray, Buri, J. Chem. Soc., 95, 1633 (1909).
7. Krikorian, J. Phys. Chem., 67, 1586 (1963).
8. Rihards, Davis, J. Am. Chem. Soc., 42, 1599 (1920).
9. Torgeson, Shomate, J. Am. Chem. Soc., 69, 2103 (1947).
10. O’Hara, Hepler, J. Phys. Chem., 65, 2107 (1961).
11. Browne, Rossini, J. Phys. Chem., 64, 927 (1960).
12. Huff, Squitieri, Snyder, J. Am. Chem. Soc., 70, 3380 (1948).
13. Kistiakowsky, Runoff, Smith, Vaughan, J. Am. Chem. Soc., 57, 876 (1935);
58, 137, 146 (1936).
14. Rulon, Mason, J. Am. Chem. Soc., 73, 5491 (1951).
15. Stephenson, J. Am. Chem. Soc., 68, 721 (1946).
16. Hubbard, Ftow, Waddington, J. Phys. Chem., 65, 1326 (1961).
17. Halle, Izatt, Christensen, J. Phys. Chem., 67, 2605 (1963).
18. Parris, Raybin, Labowitz, J. Chem. a. Eng. Data, 9, 221 (1964).
19. Hirth, Kobe, J. Chem. a. Eng. Data, 2, 229 (1961).
20. Flotow, Lohr, J. Phys. Chem., 64, 904 (I960).
21. Giauque, Gordon, J. Am. Chem. Soc., 71, 2176 (1949).
22. Branch, J. Am. Chem. Soc., 37, 2316 (1915).
23. Gibson, Latimer, Parks, J. Am. Chem. Soc., 42, 1533 (1920).
24. Anderson, Schnizlein, Tolle, O’Brien, J. Phys. Chem., 56, 473 (1952).
25. Sugden, J. Chem. Soc. (London), 1167 (1924).
26. Stowe, J. Am. Chem. Soc., 51, 410 (1929).
27. Ring, Ritter, J. Phys. Chem., 65, 182 (1961).
28. Soldate, J. Am. Chem. Soc., 69, 987 (1947).
29 Bozorth, J. Am. Chem. Soc., 44, 317 (1922).
30. Rundle, Goring, J. Am. Chem. Soc., 72, 5337 (1950).
31. Harris, Meibohm, J. Am. Chem. Soc., 69, 1231 (1947).
32. Розенберг, Ушакова, ЖОХ, 30, 3531 (1960).
33. Copenhafer, Kraus, J. Am. Chem. Soc., 73, 4557 (1951).
34. Beckman, Z. Physik. Chem., 6, 437 (1890).
35. Douglas, Z. Physik. Chem., 68, 169 (1964).
36. Cady, Elsey, Berger, J. Am. Chem. Soc., 44, 1456 (1922).
37. Hilderbrand, Foster, Beebe, J. Am. Chem. Soc., 42, 545 (1920).
38. Мищенко, Яковлев, ЖОХ, 29, 1761 (1959).
39. Fleischer, Freiser, J. Phys. Chem., 66, 389 (1962).
40. Argue, Mercer, Cobble, J. Phys. Chem. 65, 2041 (1961).
41. Mikhail, Kimel, J. Chem. a. Eng. Data, 6, 533 (1961).
42. Makansi, Selke, Bonilla, J. Chem. a. Eng. Data, 5, 441 (1960).
43. Cubiccoti, J. Phys. Chem., 65, 521—523 (1961).
44. Stephenson, J. Am. Chem. Soc., 68, 721 (1946).
45. Hisatsune, J. Phys. Chem., 65, (2249) (1961).
46. Eastman, J. Am. Chem. Soc., 44, 975 (1922).
47. Adler, Stewart, J. Phys. Chem., 65, 172 (1961).
48. Hempson, Walker, J. Res. Natl. Bur. Std. 66A, 177 (1961).
Литература
441
49. Taylor, J. Am. Chem. Soc., 73, 315 (1951).
50. Higuchi, Zuck, J. Am. Pharm. Assn. Sci. Ed., 41, 10 (1952).
51. Murch, Giauque, J. Phys. Chem., 66, 2052 (1962).
52. Kennard, McCusker, J. Am. Chem. Soc., 70, 3375 (1948).
53. Bundy, Science, 147, 1057 (1962).
54. Ewert, Bull. Soc. Chim. Belg., 46, 90 (1937).
55. Stokes, Streng, J. Chem. Phys., 37, 920 (1962).
56. Waddell, J. Phys. Chem., 2, 233 (1898).
57. Schreinemakers, J. Physik Chem., 59, 641 (1907).
58. Vogel, Z. Anorg. Chem., 50, 145 (1906).
59. Jones, J. Inst. Metals, 46, 395 (1931).
60. Keavney, Smith, J. Phys. Chem., 64, 737 (1960).
61. Hudson, Z. Physik Chem., 47, 113 (1904).
62. Beard, Lyerly, Anal. Chem., 33, 1781 (1961).
63. Handler, Jache, J. Am. Chem. Soc., 72, 4137 (1950).
64. Bronsted, King, J. Am. Chem. Soc., 49, 193 (1927).
65. McDowell, Kraus, J. Am. Chem. Soc., 73, 2170 (1961).
66. Monk, J. Am. Chem. Soc., 70, 3281 (1948).
67. Basinski, Zzymanski, Betlo, Roczniki Chem., 33, 289 (1959).
68. Jones, J. Am. Chem. Soc., 69, 2066 (1957).
69. Longsworth, J. Am. Chem. Soc., 54, 2741 (1932).
70. La Mer, King, Mason, J. Am. Chem. Soc., 49, 363 (1927).
71. Matheson, J. Phys. Chem., 66, 439 (1962).
72. Stokes, Levien, J. Am. Chem. Soc., 68, 1852 (1946).
73. Maclnnes, Beattie, J. Am. Chem. Soc., 42, 1117 (1920).
74. Hetzer, Robinson, Bates, J. Phys. Chem., 66, 1423 (1962).
75. Danner, J. Am. Chem. Soc., 44, 2832 (1922).
76. Ewing, Eldridge, J. Am. Chem. Soc., 44, 1484 (1922).
77. Lamb, Larson, J. Am. Chem. Soc., 42, 2024 (1920).
78. Bartlet, Nozaki, J. Am. Chem. Soc., 69, 2999 (1947).
79. Farkas, Lewin, Bloch, J. Am. Chem. Soc., 71, 1988 (1949).
80. Lichty, J. Phys. Chem., 11, 225 (1907).
81. Crowell, Hammett, J. Am. Chem. Soc., 70, 3444 (1948).
82. Borown Eldred. J. Am. Chem. Soc., 71, 445 (1949).
83. Bragg, McCarty, Norton, J. Am. Chem. Soc., 73, 2134 (1951).
84. Kunsman, J. Am. Chem. Soc., 50, 2100 (1928).
85. Branch, Tolbert, J. Am. Chem. Soc., 69, 523 (1947).
86. Fates, Morrell, J. Am. Chem. Soc., 44, 2071 (1922).
87. Lalor, Lang, J. Am. Chem. Soc., 1963, 5620.
88. Wilson, J. Chem. Phys., 46, 2017 (1967).
89. Fates, Roller, J. Am. Chem. Soc., 51, 345 (1929).
90. Swain, Ross, J. Am. Chem. Soc., 68, 658 (1946).
91. Potts, Amis, J. Am. Chem. Soc., 71, 2112 (1949).
92. Morgan, Crist, J. Am. Chem. Soc., 49, 16 (1927).
93. O’Ferrall, Ridd, J. Chem. Soc., 1963, 5025.
94. Ross, Swain, J. Am. Chem. Soc., 69, 1325 (1947).
95. Tamaru, J. Phys. Chem., 59, 777 (1955).
96. Swain, Morgan, J. Org. Chem., 29, 2097 (1964).
97. Sullivan, J. Chem. Phys., 46, 73 (1967).
98. Anderson, Freeman, J. Phys. Chem., 65, 1648 (1961).
99. Chen, Johnson, J. Phys. Chem., 66, 2249 (1962).
100. Cagle, J. Chem. Phys., 25, 1300 (1956).
101. Johnson, Foering, Thompson, J. Phys. Chem., 57, 390 (1953).
102. Zillen, Sullivan, Chohen, Hindman, J. Am. Chem. Soc., 80, 5632 (1958).
103. Discher, Smith, Lipman, Turse, J. Phys. Chem., 67, 2501 (1963).
104. Robinson, Peiperl, J. Phys. Chem., 67, 2860 (1963).
105. Buxton, Walker, J. Phys. Chem., 67, 2835 (1963).
106. De Mare, Raper, J. Chem. Phys., 44, 1780 (1966),
442
Литература
107. Bunbury, Lacher, Park, J. Am. Chem. Soc., 80, 5104 (1958).
108. Oncley, Scatchard, Brown, J. Phys. Chem., 51, 184 (1947).
109. Fox, Flory, J. Phys. Chem., 53, 197 (1949).
110. Skott, Carter, Magat, J. Am. Chem. Soc., 71, 220 (1949).
111. Armbruster, Austin, J. Am. Chem. Soc., 68, 1347 (1946).
112. Szyszkowski, J. Phys. Chem., 64, 385 (1908).
113. Me Bain, Britton, J. Am. Chem. Soc., 52, 2198 (1930).
114. Cowperthwaite, La Mer, J. Am. Chem. Soc., 53, 4333 (1931).
СОДЕРЖАНИЕ
Предисловие ......................................................... 5
Предисловие авторов ................................................. 6
ЗАДАЧИ
Глава I. Газы.................................... 9
Глава II. Первый закон термодинамики и термохимия.................. 20
Глава III. Второй закон термодинамики ........................ 35
Глава IV. Третий закон термодинамики ........................ 49
Глава V. Жидкости и сжижение газов.......................... 51
Глава VI. Твердые тела................................ 55
Глава VII. Растворы................................. 60
Глава VIII. Свободная энергия и химическое равновесие........... 70
Глава IX. Правило фаз................................ 87
Глава X. Электрохимия.................................ПО
Глава XI. Кинетика..................................127
Глава XII. Фотохимия и спектрофотометрия.......................141
Глава XIII. Радиохимия......................................... . 147
Глава XIV. Химия поверхности и коллоиды.......................151
Глава XV. Квантовая химия и спектроскопия......................155
Глава XVI. Статистическая термодинамика ......................164
РЕШЕНИЯ ЗАДАЧ
Глава I. Газы....................................175
Глава II. Первый закон термодинамики и термохимия.............198
Глава III. Второй закон термодинамики........................218
Глава IV. Третий закон термодинамики.........................249
Глава V. Жидкости и сжижение газов..........................252
Глава VI. Твердые тела................................259
Глава VII. Растворы.................................266
Глава VIII. Свободная энергия и химическое равновесие...........279
Глава IX. Правило фаз................................308
Глава X. Электрохимия................................334
Глава XI. Кинетика..................................367
Глава XII. Фотохимия и спектрофотометрия.......................383
Глава XIII. Радиохимия................................390
Глава XIV. Химия поверхности и коллоиды.......................395
Глава XV. Квантовая химия и спектроскопия......................398
Глава XVI. Статистическая термодинамика.......................415
Приложение ........................................................438
Литература....................................................... 440