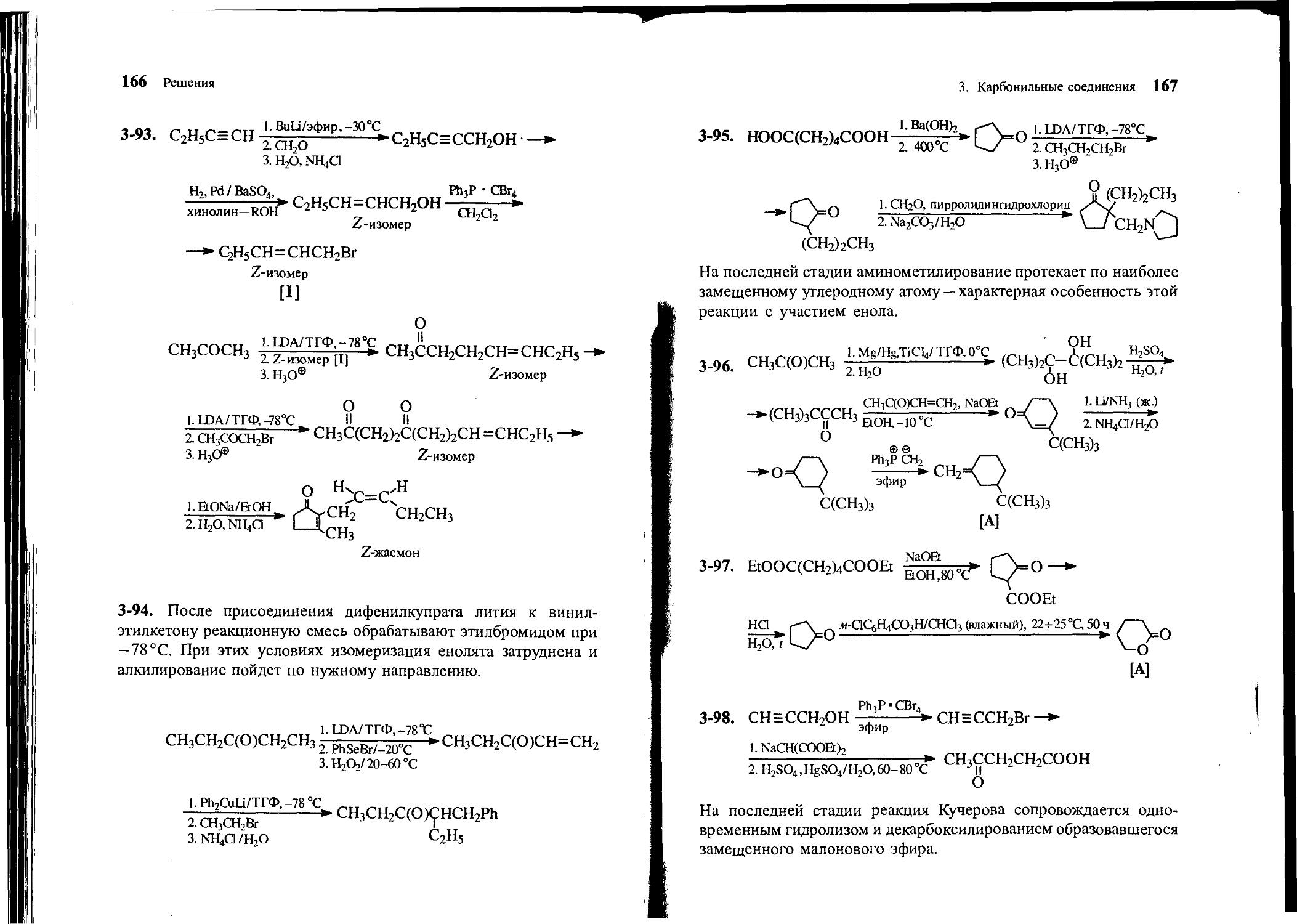
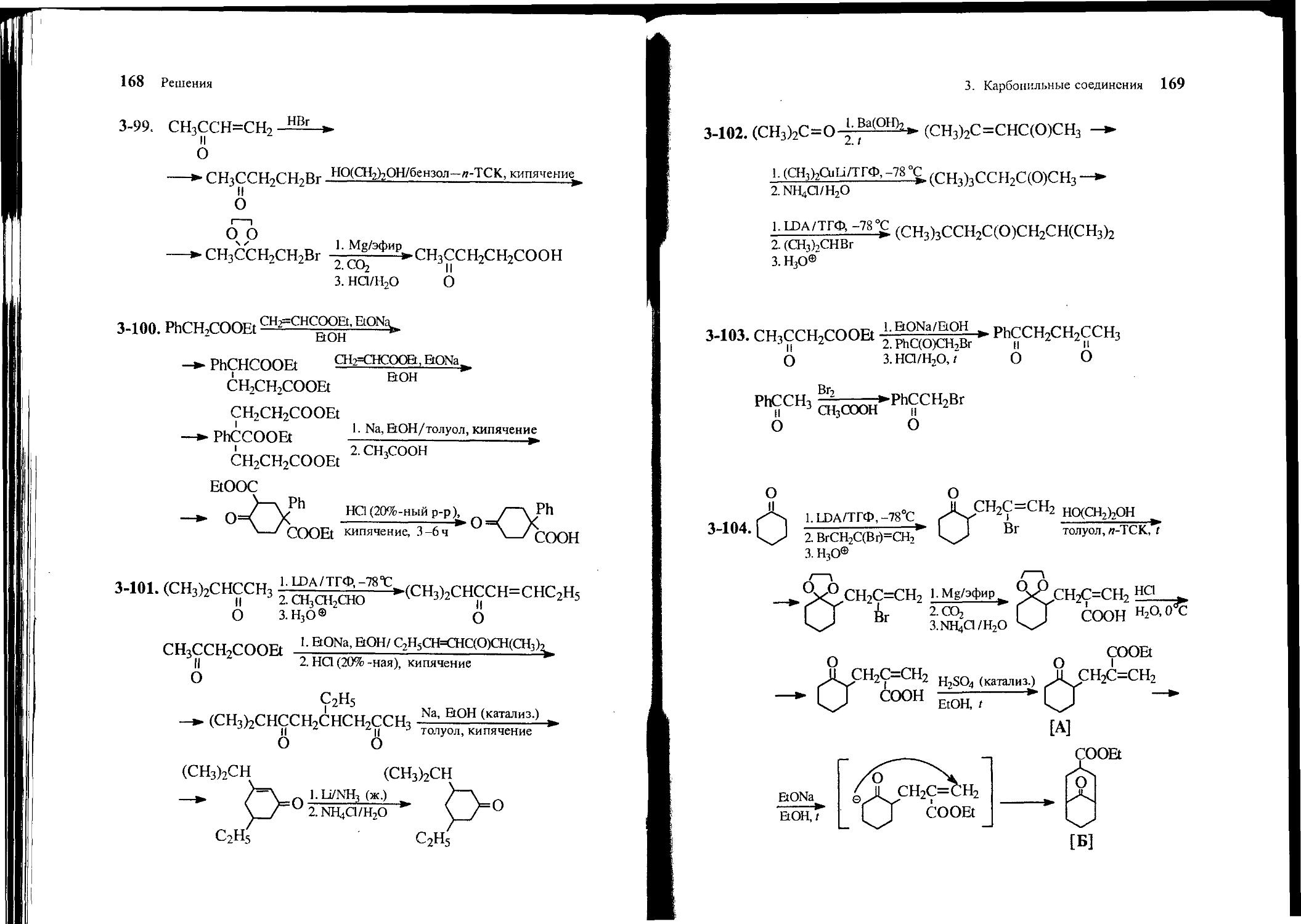
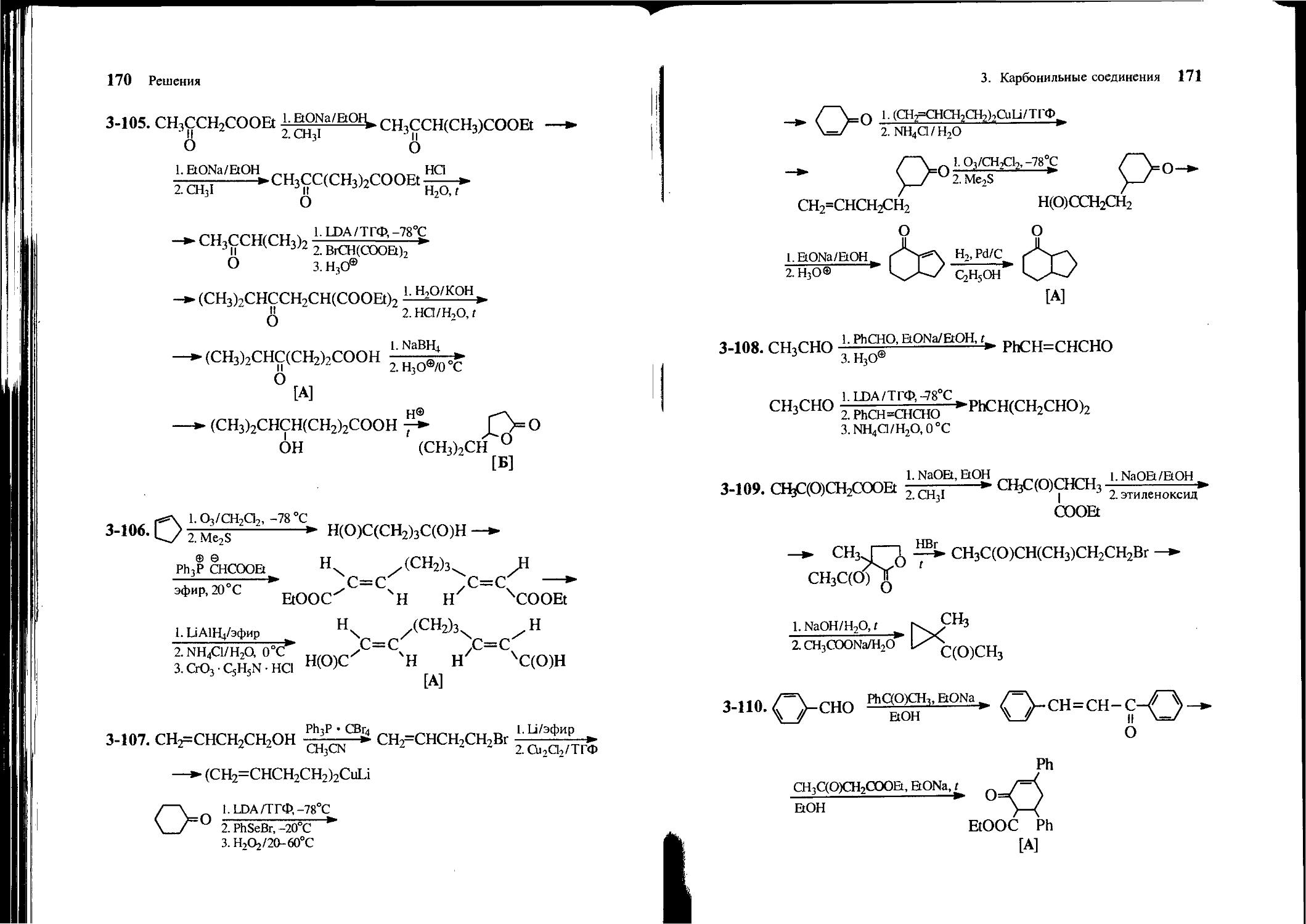
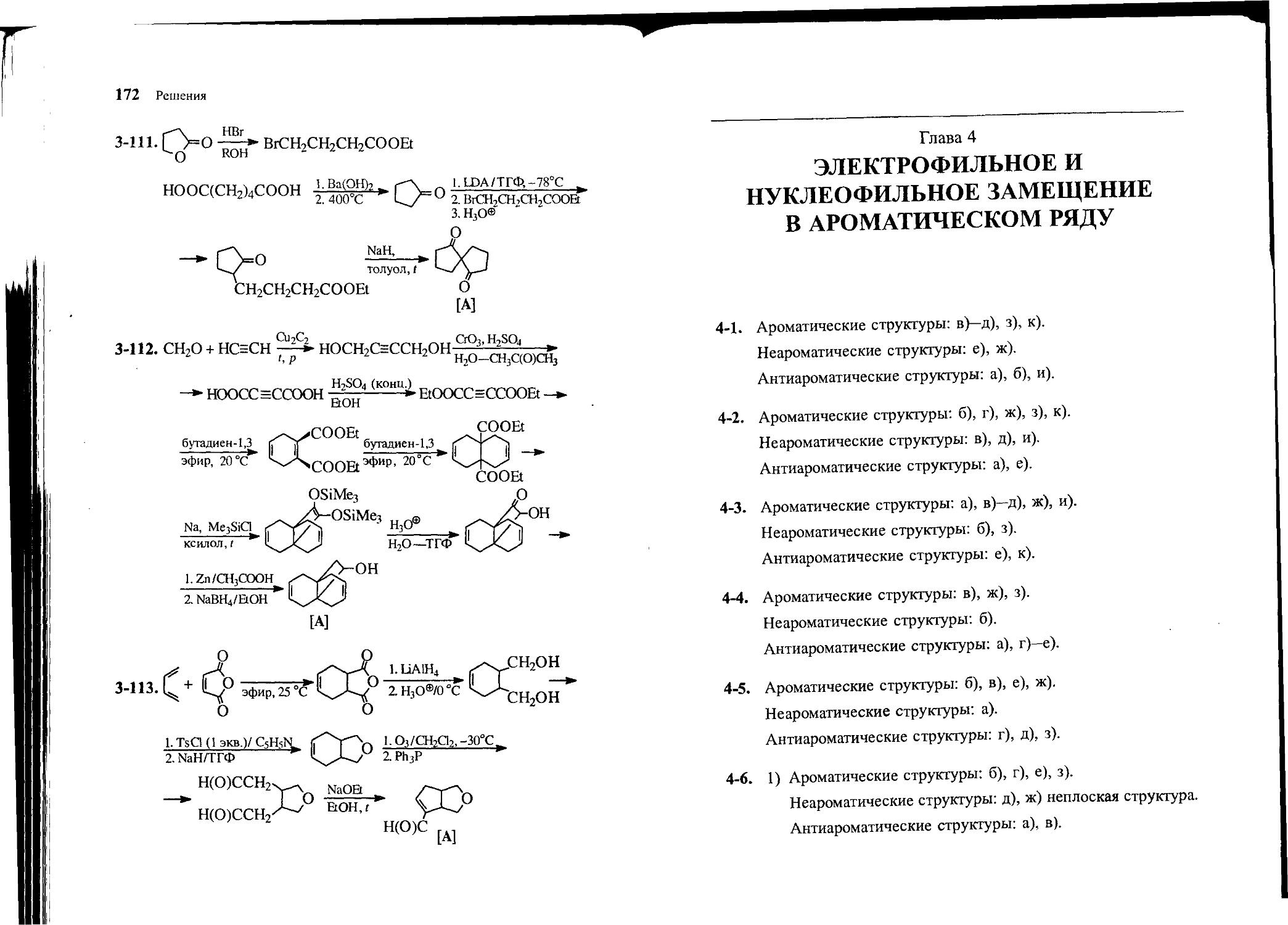
Text
ЗАДАЧИ ПО
ОРГАНИЧЕСКОЙ ХИМИИ с решениями
*
А. А. Кури, M. В. Ливаниов, А. В. Чепраков, Л. И. Ливаниова, Г. С. Зайиева, М. М. Кабачник
ЗАДАЧИ ПО ОРГАНИЧЕСКОЙ ХИМИИ с решениями
Допущено Советом по химии УМО по классическому университетскому образованию в качестве учебного пособия для студентов вузов, обучающихся по специальности 0110ОО — Химия
Москва
БИНОМ. Лаборатория знаний 2 00 4
УДК 547
ББК 24.2я73
К93
Курц А. Л.
К93 Задачи по органической химии с решениями / А. Л. Курц, М. В. Ливанцов, А. В. Чепраков, Л. И. Ливанцова, Г. С. Зайцева, М. М. Кабачник. — М.: БИНОМ. Лаборатория знаний, 2004,— 264 с., ил.
ISBN 5-94774-053-2
Учебное пособие содержит задачи по общему курсу органической химии, которые предлагались студентам Ш курса химического факультета МГУ им. М. В. Ломоносова в рейтинговых контрольных работах. Все задачи снабжены подробными решениями, а там, где это необходимо, комментариями. Разделы соответствуют программе преподавания основного курса органической химии на химическом факультете МГУ. Задачи заметно различаются по сложности; в решениях учтены условия и реагенты, обычные при проведении многих ключевых химических превращений. Такой методический прием способствует выработке у студентов самостоятельного подхода к построению скелета сравнительно сложных органических молекул.
Для студентов вузов, изучающих органическую химию, аспирантов, преподавателей.
УДК 547
ББК 24.2я73
Учебное издание
Курц Александр Леонидович, Ливанцов Михаил Васильевич, Чепраков Андрей Владимирович, Ливанцова Людмила Ивановна, Зайцева Галина Степановна, Кабачник Мария Мартиновна
ЗАДАЧИ ПО ОРГАНИЧЕСКОЙ ХИМИИ С РЕШЕНИЯМИ
Ведущий редактор канд. хим. наук Почкаева Т. И.
Технический редактор Блёнцева Т. Н.
Компьютерная верстка Лапка О. Г.
Лицензия на издательскую деятельность №06331 от 26 ноября 2001 г.
Подписано в печать 5.11.03 г. Формат 60 X 90/16. Гарнитура Таймс.
Бумага офсетная. Печать офсетная. Усл. печ. л. 16,50. Тираж 3000 экз. Заказ 3771
Издательство «БИНОМ. Лаборатория знаний»
Телефон (095)955-0398 E-mail:lbz@aha.ru
Отпечатано с готовых диапозитивов в полиграфической фирме «Полиграфист»
160001, г. Вологда, ул. Челюскинцев, 3
По вопросам приобретения обращаться:
«БИНОМ. Лаборатория знаний» (095) 955-03-98, email: lbz@aha.ni
ISBN 5-94774-053-2
© коллектив авторов, 2004
© БИНОМ. Лаборатория знаний, 2004
ПРЕДИСЛОВИЕ
Несколько лет назад на кафедре органической химии химического факультета МГУ им. М. В. Ломоносова было принято решение о введении в учебный процесс рейтинговых контрольных работ. С помощью этих контрольных работ предполагалось достичь нескольких целей: проверить усвоение текущего материала; научить конструировать и последовательно реализовать схемы синтеза относительно сложных органических молекул, т. е. уже на ранних стадиях обучения ознакомить студентов с основными приемами ретросинтетического анализа, не вводя его в качестве специального предмета. Фактически предлагаемое читателю пособие преследует те же цели в рамках программы основного курса органической химии.
Вошедшие в пособие задачи различны по степени сложности, и мы сознательно приводим решения всех задач с тем, чтобы продемонстрировать конкретные условия и конкретные реагенты для проведения тех или иных химических превращений.
Для решения подавляющего большинства задач вполне достаточно знаний, полученных студентами на лекциях, семинарах и коллоквиумах в рамках университетской программы по органической химии. По нашему мнению, систематическое решение подобного рода задач поможет студентам лучше усвоить основной материал общего курса органической химии и, кроме того, овладеть стратегией синтеза относительно сложных органических молекул, в основе которой положен прием расчленения их скелета на более простые составляющие фрагменты (ретросинтетический анализ).
При желании многие задачи легко могут быть разделены на несколько частей, упрощены или усложнены, что делает материал пособия весьма полезным при составлении контрольных работ различного уровня. Часть задач взята из оригинальной химической
4 Предисловие
литературы, но большинство придумано нами на основе реальных химических процессов.
Пособие предназначено прежде всего для студентов химических факультетов университетов, особенно для тех, кто намерен стать химиками-органиками, и, конечно же, для преподавателей и аспирантов тех вузов, где органическая химия входит в число основных учебных курсов.
По нашему мнению, этот задачник будет полезным и необходимым дополнением к учебнику Реутов О. А., Курц А. Л., Бутин К. П. «Органическая химия» (в 4-х томах. — М.: БИНОМ. Лаборатория знаний, 2004).
Авторы с благодарностью примут от коллег конструктивные замечания и предложения.
ОБОЗНАЧЕНИЯ
СН3 СН3
AIBN или азобис(изобутиронитрил) 1 ** 1 J N=CCN=NCC=N
АБИБН сн3 сн3
В
9-BBN 9-борабициклононан
втор- вторичный
ДИБАЛ-Н диизобутил-алюминийгидрид [(СН3)2СНСН2]2А1Н
ДМСО диметилсульфоксид © © Me2S- О
ДМФА диметилформамид HC(O)NMe2
i- изо-
LDA или ЛДА диизопропиламид лития [(CH3)2CH]2NLi
н- нормальный О
NBS N-бромсукцинимид фг
о
ПФК полифосфорная кислота Н3РО4Р4О10
Р-2-Ni коллоидальный никель Ni[OC(O)CH3]2/ NaBH4/C2H5OH/ NH2CH2CH2NH2
6 Обозначения
Ру Sia2BH t
трет-, t-
ТГФ
ТГП
ТМЭДА
ТЭБА-СЦ ТЭБАХ /
TsCl TfO-
пиридин
дисиамил боран
нагревание
третичный
тетрагидрофуран
тетрагидроп Иран ил-2
тетраметил-этилендиамин
хлорид триэтил-бензиламмония
тозилхлорид
трифлат
C5H5N
[(СН3)2СНСН(СН3)]2ВН
О \ Me2NCH2CH2NMe2 (вдДсНгдаа®
4-CH3C6H4SO2Cl
cf3so2-o-
ЗАДАЧИ
Глава 1
АЛКАНЫ, АЛКЕНЫ, АЛКИНЫ, ДИЕНЫ
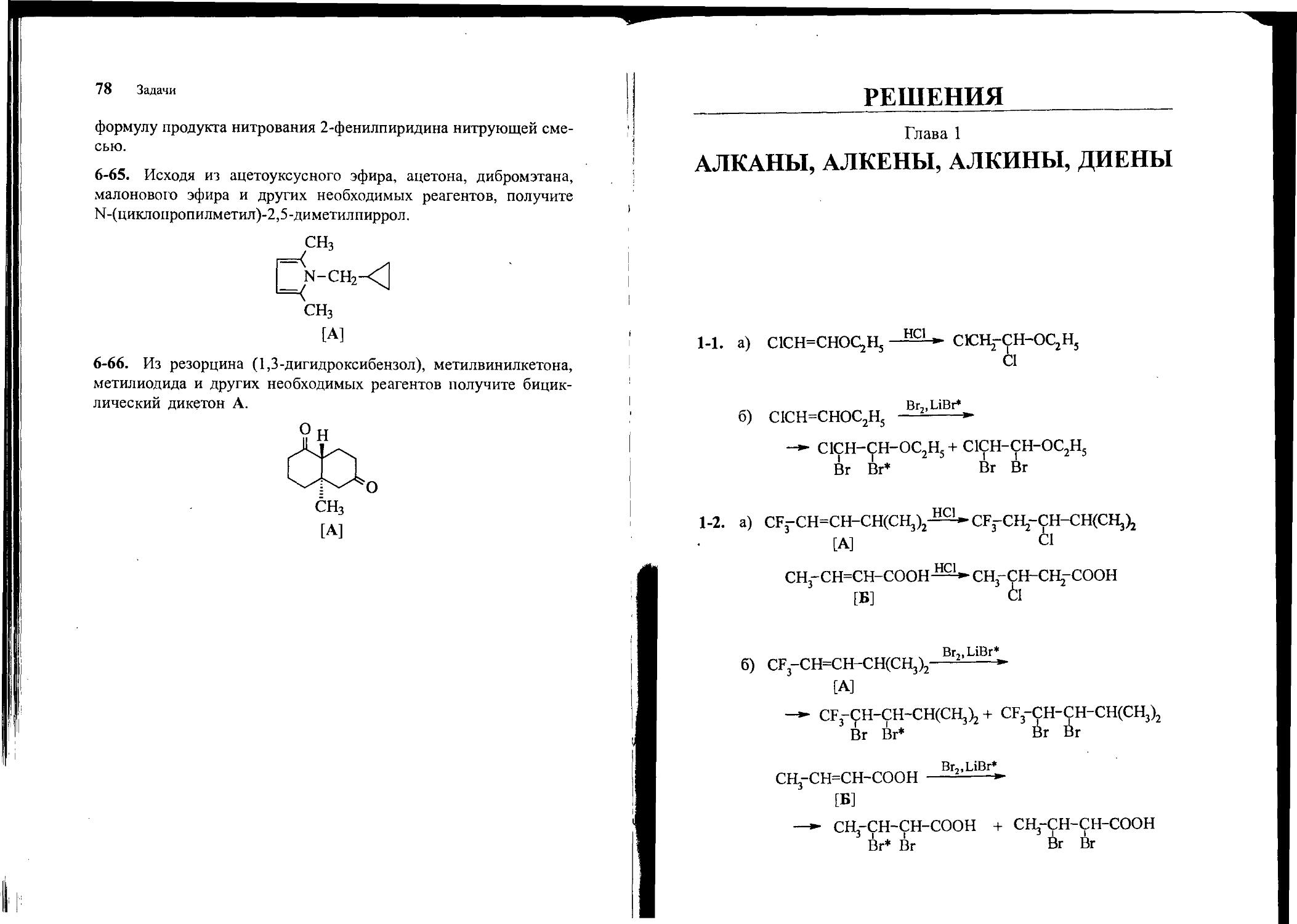
1-1. Какие продукты образуются при присоединении к С1СН=СНОС2Н5 НС1 (а) или Вг2 в присутствии меченого LiBr* (б)?
1-2. Какие продукты образуются при присоединении НС1 (а) или Вг2 в присутствии меченого LiBr* (б) к следующим соединениям: CF3CH=CHCH(CH3)2 сн3сн=снсоон
[А] [Б]
1-3. Из транс-бутена-2 и других необходимых реагентов получите .иезо-С4Н8О2. Приведите клиновидную проекцию для этого продукта и стандартную формулу Фишера (расположите углеродную цепь по вертикали). Дайте R, 5-обозначения асимметрическим центрам.
1-4. Из ацетилена, этилбромида и других необходимых реагентов получите л/езо-гександиол-3,4. Приведите клиновидную проекцию для этого продукта и стандартную формулу Фишера (расположите углеродную цепь по вертикали). Дайте R,5-обозначения асимметрическим центрам.
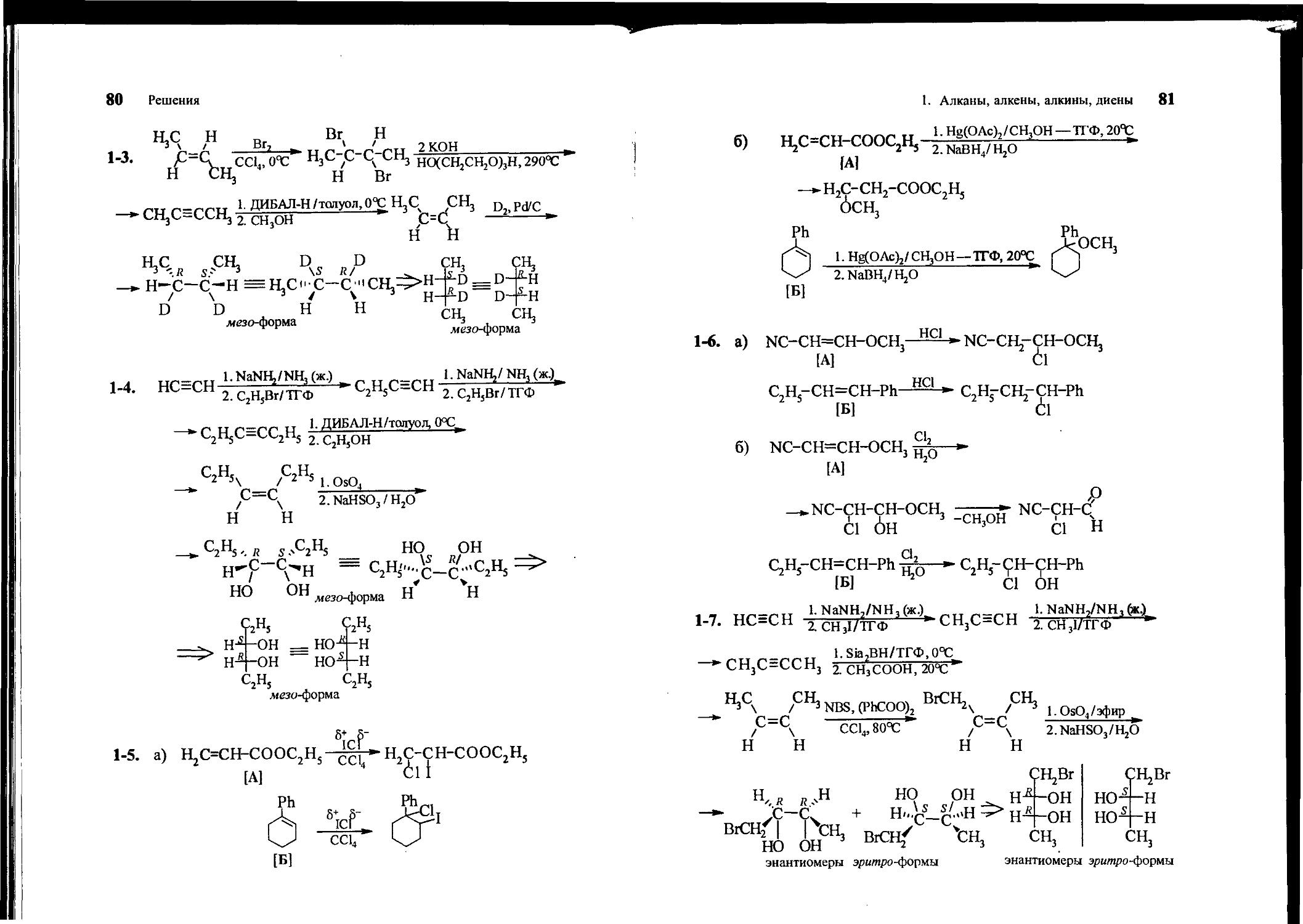
1-5. Какие продукты образуются при присоединении IC1 (а) или Hg(OAc)2 в метаноле (с последующим демеркурированием) (б) к следующим соединениям:
СН2 =CHCOOEt 1-фенилциклогексен
[А] [Б]
1-6. Какие продукты образуются при присоединении НС1 (а) или С12 в воде (б) к следующим соединениям:
N=CCH=CHOCH3 EtCH=CHPh
[А] [Б]
8
Задачи
1-7. Предложите метод синтеза эрмю/го-1-бромбутандиола-2,3 из ацетилена, метилиодида и любых других реагентов.
1-8. Предложите химические способы превращения /иранс-деце-на-5 в цис-децен-5.
1-9. Используя любые необходимые реагенты, превратите метиленциклопентан в следующие соединения:
он ?н QCH2OH QfcH3 QCH3 [А] [Б] [В]
1-10. Из ацетилена, пропилена и других необходимых реагентов получите Z,Z- и Е, Е-декадиены-4,6.
1-11. Исходя из 14С-пропанола-1, меченного по всем атомам углерода, и любых других реагентов, не содержащих 14С, получите (£)-2-бромгексен-2, все атомы углерода которого мечены 14С.
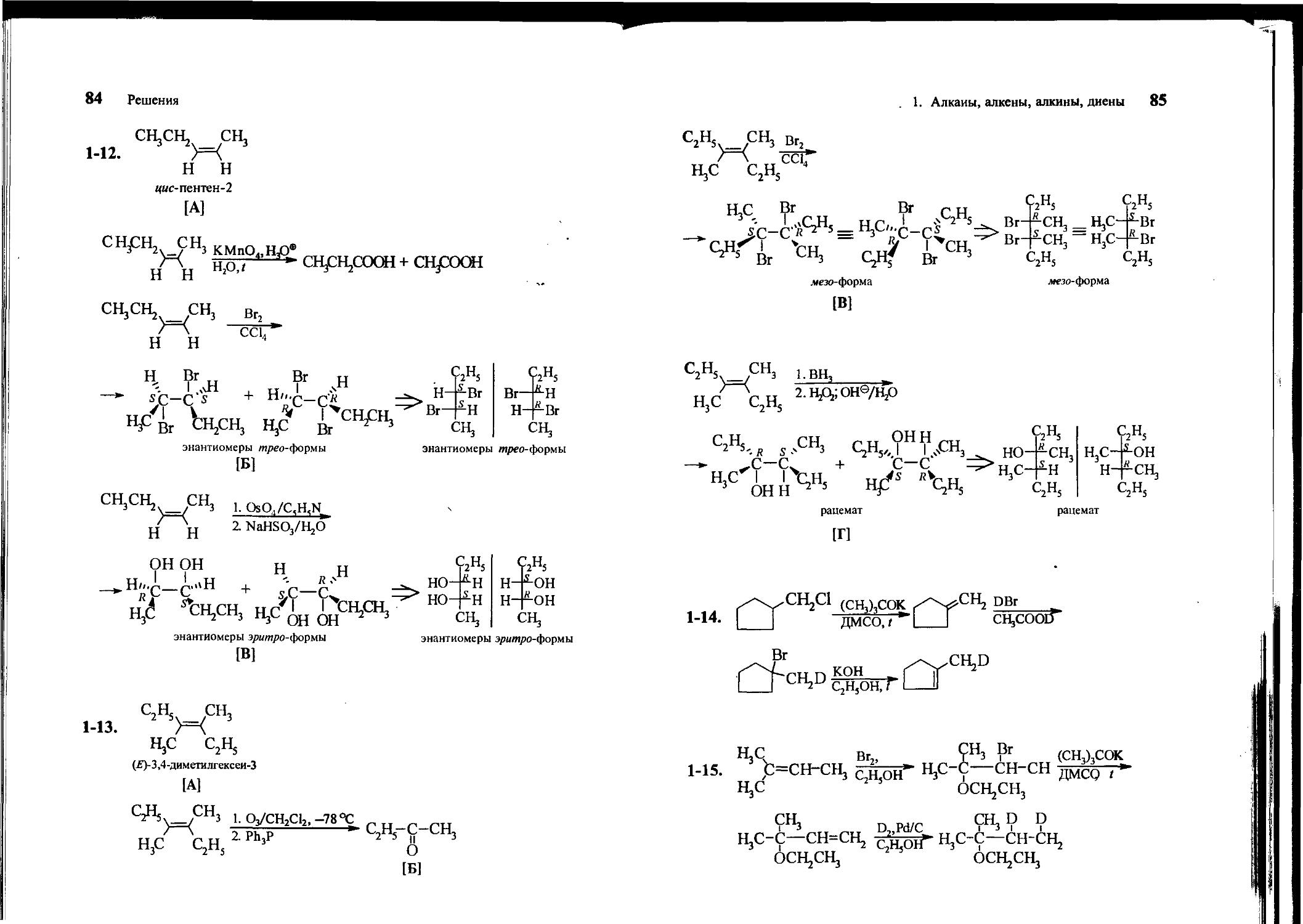
1-12. Углеводород С5Ню [А] вступает в следующие реакции: А КМп°4> н ► две кислоты А _J i >. 5 (/ирео-форма) А 2. NaHSOj/H2O* В (эрмтро-форма)
Напишите уравнения реакций и структурные формулы А, Б и В, а для соединений Б и В также стандартные проекции Фишера.
1-13. Углеводород CgH^ [А] вступает в следующие реакции: А ? р^р *• Б (единственный кетон) А —-— *• В (мезо-форма) А 2.H2O2,HO~> Г (РаЦемат)
Напишите уравнения реакций и структурные формулы А, Б, В и Г, а для соединений В и Г также стандартные проекции Фишера.
1-14. Получите I-(дейтерометил)циклопентен из 1-(хлорме-тил)циклопентана и неорганических реагентов.
1. Алканы, алкены, алкины, диены
9
1-15. Предложите схему синтеза 3,4-дидейтеро-2-метил-2-эток-сибутана из 2-метилбутена-2, этанола и любых неорганических реагентов.
1-16. При обработке пентен-4-ола-1 бромом в четыреххлористом углероде образовалось вещество с брутто-формулой С5Н9ВГО. Напишите структурную формулу этого вещества и предложите возможный механизм его образования.
1-17. Предскажите структурную формулу продукта А и предложите механизм его образования:
СН2ОН
СН3ССН2СН=СН2 с7н14О2
СН2ОН [А]
Сколько пространственных изомеров возможно для А?
1-18. При обработке гептадиена-1,6 бромной водой образовалось вещество следующего строения:
Предложите возможный механизм реакции.
1-19. Из бутена-2, метилбромида и любых других необходимых реагентов получите цис- и транс-изомеры пентена-2.
1-20. Из метиленциклогексана и других необходимых реагентов (некоторые содержат изотопную метку) получите следующие соединения:
HzD ззн2о
ОН D
[А] [Б]
1-21. Исходя из ацетилена, этилбромида и любых других реагентов, получите транс-\-дейтеробутен-1 [А] и 2-дейтеробутен-1 [Б].
1-22. Используя любые необходимые реагенты, превратите метиленциклопентан в транс-2-дейтеро-1-метилциклопентан [А] и 1-дейтеро-1-метилциклопентан [Б].
10 Задачи
1-23. Из гексена-2 и любых других необходимых реагентов получите пентановую кислоту.
1-24. Из бутена-1 и любых других необходимых реагентов получите пентин-1.
1-25. Из гексена-3 и любых других необходимых реагентов получите гексаналь.
1-26. Из ацетилена, этилбромида, хлороформа, неорганических реагентов и необходимых катализаторов получите соединение А следующего строения:
Н Н
н н [А] 1-27. Расшифруйте цепочку превращений: Z-BuOH НзР^ * a Б + В изомеры CsHie Вг2(1 моль),„ (СН3)3СОК, (СН3)3СОН, t г
1-28. Углеводород СюНго [А] вступает в следующие реакции:
' T&ciTcooiT 2 (СН,)2СНС(О)СН,
A IRCOOOH
А 2. н2о/но® Б Йезо-форма)
А -----------► в (мезо-форма)
А хнХ/но0 * г (Ра«емат)
Напишите уравнения реакций и структурные формулы А, Б, В и Г, а для соединений В и Г (два энантиомера) также проекции Фишера. 1-29. Углеводород CgHl6 [А] вступает в следующие реакции:
А 2. Zn/CHjCOOH* 2 С2Н5СОСН3
А 2.NaHSO3/H2o” Б (мезо-форма)
1. Алканы, алкены, алкины, диены 11
А 2.СН3СООН.. * В (^зо-форма)
A -----------► р (рацемат)
A2CCh--------д
Напишите уравнения реакций и структурные формулы А, Б, В, Г и Д, а для соединений В и Г (два энантиомера) также проекции Фишера.
1-30. Из ацетилена и других необходимых реагентов получите 2-метилбутадиен-1,3. Напишите структурную формулу его аддукта с малеиновым ангидридом (отразив пространственное строение).
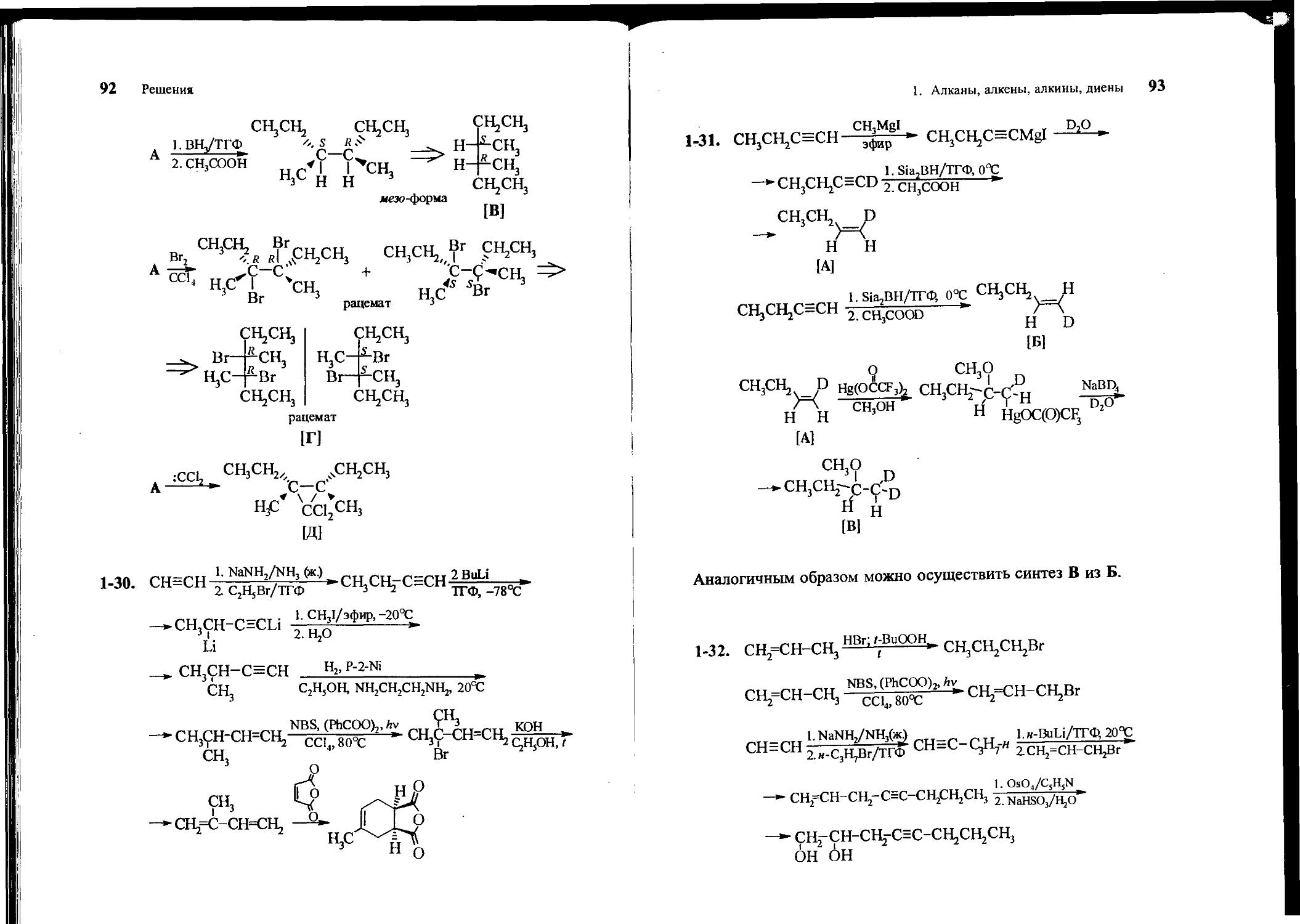
1-31. Используя любые необходимые реагенты, превратите бутин-1 в следующие соединения:
СН3СН2.„ D СН3СН2^„=„/Н CH3CH2-CH-CHD2
ЬГ н IT "D ОСНз
[А] [Б] [В]
1-32. Из ацетилена, пропилена и других необходимых реагентов получите октин-4-диол-1,2.
1-33. Предложите способ синтеза 1,2,4-тридейтеробутанола-1 HOCHDCHDCH2CH2D, исходя из ацетилена, этилена и неорганических реагентов.
1-34. Из ацетилена, метилбромида и других необходимых реагентов получите соединение А.
СН3С(О)СН2ч ZCH2C(O)CH3
с-с
н н
[А] 1-35. Исходя из этилена, ацетилена, формальдегида, толуола и других необходимых реагентов, получите соединение А.
С6Н5СН2ОСН2С=ССН2СН2ОСН2С6Н5 [А]
12 Задачи
1-36. Исходя из бутадиена, ацетилена и формальдегида, получите диен А.
СООСНз
СООСНз
[А]
1-37. Из малеинового ангидрида, бутадиена-1,3 и неорганических реагентов получите соединение А, которое является предшественником бензола Дьюара.
1-38. Исходя из ацетилена, ацетона и других необходимых реагентов, получите 2,2,5,5-тетраметил-З-оксотетрагидрофуран [А].
1-39. Из ацетилена, этилбромида, формальдегида и других необходимых реагентов получите соединение А. Напишите структурную формулу продукта реакции соединения А с хлороформом и водной щелочью в присутствии ТЭБАХ (конечный продукт содержит только два атома хлора).
COOEt
COOEt
[А]
Глава 2
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АЛИФАТИЧЕСКОМ РЯДУ, ЭЛИМИНИРОВАНИЕ
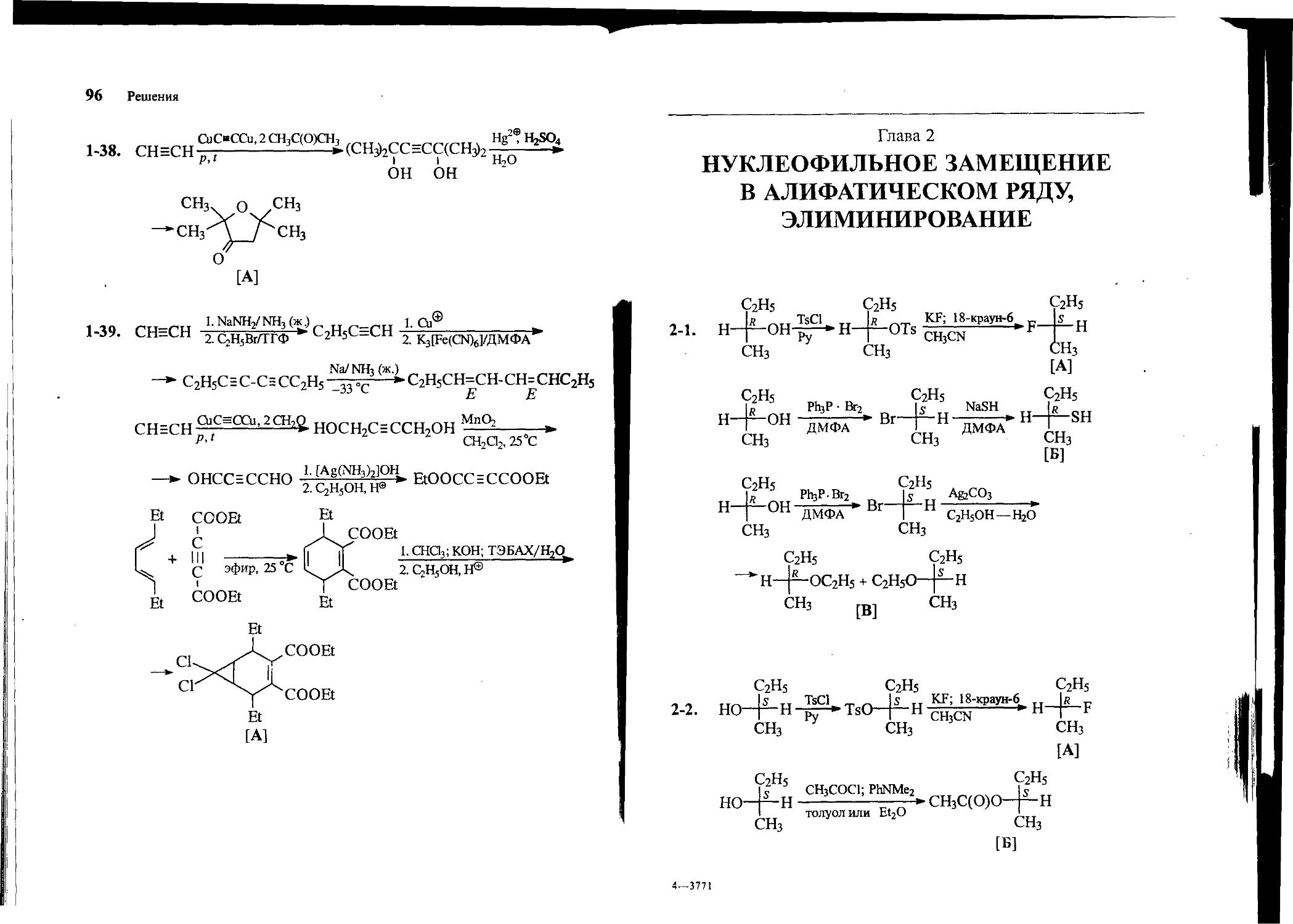
2-1. Превратите (Я)-бутанол-2 в следующие соединения: (5)-2-фторбутан [А], (Я)-бутантиол-2 [Б] и (Л, 5)-в/ио/?-бутилэти-ловый эфир [В].
2-2. Превратите (5)-бутанол-2 в следующие соединения: (Я)-2-фторбутан [А], (5)-в/яо/?-бутилацетат [Б] и (Л, S)-emop-6y-тилформиат [В].
2-3. Сравните скорости реакций в разных растворителях.
а) Растворители: С2Н5ОН (1) и ДМСО (2): (2)“N(CH3)3l0 + NaOH Л- + N(CH3)3 + Nal + Н2О
б) Растворители: Н2О (1) и смесь Н2О/ацетон (2): (С2Н5)зСС1 + Н2О —► (С2Н5)зСОН + НС1
в) Растворители: СН3ОН (1) и ДМФА (2): CH3OSO2^>-CH3 +KI —► CH3I + koso2-©-ch3
Укажите механизмы приведенных реакций.
2-4. Сравните скорости реакций в разных растворителях.
а) Растворители: Н2О (1) и смесь Н2О/диоксан (2): (СНз)зСС1 + Н2О—>► (СНз)зСОН + НС1
б) Растворители: Н2О (1) и ДМФА (2):
C2H5Br + NaSH—► C2H5SH + NaBr
в) Растворители: Н2О (1) и ДМСО (2):
(СНз)2СнЙ(СНз)зВге + NaOH—►
—- СН3СН=СН2 + N(CH3)3 + NaBr + Н2О Укажите механизмы приведенных реакций.
14 Задачи
2-5. Сравните скорости реакций в разных растворителях: а) Растворители: Н2О (1) и С2Н5ОН (2):
(сн3)3сс1 + н2о -Иг2аЦсн3)3сон + НС1
(СН3)3СС1 + С2Н5ОН С^0Н<21 (СН3)3СОС2Н5 + НС1
б) Растворители: Н2О (1) и СН3ОН (2):
CH3Br + KI—>► СН31 + КВг
в) Растворители: Н2О (1) и ДМСО (2): (C2H5)2CHN®(CH3)3Ie+KOH—>-
—>СН3СН=СНСН2СН3 +N(CH3)3 + KI + Н2О
Укажите механизмы приведенных реакций.
2-6. Расположите следующие соединения в порядке уменьшения скорости сольволиза в муравьиной кислоте:
PhCH2Cl, H-C4H9CI, (Ph)2CHCl, Ph3CCl, Z-BuCl, CH3CHCH2CH3, ch3o-^^-2chci
2-7. Расположите соединения RC1 в порядке уменьшения реакционной способности в следующей реакции:
RC1 + KI ^^RI + KCl
где R = h-C3H7, втор-С4Н^, W30-C4H9, СН3, PhCH2, СН2=СН, СН3С(О)СН2, СН2=СНСН2.
2-8. Соединение А с брутто-формулой СэНуСЮ легко подвергается сольволизу в этаноле (О °C, период полупревращения 10 мин). Соединение Б с той же брутто-формулой в тех же условиях реагирует в 105 раз медленнее, чем соединение А. Соединение В с брутто-формулой С3Н?С1 реагирует с фенолятом натрия в этиловом спирте при 80°С с образованием продукта замещения в 103 раз медленнее, чем этилхлорид. Предложите структурные формулы соединений А, Б и В.
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 15
2-9. Сравните скорости сольволиза в муравьиной кислоте для следующих пар соединений:
a) CH3CH2CHOTs СН3
6)<^-CH2OTf
в) СН3СНСН3
Вг
aSC2H5
Вг
и СН3СН2СНС1
сн3
и СН2ОАс
и CH3CHCH2N(CH3)2 Вг
asc2H5
Вг
2-10. Из пентен-4-ола-1, циклогексанола и других необходимых реагентов получите соединение А. Напишите структурную формулу продукта с брутто-формулой СцН2оО, который образуется, если соединение А последовательно обработать ацетатом ртути в ТГФ и боргидридом натрия.
_/СН2)3СН=СН2
он
[А]
2-11. Из гексена-3 и других необходимых реагентов получите
гексанон-2.
2-12. Из ацетилена, (Я)-пентанола-2 и других необходимых реагентов получите гщс-(4Я,7У)-4,7-диметилдецен-5. Обладает ли этот продукт оптической активностью?
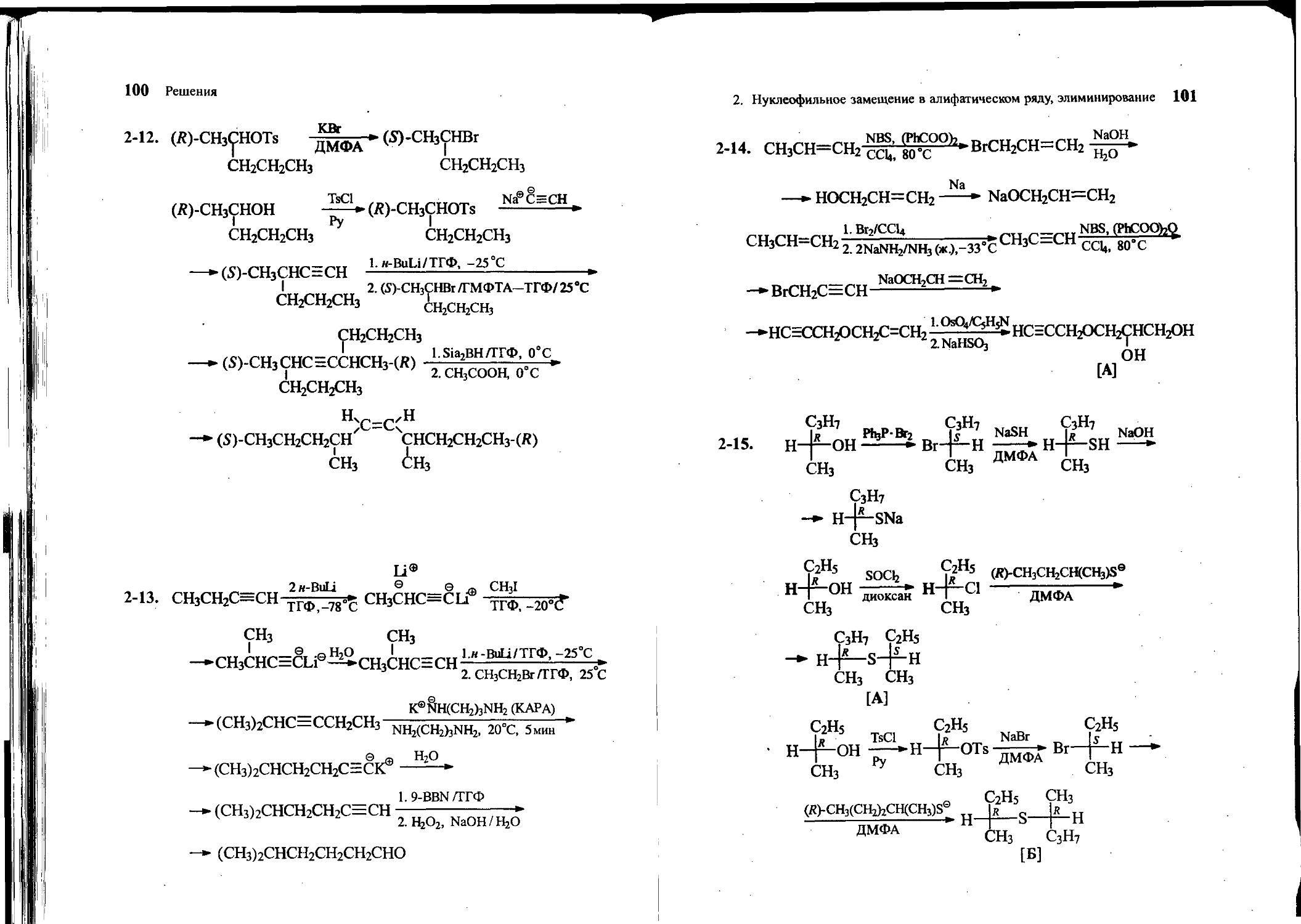
2-13. Исходя из бутина-1, метилиодида, этилбромида и других необходимых реагентов, получите 5-метилгексаналь.
2-14. Из пропилена и других необходимых реагентов получите 1-монопропаргиловый эфир глицерина [А].
снессн2осн2снсн2-он
ОН
[А]
16 Задачи
2-15. Из (7?)-бутанола-2, (Я)-пентанола-2 и других необходимых реагентов получите сульфиды А и Б.
сн3 сн3
I S I R
CH3(CH2)2CHSCHCH2CH3 и CH3(CH2)2CHSCHCH2CH3
R 1 n I
сн3 R сн3 .
[А] [Б]
2-16. Исходя из стирола, диэтилового эфира малеиновой кислоты и других необходимых реагентов, получите соединение [А] следующего строения:
n COOEt Ph
% I I
'C-CH-CH-CH-CH-C^
H I I H
Ph COOEt
[A]
2-17. Из изопропилацетилена (З-метилбутина-1), метилбромида, диметиламина и других необходимых реагентов получите соединение А. Превратите соединение А в З-изопропилпентадиен-1,4, используя метилбромид, вимипбппМид и другие необходимые реагенты.
N(CH3)2
СН3СНСЦСН(СН3)2
ОН г41
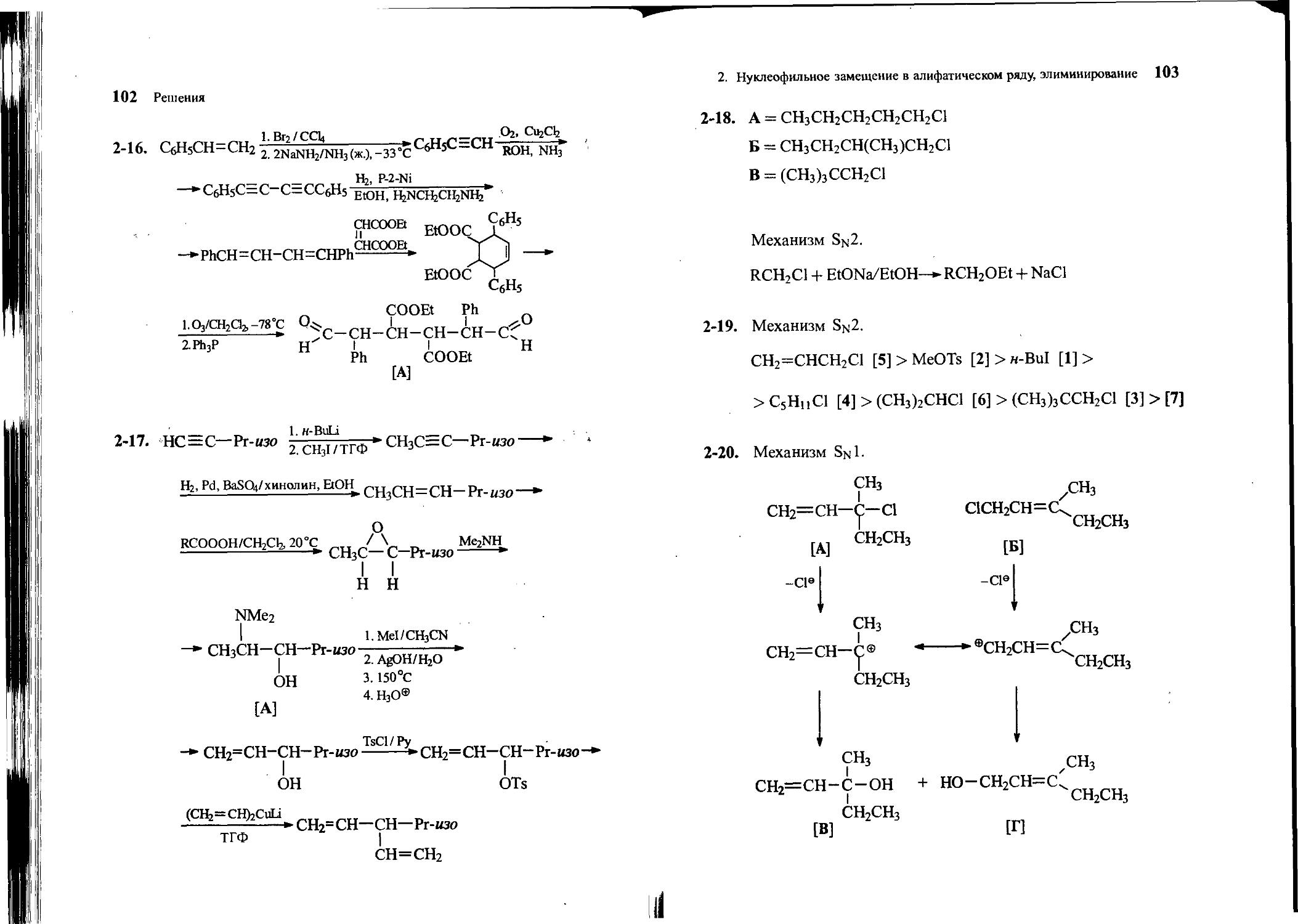
2-18. Определите строение трех (А, Б и В) первичных хлоридов C5H11CI, если известно, что изомер А реагирует в реакции Вильямсона с этилатом натрия в этаноле в 100 раз медленнее, чем изомер Б. Изомер В в этой реакции реагирует в 105 раз медленнее, чем Б. Напишите уравнения реакций изомеров А, Б и В с этилатом натрия в этаноле и обсудите их механизм.
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 17
2-19. Расположите соединения RX в порядке уменьшения их реакционной способности в следующей реакции:
RX + KCN Д^-°> RCN + КХ
RX = н-С4Н91; CH3OTs;
[1] [2]
(СН3)3ССН2С1; н-С5ЙиС1;
[3] [4]
СН2=СНСН2С1;
[5]
изо-С3Н7С1;
[6]
Предложите механизм данной реакции.
2-20. Гидролиз третичного аллильного галогенида А с брут-то-формулой СбНцС1 и изомерного ему первичного аллильного галогенида Б приводит к смеси двух изомерных спиртов В и Г в одном и том же соотношении. Напишите структурные формулы соединений А-Г, уравнения реакций гидролиза и укажите механизм гидролиза.
2-21. Получите З-метилбутен-1 [А] и 2-метилбутен-2 [Б] из изопропанола, этанола и неорганических реагентов.
2-22. Получите метиленциклогексан [А] (а) и 1-метилциклогексен [Б] (б) из бромциклогексана и метанола.
2-23. (/?)-!-Фенилпропанол-2, содержащий изотопную метку 18О, введен в следующую цепочку превращений:
/РА РЬСЫ ГИГИ CH3SO2CI NaOH /Н2О
(R)-PhCH2CHCH3 „ирИдаИ ► А —кса- ► Б + CH3SO3Na isOH
Какова конфигурация соединений А и Б? В каком из конечных продуктов окажется изотопная метка 18 О? Ответ подробно мотивируйте.
18 Задачи
2-24. Исходя из оптически активного 1-фенилпропанола-2, был получен простой эфир В двумя путями:
TsCl/Py способ 1
CH3CHCH2Ph-
ОН
металлич. К _
-----«т—Б
способ 2
С2Н5ОН д
К2СО3
С2Н5ВГ „ о
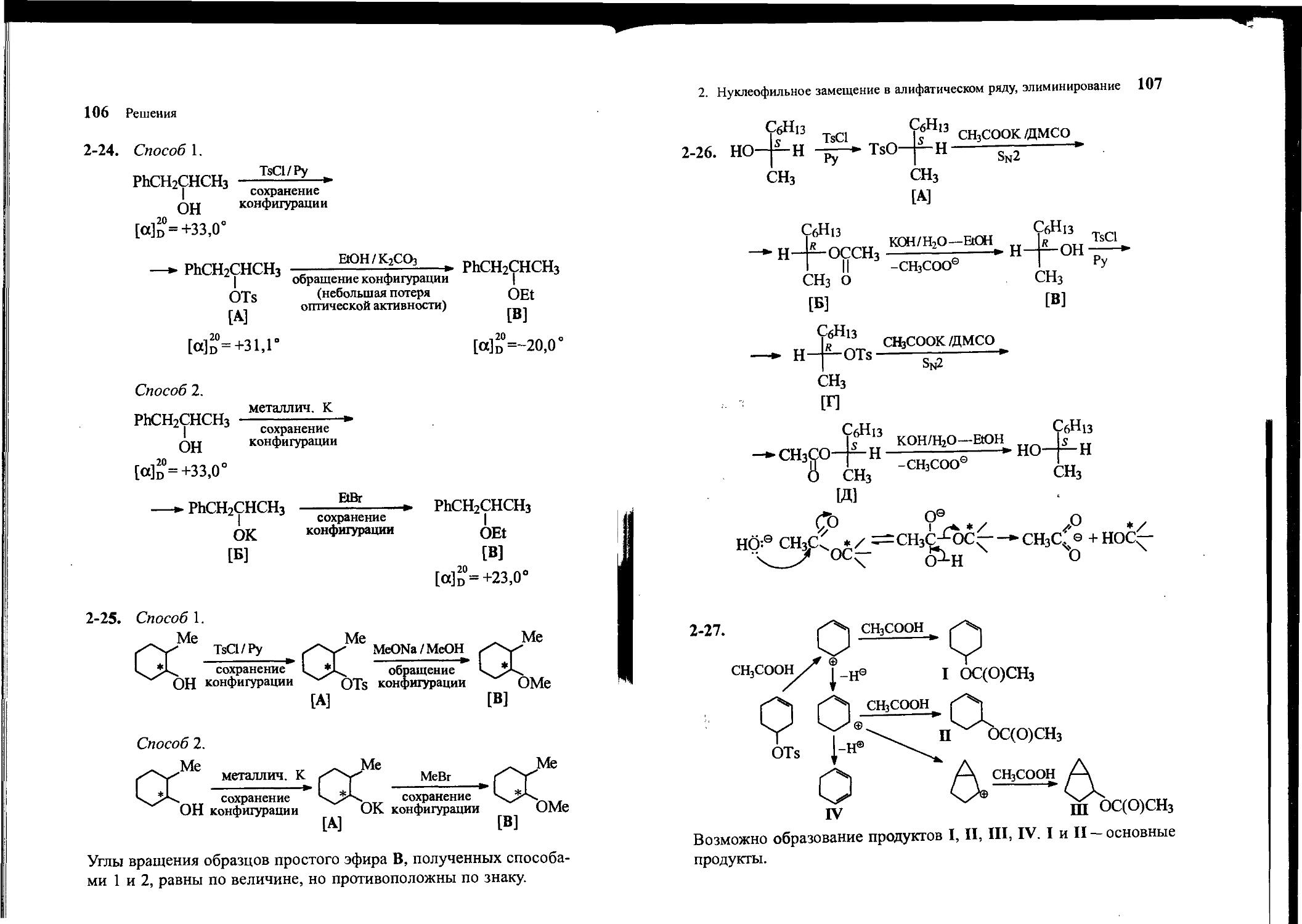
Угол вращения плоскости плоскополяризованного света для эфира В, полученного по способу 1, составил [oJo = — 20,0°, а по способу 2 — [а]д° = +23,0°. Для образцов простого эфира В, полученных двумя способами, объясните причину различия угла вращения по величине и по знаку.
2-25. Сравните углы вращения плоскости плоскополяризованного света для простого эфира В, полученного двумя различными способами из оптически активного спирта:
TsCl/Py * CH3ONa способ 1 СН3ОН
металлич. К СН3Вг
------------► гэ-----------►
способ 2
2-26. Расшифруйте цепочку превращений и укажите конфигурацию (R или S) соединений на каждой из стадий:
(5)-Октанол-2
TsCl, Руг . СН3СООК к КОН д СН3СОО1^ А ДМСО ь HjO-EtOH* Ь ДМСО
-*Д^оГ(5)-°™л'2
2-27. Напишите основные продукты (не менее трех) ацетолиза (сольволиза в уксусной кислоте) тозилата циклогексен-4-ола.
2-28. Расшифруйте цепочку превращений и укажите конфигурацию (R или S) соединений на каждой стадии:
ОН
**Б
© ©
CH3I Bu^NOAc ацетон* ® ДМ Ф А
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 19
2-29. Исходя из гексена-3 необходимой конфигурации, метил-иодида, бромоформа, Cu2Br2 и других необходимых реагентов получите транс-1,1 -диметил-2,3-диэтилциклопропан.
2-30. Исходя из (2?)-бутанола-2, фенилацетилена и других необходимых реагентов, получите Z- и Е-изомеры (5)-3-метил-1-фе-нилпентена-1.
2-31. Из циклопентанола, метилиодида и других необходимых реагентов получите цис- 1,2-диметилциклопентан.
2-32. Исходя из циклопентанола и других необходимых реагентов, получите г/мс-1-метокси-2-фторциклопентан.
2-33. Из ацетилена и неорганических реагентов синтезируйте динитрил гексен-3-диовой кислоты.
2-34. Из ацетилена и неорганических реагентов получите гекса-триен-1,3,5.
2-35. Расшифруйте цепочку превращений:
и с=сс t_r NaAH1^i А RCOOOH 1. CHjMgBr/эфир
С2Н5С-СС2Н5 _зз°С А СН2С12, 200С ь 2.Н3О® Ь
TSC1 СдНдО®
^у ь С2Н5ОН ж
в—
I РЬзР-Вг2 С2н5о0>д
1 С2Н5ОН
Ответ подробно мотивируйте, используя стереохимические формулы.
2-36. Расшифруйте цепочку превращений:
Ph Ph RCOOOH LiAlD4
X --------------------*"Б
H H
TsCl „ Py“*B
C2H5Oe
C2H5OH
*Г + Д (Г>Д)
Ответ подробно мотивируйте, используя стереохимические формулы.
20 Задачи
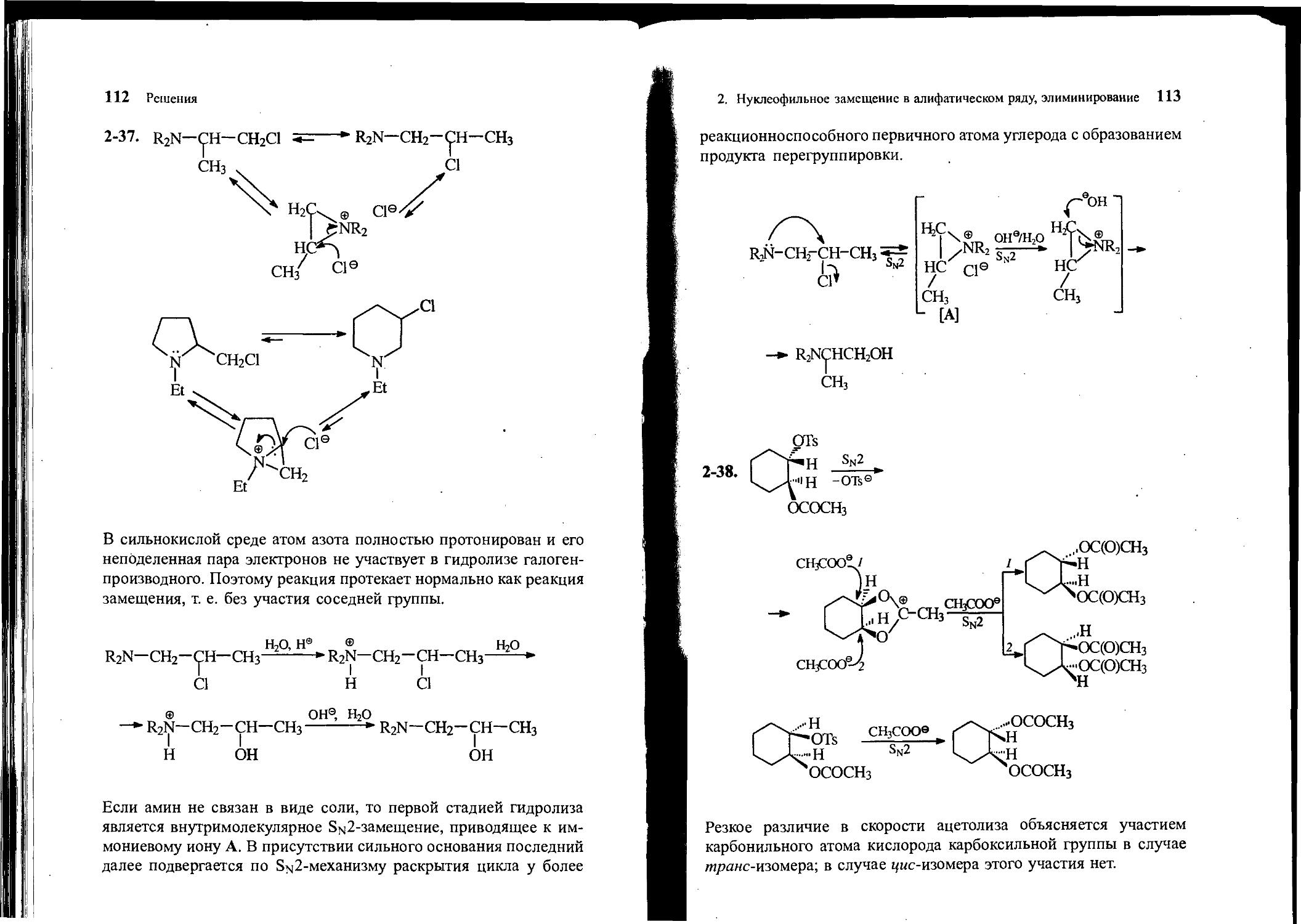
2-37. Напишите механизм изомеризации /3-галогенаминов:
r2nchch2ci *r2nch2chch3
СН3 С1
о
N CH2CI
С2н5
Почему в равновесии преобладает галогенид, содержащий галоген у вторичного атома углерода? Почему гидролиз /^-хлораминов R2NCH2CH(C1)CH3 в щелочной и кислой средах приводит к изомерным /?-аминоспиртам? Объясните.
r2nch2chch3-ci
0
OH.Hjp
----------► R2N С Н С Н 2О н
0 СИз
1 .Н3О
—0-------► R2N с н 2С н сн з
2 . ОН, HjP
2-38. Скорости ацетолиза цис- и /ир«нс-изомеров 2-ацетокси-циклогексилтозилата в уксусной кислоте в присутствии ацетата натрия резко различаются: транс-изомер реагирует в 670 раз быстрее, чем цмс-изомер. При этом в обоих случаях образовавшийся диацетат имеет /иранс-конфигурацию.
,,OTs
ОС(О)СНз
СН3СОО® СНзСООН 100°С
К=
,,ОС(О)СНз з^^ОС^СНз
OTs е
СН3С00, СН3СООН 100°С *
ОС(О)СН3
к=
,,ОС(О)СН3
0С(0)СН’
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 21
При ацетолизе в данных условиях оптически активного транс-2-ацетоксициклогексилтозилата образуется рацемический транс-w ацетат. Объясните:
1) резкое различие в скорости ацетолиза исходных цис- и транс-тозилатов;
2) наблюдаемый стереохимический результат ацетолиза этих изомеров;
3) образование рацемического транс-диацетата при ацетолизе оптически активного /иранс-З-ацетоксициклогексилтозилата.
2-39. Объясните различный стереохимический результат взаимодействия метилового эфира (5)-2-бромпропионовой кислоты с метилатом натрия и Na-соли (5)-2-бромпропионовой кислоты с метанолом.
СНзСНСООСН з 41§5П*СНзСНСООСНз
Вг ОСН3
CH3CHCOONa --е0Н -» CHjCHCOONa
Вг ОСНз
Какое влияние на скорость второй реакции окажет добавление солей серебра? Изменится ли при этом ее стереохимический результат?
2-40. Из циклогексена и других необходимых реагентов получите транс-1 -дейтеро-2-фторциклогексан.
2-41. Из фенилацетилена, винилбромида и других необходимых реагентов получите Е-1-фенилбутадиен-1,3.
2-42. Из циклогексанола и этанола получите 2-этокси-1-этилциклогексанол.
2-43. Из аллилового спирта и ацетона получите 3,4-диметилцик-логексен-3-карбальдегид (4-формил-1,2-диметилциклогексен).
22 Задачи
2-44. Диен А в реакции Дильса—Альдера с и-бензохиноном образует циклоаддукт [Б].
[Б]
Напишите структурную формулу диена А и получите его из циклогексанола, ацетилена и неорганических реагентов.
2-45. Из каких диена и диенофила получен циклоаддукт А?
СООМе
СООМе
[А]
Предложите метод синтеза данного диена из бутадиена-1,3, диметилового эфира малеиновой кислоты и необходимых реагентов.
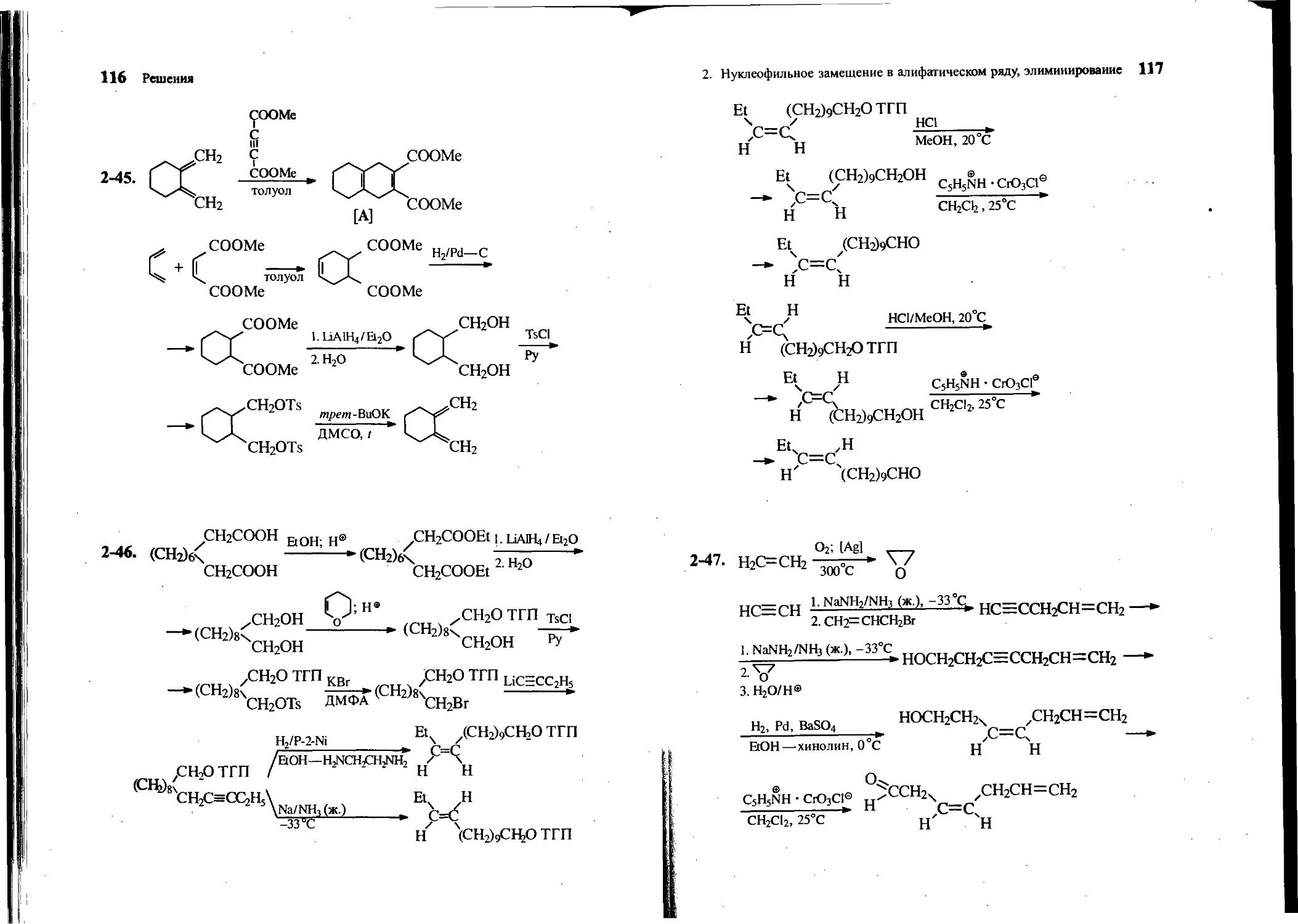
2-46. Предложите синтез цис- и транс-тетрадецен-11 -алей (феромонов) из декандиовой кислоты, бутина-1 и других необходимых реагентов, используя на одной из стадий защитную группировку.
2-47. Из этилена, ацетилена, аллилбромида и других необходимых реагентов получите соединение А.
сн2=снсн2к СН2СНО
/С=СС н н
[А]
2-48. Исходя из ацетилена, формальдегида и других необходимых реагентов, получите соединение А.
Н>С-СН2-СН2-О-СН2-СН2-С<Н
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 23
2-49. Исходя из З-метилбутина-1, этилиодида и других необходимых реагентов, получите 5-метилгексанон-2 [А] и 5-метилгек-саналь [Б]. Оба соединения должны быть получены из одного и того же предшественника.
2-50. Из пропилена, ацетилена и неорганических реагентов получите 7-октен-4-он-2 [А].
2-51. Расшифруйте цепочку превращений, изобразив стереохимические формулы продуктов.
СН3 СН2СН3
С=с'
СН3СН27 ЧСН3
RCOOOH > А 1, LiAlH4/Et2O1. г TsCl» СН2С12,20°С> А 2. Н2О Ь Ру *
KBr t r EtONa> _ ДМФА 1 ЕЮН *
2-52. Расшифруйте цепочку превращений и укажите возможный механизм последней стадии.
Ч /СНз с=с.
е/ сн3
NBS (1 моль)
RCOOOH „
А------►Б
СН3О® /СНз
VCD2OCH3
2-53. Из бутена-1, ацетилена, л/-хлорпербензойной кислоты и неорганических реагентов получите динитрил г/мс-2,7-диэтилок-тен-4-диовой кислоты [А].
NCCHCH2\ ch2chcn
С2Н5 С=С^ С2Н5 Н Н
[А]
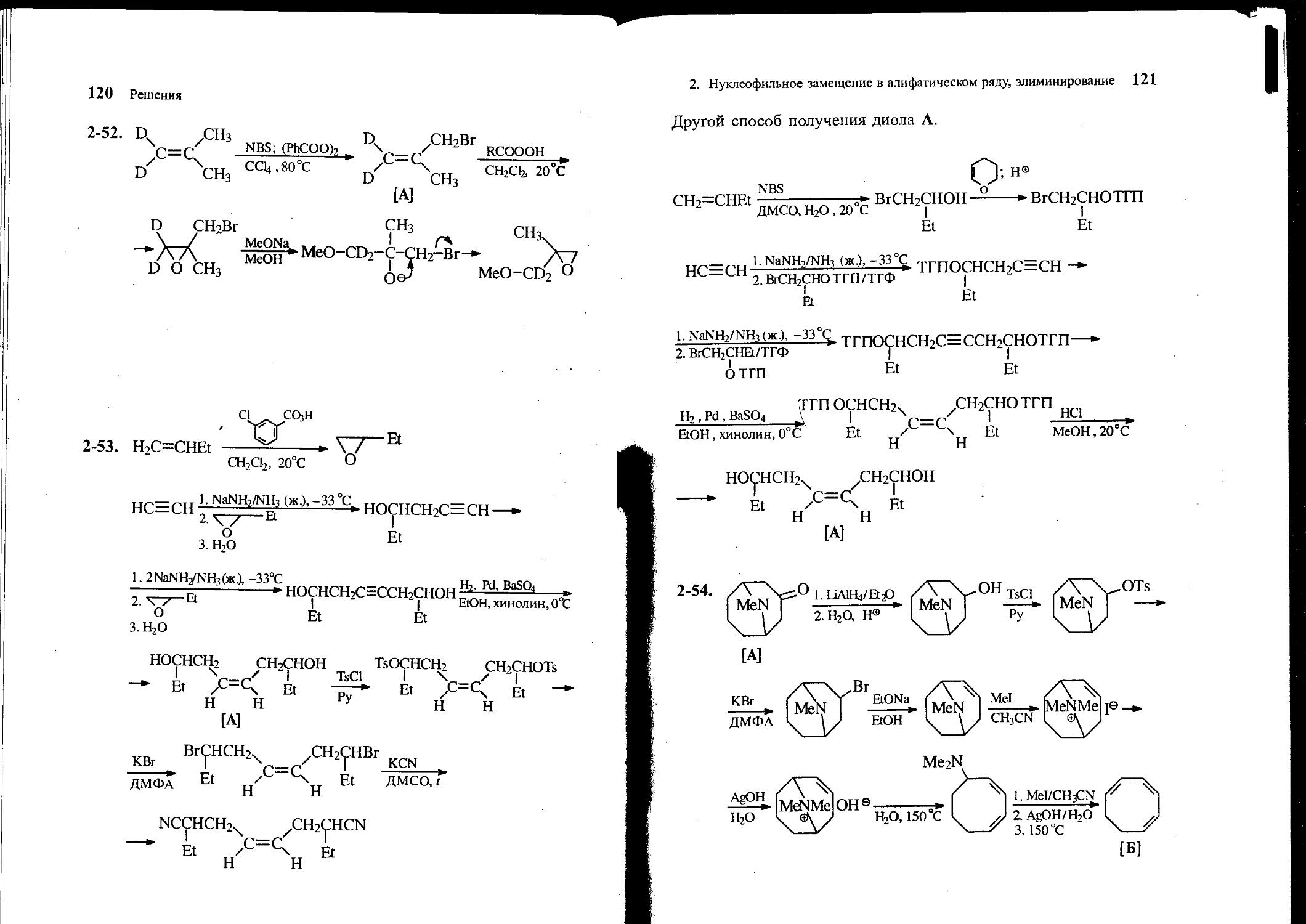
2-54. Из алкалоида А и других необходимых реагентов получите циклооктатриен-1,3,5 [Б].
24 Задачи
2-55. Из триэтилового эфира циклопропан-1,2,3-триовой кислоты получите триметиленцикло пропан (радиал ен) [А]. Используйте любые необходимые реагенты.
СН2
Н2С сн2
[А]
Замечание: В присуствии кислотных реагентов и А12Оз продукт А совершенно нестабилен.
2-56. Из бромциклогексана и других необходимых реагентов получите (фторметил)циклогексилкетон.
2-57. Исходя из пентандиола-1,5, дигидропирана, пропина-1 и других необходимых реагентов, получите 8-гидроксиоктаналь [А].
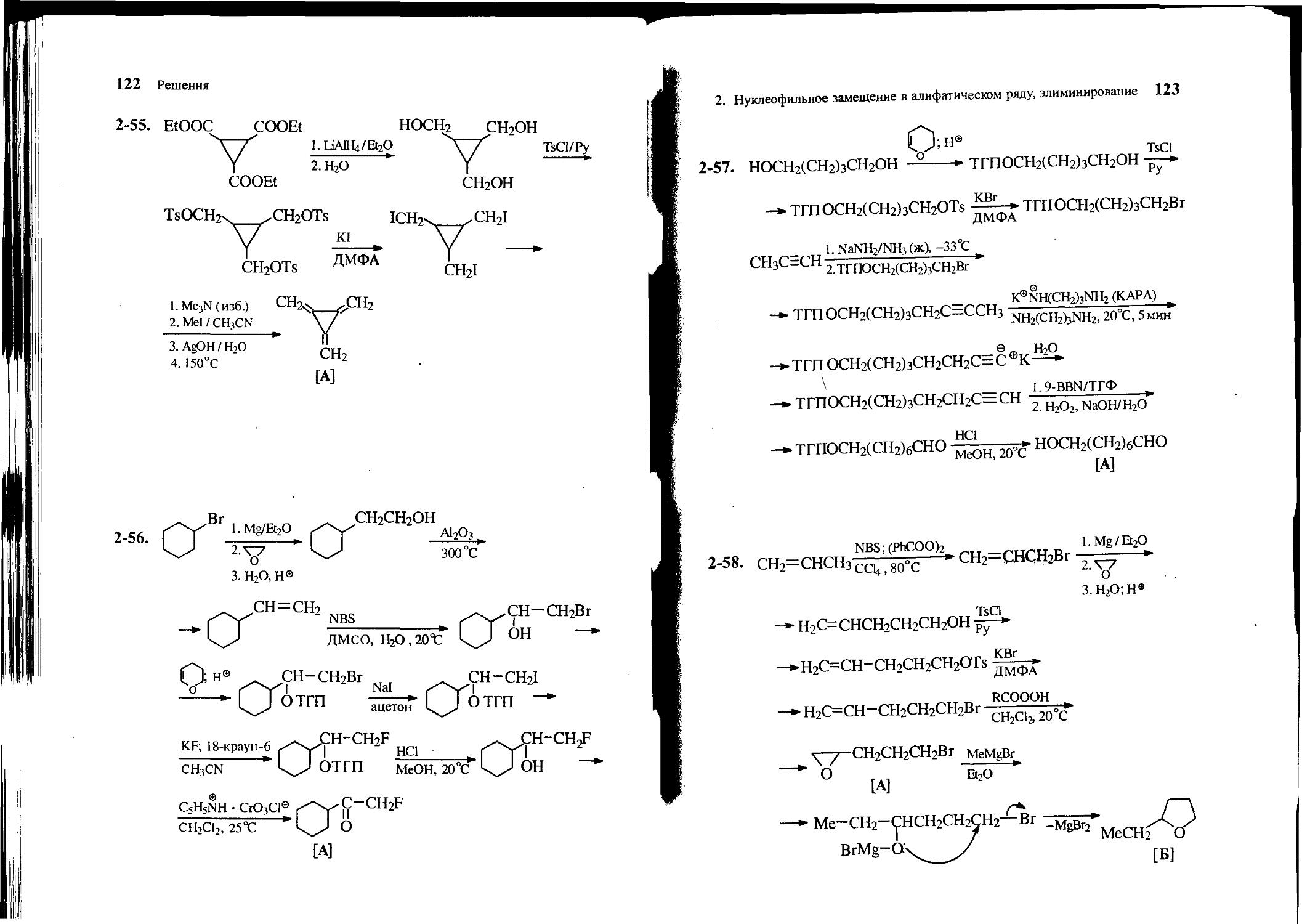
2-58. Из пропилена, этиленоксида и других необходимых реагентов получите 2-(3-бромпропил)оксиран [А]. Какое соединение образуется при обработке соединения А метилмагнийбромидом? Напишите структурную формулу.
\ у (СН2)3Вг
О
[А]
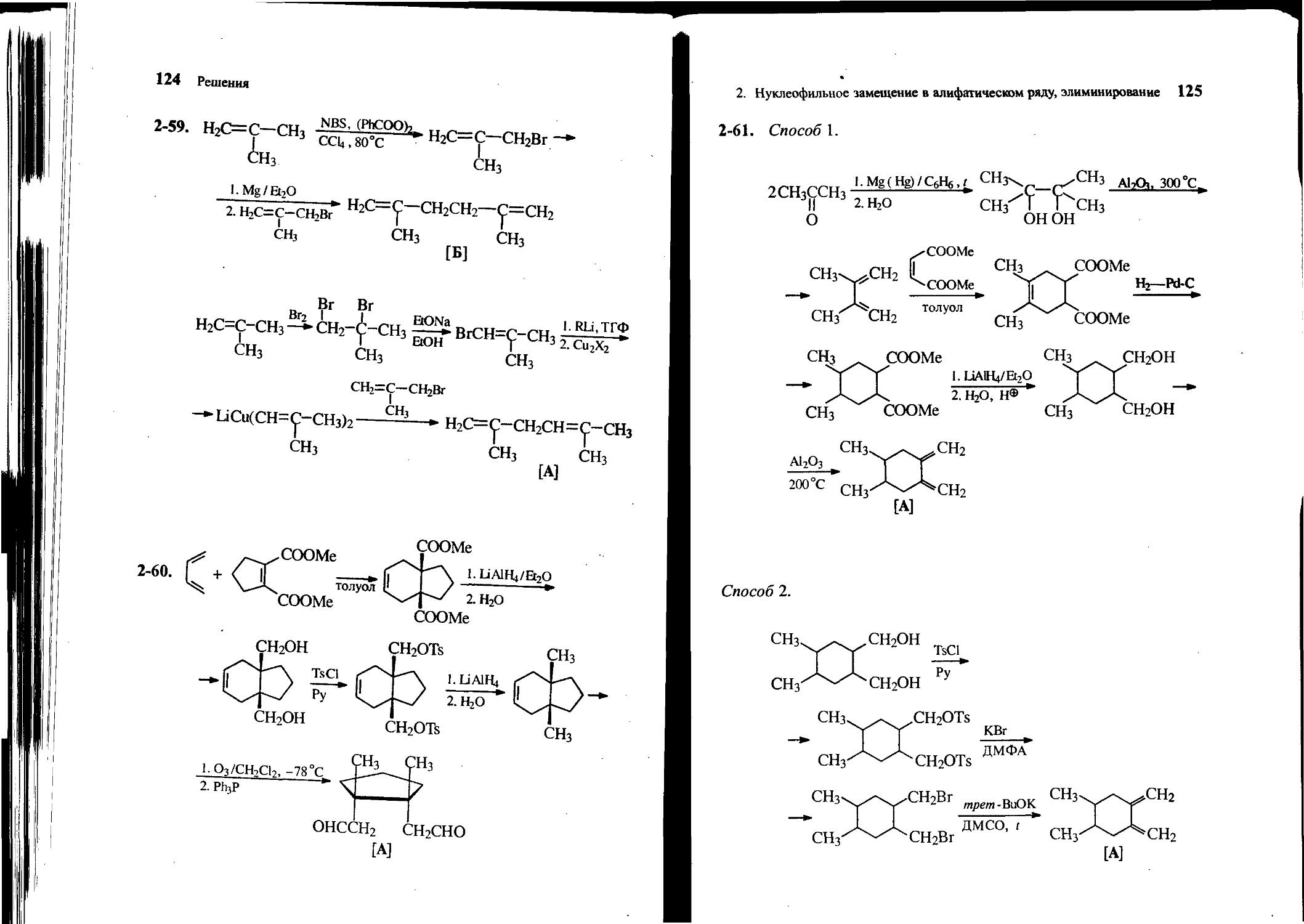
2-59. Исходя из изобутилена и других необходимых реагентов, получите 2,5-диметилгексадиен-1,4 [А] и 2,5-диметилгексади-ен-1,5 [Б].
2-60. Получите соединение А, исходя из бутадиена-1,3, диметилового эфира 1-циклопентен-1,2-дикарбоновой кислоты и других необходимых реагентов.
СН3 СНз
онссн2 СН2СНО
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 25
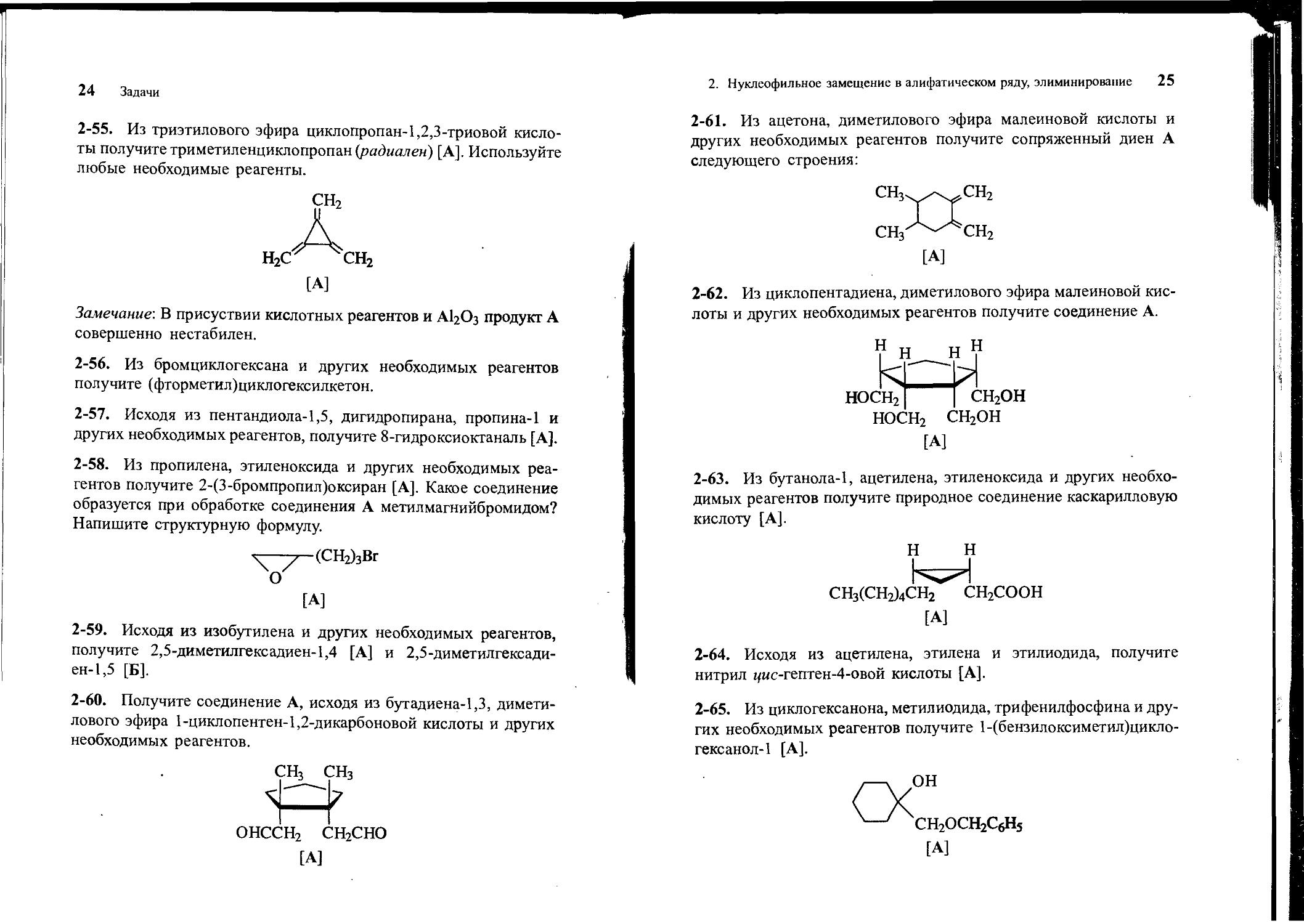
2-61. Из ацетона, диметилового эфира малеиновой кислоты и других необходимых реагентов получите сопряженный диен А следующего строения:
[А]
2-62. Из циклопентадиена, диметилового эфира малеиновой кислоты и других необходимых реагентов получите соединение А.
НОСН2| СН2ОН носн2 сн2он [А]
2-63. Из бутанола-1, ацетилена, этиленоксида и других необходимых реагентов получите природное соединение каскарилловую кислоту [А].
Н Н
СН3(СН2)4СН2 СН2СООН [А]
2-64. Исходя из ацетилена, этилена и этилиодида, получите нитрил г/мс-гептен-4-овой кислоты [А].
2-65. Из циклогексанона, метилиодида, трифенилфосфина и других необходимых реагентов получите 1-(бензилоксиметил)цикло-гексанол-1 [А].
/—\ °Н
^-/^СЩОСНгСбНз
[А]
26 Задачи
2-66. Исходя из бутадиена-1,3, малеинового ангидрида и других необходимых реагентов, получите соединение А:
° X
[А]
2-67. Из циклогексена, пропилена, бромбензола и других необходимых реагентов получите цис- и транс- 1-аллил-2-фенилцикло-гексаны [А и Б].
Глава 3
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
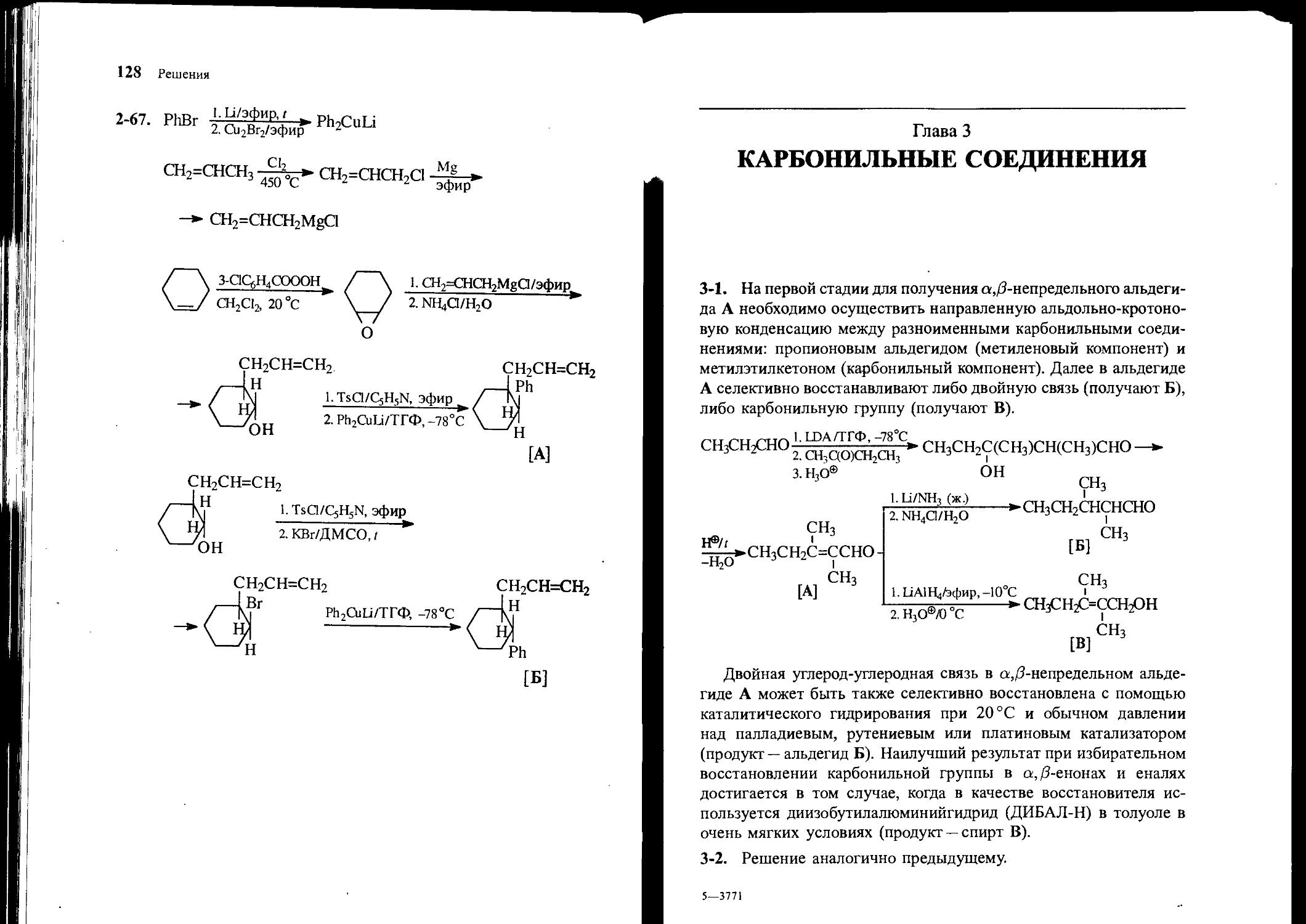
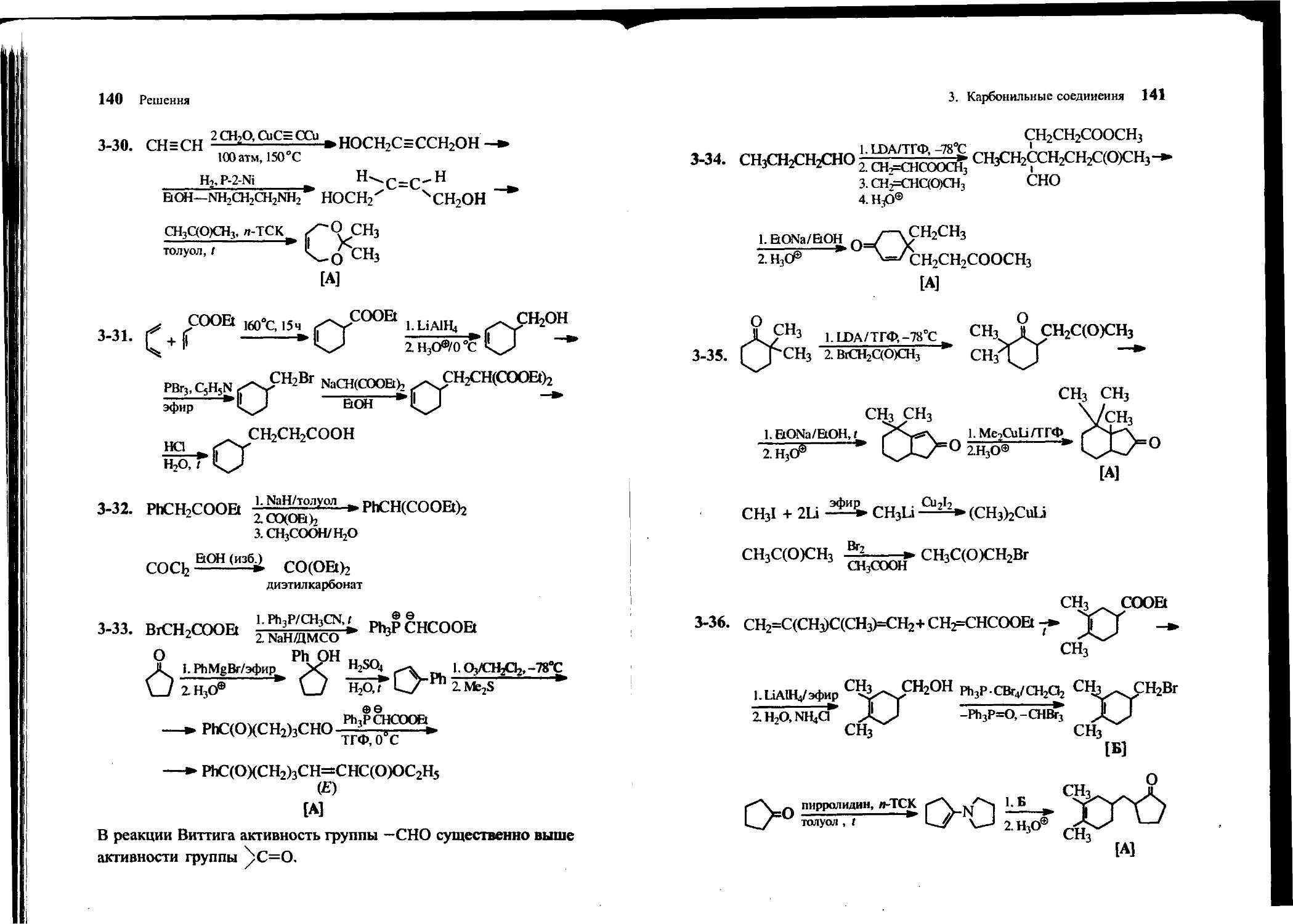
3-1. Исходя из метилэтилкетона и пропионового альдегида, получите 2,3-диметилпентен-2-аль [А], 2,3-диметилпентаналь [Б], 2,3-диметилпентен-2-ол [В]. Используйте любые органические или неорганические основания и восстановители.
3-2. Исходя из ацетона и изомасляного альдегида, получите 5-метилгексен-3-он-2 [А], 5-метилгексанон-2 [Б], 5-метилгексен-З-ол-2 [В]. Используйте любые органические или неорганические основания и восстановители.
3-3. Расшифруйте цепочку превращений:
. . п с- 2Mg_ . 1. СНзСНО (2 экв.у
1,4- Дибромбутан А 2 ^5®-
г Сг°3___> т* КОН С П П
Ру(2экв.Г В ЕЮН. Г С8Н12О
[Г]
3-4. Расшифруйте цепочку превращений:
О
1- CHjLi/эфир» . Р2О;,<_ г; 1. Оз_
2. Н3О®,0°С А 2. Zn/СНзСООН
„ KOH/C2H5OH,Z. тт
—*• В C11H16U
[Г]
3-5. Расшифруйте цепочку превращений:
[^0+hn3^ а
— Б
CzHgONa/CaHiOH
С8Н10О [В]
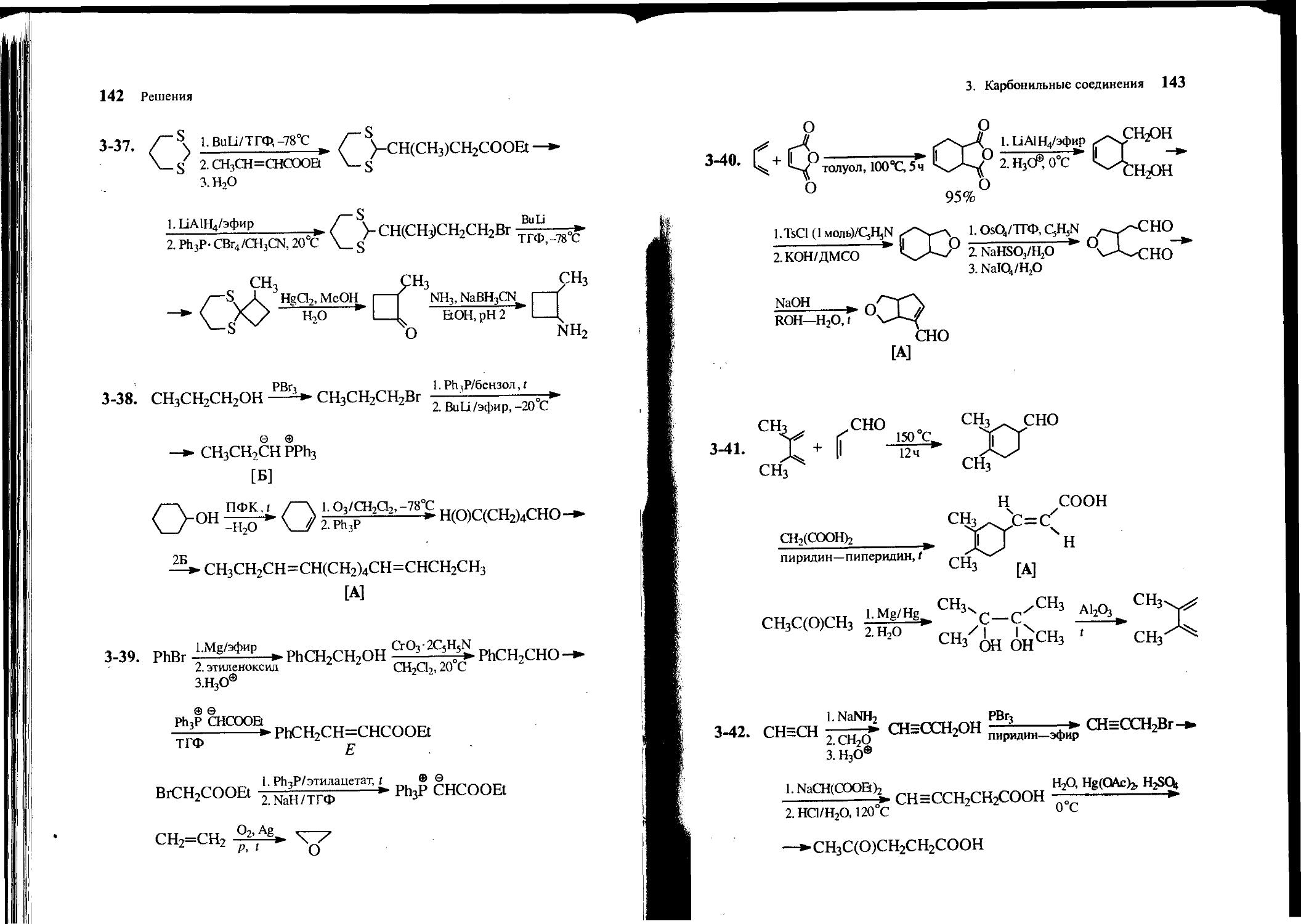
28 Задачи
3-6. Расшифруйте цепочку превращений:
O + HN О
н®
1. СНзС(ОХ2НгВг>
2. Н3О®
C2H5ONat
С2Н5ОН
С9Н12О [В]
А
Б
3-7. Из уксусного альдегида, ацетона, бензальдегида и других необходимых реагентов получите З-гидрокси-З-метил-5-фенил-пентаналь — душистое вещество с запахом ландыша, используемое в парфюмерии.
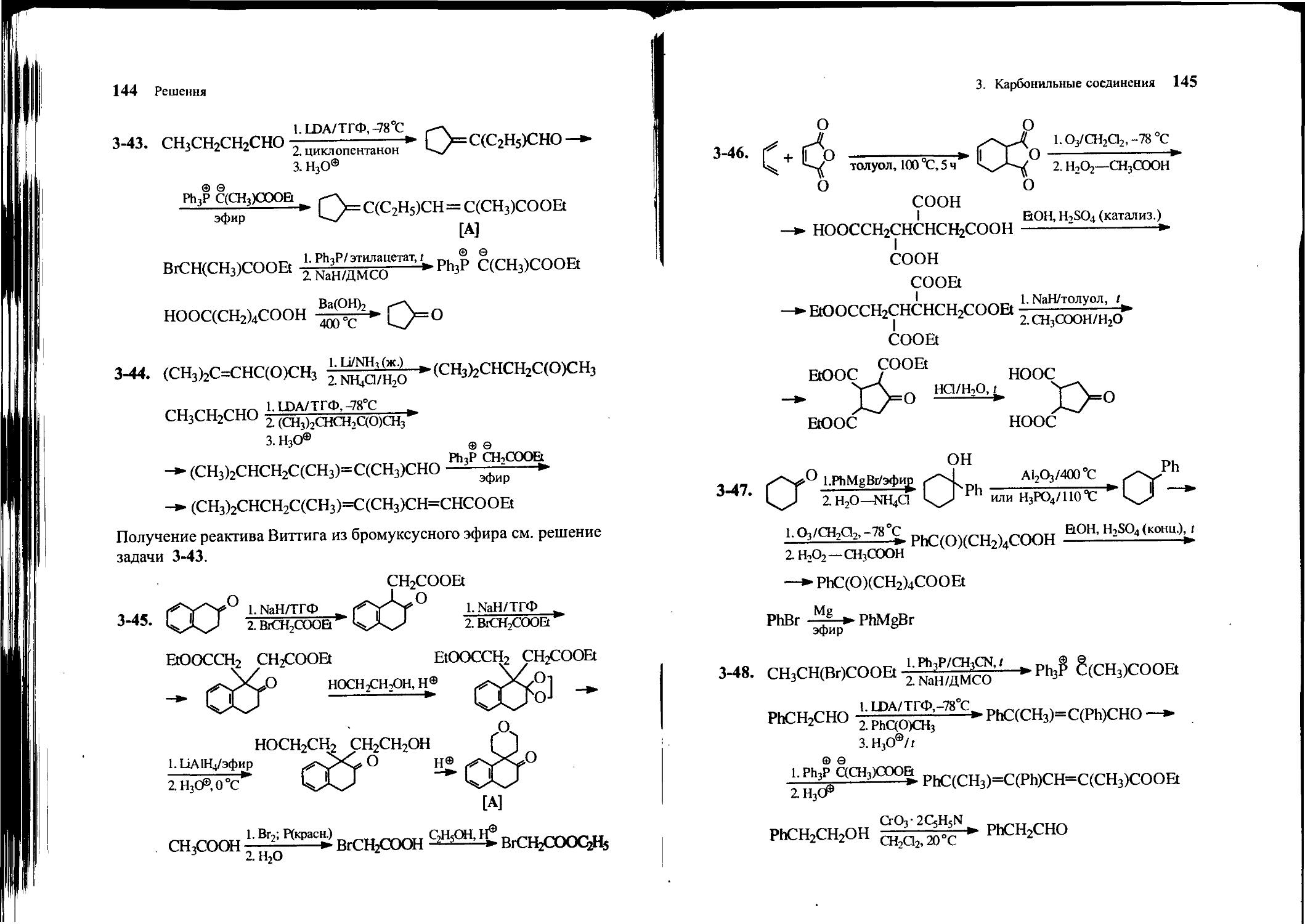
3-8. Предложите путь синтеза лактона 5-гидроксипентановой кислоты из циклогексанона.
3-9. Исходя из изомасляного альдегида (2-метилпропаналь), пиперидина и метилвинилкетона, получите 4,4-диметилциклогек-сен-2-он.
3-10. Из бромбензола, циклогексанона и других необходимых реагентов получите кетон следующего строения:
О
II
FVC-Ph
3-11. Исходя из акролеина СН2=СНСНО и других необходимых реагентов, получите пропандиаль.
3-12. Из 5-гидроксипентанона-2, метилацетилена и любых необходимых реагентов получите октин-6-он-2.
3-13. Из малонового эфира и этиленоксида получите 7-бутиро-лактон — циклический эфир 4-гидроксибутановой кислоты.
3-14. Из ацетона, ацетоуксусного эфира и других необходимых реагентов получите соединение А:
О
[А]
3. Карбонильные соединения 29
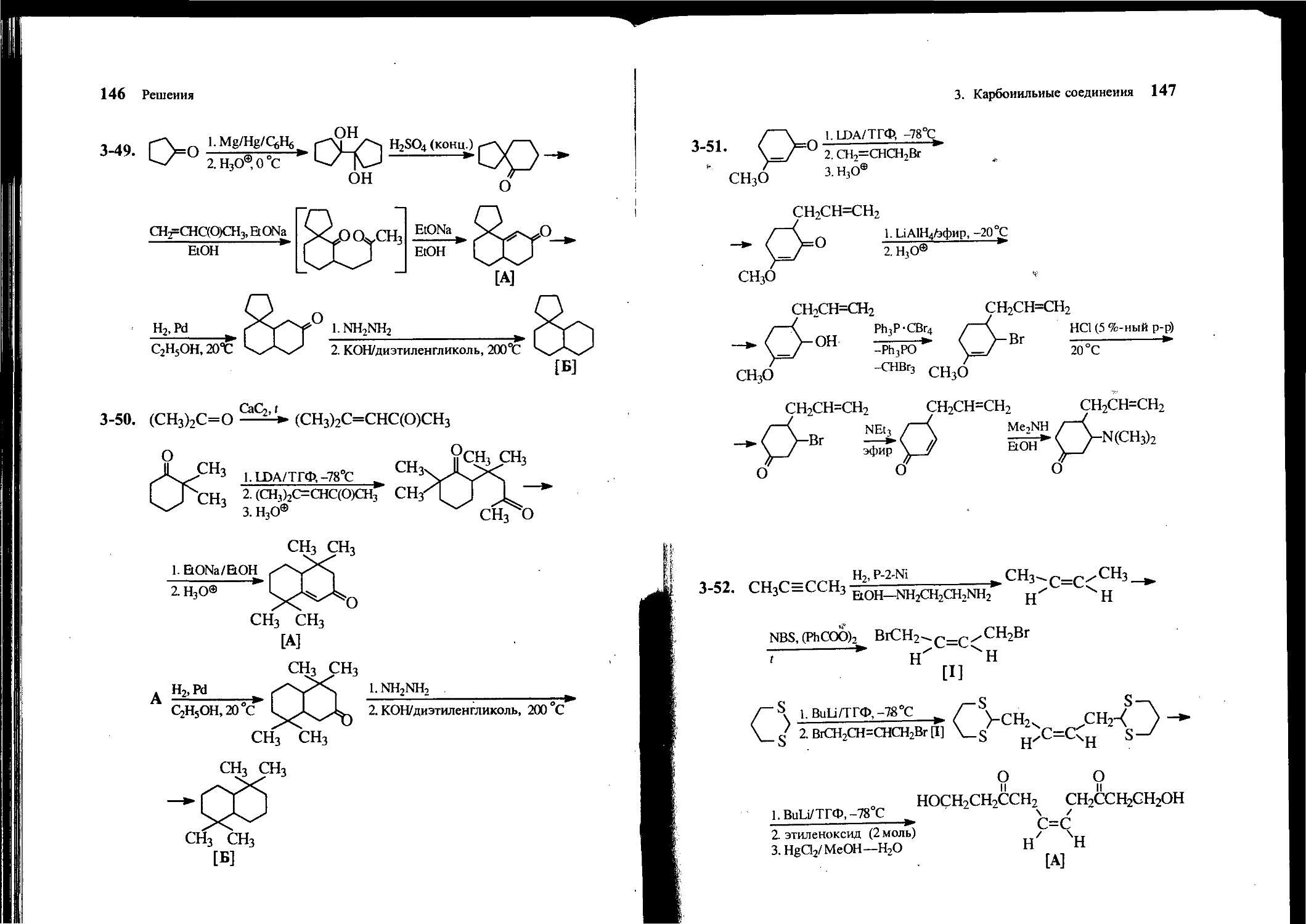
3-15. Осуществите следующее превращение:
а ОН ^^NMe2
СНО ^^^СНгОН
3-16. Предложите методы синтеза 1-бензил-2-метил- и 1-бензил-3-метилциклогексанов, исходя из 4-метилциклогексанона, бензилового спирта, толуола и других необходимых реагентов.
3-17. Из циклогексанона, бромбензола и других необходимых реагентов получите 3-фенилциклогексанон и 2-фенилциклогексадиен-1,3.
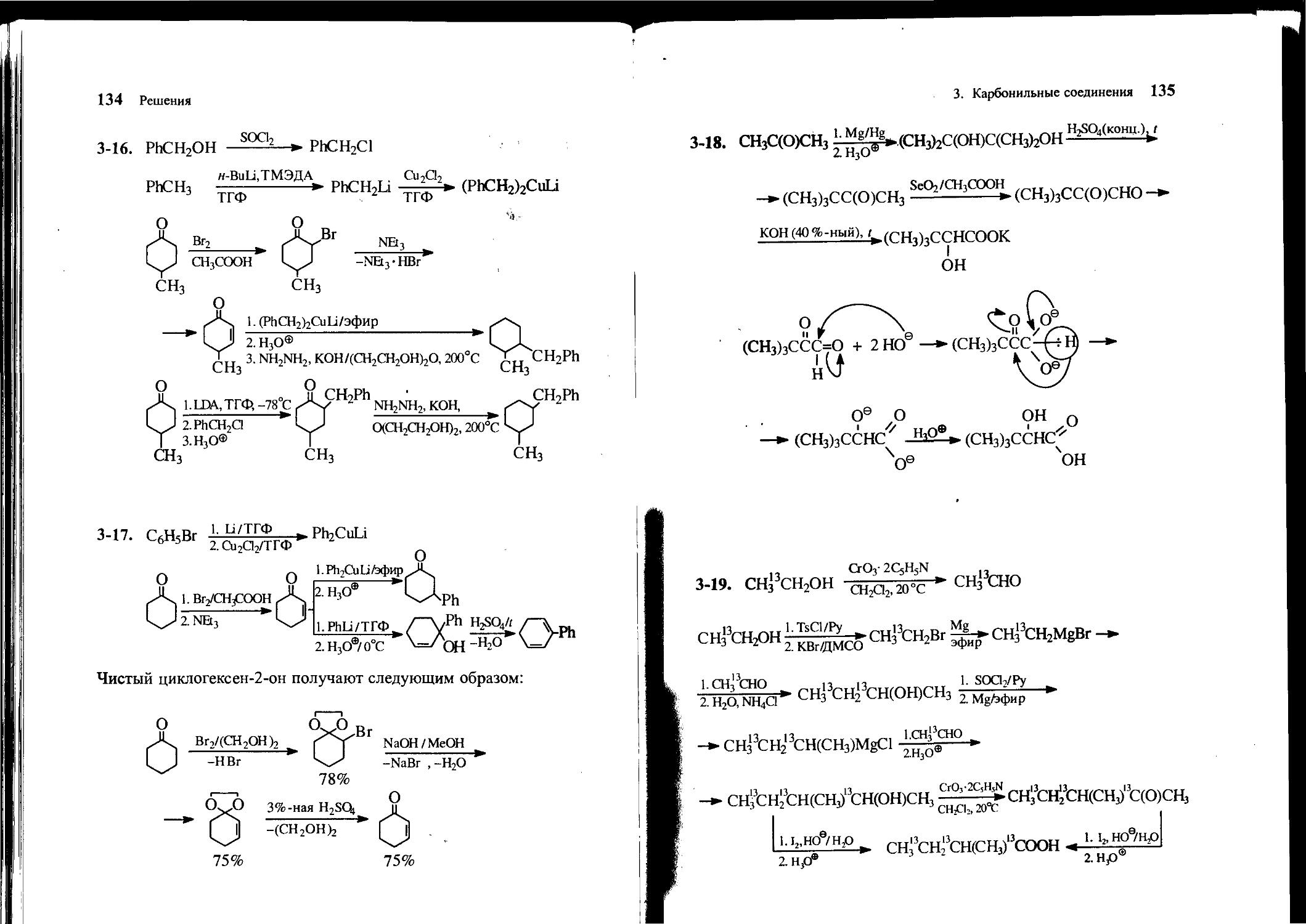
3-18. Исходя из ацетона и неорганических реагентов, получите 3,3-диметил-2-оксобутаналь. Что происходит при обработке его концентрированным раствором гидроксида калия при нагревании? Приведите механизм последней реакции.
3-19. Исходя из меченного по Cj этанола СН3СН2ОН и любых неорганических реагентов, не содержащих углеродную метку, получите меченную по С], Сг и С3 2-метилбутановую кислоту сн;сн*сн(сн3)*соон.
3-20. Из 6-бромгептанона-З и любых других необходимых реагентов получите 5-оксогептановую кислоту.
3-21. Из пентанона-3, ацетоуксусного эфира и других необходимых реагентов получите 4-метилгептандион-2,5.
3-22. Предложите схему синтеза ненасыщенной дикарбоновой кислоты А из циклогексанола, трифенилфосфина и этилового эфира бромуксусной кислоты.
(СН2)4
соон
соон
[А]
3-23. Из циклопентанона, метилиодида и других необходимых реагентов получите 1,3,3-тридейтеро-1-метилциклопентан.
30 Задачи
3-24. Исходя из ацетона, малоновой кислоты, трифенилфосфина и любых других необходимых реагентов, получите хризантемовую кислоту [А].
СНз СН=С(СН3)2 [А]
3-25. Исходя из ацетона, бензальдегида и метиламина, получите соединение А и восстановите его до соединения Б.
3-26. Предложите рациональный метод синтеза 1-(диметилами-но)пентанона-3, исходя из этилена и пропионовой кислоты. Используйте любые амины.
3-27. Получите 5-оксогексен-З-овую кислоту из ацетона, ацетальдегида и других необходимых реагентов.
3-28. Получите 3-(3-бромпропил)циклогексанон из циклогексанона, аллилхлорида и других необходимых реагентов.
3-29. Из бензальдегида, этилформиата и других необходимых реагентов получите циклон (2,3,4,5-тетрафенилциклопентадиен-2,4-он).
3-30. Исходя из ацетона, формальдегида и ацетилена, получите циклический ацеталь А.
СН3
( X
\-0 СНз
[А]
3-31. Из бутадиена, этилакрилата, диэтилмалоната и неорганических реагентов получите 3-(циклогексен-3-ил)пропановую кислоту.
3. Карбонильные соединения 31
3-32. Из этилового эфира фенилуксусной кислоты, фосгена, этанола и неорганических реагентов получите диэтиловый эфир фенилмалоновой кислоты.
3-33. Получите этиловый эфир 7-оксо-7-фенилгептен-2-овой кислоты [А] из циклопентанона, бромбензола, этилового эфира бромуксусной кислоты, трифенилфосфина и других необходимых
реагентов.
[А]
3-34. Исходя из н-бутаналя, метилвинилкетона, метилакрилата,
пирролидина и других необходимых реагентов, получите соеди-
нение А.
=AVC2H5
СН2СН2СООСН3
О
[А]
3-35. Предложите метод синтеза бициклического кетона А из
2,2-диметилциклогексанона, ацетона, метилиодида и других необ-
ходимых реагентов.
3-36. Исходя из 2,3-диметилбутадиена-1,3, этилового эфира акриловой (пропеновой) кислоты, пирролидина и циклопентанона, получите кетон следующего строения:
О СНз
3-37. Исходя из метилового эфира кротоновой кислоты СН3СН=СНСООСНз, 1,3-дитиана и других необходимых реагентов, получите (2-метилциклобутил)амин.
32 Задачи
3-38. Из циклогексанола, пропанола-1, трифенилфосфина и других необходимых реагентов получите додекадиен-3,9 (С12Н22 [А]).
3-39. Получите этиловый эфир 4-фенилбутен-2-овой кислоты, исходя из этилена, бромбензола, этилового эфира бромуксусной кислоты, трифенилфосфина и других необходимых реагентов.
3-40. Исходя из бутадиена-1,3, малеинового ангидрида и других необходимых реагентов, получите соединение А.
°0О
Х""^сно
[А]
3-41. Исходя из ацетона, акролеина, малоновой кислоты и других необходимых реагентов, получите соединение А.
СН1
. .—соон
сн3—е
[А]
3-42. Получите левулиновую (4-оксопентановую) кислоту из малонового эфира, ацетилена, формальдегида и неорганических реагентов.
3-43. Исходя из адипиновой (гександиовой) кислоты, бутаналя и этилового эфира 2-бромпропионовой кислоты, получите соединение А. Пусть в распоряжении имеются также диизопропил-амид лития (LDA), трифенилфосфин и любые неорганические реагенты.
г"У с-сн=с-соос2н5
^СгНз СН3
[А]
3-44. Исходя из (4-метилпентен-3-он-2)мезитилоксида, пропана-ля и этилового эфира бромуксусной кислоты, получите этиловый эфир 4,5,7-триметилокгадиен-2,4-овой кислоты. Пусть в распоряжении имеются также диизопропиламид лития (LDA), трифенилфосфин и любые неорганические реагенты.
3. Карбонильные соединения 33
3-45. Исходя из /3-тетралона (2-оксо-1,2,3,4-тетрагидронафта-
лин), уксусной кислоты, этанола и неорганических веществ, получите спирокетон А.
[А]
3-46. Из бутадиена-1,3, малеинового ангидрида, этанола и неорганических реагентов получите 4-оксоциклопентан-1,2-дикарбо-новую кислоту.
3-47. Исходя из бромбензола, циклогексанола, этанола и неорганических реагентов, получите этиловый эфир 6-фенил-6-оксогек-сановой кислоты.
3-48. Исходя из 2-фенилэтилового спирта, ацетофенона (метил-фенилкетона) и этилового эфира 2-бромпропионовой кислоты, получите этиловый эфир 2-метил-4,5-дифенилгексадиен-2,4-овой кислоты. В распоряжении имеются также диизопропиламид лития (LDA), трифенилфосфин и любые неорганические реагенты.
3-49. Из циклопентанона, метилвинилкетона и других необходимых реагентов получите трициклический кетон А и превратите его в насыщенный трициклический углеводород Б.
[А] [Б]
3-50. Из ацетона, 2,2-диметилциклогексанона и других необходимых реагентов получите бициклический кетон А и превратите его в насыщенный бициклический углеводород Б.
[А]
сн3ч сн3
СН3 СН3
[Б]
34 Задачи
3-51. Получите З-диметиламино-4-аллилциклогексанон из 3-ме-токсициклогексен-2-она, пропилена, диметиламина и других необходимых реагентов.
3-52. Из диметилацетилена, 1,3-дитиана, и других необходимых реагентов получите следующее соединение:
Н Н
НОСН2СН2С(О)СН2^~^СН2С(О)СН2СН2ОН
[А]
3-53. Исходя из пропилена, ацетилхлорида и других необходимых реагентов, получите 2-метилоктандиол-3,5.
3-54. Получите 4-метилгептан, исходя из н-пропанола, этанола и других необходимых реагентов.
3-55. Получите 2-метил-З-этилпентан, исходя из н-пропанола, этанола и любых неорганических реагентов.
3-56. Получите 2-метилоктандион-4,5 из бутанола-1, 3-метил-бутанола-1, 1,3-дибромпропана, н-бутиллития и неорганических реагентов.
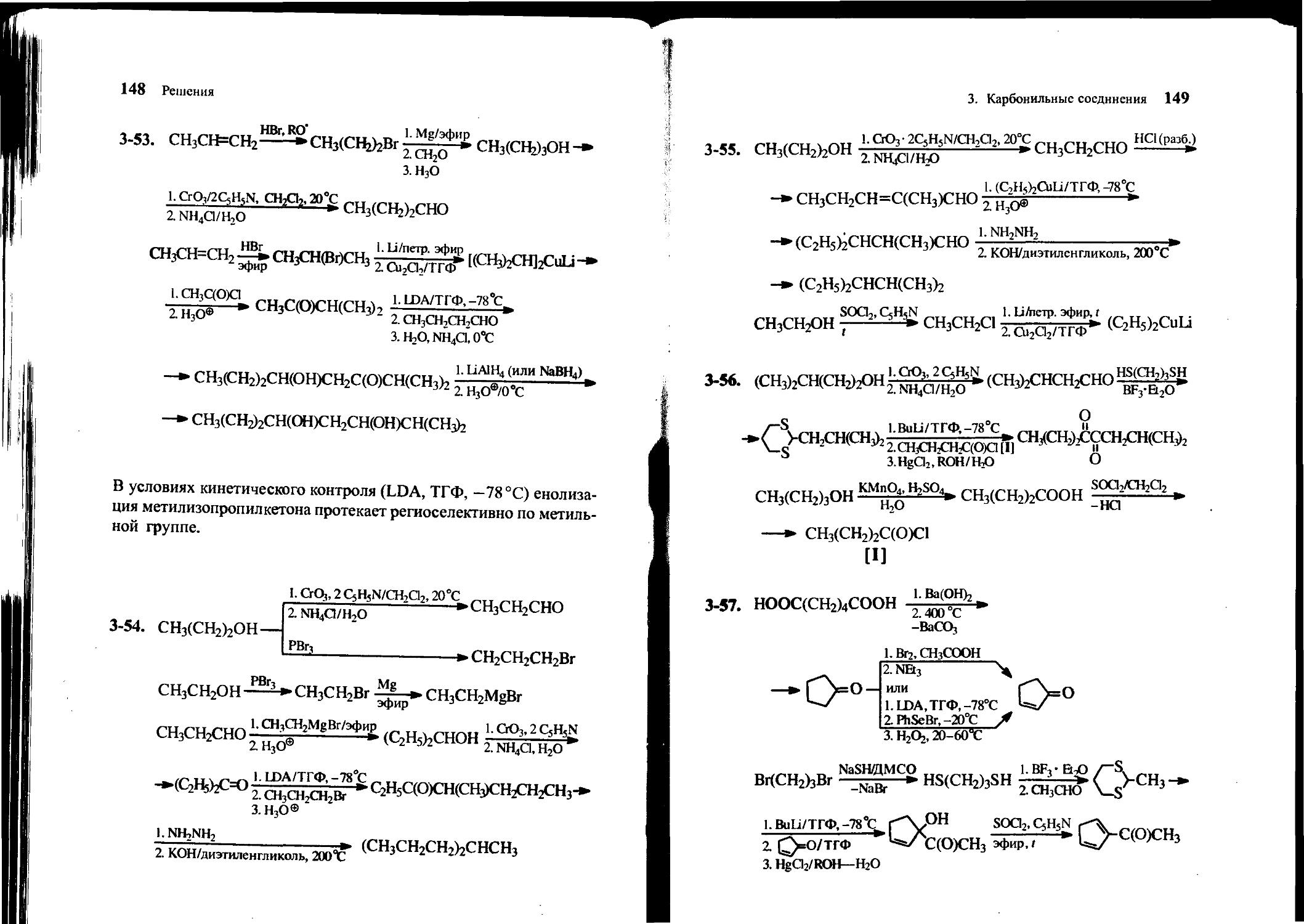
3-57. Получите 2-ацетилциклопентадиен-1,3 из адипиновой (гександиовой) кислоты, ацетальдегида, 1,3-дибромпропана, н-бутиллития и неорганических реагентов.
3-58. Предложите метод синтеза 1,3-диизопропил-4-этилцикло-гексана из циклогексанона, пропанола-2, этилбромида и других необходимых реагентов.
3-59. Исходя из ацетона и этанола, получите 7-3,3,5-триметил-гептен-2. Используйте любые необходимые реагенты.
3-60. Исходя из изомасляного альдегида (2-метилпропаналя), получите 2,4,4,7-тетраметилоктан [А]. Используйте любые необходимые реагенты.
сн3х СНз ^СН3
сн-сн2-с-сн2-сн2-сн
СНз' СНз "СНз
[А]
3. Карбонильные соединения 35
3-61. Из 2,2-диметилциклогексанона, этанола, метилиодида, 4-диметиламинобутанон-2-гидрохлорида и других необходимых реагентов получите бициклический кетон [А] и превратите его в насыщенный бициклический углеводород [Б].
О
[А]
[Б]
3-62. Исходя из циклогексанона, метилиодида, формальдегида, пирролидина и неорганических реагентов, получите следующее соединение:
CH2-N
СН3 '
3-63. Исходя из гептандиовой кислоты, пиперидина, метилиодида и других необходимых реагентов, получите следующее соединение:
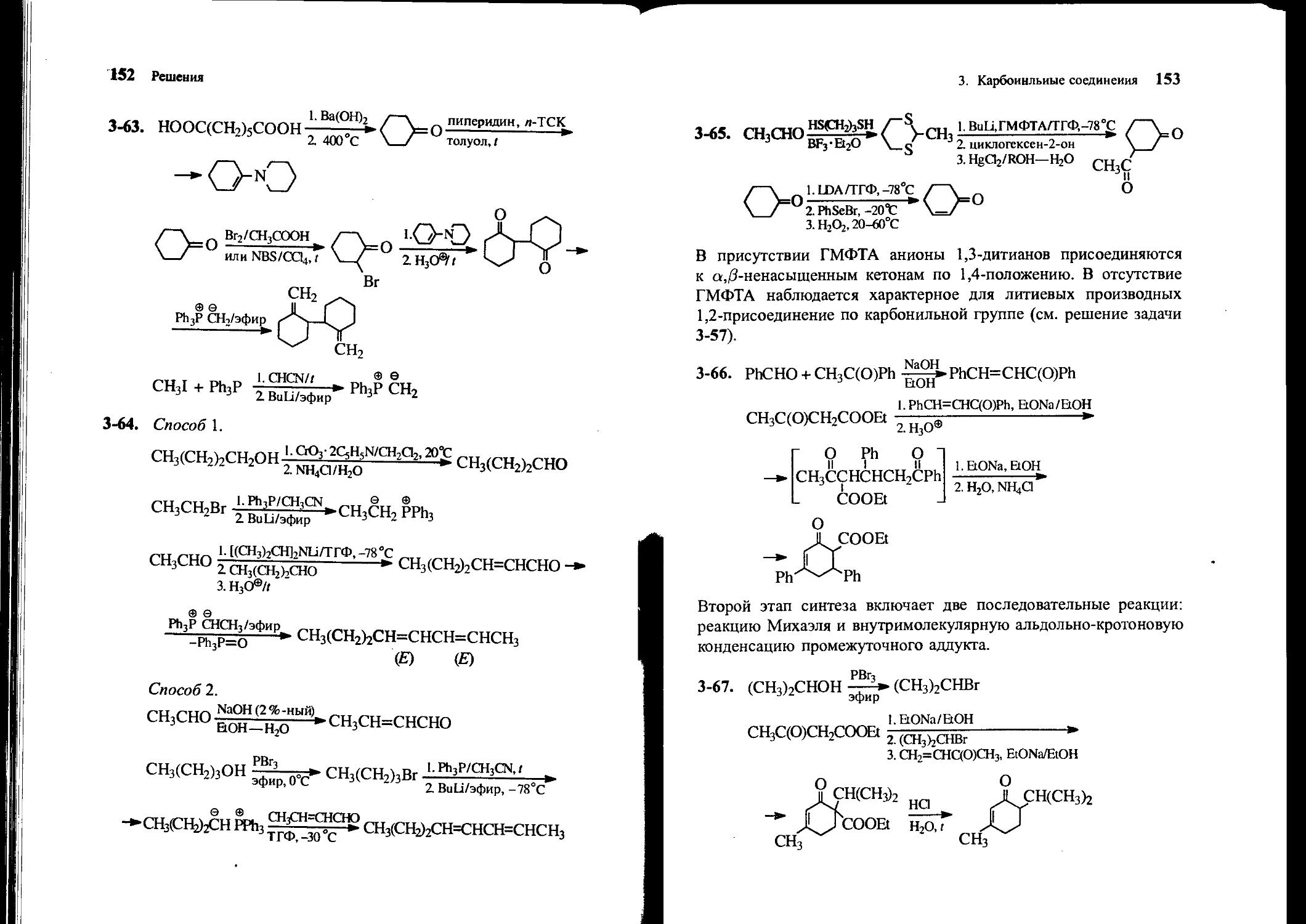
сн2
3-64. Предложите метод синтеза октадиена-2,4, исходя из ацетальдегида, этилбромида, н-бутанола и других необходимых реагентов.
3-65. В распоряжении имеются уксусный альдегид, пропандитиол-1,3, циклогексанон, любые основания и неорганические реагенты. Предложите способ синтеза 3-ацетилциклогексанона, не используя реакцию Гриньяра.
3-66. Исходя из бензальдегида, ацетофенона, ацетоуксусного эфира и других необходимых реагентов, получите этиловый эфир 4,6-дифенил-2-оксоциклогексен-3-карбоновой кислоты.
36 Задачи
3-67. Исходя из изопропилового спирта, метилвинилкетона, ацетоуксусного эфира и других необходимых реагентов, получите 6-изопропил-З -метилциклогексен-2-он-1.
3-68. Получите этиловый эфир 5-изопропилиден-2-оксоцикло-гексанкарбоновой кислоты из ацетона, малонового эфира и неорганических реагентов.
3-69. Из ацетона, циклогексанона, пирролидина и других необходимых реагентов получите бициклический кетон [А] следующего
строения:
[А]
3-70. Из 2-хлорпропана, метилэтилкетона, ацетона и ацетилхло-рида получите непредельный кетон А.
[А]
3-71. Из диэтилкетона, ацетона и других необходимых реагентов получите вицинальный диол А следующего строения:
с2н5 с2н5
СН3
ОН он СН3
[А]
3-72. Из ацетофенона, акролеина и других необходимых реагентов получите 5-оксо-5-фенилпентаналь [А]. При обработке А концентрированным раствором КОН при нагревании выделено соединение Б с брутто-формулой СцН140з. Напишите структурную формулу Б и механизм его образования.
3. Карбонильные соединения 37
3-73. Исходя из трифенилфосфина, этилбромацетата, аллилбро-мида и циклопентена, получите сложный эфир А. Используйте внутримолекулярную циклизацию Дильса—Альдера.
COOEt
[А]
3-74. Исходя из фурана, ацетилена, формальдегида и бутадиена-1,3, получите соединение А.
О СООСНз
СООСНз
[А]
3-75. Получите изомер дитерпена бисаболена (/?- или изобисабо-лен) [А] из ацетона, трифенилфосфина, метилиодида, ацетилена, метилвинилкетона и 2-метилбутадиена-1,3.
[А]
3-76. Получите соединение А из циклогексанона, этилхлорфор-миата, акролеина и неорганических реагентов.
О
СН2СН2СНО
[А]
38 Задачи
3-77. Исходя из метилвинилкетона, этиленгликоля и этилхлор-формиата получите лактон (циклический эфир) 4-гидроксипентановой кислоты [А].
СН3
[А]
3-78. Исходя из ацетоуксусного эфира, этилакрилата, этиленгликоля, метилиодида, трифенилфосфина и других необходимых реагентов получите бициклический кеталь А.
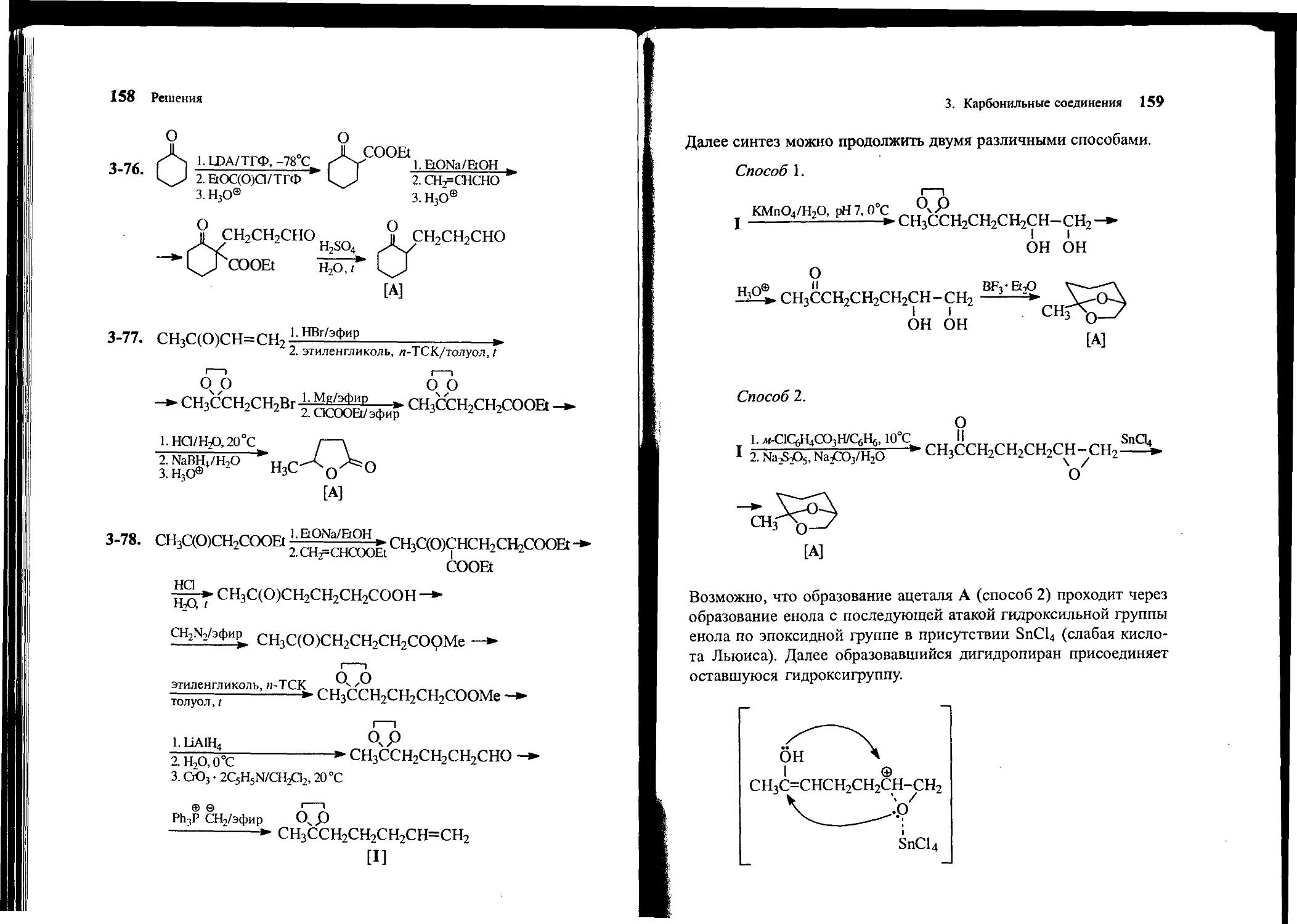
3-79. Исходя из метилвинилкетона, изомасляного альдегида и пирролидина, получите соединение А.
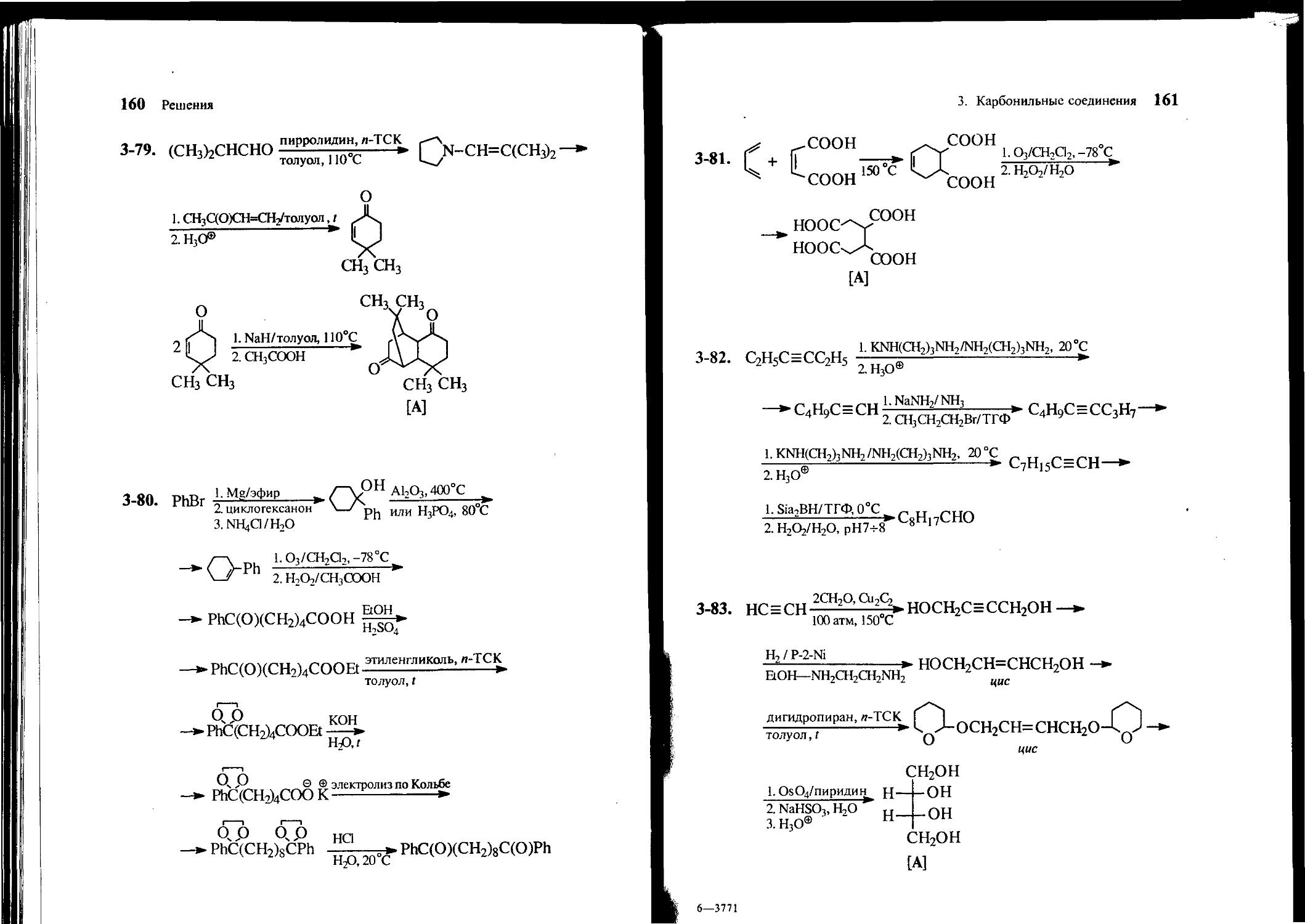
СН3 СН3 °
СН3 СНз
[А]
3-80. Исходя из бромбензола, циклогексанона, этанола, этиленгликоля и неорганических реагентов, получите 1,10-дифенилде-кандион-1,10.
3-81. Из бутадиена-1,3, малеиновой кислоты и неорганических реагентов получите 1,2,3,4-бутантетракарбоновую кислоту А.
соон
I ноос-сн2-сн-сн—сн2-соон соон [А]
3-82. Исходя из гексина-3, получите нонаналь, используя любые необходимые реагенты.
3. Карбонильные соединения 39
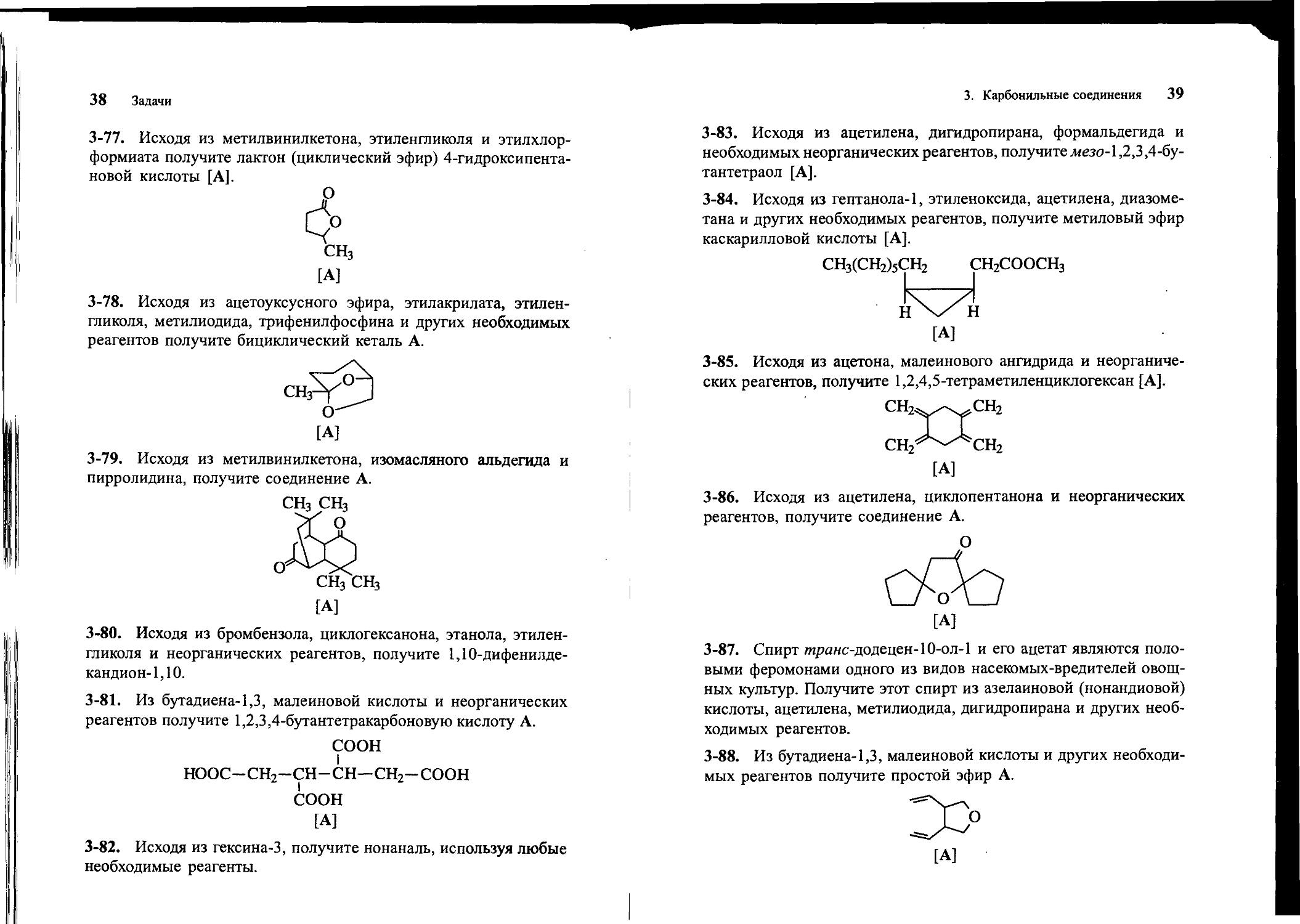
3-83. Исходя из ацетилена, дигидропирана, формальдегида и необходимых неорганических реагентов, получите мезо-1,2,3,4-бу-тантетраол [А].
3-84. Исходя из гептанола-1, этиленоксида, ацетилена, диазометана и других необходимых реагентов, получите метиловый эфир каскарилловой кислоты [А].
СН3(СН2)5СН2 СН2СООСН3
4\zi
[А]
3-85. Исходя из ацетона, малеинового ангидрида и неорганических реагентов, получите 1,2,4,5-тетраметиленциклогексан [А].
СН2<!-^СН2 СН2^^СН2 [А]
3-86. Исходя из ацетилена, циклопентанона и неорганических реагентов, получите соединение А.
О
[А]
3-87. Спирт тпранс-додецен-10-ол-1 и его ацетат являются половыми феромонами одного из видов насекомых-вредителей овощных культур. Получите этот спирт из азелаиновой (нонандиовой) кислоты, ацетилена, метилиодида, дигидропирана и других необходимых реагентов.
3-88. Из бутадиена-1,3, малеиновой кислоты и других необходимых реагентов получите простой эфир А.
О
[А]
40 Задачи
3-89. Исходя из 4-гидроксициклогексанкарбальдегида, метилио-дида и других необходимых реагентов, получите 4-гидрокси-4-метилциклогексанкарбальдегид.
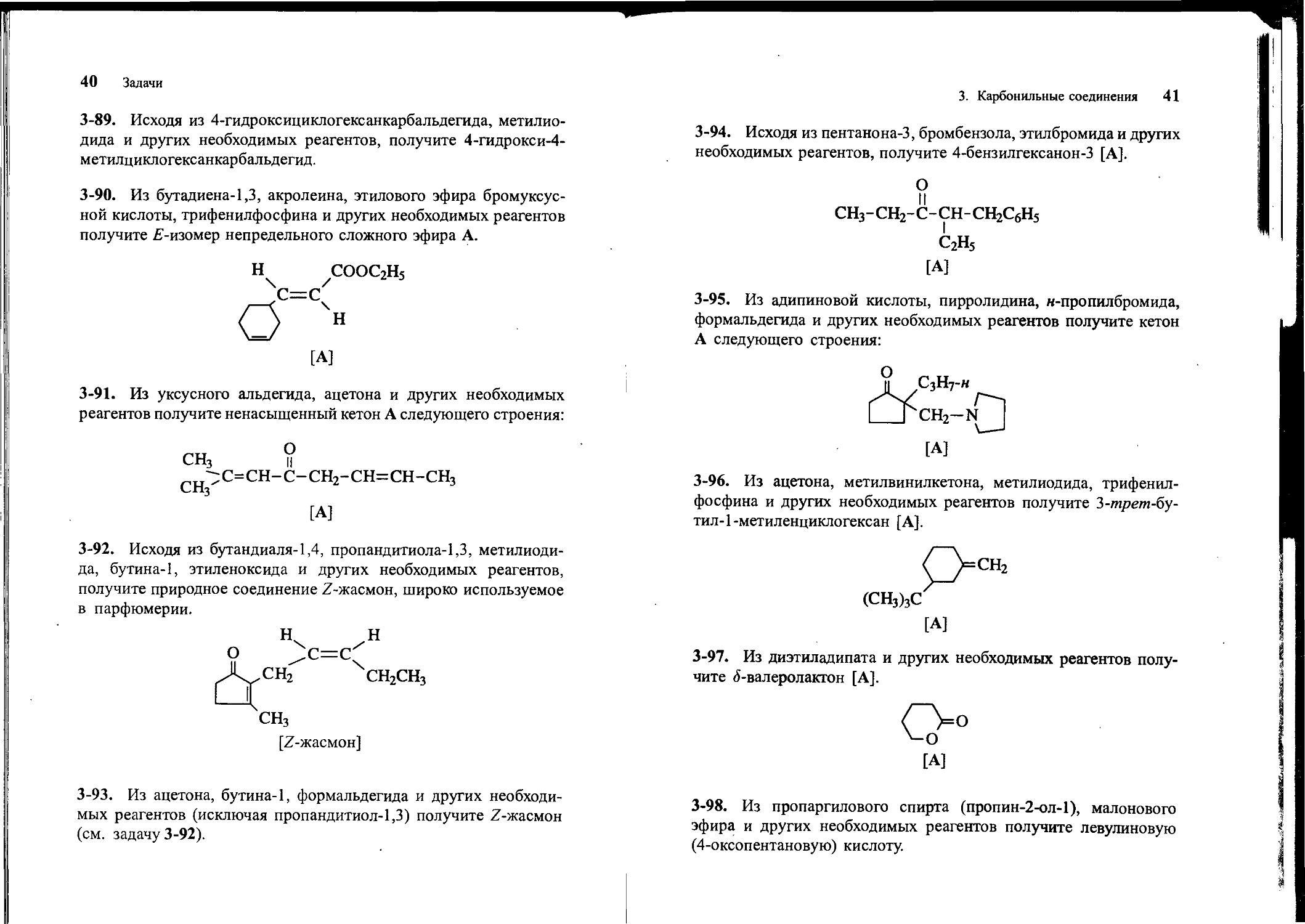
3-90. Из бутадиена-1,3, акролеина, этилового эфира бромуксусной кислоты, трифенилфосфина и других необходимых реагентов получите Е-изомер непредельного сложного эфира А.
н СООС2Н5
^С=Сч
0 н
[А]
3-91. Из уксусного альдегида, ацетона и других необходимых реагентов получите ненасыщенный кетон А следующего строения:
СН3 °
^ТТ^С=СН-С-СН2-СН=СН-СН3
сн3
[А]
3-92. Исходя из бутандиаля-1,4, пропандитиол а-1,3, метилиоди-да, бутина-1, этиленоксида и других необходимых реагентов, получите природное соединение Z-жасмон, широко используемое в парфюмерии.
Н Н
0 J^C=C\
^ДуСН2 СН2СН3
сн3
[Z-жасмон]
3-93. Из ацетона, бутина-1, формальдегида и других необходимых реагентов (исключая пропандитиол-1,3) получите Z-жасмон (см. задачу 3-92).
3. Карбонильные соединения 41
3-94. Исходя из пентанона-3, бромбензола, этилбромида и других необходимых реагентов, получите 4-бензилгексанон-З [А].
О
II
СНз-СН2-С-СН-СН2С6Н5
С2Н5
[А]
3-95. Из адипиновой кислоты, пирролидина, н-пропилбромида, формальдегида и других необходимых реагентов получите кетон А следующего строения:
? С3Н7-н [_^сн2->Г]
[А]
3-96. Из ацетона, метилвинилкетона, метилиодида, трифенилфосфина и других необходимых реагентов получите 3-трет-бу-тил-1-метиленциклогексан [А].
/2)=СН2
(СН3)3(3
[А]
3-97. Из диэтиладипата и других необходимых реагентов получите 6-валеролактон [А].
[А]
3-98. Из пропаргилового спирта (пропин-2-ол-1), малонового эфира и других необходимых реагентов получите левулиновую (4-оксопентановую) кислоту.
42 Задачи
3-99. Из метилвинилкетона, этиленгликоля и других необходимых реагентов получите левулиновую (4-оксопентановую) кислоту.
3-100. Из этилового эфира фенилуксусной кислоты, этилакрилата и других необходимых реагентов получите 1-фенил-4-оксоцикло-гексанкарбоновую кислоту.
3-101. Из З-метилбутанона-2, пропионового альдегида, ацетоуксусного эфира и других необходимых реагентов получите 3-изо-пропил-5-этилциклогексен-2-он и превратите его в насыщенный кетон.
3-102. Из ацетона, изопропилбромида, метилиодида и других необходимых реагентов получите изобутилнеопентилкетон.
3-103. Из ацетофенона, ацетоуксусного эфира и других необходимых реагентов получите 1-фенилпентандион-1,4.
3-104. Из 2,3-дибромпропена-1, циклогексанона и других необходимых реагентов получите соединение А. При обработке этилового эфира соединения А основанием образуется эфир бициклической кетокислоты Б. Напишите структурную формулу Б и приведите механизм его образования.
3-105. Из ацетоуксусного и малонового эфиров, метилиодида и других необходимых реагентов получите кетокислоту А и превратите ее в лактон Б.
ноос
(к о
[А]
[Б]
3. Карбонильные соединения 43
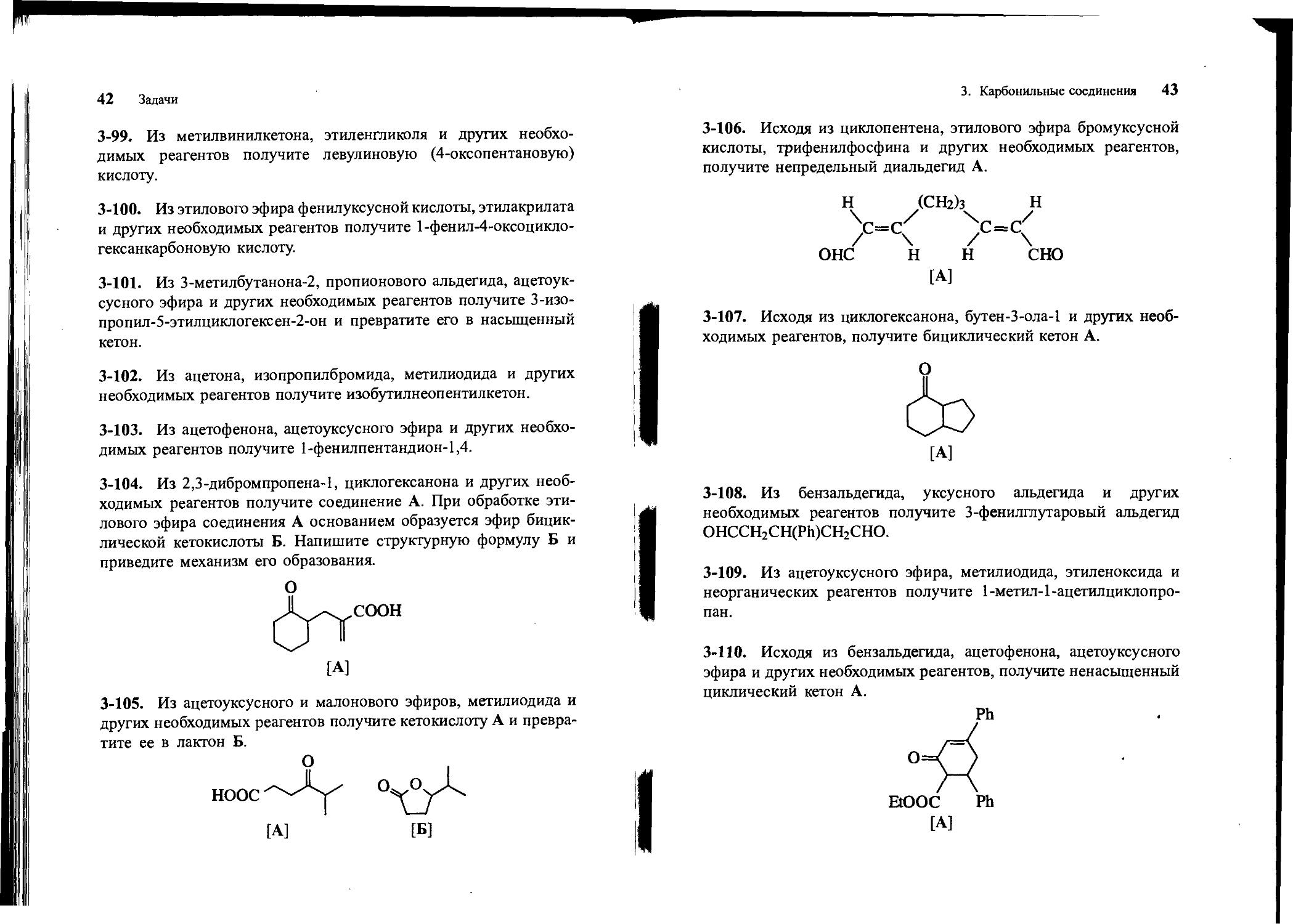
3-106. Исходя из циклопентена, этилового эфира бромуксусной кислоты, трифенилфосфина и других необходимых реагентов, получите непредельный диальдегид А.
Н (СН2)з н /с=с\ /с=с\ онс н н сно [А]
3-107. Исходя из циклогексанона, бутен-З-ола-1 и других необходимых реагентов, получите бициклический кетон А.
[А]
3-108. Из бензальдегида, уксусного альдегида и других необходимых реагентов получите 3-фенилглутаровый альдегид OHCCH2CH(Ph)CH2CHO.
3-109. Из ацетоуксусного эфира, метилиодида, этиленоксида и неорганических реагентов получите 1-метил-1-ацетилциклопропан.
3-110. Исходя из бензальдегида, ацетофенона, ацетоуксусного эфира и других необходимых реагентов, получите ненасыщенный циклический кетон А.
Ph
EtOOC Ph [А]
44 Задачи
3-111. Исходя из адипиновой кислоты, 7-бутиролактона (циклический эфир 4-гидроксибутановой кислоты) и других необходимых реагентов, получите спиродикетон [А].
3-112. Из ацетилена, формальдегида, бутадиена-1,3, триметил-хлорсилана и других необходимых реагентов получите спирт А, содержащий циклобутанольный фрагмент.
ОН
[А]
3-113. Исходя из бутадиена-1,3, малеинового ангидрида и других необходимых реагентов, получите соединение А.
сно
[А]
Глава 4
ЭЛЕКТРОФИЛЬНОЕ И НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРОМАТИЧЕСКОМ РЯДУ
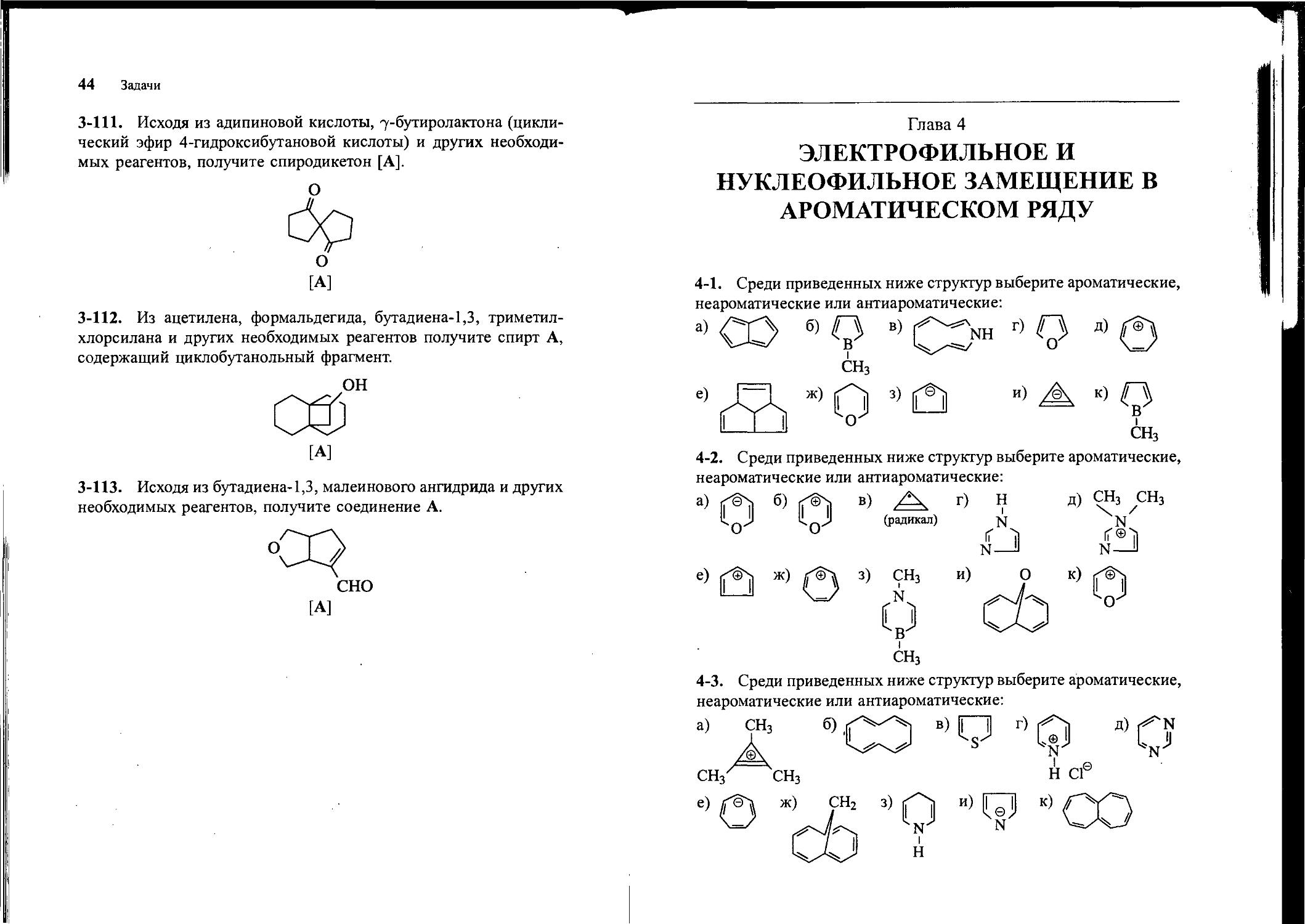
4-1. Среди приведенных ниже структур выберите ароматические, неароматические или антиароматические:
4-2. Среди приведенных ниже структур выберите ароматические, неароматические или антиароматические:
СН3
4-3. Среди приведенных ниже структур выберите ароматические, неароматические или антиароматические:
46 Задачи
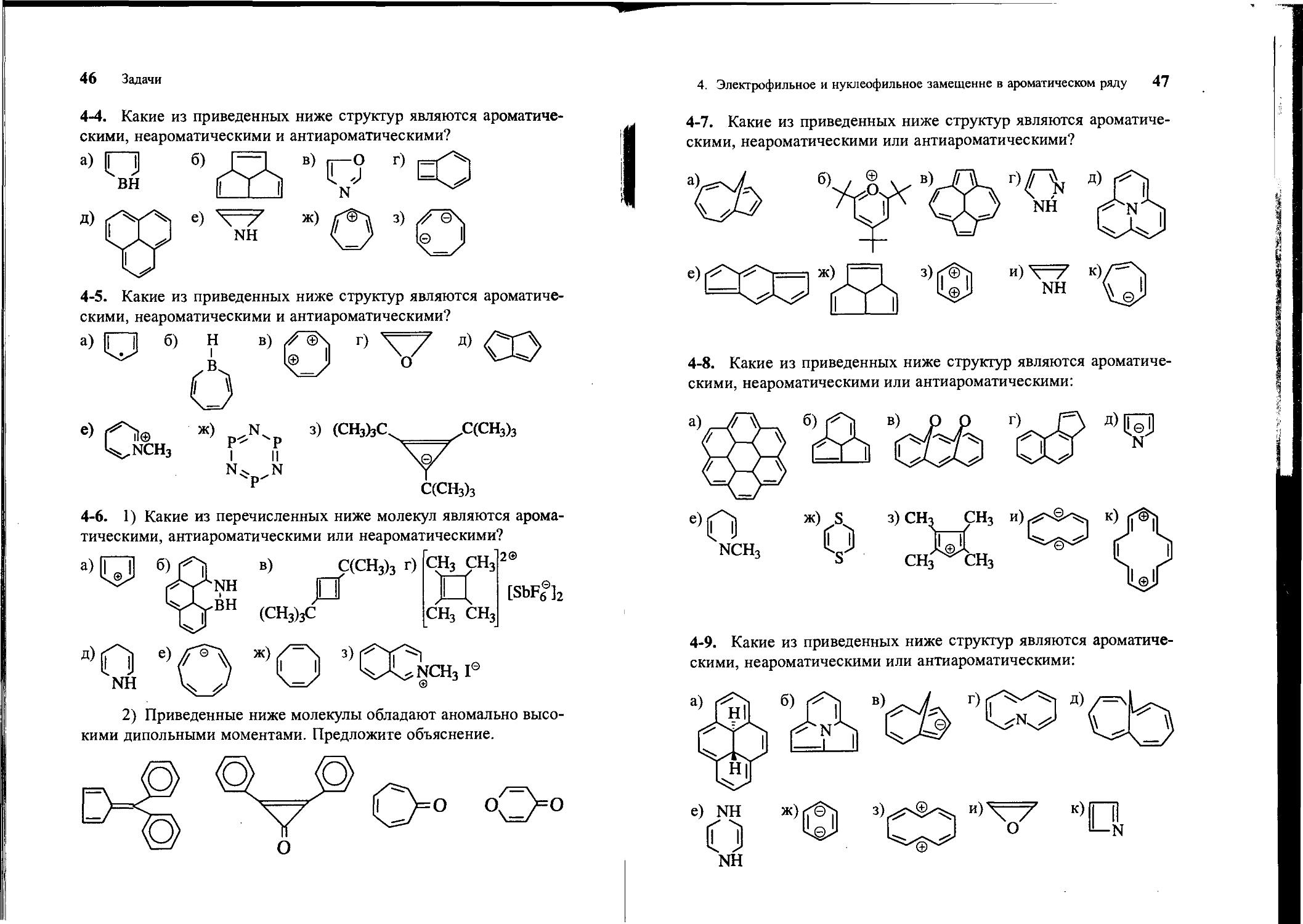
4-4. Какие из приведенных ниже структур являются ароматическими, неароматическими и антиароматическими?
4-5. Какие из приведенных ниже структур являются ароматическими, неароматическими и антиароматическими?
з) (СН3)зС
С il©
NCH3
ж)
С(СН3)3
4-6. 1) Какие из перечисленных ниже молекул являются ароматическими, антиароматическими или неароматическими?
в) С(СН3)3 г) СН3 СН3 2® хПГ Д [SbF6Q]2
(СН3)3С сн3 сн3
О \ < J) kA>NCH3Ie
NH \=/ ®
2) Приведенные ниже молекулы обладают аномально высокими дипольными моментами. Предложите объяснение.
О
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 47
4-7. Какие из приведенных ниже структур являются ароматическими, неароматическими или антиароматическими?
4-8. Какие из приведенных ниже структур являются ароматическими, неароматическими или антиароматическими:
4-9. Какие из приведенных ниже структур являются ароматиче-
скими, неароматическими или антиароматическими:
4
>1'ате следующих реакций образуются устойчивые (в .шосфере) солеобразные продукты. Какие это продукты лни образуются?
4-11. В результате следующих реакций образуются устойчивые (в инертной атмосфере) солеобразные продукты. Какие это продукты и как они образуются?
В (основание)
-ВН® *
4-12. Объясните различие СН-кислотности метиленовых прото-
нов в следующих соединениях:
Н Н [А] рКа: 22,9
Н Н
[Г]
36
4-13. а) При взаимодействии азулена А с 1 моль серной кислоты образуется кристаллическое соединение [CioH9]®HSO® [Б]. Предложите структурную формулу Б.
[А]
4. Электрофильное н нуклеофильное замещение в ароматическом ряду 49
б) Известно, что соединения В—Д обладают аномально высокими дипольными моментами. Объясните этот факт.
4-14. а) Соединение А, образующееся в результате приведенной ниже реакции, обладает высоким дипольным моментом (13,5 D). Дайте объяснение этому факту и приведите строение соединения А.
б) Циклопентадиен-2,4-он по сравнению с циклогептатри-ен-2,4,6-оном является весьма лабильным соединением и легко димеризуется при комнатной температуре. Объясните причину этого различия и напишите структурную формулу димера циклопентадиен-2,4-она.
4-15. Исходя из бензола, этанола и неорганических реагентов, получите 1-бром-2,4,6-триэтилбензол. Подействуйте на это соединение а) амидом калия в жидком аммиаке; б) амидом калия в жидком аммиаке в присутствии металлического калия.
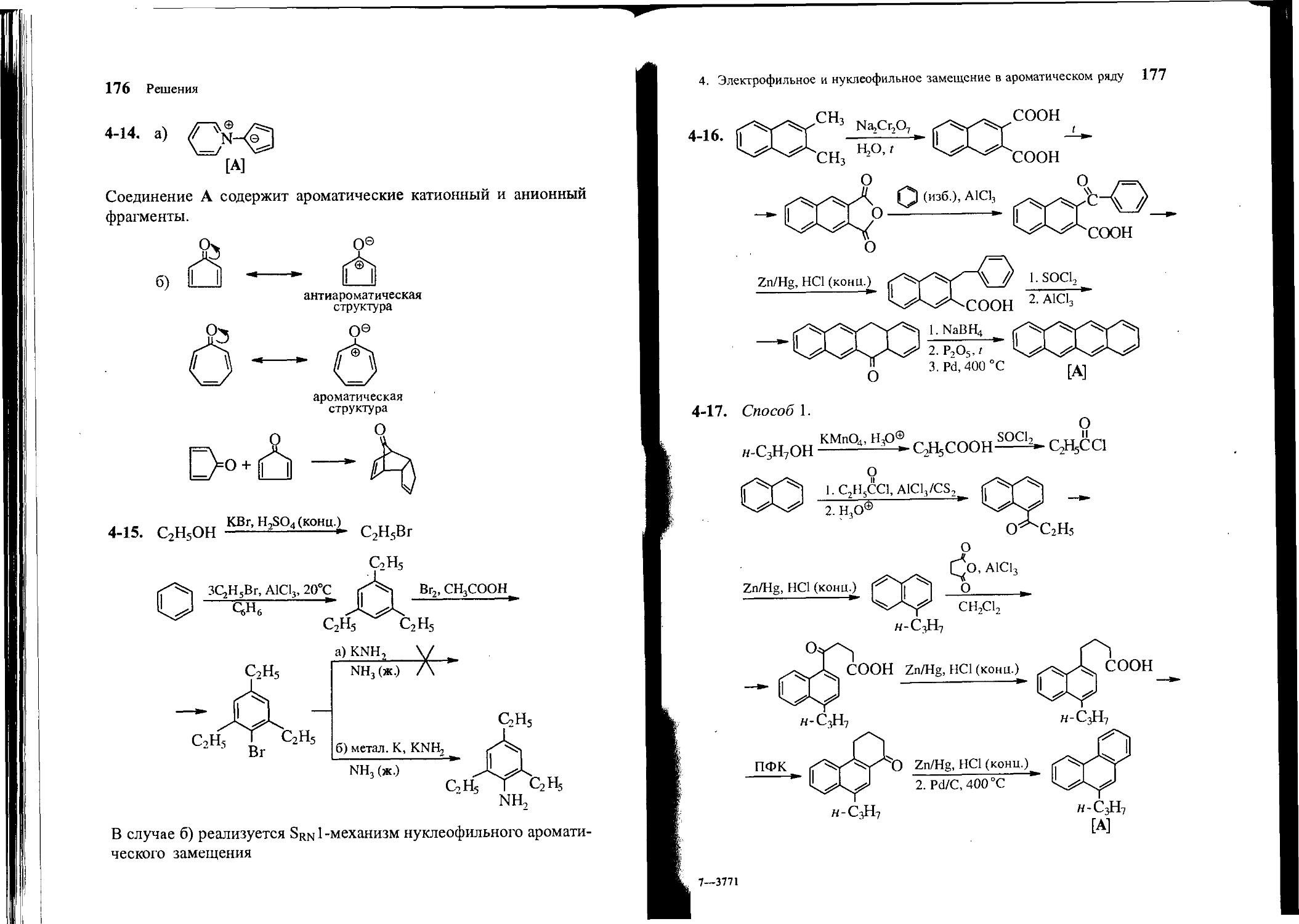
4-16. Из бензола, 2,3-диметилнафталина и неорганических реагентов получите тетрацен [А].
50 Задачи
4-17. Из нафталина, пропанола-1, янтарного ангидрида и любых неорганических реагентов получите 9-(н-пропил)фенантрен [А].
4-18. Исходя из нафталина и неорганических реагентов, получите бенз[а]антрацен [А].
4-19. Из бензола, этанола, уксусной кислоты и неорганических реагентов получите кетон А следующего строения:
с2н5 [А]
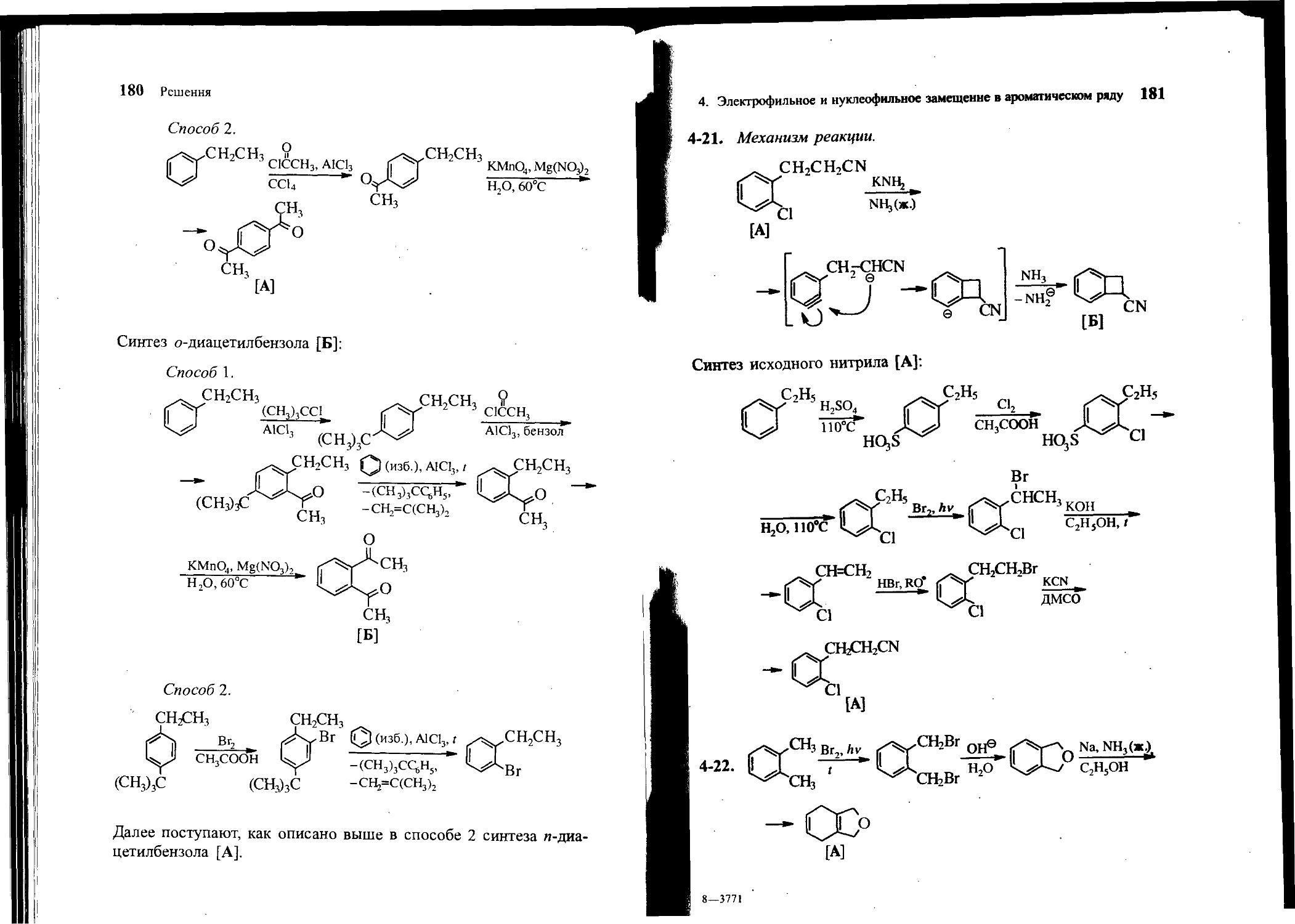
4-20. Из толуола или этилбензола и других необходимых реагентов получите и-диацетилбензол [А] и о-диацетилбенхол [Б] без примеси других изомеров.
4-21. Предложите механизм следующей реакции:
ch2ch2cn
knh2
Cl NH3 (ж.)*
[A]
Получите исходное соединение А из этилбензола.
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 51
4-22. Из о-ксилола и других необходимых реагентов получите простой эфир А.
Ос°
[А]
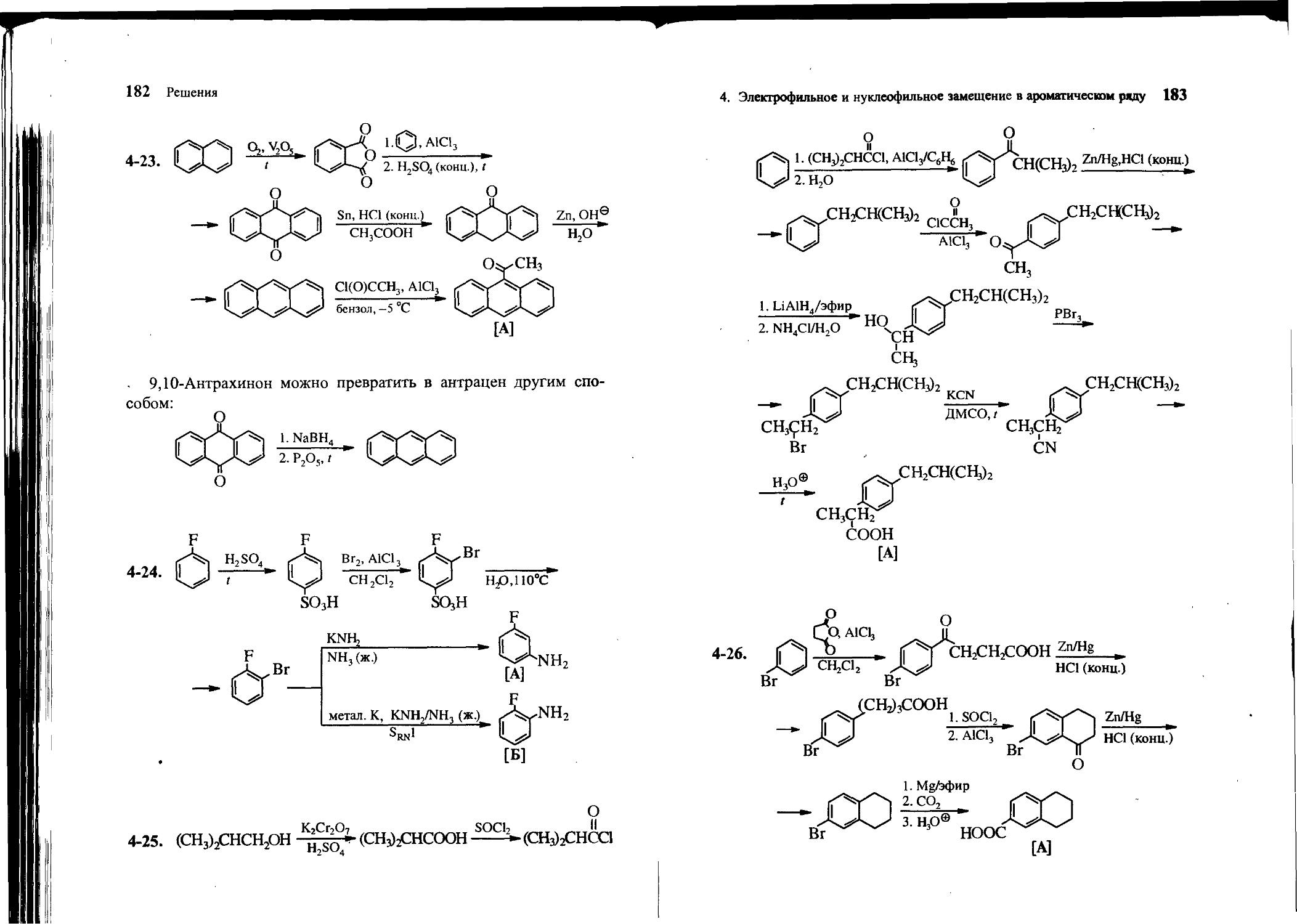
4-23. Исходя из нафталина, бензола, уксусной кислоты и неорганических реагентов, получите 9-ацетилантрацен [А].
4-24. Из фторбензола и других необходимых реагентов селективно получите изомерные о- и л/-фторанилины [А и Б], не прибегая к реакции диазотирования.
4-25. Исходя из изобутанола, уксусной кислоты, бензола и неорганических реагентов, получите бруфен — 2-(4-изобутилфенил)-пропановую кислоту [А].
4-26. Получите соединение [А], исходя из бромбензола, янтарного ангидрида и других необходимых реагентов:
[А]
4-27. Получите 4-(3-амино-4-пропилфенил)бутановую кислоту [А] из бензола, янтарного ангидрида и других необходимых реагентов.
4-28. Предложите путь синтеза 3-бром-2,5-диметилбензальдеги-да [А] из толуола.
4-29. Предложите путь синтеза 4/,5-ди(тпре7п-бутил)-2-(н-про-пил)бензофенона [А] из бензола и других необходимых неароматических реагентов.
52 Задачи
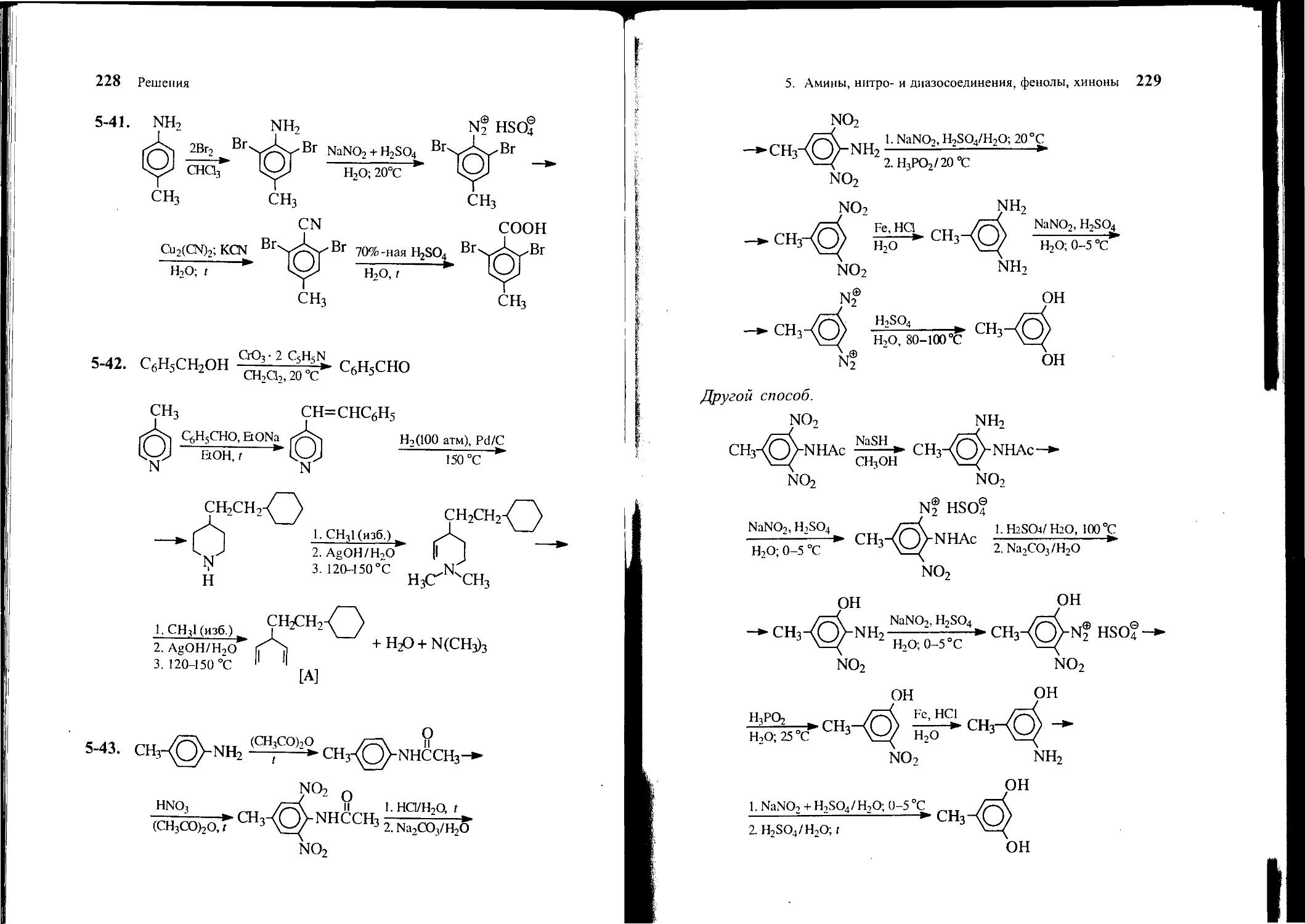
4-30. Из бензола и других необходимых реагентов получите 5-амино-4-бром-2-нитробензойную кислоту [А], не используя ни на одной из стадий солей диазония.
4-31. Из хлорбензола и неорганических реагентов получите 3,4',5-трихлорбензофенон [А].
4-32. Из бромбензола, диизопропилкетона и других необходимых реагентов получите кетон А.
СН3 СН3
СН3 СН3
[А]
4-33. Из бензола, этанола, метилбромида и неорганических реагентов получите 1,3,5-триацетилбензол [А].
4-34. Из «реяг-бутилбензола, метанола и неорганических реагентов получите синтетический компонент А душистого вещества амбрового мускуса.
NO2
(СНз)зС-СНз
сн3о no2
[А]
4-35. Исходя из бензола и неорганических реагентов, получите 2,6-динитродифениловый эфир [А].
4-36. Из толуола и других необходимых неароматических реагентов получите 3,5-динитро-4-метоксибензойную кислоту [А].
4-37. Из анилина и других необходимых неароматических реагентов получите 3,4,5-тринитробромбензол [А].
4-38. Из бензола, этанола, пропанола-1 и неорганических реагентов получите и-этил-н-пропилбензол [А].
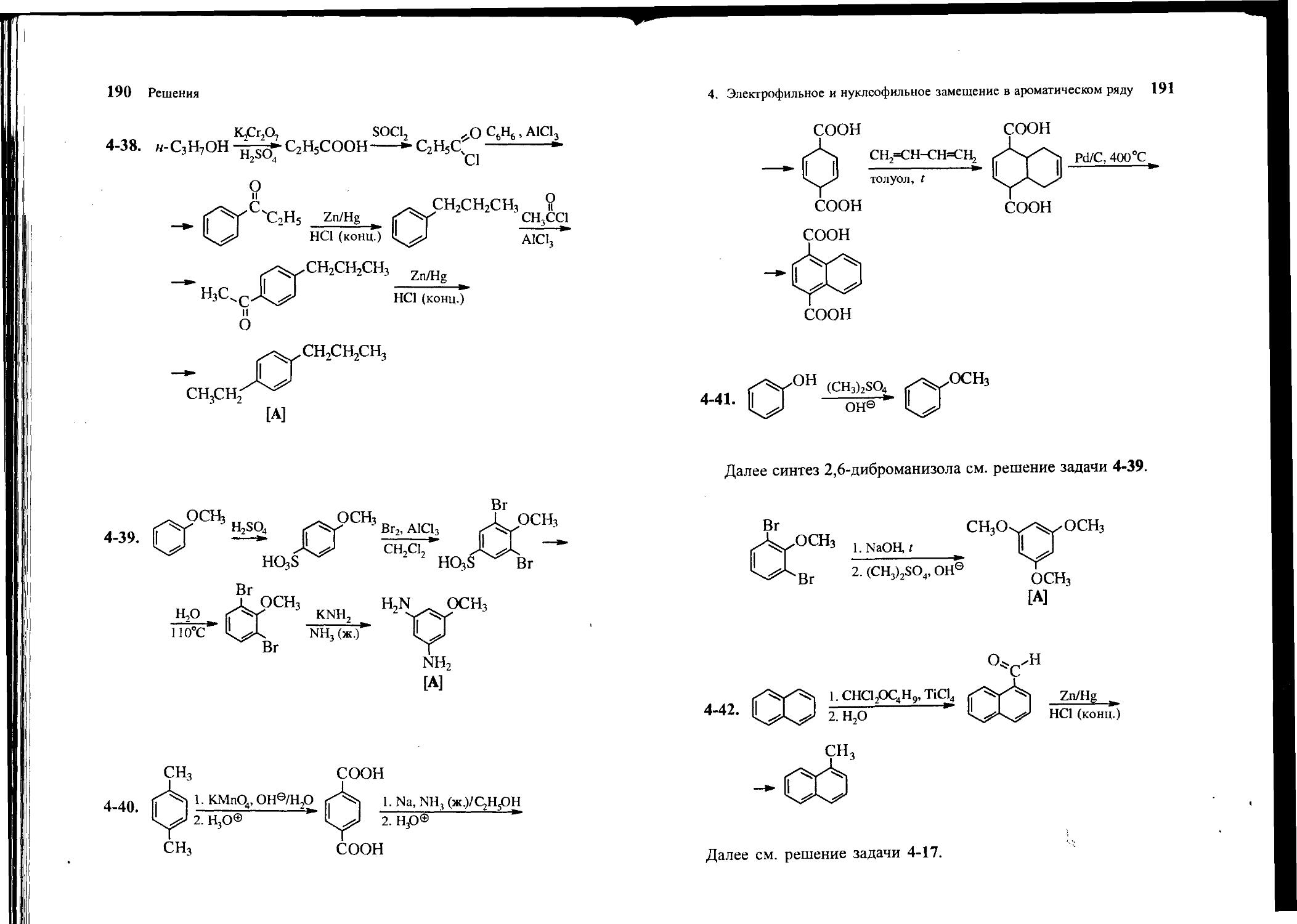
4-39. Из анизола и неорганических реагентов получите 3,5-ди-аминоанизол [А].
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 53
4-40. Из н-ксилола, бутадиена-1,3 и неорганических реагентов получите нафталин-1,4-дикарбоновую кислоту [А].
4-41. Из фенола, метилата натрия и других необходимых реагентов получите 1,3,5-триметоксибензол [А].
4-42. Из нафталина, янтарного ангидрида и других необходимых реагентов получите 9-метилфенантрен [А].
4-43. Из фторбензола получите 1-бром-2-фторбензол [А]. Какое соединение образуется при действии на А амида натрия? Объясните механизм реакции. Какое соединение образуется при действии на А амида натрия при УФ облучении?
4-44. Предложите путь синтеза фенил-(2,4-динитрофенил)ацети-лена [А] из бромбензола и любых других реагентов.
4-45. Исходя из толуола, о-ксилола и неорганических реагентов, получите соединение А. Какое соединение образуется при реакции А с ацетилхлоридом в присутствии пиридина? Какое строение имеет продукт ацилирования соединения А?
О
[А]
4-46. Исходя из о-ксилола и янтарного ангидрида, получите 1-(3,4-диметилфенил)-6,7-диметилнафталин [А].
4-47. В распоряжении имеются бензол, метанол, янтарная кислота и любые неорганические реагенты. Предложите способ синтеза 4-метил-1-фенилнафталина [А].
4-48. В распоряжении имеются бензол, .w-ксилол, изобутилен и любые другие необходимые неароматические реагенты. Предложите способ синтеза 3,4,5-триметилбензальдегида [А].
54 Задачи
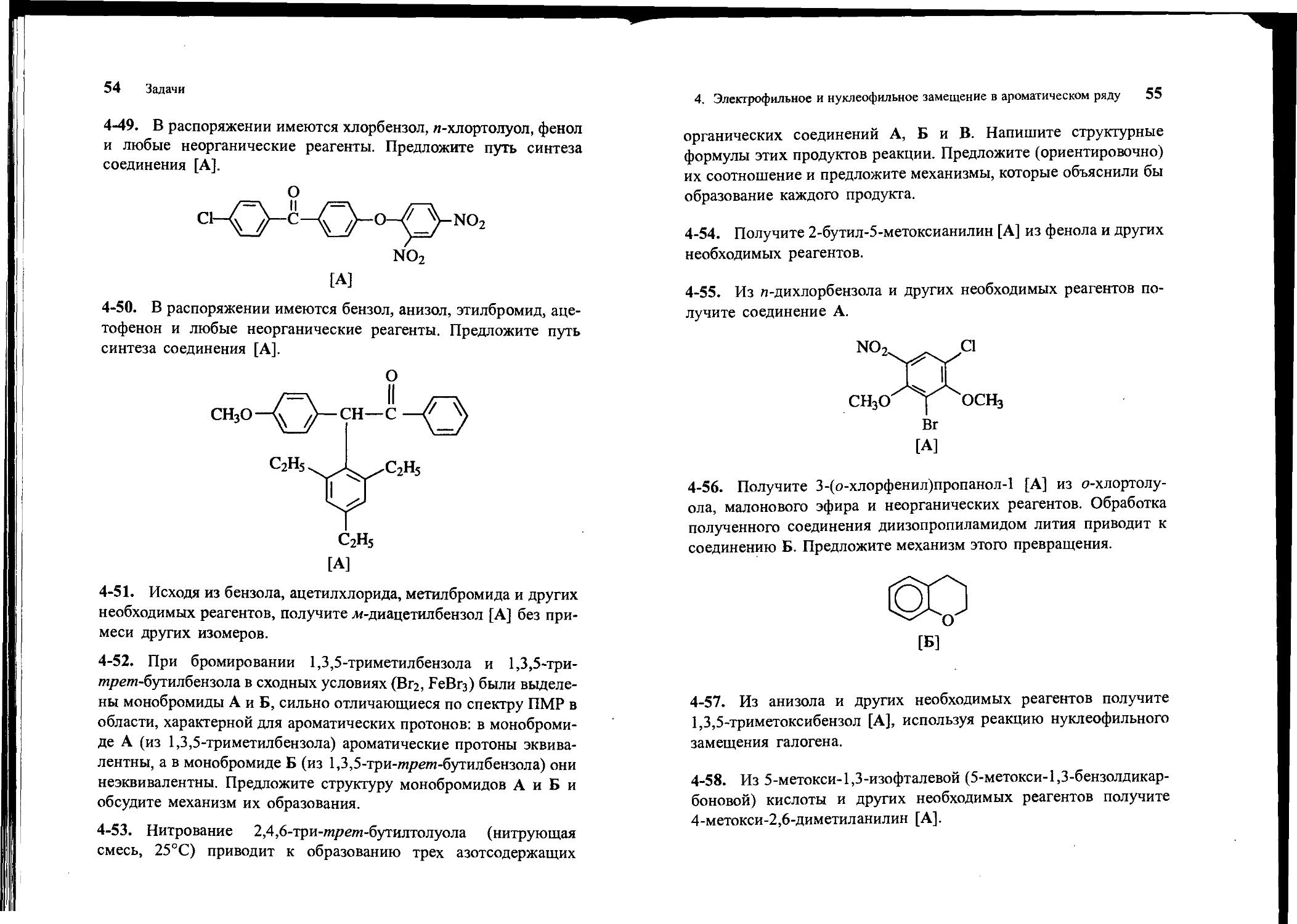
4-49. В распоряжении имеются хлорбензол, л-хлортолуол, фенол и любые неорганические реагенты. Предложите путь синтеза соединения [А].
4-50. В распоряжении имеются бензол, анизол, этилбромид, ацетофенон и любые неорганические реагенты. Предложите путь синтеза соединения [А].
с2н5
[А]
4-51. Исходя из бензола, ацетилхлорида, метилбромида и других необходимых реагентов, получите л/-диацетилбензол [А] без примеси других изомеров.
4-52. При бромировании 1,3,5-триметилбензола и 1,3,5-три-тпретп-бутилбензола в сходных условиях (Вгг, РеВгз) были выделены монобромиды А и Б, сильно отличающиеся по спектру ПМР в области, характерной для ароматических протонов: в монобромиде А (из 1,3,5-триметилбензола) ароматические протоны эквивалентны, а в монобромиде Б (из 1,3,5-три-теретп-бутилбензола) они неэквивалентны. Предложите структуру монобромидов А и Б и обсудите механизм их образования.
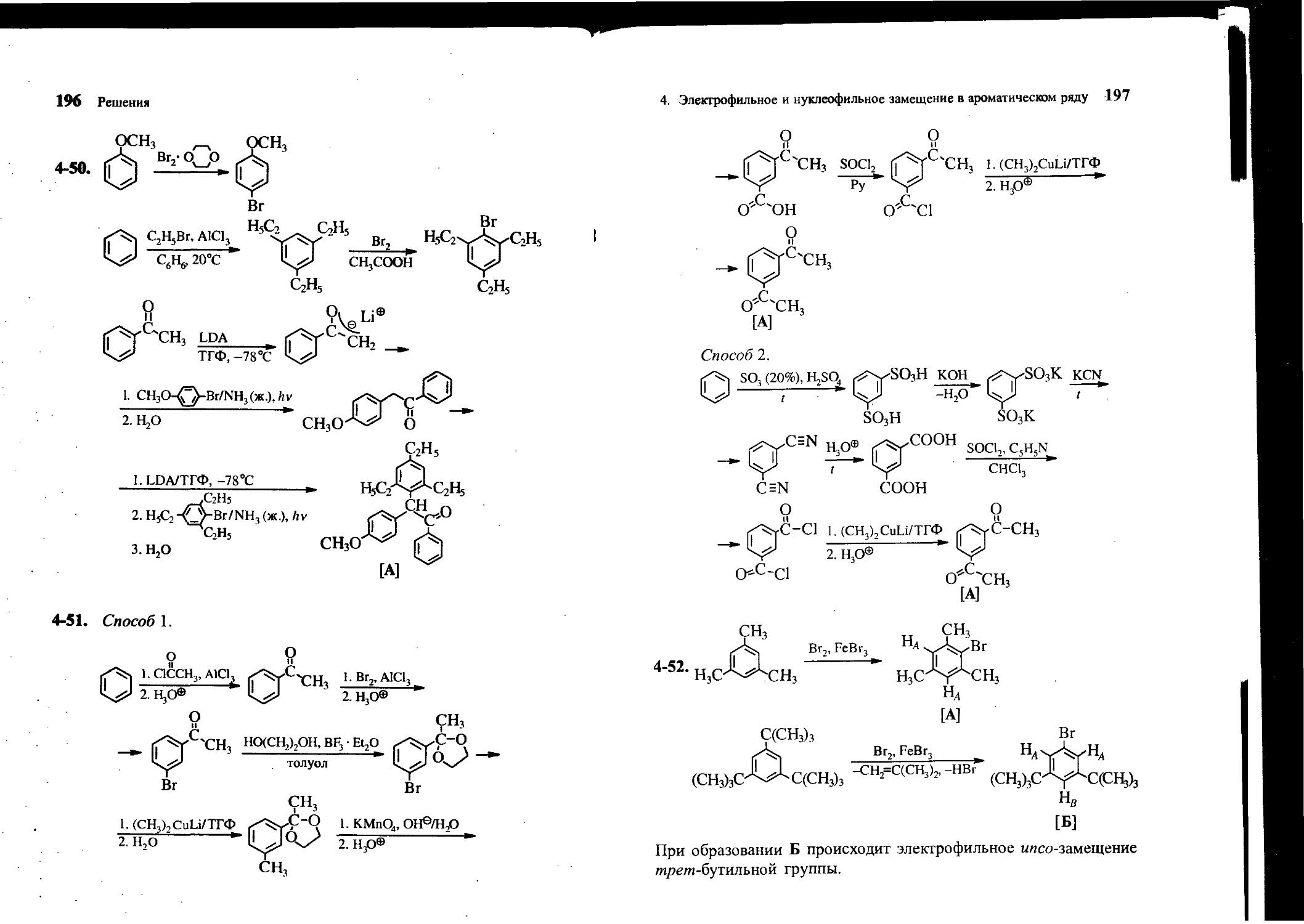
4-53. Нитрование 2,4,6-три-тпретп-бутилтолуола (нитрующая смесь, 25°С) приводит к образованию трех азотсодержащих
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 55
органических соединений А, Б и В. Напишите структурные формулы этих продуктов реакции. Предложите (ориентировочно) их соотношение и предложите механизмы, которые объяснили бы образование каждого продукта.
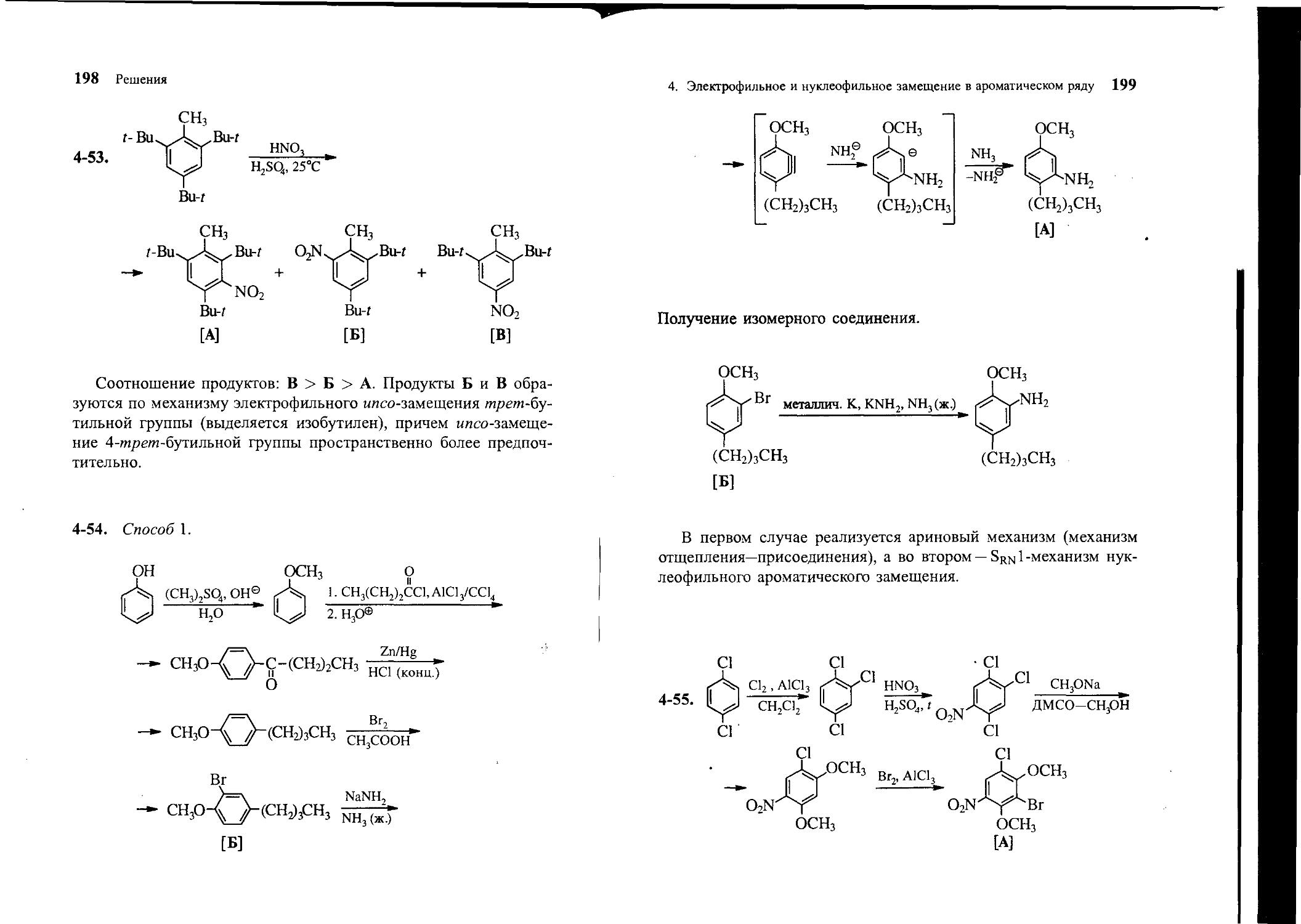
4-54. Получите 2-бутил-5-метоксианилин [А] из фенола и других необходимых реагентов.
4-55. Из «-дихлорбензола и других необходимых реагентов по-
4-56. Получите 3-(о-хлорфенил)пропанол-1 [А] из о-хлортолу-ола, малонового эфира и неорганических реагентов. Обработка полученного соединения диизопропиламидом лития приводит к соединению Б. Предложите механизм этого превращения.
[Б]
4-57. Из анизола и других необходимых реагентов получите 1,3,5-триметоксибензол [А], используя реакцию нуклеофильного замещения галогена.
4-58. Из 5-метокси-1,3-изофталевой (5-метокси- 1,3-бензолдикарбоновой) кислоты и других необходимых реагентов получите 4-метокси-2,6-диметиланилин [А].
56 Задачи
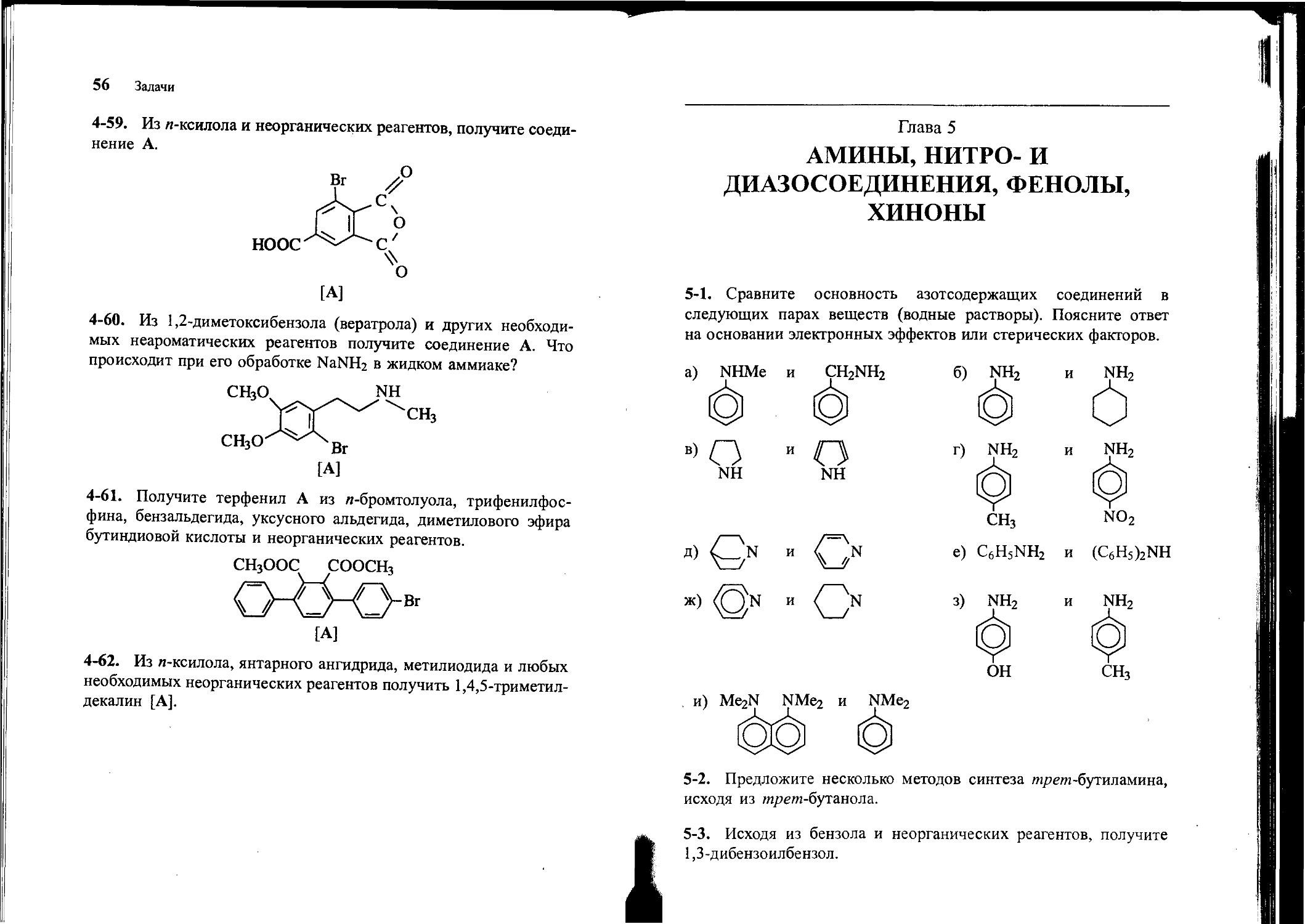
4-59. Из л-ксилола и неорганических реагентов, получите соединение А.
[А]
4-60. Из 1,2-диметоксибензола (вератрола) и других необходимых неароматических реагентов получите соединение А. Что происходит при его обработке NaNH2 в жидком аммиаке?
СН3О NH
СНЗ
[А]
4-61. Получите терфенил А из л-бромтолуола, трифенилфосфина, бензальдегида, уксусного альдегида, диметилового эфира бутиндиовой кислоты и неорганических реагентов.
СН3ООС СООСНз
0-^_0-вг
[А]
4-62. Из л-ксилола, янтарного ангидрида, метилиодида и любых необходимых неорганических реагентов получить 1,4,5-триметилдекалин [А].
Глава 5
АМИНЫ, НИТРО- И ДИАЗОСОЕДИНЕНИЯ, ФЕНОЛЫ, ХИНОНЫ
5-1. Сравните основность азотсодержащих соединений в следующих парах веществ (водные растворы). Поясните ответ на основании электронных эффектов или стерических факторов.
no2
е) C6H5NH2
и (C6H5)2NH
з) ^Н2
ОН
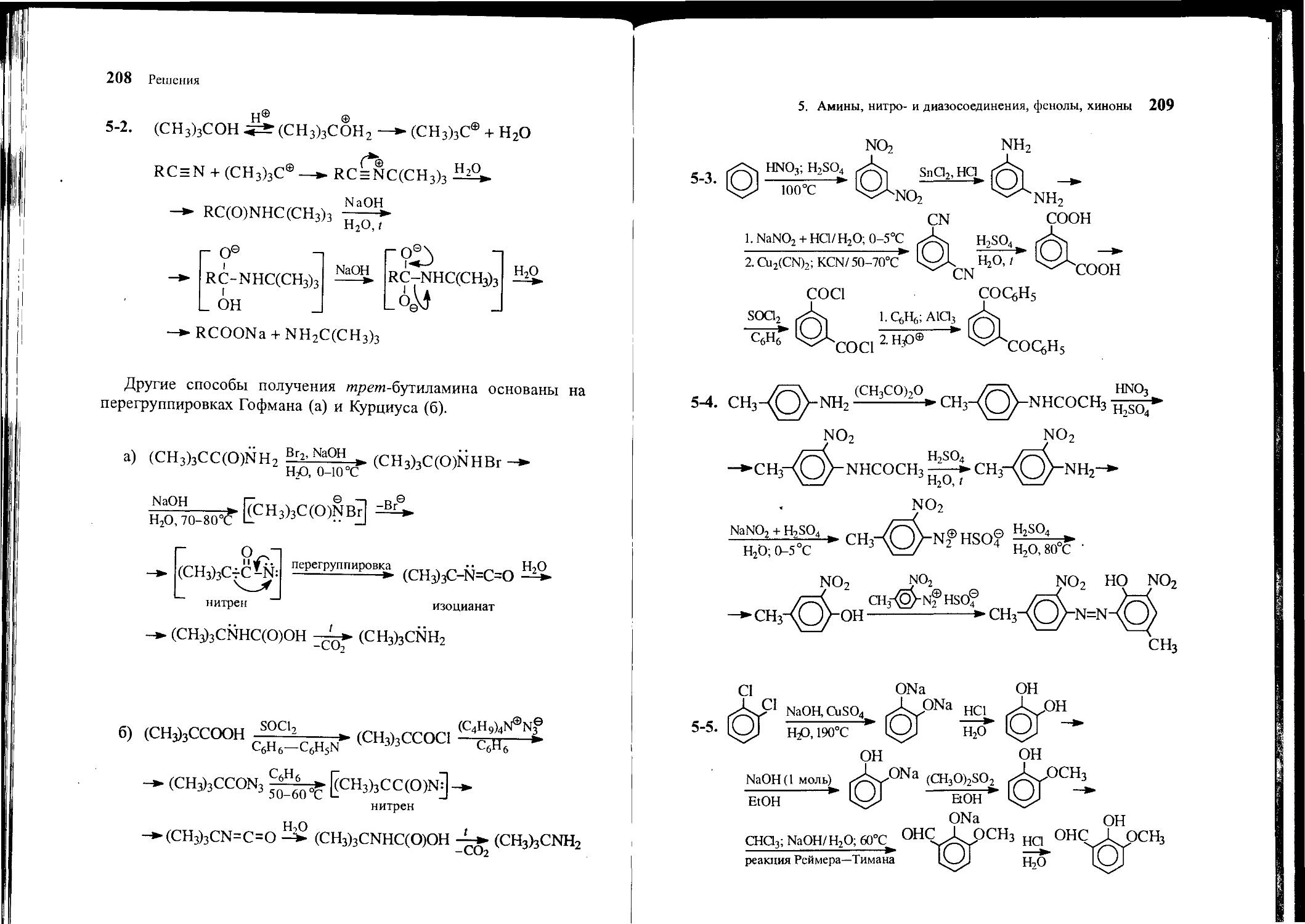
5-2. Предложите несколько методов синтеза гп/>е?п-бутиламина, исходя из »гре/н-бутанола.
5-3. Исходя из бензола и неорганических реагентов, получите 1,3-дибензоилбензол.
58 Задачи
5-4. Исходя из л-толуидина (4-метиланилина) и других необходимых реагентов, получите 2-гидрокси-4',5-диметил-2',3-динитро-азобензол
5-5. Из о-дихлорбензола и других необходимых реагентов получите 2-гидрокси-З-метоксибензальдегид.
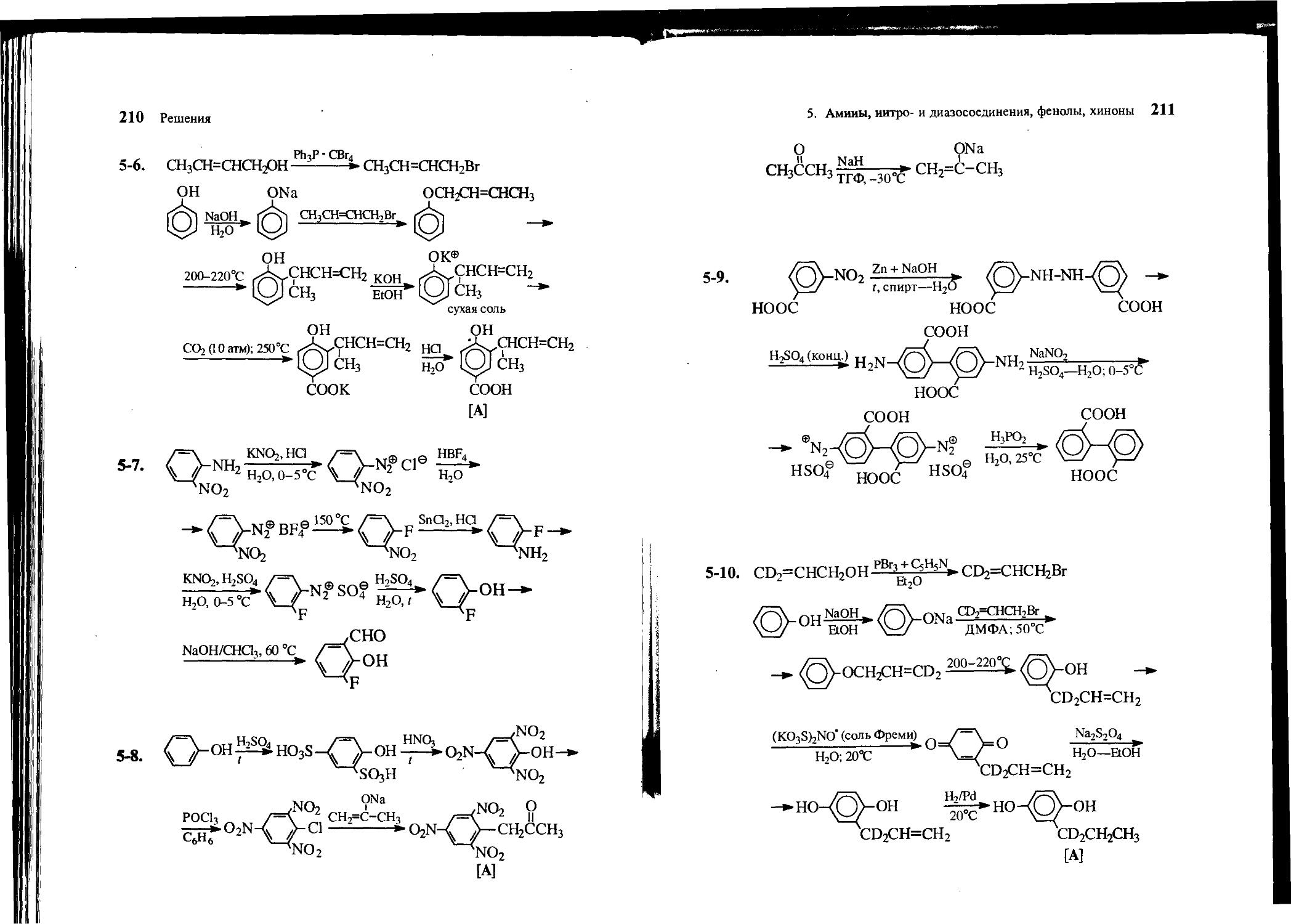
5-6. Из фенола, кротилового спирта СН3СН=СНСН2ОН и неорганических реагентов получите 3-(1-метилпропен-2-ил)-4-гидрок-сибензойную кислоту [А].
ОН
гнсн=сн2 Ген у ^*13
соон
[А]
5-7. Из о-нитроанилина и других необходимых реагентов получите 2-гидрокси-З -фторбензальдегид.
5-8. Из фенола, ацетона и других необходимых реагентов получите соединение А.
О СН2ССН3
o2n no2
no2
[A]
5-9. Получите 2,2'-дикарбоксибифенил, исходя из ти-нитробен-зойной кислоты и неорганических реагентов.
5-10. Из фенола, дейтерированного аллилового спирта CD2=CHCH2OH и неорганических реагентов получите 2-(1,1-дидейтеропропил )гидрохинон [А].
HO-G J-OH
4CD2CH2CH3
[А]
5. Амины, нитро- и диазосоединения, фенолы, хиноны 59
5-11. Из о-крезола (2-метилфенола), кротилового спирта и других необходимых реагентов получите этиловый эфир 2-гидрокси-З -метил-5-(бутен-2-ил)бензойной кислоты [А].
соос2н5
1 I СН3СН=СНСН2/Ч^СН3
[А]
5-12. Амин C7H]3N [А] образует значительно более прочный комплекс с В(СН3), чем триэтиламин (почему?), и не образует устойчивого продукта в реакции с бензолсульфохлоридом. Если этот амин ввести в следующую цепочку превращений, то образуется тривинилметан.
А 1 СНз!__ т- 1 CH3I_ Т> ! CH3I___ /Г-ТГ — СЬТЗ СИ
А 2. Ag2O/H2O,Z Б 2. Ag2O/H2O,Z> В 2. Ag2O/H2O,Z ^СН2 СН)зСН
Какое строение имеют соединения А, Б, В? Ответы на все поставленные вопросы подробно аргументируйте.
5-13. Установите строение аминоспирта состава C8H]5NO [А], содержащего вторичную гидроксильную группу, по продуктам его деструкции:
. А12Ог тт м СН31 (изб.) _ „ СН31 (изб.)
А 2. Ag2O/H2O ® 2- Ag2O/H2cT
С7Н8 Ph3c@BF?> [C7H7]®BF4e + Ph3CH
[Г] [Д]
Соль Д содержит устойчивый ароматический катион; А оптически неактивно (нельзя разделить на оптические антиподы).
5-14. Алкалоид кониин C8H]7N при элимировании по Гофману (1.СН31 (изб.); 2. Ag2O/H2O; 3./) в качестве главного продукта дает 5-(М,Ы-диметиламино)октен-1. Реакция кониина с бензолсульфохлоридом приводит к не растворимому в щелочи бензол
60 Задачи
сульфамиду. Исходя из приведенных выше фактов, предложите структуру кониина.
5-15. В распоряжении имеются толуол, изомасляная кислота и любые неорганические реагенты. Предложите путь синтеза К-бензил-К-изобутил-М-изопропиламина.
5-16. Исходя из циклогексанона и неорганических реагентов, получите третичный амин А.
[А]
5-17. Из о-бромнитробензола и о-нитротолуола получите 3-бром-3' -метилбензидин.
5-18. Из 3-фенилпропановой кислоты и других необходимых реагентов получите фентермин [А]. Это вещество интересно тем,
что снижает аппетит.
/=\
^Jfch2cch3 nh2 [А]
5-19. Из диэтилкетона и неорганических реагентов получите Ы-пропил-К-этилгидразин (н-СзН7)(С2Н5)К—NH2.
5-20. Из фенола, метилиодида, аллилбромида, фталимида калия и неорганических реагентов получите 3-(2-метоксифенил)пропил-амин.
5-21. Исходя из адипиновой кислоты и неорганических реагентов, получите N-циклопентилпиперидин.
5-22. Исходя из ацетона и неорганических реагентов, получите неопентил-трет-бутиламин.
5. Амины, нитро- и диазосоединения, фенолы, хиноны 61
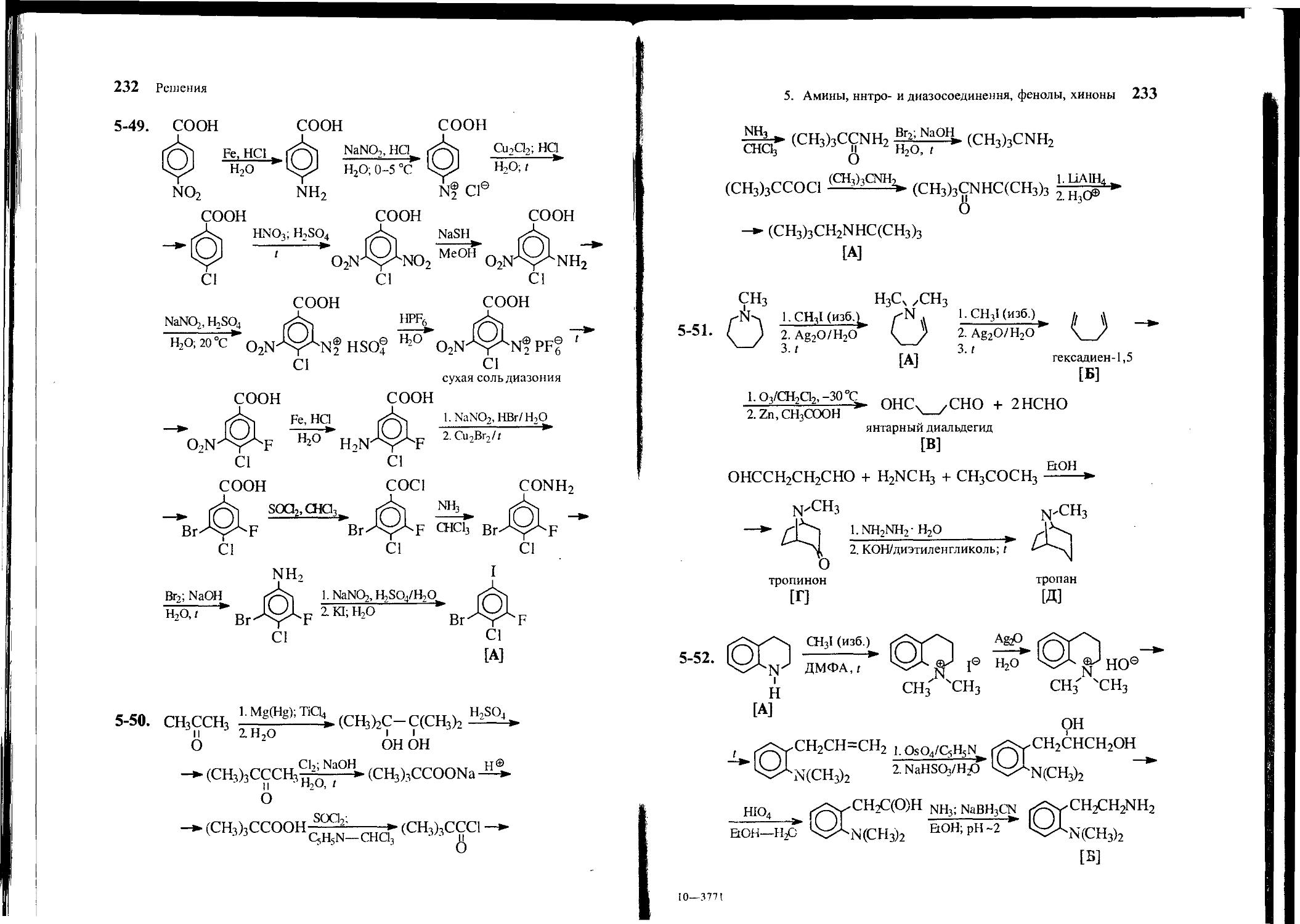
5-23. Расшифруйте цепочку следующих превращений:
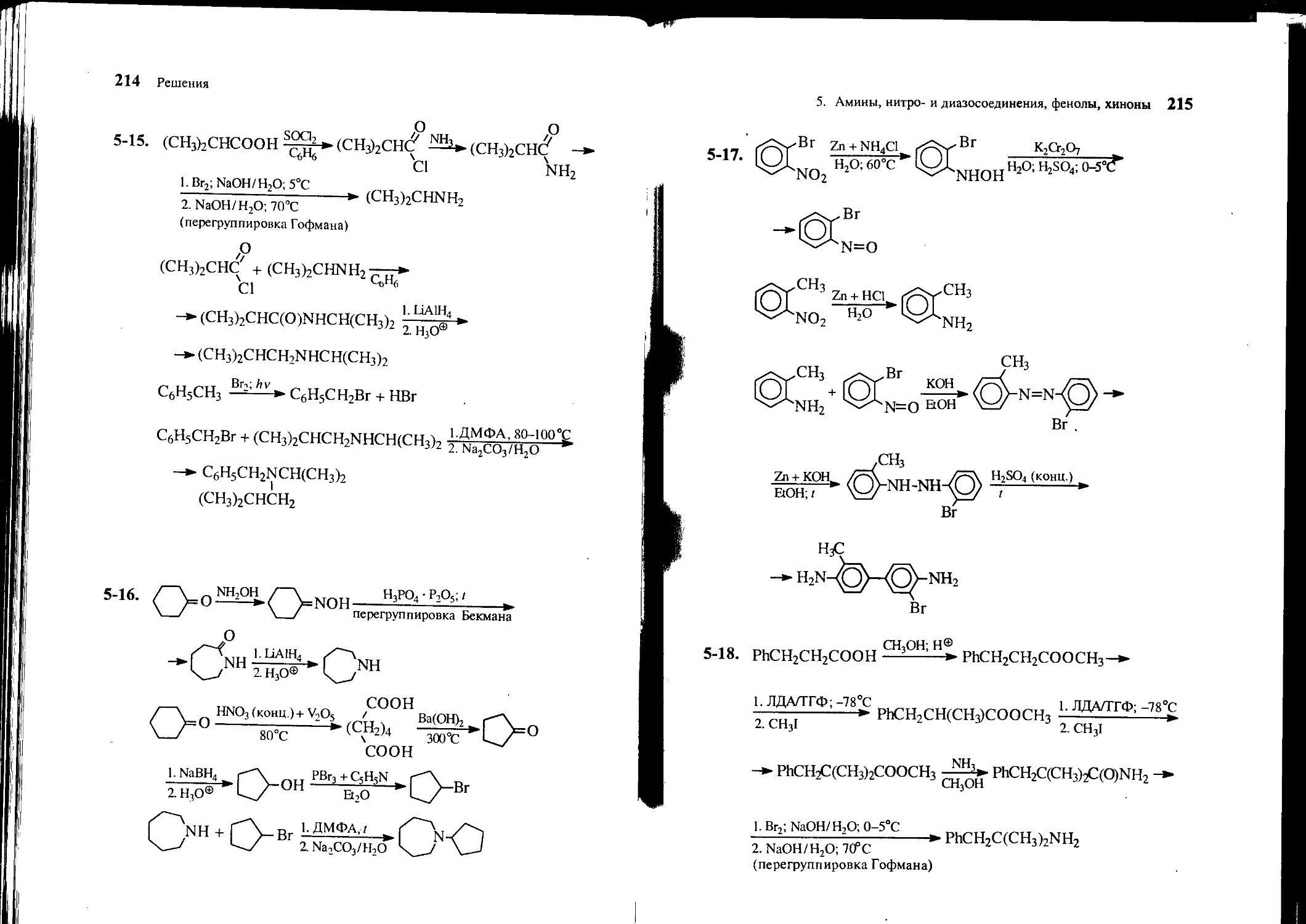
5-24. Из бензола, аллилхлорида, метилиодида и неорганических реагентов получите З-аллил-4-метоксибензиламин.
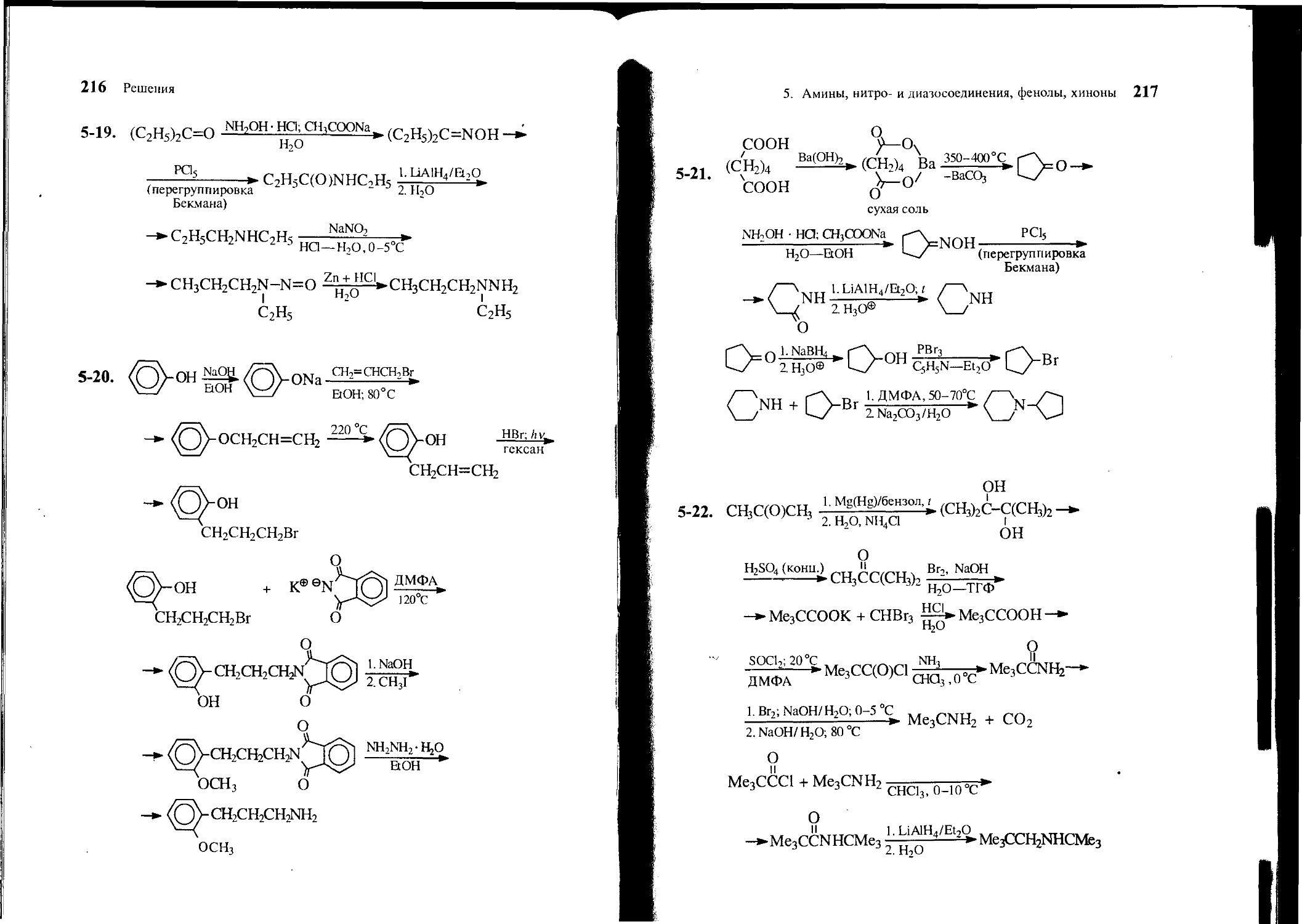
5-25. Предложите способ синтеза фармацевтического препарата эфедрина СбН5СН(ОН)СН(КНСНз)СНз, используя в качестве исходных веществ бензол, пропановую кислоту, оксид селена(1У), метиламин и другие необходимые реагенты. Напишите проекционные формулы Фишера для двух энантиомеров эритро-изомера (эфедрин) и двух энантиомеров wpeo-изомера (псевдоэфедрин).
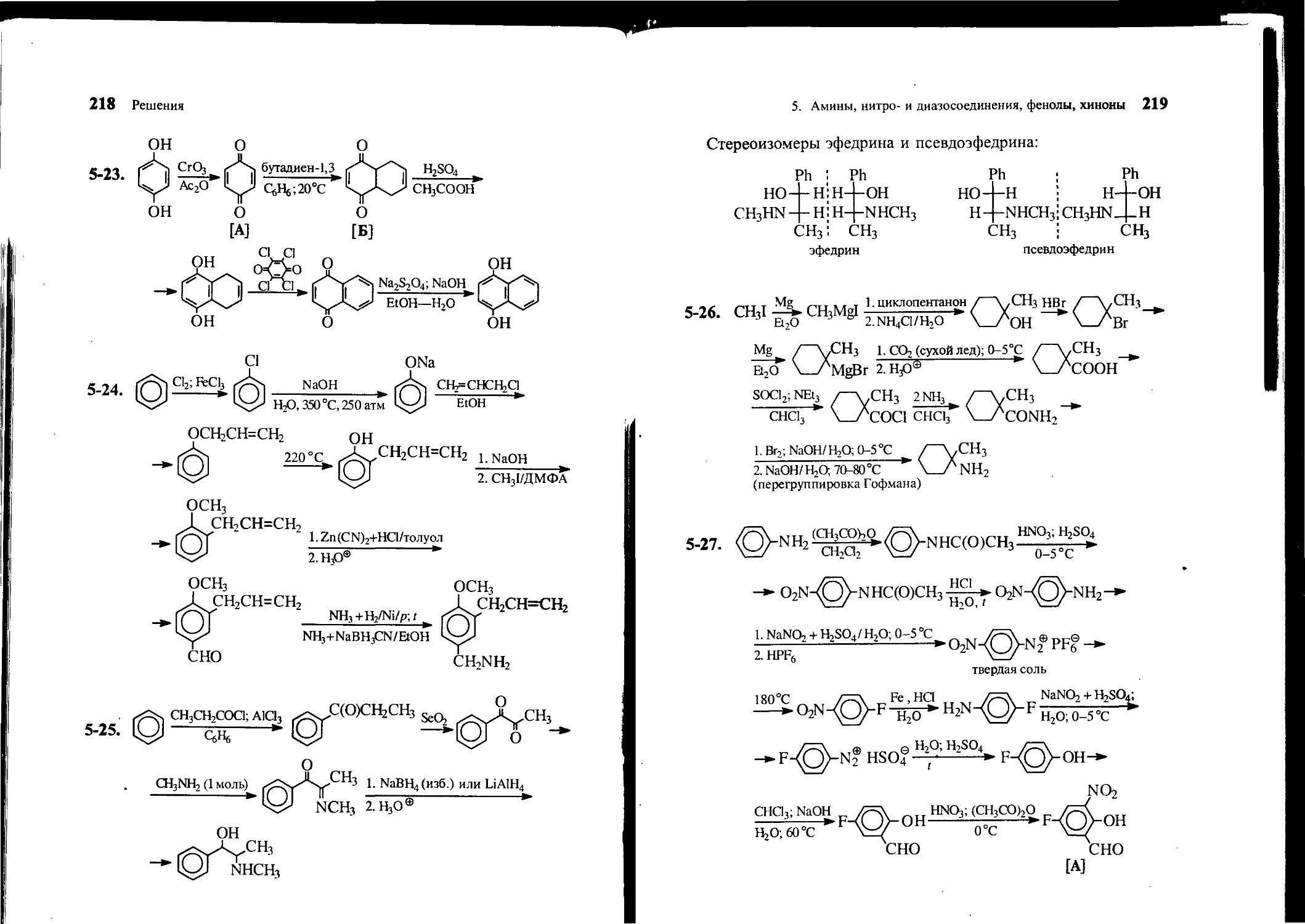
5-26. Из циклогексанона, метилбромида и неорганических реагентов получите 1-амино-1-метилцикло гексан.
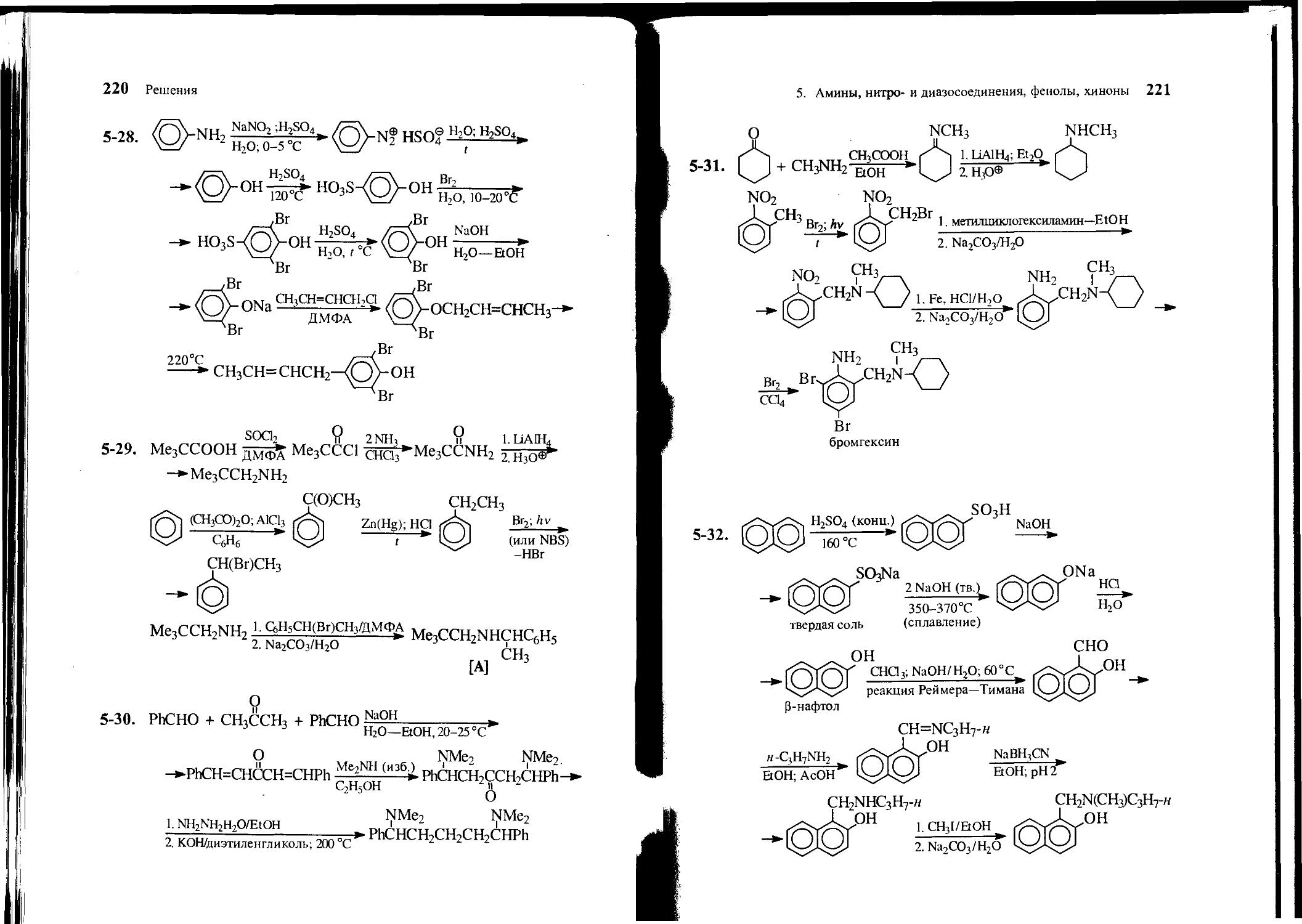
5-27. Исходя из анилина, хлороформа и других необходимых реагентов, получите следующее соединение А.
NO2
н°^>
сно
[А]
5-28. Из анилина, кротилхлорида (1-хлорбутена-2) и неорганических реагентов получите 4-(бутен-2-ил)-2,6-дибромфенол.
5-29. Получите вторичный амин А из бензола, уксусного ангидрида, триметилуксусной кислоты и неорганических реагентов.
СН3
C6H5CHNHCH2C(CH3)3
62 Задачи
5-30. Исходя из бензальдегида, ацетофенона, диметиламина и метилиодида, получите 1,5-бис(диметиламино)-1,5-дифенил-пентан.
5-31. Из о-нитротолуола, циклогексанона, метилиодида и неорганических реагентов получите фармацевтический препарат бромгексин (средство от кашля).
Вг
5-32. Из нафталина, н-пропиламина и других необходимых реагентов получите 1-(М-метил-М-пропиламинометил)нафтол-2.
CH2N(CH3)CH2CH2CH3
5-33. Из толуола и других необходимых неароматическтих реагентов получите 2-диметиламино-5-метил-4'-карбоксиазобен-зол [А].
5-34. Исходя из о-нитротолуола, получите амин А.
[А]
5. Амины, нитро- и диазосоединения, фенолы, хиноны 63
5-35. Из фенола, кротилхлорида С1СН2СН=СНСНз и других необходимых реагентов получите хинон А.
СН
I сн2=снсн
3 О
соос2н5
о
[А]
5-36. Из .м-динитробензола и неорганических реагентов получите 4,4'-дииод-2-хлор-2'-фторбифенил.
5-37. Из jw-динитробензола и любых необходимых реагентов получите 2-гидрокси-3,5-дифторбензойную кислоту.
5-38. В распоряжении имеются фенол, н-бутилбромид, этиленок-сид, диэтиламин и любые неорганические реагенты. Предложите способ синтеза примакаина [А] (обезболивающий фармацевтический препарат).
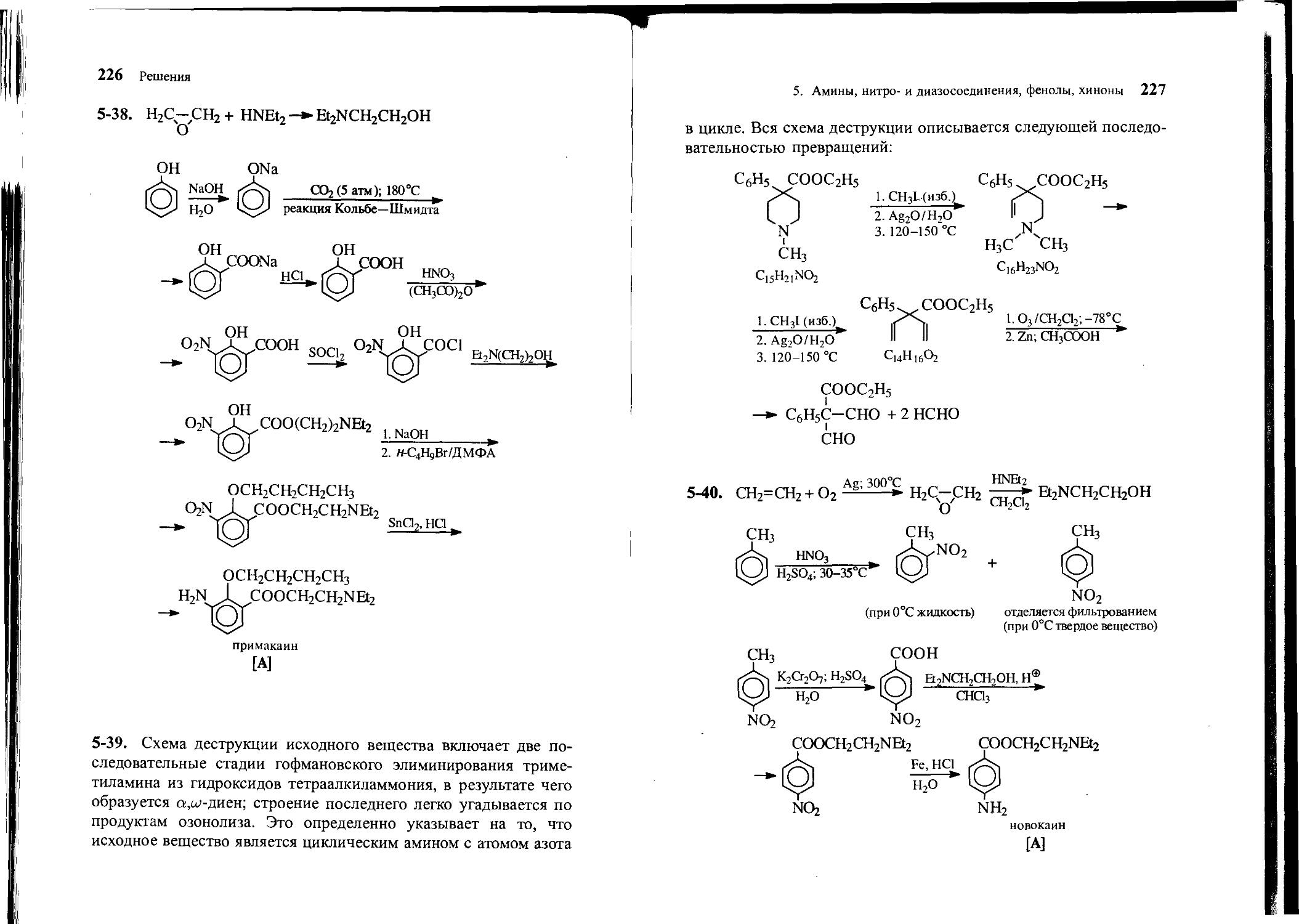
nh2
Л.ОСН2СН2СН2СН3
^^COOCH2CH2N(C2H5)2
[А]
5-39. Установите строение алкалоида C15H21NO2, обладающего свойствами сильного анальгетика. Деструкция этого алкалоида приводит к следующим продуктам:
Ci5H21NO2
I. CH3I (изб.) тт 1. CH3I (изб.)
2.AgOH-H2O v16n23^v»2 2,AgOH-H2O
_ СООС2Н5
»-М(СНз)з+С14Н26О2 2 /n/cHjCOOH*С С®) +2СНгО
сно
5-40. В распоряжении имеются толуол, этилен, диэтиламин и любые неорганические реагенты. Получите фармацевтический
64 Задачи
препарат новокаин (2-диэтиламиноэтиловый эфир 4-аминобензой-ной кислоты) [А], обладающий обезболивающим действием.
NH2—COOCH2CH2N(C2H5)2
[А]
5-41. Предложите способ синтеза 2,6-дибром-4-метилбензойной кислоты из л-толуидина (4-метиланилин) и других необходимых реагентов.
5-42. Из 7-пиколина (4-метилпиридина), бензилового спирта, метилиодида и других необходимых реагентов получите диен А.
CH2CH2C6Hn
Ml
[А]
5-43. Предложите способ синтеза 5-метилрезорцина (1,3-дигид-рокси-5-метилбензол) из л-толуидина (4-метиланилин) и других необходимых реагентов.
5-44. Исходя из циклогексанона, диметиламина и других необходимых реагентов, получите диамин А.
<^2>~N(CH3)2
h2n
[А]
5-45. Получите вторичный амин А из бензола, уксусного ангидрида, триметилуксусной кислоты и неорганических реагентов.
СН3
C6H5CHNHCH2C(CH3)3 [А]
5. Амины, нитро- и диазосоединения, фенолы, хиноны 65
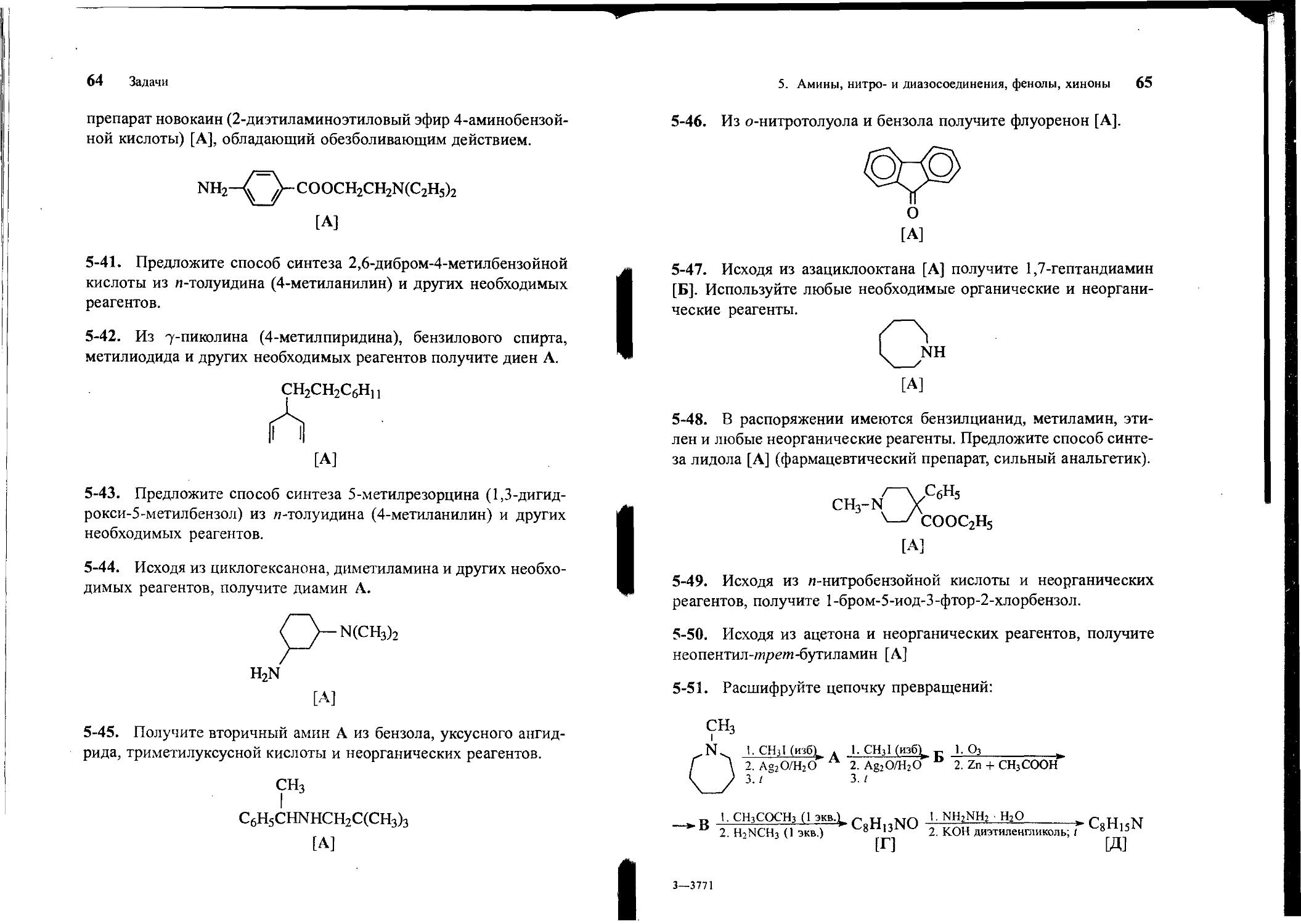
5-46. Из о-нитротолуола и бензола получите флуоренон [А].
О
[А]
5-47. Исходя из азациклооктана [А] получите 1,7-гептандиамин
[Б]. Используйте любые необходимые органические и неоргани-
ческие реагенты.
[А]
5-48. В распоряжении имеются бензилцианид, метиламин, этилен и любые неорганические реагенты. Предложите способ синтеза лидола [А] (фармацевтический препарат, сильный анальгетик).
соос2н5
[А]
5-49. Исходя из л-нитробензойной кислоты и неорганических реагентов, получите 1-бром-5-иод-3-фтор-2-хлорбензол.
5-50. Исходя из ацетона и неорганических реагентов, получите неопентил-/ирет-бутиламин [А]
5-51. Расшифруйте цепочку превращений:
СН3
1. СН31 (изб^ . 1, СН31 (изб^ г 1. О3________
2. Ag2O/H2O А 2. Ag2O/H2O Ь 2. Zn + СН3СООН
3. t 3. /
1, СН3СОСН3 (1 экв.^
2. H2NCH3 (1 экв.)
c8h13no
[Г]
[. nh2nh2 н2о
2. КОН диэтиленгликоль; t
c8h15n
[Д]
3—3771
66 Задачи
5-52. Из 1,2,3,4-тетрагидрохинолина и других необходимых реагентов получите диамин А:
CH2CH2NH2
N(CH3)2
[А]
5-53. Осуществите синтез триоксазина [А] (триметозин; транквилизатор) из гваякола, морфолина и других нобходимых реагентов.
ОСН3
Глава 6
АЛИЦИКЛЫ И ГЕТЕРОЦИКЛЫ
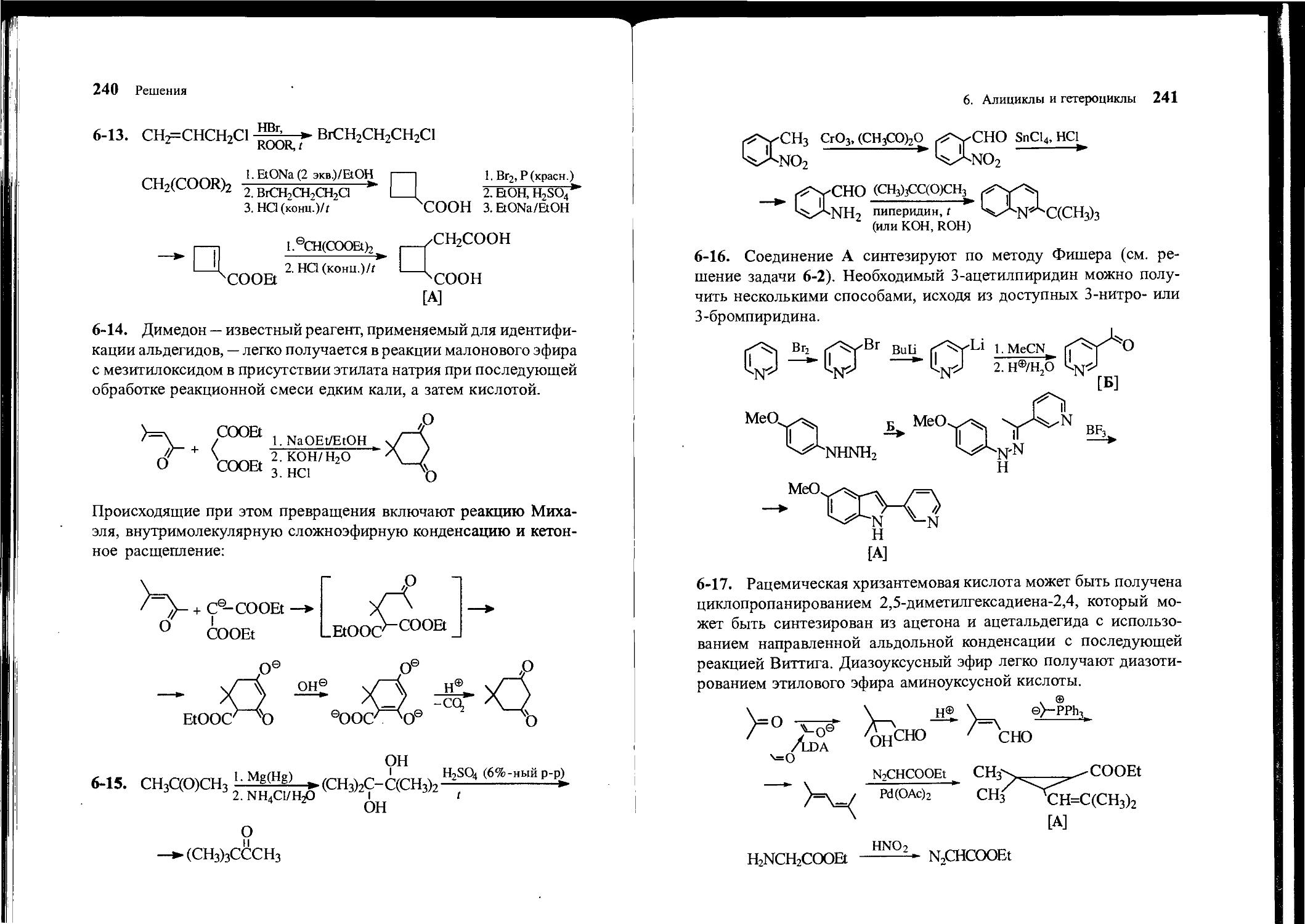
6-1. В распоряжении имеются бензальдегид, бензойная кислота, этилацетат, этанол и любые неорганические реагенты. Предложите способ синтеза 2,4,6-трифенилпиридина.
6-2. В распоряжении имеются анилин, пировиноградная (2-оксо-пропановая) кислота, диметилформамид и любые неорганические реагенты. Получите индол-2-карбоновую кислоту и превратите ее в индол-3-карбоновую кислоту.
6-3. Предложите схему синтеза 2-(дейтерометил)-8-метилхино-лина из толуола, ацетальдегида и других необходимых реагентов.
6-4. Получите 1,2,3,4,5-пентаметилпиррол, исходя из ацетоуксусного эфира, метилиодида, метиламина и неорганических реагентов.
6-5. Получите 3,4-дифенилтиофен из эфира хлоруксусной кислоты, этанола, бензальдегида, сульфида натрия и других неорганических реагентов.
6-6. Синтезируйте замещенный карбазол А из n-толуидина, пиме-линовой (гептандиовой) кислоты, метилиодида и неорганических реагентов.
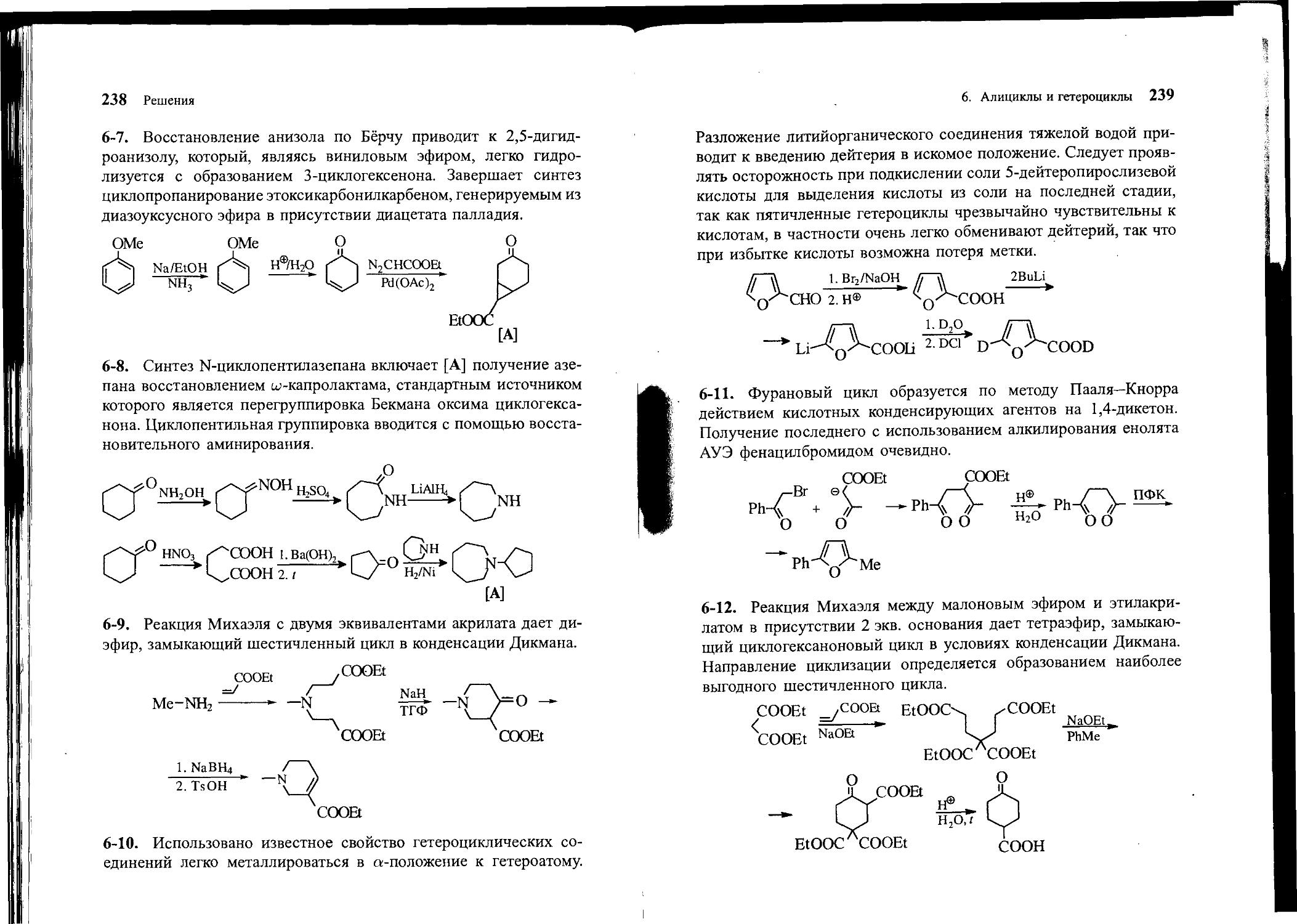
6-7. Исходя из анизола и диазоуксусного эфира, получите сложный эфир А.
7 Т>-соос2н5
[А]
68 Задачи
6-8. Исходя из циклогексанона и неорганических реагентов, получите третичный амин А.
[А]
6-9. Исходя из этилакрилата, метиламина и других необходимых реагентов, осуществите синтез природного алкалоида ареколина, содержащегося в листьях арековой пальмы (Areca catehu L.).
СООН
N сн3
6-10. Из фурфурола и любых других реагентов получите 5-дей-теропирослизевую кислоту.
6-11. Из ацетоуксусного эфира (АУЭ), бензола, уксусного ангидрида и других необходимых реагентов получите 2-метил-5-фенилфуран.
6-12. Предложите способ синтеза 4-оксоциклогексанкарбоновой кислоты из малонового эфира, этилакрилата, этанола и неорганических реагентов.
6-13. Предложите способ синтеза 2-(2-карбоксициклобутил)ук-сусной кислоты [А] из аллилхлорида, малонового эфира, этанола и неорганических реагентов.
,СН2СООН
соон
[А]
6-14. Исходя из ацетона, малонового эфира и других необходимых реагентов, получите 5,5-диметилциклогександион-1,3 (димедон).
6-15. Получите 2-трет-бутилхинолин из о-нитротолуола, бензола, ацетона, этанола и неорганических реагентов.
6. Алициклы и гетероциклы 69
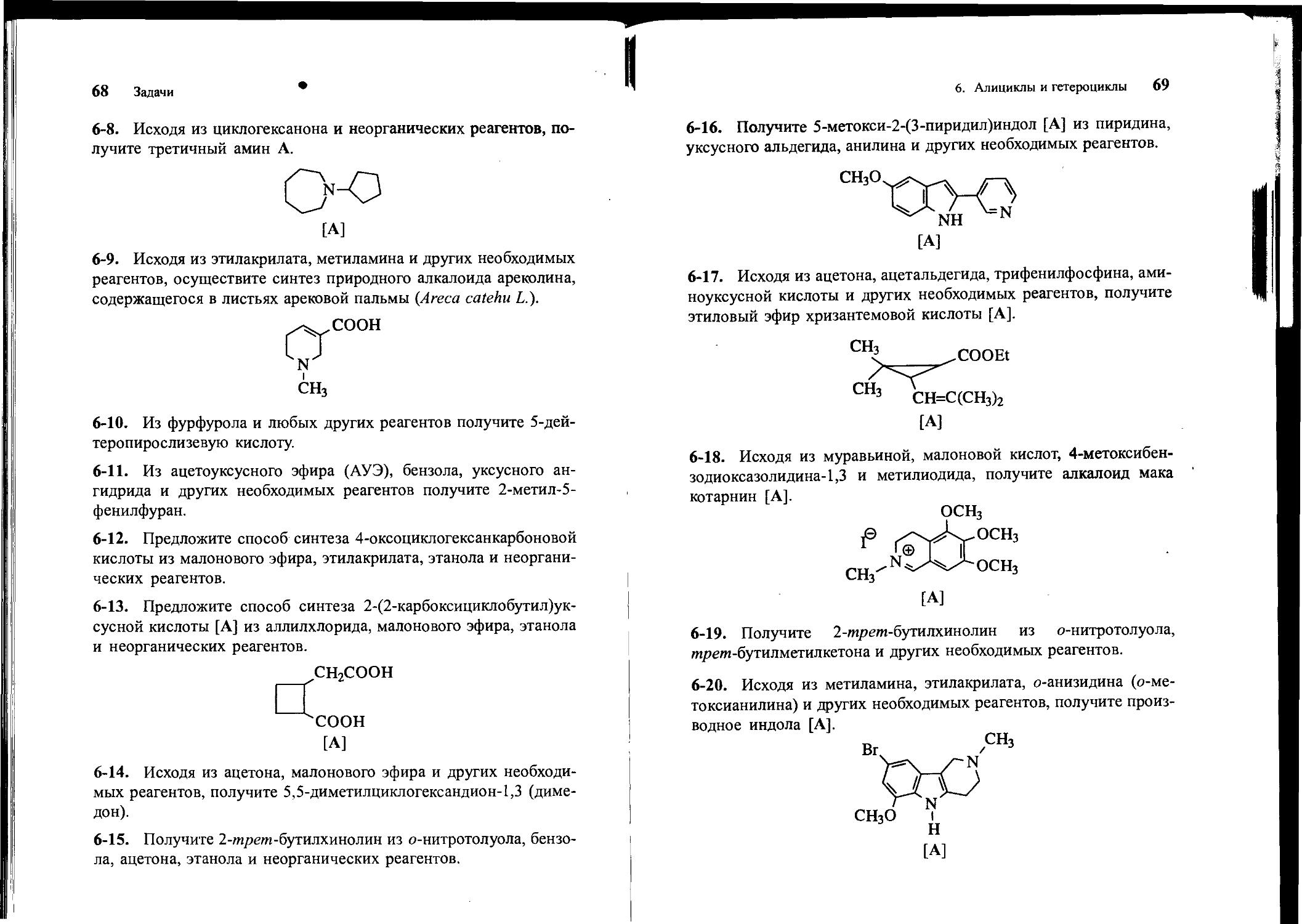
6-16. Получите 5-метокси-2-(3-пиридил)индол [А] из пиридина, уксусного альдегида, анилина и других необходимых реагентов.
[А]
6-17. Исходя из ацетона, ацетальдегида, трифенилфосфина, ами-ноуксусной кислоты и других необходимых реагентов, получите этиловый эфир хризантемовой кислоты [А].
СН3
COOEt
СНз СН=С(СН3)2 [А]
6-18. Исходя из муравьиной, малоновой кислот, 4-метоксибен-зодиоксазолидина-1,3 и метилиодида, получите алкалоид мака
котарнин [А].
f3
СНз''
осн3 ^^к^ОСНз । © Т н N<ixKzAoCH3
[А]
6-19. Получите 2-/и/?е/и-бутилхинолин из о-нитротолуола,
mpem-бутилметилкетона и других необходимых реагентов.
6-20. Исходя из метиламина, этилакрилата, о-анизидина (о-ме-токсианилина) и других необходимых реагентов, получите производное индола [А].
Вг
СНз
N
СН3О I Н
70 Задачи
6-21. Исходя из анизола, ацетоуксусного эфира, хлоруксусной кислоты и неорганических реагентов, получите замещенный индол [А].
ClhCU^ /СН?СООС?Ня
Т £1
СН3
н
[А]
6-22. Из вератрола (1,2-диметоксибензол) и неорганических реагентов получите алкалоид папаверин [А].
6-23. Из пиррола, этилакрилата и неорганических реагентов получите гетероциклическое соединение А.
[А]
6-24. В распоряжении имеются тиофен, фуран, этиловый эфир уксусной кислоты и другие необходимые реагенты. Получите замещенный пиридин А.
[А]
6-25. Исходя из малонового эфира, аллилхлорида, хлороформа и других необходимых реагентов, получите спирогексан [А].
[А]
6. Алициклы и гетероциклы 71
6-26. Получите соединение А из пимелиновой (гептандиовой) кислоты, ацетона и других необходимых реагентов нециклического строения.
СН3 [А]
6-27. Из бициклического алкена А и неорганических реагентов получите ароматический углеводород азулен [Б]. Напишите продукт формилирования азулена по Вильсмейеру с ДМФА и РОСД.
[А]
[Б]
6-28. Из диэтилового эфира октандиовой кислоты и других необходимых реагентов получите циклотетрадецен.
6-29. В распоряжении имеются циклопентанон, акролеин, этиленгликоль и другие необходимые реагенты. Получите бициклический кетон А и превратите его в трициклический дикетон Б.
[Б]
[А]
6-30. Из бицикло[2,2,1]гептена-2 (норборнен) [А], малонового эфира и других необходимых реагентов получите карбоновую кислоту Б.
соон [Б]
[А]
72 Задачи
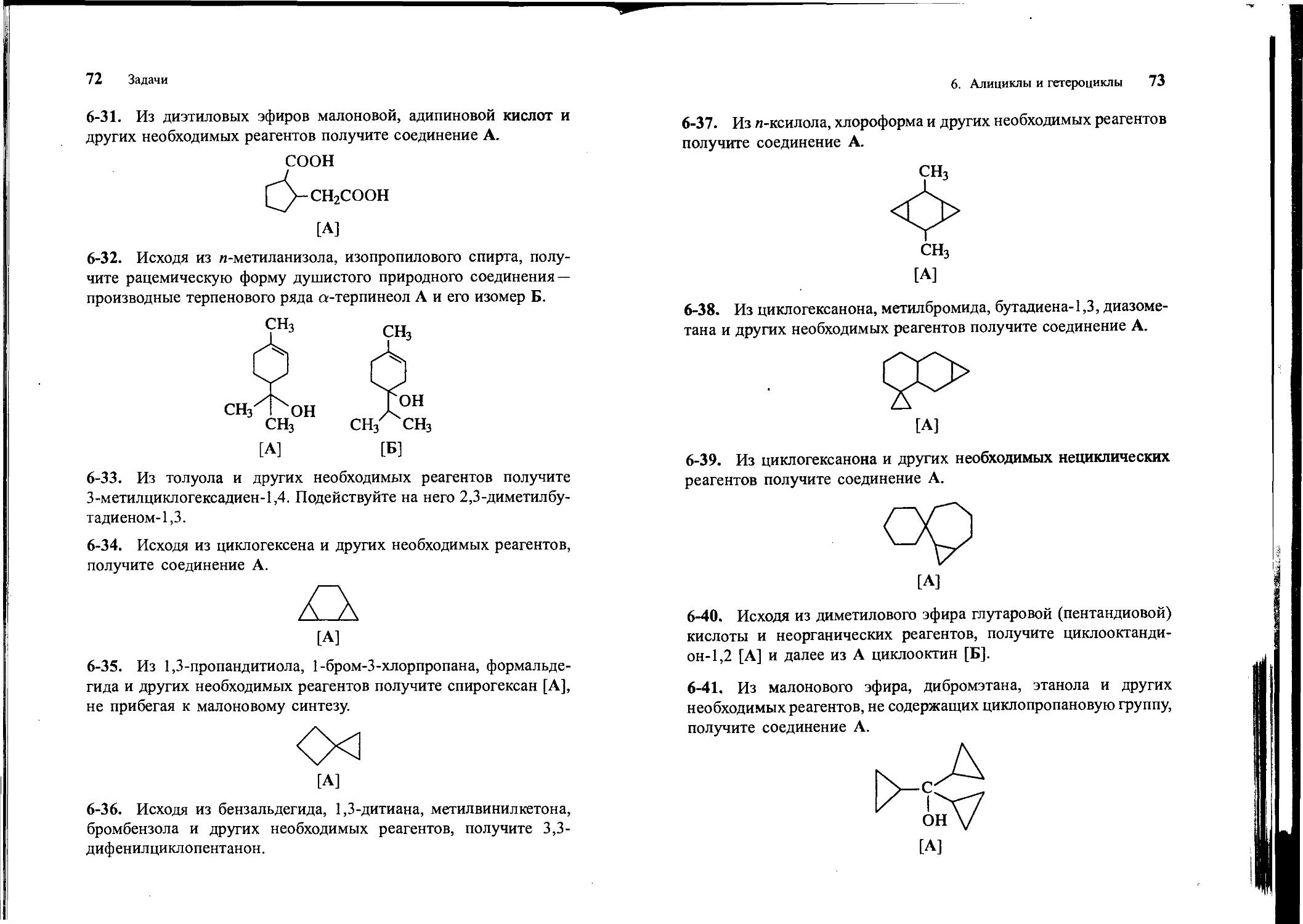
6-31. Из диэтиловых эфиров малоновой, адипиновой кислот и других необходимых реагентов получите соединение А.
СООН
СН2СООН
[А]
6-32. Исходя из л-метиланизола, изопропилового спирта, получите рацемическую форму душистого природного соединения — производные терпенового ряда «-терпинеол А и его изомер Б.
СН3
[А]
6-33. Из толуола и других необходимых реагентов получите З-метилциклогексадиен-1,4. Подействуйте на него 2,3-диметилбу-тадиеном-1,3.
6-34. Исходя из циклогексена и других необходимых реагентов, получите соединение А.
[А]
6-35. Из 1,3-пропандитиола, 1-бром-3-хлорпропана, формальдегида и других необходимых реагентов получите спирогексан [А], не прибегая к малоновому синтезу
6-36. Исходя из бензальдегида, 1,3-дитиана, метилвинилкетона, бромбензола и других необходимых реагентов, получите 3,3-диф енил цикл опентанон.
6. Алициклы и гетероциклы 73
6-37. Из л-ксилола, хлороформа и других необходимых реагентов получите соединение А.
СН3 [А]
6-38. Из циклогексанона, метилбромида, бутадиена-1,3, диазометана и других необходимых реагентов получите соединение А.
[А]
6-39. Из циклогексанона и других необходимых нециклических реагентов получите соединение А.
[А]
6-40. Исходя из диметилового эфира глутаровой (пентандиовой) кислоты и неорганических реагентов, получите циклооктанди-он-1,2 [А] и далее из А циклооктин [Б].
6-41. Из малонового эфира, дибромэтана, этанола и других необходимых реагентов, не содержащих циклопропановую группу, получите соединение А.
74 Задачи
6-42. Из ацетона, малонового эфира, метилиодида и других необходимых реагентов получите несопряженный 3,3,6,6-тетраме-тилциклогексадиен-1,4.
6-43. В распоряжении имеются о-ксилол, малоновый эфир, ди-бромэтан и другие необходимые реагенты. Получите дикетон А.
6-44. Из циклогексанона, анилина и других необходимых нециклических реагентов получите ЬГ-метил-2,3-циклогептеноиндол [А].
6-45. Из ацетилена, малеиновой кислоты и неорганических реагентов получите соединение А.
/VCH3
сн^-соосн3
[А]
6-46. Исходя из 2,6-диметилциклогексанона, метилового эфира акриловой кислоты, триметилхлорсилана, этанола и неорганических реагентов, получите бициклический углеводород А.
[А]
6. Алициклы и гетероциклы 75
6-47. Расшифруйте возможную схему синтеза алкалоида никотина [Г]:
1. RMgBrfAl т, 1. CHjNH^ „ 1. НВг (кони! тт хт •J) 2. н2о k Б 2. Н^’^ В Ткт------------------v C10H14N2
N никотин
[Г]
R=C6H5OCH2CH2CH2CH2-
Получите алкилбромид для реактива Гриньяра [А], исходя из З-бромпропанола-1 и фенола.
6-48. Предложите способ синтеза триоксазина [А] (морфолид галловой кислоты; транквилизатор), исходя из гваякола (2-меток-сифенол), морфолина и других необходимых реагентов.
сн3и
[А]
6-49. Исходя из циклогексанона, винилбромида, этиленгликоля и других необходимых реагентов, получите дикетон А.
[А]
6-50. В распоряжении имеются ацетон, малеиновый ангидрид и другие необходимые реагенты. Получите соединение А.
[А]
76 Задачи
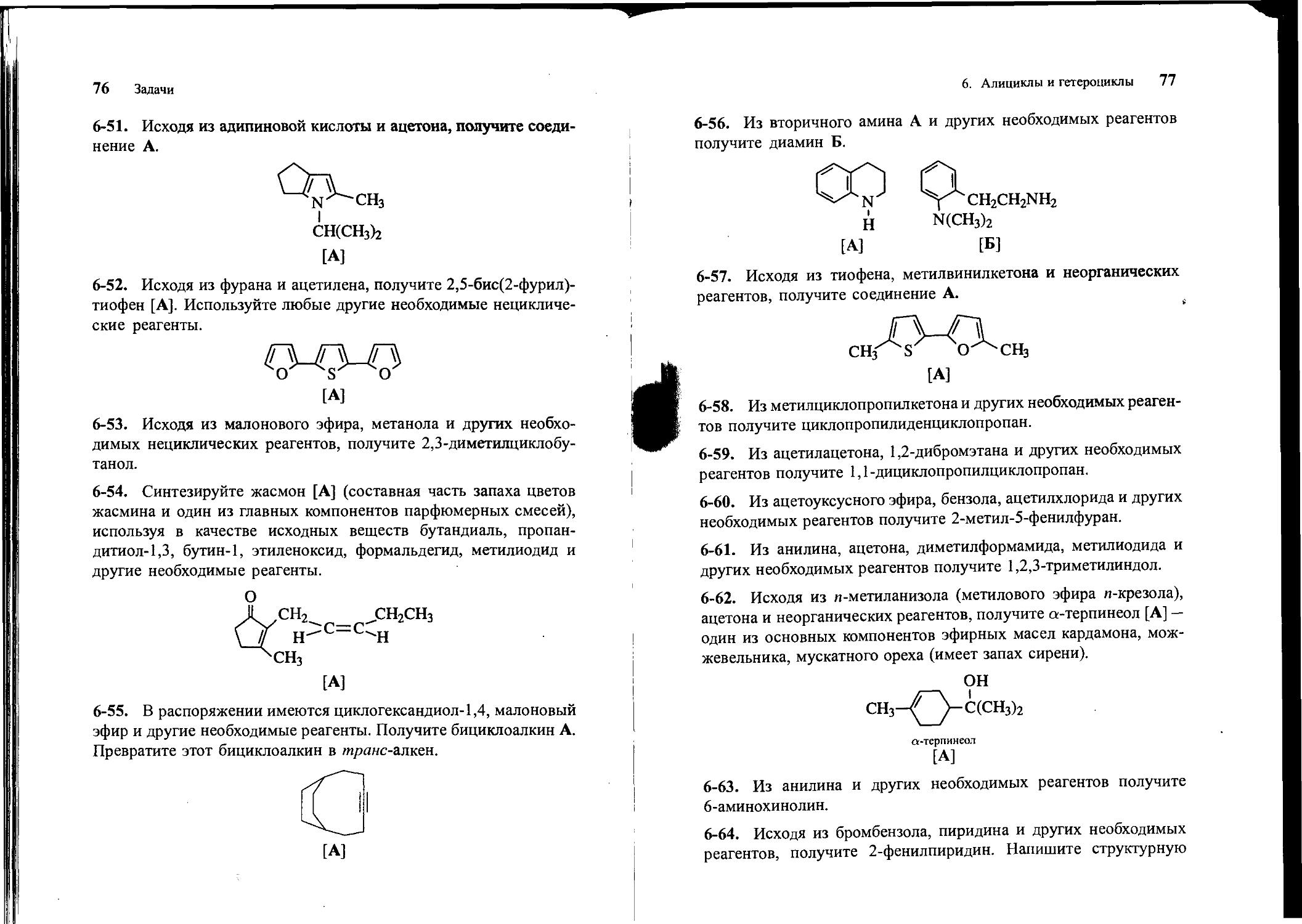
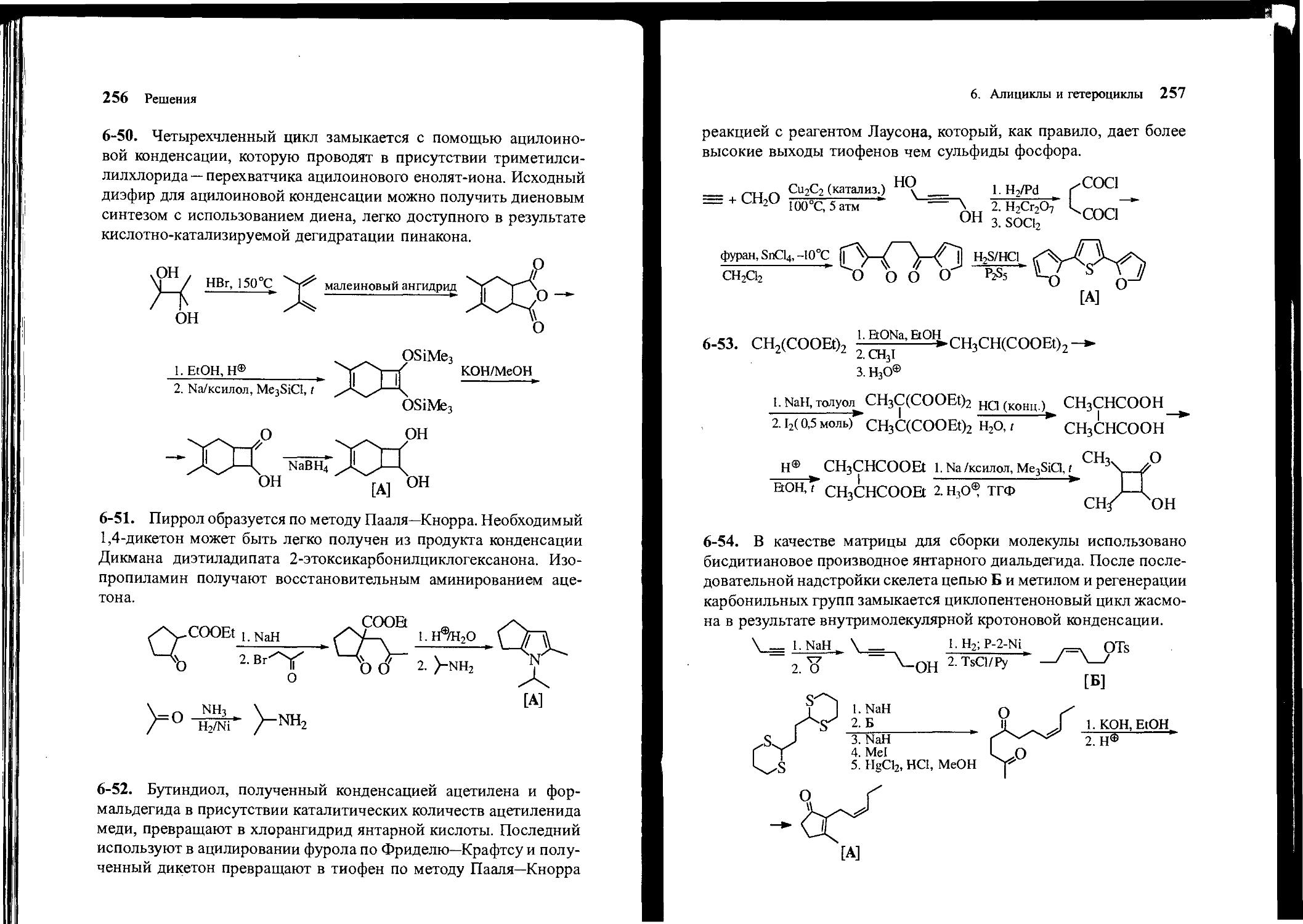
6-51. Исходя из адипиновой кислоты и ацетона, получите соединение А.
СН(СН3)2
[А]
6-52. Исходя из фурана и ацетилена, получите 2,5-бис(2-фурил)-тиофен [А]. Используйте любые другие необходимые нециклические реагенты.
[А]
6-53. Исходя из малонового эфира, метанола и других необходимых нециклических реагентов, получите 2,3-диметилциклобу-танол.
6-54. Синтезируйте жасмон [А] (составная часть запаха цветов жасмина и один из главных компонентов парфюмерных смесей), используя в качестве исходных веществ бутандиаль, пропандитиол-1,3, бутин-1, этиленоксид, формальдегид, метилиодид и другие необходимые реагенты.
S СН^ СИ2СНз
\J
^СН3
[А]
6-55. В распоряжении имеются циклогександиол-1,4, мало новый эфир и другие необходимые реагенты. Получите бициклоалкин А. Превратите этот бициклоалкин в транс-алкен.
[А]
6. Алициклы и гетероциклы 77
6-56. Из вторичного амина А и других необходимых реагентов получите диамин Б.
Н
[А]
'y^CH2CH2NH2
N(CH3)2
[Б]
6-57. Исходя из тиофена, метилвинилкетона и неорганических реагентов, получите соединение А.
СН3 S О^СНз
[А]
6-58. Из метилциклопропилкетона и других необходимых реагентов получите циклопропилиденциклопропан.
6-59. Из ацетилацетона, 1,2-дибромэтана и других необходимых реагентов получите 1,1-дициклопропилциклопропан.
6-60. Из ацетоуксусного эфира, бензола, ацетилхлорида и других необходимых реагентов получите 2-метил-5-фенилфуран.
6-61. Из анилина, ацетона, диметилформамида, метилиодида и других необходимых реагентов получите 1,2,3-триметилиндол.
6-62. Исходя из л-метиланизола (метилового эфира л-крезола), ацетона и неорганических реагентов, получите а-терпинеол [А] — один из основных компонентов эфирных масел кардамона, можжевельника, мускатного ореха (имеет запах сирени).
ОН
СН3-С(СН3)2
а-терпинеол
[А]
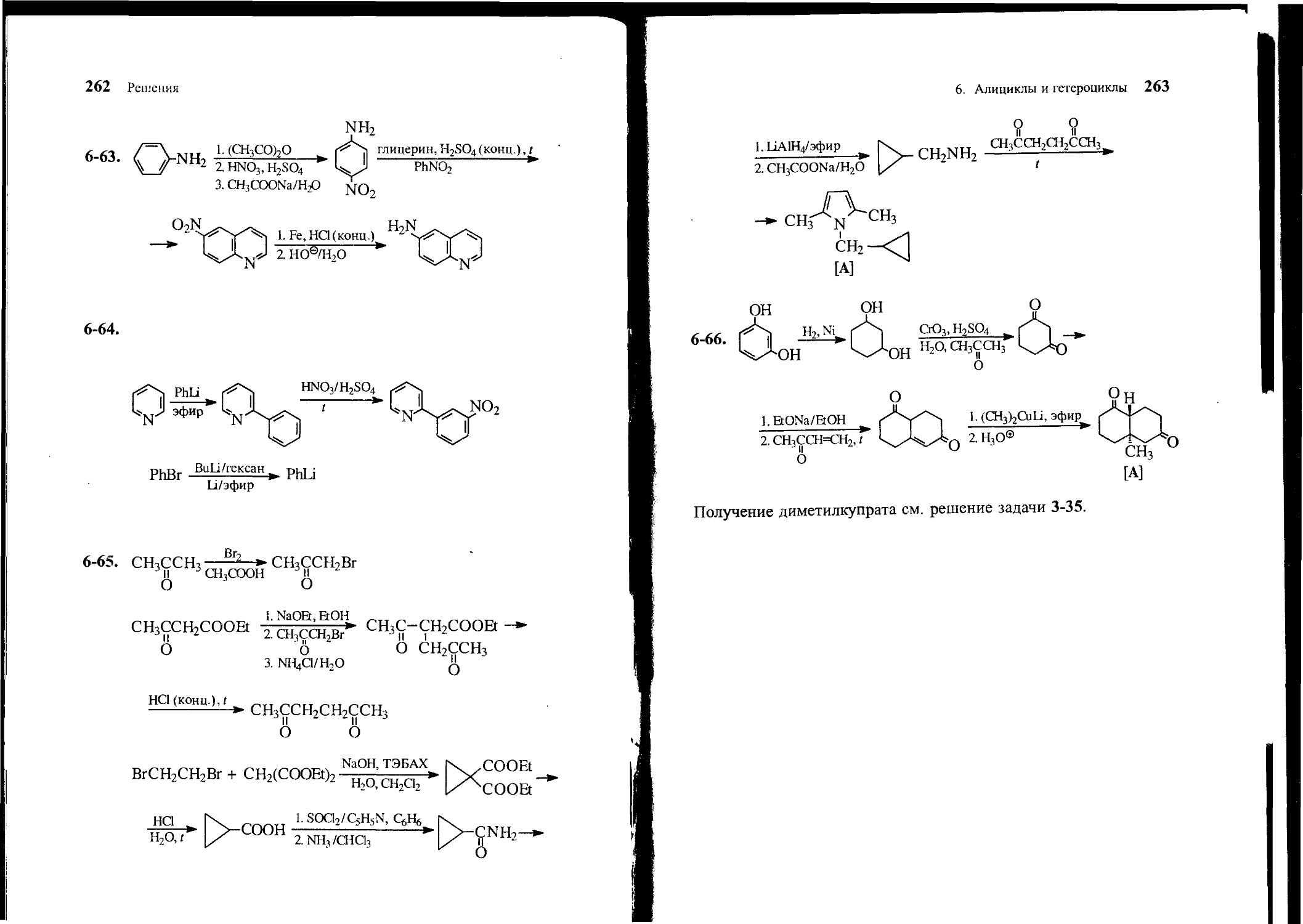
6-63. Из анилина и других необходимых реагентов получите 6-аминохинолин.
6-64. Исходя из бромбензола, пиридина и других необходимых реагентов, получите 2-фенилпиридин. Напишите структурную
78 Задачи
формулу продукта нитрования 2-фенилпиридина нитрующей смесью.
6-65. Исходя из ацетоуксусного эфира, ацетона, дибромэтана, малонового эфира и других необходимых реагентов, получите М-(циклопропилметил)-2,5-диметилпиррол.
СН3
^n-ch2-<]
сн3
[А]
6-66. Из резорцина (1,3-дигидроксибензол), метилвинилкетона, метилиодида и других необходимых реагентов получите бициклический дикетон А.
ОН
дн3
[А]
I
РЕШЕНИЯ
Глава 1
АЛКАНЫ, АЛКЕНЫ, АЛКИНЫ, ДИЕНЫ
1-1. а) С1СН=СНОС2Н5 —С1->- CICHj-CH-OqHj Cl
Br,,LiBr*
б) С1СН=СНОС2Н5 —-—-
-*► С1СН-СН-ОС2Н5+С1СН-СН-ОС2Н5
Вг Вг* Вг Вг
1-2. a) CF3-CH=CH-CH(CH3)2-^£1*CF3-CH2-CH-CH(CH3)2
[А] С1
СН3-СН=СН-СООН CHj-CH-CHj-COOH
[Б] 6
б)
Br,,LiBr* CF3-CH=CH-CH(CH3)2---------
[А]
-*> CF3-CH-CH-CH(CH3)2 + CF3-CH-CH-CH(CH3)2 Вг Вг* Вг Вг
Br,,LiBr* сн3-сн=сн-соон —г-----*
[Б]
— СНз-СН-СН-СООН + СНз-СН-СН-СООН Вг* Вг Вг Вг
80 Решения
1-3.
H С H Вг Н
"А / _В£2_ н ' с'_сн 2кон_____________________
CClj.O't M3V Л Л 3 НО(СН,СН2О)3Н, 290^0
Н СНз н Вг
„тт г_ггтт 1- ДИБАЛ-Н/толуол, ОТ ЩС СН3 DPd/c
СН3С-ССН3 2 СН3ОН с=с ----------*•
н н
D _ D
S.-CH3 Rp SH3
_ H-C-C-H == H.C" c-c"I CH,=>H- д D = D / \ \ H--D D
СИз ,-S-H i-f-H СНз СНз мезо-форма
D D H H
мезо-форма
1 А МГ =ГИ l-NaNH,/NH3(«.) LNaN^/NH^ W,
1-4. MV-си 2. с2Н5Вг/ТГФ 2. С2Н5Вг/ТГФ
„ „ г=гг тт 1- ДИБАЛ-Н/толуол, (УС, С2П5С-СС2П5 2 с2Н5ОН
с2н5х C2Hs
/С=Сч н н
l.OsO4________
2,NaHSO3/H2o’
_^C2HS, R s _________ но pH
н-р~сгн = c!H?.Jcs_«..c2H! HO OH ^езр-форма H H
C2H5 C2H5
H-S-OH = но^-н
н-4-он ho^-h
c2H5 C2H5
мезо-форма
1-5. a) H2C=CH-COOC2H5-^r*H2C-CH-COOC2H5
[A] Cl 1
[Б]
1. Алканы, алкены, алкины, диены 81
б)
н Г-ГН-СООС И ^(ОАсуСНзОН-ТГФ.гоЧС lljC-CH LOUGHS 2,NaBH4/H2O fA]
н,с-сн2-соос,н, осн3
Ph
1. Hg(OAc)2/CH3OH—ТГФ, 20°C 3
2. NaBH4/H2O 4/
[Б]
1-6. a)
NC-CH=CH-OCH3^^ [A]
NC-CH-CH-OCH3
Cl
6)
C2H5-CH=CH-Ph-^ [Б]
C2HS-CH£-CH-Ph di
NC-CH=CH-OCH3 [A]
P
NC-CH-CH-OCHL ——* NC-CH-C ci дн 3 -CH’OH Cl H
C2H5-CH=CH-Ph-^—*- C2H5-CH-CH-Ph [Б] Cl OH
1 7 ИС=СН 1-NaNH2/NH3(ж.) 1. NaNH2/NH3(ж.^
1-7. HC-CH 2 СН31/ТГФ *CH3C-CH 2. СН31/ТГФ
_____ 1.8й2ВН/ТГФ,0рС
—*CH3C=CCH3 2. СНзСООН, 204:*
/CH3 NBS, (PhCOO)2
~* /С=С\ СС14,804: *
н н
ВгСН2ч СНз
С=С / \ н н
1.05О4/эфир _
2.NaHSO3/HjO
«Л1
H'.R Г. С—С Bi€H2Z| |ЧСН3 но он энантиомеры
НО он
+ Н/.^С^-.'Н =>
BrCHf ЪНз
•эриот/ю-формы
CHjBr
н^-он
н^он сн3
9Н2Вг
HO--H
HO^j-H сн3
энантиомеры эритро-формы
82 Решения
1-8. Способ 1.
«-ед н ВГ2____________
ед-н сс‘4’ 0°С
«-СдНц С С С^-и НСХСН2СН2О)3Н, 290°С
н-С4Н9С=СС4Н9-«
1, ДИБАЛ-Н/толуол, 0°С_
2. С2Н3ОН
н-с4Н9 С4Н9-н
1-9.
Н Н
Способ 2.
С1
СУсо3н
СН2С12
l.Sia^H/ТГФ, 0сС
н-С4Н^ Н Ph3P, t
ТСЛ -РКРО*
н о ед-н
2.NaOH—Н2О2/Н2О
СН.ОН
[А]
1. Hg(OAc)2/H2O—ТГФ, 20^С _
2. NaBH4/H2O *
[Б]
НВг сн3соон
кон С2Н5ОН
НзС Н н 1.ВН3/ТГФ
2. NaOH—[J" ОН
[В]
1. Алканы, алкены, алкины, диены 83
1-10.
СН2=СН-СН3 СН3СН2СН2Вг
нс=сн DuLi —> пг=гг; w-C3H7Br nv-LH тгф 25Ос НС-СЫ ТГф; 25°С
Cu,Cl„ О,
НС=С-С3Н7-н СН3ОН—Ру*
си-с=с-с=с-ги ц l-SiajWlTO.oqc н Н
""Ч0? v-c 2.СН3СООН/ТГФ \=/
,-Н
или НуР-2-Ni,______________ "’<-зп7 сч
С2Н;ОН—NHjCHjCHjNHj, 2(У£ Н Н (ZJZ)
_ Sia2BH
Л-С3Н7-С = СН ТГф, QOQ
«-с3н7 н
1-11.
1. CH3ONa/TTO, 0°С
Н
Н Н
BSi^
2. Cu2Br2, ЗССНзУТГФ и-СД
Н Н
С3Н7-и (£,Е)
сн3-сн2-сн2-он
85%-наяН3РО4, 17QAC
* ♦ ♦ Вг,
-*сн3-сн=сн2с^
сн3-сн-сн7
з I I 2
Вг Вг
l.NaNH2/NH3(»Q
2. Н2О
--►СН3-С=СН CH3-C=CLi
* * * KBr.HjSQ, , * . CIL-C^CLi
сн3-сн2-сн2-он-----------сн3-сн2-сн2-Вг
.о
'ВН.ТТФ, 65ЯС о
СНз-С^С-СЬ^СЬ^СНз
СНзСНзСН^СНз н bc^qh4
Br2;CH/JNa CHjCHjCH, СН3
СН,ОН * ‘УК*
Н Вг
84 Решения
CHjCHj CH, 1-12. >=<
Н Н
Чис-пентен-2 [А]
3 CHjCHjCOOH + снрэон
Вг2 cci;
н н
?Г хН Н'''С-С* нД Гсн^
од
н- - Вг
Вг—pH СНз
<рН5 -Д-ц
--Вг СНз
энантиомеры трео-формы [Б]
энантиомеры трео-формы
CHjCHj _ СНз н н
1. OsOj/C^N*
2. NaHSOj/HjO
ОН ОН
Нр'С—С’"Н
р V-* ^-z S.C —
WH,
CjH, но- - н но—pH
СНз
<?2Н5 н-*-он н-рОН
СНз
энантиомеры эритро-формы
[В]
энантиомеры эритро-формы
С2Н5 СН3
1-13. >=<
Н3С С2Н5 (£)-3,4-Диметилгексеи-3
[А]
СгН5\=/СНз 1O3/CH2C12,-78AQ и_г_ги
н,с од2 р‘>р ’Os’
[Б]
1. Алканы, алкены, алкины, диены 85
С2Н5 СИ3 Вг2
НзС С2Н5СС'4
?Г чС2Н5 cd Гсн>
лезо-форма
[В]
С2Н, с,н,
Вг-—СН3 __ HjC—^~Вг
Вг~рСН3 - Н3С—рВг с2н5 с2н5
мезо- форма
с2н5 _ сн3
н3с с2н5
1.ВН3_____
г.нр^оно/нр
С^,Я 5>СНз ^с-с.
н,с^ I I Vh, 3 ОН Н 5
ед НО--СН, HjC-f-H
ед5
<рН5
FLC-S-OH Н-КсНз ед5
рацемат
рацемат
[Г]
(СНАСОК Х\г>СН2 РВг
1-14. |I ДМСО, t * I I CHjCOOD
Вг Г"[~СН;Р
КОН с2н5он, Г
CH,D
HjC Вг2, 9Н3 Рг (СН3)3СОК
1-15. (^СН-ед с±5н* HjC-C—CH-CH ;zmCq 7' HjC OCHjCHj
H^-t-CH.CH, н,с
оснед
СНз 9 Р -с—CH-CHj dcHjCHj
86 Решения
1-16. Cjt^OBr \.CHBr
(рн2-сн2-сн2-сн=сн2 -Ц|»-он 4
:0: н
H2 /СНг-СНг
* CH2^®/CH
СНзВг "9 CHjBr
-НВт ^Q^CHjBr
CHjOH 1-17. CHy-C-C^C^CF^
СН,ОН
НО-CH, @
-* CHfC"CH’^CH-CH2HgOC(O)CF3
CHj-QH
(CF3COO),H^
ТГФ *
НО-СНг
CHftXH2~CH-CH2HgOC(O)CF3
CF3C(O)O®
-CF3COOH:
H
HO-CHj
CH3-C>CH2'CH-CH2HgOCXO)CF3
CHrO
HO—CH,
СНз-С^И^СН-СН,
CHj-0
[A]
А имеет два асимметрических атома углерода, поэтому реализуется четыре пространственных изомера.
1. Алканы, алкены, алкнны, диены 87.
1-18. СН^СН-СН^СН^СН^СЬ^СН^
— сн2-сн-сн2сн2сн2сн=сн2 Вг ОН 2
xCHrCtL ©
CHfCH ^СН-СНз Вг \q. Вг
_ СН, сн2
* ZCH сн BrCH, XoZ СЬ^Вг
н
Вг°
-НВг
ВгСН/ О СН2Вг
Вг
№NH/NH3(»J
- Wb J 1 J
4 Вг
ГН r=rrH 1 • NH2(CH2)3NH К®/ NH2(CH2)3NH2,20°С
СН3 С- ССНз 2. Н2О
1. NaNH,/NH, (ж.) СНзСН^СН 2 ^зВ;..........
И» Р-2-Ni, ______
N^/NH3»> сНзС^-СЛ-СНз н
Вг
CJc";D W
1-20.
CH2D р2, pd/c
СН2 РВг
СН3СООР
CH2D 1,вн3/тгф
2. H2O2; NaOH/HjO к/
[А]
£H2D M"D Н
[Б]
88 Решения
1-21.
гн=гн 1-Na/NH3(*.) rH=r_^„ Sia2BH _
CH-CH 2 с2н5Вг/ТГФ СН-С-СНгСНз 0
» Н^_^СН2СНз СНдСООР Ц>_/СН2СН3 SiajB Н D Н
транс-1 -дейтеро бутен-1 [А]
СН=С-СН,СН. к а^ВВ/ТГФ.ОТ
2.СН3СООН
CH^C-CHjCHj Ь
[Б]
1-22.
1 НВг , СН3СООН
С2Н5ОН
СН3 l.Si^BH/ТТФ
2. CH.COOD
Н
----н
D [А]
! НВг ; СН3СООН
СИз
С2Н5ОН
СНз l.Si^BD, ТГФ
2. СН3СООН
СН3
Н
IB]
1-23.
снэсн=сн-сн!сн1сн, ^н^н,».Г
— CH^C-CHjCHjCHjCHj
CHjCHjCHjCHjCOOH + со2
1. Алканы, алкены, алкины, диены 89
1-24. CHjCHjCHCH^ 2 NgNHj/NH3 (Ж.*
г^тт рц р=гц 1. LDA/ТГФ “*'-н3СМ2С СН 2. СН3Вг
— СН СН,С=С~СН *• Ш2(СН2)зКН K®/NH2(CH2)3NH2,20oC
3 *2 3 2. HjO
^*сн3сн2сн2с=сн
1-25. CHjCHjCH CHCHjCHj ^NaNH^/NH^T
-С^СН^СС^СН, I-WChA^/nh^NH^O^C
1. Sia2BH/TT<D,O°C
-* CH3CH2CH2CH2C=CH 2 NaOH/H2o^
/О
-* сн3сн2сн2сн2сн2с'
l.NaNH,/NH,fa.) _ Cu,Cl„ О,
1-26. СН=СН 2.с2Н3Вг/ТГФ СН3СН2С=СН с^оц
1. SiaiBH/ТГФ, 0°С
— CHjCHjC^C-C^CCHjCHj Га7зсбон—*
н н
Н Н
ci а
СНС13, NaOH, ТЭБАХ^ Н^б
Na—СНрН эфир
Для восстановления гем-дигалогенидов можно также использовать системы: Zn/СНзСООН и Na/NH3 (ж.); Li/znpezn-бутанол.
90 Решения
_ сн, 1-27. Z-BuOH CCHj СНз [A]
CH3 СНз W ,СН.
—*Н3С-С-СН2-С=СН2 + НзС-С-СН=С. 3
СНз СНз СНз
[Б] 80% [В] 20%
(изомеры С8Н16)
H^PtO-, С2Н5ОН, 20°С
1-28.
СН3 СН3
-^HjC-C-CH^CH
СН3 СНз
Вг2 (1 моль), ЙУ СС14, 20°С
СН3 СН3
HjC-C-CH^-C-СНз
СНз Вг
(СНОСОК (СН3)3СОН
СН3 СН3
-* НзС-С-СНз-С^Нг СН3
[Б] (главный продукт)
СН3 н3с-сн_ сн3
H3C
сн-сн,
I 3
СНз
(£)-2,3,4,5-тетраметилгексен-3 (С^Н^)
[А]
А
1. о3 НзСч
2. Zn/CHjCOOH* 2г,^СН-д”СНз Н3С б
А
1. RCOOOH г
2. Н2О, ОН®
СИ3?11 сн, НзС-СН,,^.^
u I \н-СНз
Н3С ОН^нз
сн3
СН-СН3 НзС-^-ОН H3CT-OH
СН-СН3
мезо -форма
сн3 [Б]
1. Алканы, алкены, алкины, диены
91
1-29.
<?Н>Г<г СН
_В£^ ЦС-СН^^А
£< I 'сн-сн,
Н,с Вг feHj
. 1-РН3
2. Н2О2-ОН®/Н2О
сн3
HjC-CH сн3
j '.R S' zc-c ' нД| рсьь но
сн3
СН-СНз НО--СН H3C-^H сн-сн3 СНз
1з
мезо -форма
-сн3 йсн3
рацемат
сн3 сн-сн3 -Чэн
[3
рацемат [Г]
ELC
QH-CH сн3
CHjCI^ _ CHjCHj
Н3С СН3
(Z)-3,4-диметил гексеи-3 (С8Н16)
[А]
сн3
сн-сн3
Н,С~ —Вг
Н7С-|^Вг
СН-СНз сн3
[В]
1з
з
СН, и нрсн, ?н 'с—с
4s
н3с
сн-сн3 сн3
а Р 78^0 СН-С-СН
А 2. Zn/CH3COOH 2СН3СН2^ CHj
l.OsCyc^N
А 2, NaHSO3/H2O
СН3СН2 СНзСНз r s С—С н с* I I '’СНз ОН ОН мезо -форма
С^СНз но--сн3
-^СН3 СНзСНз [Б]
92 Решения
CI^CHj CHjCH3 (
л 1РН/ГГФ "'•ЛД''4 н- tCH3
‘ 2-СН3СООН Л У>сн п- Н3С н н 3 ( мезо -форма - сн3 ^СНз [В]
Вг, снр\ ,?гсн,сн, сн3сн, ?г CHjCHj
' н=с ,'(г сн> н,с" & 3 1J1 рацемат 3
( :^сНз CHjCHj
Вг- JCH3 н3с- *-Вг
HjC- -Вг Вг- - СНз
CHjCH3 ( З^СНз
рацемат
[г]
,сс1 сн3сн2< чЧсн2сн3 д 2 » '‘q—с'4
СС12СН3 [Д]
1 СТТ~СГТ NaNH2/NH3 (ж.) г’о—г»— рт-г 2 BuLi 1-30. СН-СН 2 с2Н5Вг/тГф ’►CHjCHj С-СН——80с>
— CH3CH_C=CLi Li сн3сн-с=сн
CH, С2Н5ОН, NH2CH2CH2NHj, 20°С
9н3
сеют -
О
Н„ Р-2-Ni
NBS, (PhCOO),, Av
СН3СН-СН=СН2—---------
сн3
сн3 I з
1. Алканы, алкены, алкины, диены 93
CH.Mgl D,O
1-31. СН3СН?С=СН э^и ° > CHjCHjC^CMgl —
1. Sia.BH/ТГФ, 0°С СН3СН,С=СО Тсн^собн—*
CHjCH, __ D Н^Н
[А]
СЬЦСН^С^СН
l .^BH/ТГФ, 0°С CH3CH2\__ZH ь
2 . CHjCOOD
о CH3CHj D Hg(OCCF3)2 НН сн’он
[А]
сн3о
— С^СН^-Л, Н Н [В]
Н [Б]
СН3О СКСНг-с-о!?,
Н HgOC(O)CF3
NaBD^ D2O*
Аналогичным образом можно осуществить синтез В из Б.
1-32. СИ =СН-СН3 HBr; Z(-Bu-^^ СНзС^С^Вг
СН^СН-СНз NBcSciPh80^))?’^ СН^СН-СНэВг
l.NaNHyWac.) г„=р_р „ и l.H-BuLi/ТГФ, 20^С CH-Cti 2 к с^ВгдГф сн-с ЧПу-" 2.СН2=СН-СН2Вг
1. OsO./C5H5N
—* СН2=СН-СН2-С=С-СН2СН2СН3 2 NaHSOj/HjO*
— CH^CH-CHj-C^C-CHjC^CHj
ОН он
94 Решения
1-33. СН2 СН2 CH3COOD * BrCHjCHjD _^„и=гц 1. NaN^/NH, (ж) Lti-LH 2 DrCH2CH2D D„ Pd/BaSO,, хинолин — CH-C СН.СНР c;H-oH -*CHD=CD-CHCHD lsiaW™,0°C CHU CD CHjCHjD 2. H2O2—NaOH/H2O — D-CH-CHD-CHjCHjD OH
1-34. /"Ч4~Г'ТТ 1- NaNH2/NH3 (ж.^ r^ii—!• NaNH?/ NH3 (Ж-Ь сн-сн 1сн,1/тгФ v C1I-CCH3 ra.vlri1 * .гц рхггц Р-2-Ni <,П31,_V.L.I13 C2H5oH_NH2CH2CH2Ni72 —сн3сн=снсн3 -^сег?00^’ /'v> ВгСн2сн=снсн2вг цис 41 цис ^.тт г.тг NaNH2 „жт СН-СН Nn^^CH-CNa вгсн2сн=снсн2вг ^^-а(2экв')» цис -+нс=ссн2сн=снсн2с=сн ^S°4» Н-7О цис -* СН3С(О)СН2СН=СНСН2С(О)СН3 цис [А]
1-35. Oi, Ag сн2-сн2^^ \ у 0 нс=сн сн=ссн2сн2он 2. этиленоксвд/эфир 2. РпСН2Вг 3. нр® _^CH-CCII,Cll,OCll,Ph 3. Н3О®
1. Алканы, алкены, алкины, диены 95
-*HOCH2CECCH2CH2OCH2Ph
— PhCH2OCH2C=CCH2CH2OCH2Ph
[А]
1-36.
СН=СН + 2НСН0 CuC-CCu
P<t
О
СгОз, Н2О—СН3ССН3 HOCH^fCCH^H----------------:—►
НООСС=ССООН^^-^СН3ООСС=ССООСН3
СН2=СН-СН=СН2 +СН3ООСС^ССООСН3 эфи^^
^.СООСНз
СООСНз
СООСНз
+ сн2=сн-сн=сн2
СООСНз
эфир, 25 °C
СООСНз
СООСНз
[А]
1-37.
96 Решения
СиС»ССи,2СН3С(О)СНз г Hg2^80^
Н=СН —t-------------►(СН&СС=СС(СНз)2 —-------►
ОН ОН
СНз о СНз
-^сн3^\ / "СНз
о7
[А]
1 10 ги=гН INaNHyNHH*.) 1,0.^___________.
1-ЛУ. СН-СН 2 (^^ВгЯГФ ^2п5'—’-п 2. К3[Ре(СМ)б]/ДМФА
-* С2Н5СеС-С=сс2н5 с2н5сн=сн-сн=снс2н5 J —55 с ЕЕ
СН=СН 2-Ок£ НОСН2С=ССН2ОН --------г-»-
СН2С1> 25 С
—*- ОНССЕССНО EtOOCCECCOOEt
Z. V2H5OH., п
[А]
Глава 2
НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АЛИФАТИЧЕСКОМ РЯДУ, ЭЛИМИНИРОВАНИЕ
2-1.
С2Н5
—ОН СНз
С2Н5 Н——OTs СНз
KF; 18-краун-6
CH3CN ”
с2н5
F— — Н
СНз [А]
с2н5 н—р~ОН СНз
PhjP • Вг2 ДМФА '
С2Н5
Вг—р-Н СНз
NaSH
ДМФА
С2Н5
р—SH СНз [Б]
С2Н5
Н—р-ОН СНз
РЬзР.Вг2^ ДМФА *
С2Н5
Вг—р-Н СНз
AgzCOj »
С2Н5ОН—Н2О
С2Н5 С2Н5
н—р-ОС2Н5 + С2Н5О—р-н
СНз rni СНз
С2Н5 С2Н5 с2н5
-> тт^ |S и TsCl, ~ „ Is и KF; 18-краун-6 д 2-2. НО-р-Н -р—* TsO—р~Н H-f—F
СНз СНз СНз
[А]
CH3COCI; PhNMe2
толуол или Et2O
[Б]
С2Н5 но—р-н
С2Н5
СН3С(О)О—р-Н СНз
4—3771
98 Решения
HQ
c2H5 -|^-н СНз
Ph3P • Вгг ДМФА * Н
С2Н5
Вг
СНз
HCOOAg НСООН
Н
С2Н5
-|^-ОС(О)Н + Н(0)СО
CHi [В]
С2н5
-f-н
СНз
2-3. а) Механизм Е2; скорость реакции в ДМСО (2) больше, чем в С2Н5ОН (1).
б) Механизм SN1; скорость реакции в Н2О (1) больше, чем в Н20/ацетон (2).
в) Механизм Sn2; скорость реакции в ДМФА (2) больше, чем в СН3 ОН (1).
2-4. а) Механизм SnI; скорость реакции в Н2О (1) больше, чем в Н20/диоксан (2).
б) Механизм Sn2; скорость реакции в ДМФА (2) больше, чем в Н2О (1).
в) Механизм Е2; скорость реакции в ДМСО (2) больше, чем в Н2О (1).
2-5. а) Механизм SnI; скорость реакции в Н2О (1) больше, чем в С2Н5ОН (2).
б) Механизм Sn2; скорость реакции в СН3ОН (2) больше, чем в Н2О (1).
в) Механизм Е2; скорость реакции в ДМСО (2) больше, чем в Н2О (1).
2-6. Механизм Sn 1.
(и-СН3ОС6Н4)2СНС1 (С6Н5)3СС1 > (С6Н5)2СНС1 >
> С6Н5СН2С1 > (СН3)3СС1 > СН3(С2Н5)СНС1 >
> СН3СН2СН2СН2С1
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 99
2-7. Механизм Sn2.
CH3COCH2CI > С6Н5СН2С1 > СН2=СНСН2С1 > СН3С1 > > СН3СН2СН2С1 > (СН3)2СНСН2С1 > > СНз СН2 СН(СН3 )С1 > СН2=СНС1
2-8. А = СН3СН(ОН)СН2С1 Б = СН2(ОН)СН2СН2С1 В = (СН3)2СНС1
2-9.
a) CH3CH2CH(CH3)OTs > СН3СН2СН(СН3)С1
б) C6H5CH2OTf > С6Н5СН2ОАс; OTf = OSO2CF3
в) CH3CH(Br)CH2N(CH3)2 > (CH3)2CHBr
г)
a.iSC2H5 'Вг
aSC2H5
Вг
2-10. СН2=СН(СЩ)2СН2ОН^^^CH2=CH(CH2)2CH2MgCl a°H K2Cr2O7;H2SO4 1- CH2=CH(CH2)2CH2MgCl/ Et2Or
” 2. H3O®
CH2(CH2)2CH=CH2
a OH 1- Н^ОАс)2/ТГФ X
2. NaBH4/CH3OH О CH3
[A]
Br
Bro 1
2-11. CH3CH2CH=CHCH2CH3 CH3CH2CH-CHCH2CH3-*
Br
2NaNH2/NH3fe,),-33°C
CH3CH2C= CCH2CH3 —►
K®NH(CH2)3NH2 (KAPA)
NH2(CH2)3NH2,20°C , 5 мин
CH3CH2CH2CH2C=C K® —
НвСОАс^НгЗОд II
— CH3CH2CH2CH2C=CH —----------► CH3CH2CH2CH2CCH3
H2U
100 Решения
2-12. (5)-CH3(j?HOTs ^фл > (<S)-CH3CHBr
СН2СН2СН3 СН2СН2СН3
(Л)-СН3СНОН
СН2СН2СН3
TsCl
(5)-СН3СНС=СН
СН2СН2СН3
(7?)-CH3CHOTs -СН2СН2СН3 1. H-BuLi/ТГФ, -25°С 2. (5)-СН3СНВг/ГМФТА—ТГФ/25°С СН2СН2СН3
СН2СН2СН3 (S)-CH3CHC=CCHCH3-(R) 4Sia2BH™\°4 I 2. CHjCOOH, О С
СН2СНгСН3
ЩС=СгН
-* (S)-CH3CH2CH2CHZ 4CHCH2CH2CH3-(R)
сн3 сн3
Li®
„ .. „„ „ 2«-BuLi 0 е д СН31
2-13. СН3СН2С=СН 7Й.» CH3CHC=CLi® ->п°Л
СН3 СН3
^СН3СНС=ёц^сНзСНСНСН^^ТГФ’-К'С..
3 2.СН3СН2Вг/ТГФ, 25 С
K®NH(CH2)3NH2 (КАРА)
(СНз)2СНС=ССН2СНз-Nri2(CH2)3NH2, ^с, 5мин * 0 нгО
—>(СН3)2СНСН2СН2С=СК®-------
1.9-ВВ\/ГГФ
— (СН3)2СНСН2СН2С=СН--------------►
2. Н2О2, NaOH / Н2О
— (СН3)2СНСН2СН2СН2СНО
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 101
2-14. СН3СН=СН2 cS’ K°°h> BrCH2CH=CH2
WI4, OU v JUjU
Na
НОСН2СН=СН2------ NaOCH2CH=CH2
сн,сн-ГН 1Вг2/сси__________NBS.ytcoq^
СНзСН-СН22 2NaNH2/NH3(M.)-33°CCH3C-CH СС1,, 80°С
—-ВгСН2С=СН №ОСН2(У-^
HC=CCH2OCH2C=CH2^^^iHC=CCH20CH2(pHCH2OH
2.NaHSO3 он
[А]
2-15.
СзН? PhjP-Br2 V/H7 NaSH ^Н7 NaQH —H-p-SH —* ДМФА
СНз
С3Н7
СНз
CH3
socb ftH5 н-р-он h-Tci СНз СНз
C3H7 C2H5
-► н-р—S-р-н
СНз СНз
[А]
(«)-CH3CH2CH(CH3)Se ДМФА *
С2Н5 TsCl |о ----н-р—OTs Ру-ДМФА
vrl3
С2Н5
• н—р-он СНз
с2н5
NaBr |£
Вг—Р-Н
СНз
п С2Н5 СНз
(Ю-СН3(СН2)гСН(СН3)5® |/ 3 |Д тт
" НХ
[Б]
102 Решения
2-16.
г н ги-гн 1Вг2/СС1*________________►сС=СН—
С6Н5СН-СН2 2.2НаКН2/НН3(ж.),-33'‘С^бП5------- ROH, NH3
тт ______„ тт Н2, Р-2-Ni
—►CfiHsC—С С-ССбН5 EtOH HjNCHjCHzNHz*
CHCOOEt EtOQQ C6H5
-* PhCH=СН-СН=СНРЬСНСО°-Й»-
Etooc С6Н5
„ COOEt Ph
^c-CH-iH-CH-in-ct
2.Ph3P H lh
Н
COOEt
[А]
_ _______ 1. н-BuLi _
2-17. HC=C—Рг-изо 0 T /тг^ » CH3C=C—Рг-цзо----------
Z. CH3I /114?
H2, Pd, ВаЗОд/хинолин, EtOH
CH3CH=CH-Pr- изо —►
RCOOOH/CH2C12, 20°C „./V ~ MejNH -------------------► CH3C— С—Рг-изо----------*"
I I H H
NMe2
I l.MeI/CH3CN
OH 3. 150°C
4. H3O®
[A]
— CH2=CH-CH-Рг-изо ^^СН2=СН-СН-Рг-изо
OH OTs
(CH2=CH)2CuLi
—----------► CH2=CH-CH—Рг-изо
ТГФ I
CH=CH2
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 103
2-18. А = CH3CH2CH2CH2CH2CI
Б = СНзСН2СН(СНз)СН2С1
В = (СНз)3ССН2С1
Механизм Sn2.
RCH2C1 + EtONa/EtOH—►RCH2OEt + NaCl
2-19. Механизм Sn2.
CH2=CHCH2C1 [5] > MeOTs [2] > н-Bui [1] >
>C5HnCl [4] > (CH3)2CHC1 [6] > (СН3)зССН2С1 [3] > [7]
2-20. Механизм SnI.
СНз ZCH3
сн2=сн—с—Cl С1СН2СН=СХ
Г СН2СН3
[А] СНгСНз [Б]
-С1® -С1в
СНз СН3
сн2=сн—с ® ------- ®СН2СН=С
| СН2Спз
СН2СН3
СН3 сн2=сн-с-он
СН2СН3
[В]
+ но-сн2сн=с
ZCH3 ^СН2СН3
[Г]
104 Решения
2-21.
PBr3
Mg
Br
ОН
MgBr
гн гн пп К2Сг2О7; H2SO4 l.CCH^CHMgBr/Et^
СН3СН2ОН ►СН3СНО 2 н ►
СН3 СНз
I PhjP I (СНОСОК/(СН3)3СОН
—CH3CHCHCH3—* CH3CHCHCH3 ----------------->
| L-C-ц |
ОН С1
СН3
— сн2=снснсн3
[А]
КВг + H7SO4 Mg
C2H5OH-----—C2H5Br —C2H5MgBr
ГНоСНГМ CrO3-2C5H5Nr rnr„ l-C2H5MgBr
СН3СНСН3 СНД 25 °С * СН3СОСН3 2 Нг0 н® *
ОН
СНз СНз
— СН3ССН2СН3 КОНЦ-СНзССНгСНз^-*
ОН Вг
-* СН3С=СНСНз
[Б]
2-22. а) Способ 1.
СНэОН Си сн о 1- CfiHuMgBrZEfcO
СН3ОН б00 Ос сн2 о 2 Нг0 н@
СН2ОН
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 105
СН2Вг
PhjPBr2
ДМФА,20°сГ
__________NaNH2__________
или ffipeffi-BuOK/mpem-BuOH
[А]
Способ 2.
ftlPaLphlklIs Вге NaNH/ГГФ
—-Ph3P=CH2
б) Способ 1.
СН2 НВт СН3СООН1
EtOK EtOH
Способ 2.
СН3ОН KBr + HzS^-> СНзВг CH3MgBr
NaOH
Н2О
К2Сг2О7
H2SO4
l.CH3MgBr/Et2O
2. Н2О, Н®
85%-ная Н3РО4
160-170°С '
2-23. (Л)-РЬСН2СНСНз (Л)-РЬСН2СНСН3 —►
18ОН 18OSO2CH3
[А]
NaOH/H2O—диоксан
Sn2
(S)-PhCH2CHCH3 + CH3SO218ONa
ОН
[Б]
106 Решения
2-24. Способ 1.
PhCH2CHCH3
ОН [а]“=+33,0о
TsCl/Py сохранение конфигурации
— PhCH2CHCH3 -----------BOH/iy°3------> PhCH2CHCH3
| обращение конфигурации |
QTS (небольшая потеря QEt
оптической активности) _
[A]
[a]D = +31,l° [a]D=-20,0°
Способ 2.
PhCH2CHCH3
ОН [oc]d = +33,0°
металлич. К
сохранение конфигурации
PhCH2CHCH3
ОК [Б]
ВВг
сохранение конфигурации
PhCH2CHCH3
OEt
[В] [<x]d = +23,0°
2-25. Способ 1.
Me
TsCl/Py
сохранение
ОН конфигурации
MeONa/MeOH обращение конфигурации
Способ 2.
Me металлич. К
сохранение
ОН конфигурации
Me
МеВг , сохранение ОК конфигурации
[А]
Углы вращения образцов простого эфира В, полученных способами 1 и 2, равны по величине, но противоположны по знаку.
2. Нуклеофильное замещение в алифатическом ряду, элиминирование
107
2-26. НО
С<йз с TsCl - —Н -5—
СбН13
TsO~—Н
СН3СООК/ДМСО
Sn2
СН3
СНз [А]
СбН13
ОССНз СНз о
[В]
СбН1з I-—OTs-
ш/н;о-вон
-СНзСОО®
СбН1з
₽ TsCl
н-—он-—
Ру
СНз
[В]
СНзСООК/ДМСО
СНз [Г]
Sn2
|Г КОН/Н2О—Etc
-► СНзСО—Р- Н-------Z—
8 отз -СНзСО°
[Д]
9е */
НО:0 CH3ct */—СНзб^ЮС^
V___/ ис\ О-З-Н
СбН1з
S тт
р */
СНзС 9 +НОС— о
Возможно образование продуктов I, II, III, IV. I и II — основные продукты.
108 Решения
2-28.
СзН7
H-f-OH
СНз
TsCl
Ру
СзН7
-p-OTs СН3
MeSNa/MeOH
S№
С3Н7
MeS-f-H
СНз
Mel ацетон
[А]
С3Н7 © | с
“*Me2S—р-Н Iе СНз
®е
ВщКОАс/ДМФА
Sjq2
[В]
С3Н7
|я кон/н2о-еюн
Т"ОАС -СНзСООР СПз
С3Н7 н—1^-ОН СНз
[Г]
Замечание. Механизм щелочного гидролиза сложных эфиров приведен в решении задачи 2-26.
2-29.
Et Н \ / С=С / \
Н Et
© е
Et3NCH2C6H5CI, СНВг3; NaOH
Н^О ' ”
Et Н 2Me2CuLi
В2О, 25°С
Вг
Me
Mel + 2 Li MeIi-CU2Br2> Me2CuLi
2-30.
c2H5
Т"он^
СНз
С2н5
Н—р—OTs
СН3
NaCSECPh/ДМСО
S^2 ”
Н2, Pd, BaSO4/ хинолин, EtOH, 0°Q
С2н5/
^РЬСхС-^Н
СНз \ Na/NHafoj.-aay
Ph /^(CHjJQHs ^=cx HZ H
Ph H
н CH(CH3)C2H5
и
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 109
Ь^СгтО?; H2SO4
Ol.CH3MgI/Et2Q
2. Н2О, Н® *
2. СН3СООН, 0 °C
2-32.
85%-ная Н3РО4 160-170°C *
RCOOOH
СН2С12, 20 °C
1. MeONa
2. Н2О
KF/ДМСО________________
или KF / 18-краун-6, CH3CN
IICZCII ' NaNH2/NH3(^ ~33Т HCZCCII L NafwNH3(*), -зз*£
H 2. CH3Br 3 2. CH3Br
H2, Pd, Ва8О4/хинолин, EtOH, 0°C ^СНзСххССНз *
---► CH3CH=CHCH3 NBS’ (PhCO9)?1CC1?’ 80 4
— BrCH2CH=CHCH2Br rcN/flMCO,
но Решения
2-34. НС=СН Н2°’ -?S°4, HgS°4> СН3СНО
^„^ой сн3снсн=снснсн,^ он он
— сн2=сн-сн=сн-сн=сн2
2-35.
Et~C=C— Et
Na/NH3(».), -33 °C *"
[А]
RCOOOH
СН2С12, 20 °C*
Et Н
H О Et 2 H2°’ H®
[Б] смесь энантиомеров
Et
1. MeMgBr / Et2O H-OH
H~|—Me . Et
Et
+ HO-i-H TsCI
Me----H Py
Et
[B]
H-----OTs TsO-----------H EtONa
H-----Me + Me-----------H EtOH, *
Et
Et
Et Et
H-----OH HO--------H Ph3P Br2
H-----Me Me--------H
Et Et
Br---H H---------Br
H---Me Me-------H
Et
Et Et
[Г]
EtONa_ EtOH '
[Д]
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 111
2-36. Ph,
,С=
Н
Ph Р^
гп RCOOOH
СН2С12, 20 °C Н
Ph
H О н [А]
I.UAID4
2. Н2О
Ph
Ph
Н---ОН
D---Н
+
но—н TsC, Н
D РУ
Ph
[Б]
Ph
Ph
Ph
Н----OTs
TsO--H
+
H---D
EtONa EtOH
Ph [В]
Ph
Н Ph
>=сх Ph D
[Г]
Ph ;с=с; н н [Д]
Ph
Выход Г существенно выше, чем выход Д, так как конформация
I, предшествующая Е2-элиминированию, выгодна, чем конформация II, в которой группы
энергетически более объемные
фенильные
сближены.
Ph
TsCl/Py.
Ph
[И]
D
[I]
1.UAID4
2. H2O
EtONa/EtOH E2
EtONa/EtOH E2
H.
Q
Ph‘
Ph
Ph zPh
/С=Сч н н [Д]
Н\ zPh
/С=С\ Ph D
[Г]
112 Решения
В сильнокислой среде атом азота полностью протонирован и его непбделенная пара электронов не участвует в гидролизе галоген-производного. Поэтому реакция протекает нормально как реакция замещения, т. е. без участия соседней группы.
Н2О, Н® ® Н2О
R2N—СН2-(рН— СН3—--->R2N—СН2-СН—СНз——*
С1 Н С1
© ОН®, Н2О
-* r2n-ch2-ch-ch3------- r2n-ch2-ch-ch3
н он он
Если амин не связан в виде соли, то первой стадией гидролиза является внутримолекулярное 8х2-замещение, приводящее к им-мониевому иону А. В присутствии сильного основания последний далее подвергается по 8х2-механизму раскрытия цикла у более
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 113
реакционноспособного первичного атома углерода с образованием продукта перегруппировки.
И^-СН2-СН-СНз*^ к Sn2
С1»
н2с ®
|/NR2
НС С1е
СН3
L [А]
ОНв/Н2О
*
-*• R2N(pHCH2OH СНз
2-38.
OTs
Sn2
-OTs®
ОСОСНз
СНзСОО® /
°\® СНзСОО9 Н/С-СНз-д^— О7
СНзСОО^
,.ОС(О)СН3
<-Н
^...Н
>ОС(О)СНз
..н
<ОС(О)СН3
<'ОС(О)СН3 хн
,-н
'"•OTs
ОСОСНз
СНзСОО® Sn2
...•ОСОСНз
ЧН
S?H
ОСОСНз
Резкое различие в скорости ацетолиза объясняется участием карбонильного атома кислорода карбоксильной группы в случае /я/>яяс-изомера; в случае z/uc-изомера этого участия нет.
114 Решения
2-39. (5)-СН3-СН-СООСНз - (tf)-CH3-CH-COOCH3
Вг ОМе
($)-
Н / 0е сн^с-с; -в/) 0
Me ОН
Sn2
н Ое
снз>-с; МеО 0
Стереохимический результат последней реакции не изменится при добавлении солей серебра; ее скорость увеличится. Ион серебра координируется по атому брома, ускоряя его отщепление.
2-41.
^ВН/ТГФ, 65°С
I.
PhC=CH—
2. Br2, MeONa/MeOH
Ph Н
\ _г/ (CH2=CH)2CuLi
ZC— н
ч ЕьО, 25 °C Вг
Ph Н
,с=<
н сн=сн2
CH2=CHBr -J^*CH2=CHLi -g^(CH2=CH)2CuU
Et2O Et2(J
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 115
2-42.
K2Cr2O7; H2SO4
0 1. C2HsMgBr / В2О
2. Н2О, Н®
RCOOOH
СН2С12, 20°С
-°С2Н5
2-43.
l.MgCHgVQHe.r
2СНЗЙСНЗТ^---------
О
С113с _ хСНз а12°з, 30°°С
СН3 I I СН3
ОН ОН
ОК Х'Н2
zCHO
СН и СН2
толуол
СНз" "СН2
МпО2 н2с=снсн2он -н- сн2=снсно
2-44.
ОН
K2Cr2Oy, H2SO4
l.HC=CNa/EtP
2. Н2О, Н®
Н2, Pd , BaSO4
EtOH—хинолин
,ОН
ч А12Оз, СН=СН2^
[А]
толуол
н
О
[А]
[Б]
116 Решения
2-45.
СООМе I fi
С
СООМе
толуол
СООМе
СООМе
СООМе
H2/Pd—С
СООМе
толуол
СООМе
СООМе
1. LiAlH4/a2O
2. Н2О
сн2он
сн2он
TsCl
Ру
_.CH2OTs
4'/<H2OTs
/прети-ВиОК
ДМСО, t
СН2СООН EtOH-Н® CH2COOEt 1. LiAHj I Et2O
2-44. (СВДеС --------------(СНЛС ГЙ7--------------'
СН2СООН CH2COOEt 2°
(СН2)<
СН2ОН
СН2ОН
(СН2)<
СН2О ТГП TsCl
СН2ОН Ру ’
,СН2О ТГП KRr СН2О ТГП J 1Г=ГГ н
Ж(СНЧн2Вг
H2/P-2-Ni______
/вон-нтчснда:
(СНг)8(
СНэС^ССНД
\Na/NH3(».) -33ЬС *
Etx (СН2)9СН>0 ТГП zCS н н
Et\ /н с=с
Н Ч(СН2)9С}^0 ТГП
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 117
Et (СН2)9СН2ОТГП
н н
НС1 г
МеОН, 20 °C
Et (СН2)9СН2ОН ®Н.Г1ПГ.®
ЙС~СН СН2С12?25ОС
Et4 '(CH^tjCHO
— 'с=С\ н н
Pt н НС1/МеОН, 20°Сг
Н (СН^цСНгОТГП
Ft Н ® а
ч / C5H5NH • С1О3СГ
НС~С(СН2)9СН2ОН СНгС'2’25 С
Et. ZH
с=с н' '(СН2)9СНО
2-47. Н2С=СН2
О2; [Ag] 300°С
О
НС=СН 33°С> нС=ССНгСН=СН2 —
^НгМН| -”'с> носн2снгс=сснгсн=снг — 2-V
3. Н2О/Н®
Н2, Pd, BaSO4 НОСН2СН2чс=с/СН2СН=СН2^
EtOH—-хинолин, 0°C т_/ \т
C5H5NH • cro3ci® н/ссн2ч _ ZCH2CH=CH2
СН2С12, 25°С Н'С С'о
118 Решения
2-48.
2-49.
НС=СН HteCCH2OH
3. Н2О; Н®
—HC=CCH2OTs -£^*HC=CCH2Br -?c-CCH2°Na, ДМФА z
-*нс=ссн пен г-стт 1Sia2BHHTO,Q<t — НС-ССН2ОСН2С-СН 7ЙА,№ОН/Н0 ’
Ч
-► ZCCH2CH2OCH2CH2C4
Н [А] Н
(СН3)2СНС=СН (ж)’ 33°£(СНз)2СНС=СС2Н5 —
Z. C2H5I /11 Ф
K®NH(CH2)3NH2 (КАРА) © н„о
NH2(CH2)3NH2,20°С , 5 мин (СНз)2СНСН2СН2С=С К®
HggjAcb; HsSQ^ (СНз)2СНСН2СН2(!!сНз
^^-♦.(СН^СН^^СН^НО
[Б]
2-50. СН2=СНСН3 -^/RoP> СН3СН2СН2Вг
О; н®
СН2=СНСН,^ й;0 ^ВгС^СНСНз-а-^ВгСН2СНСН3 он о тгп
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 119
2-51.
Гн=гн l.NaNH2/NH3(M.),-33°C
2. СН3СН2СН2Вг
СН3СН2СН2С=СН —►
1. NaNH2/NH3(M.), 33_(^ Сн СН СН С=ССН2СНСН3
2. ВгСН2СНСН3 3 |
ОТГП °ТГП
СН2СН2СН2 СН2СНСН3
Н2, Pd, BaSO4 ХС=С/ ОТГП
EtOH, хинолин, О °C ]_j
НС1
МеОН, 20°5
СН2СН2СН2ч _ хСН2СНСНз c5H5NH-CiO3C1q
ZC=CS ди СН2С12,25°С *
Н Н
/
сн3сн2сн2ч СН2ССН3
Л Ч о
н н
[А]
Me. zEt /С=С\
Et Me
RCOOOH
CH2C12,20 °C
Me Et
1. LiAIH4/Et2O
2. H2O
[A]
Et
Me—OH
Me--H
HO- -Me TsCl Me- -OTs
H-j-Me Py Me-pH Et Et
TsO—Me
[Б]
H—|— Me Et
[B]
Et Et
KBr
ДМФА
Br----Me Me--------Br
Me----H + H--------Me
EtONa X ______
EtOH* . . / Me Et
Et Et
[Г]
[Д]
120 Решения
2-52.
D\=
DZ ~ЧСНз CCI»’8O°C
>СНЗ NBS; (PhCOO)2 D\c_(-/CH2Br
DZ CH3
[A]
RCOOOH
СНгСЬ 20°C
D CH2Br _\__J MeONa
D О СНз
CH3
МеОН^ MeO-CD2-C-CH2HBr-*
AqJ MeO-CD2 О
СН
Cl СОзН
2-53.
H2C=CHEt
СН2С12, 20°С
HC=CH33 c„ HOCHCH2C=CH—►
Et
2 V7—a о
з. н2о
1. ZNaNHyNHjfjK.), -33°C H2, Pd, BaSO4 .
НОСНСН2С-ССН2СНОН^н-нол^н0^
Et
О
З.Н2О
Et
НОСНСНг Et /С=
Н Н [А]
СН2СНОН
ч Et
TsCl РУ
TsOCHCH? CH2CHOTs
в, >=< L -
H H
О
BrCHCH2 CH2CHBr
ДМФА Et Hz Et
KCN дмсо, *
ncchch2x ch2chcn
I I
Et Л 4 Et
H H
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 121
Другой способ получения диола А.
|Q); Н®
CH2=CHEt —----------ВгСН2СНОН —------► ВгСН2СНОТГП
ДМСО, Н2О,20 С I |
Et Et
НС=СН 1NaNH?/NH3 -33 °C ТГПОСНСН2С=СН -►
2. ВгСН2СНОТГП/ТГФ |
В Et
2 Bi€H СЬ^/ТГФ~33 ~С,> ТГПОСНСН2С=ССН2СНОТГП О ТГП Et Et
, ТГПОСНСНх СН2СНОТГП,
Н2, Pd, BaSO4 Д | с=с' 1 НС1 ,
ВОН, хинолин, 0°С Et / Et МеОН,20°С
н н
носнсн2.
Et
хсн2снон
с=с '
. С Et
Н Н [А]
[Б]
122 Решения
2-55.
EtOOC
COOEt НОСН2 СН2ОН
1. LjAlH4/Et2O V/ TsCl/Py
COOEt
2. Н2О
СН2ОН
2-56.
TsOCH2-
.CH2OTs
Y KI r
ch2ots ДМФА
ch2i
1. Me3N (изб.)
2. Mel / CH3CN
3. AgOH/H2O
4. 150°C
CH2
[A]
Rr
al.Mg®2O
2.V7 О
CH2CH2OH
A12O3 r 300 °C
3. H2O, H®
^^CH=CH2
NBS_________
ДМСО, H2O ,203c
CH-CH2Br
OH —*
о
CH-CH2Br
ОТГП
Nal ацетон
CH-CH2I
ОТГП "
KF; 18-краун-6
CH3CN
HC1
MeOH, 20 °C
рН-СНгБ
OH ~
C5HSNH • CrO3Cl® ^yC-CH2F
CH2C12, 25°C О
[A]
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 123
О; Н® ’ TsCl
2-57. НОСН2(СН2)зСН2ОН —-------► ТГПОСН2(СН2)зСН2ОН
-> ТГП OCH2(CH2)3CH2OTs ТГПОСН2(СН2)зСН2Вг
ДМ ФА
1. NaNH2/NH3 (Ж.Х -33°С
СН3С=СН 2>ТГП0СН2(СН2)3СН2Вг *
_ K®NH(CH2)3NH2 (КАРА)
- * ТГП ОСН2(СН2)зСН2С—ССНз NH2(CH2)3NH2; 20°С, 5 мин
Н2О
— ТГП ОСН2(СН2)зСН2СН2С=С ®к—-
\ ___1.9-ВВМ/ТГФ
— *• ТГПОСН2(СН2)зСН2СН2С—CH 2 Na0H/H2Q*
ТГПОСН2(СН2)бСНО НОСН2(СН2)6СНО
[А]
NBS;(PhCOO)2 _ __l.Mg/Et2O
2-58. СНг^СНСНзсс^о^----* СН2=СНСН2Вг
2.V7 о
3. Н2О; Н®
TsCl
- * Н2С=СНСН2СН2СН2ОН
KRr
->H2C=CH-CH2CH2CH2OTs
RCOOOH
— *• Н2С=СН-СН2СН2СН2Вг о»
Cri2C12, С
СН2СН2СН2Вг MeMgBr
° м “
—* Ме~СН2—
BrMg-Q'
-MpRr-Л хА
2 МеСН2 О
[Б]
124 Решения
2-59.
н2с=с-сн3 Н2С=С-СН2Вг
I ССц, oU С I
СНз СНз
l.Mg/Et2O
2НС-С-СНВГ н2с=с-сн2сн2-с=сн2 Z. гЪС— С СгЬоГ I |
сн3 ‘ СНз СНз
[Б]
Вг Вг
Br2 I I EtONa 1 Ши.ТГФ
Н2С=С-СНз-*СН2-£-СНз ВгСН^-СНз 5^-СНз СНз СНз
LiCu(CH=<p- СНз)2
СНз
СН2=С-СН2Вг
СН3
» Н2С=<^-СН2СН=(р-СНз
СНз СНз
[А]
2-60.
СООМе
толуол
СООМе
СООМе
1. ЬА1Н4/Е12О
2. Н2О СООМе
сн2он
TsCl
Ру
СН2ОН
CH2OTs
СНз
l.UAlHt
2. Н2О ’
СНз
CH2OTs
1.О3/СН2С12, -78 °C
2. Ph3P ’
сн3 СНз
онссн2 СН2СНО [А]
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 125
2-61. Способ 1.
rrn l-MgfHgKQHe.t СНз\ ^СН3 300°с
2с%СНэ Тм СН.Л Ьси, ----------------------
О он он
СООМе
СН3\.СН2 f
^-СООМе
”*снАн2 толуол
н2—ро-с
1. LiAlH4/Et2O
2. Н2О, Н® *
А12О3
200 °C
Способ 2.
СН2ОН
СН2ОН
СН3
TsCl
Ру
СНз
CH2OTs
CH2OTs
КВг
ДМФА
^СНзу-уСНгВг отреот_ВиОк СН3^р.СН2
СНз^АСн2Вг ДМС0’ ' СН3ААСн2
[А]
126 Решения
2-62.
СООМе
СООМе
1.О;/СН2С12,-78оС
2. NaBH4/MeOH
СООМе
толуол
СООМе
НОСН2 СН2ОН
МеООС СООМе
1. LjAlH4/Et2O
2. Н2О ”
НОСН2 СН2ОН носн2 СН2ОН
[А]
2-63. СН3(СН2)3ОН 7^Гз--> СН3(СН2)3Вг *-м£/эФ-иР..>
2 J эфир 2. этиленоксид
3. Н3О®
— СН3(СН2)5ОН
* СН3(СН2)5Вг
l.№NHyNH3(x)
2.и-СУНвВг/ТГФ
И-С6Н13С=СН
l.NaNH2/NH3fo.)
2. этиленоксид/ТГФ
З.Н2О
-*«-С6Н13С=ССН2СН2ОН
Н2, р-2 -Ni,_______
ROH — NH2CH2CH2NH2
— rt-C6H13CH=CHCH2CH2OH цис
CH2I2, Zn/Cu или CH2N2, PdCl2/ эфир
КМпО4
Н2О *
CH3(CH2)4CH2 сн2сн2он
СН3(СН2)4СН2 СН2СООН
2. Нуклеофильное замещение в алифатическом ряду, элиминирование 127
О2, Ag
2-64. СН2=СН2—^*
l.NaNH2/NH3(«-) гн=ссн
CH-CH 2^н5ОДМСО 2 5 2 эгилен0ксвд/дМСо
-► С2Н5С = ССН2СН2ОН ROH_nh2CH2CH2NH2W’
-► С2Н5СН=СНСН2СН2ОН С2Н5СН=СНСН2СН2Вг-»’
цис цис
КС-- »• C2H5CH=CHCH2CH2CN
дмсо цис
[А]
[А]
СН31
© ©
•*. Ph3P СН2
2-66.
l.PhjP/QHfrt
2. BuLi /эфир
1, ЦАШд/эфнр /^уСН2ОН
2. Н3О®, О °C СН2ОН
1. TsCl (1 3KB.)/QHSN—эфнр^ 1-Оз/СН2аг,-30°С
2. КОН ' 2. NaBHj/H2O—ROH
,сн2сн2он L TsC[/C5h5N) эфнр^ _CH2CH2CN
'СН2СН2ОН 2К№/ДМСО 4'ch2ch2cn
[А]
128 Решения
2-67.
PhBr I » Ph2CuLi
2. Си2Вг2/эфир z
CH2=CHCH3 CH2=CHCH2C1 »
450 C z z эфир
-» CH2=CHCH2MgCl
03-ClQH4COOOHy CH2C12, 20 °C
i. сн2=ст1сн2ь^а/эфир
2. NH4a/H2O
о
CH2CH=CH2 Дн
OH
l.Tsa/QHsN, эфир
2. РЬ2СиЬ/ТГФ, -78°C
CH2CH=CH2
4 Ph
H
[A]
CH2CH=CH2
1. TsCl/QHsN, эфир
Чи 2. КВг/ДМСО, t
-Лэн
СН2СН=СН2 Двг
РЬ2СиЬ/ТГФ, -78°C
СН2СН=СН2 4н
н
Ph
[Б]
Глава 3
КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ
3-1. На первой стадии для получения а,Д-непредельного альдегида А необходимо осуществить направленную альдольно-кротоновую конденсацию между разноименными карбонильными соединениями: пропионовым альдегидом (метиленовый компонент) и метилэтилкетоном (карбонильный компонент). Далее в альдегиде А селективно восстанавливают либо двойную связь (получают Б), либо карбонильную группу (получают В).
СН3СН2СНО ___ J z 2. CH3QOXU2CH3
3. Н3О®
1. LDA/ТГФ, 78 С^ СНзСН2С(СНз)СН(СНз)СнО __* 6н СНз
-----сн3сн2снснсно
[Б] СНз
сн3
Н®/г ^У^СН3СН2С=ССНО --Н2О J 1
СН3
[А]
о СНз
1. LiAlIL/эфир,-10 С ।
------СНзСН^ССНРН
СН3
[В]
Двойная углерод-углеродная связь в а,/3-непредельном альдегиде А может быть также селективно восстановлена с помощью каталитического гидрирования при 20 °C и обычном давлении над палладиевым, рутениевым или платиновым катализатором (продукт — альдегид Б). Наилучший результат при избирательном восстановлении карбонильной группы в а,/3-енонах и еналях достигается в том случае, когда в качестве восстановителя используется диизобутилалюминийгидрид (ДИБАЛ-Н) в толуоле в очень мягких условиях (продукт — спирт В).
3-2. Решение аналогично предыдущему.
5—3771
130 Решения
3-3. ВГСН2СН2СН2СН2ВГ -^|Ир—» BrMgCH2CH2CH2CH2MgBr -*•
СНзСН(СН2)4СНСНз
3 он он
1. CrO3/2QH5N—СН2С12,20°С
2. NH4C1/H2O
[Б]
[Г] 83%
— CH,C(CH2)4CCH,-^f о о
[В]
1.03/CHjOH, -70°С
2.Ph3P '
3.20°С
О
КОН/Н2О (СН^ОДСНз 20Г *
ПФК (Н3РО4+ Р2О5) —полифосфорная кислота.
пирролидин, л-ТСК/толуол, 110°^
[А]
[5_сн2С(О)сн3^!2Ь^-[Б]
1. ВгСН2С(О)СН3
2. НзО®
Из решения видно, что в синтезе а-замещенных карбонильных соединений енамины играют роль синтетических заменителей енолят-анионов, причем реакции /3-алкилирования, /3-ацилирования и присоединения по Михаэлю (реакция Сторка) протекают в случае участия енаминов в нейтральных условиях, что сводит к минимуму побочные процессы конденсации.
3-6. Решение аналогично предыдущему.
3. Карбонильные соединения 131
3-7. Перед тем как приступить к решению, изучите решение задачи 3-1.
СН3С(О)СН3 Сбн5фО,К2С°з » с6Н5СН=СНС(О)СН3 —*
Н2О
Н2, Pd/C этилацетат
* С6Н5СН2СН2С(О)СН3
снзсн0 2. С6Н5СНгСНгС(СН3)СН2СНО
3. NH4CI/H2O он
3-8.
1. Ва(ОН)2
2.400°С
1. КМпО4, КОН/Н2О, I
-------------+ НООС(СН2)4СООН —»•
2. НЭО®
S-CIQHjCOjH^
3-9. (СН3)2СНСНО пипеР.иди»’ «-ТСК/толуол, 1 Ю°С (СНз)2С=с№£~^
СНз;с-сн=ЙЗ
СН3ХI
СН2СН-ССН3
О', 6 -
. , гыгчт гго 1.К0Н/Н20,20°С СН3
(СН3)2СНСН2СН2ССН31Ж^-------*
сно о
СН3С(О)СН=СН2 толуол
н2о
Реакция енамина (донор Михаэля) с метилвинилкетоном (акцептор Михаэля) — типичный пример присоединения по Михаэлю.
3-10.
/ \ о I.L1AIH4 / \ П„ПФК /~\ 1.03/СН2С12,-78°С
V-/ 2. Н3О®0°С>Г V/ ~t ” \_J 2. (CH3)2S илиРЬзР*
-► Н(О)С(СН2)4С(О)Н О" СН0
1,РЬЦ/эфик -ЗО°С
2.Н®/Н2О
CHPh
ОН
1.Q-O3HC1C5H5N
2. NH4C1/H2O
(Q)-C(O)Ph
Окисление аллиловых и бензиловых спиртов можно проводить также под действием МпО2 в метиленхлориде.
132 Решения
3-11.
Способ 1.
сн2=снсно в<н2сн2сно g^'"TC>
О—О—]
-►BrCH2CH2CH НОСН2СН2СН
XO-J Н2° XOJ
1. СЮ3- 2 C5H5N/CH2C12, 25 °C
2. NH4C1/H2O
* Н(О)ССН2С(О)Н
Способ 2.
сн2=снсно ^ОН)2’ ”~т-с-к-» толуол,t
z°~l
-* СН2=СНСН
'О-1
1. 9-ВВ1Ч/эфир
2. H2O2/NaOH
О-.
-►носн2сн2сй
'О-1
1. СЮ3,2QH5N/CH2C12,20°С 2
2. NH4C1/H2O
-►Н(О)ССН2С(О)Н
3-12.
НОСН2СН2СН2С(О)СН3 ^^Н)’я'тс^.
(Г--)
-►НОСН2СН2СН2ССН3 -Br4,Ph3Z-.»
J СН2С12,0°С
<---1
CH3C=CNa
-► ВгСН2СН2СН2ССН3 --------►
।--1
О О ®
—► СН3С=ССН2СН2СН2ССН3-^-
СН3С=ССН2СН2СН2С(О)СН3
3. Карбонильные соединения 133
3-13.
ОЫСОООД);
О II Pi
V „с-о-сн2снз сложен
сн2 хое "сн2
3-14.
Н3О^
СаС t
СН3С(О)СН3 2^(СН3)2С=СНС(О)СН3 ИЛИ *
СНэВДСН^ООСЛ
НС1 (конц.), г
-► СИ3С(О)СНСО(Х'2Н5--------------•
(СНз)2ССН2С(О)СН3
_ r QiHsONa/QHsOH, t
CH3C(O)CH2C(CH3)2CH2C(O)CH3-2-2———►
3-15.
^хно
Н®/г
-Н2О
Me2NH
сно
NMe2
NaBEt/EtOH
fXX<-NMe2
^^СНоОН
134 Решения
3-16. PhCH2OH -S0C1?--> PhCH2Cl
и-ВиЬ,ТМЭДА Cu2G2 , . ^.тт x т •
PhCH3 PhCH2Li ТГф > (PhCH2)2CuLi
3-17.
1. (РЬСН2)2СиЬ/эфир _____ **
3. NH2NH2, KOH/(CH2CH2OH)2O, 200°C
1.1ДА,ТГФ,-78°C Jk?H2Ph NH2Nh2; kqh
2.PhCH2Cl CXCH2CH2OH)2,200°C
CH3 ' 3
CH3
C6H5Br
L Li/ТГФ___ Ph2CuLi
2. Си2а2/ТГФ
q 1.РЬ2Си1_1/эфир l.BryCHjCOOH/^X 2.H3O®
2.NEt3 l.PhLi/ТГФ»
2. H3O®/0°C
QPh Н^Од/г
Чистый циклогексен-2-он получают следующим образом:
Вг2/(СН2ОН)2
-НВг
78%
NaOH/MeOH
-NaBr ,-Н2О *
О
3%-ная H2SQj
-(СН2ОН)2
75%
75%
3. Карбонильные соединения 135
3-18. СН3С(О)СНз L^^.(CH3hC(OH)C(CH3hOH^^^ Z. Н3О
-*• (СН3)3СС(О)СН3 Se°2/CH3OOO]^, (СН3)3СС(О)СНО -*>
КОН(40%-ный), (СН3)3ССНСООК он
0е /0 он 0
—► (CH3)3CCHCZ нз°Ф» (СНзЭзССНС* Чое Ч0Н
,, СгО3- 2C5H5N
з-19. сн3сн2он ch2ci;,2o°F*> снз сно
СНРСН?СН(ОН)СН3 >
-* CH]3CH213CH(CH3)MgCl
Z.M3U
-* СН;3СН;3СН(СН/СН(ОН)СН3 ^^*СН;Ы3СН(СН3)13С(О)СН3
CHjCb» 2U V
l-b.HQ^Hp ^ сн;3СНз3СН(СН3)13СООН ч L
2.н3О® 3 2. нр®
136 Решения
3-20.
TsOH, (СН2ОН)2
СН3СН(Вг)СН2СН2С(О)СН2СНз то-ол ( »
сГо . № — СН3СН(Вг)СН2СН2ССН2СНз Та^/Н2о 3.t
—*• СН2=СНСН2СН2ССН2СНз
О С) ©
НОСН2СН2СН2СН2ССН2СН3
—* СН3СН2С(О)СН2СН2СН2СООН
3-21. СН3СН2С(О)СН2СН3 ГСН£ВДО)СН(Вг)СНз-С HjLUUn
1. EtONa, EtOH
сНзС(О)сн2сооЕ1
Z 3. HC1 (КОНЦ.), t
-CO2, -EtOH
—► СНзСН2С(О)СН(СНз)СН2С(О)СНз
3-22. BrCH2COOEt 1PhLp/t » Ph3PCHCOOEt
2. NaH
©e
^зКуСООЕ^ Н0(0)ССН=адСН2)4СН=СЖ(0)0Н
2.H3O It [A]
l.D2O/NaOD_____________________ D^/\.CH3
2. NH2NH2, КОН/(СН2СЯ2ОН)гО, 200°C* Э'Л /'D
3. Карбонильные соединения 137
СНзС(О)СНз пиперидин
3-24. + —кг------1
СН2(СООН)2 У
(СН3)2С=СНСООН
— (СН3)2С=СНСН2ОН
Ph,P ® Л
(СН3)2С=СНСН2С1 ^—►(СНз)2С=СНСН2РРЬ3С1е->.
_аЬ,^УМезУТГФ> 20 с„ (СНл)2ОСНСНРРЬзСНзС(0)СНз
-NaCl, -HN(SiMe3)2 к 113 -Ph3P(O)
(СЩ2ОСНСН=С(СЩ2 ^СНСООВ.И(0^йфир
СНз COOEt СНз СООН
СНзУ 2Нз°Ф
СН=С(СН3)2
СНзу
СН=С(СН3)2
[А]
3-25. СНзС(О)СНз ^[И^.^(ОН);1
(снз)2с=снс(о)сн3
-*(CH3)2C=CHC(O)CH=CHPh
СН3 СНз
СНз СНз
f^-СНз __
'—( 2. КОН/диэтиленгликоль, 200 °C
Ph Ph
[А] [Б]
138 Решения
3-26. СН3СН2СООН СН3СН2С(О)С1 СНг“сн’«5Г свдадвг g? CH2-CHBr >1™» (СН2=СН)2Си1л Z. VU2VI2 CH3CH2C(O)C1 » CH3CH2C(O)CH=CH2 Ун2 m » C2H5C(O)CH2CH2NMe2
3-27. /->tr 1. LDA/ТГФ, -78°C_ iru-ruru CH3C(O)CH3 2 сн CHO * CH3C(O)CH—CHCH3 —• 3.H3O® , _ A A l.NBS/АБИБН TsOH, (CH2OH)2 гн'гхгн_гнгн 2. Mg/эфир толуолу * <-Н3ССН-СНСН3 3 > 4. H3O® —► CH3C(O)CH=CHCH2COOH
3-28. 1. LDA/ТГФ,-78°C i—\ 1. (CH^CHO^CuU/TP VJ ° 2. PhSeBr a * \=/ ° 2. H3O® 3.H2O2,HO0/2OeC t—\ TsOH, (CH2OH)^ * \ Z=^ толуол, t * CH2=CHCH2 ЛЛЯп 1Sia2BH - AVn \_/0J 2.HO0H2O2 гu CH2=CHCH2 3. Ph3P/CBr4 Вг<СН2)з
3. Карбонильные соединения 139
Диаллилкупрат можно получись следующими способами:
a) CH2=CHCH2Cl^CH2=CHCH2MgCl^
— CH2=CHCH2Li (CH2=CHCH2)2CuLi тгф 50%
б) Ph3SnCl + ClMgCH2CH=CH2 Ph3SnCH2CH=CH2 —►
H-BuLi/гексан СичСЬ/ТГФ
* CH2=CHCH2Li ► (CH2=CHCH2)2CuLi
86%
-Ph3SnBu-«
3-29.
KCN
PhCHO 777Г* PhCCH(OH)Ph
KUH—HjU, I
CuSO4 • 5 H2O /C5H5N—H2C) или HNO3
II II
—► Ph-C-C-Ph
phCH0 5^?phcH^0H
PBn 1- Ме/эфир
^рьсн2вг2дтаг з.н3д®
-► PhCH2CH(OH)CH2Ph
1. CrO3- 2C5H5N/CH2C12> 20°C
2. NH4C1/H2O
О II PhCH2CCH2Ph
[I]
11 11 Ph-C-C-Ph ElONa/BOH*
Другой способ получения I. 1 Mu BaCO3 _
PhCH2Br 2.c(^-.» PhCH2COOH ------(PhCH2COO)2Ba
3.H3O®
(PhCH2COO)2Ba PhCH2C(O)CH2Ph сухая соль
140 Решения
3-30. СН=СН » НОСН2С=ССН2ОН -*
100 атм, 150°С
Н2, Р-2-Ni с _ с Н
ROH—NH.CTbClbMb* НОСН/ ЧСН2ОН
СН3С(О)СН3, л-ТСК толуол, t
z^Q снз Со^СНз
3-31
COOEt 16О‘с,15ч /vCOOEt
l.LiAlH, » ,/хСН2ОН
2. Н3О®/0°С ~1
PBr3,C5H5N (XXfPH2Br NaCHCCOOEt), -^CH2CH(COOEt)2 эфир * ВОН
на ^сн2сн2соон н2о, Г
3-32. PhCH2COOEt ?7^Д°луаП - PhCH(COOEt)2 2. СХдОВ)?
3. СН3СООН/Н2О
СОСЬ — (из6^ CO(OEth диэтилкарбонат
3-33. в«н2соов 1'Хмго» ^снсоов
О Ph он м __
А 1. PhMgBr/эфир X. - °i „ l.Oj/CHjCk-TS’C
\_/ 2. Н3ОР \_J HfiT Ly™ 2.Me2S *
ее
—► РЬС(О)(СН2)зСНО — ф --------►
—► PhC(OXCH2)3CH=CHC(OX)C2H5 (£)
[А]
В реакции Виттига активность группы —СНО существенно выше активности группы /С=О.
3. Карбонильные соединения 141
СН2СН2СООСН3
3-34. СНзСНгСНгСНО СНзСНгССНгСНгС^СНз-*
3. СН/=СНС(О)СН3 СНО
4.НР®
l.EtONa/EtOH Л~\ЯН2СН3
-----s----► О=< X
2. Н30^ \=/ СН2СН2СООСН3
[А]
ЙСНЗ l.LDA/ТГФ,-78°С СН3 1(СН2С(О)СНз
-СН3 2. BrCH2C(OXH3 *" СНз^Г Y “1
СН3 СН3
1. EtONa/EtOH, t
2.Н3О^ *
СН3 СН3 \/сНз
1. Ме2СиЬ/ТГФ
2.Н3О® *
[А]
эфир CuiI->
CH3I + 2U - > CH3L1—(CH3)2CuLi
СН3С(О)СНз > СН3С(О)СН2Вг
CHjVAAJrl
3-36.
снз^С°°В
СН2=С(СНз)С(СНз)=СН2+СН2=СНСООВ-^ Y J СНз^
142 Решения
3-37.
l.BuLi/ТГф 78°C AS^CH(CH3)CH2COOEt ^-S
с 2. CH3CH=CHCOOEt З.Н2О
1'LiA1H4/-^-ttp-Z-S>-CH(CH3)CH2CH2Br Bu^ &
2. PhjP- CBr4/CH3CN, 20 C \_g ТГФ.-78 C
HgCl2, MeOH
CH3
О
NH3, NaBH3CN
EtOH, pH 2
CH3
nh2
3-38.
PBr3 1 • Ph ,Р/бензол, t
CH3CH2CH2OH —^CH3CH2CH2Br 2.ВиЦ/эф-:^
0 ®
—► CH3CH2CH PPh3
[Б]
Q нсоххснлсно-
CH3CH2CH=CH(CH2)4CH=CHCH2CH3 [A]
3-39.
PhBr PhCH2CH2OH Cr°3'2^”5» PhCH2CHO -►
2. этиленоксид CH2C12,20 C
3.H3O®
® ®
Ph3P CHCOOEt
—b;------► PhCH2CH=CHCOOEt
ТГФ z E
1. Ph3P/этилацетат, t
BrCH2COOEt 2 №й7-тТф----------► Ph3P CHCOOEt
CH2=CH2
О
3. Карбонильные соединения 143
3-40.
1. Li Al Н4/эфир ^СН2°Н
2.н^.о-с M:iwh
1. TsCl (1 MonbJ/CjHjN
2.КОН/ДМСО
1 , СЩ/ТГФ, QH,N
2 NaHSO3/H2O * О'^Х^сНо”*
3 . NaIO4/H2O
[A]
CH2(COOH)2_________
пиридин—пиперидин, t
COOH
H
CH3C(O)CH3
, CH3. .CH3 l.Mg/Hg*
2. H2O .J / | | 'S-'tT
СНз он ОНСНз
3-42.
l.NaNH, PBr,
ch=ch-----► CH=CCH2OH —-—СН=ССН2Вг-»>
2, CH2O 2 пиридин—эфир
3. H3O®
1. NaCH(COOEt)2 --------------».
2. HC1/H20,120°C
СН=ССН2СНгСООН
H2O, HglOAc^ Н^Од о°с
СН3С(О)СН2СН2СООН
144 Решения
1. LDA/ТГФ,-78°С г*~\
3-43. СН3СН2СН2СНО ----------------► Г >=С(С2Н5)СНО—1
J L L 2. циклопентанон J
3. Н3О®
® э
Ph3P C(CH3)COOEt С(С2Н5)СН = C(CH3)COOEt
Э ИР [А]
BrCH(CH3)COOEt |^g=I^Ph3P C(CH3)COOEt
Ba(OH)2
HOOC(CH2)4COOH »
3-44. (CH3)2C=CHC(O)CH3 ? jr> (СН3)2СНСН2С(О)СНз
I'lnJv'l/ Пэ*-,
CH сн енп i-lda/тгф,-78°c
LH3L.tl2LHO 2 (CH3)2CHCH2QO)CH3
3-H3O® @0
Ph3P CH>COOEt (сн3)2снсн2с(сн3)=с(сн3)сно эф-^----------►
-*-(CH3)2CHCH2C(CH3)=C(CH3)CH=CHCOOEt
Получение реактива Виттита из бромуксусного эфира см. решение задачи 3-43.
CH2COOEt
Ш° 1- NaH/ТГФ „ [^Y| ° 1- NaH/ТГФ
2. ВгСН2СООЕ ЧхЧ/ 2. ВгСН2СООЕ
EtOOCCH2 CHjCOOEt EtOOCCIb CH^OOEt
HOCH^H-OH, H® ~ * /)-]
О
НОСН2СН2 СН2СН2ОН
ШАМд/эфир О
2.Н3СР,О°С>
[А]
CH3COOH BrCH2C00H SH5°Hjg BrcH2COOC2Hs
2. H^O
3. Карбонильные соединения 145
3-46.
толуол, 100t, 5 ч*
1.0з/СН2С12,-78°С ------------------ 2. Н2О2—СН3СООН
I ВОН, H->SO4 (катализ.)
НООССН2СНСНСН2СООН -----------------►
соон
COOEt
-* EtOOCCH2CHCHCH2COOEt
COOEt
3-47.
НС1/Н2О,
ЕЮОС
О l.PhMgBr/эфир
2. Н2О—NH4a
НООС
ноос
А120з/400°С или H3PO4/110t
'°.'СИД.-73Х н ВОН, H.SO, <конц.)^,
2. НА—СН3СООН
—* PhC(O)(CH2)4COOEt
PhBr ». phMgBr
эфир
3-48. CH3CH(Br)COOEt Ph3P ^(CH3)COOEt
1 LDA/ТГФ -78°C
PhCH2CHO '• > PhC(CH3)=C(Ph)CHO —»
3. H3O®/t © e
L PhjP C(CH3tOOB рьС(СНз)=С(рЬ)СН=с(СНз)СООВ
PhCH2CH2OH PhCH2CHO
146 Решения
3-49.
LMg/Hg/QH.
2. Н3О®, 0 °C *
[А]
С2Н5ОН, 20“С
3-50.
(СН3)2С=О СаС2’> (СН3)2С=СНС(О)СН3
о
1. LDA/ТГФ, -78°С
2. (СН,)2С=СНС(О)СН3
3. Н3О®
СН3
СН3
°сн3 сн3
СН3 'О
сн3 сн3 1. EtONa/EtOH
2. Н3О® I JL X сн3 сн3 [А] сн3 сн3
A H2)Pd r Xll L Ш2Ш2 ___________________________________
С2Н5ОН, 20°C 2. КОН/диэтиленгликоль, 200 °C
СН3 2Н3
СН3 СН3
СН3 СН3 [Б]
3. Карбонильные соединения 147
сн3о
l.LDA/ТГФ, -78°С
2. СН2=СНСН2Вг
3. Н3О®
сн3о
1. ЫА1Н4/эфир, -20°С
2. Н3О®
СН3О
СН2СН=СН2
Ph3P-CBr4
0Н Wo*
-СИБгз CHj(5
СН2СН=СН2
НС1 (5 %-ный р-р) ----------► 20 °C
Вг
□ « СН г=ггн Н2’р-2~№_________^СН3^С=С/СН3
3-52. СН3(—ссн3 ВОН—NH2CH2CH2NH2 нх \н
NBS, (PhCOO)^ BrCH2^c_cx-CH2Br
7 * н'
[I]
/~S\ 1ВиЬ/ТГФ,-78°С х
\_/ 2. BrCH2CH=CHCH2Br [I]
О
НОСН2СН2ССН2
1.ВиЕ1/ТГФ,-78 С
2. этиленоксид (2 моль)
3. HgCl2/MeOH— Н2О
О
СН2ССН2СН2ОН
С=С н' чн [А]
148 Решения
_ HBr, RO 1, Мс/эфир
3-53. CH3CH=CH2-----* СНзССН^Вг £ C^CH^OH -•
3. Н3О
l.CrQ,/2C5H5N, СН/Д^С
2.NH4C1/H2OСН3(СНг)2СНО
^Н^^сНзОКВОСНз [(CH3)2CH]2CuLi-»
СН3С(О)СН(СНз),
l.LDA/ТГФ, -78 °C
2. СН3СН2СН2СНО
3.H2O,NH4d,0°C
->► СНз(СН2)2СН(ОНК:Н2С(О)СН(СНз)2
Z. njU /и С
-* СНзССН^СНССЙВСНзСНСОН^НССНзИ
В условиях кинетического контроля (LDA, ТГФ, —78 °C) енолиза-ция метилизопропилкетона протекает региоселективно по метильной группе.
3-54. СН3(СН2)2ОН —
1.ОгО,,2С5Н5М/СН2а2,20°С
Z1W1/H2O------------*сн3сн2сно
РВг3
♦ СН2СН2СН2Вг
СН3СН2ОН-^^ CH3CH2Br CH3CH2MgBr
Си СЧ.ГЧ1О 1СН3СН2МеВг/эфИр l.GO3,2C5H5N
СНзСНгСНО^^ ► (С2Н5)2СНОН
-MQHshCX) САССОХ^ССНз^НгСНгСНз-»
3. Н3О®
-----------—г* (СН3СН2СН2)2СНСН3
2. КОН/диэтиленгликоль, 200Х! л
3. Карбонильные соединения 149
3-55. СН3(СН2)2ОН
l.G03-2C5H5N/CHoa2,20t‘C^„ НСЦразб.)
zww)----------8----*СН3СН2СНО-----------
1.(СэН5)2Сии/ТГФ,-78оС
-* СН3СН2СН=С(СН3)СНО ZH-^51 2 3-----------►
-•> (С2Н5)2СНСН(СН3)СНО
1. nh2nh2_________________
2. КОН/диэтиленгликоль, 200вС
-♦ (С2Н5)2СНСН(СН3)2
SOCL.QHjN l.Li/петр. эфир,; .
СН3СН2ОН t СН3СН2С1 2-си-с1'/ТГФ> (С2Н5)2СиЬ
3-56. (СНзЪСНСНгСНО
<VcH2CH(CH3h;^^>g-?r] CH^CH^CCH^CH^
V.C Z. Crl^vri [1J II
З.Нё02,ЙОН/НтО о
сн3(сн2)3он сн3(сн2)2соон S”:CT-CI; »
СН3(СН2)2С(О)С1
[I]
3-57. НООС(СН2)4СООН —Sfe*
К..
-ВаСО,
1. Вгг, СНзССЮН
ZNEri '
О— или
1.и>А,ТГФ,-78°С
3. HA, 20-60t
NaSHZQMCO 1. BF>-ВО Г~S.
вксн2)звг HS(CH2)3SH Qch3
1. ВиЦ/ТГФ,-78°Сг
2. О=О/ТГФ
3. HgCl2/ROH—Н2О
,он
С(О)СН3 эфир,7
SOC12,C5H5N
150 Решения
3-58.
1. LDA/ТГФ, -78°С
2. PhSeBr,-20°С * З.Н2О2, 20-60°С
1. LDA/ТГФ, -78°С
2. СН3СН2Вг
3. Н3О®
с2н5
КСН3)2СН]2СиЬ» лЛ=г) №зР с;сн3)2/эфирг
ТГФ,-78°С “-Ph3P=O ”
(СН3)2СН
С2Н5 С2Н5
—* 0=С(СН’Ь!|^ С^СН(СН3)2
(СН3)2СН (СН3)2СН
РВг3 (СН3)2СНОН —*(СНз)2СНВг-
1. Li/петр. эфир, t
2.Си2а2/ТГФ * KCH3)2CH]2CuLi
----►РЬзР С(СН3)2
2. ВиЬ/эфир •’ v i7Z
3-59. (СН3)2С=О 4'-уЧ (СНз)2С=СНС(О)СНз “►
l.(QH5)2CuLi/Tro,-78oC
^-3®-------------► СгВДСНЖСНгОДСНз
© ©
Ph3P СНСН3
^_'10°с> С2Н5С(СН3)2СН2С(СН3)=СНСН3
Z-изомер
Получение диэтилкупрата лития см. решение задачи 3-55.
3-60. (СН3)2СНСНО } ^(СН3)2СНСН2ОН
-►(СН3)2СНСН2Вг
1. Ph3P/CH3CN, г е ©
Т^Й7;фир,-20°С> (СН3)2СНСН РРЬз
3. Карбонильные соединения 151
(СН3)2СНСНО ^*(СНз)2С=СНС(СН3)2СНО —
© 0 ртт 9-^3
Ph3P СНСНССН^ <-Н3 /=/ H?,Pd/C сн3А=™3
СН(СН3)2
—► (СН3)2СНСН2С(СН3)2(СН2)2СН(СН3)2
[А]
3-61. [(Ch3)2nch2ch2C(O)ch3] • на
диэтилфталат, 1бО°С
-Me2NH • HQ
-* СН2=СНС(О)СН3
80%
ДРЬ 1. LDA/ТГФ,-78 ?СН3 2. СН2=СНС(ОКНз 3. Н3оР
EtONa
EtOH
(CH,)2CuLi Т ГФ,-78 °C
1. NH2NH2________________
2. КОН/диэтиленгликоль, 200°С
СНЛ СН3 'сн3
[А] [Б]
Получение диметилкупрата лития см. решение задачи 3-35.
3-62.
l.Mg/Hg
2.Н3О^,20°С
H2SO4 (kohu.J t
1. LDA/ТГФ,-78°С
2. CH,I
З.Н3ОР
1. CH2Q пирролидин/EtOH, НО(конц.)
2. NaHCO3/H2O
CH3
152 Решения
3-63. НООС(СН2)5СООН n"ncplw"- >тск>
23 2 400 С толуол, г
1 CHCN/t ® ®
CH3I + Ph3P Уц-т, £ > Ph3p СН2
J J 2 Bub/эфир J 4
3-64. Способ 1.
СН3(СН2)2СН2ОН 29H5N/CH2a2,20°с СНз(СН2)гСНО
r^LJ Л1 и D- ЬРЬзР/СНзСЫ т-^тт ^тт гъгм
СН3СН2Вг -2-виЦ/эфир »СНзСН2 PPh3
снзсно СН3(СН2)2СН=СНСНО
3. Н3О®/Г
-^^^/Эфир> СН3(СН2)2СН=СНСН=СНСН3
3 (Е) (Е)
Способ 2.
снзсно сн3сн=снсно
СНз(СН2)3ОН снз(сн2)звг {Ж^;8ОС>
-^СНз^О^гСНH>h3СН3(СН2)2СН=СНСН=СНСНз
3. Карбоинльиые соединения 153
3-65. CHJCHO?Sg^lf~>CHJl li"hJMOTA,ll<11--,8'£ (
BF3-Et2O \—S 2. циклогексен-2-он \
3. HgCl2/ROH—Н2О сн £ 3П
1. LDA/ТГФ,-78 °C /~Л О
\ / О ZPhSeBr,-20Г * \=/
3. НэО^ 20-60°С
В присутствии ГМФТА анионы 1,3-дитианов присоединяются к а,/3-ненасыщенным кетонам по 1,4-положению. В отсутствие ГМФТА наблюдается характерное для литиевых производных 1,2-присоединение по карбонильной группе (см. решение задачи 3-57).
3-66. PhCHO + CH3C(O)Ph 4-^* PhCH=CHC(O)Ph ЫОН
CH3C(O)CH2COOEt
1. PhCH—CHC(O)Ph, EtONa/EtOH
2. H3O®
’ О Ph О ’ CH3CCHCHCH2CPh COOEt
I.EtONa, EtOH
2. H2O, NH4C1
Второй этап синтеза включает две последовательные реакции: реакцию Михаэля и внутримолекулярную альдольно-кротоновую конденсацию промежуточного аддукта.
3-67. (СН3)2СНОН (СН3)2СНВг
1. EtONa/EtOH CH3C(O)CH2COOEt 2 (сн^сНВг *
3. СН2=СНС(О)СН3, EtONa/EtOH
НС1
* ITcOOEt нДГГ х
СН3 СН3
О
А СН(СН3)2
154 Решения
3-68.
Следует использовать конденсации Кневенагеля и Дикмана.
(CH3)2C(O) + СН2(СООВ)2
-(СНЛС^СООЕОз »
3. PBrj/пиридин
^(СНз)2С=С(СН2Вг)2^^^^
на
(CH3)2OC[CH2CH(COOEt)2]2T77—-о*
тт®
-*(СН3)2С=С(СН2СН2СООН)2 ctUri
NaH
—(CHjhC^fCH^HzCOOBh TO1,yml00.f
О
COOEt
СН(СН3)2
3-69.
Br-i
СН3С(О)СН3 -2 » СН3С(О)СН2Вг
CrijCAjL/rl
пирролидин, л-ТСК толуол,t
1. СН3С(О)СН2Вг
2. Н3О®
СН2С(О)СН3
2. Н3О®
1. EtONa, EtOH
и 2. мща / н2о’
О
[А]
Синтез спланирован на основе предложенных в условии реагентов (см. решение задачи 3-35).
3. Карбонильные соединения 155
3-70. Способ 1.
СН3С(О)С1 2’н3О®7)2а1Ь/ТГФ’ 78 * СН3С(О)СН(СНз)2
СН3СН2С(О)СН3 2^Aqo^~78> Z. СНзС(и)Сг1з 3. Н3О®
CH3C(O)CH(CH3)2, NaOEt сн3сн2с(о)сн=с(снз)2 ........L 3J2’--►
EtOH, t
о о
11 II
[С2Н5ССН2С(СН3)2С(СНз)2ССН3]
NaOEt, EtOH t
СНг СНз
Х,СН3
Г Тсн3
сгт сн3 сн3
[А]
Способ 2.
СН3С(О)СН(СН3)2 ПИРР°ЛИДИН’ ”-тск толуол, 110°С
N ГГГН>-ГГГН> 1СНзСН2С(О)СН=С(СНА,Толуол,/
N -СДСН^-СССНз) 2 ——©----------------------»
' Z. H3U
—► [С2Н5С(О)СН2С(СН3)2С(СН3)2С(О)СН3]
СН3 СН3
H2S°4 г Х<™3
сн3 [А]
156 Решения
3-71.
1. LDA/ТГФ,-78“С сн3с(о)сн3 2. (с2н5)2с=о
3.
-► (С2Н5)2С(ОН)СН2С(О)СН3 (С2Н5)2С=СНС(О)СН3
СНзСЮСНзй^^й^ (С^СНзСдаНзЪ-
3.HjO®
СН3
Zn, TiC14 » С2Н5 /-J qh
ТГФ, 25°С,2ч С9Н<\--4-ОН
СН3
[А]
3-72. PhC(O)CH3 2^XcHCHO78°C> РЬС(О)СН2СН2СН2СНО -* 3. Н36® [А]
КОН (40%-ный р-р ROH—Н2О,100 °C
i. PhCH(OH)CH2CH2CH2COOH СцН14О3 [Б]
Последняя стадия — это внутримолекулярная реакция Канниццаро, где альдегидная группа окисляется, а кетонная — восстанавливается (см. также решение задачи 3-18).
3-73. BrCH2COOEt T-NaH^eoeTaT’ Ph^ CHCOOEt
BrCH2CH=CH2 )CH3L»Ph3P CHCH=CH2
2 1 2 2. BuLi/эфир J 2
1 /СН2С1г, -78 C H/CHC/CM 1 СНГ)_-
кУ 2. РИ3Р(или Me2S),0°C н(°)с((-н2)з(-НО —►
© Э
2^*H(O)C(CH2)3CH=CHCOOEt —►
©э
Ph3P™t~CH2» CH2=CHCH=CH(CH2)3CH=CHCOOEt
3. Карбонильные соединения 157
.COOEt
_ сн2----СН2-"СН2
COOEt
[А]
CH2O,Cu2C2
3-74. СН=СН —------► НОСН2С=ССН2ОН —►
сгоз-здч дд'снд>н(о)сСЕСС(о)Н или МпО2/СН2С12
LAg^NH^ СНзОосСнССООСН3Ь^
2. СН3ОН, Н®
О о СООСНз
СООСНз СН2=СНСН=СН2
соосн3 ‘
соосн3
[А]
3-75- он=сн 7 ^ХГТГФ> НС5СС(СН3)2ОН
3.NH4C1/H2O
аон, nh2ch2ch2nh2 * сн2=снс(СНз)2ОН
CH^CHC(CH3hOH (СН3)2С=СНСН2Вг
перегруппировка)
СН2=СНС(О)СН3
сн3
CTif=C(CH3)CH=ai2
С(О)СН3
1, LDA/ТГФ,-78°Сг
2. (СН3)2С=СНСН2Вг
3. Н3О®“
[А]
1. СН31/г Ph3P
© э
♦ Ph3P СН2
2. «-С4Н91а/эфир
158 Решения
О О
61. LDA/ТГФ,-78°С ДСООЕ^ aoNa/EtOH
2. ЕЮС(О)С1/ТГФ 2. СН^СНСНО
3. Н3О® 3. Н3О®
? СН2СН2СНО
Н2О, '
COOEt
[Д^СН2СН2СНО
[А]
3-77. СН3С(О)СН=СН2 --------------►
2. этиленгликоль, л-ТСК/толуол, t
БЪ 00
— СН3ССН2СН2Вг^^эфи> CH3CCH2CH2COOEt —
1 .на/нр,20°С^ /—\
2 . NaBH4/H2O *“ „ r А А? п
З .Н3О® Н3С О °
[А]
3-78. CH3C(O)CH2COOEt CH3C(O)CHCH2CH2COOEt
х. снт^снсииьс |
COOEt
СН3С(О)СН2СН2СН2СООН -*►
СН2^/эфир CH3C(O)CH2CH2CH2COOMe —►
толуолГ™К°ЛЬ’ " СЩССН2СН2СН2СООМе
1 . LiAlH; °' Р
X й'й'Аг---------” СН3ССНоСН2СН2СНО -►
3. С1О3 • гСАМ/СНгС!,, 20 °C
® ® /ГА
Ph3P СНэ/эфир ОЧР
-----:—► СН3ССН2СН2СН2СН=СН2
[I]
3. Карбонильные соединения 159
Далее синтез можно продолжить двумя различными способами.
Способ 1.
КМпО4/Н20, pH 7, 0°С ^тт
I ---------------► С1{3ССН2СН2СН2СН—СН2—*
он он
о
СН3ССН2СН2СН2СН-СН2 он он
BF3- ВтО
[А]
Способ 2.
1. Л<-С1С6Н4СО3Н/С6Н(„ 10°С
2. NajSA, Na-CO3/H2O
О
СН3ССН2СН2СН2СН-СН2 ^ч
[А]
Возможно, что образование ацеталя А (способ 2) проходит через образование енола с последующей атакой гидроксильной группы енола по эпоксидной группе в присутствии SnCl4 (слабая кислота Льюиса). Далее образовавшийся дигидропиран присоединяет оставшуюся гидроксигруппу.
160 Решения
3-79.
(СНзЪСНСНО r-N-CH=C<CH112
3 толуол, 110 С ।
О
1, СН3С(О)СН=СН2/толуол ,j
2.Н3О® *"
СН3СН3
о
_ tj] 1- NaH/толуол, 110°С
2. СН3СООН *
сн3 сн3
сн3 ch3q
о X
сн3 сн3
[А]
3-80.
р, £ 1. Mg/эфир____f АЬОз, 400 С
Г Г 2. циклогексанон ХАр, или н3РО4, 80°С
3. КИдО/НЮ
-*Q-ph
1.О3/СН2СЬ, -78°С
2. НэОэ/СНзСООН
-*• PhC(O)(CH2)4COOH
—► PhC(O)(CH2)4COOEt
этиленгликоль, л-ТСК толуол,t
О. Р кон
-► PhC(CH2)4COOEt
Q. Р _______0 ®. электролиз по Кольбе
РЬС(СНз)4ССХ) к-----------------►
Q. Р Рч Р на PhC(CH2)8CPh PhC(O)(CH2)8C(O)Ph
Г12О, 2U с
3. Карбонильные соединения 161
3-81.
соон
150 °с СООН
соон
1.03/СН2С12,-78 С
, 2. Н2О2/Н2О
СООН
3-82.
НООС-^уСООН ноосЛоон
[А]
С2Н5С=СС2Н5
1, KNH(CH2)3NH2/NH2(CH2)3NH2, 20 °C
2. Н3О®
—►С4НУС=СН
l,NaNH2/NH3
2. СН3СН2СН2Вг/ТГФ>
С4Н9С=СС3Н7
1. KNH(CH2)3NH2/NH2(CH2)3NH2, 20°с гт _
с7н15с=сн-*
1. &а2ВН/ТГФ, 0°С
2. Н2О2/Н2О, рН7+8
с8н17сно
3-83. НС=СН ^^^^HOCHzCsCCHzOH-»
100 атм, 150 С
Н2 / Р-2-Ni________
EtOH— NH2CH2CH2NH2
НОСН2СН=СНСН2ОН -► цис
дигидропиран, л-ТСК Г | „ Г ]
толуол, г ---* 1оЛосн2сн=снсн2оДо;
цис
1. О5О4/пИрИДИ1£
2. NaHSO3, Н,О *
3. Н3О®
сн2он h-Loh н—он
СН2ОН
6—3771
[А]
162 Решения
3-84.
нг=гм 1ВиЦ/ТГФ,-30°С ТВиЦ/ТГф-ЗОЧс
СН 2. CH3(CH2)5CH2Br [I] Н <-'7Н15(—СН 2. этиленоксид
—► с7н15с=ссн2сн2он ^Рс11 BaS°4, хиноли»
ВОН
— с7н15сн=снсн2сн2он
цис СН2С12,25°С
Ag2O
C7H15CH=CHCH2CHO
цис ТГФ—Н20,20°С
CH2N2, Pd(OAc)2
С7Н15СН=СНСН2СООН ^i0.()oc2: цис
СН3(СН2)5СН2 СН2СООСН3
[А]
СН3(СН2)6СН2ОН -^-*СН3(СН2)5СН2Вг
CsH5N [J]
3-85.
(СН3)2СО (СН3)2С-С(СН3)2-^2з
Z,. Пае/ J J f
НО ОН сн3 ВгСН2
'Х NBS’(PhCOO)jO, 'y TsOAg
BrCH2^ ai,CN
СН3
t
TsOCH
TsOCH2'
малеиновый TsOCH? ангидрид^ 4
эфир, 25 °C
TsOCH2
о
{ l.LiAH4 0 -------z—>.
/ 2. H3O®/0°C
О
TsOCH2 СН2ОН TsOCH2 CH2OTs
Ду л-TsCl Ду Н2, Pd/C
► I ---► ‘2--т»
АД Ру ДА вон
TsOCH2 СН2ОН TsOCH2 CH^Ts
3. Карбонильные соединения 163
JsOCH, CH2OTs СН2
TsOCH^C^OTs2-' СНЛ^СНг
[A]
3-86.
сн=сн
1. NaNH?/NH, (ж.)ж
2. циклопентанон
ONa
1. NaNH2, NH3 (ж.)
2. циклопентанон
3.NH4C1/H2O
О
Hg(OAc)2
H2O, H2SO4
OH OH
[A]
3-87.
HOOC(CH2)7COOH HOCH2(CH2)7CH2OH
дигидропиран, «-ТСК „ Г |
-------- HO(CH2)8CH2O^OJ
Ph3P • CBr4
ДМФА, 20°C
П1. CH3C= CNa/NH3 (ж.),-33 °C
2. Na/NH3 (ж.), -33°C *“
U 3. HC1 / H20,20 °C
—► CH3CH=CH(CH2)8CH2OH
E -изомер
3-88.
СООН
соон
150 °C*"
^соон ОС ^'СООН
!.LiAlH4
2. Н3О®/0°С
СН2ОН
СН2ОН
l.TsCiqaKBj/CiHsN 1.0уСН2а2,-75НОСН2"\^
2. КОН/ДМСО * гкавщ/снрн* НОСНг^^
РВг3_________
пиридин—эфир
ВгСНз^а
BrCH2x>-v
1. NMe3
2. Ag2OZ Н2О
З.Н2О, 150 °C
[А]
164 Решения
3-89.
НО
сно
этиленгликоль, л-ТСК
толуол, ПО °C ’ НО
CrO3-2C5H5N /ДуО> 1. СН3МёТ/эфир НО^д.0-.
* ° '^О^ 2 нз°® ** СН3'^'о^*
Н2О, НС1 (0,5 моль), кипячение (30 мин)
СНО
3-90. Стереоселективность реакции Виттита можно контролировать присутствием солей лития (например, бромида или иодида), если в качестве депротонирующего агента применять н-бутил-литий. Получение бетаина в этом случае проводят при низкой температуре —78 °C. Затем бетаиновый интермедиат обрабатывается еще 1 экв. н-бутиллития с целью получения нового илида. При этом протонирование промежуточного интермедиата после введения в реакционную смесь небольшого количества трет-бута-нола в качестве протонирующего агента приводит к образованию более стабильного гп/?ео-бетаина, разложение которого приводит к алкену с гп/?<знс-конфигурацией.
_ _ бутадиен-1,3
сн2=снсно * - » z 160 С, 5ч
® 0
1. Ph3P CHCOOEt/эфир, -78 С, LiBr
2. BuLi
3. r-BuOH
—► ^_J)-CH=CHCOOEt
Е- изомер
[А]
BrCH2COOEt 2 мХтГФ°”ИТ'1;,,ИЛ'Ph3P CHCOOEt
3-91. СН3СНО |;^CoS3~Z8'g> (CH3)2C=CHCHQ-»
3. H3O®, t
1 ТГФ^ЗО™™^ 'I]>> (CH3)2C=CHCHCH2CH=CHCH3 -►
2 . H2o' ОН
gfg-' (СН3)2С=СНСНСН2СН=СНСН3 2 21 Г)
[А]
3. Карбонильные соединения- 165
Получение I.
СН3СНО
l.KOH/ffl3OH.10715°C о
2. Н2О, NH4CI J I 1 2
ОН
60%
или
сн3сно *• ^аюФ’ ~7• р»сн3снсн2сно
3. Н3О® ОН
80%
CH3CHCH2CHO СН3СН=СНСНО 1И^4пог» он
—CH3CH=CHCH2OH СН3СН=СНСН2С1;^7*
—► СН3СН=СНСН2Ы
[I]
3-92. С2н5с=СН С2Н5С=ССН2СН2ОН —
3.NH4C1/H2O
H2,Pd/BaSO4 с н Сн=СНСН2СН2ОН -------------*
ХИНОЛИН—ROH ~ пиридин—эфир
Z-изомер
-► С2Н5СН= СНСН2СН2Вг Z- изомер
[I]
Н(О)ССН2СН2С(О)Н
вр™оН(2мол" Осн2снчЗ
1. BuLi/ТГФ,-78°С
2. СН31 *"
^СНз S-л
'-S CHiOVS^
|§^^СНзС(СН2)2С(СН2)2СН=СНС2Н5
3.Hgd2/EtOH-H2O О О z.H30Mep
1. EtONa/EtOH, 70°С
2. Н2О, NH4CI
Н''С=С''Н
ChJ 'СН2СНз
СНз 7
Z-жасмон
166 Решения
-» Л-» ГУ тт гт—гттт L Ви1и/эфир,-30°С
3-93. С2Н5С=CH Ycho------------* С2Н5С=ССН2ОН
3. Н2О, NH4CI
Н2, Pd/BaSO4,^ хинолин—ROH
С2Н5СН=СНСН2ОН
Z-изомер
Ph3P • СВГ4 сн2а2 *
—► С2Н5СН=СНСН2Вг
Z-изомер
[I]
О
1 TDA/ТГФ -7R°C II
СН3СОСН3 Ту „’m » сн3ссн2сн2сн=снс2н5-*
J -3 2. Z- изомер [I] л z z z э
3. H3O® Z-изомер
О о
1. LDA/ТГФ, -78°C и II
ГсндеНА * СНзС(СН2)2С(СН2)2СН=СНС2Н5 —
3. Н3С/® Z-изомер
О Н-с=СЛ ,?-.B.ONa/&OH ДгСНг 'СН2СН3 2.H2O,NH4C1 I______!tCH3
Z-жасмон
3-94. После присоединения дифенилкупрата лития к винил-этилкетону реакционную смесь обрабатывают этилбромидом при —78 °C. При этих условиях изомеризация енолята затруднена и алкилирование пойдет по нужному направлению.
1. LDA/ТГФ, -78 Т
СН3СН2С(О)СН2СНз 2 phSeBr/_20oc > СН3СН2С(О)СН=СН2
З.Н2О2/20-60 °C
£а£ХГФ"78°С> СНзСН2С(О)(рНСН2РЬ
3. NHjCI/HtO С2Н5
3. Карбонильные соединения 167
3-95. НООС(СН2)4СООН
1Ва(ОН)2» <\_Q 1. LDA/ТГФ,-78°С
2. 400°C U 2. СН3СН2СН2Вг
3. Н3О®
I. П12О, пирролидингидрохлорид
2. Na2CO3/H2O *“
(СН2)2СН3
9(СН2)2СН3
C?CH2hQ
На последней стадии аминометилирование протекает по наиболее замещенному углеродному атому — характерная особенность этой реакции с участием енола.
i.Mg/Hg,TiCl4/Tro,0°c Л,™тч H2SO4
3-96. СН3С(О)СН3 -------------------► (СН3)2С-С(СН3)2уу-у-
2 ОН
-*(СНз)3СССН3 о
СН3С(О)СН=СН2, NaOEt J—\ 1. U/NH, (ж.)
EtOH,-10 °C ° 2- NH4C1/H2O
©е С(СН3)3
Ph3P СН2 эфир
С(СН3)3
С(СН3)3
[А]
3-97. EtOOC(CH2)4COOEt ГУ О-
t!iUri,oU С COOEt
HCl ^-GQHjCOAt/GIClj (влажный), 22+25°С, 50ч
нл*7 Г/0
[А]
Ph3P • СВп
3-98. СН=ССН2ОН СН=ССН2Вг -►
эфир
1. NaCH(COOEt)2
————г СН3ССН2СН2СООН
Z. Г12оОд, rlgoLJ^/112O, DU-oU V ||
На последней стадии реакция Кучерова сопровождается одновременным гидролизом и декарбоксилированием образовавшегося замещенного малонового эфира.
168 Решения
3-99. СН3ССН=СН2 ™г » и О
СН3ССН2СН2ВГ НСХСНг^ОН/бензол—л-ТСК, кипячение»
О
ор
—► CH3CCH2CH2Br -эфир» CH3CCH2CH2COOH
2- C(J2 II
3. НС1/Н2О о
3-100. PhCH,COOEt
-*► PhCHCOOEt Oj£CHCCm,BONa> CH2CH2COOEt BOH
CH2CH2COOEt
—► PhCCOOEt
CH2CH2COOEt
I. Na, EtOH/толуол, кипячение 2. CH3COOH *“
EtOOC
HC1 (20%-ный p-p), кипячение, 3-6ч
3-101. (СНэЪСНССН, ^^^(СНэЬСНССН-СНСзН, О З.Н3О® о
СН ССН COOEt 1* ^0^*4 EtOH/ C2HgCTI=CllC(O)CH(CH3)2
II 2. НС1 (20% -ная), кипячение
О
с2н5
-► (СНзЬСНССНгСНСЩССНз -^а’ Вон <катали3-) II II J толуол, кипячение
О о
(CH3)2CH
c2H5
(СНз)гСН
1. U/NH3 (ж.) U 2. NH4CI/H2O
С2Н5
о
3. Карбонильные соединения 169
3-102. (СН3)2С=О (СН3)2С=СНС(О)СН3 -►
1.(СТ3)2СнЦ/ТГФ,-78°С (СН3)3ССН2С(О)СН3 —►
2.NH4C1/H2O j j
(СН3)3ССН2С(О)СН2СН(СН3)2
2. (СНз^э^НВГ
3. Н3О®“
3-103. CH3CCH2COOEt PhCCH2CH2CCH3
о З.НС1/Н2О, / О о
Ph£CH3 CH2Br
о о
1. LDA/ТГФ, -78°С^
2. ВгСН2С(Вг)=СН2Г
3. Н3О®
О
ДСН2С-СН2 НО(СН2)2ОН
\ Вг толуол, «-ТСК*
СН2С=СН2
к
1. Mg/эфир^
2. СХ)2 *"
3.NH4C1/H2O
J>Ach2c=ch2 НС1 л
L J СООН Н2°>0 С
COOEt ° L H2SO4 (катализ.) 11 ^С^С—СН2
EtOH, t
EtONa^ аон,Г
СН2С=СН2
COOEt
170 Решения
3-105. CH3CCH2COOEt ' ^а/ВОЧ. CH3CCH(CH3)COQEt —► II 2. CH3I -’ll
о о
^^2^CH3CC(CH3)2COOEt
z. СН31 II НэО, t
о
к СТТ ССТкСП'i 1-LDA/ТГФ,-78 С
"* снзССН(СН3)2 2 BlCH(C00Et)2 > о 3. Н3О®
-► (CH3)2CHCCH,CH(COOEt)2 ^о^он».
2. на/н2о, t
1. NaBHi
—>(СН3)2СНС(СН2)2СООН II Z. ITiU /и V
о
[А] н® г-"Х
—► (СН3)2СНСН(СН2)2СООН 7* JZ /= 0
ОН (СН3)2СН 0
[Б]
О1. Oj/CH2C12, -78 °C
2. Me2S --------* Н(О)С(СН2)3С(О)Н -*
Ph3P CHCOOEt^ Нч _ Х(СН2)3^ _ 21 г эфир, 20°С Et00C/C С'Н Н/С CxCOOEt
>тл1и/л. НК ,(СН2)з Н
1. ЬА1Щ/эфир ^с-с7
2. МН4С1/Н2О, 0 С чи ''С'/'СПН
3. СгО3 C5H5N • НС1 Н Н С(О)Н
[А]
3-107. СН2=СНСН2СН2ОН СН2=СНСН2СН2Вг * ^7^
Cri3UlN Z. CU2CI2/ L L Ф
—>► (CH2=CHCH2CH2)2CuLi
/—\=п 1ЕРА/ТГФ--78°С1 \___2. PhSeBr,-20°С *
з. н2О2/2а-б0ос
3. Карбонильные соединения 171
/ Vq 1. (СН2=СНСН2СН2)2Сии/ТГФ \=/ 2. NH4C1/H2O
СН2=СНСН2СН2
1.03/СН2С12,-78°С ° 2. Me2S
Н(О)ССН2СН2
l.BONa/BOH
2. Н3О®
О
Н2’Pd/C-
С2Н5ОН>
[А]
3-108. СН3СНО 1-phcH°’EtONa/EtOH’f>» PhCH=CHCHO J 3. H3O®
СНзСН0 I^g^F*pbCH(CH2CHO)2
3.NH4Cl/H2O,0°C
3-109. Cl^C(O)CH2COOEt
l.NaOB, BOH CH^(O)CHCH 1-NaOEt/EtOH, 2. CH3I J । J 2. этиленоксид
COOEt
-► СН3^~П) CH3C(O)CH(CH3)CH2CH2Br -► CH3C(6)Y
1. NaOH/H2O, t
2.CH3COONa/H2cT
CH3
C(O)CH3
3-110. Q-CHO PhC^l3’EtO^a~*' Q"CH=CH-$~O_> о
CH3C(O)CH2COOB, BONa,£ BOH
Ph
EtOOC Ph
[A]
172 Решения
НВг
—* BrCH2CH2CH2COOEt
КОН
НООС(СН2)4СООН
1. LDA/ТГФ,-78°C
0 2. BrCH2CH,CH2COOEt
3. H3O®
О
NaH, толуол,t
CH2CH2CH2COOEt
о
[А]
О
3-112. CH2O + HC=CH HOCH2C=CCH2OH^3-^^-^
H2SO4 (кони.) _
-► НООСС=ССООН - -- -------EtOOCC=CCOOEt -►
ЕЮН
бутадиен-1,3 эфир, 20 °C*
COOEt
бутадиен-1,3
COOEtэфир’ 20°С
COOEt
OSiMe3 A-OSiMe,
н2о—тгф’
OH
Na, MejSiCl ксилол,t
l.Zn/CH3COOH
2. NaBHt/SOH
COOEt о . />он
[А]
3-113.
1.03/CH2CI2, -30°C
2. Ph3P
1. LiAlH4
2.H3O®/0°C
,СН2ОН
СН2ОН
Н(О)ССН2
Н(О)ССН2
NaOEt
EtOH,z
H(O)C [A]
Глава 4
ЭЛЕКТРОФИЛЬНОЕ И НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРОМАТИЧЕСКОМ РЯДУ
4-1. Ароматические структуры: в)—д), з), к).
Неароматические структуры: е), ж). Антиароматические структуры: а), б), и).
4-2. Ароматические структуры: б), г), ж), з), к). Неароматические структуры: в), д), и). Антиароматические структуры: а), е).
4-3. Ароматические структуры: а), в)—д), ж), и).
Неароматические структуры: б), з).
Антиароматические структуры: е), к).
4-4. Ароматические структуры: в), ж), з).
Неароматические структуры: б).
Антиароматические структуры: а), г)—е).
4-5. Ароматические структуры: б), в), е), ж).
Неароматические структуры: а).
Антиароматические структуры: г), д), з).
4-6. 1) Ароматические структуры: б), г), е), з).
Неароматические структуры: д), ж) неплоская структура. Антиароматические структуры: а), в).
174 Решения
2) Аномально высокие дипольные моменты этих молекул (по сравнению с молекулами простых алкенов и кетонов) обусловлены ароматическим вкладом энергетически выгодных структур с разделенными зарядами:
4-7. Ароматические структуры: а)—г).
Неароматические структуры: д) неплоская структура, е) неплоская структура, ж).
Антиароматические структуры: з)—к).
4-8. Ароматические структуры: а)—д).
Неароматические структуры: е), ж) не плоская структура.
Антиароматические структуры: з)—к).
4-9. Ароматические структуры: а)—г).
Неароматические структуры: д) неплоская структура, е) неплоская структура.
Антиароматические структуры: ж)—к).
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 175
А и Б — ароматические структуры.
А и Б — ароматические структуры.
4-12. СН-Кислотность метиленовых протонов в этих соединениях связана со стабильностью образующихся под действием основания карбанионов — сопряженных оснований. В соединении В кислотность метиленовых протонов наибольшая, так как де-протонированпе приводит к ароматическому циклопентадиенил-аниону; в соединении Г она наименьшая — при депротонировании образуется антиароматический тропилий-анион. Промежуточное положение занимают соединения А и Б, формально содержащие циклопентадиенильный фрагмент, однако стабилизация образующихся в этих случаях карбанионов должна осуществляться с нарушением устойчивой ароматической системы бензольных колец.
4-13. а)
HSO®
б) См. ответ к задаче 4-6, пункт 2).
176 Решения
Соединение А содержит ароматические катионный и анионный фрагменты.
О> О®
6)d — 6
антиароматическая структура
4-15. с2Н5ОН с2Н5Вг
В случае б) реализуется SrN 1 -механизм нуклеофильного ароматического замещения
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 177
4-16.
4-17.
Способ 1.
О и-С3Н7ОН -КМ-^3°1 С2Н5СООН^- С,Н5СС1
H-C3H7 И-Сзн?
[А]
7—3771
178 Решения
Другой метод синтеза 2-(н-пропил)нафталина [Б].
Вг
1. (н-С;Н7)2СиЦ/ТГФ_
2. Н3О®
Способ 2. Приведенным выше методом (см. способ 1) из нафталина и янтарного ангидрида можно получить незамещенный фенантрен, а затем в две стадии превратить его в 9-(н-про-пил)фенантрен [А].
4-18. Способ 1.
[А]
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 179
Замечание. Продукт а-ацилирования нафталина фталевым ангидридом в результате вышеуказанных реакций также превращается в искомый бенз[а]антрацен [А].
Получение 1-бром-2,4,6-триэтилбензола см. решение задачи 4-15.
4-20. Синтез л-диацетилбензола [А].
Способ 1. В предложенном способе используется защита о-положения толуола сульфогруппой при последующем бромировании. Смесь о- и п -толуолсульфо кислот разделяют, используя их различную растворимость в холодной концентрированной соляной кислоте. л-Толуолсульфокислота выпадает в осадок, а о-изомер остается в растворе.
О^с-С1 СЬс-СНз
1КМпО4,НО9 рЛх. 1,Ме2Сии,ТГФ
2. SOCb/бензол, / 2. Н3О®
О*С"С1 О^С-сНз
[А]
180 Решения
Способ 2.
[А]
KMnO4, Mg(NOj2 Н20,60°С
Синтез о-диацетилбензола [Б]:
Способ 1.
СН2СН3 9
' 2 3 С1ССН3
А1С13, бензол
СН2СН3
" (СН3)3СС1г
А1С1э (CHj)3C
сн3
[Б]
Способ 2.
CH2CH3
Вг2 СН3СООН (СН3)3С (СНз)3С
СН2СН:
-(СН^СС^, ’
-CHj=C(CH3)2
,<^СН2СН3
Далее поступают, как описано выше в способе 2 синтеза н-диа-цетилбензола [А].
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 181
4-21. Механизм реакции.
НВг, Rtf
СН2СН2Вг
KCN
ДМСО
8—3771
182 Решения
9,10-Антрахинон можно превратить в антрацен другим спо-
О
4-25. (СН3)2СНСН,ОН (ВДРНСООН (СН3)2СНСС1 £>2^0^
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 183
и 1. (СНз)2СНСС1, А1С13/С6Н6 |ХЧ 2. Н2О * jCH(CH3)2 Zn/Hg'HCl (кони.) СН2С1КСН3)2
s 1. ЫА1Н4/эфир 2. nh4ci/h,o * HQ Сп сн, -СН2СН(СН,)2 — X J СНзСНА mci3 сн3 СН2СН(СН3)2 J РВгзг KCN ^СН2СН(СН3). ДМСО, * Д J 1 сн3сн2
Вг н3о® сн3снг 1 соон [А] О Cq aici3 CN CH2CH(CHj)2 1 О
Zn/Hg
Mg/эфир
Вг Вг _ (СН2)3СООН i.soa2 А ~2. Aicij JL Вг Вг :::5тx', Zn/Hg НС1 (конц.) О
3. Н3О® Вг 3 ноос^4^ [А]
184 Решения
/4s CHjCHpOjCl, AIC13 /4j ^-6^6 ^(сн2)2сн3 ф дюз %/ ch2cl. ГсНзСНз Zn/Hg » J HCl (конц.) (СН^СНз fV hnoj O<s/k/ H2SQ* CH2CH2COOH
(CH2)2CH3 r /4/ SnC12> HC1 OyA/^NO2 Q CH2CH2COOH . (CH2)2CH Zn/Hg (|*И HCl (KoHu.f HOOC(CH2)3 2 [A] , /Ч^Нз CO, HCl, Cu^Cly AICI3 CH2C12 H CH /Чу• ’ CO, HCl, Си2СЦ / _A1CL, CHjQ," As- H3C 2 2 H,C Br ACH3 “* JOl>o ИзС^Х [A] ^(CH2)2CH3 CH2CH2COOH ? *3 N2H„ KOH HO(CH2)2O(CH2)2OH, iscfc CH5 Br2, A1C13 As^O CH2C12 * H
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 185
4-29. Способ 1.
4s l.(CH3)3CCl, А1С1
2- QH6
KjCrA
Н
H2SO4 ноос
С(СНз)3
C(CHj)3
' CO, HCl, A1C13, CujCl2
CH2C12 *
С(СНз)3
SOC12
C6H6
(снжс
Cl-c^4^
II
° 9
1. CHjCHjCCl, A1CL
1,0
(СНя)3С .(ОДзСН,
О
АСН2СН3 Zn/Hg
(СНз)£
НС1(конц.)
газ С(СН()’ LA]
Способ 2.
ВГ1 “^(СНЛС^Вг
(CHj-CHj ^(CHjjjCHj
(СН3
Вг
(СНз)3(Г "СООН
(СНз)3С-0, А1С13
СНзС12 (СН^зС
ГА1 <СНзЬ
IAI
(СНз)зСх "С(О)С1
(СН2)2СН3
186 Решения
4-30.
Способ 1.
Вг
СН3 0
х 1. КМпО4, он°/н2о
2. Н3О®
СООН
' HNO3
H>SQ
o2n . соон
" ' Fe
НС1 (конц.)
Вг
Вг
h2n . соон, „ „
1. (СН3СО)2О, t
2. HNO3, H,SO4*
3. НС1 (конц.), t
Вг
H2N - СООН
Вг ' NO2
[А]
Способ 2.
О
Л CO,HC1,A1C13,CU2C12 Zn/Hg О Вг2
снр2 *" НС1 (конц*) ~ *
HNO3
h2so7
KMnQ, ОН®Н2О
СООН
no2
Br2 А1С13‘
1. KNH2 (2экв.)
2. H3O®
[A]
4-31.
rp^<C1 l.Mg/ТГФ x^yCOOH Cl2, A1C13 С1У<УС0Ш SOC12
2. COj * IIJ CH2C12 * CHCL
3.Н3О® x
4. Электрофильное и нуклеофильное замещение в ароматическом ряду
187
Вг
4-32. f4r H2SO4^t f| 4 Вь, A1Q3 [| HPr || |
НО,5>^ CH2C’2 HO3d^Br 110°C ^Br
(CH3)2CHCCH(CH3)21ЬР^ГФ’-78°9 .
О 2.Q( ZNH3(jk.),/jv
Br
XC~C
HC-CH3 2. NH3(».), /iv
Br CH3
1. LDA/ТГФ, -78°C
C2H5
4-33.
C2H5Br, A1C13, 20 °C
l.KMnO4, OH8, FLO
4-34.
C6H6 о о
H5c2
COOH
A l.SOCl2
c2H5
2. H3O®
(bCxCH3
.0
JI J 2. (CH3)2CuLi H3C
HOOC^^COOH 3 H3°® П
° [A] CH’
(CH3)3C>^ co,HCi,cu2ci2 (СНз)зС
AlClj, CH2C12
Br2, A1C13
H
(CHJjC
Br
Zn/Hg
H
HC1 (конц.)
(CH3)3C^_NO2
no2
Вг-^х^СНз
no2
CH3ONa (СНз)3С, CH3°H CH3O^\^CH3 no2 [A]
188 Решения
4-35. fF С>2’ FeC1V [F QH6 Cl ([Y h2so4 Cl он OK Y NaOH r f| KOH r no2 ci X ci (iY KNCY nV KOH
Н.
—► Il KO3S NO P 4-36. Способ 1. [0-СНз —- J HO O,N CH3O F2 ok F* /=\ i=yc QT _ |fVo H3S°4 ТГФ * HjO.HO’C NO2 KObS^^NOz 2 /^X. x° AJ kNO2 M CH H2SO4> (lY 3 L K0H 110°C* JL^l 2. KOH, t " HO3S 3. H3O® |Y (ch3)2so4, он® f|V HNO3 LxJ r Лх H2SO4, t v CH3O .^СНз O2N COOH Y yT кмпо4, н® H j h,o * -FF т сн,о т NO, NO2 [A]
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 189
4-37.
Способ 2.
[А]
HNO3 нД
Вг
[А]
(CF3CO)2O
Н2О2 *
190 Решения
4-38.
K,Cr2O7 SOCL XO С6Н6, A1CL
и- C3H7OH -^7* C2H5COOH —► C2H5Cf —--------------*
H2au4 ci
Zn/Hg
HCl (конц.)
CH2CH2CH3
II CH3CC1 Alclj *
4-40.
Zn/Hg
HCl (конц.)
[A]
CH2CH2CH3
4-39.
H2O 110°C*
knh2
NH3 (ж.)'
сн3 COOH
^4 1. KMnO4, OHe/H2O
CH3
1. Na, NH, (ж.уСгНрН
2. H3O<® *
COOH
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 191
СООН
толуол, t
соон
соон
Pd/C, 400°С
соон
соон
4-41.
(CH3)2SC\ OHQ *
ОСНз
Далее синтез 2,6-диброманизола см. решение задачи 4-39.
Далее см. решение задачи 4-17.
192 Решения
Для защиты лара-положения в молекуле фторбензола при синтезе 1-бром-2-фторбензола можно использовать нитрогруппу:
4-44.
1. Mg/эфир
2. СН3СНО
3. Н3О®
Вг
СН-СН2Вг КОН
этиленгликоль, t
с=с-н
H-BuLi
ТГФ
C=C-Li
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 193
Вг
0HNO3
H2SO4, t
-► O2N
[А]
4-45.
1. КМпО4, ОН^ГО
2.113СУ®
а СООН t
соон
Zn/Hg
НС1 (конц.)
194 Решения
Hr _ 1- £р,А1С13,СС14
НзСУч1 О______________„
НзСА> 2. Н3О® О U
-* Т 1 ^HjCH2COOH Zn/Hg r
HC1 (конц.)
НзС^^(СН2)3СООН
—* JI J
H3C^
l.SOCL, 2. А1С13 ’ 3. Н3О®
Н3С
Н3С
Br2- О^О Нзсу^ 1. Mg/эфир
- н,сАДвг 2. «J.JCQ
О
3. NH4C1, н2о
о
1. С^О, А1С13/СС14 о
4-47.
2. Н3О®
BrMgp Ph
Ph
i® <^C=CHCH2COOH
Ph
l.SOCl2 2. А1С* з.нр®
Ph
1, СН3Ц/эфир
2.NH4C1/H2O
о но CH3
СН3
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 195
4-49.
4-48.
СН2=С(СН3)2 Н3РО4
(СНз)зС
СН3
СНз
1. РОС1Э/ДМФА, t
2. CH3COONa/H2O
[А]
a ci hno3 (pYC1 О'0143
H2SCV o2n^^no2 тгф-дмсо,7
L С1“©"С^С1’ А1С13’ СН2С12
“*O2fAAo2 2. Н3О® *"
СН3 СООН О^С.С1
1,КМпО4, OH6/HjO [хЛх SOCl;
У 2. Н3О® * СНС1* У а а а
196 Решения
4-50.
С2Н5Вг, А1С13
СЛ 20°С ’
Вг2 , сн3соон
С2Н5
LDA
ТГФ, -78 °C
1. CH3O-@-Br/NH3(>K.),/jv
2. HjO
1. LDA/ТГФ, -78 °C
,С2Н5
2. HjC2-O-Br/NH3 (ж.), hv С2Н5
З.Н2О
4-51. Способ 1.
н ”
01. С1ССН3, AlClj l.Br2, А1С13
2.H3O® - 2.H3O® *
HO(CH,)2OH, BF3 • Et2O толуол
1. (СН3)2СиЬ1/ТГФ
2. Н2О •"
1. КМпО4, ОН®/Н2О
2. Н3О®
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 197
CfC'OH
О II
SOC12 <^С'СН3 1. (СН3)2СиН/ТГФ
Ру * 2. Н£й *"
С
Ст Cl
Способ 2.
SO3 (20%), H,SQ, ^SO3H КОН X^ySOjK KCN
S 't T*
SO3H SO3K
1. (СН3)2СиЫ/ТГФ
2. H3O®
H3O® X^COOH SOC1^ С5н5]^ ~ CHC13 *
COOH
O*C'CH3 [A]
При образовании Б происходит электрофильное мисо-замещение wpew-бутильной группы.
198 Решения
Bu-r
Соотношение продуктов: В > Б > А. Продукты Б и В образуются по механизму электрофильного ппсо-замещения трет-бу-тильной группы (выделяется изобутилен), причем ппсо-замеще-ние 4-тре/и-бутильной группы пространственно более предпочтительно.
4-54. Способ 1. ОН jjAs (CH3)2SO4, он® Н2° -* сн3о^> — CH3o\J>- Вг -* снр-^н [Б] осн3 о /Ц 1, СН3(СН2)2СС1,А1С13/СС14 2. Н3О® Zn/Hg -С-(СН2)2СН3 ЦГ1, т и v J НС1 (конц.) О Вг, (СН2)зСН3 CHjC00H* NaNH2 (СН^зСНз NHj(jk^
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 199
(СН2)3СН3 (СН2)3СН3
осн3
nh2 (СН2)3СН3 [А]
Получение изомерного соединения.
ОСН3
Вг металлич. К, KNH2, NH3 (ж.)
(СН2)3СН3
осн3
V
(СН2)3СН3
[Б]
В первом случае реализуется ариновый механизм (механизм отщепления—присоединения), а во втором — SRN1-механизм нуклеофильного ароматического замещения.
200 Решения
/C-OQHj еСН
.^CILCILCOOH * ОС \^ci ^СН2СН2СН,ОН а° w СН. * OTV-^j' W О-СНз < 1. Н®/ОДОН 2. LiAlH4, эфир^ 3. Н,О® LDA/ТГФ -(i-C^H7)2NHW' СН2 ~ "Y Х(ГН2 ('-c3h7)2nh_ ^\^СН2 -('-C3H7)2NLi е О J
-*ОО [Б] ОСН3 ОСН, J) - С(СНз)3 ОСН3 Br^lsz-Br А1С13 Вг "Vo’ С(СН3)3 ОСНз СНзО^О^ОСНз [А] 2- О^О (2 экв.) CHjCN ОСН3 уЛх/Вг NaOCH3, 350°С, 100 атм СН3ОН
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 201
сно
1. NH2NH, 2, ОНе__________
(НОСН2СН2)2О,180°С
1. ДМФА/РОС13,2
2. Н2О, СН3СОО№
Ag2O, NH/Hp/QH/DH
1. SOC12
2. NH3 *
CH, fl p-r-'C'NH, Br„ OH^H,O, -CO2
CH3O CH3
9—3771
202 Решения
4-59.
1, СО, HCl, Си2С12, АЮЦ/СНдС^
з
КМпО4, КОН
Нр *
4-60.
СНзО
сн30
СНзСК^у СН3сА>
Вг 1. Mg/эфир
2. Н£-£Н,' О
з. нр®
Вг2
СН3СООН
сн3о
сн3о
СН2СН2ОН
РВг3 эфир
СНзОу^Ч^СНгСНгВг
СН3сА^
Вг2 СН3СООН
СН2СН2Вг
Вг
CH3NH2 (изб.)
сн30
СН3О
CH2CH2NHCH3 NaNH2, NH3 (ж.)
или
LDA, ТГФ, -78°С
На последней стадии реализуется ариновый внутримолекулярный механизм нуклеофильного ароматического замещения (механизм отщепления—присоединения).
4. Электрофильное и нуклеофильное замещение в ароматическом ряду 203
4-61.
СН2Вг
1. Ph3P/CH3CN, г
2. NaH/ДМСО
Вг Вг
CH=PPh3
СН3СНО^
Вг
СН=СНСН3
A
RO
Вг
СН=СНСН2Вг
Вг
СН=СНСН=РРЬ, ф
Вг
1. Ph3P/CH3CN, z
2. NaH/ДМСО
О О
О о СН3ОС СОСН3
СН3ОСС=ССОСН3 \ /= \ /^Х г. 38>г «л*1.
* \ / \ / \\ z< 13 г *
\—/ \г=/ v____V хлоранил, t
Синтез хлоранила:
С1 С1
[Н]
С1 С1
С1 С1
С1 С1
204 Решения
0 фф3 1. (Л>, А1С13, CCl4 li^ 0 сн3 0 (<VC'(CH^2COOH
,Z’ 2. H3O® CH3 СН3 сн3 _Х-(СН!)!СООНД^^ СН3 СН3 СН3 —фэ фф СН3 он Нз СН3 СН НС1 (конц.) СНз 1 СН}Мё1/эфир> 2. NH4C1/H2O СНз О СН3 Н2, Pd/C С,Н5ОН* з СНз СНз [А]
Глава 5
АМИНЫ, НИТРО- И ДИАЗОСОЕДИНЕНИЯ, ФЕНОЛЫ, ХИНОНЫ
5-1. а)
NHMe
4.85
рКь 9.15
CH2NH2
рКа 9.33 рК* 4.67
N-Метиланилин — более слабое основание, чем бензиламин, вследствие +Л/-эффекта аминогруппы, связанной непосредственно с бензольным кольцом. В бензиламине этот эффект не проявляется, так как аминогруппа отделена от ароматического кольца СН2-группой. В то же время бензиламин более слабое основание, чем метиламин (рКа 10.62; рКь 3.38), вследствие -7-эффекта группы СбН5.
б)
NH2
рКа 4.63
р^ 9.37
рКа 10.64 ря; з.зб
Циклогексиламин — на шесть порядков более сильное основание, чем анилин, вследствие +Л/-эффекта аминогруппы при ароматическом бензольном кольце.
в) О О
NH NH
рКа 11.31 рАГа-3.8
рКь 2.69 рКь 17.8
Различие в основности пирролидина и пиррола достигает пятнадцати порядков. Это обусловлено тем, что пирролидин — обычный
206 Решения
вторичный амин, а в пирроле неподеленная пара электронов азота входит в состав секстета электронов ароматического гетероцикла и не принимает участия в протонировании, которое осуществляется во второе положение кольца по атому углерода.
г)
NH2
СН3 рКа 5.10 рКь 8.90
NH
р/С 1.02 рКь 12.98
и-Толуидин — на четыре порядка более сильное основание, чем и-нитроанилин, поскольку нитрогруппа увеличивает степень сопряжения пары электронов азота аминогруппы с бензольным кольцом, благодаря чему основные свойства амина при этом резко понижаются.
Д)
пиридин р/С 5.23 рКь 8.77
хинуклидин рКа 10.58 рК* 3.42
Хинуклидин представляет собой бициклический жестко закрепленный третичный амин с высокой основностью. В ароматическом пиридине неподеленная пара электронов атома азота находится на хр2-гибридной орбитали, ортогональной ароматическому секстету р-электронов. Поэтому пиридин на пять порядков менее основен, чем хинуклидин, имеющий sp3-гибридную неподеленную пару электронов атома азота.
е) QH5NH2
рКа 4.69
pKfc 9.31
(QH5)2NH;
рКа 0.77
рКь 13.23
В паре дифениламин—анилин, анилин более основен, так как его неподеленная пара электронов участвует в сопряжении (+Л/-эф-
5. Амины, нитро- и диазосоединения, фенолы, хиноны 207
фект) с одним ароматическим кольцом, а в дифениламине — с
двумя бензольными кольцами.
ж)
пиридин рКа 5.23 рКь 8.77
С™ пиперидин р/Га 11.12 рК/, 2.88
Пиперидин на шесть порядков основнее пиридина, так как непо-деленная пара электронов в пиперидине занимает sp3 -гибридную орбиталь, а в пиридине — sp2-гибридную орбиталь.
он сн, рКа 5.65 рКа 5.08
рКь 8.35 рКь 8.92
Основности и-гидроксианилина и n-толуидина весьма близки; различие менее, чем на порядок. л-Гидроксианилин (я-аминофенол) немного более основен, так как +Л/-эффект ОН-группы понижает +М-эффект аминогруппы, и она становится более основной.
и) Me2N NMe2 NMe2
рКа 12.37 рКа 5.06
рКь 1.63 рКь 8.94
В этой паре 1,8-бис(диметиламино)нафталин («губка протонов») представляет собой достаточно сильное основание, поскольку в протонированной форме водород образует прочную водородную связь с атомом соседней диметиламиногруппы в яерм-положении.
208 Решения
5-2. (СН3)3СОН -X* (СН3)3СОН2 —► (СН3)3С® + Н2О
RC = N + (CH3)3C® —► RC = NC(CH3)3
NaOH
— RC(O)NHC(CH3)3 —*
tll'-J, I
“9X3
RC-NHC(CH3)3
r 0s
-► RC-NHC(CH3)3 - OH
-► RCOONa + NH2C(CH3)3
NaOH
Н2О
Другие способы получения яу?ет-бутиламина основаны на перегруппировках Гофмана (а) и Курциуса (б).
a) (CH3)3CC(O)NH2 gfg(CH3)3C(O)NHBr -*
-Br®
NaOH Н20,70-80°С
О -(CH3)3CrC*N:
пррегрурпнрю.к. JbO
нитрен изоцианат
-> (СЩ)3СМНС(О)ОН (CH3)3CNH2
6) (CH^CCOOH cg^CtHsN> (CH3)3CCOC1
— (CH3)3CCON3 |(CH3)3CC(O)N?) —
нитрен
-»(CH3)3CN=C=O (CH3)3CNHC(O)OH (СНзЪСМНг
-СС>2
5. Амины, нитро- и диазосоединения, фенолы, хиноны 209
5-3.
HNO3; H2SO4
Ю0°С *
1. NaNO2 + НС1/Н2О; 0-5°С
2. Cu2(CN)2; KCN/50-70°C
СООН
SOC12 "сХ
СОС1
l.CftHg; А1С13
COCI 2 Нз°®
COQH5
coqh5
(CH3CO)2O Z^\ HNO3
5-4. CH3-/^jY-NH2 -— CH34Td-NHCOCH3 H?s0 »
NaNO2 + H2SO4
H2O; 0-5 °C
H2SO4
H2O, 80°C
Cl ONa OH
NaOH, CuSO4 1 /0Na НС1» 1 /0H
HP, 190°C II H2O I I “*
OH ' OH
0Na (CH3O)2SO2 . 1 J3CH3 EtOH * I I
ONa OH
CHC13; NaOH/H2O; 60°^ 0HQ PCH3 HC^ 0Н(ч 1 PCH3 реакция Реймера—Тимана H2O
5-5.
NaOH(l моль) EtOH
210 Решения
Ph Р" СВг
5-6. СН3СН=СНСН2ОН —------► СН3СН=СНСН2Вг
ОН ОК®
200-220°с Г^ГСНСН=СН2 кон ^СНСН-СНг
------*1У1сн3 ^юй*1У1сн3
сухая соль
он он
СО2 (10 атм); 250 °C xJs^CHCH-CH2 щ А.СНСН-СН2
* СН3 So* О сн3
COOK соон
[А]
5-7.
KNO,, на __ Н2О, 0-5°C
hbf4^
Н2О
H2SO4
Н2О, г
KNO,, H2SO4
Н2О, 0-5 °C
он—►
NaOH/CHa3, 60 °с^
ONa
СН2=С-СН3 --------*>
РОС13 _
C-H*°2N
С6Н6
/=<N02 О
°2NX )>—CH2CCH3
no2
[А]
5. Амииы, нитро- и диазосоединения, фенолы, хиноны 211
О ON а
СН3ССН3 -^_30о> СН2=С-СН3
5-9.
ноос
Zn + NaOH
t, спирт—Н2(?
НООС соон
соон
NaNO2_________
H2SO4—Н2О; 0-5°(Г
соон соон
HS°4e ноос HS0° Н2°,25°С ноос
5-10. CD2=CHCH2OH РВ1~3^ Q —CD2=CHCH2Br
NaOH» EtOH
CP2=CHCH2Br r ДМФА;50°С
ОН
cd2ch=ch2
(КО35)2МО'(сольФреми) Na2S2O4
H2O; 20°C *" H2O—EtOH
cd2ch=ch2
H2/Pd 20oC* H°
'cd2ch=ch2
CD2CH2CH3
[A]
212 Решения
5-11.
СН3 СН3
СНзСН=СНСН2Вг
—<Ц>-0№ -ДМ-Д >(Г)>ОС112СНСНСН]-
СООС2Н5 СООС2Н5
сн3
—~250°» СНзСН=СНСН2-^-он
^СООС2Н5
[А]
5-12. Амин C7Hj3N [А] по условиям задачи должен быть бициклическим, жестко закрепленным третичным амином, у которого неподеленная пара sp3-гибридных электронов не блокирована углеродным скелетом. Его принадлежность к третичным аминам следует из того, что он не образует устойчивого аддукта с C6H5SO2CI в водной щелочи (этот аддукт расщепляется раствором NaOH или даже просто водой). Строение амина А вытекает из трех последовательных стадий элиминирования четвертичных аммониевых гидроксидов по Гофману:
/=У-сн31
2 Ag2O/H2O газ Зл
CH2=CH-(Q^N-CH3 [Б]
1, СН31
2Ag2O/H2O Зл
—сн2=сн-< snc
СН=СН2 СНз
[В]
1.СН31
2 Ag,0/H,0 Зл
сн=сн2
-*СН2=СН-< +N(CH3)3
сн=сн2
5. Амины, нитро- и диазосоединения, фенолы, хиноны 213
5-13. Конечный продукт деструкции, ароматический катион (С7Н7)®, представляет собой катион тропилия, поэтому Г —тро-пилиден (циклогептатриен-1,3,5), вещество В — циклогептадиен, содержащий диметиламиногруппу, удаляемую в виде NMe3 при отщеплении по Гофману из гидроксида триметилалкиламмония. Всю цепь превращений тогда следует представить следующим образом:
1. CH3I (изб.)
2. Ag2O/H2O 3. t
1. CH3I (изб.^
2. Ag,O/H2O l.t
Me Me "N"
[В]
РЬзС^БР^ (C7H7)®BFe + рЬзСН
5-14. Образование 5-(М,М-диметиламино)октена-1 из гидроксида тетраалкиламмония при элиминировании по Гофману указывает на строение кониина, как 2-н-пропилпиперидина. Тогда вся цепочка превращений может быть выражена следующим образом:
g снгснгсн3;:^;^
КОНИИН 3. t
-► СН2=СНСН2СН2СНСН2СН2СН3
N(CH3)2
N СН2СН2СН3 н
PhSC^CI; NaOH
ЬЬО *"
N СН2СН2СН3
SO2Ph
Кониин — вторичный амин; следовательно, соответствующий бензолсульфамид в щелочи не растворим.
214 Решения
5-15.
/° /°
(СН3)2СНСООН^*(СНз)2СНС ^*(СН3)2СН(/ -ci nh2
1. Br2; NaOH/H2O; 5°C ____
---------------------► (CH3)2CHNH2
2. NaOH/H2O; 70 C
(перегруппировка Гофмана)
/Р
(CH3)2CHC + (CH3)2CHNH2—*-
Cl
—* (CH3)2CHC(O)NHCH(CH3)2 X. flзи
(CH3)2CHCH2NHCH(CH3)2
С6Н5СН3 Вг?; *- » С6Н5СН2Вг + НВг
С6Н5СН2Вг + (CH3)2CHCH2NHCH(CH3)2
-► C6H5CH2NCH(CH3)2 (СН3)2СНСН2
5-16.
^ОН_/-унон__ НзРО4-Р2О5;/
\ / перегруппировка Бекмана
1. UAIH4
2. Н3О®
СООН
HNO3 (конц.) + V2O5 / Ва(ОН)2
* (С\Н2)4 зоо°с
СООН
О
80°С
РВгз+СЗН^ г В2О
l.NaBH4
2.Н3О® *
1.ДМФА,?
2. Na2CO3/H2O
5. Амины, нитро- и диазосоединения, фенолы, хиноны 215
Zn + NH4C1 Н2О; 60°С *
Вг
NHOH
К2Сг2О7
Н2О; H2SO4; 0-5°С
РЬСН2СН(СНз)СООСН3 !-лДА/ггф; 78°£
z. сн31 2. СН31
-> РЬСН£(СНз)2СООСНз PhCH2C(CH3)£(O)NH2 -*
С-г13Ог1
1. Br2; NaOH/ Н2О; 0-5°С
2. NaOH/H2O; 7(РС
* PhCH2C(CH3)2NH2
(перегруппировка Гофмана)
216 Решения
5-19. (С2Н5)2С=О (C2H5)2C=NOH -»
-----------► C2H5C(0)NHOH5 (перегруппировка " 2. Н2О
Бекмана)
->c2h5ch2nhc2h5------
Z э 2 2 5 НС1__Н,О 0-5°С
-►CH3CH2CH2N-N=O Z^oig> ch3ch2ch2nnh2 С2Н5 " с2н5
5-20.
/("Sy ОН /Г^У-ONa
V-V аон \<>/
СН,=СНСН,Вг — -------—►
ВОН; 80°С
220 °C
HBr; hVy гексан
СН2СН=СН2
СН2СН2СН2Вг
СН2СН2СН2Вг
ДМФА^
120°С
l.NaOH
2. СН31*
5. Амины, нитро- и диазосоединения, фенолы, хиноны 217
О
COOH )>—O\
5_21 (C^ -^^(CH2)4 Ba^C
COOH
О
сухая соль
NHnOH • HQ; CHiCOONa f^\ -____________г_____I \
РС15
Н2О—EtOH
NOH (перегруппировка Бекмана)
/ '• LiA1H4/Et2°^
2. H3O®
n 1. NaBHi
2. H3O®
0TT PBr3 ,
C5H5N—Et,O
Вг
R 1. ДМФА, 50- 70°C
ЬГ 2Na2CO3/H2O
5-22. СН3С(О)СН3
2. Н2О, NH4C1
OH
1. Мё(Нё)/бензол,^ (СНз)2(\_С(Снз)2
OH
Br2, NaOH
О H2SO4(kohhJ СН (Ц.С(СН > - H2O—ТГФ
—*-Me3CCOOK + CHBr3 Me3CCOOH -► H2O
о
^XMe3CC(0)C1 ^-^Me3CCNH2-*
1. Br2; NaOH/H2O; О ГС, M CNH + CQ
2. NaOH/H2O; 80 °C
О
Me3CCCl + Me3CNH2cHci3|0_10^>
о
-*»Me3CCNHCMe3 EiAWEt£» мезССН2Ь1НСМе3
2. H2O
218 Решения
5-24.
ONa
NaOH CHrCHCHzCl
HjO, 350 °C, 250 атм EtOH *"
5-25.
ОСН2СН=СН2 он
220 СН2СН=СН2 1. Na0H
2. СН31/ДМФА
ОСН3
СН2СН=СН2
' 1.2п(СМ)2+НС1/толуол
2.Н3О® *"
ОСН3
СН2СН=СН2
' NH3 +H2/Ni/p; t
NHj+NaBHjCN/EtOH
СНО
OCH3 сн2сн=сн2
ch2nh2
CH3CH2COC1; Aia3
CH3NH2 (1 моль)
1. КаВН4(изб.) или LiAlH4
2.H3O® *
ОН
А\сн3
NHCH3
5. Амины, нитро- и диазосоединения, фенолы, хиноны 219
Стереоизомеры эфедрина и псевдоэфедрина:
Ph : Ph Ph ; Ph HO-t-HlH-l-OH но4-н • H-4-OH CH3HN-|-H:H-|-NHCH3 h4-NHCH3;CH3HN-4_H ch3; сн3 сн3 : ch3 эфедрин псевдоэфедрин
5-26. Mg „ T 1.циклопентанон / \,CH3 HBr / \/CH3 СНз1 CH3MgI 2.NH4C1/H;O* Uoh * UBr Mg / V,CH3 ! CO; (сухой лед); 0 5°C / \/CH3 —► ВгсГ V-T'MgBr 2. HjO® * V_/cOOH SOC12; NEt; /—.СН3 2NH3* / > CHC13 * V_/'COCI CHCh* V_Zconh2-*' 1. Br2; NaOH/H2O; 0-5°C / \yCH3 2. NaOH/H2Q 70-80°C * \ /'NH2 (перегруппировка Гофмана)
5-27. <^Nh2<^©-nhc(O)CH,^^ -* 02N-O-NHC(0)CH3^U02N-^-NH2-> 1. NaNO;+ H2SO4/H2O; 0-5°C @ e 2.HPF6 -O2N^N2PF6- твердая соль 180°C T.Fe.Hq ТТхГ ^NaNCh + HzSO^ ► q2n~\O/~F Нг0 ► II2N \О/-Г H^0; 0_5oc /^\ s H2O; H2SO4 -*>p-<Q/-n2 hso°♦ f-<Q>-oh^- NO2 CHCI3; NaOH QII HNQ3; (CH3CO)2O f H2O;60°C 0°C Vry"
СНО
сно
220 Решения
5-28.
NaNO2 ;H2SO4_
H2O; 0-5 °C ”
i© H2O; H2SO4,
H2SO4 120 °C*
Br2________
H2O, 10-20°^
H2SO4
H2O, t °C
NaOH
H2O—EtOH
SOC12 11 2NH3 11 I.UAIH4
5-29. Me3CCOOH Me3CCCl cHO7*Me3CCNH2 2 н3Ь>
—* Me3CCH2NH2
C(O)CH3
CH(Br)CH3
CH2CH3
; HC1 6^ Br2’ hv * In—(или nbs)
-HBr
Me3CCH2NH2 1- ЦН5СН(Вг)СНз/ДМФА Me CCH2NHCHC6H5 2. Na2CO3/H2O 1 ° J
[A] ™3
5-30.
О
PhCHO + CH3CCH3 + PhCHO >
J J H2O—EtOH, 20-25 °C
mu NMe2 NMe2
-►PhCH=CHCCH=CHPh ^“(из6^ PhCHCH2CCH2CHPh-
C2H5OH И)
l .NH2NH2H2O/EtOH_______^PhCHCH CH CH CHPh
2 . КОН/диэтиленгликоль; 200 °C hCHCH2CH2CH2CHPh
5. Амины, нитро- и диазосоединения, фенолы, хиноны 221
О NCH3 NHCH3
СН3СООН <4 1. L1AIH4; Et2O
+ CHjNH2 вон 2. Н3О®
1 метилциклогексиламин—EtOH >
2 . Na2CO3ZH2O
l.Fe, HC1/H2O^
2. Na2CO3/H2O*^
2 NaOH (tb.)^ 350-370°C
твердая соль (сплавление)
CH2NHC3H7-h
0H 1,СН3[/ЕгОН^
2. Na,CO3/H2O
222 Решения
z^x hno3,h2so4 _
5-33. CH3/O>--------- - » CH3-(O) + CH3-(O)-N02
\=Д 30°С у~/ \=-/
02N отделить фильтрованием
(при 0°С жидкость) (при 0°С твердое вещество)
Zn, НС1, Н2О
н2со г нсоон
СН3^О2 ™"°4; КОН» KOOC-/(5yNO2^^
\*^~**^/ Н2О, t х4*^**^/
Fe, HQ
Н2О
hooc-<^>-nh2^-
NaNO2, НО_ Н2О,0-5°С
Другой способ.
HNO3, OI3COOH (CH3CO)2O
NMe2 -► NO2
N=O
Zn, NH4C1// — ► С'.Н.
Al(Hg)/H2O—EtOH
К2СГ2О7', H2SO4
H2O, 0-5 °C
5. Амины, нитро- и диазосоединеиия, фенолы, хиионы 223
5-34.
NaSH, x^yCH2CN NaNO2|HBr
MeOH ^NH2 Н2О;0-5-(Г Bre“*
5-35.
OH xix. NaOH Oiis*
ONa OH
CO; (5-10 атм); 180°C NaQQQ реакция Кольбе—Шмидта
HC1
H2O*
H®
толуол—EtOH; t
OK
KOH (1 моль) EtOCX4^s СН3СН=СНСН2С[
EtOH, 20°C IOJ ДМСО
EtOOC 9СНгСН ^H^^EtOOC °HJZHCH=CH2
О
(KOjS^jNO'(сольфреми) ^ООС ¥сНСН=СН2 ацетон—Н2О; 20 °C VTcH3
О [А]
224 Решения
NaSH
N02 C2H5°H, t
NaNO2, H2SO4
NH2 н2°> O-5 °C
N® HSO®
Zn; NH4C1
H2O, -70 °C
NHOH
K2Cr2C>7; H2SO4
IM), 0-5 °C *
NaNO2, IICl^ H2O; 0-5 °C
Cu2Cl2; HQ N® C1® H2O; 70-80 °C*
Zn, KOH, /p=\ XTTT XTTT H2SO4(KOHU.j вдн-н2о,Г O"NH"NH-O----------------------------
СГ
1. NaNO2, H2SO4/H2O; 0, 5 °C
2. KI/H20,30 °C
5. Амины, нитро- и диазосоединеиия, фенолы, хиноны 225
NaSH
NO2C2H5°H’ 1
NaNO2, H2SO4^
NH2 H2O; 0-5 °C *
N® HSO?
Na®PF® -----2-1 11,0
180 °C
NH2 n? hso?
Fe, HO NaNQ,, H2SO4 Na®PF6e
F НэО* чр H2O;0-5°C ” чр H2O ‘
226 Решения
5-38. Н2С-СН2 + HNEt2-*Et2NCH2CH2OH
СО2(5 атм); 180°С реакция Кольбе—Шмидта
Et2N(CH2)2OH
1. NaOH_______
2. //-С4Н9Вг/ДМФА
COO(CH2)2NEt2
ОСН2СН2СН2СН3
C^N I COOCH2CH2NEt2
Snci2, на
ОСН2СН2СН2СН3
H2NlcOOCH2CH2NEt2
примакаин
[А]
5-39. Схема деструкции исходного вещества включает две последовательные стадии гофмановского элиминирования триметиламина из гидроксидов тетраалкиламмония, в результате чего образуется а,ц?-диен; строение последнего легко угадывается по продуктам озонолиза. Это определенно указывает на то, что исходное вещество является циклическим амином с атомом азота
5. Амины, нитро- и диазосоединения, фенолы, хиноны 227
в цикле. Вся схема деструкции описывается следующей последовательностью превращений:
С6Н5 СООС2Н5
4 ।
сн3
1. СНз1-(изб.)^
2. Ag2O/H2O
3. 120-150 °C
H3CZ хсн3
С6Н5 СООС2Н5
1. СН31 (изб.) ,<>, 1. о3 /СН2С12^-78°С
2. Ag2O/H2O> 'I II 2. Zn; СН3СООН *
3.120-150 °C C14H16Q2
СООС2Н5
—» С6Н5С-СНО + 2 нсно сно
Аг- 300°C HNEt2
5-40. СН2=СН2 + О2 -g’ Н2С-СН2 Et2NCH2CH2OH f) CH2U2
сн3
HNO3 H2SO4; 30-35°С
(при 0 °C жидкость)
NO2
отделяется фильтрованием (при 0°С твердое вещество)
СООН
Et2NCH2CH2OH, Н®
СН3
КзСгэО-?; H2SO4
нр СНС13
ЬГОг NO2
COOCH2CH2NEt2 COOCH2CH2NEt2
Fe, HQ H2O *
NH2
новокаин
NO2
[A]
228 Решения
cu2(CN)2; kcn
H2O; t *
70%-ная H2SC>4 H2O, г *
5-42. С6Н5СН2ОН С6Н5СНО
vrb'-'b, /v U
сн3 СН=СНС6Н5
гДо QH5CHO, EtONa <<=>, H2(100 атм), Pd/C
EtOH, t *“ 150 °C *"
1. CH31 (изб.)
2. AgOH/H2O*"
3. 120-150°C
1. CH3I (изб.) CH2CH2^)
Г^ОН/Н.О* A + Hp + N(CH,)3
3.120-150 °C 11 11 ril
[A]
(CH3CO)2O
NHCCH3-*-
no2 o
HNO, Z^\ II l.HCl/H2O, 1
(CH3CO)2O,* СИз-^З^-ЯНССНэ 2 Na2CQ3/H25
NO2
5. Амины, нитро- и диазосоединения, фенолы, хиноны 229
NO2
no2
1. NaNO2, H2SO4/H2O; 20 °C
2. H3PO2/20°C
Fe, HC1
H2O *
NaNO2, H2SO^
H2O; 0-5 °C*
Другой способ.
NaSH -----►
CH3OH
NHo
NO2
NO2
NaNO2, H,SO4
H2O; 0-5 °C
N® HSO®
CH3^>-NHAc
I.H2SO4/H20,100 °C
2. Na2CO3/H2O
OH
OH
H3PO2 r
H2O; 25 °C
no2
NaNO2, H2SO4
H2O; 0-5 °C
NO2
NO2
Fe, HC1
H2O
1, NaNO2 + H2SO4/H2O; 0-5 °C
2. H2SO4/H2O; t
OH
230 Решения
Et2NH (1 моль)
С2Н5ОН *
H2/Ni;NH3//M
ч или NaBH.CbT
N(CH3)2
О о
5-45. (СНз)зССООН (СН3)3ССС1(CH3)3CCNH2-*
ДМФА СглДз
7^*(CH3)3CCH2NH2
Д n3L/
о
НСНзСО^О-.АЮз/дН^ II (СН3)зОСН2^;Н®
2 н3О®
— C6H5C=NCH2C(CH3)3 C6H5CHNHCH2C(CH3)3
сн3 3 сн3
[А]
5-46.
1. КМпО4; КОН/Н2О;2
2. НзО®
SCX?I2; C5H5N
Н2О; t *"
l.QHfrAICk
2. Н3ОЙ *
NaNOjJIQ
СН3СООН—Н2О; 0-5 °C
5. Амины, нитро-и диазосоединения, фенолы, хиионы 231
5-47. NH 1СЩ1 (изб.)г y\^/sNMe2 L снз' <из6) \_2 2. AgOH/H2O 2 AgOH/H2O
|-А] 3.120 °C 3.120 °C
1. (81а)э13Н/ТГФ; 0°С
2.^NaOH/H^o--> НО(СН2)7ОН—►
РВг3____ р , R 1, фталимид калия (2моль)/ДМФА; £
c5h5n—а,о Ьг 27 г 2. nh2nh2- н2о
-*• H2N(CH2)7NH2 [Б]
Ар- 25О°С CH3NH,
5-48. СН2=СН2 + О2 ё’ > НгС- СН2 —-—►
V
н с-сн СН2СН2ОН
CH3NHCH2CH2OH --СНз-N
'сн2сн2он
зось /Н2СН2С1
C5H5N—II2^ CHs-N
45 5 2 СН2СН2С1
СН2СН2С1
_ z „ тт „XTNaNH2 или r-BuOK
СН3—N + C6H5CH2CN------2-------►
\ „ „ толуол,t
СН2СН2С1
/—V С6Н5 H2SO4
-ch’-nOcn
ОСбН5 ^СООС2Н5 л идол
[А]
232 Решения
СООН
COOH
o2n
N® HSO?
Cl
HPF6^
1120 O2N N? PFf
Cl
сухая сольдиазония
NaNO2, H2SO4
H2O; 20 °C *"
1, NaNO2, НВг/ H2O
2. Cu2Br2/t
Fe, HQ
H2O*
5-50. CH3CCH3 L Mg(Hg); T1C14» (CH3)2C- C(CH3)2 H2-4»
11 2. H,O 1 1
о OH OH
С1,- NaOH LT®
-* (СНз)зСССНз^ (СН3)зССОО№
II " Н2<Л t О
ЧГ¥~1 •
+ (CH3)3CCOOH^-^ (СНз)зССС1 -
5. Амины, ннтро- и диазосоединення, фенолы, хиноны 233
^7* (CH3)3CCNH2 £r*N;OIk (CH3)3CNH2 (СН3)3ССОС1 ^-3)?CNH2» (CH3)3CNHC(CH3)3
— (CH3)3CH2NHC(CH3)3
[A]
5-51.
CH3
H3C\ ZCH3
l. CH3I(изб.) <N . 1.CH3I(изб.)* Л a
2. Ag2O/H2O 2. Ag2O/H2O \ /
3. t 3. t
[Al гексадиен-1,5
[В]
ОНС^СНО + 2НСНО янтарный диальдегид
[В]
F1OF4
ОНССН2СН2СНО + H2NCH3 + СН3СОСН3------
NxCH3
i.nh2nh2- н2о_________
2. КОН/диэтиленгликоль; t
тропан
[Д]
СН31 (изб.)
ДМФА, г
н^сГ но0-*'
СН3" "СН3
он
СН2СН=СН2 tOso^N
N(CH3)2
2. NaHSOj/H#
^^.СНгСНСНгОН M^N(CH3)2
ню4 ----2-->
EtOH—Hfi
СНгС^Н NH3; NaBH3CN N(CH3)2 ЙОН; pH ~2 *
х^^уСНтСН^Н;, Мк\-(СН3)2
[В]
10—3771
234 Решения
5-53.
ОСН3 ОСН3
КОН
С02; р; t
ОСНз
’ КОН
COOK
(реакция Кольбе—Шмидта)
ОСН3
К0 1 (СНзО^ЗОг (изб)
х СН3ОН; t
COOK
О СН3
СН3О ’
HNO3, (СН-рОЭтО
СООСНз осн3
CH3O
SnCl2; на х а"он '
O2N СООСНз
ОСН3
СН3О '
. l.NaOH
НО - СООСНз 2 СН,!
[А]
Глава 6
АЛИЦИКЛЫ И ГЕТЕРОЦИКЛЫ
6-1. Сборка пиридинового кольца осуществляется по методу Ган-ча через промежуточный дигидропиридин, претерпевающий ароматизацию под действием окислителей. Получение необходимого для синтеза бензоилуксусного эфира происходит ацилированием енолята ацетоуксусного эфира бензоилхлоридом с последующим кислотным расщеплением дикетоэфира. Прямая сложноэфирная перекрестная конденсация эфиров бензойной и уксусной кислот дает плохие результаты из-за преимущественной самоконденсации более активного этилацетата.
COOEt
О
1. NaOEt/ТГФ
2. PhCOCl *
О
6-2. Ключевая стадия — синтез индолов по Фишеру действием кислотных агентов на соответствующий фенилгидразон. Использованы также декарбоксилирование индолкарбоновой кислоты при нагревании (индол не может быть получен при прямом син-
236 Решения
тезе Фишера с использованием фенилгидразона ацетальдегида), формилирование получающегося индола по Вильсмейеру—Хааку и окисление индол-3-альдегида высокоселективным окислителем хлоритом натрия (другие окислители дают плохие результаты из-за деструкции индольной системы).
1. NaNQ,, НС1^
2. NaHSO3
6-3. Ключевая стадия синтеза — сборка хинолина по Дебнеру— Миллеру из сооветствующего анилина и кротонового альдегида. Образование в этой реакции 2-метилхинолина, а не изомерного 4-метилхинолина обусловлено тем, что при замыкании пиридинового кольца первоначально происходит атака по Михаэлю нуклеофильного азота аминогруппы по активированной двойной связи. Далее использована повышенная СН-кислотность а-водородов в 2- или 4-алкилзамещенных пиридинах и хинолинах.
6. Алициклы и гетероциклы 237
6-4. Пиррольное кольцо строят по Паалю—Кнорру из соответствующего 1,4-дикетона, который получают окислительным сдваиванием енолята метилацетоуксусного эфира.
EtOOC-) 0
G^COOEt
О
СН2 СН2
6-5. ClCH2COOEt + Na-S т—т* EtOOC'' ""COOEt EtOH
KCN Phx___.Ph CuSO4/Py Ph\_/Ph
PhCH0 EtOlT HCT^O O^O
Phx/Ph CH2 CH2 Na0Et
0*4(3 + EtOOC s' COOEt-----------
Ph\__/Ph l.H2O, H® Phy/Ph
EtOOC-4sXCOOEt 2''
6-6. Ключевая стадия — синтез индола по Фишеру из циклогексанона и 4-толилгидразина (синтез фенилгидразинов см. решение задачи 6-2). Образовавшийся гексагидрокарбазол подвергается ароматизации.
238 Решения
6-7. Восстановление анизола по Бёрчу приводит к 2,5-дигид-роанизолу, который, являясь виниловым эфиром, легко гидролизуется с образованием 3-циклогексенона. Завершает синтез циклопропанирование этоксикарбонилкарбеном, генерируемым из диазоуксусного эфира в присутствии диацетата палладия.
[А]
6-8. Синтез N-циклопентилазепана включает [А] получение азепана восстановлением w-капролактама, стандартным источником которого является перегруппировка Бекмана оксима циклогексанона. Циклопентильная группировка вводится с помощью восстановительного аминирования.
I^COOH 1,Ва(ОН)2 QH
L^COOH ~t Ly ° H2/Ni*
[A]
6-9. Реакция Михаэля с двумя эквивалентами акрилата дает диэфир, замыкающий шестичленный цикл в конденсации Дикмана.
COOEt =/
Me-NH2--------
COOEt
COOEt
NaH
ТГФ
1. NaBH4
2. TsOH
COOEt
6-10. Использовано известное свойство гетероциклических соединений легко металлироваться в «-положение к гетероатому.
6. Алициклы и гетероциклы 239
Разложение литийорганического соединения тяжелой водой приводит к введению дейтерия в искомое положение. Следует проявлять осторожность при подкислении соли 5-дейтеропирослизевой кислоты для выделения кислоты из соли на последней стадии, так как пятичленные гетероциклы чрезвычайно чувствительны к кислотам, в частности очень легко обменивают дейтерий, так что при избытке кислоты возможна потеря метки.
' ft 1. Br2/NaOH
О^СНО 2. Н® *
соон
2BuLi -----►
~~* Li-^o^COOLi 275а* D^q^COOD
6-11. Фурановый цикл образуется по методу Пааля—Кнорра действием кислотных конденсирующих агентов на 1,4-дикетон. Получение последнего с использованием алкилирования енолята АУЭ фенацил бромидом очевидно.
COOEt COOEt
6-12. Реакция Михаэля между малоновым эфиром и этилакри-латом в присутствии 2 экв. основания дает тетраэфир, замыкающий циклогексаноновый цикл в условиях конденсации Дикмана. Направление циклизации определяется образованием наиболее выгодного шестичленного цикла.
COOEt /COOEt EtOOC\ /COOEt
< —----► I I NaOEt
COOEt NaOEt 4/ PhMe
EtOOC COOEt
О
COOEt m H® r
H2O, t
О
EtOOC COOEt
COOH
240 Решения
6-13. СНг=СНСН2С1 » BrCH2CH2CH2Cl ROOR, t
CH2(COOR)2
1. EtONa (2 экв.)/Е1ОН
2. BrCH2CH,CH2CI
3. HG (конц.)//
1. Br2, Р(красн.)
2. ElOH,H2SO4* COOH 3. EtONa/EtOH
VOGEt
l.QCH(CXX)Et)2
2. НО (конц.)//
/СН2СООН
^COOH
[A]
6-14. Димедон — известный реагент, применяемый для идентификации альдегидов, — легко получается в реакции малонового эфира с мезитилоксидом в присутствии этилата натрия при последующей обработке реакционной смеси едким кали, а затем кислотой.
СООН 1 NaOEt/EtOH WEtX^20
Происходящие при этом превращения включают реакцию Михаэля, внутримолекулярную сложноэфирную конденсацию и кетон-ное расщепление:
«5. СИ,00,01!, ' уд; > (СНз)2С-С(СН3)г (СТ-"Ь|Й р-й Z. INrtyd/rljU ОН
о
-► (СН3)3СССН3
6. Алициклы и гетероциклы 241
ОуСН3 СгО3, (СН3СО)2О [^уСНО SnCl4, НС1
^no2 ”чДмо2 *"
0-гСНО (СН3)3СС(О)СН3 11 --------------► Il I
-<NH2 пиперидин, t
(или KOH, ROH)
6-16. Соединение А синтезируют по методу Фишера (см. решение задачи 6-2). Необходимый 3-ацетилпиридин можно получить несколькими способами, исходя из доступных 3-нитро- или 3-бромпир идина.
6-17. Рацемическая хризантемовая кислота может быть получена циклопропанированием 2,5-диметилгексадиена-2,4, который мо-
жет быть синтезирован из ацетона и ацетальдегида с использо-
ванием направленной альдольной конденсации с последующей реакцией Виттига. Диазоуксусный эфир легко получают диазотированием этилового эфира аминоуксусной кислоты.
N2CHCOOEt
Pd(OAc)2
©
•РРЬ3
СН3у COOEt
СН3 Yh=C(CH3)2
[А]
H2NCH2COOEt HN°2» N2CHCOOEt
242 Решения
6-18. Дигидроизохинолиновый цикл получается по методу Би-шлера—Напиральского из N-ацил-Д-фенилэтиламина, который легко получить с помощью реакции Анри.
МеО^^Ч 1 Me2NCHO/POCl3 MeO-y-'-^Y'CHO Ch3no2
Мс0Д^ 2. CH,COON, Ме0ДД ОМе ОМе
_МеОх^г^Х| HCOOEt МеО^у NH2 E4N
ОМе
6-19. Хинолин получается по методу Фридлендера из о-нитро-ацетальдегида. Замыкание цикла происходит после восстановления in situ нитрогруппы до аминогруппы.
6-20. Индол синтезирован по Фишеру с использованием 4-пи-перидона, получаемого в результате присоединения по Михаэлю метилакрилата к метиламину с последующим замыканием цикла
6. Алициклы и гетероциклы 243
конденсацией Дикмана. Для селективного бромирования о-анизи-дина использован диоксандибромид.
ОМе
ZnCl2
NHNH2 -n3=O
1Вг2 С4Н8О2 г
2. NaNCh, НС1‘
3. NaHSO3
_/СООМе
Me-NH2 + _ — -N^COOMe NaH^
^COOMe ^COOMe
_0 h^HtQ
СООМе
6-21. Индол А получается по Фишеру из 7-кетовалериановой (левулиновой) кислоты и и-метоксифенилгидразина.
244 Решения
6-22. Изохинолин образуется по методу Бишлера—Напиральско-го. Необходимый для синтеза /3-фенилэтиламин получается из вератрового альдегида с помощью конденсации с нитрометаном, катализируемой основаниями (реакции Анри).
Me2NCHO РОС13
CH3NO2
Et3N
1. ХаВЩ
2. SOC12
3. KCN
4. H®!lbO 5. SOC12
6-23. В синтезе использована способность пирролильного аниона взаимодействовать с электрофилами (в данном случае акцепторами Михаэля) по азоту. После восстановления сложноэфирной
6. Алициклы и гетероциклы 245
функции происходит кислотно-катализируемое внутримолекулярное алкилирование с образованием пятичленного цикла.
6-24. Аналогично решению задачи 6-1 пиридиновое ядро собирают по методу Ганча.
COCI
II \\ 1.ДМФА/РОС13
2. CH3COONa/H2O
246 Решения
6-25. После замыкания циклобутанового кольца обычным малоновым синтезом для получения экзоциклической двойной связи используется элиминирование по Гофману.
НВг f (PhCOO)2
Вг'^/чС1
.COOEt
VOQEt________
NaOEt/EtOH (абс.)
~ COOEt
COOEt^
COOH
LLA1H4
NaOEt
EtOH (абс.)'
COOEt н®/н2о
COOEt
1. Mel
"\тл x 2. Ag2O/H2O NMe2 3. t
NHMe2 EtOH
CHCI3
ТЭБА-Cl/NaOH
[A]
6-26. Для синтеза 1,4-дикетона, подвергающегося по Паалю— Кнорру циклизации в искомый фуран, используется алкилирование енолята /3-кетоэфира бромацетоном.
./COOEt ..
NaOEt
COOEt PhMe
COOEt
1. Н®/Н2О
2. ПФК-'"
[А]
6-27. Озонолиз окталина [А] и последующая кротоновая конденсация дают необходимый бицикло[5,3]декановый скелет. Превращение бициклического енона в ароматический углеводород азулен достигается элиминированием и ароматизацией с помощью дихлордицианбензохинона. Электрофилы атакуют азулен по положению 1, так как при этом образуется устойчивый катион
6. Алициклы и гетероциклы 247
тропилиевого типа. Следовательно, продукт формилирования — 1 -формилазулен.
О
1. ДМФА/РОС13
2. CH3COONa/H2O
[Б]
6-28. См. решение задачи 6-40.
6-29. Ключевая идея этого синтеза — использование купрата, полученного из защищенного 2-бромпропионового альдегида в результате сопряженного присоединения к енону. Получающиеся таким образом дикарбонильные соединения замыкают пятичленные циклы во внутримолекулярной альдольно-кротоновой конденса
ции.
СПО =/
1. НВг______
2. НОСН2СН2ОН, TsOH, PhH
1. Li, Et2O
2. Cui
[Б]
248 Решения
6-30. /Г] 1Q3 г /Н СНО EUAlH4r 2. Ph3P ^"СНО 2 РВгз ^-^-дВг [А] Вг l.NaOEt, CH2(COOEt)2 К 2,iM6 ' ‘ДУ соон IB]
6-31. в синтезе использован 2-этоксикарбонилциклопентанон, получаемый при конденсации Дикмана из диэтиладипата. Ключевая стадия синтеза — присоединение енолята малонового эфира по Михаэлю.
COOEt COOEt COOEt
NaBHt TsOH, f
OH ------*
.COOEt EtOOC СООН
QVoOEt COOEt н®/н,0
COOEt
СООН [А]
6-32. Удобным промежуточным продуктом в синтезе рацемического терпинеола является продукт восстановления п-метилани-зола по Бёрчу, который, являясь виниловым эфиром, легко расщепляется в ходе кислотного гидролиза с образованием енона — непосредственного предшественника искомых структур.
1. Mg/Et2O
2. Ме2СО
6. Алициклы и гетероциклы 249
сн3 соон соон
' 1. КМпО4, НО0 Na/EtOH, NH3 (ж.)
Гй^5»------ U ------------------
СН3
1. 1ДА1Н4/эфир 2,3-диметилбутадиен-1,3 (2 экв.)
2. TsC1/C5H5N* эфир, 20 °C ’
3. ЫА1Н4/эфир
6-34. Продукт получается двойным циклопропанированием цик-логексадиена, который может быть легко получен из циклогексена аллильным бромированием и элиминированием. AIBN —азобис-изобутиронитрил; это известный радикальный инициатор.
NBS, A1BN
СС14
f-BuOK
ДМСО
ch2n2 г
Pd(OAc)2
[А]
6-35. Альтернативный путь к спирогексану [А] (см. решение задачи 6-25) включает «построение» циклобутанона с использованием 1,3-дитиана. Последующее образование экзоциклической метиленовой группы по Виттиту и ее циклопропанирование очевидны.
HS“\ • Et2O /S-Д NaH _ /S-д C]x^.Br CH2O + ) \ ) ТГФ 0\ ) ТГФ, 0°C
HS~7 S—7
/\?“\ NaH, ТГФ HgCl2/HCl /\_^CH2PPh3
VSV Me0H
Cl
ch2n2 r
Pd(OAc)2
6-36. Наиболее прямой путь синтеза использует присоединение по Михаэлю к метилвинилкетону синтетического эквивалента
250 Решения
несуществующего бензоил-аниона. В данном случае в качестве такой частицы используется карбанион, образующийся в равновесной смеси при действии цианида на бензальдегид (см. бензоиновую конденсацию). Этот карбанион эффективно перехватывается акцепторами Михаэля, например метилвинилкетоном. Таким образом, бензальдегид в этой реакции выступает в качестве нуклеофильного, а не электрофильного реагента, хотя типичной реакционной способностью карбонильного углерода является именно последний. Этот прием (изменение доминирующего типа реакционной способности на противоположный) носит в органическом синтезе название Umpolung (термин не имеет адекватного перевода на русский язык).
О® ОН
PhCHO + CN® — PhCH PhC®
CN CN
Y NC OH
Ph
-HCN
Дальнейший путь синтеза использует внутримолекулярную кротоновую конденсацию и последующее сопряженное присоединение дифенилкупрата лития.
PhCHO, NaCN EtOH
О
1 • кон' ЕЮН. чх>0 2. Н®
Ph
О
Ph2CuLi
Ph
6-37. Очевидно, что продукт А образуется в результате циклопропанирования 1,4-диена. Обычный путь к таким соединениям — восстановление по Бёрчу производных бензола. Однако, так как при этом из бензолов с донорными заместителями образуются диены, в которых заместители остаются у двойных связей, для
6. Алициклы и гетероциклы 251
получения нужного изомера необходимо временно изменить природу заместителей.
HNO3 (разб.^
соон
LiAlHj
СООН
1. Na/EtOH, NH3r
2. HCl
СООН
соон
6-38.
[А]
6-39. Для синтеза спиросистемы используется пинакон-пинако-
линовая перегруппировка.
252 Решения
6-40. Восьмичленный цикл получается в результате ацилоиновой конденсации из диэфира, кратчайший путь к которому — электролиз карбоксилата по Кольбе. Моноэфир дикарбоновой кислоты получается частичным гидролизом диэфира, легко осуществимым по причине значительного различия в реакционной способности сложноэфирной группы в диэфире и анионе моноэфира.
-ООС-^Х^ COOEt
— -ООС-^Х^ COOEt + -OOC^Xx^COOEt-*
-2eQ
-CO2
COOEt
1, Na/ксилол COOEt 2’ Cu(°Ac)2
[A]
i. n2h4_
2. HgO
[Б]
6-41. Ключевой полупродукт —циклопропанкарбоновую кислоту — получают малоновым синтезом. Необходимый в этом синтезе циклопропиллитий получают из циклопропилбромида. Поскольку для циклопропильных производных нельзя использовать нуклеофильное замещение, единственный доступный путь к циклопро-пилбромиду — реакция Бородина—Хунсдиккера.
ВГ + /C00Et 2NaOEt, Вг 'COOEt Et0H
,COOEt
COOEt
H^H2O
---*[>COOH^
HgO, ССЦ ^ВГ Et2O ^L1
t>COOH^
6-42. Синтез димедона см. решение задачи 6-14.
ОН
1. РВг3, Ру______
2. t-BuONa/Z-BuOH, ‘ ОН
6. Алициклы и гетероциклы 253
6-43. Первый мостик получается в результате сшивания двух остатков малонового эфира дибромэтаном. Поскольку образуется энергетически маловыгодный восьмичленный цикл, то для достижения хорошего выхода продукта циклизации и подавления межмолекулярной реакции следует использовать низкие концентрации реагентов. Второй мостик образуется в результате ацилоиновой конденсации.
Вг2 hv
Вг
Вг
2е<
COOEt
COOEt
EtOOCvxCOOEt
EtOOC''4 COOEt
1.2NaH
2. BrCH2CH2Br
3. H^H2O
1. Na/ксилол, t \
2. СН3СООН
ОН
О Си(ОАс)2 С2Н5ОН
6-44. Аналогично решению задачи 6-6. Циклогептанон (суберон) обычно получают из циклогексанона расширением цикла с помощью диазометана.
CH2N2, А1Вг3
6-45. Соединение А — аддукт сильнейшего диенофила диметило-вого эфира ацетилендикарбоновой кислоты и 2,5-диметилфурана, играющего роль диена. Реакции, приводящие к компонентам диенового синтеза показаны на схеме. Ацетилендикарбоновую кислоту обычно получают отщеплением НВг от продукта присоединения брома к малеиновой или фумаровой кислоте. Диметил-
254 Решения
фуран получают по Паалю—Кнорру из 2,5-гександиона, ключевой стадией в синтезе которого является синтез Фаворского—Реппе.
х-СООН j Br^ Br^xCOQH j кон
^СООН 2- кон ^СООН 2- МеОН> н®
МеООС-^г-СООМе
__ и 1. NaNH2 _ / 1. NaNH2
Н 2. МеСНО * Н ~ ЮН 2. МеСНО
H2/Pd
ПФК
СООМе
CrO3, H2SO4 г
Ме2СО—Н2О*
МеООС
[А]
6-46. Макроцикл образуется в результате ацилоиновой конденсации диэфира, для синтеза которого использована реакция Михаэля. Удаление карбонильной группы следует провести перед ацилоиновой конденсацией во избежание осложнений, так как карбонильная группа легко присоединяет электрон при реакции со щелочными металлами. Для восстановления карбонильной группы здесь нельзя использовать стандартный метод Кижнера—Вольфа, так как СООМе реагирует в условиях этой реакции. Использована никелькатализируемая десульфуризация дитиоланового производ-
ного.
СООМе
СООМе
1. HSCH2CH2SH, BF3 • Et2O
2. Н2, Ni-Re
СООМе кЫа/ксилол^
СООМе 2 СНзСООН
^О 1- NaBH4
| 2- РВг3
< 3. Zn
ОН 4. H2/Pd/C
[А]
6. Алициклы и гетероциклы 255
6-47.
6-48.
ОН
МеО кон
со2
HNO3
(СН3СО)2О
6-49.
1. Вг2/АсОН
2. Et3N '
1. Mel, К,СО, 2. Sn/HCl
ОМе
СООМе
1, NaNCh, H2SO4, 0-5 °C
2. t
3. Mel, К2СОэ
ОМе
СООМе
морфолин СНС13
2. BH3 THF
3. H2O2, NaOH
(CH2=CH)2CuLi
1. HOCH2CH2OH/TsOH
l.PBr3/Et2O
2. Mg/Et2O
3. HC(OEt)3/Et2O
4. H^H2O
О о он
CHO KOH, EtOH ГТ'Л СгОз • НС1 • Ру
СН2С12
256 Решения
6-50. Четырехчленный цикл замыкается с помощью ацилоиновой конденсации, которую проводят в присутствии триметилси-лилхлорида — перехватчика ацилоинового енолят-иона. Исходный диэфир для ацилоиновой конденсации можно получить диеновым синтезом с использованием диена, легко доступного в результате кислотно-катализируемой дегидратации пинакона.
6-51. Пиррол образуется по методу Пааля—Кнорра. Необходимый 1,4-дикетон может быть легко получен из продукта конденсации Дикмана диэтиладипата 2-этоксикарбонилциклогексанона. Изо-пропиламин получают восстановительным аминированием ацетона.
1.Н®/Н2О
2. )-NH2
[А]
6-52. Бутиндиол, полученный конденсацией ацетилена и формальдегида в присутствии каталитических количеств ацетиленида меди, превращают в хлорангидрид янтарной кислоты. Последний используют в ацилировании фурола по Фриделю—Крафтсу и полученный дикетон превращают в тиофен по методу Пааля—Кнорра
6. Алициклы и гетероциклы 257
реакцией с реагентом Лаусона, который, как правило, дает более высокие выходы тиофенов чем сульфиды фосфора.
r-u Си2С2 (катализ.) НО ________ l.H2/Pd
+ LH2O 100ос 5 атм ---Д 2. Н2Сг2О7
ОН 3.SOC12
^COCi ^COCl
фуран, SnCl4, ~10°С (| ч—/ \—Г
СН2С12 ” О О О О'
H2S/HC1 P2S5
6-53. CH2(COOEt)2 y^^^*-CH3CH(COOEt)2-*
3. Н3О®
l.NaH, толуол* CH3C(COOEt)2 на (конц ) CH3CHCOOH
2.12(0,5 моль) CH3C(COOEt)2 H2O, г СНзСНСООн”*"
H® вон,Т
CH3CHCOOEt 1. Na /ксилол, Me3SiCl, t
CH3CHCOOEt 2. H3O® ТГФ
CH3 О
CH/^OH
6-54. В качестве матрицы для сборки молекулы использовано бисдитиановое производное янтарного диальдегида. После последовательной надстройки скелета цепью Б и метилом и регенерации карбонильных групп замыкается циклопентеноновый цикл жасмона в результате внутримолекулярной кротоновой конденсации.
258 Решения
6-55. Надстройка скелета до необходимого числа атомов углерода осуществлена в две стадии, включающие малоновый синтез (а) и реакцию Арндта—Эйстерта (б). Для построения 10-членного цикла используется ацилоиновая конденсация. Для региоселективного образования тройной связи используется элиминирование азота из бисдиазосоединения, генерируемого окислением бисгидразона. Возможная альтернатива — элиминирование НВг под действием оснований из дигалогенпроизводного здесь неудачна, так как эти реакции приводят к образованию примесей алленов и изомерных алкинов.
СООМе
1. SOC12
2. CH2N2
3. Ag2O/H2O
4. CH2N2
(6)
1. Na, ксилол, t
2. СН3СООН
СООМе
Cu(OAc)2_ ДМФА
1. n2h4_______________
2. РЬ(ОАс)4 -20°С, СН2С12
Na _
NH3 (ж.)
6-56. Исходный амин подвергают исчерпывающему метилированию по Гофману; двойную связь расщепляют, причем возможно одностадийное расщепление, в котором используется смесь ОзОд—NaIO4 (дорогостоящий тетраоксид осмия в каталитических
6. Алициклы и гетероциклы 259
количествах). Альдегид превращают в амин с помощью восстановительного аминирования.
СНО
NMe2
6-57. Фурановый фрагмент синтезирован по реакции Пааля— Кнорра. Необходимый для этой реакции 1,4-дикетон получен с помощью дитианового синтеза из двух фрагментов — 5-метилтио-фенальдегида и метилвинилкетона. Сопряженное присоединение литиевого производного дитианового производного к метилвинил-кетону осуществляется в присутствии солей меди(1).
/ГЛ L Me2NCHO/POCI3_ fj~Л N2H4, КОН r
2. CH3COONa/H2O CHO ДЭГ, 180 °C
HS-x
1. Me2NCHO/POCl3 HS-^r
2. CH3COONa/H2O "^«f'CHO BF3
HgClz, НС1
MeOH
О О
260 Решения
6-59.
6-58.
SiMe3
l.NaH/ТГФ
2. MejSiCI/эфир
OSiMe3
С=СН2
KF, HF
HtO, 0°C*
l.TsCl, С^ЩМ/эфи^
2. t-BuOK/ДМСО *'
О О
СН3ССН2ССН3 В1СН2СН2Вг, К2СОз^
1. UAIH4, эфир
2. NH4CI/H2O*
CH2I2, Zn/Cu эфир, 36 °C *
р-\/СН(СН3)ОН PBr3, C5H5N
Ь^СЩСНзЮН сн,С12 *
[\/CH(CH3)Br z-BuOK, t-BuOH
IX^CH (СН3)Вг > ”
CH2I2, Zn/Cu эфир, 36 °C *
1. сн3са, AiaycHCh
2 на/н2о
СН=СН2 сн=сн2
о
/ \-CCM Вг2 СНз сн3соон
о
ССН2Вг
CH3CCH2COOEt
1. Et ONa, EtOH _
2. PhC(O)CH2BrM
3.NH4C1/H2O
CH3CCH2COOEt—* CH2CPh
О
6. Алициклы и гетероциклы 261
О
НСЦконц.),/ ____К.
0 г-х
CH3CCH2CH2CPh ПФКг сн ЛХРЬ
6-61.
ЛА хттт l.KNOz.HCl/HzO v_7 WH2 2. 8пС12,НС1(конц*
СН3С(О)СН3,ПФК
или Na2S0^,NaHSO3
{~^-NHNH2
-►ОГУсНз АЛ-NH
сно
1.дмФА,роа3г сн
2 CH3COONa/H2O
СН3 l.NH2NH2_______________►Г’г>Ч|ГА-СН 1NaH/Tr<^
2. КОН/200 °C, диэтиленгликоль ^4/~NH 3 2-СН31
/=\ Na/NHi(».) Z—\
6-62. СН3Ч /)-ОСН3-----------—►СН3-С />-ОСН3-»
вон,-зз °с
3. PBr3/C5H5N
2. СН3ССН3
3. Н2О, NH4CI
С(СН3)2
[А] 0Н
262 Решения
6-63.
nh2
глицерин, H2SO4 (конц.), t
1. (СН3СО)2О____________________
2 2, HNO3, H2SO4 " PhNQ,
3. CHjCOONa/H^O j<fQ
1. Fe, НСКконц )^
2. HOe/H2O
6-64.
PhBr Buli/гексан» phLi Li/эфир
6-65.
CH3CCH3 --CH3CCH2Br
Oi J CH ,COOH II
о о
1. NaOEt.EtOH _TT _ CH3CCH2COOEt 2 сн сен Br* CH3C-CH2COOEt -*
О 6 о CH2CCH3
3. NF^G/HiO
на (конц.), / > CH3CCH2CH2CCH3
6 6
BrCH2CH2Br + CH2(COOEt)2
X/COOEt /VoOEt
[>COOH
i. soa2/C5H5N, свн6^
2. NH3/CHa3 Lx" NH2—* I/ o
6. Алициклы и гетероциклы 263
I. ИА1Н4/эфир
2. CH3COONa/H2O
СН3ССН2СН2ССН3
t
6-66.
CrO3,H2S04
Н20, СН3ССН3*
Z J II 3
о
1. EtONa/EtOH
2. СН3ССН=СН2, t
О
1. (CH3)2CuLi, эфир^
2. Н3О®
Получение диметилкупрата см. решение задачи 3-35.
ОГЛАВЛЕНИЕ
Предисловие ................................................ 3
Обозначения .................................................. 5
Задачи........................................................ 7
Глава 1. Алканы, алкены, алкины, диены ....................... 7
Глава 2. Нуклеофильное замещение в алифатическом ряду, элиминирование ............................................ 13
Глава 3. Карбонильные соединения ............................ 27
Глава 4. Электрофильное и нуклеофильное замещение в ароматическом ряду 45
Глава 5. Амины, нитро- и диазосоединения, фенолы, хиноны .... 57
Глава 6. Алициклы и гетероциклы ............................. 67
Решения...................................................... 79
Глава 1. Алканы, алкены, алкины, диены ...................... 79
Глава 2. Нуклеофильное замещение в алифатическом ряду, элиминирование ............................................ 97
Глава 3. Карбонильные соединения ...................... 129
Глава 4. Электрофильное и нуклеофильное замещение в ароматическом ряду ......................................... 173
Глава 5. Амины, нитро- и диазосоединения, фенолы, хиноны .... 205
Глава 6. Алициклы и гетероциклы ............................ 235