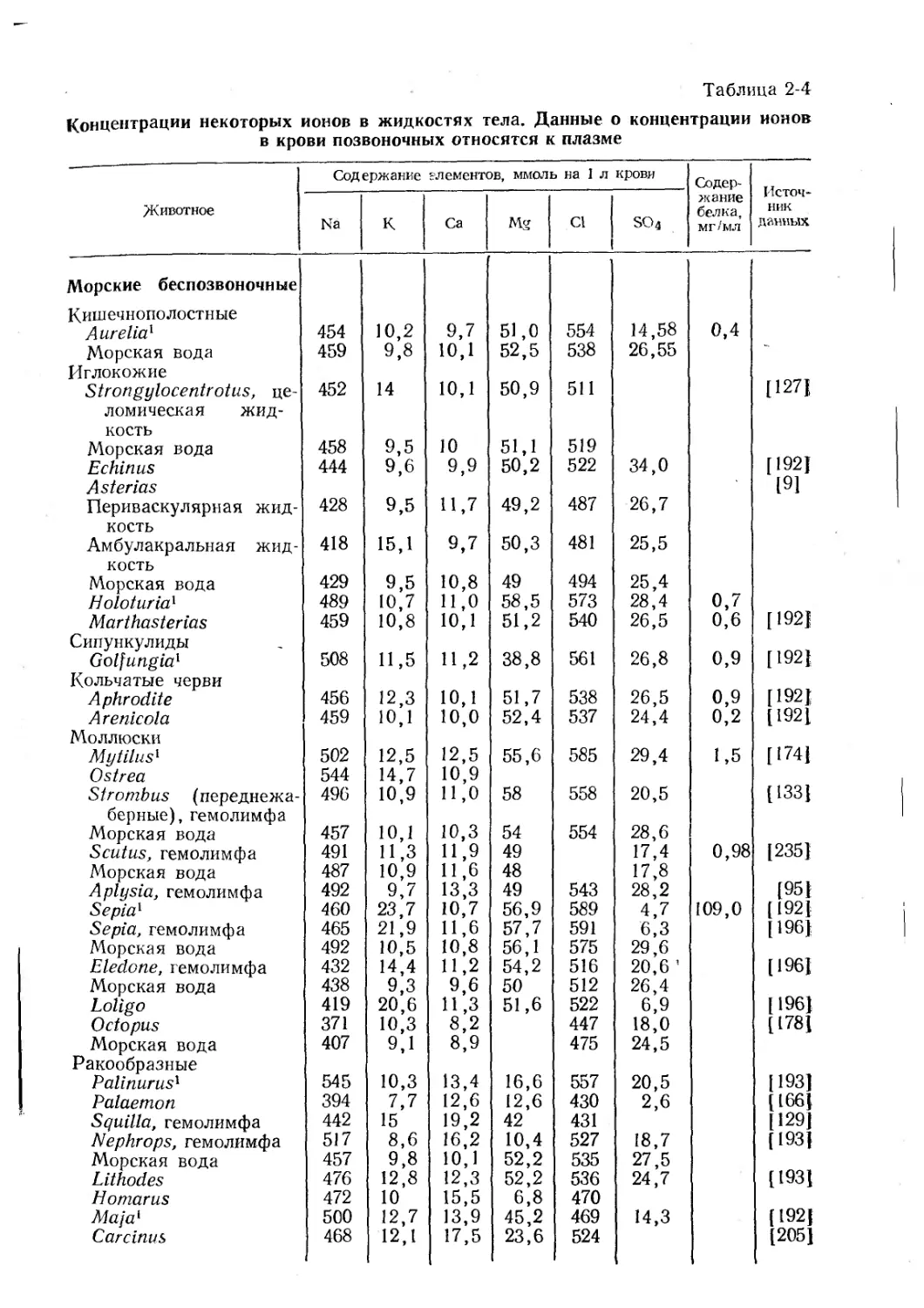
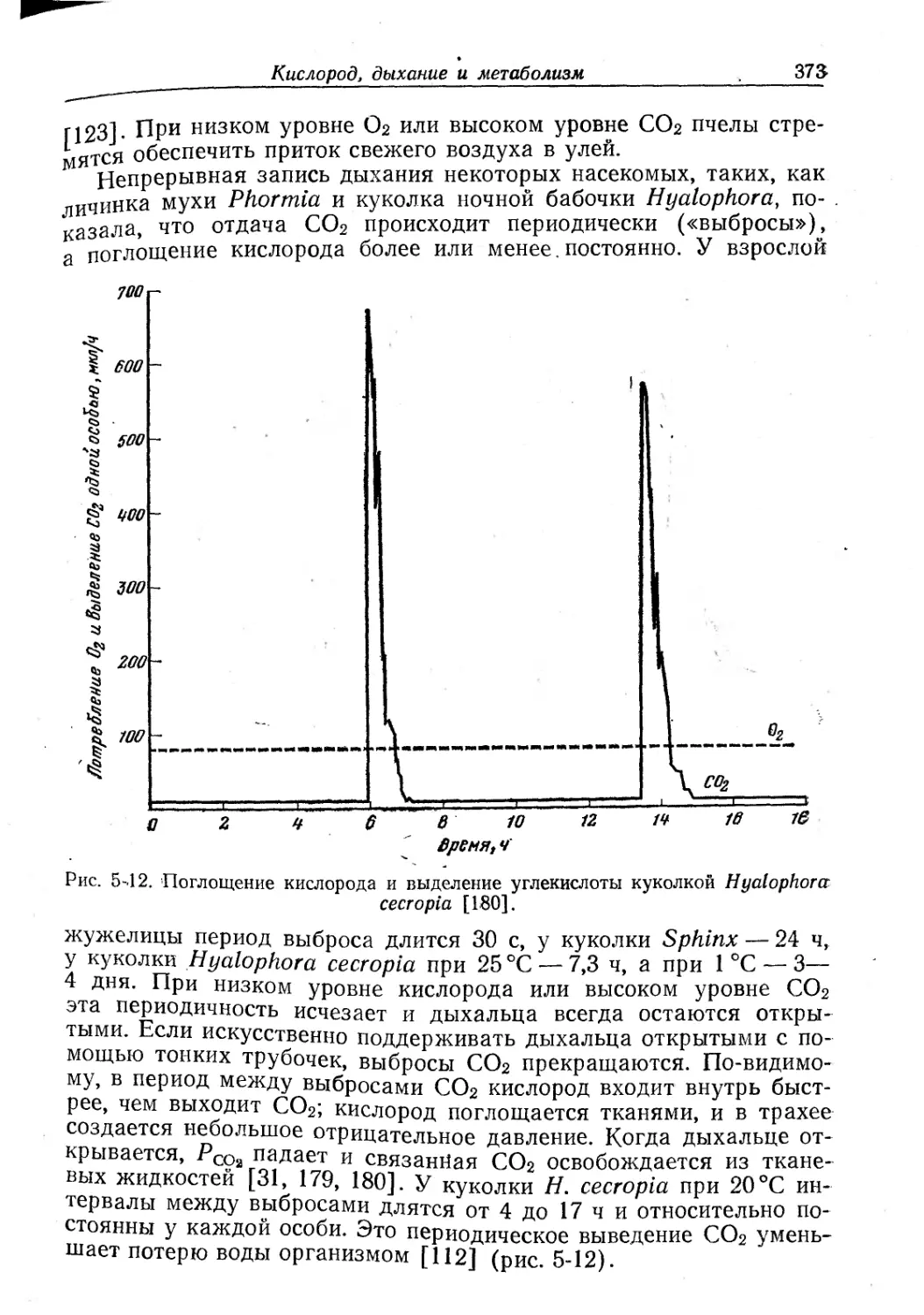
Text
Comparative Animal Physiology
Edited by C. Ladd Prosser
Professor of Physiology and Zoology Department of Physiology and Biophysics University of Illinois at Urbana — Champaign
Third Edition
W. B. SAUNDERS COMPANY PHILADELPHIA.LONDON-TORONTO 1973
Сравнительная Физиология
ЖИВОТНЫХ
Под редакцией проф. Л. Проссера
У lb
том 1
Перевод с английского
под редакцией
чл.-корр. АН СССР Т. М. Турпаева
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА
1977
УДК 591.1
Фундаментальное руководство по сравнительной физиологии животных, выходящее в 1977—1978 гг. в трех томах, значительно отличается от предыдущего издания, вышедшего на русском языке в 1967 г. Расширился авторский коллектив, переработаны многие разделы, написаны новые главы, обновлены иллюстрации. Книга удачно сочетает в себе достоинства учебного пособия и справочника, содержащего 'основные факты и обширную литературу по одному из важнейших разделов биологии. В первом томе рассмотрены регуляция водного обмена, транспорт и обмен неорганических ионов, питание, физиология и биохимия пищеварения, дыхание, основные пути обмена веществ, типы экскреции азота, детоксикация некоторых метаболитов.
Предназначена для физиологов, биохимиков, экологов, зоологов, студентов, аспирантов и преподавателей соответствующих кафедр университетов и институтов, а также для инженеров, занимающихся проблемами бионики и кибернетики.
Редакция биологической литературы
СРАВНИТЕЛЬНАЯ ФИЗИОЛОГИЯ ЖИВОТНЫХ
Том I
Редакторы Н. Д. Аграчева, Ю. И. Дашкевич, Н. Н. Шафрановская. Художник В. Медников. Художественный редактор В. Бисенгалиев. Технический редактор Г. Алюлина
Сдано в набор 17/1 1977 г. Подписано к печати 19/V 1977 г. Бумага кн. журн. бОХЭО'/и— — 19 бум. л. Печ. л. усл. 38,00. Уч.-изд. л. 45,07. Изд. № 4/8748. Цена 3 р. 40 к. Зак. 1332.
ИЗДАТЕЛЬСТВО «МИР» Москва, 1-й Рижский пер., 2
Московская типография № 11 Союзполиграфпрома при Государственном комитете Совета Л1инистров СССР по делам издательств, полиграфии и книжной торговли. Москва, 113105, Нагатинская ул., д. 1.
50300-369
С 041(01 )-77 ПОД’ ИЗД"
© 1973 by W. В. Saunders Company
© Перевод на русский язык, «Мир», 1977
Предисловие к русскому изданию
В 1967 г. издательство «Мир» опубликовало перевод второго издания (1961 г.) руководства «Сравнительная физиология животных» американских физиологов Л. Проссера и Ф. Брауна. Новое издание этой ценной книги на русском языке является переводом третьего издания, опубликованного в 1973 г. под редакцией профессора Иллинойсского университета Л. Проссера.
Книга состоит из 24 глав: 1. Обмен воды: осмотический баланс, гормональная регуляция; 2. Неорганические ионы; 3. Питание; 4. Сравнительная физиология и биохимия пищеварения; 5. Кислород: дыхание и метаболизм; 6. Сравнительные аспекты промежуточного обмена; 7. Экскреция азота; 8. Дыхательная функция крови; 9. Температура; 10. Биологические ритмы; 11. Возбудимые мембраны; 12. Механорецепция, фонорецепция и рецепция равновесия; 13. Хеморецепция; 14. Фоторецепция и зрение; 15. Центральная нервная система; 16. Мышцы; 17. Электрические органы и электрорецепторы; 18. Амебоидное движение; 19. Реснички; 20. Циркуляция жидкостей в организме; 21. Эндокринные механизмы; 22. Нематоцисты и их аналоги; 23. Хроматофоры и изменение цвета; 24. Биолюминесценция.
В отличие от однотомного оригинала русский перевод книги Л. Проссера издается в трех томах без каких-либо изменений в тексте и последовательности расположения глав. В нашем трехтомном издании дана следующая разбивка на главы: том I — главы 1—7, том II — главы 8—14, том III — главы 15—24.
В новой книге не только значительно возрос объем и расширился авторский коллектив (кроме Л. Проссера, автора большей части книги, в написании ряда глав приняли участие восемь известных физиологов и зоологов из различных университетов США и Великобритании), но, главное, коренным образом переработан весь текст, почти полностью обновлены иллюстрации и таблицы, составлен новый справочный аппарат книги, введены новые главы (6, 10, И), а старые в большой мере написаны заново.
Следует отметить, что предыдущее издание «Сравнительной физиологии животных» отнюдь не утратило своего значения до сих
6 Предисловие к русскому изданию______________
пор, так как многие проблемы, не получившие дальнейшего развития за последние годы и исчерпывающе полно изложенные в издании 1961 г., в книге 1973 г. вообще не рассматриваются. Новое издание дает сводку работ, опубликованных преимущественно за последние 10—15 лет, в которой отражены следующие современные тенденции развития сравнительной физиологии.
1. Использование для сравнительно-физиологических и сравнительно-биохимических исследований новейших биохимических, фармакологических, биофизических и морфологических методов.
2. Использование для сравнительно-физиологических обобщений достижений в области молекулярной биологии, биохимии, биофизики, цитологии, зоологии.
3. Использование многих объектов сравнительной физиологии для изучения важнейших вопросов общей физиологии, например механизмов транспорта ионов через мембраны, процессов возбуждения и торможения.
Значительно слабее отражено другое, очень важное направление современной сравнительной физиологии — реконструкция путей и закономерностей эволюции разных функций на основании данных сравнительной физиологии и сравнительной биохимии.
Эволюционный подход к анализу экспериментальных данных по сравнительной, возрастной и экологической физиологии традиционно разрабатывался в нашей стране, начиная с исследований И. М. Сеченова, И. П. Павлова, А. Ф. Самойлова, Н. К. Кольцова и других выдающихся биологов. Сам термин «эволюционная физиология» был предложен еще в 1914 г. крупнейшим дарвинистом, эволюционным морфологом А. Н. Северцовьгм. В конце 20-х и начале 30-х годов в СССР были созданы первые научные коллективы сравнительных физиологов (X. С. Коштоянцем в Москве, Л. А. Ор-бели и Е. М. Крепсом в Ленинграде), в которых разрабатывались различные проблемы эволюции физиологических функций. После войны сравнительно-физиологические исследования широко развернулись во многих научных коллективах страны. Этому способствовало издание в 1950 и 1957 годах двухтомного руководства X. С. Коштоянца «Основы сравнительной физиологии», которое стало настольной книгой многих биологов. В отличие от «Сравнительной физиологии животных» Л. Проссера и Ф. Брауна «Основы» X. С. Коштоянца были изложены в эволюционном аспекте.
Важными событиями, стимулировавшими исследования в области эволюционной физиологии в нашей стране, была организация академиком Л. А. Орбели в 1956 году в Ленинграде Института эволюционной физиологии им. И. М. Сеченова АН СССР (теперь Институт эволюционной физиологии и биохимии им И. М. Сеченова АН СССР) и основание в 1965 г. академиком Е*. М. Крепсом «Журнала эволюционной биохимии и физиологии». В СССР стали издаваться специальные сборники трудов совещаний, конференций и симпозиумов по сравнительной, онтогенетической и экологической
Предисловие к русскому изданию
7
^физиологии и биохимии. В связи с тем, что материалы этой обширной и разносторонней литературы на русском языке не были включены Л. Проссером в третье издание руководства «Сравнительная физиология животных», в конце предисловия мы даем список некоторых изданий, посвященных различным проблемам эволюционной физиологии и список журналов, издаваемых АН СССР, в которых публикуются работы по сравнительной физиологии. Много работ в области сравнительной физиологии публикуют издательства АН союзных республик в своих биологических журналах и специальных изданиях.
В переводе этого издания принимали участие известные ученые в области сравнительной физиологии, биохимии и морфологии, что в значительной мере облегчило работу по редактированию перевода. Большая помощь в редактировании перевода зоологической и экологической терминологии и соответствующих текстов была оказана зоологом Ю. М. Фроловым.
Несомненно, что новое издание на русском языке «Сравнительной физиологии животных» Л. Проссера, так же как и предыдущее издание этой книги, станет очень ценным пособием для студентов и аспирантов университетов и большого отряда исследователей, работающих в самых разнообразных областях биологии.
СПИСОК ЛИТЕРАТУРЫ
Александрян Э. А., Сенсорное развитие на ранних этапах онтогенеза и роль двигательного анализатора в этом процессе, изд-во «Айастан», Ереван, 1972.
Анохин П. Очерки по физиологии функциональных систем, изд-во «Медицина», М„ 1975.
Аршавский И. А., Очерки по возрастной физиологии, изд-во «Медицина», М„ 1967.
Астауров Б. Л. (ред.), Гормональные факторы индивидуального развития, изд-во «Наука», М., 1974.
Батуев А. С., Эволюция лобных долей и интегральная деятельность мозга, изд-во «Медицина», Л., 1973.
Бериташвили И. С., Память позвоночных животных, изд-во «Наука» М 1974. У ' "
Вианки^В. Л., Эволюция парной функции мозговых полушарий, Изд-во ЛГУ, Л.,
Бирюков Д. А., Экологическая физиология нервной деятельности, «Медгиз», М., 1960.
Бузников Г. А., Низкомолекулярные регуляторы зародышевого развития изд-во «Наука», М., 1967.
Бызов А. Л., Электрофиизологические исследования сетчатки, изд-во «Наука», М, 1966.
Винников Я. А., Цитологические и молекулярые основы рецепции, изд-во «Наука», __ «И., 1971.
инников Я. А., Газенко О. Г. и др., Рецептор гравитации. Эволюция структурной, цитохимической и функциональной организации, изд-во «Наука», Л., * У / J ,
оино-Ясенецкий А. В., Первичные ритмы возбуждения в онтогенезе, изд-во «Наука», Л., 1974.
8 П редисловиек русскому изданию______________________
Волохов А. А., Закономерности онтогенеза нервной деятельности в свете эволюционного учения, Изд-во АН СССР, М.— Л., 1951.
Воронин Л. Г., Лекции по сравнительной физиологии высшей нервной деятельности, Изд-во МГУ, М., 1957. u
Воскресенская А. К., Функциональные свойства мышц насекомых, Изд-во АН СССР, Л„ 1959.
Гербильский И. Л. (ред.), Нейросекреторные элементы и их значение в организме, изд-во «Наука», М. — Л., 1964.
Гинецинский А. Г., Об эволюции функций и функциональной эволюции, Изд-во АН СССР, М. — Л., 1961.
Гинецинский А. Г., Физиологические механизмы водно-солевого равновесия, Изд-во АН СССР, М. — Л., 1963.
Говырин В. А., Трофическая функция симпатических нервов, сердца и скелетных мышц, изд-во «Наука», Л., 1967.
Голубева Е. Л., Формирование центральных механизмов регуляции дыхания в онтогенезе, изд-во «Наука», М., 1971.
Жуков Е. К., Очерки по нервно-мышечной физиологии, изд-во «Наука», Л., 1969.
Жуков Е. К. и др., Развитие сократительной функции мышц двигательного аппарата, изд-во «Наука», Л., 1974.
Итина Н. А., Функциональные свойства нервно-мышечных приборов, Изд-во АН СССР, М. —-Л., 1959.
Карамян А. И., Функциональная эволюция мозга позвоночных, изд-во «Наука», Л., 1970.
Карамян А. И., Эволюция конечного мозга позвоночных, изд-во «Наука», Л., 1976.
Корнева Е. А., Эволюция рефлекторной регуляции сердечной деятельности, изд-во «Медицина», Л., 1965.
Коштоянц X. С., Основы сравнительной физиологии, т. I, Изд-во АН СССР, 1950; т. II, Изд-во АН СССР, 1957.
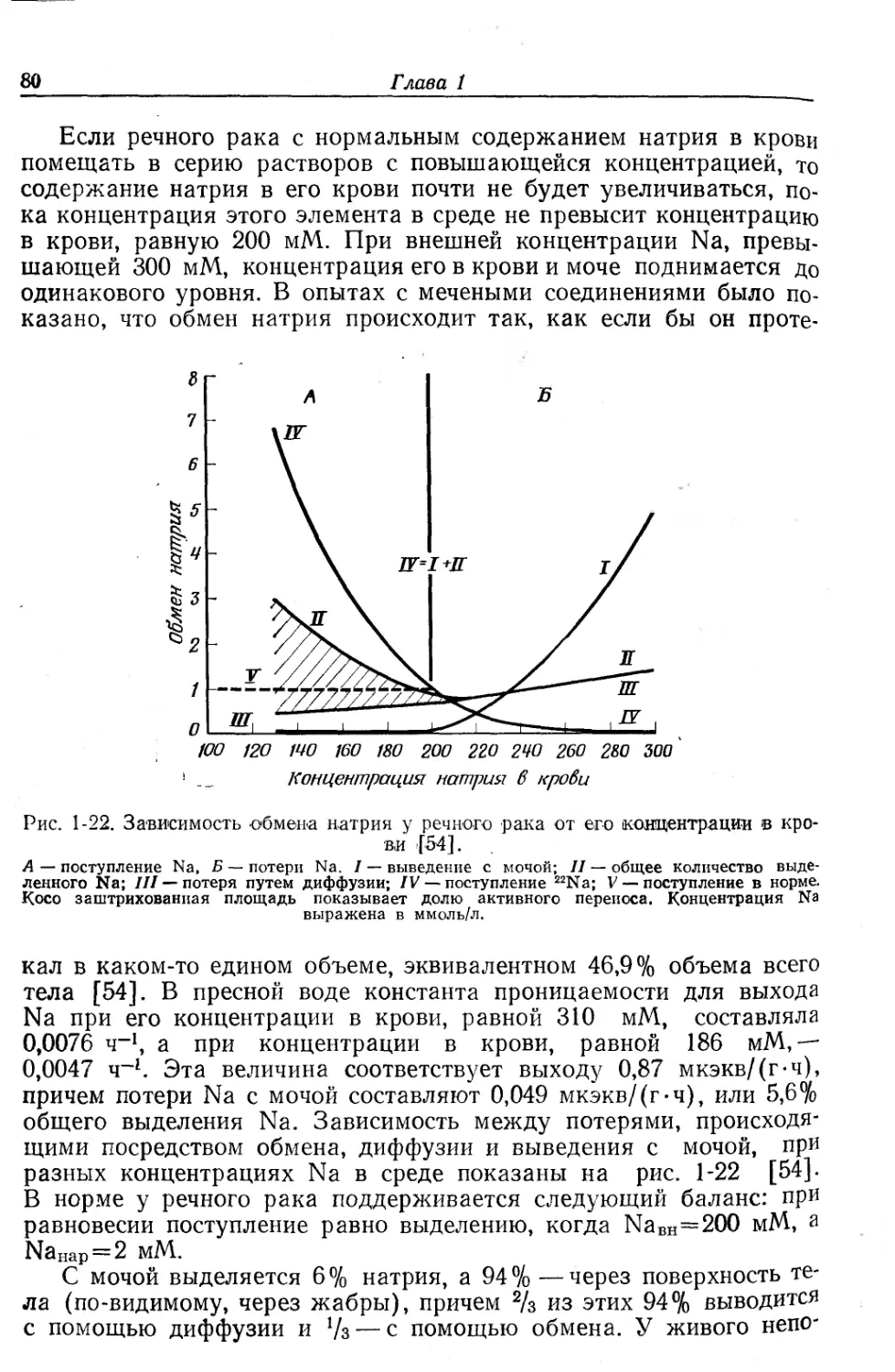
Коштоянц X. С., Проблемы энзимохимии процессов возбуждения и торможения и эволюции функций нервной системы, Изд-во АН СССР, М., 1963.
Крепе Е. М. и др., (ред.), Эволюция функций. Физиологические, биохимические и структурные основы эволюции функций, изд-во «Наука», М.— Л., 1964.
Крепе Е. М., Фосфолипиды клеточных мембран нервной системы в развитии животного мира, изд-во «Наука», Л., 1967.
Лейбсон Л. Г., Сахар крови, Изд-во АН СССР, М. — Л., 1962.
Мантейфель Ю. Б., Вызванные потенциалы зрительного .центра среднего мозга амфибий, изд-во «Наука», М., 1974.
Маркосян А. А., Вопросы возрастной физиологии, изд-во «Просвещение», М., 1974.
Михельсон М. Я., Зеймаль Э. В., Ацетилхолин. О молекулярном механизме действия, изд-во «Наука», Л., 1970.
Образцова Г. А., Вопросы онтогенеза высшей нервной деятельности, изд-во «Наука», Al. — Л., 1964.
Ониани Т. И., Вопросы сравнительной физиологии нервно-мышечного аппарата, изд-во «Мецнеироба», Тбилиси, 1964.
Орбели Л. А., Избранные труды, т. I. Вопросы эволюционной физиологии, Изд-во АН СССР, М. — Л., 1961.
Плисецкая Э. М., Гормональная регуляция углеводного обмена у низших позвоночных, изд-во «Наука», Л., 1975.
Поленов А. Л., Гипоталамическая нейросекреция, изд-во «Наука», Л., 1971.
Сахаров Д. А., Генеалогия нейронов, изд-во «Наука», М., 1974.
Свидерский В. Л., Нейрофизиология полета насекомых, изд-во «Наука», Л „ 1973.
Серавин Л. Н., Двигательные системы простейших, строение, механохимия и физиология, изд-во «Наука», Л., 1967.
Сергеев Б. Ф„ Эволюция ассоциативных временных связей. Филогенез замыкательной деятельности хордовых, изд-во «Наука», Л., 1967.
Пр ед и словие к русскому изданию
Слоним А Д., Частная экологическая физиология млекопитающих, Изд-во АН СССР, М. —Л., 1962.
Строганов Н. С., Экологическая физиология рыб, Изд-во МГУ, М., 1962.
Тетяева М. Б., Эволюция функций блуждающего нерва в деятельности желудочно-кишечного тракта, Изд-во АН СССР, М. — Л., 1960.
Тцрпаев Т. М. (ред.), Проблемы эволюции функций и энзимохимии процессов возбуждения, Изд-во АН СССР, М., 1961.
У голев А. М., Пищеварение и его приспособительная эволюция, изд-во «Высшая школа», М., 1961.
Фирсов Л. А., Память у антропоидов, изд-во «Наука», Л., 1972.
Шапиро Б. И., Зрительные проекции промежуточного и среднего мозга костистых рыб, изд-во «Наука», Л., 1971.
Шаповалов А. И., Нейронная организация и синаптические механизмы супраспи-нального моторного контроля, изд-во «Наука», Л., 1976.
Шулейкина К. В., Системная организация пищевого поведения, изд-во «Наука», М., 1971.
Штарк М. Б., Мозг зимнеспящих, изд-во «Наука», Новосибирск, 1970.
Журналы, издаваемые издательством «Наука»
Журнал эволюционной биохимии и физиологии Физиологический журнал СССР им. И. М. Сеченова Журнал высшей нервной деятельности им. И. П. Павлова Нейрофизиология
Успехи физиологических наук
Цитология
Биофизика
Биохимия
Молекулярная биология
Журнал общей биологии
Зоологический журнал
Онтогенез
Ихтиология
Экология
Доклады Академии Наук СССР
Известия АН СССР, серия биологическая
Природа
Химия и жизнь
Т. М. Турпаев
Предисловие
к английскому изданию
Эта книга представляет собой совершенно новое издание руководства по сравнительной физиологии животных. Оно может служить: 1) учебным руководством для студентов старших курсов и аспирантов, 2) библиографическим справочником для начинающих исследователей и 3) обзором литературы по отдельным вопросам для исследователей, занимающихся другими проблемами. В написании книги участвовало больше авторов, и она шире по проблематике, чем издания 1950 и 1961 гг. За последние 10 лет область сравнительной физиологии сильно расширилась; для объяснения физиологических явлений все чаще используются подходы и представления биохимии и биофизики.
В соответствии с пожеланиями многих читателей увеличен объем таблиц, включающих различные биологические данные. В книге использовано большое количество специально подобранной литературы. Подробно рассмотрены многие физиологические явления, краткая интерпретация которых дана в многочисленных резюмирующих разделах. В списках литературы сохранены ссылки на ряд старых классических работ, но главное место занимают статьи, опубликованные после 1960 г. Некоторые данные приводятся без указания литературного источника; это относится к работам, цитированным в предыдущих изданиях книги, и к фактам, вошедшим в элементарные учебники физиологии. Названия статей в списках литературы сокращены.
Предполагается, что читатель имеет некоторую исходную подготовку и, в частности, знаком с основными типами и классами животных, хотя в книге широко используются тривиальные названия организмов. Предполагается также знание основ клеточной физиологии, и некоторые факты из этой области использованы для сравнительно-физиологических обобщений. Для понимания глав о пищеварении, азотистом обмене, дыхании и промежуточном обмене необходимо элементарное знание биохимии. Читатель должен быть знаком и с основными функциями различных органов в объеме обычных учебников физиологии животных и человека. Данные, полученные на млекопитающих, часто используются в этой книге для
Предисловие к английскому изданию И иллюстрации общих подходов и выводов сравнительной физиологии.
Мы увеличили объем книги, стремясь не отстать от быстрого прогресса науки. В первой половине книги речь идет о физиологических проблемах адаптации к условиям жизни; эту часть книги можно использовать как пособие по экологической физиологии. Кроме того, эти разделы содержат довольно много данных по сравнительной биохимии. Вторая половина книги посвящена физиологии органов чувств, эффекторных органов и интегративных систем-(нервной, эндокринной); она может быть полезна при прохождении курса физиологии поведения. В книгу включена глава по сравнительной физиологии возбудимых мембран, которой не было в предыдущих изданиях.
В новом издании сохранен принцип разделения материала по функциональным системам. Порядок изложения данных по каждой системе и наличие указателя помогут читателю найти нужные ему сведения о тех или иных внешних факторах, группах животных ил’и ферментах.
Авторы стремились сохранить равновесие между широтой охвата и глубиной изложения материала. Все главы были прочитаны специалистами-рецензентами. Мы благодарны многим коллегам за ценные замечания. В частности, такие замечания сделали М. В. Гринберг (по введению), Л. Б. Киршнер, Дж. Виллис (по гл. 2 и 3), А. Риггс, К. ван Хольде (гл. 8), Дж. Э. Хит, Дж. Хейзел (гл. 10), Дж. Мак-Рейнолдс, Дж. Парнас, Д. Кеннеди, Д. Хёрст (гл. 11), Л. Айткен, Т. Трахиотис, Дж. Оффатт, Б. А. Будельман (гл. 12), Д. Кеннеди, Н. Котчабхакди, Р. Джозефсон (гл. 15), Л. Барр, М. Холман, Дж. Кэмпбелл, Р. Робсон (гл. 16), М. В. Беннетт (гл. 17), М. Чайлд (гл. 19), К- Р. Рао (гл. 21), К- Р. Рао, М. Фингерман (гл. 23), Дм. У. Хастингс, Дж. Ф. Кейс, Дж. В. Бакк (гл. 24).
Редактор книги благодарит госпожу М. Уолден, принявшую участие в перепечатке рукописей для всех трех изданий книги. Он особенно признателен своей жене X. Б. Проссер, оказавшей большую помощь в подборе литературы, подготовке текста и работе над рукописями.
Л. Проссер
Введение
л. ПРОССЕР
Задача физиологии заключается в анализе функций живых организмов. Физиология — это своего рода синтетическая наука, использующая для изучения биологических объектов физические и химические методы. Для понимания сравнительной физиологии животных необходимо знание основ общей зоологии, морфологии животных, биохимии и физиологии клетки.
Направления в физиологии
Для практических целей физиологию можно подразделить на следующие три ветви.
Физиология клетки. Клеточная, или общая, физиология изучает основные свойства, присущие большинству животных организмов. Протоплазма еще до появления многоклеточных организмов претерпела длительную биохимическую эволюцию; поэтому клетки приобрели необычайно сложную функциональную организацию. Основные свойства любых клеток, будь то дрожжевая клетка, мышечная или клетка паренхимы листа, весьма сходны, например избирательная проницаемость мембран, наличие окислительных ферментов, участие нуклеотидов в важнейших жизненных процессах, взаимодействие ядра и цитоплазмы, биоэлектрические свойства мембран при возбуждении и многие другие характеристики. На клеточном уровне все организмы имеют больше общих черт, чем различий, и это сходство создает фундамент для эволюционного подхода к изучению физиологии. Клеточная специализация приводит к возникновению разнообразных типов клеток и нередко свя-зана с утратой какой-либо одной функции и усилением другой, В этом смысле можно говорить о сравнительной физиологии клеток в пределах одного организма. Свойства, изучаемые клеточной физиологией, почти универсальны и чрезвычайно устойчивы к воздействию факторов внешней среды; в настоящей книге они рассматриваться не будут. Мы остановимся лишь на тех из них, которые необходимы для объяснения функций органов.
14
Введение
Физиология отдельных групп организмов. Эта область физиологии изучает функциональные особенности отдельных групп растений и животных.
Одинаковые функции осуществляются у разных видов животных различным образом. Физиология некоторых групп животных изучена особенно подробно. Под физиологией животных по традиции понимают физиологию человека и млекопитающих; эта наука создает рациональную основу для медицины и животноводства. Физиология высших растений имеет важное значение в качестве теоретической основы растениеводства. Физиология насекомых, физиология рыб и физиология паразитов выделились в самостоятельные области науки.
Сравнительная физиология. Сравнительная физиология изучает функции отдельных органов и их систем у самых разных групп организмов, выявляя общие принципы их функциональной организации. Она рассматривает способы, посредством которых различные организмы осуществляют одинаковые функции; нередки случаи, когда генетически несходные организмы проявляют удивительное сходство своих функциональных характеристик и реакций на одни и те же внешние раздражители, в то же время близкородственные животные часто реагируют на факторы среды весьма различно. Помимо таких показателей, как свет, температура, напряжение кислорода или гормональное равновесие, используемых в любых физиологических исследованиях, сравнительная физиология анализирует каждую функцию в зависимости от положения животного в филогенетическом ряду. Такой подход позволяет делать весьма оригинальные биологические обобщения.
Сравнительное изучение поведения животных и их взаимоотношений со средой охватывает как молекулярный, так и организменный уровни, как редукционистское, так и холистическое направления в философии естествознания.
Важная задача сравнительной физиологии состоит в определении места человека в биологической истории и филогенетических связях. Медицинская физиология по своей сути антропоцентрична. Но человек как биологическое существо есть результат длительной истории естественного отбора физиологических процессов. Поэтому изучение какого-либо животного, у которого исследуемая функция развита сильнее, чем у человека, может пролить свет и на физиологию человека.
Филогения
Физиологические особенности любой группы животных отражают ее эволюционную историю. Специалист по филогении в своих исследованиях использует палеонтологические данные, если они имеются, и, кроме того, обращается к таксономии и сравнительной морфологии. Поскольку проведение физиологических эксперимен
Введение
15
тов на ископаемых животных невозможно, более важное значение приобретает изучение функциональных аналогий и гомологий и их соответствие с морфологическими данными о родстве тех или иных животных друг с другом. Гомология является следствием общности генофонда, имевшейся в древности. Она прослеживается главным образом в структуре как на уровне белков и липидов, так и на уровне целых органов или их частей. Понятием физиологической гомологии пользуются, когда говорят о функциях генетически родственных систем (или ферментов), служащих одинаковым целям (в качестве примера можно привести натриевый насос в разных органах или родопсин в глазах различных животных). Понятие физиологической аналогии применяют в случаях эволюционной конвергенции или сходного решения определенной жизненной задачи с помощью различных не связанных между собой средств (например, использование разнообразных металлопротеидов для транспорта кислорода).
Поскольку сравнительная физиология использует в качестве экспериментальных переменных таксономические единицы — от подвида до типа, — весьма важно знать, какие родственные отношения существуют между различными организмами и как они развивались. Знание филогении помогает в выборе экспериментального животного, наиболее подходящего для исследования некоторых физиологических процессов, например процессов возбуждения и сокращения, сопряженно протекающих в мышцах, а также для решения вопроса о том, однократно или повторно они возникают. В каждой данной группе животных функция четко определяется происхождением этой группы. Физиологический анализ оказывается полезным и для выяснения эволюционных взаимосвязей.
Основные типы животных возникли более или менее одновременно в кембрийском периоде; следовательно, принятое сейчас эволюционное древо более полифилетично и менее монофилетично,, чем конструировавшееся раньше. В положении многих типов на цреве животного мира пока нет полной уверенности, а между типами постулируется наличие многочисленных «недостающих звеньев». Принятая сейчас филогенетическая схема дана на рис. 1.
Жгутиковые — наиболее примитивные простейшие; другие современные простейшие и губки представляют собой боковую ветвь, отходящую от основного ствола. Близ основания ствола от него отделяются круглые черви и другие не обладающие целомом животные. Примерно на этом же уровне происходит разделение на две основные линии: 1) линию кольчатых червей, членистоногих и моллюсков и 2) линию иглокожих и хордовых. Наивысшей специализации среди моллюсков достигли головоногие, среди членистоногих насекомые, а среди хордовых — птицы и млекопитающие. Разные линии характеризуются, как правило, особенностями эмбрионального развития животных. Группе кольчатых червей, членистоногих и моллюсков свойственно детерминированное, или спираль-
Головоногие
•Млекопитающие ]
Насекомые
Птицы
•Многоножки
Бесчерепные
Погонофоры
Морские пауки
Морские лилии
Осриуры
Морские звезды
Морские ежи
Земноводные
Голотурии
I Костные
I рыбы
Хрящевые
и" рыбы
^•Весчереп- ^-1
ные I_______________|
,-Личииочно- и-СипункулиВы хордовые ।
Пиявки
Малощетин новые червг
Онихофоры Тихоходы
Пятиустки
Полихопдооые
Губки
Простейшие
Немертины Плоские черви
Билатеральные планулоиды
Примитивные Ькгцтикобые
Примитивные вторичноротпые
Щетинкочелю-— сотые I—
Примитивные кольчатые черви
Водоросли Гребневики \ \ \бораллобые палицы \\\ Сцифоибные^^.
V V\ Гидроидные -—
Радиальные-Длтулоиды
Пресмыкающиеся
Ракообразные Паукообразные Мечехвосты.
Зхиуры
Многбиуити _____новые черви
Приапулиды Нематоды
Скребни Волосатиковые ! киноринхи Гастротрихи
Плеченогие
ФорОНидЪ1
-Внепорошицевые [
Внутрипороши- \ Коловратки цевые
Двустворчатые — моллюски
—Лопатоногие моллюски
—Брюхоногие моллюски
—Моноплако-сроры
—Полиплако-(роры
f-Беспанцирные
Рис. 1. Филогенетическое древо животного царства.
В настоящее время большинством ученых признается полифилетическое происхождение животных. Кишечнополостные — гребневики, коралловые полипы, сцифоидные и гидроидные — связаны родством между собой, но не считаются прямыми предками высших животных; губки также находятся в стороне от главной ветви. Радиация первичноротых берет начало от вымершей линии организмов, подобных плоским червям, и включает три ветви: 1) современные плоские черви и немертины, 2) моллюски (классы показаны справа), 3) линия кольчатых червей — членистоногих, включающих различные близкие кольчатым червям формы. Происхождение и взаимосвязи нескольких псевдополостных ветвей, таких, как коловратки и нематоды, неясны. Положение некоторых полостных животных, таких, как брюхоногие, внепорошицевые и форониды, тоже неясно. Примитивные вторичиоротые возникли независимо, дав начало иглокожим и хордовым. (Любезно пред ставлено М. Лж. ГпигЛтггм: s;st Яоо1. 22. 1973.)
Введение
17
ное дробление: их бластомеры распределяются по определенному, оаз’и навсегда установленному типу; равнопотенциальность клеток выражена слабо, и судьба каждой клетки строго предопределена; группе иглокожих и хордовых свойственно недетерминированное дробление. В первой группе образование мезодермы начинается с одной определенной клетки бластулы, которая дает две боковые мезодермальные полоски; во второй же группе мезодерма закладывается в виде выпячиваний первичной кишки, т. е. энтодермы. У первой группы целом возникает в виде полостей в мезодермальных полосках, а во второй группе—в виде первичной кишки. Несколько мелких типов относятся к псевдоцеломическим, так как полость тела у них не является истинным целомом. У кольчатых червей, членистоногих и моллюсков бластопор превращается в ротовое отверстие (первичноротые), а анальное отверстие образуется вторично на противоположном конце гаструлы; у иглокожих же и хордовых бластопор превращается в анальное отверстие, а рот образуется вторично (вторичноротые).
Концепция вида
Существует несколько определений, или концепций, вида, но ни одно из них не может быть применено ко всем организмам, главным образом из-за различий в типах размножения. Типологическая концепция вида основывается на устойчивых отличительных признаках — обычно морфологических или белковых (изофермент-ных), причем не обязательно адаптивных; эта концепция наиболее широко используется для классификации. В принципе классификация должна соответствовать филогении, но для ее практического применения это не обязательно. Таким образом, таксономия сама возникла в результате филогенетических построений и не может служить доказательством филогении.
Физиологические признаки, с которыми имеет дело клеточная физиология, слишком универсальны, чтобы их можно было использовать для построения детальной классификации, хотя по некоторым клеточным признакам можно различать крупные таксономические группы. Многие физиологические свойства весьма чувствительны к влиянию окружающей среды, т. е. настолько нестабильны, что не могут быть использованы в таксономии. Некоторые физиологические признаки были подвергнуты генетическому анализу, показавшему, что они обусловлены несколькими генами; диапазон изменчивости адаптивных признаков нередко бывает очень широк, и кроме того, соответствующие функции могут обеспечиваться различными параллельными или альтернативными путями. Однако есть случаи, когда некоторые очень близкие виды (виды-двойники), похожие морфологически, хорошо различимы физиологи-
2-1332
18
Введение
Вторая и наиболее употребимая концепция вида, биологическая, рассматривает вид как популяцию сходных особей, в пределах которой может происходить обмен генами. Популяции, которые сохраняют обособленность, обитая в одной и той же области (т. е. будучи симпатрическими), несомненно, относятся к разным видам. Если же две популяции пространственно разобщены (т. е. являются аллопатрическими), то в них за геологическое время могут развиться изолирующие механизмы, которые будут препятствовать скрещиванию между ними, если когда-либо эти популяции встретятся друг с другом. Биологической концепции вида не вполне соответствует ситуация, когда имеется серия популяций (образующих кольцо, клин и т. д.), среди которых две крайние популяции не способны скрещиваться друг с другом, хотя каждая популяция серии может скрещиваться с соседней. В природе многие скрещивающиеся популяции пространственно изолированы и все же гибридизация между таксономическими видами происходит чаще, чем это подчас предполагают. Репродуктивная изоляция может быть обусловлена морфологическими различиями, различиями в сезонных и суточных ритмах, хромосомными, гормональными и поведенческими различиями, физиологической и этологической несовместимостью и экологической разобщенностью.
Третья, физиологическая, концепция вида основана на двух главных предположениях: 1) два вида не могут занимать одну и ту же экологическую нишу на одной и той же стадии их жизненных циклов и 2) два вида из сходных ниш не могут одновременно занимать один и тот же географический ареал на протяжении соответствующих стадий их жизненных циклов. Все это означает, что> каждый вид уникальным образом адаптирован к своей экологической нише и к своему географическому ареалу и что если бы все особенности функциональной адаптации были нам до конца ясны, то стало бы возможным действительно эволюционное описание вида. Адаптация — это термин, обозначающий любое изменение или реакцию организма, которая способствует выживанию в изменившихся условиях. Физиологическое описание видов требует сочетания полевых наблюдений и лабораторных исследований, что возможно в отношении лишь очень немногих организмов. В первую очередь необходимо дать описание — сделанное на основании наиболее важных признаков — физиологической изменчивости в естественных популяциях, т. е. провести статистический анализ способности к приспособлению. Во-вторых, следует проанализировать наблюдаемую в популяции изменчивость и выяснить, в какой мере она обусловлена генетически и в какой определяется влиянием окружающей среды; для этого требуется проведение экспериментов по перекрестной акклимации, трансплантации и скрещиванию. Наконец, в-третьих, необходим анализ физиологических механизмов, лежащих в основе изменчивых признаков. Согласно любой концепции вида, процесс видообразования развивается в определенной по
Введение
19
следовательности и состоит из нескольких физиологических этапов. Можно выделить следующие этапы:
1 Обусловленное средой изменение лабильных признаков.
2 Перестройка поведения для завоевания новых ниш и изменения границ ареала.
3. Случайные генетические изменения, порождающие разновидности, расы, подвиды и т. д.
4. Отбор генетических изменений, адаптированных к условиям ниш и ареалов.
5. Изоляция — экологическая или географическая — прошедших отбор популяций.
6. Формирование вторичных признаков, обеспечивающих репродуктивную изоляцию.
Физиологические признаки вступают в действие на этапах 1, 2, 4 и 6.
В природе генетическая изменчивость может быть более выражена, чем фенотипическая, однако естественный отбор действует именно на фенотипы. Таким образом, функциональный признак, имеющий опосредованную связь с генетическим кодом, либо будет отобран, либо исчезнет. Так, например, отбор действует на процесс регуляции содержания ионов в организме скорее через экскреторные органы, чем через ДНК, которая кодирует белки транспортных ферментов.
Физиологическая изменчивость
При анализе любой популяции необходимо отличать изменчивость, обусловленную генетическими причинами, от изменчивости, вызванной влиянием окружающей среды. Каждая популяция имеет в своем составе особи с разными генотипами, что графически можно представить в виде кривой распределения. Адаптивное генетическое изменение, возникающее в популяции вблизи границы ареала, имеет больше шансов сохраниться, чем изменение, появляющееся в менее стрессовых условиях центра ареала. Как правило, уровень генетической изменчивости в популяциях (например, типы исчерченности хромосом у видов Drosophila) в центральных частях ареала выше, чем на его границе. Пределы изменчивости, возникающей под влиянием внешней среды, у каждого отдельного животного определяются свойствами его генотипа. Генетическую и и связанную с условиями среды изменчивость (т. е. обусловленную генотипом или влиянием внешней среды) можно разграничить путем акклимации или акклиматизации с последующим скрещиванием неродственных друг другу особей. Аккламацией обычно называют компенсаторное изменение, возникающее в организме в ответ на длительное отклонение какого-то одного фактора внешней среды (обычно в лабораторных условиях) от первоначального Уровня. Полная акклимация выражается в том, что функциональ-2*
20
Введение
ный уровень остается одинаковым в различных условиях среды. Под акклиматизацией понимают компенсаторные изменения в организме, возникающие в ответ на изменение одновременно многих факторов внешней среды — климатических, физических и биологических.
Критерии физиологической изменчивости, которые могут быть использованы для оценки адаптивных свойств генотипов, должны учитывать все функциональные системы и все уровни организации животных. Большая их часть касается взаимодействий организма с внешней средой. К наиболее употребительным критериям относятся функциональные различия между животными, находящимися в условиях экстремальных воздействий среды.
А
Внешние условия В
•Рис. 2. Изменение внутреннего состояния в зависимости от внешних условий (для данного параметра).
А. Конформация — изменение внутреннего состояния соответствует изменениям внешних условий. Б. Регуляция — внутреннее состояние в какой-то степени не зависит от внешних условий; О1 и а2 — две степени акклимации. Сплошной линией показаны пределы обычной устойчивости, а пунктирной — пределы устойчивости лишь в течение коротких периодов времени.
1. Тесты на выживание при экстремальных значениях факторов среды, например определение средних летальных значений для высоких и низких температур, солености и кислородного режима. Можно получить данные о выживании как целых животных, так и их тканей или определенных ферментов (по степени их инактивации). В целом наибольшей устойчивостью обладают ферменты, несколько меньшей — отдельные ткани и самой малой — целые организмы. Чувствительность разных органов и систем животного к внешним воздействиям далеко не одинакова; например, у многоклеточных нервная система чувствительнее других систем. Пределы выживаемости организмов или их частей до некоторой степени можно изменить, поставив их в условия постепенного привыкания к воздействию конкретного фактора внешней среды.
2. Определение предельных значений факторов среды, еще допускающих размножение. Эмбрионы зачастую более чувствительны к экстремальным условиям, чем взрослые животные. Между тем в природе имеет значение именно завершение полного жизненного цикла, т. е. возможность оставить потомство. Ранние стадии жиз-
Введение
2й
енного цикла в физиологическом отношении изучены пока слабо, Н 3 Внутреннее состояние как функция факторов окружающей
e„bI (рис. 2). Некоторые животные при изменении условий среды (например, пойкилотермные животные при колебаниях внешней температуры) изменяют свое функциональное состояние, т. е. способны к конформации. Другие же животные при изменении окружающих условий сохраняют относительное постояство своего функционального уровня, т. е. осуществляют регуляцию (примером может служить регуляция температуры тела у гомойотермных животных). Можно определить степень конформации или регуляции в отношении всех физических факторов внешней среды. В целом животные, способные к конформации (конформеры), устойчивы к колебаниям внутренней среды в широких, а к колебаниям внешней среды лишь в узких пределах. В то же время животные, способные к регуляции («регуляторы»), устойчивы к изменениям внутренней среды лишь в узких пределах, зато к изменениям внешней среды они устойчивы в значительно более широких пределах. У животных первого типа в результате акклимации может произойти сдвиг пределов устойчивости к изменениям внутренней среды; у животных второго типа акклимация может привести к сдвигу функционального состояния до уровня, при котором гомеостатическая регуляция нарушается или, напротив, активируется. Оба механизма — конформация и регуляция — являются гомеостатическими в том смысле, что дают возможность животным выжить в изменившихся условиях среды, и у большинства животных наблюдается сочетание' этих двух механизмов.
4. Возврат в нормальное состояние. Животные стремятся к некоторым «нормальным» условиям и при нарушении этих условий (например, при избыточной гидратации или обезвоживании, чрезмерном нагревании или охлаждении) могут компенсировать эти нарушения или же (после устранения нарушения) вернуться к состоянию, соответствующему исходным, «нормальным», условиям, причем этот возврат происходит совершенно определенным образом. Скорость возврата к исходному состоянию специфична для каждого вида животных. До сих пор, однако, вопросу о том, какое состояние можно считать нормой и каков механизм чувствительности к отклонениям от нормальных условий, уделялось слишком мало внимания.
5. Функциональные уровни. Скорость движений животного или процессов обмена веществ, а также скорость той или иной ферментативной реакции можно измерять как in vivo, так и in vitro в зависимости от факторов внешней среды или от внутренних условий. Для измерения скорости ферментативных реакций используют два метода: 1) измерение максимальной скорости, при которой реакция лимитируется уровнем активности самого фермента, и 2) измерено констант Михаэлиса (величина /См), которые соответствуют коростям, наблюдаемым при более физиологических концентра
22
Введение
циях субстрата. Колебания скоростей реакций (например, в зависимости от температуры) определяются генетическими причинами или условиями внешней среды.
6. Макромолекулярное разнообразие. Смесь сходных белков можно разделить путем электрофореза, аминокислотного анализа или иммунологических реакций. Сходные нуклеиновые кислоты можно охарактеризовать исходя из соотношений их оснований. Изоферменты, представляющие собой варианты форм одного и того же белка, синтезируются под контролем разных генов или возникают как результат комбинаций продуктов этих генов. Ал-.лоферменты являются продуктами множественных аллелей одного и того же гена и встречаются в популяциях со сбалансированным полиморфизмом. Биохимическое разнообразие приобретает физиологический смысл в тех случаях, когда данная структура химических соединений обладает определенной адаптивной ценностью.
7. Поведение. К поведению относятся таксисы, выбор «предпочитаемых» условий, а также сложные типы поведения, такие, как «ухаживание», спаривание и забота о потомстве.
Сравнительная экологическая физиология
Область обитания какого-либо животного зависит от области обитания его предков. Суммировать все факторы среды, влияющие на организм, непросто. Тем не менее можно выделить 4 основные •среды обитания — море, пресные водоемы, сушу и среду обитания эндопаразитов. Каждую из этих сред специалисты в области зоогеографии, биологии моря и экологии подразделяют на многочисленные более мелкие единицы. Животные, обитающие в разных условиях, сталкиваются с неодинаковыми проблемами; в то же время, живя в одинаковых условиях, разные животные одну и ту же проблему решают различными способами.
Сравнительная физиология рассматривает организм в связи с влияющими на него многочисленными факторами внешней среды, к которым относятся вода, неорганические ионы, органические питательные вещества, кислород и углекислый газ, свет, механические колебания высокой и низкой частоты, давление, сила тяжести, ионизирующие и другие виды излучений, температура. Сравнительная физиология изучает приспособительные реакции животных на действие всех этих факторов. Кроме того, животное, находясь в своей естественной среде обитания, испытывает влияние со стороны других организмов. Для понимания биотической среды необходимо изучить поведение животных.
Область распространения каждого вида формируется в процессе естественного отбора в зависимости от пределов устойчивости этого вида. Один какой-либо фактор окружающей среды, например соленость, может ограничивать распространение одной группы; другой фактор, например температура, может ограничивать распро-
Введение
23
тпанение другой группы животных. Внутри определенного диапазона условий отдельные организмы могут отличаться друг от друга границах, определяемых их генотипом; фенотип представляет собой результат сочетания генетических влияний и воздействия окружающей среды.
Выше уже говорилось о проведении физиологических измерении в опытах на животных, находящихся под воздействием стрессовых или каких-либо других условий. В целом адаптивные изменения, возникающие при изменении внешней среды, обозначаются термином «гомеокинез». Гомеостазом называют постоянство внутреннего* состояния организма; этот термин применяется обычно к тем физиологическим признакам, которые поддаются регулированию. Го-меокинезом называют постоянство жизненно важных функций, таких, например, как локомоторная активность и освобождение энергии, т. е. функций, обеспечивающих выживание в изменившейся внешней среде, иногда даже при изменившемся внутреннем состоянии. Таким образом, гомеокинез определенной функции может поддерживаться и в отсутствие гомеостаза.
При рассмотрении реакций на изменение среды обнаруживаются три основных этапа их развития. Во-первых, непосредственный ответ. Он связан либо со стимуляцией органов чувств, которые включают целую цепочку ответов, либо с прямым воздействием на процессы обмена веществ. Так, изменения ионного состава, температуры, содержания кислорода или состава пищи могут приводить к изменениям скорости протекания ферментативных реакций. Нередко, если условия внешней среды меняются слишком сильно или внезапно, как при резком охлаждении или нагревании, у животного сначала наблюдается скачок или серия колебаний уровня обменных реакций^ после чего устанавливается новый относительно стабильный функциональный уровень. Продолжительность прямого ответа или установления нового функционального уровня обычно измеряется минутами или часами.
Второй этап развития ответа животного на изменение окружающей среды может продолжаться несколько дней или недель. Это период акклимации, или компенсации, и степень физиологической приспособительной перестройки зависит здесь от степени изменения внешней среды и от генотипа животного. При сезонных изменениях компенсаторные реакции развиваются постепенно. Переход о г влажного сезона к сухому, слабые колебания солености в эстуариях, сезонные сдвиги температуры или изменения доступной пищи все эти факторы могут вызвать миграции или изменения гор-нального равновесия и половой активности. В лабораторных ус-виях компенсаторную акклимацию можно наблюдать на примере обрг00бРазных биохимических сдвигов, которые в конечном счете гппп?еЧИВаЮТ гомеокинез или поддерживают на определенном bhptttJ2 „энеРгетический баланс. Другой тип ответа на изменение ей среды заключается в том, что у животного вместо ком-
24 Введение
пенсации происходит изменение физиологического состояния, на-> пример наступает спячка, высыхание или преждевременное старение. В таких случаях животные переходят в состояние физиологической активности и покоя без истинной акклиматизации.
Еще один тип ответа на изменения внешней среды состоит в реакции органов, регулирующих внутреннюю среду, на соответствующие параметры окружающей среды. У таких организмов вторичные изменения, часто морфологические (например, возникающие при содержании птиц и млекопитающих на холоде), уменьшают затраты энергии в измененном состоянии, что приводит к метаболической и поведенческой акклимации.
Третий этап биологических реакций охватывает несколько поколений, т. е. время, необходимое для отбора генетических вариантов. Этот период может длиться многие годы — в зависимости от вида животного и от интенсивности воздействия факторов внешней среды. Эволюционные изменения в значительной степени подвержены влиянию биологических факторов, таких, как конкуренция, хищничество и групповые взаимодействия. Идентификация генетически закрепленных физиологических различий между популяциями и между близкими видами, обитающими в мало различающихся нишах или областях, позволяет сопоставлять их с экологическими и филогенетическими чертами. Это та изменчивость, которая слу-1 жит основой для видообразования.
В физиологической изменчивости каждого из этих трех периодов можно вычленить генетический и экологический компоненты. Прямые реакции, компенсаторные акклимации и длительные изменения имеют обычно различные клеточные механизмы. Для первого периода характерны непосредственные сдвиги в протекающих в организме химических реакциях под влиянием изменения таких факторов, как ионная сила, напряжение кислорода и температура. Во втором периоде вступают в силу обратные связи, действующие на синтез белка, на превращения кофакторов метаболизма и на мембранные структуры. В третьем периоде генетические изменения закрепляются путем изменения важнейших белков и функций нервной системы. Во всех трех периодах взаимодействия между средой и организмом имеют весьма сложный и тонкий характер. Такие взаимодействия являют собой пример биологического равновесия, иллюстрируя переход от макромолекул к целым организмам и к популяциям.
Очевидно, что идентификация физиологических изменений, возникающих в процессе взаимодействия организма и среды, и обнаружение молекулярных механизмов этих изменений — задача эко-1 логической физиологии. Понимание механизмов таких взаимодействий необходимо для построения теории возникновения и распространения жизни на Земле. Кроме того, экологическая физиология| создает рациональную научную основу для решения многих прак-| тических вопросов. Человек стоит сейчас перед необходимостью не-|
Введение
25
епывного увеличения пищевых ресурсов и перед проблемой защи-пр природы от разрушения. Для поддержания биологического равновесия между организмом и средой его обитания практическая Н ятельность человека должна опираться на понимание этих взаимодействий. Наши действия, связанные с регулированием физических условий окружающей среды, изменением почвы и воды, изменением географии с помощью дамб и каналов, с загрязнением среды промышленными отходами, — все это должно сопровождаться серьезным исследованием влияния деятельности человека на биосферу.
Распространение новых продуктов питания человека и новых средств биологического контроля над болезнями и вредителями также должно опираться на понимание характера физиологической адаптации затрагиваемых организмов. Таким образом, сравнительная экологическая физиология должна внести существенный вклад как в биологическую науку, так и в благосостояние человечества.
Сравнительная физиология поведения
Расширение ареала с помощью изменения поведения животных играет важную роль во всестороннем использовании ими окружающей среды, в освоении новых источников питания и новых экологических ниш. Различия в брачном поведении животных имеют большое значение в изоляции как истинных, так и зарождающихся видов. Первичный ответ на изменение внешней среды выражается обычно в поведении, что обеспечивается исключительной чувствительностью целого ряда органов чувств к специфическим раздражителям, или стимулам. Поведение в значительной степени запрограммировано в генетически закрепленных типах нейронных сетей. Однако эти последние способны изменяться в неких пределах, которые могут варьировать в зависимости от типа нервной системы. Эффекторные системы обеспечивают широкий диапазон- ответов на внешние раздражители — быстрое и медленное движение, изменение окраски, люминесценция или электрический разряд. Механизмы поведения, включающие как органы чувств, так и эффекторы, интегрирующие деятельность нервной и эндокринной систем, гораздо более изменчивы в мире животных, чем обменные процессы.
На клеточном уровне поведение формируется в основном за счет функционирования поляризованных клеточных мембран, элек-рических и химических взаимодействий между клетками, участия ократительных белков в движении и переходов одной формы энер-ии в другую. I оворя точнее, механизмы, используемые клетками, ' сзвычайно разнообразны, и именно в этой области физиологии твс)ЧеПИе специализиРованных структур оказывается весьма плодо-
рным. Так, например, природу нервных импульсов удалось по
26
Введение
нять в основном при исследовании гигантских нервных волокон. Сравнительная физиология ставит себе целью не только познание путей эволюции и распространения животных, но и изучение разнообразия их реакций на встречающиеся в обычных условиях -стрессовые воздействия. Специалист по физиологии поведения ищет различия в общих явлениях: например, в световой чувствительности разных типов фоторецепторов; в движении с помощью -быстрых и медленных мышц, с помощью ресничек и тока протоплазмы; в химической сигнализации с помощью нейросекреторных, синаптических и эндокринных клеток.
Одна из задач, стоящих перед биологией будущего, состоит в изучении типов центральной нервной системы. В какой степени и каким образом программируется поведение — генетически или в процессе индивидуального развития? Каков механизм изменений, возникающих в нервных центрах, в частности в процессе выработки разнообразных условных рефлексов? Один из подходов к изучению функций нервной системы заключается в наблюдении за поведением животных, другой — в изучении процессов, происходящих на клеточном и молекулярном уровнях. Сравнительная нейрофизиология объединяет эти два подхода (в качестве примера можно привести изучение деятельности нейронов у моллюска Aplysia). Значение таких исследований для науки о человеческом обществе, для медицины и для будущего цивилизации очевидно.
План изучения сравнительной физиологии
Реакция животного на сложные ситуации в окружающей среде не ограничивается изменением деятельности одного какого-либо органа или системы органов. Части организма взаимодействуют между собой, и целый организм имеет меньше степеней свободы, чем каждая из его частей в отдельности. Организм постоянно взаимодействует со своей микросредой, поэтому без учета всего диапазона таких взаимодействий он не может быть правильно описан. Свойства целостного организма несводимы к сумме свойств -его частей. Он обладает уникальными особенностями, которых лишена любая выделенная из него часть. Важно, таким образом, изучить связи и отношения между различными факторами окружающей среды и организмом и проанализировать их в терминах органной и клеточной физиологии. В настоящей книге мы намерены сначала описать реакции животных на определенные изменения окружающей среды, а затем рассмотреть их сенсорные, эффекторные и координирующие механизмы. Делается также попытка приблизиться к некоторым общим законам биологии, которые можно постичь, лишь оценив место, занимаемое каждым конкретным организмом на филогенетической лестнице.
Глава 1
Обмен воды: осмотический баланс, гормональная регуляция л. ПРОССЕР
Введение
Вода представляет собой важнейший компонент всего живого. Она является универсальным биологическим растворителем, той неизменной средой, в которой происходит большинство реакций клеточного обмена. Из всех компонентов внешней среды вода — наиболее важный для жизни компонент. Жизнь, несомненно, зародилась в водной среде. В ходе эволюции живой материи различные представители животного мира неоднократно выходили из воды на сушу; однако только некоторые группы животных смогли жить и развиваться вне водной среды. Каждая группа животных, покидавшая воду, по-своему приспосабливалась к жизни в воздушной среде— одна более, другая менее успешно. Из всех животных наиболее полно порвали связи с водной средой насекомые; лишь немно
гие из них возвращаются в воду на отдельных стадиях жизненного цикла. Все другие животные, включая птиц и млекопитающих, по крайней мере на стадии эмбрионального развития, сохранили свои связи с водной средой.
Одно из условий жизни животных заключается в сохранении в тканях организма строго определенного количества воды — не слишком большого, но и не слишком малого.
Само по себе количество содержащейся воды менее важно, чем ее концентрация (химическая активность), концентрация же воды лимитирует концентрацию растворенных в ней ионов, что исключительно важно для организма. Наземные животные должны сохранять и использовать ту воду, которую они получают с питьем; пресноводным животным приходится удалять из организма избыток воды для предотвращения чрезмерной гидратации; что касается морских и паразитических организмов, то одни из них находятся в осмотическом равновесии со средой, тогда как другие гипоосмо-тичны по отношению к среде, в которой они обитают, и для них представляется серьезной задачей поглощение воды в требуемом количестве. Содержание воды в различных средах обитания — от пресных вод до морей и соленых озер, от сырых болот до сухих устынь варьирует в значительных пределах; границы допусти-ых изменений концентраций жидкостей тела гораздо уже; отсю-*СЛеДует’ ЧТ0 ЖИВ0ТНЬ1е> по-видимому, снабжены специальными анизмами для регуляции осмотического баланса.
28
Глава 1
Физические аспекты
Свойства воды. Уникальный характер воды как растворителя, в котором протекают все биологические реакции, часто подчеркивался Л. Дж. Гендерсоном в его книге «Fitness of the Environment». Можно сказать, что это свойство воды создало условия для химической эволюции, которая привела к возникновению жизни. В диапазоне температур от 0 до 100 °C вода представляет собой жидкость; почти всюду на Земле, где встречается жизнь, господствуют температуры, колеблющиеся в этих пределах. Вода имеет очень высокую теплоемкость; это означает, что требуется добавить или отнять большое количество тепла, чтобы изменить ее температуру. .Для воды характерна большая величина скрытой теплоты испарения, поэтому испарение с поверхности прудов и озер происходит медленно. Испарение с поверхности тела протекает с потерей тепла. Вода в твердом состоянии (т. е. лед) имеет меньшую плотность, чем в жидком; ее плотность максимальна при 3,98 °C (для D2O максимум плотности отмечается при 11,23°C), т. е. при более высокой, чем точка замерзания, температуре [193]. Это свойство обеспечило развитие жизни в умеренных и приполярных регионах, тде зимой лед, менее плотный, чем вода, образуется только на поверхности водных масс.
Вода замечательна и тем, что хорошо растворяет электролиты и большинство органических неэлектролитов, а также кислород и двуокись углерода. В воде нерастворимы только неполярные соединения типа некоторых жиров. Растворимость неорганических солей зависит от водородных связей воды с ионами; освобождающаяся при растворении энергия используется для диссоциации солей на ионы. Кроме того, некоторые молекулы становятся ионизированными в результате гидратации; например, ионы водорода в воде присутствуют в основном в виде иона гидроксония (Н3О+).
Многие замечательные свойства воды обусловлены ориентацией ее атомов. Два атома водорода в молекуле воды расположены под углом около 105° по отношению к атому кислорода; межатомное расстояние О—Н равно примерно 0,95 А. Атомы водорода имеют по одному положительному, а атом кислорода — два отрицательных заряда; таким образом, молекула воды представляет собой электрический диполь. Дипольная молекула ориентирована обычно в направлении иона или заряженной группы на поверхности белково?! молекулы, обеспечивая этим ее гидратацию. Молекула воды образует водородные связи с многочисленными молекулами, имеющими отрицательный заряд; в твердом состоянии (в виде льда) молекулы воды связаны между собой водородными связями таким образом, что атомы кислорода расположены в вершине тетраэдра на расстоянии 2,76 А друг от друга. Энергия водородной связи очень мала — 5 кал/моль (по сравнению с 50—100 кал/моль в ковалентной связи), поэтому водородные связи довольно слабы. В находя-
Об воды: осмотический баланс, гормональная регуляция
29
„ в жидком состоянии воде имеется значительное количество щеИоподных связей, особенно в биологическом диапазоне темпера-В°п чем по-видимому, объясняется наличие ряда примечательных Особенностей в физических свойствах воды. В потоке все водородные связи рвутся. Статистическая неопределенность и непредсказуемость количества водородных связей и степени структурированности воды в растворах приводят к неопределенности в представлении о состоянии и количестве свободной воды в протоплазме. Измерения, проведенные с помощью ядерного магнитного резонанса, показали. что в тканях часть воды, находящаяся в структурированном состоянии, значительно больше, чем в обычной воде (в мышцах 27%). Количество свободной 'воды, или воды-растворителя, в противоположность связанной воде (или воде гидратной оболочки) варьирует в соответствии с содержанием белка; количество воды-растворителя меняется также и в зависимости от того, растворены ли в ней ионы или неэлектролиты. Подобным же образом точки замерзания биологических систем, богатых растворенным органическим веществом (которое образует многочисленные водородные связи), могут не соответствовать осмотическим характеристикам. Эти свойства помогают некоторым животным переносить состояние переохлаждения (см. гл. 9).
Коллигативные свойства растворов. Состояние воды в протоплазме не совсем понятно, но в первом приближении биологические жидкости можно рассматривать как разбавленные растворы. Содержание воды в растворе во внутренней или в окружающей животное среде еще не дает представления об истинной активности воды (т. е. об эффективной концентрации воды в термодинамическом смысле). Эффективные концентрации всех растворов, или осмотические концентрации, часто выражают в осмолях, т. е. в общем числе молей растворенных веществ на 1 л растворителя. Ос-моляльная концентрация определяется так называемыми коллига-тивными свойствами растворов. Это означает, что между всеми свойствами растворов, определяемыми общей концентрацией частиц, существует взаимозависимость. Так, чем выше концентрация раствора, тем больше осмотическое давление, снижение давления пара, повышение точки кипения и понижение точки замерзания раствора. Под осмотическим давлением подразумевается давление, которое необходимо приложить к раствору для предотвращения посгупления в него воды через полупроницаемую мембрану (т. е. меморану, пропускающую только растворитель). Строго полупро-шщаемые^мембраны встречаются в живых организмах очень редко (если воооще встречаются), иначе был бы невозможен обмен рас-гг Ве^Ь ,клетки практически никогда не омываются чистой дои) Но этой причине понятие осмотическое давление менее употребительно в биологии, чем осмотическая концентрация. гг 1СГС),Рия теории растворов начинается с наблюдений биологов. •Ц Спии физиолог растений Пфеффер в 1877 г. наблюдал, как из
30
Глава 1
меняется объем тычиночных волосков в растворах сахара разной концентрации; на основании этих наблюдений Вант-Гофф показал, что разбавленные растворы ведут себя подобно газам. Таким образом, осмотическое давление (л) равно осмоляльной концентрации (С), умноженной на газовую постоянную J? = 0,082 (л-атм)/(град-•моль) и на абсолютную температуру (Г):
Растворы л —CRT;
Газы Р=~ RT.
Ботаник де Врие нашел, что эквимолярные растворы солей имеют более значительное осмотическое давление, чем растворы сахара; исходя из этого датский физико-химик Аррениус сформулировал теорию электролитов. Для электролитов осмотическая концентрация превышает моляльную в i раз, где i — изотонический коэффициент; следовательно, для электролитов
n=iCRT.
Несмотря на то что в разбавленных растворах слабые электролиты полностью диссоциированы (как показывают измерения электропроводности), i меньше 2 для одновалентных солей и меньше 3 для солей, диссоциирующих на 3 иона. Это — следствие межионных взаимодействий; таким образом, величина i должна определяться эмпирически.
Водный раствор с концентрацией 1 осмоль замерзает при —1,86 °C; следовательно, понижение точки замерзания раствора (Азамерз) с концентрацией С равно —1,86 iC. Поскольку осмотическое давление (л) осмоляльного раствора равно 22,4 атм, то
= 12,06 А.
1 ,ОО
Практически осмотические концентрации обычно выражают либо в осмолях (или в миллиосмолях), либо через понижение точки замерзания, либо в эквивалентной концентрации NaCl (миллимо-ляльные концентрации). Приводим несколько величин для NaCl из таблиц Бюро стандартов:
NaCl, % Моляльность i А за мерз’
4,08 0,7 1,806 —2,38
2,92 0,5 1,81 —1,69
1,75 0,3 1,83 —1,02
1,17 0,2 1,84 —0,68
0,58 0,1 1,87 —0,34
Обмен воды: осмотический баланс, гормональная регуляция
31
Физические законы обмена между жидкостью и растворенным веществом
физиологически проблемы, касающиеся пассивного и активного „ступления ионов и воды в клетку, рассматриваются в многочисленных книгах по общей физиологии. Тем не менее мы приведем здесь несколько наиболее часто применяемых уравнений, которые помогут понять законы движения воды и ионов против градиента концентраций в организме животных, помещенных в различные условия [188]. Знаком / обозначим поступление, или скорость перемещения из одной точки пространства в другую.
Законы движения жидкости и растворенного вещества. Растворенное вещество может двигаться в растворе под влиянием нескольких сил; важнейшие из них — это градиенты (разности) химического потенциала, или концентрации, и электрического потенциала. При диффузии в каком-то направлении, в том числе через мембрану, движение растворенного вещества (/) описывается уравнением
т ____ дП[ dC , zF р dE\
«'общ— \jbr^r'RT'^~dx)'
градиент концентрации электрический градиент
(моль/смЗ \ (В/см)
см I
где Л — площадь (см2), D — коэффициент диффузии (см2/с), z— заряд раствореного вещества, F — число Фарадея (96,500 Кл/моль), R — газовая постоянная (8,314(В-Кл)/(град-моль)), Т—абсолютная температура (К), х— расстояние (см).
В таком виде это уравнение никогда не используют в биологических исследованиях, обычно его упрощают. Например, для случая с неэлектролитами, заряд которых равен нулю (z = 0), второе слагаемое в скобках превращается также в 0, и получается уравнение закона Фика
J „ —___дп dC
•'общ— AU dx .
Далее, если градиент концентрации между обеими сторонами мембраны линейный, т. е.
dC _ АС __ С2 — Ct dx dx х ’
где х толщина мембраны, тогда /общ=—~(С2—=
Ci), что позволяет оценивать проницаемость (Р) мем-ораны для испытуемых веществ.
ппрпДНаК° многие вещества, имеющие биологическое значение, Р дставляют собой ионы (т. е. заряжены, так что 2#=0), поэтому
Р ностыо потенциалов (Е) пренебречь нельзя. Кроме того, нам
32
Глава 1
редко бывает известна форма градиента концентрации, линейный же градиент встречается нечасто, особенно когда это касается ионов, движущихся через заряженные мембраны. Для таких более сложных ситуаций имеются и другие, менее распространенные решения уравнения диффузии. Одно из них, уравнение Гольдмана, используется для оценки проницаемости мембраны для ионов. Другое, уравнение Юссинга, служит критерием активного транспорта [360]. Как было показано, в этом случае если рассматривать не общий ток какого-то иона, а два ионных потока (однонаправленные токи), причем один ион переходит из компартмента 1 в компартмент 2, а второй — из 2 в 1, то
Л-»2 Сг /</- (Ei—Es) дТ е№
J 2->1 ^2 *
где Ем — разность потенциалов между двумя сторонами мембраны. Это значит, что если ион подчиняется уравнению диффузии, то отношение однонаправленных токов можно рассчитать из концентраций ионов и разности потенциалов между обеими сторонами мембраны. Если истинное отношение (измеренное с помощью метки) не согласуется с расчетной величиной, значит, имеет место активный транспорт. Можно сделать еще два упрощения. Для неэлектролитов 2=0, поэтому второй множитель в приведенном выше уравнении равен 1 и, следовательно, ожидаемое отношение токов будет равно отношению концентраций. Если в действительности система ведет себя не так, это означает, что имеется активный транспорт. Если система находится в состоянии равновесия (Л->2 = — Л-и), то отношение токов равно 1 и
(Е1-£2)=Е„=^-1п^-.
Это уравнение Нернста, которое, так же как и более общее уравнение Юссинга, применяется в качестве критерия активного транспорта ионов, но лишь в тех случаях, когда нет общего перемещения ионов из одного объема в другой.
При рассмотрении уравнения Нернста возникает вопрос о том, какие причины могут вызвать такое асимметричное распределение диффундирующих ионов при равновесии. Одна из таких ситуаций возникает в случае, когда по одну сторону мембраны находятся ионы, неспособные свободно диффундировать (например, белки, для которых мембраны непроницаемы). Если Na+ и С1~ диффундируют, а А-— нет, тогда распределение ионов будет, очевидно, таким:
Внутри (вн) Снаружи (нар) J
^а вн ^анар I
С1Бн бПнар
•^вн 1
Обмен воды: осмотический баланс, гормональная регуляция 33
Чтобы сохранить электростатическую нейтральность, Na„ap =Cl„ap, но Nbh = С1вн ДАЁн, следовательно, Ыавн=#С1Ён- Можно показать, когда такая система находится в равновесии, [ЫаЁн] • [CIЁн] =
4 ’ - N<H Cl~
= Г Na нар] • [Cl нар], ИЛИ= и это отношение не может
равняться 1. Таким образом, асимметричное распределение диффундирующих ионов может быть вызвано наличием недиффундирующих ионов по одну сторону мембраны. Это выражение называется уравнением Доннана, а само отношение именуется донна-невским отношением или распределением. Из уравнения Нернста следует, что при равновесии должна существовать разность потенциалов. Можно также показать, что общая концентрация растворенных веществ внутри (S(NaL +С1Ён+АЁн)) больше, чем снаружи (S (МаЁар+С1ЁаР) )• Как будет видно из дальнейшего, это следствие очень важно для установления осмотического равновесия.
Как уже говорилось выше, принятые для измерения концентрации единицы (молярность, моляльность) не вполне подходят для измерения химического потенциала воды. Однако, поскольку диффузия воды, так же как и растворов, происходит благодаря разнице в химических потенциалах, очень важно суметь оценить эту разницу количественно. Более подходящей мерой для измерения химического потенциала воды в растворе является осмотическое давление л, возникающее вследствие разницы в химических потенциалах между разными растворами (щ—л2 = Ал). Ток воды (осмос) пропорционален Ал:
•^осМ=^ААл,
где L—коэффициент осмотической проницаемости. Так как л = = cRT, то Ал=(с1—c^RT, где Ci и с2— общие концентрации растворенных веществ в компартментах 1 и 2. Для клетки, находящейся в состоянии, близком к доннановскому равновесию, общая внутриклеточная концентрация растворенных веществ превышает внеклеточную концентрацию; в вышеприведенном примере
2(NaBH ~+*С1Вн ~t~ АВн) 2(NaHap-t- С1нар),
поэтому здесь должны были бы происходить осмотический приток воды и разбухание клетки. Растительные клетки имеют жесткие целлюлозные ^оболочки, препятствующие разбуханию; благодаря этому в;, клетке развивается сильное внутреннее давление, называемое тургором; .когда.дургордое . давление равно Ал, клетка находится в состояиии .воднот'о-бдчанса.:- <
Бели в клетку-: поступает больше воды, чем можно ожидать, ис-°дя из учета физических сил, это значит, что имеет место актив-1и транспорт. Доказательствами активного транспорта могут Ужить и другие явления: например, потребность в дополнитель
1332
34
Глава 1
ной энергии, блокирование специфическими ингибиторами, конкурентное ингибирование сходными веществами. Обычно для сравнения эффективности нескольких систем активного транспорта измеряют количество вещества, поступившего из растворов с разной его концентрацией. Концентрация, при которой интенсивность транспорта равна половине максимальной, соответствует Ks для ферментативной системы и отражает состояние полунасыщения транспортной системы. Другой, часто применяемый метод заключается в измерении пороговой концентрации, необходимой для активации, или «запуска», механизма транспорта.
Выше мы рассмотрели движущие силы транспорта веществ через мембраны. Теперь необходимо остановиться на разнообразии способов этого транспорта. Движение через мембраны может происходить следующими путями.
1. Пассивный ток, например через поры при наличии концентрационного и электрического градиентов; скорость процесса рассчитывается исходя из концентраций и разности потенциалов в соответствии с приведенными выше уравнениями.
2. Обменная диффузия (пассивная) с помощью молекул-переносчиков, находящихся в мембране, которые в тех или иных местах пассивно связывают или отдают определенные молекулы, обеспечивая их обмен между объемами по обе стороны мембраны. Этот процесс оценивается количеством меченого вещества, поступающего в среду с соответствующим ионом и без него.
3. Активный транспорт, когда транспортная система расходует энергию и сам транспорт может происходить (но не обязательно) против градиента концентрации. Процесс измеряется разностью между общим поступлением вещества и пассивным его притоком.
4. Облегченная диффузия, когда переносчик соединяется с веществом и движется из области с высокими концентрациями этого вещества в область с низкими его концентрациями (например, перенос кислорода миоглобином).
Для измерения количества любого вещества, будь то ионы или вода, переходящего из жидкости тела животного во внешнюю среду и обратно, используют обычно радиоактивные изотопы. Более широкое освещение этого вопроса выходит за рамки настоящей главы, но один простой случай следует рассмотреть подробнее, поскольку он встречается часто и поскольку он показывает, каким образом применяются параметры такого транспорта. Предположим, что нас интересует передвижение какого-то иона из жидкости тела водного животного в окружающую среду и обратно. В начале эксперимента во внешнюю среду можно добавить известное количество изотопа этого иона, часть которого будет поглощаться животным. Если количество изотопа в среде обозначить как Снар» то скорость его исчезновения можно описать выражением
^наР__ т V ____ I Y (1)
jbii нар */наруувн’ '
35
Обмен воды: осмотический баланс, гормональная регуляция
f и j ______поступление ионов соответственно внутрь (вн) и
где «V (нар), а Хвн И Хнар — специфическая активность (т. е. от-НЗР ние концентрации меченых ионов к общей концентрации иссле-1ЮШых ионов 3*/<2общ). Когда животное находится в равновесном состоянии, 7вн = /наР; если измерения делаются гораздо раньше чем метка поступит внутрь организма, то лвн = 0. Уравнение (1) можно тогда переписать так:
^нар, у _ J вн г)# ИГ-—•/внАнар— QHap ’хнар»
что после простого интегрирования дает
_£вн_ Фнар
(2)
1п Фнар (t) _ _
Qiiap (0)
где Q нар (Лколичество радиоактивного вещества, обнаруженное за время измерения, а Фнар(О) — начальное его количество, добав-
•t =—kt,
(3)
lnQnap(t)
ленное в момент начала отсчета (нулевое время). Пока животное находится в равновесном состоянии, /вн и QHap будут постоянными; их отношение (/Вн/фНаР) также будет постоянным. Последнее, обозначаемое буквой k, называется константой скорости движения испытуемого иона.
Если необходимые для такого анализа условия будут строго соблюдаться (животное должно находиться в равновесном состоянии и замеры должны быть сделаны задолго до начала поступления изотопов), то оценка кинетики может быть вполне удовлетворительной. Некоторое количество изотопа добавляется в момент начала отсчета времени, берется серия проб и анализируется количество оставшегося изотопа. В логарифмических координатах строится логарифмическая зависимость этих величин от времени (рис. *'1). Прямая пересекает ось ординат в точке, соответствующей п ц/нар(о), а наклон кривой определяет константу скорости k.
ели QHap (общее количество ионов в среде) известно, то по-прг>ПЛеНИе ионов внУтРь (/Вн) можно рассчитать. Скорость такого э ^движения ионов обычно выражают через / или k. Иногда для и цели используют количество времени, необходимого для того, 3*
36
Глава 1
чтобы величина фнар снизилась наполовину от первоначальной («полупериод»,
Варианты этого метода касаются способа введения метки животному или заключаются в исследовании животного (вместо окружающей его среды) путем измерения радиоактивности его тела — целиком (с помощью счетчика для целого организма) или в образцах крови. Соответствующие уравнения по форме мало отличаются от уравнения (3), но дают возможность графически оценить k в пределах, в которых поддерживаются описанные выше условия. Например, если введенная животному метка обнаруживается во внешней среде, то
Qnap (t) ==Qnap (равн) (1 б ^), (4)
где фнар (равн)—количество радиоактивного вещества в среде в условиях равновесия. Если делается серия измерений и In (фнар(равн)— —Фнарщ) откладывается на графике против времени, то получается прямая с наклоном k.
Более сложная ситуация имеет место, если вещество распределено между внутриклеточной, внеклеточной и внешней средами. Они поддаются анализу, но этот анализ более сложен. Этот вопрос неоднократно разбирался в разных работах [Solomon А. К., Compartmental methods of kinetic analysis, in: Comar C. F., Bronner F. (eds.), Mineral Metabolism, Vol. 1, Part A, Academic Press, New York, 1960; Sheppard C. W., Basic Principles of the Tracer Method, John Wiley and Sons, New York, 1962; Robertson J. S., Theory and use tracers in determining transfer rates in biological systems, Physiol. Rev., 37, 133—154 (1957)].
Биологическое приспособление к осмотическим условиям окружающей среды
Изоосмотическими растворами называются растворы с равными осмотическими концентрациями. Изотоническим называют такой раствор, в котором клетка (или организм) не изменяет своего объема. Изоосмотический раствор вещества, отсутствующего в клетке, но способного в нее проникнуть, не будет изотоническим. Например, эритроциты в 0,3 М растворе сахарозы, для которого они непроницаемы, не изменяют своего объема, в то время как в изоос-мотическом растворе мочевины они набухают, так как мочевина проникает внутрь клетки, а за ней следует вода. Термин «изоосмотический» более подходит к растворам с равными осмотическими концентрациями, чем термин «изотонический». Подобным же образом раствор, осмотическая концентрация которого ниже, чем у данного раствора, называется гипоосмотическим, а раствор, осмотическая концентрация которого выше, — гиперосмотическим.
Почти у всех пресноводных и наземных растений благодаря их целлюлозным оболочкам и активным цитоплазматическим мембра-
Обмен воды: осмотический баланс, гормональная регуляция 37
концентрации клеточных компонентов, в частности вакуоляр-^ого сока, поддерживаются на более высоком уровне, чем концен-Нпации этих же компонентов в жидкостях, омывающих их ткани. Концентрация веществ, содержащихся в клетках, всегда выше, чем концентрация веществ, содержащихся в тканевых жидкостях. Следовательно, клетки находятся в состоянии тургора, так как защищены от набухания прочными клеточными оболочками. У растений, растущих в пустынях, разница между величинами осмотического давления клетки и внеклеточной воды может достигать почти 50 атм; у ксерофитов осмотическое давление больше, чем у мезофитов, росших с ними в одинаковых условиях, что свидетельствует о генетической природе этих различий. У животных нет неэластичных клеточных стенок и, хотя наружный слой геля цитоплазмы имеет некоторый тургор, концентрация веществ внутри клетки почти равна концентрации их во внеклеточной жидкости. Изолированные ткани, помещенные в изоосмотический солевой раствор, могут набухать, особенно при низкой температуре и недостатке кислорода; содержание воды в них увеличивается, но затем падает при возвращении к более высокой температуре и достаточному уровню кислорода. Это объясняется тем, что в условиях равновесия Доннана для поддержания осмотического равновесия нужна энергия. В таких процессах участвуют: 1) натрий-калиевый насос, поддерживающий концентрацию ионов внутри клетки на уровне, несколько меньшем, чем та равновесная величина, которая необходима для компенсации соответствующего влияния белков (охлаждение или аноксия останавливают этот насос, помогая ионам диффундировать вплоть до равновесия, а клеткам — поглощать ионы и затем набухать); 2) колебания внутриклеточной концентрации свободных аминокислот (особенно у морских беспозвоночных) , обеспечивающие осмотическое равновесие.
Содержание воды в тканях весьма различно и зависит от типа ткани, возраста, активности обмена и разнообразных окружающих условий. Содержание воды в мышцах обычно составляет 75—82%, в костях—35%, а в жировой ткани—10%. Медузы, состоящие на 95 и более процентов из воды, имеют более высокую осмотическую концентрацию, чем рыбы, содержание воды у которых составляет только 70%; однако последние содержат относительно больше органических веществ и меньше электролитов. Аналогичным образом плотность или удельный вес раствора не являются прямой функцией осмотической концентрации, но зависят от природы растворенных веществ, их концентрации, температуры и барометрического Давления.
Диапазон осмотических условий внешней среды, переносимых животными, довольно широк, допустимый же диапазон внутренних осмотических концентраций гораздо уже. Табл. 1-1 показывает, что Разнообразие условий окружающей среды образует непрерывный Ряд от очень мягкой пресной воды до воды соленых озер и от на
38
Глава 1
сыщенной влагой атмосферы до воздуха сухих пустынь, для биологических же жидкостей характерны только 20-кратные колебания осмотических концентраций.
Таблица 1-1
Характерные величины осмотических концентраций для водных сред и жидкостей тела животных и их связь с влажностью воздуха (выраженные в понижении точки замерзания)
Среда днар- °С1 Животные Двн- СС2
Пресная вода —0,01 Пресноводные мидии —0,08
<5°/оо Pelomyxa Пресноводные рыбы Лягушка Речной рак —0,14 От —0,50 до —0,55 —0,45 —0,82
Солоноватая вода 5—35% От—0.2 до —0,5 Эвригалинные беспозвоночные От —0,5 до —1,8
Морская вода 35% —1,85 Морские рыбы Морские беспозвоночные Морские акуловые От —0,65 до —0,7 От —1,8 до —1,85 От —1,85 до—1,92
Соленые озера 60—250 % о От—13,5 до—15 Морские креветки (Arte-mia) От —1,2 до —1,6
Влажная среда Земляные черви От —0,3 до —0,4
(относительная влажность 80— Личинки некоторых насекомых От —0,5 до —1,0
95%) Млекопитающие Взрослые насекомые От —0,5 до —0,58 От —0,8 до —1,2
Сухой воздух (от- Рептилии От —0,6 до —0,7
носительная влажность меньше 10%) Насекомые От —0,8 до —1,2
1 Точка замерзания среды.
2 Точка замерзания жидкости тела.
Океан является той средой, в которой возникли животные организмы. Со времени зарождения жизни общая эффективная осмотическая концентрация океана увеличилась очень немного. В мировом океане концентрация соли сейчас эквивалентна 3,5%-ному солевому раствору; в более мелких морях и заливах она несколько разведена вследствие притока пресной воды, а в эстуариях и устьях рек солоноватая вода смешивается с пресной. В морях типа Средиземного, где испарение очень велико, соленость выше, чем в океане. Разведение морской воды пресной выражают обычно в процентах морской воды, а соленость, или общее содержание солей,— в количестве частей на тысячу (°/оо). В среднем морская вода (100%-ная морская вода) имеет следующие показатели:' соленость— 34,5°/оо; Лзамерз=—1,88°С; удельный вес при 10°С—1,0215; содержание хлоридов— 18,8%0;_ осмоляльность— 1,01 [151].
Любую воду с соленостью менее О,5%о (Дзамерз< ~0,05 °C) можно считать пресной. Мы будем называть всякую воду, промежуточ-
Обмен воды: осмотический баланс, гормональная регуляция
39
ю между пресной и 30%о-ной, солоноватой; заметим, что экологи различают по крайней мере 4 промежуточных типа вод, для каждого из которых характерен свой биоценоз.
Животные и растения, приспособленные к узкой зоне солености, обычно к неразбавленной морской воде, называются стеногалинны-яи- те Же, которые устойчивы к различным соленостям, называются 'эвригалинными. Пределы устойчивости к изменениям солености у отдельных животных на разных стадиях жизненного цикла определяются их акклиматизационным опытом в пределах их генетических возможностей.
В процессе эволюции многие живые организмы сменили среду обитания (океан на пресную воду) и вышли из воды на сушу, причем некоторые из них вновь вернулись в водную среду. Все филогенетические типы и большинство классов животных имеют своих представителей, обитающих в морях; некоторые животные не покидали моря за всю историю своего развития, другие в него возвратились. Представители немногих филогенетических ветвей животных отважились перейти в солоноватые воды, и сравнительно мало животных сумело преодолеть трудности, связанные с осморегуляцией в пресной воде. Одни животные вышли на сушу прямо из океана, другие — через эстуарии и пресные водоемы. Многие группы морских, пресноводных и почвенных организмов перешли к паразитическому образу жизни. Распространение той или иной группы животных ограничено закономерностями, связанными с осмотическими свойствами среды. Об этом убедительно говорит ответная реакция животных на осмотический стресс.
Существует два крайних типа реакций животных на осмотический стресс. Животные могут быть осмотически лабильными, концентрация жидкостей их тела зависит от осмотической концентрации среды; это животные, лишенные осморегуляции (осмоконформеры). Другие животные осмотически стабильны, и при различном изменении среды их внутренняя концентрация остается относительно постоянной; эти животные являются осморегуляторами. К первому и второму типам животных часто применяют термины соответственно пойкилоосмотические и гомойоосмотические животные.
Между крайними случаями лабильности и постоянства осмотических свойств внутренней среды имеются промежуточные стадии. Кроме того, животное может быть осморегулятором в одном диапазоне концентраций среды и осмоконформером — в другом. Осмотические изменения могут вызывать прирост или убыль воды и связанные с ними изменения объемов организма; если при этом происходит перенос солей, и их концентрация у животного изменяется вместе с концентрацией в среде, то объем сохраняется постоянным. Животные, лишенные осморегуляции, переносят более широкие колебания внутреннего осмотического давления, в то время как осморегуляторы могут противостоять более широким колеба-иям концентраций внешней среды. Оба типа приспособления по-
40
Глава 1
могают поддерживать гомеостаз, т. е. позволяют сохранять жизненные функции в изменяющихся условиях.
Животные стремятся поддерживать «оптимальную» осмотическую концентрацию, соответствующую условиям окружающей их среды. Будучи помещенными в нормальные условия, они после периода обезвоживания поглощают воду, а после усиленной гидратации теряют ее, пока осмотическая концентрация не достигнет «оптимума» для данного животного [2]. Время восстановления нормального водного баланса может служить признаком, присущим конкретным видам животных. /Механизмы связанных с гомеостазом процессов гидратации и обезвоживания включают в себя множество звеньев: нервную и гормональную регуляцию, деятельность органов чувств, поведенческие акты.
Осмотическая лабильность клеток
Клеточный гомеостаз: активность воды и клеточный объем. Большинство морских беспозвоночных изоосмотичны по отношению к внешней среде; точно так же большинство клеток более высокоорганизованных многоклеточных животных изоосмотичны по отношению к межклеточной жидкости. Существует предел разведению жидкости, при котором протоплазма еще может выполнять свои основные метаболические функции. Организм или клетка, которые имеют оболочку, проницаемую лишь для воды (полупроницаемую), функционируют как простой осмометр: они набухают или сжимаются пропорционально концентрации растворенных в них веществ, т. е. не регулируют своего объема. Измерение объема яиц морского беспозвоночного животного или эритроцитов после установления равновесия при погружении их в морскую воду или в физиологический раствор разных разведений обнаружит в них (как и в осмометрах) следующее отношение:
Давление (л) • Объем (и) = Константа (/С).
Однако в действительности объем изменяется меньше, чем следует из этого простого уравнения.
По-видимому, определенная часть объема клетки осмотически неактивна (чем можно было бы объяснить это отклонение). Если ввести поправку на этот осмотически неактивный объем (6), то n(b^-b) =К. Осмотически неактивный объем составляет 7,3% пер-вЫМчаЛьгтойо клеточного объема неоплодотворенных яиц и 27,4% оШШа* оплодотворенных яиц: Arbacicr, для эритроцитов человека эта Величина равна 11%-'
Одно из возможных объяснений такого отклонения от предсказанного на основании расчета осмотического поведения заключается в том, что в клетке не вся вода выполняет роль растворителя. Возможность замораживания части внутриклеточной! воды без ка-
Обмен воды: осмотический баланс, гормональная регуляция 41
х-либо вредных для клетки последствий (см. гл. 9) согласуется К осмотическим доказательством того, что часть клеточной воды 5пг)Имерно 15—25%) находится в связанном состоянии в результате процесса гидратации. Однако в эритроцитах объем воды, служащей растворителем для ионов хлора [70] и для глюкозы [289], приближается к общему объему клеточной воды; в то же время осмотически неактивный объем (6) возрастает с уменьшением объема клеток. Объем воды — растворителя для ионов хлора — изменяется при изменении pH; это значит, что для поддержания равновесия Доннана хлориды могут в разной степени замещать гемоглобин как анион [70, 121, 283, 311, 312].
В поперечнополосатых мышцах лягушки объем линейно связан с осмотической концентрацией в интервале от 0,77 до 1150 моем [37]. Однако около 33% объема, или 13% клеточной воды, осмотически неактивно. Система трубочек (Т- и S-трубочки) составляет 11—18% клеточного объема, т. е. какая-то часть осмотически неактивного объема, по-видимому, заключена в трубочках [37]. Мышцы ракообразных имеют хорошо развитую систему трубочек, в которой вода и ионы могут быть изолированы друг от друга, так что в целом объем клетки во время осмотических стрессов не изменяется. Доля осмотически активной воды в мышцах составляет у лягушки 85%, у краба 87, у лангуста 78, у усоногого рака 66% [157]. В гигантских нервных волокнах кальмара или омара аксон набухает или сжимается сильнее, чем все волокно; оболочка образует мертвое пространство, составляющее 20—40% общего объема [117].
Таким образом, величина Ь, которая служит мерой отклонения реального набухания от теоретически предсказанного, сильно варьирует от вида к виду в соответствующих типах клеток. Величина b колеблется от 25—50% клеточного объема для икры морских ежей до 60—80% для икры амфибий и до 90% для икры осетра и аксолотля [388]. Наличие связанной воды объясняет отнюдь не все случаи отклонения реального, измеренного объема от теоретической величины, и, вероятно, какая-то часть воды, связанная с белком, может служить растворителем для небольших молекул и ионов.
Проницаемость для воды. Исходя из степени изменения объема, можно рассчитать осмотическую проницаемость для воды. Она будет равна объему воды, проникающей через единицу площади поверхности за единицу времени при данном осмотическом градиенте. Из скорости входа и выхода меченой воды (D2O или ТИО) рассчитывают константы скорости диффузионной проницаемости, табл. 1-2 приведены данные двух типов измерений, представленные, где это было возможно, в одних и тех же единицах. Из таблицы видно, что осмотическая проницаемость для воды самых Разных тканей значительно выше их диффузионной проницаемости, причем различия в скоростях свободной диффузии между D2O или
42
Глава 1
ТНО и Н2О недостаточны, чтобы объяснить различия в проницаемости [310, 311].
Таблица 1-2
Сравнение коэффициентов проницаемости, определяемых с помощью диффузии (Рдиф) И осмотического давления (Роем)1
Рдиф’ см/с Лэсм- см/с Р Л./Р диф' Осм
Эритроциты человека 3-10-3 7-Ю-з 2,3
Эритроциты быка 2,7-10-3 8-Ю-3 3,0
Эритроциты собаки 2,4-Ю-з 10,5-10-з 4,4
Амеба 0,023-Ю-з 0,037-Ю-з 1,6
Икра лягушки из полости тела 0,075-10-з 0,13-10-з 1,7
Икра Xenopus 0,09-Ю-з 0,159-10-з 1,8
Икра из ястыков перцины 0,068-Ю-з 2,93-10-з 43
Незрелая икра перцины 0,036-Ю-з 0,045-Ю-з 1,3
Икра из яичников лягушки 0,128-Ю-4 8,9-10-з 69
Амнион человека 3,62-10-4 3,7-10-2 102
Кожа лягушки (слегка колеблемая) 6,5-10~5 5,4-Ю"4 12
(сильно колеблемая) 11,1-10-5 1,2-10-5 0,108
1 Расчеты сделаны на основании данных следующих авторов: Paganelli С. V., Solomon А. К., J. Gen. Physiol., 41, 259—277 (4957); Prescott D. M., Zeuthen E., Acta Physiol. Scand., 28, 77—94 (1953); Villegas R. et al., J. Gen. Physiol., 42, 355—369 (Ц958), а также [25„ 82, 288, 3.11 и 312].
Одно из объяснений, предложенное для эритроцитов, состоит в том, что в них существуют наполненные водой каналы, свободная диффузия через которые ограничена [311, 312]. Другое объяснение^ основанное на проницаемости для воды кожи лягушки при разных скоростях перемешивания растворов, предполагает, что непереме-шиваемый вблизи мембраны слой воды препятствует свободной диффузии [82]. Это объяснение не подходит для эритроцитов [312]. В искусственных мембранах, изготовленных из липидов мозга, при надлежащем перемешивании не отмечалось разницы между диффузионной и осмотической проницаемостью. Однако в искусственных мембранах, имеющих высокие значения отношения концентраций холестерина и фосфолипида, проницаемость для воды (измеренная осмотически) была меньше, чем в мембранах с низким значением отношения этих компонентов [111].
Другая сложность состоит в том, что экзоосмос может не быть равным эндоосмосу. Так, степень набухания икринок морского ежа меньше, чем степень ее сморщивания. В эритроцитах же оба процесса .идут одинаково в почти изотоничном диапазоне.
У некоторых осмотически лабильных морских животных основные изменения в концентрации осмотически активных растворенных веществ, происходящие в гемолимфе и мышцах, осуществляются главным образом за счет увеличения или уменьшения количества небольших органических молекул; при этом концентрация
Обмен воды: осмотический баланс, гормональная регуляция 43
ионов сохраняется относительно постоянной (см. гл. 2). Когда европейская камбала мигрирует из морской воды в пресную, осмотическая концентрация ее плазмы уменьшается на 20%. Выделенные из крови камбалы эритроциты, помещенные в среду, также разбавленную на 20%, вначале набухают, а затем возвращаются к своему первоначальному объему; анализ показал, что регуляция объема обусловлена потерей нингидринположительных веществ [119]. В такой ткани нервная регуляция объема происходит путем изменения концентрации свободных аминокислот. Объем помещенного в разбавленный раствор нерва краба сначала увеличивается, а затем уменьшается благодаря потере аминокислот. В солевом растворе, изоосмотичном крови, нервное волокно пресноводного краба Eriocheir теряет часть свободных аминокислот, тогда как в более концентрированных солевых растворах концентрация свободных аминокислот в нерве увеличивается.
Еще одно доказательство существования некоторой регуляции объема в изоосмотических клетках усматривают в разнообразии форм клеток разных тканей и в том, что сферическая форма клеток встречается редко. Это явление можно в какой-то мере объяснить широким распространением относительно неэластичных оболочек, кортикальных покровов высокой вязкости и сократительных белков. Однако многие клетки специфической несферической формы, набухая в гипотонической среде, превращаются в сферические.
Эксперименты с различными растворенными веществами позволяют оценить диаметр пор, через которые могут проходить неэлектролиты (и вода). Коэффициент Ставермана о есть мера отклонения от полной проницаемости для данной молекулы. Если мембрана полностью проницаема для неэлектролита, как для воды, то сг=О; если мембрана полупроницаема по отношению к неэлектролиту, то 0=1. Сравнивая одновременные изменения объемов в растворах разных веществ, можно рассчитать самый малый диаметр, при котором молекулы уже не могут свободно проходить через мембрану, а следовательно, и размер «пор», необходимый для обеспечения полупроницаемости. Оцененный таким образом радиус пор в эритроцитах человека равен 3,5 А, коровы — 4,1 А, собаки — 7,4 А
*• J *
Считалось, что клетки некоторых тканей могут быть гиперос-мотичными (тургесцентными) по отношению к межклеточной жидкости. Однако точные измерения осмотических концентраций во внутри- и межклеточной жидкостях показало, что большинство клеток животных изотонично. Правда, в некоторых случаях внутриклеточное гидростатическое давление может создавать некоторую гипертоничность, но для практических целей можно принять, что осмотические концентрации в клетках и в межклеточной жидкости равны.
Таким образом, механизм регуляции объема и формы клеток не полне понятен, и большинство клеток ведет себя не как простые
44
Глава 1
осмометры; их поведение напоминает скорее поведение идеальных растворов. Проницаемость клеточных мембран меньше, чем отмечаемая при простой диффузии в большинстве растворов, и сильно варьирует от клетки к клетке. Различия между диффузионной и осмотической проницаемостью поняты еще не до конца.
Осмотически лабильные многоклеточные животные (осмоконформеры)
У большинства морских беспозвоночных осмотическая концентрация жидкостей тела (меж- и внутриклеточной) находится в пассивном равновесии с концентрацией морской воды, хотя общая осмотическая концентрация крови может быть — в силу равновесия Доннана — несколько выше, чем в среде. Иглокожие, сипункулиды, головоногие, асцидии и большинство кишечнополостных обитают только в настоящей морской воде (т. е. являются в высокой степени стеногалинными). Они приспосабливаются к среде только в узком диапазоне осмотических концентраций. Регуляция объема и ионного состава у этих животных выражена в разной степени. Все они регулируют ионный состав клеток и в меньшей степени состав внеклеточной жидкости. Ионная регуляция и осмотическая адаптация достигаются в основном за счет изменения концентрации азотистых органических молекул, тогда как содержание неорганических ионов поддерживается на весьма стабильном уровне.
Осмотические концентрации у морских медуз почти равны осмотическим концентрациям морской воды, в которой они обитают. Медузы относительно неустойчивы к разведению среды, а кораллы и гребневики могут переносить уменьшение солености на 20%. Кровь Ascidia и Molgula остается изоосмотичной по отношению к морской воде в условиях небольшого уменьшения или увеличения ее концентрации.
Иглокожие (голотурии, морские ежи [124] или морские звезды [35, 36]), перенесенные в разбавленную (до 80%) морскую воду, увеличивают вес своего тела за счет насасывания воды; перенесенные в сконцентрированную (до 110%) морскую воду, они теряют в весе, и по крайней мере в течение нескольких дней их объем не восстанавливается или восстанавливается очень медленно (рис. 1-2). Нижний предел солености для выживания морских звезд из Северного моря (где соленость 35%о) равен 23°/оо, а для морских звезд, обитающих в Балтике (где соленость 15°/оо),— 8%о [35, 36].
Биологические последствия осмотической лабильности при разбавлении внутренней среды могут быть весьма существенными. Балтийские морские звезды Asterias по сравнению с североморскими имеют мягкий интегумент, повышенное содержание воды, пониженную устойчивость к теплу и менее интенсивный обмен веществ. Asterias не размножается в Балтийском море, а находимые там популяции представляют собой часть популяций Asterias, раз-
Обмен воды: осмотический баланс, гормональная регуляция
45
жающихся в Северном море. У Asterias rubens около половины МН отической концентрации тканей обусловлено наличием свобод-°С]Х аминокислот и азотистого основания таурина. При переходе
Рис. 1-2. Объем тела морской звезды Asterias при разных разведениях морской воды [35].
(Печатается с разрешения Издательства Кембриджского университета.) фкрупные животные; ▲ мелкие животные.
животных от одной солености среды к другой в большей степени изменяется концентрация именно этих компонентов по сравнению с концентрациями солей в тканях [173, 206].
Морская вода 60%-ная морская вода
Азамерз среды —2,09 °C Азамерз жидкости тела —2,12 °C Азамерз жидкости желудочных выростов, —0,6°C обусловленная аминокислотами и таурином замерз жидкости желудочных выростов, —0,35 °C обусловленная другими азотистыми компонентами онцентрация в жидкости желудочных выростов г уРин 3,9 ммоль/100 мл лицин 17,3 ммоль/100 мл —1,23 °C —1,24 °C —0,32 °C —0,30 °C 2,2 ммоль/100 мл 9,5 ммоль/100 мл
Черви-сипункулиды набухают и сморщиваются, подобно осмо-пРичем осмотически неактивный объем их составляет око-/о. У Golfingia объем не регулируется, а у Dendrostomum
46
Глава 1
происходит выведение солей через кишку и особенно через нефридии; через 4—6 дней пребывания в разбавленной среде происходит частичное восстановление их объема [177]. Клетки стенки тела Golfingia содержат 550 мМ свободных аминокислот, а целомическая жидкость — 80 мМ. При уменьшении солености резко уменьшается концентрация аминокислот, что препятствует избыточному вводнению и набуханию без потери ионов [364]. Сипункулида
Рис. 1-3. Изменения во времени веса тела сипункулиды Themiste в морской воде разных разведений {258].
а— 139%-ная морская вода (М. В.); б — 111%-ная М. В.; в — 98%-ная М. В.; г — 89%-ная М. В.; д — 80%-ная М. В.; е — 49%-ная М. В.
В точках, отмеченных стрелками, червей возвращали в 98%-ную М. В. Регуляция объема отсутствует.
Themiste — это осмоконформер; концентрация хлоридов в целомической жидкости при помещении его в концентрированную среду не изменяется, а при помещении в разбавленную уменьшается. Он свободно набухает в разбавленной среде и незначительно сморщивается в концентрированной [258] (рис. 1-3).
Плоский червь Gunda (его новое название — Procerodes) ulvae живет в приливной зоне, где он дважды в день попеременно по нескольку часов находится либо в пресной, либо в неразбавленной морской воде. В мягкой водопроводной воде Procerodes быстро на-
Обмен воды: осмотический баланс, гормональная регуляция
47
бухают держащей
I
* у
i f ч
(Астаеа), отмечается воды в целом теле, а солености (в течение объема. В полости его буфера, приспособлен-
и в течение 48 ч погибают; в разбавленной морской или со-_'-ч[ много кальция проточной воде процесс набухания за-Др дляется. Присутствие в воде других веществ (помимо солей альция) не предотвращает набухания [373]. Когда Procerod.es аходится в разведенной морской воде, вода проходит через его паренхиму, которая при этом набухает, затем собирается в вакуоли в эктодермальных клетках, выстилающих кишечник. Таким образом, объем тела поддерживается на относительно постоянном уровне, другие же клетки тела предохраняются от чрезмерной гидратации. Вакуоли сохраняются, пока червь находится в разведенной морской воде, но они не увеличиваются в объеме благодаря какому-то активному процессу.
Морские моллюски относятся также к осмоконформерам с разной степенью стеногалинности. Так, головоногие могут существовать только в условиях полноценной солености. Некоторые из без-раковинных брюхоногих (голожаберные и первичножаберные, такие, как Doris и Onchidium) набухают в разбавленной или сморщиваются в концентрированной морской воде с одновременной незначительной регуляцией объема в течение многих часов. У других видов (например, Aplysia) ограниченная регуляция объема сопровождается увеличением или падением концентрации солей.
У моллюска, называемого «блюдечком» линейная зависимость между содержанием также в мышцах и соленостью: изменение недели) не сопровождается изменением его тела содержится нечто вроде осмотического ного для быстрых изменений; эти изменения весьма существенны в концентрированной среде и невелики в разбавленной [372].
В ответ на изменение солености может изменяться и поведение. Так, повторное прикрепление «блюдечка» к субстрату удается лишь в ограниченном диапазоне разведений. Улитка, например Hydrobia, обитающая в солоноватых водах, будучи в активном состоянии, быстро изменяет концентрацию своей крови, а в неактивном (находясь в раковине) проделывает это гораздо медленнее. Она сохраняет изоосмотичность при всех концентрациях среды [10]. Lit-torina выживает в разбавленной морской воде или на воздухе в зависимости от того, насколько плотно закрыта ее раковина. У Aplisia спонтанная электрическая активность специального нейрона висцерального ганглия уменьшается, когда разбавленная морская вода соприкасается со специфическими осморецепторами осфрадиума, побуждая моллюска к поведению, нацеленному на избавление от действия вредящего фактора.
Если двустворчатых моллюсков, таких, как Crassostrea, Modio-Us и Mytilus, перенести в разбавленную морскую воду, створки их Раковин надолго закроются, что даст им возможность выжить, так Как при этом их гемолимфа разбавляется очень мало, если вообще Разбавляется. Если же створки открыть, то произойдет увеличение
48
Глава 1
веса тела и быстрое разбавление гемолимфы. Эти моллюски могу? регулировать объем своего тела только в условиях малых разведи ний воды; при сильном разведении у них в течение двух дней не удалось обнаружить регуляции. Только такие виды моллюсков, как Mytilus, могут жить в морской воде, разведенной до 50% [268] (рис. 1-4). Различия в устойчивости к солености среди разных ро> дов коррелируют с условиями их естественного обитания [362].
Рис. 1-4. Изменения во времени веса тела моллюска Modiolus (при открытых створках раковины) i[269].
Животные были перенесены из нормальной среды (соленость 36%о) в среды с различной соленостью. Некоторое восстановление объема отмечено при 27%о;
А3%о; + 27°/оо; 48%о.
Тщательные измерения осмотических концентраций жидкостей у нескольких моллюсков обнаружили слабый градиент осмотической концентрации, соответствующий эффекту Доннана в следующем ряду: морская вода<мантийная жидкость<перикардиальная жидкость<гемолимфа. Жидкость каждого органа может иметь более высокую или более низкую по сравнению с внешней средой концентрацию, тогда как в гемолимфе концентрация всегда на некоторую постоянную величину выше, чем в морской воде [267]-Если створки раковины Modiolus открыты, то в разбавленной солевой среде объем регулируется в сторону уменьшения внутренней
Обмен воды: осмотический баланс, гормональная регуляция
49
тической концентрации — за счет потери аминокислот; в кон-°СМтцированной морской воде объем регулируется очень слабо и цеНтом за счет потери воды. При различных концентрациях внеш-ПР? среды кровь всегда остается на 20 моем более концентрирований чем морская вода (т. е. адаптация происходит, но с сохране-н ’ равновесия Доннана) [268]. Когда Mytilus приспосабливает-Ня к различной солености, то основные изменения в концентрации
Рис. 1-5. Концентрации небелковых азотистых веществ (нингидринположительных компонентов, НПК) и таурина в жидкости тела у мидии Mytilus при разных уровнях солености [205]. #НПК; X таурин.
внутри клеточной жидкости и отчасти гемолимфы происходят скорее за счет малых органических молекул, чем за счет солей. Рис. 1-5 показывает, что уменьшение или увеличение осмотической концентрации в мышцах в основном обусловлены нингидринпо-ложительными веществами (аминокислотами и особенно таурином) [205]. У некоторых двустворчатых моллюсков (Rangia [5] и Муа) сначала изменяется соотношение между концентрацией свободных аминокислот и общей осмотической концентрацией, потом может измениться концентрация таурина. В замыкательной Мышце у Муа концентрации аланина и глицина пропорциональны солености среды [365]. Таким образом, осмотическая адаптация Осуществляется путем поддержания относительного постоянства йонных концентраций во внутренней среде животных.
4—1332
50
Глава 1
В солоноватых водах, например в Балтике, Mytilus потребляет больше кислорода, чем в нормальной'морской воде (в Северном
Рис. 1-6. Относительная активность ресничек в жабрах мидий, обитающих в Балтийском и Северном морях и адаптированных к солености среды 15 и 30%. (Тид, см. [185]).
Измерения производились в широких пределах колебания солености. Первоначальные различия, имевшиеся между двумя популяциями, были в значительной степени изменены на обратные с помощью перекрестной акклимации.
море); сердечная деятельность, активность ресничек и теплоустойчивость в разбавленной морской воде снижаются [299]. Скорость фильтрации уменьшается как при повышении, так и при понижении солености, и пределы этих изменений в популяциях, оби-
Обмен воды: осмотический баланс, гормональная регуляция 51
»ощих в Балтийском и в Северном морях, различны. Однако пос-та* у_.jo дней перекрестной акклимации максимум фильтрации у
Лрвероморских животных обнаруживается при меньшей солености, а у балтийских — при большей, чем первоначально [349] (рис. 1-6). По-видимому, различия в условиях оптимальной солености у разных популяций не закреплены генетически. Пределы разведения, в которых еще сохраняется активность жаберных ресничек, также характеризуются видовыми различиями. Так, у Aquipecten жабры теряют активность при солености морской воды, равной 12—15°/оо, а у Modiolus и Crassostrea — равной 3—4°/оо [362].
Некоторые полихеты, например Arenicola marina, Nereis-pela-gica и Perinereis cultrifera, обладают осмотической лабильностью и слабо регулируют объем или не регулируют его вовсе. Внутриклеточная концентрация в мышцах Arenicola регулируется с помощью изменений концентрации свободных аминокислот, подобно тому как это имеет место у Mytilus [98].
Осмотические свойства морских ракообразных и паукообразных отчасти подобны свойствам видов, обитающих в солоноватых водах. Глубоководные крабы, такие, как Maja, могут прожить лишь несколько часов в морской воде, разбавленной более чем на 20%. Помещенный в 80%-ную воду краб сначала набухает, затем в течение трех часов его вес падает, и кровь становится изоосмотичной среде. Множество других морских ракообразных ведет себя подобным же образом — Palinurus, Portunus, Cancer antennarius, Hyas и Pagurus. В то же время Libinia не выживает в морской воде, разбавленной более чем до 90—95%. Homarus изоосмотичен среде и выделяет изоосмотичную мочу, которая отличается от гемолимфы своим составом. Морской желудь Balanus balanoides закрывает свою раковину на воздухе или в разбавленной (до 50%) морской воде и открывает ее лишь при погружении в нормальную морскую воду. Планктонный рачок Arartia tonsa, хотя и является осмотически лабильным, сохраняет небольшую гиперосмотичность по отношению ко всем концентрациям внешней среды, по-видимому, за счет эффекта Доннана [203]. Подобным же образом королевский краб Paralithoides поддерживает осмотическую концентрацию гемолимфы почти на 15 моем выше любых возможных концентраций среды [225]. У мечехвоста Limulus кривая, описывающая изменения отношения внутренней осмотической концентрации к наружной, при концентрациях, меньших чем концентрация морской воды, проводит несколько выше изоосмотической линии. Как у Paralithoides, так и у Limulus изменения в осмотической концентрации крови связаны с изменением концентрации солей, а в мышцах Limulus — с изменением концентрации аминокислот, гомарина и других азотистых веществ [2Ю].
Таким образом, осмотически лабильные морские беспозвоночные не находятся в абсолютной зависимости от внешней среды. Их ответы на осмотические изменения гомеокинетичны; их биоло
4*
52
Глава 1
гическая активность может осуществляться в ограниченном диапазоне колебаний внутренней осмотической концентрации. Многие из этих животных могут до некоторой степени регулировать свой объем путем поглощения или выделения солей. У животных-конформеров часто изменения концентрации солей значительно менее заметны, чем изменения концентрации небелковых азотистых веществ, чаще всего аминокислот, особенно в мышцах и нервах; следовательно, осмотическая концентрация может изменяться сильнее, чем ионная. У некоторых эвригалинных видов концентрация жидкости тела изменяется параллельно концентрации внешней среды, но всегда несколько превышает последнюю, т. е. в этих случаях поддерживается не постоянство внутренней концентрации, а постоянство различия с внешней средой. Некоторые осмоконформеры обладают запасами жидкости для забуферивания клеток. Другие животные стараются избегать попадания в разбавленную среду. Регуляция ионного состава, по-видимому, более существенна для организма, чем регуляция объема; последняя же в свою очередь более значима, чем регуляция осмотической концентрации.
Ограниченная гиперосмотическая регуляция
Адаптация к солоноватым водам
Некоторые типы и классы, состоящие в основном из морских организмов, включают отдельные роды, обитающие в солоноватых и пресных водах. У нереид (полихет) способность регулировать объем тела и устойчивость к разведенной среде повышается в ряду: Perinereis cultrifera, Nereis vexillosa<Nereis pelagica<Neanthes virens <Nereis diversicolor, Nereis succinea, Leonereis culveri<Ne-reis limnicola, Neanthes lighti [332]. Первые три вида относятся к морским стеногалинным формам; Neanthes virens может регулировать свой объем при концентрациях до 3—8%, а в лабораторных условиях выдерживает соленость ниже 1°/оо (т. е. 1,4%-ную морскую воду или воду, содержащую 2—4 мМ Cl). Leonereis culvert выдерживает концентрации ниже 10 мМ Cl, a Nereis limnicola может жить и размножаться в пресной воде [256, 257, 328, 329] (рис. 1-7). Распространение Nereis diversicolor в Финляндии, по-видимому, ограничено его малой устойчивостью к разведенной морской воде при низких температурах, к чему его личинки более чувствительны, чем взрослые черви.
В разведенной морской воде N. diversicolor остаются гиперос-мотичными, но они не в состоянии сохранить при этом концентрацию крови на том уровне, на котором поддерживают ее, находясь в морской воде. При переносе этих животных в разведенную морскую воду поглощение ими кислорода вначале увеличивается (частично благодаря сопротивлению мышц набуханию). Осмотическая регуляция и регуляция объема в разведенной воде у них от-
Обмен воды: осмотический баланс, гормональная регуляция 53
тсТВуют, если к воде добавлен цианид, резко снижено содержаще кислорода или отсутствует кальций.
ВИ С помощью изотопных методов было показано, что обмен нона-хлора со средой и проницаемость для воды у N. virens значи-Щльно больше, чем у N. diversicolor, а проницаемость для ионов
Регуляция происходит в пределах изменений концентрации от 20 до 180 мМ С1_.
натрия у N. cultrtf era гораздо выше, чем у N. diversicolor. При помещении N. diversicolor в очень разбавленную морскую воду проницаемость ее для ионов и воды снижается по сравнению с обычной м°рской водой [175]; при этом N. diversicolor всей поверхностью тела активно абсорбирует из среды ионы хлора. В морской воде v- diversicolor обычно обменивает около 8% содержащихся в теле ионов хлора в 1 ч [175]. В дистиллированной воде скорость потери солей у succinea больше в 2,5 раза, а скорость набухания (осмотическое насасывание) — в 4 раза, чем у N. limnicola. Измерен-
S4
Глава 1
лая с помощью поглощения D2O проницаемость для воды у N. succinea и N. limnicola оказалась одинаковой и независимой от осмотического градиента [328]. Диффузионное поступление оказалось более значительным, чем можно было ожидать, основываясь на осмотическом набухании. У особей N. limnicola, собранных в пресных водах верховьев рек, почечные канальцы имеют диаметр 20,8 мк тогда как у червей из солоноватых участков вблизи устья реки .диаметр почечных канальцев равен 8,5 мк [174]. У N. limnicola размножение тоже приспособлено к разведенной морской воде-— они живородящи в отличие от червей морских и солоноватых вод, которые выделяют икру и сперму [329, 332]. Ниже представлены величины, характеризующие потерю солей и поступление воды в юрганизм животных четырех видов, помещенных в дистиллированную воду [328]:
Потеря солей, мМ/ч Увеличение объема в 1 ч, % Район
Морской N. succinea 0,068 55 Киль
Морской N. succinea 0,039 57 Беркли
Солоноватоводный N. diversicolor 0,0129 24 Киль
Пресноводный N. limnicola 0,0086 10 Сан-Франциско
JV. limnicola из залива Сан-Франциско подвергается сезонным колебаниям солености воды от почти пресной до 85 %-ной морской; ему свойственна хорошая регуляция объема, и передвижение солей у него происходит медленнее, чем ток воды. Сравнение проницаемости для солей у животных, предварительно адаптированных к 49 и к 3—5%-ной морской воде и перенесенных затем в более концентрированную среду, обнаружило, что у особей, адаптированных к более низкой солености, она заметно ниже. Очевидно, акклима-ция вызвала какие-то изменения в клетках [256, 257]. При переносе разных видов полихет в разбавленные среды их приспособление к новым условиям начинается с перехода аминокислот из тканей в целомическую жидкость [64]. N. diversicolor относится к обитающим в солоноватых водах полихетам, которые могут переносить •очень сильные разведения. Они активно поглощают ионы хлора против градиента концентрации из среды с 20 мМ С1—, особенно если предварительно выдерживались в пресной воде (т. е. при концентрации менее 10 мМ С1_). Пассивная проницаемость для воды и ионов хлора при этом уменьшается, в то время как активное поглощение ионов хлора увеличивается. Разность потенциалов между двумя сторонами стенки тела равна —17,3 мВ в прудовой воде» —3,7 мВ в 10%-ной и 0 — в 50%-ной морской воде. Обмен воды через стенку тела (измеренный с помощью D2O) падает с 12,53 /о ©сей воды тела за 1 ч в морской воде до 5,9—6,9% за 1 ч — в прУ'
Обмен воды: осмотический баланс, гормональная регуляция 55
вой. Однако зависимость между концентрацией хлоридов в среде ^потерей хлора и воды с мочой не является линейной: максимум й выделения с мочой наблюдается в 10%-ной морской воде ^62 мМ С1-). Это может быть связано с очень резким падением проницаемости для воды при более сильных разведениях среды и
Рис. 1-8. Зависимость концентрации ионов хлора и объема мочи у Nereis diversicolor от солености среды '[332].
Соленость среды выражена через концентрацию ионов хлора. Объем мочи и потери ионов хлора максимальны при низких концентрациях CI- в среде. I — общее количество выделенных С1-; II — количество мочи (правая ордината); III — потеря С1~ при изотоничной моче; • V ~ расчетное число ионов С1~, выделяющихся с мочой. Разведение морской воды указано приблизительно.
кальция и магния в целомической жидко-
максимальным уровнем Де 332] (рис. 1-8).
Концентрации ионов__________ ________ _______________
сти N. diversicolor оказываются меньше, чем можно было бы ожи-Дать, исходя из электрохимического градиента. Поток кальция про-°Рционален уровню солености среды, а не только концентрации альция в ней. Поглощение кальция, измеренное с помощью ме-ttbix атомов, происходит в два этапа следующим образом:
поглощения хлора в 10%-ной морской во-
56
Глава 1
В 100%-ной морской воде
В 1 % -ной морской воде
Быстрый обмен
«7=4,3 ммоль/кг
Л/г=8 ч
«7=0,62 ммоль/кг
Ти =22 ч
Х/2
Медленный обмен
«7=0,8 ммоль/кг =50 ч
«7=0,62 ммол/кг
Г, =300 ч
1/2
Следовательно, быстрый обмен кальция уменьшается при разведении среды, так же как и обмен ионов хлора и воды.
Итак, разные виды нереидных червей различаются между собой следующими особенностями адаптации: устойчивостью личинок к разбавлению, проницаемостью для воды и солей, активным поглощением ионов, особенностями выделения через почки и способом размножения.
Эвригалинные виды, как, например, N. diversicolor, в зависимости от солености среды могут регулировать свою проницаемость для воды и солей, а также уровень активного поглощения ионов.
Ракообразные: морские, солоноватоводные, пресноводные и наземные
Среди ракообразных разнообразие всевозможных типов осмотических адаптаций выше, чем среди любых других групп животных. Многие из них являются стеногалинными, осмотически ла-
Рис. 1-9. Зависимость осмотической концентрации крови Двн от осмотической концентрации окружающей среды Анар У нескольких морских ракообразных.
I— Carcinus; II — Hemigrapsus; Ш " Maj а.
бильными формами и обитают только в 100%-ной морской воде-Некоторые (особенно прибрежные крабы) способны сохранять гй-перосмотичность в разбавленной морской воде, хотя при повышенной солености они становятся изоосмотичными или даже гипоосмо-тичными. Как показано на рис. 1-9—1-12, существует большое различие в способностях взрослых форм поддерживать осмотическую концентрацию в гемолимфе более высокой или более низкой, чем
Обмен воды: осмотический баланс, гормональная регуляция
57
окружающей среде. Некоторые ракообразные большую часть жизни проводят на земле и в морской воде тонут. Жаброногие рач-ки-артемии живут в сверхсоленой воде и замечательны своей спо-
рис. 1-10. Зависимость осмотической концентрации крови Двн от осмотической концентрации окружающей среды Анар у нескольких ракообразных с гипер- и гипоосмо-тической регуляцией.
I — Uca;; II — Pachygrapsus; 111 — Erio-cheir; IV — Palaemonetes.
A Рис. 1-11.
coalКонЧентрация крови,, выраженная в единицах относительной проводимости, как функция
КонцрОСти сРеды для осмотическая
чентрацня кровн А н как’ функция солености для-, Gaj^iarus;-<duebefii-,- адаптированного к 7 (III) и 20 °C (7V)- ’
^бностью к гипоосмотической регуляции. У некоторых крабов и йодХ Речных раков жизненный цикл целиком проходит в пресной
58 Глава 1
Гиперосмотическая регуляция; заселение эстуариев; прибрежные крабы
Крабы Carcinus, обитающие в Балтийском море, более гипер. юсмотичны по отношению к среде с соленостью 5—10°/оо, чем Caret, nus, обитающие в Северном море; в условиях же более высокой солености они ведут себя одинаково. Эти различия между двумя популяциями, обусловленные частично генетическими причинами,
ОЬСидкость тела, мосМ
Рис. 1-12. Осмотическая концентрация крови |(светлые кружки) и мочи (чеРй^. кружки) у животного-осмоконформера (Callianassa) и у животных с ограни'1 ной осморегуляцией (два вида Upogebia) [352]. с.
j _ Upogebia pugeitensis; II — Upogebia offinis; III — Callianassa californiensis; IV — i'30 мотичность.
Обмен воды: осмотический баланс, гормональная регуляция
59
частично влияниями среды, уменьшаются после перекрестной ак-климации [350].
Голубые крабы Callinectes во взрослом состоянии живут в пресой воде, особенно если она содержит много кальция, как, напри-мер в верхнем течении реки Св. Джона во Флориде. Однако для оазмножения они должны спускаться к устью реки, и потому некоторые из них могут не оставить потомства. Их личинки — зоеа — поглощают воду в период линьки и могут быть очень чувствительными к разведению среды. Крабы Rithropanopeus поддерживают гиперосмотичность с момента вылупления, но на пятый день после превращения в зоеа они становятся осмотически лабильными; затем перед линькой с превращением в мегалопу они вновь обретают способность поддерживать гиперосмотичность. Callinectes всю жизнь сохраняют гиперосмотичность, за исключением 48-часового-периода личиночной стадии [76]. Таким образом, эти виды могут-всю жизнь существовать в разбавленной морской воде, кроме кратковременного личиночного периода, который они должны проводить в морской воде. Libinia изоосмотичны при вылуплении, затем: у них развивается способность к гиперосмотической регуляции,, впоследствии утрачиваемая. Поэтому Libinia должны обитать в море [176]. Некоторые десятиногие раки полностью перешли в пресную воду, где проходит весь их жизненный цикл, в том числе и размножение.
Температура вместе с соленостью влияют на регуляторные способности некоторых крабов и определяют характер миграций у креветок и десятиногих раков. Callinectes может поддерживать свою гипоосмотичность только при высоких температурах: летом он может жить в сверхсоленых лагунах. При низких температурах концентрация его гемолимфы выше, чем при высоких температурах; зимой она превышает концентрацию воды как с низкой, так и с высокой соленостью [12].
У Hemigrapsus oregonensis зимой концентрация крови также выше, чем летом, а у Н. nudus таких колебаний нет [90]. Личинки Halicarcinus australis погибали в воде при температуре 30 °C и любой солености; однако их выживаемость достигала почти 100% при температуре 25°C и концентрации ионов хлора, равной 6,4—12,1%, при 19 °C и концентрации ионов хлора, равной 6,4—19,3%, и при
и концентрации ионов хлора, равной лишь 12,4% [220]. Очевидно, что в естественных условиях осмотические концентрации у м°рских ракообразных, населяющих эстуарии, зависят в одинаковой мере как от температуры, так и от концентрации среды.
Проницаемость для воды и ионов. Одно из важнейших условий Поддержания эвригалинности заключается в пониженной прони-Диемости поверхности тела для воды и солей; так, прибрежные Рабы менее проницаемы для этих веществ, чем стеногалинные ^орские крабы. Например, пелагический краб Maja восстанавлива-м свой нормальный объем после первоначального набухания в раз
60
Глава 1
веденной морской воде гораздо быстрее, чем прибрежный краб Cancer. Приводимые ниже константы скорости обмена меченой воды, выраженные в ч"1, демонстрируют уменьшение проницаемости в следующем ряду [296]:
Macropipus (Portunas) в морской воде 2,39
Carcinus в морской воде (или в 70%-ной морской воде) 0,79 Palaemonei.es в 120 и 70%-ной морской воде 0,64
в 10 %-ной морской воде 0,55
Astacus в пресной воде 0,20
Подобное же свидетельство пониженной проницаемости в разведенной среде можно видеть и на примере круговорота воды у Carcinus [330, 331].
Среда морская вода (разведение)
30% 75% юо%
Суточное поступление воды (в % от веса тела) 17,2 11,5 0
Суточный объем мочи (в % от веса тела) 31,3 11,1 3,6
Процент воды организма, обмениваемой за 1 ч 1,76 2,73 2,36
При установлении равновесия в данной среде поступление равно выделению. Осмотическое передвижение воды можно оценить, исходя из объема мочи, выделяемого в различных средах; как правило, осмотический поток превышает величину, получаемую при измерении с помощью меченой воды. Проницаемость для воды морских крабов больше, чем это наблюдается у видов, обитающих в солоноватых и пресных водах; морские крабы не могут изменять свою проницаемость, как это делают пресноводные формы. Вода внутренней среды у Carcinus и Macropipus в осмотических процессах ведет себя как система, состоящая из двух компонентов. У Macropipus быстрообменивающийся компонент составляет 70% всей воды тела [296] (рис. 1-13); у Rhithropanopeus пассивный при-
Среда
морская вода (разведение)
160% 100% 60%
Пассивный приток 814 495 234
Активное поглощение —• — 158
Потери с мочой 6 14 91
Пассивные потери 749 485 91
Активное выделение 59
Обмен воды: осмотический баланс, гормональная регуляция
61
ток D2O в разбавленной среде меньше, чем в нормальной морской воде [331].
В разведенной среде уменьшается проницаемость не только для воды, но и для солей, как видно, например, из данных для Pachy-grapsus (в мкэкв Na/20 г веса краба в 1 ч) [296] (см. нижнюю таблицу на стр. 60).
У Hemigrapsus nudus пассивное поступление ионов натрия равно 20 мкмоль/(г-ч) в нормальной и только 3,9 мкмоль/(г-ч) — в
35 %-нои морской воде. У Pachygrapsus в морской воде в период между линьками обмен натрия протекает со скоростью 20 мкэкв/г-ч. При этом весь обмениваемый натрий также подразделяется на две порции и около 15% всего количества натрия в организме не обменивается. На стадии мягкого незатвердевшего панциря обмен идет в г 4 раза быстрее, чем меж-ду линьками. В основном обмен осуществляется че-
Рис. 1-13. Проницаемость для воды (в порядке убывания) у осмоконформера (Macropipus) умеренного регулятора (Carcinus) и пресноводного ракооб-
разного (Astacus) [296].
Измерено по количеству тритированной воды, оставшейся у краба через разные сроки после Удаления его из меченой среды. 1 — Astacus; II — Carcinus; III — Macropipus.
Время, ч
рез жабры и совсем не происходит через карапакс. Таким образом, виды, которые могут жить в солоноватых водах, имеют меньшую проницаемость для воды и ионов, чем строго морские виды; когда первые переходят* из концентрированной среды в разведенную, их проницаемость уменьшается. Особенности мембран, обусловливающие эти изменения проницаемости, пока еще неизвестны.
Выделение. Второе качество, способствовавшее заселению солоноватых вод, заключается в способности к увеличению объема и Разбавлению мочи. В морской воде моча Carcinus может быть либо Изоосмотичной, либо слегка гиперосмотичной, либо гипоосмотичной
62
Глава 1
по отношению к гемолимфе. Она участвует главным образом в ионной, а не в осмотической регуляции. В разведенной морской среде моча гипоосмотична по отношению к гемолимфе и, следовательно, участвует в осморегуляции; тем не менее она остается более концентрированной, чем окружающая среда. У Carcinus выведение мочи с 3,6% веса тела за день в условиях обычной морской воды увеличивается до 33% веса тела за день в 40 %-ной морской воде
Рис. 1-14. Электронная микрофотография клеток жабр краба Callinectes (любезно предоставлено Коллендом).
Внизу — поверхность кутикулы; вверху — гемолимфа с гранулярной основной мембраной» Г—аппарат Гольджи; ПД — перегородчатые десмосомы.
[315]. Потери натрия с мочой составляют 2,7% общего его выделения в морской воде и 21 %—в 40%-ной морской воде. Каждая антеннальная железа у Carcinus является выделительным органом, состоящим из целомического мешка, через который может идти фильтрация канальцевого лабиринта и пузыря. Соотношение концентраций в моче и крови (моча/кровь) для нереабсорбируемых веществ (вроде инулина или сорбитола) в морской воде равно 1» что свидетельствует об отсутствии поглощения воды после фильтрации.
Обмен воды: осмотический баланс, гормональная регуляция
63
Глюкоза активно реабсорбируется до достижения пороговой концентрации в крови, равной 150 мг%; если же реабсорбцию затормозить флоридзином, то отношение моча/кровь для глюкозы станет близким к 1. В 50 %-ной морской воде образование мочи увеличивается в 4 раза, а реабсорбция глюкозы возрастает лишь вдвое [34].
Омар Homarus относится к осмотически лабильным формам, у которых внутренняя осмотическая концентрация на небольшую постоянную величину превышает наружную; моча у них изоосмотич-на крови, а ректальная жидкость слегка гиперосмотична [84]. у Hemigrapsus nudus потери натрия с мочой равны 0,95 мкмоль/(г-ч) в 100%-ной морской воде, а в 30%-ной составляют 4,49 мкмоль/(г-ч) [282]. Отношение моча/кровь для хлора равно 1,26 в изоосмотической среде и 1,63 в гиперосмотической, что говорит о более быстрой по сравнению с хлором реабсорбции воды из жидкости канальцев. В гипотонической же среде отношение моча/кровь для хлора составляет 0,64; это означает, что здесь реабсорбция хлора идет быстрее, чем реабсорбция воды.
Итак, у морских животных моча выводится в меньшем количестве, чем у эвригалинных форм и у животных, обитающих в солоноватой воде; пресноводные животные, как правило, выделяют меньше мочи, чем прибрежные крабы, посаженные в пресную воду. Eriocheir, мохнаторукий краб из Западной Европы, является исключительно эвригалинным, и объем его мочи при изменении концентрации среды изменяется очень мало; осморегуляция осуществляется за счет малой проницаемости и активного поглощения солей жабрами. Ниже приводятся данные о норме потерь натрия с мочой у следующих видов [317]:
Потери Na с мочой, мкмоль! (100 г-ч}
Carcinus Eriocheir Potamon Astacus
1782 в морской воде
20 в солоноватой воде
80 в пресной воде
15 в пресной воде
Активное поглощение ионов. Третий и очень важный механизм осмотической регуляции в разведенной среде—-это активное поглощение ионов натрия и хлора, главным образом жаберными мембранами. Если Carcinus поместить в разведенную среду, он теряет соли; по достижении в крови критической концентрации натрия начинается мобилизация аминокислот из тканей и активное поглощение натрия из внешней среды [33]. Механизм активного поглощения натрия насыщается наполовину при концентрации 20 мМ Na в среде. Активация зависит от внутренней концентрации натрия [315, 316]; поглощение начинается, когда концентрация натрия в крови падает примерно до 400 мМ и достигает максимальной скорости (насыщения) при 300 мМ. Если концентрация натрия в кро-
64
Глава 1
ви Carcinus падает с 10 до 30 мМ, его поглощение возрастает в 13 раз. У Hemigrapsus активное поглощение натрия стимулируется в 50 %-ной морской воде.
Краб Callinectes активно абсорбирует соли из разведенной среды, о чем свидетельствуют участки жабр, легко окрашиваемые серебром. Эти окрашенные участки гораздо больше и ярче у животных, живущих в разведенной солоноватой или пресной воде; их клетки между складками или выростами со стороны, соприкасающейся с гемолимфой, содержат длинные плоские митохондрии (рис. 1-14). Строго морские виды не способны к активной абсорбции солей. Сравнение представителей разных родов по тем концентрациям натрия в среде, которые необходимы им для полунасыщения процесса поглощения, показывает, что у форм, обитающих в солоноватых водах, вроде Carcinus, насыщение происходит в средах с более высокими концентрациями, чем у пресноводных форм.
Корреляция между транспортом натрия и экологическими условиями проявляется следующим образом [316]:
Среда, вид животного Na крови, мМ Потери, мкМ/(ч -50 г) Наружная концентрация для полунасыщения системы поглощения, мМ
Морской Carcinus Eriocheir, обитающий в солонова- 300 280 891 102 20 1,0
той воде Gammarus duebeni, обитающий в со- 1,5
лоноватой воде Пресноводный Astacus Пресноводный Gammarus pulex 184 7,5 0,2—0,3 0,15
Разность потенциалов между наружной и внутренней средами организма. С проницаемостью и активным транспортом ионов через жабры связано возникновение электрических потенциалов, обнаруживаемых, например, между кровью и внешней средой интактных животных или между поверхностями изолированных жабр. Кровь интактного Callinectes обнаруживает по отношению к нормальной морской воде некоторую электроотрицательность, увеличивающуюся при разведении этой воды до 50%; по сравнению же со 150 %-ной морской водой кровь электроположительна. Замена хлорида среды сульфатом или ацетатом изменяет ситуацию на обратную, что говорит об активном поглощении хлоридов в разбаВ" ленной среде [234]. Поглощение ионов жабрами Callinectes можно замедлить с помощью уабаина или замены некоторого количества натрия литием. Подобным же образом гемолимфа Pachygrapstis имеет отрицательный потенциал 3 мВ в 80%-ной, 2 мВ в 100%_ной и 1 мВ в 140 %-ной морской воде [296]. У стеногалинного морского краба Libinia потенциалы не бонаружены даже в 90 %-ной морской
Обмен воды: осмотический баланс, гормональная регуляция
65
воде, т. е. при том максимальном разведении, которое он еще переносит; скорее всего, у этого краба отсутствует механизм активного транспорта. У креветки Palaemonetes потенциал минимален в среде, изоосмотичной крови (50—65%-ная морская вода), и более отрицателен в случаях, когда среда концентрирована в большей или меньшей, чем кровь, степени. Это объясняется тем, что хлориды активно поглощаются в разбавленной среде, а натрий активно выделяется в концентрированной среде [275]. По-видимому, ионы хлора и натрия участвуют в образовании потенциала в различных соотношениях у разных животных. Между наружной и внутренней стенками жабр Maja, у которого ионный обмен протекает пассивным путем, никакого потенциала обнаружено не было; однако у Carcinus внутренняя поверхность жабр оказалась слабоположительной, когда NaBH = NaHap, и отрицательной, когда Na вн <NaHap [184].
Чтобы установить, имеет ли в данном случае место активное поглощение натрия, применили анализ соотношения потоков ионов внутрь и наружу (см. стр. 31). Разности потенциалов между обеими поверхностями стенки жабр у Maja и Carcinus оказались близкими к нулю во всем применявшемся диапазоне разведений морской воды. Следовательно, если ион диффундирует пассивно, то Лш/Лир должно равняться Свн/Снар. Приводимые ниже данные указывают на то, что в ряду разведенных сред, где отношение Свн/^нар уменьшается, у Carcinus активное поглощение имеет место, а у Maja — нет [184]:
NaBH/NaHap 1,0 0,76 0,4 0,2
Maja, /внМнар 1,0 0,76 0,38 0,19
Carcinus, «/вн/7нар 0,95 0,90 0,70 0,60
Обмен веществ. В разведенной среде эвригалинные ракообразные (Carcinus, Gammarus, Locusta или Uca) поглощают больше кислорода, чем в нормальной морской воде. Часть этих повышенных энергетических потребностей связана с активным поглощением ионов и образованием разведенной мочи. У других ракообразных, таких, как Ocypode и Palaemonetes, поглощение кислорода возрастает как при уменьшении, так и при повышении солености морской воды, а метаболизм у третьих, например у Eriocheir, от солености не зависит [185]. Поглощение кислорода митохондриями, выделенными из жабр краба, в разведенной среде повышается, причем такое повышение выражено больше в митохондриях крабов, живущих в солоноватой воде, чем в митохондриях морских крабов. Это явление может явиться результатом набухания митохондрий, которое идет и in vivo [183]. Поглощение ионов жабрами Callinectes уменьшается под действием уабаина или натриево-ли-тиевой среды, т. е. этот участок обмена веществ связан с транспортом натрия [234].
5—1332
66
Глава 1
Изменения содержания аминокислот. Ранее уже упоминалось о том, что осмотические изменения (особенно тканевые) у многих осмотически лабильных организмов обусловлены в большей степени сдвигами в концентрациях аминокислот, чем движением неорганических ионов. Если Carcinus перенести в разведенную среду, то концентрации аминокислот в его мышцах уменьшатся, а в крови увеличатся. Отношение моча/кровь увеличивается следующим образом [33]:
Среда
морская вода пресная вода
Свободные аминокислоты в мышцах, мМ. 271 160
Свободные аминокислоты в крови, мМ. 5,6 2,4
Сравнение креветок (Leander) из 30 и из 100%-ной морской воды показало, что осмотические концентрации в крови и тканях у животных из нормальной морской воды на 30% выше. Содержание аминокислот в мышцах этих животных также было больше на 23%, чем у креветок из разведенной среды (ср. с различием в 300% между осмотическими концентрациями двух сред [173]). У Eriocheir мышечные концентрации аланина, глутаминовой кислоты, пролина и глицина (но не аргинина) были больше при обитании в морской воде, чем пресной. Аммиак в морской воде также выделялся в меньшем количестве, чем в пресной, что свидетельствует о процессах синтеза аминокислот, имеющих место при обитании в морской воде [ИЗ]. После пребывания краба в течение 46 дней в пресной воде (последовавшего за пребыванием в морской воде) концентрация аминокислот в его мышцах уменьшалась на 41% [363].
Поведение. У некоторых ракообразных, живущих в эстуариях и на литорали, адаптивное поведение может играть важную роль в выборе определенной солености воды. Например, Pachygrapsus, помещенный после адаптации к значительной солености в условия, где есть градиент концентраций, предпочитает выбирать пониженные концентрации; для особей, адаптированных к разведенной среде, характерен противоположный выбор. У африканского морского краба Jasus на антеннулах имеются рецепторы, возбуждаемые разведенной морской водой. Розовые креветки Penaeus, которые вылупляются в морской воде, а на личиночной стадии входят в эстуарии, на послеличиночной стадии держатся в прибрежных водах с низкой соленостью. Они могут воспринимать градиент концентра-
Обмен воды: осмотический баланс, гормональная регуляция
67
пии равный 1%. Когда позже их молодь возвращается в море, лир'уже обладает положительным реотаксисом только к высокой солености [169].
Гаммариды — эвригалинные оюивотные
У представителей рода Gammarus, куда входят морские, солоноватоводные и пресноводные виды, можно найти примеры взаимодействия самых разнообразных механизмов осмотической регуляции. Некоторые виды приспособлены лишь к узкому диапазону солености, другие же проявляют исключительную эвригалинность.
Рис. 1-15. Зависимость осмотической концентрации крови от осмотической концентрации морской воды у 4 видов гаммарид -[376].
О Marinogammarus finmarchicus; ф Gammarus occanicus; □ Gammarus tigrinus; Gammarus fasciatus.
Морские виды рода Gammarus в разбавленной среде осуществляют гиперосмотическую регуляцию; эта регуляция прекращается у них пРи более высоких концентрациях, чем у видов, обитающих в солоноватых и пресных водах (рис. 1-15). Характер осмотической регуляции у морского вида G. locusta и обитающего в солоноватых во-Дах вида G. duebeni резко отличается от наблюдаемого у пресно-в°Дных видов G. pulex и G. lacustris. Gammarus duebeni (встреча
5*
68
Глава 1
ются в Черном море, в пресных водоемах Англии и в теплых источниках Исландии) переносят значительные изменения солености и температуры воды. Температурная адаптация и устойчивость к солености взаимно связаны таким образом, что в условиях оптимальной солености (от 8 до 20%) организм устойчив к крайним температурам; предельные же солености (высокая или низкая) переносимы только при оптимальных температурах (4—16°C), а для гиперосмотической регуляции низкая температура благоприятнее, чем высокая [184а]. У G. duebeni содержание натрия в гемолимфе уменьшается с 230 до 175 мМ при переходе из среды, содержащей 6 мМ, в среду, содержащую 0,5 мМ натрия. В течение двух часов после помещения его в разведенную среду начинается образование гипоосмотической мочи, хотя кровь за это время еще не успевает сильно разбавиться. Следовательно, стимуляция разведения мочи не может достигаться только концентрацией крови [213—216]. В морской воде моча изоосмотична крови, и 80% натрия выводится с мочой. В разведенной среде объем мочи увеличивается, а концентрация ее уменьшается, т. е. выделительные органы препятствуют потере натрия. В пресной воде у G. pulex моча более разбавлена и меньше подвержена изменениям в связи с условиями внешней среды, чем у G. duebeni. Экскреторные канальцы у G. duebeni длиннее, чем у морского G. locusta. У G. pulex при концентрациях Na ниже 0,2 мМ 82% Na теряется благодаря диффузии, а 18% выводится с мочой [344].
Подобно крабам, морской вид Marinogammarus finmarchicus более проницаем для воды и солей, чем виды солоноватых вод G. zaddachi и G. tigrinus [344]. Другой эвригалинный равноногий рачок выделяет гипоосмотическую мочу в среде с концентрацией 20% или изоосмотическую мочу в среде, более концентрированной. В крови концентрации Na, К, Са и С1 выше, a Mg значительно ниже, чем в окружающей среде [242].
Важное различие между видами рода Gammarus состоит в их способности поглощать натрий. У эвригалинного G. duebeni процесс поглощения прекращается при более высоких внешних концентрациях, чем у пресноводного G. pulex. У G. lacustris активность этого процесса достигает половины максимальной его скорости (т. е. Км) при внешней концентрации натрия, равной 0,14 мМ, а у G. duebeni Км находятся между 1,5 и 2,5 мМ натрия [344]. Если внешняя концентрация натрия уменьшается, то активное поглощение его из среды и реабсорбция в органах выделения увеличиваются. Механизм чувствительности и природа регуляции активного поглощения через мембраны еще не выяснены, но они, вероятно, различны у разных видов и изменяются при акклимации отдельных особей.
Итак, разнообразные виды адаптаций позволяют морским ракообразным осваивать эстуарии и в большей или меньшей степени вторгаться в пресноводные водоемы. Адаптация частично основана
Обмен воды: осмотический баланс, гормональная регуляция
69
генетической базе, а частично вызывается модифицирующим влиянием среды.
Дичинки более чувствительны к разбавлению среды, чем взрослые животные, причем их чувствительность повышается при крайних температурах. Адаптация, обеспечивающая гиперосмотичность животного, проявляется в наличии ограниченной и изменяющейся проницаемости для воды и солей; выделении обильной разбавленной мочи; активном поглощении ионов; существовании градиента потенциалов между наружной и внутренней поверхностями жабр; использовании аминокислот для забуферивания осмотических сдвигов и, наконец, в адаптивном поведении.
Гипоосмотическая регуляция
Освоение суши и очень соленых вод. Некоторые ракообразные, обладающие гиперосмотической регуляцией, способны и к гипо-осмотической регуляции, т. е. они могут поддерживать концентрацию своей крови на более низком, чем концентрация среды, уровне. Полученные для них кривые «кровь — среда» обнаруживают в определенных пределах концентраций более или менее четко выраженные плато (рис. 1-16). У некоторых ракообразных, обладающих гипоосмотической регуляцией, жидкости тела в норме менее
Рис. 1-16. Зависимость осмотической концентрации сыворотки от солености среды у трех видов сухопутных крабов [145].
величины выражены в процентах морской воды. / — Cardlsoma; II — Varuna; III — Se-sarma; IV — изоосмотичность.
'О
Глава 1
концентрированны, чем морская вода; часть из них живет в гипер-галинных озерах, а многие проводят немало времени на суше. Солоноватоводные виды каляноидных веслоногих рачков способны как к гиперосмотической, так и к гипоосмотической регуляции, пресноводные же виды обладают только гиперосмотической регуляцией.
Крабы, обитающие в приливно-отливной зоне и на суше. Многие крабы, немало времени проводящие на суше, могут сохранять свою гипоосмотичность. Pachygrapsus crassipes живет среди скал выше линии низкого прилива; в концентрированной морской воде он обнаруживает слабую гипоосмотическую регуляцию. Скрипучий краб Uca подолгу находится на воздухе среди песка и ила. Он хорошо поддерживает свою гипоосмотичность и защищен от высыхания. Во время длительного пребывания на воздухе концентрация его крови увеличивается в меньшей мере, чем концентрация крови скальных крабов, таких, как Hemigrapsus. Краб пальмовый вор Birgus, обитающий в южных районах Тихого океана, способен к гипоосмотической регуляции только в крайних, создаваемых в эксперименте условиях, в норме он — обитатель суши и может даже утонуть в морской воде. Birgus пьет пресную воду и заполняет ею свою жаберную камеру без погружения в воду [144]. У Uca, живущего в 100 или 175%-ной морской воде, моча может быть несколько гиперосмотичной по отношению к крови.
Подсушенный краб Pachygrapsus, погруженный в 140%-ную морскую воду, активно поглощает ее всем телом. На воздухе он может выделять ее в жаберные камеры. У Pachygrapsus и Uca, помещенных в 175%-ную морскую воду, концентрация магния в моче гораздо выше, а натрия ниже, чем у тех же организмов, со-'держащихся в 100%-ной морской воде; при этом у них наблюдается экстраренальное выделение натрия. Отношение моча/кровь для кальция и магния и общая осмотическая концентрация у наземного краба Cardisoma характеризуются следующими величинами [145]:
Среда
водопроводная вода морская вода 150%-ная морская вода
Са 0,42 0,47 0,42
Mg 1,93 4,4 15,7
Осмотическая концентрация 0,99 0,99 0,99
У Cardisoma, Sesarma, Pachygrapsus и Uca концентрации Mg в моче и ее осмотическая концентрация в гиперосмотической среде увеличиваются, чего не отмечали у наземного Gecarcinus, очень хорошо приспособленного к жизни на суше. У наземных крабов
Обмен воды: осмотический баланс, гормональная регуляция 71
потеря воды совершается главным образом через покровы тела; краб Potamon на воздухе теряет воды меньше, чем насекомые, и меньше, чем речной рак. Функциональное значение имеющейся у наземных крабов способности к гипоосмотической регуляции неясно. Было высказано предположение, что такая регуляция представляет собой адаптацию к испарению из жаберной камеры. Однако объем жаберной воды составляет менее 3% объема тела, поэтому соли, содержащиеся в ней, не должны были бы оказывать сильного влияния на кровь. Степень гипертоничности мочи очень невелика, и она может быть связана с активным выделением магния через антеннальные железы. У довольно значительной группы крабов, обитающих в условиях, сильно различающихся между собой, отношение осмотических концентраций моча/кровь близко к 1. Сюда относится Cancer, обитающий на сублиторали; Hemigrapsus, встречающийся от солоноватоводных до гипергалинных водоемов; полуназемный Pachygrapsus-, ночной, живущий среди песка Осуро-de; дневной, населяющий заиленные пески Uca; почти исключительно наземный Gecarcinus [144]. Способность к регуляции содержания натрия в крови и ее осмотической концентрации теряется при высоких температурах; в концентрированной морской воде Uca и (Jcypode погибают при 30 °C [125].
Для наземных крабов характерна способность к адаптации, связанной с дыханием, сохранением воды и поведением. Кровь Coenobita изоосмотична 80 %-ной морской воде и моче, которая образуется в небольших количествах. Обычно этот краб ночью ненадолго заходит в море, чтобы смочить жабры [144]. Gecarcinus обитает во влажном песке, откуда он может поглощать воду, но он гибнет, если песок смачивается морской водой. Gecarcinus имеет большие снабженные множеством мембран перикардиальные сумки, которые помогают поддерживать высокую влажность в жаберной камере и наполняются водой перед линькой, обеспечивая краба водой на стадии мягкой оболочки панциря [39]. Гормон центральной нервной системы, тормозящий линьку, в промежутках между линьками уменьшает или ограничивает набухание, возникающее при линьке [39]. Передняя кишка Gecarcinus между линьками хорошо проницаема для воды и солей; если удалить у него глазной стебелек, то кишка теряет свою проницаемость, которую, однако, можно восстановить введением экстракта торакального ганглия [233]. Gecarcinus будет пить воду, если она доступна; вода из песка благодаря капиллярным силам поступает по пучкам волосков, имеющимся между вторыми и третьими ходильными ногами, к перикардиальным сумкам, где она может сохраняться или поступать в жаберную камеру. Отсюда она может поглощаться Жабрами. Таким образом, перикардиальные сумки сохраняют воду и обеспечивают водоснабжение при линьке. Сами жабры невелики, а Жаберные камеры частично могут быть заполнены воздухом (38, 40].
72
Глава 7
Поведение наземных крабов обусловлено в основном зрительными и слуховыми ощущениями. При высоких температурах, например в полдень, эти крабы скрываются в норах. Основная потеря воды за счет испарения происходит через наружные оболочки. Кутикулярная проницаемость возрастает в следующем ряду видов: Gecarcinus < Cardlsoma < Uca<Sesarma< Callinectes < Menippe [156].
Рис. 1-17. Зависимость осмотической концентрации крови от солености среды у креветки Crangon при 5 и 15 *43,
Гиперосмотическая регуляция идет лучше в холодной, чем в теплой среде [114]. / — кровь при 5° С; // — кровь при 15° С; III— внеклеточная концентрация.
Креветки, морские креветки (артемии), некоторые равноногие раки. Способность .к гипоосмотической регуляции обнаружена у многих креветок и десятиногих раков, отдельные виды которых мигрируют между морем и солоноватыми водоемами. Европейский десятиногий рак Palaemonetes varians в норме изоосмотичен 65 %-ной морской воде, т. е. гипоосмотичен по отношению к нормальной морской воде. Как в более разведенной, так и в более концентрированной морской воде у него усиливается образование мочи. У Crangon из Балтийского моря устойчивость к повышенной и пониженной солености максимальна при 5 °C, однако в солоноватой воде при температуре замерзания он погибает. Пересекающиеся осмотические кривые «кровь — среда» у Crangon и Gamma'
Обмен воды: осмотический баланс, гормональная регуляция
73
duebeni наглядно показывают, что в условиях низкой солености
5 °C концентрация крови у них выше, чем при 15 °C, а в условиях высокой солености имеет место обратная картина [114] /рис. 1-17)- Из двух видов креветок у Syncaris в разбавленной спеде образуется гипоосмотическая моча, а у Palaemon моча и кровь как в разведенной, так и в концентрированной морской воде изоосмотичны.
В нормальной морской воде Palaemonetes varians гипоосмоти-чен а его моча изоосмотична крови. Важное значение внепочечной регуляции демонстрируют следующие данные (в мэкв) [276]:
Морская вода
100%-ная 65%-ная 2%-ная
Na среды Na крови С1 среды С1 крови Константа скорости поступления Na, ч-1 Константа скорости выделения Na, с"1 Обмен Na, ммоль/(кг-ч) Обмен С1, ммоль/(кг-ч) Потенциал (отрицательный), мВ 460 328 540 342 1,25 1,09 150 50 13—40 73,5 20,7 7—10 (50%-ная морская вода) 18 28,2 11—32
В 100%-ной морской воде происходит активное внепочечное выделение Na, благодаря чему кровь делается электроотрицательной и поддерживается равновесие хлоридов в организме. В 2%-ной морской воде активно поглощаются хлориды, что также обеспечивает электроотрицательность; при этом происходит активное поглощение некоторого количества натрия. При концентрациях морской воды, меньших чем 2%., регуляция прекращается. Artemia прекрасно приспосабливается к воде Большого Соленого озера, соленость которой равна 22О%о- Она может жить и в солеварнях, гДе хлористого натрия так много, что он выпадает в осадок. Вместе с тем она выживает и в морской воде, разбавленной до солености 2,6%о. Ее потребность в солях удовлетворяется в основном за счет NaCl. При солености среды, равной 58%о, осмотическая концентрация ее крови эквивалентна 13%о-ному раствору, а в среде, концен-тРация которой выше втрое, концентрация ее крови возрастает ме-иее чем в 2 раза. В любой среде, более концентрированной, чем ^5%-ная морская вода, кровь этого животного становится гипоос-мотичной. Проницаемость для воды и солей у Artemia ниже, чем У большинства других микроскопических ракообразных. Она обес-
74
Глава 1
Осмотическое давление гемолимфы Б
Рис. 1-18.
А — осмотическая концентрация кишечной жидкости (I) и гемолимфы (II) у Artemia при различной солености среды (в % NaCl). Б — концентрации (ммоль/л) Na+ (I), К+ (II) и С1" (III) в гемолимфе (а) и кишечной жидкости (б) у Artemia при разных осмотических концентрациях гемолимфы (в % NaCl) [78].
Рис. 1-19. Основные пути движения ионов и воды у гипоосмотическей ио отношению к среде Artemia.
Сплошными стрелками показано активное, а пунктирной — пассивное движение.
Обмен воды: осмотический баланс, гормональная регуляция
75
печпвает себя водой, абсорбируя ее из среды и выделяя соли с фекалиями. Artemia может выпивать воду в количестве, эквивалентном 3% веса ее тела, в 1 ч. На рис. 1-18 и 1-19 показано, что при разных концентрациях морской воды в кишечной жидкости поддерживается более высокая осмотическая концентрация, чем в гемолимфе, однако ее величина всегда ниже осмотической концен-
Рис. 1-20. Электронная микрофотография секреторных клеток жабр Artemia [73]. Четко выявлена структура митохондрий. А — синусоиды темной клетки с канальцами, переплетающимися с эндоплазматической сетью (Б). Гемолимфа вверху, за пределами изображения.
трации концентрированных сред. В кишечной жидкости содержание натрия и хлоридов ниже, чем в гемолимфе, поэтому NaCl и вода всасываются из кишечника, в то время как другие соли удаляются из кишечника наружу. Эпителий первых десяти жабр активно выделяет NaCl в гиперосмотическую среду и может поглощать его из разведенной среды. Таким образом, кишечник является основным органом регуляции водного баланса у Artemia, а жабры — органом регуляции баланса NaCl [78].
В жабрах Artemia имеются участки эпителия, окрашивающиеся серебром, а клетки, участвующие в транспорте ионов, содержат группы митохондрий, расположенных между плоскими синусами, которые омываются гемолимфой [75] (рис. 1-20). Уабаин-чувствительная АТФаза, выделенная из Artemia, содержавшихся в 400%-ной морской воде, в 5 раз более активна, чем такая же ЛТФаза,
76
Глава 1
выделенная из креветок, содержавшихся в 50 %-ной морской воде. Уабаин, который блокирует натриевую АТФазу, в среде с высокой соленостью вызывает гибель животного [9].
Как показывают эксперименты с мечеными атомами, общий обмен натрия у Artemia весьма высок, причем в концентрированной среде он выше, чем в разведенной:
[Обмен Na
%/ч экв/(чг)
В морской воде В 50%-ной морской воде 42 35 42,5 31,7
Через кишечник в организм поступает около трети общего количества Na; большая часть остального Na получается с помощью обменной диффузии или пассивной диффузии через жабры, причем эта доля уменьшается при помещении животного в разбавленную среду (см. гл. 2). Такое уменьшение представляет собой реакцию на общую осмотическую концентрацию, а не на концентрацию Na или С1. Тем не менее ионы натрия и хлора обмениваются независимо друг от друга [354]. Основные механизмы гипоосмотической регуляции у Artemia удивительно похожи на аналогичные механизмы эвригалинных морских рыб.
Неактивные цисты Artemia исключительно устойчивы к обезвоживанию и холоду. В норме в их крови содержится трегалоза, которая может превращаться в гликоген. Перед инцистированием (которое может быть вызвано значительным повышением осмотической концентрации среды) потребление кислорода и концентрация трегалозы уменьшаются, а концентрация глицерина повышается до значительного уровня. Глицерин накапливается между эмбрионом и оболочкой, а при вылуплении вытекает во внешнюю среду [67].
Равноногие рачки встречаются в морской и пресной воде и в разнообразных наземных местообитаниях. Ligia oceanica живет между камнями у границы высокого прилива и выше нее, он гипо-осмотичен в морской воде (Двн=—2,15 при Днар =—1,98) и хорошо поддерживает гиперосмотичность при снижении концентрации морской воды по крайней мере до 50%. Во влажном воздухе концентрация его гемолимфы падает до Двн=—1,44, а в сухом воздухе Двн——3,48 (рис. 1-21). Таким образом, рачки Ligia устойчивы к изменениям осмотических концентраций среды в довольно широком диапазоне. Равноногий морской рак Idotea, живущий среди растительности в межприливной зоне, напротив, поддерживает изо-осмотичность по отношению к среде [355]. Было проведено сравнение популяций Mesidotea из Балтийского моря и озер Сканди
Обмен воды: осмотический баланс, гормональная регуляция
навии. Оказалось, что балтийские популяции не живут при разве-ениях ниже 5,5 мМ Na на 1 л, в то время как озерные популяции Размножаются в пресной воде. Поверхность тела равноногих раков из озерных популяций менее проницаема, а активное поглощение натрия у них достигает состояния полунасыщения при 2,4—5 мМ в противоположность 10—14 мМ, характерных для балтийских популяций [80]. Очевидно, приспособление к жизни в пресной воде
Рис. 1-21. Зависимость осмотической концентрации гемолимфы от солености среды у равноногого рачка Ligia, обладающего гипоосмотической регуляцией [380].
I — при температуре 22° С; II — при 12° С; III — изоосмотичность.
сопровождалось уменьшением проницаемости для NaCl и повышением сродства к Na в системе активного всасывания [80]. Другой Равноногий рак, Halmiscus, обитает в гипергалинных озерах Австралии; он изоосмотичен при 19°/оо и переносит изменения солености в диапазоне от 1 до 160%о [15].
Итак, способностью к гипоосмотической регуляции обладают Ракообразные, много времени проводящие на суше, обитатели гипергалинных озер и некоторые морские креветки и равноногие ра-Ки- Для большинства этих животных характерна низкая проницае
78
Глава 1
мость поверхности тела, с помощью которой наземные крабы защищаются от пересыхания, а ракообразные, живущие в гипергалин-ных водах, — от осмотических потерь. У наземных крабов выработались структурные и поведенческие приспособления для поглощения воды. Водные формы активно выделяют соли главным образом через жабры. Все эти виды образуют небольшое количество гипо-осмотической мочи.
Хорошо развитая гиперосмотическая регуляция.
Пресноводные ракообразные
Осмотическая концентрация гемолимфы у пресноводных ракообразных выше, чем у других пресноводных животных: Авн крови итальянского краба Telphusa fluviatiles равна —1,17, а Авн речных раков Orconectes и Astacus в пресных водоемах характеризуется величинами от —80 до —85. Осмотическая регуляция у пресноводных крабов изучена еще недостаточно. Когда речного рака помещают в разведенную (до 50%) морскую воду, концентрация его гемолимфы повышается, и рак продолжает оставаться гиперосмо-тичным; однако при более высоких концентрациях среды (60%-ная морская вода) он становится изоосмотичным ей. Речных раков удавалось сохранять живыми в течение нескольких месяцев в 50%-ной морской воде, хотя в норме эти раки в солоноватых водах не встречаются. Приводимые ниже цифры говорят о том, что, когда рака Astacus, взятого из пресной воды, акклимируют в течение месяца к 50%-ной морской воде, концентрация аминокислот в его мышцах повышается значительно сильнее, чем концентрация солей [99].
Пресная вода 50%-ная морская веда
Анар, °C —0,02 —0,95
Авн, °C —0,8 —1,04
Аминокислоты мышц, мМ. 139,9 204
К мышц, мэкв 95 105
К крови, мэкв 4,6 6
У речного рака, Pacificastacus, адаптировавшегося в течение 48 ч к 60%-ной (или 70%-ной) морской воде, содержание ионов в крови увеличивалось более значительно. Образование мочи, т. е. фильтрация, уменьшалось, хотя отношение концентрации инулина в моче к концентрации его в крови и не изменялось [280]. Эти данные приведены в табл. 1-3.
Если экскреторные поры речного рака закупорены, то в пресной воде вес его тела будет увеличиваться, а в гиперосмотической среде— уменьшаться. Образование мочи в пресной воде будет выражаться в несколько более высоких цифрах, чем у многих морских ракообразных (4,37 [178] или 8,37% веса тела [54] в день). У Astacus в пресной воде моча образуется в количестве, эквивалентном 4,6% веса тела в день. Это говорит о существовании хотя и низкой, но все же заметной проницаемости его для воды. Изо-
Обмен воды: осмотический баланс, гормональная регуляция
79
Таблица 1-3
Ионные концентрации жидкостей тела речного рака Pacificastacus до и после акклимации в 60%-ной морской воде
Пресная вода 60%-ная морская вода
величины моча/кровь величины моча/кровь
Осмотическая концент- 421 моем 0,095 ’500 моем 0,38
рация крови Na крови 195 мМ 0,07 232 мМ 0,266
С1 крови 180 мМ 0,016 213 мМ 0,278
К крови 4,9 мМ 5,5 мМ
К мышц 111,9 мМ 122,4 мМ 2,13
Инулин Выведение инулина 2,45 мл/(кг-ч) 2,Н 0,03 мл (кг*ч)У
лированные жабры проницаемы для воды на уровне примерно 19 л/(г-день); эта величина постоянна и, как показывает расчет, равна 0,12 с-1 [25]. Моча речного рака очень разбавлена, что можно видеть из следующих данных:
Осмотическая концентрация, ДзаМерз Na, мМ.
Хлориды, мМ
Среда Гемолифма Моча
0,018 0,81 0,09
0,4 203 6,0
195 10
В каких бы условиях ни находился речной рак, его моча всегда содержит соли. Речной рак весом 50 г теряет 600 мМ хлоридов в день. Некоторое количество солей обычно поставляется с пищей, однако речной рак неделями может поддерживать солевой баланс, находясь без пищи в водопроводной воде. Крог в течение 3 дней промывал речных раков дистиллированной водой и помещал их затем в 0,02%-ный рингеровский раствор; животные начинали поглощать хлориды со скоростью 2,3 мМ/ч, несмотря на то, что наружная их концентрация была равна 2 мМ, а внутренняя — 100 мМ. Речной рак активно поглощает также Вг~; кроме того, он поглощает С1~ из КС1, Na+ и С1_ из NaCl и Na+ из Na2SO4 [193]. При перемещении речного рака из водопроводной воды в дистиллированную содержание натрия в его моче уменьшается с 8 до 1 мМ; выход натрия в дистиллированную воду составляет 64,5% выхода его в водопроводную воду [54].
Пребывание в течение некоторого времени в дистиллированной в°Де с последующим возвращением в водопроводную воду вызывало (в связи с уменьшением запасов натрия) значительное увеличение— в 6,8 раза — общего поглощения; потери натрия при этом были больше, чем обычно бывают в водопроводной воде. Следовательно, в этом случае имело место усиление обмена натрия, а не общего поглощения.
80
Глава 1
Если речного рака с нормальным содержанием натрия в крови помещать в серию растворов с повышающейся концентрацией, то содержание натрия в его крови почти не будет увеличиваться, пока концентрация этого элемента в среде не превысит концентрацию в крови, равную 200 мМ. При внешней концентрации Na, превышающей 300 мМ, концентрация его в крови и моче поднимается до одинакового уровня. В опытах с мечеными соединениями было показано, что обмен натрия происходит так, как если бы он проте-
1ОО 120 то 160 180 200 220 2W 260 280 300' Концентрация натрия В кроВи
Рис. 1-22. Зависимость обмена натрия у речного рака от его концентрации в крови [54].
А — поступление Na, Б — потери Na. I — выведение с мочой; II — общее количество выделенного Na; III — потеря путем диффузии; IV— поступление 22Na; V — поступление в норме. Косо заштрихованная площадь показывает долю активного переноса. Концентрация Na выражена в ммоль/л.
кал в каком-то едином объеме, эквивалентном 46,9% объема всего тела [54]. В пресной воде константа проницаемости для выхода Na при его концентрации в крови, равной 310 мМ, составляла 0,0076 ч-1, а при концентрации в крови, равной 186 мМ,— 0,0047 ч-1. Эта величина соответствует выходу 0,87 мкэкв/(г-ч), причем потери Na с мочой составляют 0,049 мкэкв/(г-ч), или 5,6% общего выделения Na. Зависимость между потерями, происходящими посредством обмена, диффузии и выведения с мочой, при разных концентрациях Na в среде показаны на рис. 1-22 [54]. В норме у речного рака поддерживается следующий баланс: при равновесии поступление равно выделению, когда NaBH=200 мМ, а NaHap = 2 мМ.
С мочой выделяется 6% натрия, а 94%—через поверхность тела (по-видимому, через жабры), причем 2/з из этих 94% выводится с помощью диффузии и 7з — с помощью обмена. У живого непо-
Обмен воды: осмотический баланс, гормональная регуляция
81
врожденного рака кровь по отношению к водопроводной воде электроположительна и ее потенциал равен 6,6 мВ [79].
F Различия в количестве хлоридов, содержащихся в крови и в моче, можно, по-видимому, объяснить реабсорбцией солей в гемолимфу через почки. Почка речного рака (антеннальная железа) в ее начальном отделе представляет собой целомический мешок, пронизанный кровеносными сосудами и синусами и выстланный однослойным эпителием. За ним следует зеленый канальцевый лабиринт губчатого строения и длинный (3 см) нефридиальный канал. Последний открывается в мочевой пузырь. Все эти отделы, кроме мочевого пузыря, обильно снабжаются кровью, поступающей из сосудов в пространство гемоцеля. У омара, выделяющего изо-осмотическую мочу, лабиринт длиннее, но зато нефридиальный каналец недостаточно дифференцирован. У краба Carcinus совсем нет канальца. У пресноводного Gammarus pulex нефридиальный каналец длиннее, чем у морского G. locusta. Таким образом, вся почка ракообразного животного в принципе подобна одной структурной единице почки позвоночного. Эпителиальные клетки целомического мешка имеют длинные отростки с многочисленными отверстиями и широкие межклеточные лакуны, подобно подоцитам почечных клубочков млекопитающих [198]. Длинный нефридиальный каналец у пресноводных животных приспособлен, очевидно, для выделения разбавленной мочи.
Состав жидкостей, полученных из различных отделов почки ракообразного, представлен в следующей таблице (в миллимолях) [291]:
Кровь Целомический мешок Лабиринт Проксимал ьный каналец Дистальный каналец Лабиринт
С1 196 198 209 212 90 10
Na 242 207 168 168 182 12,4
К 7 8,5 6,8 13,3 12 0,9
Считается, что жидкость целомического мешка и лабиринта представляет собой фильтрат крови, практически изоосмотичный по отношению к ней, и что в нефридиальном канальце, по-видимому, происходит реабсорбция хлоридов и других растворенных веществ, после чего разбавленная моча поступает в мочевой пузырь. Доказательством того, что процессы фильтрации действительно имеют место, могут служить данные, полученные в опытах с инулином (который фильтруется, но не реабсорбируется). Если выделенная в течение 24 ч моча составляет 3% веса тела, то количество выведенного за этот срок инулина равно 4,4% веса тела, а отношение концентрации инулина в моче к концентрации в крови в дисталь-н°м канальце равно 1,8, что говорит о происходящей здесь реабсорбции воды [291]. По-видимому, фильтрование возникает в свя-6-1332
2
Глава 1
зи с необходимостью задержать углеводные полимеры с молекулярным весом от 50000 до 100 000 [186]. У омара, моча и кровь которого изоосмотичны, концентрации инулина в моче и в крови равны. У омара [57] и у речного рака [186] содержание глюкозы в крови довольно велико, а в моче оно близко к нулю; эти величины выравниваются под действием флоридзина (блокирующего поглощение глюкозы у млекопитающих). С повышением солености среды выведение почками инулина и объем мочи сокращаются; следовательно, доля реабсорбируемой воды остается постоянной. Основная задача заключается в уменьшении количества первичной мочи.
Поверхность клеток дистального канальца почки речного рака со стороны базальной мембраны имеет множество складок, а со стороны просвета гладкая; следовательно, активный перенос должен происходить со стороны, омываемой кровью. Клетки лабиринта снабжены микроворсинками и большими выбухающими вакуолями. Эпителиальные клетки целомического мешка и канальцев почек речного рака, находящегося в пресной воде, содержат крупные вакуоли. В клетках канальцев образуются тельца, имеющие форму пузырьков, которые выходят в просвет канальца [292].
У рака Procambarus обнаружена гормональная регуляция образования мочи: удаление глазного стебелька ведет к увеличению количества выделяемой им мочи и уменьшению концентрации крови. Инъекция экстракта мозга или глазного стебелька нормализует эти показатели. Так, в норме концентрация хлоридов в крови речного рака равна 195 мМ, после удаления глазного стебелька — 175 мМ, а после введения гомогената мозга—197 мМ [178].
У Eriocheir sinensis, мохнаторукого краба из северной Европы, гиперосмотическая регуляция настолько хорошо развита, что краб достигает половой зрелости в пресных водах; однако осенью он возвращается для размножения в море. Проницаемость для воды и солей, измеренная с помощью метки, у него очень мала. Концентрация его крови в то время, когда он находится в пресной воде, лишь немного меньше (Авн=—1,22°C), чем ее концентрация в то время, когда он находится в Северном море (Авн=—1,66 °C). Выделение мочи в пресной воде невелико (только 3—5 мл/день у краба весом 60 г), причем моча может быть слабо гиперосмотич-ной по отношению к крови независимо от характера среды. Потери хлоридов и аммиака при открытых и закрытых выделительных порах одинаковы. Eriocheir поглощает соли из очень разбавленных растворов против градиента концентраций. В изолированных жабрах, наполненных кровью, происходит перенос натрия из наружной среды, содержащей 8 мМ, в кровь, где концентрация натрия равна 300 мМ. Таким образом, в пресной воде почки повышают выделение ионов и задерживают сравнительно мало воды. Краб может жить в пресной воде благодаря низкой проницаемости его для воды и солей и способности жабр активно поглощать соли.
Обмен воды: осмотический баланс, гормональная регуляция 83
Итак, у большинства пресноводных ракообразных наблюдается весьма существенное усовершенствование механизмов гиперосмотической регуляции, имеющихся у крабов солоноватых вод. Это усовершенствование выражается в значительном снижении проницаемости, выделении разбавленной мочи и активном поглощении натрия, которое происходит при малых концентрациях его в среде.
Икра морских рыб и пресноводных животных
Яйца морских беспозвоночных изоосмотичны по отношению к окружающей среде и в соответствии с ее изменениями могут набухать или сморщиваться. Икра морских костистых рыб гипоосмо-тична по отношению к морской воде, тогда как икра пресноводных организмов гиперосмотична к среде. По-видимому, до того как разовьются выделительные органы, регуляция осмотического градиента осуществляется какими-то иными механизмами.
В оплодотворенной икре карпозубой рыбы Fundulus внутренняя концентрация соответствует АВн =—0,76 °C, т. е. составляет меньше половины концентрации окружающей морской воды. Если эту икру поместить в морскую воду при различных разведениях, то ее точка замерзания изменится незначительно. Содержание хлоридов в зародышах некоторых морских костистых рыб составляет от ’/so до ’/2 концентрации хлоридов в морской воде. После оплодотворения гидростатическое давление в икре Fundulus увеличивается до 150 мм рт. ст., а электрическое сопротивление оболочек яиц возрастает от 3450 до 13 290 Ом/см2 [181]. Наружный неэластичный хорион препятствует набуханию. Между хорионом и яйцом находится перивителлиновое пространство, заполненное прозрачным коллоидом, который, набухая за счет впитывания воды, заставляет яйцо сморщиваться и оказывает на него гидростатическое давление. Результаты экспериментов, в которых икру помещали в различные среды, свидетельствуют о том, что хорион проницаем для воды и солей, а желточная оболочка фактически непроницаема.
Икра пресноводных животных также должна быть защищена от разбавления. У зародыша форели Salmo Авн составляет от —0,43 До —0,49 (220 моем), а для перивителлиновой жидкости эта величина равна 31 моем при осмотической концентрации речной воды, равной 2 моем. Только что отложенная икра форели относительно проницаема; при помещении в солевой раствор ее проницаемость сохраняется. Будучи отложена в пресную воду, икра уплотняется, причем в течение первых трех часов происходит быстрое падение ее проницаемости. Для осмотической проницаемости икры характерны следующие константы:
Р, МКЗ/(мк2 с)
Икра форели перед откладыванием 0,06
Икра форели, уплотнившаяся в воде Меньше чем 0,004 Личинки Sialis 0,04—0,05
в*
84
Глава 1
Amoeba 0,35
Икра из яичников лягушки 0,89
Отложенная икра лягушки 1,2
Эритроциты 125
Другие данные говорят о том, что проницаемость для воды икры лягушки в 5—10 раз выше, чем икры форели. Этот расчет основан на том, что икра лягушки может поглощать воду в количестве, составляющем 7зоо ее объема в день [217], т. е. фактически проницаемость ее для воды очень мала. Подобным же образом в обмене натрия участвует только околожелточная жидкость. Накопления натрия в эмбрионе не происходит до тех пор, пока он не достигнет стадии «глазка» [277]. Снижение проницаемости у отложенной оплодотворенной икры по сравнению с икрой, находящейся еще в яичниках, наблюдалось также у перцины и ручьевой миноги. В икре лягушки осмотическая концентрация падает от величины, примерно эквивалентной 120 мМ NaCl (период откладывания икры), до 80 мМ (период закрывания бластопор), поскольку первоначальное набухание сменяется пониженной проницаемостью.
Раньше считали, что яйца пресноводных беспозвоночных покрыты относительно непроницаемыми оболочками. Однако яйца пла-норбид (брюхоногих моллюсков) при гаструляции теряют желточную оболочку и капсулярная оболочка (хорион) не задерживает воду и ионы. Зародыш, лишенный своей капсулы, может сам регулировать содержание воды и солей. Если обмен веществ подавлен, то зародыш набухает и жидкость накапливается в межклеточном пространстве, особенно в полости сегментации (дробления) бластулы. По-видимому, в норме жидкость активно удаляется из полости бластулы, эмбриональные клетки могут активно поглощать натрий, и, таким образом, возможно, что клеточная регуляция есть уже на самых ранних стадиях развития [16, 17].
Итак, можно заключить, что до развития выделительной системы проницаемость зародыша для воды и ионов крайне мала; о механизмах активного транспорта на ранних стадиях эмбрионального развития морских и пресноводных животных известно очень немного.
Адаптация к морской и пресной воде, к почве и к эндопаразитическому существованию
Простейшие
Тип простейших объединяет огромное многообразие довольно отдаленных форм, которые и обитают в чрезвычайно разнообразных условиях. У морских и паразитических простейших, по-видимому, нет никаких осмотических трудностей: они изоосмотичны. Однако эти организмы все же регулируют свой ионный состав и поддерживают определенный клеточный объем и форму. Некоторые
Обмен воды: осмотический баланс, гормональная регуляция
85
из них относятся к эвригалинным организмам и могут переходить от изоосмотической к гиперосмотической регуляции. Пресноводные простейшие гиперосмотичны по отношению к своей среде, и избыток воды у них выбрасывается их сократительными вакуолями. Обследование многих представителей ресничных показывает, что некоторые пресноводные виды могут выживать в растворах, соленость которых превышает 5%о, что виды солоноватых вод крайне эригалинны и что некоторые морские виды могут жить при солености среды 3%о [Н].
Водный баланс различных простейших определяли на основе данных об изменении объема и вакуолярного выделения в различных средах и с помощью анализа содержимого цитоплазмы и вакуолей. Регуляция объема у морских видов происходит обычно быстрее, чем у пресноводных.
Осмотическая концентрация у крупной корненожки Pelomyxa carolinensis, по данным измерения упругости пара, равна 103 моем, а у Spirostomum — 89 моем. Данные объемных измерений дают для Pelomyxa величину 94 моем. Осмотическая концентрация у Paramecium обусловлена в основном мелкими молекулами: осмотическая концентрация в 111 моем складывается из 6,5 мМ Na, 28,8 мМ К, 9,2 мМ С1 и 56,5 мМ аминокислот. Если осмотическую концентрацию среды увеличить, добавив сахарозу, то внутренняя концентрация возрастет вследствие увеличения количества аминокислот. Таким образом, внутренняя концентрация ионов у них поддерживается на относительно постоянном уровне [342] (рис. 1-23).
Вода поступает в организм простейших путем обменной диффузии, осмотического движения и через пищевые вакуоли. Корненожки имеют более низкую проницаемость для воды, чем инфузории, но у всех простейших проницаемость ниже, чем у развивающихся в воде яиц. На основании данных о проницаемости тяжелой воды и вычисленных площадей поверхностей тела было подсчитано, что у Pelomyxa количество жидкости, проходящей с помощью диффузионного обмена в течение 1 ч в клетку и из нее, превышает объем клетки в 13 раз. Однако осмотически активными являются только 2% рассчитанного клеточного объема, т. е. именно такое количество жидкости за это время должно быть выделено сократительной вакуолью [219]. Это хорошо согласуется с данными о том, что объем жидкости, выделившейся за 1 ч, составляет 3,8% клеточного объема.
Помимо той воды, которая проникает через клеточную поверхность, значительное ее количество поступает также с пищей; у ресничных проницаемость мембраны цитофаринкса, вероятно, выше проницаемости всей остальной поверхности тела. У пресноводных инфузорий отряда Peritricha количество воды, поглощаемой Пищеварительными вакуолями, может составлять от 8 до 20% количества, выделяемого сократительными вакуолями, а у Рагате-
36
Глава 1
cium эта величина составляет 30%. Связанное с питанием увеличение вакуолярного выделения наблюдалось у многих видов. У морской Amoeba mira, не получающей пищи, вакуолярное выделение почти прекращается, когда же она начинает питаться, у нее появляются большие вакуоли. У Paramecium активность сократительных вакуолей возрастает не только при получении пищи», но и
Рис. 1-23. Осмотическая концентрация у Тetrahymena в средах с различной осмоляльностью '[342].
<О — в разбавленной культуральной среде; в растворах сахарозы; неорганической
среде.
в том случае, когда вода просто насасывается ротовым отверстием. Некоторые инфузории, такие, например, как паразитические Ophryoscolecidae, могут закрывать свои ротовые отверстия; в это время пульсация их сократительных вакуолей сильно замедляется.
Сократительные вакуоли имеются у всех пресноводных простейших, у многих морских и у некоторых эндопаразитических видов. Результаты измерения объема и скорости их пульсации свидетельствуют о выполнении ими осмотических функций. У пресноводных .видов выделение идет активнее, чем у морских. У эвригалинных
Обмен воды: осмотический баланс, гормональная регуляция
87
видов вакуоли могут появляться в случаях, когда животные находятся в разбавленной среде. При переносе морской инфузории Amphileptus в 70%-ную морскую воду скорость сокращения ее вакуолей увеличивается на 21%. Когда пресноводную Amoeba verrucosa культивировали в морской воде возрастающих концентраций,, вакуолярная пульсация у нее замедлялась, а в 50 %-ной морской воде вакуолей совсем не было заметно. При первом погружении туфельки Paramecium в гипертонический солевой раствор ее тело уплощается, но затем возвращается к своей нормальной форме, а вакуолярное выделение заметно уменьшается. У одного из солеустойчивых видов Paramecium, у которого вакуолярная пульсация в пресной воде протекает со средним интервалом, равным 13 с, в 50 %-ной морской воде отмечается увеличение этого интервала до 32 с, а в 100%-ной до 65 с [118].
Морская инфузория Miamiensis в 25%-ной морской воде выделяет жидкость в объеме, эквивалентном своему клеточному объему, за 0,5 ч, в 100%-ной морской воде — за 1,1 ч, а в 175 %-ной — за 2 ч, т. е. она реагирует на осмотическую концентрацию, а не просто на наличие ионов самих по себе. Анализ цитоплазмы культивируемых в морской воде животных дает следующие результаты (в мМ): Na — 87,9; К — 73,7; Са — 3,7; Mg — 28,5; Cl — 60,8. Внутриклеточные концентрации К, Са и Mg в различных средах хорошо регулируются, регуляция же Na и С1 идет хуже. В 100%-ной морской воде общее содержание аминокислот в клетке равно 317 ммоль/кг; среди них больше всего аланина, несколько меньше глицина и еще меньше пролина; вместе они составляют 75% общего количества аминокислот. В морской воде различных концентраций увеличение клеточной осмотической концентрации обусловлено в гораздо большей степени повышением содержания аминокислот, чем электролитов. Важную функцию сократительных вакуолей составляет также выделение натрия [180].
Обычно сократительные вакуоли образуются при слиянии маленьких вакуолей или пузырьков. Они могут возникнуть в какой-то одной части клетки или в разных ее участках. У некоторых инфузорий имеется система специальных каналов, которые изливают свое содержимое в сократительные вакуоли. Сократительные вакуоли играют также определенную роль как секреторный орган. Об этом свидетельствуют результаты опытов, в которых применялись дыхательные ингибиторы.
Когда такие ингибиторы, как, например, цианид, динитрофенол или амитал, добавлялись к разбавленной среде, в которую были помещены инфузории, вакуолярное выделение у последних уменьшалось, а клеточный объем увеличивался. Вакуолярное выделение в значительной степени зависит и от температуры. Вокруг сократительных вакуолей сосредоточены митохондрии и другие гранулы,. а между каналами и саркоплазматическим ретикулумом заметны тончайшие канальцы. Как происходит наполнение мелких вакуолей
88 Глава 1
и каналов, неизвестно. Анализ содержимого цитоплазмы и вакуолей указывает на то, что мелкие вакуоли изоосмотичны, что они способны к активному поглощению жидкости и, становясь гипоос-мотичными, сливаются друг с другом.
Осмотическая концентрация, моем Na. мМ К. мМ
цитоплазма сократительные вакуоли среда цитоплазма сократительные вакуоли цитоплазма сократительные вакуоли
Pelornyxa carolinensis 117 51 2 0,57 19,9 31 4,6
[290] Amoeba proteus [304] 101 32 7
Эти результаты говорят о том, что калий реабсорбируется цитоплазмой, тогда как натрий выделяется из нее. Образование вакуолей обеспечивает, таким образом, и ионную, и осмотическую регуляцию.
Чем определяется конечный объем или время опорожнения сократительных вакуолей, неясно. У некоторых инфузорий вакуоли опорожняются в какой-то определенной точке поверхности или через пору. Фибриллярные пучки, которые, возможно, являются сократимыми, тянутся у Paramecium от вакуоли к клеточной оболочке (пелликуле). Если сосущую инфузорию Discophrya подвергнуть гидростатическому давлению ~ 176 кг/см2, то оболочка ее растянется, частота пульсаций вакуолей увеличится, а их объем станет меньше. При очень высоком давлении, которое, как известно, вызывает превращение геля протоплазмы в золь, вакуолярное выделение падает и клетки округляются [190]. Поверхность изолированной сократительной вакуоли при обработке ее с помощью АТФ и Mg может сокращаться подобно мышечным белкам [281]. Поэтому возможно, что опорожнение вакуоли является результатом сокращения белковых филаментов в ее стенках.
Функции сократительных вакуолей в регуляции ионного состава, осмотического давления и объема, а также механизмы наполнения и опорожнения вакуолей, вероятно, у разных видов простейших различны.
Паразитические гельминты
Среда обитания кишечных паразитов может время от времени подвергаться значительным изменениям. Немногочисленные измерения, проводившиеся на кишечных ленточных червях (цестодах), показывают, что в норме они изоосмотичны по отношению к среде, но в разных экспериментальных средах способны к незначительной регуляции.
Обмен воды: осмотический баланс, гормональная регуляция
89
у нематод имеются нефридиеподобные выделительные органы, которые могут участвовать в ионной и осмотической регуляции. Установлено, что выделительные ампулы личинок третьей стадии Nippostrongylus и Ancylostoma пульсируют с гораздо большей частотой в разведенной среде, чем в концентрированной.
Анализ полостной жидкости круглого червя Ascaris показывает, что он скорее всего гипоосмотичен по отношению к кишечной жидкости, в которой обитает. В разведенной среде вес его тела увеличивается; однако прирост веса тела уменьшится, если на кишечник червя будет наложена лигатура; следовательно, стенки его тела в какой-то степени проницаемы для воды [159]. В солевой среде осмотическая регуляция у аскариды отсутствует. В изотонической солевой среде Ascaris выделяет мочу, изоосмотичную полостной жидкости:
МОСМ Na К
Среда 310 140 3
Полостная жидкость 333 107 8,5
Моча 329 ПО 40
По-видимому, выделительные органы в большей степени участвуют в ионной регуляции, чем в осмотической. Введенный внутрь тела инулин не выделяется, поэтому едва ли здесь у Ascaris имеется механизм фильтрации. Нефридий имеет структуру секреторного органа [199]. Ленточный червь Hymenolepis изоосмотичен по отношению к своей среде. Возможно, что при дальнейшем изучении водно-солевого обмена различных паразитических червей у них также будут найдены разные степени регуляции.
Регуляция у пресноводных беспозвоночных
Пресноводные губки, кишечнополостные и двустворчатые моллюски представляют собой животных с самой разбавленной внутренней средой. Соответственно поддержание свойственного им очень небольшого концентрационного градиента с внешней средой требует небольших энергетических затрат; правда, их двигательная и метаболическая активность также ограничена. Осмотическая концентрация клеток пресноводной губки Spongilla эквивалентна 25— 30 мМ NaCl; в период почкования она увеличивается в несколько Раз. У пресноводных губок в амебоцитах и хоаноцитах можно видеть сократительные вакуоли; у морских губок вакуолей нет.
Клетки изолированных щупалец Hydra viridis и Pelmotohydra °Hgactis в растворах сахарозы, концентрация которых выше 0,04 М, постепенно уменьшаются в объеме, а пищеварительные клетки Chlorohydra viridissima изотоничны 50 мМ раствору сахарозы. Ос
•90
Глава 1
мотическая проницаемость обеспечивает поступление 0,3—0,6 мк3 воды на 1 мк2/(мин-атм) [211]. В растворах, концентрация которых выше 200 мМ, объем клеток Chlorohydra уменьшается пропорционально увеличению концентрации среды, т. е. клетки ведут себя как осмометры (осмотически неактивный объем составляет у них около 70%). В растворах с концентрацией ниже 200 мМ гидростатическое давление достигает максимума (т. е. их объем остается почти постоянным при снижении концентрации до 50 мМ, ниже которой клетки снова начинают вести себя как осмометры) [192]. Hydra аккумулирует калий и выводит натрий. Гастральная полость у нее заряжена положительно (30 мВ) по отношению к наружной стороне ее стенки — очевидно, вследствие общего поступления натрия внутрь.
Пресноводная медуза Craspedacusta в среде с концентрацией 7 моем путем активной абсорбции Na и К поддерживает в тканях осмотическую концентрацию на уровне 27 моем, а содержание воды— на уровне 99%. Гиперосмотическая регуляция наблюдалась у нее в растворах с концентрациями до 69 моем; при повышении концентрации животные уменьшались в объеме и становились изо-осмотичными [154]. У этих медуз в среде, содержащей 2 мМ Na и 0,6 мМ К, содержание Na равно 15 мМ, а содержание К — 0,6 мМ. Считается, что животные с такой разбавленной внутренней средой активно поглощают натрий, который затем они выделяют в гиперосмотический раствор в кишечнике, удаляя таким образом воду из тела. Проницаемость их для воды мала, но все же заметна [154].
У коловраток внутренняя концентрация чуть больше, чем у кишечнополостных [52]:
моем Na, мэкв К, мэкв
Прудовая вода 17,7 4,2 1,7
Жидкость тела 81 21 7
Моча 42 13,4 2,7
Коловратки снабжены синцитиальными протонефридиями, которые состоят из терминальных луковиц, имеющих внутри колеблющиеся (как пламя) пучки ресничек, из канальцев и мочевого пузыря. Обычно активность таких луковиц максимальна в разведенной среде [271]. В прудовой воде моча образуется со скоростью 47-10-9 мл/мин (рассчитанной на основании объема пузыря), а натрий выделяется со скоростью 0,63-10~9 мэкв/мин; отношение концентраций инулина в моче и в жидкости тела составляет 1,42, а общая скорость фильтрации равна 33,1 • 10~9 мл/мин [52].
У пресноводных двустворчатых моллюсков, таких, как Anodonta, очень низкая концентрация крови (Лвн=—0,08 °C, или приблизительно 42 моем). Вес тела Anodornta в растворах с концентрацией,.
Обмен воды: осмотический баланс, гормональная регуляция
91
большей чем Днар^—0,1, уменьшается. У анестезированных или охлажденных моллюсков вес тела в пресной воде также уменьшается. Таким образом, Anodonta проницаема для воды и выделяет разбавленную мочу, объем которой может за сутки достигать 50% объема тела. Жидкость из перикардиальной полости движется через нефростом в почки. Гидростатическое давление крови составляет около 6 см водяного столба, а коллоидно-осмотическое давление в крови равно примерно 3,8 мм водяного столба. Следовательно, здесь может происходить фильтрация жидкости через стенки сердца в перикардиальную полость. В соответствии с данными, полученными при определении клиренса инулина, интенсивность фильтрации составляет 1—1,3 мл/ч на 100 г веса тела. Концентрация мочи достигает 23,6 моем, т. е. примерно в 2 раза меньше концентрации крови [272].
Пресноводная улитка Lymnaea аккумулирует Na и С а из воды пресных водоемов [141]. В водопроводной воде кровь улитки имеет отрицательный заряд 16,6 мВ, который не зависит от наружной концентрации натрия. Такой потенциал должен поддерживать кон-: центрацию крови на уровне 0,67 мМ, однако в действительности ее
концентрация составляет 57 мМ. Было показано, что активное поглощение меченого Na изменяется в соответствии с изменением наружной его концентрации, причем концентрация полунасыщения г для механизма активного поглощения составляет 0,25 мМ. Уста-с новлено, что у улитки, адаптированной к среде с 0,35 мМ Na, его поступление составляет 0,132 мкМ/(г-ч), из которых, как показывает расчет, постоянному обмену подвергается 0,053 мМ. У улиток с частично истощенным запасом Na его поглощение из среды уве-? личивается вдвое. Поглощение кальция улиткой Limnaea с увели-? чением концентрации кальция в среде также возрастает, а величи-
i на /См найдена равной 0,3 мМ Са. С уменьшением концентрации
। Са в крови увеличивается ее отрицательный потенциал, что, по-ви-; димому, и обеспечивает поглощение Са; однако при низких кон-• центрациях кальция поглощение его из среды, вероятно, становится j активным. Очевидно, пресноводные моллюски, несмотря на низкие } осмотические концентрации жидкостей их тела, приспособились к j выделению разбавленной мочи и активному поглощению Na+ и» ’ вероятно, также Саi 2+.
I W
I Дождевые черви и пиявки
i Существуют большие группы пресноводных кольчатых червей— CHigochaeta (малощетинковые черви) и Hirudinea (пиявки). Дож-
девые черви приспособились к жизни во влажной почве, где интенсивность осмотического стресса занимает промежуточное положение между его интенсивностью в пресной воде и на воздухе. Если Дождевого червя перенести из почвы в водопроводную воду, то примерно в течение 5 ч он поглотит воду в количестве, равном 15%
*92 1 Глава 1
первоначального веса его тела. При возвращении в почву или на воздух этот червь будет терять воду. Дождевые черви могут переносить потерю 50—80% всей воды, содержащейся в их теле, причем червь Allobophora более устойчив к такой потере, чем Pheretima или Eisenia [140]. После избыточной гидратации вода удаляется из тела червя с большей скоростью, чем поглощается после дегидратации. В градиенте влажности дождевой червь ориентирован в направлении большей влажности и избегает сухих мест. На воздухе поверхность его тела остается влажной за счет экскретируемой воды; в ответ на раздражение происходит выдавливание целомической жидкости через дорсальные поры.
Характерные величины концентраций целомической жидкости и мочи приведены ниже [283].
Целомическая жидкость Моча
Л сс замерз’ О, мэкв ^замерз’ & С1, мэкв
Lumbricus из водопроводной воды Lumbricus из раствора Рингера, эк- вивалентного 65% NaCl —0,31 —0,49 46,5 74 —0,10 —0,23 3,4 17
Будучи помещенными в морскую воду разных разведений, дождевые черви поддерживают гиперосмотичность целомической жидкости по отношению к среде; концентрация хлоридов в них может, однако, стать более низкой, чем в среде. Моча при любых ее концентрациях остается гипоосмотичной по отношению к крови [283].
У некоторых малощетинковых червей имеются крупные нефридии — по одной паре в каждом сегменте. У других видов в каждом сегменте расположено большое количество мелких нефридиев. В одних случаях нефридии открываются в полость тела ресничными воронками, или нефростомами, в других они не имеют отверстий. У некоторых червей (например, у Pheretima postuma из сухих почв) нефридии выводят свое содержимое прямо в кишечник, что способствует сохранению воды, а у других видов (например, Lumbricus) они открываются наружу. Целомическая жидкость попадает в нефростомы благодаря биениям ресничек. Красители и продукты распада гемоглобина могут накапливаться в канальцевом эпителии. Выделение мочи нефридиями у дождевых червей, содержащихся в водопроводной воде, составляет 2—2,5% веса тела в 1 ч. Концентрация хлоридов в моче равна 7,7% содержания С1_ в целомической жидкости у Lumbricus и 4,6% —у Pheretind-У Pheretima содержание глюкозы в крови равно 100 мг/100 мл, тогда как в целомической жидкости и в моче глюкозы не обнарУ' жено.
Обмен воды: осмотический баланс, гормональная регуляция
93
Пробы, взятые из помещенных в рингеровский раствор изолированных нефридиев, выявили очень малое снижение (или его отсутствие) количества хлоридов в проксимальном и среднем каналах и заметное уменьшение его в дистальном канале и мочевом пузыре [283]. Проведенные недавно измерения концентрации хлоридов в разных отделах выделительной системы Lumbricus (при инкубации их в рингеровском растворе) дали следующие результаты (в %): ресничный канал — 72, проксимальный канал — 62,
дистальный канал — 31, мочевой пузырь — 26. Внутренняя стенка канала электроотрицательна по отношению к наружной его поверхности (разность потенциалов равна 14 мВ), что свидетельствует об активной реабсорбции Na+ [43, 46]. Количество Na, выводимого из нефридиального канала, было вычислено и приводится ни-
же в сравнении с соответствующими величинами, полученными на других видах:
мкэкв/(мм2-с)
Нефридии Lumbricus проксимальный каналец 0,9ЫО-5
Подвздошная кишка собаки Проксимальный каналец крысы Мочевой пузырь лягушки Проксимальный каналец Necturus 2,01-Ю-5 8,5-10-5 0,44-10“5 0,062-IO"5
Отношение концентрации инулина в моче к его концентрации в целомической жидкости превышает единицу — очевидно, вследствие реабсорбции воды.
Как и у большинства эвригалинных животных, у адаптирующихся к пресной воде червей пассивное поступление (свидетельствующее о величине проницаемости) уменьшается, а активное поглощение увеличивается. Пассивное поглощение Na и С1 было рассчитано исходя из уравнений поглощения (см. выше) с использованием измеренных концентраций и потенциала (—20 мВ), найденного для целомической жидкости животных, содержавшихся в пресной воде.
Полученные в эксперименте значения как для Na, так и для С1 в 20—50 раз выше расчетных, что свидетельствует об активном характере поступления обоих элементов. У червей, перенесенных в прудовую воду прямо из почвы, активное поглощение Na в 6 раз, а С1 в 3 раза выше, чем у червей, предварительно адаптированных к пресной воде.
Измерения поглощения при различных концентрациях показали, что оно увеличивается до максимума при 0,94 мкэкв/(10 г-ч) по сравнению с 1,5 для речного рака и 3,0 для саламандры; концентрация полунасыщения для механизма поглощения (т. е. Км) равна 1,3 мМ NaCl по сравнению с 0,2 мМ для речного рака и 20 мМ Для краба Carcinus [182а].
У пресноводной пиявки осмотическая концентрация жидкости тела равна 202 моем; потребление кислорода минимально в 25%-
94
Глава 1
ной морской воде. Моча образуется со скоростью 3—6 л/см2 поверхности тела в 1 ч. Кровь гиперосмотична по отношению к моче в широком диапазоне наружных концентраций [45] (рис. 1-24). Для пиявок, находящихся в пресной воде, получены следующие данные:
Na, мМ С1, мМ Осмотическая концентрация, моем Выделение мочи, мкл/(гч)
Hurido, кровь 125 36 202
моча 6 6 15 46,5
Lumbricus, кровь 167 25
Выделительный орган пиявки — нефридий — снабжен имеющим реснички органом, окруженным перинефридиальным кровеносным
Рис. il-24. Схема строения нефридия пиявки {45].
I — перинефростомный сосуд; II — ресничный орган;- III — начальная доля; IV — укороченный канал; V — внутренний канал; VI— дистальная часть; VII — первичная доля; VIII — апикальная доля; IX — проксимальная часть большого канала; X — внутренняя доля; XI — концевой канал; XII — нефридиопора; XIII — мочевой пузырь.
сосудом. Кровь, проходя через систему мелких канальцев, фильтруется, после чего фильтрат поступает через канальцы в мочевой пузырь [44, 45]. Пиявки, содержавшиеся в течение нескольких дней в дистиллированной воде и помещенные затем в разбавленный рингеровский раствор, очень активно поглощают из него соли.
В характере функционирования нефридия кольчатых червей и нефрона позвоночных прослеживается поразительное сходство.
Обмен воды: осмотический баланс, гормональная регуляция
95
Насекомые
Большинство насекомых обитает на суше, поэтому основная задача их осмотической регуляции состоит в получении достаточного количества воды с пищей и из окружающего воздуха для предотвращения высыхания. Отдельные виды насекомых живут в пресной Б0Де—по крайней мере в течение личиночного периода, а личинки некоторых двукрылых живут в соленых озерах, в солоноватой и морской воде.
Осмотическая концентрация гемолимфы насекомых колеблется в пределах Дзамерз от —0,4 до —1,3 °C, что соответствует 120— 376 ммоль/л NaCl. Главную роль в поддержании осмотического давления у насекомых в отличие от других животных играют не хлориды, а органические вещества, в особенности аминокислоты. В плазме млекопитающих хлориды составляют 2/з всех анионов, у шелкопряда — только 12—18%, а у личинки овода — только 7%. В жидкости тела личинок Culex и Aedes на долю хлоридов приходится только 25%, а у Drosophila — 20% общей осмотической концентрации.
Водные насекомые
Многие насекомые, обитающие в воде, дышат воздухом. У некоторых личинок имеется жаберная система, позволяющая им использовать растворенный в воде кислород. Отдельные виды дышащих воздухом насекомых периодически поднимаются на поверхность, другие постоянно носят с собой пузырек воздуха (см. гл. 9). Среди клопов-гребляков (Corixidae) есть как пресноводные виды (Sigura distincta и Corixa dentipes), так и солоноватоводные формы (Sigura lugubris). У пресноводных Corixa dentipes концентрация гемолимфы эквивалентна 149 мМ NaCl, а концентрация выделяемой ректальной жидкости — 57 мМ NaCl; ежедневная потеря воды составляет 49% веса тела этого насекомого [338].
Проницаемость кутикулы водных насекомых для воды в значительной степени варьирует. Жабры более проницаемы, чем поверхность тела, а личинки и нимфы более проницаемы, чем взрослые насекомые. Процесс испарения на воздухе имеет определенную критическую температуру, выше которой потеря воды заметно увеличивается; эта переходная температура ниже у наземных видов [81]. У водных видов рода Collembola кутикула почти водонепроницаема, однако при удалении воскового покрытия она начинает намокать. Водоотталкивающие свойства кутикулы водных насекомых, вероятнее всего, обеспечивают несмачиваемость, а не предохраняют от высыхания [253].
Личинки хирономид (комаров-дергунов) живут в самых разнообразных водных средах. Африканские виды размножаются в мелких временных водоемах, переживают засуху и вновь оживают
96
Глава 1
после дождя. В сухом воздухе эти личинки могут содержать только 3% воды, а после 6 ч пребывания во влажном воздухе — 33%; они могут переносить (в течение коротких периодов) нагревание воды до 41 °C [158]. Пресноводный вид Chironomus thummi не может жить в воде, соленость которой превышает 0,5 %о, тогда как Ch. sa-linarius выживает при соленостях от 1 до 37%о [252а].
Для личинок некоторых двукрылых, культивируемых в разведенной среде, характерны большие анальные бугорки, а для личинок, выращиваемых в солевом растворе, — маленькие.
У Chironomus thummi наблюдается гипертрофия бугорков в отсутствие С1~, но не в отсутствие Са2+. У эвригалинных личинок комара Aedes aegypti анальные бугорки обеспечивают 90% обмена С1~ и могут активно поглощать С1~ из разбавленных растворов NaCl и в меньшей степени — из растворов КС1, СаСЬ и NH4C1. Вероятно, поглощение С1~ может идти частично за счет обмена на ионы ОН- или НСОз из гемолимфы, поскольку поступление Cl-уменьшается при возрастании концентрации этих ионов в среде. Натрий активно поглощается из растворов NaCl и в меньшей степени из растворов NaNO3, NaHCO3 или Na2SO4. Полунасыщение абсорбции достигается при концентрациях 0,2—0,5 мМ С1 и 0,55 мМ Na [340, 341].
Проницаемость анальных бугорков для воды может быть продемонстрирована с помощью перевязывания тела личинки и помещения ее в среды с разными осмотическими концентрациями. Личинки Aedes argenteus в норме поглощают мало воды; эта вода под влиянием осмотических процессов поступает внутрь тела через анальные бугорки, а экскретируется через мальпигиевы сосуды. Гемолимфа остается относительно постоянной в средах разной солености вплоть до концентрации, эквивалентной 0,65% NaCl, но в средах с более высокой соленостью осмотическая концентрация гемолимфы изменяется в соответствии с концентрацией среды. Путем постепенной акклимации личинки могут быть адаптированы к разведенной морской воде, эквивалентной 1,4% NaCl. При культивировании личинок Culex pipiens в 0,65%-ном растворе NaCl их анальные бугорки имеют очень малый размер, в 0,006%-ном растворе NaCl они больше, а в дистиллированной воде делаются очень крупными; в эпителиальных клетках при этом появляются вакуоли. У личинок Aedes detritus из алжирских водоемов с соленостью, эквивалентной 1,2—10% NaCl, анальные бугорки имеют меньший размер, чем у личинок Aedes aegypti из пресных вод [377]. Эндотелиальные клетки анальных бугорков A. aegypti имеют глубокие базальные (кутикулярные) складки с длинными плоскими митохондриями между ними. С дистальной стороны (со стороны гемолимфы) у них имеются мелкие пузырчатые канальцы и митохондрии [72]. Эти эндотелиальные клетки, по-видимому, активно поглощают Na и О, но это пока еще как следует не изучено.
В процессе выделения участвуют мальпигиевы сосуды и прямая
Обмен воды: осмотический баланс, гормональная регуляция
97
кишка, в которой происходит реабсорбция. У личинок ручейника Limnophilus, содержащихся в среде, соленость которой эквивалентна 0,01% NaCl, осмотическая концентрация жидкости тела эквивалентна 0,031—0,048% NaCl, жидкость из мальпигиевых сосудов имеет сходную концентрацию, а концентрация мочи эквивалентна
Рис. 1-25. Основные пути движения ионов и воды в процессе осморегуляции у личинки комара Aedes Mosquito.
Изображены пассивный вход воды, активное поглощение NaCl из среды и активное обратное всасывание калия в задней кишке.
менее чем 0,009% NaCl. У личинок пресноводного комара Aedes aegypti кишечная жидкость (эквивалентная жидкости мальпигиевых сосудов) изоосмотична по отношению к гемолимфе, тогда как ректальная моча сильно разбавлена (рис. 1-25). В противоположность этому у личинок Aedes detritus, живущих в разбавленной морской воде, кишечная жидкость, изоосмотичная по отношению к крови в переднем отрезке кишечника, становится гиперосмотичной в задней кишке [282а]:
Эквивалентная концентрация NaCl, %
ЖИДКОСТЬ задней кишки жидкость тела кишечная жидкость
A. aegypti (в дистиллированной 0,07 0,63 0,57
воде) A. detritus (в морской воде) 3,5 0,93 1,2
В мальпигиевых сосудах личинок комаров накапливается жидкость, осмотически не очень отличающаяся от гемолимфы, а абсорбция воды и солей происходит у них через ректальный эпителий. Имеются данные о регуляции этих процессов со стороны гормонов торакальных ганглиев и ретроцеребрального комплекса
Личинки Stalls (пресноводные вислокрылки) в отличие от личинок комаров не имеют специальных механизмов для поглощения
7—1332
98
Глава I
ионов; при этом они хорошо проницаемы для воды. В выделяемой ими ректальной жидкости концентрация электролитов (в основном NH4HCO3) составляет 65% концентрации гемолимфы; в значительно меньших по сравнению с гемолимфой количествах ректальная жидкость содержит Cl-, Na+ и К+. Внутренняя поверхность задней кишки имеет положительный по отношению к гемолимфе заряд, равный 24 мВ, что может свидетельствовать об активной реабсорбции анионов. Для иллюстрации приводятся следующие данные (в мэкв) [313а]:
Na К Cl NHtf нсо3
Г емолимфа 109 5 31
Выделяемая жидкость 12 4 0 100 91
Было проведено сравнение некоторых особенностей личинок солоноватоводных и пресноводных видов ручейника Limnophillus. давшее следующие результаты [343]:
L. affinis, солоноватая вода
Гемолимфа может быть гиперосмо-тичной среде
Моча может быть гиперосмотичной гемолимфе
Временная константа обмена Cl 6/2= =400 ч
Проницаемость низкая
Потребляет мало воды
Может переносить концентрацию среды, равную 75% концентрации морской воды
L. stigma, пресная вода
В солоноватой воде погибает
Ректальная жидкость гипо- или изоосмо-тична гемолимфе 6/2=40 ч
Проницаема для ионов
Пьет в соленой среде и срыгивает
Погибает при солености выше 60 моем
Личинки двукрылых рода Ephydra могут жить в соленых озерах. Ephydra riparia, вид из солоноватых вод, гипоосмотична по отношению к среде. Е. cinerea встречается в Большом Соленом озере, где в среде с осмотическим давлением 250 атм осмотическое давление ее гемолимфы равно 20,5 атм (Азамерз =—1,89°C). В дистиллированной воде осмотическое давление гемолимфы составляет 20,1 атм, или Азамерз^—1,67°C. Эти личинки должны быть практически непроницаемы для солей [252].
Известны виды-двойники Anopheles, идентичные морфологически; их яйца заметно различаются, и гибриды, получающиеся при их скрещивании, стерильны; один из этих видов, A. gambiae, развивается в пресной воде, другой, A. melas, обычно размножается в солоноватой среде, но может развиваться при концентрациях, в 1,5 раза превышающих концентрацию морской воды.
Обмен воды: осмотический баланс, гормональная регуляция
99
Наземные насекомые, двупарноногие и паукообразные
Наземные насекомые весьма успешно приспособились к жизни в сухой атмосфере. Их потребность во влаге широко варьирует, а осмотические концентрации гемолимфы, как правило, превышают соответствующие концентрации у водных насекомых:
Паукообразные
Наземные насекомые
Водные насекомые
Скорпион Паук Carabus Богомол
Ephestia (личинка) Acheta
Drosophila (личинка)
Комар (личинка)
—1,125
—0,894
—0,94
—0,885
—1,12
—0,72
—0,70
—0,65
Потеря воды у наземных насекомых происходит главным образом благодаря испарению. Если у млекопитающих отношение поверхности тела к его объему составляет около 0,5, то у насекомых эта величина может достигать 50 [18]. Одним из путей испарения являются дыхальца, и большинство насекомых приоткрывает их только при дыхательных движениях. Виды, не способные закрывать дыхальца, теряют воду значительно быстрее. Если дыхальца долгое время остаются открытыми, например в атмосфере СОг или в период активности насекомого, потеря воды увеличивается во много раз. У саранчи Locusta в сухом воздухе вентиляция уменьшается и потеря воды сокращается пропорционально недостатку насыщения; при высокой температуре воздуха гипервентиляция может удвоить потерю воды. Вентиляция может изменяться в зависимости от состояния запасов воды и от относительной влажности [218]. У некоторых видов жуков, обитающих в пустыне, при дыхании теряется гораздо меньше воды, чем через кутикулу. С повышением температуры до 40°C эти потери возрастают в значительно меньшей степени (по сравнению с резким увеличением испарения через дыхальца, наблюдаемым в этих условиях) [3]. Сходным образом у скорпионов потери воды через кутикулу относительно больше при низких температурах (<38°С), а респираторные потери значительнее при высоких температурах (>40°С) [148].
У таракана Periplaneta при обезвоживании происходит уменьшение объема гемолимфы с 17,5 до 13,5%, а содержание воды в ней сокращается с 16,4 до 11,0 мл/100 мг; при этом осмотическая концентрация увеличивается с 410 до 467 моем, а концентрация хлоридов снижается со 132 до 127 мМ. Таким образом, содержание хлоридов у таракана регулируется; в то же время содержание органических компонентов (вероятно, аминокислот) может увеличиваться '[104, 105].
7*
5
100 Глава 1
Свойства покровов насекомых, позволяющие поддерживать водный баланс
Покров насекомого представляет собой сложное образование, состоящее из хитина, дубленых белков, восков, полифенолов и цемента. Как правило, слабое испарение объясняется наличием слоя кутикулярного воска, толщина которого равна примерно 0,2 мк. Константы проницаемости воска и кутикулы для воды почти в 2000 раз меньше, чем соответствующие константы эритроцитов.
Рис. 11-26. Схема строения кутикулы насекомых [21].
/ — липиды (0,2 мк); II— липопротеиды (0,2 мк); III — хитиново-белковая кутикула (1—20 мк); IV— пористые каналы; V — эпидермальные клетки.
Водные насекомые на воздухе обычно теряют путем испарения больше воды, чем наземные насекомые, а активные растительноядные формы — больше, чем куколки: личинки Limnophilus—11, Corix — 2, взрослый Hydrobius — 0,3, куколка Tenebrio — 0,02 мг/(см2-ч) при 20 °C [161]. Потери воды увеличиваются при повреждении кутикулы, при удалении воска соответствующими растворителями и при изменении физических свойств воска, связанных с повышением температуры. Увеличение потерь воды, вызываемое повышением температуры, происходит сначала постепенно, а потом— выше некой точки перехода — все более круто [19] (рис. 1-26). Гибель насекомого, наступающая при значительном повышении температуры, может быть связана скорее с высыханием, чем с собственно нагреванием. При повышенной температуре воздуха высокая его влажность снижает потери от испарения. У пустынного скорпиона кривая зависимости проницаемости кутикулы от температуры имеет две ступени — при 35 и 60 °C. У пустынных членистоногих потери воды в сухом воздухе (в процентах от веса тела в час) при 30 °C меньше, чем у животных, привыкших к большей влажности; например, у скорпиона — 0,028—0,091, у тарантула— 0,147; у Locusta — 0,32; у мучных червей 0,12—0,245 [148].
Совершенно уникальной представляется способность кутикулы насекомых и клещей поглощать воду из достаточно влажной, но не насыщенной водой атмосферы. Такая способность обнаружена у различных клещей, блох, личинок Tenebrio и чешуекрылых, однако
Обмен воды: осмотический баланс, гормональная регуляция 101
отсутствует у Periplaneta и Blatta [104]. Поглощение воды усиливается при высыхании и уменьшается при гидратации животного. Уровень относительной влажности (в процентах насыщения), выше которого начинается поглощение воды из атмосферы, для Ixodes равен 94, Tenebrio— 88, Xenopsilla — 65, Termobia — 50 [21]. Личинки третьей стадии блохи Xenopsilla поглощают 2 мкг/(ч-мм2) при 93% относительной влажности, тогда как при нулевой относительной влажности у них происходит испарение со скоростью 0,9 мкг/(ч-мм2), т. е. интенсивность поглощения воды из влажной атмосферы вдвое превышает ее испарение в сухой среде [191]. Чешуйница Termobia при 43 %-ной относительной влажности теряет воду путем испарения, а при 63 %-ной начинает поглощать ее.
Механизм абсорбции атмосферной воды неизвестен. Кутикула пронизана порами диаметром 0,1 мк, по которым вода движется внутрь тела втрое быстрее, чем наружу (даже у тараканов, которые не поглощают воды). Движение воды из капли на кутикуле внутрь не зависит от осмотической концентрации жидкости. Считается, что капелька воды может изменить угол ориентации липидных монослоев в кутикулярных порах. Кроме того, дубленый белок, покрытый с одной стороны воском, обнаруживает одностороннее поглощение воды. Такого рода абсорбция свойственна только живым насекомым; следовательно, вода, поступившая через кутикулу, должна с помощью гемолимфы распределиться по тканям [253]. Эксперименты с перевязыванием тела у Termobia показали, что основное участие в потреблении воды принимает задняя кишка [253].
Таким образом, ограничение количества испаряемой воды осуществляется у насекомых с помощью дыхалец и — вплоть до критической температуры — воскового кутикулярного покрытия. Вода может поглощаться из влажного воздуха благодаря асимметричности кутикулярных пор.
Поведение
Другим адаптивным механизмом осморегуляции у насекомых служит их поведение, направленное на выбор мест с «предпочитаемой» (или оптимальной) влажностью. Так, после небольшого высыхания животные стремятся в места с повышенной влажностью, а после гидратации — в более сухую атмосферу. Tribolium при температуре 27 °C может отличить 95%-ную относительную влажность от 100%-ной, но нечувствителен к столь же малому различию между 40 и 55%-ной относительной влажностью. Только что пойманный клеверный клещик Bryobia praetiosa в градиенте влажности выбирает более сухой участок, но, подсохнув, может переместиться на самый влажный конец [381]. Нормальная взрослая Drosophila предпочитает сухую атмосферу, однако ее поведение становится прямо противоположным, если содержание воды в ее
102
Глава 1
теле уменьшается до 12—16%; гигрорецепторы расположены у нее в жгутиковых сегментах антенн, на щупиках и на хоботке. Те-nebrio confusum не ощущают разницы во влажности после удаления гигрорецепторов, находящихся на 7-м и 11-м антеннальных сегментах. Антенны Locusta могут быть снабжены сенсиллами трех типов: 1) воспринимающими влажность; 2) реагирующими на сухой воздух; 3) повышающими разряд в теплом воздухе и понижающими его в холодном [366]. У гусениц некоторых чешуекрылых третий антеннальный сегмент имеет три рецепторных нейрона, разряд которых увеличивается с повышением температуры, и три других нейрона, спонтанный множественный разряд которых повышается во влажном воздухе и снижается в сухом. Они способны чувствовать изменения, вызываемые испарением из листьев, и с помощью информации, получаемой рецепторами о температуре и влажности, они могут отличить свежие листья от увядающих [92]. У синей мухи Phormia один биполярный нейрон на вкусовой сенсилле стимулируется водой, другой — солевым или сахарным растворами [107].
Предпочтение определенной степени влажности, возможно, оказывает влияние на распространение некоторых насекомых. Например, тропические лесные комары Anopheles bellator и A. homunculus обитают в частично перекрывающихся участках в верхнем ярусе деревьев; из этих двух видов первый вследствие большей устойчивости к низкой влажности по вечерам поднимается выше, а днем спускается не так низко, как второй. Из двух видов Drosophila один-—D. persimilis — занимает более холодные и сырые места, чем D. pseudoobscura. Комары выбирают для яйцекладки неодинаковые солевые растворы; предполагается, что они имеют солевые рецепторы, локализующиеся на лапках и голенях. Рецепторы, воспринимающие вкус воды и влажность, широко распространены.
Выделение и его связь с водным и солевым балансом
Выделительная система насекомых состоит из мальпигиевых сосудов, средней и задней кишок. Мальпигиевы сосуды обычно отходят от места соединения средней кишки с задней и слепо заканчиваются в полости тела. У насыщенных водой Periplaneta или Calliphora ректальная жидкость (моча) гипоосмотична по отношению к гемолимфе; у обезвоженных Periplaneta осмотическая концентрация мочи может быть вдвое выше, чем концентрация гемолимфы [370]. У Schistocerca ректальная жидкость всегда гипер-осмотична, и лишь незначительная доля растворенных в ней веществ приходится на неорганические ионы [262] (см. таблицу на стр. 103).
У кровососущего клопа Rhodnius диурез наступает через 2— 3 ч после получения пищи. При помещении изолированных мальпи-
Обмен воды: осмотический баланс, гормональная регуляция
103
Л °C замерз’
гемолифма ректальная жидкость
При потреблении водо- —0,74 —155
проводной воды При потреблении соле- —0,96 —3,4
вых растворов
гиевых сосудов в соответствующий солевой раствор в них происходит очень быстрое образование жидкости; последующее замедление этого процесса можно обратить добавлением к среде гемолимфы. Фактор, экстрагируемый из нейросекреторных клеток мезото-ракального ганглия, стимулирует образование жидкости в изолированных мальпигиевых сосудах [227].
В изолированных мальпигиевых сосудах палочника Carausius образуется слегка гипоосмотическая жидкость, в которой по сравнению с гемолимфой или эквивалентной средой содержится больше К и меньше Na. Внутренняя поверхность сосуда несет положительный электрический заряд 15—20 мВ [284]. Секреция в сосудах приостанавливается, если гидростатическое давление внутри них поднимается выше 20 см вод. ст. Образование мочи в изолированных мальпигиевых сосудах Calliphora стимулируется следующими катионами (расположенными по убывающей интенсивности воздействия): K>Rb>Ca>Na. Моча может быть слабо гиперосмотичной по отношению к среде, но ее образование не зависит от внешней осмотической концентрации. У Calliphora в сосудах встречаются клетки двух типов: 1) первичные клетки, имеющие базальную (наружную) зону с глубокими впячиваниями мембраны и апикальную (обращенную в просвет сосуда) зону с микроворсинками, снабженными в изобилии митохондриями [27] (рис. 1-27); 2) звездчатые клетки, расположенные между первичными; в их апикальных мик-повоцсинках митохондрий нет. Считается, что натрий диффундирует в первичные клетки (с их базального конца), а затем выдавливается обратно в обмен на калий; звездчатые клетки также могут возвращать натрий в гемолимфу. На апикальном конце клеток, как было показано, действует электрогенераторный калиевый насос [29, 31]. В местах впячиваний с базальной стороны клеток могут существовать устойчивые концентрационные градиенты, где гипоосмотичность жидкости повышается в направлении закрытого конца этого участка. Вода и хлориды, по-видимому, пассивно продвигаются по градиенту в просвет сосуда (рис. 1-28). Насос нечувствителен к уабаину; он ингибируется ионами Си в присутствии ионов С1, но не НРО^. Многие мелкие анионы в отличие от крупных способствуют образованию мочи. Расчетный размер пор равен 3,6 А [30, 31]. Аналогичным образом у Carausius мальпигиевы сосуды транспортируют К из гемолимфы (18 мМ) в заполняющую их
104
Глава 1
Рис. 1-27. Схема строения мальпигиева сосуда таракана [259].
Митохондрии расположены между выемками со стороны гемолимфы, а разветвленные межклеточные сосуды — со стороны просвета.
Рис. 1-28. Схема движения воды и растворенных веществ в мальпигиевом сосуде [31].
Черными стрелками показано направление транспорта растворенных веществ, светлыми — направление пассивного тока воды. I — просвет сосуда; II — первичная клетка; III — кровь; IV — микроворсинки; V — базальная складка; VI— основная мембрана.
Обмен воды: осмотический баланс, гормональная регуляция 105
жидкость (145 МхЧ), причем этот процесс нечувствителен к уабаину, но тормозится при добавлении динитрофенола (ДНФ) [270]. Изолированные мальпигиевы сосуды личинок чешуекрылых, помещенные в среду, в которой концентрация калия ниже 0,45 мМ., образуют жидкость, содержащую 13 мМ калия. Они могут секретировать и натрий, если среда при малом количестве калия содержит много натрия; калий реабсорбируется в нижней (по ходу) части этого сосуда [171].
у Rhodnius в верхней части мальпигиевых сосудов секретируется прозрачная, изоосмотическая моча, имеющая щелочную реакцию; затем ниже по ходу сосудов моча закисляется, в ней выпадают кристаллы мочевой кислоты, очевидно, вследствие некоторой реабсорбции воды. При максимальном диурезе мальпигиевы сосуды Rhodnius могут in vitro секретировать до 3,3 мкл/(см2-мин); эта скорость уменьшается, если в омывающей их среде нет натрия; однако в отсутствие калия низкая концентрация натрия не оказывает такого влияния. В среде, содержащей холин, интенсивность секреции пропорциональна содержанию Na, или К, или их сумме. Секретируемая жидкость изоосмотична по отношению к гемолимфе и нечувствительна к уабаину. Секреция может идти и против градиента, особенно калиевого (от 14 до 85 МхЧ). Предполагается, что существуют раздельные механизмы обмена («насосы») для Na, К и CI [227].
У большинства насекомых из жидкости, попадающей в заднюю кишку, калий и вода начинают реабсорбироваться в гемолимфу. У личинок Aedes ректальная жидкость становится гипоосмотичной, тогда как жидкость из предшествующих отделов кишечника почти изоосмотична по отношению к гемолимфе.
Изолированная задняя кишка саранчи Schistocerca может транспортировать воду из своего содержимого, даже если оно представляет собой раствор неэлектролита, например трегалозы, причем транспорт воды не зависит от осмотической концентрации [261] (рис. 1-29). Однако он более эффективен, если в задней кишке содержится раствор электролита. Задняя кишка саранчи, получающей с пищей раствор соли, транспортирует воду в 2,5 раза быстрее, чем кишка насекомого, получающего только водопроводную воду. Внутренняя поверхность задней кишки Schistocerca имеет электроположительный по отношению к гемолимфе потенциал, равный 2—30 мВ. Если заднюю кишку заполнить солевым раствором, сходным по составу с гемолимфой и гиперосмотичным ей (за счет добавления 1 М ксилозы), то произойдет абсорбция 31% Na, ^5% К и 44% С1 против градиентов концентрации; содержание вместе Na и С1 в ректальной жидкости будет в этом случае в 3— 5 раз выше, чем в гемолимфе. Вода уходит из задней кишки в 4— 12 раз быстрее в присутствии К, чем в присутствии Na. Расчеты, основанные на данных о проницаемости стенок для разных молекул, показали, что поры в утолщениях вдоль задней кишки имеют
06
Глава 1
Жидкость задней кишки
Na 20 ммоль/л
К 139 »
CI 93 »
Н2О 8 мкл/ч
Д“С 0,78 »
pH 5,8 »
Гемолиукра.
Na 108 ммоль/л
К И „
а ив „
£££, 0,76 pH 7,/
Мальпигиевы сосуды
Пассивное Активный движение транспорт
Прямая кишка
Анус
Экскременты
Na / ммоль/л
К 0,2 »
CI 5 »
Н2О со,1 мкл/ч
Д°С 1,52 »
pH 4,7 »
Рис. 1-29. Схематическое изображение движения воды и концентрации ионов в различных отделах выделительной системы саранчи [261].
Рис. 1-30. Схема движения воды, вызываемого стойким градиентом [356].
В направлении градиента растворенные вещества переносятся в межклеточное прострайство, где создают осмотическую концентрацию, обеспечивающую пассивный приток воды. Межклеточное пространство открывается в просвет, закрытый с другого конца.
Обмен воды: осмотический баланс, гормональная регуляция 107
радиус 6,5 А [262]. Возможность образования гиперосмотической мочи даже из растворов неэлектролитов говорит о том, что здесь функционирует одна из форм активного транспорта воды из растворов.
Модель ректального транспорта насекомых можно построить по схеме, разработанной Даймондом, используя эпителий некоторых позвоночных [93, 94, 356] (рис. 1-30). Модель Даймонда состоит из двух клеток, отделенных друг от друга небольшим межклеточным пространством, закрытым с одной стороны и имеющим узкое отверстие с другой — в направлении участка, в котором происходит секреция. Растворенные вещества (ионы) секретируются на апикальном конце, благодаря чему жидкость в межклеточном пространстве становится гиперосмотической; из клеток в нее поступает вода — до тех пор, пока их проницаемость для воды не станет выше, чем для растворенных веществ. Вдоль межклеточного канала (сверху вниз) устанавливается градиент концентрации (и, вероятно, гидростатический градиент), а секретируемая жидкость может быть либо изоосмотичной, либо гипертоничной. Когда жидкость активно секретируется, канал расширяется. Эта модель была предложена для изучения секреции желчи в желчном пузыре млекопитающих.
Для того чтобы эту схему можно было применить для исследования насекомых, ее следует дополнить (1) мембраной (возможно, кутикулой), избирательно проницаемой для воды со стороны просвета кишечника, и (2) механизмом реабсорбции растворенных веществ (обычно Na) через мембрану из секреторного канала. Натрий должен циклически выходить и вновь входить в клетки, а вода должна перемещаться против общего градиента при движении из кишки в гемолимфу, оставляя гиперосмотическую мочу [369] (рис. 1-31).
Изучение ультраструктуры задней кишки таракана, мухи Calliphora и саранчи Locusta подтвердило правильность описанной модели. У Calliphora корковые клетки расположены в конусах, которые выступают в просвет задней кишки. Большие межклеточные синусы, образованные складками латеральных мембран, у мух, которым в заднюю кишку вводили гипотонический раствор, растягиваются, а у голодающих спадаются. Синусы открываются в гемоцель; на их поверхности можно гистохимически выявить Mg-АТФазу. Считается, что катионы выдавливаются в межклеточные пространства, делая их среду гиперосмотической; затем вода в силу осмотического градиента всасывается из просвета кишечника и таким образом поглощается. Такой механизм вполне мог бы Функционировать в просвете кишечника без участия ионов и обеспечивать поглощение воды из раствора неэлектролитов в задней кишке [27].
У Periplaneta в стенках задней кишки располагаются утолщения из цилиндрических клеток с перегородчатыми десмосомами на
108
Глава 1
апикальном и базальном концах. Между клетками имеются расширения и апикальные синусы. Вода может быть перемещена из просвета кишки снова в среду (гемолимфу). В условиях нормальной гидратации осмотическая концентрация кишки (включая и жидкость из мальпигиевых сосудов) может равняться 275 моем, а
Рис. 1-31. Рисунок и схема ректальной подушечки таракана Periplaneta [369]. М — мышечный слой, омываемый гемолимфой, К — кутикула, выстилающая внутренность задней кишки. Трахеи (Т) проходят через субэпителиальный синус (С) и входят в межклеточные синусы (МС). Клетки с ядрами (Я) разделены межклеточными каналами (МК) и крупными расширениями (Р). На схеме движение воды показано светлыми стрелками, а растворенных веществ — черными.
гемолимфы — 379 моем, тогда как у обезвоженного животного первая величина может достигать 1000 моем. Полагают, что растворенные вещества (вероятно, какие-то органические молекулы) выдавливаются в межклеточные расширения, и туда же из просвета кишки через выстилающую ее кутикулу осмотически всасывается вода. Растворенные вещества потом диффундируют обратно в гемолимфу и эпителиальные клетки. Ионы калия совершают кругооборот, но концентрация их в задней кишке выше, чем в гемолимфе. Однако, для того чтобы обеспечить реабсорбцию необходимого количества воды, одних ионов натрия и калия, содержащихся в межклеточной жидкости, явно недостаточно; очевидно, активную роль должны играть и другие растворенные вещества.
Обмен воды: осмотический баланс, гормональная регуляция 109
Аминокислоты также реабсорбируются задней кишкой. Система абсорбций ингибируется ДНФ, а скорость всасывания воды усиливается под действием экстрактов из corpora allata и из грудного и брюшного ганглиев [370].
У мучного червя Tenebrio molitor экскременты поступают в заднюю кишку жидкими, а из анального отверстия выходят в виде сухих частиц. При получении им влажной пищи осмотическая концентрация его гемолимфы соответствует понижению точки замерзания на 0,75 °C, а при сухой пище — на 1,5 °C. Мальпигиевы сосуды не свободно располагаются в полости тела, а тесно прилегают к задней кишке (и называются поэтому периректальными сосудами), причем весь криптонефрический ректальный комплекс окружен перинефрической мембраной [143, 286] (рис. 1-32). Содержимое начального отдела задней кишки изоосмотично с гемолимфой, а в нижележащих отделах гиперосмотично. Калий из задней кишки всасывается в периректальное пространство, из которого поступает затем в сосуды; кроме того, калий поглощается и из гемолимфы периректальными сосудами. Стенка мальпигиевого сосуда имеет положительный по отношению к гемолимфе потенциал, равный 50 мВ. В соответствии с осмотическим градиентом вода поступает из задней кишки в мальпигиевы сосуды, которые в свою очередь возвращают ее в гемоцель. Таким образом, передвижение веществ в этих видоизмененных мальпигиевых сосудах идет в обратном (по сравнению с другими насекомыми) направлении. Изнутри поверхность перинефрической мембраны покрыта многопластинчатой оболочкой, а клетки стенок сосудов имеют со стороны, обращенной к периректальному пространству, складчатую поверхность. За счет поглощения К из гемолимфы и транспорта его из задней кишки создается осмотический градиент, благодаря которому пери-ректальные (мальпигиевы) сосуды перемещают воду в гемолимфу [261] (рис. 1-33).
Мальпигиевым сосудам и задней кишке свойственны некоторые общие черты. Так, каждый из них активно транспортирует калий и может создавать осмотический градиент. (Эти транспортные механизмы нечувствительны к уабаину и, очевидно, не относятся к транспортирующей натрий АТФазной системе; в клетках каждой из них имеются глубокие складки, заполненные митохондриями и расположенные на той стороне клеток, на которой происходит транспорт веществ.) По-видимому, насекомые — единственные представители беспозвоночных, вырабатывающие весьма гиперосмотическую мочу и сохраняющие этим воду. Только млекопитающие обладают аналогичной способностью, однако механизм подобных процессов у них отличается от механизма, имеющегося у насекомых. У наземных насекомых совершается круговорот калия и иода может двигаться в направлении осмотического градиента по ограниченным внутриклеточным каналам обратно в гемолимфу, оставляя гиперосмотические продукты выделения.
110
Глава 1
Р,ис. 1-32, Криптонефрический комплекс мучного червя Tenebrio {369]у
1 — периректальный мальпигиев сосуд; 2 — периректальное пространство; 3 — анальное ОТ* верстие; 4 — просвет кишки.
Точки замерзания содержимого отделов
Ректальный комплекс
0,7-^2,2 Просвети
Направление потока Г^>0бщее количестве перенесенной воды И^ Общее количес тво перенесен кого KCL
Анус
кишки
Сухие срекалии
Рис. 1-33. Схема движения КО и воды в ректальном комплексе личинки Тепе-brio J261].
Обмен воды: осмотический баланс, гормональная регуляция 111
Рыбы
Происхождение позвоночных неясно. Все первичнохордовые — обитатели морей, и тип хордовых, несомненно, имеет морских предшественников. Следующие факты могут свидетельствовать о пресноводном происхождении рыб: кровь всех современных костистых рыб очень разбавлена, кровь хрящевых рыб также содержит низкие концентрации солей; почки состоят из клубочков, приспособленных к выделению гипоосмотической мочи. Однако процесс фильтрации с последующей реабсорбцией встречается и у морских ракообразных и моллюсков, поэтому он не может служить доказательством пресноводного происхождения. Древняя кистеперая рыба Latimerla почти изоосмотична морской воде и обладает осмотической концентрацией 1181 моем [266].
Каким бы ни было их происхождение, костные и хрящевые рыбы, очевидно, мигрировали из пресной воды в морскую в течение мелового периода. Многие современные рыбы (костистые) вновь заселили пресные воды, тогда как некоторые другие (костные га-ноиды) на протяжении всей истории позвоночных постоянно жили в пресной воде. Некоторые морские рыбы и теперь еще сохранили зависимость от пресной воды; одни из них, подобно лососю (анадромные), возвращаются для размножения в пресную воду, другие, подобно угрю (катадромные), размножаются в океане, а созревают в пресной воде. Некоторые рыбы, например Fundulus, встречаются в устьях рек и в пресной и в солоноватой водах — как молодь, так и взрослые формы. У других видов рыб, в частности у менхадены и циносционы, в пресную воду мигрирует молодь.
Бесчелюстные (круглоротые)
Миксины обитают только в море. Они {Myxinae и Polistotrema) почти изоосмотичны своей среде, и их осмотические концентрации равны 600—1540 моем. У них хороню развита ионная регуляция, а общая осмотическая концентрация варьирует в основном за счет изменений концентрации аминокислот. У миксины при изменении осмотической концентрации в 2,5 раза 80% сдвига концентрации в мышцах приходится на долю аминокислот, особенно пролина, аланина и лейцина [62].
Миноги представлены как анадромными (размножающимися в пресной воде), так и живущими исключительно в пресной воде формами. У миноги Petromyzon Лзамерз крови равна —0,48 °C в пресной воде и —0,59 °C в морской. Когда морские миноги входят в пресную воду, они перестают ее заглатывать. По возвращении их в солоноватую воду этот процесс возобновляется; при этом активируется внепочечное выделение Na и С1. В пресной воде они могут активно поглощать хлориды. У особей, обитающих в озере Мичи
112
Глава 1
ган, отношение моча/плазма для Na+ равно 13,5/124, а для К+ — 2,0/4,1 [232].
Встречающаяся в Англии минога Lampetra planeri живет только в пресной воде; другой вид — L. fluviatilis— относится к анадром-,ным формам, и его личинки мигрируют в солоноватые воды, где созревают, а затем поднимаются в реки для размножения. Молодь L. fluviatilis обладает гипоосмотической регуляцией.
Среда ДзаМерз сРеды Дзамер плазмы
Пресная вода 33%-ная морская вода 50%-ная морская вода 0,66 0,97 0,46 0,54 0,57
L. fluviatilis сохраняет гипотоничность, заглатывая солоноватую воду и экскретируя С1~ внепочечным путем. Взрослые зрелые миноги теряют способность к выживанию в разбавленной морской воде. L. planeri в несколько раз более проницаема для воды, чем jL. fluviatilis.
Взрослые особи Lampetra в пресной воде подобны другим рыбам: концентрация их крови составляет около 255 моем, а объем мочи равен 200 мл/(кг-сут) [45]. Личиночные формы имеют меньшую осмотическую концентрацию (215 моем). Они активно поглощают Na с помощью транспортной системы, Км (величина полунасыщения) которой равна 13 мМ и скорость максимального транспорта составляет 1,08 мкМ/(г-ч) [246].
Итак, осмотические свойства миксин и миног весьма различны: миксины изоосмотичны среде, миноги же обнаруживают как гипо-, так и гиперосмотическую регуляцию.
Хрящевые рыбы (пластиножаберные)
Акулы и различные скаты сбитают в основном в море; лишь немногие виды найдены в пресной воде. Среди морских рыб они представляют собой уникальные формы, так как осмотические концентрации их крови всегда выше, чем в окружающей среде (табл. 1-4). Содержание солей в плазме морских пластиножаберных почти равно их содержанию в плазме костистых рыб, но доля осмотической концентрации, обусловленная NaCl, составляет лишь 45% общей осмотической концентрации. Осмотическое давление создается у них главным образом за счет накопления большого количества мочевины и некоторого количества триметиламиноксида (ТМО) во всех тканях и жидкостях тела. Это позволяет акуловым рыбам поддерживать в морской воде такой же осмотический градиент, что и в пресной, и в обоих случаях выделять мочу, гипо-осмотичную по отношению к крови. Реабсорбция мочевины в поч-
Обмен воды: осмотический баланс, гормональная регуляция 113
ках акулы изменяется обратно пропорционально концентрации мочевины в плазме. Кожа и жабры пластиножаберных относительно непроницаемы для мочевины. Развивающийся зародыш получает необходимую мочевину либо из организма матери (у живородящих видов), либо из заключенного в непроницаемую камеру яйца, запаса мочевины в котором хватает до тех пор, пока у малька не разовьется свой собственный механизм для ее удержания.
Таблица 1-4
Осмотические концентрации жидкостей тела некоторых хрящевых рыб
Животное Днар* °С А °C сыворотки* А . °C МОЧИ Кровь Источник данных
С1, мэкв мочевина, мМ
Морской скат Raja —1,85 (1000 моем) —1,94 (1041 моем) — 1,68 (950 моем) 230 357 (2140 мг%) [327]
Пресноводный Pristis Акула Carcharhinus Potamotrigon 0 — 1,0 (538 моем) 308 моем —0,1 (54 моем) 170 219 107 (642 мг%) 180 (504 мг N/100) 1,07 (3,0 мг N/100) [327] [353] [353]
Скат Raja eglanteria —1,52 —1,13 — 1,57 —1,37 222 195 368 320 [280]
Концентрация мочевины у разных видов различна. Так, акула Potamotrigon из верховьев Амазонки содержит лишь 1,07 мМ мочевины, а серая акула Carcharhinus из озера Никарагуа—180 мМ (табл. 1-4). Разные виды морских пластиножаберных отличаются своей устойчивостью к слабосолоноватым водам. Например, кошачья акула Scyliorhinus не выживает в 60 %-ной морской воде, однако останется живой, если осмотическую концентрацию среды повысить до уровня, свойственного морской воде (добавив в нее, например, мочевину или сахарозу) [4]. Скат Raja eglanteria хорошо переносит акклимацию к солености в диапазоне от 16,2 до 31°/оо, при этом содержание мочевины в его крови увеличивается немного больше (на 35%), чем содержание ионов хлора (на 31%) [280]. Лимонные акулы Negaprion в течение недели подвергались аккли-мации к 50 %-ной морской воде; в результате этого осмотическая концентрация их крови снизилась на 40%, содержание мочевины в плазме — на 55, триметиламиноксида — на 60 и хлоридов — на 20%; выведение мочевины почками повысилось втрое [132]. Когда ската Raja erinacea переносили из 100%-ной морской воды в 50%-ную, выделение мочи у него увеличивалось в 6 раз, доля клубочковой фильтрации повышалась в 4 раза, выведение мочевины — в 22 раза, выведение С1~ — в 4 раза, а выведение ТМО — в 13 раз [131].
Как и у многих морских костистых рыб, у акуловых почки представляют собой главный путь выделения магния, фосфатов и суль-8—1.439
114
Глава 1
фатов; моча гипоосмотична по отношению к крови, NaCl выводится внепочечным путем. Его выведение осуществляется ректальными железами, выделяющими секрет, который у акулы, по-видимому, изоосмотичен по отношению к крови, но содержит более значительное количество NaCl и не содержит практически Са2+, Mg2+ и мочевины. Находясь в морской воде, колючая кошачья акула выделяет 0,47 мл/(кг-ч) жидкости, содержащей 495 ммоль/л С1. У голодающей акулы отношение концентрации ионов хлора в секрете слабо активных ректальных желез к их концентрации в плазме равно 1,24; введение ей NaCl усиливает секрецию. Инъекция сахарозы или мочевины дает более слабый эффект, секреция ректальных желез стимулируется раздражением осмотических рецепторов и рецепторов, воспринимающих изменение объема, и особенно введением NaCl [56]. Ректальные железы (у 9 видов) богаты АТФ-азами, требующими для своей активности Mg, Na и К и чувствительными к уабаину; следовательно, механизм транспорта ионов в этом случае подобен другим мембранным натриевым «насосам» [41]. В эпителиальных клетках желез имеются пузырьки, расположенные апикально и латерально между зубчатыми отростками ;[96]. У колючей акулы Squalus содержание Na+ в плазме составляет 250 мМ при содержании его в среде, равном 440 мМ. Как показали опыты с радиоактивными метками, общее поступление Na, происходящее главным образом через жабры, составляет 0,52 ммоль/(кг-ч). Оно уравновешивается следующими видами выделения: через почки — 0,15, через ректальные железы — 0,24 и через жабры — 0,16 ммоль/(кг-ч) [164]. Пока не установлено, обладают ли пластиножаберные способностью активно поглощать Na в пресной воде.
Костистые рыбы
Экологические корреляты. У пресноводных костистых рыб осмотическая концентрация крови равна 130—170 моем; моча у них сильно разбавлена и образуется в большом количестве. Ниже приведены данные для панцирной щуки:
Среда, Диар Кровь, Д СП Моча, А,, ' м Объем мочи, мл/(кг-сут)
—0,03 —0,57 —0,08 200—400
Пресноводные рыбы поглощают очень мало воды. Кожа у них относительно непроницаема для воды, однако вода осмотическим путем может проникать через жабры и слизистую рта.
Поступающая в организм вода создает в тканях рыб определенную водную нагрузку; почки пресноводных рыб имеют хорошо развитые гломерулы, которые могут фильтровать значительные объемы жидкости. По мере продвижения фильтрата по канальцам боль-
Обмен воды: осмотический баланс, гормональная регуляция 115
гпинство растворенных в нем веществ реабсорбируется, в результате чего моча становится менее концентрированной. Концентрация этой разведенной мочи все же выше концентрации пресноводной среды; некоторая потеря солей происходит также за' счет диффузии и в малых количествах — с фекалиями (рис. 1-34). Потеря солей частично компенсируется поступлением их с пищей; кроме того, необходимые соли поглощаются из среды клетками жабр. Ионы хлора могут абсорбироваться из очень разбавленных растворов против
Рис. 1-34. Основные пути движения ионов и воды в процессе осморегуляции, у пресноводной, гиперосмотичной по отношению к среде |(Д), и морской, гипоосмо-тичной по отношению к среде (Б), костистой рыбы.
Сплошными стрелками показано активное, а пунктирными — пассивное движение.
градиента концентрации. Некоторые виды рыб зависят в основном от пищевых источников солей (ерш Acerina, окунь Регса), другие же имеют более активные системы абсорбции солей (плотва Leuciscus, карась Carassius).
Катадромные рыбы размножаются в море, а созревают в пресной воде. Американский и европейский угри (Anguilla vulgaris) размножаются в Саргассовом море, откуда молодь мигрирует в пресные воды соответствующих континентов. Осмотическая концентрация крови угрей в морской воде колеблется в пределах от Азамерз=—0,69 до Д3амеРз=—75 °C, а в пресной воде — от Азамерз=—0,61 до Д3амерз=—0,62 °C. В почках Anguilla имеются гломерулы и дистальные сегменты. Проницаемость кожи угря для хлора и воды низка. В пресной воде интенсивность выделения мочи составляет 84 мл/(кг-сут), а в морской воде — только 15,1 мл/(кг-сут). В морской воде угри активно выделяют С1~ через жабры, в пресной же воде ионы хлора частично поглощаются жабрами, а частично поступают с пищей.
Анадромные рыбы, такие, как лосось, размножаются в пресной воде, а их подросшие мальки затем мигрируют в море. Кровь лососевых, обитающих в море, замерзает при —0,762 °C, а кровь этих же рыб, взятых из пресной воды во время нереста, имеет точку замерзания —0,668 °C. Кровь чавычи при миграции ее в нерестовые озера разбавляется только на 12%. У кижуча происходят более значительные изменения: осмоляльность его крови в морской воде равна 400 моем, а в пресной — 295 моем. Еще в период жизни в пресной воде у молоди Oncorhynchus kisutch обнаруживается 8*
116
Глава 1
адаптация к морской воде, и крупные особи в том же году мигрируют в море; мелкие особи, сохранив уже выработанную способность адаптации, мигрируют на следующий год. У стальноголового лосося Salmo gairdneri подобная адаптация утрачивается, если миграция в море почему-либо не состоялась [68, 136]. У Oncorhyn-chus nerka адаптация к морской воде возникает перед самой миграцией; точка замерзания ее мочи становится равной —0,44 °C, если же эту рыбу оставить на несколько дней в пресной воде, ее адаптация утрачивается и моча становится разбавленной (ДМочи== =—0,23°C). Концентрация натрия в ее крови в морской воде равна 172 мМ, в пресной воде—150 мМ [386].
В океане костистые рыбы сталкиваются с необходимостью сберегать воду и выделять соли, поэтому выделяющие воду гломерулярные почки им не нужны (рис. 1-34). Концентрация крови у морских рыб ненамного выше, чем у пресноводных (Авн=—0,7 °C); по-видимому, первые обладают механизмом, поддерживающим высокую степень гипотоничности. Их моча гипоосмотична по отношению к крови и образуется в очень небольших количествах. Морские рыбы в отличие от пресноводных заглатывают некоторое количество воды, правда меньше, чем полагали раньше. По мере того как морская вода проходит по кишечнику, из нее поглощаются вода и некоторые соли, причем Na+ и С1~ поглощаются в большей степени, чем Mg2+ и SOl”. Следовательно, концентрация Na+ и Cl-при этом уменьшается, тогда как концентрация К+, Са2+, Mg2+ и SOI- увеличивается [372а]. Некоторые ионы морской воды, особенно Mg2+ и SO4-, теряются с фекалиями; с мочой выделяются в основном Mg2+, Са2+, SOI' , фосфаты и некоторое количество К+, тогда как большая часть Na+ и С1~ экстрагируется внепочечным путем— через жабры.
На перфузируемых препаратах жабры — сердце угря было четко показано, что NaCl выводится в основном через жабры [196]. Хлор выделяется в морскую воду, концентрация его в которой выше, чем в крови. Изменение концентрации ионов хлора в перфузионной жидкости влечет за собой изменение уровня их выделения. Когда угрей переносили из пресной воды в морскую, содержание Na в их плазме повышалось с 108 до 153 мэкв, а выделение Na возрастало от 8,3 до 700 мкэкв/(100 г-ч). Добавление NaCl в омывающую среду также повышало выделение Na, любое изменение NaBH стимулировало изменения обмена через жабры. Механизм, с помощью которого в организме происходит определение содержания натрия, пока неизвестен [236].
У таких рыб, как бычок-подкаменщик, морской черт, камбала или пикша, в норме С1~ в моче отсутствует или его очень мало; однако можно повысить его содержание в моче экспериментальным путем. Азотистые продукты обмена, состоящие в основном из аммиака, выделяются путем диффузии через жабры. Камбала поглощает морскую воду в количестве от 0,5 до 1 % веса своего тела
Обмен воды: осмотический баланс, гормональная регуляция
117
в 1 ч. Морской окунь Serranus поглощает 0,5%, а морская собачка— только 0,03% веса тела в 1 ч [249, 250].
Агломерулярные почки. Морские костистые рыбы выделяют намного меньше мочи, чем пресноводные рыбы, что не удивительно, так как первые имеют менее развитые почки. Так, в почках взрослых особей опсануса Opsanus и морского черта Lophius отсутствуют гломерулы, хотя у молодых рыб, возможно, имеются псевдогло-мерулы. У опсануса выделение мочи за сутки составляет только 2,5 мл/кг по сравнению с 300 мл/кг, выделяемыми пресноводным сомом. В типичных почках морских костистых рыб отсутствуют также дистальные извитые сегменты канальцев. Скорость фильтрации довольно низка даже у имеющих гломерулы морских рыб. Выделение мочи в процентах веса тела в сутки у угря равно 1,5; у камбалы— 1,4; у Fundulus—1; у Xiphister — 0,34. У камбалы обнаружена реабсорбция в мочевом пузыре [200].
Экскреция агломерулярными почками представляет собой в основном канальцевую секрецию. Такие почки могут выделять Mg2+, НРОГ, SOF, С1“ и креатинин и способны концентрировать также такие мелкие молекулы, как молекулы фенолового красного. Они не выделяют глюкозу или инулин даже после отравления флоридзином (веществом, блокирующим реабсорбцию глюкозы в гломерулярных почках). У Lophius, имеющего Дплазмы=—0,67 и Амочи——0,57, моча практически свободна от С1—, но может содержать Mg2+ и SOF в концентрациях, в 100 раз превышающих соответствующие концентрации в крови, и Са2+ — в меньших концентрациях [115].
Некоторые рыбы с агломерулярными почками могут адаптироваться к обитанию в пресной воде, при этом объем мочи у них увеличивается, а ее концентрация становится меньше, как показывают следующие данные, полученные при исследовании опсануса {Ops an us tau) [201]:____________________________________
Среда
морская вода 50%-ная морская вода пресная вода
Плазма
Na (мэкв) 159,8 153 107
К (мэкв) 5,2 4,5 7,1
моем Моча из мочеточников 392 385 250
Na (мэкв) 72,7 71,5 87
К (мэкв) 9,0 7,8 6,6
моем 356,3 331 213
выделение (мл) Моча из мочевого пузыря 0,018 0,019 0,087
Na (мэкв) 62,4 107
К (мэкв) 8,5 8,5
моем 348,5 300 231
118
Глава 1
Самые значительные изменения претерпевает внепочечное выделение натрия, которое в морской воде составляет 840 мкэкв/(100 г-ч), после 1—2 дней пребывания в пресной воде падает до 19,4 мкэкв/(100 г-ч), а после 3—4 дней — до 5,7 мкэкв/(100 г-ч). В норме выделение натрия в морской воде составляет 16% его содержания в организме за 1 ч, еще выше оно у морской собачки Xiphister (23%) и у тиляпии Tilapia (66%) [200].
Выделение ионов костистыми рыбами в пресной и морской воде. Количество Na, выделяемого карпозубой рыбой Fundulus hete-roclitus, говорит о существовании как бы двух разных объемов, в которых содержится натрий: константа быстрой фазы выхода натрия (kF) равна 0,55 ч-1, а константа медленной фазы (k2)—0,16 ч-1. У другой морской рыбы, Pelates, найдена единая константа скорости; она равна 0,49 ч-1 в морской воде при солености 35°/оо и уменьшается до 0,18 ч-1 при солености Ю%0 [83]. Как правило, константы поступления (kn) и выделения (&в) уменьшаются при понижении солености, как показано, например, для Fundulus [273].
Среда ke (Na)
Морская вода 0,464 ч-1
40%-ная морская вода 0,135
Пресная вода 0,017
kn (Na)
Морская вода 0,261, или 20,5 ммоль/(кг-ч) Na
40%-ная морская вода 0,154
Пресная вода 0,012, или 0,58 ммоль/(кг-ч) Na
Эти данные свидетельствуют о том, что, когда рыба переходит из морской воды в пресную, обмен ионов у нее резко уменьшается.
Роль кишечника в обмене ионов может быть продемонстрирована с помощью изменения движения воды и ионов через стенку изолированного кишечника. Когда обе стороны изолированного участка кишечника морского подкаменщика Cottus scorpius омываются рингеровским раствором, процесс всасывания в нем достигает 11,5 мкэкв/(см2-ч) и сопровождается поглощением воды. Между двумя сторонами стенки кишечника нет заметной разности потенциала, что свидетельствует о существовании электронейтрального «насоса» [166]. Подобным же образом в перфузируемом in vivo кишечнике угря идет активное поглощение натрия, причем поглощение воды тесно связано с транспортом натрия, так что может идти против осмотического градиента. У морских угрей транспорт натрия, а вместе с ним и поглощение воды из почти изоосмотиче-ского раствора больше, чем у угрей, адаптировавшихся к пресной воде; оно превышает также и соответствующий транспорт в кишечнике лягушки или собаки [325] (см. таблицу на стр. 119).
У ряда рыб проводилось исследование баланса натрия и воды при разных соленостях. Концентрация Na в крови у морской собачки Blennius, обитающей в приливно-отливной зоне, составляла
Обмен воды: осмотический баланс, гормональная регуляция
119
Угорь в морской воде Угорь в пресной воде Лягушка, толстая кишка Собака, подвздошная кншка
Общий транспорт Na, 10~5 мэкв/(мм2-с) 6,03 2,77 1,03 2,01
Транспорт воды, 10-4 мкл/(мм2-с) 4,5 1,83 0,5—1
170 ммоль/л; в 100%-ной морской воде наблюдался обмен натрия, протекавший со скоростью 100 ммоль/л крови в 1 ч, тогда как в 10 %-ной морской воде он снижался до 20 ммоль/л крови в 1 ч. В норме кровь этой рыбы электроположительна по отношению к 100%-ной морской воде, и ее потенциал равен 23 мВ; по отношению
Na 4,0
Н2о 8,0
Na 54,3 H2O
Cl 67,5 Na 18,2 H2O 2477 \ \ Cl /8,8 2445
Na St,7
U C1 0,60
H2O 3,W
,4
Na 0,08
Cl O,OOZZ>
H2O 1,60
Na 9,23 H2O N&3./O ci 15,302585 H2O C\6,8O<^ \\ 2579
Na 6,72 N 0 67 ^9,00 Ci0\57
H2O 11,00
Рис. 1-35. Водно-солевой баланс у Xiphister: различные пути движения воды, Na и Cl у рыбы, находящейся в 100%-ной |(Д) или в 10%-ной \(Б) морской воде [108]. 100%-ная морская вода=480 мМ Na на 1 кг или 560 мМ С1 на 1 кг. Все величины даны в мМ (мл)/кг веса рыбы в сутки.
к 10%-ной морской воде она электроотрицательна, и ее потенциал равен 3 мВ. Следовательно, в морской воде С1~ активно выделяется, по-видимому, через жабры, а в 10%-ной морской воде, наоборот, поглощается [165]. Аналогичная картина, характерная для морской собачки Xiphister, представлена на рис. 1-35 [108]. Расчет, сделанный на основании сравнения потерь натрия в растворе маннита с потерями в морской воде, показывает, что 47% его потери в морской воде приходится на долю обменной диффузии; в 10%-ной морской воде этот тип потерь совершенно ничтожен.
Баланс поступления и выведения Na+ и С1~ рыбы-маслюка Pholis gunnelus, обитающей в приливно-отливной зоне, дан в табл. 1-5 [109].
Морской подкаменщик Cottas b abatis в пресной воде живет лишь несколько часов, а пресноводный вид Cottas morio не может жить в морской воде. Найдены следующие величины потока нат-
120
Глава 1
Таблица 1-5
Баланс поступления и выведения ионов у рыбы Pholis gunnelus
Поступление внутрь. ммоль/(кг-сут) Выведение, ммоль/(кгсут)
Na С1 Na С1
Морская вода
5,1 5,9 Питье -— —.
— — Моча 0,5 0,5
47,6 36,4 Диффузия и потенциал 37,5 5,6
64,3 25,1 Только диффузия 27,7 8,1
—— Активный транспорт Потенциал, +18 мВ 14,8 36,2
Пресная вода
0,14 0,16 Питье —— 0,6 5,3 5,8
— — Моча 0,5
7,2 3,7 Диффузия и потенциал 7,6
6,6 4,1 Только диффузия 8,3
0,69 1,87 Активный транспорт Потенциал, —6 мВ
рия в процентах от его количества, обмениваемого в течение 1 ч [Н6]:
Cottas bubalis Cottas morio В пресной воде 1,1 В морской воде 16
Cottas scorpius 12,5
Fundulis heteroclitus 1,4 29
Tilapia 4,9 55,5
По-видимому, С. scorpius и С. bubalis не могут настолько сократить потери Na, чтобы иметь возможность существовать в пресной воде, а С. morio не может настолько избавиться от избытка солей, чтобы переносить морскую воду.
Fundulus heteroclitus, в норме обитающая в море, хорошо переносит и морскую и пресную воду; удельный вес ее тела изменяется в соответствии с новыми условиями через 6 ч после перехода в морскую воду и через 24 ч после перехода в пресную. В пресной воде удельный вес тела уменьшается в основном за счет увеличения объема газа в плавательном пузыре; в морской воде происходит интенсивное поглощение натрия — 20 ммоль/ (кг • ч); примерно половина его поступает путем диффузии через жабры, а половина — с выпиваемой водой. В пресной же воде поглощение натрия составляет 0,6 ммоль/(кг-ч) и происходит целиком за счет активного поглощения. Проницаемость для Na снижается после нескольких минут пребывания в пресной воде; в течение нескольких часов пре
Обмен воды: осмотический баланс, гормональная регуляция
121
бывания в морской воде проницаемость для Na возрастает [273]. В жабрах Fundulus содержатся секреторные клетки с многочисленными митохондриями и хорошо развитой эндоплазматической сетью; последняя имеет (в морской воде) выпуклые дистальные пузырьки, в основаниях которых при специальном окрашивании выявляются хлориды (рис. 1-36 и 1-37). В жабрах же у пресноводной Fundulus нет дистальных пузырьков [263]. Предполагается, что эти клетки при обитании в морской воде активно секретируют С1~ (а вместе с ним и Na+); клеток, которые поглощали бы NTaCl из пресной воды, не обнаружено.
Другой вид рода Fundulus (F. kansae) найден в сверхсоленых озерах; эта рыба выживает в растворах, содержащих от 0,2 мМ Na и 0,1 мМ Са, вплоть до 250 %-ной морской воды. Она гораздо менее проницаема для Na: в морской воде поступление Na у нее равно 1,7 ммоль/(кг-ч) по сравнению с 20 ммоль/(кг-ч) у F. heteroclitus [274].
Изменения потока Na при разных значениях солености среды изучались у эвригалинной звездчатой камбалы Plathychthys [248]. Было обнаружено, что в морской воде обмен натрия составляет у нее 2,6 мкэкв/(100 г-ч). Обмен через жабры совершается двояким путем: в морской воде 85% Na переносится с помощью обменной диффузии и 15%—за счет экскреции. Возможные механизмы изменений проницаемости жабр для натрия обсуждаются в гл. 2.
В целом у стеногалинных видов, которые не переносят переселения в пресную воду, выделение Na довольно значительно: у Serranus — 58% общего содержания Na в организме на 100 г веса за 1 ч, у Uranoscopus — 51%, в то время как у эвригалинных Plathychthys—15,9% и Anguilla—19,2% [247]. Была обнаружена четкая зависимость деятельности почек от свойств среды: находясь в морской воде, организм реабсорбирует в большей мере воду, а находясь в пресной воде, — в большей мере соли, что обнаружено, например, у Plathychthys [200].
Фильтрация, мл/(кг-ч) Отношение моча/плазма, инулин мэкв/л моем
Na К С1
В морской воде Моча 0,24 4 59,7 2,5 145 275
Плазма В пресной воде Моча 0,42 2,3 142 30,4 3,4 1,2 168 36 297 90
Плазма 124 3 132 240
Имеются сведения и о реабсорбции некоторго количества растворенных веществ и воды в мочевом пузыре. Кроме того, различия в интенсивности выделения позволяют предполагать вовлечение в процесс различного числа гломерул.
122
Глава 1
Рис. 1-36. Хлоридные клетки в жабрах Fundulus, адаптированного к морской воде [263].
Три клетки находятся в одной апикальной полости (указано стрелками); аморфный материал в полости находится в стадии выделения. Эп — эпителий; ХК — хлоридная клетка.
Рис. 1-37. Хлоридные клетки Fundulus, адаптированного к морской воде [263]. С1 осажден при окрашивании сепаром.
Обмен воды: осмотический баланс, гормональная регуляция 123
При перемещении рыбы из морской воды в солоноватую изменяется не только проницаемость их жабр для Na и функции почек, но изменяется также распределение воды и ионов между клетками и внеклеточной жидкостью. Когда камбалу Pleuronectes переносили из 100%-ной морской воды в 75%-ную, у нее сначала наблюдалось увеличение объема внеклеточной жидкости, затем после урегулирования концентраций ионов в мышцах содержание азотистых компонентов изменялось таким образом, что при равновесии количество нингидринположительных веществ снижалось с 71 до 44 ммоль/кг, а количество триметиламиноксида — с 30 до 12 ммоль/кг; в то же время содержание Na уменьшалось с 14,7 до 10 мэкв, а С1 — с 41 до 30 мэкв [207].
Проницаемость для воды. Еще одно отличие пресноводных рыб от морских состоит в неодинаковой проницаемости их жабр для воды. Диффузионная проницаемость, измененная с помощью ТНО, в пресной воде выше, чем в морской. Осмотический приток, определяемый по различию объемов поступившей при питье и выделенной с мочой воды, также выше в пресной воде. Коэффициент проницаемости (диффузионный и осмотический) рассчитывается исходя из площади жабр. В табл. 1-6 приведено сравнение ряда констант, полученных для рыб, с константами, полученными для мембран некоторых амфибий [250].
Таблица 1-6
Коэффициенты проницаемости мембран у рыб и амфибий
Диффузионное поступление, мкл/(см2-ч) Поступление с питьем, мкл/(100 г-ч) Общий осмотический обмен, мкл/(мм2-ч) р OCM’ 104 см/С Р Диф’ 104 см/с
Адаптированные к морской воде Anguilla 64 325 —294 0,19 0,18
Platichthys 61 192 —145 0,14 0,17
Serranus 33 277 —207 0,10 0,10
Адаптированные к пресной воде Anguilla 91 135 4-403 0,79 0,25
Platichthys 97 37 4-250 0,70 0,27
Carassius 121 51 + 1394 2,08 0,34
Амфибии Xenopus, кожа Рапа esculenta, кожа мочевой пузырь Рапа temporaria, кожа Bufo bufo, кожа Bufo marinus, мочевой пузырь Степень влияния со. лености среды на i фоницае 2,8 5,6 7,5 3,3 23,6 6,9 !МОСТЬ Д о,з 0,55 1,0 0,65 1,48 0,95 ЛЯ ВОДЫ
У разных видов различна. У желтого угря Anguilla в пресной воде
124
Глава 1
обмен воды идет гораздо интенсивнее, чем в соленой, а у серебряного угря он в обеих средах одинаков [ПО]; у Pholis проницаемость для воды в 100 и в 20 %-ной морской воде одинакова [109]. Более низкая проницаемость для воды в условиях высокой солености может быть результатом влияния Са и Mg на жаберные мембраны (см. гл. 2).
У некоторых беспозвоночных (ракообразных Carcinus и Rhithropanopeus [331], червя Nereis [332]) при перемещении их из морской воды в пресную проницаемость для воды либо очень мало изменяется, либо уменьшается, подобно проницаемости для Na. У эвригалинных рыб различия более выражены: в морской воде их проницаемость для воды ниже, чем в пресной. Для рыб, по-видимому, более существенной является регуляция диффузионных потерь, поскольку их почки приспособлены для образования разбавленной мочи и в морской воде должен поддерживаться значительный градиент для воды в направлении внешней среды.
Влияние температуры. У некоторых морских рыб, которым приходится зимой переносить холода, при низких температурах происходят изменения осмотических и ионных свойств. У одних видов, обитающих близко к поверхности, где образуется лед, кровь замерзает при —1,5, —1,8 °C зимой и при —0,7, —0,8 °C летом; понижение температуры замерзания обусловлено наличием в крови растворенных органических веществ (см. гл. 9). У других видов, особенно у глубоководных, осмотические концентрации повышаются очень незначительно, что, однако, не мешает им переносить сильное охлаждение. В целом в крови морских рыб при низких температурах обнаруживаются более высокие концентрации ионов, чем при высоких температурах; у пресноводных рыб концентрация ионов крови зимой или при акклимации к холоду ниже, чем летом. У радужной форели осмотическая концентрация и содержание ионов хлора в крови выше при 5, чем при 15 °C. Результат подобных изменений как у морских, так и у пресноводных костистых рыб проявляется в незначительном уменьшении осмотической работы при низких температурах (см. гл. 10). Антарктическая рыба Trematotnus при низких температурах выделяет с мочой больше С1 и Na, а при высоких'—больше Mg.
Ферменты и гормоны. У многих животных в транспорте натрия принимает участие NaK-АТФаза, чувствительная к уабаину. Ее активность в жабрах морских костистых рыб довольно значительна, а в жабрах пластиножаберных и пресноводных костистых рыб мала. Активность этого фермента у угря при переходе из пресной воды в морскую удваивается (см. гл. 2). В процессы ионной и осмотической регуляции у рыб могут быть вовлечены также некоторые гормоны. Их роль обсуждается в конце настоящей главы.
Таким образом, как хрящевые, так и костистые рыбы обладают весьма богатыми возможностями осмотической регуляции. Пластиножаберные обитают главным образом в морской воде, однако сре
Обмен воды: осмотический баланс, гормональная регуляция
125
ди них встречаются и пресноводные виды; они в значительной степени гиперосмотичны, и высокая концентрация их крови поддерживается за счет незначительного выведения ионов с мочой. У некоторых видов очень активно функционируют ректальные железы, секретирующие соли. Морские костистые рыбы гипоосмотичны — в основном благодаря секреции солей через жабры. Пресноводные рыбы выделяют обильную мочу и активно поглощают соли через жабры. Эвригалинные рыбы, которые могут мигрировать из пресной воды в соленую и обратно, сохраняют относительное постоянство концентрации внутренней среды, изменяя свою проницаемость и свойства транспортных механизмов.
Амфибии
Экологические корреляции с осмо регуляцией
Одни виды амфибий постоянно обитают в воде, другие по крайней мере часть жизни проводят на суше. Яйца амфибий откладываются в воду или в сильно увлажненные места суши, такие, как скопление заплесневевших листьев, углубления между листьями, в которых собирается вода, и т. п. Головастики, только что вылупившиеся из яйца, поглощают воду в несколько раз интенсивнее, чем взрослые. Амфибии, живущие в пустынях, развиваются очень быстро, взрослые животные роют себе норы, которые покидают только во время дождя. Известно несколько видов лягушек, размножающихся в солоноватых водах, но ни один из них не является истинно морским видом.
Содержание воды у наземных и водных бесхвостых амфибий (жаб и лягушек) одинаково, но допустимая потеря воды при высыхании уменьшается следующим образом [300]:
Вид Местообитание Допустимая потеря воды, % веса тела
Scaphiopus hamniondi Норы 50; 60
Pseudacris sequita Деревья 58
Pana piplens Вода и суша 46; 52
Rana clamitans Вода 39
Rana septentrionalis Вода 35
Вес Rana pipiens, помещенной после обезвоживания в воду, увеличивается со скоростью до 12% веса тела за 1 ч; после значительной водной нагрузки (инъекции воды) скорость потери воды (т. е. возвращение к нормальному ее уровню) меньше скорости регидратации и прямо пропорциональна количеству избыточной воды в организме.
У водных саламандр процесс регидратации идет медленнее, чем у наземных видов; саламандры могут извлекать воду из почвы в объеме, пропорциональном степени их обезвоживания [337].
126 Глава 1
Пустынная жаба Bufo cognatus может накапливать в мочевом пузыре запас воды в количестве, достигающем 30% ее максимального веса. Другая пустынная жаба, Bufo punctatus, прижимается брюшком (в области таза) к содержащему влагу веществу и получает таким образом до 423 мг воды на квадратный сантиметр в час; ее мочевой пузырь также сохраняет воду, которая затем может быть использована при засухе [238, 239].
Потеря воды за счет испарения через кожу лягушки или саламандры составляет 7зо уровня испарения со свободной водной поверхности, однако превышает интенсивность испарения с миллипо-рового фильтра [155]. Скорость выведения воды в воздушную среду равна скорости ее выведения в раствор сахарозы, когда осмотический градиент эквивалентен градиенту упругости пара [224]. У солоноватоводной жабы Bufo marinus, обезвоженной на 80%, концентрация натрия в мышцах увеличивается на 43%, а в плазме— на 33%; если обезвоженной В. marinus ввести раствор NaCl, то поглощение воды через кожу у нее повысится, а потеря воды с мочой уменьшится ;[319].
Проницаемость кожи для воды у наземных видов амфибий меньше, чем у водных, и имеет следующие значения [61]:
Осмотический ток воды, мкл/(см2-ч)
Земноводное Lepidoba- В воде ad lib 502
ctracus На воздухе, 3 дня 44
Наземная Bufo В воде ad lib 441
На воздухе, 3 дня 372
Кровь лягушки гиперосмотична по отношению к прудовой воде; моча гипоосмотична по отношению к крови и более обильна в разведенной среде, чем в концентрированной:
^нар ^вн
—0,07°С От—0,44 до—0,56°C —0,17°С
Пустынная лягушка Scaphiopus во время засухи зарывается в песок и может оставаться там в течение 10 месяцев. Концентрация ее крови при этом составляет 456 моем, концентрация ионов хлора —126 мэкв и мочевины—148 мМ; при нормальной гидратации организма соответствующие показатели крови характеризуются следующими величинами: концентрация крови 326 моем, С1~ — 118 мэкв, мочевины — 69 мМ [239].
Солоноватоводная жаба Bufo marinus при обезвоживании использует воду из мочевого пузыря, причем отношение осмотических концентраций мочевой пузырь/плазма в этих условиях может приближаться к единице. Адаптация этого животного к солоноватой воде ведет к снижению количества образовавшейся мочи. И наоборот, при адаптации к пресной воде у него уменьшается выделение натрия через почки. Таким образом, у обезвоженной жабы происходит реабсорбция воды и натрия из мочевого пузыря. Уменьшение
Обмен воды: осмотический баланс, гормональная регуляция 127
объема также стимулирует реабсорбцию воды из мочевого пузыря [244]. В норме водяная шпорцевая лягушка Xenopus laevis является аммониотелическим (см. гл. 7) организмом; однако после 2— 3-недельного пребывания в солевом растворе содержание мочевины в ее крови повышается в 15 раз, выделение мочи сокращается, и она начинает выделять мочевину вместо аммиака. Гормон арги-нин-вазотоцин, обладающий антидиуретическим действием у живущих на суше амфибий и диуретическим у рыб, влияния на Xenopus не оказывает [237].
Движение воды и солей через кожу
Кожа лягушек обладает хорошо развитой способностью избирательно поглощать соли. Когда лягушек, в течение нескольких дней содержавшихся в дистиллированной воде и потерявших некоторое количество солей из тканей, возвращали в водопроводную воду или разбавленные солевые растворы, у них наблюдалось активное поглощение солей. Ионы хлора поглощались вместе с ионами натрия из растворов NaCl и без катиона.— из растворов КС1, NH4C1 и CaCU; Вг_ поглощался, а I- не поглощался [196]. В изолированной коже лягушки сохраняется функция активного ионного насоса. Натрий может поглощаться из среды, разведенной вплоть до 10~5 М, причем транспорт против значительного градиента идет с поглощением энергии и вызывает образование электрического потенциала. В прудовой воде (1,4 мМ Na) лягушки поглощают 4,5 мкэкв/(г-сут), что уравновешивает потери натрия [142]. Выведение натрия на 10% осуществляется через кожу, а на 90% —через почки. У головастиков до 22-й стадии развития жидкости тела заряжены отрицательно по отношению к внешней среде; позднее их заряд изменяется на положительный. В этот период внутренняя сторона изолированной кожи, омываемой со всех сторон раствором Рингера, также оказывается положительно заряженной. На ранних стадиях развития поглощение ионов происходит через жабры, а у взрослых амфибий—.через кожу [6]. В табл. 1-7 сравниваются солоноватоводные лягушки Rana cancrivora, обитающая в Южном Вьетнаме, жаба Bufo viridis из Юго-Восточной Европы и эвригалинная американская жаба В. boreas.
Повышение осмотической концентрации плазмы, связанное с мочевиной, наиболее значительно у R. cancrivora, менее выражено У В. viridis и наименьшее — у В. boreas, у которой сохранение ги-перосмотичности достигается увеличением концентрации С1. У Rana cancrivora гипотоничность крови и гипертоничность мочи по отношению к крови поддерживаются благодаря накоплению мочевины, уменьшению почечной фильтрации и увеличению реабсорбции воды в почечных канальцах (рис. 1-38). При переходе из пресной воды в 40%-ную морскую воду концентрация К в мышцах этого животного увеличивается только на 23%, а мочевины — на 770%; таким
128
Глава 1
Таблица 1-7
Осмотические концентрации в крови бесхвостых амфибий
Среда моем Na, мэкв Мочевина, мМ CL мэкв Источник данных
В. viridis Пресная вода 279 ИЗ 35,8 99 [137]
(Юго-Восточная Европа) 40%-ная морская вода 441 173 71,6 99
В. viridis 144 моем 618 моем 484 544 145 230 89 101 118 179 [308а]
R. cancrivora Пресная вода 290 122 40 113 [138]
(Вьетнам) 60%-ная морская вода 830 181 300 131
В. boreas Пресная вода 156 64 23,3 61 [137]
(Америка) 40%-ная морская вода 366 183 31,6 172
В. bufo Пресная вода 410 моем — 213 318 145 179 12,5 10,5 [308а]
R. temporaria Пресная вода 407 моем 510 104 172 5,9—11,7 4,4 75,4 134 [308а]
Наружная концентрация^ мосмолъ/л
Рис. 1-38. Осмотические концентрации и концентрации К, Na, CI и мочевины в плазме и моче у лягушки Rana cancrivora, акклим'ированной к различным соленостям среды {134].
Косая штриховка — СГ"; горизонтальная штриховка — Na+. квадраты — К+» незаштрихован-ное пространство — мочевина.
Обмен воды: осмотический баланс, гормональная регуляция
129
образом, мочевина компенсирует осмотические сдвиги, ионные же изменения минимальны [137, 138]. В противоположность Rana cancrivora и В. viridus такие виды, как R. temporaria и В. bufo, обладают ограниченными возможностями для выживания в солоноватой воде. У этих видов повышение осмотической концентрации крови происходит в основном за счет ионов, а не мочевины. Ни одна из амфибий не способна поддерживать гипоосмотичность крови с помощью внепочечной экскреции, как это происходит у морских костистых рыб.
Головастики амфибий являются, как правило, аммониотеличе-скими формами и переходят к выделению мочевины (уреогенезу) лишь с приближением метаморфоза (см. гл. 7). Концентрация солей у головастиков R. cancrivora в солоноватой воде высока; переход к уреогенезу происходит у них на 25-й стадии развития. Когда взрослую В. viridis переносят из пресной воды в 30%-ную морскую воду, активность аргиназы ее печени повышается, так как при этом происходит образование и накопление мочевины [150].
Функция почек; мочевой пузырь к ‘^1
Солевой состав тела амфибий поддерживается благодаря хорошо развитой способности их почек к удержанию солей. Почки Rana и Necturus представляют собой очень удобные объекты для изучения ввиду небольшого числа относительно крупных нефронов, входящих в их состав. Их гломерулы расположены в один слой ближе к внутреннему краю почек. Каждый клубочек соединен при помощи «перешейка», снабженного ресничками, с толстостенным проксимальным канальцем, переходящим в узкий вставочный каналец и затем в дистальный каналец, который открывается в собирательную трубку, Гломерулы и канальцы имеют раздельное кровоснабжение.
Объем гломерулярной фильтрации определяется по клиренсу особых веществ, которые не реабсорбируются, не задерживаются и не секретируются канальцами. Клиренс таких веществ можно представить формулой С=-р-, где С — количество (в мл) безбел-ковой плазмы, профильтрованной за единицу времени, U—концентрация искомого вещества в моче, V — объем мочи, образовавшейся за данный период времени, и Р — концентрация вещества в плазме. Клиренс веществ, которые фильтруются в гломерулах, но не реабсорбируются и не секретируются почечными канальцами, равен скорости фильтрации; клиренс веществ, которые в какой-то степени реабсорбируются (Na+, С1“ или глюкоза), меньше скорости фильтрации; клиренс веществ, секретируемых канальцами, например n-аминогиппуровой кислоты (ПАГ), больше 1, т. е. больше скорости фильтрации. У лягушек в нормальных условиях фильтрация протекает со скоростью 30 мл/(кг«ч).
9—1332
130 Глава 1
Из разных отделов нефрона можно брать содержащуюся в них жидкость и анализировать ее состав. Было показано, что как у лягушки, так и у Necturus концентраций сахара и ионов хлора в гломерулярной жидкости и в плазме крови одинаковы; плазменных белков в гломерулярной жидкости обнаружено не было. Давление, под которым идет фильтрация, определяется разницей между гидростатическим (29 мм рт. ст.) и коллоидно-осмотическим (белковоосмотическим) давлением (7,7 мм рт. ст.) крови. Поскольку содержание ионов хлора в фильтрате уменьшается на протяжении дистального канальца, реабсорбция С1_ должна идти именно в этом сегменте. Концентрация глюкозы уменьшается в начале проксимального канальца. После инъекции флоридзина реабсорбция.глюкозы прекращается и ее концентрация вследствие реабсорбции воды фактически увеличивается.
' Вода и. соли могут реабсорбироваться на протяжении всего канальца, т. е. и в дистальном - и в проксимальном его отделах. Закисление мочи происходит в дистальных канальцах. В дистальных же канальцах происходит и удаление солей; поскольку проницаё-мость для . воды стенок канальцев низка, моча получается гипото? пичной. Антидиуретический гормон (известный как aprHHHH-Ba30L тоцин, или АДГ), .выделяемый задней долей гипофиза, увеличивает проницаемость дистального канальца для воды и, следовательно, повышает концентрацию мочи, уменьшая ее объем.
‘ ' У лягушки-быка Rana catesbiana обратное всасывание воды Происходит менее интенсивно, так что клиренс мочевины в 7— ГО раз выше, чем скорость фильтрации; отсюда .следует, что некоторое количество мочевины должно секретироваться клетками канальцев. Мочевина может секретироваться клетками , канальцев,-если на почечные зртерии наложена лигатура и функционирует только почечное портальное кровообращение.
Канальцы могут секретировать также введенные в организм красители, такие, как феноловый красный.
. У тритона Necturus около ЗО°/о профильтрованного NaCl реабсорбируется. в проксимальных канальцах^ Опыты с изолированными канальцами показали, что Na может абсорбироваться против электрического и концентрационного градиентов [123]. В соответствии с транспортируемым Na в обходных анастомозах канальцев должен идти эквивалентный поток, поэтому всасывание можно заблокировать уабаином или ДНФ. Вода также абсорбируется, о чем свидетельствует повышение концентрации инулина в канальцах. Поглощение К в норме очень невелико — поступление идет со скоростью 52 пМ/(см2-с), а выход — 49 пМ/(см2-с). Если учитывать движение воды, то можно считать, что общее поглощение калия и хлора происходит пассивно, а поглощение натрия — активно. Изменяя осмотическую концентрацию в канальцах, удалось замерить поток воды; было установлено, что он равен 0,15-10-8 мл/(см2-с) на 1 см вод. ст. Пассивное движение воды пропорционально транс-
Обмен воды: осмотический баланс, гормональная регуляция 131
порту Na- Однако у интактных пресноводных амфибий и рыб Отношение моча/кровь для инулина составляет соответственно 1,1 и 1 3; это заставляет предполагать, что здесь имеет место реабсорб-: дня Очень малого количества воды; данные, полученные в бпйтах' in vitro, могут отражать развитие антйДиуретйЧескдй реакций [189].' ’
Активный транспорт у амфибий идет не только через кожу‘ и’ почечные канальцы, но и через мочевой пузырь. У пустынных бесхвостых амфибий количество транспортируемой через мочевой пузырь воды соответствует примерно 50% веса тела, у Тропической* В. marinus — 25%, а у водной Xenopus— только* 1 %. После адаптации В: marinus к солоноватой воде Образование мочи у Неё уменьшается; концентрация Na в моче, взятой Из клоаки, оказывается в 10—12 раз выше, чем в моче из мочеточников (т. ё. При обезвоживании организма вода абсорбируется Из мочевого пузыря).1 В состоянии же гидратаций реабсорбируется натрий. Уменьшившийся объем крови таюйе стимулирует реабсорбцию' воды из мочевого пузыря [244].
Рептилии
Класс рептилий представляет собой Тетерогёйную груййу жй-* вотных, в-которую входят обитатели моря, пресной воды, сухихй влажных мест на земле. Раньше считали, что’ роговая чешуя рёп-тилйй ограничивает потери воды, связанные с испарением; Однако недавние эксперименты показали, что скорость испарений у нйх почти так же велика, как и у некоторых амфибий; Через кожу по-груженных в воду, рептилий внутрь организма может поступать довольно много воды. Результаты экспериментов ё тритированной водой Также свидетельствуют о значительной проницаемости КОЖИ' пресмыкающихся [23]. ”
Потеря воды с испарением четко связана с экологическими особенностями рептилий. Испарение воды через кожу характеризуется следующими цифрами (в мг/(см2-ч)): субтропический Spheno-morphus — 0,25;Anolis— 0,19; Gehyra— 0,21; полупустынная Uta,— 0,10; Sauromalus— 0,05 [66]. Точно так же змеи, обитающие в пустыне, теряют очень мало воды, тогда как виды из тропических лесов, где часты дожди, испаряют воду в больших количествах. На воздухе доля испарения через кожу у водных рептилий выше, чем у пустынных ящериц. Она составляет 87% у Caiman, 78% у Pseudemys, 72% у Iguana, 66% у пустынной Sauromalus [22, 23} и 76% у Anolis и Uta [66]. На втором месте стоит потеря воды с дыханием. Интенсивность испарения на воздухе пропорциональна Дефициту насыщения водой. Черепаха с мягким панцирем Trionyx в 4 раза более проницаема для воды, чем обладательница рогового панциря Pseudemys. Потеря воды через легкие у двух ящериц, обитающих в пустыне, составляет половину (в % от общей потери воды) величины, теряемой сцинком [89]. Испарение воды зависит от 9»
132
Глава 1
температуры в большей степени у тех ящериц, которые имеют высокие температурные преферендумы [348]. Испарение через участки кожи в сухой атмосфере составляет 0,5 мл/(см2-ч) у Lacerta, но 8,3 мл/(см2-ч) у Rana. У рептилии Uromastrix ток воды через кожу увеличивается при воздействии АДГ, как и у амфибий Rana и Bufo. Поведение рептилий также направлено на выбор таких условий температуры и влажности, которые могут свести потери воды к минимуму.
Осмотическая концентрация крови у рептилий, как правило, выше, чем у амфибий, но почти равна осмотической концентрации крови птиц и млекопитающих. Для крови рептилий характерны следующие значения температуры замерзания: морская черепаха Caretta —0,66; наземная черепаха Testudo —0,6; уж —0,68; пустынная ящерица Trachysaurus —0,65 °C.
Пресноводные рептилии могут активно поглощать ионы. Черепаха с мягким панцирем Trionyx активно поглощает натрий из разбавленной (5 мкМ) среды, вероятно, через глотку |[100, 101]; у нее нет активного поглощения К или С1.
Рептилии выделяют небольшое количество мочи, причем моча змей и ящериц может быть твердой или полужидкой. В каком органе происходит реабсорбция воды, еще не известно (возможно, в клоаке). У аллигатора выделение мочи равно 0,4—1,2, а у Rana — 1,5—2,0 мл/(кг-ч); гломерулярная фильтрация составляет у аллигатора 1,5—3,4 против 2,8—4,0 мл/(кг-ч) у лягушки. В состоянии нормального насыщения водой ящерица Trachysaurus образует на 1 кг веса 5,7 мл мочи в час, а при обезвоживании — только 0,24 мл/ч.
Водная черепаха Pseudemys является уреотелическим организмом; обезвоживание уменьшает у нее гломерулярную фильтрацию, повышает реабсорбцию воды и уменьшает выделение мочи. Наземная черепаха Gopherus, напротив, относится к урикотелическим организмам и не обнаруживает анурии при обезвоживании до тех пор, пока осмотическая концентрация крови не поднимется по крайней мере до 100 моем [86]. У Gopherus в клубочках моча гипоос-мотична, а в мочевом пузыре изоосмотична, т. е. в мочевом пузыре идет реабсорбция воды. При переносе солоноватоводной черепахи Malacletnys из раствора с 3,3 %-ной соленостью в пресную воду объем ее мочи повышается с 0,44 до 2,4 мл/(г-сут), а осмотическая концентрация мочи снижается с 207 до 57 моем. Реабсорбция ионов может идти и в клоаке. В пресной воде в почках крокодила образуется гипоосмотическая моча; скорость ее образования равна 3,5 мл/(кг-ч); в клоаке из мочи реабсорбируется натрий, и в течение 3 ч его концентрация может упасть вдвое ;[22].
При нормальной водной нагрузке скорость гломерулярной фильтрации у крокодила составляет 9 мл/(кг-ч), а в проксимальных канальцах реабсорбцруется примерно половина жидкости и более половины натрия. ’
Обмен воды: осмотический баланс, гормональная регуляция
133
Сравнительные данные, характеризующие скорость гломерулярной фильтрации и отношение осмотических концентраций мо-ча/плазма у рептилий и лягушки, находящихся в состоянии нормальной гидратации, приведены в нижеследующей таблице.
Животное Моча/плазма, осмотическая концентрация Скорость гломерулярной фильтрации, мл/(кгч)
Лягушка (Rana) 0,2 34,2
Черепаха (Pseudemys) 0,62 4,7
Пустынная черепаха ,(Gophe- 0,34 4,7
Геккон (Hemidactilus) 0,64 10,4
Жабовидная ящерица (Phrynosotna) 0,93 3,5
Ящерица (Tropidurus) 0,91 3,4
Крокодил (Crocodylus) 0,82 9,6
У крокодила в проксимальных канальцах происходит реабсорбция некоторого количества воды и натрия, однако большая часть Na+ и С1~ и немного воды (но не NHt) реабсорбируются в клоаке.
моем Na Cl nh4
Моча из мочеточни- 234 61 45 53
ков, мэкв Моча из клоаки, мэкв 251 5,9 16,5 118
Реабсорбция воды в клоаке может происходить за счет высокого коллоидно-осмотического давления в крови [305].
Пресноводная змея Natrix в воде выделяет с мочой около 10% профильтрованного Na и 60% К. Отношение концентраций мо-ча/плазма для инулина повышается, а отношение аналогичных концентраций для натрия уменьшается, следовательно, дистальные канальцы реабсорбируют воду и натрий [85]. При меняющихся водных нагрузках уровень выделения контролируется различным числом функционирующих канальцев и скорость фильтрации может изменяться в 10 раз [208]. На процесс реабсорбции, происходящий в дистальных канальцах оказывает влияние АДГ. Скорость гломерулярной фильтрации у змеи Pituphis гораздо меньше, чем у водяной змеи Natrix-, инъекция гипертонического солевого раствора увеличивает фильтрацию у Pituphis, но не влияет на фильтрацию у Natrix или же снижает ее [194].
У жабовидной и галопагосской ящериц реабсорбируется около 55% гломерулярного фильтрата; гекконы реабсорбируют 75%. У первых двух видов канальцевые клетки лишены складок и имеют мало митохондрий; у геккона же, напротив, эти клетки имеют
134
Глава 1
складчатое строение и содержат большое количество митохондрий '[293]. В клоаке Iguana и ящерицы Varanus происходит реабсорбция -воды; аргинин-вазотоцин увеличивает абсорбцию путем повьр тения как проницаемости для воды, так и транспорта Na [53].
Бугорчатая черепаха Malaclemys centrata живет в соленых болотах и эстуариях. Содержание Ыа и С1 в ее крови повышается при переходе из пресной воды в солоноватую, а после перехода из солоноватой воды в морскую у Нее отмечается значительное повышение содержания мочевины [127].
Na, мэкв С1, мэкв К, мэкв Мочевина, мМ моем
Пресная вода 50%-ная морская вода Морская вода Кровь Моча Кровь Кровь Моча 129 4,4 156 163,4 7,9 88 113 \ 136,6”' 3,1 16,8 4,1 3,8 59,7 21,5 22 30,1 115 107,4 309 107 355,5 458,8 372
Пример исключительной устойчивости к пересыханию представляет собой австралийская пустынная ящерица Amphibolorus, которая обитает в сухих жарких районах и питается богатыми натрием муравьями. Натрий накапливается во внеклеточной жидкости, в которую перемещается и вода из клеток; в течение жаркого лета объем внеклеточной жидкости у нее уменьшается с 33 до 25,4% объема тела. С началом дождей объем жидкости восстанавливается, а натрий выделяется. Таким образом, задержка натрия предохраняет ящерицу от потерь воды, хотя осмотические концентрации должны прй этом в значительной степени изменяться [49, 50].
Внепочечное выделение солей осуществляется носовыми железами, которые обнаружены у ложной каретты, крокодилов, морских змей и ящериц. У игуаны Ctenosaura секрет носовых желез может содержать в 190 раз больше натрия, чем плазма крови; образование секрета может идти со скоростью 190 мкл/ч. Инъекция NaCl усиливает выделение калия через эти железы. У Sauromalus отношение Ксекр/Кплаз равно 77,2, а аналогичное отношение для Na равно 0,67. У Ctenosaura отношение секрет/плазма для К равно 69,. а для Na — 0,43 [347]. После введения NaCl начинает секретироваться Na, причем у травоядной Dipsosaurus интенсивнее, чем у Sceloporus. У морской змеи Laticauda солевая секреция через железы может стимулироваться инъекцией NaCl или сахарозы, т. е. зависит от осморецепторов. Максимальное выделение Na составляет 72 мкмоль/(100 г-ч); для К эта величина равна 3 мкмоль/(100 г-ч) £102]. Морская черепаха выделяет через солевые железы больше К и Na, чем через почки, и не может поддерживать водный баланс только за счет одной почечной экскреции. Секрет солевой железы; крупной черепахи содержит 685 мэкв Na и 21 мэкв К на 1 л [163]л
Обмен воды: осмотический баланс, гормональная регуляция Г35
Ниже для сравнения приведены концентрации секретов солевых желез у нескольких рептилий [101, 102].
Na, мМ Cl, мМ К, мМ Отношение Na/K
Морская игуана Amblyrhynchus 1434 1256 235 6,7
Наземная игуана Conolophus 692 486 214 3,4
Морская змея Palamis 607 627 28 21,7
Морская черепаха Lepidochelys 713 486 29 24,5
Как правило, наземные рептилии содержат много калия, а морские, подобно птицам, секретируют много натрия. Это, вероятно, можно объяснить высоким содержанием К в растениях, составляющих основную пищу рептилий; морские же игуаны питаются водорослями.
Птицы
Большинство птиц имеют доступ к пресной воде. Однако некоторые из них живут в пустынях, питаясь сухими семенами, и должны обходиться только той водой, которая образуется у них в результате обмена веществ (метаболической водой). Другие птицы, живущие на соленых болотах илина море, также испытывают трудности с получением пресной воды. Обмен веществ протекает у. птиц-очень активно, поэтому потери воды с дыханием у них довольно значительны. Клоакальная моча может представлять собой вязкую массу кристаллов мочевой кислоты; реабсорбция воды может происходить в почках, клоаке и в нижних отделах кишечника.
У мелких птиц потеря воды (в процентах от веса тела в сутки) при питании семенами выше, чем у крупных птиц, и возрастает быстрее, чем происходит образование метаболической’ воды [14] (рис. 1-39). В группе птиц, которые в норме имеют доступ к пресной воде, а в эксперименте получают солевой раствор, Объем поглощаемой в течение дня жидкости возрастает до величины, равной весу тела; максимальное отношение моча/сыворотка для С1~ равняется 1,9 у траурного голубя и 2,4 у чечевичника [278] (рис. 1-40). Калифорнийский перепел выпивает постоянное количество воды независимо от ее солености. Подвид воробья из саванны, под названием beldingii, обитающий в соленых болотах, и волнистый попугайчик при повышении солености жидкости сокращают ее потребление. Концентрация мочи этих птиц может достигать значительного уровня. Из двух подвидов упомянутого выше воробья подвид beldingii способен сохранять свой вес при концентрации 0,6—0,7 М NaCl, тогда как подвид brooksi начинает терять вес при 0,3 М NaCl [279].
Красный клест, утоляя жажду, поглощает за сутки воду в количестве, доходящем до 22% веса его тела. В эксперименте, когда
136
Глава 1
Рис. 1-39. Зависимость величины ежедневной потери воды у птиц от весд Их тела при окружающей температуре 25 °C {14].
1 — Troglodytes aedon; S — Esrtrllda troglodytes; 3 — Taeniopygia castanotis; 4 — Carpodacus-mexicanus; S — Passer domesticus; 6 — Zonatrichia leucophrys; 7 — Pipilo maculatus; 8 — Pipi-to aberti; 9 — Chordeles acutipennis; 10—Phalaenoptilus nuttallli; 11 — Pipilo fascus; 12Lantus ludovicianus; 13 — Richmendena cardinalis; 14 — Mimus polyglottos; 15 — Toxostoma re-divivum; 16 — Otus asio; 17 *— Zenaidura macroura; 18 — Lophortyx californicus.
Свободное Jlucrnunmipo- 0,3 0,4 0,5 0,6
содержание ванная бода — Молярность (/VaClj—a*-
Рис. 1-40. Осмотические концентрации мочи и сыворотки крови у саванного воробья, получавшего различные растворы для питья (обозначенные на оси абсцисс)) в достаточном количестве [279].
Обмен воды: осмотический баланс, гормональная регуляция
137
имеется доступ только к солевому раствору, он с повышением концентрации раствора увеличивает его потребление, пока эта концентрация не достигнет уровня 0,25 М NaCl; при более высокой концентрации раствора его потребление уменьшается. Эта птица при выборе между 0,1 М NaCl и пресной водой не оказывает предпочтения ни тому, ни другому, но легко отличает воду от 0,2 М раствора NaCl.
Некоторым обитающим в пустыне птицам необходимо очень небольшое количество воды, и они обходятся метаболической водой. Австралийский зебровый ткачик прекрасно живет, питаясь лишь сухими семенами, но, получив доступ к воде, он поглощает ее в количестве 24 мл/(100 г-сут). Африканский воскоклювый ткачик, наоборот, при питании только сухими семенами погибает, так как в норме он потребляет до 42 мл воды на 100 г веса тела в сутки [60]. Общий водный баланс у жаворонка из юго-западной африканской пустыни, весящего 16 г, складывается из поглощения 1,9 г семян в сутки, часть веса которых — 0,17 г — приходится на воду, и метаболической воды — 0,93—1,1 г. Ежедневно он теряет 1,38 г воды за счет испарения (в основном с дыханием) и от 0,37 до 1,75 г выделяет с экскрементами. Следовательно, он должен компенсировать потерю примерно 0,65 г воды, поедая зеленые растения и насекомых [379]. Зебровый ткачик, питающийся сухими семенами, будет пить 0,2 М раствор NaCl, но не 0,3 М; отношение концентраций моча/плазма для С1~ может достигать у него 2. В условиях сильной влажности потеря воды путем испарения через кожу у ткачика уменьшается, но обязательная потеря с дыханием составляет 0,54 мг воды на 1 мл потребленного кислорода [209]. Выделения воробья в норме состоят на 81% из воды; однако, если его содержать на безводной диете, содержание воды в них уменьшится до 57% [333].
Почки кур могут изменять осмотическую концентрацию мочи в зависимости от насыщения организма водой и в отличие от почек низших позвоночных могут вырабатывать мочу, гиперосмотичную по отношению к крови. В состоянии насыщения водой скорость гломерулярной фильтрации и выделения мочи у них увеличивается, превышая скорость этих процессов, наблюдаемую при обезвоживании. Отношение осмотических концентраций моча/плазма у кур составляет 0,37 при водной нагрузке, 1,1 при солевой и 1,6—2,0 при 'обезвоживании. В почках обезвоженных кур и индюков существует повышающийся градиент осмотической концентрации от 447 моем в корковом слое до 463 моем в мозговом слое и 522 моем в моче [326].
Вливая в клоаку воду и натрий, попадающие затем в толстую кишку, показали, что в кишечнике происходит всасывание некоторого количества натрия и воды; при концентрации выше 80 мэкв всасывание натрия от его концентрации не зависит, а всасывание воды идет в соответствии с градиентом. При обезвоживании орга-
138
Глава 1
низма 50% натрия и 15% воды из мочи мочеточников могут абсорбироваться в клоаке и толстом кишечнике [324].
Na, МЭКВ/(кг-мин) к, мэкв/(кг-мин) С1, мэкв/(кг-мин) н2о, мкл/(кг-мин)
Моча из мочеточников 3,58 1,21 1,66 17,94
Выделенная моча 1,26 1,43 0,92 7,39
Однако в состоянии нормальной гидратации всасывание в клоаке совсем невелико.
У кур выделяемая моча может за счет обратного всасывания в почках, клоаке (и кишечнике) стать гиперосмотичной. При переходе организма из состояния обезвоживания в состояние нормального насыщения водой скорость гломерулярной фильтрации повышается на 23%, выход мочи увеличивается с 20 до 300 Мкл/(кг-мин), а отношение моча/плазма падает с 1,58 до 0,3 [323]. У кур инъекция аргинин-вазотоцина снижает выход мочи на 23%, увеличивает осмоляльное отношение моча/плазма с 0,33 до 1,11 и уменьшает выделение NaCl на 20% по сравнению с 50% —у лягушки и 25% — у ящерицы. Максимальное осмоляльное отношение моча/плазма при обезвоживании составляет у курицы 1,58 [7].
Морские птицы — чайки, бакланы и пеликаны — и многие разновидности домашних кур и уток имеют носовые железы, представляющие собой орган внепочечного выделения солей. Водно-солевой баланс у бакланов и чаек характеризуется следующими значениями:
С1, мэкв Na, мэкв К, мэкв Н2О, мл
Баклан, получивший 60 г рыбы и 3 г NaCl Поглощение 54 . 54 4 50
Выделение через клоаку 27,5 25,6 2,7 108,9
Выделение через носовые 26,1 23,8 0,3 51,4
железы Чайка, получившая 0,5 г NaCl Плазма Железы неактивны Железы активны 124 154 169 190 4,5
Жидкость из носовых же- 690 783 37,8
лез Клоакальная жидкость 191 184 18,2
Чайки даже в отсутствие осмотического стресса выделяют большие количества Na+ и К+ внепочечным путем [170].
У уток концентрация Na в секрете носовой железы может быть в 7 раз, а концентрация К — в 3 раза больше, чем в моче. Секрецию можно стимулировать солевой нагрузкой или гиперосмотиче
Обмен воды: осмотический баланс,, гормональная регуляция
139
ским раствором сахарозы, так как оба воздействия вызывают увеличение объема плазмы путем извлечения воды из тканей. У утки Anas эту секреторную реакцию можно снять путем адреналэктомии или стимулировать инъекцией глюкокортикоидов, экстрагированных из коры надпочечников [162]. Секреция блокируется также холинергическими агентами, такими, как метахолин [351]. Содержимое железы заряжено положительно по отношению к крови; уабаин ингибирует транспорт Na и снимает положительный потенциал [351]. Размеры солевых желез уменьшаются у разных групп птиц в следующем порядке: морские>солоноватоводные>преснородцые, Имеются следующие данные о секреции [385],
Животное ^saKteps плазмы, °C ^замерз секрета, °C Концентрации секрета, мэкв
Na К
Серебристая чайка —0,77 —3,46 775 34
Larus Арктическая крачка —0,68 —2,96 765 33
Чистик Кулик-сорока —0,73 —0,70 —3,37 —3,72 836 90
Некоторые живущие в пустыне птицы, такие, как африканский страус и пустынная куропатка, выделяют через носовые железы жидкость, которая содержит больше калия, чем натрия.
Мембраны клеток носовых желез имеют складчатое строение; их глубокие складки направлены от основания к вершине, образуя каналы, проходящие через всю клетку. Между складками расположено много тонких митохондрий [95, 195].
Обычно секреция через солевые железы возбуждается холин-ергическими нервами, поэтому на нее можно весьма эффективно влиять с помощью инъекции ацетилхолина. В гомогенатах солевых желез ацетилхолин вызывает образование фосфатидной кислоты. Срезы железы под воздействием ацетилхолина аккумулируют натрий. В экстрактах солевых желез преобладает NaK-АТФаза, кото-1 рая, вероятно, участвует в транспорте натрия [160]. Очевидно, можно считать, что первой стадией образования секрета является накопление натрия, а второй стадией — транспорт его внутрь железы, вероятно, с помощью NaK-АТФазы.
Млекопитающие
Пути потери воды
Наличие регуляции водного баланса у млекопитающих позволяет им хорошо переносить влажный и сухой воздух, пресные и соленые воды, а также большие колебания температуры. В условиях
140
Глава 1
осмотического стресса и обезвоживания млекопитающие поддерживают водный баланс путем изменения интенсивности поглощения воды и контроля всех возможных путей ее выделения. У млекопитающих лучше, чем у птиц, развита способность к образованию гиперосмотичной по отношению к крови мочи и нет других внепо-чечных путей выделения солей, кроме как с потом.
Так, человек весом 70 кг ежедневно теряет 600—2000 мл воды с мочой, 50—200 мл с фекалиями, 350—700 мл при испарении через кожу, 50—400 мл с потом и 350—400 мл через легкие. Кормящая мать может дополнительно терять 900 мл воды с молоком. Таким образом, в норме общая ежедневная потеря воды колеблется от 1 до более чем 9 л (в тропиках до 12 л в день) в зависимости от температуры, физической нагрузки, насыщения водой и других факторов. Эта потеря воды должна восполняться выпиваемой водой, водой пищи и водой, образующейся в процессе обмена веществ.
У большинства млекопитающих концентрация плазмы составляет 0,3 осмоль т. е. эквивалентна 0,95%-ному раствору NaCl или Двн=—0,8°C). У человека концентрация мочи обычно приближается к 0,65 осмоль, максимальная же концентрация мочи у испытывающего жажду человека близка к 1,4 осмоль (Дмочи=-—2,6°С) 1[382].
Проницаемость кожи для воды у млекопитающих очень мала; это способствует уменьшению потери воды с испарением на воздухе и избыточной гидратации в воде. Однако у многих млекопитающих испарение (либо в результате функции потовых желез, либо» благодаря учащению дыхания) служит средством охлаждения организма. В определенных условиях эти потери могут стать критическими. У человека потеря воды при незаметном испарении через кожу связана нелинейной зависимостью с давлением паров в окружающем воздухе [133]. У мелких млекопитающих, как, например,, у грызунов, испарения, с которым связано охлаждение тела, либо вообще нет, либо оно очень мало.
У человека потеря 10% воды ведет к серьезным патологическим изменениям, а мышей, верблюдов и овец потеря 30% воды приводит к гибели. Находясь в воде, человек может поглощать ее через кожу, в основном за счет набухания рогового слоя. У верблюда лактация может удвоить уровень водного обмена и серьезно истощить водный запас.
Бобр Aplodontia в норме поглощает количество воды, равное 32,7% веса тела, в сутки [254, 303], Обитающий в пустыне грызун Liomys salvani из семейства прыгунов выпивает количество воды, составляющее до 5,7% веса тела в сутки [168]. Чтобы поддержать водный баланс в условиях жары, один из видов антилопы—водяной козел — должен поглощать воду в количестве, равном 12% веса тела в сутки. Ректальная температура у нормально гидратированных копытных в тропической Африке ниже температуры окру
Обмен воды: осмотический баланс, гормональная регуляция
141
жающего воздуха, однако при обезвоживании у газели и сернобыка она приходит в соответствие с окружающей температурой. Обезвоживание снижает скорость потоотделения и частоту дыхания и повышает критическую температуру, при которой начинается учащенное дыхание [345]. Сомалийский осел в состоянии 20—22%-ного обезвоживания перестает принимать пищу; осел может вынести потерю воды до 30% веса своего тела и может выпить в течение 2—5 мин от 24 до 30 л воды, восполняя ее потерю. В сравнимых условиях летом верблюд благодаря испарению теряет воду в количестве равном 1 % веса тела в день; у осла аналогичная величина составляет 4,5%, у человека — 7%. Потери воды через легкие и кожу в нейтральных условиях приводятся ниже.
Грызун Liomys Белая крыса Человек
Грызун Dipodomis
Грызун Perognathus
мг воды на 1 мл потребленного кислорода
0,9—1,0
0,94 0,84 0,54
0,5
Концентрации К, Na и воды в поте и моче находятся в обратной зависимости, т. е. когда пот обилен, он более разбавлен; в этих условиях объем мочи сокращается, а ее концентрация повышается.
Дельфин Tursiops теряет с испарением только 30% того количества жидкости, которое теряется сравнимыми видами наземных млекопитающих. Если считать, что выдыхаемый воздух содержит то же количество воды, что и альвеолярные воздушные полости, то дельфин весом 140 кг должен терять 290 г в день, тогда как в действительности потери с испарением составляют 60 г в день. Скорость вентиляции в этом случае мала, а потребление кислорода велико. К тому же температура в верхней части дыхательного тракта дельфина на 9 °C ниже, чем в легких; конденсация, вызываемая таким перепадом температуры, способствует сохранению до 80% воды, имеющейся в выдыхаемом воздухе [77].
Для каждого из различных комплексов наземных условий можно подобрать группу обитающих в них млекопитающих с уменьшающимся водным обменом, измерявшимся при сравнимых условиях. В каждой группе наибольшим водным обменом обладают животные с активным обменом веществ [22]. Некоторые из этих групп Приведены в табл. 1—8.
У верблюда в условиях пустыни время полужизни тритированной воды составляет 12,2 сут зимой и 6,4 сут летом. Очевидно, в каждом климате существуют какие-то виды, которые лучше других приспособлены к условиям той или иной экологической ниши.
У тюленя Phoca общий обмен воды равен 0,5—1,8 л в 1 сут. Количество воды, образующейся у него в процессе обмена ве-
I лава 1
Таблица 1-8
Обмен воды у некоторых наземных животных
Климат Животное Обмен воды, мл/(кг-сут)
Влажные тропики Bos bubalos (бык-буффало) Bos taurus (короткорогий бык) Bos indicus 200 161 123
Сухая пустыня Крупный рогатый скот Овца Коза Верблюд 135 107 96 61
Арктика (Аляска) ; Северный олень Американский олень Овца Мускусный бык 128 111 62 35
Пустыня Сумчатые: Sminthopsis crassicaudata Dasy cercus cristicaudata Das у cercus byrnei 461 134 125
ществ, превышает количество воды, получаемое с пищей, при малой скорости .ее потребления; однако, когда тюлень съедает много рыбы, это отношение становится обратным [91]. Сумчатая крыса Trichosurus вылизывает свою шерсть для охлаждения тела испарением, но если она по какой-то причине не может этого сделать, го у неё увеличивается частота дыхания, в результате чего общее Охлаждение путём испарения сохраняется на более или менее постоянном уровне [87]. Питающаяся рыбой летучая мышь Pizonyx испаряет 12—.14 мл воды на 1 г веса в 1 ч, или 1,2—3,7. мл в . сут; 1,3. мл воды она теряет с фекалиями и около 6,35 мл — с мо-юй. 13 г съеденных рачков обеспечивают ей 11,3 мл воды т. е. фак-'ичёски поддерживают водный баланс.
Объем воды, выводимой с фекалиями, у млекопитающих силь-:о варьирует. Фекалии верблюда, не имеющего возможности пить оду, содержат 76 г воды на 100 г сухого веса; верблюд, получив-зий доступ к воде, выделяет фекалии, содержащие 109 г воды а 100 г сухого веса. В фекалиях белой крысы на 100 г сухого веса одержится 225 г воды, а у пасущейся коровы — более 566 г. Вер-люд весом 400—500 кг (при наличии или отсутствии питьевой во-ы) может выделять 1,5 л мочи в 1 сут, тогда как пасущиеся жи-отные выделяют от 0,5 до 8 л в 1 сут. Лишенный питьевой воды, итающийся только сухими финиками и сеном, верблюд теряет в учение 8 сут около 17% своего первоначального веса или 30% .идкости тела; это соответствует потере 30% межклеточной или
Обмен воды: осмотический баланс, гормональная регуляция 143 24% внутриклеточной воды [306]. Верблюд использует воду, запасенную в рубце, для охлаждения [221]. Осел может потерять 1300 г воды с фекалиями и 1—1,2 л с мочой, т. е. около 2,5% веса тела в день.
Водный обмен жвачных животных при температуре 41 °C (в пустыне), измеренный с помощью ТНО, характеризуется следующими цифрами [мл/(кг-сут)]: верблюд — 41, мериносная овца — ПО, шортгорнский крупный рогатый скот— 148. У верблюда охлаждение тела достигается с помощью потоотделения, которое идет со скоростью 300 мл/(м2-ч); с мочой же выделяется при любой пище 2—3 мл/(кг-сут). Концентрация мочи у верблюда равна 3,7 моем по сравнению с 3,8 моем у обезвоженных овец [221].
Возврат в нормальное состояние после обезвоживания — при свободном доступе к воде — происходит у разных млекопитающих по-разному: так, верблюд может восполнить большой дефицит воды за 10 мин и в один прием выпить количество воды, составляющее до 25% веса его тела; крыса может выпить даже больше воды, чем содержит ее в состоянии нормальной гидратации. У человека восстановление нормы обычно идет медленно [2]. Время, необходимое для выделения сопоставимых количеств воды, также сильно варьирует: чтобы выделить 40% выпитой воды (в количестве 5 мл/100 г), пустынной кенгуровой крысе Dipodomys требуется 367 мин по сравнению с 84 мин, затрачиваемыми белой крысой [63].
Некоторые живущие в пустыне грызуны и сумчатые (так же как овцы и верблюды зимой) не нуждаются в питьевой воде, так как им вполне достаточно воды, образующейся в ходе процессов обмена веществ. У грызунов, которые проводят весь день в норах, потери воды через легкие снижаются на 25% • У кенгуровой крысы Dipodomys, дышащей сухим воздухом, потери воды с испарением через легкие составляют 0,54 мл на 1 мл потребленного кислорода по сравнению с 0,84 у человека и 0,94 у лабораторной крысы.
У кенгуровой крысы, питающейся сухим зерном, при 10%-ной относительной влажности нет никаких признаков отрицательного водного баланса; она использует воду, образующуюся в процессах окисления, количество которой может быть следующим [306]:
Вода, г/г пищи Вода, г/ккал
Жиры 1,07 0,113
Углеводы 0,556 0,133
Белки 0,396 0,092
Относительная эффективность обмена воды у кенгуровой и белой крыс приведена ниже.
Многие млекопитающие могут пить и солевые растворы (до определенных их концентраций). Например, кошка и верблюд могут поддерживать свой водный баланс, потребляя морскую воду;
144
Глава 1
% Потери воды в г/100 кал метаболизированной пищи при 22 мл воды в I л воздуха
Фекалии Моча Испарение Общая потеря Поступление воды, связанное с процессами окисления
Белая крыса 4 5 14 23 13
Кенгуровая 0,63 3,4 3,4 8 13
крыса
то же относится и к кенгуровой крысе. У человека ограничение потребления морской воды связано, по-видимому, не с почками, а с ее влиянием на желудочно-кишечный тракт и кровеносные сосуды.
Функция почек
Почки млекопитающих очень хорошо приспособлены к образованию мочи, гиперосмотичной по отношению к крови. Рептилии не способны вырабатывать гиперосмотическую мочу; концентрация мочи птиц может быть вдвое, а мочи некоторых млекопитающих — в 20 раз выше концентрации их плазмы. У белоногой мыши Рего-myscus crinitus максимальная осмоляльность мочи равна 3430 моем, максимальное осмоляльное отношение моча/плазма составляет 10,4, а максимальное отношение концентраций моча/плазма для мочевины равно 127 [1].
У человека нижний предел концентрации мочи составляет 50 моем, а верхний— 1400 моем; у пустынной крысы концентрация мочи может достигать 5000 моем.
Данные о механизме регуляции концентрации мочи были получены с помощью следующих методических приемов: 1) анализа канальцевой жидкости, взятой при микропункции; 2) остановки тока мочи на определенный период при помощи создания противодавления в мочеточнике и 3) изучения срезов почек. Млекопитающие, вырабатывающие наиболее концентрированную мочу, имеют самые длинные петли Генле (длинный сосочек) (рис. 1-41).
У собаки гломерулярная фильтрация в норме равна примерно 4,3 мл/мин на 1 г веса тела, у человека — 1,73. Это означает, что объем жидкости, ежедневно перерабатываемой почками, в 16 раз превышает объем внеклеточной жидкости. У человека из 1100 л плазмы, прошедшей в день через гломерулы, образуется 180 л фильтрата; из них реабсорбируется 178,5 л, и в результате выделяется 1,5 л мочи в день. Фильтрат мочи не содержит белков, но включает все мелкие ингредиенты плазмы, относительное содержание которых определяется ионным балансом плазменных белков. Скорость фильтрации в гломерулах определяется в основном разницей между гидростатическим (кровяным) давлением и коллоидно-осмотическим давлением сывороточных белков. Размер задер-
Обмен воды: осмотический баланс, гормональная регуляция 145
жива ем ых белковых молекул определяется сложной системой щелевых пор. Жидкость проходит сквозь поры в эндотелиальных клетках, через проницаемые базальные мембраны и выходит меж-
ч
Корковое- v бещеашва
•s Лэ?
t/
Наружная-1 зона
> .Мозговое' Вещество
Внутренняя зона
Рис. 1-41. Схема строения двух нефронов почки млекопитающих; один иефрон имеет длинную петлю Генле, другой — короткую i(no Шмидту-Нильсену). Стрелки показывают направление движения; сдвоенная стрелка — активный перенос Na+, обычная — пассивный ток воды.
Ду отростками подоцитов в просвет капсулы. Из профильтрованных таким образом растворенных веществ глюкоза, аминокислоты, витамины и электролиты реабсорбируются в проксимальном каналь-Де, а n-аминогиппуровая кислота (ПАГ) в этом участке экскретируется. Жидкость в проксимальном канальце изоосмотична по от* ношению к плазме крови.
10—1332
146
Глава 1
В петле Генле осмотическая концентрация жидкости постепенно увеличивается по направлению к почечному сосочку и вновь уменьшается в восходящей части петли, поднимающейся к корковому слою почки. В начале дистальной извитой части канальца жидкость заметно гипотОнйчна по отношению к плазме.'
Петли Генле действуют по принципу противоточных многоходовых систем, в которых .диффузия, сопряженная с активным переносом натрия, обеспечивает гораздо более высокую осмотическую концентрацию мочи в сосочках, чем в корковом слое почки. В восходящей и нисходящей ветвях петли Генле жидкость движется в противоположных направлениях, причем натрий активно выводится из восходящей ветви и пассивно входит в нисходящую,, циркулируя, таким образом, в пределах петли. Благодаря абсорбции натрия между жидкостью восходящей ветви и жидкостью собирательной трубочки возникает осмотический градиент. Осмотическая концентрация в нисходящей ветви возрастает, так как вода диффундирует из трубочки в гипертоничное межклеточное пространство, a Na+ диффундирует внутрь нисходящей ветви. Наличие такого обмена и осмотического градиента между двумя ветвями петли Генле, в которых жидкость течет в противоположных направлениях (противоточная многоходовая система), обеспечивает возрастание осмотической концентрации в направлении от наружной зоны мозгового слоя почки к его внутренней зоне.
Жидкость начального отдела дистального извитого канальца гипотонична, поэтому вода может диффундировать наружу, и к моменту попадания в собирательные трубочки жидкость становится уже изоосмотичной по отношению к крови. При дальнейшем движении по собирательной трубочке вода диффундирует из нее в окружающий мозговой слой, имеющий более высокую осмотическую концентрацию. Таким образом, вытекающая из собирательной трубочки моча становится изоосмотичной по отношению к почечным сосочкам и гипертоничной по отношению к крови. При выведении с мочой больших количеств воды проницаемость дистального канальца и собирательной трубочки находится на низком уровне, поэтому моча остается гипоосмотичной. Однако при снижении количества выделяемой мочи, когда в крови находится антидиуретиче-ский гормон вазопрессин, проницаемость дистального канальца и собирательной трубочки возрастает, вода диффундирует из канальцев и моча становится гиперосмотичной.
У обезьян Масаса регуляция концентрации мочи осуществляется с помощью канальцевой реабсорбции и максимум осмоляльного отношения моча/плазма может быть равным 22 [81]. У шиншиллы при обезвоживании осмоляльность мочи увеличивается с 2350 до 7599 моем; при гидратации эта величина падает до 130 моем. В нормальных условиях 32% воды, поступающей в петлю Генле, и 38% Na реабсорбируются в дистальном извитом канальце [375].
Опыты, проводившиеся на крысах с применением микропунк-
Обмен воды: осмотический баланс, гормональная регуляция 147
ции, показали, что отношение концентраций Na в жидкости проксимального извитого канальца и в плазме при антидиурезе равно 1, а при диурезе меньше 1, тогда как отношение концентраций натрия в дистальном извитом канальце и плазме равно 0,6. при антидиурезе и 0,2 при диурезе. Аналогичным образом концентрация мочевины в проксимальном извитом канальце может быть равна 15 мМ, в начальном участке дистального канальца — 65 мМ и в концевом его участке—190 мМ, тогда как в жидкости мозгового вещества почек концентрация мочевины равна 135 мМ [358] (рис. 1-42). Итак, и вода и натрий покидают проксимальный каналец и собирательную трубочку и входят вновь в петлю Генле. Натрий активно транспортируется из проксимальной и дистальной трубочек, за ним выходит С1. Благодаря наличию NaCl и мочевины межклеточная жидкость становится гиперосмотичной, что влечет за собой усиление реабсорбции воды. Энергетические потребности транспорта из дистальных канальцев покрываются за счет процесса гликолиза, тогда как транспорт из проксимальных канальцев в большей степени связан с системой транспорта электронов. Вазопрессин
Таблица 1-9
Максимальный уровень концентрации мочи млекопитающих1
Моча, моем Осмотическая концентрация моча/плазма
Мышь Notomys, обитающая в пустыне Мышь Psammomys, обитающая в пустыне Крыса Dipodomys, обитающая в пустыне Прыгун Liomys Земляная белка Citellus Верблюд Лабораторная крыса Лабораторная кошка Лабораторный хомяк Лабораторная собака Тюлень Шиншилла Рыбоядная летучая мышь Pizonyx Дельфин . Кролик Человек Масаса Лабораторный голубь Крт-сейвал Сумчатое Trichosurus Бобер Aplodontia Ленивец Choloepus 5540—6400 5700—6000 5500—6000 3580—4000 3900 2500—3170 2560—3000 2100—3250 3000 2006—2660 2150—2420 2006 2006 1833 1502—1910 1400—1480 1191 1100 900—1340 1066 495—770 460—907 10,3—14; 9,5 8 8,9 4,0 4,8 2,4
1 По даяным [128, 147, ,167, 223, 254, 255, 287].
10*
148
Глава 1
повышает проницаемость собирательной трубочки для воды и мочевины [120].
Данные о максимальном уровне способности почек млекопитающих концентрировать мочу представлены в табл. 1-9.
Рис. 1-42. Схема циркуляции воды и .мочевины при антидиурезе (задержка воды в организме) <[120].
Косая штриховка — циркуляция мочевины, точки — воды.
У кенгуровой крысы отношение концентраций моча/плазма достигает 18 по сравнению с 4 у человека и 2 у белой крысы. Отношение концентраций моча/плазма для мочевины может составлять 400 у кенгуровой крысы, 170 у человека и 200 у белой крысы. У пустынного грызуна Psamniomys 9% профильтрованной воды достигает верхушки петли и только 0,9% остается в выделяемой моче; в жидкости петли Генле 64% растворенных веществ составляет Na и 19% —мочевина, тогда как в собирательной трубочке осмотически эффективным компонентом служит главным образом мочевина [139]. Кровососущие летучие мыши поглощают в течение 7 ч количество крови, равное 37% веса их тела; вначале они выделяют мочу с концентрацией 475 моем, позднее — с концентрацией 4656 моем, причем 73% осмотической концентрации обусловлено мочевиной.
Эффективность деятельности почек, связанной с концентрированием мочи, зависит от относительного процента имеющихся
Обмен воды: осмотический баланс, гормональная регуляция 149»
длинных и коротких петель. Животные, обитающие в пустыне, имеют в основном длинные петли, а млекопитающие, обладающие малой концентрирующей способностью, — только короткие петли [302, 303]:
Организм Относительная толщина мозгового вещества Процент длинных петель Моча, максимальная ^замерз
Бобр 1,3 0 0,96
Свинья 1,6 3 2,0
Человек 3,0 14 2,6
Кошка 4,8 100 5,8
Тушканчик 9,3 33 12,0
Пустынная мышь 10,7 100 9,2
Исключением является шиншилла, имеющая в почках длинные сосочки; однако у лабораторной крысы способность концентрировать мочу выше [147].
У животных, подобных крысе, потолок осмотической концентрации мочи повышается с возрастанием количества белка в пище; почки имеют объемистое мозговое вещество в сводах почечных лоханок, а максимальное осмоляльное отношение моча/плазма превышает 2. У других видов, таких, например, как бобр (Aplodon-tia), увеличить максимальную осмотическую концентрацию мочи с помощью богатой белками диеты не удается; своды почечных лоханок у них слабо развиты, и максимальное отношение моча/плазма довольно низко. У выхухоли отношение моча/плазма равно 3,3 при получении богатой белком пищи и 2,5 при содержании их на малобелковой диете:
Осмоляльность мочи, моем
на богатой белком диете на бедной белком диете
Белая крыса 2834 2078
Бобр 640 672
Выхухоль 1063 934
Увеличение гломерулярной фильтрации в ответ на дополнительную солевую нагрузку наблюдается только у млекопитающих. У всех других позвоночных, особенно у амфибий, дополнительное введение соли вызывает уменьшение гломерулярной фильтрации. Приток крови к почкам и проницаемость почечных канальцев регулируются у млекопитающих гормональным путем.
Уровень антидиуретического гормона (вазопрессина) в крови* млекопитающих рефлекторно регулируется осморецепторами, ло^
150
Глава 1
кализованными в передней медиальной части гипоталамуса, в области супраоптического ядра. Эти рецепторы чувствительны к незначительным (1—2%) изменениям осмотической концентрации плазмы. Введение в сонную артерию небольшого количества гипертонического раствора NaCl рефлекторно увеличивает уровень вазопрессина в крови и уменьшает выход мочи. Инъекция небольшого объема гиперосмотического солевого раствора (0,005—0,01 мл ,2—3%-ного'раствора NaCl) в паравентрикулярное ядро козы приводите полидипсии (поглощению большого количества воды) с последующей полиурией. После инъекции гиперосмотических растворов в сонную артерию отмечается повышенная электрическая активность супраоптического ядра.
Другие рецепторы, расположенные в стенках артериол, особенно в печени и почках, чувствительны к объему плазмы и, следовательно, к ее концентрации. Они рефлекторно активируют высвобождение альдостерона из коры надпочечников, что в свою очередь вызывает активную абсорбцию натрия в почкам и потовых железах и способствует удержанию воды и увеличению объема плазмы. Осморецепторы, находящиеся в печени, посылают афферентные импульсы по блуждающему нерву в мозг.
Рецепторы вкуса воды, располагающиеся на языке, обнаружены у собак, свиней, кошек; лабораторные крысы и человек вкуса воды не воспринимают. Жажда есть сложное ощущение, складывающееся под влиянием нескольких факторов, включающих стимуляцию мозговых осморецепторов, уровень общего обезвоживания тканей и степень сухости ротовой полости.
Концентрация крови у морских млекопитающих лишь ненамного’ выше, чем у наземных. Моча морских млекопитающих может быть более концентрированной, чем морская вода. У таких млекопитающих, как тюлень (Phoca vitulind), терморегуляция происходит без потери воды; около 10% воды теряется у них через легкие, 20% —с фекалиями и 70% —с мочой. Было рассчитано, что, поедая 1250 г сельди, тюлень получает соли и мочевину в количестве, достаточном для образования примерно 800 мл мочи (с точкой замерзания, равной — 2,7°C), что находится в пределах нормы для сытых тюленей. Морские млекопитающие, питающиеся ги-поосмотичной по отношению к морской воде рыбой, по-видимому, получают с пищей достаточно воды, чтобы поддерживать концентрацию крови на более низком, чем концентрация окружающей их среды, уровне. Они не пьют морской воды. Моржи и киты, однако, питаются беспозвоночными, содержащими более концентрированную жидкость, чем кровь самих млекопитающих. Киты теряют через легкие меньше воды, чем наземные млекопитающие; очевидно, их почки могут экскретировать соли и мочевину вместе -с водой, получаемой из пищи, и могут вырабатывать гиперосмотическую мочу в необходимом для сохранения гипоосмотичности .крови количестве. .
Обмен воды: осмотический баланс, гормональная регуляция
151
Итак, важнейшая проблема, с которой сталкиваются наземные-позвоночные, т. е. большинство рептилий, птиц и млекопитающих, заключается в снижении потерь воды, связанных с испарением. В процессе адаптации вырабатывались особые структуры, служащие для уменьшения испарения с поверхности тела, — роговые чешуи, перья и волосы. Потери воды с дыханием сокращаются путем уменьшения локомоторной активности при высоких температурах и путем конденсации воды в более холодных носовых проходах. Использование дыхательного испарения, потовой секреции и слюноотделения для охлаждения тела при высокой температуре окружающей среды увеличивает кругооборот воды в организме и требует поддержания равновесия — с помощью центральной нервной системы — между дегидратационным стрессом и переохлаждением. Сигналы от находящихся в мозгу осморецепторов, от рецепторов вкуса воды и объема жидкости обеспечивают возникновение соответствующих поведенческих и гормональных реакций животного. Вода удерживается с помощью снижения количества вырабатываемой мочи; у некоторых птиц и рептилий сохранение воды происходит благодаря выделению солей через носовые железы. У млекопитающих наиболее высоко (по сравнению> с другими животными) развита способность к образованию гипер-осмотичной по отношению к крови мочи. Гормональная регуляция притока крови к почкам, а также проницаемости канальцев и циркуляции натрия внутри нефрона обеспечивает возможность образования мочи, концентрация которой может изменяться в широких пределах в соответствии с уровнем гидратации организма. Приспособительные механизмы почек служат одинаково успешно как. обитающим в пустыне млекопитающим, которым приходится долгое время обходиться без воды, так и морским млекопитающим,, которые питаются организмами, обладающими высокой осмотической концентрацией.
Гормональная регуляция осмотического и ионного баланса1
Водное и солевое равновесие у позвоночных регулируется определенными видами гормонов. Наиболее известны (в сравнительном плане) нейрогипофизарные полипептиды [33, 34]. Гормоны, в молекуле которых имеются основные аминокислоты (в 8-м положении), такие, как аргинин или лизин, называются вазопрессинами3 и обладают заметной антидиуретической, или задерживающей воду, способностью (антидиуретические гормоны, АДГ). Другие,, с нейтральной аминокислотой в 8-м положении, называются окситоцинами и обладают слабой АДГ-активностью. Функция нейтрального действующего начала в организме немлекопитающих.
1 См. также гл. 21.
Соединения, обладающие сосудосуживающим действием । 1 1 . ""——t
I Цис — Тир- Фен-Глн-Асн -Цис-Про-Лрг-Глн \ 1 2 3 Ч 5 6 7 8 9
Аргинин—вазопрессин
Цис— Фен--------------Цис—Лиз-----
Лизин- вазопрессин i—'— ........ ।
цис—иле--------------Цис—Арг------
Аргинин- вазотоцин
Окситоциноподобные соединения цис—иле-----------------Ц ис—Лей-----
Окситоцин i------------------------
Цис----иле- Сер-------Цис—Иле-------
Ц-серин— 8-изолейцин - окситоцин , ।-----------------------1
Цис—иле--------------Цис—иле—
* В—изолейцин-окситоцин
Рис. 1-43. Формулы мейрогипоф.из'арных гормонов, регулирующих водный баланс у разных классов позвоночных (>[33], см. в списке литературы о гормональной регуляции обмена воды).
Птицы
АВт, Мт, От
Млекопитающие —Свинья
АВр, от лвп, авп, От
- ч
химера
АВт, От
Пресмыкающиеся
АВт, Мт, От
Костистые рыбы
АВт, ит
Акулы АВт, Отп
Земноводные
АВт, Мт, От
Двоякодышащие рыбы
1Скаты АВт, Гт
Пластиножабер-
ные
АВт, Мт, От
Цельнокостные рыбы АВт, Um
Осетровые рыбы АВт
/Мноеоперые рыбы S АВт, Um
Хрящекостные рыбы
Хрящевые рыбы
! Хуиеперые рыбы Постные рыбы круглоротые АВт
’Рис. 1-44. Схема распределения нейрогипофизарных пептидов у некоторых позвоночных (Сойер У. X., личное сообщение).
^Подчеркнутое сокращенное название пептида означает, что его идентификация была произведена на основании химического анализа в дополнение к фармакологическим и хроматографическим методам. Использованы следующие сокращения:
АВп — аргинин-вазопрессин; ЛВп — лизин-вазопрессин; АВт — аргинин-вазотоцин; От — окситоцин; Мт—мезотоцин (&*изолейцин-окситоцин); Ит— изотоцин (4-сернн-8-изолейцин-оксито-Цин); Гт — глумитоцин .(4-серии-8-глутамин-окситоцин); Отп —по крайней мере два неизвестных окситоциноподобных гормона; они не являются ни глумитоцином, ни любым другим известным .гормоном, найденным у позвоночных.
Обмен воды: осмотический баланс, гормональная регуляция 153^
неизвестна. Эти полипептиды вырабатываются супраоптическим (паравентрикулярным) ядром гипоталамуса; по воронке они поступают в нейрогипофиз, где сохраняются и освобождаются ш> мере необходимости.
Все млекопитающие, за исключением некоторых Suiformes, вырабатывают аргинин-вазопрессин (АВП); некоторые Suiformes содержат как АВП, так и лизин-вазопрессин (ЛВП); третьи же (дикая свинья и гиппопотам) имеют только ЛВП [13а] (рис. 1-43). У кита-полосатика в отличие от других млекопитающих окситоцин образуется в количестве, в 5 раз превышающем количество вазопрессина [1]. У птиц, амфибий, рептилий и большинства рыб активными полипептидами являются окситоцин и аргинин-вазопрессин, причем последний представляет собой главный антидиурети-ческий гормон (рис. 1-44). У круглоротых (миног) имеется только один из полипептидов, аргинин-вазотоцин, который распространен наиболее широко и, по-видимому, представляет собой наиболее примитивный гормон. У представителя цельноголовых — ската Hydrolagus — имеется аргинин-вазотоцин и окситоцин. У лучепе-рой рыбы Polypterus и двоякодыщащей рыбы Protopterus вырабатываются и аргинин-вазотоцин и нейтральный гормон; у Polypterus последний представлен изотоцином (4-серин-8-изолейцин-окси-тоцин), так же как и у ганоидов и костистых рыб; у Protopterus же содержится мезотоцин (8-изолейцин-окситоцин), как у амфибий и птиц [8]. У пластиножаберкых встречаются два окситоцина, отличающиеся от соответствующих гормонов у других позвоночных; один из них (обнаруженный у Raja) является, видимо, 4-серин-8-глутамин-окситоцином (глумитоцином), а другой может быть 3-се-рин-8-изолейцин-окситоцином {37, 38]. Была предложена гипотетическая схема, показывающая, как различные основные и нейтральные пептиды могли возникнуть путем серии точковых мутаций [39].
Способ действия вазопрессина в разных классах позвоночных различен. У млекопитающих и птиц основное его действие проявляется в увеличении проницаемости для воды почечных канальцев, особенно дистальных извитых канальцев и собирательных трубочек, и, следовательно, в реабсорбции большего количества воды и в уменьшении объема образующейся мочи. У рептилий и птиц аргинин-вазотоцин (АВТ) также обладает антидиуретическим действием, и, кроме того, в дополнение к некоторому влиянию на канальцы этот гормон снижает скорость гломерулярной фильтрации — по-видимому, за счет сокращения гломерулярных артериол [31, 39]. У бесхвостых амфибий его дополнительное действие проявляется в увеличении проницаемости кожи для натрия и — в разной степени — для воды; все это (в сочетании с натриевым насосом) обеспечивает поглощение солей.
При действии аргинин-вазотоцина на кожу лягушки повышается проницаемость ее наружной поверхности для натрия; этот эф
154
Глава 1
фект проявляется только в том случае, если АВТ соприкасается с внутренней поверхностью кожи [10]. Окситоцин и норадреналин также усиливают поглощение натрия; их эффект напоминает действие циклической 3,5-АМФ; норадреналин действует через ос-рецепторы [4].
Другая функция аргинин-вазотоцина состоит в стимуляции обратного всасывания воды в мочевом пузыре. Проницаемость для воды пузыря жабы оказывается чувствительной к АВТ в концентрациях др 10~н М [17]. У тритона Triturus регуляция водного баланса осуществляется почками и мочевым пузырем [5].
У пресноводных рыб (угря, серебряного карася) АВТ повышает выход мочи и скорость гломерулярной фильтрации [18], Таким образом, влияние АВТ на почки пресноводных рыб и на. почки четвероногих (т. е. на их диурез) направлено в противоположные стороны. Поглощение натрия в жабрах под воздействием АВТ увеличивается. У угря гипофизэктомия сокращает образование мочи и поглощения натрия; у серебряного карася уровень натрия в , плазме снижается [8]. У Opsanus —- агломерулярной морской рыбы АВТ увеличивает давление крови, но не вызывает диуреза, как у. серебряного карася [21]. У двоякодышащей рыбы Proio-pierus он повышает скорость гломерулярной, фильтрации, как и у пресноводных рыб, но, кроме того, усиливает также выделение натрия, т. е. оказывает натрийуретическое действие [39]. Возможно, эта рыба нуждается в диуретическом и натрийуретическом действии АВТ во время пробуждения от летней спячки. У миноги АВТ также стимулирует выделение натрия [35]. Функция необычного окситоцина у пластиножаберных неизвестна.
Таким образом, аргинин-вазотоцин является примитивным ан-тидиуретическим гормоном, вазопрессин встречается только у млекопитающих, а пластиножаберные имеют два необычных вида окситоцина. Способ действия гормонов различен у разных позвоночных и зависит от потребности животных в воде: у животных, обитающих на суше, вода с их помощью удерживается в организме, а у гиперосмотических водных форм они стимулируют ее выделение4.
У костистых рыб гормон пролактин, вырабатываемый в передней доле гипофиза, усиливает образование разбавленной мочи. Ги-пофизэктомированная эвригалинная рыба Fundulus heteroclitus с трудом выживает при пересадке из морской воды в пресную; инъекция пролактина (но не аргинин-вазотоцина) стимулирует ее выживание [29]. Гипофизэктомированная пресноводная Fundulus (а также колюшка Gasterosteus или Xiphophorus) быстро теряет натрий — главным образом через жабры; с помощью пролактина можно снизить скорость этого процесса в 4 раза, что дает рыбе возможность выжить [23, 30].
Колюшки (Gasterosteus) осенью мигрируют в море, а весной идут в пресную воду вверх по рекам. Зимой в градиенте солености
Обмен воды: осмотический баланс, гормональная регуляция 155
они выбирают морскую воду, а поздней весной — пресную. Зимой при переносе из морской воды в пресную осмотическое'давление них падает гораздо более заметно, чем в такой же ситуации поздней весной. Если колюшкам зимой ввести пролактин, он уменьшит падение концентрации плазмы и будет способствовать образованию разбавленной мочи. Таким образЬм, пролактин стимулирует пресноводную осморегуляцию, осуществляемую как через жабры, так И через почки [23].
У костистых рыб в спинном мозгу имеется секреторный орган урогипофиз, который может выполнять некоторые функции в поддержании водного баланса [45]. После введения, рыбе солевого раствора было отмечено появление пиков потенциала действия, исходящих из нейросекреторных клеток. Экстракт урогипофиза рыб увеличивает скорость движения воды через мочевой пузырь у жабы и стимулирует сокращение мочевого пузыря у.форели [16].
У Fundulus активность щитовидной железы (судя по высоте эпителиальных клеток, йркости окрашивания коллоидов и потере включенного 1311).: в пресной воде меньше, чем в морской, и при низкой температуре меньше, чем при высокой [25].
Некоторые вещества из коры надпочечников также участвуют в поддержании солевого равновесия. Так, альдостерон увеличивает реабсорбцию натрия в мочевом пузыре жабы Bufo marinus [42]; У млекопитающих альдостерон способствует удержанию: натрия и выделению калия, а также усилению реабсорбции в дистальных извитых канальцах. В опытах на собаке, у которой была создана недостаточность натрия, низкая концентрация его в плазме усиливала секрецию альдостерона и кортикостерона [6].- Кортикостерон усиливает выделение калия, но ослабляет выделение-' натрия как в слюнных железах, так и в почках. Действие алВдостерона на мочевой пузырь жабы заключается, вероятно, в индуцировании синтеза какого-то медиатора или транспортного белка, поскольку его эффект блокируется ингибиторами белкового синтеза. Действие же вазопрессина на транспорт Na в мочевом пузыре этими веществами не блокируется [11, 13]. У птиц глюкокортикоиды коры надпочечников стимулируют выделение солей через солевые железы [14, 15]. Дезоксикортикостерон и кортизол уменьшают секрецию через ректальную железу у акулы, однако гипертонический солевой раствор с кортизолом увеличивает выделение натрия этим путем. У миноги Lampetra альдостерон и АКТГ уменьшают потери натрия [5]. В какой степени гормоны коры надпочечников регулируют в норме концентрацию натрия и калия у рыб, пока неизвестно.
У млекопитающих повышенный уровень натрия в крови вызывает освобождение из юкстагломерулярных клеток почек гормона ренина, который энзиматически превращает предшественник ангиотензина в крови в ангиотензин I; последний превращается в ангиотензин II, который затем действует на кору надпочечников^
156
Глава 1
вызывая высвобождение альдостерона. Альдостерон стимулирует реабсорбцию натрия в почках, что в свою очередь способствует удержанию воды. Ренин обнаружен и у рыб, причем в большей мере у пресноводных, чем у морских видов; у пластиножаберных и круглоротых он, по-видимому, не встречается [27, 28]. Когда угря переносят из пресной воды в морскую, уровень ренина в его тючках уменьшается в течение трех недель {43]. Ниже приводятся данные о содержании ренина в почках рыб (в крысиных единицах) :
Агломерулярный фахан в морской 3,7 воде
Агломерулярный фахан в разбавлен- 47 ной морской воде
Пресноводный серебристый карась 49
Анадромная сельдь (шэд) в 2,7%-ной 0,6 морской воде
Анадромная сельдь (шэд) в пресной 5,6 воде
Сельдь в 2,7%-ной NaCl 0
Сельдь в пресной воде 2,7
Другим гормоном, участвующим в ионной регуляции, является тиреокальцитонин, который освобождается из щитовидной железы при наличии в крови высоких концентраций кальция. Он снижает уровень кальция, ингибируя резорбцию костей. У рыб клетки уль-тимобранхиальных телец выделяют полипептид, состоящий из 32 аминокислот, который снижает уровень кальция в крови у угря и сома, но не у Fundulus [9].
Нейро-эндокринную регуляцию солевого и водного баланса удалось наблюдать также у ракообразных и насекомых. У грапсоид-ного краба, обладающего гиперосмотической и гипоосмотической регуляцией, при переносе в разбавленную морскую воду в жабрах увеличивается активность NaK-АТФазы; при наложении лигатур на его глазные стебельки активность АТФазы уменьшается, а осмотическая концентрация крови и мочи в разбавленной среде падает. Экстракт, полученный из брюшного нервного ствола сохраняет активность АТФазы [20]. У речного рака перевязка глазных стебельков увеличивает поступление воды и образование мочи в пресной воде и повышает осмотическую концентрацию крови в 50 %-ной морской воде; экстракт мозга снимает эти эффекты [19].
У кровососущего клопа Rhodnius образование и выделение мочи после приема пищи требуют участия некоего фактора, образующегося в гемолимфе. Этот фактор может стимулировать образование жидкости в изолированных мальпигиевых сосудах (см. выше). Местом образования гормона служат нейросекреторные клетки мезоторакального и церебрального ганглиев [9, 24]. У тараканов этот фактор вырабатывается последним брюшным ганглием 126].
Обмен воды: осмотический баланс, гормональная регуляция
157
Эндокринная секреция регулирует осмотическое и ионное равновесие у позвоночных и беспозвоночных путем воздействия на проницаемые мембраны (жабры и кожу) и на выделительные органы, а также на ткани (по отношению к внеклеточным нонам). Механизм этого контроля, особенно его сенсорного звена, исследован только применительно к нейрогипофизарным гормонам млекопитающих.
Заключение -
Регуляция осмотической концентрации или активности воды (в термодинамическом смысле) очень тесно связана с регуляцией ионной концентрации, клеточного объема и объема тела. Живые организмы могут встречаться в сверхсоленых озерах и в водоемах, наполненных дождевой водой, в сырых лесах, где часты дожди, и в сухих пустынях, иными словами, в условиях самой разнообразной солености и влажности. Их адаптивные механизмы в общем довольно схожи и меняются в зависимости от особенностей окружающей среды. Жизнь зародилась в море, и наиболее универсальное свойство живых организмов состоит в отделении их внутренней среды от наружной с помощью особого пограничного слоя. Все живые клетки окружены мембраной, обладающей ограниченной проницаемостью для воды, ионов и неэлектролитов. Возникновение неограниченной проницаемости есть первый признак смертельного повреждения клетки.
Большинство клеток, как свободноживущих, так и входящих в состав многоклеточных организмов, находится в осмотическом равновесии с окружающей их средой. Некоторые свободноживущие одноклеточные организмы могут в определенные периоды своего жизненного цикла осуществлять осмотическую регуляцию благодаря существующей вначале непроницаемости их оболочек для воды (например, икра пресноводных животных) или благодаря развитию сложных органоидов, служащих для выделения воды (например, пресноводные простейшие). Концентрация ионов в клетках отличается от их концентрации в окружающей среде, поэтому столь важное значение имеет регуляция внутриклеточного ионного состава. Осмотическая регуляция в клетке, как правило, осуществляется путем изменения концентраций растворенных органических компонентов, особенно аминокислот; концентрация неорганических ионов при этом остается относительно постоянной. В дополнение к избирательной проницаемости, эффектам Доннана И другим «пассивным» свойствам в большинстве клеток имеются още ионные «насосы»; с помощью этих механизмов часть метаболической энергии используется для создания такого уровня концентраций специфических ионов, который не может быть достигнут лри пассивном поддержании равновесия.
Если нарушится изотоничность клеток или начнут «протекать»
158.' - , . - * Глава 1
иХ ‘мембраны, вода будет пассивно входить в них й выходить и клеточные объемы могут измениться. Для сохранения оптимально-’ го уровня обмена веществ очень важно, чобы объем клетки й ее ионный состав оставались относительно постоянными. Регуляция объема зависит от движения воды и от устойчивости клетки к де- формациям, пути поддержания которой в клетках животных непонятны.
Сольватная (т. е. активная) вода есть лишь часть общего количества содержащейся в клетках воды. Однако вода, связанная. электростатически с белковыми молекулами, может служить также растворителем и для мелких ионов. Поэтому оценка воды как «Свободной» или «связанной» варьирует у разных исследователей в зависимости от Используемого ими метода. Точно так же проницаемость для воды, определяемая с помощью диффузий ’ метки, оказывается значительно меньшей, чем определяемая при осмотическом движении жидкости. ВоДа, как и большинство Других клеточных компонентов, распределена по разным компартментам клетки; нейеремешивающиеся слои молекул также препятствуют, ее равномерному распределению. Кроме того, становится всё' более очевидным, что большая часть воды протоплазмы превращает-, ся благодаря водородным' связям в подобие «жидкого льда». Все сказанное'заставляет сделать вывод о. том, что любые' попытки; определить количество активной воды в клетке и вокруг нее дают пока весьма приблизительные результаты.
Располагая столь неточными сведениями о клеточной воде, мы все же можем полагать, что основные механизмы регуляции воды, ионов И объема возникли на ранних этапах процесса Химической эволюции. Модификации этйх свойств у многоклеточных организмов являются в большей степени количественными, чем качественными, хотя с усложнением всей системы биологической организации развились и некоторые новые регуляторные механизмы.'
Основное и, по-видимому, наиболее примитивное осмотическое состояние представляет собой поддержание концентрации жидко-' сти тела на постоянном уровне или на уровне концентрации внешней среды. Яйца или икра морских беспозвоночных и некоторые виды взрослых морских беспозвоночных являются осмоконформерами, почти изоосмотичными морской воде; они не нуждаются в регуляции объема и поэтому могут — в допустимых пределах сморщиваться или набухать. Многие осмоконформеры снабжены приспособлениями для выделения или поглощения ионов, так что при изменении условий солености среды они (спустя некоторое время) могут изменить свой объем. Интересно, что отдельные родственные осмоконформерам формы, живя в пресной воде, обладают хорошо развитыми механизмами для ограничения набухания или для выделения воды (например, Hydra, по-видимому, пресноводные губки, пресноводные медузы и аннелиды); в то же время среди представителей других групп — Иглокожих, головоногих —
Обмен воды: осмотический баланс, гормональная регуляция 159
не обнаружено таких, которые могли бы. осуществлять осмотиче? скую регуляцию и обитали бы не в полноценной морской воде.
В ходе эволюции неоднократно совершались переходы из мор’ ской воды в пресную, поэтому ограниченная способность к осморегуляции в какой-то мере свойственна многим животным. Некоторые из них, как, например, литоральные двустворчатые моллюски, просто «захлопывают» раковину, исключая тем самым на короткое время соприкосновение с пресной водой. Отдельные формы могут запасать воду в специальных структурах. Проницаемость, для во-ды и ионов большинства обитающих в эстуариях беспозвоночных в. морской воде выше, чем в разбавленной, среде. Способность изменять- проницаемость (особенно проницаемость жабр) в зависимости от внешней концентрации широко распространена, но механизм ее.едва ли исследовался. Кроме того, многие животные^ перешедшие когда-то из моря в эстуарии, сохранили выделительные органы, служившие им в море главным образом для ионной регуляции,. и приспособили их в новых условиях для выделения осмотической воды. Животные, наиболее успешно освоившие разбавлен? ную среду, имеют специальные клетки (обычно в жабрах)., фуню ция которых заключается в активной абсорбции ионов из окружающей среды. Появление механизмов активной абсорбции представляет собой модификацию широко распространенных ионных насо* сов, выводящих определенные вещества, особенно Na, из многих клеток независимо от осмотических условий. Подобным же образом выделительные органы сохраняют растворенные вещества, перекачивая ионы обратно в. кровь. Ряд. животных, населяющих эстуарии, во взрослом состоянии хорошо переносят почти пресную воду и связаны с морем лишь в течение краткого личиночного периода. < -
. Некоторые обитающие в эстуариях беспозвоночные и родствен-; ные им формы, особенно отдельные отряды ракообразных, кольчатых червей и моллюсков, перешли к жизни в пресной воде полностью, б течение всего жизненного цикла. Обычно они имеют очень «плотные» или непроницаемые жабры и поверхностные покровы. У них хорошо развиты почки, вырабатывающие обильную разведенную мочу, и они активно поглощают ионы в дополнение к тем, которые поступают с пищей.
Отдельные виды морских беспозвоночных, главным образом крабы, на долгое время покидают море, порой на полный жизненный цикл, и живут во влажном песке. Так же как и некоторые литоральные виды, они обладают гипоосмотической регуляцией, т. е. могут поддерживать концентрацию своей крови на более низком, чем концентрация окружающей среды, уровне. Эта способность обнаружена у ряда морских ракообразных, причем наиболее хорошо она развита у обитателей соленых озер (например, у Arte-mia). Гипоосмотическая регуляция обеспечивает интенсивное выделение диффундирующих внутрь ионов. Частично оно осущест-
160
Глава 1
вляется почками и кишечником, но главным образом клетками жабр, снабженными механизмом активного транспорта. В этом случае направление транспорта обратно тому, который наблюдается у пресноводных видов. С чем связаны различия между насосами, действующими в противоположных направлениях, непонятно. Почки у таких животных участвуют главным образом в ионной регуляции.
Самый успешный переход из моря на сушу был сделан насекомыми на раннем этапе эволюции членистоногих. Наземные насекомые имеют ряд совершенно уникальных адаптационных механизмов. Так, их покрытая воском кутикула, а также дыхательная система, которая может открываться и закрываться, снижают до минимума потери воды с испарением; многие насекомые могут через кутикулу абсорбировать воду из влажного воздуха — способность, не встречающаяся у других животных; они имеют также наружные гигрорецепторы, которые обеспечивают точную настройку поведенческих реакций. Сложная выделительная система насекомых обеспечивает образование гиперосмотических продуктов выделения в условиях крайнего дефицита воды. В выделительной системе, включающей мальпигиевы сосуды и заднюю кишку, циркулируют растворенные вещества (К, мочевая кислота и некоторые не идентифицированные органические вещества), попадающие в узкие межклеточные каналы, где осмотический градиент может перемещать воду из кишки в ткани и гемолимфу.
Хордовые возникли в море; от них рано отделилась ветвь позвоночных, дальнейшее развитие которых шло в пресной воде. Некоторые позвоночные — миноги и различные костистые рыбы — могут мигрировать из морской воды в пресную и обратно. Другие, например миксины, являются осмоконформерами; пластиножаберные обладают уникальной способностью поддерживать гипертоничность своей внутренней среды по отношению к морской воде с помощью удержания в организме мочевины. Многие из них выделяют соли через ректальную железу. Как эвригалинные костистые рыбы, так и рыбы, обитающие либо в пресной, либо в соленой воде, сохраняют гиперосмотичность в пресной воде и гипоосмотич-ность в морской. Гипоосмотичность зависит в основном от активного выделения солей через жабры, как это отмечено, например, у гипоосмотичных морских креветок. Жабры морских рыб богаты NaK-АТФазой и содержат особые секреторные (хлоридные) клетки. В пресной воде почки выделяют обильную разбавленную мочу, а жабры активно поглощают соли против градиента (по-видимому, через другие, не секреторные клетки). Амфибии на стадии головастиков поглощают соли через жабры, а во взрослом состоянии переходят на абсорбцию через кожу и мочевой пузырь. При переносе эвригалинных рыб в пресную воду их проницаемость для натрия может снизиться в течение нескольких минут; в морской воде они часто менее проницаемы для воды, чем в пресной, что
Обмен воды: осмотический баланс, гормональная регуляция
161
прямо противоположно изменениям проницаемости, наблюдаемым у некоторых беспозвоночных.
Другим примером внепочечного выделения солей служат солевые железы птиц и рептилий, обитающих в море и в пустыне. Главным катионом секрета носовой железы бывает обычно Na или К. Как птицы, так и млекопитающие используют (в разной степени) испарение для охлаждения; поэтому в пустыне такие потери воды увеличиваются. Млекопитающие, подобно насекомым, обладают способностью вырабатывать продукты выделения, заметно гиперосмотичные по отношению к крови. Способность концентрировать мочу значительно варьирует у различных видов млекопитающих; это свойство частично определяется длиной петель Генле и их противоточных многоходовых систем.
Среди позвоночных широко распространена эндокринная регуляция кожной и жаберной проницаемости, гломерулярной фильтрации и канальцевой реабсорбции, причем обычно в нее вовлекается несколько гормонов. Освобождение гормонов, особенно гипофизарных, стимулируется с помощью нервных импульсов, которые в свою очередь стимулируются рецепторами объема и осморецепторами.
Эволюция осморегуляции способствовала освоению весьма разнообразных условий обитания. При подробном рассмотрении обнаруживается много ответвлений от общего направления, характерных для отдельных групп животных; можно обнаружить также заметные различия внутри групп, относящиеся к способности противостоять значительным колебаниям осмотических условий среды. Некоторые свойства клеточных мембран — избирательный и адаптивный характер проницаемости, активный транспорт одного или более ионов через наружную оболочку клетки — развились на ранних этапах эволюции и затем были модифицированы в соответствии с разными осмотическими условиями. На клеточном уровне произошла интеграция водной и ионной регуляции и регуляции объема, расширившаяся вслед за тем за счет включения систем различных органов у высших животных. Вода является одним из существенных компонентов жизни, поэтому в процессе эволюции развились многочисленные способы обеспечения клеток водой в нужных количествах.
СПИСОК ЛИТЕРАТУРЫ
Осмотический баланс
1. Abbott К. D., Comp. Biochem. Physiol., 38А, 37—52, 1971. Water economy in Peromyscus.
2. Adolph E. F, Physiological Regulations, Jacques Cattell Press, 1943, 502 pp.
3. Ahearn G. A., J. Exp. Biol., 53, 573—595, 1970. Water loss in desert beetles.
4. Alexander M. D., Haslewood E. S., Haslewood G. A. D., Watts D. C.,
, И—1332
162
Глава 1
Watts R. L., Comp. Biochem. Physiol., 26, 971—978, 1968. Osmotic control and urea synthesis in elasmobranchs.
5. Allen K., Biol. Bull., 121, 419—424, 1961. Effect of salinity on amino acids in Pelecypoda.
6. Alvarado R. H„ Kirschner L. B., Comp. Biochem. Physiol., 10, 55—67, 1963. Ionic regulation in Ambystoma.
7. Ames E„ Steven K., Skadhauge E., Amer. J. Physiol., 221, 1223—1228, 1971. Arginine vasotocin effects on renal function in chicken.
8. Anderson E„ Harvey W. R., J. Cell BioL, 31. 107—134, 1966. Active transport in midgut of Saniia cecropia.
9. Augenfeld J. M., Life Sci., 8, 973—978, 1969. Na-K activated ATPase in Arte-mia, different salinities.
10. Avens A. C., Comp. Biochem. Physiol., 16, 143—153, 1965. Osmotic balance in brackish water gastropod.
11. Ax P., Ax R., Biol. ZentalbL, 79, 7—31, 1960. Salinity tolerance, brackish a.nd freshwater cilistes
12. Ballard B. S., Abbott W., Comp. Biochem. Physiol., 29, 671—687, 1969. Osmotic regulation in Callinectes.
13. Barnes H., Finlayson D. M., Piatigorsky J., J. Animal Ecol., 32, 233—252, 1963. Behavior of barnacles out of water.
14. Bartholomew G. A., Cade T. C., Auk, 80, 504—539, 1963. Water economy of land birds.
15. Bayley I. A. E., Ellis P., Comp. Biochem. Physiol., 31, 523—528, 1969. Hy-posmotic regulation, aquatic isopod.
16. Beadle L. C., J. Exp. Biol., 50, 473—479, 1969. Osmotic and ionic regulation, embryos of aquatic pulmonates.
17. Beadle L. C., J. Exp. Biol., 50, 49b—499, 1969. Regulation of water during development, pulmonate embryo.
18. Beament J. W. L., Biol. Rev., 36, 281—320, 1961; J. Exp. BioL, 38, 277—290, 1961. Water relations of insect cuticle.
19. Beament J. W. L., Nature, 191, 217—221, 1961. Electrical properties of oriented lipid membranes.
20. Beament J. W. L., Adv. Insect Physiol., 2, 67—129, 1964. Water movement in insect cuticle.
21. Beament J. W. L., Soc. Exp. Biol. Symp., 19, 273—298, 1965. Active uptake of water by insects; models and mechanisms.
21a. Beament J. W. L., Treherne J. E., eds, Insects and Physiology, Elsevier, New York, 1968, 378 pp.
22. Bentley P. J., Schmidt-Nielsen K., J. Cell. Comp. Physiol., 66, 303—310, 1965. Permeability to water and sodium, crocodilian.
23. Bentley P. J., Schmidt-Nielsen K., Science, 151, 1547—1549, 1966. Cutaneous water loss, reptiles.
24. Bentley P. J., Schmidt-Nielsen K-, Comp. Biochem. Physiol., 32, 363—365, 1970. Water exchange, aquatic turtles.
25. Bergmiller E., Bielawski J., Comp. Biochem. Physiol., 37, 85—91, 1970. Water permeability of gills, crayfish.
26. Berridge M. J., J. Exp. Biol., 43, 511—521, 523—533, 1965. Excretion in cotton stainer Dysdercus.
27. Berridge M. J., Gupta B. L., J. Cell. Sci., 2, 89—112, 1967. Ultrastructure and ion and water transport in renal papillae of Calliphora.
28. Berridge M. J., Gupta B. L., J. Cell. Sci., 3, 17—32, 1968. Localization of ATPase in rectum of Calliphora.
29. Berridge M. J., J. Exp. Biol., 48, 159—174, 1968; 50, 15—28, 1969. Urine formation by malpighian tubules, Calliphora.
30. Berridge M. J., pp. 329—347, in Insect Physiology, ed. by J. E. Beament and J. E. T. Trehern, American Elsevier Publishing Co., 1968. Ion and water transport across insect epithelia.
31. Berridge M. J., Oschman J. L., Tissue & Cell, 1, 247—272, 1969. Structural basis for fluid secretion, malpighian tubules.
Обмен воды: осмотический баланс, гормональная регуляция
163
32 Biber Т. U. L., Curran Р. F., J. Gen. Physiol., 56, 83—99, 1970. Uptake of -53 BMns J^Exp. Biol., 51, I—10, 11—16, 1969. Urine formation by antennal p-land of Carcinus.
34 Binns R., J. Exp. Biol., 51, 17—27, 29—39, 1969. Glucose and ammo acid reabsorption in antennal gland of Carcinus.
35. Binyon J., J. Marine Biol. Assoc. U.K., 41, 161—174, 1961. Salinity tolerance and water permeability, Asterias.
36. Binyon J., J. Marine Biol. Assoc. U. K., 42, 49—64, 1962. Ionic regulation in low salinity, Asterias.
37. Blinks J. R., J. Physiol., 177, 42—57, 1965. Osmotic properties of striated muscle fibers.
38. Bliss D. E„ Phylogeny and Evolution of Crustaceans, Harvard University Press, 1963, pp. 59—78. Pericardial sacs of terrestrial crustaceans.
39. Bliss D. E., Amer. Zool., 6, 197—212, 1966. Water balance in land crab, Ge-carcinus.
40. Bliss D. E., Amer. Zool., 8, 355—392, 1968. Transition from water to land in decapod crustaceans.
41. Bonting S. L., Comp. Biochem. Physiol., 17, 953—966, 1966. Na-K ATPase in rectal glands of elasmobranchs.
42. Boonkoom V., Alvarado R. FL, Amer. J. Physiol., 220, 1820—1824, 1971. ATPase in gills of Rana tadpoles.
43. Boroffka I., Z. vergl. Physiol., 51, 25—48, 1965. Ion transport in nephridium of Lumbricus.
44. Boroffka L, Z. vergl. Physiol., 57, 348—375, 1968. Osmotic and volume regulation in Hirudo.
45. Boroffka L, Altner FL, Haupt J., Z. vergl. Physiol., 66, 421—438, 1970. Function and structure of nephridium of Hirudo.
46. Boroffka Frick A., Pfliiger. Arch., 281, 20 (abstr.), 1964. Ion excretion in nephridium of Lumbricus.
47. Born J. IF., Biol. Bull., 134, 235—244, 1968. Osmoregulation in caridean shrimps.
48. Bourguet J., Lahlou B., Maetz J., Gen. Comp. Endocr., 4, 563—576, 1964. Regulation if ion and water balance in goldfish.
49. Bradshaw S. D„ Comp. Biochem. Physiol., 36, 689—719, 1970. Seasonal changes in water and ion balance, lizards.
50. Bradshaw S. W., Shoemaker V. FL, Comp. Biochem. Physiol., 20, 855—865, 1967. Water and electrolyte balance in desert lizards.
51. Brand G. W., Bagly I. A. E., Comp. Biochem. Physiol., 38B, 361—371, 1971. Osmoregulation in four species of copepod.
52. Braun G., Rummel G., Mangos J. A., Pfliiger. Arch., 289, 141 — 154, 1966. Ultrastructure and excretory function in protonephridium of a rotifer.
53. Braysher M., Green B., Comp. Biochem. Physiol., 35, 607—614, 1970. Water and ion balance in Australian lizard.
54. Bryan G. W., J. Exp. Biol., 37, 83—99, 100—112, 113—128, 1960. Sodium regulation in crayfish.
55. Bull J. M., Morris R., J. Exp. BioL, 47, 485—494, 1967. Osmoregulation in larva of Lampetra.
56. Burger J. W., Physiol. Zool., 35, 205—217, 1962. Function of rectal gland, dogfish.
57. Burger J. W„ Biol. Bull., 113, 207—223, 1965. Excretion, lobster.
58. Butler D. G., Comp. Biochem. Physiol., 18, 773—781, 1966. Hormonal regulation of water balance in Anguilla.
59. Cade T. J., pp. 237—256. In thirst: Proceedings. International Symposium on Thirst in the Regulation of Body Water, edited by M. J. Wayner, Pergamon Press, 1963. Water and salt balance in birds.
60. Cade T. J., Tobin C. A., Gold A., Physiol. Zool., 38, 9—33, 1965. Water economy in finches.
11*
164
Глава 1
61. Carlisky N. J. et al., Comp. Biochem. Physiol., 36, 321—337, 1970. Water balance in excretion of urea in amphibians.
61a. Carpenter R. E., Comp. Biochem. Physiol., 24, 951—964, 1968. Salt and water metabolism in marine fish-eating bat, Pizonyx vivesi.
62. Cholette C., Gagnon A., Germain P., Comp. Biochem. Physiol., 33, 333—346, 1970. Isosmotic adaptation in Myxine.
63. Chew R. M., Biol. Rev., 36, 1—31, 1961. Water metabolism of desert vertebrates.
64. Clark M. E., Biol. Bull., 134, 252—260, 1968. Effect of osmotic dilution on amino acids in polychaetes.
65. Clarke M. R., Denton E. J., Gilpin-Brown J. B., J. Physiol., 203, 49P — 50P, 1969. Buoyancy mechanisms in squid.
66. Claussen D. L., Comp. Biochem. Physiol., 20, 115—130, 1967. Water loss in lizards.
67. Clegg J. S., J. Exp. Biol., 41, 879—892, 1964. Osmotic function of glycerol in cysts of Artemia.
68. Conte F. P., Wagner H. H., Fessler F., Gnose C., Comp. Biochem. Physiol., 18, 1—15, 1966. Development of osmotic and ionic regulation in young salmon.
69. Conway E. J., Biol. Rev., 20, 56—72, 1945. Electrolytes in muscle and plasma.
70. Cook J. S., J. Gen. Physiol., 50, 1311—1325, 1967. Nonsolvent water in human erythrocytes.
71. Cope F. W., Biophys. J., 9, 303—319, 1969. Structure of water in tissues.
72. Copeland D. E., J. Cell BioL, 23, 253—264, 1964. Mitochondrial osmotic pump in anal papillae, mosquito larvae.
73. Copeland D. E., Science, 151, 470—471, 1966. Protoplasma, 63, 363—384, 1967. Salt secreting cells in Artemia.
74. Copeland D. E., Amer. Zool., 8, 417—432, 1968. Ultrastructure of salt trans-port cells in Gecarcitius.
75. Copeland D. E., Z. Zellforsch., 92, 1—22, 1968. Ultrastructure of salt absorbing cells in gills of Callinectes.
76. Costlow J. D., Bookhout C. G., Monroe R., Physiol. Zool., 39, 81—100, 1966. Effect of salinity on larval development of crab Rhithropanopeus.
77. Coulombe H. N., Ridgway S. H., Evans W. E., Science, 149, 86—88, 1965. Respiratory water exchange in porpoises.
78. Croghan P. C., J. Exp. Biol., 35, 219—233, 243—249, 1958. Osmotic and ionic regulation in Artemia.
79. Croghan P. C., Carra R. A., Lockwood A. P. M., J. Exp. Biol., 42, 463—474, 1965. Electrical potentials across gills of crayfish.
80. Croghan P. C., Lockwood A. P. M., J. Exp. Biol., 48, 141—158, 1968. Ionic regulation in aquatic isopods.
81. Cronin R. J., Solomon S., Klingler E. L., Comp, Biochem. Physiol., 37, 511— 516, 1970. Renal function in Macaca.
82. Dainty J., House R., J. Physiol., 185, 172—184, 1966. Permeability to water of frog skin.
83. Dall W., Milward N. E„ Comp. Biochem. Physiol., 30, 247—260, 1969. Water and ion balance in amphibious and aquatic fishes.
84. Dall W., J. Fish. Res. Bd. Canad., 27, 1123—ИЗО, 1970. Osmoregulation in lobster.
85. Dantzler W. H„ Comp. Biochem. Physiol., 22, 131—140, 1967. Renal function in water snake, Natrix
86. Dantzler W. H„ Schmidt-Nielsen B., Amer. J. Physiol., 210, 198—210, 1966. Excretion by Pseudemys.
87. Dawson T. J., Comp. Biochem. Physiol., 28, 401—407, 1969. Evaporative water loss in possum, Trichosurus.
88. Dawson W. R., Shoemaker V. H., Trodoff H. B., Borut A., Auk, 82, 606—623, 1965. Salt balance in red crossbill.
Обмен воды: осмотический баланс, гормональная регуляция_______________165
й ________——-— ----- ——-------- “ ' ~
| 89 Dawson W. R., Shoemaker V. Н., Licht Р., Ecology, 47, 589—594, 1966. Eva-
porative water losses in Australian lizards.
3 gO. Dehnel P. A., Physiol. Zool., 39, 259—265, 1966. Chloride regulation in crab, Hemigrapsus.
i 51. Depocas F., Dart J. S., Canad. J. Physiol. Pharmacol., 49, 53—62, 1971. Water fluxes in seal, Phoca.
I 92. Dethier V. G., Schoonhoven L. M., J. Insect Physiol., 14, 1049—1054, 1968.
Humidity receptors on antennae of caterpillars.
i 53. Diamond J. M., Soc. Exp. Biol. Symp., 19, 329—347, 1965; Fed. Proc., 30, | 6—13, 1971. Mechanism of isotonic water absorption.
? 54. Diamond J. M., Bossert IF. H., J. Gen. Physiol., 50, 2061—2083, 1967. Stan-
I ding-gradient osmotic flow.
95. Doyle W. L., Exp. Cell Res., 21, 386—393, 1960. Ultrastructure of salt gland
in marine birds.
96. Doyle W. L., Amer. J. Anat, 111, 223—229, 1962. Tobule cells of rectal gland of sting ray.
97. Duchateau-Bosson G., Florkin M., Arch. Int. Physiol. Biochem., 70, 345—355, 1962. Osmotic regulation in crab, Eriocheir.
98. Duchateau-Bosson G., Florkin M., Arch. Int. Physiol. Biochem., 70, 393—396, 1962. Intracellular amino acids in polychaetes.
99. Duchateau-Bosson G., Flor kin M., Comp. Biochem. Physiol., 3, 245—247, 1963. Intracellular amino acids in crayfish in different salinities.
100. Dunson W. A., Weymouth R. D. Science, 149, 67—69, 1965. Absorption of sodium by soft-shelled turtle, Trionyx.
101. Dunson W. A., J. Exp. Zool., 165, 171—182, 1967. Sodium fluxes in freshwater turtles.
102. Dunson W. A., Taub A. M., Amer. J. Physiol., 213, 975—982, 1967; 216, 995— 1002, 1969. Extrarenal salt excretion in sea snake.
103. Dunson W. A., Comp. Biochem. Physiol., 32, 161—174, 1970. Salt and water balance in estuarine reptiles.
104. Edney E B., Comp. Biochem. Physiol., 19, 387—408. Absorption of water vapor by insects.
105. Edney E. B., Water Relations of Terrestrial Arthropods, Cambridge University Press, 1957, 108 pp.
106. Epstein F. H., Manitius A. J., Weinstein T., Katz A. I., Pickford G. E., Yale J. Biol. Aled., 41, 388—393, 1969. Na-K ATPase in kidney of euryhaline Fundulus.
107. Evans D. R., Mellon D., Jr., J. Gen. Physiol., 45, 487—513, 1962. Water receptor in taste sensilla of blowfly.
108. Evans D. H., J. Exp. Biol., 47, 513—517, 525—534, 1967. Chloride and water balance of intertidal teleost, Xiphister.
109. Evans D. H., J. Exp. Biol., 50, 179—190, 1969. Water and salt balance in teleost Pholis.
. 110. Evans D. H., J. Exp. BioL, 50, 689—703, 1969. Water permeability of marine,
freshwater and euryhaline teleosts.
111. Finkelstein A., Cass A., Nature, 216, 717—718, 1967. Cholesterol effects on water permeability of lipid membranes.
112. Fleming W. R., Hazelwood D. H„ Comp. Biochem. Physiol., 23, 911—915, 1967. Ionic and osmotic regulation in freshwater medusa.
113. Florkin M„ Duchateau-Bosson G„ Jeuniaux C., Schoffeniels E„ Arch. Int. Physiol. Biochem., 72, 892—906, 1964. Osmotic and ionic regulation in Eriocheir.
H4. Flugel H., Kieler Meeresforsch., 16, 186—200, 1960. Osmotic resistance and regulation in prawn, Crangon.
115. Forster R. P., Berglund F., Rennick B. R., J. Gen. Physiol., 42, 319—327, 1958. Tubular secretion of organic bases in aglomerular kidney of Laphius.
116. Foster M. A., Comp. Biochem. Physiol., 30, 751—759, 1969. Osmotic and ionic regulation in Cottus.
117. Freeman A. A., Reuben J. P., Brandt P. W., Grundfest H„ J. Gen. Physiol., 50, 423—445, 1966. Osmotic properties of nerve membranes.
166
Глава 1
118. Frisch J. A., Anat. Rec., 89, 571, 1944. Contractile vacuole functions in para-mecia.
119. Fugelli K., Comp. Biochem. Physiol., 22, 253—260, 1967. Regulation of red cell volume in flounder.
120. Gardner K. D., Maffly R. H., J. Clin. Invest., 43, 1968—1975, 1964. Urea absorption in kidney.
121. Gary-Bobo С. M., Solomon A. K., J. Gen. Physiol., 52, 825—853, 1968. Solvent water in red blood cells.
122. Giebisch G„ J. Gen. Physiol., 44, 659—678, 1961. Transtubular potentials in Neciurus kidney.
123. Giebisch G., Windhager E. E., Amer. J. Physiol., 204, 387—391, 1963. Chloride movement in proximal tubules of Necturus.
124. Giese A. C., Farmanfarmaian A., Biol. Bull., 124, 182—192, 1963. Osmotic resistance of sea urchins.
125. Gifford C. A., Publ. Inst. Marine Sci. U. Texas, 8, 97—125, 1962. Osmotic regulation, crabs.
126. Gilles R., Schoffeniels E., Comp. Biochem. Physiol., 31, 927—939, 1969. Osmotic regulation in crab nerves.
127. Gilles-Baillien M., J. Exp. Biol., 52, 691—697, 1970. Urea osmoregulation in terrapin.
128. Goffart M., Function and Form in the Sloth, Pergamon Press, 1971, 225 pp.
129. Goffart M., Nys J., Arch. Int. Physiol. Biochem., 73, 166—168, 1964. Water balance in sloths.
130. Goldstein D., Solomon A. K., J. Gen. Physiol., 44, 1—17, 1960. Pore sizes in red cells.
131. Goldstein L„ Forster R. P., Amer. J. Physiol., 220, 742—746, 1971. Osmoregulation and urea metabolism in skate, Raja.
132. Goldstein L„ Oppelt W. W., Maren T. H., Amer. J. Physiol., 215, 1493—1497, 1968. Osmotic and urea metabolism in shark, Negaprion.
133. Goodman A. B., Wolf A. V., J. Appl. Physiol., 26, 203—207, 1969. Water loss from human skin.
134. Gordon M. S., Schmidt-Nielsen S. K., Kelly H. M., J. Exp. Biol., 38, 659—678, 1961. Osmotic regulation in brackish water frog.
135. Gordon M. S., J. Exp. Biol., 39, 261—270, 1962. Osmotic regulation in green toad.
136. Gordon M. S., Biol. Bull., 124, 45—54, 1963. Chloride exchange in rainbow trout.
137. Gordon M. S., Biol. Bull., 128, 218—229, 1965. Intracellular osmoregulation in toad muscle.
138. Gordon M. S., Tucker V. A., J. Exp. BioL, 49, 185—193, 1968. Salinity adaptation in crab-eating frog.
139. Gottschalk C. W., Amer. J. Med., 36, 670—685, 1968. Concentration of urine by mammalian kidney.
140. Grant W. C., Ecology, 36, 400—407, 1955. Tolerance of water loss in earthworms.
141. Greenaway P„ J. Exp. BioL, 53, 147—163, 1970; 54, 199—214, 1971. Sodium and calcium fluxes in snail, Limnaea.
142. Greenwald L., Physiol. Zool., 44, 149—161, 1971. Sodium balance in frog.
143. Grimstone A. V., Mullinger A. M., Ramsay J. A., Phil. Trans. Roy. Soc. bond. B, 253, 343—382, 1968. Water and ion movements in rectal complex of Tenebrio.
144. Gross W. J., Biol. Bull., 126, 54—68, 1964. Water balance in land crabs.
145. Gross W. J. et al., Comp. Biochem. Physiol., 17, 641—660, 1966. Salt and water balance in Madagascar ciabs.
146. Gupta B. L., Berridge M. J., J. Morph., 120, 23—82, 1966. Fine structure of rectum of Calliphora.
147. Gutman Y., Beyth Y., Life Sci., 9, 37—42, 1970. Urine concentration by kidney of chinchilla.
Обмен воды: осмотический баланс, гормональная регуляция
148 Hadley N. F., J. Exp. Biol., 53, 547—558, 1970. Water relations of desert
149 Hardisty M. J. Exp. Biol., 34, 237—251, 1957. Osmotic regulation in larval and adult lampreys.
150 Harpur R. P., Canad. J. Zool., 46, 295—301, 1963. Osmoregulation and urea metabolism in toads and frogs.
151. Harvey H. W., The Chemistry and Fertility of Sea Waters, Cambridge University Press, 1955, 224 pp.
152. Harvey W. R., Zerahn K., J. Exp. Biol., 50, 297—306, 1969. Potassium transport in Sarnia cecropia midgut.
153. Harvey W. R., Nedergaard S., Proc. Nat. Acad. Sci., 51, 757—765, 1964. Active transport of potassium in midgut of Samia cecropia.
154. Hazelwood D. FL, Potts W. T. W., Fleming R. R., Z. vergl. Physiol., 67, 186— 191, 1970. Sodium and water balance in freshwater medusa.
155. Heatwole H., Torres F„ de Austin S. B., Heatwole A., Comp. Biochem. Physiol., 28, 245—269, 1969. Evaporative water loss in frog.
156. Herreid C. F., Comp. Biochem. Physiol., 29, 423—429, 1969. Permeability of crabs to water.
157. Hinke J. A. M., J. Gen. Physiol., 56, 521—541, 1970. Solvent water in muscle fibers of barnacle.
158. Hinton H. E., Nature, 188, 336—337, 1960. Tolerance of desiccation in chiro-nomid larvae.
159. Hobson A. D. et al., J. Exp. BioL, 29, 1—17, 22—29, 1952. Osmotic concentration in intestinal parasites.
160. Hokin M. R., Hokin L. E., J. Gen. Physiol., 50, 793—811, 1967. Salt secretion in bird salt gland.
161. Holdgate M. W., Seale M., J. Exp. Biol., 33, 82—118, 1956. Water loss through insect cuticle.
162. Holmes W. N., Phillips J. G., Butler D. G., Endocrinology, 69, 483—495, 1961. Effects of adrenal hormones on renal function in duck.
163. Holmes W. N., McBean R. L., J. Exp. Biol., 41, 81—90, 1964. Ion excretion in turtle. Chelonia.
164. Horowicz P., Burger J. W., Amer. J. Physiol., 214, 635—642, 1968. Sodium balance in dogfish, Squalus acanttias.
165. House C. R., J. Exp. Biol., 40, 87—104, 1963. Osmotic regulation in brackish water fish, Blennius.
166. House C. R., Green K., J. Exp. BioL, 42, 177—189, 1965. Ion and water transport by intestine of teleost, Cottus.
167. Hudson J. W., pp. 211—236. In Thirst: Proceedings. International Symposium on Thirst in the Regulation of Body Water, edited by M. J. Wayner, Perga-mon Press, 1963. Water metabolism in desert mammals.
168. Hudson J. W., Rummel J. A., Ecology, 47, 345—354, 1966. Water metabolism and temperature regulation in heteromyids.
169. Hughes D. A., Biol. Bull., 136, 43—-53, 1969. Osmotic responses of shrimp, Penaeus.
170. Hughes M. R., Comp. Biochem. Physiol., 32, 315—325, 807—812, 1970. Cloacal and salt gland excretion in seagull.
171. Irvine H. B., Amer. J. Physiol., 217, 1520—1527, 1969. Sodium and potassium secretion by insect malpighian tubules.
172. Jampot L. M., Epstein F. FL, Amer. J. Physiol,. 218, 607—611, 1970. Na-K ATPase and osmotic regulation in fishes.
173. Jeuniaux C., Bricteux-Gregoire S., Florkin M„ Cahiers de Biol. Marine, 2, 373—379, 1961; 3, 107—114, 1962. Role of amino acids in osmoregulation of invertebrates.
174. Jones Al. L., Biol. Bull., 132, 362—380, 1967. Morphology of nephridia of ( Nereis.
’ 175. Jorgensen С. B., Dales R. P., Physiol. Comp. OecoL, 4, 357—374, 1957. Volu-
me and osmotic regulation in nereid polychaetes.
168 Глава 1
176. Kalber F. A., Costlow J. D„ Amer. Zool., 8, 411—416, 1968. Osmoregulation in larvae of land crab Cardisoma.
177. Kamemoto F. I., Larson E. J., Comp. Biochem. Physiol., 13, 477—480, 1964. Chloride concentration in coelomic and nephridial fluids of sipunculids.
178. Kamemoto F. L, Ono J. K., Comp. Biochem. Physiol., 27, 851—857, 1968. Hormone control of urine flow in crayfish.
179. Kamiya M., Utida S„ Comp. Biochem. Physiol., 31, 671—674, 1969. Na-K ATPase in gills of fish.
180. Kaneshiro E. S., Dunham P. B., Holz G. G., Biol. Bull., 136, 63—75, 1969;
137, 161—169, 1969. Osmoregulation in a marine ciliate.
181. Kao C. Y., J. Gen. Physiol., 40, 91—105, 107—119, 1956. Membrane properties in Fundulus eggs.
182. Kerley D. E., Pritchard A. W., Comp. Biochem. Physiol., 20, 101—113, 1967. Osmoregulation in crayfish.
182a. Kerstetter T. H. et al., J. Gen. Physiol., 56, 342—359, 1970. Sodium uptake by earthworms.
183. King E. N„ Comp. Biochem. Physiol., 17, 245—258, 1966. Oxidative activity of crab gill mitochondria.
184. King E N., Schoffeniels E., Arch. Int. Physiol., Biochem., 77, 105—111, 1969. Gill potentials in crab.
184a. Kinne O., Z. wiss. Zool., 157, 427—491, 1953. Gammarids from different salinities
185. Kinne O., Neth. J. Sea Res., 3, 222—224, 1966. Metabolism of invertebrates in different salinities.
186. Kirschner L. B., Wagner S., J. Exp. Biol., 43, 385—390, 1965. Filtration and reabsorption in crayfish antennal gland.
187. Kirschner L. B., Amer. J. Physiol., 217, 596—604, 1969. Sodium fluxes in suffused eel gills.
188. Kirschner L. B., Amer. Zool., 10, 365—376, 1970. Salt transport in aquatic animals.
189. Kirschner L. B., Kerstetter T. H., Porter D., Alvarado К. H., Amer. J. Physiol., 220, 1814—1819, 1971. Adaptation of larval Anbystoma to concentrated solutions.
190. Kitching J. A., J. Exp. BioL, 31, 56—67, 68—73, 76—83, 1954. Contractile vacuoles.
191. Knulle W., J. Insect. Physiol., 13, 333—357, 1967. Absorption of water vapor by small insects.
192. Koblick D. C., Yu-Tu L., J. Exp. Zool., 166, 325—330, 1967. Osmotic properties of digestive cells of Chlorohydra.
193. Kohn P. G., Soc. Exp. Biol. Symp., 19, 3—16, 1965. Physical and chemical properties of water.
194. Komadina S., Solomon S., Comp. Biochem. Physiol., 32, 333—343, 1970. Renal function in snakes.
195. Komnick H., Protoplasma, 56, 274—314, 385—419, 605—636, 1963. Ultrastructure of salt glands of birds.
196. Krogh A., Osmotic Regulation in Aquatic Animals, Cambridge University Press, 1939, 242 pp.
197. Kummel G., Z. Zellforsch., 57, 172—201, 1962; Z. Naturforsch., 16b, 692—697x 1961. Evolutionary cytology of primitive excretory organs.
198. Kummel G., Zool. Beitr., 10, 227—252, 1964. Structure of antennal glands of crayfish.
199. Kummel G., Dankworth L., Braun-Schubert G., Gertz К. H., Z. vergl. Physiol.,. 64, 118—134, 1969. Structure and function of nephridia of Ascaris.
200. Lahlou B., Comp. Biochem. Physiol., 20, 925—938, 1967. Renal function in. flounders.
201. Lahlou B., Henderson J. W., Sawyer W. H., Amer. J. Physiol., 216, 1266—1272 . 1273—1278, 1969. Renal adaptations of toadfish, Opsanus.
202. Lahlou B„ Henderson J. W., Sawyer W. H., Comp. Biochem. Physiol. 28 1427—1433, 1969. Sodium fluxes in goldfish.
Обмен воды: осмотический баланс, гормональная регуляция______________169
203 Lance I., Comp. Biochem. Physiol., 14, 155—165, 1965. Respiration and osmotic behavior of copepod Acartia,
204. Lang M. A., Gainer H„ Comp. Biochem. Physiol., 30, 445—456, 1969. Osmotic regulation and volume control in crab muscle fibers.
205. Lange R., Comp. Biochem. Physiol., 10, 173—179, 1963. Osmotic function of amino acid and taurine in Mytilus.
206. Lange R., Comp. Biochem. Physiol., 13, 205—216, 1964. Osmotic adjustment in echinoderms and molluscs.
207. Lange R., Fugelli R., Comp. Biochem. Physiol., 15, 283—292, 1965. Osmotic adjustments in euryhaline teleosts.
208. LeBrie S. J., Sutherland I. D. W., Amer. J. Physiol., 203, 995—1000, 1962. Renal function in water snake.
209. Lee P., Schmidt-Nielsen R., Amer. J. Physiol., 220, 1598—1605, 1971. Water balance in zebra finch.
210. Levy R. A., Comp. Biochem. Physiol., 23, 631—644, 1967. Homarine in osmotic regulation of Limulus.
211. Lilly S. J., J. Exp. BioL, 32, 423—439, 1955. Water osmoregulation in Hydra.
212. Lloyd S. J., Gerlid R. D., Reba R. C„ Seeds A. E., Amer. J. Physiol., 26, 274—
276, 1969. Water permeability of human placenta.
213. Lockwood A. P. M., J. Exp. Biol., 38, 647—658, 1961. Urine in two species of Gammarus.
214. Lockwood A. P. M., Biol. Rev., 37, 257—305, 1962. Osmoregulation of Crustacea.
215. Lockwood A. P. M., Animal Body Fluids and their Regulation, Harvard University press, 1964, 177 pp.
216. Lockwood A. P. M., J. Exp. BioL, 42, 59—69, 1965; 53, 737—751, 1970. Sodium balance in amphipod Gammarus.
217. Loeffler C. A., Lovtrup S., J. Exp. BioL, 52, 291—298, 1970. Water balance in salmon egg.
218. Loveridge J. P., J. Exp. BioL, 49, 15—29, 1968. Water loss from spiracles of locust.
219. Lovtrup S., Pigon A., Lab C. R., Carlsberg Sci. Chim., 28, 1—36, 1951. Water permeability of cells.
220. Lucas J. S., Hodgkin E. P., Austral. J. Marine and Freshwater Res., 21, 163—
173, 1970. Growth of Halicarcinus in different salinities and temperatures.
221. MacFarlane W. V., Morris R. J. H., Howard B., Nature, 197, 270—271, 1963. Water turnover in desert mammals.
222. MacFarlane W. V. et al., Nature, 234, 483—484, 1971. Series of water requirements in mammals from different habitats.
223. MacMillen R. E., Lee A. R., Comp. Biochem. Physiol., 28, 493—514, 1969; 35, 355—369, 1970. Water metabolism of Australian mice.
224. Machin J., Amer. J. Physiol., 216, 1562—1568, 1969. Water permeability of skin of Bufo.
225. Mackay W. C., Prosser C. L., Comp. Biochem. Physiol., 34, 273—280, 1970. King crab, ions in blood.
226. Macklin M., J. Cell. Physiol., 70, 191—196, 1967. Osmotic regulation in Hydra.
227. Maddrell S. H. P„ J. Exp. BioL, 45, 499—508, 1966; 51, 71—97, 1969. Hormonal regulation of function in malpighian tubules of Rhodnius.
228. Maetz J., Lahlou B., J. Physiol. Paris, 58, 249, 1966. Na and Cl exchange in elasmobranch.
229. Maetz J., Science, 166, 613—615, 1967. Na-K exchange in branchiopump of flounder.
230. Maetz J., Sawyer IF. H„ Pickford G. E., Mayer N., Gen. Comp. Endocr., 8, 163—176, 1967. Ionic balance in Fundulus.
231. Maloiy G. M. O., Amer. J. Physiol., 219, 1522—1527, 1970. Water economy of desert donkey.
170
Глава 1
232. Malvin R. L., Carlson E„ began S., Churchill P., Amer. J. Physiol., 218, 1506— 1509, 1970. Renal function of freshwater-lamprey.
233. Mantel L. H., Amer. Zool., 8, 433—442, 1968. Role of foregut in ion and water balance in crab, Gecarcinus.
234. Mantel L. H., Comp. Biochem. Physiol., 20, 743—753, 1967. Gill potentials and ion regulation in Callinectes.
.235. Martin D. W., Diamond J. M„ J. Gen. Physiol., 50, 295—315, 1966. Na and Cl transport in gall bladder.
236. Mayer N., Nibelle J., Comp. Biochem. Physiol.; 35, 553—556, 1970. Salt balance in Anguilla.
237. McBean R. L., Goldstein L., Amer. J. Physiol., 219, 1115—1123, 1124—1130, 1970. Renal function in Xenopus.
238. McClanahan L., Comp. Biochem. Physiol., 20, 73—99, 1967. Adaptations of desert toad.
239. McClanahan L., Baldwin R., Comp. Biochem. Physiol., 28, 381—389, 1969. Water uptake through skin of desert toad.
240. McFarland L. Z., Nature, 204, 1202—1203, 1964. Salt excretion by seagulls.
241. McFarland 1Ё. N., Wimsatt W. A., Comp. Biochem. Physiol., 28, 985—1006, 1969. Renal function of vampire bat.
242. McLusky D. S., J. Marine Biol. Assoc., 48, 769—780, 1968. Osmotic and ionic regulation in amphipod Corphium.
243. Marshall E. E., Physiol. Rev., 14, 133—159, 1934. Vertebrate kidneys.
244. Middler S. A., Kleeman C. R., Edwards E., Comp. Biochem. Physiol., 25, 335—• 341, 1968; 26, 57—68, 1968. Water reabsorption in bladder of toad.
245. Morris R., J. Exp., 33, 235—248, 1956; 35, 649—665, 1958. Osmoregulation of Lampetra during spawning.
246. Morris R., Bull J. M., J. Exp. Biol., 52, 275—290, 1970. Osmoregulation of larvae of Lampetra.
247. Motais R., Ann. Inst. Oceanogr. Monaco, 45, 1—83, 1967. Ionic and osmotic regulation, water and salt fluxes in marine and freshwater fishes.
248. Motais R., C. R. Acad. Sci. Paris, 253, 724—-726, 1961. Sodium exchange in Platichthys in sea and fresh water.
249. Motais R., Maetz J., Gen. Comp. Endocr., 4, 210—224, 1964. Pituitary hormones, sodium exchange in teleosts.
250. Motais R., Rankin L, Maetz J., J. Exp. Biol., 51, 529—546, 1969. Water fluxes in marine fishes.
251. Motais R., Romeu F. G., Maetz J., J. Gen. Physiol., 50, 391—422, 1966. Exchange diffusion in teleosts.
252. Netnenz H., J. Insect. Physiol., 4, 38—44, 1960; Sitzungsb. Oster. Akad. Wiss. Mat.-Nat. KI.. 169, 17—41, 1960. Osmotic and ionic regulation, Ephydra larvae.
252a. Neumann D., Kieler Meeresforsch., 18, 38—54, 1962. Ions in brackishwater animals.
253. Noble-Nesbitt J., J. Exp. BioL, 50, 745—769, 1969; 52, 193—200, 1970. Water balance in the firebcat, Thermobia.
254. Nungesser W C., Pfeiffer E. W., Comp. Biochem. Physiol., 14, 289—297, 1965. Kidney function in moutain beaver, Aplodontia.
255. O’Dell R. M., Radwin H. M., Bernstein L. H., Schlegel J. W., J. Appl. Physiol., 24, 366—368, 1968. Renal function in Macaca.
256. Oglesby L. C„ Comp. Biochem. Physiol., 14, 621—640, 1965; 16, 437—455, 1965. Water and chloride regulation in nereids.
257. Oglesby L. C., Biol. Bull., 134, 118—138, 1968. Responses of estuarine po-lychaetes to osmotic stress.
258. Oglesby L. C., Comp. Biochem. Physiol., 26, 155—177, 1968. Osmotic responses of sipunculid worms.
259. Oschman J. L„ Berridge M. J., Fed. Proc., 30, 49—56, 1971. Structural basis of fluid secretion.
260. Oschman J. L„ Wall B. J., J. Morph., 127, 475—510, 1969. Fluid transport in rectal pads of Periplaneta.
Обмен воды: осмотический баланс, гормональная регуляция
171
261 Phillips J. Е., Amer. Zool., 10, 413—436, 1970. Review of excretion in in-262 ^Philips J. E., J. Exp. BioL, 41, 15-38, 39-67, 69-80, 1964; 48, 521-532, 1968* Rectal absorption and excretion in the desert locust.
9R3 Philoott C. W., Protoplasma, 60, 7—23, 1965; Philpott C. W., Copeland D. E., J Cell Biol., 18, 389—404, 1963. Chloride cells in gills of Fundulus.
264. Pickering A. D., Morris R„ J. Exp. BioL, 53, 231—243, 1970. Osmoregulation in cyclostomes.
265. Pickford G. et al., Comp. Biochem. Physiol., 18, 503—509, 1966. Effect of calcium on survival of hypophysectomized Fundulus in fresh water.
266. Pickford G. E., Grant F. B., Science, 155, 568—570, 1967. Osmotic concentration in coelacanth Latimeria.
267. Pierce S K-, Comp. Biochem. Physiol., 36, 521—533, 1970. Water balance of mollusc Modiolus.
268. Pierce S. K., Comp. Biochem. Physiol., 38A, 619—635, 1971. Volume regulation in marine molluscs.
269. Pierce S. K-, Comp. Biochem. Physiol., 39A, 103—117, 1971. Volume regulation by marine mussels.
270. Pilcher D. E. M„ J. Exp. BioL, 52, 653—655; 53, 465—484, 1970. Hormone effects on urine secretion in Carausius.
271. Pontin R. M., Comp. Biochem. Physiol., 17, 1111—1126, 1966. Osmotic function of secretory vesicles in a rotifer.
272. Potts W. T. F., J. Exp. BioL, 31, 614—617, 618—630, 1954. Urine production in Anodonta.
273. Potts W. T. W„ Evans D. H., BioL Bull., 133, 411—425, 1967. Ion fluxes in Fundulus.
274. Potts W. T. W., Fleming W. R., J. Exp. BioL, 53, 317—327, 1970. Hormone effects on ion and water regulation in Fundulus.
274a. Potts W. T. W„ Foster M. A., Rudy P. P., Howells G. P., J. Exp. BioL, 47, 461—470, 1967. Sodium and water balance in Tilapia.
275. Potts W. T. W., Parry G., J. Exp. BioL, 41, 591—601, 1964. N and Cl balance in prawn, Palaemonetes.
276. Potts W. T. W., Parry G., Osmotic and Ionic Regulations in Animals, Perga-mon Press, 1964, 423 pp.
277. Potts W. T. W., Rudy P. P., J. Exp. BioL, 50, 223—237, 1969. Water balance in eggs of salmon.
278. Poulson T. L., Bartholomew G. A., Condor, 64, 245—252, 1962. Salt utilization in house finch.
279. Poulson T. L., Bartholomew G. A., Physiol. Zool., 35, 109—119, 1962. Salt balance in Savannah sparrow.
280. Price K. S., Creaser E. P., Comp. Biochem. Physiol., 23, 65—76, 77—82, 1967. Water, urea, and sodium regulation in skate, Raja.
280a. Pritchard A. W., Kerley D. E., Comp. Biochem. Physiol., 35, 427—437, 1970. Kidney function in crayfish.
281. Prusch R. D., Dunham P. B., J. Cell BioL, 49, 431—434, 1970. Contractions of contractile vacuole of amoeba.
282. Ramamurthi R., Scheer В. T., Personal communication. Sodium balance in crab, Hetnigrapsus.
282a. Ramsay J. A., J. Exp. BioL, 27, 145—157, 1950; 28, 62—73, 1951. Osmoregulation in mosquito larvae.
283. Ramsay J. A., J. Exp. BioL, 26, 46—56, 65—-75, 1949. Osmotic relations and urine production in Lumbricus.
284. Ramsay J. A., J. Exp. BioL, 32, 200—216, 1955. Excretion by malpighian tubules, Dixippus.
285. Ramsay J. A., J. Exp. BioL, 35, 871—891, 1958. Excretion in Tenebrio.
2oo. Ramsay J. A., Phil. Trans. Roy. Soc. bond. B, 248, 279—314, 1964. Rectal complex of meal worm, Tenebrio.
287. Reid I. A., McDonald I. R., Comp. Biochem. Physiol., 25, 1071—1079, 1968. Renal function in marsupial, Trichosurus.
172
Глава 1
288. Rich G. T., Sha’afi R. I., Barton T. C„ Solomon A. K., J. Gen. Physiol., 50, 2391—2405, 1967. Permeability of red cells.
289. Rich G. T., Sha’afi R. I., Romualdez A., Solomon A. K-, J. Gen. Physiol., 52, 941—954, 1969. Osmotic permeability of red cells.
290. Riddick D. FL, Amer. J. Physiol., 215, 736—740, 1968. Contractile vacuoles in amoeba.
291. Riegel J. A., J. Exp. Biol., 38, 291—299, 1961. Function of crayfish antennal gland.
292. Riegel J. A. Comp. Biochem. Physiol., 36, 403—410, 1970. Fluid movement in crayfish antennal gland.
293. Roberts J. S., Schmidt-Nielsen B., Amer. J. Physiol., 211, 476—486, 1966. Excretion in terrestrial lizards.
294. Robertson J. D„ Biol. Bull., 138, 157—183, 1970. Osmotic and ionic regulation in Limulus.
295. Romeu F. G., Salibean A., Pezzani-Hernandez S., J. Gen. Physiol., 53, 816— 835, 1969. Na and Cl uptake through skin of frog.
296. Rudy P. P., Comp. Biochem. Physiol., 22, 581—589, 1967. Water permeability in decapod crustaceans.
297. Ruibal R., Physiol. Zool., 35, 133—147, 218—223, 1962. Osmotic capacity of toads.
298. Sawyer IF. FL, Amer. J. Physiol., 218, 1789—1794, 1970. Hormone effect on lungfish kidney.
299. Schlieper C., Helg. wiss. Meeresunters., 14, 482—502, 1966. Osmotic resistance of gills of Mytilus.
300. Schmid W. D„ Ecology, 46, 261—269, 1965. Water economy of amphibians.
301. Schmidt-Nielsen B., Laws D. F., Ann. Rev. Physiol., 25, 631—658, 1963. Survey of comparative aspects of excretion in invertebrates.
302. Schmidt-Nielsen B., O’Dell R„ Amer. J. Physiol., 200, 1119—1124, 1961. Structure and function in mammalian kidney.
303. Schmidt-Nielsen B., Pfeiffer E. W., Amer. J. Physiol., 218, 1370—1375, 1970. Kidney function in moutain beaver, Aplodontia.
304. Schmidt-Nielsen B., Schrauger C. R., Science, 139, 606—607, 1963. Contractile vacuoles of amoeba.
305. Schmidt-Nielsen B., Skadhauge E., Amer. J. Physiol., 212, 973—980, 1967. Renal function in crocodile.
306. Schmidt-Nielsen K., Desert Animals, Oxford University Press, 1964, 277 pp.
307. Schmidt-Nielsen K., Lee P., J. Exp. Biol., 39, 167—177, 1962. Kidney function in crab-eating frog.
308. Schmidt-Nielsen K-, Bentley P. J., Science, 154, 911, 1966. Cutaneous water loss in tortoise.
308a. Schoffeniels E., Tercafs R. R., Ann. Soc. Roy. Zool. Belgique, 96, 23—29, 1965. Osmotic and ionic balance in brackish water amphibians.
309. Schreibman M. P., Kaliman K. D., Gen. Comp. Endocr., 6, 144—155, 1966. Endocrine control of fresh water tolerance in teleosts.
310. Seeds A. E., Amer. J. Physiol., 219, 551—554, 1970. Water movement across human placenta.
311. Sha’afi R. I., Rich G. T., Mikulecky D. C., Solomon A. K., J. Gen. Physiol., 55, 427—450, 1970. Urea entrance into red cells.
312. Sha’afi R. L, Rich G. T., Sidel V. W., Basset W„ Solomon A. K., J. Gen. Physiol., 50, 1377—1399, 1967. Red blood cell permeability.
313. Sharrat В. M., Jones I. C., Bellamy D., Comp. Bichem. Physiol., 11, 9—18, 1964. Water and salt composition and renal function in eel.
313a. Shaw J., J. Exp. BioL, 32, 353—382, 1955. Water relations of aquatic insect Sialus.
314. Shaw J., J. Exp. BioL, 36, 126—144, 1959. Sodium balance in crayfish.
315. Shaw J., J. Exp. BioL, 38, 135—152, 1960. Sodium fluxes in crayfish.
316. Shaw J., J. Exp. BioL, 38, 153—162, 1961. Sodium balance in Eriocheir.
317. Shaw J., Soc. Exp. BioL Symp., 18, 237—254, 1964. Salt balance in crusta-
ceans.
Обмен воды: осмотический баланс, гормональная регуляция 173
318. Shaw L, Stobbart R. FL, Adv. Insect. Physiol., 1, 315—399, 1963. Osmotie and ionic regulation in insects.
319. Shoemaker V. H., Comp. Biochem. Physiol., 15, 81—88, 1965. Responses to dehydration in toads. .
320. Shoemaker V. H., Licht P., Dawson D. R., Comp. Biochem. Physiol., 23, 255— 262, 1967. Water and salt excretion in lizards.
321. Siebert B. D., MacFarlane W. W., Austral. J. Agric. Res., 20, 613—622, 1969. Water balance in ungulates.
322. Siebert B. D., MacFarlane W. W., Physiol. Zool., 44, 225—240, 1971. Water balance in camels in the desert.
323. Skadhauge E., Comp. Biochem. Physiol., 23, 483—501, 1967. Cloacal water and salt reabsorption in chicken.
324. Skadhauge E., Comp. Biochem. Physiol., 24, 7—18, 1968. Cloacal function in chicken.
325. Skadhauge E., J. Physiol., 204, 135—158, 1967. Salt and water fluxes in Anguilla.
326. Skadhauge E., Schmidt-Nielsen B., Amer. J. Physiol., 212, 793—798, 973—980, 1313—1318, 1967. Renal function in domestic fowl.
327. Smith H. W., Biol. Rev., 11, 49—82, 1936. Urea in elasmobranchs.
327a. Smith H. W., Quart. Rev. Biol., 7, 1—26, 1932. Evolution of excretion in fishes.
328. Smith R. I., Biol. Bull., 125, 322—343, 1963. Salt loss in nereids.
329. Smith R. I., Biol. Bull., 126, 142—149, 1964. Water uptake in two nereids.
330. Smith R. I., Biol. Bull., 133, 643—658, 1967. Osmoregulation and water permeability in estuarine crab.
331. Smith R. I., Biol. Bull., 139, 351—362, 1970. Water permeability of Car-cinus.
332. Smith R I., J. Exp. Biol., 53, 75—92, 93—100, 1970. Ionic regulation in nereids.
333. Smyth M., Bartholomew G. A., Condor, 68, 447—458, 1966. Water economy of desert birds.
334. Smyth M., Bartholomew G. A., Auk, 83, 597—602, 1966. Water and salt balance in mourning doves.
335. Sohal R. S., Copeland E., J. Insect Physiol., 12, 429—439, 1966. Ultrastructure of anal papillae of Aedes.
336. Solomon A. !(., J. Gen. Physiol., 43, 1—15, 1960. Red cell membrane structure and ion transport.
337. Spight T. M„ Comp. Biochem. Physiol., 20, 767—771, 1967; Biol. Bull., 132, 126—132, 1967. Water economy of salamanders.
338. Staddon B. W., J. Exp. BioL, 41, 609—619, 1964. Water balance in hemipteran, Corixa.
339. Stanley J. G., Fleming IV. R., Science, 144, 63—-64, 1964. Excretion of hypertonic urine by teleosts.
340. Stinnakre J., Tauc L., J Exp. Biol., 51, 347—361, 1969. Central nervous responses to osmoreceptors of Aplysia.
340a. Stobbart R. EL, J. Exp. Biol., 42, 29—43, 1965; 47, 35—37, 1967. Ion fluxes in larvae of Aedes.
341. Stobbart R. H., J. Exp. Biol., 54, 29—66, 1971. Sodium uptake by mosquito larvae.
342. Stoner L. C., Dunham P. B., J. Exp. Biol., 53, 391—399, 1970. Osmotic and volume regulation of Tetrahymena.
343. Sutcliffe D. W„ J. Exp. BioL, 38, 521—530, 1961; 39, 141—160, 1962. Osmotic and ionic regulation in aquatic insects.
344. Sutcliffe D. W., Shaw J., J. Exp. Biol., 46, 499—518, 519—528, 529—550, 1967. Sodium balance in freshwater amphipod, Gamtnarus.
345. Taylor C. R. et al., Amer. J. Physiol., 220, 823—827, 1971. Water balance in African ungulates.
346. Taylor C. R., Spinage C A., Lyman С. P., Amer. J. Physiol., 217, 630—634, 1969. Water relations of African antelope.
174
Глава 1
347. Templeton J. R., Comp. Biochem. Physiol., 11, 223—229, 1964. Nasal salt secretions in lizards.
348. Tercafs R. R., Arch. Int. Physiol. Biochem., 71, 318—320, 1963. Permeability of skin of reptiles.
349. . Theede H., Kieler Meeresforsch., 19, 20—41, 1963; 21, 153—166, 1965. Effect of salinity on cilia of two populations of Mytilus.
350. Theede H., Marine Biol., 2, 114—120, 1969. Osmoregulation in Carcinus.
351. Thesleff S., Schmidt-Nielsen K., Amer. J. Physiol., 202, 597—600, 1962. Electrophysiology of salt glands of gulls.
352. Thompson L. C., Pritchard A. W., Biol. Bull., 136, 114—129, 1969. Osmoregulation of crustaceans.
353. Thorson T. W., pp. 265—270. In: Sharks, Skates, and Rays, ed. by P. W. Gilbert, R. F. Mathewson, D. P. Rail, Johns Hopkins Press, 1967. Osmoregulation in freshwater elasmobranchs.
354. Thuet P., Motais R., Maetz J., Comp. Biochem. Physiol., 26, 793—819, 1968. Ionic regulation in Artemia.
355. Todd M. E., J. Exp. Biol., 40, 381—392, 1963. Osmoregulation in marine isopods.
356. Tormey J. M., Diamond J. M., J. Gen. Physiol., 50, 2031—2060, 1967. Fluid transfer in gall bladder.
357. Tosteson D., Hoffman J., J. Gen. Physiol., 44, 169—194, 1960. Criteria of active transport in red blood cells.
358. Ellrich K. J., Schmidt-Nielsen B., O’Dell R., Pehlling G., Gottschalk G. W., Lassiter W. E., Mylle M., Amer. J. Physiol., 204, 527—531, 1963. Micropuncture studies of rat kidney.
359. Ullrich K. J., Rumrich G., Schmidt-Nielsen B., Pfluger. Arch., 295, 147—156, 1967. Urea transport in collecting duct of rat kidney.
360. Ussing H., Acta Physiol. Scand., 19, 43—56, 1949. Theory of active and passive fluxes across membranes.
361. Utida S., Kamiya M., Shirai N., Comp. Biochem. Physiol., 38A, 443—447, 1971. ATPase in eel gill.
362. Vernberg F. J., Schlieper C., Schneider D. E., Comp. Biochem. Physiol., 8, 271—285, 1963. Effects of salinity on cilia of molluscan gills.
363. Vincent-Marique C., Gilles R., Life Sci., 9, 509—512, 1970. Amino acids in blood and muscle of Eriocheir.
364. Virkar R. A., Comp. Biochem. Physiol., 18, 617—625, 1966. Amino acids in salinity adaptation of Golfingia.
365. Virkar R. A., Webb K. L., Comp. Biochem. Physiol., 32, 775—783, 1970. Amino acids in clam, Mya.
366. Waldron W., Z. vergl. Physiol., 69, 249—283, 1970. Humidity receptors in locusts.
367. Wall B. J.. J. Insect Physiol., 13, 565—578, 1967. Hormonal control of rectal water absorption in cockroach.
368. Wall B. J., J. Insect Physiol., 16, 1027—1042, 1970. Effects of hydration and dehydration on Periplaneta.
369. Wall B. J., Fed. Proc., 30, 42—48, 1971. Osmotic gradients in rectal pads of an insect.
370. Wall B. J., Oschman J. L., Amer. J. Physiol., 218, 1208—1215, 1970; Science, 167, 1497—1498, 1970. Water and salt uptake by rectal pad of Periplaneta.
371. Webb D. A., Proc. Roy. Soc. bond., B, 129, 107—136, 1940. Osmotic and ionic regulation in Carcinus.
372. Webber H., Dehnel P. A., Comp. Biochem. Physiol., 25, 49—64, 1968. Water and ion regulation in limpet.
373. Weil E., Pantin C. F. A., J. Exp. Biol., 8, 73—81, 1931. Adaptations of Gunda to salinity.
374. Weinstein S. W., Klose R. M„ Amer. J. Physiol., 217, 498—504, 1969. Micropuncture studies on mammalian kidney.
375. Weisser F., Lacey F. B., Weber H., Jamison R. L., Amer. J. Physiol., 219, 1706—1713, 1970. Renal function in chinchilla.
Обмен воды: осмотический баланс, гормональная регуляция
175
376. Werntz Н. Р., Biol. Bull., 124, 225—239, 1963. Osmoregulation in gamma-
377 'wiggles'&'orth К B., Principles of Insect Physiology, 6th ed., Methuen, 378 Wigglesworth V. B., Salpeter M. M., J. Insect Physiol., 8, 299 307, 1962.
Histology of malpighian tubules in Rhodnius.
379. Willoughby E. J., Comp. Biochem. Physiol., 27, 723—745, 1968. Water economy of African birds.
380 Wilson W„ Biol. Bull., 138, 96—108, 1970. Osmoregulation in isopods.
381. Winston P. W., Nelson V. E„ J. Exp. Biol., 43, 257—269, 1965. Regulation of
transpiration in mites.
382. Wolf A. V., Thirst, Charles C Thomas, Springfield, 1958, pp. 340—372.
383. Wood J. L., Farrand P. S., Harvey W. R., J. Exp. Biol., 50, 169—178, 1969.
Active transport of potassium by midgut of Samia cecropia.
384. Zahn T. J., Comp. Biochem. Physiol., 25, 1021—1033, 1968. Protein effects on secretion in muskrats.
385. Zaks M. G., Sokolova M. M., Sechenov Physiol. J. (U.S.S.R.), 47, 120—127, 1961. Salt glands of marine birds.
386. Zaks M. G., Sokolova M. M., Fed. Proc. Transl. SuppL, 25, T531—534, 1966. Osmotic regulation in migrant salmon.
387. Zaugg IF. S., McLain L. R., Comp. Biochem. Physiol., 35, 587—596, 1970. ATPase in gills of salmon.
388. Zolin A. I., Soc. Exp. Biol., Symp., 19, 365—384. Uptake of water by embryos.
Гормональная регуляция
1. Archer R., Chauvet J., Chauvet M. T., Nature, 201, 191—192, 1964. Neurohypophyseal hormones in finback whale.
2. Archer R., Chauvet J., Europ. J. Biochem., 17, 509—513, 1970. Mesotocin in birds.
3. Baehr J. C., Bandry N., C. R. Acad. Sci. Paris, 270, 3134—3136, 1970. Hormonal control of water balance in Rhodnius.
4. Bastide F., Jard S., Biochim. Biophys. Acta, 150, 113—123, 1968. Action of hypophyseal polypeptides.
5. Bentley P. J., Heller H., J. Physiol., 109, 124—129, 1965. Hormonal control in Salamandra.
6. Brown T. C., Davis J. O., Johnston С. I., Amer. J. Physiol., 211, 437—441, 1966. Responses of renin and aldosterone secretion in dogs.
7. Capelii J. P., Wesson L. G., Aponte G. E„ Amer. J. Physiol., 218, 1171—1178, 1970. Phylogenetic study of the renin-angiotensin system.
8. Chan D. R„ Jones I. C., Mosley W., J. Endocr., 42, 91—98, 1968. Hormonal control of water and ions in Anguilla.
9. Copp D. H„ pp. 377—398. In: Fish Physiology, Vol. 2, ed. by W. S. Hoar and D. J. Randall, Academic Press, 1969. Calcitonin in fish.
10. Cuthbert A. W., Painter E., J. Physiol., 199, 593—612, 1968. Hormonal effects on frog skin.
11. Edelman I. S., Timognori G. M., Rec. Prog. Horm. Res., 24, 1—34, 1968. Action of vasopressin cn Na transport in bladder.
12. Eggena P., Schwatz O. L., Waller R., J. Gen. Physiol., 52, 465—481, 1968. Effects of vasotocin on toad bladder.
13. Fancstil D. D., Edelman I. S., Fed. Proc., 25, 912—916, 1966. Effects of vasopressin on toad bladder.
13a. Ferguson D. R., Heller H., J. Physiol., 180, 846—863, 1965. Neurohypophyseal hormones in mammals.
14. Holmes W. N., Butler D. G., Phillips J. G., J. Endocr., 23, 53—61, 1961. Saline stimulation of salt gland in gull.
15. Holmes W. N„ Phillips J. G., Chester Jones I., Rec. Prog. Horm. Res., 10, 619— 666. 1963. Glucocorticoids in ion balance of birds.
176
Глава 1
16. Ireland М. Р„ J. Endocr., 43, 133—138, 1969. Effect of urophysectomy on survival of Gasterosteus in osmotic stress.
17. Jard S., J. Physiol. Paris, 58, Supp. 15, 1—124, 1966. Hormonal effects on water balance in frog.
18. Jones I. C et al., J. Endocr., 43, 21—31, 1968. Effects of AVT in freshwater
19. Kamemoto F. I., Ono J. K., Comp. Biochem. Physiol., 29, 393—401, 1969. Endocrine control of osmoregulation, Crustacea.
20. Kato K. N„ Kamemoto F. I., Comp. Biochem. Physiol., 28, 665—674, 1969. Endocrine control of osmoregulation, crab.
31. Lahlou B., Sawyer V/. H., Gen. Comp. Endocr., 12, 370—377, 1969. Ion balance in hypophysectomized goldfish.
32. Lam T. J., Comp. Biochem. Physiol., 31, 909—913, 1969. Effect of prolactin on sickleback fish
‘2 3. Lam T. J., Leatherland J. F., Comp. Biochem. Physiol., 33, 295—302, 1970. Prolactin in osmotic and ionic balance, Fundulus.
24. Maddrell S. H. P., J. Exp. BioL, 45, 479—508, 1966; 51, 71—97, 1969. Hormonal regulation of function in malpighian tubules of Rhodnius.
25. McNabb R. A., Pickford G. E., Comp. Biochem. Physiol., 33, 783—792, 1970. Thyroid function in euryhaline Fundulus.
26. Mills R. R., J. Exp. BioL, 46, 35—41, 1967. Hormonal control of excretion in cockroach.
27. Mizogami S., Oguri M., Sokabe H., Nishimura FL, Amer. J. Physiol., 215, 991—994, 1968. Renin in teleost kidneys.
28. Nishimura H., Oguri M., Ogawa M., Sokabe FL, Imai M., Amer. J. Physiol., 218, 911—915, 1970. Absence of renin in elasmobranchs and cyclostomes.
29. Pickford G. E., Comp. Biochem. Physiol., 18, 503—509, 1966. Effect of prolactin on Fundulus in various salinities.
30. Potts W. T. W., Evans D. EL, BioL Bull., 131, 362—368, 1966. Prolactin in fish.
31. Sawyer W. FL, Amer. J. Physiol., 164, 457—466, 1951. Glomerular antidiuretic effects in amphibians.
32. Sawyer W. H., Endocrinology, 75, 981—990, 1964. Vertebrate neurohypophyseal principles.
33. Sawyer W. FL, Arch. d’Anat. Micro. Morph. Exper., 54, 295—312, 1965. Review of action of pituitary polypeptides.
34. Sawyer W H., Gen. Comp. Endocr., 5. 427—439, 1965. Neurohypophyseal principles from lamprey and two Chondrichthyes.
35. Sawyer W. H., Amer. J. Physiol., 210, 191—197, 1966. Hormonal effects on ion balance in lamprey.
36. Sawyer W. H., Amer. J. Med., 42, 678—686, 1967. Evolution of antidiuretic hormones.
37. Sawyer W. H, J. Endocr., 44, 421—435, 1969. Hormones in elasmobranchs.
38. Sawyer W. FL, Manning M., Heinicke E, Parks A. M., Gen. Comp. Endocr., 12, 387—390, 1969. Elasmobranch hormones of water balance.
39. Sawyer W. FL, pp. 257—269. In: Miami Winter Symposia. Vol. 1. Homologies in Enzymes and Metabolic Pathways, ed. by W. J. Whelan and J. Schultz, Elsevier, New York, 1970. Homologies among neurohypophyseal peptides.
40. Sawyer W. FL, Amer. J. PhysioL, 218, 1789—1795, 1970. Hormones of water balance in lungfish, Protopterus.
41. Sawyer W. H., Freer R. J., Tseng T., Gen. Comp. Endocr., 9, 31—37, 1967.
42. Sharp G. W. G., Leaf A., Rec. Prog. Horm. Res., 22, 431—466, 1966. Action of aldosterone on toad bladder.
43. Sokade H., Mizogami S., Sato A., Japan. J. Pharmacol., 18, 332—343, 1968. Role of renin in adaptation to sea water in euryhaline fishes.
44. Stanley J. G., Fleming W. R., BioL Bull., 131, 155—165, 1966. Hypophyseal effects on Na transport in Fundulus kansae.
45. Takasugi N., Bern H. S., Comp. Biochem. PhysioL, 6, 289—303, 1962. Caudal neurosecretory organ in Tilapia.
Глава 2
Неорганические ионы
Л. ПРОССЕР1
Осмотическая концентрация раствора зависит только от общего числа растворенных частиц и не зависит от их химической природы. У многих животных жидкости тела по их осмотической концентрации соответствуют внешней среде, но отличаются от нее ионным составом. Нет такого организма, у которого концентрации ионов внутри и вне клетки были бы одинаковы. Избирательность поглощения клеткой одних ионов и выведение других есть одно из наиболее универсальных свойств живого. Регуляция ионного состава как на клеточном, так и на организменном уровне представляет собой основную и общую всем живым существам способность.
Жизнь зародилась в море. Как показывают данные геохимии, ионный состав морской воды не претерпел существенных изменений с раннекембрийского периода, хотя ее общая соленость, по-видимому, несколько возросла. Ниже приводятся данные о содержании (в процентах) отдельных элементов в земной коре, океанах и протоплазме [140, 172].
Земная кора: О — 49, Si — 26, Al — 7,5, Fe — 4,7, Са, Na, К, Mg, Н. Океаны (соотношение элементов, входящих в состав солей): О, Н, С1 — 55,2, Na — 30,6, Mg — 3,7, Са — 1,6, К — 1,1, S, Р.
Протоплазма: О — 76, С — 10, Н—10, N — 2, К, Са, Mg, Na, Cl, Fe, S, P.
В вулканических породах содержание калия и натрия примерно одинаково. Однако по мере выщелачивания пород калий сильнее адсорбируется частицами глины, в результате чего он обнаруживается в почве в большем количестве, чем натрий. Соответственно в морях и реках содержится больше натрия, чем калия. Натрий — основной катион внеклеточной жидкости большинства животных; он необходим также морским растениям, тогда как наземные, как правило, не испытывают в нем необходимости. Калий — основной вш/тушклеточный катион всех животных и растений. Таким образом, зависимость между распространенностью и доступностью элементов, с одной стороны, и их утилизацией живыми организмами — с другой, весьма мала.
1 При участии Л. Киршнера. 12—1332
178
Глава 2
Биологическая ценность элементов определяется главным образом их химическими свойствами. Так, металлы имеют большое значение, особенно в комплексе со специфическими белками; в то же время кремний и алюминий — наиболее распространенные элементы земной коры — находят в биологических системах лишь ограниченное применение. Морские животные извлекают из морской воды калий и натрий (причем первый в большем количестве, чем второй), а магний и сульфаты они выводят. Концентрация водородных ионов в жидкостях тела обычно несколько выше, чем в окружающей водной среде.
Количество различных ионов, существующих в организме как в свободной, так и в связанной с белками форме, изменяется во времени и поддается определению с известным трудом. Механизм ионной регуляции чрезвычайно сложен и еще недостаточно изучен.
Регуляция внутриклеточной концентрации ионов
Состав неорганических веществ любой клетки и омывающей ее жидкости различен. Содержание ионов в цитоплазме избирательно регулируется клеточными мембранами. В табл. 2-1 приведен состав различных клеток и тканей в сравнении с их средой. Неопло-дотворенные яйца морского ежа содержат примерно в 20 раз больше калия и в 9 раз меньше натрия, чем морская вода. Общее количество катионов в них в сумме составляет 292 мэкв на 1 кг воды, а неорганических анионов — менее 100 мэкв. Разница между этими величинами сбалансирована фосфатами и органическими анионами [201]. Эритроциты млекопитающих содержат обычно калия больше, чем плазма, причем в эритроцитах хищников количество калия уступает количеству натрия; у овец некоторых линий на ранних стадиях развития преобладание калия в эритроцитах сменяется преобладанием натрия. Эта особенность наследуется согласно правилу Менделя [64]:
Кровь овец, мМ
Кнар NaHap квн Na вн С1вн Объем воды
С^нар
Линия с высокой концентрацией к 4,9 139 121 36,1 0,67 0,69
Линия с низкой концентрацией к 5,0 139 17,3 139 0,70 0,69
Ионы хлора пассивно проникают в эритроциты, а ионы натрия и калия насасываются активно за счет использования энергии гликолиза. Полупериод проницаемости для меченной тритием воды составляет несколько миллисекунд, для хлора — несколько сотен миллисекунд, для натрия и калия — несколько часов [231].
Таблица 2-1
Общий ионный состав тканей и плазмы1
Животное Ткань Na К Са Mg Cl Источник данных
Aplysia Кровь 492 9,7 13,3 49 453 [95]
Мышца 325 47,8 14,7 95,5 378
Bucciniutn Кровь 413 7,7 10,6 42 [95]
Мышца 62,4 82,1 7,8 35,0 121
Астаеа Кровь 432 11,8 10 48,9 497 [246]
Мышца 45,7 162 39,8 22,6 28,8
Caudina Плазма 460 П,8 10,7 50,5 523 [124]
Мышца 191 138 89,0 39,0 122
Mytilus Кровь 490 12,5 573 [19]
Мышца 73 158 56
Ostrea Белые мышцы 274 61,5 12,5 290 [19]
Желтые мышцы 182 102 6,75 165
Sepia Плазма 465 21,9 11,6 57,7 591 [196]
Мышца 67,7 174,7 2,7 22,3 91,4
Loligo Плазма 419 20,6 11,3 51,6 522 [196]
Мышца 78 152 з,о 15,2 91,3
Eledone Плазма 432 14,4 Н,2 54,2 516 [196]
Мышца 91,9 144,5 4,3 22,8 123
Paralithodes Кровь 461 13,5 13 36,9 [142]
Мышца 62 105 9 8
Squilla Плазма 442 15 9,6 21 431 [129]
Мышца 163 87 8,5 21,2 176,7
Carcinus Плазма 468 12,1 35 47,2 524 [205]
Мышца 54 120 5,5 17,5 54
Nephrops Плазма 517 8,6 16,2 10,4 527
Мышца 83,2 166,6 5,2 19,1 109,9
Limulus Плазма 445 11,8 9,7 46 514 [197]
Мышца 126 99 3,7 20 159
Carausius Плазма 20 33,7 6,4 61,8 [233]
Нервный тяж 86,3 556 61,8 10,7
Anodonta Плазма 15,4 0,38 5,3 0,35 10,5 [95]
Мышца 5,2 10,5 5,4 2,5 10,6
Limnaea Кровь 57 1,8 4,9 43,9 [85]
Мышца 37,2 14,7 26,6
Myxine Сыворотка 560 9,5 6,1 18,4 570 [195]
Мышца 122 117 1,8 12,9 107
Угорь (Anguilla, Плазма 155 2,7 106 [204]
в пресной воде) Мышца 30,4 110,1
Muraena Плазма 21,2 1,95 3,9 2,4 188 [194]
Мышца 25 165 9,3 7,4 23,7
Лягушка Плазма 104 2,5 2,0 1,2 74,3 [45а]
Мышца 11,4 126
(23,9) (84,6) (2,5) (Н,3) (Ю,5)
Ящерица Dipso- Плазма 168 3,4 120 [51]
saurus Мышца 44,9 122 30
Утка (Anas) Плазма 138 3,1 2,3 103 [102]
Мышца 21 83,3 13,1
Крыса Плазма 145 9,6 3,6 1,9 116 [31, 39]
(6,2) (3,1) (1,6)
Эритроциты 34 105 1,0 5,4
Мышца желудка 11,0 13,6
12*
180 Глава 2
’’W
Продолжение
Животное Ткань Na К Са Mg Cl Источник данных
Мышца 8,4 185 1,5 11,0
(26,6) (101,4)
Собака Плазма 159 4 3,7 1,7 [31]
Эритроциты 93 5,8 0,14 8,4
Мышца желудка 7,0 19,6 [221}
Человек Плазма 151 4,9 1,9
Эритроциты Мышца 150 0,12 4,7
Кошка Плазма 143 3,2 [45aJ
Эритроциты 104 5,9
1 Концентрация ионов выражена в ммоль/л (плазма) или в ммоль/кг.
В ядрах ооцитов амфибий содержится больше воды, меньше натрия и немного больше калия, чем в цитоплазме. В этих клетках с помощью изотопного анализа выявили наличие двух цитоплазматических фракций (пулов) натрия [32]. Показано, что Tetrahymena удерживает калий и выводит натрий; так, в процессе адаптации культуры этих клеток к среде с высоким содержанием натрия (220 мМ) количество натрия в них вскоре после переноса их в такую среду составляло 105 мэкв, через 2 нед — 43 мэкв, через 22 мес — 21 мэкв. Очевидно, что в этом случае произошел отбор клеток, способных к выведению натрия [58].
Эффективность ионной регуляции у простейших можно проиллюстрировать на примере Tetrahymena [58, 59]:
Na К C1
Среда, мМ Цилиарные клетки, мМ 36,5 12,7 4,7 31,7 28,7 6,4
Высокие концентрации калия и магния (в мкэкв/мг сухого веса) у амеб видны из следующего примера [72]:
К Na Mg Ca Fe
Amoeba proteus Pelomyxa carolinensis 0,376 0,554 0,026 0,021 0,434 0,413 0,127 0,124 0,102 0,031
В тканях многоклеточных организмов концентрацию ионов внутри клеток можно рассчитать, измерив объем межклеточного пространства с помощью веществ, не проникающих в клетки, на
Неорганические ионы
181
пример инулина. На долю межклеточного пространства (как это-было определено с помощью инулина) приходится от 18% до 30% объема ткани. В некоторых тканях, в частности в мышцах, внутриклеточная концентрация хлоридов низка; на кривых вымывания ионов хлора (и иногда натрия) видна начальная фаза, соответствующая перемещению ионов в экстрацеллюлярное пространство. Исходя из результатов анализа состава ткани и измерения или вычисления объема межклеточного пространства, можно определить внутриклеточные концентрации ионов (табл. 2-1).
Таблица 2-2’
Соотношение внутриклеточной и внеклеточной концентраций Na и К в мышцах различных животных [196, 221]
Животное Na_H/Na К-вн^нар
Strongylocentrotus 0,72 14,3
Golfingia 0,17 14,0
Sepia 0,006 8,6
Eledone 0,077 11,6
Loligo 0,03 n,o
Carcinus o,n 9,0
Eriocheir 0,07 18,0
Nephrops 0,16 19,3
Limulus 0,28 8,4
Limnaea 0,65 8,2
Carausius (нервный 4,3 7,4
тяж)
Myxine 0,22 12,3
Muraena 1,2 8,5
Rana 0,15 49
Callus 0,05 20
Rattus 0,02 38
Исследование мышц (и некоторых других тканей) животных разных видов обнаруживает удивительно постоянный уровень калия в клетках, составляющий ПО—160 мМ, в среднем 150 мМ. (табл. 2-2). Уровень натрия варьирует в значительно больших пределах (рис. 2-1). Исключение составляют лишь пресноводные моллюски и простейшие, у которых содержание калия в клетках существенно ниже, чем у остальных животных, и колеблется между 15 и 32 мМ. Калий обладает способностью активировать некоторые ферменты (например, трансферазы) и играет центральную роль в поддержании нормальной возбудимости мембран. Поэтому постоянство внутриклеточной концентрации калия, не зависящей от колебаний общей осмотической концентрации и от изменений среды обитания, представляет собой, по-видимому, эволюционно очень древнюю черту [220, 221]. В целом можно сказать, что растения содержат больше калия, чем натрия, в то время как в организме
182
Глава 2
животных содержание этих элементов почти одинаково. Соответственно пища травоядных животных содержит большое количество калия, а хищники получают больше натрия (чем травоядные). Из сказанного следует сделать некоторые выводы: 1) содержание натрия в тканях не является постоянной величиной; 2) соотноше-
ние. 2-1. Зависимость между концентрацией Na и К внутри клетки и соленостью среды, выраженной в эквивалентах NaCl {221].
Заштрихованная часть соответствует крайним величинам концентраций калия в клетках животных, находящихся в солоноватой воде. I—Na во внешней среде; II—Кв клетках; /// — Na в клетках; IV— К во внешней среде.
ние калия и натрия внутри клеток относительно постоянно и, наконец, 3) внутриклеточная концентрация калия — одна из наиболее постоянных величин в животном, организме.
Беспозвоночные животные, у которых регуляция ионного состава жидкостей тела развита слабо, характеризуются пониженным содержанием натрия и хлора в клетках различных тканей.
Морской еж Strongylocentrotus обладает способностью изменять осмотическую концентрацию клеток кишечника в зависимости эт солености среды. Однако в основе этого процесса лежит изменение концентрации азотистых соединений, в то время как ионный юстав клеток остается относительно постоянным. Нингидринполо-
Неорганические ионы
183
жительные соединения составляют примерно 50% общего количества веществ, растворенных в клетках его кишечника. Эта величина у животного, находящегося в концентрированной морской воде, намного выше, чем у животного, помещенного в разбавленную морскую воду [127].
У различных моллюсков — морских Астаеа, Ostrea и Mytilus, наземных Strophocheilus и пресноводных Anadonta — концентрация калия и кальция внутри клеток выше, а натрия и магния ниже, чем в крови. При этом Mytilus тратят на поддержание градиента концентраций между клетками и кровью в 6 раз больше энергии,, чем Anadonta. С другой стороны, Anadonta тратит энергию на поддержание градиента на границе кровь — среда [174]. Кривые выведения натрия из нервной ткани Anadonta выявляют две фракции натрия. В регуляции осмотической концентрации клеток морские моллюски в большей мере, чем пресноводные, используют органические ионы — аминокислоты и нейтральные азотистые соединения [19].
Ткани головоногих могут иметь различный состав, но они всегда изоосмотичны морской воде. Отношение концентрации ионов внутри клетки (мышца) к концентрации в плазме характеризуется следующими величинами [196]:
Na К Са Mg Cl SO4 Фосфаты
Sepia 0,006 8,6 0,16 0,33 0,076 0,34 115
Eledone 0,077 П,6 0,28 0,32 0,106 0,22 322
В целом 10% общей осмотической концентрации мышц головоногих моллюсков приходится на долю фосфатов, 40% — на долю аминокислот и 15—20%—на долю азотистых оснований [196].
Содержание указанных веществ в мышце, ммоль/кг воды
Внд животных Аминокислоты Триметил-аминоксид Бетаин ci-
Sepia 442 78,8 99 89,3
Loligo 388 117 71
Eledone 279 33,7 99,7 128
В гигантских волокнах нерва кальмара глицериды и миоинозит составляют 13—18% сухого веса. В сухой аксоплазме обнаруживается следующее общее содержание катионов, анионов и нейтральных осмотически активных веществ (в мкэкв/100 г сухого веса) [47]:
184
Глава 2
Катионы Анионы Нейтральные вещества
К 344 С1 140 Глицин 10
Na 65 НРО4 26,6 Аланин 8
Са 7 Изотионат 152 Серин 4
Mg 20 Аспартат 73 Лейцин 2
Аргинин Лизин Орнитин 3,2 2,4 1,8 Глутамат 19,6 Валин-Треонин Пролин Тирозин Гомарин Глицерин Бетаин Таурохолин Миоинозитол 2 2 1 0,7 20,4 82 68 98 i 7
Обращает на себя внимание высокое содержание изотионата, гомарина и бетаина. Играют ли эти соединения иную роль, кроме обеспечения изотоничности и нейтральности внутренней среды, пока неизвестно.
Высокий процент органических соединений по отношению к растворенным в клетке веществам характерен также для морских ракообразных. Так, мышцы омара Nephrops содержат (в мэкв.): Na — 83, К— 176, С1 — ПО; концентрация аминокислот в них равна 405 мМ, триметиламиноксида — 59 мМ, бетаина — 66 мМ. Следовательно, аминокислоты обеспечивают половину общей осмотической концентрации [196].
Вид животного Содержание в мышце
неорганические поны+ органическне фосфаты органические соединения
мМ общее количество растворенных веществ, % мМ общее количество растворенных веществ, %
Круглоротые (Myxine) 491 42 690 58
Костистые рыбы (Мигеле) 308 74 111 28
Млекопитающие (крыса) 273 87 41 13
У миксиновых и акуловых рыб наблюдается более высокая ос-ютическая концентрация крови и тканей, чем у высших позвоноч-ых (табл. 2-1). В мышцах Myxine среди растворенных веществ □держится относительно много органических веществ, особенно
Неорганические ионы
185
анионов; концентрация кальция в ее крови и мышцах очень низка [196].
Выше уже упоминалась существенная роль мочевины и несколько меньшая аминокислот в обеспечении высокой осмотической концентрации мышц у акуловых рыб, а также у лягушек, обитающих в солоноватых водах. Однако у химеровой рыбы Hydro-lagus изоосмотичность сыворотки крови по отношению к морской воде обеспечивается высокой концентрацией NaCl, а не мочевины, как у акуловых [185].
В нервах многих растительноядных насекомых и других животных потенциал покоя определяется высоким отношением Квн/Кнарг а спайк потенциала действия — движением натрия внутрь нервной клетки; в то же время гемолимфа обычно характеризуется высоким содержанием калия и низким натрия; в этих случаях функционирование нерва обеспечивается избирательным и (или) активным транспортом ионов в оболочке нерва (см. гл. 11).
У высших позвоночных центральная нервная система защищена от влияния изменений ионного состава крови. Спинномозговая жидкость содержит меньше белка, чем кровь, ионный состав ее формируется посредством как активного, так и пассивного переноса. Соотношение концентраций ионов в плазме и спинномозговой жидкости у человека следующее [145]: Na — 1,04, К—1,8, С1 — 0,86, Са — 2,1, Mg — 0,84, белки — 300. У Necturus при возрастании количества калия в плазме в 5 раз его количество в спинномозговой жидкости возрастает лишь в 2 раза; при этом глиальные и нервные клетки приспосабливают мембранный потенциал к составу спинномозговой жидкости, в то время как мышечные клетки — к составу плазмы [38]. В нервной системе пиявок глия образует до половины массы нервной системы; концентрация Квн в глии равна 108 мэкв, в нейронах— 138 мэкв [161].
Состав жидкостей тела
Поскольку животные организмы возникли в море, а губки, кишечнополостные и иглокожие и по сей день до некоторой степени используют морскую воду в качестве жидкости тела, можно было бы ожидать соответствия солевого состава жидкостей организма солевому составу морской воды. Высказывалось предположение, что у некоторых животных, в особенности у животных с замкнутой системой кровообращения, ионный состав жидкостей тела имеет сходство с составом морской воды того периода, когда у их далеких предков происходило «замыкание» кровеносной системы. Этой гипотезе, однако, противоречат такие факты, как различия в ионном составе жидкостей у близкородственных животных, регуляция ионного состава, происходящая при изменении условий среды, а также геохимические данные об относительном постоянстве соотношения ионов в морской воде с кембрийского периода. Все же сравне
186
Глава 2
ние морской воды и жидкостей тела морских животных оказывается полезным.
Таблица 2-3
Состав «усредненной» морской воды [4]
ммоль/л г/к г НЮ
Соленость 34,33%о
Содержание хлора 20 °C
19°/оо
Натрий 470,2 10,933
Магний 53,57 1,317
Кальций 10,23 0,414
Калий 9,96 0,394
Стронций 0,156 0,014
Хлориды 548,3 19,657
Сульфаты 28,25 2,744
Бромиды 0,828 0,067
Борат (Н3РО3) 0,431 0,027
Бикарбонат 2,344 0,145
Осмотическая °’557 М NaC1
эквивалентность пп.п Ал
0,949 М сахарозы
«Усредненный» состав морской воды приведен в табл. 2-3. Существуют таблицы для расчета концентраций распространенных ионов при различной солености воды [4, 93]. Показатель концентрации водородных ионов морской воды зависит в основном от соотношения Н2, СОз и НСОз; можно принять, что при 20 °C и в условиях уравновешивания воды с воздухом pH морской воды будет 8,16.
Ионный состав внеклеточных жидкостей тела зависит от условий среды обитания, питания и физиологического состояния животного. Выборочные данные относительно концентрации ионов в крови (плазме) и целомической жидкости представлены в табл. 2-4.
Если предположить, что у морских животных разница между концентрацией ионов в жидкостях тела и в морской воде обусловлена связыванием ионов белками, то состав жидкостей до и после диализа против морской воды должен быть одинаков. Действительно, в жидкостях с высоким содержанием белка связывание белками кальция игра'ет существенную роль. Однако у всех морских животных диализ настолько выравнивает состав морской воды и диализируемых жидкостей, что в целом роль белков в регулировании ионного состава можно признать незначительной.
Морские беспозвоночные. Среди морских животных в наимень- шей степени регуляция ионного состава выражена у иглокожих. ’ Концентрация ионов калия в их целомической жидкости немного, ] а ионов водорода значительно выше, чем в морской воде. / -
Таблица 2-4
Концентрации некоторых ионов в жидкостях тела. Данные о концентрации ионов в крови позвоночных относятся к плазме
Содержание элементов, ммоль на I л крови Содер- Источ-
жание
^Животное белка, НИК
Na К Са Mg С1 so4 мг/мл данных
Морские беспозвоночные Кишечнополостные
Aurelia1 454 10,2 9,7 51,0 554 14,58 0,4
Морская вода Иглокожие 459 9,8 10,1 52,5 538 26,55
Strongylocentrotus, це- 452 14 10,1 50,9 511 [1271
ломическая жидкость
Морская вода 458 9,5 10 51,1 519
Echinus 444 9,6 9,9 50,2 522 34,0 [192J
Asterias [91
Периваскулярная жид- 428 9,5 И,7 49,2 487 26,7
кость
Амбулакральная жид- 418 15,1 9,7 50,3 481 25,5
кость
Морская вода 429 9,5 10,8 49 494 25,4
Holoturia1 489 10,7 11,0 58,5 573 28,4 0,7
Marthasterias Сипункулиды 459 10,8 Ю,1 51,2 540 26,5 0,6 [192]
Golfungia1 Кольчатые черви 508 11,5 Н,2 38,8 561 26,8 0,9 [192J
Aphrodite 456 12,3 Ю,1 51,7 538 26,5 0,9 [ 192 J
Arenicola Моллюски 459 Ю,1 10,0 52,4 537 24,4 0,2 [1921
Mytilus1 502 12,5 12,5 55,6 585 29,4 1,5 [1741
Ostrea 544 14,7 10,9
Strombus (переднежа- 496 10,9 11,0 58 558 20,5 [1331
берные), гемолимфа Морская вода 457 10,1 10,3 54 554 28,6
Scutus, гемолимфа 491 н,з П,9 49 17,4 0,98 [2351
Морская вода 487 10,9 П,6 48 17,8
Aplysia, гемолимфа 492 9,7 13,3 49 543 28,2 [951
Sepia1 460 23,7 10,7 56,9 589 4,7 109,0 [1921
Sepia, гемолимфа 465 21,9 П,6 57,7 591 6,3 [196J
Морская вода 492 10,5 10,8 56,1 575 29,6
Eledone, гемолимфа 432 14,4 П,2 54,2 516 20,6 ’ [1961
Морская вода 438 9,3 9,6 50 512 26,4
Loligo 419 20,6 11,3 51,6 522 6,9 [196J
Octopus 371 10,3 8,2 447 18,0 [178J
Морская вода Ракообразные 407 9,1 8,9 475 24,5
Palinurus1 545 10,3 13,4 16,6 557 20,5 [1931
Palaemon 394 7,7 12,6 12,6 430 2,6 [ 166[
Squilla, гемолимфа 442 15 19,2 42 431 [1291
Nephrops, гемолимфа 517 8,6 16,2 10,4 527 18,7 [1931
Морская вода 457 9,8 Ю,1 52,2 535 27,5
Lithodes 476 12,8 12,3 52,2 536 24,7 [1931
Homarus 472 10 15,5 6,8 470
Maj а1 500 12,7 13,9 45,2 469 14,3 [ 192J
Carcinus 468 12,1 17,5 23,6 524 [2051
Продолжение
Животное Содержание элементов, ммоль на 1 л крови Содержание белка, мг/мл Источник данных
Na К Са Mg Cl SO4
Pachygrapsus 465 12,1 П,4 29,2 [179]
Carcinus 525 12,7 14,3 21,2 502 [190]
Gecarcinus ) 459 9,3 20,9 13,5 [89]
Coenobita / Hd uecRe 465 10,5 14,7 30,9 [89]
Ocypode 449 7,0 15 28,6 475 24,1 56 [77]
Eriocheir, сыворотка 407 8,8 12,2 12,1 398 8,2 [50]
Limulus, сыворотка 445 11,8 9,9 46 514 14,1 [197]
Морская вода 440 49,4 9,7 50,2 514 26,5
Paralithodes, гемолим- 461 13,5 13 36,9 577 [142]
фа
Морская вода 452 12,1 52 494
Pandalus, гемолимфа 395 7,4 12,3 5,8 466 [142]
Морская вода 380 7,8 9,3 52 493
Chinoectes, гемолимфа 403 И,1 8,1 495 [142]
Морская вода 420 11,4 10,4 482
Беспозвоночные пресных
вод и влажной среды
обитания
Моллюски
Anodonta 13,9 0,28 11,0 0,31 12 (pH 7,5) 3,0
Пресная вода 0,48 0,059 2,7 0,375
Anodonta 15,55 0,487 8,4 0,19 И,7 0,73 [174]
Viriparus 34 1,2 5,7 1 31 [132]
Пресноводная среда 2,5 0,2 3,0 8
Otala 70,7 3,4 7,1 5,7 [26]
Helix pomatia 5,1 3,7 10,0 12,6 [25]
Helix aspersa 67,9 2,86 6,2 3,6 [28]
Arion 61,5 2,7 2,3 5,7 52,5 [191]
Arion 60 2,7 6,9 5,4 [28]
Limnaea 57 1,8 4,9 43,9 [85]
Кольчатые черви
Lumbricus, цело ми че- 75,6 4,0 2,9 42,8 [14]
ская жидкость
Lumbricus, кровь 85,7 5,5 8,3 39,9 [14]
Lumbricus, целомиче- 83,2 12,4 46 [183]
ская жидкость
Lumbricus, кровь 105 8,9 43 [183]
Hirudo, кровь 125 4 36 [15]
Heliodrilus, целомиче- 78,6 5,8 3,6 35,6 [H4J
ская жидкость
кровь 88,5 7,9 13,4 35,9
Pheretima, кровь 42,8 6,7 3,6 54,3 0,13 [49]
Glossoscolex, кровь 74,5 8,4 2,3 78,7 0,14 [49]
Круглые черви, Ascaris 129 24,6 5,9 4,9 52,7 [96]
Ракообразные
Cambarus 146 3,9 8,1 4,3 139
Пресная вода 0,65 0,01 2,0 0,21 0,48
Asellus 137 7,4 125 [134]
Triops 74 4,5 1,7 0,9 56,2 [104]
-Pacifastacus 195 4,9 12,6 180 [П7]
Paratelphusa 330 6,8 7,8 7,8 255 [181]
Продолжение
Животное Содержание элементов, ммоль на 1 л крови Содержание белка, мг/мл Источник данных
Na К Са Mg Cl SO4
Насекомые 1
Aeschna (личинка) 145 9 3,8 3,6 ПО [224]
Aedes (личинка) 100 4,2 51,3 [222]
Chironomus (личинка) 104 2,1 10 15
Dytiscus 115 20 52 [224]
Наземные беспозвоночные
Насекомые
Diapherma 4,8 15,5 7,5 88,8 69,2
Carausius 13,3 15,4 8,6 86,1 68,6 [248]
Carausius 20,1 33,4 6,4 61,8 [233]
Carausius 15 18 7,5 53 101 [260]
Carausius 21 25 (10|
Dixippus 8,7 27,5 8,1 72,5 93 [182]
Locusta 60 12 17 25 [56а]
Periplaneta 161 7,9 4,0 5,6 144
Calliphora 140 26 21 34 [56а]
Gastrophilus (личинка) 175 11,5 2,8 15,9 14,9
Ephestia 33 33 41 51 [56а]
Sarnia (куколка) 2,6 42 9,4 32,5 [56а]
Bombyx 14 46 24 81 [56а]
Apis 11 31 18 21 [56а]
Antherea 12 30 7 49 [247]
Leptinotarsa 3,5 55 47 188 [56а]
Паукообразные
Скорпион 210 1,4 6,1 266 [164]
Скорпион 262 7,9 2,4 270 [18]
Capiennis 258 6,8 8,0 258 [137а]
Морские рыбы2
Круглоротые
Myxine 558 9,6 6,25 19,4 576 6,6 [194]
Myxine 533 8,3 567 [75]
Polistotrema 450 500 [194]
Акуловые рыбы
Narcine 134 7 12 3 159 [202а]
Rhinobatus 143 12,8 7,3 2 144 [202а]
Dasyatis 238 17 8 3 238 Мочеви- 41,2 [5]
на 1064
Целокантовые
Latimeria 181 51,3 6,9 28,7 199 Мочеви- [171]
на 355
Костистые рыбы
Lophius 185—200 5 6 5 153 [22J
Corregonus 141 2,8 2,7 1,7 117 2,29 41,9 [192]
Скумбрия 188 9,8 167
Барракуда 215 6,4 189
Hemilepidotus 184 5,6 2,8 2,5 170 [179а]
Myoxocephalus 194 4,3 3,0 2,4 177 [179а]
Пресноводные рыбы
Круглоротые
Lampetra 116,4 7,5 95,1 2,7 36
190
Глава 2
Продолжение
Животное Содержание элементов, ммоль на 1 л крови Содержание белка, мг/мл Источник данных
Na К Са Mg С1 so4
Petromyzon (личинка) 103 3,4 2,4 1,6 91 123]
Petromyzon (взросл) Акуловые 139 6,2 6,5 2,4 1,9 113 [23]
Prist is 217 8,3 1,7 193 37 [227}
Carcharhinus 246 6,4 8,9 3,2 219 30 [228]
Potamotrygon Костистые 150 5,9 3,6 1,7 149 18 [227]
Salmo 149 5,1 140,5
Salmo 144 6,0 5,3 151 [73]
Oncorhynchus 147 8,6 3,4 117 [150]
Oncorhynchus 176 з,о 3,4 0,6 172 [167}
Cyprinus 130 2,9 2,1 125 [106]
Carassius Земноводные 163 3,1 122 [179а]
Necturus 99 2
Лягушка Пресмыкающиеся и пти- 104 2,5 2,0 1,2 74,3 1,9 [91]
цы ar anus
летом 181 3,4 3,2 1,1 148
зимой 131 4,3 3,6 1,8 135
аллигатор 141 3,8 2,1 1,4 112 51,7 [40]
Dipsosaurus 168 3,4 120 [151F
Anas 3,1 2,3 103 [102]
Callus Млекопитающие 154 6,0 5,6 2,3 122
Т ursips 166 4,2 2,2 0,92 116 75 [149]
Лошадь 150 з.о 5,5 0,9 100 75 [149}
Собака 147 4,5 10 1,8 108 70 [149]
Собака 150 4,4 5,3 1,8 2,0 58 [45а]
Крыса 152 3,7 2,6 1,1 114- [16]
Крыса 145 6,2 3,1 1,6 116 59
Человек 147 6,3 2,6 1,1 109 75
1 Концентрация выражена в ммоль элемента на 1 л воды.
2 Данные, касающиеся концентрации ионов в крови позвоночных, относятся к плазме.
У морских звезд Asterias концентрация калия в амбулакральной системе выше, чем в перивисцеральной жидкости; для последней характерно повышенное по сравнению с морской водой содержание кальция [9]. Мезоглея кишечнополостного животного медузы состоит в основном из внеклеточной жидкости и отличается от морской воды содержанием большего количества калия и меньшего SOI. Благодаря низкому содержанию сульфатов (40—85% имеющихся в морской воде) медузы имеют низкий удельный вес, что обеспечивает их плавучесть. Ионы SO4 могут образовываться в клетках, выстилающих гастроваскулярную полость медуз [141]. В жидкости тела сипункулид концентрация ионов калия выше,
Иеорганические ионы
191
а ионов магния и SO4 ниже, чем в морской воде (табл. 2-4). Интересно, что некоторые представители этих червей характеризуются крайне низкой проницаемостью по отношению к солям и могут в течение нескольких часов вести себя как полупроницаемая система (см. гл. 1).
Переднежаберные брюхоногие моллюски относятся к пойкило-осмотическим животным и не могут существовать при разведении морской воды ниже 85%. Концентрация ионов калия и магния в них выше, чем в морской воде [235]. Nereis diversicolor приспосабливают свою осмотическую концентрацию к осмотической концентрации среды (осмоконформизм), но при всех значениях солености соотношение натрия и хлора в их целомической жидкости остается равным существующему в окружающей среде [161а].
У морских пластинчатожаберных моллюсков концентрация калия и кальция в крови выше, чем в морской воде. У брюхоногих отмечается относительно высокое содержание ионов калия и низкое SO4; в жидкостях тела головоногих содержится мало ионов SO4, много ионов калия и необычно много ионов NH4 [36]. У по-лихет обнаруживается повышенная концентрация калия. Асцидиям свойствен низкий уровень сульфатов в крови. Для сипункулид, моллюсков и большинства полихет характерен осмоконформизм, однако у них есть хорошо развитые органы выделения, которые в первую очередь участвуют в их ограниченной ионной регуляции (см. гл. 1). Это позволяет предположить, что органы выделения возникли первоначально как приспособление для ионной регуляции.
У морских членистоногих способность к ионной регуляции варьирует от вида к виду (табл. 2-4). В то время как у большинства видов происходит накопление калия, у некоторых из них, например Homarus, его содержание так же низко, как и в морской воде. Уровень магния и сульфата у морских членистоногих ниже, чем в морской воде. В крови ракообразных, ведущих весьма активный образ жизни, — Carcinus, Portunas, Pachygrapsus, Nephrops и Palaemon — обнаруживается низкое содержание магния (14—18% имеющегося в морской воде); у менее подвижных ракообразных — Maja, Hyas — магний содержится в более высокой концентрации [193]. Большинство морских ракообразных содержит кальция больше, чем морская вода, a Homarus замечателен тем, что в его крови содержится больше кальция, чем калия. Ракообразные, помещенные в солоноватую воду, поддерживают примерно такое же соотношение ионов в крови, какое отмечалось у них в морской воде; уровень кальция у них довольно высок, но зависит от стадии личиночного цикла.
Пресноводные беспозвоночные. Само собой разумеется, что концентрация ионов в жидкостях тела всех пресноводных животных и в окружающей их среде различна. Наиболее высокая концентрация ионов свойственна пресноводным ракообразным; напротив,
192
Неорганические ионы
пресноводные моллюски и кишечнополостные относятся к категории самых «разбавленных» многоклеточных животных. Однако содержание кальция в обеих группах поддерживается на одинаковом уровне.
Насекомые. Ни в одной другой группе животных нет такого разнообразия ионного состава крови, какое характерно для гемолимфы насекомых. Особенно это относится к содержанию калия и натрия. Проблема защиты нервной системы от воздействия высоких концентраций калия и низких — натрия, свойственных гемолимфе, обсуждается в данной главе. Некоторые насекомые с высоким содержанием калия в гемолимфе имеют относительно низкое содержание магния. Отношение Ca/Mg возрастает в следующем порядке: травоядные<всеядные<хищные<кровососущие; pH крови многих насекомых находится в пределах 6,4—6,8. В гемолимфе насекомых обнаруживается тенденция к поддержанию высокого уровня содержания аминокислот и низкого — ионов хлора.
Позвоночные. Относительное содержание различных ионов в крови у позвоночных варьирует в меньшей степени, чем у беспозвоночных (табл. 2-4). Уровень магния в крови позвоночных низок, а отношение (Na-|-K)/(Ca-|-Mg) выше, чем в жидкостях тела беспозвоночных. Морские позвоночные способны регулировать содержание каждого иона. Миксина изоосмотична морской воде; хотя осмотическая концентрация у этих рыб на 88% создается хлористым натрием, все же они могут регулировать концентрации всех ионов. Пресноводные миноги в отношении ионной регуляции похожи на пресноводных костистых рыб. Морские костистые рыбы содержат обычно больше ионов магния и кальция, чем пресноводные. Акуловые рыбы по своему ионному составу близки к костистым, но отличаются от них высокими концентрациями мочевины (см. гл. 1). Кистеперая рыба Latimeria содержит много магния и мочевины [171].
Зависимость ионной регуляции от условий среды и от жизненного цикла
У ракообразных концентрация кальция в гемолимфе зависит от стадии личиночного цикла. Перед линькой кальций накапливается в гепатопанкреасе; содержание его в крови при этом находится также на высоком уровне. У Homarus, например, концентрация кальция в плазме перед линькой составляет 40 мМ, а после линьки—ИЗ мМ; содержание кальция в гепатопакреасе составляет (в мг/г сухого веса) в начале стадии предлиньки — 85, в конце стадии предлиньки — 285, сразу после линьки — 326 и в период между линьками — от 65 до 95. Перед линькой в гепатопанкреасе накапливаются также магний и фосфаты [80]. У Carcinus по мере приближения линьки уровень кальция в крови возрастает со 126
Неорганические ионы
193
до 164% по отношению к его количеству в морской воде; содержание магния увеличивается с 37,1 до 55,5%. После линьки происходит насасывание воды в количестве, достигающем 66% веса тела до линьки [193]. У Pachygrapsus в стадии мягкого панциря интенсивность обмена натрия увеличивается в 4 раза по сравнению с его уровнем, наблюдаемым между линьками [202].
Как упоминалось выше (см. гл. 1), эвригалинные ракообразные при переходе к обитанию в разведенной морской воде начинают активно поглощать ионы, причем в количестве, пропорциональном концентрации натрия в крови. Carcinus интересен тем, что при уменьшении внутренней концентрации натрия до 400 мМ у него резко возрастает потребление этого иона; снижение уровня Na на 10—30 мМ вызывает 13-кратное увеличение его поглощения [205]. У эвригалинного Gammarus duebeni процесс потребления натрия достигает уровня насыщения при наружной его концентрации, равной 10 мМ, в то время как у Eriocheir кривая транспорта натрия достигает 50% насыщения при наружной концентрации иона, равной 1 мМ, у Astacus — 0,25 мМ, у пресноводного Gammarus pulex — 0,15 мМ [159, 225]. Потребление натрия в пресной воде уменьшается при добавлении 2—10 мкМ кальция.
При сравнении пресноводного плоского червя Dugesia с морским Bdelloura обнаружилось, что обмен натрия и калия у последнего протекает намного интенсивнее; так, скорости выхода обоих ионов составляли (в пМ/(см2-с)) [219]:
Na К
Bdelloura Dugesia 14,5 0,006 1,26 0,015
Если поместить морское животное в разбавленную или в искусственную морскую воду с измененным содержанием некоторых ионов, то у него возникают диспропорциональные изменения концентрации различных ионов. Например, у голотурии Caudina chi-lensis, помещенной в искусственную морскую воду, соотношение ионов в которой было изменено, состав целомической жидкости через пять дней полностью соответствовал новой среде [124]. Содержание калия у нее увеличилось в 3 раза, кальция — в 2,5 раза, концентрации же хлора, натрия и SO4 снизились. С другой стороны, если Golfingia поместить в среду с увеличенным содержанием ионов калия и хлора, то содержание хлора в мышцах этого животного возрастет в большей степени, чем содержание калия. У Carcinus, перенесенного в морскую воду, разбавленную на 1/3, концентрация всех ионов уменьшается; однако содержание магния и сульфатов при этом уменьшается в большей степени, чем содержание натрия, калия и хлора. В результате отношение количества
13—1332
194
Глава 2
поглощаемых ионов к количеству выделяемых (вход/выход) для магния и сульфатов уменьшается, тогда как для других ионов это отношение растет [243]. При переносе Eriocheir из пресной воды в соленую содержание натрия и хлора в жидкостях тела этого животного возрастало в большей степени, чем содержание калия и кальция. Наконец, у Pachygrapsus и Еса в гиперосмотической морской воде концентрация магния в сыворотке увеличивалась в большей степени, чем концентрация натрия и калия. Можно сделать вывод, что при изменении солености воды содержание магния и сульфатов в крови претерпевает значительные изменения, тогда как уровень натрия, калия и хлора регулируется более строго.
У позвоночных соотношения различных ионов более постоянны, чем у животных с незамкнутыми циркуляторными системами. Все же у эвригалинных рыб при переходе из пресной воды в морскую происходят некоторые изменения в ионном составе:
Na в плазме, мэкв Na в среде, мл/100 г
Угорь
в морской воде 139 32
в пресной воде 122 24
Камбала
в морской воде 34
в пресной воде 32
В плазме кижуча Oncorhynchus kisutch при его миграции из рек в море происходит временное увеличение уровня натрия и магния. Рыба начинает потреблять воду после 12 ч пребывания в морской воде, через 24 ч у нее отмечается повышенная экскреция двухвалентных ионов, а через 36 ч концентрация всех ионов в крови достигает постоянного уровня, несколько превышающего исходный [150]. Однако при этом концентрация ионов хлора в плазме возрастает в меньшей степени, чем концентрация ионов натрия; следовательно, повышается доля органических ионов в ионном балансе [167]. Подобным же образом у угрей, перенесенных из пресной воды в морскую, концентрация натрия и хлоридов в плазме возрастает, а концентрация калия практически не меняется.
Жабры угря обладают способностью в морской воде выделять NaCl, а в пресной поглощать его. При этом в жабрах имеются 2 системы кровотока: одни сосуды, пронизывающие жаберные пластинки, расширяются под действием адреналина и недостатка кислорода, тогда как другие открываются под действием ацетилхолина; этот второй путь (шунт) не зависит от уровня газообмена, так как его основная функция — участие в обмене ионов [121а].
При понижении температуры среды у пресноводных рыб происходит небольшое уменьшение концентрации ионов в сыворотке
Неорганические ионы
195
крови; У морских рыб, наоборот, в тех же условиях концентрации ионов’ возрастают. Примером могут служить следующие данные, полученные при исследовании 'пресноводной рыбы Fundulus [237]:
Температура, СС Na, мМ Ci, мМ
0,1 114 76
4,0 127 85,5
11,0 162 130
У акулы Sqitaliis, обитающей в морской воде, градиент ионов направлен внутрь и практически все потребление ионов происходит через жабры, причем скорость транспорта составляет 0,9—1,0 мМ Иа/(кг-ч) [24, 105].
У амфибий, помещенных в разбавленный солевой раствор, концентрация натрия в плазме возрастает в несравненно большей степени, чем концентрация калия, как это видно на примере Rana esculenta [146]:
Rana esculenta В пресной воде В 0,8% NaCl В растворе Рингера
Na К моем Na К моем Na К моем
Плазма, мМ 92 2,7 210 119 2,9 260 105 2,8 249
Моча, мМ 4,6 1,6 25,9 56 1,2 168 39 2,0 ИЗ
Изменения концентрации ионов в крови происходят также при спячке. У ящериц Varanus во время зимней спячки содержание магния возрастает на 55% по сравнению с периодом активности [91]. Повышение магния в крови во время спячки имеет место также у млекопитающих (ежей, сурков, летучих мышей) [188].
У млекопитающих и птиц наблюдается стремление активно регулировать потребление солей с водой и пищей в зависимости от существующего в их крови уровня ионов. Так, тропические птицы отличают 0,05 М раствор NaCl (но не 0,03 М) от воды [29]. Животные, испытывающие дефицит натрия в организме, обычно с особенным аппетитом поедают соль. Обезвоженные крысы предпочитают пить воду, а не солевой раствор, хотя в норме они предпочитают изоосмотический солевой раствор. Овцы, у которых с помощью фистулы паротидной железы создавали дефицит NaHCO3, потребляли повышенное количество натриевой соли. Все это означает, что центральные рецепторы вместе со вкусовыми координируют выбор пищи, благодаря чему регулируется уровень ионов в крови [51].
У некоторых насекомых обнаруживается зависимость между концентрацией ионов в крови, с одной стороны, и жизненным цик
13*
196
Глава 2
лом, а также характером питания — с другой. В крови гусениц некоторых чешуекрылых содержится больше магния и хлора и меньше калия и фосфатов, чем в крови их куколок. При кормлении таракана молочным порошком уровень кальция в его крови оказывается выше, а уровень калия — ниже, чем при кормлении зерном пшеницы или латуком [170]:
Диета Na К Са
Латук 119 28 6,2
Зерно пшеницы 183 30 5,9
Молочный порошок 122 21 8,7
С другой стороны, при изучении целого ряда водных насекомых корреляции между характером их питания и отношением Na/K в гемолимфе обнаружено не было [224].
Среди насекомых отношение Na/K в гемолимфе было самым высоким (от 11 до 27) у кровососущих видов, умеренно высоким (от 1 до 18) —у хищных видов и низким (менее 1) —у травоядных. В жидкостях тела шелковичного червя натрий содержится примерно в той же концентрации, что и в листьях тутового дерева, которыми червь питается; однако по мере превращения его в куколку происходит практически полная потеря натрия; ткани куколки шелковичного червя содержат много калия и ничтожные количества натрия. Таким образом, у насекомых концентрация ионов в крови определяется как генетическими, так и пищевыми факторами.
Выделение
Экскреторный орган осуществляет реабсорбцию веществ, выделенных путем фильтрации в концентрации, равной их концентрации в крови; благодаря этому процесс реабсорбции требует существенно меньших затрат энергии, чем потребовал бы процесс поглощения вещества из более разбавленного раствора. Неиспользуемые ионы, попадающие внутрь путем диффузии или с пищей, могут концентрироваться в экскреторной жидкости. Почки развились у тех морских животных, которые, будучи изоосмотичными со средой, способны при этом регулировать свой ионный состав. У кишечнополостных и иглокожих отсутствуют специальные экскреторные органы и способность к ионной регуляции минимальна. Вполне вероятно, что у кольчатых червей, моллюсков и членистоногих почки возникли как органы ионной регуляции; после миграции в пресную воду почки берут на себя функцию осмотической регуляции (регуляции содержания воды в организме). Однако у некоторых ракообразных (например, у Eriocheir в пресной воде) поч
Неорганические ионы
197
ки выделяют изоосмотическую мочу, т. е. экскретируют не только соль, но и воду; поступление воды в организм происходит осмотическим путем. У рыб почки первоначально участвовали в регуляции содержания воды; однако после миграции в море выявилась недостаточная эффективность почек позвоночных в осуществлении ионной регуляции, что привело к развитию внепочечных путей регуляции концентраций ионов натрия и хлора; в то же время регуляция содержания магния и сульфатов осталась функцией почек. Способность экскреторных органов к выведению азотистых шлаков представляет собой очень позднюю стадию развития выделительной функции. Прямого эволюционного перехода от сократительной вакуоли, нефридия, антеннальной железы и пламенных клеток к гломерулярным почечным структурам проследить не удается. Однако на основных процессах фильтрации, реабсорбции и секреции построена деятельность почек самых различных типов, а наличие процессов фильтрации — реабсорбции настолько широко распространено, что не позволяет делать выводы об экологии предков той или иной группы животных.
Данные об активном выделении определенных ионов можно получить, измерив соотношение концентраций ионов в моче и плазме (отношение моча/плазма); некоторые выборочные данные приведены в табл. 2-5. Зависимость этого отношения от природы ионов свидетельствует о том, что каждый конкретный ион контролируется особо. Отношение моча/плазма меньше 1 указывает на реабсорбцию иона из фильтрата; отношение моча/плазма, превышающее 1, означает, что имеет место либо реабсорбция воды, либо выведение иона из организма. Хотя это отношение и подвержено значительным колебаниям, связанным с условиями питания и жизненным циклом, оно все же служит критерием эффективности деятельности почек в регуляции солевого баланса. Для изменения степени реабсорбции воды используют инулин — вещество, которое хорошо фильтруется, но не реабсорбируется, вследствие чего концентрация инулина в моче может служить мерой реабсорбции воды.
У морских ракообразных почки (антеннальная железа) удерживают калий и кальций и выводят магний и сульфаты. При выдерживании Pachygrapsus и Uca в гиперосмотической морской воде концентрации магния и сульфатов в их моче возрастают в значительно большей степени, чем концентрации калия, кальция и хлора, а выделение натрия заметно падает. Этот пример демонстрирует роль внепочечных путей выделения (жабры, кишечник), особенно в регуляции натрия. Некоторые красители, введенные омару с помощью инъекции, обнаруживаются позже в его желудке, откуда они затем выводятся; в целом роль желудочно-кишечного тракта в процессах выделения у ракообразных остается неясной [89, 179].
Если крабов, в разной степени адаптированных к наземному образу жизни, поместить в воду повышенной солености, у них
Таблица 2-5
Процессы выделения: отношение концентраций ионов в моче к их концентрациям в плазме (М/П)
Животное Na К Са Mg Cl so4 Источник данных
Морские животные
Беспозвоночные
Животные со слабой осмоти-
ческой регуляцией S trombus 0,96 1,22 1,4 1,0 1,0 1,06 [1331
Octopus 0,98 1,3 0,53 0,9 1,8 [178]
Sepia 0,79 0,5 0,7 0,68 1,0 2,15 [192]
Homarus 0,99 0,91 0,64 1,8 1,0 1,59 [192]
Nephrops 0,98 0,83 0,81 1,3 1,0 1,1 2,14 [192]
Maja Животные с гиперосмотиче- 0,99 0,98 0,99 1,1 0,98 (1921
ской регуляцией Carcinus 0,95 0,78 0,94 3,9 0,98 2,24 [243J
Carcinus 0,92 0,98 1,2 4,2 1,02 [190]
Pachygrapsus 0,78 0,82 1,17 13,6 [90]
Uca 0,65 1,87 0,64 5,32 [881
Hemigrapsus 1,14 1,69 1,31 2,43 [88]
Gecarcinus, MB1 1,08 1,19 0,35 3,08 [891
ПВ2 1,06 1,03 1,01 2,43
Ocypode 0,85 1,4 0,8 1,13 0,92 0,79 [77]
Eriocheir, MB 1,15 0,93 2,17 1,14 5,6 [50]
Eriocheir, MB 0,95 1,3 0,70 3,9 0,97 [50]
Рыбы
Круглоротые Myxine Костистые 0,95 0,89 1,6 1,13 1,02 2,2 [152]
Hydrolagus 0,54 2,3 3,9 8,7 0,87 50,6 [1851
Sy gnat us 0,41 0,24 0,85 10,75 1,70
Lophius 0,94 0,4 1,0—3,3 62 1,1 [22]
Угорь (Anguilla), MB 0,11 0,75 3,6 26,3 0,77 [204]
Muraena 0,58 0,12 1,75 [204]
Пресноводные животные
Беспозвоночные
Eriocheir, ПВ 1,39 0,47 0,22 0,95 0,97 [501
ПВ 1,07 1,14 0,42 0,49 1,05
Речной рак, ПВ 0,092 0,176 0,082 [1891
Речной рак, ПВ 0,46 0,14 0,09 0,45 [151
Пиявка 0,04
Рыбы
Угорь (Anguilla), ПВ 0,042 0,24 0,25 0,067 [204]
Salmo 0,065 0,2 1 /з]
Salmo Молодь, «скатывающаяся» 0,09 1,45 0,087 [103]
в море Молодь перед «скатывани- 0,62 1,49 0,06
ем» в море
Неорганические ионы
199
Продолжение
Животное Na К Са Mg Cl SO4 Источник данных
Пресноводные и наземные животные
Rana Ambystoma Alligator Anas Человек 0,05 0,055 0,0004 0,062 1,16 0,6 0,11 o.i 12 7,5 0,006 0,52 1,87 0,01 2,4 0,018 0,0005 0,10 1,63 [146J [521 [40] [102]
1 В морской воде.
2 В пресной воде.
произойдет пропорциональное степени адаптации уменьшение отношения моча/плазма для натрия и увеличение этого отношения для магния. У Pachigrapsus, например, отношение моча/плазма для инулина составляло 1,11 в обычной морской воде и 1,16 в 158%-ной; отношение моча/плазма для магния увеличилось с 8,7 в обычной морской воде до 13,3 в 158 %-ной [90]. Создается впечатление, что при повышенной солености воды часть кальция и натрия реабсорбируется, тогда как магний выделяется с мочой без реабсорбции. Основным фактором, обусловливающим такую реакцию, служит, по-видимому, соленость воды, а не повышение концентрации магния в ней. У Carcinus после четырех дней содержания его во влажной атмосфере моча/плазма для магния увеличивается с 4,5 до 10 [190]. У Hemigrapsus наличие специальной регуляции ионов магния также обеспечивает возможность секрети-рования этого иона [48]. Самое большое увеличение магния в моче в условиях повышенной осмотической концентрации среды отмечено у грапсоидов и подобных им крабов, которым свойственно проводить значительную часть времени в воздушной среде. Однако у сухопутного краба Gecarcinus отношение моча/плазма для магния в морской воде составляет всего 1,74 и не увеличивается в солевой среде повышенной концентрации; низкое отношение моча/плазма для магния обнаружено также у Ocypode [77]. Таким образом, гипоосмотическая регуляция, сохранение магния и наземный образ жизни являются независимыми функциями, и здесь имеют место большие видовые различия.
Выше (см. гл. 1) уже приводились доказательства наличия процессов фильтрации и реабсорбции в трубочках пресноводного рака. Отношение моча/плазма для инулина возрастает при переходе от целомического мешка к дистальным трубочкам с 1,2 до 1,8; концентрация калия при этом увеличивается с 7,4 до 11,2 мМ. Эти сдвиги указывают на реабсорбцию воды. Концентрация натрия уменьшается с 242 до 183 мМ; следовательно, ионы натрия и
200
Глава 2
хлора также реабсорбируются. В мочевом пузыре происходит всасывание натрия и калия [189].
У моллюсков моча образуется, по-видимому, таким образом: сначала происходит фильтрация через стенки сердца в перикард, затем жидкость попадает в почки, где уже происходят реабсорбция и выделение. Скорость образования мочи у морского брюхоногого моллюска Strombus составляет 3 мл/(кг-ч); состав его перикардиальной жидкости отличается от гемолимфы большим содержанием калия и меньшим кальция и белка; выведение сульфатов происходит экстраренальным путем [133]. У пресноводного моллюска Vivaparus скорость образования мочи составляет 15— 50 мл/(кг-ч), причем эта скорость тем выше, чем выше кровяное давление, перикардиальная жидкость представляет собой более концентрированный раствор, чем выделяемая моча, что указывает на реабсорбцию солей в почках [132]. У наземного брюхоногого моллюска Achatina отношение моча/плазма для инулина составляет 2,8; при отравлении его динитрофенолом это отношение становится равным 1,0; следовательно, в нормальных условиях происходит обратное всасывание воды. Реабсорбции подвергаются также глюкоза и хлориды; феноловый красный и п-аминогиппуровая кислота (ПАГ) выделяются с мочой [1446]. Подобным же образом выделительная система моллюска «морское ухо» (Haliotis) способна к фильтрации инулина и секретированию альфа-аминогип-пурата [92]. У Octopus фильтрация происходит в жаберных сердцах, тогда как почки выделяют калий, медь, цинк, SO4, NH4, ПАГ и красители. Интенсивность фильтрации из жаберных сердец пропорциональна разнице между систолическим и диастолическим давлением при условии, что эта разница не ниже 4 см вод. ст. — давления, которое уравновешивает коллоидно-осмотическое давление крови, находящееся в пределах 4,3—5 см. вод. ст. [178].
У кольчатых червей имеются нефридии, в которые через цилиарный нефростом попадает целомическая жидкость. Функция нефридиев у дождевого червя и пиявок обсуждалась в главе 1. Ниже приводятся некоторые величины, характеризующие выделительную функцию у двух кольчатых червей [14, 15]:
Lumbricus Целомическая жидкость Моча
Органические катионы, моем С1, мМ NH4, мМ Мочевина, мМ 182 34 46 3,5 0,0012 0,0019 0,00099 0,0012
Н irudo Кровь Моча
Органические катионы, моем Na, мМ К, мМ С1, мМ 202 15 125 6 4 36 6
Неорганические ионы
201
Морские кольчатые черви имеют хорошо развитые нефридии, однако они приспосабливают свою осмотическую концентрацию к осмотической концентрации среды и только в ограниченных пределах способны к ионной регуляции. Механизм регуляции ионного состава с помощью нефридиев еще мало исследован.
Обобщенная схема строения нефрона млекопитающих описана в главе 1. Там же обсужден процесс образования гипоосмотической мочи в нефроне и образование в нем гиперосмотической мочи. Роль почек в регуляции ионного состава позвоночных животных может быть показана на примере морской миксины (Myxine). У этого круглоротого содержание хлоридов в моче и крови примерно одинаково; натрий в почках подвергается реабсорбции, содержание кальция и магния в моче несколько выше, чем в плазме, а содержание сульфатов намного выше, чем в плазме [152]. Точно так же у пресноводного круглоротого Lampetra калий удерживается в большей степени, чем натрий. Миноги, которым свойственно мигрировать, в 50 %-ной морской воде потребляют воду в количестве, достигающем 99 мл/(кг-сут); они абсорбируют натрий, калий и хлор, причем выведение этих ионов происходит главным образом экстраренально; выведение кальция, магния и сульфатов происходит у них как через почки, так и через кишечник. Отношение моча/плазма для магния и сульфатов составляет у них соответственно 11 и 12,9, тогда как для натрия — только 0,42 [23, 153]. У акулы Squalus выведение NaCl происходит в основном через ректальные железы, что видно из следующего расчета: суммарная скорость выведения натрия составляет 0,87—0,92 мМ/(кг-ч), из них выводится почками от 0,1 до 0,2, т. е. от 10 до 30% (остальное выведение приходится на долю ректальных желез) [24].
В гломерулярной почке Salmo происходит более активная абсорбция ионов натрия и хлора, чем калия и кальция; перенос хлора через мембраны происходит, вероятно, пассивно [73].
В агломерулярных почках морских рыб вся моча образуется путем секреции. При повышении в плазме уровня различных ионов скорость выделения ионов магния, тиосульфата, сульфата и других веществ достигает максимума. Повышение содержания магния в плазме тормозит выделение кальция, а избыток тиосульфатов в плазме угнетает экскрецию сульфата; таким образом, выделение катионов и анионов осуществляется с помощью разных транспортных систем. На эти транспортные системы не влияет препарат бе-немид, тормозящий выделение ПАГ. Рыба Opsanus tau с агломеру-лярным типом почек способна выживать в разведенной морской и даже пресной воде. При этом скорость выделения мочи в пресной воде у нее в 5 раз выше, чем в морской или 50 %-ной морской воде; несмотря на отсутствие процесса фильтрации, в этих условиях происходит выделение некоторого количества инулина. В мочевом пузыре имеет место обратное всасывание ионов хлора, как видно из следующих данных [126]:
202
Глава 2
Среда Пресная вода 50%-ная морская вода 100%-ная морская вода
С1 (мэкв), плазма 94,2 159 159
моча в уретре 38 104 169
моча в мочевом пузыре 0 7 40
Активный транспорт ионов
Движение ионов из клетки в клетку может происходить пассивно через поры в плазматических мембранах, причем степень проницаемости мембран определяется величиной пор и их зарядом. В основе пассивного движения может лежать кинетический обмен одного и того же типа ионов, входящих и выходящих из клетки («обменная диффузия»). Этот процесс не вызывает изменения концентрации ионов и потому не играет роли в ионной регуляции. Пассивное движение ионов может происходить также по законам диффузии или по градиенту концентраций — из области более высокой концентрации в область более низкой, а также по градиенту электрического потенциала (см. гл. 1). Сохранение постоянной концентрации ионов заставляет предполагать, что их утечка, связанная с диффузией, уравновешивается активным транспортом ионов против химического и электрического градиентов. Об активном переносе (транспорте) ионов можно говорить в тех случаях, когда на их движение в клетку или из клетки требуется больше энергии, чем может обеспечить электрохимический градиент, т. е. если движение ионов не подчиняется равновесию Доннана. При этом перенос ионов происходит за счет метаболической энергии (см. гл. 1).
Активный транспорт ионов необходим в двух ситуациях: 1) при регуляции концентрации ионов внутри клетки в условиях, когда внеклеточная жидкость значительно отличается от внутриклеточного содержимого своим составом; 2) для поддержания постоянства концентрации ионов в жидкостях тела, когда состав этих последних значительно отличается от состава внешней среды. Некоторые аспекты второй ситуации уже обсуждались в связи с проблемой осмотической регуляции. Из сказанного следует, что одним из условий освоения пресной воды как среды обитания явилось развитие механизма активного транспорта ионов через поверхность тела. С другой стороны, для поддержания гипотоничности крови при обитании животного в концентрированной среде, а также для сохранения воды при наземном обитании потребовалось формирование как почечного, так и внепочечного путей активного' выведения ионов. Подробное описание физико-химического механизма транспорта ионов не входит в задачу настоящей главы; по
Неорганические ионы
203
этому мы ограничимся рассмотрением этой проблемы в сравнительно-биологическом аспекте.
Ионная регуляция на клеточном уровне. Как уже отмечалось выше, в большинстве клеток накапливается калий и выводится натрий. Эксперименты, проведенные с помощью меченых атомов, показали, что этот феномен не связан с различной проницаемостью мембраны по отношению к калию и натрию. Кроме того, поскольку градиенты концентраций этих катионов направлены в противоположные стороны, их распределение не может зависеть от электрического потенциала. Отсюда следует, что распределение калия и натрия по обе стороны клеточной мембраны создается в результате активного транспорта этих ионов. Особенности мембранных ионных насосов могут быть продемонстрированы в следующих экспериментах. Мышечные клетки, содержащие в нормальных условиях относительно много калия и мало натрия, при хранении на холоде начинают терять калий и насасывать (путем диффузии) натрий; при возвращении этих клеток в нормальные температурные условия они восстанавливают исходный градиент ионов путем выведения натрия и насасывания калия. Сопряжение этих процессов обязательно. При отсутствии калия в омывающем растворе выведение натрия из мышечных клеток прекращается. Точно таким же образом ведут себя красные кровяные клетки большинства млекопитающих. Выделение натрия (и насасывание калия) сопровождается расщеплением АТФ; ингибиторами процесса являются сердечные гликозиды (дигиталис, уабаин). Кинетика процесса отражается на кривой, имеющей уровень насыщения; Км Для наружного калия равно 1—2 мМ, а для внутриклеточного натрия — 10— 20 мМ. В изолированных эритроцитах человека 3 иона натрия обмениваются на 2 иона калия [173]; такое же соотношение характерно для гигантского аксона кальмара [97].
Количество энергии, затрачиваемой на транспорт ионов, зависит от природы ткани и условий транспорта. В нерве краба расщепление 1 молекулы АТФ обеспечивает перенос 1,9—3,4 иона натрия. В эритроцитах отношение числа транспортируемых ионов к количеству расщепившихся молекул АТФ составляет 3/1 [74, 173, 250, 251]. В срезах почек бурундука и хомячка отношение числа поступивших в клетку ионов калия к потребленному кислороду колеблется от 17 до 66 (отношение К/А.ТФ колеблется от 3 до 12). Уабаин снижает потребление кислорода с 16 до 10 мл/(мг сухого веса-ч). Такое же действие оказывает удаление натрия из среды инкубации. Следовательно, на активный транспорт ионов расходуется 35—45% энергии дыхания [257]. Показателем энергетических затрат обычно служит количество потребленного кислорода, однако, как это было четко показано на эритроцитах [98, 99] и аксоне кальмара [97], транспорт ионов натрия и калия зависит от уровня АТФ в клетках.
204
Глава 2
Фермент, ответственный за сопряженный с транспортом ионов гидролиз АТФ, был впервые выделен Скоу из нервной ткани крабов [211, 212]; в дальнейшем такой же фермент был найден практически во всех подвергавшихся анализу животных тканях, а также в некоторых растительных клетках [11]. Свойства этого фермента почти в точности совпадают со свойствами клеточного ионного насоса. Так, он локализован в мембранной фракции гомогената клеток, активен только в присутствии Mg, Na и К; его ингибиторами являются сердечные гликозиды, олигомицин и фторид и, наконец, действие фермента сопряжено с выведением натрия и накоплением калия. В системах, выделенных из различных клеток, отношение числа транспортированных ионов натрия к количеству распавшихся молекул АТФ составляет 2/3, т. е. близко к отношению, характеризующему работу клеточных насосов [12]. Совершенно очевидно, что описываемый фермент непосредственно связан с энергетическим обеспечением процесса транспорта ионов; принимает ли он прямое участие непосредственно в переносе ионов через мембрану, остается пока неясным [212].
В том случае, когда выведение натрия в точности уравновешивается входом калия, переноса заряда не происходит, но если один из процессов количественно преобладает над другим, то- работа насоса приведет к возникновению электрического заряда, т. е. будет способствовать возникновению мембранного потенциала. Именно это происходит в эритроцитах человека, где 3 иона натрия обмениваются на 2 иона калия. На клетках ганглия брюхоногого моллюска было показано, что введение натрия со скоростью 4,4 мМ/мин стимулировало работу натриевого насоса и повышало потенциал покоя на 30 мВ за 10 мин. Добавление уабаина или удаление калия из омывающего клетку раствора блокировало гиперполяризацию [116].
Эпителий. Транспорт ионов, направленный внутрь клеток. Активный транспорт ионов из внешней среды во внутреннюю осуществляется рядом сложных многоклеточных мембран — кожей, жабрами, почечными канальцами, мочевым пузырем, благодаря чему происходит регуляция состава жидкости тела. Этот процесс включает движение ионов не только между внутри- и внеклеточной средой, но и сквозь клетку из жидкости, омывающей одну поверхность (например, из наружной среды), к жидкости, омывающей другую поверхность (например, к крови). Мембраны наружных и внутренних поверхностей таких эпителиальных клеток должны иметь совершенно различные характеристики. Тем не менее параметры, характеризующие транспорт ионов в этих клетках, сходны с параметрами работы натрий-калиевого насоса в симметричных клетках.
Пресноводные животные обладают способностью переносить NaCl из окружающей среды в кровь против градиента концентрации. Процессы переноса ионов натрия и хлора протекают независи
Неорганические ионы
мо друг от друга [125] и происходят, по-видимому, путем обмена этих ионов на другие, благодаря чему сохраняется электронейтральность омывающих растворов. Так, выведение иона аммония серебряным карасем Carassius, помещенным в водопроводную воду, примерно равно потреблению им натрия [143]; то же самое
Рис. 2-2. Схематическое изображение активной абсорбции ионов натрия и хлора в жабрах пресноводных рыб. Показано поглощение Na+ в обмен на Н+ и С1— в обмен на НСО3 . Пассивный вход Na и Cl достигает значительного объема только при высокой концентрации NaCl в окружающей среде. На схеме показано, что соответствующие градиенты Na и К между клетками и плазмой поддерживаются с помощью KNa-насоса. А — плазма;
Б — эпителий жабр; В — пресная вода.
показано для личинки Ambystoma tigrinum [55]. Инъекция NH4 рыбке Carassius увеличивает приток натрия, в то время как добав-ление_ЫН4 к среде уменьшает его. Аналогичным образом инъекция НСОз стимулирует потребление хлора, а добавление НСОз в среду тормозит этот процесс. Угнетение активности карбоангидразы снижает транспорт как натрия, так и калия. Сходные результаты были получены при изучении транспорта иона аммония у речного рака [206]. Былсу высказано предположение, что NH4 обменивается на Na, а НСОз — на С1, как показано на рис. 2-2. Однако у лосося Salmo gairdneri выведение NH4 не всегда эквивалентно потреблению натрия и не меняется при изменении скорости его притока. По-видимому, в этом случае вход натрия сопряжен с транспортом Н+. Такое же сопряжение транспорта Na+ и Н+ было обнаружено у лягушки Calytocephalella, которая выделяет преимущественно мочевину и только в незначительных количествах аммиак. Потребление натрия кожей этой лягушки в точности эквивалентно экскреции Н+. Прокаин тормозит транспорт натрия, а также выведение Н+. Потребление ионов хлора представляет собой самостоятельный процесс. После адаптации лягушки к раствору NaCl по
206
Глава 2
глощение ионов натрия и хлора происходит в равных количествах. Если в организме лягушки избирательно понижена концентрация ионов хлора, то при перенесении ее в раствор NaCl поглощение хлора идет более активно; наоборот, при дефиците натрия в организме потребление натрия преобладает над потреблением_хлора. Поглощение ионов хлора происходит в обмен на ионы НСОз и может быть ингибировано с помощью пентобарбитурата [199]. Независимость систем транспорта ионов была выявлена также у личинки Aedes aegypti. В растворе Na2SO4 личинка компенсирует поглощение натрия на 33% выделением калия, на 49% выделением Н+ и на 18% поглощением SO4~. В растворе КС1 личинка поглощает С1, компенсируя это на 36% выделением неизвестного аниона, на 41% выделением НСОз (и, возможно, ОН) и на 23% поглощением К [223].
Транспортные системы обладают ограниченной емкостью (способны к насыщению) и характеризуются определенными Км для Na+ (величины Км приведены в табл. 2-6) [86а]. Перенос иона часто сопровождается возникновением на транспортирующем эпителии разности потенциалов, которая, как было показано на лягушках [21] и саламандрах [55], зависит от концентрации натрия; подобной же зависимости от транспорта ионов хлора выявить in vivo не удалось. В кишке Bufo marinas натрий транспортируется от мукозной оболочки к серозной; количество натрия, поступающего в последнюю, лимитируется проницаемостью мукозной оболочки; альдостерон увеличивает проницаемость клеточных оболочек для натрия и таким образом повышает содержание натрия в клетках [37].
Исследования механизма ионного транспорта проводились in vitro на различных препаратах эпителиальной ткани. Внутренняя поверхность кожи лягушки, помещенной в раствор Рингера, электроположительна по отношению к наружной стороне. Используя внешнюю батарею, можно создать замкнутую цепь и измерить величину тока, необходимого для компенсации разности потенциалов в коже. Как показано с помощью радиоизотопного метода, ток в такой цепи эквивалентен суммарному поступлению ионов натрия; на этом явлении основан метод простого электрического измерения транспорта Na [17]. Кинетика транспорта характеризуется насыщаемой кривой [120, 121, 215] с Км, равной приблизительно 10 мМ; ингибиторы клеточного метаболизма оказывают на транспорт тормозящее действие. Высокие концентрации кальция снижают ток в замкнутой цепи, уменьшая проницаемость наружной поверхности по отношению к натрию [41, 42, 187]; амилорид — препарат, влияющий на почки и вызывающий повышенный диурез, — также тормозит вход натрия через наружные мембраны. Поскольку для возникновения тока в замкнутой цепи необходимо присутствие калия в растворе, омывающем внутреннюю поверхность кожи, а при добавлении уабаина ток исчезает, следует предполо-
1
Таблица 2-6
Сродство к натрию (Км) системы потребления натрия у различных животных
Животное Класс Сродство к Na, мМ Предпочтительная среда обитания Источник данных
Carcinus maenas Ракообразные 20 Эстуарии с морской или слабосоленой водой [205]
Marinogammarus finmarchius » 6—10 То же [225]
Fundulus heteroclitus Костистые рыбы 2,0 Солоноватая вода, плохо выживают в пресной воде [176]
Gammarus duebeni (солоноватоводный подвид) Ракообразные 1,5— 2,0 Солоноватая вода [207]
Gammarus tigrinus » 1—1,5 » » [225]
Gammarus zaddochi » 1—1,5 » » [225]
Lumbricus terrestris Олигохеты 1,3 Влажная почва |54]
Bufo americanus Земноводные ^>1 Наземная среда [86]
Eriochier sinensis Ракообразные 1,0 Выводится в морской воде, достигает зрелости в пресной воде [205]
Salmo gairdner (жабры) Костистые рыбы 0,5 Пресная вода; способны жить в морской воде [И8]
Gammarus duebeni (пресноводный подвид) Ракообразные 0,4—0,5 Пресная вода [225]
Rana cancrivora Земноводные 0,4 Пресная вода, слабосоленая вода [86]
Ambystoma gracile » 0,3—0,5 Пресноводная личинка наземной формы [2]
Limnea stagnalis Брюхоногие 0,25 Пресная вода [85]
Astacus pallipes Ракообразные 0,25 » » [206]
Rana pipiens Земноводные 0,2 Водный или полуназемный образ жизни [86]
Amphiuma » г^0,2 Пресная вода [86]
Gammarus pulex Ракообразные 0,15 » » [207]
Gammarus lacustris » 0,1—0,15 » » [207]
Lampetra planeri Круглоротые 0,13—0,26 Пресная вода; после метаморфизма мигрируют в океан [153]
Carassius auratus Костистые рыбы <0,05 Пресная вода [ИЗ]
Xenopus laevis Земноводные <0,05 » » [86]
208
Глава 2
жить, что в механизме переноса ионов через внутренние мембраны участвует транспортная АТФаза (см. выше). Наличие связанной с мембранами АТФазы было выявлено на латеральных и внутренних поверхностях клеток всех слоев эпидермиса [33]. У головастиков АТФазная активность кожи намного ниже, чем у лягушек, и в препаратах кожи головастиков не возникает ни разности потенциалов, ни обусловливающего ее тока; однако транспортная система, включающая активную АТФазу, присутствует у них в жабрах [13]. На одну молекулу потребленного кислорода транспортируется 18 ионов натрия, или примерно 3 Na+/1 АТФ [264]. У головастика лягушки-быка потребление Na+ и С1~ взаимно не связано; к моменту появления разности потенциалов на коже (на поздней стадии развития) знак потенциала жидкости тела меняется от — к + [2].
Если изолированную кожу лягушки поместить в раствор с высокой концентрацией ионов хлора, например в раствор Рингера, то поглощение ею С1_ будет происходить пассивно. У интактных лягушек, напротив, имеет место активное потребление С1~, что можно продемонстрировать экспериментально в условиях, когда изолированная кожа омывается с наружной стороны не раствором Рингера, а разбавленным раствором КС1 [145]. В изолированной коже южноамериканской лягушки Leptodactylus активный транспорт С1“ продолжается даже в том случае, если препарат с обеих сторон омывается раствором Рингера [262].
Препарат мочевого пузыря жабы ведет себя in vitro подобно коже лягушки. Разность потенциалов в растворе Рингера по обе стороны эпителия пузыря составляет около 50 мВ; при этом серозный слой стенки пузыря оказывается электроположительным. Опыты с последовательной заменой ионов в омывающем растворе показали, что для возникновения асимметрии потенциала на монослое эпителиальных клеток необходимо наличие ионов натрия в омывающем растворе, причем суммарное количество ионов натрия, переносимых от мукозной поверхности к серозной, равно величине тока в замкнутой цепи [65, 70, 71, 203]. Потребление 1 молекулы кислорода обеспечивает энергией перенос около 16 ионов натрия. Если из раствора, омывающего серозную сторону эпителия, исключить калий, то транспорт натрия прекратится и знак потенциала изменится на противоположный. Предполагалось, что действие калия состоит в увеличении Риа на стороне мукозной оболочки. Однако было показано, что амфотерицин В в бескалиевой среде увеличивает Риа в мукозе, не повышая скорости транспорта Na; последний показатель возрастает при добавлении К- Отсюда следует, что К необходим для функционирования натриевого насоса в серозной оболочке [65]. Как и в опытах с кожей лягушки, возникновение тока в замкнутой цепи тормозится уабаином и ингибиторами метаболизма.
Неорганические ионы
209
Перенос ионов хлора можно четко продемонстрировать на препарате мочевого пузыря черепахи, где суммарная величина транспорта натрия превышает ток в замкнутой цепи на 44 мкА; оказа^ лось, что разница обусловлена переносом анионов С1~ и НСОз [83]. Таким образом, ионы натрия и хлора активно транспортируются со стороны мукозной оболочки в сторону серозной, причем закисление мукозы может быть связано с абсорбцией НСОз [20]. Перенос натрия зависит от процессов окисления: на 1 молекулу потребленного кислорода приходится транспорт примерно 20 ионов натрия [123, 130].
Тон ионов пмоль(см2- с)
Просвет канальца Na К
Просвет канальца Na К
Перитубулярная
-^-Клетка Клепка-^э+сибкостъ
308 132
57 378
Перитубулярная
+Клетка Клетка*- тсивкость
246 89
57 378
Рис. 2-3. Схема распределения потенциалов, .а также градиента концентраций и тока номов через стенку проксимального канальца почки Necturus [216, 253 (с некоторыми изменениями)].
Изолированные канальцы почек Necturus реабсорбируют соли из находящейся в просвете канальцев жидкости. Закрывая конец канальца слоем масла и вводя в его просвет определенные вещества, можно изучать процессы их транспорта в канальце. Если препарат изнутри и снаружи омывается раствором Рингера, то внутренняя поверхность несет отрицательный заряд и разность потенциалов составляет 20 мВ (рис. 2-3). Содержимое клеток канальцев электроотрицательно по отношению к обеим поверхностям, причем разность потенциалов между внутренним пространством клеток и просветом канальца составляет 73 мВ, а между внутренним содержимым и интерстициальным пространством — 53 мВ; сумма этих двух мембранных потенциалов составляет транстубулярный потен-
14__
210
Глава 2
циал. Если ионы натрия в содержимом просвета канальцев заменить на калий или холин или добавить к препарату уабаин, то электрическая асимметрия исчезнет. Предполагается, что на перитубулярной (серозной) поверхности функционирует насос, осуще-
Рис. 2-4. Выведение 24N у эвригалинной рыбы камбалы Platichthys (слева) и у стеногалинной рыбы Serranus .(справа) в морской воде (Л) и после быстрого переноса в пресную воду .(Б) [Г55].
Время указано в часах. Наклон кривых отражает скорость выведения. У камбалы снижение выведения Na происходит в два этапа (I, II), у Serranus в один.
с
с
ствляющий сопряженный транспорт ионов натрия и калия. Величина потока ионов, измеренная с помощью замкнутой цепи, составляет 4,8-10—6 А/см2, или 5-10~11 экв/(см2-с). На рис. 2-3 изображено движение ионов через мукозную и серозную поверхности канальцев.
Обобщение данных, полученных при изучении поверхностного эпителия таких органов, как кожа, жабры и мочевой пузырь, позволяет предположить существование единой системы транспорта ионов, основные характеристики которой, полученные в опытах как in vivo, так и in vitro, представлены на рис. 2-4. Как показано на изображенной модели, наружная мембрана характеризуется очень
Неорганические ионы
211
низкой проницаемостью по отношению к калию. Поступление натрия и хлора происходит либо путем диффузии, либо путем обмена; первый способ преобладает в концентрированных растворах, второй — в разведенной солевой среде. В процессах, связанных с ускорением гидратации СО2 и образованием Н+ и НСО , может принимать (в жабрах рыб) или не принимать (в коже лягушки) участие карбоангидраза. Поступивший в клетку натрий с помощью сопряженного натрий-калиевого насоса выводится, по-видимому, в латеральные межклеточные каналы; переход анионов в эти каналы может происходить пассивно, а вода может насасываться в них осмотическим путем. Таким образом, солевой раствор непрерывно проникает в канал и движется по нему в среду, омывающую внутреннюю поверхность. Система транспорта натрия обладает чувствительностью к уабаину и требует присутствия калия в растворе, омывающем внутреннюю поверхность. Это позволяет предположить, что движение натрия через обращенную внутрь мембрану зависит от такой же сопряженной натрий-калиевой транспортной системы, какая описана для клеток мышечной и нервной тканей. В результате движения ионов возникает разность потенциалов между поверхностями мембран эпителиальных клеток, однако тонкий механизм его возникновения не вполне понятен; нет даже единой точки зрения в вопросе о том, повышается он в коже лягушки — по направлению от наружной к внутренней ее поверхности— постепенно [35] или дискретно, в два [61] или более [7] этапов.
Ткани беспозвоночных животных изучались в значительно меньшей мере; исследования, проведенные in vivo, показали, что механизм транспорта ионов в поверхностном эпителии беспозвоночных (например, в жабрах речного рака) или в экскреторных канальцах напоминает механизм, характерный для позвоночных. Внутренняя поверхность изолированных жабр речного рака электроотрицательна, и ионы хлора активно переносятся внутрь клеток. Система транспорта ионов хлора достигает насыщения в 0,2 %-ном растворе NaCl [8]. Имеется несколько сообщений о способности препаратов, обладающих антихолинэстеразной активностью, тормозить потребление натрия в жабрах и мочевом пузыре пресноводных ракообразных. Было показано, что эти ингибиторы тормозят также транспорт натрия через кожу лягушки.
В жабрах сухопутного краба Cardisoma присутствует активная NaK-АТФаза, ингибируемая уабаином; максимальное потребление кислорода изолированными жабрами наблюдается в 75 %-ной морской воде. В разведенной морской воде эти крабы поддерживают гиперосмотическую концентрацию ионов, а в более соленой среде меняют свою осмотическую концентрацию в соответствии с внешними условиями [180].
В средней кишке гусеницы ночной бабочки Hyalophora cecropia происходит перенос калия из крови в просвет кишки [3, 94]. Раз
14*
212
Глава 2
ность потенциалов между внешней и внутренней поверхностями эпителия кишки составляет 84 мВ (внутренняя поверхность электроположительна), и в квазифизиологических условиях весь ток замкнутой цепи определяется транспортом калия; этот потенциал не меняется при изменении концентрации натрия; рубидий может транспортироваться в той же мере, что и калий. При отсутствии калия в среде или при низком его содержании может наблюдаться транспорт натрия; при равенстве концентраций калия и натрия имеет место перенос только ионов калия. Рассматриваемая система нечувствительна к ионам кальция и магния; уабаин также не оказывает влияния на транспорт как К+, так и Na+. Однако аноксия и ДНФ тормозят процессы транспорта ионов. Колончатые клетки кишечного эпителия имеют базальные складки, между которыми расположены удлиненные митохондрии и апикальные микроворсинки, выступающие в просвет кишечника в направлении транспорта К+.
Эпителий. Выведение ионов из клеток. Многие животные сталкиваются с проблемой солевой нагрузки: водные животные, жидкости тела которых гипотоничны по отношению к внешней среде; акуловые рыбы, изо- или гиперосмотичные по отношению к окружающей среде, которые должны приспосабливаться к высокой солености морской воды; наконец, птицы и рептилии, питающиеся морскими беспозвоночными. Для поддержания постоянства состава своей внутренней среды эти животные вынуждены постоянно выводить соли с помощью таких органов выделения, как жабры у костистых рыб и ракообразных, солевые железы у птиц и рептилий, ректальные железы у акуловых рыб. Наблюдать in vitro можно только деятельность последних из перечисленных органов; о механизмах действия остальных можно судить на основании изучения их в условиях целого организма.
Жабры рыб характеризуются способностью выделять соли в морскую воду и активно поглощать их из пресной воды [142а]. Так, у эвригалинных рыб при переходе их из одной среды в другую направление транспорта ионов меняется на противоположное. Разность потенциалов между внутренней и наружной поверхностями жабр рыб в морской воде составляет около 20 мВ (угри) или j 30 мВ (цебидихтис), причем поверхность, омываемая жидкостью | тела, электроположительна по отношению к наружной, а градиент i концентрации направлен внутрь тела. Ясно, что выведение жабра- J ми ионов хлора происходит активно; сложнее обстоит дело с иона- ми натрия; в этом случае электрический градиент практически уравновешивает солевой и таким образом концентрация натрия поддерживается равновесной соответственно уравнению Доннана. Исследование скорости транспорта ионов, проведенное у ряда рыб с помощью изотопного метода, показало, что у большинства видов поступление ионов происходит чрезвычайно быстро; у эвригалин- ; пых рыб (камбалы, угря, опсануса) и у стеногалинного вида лосося ।
Неорганические ионы
213:
скорость транспорта ионов по данным изотопного обмена соста-вила 1—з мэкв/(100 г-ч). Общее количество соли, подлежащей выделению, можно рассчитать из количества соли, полученной с выпитой водой (см. гл. 1); у угря последняя величина составляет всего 0,17 мэкв/(100 г-ч) [209]. Сопоставление этих величин заставляет предположить, что большая часть изотопного обмена происходит в результате обменной диффузии (Na-Na — обмен между кровью и морской водой, не имеющий физиологического смысла). Это предположение подтвердили опыты, в которых рыб быстро переносили из морской воды в пресную. У камбалы при этом наблюдалось быстрое начальное уменьшение скорости выведения натрия с 2,6 до 0,4 мэкв/(100 г-ч) и последующее (в течение 30 мин) постепенное снижение ее до 0,1 мэкв/(100 г-ч) (рис. 2-4). Фаза быстрого снижения зависит от концентрации Na, тогда как медленная фаза чувствительна только к осмотической концентрации (как если бы раствор состоял из неэлектролитов). Следовательно, быстрая фаза обусловлена обменной диффузией, а медленная — какими-то невыясненными свойствами жабр, имеющими отношение к осмотической проницаемости. При изучении стеногалинных видов Serranus, а также Gobius и Uranoscopus была выявлена только быстрая фаза снижения скорости выведения меченого Na, причем в пресной воде животные непрерывно продолжали терять, соль [154]. Быстрая фаза наблюдалась также у Fundulus и Platichthys [156].
В отличие от приведенных случаев скорость обменной диффузии у радужной форели низка, так что суммарная величина транспорта Na в морской воде составляет только 0,1 мэкв/(100 г-ч) [87], что близко к величине потребления соли через желудочно-кишечный тракт [204].
После первой работы, в которой проводилась перфузия жабр угря [119а], исследований на изолированных препаратах жабр не было опубликовано, тем не менее некоторые заключения о механизмах транспорта ионов в этом органе все же могут быть сделаны. Как уже упоминалось, ионы хлора выводятся в результате-активного транспорта; с меньшей уверенностью это можно утверждать и в отношении Na. У морских костистых рыб NaK-АТФазная активность жабр выше, чем у пресноводных рыб [ПО, 111, 115]. Жабры акуловых рыб лишены способности к выведению солей и соответственно АТФазная активность этого органа низка; в то же время ректальные железы — активно функционирующий орган выведения солей у акуловых — характеризуются высоким уровнем активности АТФазы [111].
У угрей, бычков и форелей уровень NaK-АТФазной активности жабр изменчив: у рыб, находящихся в морской воде, он выше, чем у рыб, помещенных в пресную воду. Под влиянием уабаина снижается активность АТФазы и соответственно уменьшается выведение Na жабрами угря [115]. У эвригалинного японского угря, по
214
Глава 2
мещенного в пресную воду, активность жаберной NaK-АТФазы находится на низком уровне; однако при переносе рыбы в морскую воду активность фермента повышается, достигая максимума после 30 дней пребывания в морской воде; после 2 нед пребывания в морской воде как NaK-АТФазная активность, так и число клеток, выводящих С1, возрастает в 5—6 раз [240]. У Fundulus NaK-АТФазная активность жабр в морской воде в 6 раз выше, чем в пресной; при гипоксии эта разница несколько уменьшается. При переносе Fundulus из морской воды в пресную активность NaK-АТФазы в жабрах снижается, тогда как в почках она увеличивается [62].
Ниже приводится сравнение АТФазной активности жабр пресноводных и морских рыб [ПО, 111]:
NaK-АТФазная активность жабр
Пресноводные костистые рыбы Netropis Anguilla Морские костистые рыбы Myoxocephalus Fundulus Pseodo pleuronectes Lophius Anguilla Морские акуловые Squalls 1,0 6,0 9,4 11,0 16,0 21,3 П,4 2,7
Аналогичное увеличение АТФазной активности в жабрах при адаптации к морской воде наблюдается у лосося Oncorhynchus [263]. Введение в брюшную аорту уабаина приводит к торможению активности фермента. Вполне понятно, что для выведения натрия из жабр АТФаза как основной компонент насоса, сопрягающего транспорт ионов калия и натрия, должна быть расположена на мембране, омываемой наружной средой, откуда поступают ионы калия. Действительно, у угря и лосося, помещенных в пресную воду, выведение натрия тормозится; торможение снимается при добавлении в воду 10 мМ КС1; другие компоненты морской воды не оказывают влияния на процесс [87, 143].
Жаброногие рачки Artemia способны поддерживать в крови относительно стабильную концентрацию солей при значительных изменениях солености воды (см. гл. 1). Находясь в морской воде, они потребляют воду в количестве, эквивалентном 2% веса тела в 1 ч; большая часть соли, попавшей при этом в организм, выводится через жабры. У рачков, перенесенных в разбавленную среду, активное выведение солей жабрами прекращается. В безнатриевой морской воде выведение натрия жабрами уменьшается на 70%.
Неорганические ионы
215
Уменьшение выведения наблюдается также в разведенной морской воде или в растворе маннитола, изоосмотичном морской воде; следовательно, на активность процесса оказывает влияние уровень NaCl, а не осмотическая концентрация. Транспорт хлора осуществляется также с высокой скоростью, однако механизмы переноса хлора и натрия различны [229]. Потенциал крови Artemia на 23,4 мВ выше потенциала морской воды, причем, как показали опыты с последовательной заменой ионов, эта разность потенциалов возникает главным образом в результате активного выведения ионов хлора. Как и у рыб, у рачков концентрация натрия в крови близка к величине, предсказываемой уравнением Нернста, тогда как концентрация ионов хлора далека от равновесия. Около 70% ионов хлора выделяется в морскую воду в результате обменной диффузии, остальные 30% —путем активного транспорта; выведение натрия происходит пассивно [142а, 213].
Солевые железы пресмыкающихся и птиц, а также ректальные железы акуловых рыб выделяют соли против градиента концентрации: из менее концентрированного солевого раствора — крови — в более концентрированный раствор — экскреторную жидкость. Как ни мало известно нам о механизмах активного транспорта, все же некоторые данные свидетельствуют об определенном сходстве механизмов функционирования упомянутых выше органов и выделительной системы жабр. Так, в функционирующих солевых железах в большом количестве содержится NaK-АТФаза; при инволюции желез уровень активности фермента снижается вследствие возникновения солевой недостаточности [68, 100]. Торможение выделения солей происходит при введении уабаина в кровь, но не при ретроградном введении его в просвет железы. Ректальная железа также характеризуется очень высоким содержанием NaK-АТФазы; уабаин тормозит секреторную активность железы.
В процессе деятельности рассматриваемых двух органов возникает разность потенциалов, однако в отличие от жабр морских рыб жидкость просвета желез электроположительна по отношению к крови [226]. Это означает, что выведение Na+ происходит посредством активного транспорта, тогда как в отношении С1~ с уверенностью утверждать это нельзя.
В следующих главах мы опишем некоторые другие системы активного транспорта, например всасывание сахара и аминокислот в кишечнике, которое сопряжено с активным транспортом натрия (гл. 5). Ранее мы уже приводили данные об активном транспорте Mg2+ в почках ракообразных (см. стр. 191, а также [90, 137, 179]); механизмы упомянутых процессов пока неизвестны.
Активный транспорт кальция происходит в некоторых тканях животных, накапливающих кальций, как, например, у моллюсков в процессе образования раковины [112]. У пресноводной улитки Lymnaea обнаружено активное потребление кальция из среды, со-
216
Глава 2
держащей этот катион в низкой концентрации [85]. В мышечной ткани гранулы саркоплазматического ретикулума содержат фермент Mg-АТФазу, с помощью которой происходит накопление Са2+ в этих структурах (см. ниже). Слизистая оболочка скорлупных железок птиц выделяет кальций и генерирует противоток ионов, обусловленный СОз'-Транспорт Са2+ и СО!-может идти независимо друг от друга [60]. Вполне вероятно, что транспорт кальция распространен более широко, чем это нам сейчас представляется. Результаты измерений токов ионов и анализа состава тела медуз позволяют заключить, что медузы активно выводят ионы сульфата; при этом Aequorea способна поддерживать градиент между своим телом и морской водой, равный 9 мМ [141].
Изменение транспорта ионов и ионной проницаемости. Кальций служит универсальным регулятором проницаемости клеточных мембран по отношению к воде и ионам; высокое содержание кальция, как правило, ведет к снижению проницаемости, низкое содержание увеличивает ее. В опытах на коже лягушки было показано, что повышение уровня Са2+ на внешней ее поверхности снижает вход Na+ и С1_ [41, 42]. Добавление кальция к пресной воде вызывает изменение знака потенциала крови лосося от отрицательного к положительному (5—6 мВ), но мало влияет на транспорт натрия и хлора [121]. У Fundulus скорость обмена ТНО возрастает при отсутствии кальция в среде [177].
Среда Константа скорости обмена ТНО (ч—1) у Fundulus
Пресная вода Пресная вода 5 мМ Са2+ Пресная вода + 10 мМ. Са2+ -f- Mg2+ 100%-ная морская вода Бескальциевая морская вода 2,02 1,36 0,93 0,87 1,75
В бескальциевой солоноватой воде Nereis diversicolor теряет способность к осморегуляции [214]. У Platichthys кальций снижает транспорт Na [155]. Было высказано предположение, что кальций уменьшает степень гидратации полярных органических молекул путем снижения взаимного отталкивания между фиксированными анионами, благодаря чему достигается более плотная упаковка органических молекул и проницаемость мембран, состоящих из таких молекул, уменьшается.
Уменьшение транспорта натрия при переходе из морской воды в пресную более выражено у эвригалинных видов рыб, чем у стеногалинных [155]. Ниже приводятся сравнительные данные, характеризующие эвригалинную рыбу — камбалу и стеногалинную —• морского ерша (см. также рис. 2-4).
Неорганические ионы
217
Скорость тока Na, мэкв/(100 г-ч)
Выведение Всасывание
морская вода пресная вода морская вода пресная вода ИСТОЧНИК данных
Platichthys 2,6 0,022 2,2 0,014 [154]
Anguilla 1,45 0,048 — 0,021 [154]
Opsanus 0,80 0,013 — 0,003 [126]
Т ilapia 2,0 0,015 2,4 0,011 [177а]
Salmo1 0,17 0,014 — 0,019 [87, 118]
Serranus2 2,6 0,55 2,6 0,54 [154]
1 Ток ионов только через жабры. Остальные данные характеризуют общий ток ионов, включая выведение ионов с мочой и всасывание в желудочно-кишечном тракте.
2 Стеногалинная морская рыба. Остальные перечисленные рыбы — эвригалинные.
Аналогичное уменьшение выведения Na при переходе из морской воды в пресную происходит у Salmo gairdneri', добавление калия к пресной воде увеличивает выведение натрия, что указывает на наличие Na-K-обмена [121]. При переносе камбалы из морской воды в разведенную среду наблюдается двухэтапное уменьшение выведения Na. По возвращении ее в морскую воду происходит также двухэтапное увеличение выведения Na, но обратная адаптация к морской воде протекает медленнее, чем адаптация к пресной. Выведение Na после адаптации к пресной воде выше у рыб Serranus и Uranoscopus (соответственно 58 и 51 % выведения в морской воде), чем у рыб Platichthys и Anguilla (15,9 и 19,2%) [156]. Приведенные данные свидетельствуют о том, что эвригалинные рыбы, находясь в пресной воде, сохраняют натрий лучше, чем стеногалинные рыбы. Молекулярные процессы в жаберных мембранах, лежащие в основе этих явлений, нам неизвестны.
Описанные здесь случаи позволяют сделать вывод о том, что у многих животных при переходе из морской воды в пресную уменьшается проницаемость жабр для ионов Na. В какой мере это обусловлено изменениями проницаемости (диффузия+обмен), трансэпителиальными потенциалами или состоянием переносчиков, осуществляющих активный транспорт, остается неясным. Часть указанных изменений может быть вызвана сдвигами концентрации NaCl, тогда как другие связаны с изменением собственно осмотической концентрации. Остается также невыясненным, в какой мере эти явления представляют собой результат прямого воздействия на эпителиальные клетки и в какой опосредованы чувствительными клетками и гормональными или нервными влияниями.
218
Глава 2
Менее распространенные элементы и микроэлементы
Из 48 элементов, входящих в состав морской воды, животные используют почти половину. Некоторые неорганические вещества накапливаются в неактивных тканях. Одни микроэлементы широко представлены в живых организмах, распространение других не столь универсально. Ряд элементов, присутствие которых в следовых количествах необходимо для жизни, в более высоких концентрациях оказываются токсичными. Причины неравномерного распределения отдельных элементов в тканях остаются часто неясными. При анализе ионного состава необходимо отличать элементы, накапливаемые самим животным, от содержащихся в ассоциированных с ним организмах. Активационный анализ дает возможность обнаружить следовые количества тяжелых элементов, не поддающихся определению химическими методами. Подробные таблицы элементарного состава биологического материала приводятся в ряде работ [242].
Галогены. Хлор — обычный компонент животных тканей (но не растений) и представляет собой наиболее распространенный и безвредный анион. В некоторых случаях хлор может быть заменен бромом, но большинство животных в норме брома не содержит. Тем не менее в пищеварительной железе моллюска Aplysia бром накапливается в больших количествах (до 10% сухого веса органа); видимо, его источником в данном случае служат красные водоросли, которыми это животное питается [258]. В морской воде концентрация брома в несколько тысяч раз превышает концентрацию иода, однако иод используется животными в большей мере. Некоторые губки с роговым скелетом содержат иода больше, чем брома (отношение I/Вг равно 3,9); у нероговых губок этих элементов меньше, и отношение I/Вг у них равно 2,1. Широко распространены иодсодержащие белки, например спонгин у губок или склеропротеины у полихет. Nereis diversicolor связывает иод в участках склеротизации [66, 67]. Широко распространены также иодтиро-зин и дииодтирозин; у позвоночных производные тироксина синтезируются в щитовидной железе. У оболочников, например у Cio-па, иод в связанной форме находится в эндостиле (у личинок) и в тунике (у взрослых животных). У ланцетника Branchiostoma эндостиль и слизистые железы кишечника накапливают иод, причем эндостиль содержит тироксин. В эндостиле пескоройки (личинки миноги) происходит включение иода в тиреоглобулин и гидролиз последнего до тироксина.
Фтор имеется в мантии некоторых брюхоногих (Archidoris), а также присутствует в виде флюорита в раковине. Обнаружено накопление фтора у некоторых губок. В следовых количествах фтор находится также в костях позвоночных и способствует укреплению эмали зубов; однако избыток фтора приводит к патологическим изменениям структуры костей.
Неорганические ионы
219
Металлы. О том, что в организме животных имеется некоторое количество тяжелых металлов, было известно уже давно. Многие из них необходимы для активации специфических ферментов. Так, железо является компонентом гемсодержащих белков, таких, как каталаза, пероксидаза и цитохромы, свойственные клеткам с аэробным обменом. Геминовые пигменты, гемоглобины, служат переносчиками кислорода. Высокое содержание железа обнаружено у некоторых улиток, а в зубцах радулы Patella содержание Fe2O3 доходит до 50% веса золы. У пресноводных перловиц железо и марганец накапливаются в неактивной форме в жабрах, мантии и пищеварительных железах [95а].
Содержание меди в морской воде составляет примерно 1 мг на 100 л. У ряда морских моллюсков и членистоногих, у которых медь входит в состав дыхательного пигмента гемоцианина (гл. 8), концентрация меди достигает 1 мг на 100 мл крови. Медь необходима для синтеза некоторых железосодержащих белков. К медьсодержащим белкам относится церулоплазмин, присутствующий в плазме крови; он обладает способностью переводить железо из закисной формы в окисную и участвует в обмене железа между плазмой и клетками [198]. Медь необходима для проявления ферментативной активности полифенолоксидазы, цитохромоксидазы, уриказы, лакказы, оксидазы аскорбиновой кислоты и тирозиназы. У краба Maja содержание гемоцианина в крови во время линьки понижается и часть теряемой из крови меди накапливается в гепатопанкреасе и затем вновь используется для ресинтеза гемоцианина после линьки. При голодании высвобождающаяся в процессе распада гемоцианина медь также накапливается в гепатопанкреасе (Crangon) [56]. У Helix летом медь концентрируется в больших количествах в гепатопанкреасе; зимой она обнаруживается в составе гемоцианина в гемолимфе [240]. У наземных содержится много меди, особенно в клетках панкреаса; во время линьки ее количество резко падает. Концентрация меди в гепатопанкреасе (в мкг/мг сырого веса) составляет: у Porcellio — 0,21, у морского вида Ligia — 0,037, у Gammarus — 0,009 [255]. В крови осьминога накапливается медь (в составе гемоцианина) и в меньшем количестве цинк:
Концентрация, мкмоль/л воды
Вг Zn Си
Морская вода 720 0,1—0,3 0,02—0,04
Кровь осьминога 1010 6,1 870
Моча осьминога 600 13,8 14,9
В условиях недостаточности меди цыплята погибают от разрыва аорты; при этом у них наблюдается увеличение количества му-
220
Глава 2
кополисахарйдов в аорте и снижение уровня цитохромоксидазы в сердце и печени [109]. В красном пигменте турацине в перьях ту-рако концентрация меди может достигать 7%. Человеку необходимо 2 мг меди в день, в период роста потребность в меди увеличивается; концентрация меди в крови составляет 0.5-10-4—1-10~4% [44].
Цинк широко распространен в животных тканях — шире, чем медь. Он обнаруживается в относительно больших количествах у двустворчатых моллюсков, особенно у Pecten и Ostrea (0,04% сухого веса). Концентрация цинка в моче Ostopus в 170 раз выше, чем в морской воде [178]. Цинк накапливается в предстательной железе млекопитающих и содержится в семенной жидкости. При недостатке цинка в пище у самок крыс уменьшается число беременностей и возрастает частота резорбции эмбрионов [За]. Недостаточность цинка в организме птиц приводит к нарушению нормального развития перьев и кожи. Цинк является необходимым компонентом фермента карбоангидразы (см. гл. 8) и фактором активации карбоксипептидазы поджелудочной железы. Этот элемент входит также в состав дегидрогеназ глутаминовой и молочной кислот, алкогольдегидрогеназы и щелочных фосфатаз.
Молибден обнаруживается у морских животных в следовых количествах (0,0002—0,002% сухого веса). В таких же следовых количествах он необходим и млекопитающим; избыток его, однако, токсичен; молибден способствует нормальному использованию меди в обмене веществ: Повышение концентрации молибдена вызывает понос у крупного рогатого скота, а также приводит к накоплению меди в почках. Молибден необходим для проявления активности некоторых флавопротеинов, в частности ксантиноксидазы. Высокий уровень молибдена уменьшает утилизацию меди в организме. Молибден индуцирует синтез ксантиноксидазы у крыс, что приводит к повышению уровня мочевой кислоты; последняя в свою -очередь индуцирует синтез медьсодержащего фермента — оксидазы мочевой кислоты [124а].
Кобальт входит в состав витамина В12 и используется микроорганизмами при синтезе этого витамина. Он нужен жвачным животным для флоры рубца; так, например, овца должна ежедневно получать примерно 0,05 мг кобальта. Кобальт входит в число немногих металлов, необходимых для Tetrahymena, в организме которых он накапливается.
Ванадий присутствует в тканях многих животных в чрезвычайно малых количествах (около 0,1 • 10~4%). По-видимому, он участвует в некоторых окислительных процессах, происходящих в клетках. В опытах на крысах, пищевой рацион которых содержал контролируемые концентрации микроэлементов, было показано, что для нормального роста животных ванадий необходим в количестве 10 мкг на 100 г пищи [202b]. Некоторые асцидии накапливают ванадий в концентрациях, в 5-105 раз превышающих концентрацию
Неорганические ионы
221
его в морской воде [6]. При этом у двух семейств асцидий ванадий обнаруживается в плазме, а у двух других — в особых клетках крови — ванадоцитах. В морской воде (в сухом остатке) содержится 2- 10~4% ванадия, а у некоторых асцидий — 6500-10~4%. Однако Styela и Molgula в большей степени накапливают ниобий, чем ванадий [НЗ]. Основываясь на количестве ванадия, имеющегося в морской воде и в тканях Ciona, а также на скорости движения воды через это животное, вычислили, что в год Ciona может извлечь из морской воды не более 45% содержащегося в ней ванадия; отсюда следует, что непосредственным источником ванадия в этом случае должны служить взвешенные в воде частицы. Концентрация ванадия у оболочников, обитающих в теплых водах, выше, чем у обитающих в холодных [244]. Почему у этой небольшой группы животных накапливается ванадий, а у нескольких родственных им семейств — ниобий, остается загадкой.
Ртуть накапливается в организме многих животных, однако концентрации ее, превышающие 24-10~4%, токсичны. Особенно токсичны метилированные соединения ртути, которые вызывают повреждение центральной нервной системы у позвоночных.
Марганец в количестве 5—10 мг/100 г золы обнаружен у многих животных. У устриц отмечается высокое содержание марганца, особенно в жабрах. Наличие марганца очень важно для млекопитающих, у которых он накапливается в печени. Он является кофактором реакций окислительного фосфорилирования, протекающих с участием изоцитратдегидрогеназы и L-малатдегидрогена-зы; Мп необходим также для активации аргиназы печени. В рационе утят содержание Мп должно составлять 0,0015%. Марганец может заменять магний в качестве кофактора некоторых ферментов.
Магний совершенно необходим всем животным. Tetrahymena нуждается в магнии в большей степени, чем в кальции. Будучи активным компонентом хлорофилла, магний содержится во всех зеленых ^растениях. Он служит кофактором ряда АТФаз, гексокина-зы, енолазы, пируваткиназы и миозиновой АТФазы мышц.
Алюминий у многих животных встречается в следовых количествах; повышенный уровень его отмечен у некоторых брюхоногих. Данных об участии алюминия в ферментативной активности не имеется.
Никель присутствует в ороговевших тканях, особенно в перьях, а также в печени и тимусе. Олово, серебро и титан относятся к тем элементам морской воды, которые обнаруживаются в тканях животных. Свинец распространен широко, причем у моллюсков его содержание (до 0,05% веса золы) выше, чем у других животных. Бор обнаруживается часто; содержание его у улитки Helix достигает 0,25% веса золы [245]. Селен необходим в следовых количествах; у ягнят и цыплят при селеновой недостаточности развивает
222
Глава. 2
ся мышечная дистрофия. У цыплят при этом наблюдаются также патологические изменения в поджелудочной железе и оперении.
Патологические изменения, возникающие в живых организмах в результате воздействия тяжелых металлов, в особенности урана, свинца и ртути, являются следствием промышленного загрязнения среды. При сгорании бензина в атмосферу попадает свинец, который аккумулируется в растениях; попадая затем в организм животных, он на 90% накапливается в костях, что может привести к нарушению структуры последних. Свинец, как и UO2+, образует комплексы с фосфорильными группами, особенно связанными с белками на наружной мембране клеток; в концентрации 0,06 мМ свинец ингибирует АТФазу эритроцитов. Ртуть активно реагирует с сульфгидрильными группами и является сильным диуретиком; ртуть тормозит реабсорбцию NaCl в почках, а также накапливается в корковом слое почек. Тяжелые металлы взаимодействуют с группами POf, SH- и СОО- молекул белков и вследствие этого ингибируют многие ферменты. Свинец в пище токсичен для крыс в количестве 25-10“4%, селен — 3-10~4% [144а, 167а, 202b].
Элементы скелета
Скелет животных строится как из органических соединений, так и из неорганических солей. Целлюлоза — углевод, составляющий основу скелета растений, — входит и в состав экзоскелета оболочников. Близкое к целлюлозе вещество обнаруживается в соединительной ткани хордовых [232]. Широко распространен хитин— глюкозамин, содержащий 6% азота; особенно часто он встречается у членистоногих, кольчатых червей и некоторых моллюсков; хитин может быть, как у многих ракообразных, пропитан соединениями кальция, что увеличивает его прочность. В состав скелета входит много белков: спонгин у Porifera, конхиолин у некоторых моллюсков, кератин и коллаген у позвоночных. Коллаген может быть заменен костью, однако у некоторых позвоночных, например у акуловых и круглоротых, скелет остается хрящевым, причем иногда в его структуру включаются микрокристаллы апатита; из-за отсутствия костной ткани акулы нечувствительны к введению витамина D или паратгормона [238].
Неорганические скелеты можно разделить на 2 основных класса в зависимости от того, какое вещество послужило основой для их построения — окись кремния или карбонат кальция. Кремний широко используется как опорный материал у растений и диатомей, в качестве примера можно назвать злаки и хвощи. Среди простейших кремний обнаружен у Heliozoa, которые имеют спикулы, состоящие из SiO2; радиолярии содержат относительно больше окиси кремния, чем окисей кальция и магния. Две группы губок —• Demospongia (обыкновенные губки) и Hyalospongia, или стеклянные губки, — имеют спикулы из SiO2-H2O; обнаружены кремние-
Неорганические ионы
223
вне ископаемые скелеты губок докембрийского периода. Кремний встречается также в скелетах некоторых мшанок.
Кальциевые скелеты бывают нескольких видов. Наиболее распространенным материалом скелета является карбонат кальция. Иногда он находится в аморфном состоянии, иногда в виде кальцита, часто в сочетании с MgCO3 — тогда он образует гексагональные кристаллы. В ряде случаев углекислый кальций встречается в виде ромбических кристаллов арагонита, иногда со SrCO3. Кальций обнаруживается также в костях позвоночных в виде различных фосфатов, подобных апатитам (Са3Р2О8-СаСО3). Раковина брюхоногих моллюсков сем. Doriidae содержит флюорит.
Ископаемые остатки раковин фораминифер образуют огромные залежи углекислого кальция; многие из этих залежей встречаются вместе с нефтью. Отложения кораллов состоят преимущественно из СаСО3, но некоторые содержат 1 % CaSO4, другие — до 10% MgCO3. Кораллы активно поглощают кальций из морской воды. Он адсорбируется на их мукополисахаридных компонентах и затем соединяется с угольной кислотой, образованной из СО2 в карбоангидразной реакции; конечный продукт процесса — карбонат кальция — идет на построение скелета [84]. Основным источником СО2 при этом служат водоросли — симбионты зооксантеллы. Кальцификация угнетается ингибиторами карбоангидразы, а также удалением зооксантелл. Медузы Aurelia содержат статолиты, состоящие из CaSO4; в морской воде, освобожденной от сульфатов, статолиты не образуются.
Раковины плеченогих могут содержать, кроме карбоната, 50% Са3(РО4)2; некоторые из брахипод содержат также CaF2. Трубки полихет сем. Serpulidae и скелет иглокожих состоят преимущественно из СаСО3 (в виде кальцита) с небольшим количеством фосфатов и сульфатов, а также MgCO3. Трубки полихет, сформировавшиеся летом, содержат больше арагонита, чем трубки, сформированные зимой. У брюхоногих относительно много арагонита, тогда как у двустворчатых моллюсков содержание кальцита и арагонита варьирует. Домик морского желудя состоит из кальцита. Зубцы радулы хитона покрыты оболочкой, состоящей более чем на 65% из магнетита (80% Fe2O3 и 20% FeO) [139].
Раковины моллюсков образуются благодаря секреторной деятельности эпителия на краю мантии. Сначала формируется двояко-преломляющий белковый матрикс, который затем заполняется углекислым кальцием. Источником кальция, накапливающегося в раковине, служит как кальций, всосавшийся в кишечнике и доставляемый кровью, так и кальций, поглощенный клетками мантии непосредственно из морской воды [112]. В течение долгих периодов пребывания вне воды у двустворчатых вырабатываются кислые продукты метаболизма, которые могут быть забуферены кальцием, вымытым из раковины, что позволяет сохранить на постоянном уровне pH крови [57]. Личиночная раковина Crassostrea со
224
Глава 2
стоит из арагонита, в то время как взрослая — из кальцита; в самых твердых раковинах моллюсков содержится больше арагонита, чем кальцита [232].
У многих членистоногих происходит кальцификация хитинового наружного скелета. Крабы перед линькой часто запасают кальций в гепатопанкреасе; речной рак может запасать его в виде гастролитов (жерновок). Образование гастролитов и линька регулируются гормоном глазных стебельков. Удаление последних способству-ет образованию гастролитов и началу линьки [148]. У равноногого [
Limnoria линька протекает в две стадии: сначала линяет задняя Л
половина, после чего большое количество кальция переносится из J
передней части в заднюю, где, таким образом, кальций запасается ]
перед линькой передней половины. Следовательно, у ракообраз- ;
ных существуют различные способы ограничить потери кальция во >
время линьки.
У дождевого червя известковые железы эпителия пищевода вы- | деляют сферулы кристаллов СаСОз, что, по-видимому, является ? способом накопления запасов кальция.
В костях позвоночных СаСО3 находится в виде арагонита, причем отношение Са3Р2О8 к СаСО3 составляет около 7 у млекопи- i тающих и около 11 у рыб (что близко к соотношению, характеризу- |
ющему апатит). Зубы и клыки содержат 2% солей магния, кости— I
меньше чем 0,3%; витамин D регулирует уровень кальция в крови и минерализацию костей путем усиления всасывания его в кишеч- . нике и вместе с паратгормоном и кальцитонином путем мобилиза- • ции Са из костей.
Отношение содержания стронция к содержанию кальция колеблется от 0,1 до 0,8; оно несколько выше у морских, чем у пресноводных животных, но в пределах каждого класса довольно постоянно [200]. Это отношение в организме кишечнополостных, мшанок, полихет и усоногих несколько выше, чем в морской воде.. -тогда как у брюхоногих, двустворчатых и головоногих моллюсков * ниже. В раковинах ископаемых моллюсков отношение Sr/Ca выше, чем у современных видов, хотя в океанической воде это соотношение остается постоянным на протяжении 108 лет [138, 139]. По-видимому, соотношение количества стронция и кальция в боль-, шей мере определяется генетическими факторами, чем условиями среды.
Сбалансированная солевая среда
Для культивирования водных животных было разработано много искусственных сред. Среды для выращивания тканевых культур имеют очень сложный состав, так как должны обеспечивать клетки тканей не только органическими питательными веществами, но и неорганическими компонентами. Часто в культуральную среду добавляют смесь микроэлементов. Иногда элемент, не являю
Неорганические ионы
225
щийся необходимым для выживания, все же ускоряет клеточный рост. Очень важно соблюдать условия стерильности, поэтому в состав культуральных сред включают антибиотики. Среда для выращивания тканей клещей включает 14 аминокислот, помимо солей, сахара и сывороточного альбумина [186]. Обсуждение культуральных сред не входит в задачу настоящей главы, однако состав некоторых типичных сред мы приводим в табл. 2-7 [168, 259].
Сохранение жизнеспособности выделенных тканей имеет большое значение в физиологических опытах, особенно при работе с возбудимыми тканями. Компоненты, добавляемые*в омывающие ткань растворы, обычно подбираются эмпирически, и потому состав этих растворов не обязательно соответствует составу плазмы крови или даже интерстициальной жидкости. Концентрация Na и С1 обычно соответствует их концентрации в крови; количество К в растворе может быть несколько выше, чем в крови, а Са — таким же, как количество свободных ионов Са в плазме крови, или несколько большим. Важно соблюдать правильное соотношение элементов, в частности, (Na+K)/(Ca-|-M.g) [136]. Далее, необходимо добавление соответствующей буферной системы, а также субстратов метаболизма, в особенности в продолжительных экспериментах. Основной недостаток большинства предложенных до сих пор солевых смесей состоит в отсутствии набора органических соединений, омывающих клетки тканей в организме. Недавно в смеси стали добавлять ряд аминокислот, подобранных эмпирически. Второй недостаток этих смесей состоит в отсутствии веществ с большим молекулярным весом для обеспечения коллоидно-осмотического давления, хотя в опытах с перфузированием органов добавление полимеров общепринято.
В табл. 2-7 приведен состав растворов, используемых для под-держания жизнеспособности тканей некоторых довольно распространенных лабораторных животных.
Заключение
Специфическая роль некоторых неорганических ионов в жизненных процессах определилась, по-видимому, еще до начала значительной биологической дифференциации. Эта роль определяется не распространенностью элемента в земной коре или морской воде, а его свойствами: зарядом, формой, размерами, реактивностью (особенно по отношению к воде) и способностью к образованию химических связей. Специфичность часто проявляется в способности активировать какой-либо фермент или детерминировать свойства возбудимых мембран. Постоянство внутриклеточной концентрации ионов более существенно для жизнедеятельности, чем постоянство осмотической концентрации. Из всех клеточных ионов наиболее жестко регулируется калий; концентрация натрия более изменчива и внутри клетки обычно ниже, чем вне ее. Значитель-
15—1332
Физиологические растворы1
Таблица 2-7
NaCl ЦС1 СаС12 MgCl2 NaHCO3 Другие компоненты Источник данных
Искусственная морская вода 493 10,95 10,65 28,0 MgSO4 31
Морская вода 405 8,9 10,0 53,0 2,25 Na2SO4 27,6 [93]
KBr 0,8
455 H3BO3 SrCl2 NaF 0,42 0,15 0,07
Homarus 13,5 16,5 4,0 4,0 H3BO3 + NaOH, буфер [261]
Краб 466 10 10,2 24,8 28,2
Gecarcinus 430 5 9 7 Трис-буфер 10 [210]
Carcinus 585 14 12,7 24,4 NaHCO3 до pH 7,0 [165]
Strombus 430 11 10 58 10 Na2SO4 20 [133]
Кальмар 475 10,3 10,6 53,1 25,7 Фосфат до pH 7,6
Кальмар 436 10,0 9,9 24,3 MgSO4 2,72 [Н9]
224 1,35 1,8 1,1 Буфер до pH 7,6
Морская собака 2,38 Глюкоза 15 [Ю8]
Мочевина 333
Пластиножаберные 134 6,8 6,1 1,1 Глюкоза 5
0,4 Мочевина 208
Искусственная прудовая вода 0,5 0,05 1,0 0,2 [54]
Opalina 60 5 0,1 Трис-буфер до pH 7,8 [157]
Глюкоза Казеин 0,2
A scar is 129 19,2 4,1 4,43 Фосфат до pH 6,7
Пиявка 115 4 1,8 Глюкоза 10 [160]
110 4,9 6,4 18,3 Трис-буфер 10
Пресноводный брюхоногий моллюск MgSO4 3,5 [34]
Arion 43,7 3,5 3,0 MgSO4 Na2HPO4 4,1 0,25 [191]
Речной рак 207 5,4 13,6 2,64 2,4 [241]
Tinea 121,5 2,7 1,8 1,07 11,9 Глюкоза 5,5 [162]
NaH2PO4 0,42
1
uj Cottus 163,9 2,6 2,7 1,0 18 Г люкоза 7
Gastrosteus 170 6 1,6 1,0 2,3 NaH2PO4 Г люкоза 3,2 15
Пресноводные рыбы 101,8 3,38 1,36 2,5 КН2РО4 MgSO4 0,5 1,19
Лягушка 112 1,9 1,1 2,4 КН2РО4 Г люкоза 1,2 11,1
Жаба 124 3,8 1,1 2,4 NaH2PO4 Глюкоза 0,7 1,1
Amphiuma (перфузия почки) 75 з,о 1,8 1,0 20 NaH2PO4 Na2HPO4 0,85 0,56
Locusta 120 2,7 1,8 1,05 6 NaH2PO4 0,14 Глюкоза 12 Г лицин 250 мг Поливинилпирролидон 15 г NaH2PO4 0,17
Carausius 15 18 7,5 50 Глюкоза НРОГ 4,5 6
Таракан Таракан Antherаеа личинка куколка Саранча 210 188 12 4 130,5 3,1 21,2 30 40 10,1 1,8 7,7 3 3 2,0 1,8 18 18 1,98 4 H2POi- 4,5 Фосфатный буфер до pH 7,2 КН2РО4 . 5,5
Ящерица Ящерица 130 116 з,о 3,2 з,о 1,2 2,0 2,0 2,0 NaH2PO4 0,3
Цыпленок 150 5 5 2 20 Глюкоза MgSO4 Глюкоза 1,7 1,4 12
Птицы; раствор Рингера, 117 2,33 5,8 28 MgSO4 2,12
Млекопитающие; раствор Тироде 138 2,7 1,84 1,06 П,9 NaH2PO4 0,5
раствор Кребса 118,9 4,8 2,56 2,5 MgSO4 1,2
Раствор Кребса (модификация) 119 5,0 2,5 1,0 2,5 КН2РО4 Глюкоза NaH2PO4 1,3 20,4 0,5
Раствор Кребса — Бора 119 4,7 1,6 14,9 Глюкоза MgSO4 11,0 1,17
КН2РО4 1,18
[107]
[126а]
[30]
[168]
[260]
[169]
[158]
[247]
[30]
[78]
Продолжение
NaCl КС1 CsCIo MgCl2 NaHCO3 Другие компоненты Источник данных
Крыса' Среда Кребса для млекопитающих Среда для культивирования тканей лягушек Среда для культивирования тканей рыб Культура тканей млекопитающих, 108,5 95,4 114 125 3,5 Кулы 4,8 4,8 5,1 1,5 уральные 2,54 1,8 1,9 среды 1,44 26,2 2,5 1,2 MgSO4 0,69 NaH2PO4 1,67 Глюкоза 5,55 Глюконат Na — соль 9,64 Сахароза 7,6 MgSO4 1,2 КН2РО4 1,25 Глюкоза 20,4 Пируват Na — соль 0,542 г Фумарат Na — соль 0,745 г L-глутамат Na — соль 0,813 г Пенициллин 100 мкг Сыворотка эмбриона теленка 7% Глюкоза 10 NaH2PO4 3,0 MgSO4 0,94 Глюкоза 5,6 Сыворотка 7% [16] [131] [259]
среда Хенкса 138 5,4 1,3 0,49 Na2HPO4 0,25 MgSO4 0,41 Сыворотка 7 % Глюкоза 5,6 [259]
1 Концентрации всех веществ даны в ммолях, за исключением специально обозначенных случаев.
Неорганические ионы
229
Ную часть растворенных веществ в клетках составляют органические анионы; неорганические анионы обычно выполняют роль буферной системы, а также благодаря отрицательному заряду взаимодействуют с некоторыми органическими основаниями. Кальций в клетках представлен главным образом в связанной форме, и потому концентрация его в виде иона очень низка. Уровень концентрации различных ионов внутри клеток определяется генетически, и между разными видами существуют значительные различия; достаточно вспомнить эритроциты с высоким или низким содержанием калия, растения, способные обходиться без натрия, или бактерии с переменным содержанием калия. В организме одного животного концентрация ионов, обладающих специфическими функциями, в разных тканях неодинакова. В некоторых тканях происходит накопление отдельных элементов для последующего их использования или элиминирования.
Регуляция концентрации ионов в клетках производится в первую очередь самой клеткой и лишь во вторую — целостным организмом; изменение ионного состава внеклеточных жидкостей приводит к нарушению функционирования тканей. Регуляция ионного состава плазмы может осуществляться разными способами: с помощью понижения проницаемости мембран, связывания ионов белками, избирательного выделения (через почки и внепочечными путями), активного всасывания. Эти процессы чаще всего протекают под гормональным контролем. Выделительные органы возникли у организмов-осмоконформаторов и вначале служили, по-видимому, для ионной регуляции. Использование экскреторных органов для осморегуляции произошло при освоении новых сред обитания — пресных вод и суши, способность же к выведению азотистых шлаков появилась уже как результат позднейшей специализации. В каждой выделительной системе имеются механизмы транспорта ‘Отдельных ионов. Некоторые из этих механизмов необходимы для избирательного обратного всасывания из профильтрованной жидкости, другие — для активного выделения в мочу и, наконец, третьи — для активного транспорта ионов с помощью экстраре-лальных выделительных органов. Некоторые из перечисленных систем очень сложно устроены и включают в себя активную секрецию из клеток в межклеточные канальца, обеспечивающую локальный осмотический градиент, и последующую активную реабсорбцию; в результате этих процессов происходит циклическое движение отдельных ионов, примером чему могут служить процессы, протекающие в мальпигиевых сосудах или в ректальном комплексе насекомых.
До сих пор ни одна система транспорта какого-либо иона до конца не расшифрована. Наибольшее биологическое распространение имеет натриевый «насос», использующий специфическую АТФазу, активаторами которой служат внеклеточный калий и .внутриклеточный натрий в присутствии магния; ингибитором нат*
230
Глава 2
риевого насоса является гликозид уабаин. Насос функционирует за счет энергии АТФ, и обычно потребление и использование в процессах окисления одной молекулы кислорода позволяет обеспечить энергией транспорт более чем 10 ионов натрия. Эта система транспорта натрия изучалась на эритроцитах, нервах, мышечных волокнах и клетках почек.
Активный перенос ионов в эпителиальных системах может быть направлен как внутрь тела, так и наружу, во внешнюю среду. Транспорт ионов во внешнюю среду имеет место в экскреторных органах, в жабрах морских рыб, в солевых железах птиц. Внутрь тела направлен транспорт ионов в жабрах пресноводных рыб и в коже лягушек. Действие некоторых трансэпителиальных натриевых насосов основано на том же механизме сопряжения с переносом калия, на котором основан и процесс выведения натрия из клетки. В некоторых видах эпителия потребление Na+_ происходит в обмен на Н+ или NHt, а С1~ обменивается на НСОз. Молекулярные механизмы пространственного перемещения транспортируемых ионов остаются пока неисследованными.
Менее подробно изучены процессы активного переноса других ионов, в частности процесс переноса ионов хлора в клетах кожи и мочевого пузыря лягушек или транспорт калия в средней кишке Cecropia — системе, способной переносить другие одновалентные катионы в отсутствие калия. Известно, что существуют также кальциевые и магниевые насосы, однако они мало изучены.
Способность к изменению и регуляции ионной проницаемости и активного транспорта ионов имеет большое значение в процессах адаптации. Так, у многих эвригалинных водных животных проницаемость жабр для натрия и воды ниже в пресной воде, чем в морской. Адаптация к среде при этом осуществляется частично путем изменения проницаемости и частично путем изменения скорости процесса активного транспорта ионов (как это происходит у некоторых рыб). В регуляции проницаемости различных мембран большую роль играют ионы кальция. Однако механизмы рецепции изменения солевого состава среды, процессы интеграции нервной и гормональной регуляторных реакций, а также непосредственные реакции клетки на изменение ионного состава среды — все эти проблемы остаются неизученными. Известно, что проницаемость кожи, жабр и почек по отношению к воде и к натрию регулируется полипептидными гормонами гипофиза, различными у позвоночных разных классов.
Помимо ионов, имеющих общебиологическое значение, существуют элементы, используемые в специфических процессах. Многие из них необходимы в количествах, приближающихся к следовым,, как, например, элементы, принимающие участие в активации какой-либо ферментной системы. Другие (например, медь и железо) входят в состав пигментов, а Са, Mg, Sr и Si являются составными частями скелета. Содержание в тканях элементов, образующих
Неорганические ионы ______________231 скелет, и микроэлементов регулируется главным образом пищевыми и гормональными факторами. Недостаточность определенных элементов в отдельных районах лимитирует расселение ряда животных.
Предел развития многих биологических функции ограничен свойствами неорганических ионов. В то же время живые организмы проявляют очень высокую избирательность в отношении ионов и более строго регулируют свой ионный состав, чем большинство других физических параметров. Особенности, обусловливающие на атомном уровне участие определенных элементов в процессах "жизнедеятельности, составят содержание главы, которую напишет будущее.
СПИСОК ЛИТЕРАТУРЫ1
1. Alvarado R. Н., Kirschner L. В., Comp. Biochem. Physiol., 10, 55—67, 1963. Ionic regulation in Ambystoma.
2. Alvarado R. H., Moody A., Amer. J. PhysioL, 218, 1510—1516, 1970. Na and Cl transport in tadpoles.
3. Anderson E., Harvey W. R., J. Cell Biol., 31, 107—134, 1966. Active transport in midgut of Samia cecropia.
3a. Apgar J. Nutr., 100, 470—476, 1970. Requirement of female rats for zinc.
4. Barnes H. J., J. Exp. BioL, 31, 582—588, 1954. Ionic composition of sea water.
5. Bernard G. R., Wynn R. A., Wynn G. G., BioL Bull., 130, 18—27, 1966. Ions in body fluids of sting ray.
6. Bertrand D., Bull. Amer. Mus. Nat. Hist., 94, 407—455, 1950. Biogeochemistry of vanadium.
7. Biber T. U. L., Curran P. F., J. Gen. PhysioL, 56, 83—99, 1970. Sodium uptake by frog skin.
8. Bielawski J., Comp. Biochem. PhysioL, 13, 423—432, 1964. Chloride transport into gill of crayfish.
9. Binyon J., J. Marine BioL Assoc., 42, 49—64, 1962. Ions in body fluids of Asterias.
10. Bone G. J., Ann. Soc. Roy. ZooL Belg., 75, 123—132, 1944. Sodium-potassium ratio in insect hemolymph.
11. Bonting S. L., Chapter 8, pp. 257—363. In Membranes and Ion Transport, ed. E. E. Bittar, Wiley — Interscience, 1970.
12. Bonting S. L„ Caravaggio L. L„ Arch. Biochim. Biophys., 101, 36—46, 1963. NaK-ATPace in various tissues.
13. Boonkoom V., Alvarado R. H., Amer. J. PhysioL, 220, 1820—1824, 1971. ATPase in gills of Rana tadpoles.
14. Boroffka I., Z. vergl. PhysioL, 51, 25—48, 1965. Ion transport in nephridium of Lumbricus.
15. Boroffka I. Z., vergl. PhysioL, 57, 348—375, 1968. Osmo- and volume regulation in Hirudo.
16. Bretag A. H., Life ScL, 8, 319—329, 1969. Synthetic interstitial fluid for mammalian tissue.
17. Bricker N. S., Biber T., Ussing H. H„ J. Clin. Invest., 42, 88—99, 1963, Transport of ions by frog skin.
1 Обзорные статьи отмечены звездочкой (*)
232
Глава 2
18. Bricteux-Gregoire S., Duchateau-Bosson G., Jeuniaux C., Schoffeniels E., Flor-kin M , Arch. Int. Physiol. Biochem., 71, 393—400, 1963. Ions in body fluids of scorpions.
19. Bricteux-Gregoire S., Duchateau-Bosson S. G„ Jeuniaux C., Florkin M., Arch. Int. Physiol. Biochem., 72, 267—275, 1964. Ions in muscle of oyster.
20. Brodsky W. A., Schilb T. P., Fed. Proc., 26, 1314—1321, 1967. Mechanism of acidification in turtle bladder.
21. Brown A. C., J. Cell. Comp. Physiol., 60, 263—269, 1962. Na absorption by frogs.
22. Brull L., Cuypers У., J. Marine Biol. Assoc. U.K-, 34, 637—642, 1952. Kidney function in Lophius.
23. Bull J. M., Morris R., J. Exp. Biol., 47, 485—494, 1967. Ions in tissues of larva of Lampetra.
24. Burger J. W., Tosteson D. C., Comp. Biochem. Physiol., 19, 649—653, 1966. Ion fluxes in Squalus.
25. Burton R. F., Comp. Biochem. Physiol., 25, 501—508, 1968. Ion regulation in Helix.
26. Burton R. F., Comp. Biochem. Physiol., 2-5, 509—516, 1968. Ion balance in pulmonates.
27. Burton R. F., Comp. Biochem. Physiol., 27, 763—773, 1968. Plasma and muscle ions, invertebrates and vertebrates.
28. Burton R. F„ Comp. Biochem. Physiol., 39A, 267—275, 1971. Cations in land S П 311 s
29. Cade T. J., Tobin C. A., Gold A., Physiol., Zool., 38, 9—33, 1965. Water economy finches.
30. Campbell G., Burnstock G., Wood M., Quart. J. Exp. Physiol., 49, 268—276, 1964. Saline for lizard.
31. Cassidy M. M., Tidball C. S„ Amer. J. Physiol., 217, 674—679, 1969. Ions in mammalian tissues.
32. Century T. J., Fenichel I. R., Horowitz S. B., J. Cell Sci., 7, 5—14, 1970.. Concentrations of ions in amphibian oocytes.
33. Cereijido M., Rotunno C. A., J. Physiol., 190, 481—497, 1967. Sodium transport across frog skin.
34. Chiarandini D. J., Life Sci., 3, 1513—1518, 1964. Saline for pulmonates.
35. Chowdhury T. R., Snell F. M., Biochem. Biophys. Acta, 94, 461—471, 1965. Microelectrode study of asymmetry potentials, frog skin, toad bladder.
36. Clark M. R., Denton E. J., Gilpin-Brown J. B., J. Physiol., 203, 49P — 50P, 1969. Cephalopod buoyancy.
37. Cofre G., Crabbe J., J. Physiol., 188, 177—190, 1967. Sodium transport by colon of Bufo.
38. Cohen M. W„ Gerschenfeld H. M., Huffler S. W., J. Physiol., 197, 363—380, 1968. Ionic environment of neurones and glia in Necturus.
39. Coldman M. F., Good W., Comp. Biochem. Physiol., 21, 201—206, 1967. Ions irt blood of mammals.
40. Coulson R. A., Hernandez T., Biochemistry of the Alligator, Louisiana State University Press, 1964, 133 pp.
41. Curran P. F., Cereijido M., J. Gen. Physiol., 48, 1011—1033, 1965. Na and K. fluxes, frog skin.
42. Curran P. F., Gill J. R., J. Gen. Physiol., 45, 625—641, 1962. Effect of calcium on sodium transport, frog skin.
43. Daniel E. E., Robinson R., J. Physiol., 154, 421—444, 1960. Ion transport in» muscle of uterus.
44. Davis G. /<., in: Copper Metabolism, ed. by W. McElroy and B. Glass, New York, Academic Press, 1950, pp. 216—229. Requirement of cattle for copper.
45. Davson H., Physiology of the Cerebrospinal Fluid, London, Churchill and Boston, Little, Brown & Co., 1967, 445 pp.
45a . Davson H., A Textbook of General Physiology, 4th ed., Vols. I and II, London, Churchill, 1970, 1694 pp.
Неорганические ионы
233
46.
47.
48.
49.
50.
51.
52.
53.
54.
Deffner G. G., Hafter R. S., Biochim. Biophys. Acta, 32, 362—374, 1959. Ion analysis of squid axon. ...
Deffner G. G., Biochim. Biophys. Acta, 47, 378—388, 1961. Amino acids in sauid blood and axon.
Dehnel P. A., Carefoot T. H., Comp. Biochem. Physiol., 15, 377—397, 1965.
Ion regulation, intertidal crabs.
de Jorge F. B. et al., Comp. Biochem. Physiol., 16, 491—496, 1965. Ions in giant earthworm.
de Leersnyder M., Etude Exper. Cahiers de Biol. Marine, 8, 295—321, 1967.
Ion composition of blood and urine in Eriocheir.
Denton D. A., Sabine J. R., J. Physiol., 157, 97—116, 1961. Appetite for salt in sheep.
Deyrup I. J., in: Physiology of Amphibia, ed. by J. A. Moore, New York, Academic Press, 1964, pp. 251—328, Water balance in kidney.
Diecke F. P., W eidler D. J., Z. vergl. Physiol., 64, 372—399, 1969. Effect of cations on conduction in nervous system of insect Carausius.
Dietz T. H., Alvarado R. H., Biol. Bull., 138, 247—261, 1970. Ionic regulation
in Lumbricus.
55. Dietz T. H., Kirschner L. B., Porter D., J. Exp. Biol., 46, 85—96, 1967. Tran-sepithelial P. D.’s in larval salamanders.
56. Djangmat J. S„ Comp. Biochem. Physiol., 32, 709—731, 1970. Copper in tissues and blood in Crangon.
56a. Duchateau G., Flor kin M., Leclercq J., Arch. Int. Physiol. Biochem., 61, 518—
549, 1953. Ions in insect hemolymph.
57. Dugal L. P., J. Cell. Comp. Physiol., 13, 235—251, 1939. Calcium in shell as buffer in clams.
58. Dunham P. B., Biol. Bull., 126, 373—390, 1964. Adaptation of Tetrahymena to NaCl.
59. Dunham P. B., Child F. M., Biol. Bull., 121, 199—140, 1961. Ion regulation and Tetrahymena.
€0. Ehrenspeck G„ Schraer H., Schraer R., Amer. J. Physiol., 220, 967—972, 1971. Calcium transfer by avian shell gland.
<61. Engbaack L., Hoshiko T., Acta Physiol. Scand., 39, 349—355, 1957. Electrical potantial gradients through frog skin.
62. Epstein F. H., Katz A. L, Pickford G. E., Science, 156, 1245—1247, 1967.
Na-K ATPase in gills of Fundulus.
63. Evans D. H., J. Exp. Biol., 50, 179—190, 1969. Water and salt balance in teleost Pholis.
64. Evans J. V. et al., Proc. Roy. Soc. bond. B, 148, 249—262, 1958. Genetic differences in K+ and Na+ in red cells, sheep.
65. Finn A. L., Amer. J. Physiol., 218, 463—469, 1970. Ion transport in toad bladder.
66. Fletcher C. R., J. Exp. Biol., 53, 425—443, 1970. Regulation of Ca and Mg in Nereis.
67. Fletcher C. R., Comp. Biochem. Physiol., 35, 105—123, 1970. Metabolism of iodine by polychaete.
68. Fletcher G. L., Stainer L. M„ Holmes W. N., J. Exp. Biol., 47, 375—391 _n lS61L.ArFase*alt glands of duck.
69. ; Florkin AL, Duchateau-Bosson G., Jeuniaux C., Schoffeniels E. Arch Int Physiol. Biochem., 72, 892-906, 1964. Osmotic and ionic regulation in Eriocheir. &
70. Frazier H. S., Dempsey E. F., Leaf A., J. Gen. Physiol., 45, 529—543, 1962. (See reference 71.)
71. Frazier H. S , Leaf A J. Gen. Physiol., 46, 491—515, 1963. Active sodium transport in toad bladder.
72. Friz С. T., Comp. Biochem. Physiol., 38A, 477-482, 1971. Cations in amoebae.
73. Fromm P. O., Comp. Biochem. Physiol., 10, 121-128, 1963. Ion excretion in
234
Глава 2
74. Garrahan Р. J., Glynn I. M., Nature, 207, 1098—1099, 1965. Sodium pump in red blood cells.
75. Germain P„ Gagnon A., Comp. Biochem. PhysioL, 26, 371—375, 1968. Ions-in blood of hagfish.
76. Giebisch G., J. Gen. PhysioL, 44, 659—678, 1961. Transport by nephrons of Necturus.
77. Gifford C. A., Publ. Inst. Marine Sci. U. Texas, 8, 97—125, 1962. Osmotic and ionic regulation. Callinectes and Ocypode.
78. Ginsberg B. L., J. PhysioL, 150, 707—717, 1960. Chicken Ringer solution.
79. Glynn I. M., Brit. Med. Bull., 24, 165—169, 1968. Membrane ATPase and ca-rion transport.
80. Glynn I. P., Comp. Biochem. PhysioL, 26, 937—946, 1968. Ions in relation to moult cycle of Homarus.
81. Goffart M., Function and From in the Sloth, Pergamon Press, 1971, 225 pp.
82. Goffart M., Nys J., Arch. Int. PhysioL Biochem., 73, 166—168, 1964. Water balance in sloths.
83. Gonzalez C. F., Shamoo У. E., Wyssbrod H. R., Solinger R. E., Brodsky W. A.,. Amer. J. PhysioL, 213, 333—340, 1967. Transport across turtle bladder.
84. Goreau T., Endeavour, 20, 32—39, 1961. Calcium deposition in reef corals.
85. Greenaway P., J. Exp. BioL, 54, 199—214, 1971. Calcium regulation in snaili Limnaea.
86. Greenwald L., PhysioL Zool., 44, 149—161, 1971. Sodium balance in frog.
86a. Greenwald L., PhysioL Zool., 44, 149—161, 1972. Km values.
87. Greenwald L„ Kirschner L. B., Amer. ZooL, 11, 664, 1971.
88. Gross W. J., BioL Bull., 127, 447—466, 1964. Water and regulation in crabs..
89. Gross W. J., PhysioL Zool., 36, 312—324, 1963. Ion balance in terrestrial crab s
90. Gross W. J., Capen R. L., BioL Bull., 131, 272—291, 1966. Excretion of ions in crab Pachygrapsus.
91. Haggag G., Raheem K- A., Khalil F., Comp. Biochem. PhysioL, 16, 457—465,.
1965. Ions in blood of reptiles.
92. Harrison F. M., J. Exp. BioL, 39, 179—192, 1962. Excretion in Haliotis.
93. Harvey H. W., The Chemistry and Fertility of Sea Waters, Cambridge University Press, 1955, 224 pp.
94. Harvey W. R., Haskeli J. A., Zerahn K-, J. Exp. BioL, 46, 235—248, 1967;
54, 269—274, 1971. Active transport by midgut of moth larva.
95. Hayes F. R. et al., J. Marine BioL Assoc. U. K-, 26, 580—589, 1947. Inorganic-constituents of molluscs.
95a. Hobden D. J., Canad J. ZooL, 48, 83—86, 1970. Storage excretion of heavy metals, freshwater mussels.
96. Hobson A. D. et al., J. Exp. BioL, 29, 22—29, 1952. Ions in Ascaris.
97. Hodgkin A. L., Keynes R. D., J. PhysioL, 128, 28—60, 1955. Active transport of cations in giant axons from Sepia and Loligo.
98. Hoffman J. F., pp. 13—17 in Biophysics of Physiological and Pharmacological Action, ed. by A. M. Shanes, AAAS meeting, 1960. Cation transport.
99. Hoffman J. F., Circulation, 26, 1201—1213, 1962. Cation transport and structure of the red cell plasma membrane.
100. Hokin M. R., Hokin L. E., J. Gen. PhysioL, 50, 793—811, 1967. Salt secretion in bird salt gland.
101. Holley A., Regondaud P., Compt. Rend. Soc. BioL, 157, 1100—1102, 1963. Ionic composition of isopod Porcellio.
102. Holmes W. N., Fletcher G. L., Stewart D. J., J. Exp. BioL, 48, 487—508,. 509—520, 1968. Salt excretion by duck.
103. Holmes W. N., Stainer I. M., J. Exp. BioL, 44, 33—46, 1966. Renal excretion-! of salts by trout.
104. Horne F. R., Comp. Biochem. PhysioL, 19, 313—316, 1966. Ionic regulation in tadpole shrimp.
105. Horowicz P., Burger J. W., Amer. J. PhysioL, 214, 635—642, 1968. Sodium transport in dogfish Squalus.
Неорганические ионы fjfo
106. Houston А. Н., Madden I. A., Nature, 217, 969—970, 1968. Plasma electrolytes in. earn
107. Hudson R. C. L., Comp. Biochem. Physiol., 25, 719—725, 1968. Physiological saline for fish.
108. Hugnel H., Z. vergl. Physiol., 42, 63—102, 1959. Sahne for fish heart.
,109. Hunt С. E., Landesman J., Newberne D. M., Brit. J. Nutr., 24, 607—614, 1970. Copper deficiency in chickens.
HO. Jampot L. M., Epstein F. H„ Amer. J. Physiol., 218, 607—611, 1970. Na-K ATPase in gills of marine and freshwater fish.
111. Jampot L. M„ Epstein F. H., Amer. J. Physiol., 218, 607—611, 1970. Salt glands of elasmobrachs.
112. Jodrey L. H„ Wilbur K. M., Biol. Bull., 108, 346—358, 1955. Calcium deposition in oyster shells.
113. Kakubu N., Hidaka T., Nature 205, 1028—1029, 1965. Vanadium and niobium in ascidians.
114. Kamemoto F I., Spalding A. E., Keister S. M., Biol. Bull., 122, 228—231, 1962. Ion balance in earthworms.
115, Kamiya M., Utida S., Comp. Biochem. Physiol., 26, 675—685, 1968. ATPase in gills of eel.
116. Kerkut G. A- Thomas R. C., Comp. Biochem. Physiol., 14, 167—183, 1965. Sodium pump in nerve cells.
117. Kerley D. E., Pritchard A. W., Comp. Biochem. Physiol., 20, 101—113, 1967. Osmoregulation in crayfish.
118. Kerstetter T. H., Kirschner L. B., Rafuse D. D., J. Gen. Physiol., 56, 342—359, 1970. Na uptake by rainbow trout.
119. Keynes R. D., J. Physiol., 117, 119—150, 1952. S’quid saline.
420. Kidder C. W., Cerejido M., Curran P., Amer. J. Physiol., 207, 935—940, 1964. Potential differences across frog skin.
12L Kirschner L. B., J. Cell. Comp. Physiol., 45, 61—87, 1955.
121a. Kirschner L. B., Amer. J. Physiol., 217, 596—604, 1969. Sodium fluxes in perfused eel gills.
121b, Kirschner L. B., Amer. Zool., 10, 365—376, 1970. NaCl transport in aquatic animals.
122. Kirschner L. B„ Kerstetter T., Porter D., Alvarado R. H., Amer. J. Physiol., 220, 1814—1819, 1971. Adaptation of Ambystoma larvae to saline medium.
123. Klahr S., Bricker N. S., J. Gen. Physiol., 48, 571—580, 1965. Sodium transport by turtle bladder.
124. Koizumi T., Sci. Rep. Tohoku Univ., ser. IV, 10, 269—275, 277—286, 1935. Inorganic composition of tissues in holothurian Caudina, and effect of changes in the medium.
i!24a. Kovalskii V., Vorotaitskaya I. E., Dokl. Akad. Nauk SSSR, 187, 1422—1424, 1969. Interaction of Mo and Cu.
125. Krogh A., Osmotic Regulation in Aquatic Animals, Cambridge University Press, 1939, 242 pp.
126. Lahlou B., Henderson J. W., Sawyer W. H., Amer. J. Physiol., 216, 1266— 1278, 1969. Renal adaptation in toadfish Opsanus.
126a. Lam T. J., Comp. Biochem. Physiol., 31, 909—913, 1969. Ringer solution for stickleback fish.
327. Lange R„ Comp. Biochem. Physiol., 13, 205—216, 1964. Osmotic adjustments, echinoderms and molluscs.
128. Leaf A., Ann. Rev. Physiol., 22, 111—168, 1960. Ion transport, toad bladder.
<129. Lee B. D., McFarland W. N., Publ. Inst. Marince Sci. U. Texas, 8, 126—142, 1962. Osmotic and ionic regulation in Squilla.
330. LeFevre M. E., Gennaro J. F., Brodsky W. A., Amer. J. Physiol., 219, 716— 723, 1970. Transport by isolated turtle bladder.
Й31. Liebowitz A., Amer. J. Hygiene, 78, 173—180, 1963. Frog tissue culture medium.
236
Глава 2
132. Little С., J. Exp. Biol., 43, 23—37, 1965. Osmotic and ionic regulation in snail Viviparus.
133. Little C., J. Exp. Biol., 46, 459—474, 1967. Ionic regulation in conch Strom-bus.
134. Lockwood A. P. M., J. Exp. Biol., 36, 546—555, 556—565, 1959. Ion regulation in fresh water isopod Asellus.
135. Lockwood A. P. M., Animal Body Fluids and their Regulation, London, Heinemann, 1963, 177 pp.
136. Lockwood A. P. M., Comp. Biochem. Physiol., 2, 241—289, 1969. Catalog of physiological salines.
137. Lockwood A. P. M., Piegel J. A., J. Exp. Biol., 51, 575—587, 1969. Excretion magnesium by Carcinus.
137a. Loewe R. et al., Z. vergl. Physiol., 66, 27—34, 1970. Spider Cupiennis hemolymph.
138. Lowenstam H. A., J. Geol., 69, 241—260, 1961. Mg and Sr in fossil brachio-pods.
139. Lowenstam H. A., pp. 114—132, in: Isotopic and Cosmic Chemistry, ed. by H. Craig, New York, Humanities Press, 1963. Sr/Са ratios in fossil gastropods.
140. Lowenstam H. A., pp. 137—195, in: The Earth Sciences, ed. by T. W. Donnelly, Chicago, University of Chicago Press, 1963. Composition of earth sediments.
141. Mackay W. C., Comp. Biochem. Physiol., 30, 481—488, 1969. Sulfate regulation in jellyfish.
142. Mackay W. C„ Prosser C. L„ Comp. Biochem. Physiol., 34, 273—280, 1970. King crab concentrations.
142a. Maetz J., Phil. Trans. Roy. Soc. bond. B, 262, 209—249, 1971. Review, ion transport by fish gills.
143. Maetz J., Romeu F. G., J. Gen. Physiol., 47, 1195—1207, 1964. Na and Cl uptake gills of goldfish.
144. Mandel L. J., Nature, 225, 450—451, 1970. Ionic transport across biological membranes.
144a. Maniloff J. et al., Effects of Metals on Cells, Subcellular Elements and Macromolecules, Charles C Thomas, Springfield, 1970, 397 pp.
144b. Martin A. W., Stewart D. M., Harrison F. M., J. Exp. Biol., 42, 99—123, 1965. Urine formation in pulmonate land snail Achatina.
145. Martin D. W., Curran P. F., J. Cell. Physiol., 67, 367—374, 1966. Reversed potentials in isolated frog skin.
146. Mayer N., Comp. Biochem. Physiol., 29, 27—50, 1969. Ion regulation in Rana.
147. Mayer N., Nibelle J., Comp. Biochem. Physiol., 31, 589—597, 1969. Sodium space in eels.
148. McWhinnie M A., Comp. Biochem. Physiol., 7, 1—14, 1962. Gastroliths in crayfish.
149. Medway W„ Gerach I., Amer. J. Physiol., 209, 169—172, 1965. Blood composition in dolphin Tursiops.
150. Miles H. M., Smith L. S.. Comp. Biochem. Physiol., 26, 381—398, 1968. Ionic regulation in migrating salmon.
151. Minnich J. E., Comp. Biochem. Physiol., 35, 921—933, 1970. Ion balance in desert Iguana.
152. Morris R., J. Exp. Biol., 42, 359—371, 1965. Salt balance in Myxine.
153. Morris R.t Bull J. M., J. Exp. Biol., 52, 275—290, 1970. Osmoregulation of larva of Lampetra.
154. Motais R., Ann. Inst. Oceanogr. Monaco, 45, 1—84, 1967. Mechanisms of osmotic and ionic regulation in fish.
155. Motais R., Romeu F. G., Maetz J., C. R. Acad. Sci. Paris, 261, 801—804, 1965. Responses of flounder and serran on transfer to fresh water.
156. Motais R., Romeu F. G., Maetz J., J. Gen. Physiol., 50, 391—422, 1966. Exchange diffusion in teleosts.
Неорганические ионы
237
157. Naitoh Y,. Zool. Mag., 73, 267—274, 1964. Physiological saline for Opa-
158. lNarahashi T„ Adv. Insect. Physiol., 1, 175—256, 1963. Physiological salines for insects. т .
159. Neumann D., Kieler Meeresforsch., 18, 38—54, 1962. Ions in brackish water animals. л
160. Nicholls J. G., Baylor D. A., J. Neurophysiol., 31, 740—756, 1968. Physiological saline for a leech.
161. Nicholls J. G., Huffier S. W., J., Neurophysiol., 27, 645—671, 1964. Ion distribution in nervous system of leech.
161a. Oglesby L. C., Comp. Biochem. Physiol., 36, 449—466, 1970. Salt and water balance in Nereis.
162. Ohnesorge F. K., Z. vergl. Physiol., 58, 153—170, 1968. Saline for fish T inca.
163. Okin D. E., Whittenburg G., Windhage E. E., Solomon S. Amer. J. Physiol., 204, 372—376, 1963. Na fluxes in tubules of Necturus.
164. Padmanabhanaidu B., Comp. Biochem. Physiol., 17, 157—166, 1966. Ions in blood of scorpion.
165. Pantin C. F. A., J. Exp. Biol., 11, 11—27, 1934. Saline for Carcinus.
166. Parry G., J. Exp. Biol., 31, 601—613, 1954. Ionic regulation in prawn Pa-laemon.
167. Parry G., J. Exp. Biol., 38, 411—427, 1961. Osmotic and ionic changes in migrating salmon.
167a. Passoro H. et al., Pharmacol. Rev., 13, 185—224, 1961. Pharmacology of heavy metals.
168. Paul J., Cell and Tissue Culture, 4th ed., Baltimore, Williams & Wilkins, 1970.
169. Pichon У., J. Exp. Biol., 53, 195—209, 1970. Ionic content of hemolymph, cockroach.
170. Pichon У., Boistel J., J. Insect. Physiol., 9, 887—891, 1963; J. Exp. Biol., 47, 357—373, 1967; 49, 31—38, 1968.
171. Pickford G. E., Grant F. B., Science, 155, 568—570, 1967. Osmotic concentration of coelacanth Latimeria.
172. Poldervaart A., pp. 119—144, in: Geol. Soc. Amer. Sp. Paper 62, ed. by A. Poldervaart, New York, 1955. Chemistry of the earth’s crust.
173. Post R. L., pp. 19—30, in: Biophysics of Physiological and Pharmacological Action, ed. by A. M. Shanes, AAAS meeting, 1960. Sodium and potassium transport in human red cells.
174. Potts W. T. W., J. Exp. Biol., 31, 376—385, 1954. Composition of blood, Mytilus and Anadonta.
175. Potts W. T. W., Ann. Rev. Physiol., 30, 73—104, 1968. Osmotic and ionic regulation.
176. Potts IE. T. W., Evans D. H., Biol. Bull., 133, 411—425, 1967. Sodium balance in Fundulus.
177. Potts W. T. IE., Fleming IE. R., J. Exp. Biol., 53, 317—327, 1970. Hormone effects on ion and water regulation in Fundulus.
177a. Potts W. T. IE., Foster M. A., Rudy P. P., Howells G. P„ J. Exp. Biol. 47 461——4/0, 1967.
178. Potts IE. T. IE., Todd M., Comp. Biochem. Physiol., 16, 479—489, 1965. Kidney function in Octopus.
179. Prosser C. L., Green J. IE., Chow T. J., Biol. Bull., 109, 99—107, 1955. Ionic balance in Pachygrapsus.
179a. Prosser C. L., Mackay IE., Rato K„ Physiol. Zool., 43, 81—89, 1970. Ions in marine and fresh-water fish.
180. Quinn D. J., Lane С. E., Biol. Bull., 133, 245—254, 1967; Comp. Biochem. Physiol., 19, 533—543, 1966. Ion transport by gill of land crab.
181. Ramamurthi R., Comp. Biochem. PhysioL, 23, 599—605, 1969. Metabolic responses to salinity stress in fresh water crab.
238____________________________________Глава 2_____________________________________
182. Ramsay J. A., J. Exp. Biol., 31, 104—113, 1954; 32, 183—199, 1955; 33, 697— 708, 1956. Excretion by stick insect Dixippus.
183. Ramsay J. A., J. Exp. Biol., 26, 46—56, 65—75, 1949. Chloride excretion by earthworms. , „
184*. Ramsay J. A., J. Exp. Biol., 30, 358—369, 1953; Symp. Soc. Exp. Biol., 8, 1—15, 1954. Movements of electrolytes in insects and other invertebrates.
185. Read L. J., Comp. Biochem. Physiol., 39A, 185—192, 1971. Body fluids and urine of holocephalan fish.
186. Rehacek J., Brzostowski H. W„ J. Insect. Physiol., 15, 1431—1436, 1969. Physiological saline for tissues of ticks.,
187. Rider J., Thomas S., J. Physiol., 203, 72P —73P, 1969. Vasopressin influence on Na transport by frog skin.
188. Riedesel M. L., Volk G. E., Nature, 177, 668, 1956. Serum magnesium in hibernants.
189. Riegel J. A., J. Exp. Biol., 43, 379—384, 1965; 48, 587—596, 1968. Renal functions in crayfish.
190. Riegel J. A., Lockwood A. P. M., J. Exp. BioL, 38, 491—499, 1961. Excretion by Carcinus.
191. Roach D. K., J. Exp. Biol., 40, 613—623, 1963. Ion analysis, blood of snail.
192. Robertson J. D„ J. Exp. Biol., 26, 182—200, 1949; 30, 277—296, 1953. Ionic regulation in marine invertebrates.
193*. Robertson J. D., pp. 229—246, in: Physiology of Invertebrate Animals, ed. by В. T. Scheer, University of Oregon Press, 1957. Ionic regulation by invertebrates.
194. Robertson J. D., J. Exp. Biol., 31, 424—442, 1954. Composition of blood of lower chordates.
195. Robertson J. D., J. Exp. Biol., 37, 879—888, 1960. Composition of muscle of hagfish and eel.
196. Robertson J. D., J. Exp. BioL, 38, 707—728, 1961; 42, 153—175, 1965. Composition of muscle in lobster and cephalopods.
197. Robertson J. D., BioL Bull., 138, 157—183, 1970. Osmotic and ionic regulation in Limulus.
198. Roeser H. P., Lee G. R., Nacht S., Cartwright G. E., J. Clin. Invest., 49, 2408— 2417, 1970. Ceruloplasmin in iron metabolism.
199. Romeu F. G., Salibean A., Pezzani-Hernandez S., J. Gen. Physiol., 53, 816— 835, 1969. Na and Cl uptake through skin of frog.
200. Rosenthal H. L., Eves M. M., Cochran O. A., Comp. Biochem. Physiol., 32, 445—450, 1970. Strontium and calcium in skeletons.
201. Rothschild L., Barnes H., J. Exp. BioL, 30, 534—544, 1953. Ions in sea-urchin eggs.
202. Rudy P. P., Comp. Biochem. Physiol., 18, 881—907, 1966. Sodium balance in Pachygrapsus.
202a. Salome Pereira R., Sawaya P., Bol. Fac. Fil. Cien. Univ. Sao Paulo Zool. no. 21, 85—92, 1957. Ions in blood of elasmobranchs.
202b. Schroeder H. A. et al„ J. Nutr., 100, 59—68, 1970. Metal toxicity in rats.
202c. Schwarz K„ Milne D. B., Science, 174, 426—428, 1971. Growth effects of vanadium in rat.
203. Sharp G. W. G„ Coggins C. EL, Lichtenstein N. S., Leaf A., J. Clin. Invest., 45, 1640—1647, 1966. Permeability of toad bladder.
204. Sharrat В. M., Jones I. C., Bellamy D., Comp. Biochem. Physiol., 11, 9—18, 1964. Water and salt composition and renal function in eel.
205. Shaw J., J. Exp. BioL, 32, 383—396, 1955. Ionic regulation in muscle of Carcinus.
206. Shaw J., J. Exp. BioL, 36, 126—144, 1959; 38, 135—152, 1960. Sodium fluxes in crayfish.
207. Shaw J., Sutcliffe D. W., J. Exp. BioL, 38, I—15, 1961. Sodium balance, two species of Gammarus.
Неорганические ионы
239
208. Shehadeh Z. Н., Gordon М. S., Comp. Biochem. Physiol., 30, 397—418, 1969. Osmotic and ionic regulation in rainbow trout.
209. Skadhauge E., Maetz J., C. R. Acad. Sci. Paris, 265, 347—350, 1967. Water permeability of teleost gill.
210. Skinner D. M., Marsh D. J., Cook J. S., Biol. Bull., 129, 355—365, 1965. Physiological saline for crab Gecarcinus.
211. Skou J. C„ Biochim. Biophys. Acta, 42, 6—23, 1960. Na-K ATPase in nerve membranes. . „.
212. Skou J. C., Prog. Biophys. Molec. Biol., 14, 133—166, 1964; Physiol. Rev., 45 596—617, 1965. Active transport by cell membranes.
213. Smith P. G., J. Exp. Biol., 51, 727—738, 739—757, 1969. Ionic relations of Artemia.
214. Smith R. L, J. Exp. Biol., 53, 75—92, 93—100, 1970. Chloride regulation at low salinities by Nereis.
215. Snell F. M„ Leeman С. P., Biochim. Biophys. Acta, 25, 311—320, 1957. Na transport by frog skin.
216. Solomon A. K., Amer. J. Physiol., 204, 381—386, 1963. Fluxes across priximal 111h111 pNprfurijs kidnev
217. Spangenberg D. B., J. Exp. Zool., 169, 487—500, 1969. Statoliths in Aurelia.
218. Steinbach H. B., J. Gen. Physiol., 44, 1131—1142, 1961. Sodium extrusion by frog sartorius.
219. Steinbach H. B., Biol. Bull., 127, 310—319, 1962. Ionic balance in plana-rians.
220. Steinbach H. B., pp. 677—720, in: Comparative Biochemistry, vol. 4, by M. Florkin and H. S. Mason, New York, Academic Press, 1962. Comparative biochemistry of alkali metals.
221. Steinbach H. B., Perspectives in Biology and Medicine, 5, 338—355, 1962. The prevalence of potassium.
222. Stobbart R. H., J. Exp. Biol., 36, 641—653, 1959. Sodium regulation in larvae of Aedes
223. Stobbart R. H., J. Exp. Biol., 54, 19—27, 1971. Na and Cl exchanges during slat uptake, Aedes larva.
224. Sutcliffe D. W., J. Exp. Biol., 39, 325—343, 1962. Composition of hemolymph, aquatic insects.
225. Sutcliffe D. W., J. Exp. BioL, 55, 325—370, 1971. Ionic balance in gammarids.
226. Thesleff S., Schmidt-Nielsen K., Amer. J. Physiol., 202, 597—600, 1962.
Electrophysiology of salt glands of gulls.
227*. Thorson T. B., Life Sci., 9, 893—900, 1970; pp. 265—270, in: Sharks, Skates and Rays, ed. by P. Gilbert, R. Mathewson, and D. P. Rail, Johns Hopkins University Press, 1967. Osmoregulation and urea ^content in elasmobranchs from sea, brackish and fresh waters.
228. Thorson T. B., Cowan С. M., Watson D. E., Science, 158, 375—377, 1967,
229. Thuet P„ Motais R., Maetz J., Comp. Biochem. Physiol., 26, 793—819, 1968. Ionic regulation in Artemia.
230* . Tosteson D. C., Fed. Proc., 22, 19—26, 1963. Genetics of active transport, red. cells.
oqo* leSteSOn В' C’’ Fed- Proc-, 26, 1805, 1967. Ion composition in red cells.
232 . Lracey M. V., Adv. Comp. Physiol. Biochem., 3, 233—270, 1968. Biochemistry of skeletons.
233. Treherne I. E., J. Exp. Biol., 42, 7—27, 1965. Ion distribution and axon function in stick insect Carausius.
234. Treherne J. E., Lane N. J., Moreton R. B., Pichon Y., J. Exp. Biol., 53, 109— 136, 1970. Potassium fluxes in Periplaneta nervous system
235. Tucker L. E., Comp. Biochem. Physiol., 36, 301—319, 1970. Ionic regulation in gastropod Scutus.
236. Turekian K. K„ Armstrong R. L„ J. Marine Res., 18, 133—151, 1960. Sr, Ba, and calcite-aragonite in shells.
237. Umminger B. L„ Nature, 225, 294—295, 1970. Ions in blood of Fundulus.
240
Глава 2
238. Urist М. R., pp. 151—179, in: Bone Biodynamics, ed. by H. M. Frost, Boston, Little, Brown & Co., 1964. Composition of skeleton in fishes.
239. Ussitig H. H., Windhagen E. E„ Acta Physiol. Scand., 61, 484—504, 1964. Paths of sodium transport in frog skin.
240. Utida S. et al., Comp. Biochem. Physiol., 38A, 443—447, 1971. ATPase activity in eel gill.
241. Van Harreveld A., Proc. Soc. Exp. Biol. Med., 34, 428—432, 1936. Physiological saline for crayfish.
:242*. Vinogradov A. P., The Elementary Composition of Marine Organisms. Memoir Sears Found. Mar. Res. II, Yale University Press, 1953, 647 pp.
.243. Webb D. A., Proc. Roy. Soc. bond. B, 129, 107—136, 1940. Osmotic and ionic regulation in Carcinus.
244. Webb D. A., Publ. Staz. Zool. Napoli, 28, 273—288, 1956. Vanadium in marine invertebrates.
245*. Webb D. A., Fearon W. R., Sci. Proc. Roy. Dublin Soc., 21, 487—503, 505— 539, 1937. Chemical elements in marine animals.
246. Webber И. H., Daniel P. A., Comp. Biochem. Physiol., 25, 49—64, 1968. Ion balance in gastropod Acmaea.
247. Weevers R. de G„ J. Exp. Biol., 44, 163—175, 1966. Physiological saline for moths.
248. Weidler D. J., Diecke F. P. J., Z. vergl. PhysioL, 69, 311—325, 1970. Regulation of Na/K in relation to nervous functions in Carausius.
249. Weischer M. L., Zool. Beitr., 11, 517—540, 1965. Copper metabolism in Helix.
250. Whittam R., pp. 313—325, in: The Neurosciences, ed. by F. O. Schmitt, Rockefeller Press, New York, 1967. Molecular mechanisms of active transport.
251. Whitiam R., Ager M. E., Biochem. J., 97, 214—227, 1965. The connection between active cation transport and metabolism in erythrocytes.
252. Whittam R., Willis J. S., J. Physiol., 168, 158—177, 1963. Ion accumulation by kidney slices.
253. Whittembury G., Sugino N., Solomon A. K„ J. Gen. PhysioL, 44, 689—712, 1961. (See reference 253a).
253a. Whittembury G., Windhagen E. R., J. Gen. PhysioL, 44, 679—687, 1961. Ion permeability and electrical potentials in Necturus kidney tubules.
254. Wiederholt M. et aL, J. Gen. PhysioL, 57, 495—525, 1971. Saline for Am-phiuma.
255. Wieser W., J. Marine BioL Assoc. U. K., 45, 507—523, 1965. Copper metabolism in isopods and amphipods.
256*. Williams R. J. P., BioL Rev., 28, 381—415, 1953. Metal ions in biological systems.
257. Willis J. S., Biochem. Biophys. Acta, 163, 516—530, 1968. Cation transport and respiration in kidney slices.
258. Winkler L. R., Veliger, 11, 268—271, 1969. Bromine in Aplysia.
259. Wolf R., Quimby M. C., pp. 253—305, in: Fish Physiology vol. Ill, ed. by W. Hoar and D. J. Randall, New York, Academic Press, 1969. Culture media for fish tissues.
260. Wood D. W„ J. PhysioL, 138, 119—139, 1957. Physiological saline for Carausius.
261. Wright E. B., Tomita T., Amer. J. PhysioL, 202, 856—864, 1962. Na and К carriers in crustacean axons.
262. Zadunaisky J. A., Canolia O. A., Nature, 195, 1004, 1962. Active transport of Na and Cl by the isolated skin of frog Leptodactylus.
263. Zaugg W. S., Mclain L. R., Comp. Biochem. PhysioL, 38B, 501—506, 1971. Increased gill Na-K. ATPase in salmon in sea water.
264. Zerahn R., Acta PhysioL Scand., 36, 300—318, 1956, O2 consumption and active Na transport in isolated and short circuited frog skin.
Глава 3
Питание
л. ПРОССЕР
Пищевые потребности животных различаются очень сильно в зависимости от того, какие питательные вещества данный организм может синтезировать и какие должны поступать извне. Однако в целом потребности животных однородны и удовлетворяются за счет трех категорий питательных веществ, необходимых в весьма различных количествах. К первой категории относятся те вещества, которые служат источником энергии; они должны поступать в количестве, достаточном для обеспечения энергией процессов роста и жизнедеятельности, обычно порядка нескольких граммов на 1 кг веса тела в сутки. Ко второй категории относятся вещества типа аминокислот, пуринов и некоторых липидов, которые должны поступать с пищей в количестве нескольких миллиграммов в день или синтезируются самим животным; они используются для построения углеродных скелетов более сложных органических молекул. Наконец, к третьей категории относятся специфические вещества — витамины и коферменты, потребность в которых составляет несколько микрограммов на 1 кг веса тела в сутки.
Животные весьма различаются по своим способностям использовать различные вещества в качестве источников энергии, превращать одни питательные вещества в другие и синтезировать специфические соединения. Так, вещество, играющее роль витамина для одного животного, может не представлять питательной ценности для другого. Белки животных различаются по своему аминокислотному составу, но сами аминокислоты, из которых они состоят, сходны у всех организмов. Одинаковы во всех клетках и коферменты клеточного обмена, такие, как фосфопиридиннуклеотиды. Однако потребность животных в аминокислотах и коферментах различна в зависимости от того, могут ли они синтезировать данные аминокислоты и коферменты или должны получать их с пищей. Поступление таких веществ извне необходимо и в тех случаях, когда их биосинтез протекает недостаточно интенсивно. Наконец, многие животные получают важнейшие питательные вещества от симбиотических бактерий.
Питание животного определяется средой обитания, но на выбор пищи часто в большей степени влияют ее вкусовые качества,
16-1332
242
Глава 3
чем питательная ценность (гл. 13). Травоядные, плотоядные, всеядные и животные со специализированным питанием обычно различаются по своим возможностям переваривать пищу (гл. 4). Основные же типы питания сложились еще до появления современных животных, и эволюция функции питания изобилует примерами утраты способности к специфическому синтезу и возникновения обусловленной этим зависимости от внешней среды.
Происхождение типов питания
В зависимости от используемых источников энергии все организмы делятся на три группы: 1) хемотрофы (главным образом бактерии) получают энергию за счет неорганических реакций, таких, как окисление железа или серы; 2) фототрофы используют солнечный свет для фотосинтеза; 3) гетеротрофы окисляют имеющиеся органические соединения разной степени сложности: некоторые могут использовать низкомолекулярные жирные кислоты, например уксусную кислоту, но большинству необходимы сахара или более сложные углеводы.
По источникам получения азота организмы подразделяются на 1) автотрофов (большинство фотосинтезирующих водорослей и высших растений), которые могут использовать неорганический азот в виде нитратов или аммиака; 2) мезотрофов, использующих отдельные аминокислоты (или аммиак и органические кислоты), и 3) метатрофов, требующих многих аминокислот в связанной форме или в виде смесей. В конечном счете все животные, за исключением зеленых жгутиковых (простейшие), зависят от фотоавто-трофных растений, так как получают от них энергетический материал в виде углеродсодержащих соединений. Жгутиковые интересны необычным разнообразием типов питания: среди них встречаются фотосинтезирующие организмы, гетеротрофы, организмы, усваивающие нитраты и аммиак, изредка мезотрофы или метатро** фы. Многие жгутиковые нуждаются в тех или иных витаминах, в частности в кобаламине. Словом, питанию жгутиковых свойственны черты, характерные для питания как растений, так и животных.
Согласно современным представлениям о происхождении жизни, выдвинутым Опариным, первичные организмы были гетеротрофными и потребляли готовые органические соединения, затем появились фототрофы и, наконец, те гетеротрофы, которых мы сейчас называем животными.
По данным геохимии, возраст Земли составляет от 4,5 до 5 млрд. лет. Газы, высвобождавшиеся из щелочных пород земной коры и при извержении вулканов, создали атмосферу, которая состояла из N2, Н2, СО, Н2О и некоторого количества СО2, и фиксировали pH океанской воды между 8 и 9. Ультрафиолетовое излучение Солнца способствовало образованию HCN. Раньше считали, что первыми источниками С и N для процессов биосинтеза были
Питание 243
метан и аммиак, но, согласно современным представлениям, наиболее вероятным первоисточником этих элементов является HCN. Облучение растворов HCN ультрафиолетовым светом или пропускание через них электрического разряда приводит к синтезу NH3 и аминокислот, главным образом серина и глицина, а также пировиноградной кислоты и некоторого количества метана [1]. В смеси HCN, NH3 и Н2О происходит синтез аденина и амидов [98]. Облучение же растворов метана, аммиака и водорода приводит к синтезу разнообразных аминокислот и низкомолекулярных жирных кислот и пуринов [91]. Аналогичные небольшие органические молекулы были найдены в метеоритах, а лабораторные опыты показали, что органические вещества могут образовываться под действием космического излучения даже в отсутствие воды. Дополнительным источником энергии на древней Земле было и вулканическое тепло. Обнаружено, что при осторожном нагревании аминокислот они полимеризуются в некоторых предпочитаемых последовательностях, и в результате иногда, синтезируются белковоподобные вещества, обладающие каталитической активностью в процессах гидролиза, декарбоксилирования, аминирования, дезаминирования и окисления-восстановления [45, 46, 56].
Искусственные пептиды после того, как их длина достигнет 8—10 аминокислотных остатков, обычно скручиваются в «-спираль, причем процесс скручивания ускоряет полимеризацию [50]. В первичном «органическом бульоне», покрывавшем Землю, процесс образования белковых молекул шел за счет L-аминокислот. Очень рано, по-видимому, появились металлоорганические комплексы, в том числе железопорфирины, которые могли играть роль мощных катализаторов в реакциях окисления с выделением энергии. Отсюда недалеко было и до фотохимических превращений.
Таким образом, синтез белковых молекул, вероятно, являлся уже достаточно сложным процессом к тому времени, когда сформировался механизм трансляции. Белковые «протоклетки» могли образовываться путем формирования поверхностей с избирательными свойствами [46].
Среди многих небольших органических молекул, возникших в условиях примитивной Земли, были пурины, пиримидины и рибозы [13]. Известно, что нагревание нуклеозидов вместе с неорганическими фосфатами приводит к образованию нуклеотидов, причем для образования, например, уридинфосфата и его циклизации необходимо участие таких конденсирующих агентов, как синильная кислота [85]. Вероятно, образование нуклеиновых кислот шло независимо от белков, а их комплексы возникли уже позднее.
Полипептидные цепочки образуют с полинуклеотидами специфические комплексы, так что положительно заряженные остатки аминокислот связываются с отрицательно заряженными нуклеотидами, причем последние стабилизируют полипептидную цепь [82]. Полилизин образует комплекс с АТ-полимером, полиаргинин —
1 п*
244
Глава 3
с ГЦ-полимером [44]. Если в полилизине лизиновые остатки через один заменить какой-либо другой аминокислотой, то такая молекула будет связываться лишь с одной из двух цепей двухцепочечного полинуклеотида. Были предложены разнообразные модели возникновения кодонов и механизма трансляции участка нуклеиновой кислоты в последовательность аминокислот [121].
Первые организмы представляли собой агрегаты нуклеопротеидов, способных к самоудвоению (дупликации) и связанных с другими белками, осуществляющими ферментативное расщепление органических веществ с высвобождением энергии [50]. Эти первичные гетеротрофные организмы обладали свойствами, составляющими основу всего живого. Для них были характерны: способность использовать энергию макроэргических фосфатных связей для выполнения различных жизненных функций; ступенчатый перенос электронов в промежуточном обмене; использование металлопро-теидов в качестве катализаторов окислительных процессов; включение L-аминокислот в естественные белки; активный транспорт ионов через клеточные мембраны; использование одних ионов внутри клеток и удаление других; избирательная проницаемость мембран; регуляция белкового синтеза нуклеиновыми кислотами и многие другие свойства, общие для всего живого.
Химическая эволюция длилась значительно дольше, чем последовавшая за ней эволюция биологических молекул. Начавшаяся затем эволюция живого (биохимическая и биофизическая) протекала неравномерно: гораздо более длительной была эволюция до появления современных видов животных, чем после их появления. Может быть, именно этим и объясняется, что подобие живых организмов проявляется гораздо ярче, чем их различия.
По мере истощения запасов абиогенных органических соединений все большую эволюционную ценность приобретали механизмы синтеза, и постепенно из первичных гетеротрофных организмов развились фотоавтотрофы и отдельные хемоавтотрофы. Ранними гетеротрофами и хемотрофами были в основном прокариотические бактерии, а первыми протоавтотрофами — прокариотические сине-зеленые водоросли [1116]. Первые протоавтотрофы появились 1,8-109 лет назад (2-109 по Баргхорну и Тайлеру [7]) (рис. 3-1). Этой же цифрой исчисляется и возраст некоторых полосчатых отложений окислов железа. По-видимому, железо связывало О2, который образовывался при фотосинтезе и был токсичным для существовавших тогда анаэробных прокариотов. Кислород, выделявшийся фотоавтотрофами, изменил состав атмосферы от анаэробного (с восстановительными свойствами) до аэробного (с окислительными свойствами), в результате чего рост анаэробов затормозился, а ультрафиолетовое солнечное излучение стало задерживаться атмосферой.
Прокариоты и эукариоты отличаются друг от друга не только способом питания, но имеют гораздо более существенные разли-
Питание
24£>
чия. У эукариотов имеется оформленное плотное ядро, митохондрии, где локализованы реакции энергетического обмена, эндоплазматическая сеть и микротрубочки, расположенные по системе 9-|-2 в каждом жгутике; у прокариотов эти структуры отсутствуют [89а]. Самым ранним ископаемым остаткам водорослей-эукариотов приписывается возраст 1,6-109 лет [7]. Если организмы для
Годы*Ю9 (без масштаба)
•Многоклеточные
Осадочный CaSOi/
Палеозой
О^-ол-окисюше ПЖФ -lrs-s——
Эукариоты
Увеличение Ог
Уменьшение СОг Образование озона
Совершенствование окислительно-восстановительных ферментов
7, 8-2,0
I
интенсивное осаждение Са Mg(Co3)z
+СаСо3
Красноцветные слои
0г б атмосфере
Прокариоты
Биогенное образование Ог в гидросфере в подвижном равновесии с + *
I Допалеозой
(докембрии^
пжф
’ Первые автотрофы. Разнообразные формы прокариотов
Биогенез
Высокоэнергетпическое ультрафиолетовое излучение, достигающее поверхности Земли, химическая эволюция
Атмосфера, образованная ювенильными газами. Нет свободного Ог
3,2 i 0,1 --------Захват Луны?Частичное плавление
Дегазация
Сведения нечеткие или отсутствуют
4,6 ± 0,2 Древнейшие метеориты и земной свинец
Рис. 3-1. Основные черты предполагаемых взаимосвязей в эволюции биосферы, литосферы и атмосферы на примитивной Земле '[17].
ПЖФ — полосчатые железорудные формации.
восстановления СО2 используют энергию света или каких-либо неорганических реакций, то они, как правило, в качестве источника азота способны использовать нитраты или аммиак [17].
Изменения в составе атмосферы и накопление органических веществ в результате фотосинтеза вновь сделали возможным существование гетеротрофных организмов; началась эволюция животных. Фототрофйя и гетеротрофия не всегда четко отделены друг от друга; так, некоторые фотосинтезирующие жгутиковые способны к фагоцитозу, а многие бесцветные жгутиковые являются хищниками. Гетеротрофия развивалась у эукариотов как наряду, так иг без потери фотосинтезирующих способностей.
246
Глава 3
Весь О2 атмосферы образовался за счет фотосинтеза, причем его полное обновление происходит в течение 2000 лет, а кругооборот СО2 совершается за 300 лет [8].
Многоклеточные возникли довольно быстро и от нескольких предшественников в период раннего кембрия (от 520 до 440 млн. лет назад), так как фактически все экологические ниши были свободны.
Начиная от жгутиковых с их разнообразными типами питания, у животных наблюдается все возрастающая специализация и зависимость организма от окружающих источников питания. Основной состав пищи, потребляемой животным, отчасти обусловлен положением этого животного в трофической цепи. Многие животные используют микроорганизмы-симбионты не только для синтеза витаминов, но и для переваривания основной пищи. Известны такие организмы, которые содержат в тканях фотосинтезирующие зооксантеллы и используют продукты их обмена для собственного питания.
Потребности в углероде и азоте
Фототрофные зеленые жгутиковые (хлорофлагелляты) на свету непосредственно восстанавливают СО2, а в темноте в качестве источника энергии используют сахара или органические кислоты. Бесцветные жгутиковые (лейкофиты) произошли от зеленых форм, ’ и некоторые их виды могут менять цвет и форму тела в зависимости от степени освещенности. Лейкофитов успешно культивируют на уксусной и других органических кислотах, их виды различаются между собой по потребляемым кислотам. Многие жгутиковые используют низшие жирные кислоты и спирты и не могут питаться сахарами. Phototheca использует насыщенные жирные кислоты (вплоть до пальмитиновой) и некоторые спирты, но муравьиная кислота и дикарбоновые кислоты для нее непригодны.
Polytoma caeca может использовать кислоты вплоть до валериановой (С5), но не капроновую, и тем не менее она способна усваивать гексиловый спирт [120]. Chlamydomonas питается только жирными кислотами и спиртами с четным числом углеродных атомов, а также молочной и трикарбоновыми кислотами, спирты же с нечетным числом углеродных атомов (от трех и выше) подавляют ее рост. Chilomonas использует только жирные кислоты с четным числом углеродных атомов, спирты, молочную кислоту и кислоты цикла Кребса. Кислоты с нечетным числом атомов (от трех и выше) подавляют его рост, а сахара вообще не используются этим организмом [27]. У некоторых жгутиковых способность к использованию специфических субстратов изменяется благодаря ферментной индукции.
Некоторые кишечнополостные существуют в симбиозе с водорослями, которые путем фотосинтеза снабжают хозяина жирными
Питание
247
кислотами. У зеленой гидры около 10% углерода, фиксированного-симбиотическими водорослями, усваивается самим животным в виде глюкозы или мальтозы [93]. У рифовых кораллов от 35 до 50% общего усвояемого углерода появляется в тканях главным образом в виде глицерина [94]. Аналогичным образом внутриклеточные водоросли используются также простейшими губками, свободно-живущими плоскими червями и моллюсками. Другим примером зависимости многоклеточных от микроорганизмов в получении ряда органических веществ являются жвачные животные. Бактерии рубца (и в меньшей степени простейшие рубца) синтезируют низкомолекулярные жирные кислоты, в основном уксусную, которые всасываются в кишечнике хозяина (стр. 310). Термиты, по-видимому, питаются главным образом низкомолекулярными жирными кислотами, которые образуются в их пищеварительном тракте симбиотическими жгутиковыми из целлюлозы.
Многие паразиты могут питаться только частично переваренной пищей. Так, некоторые виды ленточных червей используют отдельные моносахара, но не дисахариды. Например, паразитирующий у акулы Lacistorhynchus может использовать глюкозу и галактозу, но не маннозу, фруктозу, мальтозу, сахарозу и лактозу [104].
Инфузории Tetrahymena могут синтезировать углеводы и жирные кислоты из уксусной кислоты. Они хорошо развиваются на среде, содержащей глицерин, уксусную кислоту и кислоты цикла Кребса, и обычно эту инфузорию культивируют на среде, содержащей в качестве основного источника энергии глюкозу. Они могут усваивать также левулезу, маннозу и мальтозу, но не используют другие 13 сахаров, в том. числе сахарозу [68]. Tetrahymena, подобно растениям и многим бактериям, использует в качестве источника энергии также глицин путем использования глиоксилат-ного цикла; у многоклеточных не хватает двух ферментов глиокси-латного цикла —изоцитразы и малатсинтетазы.
Некоторые взрослые формы насекомых в норме питаются исключительно сахарами. Взрослые медоносные пчелы могут жить на любом из 7 сахаров, имеющих для них сладкий вкус, а также на 6 безвкусных сахарах, но не усваивают пять других безвкусных для них сахаров. Взрослые мясные мухи могут потреблять все пентозы, кроме фукозы, и все гексозы, кроме сорбозы; хорошо усваиваются ими мальтоза, сахароза, трегалоза и мелезитоза и в малой степени — лактоза и целлобиоза; имеется лишь слабая корреляция между использованием сахара и вкусовой стимуляцией предплюсны насекомого [57]. Из всех глюкозидов мясные мухи используют только а-глюкозиды и а-галактозиды [47]. Древоточцы Ips cembrae плохо культивируются на среде, не содержащей сахарозы, глюкозы или фруктозы [6] .
Взаимные превращения углеводов, жиров и белков изучены лучше всего у млекопитающих. В тканях ряда животных, как и У бактерий, происходит фиксация некоторого количества СО2 на
248
Глава 3
пировиноградной кислоте с образованием щавелевоуксусной кислоты. Такое карбоксилирование, вероятно, имеет место в большинстве клеток; например, если дать мыши вдохнуть небольшое количество 14СО2, то спустя несколько минут 14С обнаружится в гликогене печени. Однако в норме фиксация СО2 не играет большой ро--ли в общем углеводном балансе. В пище крыс уксусная кислота может частично заменить углеводы. Млекопитающие, в том числе .и человек, нуждаются в белках и жирах — источниках незаменимых аминокислот и жирных кислот, но они могут обойтись без углеводов.
Вообще потребность в углеродных соединениях определяется в основном потребностью в калориях. Человеку в среднем необходимо от 65 ккал/ч во время сна и до 500 ккал/ч при напряженной работе. Калорийная ценность различных пищевых веществ в килокалориях на 1 г составляет приблизительно 4,1 для белков и углеводов и 9,3 для жиров.
Относительно немногие организмы — азотфиксирующие бактерии и грибы — могут усваивать атмосферный азот. Большинство фотосинтезирующих растений может усваивать нитраты. Так, сине-зеленые водоросли используют NO3 или аммиак, но не газообразный азот. Некоторые бесцветные жгутиковые (Astasia и 'Chilomonas) нуждаются в аммиаке как источнике азота [70].
Всем животным, кроме жгутиковых, необходимы смеси аминокислот. Жвачные млекопитающие имеют симбиотических бактерий, которые синтезируют необходимые аминокислоты из аммиака и мочевины. В рубце из NH3 и аминокислот образуются также пурины, поставляющие значительную часть выделяемого азота [39]. Другие млекопитающие усваивают в небольшом количестве аммонийные соли, добавленные к смеси незаменимых аминокислот.
Многих животных — простейших, насекомых и позвоночных — удавалось культивировать или содержать на смесях аминокислот ® качестве единственных источников азота. Некоторые из них нуждались также в экзогенных пуринах и пиримидинах, тогда как .другие могли синтезировать эти вещества самостоятельно. Ленточные черви, по-видимому, не способны использовать цельные белки и нуждаются в свободных аминокислотах; их естественная среда •обитания — кишечник хозяина — богата аминокислотами. Некоторые инфузории (Tetrahymerui) прекрасно усваивают аминокислоты в качестве единственного источника азота, тогда как другие — хищные инфузории (Stylonichia, Euplotes) — растут только в присутствии белка или полипептидов [77]. Инфузория Paramecium aurelia не нуждается в дополнительном источнике углерода, если среда содержит адекватное количество аминокислот [115].
В заключение укажем, что промежуточные продукты распада трех основных классов питательных веществ включаются в общие .для всех животных пути ферментативных превращений, а следовательно, используются сходным образом и даже могут превра
Питание
249
щаться друг в друга. Различия в пищевых потребностях гетеротрофов в отношении источников азота и углерода обусловлены главным образом различиями в пищеварительных ферментах, катализирующих начальные этапы распада веществ в тканях.
Идентификация специфических факторов пищи
В процессе биохимической эволюции возникла потребность в органических соединениях определенных типов. Они стали незаменимыми для построения и функционирования протоплазматических структур. Для синтеза белков, углеводов, жиров и нуклеиновых кислот требуются определенные структурные компоненты.. Кроме того, в процессе эволюции появились ферменты, катализирующие реакции синтеза и выделения энергии; эти ферменты состоят из белков и специфических кофакторов. Позднее появилась функциональная специализация в одной или нескольких тканях отдельных групп животных. Вместе с этим возникли потребности в-особых углеродных соединениях.
Эволюция пищевых потребностей отчасти состояла в утрате способности к синтезу тех или иных соединений. Поэтому некоторые вещества, необязательные для одного животного, незаменимы для другого. Во многих случаях незаменимые питательные вещества синтезируются симбиотическими микроорганизмами, и поэтому хозяину в отсутствие таких микроорганизмов требуются дополнительные «витамины», в которых нет надобности при наличии обычных симбионтов. Другие организмы, например паразиты, живут в среде, богатой незаменимыми веществами, и пользуются только’ экзогенными источниками. В качестве примера, иллюстрирующего потребность организмов в сбалансированном рационе, можно привести личинок мухи Agria, которые лучше всего растут в среде, содержащей аминокислоты и глюкозу в отношении 2,25 : 0,5 [67].
Многие незаменимые питательные вещества необходимы в гораздо больших количествах для роста, чем для поддержания жизни взрослой особи. Эти вещества называются «факторами роста». Потребность в таком незаменимом питательном веществе устанавливается по замедлению роста или появлению каких-либо физиологических дефектов у взрослого животного, выросшего на диете, лишенной данного вещества. Первым требованием, предъявляемым к подобным опытам, являются стерильные условия для исключения каких бы то ни было других организмов, особенно бактерий, дрожжей и простейших. В пищевой рацион подопытного животного сначала вводят белки и углеводы, а также стерильный экстракт Дрожжей, печени или другую сложную биологическую смесь. Затем белки заменяют более мелкими фрагментами и, наконец, сводят рацион к смеси аминокислот, а экстракт ткани заменяют раз’ личными витаминами.
Таблица 3-1 а
Стерильная среда для культивирования трех видов простейших. Соответствующие компоненты даны в мг/100 мл среды
Tetrahy-тепа [68] Paramecium aurelia LI15J Crithidla [79]
Глицин — 40 —
Валин 15 80 66
Лейцин 50 60 97
Серин 15 80 —
Лизин 30 50 76
Изолейцин 30 40 63
Г истидин 250 20 21
Аргинин 40 60 43
Фенилаланин 10 40 50
Тирозин 5 20 20
Триптофан 12 15 12
Пролин — 40 —
Глутаминовая кислота 250 —
Треонин 30 80 44
Метионин 25 25 34
Тиамин 0,5 1,5 0,2
Биотин 0,0001 0,0001 0,02
Рибофлавин 0,3 0,5 0,2
Ниацин 2,0 0,5 0,5
Пиридоксин 0,2 0,5 0,4
Фолиевая кислота 0,05 0,5 0,2
Пантотенат кальция 3 1,0 0,8
Стерины — Стигма-стерин 0,2 ——
Холин — 0,3
Пурины Гуанилат Аденозин Аденин
12 22,5 Гуанозин 37,5 5
Пиримидины Урацил 6 Цитидин 22,5 Тимидин 20,0 Уридин 22,5
Тиоктовая кислота 0,01 0,01 —
Глюкоза (экв.) 400 50 100
Питание
251
Таблица 3-16
Стерильная среда для культивирования четырех видов насекомых. Соответствующие компоненты даны в мг/100 мл среды, кроме столбца
Tribolium, где все величины выражены в г/100 г сухого веса
Tribolium [81] Oncopeltus [116] Hymenole-Pis [10] Hylemla [49]
Аланин 120 80 15 175
Глицин 400 100 17,8 ПО
Валин 2440 80 23,4 136
Лейцин 1470 80 — 235
Серин 240 80 21 8-8
Лизин 1800 120 36,4 134
Изолейцин 1950 80 26,2 126
Гистидин 1050 80 31 48
Аргинин 600 270 42 80
Фенилаланин 1470 40 33 101
Тирозин 730 40 36,2 124
Триптофан 490 80 40,8 175
Пролин 240 80 23 168
Оксипролин 120 — — 38
Глутаминовая кислота 2440 140 29,4 440
Аспарагиновая кислота 500 26,6 122
Треонин 1700 140 21,3 38
Метионин 980 40 29,8 34
Цистеин —— 40 — 48
Цистин 240 — 48 —
Аспарагин — 550 26,4
Глутамин — 150 29,2 —
Тиамин 0,1 2,5 — 0,15
Биотин 0,005 0,1 — 0,002
Рибофлавин 0,2 0,5 — 0,24
Ниацин 0,8 10 — 1,0
Пиридоксин 0,1 2,5 — з,о
Фолиевая кислота 0,002 0,5 — 0,6
Пантотенат кальция 0,4 5,0 0,6
Стерины (холестерин) 1000 — — 10
Холин 150 50 — 2
Карнитин 0,001 — — —
Пурин — 40 РНК 100
Инозит — 50 — 33
Пиримидин — — 30 Тимин
0,4
Сахар 69 300 50 000 200 1500
Многие виды простейших животных культивируют обычно в среде, содержащей следующие вещества: какой-либо белок типа казеина в качестве источника аминокислот, сахар (или низкомолекулярную жирную кислоту), экстракт дрожжей или печени и некоторые витамины. В табл. 3-1 а и 3-16 приведен состав культуральных сред для нескольких выбранных видов животных, которые хорошо развиваются на известных питательных компонен
252
Глава 3
тах. Эти смеси подобраны эмпирически и не отражают минимальных потребностей.
Количественная оценка питания весьма затруднительна, поскольку иногда потребность в одном веществе проявляется только в отсутствие другого. Кроме того, незаменимые соединения могут быть замещены родственнными соединениями или предшественниками. Наконец, один компонент пищи может снижать потребность в другом, более привычном или может частично и даже полностью замещать его. Другая трудность состоит в том, что, прежде чем использовать пищу, животное должно поглотить ее, а оно может отказаться от предложенной пищи, несмотря на ее питательную полноценность.
Иногда потребность в данном веществе обнаруживается только во втором поколении; очевидно, в таких случаях с яйцами передаются небольшие количества этого вещества, достаточные для одного поколения, особенно у насекомых.
Обзор данных по незаменимым питательным веществам показывает, что одни из них являются необходимыми в пределах классов и, возможно, типов, а другие — для отдельных родов и даже видов. Большинство незаменимых компонентов действительно требуется для деятельности клеток всех организмов, но многие животные не нуждаются в их поступлении извне, потому что сами их синтезируют. Способность к биосинтезу некоторых веществ сохранилась у всех животных, но многие пути синтеза утрачены: одни в самом начале эволюции животных, другие при становлении определенных классов или типов, третьи в результате генетических мутаций у отдельных видов и даже линий.
Удовлетворительной классификации всех питательных веществ не существует, однако их можно сгруппировать согласно способу их использования.
1. Некоторые органические соединения служат для образования углеродных скелетов или важных боковых групп органических молекул; они необходимы в относительно больших количествах (0,5—2 г в сутки для человека). Обычно их могут заменить органические гомологи или вещества с принципиально сходной структурой. Наиболее изученные представители этой категории — незаменимые аминокислоты.
2. Небольшие органические молекулы (необходимые в тех же количествах, что и предыдущая группа питательных веществ), из которых затем синтезируются макромолекулы. Потребности в этих веществах сильно варьируют у разных животных. Сюда относятся пурины, незаменимые жирные кислоты и стеролы.
3. Другие незаменимые питательные вещества играют роль коферментов в отдельных реакциях промежуточного обмена. Они требуются в малых количествах (0,1—1 мг в сутки для человека) и объединяются в группу водорастворимых витаминов.
Питание
253
4. Еще одну группу составляют соединения, которые необходимы для функциональной активности отдельных специализированных тканей; потребность в них менее универсальна. Примером могут служить некоторые жирорастворимые витамины. Они напоминают гормоны, которые действуют на специфические органы. Потребность в коферментах возникла очень рано и распространена наиболее широко. Потребность в специфических аминокислотах появилась несколько позже в процессе эволюции, но тоже очень давно. Наконец, может существовать потребность в специфических соединениях, ранее выполнявших другую, ныне утраченную функцию.
Потребность в аминокислотах
Во время роста организма непрерывно синтезируются новые белки. У взрослых животных обновление белка в организме происходит с различной скоростью; полупериод обновления всего белка составляет 17 сут у крысы и 80 сут у человека [111а]. Для синтеза белка животному всегда требуются одни и те же двадцать аминокислот, но нужны они в различных пропорциях. Кроме того, специфические аминокислоты необходимы для синтеза различных небелковых азотсодержащих соединений. Некоторые аминокислоты требуются как источник углеродного скелета, и тогда они могут быть заменены аналогами; например, фенилпировиноградная кислота может быть путем аминирования превращена в фенилаланин, который затем превращается в аланин.
Фотоавтотрофные организмы могут синтезировать любую из двадцати обычно встречающихся аминокислот, но большинство животных утратило способность синтезировать некоторые из этих аминокислот. Некоторые белки неполноценны в питательном отношении, так как в них отсутствуют отдельные незаменимые аминокислоты. Зеин является неполноценным белком для млекопитающих, поскольку в нем недостает триптофана, лизина, цистеина и оксипролина; в гемоглобине человека и быка не хватает изолейцина, но содержится много метионина; в гемоглобине собаки, напротив, много изолейцина и не хватает метионина. В яичном альбумине очень мало лейцина и глутаминовой кислоты, а в казеине мало глицина. Таракан Blatella хорошо развивается на фибрине или казеине, хуже — на яичном альбумине и пшеничном глутине и очень плохо — на зеине, желатине и гемоглобине [83]. Tetrahyme-па усваивает белки рыбной муки и яичный альбумин вдвое эффективнее, чем белки соевых бобов и льняных семян и почти совсем не использует желатин. Для мучного червя Tenebrio лактальбумин является более бедным белком, чем казеин, однако его питательную ценность можно улучшить добавлением аргинина, тирозина или смеси этих и других аминокислот [28]. В питании человека и Домашних животных сбалансированная диета в том случае, если
254
Глава 3
в пище недостаточно аминокислот, создается добавлением синтетических аминокислот. Кроме того, ведется селекция генетических линий зерна, богатого определенными аминокислотами, например злаков, богатых лизином. Если пшеничная мука служит единственным источником белка, то рекомендуется обогащать ее лизином в дозе 0,75—1 г на 1 кг белка. Основной лимитирующей аминокислотой зерна является лизин, на втором месте стоит метионин, за исключением случаев диеты с высоким содержанием зеина, когда лимитирующей аминокислотой становится триптофан.
Идентификация незаменимых аминокислот проводилась путем 1) систематического исключения каждой аминокислоты из диеты, 2) измерения способности (или отсутствия ее) к включению 14С из жирных кислот или сахаров в аминокислоты. Некоторые аминокислоты не являются незаменимыми, но они оказывают значительное стимулирующее действие на рост и необходимы в качестве питательных добавок на определенных стадиях развития. Количественная потребность в каждой аминокислоте зависит от баланса других аминокислот. Взаимопревращения аминокислот очень широко распространены, и одни из них могут служить предшественниками других. Поступление какой-либо аминокислоты в большом количестве может привести к недостаточности другой, ставшей теперь лимитирующей. Например, если к субоптимальной диете добавить один треонин, рост крыс будет замедляться, пока не добавят в нужном количестве и триптофан. При добавлении лейцина к диете, содержащей 9% казеина, прирост веса тела меньше, чем без добавки, но если одновременно добавить еще и изолейцин, то восстанавливается нормальный рост [40].
Токсическое действие отдельных аминокислот снимается не только другими аминокислотами, но и некоторыми витаминами группы В. Например, избыток метионина на фоне малобелковой казеиновой диеты отрицательно влияет на состояние животного, но его действие нейтрализуется пиридоксином [40]. Естественные аминокислоты принадлежат к L-ряду и усваиваются гораздо лучше, чем D-аминокислоты. Однако поведение D-аминокислот может быть весьма различным: одни из них усваиваются, другие не усваиваются, но безвредны, а третьи токсичны. Следовательно, говорить о незаменимости аминокислот можно только при учете других компонентов пищи.
В табл. 3-2 суммированы последние данные по заменимым и незаменимым аминокислотам (с учетом перечисленных выше ограничений). Самым удивительным является сходство в потребностях у всех животных. По-видимому, способность к синтезу девяти (или десяти) аминокислот была утрачена очень рано в процессе эволюции животных. Это и создало основной тип потребностей в аминокислотах, на который накладываются специфические потребности отдельных животных. Установлено, что некоторые аминокислоты служат стимуляторами роста, но не являются жизненно необ
Питание
255
ходимыми для взрослого животного; другие аминокислоты могут взаимно заменять друг друга.
Tetrahymena gelei, штамм W, была первой из ресничных инфузорий, которую удалось культивировать на синтетической среде с известным химическим составом; при этом потребовалось 10 аминокислот (табл. 3-2). В этих опытах метионин можно было заменить гомоцистеином как серусодержащей аминокислотой [77], и рост стимулировался глицином или серином. Из шестнадцати штаммов Т. gelei только одному был необходим экзогенный серин; у этого штамма отсутствовала альдолаза, которая синтезирует серин из треонина. Четырнадцать штаммов могли синтезировать серин из глицина или треонина, если в среде имелся витамин фолиевая кислота [30]. У Tetrahymena тирозин снижает потребность в фенилаланине, но не может заменить его полностью, а цитруллин и орнитин снижают потребность в аргинине [76]. Гистидин является токсичным; в высоких концентрациях D-изомеры треонина, изолейцина и триптофана не усваиваются, а D-аргинин усваивается [77]. Цистеин и гомоцистеин могут снижать потребление метионина у Tetrahymena', количественные потребности в этих кислотах зависят от наличия других аминокислот. При культивировании инфузории Paramecium aurelia глицин можно заменить серином, если одновременно присутствует и тимидин.
У Crithidia — жгутикового, относящегося к семейству трипано-сомид, паразитирующего у комара, — фенилпировиноградная кислота может заменить фенилаланин; цистеин, цистатионин и гомоцистеин могут заменить метионин, а цитруллин (но не орнитин) — аргинин [79]. Ленточные черви используют не белки, а аминокислоты, содержащиеся в кишечнике хозяина; Hymenolepis синтезирует L-аминокислоты при наличии в среде сс-кетоглутаровой, пировиноградной или щавелевоуксусной кислот и солей аммония [25].
Некоторые насекомые растут на смесях аминокислот, используемых в качестве единственного источника азота (табл. 3-16). Личинкам мясной мухи Calliphora не требуется пролин. Личинки мухи Phormia используют вместо метионина цистеин и вместо глутаминовой кислоты аспарагиновую [60]. Для жука Oryzaephilus необходим аргинин, который может быть заменен цитруллином, но не орнитином; аргинин может синтезироваться также из аланина и пролина, и потребность в этих двух аминокислотах отпадает, если аргинин присутствует в нужных количествах. Цистеин может заменить цистин, но в высоких концентрациях он токсичен; токсичность его можно уменьшить, увеличив концентрацию метионина [27]. Совка Agrotis не может использовать углерод из глюкозы для синтеза тирозина, но зато может синтезировать тирозин из фенилаланина [73]. В отсутствие лейцина, изолейцина и валина тараканы Blatella достигают половой зрелости, но откладывают нежизнеспособные яйца [54]. Для бабочки-листовертки Argyrotaenia
Потребности животных
X я К ft И г" s S я S К S § Д' ® s a я ft ft ’ft R £2 о t So g* ft « £ < CQ О S
Гистидин
Простейшие Tetrahymena pyri-formis [38, 771 Paramecium, aurelia -— + + +
[И5] Paramecium multi-micronuncleatum [71] Crithidia [79] -I- Стам. Или глицин + — —
Аскариды Caenorhabditis [33] Насекомые —. — — t -г
Phornda [60] — — -I— — 1 —1—
Phormia [74] — — -I— —— + + _L 1
Bombyx [69] — — + —I— + —
Musca [14] Calliphora [112] Drosophila [59] Стам. — “j— + + + + ~ь
Aedes, larva [114] Agrotis [49] (+ Кук.) -— Стам. 1 +
Apis [86] Apis [29] A.rgyrotaenia [107] — — + + —р —— + + Н—F+
Ракообразные Astacus [122] и « — — |'.w + + — *4~
1 -J—J--J- + + line + Или ЦИТО- 1 -Г 4~ 4~ + цитозин Или —1— 4~ + Аргинин
— ~j—[— —|-• — —1 4 тирозин Или + + -1-1 + 4~ Фенилаланин
1 1 *”F" НИН ! Или ала- 1 I 1 1 НИН ала- Или 4- 4- + 4~ [ Тирозин
_j—1—[_ +1 —p" 4~- 1 4~ 1 Триптофан
1 Стим. 1 Стим. 1 1 1 4~ 1 ] — 4~ | Пролин
1 1 1 g 1 1 1 1 III Оксипролин
1 1 1 1 лота к s <> 1 новая раги- аспа- тт Или лота кис- ратиновая ! аспа- Или | Стим. Глутаминовая кислота
1 1 1 1 1 1 лота кис- вая МИНО- глута- Или лота кис- вая МИНО- I глута- 1 Или Стим. [ | Аспарагиновая кислота
+ H—1—H — ++l~ 4 ~j— ~j— Стим. 4~ 4~- Треонин
+ Стим. Стим. —1 1—j— 4 тин 1 цис- 1 Или ЦИС-1 тин Или 4~ 4- 4~ Метионин
1 НИНО 1 мети- Или 1 метионин Или 4~- | Цистеин
1 4~ + +Кук. 4~ ! Цистин
Co О
s
co bO
j аминокислотах1
258
Глава 3
Глицин Аланин В ал нн Лейцин Серин Лизин Изолейцин Гистидин ,
Позвоночные Лосось [551
Цыпленок [4] Стим. — —Н — + •— +
Крыса [109] —* — — ——— — 1 •— —
Человек [109] II -1.. —I—.
Рост
1 Стим. — стимулирует рост, но не требуется; — не требуется; + требуется; + Рост —
па основании анализа тушек составлялась диета. Выяснилось, что несбалансированные питательные смеси можно использовать при наличии высоких концентраций аминокислот или при увеличении концентраций одних заменимых аминокислот; цистеин снижал по- | требность в метионине, а тирозин — в фенилаланине [107]. Муха | Phormia может обходиться без тирозина, если в пище присутству- Г ет аланин [74]. Для шелкопряда Bombyx гистидин не является незаменимой аминокислотой, но при его добавлении улучшается рост личинок, особенно в отсутствие аспарагиновой кислоты; цистеин I снижает потребность в метионине, а тирозин — в фенилаланине | [69]. I
Заменимые и незаменимые аминокислоты для насекомого Heli- | othis zea были определены путем 1) исключения их из питания и j 2) включения * 14С из глюкозы в аминокислоты. Оба метода показа-ли, что незаменимые аминокислоты включают лейцин, лизин, гис- г тидин, аргинин, валин, метионин и изолейцин; заменимые аминокислоты включают аспарагиновую и глутаминовую кислоты, глицин, серин, аланин и цистеин. Триптофан является незаменимым в питании; однако его не удается определить методом включения
14С, так он разрушается в процессе гидролиза белка. Фенилаланин незаменим, а тирозин заменим в питании; эти вещества взаимосвязаны — тирозин синтезируется из фенилаланина. Треонин и метионин включают метку, но, по-видимому, синтезируются в недостаточном количестве, поэтому фактически оказываются незаменимыми в питании. Таким образом, оба метода, за исключением специальных случаев, приводят к одинаковым результатам [106].
У разных насекомых существуют количественные различия в запасах необходимых для них отдельных аминокислот. У луковой
Питание
259
Продолжение
необходимо для роста, но не для существования-, +Кук. — необходимо для куколки.
мухи Hylemia antiqua отсутствие одних аминокислот вызывает гибель на первой личиночной стадии, отсутствие других — гибель на третьей личиночной стадии, а отсутствие третьих — гибель личинок непосредственно перед окукливанием [49]. Цистеин необходим для вылета взрослых форм комаров Aedes aegypti, а для роста их личинок требуется либо фенилаланин, либо тирозин, либо тот и другой вместе [53]. Имеются различия в аминокислотных потребностях и у разных линий Drosophila melanogaster.
Для изучения потребностей млекопитающих в аминокислотах из их пищевого рациона исключали те или иные аминокислоты и наблюдали за весом и азотистым равновесием, а также за включением в аминокислоты 14С из других источников. Крыса синтезирует аргинин, но недостаточно интенсивно для нормального роста. Необходимый цистеин она может синтезировать из метионина, если последний имеется в достаточном количестве. Взрослому человеку требуется 8 аминокислот, тогда как растущим крысам — 10 аминокислот (табл, 3-2). Детям, кроме тех 8 аминокислот, которые нужны взрослому, необходимы аргинин и гистидин [2а]. Процесс синтеза тех аминокислот, которые у человека должны обязательно поступать с пищей, включает шесть и более ферментов, тогда как синтез заменимых аминокислот состоит из трех или менее ступеней. Если с пищей поступает большое количество какой-то аминокислоты, то ее синтез ингибируется по принципу обратной связи [26]. Большинство незаменимых аминокислот должно поступать с пищей человека в количествах от 0,25 до 1,0 г в сутки. Как правило, из всех аминокислот только фенилаланин и метионин могут усваиваться в D-форме [109]. Если в пище мало фенилаланина, то и у человека, и. у крысы возникает потребность в.тирозине. При 17*
260
Глава 3
достаточном и повышенном содержании цистеина и тирозина в пище потребность в метионине и фенилаланине снижается. Когда ягнятам в качестве единственного источника азота дают мочевину, то азотистый баланс будет более положительным, если добавлять в пищу и метионин; лизин и треонин в этом случае менее эффективны, и каждый из них улучшает усвоение азота только в присутствии метионина [95]. Цыплятам необходимы глицин и аргинин; последний может быть заменен цитруллином, ио не орнитином; если же в рационе мало фенилаланина, то возникает потребность в тирозине [4]. Лососям необходимы те же 9 аминокислот, что и взрослым крысам [117].
В заключение можно сказать, что основные потребности в незаменимых аминокислотах одинаковы у всех животных. Однако имеются и некоторые специфические различия у животных разных видов и даже у разных генетических штаммов; они обусловлены недостатком одного или более ферментов, участвующих в процессах биосинтеза. Количественные потребности зависят как от наличия предшественников, так и от возможности замены аминокислот другими соединениями со сходным углеродным скелетом.
Особые пищевые потребности некоторых животных
Холин. Холин, называемый иногда водорастворимым витамином, служит важным исходным веществом для ряда процессов синтеза. Он входит в состав лецитина (фосфатидилхолина). Холин содержит четвертичный азот и поэтому играет важную роль в таких соединениях, как ацетилхолин, а также является важнейшим источником лабильных метильных групп в процессах трансметилирования.
НО—СН2—СН2—N=(CH3)3.
Холин
У млекопитающих холин синтезируется из метионина и этанол-амина; он служит донором метильных групп, которые переносятся через бетаин или метионин. При содержании на диете, бедной бел-, ком (особенно аминокислотой метионином) и богатой жирами, у млекопитающих возникает потребность в холине. При недостаточности холина у крыс развиваются очаговые кровоизлияния, ожирение печени и в конце концов поражение почек. При достаточном количестве метионина в пище млекопитающие не нуждаются в экзогенном холине. Однако для многих насекомых холин является незаменимым соединением и требуется в относительно больших количествах. Таракан не способен синтезировать холин из этаноламина и метионина, хотя может использовать вместо холина бетаин (триметилглицин) [96]. Drosophila холин необходим для образования куколки, но может быть заменен лецитином [110,
Питание
261
111J; холин абсолютно необходим для обеспечения подвижности сперматозоидов, а также способствует оптимальному росту животных [51]. В синтетические диеты для большинства насекомых холин добавляют в относительно больших количествах (100 мг/г). В стерильной культуре личинкам комара Aedes aegypti на 100 частей холина необходимы 10 частей ниацина, 2 части тиамина и 0,1 части биотина [2].
Пурины и пиримидины. Пурины и пиримидины необходимы для синтеза нуклеиновых кислот (РНК и ДНК) -
Большинство животных, по-видимому, синтезирует пурины в достаточных количествах, причем синтез осуществляется за счет глицина, СО2, NH3 и ацетата. Пурины и пиримидины не являются витаминами для позвоночных и насекомых, хотя добавление РНК в рацион некоторых насекомых ускоряет их рост. Для Drosophila тимин и аденин не менее эффективны, чем сама РНК, но одному из штамов Drosophila необходимы или РНК, или цитидин [111]. Аналогичные потребности наблюдаются и у некоторых простейших. Так, одному из видов жгутиковых Chlamydomonas требуется урацил. Трипаносомы Crithidia нуждаются в пиримидине и пурине; избыток фолиевой кислоты в среде снимает потребность в пиримидине, а недостаток ее повышает потребность в тимине и метионине. У Tetrahymena отсутствует декарбоксилаза оротовой кислоты, поэтому ей необходимы экзогенные пурины и пиримидины, обычно в виде аденозина, гуанозина, цитидина, тимидина и уридиловой кислоты. Аденин и гипоксантин могут несколько снизить, но не снять полностью потребность в гуанине, тогда как ксантин и мочевая кислота вообще неэффективны в этом отношении. Следовательно, Тetrahymena не способна замыкать имидазольное кольцо [76]. Из пиримидинов для Tetrahymena необходим урацил, хотя его можно заменить цитидином и цитидиловой кислотой, но не цитозином, тимином и оротовой кислотой. Тимин не снижает потребности в урациле, но может частично заменить витамин фолиевую кислоту.
Потребности Paramecium multimicronucleatum в пуринах могут быть удовлетворены за счет гуанина, гуанозина или гуаниловой кислоты, но не аденина, а потребности в пиримидинах — за счет цитидина или урацила, но не тимидина [71]. Простейшему Glaucoma необходим гуанин или урацил (или их эквиваленты) [78]. Таким образом, потребности «высших» простейших в пуринах и пиримидинах представляют собой следствие пищевой специализации.
Гематин. У всех аэробных организмов имеются окислительные ферменты и переносчики электронов (цитохромы), которые содержат железо в порфириновом кольце; последнее в некоторых случаях подобно, а в других — идентично гематину (глава 8). Гем цитохрома синтезируется многими растениями и животными, которые не синтезируют гемоглобина. В условиях культивирования
262
Глава 3
in vitro некоторым жгутиковым, паразитирующим в крови птиц и млекопитающих, — Leishmania и Trypanosoma — требуется гематин или его эквиваленты [87]. Паразитической трипаносоме из пищеварительного тракта комара также необходим гематин, тогда как трипаносома — паразит полужесткокрылых и мух — не нуждается в нем [88]. Это еще один случай утраты синтетической функции паразитом при возрастании его зависимости от хозяина. Кровососущие полужесткокрылые Triatoma также нуждаются в гематине [88]. Таким образом, гематин служит витамином для некоторых кровососущих животных.
Карнитин (p-оксибутиробетаин). В мышцах всех животных, по-видимому, имеются азотсодержащие кислоты, такие, как карнозин, ансерин и карнитин. Эти кислоты могут играть роль анионов, уравновешивая избыток неорганических катионов в мышцах (стр. 184). У млекопитающих концентрация карнитина в мышцах составляет 1000 мкг/г, в мозгу — 87 мкг/г [48]. Карнитин синтезируют практически все животные; известна, правда, одна группа животных, которым необходимо получать карнитин с пищей, — это питающиеся зерном жуки сем. Tenebrionidae [48]. Личинки мухи Phormia превращают в карнитин холин (но не бетаин). Применяя различные производные, удалось показать, что основное значение в молекуле карнитина принадлежит четвертичной аммонийной группе, отделенной от карбоксила тремя атомами углерода.
(CH3)3=N—СН2—СНОН—СН2—СОСГ.
Карнитин
Карнитин является витамином для питающихся мукой Tenebrio molitor, Т. obscuras, Т. confusum, Т. castaneum и Polorus; потребность в карнитине у этих организмов может удовлетворяться смесью из 1 части карнитина и 7 частей холина. Карнитин не требуется Gnathocerus. Dermestes и Phormia почти полностью удовлетворяют потребность в карнитине за счет собственного синтеза [80]. Для роста Drosophila melanogaster необходим холин, но при наличии карнитина последний декарбоксилируется и далее может превращаться в метилхолип; при наличии холина рост личинок улучшается, если добавлять карнитин [52].
Незаменимые жирные кислоты. Большинство животных хорошо растет и развивается, совсем не потребляя жиров или потребляя их в очень малом количестве. Однако именно жиры служат резервными питательными веществами, и поэтому они тесно связаны взаимными превращениями с углеводами, а иногда и с белками. Жир может откладываться в «депо» после приема любой высококалорийной пищи, даже и не содержащей жира. У многих животных депонированный жир отличается от потребляемого по температуре плавления или степени насыщенности. Крысы, содержащиеся на диете с небольшим количеством жира, заболевают
Питание
263
гематурией и теряют в весе; кроме того, у них начинают шелушиться конечности и хвост. Все эти явления исчезают при введении в пищу линолевой кислоты (в виде натриевой соли) в дозе 30 мг в сутки. Крысы усваивают также арахйдоновую кислоту, но не линоленовую. Показано, что незаменимые жирные кислоты необходимы для включения 32Р в фосфатидные кислоты микросом мозга. Из различных предшественников фосфолипидов только 4 из 26 стимулируют вылет взрослых мух Phormia из куколок [61].
При незначительном содержании жиров в пище человека снижается концентрация линолевой кислоты в крови. По-видимому, у человека синтез этой кислоты протекает интенсивнее, чем у крысы.
Некоторым бабочкам, например огневкам Ephestia, рисовой моли Согсуга и луговому мотыльку Loxostege, для полного развития, вылета и нормального образования чешуек требуется линолевая кислота [83]. Недостаточность линолевой кислоты приводит к недоразвитию яйцевых камер у таракана и к гибели второго поколения нимф. Ephestia (но не таракан) усваивает линоленовую кислоту вместо линолевой [54]. Drosophila может синтезировать (из уксусной кислоты) ряд насыщенных и мононенасыщенных жирных кислот, но не синтезирует полиненасыщенные кислоты [75]. Бабочке Argirotaenia для нормального развития крыльев и чешуек тела необходима линолевая или линоленовая кислота [108]. Хлопковому долгоносику Anthonomus жирные кислоты необходимы для размножения, причем оптимальными оказались трилинолеин или три-линоленин [36]. Восковая моль Galleria обычно питается пчелиным воском, главным компонентом которого является мирицин, эфир пальмитиновой кислоты и мирицилового спирта; простые жирные кислоты, содержащие в углеродной цепочке от 14 до 30 атомов углерода, не усваиваются Galleria [21].
Из четырех видов Tetrahymena трем необходимы ненасыщенные жирные кислоты или фосфолипиды, а у одного вида (Г. pyrifor-mis) потребности в жирах нет [43]. Все Tetrahymena содержат линолевую кислоту [62]. Трипаносоме Crithidia требуется несопряженный птеридин, потребность в котором частично может быть удовлетворена смесью жирных кислот; при этом ненасыщенные жирные кислоты синтезируются из насыщенных [31].
Ненасыщенные жирные кислоты участвуют как в энергетическом обмене, так и в биосинтезе некоторых соединений. Все животные, по-видимому, нуждаются в специфических жирных кислотах, но отдельным животным нужны и неспецифические ненасыщенные жирные кислоты, поскольку они не могут удовлетворить свои потребности за счет биосинтеза.
Стерины. Стерины составляют большой класс полициклических соединений. Самым распространенным стерином у животных является холестерин. По-видимому, все животные используют холестерин в жировом обмене, но не все способны его синтезировать.
264
Глава 3
Большинство животных, включая позвоночных, синтезируют холестерин в достаточном количестве из уксусной кислоты. Однако многие насекомые и головоногий моллюск Sepia не способны синтезировать холестерин в нужном количестве [122].
СН:, СН,
Все насекомые, по-видимому, должны получать стерин с пищей; как правило, этим стерином является холестерин. Некоторые насекомые, особенно травоядные, могут использовать и другие стерины. Bombyx обычно питается растительным ситостерином, хотя 85% стеринов его тела составляет холестерин. Таракан В1а-tella предпочитает холестерин, но может использовать и различные растительные стерины, и в частности может превращать эргостерин в 22-дегидрохолестерин, видимо при помощи симбиотических микроорганизмов [16]. Личинки домашней мухи Musca хорошо развиваются на холестерине или ацетате холестерина; вдвое менее эффективны 7-дегидрохолестерии и эргостерин, а 7-оксихоле-стерин или 7-кетохолестерип вообще не усваиваются личинками [84]. Жук-кожеед Dermestes усваивает стерины только животного происхождения — холестерин или 7-дегидрохолестерин (обычные предшественники их не используются) [16]. Хлопковому долгоносику требуется 20 мг холестерина на 100 г пищи, а время полного обмена холестерина равняется 15 сут [37]. Жук-короед Xyleborus в период личиночного развития может использовать холестерин или ланостерин, но для окукливания ему требуются эргостерин или 7-дезоксихолестерин [15]. Сосущих сок растений тлей можно поддерживать на жидкой пище, высасываемой из пленочных мешочков, которая содержит сахарозу, аминокислоты, витамины и минеральные соли, но не содержит стеринов или жиров; вероятно, стерины в данном случае поставляются симбионтами [5].
Стерины необходимы и некоторым паразитам. Так, паразитическая нематода Caenorhabditis может расти на культуре Е. coli, если в нее добавить стерины [58]. Факультативному паразитическому виду Tetrahymena требуется холестерин или его предшественники [63]. Trichomonas columbae — кишечному паразиту голубей— требуется холестерин или близкие стерины [76].
В целом можно, видимо, считать, что для синтеза холестерина необходимо, чтобы с пищей поступал его предшественник, имеющий специфическую конфигурацию. Травоядные насекомые обла-
Питание
265
дают более широкими способностями к синтезу, чем хищные, а всеядные виды, такие, как тараканы, занимают промежуточное положение. Основным стерином насекомых и позвоночных, у которых доля неомыляемых жиров составляет менее 7% общего количества липидов, является холестерин с 27 атомами углерода, у большинства беспозвоночных неомыляемые жиры образуют большую фракцию. Губки содержат разнообразные стерины, в том ? числе стерины с 27, 28 и 29 атомами углерода, причем некоторые из них являются уникальными. У брюхоногих и двустворчатых моллюсков преобладает холестерин, но, кроме того, двустворчатые имеют стерины с более высокой температурой плавления, главным образом стерины с 28 атомами углерода. Улитке Helix необходим пищевой стероид, и обычно она использует ситостерин. Из иглокожих морские лилии, офиуры и морские ежи содержат холестерин, а морские звезды и голотурии — различные соединения, называемые стелластеринами [9]. Таким образом, биохимии стероидного обмена свойственно исключительное разнообразие.
Водорастворимые витамины
Ряд незаменимых компонентов пищи — водорастворимые витамины — выполняет роль коферментов в специфических обменных реакциях, протекающих в большинстве (если не во всех) животных клеток. Одни водорастворимые витамины необходимы для подавляющего большинства животных, другие могут синтезироваться самими животными (частично или полностью), третьи нужны лишь немногим животным, утратившим способность к их синтезу. Потребность в некоторых витаминах столь мала, что ее не удалось выявить у многих животных, и возникло неверное предположение о способности этих животных синтезировать водорастворимые витамины.
Мы начнем рассмотрение витаминов группы В с тех, потребность в которых наиболее всеобща (табл. 3-3).
м мм ч Тиазол
N Nh2 S Z
н3с—с нс с—сн2—-СНгОН
II I fl II
N C N---C—CH3
/ ^C 'V +
Пиримидин H H*
Тиамин
Тиамин. Тиамин, открытый первым из витаминов группы В, предотвращает заболевание бери-бери у людей и полиневриты у птиц. Соединяясь с аденозинтрифосфатом, тиамин образует кокар-боксилазу (дифосфотиамин) — важный кофермент окислительного Декарбоксилирования пировиноградной кислоты (стр. 432). Ти-
I
Таблица 3-3
Потребности животных в водорастворимых витаминах1
ё
s Н
Tetrahymena [77] Paramecium [71]
Caenorhabditis [33] +
Pseudosarcophaga +
[65] Tenebrio [47] +
Calliphora [112]
Musca [11] +
Phortnia [12] Hylemya [49] Tribolium [89] Palorus [23] 4~ +
Neomyzus [41] Locusta [20] Acheta [90] + +
Xenopsylla [99] Artemia [103] +
Лосось [55] Морская свинка -j—
[Ю5] Крыса [3] +
i Кобала Биотин •& £
—? —
-
? ?
Стим, ч— -j-
+
? *~н
— +
Стим.
Стим. +
Стим. +
— +
+ И-
+
+
+
+? +
— — ч—
+ +
। „ не требуется; + требуется, Стим. — стимулирует рост, но не требуется; ? — под вопросом, Сл. + требуется в небольшом количестве.
Питание
амин участвует и в других реакциях декарбоксилирования, а также в превращениях глюкозы по пентозофосфатному пути (стр. 445). Тиамин широко распространен в растительных и животных тканях и, вероятно, необходим всем клеткам, как аэробным, так и анаэробным. Молекула тиамина состоит из двух частей — пиримидина и тиазола.
Тиамин встречается в естественных водоемах, как в пресных, так и в соленых, особенно в тех, в которых происходит бактериальный рост; встречается он и в почве. Многие бактерии, плесени и некоторые жгутиковые могут синтезировать пиримидиновое и тиазоловое кольца и соединять их в молекулу тиамина. Некоторые микроорганизмы должны получать с пищей либо пиримидин, либо тиазол, а другие'—и пиримидин и тиазол [87]; для многих простейших и некоторых плесеней нужна цельная молекула тиамина, так же как и для всех изученных в этом отношении многоклеточных (табл. 3-3). Потребности жгутиковых, в том числе и зеленых, в тиамине весьма различны.
Размножение Chilomonas ускорялось вдвое при добавлении тиамина и железа. Chilomonas может синтезировать некоторое количество тиамина из тиазола и пиримидина. Всем бесцветным жгутиковым — Trypanosoma, Leishmania и Strigomonas — нужен тиамин [76].
Насекомым тиамин нужен в малых количествах: для Phormia— 3 мкг, a Tenebrio — 1 мкг на 1 г пищи [47]. Потребность форели -в тиамине составляет около 0,16 мг на 1 <кг веса тела в сутки [100]. Считается, что человеку необходимо около 0,5 мг тиамина на 1000 кал пищи. В пищеварительном тракте многих животных (особенно насекомых и млекопитающих) имеются микроорганизмы. В этом случае наличие тиамина в пище необязательно. Так, у оленя симбионты синтезируют в 5—12 раз больше тиамина, чем его поступает извне [118].
Кобаламин (витамин BJ2). Кобаламин соодержит кобальт и встречается в естественных водоемах обычно в концентрации 0,1— 1 мкг/мл. Молекула кобаламина состоит из двух частей — порфириноподобного кольца с кобальтом и нуклеотида рибазолфосфата. Кобаламин выделяют обычно в виде цианида — цианокобаламина.
Витамин В12 играет роль в обмене одноуглеродных фрагментов. Он может участвовать в синтезе белка и служит кофактором нескольких изомераз в переносе метильной группы. Кобаламин требуется многим жгутиковым — и зеленым фотосинтезирующим формам, и бесцветным. Euglena gracilis как чувствительный к кобаламину организм применяется для биологических испытаний на витамин В12.
Витамин В12, необходимый водорослям и простейшим, синтезируется, как правило, бактериями. Имеются данные, что доступность витамина Bi2 может служить фактором, определяющим общую продуктивность некоторых естественных водоемов. Среди
268
Глава 3
nh2—СО—СН — сн2 сн3 СН3 СН2— СО—NHt
^с.
Хсн—СН2—СН2—СО—NHt
NHa— СО—СН2 СН
с c"^N
С II III
X — N С
СН3 с \ .
N==C
» СН\ .
/ V
. NHf— СО—СН2—СН I
\ С
/ СН
со—сн2—сн2
Со*
СН
^СНа tT
NH
СН2
CHj—СН
ОН
о
'з/ 1
/ сн3
СН
СН—СН2—СО—NHX
СН3
/ 1
СН £
N СН СН3
С
С
С
з
С--С
/Н н\
СН^^ ^СН
НО СН2 °
циано кабал амин
большого числа видов водорослей 80% нуждается в Bi2, 53% необходим также и тиамин, а 10% •— еще и биотин [34].
Дафниям, выращиваемым на культурах специальных видов жгутиковых, необходимы Bi2 и тиамин, которые действуют, по-ви-димому, через этих жгутиковых [24]. У многих животных витамин Bi2 синтезируется симбиотическими микроорганизмами. Таракан в отсутствие кобаламина развивается нормально, но откладывает нежизнеспособные яйца. Потребность других насекомых в витамине Bi2 не доказана. У млекопитающих недостаток кобаламина приводит к развитию анемии, обусловленной нарушением созревания эритроцитов. Витамин Bi2 представляет собой антианемический фактор; он необходим человеку в количестве 1 мг в сутки.
Показано, что у лишенных материнского молока крысят на диете без кобаламина сильно замедляется рост, если увеличивать содержание белка в диете; это означает, что кобаламин участвует в метаболическом превращении углеродных скелетов аминокислот [35].
Биотин. Биотин участвует в процессе фиксации СО2 бактериями и млекопитающими и, вероятно, в синтезе щавелевоуксусной кислоты. Яичный желток богат биотином, а в яичном белке содержится антибиотиновый фактор. Биотин встречается в естествен-
Питание
269
них водоемах и необходим некоторым жгутиковым, в том числе зеленым (табл. 3-3). Биотин стимулирует рост мучных хрущаков и необходим для метаморфоза личинок комаров. Вообще в малых количествах он нужен всем изученным насекомым (во всяком случае, всем изученным достаточно тщательно).
HN^ \nH
I I
НС----CH
H2C CH—(СНД— COOH
sz
В UОГЛ UH
Виды Drosophila различаются по своим потребностям в витаминах группы В; например, D. simulans не нуждается в биотине, тогда как D. melanogaster он необходим [42]. У шелкопряда недостаточность в биотине приводит к уменьшению содержания нескольких жирных кислот; оптимальный его уровень равен 0,2 мкг на 1 г сухого веса пищи [64].
Биотин синтезируется в кишечнике многих животных симбиотическими бактериями. У хомячка симбионты синтезируют биотин в количествах, недостаточных для удовлетворения потребностей хозяина, а кролику продукции симбионтов, вероятно, вполне достаточно. Недостаточность биотипа у кур приводит к высокой смертности зародышей и к патологическим изменениям скелета у цыплят [19]. Биотиновую недостаточность можно вызвать у обезьян, телят и других млекопитающих путем стерилизации кишечного тракта или введением в пищу антибиотинового фактора из яичного белка. Рекомендуемые количества биотина для человека составляют менее 10 мкг в сутки.
Рибофлавин. Рибофлавин — производное аллоксазина — входит в состав флавинмононуклеотида (ФМН) и флавинаденинди-нуклеотида (ФАД). Последние играют роль простетических rpvnn флавопротеидных ферментов, участвующих в процессах клеточного дыхания (гл. 6). Рибофлавин представляет собой кофактор ксан-тиноксидазы, оксидазы D-аминокислот и цитохромредуктазы.
Многие микроорганизмы — дрожжи, бактерии и, вероятно, жгутиковые — синтезируют рибофлавин. Рибофлавин нужен инфузории Tetrahymena и многочисленным насекомым (табл. 3-3). Некоторые насекомые (Blatella), по-видимому, получают достаточно рибофлавина от своих кишечных симбионтов, другим же (Tenebrio, Drosophila) необходимо получать его с пищей. Потребность форели составляет примерно 0,5 мг рибофлавина на 1 кг веса тела в сутки. У крыс при недостаточности рибофлавина развиваются поражения кожи и глаз, вылезает шерсть. Рибофлавин синтезирует-
270
Глава 3
Н с
он он он
СН2—С—С—С—CHjOH н н н
N N
Н II
° рибофлавин
ся кишечными микроорганизмами, и поэтому у многих млекопитающих трудно установить действительную потребность в этом витамине. Кролики могут выделять с фекалиями в 10—15 раз больше рибофлавина, чем потребляют его. Они хорошо растут и в отсутствие пищевого рибофлавина, потому что всасывают его в слепой кишке или потому, что поедают фекалии [97]. Жвачные получают достаточно рибофлавина за счет синтеза его микрофлорой рубца; в содержимом рубца может быть в 100 раз, а в молоке — в 10 раз больше рибофлавина, чем в пище коровы. Телята, не содержащие в рубце микроорганизмов, должны получать рибофлавин с пищей. Рекомендуемая доза рибофлавина для человека составляет 1,0—1,5 мг в сутки.
Ниацин (никотиновая кислота). Амид никотиновой кислоты в соединении с аденином, пентозой и фосфатом образует НАД (ни-котинамидадениндинуклеотид, ранее называвшийся ДПН — ди-фосфопиридиннуклеотид, или кофермент I) и НАДФ (никотин-амидадениндинуклеотидфосфат, ранее называвшийся ТПН — трифосфопиридиннуклеотид, или кофермент II), которые служат коферментами многих дегидрогеназ (стр. 442). Многие животные и симбиотические бактерии синтезируют ниацин из триптофана. Этот синтез наблюдался у жгутикового Chilomonas, однако инфузории Tetrahymena и Colpoda не способны синтезировать ниацин.
н с / Ч нс с—соон
пс. сн
N
Ниацин
Ниацин требуется различным насекомым (табл. 3-3), но у некоторых из них он синтезируется симбиотическими микроорганизмами, и поэтому их потребность в ниацине не всегда выявляется. Phormia не может использовать триптофан вместо ниацина. У крыс, мышей и человека триптофан превращается в ниацин от-
Питание
271
4асти под действием микроорганизмов в кишечнике, но главным образом — в печени. Это объясняет, почему ниацин может экскретироваться в большем количестве, чем поглощаться, даже после подавления кишечной микрофлоры или после введения триптофана [72]. Телята, не содержащие микроорганизмов в рубце, синтезируют достаточно ниацина, а у собак и лисиц с ниациновой недостаточностью развивается заболевание «черный язык», которое излечивается при введении в пищу никотиновой кислоты. Ниациновой недостаточностью частично объясняется и заболевание человека пеллагрой. Пеллагра обычно возникает при питании кукурузой, так как в ее белке зеине не хватает триптофана и, кроме того, обычно содержится какой-то антиниациновый фактор. Рекомендуемая для человека доза ниацина составляет 10—15 мг в сутки.
Пиридоксин (пиридоксаль, пиридоксамин). Витамин В6 представляет собой производное пиридина. И пиридоксин, и пиридоксаль, и пиридоксамин могут служить источником витамина Вб. Пиридоксальфосфат является коферментом переаминирования а-аминокислот и, следовательно, играет важную роль в белковом обмене. Его недостаточность у млекопитающих приводит к уменьшению синтеза фосфорилаз. Пиридоксин стимулирует рост, но не обязателен для развития Chilomonas. Он необходим в относительно больших количествах для оптимального роста Tetrahymena и Colpoda.
сн.он
но—р\—сн2он
н,с А/ N х Пиридоксин
Пиридоксин требуется большинству насекомых, за исключением тех видов, у которых он синтезируется симбиотической микрофлорой (табл. 3-3).
Ленточный червь Hymenolepis, паразитирующий в кишечнике крысы, начинает страдать от недостаточности витамина Вб, если хозяина лишают возможности поедать фекалии, однако эта недостаточность устраняется добавлением в пищу пиридоксина, который, очевидно, необходим этому ленточному червю [101].
Содержание пиридоксина в рубце овец и в молоке коров может быть в 10 раз выше, чем в пище; у жвачных пиридоксин синтезируется микрофлорой рубца, а у человека — кишечными бактериями. При сильном авитаминозе у крыс и голубей появляются судороги; у крыс, кроме того, развиваются дерматиты, а у собак/лисиц и свиней — анемия.
Пантотеновая кислота (пантоил-р-аланин). Пантотеновая кислота в комплексе с адениловой кислотой, 2-меркаптоэтаноламииом
272
Глава 3
и тремя остатками фосфорной кислоты образует кофермент А, который играет важную роль в переносе ацильных групп. В частности, он участвует в процессе включения ацетила, возникшего из пировиноградной кислоты, в цикл трикарбоновых кислот, а также в ацетилировании холина с образованием ацетилхолина. Обычно пантотеновую кислоту применяют в виде кальциевой соли.
сн3 он о
НО—СН2—С—СН—С—N—СНа—CHt—соон
СНз Н
Пантотеновая кислота.
Потребность в пантотеновой кислоте у Colpidititn в 20 раз выше, чем у Tetrahymena [77]. Она требуется почти всем насекомым независимо от наличия в их кишечнике микроорганизмов (табл. 3-3). У жвачных пантотеновая кислота синтезируется в значительных количествах микроорганизмами рубца (концентрация этого витамина в рубце в 6—25 раз выше, чем в пище), у кроликов — бактериями слепой кишки, а у человека — микрофлорой толстого кишечника. Недостаточность пантотеновой кислоты у крыс характеризуется геморрагическим некрозом коры надпочечников и ослаблением ее функции.
Фолиевая кислота (птероилглутаминовая кислота). Фолиевая кислота состоит из глутаминовой кислоты, р-аминобензойной кислоты и замещенного птерина. В некоторых клетках (дрожжи, клетки печени цыплят) встречается фолиновая кислота (цитроворум-фактор), которая обладает более высокой витаминной активностью, чем фолиевая кислота. Этот витамин участвует в промежуточном обмене одноуглеродных фрагментов. Фолиевая кислота необходима для синтеза пуринов и пиримидинов; у Tetrahymena (но не у Glaucoma) тимин может частично заменять фолиевую кислоту [78]. Аминоптерин служит антагонистом фолиевой кислоты как фактора роста, и в низких концентрациях он может подавить гематопоэз и рост у мышей.
он
О И Н В I I С—N—С—СН2—-СН—СООН
СООН
С N
N
C-CH—N
СН Н
H,N-C^ с^ N N Фолиевая кислота
Тимин, пурины и в больших количествах серин могут частично заменить фолиевую кислоту у Drosophila [НО]. Потребность в малых дозах фолиевой кислоты, вероятно, в какой-то степени свойственна всем животным, хотя обычно она синтезируется симбиотическими микроорганизмами. Что касается человека, то имеются
Питание
273
данные о синтезе кишечными бактериями фолиевой кислоты в относительно больших количествах, и тем не менее недостаток этого витамина в пище может вызвать анемию.
а-Липоевая кислота (тиоктовая кислота). а-Липоевая кислота представляет собой серусодержащую кислоту (6,8-дитио-п-октано-вую кислоту), образующую с тиамином липотиамин, который первым принимает ацетильную группу пировиноградной кислоты в процессе окислительного декарбоксилирования этого ключевого метаболита (гл. 6). Затем ацетил переносится на кофермент А с последующим восстановлением НАД. Примечательно, что для этой важнейшей реакции клеточного обмена требуется 4 витамина — тиамин, а-липоевая кислота, пантотеновая кислота и ниацин.
S—снг
снг I \
S—сн '
, (СНг)4
соон
к-Липоевая кислота
сс-Липоевая кислота синтезируется в организме у большинства животных, ее можно получить из печени млекопитающих, из тканей куриного эмбриона и других функционально активных тканей. Единственный выявленный к настоящему времени организм, которому необходимо получать а-липоевую кислоту с пищей, это Tetrahymena.
Аскорбиновая кислота (витамин С). Аскорбиновая кислота, подобно глутатиону, обратимо восстанавливается и окисляется многими восстановителями и окислителями. Она не связана ни с одним из известных коферментов, но участвует в окислении тирозина у животных.
но—с i
НО—С I I О
Н—С---[
но—с—н
I си,он Аскорбиновая кислота
Аскорбиновая кислота широко распространена в растительных и животных тканях. Она присутствует в высокой концентрации в коре надпочечников, и в этом органе ее содержание быстро падает при стрессе. Аскорбиновая кислота давно известна как противоцинготный витамин для человека; недостаток витамина С в организме приводит к развитию множественных кровоизлияний, особенно на деснах, и к отечности суставов. Большинство позвоноч
18—1322
274
Глава 3
ных, например крыса и хомячок, синтезируют аскорбиновую кислоту в достаточных количествах, но морская свинка, обезьяна и человек должны получать аскорбиновую кислоту с пищей. Суточная потребность в витамине С у человека составляет 1,6 мг/кг [113]. Насекомые и жгутиковые не нуждаются в ней (личинки пчел, например, синтезируют ее). Примечательно, что многие трипаносо-миды — гемопаразиты млекопитающих, например Leishmania и Trypanosoma, нуждаются в витамине С, тогда как свободноживу-щим формам — Strigomonas и Leptomonas — он не нужен [88].
Трем видам насекомых, питающихся хлопком, — хлопковому долгоносику Anthonomus, совке хлопковой Heliothis и гусенице бабочки-медведицы Estigmene — необходимо по 0,4 г аскорбиновой кислоты на 100 г пищи [119].
Жирорастворимые витамины
Жирорастворимые витамины используются менее широко, чем водорастворимые. В витаминах A, D и К, по-видимому, нуждаются только позвоночные; потребность в витамине Е, вероятно, является более общей.
Витамин А. Он известен в двух формах: Ai и А2. Из одной молекулы p-каротина, который широко распространен у растений, образуются две молекулы витамина А. Расщепление р-каротина, или провитамина, происходит частично в печени, но главным образом в кишечнике. Эти витамины откладываются в печени, а также в сетчатке глаза — в палочках и в пигментных клетках. Значение витаминов Ai и А2 для зрения рассмотрено в гл. 14. Витамин Ai встречается у высших позвоночных и у морских рыб; витамин А2 преобладает у пресноводных рыб.
н3с сн3
СНз СНз
Н.-С^ \-сн=сн—с=сн-сн=сн-с=сн—снаон
I II
Н,—С С СНз
• сн2 „ .
Витамин /у
Недостаточность витамина А у человека приводит сначала к развитию куриной слепоты, а затем к ксерофталмии; при тяжелом авитаминозе задерживается рост скелета и возникают поражения кожи. Избыток витамина А в пище может оказывать токсическое действие. Потребность в витамине А зависит от способности животного синтезировать этот витамин и от количества пищевых каротинов. Концентрация этого витамина в печени у разных животных различается в несколько тысяч раз, причем наименьшая концентрация обнаружена у морской свинки, а наибольшая — у белого медведя и у тюленя [92]. Белый медведь накапливает так
Питание
275
много витамина А, что его печень токсична для человека. У беспозвоночных потребность в витамине А не выявлена, хотя сам витамин найден у многих из них. В печени кальмара содержится очень много витамина А, который необходим для зрения. У различных морских ракообразных — эуфаузид, амфипод (бокоплавов), веслоногих — 90% витамина А содержится в глазах. Каротиноиды синтезируются только растениями, но многие животные способны избирательно накапливать поглощенные ими каротиноиды и превращать их в витамин А.
Витамин D. Из всех соединений этого класса наиболее важными являются витамин D2, или кальциферол, образующийся при облучении ультрафиолетовым светом эргостерина, и витамин D3, образующийся при облучении 7-дегидрохолестерина. Витамин D3 содержится в печени рыб и синтезируется в коже высших животных под действием солнечного света. Птицы секретируют предшественник витамина D в копчиковой железе и смазывают им перья. Здесь предшественник активируется, и витамин либо поедается птицей, либо всасывается непосредственно [92]. У человека витамин D3 образуется в коже при облучении 7-дегидрохолестерина; затем в печени он превращается в 25-оксихолекальциферол, который в почках превращается в 1,25-дигидровитамин D. Таким образом, синтез этого витамина в одном месте, последующие изменения его в других местах и транспорт с кровью к местам непосредственного действия делают витамин D3 более сходным с гормонами, чем с витаминами.
Витамин D способствует всасыванию кальция из пищеварительного тракта и совместно с гормоном паращитовидной железы регулирует уровень кальция в крови и мобилизует кальций для минерализации костей. Недостаточность витамина D у людей приводит к рахиту; у крыс рахит не развивается, если не нарушен кальцие-во-фосфорный баланс. Потребность в витамине D не обнаружена ни у одного беспозвоночного, хотя стерины широко используются ими для других целей.
Витамин в2
1Я*
276
Глава 3
Витамин к. Витамин К встречается в двух формах: Ki и Кг-Витамин Ki представляет собой 2-метил-3-фитил-1,4-нафтохинон. Его обычно получают из люцерны, а витамин Кг — из рыбной муки. Витамин К участвует в фотосинтезе и поэтому широко распространен. Он сходен с эхинохромом — пигментом с неизвестной функцией, обнаруженным у иглокожих. Симбиотические микроорганизмы кишечника вырабатывают витамин К, и даже человек,
н с
НС
НС
с
Н
с И с
о С СНз СНз СНз СНз СН3
С—СН»СН=С—(СНз)з— СН—(СНРг-СН—(СН,)3—сн
ч / СНз
о Витамин К!
по-видимому, получает вполне достаточные количества этого витамина за счет кишечных бактерий; однако у новорожденных детей возможно проявление авитаминоза. Поскольку цыплята очень чувствительны к недостатку витамина К, их используют для биологического определения витамина. Витамин К стимулирует образование протромбина и необходим для нормального свертывания крови. Недостаточность витамина К приводит к кровотечениям.
. Витамин Е (а-токоферол). Различают три вида токоферола по числу и положению замещающих метильных групп.
= сн3
но—с с сн, сн}
{ II I I
... HSC—С^ С С—СНз—СНз— СН,—СН—СН2—СНз—СН,—СН—(СИзХ— СИ
С О СНз СНз СНз сн,
: сн3 ес-Токосрерол
а-Токоферол, подобно хлорофиллу и витамину К, содержит с цепь фитола. Недостаточность витамина Е у млекопитающих при- с водит к перерождению зародышевого эпителия, к потере подвижности сперматозоидов и к рассасыванию эмбрионов. При авитаминозе у цыплят, головастиков и рыб наблюдаются некротические изменения печени, местные кровоизлияния и поражение семенников. У кроликов и морских свинок потребность в витамине Е выше, чем у крыс. Вероятно, витамин Е необходим всем позвоночным. В экстрактах сердечной и скелетной мышц крысы содержится а-токоферол; по-видимому, он является кофактором цитохромре-дуктазы этих тканей, поскольку активность последней в реакциях окисления НАД-Н и янтарной кислоты усиливается при добавлении токоферола. Кроме того, витамин Е служит неспецифическим
Питание
277
ингибитором процессов окисления. Суточная потребность курицы-несушки составляет 1,2 мг а-токоферола [32].
Потребность в витамине Е свойственна и некоторым беспозвоночным. У сверчков размножение идет нормально при условии, что самцы получали витамин Е на последней стадии нимфы, для самок же этот витамин значения не имеет [90]. Потребность в а-токофероле выявлена у жука Oryzaephilus [26], он нужен также для созревания самок у мухи Agria [66].
Заключение
Питательные потребности животных обусловлены присущими им типами промежуточного обмена веществ. Многие из этих веществ сформировались еще в период химической эволюции, т. е. до того, как появились современные животные. Период синтеза органических молекул из простых источников азота и углерода в атмосфере с восстановительными свойствами продолжался очень долго, но в современных условиях этот процесс идти не моэйет, так как возникли фотосинтезирующие организмы и атмосфера приобрела окислительные свойства. Экзобиологи четко доказали возможность синтеза аминокислот из цианида и воды, а также синтеза различных жирных кислот, сахаров, пуринов и пиримидинов из смеси CN, NH3, СО, Н2О, СН4 и других небольших молекул под действием ультрафиолетового излучения или электрического разряда. Удалось показать, что органические вещества могут образовываться и в отсутствие воды; это делает возможным существование каких-то новых ступеней химической эволюции на небесных телах, где условия отличаются от земных.
В течение длительного периода химической эволюции происходил интенсивный отбор, критерии которого нам зачастую не известны. Преимущественное использование аминокислот и сахаров, циклизация пуринов и пиримидинов и их комбинация с сахарами и фосфатами в нуклеиновых кислотах, ограниченное число аминокислот и их полимеризация с образованием веществ, названных белками, каталитическая функция белков, обычно в комплексе с более мелкими кофакторами, последовательность и различные разветвления цепей превращений, в ходе которых высвобождается энергия, — все эти реакции и многие ранее установившиеся типы молекул, раз возникнув, оказались очень удобными для использования многоклеточными. Хемо- и автотрофы сформировали новые комбинации ферментов, а у эукариотов появились совершенно новые свойства. Переход от прокариотов к эукариотам сопровождался появлением заметных изменений в питании. Многие переходные к эукариотам формы являются фотосинтезирующими, но способны и к гетеротрофному обмену веществ. У некоторых гетеротрофных эукариотов и сейчас сохранились примитивные обменные
278
Глава 3
пути, например использование глиоксалатного цикла у ресничной инфузории Tetrahymena.
Метаболизм гетеротрофов развился уже в докембрии, и затем произошло быстрое разветвление линии многоклеточных. Все они имеют общие пищевые потребности, например потребность в аминокислотах и витаминных кофакторах. Они сохранили, правда в разной степени, способность к взаимным превращениям сахаров, жиров и аминокислот и к использованию их в качестве источников энергии. Некоторые из них (например, Tetrahymena) могут существовать исключительно на аминокислотах, но большинству животных в качестве источника энергии необходимы углеводы.
Дальнейшая эволюция происходила у животных в основном в направлении утраты или сокращения путей биосинтеза. Аминокислоты, поступление которых с пищей необходимо большинству животных, синтезируются более сложными путями, чем заменимые аминокислоты. Многие животные синтезируют незаменимые аминокислоты, но в недостаточных количествах. Некоторые животные утратили способность синтезировать незаменимые пурины и пиримидины. Многим насекомым необходимо получать с пищей стерины животного происхождения, тогда как позвоночные могут синтезировать их сами. У различных видов животных спорадически возникает потребность в каких-то определенных жирных кислотах.
Физиология питания отчетливо иллюстрирует взаимозависимость разных организмов. Например, способным к фотосинтезу жгутиковым необходим кобаламин и иногда тиамин, синтезируемые бактериями. Симбионты могут поставлять хозяину многие питательные вещества (например, у кораллов, термитов и жвачных животных) или «витамины», как у насекомых и позвоночных. Практически невозможно лишить многих животных их симбиотических микроорганизмов, обитающих в пищеварительном тракте, и не вызвать при этом никаких последствий. После стерилизации кишечного тракта пищевые потребности, особенно в витаминах группы В, значительно возрастают. С другой стороны, известно, что, например, гельминты зависят от своего хозяина: некоторые из них не могут использовать белок, а нуждаются в аминокислотах — продуктах пищеварения хозяина. Питающимся кровью паразитам необходим гем для синтеза цитохромов.
Одни пищевые потребности высокоспециализированы, другие обусловлены изменением функции какого-то типа компонентов в процессе эволюции животных. Например, для родопсиновой системы зрения необходим витамин А, а в процессе кальцификации костей позвоночных используется витамин D.
Многие животные лучше развиваются на синтетической среде, если к ней добавлять экстракты дрожжей, печени или другие аналогичные органические материалы; при культивировании в стерильной среде (в отсутствие других организмов) требуются какие-то неидентифицированные вещества. Взаимосвязь животных и мик
Питание 279
роорганизмов может базироваться на каких-то пока неизвестных веществах. Так, жуки-короеды, по-видимому, получают некоторые неизвестные пока факторы от грибов, поскольку при питании стерильной корой у них не происходит окукливания.
Питательные вещества не могут быть использованы до тех пор, пока они не будут съедены и переварены. Некоторые формы очень трудно культивировать, если не создать подходящих условий для самого процесса питания. Например, Artemia может питаться только пищей в виде отдельных частиц. Тли могут усваивать жидкую пищу, если будут высасывать ее из мешочков, напоминающих стебель или лист. Пища должна быть также вкусной. Питание часто зависит от химически обусловленного «привлечения» или «отпугивания» (например, у растительноядных насекомых). Используя хемочувствительность некоторых вредителей, можно контролировать их численность.
Все более широкое применение находит стерильное культивирование. Поддерживать животное в простой среде гораздо легче, чем заставить его размножаться, для роста требуется больше факторов, чем для поддержания взрослого организма.
На питательных потребностях сказывается взаимосвязь между питательными веществами. Некоторые вещества в пределах данного класса могут превращаться друг в друга, и поэтому, например, поступление какой-то одной аминокислоты иногда снижает потребность в другой. Подобные взаимоотношения существуют между некоторыми водорастворимыми витаминами и специфическими аминокислотами. В пределах каждого класса пищевых потребностей должно существовать равновесие. Пищевые потребности могут изменяться в каких-то пределах в соответствии с условиями экспериментов по питанию. Для некоторых путей синтеза существуют индуцибельные ферменты.
Питательные потребности человека и сельскохозяйственных животных можно лучше всего понять, рассмотрев процесс развития питания и ферментативных функций многих специфических веществ. Можно считать, что витамины большинства млекопитающих уже известны. Неотложная современная проблема состоит в том, чтобы обеспечить человека сбалансированными источниками белка, особенно в условиях исключительно растительной диеты. С этой точки зрения очень важны добавки синтетических аминокислот. Хотя в мировом масштабе пища человека базируется главным образом на растительных источниках, уже сейчас она отчасти становится синтетической. В будущем, вероятно, более широко будут использоваться продукты искусственного и микробиологического синтеза.
СПИСОК ЛИТЕРАТУРЫ
1. Abelson Р. Н., Proc. Nat. Acad. Sci., 55, 1365—1372, 1966. Chemical events on primitive earth.
280
Глава 3
2. Akou S., J. Insect Physiol., 8, 319—335, 1962. Axenic culture of Aedes.
2a. Albanese Z., J. Clin. Nutr., 1, 44—51, 1952. Effects of amino acid deficiencies, rat and man.
3. Albritton E. C., ed. Standard Values in Nutrition and Metabolism, W. B. Saunters Co., Philadelphia, 1954.
4. Almquist H. J., Mecchi E., J. Biol. Chem., 135, 355—356, 1940; also J. Nutr., 28, 325—331, 1944. Amino acid requirements of chickens.
5. Auclair J. L., Ent. Exp. AppL, 12, 623—641, 1969. Nutrition of plant-sucking insects.
6. Balogun R. R., J. Insect PhysioL, 15, 141—148, 1969. Essential amino acids ;.nd sugars for Ips (=Scotylus) cembrae.
7. Barghoom E. S., Tyler S. A., Science, 147, 563—575, 1965. Precambrian fossils.
8. Beerstecher E., pp. 119—220, in: Comparative Biochemistry, Vol. 6, ed. by M. Florkin and H. Mason, Academic Press, New York, 1964. Chemical history of the earth.
9. Bergman W. J., Org. Chem., 12, 67—75, 1947; also J. Marine Res., 8, 137—176, 1949; also pp. 435—444, in: Cholesterol, ed. by R. S. Cook, Academic Press, New York, 1958. Evolutionary aspects and comparative biochemistry of ani-sterols
10. Berntzen A. K-, Ann. N. Y. Acad. Sci., 139, 176—189, 1966. Axenic cultures of parasitic worms.
11. Brookes V. J., Fraenkel G„ Physiol. Zool., 31, 208—223, 1958. Nutrition of iy Musca.
12. В rust M., Fraenkel G., Physiol. Zool., 28, 186—204, 1955. Nutrition of larvae t f blowfly Phormia.
13. Galvin M., Proc. Roy. Soc. bond. A, 288, 441—466, 1965. Chemical evolution, primeval molecules. Dehydration condensation of amino acids.
14. Bhang J. T., Wang M. У., Nature, 181, 566, 1958. Nutrition of Musca.
15. Chu H. M., Norris D. M., Kok L. T., J. Insect. PhysioL, 16, 1379—1387, 1970. Sterol requirements of bark beetles.
16. Clark A. J., Black K-, J. Biol. Chem., 234, 2578—2582, 2583—2588, 2589—2594, .959. Sterol requirements and sterol synthesis in insects.
17. Cloud P., Science, 160, 729—736, 1968. Atmospheric and hydrospheric evo-ution in primitive earth.
18. Consgrove W. B., Swanson В. K., PhysioL ZooL, 25, 287—292, 1952. Culture f Chilomonas
19. Couch J. R., J. Nutr., 35, 57—72, 1948; also Arch. Biochem., 21, 77—86, 1949. Biotin requirements of chicken.
20. Dadd R. H., J. Insect PhysioL, 6, 1—12, 1961. B-vitamin requirements of ecusts.
21. Dadd R. H., J. Insect PhysioL, 12, 1479—1492, 1966. Nutrition of waxmoth Galleria.
22. Dadd R. FL, Krieger D. L., J. Insect PhysioL, 14, 741—763, 1968. Amino acid requirements of aphid Myzus.
23. Dadd R. H. et al., J. Insect PhysioL, 13, 249—272, 1967. Requirements of aphid for water-soluble vitamins.
24. D’Agostino A. S., Provasoli L., BioL Bull., 139, 485—494, 1970. Axenic culture of Daphnia.
25. Daugherty J. W., Proc. Soc. Exp. BioL Med., 85, 288—291, 1954. Use of amino acids and ammonia by tapeworm Hymenolepsis.
26. Davis B. D., Cold Spring Harbor Symp. Quant. BioL, 26, 1—10, 1961. Enzymes for synthesis of amino acids.
27. Davis G., J. Insect PhysioL, 14, 1247—1250, 1968. Amino acid requirements of beetle Oryzaephilus.
28. Davis G. R. F„ Arch. Int. PhysioL Biochem., 77, 741—748, 1969. Protein nutrition of Tenebrio.
29. De Groot A. P., Experientia, 8, 192—194, 1952; also PhysioL Comp, Oecol., 3, 1—90, 1953. Amino acid requirements of honeybee.
Питание
281
30. Dewey V. С., Kidder G. W., J. Gen. Microbiol., 22, 72—78, 1960. Nutrition of strains of Tetrahymena.
31. Dewey V. C., Kidder G. W„ Arch. Biochem. Biophys., 115, 401—406. 1966. Lipid nutrition of Crithidia.
32. Dju M. У. et al., Amer. J. Physiol., 160, 259—263, 1950. Use of tocopherols in laying hens.
33. Dougherty E. C. et al., Anri. N. Y. Acad. Sci., 77, 176—217, 1959. Axenic culture of nematode Caenorhabditis.
34. Droop M. R., pp. 141—159, in: Physiology and Biochemistry of Algae, ed. by R. A. Lewin, Academic Press, New York, 1962. Organic nutrients.
35. Dryden L. P., Hartman A. M., J. Nutr., 101, 579—588, 1971. Vitamin Bi2 deficiency in rat.
36. Earle N. W., Slat ten B., Burks M. L., J. Insect. Physiol., 13, 187—200. 1967. Fatty acid requirements in bool weevil.
37. Earle N. W. et al., Comp. Biochem. Physiol., 16, 277—288, 1963. Steroid metabolism of adult boll weevil.
38. Elliott A. M., Physiol. Zool., 22, 337—345, 23, 85—91, 1950. Amino acid and growth factor requirements, Tetrahymena.
39. Ellis IF. C., Pfander IF. H., Nature, 205, 974—975, 1965. Role of rumen organisms in nutrition of host.
40. Elvehjem C. A., Fed. Proc., 15, 965—970, 1956. Amino acid imbalance.
41. Erhardt P., Z. vergl. Physiol., 60, 416—426, 1968. Vitamin requirements of squid.
42. Erk F. C., Sang F. H., J. Insect. Physiol., 12, 43—52, 1966. Nutrition of two Drosophilia species.
43. Erwin J., Block K-, J. Biol. Chem., 238, 1618—1624, 1963. Lipid metabolism of ciliates.
44. Felsenfeld G., Biochim. Biophys. Acta, 29, 133—144, 1958. Properties of synthetic polyribonucleotides.
45. Fox S. IF., Bioscience, 14, 13—21, 1964. Polymerization of peptides.
46. Fox S. IF., pp. 361—382, in: Origin of Prebiological Systems, ed. by S. W. Fox, Academic Press, New York, 1965. Simulation of prebiotic synthesis of proteins.
47. Fraenkel G., Ann. N. Y. Acad. Sci., 77, 267—274, 1959. Dietary requirements of insects.
48. Fraenkel G. et al., Physiol. Zool., 27, 40—56, 1954; also Arch. Int. Physiol. Biochem., 64, 601—622, 1956; also J. Nutr., 65, 361—395, 1958. Carnitine, chemistry and nutritional properties.
49. Friend IF. G. et al., Canad. J. Zool., 34, 152—162, 1956; 35, 535—543, 1957; also Ann. N. Y. Acad. Sci., 77, 384—393, 1959. Nutrition of onion maggot Hylemya.
50. Gaffron H., pp. 39—84, in: Evolution After Darwin, Vol. 1, ed. bv S. Tax, University of Chicago Press, Chicago, 1960. The origin of life.
51. Geer B. IF., Biol. Bull., 133, 548—566, 1967. Choline requirements of Drosophila.
52. Geer B. IF. et al., J. Exp. Zool., 176, 445—460, 1971. Metabolism of carnitine in Drosophila.
53. Goldberg L„ DeMeillon B., Biol. Chem., 43, 379—387, 1948. Protein and amino acid requirements of Aedes larvae.
54. Gordon H. T., Ann. N. Y. Acad. Sci., 77, 290—338, 1959. Nutrition of roach Blatella.
55. Halver J. E., J. Nutr., 62, 225—243, 1957; 63, 95—105, 1957. Nutrition of chi-nook salmon.
56. Hatada K., Fox S. IF., Nature, 201, 335—336, 1964. Thermal synthesis of amino acids.
57. Hassett С. C. et al., Biol. Bull., 99, 446—453, 1950. Nutritive value of carbohydrates for blowfly.
58. Hieb IF. F., Rothstein M., Science, 160, 778—779, 1968. Sterol requirements of a nematode.
282
Глава 3
59. Hinton Т., Ann, N. Y. Acad. Sci., 77, 366—372, 1959. Amino acid and growth factor requirements of Drosophila.
60. Hodgson E. et al., Canad. J. Zool., 34, 527—531, 1956. Choline substitutes and amino acid requirements of Phormia.
61. Hodgson E. et al., Comp. Biochem. Physiol., 29, 343—359, 1969. Choline and phospholipid requirements of Phormia.
62. Holz G., J. Protozool., 13, 1—4, 1966. Unique features of Tetrahymena.
63. Holz G., Wagner B., Erwin J., Comp. Biochem. Physiol., 2, 202—217, 1961. Sterol requirements of Tetrahymena.
64. Horie Y., Nakasone S., J. Insect. Physiol., 14, 1381—1387, 1968. Nitrition of silkworm Bombyx.
65. House H. L., Canad. J. ZooL, 32, 331—365, 1954; also Ann. N. Y. Acad. Sci., 77, 394—405, 1959. Nutrition of Pseudosarcophaga, dipteran parasite of spruce bodworm.
66. House H. L., J. Insect. Physiol., 12, 409—417, 1966. Vitamin E requirement for fly Agria.
67. House H. L., J. Insect. Physiol., 17, 1225—1238, 1971. Dietary requirements of fly larva Agria.
68. Hutner S. H. et al., pp. 85—177, in: Biology of Nutrition, ed. by R. M. Fiennes, Pergamon Press, New York, 1972. Nutrition and metabolism in Protozoa.
69. Ito T., Arai N., J. Insect Physiol., 12, 861—869, 1966; 13, 1813—1824, 1967. Amino acid requirements of silkworm Bombyx.
70. Jahn T. L., J. Protozool., 2, 1—5, 1955. Flagellate nutrition.
71. Johnson W. H., Physiol. Zool., 25, 10—19, 1952; 30, 106—113, 1957; also Ann. Rev. Microbiol., 10, 193—212, 1956. Amino acid requirements of Paramecium multinucleatum.
72. Jungulira P. B„ Schweigert B. S., J. Biol. Chem., 175, 535—546, 1948. Synthesis of nicotinic acid by rats.
73. Kasting R., McGinnis A. J., J. Insect. Physiol., 8, 97—103, 1962. Nutrition of cutworm Agrotis.
74. Kasting R., McGinnis A. J., Ann. N. Y. Acad. Sci., 139, 98—110, 1966. Amino acid requirements of Phormia.
75. Keith A. D„ Comp. Biochem. Physiol., 21, 587—600, 1967. Fatty acid metabolism of Drosophila.
76. Kidder G. W., pp. 162—196, in: Biochemistry and Physiology of Nutrition, Vol. 2, ed. by G. H. Bourne and G. W. Kidder, Academic Press, New York, 1953. Nutrition of invertebrate animals.
77. Kidder G. W., Dewey V. C., Arch. Biochem., 8, 293—301, 1945; 20, 433—443, 1949; 21, 58—65, 1949; also Proc. Nat. Acad. Sci., 33, 347—356, 1947; 34, 81—88, 566—574, 1948. Amino acid and growth factor requirements of Tetrahymena.
78. Kidder G. W. et al., Arch. Biochem. Biophys., 55, 126—129, 1955. Nitrogen, purine, and pyrimidine requirements of ciliate Glaucoma.
79. Kidder G. W., Dutta B. N., J. Gen. Microbiol., 18, 621—638, 1958. Nutrition of trypanosomiid flagellate Crithidia.
80. Leclerq J., Arch. Int. Physiol. Biochem., 62, 101—108, 1954; 65, 337—346, 1957. Carnitine in nutrition of Tenebrio and Gnathocerus.
81. Lemonde P„ Bernard R., Canad. J. Zool., 29, 80—83, 1951. Nutrition of Tribolium.
82. Leng M., Felsenfeld G., Proc. Nat. Acad. Sci., 56, 1325—1332, 1966. Binding of polypeptides to nucleic acid chains.
83. Levinson Z. H., Riv. ParasitoL, 16, 113—138, 189—204, 1955. Nutritional requirements of insects.
84. Levinson Z. H., Bergman E. D., Biochem. J., 65, 254—260, 1957. Steroid use and fatty acid synthesis by Musca larvae.
85. Lohrmann R., Orgel L. E., Science, 161, 64—66, 1968. Phosphorylation under prebiotic conditions.
Питание
283
86. Lue Р. Т„ Dixon S. Е., Canad. J. Zool., 45, 595—599, 1967. Nutritional value of royal jelly of honeybees.
87. Lwoff M., [/evolution physiologique, Hermann, Paris, 1944.
88. Lwoff M., pp. 129—177, in: Biochemistry and Physiology of Protozoa, Vol. 1, ed. by S. H. Hutner and A. Lwoff, Academic Press, New York, 1951. Nutrition of parasitic flagellates.
89. Magis N., Bull. Ann. Soc. EntomoL Belg., 90, 49—58, 1954. Nutritional requirements of Tribolium.
89a. Margulis L., pp. 342—368, in: Exobiology, ed. by C. Ponnamperuma. North Holland Publ. Co., Amsterdam, 1972. Properties of prokaryotes.
90. Meikle J. E. S., McFarlane J. E., Canad. J. Zool., 43, 87—98, 1965. Lipids in nutrition of cricket Acheta.
91. Miller S. L., J. Amer. Chem. Soc., 77, 2351—2361, 1955. Production of organic substances under possible primitive earth conditions.
92. Moore T., pp. 265—290, in: Biochemistry and Physiology of Nutrition, Vol. 2, ed. by G. H. Bourne and G. W. Kidder, Academic Press, New York, 1953. The fat-soluble vitamins.
93. Muscatine L., Comp. Biochem. Physiol., 16, 77—92, 1965. Symbionts of Hydra.
94. Muscatine L., Cernichiari E., Biol. Bull., 137, 506—523, 1969. Utilization of products of zooxanthellae by corals.
95. Niinrock K. et al., J. Nutr., 100, 1273—1300, 1970. Amino acid supplementation of urea in diet of lambs.
96. Noland J. L., Baumann C. A., Ann. Entomol. Soc. Amer., 44, 184—188. 1951. Choline and amino acid requirements of Blatella.
97. Olcese O., et al., J. Nutr., 35, 577—590, 1948. Synthesis of В vitamins in rabbits.
98. Oro J., Nature, 190, 387—390, 1961; also Arch. Biochem. Biophys., 93, 166— 171, 1961. Origin of life.
99. Pausch R. D., Fraenkel G., Physiol. Zool., 39, 202—222, 1966. Nutrition of rat flea Xenopsylla.
100. Phillips A. M., Trans. Amer. Fish. Soc., 74, 81—87, 1944; 76, 34—45, 1946. Vitamin requirements of brook trout.
101. Platzer E. G., Roberts L S., J. Parasit., 55, 1143—1152, 1969. Developmental nutrition of cestodes.
102. Provasoli L., D’Agostino R. S., Amer. Zool., 2, 439, 1962. Vitamin requirements of Arlertnia.
103. Provasoli L., D’Agostino A., Biol. Bull., 136, 434—453, 1969. Synthetic medium for Artemia.
104. Read С. P., Exp. Parasit., 6, 288—293, 1957. Carbohydrate utilization by cestodes.
105. Reid M. E., Proc. Soc. Exp. BioL Med., 85, 547—550, 1954. В vitamin requirements of guinea pig.
106. Rock G. C., Hodgson E., J. Insect. Physiol., 17, 1087—1098, 1971. Amino acid requirements of Heliothis.
107. Rock G. C., King K. W., J. Insect Physiol., 13, 175—186, 1967. Amino acid requirements of leaf-roller Argyrotaenia.
108. Rock G. C., Patton R. L., Glass C. H., J. Insect PhysioL, 11, 91—101, 1965. Fatty acid requirements of Argyrotaenia.
109. Rose W. C., PhysioL Rev., 18, 100—136, 1938; also Fed. Proc., 8, 546—552, 1949. Amino acid requirements in rat and man.
110. Sang J. H., J. Exp. BioL, 33, 45—72, 1956; also Ann. N. Y. Acad. Sci., 77, 352—365, 1959. Nutritional requirements of Drosophila.
111. Sang J. H., King R. C., J. Exp. BioL, 38, 793—809, 1961. Axenic culture of Drosophila.
Illa. Schoenheimer R., The Dynamic State of Body Constituents, Harvard University Press, Cambridge, 1942.
Hlb. Schopf J. W., pp. 12—61, in: Exobiology, ed. by C. Ponnamperuma, North Holland PubL Co., Amsterdam, 1972. Precambrian fossils.
284
Глава 3
112. Sedee D. J. W., Experientia, 9, 142—143, 1953; also Acta Physiol. Pharm. NeerL 3, 262—269, 1954. Nutrition of blowfly larvae.
113. Sherman H. C., The Chemistry of Food and Nutrition, Macmallan Co., New York, 1946.
114. Singh /(. R. P., Brown A. W. A., J. Insect Physiol., 1, 199—220, 1957. Nutritional requirements of Aedes aegypti.
115. Soldo A. T., van Wagtendonk W. J., J. Protozool., 16, 500—506, 1969. Culture medium for Paramecium aurelia.
116. Srivastava P. N., Auclair L., Ent. Exp. Appl., 13, 208—216, 1970. Dietary responses of milkweed bug Oncopeltus.
117. Tarr H. L., Ann. Rev. Biochem., 37, 223—244, 1958. Fish nutrition.
118. Teeri A. E. et al., J. Mammal., 36, 553—557, 1955. Vitamin excretion, deer.
119. Vanderzant G. S. et al., J. Insect. Physiol., 8, 287—297, 1962. Ascorbic acid in nutrition of cotton insects.
120. Wise D. L., J. Protozool., 2, 156—158, 1955; 6, 19—23, 1959. Carbon nutrition, Polytomella.
121. Woese C., in: Exobiology, ed. by C. Ponnamperuma, North Holland Press, Amsterdam, 1972. Origin of nucleic acid coding of protein structure.
122. Zandee D. I., Arch. Int. Physiol. Biochem., 74, 35—44, 1966. Biosynthesis of amino acids by crayfish.
123. Zandee D. I., Arch. Int. Physiol. Biochem., 75, 487—491, 1967. Cholesterol requirement of Sepia.
Глава 4
Сравнительная биохимия и физиология пищеварения
I. Пищеварение
Е. БАРНАРД
Пищеварительный аппарат
Все животные (за исключением некоторых эндопаразитов, о которых будет идти речь ниже) в качестве основных питательных веществ используют набор определенных макромолекул или других сложных компонентов. Для того чтобы эти вещества могли участвовать в метаболизме, необходимо расщепить их до простых форм с помощью специальных ферментов. Под термином «пищеварение» обычно подразумевают процессы такого расщепления. Ферменты, участвующие в пищеварении, относятся исключительно к гидролитическому типу; никаких, других возможных реакций типа фосфоролиза или окисления на этой стадии не обнаружено. Дополнительным субстратом, участвующим в реакциях, которые протекают в пищеварительном тракте, является вода; потребность в каких-либо других дополнительных субстратах была исключена в процессе естественного отбора.
Макрокомпоненты пищи включают углеводы, белки, жиры и нуклеиновые кислоты. В ходе эволюции сформировался такой набор пищеварительных ферментов, который способен расщеплять каждое из перечисленных выше веществ до простых единиц, всасываемых и включаемых затем в обмен веществ. Именно этот набор ферментов мы будем рассматривать в настоящем разделе. Некоторые потенциальные питательные вещества не могут перевариваться отдельными животными. Для большинства позвоночных такими веществами являются p-гликозидные полисахариды и нуклеиновые кислоты. Этот вопрос будет подробно обсуждаться в разд. III. У разных групп животных набор пищеварительных ферментов сильно варьирует, отражая сложный характер влияния адаптации к разным видам пищи и эволюционное происхождение.
Внутриклеточное и внеклеточное пищеварение. Самая простая пищеварительная система — это внутриклеточная; действительно, пищеварительные вакуоли образуются в основном у простейших и губок. Выделение пищеварительных ферментов из клеток в полость впервые появляется у кишечнополостных и гребневиков. У кишечнополостных сохранилось на вторичных стадиях и вакуолярное пи
286
Глава 4
щеварение [206]; часто его обнаруживают и v плоских червей [169]. У последних известно как исключительно внеклеточное пищеварение, например у печеночной двуустки Fasciola hepatica [79, 169] и у турбеллярии Cycloporus [169], так и чисто внутриклеточное пищеварение, например у бескишечного ресничного червя Соп-voluta convoluta [169]. Внутриклеточное пищеварение как дополнительное встречается у некоторых высших беспозвоночных [24], несмотря на наличие у них хорошо развитого специализированного пищеварительного тракта. Его обнаружили также у немертин, иглокожих, некоторых кольчатых червей и многих групп моллюсков. У большинства этих животных внутриклеточное переваривание обеспечивается в стенках пищеварительного тракта подвижными амебоцитами, которые обладают свойствами фагоцитов и содержат определенное количество пищеварительных ферментов. Такое аме-боцитарное пищеварение обычно служит дополнением к внеклеточному. Соответственно характеру питания встречаются и другие типы пищеварения [24, 74, 280]. Например, полихета Arenicola, которая питается органическими веществами, заглатываемыми вместе с песком, выделяет ферменты в полость своего кишечника и одновременно использует для максимальной экстракции фагоцитарные эпителиальные клетки [74, 186]. Другие полихеты, такие, как Clymenella, питающаяся диатомовыми водорослями, и члены сем. Terebellidae [74], которые захватывают пищу с помощью покрытых ресничками щупалец, обладают исключительно внеклеточным пищеварением. У головоногих моллюсков, ракообразных, насекомых и нематод внутриклеточное пищеварение встречается редко [24]. Однако у хордовых, например у Amphioxus [24], иногда еще встречается вторичное внутриклеточное пищеварение.
Современные представления о внутриклеточном переваривании пищи основаны на предположении об участии в этом процессе лизосом. Лизосомы — это пузыревидные органеллы цитоплазмы, содержащие набор различных гидролаз (фосфатаз, пептидаз, гликозидаз и других) с оптимумом действия в кислой области pH [81]. Предполагают, что в целом механизм переваривания (включая и пищеварение у простейших [244]) состоит в том, что вакуоли, содержащие захваченный пищевой материал, сливаются с лизосомами и переваривание осуществляется содержащимися в них кислыми гидролазами [167, 257]. Ферменты лизосом образуют вполне определенный набор независимо от того, какому организму они принадлежат [81], и существенно отличаются от типичных ферментов внеклеточного пищеварения. Вероятно, это связано с их значительной эволюционной дивергенцией.
Локализация внеклеточного пищеварения. В общих чертах пищеварительный тракт — это трубка, представленная многочисленными сложными вариантами, приспособленными к типу используемой пищи и способу питания организма. Последовательность его функционирования, как правило, одинакова во всех случаях.
Сравнительная биохимия и физиология пищеварения 287
А. Прием пищи. Ротовое отверстие и его придатки отражают все разнообразие форм в разных группах животных, которое обусловлено особенностями способов поглощения пищи (разд. IV). Если рот хорошо развит, то он обычно снабжен ротовыми железами, которые вырабатывают водянистую или слизистую слюну. Главная функция слюны в процессе пищеварения состоит в смачивании пищи для облегчения жевания и прохождения ее через пищеварительный канал. У жвачных животных слюна выполняет и ряд других функций (разд. III). Когда в процессе перерабатывания пищи интенсивно используются зубы, существенное значение приобретает также смазывание пищи слизью, поэтому все позвоночные выделяют слюну, богатую слизистыми гликопротеидами. Составлены таблицы, отражающие общий состав слюны человека и некоторых других млекопитающих [8].
В ферментативном переваривании слюна играет весьма ограниченную роль. Она обладает пищеварительной функцией у отдельных насекомых, некоторых брюхоногих моллюсков и у тех хищных головоногих, многоножек и змей, которые вместе с пищеварительными ферментами секретируют парализующие токсины. Известно, что среди насекомых [71, 95, 366] в слюне шелкопряда, пустынной саранчи, некоторых полужесткокрылых и тараканов содержатся высокоактивные карбогидразы, протеазы и липазы, т. е. основные ферменты пищеварения; однако слюна многих мух и жуков, как выяснилось, не содержит ферментов [366]. Последние отсутствуют, насколько это известно, также и у ракообразных [353]. Среди моллюсков у некоторых брюхоногих [126] (например, Helix) и хитонов [232] слюнные железы вырабатывают секрет, который участвует в переваривании углеводов; у многих хищных улиток железы выделяют аспарагиновую и серную кислоты вплоть до 1 н. концентрации, необходимые этим животным для растворения раковины жертвы [356]. Слюна некоторых млекопитающих содержит амилазу [8, 56, 356], которая в значительных количествах имеется, однако, только у человека, других приматов и у грызунов, в том числе у кролика; у других исследованных видов амилаза в слюне вообще не обнаружена или ее содержится очень мало. Некоторые хищные позвоночные, например лягушки [258, 356], тоже могут выделять слюнную амилазу, хотя ее субстрат, содержащийся в жертве (гликоген), становится доступным лишь после частичного переваривания в кишечнике. Этим позвоночным редко случается питаться крахмалом в чистом виде, т. е. во рту или желудке он у них оказывается редко; поэтому слюнная амилаза, вероятно, является рудиментом.
Б. Продвижение пищевой массы и откладывание пищи про запас. Для этих целей служат пищевод и зоб, которые обычно имеют мышечные стенки. Зоб представляет собой «камеру» для хранения пищи и имеется у большинства птиц [42, 328]/Аналогичные структуры встречаются в некоторых группах беспозвоночных (на
288
Глава 4
пример, у тех насекомых, которые редко принимают пищу). В зобе происходит размягчение пищи и переваривание большей части углеводов (обычно с помощью слюнных амилазы и дисахаридаз) [42, 71, 328, 366].
У некоторых позвоночных пища до переваривания хранится в течение какого-то времени в желудке, в мешковидных или лишенных желез отделах, как у некоторых рыб (например, угрей) и отдельных рыбоядных птиц.
В. Начальное переваривание. Структуры для внутреннего растирания или перемешивания пищи (терки, «желудочные мельницы», мускульный желудок), функционирующие на этой стадии, характерны для коловраток и многих кольчатых червей, для ракообразных, моллюсков и насекомых. У большинства птиц также имеется сильно сокращающийся мускульный желудок, который содержит мелкие камешки и имеет нежелезистый кератинизированный выстилающий слой. Подобные отделы желудка, выполняющие механическую функцию, имеются у крокодилов и у некоторых рыб (например, у Mugil и Mormyrus). Когда такие перетирающие структуры хорошо развиты, процесс размельчения пищи во рту утрачивает свое значение. У многих растительноядных моллюсков (у двустворчатых, кроме перегородчатожаберных и некоторых брюхоногих) обнаружены выполняющие механическую функцию вращающиеся кристаллические стебельки; они являются одновременно и главным источником ферментов. Стебелек выглядит как мукопротеидная палочка, сидящая в углублении переднего желудка и содержащая амилазу, липазу [24, 126] и другие ферменты [235]. Вероятно, он является источником нерастворимых ферментов, необходимых вследствие недостаточной изоляции кишечника этих животных от внешней среды.
Средняя кишка, или желудок, у высших беспозвоночных является основным местом переваривания пищи. Пищеварительные ферменты вырабатываются здесь либо одноклеточными железами выстилающей слизистой желудка, либо (у моллюсков и многих членистоногих) железистым выростом, или дивертикулом, называемым железой средней кишки или гепатопанкреасом. Эта железа иногда несет чисто секреторную функцию (например, у первичнохордовых и некоторых моллюсков [24]), а у многих других моллюсков, ракообразных и паукообразных в ее слепых выростах происходит и переваривание пищи. Нередко эта железа служит также местом всасывания. В большинстве случаев она выполняет одновременно и функцию запасающего органа (для гликогена и жиров), и метаболические функции, т. е. функционально аналогична печени позвоночных.
У головоногих моллюсков происходит обособление железы чисто панкреатического типа, содержащей зимогены протеаз. У большинства примитивных позвоночных (круглоротых) печень развита почти так же, как у млекопитающих, и имеет отдельный желчный
Сравнительная биохимия и физиология пищеварения
289
пузырь [1]. У них нет экзокринной поджелудочной железы, но в кишечном эпителии имеются изолированные клетки, вероятно панкреатического зимогенного типа [252]. У акуловых рыб экзокринная часть поджелудочной железы представлена ацинарными клетками и функционально полностью дифференцирована, как и у всех высших позвоночных. Ниже будет рассмотрена высокоразвитая система секреции пищеварительных ферментов у позвоночных. Следует отметить, однако, что даже в более примитивной группе многоклеточных, у которых встречается внеклеточное пищеварение (например, в гастральных нитях у кишечнополостных [121, 169] и в гастродерме некоторых плоских [169] и круглых [205] червей), секреторные клетки содержат плотные гранулы, подобные панкреатическим зимогенным гранулам и заполненные протеазами и другими ферментами, которые выделяются в кишечную полость. В гранулах эти протеазы могут присутствовать в виде предшественников, или активируемых молекул [121], как и у позвоночных. Показано, что в эпителии пищеварительной железы двустворчатых моллюсков некоторые базофильные клетки содержат секреторные гранулы и по тонкой структуре подобны ацинарным клеткам поджелудочной железы позвоночных [262]. Предполагают, что эти клетки являются источником обнаруженных здесь внеклеточных протеаз [280]. Следовательно, основные механизмы образования зимогенных гранул, по-видимому, возникли на ранних этапах эволюции многоклеточных.
Г. Завершение переваривания и всасывание питательных веществ. Эти процессы идут либо в большей части кишечника, либо в задней части средней кишки. У позвоночных кишечник имеет довольно сложное строение; его поверхность образует многочисленные складки, идущие в разных направлениях. У человека всасывающая поверхность тонких кишок увеличивается в 2—3 раза за счет круговых складок и, кроме того, еще в 8—10 раз за счет выдающихся пальцеобразных ворсинок длиной около 1 мм. Ворсинки в тонком кишечнике имеются не у всех позвоночных [228]. Наиболее выражены они у человека, хомяка и голубя, в то время как у других позвоночных, например у крысы, морской свинки и журавля (Grus grus) [382], ворсинок нет совсем, а поверхность кишок покрыта длинными гребнями, которые увеличивают общую площадь, а значит, и интенсивность всасывания в гораздо меньшей степени [228]. Для всасывающих клеток кишечного эпителия позвоночных характерна «щеточная» поверхность, образуемая микроворсинками (рис. 4-1), которые в свою очередь увеличивают площадь поверхности ворсинок [49] примерно в 40 раз. Микроворсинки встречаются и у беспозвоночных с хорошо развитым эпителием кишечника (например, в средней кишке насекомых). Крейн с сотр. [236, 260], выделив слой таких микроворсинок из кишечника млекопитающих и определив их функциональные компоненты, отметил центральную роль микроворсинок в окончательном этапе
19-1332
290
Глава 4
пищеварения и всасывания. Первоначально считали, что пищеварительные секреты, или кишечный сок, изливаются в тонкий ки
шечник; теперь же твердо установлено, что у различных млекопитающих [105, 236, 260, 307], птиц [312, 382], рептилий [382], амфибий [264], а возможно и у всех позвоночных, такого выделения
Рис. 4-1. Схема функциональной системы кишечной щеточной каймы.
Светлые кружки — панкреатические гидролазы, которые, по-видимому, частично доступны для адсорбции на гликокаликсе [347]. Темные кружки — собственные гидролазы мембраны микроворсинки (табл. 4-3). Молекулы-переносчики аминокислот и сахаров находятся в тесном контакте с гидролазами мембраны [66]. 1 — собственные ферменты: 2 — панкреатические ферменты; 3 — места переноса; 4 — АТФаза; 5 — липоидный матрикс; 6 — гликокаликс.
ферментов не происходит, а пищеварительные ферменты вырабатываются щеточной поверхностью эпителия (рис. 4-1). К таким ферментам относятся карбогидразы, липазы, энтерокиназы [255], некоторые пептидазы [156, 283] и щелочная фосфатаза [156]. Следовательно, конечные стадии пищеварения тесно связаны с процессом всасывания веществ клетками слизистой; предполагают, что в щеточной поверхности клеток имеет место кооперативная организация ферментов и переносчиков (рис. 4-1). Было показано [236], что всасывание только что расщепившихся сахаров идет быстрее, чем тех же продуктов, добавленных в просвет кишки; это предполагает наличие «кинетических преимуществ», создаваемых тесной взаимосвязью данных процессов. Единственный вид секреции, наличие которого убедительно доказано для кишечника позвоночных (помимо секреции слизи бокаловидными клетками), — это секреция воды и электролитов, необходимых для сбалансированного протекания кишечного пищеварения и эффективного всасывания [149].
Д. Выделение непереваренных остатков. Конечный участок пищеварительного тракта хорошо выражен у тех наземных животных, у которых он выполняет важную функцию во всасывании во-
Сравнительная биохимия, и физиология пищеварения 291 дьт из фекальной массы, как это происходит, например, в задней кишке насекомых и в толстой кишке позвоночных. У ракообразных и v большинства моллюсков весь кишечник, вообще говоря, представляет собой именно такой орган, а у паукообразных :— это средний и задний кишечник. У двустворчатых и многих брюхоногих моллюсков непереваренные частицы пищи обволакиваются слизью и прогоняются в виде нитей вниз по кишечнику под действием ресничек и перистальтики. Подобная слизистая оболочка фекалий препятствует заглатыванию их моллюсками, имеющими фильтрующий тип питания.
На стадиях Г и Д у многих животных существенную роль играют бактерии, населяющие кишечник (разд. III).
Защита пищеварительного эпителия. У всех животных с внеклеточным пищеварением поверхность пищеварительного тракта должна быть защищена от действия секретируемых ферментов, особенно протеаз. Кроме того, если по кишечному тракту проходит грубая пища, необходима защита его поверхности от ссадин. Наиболее распространенным способом, служащим той и другой цели, является секреция слизи. Она обнаружена у всех позвоночных и многих других групп животных (например, у брюхоногих, ракообразных и голотурий). Пищеварительный эпителий, по-видимому, вообще непроницаем для внеклеточных ферментных белков. Слизистая желудка позвоночных защищена также благодаря очень плотному сцеплению между верхними стенками его эпителиальных клеток, что помогает поддерживать непроницаемость таких поверхностей для ионов водорода [76]. Известно, что кишечный эпителий позвоночных покрыт наружной защитной оболочкой из мукополисахаридов, называемой гликокаликсом [164]. Описана обратимая адсорбция на поверхности слизистой некоторых пищеварительных ферментов из просвета кишечника без их проникновения внутрь клеток [7, 346]; это происходит в основном на гликока-ликсе.
Для защиты от механических повреждений участки пищеварительного тракта, по которым проходит грубая, царапающая пища, выстланы более жестким слоем клеток. У ракообразных и насекомых, питающихся твердой пищей, передняя и задняя кишки выстланы жестким хитиновым слоем. Эпителий средней кишки не имеет такого покрытия, но у большинства насекомых пищевая масса вместе с пищеварительными секретами окружена защитной «перитрофической оболочкой». Толщина ее менее 0,5 мкм; онз состоит из белка и хитина и специализирована таким образом, чтобы облегчить выход конечных продуктов для последующего всасывания их в кишке. Показано, что у двукрылых [383] -оболочка обладает избирательной проницаемостью. Аналогичные мембраны, окружающие перевариваемую массу, обнаружены также у некоторых полихет и у отдельных позвоночных. Например, в зобе некоторых рыбоядных птиц секретируется эластичная оболочка, оку-
Ю*
292
Глава 4
тывающая пищевую массу [349]; подобное явление наблюдается и в кишечнике круглоротых [1]. У позвоночных в тех участках кишечника, где требуется специальная механическая защита, как правило, развиваются кератинизированные, нежелезистые поверхности (например, в зобе птиц и в сложном желудке жвачных, стр. 310).
Секреция пищеварительных ферментов у позвоночных
Внеклеточные пищеварительные ферменты позвоночных выделяются вместе с желудочным и панкреатическим соками. Показано, что у позвоночных разных классов желчь содержит также щелочную фосфатазу [8] и амилазу [36, 57], причем особенно много амилазы у всеядных и травоядных. Выделение НС1 и кислых протеаз различными желудочными железами очень характерно для млекопитающих, птиц [99], рептилий [316, 372] и амфибий [256, 279], но не является универсальным правилом среди позвоночных и даже среди млекопитающих. У некоторых исследованных с этой точки зрения однопроходных и у хомячка Onychomus toridus желудок не имеет железистого строения [135]; его содержимое обладает нейтральным pH, что способствует действию обильной слюнной амилазы. У некоторых рыб желудок вообще отсутствует, например у химер, двоякодышащих рыб и в некоторых родах отдельных семейств костистых рыб (например, у Cyprinidae и Land-ridae) [23], а также у круглоротых [1]. Как показали исследования, ни у одного из этих видов не образуется ни НС1, ни пепсина [23, 252]. У таких лишенных желудка рыб пища попадает прямо в нейтральную или щелочную среду кишечника, который имеет расширенную начальную часть, структурно, однако, не отделенную от остального кишечника [4, 23]. Подавляющее большинство рыб имеет все же настоящий желудок, хотя в желудочных железах идентифицирован лишь один тип секреторных клеток, которые вырабатывают, по-видимому, НС1 и пепсиноген [4, 23, 318, 363]. У большинства высших позвоночных эти функции распределены между пристеночными (обкладочными) и главными (пептическими) клетками. У многих амфибий по неизвестным причинам пептические железы располагаются отдельно, в пищеводе [256, 279], а железы, вырабатывающие кислоту, находятся в эпителии желудка. Во всех классах позвоночных обнаружена значительная секреция НС1, а pH желудочного сока равен 1—2 [318]. На этой начальной кислой стадии пищеварения активно действуют протеолитические ферменты, убиваются бактерии, разрушаются клетки, составляющие основу пищи, которая заглатывается живой, растворяются кальцифицированные структуры пищи и, вероятно, облегчается всасывание железа [299].
Таблица 4-1
Ферменты, выделяемые поджелудочной железой позвоночных
Ферменты или предшественники! Место действия Источник данных
А. Протеазы Химотрипсиноген Трипсиноген Проэластаза Прокарбоксипептидаза А Прокарбоксипептидаза В Б. Другие ферменты Амилаза Липаза2 ч Карбоксилэстераза и хо-лестер оэсте раза3 Профосфолипаза А Рибонуклеаза Дезоксирибонуклеаза 1 Главным образом пептидные связи, образованные с участием карбоксильных групп триптофана, фенилаланина и тирозина Связи, образованные с участием карбоксильных групп лизина и аргинина Связи, образованные нейтральными аминокислотами, особенно в эластине Все связи с С-конца, кроме связей, образованных с участием карбоксильных групп лизина, аргинина и пролина; наиболее эффективно действует на связи, образованные ароматическими и неполярными аминокислотами с С-конца Связи, образованные с участием карбоксильных групп лизина и аргинина а (1—>4)-Глюкозиды Триглицериды с образованием 2-моно-глицеридов и жирных кислот (рис. 4-3) Водорастворимые или диспергированные солями желчных кислот моноэфиры 3-£п-фосфоглицериды, по С-2 (например, лизолецитин) РНК, с образованием Цф, Уф и олигонуклеотидов ДНК, с образованием олигонуклеотидов [100, 184, 237, 252, 277, 293, 295, 300, '330. 343 , 367 , 381] [45, 100, 484, 192 , 252 , 278, 293 , 295 , 300, 367, 381] [120, 184, 199, 200, 223, 252, 278, 310, 381] [107, 184, 198, 249 , 252 , 278, 381] [184, 249, 252] [37, 100, 184, 220, 230, 265, 278, 288, 370] [46, 57, 99, 100, 130, 184, 220, 226, 240, 265 , 298 , 364] [61, 93, 226, 240, 298] [9, 31, 82, 217, 365] [21, 130, 184, 278, 281] [184, 278, 297]
Некоторые из этих ферментов (или зимогенов) у одного и того же животного могут существовать в нескольких формах. Более ранние ссылки приводятся во втором издании этой книги.
2 В настоящее время неизвестно, существует ли специальная панкреатическая лецитиназа, действующая на эфирные связи в таких фосфолипидах, как лецитин.
3 Установлено [240], что обе эти активности принадлежат одному ферменту и их действие проявляется в зависимости от того, нужны ли для растворения субстрата соли желчных
294
Глава 4
У всех основных классов позвоночных экзокринная поджелудочная железа выделяет целый набор пищеварительных ферментов (табл. 4-1).
Ферменты содержатся в особых зимогенных гранулах, на долю которых приходится до 40% общего количества белка железы. У акуловых рыб [23], включая и примитивных химер [НО], экзокринный отдел поджелудочной железы представляет собой отдельный гроздевидный орган такого же типа, как и у млекопитающих, с панкреатическим протоком, открывающимся в кишечник, и набором характерных панкреатических ферментов [252, 381]. У большинства костистых рыб [4, 23, 57] экзокринная поджелудочная железа представляет собой диффузный, нередко имеющий вид тонких нитей орган, который может пронизывать печень; во многих случаях макроскопическая анатомия не обнаруживает в нем железистого строения, и участки панкреатической ткани далеко рассеяны вдоль кишечника. У таких костистых рыб кишечник обычно имеет ряд отростков в виде пилорических слепых кишок (или пилорических придатков), представляющих собой складчатые, узкие выпячивания кишечника [4, 23, 356], увеличивающие поверхность пищеварения и всасывания. Рассеянные панкреатические клетки обычно изливают свой секрет в эти слепые отростки, поэтому отдельный анализ панкреатических ферментов очень затруднителен. Например, протеазы из таких костистых рыб можно выделить только в активированной форме, хотя в панкреатических клетках они, вероятно, находятся в виде зимогенов [381].
Значения pH, при которых происходит внеклеточное пищеварение
Последующие стадии пищеварения, как правило, протекают при нейтральном или щелочных pH. Выше уже рассматривалась свойственная позвоночным фаза кислого желудочного пищеварения. У беспозвоночных некую предварительную фазу пищеварения с выраженной кислой секрецией удалось обнаружить лишь у очень немногих видов (например, у отдельных иглокожих, которым требуется растворять известковый материал [208], и у хищных улиток, упоминавшихся выше). У некоторых двукрылых насекомых выработалась подобная специализация для переваривания белков в средней кишке, где поддерживается среда с pH 2—3 и секретируются протеазы с оптимумом действия именно в этой области pH [158]. Такая кислая среда обнаружена в средней кишке личинок мух Calliphora, Musca и Stomoxys [129]. Данные о pH в пищеварительном тракте насекомых собраны Хаусом [158]; эти pH находятся в интервале от 6 до 8, т. е. характерны вообще для беспозвоночных, за исключением специальных случаев. Иногда кислотность секрета у насекомых обусловлена, по-видимому, фосфорной кислотой [158]. Значения pH желудочного сока и оптимум
Сравнительная биохимия и физиология пищеварения 295
pH его протеолитической активности находятся между 7 и 8 у 20 видов веслоногих, равноногих и десятиногих ракообразных, однако у морского желудя Balanus nubilus [85] и у креветки Ре-naeus setiferus [118] оказалась кислая среда (pH 4—5). У немер-тин в передней кишке имеются железистые клетки, содержащие карбоангидразу и напоминающие обкладочные клетки позвоночных, в которых образуется кислый секрет; последний используется как для умерщвления жертвы, так и для протеолиза с помощью кислой протеазы, которая секретируется гастродермисом [168, 169]. Такого рода исключения, обусловленные пищевой адаптацией, вероятно, встречаются и в других группах беспозвоночных.
pH панкреатического сока позвоночных находится между 7,5 и 8,5; при стимуляции секреции сок содержит большое количество бикарбоната натрия. Слизистая кишечника активно секретирует или абсорбирует ионы натрия, бикарбоната, хлора и воду [149], поддерживая ионный баланс таким образом, чтобы нейтрализовать кислоту, поступающую из желудка, и сохранять pH в диапазоне 7—8,5, который характерен для кишечника фактически всех позвоночных [8].
Заключение
Прибегнув к некоторому упрощению, можно утверждать, что пищеварительная система отражает усложнение процессов питания в ходе эволюции последовательных линий беспозвоночных и хордовых. У более высокоорганизованных позвоночных в пищеварительном тракте и сопутствующих ему железах содержится более разнообразный набор клеток, анатомически и биохимически специализированных для секреции большего числа ферментов и гормонов (разд. V), чем в какой-либо другой группе животных.
II. Сравнительная биохимия пищеварительных ферментов
Е. БЛРНАРД
Переваривание углеводов
Большинство углеводов, входящих в пищу животных, имеет растительное происхождение. Пища хищников, естественно, менее богата углеводами. У человека около 50% поглощаемых калорий приходится на долю углеводов, представленных в основном крахмалом, сахарозой, лактозой и фруктозой [155, 380]. В развивающихся странах углеводы составляют основную часть рациона. Но если последовательно рассматривать все звенья пищевых цепей, то можно сказать, что в конечном итоге вся пища животных имеет растительное или бактериальное происхождение.
Полисахариды, входящие в пищу животных, относятся в основ
296
Глава 4
ном к двум классам: а) структурные полисахариды, которые не перевариваются позвоночными, — целлюлоза, лигнин, декстраны, маннаны, инулин, пентозаны, пектиновые и альгиновые кислоты, агар и хитин; б) универсальные пищевые полисахариды — главным образом крахмал и гликоген. Крахмал служит самым важным резервным питательным веществом растений и состоит из амилозы и амилопектина (табл. 4-2), который составляет внешнюю оболочку крахмального зерна. Гликоген является резервным полисахаридом животных. Структура и характер расщепления углеводов, имеющих питательную ценность, приведены в табл. 4-2.
Способы, с помощью которых травоядные используют структурные полисахариды, рассматриваются отдельно (разд. III).
Таблица 4-2
Основные углеводы, перевариваемые животными
Углеводы Структура! Фермент Действие фермента
Полисахариды Амилоза (Глюк-а(1->4)Глюк)эт а-Амилаза или Эндо; расщеп-
Крахмал Амило- (Гл юк- а (1 ->4) Глюк) т Р-Амилаза ляет связи
пектин Гликоген ответвления по связям а (1->6) Глюк; —12 Такая, как у амило- у-Амилаза (глюко- н(1->4) Экзо; последовательно отщепляет мальтозные единицы Эндо
Целлюлоза пектина с т=3—6 (Глюк-Р(1->4)Глюк)п амилаза) Целлюлаза2 »
Хитин (Ац Глюк-Р(1->4)Ац Хитиназа2 »
Олигосахариды а-Глюкозиды: Мальтоза Изомальтоза Глюк)п Глюк-а(1->4) Глюк Глюк-а(1->6) Глюк Мальтаза и у-амилаза Изомальтаза
Сахароза а, а-Трегалоза Глюк-а(1->2) Р-Фрук-Глюк-а(1->1)а-Глюк Сахараза Грегалаза
Р-Глюкозиды: Целлобиоза Глюк-Р(1->4) Глюк Р-Глюкозидаза
(3-Галактозиды: Лактоза а-Галактозиды: Раффиноза Гал-р( 1->4) Глюк Г ал-а (1->4) Глюк-а Лактаза а-Галактозидаза Высвобождает
р-Фруктозиды: Сахароза (3->2) р-Фрук Фрук-Р (2->1) а-Глюк Инвертаза а-галактозу
i Глюк - D-глюкопиранозил; Фрук - D-фруктофуранозил; Гал -р-галактопиранозил; АпГпюк___2-М-ацетил-И-глюкозамил; моносахариды последовательно соединяются между
собой от С-1 к С-4 (1—>4); п — большое неидентифицированное число.
2 У животных секретируется редко.
Сравнительная биохимия и физиология пищеварения
Пищеварительные карбогидразы позвоночных. Панкреатическая ot-амилаза гидролизует амилозу (табл. 4-2) не беспорядочно, просто чтобы дать большие количества глюкозы, а расщепляет одновременно по 2—6 последовательных связей [132, 287]. Мальтоза и мальтотриоза при физиологических условиях весьма устойчивы к действию а-амилазы; эти сахара и в меньших количествах более крупные олигосахариды являются единственными продуктами переваривания амилозы а-амилазой [132, 287]. Амилопектин (как и гликоген) также не расщепляется на глюкозу, а образует мальтозу, мальтотриозу и большое количество разветвленных олигосахаридов [148, 284], наличие в которых а (1—>т6)-глюкозидных связей препятствует дальнейшему их расщеплению. Поэтому роль кишечных ферментов в расщеплении олигосахаридов и мальтозы весьма существенна, так как всасываться могут только свободные моносахариды.
Таблица 4-3
Ферменты, связанные со щеточной каймой слизистой кишечника позвоночных
Фермент Источник данных
у-Амилаза (мальтаза I)1 Мальтаза 2 Мальтаза-сахараза (мальтазы 3 и 4) Мальтаза-изомальтаза (мальтаза 5) Трегалаза Лактаза р-Глюкозидаза Щелочная фосфатаза Аминопептидаза Олигопептидаза Энтерокиназа Карбоксилэстераза2 [7, 73, 89] [72, 193] [72, 193, 307, 312, 382] [72, 193, 307] [187, 307, 312] [6, 187, 307, 336, 382] [219, 307] П56] [109, 156, 283] [88, 182, 266, 286] [140, 255] [77, 218]
1 Нумерация мальтаз дана в соответствии с классификацией Семенза [307]. Другая классификация сделана Дальквистом [72].
.... "Инолнтическая активность, обусловленная скорее ферментами щеточной кай-достаточно 5четкоЛеТОЧНЫМИ И кишечнополоСтными Ферментами, была определена не-
Переваривание олигосахаридов и дисахаридов (освобождаемых амилазои или поступающих с едой) в кишечнике позвоночных осуществляется специфическими ферментами (табл. 4-3), которые прочно связаны с мембранами в микроворсинках. Всасывание моносахаридов через мембраны эпителиальных клеток происходит после loro, как моносахариды образуются из полисахаридов при ферментативном расщеплении [67, 236]. Частично в этих конечных стадиях переваривания участвует и у-амилаза, которая последовательно отщепляет остатки глюкозы с концов олигосахаридов и мальтозы, а также от крахмала и гликогена [7, 73, 89]. В отли
298
Глава 4
чие от сс-амилазы животных у-амилаза не активируется ионами хлора и гораздо более термоустойчива [7, 73, 89]. Различные а-глюкозидазы называются мальтазами; число таких ферментов, находящихся в щеточной поверхности кишечника человека, пока неизвестно. Современная классификация этих ферментов представлена в табл. 4-3. У млекопитающих эти ферменты могут различаться скоростями тепловой инактивации [72, 193], сродством к сахарам [89, 193] и поддаются хроматографическому разделению [72, 193]. У других позвоночных, помимо млекопитающих, имеется набор тех же самых гликозидаз, хотя может и отсутствовать какой-либо тип ферментов [187, 307, 382]. Одна из мальтаз у разных млекопитающих встречается в виде «сахаразо-изомальтазного комплекса», обладающего этими двумя активностями в равных пропорциях [193, 307, 382]. Такое явление обусловлено, вероятно, наличием двух независимых активных центров [193], которые ведут себя так, как если бы они находились под единым генетическим контролем [308]. В слизистой кишечника птиц [312, 382] и черепах [312] также обнаружены обе активности, хотя и в неравном соотношении.
Другой кишечной «-гликозидазой, широко распространенной у всех видов, от человека до рыб (но отсутствующей у кошек, ластоногих, медведя-коала и у птиц) [187, 307, 312], является трега-лаза. Для нее известен только один субстрат — а,«-трегалоза (табл. 4-2). Этот дисахарид встречается у водорослей, грибов и насекомых; доля его в пище западного человека ничтожна, однако у жителей Востока (и, вероятно, у первобытного человека [307]) трегалоза составляет заметную часть пищи.
Лактаза имеется только у млекопитающих [307, 382], у которых она связана со щеточной поверхностью ворсинок. В слизистой кишечника млекопитающих встречаются и другие р-галактозидазы, но они хорошо растворимы, имеют более слабую лактазную активность и кислый оптимум pH. Эта активность локализована в лизосомах и не участвует во внеклеточном пищеварении, идущем в щеточной кайме [6, 15]. Как показывают исследования, проведенные на человеке [6, 15], обезьянах [336] и крысах [6], подобную локализацию и оптимум pH при 6,0 имеет только лактаза. В щеточной кайме млекопитающих была найдена и р-глюкозидаза [219, 307].
Наличие тех или иных карбогидраз полностью коррелирует с характером питания позвоночных. Так, лактоза в качестве основного углевода питания синтезируется в молоке всех наземных млекопитающих (от 3 до 7 г на 100 г) [8]; поэтому лактаза в большом количестве содержится в кишечной щеточной кайме этих животных перед рождением и сразу после него [307]. У других позвоночных, детеныши которых не питаются молоком, лактаза отсутствует [307, 312]. У некоторых морских млекопитающих, особенно ластоногих (тюленей, морских львов и моржей), молоко не содержит лактозы (как и других углеводов), поэтому у их детенышей
Сравнительная биохимия и физиология пищеварения
299
нет кишечной лактазы [307, 335]. По этим признакам сумчатые подобны плацентарным наземным млекопитающим [187]. У детенышей млекопитающих количество кишечной лактазы обычно уменьшается после прекращения кормления их материнским молоком, когда лактоза исчезает из пищи. У человека такое уменьшение выражено в гораздо меньшей степени, чем у других млекопитающих [307].
Наличие сахаразы тоже соответствует характеру пищи; так, она отсутствует у ластоногих [307, 335] и в очень малых количествах имеется у некоторых рыбоядных птиц [187]. Сахараза и мальтаза, содержащиеся в кишечнике млекопитающих (за исключением человека), появляются только после окончания периода кормления материнским молоком [307], т. е. когда животное начинает получать с пищей соответствующие субстраты. У многих жвачных, которые расщепляют сахара в рубце, эти кишечные ферменты либо имеются в малых количествах, либо вообще отсутствуют [72, 311, 357].
Нехватка одного из ферментов, необходимых для переваривания дисахаридов, приводит у животных к непереносимости соответствующего дисахарида, которая в свою очередь ведет к диарее и смерти [29, 335]. Эти симптомы связаны с тем, что в норме ни один из дисахаридов не всасывается; если их не гидролизовать, то они создают в кишечнике избыточную осмотическую нагрузку. Этот факт иллюстрирует влияние отбора, который направлен в сторону сохранения животных, обладающих достаточным количеством кишечных ферментов для расщепления дисахаридов, содержащихся в пище. Этот фактор имеет большое значение и для человека: известно, что некоторые дети и довольно значительная часть взрослого населения Земли (особенно народы Азии и Африки) страдают недостаточностью лактазы в щеточной кайме кишечника [127, 128]. Изучена также врожденная комбинированная са-харазо-изомальтазная недостаточность [127, 308].
Беспозвоночные. У беспозвоночных ферменты, переваривающие углеводы, изучены хуже, чем у позвоночных, хотя известно, что амилазы и дисахаридазы распространены здесь очень широко. У ракообразных эти ферменты выделяются в основном железой средней кишки; данные о их наличии у этого класса животных собраны ван Уилем [353]. Как показали специальные исследования, все ракообразные секретируют а-амилазу. Там, где ее удалось детально исследовать, как, например, у краба Carcinus mae-nas [39], выяснилось, что в отношении инактивации ионами хлора и кальция она подобна а-амилазе позвоночных. Очищенный фермент из Carcinus [39] имеет вчетверо меньший молекулярный вес по сравнению с сс-амилазой из поджелудочной железы млекопитающих [101, 348]. У многих насекомых активируемая ионами хлора а-амилаза также выделяется средней кишкой [20, 60, 71, 95, 157]. Интересно, что оптимум pH этого фермента очень сильно
300
Глава 4
варьирует в соответствии с pH средней кишки. Например, средняя кишка у чешуекрылых имеет сильно щелочную среду и секретирует амилазу с оптимумом pH, близким к 10, тогда как у некоторых разнокрылых бабочек соответствующие значения pH близки к 4. Слюнная сс-амилаза встречается лишь в некоторых группах насекомых [20, 71, 366]. Это дополнительное переваривание полисахаридов связано в основном с сохранением растительной пищи в зобе. P-Амилаза у животных встречается крайне редко, но имеется у большинства растений.
Лактаза, как правило, отсутствует у беспозвоночных; исключение составляют некоторые малощетинковые черви [209, 251], улитки Helix [247] и отдельные насекомые, такие, как пчелы (личинки), тараканы [104, 335], саранча [78, 95] и жуки-кожееды [60]. В этом, как и в других случаях обнаружения необычной ферментативной активности в пищеварительной системе у беспозвоночных, нельзя полностью исключить возможное участие симбиотических микробов или простейших. Хорошо охарактеризованы пищеварительные карбогидразы, включая и лактазу, у саранчи [78] и жуков [60]. У ракообразных лактаза в ощутимых количествах не обнаружена [353].
Активность сахаразы обнаружена в кишечнике самых разных беспозвоночных, включая всех исследованных насекомых в тот период их развития, когда они активно питаются, и свойственна главным образом ос-глюкозидазе, которая расщепляет также и мальтозу (табл. 4-2) в отличие от инвертаз растений и грибов. Имеются и исключения: известно, что некоторые насекомые [24], в том числе шелкопряд [242] (который использует инулин) и некоторые жуки [60] и тараканы [20, 104], обладают |3-фруктозидаз-ной активностью. Получаемые с пищей р-глюкозидные дисахариды расщепляются у многих беспозвоночных, главным образом у травоядных, включая некоторых насекомых, брюхоногих моллюсков и ракообразных [20, 24, 95, 242, 353]. Личинки дневных и ночных бабочек, помимо липазы и протеазы, содержат в средней кишке и сахаразу, тогда как у взрослых форм, которые питаются нектаром, из пищеварительных ферментов остается только сахараза; у ночных бабочек в тот период их развития, когда они не питаются, пищеварительные ферменты вообще отсутствуют.
У хищных беспозвоночных переваривание сахаров идет очень слабо. Например, у кровососущей мухи Chrysops нет слюнных карбогидраз, а сахараза содержится лишь в задней части средней кишки, тогда как у близкородственного вида — мухи Calliphora, не сосущей кровь, — амилаза имеется в слюнных железах, а кроме того, амилаза, мальтаза и сахараза содержатся как в переднем, так и в заднем отделах средней кишки [366]. Аналогично животные, питающиеся планктоном, и травоядные брюхоногие моллюски обладают высокой активностью внеклеточной амилазы в кристаллическом стебельке (разд. I) и в секрете гепатопанкреаса,
Сравнительная биохимия и физиология пищеварения 301
а также имеют широкий спектр других карбогидразных активностей [24, 261]. С другой стороны, у хищных брюхоногих кристаллического стебелька нет, и небольшое количество амилазы образуется только в гепатопанкреасе [261]. .....
Трегалаза обнаружена в кишечнике многих насекомых [20, 24, 95, 373] и других беспозвоночных, питающихся грибами, в которых содержится трегалоза (например, у дождевых червей [209] и некоторых других малощетинковых червей [251], чья пища включает споры грибов). Она может содержаться в заметном количестве и у насекомоядных животных, так как трегалоза, вероятно, служит у всех насекомых резервным питательным веществом [345, 373], концентрация которого в гемолимфе достигает 7% (см. стр. 444). Считается, что одна из функций трегалозы у насекомых состоит в облегчении кишечного всасывания глюкозы путем ее удаления из гемолимфы [345]. Трегалаза в кишечнике насекомых может быть необходимой в связи с обратной диффузией трегалозы [345].
Однако корреляция карбогидразной активности с особенностями питания у беспозвоночных не всегда очевидна. Некоторые насекомые, питающиеся главным образом белковой пищей, секретируют большой набор карбогидраз [60]. Пища многих беспозвоночных, в кишечнике которых имеется заметная лактазная активность, по-видимому, совсем не содержит никаких р-галактозидов. Очевидно, эти и подобные им явления в настоящее время можно рассматривать как атавизм.
Переваривание белков
Пищеварительные эндопептидазы расщепляют как внутренние пептидные связи, так и связи, расположенные на конце молекулы белков и пептидов, а экзопептидазы последовательно отщепляют аминокислоты с аминного или карбоксильного конца. Некоторые экзопептидазы расщепляют как белки, так и пептиды; другие, также участвующие в пищеварении, расщепляют только пептиды (например, три- и дипептидазы кишечной щеточной каймы у млекопитающих) [283]. Ферменты, участвующие в переваривании белков пищи, должны отличаться от протеаз, используемых в клетках для других целей. Таким образом, группа внутриклеточных протеиназ, называемых катепсинами, обладает широкой специфичностью, наибольшей активностью при слабокислых значениях pH и локализована в лизосомах. В эксперименте, когда используют экстракты целых тканей или организмов, катепсины можно ошибочно принять за внеклеточные пищеварительные кислые протеазы.
Кислые протеазы. У беспозвоночных внеклеточные кислые протеазы встречаются довольно редко (разд. I). О них известно очень немного,^ и в частности то, что они подобны катепсинам [169]. С другой стороны, все исследовавшиеся на этот счет позвоночные
302
Глава 4
(за исключением не имеющих желудка рыб [23], круглоротых [252] и нескольких видов с нежелезистым желудком [135]) секретируют пепсиноген с молекулярным весом около 39000 [338]. Он автокаталитически активируется в кислой среде, переходя в протеазу пепсин, имеющую оптимум активности при pH 1,8—2,0. У представителей одного вида встречается несколько слегка различающихся форм пепсина, как это, например, имеет место у человека и свиней [296, 306]. Кроме того, в желудочном соке человека идентифицирована по крайней мере еще одна химически отличная протеаза, названная гастриксином [169, 338]. Есть сведения, что она встречается и у других видов позвоночных и имеет оптимум pH 3,3—4,0. У сосущих детенышей жвачных обнаружен реннин, особая створаживающая молоко протеаза с оптимумом pH при 3,7. Очевидно, все эти ферменты образуются из разных зимогенов [169]. Частично известны аминокислотные последовательности пепсина, гастриксина и реннина. Оказалось, что они весьма сходны между собой, и на этом основании было высказано предположение [160], что эти ферменты эволюционировали от общего предшественника протеазы путем удвоения гена через гипотетическую, ныне исчезнувшую протеазу 2:
^Пепсины
Предшественник (Кислая протеаза 1)->Протеаза 2ч
^Реннин ^Гастрикаш
Сразу после поступления в желудок позвоночных pH пищи сохраняется обычно выше 2 до тех пор, пока не выделится достаточное количество кислоты; внутри пищевой массы pH может быть выше [318], поэтому наличие желудочных ферментов с более высокими оптимумами pH, чем у пепсина, имеет свои преимущества.
Группа сериновых протеаз. Насколько известно, химотрипсиногены и трипсиногены секретируются поджелудочной железой всех позвоночных [45, 143, 367, 381] (табл. 4-1). Они имеют молекулярный вес около 25 000. Сравнение аминокислотных последовательностей этих ферментов различных видов позвоночных обнаруживает строгую гомологию между химотрипсинами, трипсинами и эластазой [45, 143, 310, 367], свидетельствуя о том, что они произошли от общей нейтральной протеазы, вероятно, в результате такого же эволюционного процесса, который предполагается для пепсинов. Все эти ферменты имеют активные центры одинаковой структуры, включающие гистидиновые и сериновые остатки [143, 381]. Для бычьего химотрипсина А и эластазы свиньи [38, 359] полностью определена молекулярная структура.
Трипсиноген активируется энтерокиназой в кишечнике позвоночных. Сам трипсин активирует новые порции трипсиногена и все остальные протеазные зимогены, перечисленные в табл. 4-1. Процесс активации всегда начинается с расщепления в молекуле зимогена одной или нескольких пептидных связей. Известны два
Сравнительная биохимия и физиология пищеварения 303
типа специфических панкреатических белковоподобных ингибиторов трипсина: ингибитор Кунитца (основной) [183], который обнаружен в поджелудочной железе и в других тканях жвачных животных, и ингибитор Казаля (кислый) [52]. У всех исследованных млекопитающих с соком поджелудочной железы секретируется, только второй ингибитор. Его роль заключается в контролировании автоактивационного процесса до поступления энтерокиназы в кишечник, после чего начинается каскад активации протеаз.
У позвоночных известны по крайней мере три формы химотрипсиногеновых молекул — А, В и С, которые все вместе могут присутствовать у одного вида. Они отличаются структурой и вторичной специфичностью (форма С) [237, 343]. Их не следует путать с вариантами се, у, б и другими, происходящими от какой-то одной формы (например, химотрипсиногена А) путем различных вторичных расщеплений пептидных связей при активации соответствующего зимогена.
Эластаза, по-видимому, вырабатывается у всех исследовавшихся млекопитающих [310]. Она выделяется с панкреатическим соком в виде зимогена проэластазы [120, 199], от которой отщепляется небольшой пептид и образуется фермент с молекулярным весом 26 000 (у свиньи). Эластаза расщепляет многие белки, но в отличие от других панкреатических ферментов обладает уникальной способностью переваривать эластин — фибриллярный белок с поперечными сшивками, входящий в состав стенок сосудов и соединительной ткани позвоночных. Предполагают, что в поджелудочной железе хищных позвоночных проэластаза содержится в гораздо больших количествах, чем у травоядных [310]. Известно, что эластаза отсутствует в кишечнике круглоротых [252]. Она обнаружена в поджелудочной железе многих млекопитающих [184, 310], цыплят [223] и некоторых рыб [200, 252, 278, 381]. Поджелудочная железа выделяет также ферменты с муколитической и эстеразной активностями, которые, как это было показано [142, 212], связаны с эластазой («эластомуказа» и «эластолипопротеиназа») и действуют совместно с ней на связи углеводов с липидами в эластической ткани [142, 212].
Трипсиноподобные протеазы очень широко распространены в секретах кишечника беспозвоночных1); их идентифицируют по действию на N-ацил-Ь-аргининовые (или a-N-ацетил-Е-лизиновые) эфиры или амиды при щелочных значениях pH. Это минимально необходимые условия для подобной идентификации; все ранние данные (почти до 1960 г.) по пищеварительным протеазам беспозвоночных страдают неточностью из-за отсутствия специфических методов определения протеаз, а в некоторых случаях — даже соответствующего контроля pH (как заметил Болдуин [18]), а также из-за невозможности разграничить внеклеточные и внутриклеточ
1 См. работы [36, 46, 54, 62, 75, 85, 267, 367, 384].
304
Глава 4
ные протеазы (во многих случаях готовились экстракты из смеси различных тканей и даже из целых животных). Результаты, полученные с помощью таких низкомолекулярных субстратов, более или менее специфичных для трипсина млекопитающих, не позволяют получить достаточно четких данных о таком разграничении. В ряде случаев дополнительные доказательства сходства исследуемых протеаз с трипсином позвоночных были получены с помощью специфического триптического расщепления белковых субстратов или таким убедительным способом, как ингибирование алкилирующим активный центр трипсина [302, 381] веществом, называемым TLCI\ (1-хлор-3-тозиламило-7-амино-3-гептанон), а также путем перекрестных иммунологических реакций [14].
С помощью параллельных методов химотрипсины были обнаружены также у некоторых беспозвоночных; правда, у отдельных видов беспозвоночных, содержащих трипсин, активности химотрипсина не найдено [36, 118]. Однако у нескольких видов кишечнополостных [62, 121] и иглокожих [75] в пищеварительном тракте был найден химотрипсин вместе с трипсином, т. е. дивергенция этих двух типов протеаз произошла на весьма ранних стадиях эволюции многоклеточных. У исследованных видов беспозвоночных химотрипсины и трипсины по химическим свойствам активного центра подобны сериновым протеазам млекопитающих.
Доказательства существования зимогенных форм химтрипсино-и трнпсиноподобных протеаз беспозвоночных были получены лишь в нескольких случаях [34, 54, 62, 75, 121], но можно ожидать, что еще появятся новые данные на этот счет. Известно, что по крайней мере в одном случае [34] образование активного фермента из предшественника происходит путем протеолитического (триптического) расщепления. Трипсины и химотрипсины беспозвоночных имеют молекулярный вес, весьма близкий молекулярному весу соответствующих ферментов млекопитающих (около 25 000). Правда, из средней кишки личинок Vespa orientalis [330] был выделен гораздо более низкомолекулярный белок (12 500), обладающий свойствами химотрипсина. Подобные низкомолекулярные протеазы, которые по специфичности отличались и от трипсина, и от химотрипсина, но имели тот же оптимум pH, были обнаружены также в пищеварительном соке ракообразных [47, 267].
Коллагеназа, которая расщепляет неденатурированный коллаген, была обнаружена в гепатопанкреасе краба Uca pugilator; полагают, что у таких ракообразных этот фермент обеспечивает усвоение падали [90]. Данный фермент в отличие от известных коллагеназ, не связанных с пищеварительным трактом, является сериновой протеиназой [90]. Включение таких ферментов в пищеварительную систему у позвоночных не установлено, но коллагеназа встречается в ядах различных змей [314].
Энтерокиназа. Этот фермент строго избирательно отщепляет N-концевой пептид [278, 375] от цепи трипсиногена с образовани
Сравнительная биохимия и физиология пищеварения
305
ем трипсина (рис. 4-2). Это явление было обнаружено в кишечнике всех исследовавшихся соответствующим образом позвоночных. Возможно, энтерокиназа содержится и у многих беспозвоночных.
Корова
Эвца, коза, олень
Свинья
Лошадь
Акула
Двоякодышащая рыба
Вал- Асп- Асп- Асп- Асп- Лиз-Ва л- Асп-Асп- Асп- Асп-Лиз-Фен-Про-Вал-Асп-Асп-Асп-Асп-Лиз-Фен-Про-Тре-Асп-Асп-Асп-Асп-Лиз-Сер-Сер-Тре-Асп-Асп-Асп-Асп-Лиз-
Ала-Про-Асп-Асп-Асп-Асп-Лиз-Фен-Про-Иле-Г лу-Глу-Асп-Лиз-
Рис. 4-2. Пептиды, отщепляемые при активации от трипсиногенов позвоночных. Каждый из пептидов отщепляется по лизину (отмечено стрелкой) от соответствующих трипсиногенов энтерокиназой (или путем автоактивации); специфические последовательности представляют собой N-концевой участок молекулы трипсиногена и во всех случаях состоят по крайней мере из трех аминокислотных остатков. Эти кислотные группы связывают кальций, что ускоряет процесс активации. Аминокислотные последовательности даны по [278]. У овцы, козы, марала (Cervus elaphus) и косули (Capreolus capreolus) расщепляются две цепи, давая два пептида.
Энтерокиназа узнает последовательность, состоящую по крайней мере из трех аминокислотных остатков, расположенных непосредственно перед расщепляемой связью с лизином в трипсиногене (рис. 4-2), и не действует на другие лизиловые или аргиниловые связи [222, 278]. Предполагают [222], что подобный код имеется в трипсиногенах всех позвоночных, способствуя их защите, как и защите всех других панкреатических зимогенов, от преждевременной активации другими ферментами. Показано, что энтерокиназа локализована в щеточной кайме кишечных ворсинок эпителиальных клеток млекопитающих [140, 255]. Однако с помощью желчных солей фермент попадает в просвет кишечника, поэтому активация трипсиногена должна происходить как на поверхности слизистой, так и в просвете кишечника [339]. У людей встречается недостаточность энтерокиназы в виде врожденного дефекта [269, 339], который можно компенсировать, принимая с пищей экстракт поджелудочной железы.
Экзопептидазы. Карбоксипептидазы А и В позвоночных (табл. 4-1) образуются из специфических зимогенов — прокарбок-сипептидаз А и В. У коровы активированная прокарбоксипептида-за А образует в качестве отдельной субъединицы химотрипсин 30], но этот случай не является типичным для всех позвоночных 107, 198, 277]. Карбоксипептидаза В действует совместно с трипсином, так как отщепляет концевые пептиды основных остатков, образуемых трипсином. Аналогично карбоксипептидаза А действует совместно с химотрипсином. Таким образом, образуется эффективная ступенчатая система расщепления белков.
20—1332
306
Глава 4
Таблица 4-4
Содержание РНКазы в поджелудочной железе различных позвоночных [21а]
Группа А: высокое содержание (от 200 до 1200 мкг на 1 г поджелудочной железы). Корова, бизон, овца, коза, лось, кенгуру (красный и серый), валлаби, мышь, игуана, угандинский водяной козел, крыса, хомячок, морская свинка.
Группа Б: среднее и низкое содержание (от 20 до 100 мкг на 1 г). Свинья, черепаха (Chelydra serpentina, Podocnemis unifiilis, Pseudemys elegans), гиппопотам, аллигатор, броненосец, лошадь, индейка, цыпленок.
Группа В: очень низкое содержание (от 0 до 20 мкг на 1 г). Опоссум, кит, налим, лягушка-бык, змеи (два вида), черепаха (Chrysemis picta), Necturus, лягушка (Рапа pipiens), морской окунь, двоякодышащая рыба, дельфин, скат-хвостокол, жабы (2 вида), голубь, акула, тунец, барракуда, обезьяны (4 вида), человек, Amphiuma, слон, кролик, собака, кошка.
Конечная стадия полного расщепления до аминокислот осуществляется аминопептидазами, три- и дипептидазами. В кишечных ворсинках позвоночных аминопептидазы связаны с мембраной щеточной каймы [109, 156, 283]. Ферменты, специфически гидролизующие различные ди- и трипептиды, также локализуются в этих клетках слизистой [88, 256, 266], в основном в растворенном состоянии [266, 286]. Предполагают, что небольшие пептиды всасываются как таковые и гидролизуются внутри абсорбировавших их клеток [225, 250, 266], хотя до конца этот вопрос пока не выяснен [347].
Карбоксипептидазы и другие пептидазы обнаружены и в кишечнике беспозвоночных [24, 169, 261, 353]. У животных с четко выраженной фазой вторичного внутриклеточного переваривания пептидазы локализованы в соответствующих клетках, а не в просвете кишечника или в секреторных клетках (например, у различных плоских червей — турбеллярий [168, 169]).
Переваривание нуклеиновых кислот будет рассмотрено в разд. III.
Переваривание жиров
Триглицериды животного и растительного происхождения представляют собой главные пищевые жиры, и липазы, которые при переваривании этих веществ гидролизуют длинные цепочки эфиров (рис. 4-3), встречаются повсеместно. Карбоксилэстеразы гидролизуют эфиры с меньшим числом углеродных атомов, но четкого различия между двумя этими типами ферментов провести нельзя.
Позвоночные. Панкреатическая липаза является основньш фер-
Сравнительная биохимия и физиология пищеварения
307
ch2ocor CHOCOR ch2ocor
Липаза
-------as-
CD
CHOCOR + 2 RCOOH
сн2он
(2)\
Всасывание —e—(мицеллы)
R-COO Na+
2~ Моноглицерид
-t-Соли
желчных
кислот
Рис. 4-3. Расщепление триглицерида панкреатической липазой.
Остатки жирных кислот R во всех трех положениях могут быть разными. Реакция (1) является основной реакцией, протекающей в полости кишечника позвоночных; она идет с участием солей жирных кислот (см. текст). Реакция (2)—это образование мицелл (они обозначены прямоугольником), которое происходит на поверхности клеток слизистой при всасывании (см. рис. 4-8).
Соли желчных кислот человека
Ди-он
QH"'
соон
Дезоксихолевая (рП^б)
О
R-C-N-(CH2)2SOsO'
У н
Тауродезоксихолат
Таурохенодезоксихолат
Г Г) СООН
Хенодезокси-холевая (рИа~б) ~
кнг+(СН2)25О2О~ + Таурин
Таурохолат (j>Ka=C)
nh3+ch2coo~
+ Глицин\^
f?-C-N-CH2C00~ ti
' ГликоВезоксихолат
Гликохенодезоксихолат
Гликохолат
(рк'а=ц)
Рис. 4-4. Основные соли желчных кислот в желчи человека.
?52оЧНЫе кислоты холевая, хенодезоксихолевая и дезоксихолевая — связаны пептидной связью с глицином или таурином, что делает их устойчивыми ко всем пищеварительным ферментам. Связывание увеличивает также пределы растворимости; не связанные соли желчных кислот при pH ниже 7 выпадают в осадок [153].
20*
308
Глава 4
ментом, расщепляющим жиры, хотя в этом процессе участвуют и другие панкреатические ферменты (табл. 4-1). Липаза присутствует в зимогенных гранулах в активной форме и секретируется у всех исследованных позвоночных [46, 57, 100, 130, 346, 354]. Она функционирует в просвете кишечника, а ее субстраты эмульгируются под действием солей желчных кислот. Высказывалось предположение [46], что соли желчных кислот (рис. 4-4) предотвращают разворачивание молекулы липазы на поверхностях раздела; ко-липаза, небольшой белок, содержащийся в панкреатическом соке [227], вероятно, в свою очередь защищает липазу от ингибирования желчными солями [44]. Жирные кислоты и моноглицериды отщепляются от субстратов и всасываются эпителиальными клетками. Это всасывание также происходит при наличии солей желчных кислот, которые вместе с продуктами гидролиза жиров образуют мельчайшие частицы — мицеллы [153].
Пищевые эфиры холестерина и лецитин [303] быстро гидролизуются в просвете кишечника эстеразами, главным образом панкреатическими, а образующиеся холестерин и лизолецитин всасываются; для этих процессов также необходимо наличие солей желчных кислот. Те же самые или подобные ферменты (табл. 4-1) действуют и на растворенные молекулы эфиров-субстратов в отсутствие солей желчных кислот, а также на моноэфиры в мицеллах, диспергированных с солями желчных кислот.
Имеются данные о широком распространении желудочной липазы [165]; этот фермент может действовать только на предварительно эмульгированные жиры, например на жиры молока.
Беспозвоночные. В переваривании жиров у беспозвоночных, по-видимому, участвуют в основном простые эстеразы. Показано, что у ракообразных железа средней кишки содержит большое количество эстеразы, а в некоторых случаях — липазную активность [2, 189, 224, 352]. У многих насекомых также обнаружены пищеварительные эстеразы [19, 71, 123, 158]. У двустворчатых моллюсков встречаются как внеклеточные, так и внутриклеточные пищеварительные эстеразы [261, 281]; оба типа эстераз, по-видимому, имеются и у брюхоногих [248, 290]. Пищеварительные эстеразы выявлены в кишечнике многощетинковых червей [175], иглокожих [75, 208] (хотя в основном переваривание жиров у животных этого типа идет, вероятно, внутриклеточно) и нематод [96], но отсутствует у многих видов пиявок [170]. Гистохимические данные говорят о том, что пищеварительная эстераза у Ascaris содержится в гранулах секреторных клеток кишки, которые изливают содержимое в ее просвет [205]. У простейших также обнаружены разнообразные карбоксилэстеразы и липазы [243]. С помощью гистохимических методов показано, что эти ферменты, возможно, связаны с пищеварительными вакуолями.
Эмульгаторы. Хотя эти вещества и не относятся к ферментам, они тем не менее играют важную роль в повышении эффективности
Сравнительная биохимия и физиология пищеварения 309
переваривания и всасывания жиров. У всех позвоночных (там, где желчь секретируется в кишечник) эту функцию выполняют соли желчных кислот [153]. Последние не влияют на нелиполитические пищеварительные ферменты [210], хотя могут защищать химотрипсин и трипсин от ингибирования жирными кислотами [289]. Основой желчных кислот является структура холестерина (например, холевая кислота, рис. 4-4, наиболее широко распространенная у высших позвоночных). В боковой цепи они имеют кислую группу, поэтому молекула обладает свойствами детергента. У большинства позвоночных кислая группа образуется связыванием через концевой карбоксил таурина или глицина, но у некоторых рыб и амфибий это может быть алкогольсульфат, являющийся, по-видимому, более примитивной и менее эффективной структурой [144]. Например, у костистых рыб семейства карповых и некоторых родственных им форм главная соль желчной кислоты — это 5а-ци-принолсульфат.
У разных классов и отрядов позвоночных в ходе эволюции возникли некоторые различия в структуре желчных кислот и спиртов [144]. Структура желчных кислот млекопитающих коррелирует с характером пищи: травоядные, например, вырабатывают в основном желчные диокси- и монооксимонокетокислоты, хищники— желчные триоксикислоты [144]. У хищных и жвачных хорошо представлены оба типа (рис. 4-4).
У беспозвоночных с более специализированным пищеварительным трактом также секретируются определенные эмульгаторы [356, 374]. У некоторых ракообразных (например, Cancer pagu-rus) это ацилсаркозилтаурины [350].
CH3(CH2)nCON(CH3)CH2CONH(CH3)2SO3.
У беспозвоночных эволюция не привела к возникновению стероидных соединений, аналогичных желчным кислотам у беспозвоночных.
310
Глава 4
III. Биохимическая адаптация к пище
Е. БАРНАРД
Поскольку все животные обладают той или иной формой анатомической и физиологической адаптации к пище (как уже отмечалось в разд. I), некоторые главные типы адаптации приводят к существенным изменениям на биохимическом уровне. Самые важные среди них — это специализация у травоядных и у эндопаразитов.
Адаптация к питанию растительной пищей
Широкое распространение зеленых растений, происходившее в четвертичном периоде, и образование вследствие этого больших запасов растительных полисахаридов создали возможности для появления большого количества травоядных животных. Однако животные в большинстве случаев не обладали ферментами, необходимыми для расщепления соответствующих р-гликозидных структурных полимеров. Травоядный способ питания развился только у отдельных групп на основании одного из нескольких типов специализации: 1) образование целлюлазы и родственных гидролаз, найденных до сих пор только у очень немногих групп животных (см. ниже) и ни разу не обнаруженных у позвоночных и оболочников [174, 378]; 2) сосуществование с целлюлозолитическими микроорганизмами, которые выполняли функцию желудочных симбионтов, сбраживающих пищу перед ее окончательным перевариванием (т. е. способ, развившийся у жвачных); 3) использование таких симбионтов для вторичного сбраживания в задней кишке после основного переваривания; встречается у отдельных животных, например у лошадей и слонов; 4) копрофагия (т. е. поедание фекалий) для того, чтобы вторично подвергнуть переваренную массу действию микробов, например у кроликов; 5) использование микроорганизмов кишечника в качестве источника второстепенных ферментов для гидролиза без сбраживания, например у многих растительноядных насекомых. Эти классы травоядных способны в разной степени расщеплять структурные полисахариды, которые в основном не перевариваются другими группами животных.
Жвачные
Истинно жвачные животные имеют многокамерный желудок. Самый большой отдел, рубец, и прилегающий к нему отдел, сетка, содержат в качестве постоянной анаэробной культуры по 1011 бактерий и 106 простейших на 1 мл [161]. Общая их масса может составлять до 77 массы животного. Эти микроорганизмы частично переваривают целлюлозу, ксилан, пектин и лигнин, а получающие
Сравнительная биохимия и физиология пищеварения 311
ся продукты и другие сопутствующие углеводы сбраживают с образованием летучих жирных кислот, Н2СО3 и СН4. Эти кислоты всасываются непосредственно через нежелезистый эпителий рубца; уксусная и масляная кислоты окисляются с выделением энергии, а пропионовая кислота используется для синтеза гексоз и жиров [35, 239].
Уровень сахара в крови взрослых жвачных составляет лишь половину уровня его у других млекопитающих [239], поскольку лишь небольшая доля гексоз всасывается в кишечнике. Жвачные имеют слабую чувствительность к инсулину [11]. Пищевой белок гидролизуется, а также в основном дезаминируется и сбраживается в рубце; значительная часть входящего в его состав азота (обычно 70—90%) включается в микробные белки и нуклеиновые кислоты [91, 145, 324, 360]. Переваривание волокон облегчается в процессе жвачки (отрыгивания).
Микроорганизмы непрерывно поступают в сычуг (истинный желудок), имеющий кислую среду. Здесь начинается процесс их переваривания, который заканчивается в кишечнике. Таким образом, большую часть настоящей пищи жвачных составляют их собственные микроорганизмы. Жвачные выделяют обильную слюну (корова выделяет примерно 100 л/сут [16]), вместе с которой в рубец попадает большое количество NaHCO3 и мочевины [16, 161]. Бикарбонат натрия нейтрализует избыток образующихся при брожении кислот. Выделяющийся при этом и в процессе брожения СО2 частично фиксируется другими бактериями рубца, а частично всасывается и выделяется (вместе с СН4) при отрыжке. Ионы аммония, высвобождаемые при переваривании белка, либо используются бактериями рубца [51], либо всасываются в кровь, переносятся в печень и там превращаются в мочевину. Последняя путем обратной диффузии непрерывно поступает из крови в рубец [146]; избыток ее возвращается в рубец и с потоком слюны, 70% азота которой приходится на долю мочевины [329]. Таким образом, для пищеварения жвачных характерен специфический круговорот азота [12, 21] (рис. 4-5). Протеазы и пептидазы истинного желудка, панкреатического сока и кишечника, которые аналогичны соответствующим ферментам других млекопитающих, завершают этот цикл путем высвобождения отдельных аминокислот из белков микробной пищевой массы. В отличие от других позвоночных в качестве источника азота жвачные благодаря активности своих бактерий эффективно используют мочевину [145, 146, 229]. При неблагоприятных условиях питания количество повторно включающейся в круговорот мочевины увеличивается (рис. 4-5), что является важным адаптивным механизмом травоядных животных. Добавление к фуражу мочевины в качестве дешевого источника азота имеет поэтому большое значение в сельском хозяйстве.
Важное место в общем обмене веществ у жвачных занимает переваривание нуклеиновых кислот. Около 20% общего количества
312
Глава 4
азота микроорганизмов, поступающего в желудок, приходится на долю полинуклеотидов [325]. Выделение продуктов пуринового обмена (аллантоина и мочевой кислоты) необычайно велико [40, 344]. Вследствие этого и панкреатические нуклеазы образуются в гораздо большем количестве, чем у других животных (табл. 4-4), что способствует сохранению азота полинуклеотидного происхождения. Было показано, что эффективное расщепление (75—80%)
Рубец
Пища
N-белка Другие N
Мочевина, РОЧ
Лминокислоты л/н3 ----------
РОЧ
Непереваренный белок
Другие N, Р Рубец —....
Микробы
Белок ДНК РНК
Другие Л/,Р
(слюна;
Печень
Ткани N
Р
’ Мочевина, ' другие мета | болиты
NuP мечи
кровообра- у
щение) / NH3
р Другие NyP
Аминокислоты «£ Протеазы релон
ДНК
РНК
+РОц ДНКаза
Нуклеозиды -*—Нуклеотиды
РНК аза
NuP срекалий
Непереваренный N
1'
Рис. 4-5. Круговорот .азота и фосфора у жвачных.
Прямоугольниками обозначены процессы, происходящие в клетках. Пунктирными стрелками обозначено удаление некоторой части аммиака через систему воротной вены, когда пиша богата азотом. При недостаточном питании выделение азота резко сокращается, а возврат его и фосфора в рубец через слюну и кровь возрастает. Необходимо отметить роль панкреатических нуклеаз (РНКазы и ДНКазы) в высвобождении участвующих в этом цикле азота и фосфора бактериальных нуклеиновых кислот. 1 — сычуг; II — сычуг+кишечник [21а].
бактериальных РНК и ДНК происходит у жвачных в двенадцатиперстной кишке [325]. Часть высвобождающегося при этом азота включается в цикл мочевины (рис. 4-5), и очень важным звеном в этих процессах является также высвобождение относительно большого количества фосфора [21]. Этот фосфор служит для удовлетворения потребностей в нем как хозяина, так и вновь вступающих в пищеварительный цикл микроорганизмов рубца [229]. Круговорот фосфора (рис. 4-5) заканчивается поступлением его со слюней [320] и из крови опять в рубец [273].
Ненасыщенные жирные кислоты растительного происхождения восстанавливаются до насыщенных транс-изомеров микрофлорой рубца [309] и поступают в такой форме в жировые «депо» хозяина.
Сравнительная биохимия и физиология пищеварения
313
В рубце происходит также гидролиз жиров и сбраживание большей части образовавшегося глицерина [371].
Позвоночные, подобные жвачным. Истинные жвачные принадлежат к большому подотряду жвачных (Ruminantia) из отряда парнокопытных (Artiodactyla). У верблюда, одомашненной ламы и других животных, которые относятся к родственному подотряду Tylopoda, многокамерные желудки несколько отличаются своей анатомией и гистологией [41]. Однако процессы, идущие в рубце, брожение [368] и круговорот мочевины [301] у этих животных говорят о том, что их пищеварительная система весьма сходна с пищеварительной системой истинных жвачных.
Конвергенция со жвачными обнаруживается у некоторых гораздо более отдаленных видов млекопитающих. Так, например, длинноногие сумчатые обладают мешковидным, непропорционально большим желудком, который населен бактериями и простейшими с той же плотностью, что и у жвачных [358]. О похожем типе организации обмена веществ свидетельствуют и такие факты, как сходные продукты брожения, образование метана и СО2, низкое содержание глюкозы в крови, малое выделение азота и круговорот мочевины [239, 358]. У этих сумчатых травоядных имеется также высокоактивная панкреатическая рибонуклеаза, характерная для жвачных (табл. 4-4), что говорит о круговороте компонентов нуклеиновых кислот микробов, подобно тому как это происходит у жвачных. Общая организация обмена веществ, подобная обмену у жвачных, обеспечивает выживание этих сумчатых при очень неблагоприятных сезонных условиях [50, 334]. Некоторые приматы —колобиды и тонкотелы — питаются листьями и также имеют многокамерный желудок с богатой бактериальной популяцией, которая легко переваривает целлюлозу [27, 239]. Конвергенция со жвачными проявляется и в наличии брожения, образовании СН4, СО2, NIL;, летучих жирных кислот и всасывании, происходящем в желудке [27, 197]. Питающиеся листьями деревьев ленивцы (Вга-dipodidae) также имеют очень большой и сложный по строению желудок [238], в котором обитают расщепляющие целлюлозу бактерии [172]. Однако сам процесс жвачки у этих сходных со жвачными групп животных, по-видимому, не развит (за исключением представителей подотряда Tylopoda [197, 239]), что является либо следствием, либо причиной содержания в пище меньшего количества грубых веществ.
Меньшая степень конвергенции с системой пищеварения жвачных обнаруживается у некоторых травоядных грызунов. У многих родов среди отряда Myomorpha имеется сложный желудок, содержащий микрофлору [239], которая может переваривать целлюлозу и мочевину. К ним относятся золотистые хомячки, древесные (Neo-toma) и гамбийские крысы, но не лабораторные крысы. В этих случаях брожение в желудке служит дополнением к обычному пищеварительному процессу.
314
Глава 4
Нежвачные травоядные
Многие травоядные млекопитающие с простым желудком [33] имеют сильно увеличенную слепую или прямую кишку (или обе вместе) с богатой микрофлорой. То же характерно и для членов отряда непарнокопытных (например, лошади) и зайцеобразных (кроликов и зайцев), а также для слона и дамана [3]. Их пищеварительная система относится к обычному типу, за исключением того, что структурные полисахариды перевариваются и сбраживаются микробами за пределами тонкого кишечника. У этих животных высвобождаются и затем всасываются сахара и жирные кислоты, происходит циркуляция мочевины [146], но микробная масса не подвергается последующему перевариванию, как это наблюдается у животных, подобных жвачным. В связи с этим в данном случае невозможно и переваривание бактериальных нуклеиновых кислот, и такие животные не содержат панкреатических нуклеаз (табл. 4-4). У лошади сбраживание сахаров до летучих жирных кислот, происходящее в сильно увеличенной прямой и слепой кишках, имеет большее значение в питании, чем у кролика [233]; у последнего идут подобные же процессы, причем пищевая целлюлоза гидролизуется бактериями в слепой кишке [64]. В отряде Suiformes обнаружены оба типа пищеварения: у свиней сбраживание идет в слепой кишке, а гиппопотамы подобны жвачным [239], как и некоторые пекари (Pecari) [239]. У жвачных пищеварение более эффективно, чем у нежвачных травоядных, поэтому первые начиная с олигоцена широко распространялись, вытесняя вторых [313].
У зайцеобразных и большинства грызунов увеличению эффективности переваривания целлюлозы в слепой кишке способствует копрофагия, или поедание фекалий [340]. Копрофагия обеспечивает реутилизацию азота кишечной микрофлоры, а также витаминов [22]. Проглоченные мягкие фекальные шарики [340] могут в течение нескольких часов оставаться на дне желудка, обеспечивая дополнительное пищеварение и сбраживание полисахаридов [136].
У многих других позвоночных в пищеварительном тракте также присутствует микрофлора [321]. После принятия животным пищи бактерии обычно быстро размножаются в передней части желудка и в тонком кишечнике, но вскоре сильно угнетаются кислотой желудка; в толстом кишечнике, однако, постоянно присутствуют большие популяции определенных бактерий. Они были обнаружены у 15 исследовавшихся видов млекопитающих и птиц; у холоднокровных позвоночных это число, вероятно, значительно ниже [321]. Такие бактерии выполняют вторичную роль в питании (т. е. синтезируют биотин, фолиевую кислоту, витамин К [139] и другие кофакторы) у многих видов, включая и человека, и способствуют деконденсации и гидроксилированию желчных кислот [185]. О существовании активности такого рода догадывались уже давно, но
Сравнительная биохимия и физиология пищеварения
315
доказать ее наличие удалось только с использованием стерильных животных [63, 139, 185]. Например, крысы с абсолютно стерильным желудочно-кишечным трактом обнаруживают потребность в пищевых кофакторах именно таких типов [63] и не могут модифицировать желчные кислоты [153]. У отдельных видов питающихся фруктами позвоночных (например, у некоторых летучих мышей) активность кишечной микрофлоры направлена в значительной мере на переваривание пектинов (полимеров галактуроновож кислоты).
Приспособления травоядных, перечисленные выше в пунктах 1 и 5, хорошо развиты и у растительноядных беспозвоночных. Активность целлюлазы в кишке беспозвоночных обычно обеспечивается симбиотическими бактериями, простейшими или грибами, хотя их наличие очень трудно обнаружить и по этому поводу было много споров. Показано, что у растительноядных брюхоногих вырабатываются эндогенные целлюлазы и целлобиаза, сохраняющиеся и после стерилизации антибиотиками [111, 248, 263, 378]. Наряду с ними обычно присутствует и бактериальная целлюлаза [106]. У сверлящих дерево двустворчатых моллюсков (например, Teredo) [131] и у некоторых ракообразных [353] также секретируется эндогенная целлюлаза. Целлюлазы играют важную роль в пищеварении кольчатых червей и иглокожих; предполагают, что они имеют эндогенное происхождение [378]. Агар водорослей переваривается у морских ежей с помощью альгиназы [201]; существуют некоторые сомнения в отношении ее бактериального происхождения [97], хотя иглокожие тоже имеют в кишечнике богатую микрофлору и микрофауну. Брюхоногие также нередко секретируют альги-назу, причем такая секреция коррелирует главным образом с тем, питаются ли они растительной пищей [108, 261]. Пищеварительные железы таких моллюсков могут секретировать и р-глюкуронидазу, служащую в основном для переваривания сульфатированных полисахаридов морских водорослей [65, 87, 261].
Насекомых-древоточцев можно разделить на четыре группы: 1) насекомые, использующие, по-видимому, целлюлазу бактерий или простейших; к этой группе относится большинство насекомых [71, 158, 292, 364]; 2) некоторые виды, подобные чешуйнице Cteno-lepisma [201], выделяющие целлюлазы в кишечнике [95] или со слюной (как у таракана Periplaneta [364]); 3) истинные короеды, не имеющие какой-либо целлюлазной активности, но обладающие набором гликозидаз (включая пектиназу и ксиланазу), расщепляющих углеводы камбия [19]); 4) отдельные виды, использующие только резервный крахмал и сахара древесины [158].
Термиты [71, 254] представляют собой большую группу насекомых, питающихся целлюлозой. Они переваривают целлюлозу дерева, а некоторые виды — целлюлозу листьев или гумуса. У низших термитов эту функцию выполняют симбиотические жгутиковые, обитающие в задней кишке. У высших термитов (Termitidae)
316
Глава 4
это целлюлолитические бактерии [254]. Предполагают, что термиты секретируют некоторое количество эндогенных целлюлазы и целлобиазы [378]. Пентозаны гемицеллюлозы гидролизуются тоже симбионтами. В каждом из этих случаев, как и у жвачных, происходит анаэробное сбраживание, образуются и претерпевают дальнейшие превращения и летучие жирные кислоты [254]. У Масго-termitinae лигнин (получающийся из древесины после переваривания целлюлозы) используется для роста симбиотических грибов Termitomyces, которые в дальнейшем также поедаются термитами, обеспечивая их органическим азотом и другими питательными компонентами [297а].
Переваривание нуклеиновых кислот
Как уже говорилось, переваривание панкреатическими нуклеазами бактериальных нуклеиновых кислот играет важную роль у жвачных, включая и сумчатых жвачных. У других травоядных позвоночных поджелудочная железа вырабатывает, как правило, значительно меньшее количество нуклеаз (табл. 4-4). В тех случаях, когда в слепой кишке имеется обширная микрофлора (например, у свиней и лошадей), в ней присутствует и достаточно большое количество панкреатической рибонуклеазы, что свидетельствует о возможности переваривания некоторого количества нуклеиновых кислот местной микрофлоры. У других нежвачных травоядных (например, у кролика) содержится очень малое количество панкреатической рибонуклеазы (как и у хищных и всеядных позвоночных) (табл. 4-4). Однако специально введенная в допустимых количествах таким животным [21] и человеку [44а] РНК все-таки переваривается. Это явление пока не объяснено; не исключено, что для такого процесса достаточно тех малых количеств рибонуклеазы, которые содержит микрофлора.
Вопрос о наличии и использовании панкреатической дезоксирибонуклеазы в настоящее время не исследован. Ничего не известно и о степени переваривания нуклеиновых кислот у беспозвоночных.
Переваривание хитина, эндопаразитизм и другие адаптации
После целлюлозы хитин является наиболее распространенным полисахаридом. Он встречается в клеточных стенках грибов, особенно много его в кутикуле членистоногих, а также у моллюсков, кольчатых червей и кишечнополостных. Обычно хитин не переваривается, однако у многих хищников, питающихся перечисленными выше животными, развилась хитинолитическая активность. У дождевых червей [194, 378] (в пищу которых входят грибы) и у некоторых ракообразных [173, 194] секретируется хитиназа, которая по крайней мере отчасти может быть эндогенной. В противополож
Сравнительная биохимия и физиология пищеварения 317
ность более ранним данным Жено [174] нашел у семи родов брюхоногих, включая 9 видов легочных моллюсков, эндогенную хитиназу, которая обильно секретируется пищеварительной железой и не поддается стерилизации антибиотиками. У некоторых моллюсков, например у Aplysia depilans, хитиназа только бактериального происхождения. У многих других хищных беспозвоночных бактериальное происхождение хитиназы также или совершенно очевидно, или предполагается [174, 356]. Эндогенная хитиназа и близкая ей хитобиаза (р-ацетилглюкозоаминидаза, необходимая для завершения переваривания), вероятно, секретируются у многих позвоночных, которые поедают покрытых хитином животных (например, у насекомоядных летучих мышей, птиц и рептилий или у рыб, которые едят имеющих хитин моллюсков и ракообразных). Эти ферменты не обнаружены ни у травоядных, ни у хищников, пищей которых являются позвоночные других видов [171, 174].
Кератин перьев и шерсти, прочно сшитый многочисленными дисульфидными мостиками и обычно неперевариваемый, гидролизуется в средней кишке личинок определенных насекомых — некоторых молей, кожеедов и пухоедов [158, 366]. Эти личинки отличаются тем, что окислительно-восстановительный потенциал в их средней кишке очень низок, что способствует восстановлению дисульфидных связей. У них, по-видимому, имеется также протеаза, предназначенная для переваривания восстановленного кератина [272].
Некоторые группы животных в процессе адаптации к узкоспециализированным типам питания утратили способность к биосинтезу определенных пищеварительных гидролаз. Так, тли, которые питаются только соком флоэмы растений, используют свободные аминокислоты и сахара сока и не имеют собственных гидролаз и полисахаридаз [71]. Пиявки утратили, по-видимому, способность к секреции в свой кишечник эндопептидаз; они используют вместо них кишечную флору и экзопептидазы и отличаются большой длш тельностью пищеварения [170].
Ярким примером крайнего типа адаптации являются эндопаразиты. Ленточные черви и скребни вообще не имеют пищеварительного тракта, и у них не обнаружено никаких признаков использования пищеварительных ферментов [274]. Они способны к активному переносу аминокислот [274, 294, 370], глюкозы [103], пуринов и пиримидинов [215] из организма хозяина через стенки своего тела и к всасыванию жиров [17] (разд. VI). В кишечнике позвоночных существуют механизмы, обеспечивающие гомеостаз [275] аминокислот (но не углеводов) посредством экзокринной секреции и слущивания эпителиальных клеток, и эта ситуация, вероятно, используется такими паразитами, как ленточные черви [275]. У дигенетических сосальщиков для переваривания всасываемых тканевых белков хозяина образуются пищеварительные протеазы и пептидазы; исключение составляют сосальщики из семейства Stri-
318
Глава 4
geidae, которые секретируют эти ферменты в окружающую среду [92, 326]. Отдельные формы, такие, как Schistosoma mansoni, комбинируют переваривание в своем кишечнике крови хозяина с прямым всасыванием простых питательных компонентов через свою поверхность. Паразитические круглые черви имеют протеазу [96, 288], липазу и амилазу, которые, вероятно, секретируются в кишечнике. Малярийные паразиты поглощают белки и сахара из организма хозяина; белок (главным образом гемоглобин) переваривается в вакуолях или пузырьках протеазами, но большинство других пищеварительных ферментов у этих простейших, вероятно, отсутствует [265].
Во многих группах беспозвоночных встречается симбиоз с одноклеточными водорослями (зооксантеллами и зоохлореллами), который в отдельных случаях связан с пищеварительной адаптацией. Некоторым морским анемонам, кораллам и гидрам сахара и глицерин поставляются внутриклеточными фотосинтезирующими водорослями [206, 246], что способствует росту хозяина при недостаточном поступлении экзогенной пищи. Такая адаптация может идти и дальше; например, у турбеллярии Convoluta roscoffcensis пищеварительный тракт совсем исчезает на взрослой стадии, когда в клетках размножается зоохлорелла [361]. У отдельных моллюсков, таких, как тридакны, поверхностные ткани содержат фотосинтезирующие водоросли, которые, очевидно, перевариваются амебоцитами, поставляя питательные вещества прямо в ткани [379].
В ядах многих змей имеется целый набор гидролаз, однако неясно, служат ли они для облегчения переваривания проглоченной жертвы [191]. Имеется обширный обзор по ферментам, найденным в этих ядах [176].
В настоящее время установлен адаптивный характер фенотипических различий в образовании пищеварительных ферментов. Показано, что поглощение определенного субстрата вызывает в некоторых случаях усиленную секрецию соответствующей пищеварительной гидролазы. У различных млекопитающих выделение панкреатической амилазы и протеазы повышается соответственно содержанию крахмала или белка в пище [32, 159, 327], но ни липаза, ни рибонуклеаза такой связи со своими субстратами не имеют [21, 276]. Эти эффекты коррелируют с увеличением биосинтеза соответствующих белков [276], хотя в целом синтез белка в экзокринной части поджелудочной железы, по-видимому, не зависит от питания [271]. Продукты пищеварения, очевидно, стимулируют такие адаптивные воздействия на поджелудочную железу [32, 216, 271, 276, 327], но взаимосвязь различных факторов пока остается неясной. Имеются данные, что у лягушек, например, общий синтез белка в поджелудочной железе сильно увеличивается после приема пищи [270]. Уровень кишечных дисахаридаз также можно поднять, вводя в рацион в течение нескольких дней соответствующие субстраты [291].
Сравнительная биохимия и физиология пищеварения»319
У беспозвоночных лишь немногие фенотипические адаптации были исследованы в биохимическом отношении. Показано, что у улиток на крахмальной диете образуется больше амилазы, однако адаптации протеаз к разным уровням поглощения белка не обнаружено [351]. У улиток, которые по мере созревания переходят от питания растениями к всеядности, отношение амилаза/протеаза уменьшается [319]. Изменение соотношения между различными ферментами часто коррелирует с изменением характера питания в ходе развития организма. Желудочная протеаза, створаживающая молоко у жвачных, реннин [102] и лактаза млекопитающих [307] (за исключением человеческой [117, 127, 307]) образуются в больших количествах лишь у детенышей в период их вскармливания.
Заключение
Обобщая все вышесказанное, можно сделать вывод, что пищеварительные ферменты разных животных в принципе сходны между собой. Это говорит о происхождении и развитии всех ферментов от небольшого числа основных родоначальных типов. Принципиальное сходство не исключает большого разнообразия ферментов, в котором часто можно проследить проявление адаптивной специализации к использованию всевозможных источников питания.
*
IV. Способы питания
Л. ПРОССЕР
Способы питания зависят от типов пищи, среди которых можно выделить следующие: 1) органические молекулы, растворенные в тканях или естественных водах; 2) мелкие частицы, в основном представляющие собой мертвый детрит, а частично — живой фитопланктон; 3) крупные частицы, куски пищи или пойманная жертва.
Растворимая пища. Вода в естественных водоемах содежит органические вещества в концентрации 2—20 мг/л. В океанической воде эти количества сильно изменяются в зависимости от места и сезона. Так, в Атлантическом океане на 30° северной широты приповерхностные воды содержат органические вещества в концентрации 4,7 мг/л, а на 38° северной широты их концентрация равна 0,6—1,7 мг/л. В некоторых озерах Скандинавии в 1 л воды содержится 14,3 мг общего органического материала; из них 1,7 мг приходится на фитопланктон, 1,0 мг — на коллоидные вещества и 11,6 мг — на растворенные органические вещества [96].
В близких концентрациях (около 15 мг/л) присутствует органический материал в озерах штата Висконсин в летнее время. Содержание органического материала при этом получают умножением на 2 количества обнаруженного в воде углерода, а содержа
320
Глава 4
ние белка — умножением на 6,25 количества азота. Соответствующие измерения, проведенные в Средиземном море, дали величину 1,4 мг/л, из которых 0,81 мг приходится на белок. В водах средней части Тихого океана содержится 3,2 мг/л растворенного органического вещества; минимум концентрации приходится на глубины 500—1000 м [180]. Содержание углеводов в пересчете на сахар обычно равно 0,5—-3,5 мг/л, белка — 0,5—0,6 мг/л и растворенных жиров — 40—50 мкг/л [180].
Растворенные органические молекулы активно поглощаются некоторыми водными животными. Хотя поглощаемых таким образом количеств в большинстве случаев недостаточно для жизнедеятельности организма, они тем не менее могут вносить существенный вклад в питание этих животных.
Многие эндопаразиты, такие, как ленточные черви и паразитические простейшие, получают путем диффузии столько веществ из окружающей их среды, что обходятся без специальных пищеварительных органов (разд. III). Не имеют пищеварительной системы отдельные морские животные. Например, показано, что у погонофор нет кишечника, но они могут включать аминокислоты в клетки своих тканей из растворов с концентрацией 10~7 М [211]. У разных организмов способность поглощать аминокислоты из морской воды различна. Так, одиночный коралловый полип Fungia поглощает за 1 ч до 25% меченой глюкозы или тирозина из раствора с концентрацией всего лишь 1 мг/л [331]. Двустворчатый моллюск Spisula уменьшает концентрацию глицина в пропускаемом им через себя растворе на 14% при содержании глицина в поступающем растворе 1,5 мг/л. Моллюск Littorina извлекает фактически весь глицин из раствора, в который его помещают. Уменьшение концентрации глицина в течение 24 ч в растворах с низкой его концентрацией для других животных имеет следующие значения: многощетинковый червь Chaetopterus— 50%; асцидия Molgula — 90; губка Microciona — 90; морская звезда Asterias — 97%. Ракообразные, как правило, плохо поглощают аминокислоты из растворов: у Artemia поглощение идет очень слабо, a Balanus вообще не извлекает глицин из раствора [332, 333]. Некоторые животные, наоборот, выделяют аминокислоты в окружающую среду; у турбел-лярии Bdelloura [177] такие потери даже превышают поглощение. Однако включение в ткани, кинетика активного поглощения и всасывание веществ животными без пищеварительного тракта — все это свидетельствует о широком использовании растворенных органических веществ в питании различных животных, хотя относительный вклад этого процесса в энергетический баланс организма у разных животных может сильно варьировать. Некоторые насекомые, такие, как тли, всасывают в больших количествах сок растений и экстрагируют из него питательные вещества. Многие животные являются кровососущими и используют как плазму, так и клеточные компоненты крови.
Сравнительная биохимия и физиология пищеварения 321
Взвесь питательных веществ (пища в виде частиц). Такую взвесь составляют частицы детрита, органические соединения, адсорбированные на инертных частицах, мертвый планктон, а также живой фитопланктон, главным образом диатомовые водоросли, жгутиковые и бактерии. В поверхностных слоях морской воды таких веществ содержится от 0,2 до 1,7 мг/л, причем 10% этого количества приходится на долю белка. Содержание взвешенного органического вещества быстро падает с глубиной и обычно в открытом океане меньше, чем вблизи континентов. Количество фитопланктона зависит главным образом от времени года, географического положения и глубины; в прибрежный морских водах его содержание доходит до 700 мкг/л. Пресные озера также могут быть богаты фитопланктоном (2 мг/л), особенно летом в поверхностном слое; зимой он может исчезать. В северных водах Атлантического океана общая концентрация взвешенного материала составляет 500—1500 мкг/л, из которых на фитопланктон приходится 14—60% [180].
Многие животные питаются исключительно подобной суспензией, прокачивая большие количества воды через свои фильтрующие органы. Существует два основных способа питания путем фильтрации — использование либо слизистых сетей, либо ресничек или жгутиков.
лМногие животные секретируют слизь, к которой при фильтрации воды прилипают взвешенные частицы, поедаемые затем животным. Живущая в трубке полихета Chaetopterus и эхиурида Urechis секретируют слизистую сеть и прогоняют через нее воду активными движениями спинных придатков. Сеть заполняется прилипшими пищевыми частицами, и животные проглатывают их через каждые 15 мин. Эта сеть у Chaetopterus задерживает не только мелкие частицы, но даже крупные белковые молекулы, например молекулы гемоцианина, хотя и пропускает низкомолекулярные компоненты, например молекулы яичного альбумина. Следовательно, поры этой сети имеют диаметр около 40 А [214]. Для некоторых моллюсков и асцидий характерно фильтрование воды как через слизистую сеть, так и через реснички. Брюхоногий моллюск Crepidula имеет два слизистых фильтра: один — у входа в мантийную полость, другой — над передней поверхностью жабр; эти фильтры собирают пищевые частицы, периодически свертываются и поедаются моллюском [362].
Улавливание мелких частиц при помощи ресничек — способ питания ресничных^ инфузорий, губок, многих живущих в трубках кольчатых червей, эхиурид, коловраток, мшанок, плеченогих, некоторых брюхоногих, большинства пластинчатожаберных, а также многих оболочников и головохордовых. У губок ток воды создается жгутико-воротничковыми клетками (хоаноцитами). Пресноводная губка Spongilla задерживает частицы величиной 1 мкм. Ephy-datia (тоже пресноводная губка) перекачивает за сутки объем 21—1332
322
Глава 4
воды, в 1200 раз превышающий объем ее собственного тела [188].
У пластинчатожаберных моллюсков описано три разных механизма фильтрации: ряды ресничек, расположенные на жаберных нитях, сортируют пищевые частицы по размеру и перемещают их к ротовым щупальцам; идет процеживание через ряды переднебоковых ресничек жаберных нитей; секретируется слизь [214]. У мидии частицы прилипают к длинным переднебоковым ресничкам, затем собираются передними ресничками и переносятся к ротовым щупальцам [337]. Ротовые щупальца могут отличать съедобные частицы от несъедобных, которые выбрасываются в виде псевдофекалий. Ресничный фильтр Mytilus отбрасывает частички размером 30 мкм, задерживает или пропускает частицы в 7 мкм и не может задерживать частицы менее 1,5 мкм [180]. Взрослые устрицы перекачивают около 10 л/ч воды [195]. Устрица Crassostrea задерживает до 33% частиц размером от 1 до 3 мкм, поскольку расстояние между переднебоковыми ресничками у нее составляет 2—3 мкм [147]. Скорость перекачивания увеличивается после периода голодания или при наличии в воде питательных веществ [341]. Скорость фильтрации у Ostrea в 6 раз выше, чем у Муа и Venus [5]. чн
Веслоногие рачки задерживают частицы размером от 5 до 10 мкм. С повышением концентрации одноклеточных водорослей такого размера количество фильтруемой рачками воды уменьшается. Один веслоногий рачок Calanus может очищать в сутки 29— 150 мл воды [180].
Как правило, количество воды, прогоняемое животным для обеспечения себя кислородом, больше того количества, которое необходимо для его питания. Двустворчатые моллюски и асцидии обычно перекачивают 10—20 л воды на 1 мл поглощенного О2; при этом каждый литр воды должен содержать 0,05 мг усвояемой пищи [179].
Daphnia регулирует свое питание, изменяя скорость прокачивания и выбрасывая избыток пищи. Когда ее культивируют на суспензии хлореллы или дрожжей, поглощение пропорционально концентрации суспензии вплоть до 105 клетка/мл, а выбрасывание пищи наступает при концентрации 106 клетка/мл [231].
Фагоцитоз, или поглощение различных частиц с помощью цитоплазматических выростов, свойственен простейшим, которые затем переваривают частицы в пищеварительных вакуолях. Этот механизм встречается также в специализированных клетках многих многоклеточных (см. раздел II).
Способы поглощения твердой пищи. В этой главе мы не будем обсуждать разнообразные методы добывания пищи в разных средах обитания. Многие роющие животные заглатывают грязь или песок, извлекают из них питательные вещества, а остальное выбрасывают. У некоторых животных имеются специальные приспособления для соскабливания пищи с камней или для сверления
Сравнительная биохимия и физиология пищеварения
323
дерева. Многие хищные животные имеют приспособления для отравления жертвы (например, нематоцисты щупалец у кишечнополостных или ядовитые железы). Органами захватывания и пережевывания жертвы являются челюсти и радулы разных типов. В других случаях захват жертвы сопровождается внешним пищеварением. У отдельных животных развиты приспособления для прокалывания и высасывания жидкости, например у кровососущих и у насекомых, высасывающих сок растений.
Использование в питании организмов-симбионтов. Многие животные используют для получения питательных веществ организмы-симбионты. Пищеварение у жвачных и переваривание полисахаридов с помощью симбионтов уже обсуждались в разделе III. Некоторые беспозвоночные сосуществуют вместе с водорослями (см. выше), которые могут служить дополнением к той пище, которая захватывается щупальцами (например, у гидроидов и коралловых полипов) и переваривается в полости тела. В ряде колоний кораллов биомасса симбиотических водорослей в 3 раза превышает биомассу самих кораллов, и фотосинтез идет здесь в больших масштабах. Если в морскую воду ввести 14СО2 и подержать кораллы на свету, то уже через несколько часов в клетках можно обнаружить меченые органические продукты фотосинтеза [245].
Выбор пищи. Выбор пищи опирается на многочисленные типы химической стимуляции. Одни животные являются исключительно хищниками, другие — чисто растительноядными, тогда как третья многочисленная группа обладает в разной степени выраженной всеядностью. Избирательность по отношению к пище очень хорошо развита как у хищных, так и у растительноядных насекомых. Выбор того или иного растения для питания определяется требованиями, предъявляемыми животными к вкусовым качествам пищи, и каждое растение обладает уникальным набором веществ химической стимуляции.
У Hydra заглатывание пищи стимулируется специфическими продуктами тканевого распада, особенно глутатионом, который активирует реакцию питания при таких низких концентрациях, как 5-10~6 М. Эта реакция блокируется N-метилмалеимидом или тяжелыми металлами; присутствие SH-группы глутатиона необязательно, так как реакция вызывается и некоторыми трипептидами [206]. У отдельных кораллов пищевые реакции вызываются с помощью таких аминокислот, как пролин; аналоги пролина и глутатиона тоже эффективны в высоких концентрациях [206, 221].
У кровососущих животных питание искусственной пищей (растворами) стимулируют с помощью различных компонентов крови. Например, крысиную блоху Xenopsylla можно заставить питаться солевыми или сахарными растворами той же осмотической концентрации, что и плазма, тогда как комары будут сосать жидкость только при условии, если в ней присутствует аденин [112]. Муху 21*
'324
Глава 4
цеце Glossina стимулируют к искусственному питанию с помощью АТФ [115]. Клеща Ornithodorus можно заставить сосать жидкость, воздействуя на один набор рецепторов глутатионом и АТФ или на другой — аминокислотами [112]. Пиявку Hirtido привлекают различные сахара и NaCl; последний индуцирует, вероятно, сосательный рефлекс, а присутствие сахаров усиливает поглощение пищи [ИЗ].
У синей мухи Phormia поглощение пищи регулируется рефлекторно в ответ на растяжение передней кишки безотносительно к типу растворенного вещества, тогда как опустошение зоба в среднюю кишку контролируется концентрацией сахара в крови с помощью механизма, который не относится к нервной системе [119]. Поглощение жидкости синей мухой зависит от количества имеющейся в ее организме воды; эксперименты с инъекциями показали, что в этом случае играет роль объем жидкости, а не концентрация или осмотический фактор [83].
Поглощение пищи у млекопитающих регулируется потребностью в том или ином количестве калорий и вкусом. У крыс при равновесном состоянии обмена веществ или в состоянии пресыщения решающим фактором является калорийность пищи, а ее запах и вкус начинают играть роль, когда крысы голодны. Состояние энергетического баланса влияет на переработку центральной нервной системой информации о вкусе и калорийности пищи [166].
V. Стимуляция секреции пищеварительных соков
Л. ПРОССЕР
У большинства животных питание представляет собой периодический процесс, и секреция в желудочно-кишечном тракте приурочена к поступлению пищи. При голодании наблюдается скудное, но непрерывное выделение очень разбавленного сока. Клетки пищеварительных желез могут стимулироваться непосредственно пищей, находящейся в пищеварительном тракте, химическими агентами, присутствующими в крови (т. е. гормонально), нервными импульсами или всеми перечисленными факторами совместно.
Позвоночные. У млекопитающих регуляция секреции слюны осуществляется исключительно нервным путем: все три пары слюнных желез иннервируются парасимпатическими волокнами. Кроме того, они имеют менее важную симпатическую инервацию. Секреция слюны стимулируется как парасимпатическими, так и симпатическими нервами, причем состав слюны варьирует в зависимости от участия в регуляции тех или иных нервов и от активности тех или иных желез. В обычных условиях секреция происходит непрерывно, но отделение слюны может стимулироваться рефлекторно самой пищей или условнорефлекторно какими-то другими раздражителями, связанными с пищей. Стимулирующее влияние парасим
Сравнительная биохимия и физиология пищеварения 325
патической системы снимается атропином, который, вероятно, блокирует действие ацетилхолина, высвобождающегося из нервных окончаний. Сами клетки слюнных желез также содержат много ацетилхолина, функция которого здесь не выяснена. Некоторые железистые (ацинарные) клетки желез при нервном возбуждении обнаруживают повышенную электроотрицательность, а другие деполяризуются; железистые клетки не возбуждаются электрическим током [53]. Секретируемая жидкость первоначально гиперосмо-тична по отношению к плазме, поэтому в главном протоке Na+ реабсорбируется.
Секреция желудочного сока у позвоночных стимулируется блуждающим нервом, а симпатический нерв вызывает слабую секрецию слизи. Основная секреция желудочного сока уменьшается после удаления блуждающего нерва. Регуляция секреции желудочного сока может осуществляться с помощью условных рефлексов и связана с эмоциональным состоянием. Рецепторы растяжения, расположенные в желудке, связаны эфферентными волокнами с мозгом через блуждающий нерв. Пища, механическое раздражение или ацетилхолин вызывают высвобождение из клеток слизистой вблизи входа в желудок специального вещества, которое поступает в кровь и побуждает обкладочные клетки желудка секретировать соляную кислоту, а главные клетки (в меньшей степени) — пепсиноген. Этот гормон, называемый гастрином [134], был выделен в двух очень близких формах — гастрин I и гастрин II. Уже осуществлен синтез гастринов и различных их гомологов. Гастрин — это полипептид с мол. весом около 2000, содержащий 17 аминокислотных остатков [138]. N-концевая группа представлена пироглутамином, а С-концевая — фенилаланином; в цепи гастрина II присутствует сульфатированный тирозин. Желудочная секреция стимулируется также гистамином, но, по-видимому, это явление не имеет существенного физиологического значения.
Блуждающий нерв оказывает слабое стимулирующее действие на поджелудочную железу, и особенно на секрецию ферментов (у собак). Когда кислый химус поступает из желудка в двенадцатиперстную кишку, слизистая кишечника выделяет гормон, называемый секретином. Этот гормон поступает в кровь и эффективно стимулирует секрецию из поджелудочной железы сока, ферментов и особенно ионов НСО3. Секретин [315] представляет собой линейный полипептид,^ содержащий 27 аминокислотных остатков; он имеет молекулярный вес 3200. Секретин стимулирует и выделение пепсина.
Второй гормон, также выделяемый слизистой кишечника, первоначально был назван панкреозимином (ПЗ), так как он *вызы-вает секрецию панкреатических ферментов. Третий кишечный гормон, вызывающий сокращение желчного пузыря и опорожнение его, называется холецистокинином (ХЦК). Сейчас считают, что эти гормональные активности принадлежат одному и тому же вещест
326
Глава 4
ву, название которого сокращенно записывается как ХЦК-ПЗ. Этот гормон представляет собой полипептид, содержащий 33 аминокислотных остатка [315]. Он напоминает декапептид церулищ выделенный из кожи австралийской лягушки [94].
Глюкагон — это вещество, которое освобождается из слизистых желудка и кишечника и из альфа-клеток поджелудочной железы. Он стимулирует секрецию инсулина, расслабляет желудочно-кишечную гладкую мускулатуру и угнетает секрецию кислоты в желудке. Глюкагон содержит 29 аминокислотных остатков, из которых 14 находятся в тех же самых положениях, что и в секретине [134]. Инсулин тоже уменьшает желудочную секрецию.
Нервная система оказывает лишь незначительное влияние на секрецию желез кишечника. Эти железы реагируют на особое вещество из слизистой, называемое энтерокринином. ХЦК-ПЗ также стимулирует кишечные железы [315], и отличается ли энтерокри-нин от него, неизвестно. Клетки кишечника, секретирующие слизщ непрерывно замещаются новыми клетками, образующимися на дне крипт.
Несмотря на то что каждый из рассмотренных гормонов — гастрин, секретин, ХЦК-ПЗ — выполняет вполне определенную функцию, убедительно показано, что все они в той или иной степени обладают и одинаковым действием. Характер действия их в органах-мишенях, по Гроссману, следующий [137]: желудок — секреция кислоты и пепсина, усиление сокращений; поджелудочная железа (ацинарные клетки) — секреция НСОз и ферментов; желчный пузырь — сокращение; тонкий кишечник — выделение секрета бруннеровых желез и стимуляция перистальтики; островковые клетки поджелудочной железы — высвобождение инсулина.
Суммируя вышесказанное, можно отметить постепенный переход от нервной регуляции слюнных желез к смешанной нервной и гормональной регуляции секреции в желудке и, наконец, к преимущественно гормональной регуляции деятельности кишечника и поджелудочной железы. Все гормоны желудочно-кишечного тракта относятся к полипептидам, и каждый из них в той или иной степени действует на все подходящие мишени. ^Механизм их действия на уровне клеток пока еще неизвестен.
У птиц секреция желудочного сока в железистом желудке стимулируется блуждающим нервом, а также гастрином. Была обнаружена и условнорефлекторная секреция [318].
У лягушек выделение желудочного сока активируется рефлекторно при механическом растяжении желудка. Выведение из строя блуждающего нерва секрецию кислоты не уменьшает, а секрецию пепсина снижает примерно на 40%. Ацетилхолин является эффективным стимулятором; считается, что в локальных рефлексах участвуют холинэргические нейроны, расположенные в стенках желудка. Для получения здесь рефлекторных реакций необходимо активное кровоснабжение желудка [190, 317, 318]. Низкие дозы гастри
Сравнительная биохимия и физиология пищеварения*327
на стимулируют секрецию кислоты у лягушек; для стимуляции секреции пепсина требуются более высокие дозы [241].
У костистых рыб, как и у других позвоночных, секреция желудочного сока активируется пищей, поступающей в желудок. Имеются данные о двух фазах стимуляции секреции: с помощью блуждающего нерва и гормональным путем. У цельноголовой рыбы Chimaera желудок отсутствует, но в слизистой кишечника образуется вещество, способное стимулировать секрецию пищеварительных ферментов из поджелудочной железы. Кроме того, экстракты из слизистой кишечника Chimaera могут вызывать сокращение мочевого пузыря млекопитающих и образование НСОз поджелудочной железой; очевидно, у этой рыбы вырабатывается секретин и ХЦК-ПЗ [252]. Поскольку в данном случае желудок отсутствует, эти гормоны должны стимулировать выделение не кислоты, а чего-то иного. У акуловых рыб выделение кислоты стимулирует пища, находящаяся в желудке; стимуляторами служат также гистамин и ацетилхолин; в желудке найдено нервное сплетение. Из слизистой кишечника удалось выделить секретин [28].
Таким образом, основные типы полипептидных желудочно-кишечных гормонов, по-видимому, сходны у всех позвоночных. Внутренние рефлексы в нервных сплетениях желудка могут различаться по относительной значимости.
Беспозвоночные. У беспозвоночных регуляция секреции пищеварительных соков изучена слабо. У головоногих слюнные железы многофункциональны: они секретируют яды, которые парализуют жертву, секретируют протеазы и, вероятно, имеют эндокринную функцию. Пищевод и кишечник головоногих богато снабжены нервными сплетениями.
Цитологически показано, что у улиток и речного рака секреторная активность заметно усиливается после приема пищи. У дождевого червя Lumbricus раздражение брюшной нервной цепочки вызывает секрецию пищеварительных ферментов в зобе и кишке [150]. Активность секреторных клеток у жука-плавунца Dytiscus становится максимальной спустя 45 мин после приема пищи [80]. Неизвестное вещество, содержащееся в крови сытых жуков-чернотелок Tenebrio, стимулирует митозы в средней кишке у голодающих особей; при голодании в клетках средней кишки Tenebrio накапливаются протеазы, которые после приема пищи выделяются в зоб [70]. Образование кишечных протеаз у мухи Calliphora зависит откачества пищи: если в пище нет мяса, то стимуляция идет крайне слабо. Если из мозга Calliphora удалить нейросекреторные клетки, то количество кишечных протеаз уменьшится до одной трети. Инъекция нейросекреторных тел восстанавливает об-^342]ЯНИе ПРОтеаз’ что свидетельствует о наличии нейрогормона
^Таким образом, у беспозвоночных разграничения между прямой стимуляцией пищей, стимуляцией гормонами и нервной систе
328
Глава 4
мой очень слабые. Пища является основным стимулом секреции пищеварительных соков у всех животных, хотя способы ее действия весьма разнообразны.
VI. Всасывание
Л. ПРОССЕР
Всасывание продуктов пищеварения частично идет за счет диффузии, а частично—путем активного переноса [116]. Относительная значимость этих двух процессов до конца еще не выяснена; не исключено, что активные переносчики многих веществ еще ждут своего открытия. Всасывание аминокислот и сахаров, будь то в кишечнике млекопитающих или у паразитических червей, сопряжено с активным переносом натрия, и, вероятно, существует несколько более или менее сходных между собой переносчиков этих ионов. Всасывание изучали по переносу различных веществ in vivo из кишечника в кровь, по переносу в вывернутый кишечный мешок in vitro и по поглощению веществ эпителиальными клетками из слизистых растворов. Свойства слизистой и серозной оболочек клетки различны. Во всех клетках происходит активный перенос натрия через серозную оболочку, в результате чего просвет кишечника (со стороны слизистой) становится электроотрицательным [117].
Сахара. Глюкоза может всасываться в эпителиальные клетки против градиента концентрации; этот процесс идет за счет энергии аэробных процессов, и флоридзин полностью подавляет поглощение глюкозы поверхностью слизистой. Накопление сахара и его перенос идут только в присутствии Na+; при активном всасывании между поверхностями эпителия возникает разность потенциалов (серозная оболочка несет положительный заряд), величина которой пропорциональна интенсивности переноса Na+ [68]. Уабаин (строфантин G), добавленный со стороны серозной оболочки, уменьшает потенциал и соответственно всасывание сахара. Как уже говорилось (стр. 203), уабаин является ингибитором активного переноса натрия во многих тканях [67].
Модель этого процесса схематически изображена на рис. 4-6. В молекуле-переносчике имеются участки для связывания глюкозы и Na+ путем каких-то кооперативных взаимодействий; натрий, поступающий в клетку вместе с глюкозой, освобождается от переносчика и затем активно откачивается, в основном в сторону серозной оболочки, с помощью системы, которая чувствительна к уабаину. Перенос подавляется и такими ингибиторами обмена веществ, как динитрофенол (ДНФ). Разность потенциалов зависит от интенсивности переноса Na+ и пропорциональна его концентрации в клетке. Связанная с переносчиком глюкоза диффундирует через серозную мембрану; глюкоза стимулирует также действие натрие-
Сравнительная биохимия и физиология пищеварения
329
го насоса. Всасывание сахара ингибируется при замене Na+ ионами К+ и Li+. Перенос глюкозы тоже тормозится ионами К+ и JJ+; они уменьшают разность потенциалов, причем в большей степени чем трис. Если в эпителиальных клетках накопить глюкозу и Na+ в присутствии ДНФ, который ослабляет действие насоса, а клетки поместить затем в богатый глюкозой раствор, свободный от ионов Na+, то глюкоза будет откачиваться наружу против своего градиента (т. е. ее транспорт обратим) [6, 7, 68].
Сахар Na+
Слизистая оболочка '
\ Сахар >
Na+
Серозная оболочка
Na+
Саха;.
---а«»С1
—з^Н2О
Р,ис. 4-6. Схематическое .изображение процесса переноса сахаров.
На границе слизистой молекула-переносчик соединяется с натрием и сахаром, а проникнув в клетку, диссонирует. Затем сахар диффундирует через границу серозной оболс^ки, a Na удаляется путем активного переноса [67].
Ксилоза и 6-дезоксиглюкоза, по-видимому, связываются тем же самым переносчиком, что и глюкоза, но концентрация полунасыщения такого переносчика для глюкозы равна примерно 2 мМ, а для ксилозы—100 мМ, т. е. сродство у глюкозы значительно выше. D-глюкоза может всасываться против 20-кратного градиента, тогда как L-глюкоза диффундирует только пассивно и распределяется поровну по обе стороны мембраны. Фруктоза также может накапливаться с помощью различных процессов [67]. D-глю-козамин непосредственно не переносится, но оказывает ингибирующее действие на всасывание глюкозы. Галактоза диффундирует и увеличивает потенциал слизистой, однако ее перенос не влияет на накопление глюкозы, к тому же галактоза не включается в обмен веществ клетки. Манноза участвует в обмене веществ, но активно не переносится и не влияет на потенциал [25].
Механизмы переноса сахаров в кишечнике низших позвоночных, за исключением некоторых деталей, сходны с аналогичными механизмами у млекопитающих. У лягушки-быка Rana catesbeiana D-глюкоза и D-галактоза всасываются против концентрационных градиентов, а D-ксилоза и D-арабиноза не всасываются [203]. У золотой рыбки глюкоза и вода транспортируются в серозную сторону; серозная оболочка электроположительна по отношению к слизистой как в равновесном состоянии, так и при переносе глюкозы. Равновесного потенциала не возникает, когда в окружающей слизистую среде нет ионов Na+. Реакция на глюкозу происходит
330
Глава 4
очень быстро; флоридзин ингибирует потенциал, связанный с переносом глюкозы, а строфантин — равновесный потенциал [323].
Ленточные черви [103, 274] и скребни из кишечника утки [69] всасывают глюкозу против градиента концентрации; система всасывания достигает состояния полунасыщения при концентрации 0,25 мг/мл. Другой вид скребня, обитающий у насекомых, может использовать трегалозу в отличие от родственных видов из других хозяев [69]. У моллюска хитона (Cryptochiton) через стенки кишечника транспортируются D-глюкоза, метилглюкоза и D-галактоза, но не переносится манноза или фруктоза [204]. В кишечнике голотурии Stychopus не обнаружено активного переноса глюкозы, метил-О-глюкозида или галактозы [204].
Аминокислоты. Всасывание аминокислот [369], образующихся в результате переваривания белка, происходит избирательно и может идти против градиента концентрации, в основном путем активного переноса. Как и для сахаров, определенное значение здесь имеют стереоспецифичность и зависимость от ионов натрия. L-аминокислоты всасываются гораздо лучше D-аминокислот: отношение скоростей всасывания L- и D-форм в кишечнике крысы равно 6 для гистидина и 1,6 для метионина. Тем не менее между D- и L-формами одной и той же аминокислоты существует конкуренция. Всасывание различных аминокислот создает разные градиенты концентраций соответствующих компонентов; например, в изолированном кишечнике хомячка, омываемом с обеих сторон раствором с концентрацией аминокислоты 20 мМ, создается отношение концентраций между слизистой и серозной поверхностями, равное 2 для пролина, 1,4 для валина и 1,2 для метионина и лейцина. Характер конкуренции между различными аминокислотами говорит о существовании отдельных переносчиков для следующих классов: нейтральных, кислых и основных аминокислот и иминокислот [151, 369].
Дикарбоновые (анионные) аминокислоты — аспарагиновая и глутаминовая — по-видимому, не транспортируются; правда, недавно полученные факты говорят о том, что в действительности они переносятся в эпителиальные клетки и очень быстро подвергаются переаминированию; таким образом, их аминогруппа появляется с серозной стороны в составе аланина [304]. Для переноса этих и нейтральных кислот в клетки необходимо наличие со стороны слизистой ионов Na+. Различия между предполагаемыми переносчиками для разных аминокислотных групп, по-видимому, очень невелики, и некоторые кислоты могут использовать несколько молекул-переносчиков. Кроме того, известно, что транспорт глюкозы через эпителий угнетается аминокислотным транспортом; по-видимому, между переносчиками сахаров и аминокислот существует конкуренция. Активное всасывание L-фенилаланина срезами кишечника крысы идет только в присутствии ионов Na+ и в аэроб
Сравнительная биохимия и физиология пищеварения
331
ных условиях; выход меченого фенилаланина на серозную сторону стимулируется в присутствии немеченых кислот [285].
В опытах на подвздошной кишке кролика, в которых измеряли ток короткого замыкания, обусловленного переносом натрия, и поступление меченых аминокислот и Na+ в эпителиальные клетки и в серозную жидкость, показано, что общий перенос аланина и Na+ уменьшается под действием цианида, динитрофенола, иодацетами-да и строфантина. Однако эти же самые препараты не останавливают поступления веществ через щеточную кайму в клетки [58]. Ни один из указанных препаратов не препятствует образованию комплекса между аминокислотой и переносчиком со стороны слизистой, как это имеет место для флоридзина, который ингибирует присоединение глюкозы к переносчику. Серозная оболочка электроположительна по отношению к слизистой, и уабаин эффективно блокирует перенос ионов Na+ со стороны серозной поверхности. Поглощение аланина эпителиальными клетками в среде, не содержащей ионов Na+, менее эффективно, тогда как изменение внутриклеточной концентрации Na+ на него не влияет. При концентрациях среды с обеих сто рои кишечной стенки, равных 140 мМ Na+ и 5 мМ аланина, последний перемещается в направлении от слизистой к серозной оболочке со скоростью 1,4 мкМ/ч/см2, тогда как в отсутствие Na+ (при замещении его холином, трисом, Li+ или К+) при той же концентрации аланина диффузия аминокислоты вообще прекращается. Уровень насыщения, при котором аланин выходит из клеток, пропорционален количеству поглощенного натрия. Перенос лизина происходит менее эффективно, чем аланина; это связано, по-видимому, с меньшей скоростью диффузии аланина через серозную оболочку, поскольку поглощение эпителиальными клетками обеих аминокислот одинаково [58].
На основании ранее полученных данных и последующих кинетических измерений была предложена следующая модель переноса аминокислот [58, 304]. На поверхности слизистой сначала образуется комплекс между аминокислотой и молекулой переносчика (X), а затем тройной комплекс аминокислоты и переносчика с Na+ (рис. 4-7). Аминокислоты в катионной форме образуют более стабильные двойные комплексы, чем в анионной; по-видимому, кислоты в катионной форме в этом случае подобны Na+. Некоторые одновалентные катионы тормозят зависящее от Na+ поступление веществ внутрь клетки, образуя с точки зрения сродства следующий ряд: H>K>Rb>Li>Cs>Na.
Считается, что тройной комплекс проходит через мембрану клетки слизистой, высвобождая внутри клетки сначала аминокислоты, а затем Na+. Освободившийся переносчик вновь присоединяет аминокислоту и Na+. Na+ удаляется из клетки путем активного переноса, а аминокислоты диффундируют наружу через серозную оболочку. Эффективность этой диффузии пропорциональна клеточ
332
Глава 4
ной концентрации аминокислоты и не зависит от концентрации Na+ в клетках. Выход Na+ блокируется различными ингибиторами, а влияние Na+ на поглощение аминокислоты со стороны слизистой нечувствительно к ингибиторам. Рецепторные участки переносчика пока плохо изучены: удаление аминогруппы из молекулы фенилаланина уменьшает ее сродство к рецептору в 50 раз, а удаление карбоксильной группы — в 12 раз. Длина цепи переносчика также
Слизистый клеточная цитоплазма. раствор мембрана
XANa+ XANa+
Рис. 4-7. Схема переноса аминокислот через обращенную к просвету кишечника клеточную мембрану; перенос происходит с помощью молекулы-переносчика (X), которая соединяется с Na+ и аминокислотой |(А) {304].
имеет существенное значение. Связывание ионов водорода говорит о том, что переносчик имеет анионные группы с рА=4 [141, 369].
Поглощение аминокислот изучено современными методами лишь у представителей млекопитающих. В кишечнике золотой рыбки обнаружен активный перенос треонина, аланина, серина, гистидина, валина, метионина, фенилаланина и лейцина; он зависит от скорости переноса натрия со слизистой на серозную сторону [323]. У морской костистой рыбы Maemalon обнаружен активный перенос глицина, который зависит от Na+ и нуждается в аэробной энергии. Этот процесс полностью ингибируется глицином [322]. Наличие активного переноса нескольких аминокислот обнаружено и в кишечнике черепахи. У голотурии Stichopus отмечено активное всасывание L-аланина и глицина [204].
Ленточные черви активно поглощают аминокислоты из окружающей среды, содержащей Na+. Наличие в среде сахара препятствует их всасыванию; отмечалась конкуренция между лейцином и глюкозой [163, 274]. Аналогично в кишечнике млекопитающих перенос глюкозы ингибируется гистидином, метионином и аланином, но не зависит от тех аминокислот, которые переаминируются (глутаминовая и аспарагиновая кислоты); этот факт рассматривается как доказательство конкуренции между аминокислотами и гексозами за переносчики [152].
Жирные кислоты и глицериды. Всасывание продуктов переваривания жиров существенно отличается от процессов всасывания
Сравнительная биохимия и физиология пищеварения 333
продуктов расщепления белков и углеводов. Известно, что большая часть жиров всасывается у млекопитающих в лимфатических железах в виде триглицеридов и затем поступает в виде нейтральных жиров в кровь. Панкреатическая липаза действует в кишечнике на эмульгированные жиры, гидролизуя их в положениях 1 и 3 до жирных кислот и моноглицеридов (рис. 4-3). Электронномикроскопические исследования кишечной слизистой млекопитающих через разные сроки после принятия жирной пищи показали,
Мицеллы
Свободные жирные кислоты
Моноглицериды
АТФ
КоА
V
КоА -производные жирных кислот
ос-Глицерофосфат
фосфатидная кислота
Диглицериды
фосфолипид
Триглицериды
Рис. 4-8. Реакции, протекающие в клетках слизистой после поглощения липидных мицелл '[162].
что свободные жирные кислоты (главным образом с большой длиной цепи) и моноглицериды объединяются с помощью солей желчных кислот в мицеллы диаметром 40—50 А [43]. Из одной частички эмульсии получается 106 мицелл. Эти мицеллы проникают в клетки, по-видимому, путем диффузии, так как поглощение моноглицеридов происходит и при 0 °C и не является энергозависимым процессом [43, 178]. Участвует ли в этом процессе какой-то мембранный переносчик, неизвестно [125, 178]. Жирные кислоты с небольшой длиной цепи могут переноситься против градиента концентрации, причем процессы здесь могут быть другими, чем в случае аминокислот с большой длиной цепи [26]. Внутри клеток слизистой свободные жирные кислоты в присутствии соответствующих ферментов, АТФ, Mg2+ и кофермента А образуют комплекс ~жиРная кислота (рис. 4-8). Моноглицериды превращаются в фосфатидные кислоты, а затем в триглицериды. Триглицериды или нейтральные жиры появляются в виде капелек в эндоплазматической сети. Параллельно с биосинтезом триглицеридов фосфолипиды, белки и холестерин взаимодействуют друг с другом с образованием p-липопротеидов, которые покрывают и стабилизируют нейтральные жиры. Образовавшаяся в результате капелька называется хиломикроном. Такие хиломикроны вытесняются через серозную поверхность с помощью отрицательного пиноцитоза в лимфатические железы [126, 162].
334
Глава 4
Ленточные черви содержат большое количество жиров, особенно триглицеридов и ненасыщенных жирных кислот. Сами они не могут синтезировать жирные кислоты, поэтому должны всасывать моноглицериды и жирные кислоты из мицелл хозяина. Такие насыщенные жирные кислоты, как моностеариновая и пальмитиновая, всасываются со скоростью, вдвое меньшей, чем олеиновая и линолевая кислоты [17]. Имеются данные о наличии у ленточного ^червя Hymetwlepis одной всасывающей транспортной системы для жирных кислот с короткой цепью (уксусная) и второй — для выевших жирных кислот (более двенадцати углеродных атомов) [13, 155].
Таким образом, механизм всасывания питательных компонентов изучен пока у очень немногих видов. Принимая во внимание большое разнообразие таких систем в царстве животных, приходится признать, что главные принципы абсорбции в сравнительном плане еще не выяснены.
Заключение
В питании, кормлении и пищеварении животных существует немало адаптаций, которые способствуют полной утилизации потребляемых в пищу растений. Все животные, будь то травоядные, хищные или всеядные, в получении органических веществ в конечном счете зависят от растений. Некоторые животные сосуществуют вместе с симбиотическими водорослями, например коралловые полипы и гигантские двустворчатые моллюски, сосуществующие с зооксантеллами. Многообразные способы питания помогают разным животным использовать широкий диапазон всевозможных питательных веществ. Органические молекулы, присутствующие в естественных водах, составляют дополнение к питанию взвешенными частицами для многих водных беспозвоночных. Организмы, питающиеся с помощью фильтрации, извлекают из воды как пищу, так и кислород для дыхания. Многие эндопаразиты получают питательные вещества исключительно путем всасывания низкомолекулярных компонентов через поверхность своего тела. Для захватывания, расчленения и переваривания частичек пищи развились разнообразные анатомические структуры.
Пищеварение — это последовательный процесс, и во всех пищеварительных системах (кроме внутриклеточных, существующих у примитивных беспозвоночных) имеются определенные участки для начальной фазы смачивания, а иногда и предварительного гидролиза пищи. На второй фазе в условиях кислого pH почти у всех позвоночных и лишь в отдельных случаях у беспозвоночных протекают первые стадии гидролиза белка. На последующих этапах происходит гидролиз всех питательных макромолекул до мелких молекул, всасывание веществ и удаление из организма отхо
Сравнительная биохимия и физиология пищеварения
335
дов. Ферменты всех этих гидролитических процессов секретируются железами, которые размещены соответствующим каждой стадии образом и наиболее специализированы у высших животных. И всеядные, и специализированные в питании формы имеют адаптации как в механизмах питания, так и в пищеварительных ферментах.
Отдельные пищеварительные ферменты распространены очень широко, другие встречаются только у животных; кроме того, дополнительные гидролазы поставляют животным микроорганизмы. К разряду относительно универсальных ферментов относятся а-амилазы и а-глюкозидазы, триптические и химотриптические протеазы, некоторые пептидазы, а также липазы и родственные им эстеразы. Более ограниченное распространение имеют р-глюкозид-азы, лактаза, трегалаза и пепсины. Только немногие животные переваривают нуклеиновые кислоты. Протеазы одного класса встречаются во многих формах, например химотрипсиногены. Некоторые животные содержат целлюлазу, хитиназу, лигназу, кератиназу и коллагеназу. В тех случаях, когда значительную часть рациона составляет целлюлоза, в ее переваривании участвуют симбиотические бактерии, выполняющие разную роль у различных типов растительноядных. Жвачные наиболее преуспели в совершенствовании своей пищеварительной «экономики» в целом на основе такого симбиоза.
Переваривание жиров связано с механизмами всасывания, поскольку образовавшиеся после гидролиза жирные кислоты и моноглицериды всасываются главным образом в виде мицелл, которые могут далее гидролизоваться и вновь объединяться уже внутри клеток слизистой. Всасывание аминокислот и сахаров независимо от того, каким образом это происходит — прямо из окружающей среды у водных животных или из просвета кишечника, — сопряжено с переносом натрия, причем катионные насосы выступают здесь как главные компоненты всасывающей системы.
Взаимосвязь между характером питательных веществ и типом питания и пищеварения способствует появлению определенного* рода изменений, вызванных внешней средой. У многих животных количество поглощаемой пищи изменяется в соответствии с ее питательной ценностью и вкусом. Образование ферментов гидролиза идет более или менее интенсивно под влиянием той или иной пищи, рирода такой регуляции по принципу обратной связи неизвестна, ыделение ферментов для внеклеточного пищеварения часто стимулируется локальными гормонами, а иногда нервными рефлек-
Специализация в выборе пищи и в пищеварительных способностях (последнее может касаться ферментов или микроорганиз-ов) облегчает отдельным животным использование таких пита-ельных веществ, которые недоступны другим. Пищеварительная система принадлежит к тем немногим физиологическим системам,
336
Глава 4
для которых характерно наличие некоторого общего типа с наложением на него особенностей, связанных с экологическими условиями.
СПИСОК ЛИТЕРАТУРЫ1
1. Adam И., рр. 256—288, in: Biology of Myxine, ed. by A. Brodahl and R. Fan-ige, Universitets Forlaget, Oslo, Norway, 1963. Physiology of digestion in cyclostomes.
2. Agrawal V. P„ J. Zool., 143, 133, 1964. Digestion in Orchestia.
3. Alexander F., Brit. Vet. J., 110, 146, 1954. Digestion in horse.
4. Al-Hussaini A. H., J. Morph., 80, 251, 1947; Quart. J. Mier. Sci., 90, 109, 1949. Functional morphology of teleost alimentary tracts.
5. Allen J. A., J. Marine Biol. Assoc. U. K-, 42, 609—623, 1962. Filter feeding in molluscs.
6. Alpers D. H., J. Biol. Chem., 244, 1238—1246, 1969. [3-Galactosidases: rat, human.
7. Alpers D. H., Solin M., Gastroenterology, 58, 833, 1970. Intestinal amylase.
8* . Altman P. L„ Dittmer D. S. (editors, for the Committee on Biological Handbooks), Metabolism. Fed. Amer. Soc. Exp. BioL, Bethesda, Maryland, 1968. Tables of biological values.
9. Ames jo В, Barrowman J., Borgstrom B., Acta Chem. Scand., 21, 2897, 1967. Pancreatic pro-phospholipase A.
10. Anderson J. A., Stephens S. C., Marine Biol., 9, 242—249, 1969. Absence of uptake of dissolved organic molecules by crustaceans.
11. Annison E. F., White R. R., Biochem. J., 80, 162—-169, 1961. Glucose utilization in sheep.
12* . Annison E. F., Lewis D., Metabolism in the Rumen, Methuen, London, 1959
13. Arme C., Read С. P., Biol. Bull., 135, 80—91, 1968. Absorption of acetate and butyrate by a cestode.
14. Amon R., Neurath H., Proc. Nat. Acad. Sci., 64, 1323, 1969. Immunochemical relations of trypsins.
15. Asp hl.-G., Biochem. J., 121, 299—308, 1971. Human intestinal p-galactosi-d hsc
16. Bailey С. B., Brit. J. Nutr., 15, 443—-451, 1961. Saliva secretion in cattle.
17. Bailey H. FL, Fairbairn D., Comp. Biochem. PhysioL, 26, 819—836, 1968. Absorption of fatty acids and monoglycerides by a cestode.
18. Baldwin E., An Introduction to Comparative Biochemistry, Cambridge University Press, London and New York, 1948.
19. Balogun R. A., Comp. Biochem. PhysioL, 29, 1267—1270, 1969. Digestive enzymes of larch bark beetle.
20. Banks W. M., Science, 141, 1191—1192, 1963. Carbohydrate digestion in the cockroach.
21. Barnard E. A., Nature, 221, 340—344, 1969. Function of pancreatic ribonuclease.
21a*. Barnard E. A., Ann. Rev. Biochem., 38, 677—732, 1969. Ribonucleases.
22. Barnes R. FL, Fiala G„ Kwong E., Fed. Proc., 22, 125, 1963. Effects of coprophagy.
23* . Barrington E. J. W., pp. 109—161, in: The Physiology of Fishes, Vol. 1, ed. by M. E. Brown, Academic Press, New York, 1957. Digestion in fishes.
24* . Barrington E J. W., Adv. Comp. Biochem. PhysioL, 1, 1—65, 1962. Digestive enzymes.
25. Barry R. J., Eggenton C. J., Smyth D. H., J. PhysioL, 204, 299—310, 1969. Relation of Na+ pump to sugar absorption.
1 Обзорные статьи отмечены звездочкой (*).
Сравнительная биохимия и физиология пищеварения
337
26. Barry R. J., Smyth D. Н., J. Physiol., 152, 48—66, 1960. Absorption of fatty
27. ^B audio p T„ Martucci R. W., Science, 161, 698—699, 1968. Ruminant-like digestion of langur monkey.
98 Bayliss L. E., Starling E. H., J. Physiol., 29, 174, 1903. Secretin.
29. ' Becker D. E., Ullrey I). E., Terrill S. W., Notzold R. A., Science, 120, 345— 346, 1954. Failure of newborn pig to digest sucrose.
30. Behnke W. D., Wade R. D., Neurath H., Biochemistry, 9, 4179—4188, 1970. Bovine pro-carboxypeptidase A.
31. Belleville J., Clement J., Bull. Soc. Chim. Biol. (Paris), 50, 1419—1424, 1968. Pancreatic phospholipase (man, rat).
32. Ben Abdeljlil A., Desnuelle P., Biochim. Biophys. Acta, 81, 136—149, 1964. Adaptation of pancreatic enzymes to diet.
33. Bensley R. R., Amer. J. Anat, 2, 105, 1902. Stomach morphology of mammals.
34. Berger E., Kafatos F. C., Felsted R. L., Law J. H., J. Biol. Chem., 246, 4131— 4137, 1971. Cocoonase.
35. Bergman E. G., Reid R. S., Murray M. G., Brockman J. M., Whitelaw F. G., Biochem. J., 97, 53—66, 1965. Volatile fatty acids of sheep rumen.
36. Bewley G. C., DeVillez E. J., Comp. Biochem. Physiol., 25, 1061—1069, 1968. Digestive proteases of earthworm.
37. Bhattacharya S., Ghose K. C., Comp. Biochem. Physiol., 37, 581—587, 1970. Amylase in bile.
38. Birktoft J. J., Blow D. M., Henderson R., Steitz T. A., Phil. Trans. Roy. Soc. Lond. B, 257, 67—76, 1970. Chymotrypsin structure.
39. Blandamer A., Beechey R. B., Biochim. Biophys. Acta, 118, 204—206, 1966. Amylase of crab hepatopancreas.
40. Blaxter K. L., Martin A. K., Brit. J. Nutr., 16, 397—407, 1962. Nitrogen metabolism of sheep.
41. Bohlken H., Proc. Zool. Soc. London, 134, 207, 1960. Stomach of camels.
42. Bolton W., Brit, Poultry Sci., 6, 97, 1965. Crop, in fowl.
43. Borgstrom В, Biochim. Biophys. Acta, 106, 171—183, 1965; also Johnston J. M., Borgstrom B., Biochim. Biophys. Acta, 84, 412—423, 1964. Bile salt micelles; intestinal absorption of fats.
44. Borgstrom B., Erlanson C., Biochim. Biophys. Acta, 242, 509—513, 1971. Co-lipase.
44a. Bowering J., Calloway D. H., Mangen S., Kaufman N. A., J. Nutr., 100, 249—261, 1970. RNA digestion in man.
45. Bradshaw R. A., Neurath H., Tye R. W„ Walsh K. A., Winter W. P„ Nature, 226, 237—239, 1970. Dogfish trypsinogen.
46. Brockerhoff H., J. Fish. Res. Bd. Canad., 23, 1835, 1966; J. Biol. Chem., 246, 5828, 1971. Intestinal digestion of fats.
47. Brockerhoff H„ Hoyle R. J., Hwang P. C., J. Fish. Res. Bd. Canad., 27, 1357, 1970. Digestive enzymes of lobster.
48*. Brooks F. P., Control of Gastrointestinal Function, Macmillan Co New York
1970. Uptake of fatty acids. ’
49. Brown A. L., Jr., J. Cell Biol., 12, 623—627, 1962. Microvilli of human intestinal mucosa.
50. Brown G. D„ Main A. R., Austral. J. Zool., 15, 7, 1967. Marsupial nutri-
51. Bryant M. P., Robinson I. M., J. Dairy Sci., 46, 150, 1963. Ammonia utilization in the rumen.
52. Burck P. J., Methods Enzymol, 19, 906, 1970. Pancreatic inhibitors of trypsin.
53*. Burgen A. S. V., pp. 561—580, in: Handbook of Physiology, Vol. 2, Ses 6 ed by C. F. Code, Amer. Physiol. Soc., Washington D. C„ 1968. Secretion by salivary glands.
54. Camacho Z., Brown J. R., Kitto G. B., J. Biol. Chem., 245, 3968—3972, 1970. Starfish trypsin.
22—1332
338
Глава 4
55. Chappell L. H., Arme C., Read С. P., Biol. Bull., 136, 313—326, 1969. Absorption of fatty acids by cestodes.
56. Chauncey H. H., Henriques B. L., Tanzer J. M., Arch. Oral Biol., 8, 615, 1963. Salivary amylase: occurrence.
57. Chesley L. C., Biol. Bull., 66, 133—144, 1934. Amylase in bile of fishes.
58. Chez R. A., Palmer R. R., Schultz S. G., Curran P. F., J. Gen. Physiol., 50, 2357—2375, 1967. Effects of inhibitors in amino acid absorption.
59. Cheung A. C., Gooding R. H., Comp. Biochem. Physiol., 37, 331—338, 1970. Insect trypsin.
60. Chinnery J. A. B., J. Insect Physiol., 17, 47, 1971. Carbohydrases in midgut of beetle.
61. Clement J., Rigollot B., Nutr. Dieta, 6, 61, 1964. Lipases and phosphatidase.
62. Coan M. H., Travis J., Comp. Biochem. Physiol., 32, 127—139, 1970. Coelenterate proteases.
63*. Coates M. E. (ed.), The Germ-free Animal in Research. Academic Press, 1968.
64. Cools A., Jeuniaux C„ Arch. Int. Physiol. Biochem., 69, 1, 1961. Digestion of cellulose in rabbit cecum.
65. Corner E. D. S., Leon У. A., Bulbrook R. D„ J. Marine Biol. Assoc. U. K., 39, 51, 1960. Sulphatases and P-glucuronidase in marine invertebrates.
66. - Crane R. R., pp. 2535—2542, in: Handbook of Physiology, Vol. 5, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1968. Intestinal brush border function.
67*. Crane R. K., pp. 1323—1351, in: Handbook of Physiology, Vol. 3, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1968. Intestinal absorption of sugars.
68. Crane R. K., Forstner G., Eichholz A., Biochim. Biophys. Acta, 109, 467—477, 1965. Relation of Na+ to sugar transport.
69. Crompton D. W. T„ Lockwood A. P. M., J. Exp. Biol., 48, 411—425, 1968. Absorption of glucose by acanthocephalans.
70. Dadd R. H., J. Exp. Biol., 33, 311—324, 1956. Control of proteolysis in beetles Tenebrio and Dytiscus.
71*. Dadd R. H., pp. 117—142, in: Chemical Zoology, Vol. V, Part A, ed. by M. Florkin and В. T. Scheer, Academic Press, New York, 1970. Digestion in insects.
72. Dahlqvist A., J. Clin. Invest., 41, 463, 1962; also Dahlqvist A. and U. Telenius, Biochem. J., Ill, 139, 1969. Intestinal disaccharidases.
73. Dahlqvist A., Thomson D. L., Biochem. J., 89, 272—277, 1963. Rat intestinal amylases.
74. Dales R. P., J. Marine Biol. Assoc. U.K., 34, 55, 1955. Digestion in poly-сЬэеtes
75. Das P. K., Watts R. A., Watts D. C., Dimelow E. J., Comp. Biochem. Physiol., 39B, 979—997, 1971. Distribution of some proteases and esterases in starfish.
76. Davenport H. W., Sci. Amer., 226, 86—93, 1972. Protection of the stomach against digestion.
77. David J. S. R.„ Malathi P., Ganguly J., Biochem. J., 98, 662, 1966. Absorption of cholesterol, rat.
78. Davis G. R. F., Arch. Int. Physiol. Biochem., 71, 166, 1963. Carbohydrases of grasshoppers.
79. Dawes B„ Parasitology, 52, 483, 1962. Digestion in Fasciola.
80*. Day M. F., Waterhouse D. F., pp. 273—349, in: Insect Physiology, ed. by K. D. Roeder, John Wiley and Sons, New York, 1953. Feeding and digestion in insects.
81*. DeDuve C., Watteaux R., Ann. Rev. Physiol., 28, 135, 1966. Lysosomes.
82. DeHaas G. H., Posterna N. M., Niewenhuizen W., van Deenen L. M., Biochim. Biophys. Acta, 159, 118—129, 1968. Pancreatic prophospholipase A.
83*. Dethier V. G., Ch. 6, pp. 79—96, Handbook of Physiology of the Alimentary Canal, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1967. Feeding and drinking behavior of invertebrates.
Сравнительная биохимия и физиология пищеварения 339
84. Devigne J., Jeuniaux С., Arch. Int. Physiol. Biochem., 69, 223, 1961. Chitinase of earthworms.
85. DeVillez E., Buschlen K., Comp. Biochem. Physiol., 21, 541—546, 1967. Trypsin in crustaceans.
86. DeVillez E., Reid R. M., Comp. Biochem. Physiol., 38B, 235—238, 1971. Po-lychaete trypsin.
87. Dodgson K. S., Lewis J. M., Spencer B., Biochem. J., 55, 253—259, 1953. Sulphatases.
.88. Dolly J. 0., Fottrell P. F., Clin. Chim. Acta, 26, 555, 1969. Dipeptidases of human intestinal mucosa.
89. Eggermont E., Europ. J. Biochem., 9, 483, 1969. Glucosidases of human intestinal mucosa.
90. Eisen A. Z„ Jeffrey J. J., Biochim. Biophys. Acta, 191, 517—526, 1969. Collagenase of crustacean hepatopancreas.
<91. Ellis W. C., Pfander W. H„ Nature, 205, 974—975, 1965. Rumenal necleic acids.
92. Erasmus D. A., Ohman C., Ann. N. Y. Acad. Sci., 113, 7, 1963. Adhesive organ of trematodes.
93. Erlanson C., Borgstrom B., Biochim. Biophys. Acta, 167, 629—631, 1968. Pancreatic esterase.
94. Erspamer V., Gut, 11, 79—87, 1970. Caerulein.
95. Evans W. A. L, Payne D. W„ J. Insect. Physiol., 10, 657, 1964. Digestive carbohydrases of a locust.
96*. Fairbairn D., pp. 361—378, in: Chemical Zoology, Vol. Ill, ed. by M. Florkin and В. T. Scheer, Academic Press, New York, 1969. Lipid metabolism in nematodes.
97. Farmanfarmaian A., Phillips J. H., Biol. Bull., 123, 105—120, 1962. Digestion of algae in sea urchin.
98. Farner D. S., Poultry Sci., 22, 245, 1943; BioL Bull., 84, 240—243, 1943. Amylase in bile of fowl.
99*. Farner D. S., pp. 411—467, in: Biology and Comparative Physiology of Birds, Vol. I, ed. by A. J. Marshall, Academic Press, New York, 1960.
100. Figarella C., Bull. Soc. Chim. Biol., 48, 97, 1966. Enzymes of mammalian pancreatic juice.
101. Fischer E. H., Stein E. A., pp. 313—343, in: The Enzymes, Vol. 4, ed. by P. D. Boyer, H. Lardy, and L. Myrback, Academic Press, New York, 1960. Mammalian a-amylase.
102. Fish J. C„ Nature, 180, 345, 1957. Rennin.
103. Fisher F. M., Read С. P., Biol. Bull., 140, 46—62, 1971. Sugar transport in tapeworm.
104. Fisk F. W., Rao B. R., Ann. Entom. Soc. Amer., 57, 40, 1964. Digestive carbohydrases of the cockroach.
105. Flock A. H., van Norden S., Spiro H. N., Gastroenterology, 52, 230, 1967. Gastric and intestinal mucosal enzymes, primates.
106. Flor kin M.t Lozet F., Arch. Int. Physiol. Biochem., 57, 201—207, 1949. Chitinase.
107. Folk J. E., Schirmer E. IF., J. Biol. Chem., 240,181—192, 1965. Chymotrypsin C (pig).
108. Franssen J., Jeuniaux C., Arch. Int. Physiol. Biochem., 71, 301, 1963. Alginase in molluscs.
109. Friedrich M., Novack R., Schenk G., Biochem. Zeitschr., 343, 346, 1965. Pepti-dases of rat intestinal mucosa.
10. Fujita T., Zellforsch. Mikr. Anat., 57, 487, 1962. Pancreas of Chimaera.
Hl. Galli D. R., Giese A. C., J. Exp. Zool., 140, 415, 1959. Carbohydrate digestion in herbivorous snail.
2. Galun R., Life Sci., 5, 1335—1342, 1966. Stimulation of feeding in rat flea.
*13. Galun R., Kindler S. EL, Comp. Biochem. Physiol., 17, 69—73, 1966. Stimulation of feeding in leech.
90*
340
Глава 4
114. Galtin R., Kindler S. H., J. Insect Physiol., 14, 1409—1421, 1968. Stimulation of feeding in tick Ornithodoros.
115. Galun R., Margalib J., in: First Int. Symp. Tsetse Fly Breeding, ed. by J. de Azevedo, Lisbon, 1970. Stimulation of feeding in tsetse fly.
116. Gardner J. D., Brown M. S., Laster L., New Eng. J. Med., 283, 1196, 1970. Transport in mammalian intestinal epithelium.
117. Gardner J. D., Brown M. S., Laster L., New Eng. J. Med., 283, 1264—1271 , 1317—1324, 1970. Digestion in mammalian intestinal epithelium.
118. Gates B. J, Travis J., Biochemistry, 8, 4483, 1969. Shrimp trypsin.
119. Gelperin A., J. Insect Physiol., 12, 331—345, 829—841, 1966. Control of crop emptying and food intake in blowfly.
120. Gertler A., Birk Y., Europ. J. Biochem., 12, 170, 1970. Pig pancreatic pro-d3st2.se
121. Gibson D., Dixon G. H., Nature, 222, 753—756, 1969. Proteases of sea anemone.
122. Giebel W., Zwilling R., Pfleiderer G., Comp. Biochem. Physiol., 38B, 197—210, 1971. Proteases of honeybee.
123* . Gilbert L. I., Adv. Insect. Physiol., 4, 69, 1967. Lipid metabolism in in-sects.
124. Gooding R. H., Huang L. T., J. Insect Physiol., 15, 325, 1969. Beetle trypsin and chymotrypsin.
125. Gordon S. G., Kern F., Biochim. Biophys. Acta, 152, 372—378, 1968. Absorption of fatty acids; functions of bile.
126. Graham A., Proc. Zool. Soc. Lond., 122, 543, 1939. Amylases of lamellibranch style.
127. Gray G. M„ Ann. Rev. Med., 22, 391, 1971. Intestinal malabsorption of carbohydrates.
128. Gray G. M., Santiago N. A., J. Clin. Invest., 48, 716, 1969. Human intestinal carbohydrases.
129. Greenberg B., Ann. Entomol. Soc. Amer., 61, 365, 1968. pH of maggot digestive tracts.
130. Greene L. H„ Hirs С. H. W., Palade G. E„ J. Biol. Chem., 238, 2054—2070, 1963. Enzymes of pancreatic zymogen granules (cow).
131. Greenfield L. L, Lane С. E., J. Biol. Chem., 204, 669—672, 1953. Utilization of cellulose by Teredo.
132* . Greenwood С. T., Milne E. A., Adv. Carbohydrate Chem., 23, 281, 1968. Starchdegrading enzymes.
133. Gregory H., Hardy P. M., Jones D. S., Kemmer G. W., Sheppard R. C., Nature, 204, 931—932, 1964. Gastrin.
134*. Gregory R. A., Gastroenterology, 51, 953—959, 1966; in: Handbook of Physiology, Vol. 2, Sec. 6, pp. 827—834, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1967. Gastrin.
135. Griffiths M., Comp. Biochem. Physiol., 14, 357—375, 1965. Digestion in echidna.
136. Griffiths M., Davies D„ J. Nutr., 80, 171—180, 1963. Soft pellets in rabbit stomach.
137* . Grossman M. /., pp. 835—864, in: Handbook of Physiology, Vol. 2, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1967. Stimulation of gastric secretion.
138. Grossman M. L, Lancet, 1, 1088—1089, 1970. Gastrin, cholecystokinin, and secretin.
139. Gustaffson В. E., Paft F. S., McDaniel E. G., Smith J. C., Fitzgerald R. J., J. Nutr., 78, 461—468, 1962. Vitamin К-deficient germfree rats
140. Hadorn B., Steiner N., Sumida C., Peters T. J., Lancet, 1, 165, 1971. Intestinal enterokinase.
141. Hajjar J. J., Curran P. J., J. Gen. Physiol., 56, 673—691, 1970. Amino acid transport in intestine.
142. Hall D. A., Arch. Biochim. Biophys., 98 (Suppl. 1), 239—246, 1962. Elastase complex.
Сравнительная биохимия и физиология пищеварения 34Е
143. Hartley В. S.t Phil. Trans. Roy. Soc. bond. B, 257, 77—87, 1970. Pancreatic-proteases.
144* Haslewood G. A. D„ J. Lipid Res., 8, 535, 1967. Bile salt evolution.
MR ' Hatfield E. E., Fed. Proc., 29, 44, 1970. Ruminant nitrogen metabolism.
146. Haupt T. R., Amer. J. Physiol., 197, 115—120, 1959; 205, 1144—1150, 1963.. Utilization of urea; ruminants, rabbits.
147. Haven D. S., Morales-Alamo R., Biol. Bull., 139, 248—264, 1970. Filter feeding^ in oyster.
148. Heller J., Schramm M., Biochim. Biophys. Acta, 81, 96—100, 1964. a-Amylase action.
149*. Hendrix T. R., Bayless T. M., Ann. Rev. Physiol., 32, 139, 1970. Secretion of electrolytes and water in mammalian intestine.
150. Heran H„ Z. vergl. Physiol., 39, 44—62, 1956. Digestion in earthworms.
151. Hillman R. E., Rosenberg L. E., Biochim. Biophys. Acta, 211, 318—326, 1970. Amino acid transport in renal tubules.
152. Hindmarsh J. T., Kilby D., Wiseman G., J. Physiol., 186, 166—174, 1966. Effect of amino acids on sugar absorption.
153*. Hoffmann A. F., Small D. A., Ann. Rev. Med., 18, 333, 1967. Function of bile s ts
154. Hogben С. M., Gastroenterology, 50, 78—82, 1966. Fat absorption.
155. Hollingsworth D. F., Greaves J. P., Amer. J. Clin. Nutr., 20, 65—72, 1967. Human carbohydrate consumption.
156. Holt J. H., Miller D., Biochim. Biophys. Acta, 58, 239, 1962. Phosphatases and peptidases of intestinal brush border.
157. Hori K., J. Insect Physiol., 16, 373, 1970. Salivary amylase, hemipterans.
158* . House H. L., pp. 815—858, in: The Physiology of Insects, Vol. 2, ed. by M. Rockstein, Academic Press, New York, 1965. Digestion in insects.
159. Howard F., Yudkin J., Brit. J. Nutr., 17, 281—294, 1963. Pancreatic amylase and trypsin; responses to feeding.
160. Huang W.-Y., Tang J., J. Biol. Chem., 245, 2189—2193, 1970. Human gastrin, and pepsin.
161* . Hungate R. E., The Rumen and its Microbes, Academic Press, New York,. 1966.
162. Isselbacher K. J., Gastroenterology, 50, 78—82, 1966. Biochemistry of fat absorption.
163. Isseroff H„ Read С. P„ Comp. Biochem. Physiol., 30, 1153—1159, 1969. Aminoacid absorption by trematodes.
164. Ito S., J. Cell Biol., 27, 475, 1965. Surface coat on intestinal microvilli.
165. Itoh R., J. Biochem. (Tokyo), 33, 269, 1941. Gastric lipase.
166. Jacobs H. L., Sharma K. N., Ann. N. Y. Acad. Sci., 157, 1084—1121, 1969. Sensory and metabolic control of food intake in mammals.
167. Jacques P. J., pp. 395—420, in: Lysosomes in Biology and Pathology, Vol. 2, ed. by J. T. Dingle and H. B. Fell, North Holland Publishing Co., Amsterdam,. 1969. Digestion by lysosomes.
168. Jennings J. B„ Biol. Bull., 122, 63—72, 1962; 123, 571—581, 1962. Digestive enzymes: turbellarian rhynchocoelan.
169* . Jennings J. B., pp. 305—323, in: Chemical Zoology, Vol. 2, ed. by M. Florkirr and В. T. Scheer, Academic Press, New York, 1968. Digestion in PlatyheL minthes.
170. Jennings J. B„ van der Lande V. M., Biol. Bull., 133, 166—183, 1967. Digestion in leeches.
171. Jeuniaux C., Nature, 192, 135—136, 1961. Chitinase in digestive tract of vertebrates.
72. Jeuniaux C., Arch. Int. Physiol. Biochem., 70, 407, 1962. Polysaccharidases of stomach in sloth.
173. Jeuniaux C., Arch. Int. Physiol. Biochem., 71, 307, 1963. Chitinases of vertebrates and invertebrates.
174*. Jeuniaux C., Chitine et chitinolyse, Masson, Paris, 1963, 181 pp.
342
Глава 4
175. Jeuniaux С., pp. 64—91, in: Chemical Zoology, Vol. 4, ed. by M. Florkin and В. T. Scheer, Academic Press, 1969. Digestion in annelids.
176. Jimenez-Poraz J. M., Clin. Toxicol., 3, 389, 1970. Enzymes of snake venoms.
177. Johannes R. E„ Conrad S. J., Webb H. L., Comp. Biochem. Physiol., 29, 283— 288, 1969. Uptake of dissolved amino acids by marine invertebrates.
478*. Johnston J. M., pp. 1353—1375, in: Handbook of Physiology, Vol. 3, Ses. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1968. Lipid absorption.
179. Jorgensen С. B., Goldberg E. D., Biol. Bull., 105, 477—489, 1953. Filtration feeding in molluscs and ascidians.
180*. Jorgensen С. B., Biology of Suspension Feeding, Pergamon Press, Oxford, 1967, 357 pp.
181. Jorpes J. E., Gastroenterology, 55, 157—164, 1968. Secretin and cholecystokinin.
182. Joseffson L., Lindberg T., Ojesj L., Scand. J. Gastroent., 3, 207, 1968. Dipeptidases in human intestine.
183. Kassell B., Methods Enzymol., 19, 844, 1970. Pancreatic trypsin inhibitor.
184. Keller P. J., Allan B. J., J. Biol. Chem., 242, 281—287, 1967. Pancreatic enzymes in human.
185. Kellogg T. F., Wastmann B. S., J. Lipid Res., 10, 495, 1969. Bile acids from germfree rats.
186. Kermack D. M., Proc. Zool. Soc., Lond., 125, 347, 1955. Digestion in Areni-cola.
187. Kerry K. R., Comp. Biochem. Physiol., 29, 1015—1022, 1969. Intestinal disac-charidases: birds, marsupials, mcnotremes.
188. Kilian E. F., Z. vergl. Physiol., 34, 407—447, 1952. Ingestion and water currents in sponges.
389. Kleine R., Z. vergl. Physiol., 55, 51, 1967; 56, 142, 1967. Peptidases of hepatopancreas and stomach juice of crayfish.
190. Klok J. L., Smit H., Comp. Biochem. Physiol., 7, 251—254, 1962. Gastric secretion in frog.
191. Kochua E., Gans C., Clin. Toxicol., 3, 363, 1970. Snake venoms.
192. Koide A., Matsuoko У., J. Biochem. (Tokyo), 66, 541, 1969. Pancreatic proteases in whale.
193. Kolinska J., Semenza G., Biochim. Biophys. Acta, 146, 181—195, 1967. Sucra-se-isomaltase complex of rabbit intestine.
194. Kooiman P., J. Cell Comp. Physiol., 63, 197, 1964. Carbohydrases of hepatopancreas of crayfish and lobster.
195. Koringa P., Quart. Rev. BioL, 27, 266—308, 339—365, 1952. Filter feeding by oysters.
196. Krogh A., Biol. Rev., 6, 412—422, 1931. Utilization of dissolved foods by acquatic animals.
197. Kuhn H.-J., Folia Primat., 2, 193, 1964. Stomach of leaf-eating monkeys.
198. Lack о A. G., Neurath H., Biochemistry, 9, 4680, 1970. Fish procarboxypepti-d<ise A
199. Lamy F., Tauber S., J. Biol. Chem., 238, 939—944, 1963. Elastase.
200. Lansing A. J., Rosenthal T. B., Alex M., Proc. Soc. Exp. Biol. Med., 84, 689, 1953. Elastase of fish pancreas.
1201. Lasker R., Boolootian R. A., Nature, 188, 1130, 1960. Digestion of algae by echinoderms.
202. Lasker R., Giese A. C., J. Exp. Biol., 33, 542, 1956. Cellulose digestion in insects.
203. Lawrence A. L., Comp. Biochem. PhysioL, 9, 69—73, 1963. Sugar transport, bullfrog intestine
204. Lawrence A. L., Lawrence D. C., Comp. Biochem. PhysioL, 22, 341—357, 1967. Sugar absorption, Cryptochiton.
205. Lee D. L., Parasitology, 52, 241, 1962. Esterases in Ascaris.
206*. Lenhoff H. M., pp. 158—222, in: Chemical Zoology, Vol. 2, ed. by M. Florkin and В. T. Echeer. Academic Press, New York, 1967. Digestion in coelenterates.
Сравнительная биохимия и физиология пищеварения 34$
х>
907 Lenhoff Н. М., рр. 203—229, in: Biology of Hydra, edited by H. M. Lenhoff and M. F. Loomis, University of Miami Press, Coral Gables, Fla., 1961. Activation of feeding reflex in Hydra.
908. Lewis J. B„ Canad. J. Zool., 42, 549, 1964. Digestion in sea urchin.
209. Li Y.-T., Shellar M. R., Comp. Biochem. Physiol., 14, 275—279, 1965. Glycosidases in earthworm.
210. Lippel K., Olson J. A., Biochim. Biophys. Acta, 127, 243—245, 1966. Bile salts on non-lipolytic enzymes of pancreas.
211. Little C., Gupta B. L., Nature, 218, 873—874, 1963. Uptake of dissolved ’ nutrients by Pcgonophora.
212. Loeven W. A., Europ. J. Biochem., 12, 170, 1970; Clin. Chim. Acta, 30, 165„ 1970. Elastase complex.
213 Luppa H„ Acta Histochem., 12, 137, 1961. Stomach glands, Amphibia.
214'. MacGinitie С. E., Biol. Bull., 77, 115—118, 1939; 88, 107—111, 1945. Feedingin Chaetopterus and Urechis.
215. Maclnnis A. J., Fisher F. M„ Jr., Read С. P., J. Parasitol., 51, 260—267, 1965. Purine and pyrimidine transport in cestodes.
216. Magee D. F., Anderson E. G„ Amer. J. Physiol., 181, 79—82, 1955. Induction? of pancreatic enzymes by dietary protein.
217. Magee W. L., Gallai-Hatchard J., Snados H., Thompson R. H. S.; Biochem. J.,. 83, 1-7—25, 1962. Pancreatic phospholipase A in human.
218. Malathi P., Gastroenterology, 52, 1106, 1967. Cholesterol esterase in intestinal mucosa.
219. Malathi P., Crane R. K., Biochim. Biophys. Acta, 173, 245—256, 1969. Intestinal |3-glucosidase in hamster.
220. Marchis-Mouren G., Bull. Soc. Chim. Biol., 47, 146, 1965. Pancreatic juice enzymes in mammals.
221. Marisal R. N., Lenhoff H. M., J. Exp. Biol., 49, 689—699, 1968. Stimulation of feeding in corals.
222. Maroux S., Baratti J., Desneulle P., J. Biol. Chem., 246, 5031—5039, 1971.. Enterokinase activaton of trypsinogen.
223. Marrama P., Ferrari C., Lapiccirella R„ Parisoli U„ Ital. J. Biochem., 8, 280,. 1959. Elastase of chicken pancreas.
224. Martin A. L., J. Zool., 148, 515, 1966. Digestion in crustaceans.
225. Matthews D. M., Lis M. T., Cheng B., Crampton R. F., Clin. Sci., 37, 751, 1969. Peptide absorption in rat intestine.
226. Mattson F. H., Volpenstein R. A., J. Lipid Res., 7, 536, 1966. Esterase of pancreatic juice.
227. Maylie M. F., Charles M., Gache C., Desnuelle P., Biochim. Biophys. Acta,.
229, 286—289, 1971. Pancreatic co-lipase.
228. McaCrthy C. F., Tyor M. P., Gastroenterology, 46, 891, 1964. Morphology of intestinal surface in vertebrates.
oon*‘ ^лС^Опа^ I' Nutr. Abstr. Rev., 38, 381—400, 1968. Ruminant digestion..
230. McGeachtn R. L., Welbourne W. P., Comp. Biochem. Physiol., 38A, 457—460,. 1970. Amylase in frog tissues.
231. McMahon J. U Ryler J. H„ Canad. J. Zool., 41, 321—332, 1963. Regulation; of feeding in Daphnia.
232. Meeuse B. J D„ Fleugel W., Arch. Neerl. Zool, 13 (Suppl. 1), 301, 1958. Amylase of lamelhbranch style.
233. Mehring J. S„ Tyznik W. J., J. Animal Sci, 30, 764, 1970. Glucose tolerance in horse.
234. Michel C., Ann. Histochem, 15, 19, 1970. Intestinal proteases in annelids.
235. Michelson E. H., Dubois L., Comp. Biochem. Physiol, 38B, 263—268, 1971. fP^ymes of crystalline style of Oncomelania (mollusc).
Miller D Crane R. T., Biochim. Biophys. Acta, 52, 293—298, 1961. Enzymes oi brush border of mammalian intestine.
237. Mockel W., Barnard E. A., Biochim. Biophys. Acta, 178, 354—363, 1969 Reptile chymotrypsins.
344
Глава 4
238*. Moir R. I., pp. 1—14, in: Physiology of Digestion in the Ruminant, ed. by A. W. Dougherty, Butterworths, London, 1963. Ruminants and ruminant-like mammals.
239*. Moir R. I., pp. 2673—2694, in: Handbook of Physiology, Vol. 5, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Wastington D. C., 1968. Digestion in ruminants.
240. Morgan R. G. H., Borrowman J., Filipek-Wender J., Borgstrom B., Biochim. Biophys. Acta, 167, 355—366, 1968. Pancreatic lipases in rat.
241. Morrissen S. M., Yuk C. S., Comp. Biochem. Physiol., 34, 521—533, 1970. Gastrin effects on secretion in Rana.
242. Mukaiyama F., Horie Y., Ito T., J. Insect Physiol., 10, 247—254, 1964. Silkworm disaccharidases.
243*. Muller M., pp. 351—380, in: Chemical Zoology, Vol. 1, ed. by M. Florkin and В. T. Scheer, Academic Press, New York, 1967. Digestion in protozoans.
244. Muller M., Toro I., J. Protozool., 9, 98, 1962. Lysosomes and food vacuoles in Protozoa.
245. Muscatine L., Hand C., Proc. Nat. Acad. Sci., 44, 1259—1623, 1958. Symbiotic algae in corals.
246. Muscatine L„ Science, 156, 516—518, 1967. Symbiotic algae in corals.
247. Myers F. L., Northcote D. H., J. Exp. BioL, 35, 639, 1958. Digestive enzymes of Helix.
248. Meyers F. L., Northcote D. H., Biochem. J., 71, 749—755, 1959. Cellulase from Helix.
249. Neurath H., Bradshaw R. A., Arnon R., in: Proceedings of the International Symposium on Structure-Function Relationships of Proteolytic Enzymes, ed. by M. Otteson, Munksgaard, Copenhagen, 1969. Evolution of proteases.
250. Newey H., Smyth D. H., J. Physiol., 164, 527—551, 1962. Intestinal amino acid transport.
251. Nielson С. V., Oikos, 13, 200, 1962. Carbohydrases in annelids.
252. Nilsson A., Fdnge R., Comp. Biochem. Physiol., 31, 147—165, 1969; 32, 237— 250, 1970. Digestive proteases of cyclostome and Chimaera.
253. Nilsson A., Comp. Biochem. Physiol., 32, 387—390, 1970. Gastrointestinal hormones, Chimaera.
254. Noirot C., Noirot-Timothee C., pp. 49—88, in: Biology of Termites, Vol. 1, ed. by K. Krishna and F. W. Weesner, Academic Press, New York, 1969. Digestion of wood by termites.
255. Nordstrom C., Dahlqvist A., Biochim. Biophys. Acta, 242, 209—225, 1971. Enterokinase in brush border.
256. Norris J. L., J. Exp. Zool., 141, 155, 1959. Esophageal and gastric glands of frog.
257*..Novikoff A. B., p. 36, in: Ciba Foundation Symposium on Lysosomes, ed. by A. V. De Reuck and M. P. Cameron, Churchill, London, 1963. Enzymes of lysosomes.
258. Okamoto A., J. Biochem. (Tokyo), 37, 269, 1950. Salivary amylase of frog.
259. Ondetti M. A. et al., Amer. J. Digest. Diseases, 15, 149—156, 1970. Cholecystokinin and pancreomyzin.
260. Overton J., Eichholz A., Crane R. K.., J. Cell Biol., 26, 693, 1965. Enzymes of intestinal brush border.
261*. Owen G., pp. 53—96, in: Physiology of Mollusca, Vol. 2, ed. by К. M. Wilbur and С. M. Yonge, Academic Press, New York, 1966. Amylase in gastropods.
262. Owen G., Phil. Trans. Roy. Soc. Lond. B, 258, 245, 1970. Secretory cells of mollusc digestive gland.
263. Parnas I., J. Cell. Comp. Physiol., 58, 195, 1961. Snail cellulase.
264. Parsons D. S., Prichard J. S„ Nature, 208, 1097—1098, 1965. Disaccharide hydrolysis in amphibian intestine.
265* . Peters W., Trop. Diseases Bull., 66, 1—29, 1969. Biochemistry of plasmo-dia.
266. Peters T. J., Biochem. J., 120, 195, 1970. Intestinal proteases in guinea pig.
Сравнительная биохимия и физиология пищеварения___________,_______34S
267. Pfleiderer G., Z willing R., Sonneborn Н. Н., Z. Physiol. Chem., 348, 1319, 1967. Crayfish trypsin.
268. Pilgrim M„ Proc. Zool. Soc. bond., 147, 387, 1966. Alimentary tract of mal-donid polychaetes.
269. Polonovski C., Bier H., Acta Paed. Scand., 59, 458, 1970. Enterokinase difi-ciency in man.
270. Poori C., Geuze J. L, Z. Zellforsch. 98, 7, 1969. Feeding effects on frog pancreas.
271. Poort C., Kramer M. F., Gastroenterology, 57, 689, 1969. Feeding effects on mammalian pancreas.
272. Pawning R. F„ Irzykiewicz H., J. Insect Physiol., 8, 275—286, 1962. Digestive protease of clothes moth larvae.
273. Preston R. L., Pfander W. H., J. Nutr., 83, 369—378, 1964. Phosphorus metabolism in sheep.
274*. Read С. P., Amer. Zool., 8, 139, 1968. Nutrition in parasites.
275*. Read С. P., Simmons J. R., Physiol. Rev., 43, 263—305, 1963. Biochemistry of tapeworms.
276. Reboud J. P., Ben Abdeljlil A., Desnuelle P., Biochim. Biophys. Acta, 58, 326, 1962; also Reboud J. P. et al., Biochim. Biophys. Acta, 117, 351—367, 1966. Feeding effects on pancreatic enzymes.
277. Reeck G. R., Winter W. P., Neurath FL Biochemistry, 9, 1398, 1970. Pancreatic enzymes of lungfish.
278. Reeck G. R., Neurath H., Biochemistry, 11, 503, 1972. Trypsinogen activation peptides: fishes, mammals.
279*. Reeder W. G., pp. 99—149, in: The Physiology of Amphibia, ed. by J. A. Moore, Academic Press, New York, 1964. Digestion in amphibians.
280. Reid R. G. B., Comp. Biochem. Physiol., 17, 417—433, 1966. Digestive proteases and esterases in bivalves.
281. Reid R. G. B., Comp. Biochem. Physiol., 24, 727—744, 1968. Digestive enzymes of lamellibranchs.
282. Reid R. G. B., Rauchert K., Comp. Biochem. Physiol., 35, 689—695, 1970. Proteases of bivalve molluscs.
283. Rhodes J. B., Eichholz A., Crane R. K„ Biochim. Biophys. Acta, 135, 959—965,. 1967. Intestinal brush border enzymes.
284. Roberts P. J. P., Whelan W. J., Biochem. J., 76, 246—253, 1960. a-Amylase action.
285. Robinson L. A., Churchill C. L., White T. T., Biochim. Biophys. Acta, 222, 390—395, 1970. Human pancreatic juice content.
286. Robinson G. B., Biochem. J., 88, 162—168, 1963. Intestinal mucosal peptidases.
287. Robyt J. F., French D„ Arch. Biochem. Biophys., 122, 8, 1967; J. Biol. Chem., 3917—3927, 1970. a-Amylase action.
288 . Rogers W. P., pp. 179—428; in: Chemical Zoology, Vol. 3, ed. by M. Florkin and В T. Scheer, Academic Press, New York, 1969. Nitrogen metabolism in Acanthocephala and Nematoda.
289. Rogers A. 1 Buchorik P. S., Biochim. Biophys. Acta, 159, 200—202, 1968. Bile salt protection of chymotrypsin.
290. Rosenbaum R. M., Ditzion B„ Biol. Bull., 124, 211—224, 1963. Digestive gland enzymes ш Helix. .
291. RosenweigN. S Herman R. H., Stif el F. B., Amer. J. Clin. Nutr., 24, 65-69, goo n71;Fee^ing efTfeCTf’ mt±es^.nal.saccharidases (man).
904 er №• £’ J- lnsect Physiol., 6, 62, 1968. Digestion in scarabalid larvae.
293. Rothman S. S., Amer. J. PhysioL, 218, 372—376, 1970. Zymogens of rabbit pancreas.
294. Rothman A. M Fisher F. M., J. Parasitol., 50, 410, 1964. Uptake of amino acids by parasitic worms.
295. Ryan C. A Arch. Biochim. Biophys., 110, 169-183, 1965. Chymotrypsin and trypsin in bird pancreas.
296. Ryie A. P. Hamilton M. P., Biochem. J., 101, 176—183, 1966. Pepsinogen
346
Глава 4
-297. Salnikow J., Moore S„ Stein W. H., J. Biol. Chem., 245, 5685—5690, 1970. Bovine pancreatic deoxyribonuclease.
297a. Sands W. A., pp. 495—524, in: Biology of Termites, Vol. 1, ed. by K. Krishna and F. W. Weesner, Academic Press, New York, 1969. Fungal symbiont of termite.
298. Sarda L., Maylie M. F„ Roger L, Desnuelle P„ Biochim. Biophys. Acta, 89, 183—185, 1964. Pancreatic lipase.
299. Schade S. G., Cohen R. J., Conrad M. E., New Eng. J. Med., 279, 672, 1968. Effect of stomach acid on iron absorption.
300. Schingoethe D. J., Gorrill A. D. L„ Thomas J. W„ Yang M. G., Canad. J. Physiol. Pharmacol., 48, 43, 1970. Pancreatic protease output of mammals.
301. Schmidt-Nielsen B., Schmidt-Nielsen K-, Haupt T. P., Jamieson S. A., Amer. J. Physiol., 188, 477—484, 1957. Urea excretion in camel.
302. Schoellmann G, Shaw E., Biochemistry, 2, 252, 1963. Active reaction center of chymotrypsin.
303. Scow R. 0., Stein Y., Stein O., J. Biol. Chem., 242, 4919—4924, 1967. Lipids in chylomicrons.
-304. Schultz S. G., Yu-tu L., Alvarez O. 0., Curran P. F., J. Gen. Physiol., 56, 621—638, 1970. Amino acid transport in rabbit ileum.
305. Schultz S. G„ Curran P. F., Chez R. A., Fuisz R. E., J. Gen. Physiol., 58, 1261—1286, 1971. Amino acid transport in intestine.
306. Seijffers M. J., Segal H. L., Miller L. L., Amer. J. Physiol., 205, 1099—1105, 1963. Human pepsins.
307*. Semenza G., pp. 2543—2566, in: Handbook of Physiology, Vol. 5, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D.C., 1968. Intestinal carbohydrases.
308. Semenza G., Auricchio S., Rubino A., Prader A., Welsh J. D., Biochim. Biophys. Acta, 105, 386—389, 1965. Genetic deficiency of intestinal maltrases (man).
309. Shorland F. B., Weenink R. O., Johns A. T., Nature, 175, 1129—1130, 1955. Effects of rumen on dietary fat.
310. Shotton D. M., Methods Enzymol., 19, 113, 1970. Pancreatic elastase.
311. Siddons R. C., Biochem. J., 108, 839—844, 1968. Digestive carbohydrases, cow.
312. Siddons R. C., Biochem. J., 112, 51—59, 1969. Intestinal carbohydrases, chicken.
313. Simpson G. G., Bull. Amer. Mus. Nat. Hist, 85, 1, 1945. Radiation of ungulates.
314. Simpson J. W., Taylor A. C., Levy В. M., Comp. Biochem. Physiol., 39B, 963— 967, 1971. Collagenase in snake venoms.
315*. Singleton J. W., Gastroenterology, 56, 342—362, 1969. Humoral effects of pancreas on gastrointestinal tract.
316. Skoczylas R., Comp. Biochem. Physiol., 35, 885—903, 1970. Digestion in snakes.
317. Smit H., Comp. Biochem. Physiol., 13, 129—141, 1964. Pepsin secretion in frog.
318*. Smit H., pp. 2791—2806, in: Handbook of Physiology, Vol. 5, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1968. Non-mammalian gastric secretion.
319. Smith A. C., van Weel P. B., Experientia, 16, 60, 1960. Midgut gland enzymes in developing snails.
320. Smith A. H., Kleiber M„ Black A. L., Lof green G. P., J. Nutr., 58, 95—111, 1956. Transfer of phosphate in digestive tract.
321. Smith H. W., J. Path. Bact., 89, 95, 1965. Microflora of alimentary tract of vertebrates.
322. Smith M. W., J. Physiol., 182, 559—590, 1966. Sodium-glucose interactions in goldfish intestine.
323. Smith M. W., Comp. Biochem. Physiol., 35, 387—401, 1970. Active transport of amino acids by fish intestine.
Сравнительная биохимия и физиология пищеварения*34/
324* Smith R. Н., J. Dairy Res., 36, 313, 1969. Nitrogen metabolism and the ru-325. sSh R- H-> McAllan A. B., J. Nutr., 25, 181—190, 1971. Nucleic acid metabolism in ruminants.
326* Smyth J. D., The Physiology of Trematodes, Oliver and Boyd, London,.
327. SnooAi /. T., J. Nutr., 87, 297—305, 1965. Adaptation of pancreatic enzymes
328. ^Soldarno D„ Rare M. R., Wasserman R. H., Poultry Sci., 20, 123, 1961. Crop in birds.
329. Somers M„ Austral. J. Exp. Biol., 39, 145, 1961. Nitrogen cycling via saliva,,
330. SSonneborn H. H., Pfleiderer G., Ishay J., Z. Physiol., Chem., 350, 389, 1969. Hornet larva chymotrypsin.
331. Stephens G. C., Science, 131, 1532, 1960. Uptake of glucose by coral.
332^ Stephens G. C„ Amer. Zool., 8, 95, 1968. Dissolved organic matter as nutrient.
333. Stephens G. C., Schinske R. A., Limnol. Oceanogr., 6, 175—181, 1961. Dissolved organic matter as nutrient.
334. Storr G. M., Austral. J. Biol. Sci., 17, 469, 1964. Marsupial nutrition.
335. Sunshine P., Kretchmer N., Science, 144, 850—851, 1964. Absence of intestinal disaccharidases in sea lions.
336. Swaminathan N., Rhadhakrishnan A. N., Arch. Biochem. Biophys., 135, 288, 1969. Intestinal disaccharidases.
337. Tammes P. M. L., Dral A. D. G., Arch. Neerl. Zool., 11, 87—112, 1955. Food intake in mussels.
338. Tang J., Mills J., Chiang L., DeChiang L., Ann. N. Y. Acad. Sci., 140, 688,. 1967. Pepsin.
339. Tarlow M. J., Hadorn B., Artherton M. W., Lloyd J. K., Arch. Dis. Child., 45, 651, 1970. Enterokinase deficiency.
340. Thacker E. J., Brandt C. S., J. Nutr., 55, 375—385, 1955. Coprophagy in rabbit.
341. Theede H., Lassig J., Helg. wiss. Meeresunters., 16, 119—129, 1967. Ciliary pumping in molluscs.
342. Thomsen E., Moller 1., J. Exp. Biol., 40, 301—321, 1963. Hormonal control of protease in blowfly.
343. Tobita T., Folk J. E., Biochim. Biophys. Acta, 147, 15—25, 1967. Chy-motrpsin C, pig.
344. Topps J. H., Elliott R. C., Nature, 205, 498—499, 1965. Nucleic acid digestion,, ruminants.
345*. Treherne J. E., Ann. Rev. Entomol., 12, 43, 1967. Intestinal absorption, insects.
346. Vgolev A. M., Physiol. Rev., 45, 555—595, 1965. Contact (membrane) digestion.
347. Ugolev A. M., Kooshuck R. F., Nature, 212, 859—860, 1966. Intestinal absorption of peptides.
348. Vander meers Л., Christophe J., Biochim. Biophys. Acta, 154, 110—129, 1968. Amylase and lipase in rat pancreas.
qka’ Van Dobben W. H., Ardea, 40, 1, 1952. Protection in cormorant gizzard.
350. Van Den Oord A., Comp. Biochem. Physiol., 17, 715—718, 1966; also van den Oord A., Damelsson H„ Ryhage R., J. Biol. Chem., 240, 2242—2247, 1965. Emulsifiers in crustaceans.
351. Van Weel P. B., Z. vergl. Physiol., 42, 433—448, 1959. Adaptation of amylase in snails.
352. Van Weel P. B., Z. vergl. Physiol., 43, 567—575, 1960. Crustacean midgut gland enzymes.
353* . Van Weel P. B., pp. 97—115, in: Chemical Zoology, Vol. 5, Part A, ed. by M. Florkin and В. T. Scheer, Academic Press, New York, 1970. Digestion in Crustacea.
348
Глава 4
354. Verger R., DeHaas G. H., Sarda L., Desnuelle P., Biochim. Biophys. Acta, 188, 272, 1969. Pancreatic lipase, pig.
355. Vonk H. J., Arch. Int. Physiol. Biochem., 70, 67, 1962. Emulsifiers in invertebrate digestive fluids.
356*. Vonk H. J., pp. 347—401, in: Comparative Biochemistry, Vol. 6, ed. by M. Florkin and H. S. Mason, Academic Press, New York, 1964. Comparative aspects of digestion.
357. Walker D. M„ J. Agric. Sci., 53, 375, 1959. Carbohydrases of lamb.
358*. Waring H„ Moir R. J., Tyndale-Biscoe С. H., Adv. Comp. Physiol. Biochem.,
2, 238, 1966. Comparative physiology of marsupials.
359. Watson H. C., Shotton D. M., Cox J. M., Muirhead H„ Nature, 225, 806—811, 1970. Elastase structure.
360. Weller R. A., Pilgrim A. F„ Gray F. V., Brit. J. Nutr., 16, 83—90, 1962. Digestion in rumen of sheep.
361. Welsh M. F., Biol. Bull., 70, 282, 1936. Zooxanthellae in turbellarian.
362. Werner B., Zool. Anz., 146, 97—113, 1951. Filter feeding in Crepidula.
363. Western J. R. H., Jennings J. B., Comp. Biochem. Physiol., 35, 879—884, 1970. Secretion of HC1 and pepsinogen in teleost stomach.
364. Wharton D. R., Wharton M. L., Lola J. E., J. Insect Physiol., 6, 62, 1964. Digestion in scarabalid larvae.
365. White D. A., Pounder D. J., Hawthorne J. N., Biochim. Biophys. Acta, 242, 99—107, 1971. Phospholipase A of guinea pig pancreas.
366*. Wigglesworth V. B., The Principles of Insect Physiology, Methuen, London, 1965.
367. Wilcox P. C., Methods Enzymol., 19, 64, 1970. Chymotrypsins.
368. Williams V. H., Nature, 197, 1221, 1963. Fermentation in camel stomach.
369*. Wiseman G., pp. 1277—1307, in: Handbook of Physiology, Vol. 3, Sec. 6, ed. by C. F. Code, Amer. Physiol. Soc., Washington D. C., 1968. Absorption of amino acids.
370. Woodward С. K-, Read С. P., Comp. Biochem. Physiol., 30, 1161—1177, 1969. Transport of amino acids in tapeworm.
371. Wright D. E., New Zealadand J. Agr. Res., 4, 216, 1961. Lipid metabolism in rumen.
372. Wright R. D., Florey H. W., Sanders A. B., Quart. J. Exp. Physiol., 42, 1, 1957. Gastric mucosa of reptiles.
373*. Wyatt G. R., Adv. Insect. Physiol., 5, 287, 1967. Trehalose in insects.
374. Yamasaki K., Usui T., Iwata T., Nakasome S., Hozumi M., Takatsuki S., Nature, 205, 1326—1327, 1965. Absence of bile acids in crayfish.
375. Yamashina I., Acta Chem. Scand., 10, 739, 1956. Trypsinogen activation.
376. Yamashita K-> Ashida K., J. Nutr., 99, 267—273, 1969. Lysine metabolism in rats fed lysine-free diet.
377. Yang Y. J., Davies D. M., J. Insect Physiol., 14, 205, 1968. Trypsin in dipteran insects.
378. Yokoe Y., Yasumasu I., Comp. Biochem. Physiol., 13, 323—338, 1964. Cellulase in invertebrates.
379. Yonge С. M., pp. 86—88, in: Physiology of Mollusca, Vol. 2, ed. by К. M. Wilbur and С. M. Yonge, Academic Press, New York, 1966. Algal symbionts in molluscs.
380. Yudkin J., Amer. J. Clin. Nutr., 20, 108—115, 1967. Dietary carbohydrates in man.
381. Zendzian E„ Barnard E. A., Arch. Biochem. Biophys., 122, 699, 1967. Proteases and ribonuclease in vertebrate pancreas.
382. Zoppi G„ Shmerling D. H., Comp. Biochem. Physiol., 29, 289—294, 1969. Intestinal disaccharidase, vertebrates.
383. Zhuzhikov D. P., J. Insect. Physiol., 10, 273, 1964. Permeability of insect peritrophic membrane.
384. Zwilling R., Pfleiderer G., Sonneborn H. H., Kraft V., Studky L, Comp. Biochem. Physiol., 28, 1275—1287, 1969. Crayfish trypsin.
Глава 5
Кислород, дыхание и метаболизм
Л. ПРОССЕР
Химическая эволюция на Земле началась в условиях восстановительной атмосферы, и ранний синтез органических соединений происходил в отсутствие свободного кислорода. Кажется вероятным, что дробный перенос энергии органических субстратов соединениями типа аденозинтрифосфата (АТФ) и ферменты анаэробного обмена (гликолиза и брожения) возникли очень давно. Возможно, что некоторое количество кислорода освобождалось при фотохимическом разложении воды, катализируемом металлопор-фиринами, однако весь кислород современной земной атмосферы возник в процессе фотосинтеза. Интенсивность фотосинтеза такова, что весь атмосферный кислород мог бы образоваться за 2000 лет. Аэробный обмен, появившийся позднее анаэробного, менее универсален, зато более эффективен; оба типа обмена, видимо, возникли еще до широкой дифференциации организмов. Некоторые микроорганизмы получают энергию исключительно анаэробным путем; все растения и животные имеют ряд ферментов анаэробного обмена, однако большую часть энергии они получают в результате окислительных процессов. Некоторые животные (например, кишечные паразиты), способные долгое время обходиться без кислорода, по-видимому, вторично приспособились к анаэробиозу (см. гл. 6).
В этой главе будут рассмотрены: 1) содержание кислорода и двуокиси углерода в среде, 2) способы поглощения кислорода и регуляция этого процесса, 3) потребление кислорода интактными животными и влияющие на него факторы. В следующей главе обсуждаются ферментативные пути метаболизма.
Содержание кислорода в окружающей среде
Кислород, поступающий через дыхательную поверхность в организм или же прямо в клетки, должен диффундировать через водный раствор. Возможность использования кислорода зависит от его концентрации в среде, непосредственно окружающей организм. Максимальная концентрация кислорода определяется его содержанием в атмосфере (20,95% в сухом воздухе); парциальное
350
Глава 5
давление кислорода в воздухе составляет на уровне моря 159 мм рт. ст. В воздухе, насыщенном водяными парами, парциальное давление кислорода снижается примерно на 10 мм рт. ст. при повышении температуры от 0 до 37 °C. При подъеме на высоту парциальное давление кислорода падает пропорционально падению барометрического давления (около 11,3% на 1 км). На высоте 5500 м барометрическое давление уменьшается наполовину по сравнению с давлением на уровне моря. Содержание двуокиси углерода в сухом воздухе обычно составляет 0,03% (при обычных условиях это соответствует парциальному давлению 0,228 мм рт. ст); в промышленных районах концентрация СОг значительно выше. Содержание СО2 в земной атмосфере постепенно увеличивается в результате сжигания человеком ископаемого топлива.
Количество газа, растворенного в чистой воде (в мл/л), равно коэффициенту растворимости данного газа (а), умноженному на процентное содержание его в газовой фазе, находящейся в равновесии с водой. Количество О2 или СО2 в воде можно выражать как концентрацию (в миллилитрах, миллиграммах или молях на литр) или как парциальное давление (в мм рт. ст.) данной газовой фазы, уравновешенной с водой1. При повышении температуры и солености воды коэффициент растворимости уменьшается следующим образом: ,
Температура, °C Содержание кислорода (в равновесии с воздухом)
а Н2О Вода чистая Морская вода (соленость 34,960/00)
5 0,44 9,22 мл/л (13,2 мг/л) 6,89 мл/л (9,8 мг/л)
20 0,031 6,51 мл/л (9,4 мг/л) 5,05 мл/л (7,8 мг/л)
На рис. 5-1 представлены парциальные давления О2 и СО2 в воздухе и воде, при которых у наземных и водных животных поддерживается равенство между потреблением О2 и выделением СО2. Для наземных видов наклон прямой равен 1 и может достигать высоких значений, а для водных форм этот наклон соответствует отношению растворимостей О2 и СО2 в воде. Таким образом, для водного организма уровень PCOgB среде не может превышать 5 мм рт. ст., в то время как для наземных видов он теоретически мог бы достигнуть 150 мм рт. ст. Величина V — это количество воздуха или воды (в миллилитрах), которое должно проходить через дыхательную поверхность в 1 мин, чтобы за это время был поглощен 1 мл О2. При РО2, равном 100 мм рт. ст., эта
1 1 л 02=1429 .мг О2; 1 мг 02==0,031 моль О2.
Кислород, дыхание и метаболизм
351
величина составляет 480 мл/мин для воды и всего лишь 17 мл/мин для воздуха; при таком РО2 парциальное давление СО2 равно 50 мм рт. ст. в воздухе и менее 2 мм рт. ст. в воде.
В естественных пресных водоемах концентрация кислорода может значительно изменяться в зависимости от температуры воды, степени ее насыщенности воздухом, интенсивности фотосинтеза и потребления О2 организмами. Ниже термоклина, где вода почти не
Рис. 5-1. График, (показывающий (парциальные давления О2 и СО2, при которых потребление кислорода и выделение iCO2 одинаковы,(Rahn Н., in: Oxygen in animal organism, ed. by F. Dickens and E. Neil, Pergamon Press 1965).
перемешивается, кислорода может быть намного меньше, чем у поверхности. Напротив, в теплых поверхностных слоях воды (как в пресном водоеме, так и в море), где идет интенсивный фотосинтез, концентрация кислорода может превысить ту, которая установилась бы при равновесии с воздухом. В океане, как правило, происходит достаточное перемешивание воды и концентрации О2 и СО2 относительно постоянны. Концентрация кислорода у поверхности, где много активных водорослей, весьма высока; на средних глубинах она обычно уменьшается в результате потребления О2 нефотосинтезирующими организмами, и здесь имеется слой с минимальным содержанием кислорода (рис. 5-2). В глубоководной зоне, однако, уровень кислорода соответствует насыщению воздухом. Гидростатическое давление возрастает примерно на 1 атм с каждыми 10 м глубины, но отношение между концентрациями растворенных газов в воде и в воздухе остается таким же, как и у поверхности, поэтому содержание их в воде (мг/л) не изменяется. Дело обстоит здесь совсем не так, как на больших высотах, где барометрическое давление создается самими газами и концентрация их меняется с высотой. Очень низкие концентрации О2 могут быть в иле, где кислород используется не только в биологиче
352
Глава 5
ских реакциях. В очень бедной кислородом среде живут также кишечные паразиты млекопитающих.
Коэффициент диффузии газа D (диффузионная способность) выводится из уравнения диффузии
dV —AD~,
dx ’
dt
которое означает, что количество вещества, диффундирующее за единицу времени, равно произведению коэффициента диффузии на
Рис. 5-2. Температура и содержание кислорода на различных глубинах в южной части Тихого океана [194].
площадь поверхности, через которую идет диффузия, и на градиент концентрации по отрезку х. Размерность D — см2-время-1; величина D возрастает примерно на 3% при повышении температуры на 1 °C. Крог ввел биологическую константу диффузии К — произведение D на коэффициент растворимости а, которое имеет размерность см2• время-1 • атм. Так как при повышении температуры на 1 °C растворимость кислорода уменьшается на 1,6%, чистый
Кислород, дыхание и метаболизм 353
прирост К составляет 1,4% на 1 °C. Крог дает следующие величины К для кислорода при 20 °C [121]:
Значение К о2> см2/мин
В воздухе 11,0
В воде 0,000034
В мышце 0,000014
В хитине 0,000013
Таким образом, кислород диффундирует в воздухе примерно в 3 млн. раз быстрее, чем в воде. При 20 °C в воде растворяется в 28 раз больше двуокиси углерода, чем кислорода, а коэффициент диффузии СО2 в воде в 25 раз выше, чем для кислорода. Кроме того, СО2 образует гидрат (Н2СО3), который диссоциирует как слабая кислота, так что в растворе существует равновесие между со2, н2со3 и нсо;.
В целом живые организмы редко сталкиваются с парциальным давлением кислорода, превышающим 155 мм рт. ст., однако они могут находиться в условиях низкой концентрации О2, приближающейся к нулю.
Поглощение кислорода; внешнее дыхание
Прямая диффузия. Все клеточные поверхности проницаемы для кислорода, даже те, которые относительно непроницаемы для воды. У тех животных, у которых в жидкостях тела имеются системы переноса кислорода, определенные эпителии специально приспособлены для внешнего дыхания. При отсутствии транспортной системы кислород проникает путем диффузии непосредственно в клетки, где он используется. Возможность обеспечить все клетки кислородом зависит в этом случае от длины пути, который должен пройти диффундирующий кислород. Согласно расчетам, если организм имеет сферическую форму, то при данных величинах V02 (потребление кислорода) в мл/(г-мин) и Со (концентрация кислорода в среде) предельные размеры тела составляют J/ 8Со-~> где К константа диффузии [64]. Для небольших водных организмов величиной не более 1 мм достаточно простой диффузии кислорода. Но если ткани в глубине тела животного отстоят от поверхности более чем на 0,5 мм, необходима какая-то дополнительная транспортная система, кроме тех случаев, когда интенсивность метаболизма очень низка. Внутриклеточные величины POi приведены на стр. 399.
jPr°T^0Z-a’ P°r^era’ Coelenterata, многих Platyhelminthes, Ne-rnatoda, Rotifera, некоторых Annelida и Bryozoa клетки получают кислород путем диффузии непосредственно из окружающей воды, ряда организмов существуют каналы, через которые проходит 23-1332
354
Глава 5
вода; у других кислород диффундирует через несколько слоев клеток; иногда перенос кислорода облегчается токами цитоплазмы. У животных, обладающих системой кровообращения, максимальное расстояние от капилляра или синуса, содержащего кислород, до метаболизирующей клетки определяется возможностями диффузии. В тканях млекопитающих расстояния между соседними капиллярами редко превышают 0,1—0,3 мм.
Наружные покровы как орган дыхания. Так как все клетки проницаемы для кислорода, все многоклеточные животные в той или иной мере обладают кожным дыханием. У многих свободноплавающих личинок система кровообращения развивается раньше, чем специальные органы дыхания, и кровь насыщается кислородом у поверхности тела.
У большинства кольчатых червей (олигохет, пиявок и некоторых полихет) наружные покровы тела сильно васкуляризированы и обеспечивают практически весь газообмен. Кожное дыхание характерно также для сипункулид, иглокожих и некоторых водных насекомых. У угрей через кожу поступает 60%, а через жабры — всего лишь 40% кислорода. Легочные улитки половину необходимого кислорода поглощают через наружные покровы и половину — через легкие [121]. Личинка мясной мухи получает от 2,5 до 10% кислорода через покровы тела [31].
У лягушек кожное поглощение кислорода составляет в течение всего года около 50 мл/(кг-ч), в то время как легочное дыхание, едва заметное в зимний период, достигает весной 130 мл/(кг-ч). В выделении двуокиси углерода кожа играет у них большую роль во все времена года; даже летом через кожу выводится в 2,2 раза больше СО2, чем через легкие [48] (рис. 5-3). У саламандр через кожу выделяется 80% СО2 и поглощается 65—74% О2 [215]. У ящерицы Sauromalus на кожу приходится всего лишь около 4% выделения СО2 и менее 2% поглощения О2; при этом процент двуокиси углерода, выделяемой через кожу, возрастает при повышении уровня СО2 в крови [38]. У летучей мыши Eptesicus выведение СО2 через кожу (в основном через крылья) может составлять < 11,5% общего выделения СО2 [78а]. Для сравнения можно ука- | зать, что у человека через кожу выделяется 1,4% СО2. Поглощение | кислорода через кожу у млекопитающих может служить главным 1 образом для обеспечения метаболизма самой кожи. Кислород мо- | жет поступать в кожу как из наружного воздуха, так и из крови । [54]. Кожное дыхание регулируется в основном вазомоторными реакциями.
Жабры. Жабрами называют различного рода дыхательные придатки с хорошо развитой сетью сосудов. Они могут быть снабжены ресничками, иногда приводятся в движение мышцами, а иногда могут быть расположены в области тока воды, создаваемого специальными органами. У рыб кровь в капиллярах жабр течет в направлении, противоположном току воды; этот противоточный ме-
Кислород, дыхание и метаболизм
355
низм обеспечивает практически полное насыщение крови кис-Х* одом. Показателем эффективности жаберного дыхания служит поля кислорода (в %), извлекаемая из воды, проходящей через жаберную камеру. Функция жабр может регулироваться частотой и амплитудой их движений и изменением скорости кровотока.
Рис. 5-3. Легочное и кожное дыхание у лягушек, акклимированных к температуре 5, 15 и 25 °C [73].
1 — поступление О2 через легкие; Г1 — выход СО2 через легкие; III — поступление О2 через кожу; IV — выделение СО2 через кожу.
У полихет в поглощении кислорода наряду с кожей участвуют такие структуры, как параподии (у нереид), жабры (у Arenicola) и жаберные 'пучки (у Terebellidae и большинства Sabellidae). Червь Arenicola живет в U-образной трубке и извлекает при различных Ро яот 30 до 35% Ог. Периодическими движениями тела он прокачивает воду через трубку, и характер этих движений варьирует в зависимости от концентрации растворенных газов [213]. При низких концентрациях кислорода движения могут становиться непрерывными. Terebellidae используют 50—60% кислорода, содержащегося в воде, если движения тела служат только для дыхания; если же червь одновременно извлекает из воды пищу, то процент используемого кислорода падает до 5—10. Живущая в трубке-норе полихета может потреблять до 60% растворенного кислорода, когда она проявляет активность, а в неактивном состоянии всего лишь 14%. За 1 ч содержание кислорода в трубке падает до /ю первоначального уровня; после этого организм переключается на анаэробный обмен [144, 145].
Олигохеты Tubifex и Limnodrilus обитают в илистом дне застойных прудов, где количество кислорода временами сильно сни-ается. При достаточном содержании кислорода нет необходимости в дополнительной вентиляции; когда же парциальное давле-ие Ог падает несколько ниже атмосферного уровня, хвостовая
23*
356
Глава 5
часть червя начинает совершать медленные колебания, перемешивая воду. При исчерпании кислорода тело животного вытягивается и может становиться в 10—12 раз длиннее обычного. При очень низких концентрациях кислорода винтообразные движения тела помогают привлечь верхние слои воды ближе к червю; при полной аноксии животное расслабляется. Двуокись углерода может подавлять ритм, возникающий при недостатке кислорода. Болотная олигохета Alma, живущая в бедном О2 иле, уносит с собой вниз пузырьки воздуха на заднем конце тела [17].
У большинства морских ежей и морских звезд кислород поступает в организм главным образом через амбулакральные ножки; у некоторых форм имеются также кожные жабры (папиллы), в которых медленно текущая целомическая жидкость приходит в более тесный контакт с наружной водой, прогоняемой движениями ресничек. Некоторые голотурии, например Cucumaria, имеют разветвленную целомическую дыхательную систему; эта система открывается в клоаку и обеспечивает 60% всего поглощения кислорода. У Holothuria скорость прокачивания воды через клоаку с уменьшением количества растворенного кислорода вначале возрастает, но когда РО2в воде пвДает до 60—70% в атмосфере, прока-
чивание воды прекращается и животное становится неактивным [158].
Большинство моллюсков имеет хорошо развитые жабры с ресничками, регулирующими ток воды в соответствии с содержанием в ней кислорода. Двустворчатые моллюски время от времени с силой закрывают створки раковины, очищая таким образом полость мантии. Мидия (Mytilus), моллюск средних размеров (75—166 г), прокачивает от 2,2 до 2,9 л воды в 1 ч. При 13 °C он извлекает из воды 3—5% О2, а при более высоких температурах — еще больше. Mercenaria поглощает 1 мг О2 из 2,9 л перекачиваемой воды [140]; при понижении РО2 вентиляция усиливается, хотя процент извлекаемого из воды кислорода не возрастает. После периода анаэробиоза, когда прокачивание воды практически прекращалось, возвращение в аэробные условия приводило к возобновлению дыхания, причем эффективность извлечения О2 вначале составляла около 20%, а через несколько часов снижалась до 5—10%. Многие двустворчатые моллюски открывают и закрывают свои раковины с определенной периодичностью, а при аноксии створки остаются закрытыми (у Mytilus, Mercenaria и Ostrea, но не у Cardium или Pecten). У ряда морских брюхоногих моллюсков эффективность извлечения кислорода выше (40—80%), чем у двустворчатых. У головоногих (Octopus), как и у двустворчатых, при низких прокачивание воды усиливается, a Octopus, кроме того, чувствителен к повышенному уровню О2. Этот моллюск извлекает из воды до 80% кислорода.
Водные ракообразные имеют жабры, обычно вентилируемые с помощью особых придатков (таких, как скафогнатиты), движе-
Кислород, дыхание и метаболизм
357
ния которых сходны с движениями плавников. Крабы, обитающие на нижней литорали, обладают более развитыми жабрами, чем крабы средней и верхней литорали. У водных крабов, ведущих
Гипобранхиальное Сопротибле- Зпибранхипльное пространство ние потону пространство г г в таврах
А
Рис. 5-4. Схемы, объясняющие механизмы прямого (Л) и обратного >(Б) прокачивания воды через жаберную камеру Carcinus [99].
Знаками «+» и « » указано гидростатическое давление по отношению к внешнему давлению, принятому за 0.
^5?НЫИ9/ жизни, общая поверхность жабр больше (1367 мм/г у Callinectes), чем у литоральных форм (624 мм2/г у Uca), а у последних в свою очередь больше, чем у сухопутных
358
Глава 5
Время, мин
<i‘Zg ргоипхапеп H4>V
Рис. 5-5. Изменения дыхания и потребления кислорода у речного рака при снижении концентрации О2 !(мл/л), поступающего в жабры [126].
Животное находилось в замкнутом сосуде в течение 200 мин.
Кислород, дыхание и метаболизм 359
крабов (325 мм2/г у Ocypode). У некоторых наземных крабов из сем. Grapsidae число и размеры жабр уменьшены, а в жаберную полость выступают сосудистые пучки, которые лишь время от времени приходится увлажнять, чтобы обеспечить поглощение кислорода на суше. У Carcinus вода в жабрах течет в направлении, противоположном току крови, но может также идти обходным путем около краев жабр; ритмические движения скафогнатитов создают дополнительное давление от 3 до 12 мм рт. ст., которое накладывается на небольшое отрицательное давление в гипобран-хиальном пространстве [99] (рис. 5-4). Carcinus (и другие ракообразные) периодически меняют направление тока воды на обратное и могут рефлекторно, как бы «кашляя», выталкивать воду обратно для очистки жабр от твердых частиц. При низкой концентрации кислорода объем прокачиваемой воды возрастает и извлечение О2 может доходить до 40%. У омара (Homarus) при уменьшении содержания кислорода в воде от 5,8 до 2,4 мл/л вентиляция не изменяется (9,5 л/ч), однако эффективность извлечения кислорода возрастает с 31 до 55% [196]. У Carcinus и Balanus также не отмечено усиления внешнего дыхания при снижении уровня О2 или повышении уровня СО2.
Усиление вентиляции при снижении POi наблюдали у Squilla и Pandalus. У речного рака Astacus при снижении содержания кислорода от 6,6 до 2,1 мл/ч частота дыхательных движений возрастает в три раза, а объем вентиляции удваивается. У речного рака, так же как и у омара, потребление кислорода падает линейно с уменьшением РО2, однако процент кислорода, извлекаемого из воды, не меняется (рис. 5-5); прокачивание воды усиливается у него при низкой концентрации О2 и падает при высокой концентрации СО2, а частота сокращений сердца снижается при низком уровне О2. Действие гипоксии опосредуется через рецепторы, находящиеся где-то в системе кровообращения, и приводит к брадикардии и усиленной вентиляции. Воздействуя двуокисью углерода на основания переоподов или на жабры, можно вызвать брадикардию [6, 7]. На дыхание СО2 в обычных условиях почти не влияет, ноесли покрыть панцирь животного коллодием, то четырехкратный избыток СО2 вызывает повышение частоты дыхательных движений. Солоноватоводные равноногие и гаммариды реагируют на снижение уровня О2 усилением вентиляции, тогда как повышение уровня СО2 не оказывает никакого действия. У Limulus частота дыхательных движений пропорциональна концентрации кислорода, а при аноксии или избытке СО2 эти движения прекращаются.
У многих водных насекомых имеются жабры, из которых кислород поступает прямо в сильно разветвленные трахеи. Трахейные жабры встречаются у нимф Odonata, Plecoptera, Trichoptera и hpnemeroptera. Значение трахейных жабр для водных Hemiptera видно из следующих данных:
360
Глава 5
Потребление Оо, мл/(кг-ч)
при наличии жабр без жабр
Naucoris 241 24
Notonecta 225 29
Corixa 305 47
У рыб — как хрящевых, так и костных — вариации основного типа дыхания связаны с приспособлением к различным уровням активности и факторам окружающей среды. У очень активных рыб общая поверхность жабр (мм2 на 1 г веса тела) больше, чем у малоподвижных форм [93].
Менхэден 1241
Скумбрия 1040
Г олец 275—432
Опсанус 151—189
С помощью сканирующего электронного микроскопа на пластинках жаберных нитей можно видеть микрогребни, намного увеличивающие поверхность жабр (рис. 5-6). Однако отношение этой микроповерхности к переносу кислорода пока не установлено.
Распространено мнение, что быстро плавающие рыбы всегда держат рот открытым, чтобы через жабры проходило как можно больше воды. Это не совсем верно. Жабры находятся между двумя «насосами» — ротовым, который связан с работой мускулатуры дна ротовой полости, и жаберным, который действует за счет движений жаберной крышки (рис. 5-7, 5-8). В начале цикла рот открыт и в обеих полостях существует небольшое отрицательное давление. Когда рот закрывается, давление в ротовой полости становится положительным, вода идет через жабры и в жаберной полости тоже возникает небольшое положительное давление. Тогда жаберная крышка открывается и давление в обеих полостях падает, в ротовой полости раньше, чем в жаберной; затем жаберная крышка закрывается, а рот открывается вновь. У некоторых рыб, например у сомика и карпа, вода протекает через жабры почти непрерывно; у других — таких, как форель, каллионимус и плотва, — ток воды возникает периодически. У ильной рыбы в покое вентиляцию поддерживают ритмические сокращения жаберной мускулатуры и упругая реакция скелета, а в период активности дыхание сопряжено с плавательными движениями [177]- У форели поверхностное дыхание осуществляется в основном при помощи ротовых мышц: при более глубокой вентиляции в работу включается и жаберная мускулатура [96]. Искусственно поддерживая тот или иной градиент давления между обоими «насосами», можно экспериментально изменять скорость тока воды. При быстром движении воды процент извлекаемого кислорода падает; при увеличе-
Т*ис. 5-6. Микрофотографии жаберных пластинок форели Salmo gairdnert, полученные К. Олсоном и П. Фромме с помощью сканирующего электронного микроскопа.
Л- Ряд вторичных пластинок и жаберная нить с клетками, выделяющими слизь. Б. Участок поверхности вторичной пластинки. Эпителиальные клетки образуют на своей поверхности микрогребни. Стрелками указаны участки, имеющие вид пор.
362
Глава 5
нии разности давлений частота дыхания остается неизменной, однако объем вентиляции возрастает (рис. 5-9). У каллионимуса поглощение кислорода достигает максимума, когда разность давлений равна нулю, в' то время как у ильной рыбы оно возрастает с повышением положительного давления в ротовой полости [94]. У многих рыб обычный ритм дыхания время от времени прерывается: в результате закрытия жаберных крышек поток воды меняет направление на обратное и происходит «откашливание», очищающее жаберную полость. Твердые частицы, попадая в жабры акулы, могут вызывать рефлекторное жаберное откашливание; с помощью химических раздражителей можно вызвать жаберно-ротовое откашливание.
Извлечение кислорода из воды в различные фазы дыхательного цикла можно выражать в процентах извлекаемого О2; можно также определять объем воды, который необходимо пропустить через жабры для извлечения данного количества кислорода (например, число литров воды на 1 мл поглощенного кислорода). При оценке эффективности дыхания нужно учитывать степень оксигенации крови, поступающей в жабры, по следующей формуле [90]: Эффективность переноса =
Количество кислорода, переходящего из воды в кровь — Количество кислорода в крови при максимальном насыщении »
или точнее
—_______^2?______юо
^оа[%8-%21 ’
где Vq2— поглощение кислорода, Q — объем крови, проходящей через жабры за данное время, —растворимость кислорода в крови, Pto— парциальное давление кислорода в притекающей воде и — парциальное давление кислорода в венозной крови, входящей в жабры. Максимальное поглощение кислорода достигалось бы в том случае, если бы оксигенированная кровь уравнивалась по величине РО2 с приходящей к жабрам водой. Эффективность переноса О2 у форели приближается к 100%, однако рыба извлекает из воды лишь от 11 до 30% кислорода [171]. Эта высокая эффективность указывает на то, что кровь течет навстречу воде.
У поверхности жабр течение воды остается ламинарным, поэтому каждую жаберную пластинку окружает тонкий непереме-шивающийся слой, в котором кислород движется очень медленно; сопротивление переносу кислорода в этом месте составляет 80— 90% общего сопротивления при переходе кислорода из воды в кровь [81].
Рис. 5-7.
А. Диаграмма дыхательного цикла у карпа [9]. Б. Одновременная запись активности некоторых мышц, а также движений и давления в системе дыхательных «насосов» у форели [10]. / — mm. adductores mandibulae; 2 — m. hyohyoideus; 3 — m. protractor hyoideus; 4 —m. sternohyoideus; 5 — mm. levatores hyomandibulae; 6 — m. dilator operculi; 7 — m. adductor operculi.
открыта
открыта
закрыта
М. sternonyoideus
И. protractor hyoideus
К dilator operculi
Рис. 5-8. Схема работы различных мышц на-протяжении дыхательного цикла у каллионимуса '(Hughes G. М., Ballantijn С. М., J. Eixp. Biol., 49, 583—602, 1968).
Давление в ротовой. полости
М. tiyohyoideus
К adductor operculi
medialis Madduc-_____ I tor Lateralis m^ndi-
J bulae
Манерная крышка М. levator tiyomandibulae
Рис. 5-9. Влияние изменения градиента давлений между ротовой и жаберной камерами на минутный объем дыхания '(I) и процент извлекаемого из воды кислорода (II) (Hughes G. М„ Ballantijn С. М., J. Exp. BioL, 49, 5831—602, 1968).
Кислород, дыхание и метаболизм
365
Эксперименты с введением красителя действительно позволили обнаружить встречное течение воды и крови у ильной рыбы. Парциальное давление кислорода в артериальной крови Ра^ меньше ег0 среднего значения для притекающей и оттекающей воды, но больше, чем в оттекающей воде [72]. У форели РО2 в крови спинной аорты выше, чем в оттекающей воде; у наркотизированной акулы Р02 одинаково в оттекающей крови и выходящей воде, что подтверждает наличие встречных потоков воды и крови в жабрах [81]. У Salmo gairdneri имеются сосудистые шунты по краям и в середине жаберной пластинки, что позволяет в случае необходимости изменять распределение и скорость кровотока [173а].
Номограммы, составленные для форели, карпа и акулы, показывают соотношения между артериальным кислородом (Рао<)> поглощением кислорода (VO2), потоком крови и потоком воды. PaQ возрастает с увеличением отношения объема вентиляции к минутному объему сердца (рис. 5-10) [111].
При снижении РО2 в воде объем вентиляции значительно возрастает, дыхание слегка усиливается, ударный объем сердца сильно увеличивается, а частота его сокращений падает. При повышении РСо2 амплитуда дыхания возрастает, частота его падает, а частота сокращений сердца увеличивается [90]. Чувствительность рыб к РОе значительно выше, чем к РСО2. У форели уже при кратковременной гипоксии вентиляция возрастает в 7 раз [41]. Реакции систем дыхания и кровообращения совместно поддерживают относительно постоянный уровень потребления кислорода в широком диапазоне РО2 в воде [171, 172].
Аэрированная вода (Pq2=155 мм рт. ст.) Гипоксическая вода (Во^=30 мм рт. ст.)
Частота дыхания, мин-1 85 120
Объем вентиляции, мл 500 3500
Потребление О2, мл/(кг-ч) 100 100
Частота сокращений сердца, мин-1 75 22—28
давЛение (брюшная аорта), мм рт. ст. ’ 60 80
Лактат крови, мг% Ро2 крови (спинная аорта), мм рт. ст 12,77 120 34,86 20
Минутный объем сердца, мл/мин 80 80
При гипоксии эффективность поглощения кислорода снижается, ри уменьшении РО2 в воде у многих рыб усиливается вентиляция и потребление кислорода тканями повышается. Это создает допол-тЛ ЛЬНУЮ УГРОЗУ для организма. При повышении температуры Пп^Ле в03Растает объем вентиляции, а затем и частота дыхания.
ко при критической температуре ритм сердца замедляется
366
Глава 5
из-за недостаточного снабжения кислородом сердечной мышцы, ц тогда работа обоих дыхательных механизмов может оказаться не-согласованной [95].
Рис. 5-10. Изменение ряда физиологических параметров у рыбы при кратковременном (6 мин) снижении Ро2 в воде >[94].
Изменение Рр, и2
в воде (перед жабрами) представлено верхней кривой.
Ритмом дыхательных движений управляет спонтанная активность центра в средней части продолговатого мозга. Ритмические разряды нервных импульсов в этой области можно обнаружить даже после обездвиживания рыбы тубокурарином или сукцинилхо-
Кислород, дыхание и метаболизм367
ином [177], а также после перерезки всех чувствительных нерв-JI волокон, идущих к этой части мозга [100]. Пока нельзя указать точную локализацию рецепторов, чувствительных к О2 и к СО2, так как импульсы сохранялись, хотя и в ослабленном виде, после перерезки IX и X пар черепных нервов, иннервирующих жабры. Вероятно, у рыб есть и периферические, и центральные рецепторы. У Tinea tinea недостаток кислорода увеличивает как частоту, так и глубину дыхания, поэтому объем вентиляции возрастает. Избыток СО2 почти не оказывает влияния, хотя может вызывать небольшое снижение частоты и углубление дыхания [63]. Угорь (Anguilla) и форель извлекают из воды около 80% О2, уравновешенного с атмосферным воздухом; эта величина уменьшается при низких концентрациях кислорода. При содержании кислорода в воде менее 4 мл/л вентиляция у этих рыб может возрастать в 4 раза [121].
В экспериментальных условиях свободного выбора рыбы из сем. Salmonidae и Centrarchidae избегают низких концентраций кислорода. У чавычи такую реакцию вызывает концентрация О2 4,5 мг/л, у кижуча — 6 мг/л, у ушастого окуня — 1,5 мг/л. Эти поведенческие реакции показывают, что рыбы, по-видимому, улавливают изменения в концентрации кислорода даже тогда, когда она еще значительно выше того уровня, при котором возникает первичная реакция на гипоксию — усиление дыхания [216].
Легкие. Все типы легких, предназначенных для дыхания воздухом, имеют увлажненную поверхность, через которую диффундируют кислород и двуокись углерода и с которой может испаряться влага; поэтому легкие должны быть защищены от высыхания.
Диффузионные легкие. Многие паукообразные — пауки и скорпионы — имеют легкие в виде полости, открывающейся наружу дыхальцем и содержащей ряд складок с системой трубочек, которые служат для аэрации крови. Диффузионные легкие лучше всего изучены у легочных улиток, у которых функции легкого выполняет видоизмененная мантийная полость; она сообщается с внешней средой через пневмостом, который может открываться и закрываться в соответствии с потребностью в кислороде. Диффузия обеспечивает поступление необходимого кислорода даже при градиенте 'о2 I 2 мм рт. ст., так как диффузионная поверхность сравнительно велика, а уровень обмена невысок. У таких брюхоногих моллюсков, как Lirnax, Helix и Arion, пневмостом открывается при накоплении СО2; при 3 5% СО2 пневмостом остается открытым. anorbts поднимается на поверхность для пополнения запасов ислорода, когда содержание О2 в легких падает до 1—4%; Lum-паеа делает то же самое, когда в легких остается 6—13% О2. Во время пребывания под водой кислород расходуется значительно ыстрее, чем накапливается двуокись углерода, которая, вероятно, выделяется через покровы тела. При высокой наружной концентрации кислорода животное дольше остается под водой [ПО].
368
Глава 5
Плавательные пузыри костистых рыб и легкие двоякодышащих. Существует два типа газовых пузырей: открытые у открытопузыр-ных костистых рыб и закрытые у закрытопузырных. Открытопу-зырные рыбы могут заглатывать в пузырь воздух; кроме того, и те и другие рыбы обладают способностью выделять в полость пузыря газ. Газовый (плавательный) пузырь выполняет в первую очередь гидростатическую функцию, но у некоторых рыб он содержит много кислорода, который может быть использован в условиях гипоксии. Механизм секреции газов обсуждается на стр. 415. У двоякодышащих рыб легкие отходят от брюшной стороны глотки; рыба дышит легкими во время длительного пребывания вне воды. Увеличение РСО2в воде вызывает остановку жаберного дыхания; этот эффект снимается атропином. Поскольку при дыхании легкими СО2 такой реакции не вызывает, можно думать, что чувствительные к СО2 рецепторы находятся в области жабр [137]. Protopterus в состоянии покоя в аэрированной воде использует как жабры, так и легкие; большая часть СО2 выходит через кожу и жабры. Повышение концентрации растворенной СО2 снижает жаберное и стимулирует легочное дыхание [137].
Вентиляция легких. Возможно, что легкие первоначально возникли у примитивных рыб и лишь позднее превратились в плавательные пузыри; однако они сохранились у представителей боковой ветви — двоякодышащих рыб — и были также у кистеперых рыб, от которых произошли амфибии. Двоякодышащие обладают «ротовым насосом», и поэтому выдох не связан у них с движением ребер. По-видимому, воздушное дыхание у наземных позвоночных ведет свое начало от функции «ротового насоса» водных форм; этот насос служил первичным механизмом принудительного орошения жабр, затем дыхательных мешков и, наконец, легких. Активная легочная вентиляция возникла сравнительно недавно. У ряда примитивных хвостатых амфибий легкие имеют гладкую внутреннюю поверхность; у большинства земноводных и пресмыкающихся они разделены перегородками, а у птиц и млекопитающих имеют альвеолярное строение. У лягушки при вентиляции воздух проходит через ноздри, голосовую щель и нижнюю часть ротовой полости. Внутрилегочное давление постоянно. Вентиляция через ротовое отверстие происходит независимо, однако она сказывается на объеме легких. Стенки легких многих пресмыкающихся и земноводных содержат гладкую мускулатуру, сокращение которой создает тонус, необходимый для работы грудного и ротового «насосов». У лягушки гладкая мускулатура легких может помогать при выдохе, а у одной японской жабы изолированные легкие поддерживают самопроизвольный ритм с частотой 10—20 сокращений в 1 ч [119]. Легкое жабы сокращается при стимуляции симпатических нервов и расслабляется при раздражении вагуса [186].
Существует два типа вентиляции: 1) за счет положительного давления, когда воздух нагнетается в легкие либо заглатыванием,
Кислород, дыхание и метаболизм
369
либо движениями ротовой полости (как у лягушки), и 2) путем создания отрицательного давления, когда воздух засасывается в результате расширения окололегочного пространства (как у млекопитающих) .
При нормальном дыхании (эупноэ) у млекопитающих вдох производится активно, а выдох — в основном пассивно, за исключением усиленного выдоха; однако у некоторых животных — птиц и черепах — обе фазы осуществляются активно за счет сокращения мышц. У ящериц в дыхательных движениях участвуют как ротовая полость, так и грудная клетка, а поглощение кислорода (как и дыхание) может быть периодическим. Легочная вентиляция у ящериц остается постоянной при уменьшении концентрации Ог до 10%, а затем снижается. СО2 стимулирует дыхание, особенно при гипоксии [158а]. У водных черепах, помимо легочного и глоточного дыхания, имеется водное дыхание, осуществляемое через кожу и клоаку. Вентиляция через ротовую полость служит в основном для улавливания запахов. Легочную вентиляцию обеспечивают сокращения мышц живота, груди и конечностей; как вдох, так и выдох происходят активно [66]. Если черепаха дышит газовой смесью, содержащей менее 2% О2, вентиляция усиливается, вероятно, под действием вагуса [62].
У пресмыкающихся (Caiman) и земноводных (Xenoptis) наблюдаются периодические вспышки дыхательной активности. У Cai
man продолжительность периодов вентиляции, интервалы между ними и число дыхательных движений в период активности сильно варьируют [156]. У Xenoptis в этот период скорость кровотока в кожно-легочной артерии достигает максимума, в то время как общий кровоток остается относительно неизменным, а давление крови падает; следовательно, здесь возможна дыхательная вазодилятация. Подобные изменения помогают обеспечить относительно стабильное поглощение кислорода при периодическом дыхании
Некоторые птицы используют дыхательную систему для охлаждения тела. При дыхании холодным сухим воздухом большая часть его проходит через легкие, так что потери тепла невелики. Если же воздух горячий и влажный, то основной функцией дыхания становится охлаждение, и лишь небольшая часть вдыхаемого воздуха проходит через легочные пути. Учащенное дыхание может приводить к гипокапнии и как следствие к алкалозу. У птиц имеются о ширные воздушные мешки, в которых нет дыхательного эпителия, но объем которых в 3—4 раза превышает объем легких; это обеспечивает возможность двустороннего продувания легких, так что газообмен может происходить как при вдохе, так и при выдохе (рис. 5-11). Анализ содержания О2 и СО2 в легких и воздушных мешках у гусей показал, что в грудных и брюшных мешках конденсация кислорода выше, чем в выдыхаемом воздухе [36].
Анализ содержания О2 и СО2 в легких и
24-1322
37©
Глава 5
Рр. , мм рт. ст. Pqq^ мм Рт. ст.
, Вдыхаемый воздух 145 0
Конечный выдыхаемый воздух 100 35
Воздушные ( Грудные и брюшные 115 28
мешки ( Межключичные 100 35
Во время полета дыхание может усиливаться благодаря синхронизации дыхательных движений со взмахами крыльев; у птиц величиной с голубя и крупнее эти движения синхронизированы. Потеря
Вдыхаемый газ Ро2=1^ ^Рсог=в
Нежключичный и передний, грудной мешки
Газообмен
Задний грудной и брюшной мешки
Артериальная кровь Pog =85 Рсаг=35
Смешанная венозная кровь
Po2-WO
Вдох
Pcoz^s
Рог =115
РСО2=23
Выдыхаемый газ Po2=1OO f| PCO2~3S
Ро2=Ю0
People
Выдох
P02-115
PCD?'™
^Газообмен
Артериальная
Ss. кровь Рог=в5 рсог=в5
ч. Смешанная Зе* лозная кровь
Рис. 5-11. Схема дыхательных путей гуся, показывающая вероятные направления потоков газа при вдохе и выдохе [36].
1 — главный бронх, 2 — мезобронх, 3 — дорзальные бронхи, 4 — параброихи, 5 — вентральные бронхи. На схеме указаны средние величины парциальных давлений в мм рт. ст.
тепла в полете может увеличиваться в 5 раз [200, 201]. С помощью телеметрии было установлено, что у летящей утки на один дыхательный цикл приходятся два взмаха крыльев, а интенсивность дыхания возрастает в 7 раз [141].
Ныряющие млекопитающие, находясь на поверхности, дышат весьма интенсивно, а при погружении животного под воду легкие частично спадаются. У гринды в период между вдохами в легких остается лишь 5,6 л газа, объем вдыхаемого воздуха составляет 39,5 л, а емкость легких — 45,1 л [160]. Выдох происходит у китов очень быстро (за 0,5 с) за счет упругости тканей, однако при вдохе давление в пищеводе на 200 мм рт. ст. ниже атмосферного.
Кислород, дыхание и метаболизм'371
Дыхательный центр у млекопитающих состоит из сети само-вОзбуждающихся нейронов, активность которых видоизменяется под влиянием сенсорных сигналов. Он расположен между средним и задним мозгом вентрально на уровне варолиева моста. В дыхательном центре кошки нейроны, ответственные за вдох и выдох, перемешаны, и перерезка мозга около средней линии вызывает остановку дыхания, хотя и не выключает активность клеток. Активность нейронов сохраняется также при блокаде вагусной и проприоцептивной афферентной импульсации [176]. Наибольшее влияние на дыхательный центр оказывает концентрация СО2 в крови, притекающей к центру. Кроме того, хеморецепторы каротидного синуса чувствительны к недостатку кислорода (к РО1 ниже 100 мм рт. ст. у кошки и человека, ниже 60 мм рт. ст. у собаки) и к относительно высокому уровню СО2. Каротидные и аортальные тельца реагируют на гипоксию (например, при произвольной задержке дыхания) и чувствительны к цианиду [47].
Хеморецепторы каротидных телец весьма чувствительны к ацетилхолину, а вызванные ацетилхолином нервные импульсы блокируются атропином, гексаметонием и тубокурарином. При гипоксии из каротидных телец высвобождается ацетилхолин, а клетки гломуса имеют синаптические связи с чувствительными нервными окончаниями. По-видимому, при низких величинах Pq^, высоких величинах РСО2 и кислой реакции нейроны гломуса выделяют ацетилхолин, который в свою очередь возбуждает нервные окончания [55].
У кур имеются чувствительные к СО2 рецепторы в легких; их афферентные волокна идут к блуждающим нервам. При попадании в легкие газа с 15% СО2 уже через 0,5 с отмечается стимуляция дыхания [163]. У некоторых птиц — домового воробья, скворца, кряквы — двуокись углерода стимулирует дыхание, в то время как у некоторых пород домашних уток она вызывает апноэ, вероятно в результате тормозных рефлексов с хеморецепторов носоглотки. У ныряющих птиц и млекопитающих дыхательный центр менее чувствителен к СО2, чем у неныряющих.
У птиц, млекопитающих и находящихся в тепле рептилий вдыхаемый воздух нагревается и увлажняется. При выдохе воздух охлаждается и часть воды конденсируется в дыхательных путях. У животных, для которых существенна экономия воды, имеется механизм водного обмена, который удерживает влагу дыхательных газов, если разность между температурой окружающего воздуха и температурой тела велика. Кактусовый вьюрок сохраняет 75%, кенгуровая крыса 88% влаги, переходящей в дыхательных путях во вдыхаемый воздух. При температуре воздуха 30 °C и температуре тела 42 С игуана выдыхает воздух, нагретый до 35 °C, и удерживает при этом 31 % добавленной к нему воды. Все эти животные имеют узкие, сильно разветвленные дыхательные пути, образующие большую поверхность для конденсации [155, 178].
24*
372
Глава 5
Трахеи. При трахейном дыхании воздух попадает непосредственно к потребляющим кислород клеткам без участия крови. Трахеи характерны для насекомых, первичнотрахейных, некоторых пауков, двупарноногих и губоногих. Стенка трахеи состоит из эпителия, который является продолжением гиподермы, и выстилающей его изнутри кутикулы; в кутикуле имеются опорные утолщения (те-иидии). Как правило, трахеи открываются наружу дыхальцами, но иногда воздух поступает в трахеи через жабры. Если дыхальце одно, то оно служит как для вдоха, так и для выдоха, но чаще их бывает много, и тогда воздух входит через одни дыхальца (обычно передние) и выходит через другие. Трахеи обильно ветвятся и оканчиваются мельчайшими трахеолами, которые могут быть заполнены жидкостью. Каждая трахеола окружена трахеальной клеткой, действующей наподобие клапана. Трахеолы могут проникать в клетки, например в мышечные волокна, и таким образом обеспечивать доступ кислорода непосредственно к митохондриям. У ряда насекомых имеются воздушные мешки, которые поддерживают давление в трахеях.
У некоторых насекомых, например у блох, дыхальца всегда открыты. Как правило, однако, вентиляция осуществляется при помощи мышечных сокращений, регулируемых сегментарными ганглиями. Взаимодействие между ганглиями может быть достаточно сложным. Так, у Periplaneta брюшные ганглии, будучи изолированы, могут поддерживать более быстрый ритм дыхания, чем тогда, когда они находятся под контролем грудных ганглиев. Если эти последние обработать двуокисью углерода, ритм дыхания ускорится. У личинок стрекоз выдох происходит при нервной активации дорзовентральных мышц. Другие нервы активируют поперечные мышцы, осуществляющие вдох. Частота спайков достигает максимума в момент выдоха [92].
У большинства насекомых дыхальца могут открываться либо независимо, либо согласованно с дыханием. У взрослой мухи Phormia они снабжены клапанами, а у личинок фиксированы неподвижно [30, 31]. При низких концентрациях СО2 дыхальца остаются открытыми, при более высоких концентрациях начинается активная вентиляция; очень большие концентрации СО2 (25%) вызывают наркоз. При снижении уровня О2 работа вентилирующих мышц усиливается — вероятно, благодаря импульсам, поступающим из центральной нервной системы. У взрослых стрекоз ритм работы дыхальца обычно не всегда совпадает с дыхательными движениями, однако у трех видов СО2 вызывает синхронизацию. Гипоксия увеличивает чувствительность дыхалец к двуокиси углерода, а высокий уровень О2, наоборот, повышает порог их реакции на СО2. Помимо того что чувствительностью к СО2 обладают дыхальца и иногда центральные ганглии, у ряда насекомых (в том числе у медоносных пчел) имеются рецепторы СО2 в антеннах
Кислород, дыхание и метаболизм
373
Г1231. При низком уровне Ог или высоком уровне СО2 пчелы стремятся обеспечить приток свежего воздуха в улей.
Непрерывная запись дыхания некоторых насекомых, таких, как личинка мухи Phormia и куколка ночной бабочки Hyalophora, показала, что отдача СО2 происходит периодически («выбросы»), а поглощение кислорода более или менее.постоянно. У взрослой
Рис. 5-12. Поглощение кислорода и выделение углекислоты куколкой Hyalophora cecropia [180].
жужелицы период выброса длится 30 с, у куколки Sphinx — 24 ч, у куколки Hyalophora cecropia при 25 °C — 7,3 ч, а при 1 °C — 3— 4 дня. При низком уровне кислорода или высоком уровне СО2 эта периодичность исчезает и дыхальца всегда остаются открытыми. Если искусственно поддерживать дыхальца открытыми с помощью тонких трубочек, выбросы СО2 прекращаются. По-видимому, в период между выбросами СО2 кислород входит внутрь быстрее, чем выходит СО2; кислород поглощается тканями, и в трахее создается небольшое отрицательное давление. Когда дыхальце открывается, РСоа падает и связанная СО2 освобождается из тканевых жидкостей [31, 179, 180]. У куколки Н. cecropia при 20 °C интервалы между выбросами длятся от 4 до 17 ч и относительно постоянны у каждой особи. Это периодическое выведение СО2 уменьшает потерю воды организмом [112] (рис. 5-12).
374
Глава 5
У водных насекомых встречаются разнообразные адаптации, связанные с дыханием. Некоторые личинки делают отверстия в стебельках водных растений и используют содержащийся в них газ. Другие насекомые, например Notonecta и Dytiscus, удерживают пузырек воздуха с помощью несмачиваемых волосков, и дыхальца открываются в этот пузырек. По мере использования кислорода новые порции его диффундируют в пузырек из воды; что касается азота, то он переходит в воду, когда его парциальное давление в пузырьке становится выше, чем в воде. Таким образом пузырек воздуха может пропустить через себя объем кислорода, во много раз превышающий его собственный объем, и без смены в течение многих часов обеспечивать потребности насекомого в кислороде. У других водных Hemiptera и Coleoptera имеется пластрон из волосков, плотность расположения которых достигает 2,5-•108 на 1 см2. Этот пластрон не смачивается водой и удерживает тонкий слой газа, через который диффундирует кислород, так что получается своего рода постоянная искусственная жабра. У некоторых водных личинок пластрон образуют дыхальца, видоизмененные в жабры. Насекомым, обладающим пластроном, не приходится выходить на поверхность, хотя они и дышат воздухом [199]. В яйцах некоторых мух, личинки которых живут в воде, воздух удерживается между вертикальными колонками, расположенными во внутренней части хориона. При погружении яйца в воду создается большая поверхность раздела воздух/вода; такого рода пластрон хорошо сопротивляется сжатию и обеспечивает диффузию кислорода [83].
Вспомогательное внешнее дыхание. Выше были приведены примеры животных, способных изменять способ дыхания при гипоксии. Существует предположение, что такие дополнительные формы дыхания сыграли решающую роль в эволюции позвоночных при переходе от водной жизни к наземной. Извлеченный из воды угорь вначале использует кислород, накопленный в плавательном пузыре, а затем начинает получать все больше кислорода через кожу и, кроме того, дышит воздухом, проходящим через жабры. На воздухе жабры обеспечивают лишь одну треть, а в воде — от 85 до 90% общего поглощения кислорода. При переходе из воды на воздух интенсивность метаболизма уменьшается вдвое и ритм сердца замедляется. После нескольких часов пребывания на воздухе создается кислородная задолженность и содержание молочной кислоты в крови может возрастать с 10 до 120 мг на 100 мл. Активное дыхание воздухом резко усиливается при снижении уровня Оз; СО2 не стимулирует эту активность, а, наоборот, может подавлять ее. Все эти адаптации позволяют угрю выживать вне воды в течение целого дня [22].
Рыба Gillichthys имеет богатую сосудами ротоглотку. Когда содержание кислорода в воде снижается, она заглатывает воздух. В смеси N2 и СО2 Gillichthys чаще всплывает на поверхность, чем
Кислород, дыхание и метаболизм
375
в чистом азоте [199а]. Точно так же и электрический угорь Electrophorus чаще заглатывает ртом воздух при повышении уровня СО2 дЛИ снижении уровня О2 [104]. Другая болотная рыба, Symbran-chus, во время пребывания на воздухе периодически раздувает жаберную камеру и таким образом насыщает кровь кислородом; содержание СО2 в артериальной крови при воздушном дыхании возрастает, а при водном снижается [104]. Amia при повышении температуры или собственной активности усиленно накачивает воздух в воздушный мешок; при 30 °C из воздуха в организм поступает в три раза больше кислорода, чем из воды. Двуокись углерода выводится главным образом через жабры; при снижении РО2 в воде активируется дыхание воздухом, а жабры используются в меньшей степени [106].
У двоякодышащей рыбы Neoceratodus в гипоксической воде усиливается как легочное, так и жаберное дыхание; при повышении уровня СО2 роль жабр в дыхании уменьшается, а дыхание воздухом усиливается. Хеморецепторы находятся на наружной стороне жабр или в выносящих жаберных сосудах. Гипоксия стимулирует вентиляцию как легких, так и жабр; гиперкапния усиливает вентиляцию жабр в большей степени, чем легких, а при сочетании гипоксии с гиперкапнией вентиляция легких возрастает, а жабр — снижается [103а]. У южноамериканской двоякодышащей рыбы. Lepidosiren вода, бедная О2 и богатая СО2, вызывает активацию воздушного дыхания [105]. У некоторых африканских сомов оперкулярная и жаберная полости снабжены особыми придаточными камерами для дыхания воздухом. Saccobranchus в обычных условиях получает 41 % необходимого кислорода из воздуха; при снижении Ро3 в воде у животного возрастает роль воздушного дыхания и снижается интенсивность обмена [97а]. Clarias обычно получает 58% кислорода из воздуха, а у рыбы, извлеченной из воды, потребление О2 снижается с 93 до 65 мл/(кг-ч) и 17% всего поглощаемого кислорода проходит через кожу [186а].
У амфибий относительное значение легких, кожи и жабр может быть различным. У лягушек роль легочного дыхания возрастает с повышением температуры, причем это в большей мере касается поглощения кислорода, чем выделения СО2 [73]. Ambystoma ора-сшп поглощает 34% кислорода с помощью легких и слизистой ро-Г91^1ТК\/’ 3 66% —через кожу; через кожу выводится и 80% СО2 [215]. У головастиков, выращенных в бедной кислородом воде, бывают крупные разветвленные жабры; если же вода богата кислородом, жабры имеют малые размеры и тонкие стенки. У Ambystoma выключение жабр не сказывается на потреблении кислорода при концентрации О2 от 21 до 10%, но при содержании кислорода ниже 5% интенсивность дыхания несколько снижается. У клопа Khodnius трахеи могут усиленно прорастать в те части тела, которые хуже снабжаются кислородом, а у водных личинок двукрылых при гипоксии развиваются сильно разветвленные пери-
376
Глава 5
ферические трахеолы. У людей, акклиматизированных к большим высотам, увеличиваются размеры и жизненная емкость легких, содержание гемоглобина в крови и легочная вентиляция. У многих животных при содержании их в атмосфере, бедной кислородом, усиливается синтез гемоглобина (гл. 8).
Факторы, влияющие на потребление кислорода животными
В биологической литературе приводится много данных о потреблении кислорода различными животными, но данные об интенсивности обмена имеют определенный смысл только с учетом тех конкретных условий, при которых они были получены. Потребление кислорода зависит от температуры, времени года и суток, от активности животного, его размеров, стадии жизненного цикла, генетических особенностей, а также от снабжения организма кислородом в предшествующий период.
Активность. Одним из эндогенных факторов, влияющих на потребление кислорода, является мышечная и другая активность. Этот фактор трудно поддается учету. Согласно определению, «основной обмен» — это потребление кислорода при относительном покое организма. У человека интенсивность основного обмена измеряют натощак в состоянии расслабления, но не сна, обычно утром. Когда основной обмен определяют у животных, стараются свести к минимуму их активность затемнением, тишиной и предварительным привыканием к камере, в которой измеряют обмен. Измерения можно производить после введения кураре или наркотиков; однако следует помнить, что мышечный тонус зависит от глубины наркоза. Обычно под обменом подразумевают потребление кислорода, измеренное при возможно меньшей мышечной активности. Если измерения проводятся при мышечной нагрузке, то максимальное потребление кислорода характеризует «активный -обмен». Используя мышечные нагрузки различной величины, можно экстраполировать потребление кислорода на уровень нулевой активности; эту экстраполированную величину называют «стандартным» обменом или «обменом в покое». В табл. 5-1 приведены значения стандартного обмена для различных животных.
Если определить зависимость стандартного и активного обмена от какого-либо фактора среды, например температуры, то различие между двумя кривыми будет характеризовать «физиологический резерв активности» (рис. 5-13). Когда измеряют обе величины при различных парциальных давлениях кислорода, оказывается, что активный обмен остается постоянным лишь до какого-то нижнего предела. Стандартный обмен остается постоянным до более низкого уровня РОа, при котором животное уже неспособно к избыточной активности; при дальнейшем снижении РОз кислорода не хватает даже для поддержания стационарного состояния
Стандартный обмен
Таблица 5-1
Животное Вес тела, r Потребление кислорода, мл/(гч) Температура окружающей среды, °C
Мелкие млекопитающие
Землеройка Sorex Домовая мышь (Mus) Рыжая полевка Marmosa Microdipodops [13] Microdipodops [29] 3,4—3,6 17 21,7 13 15,2 10—14 7—10,6 1,7 2,27 1,44 1,3 2—3 (в активном состоянии) 0,035 (во время спячки) 2,06 5 5
Perognathus longimembris rqql 11,5
pjoj Perognathus crinitus [149a] Perognathus hispidus [210] Peromyscus ermicus [149a] Peromyscus californicus [149a] Liomys salvani [89] Liomys irroratus [89] Heterocephalus [149] Mier ot us Baiomys [89] Бурундук , (Tamias) [210] Gerbillus Cricetus Rattus Cavia Citellus 23,1 39,5 21,5 45,5 43,8 48,1 32 31 72—145 435 280 500 225 0,92 1,25 1,48 1,03 1,07 1,12 0,26 2,65 1,95 1,03 0,80 0,87 0,88 0,76 0,6—0,9
Крупные млекопитающие
Lepus Кролик Кошка [20] Собака Бабуин (Papia) Тюлень [3] Дельфин [3] Свинья Овца Человек Корова Верблюд Слон Кит-бутылконос [3] 1581 2700—3700 3000 7000—20 000 17 000 26 000 170 000 48 000 46800 60 000—71 500 500 000 170 000—330 000 3 700 000 0,96 0,55 0,45 0,36 0,49—0,6 0,59 0,22—0,34 0,35 0,25 0,21—0,24 0,124 0,03—0,04 0,07—0,11 0,144
Летучие мыши
Megachiroptera Synconyctris [11] Nyctimene [11] Eumops [134] Macroderma [134] Paranyctimene [11] 17,5 28,2 57 148 21 1,93 1,43 0,51 0,94 1,38
Продолжение
Животное Вес тела, г Потребление кислорода, мл/(г-ч) ' . Температура окружающей среды, •с
Dobsonia [11] 87 1,26
Pteropus scapulatus [11] 362 0,67
Pteropus poliocephalus [11] 598 0,53
Pousettus 130 0,48
.Microchiroptera
Myotis [159] 1,74
Miniopterus [153] 0,74 При нейт-
ральной
температуре
Miniopterus [153] 2,5 0
Myotis 25 2,2
Noctilio 27 1,2
Desmodus 29,4 1,2
Другие млекопитающие,
в том числе
примитивные
Dasypus 3700 0,27
0,97
Dasypus [68а] 3700 0,2—0,27
Heterohyrax 1292 0,52
Bradypus [68а] 3400 0,13
Dasyuroides [141] 89 0,87
Dasycercus [141] 88 0,52
910 0,45
22,1 1,53
Sminthopsis [43] 14,1 1,32
Aniechinus [43] 36,5 1,0
Antechinus [141] 8,5 1,26
Isodon [43] 880 0,445
Trichosurus [43] 1982 0,315 к
Me gale ia [42] 32 490 0,177
Macropus [42] 4960 0,29
Sarcophilus [141] 5050 0,28
Tachiglossus 2500—3500 0,2—0,25
Ехидна 3800 0,22
Птицы
'Колибри
Selasphorus [127] 3 4,0
Stellula [127] 3 3,9
Calypte anna [127] 5,4 3,8
Calypte costae [127] 3,2 2,9
Archilochus [127] 3,3 3,6—4,3
Eugenes [132] 6,6 2,7 (в покое)
0,1 (при полной 15
неподвижности)
1,18 (при 27
оцепенении)
Lampornis [132] 7,9 2,3
Petagona [131] 19 2,7 (в покое)
0,25 (при 16
оцепенении)
Fulgens 6.6 J 2,7 20
Продолжение
Животное Вес тела, г Потребление кислорода, мл/(г-ч) Температура окружающей среды, °C
Воробьиные П.7 3,28
Ткачик зебровый
Домовый воробей (Passer 25,5 3,53 (днем)
domesticus) [88] 2,34 (ночью)
Junco 18 2,94
Fringilla 24,8 3,3
Zonotrichia 26,4 2,8
Воробей Харриса [46] Другие птицы 33 29,4 4,1
Клест-еловик (Loxia) [46] 3,1
Клест белокрылый (Loxia) 29,8 2,8
[46]
Иволга [175] 2,4
Волнистый попугайчик 30—40 4,5 (в покое) Т
[202] 21,9 (в активном
Воскоклювый ткачик состоянии)
(Estrilda) [130] 3,7
Hesperiphona 60 2,5
Perisoreus 71,2 1,75
Козодой Chordeiles 75 1,1
Scardafella [142] 42 1,И
32 1,3
Phalaenoptilus [128] 49,5 0,72
Козодой Eurostopodus [44] 88 0,83
Калифорнийская куропатка 150 (самец) 0,96
(Lophortyx) 127 (самка) 1,05
Перепел (Coturnix) 97 2,06
Голубь (Columba) 150 0,98
Курица 2000 0,43
Эму [37] 38 300 0,023
Нанду [37] 21700 0,031
Рептилии
Сцинк Lygosoma [87] 1,5 0,295 30
0,392 40
A noils 30 0,5 40
3—6 0 117 20
Lacerta Scelophorus 6,3 0,5—5 30 0’245 0,12 0,55 19 95
Gerrhonotus 20
Crotaphytus [45] 30 0,298 0,1 35 20
Dipsosaurus [45] 34—94 0,2 0,05 0,06 (в покое) 30 20
Iguana [152] 369—1200 20
0,25 (в активном -
Amphibolurus (Agamidae) [14] 373 состоянии) 0,14 28
Alligator 49 000 0,079 0,031 0,08 28
Черепаха Chrysemys 100—300 18
Черепаха Pseudemys 150—350 24
Продолжение
Животное Вес тела, г Потребление кислорода, мл/(гч) Т емпература окружающей среды, °C
Южноамериканский удав 3270 0,018 20
[65]
Natrix 84 0,07 16
Python 5000 0,007 18
Eunectes 11 300 0,021 20
Crotalus 2000—5000 0,0078 17
Амфибии
Саламандра Ambystoma 13,4 0,075 14
Лягушка Acris [49] 0,035 (в апреле) 15
0,100 (в мае), 15
Rana 32 0,055 15
Bufo 61 0,055 15
Necturus 129 0,012 15
Amphiuma 213 0,007 15
Головастики Rana 0,065 20
Рыбы
Илистый прыгун (Ре- 10—15 0,084 (в морской]
riophthalrnus [69] воде) -
0,065 (в пресной
воде)
Серебряный карась [18] 90 0,042 20
Голец [18] 112 0,205 20
64 0,150 15
Чукучан [18] 70 0,109 15
Коричневый сомик [18] 147 0,092 20
Карп [18] 146 0,067 20
Сомик Ictalurus 43—127 0,07
Антарктические рыбы:
Notothenia [170] 200 0,056 0
Chaenocephalus [170] 0,063 0
Trematomus [170] 0,059 0
Lampetra 37 0,098 16
Личинка Ichthyornyzon [80] 0,09 22
0,022 9,5
Gadus 1000 0,03 3
Anguilla 40 0,088 17
Carassius 33 0,077 15
Cyprinus 74 0,09 14
T inca 30 0,067 18
Squalus 440 0,038 15
Scyliorhinus 149 0,060 14
Squalus 0,042
Mugil 0,065—0,1
Lepomis 30 0,06 20
Girella 70 0,131 20
Членистоногие
Насекомые и клещи
Chironornus [166]
личинка 0,38-10-3 4,75 30
предкуколка 0,44-10"3 4,7 30
куколка 0,34-IO"3 5,5 30
Продолжение
Животное Вес тела, г Потребление кислорода, мл/(г-ч) Температура окружающей среды, °C
Collembola (разные виды) 2,14-7,45-Ю-3 0,096 18
[225]
Tetrodentophora [225] 85—140-10-6 0,681 18
Lepisma [225] 0,01—0,013 0,141 18
Клещ Eugetes (Oribatidae) 0,32-Ю-3 0,161 18
[57] 0,182 12
Личинка Tenebrio
Пауки
Achaearanea [5] 0,073 0,356
Phidiphor [5] 0,337 0,147
Phidippus [5] 0,568 0,093
Filistata [5] 0,571 0,05
Lycosa [5] 0,970 0,097
Равноногие
Porcellio [218] 0,082 0,096
Armadillidium [218] . 0,085 0,076
Syspastus [218] 0,120 0,012
Другие ракообразные
Orcomella 0,176 17
Еса pugilator [195] 2,39 0,08 28
Еса pugilator и Еса pug- 0,04 (на воздухе)
пах [195]
Еса pugilator [195] 0,06 (в воде)
Еса pug пах [195] 0,10 (в воде)
Orconectes 126] 14 0,126—0,15
Callinectes 115] 0,097
Carcinus [115] 0,094
Libinia [115] 0,037
Maja [115] 0,054
Homarus americanus [196] 189 0,025 10
iHomarus vulgaris [196] 352 0,04 15
Pachygrapsus 10 0,035 16
Balanus 15 0,11 12
Emerita о,н 20
Talorchestia [225] 0,27 0,176
Моллюски
Ancylus [21] 0,02 0,177 16
Lymnaea [21] 0 24
Mytilus 0 076 15
Octopus 0*28 25
Pecten Л А7
Anodonta V О/ 0,002 10
Иглокожие
Asterias 10 Л 4
Parastichopus 50 0 006
Pt er aster [108] 0 0105 11
Pisaster [108] 0,0105 И
Кольчатые черви
Clymenella torquata [144] 0,05 0 294
Clymenella mucosa [144] 0,109 0*265
Clymenella zonalis [144] 0,023 0,324
382
Глава 5
Продолжение
Животное Вес тела, г Потребление кислорода, мл/(гч) Температура окружающей среды, °C
Eupolymnia [39] 3 0,09
Thelepus [39] 3 0,06
Lumbricus [225] 1 0,065
Arenicola 1 0,062
Другие черви
Schistocephalus (Cestoda) 0,01 з.о 20
[40]
Ochestoma (Echiuroidea) 0,069
Boneilia (Echiuroidea) 0,048—0,056
Eur echis 0,012
Ascaris 0,50
Простейшие
Bresslaua 0,015 мкл 7,3
Tetrahymena 2,85
Paramecium 0,6 мкл 1,3
Pelomyxa 10 мкл 0,5
организма. В покое и в активном состоянии биохимические пути обмена могут быть несколько различными [63].
У человека потребление кислорода при физической нагрузке может увеличиваться в 15—20 раз по сравнению с уровнем покоя, а у насекомых во время полета — в 50—200 раз; у форели обмен в период активности в 4 раза превышает величину стандартного обмена при оптимальной температуре. Установлено, что пчелы и бабочки при длительном полете потребляют 90 л О2 на 1 кг веса тела в 1 ч, т. е. объем О2, поглощаемого за 1 мин, в 15 раз больше объема их собственного тела [121]. Имеются и другие данные по насекомым, например:
Потребление кислорода, мл/(гч)
в покое во время полета
Бабочки Drosophila Schistocerca 0,4—0,7 100,8 0,63 40—100 1260 10—30
У ночной бабочки Hyalophora cecropia в активном состоянии потребление кислорода, связанное с теплопродукцией, при понижении температуры воздуха возрастает; если же насекомое находится в состоянии покоя, то потребление кислорода при охлаждении падает [76]. Колибри во время полета потребляют в 4—6 раз больше кислорода, чем в состоянии покоя, а в покое — в 6 раз
Кислород, дыхание и. метаболизм'383
больше, чем при оцепенении. Это видно из приведенных ниже данных, полученных при одинаковой, нейтральной, температуре [127, 132]: ____________________________________________
Потребление кислорода, мл/(г ч)
во время полета в покое при оцепенении
Calypte Selasphorus 42,4 85 10 14 0,17
Потребление кислорода молодью серебряного карася в период актив-и в условиях стандартного обмена (II) при различных темпер ату-рах [63].
ижняя крива я (III) "оказывает разность между активным и стандартным обменом, которая соответствует затрате энергии при физической нагрузке.
Рис. 5-13, кости (/)
Сходные различия между потреблением кислорода во время ак-вности и в покое обнаружены и у более крупных птиц:
384
Глава 5
Потребление 02, млЦг-ч}
Волнистый попугайчик
в покое
в полете
Г олубь
в покое
в полете
4,5—3,3
21,9
0,89
11,9
У ряда млекопитающих (весящих от 21 г до 18 кг) потребление кислорода линейно возрастает с увеличением скорости бега, но в неодинаковой степени: минимальная затрата энергии на преодоление данного расстояния у мелких форм выше, чем у крупных животных [193]. У серебряного карася эффективность использования кислорода возрастает с увеличением скорости плавания согласно уравнению
£=0,031Р»в5.
Потребление кислорода не всегда увеличивается пропорционально мышечной активности. Животные значительно различаются по своей способности использовать энергию, доставляемую анаэробным обменом и накапливать при этом кислородную задолженность. У Iguana анаэробный гликолиз обеспечивает % энергии, необходимой для активности [152]. У человека доля мышечного метаболизма во всём обмене энергии составляет в покое 20%, а при физической нагрузке возрастает до 80%.
На интенсивность обмена влияет не только мышечная, но и другая активность, например функция половой системы в период размножения. Мидия потребляет в июне и июле вдвое больше кислорода, чем зимой. У рыб при возбуждении потребление О2 может значительно возрастать даже без заметного усиления мышечной активности. При более быстром плавании характер движений рыбы может изменяться таким образом, чтобы при возросшей скорости сохранился прежний уровень потребления кислорода [152]. Опыты с ингибиторами обмена показали, что в покое и в активном состоянии, возможно, действуют различные метаболические пути. Например, азид не влияет на метаболизм покоя в мышечной и нервной тканях лягушки, но тормозит обмен, связанньш с активностью. У Gammarus температурный коэффициент (Qio) для стандартного обмена (т. е. при «нулевой» активности) равен 1,4, тогда как для обмена при минимальной активности он возрастает до 2,7 [74] (определение Qio дано в гл. 9).
У высокоактивных рыб, таких, как этеостома, интенсивность обмена в несколько раз выше, чем у малоподвижных видов. Это различие обнаруживается и на тканевом уровне: у активных рыб — менхэдена и кефали — потребление кислорода тканью головного мозга in vitro составляет от 11 до 14 мл/(кг-мин), у менее активных — морского окуня и крокера — от 7,7 до 9,7 и, наконец, у сов
Кислород, дыхание и метаболизм'385
сем малоподвижных — камбалы и опсануса — от 5,6 до 6,9 мл/(кг-• мин) [206].
Температура и время года. Влияние температуры на обмен веществ подробно обсуждается в гл. 9. Как правило, у гомойотерм-ных животных уровень обмена минимален при нейтральной температуре и потребление кислорода растет как при перегревании, так и при охлаждении организма. У большинства пойкилотермных организмов интенсивность обмена растет или снижается вместе с изменением температуры тела, причем Qio в физиологическом диапазоне температур составляет около 2,5. У Iguana Qi0 для стандартного обмена равен 2,3, а для обмена после периода активности— 1,8 [152]. Интенсивность стандартного обмена у рыб постепенно повышается с температурой вплоть до летального уровня. Обмен в активном состоянии может либо повышаться с температурой до определенного уровня, а затем оставаться постоянным, либо проходить через максимальное значение при температуре, выше которой рыба уже не способна совершать интенсивную мышечную работу (рис. 5-14,Л). Разность между уровнями обмена в покое и в активном состоянии — физиологический резерв активности — возрастает с повышением температуры до некоторого максимума, а затем падает. Как резерв, так и сама активность достигают максимума приблизительно при одной и той же температуре (рис. 5-14, Б) [26]. Водные пойкилотермные организмы, активные в широком диапазоне температур, обладают способностью к акклимации: у особей, адаптированных к холоду, обмен при одной и той же температуре более интенсивен, чем у тех, которые адаптировались к теплу, хотя у первых в холодной воде уровень обмена все-таки ниже, чем у вторых в теплой воде. Такая адаптация позволяет животному компенсировать эффект сезонных изменений температуры или влияние географической широты (см. гл. 9).
Кумжа наиболее активна при 15, карп — при 25 °C; для сомиков такого максимума не обнаружено [18]. У высокоактивных костистых рыб хорошо развит механизм температурной компенсации; его нет у миксин, но на холоде они впадают в летаргическое состояние [154]. У двух пресноводных улиток потребление кислорода в августе и сентябре на 40% ниже, чем в июне [21]. При малой солености воды уровень обмена у краба Hemigrapsus в летний период выше, чем зимой; в условиях высокой солености такого различия нет или же в зимний период обмен даже слегка усиливается [47]. У Gammarus oceanicus Qlo равен 2,4 для интенсивности обмена при минимальной активности и 1,4 — для стандартного обмена; последняя величина характерна также для митохондрий этого животного [74].
При высоком содержании СО2 в воде потребление кислорода многими водными животными уменьшается. У гольца такое влияние СО2 на обмен в активном состоянии при 10 °C выражено 25—1339
Рис. 5-14.
А Влияние температуры на стандартный обмен (потребление кислорода) у некоторых видов рыв —особей весом 100 г. Б. Физиологический резерв активности (разность меЗД стандартным и активным обменом) при различной температуре у пресноводных рыб [181«
Кислород, дыхание и метаболизм 387
сильнее, чем при 20 °C, а у подкаменщика этот эффект одинаков при обеих температурах [16].
Соленость. В группе сходных форм пресноводные виды обычно потребляют больше кислорода, чем морские. В слегка солоноватой воде эвригалинные организмы (например, Mytilus edulis) потребляют больше кислорода, чем в морской воде, а стеногалинные (например, Asterias) — меньше. У морских креветок потребление кислорода достигает наибольшей величины в четырехкратно разведенной морской воде; креветки, обитающие в солоноватой воде, наиболее активно потребляют кислород при помещении в пресную воду. У Artemia интенсивность обмена в морской воде на 25% выше, чем в концентрированном солевом растворе [68]. У особей Artemia, выращенных в слабосоленой воде, потребление кислорода может быть в два раза выше, чем у особей, выращенных в морской воде [68]. После переноса из морской воды в менее соленую воду потребление кислорода возрастало у Carcinus (на 33% в 50%-ной морской воде), Callinectes (на 53% в такой же воде), Eriphia, Cammarus duebeni, Uca, Hemigrapsus и Potamon [115]; у Maja и Libinia оно снижалось (на 33% в 50%-ной морской воде) [115]. У Ocypode, Palaemonetes и Metapenaeus потребление Ог минимально в солоноватой воде, тогда как у Eriocheir оно одинаково при всех уровнях солености. У Mercenaria и Modiolus потребление кислорода жабрами в малосоленой воде возрастает, у Dreissensia снижается, а у Crassostrea и Mytilus не зависит от солености воды. Как правило, интенсивность обмена у эвригалинных видов при уменьшении солености повышается, хотя есть и исключения.
Фотопериод и физиологические ритмы. У многих животных потребление кислорода подчинено суточному или лунному ритму, который сохраняется и в лабораторных условиях при поддержании освещенности, температуры и давления на постоянном уровне. Суточные и другие ритмы рассмотрены в гл. 10.
У Uca потребление кислорода в 6 часов утра на 3—50% выше, чем в 18 часов, и в соответствии с лунным циклом оно на 30— 50% выше во время верхнего или нижнего прохождения Луны через меридиан, чем тогда, когда Луна находится у горизонта [211]. У одного литорального равноногого рачка потребление Ог выше во время прилива, чем во время отлива [218]. У Diadema, обитающей на умеренной глубине, не обнаружено суточных колебаний обмена [1J8J.
Фотопериод тоже может влиять на обмен. При 8-часовом фотопериоде Pachygrapsus потребляет на 55% больше кислорода, чем при 16-часовом [47]. При 9-часовом периоде освещенности потребление кислорода у ушастого окуня выше, чем при 15-часовом, если температура воды не ниже 10 °C. У ночного млекопитающего — крысы активность сукцинатоксидазы в печени ночью на 40% выше, чем днем, а также выше отношение P/О [68а].
25*
388
Глава 5
Гормоны. Обмен веществ очень часто зависит от пола животного, но эта зависимость не всегда одинакова. У мужчин в любом возрасте интенсивность метаболизма выше, чем у женщин, однако это различие оказывается менее выраженным, если учитывать вес тела за вычетом жира. Самец комнатной мухи (Musca) потребляет больше кислорода, чем самка, но в период размножения разница уменьшается. Потребление Ог у взрослых самцов тутового шелкопряда в 3 раза выше, чем у самок, однако при низких температурах это различие исчезает. Самцы вощинной моли (Galleria) на стадии ранней куколки потребляют больше кислорода, чем самки, а в дальнейшем создается обратное соотношение. У Trilo-bium и у некоторых литоральных равноногих рачков интенсивность обмена у самок выше, чем у самцов. Мышцы самца таракана потребляют in vitro в 5 раз больше Ог, чем мышцы самки [15].
Влияние физических факторов на метаболизм во многих случаях опосредуется через гормоны. Синусовая железа ракообразных может регулировать обмен косвенным путем. Удаление глазных стебельков у крабов повышает потребление кислорода, а последующее введение экстракта из этих стебельков вновь снижает интенсивность обмена. У ракообразных потребление кислорода возрастает перед линькой. Удаление corpora allata у взрослых мух Calliphora снижает потребление Ог; после реимплантации этих желез интенсивность обмена снова повышается [198].
Экстракты щитовидной железы усиливают обмен у амфибий, но у рыб и круглоротых (миног) эта железа, по-видимому, не влияет на метаболическую активность. Стероиды половых желез, возможно, повышают интенсивность обмена у рыб. У ящериц (Eumeces) инъекции тироксина, производимые в течение 3 недель, приводили к повышенному потреблению Ог немышечными тканями, особенно печенью и головным мозгом.
Развитие. Стадия развития или жизненного цикла может сама по себе влиять на обмен, независимо от размеров тела. Как правил®, с возрастом уровень обмена понижается, но на эмбриональной стадии интенсивность дыхания может быть невысокой, а максимум может достигаться на сравнительно поздней стадии дальнейшего развития. Утробный плод млекопитающего потребляет меньше кислорода на единицу веса, чем новорожденное животное [79]; приводим данные для человека:
Потребление О2, млЦг-ч)
30—36 ч после рождения 0,316
640 ч после рождения 0,282
Взрослые 0,21—0,24
Максимум метаболической активности у человека близок ко времени отнятия от груди; у крупного рогатого скота наибольшая интенсивность обмена наблюдается у молодняка вплоть до полового созревания, у свиней — в период полового созревания, у лоша-
Кислород, дыхание и метаболизм
389
дей__в период половой зрелости [28]. У цыплят максимум прихо-
дится на 4-недельный возраст.
Скачкообразное повышение интенсивности обмена наблюдается У Rana к концу гаструляции, а у Ambystoma несколько позже — непосредственно перед тем, как начинает функционировать система кровообращения [24]. Потребление кислорода яйцами морского ежа Arbacia увеличивается в 7 раз после оплодотворения.
Рис. 5-15. Потребление кислорода куколками мясной мухи в зависимости от их возраста (Park Н. D., Buck J., J. Insect Physiol., 4, 220—228, 1960).
Для насекомых с полным превращением характерно медленное повышение интенсивности обмена в процессе развития личинки, .а затем ее резкое падение в начале стадии куколки с последующим подъемом перед вылетом имаго. Такая U-образная кривая метаболизма встречается у многих насекомых (Tenebrio, Drosophila, Phormia) (рис. 5-15). У куколок одной хирономиды уровень потребления кислорода так же высок (5,5 мм3/(мг-ч), как и у личинок (4,75 мм3/(мг-ч) [166]. У насекомых с неполным превращением потребление О2 повышается сразу же после каждой линьки и снижается в период между линьками; так обстоит дело, например, у растительноядного клопа Oncopeltus и кровососущего клопа Rhodnius.
У Protozoa обмен обычно понижается по мере созревания и старения культуры. У ресничных инфузорий после инцистирования потребление кислорода может уменьшаться на 98%.
Размеры тела. Потребление кислорода иногда выражают в расчете на одну особь, а чаще всего пересчитывают на 1 г или 1 кг
390
Глава b
веса тела (влажный или сухой вес), реже на единицу количества азота. Принято также выражать интенсивность дыхания в виде показательной функции от веса тела. QOa означает число миллилитров Ог (при стандартных давлении и температуре), потребляемых на 1 г сухого веса за 1 ч, а УОа — количество Ог на 1 г сырого веса (или единицу объема ткани).
Общее потребление кислорода растет с увеличением размеров животного, но при расчете на единицу веса оно снижается. Это легко видеть при сравнении мелких и крупных особей одного вида или разных видов, принадлежащих к одной группе животных. Как правило, интенсивность метаболизма имеет более однородные значения, если она выражена в виде показательной функции от размеров тела. Многократно обсуждалось, какой показатель величины тела лучше использовать для расчетов [20, 116, 117]. Если М — общее количество кислорода, потребляемое в единицу времени» a W — вес тела, то функция имеет вид и
log М—b log W -J- log К.
Константу b получают, измеряя наклон экспериментальной прямой, выражающей зависимость логарифма потребления Ог от веса тела; если две последние величины прямо пропорциональны осью ординат. Если нужно найти потребление кислорода в единицу времени на единицу веса, используют функцию
log ^-=(6—1) log W 4- log К.
Величина К определяет точку пересечения кривой «метаболизм — вес» с осью ординат (т. е. точку, где W= 1), и эту величину иногда называют метаболизмом, независимым от веса. Константа b отражает скорость изменения интенсивности обмена при изменении веса тела; если две последние величины прямо пропорциональны друг другу, то Ь — \. В действительности b обычно меньше 1. Это означает, что в ряду близких видов или в процессе роста интенсивность обмена увеличивается медленнее, чем масса тела. Подобного же рода экспоненциальная аллометрия выявляется при изменении длины некоторых придатков и общей поверхности тела как функции веса тела.
В результате обширных исследований установлена следующая зависимость метаболизма в виде теплопродукции (Л1) или потребления кислорода (УО2) от размеров тела (W, кг) [117]:
М (ккал/с ут)==/GW70»74.
Для многих плацентарных млекопитающих К=70, так что
M=70-U7°’74
Кислород, дыхание и метаболизм
39!
И
logM—О,74 log № + 1,845.
Для животных весом 1 кг М — 70 ккал/сут. Чтобы перевести теплопродукцию в эквивалентное потребление кислорода, следует 1153] учесть, что тепловой эквивалент 1 л О2, потребленного организмом, равен 4,8 ккал. Выразив объем О2 в миллилитрах и перейдя от 24 ч к 1 ч, получим для №=1000 г следующую формулу: К0,= --^^ут • 1000=604 мл/(г-ч).
Чтобы найти значение К, подставим полученный результат в выражение зависимости потребления кислорода от веса:
604=/С(1000)°’74—/(•158,
откуда К=3,8 и
УОа (мл/ч) =3,8№0»74.
В большинстве опубликованных работ, касающихся птиц и млекопитающих, потребление кислорода представлено в виде теплового эквивалента (ккал/сут). Величина К определяет начало кривой метаболизм — вес, но она зависит от ряда условий, и ее можно найти только путем экстраполяции. Показатель степени b характеризует соотношение между интенсивностью обмена и размерами тела.
В табл. 5-2 приведены примеры, иллюстрирующие зависимость обмена (потребления О2) от веса тела. Другие данные можно найти в специальном руководстве [2].
У млекопитающих поверхность тела равна некоторой постоянной величине, умноженной на №°>66, в то время как потребление кислорода почти пропорционально №0-75. Эти соотношения отображает известная кривая «от мыши до слона» (рис. 5-16). Тесную корреляцию между величиной поверхности тела и потреблением О2 объясняли тем, что первая из этих величин (в расчете на единицу веса) определяет относительную теплоотдачу, которая, таким образом, у мелких животных больше, чем у крупных. Если бы теплопродукция на единицу веса у кита была такой же, как у мыши, то температура его тела приблизилась бы к точке кипения воды. Это, конечно, несколько упрощенное рассуждение: на самом деле организм теряет тепло не только через поверхность тела, но и через легкие, а также иными путями. Кроме того, у некоторых млекопитающих значительная часть поверхности тела имеет низ-кую_температуру (близкую к внешней). Наконец, температура те-
~ хаРактеРистика неадаптивная, т. е. она не изменяется с внеш-и температурой, и интенсивность обмена описывается приведен-™ выше УРавнениями при различных температурах среды. По-' реоление кислорода так быстро возрастает с уменьшением разме-
Таблица 5-2
Зависимость интенсивности обмена от размеров тела
Животные Размеры тела, F Ь Потребление О2, мл/(г-ч), если не указаны иные единицы; в отдельных случаях теплопродукция, ккал/(кг-сут)
Млекопитающие Среднее для 36 видов [116, 190] 8 австралийских сумчатых [43] Сумчатые сем. Dasyuridae [141] Летучие мыши Megachiroptera [П] Грызун Heterocephalus [149] Птицы Воробьиные [131] Не относящиеся к воробьиным [131] Колибри при оцепенении [132] Рептилии и амфибии Некоторые ящерицы [14] Некоторые сцинки [87] Тропические змеи [65] Тропические удавы [65] Лягушка Acris (в мае) [49] Testudo Testudo [90а] Рыбы Лосось Oncorhyncus [26] Серебряный карась [187] Серебряный карась [18] Cadus [18] Звездчатая камбала [18] Squalus [18] Терпуг [18] Антарктическая Notothenia [170] Личинка миноги [80] Насекомые Некоторые Hymenoptera [113] Некоторые Coleoptera [113] Личинки ночных бабочек [182] 16-28700 7,2—5050 18—600 16—11 000 1—1,3 118—35 000 3—1400 10—400 30—2000 0,14—3,49 0,012—1,2 0,1—1 0,5—29 0,75 0,74 0,74 0,73 0,75 0,724 0,72 0,848 0,62 0,63 0,86 1,09 1,0 0,71 0,97 0,82 0,97 (в активном состоянии) 0,78 (стандартный обмен) 0,85 0,86 0,70 0,86 0,74 0,78 0,785 0,72 0,92 0,77 0,87 70 ккал/(кг-сут) 105 мл/(м2-ч) 2,56 70 ккал/(кг-сут) 2,45 3,8 *3,4 129ккал/(кг-сут) 7,0 78,3 ккал/(кг-сут) 4,3 0,234 (при 30°С) 0,3 (при 30 °C) 0,088 0,215 140 (в активном состоянии) 45 (в покое) 0,235 0,054 3,2 (в расчете на сухой вес^
Животные Размеры тела, V
Collembola [225] Личинка Chironomus [50] 0,0001—0,007 0,89—12,8 1,0 0,70
Ракообразные
Ligia oceanica Антарктические гаммариды 0,04—1,03 0,73 0,42 (при 2 °C)
Ра1 Balanus Artemia [68] Homarus [147] Пса pug пах [195] Пса pugilator [195] 1,2-80 0,66 0,66 (самка, в морской воде) 0,88 (самец, в морской воде) 0,88 0,68 0,77
Моллюски
Patella [39а] Lymnaea [48а] — особи, выращенные в лаборатории То же, в период выхода паразитов Mercenaria [140] Пресноводная улитка Theodo-pus Переднежаберные улитки Brachiodontes [172а] Mytilus Пресноводное блюдечко [21] 2—15 0,014—3.6 г 0,43 (сухой вес) 0,696 1,0 0,77 0,66 0,87 0,67 0,7 0,65 0,73
Иглокожие
Морской еж [152а] Черви 0,7 (зимой) 0,65 (летом)
Schistocephalus [40] ‘Clymenella [144] Прочие организмы 7,6—22,3 0,52 0,48
Почвенная нематода [78] Мелкие пойкилотермные организмы; личинки [78] МИ[78] лростейшие’ бактерии 1,0 1,0 0,756
Продолжение
Потребление Оз, мл/(г-ч), если не указаны иные единицы; в отдельных случаях теплопродукция, ккал/(кгсут)
0,11
394
Глава 5
ров тела, что в период активности млекопитающие весом меньше 3,5 г практически не смогли бы обеспечить себя пищей. У многих млекопитающих и птиц 6 = 0,75, а К имеет малую величину, поэтому кривая зависимости метаболизма от веса лежит ниже теоретической. Для некоторых животных значение К велико и кривая лежит выше теоретической. Величина К и, следовательно, интенсивность стандартного обмена в среднем в 25—30 раз выше для го-мойотермных, чем для пойкилотермных животных тех же размеров [78] (рис. 5-17).
У млекопитающих, впадающих в зимнюю спячку, потребление кислорода лучше коррелирует с весом тела, чем с его поверхностью. У новорожденных младенцев интенсивность обмена пропорциональна весу (Foa = 7,2 IF), но экспоненциальная зависимость устанавливается так медленно [79], что при весе 10—12 кг (т. е. в возрасте около 18 мес) VO1 = 20 IF0*6. У сумчатых куниц 6=0,74, а величина /С мала, поэтому кривая метаболизм — вес лежит на 32,1% ниже, чем для плацентарных млекопитающих [141]. У многих птиц из отряда воробьиных 6=0,724, а /С =129, в то время как у других птиц 6 = 0,723, а К=78,3 [131]. Следовательно, у воробьиных метаболизм в большей степени определяется весом тела, чем у остальных птиц. У грызуна Peromyscus crinitus интенсивность обмена составляет 59%, а у другого грызуна — Heterocephalus gla-ber — всего лишь 18% тех значений, которых можно было бы ожидать при данных размерах тела исходя из теоретической кривой [149]; напротив, у Microtus montanus метаболизм на 75% выше ожидаемого. У млекопитающих повышенный уровень обмена (и теплопродукции) при неизменной температуре тела и определенных размерах животного предполагает либо наличие густой капиллярной сети, особенно на периферии, либо отдачу кислорода гемоглобином при сравнительно высоком значении РОа. Отмечена хорошая корреляция между интенсивностью обмена как функцией веса и значением Р$о для гемоглобина (см. гл. 8).
Логарифмическая зависимость между потреблением кислорода и весом тела характерна и для пойкилотермных животных. Это говорит о том, что она определяется не просто условиями теплового баланса. Изучив обширный материал, Хеммингсен [78] пришел к выводу, что уравнение Al = /C-lFb, где 6 близко к 0,73, одинаково применимо и к пойкилотермным, и к гомойотермным животным и даже к буковым деревьям! В табл. 5-2 приведены значения 6 для многих беспозвоночных. Среди одноклеточных организмов очень высоким уровнем обмена отличаются бактерии: у некоторых из них потребление Ог достигает 100—500 л/(кг-ч). Простейшие поглощают меньше кислорода; например, Pelomyxa, будучи по объему в 107—108 больше бактерий Salmonella и Escherichia, потребляет всего лишь 0,2 л О2 на 1 кг в час.
Для мелких многоклеточных пойкилотермных организмов — микроскопических рачков, низших червей, моллюсков — кривая,
•jX,
ZOO
100
W
?
MspCKL
Мелкие
ооооо 20000 10000
с ООО -
.•ЛШ'И'ЬЪ
Силе*- о*
Юг 20 г О 100 200 500 1кг Z О 1О 20 50 leJ 01>0 600 ПЮО 2000 ОООО
Ове тлела
i/tew.'wa
l УМUfK&b Казуар 'Усь 9M^Morfffop Крупные дикие К!Т}ицывМ^Макак Гетух^-Мошка
А у К г1К*М*\кролил' X в Сурок Рупные крысы
e jr
< Мышь
Рис. 5-16. Зависимость средних значений общей теплопродукции от средних значений веса тела у птиц и млекопитающих (в логарифмическом масштабе) [20].
Рис.
5 17. Интенсивность обмена у различных животных как функция общего количества азота в организме [223].
396
Глава 5
построенная в логарифмических координатах, идет более круто (рис. 5-18). Для почвенных нематод 6=0,9, а для ряда беспозвоночных, весящих около 40 мг, среднее значение b составляет 0,95 [222,
10s
\ е MolLusca.
^Lambricidae
Onycbopbora
18 ° С
Юймг
ю
£
10О мкг
„ \ i \
ХУ i ' „'Isopoda.
И \
\ Amphipoda
Orlbatei
10
Nematoda.
1
100
500 1OOO 1500
Потребление Oz, мнл/гг-а)
ZOOO
Рис. 5-18. Зависимость потребления кислорода от логарифма веса тела у некого- о рых мелких беспозвоночных [225].
° ъ Collembola
4 Enchytraeidae
223]. Для более крупных пойкилотермных животных характерна кривая с меньшим наклоном: у мелких ракообразных величина b равна 0,95, а у особей, весящих примерно 40 мг и более, — 0,80. У представителей рода Pachygrapsus самых разных размеров Ь = =0,66, у Mytilus — 0,67, у Artemia из морской воды — 0,88, у Artemia из насыщенного рассола — 0,62. Для тараканов, палочников и тарантулов 6=0,8 [52]. У некоторых голометаболических насекомых величина 6 приближается к I, а у насекомых с неполным превращением она ниже [50]. Эта величина может зависеть от температуры; для тропической рыбы Etroplus она равна I при
Кислород, дыханце и метаболизм
397
О °C и падает до 0,67 при 35 °C. Для некоторых Gobiidae значения b в диапазоне от 10 до 17 °C выше, чем в диапазоне от 21 до 31 °C [Юа]. У ряда змей теплопродукция не вполне пропорциональна поверхности тела; у 50 видов Л4 = 0,34 U70-86 [65]. У сцинка Lygosoma величина b равна 0,63 при 30 °C и 0,4 при 19,5 °C [87].
Измерения, проведенные на особях одного вида, показали, что на очень ранних стадиях развития (при весе зародыша менее 40 мг) величина b равна 0,7—0,8, в дальнейшем достигает 0,9— 1,0, а затем у более крупных половозрелых животных вновь снижается. Подобные трехступенчатые кривые характерны для Mytilus, Artemia, Asterias и амфибий. У лосося Oncorhyncus значение b для обмена в покое равно 0,78 (/(=0,37), а для активного обмена 6 = 0,97 (/( = 4,29) [27]. У Mercenaria интенсивность обмена и скорость прокачивания воды характеризуются одним и тем же значением b [140]. У морского ежа Eucioraris величина b равна 0,70 зимой и 0,65 летом, а у лягушки Acris достигает высоких значений ранней весной и снижается к концу брачного сезона [49].
Подводя итоги, можно сказать, что у одноклеточных организмов потребление кислорода почти пропорционально клеточной по
си
верхности, а размеры клетки, возможно, лимитируются отношением ее поверхности к объему. У многоклеточных животных, даже равных по величине простейшим, интенсивность обмена выше, чем у одноклеточных; потребление кислорода уже не лимитируется у них поверхностью тела, а количество ферментов растет вместе с весом тела. Однако при дальнейшем увеличении веса (более 40 мг) количество ферментов растет медленнее, чем вес тела, и
может даже уменьшаться при достижении животным максимальных размеров. Цейтен отмечает, что мелкие животные быстро развиваются и обладают высоким уровнем обмена, а крупные, наоборот, растут медленно и интенсивность обмена у них невелика. В какой мере эту закономерность можно связать с величиной клеточной поверхности, пока неясно; возможно, что интенсивность обмена в большой степени зависит от дыхательной поверхности и транспорта О2.
Механизмы, определяющие зависимость обмена от размеров тела. Один из факторов, снижающих интенсивность обмена при увеличении размеров тела, — это непропорциональное развитие канеи с низкойметаболической активностью — скелета, жировой
°единительнои Тканей' ^ак как относительные веса разных ор-ох неодинаковы, потребление кислорода отдельными тканями не обязательно должно изменяться с весом тела что и общий метаболизм.
млм^СмпДЯ И3 соотиошения между размерами тела и метаболиз-окигпы'г ^Н° пРедположить> что у мелких животных активность вы тт!к?НЫХ ФеРмент°в в соответствующих тканях должна быть ней о’ п У кРУпнььх. Однако изучение дыхания различных тка-дов млекопитающих не выявило полной корреляции. Так,
в той
же степени,
398
Глава 5
у лошади общий обмен в состоянии покоя составляет (на единицу веса) 11% от интенсивности обмена у мыши, а интенсивность дыхания мозга и почек лошади составляет уже 47% от соответствующих величин для тканей мыши. Потребление кислорода печенью лошади составляет 13—23% от QO2 для печени мыши, но этот показатель почти одинаков у морской свинки, кошки и собаки [120]. У Salmo clarki величина b для метаболизма жабр и почки оказалась равной 0,85, т. е. она выше, чем для всего организма. Потребление кислорода изолированными жабрами краба Hemigrapsus составляет 170 мкл/г, если жабры взяты от особи весом 2,4 г, и ПО мкл/г, если краб имел вес 12,5 г [47].
У некоторых млекопитающих было найдено хорошее соответствие между количеством митохондрий и интенсивностью обмена всего организма. Общая масса митохондрий, отнесенная к W0’77, у вола меньше, чем у крысы [188]. Цитохромоксидазная и малат-дегидрогеназная активность тканей возрастает при переходе от крупных животных к мелким, но не пропорционально увеличению общей интенсивности обмена.
Соотношение между размером тела и интенсивностью обмена — результат сложной аллометрической адаптации. Практически не существует организма, у которого обмен был бы пропорционален весу или поверхности тела. Согласно Хеммингсену [78], разброс экспериментальных значений h можно значительно уменьшить, введя поправки на температуру и другие факторы, что приблизит величину b к 0,74. Однако Хеммингсен согласен с мнением Цейте-на [224] о том, что у одноклеточных организмов величина b близка к 0,74, у очень мелких пойкилотермных многоклеточных b составляет уже 0,95. а для более крупных пойкилотермных животных, растений и гомойотермных животных равна 0,74. Во второй из этих групп, у мелких Metazoa (морских личинок и некоторых почвенных нематод), значения b выше, хотя размеры тела варьируют от 1 мкг до 1 мг.
Как уже говорилось (стр. 353), размеры организмов, получающих кислород только путем диффузии, ограничены. Таким образом, для одноклеточных существует верхний предел общей поверхности клетки. Многоклеточность позволяет создать значительно большую площадь свободных поверхностей при данных размерах тела. Однако попытки установить связь между кривыми зависимости обмена от размеров тела и общим числом или общей поверхностью клеток нс увенчались успехом — главным образом из-за большой разнотипности клеток по форме и величине.
Было высказано предположение, что у животных, имеющих жабры или легкие, обмен может быть пропорционален площади дыхательных поверхностей. Этот фактор, возможно, играет большую роль у некоторых групп животных, но не у всех. У гомойотермных животных интенсивность обмена определяется в основном скоростью кровотока и теплоотдачей.
399
Кислород, дыхЬцие и метаболизм
То, что in vitro интенсивн -сть дыхания многих тканей более или менее пропорциональна общему уровню метаболизма, говорит о существовании тонкой клеточной адаптации. В расчете на единицу веса ткани (или азота) активность окислительных ферментов в тканях мелких животных более высока. Однако это верно лишь в самом общем виде, поскольку даже у одного животного исходный уровень дыхания разных тканей может быть весьма различным. По-видимому, существуют тонкие механизмы, регулирующие работу ферментных систем в определенных клетках в соответствии с потребностями всего организма.
Содержание кислорода в среде и интенсивность обмена
Зависимый и независимый тип дыхания. Зависимость или независимость уровня обмена от внешнего РОг можно установить, измеряя количество кислорода, поступающее в кровь при различном содержании О2 в окружающей среде. Для этого измеряют процент насыщения кислородом дыхательного пигмента. В идеале нужно было бы знать величину РО2 внутри клетки, непосредственно у крист митохондрий, где находятся дыхательные ферменты. Уже существует метод определения концентрации О2 с помощью кислородного электрода как на поверхности ткани (например, коры головною мозга), так и внутри клетки (в частности, мышечной). Весьма перспективен флуоресцентный метод количественного определения восстановленных и окисленных нуклеотидов (НАД ^НАД-Н), но этот метод применим не ко всем тканям. Соотношение между доставкой и потреблением кислорода может быть различно даже в мышцах одного животного; например, у морской свинки внутриклеточные величины РО2 составляют 6 мм рт. ст. для ш. gracilis, 19,7 — для m. soleus и >0 для m. gastrocnemius. У кошки в наружных слоях желудочка сердца РО2 достигает 10 мм рт. ст., а во внутренних — только 5 мм рт. ст. РО2 в венозной крови довольно часто бывает выше, чем в тканях; значит, нормальная функция многих клеток может поддерживаться и при 1ИЗКИХ Pqz [214].
Можно измерить потребление кислорода интактным животным в широком диапазоне внешних величин РО2 и установить предел выживаемости при гипоксии. У многих животных обнаружена регуляция обмена, т. е. они способны поддерживать неизменное потребление кислорода до тех пор, пока его парциальное давление во вдыхаемом воздухе не снизится до определенного критического уровня (Pw), ниже которого потребление О2 резко падает. У таких животных уровень обмена не зависит от внешнего РОъ при изменении этой величины в широких пределах. У других животных потребление кислорода пропорционально внешнему POt п продолжает возрастать, если эта величина поднимается выше атмосфер-
4 70
Парциальное давление О^.ммрт.ст.
Парциальное давление О? ,нмртст.
Рис. 5-19. Зависимость потребления
кислорода от его парциального давления в воде.
Л. Кривые для трех морских рыб [75]. Независимый от Р тип дыхания у лягодона и кузовка и зависимый — у опсануса. Б к В. Кривые для серебряного карася и гольца. У обеих рыб интенсивность активного обмена очень быстро растет с повышением Pq2 . Интенсивность стандартного обмена показана черными треугольниками (голец) и сплошной линией (серебряный карась) для особей, акклимированных к Pq 155 мм рт. ст., а светлыми треугольниками и прерывистой линией—для особей, акклимированных к Pq . соответствующему данной точке кривой [18].
Кислород, дыхание и\цетаболизм‘401 него уровня; это животные с зависимым'от POjs дыханием. Для животных с независимым дыханием Ркрит лежит ниже уровня РОа в воздухе при нормальном атмосферном давлении, а для животных с зависимым типом дыхания величина Ркрит выражена менее четко и лежит выше 155 мм рт. ст. У некоторых животных кривая, отражающая зависимость интенсивности обмена от содержания’ кислорода в среде, становится более пологой при величинах рО2 выше атмосферного уровня (т. е. выше 155 мм рт. ст.). Эти животные занимают промежуточное положение между формами с зависимым и независимым типами дыхания. Характер зависимости обмена от POjs и положение критической точки РкрИт определяются рядом внешних и внутренних факторов, в том числе экологическими особенностями животного (рис. 5-19). При значениях РОа ниже Ркрит интенсивность обмена зависит от количества доступного кислорода; если же Р02 выше Ркрит, то лимитирующим фактором может быть концентрация субстратов, ферментов или кофакторов. Величины РкрИт не во всех случаях постоянны; они могут несколько изменяться в зависимости от условий определения.
К организмам с независимым от POi дыханием относятся простейшие, пресноводные и наземные аннелиды, яйца иглокожих, многие моллюски и ракообразные, большинство водных позвоноч
ных, ряд водных насекомых и, вероятно, все наземные насекомые и позвоночные. Зависимым от РО2 типом дыхания обладают некоторые простейшие, многие кишечнополостные, свободноживущие аннелиды и морские черви, большинство паразитических червей, некоторые моллюски и ракообразные, взрослые иглокожие, а также несколько видов водных насекомых и позвоночных. Зависи-
мость метаболизма от парциального давления кислорода характерна для морских беспозвоночных, в особенности крупных и малоподвижных, у которых диффузия кислорода может лимитировать доставку его тканям. У таких животных срезы тканей могут потреблять (на единицу веса) больше кислорода, чем интактный организм, так как in vitro путь диффузии О2 короче. При коротком пути диффузии Ркрит может иметь очень малую величину (например, 2,5 мм рт. ст. у Tetrahymena [8]). У некоторых видов, обладающих системой кровообращения, например у речного рака, кР№ имеет тенденцию возрастать с увеличением размеров тела.
Факторы, влияющие на зависимость обмена от давления О2, и механизмы этого влияния. Во время активности уровень обмена В большей степени зависит от POjs, чем в период покоя; в обоих случаях РкриТ растет с температурой, что было показано на приме-ванГ°ЛЬЦа ^a^ve^nus fontinalis [70]. Максимальная скорость пла-жяпЯ’ Же как и потрсбление кислорода, коррелирует с содер-РастреМ В В°Де (Рис- 5-20). У ушастого окуня величина Ркрит н тс температурой, и при резком падении POjs она бывает выше,
26—1332
402
Глава 5
чем при медленном понижении. У высокоактивных рыб значения Ркрит намного выше, чем у малоподвижных (у скумбрии 70, у тау. тоги 1,6, у серебряного карася 80, у сомика 50 мм рт. ст.). У мало-подвижного опсануса интенсивность дыхания зависит от парциального давления кислорода и не подвержена никакой регуляции при снижении РОа вплоть до нуля.
Рис. 5-20. Зависимость потребления (кислорода рыбой от его содержания в воде
[90].
Сплошная линия — обмен в состоянии активности, прерывистая линия — обмен в покое, ко
торый в определенном диапазоне значений
ро2
почти не изменяется (зона толерантности.
нлн неограниченной выживаемости), а затем резко снижается вместе с Р
(зона резистеит-
ности, или ограниченной выживаемости).
У животных, обитающих в богатой кислородом среде, интенсивность дыхания при атмосферном Pq2 и величина Ркрит выше, чем у тех, которые живут при низких значениях РОл. Эти свойства коррелируют с выживаемостью в анаэробных условиях и определяются генотипом. У некоторых водных личинок насекомых при сравнении особей из застойных канав, прудов и проточной воды обнаружена возрастающая зависимость метаболизма от давления кислорода. Личинки, живущие в проточной воде, менее устойчивы к гипоксии и высокой температуре, и потребление кислорода у них больше угнетается при снижении внешнего РО2 [209]. Морское ракообразное Gnathophausia (Mysidae) живет в воде с содержанием
Кислород, дыхание и метаболизм_______ 403
кислорода от 0,2 до 1,25 мл/л и поддерживает неизменное потребление О2 при снижении его концентрации до 0,26 мл/л [34].
Акклимации к гипоксии может изменять величину Ркрит в сторону более низких концентраций О2. Например, личинки хироно-после нескольких часов адаптации к низкому уровню О2 становятся менее зависимыми от внешнего РО2 [209]. У серебряного карася, акклимированного в течение нескольких дней к пониженному уровню кислорода (’/б атмосферного РО2), отмечено уменьшение величины Ркрит и интенсивности стандартного обмена [167]. У гольца Salvelinus потребление кислорода не изменяется при акклимации к РОа от 160 до 88 мм рт. ст.; ниже 80 мм рт. ст. на-•блюдается небольшое увеличение, а затем резкое падение потребления О2. Если особи были акклимированы к низким РО2, то они потребляют меньше кислорода, чем после акклимации к атмосферному уровню РОа. Сходные результаты получены для карпа [18]. По-видимому, здесь играет роль механизм индукции ферментов.
У некоторых водных личинок потребление кислорода зависит от определенных механических воздействий. Для личинок ручейников проточная вода нужна, быть может, не столько из-за высокой концентрации в ней кислорода, сколько из-за активного перемешивания слоев воды. Личинки поденок, плавающие в бутылке с водой, потребляют значительное количество кислорода, которое изменяется в зависимости от его концентрации; если же в воду добавить мелкой гальки, то потребление кислорода уменьшится и будет оставаться неизменным при снижении концентрации О2 в воде вплоть до 1 мл/л [53]. Пелагические эуфаузииды имеют независимый от давления О2 тип дыхания и величину РКрИт, соответствующую 5% от РО2 в атмосферном воздухе, а глубоководные виды сохраняют относительно постоянный уровень дыхания при снижении Ро2 почти до нуля [194].
Важным фактором, регулирующим интенсивность обмена и определяющим величину Ркрит, является вентиляция органов внешнего дыхания и способность извлекать кислород из воздуха или воды, входящих в контакт с дыхательным эпителием. Примеры усиления вентиляции приводились на стр. 355—360. У рыбы Callioni-mus дыхание зависит от парциального давления О2: при снижении внешнего РОа частота дыхания и сокращений сердца уменьшается и потребление О2 падает. Рецепторы, чувствительные к кислороду, находятся в области жабр [94].
У ряда беспозвоночных, не имеющих в крови дыхательного пигмента, интенсивность обмена зависит от внешнего РОа, тогда Как у форм, обладающих таким пигментом, и у дышащих трахеями насекомых потребление кислорода подвержено регулированию. Днако наличие эффективной транспортной системы само по себе не всегда обеспечивает независимость дыхания от Роа. Например,
404
Глава 5
у Carcinus интенсивность обмена регулируется, а у Homarus и Li-mulus зависит от Ро2- Такая зависимость, возможно, объясняется тем, что гемоцианин в обычных условиях никогда не бывает полностью насыщен кислородом (см. гл. 8). Большинство переносящих кислород пигментов насыщается при уровнях РО2 значительно ниже атмосферного. При инактивации пигмента (например, гемоглобина) значение РкрИт может возрастать. Например, у дождевого червя потребление кислорода обычно не зависит от содержания его в среде, пока оно не понизится до 3% (22 мм рт. ст.), но если гемоглобин инактивирован окисью углерода, то дыхание начинает снижаться уже при 8% О2 (60 мм рт. ст.).
У животных, обитающих в бедной кислородом среде и способных частично получать энергию за счет гликолиза, преобладает зависимый от РО2 тип обмена. Если у водных аннелид и насекомых пребывание в среде, бедной О2, способствует возникновению регуляции, обеспечивающей независимый тип обмена и низкие величины Ркрит, то паразиты, в большей степени использующие гликолиз, напротив, чаще обнаруживают зависимость от РОз. К паразитам с независимым типом обмена относятся живущие в крови простейшие Trypanosoma cruzi и Plasmodium, а также нематода Trichinella, паразитирующая в мышцах, богатых кислородом. Зависимый от Ро2 тип метаболизма обнаружен у трематоды Fasciola, лентеца Diphyllobothrium и аскариды. У последней лимитирующим фактором, по-видимому, не является диффузия кислорода, так как дыхание измельченной ткани тоже зависит от РО2; кроме того, и мелкие нематоды весом менее 1 мг обладают зависимым от РОа типом обмена [25].
Пресноводные черепахи выживают даже после нескольких часов вынужденного пребывания под водой; при этом ритм сердца у них замедляется, содержание кислорода в крови падает и накапливается молочная кислота. Если перед погружением черепахе ввести ингибитор гликолиза иодацетат, то время выживания резко сократится (меньше 1 ч); значит, длительное выживание под водой связано с тем, что организм в основном переключается на гликолиз [19, 101, 102].
При низких уровнях РО2 звеном, лимитирующим интенсивность обмена, обычно становятся окислительные ферменты. Для измерения низких концентраций О2 лучше использовать не кислородный электрод, а более чувствительные методы — флуорометрическое определение доли восстановленного НАД или измерение люминесценции бактерий. Полумаксимальное восстановление цитохрома с из сердечной мышцы наблюдается при концентрации кислорода 7-10-8 М (около 0,015 мм рт ст.); сходные величины получены для восстановления цитохрома в свежих клетках пекарских дрожжей [160а]. Существует метод, позволяющий следить за измене
Кислород, дыхание и метаболизм.405
нием доли восстановленного НАД in vivo в коре головного мозга крысы; если вместо воздуха в дыхательную маску животного ввести азот, то НАД будет быстро восстанавливаться. Электрическая активность мозга исчезает полностью при восстановлении 80% НАД- Сродство системы цитохромов к кислороду (измеряемое концентрацией О2, при которой цитохромы восстановлены на 50%) варьирует от 0,05 до 0,5 мкМ О2 [32а]. При снижении Ро, в межклеточной жидкости напряжение кислорода в клетке может достичь критического уровня, при котором восстанавливается цито-хромоксидаза и активируется гликолиз.
Взаимосвязь метаболизма с наследственно закрепленными формами поведения. У большинства животных при уменьшении количества доступного кислорода возникают ответные реакции, позволяющие сохранить относительно неизменное энергообеспечение организма. Обычно это довольно быстрые реакции. К ним относятся,, например, снижение интенсивности обмена и увеличение количества пигмента, переносящего кислород, при акклимации к гипоксии. Существуют также генетически закрепленные механизмы, обеспечивающие жизнедеятельность в привычных для организма условиях обитания, например уже упоминавшаяся адаптация к стоячей или проточной воде, а также к высокогорью. Сюда же-можно отнести взаимосвязь обмена с двигательной активностью и/ поведением животного.
Корреляцию между интенсивностью обмена и поведением можно проследить на примере млекопитающих и птиц. Для примитивных млекопитающих — однопроходных и неполнозубых — характерен низкий уровень обмена, а сумчатые занимают промежуточное положение между примитивными группами и Eutheria; при этом зависимость обмена от веса животного (величина Ь) одинакова у всех этих групп. Интенсивность обмена у грызунов, обитающих в пустыне, как правило, ниже, чем у тех, которые живут в условиях средней влажности. У грызуна Heterocephalus потребление О2 составляет лишь 18% величины, определяемой общей' формулой для всех Eutheria (0,26 мл/(г-ч)), а у Peromyscus crtni-tus величина М хотя и несколько выше (0,92 мл/(г-ч)), но все еще на 41% ниже теоретической [149]. Напротив, у полевки Microtus — очень подвижного животного — величина М на 75% выше расчетной. У многих птиц, не относящихся к отряду воробьиных, потребление кислорода, независимое от веса (т. е. величина К, экстраполированная по кривой зависимости обмена от веса тела), составляет в виде теплового эквивалента 78,3 ккал/сут, а у воробьиных—129 ккал/сут [129, 131]. У Phalaenoptilus, относительно ма-4Ао/°ДВИЖН°й птицы» потребление кислорода составляет лишь б/о расчетного значения [128]. Крупные летучие мыши, представители Megachiroptera, приближаются по интенсивности обмена к высшим плацентарным млекопитающим (см. табл. 5-2), в то вре-я как для Microchiroptera характерны меньшие величины К.
406
Глава 5
У теплокровных животных, способных впадать в оцепенение, величина К обычно более изменчива и, как правило, несколько ниже, чем у животных, не обладающих такой способностью. Состояние оцепенения обеспечивает жизнедеятельность при отсутствии
Рис. 5-21. Потребление кислорода колибри в различных физиологических условиях при разных температурах [127].
1 — состояние оцепенения; II — состояние покоя (бодрствование) в темноте (черные кружки — потребление Oj в термонейтральной зоне); III —-в полете при температуре воздуха 24* С. Вертикальными отрезками (IV) показаны пределы колебаний интенсивности обмена в дневное время.
двигательной активности и позволяет сохранять запасы энергии; это можно видеть на примере колибри (рис. 5-21). Летучая мышь Nyctimene albiventer в состоянии бодрствования при 25 °C потребляет 2,59 мл О2 на 1 г в час, а в период оцепенения — 0,67 мл при той же температуре. Мы уже упоминали об изменениях интенсивности обмена (величины М) во время мышечной активности
Кислород, дыхание и метаболизм
407
(стр. 382). У голубя Columba в полете величина М равна 22 ккал/ч, а в покое — 2,69 ккал/ч [133].
У высокоактивных рыб интенсивность стандартного обмена выше, чем у малоподвижных. Так, потребление кислорода у рыб при-
Б юо 80 60 W
is is it
*
6
§8? 0
2 -iT 1 -«3 0.8 -i^L
20
10
животные
о Лосось
Вертолет о
Реактивный
Наземные животные
^Ящерица.
Винтовые самолеты
10'6 10'5 10-г 10-1 р]О
Вес, кг
Реантив-
Автомобили
lUm uU~‘ ские самолеты -
101 102 103 10“ IO3 ft}#
Рис. 5-22. Затрата энергии при передвижении.
Пот?ТНыШеНИе потРе^ления кислорода к скорости бега у млекопитающих разной величины Uaoj. Наклон кривой показывает минимальную затрату энергии при беге. Б. Минимальная' wJf313 энергии при передвижении: данные для насекомых (светлые кружки), птиц (чер-
•е квадратики), некоторых других животных, а также для транспортных средств, созданных человеком [203].
мерно одинаковой величины при 15 °C составляет (мг/(кг-ч)): У форели—100, у чукучана —10, у сомика —40, у карпа—30 |18]. У рыб, живущих в холодной воде, интенсивность обмена
408
Глава 5
обычно высока. Некоторым антарктическим рыбам вполне хватанет того кислорода, который при низкой температуре может быть растворен в плазме крови: рыбы, не имеющие гемоглобина, потребляют при 0 °C немногим меньше кислорода (0,012—0,022 мл/ /(г-ч)), чем те, в крови которых есть гемоглобин (0,022—0,037 мл/ /(г-ч)) [170].
Затрата энергии при передвижении (беге или полете) на единицу веса для мелких животных выше, чем для крупных (рис. 5-22). При одинаковом весе тела полет — в энергетическом •отношении более экономный способ передвижения, нежели бег. У рыб «коэффициент полезного действия» при плавании может -быть весьма различным в зависимости от формы тела.
Судя по некоторым данным, популяции из теплых областей отличаются от популяций тех же видов, обитающих в более прохладной среде, меньшей интенсивностью обмена (см. гл. 9). 1Полихеты Clymenella torquator из Коннектикута потребляют большие кислорода, чем те же полихеты из Северной Каролины. Для С. mucosa из Северной Каролины Ко2выше, чем для популяции
> из Пуэрто-Рико [144]. В популяции наземных изопод, обитающих в южной Англии, интенсивность обмена выше, чем в австрийской популяции [218, 219].
Зависимость обмена от внешней концентрации Ог в широком - физиологическом диапазоне характерна для менее активных животных, таких, как литоральные или глубоководные беспозвоноч-: ные и малоподвижные рыбы. Напротив, высокоактивным животным обычно свойственна гомеостатическая регуляция интенсивности обмена. Многие животные, способные подолгу находиться под водой, например черепахи, могут на длительное время переключаться •>с аэробного обмена на анаэробный. Анаэробный тип метаболизма без образования кислородной задолженности широко распространен у паразитических червей.
< Адаптация к нырянию
Многие животные, дышащие воздухом, способны долго нахо-. диться под водой благодаря вспомогательным механизмам дыхания, пониженной потребности в кислороде и перестройке метабо-. лизма. Легочные улитки поглощают значительное количество кис-. лорода через поверхность тела; ныряющие насекомые захватывают пузырек воздуха и дышат через пластрон или же имеют трахейные жабры. Бесхвостые амфибии (лягушки) под водой получают через кожу примерно вдвое меньше кислорода, чем на воздухе при дыхании легкими. При погружении в воду потребление кислорода у них падает, ритм сердца замедляется (брадикардия) и иногда * создается некоторая кислородная задолженность. После выхода лягушки из воды частота сердечных сокращений у нее возрастает > быстрее, чем интенсивность газообмена, причем это наблюдается
Кислород, дыхание и метаболизм
409-
паже тогда, когда животное, всплывая из-под воды, попадает в атмосферу азота. Двусторонняя ваготомия предотвращает такое учащение сердечного ритма; кроме того, если вода насыщена кислородом (РО2 = 760 мм рт. ст.), брадикардия при погружении не наступает. Следовательно, реакция со стороны сердца вызывается отчасти самим погружением в воду и отчасти — аноксией [109]. Ниже приведены некоторые сравнительные данные для двух видов черепах.
Sternothaerus Pseudemys
Vo2 на воздухе 26,6 38,5
Voa в воде, находящейся в равно- 3,4 4,1
весии с воздухом
Уо2 в воде, насыщенной кислоро- 22,2 1 ,b
дом
Ркрит на воздухе 0 б
Ркрит в воде 59,7 425
Время выживания в воде, находя- 26,5
щейся в равновесии с воздухом, ч
Время выживания в воде, насыщен- >4300 26,У
ной кислородом, ч
Время выживания в аноксической во- 12,7 24,7
де, ч
Время выживания в аноксической во- 0,32
де после введения иодацетата, ч
У Sternothaerus в отличие от Pseudemys при погружении в воду усиливается вентиляция ротоглотки. У Pseudemys постепенно развивается брадикардия. Благодаря вспомогательному дыханию и гликолизу Sternothaerus может оставаться под водой значительно дольше, чем Pseudemys [19].
У многих рыб, например у форели, при извлечении из воды возникает брадикардия; по-видимому, причина этого — не просто пониженный уровень О2, так как гипоксическая вода не вызывает того же эффекта. Илистый прыгун Periophthalmus выдерживает пребывание вне воды в течение 27 ч, а затем погибает от обезвоживания; у этой рыбы не возникает брадикардии при извлечении из воды, подобно тому как это происходит у многих рыб, менее приспособленных к пребыванию на воздухе [69].
У некоторых птиц и млекопитающих погружение в воду ведет к расслаблению тела и замедлению пульса, в то время как другие, наоборот, развивают усиленную активность и погибают. Пекинская утка способна оставаться под водой до 15 мин; при этом интенсивность обмена у нее может снижаться на 90%, частота сердечных сокращении на 92—95%, температура тела также может падать, если перед погружением утке дать возможность подышать чистым кислородом, то время пребывания под водой увеличится [164]. радикардию при погружении в воду можно вызывать, раздражая определенный участок среднего мозга [56].
410
Глава 5
Максимальная продолжительность пребывания под водой составляет для тюленя Phoca vitidina 15 мин, для кашалота (Physe-ter macrocephalus) — 1,5 ч, для кита-полосатика (Balaenoptera phy-salus) — 0,5 ч, для бутылконоса — 2 ч, для человека — 2,5 мин. Возможность длительного пребывания под водой совместно обеспечивают различные адаптации, касающиеся дыхания, кровообращения и поведения. У ныряющих животных потребление кислорода на воздухе не слишком отличается от соответствующих величин для наземных животных: у тюленя, например, оно составляет 546, у ламантина— 180, у человека — 250 мл/(кг-ч). Объем вдыхаемого воздуха у ныряющих животных значителен; например, у морской свиньи он составляет 80% всего объема легких (у человека — только 20%). Кислородная емкость гемоглобина у тюленя равна 1,78 мл на 1 г НЬ, а у человека— 1,23; объем крови у тюленя несколько больше, чем у человека. Мышцы ныряющих животных богаты миоглобином: у тюленя в 100 г мышечной ткани содержится 7715 мг Mb, а у быка — всего лишь 1084 мг. По расчетам Шо-ландера, общие запасы кислорода в организме — в легких, крови, мышцах и тканевой жидкости — у тюленя-хохлача весом 29 кг составляют 1520 мл. На суше в состоянии покоя этот тюлень потребляет за 25 мин 6250 мл Ог, что в 4—5 раз больше того запаса кислорода, который организм может использовать, находясь под водой. Кислород мышц расходуется в первые 5—10 мин пребывания под водой, после этого в мышцах преобладает гликолиз. При этом организм может потреблять в 4—5 раз меньше О2, чем в состоянии покоя на суше, хотя в воде тюлень еще активно плавает. У китов в мышцах может находиться до 40% всего запаса О2, имеющегося в организме.
Запасы кислорода, особенно в легких и миоглобине, у разных животных весьма различны [136]:
Содержание кислорода, мл/кг
Легкие Кровь Ткани Всего
артериальная венозная миоглобин в растворе
Тюлень крылатка 12,6 14,3 22,6 27,2 2 78,7
Морская выдра 51,2 6,1 9,4 8,8 2 77,5
Тюлень обыкновенный 13,6 12,2 18,8 18,6 2 65,2
Морской котик 21,8 6,7 9,9 Н,7 2 52,1
Морской лев 16,5 7,2 8,1 2 38,8
Уровень молочной кислоты в крови во время пребывания под водой почти не изменяется, но может повышаться после всплытия на поверхность (например, с 70 до 175 мг% у тюленя Cystophora). Под водой происходит накопление молочной кислоты в мышцах, так как в этих условиях здесь образуется застой крови. У всех ластоногих имеется сфинктер из поперечнополосатых мышечных
Кислород, дыхание и метаболизм
4П;
волокон, охватывающий заднюю полую вену чуть выше диафрагмы. При закрытом сфинктере кровоснабжение мозга может поддерживаться даже тогда, когда в остальных частях тела циркуляция крови прекратилась. Важное адаптивное значение имеет также брадикардия, которая наступает у хорошо приспособленных ныряющих животных, а также тренированных людей. Корейские и японские женщины — ловцы жемчуга (ама) могут находиться на глубине 18—20 м в течение 60—80 с в поисках жемчужниц или моллюсков Haliotis. Под водой у них через несколько секунд развивается выраженная брадикардия. Причина этого — не гипоксия, так как брадикардия не возникает при задержке дыхания: она появляется только после погружения лица, особенно в холодную воду. У ныряльщиц отмечен повышенный уровень основного обмена в зимний период [169].
У тюленя частота сокращений сердца на суше (в покое) составляет 80 в 1 мин, а при погружении—10. Брадикардия как рефлекторный ответ опосредуется через вагус; венозный сфинктер тюленя иннервируется диафрагмальным нервом.
У ныряющих животных чувствительность дыхательного центра к двуокиси углерода ниже, чем у наземных; высокий порог реакции на СО2 найден, в частности, у бобра, тюленя, ондатры и морской свиньи (Phocaena). Активность мозга, если судить по альфа-ритму, может поддерживаться при более низких РО2, чем у наземных млекопитающих [51]. Кроме того, ныряющие животные отличаются высоким коэффициентом использования кислорода и большим объемом вдыхаемого воздуха. У морской свиньи жизненная емкость легких равна 7 л, а объем вдыхаемого воздуха — около 5— 6 л; коэффициент использования О2 близок к 10%, т. е. в 2—3 раза выше, чем у человека. Кит совершает несколько быстрых вдохов на поверхности и иногда делает выдох перед самым погружением; морские свиньи ныряют на вдохе, а тюлень Уэддела, морской слон и обыкновенный тюлень — после выдоха. На глубине легкие и бронхи животного спадаются. У морской свиньи грудная клетка начинает сжиматься при достижении глубины 50 м, а на глубине 300 м общий объем легких уменьшается до 200—260 мл. Так как легкие сжаты и стенки альвеол, вероятно, уплотнены, а кровообращение в легких затруднено, создаются условия, препятствующие переходу азота в кровь; это позволяет избежать образования в крови пузырьков азота при подъеме животного на поверхность.
Таким образом, способность некоторых млекопитающих длительное время находиться под водой связана с целым рядом физиологических приспособлений. К ним относятся большой объем вдыхаемого воздуха, определенный запас кислорода, особенно в миоглобине мышц, способность создавать кислородную задолженность в мышцах, малая чувствительность дыхательного центра к '-'Л и молочной кислоте, возможность ограничивать циркуляцию*
-412
Глава 5
крови на периферии тела и в то же время поддерживать кровоснабжение сердца и мозга, брадикардия и экономное расходование энергии при движении.
Адаптация к высокогорным условиям
Горная болезнь характеризуется наступлением дыхательной и сердечно-сосудистой недостаточности в связи с пониженным парциальным давлением кислорода на больших высотах. На высоте 3050 м барометрическое давление равно 523 мм рт. ст., а РО2 — НО мм рт. ст., т. е. 71 % от РО2 на уровне моря. При подъеме на высоту около 5200 м РОав альвеолярном воздухе понижается у человека со 105 (на уровне моря) до 45 мм рт. ст., а Рсс>2—с 40 до 25 мм рт. ст. Когда насыщение крови кислородом у человека падает до 85% нормальной величины, появляются признаки нарушения деятельности центральной нервной системы, а при снижении до 70—80% наступает помутнение сознания. Первоначальная реакция организма на высокогорную гипоксию — гипервентиляция, при которой повышается Pq2, но падает РСОа в альвеолярном воздухе; гипокапния вызывает алкалоз и нарушает кислотно-щелочной баланс крови. Алкалоз в сочетании с гипоксией приводит к сужению сосудов мозга, хотя при отсутствии гипокапнии такая же гипоксия вызывала бы расширение сосудов. Таким образом, первые признаки горной болезни — это головокружение и ослабление функции головного мозга. Первой реакцией на гипоксию со стороны сердечно-сосудистой системы является увеличение минутного | объема сердца. |
После нескольких дней или недель пребывания человека на I высоте наступает акклиматизация. Подробнее об увеличении количества гемоглобина при высотной акклиматизации и о высоком уровне его в крови высокогорных животных (см. главу 8, т. 2). У хорошо акклиматизированных людей отмечается устойчивое повышение альвеолярной вентиляции, кислотно-щелочной баланс нормализован; минутный объем сердца вновь снижается почти до •обычного уровня. Кривая, отражающая зависимость объема вентиляции от СОг, сдвигается влево и становится круче; однако гипервентиляция при острой гипоксии менее выражена, чем до акклиматизации. Уроженцы высокогорных районов, живущие на небольшой высоте, сохраняют 'устойчивость к гипоксии. Гипервентиляция возникает у них лишь тогда, когда РО2 в артериальной крови падает до 50—60 мм рт. ст. Кроме того, при физической нагрузке вентиляция легких у горцев возрастает в меньшей степени, J чем у жителей равнины [124]. Аборигенам высокогорья свойст- ! венны высокая жизненная емкость легких и весьма значительный * (даже в норме) объем вдыхаемого воздуха, а также некоторая ги- 5 пертрофия правого желудочка. Имеются данные о повышенной ак-
Кислород, дыхание и метаболизм
413
„явности окислительных ферментов и усиленном синтезе гемоглобина (см. гл. 8, т. 2) у ряда высокогорных животных. Как у людей, так и у животных степень акклиматизации к высоте при одних и тех же условиях может быть неодинаковой в связи с генетическими различиями, и соответствующий отбор, возможно, действовал, например, в популяциях жителей Анд и Гималаев.
Токсичность кислорода
У животных имеются сложные механизмы, предотвращающие падение внутриклеточного Ро& ниже определенного уровня. Однако избыток кислорода тоже может привести к повреждению клеток. Среди бактерий есть облигатные анаэробы, а для некоторых животных оптимум лежит ниже уровня Ро3 в воздухе. Термитов можно избавить от кишечных жгутиковых, если поместить их в атмосферу чистого кислорода, причем кислород под давлением 1 атм более токсичен для этих паразитов при низких, чем при высоких температурах [35]. Паразитическое простейшее Trichomonas — факультативный аэроб. Некоторые гельминты, например Ascaris, выживают в чистом кислороде меньше часа. К атмосферному кислороду чувствительны и некоторые свободноживущие организмы, обитающие в бедной О2 среде. Личинки хирономид, один представитель Ostracoda и червь Tubifex— обитатели илистого дна застойных водоемов — лучше всего приспособлены к среде с 4 % О2; при уровне кислорода, соответствующем насыщению воздухом, они живут недолго, а в чистом кислороде — всего лишь 2—4 дня. У Tubifex при очень низких Ро2 не происходит регенерации утраченных сегментов, но уровень кислорода выше атмосферного подавляет дифференцировку и тело червя распадается на части в течение нескольких дней; токсическое действие кислорода частично снимает цианид [4]. Таким образом, обитатели ила и паразиты, которые обычно живут в условиях низкого содержания кислорода, более чувствительны к повреждающему действию высоких концентраций О2, чем животные, для которых «привычна» величина Ро2 соответствующая атмосферному воздуху. Влияние чистого кислорода, по крайней мере в случае насекомых, обусловлено не просто повышенным давлением. У перепончатокрылого Habrobracon после воздействия 1 атм О2 в течение 1 ч или 2 атм О2 в течение 5 мин появлялись цитологические аномалии; при давлении кислорода от 1 до 7 атм продолжительность жизни насекомого сокращалась. Высокое давление кислорода оказывает на Drosophila меньшее действие, если мухи получают данную «дозу» в несколько сеансов с перерывами во времени; при таком режиме в течение
7 дней выживает около 30% мух [58]. Ежедневные 8-часовые ’Сеансы при 1 атм О2 или получасовые при 2—5 атм О2 уменьшают продолжительность жизни дрозофил.
414
Глава 5
Время, в течение которого погибает 50% животных, содержащихся при 1 атм Ог, составляет для крыс 3 дня, для мышей — 5,5 для цыплят — 9,5 и для перепелов — 14 дней. У хомячков при-0,7 атм Ог возникают дегенеративные изменения в сетчатке и повреждения зачаткового эпителия семенников. В чистом кислороде-может прекращаться клеточное деление у простейших. У людей, дышащих под водой чистым кислородом, могут появляться симптомы отравления. Действие чистого кислорода несколько сходно с влиянием ионизирующей радиации, и нематода Caenorhabditis обнаруживает высокую устойчивость к обоим этим факторам. Высокие концентрации кислорода вызывают в тканях образование свободных радикалов (например, [ОН]) и перекиси водорода, окисление сульфгидрильных коферментов (таких, как КоА), инактивацию SH-ферментов, образование перекисей липидов и окисление различных SH-содержащих метаболитов. В нормальных клетках имеются различные антиоксиданты — глутатион, каталаза, витамин Е, — которые защищают SH-соединения от самоокисления [77]. Структуры клеточного ядра находятся в относительно анаэробных условиях; для работы цитохромной системы митохондрий достаточно около 4 мкМ Ог; наибольшая концентрация О2, еще не повреждающая клетку, равна в большинстве случаев 65 мкМ [67].
Секреция газа в плавательный пузырь
Перенос кислорода через дыхательные поверхности в кровь осуществляется благодаря диффузионному градиенту даже на больших высотах, при малой величине внешнего POt. Однако некото* рые водные животные, принадлежащие к различным систематическим группам, способны накапливать газы в пузырях или газовых камерах против значительного градиента давления. В этом отношении лучше всего изучены рыбы, у которых плавательные пузыри, во-первых, служат резонаторами для улавливания или издава-ния звуков (см. гл. 12), во-вторых, служат дополнительным источником кислорода для дыхания и, в-третьих, регулируют гидростатическую силу, обеспечивая плавучесть [1]. Для поддержания плавучести в морской воде нужен плавательный пузырь, объем которого составлял бы 3—5% объема тела, а в пресной воде — несколько больше. Закрытопузырные рыбы наполняют пузырь газом исключительно путем секреции, открытопузырные же могут заглатывать часть газа, но при отсутствии доступа к поверхности воды они способны секретировать его.
У большинства рыб, обладающих плавательным пузырем, имеются механизмы как для секреции газа, так и для его поглощения. В регулировании объема пузыря могут участвовать железы и мышцы. Мышцы, ответственные за наполнение пузыря воздухом, снабжены холинэргическими нервными окончаниями, а их антагонис-
Кислород, дыхание и метаболизм
415
ы — адренэргическими. Соответствующие медиаторы действуют как на мышцы, так и на железы [13].
Газ, выделяемый в плавательный пузырь, сильно отличается по составу от воздуха. Гидростатическое давление в толще воды повышается примерно на 1 атм с каждыми 10 метрами глубины. Таким образом, на глубине 100 м приходится секретировать газ против давления в 10 атм. Если рыба всплывает с глубины слишком быстро, то газ расширяется и может разорвать плавательный пузырь. Парциальное давление азота у поверхности воды равно . 0,8 атм, а кислорода — 0,2 атм (150 мм рт. ст.). На глубине, где действует гидростатическое давление, количество растворенного газа возрастает на 14% при каждом увеличении давления на 100 атм, так что на глубине 1000 м Р° достигает 0,228 атм. Газ в плавательном пузыре глубоководной рыбы может содержать 65—95% О2 [19]. Таким образом, общее давление кислорода в плавательном пузыре рыбы на глубине 1000 м составляет около 90 атм, т. е. активный перенос кислорода в плавательный пузырь увеличивает давление О2 в 394 раза. Можно добавить, что многие рыбы живут на еще больших глубинах [8, 10, 11].
У голубой рыбы газ в плавательном пузыре содержит 65—85% О2, 4—7% N2 и 17—37% СО2 [25]. У некоторых пресноводных рыб (например, у сига) газ может состоять на 95% из азота. В пузыре соотношение аргона и азота такое же, как и в воздухе. Было показано, что даже инертные газы могут транспортироваться против градиента гидростатического давления. Изотопы кислорода переходят в плавательный пузырь в том же соотношении, что и в воздухе или в искусственной газовой смеси; следовательно, кислород, выделяемый в пузырь, — это действительно молекулярный кислород [23].
Если из плавательного пузыря выпустить часть газа, то время, необходимое для восстановления прежнего объема пузыря, составляет для угря 16—18 ч, для опсануса 18—24 ч, для таутоги 24 ч, для морского конька и Fundulus 48 ч и для голубой рыбы 4 ч [25].
Железа, выделяющая газ в плавательный пузырь, расположена вдоль одной из его сторон. Секреторные клетки железы образуют около сосудов складки, в которых лежит аппарат Гольджи, и здесь могут появляться пузырьки газа [4]. Кроме того, имеется обширная сеть параллельных капилляров, пронизывающих тело железы или оплетающих ее снаружи. По подсчетам Фенге [12], У угря эта сеть состоит из 200000 капилляров общей длиной 800 м. Такая сеть служит морфологической основой противоточного механизма, участвующего в концентрировании кислорода.
Согласно одной из гипотез, объясняющих секрецию газа, в клетках железы образуются СО2 и молочная кислота; кислая реакция вызывает освобождение кислорода гемоглобином, так как сдвигает кривую равновесия вправо (эффект Бора) и снижает уровень
416
Глава 5
максимального насыщения (эффект Рута). Благодаря переплетению сосудов с встречными 'потоками крови кислород может переходить из вены, идущей от плавательного пузыря, непосредственно в артерию, идущую от сердца, а затем из общей вены в ар. терию плавательного пузыря; таким образом, в ткани секретирую, щей железы может создаваться высокая концентрация кислорода В артерии плавательного пузыря имеет место «положительный» эффект Рута, т. е. увеличение максимального уровня насыщения гемоглобина, причем процесс идет весьма медленно: он доходит до половины за 10—20 с, тогда как в эпителии выносящих сосудов плавательного пузыря возникает обычный «отрицательный» эффект Рута, для которого соответствующее время составляет всего лишь 50 мс [2].
Под микроскопом можно видеть, как перфузируемые препараты газовой железы выделяют пузырьки газа [20]. Даже при давлении О2 51 атм в ткани железы образуется молочная кислота. В железе относительно мало ферментов цикла Кребса, но зато высока активность ферментов анаэробного гликолиза, и метаболизм ее клеток относительно устойчив к токсическому действию кислорода [6, 7]. Во время секреции газа железа выделяет в кровь повышенное количество молочной кислоты. Газовая железа угря секретирует 0,37 мл О2 и 0,02 1мл N2 в 1 ч. Диамокс — ингибитор карбоангидразы— снижает секрецию [13]. У барракуды кровь, выходящая из сосудистого сплетения, может содержать до 40 мг молочной кислоты на 100 мл [10].
Стин [20, 21] произвел анализ газов крови на проксимальном и дистальном концах сосудистой сети угря (рис. 5-23). Было показано, что не только кислота способствует отщеплению кислорода от гемоглобина, но и сам кислород из приносящих сосудов благодаря противоточной системе диффундирует в выносящие капилляры, так что создается циркуляция кислорода в пределах сети. Это позволяет накапливать высокие концентрации кислорода в плавательном пузыре. РО2в венозной крови на выходе из сосудистой сети во время секреции уменьшается [20].
У некоторых глубоководных рыб полость плавательного пузыря содержит большое количество липидного материала, который состоит из фосфолипида и холестерина в соотношении 1:1. Газовая железа глубоководных рыб синтезирует холестерин. Так как кислород, возможно, хорошо растворим в этом холестеринсодержащем липиде, в пузыре может оставаться очень мало свободного газа. Напротив, у рыб, обитающих на небольших глубинах, имеется лишь тонкий слой липида на внутренней поверхности пузыря [ 17] •
Другое возможное объяснение секреции газа [14, 15, 24] состоит в том, что молочная кислота крови, входящей в железу, уменьшает растворимость газов. Такой механизм мог бы играть особенно важную роль в секреции азота и аргона. Согласно этой гипотезе, процентное соотношение газов в плавательном пузыре опреде
Кислород, дыхание и метаболизм
417
ляется в основном их растворимостью, а не парциальным давлением.
Поскольку эффект Рута проявляется медленно, давление газов в плавательном пузыре у глубоководных рыб может быть выше, чем в крови. Рассмотренные выше механизмы — влияние СО2 на
02-5,/\
CO2-7ff,Z 4-' С0г-24,4
pH -7,52 рН-7,25
к/с-24 Ксс5отск-0,5в м-к-~33
рОг~5,5 -*• pQ.~40
р№21________________________рС02~5
02-^4 02-5,5
С02~15,6 ----------------- CO2-JZ7,7
pH -7,47 Гематокрит-42 рН-5,87
МК.-31 М.К.-71)
р02~4 /-p<J250
рС02-1 / \рС0г-8
Рис. 5-23. Секреция газа в плавательный пузырь {Steen J. В., Acta Physiol. Scand., 59, 221—241, 1963).
Д. Схема железы, секретирующей газ, вместе с «чудесной сетью» и пузырем. Б. Состав входящей н выходящей крови на обоих концах сети и газа в пузыре. Содержание О2 и С02 — в миллилитрах на 100 мл крови, молочной кислоты (м. к.)—в мг%; скорость кровотока — в мл/мин; £*о2 и Pqq% —в процентах от нормального содержания в атмосфере. Анализ крови проводился после 3-часовой секреции газа.
кривую оксигенации гемоглобина, противоточный газообмен в сосудистой сети, а также низкая проницаемость стенки плавательного пузыря — не столь характерны для глубоководных рыб и, кроме того, не позволяют объяснить секрецию азота. Однако кислород, согласно расчетам, мог бы со временем накапливаться до высоких давлений.
Сифонофоры (физалия) выделяют газ в объемистый пузырь — пневматофор. Секретируя газ, животное всплывает на поверхность, а выпуская его — погружается под воду. Находящийся в пузыре газ содержит 74,4% N2, 8,9% СО, 14,4% О2, 1,1% аргона и 0,4% СО2 [18, 22]. У основания пузыря расположена газовая железа, сходная по своей ультраструктуре с железой рыб [5]. Интактное животное выделяет от 7,5 до 120 мкл СО в 1 ч, a in vitro скорость секреции СО составляет 0,06 мкл/ч на 1 мг ткани железы. Источником окиси углерода служит серин [22]. Газовые пузыри некоторых крупных бурых водорослей также содержат большие количества СО (5—10%).
У каракатицы (Sepia) щиток, или сепиолит, занимает около 9% объема тела и имеет плотность 0,6 г/см3; если его удалить, животное становится на 4% тяжелее равного объема морской воды. В полостях сепиолита содержится большое количество газа, а также жидкость, которая гипоосмотична по отношению к крови на больших глубинах и изоосмотична на малой глубине. В результате активного «откачивания.» из этой жидкости ионов Na+ и С1~ 27-1332
418 Глава 5
создается осмотический градиент, который отсасывает воду из щитка. Таким образом уравновешивается гидростатическое давление, которое в противном случае заставляло бы воду входить в газовые полости. С помощью такого осмотического насоса каракатица поддерживает свою плавучесть [9].
Заключение
Анаэробный обмен (гликолиз и брожение) более распространен у живых организмов, чем аэробный. Этот факт, так же как и ряд геохимических данных, указывает на то, что в эволюции анаэробиоз предшествовал окислительному метаболизму. Все животные — в основном аэробы, но в случае необходимости они могут в той или иной мере использовать и анаэробные пути получения энергии.
В естественных условиях кислород может лимитировать интенсивность обмена главным образом там, где его мало. Кислород под высоким давлением обладает токсическими свойствами. Однако при обычном парциальном давлении О2 в атмосферном воздухе (155 мм рт. ст.) отравление наступает лишь у очень немногих животных — у тех, которые обитают в бедной кислородом среде (некоторые зарывающиеся в ил черви и кишечные паразиты). Для животных, дышащих воздухом, содержание кислорода в среде становится лимитирующим фактором при нырянии и подъеме в горы. Для животных, получающих кислород из воды, дефицит О2 может возникать в водоемах со стоячей или теплой водой, а также при загрязнении воды промышленными отходами. В подобных условиях возникают определенные приспособительные сдвиги, в результате которых либо усиливается поглощение кислорода, либо изменяется распределение его в организме и повышается эффективность использования. Некоторые адаптации связаны с постоянным образом жизни данного вида, тогда как другие возникают только при временной нехватке кислорода, например при физической нагрузке.
Кислород проникает во все клетки путем диффузии, и проницаемость клетки для кислорода может определять величину клеток как у одноклеточных, так и у многоклеточных организмов. Потребность в кислороде ограничивает размеры тела у организмов, не обладающих циркуляторной системой, и расстояние между капиллярами у животных, имеющих замкнутую систему кровообращения. В большинстве случаев для поддержания необходимой интенсивности обмена и достаточного уровня РО2в клетке путь диффузии О2 не должен превышать 0,5—1,0 мм. Внутриклеточные величины РОа обычно на 1—2 порядка меньше внеклеточных.
У многоклеточных животных выработалось несколько различных способов доставки кислорода тканям. Лишь в немногих случаях внешний кислород поступает непосредственно в ткани — у губок, кишечнополостных и Tracheata (это в основном насекомые).
Кислород, дыхание и метаболизм
419
Вентиляция у насекомых производится через дыхальца с помощью особых дыхательных движений. У всех остальных животных источник внешнего кислорода сообщается с тканями через промежуточную жидкую фазу (кровь или целомическую жидкость), отделенную от внешней фазы (воздуха или воды) тонкой эпителиальной мембраной. Вентиляция таких мембран, через которые происходит газообмен, осуществляется с помощью специальной мускулатуры, находящейся под контролем нервной системы. Внешним стимулом, вызывающим рефлекторное усиление вентиляции, чаще всего служить снижение уровня Ог или повышение уровня СО2 во вдыхаемом воздухе, причем для водных животных более характерна реакция на гипоксию, а для наземных — на гиперкапнию. Имеются соответствующие рецепторы двух типов — чувствительные к недостатку О2 и к избытку СО2. Ответная реакция организма состоит обычно в усиленной вентиляции легких (т. е. в увеличении частоты и глубины дыхания или обоих этих параметров); кроме того, может изменяться скорость кровотока. Эти изменения направлены на то, чтобы поддерживать снабжение организма кислородом на постоянном уровне. Иногда усиленная вентиляция приводит к таким побочным явлениям, как алкалоз (в результате вымывания СО2), что затрудняет поступление необходимого повышенного количества кислорода. Кроме того, затрата энергии на усиленную работу дыхательной мускулатуры может значительно снижать полезный эффект повышенного поглощения О2, как это бывает у некоторых рыб.
У многих животных имеются вспомогательные органы внешнего дыхания — такие, как ротовая перепонка у черепах, плавательные пузыри у открытопузырных рыб и кожа у амфибий. Соотношение между поглощаемым кислородом и выделяемой СО2 в главных и вспомогательных органах дыхания неодинаково.
Мерой интенсивности аэробного обмена может служить количество кислорода, потребляемого в единицу времени. Расчет по количеству выделяемой двуокиси углерода менее точен, так как часть СО2 вступает в ряд реакций внутри организма. Используют также метод калориметрии, и тогда интенсивность обмена выражается величиной теплопродукции. Уровень метаболизма зависит от вида животного, размеров тела, условий среды и двигательной активности. Есть некоторые указания на то, что во время активности ферментативные пути обмена могут быть несколько иными, чем в покое. Интенсивность обмена в состоянии покоя, или уровень стандартного обмена, приходится определять косвенным образом: измеряют, например, потребление животным О2 при различных уровнях двигательной активности и экстраполируют полученную зависимость на уровень покоя. Для некоторых животных за величину стандартного обмена принимают потребление кислорода в период полной неподвижности. Активный обмен может отличаться от обмена в покое на 1—3 порядка величины. Расхождения в пуб
27*
420
Глава 5
ликуемых данных об интенсивности метаболизма у тех или иных животных часто объясняются отсутствием необходимого контроля двигательной активности. Значительное влияние на уровень обмена оказывают внешняя температура и температура тела, гормональное состояние организма, питание и природа пищевых веществ, используемых в окислительных процессах.
В группе сходных животных более мелкие особи и виды обладают более интенсивным метаболизмом, чем крупные. У некоторых мелких видов интенсивность обмена прямо пропорциональна весу тела; однако у одноклеточных и крупных многоклеточных животных она чаще всего пропорциональна весу тела, взятого с определенным показателем степени (часто 0,75) — близким, но не равным показателю степени, в которой вес тела входит в выражение для его поверхности. В литературе есть некоторые данные о том, что окислительная активность клеток (или митохондрий) в пересчете на 1 г белка или общего веса у мелких животных, возможно, выше, чем у крупных. Каким образом она регулируется, неизвестно. Интенсивность обмена зависит не только от размеров тела: существуют также генетически обусловленные различия в уровне основного обмена, связанные с образом жизни — с подвижностью животного, способностью его впадать в зимнюю спячку или оцепенение и т. п.
Существенное влияние на метаболизм может оказывать содержание кислорода в окружающей среде. Многие животные и, вероятно, большинство клеток имеют «зависимый» тип обмена, т. е. потребление кислорода растет у них с повышением внешнего POi и при атмосферном уровне POi еще не достигает возможного предела. У других животных интенсивность обмена остается неизменной при снижении внешнего Pq2 вплоть до определенного критического уровня, который зависит от обычных условий жизни данного вида; обмен у них обычно регулируется путем изменений внешнего дыхания (вентиляции и кровотока в легких или жабрах).
Некоторые животные могут на короткое время переходить от аэробного обмена к анаэробному (например, при нырянии, большой физической нагрузке или острой гипоксии). Иногда после периода гипоксии потребление кислорода возрастает и таким образом ликвидируется кислородная задолженность. Другие животные (например, кишечные паразиты) в течение длительного времени живут за счет энергии гликолиза и выделяют при этом кислые конечные продукты.
Аэробные и анаэробные пути обмена с их взаимосвязями образуют сложную, тонко сбалансированную систему. На уровне целого организма регуляция доставки кислорода тканям осуществляется с помощью СОг- и Ог-чувствительных рецепторов и центральной нервной системы. Мы еще не имеем полного представления о том, как регулируется активность ферментов на клеточном уров-
Кислород, дыхание и метаболизм
421
в соответствии с размерами тела, физиологическими .нагрузками неколичеством доступного кислорода. Некоторые механизмы регуляции в частности гормональные, будут рассмотрены в следующей главе.
СПИСОК ЛИТЕРАТУРЫ
1. Adolph Е. A., Respir. Physiol., 7, 356—368, 1969. Survival in anoxia, infant mammals.
2. Altman P. L., Dittmer D. S., eds., Biological Handbook, Respiration and Circulation, Fed. Assoc. Soc. Exp. Biol., 1971, 930 pp.
3. Andersen H. T., Physiol. Rev., 46, 213—243, 1966. Physiological adaptations of diving vertebrates.
4. Anderson I. C., Biol. Bull., Ill, 179—189, 1956. Relation of metabolism to regeneration in Tubifex.
5. Anderson J. F., Comp. Biochem. Physiol., 33, 51—72, 1970. Metabolic rates of spiders.
5a. Armitage К. B., Biol. Bull., 123, 225—232, 1962. Temperature and oxygen consumption, gammarid.
6. Ashby E. A., Larimer J. L., Physiol. Zool., 37, 21—32, 1964. Cardiac responses of crayfish to carbon dioxide stress.
7. Ashby E. A., Larimer J. L., J. Cell. Comp. Physiol., 65, 373—379, 1965. Cardiac and respiratory responses to carbohydrate chemoreception, crayfish.
8. Baker E. G. S., Baumberger J. P., J. Cell. Comp. Physiol., 17, 285—304, 1941. Critical O2, Tetrahymena.
9. Ballintijn С. M., J. Exp. Biol., 50, 569—591, 1969. Muscle coordination of respiratory pump in carp.
10. Ballintifn С. M., Hughes G. M., J. Exp. BioL, 43, 349—362, 1965. Respiratory pumps in trout.
10a. Barlow G. W., Biol. Bull., 121, 209—229, 1961. Metabolism of gobiid fishes.
11. Bartholomew G. A., Dawson W. R., Lasiewski R. C., Z. vergl. Physiol., 70, 196—209, 1970. Thermal regulation and oxygen consumption in flying fo-xes
12, Bartholomew G. A., et al., Physiol., Zool., 37, 179—198, 1964. Metabolism of bats.
13. Bartholomew G. A., MacMillen R. E., Physiol. Zool., 34, 177—483, 1961. O2 consumption of kangaroo mouse.
14. Bartholomew G. A., Tucker V. A., Physiol. Zool., 37, 341—354, 1964. Oxygen consumption in relation to temperature and size in varanid lizards.
15. Barron E. S. G., Tamisian T. N., J. Cell. Comp. Physiol., 32, 57—70, 1948. Metabolism of cockroach muscle.
16. Basu S. P., J. Fish. Res. Bd. Canad., 16, 175—212, 1959. Active respiration of fish in relation to ambient concentrations of oxygen and carbon dioxide.
17. Beadle L. C., J. Exp. Biol., 34, 1—10, 1957. Respiration of swamp oligochaete, Alma.
18. Beamish F. W. H., Mookherjii P. S., Canad. J. Zool., 42, 161—175, 177—188, 355—366, 47—856, 1964. Standard and activity metabolism of brook trout and m goldfish in relation to temperature and body size.
19. Belkin D. A., Fed. Proc., 22, 634, 1963; Respir. Physiol., 4, 1—14, 1968. Aquatic 9o ^spfration and diving ability of turtles.
v. Benedict F. G., Garnegie Inst. Washington Publ., 503, 1—215, 1938. Vital energetics.
Berg K., Jonasson P. M., Ockelmann K. W., Hydrobiologia, 19, 1—39, 1962.
99 Respiration of freshwater invertebrates.
• Berg T., Steen J. B., Comp. Biochem. Physiol., 15, 469—484, 1965. Aerial respiration in eel.
422
Глава 5
23, Berkson Н., Comp. Biochem. Physiol., 18, 101—119, 1966. Diving in Pacific green turtle.
24. Boell E. J., Ann. N. Y. Acad. Sci., 49, 773—800, 1948. Metabolism of amphibian embryos.
25. Von Brand T., pp. 177—234, 434, in: Biochemistry and Physiology of Protozoa, Vol. 1, ed. by S. H. Hutner and A. Lwoff, Academic Press, 1951; J. Cell. Comp. Physiol., 29, 33—48, 1947; 45, 421—434, 1955; Zool. Anz., 157, 119—123, 1956. Intermediary metabolism of trypanosomes.
26. Brett J. R., J. Fish. Res. Bd. Canad., 21, 1183—1226, 1964; 22, 1491—1501, 1965. Respiration in relation to swimming speed in sockeye salmon.
27. Breit J. R„ Amer. Zool., 11, 99—113, 1971. Energetics of salmon.
28. Brody S., Bioenergetics and Growth, Reinhold Publishing Co., 1945. 1023 pp.. Chaps. 13—15. Metabolism in relation to body size.
29. Brown J. H., Bartholomew G. A., Ecology, 50, 705—709, 1969. Energetics of kangaroo mouse.
30. Buck J., Ann. Rev. Entomol., 7, 27—56, 1962. Physical aspects of insect respiration.
31. Buck J. B., Keister M. L., Biol. Bull., 105, 402—411, 1953; 119, 144—163, 1955; J. Exp. Biol., 32, 681—691, 1955; PhysioL Zool., 29, 137—146, 1956. Cyclic CO2 release by saturnid moth pupae; cutaneous and tracheal respiration; tracheal filling in fly larvae.
32. Cade T. J. et al., Physiol. Zool., 38, 9—33, 1965. Water economy and metabolism of finches.
32a. Chance B., J. Gen. Physiol., 49, 163—188, 1965. Respiratory controls in cells.
33. Chew R. M., Lindberg R. G., Hayden P., Comp. Biochem. Physiol., 21, 487— 505, 1967. Effects of temperature on metabolism in pocket mouse.
34. Childers J. J.. Science, 160, 1242—1243, 1964. Distribution of a mysid crustacean as limited by oxygen minimum layer.
35. Cleveland L. R., Burke A. U., J. Protozool., 3, 74—77, 1956. Oxygen toxicity in symbiotic protozoa.
36. Cohn J. E., Shannon R., Respir. PhysioL, 5, 259—268, 1968. Respiration in geese.
37. Crawford E. C., Lasiewski R. C., Condor, 70, 333—339, 1968. Oxygen consumption and respiratory evaporation of emu and rhea.
38. Crawford E. C., Schultetus R., Copeia, 179—180, 1970. Cutaneous respiration in lizard, Sauromalus.
39. Dales R. P., PhysioL ZooL, 34, 306—311, 1961. Oxygen uptake and water irrigation by terebellid polychaetes.
39a. Davies P. S., J. Marine BioL Assoc. U. K., 46, 47—61, 1967. Metabolism of Patella.
40. Davies S. P., Walkey M., Comp. Biochem. PhysioL, 18, 415—425, 1966. Metabolism of cestodes.
41. Davis J. C., Cameron J. N., J. Exp. BioL, 54, 1—18, 1971. Water flow and gas exchange in rainbow trout.
42. Dawson T. J. et al., Comp. Biochem. PhysioL, 31, 645—653, 1969. Metabolism of marsupial, Macropus.
43. Dawson T. J., Hulbert A. J., Amer. J. PhysioL, 218, 1233—1238, 1970. Standard metabolism of Australian marsupials.
44. Dawson W. R., Fisher C. D., Condor, 71, 49—53, 1969. Metabolism of nightjar.
45. Dawson W. R., Templeton J. R., Ecology, 47, 759—765, 1966. Metabolism of lizards.
46. Dawson W. R„ Tor doff H. B., Condor, 61, 388—395, 1959. Metabolism of birds.
47. Dehnel P. A., Nature, 181, 1415—1417, 1958; BioL Bull., 118, 215—249, 1960. Photoperiod, temperature, and salinity effects on oxygen consumption of crabs.
Кислород, дыхание и метаболизм
423
48 Dolk Н. Е., Postma N., Z. vergl. Physiol., 5, 417—444, 1927. Frog respira-48a ^Duerr F. G., Comp. Biochem. Physiol., 20, 391—398, 1967. Size-metabolism rolfltion in Lutnnaea. , ₽ ,
49 Dunlap D. G., Comp. Biochem. Physiol., 31, 555—570, 1969. Modification of metabolism in hylid frog, Acris. .
cm Edwards G. A., Physiol. Comp. OecoL, 2, 34—50, 1950; in: Insect Physiology,
° ed by K. D. Roeder, John Wiley and Sons, 1953, pp. 55—95. Hormone metabolism of Uca; insect respiration.
51 Elsner R. et al., Respir. Physiol., 9, 287—297, 1970. Cerebral tolerance to hy-noxemia in Weddell seals.
52 Enger P. S., Savalov P., J. Insect Physiol., 2, 232—233, 1958. Metabolism of tropical arthropods.
53 Eriksen С. H., Verh. Int. Verein Limnol., 15, 903—911, 1964. Effect of substrate on respiration of burrowing mayfly naiads.
54. Evans N. T. S., Respir. Physiol., 3, 21—37, 1967. Systemic oxygen supply to human skin. ___
55. Eyzaguirre C., Zapata P., J. Physiol. (London), 195, 557—588, 589—607, 1968. Acetylcholine and stimulation of carotid sinus.
56. Feigl F., Folkow B., Acta Physiol. Scand., 57, 99—110, 1963. Diving in ducks.
57. Feldmeth C. R., Comp. Biochem. Physiol., 32, 193—202, 1970. Respiratory energetics of caddis fly larvae.
58. Fenn W. O., Philpott M., Meehan C., Henning M., Amer. J. Physiol., 213, 663—670, 1967; also Fenn W. О., M. Henning, and M. Philpott, J. Gen. Physiol., 50, 1693—1708, 1967. Oxygen toxicity in Drosophila.
59. Ferrante F. L„ Amer. J. Physiol., 218, 363—371, 1970. Diving in nutria.
60. Fishman A. P., pp. 215—219, in: Sharks, Skates and Rays, ed. by P. W. Gilbert, R. F. Mathewson, and D. P. Rail. Johns Hopkins Press, 1967. Respiration and circulation in dogfish, Squalus.
61. Forster R. E., pp. 393—407, in: Oxygen in the Animal Organism, ed. by F. Dickens and E. Neil, Pergamon Press, 1965. Exchange of oxygen between blood and tissue.
62. Frankel H. M. et al., Comp. Biochem. Physiol., 31, 535—546, 1969. Respiratory responses of turtles to changes in blood gases.
63. Fry F. E. J., Publ. Ontario Fish Res. Lab., 68, 1—52, 1947. Effects of temperature and oxygen on animal activity.
64. Fuhrman F. A., Farr D. A., Helg. wiss. Meeresunters., 9, 324—329, 1964. Oxygen diffusion in rat diaphragm.
65. Galvao P. E., Tarasantchi J., Guertzenstein P., Amer. J. Physiol., 209, 501 — 506, 1965. Heat production of tropical snakes.
66. Gans C., Hughes G. M„ J. Exp. Biol., 47, 1—20, 1967. Mechanics of lung ventilation in tortoise.
67. Gerschman R., pp. 475—492, in: Oxygen in the Animal Organism, ed. by F. Dickens and E. Neil, Pergamon Press, 1965. Oxygen toxicity.
68. Gilchrist В. M., Proc. Roy. Soc. Lond., B, 143, 136—146, 1954; Hydrobiologia, 8. 54—65, 1956; 27—37, 1958. Hemoglobin, oxygen consumption by Artemia at different salinities.
68a. Glick J. L., Cohen W. D., Science, 143, 1184—1185, 1965. Nocturnal changes enzyme activity of liver mitochondria.
fiQb- Goff art M., Function and Form in the Sloth, Pergamon Press, 1971, 225 pp.
’ Gordon M. S., Bretinus J., Evans D. H., McCarthy R., Oglesby L. C., J. Exp. 7n 141—149, 1969. Respiration of amphibious fishes.
• Graham J. M., Canad. J. Res. D, 27, 270—288, 1949. Effects of temperature, 71 Oxygen pressure, and activity on metabolism of trout.
i. Grigg g. C., Comp. Biochem. Physiol., 29, 1253—1257, 1969. Critical O2 pres-79 ^i,res l°r bullhead fish.
’ C^’ J- Exp‘ Bio1” 52’ 565—568, 1970; Z. vergl. Physiol., 73, 439—
1, 1971. Countercurrent flow of blood and water in shark gill.
424
Глава 5
73. Guimond R. W., Hutchinson V. H., Comp. Biochem. Physiol., 27, 177—195t 1968. Temperature and photoperiod effects on gas exchange in frog.
73a. Hainsworth F. R., Wolf L. L., Science, 168, 368—369, 1970. Metabolism of hummingbirds.
74. Halcrow K., Boyd С. M., Comp. Biochem. Physiol., 23, 233—242, 1967. Oxygen consumption and swimming activity of Gammarus.
75. Hall F. G., Amer. J. Physiol., 88, 212—218, 1929, O2 withdrawal and consumption by marine fish.
76. Hanegan J. L., Heath J. E., J. Exp. BioL, 53, 611—627, 629—639, 1970. Activity patters and energaetics of Cecropia moth.
77. Haugaard N., Physiol. Rev., 48, 311—373, 1968. Cellular Oxygen toxicity.
78. Hemmingsen A. M., Rep. Steno Mem. Hosp. Nordisk Insulin Lab., 9, 1—110, 1960. Metabolism in relation to body size.
78a. Herried C. F., Bretz W. L., Schmidt-Nielsen K., Amer. J. Physiol., 215, 506— 508, 1968. Cutaneous gas exchange in bats.
79. Hill J. R., Rahimtulla K. A., J. Physiol. (London), 180, 239—265, 1965. Metabolism of human infants in relation to temperature.
80. Hill B. Potter I. C., J. Exp. BioL, 53, 47—57, 1970. O2 consumption in lamprey ammocoetes.
81. Hills B. A., Hughes G., Respir. Physiol., 9, 126—140, 1970. Theoretical analysis of countercurrent water and blood flow in fish gills.
82. Hinton H. E., J. Insect. Physiol., 4, 176—183, 1960; J. Marine BioL Assoc., 47, 319—327, 1967. Plastron respiration in eggs of blowfly and of a marine fly.
83. Hinton H. E., Adv. Insect. Physiol., 5, 65—162, 1968. Spiracular gills.
84. Hoar W. S., Canad. J. Zool., 36, 113—121, 1958. Thyroxin and gonadal steroids effects on metabolism of goldfish.
85. Holeton G. F., Randall D. J., J. Exp. BioL, 46, 297—305, 317—327, 1967. Effect of hypoxia on ventilation ane metabolism of rainbow trout.
86. Houlihan D. F., J. Insect PhysioL, 16, 1607—1622, 1970. Respiration of insects that respire from aquatic plants.
87. Hudson J. W., Bertram F. W., PhysioL Zool., 39, 21—29, 1966. Metabolism of skink, Lygosoma.
88. Hudson J. W., Kimzey S. L., Comp. Biochem. PhysioL, 17, 203—217, 1966. Metabolism of house sparrow.
89. Hudson J. W., Rummel J. A., Ecology, 47, 345—354, 1966. Metabolism of primitive rodents.
90. Hughes G. M., Soc. Exp. BioL Symp., 18, 81—107, 1964. Fish respiratory ho-meostasis
90a. Hughes G. M. et al., J. Exp. BioL, 55, 651—665, 1971. Metabolism of giant tortoise.
91. Hughes G. M., Ballintijn С. M., J. Exp. BioL, 43, 363—383, 1965. Respiratory pumps in dogfish.
92. Hughes G. M., Mill L., J. Exp. BioL, 44, 317—333, 1966. Patterns of ventilation in dragonfly larvae.
93. Hughes G. M., J. Exp. BioL, 45, 177—195, 1966. Gill areas in relation to respiration of fish.
94. Hughes G. M., Umezawa S. I., J. Exp. BioL, 49, 557—564, 565—582, 1968. Respiration of the dragonet and dogfish.
95. Hughes G. M., Roberts J. L., J. Exp. BioL, 52, 177—192, 1970. Respiration in rainbow trout.
96. Hughes G. M., Saunders R. L., J. Exp. BioL, 53, 529—545, 1970. Respiratory control in trout.
97. Hughes G. M., Singh B. N., J. Exp. BioL, 53, 281—298, 1970. Respiration in air-breathing fish, Anabas.
97a. Hughes G. M., Singh B. N., J. Exp. BioL, 55, 667—682, 1971. Gas exchange in catfish Sacobranchus.
98. Hughes G. M., Shelton G., pp. 275—364, in: Advantages in Comparative Phy-
Кислород, дыхание и метаболизм
485
siology and Biochemistry, Vol. 1, ed. by O. Lowenstein, Academic Press, 1962. Rpsniratory mechanisms and their nervous control in fish.
99 Hughes G M. et al., J. Exp. Biol., 51, 203—220, 1969. Control of gill ventila-У tion in crab, Carcinus.
Ю0 Hukuhara T., Okada H., Japan. J. Physiol., 6, 313—320, 1956. Respiratory center in fishes. , ,
Ю1 Jackson D. C„ J. Appl. PhysioL, 24, 503—509, 1968. Metabolic depression during diving in turtles.
102 Jackson D. C., Schmidt-Nielsen K-, J. Cell. Comp. PhysioL, 67, 225—232, 1961. Heat production in diving turtles.
103 Jackson D. C., Schmidt-Nielsen K., Proc. Nat. Acad. Sci., 51, 1192—1197, 1964. Countercurrent heat exchange in respiratory passages.
103a. Jesse M. J., Shub C., Fishman A. P., Respir. PhysioL, 3, 267—287, 1967. Control of respiration in lungfish.
104. Johansen K., Comp. Biochem. PhysioL, 18, 383—395, 1966. Air breathing in fish, Symbranchus.
105. Johansen K-, Fed. Proc., 25, 389, 1966. Chemoreception in respiration of lungfish.
106. Johansen K. et al., Respir. PhysioL, 9, 162—174, 1970. Stimulation of air breathing in fish, Amia.
107. Johansen K., Vadas R. L., BioL Bull., 132, 16—22, 1967. Critical oxygen pressure in sea urchins.
108. Johansen K., Petersen J. A., Z. vergl.. PhysioL, 71, 365—381, 1971. Metabolism of starfish.
109.
110.
111.
112.
113.
114.
115.
115a
116.
117.
118.
119.
120.
121.
122.
123.
124.
125.
Jones D. R., J. Exp. BioL, 44, 387—411, 1966; Comp. Biochem. PhysioL, 20, 691—707, 1967. Recovery from diving in amphibia.
Jones D. R., Comp. Biochem. PhysioL, 12, 297—310, 1964. Metabolism in swamp pulmonates.
Jones D. R., Randall D. J., Jarman G. M., Respir. PhysioL, 10, 285—298, 1970. Analysis of oxygen transfer in fish.
Kanwisher J. W., BioL Bull., 130, 96—105, 1966. Tracheal gas dynamics of cecropia silkworm.
Kayser C., Heusner A., J. PhysioL, Paris, 56, 489—524, 1964. Review of metabolism in relation to size and hibernation.
Kempner W., Cold Spring Harbor Symp., 7, 269—289, 1939. Role of oxygen tension in biological oxidations.
King E. N., Comp. Biochem. PhysioL, 15, 93—102, 1965. Oxygen consumption of intact crabs and excised gills.
Kinne O., Neth. J. Sea Res., 3, 222—244, 1966. Respiratory adaptations of marine invertebrates in different salinities.
Kleiber M., Cole H. H., Amer. J. PhysioL, 161, 294—299, 1950. Body size and metabolic rate in rats.
Kleiber M., The Fire of Life, John Wiley and Sons, 1961, 453 pp.
Knight A. W„ Gaufin A. R., J. Insect PhysioL, 12, 347—355, 1966. Oxygen consumption by stoneflies.
Kobayasi S., Tsuchiya S., Takahashi K, Japan. J. PhysioL, 11, 194—204, 1961. Rhythmic contractions in lung of toad.
Krebs H. A., Biochim. Biophys. Acta, 4, 249—269, 1950. Body size and tissue respiration.
Krogh A., Comparative Physiology of Respiratory Mechanisms, University of Pennsylvania Press, 1941, 172 pp.
Jyutty M. N., Marine Biol., 4, 239—242, 1969. Oxygen consumption in mullet, Liza, at different swimming velocities.
bon^df vergl- PhysioL, 54, 75—84, 1967. Reactions of honeybees to car-LG/itri S Edelman N. H., Respir. PhysioL, 6, 375—385, 1969. Respiratory sen-r ь- У *° hypoxia in mountain natives.
SzidonJ. P., Fishman A. P., Fed. Proc., 29, 1141—1148, ’ 1970. piratory and circulatory adjustments to hypoxia in lungfish.
426
Глава 5
126. Larimer J. L., Gold A. H., Physiol. Zool., 34, 167—176, 1961. Response of crayfish to respiratory stress.
127. Lasiewski R. C., Physiol. Zool., 36, 122—140, 1963; Condor, 64, 324, 1962. Metabolism of hummingbirds.
128. Lasiewski R. C., Amer. J. Physiol., 217, 1504—1509, 1969. Metabolism of poorwill.
129. Lasiewski R. C., Calder W. A., Respir. Physiol., 11, 152—166, 1971. Allometric analysis of respiratory variables in birds.
130. Lasiewski R. C., Dawson W. R., Condor, 66, 477—490, 1964; 72, 332—338, 1970. Metabolism of night hawk and of frog-mouth owl.
131. Lasiewski R. C., Dawson W. R., Condor, 69, 13—23, 1967. Relation between standard metabolism and body weight in birds.
132. Lasiewski R. C. et al., Comp. Biochem. Physiol., 23, 797—813, 1967; Auk, 84, 34—48, 1967. Metabolism of hummingbirds.
133. LeFebvre E. A., Auk, 81, 403—416, 1964. Energy metabolism of pigeon at rest and in flight.
134. Leitner P., Comp. Biochem. Physiol., 19, 431—443, 1966. Metabolism of bats.
135. Leitner P., Nelson J. E., Comp. Biochem. Physiol., 21, 65—74, 1967. Metabolism of vampire bat.
136. Lenfant C. et al., Respir. Physiol., 9, 277—286, 1970. Oxygen stores in diving mammals.
137. Lenfant C., Johansen K., J. Exp. Biol., 49, 437—452, 453—468, 1968. Respiration in lungfish, Protopterus.
138. Lewis J. B., Physiol. Zool., 41, 476—480, 1968. Respiration of sea urchin. Diadema.
139. Lindroth A., Arkiv Zool., ЗОВ, 1—7, 1938. Respiratory regulation in crayfish.
140. Loveland R. E., Chu D. S. K., Comp. Biochem. Physiol., 29, 173—184, 1969. Respiratory movements and pumping in Mercenaria.
141. Lord D. R., Bellrose I. C., Cochran W. W., Science, 137, 39—40, 1962. Telemetered flight in ducks.
142. MacMillen R. E., Nelson J. E„ Amer. J. Physiol., 217, 1246—1251, 1969. Metabolism of dasyurid marsupials.
143. MacMillen R. E., Trost С. H., Comp. Biochem. Physiol., 23, 243—253, 1967. Metabolism of Inca dove.
144. Mangum С. P., Comp. Biochem. Physiol., 10, 335—349, 1963. Oxygen consumption in different species of polychaete worms.
145. Mangum С. P., Amer. Sci., 58, 641—647, 1970. Respiratory physiology in annelids.
146. Marvin D. E„ Heath A. G., Comp. Biochem. Physiol., 27, 349—355, 1968.
Cardiac and respiratory responses to hypoxia in three species of fish.
147. McLeese D. W., Helg. wiss. Meeresunters., 10, 7—18, 1964. Oxygen consumption of lobster.
148. McMahon B. R., J. Exp. Biol., 52, 1—16, 1970. Gas exchange across lungs and gills in African lungfish.
149. McNab В. K., Comp. Biochem. Physiol., 26, 337—343, 1968. Effect of fat on basal metabolism of desert rodents.
149a. McNab В. K., Morrison P., Ecol. Monogr., 33, 63—82, 1963. Metabolism of Peromyscus.
150. Miller P. L., J. Exp. Biol., 39, 513—535, 1962. Control of spiracles in dragonflies.
151. Mines A. H„ Sorenson S. C., J. Appl. Physiol., 28, 826—831, 1970. Ventilatory responses of goats to hypoxia.
152. Moberly W. R., Comp. Biochem. Physiol., 27, 1—20, 1968. Oxygen consumption of iguana.
152a. Moore H. B., McPherson B. F., Bull. Marine Sci., 15, 855—871, 1965. Productivity, sea urchins.
153. Morrison P., Ryser P., Physiol. Zool., 37, 90—103, 1959. Metabolism of small mammals.
Кисло род, дыхание и метаболизм
427
Munz F. W., Morris R. W., Comp. Biochem. Physiol., 16, 1—6, 1965. Oxygen Physiol., 10, 161-158, 1970. Water 349-357, 1970. Respiratory patterns in crocodilian reptiles. .
National Academy of Sciences, Handbook of Respiration, W. B. Saunders Co., ^Newell R.^C., Courtney W. A. M., J. Exp. Biol., 42, 45—57, 1965. Respiratory movements in Holothuria.
- - - r-----.n
lizards. „ „ „
Metabolism of Myotis.
Olsen C. R., Elsner R., Hale F. C., Science, 63, 953—955, 1969. The «blow» of the pilot whale. _ . _ __~
nescence probe for O2.
Otis A. B., pp. 315—321, in: Oxygen in the Animal Organism, ed. by F. Dickens and E. Neil, Pergamon Press, 1965. Response of man to alti-
154.
155.
156.
157.
158.
158а. 'Nielsen В., J. Exp. BioL, 39, 107—117, 1962. Regulation of respiration in
159. ^O’Farrell M. J., Studier E. H., Comp. Biochem. Physiol., 35, 697—703, 1970. Metabolism of Myotis.
160. Olsen C. R., Elsner R., Hale F. C., Science, 63, 953—955, 1969. The «blow» of the pilot whale.
160a. Oshino R. et al., Biochem. Biophys. Acta, 273, 5—17, 1972. Bacterial lumi-
161.
162.
163.
163a.
164.
165.
166.
167.
168.
169.
169a.
170.
171.
172.
172a.
173.
173a.
174.
175.
176.
tude.
Pearson О. P., Condor, 52, 145—152, 1950. Metabolism of humming-birds.
Peterson D. F., Fedde M. R., Science, 162, 1499—1501, 1969. CO2 receptors in lungs of chickens.
Phleger C. F., Benson A. A., Nature, 230, 122, 1971. Hyperbaric oxygen in some deep sea fish.
Pickwell G. V., Comp. Biochem. Physiol., 27, 455—485, 1968. Metabolism of ducks during diving.
Puper J., Baumgarten D., Meyer M., Comp. Biochem. Physiol., 36, 513—520, 1970. Effect of hypoxia on respiration and circulation in dogfish.
Platzer-Schultz I., Z. vergl. Physiol., 67, 179—185, 1970. Oxygen consumption, life stages of Chironomus.
Prosser C. L. et al.. Physiol. Zool., 30, 137—141, 1957. Acclimation to reduced oxygen in goldfish.
Rahn H., pp. 3—23, in: Ciba Foundation Symp. on Devel. of Lung, ed. by A. V. S. de Reuck and R. Porter, 1966. Gas transport from environment to cell.
Rahn H., West J. B., The Physiologist, 6, 259, 1963. Comparison of air and water breathing.
Rahn H., Yokoyama T., eds., Physiology of Breath-Holding; the Ama of Japan. Publ. 1341, Nat. Acad. Sci. Washington, 1967, 369 pp.
Ralph R., Everson I., Comp. Biochem. Physiol., 27, 299—307, 1968. Respiration of Antarctic fish.
Randall D. J., Holeton G. F., Stevens E. D., J. Exp. Biol., 46, 339—348, 1967. Respiratory efficiency in trout.
Randall D. J., Shelton G„ Comp. Biochem. PhysioL, 9, 229—339, 1963. Respiratory responses to O2 lack and CO2 excess in fish, Tinea.
Reid K. R. H., Comp. Biochem. PhysioL, 7, 89—101, 1962. Relation between body size and O2 consumption, brachiodonts.
R^ync^arje C. et al., J. Appl. PhysioL, 24, 93—97, 1968. Erythropoiesis at high Richards E. D., Fromm P., Comp. Biochem. PhysioL, 29, 1063—1070, 1968. Blood flow in gills of trout.
Ridgway W. H., Johnston D. G., Science, 151, 456—457, 1966. Blood oxygen and ecology of porpoises.
Rising J. D., Comp. Biochem. PhysioL, 25, 327—333, 1969; 31, 915—925, 1969.
Metabolism of orioles and sparrows.
^almoiraghi G. C., von Baumgarten R., J. NeurophysioL, 24, 203—218, 1961. Electrical responses from respiratory neurones in brain of cat.
428
Глава 5
176а. Salt W. G., Biol. Rev., 39, 113—136, 1964. Respiratory evaporation in birds.
177. Satchell G. H., Comp. Biochem. Physiol., 27, 835—841, 1968. Neurological basis for swimming and respiration in dogfish.
178. Schmidt-Nielsen K. et al., Respir. PhysioL, 9, 263—276, 1970. Countercurrent heat exchange in respiratory passages.
178a. Schmidt-Nielsen K. et al., J. Cell. PhysioL, 67, 63—72, 1966. Oxygen consumption in echidna.
179. Schneiderman H. A., Schechter A. N., J. Insect PhysioL, 12, 1143—1170, 1966. Discontinuous respiration in insects.
180. Schneiderman H. A., Williams С. M., BioL Bull., 109, 123—143, 1955. Discontinuous respiration in silkworm.
181. Schreuder G. R., Exp. ParasitoL, 2, 236—241, 1953; 5, 138—148, 1956. Intermediary metabolism of hemoflagellates.
182. Schroeder L., Dunlap D. G., Comp. Biochem. PhysioL, 35, 953—957, 1970. Respiration in cecropia moths.
183. Schwartz E., Z. vergl. PhysioL, 65, 324—339, 1969. Respiration in air-breathing fish.
184. Severinghaus J. W., Brainton C. R., Carcelen A., Respir. PhysioL, 1, 308—334, 1966. Respiratory insensitivity to hypoxia in chronically hypoxic man.
185. Shelton G., Respir. PhysioL, 9, 183—196, 1970. Circulatory adjustments to periodic respiration in Xenopus.
186. Shimada K., Kobayasi S., Acta Med. BioL, 13, 297—303, 1965. Neural control of pulmonary smooth muscle in toad.
186a. Singh B. N., Hughes G. M., J. Exp. BioL, 55, 421—434, 1971. Respiration in air-breathing catfish.
187. Smit H. et al., Comp. Biochem. PhysioL, 39A, 1—28, 1971. Oxygen consumption of goldfish.
188. Smith R. E„ Ann. N. Y. Read. Sci., 62, 403—422, 1956. Relation between mitochondrial properties and body size in mammals.
189. Spitzer K. W, Marvin D. E„ Heath A. G., Comp. Biochem. PhysioL, 30, 83—
90, 1969. Effects of temperature on respiration and cardiac response of bluegill sunfish to hypoxia.
190. Stahl W. R., J. Appl. PhysioL, 22, 453—460, 1967. Scaling of respiratory variables in mammals.
191. Steen J. B., Rruysse A., Comp. Biochem. PhysioL, 12, 127—142, 1964. Respiratory function of fish gills.
192. Stevens E. D., Randall D. J., J. Exp. BioL, 46, 307—315, 329—337, 1967. Effects of exercise on respiration in rainbow trout.
193. Taylor C. R„ Schmidt-Nielsen K„ Raab J. L., Amer. J. PhysioL, 219, 1104— 1107, 1970. Oxygen consumption during running, mammals of different si-zes.
194. Teal J. M., Carey F. G., Deep-Sea Res., 14, 725—733, 1967; Limnol. Oceanogr.,
12, 548—550, 1967. Effect of pressure and temperature on respiration of . euphausiids. \
195. Teal J. M., Carey F. G., PhysioL, ZooL, 40, 83—91, 1967. Metabolism of marsh
crabs at reduced oxygen levels. |
196. Thomas H. J., J. Exp. BioL, 31, 228—251, 1954. Oxygen uptake of Homarus. 10
197. Thompson R. K„ Pritchard A. W„ BioL Bull., 136, 274—287, 1969. Respiratory adaptation of burrowing crustaceans.
198. Thomsen E., J. Exp. BioL, 26, 137—149, 1949. Hormone effects on metabolism in flies.
199. Thorpe W. H., BioL Rev., 25, 344—390, 1950. Plastron respiration in aquatic insects.
199a. Todd E. S., BioL Bull., 130, 263—288, 1966. Air breathing by mudsucker.
200. Tucker V. A., Science, 154, 150—151, 1966. Oxygen consumption of a flying bird.
201. Tucker V. A., J. Exp. BioL, 48, 55—66, 1968. Respiration of sparrows in high altitude flight.
Кислород, дыхание и метаболизм 429
902 Tucker V. A., J. Exp. BioL, 48, 67—87, 1968. Respiration and evaporative wa-2 ' ter loss in flying budgerigar.
203 Tucker V. A., Comp. Biochem. Physiol., 34, 841—846, 1970. Energetics of locomotion.
204- Tucker V. A., Amer. Zool., 11, 115—124, 1971. Energetics of flight and walking.
905 Veghte J. H., Physiol., Zool., 37, 316—328, 1964. Metabolism of gray jay.
206. Vernberg F. J., Gray I. E., Biol. Bull., 104, 445—449, 1953. Oxygen consumption by tissues of teleosts of different sizes.
207. Vlasblom A. G., Comp. Biochem. Physiol., 36, 377—385, 1970. Oxygen transfer by physical gill in acquatic insects.
208. Walker J. G., Biol. Bull., 138, 235—244, 1970. Oxygen poisoning in annelid, Tubifex.
209- Walshe В. M., J. Exp. Biol., 25, 35—44, 1948. Oxygen requirements of chiro-nomid larvae.
210. Wang L. C., Hudson J. W., Comp. Biochem. Physiol., 32, 275—293, 1970; 38A, 59—90, 1971. Metabolism of chipmunk and Perognathus.
211. Webb H. M., Brown F. A., Physiol. Rev., 39, 127—161, 1959. Biological rhythms.
212. Weis-Fogh T., J. Exp. Biol., 47, 561—587, 1967. Respiration and tracheal ventilation in flying insects.
213. Wells G. P., Proc. Roy. Soc. Lond. B, 140, 70—82, 1932; J. Marine Biol. Assoc. U.K., 28, 447—464, 1949. Respiratory movements in polychaetes, especially Arenicola.
214. Whalen W. J., The Physiologist, 14, 69—82, 1971. Intracellular oxygen concentrations in muscle.
215. Whiford W. G., Hutchison V. H., Copeis, 573—577, 1966. Pulmonary and cutaneous gas exchange in salamanders.
216. Whitmore С. M., Warden С. E., Dondaroff P., Trans. Amer. Fish Soc., 89, 17—26, 1960. Behavior of fish in oxygen gradient.
217. Wiens A. W., Armitage К. B., Physiol. Zool., 34, 39—54, 1961. Oxygen consumption of crayfish as a function of temperature and O2 saturation.
218. Wieser W., Z. vergl. Physiol., 45, 247—271, 1962. Oxygen consumption of land isopods.
219. Wieser W., J. Marine Biol. Assoc. U. K-, 42, 665—682, 1962. Adaptations of intertidal isopods.
Глава 6
Промежуточный обмен: сравнительные аспекты
П. ХОЧАЧКА
Метаболические пути
Введение
Существует классическое разделение путей обмена на катаболические и анаболические. К первым относятся главным образом пути процессов деградации, идущих с высвобождением энергии; в этих процессах большие органические молекулы расщепляются на простые компоненты. Ко второй категории относятся процессы синтеза, в результате которых из простых предшественников образуются сложные органические компоненты клеток; эти процессы часто включают восстановительные реакции, идущие с затратой энергии. Необычайное многообразие метаболитов, участвующих в обменных процессах у различных организмов, уравновешивается не менее поразительной упорядоченностью и простотой систем метаболизма. , Среди этих систем нет более важной, чем центральная область метаболизма, связывающая катаболические и анаболические пути.
Крупные молекулы, расщепляясь на начальных анаэробных этапах катаболизма, дают наряду с СОг и Н2О сравнительно небольшую группу малых органических молекул. При этом высвобождается примерно одна треть доступной свободной энергии. Из более сложных углеводов образуются триозофосфаты и (или) пируват, из жиров — ацетил-КоА, пропионил-КоА и глицерин, из белков— ацетил-КоА, оксалоацетат, а-кетоглутарат, фумарат и сукцинат.
Список сокращений
Метаболиты
АМФ, АДФ, АТФ — аденилаты: аденозинмоно-, ди- и трифосфат
Г-1-Ф — глюкозе-1-фосфат
Г-З-Ф — глицеральдегид-3-фосф ат
Г-6-Ф — глюкозо-6-фосфат а-,Г Ф — а-,глицерофосфат ДОАф — диоксиацетонфосфат 1,3-ДФГ — 1,3-дифосфоглицерат а-КГ — а-кетоглутарат КоА —кофермент А
НАД '(НАД-Н) — окисленный ‘(восстановленный) никотинамидаденинди-«уклеотид
НАДФ |(НАДФ-Н) — окисленный (восстановленный) никотинамидаденинди-нуклеотид-фосфат
ОАц — оксалоацетат
СЖК — свободная жирная кислота
УД ФАГ — уридиндифосфат-ацетилглюкозамин
Промежуточный обмен: сравнительные аспекты
431
УДФГ — уридиндифосфатглюкоза
ФАД '(ФАД-Нг) — окисленный '(восстановленный) флавин адениндинуклеотид
ФДФ — фруктозодифосфат
ФЕ1П — фосфоен'олпируват
6-ФГ — б-фосфо глюконат
ФГА — фосфоглицерат
Ф-1 -Ф — фруктозо-1 -фосфат
Ф-6-Ф — фруктозо-б-фосфат
Ферменты ГК — гексокиназа Г-6-Фаза — глюкозо-6-фосфатаза Г-6-ФДГ —• глюкозо-б-фосфатдегидрогеназа ИД Г — изоцитратдегидрогеназа ЛДГ — лактатдегмдрогеназа МД Г — малатдегидрогеназа ПК —пируваткиназа ТДГ —• триозофосфатдегидрогеназа ФГМ — фосфоглюкомутаза ФФК — фосфофруктокиназа
ФЕП-кар'боксикиназа — фосфоенолпируват-кар'боксикиназа ФДФаза — фруктозодифосфатаза
Весьма существенным объединяющим моментом в биохимии является то, что при участии одной и той же системы реакций осуществляются три важнейшие фазы метаболизма: 1) взаимопревращение упомянутых выше продуктов катаболизма, 2) их полное сгорание до СО2 и Н2О, приводящее к высвобождению в организме оставшихся двух третей доступной свободной энергии, и 3) образование главных промежуточных продуктов, необходимых для биосинтетических (анаболических) процессов. Эти центральные пути состоят из относительно небольшого числа реакций. В основном это следующие этапы: триозофосфат^пируват; пируват—>ацетил-КоА; оксалоацетат^аспартат; а-кетоглутарат^глутамат, а также реакции цикла лимонной кислоты, предназначенные для того, чтобы катализировать полное сгорание ацетил-КоА до СО2 и Н2О.
Анаболическая и катаболическая ветви метаболизма существенно отличаются друг от друга тем, что их конкретные ферментативные пути редко совпадают в деталях. Это различие очевидно, когда продукт катаболизма не идентичен первоисточнику углерода при анаболизме, как, например, в обмене многих аминокислот. В случае жирных кислот и конечным продуктом катаболизма, и исходным предшественником в процессе биосинтеза является ацетил-КоА. Однако ферментативные реакции синтеза и деградации жирных кислот отличаются друг от друга и протекают в разных участках клетки. Биосинтез глюкозы осуществляется в значительной части путем обращения реакций гликолиза, но и здесь в ряде критических пунктов имеются различия. Например, превращение глюкозы в глюкозо-6-фосфат при катаболизме требует участия АТФ, обратная же реакция при анаболизме носит характер простого гидролиза Г-6-Ф. Пи
432
Глава 6
руват образуется при катаболизме путем трансфосфорилирования— переноса фосфата ФЕП на АДФ, тогда как процесс использования пирувата при глюконеогенезе у большинства организмов состоит из двух связанных между собой реакций: сначала пируват карбокси-лируется, превращаясь в оксалоацетат, а затем последний превра-щается в ФЕП. Из сказанного следуют два важных вывода. Во-первых, оба пути — анаболический и катаболический — не могут одновременно работать с максимальной интенсивностью, так как это привело бы к своего рода «короткому замыканию». Во-вторых, регуляция таких парных путей должна быть в какой-то мере интегрирована. Это последнее обстоятельство приводит к очень тесной взаимосвязи соответствующих путей анаболизма и катаболизма. Обсуждение материала в настоящей главе построено с учетом этих важнейших соображений.
Пути гликолиза и глюконеогенеза
В большинстве клеток главный путь катаболизма глюкозы и гликогена включает серию реакций, в результате которых глюкоза превращается в пируват. Этот путь используется при осуществлении таких различных физиологических функций, как сокращение скелетной мышцы (иногда в относительно анаэробных условиях), сокращение сердца (в относительно аэробных условиях) и перенос ионов в центральной нервной системе, почечных канальцах и эритроцитах, а также во многих случаях «сбраживания» глюкозы у беспозвоночных— факультативных анаэробов. Так как этот путь не требует присутствия кислорода, его рассматривают как первичный механизм, доставляющий клеткам необходимую энергию в полностью анаэробных условиях [154]. В большинстве тканей позвоночных первый конечный продукт этого пути — пируват — восстанавливается в лактат НАД-Н-зависимой лактатдегидрогеназой. У беспозвоночных весьма обычны другие метаболические превращения пирувата, которые мы рассмотрим позже.
Согласно общепринятым представлениям, главный путь синтеза глюкозы из пирувата включает его карбоксилирование и превращение образующегося при этом оксалоацетата в ФЕП, после чего следует серия реакций, завершающихся образованием глюкозы. Разумеется, в случае 4-углеродных предшественников карбоксилирование пирувата перестает быть необходимым и сразу образуется оксалоацетат.
На рис. 6-1 представлена ситуация, характерная для сложных тканей, например печени. На схеме указан ряд ключевых реакций обоих путей в точках, соответствующих обмену гликогена, Г-6-Ф, Ф-6-Ф и ФЕП. Во всех этих точках ферменты, катализирующие катаболические и анаболические реакции, различны и в кинетическом и в структурном отношении. Однако на некоторых участках — от Г-1-Ф до Ф-6-Ф и от ФДФ до ФЕП — прямые и обратные реак-
Промежуточный обмен: сравнительные аспекты'433
по-видимому, вполне соответствуют друг другу. Данные об Ц ом правда, не бесспорны, они не исключают того, что и здесь веются ферментативные этапы, присущие только глюконеогенезу. Известно, например, что триозофосфатдегидрогеназа существует по меньшей мере в двух кинетически различимых формах — мышечная форма благоприятствует гликолизу, тогда как в печени содержится форма, кинетически более приспособленная для глюконеогенеза.
ФДФ
Триозо.-Ф
Сукцинат Фумарат Малат Глутамат Пролин Аспартат
Аланин Серин Цистеин
7 Лактат
Рис. 6-1. Пути гликолиза и глюконеогенеза и некоторые пути обмена Г-6-Ф.
Для того чтобы понять, как работают эти пути катаболизма и анаболизма, необходимо знать факторы, регулирующие или ограничивающие прохождение по ним углерода. Первый и наиболее простои подход к этой проблеме основан на определении относительных величин максимальной каталитической активности соответствующих ферментов при оптимальных концентрациях субстратов, модуляторов, pH и т. д. Полученные результаты, если они верны, позво-яют установить верхнюю границу способности данной ткани кагатировать тот или иной метаболический процесс и могут помочь в ничен6НИИ ТеХ реакций’ для КОТОРЬ1Х возможности катализа огра-28—1332
434
Глава 6
•На пути от глюкозы до пирувата три фермента — гексокиназа фосфофруктокиназа (ФФК) и пируваткиназа (ПК) — присущ^ только системе гликолиза (табл. 6-1). Так как реакция ФФК в большинстве случаев может быть этапом, лимитирующим скорость степень регуляции гликолиза можно оценить, сопоставив мощность этого фермента с наблюдаемыми скоростями гликолиза (табл, 6-1). Такое сопоставление показывает, что гликолитический путь, по-видимому, чаще всего работает на один-два порядка слабее своих возможностей.
Таблица 6-1
Максимальная активность специфических ферментов гликолиза в тканях крысы при 37 °C, мкМ/мин на 1 г сухого веса (по Скраттону и Аттеру [127])
Фермент или процесс Печень Почки Мышца Сердце ГОЛОВНОЙ мозг
ГК (с низкой Км) 0,7 7,9 1,8 10 17
ГК (с высокой Км) 4,3 — — — —
ФФК 3,3 5,7 80 20 33
ПК 50 50 780 167 200
Гликолиз, мкМ использованной глюкозы 0,2 0,17 0,03 (в покое) 1,7 (при тетанусе) о,о (аэробные условия) ‘ 2,8 (анаэробные условия)
Высокие 'величины максимальной активности ПК, ФЕП-карбо-ксикиназы, ФДФазы и Г-6-Фазы — ферментов, действующих только на пути пируват—^глюкоза, — обнаруживаются только в тех тканях, которые интенсивно синтезируют глюкозу, например в печени и почках (табл. 6-2). Сравнение этих величин для ПК и ФЕП-карб-оксикиназы со скоростями синтеза глюкозы из 3- и 4-углеродных предшественников показывает, что этот путь функционирует с использованием примерно !/з—V2 максимальной мощности указанных ферментов. Это соотношение резко отличается от только что описанного для пути гликолиза.
Таблица 6-2
Максимальная активность специфических ферментов глюконеогенеза в тканях крысы при 37 °C, мкМ/мин на 1 г сухого веса (по Скраттону и Аттеру [127])
Фермент или процесс Печень Почка Мышца Сердце Головной мозг
Пируваткарбоксилаза 6,7 5,8 0 0 0,5
ФЕП-карбоксикиназа 6,7 6,7 <0,1 0,5 0,3
ФДФаза 15 17 0,7 0,7 2,3
Г-6-Фаза Глюкогенез, мкМ пирувата, превращенного в глюкозу 17 1,7 13 1,4 2 0
Промежуточный обмен: сравнительные аспекты
435
ферменты глюконеогенеза могут встречаться и в других тканях /например, в головном мозгу, сердце, мышце), участвуя там в различных физиологических функциях [97]. Обычно максимальная мощность ферментов, общих для гликолиза и глюконеогенеза, очень высока; в этом отношении нет существенных различий между строго гликолитическими и глюконеогенными тканями (табл. 6-3).
Таблица 6-3
Максимальная активность ферментов, общих для гликолиза и глюконеогенеза, в тканях крысы при 37 °C, мкМ/мин на 1 г сухого веса (по Скраттону и Аттеру [127])
Фермент Печень Почка Мышца Сердце Головной мозг
фДФ-альдолаза 10 10 77 24 17
Триозофосфатдегидрогеназа 170 200 590 180 160
3-фосфоглицер аткиназа 150 170 340 150 150
Енолаза 17 53 210 20 30
лдг 230 170 490 450 130
В табл. 6-4 приведены величины максимальной каталитической активности для ферментов обмена гликогена и пентозофосфатного пути. Если предположить, что фосфорилаза in vivo участвует только в расщеплении гликогена, то гликогенолитическая активность большинства тканей окажется по меньшей мере на порядок выше их способности к синтезу гликогена. Сравнение различных тканей млекопитающих показывает, что максимальная интенсивность общего обмена гликогена, в коре почек и головном мозгу ниже, чем в печени, сердце и мышцах. Это согласуется с фактом отсутствия гликогена в нормальных тканях почки и мозга.
Таблица 6-4 Максимальная активность ферментов обмена гликогена и пентозофосфатного пути в тканях крысы при 37 °C, мкМ/мин на 1 г сырого веса (по Скраттону и Аттеру [127])
Фермент Печень Почка Мышца Сердце Головной мозг
Фосфоглюкомутаза УДФГ-пирофосфорилаза 1 ликогенсинтетаза1) Фосфорилаза1) ОДана суммарная активность рг Как полагают, метабол в том, что он обеспечивает сов (в частности, для синт Теза нуклеотидов и нуклеш 43 3 5 37 13ЛИЧНЫХ фс шческая НАДФ-еза жир иовых кг 7 0,5 >рм фермеш роль ш Н для б ных кис [СЛОТ. Су 100 3 4 100 га. жтозноп иосинте! лот) и п гдя по ре 20 4 36 э цикла гических ентозы i ;зультат< 7 1,2 состоит процес-гля син-1м опре-
28*
436
Глава 6
делений in vivo, доля пентозного цикла в обмене Г-6-Ф во всех тканях, за исключением жировой, составляет менее 5%. В печени крысы максимальная каталитическая активность первых двух фер. ментов, характерных для этого пути, выше, чем активность фф|^
Печень_______
Жирные __________
кислоты g________
| Кетоновые тела -
Кора почек
COz
/ликоген |. .
ГБ-ф-^рр Пируват г Н Jt Глюкоза Лактат
Кетоновые Ацетил-тела —=► Ко А
Г-6-Ф
^Пируват
Глюкоза Лактат
Глюкоза
Глико-.—± г-6-Ф ген ' ।
Глюкоза
Глико- I _
Глюкоза
Г-6-13
Пируват
Ацегпил-КоА
_____COz
Мозг
Лак-1 Пируват mam 1
__ .^Кирные-^АцЪтип-нислоты Л Ко А Кетоно-/ J п вь/е тела ^гО
П
Лактат
Жирные кислоты Кетона- , Гые тела
'Пируват
Ацетил-Кор
Мышца
_______COz
Сердце
Рис. 6-2. Пути углеводного обмена и другие связанные с ним метаболические пути в различных тканях '[127].
и гликогенсинтетазы (см. табл. 6-1 и 6-4). Слабое участие пентозо-фосфатного цикла в общем обмене Г-6-Ф нельзя поэтому объяснить исходя из величин максимальной активности ферментов, конкурирующих за Г-6-Ф.
Качественные различия между некоторыми тканями представлены на рис. 6-2. Поступление метаболитов из каждой отдельной ткани в кровь и их поглощение различными тканями из крови количественно как следует не изучены; однако в качественном отношении ясно, что мозг, мышцы и, возможно, сердце должны получать глюкозу из крови, тогда как печень и почки могут отдавать глюкозу в кровь для последующего использования другими тканями. Подобные тканевые различия четко выражены и для общего обмена лактата и жирных кислот (рис. 6-2). Более детальное описание этих метаболических путей можно найти во всех современных учебниках биохимии, так что нет надобности еще раз описывать их.
Пути гликолиза и глюконеогенеза имеются, по-видимому, У всех представителей животного царства; данные об их существова-
П ро межуточный обмен: сравнительные аспекты 437
«" 1,1
ии у различных филогенетических групп организмов должным об-пазом рассмотрены в других работах; здесь же мы лишь проиллюстрируем на примере немногих систем роль этих путей в приспособлении к условиям жизни.
Пути гликолиза и глюконеогенеза у различных организмов
Гликолиз и глюконеогенез у паразитических червей: метаболическая адаптация к низким давлениям кислорода. Одну из самых интересных биохимических адаптаций мы находим при изучении перехода от аэробиоза к анаэробиозу у паразитических Metazoa. Способность многих паразитов использовать уникальную внутриорга-низменную среду связана с выпадением определенных ферментативных реакций и изменением кинетических свойств оставшихся ферментов.
Факторы среды играют решающую роль в метаболических системах паразитических червей; поэтому было бы неосторожно переносить данные, полученные на гельминтах, на свободноживущие формы. Тем не менее три независимых факта — наличие гликолитических ферментов, присутствие промежуточных продуктов гликолиза и предсказуемое распределение метки в конечных продуктах после введения глюкозы, специфически меченной 14С, — говорят о том, что начальные фазы гликолиза у гельминтов протекают обычным образом. В то же время заключительные реакции гликолиза часто бывают резко изменены в соответствии с главной особенностью образа жизни — анаэробиозом, нередко встречающимся в нормальном жизненном цикле гельминтов и других паразитов. Обзор этих материалов дают Бранд [153], Рид [111] и другие авторы.. Мы же сосредоточим свое внимание на кишечном паразите Ascaris lumbricoides, у которого метаболизм изучен, пожалуй, лучше, чем у всех остальных гельминтов.
Трудности, с которыми встречаются кишечные паразиты вроде A. lumbricoides, легче всего понять, представив себе результаты строгого анаэробиоза у какого-либо типичного многоклеточного организма. Катаболизм глюкозы мог бы в этом случае идти только До уровня лактата. У аэробного организма возобновление доставки Ог после кратковременной аноксии восстанавливает нормальную Цепь реакций и активирует процессы глюконеогенеза в печени, паразитов такой выход из положения невозможен. Поэтому для жизни в анаэробной среде у них должны были выработаться биохимические адаптации, позволяющие обходить подобные «тупики» Метаболизма. Именно это и произошло у гельминтов (рис. 6-3).
Начальные фазы катаболизма углеводов у паразитов сходны с путем гликолиза в аэробных клетках. Важные отличия обнаруживаются на уровне фосфоенолпирувата (ФЕП). Обмен этого вещества, которое у типичных аэробных многоклеточных организмов
438
Глава 6
превращается в пируват (а затем восстанавливается в лактат), отходит от обычного пути гликолиза в сторону синтеза оксалоацета-та. Последний подвергается ряду превращений, по сути дела представляющих собой инвертированный и сокращенный сегмент цикла Кребса (см. стр. 474). Конечный продукт этих превращений — сукцинат, который в отличие от лактата отнюдь не является метаболическим «тупиком». Он может быть использован для синтеза пропионата, так что вся эта цепь ферментативных реакций в конце концов
Цитозоль
Глюкоза
^-КАД -------ч
у^НАД-Н ФЕП
Пируват ч, th-
ОАц
*
z---^НАД-Н
х.--уНАД----У
Малат ------------
Митохондрия
Ацетил-КоА-
// Цитрат (evnafau, хтитрт
I реакции цикла
\ /(реПса а-Кетоглутарат
ОАЦ I
----------------1 -------
Г
Сукцинат
Н z---*НАД
---7НАД-Н
Малат Фумарат
Рис. 6-3. Предполагаемый путь использования глюкозы в мышцах Ascaris {123, 125].
может вести к синтезу липидов, а не к накоплению кислого конечного продукта вроде лактата.
В некоторых особенностях этой системы можно видеть специфические адаптации, которые служат для поддержания надлежащих направлений и скоростей потока углерода в анаэробных условиях. Перечислим эти адаптации.
1. Низкая активность пируваткиназы позволяет избежать образования лактата, которое было бы метаболическим тупиком. «Недостаточность» этого фермента предотвращает значительную аккумуляцию пирувата в результате расщепления ФЕП. Кроме того, в тканях Ascaris низка и активность лактатдегидрогеназы (ЛДГ), так что образующийся пируват не может в значительном количестве восстанавливаться в лактат.
2. У Ascaris в отличие от млекопитающих и птиц действие ФЕП-карбоксикиназы, по-видимому, благоприятствует синтезу ок-салоацетата, а не образованию ФЕП. Кинетическая основа этой
Промежуточный обмен: сравнительные аспекты 439
особенности — повышенное сродство к оксалоацетату. Кроме того, оксалоацетат, образовавшийся под действием ФЕП-карбоксикина-зы в физиологических условиях быстро удаляется малатдегидрогеназой, превращаясь в малат. В результате концентрация оксало-ацетата поддерживается на таком низком уровне, что не происходит значительного обращения реакции, катализируемой ФЕП-карбокси-киназой, в сторону образования ФЕП.
3. «Обычной» функцией ЛДГ у большинства организмов является регенерация НАД для дальнейшего осуществления гликолиза, у Ascaris эту функцию берет на себя активная малатдегидрогеназа (МДГ). В отличие от реакции ЛДГ реакция МДГ играет очень важную роль в главном потоке углерода, проходящем через эту точку. Продукт этой реакции — малат—быстро и обратимо превращается под действием фумаразы в фумарат.
4. Конечной специфической адаптацией метаболизма гельминтов на этом уровне является восстановление фумарата в сукцинат, катализируемое сукцинатоксидазой. У большинства организмов этот фермент служит для окисления сукцината, т. е. участвует в одном из наиболее характерных звеньев цикла Кребса, тогда как у Ascaris эта система, по-видимому, лучше приспособлена для превращения фумарата в сукцинат. Образующийся при этом НАД, вероятно, используется для продолжения процесса гликолиза [123], а сукцинат может превращаться в пропионат, который в форме пропионил-КоА служит важным предшественником при синтезе жирных кислот.
Тип анаэробного обмена, свойственный Ascaris, явно обладает большей гибкостью, чем типичный метаболизм позвоночных, и очевидно, что он выработался у паразитических червей в результате естественного отбора. У Ascaris отбор сформировал пути энергетического обмена таким образом, что произошло полное выпадение функции цикла Кребса и вид целиком переключился на преимущественно анаэробный тип обмена. Выпавшие ферменты соответствуют первому участку цикла Кребса — это цитратсинтаза, аконитаза, изоцитратдегидрогеназа и а-кетоглутаратдегидрогеназа. Такое выпадение — столь же очевидный элемент адаптации к анаэробиозу, как и специфические видоизменения заключительных реакций гликолиза.
Однако для тех гельминтов, в жизни которых анаэробные условия регулярно чередуются с аэробными, более выгодным было бы сохранение ферментов аэробного обмена. Можно ожидать, что в различных группах червей, охватывающих весь спектр от свободно-Живущих форм до высокоспециализированных паразитов, мы найдем и все градации зависимости от аэробного или анаэробного метаболизма. Ascaris — это крайний представитель всего ряда, обли-татный анаэроб. У других гельминтов (например, у Echinococcus granulosus) сохранились ферменты цикла Кребса, исчезнувшие у Ascaris [153]. Неизвестно, функционируют ли они при обычных
440
Глава 6
условиях паразитической жизни, скорее всего — нет; однако в аэробных условиях они, без сомнения, активны. Подобные организмы являются, таким образом, факультативными анаэробами Механизмы, участвующие в переключении с анаэробного обмена на аэробный, пока еще сколько-нибудь детально не изучены. ДЛя заполнения этого пробела в наших знаниях необходимо дальнейшее сравнительное исследование паразитических и свободноживу-щих червей.
Для синтеза глюкозы из неуглеводных предшественников важна также реакция фиксации СО2, катализируемая ФЕП-карбокси-киназой; однако регуляция глюкогенеза у гельминтов изучена недостаточно [124].
Гликолиз и глюконеогенез у моллюсков. Многие моллюски, особенно двустворчатые, в связи со своим образом жизни являются, по-видимому, факультативными анаэробами. Степень анаэробиоза, которую они могут переносить, была предметом споров. Такие организмы, как устрица, могут жить при полном отсутствии кислорода. Важный компонент этой адаптации — эволюционная выработка такого ферментного аппарата, при котором анаэробная диссимиляция глюкозы не приводит к образованию молочной кислоты как главного конечного продукта. У этих организмов, как и у гельминтов, в качестве такого продукта накапливается преимущественно сукцинат [51]. Конкретная метаболическая ситуация при этом, вероятно, не во всех тканях одинакова.
В мышце — ткани с высокой интенсивностью гликолиза — главным источником энергии служит гликоген. Обычные гликолитические ферменты осуществляют его деградацию до ФЕП. Дальнейшая судьба ФЕП зависит от условий среды. В отсутствие кислорода ФЕП превращается в оксалоацетат (при участии ФЕП-карбо-ксикиназы); затем из оксалоацетата последовательно образуются малат, фумарат и, наконец, сукцинат. Поэтому накопления значительных количеств лактата не происходит. В присутствии кислорода ФЕП превращается в пируват (при участии пируваткиназы), а пируват окисляется затем в ходе обычных реакций цикла Кребса. Таким образом, после образования ФЕП метаболизм может идти по двум основным путям, одному из которых благоприятствуют аэробные, а другому — анаэробные условия:
1) ФЕП-—^Оксалоацетат—►—^Сукцинат;
2) ФЕП—>Пируват— ----->СО2-|-Н2О.
Сложнее обстоит дело в мантии — ткани, играющей у моллюсков важную роль в глюконеогенезе. В ходе «чистого» гликолиза в аэробных условиях ФЕП превращается в пируват. В анаэробных условиях ФЕП обычным образом карбоксилируется, превращаясь в оксалоацетат. До сих пор все происходит примерно так же, как в мышце. Однако при синтезе глюкозы из пирувата или 4-углерод-
Промежуточный обмен: сравнительные аспекты
441
ных предшественников оксалоацетат должен превращаться в ФЕП. иными словами, в мантии ФЕП-карбоксикиназа должна быть способна действовать в обоих направлениях — в зависимости от метаболических потребностей данного момента. Кроме того, в условиях^ благоприятствующих декарбоксилированию оксалоацетата (т. е. превращению его в ФЕП), пируваткиназа обязательно должна находиться в неактивной конформации, так как функционирование этого фермента приводило бы к бесполезному «зацикливанию» углерода в данном участке.
Из этих соображений ясно, что к регуляции пируваткиназы и фЕП-карбоксикиназы в мантии предъявляются совершенно иные требования, нежели в мышце. Очевидным путем удовлетворения различных регуляторных потребностей для этих двух ферментов могла бы быть эволюционная выработка их тканеспецифичных форм, обладающих различными регуляторными свойствами. Недавно было показано [56], что это действительно так в случае пируваткиназы устрицы; аналогичные данные для ФЕП-карбоксики-назы мышечной ткани и мантии того же моллюска пока отсутствуют.
У облигатных анаэробов, например у взрослой Ascaris, метаболические процессы одновременно упрощаются (выпадение излишних ферментов) и модифицируются (изменения в количествах ферментов и в сродстве их к субстратам); в результате остается.возможным только анаэробный образ жизни. В отличие от этого паразиты, контактирующие с кислородом, сохраняют способность к аэробному обмену как важную особенность своей биологической организации.
У моллюсков литоральной зоны встречается еще один, третий, тип анаэробиоза. Сложность проблемы регуляции у двустворчатых моллюсков приливной зоны состоит в том, что они должны быть способны направлять обмен ФЕП по двум различным путям: при аэробных условиях в сторону цикла Кребса, а при анаэробных в сторону синтеза оксалоацетата. Поскольку переключение обмена ФЕП на тот или другой путь должно происходить быстро (вероятно, в пределах одного приливно-отливного цикла), ткани этих моллюсков должны содержать одновременно и пируваткиназу, и ФЕП-карбоксикиназу. Синтезировать один из этих ферментов de novo к очередному приливу и разрушать его к очередному отливу было бы попросту невозможно из-за недостатка времени. Следовательно, для решения этой сложной регуляторной проблемы необходим контроль над прохождением углерода через метаболические «перекрестки» на уровне ФЕП. По современным данным, наиболее существенные особенности действующего здесь механизма регуляции состоят в следующем.
Во-первых, активность пируваткиназы находится под сильным и постоянным регуляторным воздействием ФДФ, с одной стороны (активация предшественником), и АТФ и аланина — с другой (тор
442
Глава 6
можение продуктами). Величина /См для ФЕП существенно зависит от pH: она приблизительно в 7 раз больше при pH 6,5, чем при pH 8,5. Поэтому при низких концентрациях субстрата реакция резко замедляется под влиянием Н+. Для максимальной скорости реакции также имеется определенный оптимум pH, лежащий в щелочной зоне (при pH 8,5 активность в 5 раз больше, чем при pH 6,5). ФДФ снижает эти эффекты pH.
Во-вторых, ФЕП-карбоксикиназа имеет явно выраженный оптимум pH в кислой зоне, и при этом оптимальном pH ее сродство к ФЕП в 10 раз больше, чем у пируваткиназы. Таким образом, в отсутствие каких-либо других регуляторных факторов повышение концентрации Н+ активирует ФЕП-карбоксикиназу и тормозит пи-руваткиназу. Кроме того, аланин повышает /См для пируваткиназы и понижает /См для ФЕП-карбоксикиназы. Поэтому накопление аланина всегда повышает активность ФЕП-карбоксикиназы.
Исходя из этих данных, Мустафа и Хочачка [96] постулировали центральную роль ионов Н+ в проведении углерода через интересующую нас точку разветвления путей. В отсутствие О2 следует ожидать снижения pH в тканях устрицы в результате накопления различных кислых продуктов. Это приведет к эффективной активации ФЕП-карбоксикиназы (вследствие повышения сродства ее к ФЕП и увеличения Кмакс) и к ингибированию пируваткиназы (вследствие снижения сродства к ФЕП и уменьшения Ёмакс). При одновременном накоплении аланина оба эффекта будут усиливаться. Чем более кислой станет аэробная система, тем больше ФЕП будет забирать ФЕП-карбоксикиназный путь, ведущий к оксало-ацетату (рис. 6-4).
При возвращении к аэробным условиям следует ожидать роста pH и реверсии упомянутых процессов. При спаде концентрации Н+ понизится активность ФЕП-карбоксикиназы и одновременно возрастет активность пируваткиназы. Поскольку функции пируваткиназы и ФФК часто бывают интегрированы, можно ожидать также временного повышения концентрации ФДФ. ФДФ преодолевает торможение пируваткиназы, обусловленное ионами Н+, аланином и АТФ, и поэтому резко усиливает исходную активацию, вызванную нонами ОН .
Наиболее важная особенность этой регуляторной системы — то, что она построена по типу аутокаталитического каскада. Как только произошла активация пируваткиназы или ФЕП-карбоксикиназы, все последующие регуляторные взаимодействия будут усиливать друг друга. Таким образом, система чрезвычайно эффективно переводится из состояния «ФЕП-карбоксикиназа включена, пиру-ваткиназа выключена» в состояние «пируваткиназа включена, ФЕП-карбоксикиназа выключена». По-видимому, действие многих ферментов, находящихся в стратегических пунктах у разветвления путей, характеризуется подобным же поведением типа «включен— выключен». Нет сомнения в том, что специфические регуляторные
Промежуточный обмен: сравнительные аспекты
443
дикторы, которые действуют в интересующем нас пункте у моллюсков— факультативных анаэробов, — это результат эволюционной адаптации двух функционирующих в ней ферментов. Многие регуляторные свойства этих ферментов являются общими для моллюсков и других организмов, но у моллюсков эволюция, по-видимому, придала этим свойствам функциональное значение.
Г-б-Ф
I
Рис. 6-4. (Предполагаемые механизмы переключения тканевого обмена устрицы при переходе к аэробиозу или анаэробиозу.
Углеводный обмен у насекомых. В углеводном обмене насекомых используются те же ферменты и субстраты и действуют те же Рабочие принципы, что и у других животных. Однако у насекомых °ни организованы в своеобразную систему, главные особенности которой выясняются лишь сейчас. Мы рассмотрим только некоторые, самые интересные из этих особенностей, перечисленные ниже:
444
Глава 6
а) преобладающим сахаром крови является трегалоза — она занимает центральное место в углеводном обмене и служит главным источником углерода для гликолиза; б) конечные продукты гликолиза — пируват и а-глицерофосфат, дальнейший обмен которых по-видимому, играет важную функциональную роль в метаболических процессах, связанных с полетом; в) для насекомых и других членистоногих характерно присутствие хитина как структурного компонента наружного скелета; отложение и резорбция хитина тесно связаны с обменом других углеводов; г) превращение больших количеств гликогена в глицерин и сорбит, по-видимому, свойственно главным образом насекомым и играет важную роль в хорошо развитой у них холодоустойчивости.
Трегалоза. Это наиболее характерный сахар гемолимфы насекомых— симметричный дисахарид глюкозы (a-D-глюкопиранозил-a-D-глюкопиранозид); он относится к нередуцирующим сахарам, так как аномерные атомы углерода обеих глюкозных единиц соединены глюкозидной связью.
Хотя трегалоза была открыта и получила свое название несколько столетий назад, об ее связи с насекомыми совершенно забыли и долго рассматривали ее как сахар, характерный для низших растений. Трегалозу открыли у насекомых заново в 1956 г. почти одновременно в трех разных лабораториях [169]. В гемолимфе некоторых насекомых этого сахара так много, что его легко получить в кристаллической форме.
Регуляция сахара крови. Ранние исследователи полагали, что уровень сахара крови у насекомых зависит в основном от условий питания. Однако три группы данных указывают на то, что концентрация трегалозы в крови подвержена регулированию: 1) если в результате какого-либо экспериментального воздействия или голодания уровень трегалозы понижается, то происходит восстановление его за счет гликогена жирового тела; 2) если путем инъекции повысить уровень трегалозы в крови, то он быстро снизится до новой устойчивой величины, несколько превышающей норму; 3) хотя содержание трегалозы сильно варьирует, все же существуют величины, характерные для данных видов насекомых или данных стадий развития и в какой-то мере поддерживаемые даже при изменениях в питании. Например, у куколок Hyalophora cecropia во время 6-месячной диапаузы и последующего развития во взрослую форму содержание гликогена в жировом теле и глицерина в крови изменяется чрезвычайно резко, тогда как концентрация трегалозы в крови относительно стабильна; сначала она находится на уровне, характерном для куколки, а затем вскоре повышается до нового, более высокого уровня [169]. Опыты с 14С-глюкозой показали, что трегалоза в этих системах отнюдь не инертна — она непрерывно обновляется. Очевидно, что синтез и распад трегалозы имеют важное значение для организма насекомого и тесно связаны с обменом глюкозы и гликогена (рис. 6-5).
Промежуточный обмен: сравнительные аспекты
445
Синтез трегалозы. Участие жирового тела в синтезе трегалозы достоверно установлено в опытах с инкубацией in vitro ткани жирового тела в присутствии 14С-глюкозы и последующим выделением радиоактивной трегалозы. Жировое тело, вероятно, не единственное место синтеза трегалозы. Превращение 14С-глюкозы в трегалозу наблюдали у насекомых в мышцах, средней кишке и тканях
Путь гликолиза
Рис. 6-5, Метаболические пути, связывающие глюкозу, трегалозу и гликоген, у насекомых; указан ряд регуляторных взаимодействий.
головы. Но если рассматривать жировое тело в целом, то его участие в синтезе трегалозы, безусловно, будет у большинства насекомых преобладающим. Кэнди и Килби [24] впервые исследовали специфическую ферментную систему синтеза трегалозы в жировом теле насекомых; были получены данные в пользу того, что последовательность реакций аналогична описанной ранее у дрожжей. Донором одного из остатков глюкозы, по-видимому, служит УДФГ, а Донором другого — Г-6-Ф, из которого в результате конденсации нуклеотидом образуется трегалозо-6-фосфат; далее следует де-фосфорилирование трегалозо-6-фосфата специфической фосфа
446
Глава 6
тазой:
. ггт _ , , Трегалозофосфатсинтетаза
у ДФ-глюкоза -|- Глюкозо-6-фосфат-----------------—>
—> Трегалозо-6-фосфат 4-УД Ф;
-г с , । II гл Трегалозо-6-фосфатаза
Трегалозо-6-фосфат 4~ Н2О-----------------► Трегалоза + ФН.
Ультрацентрифугируя гомогенаты жирового тела гусениц Я. cecropia, можно получить трегалозофосфатсинтетазу, свободную от примеси гликогенсинтетазы: второй из этих ферментов выпадает в осадок вместе с частицами гликогена [95].
Возможно, что изменение активности этих двух ферментов играет главную роль в регуляции уровня трегалозы в крови [119]. Так, любое повышение уровня глюкозы, вызванное ее введением с пищей или другими причинами, приводит к росту уровня Г-6-Ф, который в свою очередь активирует как трегалозо-6-фосфатсинтета-зу, так и гликогенсинтетазу. Сродство к УДФГ у трегалозо-6-фос-фатсинтетазы выше, чем у гликогенсинтетазы, что делает возможным преимущественный синтез трегалозы при низком уровне УДФГ. Когда трегалоза накопится в количестве, достаточном для торможения трегалозо-6-фосфатсинтетазы, становится возможным повышение уровня УДФГ и, следовательно, усиление синтеза гликогена. При значительном поступлении глюкозы такая регуляторная система может обеспечивать быстрое образование и трегалозы и гликогена. Трегалоза не только ингибирует трегалозо-6-фосфат-синтетазу, но оказывает также сильное и специфическое активирующее действие на глюкозо-6-фосфатазу. Этот механизм в итоге может осуществлять косвенную регуляцию по принципу отрицательной обратной связи, удаляя субстраты, необходимые для синтетазной реакции (рис. 6-5).
Расщепление и использование трегалозы. Метаболическое использование трегалозы зависит от ее гидролиза ферментом трега-лазой:
Трегалоза4-Н2О ----> 2 Глюкоза.
Фермент, катализирующий эту реакцию, получен в достаточно очищенном виде из тотальных гомогенатов некоторых насекомых, и его кинетические свойства довольно хорошо изучены. Этот фермент существует по меньшей мере в двух формах, называемых мышечной и кишечной —по тканям, из которых эти формы обычно экстрагируют. Обе формы специфически воздействуют на трегалозу и не являются просто «-гликозидазами. В мышцах насекомых трегалаз-ная активность связана главным образом с мембранами, но ее внутриклеточная локализация еще с точностью не выяснена [119< 169].
Сактор и Вормсер-Шавит [120] показали, что у мясной мухи в начале полета заметно понижается концентрация трегалозы и
Промежуточный обмен: сравнительные аспекты
447
в то же время резко возрастает уровень глюкозы. Эти противоположные сдвиги, происходящие в период значительной интенсификации гликолиза, ясно указывают на то, что в начале полета в большой степени облегчается превращение трегалозы в глюкозу. Активация трегалазы, несомненно, находится под жестким контролем, Но механизмы регуляции этого связанного с мембранами фермента в мышцах насекомых остаются неизвестными ,[119].
Глюкоза
Г-5-
Глицеральдегид-З-сросграт ДОАФ
НАД-Н
у
I3-дигроссроглицерат
I
ФЕП
Пар у Ват
_______I_______Митохондриальная
I мембрана
Цикл лимонной кисло Кребса
Рис. 6-6. Гликолиз и цикл а-глицерофосфата в летательных мышцах насекомых.
Конечные продукты гликолиза в тканях насекомых. Обмен глюкозы, образующейся из трегалозы или гликогена, идет по пути гликолиза. У насекомых этот путь на уровне расщепления фруктозо-Дифосфата (ФДФ) отличается в операциональном отношении от гликолиза позвоночных.
Продукты расщепления ФДФ, а именно глицеральдегид-3-фос-Фат и диоксиацетонфосфат (ДОАФ), могут изомеризоваться, и Дальнейший обмен их идет по одному из двух путей (рис. 6-6): О ДОАФ может восстанавливаться в а-глицерофосфат (а-ГФ)
448
Глава 6
при одновременном окислении НАД-Н; 2) глицеральдегид-3-фос-фат может пройти 5 ферментативных этапов окисления до пирувата при одновременном восстановлении НАД+.
Значение образования пирувата и а-ГФ при гликолизе стало понятным после открытия а-глицерофосфатного цикла [119]. Как видно из рис. 6-6, этот цикл обеспечивает окисление НАД-Н, образующегося вне митохондрий. У других организмов НАД-Н гликолитического происхождения окисляется в результате лактатдегид-рогеназной реакции. Только у насекомых, которые практически не имеют ЛДГ, окисление НАД-Н происходит одновременно с восстановлением ДОАФ а-глицерофосфатдегидрогеназой. Образовавшийся в цитозоле а-ГФ свободно диффундирует в митохондрии, где снова окисляется в ДОАФ митохондриальной а-ГФ-дегидро-геназой, представляющей собой флавопротеид. Эта реакция регенерирует ДОАФ, который может диффундировать из митохондрий в цитозоль, где снова используется для окисления НАД-Н. Таким образом, мы имеем здесь дело с челночной системой, в которой субстраты, сопряженные с НАД, в восстановленной форме переходят внутрь митохондрий и в окисленной форме покидают их. При этом водород или восстанавливающие эквиваленты из внемито-хондриального пула НАД-Н проникают через барьер митохондриальной мембраны и окисляются в дыхательной цепи митохондрий. Кроме того, этот цикл является самовоспроизводящимся и нуждается только в каталитических количествах ДОАФ, необходимых для окисления НАД-Н, непрерывно образующегося при гликолизе. Это позволяет предполагать, что большая часть триозофосфата может изомеризоваться в глицеральдегид-3-фосфат и что по существу весь углерод из углеводов, используемых при длительной физической работе, может переходить в пируват. Таким образом, эта система удивительно эффективна: в отличие от аналогичной системы работающих мышц позвоночных она способна функционировать без накопления конечного продукта гликолиза — лактата.
Использование гликогена в летательных мышцах. У мясной мухи в первые несколько секунд полета изменения концентрации гликогена невелики, но примерно через 2 мин содержание гликогена в летательных мышцах резко снижается, что говорит о роли этого полисахарида как важного резервного источника энергии [120]. Быстрое использование гликогена после начала мышечной работы возможно благодаря активации гликогенфосфорилазы и одновременному торможению гликогенсинтетазы [26]. Каталитические и регуляторные механизмы, участвующие в мобилизации и синтезе гликогена, будут подробно рассмотрены ниже (стр. 487— 490).
Хитин и другие гликопротеиды насекомых. Хитин — это полимер с длинной цепью из остатков N-ацетилглюкозамина, соединенных р-1,4-связями (по-видимому, с добавкой варьирующих количеств глюкозамина). В кутикуле насекомых он образует комплекс
Промежуточный обмен: сравнительные аспекты 449
с белком, т. е. гликопротеид. Результаты интенсивного изучения структуры хитина физическими и химическими методами рассмотрены в обзоре Хэкмена [50].
Другие гликопротеиды насекомых до недавнего времени почти не изучались. Перитрофическая мембрана насекомого содержит наряду с белком хитин и другие мукополисахариды, в том числе гиалуроновую кислоту [169]. При изучении гликогена была выявлена связь между этим полисахаридом и хитином как резервами питательных веществ: в определенных условиях количественные изменения того и другого обнаруживают в известной степени противоположную направленность. Метаболическая лабильность хитина подтверждается рядом наблюдений: 1) у Hyalophora cecropia во время куколочной линьки около 80—85% покровного хитина переваривается и резорбируется; 2) у Rhodnius и некоторых других насекомых происходит резорбция эндокутикулы при длительном голодании и отложение эндокутикулы после кормления; 3) у Periplaneta americana синтез и деградация кутикулярных полисахаридов происходит непрерывно в течение всего линочного цикла [169].
Некоторые данные о предшественниках хитина и резервных материалах для его синтеза были получены с помощью радиоизотопов. Бейд и Уайят инъецировали 14С-глюкозу гусеницам Н. cecropia к концу 4-го возраста и нашли, что к концу откормочного периода 5-го возраста радиоактивность сохранялась главным образом в кутикуле. Новая куколочная кутикула, взятая через два дня после окукливания, опять-таки имела высокую радиоактивность, причем удельная активность хитина была близка к таковой у зрелых гусениц и значительно выше активности гликогена, свободных сахаров и липидов. Это, по-видимому, свидетельствует о специфическом переносе материала из личиночной кутикулы в куколочную. Возможно, что продукты переваривания старой кутикулы после их резорбции непосредственно включаются в новую кутикулу [169].
О ферментах, участвующих в синтезе и деградации хитина, несмотря на важнейшую роль этого вещества в химическом «хозяйстве» членистоногих, известно очень немногое.
Кэнди и Килби [25] показали прямыми анализами и опытами с включением изотопов in vivo, что в ногах и крыльях Schistocerca gregaria хитин активно синтезируется в течение примерно 7 дней после имагинальной линьки. Поэтому в качестве источника ферментов были использованы крылья 2—3-дневных взрослых особей, и здесь была обнаружена активность всех ферментов, необходимых Для превращения глюкозы в УДФ-ацетилглюкозамин. Однако попытки выявить активность хитинсинтетазы — фермента, который катализировал бы включение последнего вещества в хитин, — оказались безуспешными, несмотря на концентрирование экстрактов 11 различные видоизменения условий опыта.
2э—1332
450
Глава 6
Переваривание хитина и белков эндокутикулы — один из важнейших процессов, с которыми связана линька у членистоногих, но он сравнительно мало изучен. В исследованиях Жёньо [68] получены данные о двух этапах переваривания хитина:
Хитиназа Хитобназа
Хитин-------> Хитобиоза-------> N-ацетилглюкозамин.
(+ Хитотриоза
+ Ацетилглюкозамин)
Активность хитиназы определяют по снижению мутности суспензии хитина, а активность хитобиазы — с помощью колориметрического определения ацетилглюкозамина.
Эта область, безусловно, нуждается в дальнейшем детальном изучении.
Образование глицерина и сорбита из гликогена. У многих насекомых на зимующих стадиях развития существует специализированный процесс превращения гликогена в многоатомные спирты. Это было независимо обнаружено у эмбрионов Bombyx mori на стадии диапаузы, продуцирующих сорбит и глицерин [27, 28], и у куколок Н. cecropia, у которых образуется глицерин [170]. Хотя у этих видов образование глицерина совпадает с началом диапаузы, оно возможно и на других стадиях; глицерин появляется, например, у взрослых особей пенсильванского муравья-древоточца при их выдерживании на холоду [40, 136]. Поразительно высокий уровень глицерина (5 М, или около 25% веса тела) найден у диа-паузирующих предкуколок Bracon cephi — паразита американского хлебного пилильщика [121]. Образование глицерина при различных условиях тщательно изучено v личинок пилильщика Монета flavescens.
В экологическом отношении накопление глицерина и сорбита, по-видимому, связано с холодоустойчивостью. Эти вещества, вероятно, снижают точку переохлаждения, но не повышают устойчивость организма к замораживанию [1, 2, 121]. В отличие от этого у полярных рыб образуются настоящие антифризы и достигается устойчивость к замораживанию [36]. Этот вопрос будет подробнее рассмотрен в гл. 9.
Биохимический путь синтеза глицерина, вероятно, идет через процессы восстановления от триозного уровня гликолиза; соответствующие ферменты у насекомых обнаружены. Считают, что образование глицерина связано с восстановлением ДОАФ в а-ГФ (активность а-ГФ-дегидрогеназы в тканях насекомых очень высока) и последующим гидролизом а-ГФ а-глицерофосфатазой.
Пути гликолиза и глюконеогенеза у рыб. Углеводный обмен рыб, насколько мы его знаем, во многих отношениях качественно сходен с таковым у других позвоночных, в том числе млекопитающих [58, 137]. В то же время ряд очень интересных метаболических адаптаций, типичных для всех низших позвоночных, достигает у некоторых рыб необычайного развития. К такого рода феноменам
Промежуточный обмен: сравнительные аспекты . 451
относятся: 1) температурная адаптация метаболизма, 2) приспособление к низкому парциальному давлению кислорода и 3) летняя спячка двоякодышащих рыб в периоды засухи.
Температурная адаптация. Более подробно она будет рассмотрена в гл. 9. Здесь же мы хотим главным образом подчеркнуть, что у рыб организация клеточного обмена очень сильно зависит от состояния температурной акклимации. У лососевых при холодовой акклимации устанавливаются новые устойчивые уровни гликолиза, глюконеогенеза и активности пентозофосфатного пути [47] (см. гл. 9). Установление этих новых уровней в принципе может достигаться с помощью многообразных молекулярных механизмов, причем одной из фундаментальных адаптаций может быть изменение относительной активности различных изоферментов. Согласно новейшим данным, разные изоферменты приспособлены к осуществлению оптимально регулируемого катализа в различных участках биологического диапазона температур. Таким образом, изменения в их относительной активности могут вести к изменению стационарного состояния тех или иных метаболических путей, например гликолиза и глюконеогенеза.
Адаптация к низким парциальным давлениям кислорода. Не все знают, что некоторые низшие позвоночные могут становиться факультативными анаэробами и благодаря этому выживать при определенных условиях среды. Так, например, европейский карп зимой часто оказывается замурованным подо льдом в небольших прудах, где концентрация кислорода в воде постепенно снижается вплоть до полного исчезновения О2 на 2—3 мес до весеннего таяния. Пребывание карпа в этих условиях крайней аноксии не оказывает на него заметного неблагоприятного действия. Блазка [15], вероятно, первым осознал важные следствия, вытекающие из этих экологических особенностей. У карпа (в отличие от таких рыб, как лососевые, зависящих от аэробного обмена) во время анаэробиоза не создается кислородной задолженности и, так же как и у моллюсков литоральной зоны, не происходит накопления обычных конечных продуктов анаэробного расщепления углеводов.
По-видимому, сходным образом обстоит дело и у другой родственной карпу рыбы — у серебряного карася. Когда парциальное давление кислорода в воде становится низким, карась получает значительное количество энергии для активного и основного обмена с помощью анаэробных реакций. Этот частичный анаэробиоз может продолжаться очень долго. При концентрациях кислорода, соответствующих примерно 15%-ному насыщению воздухом, карась длительное время сохраняет дыхательный коэффициент (СО2/О2), близкий к 2 [78], и ясно, что СО2 образуется в процессе метаболизма даже при полном отсутствии О2.
О путях анаэробного обмена у рыб почти ничего не известно — здесь необходимы дальнейшие интенсивные исследования. Системы реакций анаэробного метаболизма значительно лучше изучены у 29*
452
Глава 6
различных беспозвоночных — факультативных анаэробов, а также у позвоночных в таких тканях, как почечная, где аэробный обмен в значительной мере вытесняется процессами анаэробного декарбоксилирования. Важнейший из этих процессов — декарбоксилирование а-кетоглутарата, сопряженное с восстановлением оксало-ацетата:
Сукцинил-Yah
АТФ кГДФ--.
АДфЛтФ-/
Сукцинат
Коэн [31] показал, что в корковом веществе почки млекопитающего благодаря этим реакциям «улавливается» в виде АТФ около 9 ккал на 1 моль а-кетоглутарата (а при анаэробном гликолизе 1 моль глюкозы дает 18 ккал). При расчете на единицу веса субстрата скорость этого процесса приблизительно равна скорости гликолиза, и, следовательно, он доставляет значительную часть энергии, необходимой для различных транспортных функций клеток почечных канальцев. Подобные же процессы анаэробного декарбоксилирования, возможно, обусловливают высокий дыхательный коэффициент и у серебряного карася при аноксии, и у других рыб при заходах в анаэробные воды.
У карпа при анаэробиозе наряду с СО2 накапливаются большие количества жирных кислот с длинной цепью [15]. Точные метаболические пути здесь опять-таки неизвестны, но интересно будет рассмотреть общий процесс синтеза жирных кислот из глюкозы, поскольку у этого вида углеводы почти наверняка служат главным источником ацетил-КоА при липогенезе. Процесс гликолиза и декарбоксилирование пирувата приводят к образованию двух молей СО2 и двух молей ацетил-КоА на каждый моль глюкозы. Таким образом, при идеальных условиях насыщения энергией на синтез жирных кислот идут 4 из 6 углеродных атомов глюкозы. Например, для синтеза пальмитиновой кислоты процесс можно стехиометрически представить так:
4CeHj>Og--> CigHggOg -р 8СО2 *р 8Н2О.
Глюкоза Пальмитиновая кислота
При этом процессе теоретический выход энергии относительно высок: 4 моля глюкозы приблизительно соответствуют 2744 ккал,
Промежуточный обмен: сравнительные аспекты•453
тогда как 1 моль пальмитата при полном окислении дает около 2400 ккал. У рыб наблюдали включение углерода глюкозы в липиды; при низких температурах количество энергии, которое можно получить в результате этого превращения, по-видимому, достаточно как для поддержания жизни, так и для активного метаболизма.
Адаптации к высоким давлениям кислорода. У рыб, плавательный пузырь которых играет роль гидростатического органа, главная функция его «противоточного обменника» (чудесной сети), по-видимому, состоит в секреции О2 из крови в плавательный пузырь, иногда против исключительно высоких градиентов концентрации (см. стр. 415). Механизм секреции газа, вероятно, основан на подкислении крови. У крови, выходящей из сети, pH примерно на единицу ниже, чем pH крови, поступающей в сеть. За это изменение pH ответственна главным образом (если не исключительно) молочная кислота, которая, как предполагают, образуется в качестве конечного продукта гликолиза в эпителии плавательного пузыря [34]. В связи с этим возникают две важные проблемы: 1) при высоких парциальных давлениях О2 интенсивность гликолиза обычно невелика из-за эффекта Пастера (торможение гликолиза кислородом); 2) если величина внутриклеточного pH определяется скоростью секреции О2, то можно ожидать большой изменчивости pH.
Эффект Пастера связан с увеличением «энергетического заряда» клетки, приводящим к торможению фосфофруктокиназы высокими концентрациями АТФ. В плавательном пузыре эффект Пастера отсутствует [5] либо из-за низкого уровня митохондриального метаболизма, либо вследствие того, что эпителий пузыря содержит особые формы фосфофруктокиназы, нечувствительные к тормозящему действию АТФ.
Мы почти ничего не знаем о влиянии pH на ферменты эпителия плавательного пузыря. Лактатдегидрогеназа пузыря, по-видимому, менее других исследованных ЛДГ чувствительна к изменениям pH, особенно при высоких уровнях субстрата. В таком случае этот фермент хорошо приспособлен для работы в микросреде эпителия, секретирующего О2. Однако мы не знаем, как обстоит дело с другими ферментами.
Метаболическая адаптация к летней спячке у двоякодышащих рыб. Сведения по этому вопросу очень скудны [58]. Двоякодышащие рыбы способны выживать в течение нескольких лет, будучи заключены в грязевой кокон и находясь в состоянии анабиоза. Интенсивность метаболических процессов при этом не превышает одной сотой обычных величин основного обмена. В этот период потенциальная активность ферментов остается весьма высокой, судя по способности рыбы пробуждаться от спячки примерно за 15 мин (этого времени заведомо недостаточно для значительного ресинтеза ферментных систем); однако механизмы наблюдаемого угне
454
Глава 6
тения метаболических процессов совершенно неизвестны. К тому же во время летней спячки, несмотря на исключительно долгое голодание, углеводные резервы организма сохраняются. Мы еще только начинаем изучать различные регуляторные механизмы, существующие у этих интереснейших рыб.
Роль гликолиза в устойчивости к аноксии у рептилий и амфибий. Среди позвоночных, по-видимому, только некоторые рыбы способны длительно выживать при полном отсутствии кислорода. В эволюции позвоночных это, вероятно, последние факультативные анаэробы. Однако и многие другие позвоночные обнаруживают впечатляющую способность переносить анаэробные условия. Среди таких животных первое место по устойчивости к аноксии, безусловно, занимают черепахи. Они обнаруживают необычайную приспособляемость к поразительному многообразию условий и превосходно существуют в пустынях, различных пресных и солоноватых водоемах и даже в пелагиали открытого океана. Среди различных групп черепах наиболее устойчивы к аноксии, по-видимому, водные формы, которым часто приходится обходиться без кислорода во время продолжительного ныряния. У всех позвоночных характерной физиологической реакцией на полное погружение в воду является пониженный обмен. У наилучших ныряльщиков среди птиц и млекопитающих — у китообразных, а также у морских и пресноводных птиц — метаболические приспособления к нырянию включают сужение периферических сосудов, вследствие которого многие ткани вынуждены все в большей и большей степени покрывать свои энергетические потребности за счет анаэробного гликолиза. Этот механизм позволяет сохранять кислород крови для мозга и сердца. Пределы работоспособности у этих животных-ныряльщиков, вероятно, зависят от выработки энергии в периферических тканях, а возможная длительность пребывания под водой — от центральной нервной системы и сердца. Рабочие функции мозга и сердца у млекопитающих и птиц неотделимы от аэробного метаболизма; поэтому невозможность дальнейшего снабжения этих органов кислородом заставляет животное вынырнуть. У ныряющих черепах дело обстоит совершенно иначе — они могут оста- ; ваться живыми в течение многих часов (а иногда и дней!), после j того как напряжение О2 упало до нуля. Устойчивость черепах к аноксии настолько велика, что при низких температурах они, может быть, даже способны выживать без кислорода неопределенно долгое время. Это еще окончательно не выяснено, но уже очевид-но, что у черепах стратегия адаптации к низкому или нулевому уровню О2 не связана с выработкой добавочных звеньев метабо- [ лизма, позволяющих избежать накопления продуктов, подобных ; лактату. Насколько мы знаем, организация клеточного обмена у черепах принципиально не отличается от таковой у типичных, более аэробных позвоночных. Устойчивость черепах к аноксии зависит 1) от высокой мощности гликолиза, приводящей к очень боль-
Промежуточный обмен: сравнительные аспекты
455
тому накоплению лактата, и 2) выработки в центральной нервной системе и других тканях механизмов, позволяющих выполнять специфические функции даже при отсутствии О2 [13].
Зависимость черепах от анаэробного гликолиза при длительном нырянии. Основываясь на прямых калориметрических измерениях обмена у черепах, Джексон [67] разделил период пребывания под водой на три метаболические фазы.
В течение фазы I, продолжающейся при 24 °C около получаса, интенсивность обмена удерживается на обычном уровне, но парциальное давление О2 в крови и легких быстро падает.
В течение фазы II, также продолжающейся около 30 мин, интенсивность метаболизма снижается до 40% исходной величины и остававшиеся резервы О2 иссякают.
Последняя фаза — фаза III — может продолжаться много часов (а у некоторых видов при низких температурах и много дней) и является полностью аноксической. Выживание и все рабочие функции в этой фазе обеспечиваются анаэробным обменом. Измеряя теплопродукцию, Джексон установил, что этот вид обмена может давать энергию, составляющую 15—20% общей энергии, которая вырабатывалась до погружения в воду. По-видимому, анаэробный метаболизм обеспечивает всю энергию, генерируемую в фазе III. Необычно высокая активность этого пути у черепах приводит к накоплению очень больших количеств лактата в крови и тканях и позволяет объяснить чрезвычайную устойчивость черепах к таким метаболическим ядам, как цианид, который специфически блокирует окислительный обмен и не действует на гликолиз.
Белкин [12] убедительно продемонстрировал решающее значение анаэробного гликолиза для черепахи, находящейся в условиях аноксии. Он использовал метаболический яд иодацетат, который, как известно, воздействует главным образом на триозофосфатде-гидрогеназу в цепи гликолиза. Если выживание черепах при аноксии зависит от гликолиза, то ингибирование этого фермента путем инъекции иодацетата должно привести к значительному снижению устойчивости к аноксии. Это предсказание подтвердилось. Кроме того, прямые калориметрические измерения, проведенные Джексоном, показали, что после введения иодацетата действительно происходит ожидаемое понижение энергетического обмена, сохраняющегося у черепахи при аноксии. Эти эксперименты наглядно выявляют центральную роль гликолиза в адаптации к аноксии, но Не объясняют устойчивость центральной нервной системы к бескислородным условиям.
Природа устойчивости центральной нервной системы черепах к аноксии. Для того чтобы понять причину этой устойчивости, полезно рассмотреть механизмы, определяющие чувствительность мозга к аноксии у других животных, например у млекопитающих. Нужно сразу же подчеркнуть, что эти механизмы еще не вполне ныяснены. Известно, однако, что мозг млекопитающего, находясь
456
Глава 6
в абслоютной зависимости от окислительного обмена, имеет также активную систему гликолиза. Как это ни странно на первый взгляд, ткань мозга обнаруживает полную зависимость и от гликолиза, так как практически единственным источником углерода и энергии для метаболизма мозга служит глюкоза. Клеточная организация системы гликолиза здесь весьма своеобразна: все ее ферменты присоединены к мембранным структурам, тесно связанным с митохондриями, или сами составляют часть этих структур. Хотя регуляция, так же как и в других тканях, осуществляется на уровнях гексокиназы, ФФК и ПК, ясно, что гликолиз очень тесно сопряжен здесь с аэробным метаболизмом митохондрий. Такая структурная организация гликолитической системы служит для высокоэффективной передачи углерода глюкозы (в форме пирувата) в цикл Кребса. Но несмотря на тесное сопряжение аэробной и анаэробной фаз катаболизма глюкозы в мозгу млекопитающих, его зависимость от кислорода обусловлена не этой тесной связью, а скорее сопряжением аэробной выработки АТФ с функцией Ыа+К+-АТФазы.
Основная функция нервной клетки — проведение потенциалов действия. Для выполнения этой функции ионный насос, связанный с Ыа+К+-АТФазой, должен создавать и поддерживать определенные трансмембранные градиенты концентраций Na+ и К+. В мозгу млекопитающего Ыа+К+-АТФаза, по-видимому, тесно связана с одним или несколькими АТФ-генерирующими звеньями в системе переноса электронов. Примерно так же обстоит дело в хорошо изученном гигантском аксоне кальмара, где, как и в мозгу млекопитающих, рабочая функция решающим образом зависит от аэробного синтеза АТФ и поэтому чувствительна к метаболическим ядам, нарушающим окислительный обмен [37]. Это сопряжение Ыа+К+-АТФазы с АТФ-генерирующим звеном (или звеньями) системы переноса электронов обусловливает крайнюю чувствительность к аноксии. Соответственно мы предполагаем, что у черепах нечувствительность мозга к аноксии обусловлена тем, что функция Ыа+К+-АТФазы не связана здесь с аэробным обменом энергии. В подкрепление этой гипотезы можно привести ряд аналогичных примеров. Хотя во многих тканях (жабры ракообразных и . рыб, почечные канальцы млекопитающих, солевая железа птиц) функция Па+К+-АТФазы, так же как и в мозгу, сопряжена с аэробным обменом, существует также ряд тканей, в которых она неразрывно связана с гликолизом. Превосходным примером могут служить эритроциты млекопитающих, в этом отношении хорошо изученные [103]. Функциональная активность Ыа+К+-АТФазы по необходимости связана здесь с АТФ гликолитического происхождения, поскольку в зрелых эритроцитах нет митохондрий. Как показали недавние исследования, функция Ыа+К+-АТФазы очень тесно ассоциирована с фосфоглицераткиназным этапом гликолиза (1,3-дифосфоглицерат-|-АДФ—>трифосфоглицерат-|-АТФ). Конкретный
Промежуточный обмен: сравнительные аспекты
457
механизм этой связи неизвестен, но уже ясно, что АТФ, будучи продуктом указанной реакции, служит субстратом для Na+K4-дТФазы. Повышение активности киназы стимулирует функцию Ка+К+-АТФазы, и наоборот, торможение мембранного транспорта 1\[а+ и К+ приводит к подавлению активности фосфоглицераткина-зы. Функции обоих ферментов, вероятно, связаны с мембраной эритроцита.
Известны и другие аналогичные примеры. В электрическом органе угря Electrophorus тоже преобладает гликолиз, и его нормальная функциональная активность обнаруживает зависимость от гликолиза. Эта зависимость опять-таки реализуется при вероятном участии фосфоглицераткиназы [89]. Третий пример подобной взаимосвязи— мочевой пузырь жабы [52]. Здесь пока еще невозможно идентифицировать конкретный локус, объединяющий функцию №+К+-АТФазы с гликолизом, но абсолютная необходимость гликолиза для мембранного транспорта Na+ и К4 установлена с полной достоверностью. Экспериментальная активация гликолиза приводит к усилению работы натриевого насоса; в то же время изменения функции насоса, вызываемые гормонами, сопровождаются изменением интенсивности гликолиза. В регуляции гликолиза участвуют различные звенья цепи, в том числе ФФК, фосфоглице-раткиназа и ПК. Случаев, когда натриевый насос зависел бы только от одного из этих регуляторных ферментов, пока не обнаружено.
Ни в одной из этих тканей нет абсолютной зависимости Na+K+-АТФазы от аэробного обмена. Более того, все эти ткани совершенно нечувствительны к аноксии. Так как центральная нервная система черепахи может функционировать при полном отсутствии Ог, мы предполагаем, что нечувствительность ее к аноксии — это тоже результат такой функциональной организации, при которой активность Ка+К+-АТФазы связана с синтезом АТФ при гликолизе и не зависит от окислительного обмена. Прямая проверка этой гипотезы— задача дальнейших исследований; однако уже известно, что в других тканях водных черепах Па+К+-АТФаза действительно использует АТФ гликолитического происхождения [115].
Жировой обмен
Введение. В результате классических работ Цунца стало очевидно, что жиры неизбежно должны быть важнейшим источником энергии при мышечной работе. Этот вывод убедительно подтвердили Крог и Линдхард в 1920 г., а после них — многие другие исследователи. Однако расшифровка гликолитического пути и цикла Кребса вызвала такой большой интерес к этим системам и привлекла такое внимание к обмену углеводов, что в биохимии возникла тенденция пренебрегать обменом жиров или предполагать, Ито жиры используются лишь косвенным образом. Все это теперь
458
Глава 6
изменилось — мобилизация, окисление и синтез липидов стали предметом весьма интенсивного изучения.
Липиды-—разнородная группа веществ, обладающих неодинаковой растворимостью в органических растворителях и, как правило, нерастворимых в воде. Сложные липиды делятся на три основных класса — нейтральные жиры и масла, фосфолипиды и стероиды. Основы химии липидов изложены во многих учебниках, поэтому мы сосредоточим внимание в первую очередь на том, что известно о катаболизме и анаболизме этих веществ.
Расщепление и синтез триглицеридов. К триглицеридам, т. е. тройным эфирам глицерина и жирных кислот, относятся два важных подкласса сложных липидов — жиры и масла. Различение этих двух подклассов основано на физическом состоянии триглицерида при комнатной температуре: масла в этих условиях будут жидкими, а жиры — твердыми. Точка плавления триглицерида определяется составом его жирных кислот. Обычно чем выше относительное количество кислот с короткой цепью и ненасыщенных кислот, тем ниже точка плавления.
Гидролиз триглицеридов пищи у млекопитающих происходит главным образом в тонком кишечнике под действием липолитических ферментов, вырабатываемых поджелудочной железой. Панкреатические липазы (гидролазы эфиров глицерина), по-видимому, делятся на два типа: одни специфически расщепляют эфирные связи в a-положении триглицеридов, а другие — в p-положении. Полный гидролиз триглицеридов происходит по этапам — сначала идет быстрый гидролиз а- и щ-связей, а затем — медленное расщепление Р-моноглицеридов. О каталитических и регуляторных свойствах пищеварительных липаз почти ничего не известно.
Мобилизацию триглицеридов как в «белой», так и в бурой жировой ткани стимулируют катехоламины. Эти гормоны оказывают активирующее действие на аденилциклазу, начинается усиленный синтез циклического АМФ, и это приводит к активации триглице-ридлипазы, гидролизующей триглицериды на свободные жирные кислоты и глицерин [22, 30, 112]. Этот гормональный контроль мобилизации жировых запасов имеет много общего с регулированием мобилизации резервных углеводов при участии циклического АМФ [106] (см. стр. 514). Драммонд и его сотрудники недавно установили, что катехоламины повышают максимальную мощность аденилциклазы, не влияя существенным образом на другие кинетические свойства этого фермента [38, 106].
Гидролиз триглицеридов в принципе обратим, и это могло бы быть использовано при их биосинтезе; однако in vivo этот путь, по-видимому, не имеет существенного функционального значения. Действительный путь биосинтеза впервые описали Вейс и Кеннеди в 1956 г. В присутствии глицерокиназы и АТФ свободный глицерин фосфорилируется, превращаясь в L-a-глицерофосфат (а-ГФ); последний может также получаться в результате восстановления
Промежуточный обмен: сравнительные аспекты
459
ДОАФ- Далее 1 молекула а-ГФ ацилируется 2 молекулами SKoA-производного жирной кислоты, образуя а, р-диглицеридфосфат (фосфатидную кислоту). Синтез триглицерида завершается дефосфорилированием, дающим а, 0-диглицерид, который затем этери-фицируется третьей молекулой SKoA-производного жирной кисло-ТЬ1 В жировой ткани и слизистой кишечника а-ГФ образуется главным образом путем восстановления ДОАФ, зависимого от НАД-Н, а глицерокиназа в этих тканях фактически отсутствует; в остальном биохимический путь, ведущий к образованию триглицеридов, подобен здесь только что рассмотренному пути синтеза триглицеридов в печени.
Приводим общие схемы путей расщепления и синтеза триглицеридов:
Триглицерид
Диглицерид 4- СЖК1 (или СЖК3)
Моноглицерид + СЖК3 (или СЖК1)
I
Глицерин 4- СЖК2
Триглицерид
А
I
ос, 13-Диглицерид -f- SKoA-производное жирной
| кислоты
ссф-Диглицеридфосфат
t
а-Глицерофосфат 4- SKoA-производное жир-
| ной кислоты
Глицерин 4- АТФ
Видно, что здесь опять-таки сохраняется правило разделения катаболических и анаболических процессов. Дальнейшее изучение механизмов, регулирующих мобилизацию и отложение триглицеридов, представляет значительной интерес, так как эти соединения, вероятно, служат главным энергетическим резервом у большинства животных.
Расщепление и синтез фосфолипидов. Большое значение имеют некоторые группы сложных липидов — производных фосфатидной кислоты. Сюда относятся фосфатидилхолины (называемые также лецитинами) и фосфатидилэтаноламины. Фосфатидилхолины и фосфатидилэтаноламины — главные фосфолипидные компоненты биологических мембран. Они играют важную структурную и функциональную роль в плазматической мембране и мембранах клеточных органелл. Большинство фосфатидилхолинов содержит одну насыщенную жирную кислоту, этерифицированную в а-положении, и одну ненасыщенную жирную кислоту, этерифицированную в {3-положении. Некоторые представители этого класса содержат две насыщенные или две ненасыщенные жирные кислоты.
В природных источниках обнаружена и свободная фосфатидная кислота, но она, по-видимому, составляет лишь очень небольшую часть всего фосфолипидного материала. Фосфатидилхолины и фос-
460
Глава 6
фатидилэтаноламины распространены в природе очень широко и часто представляют собой главный липидный компонент тканей.
Ферментативное расщепление фосфолипидов еще не изучено полностью. Известны по меньшей мере пять ферментов, расщепляющих одну или несколько эфирных связей в фосфатидах, — это фосфатидазы (или фосфолипазы) А, В, С, D и лизофосфатидазы. Совместное действие их может приводить к полному отделению жирных кислот от фосфатидов, однако последовательность этапов расщепления фосфолипидов этими и другими подобными ферментами пока не установлена.
Кеннеди [75] резюмировал данные о путях биосинтеза фосфа-тидилхолина, фосфатидилэтаноламина и фосфатидилсерина. Фос-фатидилхолин и фосфатидилэтаноламин образуются в результате реакции D-a, 0-диглицерида соответственно с ЦДФ-холином и с ЦДФ-этаноламином. Фосфатидилэтаноламин может также получаться при декарбоксилировании фосфатидилсерина и превращается в фосфатидилхолин в результате метилирования.
Мы уже отмечали почти повсеместную распространенность фосфатидов. Клеточные фосфатиды сосредоточены в ядерной, митохондриальной и микросомной фракциях. Соответствующие клеточные структуры, разумеется, обладают мембранами, и фосфатиды, по-видимому, содержатся главным образом, если не исключительно, в самих мембранах. По существующим представлениям фосфатиды выполняют ряд важных функций, в том числе функции поддержания клеточных структур, ионного транспорта, контроля проницаемости и переноса электронов в митохондриальной системе окислительного фосфорилирования. Уилсон и его сотрудники [168] показали, что свойства многих транспортных ферментов в значительной степени определяются фосфолипидами; по-видимому, эти ферменты сами являются структурными компонентами мембран.
Окисление жирных кислот. К окислительному расщеплению жирных кислот способны, вероятно, все живые организмы. У млекопитающих оно происходит во многих тканях, включая печень, почки и сердце, но количественная доля жирных кислот в общем метаболизме в разных тканях различна. В клетке эти процессы сосредоточены главным образом в митохондриях. В отличие от этого синтез жирных кислот катализируют в основном ферменты, находящиеся в цитозоле. Способность синтезировать жирные кислоты также варьирует от ткани к ткани.
Основные особенности окисления жирных кислот были выяснены в 1904 г. Кноопом и вскоре после него Эмбденом и Дэкином. Кнооп пришел к теории «р-окисления» на основании опытов, в которых он скармливал животным жирные кислоты с присоединенной в концевом положении фенильной группой, т. е. использовал метод мечения, почти на полстолетия опередив свое время. Введенная метка позволяла идентифицировать конечные продукты в моче. Полученные результаты наводили на мысль о последова
Промежуточный обмен: сравнительные аспекты - 461
тельном отщеплении двууглеродных фрагментов от исходной молекулы жирной кислоты. Потребовалось почти пятьдесят лет для полного экспериментального подтверждения выводов, которые сделал Кнооп на основании своей блестящей работы. Следующими вехами на пути расшифровки этого процесса явились: 1) наблюдения Лелуара и Муноса (1939 г.) над окислением жирных кислот в бесклеточных препаратах из печени морской свинки и 2) идентификация Линеном и Рейхертом «активированных» жирных кислот как S-ацилпроизводных кофермента А (1951 г.). Работая с бесклеточными препаратами, удалось выявить отдельные ферменты, участвующие в окислении жирных кислот, и изучить особенности катализируемых ими реакций. После открытия Липманом кофермента А были обнаружены ацильные производные KoA-SH, и это позволило разрешить самую трудную проблему — понять, почему не удавалось обнаружить ни один из предполагаемых промежуточных продуктов обмена и ни одну свободную жирную кислоту’с короткой цепью в процессе окисления более крупных молекул. Стало ясно, что все промежуточные продукты, в том числе жирные кислоты с короткой цепью, существуют только в виде производных SKoA.
Путь окисления жирных кислот выглядит следующим образом. Исходная жирная кислота активируется, превращаясь в ацил-SKoA, окисляется в а,р-ненасыщенное соединение, гидратируется, окисляется в p-кетопроизводное и, наконец, подвергается тиолити-ческому расщеплению, образуя ацетил-SKoA и SKoA-производное жирной кислоты, содержащей на два углеродных атома меньше, чем их было в первоначальной цепи. Это соединение в свою очередь проходит через тот же ряд превращений. Описание всех ферментативных этапов этого процесса можно найти в любом современном руководстве по биохимии.
О молекулярных механизмах, регулирующих окисление жирных кислот, мы почти ничего не знаем — отчасти потому, что до последнего времени трудно было изучать прямое окисление свободных жирных кислот (СЖК) во взвесях митохондрий. Теперь установлена важная роль карнитина в переносе СЖК внутрь митохондрий, где происходит их р-окисление. Вероятно, активированные жирные кислоты транспортируются через мембраны митохондрий в виде ацилкарнитинов. Последние образуются в результате реакции
Ацил-КоАКарнитин .< Ацилкарнитин -f- КоА,
катализируемой двумя различными ферментными системами. В переносе жирных кислот с короткой цепью участвует карнитинаце-тилтрансфераза, в то время как карнитинпальмитилтрансфераза катализирует перенос жирных кислот с длинной цепью [100]. Но-Рум и Бремер [101] изучили распределение последнего фермента
462
Глава 6
в различных тканях у разных организмов. Оказалось, что у трески, например, удельная активность его выше всего в печени, сердце и почках, а ниже всего — в мышцах, селезенке, гонадах и кишечнике. У рыб [70], так же как и у других животных [101], эта активность, по-видимому, коррелирует со способностью ткани окислять жирные кислоты.
Поскольку карнитинпальмитилтрансфераза играет ведущую роль в переносе активированных жирных кислот к месту их (3-окисления в митохондриях, можно было бы предполагать столь же важную роль ее в регуляции окисления жирных кислот. Однако работы Бремера и сотрудников [16] показали, что в большинстве случаев эта трансфераза не лимитирует скорость окисления жирных кислот. По-видимому, большое значение здесь имеет доступность других субстратов для окисления. Например, сукцинат тормозит окисление ацилкарнитина в митохондриях, осуществляющих •окислительное фосфорилирование, — возможно, вследствие конкуренции за кофермент А, необходимый для образования сукцинил-КоА. Для полного понимания того, как регулируется окисление жирных кислот, нужны дальнейшие исследования.
Биосинтез жирных кислот. Каждый из этапов окисления жирных кислот обратим. Поэтому предполагали, что синтез жирных кислот может происходить путем простого обращения окислительного пути. Теперь, однако, ясно, что главный аппарат биосинтеза жирных кислот состоит из внемитохондриальных компонентов.
Одним из первых указаний на то, что синтез жирных кислот идет по пути, отличному от пути их окисления, были данные о возможности синтеза жирных кислот в растворимых экстрактах из печени птиц и грудной железы [142, 150]. Для синтеза жирных кислот в растворимых клеточных экстрактах абсолютно необходимы бикарбонат, АТФ, Мп2+ и НАДФ-Н. Это позволяет четко различать пути синтеза и окисления, поскольку 1) бикарбонат никак не влияет на окисление жирных кислот и 2) окислительно-восстановительным коферментом при окислении служит НАД, а не НАДФ.
Синтез жирных кислот с длинной цепью — многоступенчатый . процесс, в котором участвуют по крайней мере шесть ферментов. [ У бактерий и растений все эти ферменты находятся в растворимой " фракции клетки и могут быть легко разделены, тогда как у дрожжей, птиц и млекопитающих они содержатся в макромолекулярных мультиферментных комплексах, называемых синтетазами жирных кислот. Наиболее изученный из таких комплексов — синтетаза из дрожжей — имеет мол. вес около 2,3 млн. и обнаруживает при исследовании в электронном микроскопе высокую степень ультра-структурной упорядоченности. Эту структуру можно диссоциировать на единицы с мол. весом около 100 000. Исходя из этих фактов, а также из того, что в синтетазном комплексе обнаружены семь концевых аминокислот, Линен высказал предположение, что
Промежуточньш обмен: сравнительные аспекты ' 463
комплекс состоит из шести или семи ферментов, каждый из которых катализирует определенный этап синтеза жирной кислоты. F Изучение биосинтеза жирных кислот сильно продвинулось вперед после открытия малонил-КоА как промежуточного продукта. В опытах с использованием различных ферментных систем, выделенных из тканей животных, из бактериальных и дрожжевых клеток, а также из растений, было показано, что для синтеза жирной кислоты из малонил-КоА помимо НАДФ-Н как восстановителя необходимы также небольшие количества ацетил-КоА. Оба атома углерода из ацетил-КоА включаются только в метильный конец синтезируемой жирной кислоты, тогда как ее остальные углеродные атомы происходят из малонил-КоА. Таким образом, стало очевидно, что ацетил-КоА служит своеобразной «затравкой» для синтетического процесса. Образование жирных кислот можно тогда описать следующим уравнением:
Ацетил-КоА пМалонил-КоА-f- 2п НАДФ• Н -ф 2п Н+ з >:
<—>- СН3(СН2СН2)пСО-КоА И- пСО2 ф п КоА -|- 2п НАДФ+ -ф п Н2О
Ферментные системы животных, растений и бактерий синтезируют свободные жирные кислоты, тогда как система из дрожжей дает КоА-производные.
Опыты Линена с дрожжевой ферментной системой позволили впервые проникнуть в химические детали процесса биосинтеза. Оказалось, что при синтезе и при расщеплении жирных кислот в качестве промежуточных продуктов образуются одни и те же карбоновые кислоты. Важное различие, однако, состоит в том, что при окислении промежуточные продукты связаны с коферментом А, тогда как при синтезе образуются карбоновые кислоты, связанные с белком через атом серы. Это свидетельствует о существенном различии между биохимическими путями расщепления и синтеза жирных кислот. В процессах синтеза участвуют сульфгидрильные группы двух типов, для различения именуемые «центральными» и «периферическими». На схеме синтеза жирных кислот, которую в 1961 г. впервые опубликовал Линен, эти два вида SH-групп обозначены соответственно жирным и обычным шрифтом (рис. 6-7).
В «затравочной реакции» синтеза остаток уксусной кислоты переносится с КоА на «периферическую» SH-группу. Затем следует перенос малонильного остатка с малонил-КоА на «центральную» SH-группу. Образовавшийся таким образом комплекс ацетилмало-нил—фермент превращается в ацетоацетил—фермент с одновременным выделением СО2. Связанная с серой ацетильная группа атакует в этой реакции нуклеофильную группу малонилового тиоэфира. Это высвобождение СО2, сопряженное с образованием ацетоацетил—фермента, существенно с термодинамической точки зрения, так как декарбоксилирование сдвигает реакцию вправо, т. е. в сторону конденсации. Вслед за образованием ацетоацетил—фер-
464
Глава 6
Перенос малонила.
Перенос ацила
2-е восстановление
Перенос пальмитоила
Конденсация
Дегидратация
SH
1-е восстановление
Реакция затравки (перенос ацила):
HS^ HS^
СН3—COSKoA + /Сермент ^=±: /Фермент + HSKoA.
HS7 СН3—COS7
Реакция удлинения цепи:
I) перенос малонила
СООН HS\
I 4- /Фермент
СН2—COSKoA СН3—(CH2-CH2)n—COS7
СООН
(^Н2-COS^
7--^ /Фермент 4- HSKoA;
СН3-(СН2—СН2),;—COS7
2) конденсация
СООН
I
СН2—COS^
/Фермент
СН3—(СН2—CH2)n—COS7
О
II
CH3-(CH2-CH2)n-C—CH2-COS\
> /Фермент 4- СО2;
HS7
3) 1-е восстановление
О
II
СН3—(СН2—СН2)П—С-СН2— COS\
/Фермент 4" НАДФ -Н + Н+
HS7
ОН
СН3-(СН2—СН2)П—СН—CH2-COSX
-<—> ^/Фермент 4- НАДФ+;
Промежуточный обмен: сравнительные аспекты
465
4) дегидратация
ОН
СН3—(СН2-СН2)П—СИ— СН2—COS^
/Фермент HSZ
СН3— (СН2—СН2)—СН=СН—COS^
/Фермент 4- Н2О;
HSZ
5) 2-е восстановление
сн3-(сн2-сн2)п-сн=сн-со5х (фмН)
/Фермент 4- НАДФ • Н+ -►
Фермент 4- НАДФ+;
6) перенос ацила
CH3-(CH2-CH2)n+1-COS^ HS^
/Фермент /Фермент.
HS/ CH3-(CH2-CH2)n+1-COS/
Конечная реакция (перенос пальмитоила)
CH3-(CH2-CH2)n+1-COS^ /Фермент 4- HSKoA -<—>• HSZ
HS^
Ч-—>: ^/Фермент 4- СН3—(СН2—СН2)п+1—COSKoA.
Рис. 6-7. Реакции |биосинтеза жирных кислот и гипотетическая структура мульти-ферментного комплекса синтетазы жирных кислот [87].
мента белковое p-кетоацилпроизводное поэтапно проходит восстановление, дегидратацию и еще раз восстановление, образуя бути-рилпроизводное фермента. В конце концов бутирильная группа переносится на периферическую сульфгидрильную группу, оставляя центральную сульфгидрильную группу свободной для присоединения второго остатка малонила. Таким образом, вся последовательность реакций начинается снова, и это повторяется до тех пор, пока не будет построена цепь насыщенной жирной кислоты из 16—18 углеродных атомов. Почему удлинение цепи после этого прекращается, неизвестно.
Попытки разделить комплекс на отдельные активные ферменты пока не привели к успеху. В пользу предложенной схемы говорят три группы данных: а) результаты изучения роли сульфгидрильных групп того и другого типа; б) данные, показавшие, что аце-30—1332
466
Глава 6
тил-КоА и малонил-КоА взаимодействуют, образуя связанные с белком ацетоацетильные производные, соединенные ковалентно тиоэфирной связью с остатком центральной сульфгидрильной группы; в) образование предсказанных продуктов при действии комплекса синтетазы жирных кислот на аналоги субстратов. Веские дополнительные данные были получены также при изучении синтеза жирных кислот у Е. coli. У этого организма все ферменты синтеза жирных кислот находятся в растворимой фракции бесклеточных препаратов; Вагелос с сотрудниками и группа Уэйкила выделили эти ферменты и изучили их по отдельности. При этом основные механизмы у Е. coli оказались совершенно аналогичными тем, которые предположил Линен для синтетазного комплекса [49, 87].
Какие преимущества может дать клетке специфическое упорядочение ферментов в функционально важные агрегаты? Было высказано предположение, что синтетазы жирных кислот у Е. coli и у дрожжей (а также в животных тканях) отражают два этапа эволюции данной ферментной системы. Согласно этой концепции, синтез жирных кислот из малонил-КоА, НАДФ-Н и ацетил-КоА первоначально мог осуществляться, как у Е. coli, отдельными ферментами и легко отделяющимся от них «ацилпереносящим белком». В ходе эволюции эти ферменты и ацилпереносящий белок объединились в комплекс — синтетазу жирных кислот, в котором эти компоненты прочно связаны друг с другом (как в мультифер-ментном комплексе дрожжей).
Возможно, что высокоорганизованная структура дрожжевой синтетазы жирных кислот в каталитическом отношении более эффективна благодаря двум обстоятельствам, которые мы сейчас рассмотрим.
1. С кинетической точки зрения перенос промежуточных продуктов от одного фермента к другому будет, по-видимому, более эффективным, если нет необходимости в свободной диффузии к нет разбавления этих продуктов в цитоплазме. Если промежуточные продукты ковалентно связаны с организованным комплексом, встреча продукта одной каталитической реакции со следующим каталитическим центром должна быть гораздо более вероятной, чем в смешанном растворе отдельных ферментов. Правда, это преимущество может быть отчасти нейтрализовано тем обстоятельством, что в любой данный момент могут быть заняты лишь некоторые центры катализа. Однако в конечном результате получается сложный процесс, который, судя по высокой удельной активности комплекса, отличается высокой эффективностью. Свежеприготовленный дрожжевой ферментный комплекс с мол. весом 2,3 млн. при 25 °C и pH 6,5 катализирует превращение в жирные кислоты до 6000 моль малонил-КоА в 1 мин. Не меньшее значение имеет тот факт, что ковалентно связанные промежуточные продукты недоступны для конкурирующих процессов. В случае синтеза жирных кислот устранены и помехи со стороны ферментов, расщепляющих
Промежуточный обмен: сравнительные аспекты
467
эти кислоты. В этом смысле мультиферментный комплекс можно сравнить со строгой компартментализацией в минимальном объеме пространства.
2. Как показали исследования, второе преимущество объединения ферментов в единый комплекс может быть связано с поддержанием активной конформации их полипептидных цепей. Известно, например, что диссоциация дрожжевого комплекса приводит к некоторому снижению каталитической активности, которая восстанавливается после реассоциации. Это позволяет предполагать, что активная конформация зависит от специфических взаимодействий между ферментами в таком комплексе. Подобные же опыты с диссоциацией и реассоциацией проводятся сейчас на синтетазе жирных кислот из печени крысы и голубя. Диссоциация также приводит здесь к полной потере некоторых каталитических функций и ослаблению других, тогда как реассоциированный комплекс по способности специфически катализировать синтез жирных кислот не отличается от нативного [77].
Синтез жирных кислот в печени и л актирующей молочной железе млекопитающих — процесс преимущественно внемитохондри-альный [132]. Однако ацетил-КоА, образующийся при окислении пирувата и жирных кислот, вырабатывается в митохондриях, и, значит, должен быть обеспечен переход его из митохондрий во вне-митохондриальное пространство клетки. Был рассмотрен ряд возможных механизмов [85]. Наиболее вероятный из них связан с участием цитрата или какого-то вещества, биохимически родственного цитрату. Цитрат образуется в митохондриях под действием конденсирующего фермента, входящего в цикл Кребса. После диффузии из митохондрий цитрат может расщепляться соответствующим ферментом с образованием оксалоацетата и ацетил-КоА, а последний мог бы затем использоваться как предшественник при синтезе жирных кислот. Возможность такого пути установлена [85], но служит ли он единственным или хотя бы главным источником ацетил-КоА для синтеза жирных кислот, пока неизвестно.
Можно полагать, что путь синтеза жирных кислот, начинающийся от цитрата, включает следующие реакции:
1) Цитрат + АТФ + КоА —> Ацетил-КоА + АДФ + Фн + ОАц;
2) Ацетил-КоА Т АТФ + СО2 —>• Малонил-КоА Jr АДФ 4- Фн;
3) Малонил-КоА + НАДФ • Н-->
---> КоА-производное жирной кислоты + НАДФ 4- СО2.
Реакцию 1 катализирует цитратлиаза, реакцию 2—ацетил-КоА— карбоксилаза, реакцию 3 — комплекс синтетазы жирных кислот.
Когда цитратлиаза насыщена субстратами, скорость синтеза Жирных кислот определяется реакцией ацетил-КоА—карбоксилазы; У млекопитающих этот последний фермент активируют карбоновые кислоты, из которых особенно эффективна лимонная кислота [85]. 30*
468
Глава 6
Кратковременный регуляторный эффект цитрата усложняется действием ионов Mg2+, также активирующих фермент, и влиянием косубстрата — АТФ, который в высоких концентрациях предотвращает активацию цитратом.
Пальмитил-КоА тоже ингибирует синтез жирных кислот из ма-лонил-КоА. Поскольку пальмитил-КоА можно рассматривать как «конечный продукт» этого синтеза, кажется вероятным, что он оказывает тормозящее действие в нескольких пунктах по принципу обратной связи. Следует ожидать, что в дальнейшем удастся обнаружить регуляторные метаболиты, а также выявить механизмы, интегрирующие регуляцию синтеза и окисления жирных кислот.
Наряду с данными о быстром регулировании синтеза жирных кислот, зависящем от модуляции специфических регуляторных ферментов (например, цитратлиазы) метаболитами, имеется также много сведений о долговременной регуляции этого процесса. У млекопитающих для максимального проявления этой регуляции требуется несколько дней. Длительное голодание, диабет, обильное потребление жиров приводят со временем к значительному снижению синтеза жирных кислот, а рацион, богатый углеводами, или введение инсулина —к его повышению. Эти долговременные эффекты сопровождаются адаптивными изменениями активности ферментов, участвующих в синтезе жирных кислот; полагают, что это связано с изменением скорости синтеза или деградации соответствующих ферментов.
Сравнительные аспекты липидного обмена. Летающие насекомые. Бегающие или плавающие животные могут в любой момент остановиться и не потеряют под собой полностью опоры, тогда как машущий полет насекомых (и, разумеется, мелких птиц) требует непрерывной мышечной работы. Это означает, что летательные мышцы не могут утомляться, так как даже после нескольких секунд анаэробиоза тело животного будет наводнено лактатом или другими подобными продуктами. Поэтому не удивительно, что активная мускулатура крыльев состоит почти исключительно из аэробной, ткани с чрезвычайно благоприятными условиями диффузионного газообмена. Это в особенности относится к летающим насекомым, а вероятно, и к птицам [160]. У птиц во время длительного полета жир служит единственным топливом, имеющим существенное значение. У насекомых же встречаются два крайних варианта. Большинство двукрылых и перепончатокрылых способно использовать для полета только углеводы, хотя в другое время у них утилизируются и жиры. Все бабочки, интенсивность обмена у которых поразительно высока, используют только жиры — как во время полета, так и в покое. Многие другие насекомые (такие, как Orthoptera, Homoptera и Coleoptera) в начале полета наряду с жирами используют и углеводы. Однако во время продолжительного полета единственным важным топливом у них служит жир, а
Промежуточный обмен: сравнительные аспекты
469
запасы трегалозы в крови и гликогена в жировом теле истощаются в течение первого часа полета или около того.
В последние 10 лет появилось много биохимических работ, посвященных синтезу, переносу и расщеплению жиров и жирных кислот у летающих насекомых. Эти работы показали, что углеводы и жирные кислоты пищи включаются в жировое тело (главным образом в форме триглицеридов) и по мере надобности высвобождаются в гемолимфу в виде диглицеридов, слабо связанных с белком. В волокнах летательных мышц жирные кислоты отщепляются, активируются и далее проходят обычную «спираль» р-окисления до ацетил-КоА. Катаболизм жира в летательной мускулатуре насекомых— самый активный из процессов этого типа, известных в природе. Поэтому имеет смысл детально рассмотреть некоторые специализации, выработавшиеся здесь в процессе эволюции.
Гексозы, ацетат и свободная пальмитиновая кислота как in vitro, так и in vivo быстро включаются в жировое тело в форме нейтральных триглицеридов (содержащих главным образом пальмитиновую и олеиновую кислоты) [29, 140, 141]. Во время полета мигрирующей саранчи уровень триглицеридов и жирных кислот в ее крови повышается в 3—4 раза; меньшее, но также существенное повышение уровня жирных кислот, наблюдаемое в мышцах, обусловлено, как полагают, их поступлением из крови. В то же время общее содержание углеводов в жировом теле и трегалозы в крови падает практически до нуля [141]. У насекомых главный липидный компонент, высвобождающийся в кровь из депо, — это диглицериды, связанные с белком (тогда как у млекопитающих это свободные жирные кислоты, связанные с альбумином). По-видимому, высвобождение диглицеридов идет с затратой метаболической энергии и находится под гормональным контролем.
Многие попытки ранних исследователей измерить прямое окисление свободных жирных кислот в гомогенатах летательных мышц саранчи окончились неудачей — вероятно, потому, что эти мышцы нуждаются в карнитине как кофакторе для переноса жирных кислот в митохондрии. Беенаккерс и Клингенберг [10] нашли в митохондриальной фракции летательных мышц саранчи карнитин-КоА—трансацетилазу, столь же активную, как и в сердце голубя, и в два-три раза более активную, чем в его грудной мышце. Этого фермента не оказалось в летательных мышцах пчелы, использующих при полете только углеводы. Для некоторых жуков карнитин является витамином, но другие насекомые, нуждающиеся в этом веществе, по-видимому, могут его синтезировать.
Судя по результатам изучения соответствующих ферментов, расщепление жирных кислот в митохондриях летательных мышц идет обычным путем [10]. Беенаккерс нашел, что в летательной мышце саранчи, использующей в качестве топлива исключительно жир, активность ферментов окисления жирных кислот в 100 раз выше, чем у пчелы, использующей только сахар. Было бы особенно
470
Глава 6
интересно провести подобные анализы у ночных и дневных бабочек с их высокой интенсивностью метаболизма.
Плавающие животные (главным образом рыбы). Быстрое плавание требует значительного расхода энергии; однако в прошлом несколько преувеличивали и скорость плавания, и необходимую мышечную работу. Например, по наиболее точным современным данным, тихоокеанский дельфин Tursiops gilli развивает максимальную скорость около 30 км/ч и расходует при этом на единицу веса мышц не больше энергии, чем люди-спортсмены [79]. Аналогичных данных для быстро плавающих рыб не имеется, но есть все основания полагать, что величины здесь того же порядка, что и у дельфина; действительно, лосось занимает одно из первых мест по эффективности передвижения среди изученных в этом отношении животных [79]. Хотя расход энергии не слишком велик и эффективность плавания высока, возможности некоторых рыб, например лососей, поистине поразительны. Тихоокеанские лососи во время нерестовых миграций проходят многие сотни и даже тысячи миль, не восстанавливая запасы энергии питанием. У рыб в отличие от птиц и млекопитающих нет специальной жировой ткани: резервные триглицериды распределены по всему телу, и их особенно много в мышечных волокнах или поблизости от них [138]. Эти триглицериды, несомненно, служат главным источником энергии для миграции лососевых, поскольку около 90% расходуемой энергии доставляет окисление жиров [65]. Срезы мышц лосося, в особенности богатой жиром красной боковой мускулатуры, могут окислять жирные кислоты [14]. Ферментативные механизмы окисления и синтеза жирных кислот у рыб и млекопитающих, по-видимому, сходны [58]. Однако при изучении рыб возникают специальные проблемы, связанные с обменом жиров при температурной адаптации. Аналогичные явления свойственны, быть может, и другим животным, но большая часть экспериментальных данных получена на рыбах, так что о них в основном и будет идти речь.
Один из основных экспериментальных результатов состоит в том, что холодовая акклимация рыб приводит к заметному повышению интенсивности как окисления [35], так и синтеза [57] жирных кислот. В ряде работ [116, 117] показано, что происходящие в процессе акклимации качественные изменения в составе фосфолипидов, связанных с мембранами, имеют большее значение, чем простые изменения концентрации каждого отдельного компонента. Иными словами, при температурной акклимации, может быть, важнее то, какие именно жирные кислоты будут включаться в фосфолипиды, чем то, в каком количестве будет представлен тот или иной компонент. Насколько известно, подобные явления встречаются только у-организмов, способных к температурной акклимации. К числу таких организмов относятся многие рыбы и, вероятно, многие беспозвоночные. В связи с этим основным наблюде
Промежуточный обмен: сравнительные аспекты
471
Нием возникает ряд очень интересных вопросов. От каких регуля-тооных механизмов зависит преимущественный синтез определенных жирных кислот и определенных фосфолипидов? Каким образом изменение температуры «включает» эти механизмы? Происходящие изменения особенно велики в нервной системе; каковы их функциональные последствия?
Уилсон и сотр. [168] получили данные, которые могут оказаться важными для ответа на эти вопросы. Работая с мутантом Е. coll, дефектным по способности синтезировать ненасыщенные жирные кислоты, эти исследователи смогли экспериментально изменить жирнокислотный состав фосфолипидов, связанных с мембранами. Они обнаружили, что свойства систем переноса р-галак-тозидов и р-глюкозидов в клеточной мембране зависят от того, какие жирные кислоты включены в мембранные фосфолипиды. Кривые Аррениуса, описывающие зависимость активности соответствующих ферментов от 1/Т, образуют заметные «переломы»; температура, которой соответствуют эти переломы, также зависит от характера жирной кислоты, включенной в мембрану. Из этих экспериментов, вероятно, следуют два фундаментальных вывода: 1) возможны два физических состояния мембраны — одно при температуре выше критической точки и другое при температуре ниже точки перехода, определяемой составом липидной фазы (см. гл. 9); 2) свойства ферментов, связанных с мембраной или составляющих часть ее структуры, в той или иной мере определяются фосфолипидами этой мембраны. Эти выводы, возможно, окажут существенное влияние на дальнейшее развитие исследований по температурной адаптации.
Китообразные. Пересекая океаны во время своих феноменальных миграций, эти животные используют в качестве топлива только жир. Кроме того, у них выработалась особая модификация жирового обмена для отложения термоизолирующих слоев ворвани. Отложения ворвани, по-видимому, метаболически инертны, поскольку они не служат резервом для выработки энергии и не используются даже в условиях крайнего истощения. Механизмы, регулирующие перемещение углерода между этими различными резервами жира, совершенно не изучены.
Копытные. Метаболизм диких копытных также совершенно не исследован. Мы упоминаем этих животных только потому, что у них, по-видимому, выработались какие-то уникальные адаптации жирового обмена. Известно, что североамериканский чернохвостый олень способен длительно выдерживать почти полное голодание; у домашних копытных при сравнимых условиях развивается сильнейший кетоз печени в результате избыточного образования ацетоацетата и p-оксибутирата. Как полагают, такая устойчивость присуща и родственным видам, например тундровому карибу, и Должна иметь приспособительное значение во время их ежегодных очень далеких миграций, когда возможен недостаток корма. Моле-
472
Глава 6
кулярная основа этой особенности метаболизма совершенно неизвестна.
Бурая жировая ткань млекопитающих. Бурая жировая ткань — единственный известный у гомойотермных животных орган, главная функция которого состоит в выработке тепла. Как показали многочисленные исследования, эта ткань специально приспособлена для усиленного термогенеза во время пробуждения после зимней спячки, при адаптации к холоду и у новорожденных особей некоторых видов [8, 54, 129]. В связи с этой функцией бурого жира особое значение имеет то, что она расположена вокруг жизненно важных органов и снабжена специальной сетью сосудов, обеспечивающей быстрый возврат теплой крови в грудную клетку [130]. Молекулярная основа теплопродукции не вполне ясна. Клетки бурой жировой ткани забиты крупными округлыми митохондриями, каждая из которых в свою очередь богата кристами [45]. На ранних стадиях развития или во время холодовой акклимации вокруг митохондрий накапливаются крупные капельки жира [8], что, возможно, говорит о высокой интенсивности жирового обмена. Поскольку выработка тепла, в-ероятно, зависит от уровня дыхательной активности митохондрий, очевидно, что проблемы регуляции теплопродукции и регуляции катаболизма тесно связаны между собой.
Четко показано, что в таких тканях, как скелетная мышца, сердце и печень, клеточное дыхание при повышении рабочей нагрузки (метаболической или сократительной) может регулироваться концентрацией АДФ. Однако в бурой жировой ткани, по-видимому, слабо развиты механизмы преобразования метаболической энергии в физиологически «полезные» формы работы; энергия от расщепления жиров в основном освобождается в форме тепла. Современные представления о метаболических особенностях бурой жировой ткани можно резюмировать следующим образом.
1. Как in vitro, так и in vivo потребление кислорода клетками бурой жировой ткани очень сильно (иногда в 30 раз) увеличивается под действием катехоламинов. Предполагают, что эти гормоны участвуют в регулировании функции бурого жира in vivo [44, 55, 69] (рис. 6-8).
2. Этот резкий подъем интенсивности дыхания связан с тем, что катехоламины активируют а дени л циклазную систему; последующая активация липазы приводит к расщеплению триглицеридов, и образующиеся жирные кислоты служат непосредственным субстратом для энергетического обмена.
3. Высокая интенсивность дыхания указывает либо на очень быстрый гидролиз АТФ (например, при липогенезе), либо на отсутствие регуляции дыхания акцептором фосфата (т. е. АДФ)-В последнем случае процессы окисления и фосфорилирования в митохондриях были бы разобщены. Вопрос о степени разобщения и механизме ее регуляции остается спорным.
Промежуточный обмен: сравнительные аспекты
473
4. Судя по некоторым данным [76], синтез триглицеридов слишком незначителен для того, чтобы в процессе этерификации жирных кислот могло использоваться количество АТФ, образующееся при нормальной эффективности фосфорилирования.
Рис. 6-8. Регуляция синтеза АТФ и теплопродукции в митохондриях бурой жировой ткани.
5. Поэтому многие авторы полагают, что при активной теплопродукции в бурой жировой ткани должно иметь место частичное разобщение дыхания и фосфорилирования.
6. Уильямсон [164] показал, что жирные кислоты, освобождающиеся при стимуляции клеток норадреналином, одновременно служат и субстратом интенсивного дыхания, и разобщающим агентом. Имеются данные о том, что высокие концентрации жирных кислот
474
Глава 6
сами способны вызвать разобщение, но в то же время доказано, что это их действие вряд ли осуществляется in vivo [164]. Таким образом, детали процесса разобщения еще предстоит выяснить (дальнейшее обсуждение этого интересного вопроса см. в гл. 9).
Простагландины. Поразительным достижением биологии в последние годы явилось открытие группы чрезвычайно активных веществ, названных простагландинами. Они образуются из различных полиненасыщенных жирных кислот с длинной цепью, например из арахидоновой кислоты; эти кислоты подвергаются циклизации под действием ферментов, связанных с микросомами. Простагландины обнаружены во всех исследованных тканях, и сравнительную интенсивность их выделения тканями можно определить in vitro или в опытах с нервной и (или) гормональной стимуляцией.
После выхода в кровоток простагландины быстро и эффективно расщепляются в печени, а возможно, и в легких. Эти вещества обладают широким спектром фармакологического действия. Их физиологическая активность не установлена сколько-нибудь определенным образом, хотя в качестве возможной главной функции простагландинов рассматривается их прямое или опосредованное аденилциклазой участие в механизме действия гормонов. В ближайшем будущем можно ожидать углубленных исследований в этой области [109].
Цикл лимонной кислоты
Этот цикл, часто называемый также циклом Кребса или циклом трикарбоновых кислот, занимает центральное место в метаболизме большинства клеток. Схема этого цикла, первоначально предложенная для объяснения полного сгорания пирувата и 2—3-угле-родных конечных продуктов окисления жирных кислот, относится к самым ранним из известных примеров интегрированного процесса, в котором все промежуточные продукты включены как катализаторы в работу системы в целом. Значение цикла лимонной кислоты выходит за пределы этих и других чисто катаболических функций; будучи узловым центром главных путей клеточного обмена, он обеспечивает ключевые реакции и субстраты для биосинтеза (анаболизма) множества важных метаболитов — от аминокислот, пуринов и пиримидинов до жирных кислот с длинной цепью и порфиринов.
Окисление моно-, ди- и трикарбоновых кислот препаратами животных тканей начали изучать больше полустолетия назад. Ранние исследователи нашли, что из множества испытанных соединений только сукцинат, фумарат, малат и цитрат окисляются достаточно быстро и могли бы поэтому быть промежуточными продуктами расщепления жиров и углеводов. В 1936 г. Мартиус и Кнооп высказали предположение, что от цитрата к сукцинату ведет следую
П ромежуточный обмен: сравнительные аспекты 475
щая цепь реакций: Цитрат—>Изоцитрат—> Оксалосукцинат—>-а-Кетоглутарат—> Сукцинат. Через год после этого Кребс, основываясь на своих опытах, доказавших образование цитрата в грудной мышце голубя из пирувата и оксалоацетата, указал, что полное окисление пирувата до трех молекул СО2 можно было бы объяснить циклическим протеканием следующих реакций: Пируват-}-Оксалоацетат —> Цитрат—^пс-Аконитат —>• Изоцитрат —> а-Кето- -глутарат—> Сукцинат—> Фумарат—>Малат—Оксалоацетат.
Основные черты этого метаболического пути, схема которого предложена Кребсом, хорошо изучены. Указанная последовательность реакций служит главным путем катаболизма пирувата и ацетата (в виде ацетил-КоА) в большинстве животных тканей. Доказательства можно кратко суммировать следующим образом.
1. Постулированные Кребсом промежуточные продукты имеются в большинстве тканей и быстро окисляются в них.
2. Добавление различных метаболитов цикла стимулирует эндогенное дыхание, и потребление кислорода возрастает при этом в гораздо большей степени, чем это мог бы вызвать добавленный промежуточный продукт сам по себе. Последний факт ясно указывает на циклическую природу процесса окисления: добавленные субстраты действуют каталитически, а не стехиометрически, так как они (по крайней мере частично) регенерируются в ходе окислительной реакции.
3. Как и следовало ожидать, малонат, действующий в низких концентрациях как высокоспецифический ингибитор превращения сукцината в фумарат, подавляет дыхание и вызывает накопление сукцината.
4. При окислении специфически меченных субстратов (например, глюкозы или пирувата) распределение 14С между различными углеродными атомами промежуточных продуктов цикла Кребса полностью согласуется с предложенной схемой.
5. Можно показать, что отдельные реакции, постулированные для цикла, действительно осуществляются как в неочищенных гомогенатах, так и при использовании высокоочищенных ферментов.
6. У большинства организмов все реакции цикла Кребса происходят в митохондриях, а активности отдельных ферментов, варьируя от ткани к ткани, находятся в примерно одинаковом соотношении друг к другу.
Мы не будем приводить здесь новейшие варианты схемы цикла лимонной кислоты, описывать входящие в него реакции и ферменты, катализирующие каждый отдельный этап, поскольку все это можно найти в любом современном руководстве по биохимии.
Катаболические функции цикла лимонной кислоты. Существует три больших класса органических соединений, находящихся в относительно восстановленном состоянии и используемых как обычное метаболическое топливо: углеводы, жиры и белки. Цикл лимонной кислоты может служить каталитическим механизмом для
Лизин
Триптофан
Аланин
Серин*
Цистеин
НАД*
НАДФ
Пропионил-КоА
Углеводы
-о2с
'Ог
Жирные кислоты
ос-Кетоадипат
СН3СОСО2-Пируват
Цистин
Ацетат
Оксалоацетат
Сукцинат
нс=о
Сукцинил-КоА
С^СЬСКрССК-КоА
А цетоацетил-КоА
фумарилацето-ацетат
2
Фенилаланин
Тирозин
Тирозин
Лактат
(сн2)2
фенилаланин
Кротонил-КоА ^Фумарат
А А цетоацетат
СО,~ HZCZ
ЧСОЙ-Л'0Л
Урацил
Ацетил-КоА
Малонилг-КоА
Цитрат
НАД-Н
Ацетальдегид
д$ _19-игоцитрат
кетоглутарат
Зтанол
со2-
NH3 СН
L-Глуталяин
СО2~
Сукцинатсеми-альдегид
СО2“
(СН2)2
СН3-С-Н
С°г“\
1-Тлутамат
Пролин
Ч-Аминобутират
Валин
Пропионил-КоА х-Метилацетпо-ацетил -КоА
COS КоА
Метилмалонил-КоА
Тимин
АцетилКоА
Жирные кислоты к-Кетповутират
—Цитруллин
Метионин Триптофан
Ацетил-КоА
Глутаматсемиалъ дегид
I /I
Цзолеррцин
Орнитин
1
Рис. 6-9. Роль цикла лимонной кислоты в катаболизме ;[88].
Многоступенчатые реакции обозначены двуконтурными стрелками. Промежуточные проДУк' ты, общие для различных путей обмена, подчеркнуты.
Промежуточный обмен: сравнительные аспекты
477
полного окисления всех этих веществ. Любой метаболит, который способен в результате своего расщепления в организме превратиться в какой-либо из промежуточных продуктов цикла Кребса, может служить субстратом для клеточного дыхания. При окислении углеводов образуются пируват и ацетил-КоА. Жирные кислоты — основной источник энергии,' доставляемой жирами, — также дают ацетил-КоА в результате реакций ^-окисления. Если, как это обычно бывает, жирная кислота содержит четное число углеродных атомов, образующих неразветвленную цепь, единственным продуктом ip-окисления будет ацетил-КоА. Другие жирные кислоты— с нечетным числом углеродных атомов или с разветвленной цепью — дают пропионил-КоА и ацетил-КоА. Путь полного окисления пропионил-КоА включает двустадийное ферментативное превращение в сукцинил-КоА. В то время как обмен ацетил-КоА может идти различными путями, судьба сукцинил-КоА ограничивается в основном превращением в сукцинат с последующим фосфорилированием ГДФ в ГТФ на уровне субстрата. Как видно из рис. 6-9, ацетил-КоА и сукцинил-КоА расположены в ключевых пунктах цикла. Через эти пункты, взятые вместе, в большинстве случаев проходит основной поток углерода, поступающего в цикл.
У определенных видов и в некоторых тканях значителен удельный вес аминокислот в катаболизме, осуществляемом через цикл лимонной кислоты. Мы не будем детально рассматривать пути расщепления различных аминокислот. Однако на рис. 6-9 ясно показаны места, в которых к циклу Кребса могут «подключаться» те или иные аминокислоты. Обычно существует два главных пути превращения а-аминокислот в соответствующие а-кетокислоты (первый этап катаболизма для большинства соединений этой группы): 1) д^гидрогенирование, катализируемое флавопротеидными оксидазами аминокислот, и 2) трансаминирование с а-кетоглутаратом при участии трансаминаз, связанных с пиридоксальфосфатом. У млекопитающих в катаболизме природных L-аминокислот (за исключением L-пролина) преобладают реакции трансаминирования. Такой путь обмена аминокислот оказывается тупиком для превращений аминогруппы, если невозможен ее переход в «свободную» форму (NH3 или NH^). В связи с этим очевидна особая роль L-глутамата, который превращается в а-кетоглутарат с освобождением NH* О важности этой реакции для клеточного метаболизма говорит и широкое распространение катализирующего ее фермента — глутаматдегидрогеназы.
Очевидно, что работа цикла лимонной кислоты как метаболического устройства для полного окисления пирувата или ацетил-КоА Должна сопровождаться обратным окислением образующихся восстановленных коферментов (НАД-Н и ФАД-Н2). Это достигается с помощью системы переноса электронов, связывающей различные Дегидрогеназы с молекулярным кислородом. В 1937—1941 гг. Бе-лицер, Цибабова и Калькар установили, что большие количества
478
Глава 6
энергии, освобождающиеся при полном окислении метаболитов в цикле Кребса, могут использоваться для синтеза АТФ, и этот процесс получил название окислительного фосфорилирования. В последующее десятилетие эти исследования сильно продвинулись, так что к 1950 г. стало ясно, что 1) окислительное фосфорилирование происходит только в митохондриях; 2) дыхание (т. е. окисление) и фосфорилирование, в обычных условиях «тесно сопряженные», можно «разобщить», т. е. отделить друг от друга, с помощью определенных агентов; 3) фосфорилирование сопряжено почти исключительно с переносом электронов, а не с окислением на уровне субстрата (11 из 12 молей АТФ, образующихся при окислении 1 моля ацетил-КоА, и 14 из 15 молей АТФ, образующихся при окислении 1 моля пирувата, синтезируются в процессе окислительного фосфорилирования); 4) для различных субстратов, претерпевающих одноэтапное окисление, отношение P/О (число молей А ГФ на 1 грамм-атом потребленного кислорода) оказывается близким к целым числам. Так, при окислении а-кетоглутарата в сукцинат отношение P/О близко к 4, при превращении малата в оксалоацетат, глутамата в а-кетоглутарат и 0-оксибутирата в ацетоацетат оно близко к 3, а при дегидрогенировании сукцината с образованием фумарата равно 2.
Основные компоненты системы переноса электронов, катализируемые реакции и кинетика этих реакций, по-видимому, совершенно идентичны в различных клетках, и их можно кратко представить следующей схемой:
Субстрат---> НАД --^НАД-Н-дегидрогеназа
Цитохром b -->
Сукцинат --> Сукцинатдегидрогеназа'
---> Цитохром cpj--> Цитохром с--► Цитохром (а ф- а3) -> О2.
Грин и его сотрудники использовали митохондрии сердца для выделения еще меньших, субмитохондриальных, частиц, переносящих электроны, и в конце концов получили четыре комплекса, каждый из которых способен катализировать одну из реакций, составляющих цепь переноса электронов. Путем воссоединения были получены более сложные комплексы, способные катализировать две или большее число этих реакций. На основании подобных экспериментов, а также спектроскопических данных о восстановлении и обратном окислении различных дыхательных частиц и опытов со специфическими метаболическими ядами удалось идентифицировать главные этапы, на которых происходит фосфорилирование: НАД-Н—>НАД-Н-дегидрогеназа, цитохром b—>цитохром Ci и цитохром а—>цитохром «з.- Считают, что синтез АТФ связан с этими реакциями, но механизм фосфорилирования остается пока неясным. Эта область клеточной биоэнергетики продолжает все боле& интенсивно изучаться, поэтому мы не будем входить здесь в какие-
Промежуточный обмен: сравнительные аспекты
479
либо детали и отсылаем интересующихся читателей к современным учебникам и обзорным статьям.
Митохондрии содержат относительно большое количество липидов, входящих в состав их мембран; более 90% этих липидов относится к фосфолипидам. Изолированные субмитохондриальные частицы сохраняют этот липидный компонент. Липиды, выделенные из митохондрий сердечной мышцы быка, содержат примерно равные количества фосфатидилхолина и фосфатидилэтаноламина, составляющих вместе около 70% всего липидного материала. Митохондриальные фосфолипиды обнаруживают относительно высокую степень ненасыщенности, что, очевидно, имеет функциональное значение. Каталитическую активность любого из четырех комплексов можно уменьшить, обработав их растворителями липидов, но она восстанавливается после добавления ненасыщенных фосфолипидов. Обычно чем выше степень ненасыщенности этих фосфолипидов, тем сильнее их реактивирующее действие. Функция фосфолипидов, по-видимому, состоит в стабилизации активных конформаций (как индивидуальных, так и общей) различных белков дыхательной цепи, конформаций, при которых эти белки могут надлежащим образом взаимодействовать.
Регуляция катаболических функций цикла лимонной кислоты. Активность ферментов. Для митохондрий характерны более или менее постоянные соотношения между величинами максимальной активности различных ферментов, в том числе дегидрогеназ цикла лимонной кислоты и переносчиков в системе переноса электронов. Это, по-видимому, относится как к летательным мышцам насекомых (саранчи), так и к различным тканям крысы. Можно предположить поэтому, что синтез и числа оборота ключевых митохондриальных ферментов координированы между собой — возможно, на генетическом уровне.
Концентрации субстратов. Доступность исходных субстратов является важным регулирующим фактором для любой цепи реакций. Хорошим показателем метаболической активности данного метаболита может служить период его полужизни. В печени и почке крысы эти периоды у всех промежуточных продуктов цикла лимонной кислоты измеряются секундами; исключение составляет окса-лоацетат, период полужизни которого измеряется десятыми долями секунды. Это указывает на важную роль оксалоацетата в регуляции митохондриального обмена, что, по-видимому, подтверждают и новейшие исследования [ПО, 167].
Регуляция дыхательного обмена. Интенсивность митохондриального дыхания зависит также от сопряжения дыхания с фосфорилированием. В интактных митохондриях эти процессы обычно «тесно сопряжены» (когда уровни АДФ и Фн не являются лимитирующими факторами) и интенсивность дыхания сильно зависит от отношения АДФ/АТФ. Если это отношение велико («состояние 3»), т- е. большая часть внутримитохондриальных адениннуклеотидов
480
Глава 6
находится в форме АДФ, то уровень потребления кислорода высок. I Напротив, при избыточном образовании АТФ из АДФ и Фн, т. е. г тогда, когда использование АТФ отстает от его синтеза, дыхание * ослабевает («состояние 4»). В литературе эти явления несколько
Г-б-Ф
Рис. 6-10. Шесть регуляторных 'взаимодействий, влияющих на выработку и использо1ва1ние цитрата '[4].
Модулирующие воздействия указаны прерывистыми линиями: отрицательные — с крестиками, положительные — со стрелками на конце.
неопределенно называют «регуляцией дыхания». Попутно стоит также упомянуть о «состояниях 1 и 2». В «состоянии 1» митохондрии лишены и АДФ и субстрата, а в «состоянии 2» АДФ имеется, но субстрата еще нет; потребление кислорода в обоих случаях невелико.
Промежуточный обмен: сравнительные аспекты
481
Регуляция на уровне цитрата и интеграция с другими путями. Судя по имеющимся данным о регуляции катаболических функций цикла лимонной кислоты, этот цикл можно подразделить на два участка: а) участок ацетил-КоА—->а-кетоглутарат, контролируемый реакциями цитратсинтазы и изоцитратдегидрогеназы, и б) участок а-кетоглутарат—>оксало ацетат, по крайней мере отчасти контролируемый реакцией а-кетоглутаратдегидрогеназы [4, ПО, 167]. Главную роль в управлении первым участком играет регуляция образования и использования цитрата.
Известно не менее шести регуляторных взаимодействий, влияющих на активность ферментов и, по-видимому, непосредственно участвующих в регуляции образования и использования цитрата (рис. 6-10). Три из них влияют на образование цитрата.
1. Аденилаты регулируют активность самой цитратсинтазы. При этом АТФ (по крайней мере в печени крысы) оказывает тормозящее действие, конкурируя как с ацетил-КоА, так и с оксало-ацетатом [48]. Таким образом, высокий уровень АТФ имеет тенденцию уменьшать кажущееся сродство фермента к обоим субстратам. Почти при всех условиях активность цитратсинтазы, по-видимому, в наибольшей степени зависит от сродства к оксалоацета-ту [ПО, 167]. Вероятно, именно благодаря этим регуляторным воздействиям поступление ацетил-КоА (образующегося при обмене углеводов или жиров) в цитратный цикл соответствует энергетическим потребностям клетки.
2. Кроме того, образование пирувата и ацетил-КоА из предше-ственников-гексоз регулируется на этапе фосфофруктокиназы (в цепи гликолиза), где положительным модулятором служит АМФ. Например, при высоком уровне АТФ и низком уровне АМФ образование пирувата из гексозы замедляется в результате ингибирования ФФК.
3. В этих условиях цитрат, который сам действует как отрицательный модулятор на уровне ФФК, может накапливаться и способствовать поддержанию неактивной конформации ФФК; напротив, при падении концентрации цитрата ниже обычного уровня это взаимодействие ведет к ускорению гликолиза.
Три других взаимодействия, показанных на рис. 6-10, влияют на утилизацию цитрата.
4. АМФ — положительный модулятор НАД-зависимой изоцитратдегидрогеназы; направляя цитрат в цикл лимонной кислоты, он способствует повышению синтеза АТФ при низкой концентрации последнего. Этот регуляторный эффект может быть сопряжен с регуляцией на уровне цитратсинтазы.
5. АДФ — отрицательный модулятор цитратлиазы; поэтому цитрат и АТФ будут расходоваться в реакции этого фермента только при высокой величине отношения АТФ/АДФ. Совместное действие этих двух механизмов, по-видимому, ответственно за распределение цитрата между циклом лимонной кислоты (где он окисляется 31—1332
482
Глава б
с одновременной регенерацией АТФ) и путем, ведущим к образованию ацетил-КоА для биосинтеза жирных кислот (с одновременным использованием АТФ).
Аспарагин
АТФ |NH,
ии/УШииГ1ПЧГХ~ 'а леотиды ^Аспартат
сн,(снДсо’
Жирные кислоты
Углеводы
Глицин
фенилаланин <=
'Цистеин,
АТФ
Пируват
Пиримидинник- А Тф
Ацетил-КоА
& • •’-----
Г
сог
Тирозин
Триптофан
Глицин
Серин
НАД-Н \ валин Лейцин
НАДф*
COS/fc4 сн« сог~ Малонил-КоЛ
Терпены, полиизопреноиды А
СНгСО8К0Л
I НАДф-Н
НО-С-СНГ
, у | АТФ
М СНгСОг“ *
$7£МфДил-д-ОН
\
A глутарйл-коА Стероиды
Оксалоацетат
Zs’-ма'лат
Оксалоацетат
г
Аспартил- Ф
НАДФ-Н^
Аспартатсемиальдегид
АТФ
Диаминопимелат
\ТФ
НАДФ 'Н
ф Треонин Метионин
Лизин ^-Пируват
Цзалейцин
Цитрат
НАДф
Тлиоксалат
'.фумарат
| \ RCOStfo/f ДГ^НАДф-Н
I Сукцинат ^^,RCOZ“ ы-Нетоглутарат | ГТ^^сукциты-КоА
I ГДФ,ФН
Глицин
Ко ASH.
H3N+
АТФ =Ф> глутамин
NH
Z- глутамат
I " I 1 RNH
1-глутамат
..> Пролин
НАД 'Н
ROH (АТФ)
~огс-(снг)гсоснсог- - J
и-Амино-Ji—кетоадипат семиальдегид-.
-сог
Г~
СОг^ " $
&
| ’‘ОгС-(СНг)гСОСН8ЫНг |
| Ъ-Аминолевулинат j
.11 И I — -II--—— —J
’’
Орнитин
Порфирины
цитруллин=^> Аргинин
Рис. 6-11. Биосинтетические функции цикла лимонной кислоты [88].
В области, обведенной пунктиром, указаны реакции, протекающие в митохондриях.
Промежуточный обмен: сравнительные аспекты
483
6. Наконец, как мы уже упоминали, цитрат сам по себе — положительный модулятор ацетил-КоА—карбоксилазы. Этот эффект можно рассматривать как прямое активирующее действие предшественника (цитрата) на путь, ведущий к жирным кислотам. Этому регуляторному эффекту благоприятствуют условия «энергонасыщенности», когда высоки уровни цитрата и АТФ.
Регуляторные механизмы второго участка (а-кетоглутарат—> __^оксалоацетат) менее изучены. В большинстве работ по регуляции клеточного дыхания использовались такие субстраты, как сукцинат, а-кетоглутарат и малат; в этих условиях регуляторное действие АДФ должно быть как-то координировано с регуляцией специфических ферментативных реакций цикла лимонной кислоты [48]; однако для выяснения механизмов этой координации нужны дальнейшие исследования.
Анаболические функции цикла лимонной кислоты. От самого цикла и его вторичных продуктов идет множество путей биосинтеза (рис. 6-11); поэтому он играет в анаболизме такую же ключевую роль, как и в катаболизме. Здесь снова возникает проблема интеграции анаболических и катаболических функций, так как утечка из цикла любого промежуточного продукта должна компенсироваться в том же или ином участке цикла, иначе работа его не будет стабильной.
В большинстве тканей, способных синтезировать углеводы, для этого синтеза нужны стехиометрические количества одной из дикарбоновых или трикарбоновых кислот, участвующих в цикле лимонной кислоты, либо их возможных предшественников. Для этого пригодны многие из органических промежуточных продуктов обмена, содержащие не менее трех углеродных атомов (поскольку оксалоацетат может синтезироваться из пирувата в результате описанных выше реакций фиксации СО2). Клетки, обладающие ферментами глиоксилатного шунта (изоцитратлиазой и малатсин-тетазой), способны к синтезу 4-углеродных дикарбоновых кислот (а значит, и углеводов) из 2-углеродных предшественников. Синтез углеводов из ацетил-КоА (продукта расщепления жирных кислот) возможен только в клетках, имеющих оба эти фермента. Поэтому большинство животных клеток совершенно неспособно осуществлять такое превращение.
Интеграция регуляторных механизмов цикла лимонной кислоты и глюконеогенеза изучена недостаточно. В регуляции глюконеогенеза на этапах ФЕП ^пируват и Ф-6-Ф=ё±=ФДФ, несомненно, участвует отношение концентраций АТФ/АМФ.
Мы уже рассматривали основные черты биосинтеза липидов. Здесь мы снова хотели бы подчеркнуть, что к ключевому предшественнику— ацетил-КоА — ведут два главных пути, локализованные в митохондриях: тиолитическое расщепление ацетоацетил-КоА, образующегося при р-окислении жирных кислот, и окислительное декарбоксилирование пирувата при участии пируватдегидрогена
31*
484
Глава 6
зы. Но, как мы уже говорили, обязательным первым этапом биосинтеза жирных кислот является карбоксилирование ацетил-КоА в малонил-КоА. Эту реакцию, так же как и последующие реакции синтеза жирных кислот, катализирует внемитохондриальный комплекс ферментов. Выше уже подчеркивалась роль цитратлиазы в образовании внемитохондриального ацетил-КоА для нужд синтеза жирных кислот и других биосинтезов.
Для синтеза белков необходимы метаболическая энергия (АТФ) и мономеры-предшественники (около 20 обычных L-аминокислот). То и другое по крайней мере отчасти обеспечивает цикл лимонной кислоты. Большинство высших животных способно синтезировать около половины из 20 необходимых аминокислот-предшественников. Мы не будем рассматривать здесь пути их образования и расщепления, но некоторые моменты все же заслуживают упоминания. Существует три группы аминокислот, которые образуются из трех кетокислот (пирувата, оксалоацетата и а-кетоглутарата) и соответствующих а-аминокислот (аланина, аспартата и глутамата). Аминокислоты, родственные а-кетоглутарату и глутамату, по-ви-димому, синтезируются всеми организмами. Что касается аминокислот— производных пирувата, то лишь некоторые из них синтезируются высшими организмами. Те аминокислоты, углеродный скелет которых образуется из оксалоацетата и аспартата, вообще, вероятно, не синтезируются у животных, во всяком случае у млекопитающих.
Синтез пуринов и пиримидинов, составляющих основу структуры коферментов и нуклеиновых кислот, также тесно связан с циклом лимонной кислоты. Углеродный скелет пиримидинов происходит из аспартата; глутамат и аспартат служат источниками уре-идного азота пуринов и аминного азота аминопуринов и аминопиримидинов. Новейшие данные об этих важных метаболических путях можно найти в современных руководствах по биохимии и обзорных статьях.
И наконец, нужно кратко упомянуть о роли цикла лимонной кислоты в биосинтезе порфиринов — важнейших составных частей дыхательных пигментов (например, гемоглобина) и системы переноса электронов. Образование их предшественников начинается в этом цикле на уровне сукцинил-КоА. Это еще один важный и непрерывно действующий путь оттока углерода, проходящего через цикл.
Сравнительные аспекты. Связь между структурой и функцией митохондрий. В таких хорошо изученных тканях, как печень крысы, в митохондриях найдены все ферменты и кофакторы, необходимые для работы цикла лимонной кислоты, дыхательной цепи и фосфорилирования на уровне субстрата, для окисления жирных кислот и пирувата и для синтеза ацетоацетата. Для поддержания функции изолированных митохондрий необходимы только подходящая по осмотическим свойствам среда, субстрат, фосфат и ак
Промежуточный обмен: сравнительные аспекты
485
цептор фосфата (например, АДФ). В особых случаях могут быть нужны еще добавочные факторы для активации транспортных систем. Например, для окисления жирных кислот с длинной цепью требуется добавить карнитин, а экзогенный изоцитрат будет окисляться только после введения малата [48].
По современным представлениям эти митохондриальные функции связаны или с внутренней мембраной и кристами (как в случае дыхательной цепи), или с матриксом (где находятся, например, цитратсинтаза и изоцитратдегидрогеназа). Через внутреннюю мембрану не могут свободно проходить белки, нуклеотиды, подавляющее большинство катионов и анионов, нерастворимых в липидах, и незаряженные гидрофильные соединения — такие, как сахароза. Эти свойства проницаемости внутренней мембраны вместе с различными транспортными системами составляют структурную основу концентрационных градиентов между внутренней средой митохондрий и окружающей цитоплазмой.
Весьма вероятно, что внутренняя мембрана по крайней мере частично построена из элементов (белков и фосфолипидов), непосредственно участвующих в таких функциях, как перенос электронов. Действительно, Грин и его сотрудники показали, что общая ультраструктура митохондрии зависит от ее метаболического состояния. Эти наблюдения позволили им постулировать существование энергизированного и неэнергизированного состояний митохондрии; полагают, что механические события при переходе из одного состояния в другое тесно связаны с фосфорилированием. Мы почти ничего не знаем о регуляторных механизмах на этом более высоком уровне организации. Важность этого уровня регуляции митохондриальных функций с очевидностью вытекает из крайней специализации ультраструктуры митохондрий в тканях различного типа (см. ниже).
Тканевая специфичность ультраструктуры митохондрий. Основная проблема здесь касается связи между различными экзергоническими реакциями и рабочими функциями, которые обслуживает в данной ткани метаболизм митохондрий. Мы сразу же подчеркнем, что данных по этому вопросу очень мало, хотя сама проблема хорошо осознана. Интуитивно кажется ясным, что такого рода связь зависит от типа ткани (т. е. от характера выполняемых тканью рабочих функций — химических, механических или осмотических) и, по-видимому, включает важные регуляторные механизмы на уровне организации митохондриальной структуры. В определенных тканях митохондрии обладают весьма характерной ультраструктурой и весьма характерно расположены внутри клетки. Приведем несколько ярких примеров.
1. Во всех «быстрых» мышцах, особенно в летательных мышцах колибри и насекомых, митохондрии расположены весьма регулярным образом вдоль миофибрилл. Кристы многочисленны, , форма
486
Глава 6
митохондрий типична — они довольно длинные и узкие. Часто около каждой митохондрии образуется капелька жира, которая, по-видимому, служит для нее индивидуальным запасом топлива. Механизм доставки АТФ к сократимым элементам неизвестен.
2. В проксимальном почечном канальце и восходящей ветви петли Генле митохондрии настолько крупны, что в литературе их часто называют «гигантскими митохондриями». Они распределены так, что как бы поляризуют клетку: на стороне, обращенной к просвету канальца, их практически нет, тогда как со стороны, обращенной к кровеносному сосуду, клетка набита митохондриями. Они лежат здесь между особыми впячиваниями плазматической мембраны, так что каждая гигантская митохондрия часто окружена этой мембраной со всех сторон, кроме одной. Очевидно, что митохондрии обслуживают активный транспорт катионов (главным образом Na+). Сходная ультраструктурная организация митохондрий обнаружена во всасывающих клетках тонкой кишки, причем здесь эти органеллы тоже сосредоточены в одном определенном участке клетки.
3. Важная функция жабр у рыб и ракообразных — перенос катионов. Для этих тканей также характерны высокоспециализированная ультраструктура митохондрий и расположение большинства крупных митохондрий у основания клетки [34, 64]. Подобная же ультраструктура обнаружена в клетках солевой железы морских птиц, и ее рассматривают как неотъемлемую часть специализации данной ткани для транспорта ионов Na+ [41].
4. Как мы уже отмечали, бурая жировая ткань млекопитающих обладает четко выраженной термогенной функцией, но в нашем контексте ее нельзя рассматривать как собственно «рабочую» функцию. Можно предполагать, что митохондрии этой ткани в известном смысле частично «освобождены» от работы: энергия, обычно «связываемая» в форме АТФ и затем либо запасаемая в виде некоторых других метаболитов, либо используемая для какого-то рабочего процесса, здесь в основном рассеивается как тепло. Ультраструктура митохондрий, свойственная бурой жировой ткани, по-видимому, нигде больше не встречается, что лишний раз подтверждает существенную связь между структурой и функцией этих органелл.
Подобные наблюдения позволяют предполагать, что ультраструктура митохондрий в какой-то мере зависит от среды, в которой они формируются; очевидно, что гигантские митохондрии почечных канальцев или жабр не могли бы функционировать в среде, характерной для мышц или бурой жировой ткани. Мы еще только начинаем изучать конкретные механизмы этих взаимоотношений.
Промежуточный обмен: сравнительные аспекты
487
регуляция метаболизма
Введение
Метаболические особенности организма, подобно другим фенотипическим признакам, формируются в процессе эволюции. Однако ни одну реакцию и ни один метаболический путь нельзя считать адаптивными, если они не могут регулироваться. Поэтому мы предполагаем, что эволюция каждой метаболической цепи сопровождалась выработкой регуляторных приспособлений, благодаря которым эта цепь могла автоматически и адаптивно реагировать на нужды организма в широком диапазоне внутренних и внешних параметров. Мы уже вкратце описали некоторые из этих регуляторных механизмов. Однако в последние 10 лет изучение регуляции метаболических процессов настолько расширилось, что следует, по-видимому, отдельно рассмотреть некоторые из главных принципов и результатов, относящихся к этой области.
За последнее десятилетие широко изучены четыре главных механизма, регулирующих участие определенных ферментативных реакций и метаболических путей в обмене веществ: 1) регуляция стационарных концентраций ферментов; 2) «выбор» того или иного изофермента для катализа данной реакции; 3) регуляция активности ферментов, находящихся в стратегических пунктах данного пути, низкомолекулярными веществами — часто промежуточными продуктами того же или близкого метаболического пути и 4) регулирование с помощью надлежащего размещения ферментов в клетке. Предполагается, что первые два механизма включают изменения скорости синтеза и (или) деградации ферментов, и обеспечивают лишь «грубую настройку»; время реакции измеряется здесь часами или днями. Тонкое регулирование, при котором время реакции составляет секунды или даже миллисекунды, осуществляется путем изменения активности ферментов. Мы рассмотрим отдельные примеры каждого из этих общих механизмов.
Р егулирование концентраций ферментов
Регуляция метаболизма инсулином и глюкокортикоидами. Установлено, что инсулин и глюкокортикоиды регулируют гликолиз и глюконеогенез, действуя совместно как антагонисты. Известные «мишени» этих гормонов показаны на рис. 6-12. При активации синтеза глюкозы глюкокортикоидами один из первых этапов состоит в мобилизации аминокислотных предшественников из периферических тканей, главным образом мышц. Эти предшественники переносятся в печень, где в результате трансаминирования превращаются в соответствующие кетокислоты, а затем поступают на путь глюконеогенеза. Эффект гормональной регуляции в печени включает индукцию ключевых ферментов глюкогенеза (пируват-
488
Глава 6
карбоксилазы, ФЕП-карбоксикиназы, ФДФазы, Г-6-Фазы и важных трансаминаз). Синтез этих ферментов ускоряется, активность их в печени увеличивается в 3—4 раза, и это приводит к усилению синтеза глюкозы [43, 158]. Сходные эффекты глюкокортикоидов обнаружены в коре почек — другой важной глюкогенной ткани позвоночных [128].
Среди аминокислот — предшественников глюкозы первое место в количественном отношении занимает аланин. У человека при активации глюкогенеза, вызванной голоданием, этот процесс может
Пируват
Индукции глюкокортикоидами и_________________
подавление инсулином ключевых ферментов глюконеогенеза
Фруктозодшросфатаза
Глюкоза -в-сроаратаза
Пируват-киназа
h
Tocipoippyкто киназа
Глюкокиназа
Индукция ключе вых гликолитических ферментов инсулином
Рис. 6-12. Регуляция гликолиза и глюконеогенеза инсулином и глюкокортикоидами— гормонами, влияющими на концентрации ферментов [158].
регулироваться на уровне мобилизации аланина и (или) на уровне доставки этой аминокислоты в глюкогенные ткани [43, 92]. По мнению Кребса, основная часть этого аланина не может быть продуктом протеолиза и, следовательно, должна синтезироваться метаболическим путем. В условиях голодания, когда синтез мочевины замедлен из-за недостатка АТФ, аланин мог бы использоваться для связывания аммиака. Поэтому мобилизация аланина в периферических тканях [92] может быть связана с его транспортной функцией — с переносом азота периферических тканей в печень. Кребс предполагает также, что аланин может служить переносчиком атомов углерода глюкогенных аминокислот. Например, глутамат или аспартат мог бы частично расщепляться в мышцах и дру
Промежуточный обмен: сравнительные аспекты
489
гих тканях до пирувата (с освобождением некоторого количества энергии); затем три углеродных атома вместе с азотом этих аминокислот могли бы в форме аланина транспортироваться в печень. Но каковы бы ни были вторичные функции аланина, он является главным аминокислотным предшественником глюкозы, и его трансаминирование в печени (превращение в пируват) находится под гормональным контролем.
Повышение уровня глюкозы не приводит к тому, что она сама тормозит свою дальнейшую выработку, как можно было бы ожидать в случае простой системы, регулируемой по принципу отрицательной обратной связи. Накопление глюкозы служит сигналом для выделения инсулина поджелудочной железой. Основные эффекты инсулина противоположны эффектам глюкокортикоидов (рис. 6-12). Таким образом, при переходе активной роли к инсулину ключевые ферменты гликолиза (гексокиназа, ФФК и пиру-ваткинада) индуцируются, а ключевые ферменты глюкогенеза репрессируются [158]. Теперь легко представить себе гормональную регуляцию обмена глюкозы с поочередными отклонениями в ту и другую сторону: глюкокортикоиды благоприятствуют потоку углерода в сторону глюкозы, а инсулин — в сторону гликолиза. Эта простая схема усложнена, однако, важными взаимодействиями с другими метаболическими путями, которые еще не все хорошо изучены.
И инсулин, и глюкокортикоиды стимулируют синтез гликогена, вызывая сравнимую по величине активацию гликогенсинтетазы [56]. Эффект инсулина, вероятно, связан с активацией метаболического пути, в котором глюкоза используется как предшественник, и это приводит к снижению уровня глюкозы в крови. Значение эффекта глюкокортикоидов пока неясно.
Существуют также важные взаимодействия между обменом жирных кислот и путями обмена глюкозы. Перфузия печени крысы жирной кислотой, например олеиновой, приводит к удвоению скорости синтеза глюкозы из различных предшественников (лактата, пирувата и аланина). Этот эффект можно снять торможением пальмитилкарнитинтрансферазы (блокирующим перенос жирных кислот в митохондрии), причем исходный уровень синтеза глюкозы не изменится. Эти эксперименты убедительно показывают, что глюконеогенез может регулироваться интенсивностью окисления жирных кислот. Происходящие в печени изменения уровней промежуточных продуктов этого пути указывают на то, что главным регулируемым звеном служит пируваткарбоксилаза и что активность ее изменяется под влиянием ацетил-КоА, образующегося при окислении жирных кислот [165]. Нужно помнить, что жирные кислоты не используются как предшественники глюкозы, поскольку, как мы уже говорили, у организмов, не имеющих глиоксилатного шунта для «затравки» цикла лимонной кислоты, не может происходить превращение жирных кислот в углеводы. В то же время
490
Глава 6
не следует преуменьшать значение этих взаимодействий между окислением жирных кислот и синтезом глюкозы. Связь между этими путями существует и на гормональном уровне регуляции: известно, что инсулин стимулирует и гликолиз, и синтез жирных кислот, а активация синтеза глюкозы коррелирует с усиленным окислением жирных кислот [43, 99, 158].
Появлялись сообщения [81, 157] о том, что жирные кислоты избирательно тормозят ряд ферментов гликолиза, не влияя на активность ферментов глюконеогенеза и бифункциональных ферментов обмена глюкозы. В связи с этим предполагали, что жирные
кислоты непосредственно регулируют глюкогенез, уменьшая поток углерода через гликолиз. Более новые работы показали, что это,
возможно, неспецифические эффекты, так как свободные жирные кислоты и пальмитил-КоА сильно ингибируют также ферменты
глюконеогенеза (ФЕП-карбоксикиназу, пируваткиназу и Г-6-Фазу) [Ю4].
Механизмы, с помощью которых инсулин и глюкокортикоиды
изменяют интенсивность синтеза ферментов, т. е. общие механиз-
мы действия этих гормонов per se, пока не вполне ясны, и в настоящее время их весьма интенсивно изучают. Кенни и его сотрудники с этой целью исследовали индукцию определенных ферментов в культивируемых клетках гепатомы. В случае тирозин-а-кетоглу-тараттрансаминазы (фермент печени, индуцируемый как глюкокортикоидами, так и инсулином) индуцирующее действие этих гормонов различно по своей кинетике, а при их совместном введении наблюдается явление синергизма. Этого можно было ожидать в том случае, если механизмы их действия различны. Новейшие данные позволяют предполагать, что стероидный гормон (гидрокортизон) индуцирует синтез трансаминазы, воздействуя на уровне транскрипции, тогда как гормон-полипептид (инсулин) влияет на какой-то посттранскрипционный процесс или на трансляцию [83, 113].
Действие глюкагона и катехоламинов на обмен глюкозы в пе
чени. Глюкагон играет также важную роль в регуляции выхода глюкозы из печени. Действие его отчасти связано с мобилизацией
гликогена в результате активации аденилциклазной системы, а отчасти зависит от активации глюконеогенеза. Глюкагон сильно активирует включение 14С из лактата, пирувата или аланина в глюкозу. Время реакции в перфузируемой печени крысы составляет около 40 с; таким образом, механизм действия глюкагона, вероятно, совершенно иной, чем у инсулина и глюкокортикоидов; предполагают, что он связан с активацией аденилциклазы [43]. Какие реакции чувствительны к циклическому АМФ, не установлено, но они должны находиться в цепи глюконеогенеза между пируватом и ФЕП. Катехоламины вызывают примерно такой же эффект, как и глюкагон, и механизм их действия, по-видимому, также сходен [43].
Промежуточный обмен: сравнительные аспекты
491
Действие гормона щитовидной железы. Основной эффект его у высших позвоночных связан со стимуляцией клеточного обмена, но механизм вызываемого ускорения клеточных реакций пока неясен. Инъекция тироксина животным стимулирует большинство изученных ферментных систем, в том числе систему окисления глюкозы, систему включения аминокислот в белки, Г-6-Фазу печени и Г-6-Ф-дегидрогеназу. При добавлении к препаратам митохондрий тироксин частично разобщает дыхание и фосфорилирование в случае окисления |3-оксибутирата. Одновременные изменения в распределении воды приводят к набуханию митохондрий. При такого рода разобщении часть энергии, доставляемой окислительными процессами, может рассеиваться в виде тепла, как это, по-видимому, происходит в митохондриях бурой жировой ткани. Однако количественное значение этих эффектов in vivo не подтверждено. Возможно даже, что вызываемое тироксином разобщение носит скорее фармакологический характер, особенно у млекопитающих, поскольку эффективные концентрации тироксина значительно выше физиологического диапазона. Длительное введение малых доз тироксина рыбам приводит к снижению фосфорилирующей активности митохондрий [93]. При добавлении тироксина к митохондриальным препаратам in vitro для разобщения необходимы его концентрации от 5-Ю-8 до 5-Ю-7 М. Сравнимый эффект в системах млекопитающих дают концентрации около 5-10~5 М. Кроме того, Мэсси и Смит [93] наблюдали при длительной обработке рыб низкими дозами тироксина повышение удельной активности окислительных ферментов, так что гормон, возможно, влияет на интенсивность их синтеза. Установлено, что при метаморфозе амфибий, когда организм переключается с экскреции NH4 на экскрецию мочевины, действие гормона щитовидной железы связано с регуляцией синтеза ферментов, участвующих в обмене мочевины.
Сравнительные аспекты регулирования концентрации ферментов. Гормональная регуляция промежуточного обмена у низших позвоночных и у беспозвоночных. Следует сразу же сказать, что молекулярные механизмы действия гормонов у низших позвоночных и у беспозвоночных еще не расшифрованы, так как до сих пор интенсивно не изучались. Существенное исключение составляют работы по эндокринологии насекомых, и мы уже говорили о гормональной регуляции уровня трегалозы в их крови. Можно с уверенностью ожидать дальнейших успехов в понимании проблем гормональной регуляции у этих животных. К сожалению, гораздо хуже обстоит дело с изучением гормонального регулирования обмена веществ у таких организмов, как ракообразные, моллюски и рыбы. Однако мы надеемся, что 'в будущем положение исправится.
Существует большая литература [47, 57, 61, 108, 131] о значении регулирования концентраций ферментов при температурной адаптации у пойкилотермных животных, особенно у рыб. При холодовой адаптации, как правило, отмечается тенденция к повышению
492
Глава 6
концентраций ферментов, но о сигналах, приводящих к этой реакции, ничего не известно. Первичным сигналом, вероятно, служит физический параметр (температура) или какое-то сочетание физических параметров (например, температура и фотопериод). Если здесь и участвуют гормональные сигналы, то об их конкретном характере не известно ничего определенного.
Конт и сотр. [32] описали совершенно аналогичную картину при адаптации жабр лососевых к солености. Эти исследователи установили, что при изменениях солености внешней среды резко изменяется скорость синтеза определенных белков. В природных условиях это происходит, по-видимому, во время превращения молоди в покатную форму. Участвующие в этой адаптации белки, вероятно, составляют часть комплекса Ыа+К+-АТФазы в мембране жаберных клеток; сигналы, вызывающие эту реакцию, опять-таки не установлены.
Регуляция глюконеогенеза и липогенеза у жвачных. Вообще у млекопитающих главным предшественником липидов служит глюкоза, получаемая с пищей. У жвачных картина не столь ясна. Углеводы пищи превращаются у них в рубце в различные промежуточные продукты с короткой цепью — триозы, ацетат, бутират и т. п. В связи с этим мы находим здесь две своеобразные адаптации: 1) так как взрослые жвачные не имеют пищевых источников глюкозы, выработка всей необходимой глюкозы (и производных углеводов) полностью зависит у них от глюконеогенеза в печени и почках; 2) главным источником углерода для построения жиров служит не глюкоза, а ацетат, образующийся в рубце.
Эта необычная зависимость от глюконеогенеза как единствен» ного источника глюкозы приводит у жвачных к более высоким стационарным концентрациям ключевых ферментов глюкогенеза, таких, как ФДФаза. Во время лактации синтез глюкозы в печени этих животных идет чрезвычайно быстро, у них отмечается также очень высокая активность пируваткарбоксилазы и ФЕП-карбокси-киназы [6]. А так как другие ферментативные пути, способные конкурировать за оксалоацетат (например, путь расщепления цитрата), у жвачных редуцированы, высокая активность пируваткарбоксилазы и ФЕП-карбоксикиназы приводит к тому, что большая часть оксалоацетата, образующегося из аминокислот, направляется в сторону ФЕП и, следовательно, глюкозы [53].
Сложнее обстоит дело с липогенезом. Как мы уже видели, у животных, не относящихся к жвачным, синтез жирных кислот из глюкозы в жировой ткани и печени включает: а) расщепление глюкозы до пирувата в цитозоле; б) декарбоксилирование пирувата с образованием ацетил-КоА, происходящее в митохондриях; в) конденсацию ацетил-КоА с оксалоацетатом, в результате которой образуется цитрат, и г) перенос углерода ацетил-КоА, вошедшего в цитрат, из митохондрий. Последующее расщепление цитрата в цитозоле, дающее внемитохондриальный ацетил-КоА и оксалоацетат.
Промежуточный обмен: сравнительные аспекты 493
рассматривают сейчас как важный пункт регуляции синтеза жир* ных кислот [155]. Ларди и сотр. [171] предполагают, что образовавшийся оксалоацетат превращается при участии НАД-зависимой малатдегидрогеназы в малат, который затем подвергается окислительному декарбоксилированию в пируват НАДФ-зависимым «яблочным» ферментом. Образующийся в этой последней реакции
Животные, не относящиеся к жвачным, и жвачные 6 период утробного развития Глюкоза
Пируват
Малат-----—»
t НАДФ
ОАц
^Цитрат—Ацетил-КоА.
Пируват
НАДФ-Н
НАДФД НАДФ
ч Жирные кислоты
Жвачные
\глюкоза
| пищи
।_______
Обмен
Врубце
, *
Ацетат
f
Ацетил-КоА.-----
v и НАДФ-н
—Цитрат
^Изоцитрат \
Л-НАДФ 1
—^а-кг-ПАДФ-Н'
Жирные кислоты
Рис. 6-13. Пути синтеза липидов в печени жвачных и в печени других животных.
НАДФ-Н служит восстановителем в процессе биосинтеза жирных кислот (рис. 6-13). Описанные реакции составляют так называемый путь расщепления цитрата, и этот путь у жвачных практически бездействует. Два главных «молекулярных дефекта» локализованы здесь на уровне цитратлиазы и «яблочного» фермента, активность которых в жировой ткани, печени [53] и молочной железе домашних жвачных крайне низка [9].
У жвачных заменой пути расщепления цитрата служит использование ацетата пищевого происхождения как главного источника углерода для синтеза липидов. В цитозоле печени и жировой ткани ацетат превращается внемитохондриальной ацетаттиокиназой в ацетил-КоА, который может затем непосредственно поступать на
494
Глава 6
путь синтеза жирных кислот (рис. 6-13) [7]. Бауман отметил также, что у коровы удельная активность внемитохондриальной НАДФ-зависимой изоцитратдегидрогеназы примерно в 20 раз выше, чем в гомологичных тканях крысы, и что соответствующие реакции могут, следовательно, доставлять весь или почти весь НАДФ, необходимый для синтеза жирных кислот [9].
Замечательным естественным «контролем» при оценке этих данных может служить утробный плод жвачного, который в отличие от материнского организма имеет превосходный и постоянный источник «пищевой» глюкозы — он получает ее из материнской крови через плаценту. Таким образом, в период внутриутробной жизни глюкоза как предшественник для липогенеза имеется в изобилии и путь расщепления цитрата нормально функционирует. Удельная активность цитратлиазы и «яблочного» фермента в печени плода приблизительно в 20 раз выше, чем в печени взрослых жвачных [9, 53]. Эти специфические различия в путях обмена зависят от изменения активности ферментов (вероятно, в результате регуляции их синтеза); однако природа гормональных или иных сигналов, вызывающих включение этих метаболических адаптаций, пока не установлена.
Регулирование липогенеза в период лактации у млекопитающих. У крысы в первые два дня лактации значительно возрастает активность цитратлиазы. Прекращение кормления уже в первые сутки приводит к быстрому снижению активности этого фермента. Эти эффекты — вероятно, общие для всех млекопитающих — указывают на то, что липогенез, возможно, регулируется здесь путем изменения уровня цитратлиазы [85]. Восстановитель для липогенеза (в виде НАДФ-Н), по-видимому, доставляет реакция Г-6-Ф-де-гидрогеназы; ее катализирует специфический изофермент, индуцируемый при лактации [114], активность которого увеличивается в это время в 20 раз.
Гормональная регуляция синтеза лактозы в молочной железе. Дисахарид лактоза, так же как и белок казеин, образуется только в молочной железе. Некоторые особенности образования лактозо-синтетазной системы привели к лучшему пониманию взаимосвязи ферментов и гормонов в молочной железе в период беременности.
Лактозосинтетаза катализирует образование лактозы:
УДФ-галактоза -{-Глюкоза -> Галактоза-]- УДФ.
Посредниками в переносе галактозы на глюкозу служат два белка — А и В [18]. Белок А — это фермент галактозилтрансфе-раза, по-видимому связанный с микросомами [19]; он катализирует реакцию [17]
УДФ-галактоза -]- N-ацетилглюкозамин -> N-ацетилгалактозамин -|- УДФ.
Белок В идентичен одному из обычных белков молока — а-лактальбумину [20]. В отличие от белка (фермента) А он сам
Промежуточный обмен: сравнительные аспекты;495
по себе не обнаруживает ферментативной активности, но в его присутствии фермент А способен использовать глюкозу как акцептор галактозильной части УДФ-галактозы [17]. Таким образом, белок В по существу направляет фермент А на катализ синтеза лактозы, а не N-ацетиллактозамина.
Для максимальной стимуляции синтеза белков А и В в эксплантатах молочной железы требуется присутствие трех гормонов — инсулина, гидрокортизона (или какого-либо другого глюкокорти-
Рис. 6-14. Схема гормональной регуляции образования белков А и В, участвующих в синтезе лактозы.
коида) и пролактина; в этих условиях in vitro количество обоих белков нарастает приблизительно синхронно. Однако у интактных мышей активность фермента А быстро повышается приблизительно в середине беременности и достигает максимума незадолго до родов, в то время как количество белка В заметно увеличивается только после родов (рис. 6-14) [147]. Это отличие реакции in vivo от реакции in vitro можно приписать действию прогестерона, так как показано, что этот стероид избирательно тормозит образование белка В в эксплантатах молочной железы [148]. Таким образом,
496
Глава 6
во время беременности синтез белка В может быть подавлен высокими уровнями циркулирующего прогестерона, тогда как синтез фермента А нечувствителен к этому гормону (рис. 6-14). В этих условиях должен накапливаться N-ацетиллактозамин.
Эти биосинтетические и метаболические процессы тесно связаны с ультраструктурными изменениями в альвеолярных клетках, а также с другими специфическими биосинтезами, происходящими одновременно в молочной железе, например с биосинтезом казеина [143].
Роль изоферментов в регуляции метаболизма
В ранних работах, посвященных гормональной регуляции метаболизма на уровне ферментов, в явной или неявной форме предполагалось, что индуцируемые ферменты идентичны тем, которые уже имеются в тканях. Это предположение часто, а может быть и в большинстве случаев, неверно. Например, инсулин и, возможно, глюкокортикоиды, регулируя обмен глюкозы, по-видимому, влияют на синтез определенных изоферментов, а не на общую активность ферментов, катализирующих данную реакцию. В подобных случаях индуцируемые формы ферментов в каком-то отношении особенно хорошо «приспособлены» для работы при изменившейся организации обмена. Это относится как к гормональной адаптации ферментов у млекопитающих [72, 135], так и к различным ферментным адаптациям у низших позвоночных и у беспозвоночных [61]. Например, при инсулиновой индукции гликолиза в печени индуцируется особая форма пируваткиназы (ПК), по своим каталитическим и регуляторным свойствам «более приспособленная» для глюконеогенеза, чем мышечная форма этого фермента. Однако последняя форма также присутствует в печени и вносит свой вклад в суммарную активность ПК при гликолизе [135]. Сходным образом обстоит дело в различных тканях при индукции инсулином гексокиназы [71]. Температурная акклимация у рыб также приводит к появлению новых изоферментов, более приспособленных для регулируемой каталитической функции при новом тепловом режиме [61]. Есть много других примеров смены изоферментов при регуляции метаболизма, но мы ограничимся рассмотрением лишь некоторых из них.
Регуляция изоферментов пируваткиназы (ПК). Глюконеогенез у позвоночных обслуживает не только собственные потребности клеток печени или почек, но и основные потребности других тканей, особенно центральной нервной системы, в энергии и углероде. Иными словами, глюконеогенез — межтканевая функция. Поэтому регуляция его необычайно сложна и включает интеграцию с метаболизмом других тканей. Ясно, что в клетках самих глюкогенных тканей во время преобладающего гликолиза к регуляции предъявляются иные требования, нежели во время преобладающего синте
Промежуточный обмен: сравнительные аспекты
497
за глюкозы. Очевидным путем удовлетворения этих различных потребностей может быть выработка в процессе эволюции таких специфических форм того или иного фермента, регуляторные свойства которых отвечали бы специфическим требованиям данного времени. Танака и сотр. [135] впервые подчеркнули именно такую роль двух типов пируваткиназы, имеющихся в клетках печени.
Рис. 6-15. Регуляция изоферментов пируваткиназы в печени и мышце.
М-ПК имеет низкую /<м для ФЕП, высокую К.^ для АТФ и нечувствительна к ФДФ, гор* монам и пищевым субстратам.
L-ПК индуцируется факторами, благоприятствующими глюконеогенезу, тогда как М-ПК, по-видимому, в кинетическом отношении лучше приспособлена для гликолиза. Эти первые данные были значительно дополнены, так что сейчас можно выделить два основных типа регуляции L-изофермента (рис. 6-15): регуляцию его синтеза инсулином или компонентами пищи, например сахарозой и фруктозой [135, 156], и регуляцию его каталитической активности различными аллостерическими модуляторами [84].
Индукция L-ПК сахарозой или фруктозой блокируется ингибиторами синтеза РНК, т. е., по-видимому, является процессом, инициируемым на генном уровне; в этом отношении она подобна регуляции L-ПК инсулином. Однако эти два типа индукторов действуют по существу аддитивно: если диабетическим крысам ввести 32—1.4.49
498
Глава 6
фруктозу и инсулин одновременно, активность L-ПК возрастает до 560% контрольного уровня, что является максимально выраженной индукцией, описанной для этого фермента [156]. Поэтому вероятно, что субстратная индукция отличается по своему механизму от гормональной. В пользу этого говорят и другие данные. Например, инсулин, по-видимому, индуцирует несколько гликолитических ферментов, кодируемых одной функциональной единицей генома (включая гексокиназу, ФФК и ПК), что приводит к активации всего пути гликолиза, в то время как индукция сахарозой или фруктозой приводит к усиленной работе лишь части этого пути.
Имеется уже много данных о кинетических и регуляторных свойствах пируваткиназ. В общем можно выделить кинетические свойства, типичные для L-ПК или соответственно для мышечного изофермента — М-ПК. В свежих экстрактах печени или почки — двух главных глюкогенных тканей млекопитающих — активность ПК могут модулировать: 1) ФЕП, который служит одновременно субстратом и аллостерическим активатором, 2) аланин и АТФ, которые оба снижают сродство фермента к субстрату, и 3) ФДФ, сильно повышающий кажущееся сродство к субстрату [84]. Таким образом, при достаточном количестве энергии (АТФ) и аминокислоты-предшественника (аланина) эти механизмы предотвращают отвлечение ФЕП от пути, ведущего к глюкозе. Понижение уровня ФДФ в результате активации глюконеогенеза (и, в частности, растормаживания ФДФазы) тоже будет резко уменьшать возможный отток ФЕП от синтеза глюкозы, обусловленный пируваткиназной реакцией.
Изоферменты ПК, содержащиеся в сердце и мышцах, не обнаруживают ни одного из этих регуляторных эффектов. Были описаны интересные регуляторные свойства ПК жировой ткани [107], но они, по-видимому, не проявляются в свежих экстрактах. Поэтому Ллоренте и сотр. [84] пришли к выводу, что ПК жировой ткани в кинетическом отношении не отличается существенно от форм ПК, преобладающих в других неглюкогенных тканях.
Мы уже говорили о роли изоферментов ПК в регуляции потока углерода через «перекресток» у ФЕП в тканевом метаболизме моллюсков.
Гексокиназы. Возможное прямое действие инсулина на гексо-киназную реакцию было темой большого числа работ, начиная с ранних сообщений из лаборатории Кори (1945—1947 гг.). Однако вопрос о механизме и величине вызываемого эффекта не был разрешен, и многое здесь до сих пор остается спорным. Часть трудностей обусловлена недостаточным пониманием природы гексоки-назной системы. Лишь в середине шестидесятых годов были открыты множественные молекулярные формы этого фермента. Стало ясно, что, во-первых, гексокиназа печени представлена не двумя формами «с низкой Км» и «с высокой Км», а смесью по меньшей мере четырех компонентов и, во-вторых, во всех остальных тканях
Промежуточный обмен: сравнительные аспекты
499
обычно обнаруживается не менее трех гексокиназ [71, 72]. Новейшие работы существенно прояснили картину.
Большинство тканей, судя по данным электрофореза в крахмальном геле, содержит в разных пропорциях изоферменты I, II и III. Типы I и II преобладают в сердце, тип II —в скелетных мышцах "тип I — в головном мозгу. В то же время хотя бы небольшие
Активность
Типы гексокиназы
под сомнением
отсутствует
высокая
средняя
низкая
Рис. 6-16. Распределение гексокиназ в тканях крысы.
Количества различных гексокиназ были определены методом электрофореза в крахмальном геле. Ткани расположены в порядке убывающей (сверху вниз) чувствительности к инсулину. А — высокочувствительные к инсулину ткани (для поглощения ими глюкозы необходим инсулин); Б — ткани, относительно нечувствительные к инсулину (способные поглощать глюкозу в отсутствие инсулина). Звездочками отмечены жировые подушечки на лапах у крыс весом 125 г (молодых) и весом 250 г (взрослых). Типы гексокиназ (кроме типа IV) расположены в порядке убывающей К для глюкозы (слева направо) [71].
количества всех этих форм в большинстве случаев обнаруживаются почти во всех тканях (рис. 6-16). Уникальной особенностью печени является наличие четвертой гексокиназы, обозначаемой как тип IV. На основании двух критериев этот тип можно отождествить с описанной в ранних работах «глюкокиназой, имеющей высокую Км»‘. во-первых, он обнаруживает очень высокую Км (10~2 М) для глюкозы; во-вторых, он исчезает у голодающих и Диабетических животных и появляется снова при введении инсу-
32*
SOO
Глава 6
лина [71]. Каталитические свойства разных форм фермента различны (например, Км для глюкозы составляет у типов I, II и Щ около 0,02; 0,2 и 0,005 мМ соответственно), но каждая отдельная форма однородна во всех тканях [71].
Как мы уже говорили, гексокиназную активность в печени можно индуцировать инсулином. Подобное действие инсулина на гексокиназную активность, по-видимому, имеет место во всех чувствительных к нему тканях. В печени реакция на инсулин обусловле-
Глюкоза. Глюкоза.
Головной, мозг
Печень
Рис. 6-17. Влияние различного содержания глюкозы в крови и пищевом рационе на 'функционирование гексокиназ типа I и типа IV в мозгу (для которого глюкоза крови — единственный источник углерода и энергии) и в печени (которая может и поглощать, и освобождать глюкозу).
на главным образом изменениями активности изоферментов типа II и IV (особенно последнего, которого в печени больше). В остальных тканях, где тип IV отсутствует, инсулин индуцирует изофермент типа II; наоборот, при диабете последний исчезает [71, 72].
Существование в печени изофермента типа IV, обладающего особыми кинетическими свойствами, хорошо соответствует особым метаболическим потребностям печени при фосфорилировании глюкозы (рис. 6-17). Печень должна постоянно выделять глюкозу в кровь для снабжения других тканей; орган депонирует глюкозу (в форме гликогена) лишь тогда, когда содержание ее в пище, а значит, и в крови велико, но должен высвобождать глюкозу при отсутствии ее в пище. /(м для глюкозы соответствует функции изофермента типа IV лишь в том случае, если глюкоза в изобилии поступает из пищеварительного тракта. Если бы фермент этого типа функционировал при физиологических уровнях глюкозы в крови (около 5 мМ), то печень забирала бы глюкозу из кровяного
Промежуточный обмен: сравнительные аспекты . 501
русла, вместо того чтобы отдавать ее в кровь. Это действительно позволяет объяснить, почему тип IV — преобладающая форма гексокиназы в печени, и наводит на мысль, что типы I, II и III обычно находятся здесь в неактивном состоянии (вероятно, вследствие торможения продуктом реакции — Г-6-Ф — или высокими концентрациями субстрата). Имеющиеся данные по кинетике подкрепляют это предположение: хотя Г-6-Ф тормозит все гексокиназы, концентрация его, необходимая для торможения гексокиназы типа IV («глюкокиназы с высокой /См»), приблизительно в 100 раз выше, чем для типов I, II и III. Таким образом, форма IV будет продолжать превращение глюкозы в Г-6-Ф даже при очень высоких концентрациях глюкозы и Г-6-Ф [126].
Физиологическая основа различий в распределении и свойствах, гексокиназ I, II и III все еще неясна. Лоури и Пассоно [86] показали, что гексокиназа мозга, представленная в основном типом I, служит одним из важных пунктов регуляции гликолиза (которых по меньшей мере три) и что это, несомненно, относится и к другим тканям, использующим глюкозу крови в качестве важного источника углерода и энергии. Поскольку кинетические свойства у разных изоферментов гексокиназы неодинаковы, очевидно, что и регуляторные потребности должны быть в какой-то мере специфичными для каждого изофермента, а значит, и для каждой ткани. Особого внимания заслуживает различное распределение гексокиназ типа I и II в тканях. Тип I преобладает в мозгу и почке, т. е. в тканях с относительно постоянной метаболической активностью.. В отличие от этого тип II содержится в тканях, метаболическая активность которых может сильно изменяться, например в скелетных мышцах. Значение этих и других подобных наблюдений [72, 126] могут полностью раскрыть только дальнейшие исследования.
Альдолазы. В гомологичных тканях разных видов позвоночных идентифицированы три тканеспецифические формы альдолазы: альдолаза А — классический мышечный изофермент, альдолаза В, содержащаяся (наряду с альдолазой А) в печени, и альдолаза С, найденная (наряду с альдолазой А) в мозгу. Эти изоферменты сходны по физическим свойствам (четыре субъединицы, близкий молекулярный вес), но различаются иммунологически. Формы А и В существенно различны по аминокислотному составу и пептидным картам; для формы С соответствующих данных пока нет. Раттер с соавторами [118] суммировал все, что сейчас известно о каталитических свойствах всех трех изоферментов. Имеющиеся данные позволяют заключить, что альдолаза А, по-видимому, лучше приспособлена для гликолитической функции, а альдолаза В — для функции глюконеогенеза (рис. 6-18).
Альдолаза А обладает более высоким сродством к ФДФ (около 0,6 мМ), чем к триозофосфатам (около 1—2 мМ); отношение максимальной скорости синтеза ФДФ к максимальной скорости era расщепления составляет примерно 2,0. Все эти каталитические па
502
Глава 6
раметры благоприятствуют тому, чтобы альдолаза А расщепляла ФДФ, т. е. действовала в направлении гликолиза.
Напротив, альдолаза В обнаруживает кинетические свойства более благоприятные для синтеза ФДФ. Кажущееся сродство изофермента В к триозофосфатам приблизительно в 10 раз больше, чем у мышечной альдолазы. Отношение максимальных скоростей синтеза и расщепления ФДФ составляет для альдолазы В из печени около 10,0. Из этого очевидно, что альдолаза В лучше приспособлена для функции глюконеогенеза, чем альдолаза А, и что именно поэтому она, вероятно, и содержится в печени.
Мышца
Высокий, уровень ФДФ
Низкие уровни Г-З-Ф+ДОАФ
к
Уровни, триозосроаратов понижены вследствие активного гликолиза
Печень
Уровни ФДФ понижены вследствие активного глюкогенеза
Активный глюконеогенез
Рис. 6-18. Регуляция активности альдолазы А в мышце и альдолазы В в печени.
У альдолазы С пока не известно ни одной каталитической особенности, которая позволила бы предположить для нее специализированную физиологическую функцию. У этой формы довольно низкая Км для ФДФ (сходная с таковой альдолазы В), что, может быть, имеет метаболическое значение. Возможно, что альдолаза С обладает какими-то специфическими регуляторными свойствами или взаимодействует с другими ферментами, образуя комплексы с митохондриями мозга. Впрочем, регуляторные свойства как следует не изучены пока ни у одного изофермента альдолазы.
Изоферменты глицеральдегид-3-фосфатдегидрогеназы (ТДГ). В мышцах млекопитающих этот фермент представлен одним видом белка, кинетически, по-видимому, хорошо приспособленным к
Промежуточный обмен: сравнительные аспекты
503
работе в направлении гликолиза. При определенных условиях гликолиза и глюконеогенеза реакция ТДГ может становиться звеном, лимитирующим скорость [165], поэтому регуляторные особенности ТДГ представляют определенный интерес.
Изофермент, типичный для скелетной мышцы, четко отличается от фермента из печени, который тоже представлен одним видом белка. Кинетические константы ТДГ печени (величины кажущегося сродства к субстратам и коферментам) благоприятствуют катализу в направлении синтеза глюкозы [Ю2].
У рыб встречается много (свыше 10) молекулярных форм ТДГ. Эти формы тканеспецифичны и, вероятно, образуются путем случайной сборки тетрамеров из двух видов субъединиц [82]. Об их функции ничего не известно.
Регуляция синтеза изоферментов сериндегидратазы. Инюо и Пито [66] идентифицировали две разновидности этого фермента. Количества их сильно варьируют в зависимости от условий питания, стадии развития и гормональных влияний. По-видимому, фермент 2 находится под контролем глюкагона, а синтез фермента 1 регулируется пищевыми субстратами и кортикостероидами. О возможном физиологическом значении этих данных мы пока ничего не знаем.
Изоферменты лактатдегидрогеназы. Гликолитический фермент лактатдегидрогеназа (ЛДГ) катализирует обратимое превращение пирувата в лактат. Он наиболее активен в таких тканях, как белые мышцы, которым приходится иногда работать при практически полном отсутствии кислорода. У млекопитающих этот фермент представлен в гораздо больших концентрациях, чем другие гликолитические ферменты, и становится «лимитирующим звеном» только тогда, когда выработка при его участии НАД для этапа, катализируемого триозофосфатдегидрогеназой, оказывается недостаточной.
У большинства позвоночных встречается пять изоферментов ЛДГ, образующихся в результате самосборки полипептидных цепей (субъединиц А и В) в активные тетрамеры А4, A3Bi, А2В2, AiB3 и В4 [91]. У костистых рыб системы изоферментов более сложны, так как у них имеется больше двух типов субъединиц. У тетраплоидных лососевых в образовании различных тетрамеров ЛДГ участвует не менее 8 типов субъединиц. Полагают, что все они возникли в результате дупликации генов, кодирующих субъединицы А и В [62]. Функции этих разнообразных форм ЛДГ в различных тканях стали предметом интенсивного изучения.
Согласно одной популярной теории, ЛДГ типа А преобладают в тканях, подобных скелетной мышце, где активный гликолиз часто служит единственным источником энергии. Эти ЛДГ нечувствительны к торможению пируватом и поэтому допускают значительное накопление молочной кислоты. В отличие от этого ЛДГ типа В якобы функционируют в более аэробных тканях, где чувстви-
504
Глава 6
дельность ЛДГ к торможению пируватом предотвращает накопление лактата и тем самым благоприятствует отводу пирувата в цикл Кребса. Веселл с соавторами [152] подвергли эту теорию суровой критике.
Возможно, что главная функция различных форм ЛДГ определяется их локализацией в определенных клетках, а не какими-либо существенными кинетическими особенностями [161, 162].
Рис. 6-19. Регулирование биосинтеза лизина, треонина и метионина у Escherichia colt по принципу обратной связи [133].
Число стрелок, которым представлено то или иное превращение, соответствует числу катализирующих его изоферментов. Крестиками отмечены звенья метаболических путей, регулируемые конечными продуктами (по [133], с изменениями).
Роль изоферментов в регуляции метаболизма у бактерий. Изучение регуляции различных метаболических процессов у бактерий привело к открытию изоферментов, функции которых очевидным образом связаны с регуляторными задачами. По-видимому, изоферменты, выполняющие регуляторные функции, вырабатываются, как правило, в тех случаях, когда данная ферментативная реакция необходима для двух или большего числа метаболических процессов. Существование такого рода изоферментов у бактерий было впервые обнаружено Ум бартером и его сотрудниками, изучавшими регуляцию биосинтеза изолейцина и валина по принципу обратной связи. В обоих этих случаях первым этапом, регулируемым обратной связью, оказалась реакция, которая в определенных условиях участвует также и в катаболическом пути.
Если бы при этих обстоятельствах критический общий этап катализировался только одним ферментом, то его регулирование избытком конечного продукта могло бы привести к недостаточности энергетического обмена. Поэтому в тех случаях, когда критический этап необходим для снабжения клетки энергией, вырабатывается другой, индуцибельный изофермент, катализирующий ту же реакцию, но нечувствительный к регуляции конечным продуктом биосинтеза. Эти данные привели Умбаргера к предположению, что в .любом случае, когда фермент находится под жестким контролем
Промежуточный обмен; сравнительные аспекты
505
конечного продукта, действующего как ингибитор или репрессор, клетка будет нуждаться в другом изоферменте (или изоферментах), если данный фермент выполняет какую-то другую важную функцию. Это правило было подтверждено многочисленными исследованиями.
Штадтман и его сотрудники обнаружили первый разветвленный биосинтетический путь, контролируемый изоферментами. Конечными продуктами здесь были лизин, метионин и треонин. Авторы показали, что все эти аминокислоты образуются из аспартата, причем первая реакция состоит в фосфорилировании аспартата при участии аспартаткиназы. Как показано на рис. 6-19, у Escherichia coli имеются три независимые аспартаткиназы, дифференциально ингибируемые тремя конечными продуктами. Кроме того, есть еще две отдельные гомосериндегидрогеназы, катализирующие первый этап превращений гомосерина: они участвуют в образовании соответственно метионина и треонина и раздельно регулируются именно этими аминокислотами. Первая реакция в каждой ветви находится также под специфическим контролем конечного продукта другой ветви. Регуляторная схема такого типа приводит к тому» что избыток всех трех конечных продуктов ингибирует всю аспартаткиназную активность. Выработка множественных ферментов» катализирующих первый общий этап разветвленного пути, обеспечивает гибкость регуляторного процесса. Такого рода изоферменты дают организму очевидное преимущество в естественном отборе: они позволяют избежать слишком резко выраженных эффектов, которые могли бы возникнуть при неограниченном контроле единственного фермента конечными продуктами [133].
Роль изоферментов фруктозодифосфатазы в распределении углерода между путями синтеза хитина и гликогена. Недавно было показано, что изоферменты ФДФазы в жабрах и гиподерме ракообразных выполняют функции, сравнимые с функциями трех вариантов аспартаткиназы у бактерий. На рис. 6-20 представлены главные метаболические пути гиподермы, и можно видеть, что ведущую роль здесь играет биосинтез больших количеств хитина и гликогена. «Решающим шагом» на пути к хитияу является образование уридиндифосфат-ацетилглюкозамина (УДФАГ), а на пути к гликогену — образование уридиндифосфатглюкозы (УДФГ). На протяжении линочного цикла наблюдается обратное соотношение между активностью этих двух путей. Между линьками и во время ранней предлиньки идет интенсивный синтез гликогена, тогда как хитин не синтезируется. Во время поздней предлиньки и в раннем послелиночном периоде происходит интенсивное образование хитина и активируется расщепление гликогена [105]. Стратегическую позицию в точке разветвления двух главных путей биосинтеза занимает превращение ФДФ в Ф-6-Ф + Фн, катализируемое ФДФазой (рис. 6-20). Очевидно, что эффективное проведение углерода через это «узкое место» должно благоприятствовать
506
Глава 6
г i лик оген
Хитин
Фосфорилаза активирована I
уСинтетаза [блокирована Низкии уровень
УДФГ
1 акти вира в ан а Низкий уровень —-
УДФАГ
Ацетилглюкозамин-1- ф
Ацетилглюкозамин -6-Ф
i ।
। I
Г-6-Ф
Глюкозамин-6-Ф
I Л.
ФДФ
X
Фосфорилаза блокирована
Гликоген
w
N Синтетаза
I активирована
[УДФГ
Г-6-Ф
Хитин л
X Синтетаза
\ блокирована
Высокий^ уровень
УДФАГ
Глюкозамин-6-ф>
ф-6-ф
I н
Б
ФДФ
Рис. 6-20. Предполагаемая регуляция активности ФДФазы II (по принципу обратной связи) в жабрах и гиподерме в периоды синтеза хитина (Л) и в гиподерме в периоды синтеза гликогена (5) '[59].
В жабрах на долю ФДФазы приходится около 90% общей ФДФазной активности, а в гиподерме в период между линьками — всего лишь около 30%. Возможные регуляторные взаимодействия описаны в тексте.
Промежуточный обмен: сравнительные аспекты
507
либо синтезу гликогена (между линьками), либо синтезу хитина (во время линьки), но не обоим этим процессам одновременно. Именно в связи с этим требованием к механизму регуляции в гиподерме выработались по меньшей мере два типа ФДФазы. ФДФаза I мало чувствительна к УДФАГ и УДФГ. ФДФаза II находится под жестким контролем обоих этих продуктов: их низкие концентрации активируют реакцию, уменьшая /См для ФДФ и повышая максимальную скорость, тогда как высокие концентрации сильно ингибируют изофермент II. И ФДФаза I, и ФДФаза II находятся под обычным контролем АМФ (см. стр. 523). Предполагается, что в результате взаимодействия этих различных метаболитов углерод проходит через «узкое место» в сторону либо гликогена, либо хитина, но не в обоих направлениях одновременно [59].
Роль изоферментов в температурной акклимации лососевых. Изоферменты играют аналогичную регуляторную роль в тепловой акклимации у лососевых рыб, а может быть, и у всех эвритермных пойкилотермных животных. Скорости ферментативных реакций у этих рыб могут очень мало зависеть от температуры. Активные центры многих ферментов пойкилотермных животных устроены так, что уменьшение тепловой энергии компенсируется увеличением сродства к субстрату. Однако при температурах выше или ниже критического диапазона, различного для разных животных и для разных изоферментов, сродство фермента к субстрату падает, т. е. резко возрастает константа Михаэлиса—Ментен. Это означает, что величины Км для субстрата могут во много раз превышать реальные концентрации субстрата в организме. В подобных условиях ферменты становятся крайне неэффективными, а возможно, и полностью неактивными. Для того чтобы обойти это затруднение, при акклимации к низкой температуре вырабатываются новые изоферменты. Они отличаются от «тепловых» изоферментов либо более высоким абсолютным сродством к субстрату, либо тем, что это сродство достигает максимума при более низких температурах, либо тем и другим [61].
При температурной акклимации главное функциональное и селективное преимущество использования «лучших» изоферментов (по сравнению с изменением количеств одних и тех же ферментов) состоит в том, что у новых изоферментов могут быть величины Км, оптимальные для регуляции каталитической активности (рис. 6-21). Например, при низких температурах незначительные изменения в концентрации субстрата или в сродстве фермента к субстрату могут приводить к большим изменениям активности «холодовых» форм этих ферментов, что чрезвычайно выгодно для регулирования скоростей реакций. При высоких же температурах даже очень большие изменения концентрации субстрата или сродства к субстрату будут вести лишь к незначительным изменениям скоростей реакций, катализируемых «холодовыми» изоферментами. Ясно, что в этом случае эффективная регуляция окажется невозможной. По-
I
508 Глава 6
видимому, в процессе эволюции идет жесткий отбор на способность синтезировать новые изоферменты, оптимальные для катализа и регуляции катализа в данных условиях температурной акклима-
Структурные гены
изофермент С изофермент И/
концентрации субстрата
концентрации субстрата
Рис. 6-21. Обобщенная модель процессов, происходящих при температурной акклимации.
ции. В результате как при акклимации, так и при эволюционной адаптации к температуре появляются новые варианты лактатдегидрогеназ, пируваткиназ, альдолаз, фосфофруктокиназ, цитрат-синтаз, ацетилхолинэстераз, изоцитратдегидрогеназ и, вероятно, многих других ферментов.
Промежуточный обмен:, сравнительные аспекты
509
регуляция катализа
Введение (общие принципы). Современные попытки связать регуляцию метаболических процессов с известными свойствами ферментных систем исходят в первую очередь из свойств аллостерических, или «регуляторных», ферментов. Как мы уже отмечали,
Рис. 6-22. Влияние концентрации субстрата на скорость реакции, катализируемой регуляторным ферментом в присутствии положительного ( + ) и отрицательного i(—) модуляторов.
Величины кажущихся Км или So,б указаны стрелками.
предпочтительное использование тех или иных метаболических путей связано с определенными регуляторными особенностями ферментов, находящихся на этих путях. Особенно важны две характеристики: а) способность определенных метаболитов изменять активность фермента, присоединяясь к специфическим участкам его молекулы, удаленным от каталитического центра, и б) необычная (т. е. негиперболическая) зависимость начальной скорости реакции от концентрации субстрата или лигандов [3, 127, 149]. Действие положительных и отрицательных модуляторов схематически представлено на рис. 6-22, из которого видно следующее: а) так как кривая насыщения фермента субстратом имеет S-образную форму, незначительные изменения концентрации субстрата могут вести к большим изменениям каталитической активности фермента; б) модуляторы изменяют кажущееся сродство фермента к субстрату, но могут не влиять на максимальную скорость реакции Ушах. Положительные модуляторы снижают кажущееся сродство к субстрату, а отрицательные повышают кажущуюся величину So,5 (концентрацию субстрата, необходимую для достижения половины максимальной активности фермента). Это означает, что такое регулирование активности ферментов метаболитами происходит толь
510
Глава 6
ко при низких концентрациях субстрата, сравнимых с величинами 7<м или S0,5. Как мы уже говорили (стр. 434), in vivo метаболические пути, подобные гликолизу, функционируют, по-видимому, гораздо менее интенсивно, чем можно было бы ожидать при работе соответствующих ферментов в условиях насыщения (т. е. при максимальных скоростях реакций). Все современные схемы регуляции метаболизма основаны на обобщении, согласно которому
Рис. 6-23. Обобщенная схема регуляции по принципу обратной связи в точке разветвления метаболических путей [4].
большинство ферментов функционируют in vivo при низких уровнях субстратов и никогда не сталкиваются с их насыщающими концентрациями.
Другое важное обобщение, первоначально сформулированное в результате изучения регуляции обмена у бактерий, состоит в том, что регулирование происходит в точках разветвления метаболических путей. Модулятором обычно служит метаболит, за который конкурируют два или несколько ферментов, и по крайней мере один из этих ферментов кинетически регулируется одним или несколькими дополнительными модуляторами. Торможение продуктом реакции (по принципу обратной связи) — это лишь частный случай подобного механизма.
Рассмотрим простую обобщенную схему (рис. 6-23). Ферменты I и II конкурируют за метаболит М, находящийся в точке разветвления путей. Исход этой конкуренции зависит от относительных величин сродства ферментов к М, а эти величины регулируются концентрациями конечных продуктов А и В. Величина пула А в значительной степени определяется сродством к А регуляторного участка фермента /; соответственно концентрация В зависит от
Промежуточный обмен: сравнительные аспекты -. 511
сродства к В регуляторного участка фермента II. Таким образом, концентрация М будет сложной функцией взаимодействий Л с ферментом I и В с ферментом II и будет косвенным образом зависеть от существующей в данный момент потребности клетки в Л и В.
На основании проведенных исследований было сделано еще одно обобщение: конкретные сети метаболической регуляции (т. е. взаимодействия ферментов с модуляторами) определяются их физиологической полезностью, а не химическим сходством регулируемых процессов. Превосходным примером может служить регуляция многих ферментов промежуточного обмена аденилатами. Еще в 1938 г. Кори и его сотрудники установили, что АМФ сильно повышает активность гликогенфосфорилазы. Эткинсон и другие исследователи нашли, что АМФ при низких концентрациях изоцитрата активирует НАД-зависимую изоцитратдегидрогеназу (ИДГ), повышая ее сродство к субстрату. Приблизительно в это же время было установлено, что АМФ аналогичным образом увеличивает сродство ФФК к ее субстрату — Ф-6-Ф. В связи с этими результатами возникла важная проблема. Дело в том, что функции трех перечисленных ферментов совершенно различны: фосфорилаза катализирует фосфоролитическое расщепление ацетальной связи, ФФК — перенос фосфатной группы, а реакция ИДГ представляет собой НАД-зависимый перенос электронов. Эти реакции в химическом отношении не имеют между собой ничего общего, и тем не менее АМФ влияет на них сходным образом.
Очевидно, что объяснение здесь следует искать в функциональных метаболических взаимодействиях, а не в химическом подобии. Все три реакции участвуют в окислении полисахарида, доставляющем электроны для системы переноса электронов. Соответствующие ферменты косвенно участвуют в выработке АТФ. По аналогии с торможением биосинтетических процессов их конечными продуктами можно полагать, что гликолиз и цикл лимонной кислоты ингибируются АТФ — «конечным продуктом» энергетического обмена. А так как концентрации АМФ и АТФ в клетке изменяются противоположным образом, активирующее действие АМФ эквивалентно тормозящему действию АТФ.
Три рассмотренные реакции занимают стратегическое положение, весьма подходящее для эффективной регуляции метаболизма. Фосфорилаза катализирует первый этап мобилизации гликогена. ФФК катализирует первый, уникальный и физиологически необратимый этап гликолиза, который, исходя из разносторонних данных, считают главным контрольным пунктом гликолитического пути. НАД-зависимая ИДГ катализирует первую окислительную реакцию в цикле лимонной кислоты. Эти и множество других подобных соображений привели Эткинсона и его сотрудников к мысли, что относительные концентрации аденилатов играют решающую роль в распределении промежуточных продуктов обмена между путями окисления, приводящими к выработке АТФ, и путями биосинтеза,
512
Глава 6
приводящими к образованию резервных веществ. Эта концепция S более полно обсуждается в работе Эткинсона [4]. Для наших же * целей достаточно будет подробно рассмотреть кинетические свой- • ства лишь немногих ферментов, участвующих в регуляции обмена. Мы познакомимся здесь с регуляторными ферментами, действующими в противоположных направлениях в соответствующих путях [ катаболизма и анаболизма: с гликогенфосфорилазой и гликоген- [ синтетазой, а также с ФФК и ФДФазой. Эти примеры дадут чи- ь тателю некоторое представление о том, какого рода молекулярные I механизмы могут использоваться для поддержания «порядка» при | наличии сотен химических реакций, потенциально способных акти- > вироваться в клетке в любой данный момент.
Регуляция гликогенфосфорилазы и гликогенсинтетазы в печени. Концентрация гликогена в печени позвоночных может изменяться в большей степени и с большей скоростью, чем в любой другой ткани. Содержание гликогена в печени может варьировать в пределах от 0,01% (после голодания) до 12% сырого веса (после возобновления питания); интенсивность синтеза при этих условиях такова, что прирост количества гликогена достигает примерно 1 % сырого веса в час! Однако при нормальном кормлении и синтез, j и деградация гликогена у млекопитающих протекают медленно и ’ время полужизни гликогена печени составляет около 24—36 ч. Из этих данных уже видно, что процессы синтеза и расщепления гликогена в печени координированы между собой и подвергаются непрерывной регуляции [56].
Как теперь хорошо известно, эта регуляция осуществляется путем взаимопревращения двух форм ключевых ферментов, реакции которых лимитируют скорость соответствующих процессов; первые из этих форм (а) активны, а вторые (Ь) неактивны при обычных концентрациях ионов и метаболитов в клетках печени in vivo. Это изменение ключевых ферментов (гликогенфосфорилазы при расщеплении гликогена до Г-1-Ф, гликогенсинтетазы при синтезе гликогена из УДФГ) происходит в результате их фосфорилирования и дефосфорилирования. Существенное различие между двумя системами состоит в том, что фосфорилирование (это тоже регулируемый ферментативный процесс) активирует фосфорилазу, т. е. превращает в данном случае форму b в а, и в то же время инак- ' тивирует синтетазу (т. е. превращает форму а в Ь). Дефосфорили- ! рование этих двух ферментов специфическими протеинфосфатаза-ми приводит к обратному результату. В биологическом смысле эта противоположная полярность — момент чрезвычайно важный, так как ясно, что сколько-нибудь значительные процессы синтеза и деградации гликогена не могут в результате происходить одновременно (рис. 6-24). Хотя сходные регуляторные механизмы в других тканях, например в сердце и мышцах, изучались дольше и поняты лучше, регуляция в печени кажется несколько менее сложной; поэтому мы рассмотрим ее раньше других систем.
Проме&суточный обмен: сравнительные аспекты
513
Обмен гликогена в печени может регулироваться с помощью нескольких различных механизмов. Самый важный из них — это активация расщепления гликогена адреналином. Этот гормональный механизм рассматривается здесь, а не в одном из предыдущих
г-ГФ Гяикоеен УДФГ
Рис. 6-24. Обобщенная схема регуляции синтеза и расщепления гликогена.
разделов (стр. 487—491) потому, что он не связан с изменениями в скорости синтеза модулируемых ферментов. В отличие от уже рассмотренных случаев гормональной регуляции время реакции здесь измеряется секундами или минутами. Таким образом, мы имеем здесь дело с истинной молекулярной модуляцией активности ферментов, а не с изменением их концентрации.
Около 10 лет назад Сазерленд и Ролл получили первые данные о влиянии различных гормонов на синтез циклического АМФ. Эти работы и весьма интенсивные исследования последующего десятилетия привели к гипотезе, согласно которой многие гормоны действуют благодаря системе, состоящей из двух медиаторов. Сам 33—1332
514
Глава 6
гормон служит первым медиатором, основной эффект которого в ткани-мишени состоит в освобождении второго медиатора, выполняющего реальную работу гормона. Циклический АМФ рассматривают как первый из таких внутриклеточных медиаторов [22, 106]. Большая часть важных деталей, касающихся механизма действия циклического АМФ, была выяснена Кребсом и Фишером, изучавшими активацию, фосфорилазы. В результате возникло предположение, что гормоны, эффекты которых опосредуются циклическим АМФ, осуществляют свое физиологическое действие, ускоряя фосфорилирование специфических белков:
Стимуляция аденилатциклазы адреналином --> Циклический АМФ ->
—" > Стимуляция протеинкиназы
I
Физиологическая функция -> Фосфорилирование фермента
или какого-то другого функционального белка
В случае расщепления и синтеза гликогена в печени [56] адреналин действует, видимо, через активацию аденилатциклазы — фермента, связанного с мембраной и катализирующего синтез циклического 3,5-АМФ из АТФ. Циклический АМФ в концентрациях от 10-8 до 10~7 М сильно активирует киназу фосфорилазы Ь; эта активация связана с аутокаталитическим фосфорилированием фермента и катализируется специфической протеинкиназой, стимулируемой циклическим АМФ. Активированная киназа катализирует дальнейшее фосфорилирование и активацию фосфорилазы Z?, переходящей в фосфорилазу а. В мышечной ткани эта активация сопровождается полимеризацией фосфорилазы (переходом из димерной формы в тетрамерную), но в печени подобного изменения степени полимеризации не происходит. Донором фосфата в обеих тканях служит АТФ. По-видимому, фосфорилаза а ответственна практически за все расщепление гликогена в печени, поскольку форма b в этом органе по существу неактивна даже в присутствии АМФ. Как мы увидим позже, мышечная форма b в присутствии АМФ активна. В результате этого каскада реакций активации (рис. 6-25) первоначальный сигнал, которым было образование циклического АМФ, многократно усиливается к тому моменту, когда эффект этого сигнала проявляется в расщеплении гликогена до Г-1-Ф. Однако без одновременного торможения гликогенсинтетазы конечный эффект всех этих реакций был бы сведен на нет, так как возник бы бесполезный цикл синтеза — расщепления.
Основные этапы торможения гликогенсинтетазы циклическим АМФ формально аналогичны этапам активации гликогенфосфо-рилазы. Циклический АМФ активирует протеинкиназу, которая фосфорилирует неактивную киназу синтетазы, переводя ее в активную форму. Последняя в свою очередь катализирует фосфорилирование синтетазы а и превращение ее в неактивную форму Ь.
Адреналин
Аденил-ииллазо.
Рис. 6-25. Регуляция гликогенфосфорилазы и гликогенсинтетазы печени циклическим АМФ.
516
Глава 6
Таким образом, в печени одновременно с активацией системы гликогенфосфорилазы происходит резкое торможение гликогенсинтетазы, причем механизм обоих процессов сходен. Интеграция регулирования этих двух ферментов предотвращает их одновременную работу, а тем самым и «зацикливание» углерода.
Когда активность фосфатаз выше активности киназ, процесс направляется в обратную сторону. Контроль всего каскада теоретически мог бы осуществляться и на уровне фосфатаз; именно так, видимо, и обстоит дело в коре надпочечников [22]. Однако в большинстве исследованных тканей циклический АМФ, по-видимому, в конечном счете оказывает влияние в основном на активацию фосфорилазы (Ь—из), катализируемую киназой, а не на обратный процесс, катализируемый фосфатазой. Имеющиеся данные указывают на то, что в регуляции активности гликогенфосфорилазы и гликогенсинтетазы, по-видимому, участвует одна и та же протеин-киназа, активируемая циклическим АМФ; именно так это и представлено на рис. 6-24 и 6-25.
Регуляция гликогенфосфорилазы в скелетной мышце и сердце. В сердце и мышцах, так же как и в печени, гликогенолитическая реакция на адреналин крови или на раздражение симпатических нервов (т. е. на норадреналин) опосредуется через циклический АМФ. Путь активации в этих тканях изучен главным образом Э. Кребсом и его сотрудниками. Основная последовательность процессов схематически представлена на рис. 6-26. Адреналин или глюкагон активирует аденилатциклазу, и концентрация циклического АМФ возрастает. Циклический АМФ нужен для активности фос-фопротеинкиназы (вероятно, той же самой, что и при регуляции гликогенсинтетазы [21]), которая в свою очередь катализирует фосфорилирование и активацию киназы Ь. Активированная киназа b в присутствии АТФ, Mg и Са катализирует присоединение фосфата к фосфорилазе b и ее сопутствующую полимеризацию в фосфорилазу а. Эта форма фермента более активна, но в сердце и мышцах (в отличие от печени) фосфорилаза а — не единственный катализатор расщепления гликогена. При высоких уровнях АМФ и Фн весь гликогенолиз может быть обусловлен действием фосфорилазы Ь. Фосфорилирование b—происходит не сразу, как думали вначале, а в несколько этапов, с образованием частично фосфорилированных промежуточных продуктов, которые отличаются по своей каталитической активности и физико-химическим свойствам от форм а и Ь. Эта каскадная система необходима для регуляции гликогенолиза катехоламинами и глюкагоном в сердце и мышцах, но вскоре выяснилось, что различные звенья ее находятся иод действием других регуляторных механизмов. Некоторые из них хотя бы частично изучены, и их можно кратко описать следующим образом [94].
В сердце имеются по меньшей мере две группы рецепторов, участвующих в активации аденилатциклазы: адренорецепторы, бло-
Электрическое раздражение или. аноксия
I \ВеактиВироВаннс^ J | киназа у |
! фосфорилазы
I 6
1 I
Са.
АктиВиро^
Ванная I киназа । ФосфориЛ \лазы b !
I i X
t
1
I
Глюкагон
Адреналин
I —
J- «>
АГФ
цикличес-
*"кий АМФ .
I I
ФОСфО-протеин-киназа
Фосфорилаза, 6
1 Высокие уровни { АМФ и Ф„
Фосфорилаза а
Гликоген+ФН
Гликоген
УДФГ
Инсулин
I I I
\ Фосфатаза
Синтетаза!
| (неактивна in vtvoj
1
| Реактивированная
I киназа — \ синтетазы
• Актидиро->* Ванная ниназа синтетазы
Рис. 6-26. Регуляция обмена гликогена в скелетной мышце и сердце.
518
Глава 6
кируемые p-адренолитиками, и рецепторы глюкагона. Трансформация b—>а в этой ткани не всегда достаточна и не всегда обязательна для мобилизации гликогена. С одной стороны, и сама фосфорилаза b может служить мощным физиологическим катализатором в условиях, когда концентрация АТФ в сердце снижена, а уровни АМФ и Фн сильно повышены, например при очень большой рабочей нагрузке или частичной аноксии. С другой стороны, даже максимальное образование фосфорилазы а под действием адреналина не приведет к мобилизации гликогена в сердце, пока будут поддерживаться достаточные концентрации макроэргических фосфатов. Таким образом, очевидно, что при определенных условиях активность гликогенфосфорилазы будет регулироваться метаболитами миокарда, а не каскадной системой, представленной на рис. 6-26. После удаления Са2+ из перфузионной жидкости адреналин вызывает в сердце крысы ожидаемое образование циклического АМФ, но превращения b—не происходит. Напротив, избыток Са2+ вызывает это превращение и в отсутствие адреналина. Эксперименты Драммонда и сотр. [39] также позволяют предполагать, что Са2+ регулирует переход фосфорилазы b в а и активирует этот фермент. В этих экспериментах электрическое раздражение скелетной мышцы вызывало быстрое образование фосфорилазы а без повышения концентрации циклического АМФ и без активации киназы фосфорилазы Ь. Таким образом, освобождение внутриклеточного Са2+, вызываемое гормонами или деполяризацией, может быть вторым механизмом регуляции фосфорилазной системы.
Регуляция гликогенсинтетазы в скелетной мышце и сердце. Ларнер и его сотрудники, изучая влияние инсулина на синтез гликогена, в 1960 г. впервые открыли две формы гликогенсинтетазы. В мышцах и сердце (рис. 6-26) гликогенсинтетаза встречается в двух различных формах: форма I (активная) при фосфорилировании превращается в форму D (неактивную). Каталитическая активность в этом случае не определяется законом «все или ничего». Форма I активна в отсутствие Г-6-Ф, а форма D активна только в случае присоединения Г-6-Ф к аллостерическому участку. В этом отношении Г-6-Ф, по-видимому, играет роль, аналогичную роли АМФ для фосфорилазы, с той разницей, что Г-6-Ф эффективен лишь при полностью фосфорилированной форме D и является прямым, стехиометрическим предшественником конечного продукта — полисахарида [80]. Превращение формы D в форму I протекает как дефосфорилирование при участии специфической фосфатазы, ингибируемой гликогеном. Другие регуляторные факторы (инсулин и адреналин) влияют на активность киназы, катализирующей превращение I—>D, и сравнимы с регуляторными факторами, описанными выше для системы гликогенсинтетазы печени. Очевидно, что в этих тканях, так же как и в печени, условия, благоприятствующие деградации гликогена, в то же время способствуют торможению синтеза гликогена, и наоборот.
Промежуточный обмен: сравнительные аспекты
519
Каталитические и регуляторные свойства фосфофруктокиназы (ФФК) при превращении Ф-6-Ф в ФДФ. Фосфорилирование «ф-6-ф с образованием ФДФ происходит при участии специфического фермента ФФК, который на основании целого ряда данных рассматривают как один из важных регуляторных пунктов гликолитического пути. ФФК имеет ряд свойств, общих с другими киназами (потребность в АТФ и Mg2+, отрицательная величина дб°), и катализирует первую реакцию, характерную для гликолиза. Ларди и Паркс в середине пятидесятых годов впервые обнаружили, что АТФ в концентрациях, превышающих молярный эквивалент Mg2+, тормозит активность ФФК из скелетной мышцы. Однако первые детальные кинетические исследования провели Мансур и его сотрудники на ферменте печеночной двуустки. Эти авторы нашли, что фермент может существовать in vivo в активной и суб-зктивной формах; превращению второй в первую благоприятствует аноксия. При неингибирующих концентрациях АТФ кривая насыщения фермента фруктозо-6-фосфатом не соответствует уравнению Михаэлиса—Ментен, а скорее имеет S-образную форму. Эта кри-
V
вая насыщения, построенная в координатах log vmax—у" и [S], где v — скорость реакции при любой данной концентрации субстрата, Vmax — максимальная скорость и [S]—концентрация субстрата (так называемый график Хилла), дает величины коэффициентов Хилла (наклона кривой) больше единицы. Коэффициент Хилла п — не элементарный кинетический параметр: он зависит от числа участков, связывающих субстрат, и силы его взаимодействия с ними. Величины п, превышающие единицу, означают, что присоединение первых молекул Ф-6-Ф облегчает связывание последующих молекул (положительная кооперативность). Поэтому Ф-6-Ф можно рассматривать в определенном смысле и как субстрат, и как положительный модулятор ФФК- Добавление АМФ или циклического 3,5-АМФ повышает сродство ФФК к Ф-6-Ф, уменьшает отличие S-образной кривой насыщения от нормальной гиперболической кривой и тем самым уменьшает коэффициент Хилла (величина п приближается к единице, по мере того как S-образная кривая приближается к классической гиперболической кривой насыщения Михаэлиса). Вместе с тем повышение концентрации АТФ равносильно торможению фермента. Более высокие, концентрации АТФ понижают также сродство фермента к циклическому АМФ. Во всех этих экспериментах АМФ действовал аналогично циклическому АМФ; in vivo АМФ, вероятно, служит физиологическим активатором фермента. Взаимодействия АТФ и АМФ позволяют предполагать, что при высоком уровне АТФ АМФ не будет эффективным активатором [90].
Позже были изучены фосфофруктокиназы, выделенные из ряда Других источников, и результаты оказались поразительно сходными. Был открыт ряд добавочных модуляторов: цитрат как отрица
520
Глава 6
тельный модулятор, Фн как активатор, ФДФ и АДФ как продукты-активаторы. Кинетическое исследование ФФК из сердца млекопитающих показало, что при щелочном pH (8,2) фермент утрачивает свои регуляторные свойства: кривые насыщения субстратом (Ф-6-Ф) здесь больше соответствуют обычному уравнению Михаэлиса—Ментен, чем взаимодействию связывающих участков, наблюдаемому при более низких значениях pH. В последнем случае (pH 6,9) и при низких уровнях фруктозо-6-фосфата АТФ, цитрат и креатинфосфат действуют как ингибиторы. Ингибированный фермент может быть расторможен (или активирован) Ф-6-Ф, ФДФ, АМФ, циклическим АМФ и Фн. Судя по кинетическим данным, эффекты этих активаторов, возможно, осуществляются на участке связывания АТФ, обособленном от каталитического центра (к последнему присоединяются и АТФ, и Ф-6-Ф). Таким образом, указанные активаторы не изменяют кажущуюся Км для АТФ, тогда как кажущаяся Кг- возрастает. Так же как и в случае фермента печеночной двуустки, активаторы, действуя на фермент из сердца, понижают кажущуюся Км для Ф-6-Ф. Опыты с модификацией фермента и прямое изучение связывания подтверждают, что субстраты и модуляторы присоединяются в совершенно различных участках [90].
Рассмотренные выше эффекты различных метаболитов имеют такое направление и такую величину, что позволяют объяснить регуляцию гликолиза фосфофруктокиназой во многих тканях (печени, сердце, мышцах, нервной ткани). Данные о такой регуляции носят косвенный характер — они касаются главным образом кратковременных сдвигов уровней различных метаболитов при изменении интенсивности гликолиза в ту или иную сторону. Наиболее убедительные результаты получил Уильямсон с сотрудниками. Изучая, например, электрический орган Electrophorus, работающий почти исключительно за счет энергии гликолиза, эти авторы нашли, что главными пунктами регуляции гликолиза служат реакции фосфорилазы и ФФК [166]. В активации фосфорилазы (которая заведомо не зависит от циклического АМФ), по-видимому, участвуют ионы Са2+ — примерно таким же образом, как в скелетной мышце. К повышенному притоку гексозофосфатов путь гликолиза приспосабливается благодаря одновременной активации ФФК; поэтому уровни Г-6-Ф и Ф-6-Ф падают, тогда как уровень ФДФ значительно возрастает. Как показали кинетические измерения уровня аденилатов, креатинфосфата и Фн, креатинфосфат исчезает в течение нескольких секунд после начала электрического разряда. Уровни АТФ поддерживаются высокой активностью креатинфосфокиназы; повышение уровней АДФ и АМФ происходит только после окончания 60-секундного разряда, когда истощаются запасы креатинфосфата. Активность ФФК, описываемая изменениями соответствующего отношения действующих масс ([ФДФ] • [АДФ]/[Ф-6-Ф] • •[АТФ]), во время разряда возрастает, а в период восстановления
Промежуточны.й обмен: сравнительные аспекты
521
после разряда наблюдается ее дальнейшее значительное, хотя и кратковременное, повышение. Основываясь на данных о кратковременных изменениях уровней метаболитов, Уильямсон и соавторы указывают, что исходная активация ФФК обусловлена ранним приростом Фн; в дальнейшем изменения отношения действующих масс для ФФК обнаруживают тесную корреляцию с изменениями уровней АДФ и АМФ (мощных активаторов ФФК) и с изменениями активации, вызываемой продуктом — ФДФ.
Рис. 6-27. Схема главных путей обратной связи .между электрической активностью и системой регуляции гликолиза в главном электрическом органе Electrophorus [166].
ФГК — фосфоглицераткиназа.
На рис. 6-27 схематически представлены вероятные события, происходящие при вызванном разряде электрического органа. Благодаря своим специфическим особенностям ФФК идеально приспособлена для быстрого «включения» гликолиза в ответ на возросшие при разряде метаболические потребности электрического органа и служит поэтому ключевым регуляторным пунктом. Как только рост уровня Фн начинает активировать реакцию ФФК, оба ее продукта — ФДФ и АДФ, действуя по принципу положительной обратной связи, быстро и эффективно осуществляют дальнейшую активацию; позднее тот же эффект дает АМФ. Снижение активности ФФК происходит в результате исчерпания субстрата или удаления АДФ и ФДФ. Быстрое удаление этих продуктов обеспечивается высокой активностью альдолазы и триозофосфатдегидрогена-зы, а также фосфорилированием АДФ на последующих этапах гликолиза.
522
Глава 6
Сходные данные о кратковременных изменениях концентрации промежуточных продуктов гликолиза и аденилатов получены при изучении сердца, скелетной мышцы, печени и мозга млекопитающих [86, 163], летательной мускулатуры насекомых [119], мышц конечностей ракообразных [60] и надосевой мышцы рыб [46]. Во всех случаях установлена ведущая роль фосфофруктокиназы, и во всех случаях в регуляции ее активности участвуют один или несколько из упомянутых выше модуляторов.
Начало полета у мясной мухи и других двукрылых сопровождается 100-кратным усилением гликолиза. Это усиление, по-видимому, превосходит любой сопоставимый процесс в природе. Как показало изучение кратковременных изменений концентраций метаболитов в первые секунды полета, регуляторные механизмы здесь настолько эффективны, что, несмотря на высокую интенсивность гликолиза, всего через 15—20 с полета концентрации большинства промежуточных продуктов достигают стационарного уровня [120].
Взаимопревращение Ф-б-Фг^ФДФ: интеграция активности ФФК и ФДФазы. В таких тканях, как печень и почка позвоночных или мантия моллюсков, где интенсивный ток углерода возможен и в направлении глюконеогенеза, и в направлении гликолиза, регуляция ФФК усложнена. Реакция этого фермента теоретически обратима, но сколько-нибудь значительному использованию ее при глюконеогенезе препятствуют кинетические и термодинамические барьеры. Организмы преодолели эту трудность в процессе эволюции, выработав второй фермент — ФДФазу, катализирующую гидролиз ФДФ с образованием Ф-6-Ф и Фн. Важно подчеркнуть, что действие этого фермента физиологически равноценно обратной реакции ФФК, но в химическом смысле эти реакции, конечно, совершенно различны: ФФК катализирует трансфосфорилирование, а ФДФ аза — простой гидролиз. Присутствие обоих ферментов в одном и том же клеточном компартменте означает, однако, возможность «короткого замыкания» путей обмена углерода и энергии в этом пункте. Ясно, что одновременная работа обоих ферментов привела бы к бесполезному круговращению углерода с затратой АТФ. Поэтому очевидно, что в тканях, содержащих и ФФК, и ФДФазу, например в печени и почке, регуляция обоих ферментов должна быть хорошо координирована. Совершенно аналогичная проблема «зацикливания» углерода и энергии возникает всегда,, когда в одной и той же клетке имеются два фермента с противоположно направленным действием. Дальнейшими примерами этого в тканях, подобных печени и почке, могут быть взаимопревращения глюкозамГ-6-Ф (катализируемые гексокиназами и Г-6-Фазами) и ФЕП^пируват (катализируемые пируваткиназой и пируваткар-боксилазойф-ФЕП-карбоксикиназой). В принципе все эти проблемы разрешаются сходным образом: внутриклеточные условия, благоприятствующие катализу в катаболическом направлении, весьма
Промежуточный обмен: сравнительные аспекты
523
неблагоприятны для катализа в анаболическом направлении, и наоборот. Следовательно, условия, подходящие для работы гексокиназы, не благоприятствуют Г-6-Фазе; условия, благоприятные для активности ФФК, не способствуют функции ФДФазы; условия, благоприятные для пируваткиназы, подавляют активность пируваткар-боксилазы и ФЕП-карбоксикиназы и т. д. Так как все эти случаи по существу сходны, мы сосредоточим свое внимание на объединенной регуляции ФДФазы и ФФК.
Рис. 6-28. Интеграция функций ФФК и ФДФазы в пределах одного клеточного компартмента.
Как это часто бывает в науке, специальные регуляторные функции ФДФазы были открыты почти одновременно и независимо по меньшей мере в трех разных лабораториях — Кребсом и его сотрудниками, Хорекером и Понтремоли с сотрудниками и в лаборатории Поджелла [63, 98]. У всех до сих пор исследованных позвоночных ФДФаза печени обнаруживает абсолютную потребность в двухвалентных катионах (Mg2+ или Мп2+), имеет сложный профиль зависимости от pH (обычно с оптимумом в щелочной области) и специфически тормозится АМФ. Кинетика торможения АМФ описывается S-образной кривой с величинами п, близкими к 4, что позволяет предполагать весьма сильную положительную кооперативность при связывании АМФ. В этом случае п соответствует истинному числу связывающих участков. Ионы Н+ и двухвалентные катионы могут изменять как величину, так и характер тормозящего действия АМФ. Таким образом, внутриклеточные отношения Mg2+/Mn2+ и pH могут использоваться для более тонкой модуляции ФДФазной реакции. В некоторых системах связывание ФДФ может обнаруживать положительную кооперативность, но Для большинства ФДФаз печени у млекопитающих кривая насы
524
Глава 6
щения субстратом (ФДФ) имеет гиперболическую форму. У низших позвоночных эта кривая может быть S-образной [11].
По мнению большинства исследователей, АМФ служит главным регуляторным сигналом для координации активности ФДФазы с активностью ФФК. В условиях глюконеогенеза отношения АТФ/АМФ высоки; благодаря низким уровням АМФ путь ФДФазы «открыт», тогда как реакция ФФК блокирована высокими концентрациями АТФ. При сдвиге в сторону гликолиза, который был бы желателен в случае нехватки энергии, возросшие уровни АМФ подавляют действие ФДФазы, одновременно активируя ФФК. Высокой эффективности этой системы способствует также активация ФФК продуктами катализируемой ею реакции — ФДФ и АДФ; эта активация приводит к резкому подъему активности ФФК, первоначально проявившейся под влиянием АМФ (рис. 6-28).
И наконец, еще одним, часто не учитываемым, компонентом этой регуляторной системы могут быть ионы Н+. Они образуются в результате реакции ФФК и, как мы показали, сильно влияют на свойства обоих ферментов [11, 46, 144]. Поэтому они также могли бы участвовать в создании противоположно направленных регуляторных характеристик ФФК и ФДФазы.
Роль внутриклеточной локализации ферментов в регулировании их активности
Потенциальная опасность бесполезного «зацикливания» углерода в результате одновременной работы ферментов с односторонним, но противоположно направленным действием может быть также устранена путем физического разделения их в пространстве и (или) во времени. Превосходным примером может служить взаимопревращение глюкозач^Г-б-Ф. Полагают, что в большинстве тканей гексокиназа находится в клеточной мембране или поблизости от нее, а в центральной нервной системе — на впячиваниях клеточной мембраны, подходящих к митохондриям. В отличие от этого фермент Г-6-Фаза, по-видимому, всегда представляет собой комплекс белка с фосфолипидом, in vivo очень прочно связанный с эндоплазматической сетью. Таким образом, хотя эти два фермента катализируют противоположно направленные реакции, пространственная разобщенность их, вероятно, исключает значительное «зацикливание» углерода и энергии [127]. Вероятно, подобное разобщение ферментов довольно обычно в живых системах. Но каким образом выработались механизмы, позволяющие каждому ферменту «найти» себе надлежащее место в клетке?
Очевидно, что при одновременном существовании в клетке тысяч различных макромолекул-полиэлектролитов и еще большего числа малых молекул растворяющая способность внутриклеточной воды может быть сохранена лишь в том случае, если концентрации этих растворенных веществ будут поддерживаться на низком уров-
Промежуточный обмен: сравнительные аспекты
525
не. Поэтому биохимическая сложность современной живой клетки могла выработаться лишь при условии параллельного развития эффективных механизмов, ограничивающих эти концентрации. Вместе с тем количества ферментов должны быть достаточными для осуществления необходимых каталитических функций. Эти два противоположных требования могли в процессе отбора способствовать включению ферментов в мембранные структуры клеточного матрикса, митохондрий, ядра и в плазматическую мембрану. Таким образом, становится все более ясным, что большинство внутриклеточных ферментных систем в той или иной степени связано с клеточными органеллами. Прямое и изящное подтверждение этой концепции получили Кемпнер и Миллер [73, 74], которые, применив центрифугирование для стратификации внутриклеточного содержимого живой Euglena-—простейшего длиной около 30 мкм,— показали, что в клетке нет свободных или несвязанных белков. Гистохимическими методами было выявлено множество разнообразных ферментов, и все они оказались, по-видимому, связанными с корпускулярными компонентами клетки. В цитозоле ферментов не было; он, вероятно, вообще не содержит свободных макромолекул. Все значение этого замечательного наблюдения для наших современных теорий регуляции ферментов еще не осознано до конца. .. j
Заключение 1
Основные функции промежуточного обмена, несмотря на его видимую сложность, немногочисленны и легко постижимы. У всех организмов клеточный метаболизм должен постоянно выполнять по существу следующие задачи:
1) он должен обеспечивать клетку достаточными количествами макроэргических соединений (таких, как АТФ)—«энергетической валютой», необходимой для жизненных функций клетки — ионной регуляции, сократимости, биосинтетической активности и т. д.;
2) он должен доставлять в соответствующих количествах промежуточные продукты, необходимые для синтеза крупных молекул— нуклеиновых кислот, белков, липидов и углеводов;
3) необходима также выработка биологических восстановителей, например НАДФ-Н, для осуществления восстановительных реакций, с которыми связаны процессы биосинтеза;
4) наконец, в результате объединения перечисленных выше трех процессов организм должен синтезировать макромолекулы, составляющие основу различных «биологических» свойств живых систем.
Существует сложная и эффективная управляющая система, работа которой, накладываясь на все эти основные функции (или, точнее, на цепи реакций, посредством которых осуществляются эти функции), обеспечивает соответствие каждого метаболического
526
Глава 6
процесса потребностям организма как единого целого. Ни один метаболический путь не функционирует независимым образом. Активность каждого пути (и по сути дела каждого регуляторного фермента) находится под воздействием множества регулирующих факторов, которые связывают работу этого пути с локальным химизмом клетки и в конечном счете с потребностями всего организма. Эти регуляторные функции представляют собой важные точки взаимодействия с внешней средой, они весьма чувствительны к естественному отбору, и поэтому у них обнаруживаются интересные видовые особенности.
Ключевой факт, установленный работами последнего десятилетия, состоит в том, что регуляторные механизмы образуют иерархическую систему. Так как практически все клеточные реакции катализируются ферментами, регуляция метаболизма сводится к регуляции интенсивности, типов и направлений ферментативных функций. Теперь ясно, что для этого есть только два пути: 1) могут изменяться количества ферментов и 2) может регулироваться их активность, т. е. степень реального использования их каталитического потенциала. Иерархическая природа регуляции вытекает из того простого факта, что регулирование ферментативной функции может осуществляться путем воздействия «включающих» и «выключающих» сигналов на любом из этих двух уровней — либо на уровне синтеза ферментов, либо на уровне их функционирования. Очевидно, что эти два типа регуляторных процессов различаются:
а) по быстроте: в первом случае время реакции обычно измеряется по меньшей мере часами, а во втором случае оно настолько ) коротко, что с практической точки зрения реакцию можно считать р мгновенной; ;
б) по тонкости регулирования: в первом случае возможна толь- h ко «грубая» адаптация, а во втором — гораздо более тонкая «на- р стройка» ферментативной функции; й
в) по гибкости: в первом случае могут изменяться и относи- 1 тельные количества, и типы ферментов, функционирующих в лю-бом данном участке метаболизма, а во втором возможна лишь мо-дуляция относительной активности различных ферментов без како- d го-либо качественного изменения в составе ферментного аппарата.
Активность ферментов в любой данный момент в основном оп- !> ределяется: а) количествами субстратов и кофакторов, б) физическими параметрами среды, например температурой и давлением, и в) взаимодействиями с группой метаболитов, называемых «модуляторами ферментов». Эти последние' вещества обеспечивают наиболее быструю, тонкую и адекватную регуляцию метаболизма.
Модуляторы делятся на две категории: положительные модуляторы повышают активность фермента, а отрицательные оказывают ; противоположное (тормозящее) действие. Ферменты, регулируе- ; мые модуляторами, называют регуляторными ферментами. Дей
Промежуточный обмен: сравнительные аспекты
527
ствие модуляторов на большинство регуляторных ферментов состоит в изменении сродства фермента к субстрату, а не в изменении максимального каталитического потенциала. Так как физиологические концентрации субстратов почти всегда слишком низки для насыщения ферментов, ясно, что каталитическая активность весьма чувствительна к изменениям сродства между ферментом и субстратом. У большинства регуляторных ферментов небольшие изменения этого сродства могут приводить к значительным изменениям интенсивности катализа; это свойство играет ключевую роль в регуляции большей части ферментативных реакций.
Метаболиты, служащие модуляторами, в химическом отношении часто мало похожи на субстраты, продукты и кофакторы регулируемых ферментов. Этого и следовало ожидать. Для того чтобы активность фермента регулировалась в соответствии с потребностями клетки в продуктах того метаболического пути, в который этот фермент входит, последний должен «чувствовать» концентрацию конечных, ключевых продуктов данного пути. Например, главная функция многих важнейших путей катаболизма состоит в выработке АТФ, и ферменты, играющие роль «вентилей» на этих путях, должны реагировать на изменения концентрации АТФ в клетке, даже если АТФ в структурном отношении резко отличается от субстратов данного фермента. Иными словами, регуляторные ферменты должны обладать сродством к модуляторам, которые по стерическим причинам не могут присоединяться к участкам, связывающим субстрат. В соответствии с этим мы находим, что большинство регуляторных ферментов имеет отдельные участки для связывания субстратов и для связывания модуляторов. Участки, связывающие модуляторы, называют «аллостерическими» (что значит «стерически отличные»), желая подчеркнуть их стерическое и пространственное обособление от того участка, где происходит собственно катализ.
Механизм аллостерической регуляции катализа служит весьма изящным примером того, насколько «хитроумным» может быть устройство белковой молекулы: структура ее такова, что модулятор, специфически изменяя конформацию ферментного белка, определяет, будет ли участок, связывающий субстрат, иметь для этого надлежащую геометрию и конфигурацию заряда. Становится понятным, почему биологические катализаторы должны быть макромолекулами: они должны иметь не только сложные участки для присоединения субстратов, но и достаточно развитую структуру, необходимую для аллостерической регуляции катализа.
Необычайно сложную, тесно переплетенную сеть метаболических реакций часто называют «картой метаболизма». Эта удачная метафора позволяет проникнуть в существо основной конструкции метаболических путей и регуляторных механизмов. Кроме сложной системы «дорог», по которым идут метаболиты, существуют также высококоординированные системы «транспортной сигнализации»,
S2S Глава 6
-благодаря которым скорости и направления метаболических потоков всегда согласуются с общими интересами клеточного «хозяйства». Без этих регуляторов и их надлежащей расстановки огромный каталитический потенциал всей системы метаболизма был бы бесполезен, подобно тому как современная система автострад была бы хаотичной без дорожных сигналов, указателей и т. п.
Общая «конструкция» регуляторной системы метаболизма удивительно проста. В основе ее лежат два следующих фундаментальных принципа.
1. Регуляторные ферменты, направляющие поток метаболизма, обычно занимают стратегические позиции — либо в начальных точках метаболических путей, либо на жизненно важных метаболических «перекрестках», где расходятся или сходятся два или большее число путей.
2. Регуляторные ферменты, как мы уже говорили, чувствительны к потребностям клетки в конечном продукте данного метаболического пути.
Существует два типа такой чувствительности. Во-первых, регуляторные ферменты, относящиеся как к биосинтетическим, так и к катаболическим путям, реагируют на аденилатный заряд клетки. Значение чувствительности к аденилатам нетрудно понять, так как аденилаты (АМФ, АДФ, АТФ) — это наиболее важные метаболиты, которые связывают между собой процессы, идущие с выделением и с затратой энергии. И во-вторых, регуляторные ферменты чувствительны также к концентрациям определенных промежуточных или конечных продуктов данного конкретного пути. Например, для фермента, определяющего скорость синтеза какой-то определенной аминокислоты, типично торможение именно этой аминокислотой— конечным продуктом данного пути (по принципу обратной связи).
Эти два типа чувствительности служат основой «грубого» и «тонкого» управления регуляторными ферментами. Модуляция энергетическим зарядом — это один из механизмов относительно грубого регулирования, тогда как модуляция специфическими продуктами данного пути позволяет осуществлять тонкую «настройку» ферментативной активности. Например, высокий энергетический заряд стимулирует все пути обмена, использующие АТФ, а специфические метаболиты доставляют клетке дополнительную информацию о том, какие из процессов, требующих затраты энергии, особенно нужны в данный момент.
Из сложной, иерархической природы регуляции метаболизма вытекает ряд важных следствий, касающихся взаимодействий между биохимией организма и окружающей его средой. Во-первых, то или иное изменение среды может нарушить один или несколько процессов в этой иерархии. Таким образом, метаболический аппарат клетки оказывается «уязвимым» в ряде различных мест. Во-вторых, если мы посмотрим на это с другой стороны, то увидим,
Промежуточный обмен: сравнительные аспекты 529
что биохимические адаптации к различным внешним условиям могли бы, по крайней мере теоретически, осуществляться несколькими различными путями: организм может использовать различные стратегии биохимической адаптации и выживания. В-третьих, взаимодействие может быть или очень быстрым, или относительно медленным в зависимости от того, где в регуляторной иерархии находится «точка приложения» внешнего воздействия. Например, изменения в интенсивности синтеза ферментов будут медленнее сказываться на метаболизме, чем прямое влияние внешних условий на активность уже существовавших ферментов, и организм должен «учитывать» это в своей реакции. Поэтому не удивительно, что у разных организмов мы находим множество различий, касающихся а) наличия или отсутствия определенных метаболических путей, б) их физиологических функций и в) их общей интеграции с остальным клеточным метаболизмом. Каждая отдельная «метаболическая карта» и каждая «регуляторная цепь» — это в известном смысле результат какого-то одного варианта адаптационной стратегии. Поэтому каждую такую «карту» или цепь можно полностью оценить только в связи с образом жизни организма, в контексте его взаимоотношений со средой. Можно надеяться, что такого рода сравнительный подход к изучению промежуточного обмена постепенно приведет нас к более глубокому проникновению в биохимические основы удивительного многообразия живой природы.
СПИСОК ЛИТЕРАТУРЫ
1. Asahina Е., Fed. Proc. Suppl., 24, 183—187, 1965. Freezing and injury in cells.
2. Asahina E., pp. 1—49, in: Advances in Insect Physiology, Vol. 6, ed. by J. W. L. Beament, J. E. Treherne and V. B. Wigglesworth, Academic Press. London, 1969. Frost resistance in insects.
a. Atkinson D. E., Ann. Rev. Biochem., 35, 85—124, 1966. Regulation of enzyme activity.
4. Atkinson D. E., pp. 23—40, in: Metabolic Roles of Citrate, ed. by T. W. Goodwin, Academic Press, London, 1968. Citrate in the regulation of energy metabolism.
5. Ball E. Q., Strittmatter C. S., Cooper O., Biol. Bull., 108, 1—17, 1955. Gas gland of the swimbladder.
6. Ballard F. J., Hanson R. W., Kronfield D. S., Biochem. Biophys. Res. Comm., 30, 100—104. 1968. Mitochondrial oxaloacetate in liver during spontaneous bovine ketosis.
7. Ballard F. J., Hanson R. W., Rronfield D. S., Fed. Proc., 28, 218—231, 1969. Gluconeogenesis and lipogenesis in ruminant and nonruminant animals.
8. Barnard T., Skala J., Lindberg O., Comp. Biochem. Physiol., 33, 499—508, >970. Changes in interscapular brown adipose tissue of the rat.
9. Bauman D. E., Brown R. E., Davis C. L., Arch. Biochem. Biophys., 104, 237— 244, 1970. Fatty acid synthesis in mammary gland of rat, cow, and sow.
10. Beenakkers A. M. Th., Klingenberg M., Biochim. Biophys. Acta, 84, 205—207, 1964. Carnitine со-enzyme A transacetylase in mitochondria.
1.1. Behrisch H. W., Hochachka P. W., Biochem. J., J., 112, 601—607, 1969. Temperature and the regulation of enzyme activity in poikilotherms.
12. Belkin D. A., Physiologist, 5, 105, 1962. Anaerobiosis in diving turtles.
34—1332
530
Глава 6
13. Belkin D. A., Resp. Physiol., 4, 1—14, 1968. Underwater survival of two freshwater turtle species.
14. Bilinski E., Canad. J. Biochem. Physiol., 41, 107—112, 1963. Utilization of lipids by fish.
15. Blazka P., Physiol. Zool., 31, 117—128, 1958. The anaerobic metabolism of fish.
16. Bremer J., pp. 65—88, in: Cellular Compartmentalization and Control of Fatty Acid Metabolism, ed. by F. C. Gran, Fed. Europ. Biochem. Soc. (Fourth Meeting), Universitetsforlaget, Oslo, 1968. Biochem. Soc. (Fourth Meeting), Universitetsforlaget, Oslo, 1968. Carnitine-dependent oxidation of fatty acids.
17. Brew K., Vanaman T. C., Hill R. L., Proc. Nat. Acad. Sci., 59, 491—497, 1968. a-Lactalbumin and the A protein in lactose synthetase.
18. Brodbeck U., Ebner К. E., J. Biol. Chem., 241, 762—764, 1966. Resolution of a soluble lactose synthetase into components.
19. Brodbeck U., Ebner К. E., J. Biol. Chem., 241, 5526—5532, 1966. Distribution of the proteins of lactose synthetase in bovine and rat mammary tissue.
20. Brodbeck U., Denton W. L., Tanahashi N., Ebner К. E., J. Biol. Chem., 242, 1391—1397, 1967. Identification of the В protein of lactose synthetase.
21. Brostrom M. A., Reimann E. M., Walsh D. A., Krebs E. G., pp. 191—203, in: Advances in Enzyme Regulation, Vol. 8, ed. by G. Weber, Pergamon Press, Oxford, 1970. A cyclic 3', 5'-AMP-stimulated protein kinase from cardiac muscle.
22. Butcher R. W., Robinson G. A., Hardman J. G., Sutherland E. W„ pp. 357—389, in: Advances in Enzyme Regulation, Vol. 6, ed. by G. Weber, Pergamon Press, Oxford, 1968. Cyclic AMP in hormone actions.
23. Arion W. J., Nordlie R. C., J. Biol. Chem., 239, 2752—2757, 1964. Liver microsomal glucose-6-phosphatase, inorganic pyrophosphatase, and pyrophosphateglucose phosphotransferase.
24. Candy D. J., Kilby B. A., Biochem. J., 78, 531—536, 1961. The biosynthesis of trehslose
25. Candy D. J., Kilby B. A., J. Exp. BioL, 39, 129—140, 1962. Studies on chitin synthesis.
26. Childress С. C., Sacktor B., J. Biol. Chem., 245, 2927—2936, 1970. Regulation of glycogen metabolism in insect flight muscle.
27. Chino H., Nature, 180, 606—607, 1957. Conversion of glycogen in the diapause egg of the bombyx silkworm.
28. Chino H., J. Insect PhysioL, 2, 1—12, 1958. Carbohydrate metabolism in the diapause egg of the silkworm Bombyx mori.
29. Chino H„ Gilbert L. I., Biochim. Biophys. Acta, 98, 94—110, 1965. Lipid release and transport in insects.
30. Christian D. R., Kilsheimer G. S., Pettett G., Paradise R., Ashmore J., pp. 71 — 82, in: Advances in Enzyme Regulation, Vol. 7, ed. by G. Weber, Pergamon Press, Oxford, 1969. Regulation of lipolysis in cardiac muscle.
31. Cohen J. J., Proc. Int. Union PhysioL Sci., VI, 233—234, 1968. Renal gaseous and substrate metabolism in vivo.
32. Conte F. P., Wagner H. H., Fessler J. et al., Comp. Biochem. PhysioL, 18, 1—15, 1966. Development of osmotic and ionic regulation in juvenile coho salmon.
33. Conte F. P., Morita T. N., Comp. Biochem. PhysioL, 24, 445—454, 1968. Cell differentiation in gill epithelium of euryhaline Oncorhynchus.
34. Copeland D. E., Amer. Zool., 8, 417—432, 1968. Fine structure of salt and water uptake in the land crab.
35. Dean J. M., Comp. Biochem. PhysioL, 29, 185—196, 1969. Metabolism of tissues of thermally acclimated trout.
36. DeVries A. L., in: Fish Physiology, Vol. 6, ed. by W. S. Hoar and D. J. Randall, Academic Press, New York, in press. Freezing resistance in fishes.
37. De Weer P., J. Gen. PhysioL, 56, 583—620, 1970. Sensitivity of sodium effleux from squid axon to external sodium and potassium.
Промежуточный обмен: сравнительные аспекты 531
38. Drummond G. I., Duncan L., J. Biol. Chem., 245, 976—983, 1970. Adenyl cyclase in cardiac tissue.
39. Drummond G. I., Harwood J. P., Powell C. A., J. Biol. Chem., 244, 4235—4240, 1969. Activation of phosphorylase in skeletal muscle.
40. Dubach P., Smith F., Pratt D., Stewart С. M., Nature, 184, 288—289, 1959. Glycerol and the winter-hardiness of insects.
41. Ernst S. A., Ellis R. A., J. Cell Biol., 40, 305—321, 1969. Surface specialization in the secretory epithelium of the avian salt gland.
42. Exton J. H., Park C. R., in: Advances in Enzyme Regulation, Vol. 6, ed. by G. Weber, Pergamon Press, Oxford, 1968. Cyclic AMP in liver metabolism.
43. Krebs E. G., Walsh D. A., Fed. Proc., 31, xiv, 1972. The mechanism of action of cyclic AMP in mammalian systems.
44. Fain J. N., Reed N., Saperstein R., J. Biol. Chem., 242, 1887—1894, 1967. The isolation and metabolism of brown fat cells.
45. Fawcett D. W., The Cell, W. B. Saunders Co., Philadelphia, 1966.
46. Freed J. M., Comp. Biochem. Physiol., 39, 765—774, 1971. Temperature effects on muscle phosphofructokinase of the Alaskan king crab.
47. Fry F. E. J., Hochachka P. W., pp. 79—134, in: Comparative Physiology of Thermoregulation, ed. by C. Whittow, Academic Press, New York, 1970. Fish.
48. Garland P. B., pp. 41—60, in: Metabolic Roles of Citrate, ed. by T. W. Goodwin, Academic Press, New York, 1968. Control of citrate synthesis in mitochondria.
49. Ginsburg A., Stadtman E. R., Ann. Rev. Biochem., 39, 429—472, 1970. Multienzyme systems.
50. Hackman R. H., Chap. 8, in: The Physiology of Insecta, Vol. 3, ed. by M. Rock-stein, Academic Press, New York, 1964. Chemistry of the insect cuticle.
51. Hammen C. S„ Amer. Zool., 9, 309—318, 1969. Metabolism of the oyster.
52. Handler J. S., Preston A. S., Orloff J., J. Biol. Chem., 244, 3194—3199, 1969. Aldosterone and glycolysis in the toad urinary bladder.
53. Hanson R. W., Ballard F. J., Biochem. J., 108, 705—713, 1968. The metabolic fate of the products of citrate cleavage in ruminants and nonruminants.
54. Hayward J. S., Ball E. G., Biol. Bull., 131, 94—103, 1966. Brown adipose tissue thermogenesis during arousal from hibernation.
55. Heim T., Hull D., J. PhysioL, 186, 42—55, 1966. Blood flow and oxygen consumption of brown adipose tissue in newborn rabbit.
56. Hers A. G., De Wulf H., Stalmans W., Van der Berghe G., pp. 171—190, in: Advances in Enzyme Regulation, Vol. 8, ed. by G. Weber, Pergamon Press, Oxford, 1970. The control of glycogen synthesis in the liver.
57. Hochachka P. W., pp. 127—203, in: Molecular Mechanisms of Temperature Adaptation, Amer. Assoc. Adv. Sci., Washington D. C., 1967, PubL No 84. Metabolism during temperature compensation.
58. Hochachka P. W., pp. 351—389, in: Fish Physiology, Vol. 1, ed. by W. S. Hoar and D. J. Randall, Academic Press, New York, 1970. Intermediary metabolism in fishes.
59. Hochachka P. W., Biochem. J., 127, 781—793, 1972. Variants of fructose-1,6-di-phosphatase in a marine crustacean.
60. Hochachka P. W., Freed J. M., Somero G. N., Prosser C. L., Int. J. Biochem., 2, 125—130, 1971. Control sites in glycolysis of crustacean muscle.
61. Hochachka P. W., Somero G. N., in: Fish Physiology, Vol. 6, ed. by W. S. Hoar and D. J. Randall, Academic Press, New York, 1971. Biochemical adaptation to the environment.
62. Holmes R. S., Markert C. L., Proc. Nat. Acad. Sci., 64, 205—211, 1969. Immunochemical homologies in trout lactate dehydrogenase isozymes.
63. Horecker B. L., Pontremoli S., Rosen O., Rosen S., Fed. Proc., 25(5), 1521— 1528, 1966. Structure and function in fructose diphosphatase.
64. Ritch R., Philpott C. W., Exp. Cell Res., 55, 17—24, 1969. Repeating particles associated with an electrolyte-transport membrane.
65. Idler D. R., Bitners I., Canad. J. Biochem. Physiol., 36, 739—798, 1958. Cholesterol, fat, protein, and water in the flesh of sockeye salmon.
34*
532
Глава 6
66. Inoue И., Pitot Н. С., рр. 289—296, in: Advances in Enzyme Regulation, Vol. 8, ed. by G. Weber, Pergamon Press, Oxford, 1970. Regulation of synthesis of serine dehydratase isoenzymes.
67. Jackson D. C., J. Appl. Physiol., 24, 503—509, 1968. Metabolic depression and O2 depletion in the diving turtle.
68. Jeuniaux C., Chitine et Chitinolyse, Masson et Cie, Paris, 1963.
69. Joel C. D., J. Biol. Chem., 241, 814—821, 1966. Stimulation of metabolism of rat brown adipose tissue.
70. Jonas R. E. E., Bilinski E., J. Fish. Res. Bd. Canad., 21, 653—656, 1964. Fatty acid oxidation by various tissues from cockeye salmon.
71. Katzen H. M., pp. 335—356, in: Advances in Enzyme Regulation, Vol. 5, ed. by G. Weber, Pergamon Press, Oxford, 1967. Multiple forms of mammalian hexo-kinase and their significance to the action of insulin.
72. Katzen H. M., Soderman D. D., Cirillo V. J., Ann. N. Y. Acad. Sci., 151, 351— 358, 1968. Tissue distribution and physiological significance of multiple forms of hexokinase.
73. Kempner E. S., Miller J. H., Exp. Cell Res., 51, 141—149, 1968. Cellular stratification by centrifuging, Euglena.
74. Kempner E. S., Miller J. H., Exp. Cell Res., 51, 150—156, 1968. Enzyme localization in Euglena.
75. Kennedy E. P., Fed. Proc., 20, 934, 1961. Biosynthesis of complex lipids.
76. Kornacker M. S., Ball E. G., J. Biol. Chem., 243, 1638—1644, 1968. Respiratory processes in brown adipose tissue.
77. Kumar S., Dorsey J. A., Muesing R. A., Porter J. W., J. Biol. Chem., 245, 4732—4744, 1970. Pigeon liver fatty acid synthetase complex and its subunits.
78. Kutty 7И. N., J. Fish. Res. Bd. Canad., 25, 1689—1728, 1968. Respiratory quotients in goldfish and rainbow trout.
79. Lang T. G., Norris K. S., Science N. Y., 151, 588—590, 1965. Swimming speed of a Pacific bottlenose porpoise.
80. Larner J., Villar-Palasi C., Goldberg N. D., Bishop J. S., Huijing F., Wenger J. I., Sasko H., Brown N. B., pp. 409—423, in: Advances in Enzyme Regulation, Vol. 6, ed. by G. Weber, Pergamon Press, Oxford, 1968. Control of transferase phosphatase and transferase I kinase.
81. Lea R. J., Weber G., J. Biol. Chem., 243, 1096—1102, 1968. Inhibition of glycolytic enzymes by free fatty acids.
82. Legherz H. G„ Rutter W. J., Science, 157, 1198—1200, 1967. Glyceraldehy-de-3-phosphate dehydrogenase variants in phyletically diverse organisms.
83. Lee K. L., Reel J. E., Kenney F. T., J. Biol. Chem., 245, 5806—5812, 1970. Regulation of tyrosine a-ketoglutarate transaminase in rat liver.
84. Llorente P., Marco R., Sols A., Europ. J. Biochem., 13, 45—54, 1970. Regulation of liver pyruvate kinase.
85. Lowenstein J. M., pp. 61—86, in: Metabolic Roles of Citrate, ed. by T. W. Goodwin, Academic Press, New York, 1968. Citrate and the conversion of carbohydrate into fat.
86. Lowry О. H., Passonneau J. V., J. Biol. Chem., 239, 31—42, 1964. The relationships between substrates and enzymes of glycolysis in brain.
87. Lynen F., Oesterhelt D„ Schweizer E., Willeckek К., pp. 1—24, in: Cellular Compartmentalization and Control of Fatty Acid Metabolism, ed. by F. C. Gran, Fed. Europ. Biochem. Soc. (Fourth Meeting), Universitetsforlaget, Oslo, 1968. The biosynthesis of fatty acids.
88. Mahler H. R., Cordes E. H., Biological Chemistry, Harper & Row, New York, 1966.
89. Maitra P. K, Ghosh A., Schoener B., Chance B., Biochim. Biophys. Acta, 88, 112—119, 1964. Glycolytic metabolism following electrical activity of Electrophorus.
90. Mansour T. E„ pp. 37—51, in: Advances of Enzyme Regulation, Vol. 8, ed. by G. Weber, Pergamon Press, Oxford, 1970. Properties of phosphofructokinase.
91. Markert C. L., Ann. N. Y. Acad. Sci., 151, 14—40, 1968. The molecular basis for isozymes.
П ром еж уточный обмен: сравнительные аспекты 533
92 Marliss Е., Aoki Т. Т., Felig Р., Pozefsky Т., Cahill G. F., Jr., pp. 3—11, in: ' Advances in Enzyme Regulation, Vol. 8, ed. by G. Weber, Pergamon Press, Oxford, 1970. The regulation of gluconeogenesis in fasting man.
93. Massey B. D., Smith C. L., Comp. Biochem. Physiol., 25, 241—255, 1968. Thyroxine and mitochondrial respiration and phosphorylation in trout.
f 94 Mayer S. E., Namm D. H., Hickenbottom J. P., pp. 215—216 in: Advances of Enzyme Regulation, Vol. 8, ed. by G. Weber, Pergamon Press, Oxford, 1970.
I The phosphorylase activating pathway in intact cardiac and skeletal muscle,
k; 95. Murphy T. A., Wyatt G. R., J. Biol. Chem., 240, 1500—1508, 1965. Glycogen L and trehalose synthesis in silk moth fat body.
96. Mustafa T., Hochachka P. W., J. Biol. Chem., 246, 3196—3203, 1971. Proper-i ties of pyruvate kinases in tissues of a marine bivalve.
97. Newsholme E. A., Crabtree B., Higgins S. G., Thornton S. D., Start C., Biochem. J., 128, 89—97, 1972. Activity of FDPase in flight muscles from bumblebee and its role in heat generation.
98. Newsholme E. A., Gevers W., Vitamins and Hormones, 25, 1—87, 1967. Glycolysis and gluconeogenesis in liver and kidney cortex.
99. Nikkila E. A., Adv. Lipid Res., 7, 63—134, 1970. Control of plasma and liver triglyceride kinetics.
100. Norum K. R., Biochim. Biophys. Acta, 89, 95—108, 1964. Palmityl-CoA: carnitine palmityltransferase. Purification and some properties.
101. Norum K. R., Bremer J., Comp. Biochem. Physiol., 19, 483—487, 1966. The distribution of palmityl CoA: carnitine palmityltransferase in the animal kingdom. > 102. Papadopoulos C. S., Velick S. F., Fed. Proc., 26, 557, 1967. An isozyme of gly-
':> ceraldehyde-3-phosphate dehydrogenase in rabbit liver.
103. Parker J. C., Hoffman J. F., J. Gen. Physiol., 50, 893—916, 1967. Membrane phosphoglycerate kinase in the control of glycolytic rate in human red blood cells.
104. Parvin R„ Dakshinamurti K, J. Biol. Chem., 245, 5773—5778, 1970. Inhibition of gluconeogenetic enzymes.
105. Passano L. M., pp. 473—536, in: Physiology of Crustacea, Vol. I, ed. by T. Waterman, Academic Press, New York, 1960.
i? 106. Pastan I., Perlman R. L., Nature, 229, 25—32, 1971. Cyclic AMP in metabolism.
107. Pogson С. I., Biochem. J., 110, 67—77, 1968. Adipose-tissue pyruvate kinase.
J 108. Prosser C. L., pp. 351—376, in: Molecular Mechanisms of Temperature Adapta-tion, Amer. Assoc. Adv. Sci., Washington, D. C., 1967, Publ. No. 84. Tempera-‘ ture adaptation in relation to speciation.
? 109. Ramwell P. W., Shaw J. J., pp. 139—187, in: Recent Progress in Hormone Re-
i search, Vol. 26, ed. by E. B. Astwood, Academic Press, New York, 1970. Biolo-
l gical significance of the prostaglandins.
i 110. Randle P. J., England P. J., Denton R. M., Biochem. J., 117, 677—695, 1970. * The tricarboxylate cycle during acetate utilization in rat heart.
111. Read С. P., pp. 327—357, in: Chemical Zoology, Vol. 2, ed. by M. Florkin and ; В. T. Scheer, Academic Press, New York, 1968. Intermediary metabolism of
j flatworms.
112. Reed N., Fain J. N., pp. 207—224, in: Brown Adipose Tissue, ed. by O. Lindberg, American Elsevier Co., New York, 1970.
= 113. Reel J. L., Lee K. L., Kenney F. T., J. Biol. Chem., 245, 5800—5805, 1970. Re-
gulation of tyrosine a-ketoglutarate transaminase in rat liver.
114. Richards A. H., Hilf R., Fed. Proc., 30, 698, 1971. Glucose-6-phosphate and lactate dehydrogenase isoenzymes in the rat mammary gland.
115. Robin E. D., Vester J. W., Murdaugh H. V., Jr., Millen J. E., J. Cell Comp. Physiol., 63, 287—297, 1964. Anaerobic metabolism in the freshwater turtle.
116. Roots В. I., Comp. Biochem. Physiol., 25, 457—466, 1968. Temperature and phospholipids of goldfish brain.
117. Roots В. I., Johnston P. V., Comp. Biochem. PhysioL, 26, 553—560, 1968. Plasmalogens of the nervous systems and environmental temperature.
118. Rutter W. J., Rajkumar T., Penhoet E., Kochman M., Valentine R., Ann. N. Y. Acad. Sci., 151, 102—117, 1968. Aldolase variants.
534
Глава 6
119. Sacktor В., pp. 267—347, in: Advances in Insect Physiology, Vol. 7, ed. by J. W. L. Beament, J. E. Treherne, and V. B. Wigglesworth, Academic Press, New York, 1970. Control mechanisms in insect flight muscle.
120. Sacktor B., Wormser-Shavit E., J. Biol. Chem., 241, 624—631, 1966. Concentrations of some intermediates in insect flight muscle during flight.
121. Salt R. W., Canad. J. Zool., 37, 59—69, 1959. Role of glycerol in the cold-hardening of Bracon cephi.
122. Salt R. W., Ann. Rev. Entomol., 6, 55—74, 1961. Principles of insect coldhardiness.
123. Saz H. J., Amer. Zool., 11, 125—135, 1971, Facultative anaerobiosis in invertebrates: pathways and control systems.
124. Saz H. J., Lescure O. L., Comp. Biochem. PhysioL, 22, 15—28, 1967. Gluconeogenesis, fructose-1,6-diphosphatase and phosphoenolpyruvate carboxykinase activities of Ascaris lumbricoides adult muscle and larvae.
125. Saz H. J., Lescure O. L„ Comp. Biochem. PhysioL, 30, 49—60, 1969. Functions of phosphoenolpyruvate carboxykinase and malic enzyme in anaerobic formation of succinate in Ascaris.
126. Schimke R. T., Grossbard L., Ann. N. Y. Acad. Sci., 151, 332—350, 1968. Studies on isozymes of hexokinase in animal tissues.
127. Scrutton M. C., Utter M. F., Ann. Rev. Biochem., 37, 249—302, 1968. Regulation of glycolysis and gluconeogenesis in animal tissues.
128. Seubert W., Henning H. V., Schoner W., et al., Adv. Enz. Res., 6, 153—187, 1968. Effect of cortisol on levels of metabolites and enzymes controlling glucose production from pyruvate.
129. Smith R. E., Horowitz B. A., PhysioL Rev., 49, 330—425, 1969. Brown fat and thermogenesis.
130. Smith R. E., Roberts J. C., Amer. J. PhysioL, 206, 143—148, 1964. Thermogenesis of brown adipose tissue in cold acclimated rats.
131. Somero G. N., Biochem. J., 114, 237—241, 1969. Pyruvate kinase variants of Alaskan king crab.
132. Spencer A., Corman L., Lowenstein J. M., Biochem. J., 93, 378—388, 1964. Citrate and the conversion of carbohydrate to fat.
133. Stadtman E. R„ Ann. N. Y. Acad. Sci., 151, 516—530, 1968. Multiple enzymes in branched metabolic pathways.
134. Steen J. B., Acta Physiol. Scand., 59, 221—241, 1963. The physiology of the swimbladder of the eel.
135. Tanaka T., Harano Y., Sue F., Morimura H„ J. Biochem. (Japan), 62, 71—87, 1967. Two types of pyruvate kinase from rat tissues.
136. Tanno K., Low Temp. Sci. Ser. B., 20, 25—34, 1962. Glycerol and frost resistance in carpenter ant.
137. Tarr H. L. A., in: Fish in Research, ed. by O. W. Neuhaus and J. E. Halver, Academic Press, New York and London, 1969.
138. Tashima L., Cahill G. F., pp. 55—58, in: Handbook of Physiology, Sec. 5, Amer. PhysioL Soc., Washington D. C., 1965. Fat metabolism in fish.
139. Threadgold L. T., Houston A. H., Exp. Cell Res., 34, 1—23, 1964. The chloride cell of Salmo salar L.
140. Tietz A., J. Lipid Res., 3, 421—426, 1962. Fat transport in the locust.
141. Tietz A., pp. 45—54, in: Handbook of Physiology, Sec. 5. Amer. PhysioL Soc., Washington D.C., 1965. Metabolic pathways in the insect fat body.
142. Tietz A., Popjack G., Biochem. J., 60, 155—165, 1955. Coenzyme A dependent reactions in mammary gland.
143. Topper У. J., pp. 287—308, in: Recent progress in Hormone Research, Vol. 26, ed. by E. B. Astwood, Academic Press, New York, 1970. Multiple hormone interactions in the development of mammary gland in vitro.
144. Trivedi B., Danforth W. H., J. BioL Chem., 241, 4110—4114, 1966. pH and frog muscle phosphofructokinase.
145. Trump B. F., Duttera S. M., Byrne W. L., Arstila A. U., Proc. Nat. Acad. Sci., 66, 433—440, 1970. Lipid-protein interactions in microsomal membranes.
Промежуточный обмен: сравнительные аспекты 535
146. Tucker V. A., Amer. Zool., И, 115—124, 1971. Flight energetics in birds.
147’ Tarkington R. W., Brew K., Vanaman T. C., Hill R. L„ J. Biol. Chem., 243, ’ 3382—3387, 1968. Control of lactose synthetase in the developing mouse mammary gland.
148. Tarkington R. W„ Hill R. L„ Science, 163, 1458—1460, 1969. Lactose synthe-tase
149. Umbarger H. E„ Ann. Rev. Biochem., 38, 323—370, 1969. Regulation of amine acid metabolism.
150. Van Baalen J., Gurin S„ J. Biol. Chem., 205, 303—308, 1953. Cofactor requirements for lipogenesis.
151. Vaughan H., Newsholme E. A., Biochem. J., 114, 81—82, 1969. Calcium ions and the activities of hexokinase phosphofructokinase and fructose-1,6-diphospha-tase
152. Vesell E. S., Pool P. E., Proc. Nat. Acad. Sci., 55, 756—762, 1966. Lactate and pyruvate concentrations in exercised ischemic canine muscle.
153. Von Brand T., Biochemistry of Parasites, Academic Press, New York, 1966.
154. Wald G., Proc. Nat. Acad. Sci., 52, 595—611, 1964. The origin of life.
155. Watson J. A., Lowenstein J. M., J. Biol. Chem., 245, 5993—6002, 1970. Citrate and the conversion of carbohydrate into fat.
156. Weber G., pp. 15—40, in: Advances in Enzyme Regulation, Vol. 7, ed. by G. Weber, Pergamon Press, Oxford, 1969. Regulation of pyruvate kinase.
157. Weber G., Lea M. A., Convery H. J. et al., pp. 257—300, in: Advances in Enzyme Regulation, Vol. 5, ed. by G. Weber, Pergamon Press, Oxford, 1967. Regulation of gluconeogenesis and glycolysis.
158. Weber G., Singhal R. L., Srivastava S. K., pp. 43—75, in: Advances in Enzyme Regulation, Vol. 3, ed. by G. Weber, Pergamon Press, Oxford, 1965. Regulation of biosynthesis of hepatic gluconeogenetic enzymes.
159. Weber G., Singhal R. L., Stamm N. B., Lea M. A., Fisher E. A., pp. 59—81, in: Advances in Enzyme Regulation, Vol. 4, ed. by G. Weber, Pergamon Press, Oxford, 1966. Synchronous behavior pattern of key glycolytic enzymes.
160. Weiss-Fogh T., pp. 143—159, in: Insect Physiology, ed. by J. W. J. Beament and J. E. Treherne, Academic Press, London, 1968. Metabolism and weight economy in migrating animals.
161. Whitt G. S., Science, 166, 1156—1158, 1969. Homology of lactate dehydrogenase genes.
162. Whitt G. S., Arch. Biochem. Biophys., 138, 352—352, 1970. Directed assembly, of polypeptides of the isozymes of lactate dehydrogenase.
163. Williamson J. R„ J. Biol. Chem., 240, 2308—2321, 1965. Inhibition of glycolysis in the isolated, perfused rat heart.
164. Williamson J. R., J. Biol. Chem., 245, 2043—2050, 1970. Control of energy metabolism in hamster brown adipose tissue.
165. Williamson J. R., Browning E. T., -Olson M. S., pp. 67—100, in: Advances in Enzyme Regulation, Vol. 6, ed. by G. Weber, Pergamon Press, Oxford, 1968. Fatty acid oxidation and gluconeogenesis in perfused rat liver.
166. Williamson J. R., Cheung W. У., Coles H. S., Herczeg B. E., J. Biol. Chem., 242, 5112—5118, 1967. Glycolytic intermediate changes in the main organ of Electrophorus electricus.
167. Williamson J. R., Scholz R., Browning E. T., J. Biol. Chem., 244, 4617—4627, 1969. Interactions between fatty acid oxidation and the citric acid cycle in perfused rat liver.
168. Wilson G., Rose S. P., Fox C. F., Biochim. Biophys. Res. Comm., 38, 617—623, 1970. Membrane lipid unsaturation and glycoside transport.
169. Wyatt G. R., pp. 287—360, in: Advances in Insect Physiology, Vol. 4, ed. by J. W. L. Beament, J. E. Treherne and V. B. Wigglesworth, Academic Press, New York, 1967. The biochemistry of sugars and polysaccharides in insects.
170. Wyatt G. R., Meyer W. L., J. Gen. Physiol., 42, 1005—1011, 1959. The chemistry of insect hemolymph: glycerol.
171. Young J. W„ Shrago E., Lardy H. A., Biochemistry, 3, 1687—1692, 1964. Enzymes involved in lipogenesis and gluconeogenesis.
Глава 7
Выделение продуктов азотистого обмена
Дж. У. КЕМПБЕЛЛ
Введение
Основные, ставшие классическими представления о конечных продуктах азотистого обмена сложились в начале 30-х годов нынешнего столетия. Сравнительные аспекты этого вопроса вполне доступно изложены Э. Болдуином в его книге «Ап Introduction to Comparative Biochemistry», впервые опубликованной в 1937 г. Суть этих представлений вкратце сводилась к тому, что в норме животные поглощают с пищей такое количество белка, которое превышает потребности в аминокислотах для синтеза нового белка с целью поддержания белкового круговорота в организме. При окислении углеродных скелетов этих аминокислот (катаболизм углерода) вначале в виде аммиака отщепляются «-аминогруппы (азотистый катаболизм). Поскольку аммиак, как правило, ядовит для животных, он должен выводиться из организма в форме какого-либо конечного продукта. К трем основным конечным продуктам азотистого катаболизма у животных относятся собственно аммиак (обычно в виде аммонийного иона), мочевина и мочевая кислота. В зависимости от того, в какой из этих трех форм животные преимущественно выделяют азот, их называют соответственно ам-мониотелическими, уреотелическими и урикотелическими1. Обычно в выделениях животных содержатся все три конечных продукта, а также другие азотистые соединения, классификация же основана на том конечном продукте, который составляет 50% и более общего выделяемого азота. Как показано в табл. 7-1, не всех животных можно точно причислить к той или иной категории, поскольку некоторые из них обладают смешанным типом выделения азотистых продуктов, причем вид преобладающего конечного продукта зависит от специфических физиологических условий.
Следует упомянуть еще об одном существенном моменте, связанном с выделением продуктов азотистого обмена и заключающемся в том, что природа основного конечного продукта зависит
1 Более общим термином—пуринотелические—называют и тех животных, которые выделяют преимущественно мочевую кислоту, и тех, которые выделяют какой-либо другой пурин, такой, как гуанин (например, гуанотелические паукообраз-
Выделение продуктов азотистого обмена
537
Таблица 7-1
Общая классификация животных, основанная на главных конечных продуктах их азотистого обмена
Способ выделения азота Главный азотистый конечный продукт Представители
Дммониотелия (в во- NH* Пресноводные и морские беспо-
де) Дммониотелия (на су- NH3 звоночные и костистые рыбы, личинки и постоянно живущие в воде амфибии Наземные равноногие раки
ше) Смешанная аммоии©- NH4 — мочевина Земляные черви, амфибии на он-
и уреотелия Уреотелия Мочевина ределенных стадиях метаморфоза Наземные планарии, взрослые ам-
Смешанная урев- и Мочевина — мочевая фибии, млекопитающие Черепахи и клювоголовые репти-
урикотелия кислота ЛИИ
Урикотелия Мочевая кислота Наземные брюхоногие, наземные
Смешанная аммонио- NH4 — мочевая кисло- насекомые, чешуйчатые рептилии, птицы Крокодилы
и урикотелия Гуанотелия та Гуанин Скорпионы, пауки
от условий существования данного вида. Из табл. 7-1 видно, что водные животные, как правило, принадлежат к аммониотеличе-ским, а наземные — к урео- или пуринотелическим. В основе этой зависимости лежит доступность воды для организма. Водные животные, особенно пресноводные, располагают большим количеством воды и выделяют аммиак в виде иона аммония, который диффундирует в среду. Наземные животные ограничены в воде, и, чтобы аммиак не накапливался в тканях и жидкостях их тела, они должны обезвреживать его, превращая в конечные продукты (мочевину или какой-либо другой), не токсичные для организма..
Очень важная роль в корреляции между конечным продуктом и окружающей средой принадлежит тем условиям, в которых развивается зародыш [187, 195]. Аммиак может быть конечным продуктом у водных животных, поскольку между средой и зародышем происходит относительно свободный прямой обмен через оболочку яйца. Когда обмен между зародышем и средой осуществляется через материнскую систему кровообращения, как, например, у яйцеживородящих и живородящих, то аммиак удаляется из организма в виде мочевины. При развитии в клейдониевых яйцах (т. е. в яйцах, которые относительно независимы от среды, за исключением газообмена) зародыш должен превращать аммиак в какой-либо пурин, обычно мочевую кислоту, поскольку накопление мочевины в таких яйцах создавало бы неблагоприятные осмотические условия для зародыша. Эта проблема разрешается благодаря образо
538
Глава 7
ванию мочевой кислоты, которая вследствие низкой растворимости выпадает в осадок, что делает ее осмотически неактивной. Выведение взрослыми животными в качестве конечного продукта мочевины требует значительного количества воды, так как мочевина хорошо растворима; для выведения же пуринов вода не нужна. Поэтому пуринотелия в основном характерна для видов, которые лучше приспособлены к засушливой среде.
Итак, мы изложили классические положения, касающиеся конечных продуктов азотистого обмена. Далее в этой главе мы попытаемся, насколько это возможно, более подробно рассмотреть отмеченные выше положения и их интерпретацию с позиций современных знаний о клеточном обмене веществ, его организации и регуляции.
Образование аммиака; катаболизм аминокислот
Поступившие с пищей белки гидролизуются в пищеварительном тракте до составляющих их аминокислот с помощью протеолитических ферментов (см. гл. 4). Эти аминокислоты концентрируются в результате деятельности кишечного эпителия [11] и поступают в систему воротной вены, следуя далее в печень, а затем в другие ткани. У млекопитающих аминокислоты активно накапливаются в клетках печени [50], где подвергаются катаболизму [109, 231]. К основным ферментам, участвующих в азотистом катаболизме аминокислот, относятся трансаминазы, глутаматдегидрогеназа, специфические дезаминазы и оксидазы аминокислот.
Ферменты катаболизма аминокислот
Переаминирование. Большинство аминокислот, входящих обычно в состав белка, подвергается реакциям переаминирования. Реакция 1, которая катализируется глутамат-пируват-трансаминазой (К.Ф. 2.6.1.2, L-аланин: 2-оксоглутарат—аминотрансфераза)1, иллюстрирует перенос а-аминогруппы в типичной реакции переаминирования:
(1) сн.—сн—соо- + -оос—сн2сн2—с—соо-
I И
NH.+ О
Z - аланин ес-Кепюглутпсграт
-оос—сн2сн2—сн—соо- + сн3—с—соо-
NH»+ о
L-глутамат пируват
1 Номер и систематическое название ферментов утверждены Комиссией по ферментам Международного биохимического союза. Полный список систематической номенклатуры для всех ферментов, обсуждаемых в этой главе, дается в «Общей биохимии» '(Comprehensive Biochemistry), т. 13, под редакцией М. Флор-кина и Е. Штотаа, изд-во Эльзевир, Амстердам, Д9(64.
Выделение продуктов азотистого обмена 539
Производные витамина В6 (пиридоксальфосфат или пиридокс-аминфосфат) служат кофакторами для трансаминаз. Обычно высо-коочищенные ферменты специфичны по отношению к своим субстратам. Однако в большинстве неочищенных препаратов тканей все основные аминокислоты, кроме серина и треонина, подвергаются переаминированию [239]. В клетках млекопитающих трансаминазы локализуются как в растворимой клеточной фракции (цитозоле), так и в митохондриях [302]. В процессе глюконеогенеза (образования глюкозы из неуглеродных предшественников), который возникает при поступлении в организм большого количества белка с пищей, при экспериментальном диабете или под влиянием гормонов активность цитоплазматических изоферментов глутамат-пируват- и глутамат-оксалоацетат-трансаминаз заметно увеличивается [136, 284], что говорит об их главной роли в катаболизме аминокислот. Митохондриальные изоферменты участвуют в образовании глутаминовой кислоты и аланина [30, 196].
Как видно из реакции 1, переаминирование не приводит к высвобождению аммиака, а заключается в переносе аминогруппы на а-кетокислоту. а-Кетоглутаровая кислота служит главной акцепторной кетокислотой, поэтому в процессе переаминирования большинства аминокислот образуется L-глутаминовая кислота. Отщепление а-аминогруппы от глутаминовой кислоты в виде аммиака осуществляется в реакции окислительного дезаминирования этой аминокислоты при участии фермента глутаматдегидрогеназы.
Глутаматдегидрогеназа. Глутаматдегидрогеназа катализирует реакцию
(2) “000—СНгСНг—СН—СОО" +)
NHJ
'^Глутамат Окисленный кофактор
-ООС— СН2СН2— С— СОО- + ЫЩ + НАД-Н(НАДФ‘Н)+ Н+
о tt-Кетпоглутарат " Зосстауобленный кофактор
Этот фермент был выделен и очищен из тканей ряда животных, и его молекулярные и кинетические свойства исследованы довольно подробно [92]. Глутаматдегидрогеназа из печени разных позвоночных, кроме крысы и акулы [144], в результате реакций ассоциации образует высокомолекулярные полимеры, на которые могут воздействовать пуриновые нуклеотиды [93]. В присутствии НАД-Н адениновые нуклеотиды (АДФ, АТФ и т. д.) стимулируют ассоциацию и активируют фермент. Гуаниновые же нуклеотиды (ГДФ, ГТФ и т. д.) способствуют диссоциации высокомолекулярных комплексов и ингибируют ферментативную активность.
Кофакторами для этих ферментов позвоночных могут служить НАД или НАДФ, причем их эффективность сильно варьирует в
540
Глава 7
зависимости от направления изучаемой реакции и от условий эксперимента. Общая константа равновесия глутаматдегидрогеназной реакции, измеренная in vitro, свидетельствует о том, что равновесие сдвинуто в направлении синтеза глутаминовой кислоты, а не ее дезаминирования [92]. Однако, как будет обсуждаться ниже, функция фермента in vivo по дезаминированию глутаминовой кислоты обусловливается его ассоциацией с другими ферментами.
Цитозоль
Аминокислота
jc-Кетокислота
ос- кетоглутарат
Трансаминаза
глутамат
а- Кетоглутарат + NH
Митохондрия
^Глутамат
Глутаматдегидрогеназа
НАДР
НАД*
Рис. 7-1. Функции трансаминаз и глутаматдегидрогеназы в высвобождении а-аминогрупп путем трансдезаминирования.
Трансдезаминирование. Предположение о том, что окисление аминокислот сопровождается отщеплением аммиака в результате совместного действия трансаминаз и глутаматдегидрогеназы, было впервые высказано Браунштейном и Бычковым [26]. Механизм этого процесса представлен на рис. 7-1. Одним из свидетельств трансдезаминирования, полученных в экспериментах, служит тот факт, что для окисления аминокислот бесклеточными препаратами печени и почки уреотелических и урикотелических позвоночных необходимо присутствие а-кетокислот [8]. Кроме того, скорости переаминирования большинства аминокислот с а-кетоглутаровой кислотой в срезах почки и печени млекопитающих также соответствуют скоростям их дезаминирования [236].
Отдельные аминокислоты могут вначале вступать в реакции переаминирования с пировиноградной кислотой, образуя аланин, который затем переаминируется с а-кетоглутаровой кислотой и образует глутаминовую кислоту, подвергающуюся в свою очередь дезаминированию [237]. Еще более убедительное доказательство трансдезаминирования аланина было получено в экспериментах с перфузируемыми печеночными системами млекопитающих.
Хотя на рис. 7-1 изображены процессы переаминирования лишь в цитоплазме, митохондриальные изоферменты трансаминаз также проявляют соответствующую активность. Однако глутаматдегидрогеназа локализуется только в митохондриях [10], и поэтом)7
Выделение продуктов азотистого обмена
541
высвобождение аммиака в результате трансдезаминирования аминокислот считается внутримитохондриальным процессом.
Специфические реакции дезаминирования. Серин и треонин обычно не переаминируются в тканях животных. Обе эти оксиаминокислоты дезаминируются особым ферментом или ферментами, которые относятся к дегидратазам, потому что, как показано в реакции 3, вначале они отщепляют воду.
(3) Н2С—СН—СОО" н2о + нс=с—СОО- — Н3С—С—СОО“ + NH?
i ! I II
НО NH> NH/ о
L-серин Яромежцтоитш Ггариват •
продукт
Треонин подвергается такой же реакции дезаминирования. Оба фермента, по-видимому, локализованы в цитоплазме клеток печени млекопитающих [205], и высвобождение аммиака с их помощью можно считать внемитохондриальным процессом. Простетическая группа этих ферментов, как и в случае трансаминаз, представлена витамином В6.
Оксидазы аминокислот. Оксидазы L-аминокислот катализируют непосредственное образование аммиака из нескольких аминокислот (реакция 4).
(4) R—сн—соо- +ФЛД + ’ о2 -
NH3+ \
L-aMWOMicflomi окисленный флавопротеиа
R—С—СОО- +ФЛД-Н2 + NH +
сс^Кетокис- Восстановленный лота флабопротпеид
При отсутствии каталазы в этой реакции образуется перекись водорода. Однако обычно в печени содержится каталаза, которая быстро разлагает перекись водорода, образующуюся при окислении L-аминокислот. Правда, роль оксидаз L-аминокислот в катаболизме аминокислот, протекающем в печени млекопитающих, до конца еще не выяснена, но эти флавопротеиды функционируют в почках и печени других животных, помимо млекопитающих.
Оксидаза L-аминокислот была выделена в кристаллическом виде из митохондрий почек млекопитающих [183]. Обнаружена она также в тканях рептилий [325] и в печени птиц [24, 279]. В последнем случае активность этого фермента связана с микросомной фракцией [279]. Полагают, что в большинстве тканей оксидаза D-аминокислот и другие ферменты, образующие перекись, содержатся в пероксисомах вместе с каталазой. Возможно, это справедливо и для отдельных оксидаз L-аминокислот почек млекопитающих [67а].
542
Глава 7
Сравнительные аспекты катаболизма аминокислот
Трансаминазы встречаются у всех видов животных и во всех тканях, но это еще не означает, что они функционируют обязательно совместно с глутаматдегидрогеназой, отщепляя аммиак в процессе катаболизма аминокислот; действительно, в ряде случаев отсутствуют доказательства такого совместного действия. Поскольку константы равновесия большинства катализируемых ферментами реакций переаминирования почти одинаковы, эти ферменты с равным успехом функционируют в направлении синтеза любой из двух аминокислот в зависимости от концентраций компонентов реакции в клетке. В опытах с перфузируемой печенью млекопитающих показано [141], что аминокислоты, синтезируемые в печени в реакциях переаминирования, могут поступать в кровь, а затем в другие ткани. Функция глутаматдегидрогеназы в трансдезаминировании заключается в удалении одного из продуктов реакции переаминирования, поэтому этот фермент можно считать ключевым в освобождении аммиака таким путем.
Трансдезаминирование у позвоночных и беспозвоночных. Этот процесс играет главную роль в катаболизме аминокислот в ткани печени большинства позвоночных, за исключением, по-видимому, отдельных видов рептилий [60, 61]. Глутаматдегидрогеназа была исследована у рыб [58, 93, 168, 303], амфибий [68, 85, 93, 316] и птиц [91, 93]. По некоторым свойствам эти ферменты отличаются друг от друга и от фермента млекопитающих, но все они осуществляют дезаминирование глутаминовой кислоты.
У беспозвоночных животных процесс трансдезаминирования изучен еще слабо. Основные трансаминазы обнаружены у представителей большинства главных типов беспозвоночных, причем было показано, что эти ферменты осуществляют in vivo взаимопревращение аминокислот [38]. При инкубации целых животных или их тканей с такими субстратами, как 14СОг или 14С-глюкоза, 14С включался в аланин, аспарагиновую и глутаминовую кислоты. Глутаматдегидрогеназа исследовалась лишь у нескольких видов беспозвоночных, главным образом членистоногих. Этот фермент обнаружен и у насекомых [64, 166], причем наиболее подробно изучена глутаматдегидрогеназа личинок Drosophila melanogaster 122]. Активация адениновыми и ингибирование гуаниновыми нуклеотидами сближают глутаматдегидрогеназу Drosophila с соответствующим ферментом позвоночных. Исключительно высокая /См этой глутаматдегидрогеназы для аммиака (0,1—0,6 М) свидетельствует о сдвиге равновесия катализируемой реакции в сторону дезаминирования глутаминовой кислоты. В данном случае наиболее эффективным кофактором служит НАД, тогда как НАДФ — более эффективный кофактор в направлении синтеза глутаминовой кислоты. Отмеченные свойства, а также митохондриальная локализация фермента у насекомых позволяют предположить, что у этих
Выделение продуктов азотистого обмена
543
видов он действует совместно с трансаминазами [59], высвобождая аммиак путем трансдезаминирования.
Глутаматдегидрогеназа ракообразных привлекла значительное внимание в связи с ее ролью в осморегуляции. Известно, что концентрация свободных аминокислот у эвригалинных беспозвоночных максимальна в условиях гипертоничности окружающей среды. При переходе к гипотоническим условиям концентрация свободных аминокислот снижается и одновременно увеличивается выделение аммиака [83]. На основании этого полагали, что глутаматдегидрогеназа играет ключевую роль в этой перестройке [88, 251]. В гипертонической среде поглощение кислорода и выделение аммиака идут на низком уровне, что объясняется в соответствии с предложенной гипотезой использованием аммиака, НАД-Н и а-кетоглу-таровой кислоты для синтеза глутаминовой кислоты. В этих условиях высокие концентрации глутаминовой кислоты используются для синтеза других аминокислот с помощью переаминирования. В гипотонической же среде глутаминовая кислота дезаминируется, в результате чего увеличивается выделение аммиака. Наблюдающееся в этих условиях уменьшение концентрации глутаминовой кислоты приводит к уменьшению концентрации других аминокислот, что обусловлено действием трансаминаз. Благодаря доступности НАД-Н и а-кетоглутаровой кислоты в гипотонической среде увеличивается также поглощение кислорода. С рассматриваемой нами гипотезой согласуется сообщение об активации глутаматдегидрогеназы ракообразных катионами Na+ в направлении синтеза глутаминовой кислоты [249, 252]. В этих условиях анионы С1~ также могут участвовать в регуляции активности глутаматдегидрогеназы [47]. По некоторым данным [250] в отсутствие активирующего аденинового нуклеотида глутаматдегидрогеназа жабр колючего лангуста Palinurus vulgaris не дезаминирует глутаминовую кислоту ни с НАД, ни с НАДФ в качестве кофакторов. Однако глутаматдегидрогеназа из мышц краба Carcinus maenus и омара Homarus vulgaris обладает полностью обратимым действием, используя при дезаминировании НАД [47]. То же самое можно сказать и о ферменте сухопутного ракообразного — мокрицы (Qniscus asellus) [115]. Таким образом, трансдезаминирование, по-видимому, свойственно ракообразным, причем у эвригалинных видов оно может, очевидно, играть главную роль в метаболических перестройках.
У дождевого червя Lumbricus terrestris митохондриальная глутаматдегидрогеназа кишечника также дезаминирует глутаминовую кислоту и может, таким образом, функционировать совместно с трансаминазами, присутствующими в этой ткани, в процессах трансдезаминирования [38]. У многощетинковых кольчатых червей глутаматдегидрогеназа [16], вероятнее всего, отсутствует.
Что касается моллюсков, то сейчас еще не ясно, осуществляется ли у них катаболизм аминокислот путем трансдезаминирова-
544
Глава 7
ния. Если у этих животных и имеется глутаматдегидрогеназа, то, по-видимому, она не дезаминирует глутаминовую кислоту [38, 43] и не окисляет в препаратах тканей моллюсков ни глутаминовую кислоту, ни пролин [39]. Окисление пролина обычно зависит от его превращения в глутаминовую кислоту, которая затем подвергается окислительному дезаминированию с помощью глутаматдегидрогеназы. Кроме того, в отличие от неочищенных препаратов трансаминаз позвоночных и членистоногих, проявляющих широкую
Рис. 7-2. Высвобождение а-аминогрупп аминокислот путем совместного действия трансаминаз и пути биосинтеза пуриновых нуклеотидов.
субстратную специфичность, субстратная специфичность трансаминаз у двустворчатых моллюсков Mytilus edulis и Modiolus modiolus ограничена L-аланином, L-аспарагиновой и L-глутаминовой кислотами [218].
Оксидаза L-аминокислот у моллюсков. Активность оксидазы L-аминокислот обнаружена у представителей нескольких типов беспозвоночных, но особенно характерна для тканей моллюсков [39]. Оксидазы L-аминокислот у моллюсков наиболее активно действуют на основные аминокислоты и в этом отношении подобны растворимому ферменту, обнаруженному в печени индюка [24]. Они неактивны в отношении таких аминокислот, как глутаминовая и аспарагиновая, аланин, пролин, изолейцин, глицин, серин и треонин, поэтому их функция в качестве альтернативной по отношению к трансдезаминированию в аминокислотном катаболизме у моллюсков, очевидно, ограничена. Однако сравнительная роль оксидазы L-аминокислот в катаболизме аминокислот у моллюсков критически не оценивалась. Эти ферменты моллюсков обычно связаны с какой-либо определенной клеточной фракцией, хотя у некоторых видов могут присутствовать и в растворимой фракции [100].
Выделение продуктов азотистого обмена
545
Другие источники дезаминирования аминокислот. Дезаминаза адениловой кислоты (АМФ) найдена во многих тканях, и Браун-штейн [25] предположил, что этот фермент может непосредственно участвовать в дезаминировании аминокислот. Модификация предложенной вначале схемы представлена на рис. 7-2. Переами-нирование глутаминовой кислоты со щавелевоуксусной, в результате чего образуется аспарагиновая кислота без высвобождения аммиака, в норме происходит у млекопитающих в митохондриях [196], а главным источником образования аммиака в работающей мышце, как выяснилось, является пуриновый нуклеотидный цикл (рис. 7-2) [155, 155а]. Предполагается, что таким же путем совершается освобождение аммиака у рыб [163] и у многощетинковых кольчатых червей, у которых нет глутаматдегидрогеназы.
Токсичность аммиака
Положение о токсичности аммиака является основным в наших знаниях об* обмене азота у животных. Однако положение это отнюдь не универсально. Устойчивость к аммиаку довольно широко распространена у прокариотов и у низших эукариотов. Например, для культивирования организма, схожего с докембрийским микроископаемым Kakabekia umbellata, необходим газообразный аммиак [264], а мутант плесневого гриба Penicillium notatum проявляет некоторую метаболическую активность при культивировании и жидкости, содержащей аммиак [263]. Исключительная устойчивость к аммиаку, свойственная организмам, подобным Kakabekia, очень интересна, поскольку жизнь могла возникнуть в среде, богатой аммиаком [194]. Сам аммиак (в непротонированной форме, т. е. NH3) ядовит для высших грибов [149]. Хотя большинство растений способно усваивать ион аммония (NH4), его избыток для них также токсичен [211а].
В этом разделе будут рассмотрены некоторые гипотезы, касающиеся механизма токсического действия аммиака на клетки животных, а также результаты сравнительных исследований по токсичности аммиака для животных.
Механизм токсического действия аммиака
Влияние на величину pH. Как известно, величина pH влияет на скорость ферментативных реакций, поэтому можно ожидать, что неконтролируемое высвобождение аммиака в непротонированной форме будет изменять клеточный обмен в результате защелачивания среды в непосредственной близости от места высвобождения NH3. Величина Ка для реакции NH34-H+^NH* равна 5,5-10~10 при 25 °C. При физиологических значениях pH (от 7,0 до 7,4) приблизительно 99 %• молекул аммиака находится в протонированной форме, т. е. в форме NH4. Некоторые ферменты высвобождают 35—1332
546
Глава 7
аммиак в непротонированной форме, которая затем присоединяет протон из окружающей среды, создавая локальное защелачивание. В реакции, катализируемой глутаматдегидрогеназой (реакция 2), протон, очевидно, поставляется участниками реакции, поэтому в данном случае локального защелачивания нет. Следовательно, токсичность аммиака не всегда можно объяснить его непосредственным влиянием на ферментативные реакции путем изменения pH.
Помимо общего влияния на ферментную активность, pH воздействует также на структуру мембран. При щелочных значениях pH, возникающих в результате бесконтрольного высвобождения аммиака, уменьшается стабильность мембран [9]. Величина pH заметно влияет также на поглощение и высвобождение кальция саркоплазматической сетью [182], а это в свою очередь оказывает воздействие на определенные мембранные транспортные системы.
Эффекты, связанные с истощением субстратов. Одна из первых гипотез, с помощью которой пытались объяснить токсичность аммиака, заключалась в том, что увеличение концентрации аммиака внутри митохондрий вызывает обращение глутаматдегидрогеназ-ной реакции, вследствие чего а-кетоглутаровая кислота изымается из цикла трикарбоновых кислот и уменьшается количество НАД-Н, доступного для окисления [13]. В таких условиях повышенная концентрация глутаминовой кислоты должна привести к снижению концентрации клеточного АТФ из-за усиленного превращения глутаминовой кислоты в глутамин через посредство глутаминсин-тетазы:
(5) -оос—сн,сн — сн—соо- + атф+ nh4+ -*
NH3+
L-глутамат
H.N—С—СНгСН —СН—СОО" + АДФ + Фя
О NH3+
I—глутамин
Эта гипотеза проверялась главным образом на мозге млекопитающих, однако результаты проведенных экспериментов оказались сомнительными [119, 262]. Количество а-кетоглутаровой кислоты, измерявшееся в мозгу крыс во время экспериментальной интоксикации аммиаком, было действительно выше, чем в норме, хотя и гораздо меньше, чем предсказывалось; не было значительных изменений и в уровне АТФ. Вместе с тем во время аммиачной интоксикации в цитоплазме наблюдалось увеличение отношения лак-тат/пируват, свидетельствующее о нарушениях окислительного метаболизма, что хорошо согласуется с известным воздействием аммонийных солей на окислительный метаболизм мозга [171].
Выделение продуктов азотистого обмена
547
Воздействие на мембраны. Известно, что соли аммония угнетают активный перенос ионов Na+ в ряде тканей, в том числе в жабрах рыб [162], в различных тканях речного рака [258], в мочевом пузыре жабы [НО] и почках птиц [193]. В этом последнем случае соли аммония подавляют также реабсорбцию ионов С1~, НСОз и воды. В мочевом пузыре жабы подавление солями аммония переноса Na+ в свою очередь подавляет накопление К+ [НО]. Таким образом, ясно, что NH* способен подавлять движение через мембраны ряда биологически важных ионов. Однако основное воздействие на нервную ткань обусловлено, по-видимому, не этим, так как во время экспериментальной интоксикации аммиаком в мозгу млекопитающих не обнаружено каких-либо изменений концентрации ионов Na+ или К+ [241]. Как теперь выяснилось, ион NH* не только препятствует транспорту через мембраны, но и сам может проникать через них [НО]. Ранее считали, что мембраны проницаемы только для непротонированной молекулы NH3 [175].
Активный транспорт ионов, и особенно ионов К+, через митохондриальные мембраны играет решающую роль в энергетическом обмене, протекающем в митохондриях [2Ю]. Следовательно, любое нарушение этих транспортных систем, вызываемое вмешательством иона NH^, будет тем самым нарушать окислительный обмен. Движение ионов Н+ через митохондриальную мембрану играет не менее важную роль, чем движение катионов металлов. Согласно гипотезе Митчелла (см. [212]), градиент ионов Н+ через мембрану митохондрий (или хлоропластов) служит движущей силой процесса фосфорилирования. В ходе окислительного фосфорилирования протоны выходят из митохондрий, а во время фотофосфорилирования они входят в хлоропласты. Соли аммония обладают способностью подавлять фосфорилирование в хлоропластах. В соответствии с одним из предложенных механизмов такого подавления NH3 проникает в хлоропласт и уменьшает протонный градиент, связывая ионы Н+, накопившиеся во время процессов, которые протекают на свету [66]. Митохондрии бычьего сердца набухают в присутствии хлористого аммония и такого ионофора, как валино-мицин1, что свидетельствует о проникновении иона NH4 в этих условиях через мембраны. Внутри митохондрий, где реакция среды щелочная, NH* превращается в NH3, который выходит из митохондрий, создавая таким образом равновесие протонов по обеим сторонам митохондриальной мембраны. В результате исчезает протонный градиент через мембрану, необходимый для нормального протекания реакций фосфорилирования [28]. В этой системе влияние ионов NH* перекрывается влиянием ионов К+, поскольку катионы обладают большим сродством к ионофору. Таким обра
1 Одно из циклических соединений, облегчающее перенос катионов [210] через мембраны.
35*
548
Глава 7
зом, вытеснение NH* ионами К+ позволяет восстановить протонный градиент. Выделение естественного ионофора из митохондрий бычьего сердца [20] указывает на вполне возможное соответствие результатов, полученных in vitro, реальной ситуации in vivo. В любом случае система NH*/NH3 влияет на транспорт катионов внутрь митохондрий, и это может оказаться весьма важным фактом для понимания универсального механизма токсического действия аммиака на клетки животных. Сейчас еще нет возможности обрисовать такой механизм, поскольку токсическое действие аммиака может слагаться из одного или нескольких влияний системы NH4/NH3, которые уже обсуждались. Токсичность аммиака для высших животных неоднократно вновь демонстрировалась и в исследованиях на целых животных.
Сравнительные аспекты токсичности аммиака
Устойчивость к аммиаку во внешней среде. Способность млекопитающих выживать при различных концентрациях аммиака в атмосфере показана в табл. 7-2.
Таблица 7-2
Токсичность аммиака для млекопитающих [283]
Вид Максимальное время жизни, мин
при содержании аммиака в атмосфере, млн—1
500 1000 3000 5000 7000 10 000
Человек 60 — — -—
Лабораторная мышь — 960 180 20 —— -—
Лабораторная крыса — 960 — 40 — —
Летучие мыши
Myotis californicus — 540 60 —- —
M. lucifugus — .— — — 45 —
Eptesicus fuscus — .— ——— — 120 20
Tadarida brasiliensis — — — >5760 180 20
У млекопитающих первые симптомы отравления при токсических уровнях аммиака в атмосфере обычно связаны с повреждением дыхательных мембран. Способность бразильского складчатогуба Tadarida brasiliensis противостоять высоким концентрациям аммиака в атмосфере, по-видимому, связана с тем, что он может нейтрализовать аммиак с помощью слизи и таким образом предотвращать повреждение дыхательных мембран [281]. Такая способность представляет собой адаптивный механизм, поскольку в пещерах, где летом эти зверьки скапливаются в огромных количествах, воздух насыщен аммиаком [176, 280]. Бразильские складчатогубы устойчивы также к высокому содержанию аммиака в крови, которое не вызывает заметных сдвигов pH крови, вероятно,
Выделение продуктов азотистого обмена
549
Б связи с их способностью нейтрализовать избыток аммиака двуокисью углерода, задерживающейся в кровеносной системе [282]. По возвращении в нормальную атмосферу эти летучие мыши «выдыхают» находящийся в легких избыток аммиака вместе с углекислым газом [280]. Большинство млекопитающих гораздо менее устойчивы к наличию аммиака в атмосфере, чем бразильские складчатогубы, и в некоторых случаях даже при низких его концентрациях в атмосфере гибнут уже через несколько минут.
Рыбы особенно плохо переносят растворенный аммиак. По дан ным Скотта [272], вода, в которой выращивают рыб и других вод пых животных, должна содержать не более 0,00001 % аммиака. Подобно аммиаку, находящемуся в атмосфере, растворенный в воде аммиак в первую очередь вызывает повреждение дыхательного эпителия. Токсичность аммиака для рыб определяется величиной pH воды: чем выше ее щелочность, тем больше токсичность аммиака [74]. Это можно объяснить большой проницаемостью не-протонированной формы аммиака, концентрация которого повышается с увеличением щелочности [175]. Гипоксия усиливает токсичность аммиака для рыб [74], что находится в соответствии с общим действием аммиака на окислительный обмен.
Экспериментальное исследование токсичности аммиака; млекопитающие. При экспериментальном исследовании токсичности аммиака для млекопитающих соли аммония вводятся путем инъекции. Токсичность этих солей связана с их непосредственным действием на pH крови; более щелочные соли оказываются более токсичными [306] (табл. 7-3). Предполагается, что это обусловлено повышенным поступлением NHS в мозг через гемато-энцефалический барьер, а также в другие ткани при более щелочных значениях pH [273, 307]. Снижение pH крови у мышей путем вливания нелетучей кислоты (не двуокиси углерода) оказывает защитное действие, поскольку в результате увеличивается количество аммиака, присутствующего в виде NH*, который не проникает через гемато-энцефалический барьер [309]. У млекопитающих основным симптомом отравления аммиаком служит полная потеря сознания, что свидетельствует о действии аммиака главным образом на мозг. (Способность тканей, особенно печени, к обезвреживанию аммиака обычно повышается при экспериментальном отравлении аммиаком.) Это наблюдается и в клинике при таких заболеваниях печени, как цирроз; наступающую в таких случаях потерю сознания принято называть печеночной комой [327]. У млекопитающих, как и у рыб, гипоксия увеличивает токсичность солей аммония [308] (табл. 7-3).
Сравнительные исследования токсичности аммиака у позвоночных. Как показано в табл. 7-3, по устойчивости к экзогенным солям аммония птицы (урикотелический тип) сходны с млекопитающими (уреотелический тип). И те и другие переносят более высокие дозы солей аммония при введении их внутрибрюшинно, а не
550
Глава 7
Таблица 7-3
Токсичность аммиака для позвоночных, определенная в эксперименте
Доза, мМ на 1 кг веса тела
Вид Соединение аммония Способ введения LD99,9*
Мышь [306] Мышь [308] Мышь [318] Цыпленок [318] Форель [317] Сом [317] Серебряный карась [317] Хлорид Ацетат Бикарбонат Карбонат Гидроокись . Ацетат » » » » » Внутривенно » » Внутрибрюшинно Внутривенно Внутрибрюшинно » » » 7,0 6,9 5,3 4,6 2,6 6,8 (в 21%-ном О2) 2,9 (в 9-%-ном °2) 5,6 10,8 2,7 10,4 17,7 25,7 29,5 7,7 18,0 4,9 26,2 40,7 41,0 76,0
*)Доза, при которой 50 и 99,9% животных погибает в условиях, описанных в указанных работах.
внутривенно, так как в первом случае аммиак всасывается, попадает в систему воротной вены и обезвреживается при первом же прохождении через печень. У высших позвоночных смерть от отравления аммиаком связана с нарушением сердечной деятельности. У экспериментальных животных сразу же после введения токсических доз аммиака наблюдаются отклонения на электрокардиограмме [318, 319]; такие же отклонения отмечаются в клинике перед возникновением печеночной комы [327]. Нарушение сердечной деятельности, вероятно, обусловлено наблюдаемым изменением pH, которое влияет на обмен кальция в сердечной мышце [182].
У пресноводных рыб устойчивость к экзогенному аммиаку выше, чем у птиц или млекопитающих (табл. 7-3), и это может объясняться аммониотелическим типом их азотистого обмена.
Уровень аммиака в крови. У большинства млекопитающих содержание аммиака в крови незначительно. Например, у человека и собак оно составляет 0,03—0,08 мкмоль/мл [29, 184, 238]. Обычно такой уровень достаточно строго регулируется, однако при определенных патологических состояниях, включая и печеночную кому, он может повышаться. Если у кролика под действием уреазы на мочевину крови образуется эндогенный аммиак, то животное погибает, когда концентрация аммиака достигает 4 мкмоль/мл .'[145]. Вместе с тем при других условиях и более высокие уровни
Выделение продуктов азотистого обмена
551
аммиака не ведут к гибели. При вдыхании аммиака у бразильского складчатогуба его содержание в крови обычно увеличивается примерно до 14 мкмоль/мл [282]. При введении уксуснокислого аммония LD50 для мыши (табл. 7-3) соответствует концентрации более 100 мкмоль/мл, если считать, что объем плазмы у этого вида составляет примерно 50 мл на 1 кг веса. У цыплят средняя концентрация аммиака в плазме составляет около 0,13 мкмоль/мл, но у кур может увеличиваться вдвое и больше во время откладывания яиц [223].
У водных позвоночных содержание аммиака в крови в среднем обычно чуть выше, чем у наземных видов. Для рыб эти величины составляют около 0,2—0,3 мкмоль/мл [71, 103] и могут увеличиваться при введении солей аммония per os [71]. Концентрация аммиака у живущей в воде шпорцевой лягушки Xenopus laevis находится в пределах 0,2—0,5 мкмоль [295].
Токсичность аммиака для беспозвоночных. Систематических исследований по устойчивости беспозвоночных к аммиаку не проводилось, поэтому мы располагаем лишь отрывочными сведениями о действии аммиака на ткани этих животных. Считается, что беспозвоночные в общем более устойчивы к аммиаку, чем позвоночные, однако многие концентрации аммиака в жидкостях тела, переносимые беспозвоночными, находятся в пределах, переносимых по крайней мере некоторыми позвоночными, в том числе и млекопитающими. Вот некоторые из этих величин, выраженных в мкмоль/мл: 7,1 для личинок синей мухи Lucilia cuprina [19]; 2— 6,9 для сухопутного краба Cardisoma guanhumi [98, 121], 1 для морского краба Carcinus maenas [14]; 0,1—0,2 для наземных улиток [289]; 0,2—0,7 для осьминога Octopus dofleini [209] и 0,5—4,4 для некоторых кольчатых червей [186].
Обнаружено, что хлористый аммоний подавляет поглощение кислорода брюшной нервной цепочкой речного рака [88]. Сходное действие хлористый аммоний оказывает и на нервную ткань млекопитающих, о чем мы упоминали выше. Правда, это характерно для нервной системы не всех ракообразных; в частности, соли аммония не подавляют поглощение кислорода нервной тканью омара Homarus vulgaris. По мере того как уменьшается поглощение кислорода нервной цепочкой речного рака под действием иона аммония, можно наблюдать двукратное увеличение синтеза глутаминовой кислоты, указывающее на использование а-кетоглутаровой кислоты и НАД-Н. В нервной ткани омара подобное увеличение синтеза глутаминовой кислоты в присутствии NH* не отмечено. У моллюсков аммиак также, вероятно, не вызывает использования ct-кетоглутаровой кислоты и НАД-Н вследствие очень слабой активности глутаматдегидрогеназы в этой ткани [228].
В процессе развития насекомого диапауза представляет собой своего рода «спячку», характеризующуюся низким уровнем окислительного обмена. Соли аммония обнаруживают любопытный эф
552
Глава 7
фект, вызывая окончание диапаузы, причем, как удалось выяснить, этот эффект специфичен именно для иона аммония. Во время нормальной диапаузы отношение НАД-Н/НАД, по-видимому, довольно высоко, а введение солей аммония снижает это отношение, поскольку НАД-Н может использоваться для синтеза глутаминовой кислоты, катализируемого глутаматдегидрогеназой. Такое влияние иона аммония на диапаузу можно объяснить еще и тем, что высокие концентрации этого иона стимулируют синтез глутамина глутаминсинтетазой (реакция 5). Действительно, во время нормальной диапаузы содержание свободного глутамина увеличивается, и то же самое наблюдается после введения солей аммония. Следовательно, образование L-глутамина может быть одним из решающих процессов, приводящих к окончанию диапаузы [160].
Пути детоксикации аммиака
Существуют два основных метаболических пути обезвреживания аммиака, высвобождающегося при катаболизме аминокислот: цикл мочевины, впервые расшифрованный в печени млекопитающих, и цикл мочевой кислоты, впервые изученный в печени птиц. Кроме того, в тех тканях, где нет ни цикла мочевины, ни цикла мочевой кислоты, главным механизмом детоксикации может служить синтез глутамина. У аммониотелических видов, не имеющих, по-видимому, каких-либо клеточных механизмов детоксикации аммиака, синтез глутамина также играет важную роль.
Клеточные аспекты
Роль печени у млекопитающих. Механизм детоксикации аммиака в печени млекопитающих схематично представлен па рис. 7-3. Аммиак, отщепляемый под действием глутаматдегидрогеназы, превращается в карбамоилфосфат под действием карбамоилфосфат-синтетазы-1 — митохондриального фермента, обладающего большим сродством к аммиаку [53]. В результате этой реакции происходит удаление аммиака, что, вероятно, способствует процессу дезаминирования глутаминовой кислоты, который in vivo катализирует фермент глутаматдегидрогеназа, тогда как in vitro этот процесс кинетически невыгоден.
Для внутримитохондриального синтеза карбамоилфосфата необходимо наличие АТФ, который образуется здесь же в процессе окислительного обмена веществ [108]. Орнитинтранскарбамилаза (также находящаяся внутри митохондрий) превращает карбамоилфосфат в цитруллин в присутствии L-орнитина. Что же является основным источником орнитина, необходимого для этой реакции? Для синтеза цитруллина [48] митохондрии используют экзогенный орнитин, поглощение которого идет с затратой энергии [96]. Вместе с тем есть факты, которые свидетельствуют о том, что орнитин
Глутамат ^-N H*j
,ЫН2 О=с
чнн2
Моиевина
^^L-орцитпик
Аргиназа
Переаминирование
1-аргинин h
^-Фумарат
1
А спартат (-U Н
Аргининосукцинат-лиаза
Аргининосухци -нат - синтетаза t
X- аргининосукцинат —
АМФ АТФ
5
ъ Е G
Е
I - цитруллин-*?
НАД+ НАД-Н
Глутамат——^-ос-Кетоглутаратп Глутамат- ]
\ Дегидрогеназа I
| NH* + НСО"
Карбамоилфосфат ! синтетаза-1
г^<А/-ацетилглута-I мат X.? рруз
Карбамоилфссфат
NH2 о=с/ 0 чо-р-о
ОН
TS с § и
о
§ Е
^*-1-орнитин >
2 А ТФ
Орнитинтранскарбамилаза
I-цитруллин
NH2
0=0
'NH снгсн2сн2сн-соо~
NHj
Рис. 7-3. Детоксикация аммиака, высвобожденного при трансдезаминировании, пу?ем превращения его в мочевину.
554
Глава 7
может синтезироваться в митохондриях из глутаминовой кислоты под действием орнитин-6-трансаминазы [299]. Было высказана предположение, что активность карбамоилфосфатсинтетазы-I, а значит, и скорость биосинтеза мочевины регулируются in viva А-ацетил-Б-глутаминовой кислотой [259, 260], представляющей собой промежуточный продукт в цикле биосинтеза орнитина; этот цикл обнаружен у микроорганизмов, и, по-видимому, именно за счет него, а не в результате участия орнитин-6-трансаминазы в митохондриях осуществляется синтез орнитина. Если бы это было так, то данный цикл служил бы регуляторным механизмом, связывающим синтез карбамоилфосфата с синтезом орнитина. Синтезируемый внутри митохондрий цитруллин выходит в цитоплазму, где под действием аргининосукцинат-синтетазы и аргининосукци-нат-лиазы превращается в аргинин. В этом превращении, происходящем в цитоплазме, участвует a-аминогруппа аспарагиновой кислоты. Аспарагиновая кислота может образоваться либо в митохондриях, либо в цитоплазме в результате реакций переаминирования, в которых щавелевоуксусная кислота служит акцепторной «-кето-кислотой. Углеродный скелет щавелевоуксусной кислоты высвобождается в виде фумаровой кислоты при образовании аргинина из цитруллина. Фумаровая кислота может вновь превращаться в аспарагиновую кислоту в реакциях цикла трикарбоновых кислот, функционирующего в митохондриях. Аргинин, образовавшийся в цитоплазме, превращается аргиназой в мочевину; при этом регенерируется орнитин, и цикл мочевины завершается. Гринштейн с сотр. [320] и другие авторы [114, 313] показали, что введенный млекопитающим аргинин защищает их от интоксикации аммиаком, вызванной либо высоким содержанием аминокислот, либо инъецированными солями аммония. Защитным действием против солей аммония обладает также смесь L-орнитина и L-аспарагиновой кислоты [240]. Защитное действие этих промежуточных соединений объясняется тем, что они стимулируют функционирование цикла мочевины, обезвреживающего аммиак.
Роль печени у птиц. Процесс биосинтеза пуринового кольца был выяснен Бахананом и сотр. [35] в пятидесятых годах на препаратах печени голубя. Обзор более поздней литературы, касающийся этой метаболической цепи, сделан Гартманом [116]. Обезвреживание аммиака посредством образования мочевой кислоты представляет собой уже старую и хорошо известную в сравнительной биохимии концепцию, тем не менее о деталях этого механизма известно гораздо меньше, чем о деталях образованиях мочевины. Наиболее прямое включение аммиака в пуриновый цикл осуществляется через L-глутамин, амидный азот (N) которого становится азотом в 3-м и 9-м положениях пуринового кольца. Другие атомы азота пуринового кольца происходят из глицина (N-7) и аспарагиновой кислоты (N-1) (рис. 7-4). Растворимая фракция из клеток печени птиц способна включать все эти предшественники азота в пурино-
%
Глутаминсин-тетаза
NH^
'ФАТФ
>АДФ
L-глутамин
NH2
. Ъ-СН9СН2СН-С0СГ " 1 .
О NH3+
а -Кетоглутарат
НАД+ ^Глутамат —
Глутамат (-NHjj
, ко
Инозин—^-Гипоксантин —^-Ксантин
О
Н
N.
о 5=0
Риёозофосфат
Инозиновая кислота
HNi
I O^N
I н
Аминоимидазол-N-сукцинокарбокс-амид-рибонуклеотид (Ы-О^-7^-Ъ,Л1-1)
АДФъ 1 АминоимиВазол-А/-сукцинокарбокс-амив рибонуклеотид-синтетаза
А ТФ у 4—Аспартпат( -N Н
Рибонуклеотид аминоимидазолкарбоновой кислоты
I' _ Переаминирование
амиВ рибонуклеотйд-синтетаза
АДФ^'
.Tai Формилглицинамидин-А 14-' тiHnninenanmijH
Мочевая кислота
КО
---------L-глутамин
Фоссрорибозилпи-росроссрагп
ФРПФ-амидотрансфе-1' раза
Фосфорибозиламин (n~9)
АТФ
АДФ^
Глицинамидрибонуклеотид— синтетаза
)формилглицинамид-рибонуклеотид"
АДФ АТФ
Формилгицинамид-
рибонуклеотид-амидотрансфераза
Рис. 7-4. Детоксикация аммиака, 'отщепляемого при трансдезаминировании, путем превращения его в мочевую кислоту.
ФРПФ — фосфорибозилпирофосфат, ГДГ — глутаматдегидрогеназа, КО — ксантиноксидаза.
556
Глава 7
вое кольцо [267], т. е. мочевая кислота, очевидно, синтезируется главным образом в цитоплазме. Недавно было обнаружено, что у птиц и других урикотелических позвоночных глутаминсинтетаза содержится преимущественно в митохондриях [301]. В противоположность этому в клетках печени млекопитающих данный фермент локализуется в цитоплазме [323]. Следовательно, митохондриальная локализация глутаминсинтетазы у птиц предполагает, что ее функция у этих видов аналогична функции карбамоилфосфатсин-тетазы-I у млекопитающих. Предполагаемый клеточный механизм детоксикации аммиака через синтез мочевой кислоты, согласующийся с изложенной концепцией, показан на рис. 7-4. Отдельные детали этого механизма очень схожи с деталями синтеза мочевины. Аммиак, образующийся в митохондриях под действием глутаматдегидрогеназы, выходит из митохондрий в виде амидного N-глутамина, если образуется мочевая кислота, и в виде уреидно-го N-цитруллина, если образуется мочевина. В обоих механизмах глутаминовая кислота выступает в роли ключевого компонента, поскольку может служить также «остовом» переносчиков для аммиака, которыми являются орнитин при образовании цитруллина или сама глутаминовая кислота при образовании глутамина. Кроме того, в обоих случаях в цитоплазме к конечному продукту добавляется азот а-аминогруппы аспарагиновой кислоты. Как обсуждалось выше, аспарагиновая кислота может образовываться либо в митохондриях (на рис. 7-4 не показано), либо в цитоплазме путем переаминирования глутаминовой или другой аминокислоты со щавелевоуксусной кислотой.
В биосинтезе мочевой кислоты образование инозиимопофосфа-та (инозиновой кислоты) представляет собой образование пуринового кольца. Инозинмонофосфат затем превращается в инозин-нуклеозид при действии б'-нуклеотидазы. Инозин в свою очередь под действием нуклеозидфосфорилазы превращается в гипоксантин. Ксантиноксидаза превращает гипоксантин в. ксантин, а последний— в мочевую кислоту. Имеются две формы ксантиноксидазы: первая — оксидаза — использует в качестве акцептора электронов кислород, а вторая — дегидрогеназа — использует такой акцептор, как НАД. В печени млекопитающих эти две формы могут взаимно превращаться друг в друга [277], а в печени птиц преобладает дегидрогеназная форма [253]. Когда у птиц подавлена активность ксантиноксидазы, то в выделениях начинают преобладать ксантин и гипоксантин, а не мочевая кислота [311].
У млекопитающих, как уже было показано, промежуточные продукты цикла мочевины оказывают защитное действие при экспериментальном отравлении аммиаком; у птиц же [21] подобное защитное действие оказывает глицин, главным образом потому, что он стимулирует биосинтез мочевой кислоты.
Основные клеточные механизмы. Помимо печени, синтез цитруллина для митохондриального обезвреживания аммиака у мле-
Выделение продуктов азотистого обмена
557
Таблица 7-4
Распределение глутаминсинтетазы в тканях крысы [158] и голубя [300]
Ткань Активность фермента, мкмоль глутамина в 1 мин на 1 г ткани при 37° С
в тканях крысы в тканях голубя
Печень 8,8 28,1
Сердце <0,5 13,6
Мозг
Кора 2,3 —
Большие полушария — 11,4
Зрительная доля — 10,4
Мозжечок — 7,5
Почка 2,3 1,3
Селезенка 2,5 5,0
Семенники 2,4 1,9
Сетчатка 6,9 —
Мышцы <0,5 1,5
Желудочно-кишечный тракт
Желудок — 1,5
Мускульный желудок — 1,3
Тонкий кишечник <0,5 7,4
Слепая кишка — 1,1
Толстый кишечник — 2.3
Поджелудочная железа <0,5 8 9
Надпочечники <0,5 —.
Легкие <0,5 1 4
Эритроциты <0,5 *
экспорт
копитающих, по-видимому, может идти еще только в мозгу и тканях кишечника [112, 133]. Быстрое включение экзогенного аммиака в глутамин у млекопитающих [78] позволяет предположить, что глутаминсинтетаза играет во многих тканях основную роль в клеточном механизме обезвреживания аммиака. По этой причине у птиц и млекопитающих данный фермент широко распространен в разных тканях, за исключением печени (табл. 7-4).
В мозгу млекопитающих глутаминсинтетаза содержится в цитоплазме [255]; в различных тканях, кроме печени, глутаминсинтетаза осуществляет главным образом детоксикацию экзогенного аммиака, причем локализация ее в этих тканях неизвестна. У млекопитающих глутамин является основной аминокислотой крови; синтезированный в разных тканях, он переносится в печень, где его амидный азот в конечном счете превращается в азот мочевины. Для этого фермент глутаминаза (реакция 6) отщепляет амидный азот в виде аммиака (процесс идет в митохондриях), который затем превращается в цитруллин [46, 48].
(6) h2n—с—сн2сн2сн—СОО“ -оос—сн2сн2 сн—соо- + nh4+
о NH3+ NH3+
558
Глава 7
Синтез глутамина и его использование в печени для образования мочевины у млекопитающих — очень важные в количественном отношении процессы, поскольку значительная часть продуцируемой ежедневно мочевины вновь проходит через кишечник в виде аммиака. Это обусловлено расщеплением мочевины в просвете кишечника под действием бактериальной уреазы [305, 322]. Аммиак, образующийся таким путем, перед превращением в печени в мочевину почти весь превращается в глутамин [157].
Возможные взаимодействия глутаматдегидрогеназы, глутамин-синтетазы и глутаминазы в регуляции уровня аммиака на клеточном уровне [134] показаны на рис. 7-5.
Рис. 7-5. Общее представление о роли тлутам-атдегидрогеназы (ГДГ), глутамина и глутаминазы в регуляции уровня аммиака в клетке.
Клеточные механизмы у аммониотелических позвоночных. Основной источник аммиака, выделяемого пресноводными и морскими рыбами, — это аммиак крови [71, 103, 199], который образуется, по крайней мере частично, в печени [201, 202] путем трансдезаминирования [127, 168]. Аминокислоты, содержащиеся в крови, также вносят свой вклад в экскретируемый аммиак, но в меньшей степени, чем аммиак крови как таковой [103]. Последний, по-видимому, может быть основным источником аммиака, выделяемого водными амфибиями [86, 296]. Представление о том, что избыток аммиака, образующегося у водных позвоночных в митохондриях клеток печени путем трансдезаминирования, непосредственно диффундирует в кровь для последующего удаления из организма, выдвигает некоторые важные вопросы, касающиеся общей токсичности аммиака и механизмов клеточной детоксикации.
Дело, по-видимому, в данном случае заключается в количественных взаимоотношениях, так как скорости катаболизма аминокислот, а следовательно, и требования к скорости детоксикации аммиака у пойкилотермных позвоночных ниже, чем у гомойотерм-ных. Такая ситуация совершенно очевидна на примере аллигатора, у которого выведение инъецированных аминокислот из крови идет в 14 раз медленнее, чем у крысы [61].
Объяснить аммониотелию у водных животных можно тем, что их водный обмен обеспечивает поддержание низких концентраций аммиака. Однако это справедливо лишь для пресноводных видов,
Выделение продуктов азотистого обмена
559
но совсем неприемлемо для морских видов, перед которыми постоянно стоит проблема обезвоживания в гипертонической внешней среде.
Таким образом, и эта «организменная» концепция не учитывает клеточных механизмов высвобождения аммиака и его детоксикации. У водных животных аммиак выделяется преимущественно внепочечным путем, через жабры, а в некоторых случаях через кожу. Это верно, например, для пресноводных ракообразных [197],
Рис. 7-6. Механизм выделения NHj и НСОз путем ионного обмена у пресноводных животных.
КА — карбоангидраза, катализирующая реакцию НЮ+СО2 у*~Н++НСО .
пресноводных рыб [94, 103, 220], некоторых пресноводных амфибий [2, 72, 86], морских ракообразных [14, 15], головоногих моллюсков [209] и морских рыб [321]. Среди изученных позвоночных только у лягушки Xenopus laevis, для которой вода вторично стала средой обитания, выделение аммиака идет главным образом через почки [5]. Поскольку органы, через которые выделяется аммиак, связаны с осмотической регуляцией, Смит [265] предположил, что выделение аммиака представляет собой часть тех регуляторных процессов, которые участвуют главным образом в поддержании кислотно-щелочного и катионного равновесия; этот взгляд недавно получил существенное подтверждение [161]. У пресноводных видов аммиак выделяется двумя способами. Один из них — простая диффузия, а другой — ионный обмен, как изображено на рис. 7-6.
Посредством такого обмена у пресноводных видов осуществляется поступление ионов Na+ и С1~ из внешней среды, что необходимо для поддержания осмотического равновесия. Поглощение иона
560
Глава 7
Na+ не обязательно сопровождается выделением иона NH^ [257, 258]. В отсутствие NH^hoh Н+ обменивается преимущественно на Na+, в результате чего поддерживается кислотно-щелочное равновесие.
Хотя у большинства водных амфибий в печени имеются все ферменты цикла мочевины, в том числе митохондриальные ферменты для синтеза цитруллина, карбамоилфосфатсинтетаза-I и орнитинтранскарбамилаза [4], основной продукт, который выделяют эти животные, — аммиак, а не мочевина. То же самое можно сказать о морских и пресноводных костистых рыбах [125], которые, как считали раньше, не имеют ферментов цикла мочевины [56, 57]. В связи с тем что некоторые водные позвоночные способны синтезировать мочевину, но не выделяют ее в качестве основного конечного продукта, для них был предложен термин уреогенные [125], для того чтобы отличать их от уреотелических видов, выделяющих главным образом мочевину. Возможное значение происходящего в печени уреогенных животных синтеза мочевины в детоксикации аммиака не известно [191].
Глутаминсинтетаза содержится в печени и других тканях морских и пресноводных позвоночных [159] и, по-видимому, принимает участие в протекающем в печени обезвреживании аммиака. Глутамин поступает из печени в кровь, по крайней мере у некоторых видов [200, 202]. Глутаминаза, которая необходима для высвобождения аммиака из глутамина на периферии (рис. 7-5), имеется в жабрах рыб [163], но отсутствует в коже водных амфибий, у которых этот орган служит главным источником выделения аммиака [86]. У водной лягушки Xenopus глутамин представляет собой предшественник аммиака, содержащегося в моче, а не аммиака вообще [296]. Центральная роль синтеза глутамина в детоксикации аммиака у аммониотелических видов пока еще убедительно не доказана.
Физиологические сдвиги в метаболических путях у млекопитающих и птиц
Глюконеогенез. При голодании и потреблении большого количества белка с пищей, под действием гормона поджелудочной железы глюкагона и коры надпочечников, а также при таких патологических состояниях, как сахарный диабет, происходит усиленный распад аминокислот. В условиях глюконеогенеза основной ответной реакцией ферментных систем, участвующих в детоксикации аммиака, является их адаптация к повышенному содержанию аммиака, образующегося при трансдезаминировании. Во время глюконеогенеза, особенно если он вызван большим потреблением белка, заметно увеличиваются в печени млекопитающих активности трансаминаз [90, 266], глутаматдегидрогеназы [312], глутаминазы [135] и ферментов цикла мочевины [242—244]. Повышенное со
Выделение продуктов азотистого обмена
561
держание ферментов цикла мочевины обеспечивает усиление способности к детоксикации аммиака in vivo, о чем свидетельствует и повышение устойчивости животных, адаптированных к пище, богатой белком, к экспериментальной интоксикации аммиаком [313]. При снижении глюконеогенеза после удаления надпочечников и после введения гормона роста уменьшается активность ферментов цикла мочевины [172].
У птиц во время глюконеогенеза, индуцированного либо большим содержанием белка в пище, либо голоданием, заметно повышается активность глутаминсинтетазы и глутаминфосфорибозилпирофосфат—амидотрансферазы [135], причем последний из этих
Кровь
Глутамин
Клетки
.Моча
Рис. 7-7. Выделение иода аммония почками млекопитающих при метаболическом ацидозе.
Глутамин—
ЫН,-* + NHj
NH3 +
ферментов участвует только в биосинтезе пуринов. У крыс при глюконеогенезе активность этих двух ферментов не меняется, а увеличение их активностей у птиц соответствует их роли в детоксикации аммиака в печени, как показано на рис. 7-4. У птиц [150] и млекопитающих [234], пища которых не содержит белка, снижается активность ксантиноксидазы — конечного фермента в биосинтезе мочевой кислоты; при введении белка в пищу активность этого фермента повышается. У птиц во время голодания ксантиноксида-за сохраняется, но активность ее заметно не увеличивается [150]. Следовательно, у птиц ответная реакция ксантиноксидазы несколько напоминает реакцию аргиназы (конечного фермента биосинтеза мочевины) у млекопитающих [243].
Метаболический ацидоз. В результате суммарной реакции как при синтезе мочевины, так и при синтезе мочевой кислоты образуются ионы Н+, поскольку в этих процессах, либо NH4 , либо —NHs превращаются соответственно в —NH2 или =NH конечных продуктов. Во время метаболического ацидоза интенсивность синтеза мочевины у млекопитающих (и главным образом синтеза мочевой кислоты у птиц) снижается. Снижение синтеза мочевины в печени млекопитающих объясняется уменьшением использования глутами
562
Глава 7
на в этом органе [157]. При метаболическом ацидозе усиливается выделение почками иона аммония, который образуется в основном здесь же под действием митохондриальной глутаминазы на глутамин, поступающий сюда из крови (рис. 7-7). Образующийся в почках аммиак нейтрализует избыток протонов при ацидозе непосредственно с помощью механизма «диффузионной оболочки» [206, 207] или косвенным путем, благодаря своему действию в виде иона аммония на систему обмена катионов в почках [170]. Следовательно, снижение использования глутамина печенью при метаболическом ацидозе обеспечивает превращение этого компонента в почках, где он служит источником образующегося аммиака [106].
Значение путей детоксикации продуктов азотистого обмена в питании
Биосинтез аргинина. Цикл мочевины (обозначаемый нами дальше как цикл аргинина—мочевины), помимо участия в детоксикации аммиака, у уреотелических позвоночных служит источником аргинина, необходимого для синтеза белков [75, 76], а также для таких реакций, как биосинтез фосфагена [186, 304]. Основной функцией этого цикла у микроорганизмов является образование аргинина; такое утверждение основано на зависимости цикла от наличия аргинина [298]. Животные, у которых отсутствует цикл аргинина— мочевины, например птицы [285, 286] и насекомые [224, 225], нуждаются в получении аргинина с пищей. Млекопитающие могут синтезировать аргинин, тем не менее некоторым видам, в том числе крысе [23] и кролику [174], для оптимального роста необходимо получать аргинин с пищей. У крысы в период постнатального развития потребности печени в большей мере удовлетворяются за счет аргинина, поступающего с пищей (экзогенного), чем за счет аргинина, синтезируемого в организме (эндогенного), что находит отражение и в способах включения аргинина из этих двух источников в белок. Отношение скоростей включения экзогенного и эндогенного аргинина составляет около 3 у новорожденных и постепенно уменьшается до 1 у взрослых животных, где для поддержания азотистого равновесия уже не требуется поступления аргинина с пищей [75]. Пока еще не ясно, полностью ли удовлетворяется потребность печени в аргинине у лягушки Rana catesbiana за счет биосинтеза этой аминокислоты, так как отношение включаемого меченого экзогенного аргинина к меченому эндогенному аргинину превышает 1 на протяжении всего жизненного цикла животного [76]. Таким образом, в процессе эволюции некоторых видов позвоночных цикл аргинина—мочевины, по-видимому, постепенно все больше специализировался в печени для обезвреживания аммиака, сохранив лишь незначительную способность к биосинтезу аргинина.
Выделение продуктов азотистого обмена ' 563
Это утверждение справедливо, например, для крысы, но, вероятно, неверно для человека [139].
У млекопитающих печень представляет собой основной орган, где происходит боисинтез мочевины и, следовательно, аргинина. Однако в некоторых других тканях, например в почках [27] и мозгу [216], аргинин может образовываться из цитруллина. Это превращение происходит также у птиц и насекомых, поскольку аргинин в их пище можно заменить L-цитруллином. Недавние работы с перфузируемой печенью млекопитающих показывают, что этот орган снабжает цитруллином другие ткани, особенно почки, для превращения последнего в аргинин и использования его в синтезе белка [77]. Такое взаимодействие органов представляет интерес и в связи с нарушением обмена у человека—цитруллинемией, при которой увеличивается выделение с мочой самого цитруллина и его N-ацетильных производных [278]. Выделение этих компонентов предполагает пониженное использование цитруллина в почках для синтеза аргинина. Аргининосукцинурия представляет собой другое метаболическое нарушение в цикле аргинина—мочевины у человека; при этом способность к синтезу мочевины, по-видимому, не нарушена [314]. В обоих случаях непеченочные ткани, и особенно мозг (поскольку такие нарушения сопровождает умственная отсталость), вероятно, лишены аргинина.
Биосинтез нуклеотидов. Подобно циклу аргинина—мочевины у уреотелических животных, путь биосинтеза пуринов у урикотеличе-ских животных также выполняет экскреторную и питательную функции. Путь биосинтеза пуринов обнаружен и у уреотелических позвоночных, где- в результате функционирования этого пути осуществляется синтез адениновых и гуаниновых нуклеотидов, необходимых для обновления нуклеиновых кислот. Синтез нуклеотидов из инозинмонофосфатов и их последующие превращения изображены на рис. 7-8. У бактерий [188] и млекопитающих [45], где пуриновый путь обеспечивает главным образом пищевые потребности, монофосфаты аденозина и гуанозина служат потенциальными ингибиторами первого фермента этого пути — глутамин-фосфорибо-зилпирофосфат—амидотрансферазы (рис. 7-4). Поскольку рассматриваемый нами путь кончается синтезом именно этих нуклеотидов, наблюдаемый эффект представляет собой ингибирование конечным продуктом. Фермент птиц менее чувствителен к ингибированию аденозинмонофосфатом, чем фермент млекопитающих [135], что свидетельствует о наличии некой модификации в регуляции пуринового пути, благодаря которой он может выполнять свою экскреторную функцию у урикотелических видов. У этих видов инозинмонофосфат синтезируется в значительно большем количестве, чем необходимо для превращения в аденозин- и гуанозинмонофосфаты [81]; избыток инозинмонофосфата соответствует тому количеству, которое образуется в процессе обезвреживания аммиака. Этот избыток превращается в мочевую кислоту в цепи превраще-
564
Глава 7
ний, ответвляющихся от основного пути и называемых «шунтом». Шунт обеспечивается тремя ферментами: 5'-нуклеотидазой, нуклео-зидфосфорилазой и ксантиноксидазой (рис. 7-8). Этот путь функционирует у человека и синтезирует некоторое количество мочевой кислоты, которая выделяется в качестве второстепенного конечного продукта. Считается, что у человека функция шунта не играет заметной роли, однако может быть причиной избыточного синтеза мочевой кислоты при подагре [137, 276].
Нуклеотиды
Нуклеозиды
7
I эк
Свободные основания
Синтез de novo
осцкцихат
ГМФ <
ИМФ.-’Ъ
Адене, и
н
•'-Гипоксантин
Гуанозин < ж Ксантозин I. д} \ di \
X > н
Ксантин -----
п
-----Аденин''
инозин —Аоенозин
Моче&хя кислота
Рис. 7-8. Взаимные превращения нуклеотидов, нуклеозидов и свободных оснований у животных.
«Шунт» показан жирными стрелками, а путь «использования отходов» — пунктирными. ГМФ — гуанозинмонофосфат; К.МФ— ксантинмонофосфат; И МФ — инозинмонофосфат. Ферменты, катализирующие взаимные превращения: а — 5'-нуклеотидаза; б — гуаниндезаминаза (гуаназа); в—аденозиндезаминаза; г — АМФ-дезаминаза; д — нуклеозидфосфорилаза; е — аденин—фосфорибозилтрансфераза; ж — гипоксантин-гуанин—фосфорибозилтрансфераза; з — аденозинкиназа; и — аденилосукцинат-спнтетаза; к — аденилосукцинат-лиаза; л — ИМФ-дегидрогеназа; м. — КМФ-аминаза; н — ксантиноксидаза; о — ГМФ-редуктаза; п — адениндезаминаза (аденаза).
У млекопитающих пурины также синтезируются главным образом в печени, хотя в ограниченном количестве они могут синтезироваться и в других тканях, например в мозгу [124]. Печень поставляет пурины в другие ткани в форме свободных оснований [211]. Подобное снабжение пуринами имеет решающее значение для таких тканей, как кровь, клетки которой (эритроциты) не способны синтезировать пурины de novo [156]. Ферменты аденин: и гипоксантин : гуанин—фосфорибозилтрансферазы обеспечивают использование свободных оснований [181] и составляют так называемый «путь использования отходов» в метаболизме пуринов. Эти ферменты обнаружены в большинстве непеченочных тканей [180]. У человека нарушение обмена веществ, называемое синдромом Леша—Нихана, связано с «путем использования отходов» [254], особенно с гипоксантин : гуанин—фосфорибозилтрансферазой. Этот синдром характеризуется повышенным образованием мочевой кислоты, которое обусловлено, по-видимому, неправильной регуляцией пути биосинтеза пуринов [138, 268].
Выделение продуктов азотистого обмена
565
Эволюция путей детоксикации продуктов азотистого обмена
Происхождение
Образование путей, связанных с питанием. Согласно принятой сейчас гипотезе о происхождении жизни на Земле, первые метаболизирующие системы возникли в среде, которая содержала полный набор питательных веществ, явившихся продуктами предшествовавшей химической эволюции [192]. По мнению Горовица [122] пути обмена веществ стали складываться, когда специфические компоненты этой полноценной в питательном отношении среды — так называемого «первичного бульона» — систематически истощались в результате биологической активности. Эволюция законченной последовательности метаболических реакций шла от ступеней», которые, как сейчас известно, катализируются конечными ферментами пути, до ступеней, катализируемых его начальными ферментами. Такой ход развития был, очевидно, свойствен не всем метаболическим путям, но лишь тем, которые поставляли низкомолекулярные предшественники белков и нуклеиновых кислот, а сейчас представляют собой пути биосинтеза аргинина—мочевины и пуринов. Происхождение пути синтеза аргинина можно себе представить следующим образом: когда в среде, где возникла жизнь, был исчерпан весь аргинин, те метаболизирующие системы, которые' обладали хотя бы ограниченной каталитической активностью для. превращения цитруллина в аргинин, должны были получить селективное преимущество перед системами, не обладавшими такой активностью. Таким же образом, когда был исчерпан весь цитруллин,, отбор стал благоприятствовать тем системам, которые могли образовывать цитруллин из орнитина. Такую же последовательность можно представить себе для установления взаимных превращений, нуклеотидов и, наконец, для самого пути биосинтеза пуринов.
Функция детоксикации. До сих пор еще не обнаружено ни одного случая, когда бы аргининовая часть цикла аргинина—мочевины у животных функционировала исключительно для синтеза, аргинина. Как будет видно дальше при обсуждении низших позвоночных, сам путь синтеза мочевины мог быть первоначально' отобран в связи с тем, что мочевина представляет собой осмотически активный компонент. Тем не менее мы не располагаем реальными фактами, которые позволили бы понять тот механизм,, который привел к использованию этого связанного вначале только с питанием пути для обезвреживания аммиака. Для детоксикации аммиака в первую очередь была необходима карбамоилфосфат-синтетаза с высоким сродством к аммиаку. Позвоночные располагают двумя карбамоилфосфатсинтетазами: ферментом-1, специфичным для цикла аргинина—мочевины, и ферментом-П, специфичным для биосинтеза пиримидинов [132]. Первый является митохондри
566
Глава 7
альным ферментом, 'который использует низкие концентрации аммиака и нуждается в N-ацетил-Ь-глутаминовой кислоте, служащей кофактором. Второй представлен цитоплазматическим ферментом, использующим L-глутамин и не нуждающимся в кофакторе. У некоторых прокариотов имеется только один фермент, использующий глутамин и функционирующий как в биосинтезе аргинина, так и в биосинтезе пиримидинов. На основании структуры субъединиц этого бактериального фермента было высказано предположение, что карбамоилфосфатсинтетаза-П возникла в процессе эволюции путем объединения использующей аммиак карбамоилфосфатсинте-тазы и глутаминазы [294] (оба фермента у высших животных содержатся в митохондриях).
Некоторые беспозвоночные помимо фермента, подобного кар-бамоилфосфатсинтетазе-I, содержат еще один фермент, отличающийся от любой карбамоилфосфатсинтетазы позвоночных. Этот митохондриальный фермент, впервые описанный у наземных улиток [290], а позднее обнаруженный также у наземных планарий и у дождевых червей [291], использует L-глутамин, но в отличие ют карбамоилфосфатсинтетазы-П нуждается в кофакторе, роль которого выполняет N-ацетилглутаминовая кислота. Имеются косвенные данные, свидетельствующие о том, что фермент, очень похожий на фермент беспозвоночных, возможно, содержится и у акуловых рыб [310]. Благодаря уникальной комбинации свойств этот фермент беспозвоночных, по-видимому, мог существовать у каких-то примитивных типов животных и впоследствии превратиться в фермент-П позвоночных, утратив потребность в кофакторе, или в фермент-1 путем изменения сродства к субстрату, в результате чего он приобрел способность вместо глутамина использовать низкие концентрации аммиака.
В эволюции цикла аргинина—мочевины система синтеза цитруллина, частью которой служит карбамоилфосфатсинтетаза, по-видимому, оказалась наиболее лабильной. Эта система отсутствует в клетках у организмов, которые не способны синтезировать аргинин de novo, но могут использовать цитруллин. Такое явление характерно, например, для некоторых простейших [143], насекомых [126, 224, 225], птиц [285, 286], а также для клеток млекопитающих в культуре, когда они претерпевают дедифференцировку [245]. Ограниченное распространение системы синтеза цитруллина в непеченочных тканях млекопитающих говорит о том, что эта система наиболее лабильна и в ходе дифференцировки тканей. Клетки и ткани, неспособные синтезировать цитруллин, могут тем не менее производить карбамоилфосфат для образования пиримидинов [132] -.значит, причина нарушения кроется в отсутствии карбамо-илфосфатсинтетазы-I. Птицы к тому же не синтезируют орнитина [286]. Другой компонент системы синтеза цитруллина — орнитинтранскарбамилаза— также существует по крайней мере в двух формах. Одна из этих форм — катаболический фермент — функ
Выделение продуктов азотистого обмена ' 567
ционирует у микроорганизмов совместно с карбаматкиназой в катаболизме цитруллина [214], а другая — анаболический фермент— принимает участие в синтезе цитруллина. У животных орнитинтранскарбамилаза существует, вероятно, только в этой последней форме. У высших животных система синтеза цитруллина локализуется в митохондриях, поэтому происхождение и стабильность этой системы в ходе эволюции представляют определенный интерес в связи с предполагаемым симбиотическим происхождением митохондрий [165].
Вторая ступень, необходимая для детоксикации аммиака посредством цикла аргинина—мочевины, заключается в том, что образующийся аргинин должен превратиться в мочевину под действием аргиназы. Однако наличие аргиназы в тканях животных еще не означает способности к синтезу мочевины de novo, поскольку этот фермент в процессе глюконеогенеза превращает аргинин в глутаминовую кислоту или пролин, которые представляют собой субстраты для окисления. О самостоятельном положении этой катаболической функции свидетельствуют сохранение и регуляция аргиназы в культуре клеток печени млекопитающих, утрачивающих способность к синтезу аргинина de novo [82]. Аргиназа встречается также у многих видов, которые не могут синтезировать аргинин; к ним относятся урикотелические позвоночные [31, 33, 178] и некоторые виды беспозвоночных [115, 224]. Удалось показать, что у насекомых этот фермент участвует в превращении аргинина в пролин, являющийся субстратом обменных процессов в мышцах при полете [225]. Следовательно, весьма вероятно, что мочевина, появляющаяся в небольшом количестве в выделениях насекомых [217] и других видов, не способных к синтезу аргинина, частйчно> возникает в результате действия аргиназы на экзогенный (поступающий с пищей) аргинин или на аргинин, образующийся при распаде белков. У прокариотов аргиназа функционирует в основном как катаболический фермент [213], поэтому вполне возможно, что этот фермент уже присутствовал в клетках и тканях, прежде чем включился в обменный цикл аргинина—мочевины. У животных обнаружено несколько разных молекулярных форм аргиназы [7, 120, 179, 208, 226], однако пока не выявлено связи между какой-либо специфической формой и особой физиологической функцией.
Мы располагаем еще более скудными сведениями относительно того эволюционного механизма, с помощью которого путь биосинтеза пуринов также стал использоваться для детоксикации аммиака. Как показано на рис. 7-4, функция глутаминсинтетазы у ури-котелических позвоночных аналогична функции карбамоилфосфат-синтетазы-I уреотелических позвоночных: оба фермента сначала связывают аммиак, освобождающийся при трансдезаминировании. Система, использующая аммиак для образования фосфорибозил-амина, была описана в печени птиц, но физиологическая роль этой системы не ясна [116, 227]. Глутаминсинтетаза содержится в клет-
'568
Глава 7
ках прокариотов и участвует в ассимиляции аммиака [274] . Как уже •обсуждалось ранее, этот фермент содержится и в большинстве тканей высших позвоночных, где основная его функция заключается в регуляции уровня аммиака (рис. 7-5). Таким образом, глутамин-синтетаза уже была предрасположена к выполнению предназначаемой ей роли в детоксикации аммиака у уреотелических видов, и необходима была лишь ее связь с митохондриями, чтобы функционировать, как показано на рис. 7-4. Продукт глутаминсинтетазной реакции, L-глутамин, необходим для синтеза белка, что еще раз свидетельствует о близкой связи между питанием и выделением у животных.
Повсеместное распространение ферментов, превращающих инозинмонофосфат непосредственно в мочевую кислоту («шунт», рис. 7-8), дает нам ключи к пониманию происхождения выделительной функции, свойственной пути биосинтеза пуринов; по-видимому, основные модификации этого биосинтетического пути проходили на уровне регуляции. Глутаминсинтетаза играет важную регуляторную роль в глюконеогенезе у птиц, но не у млекопитающих [135]. Чувствительность глутамин : фосфорибозилпирофосфат—амидотрансферазы у (птиц к подавлению нуклеозидмонофосфатами по принципу обратной связи (лабильное свойство в процессе очистки этого фермента [235]) меньше, чем чувствительность этого фермента у млекопитающих. Было высказано предположение, что у урикотелических животных «путь использования отходов» в обмене- пуринов отличается в количественном отношении от этого же пути у млекопитающих [81]; это помогает понять его роль в «сверхпродукции» мочевой кислоты, наблюдаемой при синдроме Леша—Нихана у человека. Ксантиноксидазы, выделенные из печени птиц и млекопитающих, отличаются не только по своей природе; регуляторные механизмы у этих ферментов также различны [253].
Утрату уриказы можно считать решающим событием в эволюции [137], способствовавшим тому, что мочевая кислота стала конечным продуктом азотистого обмена. Как показано на рис. 7-9, этот фермент катализирует первую ступень расщепления мочевой кислоты. Ферменты, участвующие в этом расщеплении, широко распространены как у беспозвоночных [38], так и у низших позвоночных [102, 293]. В соответствии со схемой Флоркина и Дюшато [87] в процессе эволюции происходила систематическая утрата ферментов, катализирующих распад мочевой кислоты, начиная с уреазы и кончая потерей всех ферментов, включая уриказу, у некоторых урикотелических видов, а также у человека и высших приматов. Вначале уриколитические ферменты, расщепляющие мочевую кислоту, были обнаружены всего лишь у нескольких видов животных, а затем в результате более подробных исследований было выявлено иное распределение этих ферментов, особенно у беспозвоночных [38]. Выяснилось, что некоторое количество моче-
Выделение продуктов азотистого обмена
569*
вой кислоты образуется у всех животных в процессе обновления нуклеиновых кислот в организме и распада нуклеиновых кислот, поступивших с пищей. Тип минорных компонентов, присутствующих в выделениях и являющихся конечными азотистыми продуктами распада нуклеиновых кислот, зависит от того фермента цепи уриколитического расщепления, который имеется у данного вида
Мочевая кислота (+)-Аллантоин Аллантоат
Аллантоиназа^ Q урецВогликолаза +
NH2 HC=O xnh
H . z
Мочевина (-)-Уреидогликолат Глиоксилат Мочевина
Уреаза
Мочевина
z nh, + со2 с.
Рис. 7-9. Расщепление мочевой кислоты у животных.
животного. Утрата уриказы в эволюционной линии, ведущей к человеку и высшим обезьянам, рассматривалась некоторыми исследователями как случайное событие, а развивавшаяся в результате гиперурикемия — как фактор, который мог стимулировать развитие мозга. Все за и против этой гипотезы обсуждались Кейлином [137]. В любом случае отсутствие уриказы у человека является одной из причин возникновения подагры; у животных, обладающих уриказой, подавление этого фермента in vivo приводит к гиперури-кемии и к повышенному выделению мочевой кислоты [131]. Благодаря имеющемуся у человека «шунту» и отсутствию уриказы не все выделяемые им оксипурины получаются в результате распада, нуклеиновых кислот. Частично они образуются, вероятно, за счет того же механизма, что и у птиц [81].
Клетки, которые утратили способность к синтезу пуринов de-novo, в отдельных случаях все же сохранили какие-то функциональные звенья пути биосинтеза пуринов, подобно тому как иногда сохраняются те или иные звенья цикла аргинина—мочевины. Например, зрелые эритроциты млекопитающих, неспособные синтези
570
Глава 7
ровать пурины, могут превращать продукт промежуточного обмена -5-амино-4-карбоксамндрибонуклеотид в пурины [156]; по-видимому, аналогичная ситуация наблюдается и у оболочника Melgula manhettensis [189]. У ресничных простейших, нуждающихся для роста в пуринах, в обмене этих последних соединении отсутствует -ступень синтеза глицинамидрибонуклеотида [297].
Эволюция путей детоксикации аммиака у беспозвоночных
У беспозвоночных основными экскреторными продуктами служат аммиак и пурины, причем водные животные относятся главным образом к аммониотелическому, а наземные — к пуринотели-ческому типу. Основным экскретируемым пурином обычно является мочевая кислота, хотя и на долю других пуринов, таких, как ксантин и гуанин, может приходиться довольно значительная масть общего выделяемого азота [270]. У некоторых паукообразных гуанин составляет более 90% выделяемого азота. У отдельных видов насекомых продукты распада пуринов, такие, как аллантоин, также могут составлять значительную часть выделяемого азота [217], у других же видов аллантоин вовсе не выделяется [288]. Выделение мочевины в качестве конечного продукта хотя и довольно редко, но все же встречается у беспозвоночных, например у наземной планарии Bipalium kewense и у дождевого червя Lumbricus terrestris во время голодания [18].
Некоторым наземным беспозвоночным свойствен уникальный тип иммониотелии, когда вместо иона аммония выделяется газообразный аммиак. Количество NH3, выделяемое наземными равноногими раками Oniscus asellus и Porcellio scaber, полностью соответствует общему количеству поглощаемого ими азота [315] и сравнимо с количеством азота, выделяемого в виде NH* пресноводными и морскими ракообразными [15]. Наземные брюхоногие моллюски также выделяют газообразный аммиак [269], но он не является их основным конечным продуктом [270]. Прямое выделение NH3 представляет собой, очевидно, самый примитивный способ выделения азота в наземных условиях. Когда такой процесс сопряжен с выделением СО2, то существенных изменений в кислотно-щелочном равновесии не происходит, что можно проиллюстрировать схемой обмена NH3 и СО2 между клетками крови и жабр у водных животных (рис. 7-6). Протекающее в крови превращение НСО3 в СО2 идет с присоединением одного протона, что вызывает местное защелачивание, которое в свою очередь обусловливает диссоциацию NH* с образованием NH3. Как видно из приводимой на рис. 7-6 -схемы, СО2 и NH3 проникают в клетки жабр, чтобы снова превратиться в НСО“ и NH*. У наземных же организмов, выделяющих NH3, оба продукта должны рассеиваться в атмосфере. Единствен
Выделение продуктов азотистого обмена 57 f
ное отличие между выделением NH3 и СО2 в наземных и выделением NH^ и НСО~ в водных условиях заключается в появлении компонентов воды в составе конечных продуктов обмена у водных: животных.
Путь биосинтеза аргинина—мочевины. Большинство простейших не способны синтезировать аргинин de novo, о чем свидетельствует их потребность в получении аргинина с пищей [297]. Однако низшие многоклеточные уже обладают способностью к биосинтезу аргинина, что видно на примере наземной планарии Bipaliwn kewense [36], у которой de novo синтезируются и аргинин, и мочевина. Ферменты цикла аргинина—мочевины обнаружены и у других плоских червей; имеются данные, что у некоторых видов они могут функционировать in vivo в синтезе аргинина и (или) мочевины [38].
Основная филогенетическая линия беспозвоночных, от которой ведут начало плоские черви, дивергировала на две главные ветви.. Одна ветвь через иглокожих и первичнохордовых привела к возникновению позвоночных, другая — к возникновению членистоногих. Так как линия иглокожие—первично хордовые привела к позвоночным, цикл аргинина—мочевины, очевидно, должен быть свойствен всем представителям данной линии. Однако способности представителей различных типов этой филогенетической ветви к синтезу и гидролизу аргинина не исследовались. Показано, что цикл аргинина—мочевины сохранился в линии, ведущей к члени-стоногим, и появляется у наземных брюхоногих, где он функционирует inter alia в синтезе аргинина, идущего на построение белка [40, 292]. Пищевые потребности этих организмов в аминокислотах неизвестны, но сопоставление у них скорости синтеза аргинина со скоростями синтеза аланина, аспарагиновой и глутаминовой кислот (т. е. аминокислот, которые не обязательно должны поступать, с пищей) показывает, что синтез аргинина весьма существен в питании. К настоящему времени распределение ферментов цикла аргинина—мочевины в тканях беспозвоночных известно только для наземных улиток Otala lactea, Helix aspersa и Strophocheilus ablon-gus [41, 292]. В отличие от позвоночных, у которых высокая степень дифференцировки тканей обеспечивает локализацию данного цикла преимущественно в печени (создавая зависимость непеченочных тканей от печени в получении аргинина [77]), у этих улиток наблюдается слабая дифференцировка тканей в отношении цикла аргинина—мочевины. Такая независимость тканей, по-видимому, указывает на относительное несовершенство их кровеносной системы в осуществлении межтканевых взаимодействий.
Аргиназа, имеющаяся в тканях брюхоногих [97], способна гидролизовать синтезируемый аргинин до мочевины [271]; тем не менее вряд ли можно считать, что главная функция цикла аргинина—мочевины у этих организмов связана с выделением. Митохондриальное высвобождение а-аминного азота путем трансдез
572
Глава 7
аминирования представляется сомнительным, а их основная митохондриальная карбамоилфосфатсинтетаза использует в качестве -субстрата глутамин, но не может использовать низкие концентрации аммиака. Мочевина, образующаяся у этих улиток под действием аргиназы, гидролизуется до аммиака и углекислого газа уреазой, присутствующей также в большинстве тканей у некоторых видов [269], но, по-видимому, не содержащейся у других [292]. В данном случае мочевину нельзя рассматривать как конечный продукт этого цикла. У улиток обмен мочевины, в результате которого образуется небольшое количество NH3, выделяемого отдельными видами, возможно, связан с присущим только им кислотно-щелочным равновесием, необходимым для создания и поддержания раковины из углекислого кальция [38, 42]. Некоторые факты говорят о том, что обмен мочевины у отдельных наземных (и, быть может, земноводных) брюхоногих регулируется таким -образом, чтобы обеспечить накопление мочевины в крови с целью осмотического удержания воды в период высыхания [43]. Независимо от возможных альтернативных функций цикла аргинина—мочевины у брюхоногих моллюсков само по себе наличие у них такого цикла представляет собой уникальное явление, поскольку до сих пор это пока что единственные среди исследованных пурино-телических видов [270], которые сохранили способность к синтезу аргинина de novo.
Цикл аргинина—мочевины сохранился в эволюционной линии беспозвоночных; об этом свидетельствует наличие этого цикла у малощетинковых кольчатых червей, у которых, кроме функции в питании, он выполняет функцию детоксикации аммиака, по крайней мере во время определенных физиологических состояний [18]. .Механизмы детоксикации аммиака в клетках дождевого червя Lumbricus terrestris напоминают такие же механизмы, описанные у позвоночных, поскольку у этого вида тоже имеется митохондри-.альная глутаматдегидрогеназа [43] и фермент, подобный карба-.моилфосфатсинтетазе-1 [17, 291]. Оба фермента служат обязательными компонентами процессов.высвобождения аммиака из аминокислот путем трансдезаминирования и его последующей детоксикации посредством образования мочевины. Функция детоксикации, присущая циклу аргинина—мочевины, описанная для малощетинковых кольчатых червей, в частности для Lumbricus terrestris, по-видимому, не свойственна морским многощетинковым червям, у которых, как уже обсуждалось, в катаболизме аминокислот может участвовать цикл пуриновых нуклеотидов [16] (рис. 7-2).
Цикл аргинина—мочевины, вероятно, был утрачен в эволюционной линии, ведущей от кольчатых червей к членистоногим, так как •ни ракообразные [62, 115, 324], ни насекомые [123] не способны к синтезу аргинина de novo (хотя у некоторых видов насекомых все же сохранилась часть этого пути). Онихофоры (переходная группа между червями и членистоногими) в рассматриваемом здесь плане
Выделение продуктов азотистого обмена
573
не исследовались, однако было высказано предположение, что они относятся к урикотелическому типу, подобно большинству наземных насекомых [164].
В период ранних исследований, посвященных сравнительным аспектам обмена веществ у животных, вопрос о наличии цикла аргинина—мочевины у беспозвоночных вызывал определенное сомнение [3]. Сейчас уже ясно, что этот путь имеется у представителей по крайней мере трех типов. Таким образом, можно говорить о некой эволюционной преемственности этого цикла от основной функции, связанной с питанием у прокариотов, к более специализированным его функциям у животных. Сохранность этого цикла в ходе эволюции беспозвоночных не вызывает удивления: помимо того что аргинин необходим для биосинтеза белка, он в виде фосфоаргинина выполняет функцию основного мышечного фосфагена [84], играя определенную роль в осуществлении движений, связанных с питанием, размножением и другими видами активности. Исследованию распределения фосфоаргинина в связи с распределением фосфокреатина в эволюционной линии иглокожих—первичнохордовых было уделено значительное внимание, но о синтезе аргинина de novo в этой линии, к сожалению, нет никаких данных.
Синтез выделяемой мочевины у некоторых наземных планарий и дождевых червей, идущий посредством цикла аргинина—мочевины, указывает на то, что использование этого цикла, связанного в основном с питанием, для детоксикации аммиака началось у беспозвоночных. Однако более подробными данными относительно участия этого цикла в создании продуктов выделения у этих или других беспозвоночных мы не располагаем и поэтому не можем сформулировать механизм происхождения этой основной метаболической адаптации. Тем не менее некоторые связи этого цикла со специфическими физиологическими реакциями у беспозвоночных выяснить удалось. В частности, можно упомянуть о роли цикла в поддержании кислотно-щелочного равновесия у моллюсков, которые образуют раковину из углекислого кальция. Нидхем [185] предположил также, что мочевина и углекислый кальций участвуют в кислотно-щелочном равновесии у дождевых червей. Здесь следует вспомнить, что цикл аргинина—мочевины у млекопитающих обусловливает то физиологическое состояние, которое связано с нарушенным кислотно-щелочным равновесием. У низших позвоночных необходимость удержания воды с целью сохранения осмотического давления могла быть главным фактором в отборе на высокую скорость синтеза мочевины, и, как мы уже видели, такая же ситуация наблюдается и у некоторых наземных брюхоногих. Таким образом, все адаптации цикла аргинина—мочевины, наблюдаемые ныне у позвоночных, могли иметь соответствующие эволюционные прецеденты у беспозвоночных.
Пуриновый путь. Синтез пуринового кольца de novo описан лишь у нескольких видов беспозвоночных. Низкомолекулярные
574
Глава 7
предшественники мочевой кислоты у наземных улиток Otala и Helix и у птиц одинаковы [107, 130, 151], а некоторые из этих предшественников используются в синтезе мочевой кислоты и у насекомых [70, 117, 169]. Хотя ни один из ферментов, катализирующих включение этих предшественников, еще не был охарактеризован, тип их включения свидетельствует о том, что в указанных двух группах пуринотелических беспозвоночных путь синтеза пуринов такой же, как и у других видов, способных синтезировать пуриновое кольцо. Однако пока что очень мало известно о том, какова роль пуринового цикла в питании и выделении. Простейшие нуждаются в получении пуринов и их производных с пищей [297], причем у некоторых из них удалось идентифицировать тот специфический дефект, который создает эту потребность. Неспособность оболочника Molgula включать предшественники пуринового кольца свидетельствует о потребности в пуринах у этого вида. Насекомые способны синтезировать пурины, тем не менее некоторые из них, например комнатная муха, обнаруживают специфическую пищевую потребность в аденине, гуанине [1] и в других нуклеиновых кислотах [123, 190]. Насекомые могут синтезировать основные низкомолекулярные предшественники пуринового кольца (серин, глицин и глутамин [59]) и обладают такими вспомогательными ферментами, как ферменты активации муравьиной кислоты [326], поэтому наблюдаемые потребности в пурине, очевидно, отражают неспособность пуринового пути обеспечить необходимые количества гуаниновых и адениновых нуклеотидов.
Глутаминсинтетаза, выполняющая, с одной стороны, специфическую функцию в детоксикации аммиака через пуриновый путь и, с другой стороны, более общую функцию в регуляции уровня аммиака в тканях, также присутствует у насекомых и по ряду своих свойств напоминает фермент позвоночных [153]. У наземных улиток in vivo также имеется глутаминсинтетаза [40, 140]. У этих пуринотелических беспозвоночных локализацию глутаминсинтетазы в клетке в связи с’ее функцией в детоксикации аммиака не определяли. Высокие концентрации свободного глутамина у насекомых и улиток [40, 49, 152], по-видимому, объясняются его ролью в качестве предшественника пуринов. Вместе с тем высокая концентрация глутамина у непуринотелических беспозвоночных, вероятно, обусловлена его более общей ролью в обмене аммиака в тканях.
У беспозвоночных обнаружены аденаза, гуаназа, ксантинокси-даза и специфические дезаминазы пуриновых нуклеозидов и нуклеотидов; возможно, они принимают участие во взаимных превращениях пуринов и их рибонуклеотидов, как изображено на рис. 7-8. Гипоксантин : гуанин—фосфорибозилтрансфераза обнаружена также в тканях улитки Otala [38]. Имеющаяся у насекомых ксантин-оксидаза принадлежит к дегидрогеназному типу [198], как и у птиц; различные изоферменты ксантиноксидазы насекомых участвуют в регуляции пуринового пути [261].
Выделение продуктов азотистого обмена 575
Весьма необычным явлением в пуриновом обмене у беспозвоночных представляется выделение больших количеств гуанина паукообразными [111, 215]. Как мы уже видели, мочевая кислота или продукты ее распада в небольшом количестве содержатся в выделениях большинства животных, поскольку эти продукты представляют собой конечные продукты катаболизма нуклеиновых кислот. В упомянутом случае обмен азота проходит через гуаниновые и адениновые нуклеотиды (рис. 7-8). У урикотелических видов избыток инозинмонофосфата, образующегося в ходе детоксикации аммиака, превращается непосредственно в мочевую кислоту через шунт. Следовательно, выделение гуанина в качестве конечного продукта у паукообразных представляет собой тип пуринотелии, несколько отличный от того типа, который свойствен позвоночным, причем предполагается, что основные взаимопревращения в обеих группах организмов одинаковы. Превращение инозинмонофосфата через гуанозинмонофосфат в гуанин как конечный продукт, вероятно, имеет адаптивное значение благодаря тому, что из всех пуринов гуанин содержит наибольший процент азота. Превращение ксантозинмонофосфата в гуанозинмонофосфат может обеспечивать прямо или косвенно «детоксикацию» избытка аммиака. Среди животных пока не найдено таких видов, у которых основным конечным продуктом азотистого обмена был бы аденин.
Накопление «экскретируемых» пуринов в тканях. Многие беспозвоночные, включая брюхоногих моллюсков [79, 80, 154], ракообразных [98], насекомых [12, 113, 177] и оболочников [105, 189], накапливают в тканях пурины в высоких концентрациях. По-видимому, этот процесс направлен на запасание пуринов для последующего использования их в обмене веществ, так как у некоторых видов в определенные периоды наблюдаются изменения количества пуринов в тканях. Как и при подагре у человека, накопление пуринов в тканях беспозвоночных может достигать патологических размеров. У таракана Periplaneta americana в ткани жирового тела обитают симбионты, которые расщепляют мочевую кислоту, предотвращая таким образом ее избыточное накопление [73]. У большой вощинной моли Galleria mellonella мочевая кислота превращается в соответствующий рибонуклеотид, что облегчает ее удаление из тканей [148].
Эволюция выделительной функции у позвоночных
В отличие от своих беспозвоночных предков позвоночные широко использовали цикл аргинина—мочевины для детоксикации аммиака. Наличие цикла аргинина—мочевины у примитивных рыб свидетельствует о том, что генетическая основа этого цикла непрерывно сохранялась в ходе эволюционного развития филогенетической линии от иглокожих—первичнохордовых до позвоночных
Рис. 7-.10. Эволюция процесса выделения продуктов азотистого обмена у позвоночных [247].
Сплошной линией ограничены урикотелические, крупными штрихами — уреотелические и мелкими штрихами — аммониотелические животные. Заглавными латинскими буквами отмечены вымершие переходные формы, а цифрами — представители современных видов. А—панцирные рыбы, древнейшие ископаемые позвоночные; В—членистошейные, древние челюстные рыбы; С — целакант, кистеперая рыба, предок двоякодышащих рыб и амфибий; D — лабиринтодонты, древние амфибии; Е — котилозавры, предки рептилий; F — терапсиды, древние млекопитающие, родственные рептилиям; G — архозавры, ветвь рептилий; 1, 2 — круглоротые (минога Petromyzon и миксина Myxine)-, 3, 4— хрящевые ганоиды (лопатонос Scaphyrhynchus и веслонос Polydon); 5, 6— костные ганоиды (ильная рыба Atnia и панцирная щука Lepidosfeus); 7, 8 — костистые рыбы (окунь и сельдь); 9— бесхвостые амфибии (лягушка Рапа); 10—хвостатые амфибии (протей Necturus); 11 — безногие амфибии (Chtonerpton); 12, 13— змеи, представители подотряда Serpentes; 14—ящерица, представитель семейства Lacertidae; 15, 16 — крокодилы (Crocodylus и Alligator); 17, 18—птицы (воробьиные и кулики); 19, 20 — рептилии (черепахи); 21 — клювоголовые рептилии (таутара Sphenodon); 22 — цельноголовые рыбы (химера Chimaera); 23 — пластиножаберные (акула Squalus); 24 — двоякодышащие (легочная рыба Neoceratodus); 25 — целакант (Latimeria); 26, 27— первичные млекопитающие (утконос Ornithorhynchus и ехидна Echnida); 28— сумчатые млекопитающие (кенгуру Macropus); 29, 30 — истинные млекопитающие (кенгуровая крыса Dipodomys и бобр Castor).
Выделение продуктов азотистого обмена ’ 577
(рис. 7-10). Полный набор ферментов цикла еще не найден у круглоротых [220], этой единственной сохранившейся до нашего времени группы из бесчелюстных, но наличие и функционирование всех ферментов установлено у цельноголовых [219] и у пластиножаберных (акуловых) (табл. 7-5). От этих примитивных рыб цикл аргинина—мочевины перешел в линию костистых рыб [125, 222] и в основную эволюционную линию позвоночных, ведущую к млекопитающим. Он имеется у живущих ныне двоякодышащих рыб, во всех классах амфибий, у черепах и клювоголовых рептилий и, по-видимому, у кистеперой рыбы Latimeria [32]. Этот цикл начал терять свою функцию в той линии рептилий, от которой произошли птицы, а также, вероятно, и у тех древних рептилий, от которых возникли чешуйчатые и крокодилы [33]. У птиц активность ферментов синтеза аргинина в печени находится ниже предела разрешающей способности метода (хотя в почках активность фермента определить можно) [285]; эти ферменты, вероятно, отсутствуют и в печени гремучей змеи Crotalus [178]. Однако в печени ящерицы Cte-nosaura [178] имеются все ферменты цикла аргинина—мочевины, кроме карбамоилфосфатсинтетазы. Исследования, проведенные на аллигаторе in vivo, показали наличие у него по крайней мере некоторых реакций этого цикла [60, 61]. Таким образом, эволюция этого пути у рептилий еще не ясна.
Отбор на синтез мочевины: осмотическое удержание воды в организме. Предполагается, что древние позвоночные независимо от того, в какой среде они обитали — пресноводной или морской, должны были обладать компонентами цикла аргинина—мочевины, которые участвовали по крайней мере в обмене аргинина в процессе обновления белков. Возможная роль цикла аргинина—мочевины в обеспечении аргинином современных рыб, особенно уреогенных костистых рыб [125], подробно не исследована. У изученных в этом плане видов костистых рыб обнаружена потребность в аргинине, т. е. эти виды не способны сами синтезировать аргинин [63]. По-видимому, отбор в направлении интеграции компонентов цикла аргинина—мочевины для увеличения скорости синтеза мочевины сначала происходил в морской среде. До сих пор еще не решен вопрос о том, был ли этот процесс изначально направлен на детоксикацию аммиака, или на синтез мочевины как компонента, регулирующего осмотическое давление, или на то и другое вместе. Различия в регуляции содержания воды и ионов между обитателями моря и пресных вод, вероятно, сделали невыгодным выделение аммиака в качестве конечного продукта азотистого катаболизма. Вместе с тем накопление мочевины в качестве осмотического компонента, безусловно, давало преимущество, поэтому участие цикла аргинина—мочевины в этом процессе и сегодня обнаруживается у акуловых, цельноголовых [221] и, вероятно, у кистеперых [204] рыб. У многих морских беспозвоночных основными осмотическими компонентами служат аминокислоты [88]. Использование для ос-
37-1332
Ферменты цикла аргинина — мочевины у различных видов животных
Таблица 7-5
Вид Активность фермента, мкмоль продукта на 1 г ткани в 1 ч1)
карбамоилфосфат-синтетазы орнитинтранскарбамил азы аргинпносукцинат-синтетазы аргинино-сукцинат-лиазы аргиназы
Беспозвоночные
Моллюски
Helix, aspersa (Н)2> <0,1 80 0,3 7 2200—14 400
Otala lactea (H) 0,1 200 0,1 10 2000—45 000
Strophocheilus oblongus (H) 0,5 190 0,2 17 30
Кольчатые черви
Lumbricus terrestris (H, голодный) 5 2300 6 50 2000
Позвоночные
Пластиножаберные
Scylliorhinus canicula (M) 1 600 8 25 1800
Dasyatis americana (M) 7 14 400 203> 34 900
Urolophus jamaicensis (M) 5 8500 17 14 400
Potamotrygon sp. (ПрВ) 0,4 1600 10 4300
Костистые рыбы
Anguilla anguilli (ПрВ->М) 0,2 6 1,6 1,8 4600
Salmo salar (М->ПрВ) <0,1 4 0,6 0,7 1100
Cyprinus carpio (ПрВ) 0,4 1 0,5 0,4 60
Gadus callarias (M) 0,1 1 4 1 250
Mullus barbatus (M) 0,2 180 3,4 1,7 700
Tinea vulgaris (ПрВ) 0,2 2,4 3,6 1,3 370
Opsanus tau (M) 10 10 200 15 180 31 800
Двоякодышащие
Protopterus aethiopicus (B) 30 1700 7 60 35 000
Neoceratodus forsteri (B) 0,5 150 4,3 13 1500
Амфибии
Necturus maculosus (B) 16 2100 9 56 20 000
Amphiuma means (B) 206 10 200 30 370 18 700
Pana catesbiana, головастик (В) 55 2300 2 25 1050
Q7*
П родолжение
Вид Активность фермента, мкмоль продукта на 1 г ткани в 1 ч1)
карбамоилфосфат-синтетазы орнитинтранс-карбамилазы аргининосукци-нат-спнтетазы аргинино-сукцинат-лиазы аргиназы
Rana catesbiana, взрослая особь (ПН) 980 9700 46 500 24 600
Rana temporaria (ПН) 365 9500 51 120 19 8UU
Xenopus laevis (В) 24 250 22 40 10 000—180 000
Chtonerpeton indistinctum (ПН) 97 12 780 21 10800
Чешуйчатые рептилии
Chrysemys picta (ПВ) 644 12 800 45 6030
Pseudemys scriptae (ПВ) 140 8000 45 45 000—55 000
Kinosternon hirtipes (ПВ) 125—300 7000—9000 40 38 000—60 000
Gopherus flavomarginatus (H) 9 275 10 28 000
Gopher us berlandieri (H) 27 900 18 29 600
Клювоголовые рептилии
Sphenodon punctatus (H) -1 — 7800 45 35 200
Млекопитающие
Rattus norvegicus 600 22 800 85 150 30 000
Myotis lucifugus 2800 53 400 >9С 52 000
Macaca rhesus 420 14000 4С 11 200
Человек 240 8500 50 175 7800
О Приближенные величины для гепатопанкреатической системы брюхоногих моллюсков [41, 97, 291, 292], кишечника дождевого червя [18] и печени позвоночных [6, 33, 34, 44, 101, 104, 118, 125, 178].
2) Животные морские (М); пресноводные (ПрВ); (ПрВ------>М — катадромные; М-----э-ПрВ — анадромные); водные (В); полуназемные (ПН); по-
луводные (ПВ); наземные (Н).
8) Активность общей аргининсинтетазной системы (аргинииосукцинат-синтетаза и аргининосукцинат-лиаза).
580
Глава 7
мотических целей какого-либо конечного продукта азотистого катаболизма, а не самих аминокислот дает определенное энергетическое преимущество, так как энергия, освобождающаяся при катаболизме углеродных скелетов аминокислот, не теряется. Приспособление цикла аргинина—мочевины для детоксикации аммиака впервые появилось не у позвоночных, поскольку такая же функция цикла была у наземных беспозвоночных, например у дождевого червя. То же самое можно сказать и о процессе накопления мочевины для осмотических целей у позвоночных (по-видимому, мочевина накапливалась у наземных брюхоногих, а также у ракообразных, адаптированных к гипертоническим условиям внешней среды [256]). Накопление мочевины древними позвоночными, обитавшими в море, потребовало, помимо необходимых биохимических адаптаций цикла аргинина—мочевины, значительной физиологической адаптации и в почках, поскольку именно почки в основном регулируют уровень мочевины в плазме [246]. Эта последняя адаптация обнаружена в настоящее время у акуловых рыб в гипотонической среде и у амфибий в гипертонической среде. Пресноводная акула Potamotrygon в отличие от своих морских сородичей является аммониотелическим организмом [101] и содержит в плазме менее ’/зоо того количества мочевины [287], которое характерно для морских акуловых.
Адаптация этих видов к пресной воде складывается из 1) пониженной скорости биосинтеза мочевины, которая отражается в пониженной активности печеночных ферментов цикла аргинина—мочевины в печени (табл. 7-5), и 2) в повышенном выделении мочевины с мочой [101]. При переносе эвригалинных акуловых в более разбавленную среду уменьшение уровня мочевины в плазме осуществляется в основном за счет увеличения выделения мочевины с мочой [101]. У амфибий, обитающих в гипертонической среде или адаптированных к ней, обнаруживается пониженная скорость клубочковой фильтрации, которая сказывается соответственно и в снижении скорости выделения мочевины [246]. В этих условиях наблюдается также ускорение синтеза мочевины в печени [129, 167]. Таким образом, первым позвоночным, обитавшим в море, потребовались как биохимическая, так и физиологическая адаптации: первая заключалась в повышении скорости синтеза мочевины, а вторая— в усилении реабсорбции мочевины в почечных канальцах.
Выход на сушу. Способность синтезировать мочевину в то время, когда вода была в ограниченном количестве, послужила древним позвоночным преадаптацией к выходу на сушу. Лучше всего это можно видеть на примере современных двоякодышащих рыб, которые включают африканского протоптеруса (Protopteras), южноамериканского лепидосирена (Lepidosiren) и австралийского неоцератода (Neoceratodus). Protopterus и Lepidosiren переносят высыхание и летнюю спячку при недостатке воды во время засухи, тогда как Neoceratodus может существовать только в воде. Proto-
Выделение продуктов азотистого обмена
581
pterus и Neoceratodus представляют собой аммониотелические организмы, являясь в то же время уреогенными, поскольку обладают способностью синтезировать в печени мочевину. У Protopterus содержание ферментов цикла аргинина—мочевины (табл. 7-5), а также способность печени к синтезу мочевины [104] выше; во время летней спячки при недостатке воды этот вид накапливает мочевину [128]. Накопление не связано с повышением скорости синтеза мочевины [89,101], хотя у животных во время спячки, по-видимому, непрерывно идет процесс глюконеогенеза [128]. Более подробными сведениями относительно метаболической адаптации двоякодышащих рыб к спячке мы в настоящее время не располагаем. Общий обмен веществ, очевидно, замедляется, так что процессы синтеза мочевины, протекающие с обычной скоростью, видимо, обеспечивают детоксикацию тех количеств аммиака, которые образуются при эндогенном катаболизме белков. В результате количество аммиака в организме не достигает токсических величин. Поскольку эти рыбы не способны выделять мочевину, она накапливается и вызывает осмотическую задержку воды в организме.
Водные амфибии, подобно двоякодышащим рыбам, относятся к аммониотелическим и уреогенным организмам. Переход от аммо-нио- к уреотелии, совершаемый бесхвостыми амфибиями при метаморфозе, вероятно, несколько напоминает тот переход, который сделали первые позвоночные (по-видимому, это были лабиринтодонты, родственные примитивным двоякодышащим рыбам) при завоевании суши. В отличие от пребывающего в спячке Protopterus у бесхвостых амфибий во время метаморфоза заметно усиливается способность к синтезу мочевины в печени [54]. Повышение активности карбамоилфосфатсинтетазы играет решающую роль в таком переходе к уреотелии и обусловлено синтезом de novo нового ферментного белка; эту ситуацию удается воспроизвести in vivo и in vitro с помощью гормона тироксина [55]. Кроме того, если сравнивать разные виды амфибий с точки зрения их адаптации к наземному существованию, то наблюдается хорошая корреляция между степенью такой адаптации и содержанием у них карбамоил-фосфатсинтетазы-I в печени [54]. Эти наблюдения показывают, что карбамоилфосфатсинтетаза играла ключевую роль в переходе к наземному существованию.
Установившийся у полуназемных и наземных амфибий процесс детоксикации аммиака в цикле аргинина—мочевины перешел к котилозаврам и затем к большинству примитивных млекопитающих— ехидне и утконосу [69], — чтобы стать главным механизмом •азотистого катаболизма аминокислот у млекопитающих.
Переход к урикотелии. Рептилии представляют собой самый интересный класс среди позвоночных с точки зрения эволюции выделительной функции, так как у них обнаруживаются все три типа азотистого обмена веществ и переходы между аммониотелией и уреотелией, аммониотелией и урикотелией и уреотелией и урикоте-
582
Глаза 7
лией. Последний переход был характерен главным образом для рептилий, от которых произошли птицы, еще до того, как они утратили способность синтезировать аргинин и мочевину, хотя известно, например, что древесная амфибия Phyllomedusa sauvagii выделяет большие количества мочевой кислоты [261а]. Вероятно, и в этом случае переход к урикотелии совершился в основном под влиянием изменения связей с водной средой. Это можно проиллюстрировать на примере современных взрослых черепах. Наземные виды черепах выделяют меньше мочевины, чем водные или полуводные, и этот показатель коррелирует с характерными для них уровнями ферментов цикла аргинина—мочевины в печени (табл. 7-5). Сухопутные черепахи обычно выделяют и мочевину, и мочевую кислоту, но во время дегидратации мочевая кислота начинает преобладать [142]. Такое переключение обмена регулируется, вероятно, прежде всего почками [67], вызывая задержку и накопление мочевины, которая играет роль осмотического компонента в плазме [99]. У черепах в период обезвоживания мочевая кислота, секретируемая клетками эпителия почечных канальцев, осаждается в мочевом пузыре в виде солей мочевой кислоты, тогда как мочевина, появляющаяся в моче, вновь создает равновесие с плазмой, внося тем самым свой вклад в повышение осмоляльности плазмы. Обезвоживание вызывает усиленное выделение мочевой кислоты и у водных черепах, хотя и у них мочевина остается преобладающим продуктом выделения [232]. Умеренное обезвоживание водных черепах влечет за собой снижение скорости клубочковой фильтрации, а резкое обезвоживание приводит к полному прекращению образования мочи [67]. Детали биохимических адаптаций, происходящих при ограничении воды у этих видов рептилий, еще не выяснены.
У единственного сохранившегося представителя группы Rhyn-chocephalia (клювоголовые) — Sphenodon punctatus — также выделяются и мочевина, и мочевая кислота [118]. Хотя у этого вида мочевая кислота и преобладает среди конечных продуктов азотистого обмена, все же количество выделяемой мочевины увеличивается при потреблении богатой белком пищи, что говорит об очень существенной роли цикла аргинина—мочевины в детоксикации аммиака во время глюконеогенеза.
Цикл аргинина—мочевины, видимо, характерен и для некоторых чешуйчатых рептилий, хотя здесь он еще недостаточно хорошо изучен. При определенных обстоятельствах мочевина становится основным продуктом выделения у ящерицы Lacerta [203], а у ящерицы Ctenosaura [178], как уже говорилось, в печени найдены все ферменты цикла, кроме карбамоилфосфатсинтетазы. Мочевина, по-видимому, служит основным конечным продуктом и у зародышей отдельных видов змей [51, 52]. Глутаминсинтетазу обнаружили в митохондриях западной подвязковой змеи Thamnophis elegans [301]; этот факт свидетельствует о том, что взрослые змеи этого
Выделение продуктов азотистого обмена
583
вида обезвреживают аммиак в пуриновом цикле, т. е. так же, как и птицы. Нидхем [187] первый предположил, что связь зародыша с водой является главным обстоятельством, определяющим переходы к различным способам выделения продуктов азотистого обмена, и что наличие у зародышей змеи мочевины в качестве конечного продукта имеет важное значение при рассмотрении перехода от уреотелии к урикотелии, который произошел у древних рептилий. Яйца древних рептилий, вероятно, были относительно проницаемыми, и аммиак, образующийся в ходе эмбрионального обмена веществ, мог удаляться путем обмена со средой (аммониотелия, унаследованная от их предков-амфибий [195]).
Таким образом, для развития этих яиц была необходима водная или очень влажная среда. Для того чтобы яйца могли развиваться в условиях более ограниченного доступа воды, на ранних стадиях эмбрионального развития должен был произойти переход к уреотелии. Такие условия, по-видимому, могут повторяться и сейчас во время развития змей [51, 52]. Развитие полупроницаемой яйцевой оболочки позволяет откладывать яйца в еще более сухой среде, а мочевина, накапливающаяся в качестве конечного продукта обмена, помогает сохранять воду благодаря уменьшению потерь воды с испарением. С развитием клейдониевых яиц (яиц с относительно непроницаемой оболочкой [233]) сохранение воды было обеспечено, и в этих обстоятельствах высокие концентрации мочевины, вероятно, начинали создавать осмотические и другие затруднения в развитии зародыша. Таким образом, на этом этапе отбор начал действовать против синтеза мочевины и, следовательно, в направлении детоксикации аммиака с помощью пути биосинтеза пуринов. В соответствии с уже описанным раньше механизмом этот отбор должен был быть направлен на замену функции митохондриальной карбамоилфосфатсинтетазы-I функцией глутамин-синтетазы, а также на модификацию регуляции пуринового пути таким образом, чтобы избыток инозинмонофосфата, образующегося при детоксикации аммиака, эффективно превращался в мочевую кислоту. Утрата карбамоилфосфатсинтетазы-I привела к утрате способности синтезировать аргинин, в результате чего стало необходимым потреблять эту аминокислоту с пищей (т. е. она стала незаменимой), что, например, свойственно современным птицам.
Переход к урикотелии способствовал распространению древних рептилий в засушливых районах, где в основном и обитают современные рептилии. Помимо биохимических адаптаций, установление урикотелии повлекло за собой существенные физиологические адаптации, особенно в почках. Если у млекопитающих главным образом мочевина определяет осмоляльность мочи, то у птиц этого нет [246]. Для выделения мочевой кислоты необходимо минимальное количество воды, поскольку мочевая кислота вносит очень малый вклад в осмоляльность мочи [173]. Следовательно, урикотелия представляет собой полную адаптацию к наземным условиям.
584
Глава 7
Крокодилы вторично вернулись к жизни в воде [248] и являются первично аммониотелическими [65]. В отличие от млекопитающих, у которых NH^ выделяется во время метаболического ацидоза, а НСО3 —во время алкалоза, аллигатор выделяет NH* и НСО; одновременно. Анион НСО^ образуется в почках под дей-ствием_карбоангидразы. Таким образом, выделение почками NH* и НСО 3 у аллигатора направлено на сохранение Na+ и С1—, так же как внепочечное выделение этих ионов — у пресноводных беспозвоночных, рыб и амфибий [61].
Регуляция выделения азота
У животных синтез и выделение конечных продуктов азотистого обмена в количественном и качественном отношениях находятся под влиянием физиологических, экологических, онтогенетических и филогенетических параметров. В общих чертах физиологическая регуляция включает большую или меньшую интенсивность синтеза конечного продукта и соответственно этому больший или меньший уровень ферментативной активности. Во время глюконеогенеза» индуцированного потреблением большого количества белка с пищей, голоданием или введением глюкокортикоидов, наблюдается увеличение активности ферментов цикла аргинина—мочевины в печени млекопитающих [244] и по крайней мере некоторых ферментов пуринового пути в печени птиц [135]. Такое повышение уровней ферментативных активностей связано с повышенной способностью к синтезу конечного продукта обмена и, как было показано» во многих случаях обусловлено увеличением количества соответствующих ферментных белков [245а]. У дождевого червя глюконеогенез, индуцированный голоданием, также стимулирует увеличение активности ферментов цикла аргинина—мочевины, но в этом случае возросшая способность к синтезу мочевины приводит к изменению природы главного конечного продукта, т. е. к переходу от аммониотелии к уреотелии [18]. Анаболические состояния, вызываемые, например, гормоном роста (соматотропином), приводят к уменьшению уровня ферментов цикла аргинина—мочевины в печени млекопитающих [172]. Факторы среды тоже могут влиять на уровни ферментативной активности, причем это особенно заметно у позвоночных, использующих мочевину для осмотического удержания воды. Если лягушек Xenopus laevis и Rana cancrivora [57а, 167] поместить в гипертоническую среду, то у них повышаются активности ферментов цикла аргинина—мочевины. У Xenopus увеличение активности карбамоилфосфатсинтетазы-I обусловлено синтезом de novo нового ферментного белка [167]. Вместе с тем перенос ската Raja erinacea в гипотоническую среду влечет за собой уменьшение образования мочевины; возникают при этом и другие физиологические приспособления [102а], свидетельствующие о снижении ак-
Выделение продуктов азотистого обмена
585
живности ферментов биосинтеза мочевины. Заметное увеличение 8 печени амфибий уровней ферментов цикла аргинина—мочевины во время метаморфоза служит примером влияния факторов онтогенетического развития на выделение продуктов азотистого обмена. В этом случае, как и при голодании у дождевого червя, увеличение скорости синтеза мочевины приводит к качественному изменению: переходу от аммониотелии к уреотелии. В таком переключении путей обмена в процессе развития организма участвуют и факторы среды, так как метаморфоз обычно связан со сменой водной среды обитания и переходом к земноводному образу жизни. У Xenopus, обитающей только в воде, во время метаморфоза количество выделяемой мочевины меняется очень незначительно [4]. У Rana catesbiana активности всех пяти ферментов биосинтеза мочевины во время метаморфоза увеличиваются одновременно [56, 320а], причем увеличение активности обусловлено синтезом новых ферментных белков, как и в случае с карбамоилфосфатсинтета-зой-1. Такую же ответную реакцию можно вызвать, вводя тироксин как in vivo, так и в цельной ткани печени in vitro.
У млекопитающих в период развития ферменты биосинтеза мочевины локализуются главным образом в печени [133]. Некоторые ферменты, особенно те, что превращают цитруллин в аргинин (ар-гининосукцинат-синтетаза и аргининосукцинат-лиаза), образуются и в других тканях — почках и мозге [216]. Таким образом, в процессе дифференцировки тканей генетические потенции для этих ферментов проявляются в одних тканях и не проявляются в других. Подобное явление можно наблюдать и в филогенетическом развитии. Так, в печени птиц нет ферментов биосинтеза аргинина и цитруллина, хотя в почках имеются ферменты, которые превращают цитруллин в аргинин [285]. Полагают, что в генотипе многих видов, по-видимому, заложена потенциальная 'способность к синтезу как мочевины, так и мочевой кислоты в качестве конечных продуктов обмена, но использование того или иного пути обмена зависит от условий окружающей среды и от других факторов. Особенно характерно это для тех рептилий, у которых процент выделяемой мочевины или мочевой кислоты изменяется в соответствии с состоянием гидратации [142, 232]. Выделение больших количеств мочевой кислоты амфибиями, адаптированными к засушливым условиям [261а], очевидно, можно рассматривать как показатель наличия сходной ситуации и в этом классе позвоночных. У человека некоторое количество мочевой кислоты может синтезироваться de novo тем же путем, что и у птиц и рептилий [81]. Таким образом, филогенез вносит определенный вклад и в метаболические нарушения у человека, выражающиеся в избыточном образовании мочевой кислоты.
Все описанные выше процессы, за исключением нескольких примеров модификаций выделения продуктов азотистого обмена, осуществляются основными клеточными регуляторными механиз
586
Глава 7
мами. Как правило, физиологические и экологические факторы воздействуют на уровни ферментативной активности, а онтогенетические и филогенетические факторы влияют на проявление основной генетической информации, определяющей синтез ферментов, которые участвуют в детоксикации аммиака. Такого рода приспособления организма осуществляются фундаментальными регуляторными 'клеточными механизмами, связанными с транскрипцией и трансляцией генов и с изменением активности ферментов.
Регуляция активности генов
Механизм передачи генетической информации в клетках прокариотов и эукариотов в основном одинаков. Эта информация в виде специфических нуклеотидных последовательностей ДНК транскрибируется в специфические нуклеотидные последовательности информационной РНК (мРНК), которая в свою очередь с помощью белоксинтезирующего механизма транслируется в специфические последовательности аминокислот в конечном продукте. Для наших целей в качестве конечного продукта рассмотрим специфический фермент. Молекулярные детали регуляции этих процессов, хорошо известные для клеток прокариотов, в настоящее время только еще выясняются в клетках эукариотов.
Клетки прокариотов. Оперон прокариотов состоит из структурных генов, кодирующих специфические ферменты данного метаболического пути, и регуляторных генов. Наиболее полно исследована система /ас-оперона у Escherichia coli [328]. Структурные гены этого оперона кодируют синтез ферментных белков, участвующих в усвоении 'Р-галактозидов, таких, как лактоза. К числу этих ферментных белков относятся 0-галактозидаза, 0-галактозидпер-меаза и тиогалактозид-трансацетилаза. Регуляторные гены состоят из гена-промотора, представляющего собой начальный участок транскрипции мРНК со структурных генов, гена-оператора, с которым связан репрессорный белок, подавляющий эту транскрипцию, и гена-регулятора, который кодирует репрессорный белок. Перенос клеток Е. coli на среду, содержащую галактозид, индуцирует синтез ферментов усвоения галактозы. Индукция происходит благодаря взаимодействию галактозида с репрессорным белком, вследствие чего этот последний теряет способность связываться с геном-оператором. В этих условиях мРНК соответствующих ферментов может транскрибироваться со структурных генов и затем транслироваться в синтезе специфического ферментного белка. Это приводит к заметному увеличению количества ферментов для усвоения галактозида. В отсутствие галактозида репрессорный белок связывается с операторным локусом (геном-оператором), препятствуя транскрипции. Циклический АМФ (аденозин-цикло-3,5-моно-фосфат) также оказывает влияние на транскрипцию /ас-оперона и участвует в репрессии ферментативного синтеза. Например, в при
Выделение продуктов азотистого обмена
587
сутствии глюкозы количество внутриклеточного АМФ уменьшается, подавляя транскрипцию мРНК.
Клетки эукариотов. Клетки животных существенным образом отличаются от клеток прокариотов, так как процессы транскрипции и трансляции у них пространственно разделены и локализованы соответственно в ядре и цитоплазме. В противоположность отдельным молекулам ДНК в клетках прокариотов хромосомы эукариотов представляют собой сложные структуры, содержащие, помимо ДНК, также РНК и специализированные белки. Значительная часть всей ДНК состоит из повторяющихся нуклеотидных последовательностей, возникших, по-видимому, путем дупликаций генов. И хотя в клетках эукариотов содержится гораздо больше ДНК, чем в клетках прокариотов, причем обнаружена положительная корреляция между содержанием ДНК в клетках и высотой организации [28а], функционально активной у эукариотов в данный момент бывает лишь небольшая часть генома. До сих пор еще не доказано и то, что структурные гены для ферментов различных метаболических путей у животных физически организованы в виде оперонов. Кроме того, клеткам эукариотов свойственно более быстрое обновление РНК, особенно внутриядерной РНК, и белка.
Остановимся на одной из моделей регуляции генов в клетках эукариотов, которая была предложена Бриттеном и Дэвидсоном [28а]. Эта модель включает следующие элементы: ген-продюсер, ген-рецептор, РНК-активатор, ген-интегратор и сенсорный ген. Ген-продюсер представляет собой ту часть генома, которая транскрибируется в специфическую мРНК, т. е. соответствует структурному гену клеток прокариотов. Ген-рецептор связан с геном-продюсером и вызывает его транскрипцию, если рецептор связывается с РНК-активатором. РНК-активатор образует комплекс с рецепторным геном, обладающий специфической последовательностью. Ген-интегратор кодирует РНК-активатор и обеспечивает ее синтез. Сенсорный ген представляет собой последовательность ДНК, сцепленную с геном (или генами)-интегратором, которая действует в качестве участка, связывающего агенты, регулирующие активность генома. К такого рода агентам относятся стероидные и полипеп-тидные гормоны, а также эмбриональные индукторы и продукты самих генов-продюсеров. При связывании этих агентов сенсорным геном происходит активация гена (или генов)-интегратора, которая в свою очередь путем синтеза РНК-активатора активирует батарею генов-продюсеров. Связь агентов с сенсорным геном может осуществляться через посредство таких специфических белков, как, например, белки, связывающие стероиды [271а]. В этой модели избыточное количество ДНК клеток эукариотов, не входящее в состав генов-продюсеров, или структурных генов, связано с процессом регуляции: повышение содержания ДНК в клетке, коррелирующее с возрастанием эволюционной сложности организмов, отражает потребности более сложных регуляторных механизмов»
588 Глава 7
Модель Бриттена и Дэвидсона особенно удобна при рассмотрении онтогенетических и филогенетических аспектов выделения продуктов азотистого обмена, поскольку эти параметры воздействуют на проявление того генетического потенциала данной ткани или вида, который определяет синтез всего функционального набора ферментов детоксикации аммиака. В соответствии с моделью гены-продюсеры, или структурные гены, остаются неактивными, пока не будут специфическим образом активированы сенсорными генами. Таким образом, у млекопитающих в процессе дифференцировки тканей генетическим потенциалом для ферментов детоксикации аммиака в синтезе мочевины, очевидно, обладают все ткани, но его функциональная способность в полной мере проявляется только в печени (наряду с другими ферментами катаболизма аминокислот путем трансдезаминирования). У амфибий в процессе метаболизма осуществляется согласование всех ферментативных реакций цикла биосинтеза мочевины (включая митохондриальные и цитоплазматические ферменты), причем ряд данных свидетельствует о том, что инициацию транскрипции вызывает тироксин [109а]. Модель также допускает сохранение генетического потенциала в процессе эволюции без обязательного его проявления в фенотипе. Проявление генетического потенциала наступает только после его активации специфическими условиями среды или другими факторами. Так, генетический потенциал, обеспечивающий синтез мочевой кислоты в качестве главного конечного продукта азотистого обмена, должен быть общим у животных. Как мы уже видели, мочевая кислота или другие пурины часто накапливаются у нескольких видов беспозвоночных независимо от характера окружающей среды; некоторые амфибии, адаптированные к засушливым условиям, вероятно, выделяют именно мочевую кислоту в качестве конечного продукта, хотя для других полуназемных и наземных амфибий, как правило, характерна уреотелия. Следовательно, увеличение образования мочевой кислоты при подагре у людей могло быть обусловлено мутациями, которые вызвали активацию каких-то механизмов, действующих у урикотелических видов, что позволило пути биосинтеза пуринов переключиться на выделительную функцию. Поскольку в основе своей циклы аргинина—мочевины и пуринов связаны с пищевым обменом, эволюционные изменения, обеспечившие их использование в выделении, скорее всего были изменениями главным образом в их регуляции и лишь в незначительной степени— изменениями в структурных генах.
Регуляция ферментативной активности
Регуляция ферментативной активности в тканях животных происходит либо путем изменения количества присутствующего ферментного белка, либо посредством каких-то изменений в самом ферменте, которые влияют на его активность.
Выделение продуктов азотистого обмена
589
Обновление ферментов. Как уже говорилось выше, регуляция на уровне транскрипции является одним из способов регуляции количества фермента. Кроме того, регуляция идет и на уровне трансляции, вероятно при участии циклического АМ.Ф [97а, 205а].
Регуляция на этом уровне представляется довольно сложной, поскольку тут участвует несколько классов веществ, в том числе транспортные РНК (тРНК), аминокислоты, аминоацил-тРНК-син-тетазы, рибосомы и полирибосомы. Однако регуляция на любом уровне опирается на скорость белкового синтеза, причем такая регуляция составляет только часть общего механизма, контролирующего уровень фермента в тканях животного, так как, кроме синтеза фермента, идет и непрерывный его распад [245а]. Изменение в любом из этих процессов влияет на уровень ферментативной активности. Изменения в содержании фермента в данной ткани описываются следующим уравнением:
dE —k b £ dt —Ks
где E— содержание фермента в ткани, ks— константа скорости синтеза фермента и kd— константа распада фермента. В условиях равновесия, когда dEfdt = ^, скорость синтеза равна скорости распада: ks=kdE и E = ks/kd. Таким образом, в животных клетках происходит постоянное обновление ферментов, причем время такого обновления, или время «полужизни» (/1/2), оказалось величиной, характерной для каждого изученного фермента [222а]. Изменение в содержании фермента происходит как при изменении скорости его синтеза благодаря регуляции на уровне транскрипции и трансляции, так и при изменении скорости его распада. Механизм распада ферментов в клетках животных пока неясен; известно, что в нем принимают участие лизосомы [111а]. Было установлено, что изменения в активности ферментов чаще обусловлены сдвигами в скоростях их синтеза, но, как оказалось, в некоторых случаях, например при увеличении содержания аргиназы в печени млекопитающих в результате усиленного потребления белка с пищей, изменяется и скорость распада этого фермента [245а].
Модификация ферментативной активности. Наиболее известно изменение ферментативной активности путем аллостерической регуляции. Аллостерические ферменты имеют по два и более участка связывания: каталитический центр, к которому прикрепляется субстрат, и регуляторный участок, который связывает низкомолекулярные вещества, называемые эффекторными молекулами. Связывание регуляторным участком эффекторной молекулы вызывает конформационные изменения в ферментном белке, включающие изменение во взаимодействии субъединиц [93а], что оказывает влияние на связывание субстрата, а значит, и на каталитическую активность фермента. Карбамоилфосфатсинтетаза-I, по-видимому, представляет собой аллостерический фермент, эффекторной молекулой
590
Глава 7
для которого является N-ацетилглутаминовая кислота [110а]; полагают, что процесс синтеза этой эффекторной молекулы участвует в регуляции синтеза мочевины у млекопитающих [259, 260]. Начальный фермент биосинтеза пуринов — глутамин-фосфорибозил-пирофосфат—амидотрансфераза — вероятно, тоже относится к аллостерическим ферментам [107а]. В печени млекопитающих, где пуриновый цикл участвует в обмене, связанном с питанием, активность амидотрансферазы подавляется большинством пуриновых нуклеотидов, так же как и в клетках прокариотов [188]. Как регулируется активность этого фермента в печени птиц, где пуриновый цикл участвует в функции выделения, не известно. Сообщалось, что феРмент птиц чувствителен к угнетению нуклеотидами, и хотя по отношению к АМФ. он менее чувствителен, чем соответствующий фермент млекопитающих [135], эта чувствительность, однако, утрачивается в процессе очистки [45].
Ферментативная активность модифицируется также и ковалентными изменениями в структуре фермента. Наиболее известным примером может служить ферментативное превращение неактивных химотрипсиногена и трипсиногена в активные протеазы — химотрипсин и трипсин. Взаимопревращения ксантиноксидаз типов D и О в печени млекопитающих, по-видимому, включают ферментативное окисление тиоловой группы молекулы.
Регуляторные механизмы и экскреторные пути. Ферменты экскреторных путей в клетках животных регулируются довольно сложным образом в связи с тем, что эти пути выполняют двойную функцию как в питании, так и в выделении. В клетках прокариотов, где главная функция экскреторных путей состоит в обеспечении аргинином реакций белкового синтеза и нуклеотидами — реакций синтеза нуклеиновых кислот, циклы аргинина—мочевины и пуринов регулируются конечными продуктами. Кратковременная регуляция может осуществляться путем торможения по принципу простой обратной связи, а длительная — путем индукции или репрессии фермента; оба механизма в конечном счете основаны на присутствии и н.акоплении конечных продуктов. Имеются данные о том, что у млекопитающих в основе регуляции цикла аргинина—мочевины также лежит наличие аргинина. Например, почти при всех физиологических условиях, когда усиливается катаболизм аминокислот и, следовательно, появляется потребность в детоксикации аммиака, увеличивается активность всех пяти ферментов биосинтеза мочевины. С другой стороны, если в пище животного отсутствует аргинин, то увеличивается активность только четырех ферментов синтеза аргинина [244]. Кроме того, в культуре клеток печени, которые утратили способность синтезировать цитруллин, но могут усваивать этот субстрат для удовлетворения своей потребности в аргинине, аргинин вызывает снижение активности ар-гининосукцинат-синтетазы и аргининосукцинат-лиазы [245]. Что касается участия данных путей в функции выделения, то очевидно,
Выделение продуктовазотистого обмена
595
что отрицательная регуляция конечным продуктом, будь то ферментативная репрессия или торможение обратной связью, в этом случае невозможна. Действительно, когда возникает необходимость в усиленной детоксикации аммиака, количество мочевины и мочевой кислоты обычно возрастает. Таким образом, кажется более логичным, что пути детоксикации регулируются положительной прямой связью, чтобы участвовать в экскреции. Предполагают, что такая регуляция представляет собой аллостерическую активацию карбамоилфосфатсинтетазы-1 N-ацетилглутаминовой кислотой. Аргинин, который, как известно, in vivo предохраняет от отравления аммиаком в эксперименте [114, 313, 320], стимулирует синтез N-ацетилглутаминовой кислоты в митохондриях, и именно этот механизм, вероятно, в первую очередь должен реагировать на повышение уровня аргинина в клетке. Однако повышение активности этого синтеза в ответ на возросший уровень аргинина противоречит его предполагаемому участию в путях обмена, связанных с питанием. Этот факт убедительно иллюстрирует сложность регуляции рассматриваемых путей детоксикации в связи с обеими их функциями. Становится все более ясным, что, кроме регуляции начальных ферментов путей детоксикации, особая роль придналежит также аргиназе в цикле аргинина—мочевины и ферментам, участвующим в метаболизме ИМФ в биосинтезе пуринов. Все эти ферменты можно рассматривать как ключевые, поскольку они выполняют свои функции в точках разветвления обменных путей в направлениях питания и выделения, а также регулируют уровни аргинина и ИМФ в клетке.
СПИСОК ЛИТЕРАТУРЫ
1. Altman Р. L., Ditmer D. S., eds., Metabolism, Fed. Amer. Soc. Exp. Biol., Bethesda, 1968, pp. 95—187.
2. Alvarado R. H., Dietz T. H„ Comp. Biochem. Physiol., 33, 93—110, 1970. Effect of salt depletion on hydromineral balance in larval Ambystoma gracile.
3. Baldwin E., An Introduction to Comparative Biochemistry, 4th ed., Cambridge University Press, 1964.
4. Balinsky J. B., pp. 519—637, in: Comparative Biochemistry of Nitrogen Metabolism, ed. by J. W. Campbell, London, Academic Press, 1970. Nitrogen metabolism in amphibians.
5. Balinsky J. B„ Baldwin E„ J. Exp. Biol., 38, 695—705, 1961. The mode of excretion of ammonia and urea in Xenopus laevis.
6. Balinsky J. B„ Choritz E. L., Coe C. G. L., van der Schans G. S., Comp. Biochem. Physiol., 22, 53—57, 1967. Urea cycle enzymes and urea excretion during the development and metamorphosis of Xenopus laevis.
7. Bascur L., Cabello J., Veliz M., Gonzalez A., Biochim. Biophys. Acta, 128, 149— 154, 1966. Molecular forms of human-liver arginase.
8. Bassler К. H., Hammar С.-H., Biochem. Z„ 330, 555—564, 1958. Amino acid metabolism in cell fractions of rat liver: transamination and oxidation of L-ami-no acids.
9. Bell M. L., Lazarus H. M., Herman A. H., Egdahl R. H., Rutenburg A. M., Proc. Soc. Exp. Biol., Med., 136, 298—299, 1971. pH dependent changes in cell membrane stability.
592
Глава 7
10. Bendall D. S., De Dave C., Biochem. J., 74, 444—450, 1960. Activation of latent dehydrogenases in mitochondria from rat liver.
11. Benson J. A., Rampone A. Ann. Rev. Physiol., 28, 201—226, 1966. Gastrointestinal absorption.
12. Berridge M. J., J. Exp. Biol., 43, 535—552, 1965. Nitrogen excretion and excretory metabolism in the cotton strainer, Dysdercus fasciatus Signoret.
13. Bessman S. P., Bessman A. N., J. Clin. Invest, 34, 622—628, 1955. The cerebral and peripheral uptake of ammonia in liver disease with an hypothesis for the mechanisms of hepatic coma.
14. Binns R„ J. Exp. BioL, 51, 41—45, 1969. The physiology of the antennal gland of Carcinus maenas (L): Some nitrogenous constituents in the blood and urine.
15. Binns R., Peterson A. J., Biol. Bull., 136, 147—153, 1969. Nitrogen excretion by the spiny lobster Jasus edvardsi (Hutton): the role of the antennal gland.
16. Bishop S. H., Barnes L. B., Comp. Biochem. Physiol., 40B, 407—422, 1971. Ammonia forming mechanisms: deamination of 5'-adenylic acid (AMP) by some polychaete annelids.
17. Bishop S. H„ Campbell J. W., Science, 142, 1583—1585, 1963. Carbamyl phosphate synthesis in the earthworm Lumbricus terrestris.
18. Bishop S. H., Campbell J. W., Comp. Biochem. Physiol., 15, 51—71, 1965. Arginine and urea biosynthesis in the earthworm Lumbricus terrestris.
19. Blight M. M., J. Insect Physiol., 15, 259—272, 1969. Volatile nitrogenous bases emanating from laboratory-reared colonies of the desert locust, Schistocerca gregaria.
20. Blondin G. A., DeCastro A. F., Senior A. E., Biochem. Biophys. Res. Commun., 43, 28—35, 1971. The isolation and properties of a peptide ionophore from beef heart mitochondria.
21. Bloomfield R. A., Letter A. A., Wilson R. P., Arch. Biochem. Biophys., 129, 196—201, 1969. The effect of glycine on ammonia intoxication and uric acid biosynthesis in the avian species.
22. Bond P. A., Sang P. A., J. Insect Physiol., 14, 341—359, 1968. Glutamate dehydrogenase of Drosophila larvae.
23. Borman A., Wood T., Black H., Anderson E., Osterling M., Womack M„ Rose W„ J. Biol. Chem., 166, 585—594, 1946. The role of arginine in growth with some observations on the effects of arginic acid.
24. Boulanger P., Osteux R., Biochim. Biophys. Acta, 21, 552—561, 1956. Action of L-amino acid dehydrogenase in the liver of the turkey (Meleagris gallo-paro L.) on the basic amino acids.
25. Браунштейн A. E., pp. 335—389, in: Advances in Enzymology, ed by F. F. Nord, New York, Interscience, 1957. The main pathways of assimilation and dissimilation of nitrogen in animals.
26. Браунштейн A. E., Бычков С. M., Nature (London), 144, 751—752, 1939. A cell-free enzymatic model of Z-amino-acid dehydrogenase («/-deaminase»).
27. Bray R. C., Ratner S., Arch. Biochem. Biophys., 146, 531—541, 1971. Argini-nosuccinase from bovine kidney: comparison of catalytic, physical, and chemical properties with the enzyme from bovine liver.
28. Brierley G. P., Stoner C. D„ Biochemistry (N. Y.), 9, 708—713, 1970. Swelling and contraction of heart mitochondria suspended in ammonium chloride.
28a. Britten R. J., Davidson E. H., Science, 165, 349—357, 1969. Gene regulation for higher cells.
29. Bromberg P. A., Robin E. D., Forkner С. E., Jr., J. Clin. Invest., 39, 332—341, 1960. The existence of ammonia in blood in vivo with observations on the significance of the NH t—NH3 system.
30. Brosnan J. T., Krebs H. A., Williamson D. H., Biochem. J., 117, 91—96, 1970. Effects of ischemia on metabolite concentrations in rat liver.
31. Brown G. W., Jr., Arch. Biochem. Biophys., 114, 184—194, 1966. Studies in comparative biochemistry and evolution. I. Avian liver arginase.
Выделение продуктов азотистого обмена
593
32. Brown G. W., Jr., Brown S. G., Science, 155, 570—573, 1967. Urea and its formation in coelacanth liver.
33. Brown G. W.t Jr., Cohen P. P., Biochem. J., 75, 82—91, 1960. Comparative biochemistry of urea synthesis. 3. Activities of urea-cycle enzymes in various higher and lower vertebrates.
34. Brown G. W., Jr., Brown W. R., Cohen P. P., J. Biol. Chem., 234, 1775—1780, 1959. Levels of urea cycle enzymes in metamorphosing Rana cateshiana tadpoles.
35. Buchanan J. M., Flaks J. G., Hartman S. C„ Levenberg B., Lukens L. N., Warren L„ pp. 233—255, in: Chemistry and Biology of Purines, ed. by G. E. W. Wolstenholme and С. M. O’Conner, Boston, Little, Brown and Co., 1957. The enzymatic synthesis of inosinic acid de novo.
36. Campbell J. W„ Nature (London), 208, 1299—1301, 1965. Arginine and urea biosynthesis in the land planarian: its significance in biochemical evolution.
37. Campbell J. W., pp. 48—68, *in: Urea and the Kidney, ed. by B. Schmidt-Nielsen and D. W. S. Kerr, Amsterdam, Excerpta Medical Foundation, 1970. Comparative biochemistry of arginine and urea metabolism in invertebrates.
38. Campbell J. W., in: Biochemical Adaptation, ed. by F. P. Conte, Chicago, University of Chicago Press, 1973, in press. Animal adaptations in nitrogen metabolism.
39. Campbell J. W., Bishop S. H., pp. 103—206, in: Comparative Biochemistry of Nitrogen Metabolism, ed. by J. W. Campbell, London, Academic Press, 1970. Nitrogen metabolism in molluscs.
40. Campbell J. W., Speeg К. V., Jr., Comp. Biochem. Physiol., 25, 3—32, 1968. Arginine biosynthesis and metabolism in terrestrial snails.
41. Campbell J. W., Speeg К. V., Jr., Z. Vergl. Physiol., 61, 164—175, 1968. Tissue distribution of enzymes of arginine biosynthesis in terrestrial snails.
42. Campbell J. W., Speeg К. V., Jr., Nature (London), 224, 725—726, 1969. Ammonia and the biological deposition of calcium carbonate.
43. Campbell J. W., Drotman R. B., McDonald J. A., Tramell P. R., pp. 1—54, in: Nitrogen Metabolism and the Environment, ed. by J. W. Campbell and L. Goldstein, London, Academic Press, 1972. Nitrogen metabolism in terrestrial invertebrates.
44. Carlisky N. J., Barrio A., Sadnik L. L, Comp. Biochem. PhysioL, 29, 1259— 1262, 1969. Urea biosynthesis and excretion in the legless amphibian Chto-nerpeton indistinctum (Apoda),.
45. Caskey С. T., Ashton D. M., Wyngaarden J. B., J. Biol. Chem., 239, 2570— 2579, 1964. The enzymology of feedback inhibition of glutamine phosphoribosylpyrophosphate amidotransferase by purine nucleotides.
46. Chamalaun R. A. F. M., Tager J. M., Biochim. Biophys. Acta, 222, 119—134, 1970. Nitrogen metabolism in the perfused rat liver.
47. Chaplin A. E., Huggins A. R., Munday R. A., Comp. Biochem. PhysioL, 16, 49—62, 1965. Ionic effects on glutamate dehydrogenase activity from beef liver, lobster muscle and crab muscle.
48. Charles R., Tager J. M., Slater E. C., Biochim. Biophys. Acta, 131, 29—41, 1967. Citrulline synthesis in rat-liver mitochondria.
49. Chen P. S., pp. 115—135, in: Amino Acid Pools, ed. by J. T. Holden, Amsterdam, Elsevier, 1962. Free amino acids in insects.
50. Christensen H. N., Clifford J. B., J. BioL Chem., 238, 1743—1745, 1963. Early postnatal intensification of hepatic accumulation of amino acids.
51. Clark H., J. Exp. BioL, 30, 492—501, 1953. Metabolism of the black snake embryo: nitrogen excretion.
52. С1агк H., Sisken B. F., J. Exp. BioL, 33, 384—393, 1956. Nitrogenous excretion by embryos of the viviparous snake Thamnophis s. sirtalis (L.).
53. Cohen P. P., pp. 477—494, in: The Enzymes, 2nd ed., Vol. 6, ed. by P. D. Boyer, H. Lardy, and K. Myrback, New York, Academic Press, 1962. Carbamyl grour synthesis.
54. Cohen P. P., Harvey Leet. Ser., 60, 119—154, 1966. Biochemical aspects of metamorphosis: transition from ammonotelism to ureotelism.
38—1332
594
Глава 7
55. Cohen Р. Р., Science, 168, 533—543, 1970. Biochemical differentiation during amphibian metamorphosis.
56. Cohen P. P., Brown G. W., Jr., pp. 161—244, in: Comparative Biochemistry, Vol. 2, ed. by M. Florkin and H. S. Mason, New York, Academic Press, 1960. Ammonia metabolism and urea biosynthesis.
57. Cohen P. P., Brown G. Jr., pp. 129—138, in: Proceedings of the Fifth International Congress of Biochemistry, Vol. 3, London, Pergamon Press, 1963. Evolution of nitrogen metabolism.
57a-. Colley L., Rowe IF. C., Huggins A. K., Elliott A. B., Dicker S. E., Comp. Biochem. Physiol., 41B, 307—322, 1972. Effect of short-term external salinity changes on ornithine-urea cycle enzymes in Rana cancrivora.
58. Corman L., Prescott L. M., Kaplan N. O., J. Biol. Chem., 242, 1383—1390, 1967. Purification and kinetic characteristics of dogfish liver glutamate dehydrogenase. •
59. Corrigan J. J., pp. 387—488, in: Comparative Biochemistry of Nitrogen Metabolism, ed. by J. W. Campbell, London, Academic Press, 1970. Nitrogen metabolism in insects.
60. Coulson R. A., Hernandez T., Biochemistry of the Alligator, Baton Rouge, Louisiana State University Press, 1964.
61. Coulson R. A., Hernandez T., pp. 639—710, in: Comparative Biochemistry of Nitrogen Metabolism, ed. by J. W. Campbell, London, Academic Press, 1970. Nitrogen metabolism in the living reptile.
62. Cowey С. B., Forster J. R. M., Marine Biology, 10, 77—81, 1971. The essential amino acid requirements of the prawn Palaemon serratus.
63. Cowey С. B., Adron J., Blair A., J. Mar. Biol. Assoc. U. K-, 50, 87—95, 1970. Essential amino acid requirements of plaice and sole.
64. Crabtree B., Newsholme E. Z., Biochem. J., 117, 1019—1921, 1970. The activities of proline dehydrogenase, glutamate dehydrogenase, aspartate-oxogluta-rate aminotransferase and alanine-oxoglutarate aminotransferase in some insect flight muscles.
65. Cragg M. M., Balinsky J. B., Baldwin E., Comp. Biochem. Physiol., 3, 227— 235, 1961. A comparative study of nitrogen excretion in some amphibia and reptiles.
66. Crofts A. R., J. Biol. Chem., 242, 3352—3359, 1967. Amine uncoupling of energy transfer in chloroplasts.
67. Dantzler IF. H., Schmidt-Nielsen B., Amer. J. PhysioL, 210, 198—210, 1966. Excretion in fresh-water turtle (Pseudemys scrlpta) and desert tortoise (Gopherus agassizii).
67a. DeDuve C., Ann. N. Y. Acad. Sci., 168, 369—381, 1969. Evolution of the peroxisome.
68. DeGroot N., Cohen P. P., Biochim. Biophys. Acta, 59, 588—594, 1962. Studies on dehydrogenase activity during amphibian metamorphosis.
69. Denton D. A., Reich M., Hird F. J. R., Science, 139, 1225, 1963. Ureotelism of echidna and platypus.
70. Desai R. M., Kilby B. A., Arch. Int. Physiol. Biochim., 66, 282—286, 1958. Experiments on uric acid synthesis by insect fat body.
71. De Vooys C. G. N., Arch. Int. Physiol. Biochim., 77, 112—118, 1969. Formation and excretion of ammonia in Teleostei.
72. Dietz T. H., Kirschner L. B., Porter D„ J. Exp. Biol., 46, 85—96, 1967. The roles of sodium transport and anion permeability in generating transepithe-lial potential differences in larval salamanders.
73. Donnellan J. F., Kilby B. A., Comp. Biochem. PhysioL, 22, 235—252, 1967. Uric acid metabolism by symbiotic bacteria from the fat body of Periplaneta americana.
74. Downing К. M., Merkens J. C., Ann. Appl. BioL, 43, 243—246, 1955. The influence of dissolved oxygen concentration on the toxicity of unionized ammonia to rainbow trout (Salmo gairdneri Richardson).
75. Drotman R B., Campbell J. IF., Amer. J. PhysioL, 222, 1204—1212, 1972.
Выделение продуктов азотистого обмена i 595
Protein arginine biosynthesis by mammalian liver tissue during postnatal development.
76. Drotman R. B., Campbell J. W., Amer. J. Physiol., 222, 1213—1217, 1972. Protein arginine biosynthesis by amphibian liver tissue during metamorphosis.
77. Drotman R. B., Freedland R. A., Amer. J. Physiol., 222, 973—975, 1972. Citrulline metabolism in the perfused rat liver.
78. Duda G. D., Handler P., J. Biol. Chem., 232, 303—314, 1958. Kinetics of ammonia metabolism in vivo.
79. Duerr F. G., Comp. Biochem. Physiol., 22, 333—340, 1967. The uric acid content of several species of prosobranch and pulmonate snails as related to nitrogen excretion.
80. Duerr F. G., Comp. Biochem. Physiol., 26, 1051—1059, 1968. Excretion of ammonia and urea in seven species of marine prosobranch snails.
81. Duggan D. E., Pua К. H., Elfenbein G., Molec. Pharmacol., 4, 52—60, 1968. Purine metabolism in the chick enbryo: effect of uricogenesis and xanthine oxidase inhibition.
82. Eliasson E. S., Strecker H. J., J. Biol. Chem., 241, 5757—5763, 1966. Arginase activity during the growth cycle of Chang’s liver cells.
83. Emerson D. N., Comp. Biochem. Physiol., 29, 1115—1133, 1969. Influence of salinity on ammonia excretion rates and tissue constituents of euryhaline invertebrates. ’
84. Ennor A. H., Morrison J. F., Physiol., Rev., 38, 631—674, 1958. Biochemistry of the phosphagens and related quanidines.
85. Fahien L. A., Wiggert В. O., Cohen P. P., J. Biol. Chem., 240, 1083—1090, 1965. Crystallization and kinetic properties of glutamate dehydrogenase from frog liver.
86. Fannelli G. M., Goldstein L., Comp. Biochem. Physiol., 13, 193—204, 1964. Ammonia excretion in the neotenous newt, Necturus maculosus (Rafinesque).
87. Florkin M., Duchdteau G., Arch. Int. Physiol., 53, 267—306, 1943. The configurations of the enzymatic system of uricolysis and the evolution of purine catabolism in animals.
88. Florkin M., Schoffeniels E., Molecular Approaches to Ecology, New York, Academic Press, 1969.
89. Forster R. P., Goldstein L., Science, 153, 1650—1652, 1966. Urea synthesis in the lungfish: relative importance of purine and ornithine cycle pathways.
90. Freedland R. A., Szepesi B., pp. 103—104, in: Enzyme Synthesis and Degradation in Mammalian Systems, ed. by M. Rechcigl, Jr. Basel, Karger, 1971. Control of enzyme activity: nutritional factors.
91. Freedland R. A., Martin K. D., McFarland L. Z., Biochem. J., 103, 6P 1967. Properties of glutamic dehydrogenase from several tissues of the Japanese quail.
92. Frieden C., pp. 3—24, in: The Enzymes, 2nd ed., Vol. 7, Pt. A, by P. D. Boyer, H. Lardy, and K. Myrbach, New York, Academic Press, 1963. L-Glutamate dehydrogenase.
93. Frieden C., J. Biol. Chem., 240, 2028—2035, 1965. Glutamate dehydrogenase.
93a. Frieden C., Ann. Rev. Biochem., 40, 653—696, 1971. Protein-protein interaction and enzymatic activity.
93b. Frieden E., pp. 349—398, in: Metamorphosis, ed. by W. Etkin and L. I. Gilbert, Appleton-Century-Crofts, New York, 1968. Biochemistry of amphibian metamorphosis.
94. Fromm P. O., Comp. Biochem. Physiol., 10, 121—128, 1963. Studies on renal and extra-renal excretion in Salno gairdneri.
95. Fromm P. O., Gillette J. R., Comp. Biochem. Physiol., 26, 887—896, 1968. Effect of ambient ammonia on blood ammonia and nitrogen excretion of rainbow trout (Salno gairdneri).
96. Gamble J. G., Lehninger A. L., pp. 611—622, in: Biochemistry and Biophysics of Mitochondrial Membranes, ed. by G. F. Azzore, E. Carafoli, A. L. Lehninger, E. Quagliarello, and N. Siliprandi, New York, Academic Press, 1972. Transport
38*
596
Глава 7
of ornithine and citrulline across mitochondrial membranes during urea synthesis in the liver.
97. Gaston S., Campbell J. W., Comp. Biochem. Physiol., 17, 2o9—270, 1966. Distribution of arginase activity in molluscs.
97a. Gelehrter T. D., pp. 165—199, in: Enzyme Synthesis and Degradation in Mammalian Systems, ed. by M. Rechcigl, Karger, Basel, 1971. Regulatory mechanisms of enzyme synthesis: enzyme induction.
98. Gifford C. A., Amer. Zool., 8, 521—528, 1968. Accumulation of uric acid in the land crab, Cardlsoma guanhumi.
99. Gilles-Baillien, M., Schoffeniels E., Ann. Soc. Roy. Zool. Belg., 95, 75—79, 1966. Seasonal variations of the composition of the blood of the Greek tortoise Testado hermanni J. F. Gmelin.
100. Glahn P. E., Manchon P., Roche J., C. R. Seances Soc. Biol., 149, 509—513, 1955. L-Amino acid oxidases of the hepatopancreas of lamellibranchs.
101. Goldstein L., pp. 55—77, in: Nntrogen Metabolism and the Environment, ed. by J. W. Campbell and L. Goldstein, London, Academic Press, 1972. Adaptation of urea metabolism in aquatic vertebrates.
102. Goldstein L., Forster R. P., Comp. Biochem. Physiol., 14, 567—576, 1965. The role of uricolysis in the production of urea by fishes and other acquatic vertebrates.
102a. Goldstein L., Forster R. P., Amer. J. Physiol., 220, 742—746, 1971. Osmoregulation and urea metabolism in Raja erinacea.
103. Goldstein L., Forster R. P., Fanelli G. M., Jr., Comp. Biochem. Physiol., 12, 489—499, 1964. Gill blood flow and ammonia excretion in Myoxocephalus scorpius.
104. Goldstein L., Janssens P. A., Forster R. P., Science, 157, 316—317, 1967. Lungfish Neoceratodus forsteri: activities of ornithine-urea cycle and enzymes.
105. Goodbody I., J. Exp. Biol., 42, 299—305, 1965. Nitrogen excretion in Asci-diacea: storage excretion and the uricolytic enzyme system.
106. Goodman A. D., pp. 297—318, in: Nitrogen Metabolism and the Environment, ed. by J. W. Campbell and L. Goldstein, London, Academic Press, 1972. Relation of the carbohydrate metabolism and ammonia production in the kidney.
107. Gorzkowski B., Acta Biochim. Polonica, 16, 193—200, 1969. Utilization of 14C-labelled purine precursors for uric acid synthesis in Helix pomatia.
107a. Gots J. S., pp. 225—255, in: Metabolic Pathways, 3rd ed., Vol. 5, ed. by H. J. Vogel, Academic Press, New York, 1971. Regulation of purine and pyrimidine metabolism.
108. Graaf mans W D., Charles D. J., Tager J. M., Biochim. Biophys. Acta, 153, 916—919, 1968. Mitochondrial citrulline synthesis with exogenous ATP.
109. Greenberg D. M., pp. 95—190, in: Metabolic Pathways, 3rd ed., Vol. 3, ed. by D. M. Greenberg, New York, Academic Press, 1969. Carbon catabolism of amino acids.
109a. Griswold M. D., Cohen P. P„ J. Biol. Chem., 247, 353—359, 1972. Alteration of deoxyribonucleic acid-dependent ribonucleic acid polymerase activities in amphibian nuclei during thyroxine-induced metamorphosis.
110. Guggenheim S. J., Bourgoignie J., Klahr S., Amer. J. Physiol., 220, 1651— 1659, 1971. Inhibition by ammonium of sodium transport across isolated toad bladder.
110a. Guthohrlein G., Rnappe J., Eur. J. Biochem., 7, 119—127, 1968. Structure and function of carbamyl phosphate synthetase. I. Transitions between two catalytically inactive forms and the active form.
111. Haggag G., Fouad Y., Nature (London), 207, 1003—1004, 1965. Nitrogenous excretion in arachnids.
Illa. Haider M., Segal H. L., Arch. Biochem. Biophys., 148, 228—237, 1972. Some characteristics of the alanine aminotransferase- and arginase-inactivating system of lysosomes.
112. Hall L. M., Johnson R. C., Cohen P. P., Biochim. Biophys. Acta, 37, 144—145, 1960. The presence of carbamyl phosphate synthetase in intestinal mucosa.
Выделение продуктов азотистого обмена 597
113. Harmsen R., J. Exp. Biol., 45, 1—13, 1966. The excretory role of pteridines in
114. Harper A. E., Benevenga N. J., Wohlhueter R. M., Physiol. Rev., 50, 428—558, 1970. Effects of ingestion of disproportionate amounts of amino acids.
115. Hartenstein R., Amer. Zool., 8, 507—519, 1968. Nitrogen metabolism in the terrestrial isopod, Oniscus asellus.
116. Hartman S. C., pp. 1—68, in: Metabolic Pathways, 3rd ed., Vol. 4, ed. by D. M. Greenberg, New York, Academic Press, 1970. Purines and pyrimidines.
117. Heller J., Jezewska M. M., Bull. Acad. Pol. Sci., Ser. Biol., 7, 1—4, 1959. The synthesis of uric acid in the Chinese tussur moth (Antheraea pernyi).
118'. Hill L., Dawbin IE. H., Comp. Eiochem. Physiol., 31, 453—468, 1969. Nitrogen excretion in the tuatara, Sphenodon punctatus.
119. Hindfelt B., Siesjd В. K., Life Sci., 9 (Pt II), 1021—1028, 1970. The effect of ammonia on the energy metabolism of the rat brain.
120. Hirsch-КоГо H., Heine J. P., Kolb H. J., Greenberg D. M., Comp. Biochem. Physiol., 37, 345—359, 1970. Comparative physical-chemical studies of mammalian arginase.
120a. Holzer H., Duntze W., Ann. Rev. Biochem., 40, 345—374, 1971. Metabolic regulation by chemical modification of enzymes.
121. Horne F. R., Comp. Biochem. Physiol., 26, 687—695, 1968. Nitrogen excretion in the herbivorous land crab Cardisoma guanhumi Latreille.
122. Horowitz N. H., Proc. Nat. Acad. Sci., 31, 153—157, 1945. Evolution of biochemical syntheses.
123. House H. L., pp. 769—813, in: The Physiology of Insecta, Vol. 2, ed. by M. Rockstein, New York, Academic Press, 1965. Insect nutrition.
124. Howard W. J., Kerson L. A., Appel S. H., J. Neurochem., 17, 121—123, 1970. Synthesis de novo of purines in slices of rat brain and liver.
125. Huggins A. K., Skutsch G., Baldwin E., Comp. Biochem. Physiol., 28, 587— 602, 1969. Ornithine-urea cycle enzymes in teleostean fish.
126. Inokuchi T., Horie У., J to T., Biochem. Biophys. Res. Commun., 35, 783—787, 1969. Urea cycle in the silk-worm, Bombyx mori.
127. Janicki R., Lingis J., Comp. Biochem. Physiol., 37, 101—105, 1970. Mechanism of ammonia production from aspartate in teleost liver.
128. Janssens P. A., Comp. Biochem. Physiol., 11, 105—117, 1964. The metabolism of the aestivating African lungfish.
129. Janssens P. A., Cohen P. P., Comp. Biochem. Physiol., 24, 887—898, 1968. Biosynthesis of urea in the estivating African lungfish and in Xenopus laevis under conditions of water-shortage.
130. Jezewska M. M., Gorzkowski B., Heller J., Acta Biochim. Polon., 11, 135—138, 1964. Utilization of [1-14C] glycine in purine biosynthesis in Helix pomatia.
131. Johnson W. J., Stavric B., Chartrand A., Proc. Soc. Exp. BioL, 131, 8—12, 1969. Uricase inhibition in the rat by s-triazines: an animal model for hyperuricemia and hyperuricosuria.
132. Jones M. E., pp. 35—45, in: Urea and the Kidney, ed. by B. Schmidt-Nielsen B., Kerr D. W. S., Amsterdam, Excerpta Medica Foundation, 1970. Vertebrate carbamyl phosphate synthetase I and II. Separation of the arginineurea and pyrimidine pathways.
133. Jones M. E., Anderson A. D., Anderson C., Hodes S., Arch. Biochem. Biophys., 95, 499—507, 1961. Citrulline synthesis in rat tissues.
134. Karnin H., Handler P., Ann. Rev. Biochem., 26, 419—490, 1957. Amino acid and protein metabolism.
135. Katunuma N., Matsuda У., Kuroda У., pp. 73—81, in: Advances in Enzyme Regulation, Vol. 8, ed. by G. Weber, Oxford, Pergamon Press, 1970. Phylo-genic aspects of different regulatory mechanisms of glutamine metabolism.
136. Katunuma N., Okada M., Mishii Y., pp. 317—335, in: Advances in Enzyme Regulation, Vol. 4, ed. by G. Weber, Oxford, Pergamon Press, 1966. Regulation of the urea cycle and TCA cycle by ammonia.
598
Глава 7
137. Keilin J., Biol. Rev. (Cambridge), 34, 265—296, 1959. The biological significance of uric acid and guanine excretion.
138. Kelley W. N., Fed. Proc., 27, 1017—1112, 1968. Hypoxanthine-guanine phosphoribosyltransferase deficiency in the Lesch-Nyhan syndrome and gout.
139. Kennan A. L., Gohen P. P., Proc. Soc. Exp. Biol. Med., 106, 170—173, 1961. Ammonia detoxification in liver from humans.
140. Kerkut G. A., Rick J. T., Huggins A. K., Comp. Biochem. Physiol., 28, 765— 770, 1969. The intermediary metabolism in vitro of glucose and acetate by ganglia from Helix aspersa and the effects of amphetamine.
141. Kerly M., Spruyt J. E. L., J. Physiol. (London), 216, 11—20, 1971. Amino acid metabolism in the isolated perfused rat liver.
142. Khalil F., Haggag G., J. Exp. Zool., 130, 423—432, 1955. Ureotelism and uri-cotelism in tortoises.
143. Kidder G. W., Davis J. S., Cousens K., Biochem. Biophys. Res. Commun., 24, 365—369, 1966. Citrulline utilization in Crithidia.
144. King K. S., Frieden C., J. Biol. Chem., 245, 4391—4396, 1970. The purification and physical properties of glutamate dehydrogenase from rat liver.
145. Kirk J. S., Sumner J. B., J. Biol. Chem., 94, 21—28, 1931. Antiurease.
146. Kittredge J. S., Simonsen D. G., Roberts E., Jelinek B., pp. 176—186, Amino Acid Pools, ed. by J. T. Holden, Amsterdam, Elsevier, 1962. Free amino acids of marine invertebrates.
147. Kovacevie Z., McGivan J. D., Chappell J. B., Biochem. J., 118, 265—274, 1970. Conditions for activity of glutaminase in kidney mitochondria.
148. Krzyzanowska M., Niemierko W., Bull. Acad. Polon. Sci., Ser. Biol., 17, 673— 676, 1970. Uric riboside as one of the end products of nitrogen metabolism in the wax moth larvae (Galleria mellonella L.) during starvation.
149. Leal J. A., Lilly V. G., Gallegly M. E., Mycologia, 62, 1041—1056, 1970. Some effects of ammonia on species of Phytophthora.
150. Lee P. C., Fisher J. R., Biochim. Biophys. Acta, 237, 14—20, 1971-. Regulation of xanthine dehydrogenase levels in liver and pancreas of the chick.
151. Lee T. W., Campbell J. W., Comp. Biochem. Physiol., 15, 457—468, 1965. Uric acid synthesis in the terrestrial snail, Otola lactea.
152. Levenbook L., J. Insect Physiol., 8, 559—567, 1962. The distribution of free amino acids, glutamine and glutamate, in the Southern armyworm, Prodenia eridonia.
153. Levenbook L., Kuhn J., Biochim. Biophys. Acta, 65, 219—232, 1962. Properties and distribution of glutamine synthetase in the Southern armyworm, Prodenia eridania.
154. Little C., J. Exp. Biol., 48, 569—585, 1968. Aestivation and ionic regulation in two species of Pomacea (Gastropoda, Prosobranchia).
155. Lowenstein J., Tornheim K., Science, 171, 397—400, 1971. Ammonia production in muscle: the purine nucleotide cycle.
155a. Lowenstein J. M., Physiol. Rev., 52, 382—414, 1972. Ammonia production in muscle and other tissues: the purine nucleotide cycle.
156. Lowry B. A., Williams M. K., London I. M., J. Biol. Chem., 237, 1622—1625, 1962. Enzymatic deficiencies of purine nucleotide synthesis in the human ervthrocyte.
157. Liieck J. D., Miller L. L., J. Biol. Chem., 245, 5491—5497, 1970. The effect of perfusate pH on glutamine metabolism in the isolated perfused rat liver.
158. Lund P., Biochem. J., 118, 35—39, 1970. A radiochemical assay for glutamine synthetase, and activity of the enzyme in rat tissues.
159. Lund P„ Goldstein L., Comp. Biochem. Physiol., 31, 205—210, 1969. Glutamine synthetase activity in tissues of lower vertebrates.
160. MacFarlane J. R„ Hogan T. W., J. Insect Physiol., 12, 1265—1278, 1966. Free amino acid changes associated with diapause in the egg of the field cricket, Teleogryllus commodus.
161. Maetz J., pp. 105—154, in: Nitrogen Metabolism and the Environment, ed. by J. W. Campbell and L. Goldstein, London, Academic Press, 1972. Interaction of salt and ammonia transport in aquatic organisms.
Выделение продуктов азотистого обмена•599
162. Maetz J., Garcia-Romeu F., J. Gen. Physiol., 47, 1209—1227, 1964. The mechanism of sodium and chloride uptake by the gills of a freshwater fish, Carassius auratus.
163. Makarewicz W., Zydowo M., Comp. Biochem. Physiol., 6, 269—275, 1962. Comparative studies on some ammonia-producing enzymes in the excretory organs of vertebrates. _
164. Manton S. M., Phil. Trans. Roy. Soc. London B, 227, 411—464, 1937. The feeding, digestion, excretion and food storage of Peripatopsis.
165. Margulis L., Science, 161, 1020—1022, 1968. Evolutionary criteria in thallo-phytes: a radical alternative.
166. McAllan J. W., Chefurka W., Comp. Biochem. Physiol., 3, 1—19, 1961. Properties of transaminases and glutamic dehydrogenase in the cockroach Peri planet a americana.
167. McBean R. L., Goldstein L., Amer. J. PhysioL, 219, 1124—1130, 1970. Accelerated synthesis of urea in Xenopus laevis during osmotic stress.
168. McBean R. L., Neppel M. J., Goldstein L„ Com. Biochem. Physiol., 18, 909— 920, 1966. Glutamate dehydrogenase and ammonia production in the eel (Anguilla vostrata).
169. McEnroe W., For gash A., Ann. Entomol. Soc. Amer., 50, 429—431, 1957. The in vivo incorporation of C'14 formate in the ureide groups of uric acid by Periplaneta americana (L.).
170. McGilvery R. W., Biochemistry: A Functional Approach, Philadelphia, W. B. Saunders Co., 1970, pp. 619—620.
171. McRhann G. M., Tower D. B., Amer. J. Physiol., 200, 420—424, 1961. Ammonia toxicity and cerebral oxidative metabolism.
172. McLean P., Gurney M. W., Biochem. J., 87, 96—104, 1963. Effect of adrenalectomy and growth hormone on enzymes concerned with urea synthesis in rat liver.
173. McNabb F. M. A., Poulson T. L., Comp. Biochem. Physiol., 33, 933—939, 1970. Uric acid excretion in pigeons, Columbia livia.
174. McWard G. W., Nicholson L. B., Poulton B. R., J. Nutr., 92, 118—120, 1967. Arginine requirement of the young rabbit.
175. Milne M. D., Scribner В. H., Crawford M. A. Amer. J. Med., 24, 709—729, 1958. Ncn-ionic diffusion and the excretion of weak acids and bases.
176. Mitchell H. A., J. Mammal., 45, 568—577, 1964. Investigations of the cave atmosphere of a Mexican bat colony.
177. Mitlin N., Maudlin J. K., Ann. Entom. Soc. Amer., 59, 651—653, 1966. Uric acid in the nitrogen metabolism of the boll weevil.
178. Mora J., Martuscelli J., Ortiz-Pineda J., Soberon G., Biochem. J., 96, 28—35, 1965. The regulation of urea-biosynthesis enzymes in vertebrates.
179. Mora J., Tarrab R„ Martuscelli J., Soberon G., Biochem. J., 96, 588—594, 1965. Characteristics of arginases from ureotelic and non-ureotelic animals.
180. Murray A. W., Biochem. J., 100, 664—670, 1966. Purine-phosphoribosyl-transferase activities in rat and mouse tissues and in Ehrlich ascites tumor cells.
181. Murray A. W., Elliott D. C., Atkinson M. R., pp. 87—119, in: Progress in Nucleic Acid Research and Molecular Biology, ed. by J. N. Davidson and W. E. Cohn, New York, Academic Press, 1970. Nucleotide biosynthesis from preformed purines in mammalian cells: regulatory mechanisms and biological significance.
182. Nakamaru Y., Schwartz A., Biochem. Biophys. Res. Commun., 40, 830—836, 1970. Possible control of intracellular calcium metabolism by [H+]: sarcoplasmic reticulum of skeletal and cardiac muscle.
183. Nakano M., Danowski T. S., J. Biol. Chem., 241, 2075—2083, 1966. Crystalline mammalian L-amino acid oxidase from rat kidney mitochondria.
184. Nathan D. G., Rodkey F. L„ J. Lab. Clin. Med., 49, 779—785, 1957. A colorimetric procedure for the determination of blood ammonia.
185. Needham A. E., J. Exp. BioL, 34, 425—446, 1957. Components of nitrogenous
600
Глава 7
excreta in the earthworms Lumbricus terrestris L. and Eisenia fuetida (Sa-vigny).
186. Needham A. E„ pp. 207—291, in: Comparative Biochemistry of Nitrogen Metabolism, ed. by J. W. Campbell, London, Academic Press, 1970. Nitrogen metabolism in Annelida.
187. Needham J., Biol. Rev. (Cambridge), 13, 225—251, 1938. Contributions of chemical physiology to the problem of reversibility in evolution.
188. Nierlich D. P„ Magasanik B., J. Biol. Chem., 240, 358—365, 1965. Regulation of purine ribonucleotide synthesis by end product inhibition. The effect of adenine and guanine ribonucleotides on the 5'-phosphoribosylpyrophosphate amidotransferase of Aerobacter aerogenes.
189. Nolfi J. R., Comp. Biochem. Physiol., 35, 827—842, 1970. Biosynthesis of uric acid in the tunicate, Molgula manhattensis.
190. Norby S., Hereditas, 66, 204—214, 1970. A specific nutritional requirement for pyrimidines in rudimentary mutants of Drosophila melanogaster.
191. Olson K. R., Fromm P. O., Comp. Biochem. PhysioL, 40A, 999—1007, 1971. Excretion of urea by two teleosis exposed to different concentrations of ambient ammonia.
192. Опарин А. И., Genesis and Evolutionary Development of Life, New York. Academic Press, 1968.
193. Orloff J., Kahn M., Brenes L., Amer. J. Physiol., 201, 747—753, 1961. Renal tubular effects of ammonium salts on electrolyte transport.
194. Oro J.t pp. 137—171, in: The Origins of Prebiological Systems, ed. by S. W. Fox, New York, Academic Press, 1965. Stages and mechanisms of prebiological organic synthesis.
195. Packard G. C., Amer. Naturalist, 100, 667—682, 1966. The influence of ambient temperature and aridity on modes of reproduction and excretion in am-niote vertebrates.
196. Papa S., Palmieri F., Quagliariello E., pp. 153—165, in: Regulation of Metabolic Processes in Mitochondria, ed. by J. M. Tager, S. Papa, E. Quagliariello, and E. C. Slater, Amsterdam, Elsevier, 1966. Control mechanisms of glutamate oxidation in liver mitochondria.
197. Parry G., pp. 341—366, in: The Physiology of Crustacea, Vol. 1, ed. by T. H. Waterman, New York, Academic Press, 1960. Excretion.
198. Parzen S. D., Fox A. S., Biochim. Biophys. Acta, 92, 465—471, 1964. Purification of xanthine dehydrogenase from Drosophila melanogaster.
199. Pequin L., C. R. Acad. Sci. Paris, 225, 1795—1797, 1962. The amounts of ammonia mitrogen in the blood of the carp (Cyprinus carpio L.).
200. Pequin L., Arch. Sci. PhysioL, 21, 193—203, 1967. Degradation and synthesis of glutamine by the carp (Cyprinus carpio L.).
201. Pequin L., Serfaty A., Comp. Biochem. PhysioL, 10, 313—324, 1963. Ammonia excretion by a freshwater teleost: Cyprinus carpio L.
202. Pequin L., Serfaty F., Arch. Sci. PhysioL, 22, 449—459, 1968. Hepatic and intestinal regulation of blood ammonia by the carp.
203. Perschmann C., Zool. Beitr. Ber., 2, 17—80, 1956. On the significance of the hepatic portal vein in particular for the excretion of urea and uric acid by Testudo hermanni and Lacerta viridus.
204. Pickford G. E., Grant F. B., Science, 155, 568—570, 1967. Serum osmolality in the coelacanth, Latlmeria chalumnae: urea retention and ion regulation.
205. Pitot H. C., Peraino C„ J. BioL Chem., 239, 1783—1788, 1964. Induction of threonine dehydrase and ornithine-6-transaminase by oral intubation of casein hydrolysate.
205a. Pitot H. C., Kaplan J., Cihdk A., pp. 216—235, in: Enzyme Synthesis and Degradation in Mammalian Systems, ed. by M. Rechcigl, Karger, Basel, 1971. Translational regulation of enzyme levels in liver.
206. Pitts R. F., Physiology of the Kidney and Body Fluids, 2nd ed., Chicago, Year Book Medical Publishers, 1968. pp. 195—211.
207. Pitts R. F., pp. 277—296, in: Nitrogen Metabolism and the Environment, ed.
Выделение продуктов азотистого обмена
601
by J. W. Campbell and L. Goldstein, London, Academic Press, 1972. Control of renal ammonia metabolism.
208. Porembska Z., Baranczyk A., Jachimowicz J., Acta Biochim. Pol., 18, 77—85, 1971. Arginase isoenzymes in liver and kidney of some mammals.
209. Potts W T. W., Comp. Biochem. Physiol., 14, 339—355, 1965. Ammonia excretion in Octopus dofleini.
210. Pressman В. C., pp. 213—250, in: Membranes of Mitochondria and Chloroplasts, ed. by E. Packer, New York, Van Nostrand Reinhold, 1970. Energy-linked transport in mitochondria.
211. Pritchard J. B., Chavez-Peon F., Berlin R. D., Amer. J. Physiol., 219, 1263— 1267, 1970. Purines: supply by liver to tissues.
211a. Puritch G. S., Barker A. V., Plant Physiol., 42, 1229—1238, 1967. Structure and function of tomato leaf chloroplasts during ammonium toxicity.
212. Packer E., pp. 127—172, in: Membranes of Mitochondria and Chloroplasts, ed. by E. Packer, New York, Van Nostrand Reinhold, 1970. Function and structure of the inner membrane of mitochondria and chloroplasts.
213. Ramaley R. F., Bernlohr R. W., Arch. Biochem. Biophys., 117, 34—43, 1966. Postlogarithmic phase metabolism of sporulating microorganisms: breakdown of arginine to glutamic acid.
214. Ramos F., Stalon V., Pierard A., Wiame J. M., Biochim. Biophys. Acta, 139, 98—106, 1967. The specialization of the two ornithine carbomoyltransferases of Pseudomonas.
215. Rao R. P., Gopalakrishnareddy T., Comp. Biochem. Physiol., 7, 175—178, 1962. Nitrogen excretion in arachnids.
216. Ratner S., Morell H., Carvalho E., Arch. Biochem. Biophys., 91, 280—289, 1960. Enzymes of arginine metabolism in brain.
217. Razet P., L’Annee BioL, 70, 42—73, 1966. The terminal elements of nitrogen catabolism of injects
218. Read R. R. H., Comp. Biochem. Physiol., 7, 15—22, 1962. Transamination in certain tissue homogenates of the bivalved molluscs Mytilus edulis L. and Modiolus modiolus L.
219. Read L. J., Nature (London), 215, 1412—1413, 1967. Enzymes of the ornithineurea cycle in the chimaera Hydrolagus colliei.
220. Read L. J., Comp. Biochem. Physiol., 26, 455—466, 1968. Ammonia and urea production and excretion in the fresh-water-adapted form of the Pacific lamprey, Entosphenus tridentatus.
221. Read L. J., Comp. Biochem. Physiol., 39A, 185—192, 1971. Chemical constituents of body fluids and urine of the holocephalan Hydrolagus colliei.
222. Read L. J., Comp. Biochem. Physiol., 39B, 409—413, 1971. The presence of high ornithine-urea cycle enzyme activity in the teleost Opsanus tau.
222a. Rechcigl M„ pp. 236—310, in: Enzyme Synthesis and Degradation in Mammalian Systems, ed. by M. Rechcigl, Karger, Basel, 1971. Intracellular protein turnover and the roles of synthesis and degradation in regulation of enzyme levels.
223. Reddy G„ Campbell J. W., Experientia, 28, 530—532, 1972. Correlation of ammonia liberation and calcium deposition by the avian egg and blood ammonia levels in the laying hen.
224. Reddy S. R. R., Campbell J. IF., Comp. Biochem. Physiol., 28, 515—534, 1969. Arginine metabolism in insects: properties of insect far body arginase.
225. Reddy S. R. R„ Campbell J. W., Biochem. J„ 115, 495—503, 1969. Role of arginase in proline formation during silkmoth development.
226. Reddy S. R. R., Campbell J. W., Comp. Biochem. Physiol., 32, 499—509, 1970. Molecular weights of arginase from different species;
227. Reem G. H., J. Biol. Chem., 243, 5695.—5701, 1968. Enzymatic synthesis of 5'phosphoribosylamine from ribose 5-phosphate and ammonia, an alternate first step in purine biosynthesis.
228. Roberts N. R., Coelho R. R., Lowry О. H., Crawford E. J., J. Neurochem., 3, 109—115, 1958. Enzyme activities of giant squid axoplasm and axon sheath.
602
Глава 7
Robertson J. D., Biol. Rev. (Cambridge), 32, 156—187, 1957. The habitat of the early vertebrates.
230. Rockstein M., Biol. Bull., 141, 167—175, 1971. The distribution of phosphoarginine and phosphocreatin in marine invertebrates.
231. Rodwell V. W., pp. 191—235, in: Metabolic Pathways, 3rd ed., Vol._3, ed. by D. M. Greenberg, New York, Academic Press, 1969. Carbon catabolism of amino acids.
232. Rogers L„ J. Comp. Biochem. Physiol., 18, 249—260, 1966. The nitrogen excretion of Chelodina longicollis under conditions of hydration and dehydration.
233. Romanoff A. L., Biochemistry of the Avian Embryo, New York, Interscience (Wiley), 1967.
234. Rowe P. B., Wyngaarden J. B., J. Biol. Chem., 241, 5571—5576, 1966. The mechanism of dietary alterations in rat hepatic xanthine oxidase levels.
235. Rowe P. B., Wyngaarden J. B., J. Biol. Chem., 243, 6373—6383, 1968. Glutamine phosphoribosylpyrophosphate amidotransferase: purification, substructu-- re, amino acid composition, and absorption spectra.
236. Rowsell E. V., Biochem. J., 64, 235—245, 1956. Transaminations with L-glu-tamate and a-oxoglutarate in fresh extracts of animal tissues.
237. Rowsell E. V., Biochem. J., 64, 246—252, 1956. Transaminations with pyruvate and other a-keto acids.
238. Rubin M., Knott L., Clin. Chim. Acta, 18, 409—415, 1967. An enzymatic fluorometric method for ammonia determination.
239. Sallach H. J., Fahien L. A., pp. 1—94, in: Metabolic Pathways, 3rd ed., Vol. 2, ed. by D. M. Greenberg, New York and London, Academic Press, 1969. Nitrogen metabolism of amino acids.
240. Salvatore F., Bocchini V., Nature (London), 191, 705—706, 1961. Prevention of ammonia toxicity by amino acids concerned in the biosynthesis of urea.
241. Schenker S., McCandless D. W., Brophy E., Lewis M. S., J. Clin. Invest., 46, 838—848, 1967. Studies on the intracerebral toxicity of ammonia.
242. Schimke R. T., J. Biol. Chem., 237, 459—468, 1962. Adaptive characteristics of urea enzymes in the rat.
243. Schimke R. T., J. Biol. Chem., 237, 1921—1924, 1962. Differential effects of fasting and protein-free diets on levels of urea cycle enzymes in rat liver.
244. Schimke R. T., J. Biol. Chem., 238, 1012—1018, 1963. Studies on factors affecting the levels of urea cycle enzymes in rat liver.
245. Schimke R. T., J. Biol. Chem., 239, 136—145, 1964. Enzymes of arginine metabolism in mammalian cell culture.
245a. Schimke R. T., Doyle D., Ann. Rev. Biochem., 39, 929—976, 1970. Control of enzyme levels in animal tissues.
246. Schmidt-Nielsen B., pp. 79—103, in: Nitrogen Metabolism and the Environment, ed. by J. W. Campbell and L. Goldstein, London, Academic Press, 1972. Mechanism of urea excretion by the vertebrate kidney.
247. Schmidt-Nielsen B., Mackey W. C., pp. 45—93, in: Clinical Disorders of Fluid and Electrolyte Metabolism, 2nd ed., ed. by M. H. Maxwell and C. R. Kleeman, New York, McGraw-Hill, 1972. Comparative physiology of electrolyte and water regulation with emphasis on sodium, potassium, chloride, urea, and osmotic pressure regulation.
248. Schmidt-Nielsen B., Skadhauge E., Amer. J. PhysioL, 212, 973—980, 1967. Function of the excretory system of the crocodile.
249. Schoffeniels E., Life Sci., 3, 845—850, 1964. Effect of inorganic ions on the activity of L-glutamic acid dehydrogenase.
250. Schoffeniels E., Arch. Int. Physiol. Biochim., 73, 73—80, 1965. L-Glutamic acid dehydrogenase activity in the gills of Palinurus vulgaris Latr.
251. Schoffeniels E., Arch. Int. Physiol. Biochim., 76, 319—343, 1968. The control of intracellular hydrogen transport by inorganic ions.
252. Schoffeniels E., Gilles R., Life Sci., 2, 834—839, 1963. Effect of cations on the activity of L-glutamic acid dehydrogenase.
Выделение продуктов азотистого обмена
603
253. Scholz R. W., Comp. Biochem. Physiol., 36, 503—512, 1970. Comparative studies on liver and kidney xanthine dehydrogenase in two breeds of domestic chicks (Gallus domesticus) during prolonged starvation.
254. Seegmiller J. E., Rosenbloom F. M., Kelley W. N., Science, 155, 1682—1684, 1967. Enzyme defect associated with a sex-linked human neurological disorder and excessive purine synthesis.
255. Sellinger O. Z., de Balbian Verster F., J. Biol. Chem., 237, 2836—2844, 1962. Glutamine synthetase of rat cerebral cortex: intracellular destribution and structural latency.
256. Sharma M. L., Comp. Biochem. PhysioL, 30, 309—321, 1969. Trigger mechanism of increased urea production by the crayfish Orconectes rusticus under osmotic stress.
257. Shaw J., J. Exp. BioL, 37, 534—547, 1960. The absorption of sodium ions by the crayfish Astacus pallipes Lereboullet.
258. Shaw J., J. Exp. BioL, 37, 548—556, 1960. The absorption of sodium ions by the crayfish Astacus pallipes Lereboullet.
259. Shigesada K-> Tatibana M., J. BioL Chem., 246, 5588—5595, 1971. Role of acetylglutamate in ureotelism.
260. Shigesada K., Tatibana M., Biochem. Biophys. Res. Commun., 44, 1117—1124, 1971. Enzymatic synthesis of acetylglutamate by mammalian liver preparations and its stimulation by arginine.
261. Shinoda T., Glassman E., Biochim. Biophys. Acta, 160, 178—187, 1968. Multiple molecular forms of xanthine dehydrogenase and related enzymes.
261a. Shoemaker V. H., Balding D., Ruibal R., McClanahan, Jr., Science, 175, 1018—1020, 1972. Uricotelism and low evaporative water loss in a South American frog.
262. Shorey J., McCandless D. W., Schenker S., Gastroenterology, 53, 706—711, 1967. Cerebral a-ketoglutarate in ammonia intoxication.
263. Siegel S. M., Nathan H. C., Roberts K., Proc. Nat. Acad. Sci., 60, 505—508, 1968. Experimental biology of ammonia-rich environments: optical and isotopic evidence for vital activity in Penicillium in liquid ammonia-glycerol media at —40°.
264. Siegel S. M., Roberts K., Nathan H., Daly O., Science, 156, 1231—1234, 1967. Living relative of the microfossil Kakabekia.
265. Smith H. W., From Fish to Philosopher, New York, Oxford, 1956.
266. Snell K-, Biochem. J., 123, 657—659, 1971. The regulation of rat liver L-alani-ne-glyoxylate aminotransferase by glucagon in vivo.
267. Sonne J. C., Lin I., Buchana J. M., J. BioL Chem., 220, 369—379, 1956. Biosynthesis of the purines: precursors of the nitrogen atoms of the purine ring.
268. Sorenson L. B., J. Clin. Invest., 49, 968—978, 1970. Mechanism of excessive purine biosynthesis in hypoxanthine-guanine phosphoribosyltransferase deficiency.
269. Speeg К. V., Jr., Campbell J. W., Amer. J. PhysioL, 214, 1392—1402, 1968. Formation and volatilization of ammonia gas by terrestrial snails.
270. Speeg К. V., Jr., Campbell J. W., Comp. Biochem. PhysioL, 26, 579—595, 1968. Purine biosynthesis and excretion in Otala (=Helix) lactea: an evaluation of the nitrogen excretory potential.
271. Speeg К. V., Jr., Campbell J. W., Amer. J. PhysioL, 216, 1003—1012, 1969. Arginine and urea metabolism in terrestrial snails.
271a . Spelsberg T. C., Steggles A. W., Chy til F., O’Malley B. W„ J. BioL Chem., 247, 1368—1374, 1972. Progesterone-binding components of chick oviduct. Exchange of progesterone-binding capacity from target to nontarget tissue chromatin.
272. . Spotte S. H., Fish and Invertebrate Culture, New York, John Wiley and Sons, 1970.
273. Stabenau J. R., Warren K. S., Rail D. P., J. Clin. Invest., 38, 373—383, 1959. The role of pH gradient in the distribution of ammonia between blood and cerebrospinal fluid brain and muscle.
604
Глава 7
274. Stadtman Е. R., Ginsburg A., Ciardi J. E., Yeh J., Hennig S. B., Shapiro В. M„ pp 99—118, in: Advances in Enzyme Regulation, ed. by G. Weber, Oxford, Pergamon, 1970. Multiple molecular forms of glutamine synthetase produced by enzyme catalyzed adenylylation and deadenylylation reactions.
275. Stephens G. C., van Pilsum J. F„ Taylor D., Biol. Bull., 129, 573—581, 1965. Phylogeny and the distribution of creatine in invertebrates.
276. Stetten D. W., Bull. N. Y. Acad. Med., 28, 664—672, 1952. On the metabolic defect in gout.
277. Stirpe F., Bella Gorte E., J. Biol. Chem., 244, 3855—3863, 1969. The regulation of rat liver xanthine oxidase. Conversion in vitro of the enzyme activity from dehydrogenase (type D) to oxidase (type O).
278. Strandholm J. J.t Buist N. R. M., Kennaway N. G„ Curtis H. T„ Biochim. Biophys. Acta, 244, 214—216, 1971. Excretion of a-N-acetylcitrulline in citrulli-naemia.
279. Struck J., Sizer I. W., Arch. Biochem. Biophys., 90, 22—30, 1960. Oxidation of L-a-amino acids by chicken liver microsomes.
280. Studier E. H., J. Exp. Zool., 163, 79—85, 1966. Studies on the mechanisms of ammonia tolerance of the guano bat.
281. Studier E. H., J. Exp. ZooL, 170, 253—258, 1969. Respiratory ammonia filtration, mucous composition and ammonia tolerance in bats.
282. Studier E. H., Fresquez A. A., Ecology, 50, 492—494, 1969. Carbon dioxide retention: a mechanism of ammonia tolerance in mammals.
283. Studier E. H., Beck L. R., Lindeborg R. G., J. Mammal., 48, 564—572, 1967. Tolerance and initial metabolic response to ammonia intoxication in selected bats and rodents.
284. Swick R. IE., Barnstein P. L., Strange J. L., J. Biol. Chem., 240, 3341—3345, 1965. The response of the isozymes of alanine aminotransferase to diet and hormones.
285. Tamir H., Ratner S., Arch. Biochem. Biophys., 102, 249—258, 1963. Enzymes of arginine metabolism in chicks.
286. Tamir H., Ratner S., Arch. Biochem. Biophys., 102, 259—269, 1963. A study of ornithine, citrulline and arginine synthesis in growing chicks.
287. Thorson T. B., Cowan С. M., Watson D. E., Science, 158, 375—377, 1967. Potamotrygon spp.: elasmobranchs with low urea content.
288. To jo S., Insect. Biochem., 1, 249—263, 1971. Uric acid production in relation to protein metabolism in the silkworm, Bombyx mori, during pupal-adult development.
289. Tramell P. R., Campbell J. IE., Comp. Biochem. Physiol., 32, 569—571, 1970. Nitrogenous excretory products of the giant South American land snail, Strophocheilus ablongus.
290. Tramell P. R„ Campbell J. W., J. Biol. Chem., 245, 6634—6641, 1970. Carbanyl phosphate synthesis in a land snail, Strophocheilus oblongus.
291. Tramell P. R., Campbell J. IE., Comp. Biochem. Physiol., 40B, 395—406, 1971. Carbamyl phosphate synthesis in invertebrates.
292. Tramell P. R., Campbell J. IE., Comp. Biochem. Physiol., 42B, 439—449, 1972. Arginine and urea metabolism in the South American land snail, Strophocheilus oblongus.
293. Trijbels F., Vogels G. D., Comp. Biochem. Physiol., 30, 359—365, 1969. Catabolism of allantoate and ureidoglycolate in Rana esculenta.
294. Trotta P. P., Burt M. E., Haschenmeyer R. H., Meister A., Proc. Nat. Acad. Sci., 68, 2599—2603, 1971. Reversible dissociation of carbamyl phosphate synthetase into a regulated synthesis subunit and a subunit required for glutamine utilization.
295. Unsworth B. R., Crok E. M., Comp. Biochem. Physiol., 23, 831—845, 1967. The effect of water shortage on the nitrogen metabolism of Xenopus laevis.
296. Unsworth B. R., Balinsky J. B., Crook E. M„ Comp. Biochem. Physiol., 31, 373 377, 1969. Evidence for direct excretion of blood ammonia by an ammo-niotelic amphibian.
Выделение продуктов азотистого обмена
605
297 Van Wagtendonk W. J., Soldo A. T„ pp. 1—56, in: Comparative Biochemistry of Nitrogen Metabolism, ed. by J. W. Campbell, London, Academic Press, 1970. Nitrogen metabolism in protozoa.
298 Vogel R. H„ McLellan W. L., Hirvonen A. P., Vogel H. J., pp. 463—488, in: Metabolic Pathways, 3rd ed., Vol. V, ed. by H. J. Vogel, New York, Academic Press 1971. The arginine biosynthetic system and its regulation.
299. Volpe P., Sawatnura R., Strecker H. J., J. Biol. Chem., 244, 719—726, 1969. Control of ornithine 5-transaminase in rat liver and kidney.
300. Vorhaben J. E„ Campbell J. W., unpublished observations, 1971.
301. Vorhaben J. E., Campbell J. IV., J. Biol. Chem., 247, 2763—2767, 1972. Glutamine synthetase: a mitochondrial enzyme in uricotelic species.
302. Wada EL, Morino Y., pp. 411—444, in: Vitamins and Hormones, ed. by R. S. Harris, I. G. Wool, and J. A. Loraine, New York, Academic Press, 1964. Comparative studies on glutamic-oxalacetic transaminases from the mitochondrial and soluble fractions of mammalian tissues.
303. Wainwright S. D., Bright-Asare P., Campbell J. C., Canad. J. Biochem. 45, 614—618, 1967. Exploratory studies of the liver glutamic dehydrogenase of the hagfish Myxine glutinosa. Lack of regulation on activity by ADP and diethylstilbestrol in physiological saline.
304. Walker J. B., pp. 43—55, in: The Comparative Biochemistry of Arginine and Derivatives, ed. by G. E. W. Wolstenholme and M. P. Cameron, Boston, Little, Brown and Co., 1965. Transamidination and biogenesis of guanidine derivatives.
305. Walser M„ pp. 421—429, in: Urea and the Kidney, ed. by B. Schmidt-Nielsen and D. W. S. Kerr, Amsterdam, Excerpta Medica, 1970. Use of isotopic urea to study the distribution and degradation of urea in man.
306. Warren K. S., J. Clin. Invest., 37, 497—501, 1958. The differential toxicity of ammonium salts.
307. Warren K. S., Nathan D. G., J. Clin. Invest., 37, 1724—1728, 1958. The passage of ammonia across the blood-brain barrier and its relation to blood pH.
308. Warren K. S., Schenker S., Amer. J. Physiol., 199, 1105—1108, 1960. Hypoxia and ammonia toxicity.
309. Warren K. S., Schenker S., Amer. J. Physiol., 203, 903—906, 1962. Differential effect of fixed acid and carbon dioxide on ammonia toxicity.
310. Watts D. C., Watts R. L., Comp. Biochem. PhysioL, 17, 785—798, 1966. Carbamoyl phosphate synthetase in the Elasmobranchii: osmoregulatory function and evolutionary implications.
311. Weir E., Fisher J. R., Biochim. Biophys. Acta, 222, 556—557, 1970. The effect of allopurinol on the excretion of oxypurines by the chick.
312. Wergedal J. E., Harper A. E., Proc. Soc. Exp. Biol. Med., 166, 600—607, 1964. Glutamic dehydrogenase activity of rats consuming high-protein diets.
313. Wergedal J. E., Harper A. E., J. Biol. Chem. 239, 1156—1163, 1964. Effect of high protein, intake on amino nitrogen catabolism in vivo.
314. Westall R. G., Biochem. J., 77, 135—144, 1960. Argininosuccinic aciduria.
315. Wieser W., Schweizer G., J. Exp. Biol., 52, 267—274, 1970. A reexamination of the excretion of nitrogen by terrestrial isopods.
316. Wiggert B. A., Cohen P. P„ J. Biol. Chem., 241, 210—216, 1966. Comparative study of tadpole and frog glutamate dehydrogenase.
317. Wilson R. P., Anderson R. P., Bloomfield R. A., Comp. Biochem. PhysioL, 28, 107—118, 1969. Ammonia toxicity in selected fishes.
318. Wilson R, PMuhrer M. E., Bloomfield R. A., Comp. Biochem. PhysioL, 25, 295—301, 1968. Comparative ammonia toxicity.
319. Wilson R. P„ Davis L. E„ Muhrer M. E„ Bloomfield R. A., J. Animal Sci., 23, 1221, 1964. Toxicity of ammonium carbamate.
320. Winitz M., de Ruisseau J. P., Otey M. C., Birnbaum S. M., Greenstein J. P., Arch. Biochem. Biophys., 64, 368—373, 1956. Effect of combined administration of nonprotective compounds and subprotective levels of L-arginine — HC1 on ammonia toxicity in rats.
606
Глава 7
320а. Wixom R. L., Reddy M. K., Cohen P. P., J. BioL Chem., 247, 3684—3692, 1972. A concerted response of the enzymes of urea biosynthesis during thyroxine-inducted metamorphosis of Rana cateshiana.
321. Wood J. D., Canad. J. Biochem. PhysioL, 36, 1237—1242, 1958. Nitrogen excretion in some marine teleosts.
322. Wrong O., Houghton B. J., Richards P., Wilson D. R., pp. 461—470, in: Urea and the Kidney, ed. by B. Schmidt-Nielsen and D. W. S. Kerr, Amsterdam, Excerpta Medica, 1970. The fate of intestinal urea in normal subjects and patients with uremia.
323. Wu C., Biochim. Biophys. Acta, 77, 482—493, 1963. Glutamine synthetase, intracellular localization in rat liver.
324. Zandee D. L., Arch. Int. PhysioL Biochim., 74, 35—44, 1966. Metabolism in the crayfish Astacus astacus (L.): biosynthesis of amino acids.
325. Zeller E. A., Ramachander G., Fleisher G. A., Ishimaru T., Zeller V., Biochem. J., 95, 262—269, 1965. Ophidian L-amino acid oxidase. The nature of the enzyme-substrate complexes.
326. Zielinska Z. M., Grzelakowska-Sztabert B., Acta Biochim. Polon., 15, 1—13, 1968. Formyl tetrahydrofolate synthetase from a uricotelic insect, Galleria mellonella L. (Lepidoptera).
327. Zieve L., Arch. Int. Med., 118, 211—223, 1966. Pathogenesis of hepatic coma.
328. Zubay G., Chambers D. A., pp. 297—347, in: Metabolic Pathways, 3rd ed., Vol. 5, ed. by H. J. Vogel, Academic Press, New York, 1971. Regulating the lac operon.
Оглавление
Предисловие к русскому изданию......................................... 5
Предисловие к английскому изданию. (Перевод Г. А. Бузникова) ... 10
Введение. Л. Проссер. (Перевод Е. А. Салменковой)......................13
Направления в физиологии...............................................13
Филогения..............................................................14
Концепция вида........................................................ 17
Физиологическая изменчивость...........................................19
Сравнительная экологическая физиология . 22
Сравнительная физиология поведения .................................... 25
План изучения сравнительной физиологии..................................26
Глава 1. Обмен воды; осмотический баланс, гормональная регуляция.
Л. Проссер. '(Перевод Е. А. Салменковой)....................27
Введение............................................................27
Физические аспекты..................................................28
Физические законы обмена между жидкостью и растворенным веществом 31
Биологическое приспособление к осмотическим условиям окружающей среды 36
Осмотическая лабильность клеток.....................................40
Осмотически лабильные многоклеточные животные .(осмоконформеры) . . 44
Ограниченная гипер осмотическая регуляция...........................52
Ракообразные: морские, солоноватоводные, пресноводные и наземные . . 56
Икра морских рыб и пресноводных животных............................83
Адаптация к морской и пресной воде, к почве и к эндопаразитическому существованию ......................................................84
Насекомые...........................................................95
Рыбы...............................................................111
Амфибии.............................................................. 125
Рептилии...........................................................131
Птицы..............................................................135
Млекопитающие......................................................139
Гормональная регуляция осмотического и ионного баланса.............151
Заключение.........................................................157
Список литературы ................................................... 161
Глава 2. Неорганические ионы. Л. Проссер. >(,Перевод М. Д. Гроздовой) 177
Регуляция внутриклеточной концентрации ионов.......................178
Состав жидкостей тела..............................................185
Выделение............................................................ 196
Активный транспорт ионов...........................................202
Менее распространенные элементы и микроэлементы....................218
608
Оглавление
Элементы скелета.....................................................222
Сбалансированная солевая среда ... 224
Заключение...........................................................225
Список литературы....................................................231
Глава 3. Питание. Л. Проссер. (Перевод Е .А. Салменковой) .... 241
Происхождение типов питания....................................... . 242
Потребности в углероде и азоте......................... 246
Идентификация специфических факторов пищи.........................249
Потребность в ‘аминокислотах.........................................253
Особые пищевые потребности некоторых животных . :.................261
Заключение...........................................................277
Список литературы....................................................279
Глава 4. Сравнительная биохимия и физиология пищеварения. (Перевод Е. А. Салменковой)..................................................285
I. Пищеварение. Е. Барнард....................................... 295
II. Сравнительная биохимия пищеварительных ферментов. Е. Барнард . . 295
III. Биохимическая адаптация к пище. Е. Барнард......................310
IV. Способы питания. Л. Проссер......................................319
V. Стимуляция секреции пищеварительных соков. Л. Проссер .... 324
VI. Всасывание. Л. Проссер...........................................328
Заключение...........................................................334
Список литературы....................................................336
Глава 5. Кислород, дыхание и метаболизм. Л. Проссер. (Перевод Л. Н. Гринберга) ....................................................349
Содержание кислорода в окружающей среде..............................349
Поглощение кислорода; внешнее дыхание................................353
Факторы, влияющие на потребление кислорода животными .... 376
Содержание кислорода в среде и интенсивность обмена.............399
Адаптация к нырянию..................................................408
Адаптация к высокогорным условиям................................... 412
Токсичность кислорода................................................413
Секреция газа в плавательный пузырь..................................414
Заключение...........................................................418
Список литературы.................................................. 421
Глава 6. Промежуточный обмен: сравнительные аспекты. П. Хочачка. (Перевод Г. А. Бузникова).............................................430
Метаболические пути..................................................430
Пути гликолиза и глюконеогенеза у различных организмов .... 437
Регуляция метаболизма ...............................................487
Заключение...........................................................525
Список литературы....................................................529
Глава 7. Выделение продуктов азотистого обмена. Дж. У. Кемпбелл. '(Перевод Е. А. Салменковой).........................................536
Введение.............................................................536
Образование аммиака; катаболизм аминокислот .........................538
Токсичность аммиака..................................................545
Пути детоксикации аммиака.......................................... 552
Эволюция путей детоксикации продуктов азотистого обмена .... 565
Регуляция выделения азота............................................584
Список литературы....................................................591