Author: Викторов М.М.
Tags: химия аналитическая химия высшая математика физическая химия издательство химия прикладные расчеты
Year: 1977
Text
011,1
ss -чъ
М.М.Викторов
Методы
вычисления
физи ко - хи м ических
величин
и
прикладные
расчеты
« химия»
19 7 7
М. М. ВИКТОРОВ
Методы
вычисления
физико-химических
величин
и
прикладные
расчеты
ИЗДАТЕЛЬСТВО «ХИМИЯ»
Ленинградское отделение
1977
541
В43
УДК 54.04.001.2
Викторов М. М.
В43 Методы вычисления физико-химических величин
и прикладные расчеты. Л., «Химия», 1977.
360 стр., 50 табл., 202 рис., список литературы 123 назв.
В книге приведены способы расчетов давления паров, плотности,
теплоемкости, растворимости, температур кипения и замерзания рас-
творов, теплопроводности, вязкости, диффузии, поверхностного натяже-
ния, теплот испарения, плавления, критических констант и некоторых
других величин, а также методы графических расчетов по диаграммам
растворимости, энтропийным и энтальпийным диаграммам.
Книга предназначена для,, широкого круга инженерно-технических
работников, проектировщиков . химической, нефтехимической и нефте-
перерабатывающей промышленности, аспирантов, студентов вузов и спе-
циалистов в области процессов и аппаратов химической технологии.
20503-196
050(01)-77 1-7Ь
541
© Издательство «Химия», 1977
Светлой памяти
Георгия Иосифовича
, Микулина
ПРЕДИСЛОВИЕ
Современная наука все больше становится непосредственной
производительной силой общества, мощным средством развития
технической базы, повышения эффективности производства' улуч-
шения качества работы.
Известное выражение, что нет ничего практичнее хорошей тео-
рии, вполне применимо и к теоретическим положениям и выводам
физической химии, которые могут быть положены в основу расчет-
ного определения различных физико-химических величин. Досто-
верное знание последних, а также свойств газов, жидкостей и твер-
дых веществ необходимо для инженерных расчетов и научных
исследований. Экспериментальное же определение таких свойств и
величин сложно и требует значительных затрат времени и
средств. Неизмеримо быстрее и удобнее определять физико-хими-
ческие величины расчетным путем.
Предлагаемая вниманию читателя книга подготовлена по мате-
риалам ряда литературных источников как практическое пособие
по методам расчетного определения ряда физико-химических вели-
чин и свойств веществ. Это определяет характер, структуру и со-
держание книги в целом и выбор методов расчета.
В книге даны некоторые методы расчетного определения важ-
ных физико-химических величин и свойств газов, жидкостей, рас-
творов и твердых веществ, необходимые в прикладных расчетах,
научных исследованиях и при проектировании. Изложенные ме-
тоды иллюстрированы примерами, рисунками, номограммами и
таблицами.
Общей основой расчетов при разнохарактерности содержания
глав, терминологии и их направленности являются: принципы со-
ответственных состояний, аддитивности и конститутивности, зако-
номерности критического состояния, а также некоторые термодина-
мические методы. Расчеты, связанные с высоким давлением и
свойствами растворов, произведены с использованием функций фу-
гитивности и активности, коэффициента сжимаемости и других.
3
Несмотря на разноплановость глав, выдержана единая мето-
дика их построения — изложение необходимых теоретических
положений, расчетное определение прикладных физико-химических
величин и соответствующие примеры расчетов.
При изложении сложного разностороннего и характерного для
каждой главы материала автор встретился с рядом трудностей,
что, возможно, сказалось на содержании книги. Особенно это
относится к единицам измерения, поскольку во многих случаях
существующие эмпирические зависимости столь привычны, что вво-
дить в них различные пересчетные коэффициенты (для перевода
в СИ) неразумно. Кроме того, как правило, эти эмпирические зави-
симости сочетаются с различного рода номограммами; «перестрой-
ка» же последних в координатах СИ — задача специального реше-
ния. По этим причинам в книге, наряду с системой СИ, встре-
чаются и иные системы размерностей.
Автор благодарен докт. техн, наук Р. Ю. Зенюку за подробное
и содержательное рецензирование рукописи, а проф. М. X. Кара-
петьянцу и проф. М. Е. Позину — за советы при написании ее.
Большую работу в плане сопоставления и пересчета различных
систем "размерностей выполнил канд. техн, наук Е. М. Вигдорчик;
автор глубоко признателен ему за проделанный труд; он также
благодарит Е. И. Бурову за помощь при подготовке рукописи к
печати.
Автор
Г лава I
НЕКОТОРЫЕ ПОЛОЖЕНИЯ
ВЫЧИСЛЕНИЙ
ФИЗИКО-ХИМИЧЕСКИХ ВЕЛИЧИН
§ 1. ПРИНЦИПЫ АДДИТИВНОСТИ, конститутивное™,
ПОДОБИЯ И РАВНОВЕСИЯ
Для научных исследований и технических выкладок необходимы ,
данные о различных физико-технических параметрах твердых тел,
газов и жидкостей; параметры эти можно рассчитывать. Цель рас-
четов— получение достоверных данных о физико-химических вели-
чинах и свойствах различных веществ при разных условиях. В ос-
нове расчетов физико-химических величин и свойств веществ лежит
ряд принципов: аддитивности и конститутивности свойств; соответ-
ственных состояний. Кроме того, используют критерии подобия;
зависимости свойств от независимых параметров и приближенных
закономерностей; критические состояния соединений; некоторые
положения термодинамики; функции фугитивности и активности;
коэффициенты сжимаемости и т. д. Эти принципы и положения —
обобщенная основа при изложении ряда глав книги и проводимых
методов расчета. Более подробно о расчетах термодинамических
свойств веществ см. [15, 21, 31, 33, 35, 39, 42, 85].
В простейшем случае аддитивны те свойства, значения которых
равны сумме некоторых составляющих, относящихся к элементам
и атомным группам, образующим данное соединение, т. е. сумми-
руются атомные и структурные составляющие; для молекул с ион-
ными связями суммируются составляющие для ионов, а при
ковалентной связи — составляющие для атомов и связей. Эти
составляющие приведены в соответствующих таблицах (см. ниже).
Расчеты с использованием метода аддитивности дают результаты
достаточной точности для инженерных расчетов. Например, моль-
ная теплоемкость сложных кристаллических веществ примерно
равна сумме атомных теплоемкрстей их элементов, т. е. аддитив-
на. Мольная рефракция органических соединений, равна сумме
атомных рефракций или рефракций связей. Об оценке точности
§
расчетов и о рекомендациях для выбора метода расчета соответ-
ствующей физико-химической величины см. [б, 71].
Свойства, зависящие от строения соединений (рода и числа
атомов, групп атомов, способов их связей и т. д.), обозначаются
конститутивными. Они могут быть рассчитаны по принципу адди-
тивности.
Для вычисления (оценки) значений свойств соединений, харак-
теристики химических процессов, фазовых, химических и иных
' превращений применяют различные методы сравнительных расче-
тов [32]. Последние основаны на сопоставлении значений свойств
одного или двух соединений или на сравнении двух свойств одного
соединения, т. е. на сравнении значений одного свойства в двух
рядах сходных соединений или двух свойств в одном ряду сходных
соединений. Применимы и другие методы и способы расчета. Для
расчетов удобны номограммы [12, 54, 90].
Состояние системы можно определить совокупностью свойств,
связанных друг с другом. Различают экстенсивные и интенсивные
свойства. Первые пропорциональны массе (например, теплоем-
кость); вторые же от нее не зависят (например, температура, дав-
ление) и одинаковы в любой точке системы. Состояние системы,
таким образом, можно характеризовать совокупностью ее интен-
сивных свойств — термодинамическими параметрами состояния
системы.
Основные параметры состояния системы те, которые можно
измерить (например, температура, давление, плотность, концен-
трация и др.). Энтальпию, энтропию, внутреннюю энергию и дру-
гие параметры принято рассматривать как функции основных.
Для определения состояния системы при наличии взаимосвязи
между свойствами (по уравнению состояния) достаточно указать
некоторые свойства. Так, состояние газа задается однозначно,
если указаны два параметра из трех; например, термпература и
давление определяют объем по уравнению состояния системы:
V = f(P, Т).
В гетерогенных системах условие равновесия определяется пра-
вилом фаз Гиббса (законом равновесия фаз). Оно выражает соот-
ношение числа независимых компонентов Л" и фаз Р системы с чис-
лом термодинамических степеней свободы F при равновесии:
FР = Кп (в общем виде). В этом выражении п — число
внешних факторов, влияющих на равновесие системы; при допу-
щении, что из внешних факторов только два — температура и дав-
ление — влияют на состояние равновесия, F ~ К — Р + 2.
Число степеней свободы F (вариантность) равновесной систе-
мы— это число условий (температура, концентрация, давление),
произвольное изменение которых (в известных пределах) не влияет
на число или вид фаз системы; % — наименьшее число независимых
компонентов системы, достаточное для образования всех ее фаз.
От числа степеней свободы зависит вариантность системы: безва-
риантные (F = 0) — равновесие при неизменности всех парамет-
ров; одновариантные (F = 1) — равновесие, определяется одним
6
параметром; двухвариантные (F = 2)—равновесие определяется
двумя параметрами (температурой и концентрацией).
Число фаз системы определяет ее как однофазную, двухфазную,
трехфазную и т. д.
Смеси газов (при небольших давлениях) однофазны; система
соль — вода двухфазна (раствор и пар), а твердых фаз в системе
может быть несколько. Число компонентов в растворах солей — это
то минимальное число ионов, которое может описать данную си-
стему (ионы воды не учитываются).
В системе Н2О(ж.) Н2О(п.) /<= 1, Р = 2, Л = 1 и каждой
температуре соответствует определенное давление насыщенного
пара, т. е. при данной температуре давление насыщенного пара
постоянно и не зависит от объе-
ма. При изменении одного из па-
раметров, например Р (Т =
= const) или Т (Р — const), рав-
новесие нарушается. Это озна-
чает, что число степеней свободы
системы увеличится на 1, т. е.
можно изменять одновременно и
независимо друг от друга Р и Т.
В криогидратной точке сосу-
ществуют 4 фазы — насыщен-
ный раствор, соль, пар и лед; то-
гда К = 2 и F = 0, т. е. равно-
весие сохраняется при закреплен-
ных значениях концентрации,
давления и температуры.
Таким образом, число степе-
ней свободы гетерогенных систем,
Содержание соли, % (масс.)
Рис. I. 1 Диаграмма растворимости
двойной системы (схема правила ры-
чага).
как и константа равновесия для гомогенных систем, позволяет
судить о характере равновесия в системе. Знание числа степеней
свободы и их физического смысла необходимо для успешного про-
ведения технологических процессов.
Правило фаз — основа рациональной классификации равновес-
ных систем, их графического изображения в виде химических диа-
грамм и технических расчетов по ним [1, 11, 18, 23, 30, 36, 41].
Для расчетов фазовых равновесий (испарения, кристаллизации,
растворения и т. д.), когда система заданного состава может быть
представлена фазами известного состава, удобно применить полу-
графический метод, основанный на правилах соединительной пря-
мой и рычага.
По правилам соединительной прямой и рычага фигуративная
точка, характеризующая состав двойной системы, располагается на
прямой, которая соединяет фигуративные точки сосуществующих
двух фаз. При этом длины отрезков, отсекаемых на прямой фигу-
ративной точкой системы, обратно пропорциональны’ количествам
каждой из фаз.
7
Так, на диаграмме растворимости двойной системы (рис. 1.1)
фигуративные точки системы М2, жидкой (раствор) Mi и твердой
(соль В) Р фаз расположены на одной прямой. Точка лежит
на кривой растворимости соли, а точка Р — на вертикали 100%
соли В. Например, ненасыщенный раствор А, содержащий а %
соли В, охлаждается от температуры ti до /2. При понижении тем-
пературы фигуративная точка раствора А перемещается по верти-
кали AAi вплоть до точки Ai на кривой растворимости; в этой
точке раствор становится насыщенным. При дальнейшем охлаж-
дении раствора А] из него начнет выпадать соль до точки Mi, ле-
жащей иа заданной температурной горизонтали t2. Раствор М\
содержит п% соли В (и<а). Продолжение вертикали ААГ до
пересечения с заданной температурной горизонталью t2 дает поло-
жение фигуративной точки системы М2, точками жидкой (раствор)
и твердой (соль) фаз станут Mi и Р.
Таким образом, фигуративные точки жидкой и твердой фаз и
системы расположены на одной температурной горизонтали. Из
диаграммы видно, что отношение количества твердой х и жидкой
у фаз по правилу рычага обратно пропорционально длинам отрез-
ков, прилегающих к фигуративным точкам твердой и жидкой фаз,
т. е.
х Кол-во твердой фазы AfjAfo
у Кол-во жидкой фазы М2Р
Это соотношение применяют и для графического расчета про-
цесса кристаллизации.
При изотермическом испарении ненасыщенного раствора М
относительное содержание соли в растворе увеличивается, точка
раствора М перемещается по заданной температурной горизонтали
до точки М1,' в последней наступает насыщение, сопровождающееся
выделением твердой фазы (изотермическая кристаллизация). Фи-
гуративная точка системы движется по направлению к точке Р,
и чем больше выпало твердой фазы, тем более эти точки сбли-
жаются. Относительные количества твердой и жидкой фаз при
изотермическом испарении, так же как при охлаждении раствора,
определяются отношением х)у — MiM2lM2P.
По правилу рычага можно графически определить количество
испарившейся воды в изотермическом процессе испарения, напри-
мер, при изменении состава раствора от М до Mt (т% и п%
соли В):
Кол-во испарившейся воды ЛШ1 Кол-во испарившейся воДы M\N
Кол-во оставшегося раствора MN ’ Кол-во начального раствора MN
Для определения отношения указанных отрезков (плеч рычага)
на диаграмме измеряют их длины или заменяют отношением чи-
сел, указывающим содержание компонента в растворе.
Принцип смещения равновесий Ле Шателье позволяет каче-
ственно оценить влияние различных факторов внешнего воздей-
ствия на положение равновесия системы, а также направление
изменений в равновесной системе. Если на систему, находящуюся
8
уменьшается, это ослаб-
Рис. 1.2. Диаграмма рас-
творимости двойной си-
стемы КС1—Н2О.
в устойчивом равновесии, воздействовать извне—путем изменения
какого-либо из условий равновесия, то в системе усилится то из
направлений процесса, течение которого ослабляет эффект внеш-
него воздействия. В результате равновесие начнет смещаться в
том же направлении, т. е. в направлении ослабления этого воз-
действия.
Природа внешнего воздействия может быть различной: охлаж-
дение (нагревание), сжатие (расширение) системы; в результате
возникают изменения.
Так, повышение давления смещает равновесие системы в на-
правлении, при котором объем системы
ляет влияние произведенного воздей-
ствия; понижение давления оказывает
противоположный эффект, а именно:
объем увеличивается. Например, для ре-
акции N2.+ ЗН2 2NH3 повышение дав-
ления благоприятствует в определенных
условиях образованию аммиака.
Повышение температуры смещает
равновесие системы в направлении про-
цесса, сопровождающегося поглощением
теплоты; это ослабляет эффект внешнего
воздействия. И наоборот, понижение
температуры вызывает смещение равно-
весия в направлении выделения тепло-
ты. Следовательно, повышение темпера-
туры усиливает эндотермическое направ-
ление процесса; для экзотермических
реакций благоприятно понижение темпе-
ратуры.
Следовательно, принцип смещения
равновесия показывает, как нарушается
устойчивое равновесие под влиянием
внешнего воздействия, а правило фаз устанавливает число пара-
метров, определяющих состояние равновесия системы, и позволяет
выбрать эти параметры, исходя из заданных условий.
§ 2. ПРИМЕРЫ РАСЧЕТОВ
Пример I. 1. 5,2 т 30%-иого раствора КС1 (точка а, рис. 1.2) испаряют при
100 °C; состав раствора изменяется по температурной горизонтали до точки k.
Определить количество воды, испаряющейся на участке ak. Состав конечного рас-
твора k по диаграмме — 37% КС1 и 63% Н2О.
Решение. Начальную систему а можно представить распавшейся на два ком-
плекса: испарившуюся воду (точка g на вертикали воды) и насыщенный рас-
твор k. Тогда по правилу рычага:
X
Кол-во испарившейся воды gfe 37 — 30 7
Кол-во оставшегося раствора ag 30 — 0 30
9
Обозначив массу испарившейся воды через у и массу оставшейся системы
через (5,2 — у), получим
т. е.
—2—== у = 0,986
5,2 — у 30 ’
испарилось 0,986 т НзО.
Определим количество испарившейся воды из 100 кг исходного раствора. Для
этого измерим длину отрезка ak, пропорциональную количеству испарившейся
воды (7 ед.), и длину отрезка gk, которую принимаем за 100 (37 ед.). Тогда
количество испарившейся воды из 100 кг исходного раствора составит:
nh 7
~ 100 = 4-. 100= 18,90/0
gK 61
Пример 1.2. Дан 1 кг плава состава 35% РЬ и 65% Sb при 625°C (точка х,
рис. 1.3). Охладим сплав до 425°C (точка Х[). Определить ход процесса охла-
ждения.
Рис. 1.3. Фазовая диаграмма системы Pb—Sb.
Решение. Из диаграммы плавкости системы РЬ—Sb видно, что прямая xxi
пересекает в точке Хо кривую плавкости Sb при 540 °C. Следовательно, при охла-
ждении плава до 425 °C из него при 540 °C начнет выделяться Sb и изменение
состава системы сместится по кривой АЕ до точки х2, лежащей на заданной тём-
пературной горизонтали 425 °C. Содержание РЬ в жидкой фазе 60%, a Sb —40%.
Таким образом, при охлаждении плава х точка системы переместится в положе-
ние х1( твердой фазы — в точку а и жидкой фазы — в точку х2. По правилу ры-
чага отношение твердой и жидкой фаз системы таково:
Хг — Xi 60 — 35 25
X] — а = 35 — 0 35
Обозначив количество твердой фазы через у и количество оставшегося плава
через 1 — у, получим:
10
Определим другим способом количество выпавшей сурьмы из 1 кг плава.
Для этого измерим длину отрезка x2Xi (60—35), пропорциональную количеству
выпавшей сурьмы, и длину отрезка ах2 (60), которую примем за 1, тогда:
60 — 35
60
= 0,42 кг Sb
При охлаждении плава х3 (95% РЬ и 5% Sb) от 625 до 275 °C точка системы
попадает в положение х4, жидкой фазы — в точку х3 и твердой фазы — в точку Ь.
При этом выпадает РЬ:
х4 — х5
Ь — х6
95-90
100-90
= 0,5 'кг РЬ
При охлаждении плава х от 625 до 246 °C выпадают:
Ех'} 87 — 35
твердая фаза из Sb в количестве-----------------= 0,6 кг;
эвтектика (0,4 кг) — состава 87% РЬ и 13% Sb.
При охлаждении плава х3 от 625 до 246 °C выпадают:
g
твердая фаза из РЬ в количестве----=-=- = 0,62 кг;
эвтектика (0,38 кг) — того же состава.
Вообще при охлаждении плава ниже эвтектической точки твердая фаза со-
стоит из тесного конгломерата компонента и эвтектической смеси.
Пример 1.3. Установить направление смещения равновесия в системе
Н2О(ж.) Н2О(п.) при изменении давления и температуры.
Решение. Увеличение давления приведет к уменьшению объема, т. е. к кон-
денсации пара. Для восстановления нарушенного равновесия нужно понизить
давление до первоначального или повысить температуру до точки кипения под
повышенным давлением, поскольку с ростом давления повышается температура
кипения.
Повышение температуры приведет к процессу, протекающему с поглощением
теплоты, т. е. к парообразованию. Для восстановления равновесия нужно пони-
зить температуру до первоначальной или повысить давление до давления насы-
щенного пара при повышенной температуре, поскольку с ростом температуры
давление насыщенного пара увеличивается.
Пример 1.4. Определить, как изменяется температура жидкости с увеличе-
нием ее поверхности.
Решение. При нагревании жидкости ее поверхностное натяжение умень-
шается, поэтому при увеличении поверхности жидкости ее температура пони-
жается.
Пример. 1.5. Вычислить по аддитивному методу мольную рефракцию бен-
зола СеНб.
Решение. Рефракция соединений — величина аддитивная, т. с. равна сумме
рефракций составляющих атомов и рефракций структурных связей. Тогда для
бензола (см. стр. 25) находим:
Rd = 6 (С) + 6 (Н) + 3 (двойные связи) =
= (6 • 2,418 + 6 • 1,1 + 3 • 1,733) • 10-3 = 26,36 • КГ3 м3/кмоль
Г лава II
ПРИНЦИПЫ ПОДОБИЯ
И СООТВЕТСТВЕННЫХ состояний
[6, 32, 40, 66]
§ 1. ПРИМЕНЕНИЕ ПРИНЦИПА ПОДОБИЯ
Принцип подобия применяют для вычислений как физико-хими-
ческих величин, так и свойств веществ.
Условия изменяемости свойства G от независимого параметра
л для данной группы веществ определяется функцией G — f(n).
Подобие изменений этого свойства сохраняется в пределах данной
группы. Зависимость свойства G от независимого параметра л по-
добна для сравниваемых веществ, если кривые в прямоугольной
системе координат л — G геометрически подобны. Такая система
характеризуется двумя постоянными подобия С. Для каждой пары
соединений (1 и 2) данной группы можно установить константы
подобия.
Так, для любьрс двух соответственных точек с координатами
(л', G') и (л", G") константы подобия характеризуются n'lG'
=» С„; л"/0" « Со.
Предположим, что точке Д' кривой 1 соответствует точка А"
кривой 2 (рис. П. 1,а). Тогда подобие кривых 1 и 2 характеризует
константы подобия (общий случай подобия):
п' _ п . О'
п" + а G"+& °
Если известна зависимость свойства G' вещества 1 от л' (стан-
дартное вещество), то по данному уравнению можно вычислить
свойство G" вещества для любого значения л".
В качестве соответственных в общем случае подбирают две
пары точек с одинаковыми значениями G и л — точки А’ и Д".
Точке Д' с координатами Лд и G'A на кривой 1 соответствует точка
Д" с координатами Яд и G"A на кривой 2, причем G'A — G'A. Также
точке В' с координатами G'B и л^ соответствует точка В" с коор-
12
динатами Gg и л", причем G'B = GB. Для этого случая система
уравнений имеет вид:
ял -с . л'в -с-ь-о- с -1- "л -
4 + Г я’ п^ + а Й~и’ с°“‘’ л'^ + а Л"в + а
После подстановки значений координат и решения системы
уравнений получим значения констант подобия Сл и постоян-
ных а и Ь.
Для расчетов свойства двух сравниваемых веществ л', л" и G',
G" выражают в одинаковых единицах измерения. Тогда для срав-
нения свойства G у двух сравниваемых соединений А и В при раз-
ных значениях независимого параметра л применяют прямоуголь-
ную диаграмму линейности (рис. II. 1,6). Когда зависимость л' от
Рис. II. 1. а — Общий случай подобия зависимости физико-
химических свойств от изменения параметра л для двух сравни-
ваемых веществ, б — Сравнение физико-химического свойства
у двух веществ при разных значениях параметра (диаграмма
линейности).
л" для двух произвольно выбранных соответственных точек А и В
(т. е. для точек с равными значениями свойств сравниваемых со-
единений) одинакова, она сохраняется для каждой произвольно
выбранной пары точек, т. е. можно написать основное уравнение
прямой линии в системе координат л' — л":л' = Сля," + СЛа.
Тангенс угла а наклона этой прямой к оси абсцисс л" равен
Сп; прямая отсекает от оси ординат л' отрезок Сла. Это линейное
уравнение аналогично многим известным зависимостям между
свойствами подобных веществ.
Таким образец, зависимость какого-либо физико-химического
свойства соединений G от изменений независимого пара’метра л
можно выразить в виде универсальной линейной функции, которая
будет одинаковой для всех соединений данной группы.
Последнее лежит в основе весьма важного понятия соответ-
ственных состояний сравниваемых соединений. С теорией соответ-
ственных состояний связана общая закономерность, определяющая
правило линейности функций, а тарке линейность однозначных
13
химико-технических функций (по Павлову). Графически зависимо-
стям в этом случае отвечают прямые линии, что позволяет точно
интерполировать или экстраполировать.
Известны правила линейности:
Дюринга — относительно температуры кипения жидкостей;
Портера — для температур, при которых две жидкости имеют
одинаковую вязкость;
Гарриса — для температур, при которых мольные концентрации
насыщенных растворов двух соединений одной и той же группы
одинаковы, и некоторые другие.
В этих случаях зависимость температур для соответственных
точек, т. е. для точек с равными значениями свойств (давления
Рис. II. 2. Диаграмма линейности для определения вяз-
кости.
пара, вязкости, растворимости и др.) сравниваемых соединений,
линейна. Для таких расчетов выбирают стандартное соединение
(эталон), для которого известна зависимость свойств G от пара-
метра л; кроме того, свойства и структура эталона и сравнивае-
мого соединения должны быть близкими.
Пример II. 1. Вычислить вязкость С6Н5С1 при 60 °C, если известны его зна-
чения при — 10 и t" = 100 °C: ц." — 0,91 • 10-3 и = 0,37 • 10-3 Па • с.
Решение. Примем за стандартное соединение (эталон) этиловый спирт. Ис-
пользуя справочные данные, устанавливаем температуры, при которых р,' этило-
вого спирта та же, что и у хлорбензола ц" : = 35,1 °C при и t.2 = 86 °C при ц".
Затем строим диаграмму линейности в координатах f — t" (рис. II. 2), на кото-
рой отмечаем точки: 1 — с координатами = 35,1 и t" — 10 °C; 2 — t2 = 86 и
f"=100 °C.
Через точки 1 и 2 проводим прямую. Точки последней при разных темпера-
турах характеризуют одинаковые вязкости эталона и хлорбензола.
14
От заданной на оси ординат точки Р (60 ®С) проводим прямую до пересече-
ния с прямой 1—2 (точка Л4). Пересечение прямой MR с кривой в точке S дает
искомую вязкость хлорбензола при 60°C (точка Q): 0,52-10-3 Па с.
При наличии шкалы вязкости наносят кривую р/ — р" зависимости извест-
ных значений вязкости этилового спирта (эталон) от температуры.
Возможно решение и по уравнению:
я'А л'в 35 86
па + а лв + а 10 +а 100+а
Откуда а = 51. Тогда
Ся = пг+ .г = 0,573; + = Сял" + Сяа = 0 573 60 + 0,573 51 = 63,6 °C
IU “р 01
По справочнику вязкость этанола при 63,6°C ц' = 0,52-10“’ Па-с, что со-
ответствует искомой вязкости хлорбензола при 60°C (0,52-10-3).
§ 2. ПРИМЕНЕНИЕ ПРИНЦИПА СООТВЕТСТВЕННЫХ СОСТОЯНИЙ
Принцип соответственных состояний — дальнейшее развитие
теории подобия зависимости свойств соединений от независимых
параметров [32]. Эту зависимость можно выразить на диаграмме
в виде кривых с координатами Силв физических единицах тип.
Когда во всех сравниваемые системах единицы т и п, в которых
выражаются бил, выбраны по одному методу, то в каждой си-
стеме числа их будут иными, но значения безразмерных координат
в соответственных точках сравниваемых систем будут одинако-
выми. Это есть так называемые инварианты — безразмерные пере-
менные одной кривой, общей для всех соединений данной группы.
Координатная система инвариантов позволяет выразить на одной
диаграмме зависимость свойства G от независимого параметра л
для многих соединений на одной кривой.
Во многих случаях сравниваемые соединения находятся в так
называемых соответственных состояниях, когда безразмерные при-
веденные параметры равны. Например, для реальных газов такими
соответственными точками являются их критические состояния.
Координаты критических точек Тцр, РКр и Укр удовлетворяют тре-
бованиям, предъявляемым к единицам т и п, выбранным при вы-
числении значений инвариантов подобных систем. Вычисленные
значения этих инвариантов (их называют приведенными парамет-
рами) с использованием критических параметров равны:
Т Т . П — Р . V _________ мол
1 пр — -у , 'пр-р , v пр — ТТ
1 кр ~кр v мол. кр
В приведенных параметрах отсутствуют постоянные, характер-
ные для данного вещества (газа)..
Соответственными обозначаются состояния двух или несколь-
ких веществ, когда, например, приведенные температуры, давления
и объемы этих веществ равны между собой. При одинаковых при-
веденных температурах и давлениях вещества должны обладать
одинаковым приведенным объемом.
15
Тогда для многих реальных газов обобщенное приведенное
уравнение состояния выразится, например, в виде Рпр =
= f (Tup, VUp). Общая функция приведенных переменных выра-
зится в виде ДТПр, Pup, Vnp) == 0. Здесь Тпр, Рар, Vnp — параметры
уравнения соответственно равные, когда сравниваемые соединения
находятся в соответственных состояниях.
Приведенное уравнение является общим для любых веществ и
показывает, что два различных вещества (газа), у которых две из
трех приведенных переменных одинаковы, имеют также и одина-
ковую приведенную третью переменную. Для веществ в соответ-
ственных состояниях некоторые свойства нахрдятся в простых
соотношениях (например, вязкость, коэффициенты расширения,
сжимаемости и другие свойства). Этот принцип позволяет иногда
примерно определить свойство данного вещества, если первое из-
вестно для других соединений, близких по составу и строению.
На основе принципа соответственных состояний можно вывести
обобщенные зависимости инвариантов разных физико-химических
величин от приведенных параметров (например, инварианта коэф-
фициентов теплопроводности и вязкости, давления паров и т. д.)
и обобщенные зависимости для различных физико-химических
свойств веществ.
При определении инвариантов, например, коэффициента сжи-
маемости жидкости или мольных объемов за нулевую точку тем-
пературной шкалы принимают температуры кипения или плав-
ления соединения. Тогда приведенная температура равна:
0 = (Т — Тпл)/(ТКр — Тпл)- При 01 = 02 соединения 1 и 2 нахо-
дятся в соответственных состояниях. Свойства водорода и гелия
подчиняются принципу соответственных состояний, если их при-
веденные параметры выразить так:
Т Р
7’пр== Гкр + 8 ; = Ркр + 8
(Р — в атм).
Например, сравнение мольных объемов следует выполнять в
соответственных состояниях при равных значениях поверхностного
натяжения и т. д.
Данные о свойствах соединений и их взаимосвязи могут быть
получены также из приближенных закономерностей и зависимо-
стей на основе принципа соответственных состояний методом срав-
нительных расчетов (см. известную монографию М; X. Карапетьян-
ца [32]). Методы сравнительных расчетов основаны на сопоставле-
нии значений свойств (одного или двух) нескольких соединений и
на сравнении двух свойств одного соединения, т. е. на сравнении
значений одного свойства соединения в двух рядах сходных соеди-
нений и двух свойств в одном ряду сходных соединений.
Известно, что Д. И. Менделеев широко пользовался сравни-
тельным методом. Он указывал, что «...надежный путь сравни-
тельного изучения, которого я старался держаться, скорей приве-
дет к той цели, которую стремятся достичь химики», И далее
16
«Многие химические выводы приобретают новый смысл и значе-
ние, замечается правильность там, где без того они ускользнули бы
от внимания» [47].
Метод сравнительных расчетов позволяет предсказать свойства
новых соединений, выявить их структуру, химическое взаимодей-
ствие, установить закономерность (линейную) в изменении свой-
ства, взаимосвязь между свойствами и структурой соединений.
Применяя этот метод, можно получить некоторые опытные вели-
чины, по которым остальные величины определяют расчетом. Ис-
пользуя такой общий подход, можно составить на основе системы
сравнительных методов расчета соответствующие алгоритмы для
ЭВМ*. х
§ 3. НЕКОТОРЫЕ ОПРЕДЕЛЯЮЩИЕ КРИТЕРИИ
Как указывалось, многие соединения находятся в соответствен-
ных состояниях тогда, когда приведенные параметры равны. От-
сюда, в общем, по принципу соответственных состояний значение
критерия Ван-дер-Ваальса К должно быть одинаковым для всех
сравниваемых соединений:
К = RT кр/ЛкрУмол. кр
Однако равенства приведенных параметров иногда недоста-
точно для установления соответственных состояний сравниваемых
соединений: необходимо еще равенство третьего параметра А, опре-
деляющего сходность сравниваемых соединений, принадлежность
их к одной группе (А — так называемый определяющий критерий).
В этом случае общая зависимость для соответственных состояний
имеет вид: Рпр = КТщ,, Упр, А).
Значение определяющего критерия А можно по-разному связать
со значением указанного критического коэффициента К (или дав-
ления насыщенного пара). Например, зависимость для пара Рпр
от Гдр не укладывается на общую кривую, а получается пучок по-
добных кривых — из-за разницы между группами соединений. Из-
вестны разные выражения зависимости коррелирующих безразмер-
ных величин критических параметров (определяющих критериев)
от приведенной температуры (сс, w и др.).
Так, по Риделю зависимость безразмерной величины а — ха-
рактеристического (критического) параметра — от приведенной
* Общими методами сравнительного расчета физико-химических свойств ве-
ществ пользуются для интерполяции или экстраполяции по свойствам или соеди-
нениям. При изучении закономерностей в изменениях каких-либо свойств на
основе методов сравнительного расчета пользуются переходом от единичного к
нескольким сопоставлениям (т. е. на графике вместо одной появляются несколько
прямых линейной зависимости). Эти сопоставления расширяют область приме-
нения системы методов сравнительных расчетов и позволяют установить связь
между отдельными методами, т. е. предлагается метод комбинированного расчета
физико-химических свойств соединений [34]. Метод комбинированного расчета
включает интерполяцию и экстраполяцию- по параметрам, а экстрароляццкь~4
по соединениям п свойствам. — -g g С) IlkFZT/
v
температуры:
_ т dP _ d lg P dtgP„p
~ ~p ~dT ~ ~d\gf d igтпр
(P — давление насыщенного пара).
(Величина критического параметра аналогична определяющему
критерию Л.)
По Риделю для неассоциированных жидкостей зависимость мо-
жет быть выражена соотношением:
К = 3,72 + 0,26 (акр - 7)
Значение критического коэффициента К постоянно при акр = 7
(фактически значения аКр от 6 до 8). Значение акр:
по Миллеру — акр — 0,9076 fl ”Р' К™-—\
V 1 * пр. кип /
акр = 0,9076 (1 + f ! “кр = °>9076U + I0 1п Лф/(1 - 6)1)
(Тпр. кип — приведенная температура кипения; 0 = Ткип/Ткр; Р — в атм)
по Альтенбургу - акр = 3,75 + 5 0 _ 8 )
Для определения (число внешних электронов) суммируют
числа электронов по элементам:
HCNPOSFCIBrI
145 5667777
Когда известен критический параметр аКр, можно использовать
различные зависимости для вычисления многих физико-химических
свойств соединений.
Питцер, Липпман, Кэрл, Хаггинс, Петерсен и другие предло-
жили в качестве определяющего параметра безразмерную вели-
чину— так называемый «ацентрический» фактор о (коррелирую-
щий параметр, характеризующий асимметрию молекул) или харак-
теристическое число:
<а = — 1 — lg Р'
ь пр
(ЛпР — приведенное давление насыщенного пара при Тщ, = 0,7,
принятой условно за температуру сравнения свойств соединений).
При неизвестном давлении пара значение характеристического
числа таково:
3 lg FKn
7r——г; ® = 0,1745 - 0,08387np
• 1 кр/ J КИП 1 r
(/’кр — В атм).
15
Зависимость Между w и аКр!
<в = 0,2033акр — 1,181; акр = 5,808 + 4,930(0
по Альтенбургу - <в « 0,6 0 _ 8 + JffiSAT )
3 о
по Эдмистеру. — <в + 1 = — j _ §~ 1g ^кр (0 = ТКИП/Ткр; Ркр — в атм)
Коэффициент сжимаемости в критической точке:
1 Лкр Киол. кр
ZKp = -^-==
(Ркр — в атм)
по Лидерсену — zKp ------------ _3'-2-------(£Исп. кип — мольная теп-
3,43 + 6,7-10 Аисп кип
лота испарения жидкости при Гкип, ккал/моль)
1
3,72 + 0,26 (акр - 7)
для неассоциированных жидкостей — zKp =
= 1,28<о + 3,41
Значения параметров г1:р , СХ-кр, и приведены ниже:
гкр “кр <0 гкр “кр <0
0,20 11,92 1,242 0,26 7,46 0,341
0,21 11,00 1,056 0,27 6,94 0,230
0,22 10,17 0,887 0,28 6,43 0,126
0,23 9,53 0,756 0,29 5,95 0,030
0,24 8,72 0,591 0,30 5,51 -0,060
0,25 8,08 0,461
Приближенная линейная зависимость: zKP = 0,291 —0,080ц>.
Для ассоциированных соединений (аммиак, этанол, вода, окись
азота) введена величина гкр в качестве второго определяющего
критерия (кроме аКр)- Тогда приведенное уравнение состояния для
многих газов и жидкостей (например, по Гиршфельдеру) запи-
шется так:
Ррр=Р(Рпр> Ктр, акр, 2кр)
Итак, определяющие критерии (числа) для соответственных со-
стояний (по аналогии с термодинамическими) выражаются безраз-
мерными зависимостями:
РТкр
критерий Ван-дер-Ваальса — Wa (К) = ~=——
кр
(Т dPX (dPap\
критерий Риделя - Ri (акр) = 1 = I
1 я 1 пр Р
Wa = 3,72 + 0,26 (Ri - 7); co = 0,203 (<хкр - 7) + 0,242
Т
критерий Гульдберга — Gu = тк^”- 0,635 (Р 1 атм)
J кр
критерий Тругона - Tr = — = 10,6; £и"п- ки-~ « 21,3
А-* КИП 1 КИП
Для многих неассоциированных соединений:
Тг = 10,6+ 1,24 (Ri — 7)
19
Зависимость Кайете и Матиаса
V ("у I” "у = 1 + е (1 — Тпр)
" \ ’ пр. ж •'пр, п /
где 1/Пр. ж, 14р. п — приведенные мольные объемы кипящей жидко-
сти и насыщенного пара; Тпр~ TjTKp — приведенная температура;
е —'Коэффициент.
Критерий (число) Матиаса: Mt = е (по Планку).
Критериальное уравнение состояния реального газа (безраз-
.мерное) по Планку: /(^пр, Кпр, Рпр, Тг, Gu) = 0.
Ацентрический фактор (критерий), характерное число Пит-
цера:
Pi = (О = — 1g Рпр. 0,7 — 1
(Рпр. о,7 — приведенное давление при условной Тпр = 0,7).
Критериальное уравнение по Бадылькесу:
7-ИСП. КИП О. ( dPпр \
кип ^кип/^кр’ \^7Пр/кр
Тогда Ri ~ GuTr (для неассоциированных жидкостей).
Пример II. 2. Вычислить-значение критического параметра акр и <о для уксус-
нопропилового эфира СН3СОООС3Н7.
Решение. Применим формулу Альтенбурга: акр = 3,75 + 50 — 0 288А )*
Значение Na = 5(C) + 10(H) + 2(0) = 5(4)+ 10(1)+ 2(6) = 42.
Тогда: «кр = 3,75 + 50— 8 Q 42)=* 7’25; а = 0,27 (см. стр. 19).
Пример II. 3. Вычислить фактор ацентричности а и коэффициент акр то-
луола СбН5СН3, зная Ркр = 41,6 атм, ТКР = 592 К, Ткип = 384 К.
Решение. По Эдмистеру: 6 = ТКИп/7кр=384/592=0,648; и + 1 = у j ^.’^4gX
Xlg 41,6 = 1,275;. а = 1,275 — 1 = 0,275 (опытное значение а = 0,252).
Расчет можно вести и по формуле Миллера:
, 0,648 to 41,6 \
аКр - 0,9076 0 + j _ 0,648 J - 7,21
При а = 0,275 искомый акр = 2,7 (см. стр. 19).
Г лава III
ПОЛЯРИЗУЕМОСТЬ И ДИПОЛЬНЫЙ МОМЕНТ.
ПАРАХОР, ОРТОХОР, РЕОХОР.
РЕФРАКЦИЯ, МОЛЬНЫЙ ОБЪЕМ ЖИДКОСТИ
[6, 8, 20, 40, 46, 66, 71]
$ 1. ВЫЧИСЛЕНИЕ ЗНАЧЕНИЙ ПОЛЯРИЗУЕМОСТИ
И ДИПОЛЬНОГО МОМЕНТА
Под воздействием электрического поля происходит поляриза-
ция молекул и ионов вещества. В зависимости от происходящего
различают поляризации: электронную РЭя (смещение электронов
относительно ядра атомов); атомную Рат (относительное смещение
атомов в молекуле) и ориентационную Рор (ориентация полярных
молекул в направлении поля).
Сумма электронной и атомной поляризации называется дефор-
мационной: Рд — Рэл + Рат- Величина, характеризующая способ-
ность молекул, атомов или ионов к такой поляризации, отнесенная
к единице напряженности внешнего поля, называется поляризуе-
мостью. Дипольный момент ц молекул, атомов или ионов, наводи-
мый внешним электрическим полем, можно считать пропорцио-
нальным напряженности Е: •
у. = 4лво<хЕ (СЙ) или р = аЕ (СГС)
Здесь во — абсолютная диэлектрическая проницаемость: е0 =
= 107/4лс2 = 8,85419-10-12 Ф/м; а— момент, индуцируемый полем;
с — скорость распространения электромагнитных волн в вакууме,
с = 2,997925-108 м/с.
Электронная поляризация происходит в молекулах, атомах или
ионах; атомная — в молекулах или сложных ионах; ориентацион-
ная — в полярных молекулах.
Поляризуемость молекулы является суммой:
« = «эл + «ат + «ор
Общая поляризация молекул слагается:
Р — Рэл + Рат + Pop
.Общая поляризация (мольная) описывается уравнением.
4 4 4 4
Р = -= яМо«эл + V лЛ(о«ат + -й- лУо«ор = -=- nNoa (in. 1)
и О О О
где No = 6,022-102® кмоль-1 — число Авогадро.
21
Из этих слагаемых определяют значение общей поляризуемости
а (в м3) для технических расчетов. Атомная и электронная поля-
ризация не зависят от температуры, а ориентационная поляриза-
ция уменьшается с ее повышением.
Электронная поляризуемость приближенно равна кубу радиуса
молекулы (условно имеющей объем сферы) о/2: аэп ~ о3/8.
Для некоторых неполярных молекул, когда аат = 0 и аор = О,
значение поляризации таково:
4 4 ст3
Р = ~ nWоССэл — о ~ Nо^мол — Vмол
4 <у3
где пМол — ---объем молекулы, а УМол — объем молекул в
1 кмоль.
Поляризуемости аэл молекул, не являющихся жесткими ди-
полями (аат = 0 и а.Ор = 0), можно примерно оценить, зная, что
постоянная b в уравнении Ван-дер-Ваальса равна 4УМ0Л; поэтому
Р = Ь/4. Следовательно, приближенное значение поляризуемости:
«эл = 36/16л#о
Значение Рат составляет в среднем 3—5% от Рал.
Поляризуемость молекулы можно упрощенно вычислить, зная
поляризуемости составляющих ее связей (табл. III. 1).
Таблица 111.1
Поляризуемость а • 10 (м3) в направлениях главных осей молекул
Поляризуе- мость С12 но H2S so2 NH3 NO со2 CS2 С2Н2 СН3ОН
а. 6,6 3,13 4,21 5,49 2,42 5,32 4,10 15,14 5,12 4,00
а2 3,62 2,39 3,21 2,72 2,18 1,83 1,93 5,54 2,43 2,56
«3 3,62 2,39 3,93 3,49 2,18 1,83 1,93 5,54 2,43 3,14
Ниже приведены составляющие электронной поляризуемости
атомов, входящих в различные группы:
Группа а-Ю30, м3 Группа а-1030, м3 Группа а*1030, м3
F 0,38 О (в гидроксиле) 0,59 С 0,93
Cl 2,28 О (в эфире) 0,64 СН2 1,77
Br I 3,34 О (в карбониле) 0,84 Двойная связь — 0,58 прибавить 5,11 N (первичный) 0,87
CN 2,12 N (вторичный) 0,93 Тройная связь-— 0,86 прибавить
H 0,42 N (третичный) 1,03 С6Н5 9,38
Поляризуемости в направлении главных осей молекулы, в об-
щем, неодинаковы, поэтому приводят усреднение (см. табл. III. 1):
а, + а? + «з
3
22
Поляризуемость можно вычислить также, используя значения
мольной рефракции Rd (см. ниже). Поляризуемость молекул (не-
полярных) такова: аэл = 3RD/4nN0.
Выше даны составляющие электронной поляризуемости аЭл,
приближенные средние значения которой вычисляют суммирова-
нием.
Молекулы, обладающие несимметричным распределением элек-
трических зарядов, будут полярными. Степень полярности моле-
кулы характеризует величина дипольного момента. Система из
двух электрических зарядов, равных по величине, но противопо-
ложных по знаку и расположенных на некотором расстоянии друг
от друга, называется диполем. Произведение величины одного из
зарядов е, образующих диполь, на расстояние между зарядами I
(плечо диполя) есть дипольный момент:
Й = el или Рэл = QI Кл • м
Смещение электрических зарядов I равно ~10-10 м, а элемен-
тарный электрический заряд Q = 1,602-10-19 Кл (4,8-10—10 ед. кол.
эл., СГС). Значения дипольных моментов заключены в интервале
0—10~29 Кл-м *.
Многие молекулы представляют собой «готовые» жесткие ди-
поли, момент которых увеличивается при воздействии на них элек-
трического поля. Последнее увеличивает поляризацию молекулы,
раздвигая еще дальше заряды (индуцирует диполь), ориентирует
диполи в направлении поля.
Значительным дипольным моментом обладают сильные элек-
тролиты, многие органические молекулы, в которых электроны
смещены в направлении электроотрицательных групп. Следует
отличать полярность молекулы в целом от полярности отдельных
содержащихся в ней связей.
Определяя опытным путем дипольные моменты молекул, мож-
но установить, например, структуру их.
Дипольные моменты молекул можно вычислить, например,
зная мольную поляризацию, составляющая которой — ориента-
ционная поляризация. Зависимость аор от Т имеет вид
где р — дипольный момент, Кл-м; k=R/No = 1,3806-10-23 Дж/К—
постоянная Больцмана (k = 1,3805-10-16 эрг/К) •
Подставляя уравнение (III. 2) в (III. 1), получим выражение
для мольной поляризации по Дебаю:
Р = 4 лУо (аат + аэл) 4- 1 й2 (II 1.3)
О У &QK1
По (III. 3) можно вычислить ц, измеряя поляризацию при
разных температурах. Из этого же уравнения следует, что
* В литературе иногда используют в качестве единицы дипольного момента
молекул дебай (ID — 3,33564-10~3° Кл-м = 10~18 ед. дип. мом., СГС).
23
мольная поляризация линейно зависит от 1/7, т. е.
Р = А + BIT
(III.4)
где Л = т лЛГоа, В == й2 = й2-
Подставляя в В численные значения, получим: й— 1,353786 •
• ПГ^УяКл • м.
Для определения дипольного момента составляют график
Р = /(1/Т); по тангенсу угла наклона прямой находят В и вычис-
ляют й по (III- 4). '
Дипольный момент можно вычислить также, если известна
4
мольная рефракция: Ро~ у^оаэл (аат и аор равны нулю).
Например:
для газов — (1 = 1,34988 • 10 30д/(Р — PD)T Кл-м
для растворов — ji = 1,34988 • 10 30 л/(Рт — RD) Т Кл-м (Род—поля
ризация бесконечно разбавленного раствора)
м Rg и
240
220 - - 1,80
200
180 100 - -1,60
160 80 ;
60- -
140 -
120 40- -1,40
Г ! - -
100 /20- -1,30"
80 0, - / /-х*
/ 10-
60 / / L 6- -1,20
-1,15
40 - 1,10
р, г/см 2
-г- 0,6
--0,7
.'''-0,8
--0,9
--1,0
--1,1
--1,2
--1,3
- И
- 1,5
Рис. III. 1. Номограмма для определе-
ния мольной рефракции (1 дин/см =
= 10-3 Н/м).
Между мольной поляризуе-
мостью Р и диэлектрической
проницаемостью е существует
зависимость:
_ е — 1 М 4 ,, _ „
е + 2 “у-Т яЛ^“ ~ 2,52 ’
• 1027а м3/кмоль (2,52- 1021а см3/моль)
Зная е при разных темпе-
ратурах, можно вычислить ди-
польный момент молекулы, по-
казатель преломления, моль-
ную рефракцию.
В полярных веществах при-
тяжение между молекулами
более сильно, нежели в непо-
лярных. Полярная структура
молекул оказывает влияние на
многие свойства соединений.
Так, молекулы воды, обладаю-
щие высокой полярностью,
имеют высокую активность
при химическом взаимодей-
ствии (например, диссоциация
электролитов, их раствори-
мость и др.). Отмечено, что
газы, молекулы которых по-
лярны, растворяются лучше в полярных растворителях, а неполяр-
ные газы с более высокой критической температурой лучше рас-
творяются в неполярных растворителях. Полярные вещества
должны иметь более высокие температуры кипения, большие теп-
лоты испарения, чем неполярные,
84
§ 2. Вычисление мольной рефракции
Мольную рефракцию RD можно определить по номограмме
(рис. III. 1), если известны коэффициент преломления п, плотность
р и молекулярная масса вещества М, или по формуле Лорентц—
Лоренца:
п2 — 1 м
п2 + 2 р
Диэлектрическая проницаемость е неполярных жидкостей и по-
казатель преломления п прозрачного диэлектрика связаны выра-
жением: е=-п2 (кроме молекул, имеющих собственный диполь-
ный момент).
Значение Rd (как и электронной поляризуемости) может быть
вычислено (приближенно) аддитивно суммированием приводимых
ниже составляющих:
Атом или связь Составляю- щая*^, мЗ/кмоль Атом или связь Составляю- щая* 103, мЗ/кмоль
н 1.Ю СН2 в (СН2)„ 5,618
с 2,418 соо 6,154
С1 5,967 Двойная связь 1,733
Вг 8,865 Тройная связь 2,398
I 13,90 Трехчленное коль- 0,71
F 0,81 цо
0 (в гидроксиле) 1,525 Четырехчленное 0,48
0 (в карбониле) 2,211 кольцо
О (в простом 1,643
эфире)
Если собственные диполи отсутствуют (р = 0), то мольная ре-
фракция равна мольной, поляризации: Р = Pan. = Rd. При наличии
собственных диполей можно для волн большой длины принять RD
равной индуцированной поляризации:
P = Rd + ^-^~ = Rd + B/T (Ш.5)
Зная е и п, по формуле (III. 5) определяют р..
Кроме того:
для углеводородов — Дн = 0,6 Држ
для органических жидкостей — п =
2^О + У
V~*D
«293 = 1 + 0,3218р°-837’°'р17^’006 (р - г/см3); No = 6,022 • Ю"23 моль"1
$ 3. МЕЖМОЛЕКУЛЯРНЫЕ силы.
ВЫЧИСЛЕНИЕ ЭНЕРГИИ ВЗАИМОДЕЙСТВИЯ
Кинетическая теория учитывает силы притяжения и отталки-
вания между молекулами. Взаимодействие полярных молекул при-
водит к их. притяжению; этот вид взаимодействия называют
26
Ориентационным. Энергия взаимодействия двух диполей выра-
жается отношением:
Р______2 ( Й1Й2 V 1
0₽ 3 \ 4ле0г3 J kT
(г— расстояние между диполями).
Как видно, энергия межмолекулярного взаимодействия умень-
шается с повышением температуры.
Кроме ориентационного возможно и индукционное взаимодей-
ствие, возникающее тогда, когда в неполярных молекулах инду-
цируются под воздействием соседних молекул или ионов (в осо-
бенности при их сближении) диполи.
Энергия индукционного взаимодействия не зависит от темпе-
ратуры и определяется дипольным моментом молекул и их поля-
ризуемостью а: ' - .
Е = . «й2
Ьинл 2ле0г®
Помимо указанного, возникающие в атомах и молекулах при
вращении электронов мгновенные диполи также вызывают взаим-
ное притяжение молекул, называемое дисперсионным.
Потенциальную энергию взаимодействия двух молекул, как
суммарную указанных взаимодействий трех типов сил притяже-
ния, можно выразить
£пр = - с/г6
где с — величина, зависящая от дипольного момента и поляризуе-
мости молекул.
При тесном сближении молекул проявляются и силы взаимного
отталкивания, потенциальная энергия которого равна:
£от = dlr“
Значение </==8 + 0,288 /VA или </=12 (Л/А— сумма внешних
электронов молекулы).
Потенциальная энергия взаимодействия двух молекул выра-
жается известным межмолекулярным потенциалом взаимодействия
(при q = 12) Леннарда — Джонса:
^Ч(г),! ~(т Л
Константы этого потенциала могут быть использованы, напри-
мер, для расчета вязкости неполярных газов (г — расстояние меж-
ду молекулами; а и <Fo — постоянные сил, зависящие от взаимодей-
ствия молекул).
Значения постоянных о и определяют по эмпирическим за-
висимостям, используя, например, коэффициенты вязкости, тепло-
проводности, или на основе методов статистической механики
(табл. III. 2).
26
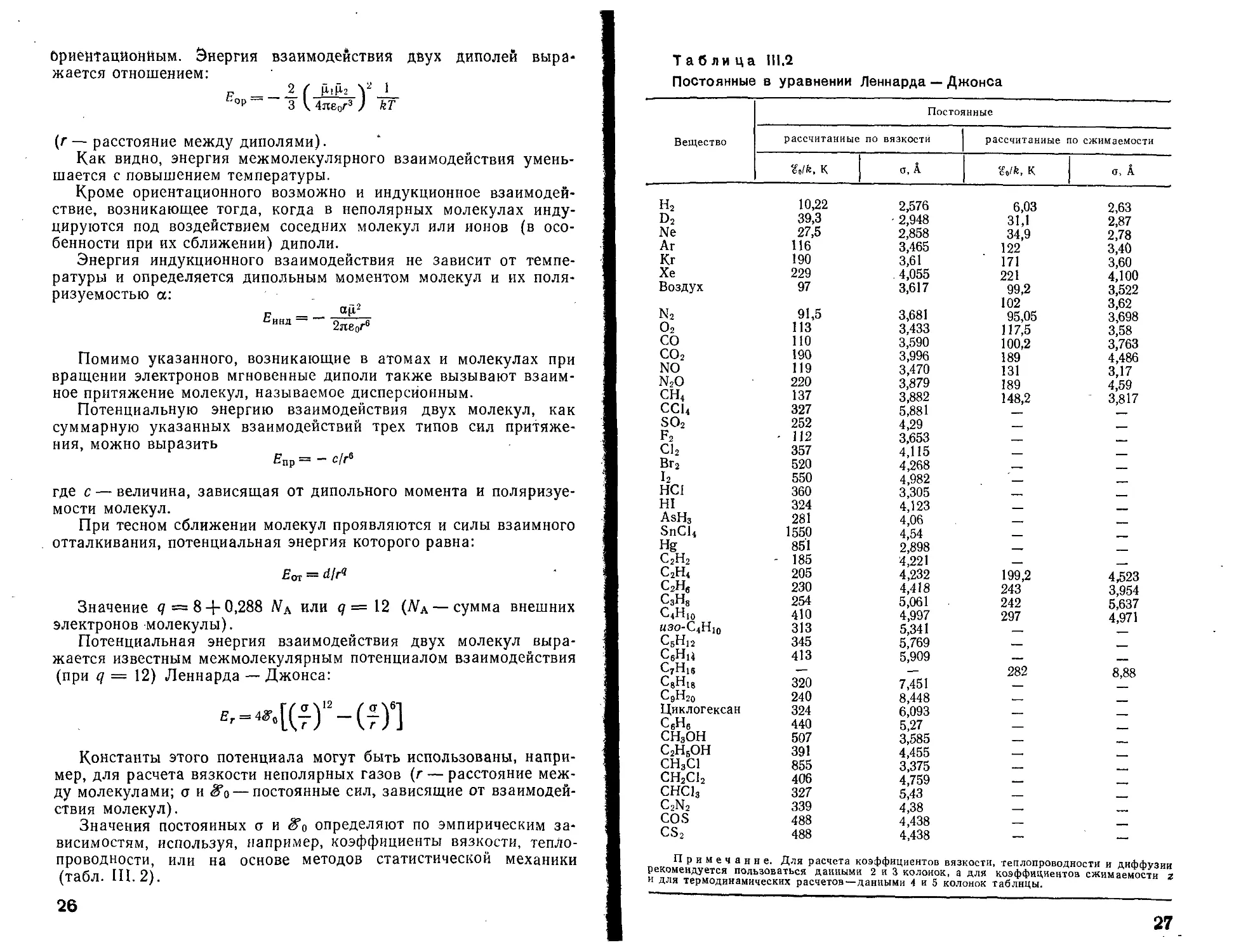
Таблица 111.2
Постоянные в уравнении Деннарда — Джонса
Вещество Постоянные
рассчитанные по вязкости рассчитанные по сжимаемости
к а, А ^olk, к а, А
н2 10,22 2,576 6,03 2,63
d2 39,3 • 2,948 31,1 2,87
Ne 27,5 2,858 34,9 2,78
Ar 116 3,465 122 3,40
Кг 190 3,61 171 3,60
Хе Воздух 229 97 4,055 3,617 221 99,2 4,100 3,522
91,5 102 3,62
N2 3,681 95,05 3,698
о2 113 3,433 117,5 3,58
со ПО 3,590 100,2 3,763
V.O2 190 3,996 189 4,486
NO 119 3,470 131 3,17
N2O сн4 220 137 3,879 3,882 189 148,2 4,59 3,817
СС14 327 5,881
so2 252 4,29 __
f2 112 3,653
Cl2 357 4,115 .
Вг2 520 4,268
I2 550 4,982 .
HCI 360 3,305
HI 324 4,123
AsH3 281 4,06
SnCl4 1550 4,54
Hg 851 2,898
С2Н2 - 185 4,221
С2ЬЦ 205 4,232 199,2 4,523
С2Нв 230 4,418 243 3,954
^-3^8 254 5,061 242 5Д37
СцНю 410 4,997 297 4,971
ИЗО-С4Н1П 313 5,341
(-'5Н12 345 5,769
С6Нй 413 5,909
С7н16 — — 282 8,88
'-'8^18 320 7,451
С9Н20 240 8,448
Циклогексан 324 6,093 -.
с6н6 440 5,27
СНзОН 507 3,585
С2Н6ОН 391 4,455
CH3C1 855 3,375
СН2С12 406 4,759 . -
СНС13 327 5,43
c2n2 339 4,38
cos 488 4,438
cs2 488 4,438 — —
„ П римечанне. Для расчета коэффициентов вязкости, теплопроводности и диЛЛучии
рекомендуется пользоваться данными 2 и 3 колонок, а для Коэффициентов сжимаемости т
п дли термодинамических расчетов—данными 4 и 5 колонок таблицы.
27
Для определения указанных постоянных а и (при взаимо-
действии двух одинаковых молекул) используют следующие эм-
пирические приближенные зависимости:'
% = 0,77Гкр; = 1,15ГКИП; = 0,92Тпл
К К к
Более точны формулы Стила и Тодоса, использующие крити-
ческие параметры (Ркр — в атм):
= 65,ЗГкрг^; а = 0,18667^. кр2-в/'; а = 0,812 (Гкр/Ркр)7’ гкр;
/’крамол-Кр
(ffo/k— в К; о — в А).
Соотношения
Ьо = 2/3лАМ3 или &о = 1,2615сг3
где Ьо= 18,4 (Ткр/Аф); Ьо = (0,676/ZkP) (Ткр/Ркр), можно приме-
нять для вычисления а (Ь — см3/моль; Р — атм; а — А).
Помимо этого
bo = 0,75Vмол. кр! *о = 2Имол. кип! = Vмол. пл
где V — мольный объем (см3/моль) в критической точке для жид-
кости при Тюш, а для твердого тела при Тпл-
Если принять 2кр постоянным и равным 0,288, то получаются
более простые зависимости:
по Свехлу-^ =0,75Гкр; Ьо = 17,28 (Гкр/Ркр)
по Чену и Отмер у - Ц == 1,276г 0-9061; а = 0,5894V°’<™p
Когда оба соединения в смеси состоят из неполярных молекул,
их потенциальная энергия взаимодействия определяется по при-
ближенной зависимости Деннарда — Джонса:
СТ|, 2 == —^1,2 =
(индекс 1,2 относится к смеси).
Для расчета свойств полярных газов (например, вязкости) при-
меним известный полярный потенциал Стоккмайера, общее выра-
жение которого для системы из двух полярных молекул таково:
£r = 4S-0[(7) -(-7) не.-02. Ф2-Ф1)
Здесь 3*0, о — параметры потенциала; г — межмолекулярное
расстояние:
1(91, 02, q>2 — Ф1) = 2 cos 0] созйг — sin 0] sin 02 cos (<р2 — Ф1)
где 01, 02, (q>2 — <Р1) — углы ориентации диполя в системе.
28
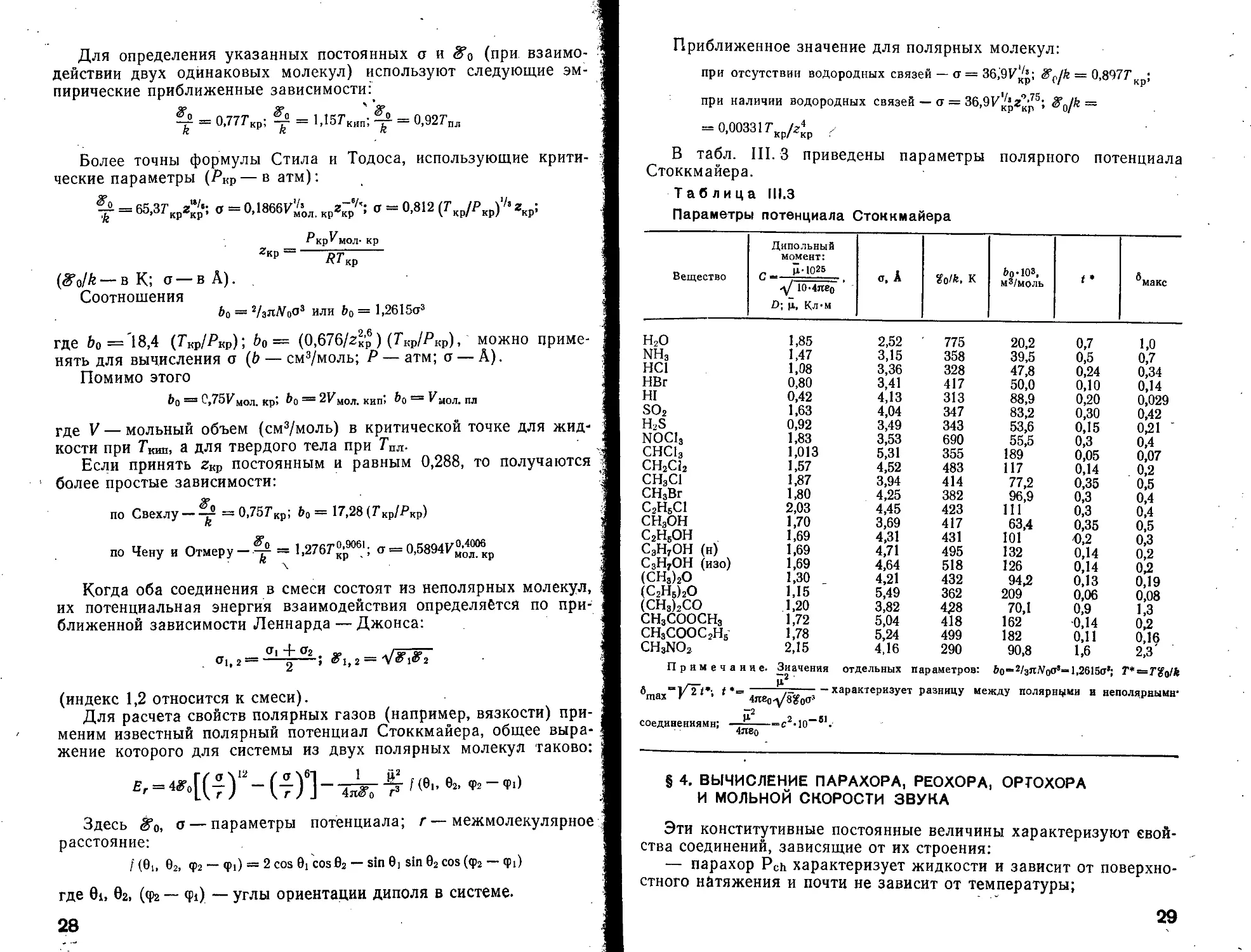
Приближенное значение для полярных молекул:
при отсутствии водородных связей — а = 36,'ЭИ^’; S'f./k = 0,8977’кр;
при наличии водородных связей — о = 36,9У^г’р5; S’g/k =
= 0,003317-кХр /
В табл. III.3 приведены параметры полярного потенциала
Стоккмайера.
Таблица 111.3
Параметры потенциала Стоккмайера
Вещество Дипольный момент: с_: Ц-1025 1(Мяе0 D; ц, Кл’М о, А %oik. к Ьо-103, м3/моль t • ^макс
Н2О 1,85 2,52 775 20,2 0,7 1,0 NH3 1,47 3,15 358 39,5 0,5 0,7 НС1 1,08 3,36 328 47,8 0,24 0,34 НВг 0,80 3,41 417 50,0 0,10 0,14 HI 0,42 4,13 313 88,9 0,20 0,029 SO2 1,63 4,04 347 83,2 0,30 0,42 H2S 0,92 3,49 343 53,6 0,15 0,21 ’ NOCI3 1,83 3,53 690 55,5 0,3 0,4 СНС13 1,013 5,31 355 189 0,05 0,07 СН2С12 1,57 4,52 483 117 0,14 0,2 СН3С1 1,87 3,94 414 77,2 0,35 0,5 СН3Вг 1,80 4,25 382 96,9 0,3 0,4 С2Н6С1 2,03 4,45 423 111 0,3 0,4 СН3ОН 1,70 3,69 417 63,4 0,35 0,5 С2Н5ОН 1,69 4,31 431 101 Ю,2 0,3 С3Н7ОН (и) 1,69 4,71 495 132 0,14 0,2 С3НТОН (изо) 1,69 4,64 518 126 0,14 ОД (СН3)2О 1,30 _ 4,21 432 94Д 0,13 0,19 (С2Н5)2О 1,15 5,49 362 209 0,06 0,08 (СН3)2СО 1,20 3,82 428 70,1 0,9 1,3 СНзСООСНз 1,72 5,04 418 162 0,14 ОД СН3СООС2Н5 1,78 5,24 499 182 0,11 0,16 CH3NO2 2,15 4,16 290 90,8 1,6 2,3' Примечание. Значения отдельных параметров: 6o=2/3nWoo’=l,2615a’; Т* = Т%$1к , u.2 ^nia/r^*' t *•= g —--характеризует разницу между полярными и неполярными* “2 соединениями; —г- =с2-10—81 .• 4лво
§ 4, ВЫЧИСЛЕНИЕ ПАРАХОРА, РЕОХОРА, ОРТОХОРА
И МОЛЬНОЙ СКОРОСТИ ЗВУКА
Эти конститутивные постоянные величины характеризуют свой-
ства соединений, зависящие от их строения:
— парахор PCh характеризует жидкости и зависит от поверхно-
стного нйтяжения и почти не зависит от температуры;
29
— peoxop Rch характеризует органические жидкости при темпе-
ратуре кипения при нормальном давлении и зависит от вязкости
жидкости;
— ортохор Ог характеризует зависимость между текучестью
1/ц и удельным объемом жидкости.
Приведем некоторые способы вычисления этих величин.
Парахор. Поверхностное натяжение а жидкости зависит от раз-
ности плотностей соединения в жидкой и газовой фазах (по Мак-
Р Леоду):
400г О — С (рж — рп)
350
О,дин/см
50
40-
>30-'
20-'
Е
8 °'51
0.6-
&0,7-
*00-
°-0,9-
c'fi-
Бачинский установил зави-
симость между поверхностным
натяжением жидкости о, плот-
ностью рж и плотностью насы-
щенного пара ра:
а = с(Рж—РпУ
Произведение
-50
-60
-70
-80
-90
-100
-150
-200
-250
О
В
-300
-350
*-400
или
^ch = ° ^мол
названо Сегденом парахором
(с — постоянная; вместо степе-
ни Чз применяют \/т, где т —
постоянная; РМОп— мольный
объем жидкости).
Значение парахора жидко-
сти по этой формуле можно
100 L
Рис. Ш. 2. Номограмма для определе- определить по номограмме
ния парахора (1 дин/см = 10-3 Н/м). (рис. III. 2), на которой точку
Е (шкала а) соединяют с точ-
кой D (шкала разностей плотностей). Затем через полученную
точку С (вспомогательная) и точку ;В (шкала М) проводят, вто-
рую прямую, которая пересекает ось парахора Рсд в искомой
точке А.
Приближенное значение парахора можно найти суммированием
составляющих для атомов, групп и связей:
Атом, группа или связи Составляющая» 103, Дж'^-м’А- •КМОЛЬ-1 Атом, группа или СВЯЗИ Составляющая Дж'5.м5/«- •кмоль-1
СН2 в (СН2)П N 3,11
п < 12 7,11 Р 7,20
п > 12 7,17 S 8,73
С 1,60 Se 11,2
Si 5,51 F 4,64
Н 2,76 Cl 9,82
Н (в ОН) 1,78 Br 12,1
н (в NH3) 2,22 I 16,05
0 3,5? Al 9,78
0 (в эфирах) 9,76
30
Атом» группа пли Составляющая* 103, Атом, группа пли Составляющая* 103,
связи Дж'/<.МБ/’- связи Дж'^-м’й-
•кмоль-1 •кмоль-1
Sn 11,47 Тройная связь 8,29
As 9,6 Кольцо
Двойная связь трехчленное 2,22
конец цепи 3,40 четырехчленное 1,07
2-, 3-положение 3,15 пятичленное 0,53
3-, 4-положение 2,90 шестичленное 0,14
Реохор. Значение реохора (введенного Френдом и Харгривзом):
Л1 (ЮЦкип) > . р _ М (ЮЦкип)
Рж Ч~ 2рп ctl рж
^ch (ЮМ'кип) ^мол. кип* ^ch 0,426УМОЛ кр
Здесь ркип вязкость при Гкип (мПа-с); ^мол. кип, ^моп. кр —
мольный объем жидкости (см3/моль) при Ткип или в критическом
точке.
Величину реохора (или рКип) можно вычислить аддитивно, пу-
тем суммирования составляющих для атомов или групп:
Атом или группа Составляю- щая Атом или группа Составляю- щая
С 12,8 nh2 20,6
Н (в СН) 5,5 ' NH 13,6
Н (в ОН) 10 ONO 39,3
О (в простых эфи- 10 no2 38,9
рах) CN 33,0
О (в спиртах) 13 COO (кислоты и 36,0
О (в альдегидах и 13,2 сложные эфиры)
кетонах) с„н5 101,7
С1 27,3
Вг 35,8
N 6,6
Вместо М/р» можо вычислить мольные объемы при темпера-
туре кипения, путем суммирования составляющих, приводимых
ниже (см. стр. 33 ).
Ортохор — наименьший мольный объем жидкости, которого
можно достигнуть снижением температуры (мнимая экстраполи-
рованная величина) (по Литвинову):
ОГ=Р1Е--_Р*Шм
, Pl ~ Ц2
(р и р — плотность и вязкость жидкости при Л и Л) .
Ортохор, поскольку он — предельный объем, не зависит от тем-
пературы. Значение ортохора можно приближенно определить ад-
дитивно, путем суммирования составляющих:
31
Связь Составляю- щая Связь Составляю- щая
С-Н 6,722 C-S 10,835
С-С 3,872 C-S 23,184
С=С 10,621 O-H 10,677
С-0 5,722 O-S 17,070
с=о 13,483 N-H 7,375
C-N 3,725 N—0 13,186
C=N 14,525 N=O 11,563
feN 19,755 N-N 8,642
C-F 14,074 N-CI 29,075
C-Cl 21,461 Br—Br 45,999
C-Br 26,018 Кольцо
C-I 33,773 шестичленное пятичлеиное 6,101 — 1,258
Мольная скорость звука. Рао для определения с (в м/с) в жид-
костях предлагает соотношения:
n з/~ м ' ( Ra р V D s/-
Ra — v с pi с — Ji Ra — Vе V мол
Параметр Ra конститутивен и аддитивен,
определять суммированием составляющих:
поэтому его можно
Связь -с- Составляю- щая, м/с -10 Связь =c=o -CH2OH -CHO -COOH Составляю- щая, м/с 186 315 282 308
-СН | 95,2 -o-c=o 260
-сн2 195 —0— (эфиры) 65
1 C-S 99,5
-сн3 282 c=s 319
С-С 4,25
с=с 129
с^с 225
С—N 20,7 S-Cl 339
C=N 174
N-H 90,7
N=N 296 s-s 177
CsN 285
C-Si 35,4
Si-Cl 266
N=O 145 Si=O 61,5
P-Cl 277
^>C=N-OH —285 p=o 85
C-Cl 230
C-Br 247
—с—о— 36 C-I 305-
32
Скорость звука в газах и парах '(по Е. А. Столярову и Н. Г. Ор-
ловой)*:
« = 340р~^п + 28
§ б. ВЫЧИСЛЕНИЕ МОЛЬНОГО ОБЪЕМА
И ТЕРМИЧЕСКОГО РАСШИРЕНИЯ ЖИДКОСТЕЙ
Мольный объем жидкости при температуре кипения можно
считать величиной аддитивной, поскольку при кипении уменьшает-
ся влияние ассоциации, нарушающей аддитивность.
Вычисления можно вести по приближенному способу, исполь-
зуя отношение объема жидкости в точке кипения к критическому
мольному объёму УМол. кр; оно заключено в интервале 3—8. При-
менимы также способы, учитывающие аддитивность, путем сумми-
рования, составляющих атомов, групп и связей. Например, по
Ле Ба:
Атомы, связи, вещества I Составляю- цая, смЗ/моль Атомы, связи, вещества Составляю- щая, смз/моль
Водород 3,7 Сера 25,6
Углерод 14,8 Фтор 8,7
Кольца Хлор 21,6
трехчленное -6 Бром 27
четырехчленное -8,5 Сжиженные газы -
пятичленное —11,5 азот 31,2
шестичлеииое -15 аммиак 25,8
нафталиновое -30 бром 53,2
антраценовое —47,5 вода 18,9
Амины 10,5 водород 14,3
первичные воздух 29,9 .
вторичные 12 двуокись серы 44,8
Кислород 7,4 двуокись углерода 34
Двойные связи закись азота 36,4
метиловые эфиры 9,1 иод 71,5
простые и сложные 9,9 кислород 25/6
этиловые эфиры окись азота 23,6
простые и сложные окись углерода 30,7
высшие эфиры прос- 11 сероводород 32,9
тые и сложные кислоты кислород, связанный с S„P, N 12 8,3 хлор 48,4
По способу Шредера следует сосчитать число атомов С, Н, О
и N, добавить по 1 на каждую двойную связь и затем полученную
сумму умножить на 7.
Шредер предлагает следующие значения составляющих моль-
ного объема (вхм3/моль):
С, Н, О, N 7 F 10,5 Кольцо —7
С=С 7 С1 24,5 14
S 21 Вг 31,5 т
I 38,5
* Более подробно см. Ощерин Б, В. Автореф. докт. дисс. Л., ЛТИ им. Лей-
совета, 1970.
2 М. М. Викторов
33
При вычислении УМол по принципу аддитивности эти составляю-
щие умножаются на число атомов (или связей), а затем сумми-
руются.
Другой расчет (по Коппу) производится суммированием состав-
ляющих для атомов (без учета их связей):
Имол. кип = 11 (С) + 7,8 (О') + 12,2 (О") + 5,5 (Н) 4- 22,8 (С1) +
4- 27,8 (Вг) 4- 37,5 (I) 4- 22,6 (S) см3/моль
Здесь (О') и (О") — число атомов О в молекуле, связанных
с двумя атомами С или О = С.
Значение мольного объема жидкостей при температуре кипе-
ния:
з
по Бенсону Vмол. кип "д’ кр! мол. кип =
Укр
0,422 1g Ркр 4- 1,552 (?кр МГ1а)
„ . tz 1000 ,
по Ьенке — V мол. кип =--?------ щ — число атомов в молекуле)
* Кр
Значение термического расширения жидкостей:
„ П. 39,4 0,434
йо Дуггару — <a20 » -------
‘ ЪНСПф кнп
, 0,3
Гкр-Т
I
йо Освальду — Дэвису — со =
; Иго —
ф----- (^исп. КИП “ Дж/моль)
1 кнп
1
2Гкр - Т
0,04314
По Смиту — со--------—-
(7\р-Г)0’64
По уравнению Ватсона мольный объем жидкости связан с эм-
пирическим коэффициентом расширения го соотношением:
V iCOi = V2o>2 = Vw
Существуют графики связи (рис. III. 3) параметра со с Тпр =
= 777кр и Рпр = Р/Рцр- Значение со, найденное по рис. III. 3, ис-
пользуют при расчете УМол при любой температуре по VKp или для
определения изменения V с температурой, зная значение УМол. кип
при нормальной температуре кипения.
В критической точке гокр ~ 0,044, и мольные объемы при лю-
бых температурах и давлениях приближенно описываются соот-
ношениями:
т/ т, т_ крМкр 0,044V кр Vмол. кип<°кнп
* МОЛ<В = VкрИкр! Vмол *= ТУ = ---------- ИЛИ Vмол = ~
r г fit ГЛ СП
Для вычисления мольного объема Умол жидких углеводородов
со средней и большой молекулярной массой предложено уравне-
ние Куртца и Санкина (от —253 до 4-200°C и до 10 000 атм):
ИМОлг> р = 4- F^2 4- - FiKiN, 4- F6K>
34
Здесь Fj — зависит от давления; F5 — зависит от давления и
температуры (рис. III. 4, а); К — зависит от температуры
(рис. III. 4, б); Ni — число групп СНз, СН2 и СН в открытых це-
Рис. III. 3. График зависимости коэффициента расширения от при-
веденной температуры.
пях; Л^г— число групп СН3 и СН в кольцах, исключая места соеди-
нений колец; /V3 — число групп СН в местах соединения колец;
IV4 — число двойных связей в молекуле.
Формула Куртца и Липкина
Ииол = 16,28#, + 13,1б#2 + 9,7#3 - 6,2#4 + С
2*
35
Рис. III. 4. Приращение мольных объемов в зависимости от давления (а) и тем
пературы (б).
где N — определены выше; С = 31,2 — постоянная (кроме пара-
финов нормального строения); С = 32,6 — постоянная для нор-
мальных алифатических цепей.
§ 6. ПРИМЕРЫ РАСЧЕТОВ
Пример III. 1. Вычислить среднее значение поляризуемости молекулы мета-
нола Н—СНг—О—Н, зная его мольную рефракцию Ro — 8,23-10-3 м3/кмоль.
Решение. По табл. III. 1 поляризуемость молекулы СН3ОН: <Xi = 4-10~30;
а2 = 2,56-10-30, а3 = 3,14- Ю"30 м3.
Таким образом:
К+ 2,56 +3,14b 10~2i = 3j23.10-3O м3
а =
= 3,24 • 1О-30 м3
а =
3
Можно воспользоваться формулой
3#л 3 • 2,83 - 10~3
4яЛГо 4 • 3,14 • 6,022 - 1026
или данными вывода на.стр. 22; суммирование дает:
Оэл = (0,42 + 1,77 + 0,59 + 0,42) - Ю-30 = 3,18 • 10“3° м3
Пример III. 2. Вычислить мольную поляризацию Р и дипольный момент NH3
при Т = 292 К; А = 5,45-10-6 м3 и В = 1,52- 10~г м3 (по измерению диэлектри-
ческой постоянной е).
Решение. Применим формулу (III. 4):
jx = 1,3538 • Ю-30 д/1,52-10~2 = 1,67 • 10“28 Кл • м
Р = А + BIT = 5,45 • IO"6 + = 5,76. Ю“2 м3/кмоль
Пример III.3*. Вычислить дипольный момент газообразного NH3 при Т =
= 292 К, зная коэффициент преломления п = 1,004 и мольную поляризацию
Р = 57,6 см3/моль.
Решение. По формуле:
RD = т •10-3 = 1Ж ^2- • 22>4 •10-3 =5'7 •10-3 м3/кмоль
Затем по формуле (II 1.5) находим:
В = (Р - Rd) Т = (57,6 10-3 - 5,7 • 19“3) • 292 = 15,155 -м3/кмоль
и окончательно по формуле (III. 4):
(1= 1,33538- 1О-30715,155 =5,26 - Ю-30 Кл-м
Пример III. 4. Вычислить мольные рефракции бензилового спирта СбН5СН2ОН
и метилциклогексаноиа СН3СОСН(СН2)4.
Решение. Применим способ суммирования составляющих, используя данные
вывода на стр. 25.
Для спирта:
Rd ™ 7 (С) + 8 (Н) + 1 (О, в ОН) + 3 (двойные связи) =» »
= 7 • 2,418 + 8 • 1,1 + 1 • 1,525 + 3 • 1,733 =
=32,45 см3/моль = 0,03245 м3/кмоль (опытные данные 32,41)
* По примерам III. 3—111. 6 см. [6],
37
Для метйлциклогексанона:
Rd = 7 (С) + 12 (Н) + 1 (О в карбониле) =
= 7 • 2,418 + 12 • 1,1 + 1 • 2,211 = 32,34 см3/моль = 0,03234 м3/кмоль
Пример III. 5. Вычислить значение мольной рефракции фторбромбензола
BrC6H4F.
Решение. Суммируем составляющие мольной рефракции, используя данные
вывода на стр. 25:
Rjj = 6 (С) + 4 (Н) + 1 (Вт) + 1 (F) + 3 (двойные связи) = 6-2,418 +
+ 4 • 1,1 + 1 • 8,865 + 1 • 0,81 + 3 • 1,733 =
= 33,78 см3/моль = 0,03378 м3/кмоль
Пример III. 6. Вычислить мольную рефракцию изопропилового спирта (М —
= 60,1), зная при 293 К п — 1,377 и р = 0,789 г/см3.
Решение. По номограмме (рис. III. 1) значение М = 60,1 соединяем с точкой
п = 1,377. Проведенная прямая пересекает вспомогательную шкалу в точке О,
которую соединяем с точкой р = 0,789. Вторая прямая пересекается со шкалой Rd
в искомой точке Rd = 17,5-10-3 м3/кмоль = 17,5 см3/моль.
Пример III. 7.' Вычислить постоянные потенциала Деннарда — Джонса &lk,
bo и а для пропана, зная, Гкр = 369,9 К; Ркр =42 атм (4,2 МПа); Умол.кр =
= 200 см3/моль; г — 0,277.
Решение. Воспользуемся уравнением:
<g?0/fe = б5,ЗГкр2^ = 65,3 • 369,9 • 0,277'’/s = 237,1 К-
По уравнению Свехла Soik — 0,75 Ткр = 0,75-369,9 — 277 К.
Расчет о ведем по формулам:
а = 0,1866 • 200,/s • 0,277~'/5 = 5,1 А;
о = 0,812 (369,9/42)‘/з 0,277-0-867 = 5,1 А
bQ = (0,676 / г'’-р6) = (0,676/0,2722,6) (369,9/42) = 167 см3/моль
Ьй = 17,28 (Гкр/Ркр) = 17,28 (369,9/42) = 152 см3/моль
Опытные данные &o/k = 237,1 К и а — 5,118 А.
Пример III. 8*. Вычислить парахор этилпентана (СгНд^СНСНгСНз.
Решение. Суммируем составляющие: (см. стр. 30)
pch = 7(С) + 16 (Н) = (7 • 1,6 + 16 2,76) • 10-3 =
= 55,36 • 10-3 Дж1''4 м% • кмоль-1 = 311,3 эрг'71 • см’72 • моль-1
Пример III. 9. Вычислить реохор пара-дихлорбензола СвНлСЬ (М = 147),
зная Рж = 1,11 г/см3 и ркип = 0,304 мПа-с.
Решение. Воспользуемся формулой
в /лл/ win V/в 147 (Ю • 0,304)'/«
^ch (М/Рж) (ЮРкип) ] ]] =
= 151,3 (экспериментальное значение 151,3)
Суммирование составляющих (см. стр. 31):
Rch = 1 (С6Н5) + 2 (Cl) — I (Н) = 1 • 101,'/ + 2 • 27,3 - 1 - 3,7 = 152,6
Пример Ill. 10. Вычислить реохор метилэтилкетона С2Н5СОСН3, зная
Рмол. кип = 96,2 см3/моль и Ркип = 0,24 мПа-с.
* По примерам III. 8—III, 13 см. [6, 71].
38
Решение. Расчет по формуле
Reh = (10Ркип)'/з Имол. кип = (Ю • 0,244)'^ . 96,2 = 108,2
что совпадает с опытным значением.
Суммирование составляющих (см. стр. 31)
Rch = 4 (С) + 8 (Н) + 1 (0-кетон) = 4 12,8 + 8 • 5,5 + 1 • 13,2 = 108,4
Пример III. 11. Вычислить ортохор пропионового альдегида СН3СН2СНО.
Решение. Суммирование составляющих (см. стр. 32):
Or = 6 (С—Н) + 2 (С—С) + 1 (С=О) = 6 • 6,722 +
+ 2 • 3,872 + 1 13,483 = 61,56
Пример III. 12. Вычислить мольную скорость звука в пропиловом спирте
С3Н7ОН (М = 60,1) при 293 К, зная р = 0,801 г/см3.
Решение. Суммирование составляющих: (см. стр. 32):
Ra = 5 (—СН) + 2 (С—С) + (- СН2ОН) = 5 • 95,2 + 2 • 4,25 + 315 = 799,5
И далее по формуле:
с = (Ra р/Л4)3 = ^799,5)3= I263 м/с (погРешыость ~ 0,8%)
Пример III. 13. Вычислить скорость звука в парах метанола (Л4 = 32) при
температуре кипения, зная Ткр = 337,9 К-
Решение. Определим вначале рп. кип.’
Рп. кип = 44/82,067’кр = [32,04/(82,06-337,9)] • 1000 = 1,15 г/л
И далее по формуле:
с = 340р“°^® + 28 = 340 • 1,15~0,56 + 28 = 340 м/с (погрешность + 8%)
Пример III. 14*. Вычислить мольные объемы этилпропиловогэ эфира
С2Н5ОС3Н7, бромбензола СеН5Вг и фурана С4Н4О при ГКип.
Решение. Воспользуемся способом Шредера.
Для эфира сумма атомов—18; Умол. кип = 18-7= 126 см3/моль (опытное
значение 129).
Для бромбензола Умол. кип = 11-7 + 31,5 + 3-7 — 7 = 122,5 см3/моль (опыт-
ное значение 120).
Для фурана по способу Коппа Умол. кип = 4-11 +4-5,5 + 7,8=73,8 см3/моль
(опытное значение 76,3).
Пример III. 15. Вычислить мольный объем жидкого хлорбензола С6Н5С1 при
Гкип, зная РКр = 4,37 МПа = 44,6 атм и объем Укр = 0,308 м3/кмоль =
= 308 см3/моль.
Решение. По способу Ле Ба имеем (см. стр. 33): С= 14,8; Н = 3,7;
С1 = 21,6; цикл = —15.
Тогда:
Умол. кип = 6 • 14,8 + 5-3,7 + 21,6 — 15 = 114 см3/моль
По способу Беисона:
У
--К-В--= 0,422 1g Ркр + 1,552 = 0,422 1g 4,37 + 1,552 = 2,68
V мол. кнп
308
Умол. кип см3/моль (опытное значение 115)
2,68
Пример III. 16. Определить Умол жидкого СС14 при 523 К, зная: давление’
паров при 523 К Р = 29,6 атм; Тнр — 556 К; Rkp = 45 атм и УКр = 276 см3/моль;
Ткип = 350 К (при 1 атм) и удельный объем У = 102 см3/моль.
* По примерам III. 14—III. 17 см. [6, 66, 71]«
39
Решение. Воспользуемся формулой: Vi<oi = V2<o2 = V<o.
Определим аи по рис. III. 3, зная приведенные температуру и давление:
Гпр = Т/Ткр = 523/556 = 0,94; Рпр = Р/Ркр = 28,6/45 = 0,658
Тогда <о( = 0,083.
Определим о>2 в точке кипения:
Рпр = 1/45 = 0,022; Гпр = 350/556 = 0,629
По рис. III. 3 значение <о2 » 0,1215.
И далее:
iz rz v V2©2 102-0,1215 ,
И1Ы1 = К2<о2; к, =-------=-----—= 150 см3/моль (опытное зна-
(О । U,Uo0
чение 152)
Можно воспользоваться формулой:
„ VK_oK_ 276 - 0,044
VИОЛ = Т = йпой-----------в 146 см3/моль
(£>1 U,Uoo
Пример III. 17. Вычислить мольный объем хлорметилового эфира С1СН2ОСН3 i
(М = 80,5) при Гкип = 333 К; число атомов в молекуле п = 9. >
Решение. Применим формулу Бенке: :
,, 1000 ^80,5-9 оп, ,, , .
У мол. кип =-----ззз-----— 80,7 см3/моль (погрешность + 0,4%) ’
Пример III. 18. Вычислить коэффициент термического расширения хлорофор-
’ ма при 293 К, зная ТКр = 536,6 К-
Решение. Применим формулу Смита:
w = 0,04314/(536,6 - 293)0,64 = 1,28 • 10~3Л-1 (погрешность - 0,9%) 1
Глава IV
ГАЗОВЫЕ ЗАКОНЫ
[6 — 8, 20, 31, 33, 401
§ 1. УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНЫХ ГАЗОВ
Уравнения состояния идеального газа:
Бойля — Мариотта — PV — const; Pi Vi = P2V2;
PJP2 = У2/У1 (ПРИ T = const)
Шарля — V\/V2 = Тt/Т2 (при Р = const); Р\!Р2 = Тi/T2 (при V = const'
Гей-Люссака-1/^ = У2/Г2= ... =
Общая зависимость между объемом, давлением и температу-
рой газа:
P1V1/T1 = p2v2/r2 = p3V3/t3 = ...
По закону Авогадро равные объемы идеальных газов при оди-
наковых температуре и давлении содержат одинаковое число мо-
лекул: No = 6,022-1026 кмоль-1 (число Авогадро).
Объем 1 моль идеального газа при нормальных условиях ра-
вен 22,4 л.
Для приведения объема газа при давлении Р и температуре Т
к нормальным условиям (760 мм рт. ст. и О °C или 101,3 кПа и
273,2 К) применимо уравнение:
P0V0/T0 = PV/Т- Уо = PVT„/PaT
PiVi/Ti = P2V2/T2-, V2 = P1V1T2/P2T1
P1V1/P2V2 = T1/T2
Для газов и газовых смесей известное обобщенное уравнение
состояния идеального газа* Менделеева — Клапейрона, выведенное
на основе указанного общего уравнения с учетом закона Авогадро
PV « nRT
где п — число молей газа.
Введя мольный объем КМол = V/n, получим для 1 моль газа:
41
Справедливо также:
Р^мол. I = RTГ, Рг^мол. 2 = RT2’,
R = РДМ0Л. 1/т, = р2умол. 2/т2
1мм рт. ст.«/33 Па
t,°c; Ъ t,°Ci 1 Ъ
-10 - -2,0 10- -9,2
- 9- 11-
-10
-8- 12-
-7- — 2,5 13- - 11
-6- 14- — 12
-5- '-3,0 15-
- 13
•4- 16-
-3,5 - 14
-3 - 17-
-15
-2 - '-4,0 18- - 16
- 1 - 19-
о- 11 20- - 17 - 18
1 - -5,0 21- - 19
2 - Г 5,5 22- -20
3 - - 23- -21
4- '-6,0 24- -22
5 — 11 > 111 25- '-23 -24
6- 1 1 1 IJ- 26- 1Г5 Сс СЧ С\ ад
7 — г 7,5 27- -27
8- ?8,0 28- -28
9- ?8,5 29- 05 11 1 1 1
10- -9,0 30- -31
Рис. IV. 1. Шкала давлений
насыщенного водяного пара
при различных температу-
рах.
Но п = т/М (т и М — масса и моле»
кулярная масса газа), поэтому:
РУ = -^рт
м
В этих уравнениях отсутствуют пара-
метры, зависящие от природы газа, по-
скольку R— универсальная газовая по-
стоянная не зависит от природы газа.
Постоянная R численно равна работе
расширения 1 кмоль идеального газа
при повышении температуры на 1°; по-
этому R = P&V и характеризует общую
работу расширения газа при постоянном
давлении.
Значение R:
8,314-103 Дж/(кмоль-К)
1,987 кал/(моль-К)
8,314-107 эрг/(моль-К)
0,0821 л-атм/(моль-К).
Зависимость для приведения объема
газа к нормальным условиям:
273УР
V о---;
VB . 273У В
V° 760 (1 + 0,00367/) ’ 760Т
(В и Р — давления газа в мм рт. ст. и
в атм).
В случае влажных газов необходимо
учитывать парциальное давление насы-
щенного водяного'пара (Ь) (см. рис. IV. 1).
Тогда:
„ 273У (в - 6)
~ 760Т
Плотность газа р и его концентрация
с при постоянной температуре прямо
пропорциональны давлению, а при по-
стоянном давлении обратно пропорцио-
нальны температуре:
Pi Pi . ci Pi . Pi __ Гз.
р2 Pl ’ С2 Pl ’ р2 Ti ’ Cl Ti
Плотность газа (кг/м3) при нормальных условиях:
Ро = М/2,2,4
42
Для любых температур и давлений:
МР
р RT
Плотность газа в зависимости от М
определяют по номограмме (рис. IV. 2).
Плотность смеси газов
р =_________2™_______
G./p, + G2/p2 + •••
где GCm, Gi, G2 ... — массы смеси и отдель-
ных компонентов; рь р2 ... — плотности от-
дельных компонентов.
Взаимосвязь между Р, V, Т и составом
газовых смесей можно установить —
сочетанием аддитивности парциальных
давлений — закон Дальтона: общее давле-
ние газовой смеси равно сумме парциаль-
ных давлений компонентов смеси —
Р = р, + р2 + Рз + ... + рп
сочетанием аддитивности парциальных
объемов — закон Амага: общий объем газо-
вой смеси равен сумме парциальных объе-
мов компонентов —
V = + У2 + 1^з + ... + Vn
Парциальное давление (или объем)
компонента смеси идеальных газов по за-
кону Рауля равно общему давлению Р (или
объему V), умноженному на его мольную
долю в смеси х:
Pi==Xip. Vi = x.v
По закону Дальтона общее давление
идеальной газовой смеси равно сумме пар-
циальных давлений всех входящих в смесь
газов:
р = Z pt
Для смеси идеальных газов, содержа-
щей пц п2 ... моль компонентов, общее
число молей в смеси п = п\ + п2 + ... =
= nz. Парциальные давления входящих
в смесь газов:
Ро м
4,20- - 95
аа
4,00“ 7 90
а.
-
3,80- —
- -
3,60- 7 80
3,40-
3,20- -
-70
3,00- -
а
2,80 ~ -
- -60
2,60-
— - ,
а^_
2,40- -
аа
2,20- г 50
а
ж
2,00- —
1,80- -40
—
*
1,60 -
а
1,40 - -
-30
1,20 — -
-25
1,00-
- -20
0,80 - а
0,70 - Г15
0,20- '-5
0,10- £-2
0,00 J
Рис. IV. 2. График для
подсчета плотности га-
зов при 273 К и 0,1 МПа
(1 атм) в зависимости
от М.
Тогда общее давление смеси равно
о / , । \РТ nRT
Р = («1 + п2 + • • • ) — =-у~
(IV. 2)
43
а общий объем:
V = (nj + n2+ ...)-p- = -p- f
Таким образом, идеальна газовая смесь подчиняется основ-
ным законам Бойля — Мариотта, Гей-Люссака, Авогадро, Менде-
леева—Клапейрона.
Разделив уравнение (IV.1) на уравнение (IV. 2), находим соот-
ношение между парциальным давлением Р, и общим давлением Р
газовой смеси
п. Р.
р =-Lp- Р, = х.Р; х. = -/
i п I I ’ i р
где Xi = njn — мольная доля компонента в смеси.
Для смеси идеальных газов:
n т RT
Л1ср V
Здесь Мср = хдМа 4" хвМв 4- ... — средняя молекулярная’ мас-
са смеси; т — масса компонентов.
Парциальный объем i-ro газа в газовой смеси: V, == V(PilPj.
Отсюда можно вычислить объемный состав насыщенной смеси.
Для технических расчетов важно следствие из закона Дальто-
на: если состав смеси газов выражен в % (об. или мол.), то пара-
метры смеси (плотность, объем, теплоемкость и др.) могут быть
вычислены по правилу аддитивности, а именно:
К = ktX! + k2x2 + ... + knxn
Здесь К — коэффициент смеси; ki, k2, .... kn — коэффициенты
Компонентов смеси; xi, х2, хп — мольные или объемные доли
этих компонентов смеси.
На основе закона Дальтона и уравнения Менделеева — Клапей-
рона можно вычислить концентрации компонентов смеси, зная их
процентное содержание. Тогда парциальное давление компонента
А, объемная доля которого в смеси равна а, при общем давлении
газовой смеси Р запишется:
РА~аР-, PAV = nART
Здесь Рд — парциальное давление компонента А в смеси; V —
объем газовой смеси; п — число киломолей компонента А в смеси.
Вышеприведенное уравнение позволяет записать:
_ PAV aPV
nb==-pf~cs‘~RT~
Формула взаимного пересчета мольных х и массовых долей у;
у/М} ________Mix_____
х~ y/Mi + (\-y)/M2 ; V Mix + Мг (1 - х)
44
§ 2. УРАВНЕНИЕ СОСТОЯНИЯ РЕАЛЬНЫХ ГАЗОВ
Свойства реальных газов, как известно, отличаются от свойств
идеальных газов. Так, чем больше плотность газа, т. е. чем меньше
расстояние между молекулами, тем больше это отклонение. По-
этому в уравнение состояния реальных газов следует внести по-
правки — общий объем уменьшить на величину b (отвечающую
собственному объему молекул) и увеличить давление с учетом сил
взаимного притяжения молекул на малых расстояниях (внутреннее
давление), прибавляющееся к внешнему давлению. Тогда уравне-
ние состояния реальных газов Ван-дер-Ваальса на основе уравне-
ния состояния идеальных газов выразится (при умеренных давле-
ниях) :
(Р + П) (V - b) = RT
Поправка b равна примерно учетверенному собственному
объему молекул, а поправка П =^a/V2 (а и b — постоянные вели-
чины, характеризующие отклонения в свойствах данного газа от
идеального).
Таким образом, уравнение состояния реальных газов Ван-дер-
Ваальса, отнесенное к 1 кмоль газа, имеет вид:
) (V - ь) = RT
Для п кмоль:
(V _ nb) = nRT
и
г, nRT ап2
V-nb V2
Для состояния газа при температурах и Т^:
Г1 _ (PV2 + п2а) (У] - nb)
~ >2(/’2И + л2а)(У2-^)
(Pi, Vi, Tj; Р2, V2, Т2 — начальное и конечное состояния газа).
Постоянные а и b в уравнении состояния реального газа вычис-
ляют с использованием критических параметров газа:
“ = злЛ;
_ 27 R2T2kp
а 64 Ркр
З^кр
р = а
^кр = 27Z)2 ,
ь
*=W3
27
п — “д- RTKpb
о
9 *ГКР
128 Ркр
т _ 8 а
кр - 27 Rb
Взаимосвязь между критическими параметрами:
__^£кр_ _ 2 67. п _ 8
Wkp *~з гкр
Р кр^кр = 8/8ЯТКр = 0,3757?ТКр
45
Фактически для разных газов, как это следует из табл. IV. 1,
вместо 0,375 должно быть от 0,2 до 0,33.
Т а б л и ц a IV.1
Значения постоянных а и Ь
Газ Гкр- К Р„п, МПа кр а-10-3 (м6-Па)/кмоль2 4», м '/кмоль Ркр^кр ^кр
н2 33 1,255 24,3 0,0219 0,331
Не 5,1 0,222 3,344 0,0237 0,320
n2 125,9 3,285 131,9 0,0385 0,292
о2 154,2 4,87 133,4 0,318 0,292
со2. 304 7,15 353 0,0427 0,287
NH3 405,4 10,98 409 0,0373 0,242
Н2О 647 21,33 536 0,0326 0,224
Взаимосвязь между Р, Т и V:
по Вертело для небольших давлений —
Г 9Р7'кп (
PV = RT 11 +-1287С1,-6^-Л
по Битти — Бриджмену для высоких давлений —
№ = рг [V + Во (1 - 6/У)] (1 - с/УР) _ Ао (1 _ a/V)
р = ^ О-Т^/КГ.3).. [у + Во (1 - 6/Ю] - Ло/У*
(здесь а, Ло, Ь, Во и с — опытные константы (табл. IV. 2)];
по Розену (для весьма высоких давлений) —
PV = А + ВР + СТ
Последнее уравнение применяют для расчета цикла сжатия
компрессора (табл. IV. 3).
Для газовых смесей постоянные а, Ь, с, Ло и Во — величины ад-
дитивные, т. е. их можно вычислять суммированием постоянных
Kt для составляющих смеси, т. е. KCM — ^XiKi и VA>,cm —
== S Xi л/ .
Указанные постоянные для газовых смесей могут быть вычис-
лены из коэффициентов сжимаемости г газовых смесей (см. ни-
же). Уравнение Кричевского (для двойных смесей — при разных
давлениях и температурах):
Р = ххР1 + хгР} + а{ххх2 (p'J — Р<0
Для расчета надо знать зависимость Р — V — Т для чистых га-
зов. Здесь P°i и Р°2 — давления чистых компонентов при одном
и том же объеме, равном объему смеси, а — константа, характер-
ная для данной смеси. Для смесей неполярных газов а не зави-
сит от температуры.
Параметры газов при высоких давлениях удобно определять
по энтальпийным и энтропийным диаграммам (см. гл. VIII), а
46
Таблица IV.2
Постоянные уравнения Битти — Бриджмена
Газ Ло-10-4 Во-10-4 (Па«мб)/кмоль Ь а, кмоль/мэ с, (Па«м9.к)/кмоль8
Не 0,212 0,1373 0 0,05984 0,039
Ne 2,084 0,2020 0 0,02196 0,990
Аг 12,719 0.3855 0 0,02328 58,7
н2 1,937 0,2055 —0,4275 —0,00506 0,4943
Н2 (ниже 1,2164 0,19830 -0,0708 0,05618 19,6
критиче- ской плот- ности) n2 13,185 0,4948 -0,0678 0,02617 41,2
NH3 23,467 0,3349 1,8743 0,17031 4676,5
о2 14,623 0,4535 0,04127 0,02562 47,07
Воздух 12,760 0,4522 —0,1080 0,01931 42,6
со2 49,097 1,0273 0,7095 0,07132 647
сн4 22,329 0,5479 -0,1556 0,01855 125,8
с2н4 60,331 1,1921 0,3527 0,04964 222,4
С2н6 57,663 0,9218 0,1878 0,05861 882,6
С3н8 116,896 1,7750 4,2100 0,07321 1176,8
С4Н10 175,93 2,41441 0,9241 0,12161 3432,3
изо-С4Н8 166,322 2,3732 0,85809 0,10860 2451,7
с7н18 534,66 6,9447 1,8800 0,020066 3922,7
СНзОН 326,65 5,9195 0,9737 0,09246 314,12
(С2н5)2о 306,73 4,4568 1,1723 0,12426 326,9
CC12F2 232,4 5,79 6,10 0,305 0
Таблица IV.3
Постоянные уравнения Розена
Газ А.10~4> (Па-м3)/кмоль В.Ю3, м8/кмоль с, (Па.м’)/(кмоль.К)
N2 (до 100 МПа) 7,86 1,244 425
N2 (до 600 МПа) 10,27 1,11 441
н2 9,71 0,721 369
СО 7,42 1,298 434
Не 9,993 0,362 349
n2 + зн2 9,54 0,818 374
Воздух 7,52 1,207 420
Идеальный газ — — —
также по специальным графикам типа рис. IV. 3, на котором при-
веден расчет процессов сгорания топлива (упрощенный — без уче-
та содержания серы в угле, горючего в шлаках, влаги в воздухе,
смолы и сажи в газе, углеводородов в отходящих газах) при выде-
лении газов (см. Пример IV. 20).
47
§ а КИНЕТИЧЕСКАЯ ЭНЕРГИЯ И СКОРОСТЬ ДВИЖЕНИЯ
МОЛЕКУЛ ГАЗА
Молекулы газа, находясь в непрерывном поступательном бес-
порядочном движении по любым направлениям, сталкиваются
друг с другом и передают кинетическую энергию- (явление тепло-
проводности), количество движений (явление вязкости) или ме-
0 20 40 ВО 80 100 120 140
Избыток воздуха,%
Рис. IV. 3. Графический расчет процесса горения.
Цифры у кривых—содержание водорода в топливе, % (Масс).
няются местами (явление диффузии). О потенциальной энергии
межмолекулярных сил можно судить по потенциалу Леннарда—
Джонса.
Для описания кинетической энергии идеальных газов справед-
I N^mU?
ливо уравнение: Р — ~^—у— (здесь Na — число молекул в еди-
нице объема газа; т — масса молекулы; й — средняя квадратич-
ная скорость движения молекул). Умножая обе части равенства
на мольный объем V газа и обозначая число молекул в 1 кмоль
газа (число Авогадро) через NA = nV, получим основное уравне*
48
ние кинетической теории газов:
ру =4-ЛГ.тй2
3 А
(IV.3)
Произведение PV зависит от средней скорости й, являющейся
функцией температуры. Поэтому для данной температуры произ-
ведение PV — const, т. е. выполняется закон Бойля—Мариотта.
Температуру простого одноатомного газа можно рассматривать
как меру средней кинетической энергии <S поступательного движе-
ния его молекул:
& = -i- гий2 = const Т
После замены в основном уравнении (IV. 3) произведения PV
на равное ему RT получим:
RT = NAmu2 или = -g- ЛГд 2 -
Подставляя сюда значение <$, получим:
2 3 RT 3 2 N.&
RT =-~NhS, откуда S »— -% kT или Р=а—-
Постоянная k = R/Na называется постоянной Больцмана; ее
можно рассматривать как газовую постоянную, отнесенную к од-
ной молекуле идеального газа. Универсальная газовая постоянная
R равна 2/з кинетической энергии молекул 1 кмоль вещества, при-
обретаемой при нагревании на 1 К.
Введение постоянной k приводит к известному уравнению
Больцмана /пы2/2 с= 3/2 kT. Значение k-. k = R/NA = 8,3143 X
X 103/6,022-1026 = 1,3806-10-23Дж/К. Уравнение состояния 1 кмоль
идеального газа PV = RT можно представить в виде: PV = NAkT.
3 RT 3
Уравнение = kT характеризует среднюю кинети-
ческую энергию поступательного движения молекул газа. Из него
следует, что <S зависит от температуры и не зависит от давления,
объема, природы газа и размеров молекулы.
Таким образом, абсолютная температура Т идеального газа
ость мера кинетической энергии его молекул и прямо пропорцио-
нальна этой энергии. Газы, находящиеся при одинаковой темпе-
ратуре, обладают одинаковой средней кинетической энергией мо-
лекул. Энергия (средняя) поступательного _движения молекул
I кмоль идеального газа = Na<S или <5 — 3lzRT.
Изменение & при повышении температуры от Г до T-f-1: ==
= 3/2Л. Это количество энергии равно изохорной теплоемкости Со
одноатомного газа: Cv = 3/2Я Молекулы газа движутся с различ-
ными скоростями, и при повышении температуры их скорость уве-
личивается. Средняя линейная скорость молекулы:
/ 3kT / 3kN кТ I 3RT
N ~in~== У M~ It
(IV. 4)
49
Например, при 290 К средняя линейная скорость молекул!
л / 3-8,314- 103-290 .
азота — и = л /----500 м/с —
V 26
водорода — 1800 м/с
Максимальная скорость молекул (по Максвеллу):
V~2kf / 5RT
Из уравнения_(1У. 4) следует, что й молекул газа прямо про-
порциональна л/Т и не зависит от давления; для различных га-
зов при одинаковой температуре ,й обратно пропорциональна
л]М, т. е. чем меньше масса молекул, тем больше их скорость.
При равных температурах средние кинетические энергии мо-
лекул Н2 и Вг2 одинаковы, несмотря на то, что молекула Вг2 тяже-
лее Н2 в 80 раз; скорость же молекул Вг2 в д/160/2 раз меньше
скорости молекул Н2. С повышением температуры квадраты обеих
скоростей возрастают одинаково. Это положение справедливо и
для свободно движущихся частиц вещества.
В действительности молекулы газа имеют не средние скорости,
а разные, изменяющиеся после каждого столкновения от очень ма-
лых до больших значений. Распределение молекул по скоростям
дается известным законом Максвелла, а распределение по энер-
гиям— известным законом Больцмана (или е-законом).
§ 4. ПРОЦЕСС СЖИЖЕНИЯ ГАЗОВ
В технологии особое значение приобрели сжиженные газы
(жидкий воздух, кислород, азот, гелий, аргон, двуокись углерода,
аммиак и др.).
Сжиженные газы при высоких температурах и давлениях — в
большинстве случаев хорошие растворители [91]. Например, во-
дяной пар при высоких давлениях и температурах растворяет мно-
гие соединения (соли, кремнеземы и др.). Для сжижения газы сле-
дует охладить ниже критической температуры.
Рассмотрим процесс сжижения СО2 (рис. IV. 4). Характер из-
менения изотерм (например, при 20 °C) показывает, что при сжа-
тии газа вначале уменьшается объем, при этом давление повы-
шается до точки с", в которой начинается конденсация газа.
В точке с” изменение объема, т. е. сжатие, происходит при по-
стоянном давлении, вплоть до точки Ь" идет конденсация газа.
Точка k отвечает критическому состоянию и лежит на изотерме,
выше которой ни при каком давлении газ не сжижается. Соответ-
ствующие температура, давление и объем и будут критическими.
На диаграмме PV — f(P) сжижению газа отвечают вертикаль-
ные участки изотерм, когда PV уменьшается при постоянном Р
(рис. IV. 5); заштрихованная область отвечает сжижению,
50
51
Для легкосжижаемых газов (например, NH3, СО2, SO2, CC12F2 —
фреоны и др.) достаточно применить для сжатия небольшое ох-
лаждение, а холод получают путем чередующихся сжижения и ис-
парения.
При высоких давлениях газ по некоторым свойствам прибли-
жается к жидкости; нарушается также способность газов смеши-
ваться.
Широкое применение высоких давлений требует знания различ-
ных свойств жидких газов, например растворимости в них тех или
иных веществ. Растворимость жидкости в сжатых газах зависит от
давления, температуры, природы жидкости и газа. Для расчета
Рис. IV. 6. Взаимная растворимость (огра-
ниченная) газов в системе азот — аммиак.
концентрации вещества в
сжатом газ^ нужно знать
его фугитивность (лету-
честь) в газовой фазе (см.
гл. VI). При высоких давле-
ниях действие межмолеку-
лярных сил становится
столь большим, что может
наступить расслоение гомо-
генной газовой смеси (обна-
ружено Кричевским).
Изотермы взаимной рас-
творимости газов в системе
N2—NH3 (рис. IV. 6) пока-
зывают, что при данной тем-
пературе имеется давление,
ниже которого газы безгра-
нично смешиваются (крити-
ческие точки k; внизу спра-
ва дана кривая равновесия
жидкость — rfap). Повыше-
ние давления до значитель-
ного приводит к расслоению смеси на две фазы. С ростом давле-
ния расслоение распространяется в большем интервале концен-
трации, что приводит к уменьшению областей все более различ-
ным. Например, при 100°C'сжимается смесь из 57% NH3 и 43% N2
(точка о) до 260 МПа (точка k). Повышение давления приве-
дет к расслоению гомогенной смеси. Например, при 320 МПа
смесь состоит из двух фаз (точки а —33% NH3 и Ь — 77% NH3).
Соотношение этих фаз йо правилу рычага:
Фаза с избытком NH3 ас
Фаза с избытком N2 be
С ростом температуры область расслоения уменьшается и пере-
мещается в область высоких давлений, а состав критических фаз
мало изменяется. О растворимости газов и газовых смесей под
давлением см. работы Кричевского с сотрудниками [43—45]. Кри-
чевский и Казарновский вывели уравнение растворимости, а Кри-
52
чевский и Хазанова дали зависимость для растворимости поляр-
ных соединений в неполярных газах.
По рис. IV. 7 можно вычислить объем газа под давлением, вы-
пускаемого из хранилища или нагнетаемого в него. Например,
если давление азота в хранилище 2,0 МПа при 20 °C, то из каж-
дого литра емкости хранилища будет извлекаться количество азо-
та, занимающее при 0,1 МПа объем 175 л (извлекаемый объем
прямо пропорционален емкости).
Добавление в систему нерастворимого в жидкости газа нару-
шает равновесие жидкость — насыщенный пар ее, что сопровож-
дается увеличением концентрации паров жидкости в сжатом газе.
Это — следствие возрастания давления пара жидкости, т. е. с рос-
том давления на жидкость давление ее пара повышается. Одно-
05ъем азота при 0,/Мпаи 15 С и}
1л объема резервуара
Рис. IV. 7. Г рафик для расчета объема
азота, выпускаемого из резервуара.
Рис. IV. 8. Зависимость концентрации
паров в сжатых газах от внешнего
давления при 50 °C.
временно может происходить растворение жидкости в сжатом га-
зе. На рис. IV. 8, например, дана зависимость концентрации пара
в сжатых газах от внешнего давления (на оси ординат дана про-
порциональная давлению пара концентрация водяных паров в
сжатом газе). Одна из причин отравления катализатора при син-
тезе аммиака — попадание масла в газовую смесь, где оно остает-
ся в виде пара, так как растворимость масла в азоте при 423 К
при повышении давления от 10 до 90 МПа увеличивается
в 45 раз.
Подобное характерно и для твердых тел,при очень высоких
давлениях. Так, уменьшение к. п. д. паросиловых установок обу-
словлено (помимо других причин) уносом из котла с паром высо-
кого давления различных соединений (особенно БЮг), которые
затем при расширении пара откладываются на лопатках турбин.
Уравнение для приближенного определения влияния внешнего
давления:
г
63
(Р и Р' — давление насыщенного пара в отсутствие и присутствии
инертного газа; Рвя — внешнее давление; V®— мольный объем
жидкости). _
§ 5. ПРИМЕРЫ РАСЧЕТОВ
[2, 6, 7, 20, 85]
Пример IV. 1. При 298 К в смеси СО2 (М — 44) с воздухом (М — 29) со-
держится 15% (об.) СО2 при общем давлении 20 МПа. Вычислить содержание
[в % (масс.) и кг/м3] и парциальное давление СО2.
Решение. Для газовой смеси объемная доля компонента равна мольной:
44 0 15
х = °,15; у = 44. од5 + 29’(1 _0>15) или 21,1 % (масс.)
Парциальное давление Р = 20-0,15 = 0,3 МПа. Объемная концентрация:
44-0,3-10е
С ~ 8,314 • 103 • 298
5,327 кг/м3
Пример IV. 2. Вычислить плотность и удельный объем паров ртути (Af =
= 200,6) при 333 К и Р = 5,3 Па.
Решение. Воспользуемся уравнением:
р = m/V = MP/RT == (200,6 • 5,3)/(8314 • 333) =
= 0,4 • 10~3 кг/м3; V = 1/р = 1/0,4 • 10“3 = 2,6 - 103 м3/кг
Пример IV. 3. Определить объем и массу водорода при нормальных условиях,
если он содержится в газгольдере емкостью 6000 м3 при 300 К и 1303-102 Па.
Решение. В газгольдере запорной жидкостью служит вода, поэтому водород
насыщен ее парами. Значение Ь при 300 К по рис. IV. 1 35,6-102 Па.
Число киломолей и масса водорода в газгольдере:
(P-b)V (1303 - 35,6)-102 - 6000
П= RT °----------------8,314- 103-300--------305’4:
т = 305,4 • 2 = 610,8 кг
Пример IV. 4. 22,2 л NH3 при 293 К и 111,2-10® Па сжимают до 2,2 л. Опре-
делить конечное давление газа, зная, что после сжатия температура газа повы-
силась до 303 К-
Решение. Воспользуемся уравнением:
_ nRT an2
V-nb V2
Данные для формулы:
РУ __ 111,2-103 - 0,0222 з
RT 8,314-103-293 = *’ '
кмоль;
а = 0,409 10s Па • м3/кмоль2; b = 0,0373 м3/кмоль
Тогда
_ 1,01 10~3-8,314 • 103 - 303 0,409 • Ю6 • 1,012 • 10-6 , пп „„
Р =?--------s------------з-------------1-----s----г------= 1,09 МПа
2,2 • 10“3 - 1,01 • 10-3 • 0,0373 2,22 • 10-ь
Пример IV. 5. 400 м3 СО2 (М = 44) находятся при 0,294 МПа и 268 К. Опре-
делить объем сжиженного газа.
Решение. Масса СО2:
MPV 44-0,294-10®-400
т= RT ~ 8,314-103 - 268 — 2320 кг
Плотность СО2(ж) р = 1190 кг/м3; следовательно:
V = т/р = 2320/1190 = 1,95 м3
54
Пример IV. 6. В автоклаве емкостью 5 л находятся 104 г ацетилена (М=26)
при 300 К. Определить Р.
Решение. Воспользуемся уравнением:
Р = . — ат?9 ; п = 0,104/26 = 4 • IO"3 кмоль;
V — по V2.
а = 0,4286 106 Па м3/кмоль3; 6 = 0,0511 м3/кмоль
„ 4 • 10~3 • 8,314 103 300 (4- 10"3)2 • 0,438 106
Р =--------5--------5-----------------------=;------- = 1,81 МПа
5 -10~3 — 4 10-3 • 0,0511 (5 10“Т
Пример IV. 7. Производительность компрессора 1500 м3/ч при нормальных
условиях. Определить объем воздуха на выходе компрессора, зная давление воз-
духа на входе Р = 5 МПа (50 атм) и температуру 370 К, а также вычислить
парциальные давления О2, N2 и Аг в нем.
Решение. Воспользуемся уравнением:
PiVi P2V2
Г. Т2 ’
т/ P,V>T2
V2=~PJ\~
1 • 1500-370
50 • 273
40,8 м3
Состав воздуха [в % (об.)]: 20,5 Оа; 78,5 N2 и 1 Аг.
Парциальные давления:
РО; = 50 0,205 = 10,2; PN, = 50 • 0,785 = 39,3;
РАг = 50 • 0,01 =0,5 атм (1,02; 3,93 и 0,05 МПа)
Пример . IV. 8. Определить содержание воды в 20 л воздуха при относитель-
ной его влажности 73,5% и 300 К (27 °C). Парциальное давление насыщенных
водяных паров в воздухе равно 35,6-102 Па (26,8 мм рт. ст.) (рис. VI. 1).
Решение. Парциальное давление водяных паров в воздухе при относительной
их влажности 73,5% составит:
Р = 0,735 • 35,6 102 = 26,2 • 102 Па
Искомое содержание воды в 20 л воздуха:
MPV 18-0,02-26,2-102 з
8,314 - 103 300~~= 0,38 ° КГ
m RT
Пример IV. 9. Компрессор подает 500 м3/ч воздуха при манометрическом
давлении 0,5 МПа и 300 К. Определить объем полученного жидкого воздуха.
Состав воздуха [в % (об.)]: 21 О2, 78 N2 и 1 Ar, СО2, H2S и другие примеси
(М = 29).
Решение. Масса 500 м3 воздуха при заданном давлении
пг
MPV
RT
29 0,5 10е 500
8,314-103-300
2907 кг
Плотность жидкого воздуха — 0,86 г/л; искомый объем жидкого воздуха:
2907/0,86 = 3380 л.
Пример IV. 10. Из газогенератора поступает 1400 м3/ч водорода при 320 К
и давлении 0,109 МПа. Определить, сколько из этого количества водорода можно
получить аммиака (М = 17) (без учета потерь).
Решение. Масса 1400 м3 водорода:
MPV 2-0,109-103-1400
m = -RF— 8,314-103-320" ° 115 КГ
34
Стехиометрическая схема ЗН2->-2МНз. Искомая масса аммиака: 115 -g- =
= 625 кг.
Пример IV. 11. Сколько гелия (М = 4) необходимо для заполнения оболочки
емкостью 1 м3 при 298 К и нормальном давлении (0,1011-10е Па). Каков объем
газа при 0,082 МПа и 240 К?
5В
Решение. Воспользуемся уравнением:
PVM 0,1011 • 10»-1-4 n1ffJ _
m = -RT “ 8,314 -103 -298 = 0, 64 КГ
О 164 • 99 4
Объем газа: V= = 0,920 л
Искомое изменение объема найдем по уравнению: PiVi/Ti = Р2У2/Г2, от-
куда:
_ 0,1011.10«-0,920-240
РгТх 0,082 • 10е • 298 = °'9 5 м
Пример IV. 12. В газгольдере имеется 3500 м3 водорода при 0,3 МПа и 298 К.
Сколько баллонов емкостью 20 л каждый можно наполнить этим водородом при
той же температуре, но под давлением 13 МПа.
Решение. Воспользуемся уравнением:
PiVi P2V2 . v Р^Т2 3500-0,3.298 . .
Ti = Т2 ’ 2 TtP2 = 13-298 М'
Искомое число баллонов: = 4050. ,
Пример IV. 13. Сколько литров ацетилена (Л/ = 26) при 9500 Па и 293 К
можно получить из 9 кг карбида кальция (М = 64,1) по реакции СаС2 + 2Н2О->-
->С2Н2 + Са(ОН)2, если примеси посторонних веществ составляют 10%.
Решение. Стехиометрическая схема: СаС2-*С2Н2. В 9 кг карбида кальция
содержится: 9 — 0,9 = 8,1 кг СаС2. Получится С2Н2:
_ ^СаС^с.н, = 8,1-26
тСгН,“ 64,1 =3’3кг
Искомый объем:
V
тС!нЛг 3,3-8,314-103-293
тСгН,Р 26 • 9500
Пример IV. 14. Вычислить плотность газовой смеси, содержащей [в % (об.)]:
50 Н2; 30 N2; 18 СО2 и 2Н2О при 298 К и 0,15 МПа.
Решение. Ме11 = 0,5-2 + 0,3-28 + 0,18-44 + 0,02-18 = 17.7.
Искомая плотность:
____т РМСЫ
р— V = RT
0,15-10» • 17,7
8,314- 103 • 298
= 1,07 кг/м3
Пример IV. 15. Вычислить температуру, при которой можно нагреть 50 кг Nj
(М = 28), занимающего объем 600 л, чтобы давление не превышало 1,5 МПа.
Решение. 50 кг — это 50/28 = 1,8 кмоль. При нормальных условиях:
V = 1,8-22,4 = 38,2 м3.
Тогда:
у, 7 PiV2 97Ч 1 £ • 600 „
Ti Tl ~РУ7 273 0,1011 • 38,2 = 636 К
Пример IV. 16. Установить общее давление и равновесный состав пара над
раствором, содержащим [в % (масс.)]: 35 СвНв (Л4 = 78); 40 С7Н8 (М = 92)
и 25 ортоксилола CeHio (М = 106) при 373 К, зиая давление пара компонентов
при 373 К [в кПа]; РСвНв = 178,2; Pc?Hs = 74,5; = 27,9.
66
Решение. Число киломолей в 100 кг раствора:
С6Н6 - 35/78 = 0,45; С7Н8 = 40/92 = 0,44; С8Н10 = 25/106 = 0,23;
2 = ‘>12!
Парциальное давление (в КПа):
П4^ • 0 44
^.Н. =178,2 -15- = 71,6; Рс,н, = 74,5^12- = 29,3;
РС,Н10 = 27.9 4g- = 5,7
Искомое общее давление:
Р = 71,6 + 29,3 + 5,7 = 106,6 кПа
Пример IV. 17. Вычислить состав насыщенных паров смеси этилового эфира
(М — 74,1) и азота (М'= 28) при 293 К и общем давлении 99 кПа, если Ра$ =
— 58,8 кПа.
ч 58 8
Решение. Парциальный объем пара в 1 м3 газа 1 • = 0,594 м3; состав
59,4 эфира и 40,6% (об.) азота; содержание эфира 0,594 (44) и азота 0,406 кмоль
(11,4 кг); всего 55,4 кг, что соответствует 79,5 и 20,5% (масс.). Объем V
= 22,4 ^з' = 24-5 м3- Масса эфира в 1 м’ 44/24,5-1000 = 1800 г.
Пример IV. 18. Вычислить парциальные давления компонентов нитрозной
смеси при 3Q3 К в объеме 0,16 м3, содержащей (в г): 132 NO, 115 О2; 980 Nj и
125 Н2О.
Решение. Общее число молей:
V 132 . 115 , 980 , 125 1п_з
2^ = “зб‘ + ^2-+"28” + ТГ = 50 моль = 50-10
Состав:
в % (мол.) - = 8.8 NO; 7,2 О2
в % (масс.) — 70,1 N2; 13,9 Н2О
Общее давление:
Р =* (щ + п2 + ...) =—° о Д’314 ’103 д О-787 • 10е Па = 8 атм
Искомые парциальные давления:
PN0 = 0,088 • 0,787 = 0,069; POi = 0,0567; PNj = 0,552;
PHj0 = 0,109 МПа (0,7; 0,6; 5,6 и 1,1 атм)
Пример IV. 19. Масса 1 л углеводорода предельного ряда 6,34 г/л. Написать
формулу углеводорода.
Решение. Определяем массу этого углеводорода: М = 6,34-22,4 = 142 моль.
Общая формула предельных углеводородов С»Н2п+2. Откуда М = пСН2 + 2.
Мсн = 14. Тогда 14п + 2 = 142; п = 140/14 = 10. Искомая формула СюН22.
67
Пример IV. 20. Топочные газы после сгорания кокса (75% С) содержат 15%
СО2. Определить избыток воздуха, объемы топочных газов и воздуха в расчете
на 1 кг кокса.
Решение. Если топочные газы содержат 15% СО2, то в отсутстиие водорода
по рис. IV. 3 избыток воздуха составляет 40%• Из 1 кг кокса при 40%-ном из-
бытке воздуха образуется 0,6 кмоль топочных газов; в пересчете на углерод это
составляет 0,6-0,75 = 0,45 кмоль, что соответствует 0,45-22,4 = 1 м3 (при
нормальных условиях). Расход воздуха — 16,5 кг при 40%-ном его избытке; в
пересчете на углерод: 16,5-0,75 = 12,4 кг, т. е. 12,4/(29-22,4) = 0,97 м3.
Пример IV. 21. Установить температуру, при которой средняя квадратичная
скорость движения молекул N2 равна 1000 м/с.
Решение.
й*М _ (103)2-28 _..
------3 -8/314. W - 1124 К
Пример IV. 22. Вычислить концентрацию паров воды в сжатом газе при 323 К
и Р = 10 МПа, зная, что в 1 л сжатого газа при давлении насыщенного пара
содержится 83 мг Н2О.
Решение. In Р'/Р = 1 откуда Р'/Р — 1,07; так как концентрация
о2,1)0 •
пара в сжатом газе пропорциональна увеличению его давления, то искомая кон-
центрация С = 83-1,07 — 89 мг/л. По рис. IV. 8 С к 90 мг/л.
Глава V
ОПРЕДЕЛЕНИЕ КРИТИЧЕСКИХ
И ПРИВЕДЕННЫХ ПАРАМЕТРОВ
ГАЗОВ И ЖИДКОСТЕЙ
[6, 31, 33, 40, 66, 71, 85]
§ 1. КРИТИЧЕСКИЕ И ПРИВЕДЕННЫЕ ДАВЛЕНИЯ,
ТЕМПЕРАТУРА И ОБЪЕМ
Общие положения
Критическое состояние вещества (смеси веществ) — это состоя-
ние, возникающее при исчезновении различия между двумя рав-
новесными фазами (жидкостью и паром, между двумя жидкостя-
ми и т, д.).
Критическая точка — единственная точка, в которой жидкая и
газовая фазы одинаковы. Выше критической температуры возмож-
на только одна фаза, причем нежидкая, т. е. критическая темпера-
тура —это та температура, выше которой вещество не может быть
переведено из газообразного состояния в жидкое (для системы
газ — жидкость).
Давление, необходимое для сжижения газа при критической
температуре, называется критическим, а объем и плотность при
этой температуре — критическими. При критических температуре
и давлении плотности жидкости и пара равны, а свойства — иден-
тичны. При критической температуре между жидкой и паровой
фазами возможно равновесие (если не достигнуто и не превы-
шено Ркр).
Знание критической температуры необходимо для предсказа-
ния поведения вещества в технологических процессах и для уста-
новления зависимости между физико-химическими свойствами.
При температурах ниже критической переход из жидкого состоя-
ния в газообразное происходит скачком в точке кипения. В крити-
ческой точке переход из одного агрегатного состояния в другое
происходит постепенно, без разрыва непрерывности в свойствах,
т. е. переход жидкости в пар и пара в жидкость непрерывен. Та-
ким образом, существует единство прерывности и непрерывности
изменений процесса и переход количественных изменений в
качественные. Количественные изменения в состоянии веществ и
свойствах неизбежно приводят со временем к коренным качествен-
ным изменениям. Количественные и качественные изменения
59
взаимосвязаны и обусловливают друг друга. Скачок (перерыв по-
степенности в развитии) — коренное качественное изменение ве-
щества, превращение старого качества в новое в результат^ ко-
личественных изменений.
При температуре ниже критической газ может быть сжижен
при достаточном сжатии, причем требуется приложить тем меньше
давления, чем ниже температура.
В отличие от любой точки на кривой равновесия жидкость —
пар в критической точке все термодинамические свойства сосу-
ществующих фаз становятся тождественными (число степеней сво-
боды в ней F = 0).
Для реальных газов применяют зависимости, включающие раз-
личные постоянные. Для исключения этих постоянных следует в
уравнении состояния газов подставить безразмерные единицы —
так называемые приведенные параметры, содержащие критические
параметры:
т L_. р р_. у _Л_. 0 __р_
Тнр - Гкр , Л.р - ркр , Ипр - Екр , Рпр - ркр
Для вычисления свойств реальных газов в широком интервале
давлений и температур удобно применять обобщенные методы рас-
чета, основанные на принципе соответственных состояний. При
этом свойства газов (жидкостей) выражаются без взаимосвязи
между Р, Т и V, а с помощью приведенных параметров. Приве-
денное обобщенное уравнение состояния реальных газов таково:
^пр ж f (Тпр> пр)
Эти приведенные параметры уравнения равны тогда, когда
сравниваемые вещества находятся в соответственных состояниях,
а уравнения универсальны, ибо не содержат величин, зависящих
от природы вещества.
Считается, что все газы подобны, когда они находятся в соот-
ветственных состЬяниях, т. е. если любые две переменные из
трех — Р, V и Т — находятся в одинаковом отношении к их крити-
ческим параметрам. Два любых газа, находящиеся при одинако-
вых Рпр и Тир, имеют одинаковый приведенный объем, одинаковые
коэффициенты сжимаемости и другие величины.
Таким образом, критическое состояние соединений — основа
для сравнения их различных свойств, т. е. свойства разных соеди-
нений можно сравнивать в критических точках. Например, водо-
род (Ткр = 33,2 К и РКр = 1,25 МПа) при 82,4 К (Рпр = 2) и
0,204 МПа (Рпр = 0,1) имеет примерно те же значения свойств,
что СОг при 608,4 К (Тщ> = 2) и 0,716 МПа (Рпр = 0,1).
Иногда в качестве соответственных точек, кроме критической,
можно рассматривать и некоторые другие (точку кипения при
нормальном давлении, точку плавления вещества, величину, свя-
занную, например, с энтропией и т. д.).
Следовательно, два вещества находятся в соответственных
состояниях, если их -приведенные температура и давление равны.
И для всех газов действительно по принципу соответственных со-
60
стояний общая функция приведенных переменных f (РПр, Тпр, Упр) =
с= 0. На основе соответственных состояний получается приведен-
ное универсальное уравнение состояния газов, связывающее при-
веденные давления, объем и температуру, без постоянных а и Ь,
например приведенное уравнение Вертело:
[9 р /
1 ч----не_ /1
128 тпр к
Основное уравнение Ван-дер-Ваальса можно выразить через
критические или приведенные параметры (приведенное уравнение)
или
Г Рпр "Ь "rj 'j (3VПр — 1) = 8Т
\ *'пр /
Если Т — 0, то:
I/ ' I/ 1
Vo = —у- ИЛИ Ио пр = -д
Это уравнение не содержит констант, зависящих
вещества, и является общим для любых веществ, т.
наковых приведенных температурах
и давлениях все вещества должны
обладать одинаковыми приведенны-
ми объемами. Отсюда следует по-
нятие соответственных состояний.
Для двух веществ А и В соответ-
ственными состояниями будут те, в
которых они обладают попарно оди-
наковыми значениями Рпр, 7пР и
УПР, т. е. при которых РП₽А== Рпрв,
^прд ~ Т’НРВ И ^прА = Упрв.
Для веществ, близких по соста-
ву и строению, в соответственных
состояниях ряд свойств находится
в простых соотношениях между со-
бой (коэффициенты вязкости, рас-
от природы
е. при оди-
' Рис. V. 1. Минимумы на кривых
Рпр Рпр = / (Рпр).
ширения, сжимаемости, показатель преломления и другие свойства).
В критической точке основное уравнение упрощается:
д' Ркр!* кр RTкр
Таким образом, если данный газ следует закону Ван-дер-Ва-
альса, то его критический объем равен 3/8 объема, который имел ,
бы идеальный газ при тех же значениях давления и температуры.
Действительно, у одноатомных газов критический объем равен
0,375 объема идеального газа, но для двухатомных газов это
61
отношение 0,263, а для углеводородов с тремя и более атомами
углерода — 0,26. Для примерной оценки критических параметров
предложены соотношения:
Р V
-^-^«22
7 кр
^кр 32
И V«P ~ 9
Каждая точка кривой РпрКпр = f (Лц>) (рис. V. 1) отвечает
различной температуре, которая увеличивается по мере увеличе-
ния PV. Для реальных газов при повышении температуры мини-
мумы на кривых PnpVnp = f(Pnp) сдвигаются вправо до тех пор,
пока не достигнут предельной изотермы T„v — 1,9. Для всех более
высоких температур минимумы сдвигаются влево; при Tnf = 3,375
минимум приходится на РПр — 0; для всех более высоких темпера-
тур минимума нет.
Многие расчеты критических и приведенных параметров осно-
ваны на сочетании метода аддитивных вычислений с методами на
основе соответственных состояний.
Расчеты различных свойств газов удобно выполнять по графи-
кам на основе уравнений, связывающих данное свойство с приве-
денными параметрами.
Вычисление критической температуры
Критическую температуру жидкости Ткр можно приближенно
определить, зная температуру кипения жидкостей Т^ип при атмо-
сферном давлении:
г. - Л Т'кИП 2 ™ Г кип
правило Гульдберга — 0 = ——«или 7 кр = (j'535'
по Лидерсену (более точно) — Ткр = 7’кип/0
Здесь 0 — постоянная, вычисляемая по принципу аддитивности
путем суммирования составляющих (предложено Воулесом [6,
с. 147]):
Д0 Д0
с -0,5592 I 0,2994
н 0,2875 С=С 0,564
-он 0,3382 с=о 0,564
О 0,0165 C-S 0,564
N —0,2625 S-0 0,564
S . 0,014 с=с 1,1415
F 0,3042 C=N 1,159
С1 0,2983 к=к 1,159
Вг 0,2990 Шестичленное кольпо 0,5666
(ароматическое или
нафтеновое)
Можно воспользоваться данными, приводимыми в табл. V. 1.
62
Таблица V.1
Составляющие для определения критических параметров
(по Лидерсену, см. [6, с. 146])
Атомы, группы, связи AT (Д0) ДР-103, кгДПа-кмоль)1^ AV*103, м3/кмоль
-СН3 и -СН2- —СН2— (в кольце) 0,020 0,013 0,725 0,588 55 44,5
I -СН I 0,012 0,671 51
I —СН (в кольце) 0,012 0,613 46
I -С— I 0,00 0,671 41
I — С— (в кольце) | (-0,007) (0,492) (31)
=СН2 0,018 0,632 45
I ^сн 0,018 0,632 45
I == СН' (в кольце) I 0,011 0,492 37
I =С— 0,0 0,632 36
«=С— (в кольце) «=С= =С= (в кольце) е=СН sC— —F -Cl -Br -I —ОН (спирты) —ОН (фенолы) —0— —0— (в кольце) I 0,011 0,0 0,011 0,005 0,005 0,018 0,017 0,010 0,012 0,082 0,031 0,021 (0,014) 0,492 0,632 0,492 0,489 0,489 0,75 1,02 (0,160) (2,65) 0,192 (-0,06) 0,511 (0,383) 36 36 36 (36) (36) 18 49 (70) (95) (18) (3) 20 (8)
-C=0 0,040 0,926 60
—C=0 (в кольце) (0,033) (0,639) (50)
HC=O (в альдегиды) —COOH (кислоты) —COO— (сложные эфиры) —0 -NH2 0,048 0,085 0,047 (0,02) 0,031 1,053 (1,277) 1,501 (0,383) 0,303 73 80 80 (И) 28
—NH 0,031 0,431 (37)
63
Продолжение
Атомы, группы, связи дт < де> др. 10s, кг/(Па.кмоль)*А ДУ-10», м*/кмоль
—NH (в кольце) (0,024) \ (0,287) (27)
1 —N— 0,014 / 0,543 (42)
1 —N— (в кольце) (0,007) (0,415) (32)
-CN (0,060) (1,149) (80)
-ЬЮ2 (0,055) (1,341) (78)
-SH 0,015 0,862 55
—S— 0,015 0,862 55
—S— (в кольце) (0,008) (0,766) (45)
=S (0,003) (0,766) (47)
Примечание. В скобках приведены ненадежные данные.
Значения 0 можно определить, например, по уравнениям:
Лидерсена — 6 0,567 + У (Д6)—' [£(дв)]2
Риделя — 0 = 0,574 + У, (Д0)
У (Ав)
Эдулие - 0 = —
Параметр 0 зависит от строения молекул, их поляризуемости
и дипольдых моментов. Для веществ с близкими дипольными
моментами можно применить приближенную зависимость:
0 = const Rd, где Rd— мольная рефракция; х —постоянная, ха-
рактеризующая определенный ряд соединений; для углеводородов,
например, х = 0,1.
По формуле Риделя можно вычислить Ткр неассоциированных
жидкостей:
«=(^p/V/4:
Функция а аддитивна; она вычисляется сложением постоянной
величины А = 2,58-10~4 с составляющими, приводимыми ниже:
«10-*, К*/«-Па-’/< «•IO*4. К3А.Па"3/‘
Постоянная А 2,58 F , 1,046
Н 0,361 С1 2,2 —0,234
С 1,244 Атом кольца
N (в аминах) 1,15 Связь
О (в эфире) 1,12 ординарная -0,271
S (в сульфидах) 2,2 двойная 0,190
(С=С)
—СОО— (в эфи- 3,53
рах)
64
Критическую температуру жидкостей можно определить по за-
висимости
т
«Р
тг-тх
(Р1/Р2)‘"/а — 1
+ Л2 +
если известны плотности жидкостей pi и р2 при двух температурах
Т1 и Т2.
Метод Филиппова:
-ода(р-т
Pi — Рг Л
г, - т2)
(р — плотность при Т К).
По Ван-дер-Ваальсу:
Гкр = 8a/27Rb
[а (Па-м3/кмоль2) и b (м3/кмоль)—
постоянные].
Для простых соединений:
Т — 1 477’1,03
кр кип
Формула Нокая:
1g (1,8Гкр) = 2 176 + 0,2985 1g р +
+ 0,6216 1g (1,8ГКИП)
Уравнение (по Кирееву — Ват-
сону) кроме очень полярных соеди-
нений) :
Рис. V. 2. График для определе-
ния критических температур.
у _ ____Ткип + А__
Кр 0,283 (М/р„ум8
Здесь Те — температура, при ко-
торой жидкость находится в равно-
весии с насыщенным паром, а мольный объем пара равен 22 4 л;
Д = Те—Гкип— поправочный фактор (см. рис. V.2)- рж.кип —
плотность жидкости при Ткип, г/см3.
Для всех соединений с TKim < 235 К и простых веществ:
Лер = ^кип - 2
Если Гкип> 235 Кив состав соединения входят галогены и
сера, то:
ГКр==1'41ГКИп + 66-11Э
кр кии
(Э — число атомов галогена или серы).
Для ароматических соединений и нафтенов (не содержащих
галогены и серу):
Гкр = 1 '41 Лиш + 66 - m (0,3837^ - 93)
3 М. М. Викторов
66
р'
Рис. V. 3. Диаграмма для определения Гкр по плотности жидкости:
а—Т' < 1,1; б—Г > 1,1.
66
Рис. V. 4. Диаграмма для определения плотности жидкости.
(т — отношение числа нециклических атомов углерода к общему
числу атомов углерода).
Кроме того:
для всех соединений, не содержащих галогенов и серы, за исключением
ароматических и нафтеновых — Ткр = 1,027Гкип + 159
для углеводородов — lg'7'Kp = 2,0791 + 0,2985 1g р + 0,62164 1g Гквп
Ткр = 1,725 1g Ткип - 5,7; Гкр = 1,4732ГКИП
Критическая температура ароматических углеводородов-гомо-
логов бензола (по Мамедову):
Ткр = (2,0996 - 0,95 • 10-12 -^) Гкип у
Здесь Гкип — средняя мольная температура кипения жидкой
фракции при перегонке; р — плотность жидкого углеводорода при
15 °C.
Для смеси углеводородов по правилу аддитивности:
г — girxp +
к₽ 100
[gi и g2 — содержание компонентов смеси, % (масс.)].
з* 67
Графически значения Tvp жидкости можно определить, если
известны плотности pi и рг при Ti и Т2 по формуле Альтенбурга:
Р = Ро7(Гпр) Z
Расчет проводят по диаграммам (рис. V. 3 и V.4). Вначале
определяют р' = pi/p2 и Т' = Т21Т\. Затем отсчитывают значение
х — Т2/Ткр (рис. V. 3) или у = pi/po (рис. V. 4) и вычисляют Ткр —
= Т2/х и ро = pi/y. Зная р0, можно определить плотность жидко-
сти при любой температуре.
Критическую температуру, а также давление и объем соеди-
нений можно вычислить, зная парахор Рсь и мольную рефракцию
Rd, которые определяют аддитивно, суммированием составляю-
щих долей, например, по формуле Мейсснера:
Ткр = 20,2Г°-бп- 143 - 6,75-103Pch + 10,4 • 10% + А
Вычисление критического давления
Критические давления жидкостей можно вычислять, например,
по формуле Риделя:
Ркп = Ю4А1/а2
кр
Составляющие для определения а приведены ниже:
а-103, (кг/(Па-кмоль)]’А а-103, (кг/(Па-кмоль)]‘А
Постоянная А 105,4 Конденсированные -31,94
Н 0 кольца
С 73,5 С=С -19,2
F 73,5 с=о -38,3
С1 102,2 C=N 0
Вг 172,5 ОН (спирты) —35,1
О 57,5 ОН (ароматические 67,1
N 44,7 спирты)
S 86,2 ОН (кислоты) 0
I 277,9 N-H х -6,4
Атом кольца — 13,73 teC -44,7 '
* C-S -16
Эти составляющие суммируют с постоянной А = 105.4- I0-3.
Формула Лидерсена — Риделя:
Р __________________________________________
КР (£ АР + 1,086-10-3)'
Значения АР определяют сложением составляющих, приведен-
ных в табл. V. 1.
Формула Воулеса (см. табл. V. 2):
Ркр = а™
Зависимость от Рсь и RD по Мейсснеру:
591 • 104Г п
Ркр (8,43 • 103Pch + 9 - 4,34 10%)1,226 Па
20,8Г
p«,"XF^aT"
S8
Таблица V.2
Составляющие для определения постоянной у
и показателя степени а
Атомы V Связь V Группа соединений а
с 1,02 с=с 2,50 Спирты 0,65
н 1,95 с=о 2,50 Фенолы 0j665
о 3,00 c=s 2,50 Нитоилы 0j68
ОН (составляющие 23,10 s=o 2,50 Карбоновые ки- 0,685
О и Н) — СЛОТЫ
N 2,45 с=с 5,59 Другие соединения 0,80
S 6.70 C=N 29,10
F 3,62 N=N 2,68
С1 7,45 Кольцо 5- или -0,14 •
6-члеиное
Вг 9,38
I 10,95
Формула Тодоса учитывает зависимость Ркр от постоянных а
и & в уравнении Ван-дер-Ваальса:
а 7\_
р — _____ . р _____ 01 КР
кр 27 b2’ КР~ ’ Кп
кр
Значения а и b вычисляют аддитивно.
Формула Филиппова:
р — ^крРкр
кр 3.83Л4
Более точная зависимость по Эдулие:
== М-104
К₽
Ниже приведены значения ДР:
ДР-103, [кгДПа-кмояь)]'^
С 29,86
Н 51,74
О (эфиры) 54,93
N 0
С1 153,3
Вг 219,7
F 127,4
S 88,78
Si 71,54
N—Н (амины) -10,1
—ОН (спирты, фенолы) 75,7
=СО (кетоны) 96,5
-СООН 184,3
-C=N , 167,7
CssC 163,2
69
Метод Бенке:
?кр = 7л^
4Гкип_ р _ 4 105ГКИП т-г
. , кр (ЛЩ)/г
(п — число атомов в молекуле).
Вычисление критического мольного объема
Значение К„р. мол (в дальнейшем для краткости VKp) жидкости
можно вычислить по правилу прямолинейного диаметра: полу-
сумма плотностей кипящей жидкости и насыщенного пара есть
функция температуры:
При построении графика рис. V. 5 получается прямая, продол-
жение которой до Т = Ткр дает значение ркр. По величине ркр
303 313 323 333 343 353 363 373
к
Рис. V. 5. Правило прямолинейного
диаметра (соотношение плотностей
кипящей жидкости и сухого насы-
щенного пара).
можно вычислить объем УКр =
= Л4/ркр.
Когда объем смеси жидкости
и насыщенного пара (влаж-
ность) меньше Ккр (точка а),т. е.
р >• ркр, то изохорный нагрев
смеси жидкости и пара по линии
ае сопровождается увеличением
давления в системе, вследствие
чего в точке е пар полностью
конденсируется и плотность смеси
не меняется. По пути от а к е
меняется только соотношение ме-
жду более плотным (чем в точке
а) газом и менее плотной (чем в
точке а) жидкостью, причем из-
менение плотности жидкости опи-
сывается движением фигуратив-
ной точки по кривой се; объем
жидкости увеличивается.
Когда V >• Ккр (р<Ркр), то изохорное нагревание (линия bf)
приведет к полному парообразованию (в точке f) и степень сухости
пара х (т. е. его масс, доля в смеси с жидкостью) увеличивается
до точки f, т. е. образуется сухой насыщенный пар.
Соотношение между количеством пара и жидкости опреде-
ляется по правилу рычага. Так, в смеси состава а:
Кол-во жидкости ad
Кол-во пара са
Формулы для вычисления критического объема —
Укр = (2,118 • 103Pch + II)1-25 Па; Укр = RT кр/3,75Ркр
УхР = ^кип (°-422 Ркр - 1-985) м’/моль; Ркип = Л1/ркнп
70
Формула Тодоса для определения Укр алифатических насы-
щенных и ненасыщенных углеводородов:
К п = ЗВ5 см3/моль
кр
Здесь b —- постоянная Ван-дер-Ваальса; значение 0 зависит от
числа атомов Nc углерода и их расположения в молекуле:
для нормальных насыщенных алифатических углеводородов — 0Я =
= 0,7849 - 0,01337^
для тех же углеводородов, но с разветвленными цепями — 0 = 0,8100 —
— 0,0138АГс
для ненасыщенных алифатических углеводородов — РсяН2 =
= О,99310Г н
СПМ2п + 2
Кроме того:
по Мейсснеру - 7кр = 0,55 (8,43 • 103Pch + 9 - 4,34 • Ю3^)1-55
по Лндерсену — 7кр = 40 + £ ДИ
Слагаемые ДУ находят по табл. V. 1.
Приводим соотношение:
УкР = -^ип/(3,43 + 2,515 • Ю-8Д2ИСП. кип)
кр
(Ьисп.кип — теплота испарения при Гкип, Дж/кмоль).
Критический объем можно определить, исходя из критического
коэффициента сжимаемости гкр:
7* кр
Vкр = гкрЯ '~П
“ кр
1
<?кр —"-----т-----я—5 * ^кр — 0,293 Да1
3,43 + 2,515. Ю~8Д2СП киП
Приводим значения дг:
-н 0,0000 Бензольные кольца 0,0178
—СН3 или —СН2— Положения:
первые 10 в моле- 0,0046 орто- 0,0122
куле мет а- 0,0072
каждая после деся- 0,0037 пара- 0,0102
той Связь С=С
X X первая 0,0133
—СН или —С— вторая (—0,0011
1 1 Изомеры
первая в молекуле -0,0035 цис- (-0,0022)
каждая последую- 0,0042 транс- (—0,0102)
щая Связь С==С (—0,0183)
—СН (в кольце) 0,0025 -nh2
Кольца алифатическая (0,0097)
трехчленные (0,0152) ароматическая (0,0252)
пяти- и шестичлен- —0,0057 1
иые —NH (алифатическая) (0,0047)
71
. =N— (алифатиЧес- —0,0057
кая)
-SH 0,0110
— S— 0,0082
-О- 0,0076
—О— (в кольце) 0,0135
НСОО— (эфиры му-.
равьиной кислоты)
при четырех или 0,0360—0.0040N
менее атомах С
яри более чемче- —0,00?5
тырех атомах С
—СОО— (сложные z
эфиры):
при < 5 атомах 0,0060—0,0040
при > 5 атомах —0,0075
- F, - Cl, —Вг, -I 0,0112
(ароматические)
§ 2. ВЫЧИСЛЕНИЕ ПСЕВДОКРИТИЧЕСКИХ ПАРАМЕТРОВ
(6,66)
Параметры Р, V и Т газовых смесей можно вычислять на
основе принципа соответственных состояний и рассматривать смесь
как индивидуальный газ средней молекулярной массы. Для этого
находят так называемые псевдокритические параметры смеси,
вместо критических, пользуясь которыми и графиком, построен-
ным в приведенных координатах, можно вычислить для газовой
смеси при заданных двух параметрах третий искомый.
Псевдокритические параметры смеси подбираются так, чтобы
при равенстве приведенных параметров смеси и эталона заданная
физико-химическая величина (приведенная вязкость, коэффициент
' сжимаемости и др.) имела бы одинаковые значения для обеих
сравниваемых систем. Приведенные параметры смеси:
Гпр. см = Гсм/^пкр; Рпр. см = ^’см/Т’пкр
1Л1р. СМ = Усм/^пкр; Рпр — Рсм/Рпкр
(пкр — псевдокритические параметры).
Приведем вкратце только две эмпирические зависимости для
приблизительного расчета псевдокритических параметров газовых
смесей.
Зависимости по Кэю
^пкр хА^"кр. А "I- хВ^кр. В'1 ^пкр = хА^кр. А + хВ^кр. В
для 1 моль газовой смеси, состоящей из хА моль компонента А
и хв моль компонента В с критическими параметрами ТКр. А, Тир. в
и Ркр. а, Ркр. в- Для смесей, содержащих п компонентов
п п
Гпкр 52 Х1^кр. I’ ^пкр 52 хЛр. i
i = l i*l
где i — номера компонентов; х{ — мольная доля компонентов.
Псевдокритический мольный объем смеси компонентов А, В, С
по Прауснитцу и Ганну:
^пкр хА^кр. А + хВ^кр. В "Г хС^кр. С
Для природных газовых смесей:
Гпкр = 105,5 + 5,42М; Рпкр = 6895 (710 - 2.07Л1) Н/м2
(JW — мол.масса смеси).
72
По модифицированному правилу Прауснитца и Ганна:
Т'пкр. см Г гпкр. см *£гкр. I
I i
V = V х V Р = z RT IV
пкр.см La i кр.Г пкр.см пкр.см х пкр.см/ пкр.см
i
§ 3. ВЫЧИСЛЕНИЕ ПАРАМЕТРОВ ГАЗОВ
ПОД ДАВЛЕНИЕМ И КОЭФФИЦИЕНТА СЖИМАЕМОСТИ
[21, 31, 66, 85J
Для вычисления свойств реальных газов под давлением очень
удобно применять обобщенные методы расчета, основанные на
принципе соответственных состояний, с использованием приведен-
ных давления и температуры.
При этом учитывают сжимаемость газов, рассчитываемую из
безразмерного коэффициента сжимаемости г. При сопоставлении
значений г для разных газов простые результаты получаются то-
гда, когда сравнение относится к соответственным состояниям га-
зов, т. е. к одинаковым приведенным температурам и давлениям,
а не к одинаковым абсолютным температурам и давлениям.
В этом случае значения z для разных газов мало различаются,
что позволяет пользоваться средними значениями.
Как указывалось, хотя точные уравнения состояния различны
для каждого газа, приведенное уравнение состояния приблизи-
тельно применимо ко всем газам. Точно так же и коэффициенты
сжимаемости в соответственных состояниях примерно одинаковы
у всех газов.
Величина г является функцией приведенных Т и Р, т. е.
z — Рдр); это приведенное уравнение состояния не содержит
констант, зависящих от природы вещества. Зная Ткр и Ркр газа,
для заданных Т и Р вычисляют приведенные параметры ТВр и Рвр,
по которым на обобщенных графиках находят коэффициенты сжи-
маемости г.
Для технических целей используют следующие зависимости:
z = PV/RT; г' = PV/Pq^o (нормальные условия)
г = г' (PV)ila/T; zfz' = 273/Г
Уравнение Розена для высоких температур и давлений:
г = А + ЪР + Ct
((значения постоянных приведены в табл. IV. 3, стр. 47).
Для газа, находящегося в двух различных состояниях: .
w iv _ 2гТгР\ . ^1^1 _ 2=17'1
2/K1 ZiT^’ P2V2 z2T2
Для всех газов при Р — 0 z « 1. Истинный нормальный объем
1 моль газа равен:
Ииюл = г • 22,41 л/моль
73
Значение z ~ 0,3—1 (кроме очень высоких давлений); для
низких давлений z » 1. Графически зависимости Р 6т V при по-
стоянной температуре для всех газов качественно подобны*
Критический коэффициент сжимаемости:
2кр m /’крГкр/ЛГкр = 1/К; 1/2кр = ЛГкрРкр/МРкр'3,83; Ро/Ркр 3,95
(К — критерий Ван-дер-Ваальса).
В критическом состоянии газов, когда Тпр= 1 и РПр — 1» при-
нимают zKp = 0,27.
По опытным данным значения zKP изменяются в пределах
0,25—0,29 (для большинства органических соединений), хотя
имеются исключения.
2 кр
кип,К
-
0,290. -Е
— -600
0,2801
0,270 1 -
-
0,280--
— -500
#2501 ’ А Л В 4,6-¥4,8
5-~5 —
0,2401 В--
"7 ' *
7- ♦
- •в< -400
0,2301 ю~‘
—
-
0,220-z 14-'
0,2101 16-: 18-: г 300
12
0,2001 1«=/0 1-200
0,190-1 ?1О0
0,180 '-0
Рис. V. 6. Номограмма для определения zKp.
Шкалы:
Л—для первичных спиртов и неорганических соединений типа Н2Х и Н3Х; В —для алифати-
ческих нитросоединений, HCN, нитрилов, карбоновых кислот, кетонов и неорганических со-
единений типа На; точка С —для всех других соединений.
74
Значения zKP можно определить по номограмме V. 6. Средняя
шкала номограммы (кроме точки С) применяется для полярных
соединений.
Кроме того:
lg PKD
zKp = 0,371 - 0,0343 —r
* кр/* кип 1
Значение гкр можно установить также аддитивно, путем сум-
мирования составляющих Аг (см. стр. 71) по формуле:
гкр = 0,293 - £ Az
Формула неприменима для полярных и неорганических со-
единений и галогенпроизводных алифатических углеводородов
Как указывалось, использование приведенных параметров зна-
чительно упрощает описание свойств реальных газов, так как
можно на один график нанести z как функцию Рвр и Тпр для всех
газов, зная значения РКр и TVp (рис. V. 7).
Эти графики применимы и для приближенного расчета общего
объема любого газа: V = пКмол-
Для неполярных газов отношение К/Ккр можно определить из
отношения:
Vnp = V'/V кр = zRT I PV Kp = zT P Kp/zKpT KpP = zT пр/Рпр^кр
Рис. V. 7. Обобщенные диаграммы z для различных значений РПр-
76
Рис. V. 1, б.
0,3 0,4 0,6 0,8 1,0 2,0 - 3,0 4,0 8,0 7,08,09,010 20 25 30
78
Когда известны температура или давление и объем и требуется
вычислить давление или температуру, исключая VKp, тогда для
расчетов предложено применять так называемые изохоры «идеаль-
ного» приведенного объема (изменение давления с температурой
при постоянном объеме данного массового количества газа);
/ ^мол ^мол z^np
Для повышения точности расчетов составляют графики коэф-
фициентов сжимаемости для данного газа (рис. V. 8),
79
CD
МПа
Рис V. 8. Коэффициенты сжимаемости:
а—этана; б —пропана; в, г—азота.
z
г
Рис. V. 8, г
3,2Г Рпр
Газовую смесь можно рассматривать как чистый газ, и тогда
можно применить значения псевдокритических параметров, кото-
рые аддитивны: " * -
Т'пкр = 12 х*Гкр. Г ^пкр ~ И XiPKJ>. i
Если вычисленная 7пкр > 1, то получается более точное соот-
ношение Р — V — Т.
Рис. V. 11. Обобщенная диаграмма коэффициента сжимаемости z для
простых газов и жидкостей.
Затем вычисляют псевдоприведенные параметры:
7ппр — ТITпкр И Рппр “ Р/Рпкр
По рис. V. 7—V.8 определяют zCp, а по уравнению z = PV/nRT
вычисляют искомый объем. Когда вместо Р и Т для расчета зада-
ны Р и V или Т и V, то расчет проводят подбором,
84
Плотность газа при высоких давлениях можно установить, при-
меняя обобщенные диаграммы коэффициента сжимаемости.
По формуле z = PVM0JI/RT находят мольный объем, а плот-
ность р = ЛТ/Умол, Приведенная плотность рпр = р/ркр; при zKP =
= 0,27 ее определяют по рис. V. 9. На рис. V. 9 нанесена погранич-
ная кривая насыщенного пара и равновесной с ним кипящей жид-
кости. Для расчетов нужно знать плотность насыщенного пара и
Рис. V. 12. Поправки к обобщенному коэффициенту сжимаемости г сложных
газов и жидкостей. •
кипящей жидкости. На рис. V. 10 даны пограничные кривые рпр
для систем с разными значениями zKp (так, для воды гкр = 0,23).
Значение коэффициента сжимаемости смеси г в критической
точке
2пкР ХА2кр. A "I" хВ2кр. В "I" хС2кв. С
Известен эмпирический способ определения значения г, осно-
ванный на сравнении приведенных давлений паров ?пр при оди-
наковой приведенной температуре. Для простых жидкостей и газов
(СН4, Аг, Хе) значение Рпр при Тпр — 0,7 равно 0,1.
Для простых соединений вносимую поправку вычисляют по
уравнению, содержащему фактор ацентричности; последний
86
характеризует асимметрию (ацентричность) молекулы: со = —1,0—
— 1g/’пр при 7’пр = 0,7.
Для простых газов и жидкостей со = 0. Значение со отыскивают
по кривой давления паров (Рпр берут при Гор = 0,7). Для этого
строят кривую зависимости приведенного давления паров Рпр от
приведенной температуры 7пр.
Для неполярных соединений значение г — z° + az' (z° иг'—
функции 7пр и Рпр; г°— коэффициент сжимаемости для простого
газа или жидкости). На основе этих положений составлены гра-
Рис. V. 13. Поправки к коэффициенту
сжимаемости для полярных моле-
кул z".
Коэффициент сжимаемости
фики (рис. V. 11—V. 13).
Формула для определения
значения со при отсутствии дан-
ных о давлении паров:
0 = -^-
* кр
(0 — приведенная температура;
РкР, Па).
Зная фактор ацентричности,
можно приближенно определить
значение: zKp = 0,291 — 0,080 ш
(и = 0—0,4).
жидкостей можно оценить, зная
ее плотность
РМ
Рпр Р КрМ Р крМ
zPT пр Ркр 7 кр
Проще пользоваться соотношением плотностей, зная плотность
жидкости при данной температуре: p/pi = (o/(oi.
На рис. V. 14 дана зависимость сжимаемости жидкости от при-
веденных Рпр и Гпр.
*
§ 4. ПРИМЕРЫ РАСЧЕТОВ
[6, 66, 71]
Пример V. 1*. Вычислить Гкр этилпропилового эфира CHjCHjOCHiCHjCHs;
Ткип = 336,8 К.
Решение. Применим формулу 0 = 0,574 + (Д0), используя данные
табл. V. 1. Составляющие для групп:
5 (—СН3 и — СН2—) + (—О—) = 5 • 0,020 + 0,021 =0,121
0 = 0,574 + 0,121 =0,695
Ткр = ТКип/0 = 336,8/0,695 = 490 К
♦ По примерам V. 1-V. 12 см. [6, 66, 71],
86
Можно воспользоваться формулой 0 = 0,567 + (Л0) — [£(Д6)]2;
5 (—СНа и —СН2—) + (—О—) = 5 • 0,020 + 0,021 = 0,121
0 = 0,567 + 0,121 - (0,1 + 0,021)2 = 0,674
Гкр - Т'кип/е - 336,8/0,674 = 500 К
Рис. V. 14. Зависимость сжимаемости жидкости от приведенных температур и
давления.
Кроме этого (см. вывод на стр. 62);
0 = 5 (С) + 12 (Н) + 1 (О) = 5 (—0,5592) + 12 • 0,2875 + 0,0165 = 0,671
Ткр = 336,8/0,671 = 502,4 К
Пример V. 2. Определить Ткр изоамилового эфира муравьиной кислоты
СбН12^2» Ткип — 396,7 К.
Решение. Применим формулу Тнр = Тнип/0 и значение У, Д0 из вывода на
стр. 62:
£ А0-6(C) + 12(H) + 1 (С=О) +2(0) =
= 6 (-0,5592) + 12 • 0,2875 + 0,564 + 2 • 0,0165 = 0,692
ТКр = 396,7/0,692 = 574К (опытное значение 576,2 К)
87
По формуле 0 = 0,567 4- £ (А0) 4- £ (А0)г и данным табл. V. 1:
(АО) = 2 (—СН2—) + 2 (—СН3) +<1 (—С—н) +
+ (—COO) + (Н) = 2 • 0,020 4- 2 • 0,020 4- 0,012 4- 0,047 4- 0 = 0,139
0 = 0,567 4- 0,139 — (0,139)2 = 0,686
Ткр = 396,7/0,686 = 578 К
Пример V. 3. Вычислить Ткр ССЦ (М = 154)? зная ТКип = 350 К и р =
= 1,48 г/см3.
Решение. Воспользуемся рис. V. 2: А = Те — ГКип = ЮК. Тогда Те = 360 и
Те/Ткр = 0,283 (М/рж. кип)°’18 = 0,283 (154/1,48)°’18 = 0,65; Ткр = 550 К
Пример V.4. Определить Ткр и Ркр дивинила СН2=СН— СН=СН2 (ЛТ =
= 54,1).
Решение. Сложение составляющих функции а (см. стр. 68). Основная по-
стоянная 105,4-10-3:
4(С)4-6 (Н) 4- 2 (С=) = |4 • 73,5 + 6-04-2 (—19,2)] • 10“3 =
= 255,6 • 10“3; а = (105,4 + 255,6) • 10“3 = 361 • 10“3
Сложение составляющих функции а (см. стр. 64) Основная постоянная
2,58-10-‘:
(4-1,244 + 6-0,361 +2-0.181)- 10“* =
= 7,504-10“*; а = (2,58 + 7,504) • 10“* = 10,084 • 10“* ' .
Тогда:
10 4 • 54 1
Ркр = , ~ = 4,15 • 106 Па = 4,15 МПа
' р (361-10“3)2
ТКр = (10,084 • 10“*)1г • 4,15 • 10е = 420 К (опытное значение 425 К)
Пример. V.5. Определить по рис. V. 3, б и V. 4 Тнр толуола. При Л = 281,2 К
р, = 0,878, а при Т2 = 383,2 К Ра = 0,780 г/см3.
Решение. Значения параметров р' = 0,878/0,780 = 1,126; Т' = 383,2/281,2 =
= 1,363. Отсчет по диаграммам: 4 = 0,642 и </ = 0,795. Следовательно:
Ткр = 383,2/0,642 = 596 К (опытное значение 593,8 К)
р0 = 0,878/0,798= 1,104
Пример V. 6. Вычислить Ркр этилпропилового эфира (М = 88,1).
Решение. Ркр = М/(£ АР + 1,086 • 10“3)2; по табл. V. 1:.
£ АР = 2 (—СНз) + 3 (—СН2—) + (—О-) =
= (2 • 0,725 + 3 • 0,725 + 0,511) • 10“3 = 4,136 • 10“3
Ркр = 88,1/[(4,136 + 1,086) • 10“3]2 = 3,231 10е Па (33 атм)
Пример V. 7. Определить Рир n-крезола; Тнр = 699 К.
Решение. Воспользуемся формулой Р“р = Ткр/у и табл. V. 2:
£ Ay = 7С + 7Н + 1 ОН + 3(С=С) + 1 кольцо =
= 7 1,02 + 7 -1,95 + 23,10 + (-0,14) = 51,25
р9,665 = 699/5)j25. ркр « 51 атм
Пример V.8. Определить Тнр, Рнр и ркр гептана (М == 100,2). При 273 К
Ро = 0,7005, а при 293 К р = 0,6836 г/см 8.
88
Решение. По формулам Филиппова:
= — 0,000845
1 \ — 12 4,10 — 2УО
Ркр = 0,253 (0,7005 + 273,2 • 0,000845) = 0,235 г/см3
ркр 1 — 7*2) 0,235
= - ’-95 - 1>95 "«45 = 543 К
Я^коРкп 8,314 • 103 543 • 0,235 • 103
^КР = 8 ЯМ = 100,2 • 3,8 = 2,76 МПа
3.8Л4
Опытные значения: ркР = 0,234 г/см3; Гкр = 540 К; Ркр = 2,63 МПа.
Пример V. 9. Вычислить УКР этилпропилового эфира; Гкр = 498 К; Ркр =
= 3,23 МПа.
Решение. Воспользуемся уравнением Лидерсена Укр = 40 4- У, ДУ и табл. V. 1:
£ ДV = 2 (—СН3) + 3 (—СН2—) + (—О—) = 2 • 55 +
+ 3 • 55 + 20 = 295;
Укр = 40 + 295 = 335 см3/моль (опытное значение 339 см3/моль)
С другой стороны: zKp = 0,293 — У Дг; У Дг = 0,031. Тогда:
zKp = 0,293 — 0,031 = 0,262
2КрЯГкр 0,262 • 8,314 • Ю3 • 498
Укр = —— =--------------32§; (де-----= °>335 м’/моль
Пример V.10. Вычислить рк₽ и УКр для пропана (М = 44), зная, что при
/ = 30°С pm = 0,4858 и р2п = 0,020, а при / = 80°С р3ж = 0,376 и р4п =
= 0,0832. г/см3; /кр = 96,8 °C.
Решение. По правилу прямолинейного диаметра (рж + рп)/2 = р + bt:
. 0Л35И+ 0.» 0|2529
2
„„а япor 0,376 + 0,0832
для oU С 2 “ 0,2о
Тогда:
0,2529 = р + Ь • 30 и 0,23 = р + Ь • 80; р «= 0,2669 и b = - 0,000046
Для критической точки:
Ркр = Р + Ь*кр = 0.2669 - 0,000046 • 96,8 = 0,2218 g
Укр = 198 см3/моль = 4,5 см3/г
Пример V. 11. Вычислить Гкр этилбензола; Ткяп = 409,4 К, р=0,867 г/см3 =»
= 0,867-10-3 кг/м3.
Решение. По формуле Нокая:
lg (1,8Гкр) = 2,176 + 0,2985 1g 0,867 • 10-3 + 0,62161g (1,8 • 409,4) = 3,0455
Ткр = 616,5 К (погрешность — 0,5%)
Пример V. 12. Вычислить РКр и Укр дихлорэтана CH3CHCI2; Гкр = 523 К;
Rd = 21,18 см3/моль.
Решение. Суммируем составляющие Рсь (см. стр. 30):
pch = 2 (С) + 4 (Н) + 2 (С1) = (2 • 1,60 + 4 • 2,76 + 2 • 9,82) • 10-3 =
= 33,88 • 10-3 Дж1/* • м‘1г • кмоль-1
89
По формуле Мейсснера!
р =__________________________591 • 10*-523___________________
КР (8,43 • 103 • 33,88 • 10~3 + 9 + 4,34 • 103 • 21,8 • 10-3)
= 4,48 • 10е Па = 4,48 МПа = 45,7 атм
По методу парахора:
Укр = (о,671 • 104 • 33,88 • 10~3 4- 11)1'25 • 10-3 =
= 0,244 м3/кмоль = 0,244 л/моль
Средняя погрешность расчетов: Рнр±5%, Унр ± 10—15%, а по методам
Лидерсеиа и Риделя ±3% и ±4,7%.
Пример V. 13. Установить Гпкр и Рпкр газовой смеси, содержащей [в % (об.)]:
50 Hi, 40 СО и 10 СО2.
Решение. Применим зависимости:
Т'пкр = хАТкр. А “Ь хВ^кр. В + ^С^кр. С' ^*пкр == хА^кр. A "J" ^В^кр. В “1“ ^С^кр. С
Значения хН2 = 0,5; хСо = 0,4; *со2 = 0,1 [мольные доли-газов пропорцио-
нальны содержанию в % (об.)].
Значения критических параметров:
Н2—Гкр = 33,ЗК; Ркр = 12,8 атм (1,3 МПа)
СО — Гкр = 134,5 К; РКр = 34,5 атм (3,5 МПа)
СО2 - ГКр = 304,3 К; Ркр = 73 атм (7,3 МПа)
Искомые значения:
Гпкр = 0,5 • 33,3 + 0,4 • 134,5 + 0,1 • 304,3 = 101 К
Рпкр = 0,5 • 12,8 + 0,4 34,5 + 0,1 • 73 = 27,5 атм = 2,75 МПа
Пример V. 14*. Определить мольный объем паров этанола при 427 К и
0,7 МПа; Ркр = 6,33 МПа и Гкр = 516 К.
Решение. Тпр = Г/Гкр == 427/516 = 0,827; Рпр = Р/РНр = 0,7/6,33 = 0,11.
По рис. V. 7, a z — 0,92 и:
V мол
zPT
Р
0,92 • 8,31 • 103 • 427
0,7 • 106
4,6 • 10 3 м3/кмоль
Пример V. 15. 1 м’ азота при 333 К и 3 МПа сжимают до 6 МПа и затем
охлаждают до 223 К. Вычислить конечный объем азота.
Решение. Коэффициенты сжимаемости по рис. V.8, в zi = 1 и z2 = 0,93.
Откуда:
v2 = vt = 1 3 = о,з1 мз
Р2Г tzi 6 • 323 • 1
Пример V. 16. Установить давление, до которого нужно сжать азот при 323 К,
чтобы при 273 К в автоклаве емкостью 10 л поместилось 1 кг азота.
Решение. По рис. V. 8, в при 0,1 МПа и 273 К Zi = 1 и при 323 К z2 = 1,02.
Объем 1 кг азота, т. е. 35,7 моль V = 22,4-1-35,7 = 800 л; откуда:
р о VtT2Z2 800-323-1,02
Р2 = ?1"Й^7Г = 760 10 - 273-1-------
= 73 155 мм рт. ст. или 99,5 атм « 10 МПа ч
Пример V. 17. Установить давление Р2, необходимое для сжатия 0,8 л паров
метанола, находящихся при Р{ = 6 МПа и Г1 = 623 К, до объема 0,1 л при
г2 -» 523 к; Гкр = 513 К и Р„р = 7,9 МПа.
Решение. Рпр. 1 = 6/7,9 = 0,076 и Гпр i = 623/513 = 1,2. По рис. V.7,a;
Zi = 0,85; Рпр. 2 = Р/7,9; Гпр. 2 = 523/513 = 1,02.
* По примерам V, 14—V. 33 см, [21, 31, 33, 66, 851,
90
По уравнению PiVi/P2V2 = ziT^z^, откуда:
г2 = - fi0’L°y = 0.002Р, = 0,002 7,9Рпр. 2 = 0,16Рпр. 2
На рис. V. 7, б проводим прямую под углом 45° до пересечения с изотермой
Гпр. 2 = 1,02 и получаем: z2 = 0,4 и Рпр, 2 = 2,8; тогда:
Р2 = 2,8 • 7,9 = 22 МПа
Пример V. 18. Установить плотность 1 моль смеси, содержащей 25,5 С2Н4 и
74,5% (об.) О2 при Р = 10 МПа и Т = 298 К, зная
для С2Н4 — Ткр = 283 К и Ркр = 5,1 МПа
для О2 — 7'Кр=154,8К и Ркр = 5 МПа
Находим:
Решение.
Для С2Н4— Тпр = 298/283 = 1,1 и Рпр = 10/5,1 = 1,96
для О2 — Гпр = 298/154,8 = 1,9 и Рпр = 10/5 = 2
По рис. V.7, г значение z4 для С2Н4 — 0,35; для О2 — z2 = 0,95 и zop =
= 0,255 • 0,35 + 0,745 • 0,95 = 0,8.
PV v 0,8-8,314-Юз-298 . ... .
zCD =---, откуда: V =-----------------------— 0,198 м3
PTlLni 10-10е
Искомая плотность: р = 100/(198-100) = 0,005 г/см3.
Пример V. 19. Вычислить критический объем воды и объем при 25 МПа и
573 К, зная плотность при 5 МПа и 423 К р = 919 кг/м3, Гкр = 647 К, РКР =
= 21,4 МПа.
Решение. Для начального состояния: Рпр = 5/21,4 « 0,2 и Тпр = 423/647 =
= 0,65.
По рис. V. 14 ш = 0,12. Из отношения р/р4 = ш/coi; 0,919/р4 = 0,12/<в4 или
Pl/mi = 0,919/0,12 = 7,7.
Для конечного состояния Рпр = 25/21,4 = 1,15 и Гпр = 573/647 = 0,89. По
рис. V. 14 о>1 = 0,096. Тогда р4 = 0,096-7,7 = 0,73г/см3 и искомый V = 1,37см3/г.
Пример V. 20. Установить давление, необходимое для сжатия 100 л азота,
находящегося при 0,1 МПа и 296 К до объема 1 л при 163 К, зная ТКР = 126 К
и Ркр = 3,3 МПа.
Решение. Для исходных условий Гпр = 296/126 = 2,35 и РпР = 0,1/3,3 =
# = 0,03; тогда по рис. V. 7, г z = 1.
Для заданных условий Тпр = 163/126 = 1,3 и Рпр = Р2/3,3.
Далее:
P1V1 _ z,?, 0,1-100 _ 1 296
P2V2 z2T2 ИЛИ Р2-1 ~ z2 ’ 163
z_> = 0,019P2 и z2 = 0,019 33,5Рпр. 2 = 0,62Рпр. 2
На рис. V. 7, г проводим прямую, соответствующую уравнению z2=0,62 Рпр, 2.
Эта прямая имеет наклон 45° и проходит через точку z — 0,62 при Рпр — 1.
Там, где эта прямая пересекает кривую Тпр = 1,3, отмечаем z2 = 0,8 и Рпр=1,3.
Тогда искомое давление Р2 = 1,3-3,3 = 4,3 МПа.
Пример V. 21. В . автоклаве емкостью 425 л находится при 473 К 127 кг азота
(М — 28). Вычислить давление газа.
Решение. Р = znRTjV. Расчет проведем путем последовательных приближе-
ний. Число киломоль азота п= 127/28 = 4,54 кмоль. Примем z = 1; тогда
_ 1-4,54-8,31 • 104-473 л1 в
Р =------1----------------= 41,5 • 10е Па = 41,5 МПа
0,425
По рис. V. 8, г z = 1,25.
Второй расчет при z = 1,4 дает Р = 58 МПа. Искомое давление лежит
между 41,5 и 58 МПа.
91
Примем z = 1,35, тогда Р = 56 МПа. Это достаточное совпадение, и тогда
искомое Р = 56 МПа.
Графическое решение:
494 р
4546-^821. 473 °°W
Это уравнение прямой линии, проходящей через начале! координат и через
точку с координатами Р — 80 и z = 1,94 (см. рис. V. 8, а). Вместо начала коор-
динат можно выбрать точку с координатами Р = 33 и z = 0,8. Тогда пересече-
ния прямой с изотермой 200 °C даст искомое Р = 56 МПа.
Пример V. 22. Определить температуру в автоклаве емкостью 20 л, в котором
находится 5 кг пропана (М = 44,1) под давлением 10 МПа.
Решение, z-— PV/RT; Т — PVjzR. Число киломоль пропана: п = 5-1/44,1 =
= 0,113; У„ол =0,020/0,113=0,176 м3/кмоль. Тогда Т= 10-10« 0,176/8,314- 103z =
= 215/z или z = 215/Т.
На рис. V. 8, б построим график зависимости z от Т для пропана (кривая KL}.
По найденному уравнению строим кривую АВ. Пересечение кривых K.L и АВ
дает 157 °C = 430 К.
Пример V. 23. Вычислить давление 100 кг этана (М = 30) в автоклаве ем-
костью 0,5 м3 при Т == 478 К, зная сжимаемость этана при 204,4 °C (рис. V. 8, а).
Решение. Число киломоль этана: « = 100/30 = 3,330; Умол = 0,5-1000 X
X 1000/3330 = 0,15 м3/кмоль. Откуда:
п RT . 8,314- 103-478
Р = z -р- = z —-------------= 265 • 106z
V 0,15
Расчет производим путем последовательных приближений. Примем z = 1
тогда Р = 26,5 МПа. По рис. V. 8, а значение по изотерме z = 0,89 (точка а),
что отличается от принятого значения. Примем z = 0,86, тогда Р = 22 МПа.
Значение по рис. V. 8, a z = 0,858. Это достаточное приближение. Тогда уравне-
ние, связывающее Р и z : z = 0,00384 Р. Этому уравнению отвечает прямая АВ,
которая пересекает изотерму в точке О, где z = 0,858, и искомое Р = 22 МПа.
Пример V. 24. Газовая смесь из 6 кг метана (М =16) и 4 кг этилена
(М = 28) сжимается до 8 МПа при 283 К; для метана Ткр = 190,6 К и Ркр ~
= 4,5 МПа; для этилена Гкр = 282,1 К и РКр = 5 МПа. Вычислить объем смеси.
Решение. Число молей метана 6/16 = 0,37 кмоль и этилена 4/28=0,14 кмоль;
всего 0,51 кмоль. Мольные доли: СН4— 0,72; и С2Н4— 0,28. Для метана ТПр =
= 283/190,6 = 1,5 и Рпр = 8,0/4,5 = 1/75; для этилена ' Тпр = 283/282 = 1 и
Pop = 8,0/5 = 1,57.
По рис. V. 7, а ?СН4 = 0,86 и zC2H4 = 0,26. Средний коэффициент сжимаемо-
сти смеси: zCp = 0,72 0,86 + 0,28-0,25 = 0,69.
Откуда:
nzc„RT 0,51 • 0,69 8,314 • 103 • 283
17 =-7-------------------гда--------------»-1"’
Пример V. 25. 7,1 м3 газовой смеси из 75 Н2 и 25% (об.) N2 при 283 К и
1 атм сжимается в цилиндре емкостью 0,028 м3. Вычислить требуемое давле-
ние, зная для Н2 Ркр = 12,8 атм и Ткр = 33,2 К и для N2 Ркр = 33,5 атм и
ТКр = 126 К.
Решение. Приведенные параметры для Н2*: Рпр = Р/20,8 и Тпр =
= 323/(33,2 + 8) = 7,8; для N2 — Рпр = Р/333,5 и Тпр = 323/126 = 2,6. Так как
давление неизвестно, применим метод .последовательного подбора. При
Р = 35,0 атм Рпр = 16,8 для На и 10,4 для N2.
Число молей n = PV/RT =0,1 105-7,1/(8,314-283) = 304.
0,028-1000 nnQ„
Мольный объем при высоком давлении V = -------л.
По рис. V. 7, д z — 1,2 для Н2 и 1,19 для N2.
• См. стр, 16.
92
Откуда:
zcp = 0,75-1.2 + 0,25-1,19 =1,2
g^RT 1,2 • 8,314 • 103 • 323 .
P = у = 0,093 = 34,3 МПа
Пример V. 26. Вычислить удельный объем природного газа при 311 К и
14 МПа. Состав газа [в % (об.)]: 83,2 СН4 (М = 16); 8,5 С2Нв; 4,4 СзН2;
0,8 U30-C4H10; 1,7 С4Н10; 0,6 CsHjj; 0,3 U30-C5H12; 0,5 С5Н14.
Решение. Воспользуемся формулой: V — zevRT/PMcv. Вычислим отн. мол.
массу, псевдокритическое давление и температуру для СН4 (М = 16), зная ТКр=
= 191,1 К и Ркр = 4,5 МПа: 25 45 МПа
Т икр — х Т кр = 0,832 Ж 4-----1“----1—----1—--1-----1-----4
X 191,1 = 159 К
Рпкр — *Ркр =
= 0,832 • 4,6 = 3,8 МПа
Могн = 0,832 • 16 = 13,3
Вычисляя подобным образом
эти значения для других компо-
нентов смеси и суммируя их, по-
лучим среднюю мол. массу смеси:
Мер = 20,4; ТПКр. см =
= 219 К и Рпкр. см =
= 4,6 МПа
Приведенные параметры сме-
си:
Рпр. СМ = Рсм/Рпкр =
= 311/219= 1,42
Рпр. СМ = Рем/Рпкр =
= 14/4,6 = 3,04
Рис. V. 15. Решение Примера V 27
Тогда по рис. V. 7, г:
_ ' 0,77 • 8,314 • 104-311 ппл, ,,
2 = 0,77 и У =-----------------------= 0,007 м3/кг
Пример V. 27. Вычислить давление, под которым находится при 0 °C смесь
из 33 СН4 и 67% (об.) Н2 при объеме V = 58,7 см3.
Решение. Воспользуемся рис. V. 15.' При V = 58,7 см3 значение Рн„ = 52 и
Р = 50 МПа.
Сп4
По уравнению: ;
Р = PjM, + Р2М2 = 52 • 0,67 + 40 • 0,33 = 47МПа
Пример V. 28. Найти коэффициенты уравнения Р = PJVi + Р2Ы2 +
+a/V1M2(Pi — Р2) для азото-водородной смеси (1:3), зная давление азота, во-
дорода и их смеси и зависимость V от Р (рис. V. 16). Вычислить давления Р',
J3", Р'", Р’"' смеси при 0 °C, отвечающие ее мольным объемам 57,8; 54,6; 49,5 и
45,8 см3/моль.
Решение. Вычисляем А в зависимости от PHj — PN
P-(0,25PN2-0,75PH2)
0,25 • 0,75
рн2-р№ 44 ~10 ~64 ~231
А 21,3 -2,7 -26,7 -116
93
МПа
По этим данным строим график (рис. V. 16, а) и получаем прямую, тангенс
угла наклона которой равен а « 0,5. Тогда искомое уравнение запишется:
Р = 0,25РН2 + 0,75PN2 + 0,5Ун (Р„2 - PNj)
Строим график зависимости V от Р (см. рис. V. 16, б), зная величины z.
Проводим изохоры по заданным мольным объемам смеси. Находим;
V 57,8 54,6 49,5 45,8
PN2
Рн2
579 )
533 J Р
658
578
1031
751
рпг/
Искомые давления смеси (атм) по найденному уравнению:
Р' = 0,25 • 579 + 0,75 • 533 + 0,5 • 0,188 (—46) = 540
Р" = 0,25 • 658 + 0,75 • 578 + 0,5 -0,188 (—80) = 591
Р"' ~ 0,25 • 830 + 0,75 665 + 0,5 0,188 (—164) = 692
, р"" = 0,25 • 1031 + 0,75 • 751 4- 0,5 0,188 (—280) = 795
Пример V. 29. Вычислить объем 1 кг смеси из 60 С2Н4 (М = 28) и 40% (об.)
Ar (М = 39,9) при 298 К и 10 МПа, зная для этилена Ркр = 5,1 МПа и Ткр =
— 282,1 К, и для аргона РКр = 4,8 МПа
и Гк₽ = 151 К.
Решение. ТикР =(0,6-282,1) +(0,4Х
X 151) =231 К: Рпкр= (0,6-5,1)4-(0,4Х
Х4,8=5 МПа; Л1ср = (0,6-28)4-(0,4 X
X 39,9) = 32,7; Гпр = 298/230 = 1,3 й
Рпр= 100/50=2. По рис. V. 7, az = 0,7 и:
22,4-0,7 218 1 _
V ~ 32,7 ’ 273 ’ 100 —
= 0,0052 м3
Пример V. 30. Установить температу-
ру, при которой плотность метана при
14 МПа равна 0,006 кг/м8, зная РКр =
= 4,6 МПа и Гкр =? 191 К.
Решение. Рар —14/4,6=3,06 и И=
= 1/0,006 = 166 м3/кг.
PV 14 • 106 • 166 _
z~ РТ ~ 8,314- 103 - 191
1,48- 105
Гпр
Рис. V. 17. Зависимость коэффици-
ента сжимаемости z метана от при-
веденной температуры (см. Пример
V. 30).
По рис. V. 7, г находим зависимость z от Гпр при Рпр = 3,06 (рис. V. 17).
Пересечение построенной кривой с кривой z = 1,48/Гпр дает значение Гпр = 1,68.
Тогда искомое значение Г = 1,68-191 = 322 К.
Пример V. 31. Вычислить давление смеси, содержащей 34,8 NH3h65,2% (об.)
Н2 при Г = 473 К, если мольный объем равен 196 см8, а Гкр для NH3 405,6 К
и для Н2 33,2 К; Ркр = И 1,5 (NH3) и Ркр = 12,8 атм (Н2).
Решение. Т = У х. (Г ) = 0,348 • 405,6 4- 0,652 (33,2 4- 8) = 168; Р =
= 0,348 • 111,5 4- 0,652 (12,8 4- 8)-= 52; Гппр = 473/168 = 2,8 и Рппр = Р/52.
Искомое давление находим путем последовательных приближений.
Примем Р = 190 атм (19 МПа); тогда Рвр = 190/52 = 3,63, а по рис. V. 7,г
Z = 0,99 и:
0,99-82,1-473 .
7 =-------Гдб-------200 см-
96
Примем Р — 200 атм (20 МПа). Аналогичный подсчет определит значение
V — 190 см’. Искомое значение Р = 195 атм = 19,5 МПа.
Пример V. 32. Вычислить объем бутена-1 при 522 К и 4,08 МПа, зная ГКр =.
= 419,6 К; Ркр = 3,97 МПа и Ткаа = 267 К.
Решение. Воспользуемся уравнением zKp = 0 293 — У Дх в данными, ариве-
денными на стр. 71.
( 1 \
хкр = 0,293 - (-СН3) - 2 (—СН2—) - CHJ - (С=С) =•
= 0,293 — 0,0046 — 2 • 0,0046 — (—0,0035) — 0,0133 =
= 0,269 (опытное значение 0,277)
Далее по формуле г = х° 4- шх' и рис. V. 11 и V. 12 находим:
7'Пр = 7’/7кр = 522/419,6 = 1,24; Рпр = Р/Ркр = 4,08/3,97 = 1,04-
0 = Гкип/ГкР = 267/419,6 = 0,636
Тогда:
{Ч • 10-5 1
10/(1-0)11g PKpJ-l-
Ч•10“5
= —~~ [0,636/(1 - 0,636)] 1g (3,97.10’) - 1 = 0,196 (опытное
значение 0,203)
По графикам V. 11 и V. 12 при Тир = 1,24 и Рпр = 1,03 находим z° = 0,805
и поправку г' = 0,07;
г = х° 4- <oz' = 0,805 4- 0,196 • 0,07 = 0,819
„ 0,819-82,06-522,1
V ---------пго-------= 861 см’/моль
40,8
Пример V. 33. Вычислить приведенную плотность смеси 40% N24- 60% NH3
при 10 МЙа и 500 К, зиая для N» Рнр = 3,3 МПа; Тир = 126,2 К; гнр = 0,29;
для NHs Ркр = 11,1 МПа; Ткр = 405,6-К} «кр = 0,24.
Решение. Псевдокритические параметры:
Рпкр = 33,5 • 0,4 + 111,5 • 0,6 = 8 МПа
Т’пкр *= 126,2 • 0,4 4- 405,6 -.0,6 = 293 К
Для смеси РПр = Ю/8 — 1,25; ТИр = 500/293 =1,73; по рис. V. 7, г г=0,95 и:
0,29-1,25 по 0,24-1,25 „ 1О ,
Р1 = 0,95-1,73 “ 0,2 и Р2 = 0,95 • 1,73 = °’ 8 Г^СМ
Окончательно:
Рдр. см “ °>2 ’ °»4 + 0,18 • 0,6 = 0,19 г/см3
Глава VI
ФУГИТИВНОСТЬ И АКТИВНОСТЬ.
ОПРЕДЕЛЕНИЕ НЕКОТОРЫХ
СВОЙСТВ РАСТВОРОВ
[11, 21, 23-25, 31, 40, 50, 85]
§ 1. ФУГИТИВНОСТЬ И АКТИВНОСТЬ
При рассмотрении и расчетах термодинамических свойств ре-
альных газов, особенно при больших давлениях, кроме уравнения
Ван-дер-Ваальса применим более простой и удобный метод, ис-
пользующий понятия фугитивности f (летучести) и активности а.
Значения фугитивности и давления при больших давлениях и
низких температурах значительно отличаются (табл. VI. 1).
Т а б л и ц а VI. 1
Значения давления и фугитивности некоторых газов
Газ т, к Р, МПа f. МПа
NH3 273 10 20,4
n2 198 600 2 - 10е
СО 273 120 260,3
Фугитивность — это такая функция концентрации всех веществ
в смеси, а также температуры и давления, которая при подста-
новке вместо давления в термодинамические уравнения для иде-
альных газов сохраняет внешнюю форму последних и делает их
применимыми для реальных газов. Являясь функцией концентра-
ции, температуры и давления, фугитивность связана с различными
термодинамическими свойствами газа так же, как с этими свой-
ствами в идеальных газах связано давление. Фугитивность можно
рассматривать как «активное» или «исправленное» давление. Оно
характеризует отклонение системы от идеальности и может быть
выражено через ^различные измеряемые свойства веществ. Для
выражения соотношений между фугитивностью и свойствами газа
достаточно подставить в соотношения, выражающие зависимость
4 М. М. Викторов
97
этих свойств от давления идеального газа, вместо давления в изо-
термических процессах фугитивность.
Значение фугитивности:
flP = PIPm- f = Pyp^-, р = ^/Тр^-, Рид — RT/v-, f = P4(RT/V)
Здесь Р — давление газа при данных условиях; Рт— давление
газа при данных Р и V, если к нему применимы уравнения со-
стояния идеального газа. Таким образом, фактическое давление
равно среднегеометрическому из фугитивности и давления, вычис-
ленного для идеального газа.
Для идеального газа, независимо от температуры,' фугитив-
ность равна его давлению (парциальному для смеси), т. е. /° = Р
и при всех температурах f° = 1.
Фугитивность жидкостей и твердых веществ, находящихся в
равновесии с паром, равна фугитивности пара. Фугитивность ком-
понента газовой смеси описывается обобщенным законом Рауля —
Генри (Р, = х,Р) путем замены парциального давления на фуги-
тивность
h = xtfi
где f°. — фугитивность чистого компонента смеси npii общем дав-
лении паров смеси; х4 —мольная доля компонента i в смеси. (За-
кон Рауля в приведенном виде применительно к газовой смеси
обозначается еще правилом фугитивности.)
Зависимость фугитивности от температуры:
Здесь (Н° — Н) ~ изменение энтальпии; Н — энтальпия веще-
ства при высоком давлении и температуре; Н°—энтальрия при
стандартных значениях.
Поскольку фугитивность f' жидкости (твердого тела) равна
фугитивности ее насыщенного пара f", постольку можно опреде-
лять свойства жидкости (твердого тела), выражая их через свой-
ства насыщенного пара при данной температуре и давлении. Фу-
гитивность жидкости зависит от общего давления так же, как
давление паров жидкости зависит от общего давления. Например,
зависимость в присутствии других газов имеет вид:
1с — = —- (Р — Р„}
S j" 2,3RT '
Здесь f' — фугитивность чистой жидкости при общем давлений
Р; f" — фугитивность пара чистой жидкости при давлении ее на-
сыщенного пара Рп; — мольный объем чистой жидкости.
Зная величину фугитивности, можно вычислить значение рав-
новесного фазового отношения — константы равновесия (коэффи-
циента распределения компонента между жидкой и паровой фа-
зами при равновесии):
k = Pt/P = f'ilt"-, I" ~ i't
98
Здесь — фугитивность компонента i при данной температуре
и давлении пара; f" — фугитивность компонента в газообразном
состоянии при температуре и общем давлении системы; х и у —
мольные доли компонентов в жидкости и паре.
С фугитивностью тесно связана величина активности. В ре-
альных растворах и газовых смесях концентрация вещества при
некоторых условиях также не является величиной, характеризую-
щей растворы или газовые смеси (последние — особенно при вы-
соких давлениях). Предложено поэтому заменить концентрацию
активностью компонента, так же как давление — фугитивностью.
Активность — это такая функция общей концентрации, темпе-
ратуры и давления, которая при подстановке вместо концентра-
ции соответствующего вещества в уравнения, определяющие рав-
новесие в идеальных газах или растворах, сохраняет внешнюю
форму этих уравнений и делает их применимыми для реальных
газов или растворов.
Активность компонента — это функция концентрации каждого
из компонентов данной фазы (и температуры и давления), кото-
рая связана со свойствами, определяющими фазовые и химические
равновесия, так же, как с этими свойствами в идеальных раство-
рах (газовых смесях) связана концентрация компонента (к таким
свойствам относятся парциальные давления насыщенного пара,
температуры замерзания и кипения, константа равновесия и др.).
Для выражения соотношений между активностью и этими
свойствами в растворе или газовой смеси достаточно подставить
активность вместо концентрации в соотношения, выражающие за-
висимость свойств от концентрации в идеальных растворах или
газовых смесях.
По аналогии с фугитивностью активность можно назвать эф-
фективной концентрацией, при которой идеальный раствор при-
обретает термодинамические свойства данного реального раствора.
Введением активности как бы учитываются взаимодействие в рас-
творе компонентов, влияние диссоциации молекул, гидратации,
т. е. все, что отличает реальный раствор от идеального.
По значению активности данного компонента в растворе (газо-
вой смеси) можно судить об отклонении свойств этого компонента
от свойств в идеальном растворе (газовой смеси). Активность по-
зволяет рассчитывать некоторые свойства растворов, газов, рас-
творимость электролитов (см. § 2 и § 3). Не стехиометрическая
концентрация, а активность данного компонента — мера реального
взаимодействия веществ в растворах и газовых смесях.
В общем виде между активностью и фугитивностью существует
связь: = /г//“,.так как для газов /° = 1, то п, = При низких
давлениях справедливо соотношение a f = Р.
Отношение
Г/Р = -Р/-Рид = У
названо коэффициентом фугитивности (в применении к активно-
сти— коэффициентом активности а). Оно характеризует степень
4*
99
отклонения газа от идеальности, т. е.
Для идеального газа Р = РИд и у = 1.
Парциальная фугитивность компонента А газовой смеси:
Ухрх< Ya = 1а/ра
Здесь Р и Ра — общее и парциальное давления; уд—коэффи-
циент активности компонента А в .смеси при температуре и дав-
Рис. VI. 1. Зависимость
коэффициентов активности
от мольных долей (по урав-
нению Ван-Лаара).
в идеальных ^растворах
лении системы; РА = хАР-
На рис. VI. 1 дана зависимость коэф-
фициентов активности для двойной газо-
вой системы от мольных долей компо-
нентов х.
При рассмотрении термодинамиче-
ских свойств растворов используют от-
ношение
которое характеризует активность ком-
понента А в растворе (РА и Ра — давле-
ние пара компонента А над раствором
и в чистом состоянии). Отношение Ра/?х
численно соответствует мольной концен-
трации компонента в растворе.
Так, активность растворителя в растворе численно соответ-
ствует отношению давлений его насыщенного пара Pi над рас-
твором й над чистым растворителем Р?, то a — Pi/P®, или, ис-
пользуя фугитивности, Это уравнение соответствует
обобщенному закону Рауля — Генри в приложении.к растворам.
Поскольку для газов f® = 1, постольку для них а = f, Иными сло-
вами
«i/af-P./P?
где а{, atf — активности растворителя в растворе и в чистом, «ин-
дивидуальном» виде.
Активность для жидкостей (чистых) и твердых веществ при-
нимают равной!, когда при данной температуре давление состав-
ляет 101,3 МПа (760 мм рт. ст.).
Значение коэффициента активности зависит от способа выра-
жения концентрации раствора. Например, при выражении кон-
центрации в мольных долях уА = O-aIxa- Если концентрация вы-
ражена через число молей на 1000 г воды, т. е. моляльностью, то
Ут == а/т. При использовании мольной концентрации с ус = а) с.
Для бесконечно разбавленных растворов у= 1. Для двойных си-
стем уд == йд/хд и ув = Цв(1 — Хд).
100
Соотношение между коэффициентами активности в зависимо-
сти от способа выражения концентрации:
V* - V" <1 + «w.> -*(•£ + ' 4wr)
Здесь Мо и М — молекулярные массы растворителя и растворен-
ного вещества; ро и р — плотности растворителя и раствора.
Коэффициент активности можно определить несколькими спо-
собами. Например, по давлению пара при летучем компоненте; по
коэффициенту распределения между равновесными фазами К =
= aja2 (ai и а2— активность растворенного вещества в двух рас-
творителях, находящихся в равновесии); по понижению темпера-
туры замерзания: 1п у = — 2 / [/ = 1 — АТзам/(Ккряг); где Кнр —
криоскопическая постоянная растворителя; т — моляльная кон-
центрация растворенного вещества]. Для электролита, диссоции-
рующего на два иона: In у = —3 I.
Активность, и коэффициент активности электролитов можно
определить также из величин разных свойств растворов (давление
насыщенного пара, температуры кипения и замерзания и др.).
Зная один из этих параметров и вычисляя затем активность,
можно по этой величине установить значения других свойств рас-
творов.
. Значения коэффициента активности и фугитивности (обобщен-
ные) являются функциями приведенных температур и давления.
Фугитивность и активность реальных газов можно прибли-
женно вычислить по принципу соответственных состояний, соглас-
но которому ряд свойств и величины коэффициентов активности
(фугитивности) разных газов равны при одинаковых значениях
приведенной температуры и давления, т. е.: у = f/P = <р(Тпр, РПр).
Эту величину можно установить по графикам.
На рис. VI. 2—VI. 6 приведены обобщенные графики для опре-
деления коэффициента активности (фугитивности), построены кри-
вые, связывающие коэффициенты активности и приведенные дав-
ления. Коэффициент активности (фугитивности) газовых смесей
определяют по этим диаграммам, исходя из значений псевдокри-
тических параметров, определяемых по формулам гл. V.
На рис. VI. 3 выше кривой АВ и при Тпр > 1 углеводороды
устойчивы в виде газов и можно определить фугитивность по
Р — V —- Т-данным. В области ниже кривой АВ и при Тщ> = 1 угле-
водороды устойчивы в виде жидкости, но график применяют для
нахождения f углеводородов в виде газа.
Для расчетов фазового равновесия углеводородов в зависимо-
сти от давления и температуры можно применить рис. VI. 3, VI. 5.
Активность электролита определяется произведением активно-
сти его ионов. Если известна электродвижущая сила, то можно
определить активность электролита, используя правило ионной
силы, согласно которому коэффициент активности у данного элек-
тролита одинаков во всех растворах с равной ионной силой.
Ионная сила — это полусумма произведений из концентраций
101
Рис. VI. 2. Зависимость коэффициента активности у от приведенных давления
и температуры,'
Рис. VI. 3. 'Коэффициент фугитивности углеводородов.
АВ соединяет приведенные давления пара и температуры.
Рис. VI. 4. Обобщенная диаграмма Для определения активности.
ФуеитидноСть атм
1_______________I_____________________1__________ ।
ЦО? О/ у 20
Рис. VI. 5. Фугитивность жидких углеводородов.
На кривых указано число атомов углерода: п — парафины; п'~диизопарафины; п" — нзо-
парафины; п'"—олефины. Кривые I, II и III объединяют критические точки алканов, нафте-
нов н ароматических соединений.
104
(моляльных и мольных) всех ионов в растворе на квадрат их за-
ряда: / = Из этого правила следует, что в растворе
разбавленных сильных электролитов одинакового валентного типа
коэффициент активности каждого из них зависит от общей концен-
трации.
Например, для раствора 0,01 моль СаС12 и 0,1-моль Na2SO4 на
1000 г воды I = >/2 (0,01 -,22 + 0,02-I2 + 0,2-12 + 0,1 -22) = 0,33. Для
Рис. VI. 6. Обобщенная диаграмма фугитивности (гкр = 0,27).
раствора 0,01 М NaCl и 0,02 М СаС12 концентрации ионов
(моль/л): Na+=0,01; Са2+= 0,02; С1" = 0,02-2 + 0,01 = 0,05.
Значение I = >/2 (0,01 I2 + 0,02-22 + 0,05-12) = 0,07. '
При содержании в растворе однозарядных ионов ионная сила I
равна общему мольному содержанию их в растворе. Например,
дан раствор 0,02 М K2SO4. Тогда концентрация ионов К+ =
= 0,02-2 = 0,04 моль/л и SO4" =0,02 моль/л.
Значение I = */2 (0,04 • 12 + 0,02 22) = 0,06.
Установлено (эмпирически), что коэффициент активности у
электролита в растворе зависит от ионной силы раствора и при
одинаковом значении ее коэффициент активности сохраняет
105
постоянное значение независимо от вида других электролитов в
растворе (применимо до значения I = 0,02 для водных растворов)
(табл. VI.2).
Таблица VI.2
Значения (приблизительные) коэффициентов активности
в зависимости от ионной силы I для очень разбавленных растворов
Ионы Коэффициент активности при ионной силе I
0,001 0,005 0,01 0,05 о,1 0,2
Одновалентные 0,97 0,93 0,90 0,81 0,76 0,70
Двухвалентные 0,87 0,74 0,65 0,44 0,33 0,24
Трехвалентные 0,73 0,51 0,39 0,15 0,08 0,04
Четырехвалентные 0,56 0,30 0,19 0,04 0,01 0,003
Коэффициенты активности отдельных ионов можно вычислять
по коэффициенту активности соли, если известен коэффициент
активности второго иона.
Практически удобно считать коэффициенты активности ионов
одинаковой 'валентности примерно равными, если одинаковы ион-
ные силы растворов.
§ 2. ОПРЕДЕЛЕНИЕ НЕКОТОРЫХ СВОЙСТВ РАСТВОРОВ
[11, 23-29, 50, 51]
В технологии приходится иметь д^ло со сложными растворами
заданного химического состава, содержащими несколько раство-
ренных веществ. В справочниках приводятся главным образом
данные о свойствах бинарных растворов отдельных соединений.
Поэтому способы расчетного определения различных свойств сме-
шанных растворов по свойствам бинарных растворов при той же
температуре имеют большое практическое значение. Для таких
расчетов предложены методы, которые позволяют определить
свойства растворов, пригодные для составления уравнений мате-
риальных и тепловых балансов и других технологических расчетов.
Расчетное определение смешанных растворов возможно, на-
пример, на основе принципа аддитивности. В простейшем случае
принцип аддитивности заключается в том, что численное значение
некоторой функции одного или нескольких свойств смешанного
раствора равно сумме произведений численных значений функций
этих свойств для бинарных растворов (из которых можно образо-
вать смешанный раствор) на их относительную долю в смеси. При
смешении бинарных изопиестических (имеющих одинаковое дав-
ление пара воды, т. е. одинаковую активность воды в растворе)
растворов солей с общим ионом давление пара воды смешанного
раствора по правилу Здановского равно исходному давлению пара
воды смешиваемых растворов (когда растворенные соли химиче-
ски не взаимодействуют). При этом значения ряда свойств сме-
106
шанного раствора складываются аддитивно из свойств смешивае-
мых растворов электролитов (удельный объем, теплоемкость, ко-
эффициенты расширения и преломления, кинематическая вяз-
кость и др.). Давление пара, температуры кипения и замерзания
смешанных растворов солей с общим ионом не изменяются, если
они были одинаковыми для бинарных растворов.
Практически расчеты свойств смешанных растворов произво-
дят на основе значений активности воды а бинарных растворов
электролитов в зависимости от концентрации растворов и темпе-
ратуры (табл. VI. 3). Таблицы значений активности воды в рас-
Таблица VI. 3
Концентрации (приведенные) растворов отдельных солей
[% (масс,)] при одинаковых активностях воды а [25]
а NaCl КС1 NH4C1 MgCh
25 °C 100 °C
0,95 7,8 10,7 7,8 7,8 8,5
0,94 9,2 12,6 9,2 9,0 9,6
0,93 10,4 14,2 10,7 10,0 10,6
0,92 11,6 15,9 12,0 10,9 11,6
0,91 12,7 17,4 13,3 11,8 12,5
0,90 13,8 19,1. 14,5 12,7 13,4
0,79 23,7 31',9 27,2 19,3 20,6
0,78 24,4 32,9 28,2 19,7 21,2
0,77 25,1 33,9 29,2 20,1 21,7
0,76 25,8 34,85 30,2 20,6 22,2
0,75 26,5 35,8 31,2 21,0 22,6
0,74 (27,1) 36,8 32,2 21,4 23,0
0,73 (27,8) (37,8) 33,2 21,8 23,5
0,72 (28,4) (38,7) 34,2 22,3 24,0
0,71 (29,0) (39.6) 35,2 22,8 24,4
0,70 (29,6) (40,5) 36,2 23,2 24,9
творах от 0 до 100°C составлены Здановским [25]. В них приведено
содержание соли в растворе для ряда равноотстоящих друг от
друга значений активности воды. Аналогичные таблицы для
растворов 150 электролитов при 25 °C составлены Вознесен-
ской [13].
Графически положение Здановского выражается в том, что
изопиеты (изоактиваты)—линии одинаковой активности воды в
растворах электролитов, соединяющие фигуративные точки рас-
творов с одинаковым давлением паров воды на диаграмме рас-
творимости тройной системы из воды и двух электролитов с общим
ионом, являются прямыми. Для построения этих прямых на диа-
грамме растворимости такой системы на координатах отдельных
солей отмечают точки с одинаковыми активностями воды
(рис. VI. 7). Через эти точки проводят прямые — изопиеты при
а = const.
107
двух электролитов, насыщенных
Рис. VI. 7. Графическое изображение изо-
пиет (изоактиват) Воды в растворе
NaCl—КС1—Н2О.
Точки пересечения изопиет с кривыми растворимости отдель-
ных электролитов определяют, в частности, составы растворов из
им из них, с данной актив-
ностью воды.
Уравнение (основное)
изопиет для смешанного
раствора двух электролитов
с общим ионом имеет вид:
+ (VI.1)
Здесь Ci и С2 — концен-
трации электролитов в сме-
шанном растворе, % (масс.);
х1 и х2— концентрации
(приведенные) бинарных
растворов электролитов АК
и ВК, имеющих одинаковые
давления паров воды (оди-
наковую активность воды а
в растворе), % (масс). Кон-
центрации Xi и х2 (приведенные) являются для каждого электро-
лита функцией активности воды в растворе и температуры.
При моляльном способе выражения концентрации равенство
(VI. 1) принимает вид:
32- + -^.
йА т тъ
— 1
(VI. 2)
1
Q
о
§
е
X
О X, х2
Концентрацияг% (масс.)
Рис. VI. 8. Зависимость изменения
активности воды а растворов от кон-
центрации отдельных солей х.
(тд и /Пв — моляльность смешиваемых растворов АК и ВК).
Для расчета по этим уравнениям можно условно разделить
заданный смешанный раствор нескольких солей с общим ионом на
составляющие растворы с тем
же самым давлением пара. Ис-
ходя из указанных закономерно-
стей, Здановский предложил спо-
соб расчетного определения со-
става этих растворов и их
свойств. Для определения свойств
смешанных растворов с концен-
траццями Ci, С2, Сп раствор
условно делят на п бинарных
растворов с
(приведенными) хь х2, ..., хп,
имеющих то же давление паров,
что и смешанный раствор. Значения Xi, х2..хп определяют гра-
фически на диаграмме, на которую нанесены кривые изменения
активности воды а для соответствующих бинарных растворов в за-
висимости от концентрации отдельных солей, т. е. a = f(x)
(рис. VI. 8).
концентрациями
108
Последовательным приближением подыскивают такое значе-
ние а, при котором *1, х2, .... хп удовлетворяли бы основному
равенству:
£l+... +-£«=1 (VI. 3)
Х1 х2 хп
Хг/х,
Схема графиче-
Рис. VI. 9.
ского определения состава
бинарных изопиестическйх
растворов.
Иными словами, находят интересующие концентрации исход-
ных бинарных растворов, путем смешения которых в изопиестиче-
ских условиях, получают раствор заданного состава. Чтобы рас-
считать аддитивные свойства данного раствора, по справочникам
находят для найденных концентраций Х\, х2, ..., хп значения
свойств бинарных растворов. После этих
определений вычисляют по соответ-
ствующим аддитивным формулам значе-
ние свойств смешанного раствора (см.
ниже).
Если речь идет о водном растворе,
состоящем только из двух солей, то мож-
но обойтись без решения уравнения
(VI. 1), подбирая значения Xi и х2 по спо-
собу, предложенному Микулиным [51].
Для этого (рис. VI. 9) откладывают на
оси абсцисс концентрации С2 и х2, а по
оси ординат — отношение концентраций
x2/xi и С2/Сь По кривым a = f(x) для
первой и второй соли находят значения
x2/xi для различных изопиестических
растворов и строят кривую x2/xi — f(x2).
Для начальной точки кривой, лежащей
на оси ординат, отношение x2/xi равно
vi/v2, где vi и v2 —число ионов, на ко-
торые распадается молекула электроли-
та.
Это позволяет для любых концентра-
ций Ci и С2 смешанного раствора опре-
делить отношение С21С\. С помощью построения (показанного
стрелками) определяют значения х2/х; и х2, а затем искомое Х].
Правило аддитивности получило дальнейшее развитие в рабо-
тах Микулина, Киргинцева и других авторов.
§ 3. ВЫЧИСЛЕНИЕ РАСТВОРИМОСТИ СОЛЕЙ
В РАСТВОРАХ ДРУГОЙ СОЛИ И В РАСТВОРЕ ДВУХ СОЛЕЙ
Раствор одной соли
Функциональная связь между растворимостью соли в смешан-
ном растворе и активностью дает возможность расчетного по-
строения кривых растворимости солей на диаграммах тройных и
четверных систем, например кривых растворимости соли в рас-
творе второй соли (электролита).
109
Рис. VI. 10. Схема расчетного
построения кривой раствори-
мости в смешанном растворе
двух электролитов одинакового
валентного типа.
Приведем приближенный способ построения кривой раствори-
мости соли А в растворе соли С, если известна растворимость
соли А в растворе соли В (соли В и С одновалентного типа) [51].
Для этого нанесем на диаграмму (рис. VI. 10) кривую раствори-
мости соли В. Для какого-то постоянного (определенного) значе-
ния активности воды а отмечаем на осях координат точки насы-
щенных растворов солей А, В и С, концентрации (приведенные)
которых вычислены при одинаковой активности воды а (см. для
некоторых электролитов в табл. VI. 3 или подробно в работе [13]).
Полученные точки А, В и С соединяем изопиетами АВ и АС, т. е.
линиями одинаковой активности воды в растворе. Прямая АВ пе-
ресекает кривую насыщения соли А в
растворе соли В в точке Ь. Затем из
начала координат проводим луч ОЬ,
который пересекает прямую АС в точ-
ке с — точке состава раствора А—С,
насыщенного солью А. Так как точки b
и с кривых насыщения двух пар солей
(электролитов А—В и А—С) соответ-
ствуют одинаковой активности воды
раствора а, то они будут отвечать на-
сыщенным трехкомпонентным раство-
рам соли А в присутствии солей В и С.
Рассмотренный метод построения
также распространяется и на смешан-
ные растворы солей разного типа, но
в этом случае он не - подходит для
точных количественных расчетов, а пе-
редает лишь качественный характер
процесса насыщения.
Для практических расчетов растворимости в тройных системах
можно использовать формулу Сеченова:
х = хоехр(— ky)-, lgx = Igx0 — ty
Здесь х — искомая концентрация насыщенного раствора соли А
в растворе соли В при концентрации у, % (масс); х0 — концентра-
ция насыщенного раствора соли А в бинарном растворе, % (масс.);
k — константа.
Эта формула не давала должной точности и была усовершен-
ствована Здановским [24, 25], предложившим для определения рас-
творимости одной соли в водном растворе общую формулу
1g х = 1g Хо — k (Д — а) у (VI. 4)
где а — активность воды в растворе двух электролитов, а кон-
станты k и А характеризуют изменение растворимости соли в при-
сутствии других электролитов и имеют разное значение для раз-
личных электролитов. Константа k обычно зависит от температуры
линейным образом; константа А постоянна или является функцией
k (табл. VI.4).
110
Таблица VI.4
Значения констант k и А в уравнении
lgx = lxx0— k (А—а) у для определения растворимости одной
соли в водном растворе другой соли [25]
Соль Интервал темпера- тур, °C k A
растворяемая (х) в раст- воре ко- торой раство- ряют (у)
NaCl NH4C1 0-100 0,0425— 0,000135/ 1
NaNO3 0-100 0,0297—0,000048/ 1
Na2SO4 0-100 0,0383—0,00007/ 1
N32CO3 0-60 0,05 1
KC1 0-100 0,0375-0,000085/ 1
MgCb 0-105 0,0925-0,00021/ 1
CaCl, 25-115 0,0820—0,00030/ 1
(до 35%)
HC1 0 0,1117—0,00019/ 1
0,1070-0,00019/ 1
КС1 NH4C1 0—100 0,0303—0,00006/ 2,4-^T
NaCl 0-100 0,0303 —0,00006/ 2>4-ОД»
Ч MgCl2 0-100 0,0368-0,0001/ 214_адз
CaCl2 0-50 0,0335—0,000092/ 2.4-T
(до 30%) k
HC1 0-50 0,0455-0,00021/ 2,4-^
(до 25%)
KCl.MgCl2-6H2O MgCl2 0-100 0,1397—0,000575/ 0,95-^ К
Na2SO4 • ЮН2О NaCl 0-30 -0,1390+0,0029/ 0,57 К
Na2SO4 • ЮН2О NaCl 0-30 -0,135+0,0031/ 0,6
Na,CO3 0—30 -0,0703+0,00155/ -0,6
MgSO4 0-30 -0,001+0,00078/ -0,6
NaaSOi NaCl 20—95 0,0780+0,000116/ к
MgSO4 • 7Н2О K,SO4 0-30 fe->0 йЛ=0,00022/
MgCl2 0-55 Z; Л=0,0375—
—0,00034/
Na2SO4 • MgSO4 • 4H2O Na2SO4 25-75 0,078 1
MgSO4 25-75 0,110 1
Na2CO3-10H2O NaCl 0-30 -0,0767+0,00131/ 0,5 + К
Na2SO4 0-30 —0,0338 0,5 + °-^ К
111
Для расчета растворимости по уравнению (VI. 4) при некото-
рой температуре выбираем два или три значения величины а и,
определяем по табл. VI. 3 (см. также [И, 13]) соответствующие
этим а приведенные концентрации Xi и у\ солей в растворе. После
этого, исходя из соотношения
строим для заданного у кривую х' — f(a) (рис. VI. 11), а по урав-
нению (VI. 4) строим для заданного у другую кривую x" = f(a).
Рис. VI. И. Графическое определение растворимости соли
в смешанных растворах электролитов (два способа).
Точка пересечения этих кривых укажет искомое значение кон-
центрации х соли, насыщающей раствор при заданной темпера-
туре t и концентрации другой соли у.
Раствор двух разных солей
Расчет растворимости в системах с числом компонентов более
трех основан на положении Здановского: растворимости одних и
тех же солей в растворах различных электролитов с общими иона-
ми при одинаковых активностях воды при смешении аддитивно
складываются [25].
Так, если нас интересует растворимость х соли X в растворе
солей Y и Z с концентрациями у и г, то ее можно определить из
формулы, основанной на свойстве аддитивности
• / = 7TXl + ^X2 (VL5)
где Xi — концентрация насыщенного раствора соли X в растворе
соли Y с концентрацией z/i; хг— концентрация насыщенного рас-
твора соли X в растворе соли Z с концентрацией z2.
Необходимо, чтобы всё три раствора имели одинаковую актив-
ность воды а, т. е. следует соблюдать основное условие:
2L + JL+JL=1 (VL6)
Здесь х, у, z — приведенные концентрации солей X, Y, Z в рас-
творе трех солей с активностью воды а; х0, Уо, г0 — приведенные
112
концентрации насыщенных растворов отдельно взятых солей X,
Y, Z при том же значении а.
Значение а может быть найдено совместным решением уравне-
ний (VI. 5) и (VI. 6). Представим уравнение (VI. 6) в виде:
х = х0(1-^--М (VI. 7)
\ Уо го J
Заданному определенному значению а соответствуют некоторые
значения Xi, yi, х2 и z2, ..., которые можно найти при помощи об-.
щей формулы растворимости (VI. 4) или
по графику, изображающему связь ме-
жду активностью воды и составом насы-
щенных растворов соли X (в присутствии
солей Y или Z). Значение приведенных
концентраций х0, у0, z0 известны (см.
табл. VI. 3 или работу [13]). Подставляя
заданные величины у и г в формулы
(VI. 5) и (VI. 7), находим некоторые х'
и х". Повторяем подобные вычисления
для двух-трех значений а.
Нанося полученные таким образом
значения х' и х" на графике и соединяя
их'линиями по одному из способов, по-
Рис. VI. 12. Графическое
определение совместной рас-
творимости двух солей.
казанных на рис. VI. 11, получаем в точках пересечения этих ли
ний искомые значения х.
Раствор двух солей в других солях
Растворимость двух солей X и Y в растворе с заданными кон-
центрациями солей z, I, ... может быть найдена путем дальней-
шего обобщения формул, основанных на положении Здановского,
т. е. сочетанием двух пар уравнений (VI. 5) и (VI. 7), соответ-
ствующих двум кривым насыщения электролитов X и Y на
диаграмме растворимости системы X—Y—Н2О.
На рис. VI. 12 точка А характеризует насыщенный раствор
соли X, точка В—Y и точка С — солей X и Y. Совместное насыще-
ние солями X и Y раствора, содержащего другие электролиты, со-
ответствуют такому значению активности воды а, при котором удо-
влетворяются следующие 4 равенства, отвечающие искомым рас-
творимостям х и у обеих солей:
-- у , z , i ।
Х = X! + —— X; + -у Х3 + ..
У! г2 ‘3
z/, Z i < \ v
х = х, I 1--------— ... I на линии насыщения соли X
Л А 1з )
у = -у у\ 4- у2 + -у-у'з + • • • на линии насыщения соли Y
Х( ц2 _ /3
113
Здесь х и у — искомые растворимости солей X и Y при задан-
ных концентрациях г, I, ... других электролитов; Xj и у\, х2 и z2,
х3 и /3 —составы трехкомпонентных растворов,-насыщенных солью
X; у'г и х', у',2 и z', у' и /'— такие же составы растворов, насы-
щенных солью Y, при одном и том же значении а в обоих случаях.
Соединяя линиями точки, отвечающие составам насыщенных
растворов отдельных солей при разных значениях а, на пересече-
нии этих линий находим искомую взаимную растворимость х и у
обеих солей (рис. VI. 12).
О методах расчета совместной растворимости многокомпонент-
ной системы см. [11, 15, 29, 51].
§ 4. ПРИМЕРЫ РАСЧЕТОВ
Пример VI. 1. Определить фугитивность метана при 273 К и 19,5 МПа, зная
Ткр = 190,6 К и Ркр = 4,43 МПа.
Решение. Тпр = 273/190,6 = 1,43 и Рпр = 19,5/4,43 = 4,4.
По рис. VI. 2, а у = 0,69. Тогда:
/ = 0,69 • 20 = 13,8 МПа
Пример VI. 2. Вычислить фугитивность кипящей воды (М — 18) при 428 К,
зная давление насыщенного пара 0,543 МПа, объем пара 0,35 м3/кг.
Решение, f = P2V/RT = (0,5432-10-2 0,35-0,18)/(8,314-103)-428=0,522-Ю6 Па.
Пример VI. 3. Вычислить фугитивность метана при 267 К и 6,65 МПа, зная
( ТКр =190,6 и Ркр = 4,43 МПа.
Решение. Тпр = 267/190,6 = 1,4 и Рпр = 6,65/4,43 = 1,5.
По рис. VI. 2, а у = 0,84 и f = 0,84-6,8 = 5,7 МПа.
Пример VI. 4. Установить фугитивность жидкого бензола (М = 78) и равно-
весного с ним пара при 533 К, зная РКр — 4,69 МПа и Ткр = 562 К Давление
насыщенного пара бензола при 533 К 3,27 МПа.
Проведем расчет при условии отсутствия других газов.
Решение-. Рпр = 3,27/4,69 = 0,7; Тпр = 533/562 = 0,94.
По рис. VI. 2, а у = 0,67 и f = 0,67-3,27 = 2,19 МПа.
Если же присутствует, например, водород и общее давление равно 13,8 МПа,
то ^мол сщ6= W),57 = 137 м3/кмоль (0,57 — плотность жидкого бензола при
указанных условиях).
Далее:
In (/72,19) = [137 (13,8 - 3,27) • 106]/(8,314 • Ю2) • 533 = 0,148;
/' = 1,4-2,19 = 3,06 МПа
Следовательно, в присутствии водорода фугитивность бензола выше.
Пример VI. 5. Определить фугитивность аммиака при 423 К и 40 МПа, зная
РКр = 11,2 МПа и Ткр = 405,6 К.
Решение. Рпр = 40/11,2 = 3,6 и Тпр = 423/405,6 = 1,03.
По рис. VI. 2, а у = 0,3 и / = 0,3-40 = 12 МПа.
Пример VI. 6. Вычислить фугитивность пропана при 2 МПа и 303 К, если
при этой температуре давление 1,1 МПа, а РКр = 4,2 МПа и Ткр = 370 К-
Решение. Рпр = 2/4,2 — 0,47 и Тпр = 303/370 = 0,82.
По рис. VI. 3 у = 0,7 и / = 13,5.
Значение Р°р = 11/42 = 0,26; и по рис. VI. 2, а у = 0,85 и /° = 0,85 -11 = 9,3.
Тогда 0,7 = 9,3//; / = 1,4 МПа.
Пример VI. 7. Вычислить активность воды в 30%-ном растворе NaOH;
/кик = 116,5 °C при Р = 101,3 кПа.
Решение. По таблицам давление паров воды при 116,5 °C Р°=173 кПа (см.
рис. VII. 1, стр. 118). Следовательно, активность воды этого раствора а—,
= 101,3/173 = 0,57.
114
Пример VI. 8. Дан 20,5%-ный раствор NaCI (Л4 = 58,5) при 298 К, давление
пара которого Р = 2,6 кПа. Давление паров воды при 298 К ^н2о = кПа (см.
рис. VII. 1). Определить аН2О и Ун2О в этом растворе.
Решение.
' а. = Р/Р„ „ = 2,6/3,4 = 0,83;
1 rijC»
79 'S/lЯ
Хн2° ~ 79,5/18 + 20,5/58,5 = 0,93 И Ун2о = «-83/0,93 = 0,89
Пример VI. 9. Давление насыщенного водяного пара при 428 К Р —
= 54,3-104 Па, а объем пара — 0,346 м3/кг. Определить фугитивность воды, рав-
новесной с насыщенным паром при 428 К-
Решение. При равновесии фаз фугитивность жидкости равна фугитивности
насыщенного пара. По уравнению
Р2 V 0 346 • 18
f=" Р2 -RT = <54’3)2 ’104 = 5’2 •104 Па
Пример VI. 10. Дан раствор 0,05 М MgCl2. Определить коэффициент актив-
ности у и активности ионов Mg“ и С1“.
Решение. Определяем значение ионной силы: / = (0,05-22 +0,05-2-12) == 0,15.
По табл. VI. 2 интерполяцией находим искомое для одновалентных ионов
у = 0,73, для двухвалентных ионов у — 0,28. Тогда значение активностей:
СГ- 0,73 - 0,1 = 0,073 и Mg2+ — 0,28 • 0,05 = 0.014Л4
Пример VI. 11. Определить концентрации X; и х2 бинарных растворов для
смешанного раствора, содержащего Ci = 6 КС1 и С2 = = 4 LiCl % (масс.).
Построим для этих солей, по данным Хг/Х1 = /(х2) [см. рис. (VI.9)]: табл. VI. 3 и работы [13] зависимости
а XI (К.С1) х2 (L1C1) Х2/Х1
1 0 0 1
0,98 4,45 2,4 0,540
0,96 8,59 4,5 0,524
0,92 15,74 7,9 0,501
0,84 26,70 13,0 0,486
Значение C2/Ci = 4/6 = 0,67; по положению точки А находим искомые:
x2/xi = 0,51; х2 = 7,1 и Xi = 7,1/0,51 = 14,2% (масс.).
Проверка: Ci/xi + C-ilxz = 6/13,9 + 4/7,1 — 1 [уравнение (VI. 1)].
Пример VI. 12. Вычислить растворимость NaCI в растворе, содержащем
10,22% (масс.) MgCl2 при 25 °C.
Решение. По табл. VI. 4 находим для растворов NaCI в присутствии MgCl2
k = 0,0925 — 0,000211 = 0,0925 — 0,00021 • 25 = 0,08725.
По таблицам растворимости NaCI при 25 °C находим х0 = 26,7% (масс.).
Следовательно, по формуле (VI. 4):
1g х = 1g 26,27 — 0,08725 (1 — а) • 10,22 = 0,5283 + 0,89120а
Для выбранных значений а = 0,70; 0,72 и 0,74 х” = 14,20; 14,79 и 15,41, Для
тех же значений а имеются в табл. VI. 3 значения приведенных концентраций xt
(NaCI) и yi (MgCl2); величину х' определяем по уравнению х' — Xi(l — ylyi)
при у = 10,22 и получаем:
а XI У1 х' X"
0,70 29,6 23,2 16,56 14,20
0,72 28,4 22,3 15,39 14.79
0,74 27,1 21,4 14,16 15,41
Строим график по типу рис. VI. 11, на котором находим для точки пересече-
ния двух линий при а = 0,727 значение х = 14,98% (опытное — 15,01%).
Глава VII
ДАВЛЕНИЕ ПАРОВ.
ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ И КИПЕНИЯ.
ПЛОТНОСТИ РАСТВОРОВ
§ 1. ВЫЧИСЛЕНИЕ ДАВЛЕНИЯ ПАРОВ
[7, 8, 25, 31, 33, 46, 61, 71, 85]
Сведения о давлении паров растворов необходимы для расче-
тов многих технологических процессов — выпаривания, высушива-
ния, перегонки, дистилляции, ректификации и других.
Пар над раствором по составу отличается от состава жидкости,
т. е. составы жидкой и паровой фаз неодинаковы. Для расчетов
надо знать соотношения между составами насыщенного пара и
жидкости при разных температурах, давлениях и концентрациях.
Парциальное давление пара компонента, так же как и давле-
ние насыщенного пара растворителя, над раствором ниже, чем над
чистым веществом. Понижение давления пара тем значительней,
чем больше концентрация растворенного вещества. Следствие( это-
го— понижение температуры замерзания и повышение темпера-
туры кипения раствора.
Исходя из закона Рауля — Р = xqP° — и заменяя мольную долю
растворителя Хо на х = 1 — Хо, т. ё. переходя к мольной доле рас-
творенного вещества, получаем: х = (Р° — Р)/Р. Это соотношение
характеризует относительное понижение давления пара; последнее
равно мольной доле растворенного вещества.
Для бинарного раствора компонентов А (растворитель) и В
(растворенное вещество):
Ра = хаРа = (1~хв)Ра и Рв = (1~»а)Рв
Общее давление бинарного раствора равно сумме парциальных
давлений компонентов:
Р = рА + рв Ра 0 ~ *в) + Рв хв = Ра “ (?А “ Рв) хв
Когда растворенное вещество (газ или летучее твердое) в раз-
бавленном растворе подчиняется закону Генри, то растворитель
подчиняется закону Рауля, и наоборот.
116
По закону Генри растворимость газа при постоянной темпе-
ратуре прямо пропорциональна давлению этого газа над раство-
ром.
Растворимость газов (абсорбция газа жидкостью) при уме-
ренном давлении увеличивается с повышением давления, а повы-
шение температуры уменьшает растворимость газов.
Равновесное парциальное давление пара растворенного веще-
ства (газа) А пропорционально его мольной доле: рА = хА, fА,' где
fA— фугитивность чистого компонента. Отношение растворимости
газа к давлению есть величина постоянная.
При повышенных давлении и температуре давление заменяется
фугитивностью. Тогда закон Рауля —Генри принимает следующий
обобщенный вид: /д = хд^, т. е. фугитивность fA компонента А
в идеальном растворе равна фугитивности f°k чистого компонен-
та А при температуре и общем давлении раствора, умноженной
на мольную долю хА компонента А в растворе. Это уравнение мож-
но записать так:
fk — ха1а = fk 0 ~ хв) 15 ?В = о — ха) )в
Величина f°k постоянна при данной температуре и общем дав-
лении, а отношение fA/fA равно активности аА компонента А в
растворе. Отношение активности к мольной доле называют коэф-
фициентом активности компонента:
Ya = «а/ха и Yb = «в/(! - ха)
Здесь f — фугитивность насыщенного пара сжиженного газа при
данной температуре. Например, давление насыщенного пара С12
при 273 К 0,37 МПа, а фугитивность — 0,34 МПа. Тогда идеаль-
ная растворимость хлора, не зависящая от природы растворителя
(в мол. долях), при 0,1 МПа х = 0,1/0,34 = 0,29.
Растворимость газов, например Н2, N2, СО, О2, мала; она срав-
нительно велика для СО2, С2Н4, СН4, поскольку критические тем-
пературы высоки и ближе к таковым растворителей.
Мольная доля у компонента в паре равна отношению пар-
циального давления р к найденному общему давлению, т. е..
У = р/Р-
Обобщенное уравнение равновесия пара и жидкости на основе
законов Рауля и Дальтона:
У к = (Рк[р) хк
Здеф уА и хА —мольные доли компонента А в паровой фазе
и в равновесной с паром жидкости; р°к — давление паров чистого
компонента при данной температуре.
На рис.'VII. 1 дана зависимость давления насыщенного водя-
ного пара от температуры, из которой следует, что это давление
с повышением температуры' возрастает.
Приведенные на рис. VII. 2 данные характеризуют растворы,
отличающиеся значениями равновесного давления пара (отложены
117
Рис. VII. 1. Зависимость давления водяных паров от температуры.
118
на ординатах при постоянной температуре). На оси абсцисс отло-
жены мольные доли низкокипящего (нк) компонента В; при дан-
ной температуре давление пара у него больше. Кривые описывают
зависимость состава равновесного пара от состава раствора; с уве-
личением относительного содержания компонента в растворе воз-
растает относительное содержание его в парах. Ординаты рА и рв
отвечают давлению пара чистых компонентов А и В. Кривая 1
отвечает ничтожной взаимной
растворимости жидкостей;
здесь образуются два жидких
слоя.
При ограниченной взаим-
ной растворимости жидкостей
(кривая 2) система состоит из
Двух фаз — фазы насыщенного
раствора второго компонента
в первом н фазы насыщенного
раствора первого компонента
во втором (сопряженные рас-
творы). Взаимная раствори-
мость компонентов увеличи-
вается с повышением темпера-
туры. Для таких сопряженных
систем имеется температура
перехода из гетерогенного со-
стояния в гомогенное (крити-
ческая температура растворе-
ния). Давление пара над со-
пряженными растворами не за-
висит от концентрации систе-
мы, а зависит от температуры.
Для несмешивающихся
жидкостей давление пара при
данной температуре не зави-
сит от соотношения между
жидкостями и равно сумме
давлений чистых жидкостей.
Рис. VII. 2. Составы равновесных жидко-
сти и пара в различных водных систе-
мах:
1 — CfHn;2-С5Н11ОН; 3~С2Н5ОН; 4-СНзОН;
5 —С2Н5ОН —СНдОН; 6 — CH3COOH; 7-HCOOH:
4 —NH4NO3: s— Na2S2O3; 10— NH3-HCI.
Поэтому температура кипения
смеси будет ниже температуры кипения наиболее летучего компо-
нента (на этом основана перегонка с водяным паром).
Давление пара (общее и парциальное) над сопряженными рас-
творами малорастворимых жидкостей одинаково (первый закон
Коновалова, подробнее см. ниже).
Рассмотрим кривую 2: при добавлении воды к амиловому спир-
ту происходит растворение до насыщения, при этом давление пара
возрастает по линии ab. Далее вода не будет растворяться в спир-
те, а, напротив, растворит часть его с образованием второго слоя.
Линия давления пара становится горизонтальной (be). Давле-
ние пара над смесью выше, чем давление каждого чистого
119
компонента, но меньше их суммы. По мере приливания воды уве-
личивается водный слой до точки с; здесь весь спирт растворится
в воде; давление будет стремиться к давлению пара чистой воды
(точка d). _
Кривые 3—7 характеризуют давление пара взаимно хорошо
растворимых жидкостей. Однако в растворах типа 4 и 6 давления
пара растворов при любом составе имеют значения, промежуточ-
ные между давлениями пара чистых компонентов, т. е. рА < Р <
< рв- Из этих растворов можно выделить чистые компоненты.
Прямая 5 отвечает растворам, дающим линейную зависимость дав-
ления равновесного пара от состава жидкости (бензол — толуол,
гексан, гептан и др.).
Зависимость состава равновесного пара от состава раствора
и общего давления характеризуется законами Коновалова. По
первому из них повышение относительного содержания компонен-
та в жидкой фазе вызывает увеличение относительного содержа-
ния его и в парах. В двойной системе пар обогащен тем компо-
нентом, прибавление' которого в системе повышает общее давле-
ние пара, т. е. понижает температуру кипения смеси при данном
давлении; Эти положения хорошо иллюстрируют данные рис. VII .2.
Состав пара над раствором определяется главным образом со-
отношением парциальных мольных теплот испарения компонентов
согласно законам Вревского. По первому закону Вревского при
повышении давления насыщенного пара над двухкомпонентной
системой в равновесном паре увеличивается относительное содер-
жание того компонента, парциальная мольная теплота испарения
которого больше (высококипящий компонент — вк).
Кривые 3 и 7 проходят через точки экстремума давления, в
которых составы жидкости и пара одинаковы. Такие растворы на-
званы азеотропными — нераздельно кипящими; они испаряются
без изменения состава и не могут быть разделены на компоненты
путем перегонки, например, С2Н5ОН—Н2О (тип 3), HNO3—НгО
(тип 7) и др.
Второй закон Коновалова устанавливает, что экстремальные
точки на кривой общего давления пара отвечают растворам, со-
став которых одинаков с составом равновесного с ним пара (азео-
тропные растворы). Максимуму кривой общего давления пара со-
ответствует минимум температуры кипения, а минимуму — макси-
мум температуры кипения.
По законам Вревского в азеотропных растворах при наличии
максимума на диаграмме кипения повышение давления насыщен-
ного пара увеличивает концентрацию того компонента, парциаль-
ная мрльная теплота испарения которого меньше; в случае мини-
мума повышается концентрация того компонента, парциальная
мольная теплота которого больше.
Состав азеотропного раствора при изменении давления насы-
щенного пара при наличии минимума на диаграмме кипения из-
меняется в том же направлении, как и состав равновесного пара,
а при наличии максимума — в противоположном направлении.
120
Вообще, чем более четок экстремум, тем меньше в системе
изменение состава с изменением давления насыщенного пара или
температуры; при плоском экстремуме небольшое изменение дав-
ления или температуры приводит к значительному изменению со-
става азеотропного раствора.
Кривая 8 характеризует растворы нелетучих веществ (напри-
мер, NH4NO3), а кривые 9 и 10 соответствуют образованию кри-
сталлогидратов или прочных соединений, например NH4CI.
Гидраты солей чаще всего содержат 2, 4 или 6 молекул воды.
Давление пара гидрата с повышением температуры возрастает;
кривые давления пара для более гидратированных форм лежат
выше, чем для менее гидратированных. Переход от одного гид-
рата к другому происходит скачкообразно; подобным образом из-
меняется и давление пара над гидратом. Графически получается
резко выраженная ступенчатая диаграмма (9), отвечающая пра-
вилу ступенчатости Оствальда. По величине давления паров гид-
ратов можно судить о степени их устойчивости, определить режим
сушки, условия, при которых происходит выветривание, расплыва-
ние или гидратация.
Итак, при испарении раствора двух взаимно растворимых жид-
костей обе переходят в пар, но в различной степени. При этом
пары обогащены низкокипящим компонентом по сравнению с со-
держанием его в смеси. В итоге содержание в дистилляте низко-
кипящего компонента выше, чем в смеси, а в остатке — ниже. Для
идеальной смеси жидкостей общее давление Р пара над жидкостью
равно сумме парциальных давлений компонентов:
^ = РнК + Рвк = Р°нк^ + Рвк(1-^) (VII-1)
Значение парциальных давлений паров низкокипящего и высо-
кокипящего компонентов над смесью описывается уравнением:
рнк = *Рнк! Рвк = 0 - *) Рвк
Решая уравнение (VII. 1) относительно мольной доли х низко-
кипящего компонента в равновесной с парами жидкости, получаем:
«Ч'1-Л)/(<-<)
Мольная доля низкокипящего компонента в равновесном паре:
P = Phk/P = (Phk/P)x
Для смеси взаимно практически нерастворимых жидкостей
(кривая 1, рис. VII. 2) парциальное давление_пара каждого компо-
нента не зависит от присутствия второго компонента и равно дав-
лению пара чистого компонента при данной температуре: р к=яс р°к;
Р — Р° •
~вк • вк*
Смесь кипит при температуре, при которой давление пара,
т. е. сумма (р°к + равно внешнему давлению.
Вообще при добавлении в равновесную систему вода — пар
нелетучего вещества (соли) часть пара конденсируется, что
121
вызывает, по принципу Ле Шателье, уменьшение давления пара
над раствором.
Давление пара повышается с увеличением температуры жидко-
сти. Изменение давления пара вещества в зависимости от темпе-
ратуры можно определить, например, методом сравнения, исходя
из известных давлений стандартной жидкости.
Методы сравнительного расчета температурной зависимости
давления насыщенного пара основаны на сопоставлении темпера-
тур кипения или давления паров различных веществ со стандарт-
ной жидкостью по уравнениям, выражающим линейную зависи-
мость, например по известному правилу Дюринга:
ТА ~ ТА
-----~- = const; ТА = + k2;
у в, ~ 1 в2
£1 =7в_
Г А Тв
Здесь Tai и Гв] температуры кипения веществ А и В при оди-
наковом давлении Тд2 и Tr2 — те же величины для другого
давления р2; А — вещество, давление паров которого определяется;
В — стандартное вещество (например, вода), давление паров кото-
рого известно; ki и k2— некоторые константы, для определения ко-
торых надо знать два значения давления пара вещества А;
Тд и Тв — температуры при равных давлениях пара.
Для вычисления давления пара вещества А при заданной тем-'
пературе Та по эталону (вода) надо составить отношение
УДОО = Та/Ткип. а- Это соотношение позволяет найти Т — темпера-
туру, при которой давление паров воды равно давлению паров
вещества А при заданной температуре Та; по графику (рис. VII. 1)
находим соответствующее температуре искомое давление пдра.
По Кирееву давление насыщенного пара равно:
lg р2 = a 1g р, + в
Здесь Р[ и Р2— давления паров сравниваемых веществ при
температурах кипения или при приведенных температурах кипе-
ния; А и В — табличные постоянные.
Зависимость давления паров двухкомпонентной системы от
температуры:
. п1 ^"исп. А ^"исп. В f 1 1 \
4,575 \Т То)
или
Р .Диеп / 1_____п
g Ро 4,575 I То Т )
Здесь tii — Пд/пв — отношение числа молей компонента А
к числу молей компонента В в парах при температуре Т;
п?— то же отношение при температуре То кипения растворителя;
Ьисп— мольная теплота испарения (средняя) компонентов А и В;
Ро — давление пара при То-
122
Относительное понижение давления пара (депрессия) связана
также с повышением температуры кипения ДТКИП или с пониже-
нием температуры замерзания Д7"зам растворителя и определяется
соотношениями, получаемыми из уравнения Клаузиуса — Клапей-
рона (см. гл. IX):
р° — р Др
^-исп
Ю'о
Р° — Р «1
Р° “
Р°~Р
Р0
«1 + «2
Р = —
«2 + «1
^Р ^ПЛ Д-р
б „„9 пл
Р
&Т кип
Здесь L — теплота испарения (плавления) растворителя при
• температуре кипения (замерзания) То; р° — давление пара чистого
I--------------1--------------1--------------1____________।________________i______________I
73 173 273 373 473 573 673
°К
Рис. VII. 3. График для определения давления паров углеводородов.
Критические области: I — ароматических соединений; 2— олефинов; 3 —парафинов.
растворителя; р — давление насыщенного пара над раствором;
П1, П2—числа молей растворенного вещества и растворителя.
Известна зависимость между давлением насыщенного пара,
температурой и мольной теплотой испарения на основе уравнения
123
Клаузиуса — Клапейрона
£цсп = "Jy Т (^МОЛ. П ^МОЛ. ж); ^ИСП = "jy TV мол. п
Рис. VII. 4. График для определения
Кокс и Антуан приводят корреляцию:
lg р = А - [В/(Т - С)] (С = 13 А)
Приведенное уравнение:
1g Рпр = [(^КИП С)/(ТКр Ткип)) [(Р Т кр)/(Т — С)] 1g Ркр
С = -18 + 0,19Ткип
Для одноатомных соединений и всех соединений при Ткиа <z
< 125 К: С = -0,3 + 0,34 T^n-
Преобразованное уравнение для давления (по Кирхгофу):
> lgPnp = n[l-(l/7’np)J
П = Ткип. пр llg Ркр/(1 Ткип. пр)]
В зависимости
Р = А - (В/Т)
124
коэффициент В соответствует тангенсу угла наклона прямой, от-
секающей на оси ординат отрезок А. Значения двух опытных
точек позволяют графически или аналитически установить эти по-
стоянные А и В и вычислить давление пара при заданной тем-
пературе.
К
давления паров различных веществ.
Известна также другая корреляция Кокса — Антуана:
Л- в
т КИП-----С
в = (1/ДгКип) [Гкип - с)2 • ^ип/2.303??Т*ип]; 1 /Дгкип « 1,05 (А, В и С-
постоянные, вычисляемые из значений давлений насыщенного пара дан-
ной жидкости при трех или более температурах)
Давление паров можно определить графически по диаграммам,
аналогичным диаграммам типа Дюринга.
На рис. VII. 3 приведена диаграмма для определения давления
паров низкокипящих углеводородов, если известна ТКИп. Например,
при 760 мм рт. ст. ТКип = 150 °C; найти Гкип при 10 мм рт. ст. Вер-
тикаль из 150 °C пересекает линию 760 мм рт. ст. в точке а;
125
O)
Р, мм pm. cm.
P^Q,MM pm.cm.
Рис. VII. 5, a
5
Температура К
IO
-4__I I i_I I I 1 I I I 1 1 I I 1 I I I I—i_I_I I > I_I—I—l__l_l—I—I_I_I_i_I_I । ।_I—L_J_I_1 I I_1_1 1 i_I—I—l_J—I—l—l-1—I—J
-270 -250 - 2J0 -210 -ISO -ITO -150 -150 -110 -90 - 70 -50 -50 -10 10 50
’c
Рис. VII. 5, 6
горизонталь из последней пересекает кривую 10 мм рт. ст. в точ-
ке Ь; соответствующая ей абсцисса — 38 °C — и есть искомая Гкип.
Давление насыщенных паров углеводородов можно установить
по методу Кокса. На диаграмму VII. 4 наносят прямую АВ по
известным значениям давления пара одного из гомологов (lg Р),
затем строят шкалу температур. Для других гомологов на диа-
грамме получается пучок прямых, пересекающихся в одной точке,
т. е. достаточно для любого гомолога знать одно значение Р, чтобы
нанести его прямую.
Рис. VII. 5. Зависимость давления паров жидкостей (а), сжижен-
ных газов (б\ и хладагентов (в) от температуры.
На рис. VII. 5 дана зависимость давления пара ряда жидкостей 1
от температуры по методу Киреева. Здесь даны температуры ки-' я
пения стандартного вещества (воды).
Температуру перегонки жидкостей можно установить по
рис. VII. 6. Пересечение линий Дюринга / с кривой данного соеди- j
нения дает температуру перегонки водяным паром при 0,1 МПа; Я
так, для СС14 t = 67 °C. 1
Простейшую формулу для расчета давления паров воды над »
растворами, близкими к насыщению, предложили Хайдуков и Ли- Ц
нецкая [84], которые предполагали, что для таких растворов общее
понижение давления паров воды складывается аддитивно из по- -Ж
нижений давлений паров, обусловленных каждой, растворенной И
солью в отдельности. Авторы допускают также применимость за- Ж
кона Рауля, т. е. понижение давления пара принимается пропор-Ж
циональным концентрации растворенных солей, выраженной в<
граммах или молях соли, на постоянное число граммов или молей Ж
128 ' Я
растворителя. Коэффициенты в линейной формуле определяют из
условия необходимости точных результатов для насыщенных рас-
творов отдельных солей
р = р» - (р» - РА) Рв) - (Р0 - Pc) (VII. 3)
где р — давление пара смешанного раствора, мм рт. ст.; р° — дав-
ление паров воды при данной температуре, мм рт. ст. (для 25°C
К
Рис. VII. 6. Диаграмма для определения температуры перегонки
с водяным паром (правило Дюринга).
р° = 3,1 кПа = 23,7 мм рт. ст.); рА, рв, рс —давления паров на-
сыщенных растворов солей при данной температуре, мм рт. ст.;
МА, Mb, Мс — растворимость каждой соли при данной темпера-
туре, г соли на 100 г Н2О или моль соли на 1000 г или 1000 моль
Н2О; All, Мг, М3 — содержание солей в смешанном растворе, г соли
на 100 г Н2О или моль соли на 1000 г или 1000 моль Н2О.
Формула применима для расчета давления пара изотермически
инвариантных смешанных растворов, а также смешанных рас-
творов, насыщенных хотя бы одним компонентом (или для раство-
ров близких к насыщению).
Наиболее точный метод расчета давления паров воды над рас-
твором предложил Здановский [24]. Его метод расчета основан на
5 М М, Викторов
129
предположении о неизменности активности воды а при смешении
изопиестических растворов электролитов (если между компонен-
тами отсутствует химическое взаимодействие).
.При смешении изопиестических растворов с концентрациями
хь хг, х3 и х4 в количествах М2, М3 и М4 получаем в смеси
концентрации С\, С2, С3 и С4. Последние определяют из уравнений:
с1 —С2 —-дрХ2, С3 дрХз, С4 —-дрХ4 (VII.4)
(М = Ml + М2 + Мз + М4).
Учитывая, что MJM -j- М2/М + М3/М + MJM = 1, находим с
помощью предыдущих формул уравнение:
Cj/xi + С2/х2 + Czlx$ + С4/х4 = 1 (VII. 5)
Заданный смешанный раствор можно условно разделить на со-
ставляющие растворы (с тем же самым давлением пара), исполь-
зуя кривые рис. VI. 9, либо непосредственно путем подстановки в
уравнение (VII. 5) табличных значений х для различных солей
при одной и той же активности воды а (табл. VI. 3, стр. 107). Пу-
тем интерполяции находим значение а, удовлетворяющее уравне-
нию (VII. 5).
Найденное значение а определит искомое давление пара сме- •
шанного раствора:
р = ар°; (ро-р)/ро.= 1-а (VII16)
Для определения искомых значений а и х вначала следует
подсчитать приближенное значение, а'
i г Ci . z С2 , г Сз ,
11 =а1‘с' + а2-ё" + аЗ-^-+ ...
где а\, а'2, а3, ... — активности воды в растворах отдельных со-
лей с концентрацией С = Ct + С2 + С3 + ... <
Для этого значения а' находим по таблицам концентрации рас-
творов отдельных солей x'v х', х3 ... Далее (табл. VI. 3, стр. 107)
определяем:
л = £). + £2.+ £1+ ...
Искомые значения Xi, х2, х3 (а значит, и давление пара сме-
шанного раствора) определяют из уравнений:
Х| 4-~ Axt; х2 —— Ах2, х3 —“ Ах3; ,, •
Если отвечающие найденным таким образом концентрациям
Xi, Хг, х3, ... значения активности воды а не вполне совпадают,
то расчет следует повторить, приняв за исходное а среднее из
этих значений а.
Если при расчете по описанному методу требуется далеко иду-
щая экстраполяция активностей воды для растворов отдельных
солей, можно использовать более удобный, хотя и менее точный
«ступенчатый» метод Здановского [25, 26]. Пусть задан состав
130
раствора из нескольких электролитов с концентрациями Съ С2, С3.
Вначале для раствора наименее гидратирующейся соли с концен-
трацией Ci находят активность воды ас,- Затем устанавливают
концентрацию ДС2 раствора второй соли, отвечающую активности
воды ас,- Для суммарной концентрации С2 + ДС2 второй соли опре-
деляют активность воды ас,+с,- Далее находят концентрацию ДС3
третьей наиболее гидратирующейся соли, отвечающую этой актив-
ности воды ас,+с2, Искомая величина активности воды в смешан-
ном растворе трех солей отвечает активности воды раствора
третьей соли с концентрацией С3 4-ДСз-
§ 2. ВЫЧИСЛЕНИЕ ТЕМПЕРАТУР КИПЕНИЯ
И ЗАМЕРЗАНИЯ РАСТВОРОВ
[6-8, 11, 20, 31, 46]
Определение температур кипения и замерзания растворов имеет
важное значение для технологических расчетов процессов выпа-
ривания, кристаллизации и сушки.
Температура кипения растворов повышается.с увеличением их
концентрации. Соотношение между повышением температуры ки-
пения растворов, их концентрацией и давлением описывается
уравнением Клаузиуса — Клапейрона (VII. 2) и законом Рауля.
Повышение температуры кипения разбавленного раствора про-
порционально концентрации растворенного вещества (нелетучего):
ДТ кип = Ет
где т — моляльная концентрация (кмоль/кг растворителя); Е —
эбулиоскопическая постоянная растворителя или моляльное повы-
шение температуры [К-кмоль/кг] (зависит только от природы рас-
творителя) :
*’^нп/1000/нсп
Здесь Ткип —температура кипения чистого растворителя, К;
/исп — удельная теплота испарения растворителя, Дж/кг.
Для понижения температуры замерзания действительны сле-
дующие соотношения:
ДГПЛ = ДГзам = Кт; К — /?Т2ПЛ/ Ю00/пл
Здесь К — криоскопическая постоянная растворителя или мо-
ляльное понижение температуры замерзания [К-кмоль/кг]; Тпл —
температура замерзания чистого растворителя, К; /пл — удельная
теплота плавления растворителя, Дж/кг.
Зная повышение Ткип или понижение Ти11, можно определить
М растворенного вещества:
1000Bg2 1000J<g2
£1ЛТКИП’ М г,ДГпл
(gi и g2 — массы растворителя и растворенного вещества).
Криоскопическая постоянная металлов весьма велика, и, сле-
довательно, небольшие примеси сильно понижают температуру
5* 131
кристаллизации. Этим пользуются для получения легкоплавких
сплавов и подбора шихты при доменной плавке.
. Зависимость для электролитов:
. ДГПЛ = КгС/ЮОМ; ДТкип = EiC/100M-,
i — 1 + a (v — 1)
*
Здесь С — концентрация вещества, % (масс.); i = n'ln — сте-
пень диссоциации; а—кажущаяся степень диссоциации; v—-число
ионов после диссоциации 1 моль.
Рис. VII. 7. Иллюстрация правила Дюринга:
1—Н2О; 2—NaCl (24); 3-СаС12 (20); 4—К2СО3; 5—H2SO4 (40); «—L1NO3 (46); 7—H2SO4 (55);
8— NaOH (47,5) В скобках приведены концентрации, в % (масс.).
Повышение температуры кипения раствора солей можно опрв'
дел ять и по соотношению:
ДТКИП = 0,52= 0.52ЛГ
(с—^концентрация соли, г/л; У —число молей соли в 1 л); £н2о =
132
Температуры кипения можно вычислить по
жающим линейную зависимость:
уравнениям, выра-
по Дюрингу — Т2 = АТ< + В
по Генглейну—=г- = Л-^-4-В
‘ 2 ‘ 1
а
Давление, атм
iauIiuiIumIuiJ -РЛ — I , . 1 . 1 J-----1 I ..1 ,, I . L-— I I - - 1 —
б 0,05 0,1 0,15 0,2 60 80 100 120 140 160 180 200 220 240 260 280 300 •
Давление, атм Температура кипения жидкости, °C
Рис. VII. 8. Диаграмма для определения температур кипения и давления паров
органических жидкостей:
а—низкокнпящие; б—высококипящне
1—этиловый эфир; 2—сероуглерод: 5—ацетон; 4—хлороформ; 5—четыреххлористый углерод;
6—бензол; 7—толуол; 8—хлорбензол; 9—орто-ксилол; 10—бромбеизол; //—бензальдегид;
12—анилин: 13—орто-крезол; 14—орто-чолутляля', 15—нитробензол; 16— нафталин: 17—орто*
нитротолуол; 18—пара-нитротолуол; 19—бензойная кислота; 20—салициловая кислота;
21—каприловая кислота; 22—глицерин.
Стрелками показан в качестве примера способ определения кипения ацетона 3 под давлением
1,033 атм; *КИП==56°С.
(?1 и ?2 — температуры кипения сравниваемых соединений при
равных давлениях пара).
133
Температуры кипения раствора и органических жидкостей при
различных давлениях можно рассчитать, исходя из известных тем-
ператур кипения стандартной жидкости (воды), по правилу Дю-
ринга (следствие общего правила линейности химико-технических
функций, на основе метода сравнительных расчетов [32]):
— -----т— = const
*н2о — ^н,о
Здесь tp, t'p — температуры кипения раствора при двух разных
-давлениях р и р'; /н2о и ^н2о — температуры кипения воды при тех
же давлениях (рис. VII. 7, VII. 8).
Зависимость (по Барнопу):
IF = М 1g Ткнп +8 VAT
Здесь W — сумма структурных : составляющих для расчета
Ткип: Атомная или Состав- Атомная нлн Состав-
структурная группа С н 0 F С1 Вг ляющая IF 23,2 10,9 51 6,8 121 255 структурная группа ляющан I 398 N 39,7 Двойная связь 16,1 < Тройная связь 33 Шестнчленное кольцо 17,6
На рис. VII.9 приведена зависимость Pap — f(Tnp), позволяю-
щая приближенно установить температуру кипения жидкости и
давления насыщенного пара, и их плотность по рис. VII. 10 (К —
критическая точка): Р = РПрРКр и р = рпрркР.
Температурная депрессия Д' связана с температурой кипения
и равна разности температур кипения раствора и растворителя
при одинаковом давлении. Значение Д' можно вычислить, если
известна одна температура кипения раствора (правило Бабо) или
две температуры кипения раствора при двух каких-либо давле-
ниях (по правилу Дюринга или уравнению Киреева).
По эмпирическому правилу Бабо отношение давления пара р
над раствором к давлению пара растворителя (воды) р° при той
же температуре есть величина постоянная, не зависящая для рас-
твора данной концентрации от температуры кипения:
k — plp° = const или (р° — р)/р° = const
Зная одну температуру кипения раствора при произвольно
взятом давлении, находим (по таблицам водяного пара) давление
пара растворителя (воды) р2 при той же температуре и вычис-
ляем по правилу Бабо значение k. Также для заданного давления
р'2 над раствором определяем давление пара растворителя • p't
а по таблицам находим соответствующую ему температуру Тъ ко-
торая отвечает температуре кипения раствора при заданном дав-
лении. Зная при этом давлении температуру растворителя, можно
134
вычислить температурную депрессию: Датм — Т2 — Т\. Для раз-
бавленных растворов Д" при любом давлении (по Тищенко)
1,62- 10“' (Г2ИП//ИСП) Даты
где Датм — депрессия при 1 атм; Т^ш и /ИСп— относятся к раство-
рителю при данном давлении.
Для определения температуры кипения раствора при повышен-
ном давлении используют правило Бабо с поправкой Стабникова.
Стабников предложил вносить в этот расчет поправку Д/, знак
которой зависит от теплоты растворения безводной соли. Поправки
определяют графически (рис. VII. 11).
Если безводная соль растворяется экзо-
термически, то поправку следует приба-
вить, а если эндотермически — вычесть
из
по
температуры кипения, определяемой
правилу Бабо.
Рис. VII. 9. Зависимость при-
веденного давления пара
от приведенной температуры
при кипении.
плотности
кипящей жидкости (К — критическая
точка).
насыщенного пара и
Данные о температурах кипения бинарных растворов при 1 атм
имеются в справочниках. Температуры же кипения при различных
давлениях приходится, как правило, определять расчетным путем,
например на основе данных активности воды а в растворе. .
Принципы расчета остаются без изменения и тогда, когда нуж-
но определить температуры кипения смешанных растворов солей.
В соответствии с правилом Здановского температура кипения сме-
шанного раствора будет та же, что и температура кипения изо-
пиестических бинарных растворов (см. § 1).
Для определения температуры замерзания растворов можно ис-
пользовать политермические диаграммы растворимости или диа-
грамму-(рис. VII. 12) с нанесенной на нее прямой, изображающей
зависимость t — — Вода начинает вымерзать из раствора
135
тогда, когда давление паров раствора становится равным давле-
нию паров льда. Строим по табличным данным (СТЭ, т. V, с. 363
и др.) на диаграмме кривую АВ зависимости /л — f° = f(fJI), где
/л и t°— температуры льда и воды при одном и том же давлении
пара. Точка пересечения С этой кривой с прямой t — t° = f(t) дает
температуру замерзания раствора.
Рис. VII. 11. Поправки к температуре
кипения водных растворов солей
(по В. С. Стабникову).
Рис. VII. 12. Графическое определение
температуры кипения и замерзания
водных растворов солей.
§ 3. ВЫЧИСЛЕНИЕ ПЛОТНОСТИ РАСТВОРОВ
(п„ — коэффициент преломления)
На практике плотность растворов достаточно точно можно
определить многими методами.
Существуют следующие формулы для расчета плотности:
Р = Рп + Pl (1—Тпр)0,3 [рп — плотность пара по формуле 1g (рп/Рп. кип) =
= 5(Т’пр—1)> где Рп. кип = М/82,06Ткип; Pi — коэффициент, равный
0,9—1,2 (в среднем 1)]
по Гольдгаммеру — р = (1 — Тпр)0’3; упрощенная формула для неболь-
ших рп
Пд — 1
по Эйкману-р= о>6(--+о;4у
по Нарсимхаиу — р = [1 + 2,5 (1 — Тпр)0,364]
v кр
Строгий метод расчетного определения плотности смешанных
растворов электролитов предложен Микулиным [49, 50]. В основе
этого метода лежит подтверждаемое опытом положение, что при
смешении двух растворов с равными парциальными мольными
объемами воды объем получившегося раствора равен сумме объе-
мов исходных бинарных растворов при условии отсутствия между
растворенными солями химического взаимодействия (нейтрализа-
ции, образования осадка, комплексного соединения и т. д.).
Объем раствора V, состоящего из No моль растворителя (воды)
и Ni моль растворенной соли, равен
У ~ Фо^о +
136
где <ро и ф{ — кажущиеся мольные объемы чистой воды (фо =
= 18,03 при 20 °C) и растворенной соли, см3/моль.
Зависимость кажущегося мольного объема растворенной соли
от мольной Хп концентрации представлена формулой Мэссона —
Геффкена
Ф; = <р* + дМп
где ф* и kt — константы, зависящие от температуры.
Обобщение для смешанных растворов сильных электролитов
(вывод опущен) дает _
Фг = ф* = йу»у;- (VII. 7)
где
/ = к'[’Сх + У2/зС2 + ... k^Ci
Здесь Ci = tijXi — мольная концентрация i-й соли в смеси;
tii — объемная доля раствора i-й соли в смеси; — «индивидуаль-
ная» мольная концентрация i-й соли.
Величина I — аддитивная линейная функция объемных концен-
траций растворенных солей.
Уравнение (VII. 7) позволяет выразить плотность р смешанного
раствора через кажущиеся мольные объемы фг растворенных
солей:
0 юоо
р р юоо + юоо
(VII. 8)
Здесь р° — плотность растворителя (воды); — молекулярная
масса соли i.
Подставляя в уравнение (VII. 8) значение ф< из формулы
(VII. 7), получим следующее выражение для определения плот-
ности смешанного раствора т солей:
р == р° + 0,001 £ (мг - р°<р*) Сг - 0,001 р°У/г (VII. 9)
i==l
Величину J определяют в зависимости от k{ по формуле
(VII. 7). В табл. VII. 1—VII. 3 приведены численные значения ве-
личин, необходимых для расчетов по уравнению (VII. 9) (см. так-
же СТЭ, т. V, с. 194).
Если концентрация раствора задана не в моль/л, а в
моль/1000 r Н2О, то плотность рассчитывают по способу, указан-
ному в работе [11].
Плотность растворов нескольких электролитов можно рассчи-
тывать также методом суммарных концентраций или «ступенча-
тым» методом (см. в работе [11]).
Метод определения плотности смешанного раствора при оди-
наковых активностях воды, по Здановскому [23—25], основан на
том, что при смешении растворов с одинаковой активностью воды
объем не изменяется. Плотность смешанного раствора поэтому
137
Таблица VII.1
Значения констант <р* для водных растворов некоторых
электролитов при 293 К
Анионы Катионы
н+ Li+ Na + K+ Rb+ Cs+ nh; Mg2+ Ca2+
ОН" — —6,90 —7,48 3,12 — — 43,03 — 30,51 F" ' — — —3,73 6,57 11,30 — 15,83 — — СГ 17,78 16,84 15,82 26,09 31,29 38,56 35.55 15,61 16,52 Вг" 24,93 23,92 22,72 33,16 38,13 45,43 42,65 28,65 29,45 Г 36,86' 35,26 34,09 44,48 49,58 57,19 53,67 48,47 49,53 NOJ 28,85 28,14 26,87 37,07 41,78 49,56 46,59 35,45 — SOf 31,36 - 7,55 - 41,42 61,32 47,47 5,50 - НСО; — — 21,92 — - — 42,40 — — СОГ — — ' 7,43 9,30 — - 75,11 — —
Таблица VII. 2 Значения слагаемого (Alz — p°«p^) в уравнении (VII. 9) для водных растворов некоторых электролитов при 293Н
Анионы Катионы
Н+ Li+ Na+ K+ Rb+ Cs+ NI-C 4 Mg2+ Ca2+
ОН" — 30,84 47,48 52,99 — — 10,08 — 43,64 F" — — 45,72 51,54 93,20 - 21,24 —. — СГ 18,72 25,59 42,66 48,51 89,71 129,88 18,01 79,65 94,51 Вг- 56,03 62,98 80,41 86,17 127,36 167,48 55,39 155,55 170,51 I" 91,14 98,66 115,89 121,62 162,91 202,74 91,38 221,78 244,48 NO; 34,22 40,86 58,19 64,10 105,78 145,45 33,92 112,94 — SO;" 66,78 — 134,51 — 225,68 300,68 84,75 125,87 — НСО; - - 62,12 _ _ - 36,72 - - COf — - 113,42 128,92 - - 21,08 - — —
Таблица VI 1.3 Значения констант fez/s для водных растворов некоторых электролитов при 293Н
Анионы Катионы
н+ Ll + Na+ K+ Rb+ Cs+ nh+ 4 Mg2+ Ca2+
ОН" — 2,34 2,74 2,58 — — 0 — 1,13 F" - — 2,17 2,07 2,41 — 2,33 — — СГ 0,93 1,32 1,75 1,80 1,78 1,76 1,38 3,31 3,62 Вг- 0,28 1,09 1,58 1,62 1,67 1,65 1,11 3,37 3,90 Г (0,30) 0,82 1,41 1,51 1,52 1,36 1,03 2,54 3,01 NO; 0,68 1,03 1,93 1,96 2,18 2,05 1,25 3,42 - SO;- 2,51 — 6,06 — 5 98 4,24 5,22 5,14 — НСО; - - 2,11 - - - 2,61 - - СО;- - - 5,45 5,63 - - 0,90 - -
138
может быть вычислена по плотности раствора отдельно взятых
электролитов
С]/*]?! + сз/*зрз + + ci/xiPi
где xt — концентрации электролитов в исходных растворах, имею-
щих одинаковую активность воды, % (масс.); Ci — концентрации
электролитов в смешанном растворе, % (масс.); р;— плотности
смешиваемых растворов электролитов концентраций х,.
Значения х,- находят так, как это описано ниже (см. Пример
VII. 3). По справочным таблицам определяют плотности раство-
ров чистых электролитов рг, соответствующие концентрациям х,.
рм (при t=15,6°С и Р -/атм), кг/л
Рис. VII. 13. Зависимость плотности жидкости от давления.
Затем по формуле (VII. 10) подсчитывают искомую плотность сме-
шанного раствора.
Шкала плотности жидкости по Боме (в градусах) :•
Be' = 140/р — 130; Be' = 145 — 145/р (для жидкостей тяжелее воды)
Плотность жидкости при температуре кипения:
Рж. кип = Ркр (1,981 + 0,422 lg Ркр); рж. кип = М/Vмол. кип
Влияние давления на рж можно определить по рис. VII. 13, на
котором Др® = рж, р — рж, где рж, Р — плотность жидкости при
данном давлении; рж — плотность при 1 атм (0,1 МПа).
При известной pi можно применить диаграмму VII. 14, ис-
пользуя соотношение fei/pi — Wp2 (^i и k2 соответствуют Гпр и Рар
для плотности pi и искомой рг); k — pnpz£J7 = z^p77/Vпр.
139
§ 4. ИСПАРЕНИЕ И КОНДЕНСАЦИЯ
[21, 33, 46, 61, 85]
Испарение лежит в основе многих технических процессов (вы-
паривание, ректификация, конденсация, перегонка и др). Извест-
но, что составы жйдкой и паровой фаз отличают (для азеотропов
они одинаковы) и для расчетов надо знать соотношения между
Рис. VII. 14. Обобщенная диаграмма для определения мольной плотности жидкости.
равновесными составами пара и жидкости (при испарении и кон-
денсации) при различных условиях, а также температуры кипения
раствора. Температура кипения раствора зависит от его состава.
На диаграмме, выражающей эту зависимость, строятся две кривые,
одна из которых связывает температуру кипения с составом жид-
кой фазы, а другая — с составом равновесного пара (рис. VII. 15).
По этим диаграммам можно установить температуру кипения рас-
твора, составы равновесных жидкости и пара.
140
141
Нижняя кривая рис. VI1.15, а описывает кипение; под ней рас-
положена область жидкого состояния; верхняя кривая характери-
зует конденсацию пара; над ней расположена область перегретого
пара. Между этими кривыми заключена гетерогенная область, со-
стоящая из равновесных жидкости и пара. Чем дальше отстоят
друг от друга равновесные кривые, тем больше различие в составе
пара и жидкости и тем проще протекает процесс перегонки.
Жидкость, имеющая большее давление пара, обладает более
низкой температурой кипения (здесь пентан). Для определения
состава пара смеси на оси абсцисс откладывают состав смеси и
из этой точки проводят вертикаль до пересечения с кривой кипе-
ния. Затем из этой точки проводят горизонталь до пересечения с
кривой конденсации. Абсцисса полученной точки дает искомый
состав пара. Например, при 75 °C кипит жидкость состава ft;
ей соответствует равновесный пар состава I. Жидкость с
хС5Н12 = 0,4 равновесна пару, содержащему 0,83 пентана (точка g,
рис. х VII. 15,б), а равновесную температуру определяем по
рис. VII. 15, а —60°C.
Таким образом, состав равновесных фаз (рис. VII. 15, а) опре-
деляют по пересечению данной изотермы с кривыми кцпения и
конденсации, а соотношение между фазами — по правилу рычага.
Точки h и I при 75 °C расположены на соединительной прямой.
Положение фигуративной точки системы k (жидкость и пар)
определяется относительными количествами каждой из фаз. При
равном количестве этих фаз точка системы k расположится по-
средине между точками h и I. Если количество жидкой фазы
в два раза больше, чем парообразной, то точка системы располо-
жится ближе к точке h и расстояние ее до точки I будет в два раза
больше, чем до точки ft. Например, при нагревании жидкости со-
става а до 75 °C система окажется в точке k. Эта гетерогенная си-
стема распадается на жидкость (точка h) и пар (точка /) в от-
ношении:
Кол-во ЖИДКОСТИ kl_
Кол-во пара kh.
На диаграмме рис. VII. 15,6 фигуративные точки системы при
изменении условий равновесия перемещаются по горизонтали —
в отличие от диаграммы рис. VII. 15, и, где точки системы переме-
щаются в процессе испарения и конденсации между фазовыми кри-
выми по вертикали. Когда точки системы рис. VII. 15, б находятся
выше диагонали, то отсчет состава проводят по ординате, а если
ниже — то по абсциссе.
Рассмотрим в общем виде процесс разделения раствора на
компоненты путем перегонки (дистилляции). Это разделение про-
текает тем легче, чем больше различие составов равновесных жид-
кости и пара. При нагревании (рис. VII. 15, а) раствора состава h
кипение начинается при 75°C; равновесному составу пара отвечает
точка I: пар более, чем раствор, богат пентаном; поэтому остаю-
щийся после испарения раствор обогащается менее летучим гепта-
142
ном и имеет состав, скажем, т. Последний не может кипеть, пока
температура не достигнет 82 °C; здесь равновесный пар имеет
состав п и более, чем раствор, богат пентаном. Итак, по мере ис-
парения остающийся раствор непрерывно обогащается гептаном и
температура его кипения повышается. В итоге остаток содержит
практически чистый гептан.
В обратном процессе —конденсации пара, например, состава I
до состава f, пар будет обогащаться более летучим пентаном.
Дальнейшая конденсация и дистилляция приведут к получению
практически чистого пентана.
Как видно из рис. VII. 15, а, температуры кипения смесей ниже
температуры кипения высококипящего компонента (гептана) и
выше температуры кипения низкокипящего компонента (пентана),
причем по мере увеличения в смеси содержания низкокипящего
компонента температура кипения понижается. Также видно, что
абсциссы линии конденсации больше абсцисс линии кипения (при
тех же ординатах), т. е. содержание низкокипящего компонента в
парах больше содержания этого компонента в жидкости; иными
словами, пар обогащается низкокипящим компонентом, что соот-
ветствует первому закону Коновалова.
Процесс испарения можно проследить также по рис. VII. 15, б.
При нагревании жидкости с хС5Н]2 = 0,35 точка системы переме-
щается вверх по вертикали. При достижении диагонали обра-
зуется первая порция пара (точка f ~*c5Hi2 = 0,8). По мере ис-
парения точка системы от диагонали перемещается влево^ но
состав системы по оси ординат будет неизменным ('/с5н12==0,35).
Так, для системы из пара и жидкости, состав которых определяется
точками h(l), имеем pCsH = 0,64, а жидкости хС5Н12 = 0,20. При
перемещений влево точка системы достигает кривой равновесия
(точка п), и тогда испарение заканчивается. Система состоит толь-
ко из пара с ^CsHl2:= 0,35 (то же, что в исходной жидкости). По-
следняя порция испаряющейся жидкости содержит хС5н12 = 0,08.
В итоге наибольшее содержание пентана в паре 0,8, а минималь-
ное в жидкости — 0,08.
Для взаимно нерастворимых жидкостей давление пара каждой
из них равно давлению ее пара в чистом виде, а общее давление
пара над их смесью равно сумме давлений пара чистых компонен-
тов. При перегонке двух взаимно нерастворимых жидкостей 1 и 2
их относительное количество в паровой фазе, а значит, и в кон-
денсате таково:
nifn2 = PVр”; Р 1 /р° =
Sil = M2P2/M1P1
Здесь «1, ti2 — числа молей веществ 1 и 2 в конденсате или
в паре, независимо от их соотношения в исходной смеси; р® и
ро — давления насыщенных паров над чистыми компонентами;
gi и g2~массы веществ 1 и 2; тогда щ = gi/Afj и n2=>g2lM2.
143
При перегонке с водяным паром:
£н,о ls Рн,о
gi Mi P°i
Первый множитель дает расход водяного пара для перегонки
единицы массы вещества 1, т. е. является расходным коэффи-
циентом пара.
Расход водяного пара при перегонке вещества:
Л = ЯВ
РпМп
РвЛ1вФ
У
Рис. VII. 16. Фазовая диаграмма
равновесия смеси компонентов А
и В. Зависимость между составом
жидкости х и пара у при различ-
ной относительной летучести а.
Р1М1
Здесь рп и рв — парциальное давление водяного пара и пара
вещества; Л4П и А1в — мольные массы воды и вещества; <р — коэф-
фициент насыщения — от 0,3 до 0,7.
Температура кипения смеси вза-
имно нерастворимых жидкостей ни-
же температуры кипения ее компо-
нентов (1 и 2). Состав пара такой
смеси [% (масс.)] gi и g2, причем
(gi + gi) = ЮО:
g, = ЮО ,
Pi'Wj + р2М2
Р°м2
р^+р^Мг
(р° и —- давление паров при тем-
пературе кипения смеси).
Так, для смеси воды и бензола
(М = 78) произвольного состава
Ткип —69°С. При 69 °C по
рис. VII. 1 и VII. 4 pi = 225 мм
рт. ст. = 29,5 кПа (вода) и р2 =
(бензол) н 225 + 535 — 760 мм рт. ст.
g2 = 100
= 535 мм рт. ст. = 70,5 кПа
По этим формулам: gi = 9% Н2О и g2 = 91 % СвН6.
При давлении 4,3 атм (0,43 МПа) Ткт — 112 °C, пар содержит
13% воды и 87% бензола.
Приведенные выше зависимости позволяют рассчитывать про-
цессы перегонки с паром.
На рис. VII. 16 приведена х — у-фазовая диаграмма, состав
пара (у)—состав жидкости (х). Зависимость у от х выражена
линиями равновесий, расположенными выше диагонали. Следова-
тельно, ординаты равновесия больше абсцисс, т. е. пары обога-
щены низкокипящим компонентом В. На этой фазовой диаграмме
кривая равновесия и диагональ ограничивают область сосущество-
вания двух фаз —выше расположена область пара, ниже — об-
ласть жидкости.
144
Для растворов смешивающихся жидкостей А и В, подчиняю
щихся закону Рауля, справедливы соотношения:
Ру = Ра = Ра*;
_ Рв___________Рв*________
У Р Р°ВХ + Рд (1 - X)
_ ах ._________________у . _ Р~ рв
у 1+(а—1)х’ а—(а—1)у' Ра~ Рв
р W - Рв) ’ Ра ~ (рл - Рв) »
Здесь Р — общее давление; Рд и рв — давления паров чистых
компонентов А и В; рд и рв — парциальные давления компонентов
А и В; а = р°/р^ — относительная летучесть; при равенстве этих
давлений а = I, тогда х = у. Из рис. VII. 16 следует, что, чем
больше а, тем сильнее отклоняется кривая равновесия от диаго-
нали, тем больше различие в составе пара и жидкости и тем проще
разделение раствора на компоненты.
Относительная летучесть а определяет форму кривой равнове-
сия х — «/-фазовой диаграммы и позволяет судить о легкости раз-
деления раствора на компоненты. Отношение числа молей ком-
понента В и А пара равно отношению их парциальных давлений:
Рв _ У
Ра 1 - У
Тогда:
Рв 1 — * У (1 — *)
х Ра *(1— У)
Следовательно, соотношение компонентов в паре в а раз выше,
чем в жидкости; от значения а зависит степень обогащения пара
компонентом В по сравнению с жидкостью, т. е. она определяет
степень обогащения паров легколетучим компонентом.
§ 5, ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА РАСПРЕДЕЛЕНИЯ
(ФАЗОВОГО РАВНОВЕСИЯ)
[33,46, 86]
Для вычисления коэффициента распределения К (константы
фазового распределения или равновесного отношения фаз) ком-
понента между раствором и газом надо знать его концентрации
в паре у и в жидкости х.
Отношение концентраций третьего компонента в двух равно-
весных фазах при данной температуре постоянно и не зависит от
145
содержания веществ, участвующих в распределении: х!у ~ К (х и
у — равновесная концентрация распределяющего вещества в пер-
вой и во второй фазах).
Для концентрированных растворов концентрация заменяется
активностью: а^/аг = К.
Задавшись составом жидкой фазы, можно найти состав паро-
вой фазы, зная и по уравнению: рв = рвхв = Рув.
Отношение
Уът1хвж~ Рв1р ~ *в
характеризует распределение компонента В между паровой и
жидкой фазами. Константу К называют константой распределения
(фазового равновесия).
В приведенных соотношениях Р — общее давление смеси; рв —
парциальное давление пара компонента В; р® — давление насы-
щенного пара над чистым компонентом В; Хв и уъ — мольные доли
компонента В в жидкой и паровой фазах.
При описании распределения газа между газообразной и жид-
кой фазами переходят от концентрации к парциальному давлению.
Так как в газовой фазе у = (\IRT)P, а при постоянной темпера-
туре у = К'Р (К' — 1/RT), то х = К К'Р = АР (х — концентрация
газа в жидкой фазе, которая по закону Генри прямо пропорцио-
нальна парциальному давлению газа.
При другом способе вычисления коэффициента распределения,
особенно при высоких давлениях, для компонента в растворе (па-
ровой фазе) надо знать значение фугитивности .f' чистого компо-
нента В в жидком (парообразном) состоянии при температуре
и давлении раствора: {в = Хв!в, где (в — фугитивность компонен-
та В в растворе.
Для двойной системы фугитивность компонента В в жидкой
и паровой фазе fB = fBx и fB = f"y, где fB — фугитивность
компонента В в жидкой фазе; fB — фугитивность компонента В
в жидком состоянии при давлении и температуре раствора; fB —
фугитивность компонента В в паровой фазе над раствором; f" —
фугитивность вещества В в парообразном состоянии при темпера-
туре и давлении раствора.
При равновесии фугитивности компонента во всех фазах равны,
т. е. fB —fB . Тогда значение равновесного отношения (коэффи-
циента распределения):
Кв = х/у = fB[fB
Фугитивность пара при всех давлениях, меньших давления на-
сыщения, можно установить на основе коэффициента сжимаемо-
сти г. Фугитивность жидкости, равновесной с паром, равна фуги-
тивности пара, т. е. известна для давлений и температур, отве-
чающих насыщенному пару (см. рис. VI.3 и VI.5, стр. 103).
146
Рис. VII. 17. Зависимость коэффи-
циентов распределения К от давле-
ния для этана, пентана и гептана (а)
и растворов углеводородов в нефти (б):
/~СН4; 2—CjHe; 3— СзНз; 4—С4Н10:
5 — С5Н12; 6—СбНн> 7—С7Н16 + высшие
углеводороды.
147
Равновесный состав жидкости и пара при высоких давлениях
можно вычислить
понентов двойной
из коэффициентов распределения К обоих ком-
системы
у.= Квх и 1—g = KA(l—х)
у х
----= а~.---
l—y 1 — х
называют относительной летучестью; она
паров легколетучим компонентом по срав-
1-КА
откуда х == ~^в _ или
Значение а — Кв!Ка
определяет обогащение
нению с жидкостью.
На рис. VII. 17 дана зависимость коэффициентов распределе-
ния К разных систем от давления, по которой можно определить
давление системы, зная К. Кривые различных углеводородов схо-
дятся в точке, соответствующей критическому давлению.
Для многокомпонентных растворов расчет состава пара и дав-
ления выполняют так, как это указано в примерах VII. 33—VII. 35,
при этом сумма мольных долей компонентов в паре и жидкости
равна 1. Это возможно только при одном значении давления, ко-
торое отыскивают путем подбора по графику типа рис. VII. 17 а.
При расчете задаются значением общего давления, находят зна-
чение К для каждого компонента и вычисляют х = у/К. Когда
сумма вычисленных мольных долей компонентов не равна 1, то
снова задаются другим давлением и расчет повторяют вплоть до
достижения х = 1.
Расчеты по насыщенному пару над солевыми растворами при
высоких давлениях даны В. Л. Пучковым *.
Коэффициент распределения К применяют также для расчета
процесса экстрагирования веществ из растворов. В данном случае
К есть отношение концентрации экстрагируемого вещества в рас-
творе к концентрации того же вещества в экстрагенте. Например,
после первого экстрагирования в исходном растворе (его объем Vi)
осталось gi растворенного вещества, а в экстрагент (его объем Кг)
перешло g = g0 — gi (go — исходное Количество экстрагируемого
вещества). Тогда:
g./У.
после первого экстрагирования — К = —^7—Д7? или
„ _ „ к.у, 8° 8'
gl go KtV, + v2
после второго экстрагирования — g2 = go
2
после т экстрагирований
КУ]
KVt + V2 )
§ 6. ПРИМЕРЫ РАСЧЕТОВ
Пример VII. 1. Вычислить давление пара при 373 К над смесью анилина и
воды, зная растворимость анилина (М =93,1) в воде — 7,2 и воды в анилине —
10,3% (масс.);, давление паров чистых анилина и воды 6,1 и 101,3 кПа.
* Пучков В. Л, Автореф. докт. дисс., Л., ЛТИ, 1975,
148
Решение. Мольные доли в сопряженных растворах:
7,2/93,1
водном - Т>2/93 j + 92,8/18 “ 0,015
89,7/93,1 .
анилиновом - = 0,63
Для сопряженных растворов по правилу Коновалова парциальные давления
обоих компонентов равны:
₽ан = ^ан (хан)и = Ран (*ан)р ^ан = Ран • (ханЬ/С*ан)п
Кан = 6,1 • 0,63/0,015 = 256,2; KHjO = 101,3 0,985/0,37 = 269,7 кПа
Р = 256,2 • 0,015 + 101,3.0,985 = 103,6 кПа
По закону Коновалова: Р = 269,7-0,37 + 0,1-0,63 = 103,6
Пример VII.2. Определить понижение давления паров воды над раствором,
насыщенным при 25°C солями: 20,42 NaCl и 11,14% (масс.) КС1.
р° = 3,159; pNaC1 = 2,381; Pj^ci = 2,66 кПа
‘^NaCl = ^КС1 = 88 г/100 г Н2О; М](№С1) = 29,83
Л12(кс[) = 16,27 г/100 г Н2О (в растворе двух солей)
Решение. По формуле (VII, 3):
р = 3,159 - (3,159 - 2,381) - (3,159 - 2,66) -^- = 2,288 кПа
оО «50
Относительное давление паров воды: а = р!р° — 2,288/23,159 = 0,724 (опыт-
ное значение 0,715).
Пример VII.3. Найти по способу Здановского относительное давление паров
воды при 25 °C над раствором, в котором С« = 20,42 NaCl иС2 = 11,14% (масс.)
КС1. р° при 25 °C 3,16 кПа.
Решение. Ищем приближенное значение а'. Для С = 20,42+ 11,14 = 31,56%
находим интерполяцией в табл. VI. 3 для NaCl ах = 0,663 и КС1 а2 = 0,793.
В этом случае (см. стр. 115):
20 42 11 14
а' = 0,663 4^- + 0,793 414^ = 0,710
О1,0б о1,об
Для этой активности воды *i=29,0% NaCl; Xj = 39,6% КС1. Тогда:
20 42 1114
а == = °-985’- = о,985 • 29-° = 28-б°/о;
хУ,и ОУ,О
х2 = 0,985 • 39,6 = 39,0%
Этим значениям Xi и х2 отвечает активность воды а — 0,717; опытное зна-
чение 0,715—0,716. Давление пара смешанного раствора: р = ар° = 0,717-3,16 =
= 2,266 кПа.
Искомое относительное давление паров воды: р/р° = а — 0,717.
Пример VII. 4. В условиях примера VII. 2 определить относительное давле-
ние паров смешанного раствора «ступенчатым» методом.
Решение. Находим интерполяцией для концентрации 11,14% КС1 значение
ас = 0,948 (см. табл. VI. 3). При этой активности воды раствор NaCl содержит
8,08% NaCl. Искомая величина а = 0,718; она найдена по концентрации рас-
твора NaCl: 20,42 + 8,08 = 28,5%. Следовательно, искомое относительное давле-
ние паров воды равно 0,718, а давление пара смешанного раствора р = 0,718 р°=
= 0,718-3,159 = 2,27 кПа.
149
!. Из табл. VI. 3 при О С нахо-
t — /0t № точки на
°C рис. VII. 12
7 4
4,1 1
проводя прямую через точки 4
Пример VII. 5*. Определить давление паров воды р° при 100 °C иад раствором,
содержащим 5,84 NaCl и 16,43% (масс.) MgCl2. Найти температуру ки-
пения.
Решение. Используя табл. VI. 3 (стр. 107) и уравнение (VI. 1), находим, что
последнему удовлетворяют значения приведенных концентраций смешиваемых
бинарных растворов 26,4 NaCl и 20,9% MgCl2: 5,84/26,4 + 16,43/20,9 = 1 (см.
пример IV. 3).
Этим концентрациям солей и их смешанному раствору соответствует при
100°С а = 0,774 (табл. IV.3). Следовательно, при 100°С р = 760-0,774 =
= 588 мм рт. ст. (78 кПа); что по рис. VII. 1 соответствует ?Кип = 93 °C.
Пример VII.6. Определить давление паров и температуру кипения f рас-
твора, указанного в примере VII. 5, при 500 кПа.
Решение. Для построения линии Дюринга (см. рис. VII. 7) следует рассчи-
тать давление паров воды при другой температу
дим: а = 0,739; р° — 0,452 кПа и — —4,1 °C.
t, °C а ро. кПа /, °C
100 0,774 78,2 93
0 0,739 0,452 —4,1
Строим диаграмму Дюринга (рис. VII. 12),
и 1. Промежуточные точки 2 и 3 для 25 и 50 °C, рассчитанные по данным Зданов-
ского, хорошо укладываются на эту прямую. Давлению 0,665 атм соответствует
t° = 81,7 °C; температурную депрессию определяем на ординате, как указано
стрелками; она равна 6,5 °C. Искомая ^Кип — 81,7 + 6,5 = 88,2 °C.
Пример VII. 7. Вычислить давление насыщенного пара ацетона при 460 К,
зная ГКр = 510 К и РКр = 4,61 МПа.
Решение. Гпр = 460/510 = 0,92; по рис. VII. 9 Рпр = 0,46. Р — РПрРкр =
= 0,46-4,61 =2,12 МПа.
Пример VII. 8. Вычислить для этилена плотность кипящей жидкости и на-
сыщенного пара при 255 К, зная ГКР = 283 К и рк₽ = 0,216 г/см3.
Решение. Гпр = 255/283 = 0,9; по рис. VII. 10 рпр = Рж/Ркр ~ 2 и рпр =
= Рг/Ркр = 0,2 и рж = 2 0,216 = 0,43 и рг = 0,2 • 0,216 = 0,0432 г/сма.
Пример VII. 9. Определить давление паров ацетона при 40 °C и <Кип.
Решение. По рис. VII. 8 находим, что вода имеет то же самое давление при
84 °C. Далее находим, что давление паров воды (рис. VII. 1,а) при 84 °C, а сле-
довательно, и давление паров ацетона при 40°C равно 430 мм рт. ст. (56 кПа);
Си = 56 °C.-
Пример VII. 10. Определить давление паров анилина при Г2 = 448 К, зная
ГНИп анилина 7\ = 457 К и воды 373 К.
Решение. Применим правило Дюринга: и паРов воды,
при которой их давление равно давлению паров анилина при 448 К, равна
457/448 = 373/7’; откуда Г = 364 К. Этой температуре соответствует давление
паров воды (рис. VII. 1,а) 537 мм рт. ст. (72 кПа), т. е. искомое давление паров
анилина при 175 °C равно 537 мм рт. ст.
Пример VII. 11. Давление паров воды при 298 К равно 3,1 кПа. Определить
давление пара при 298 К над водой (М — 18), содержащей 10% глицерина
(М = 92).
Решение. Определим мольные доли в растворе:
вода — 0,9/18 = 0,05;
глицерин — 0,1/92 = 0,0011
дгл_____________________________0,004 = 0 02
пгл + пН2о 0,0011 +0,05 ,и
Применим уравнение: (р° — р)/р° = 0,02; —’L5— - = 0,02; ,р = 3,15 кПа.
1D
* По примерам VII. 5—VII. 21 см. [2, 7, 11, 31, 66, 85].
150
Пример VII. 12. Вычислить молекулярную массу камфоры, зная, что давле-
ние паров ее раствора, содержащего 10 г в 400 г ацетона, при 293 К равно
23 710 Па, а давление паров ацетона (М = 58) при 293 К 23 940 Па.
Решение. Число молей в растворе:
ацетона — лац = Саи]Мт = 400/58
Ряп-Раа 400 23 940 - 23710
камфоры — пк = наи----------— ------------------------- 0,0662
. К ан р0ц 58 23940
С другой стороны: пк = тк/Мк; Мк — тк1пк = 10/0,0662 = 152.
Пример VII. 13. Вычислить давление паров диизопропилового эфира при
478 К, зная Г„ип = 341,3 К; Ркр = 2,78 МПа; Ркр = 500,1 К.
Решение. Применим Формулу 1g Рар= п (1 ~ у—Значение РПр. кип =
= Ркип/Ркр = 341,3/500,1 = 0,682. "Р
Тогда:
п = Тпр [1g Ркр/(1 - Гпр)] = 0,682 1g 28,4/(1 - 0,682) = 3,12 и
Гпр = Г/Гкр = 478/500,1 = 0,956
Рпр = Р/Ркр = Р/28,4; откуда 1g (Р/28,4) = 3,12 (1 - = -0,144
Искомое Р — 20,4 атм = 2,04 МПа.
Применим корреляцию:
1S Рпр = 1(Ркип С)/(Ткр Ркип)! [(Р Ркр)/(Р С)] 1g Ркр
Значение С = —18 + 0,19ГКИп = —18 + 0,19-341,3 = 47 К. Тогда:
1g Рпр = [(341,3 - 47)/(500,1 - 341,3)] X
X [478 - 500.1) (478 - 47)] 1g 28,4 = -0,138
Искомое Р = 20,4 атм = 2,04 МПа.
Пример VII. 14. Вычислить давление паров тиофена при 500 К, зная ГКип =
= 357,3 К и теплоту парообразования при температуре кипения ДДкип =
= 31486 кДж/кмоль и 1/гКИп = 1,05.
Решение. Применим корреляцию: lgP = /4—[В/(Г—С)].
Значение С — —18 -|- 0,19ГКИп = —18 4- 0,19-357,3 = 50 К. Тогда:
В = (1 /Д*кип) [(Ркип - С)2 РКип/2.303Р^ип] =
= 1,05 [(357,3 - 50)2.31486.103/2,303 • 8,314 • 163 • 357,32] = 1280 К
Л_ В И280_
Ркип-С 357,3 - 50 ’ -
Искомое Р = 2,09 МПа (опытное значение 2,01).
Пример VJI. 15. Вычислить ГНИп бромэтана СгН5Вг (Л4 = 109).
Решение. Применим формулу Барнопа. Значение W = 355,9 (см. вывод на
стр. 134). Тогда:
355,91= 109 1g Ркип + 8 V109 и РКИп = 317,6 К (погрешность + 1,6%)
Пример VII. 16. Раствор 145 г сахара в 1000 г HzO замерзает на 0,82° ниже,
чем вода. Вычислить давление пара над раствором; Рпл(н2О) = ®^8 кДж/кмоль;
р° = 0,61 кПа (4,6 мм рт. ст.).
Решение. (р°-р)/р° = £плЛРпл/ЯР2= 6008• 103• 0,82/8 314• 103• 2732 =0,00795
(0,61 - р)/0,61 = 0,00795; р = 0,605 кПа (4,6 мм рт. ст.)
151
Пример VII. 17. Дан водный раствор, который замерзает при 271,5 К. Уста-
новить температуру кипения этого раствора и давление пара при 298 К, зная
криоскопическую К и эбулиоскопическую Е постоянные воды 1,86 и 0,513; дав-
ление пара воды при 298 К — 3167 Па.
Решение. Понижение температуры замерзания воды равно 273—271,5 = 1,5°.
Тогда моляльность раствора т — &T3S„/K — 1,5/1,86 = 0,81.
Значение ДГКИП = Ет = 0,513-0,8 = 0,416 и ГКИп = 373 + 0,416 = 373,42 К.
Давление пара раствора pt = р°х; х — щ/(п1 + п2); «1 = 1000/18 = 55,6 и
п? = т = 0,81.
Тогда:
65 R
^ = 3167вдЖ = 3,2!’8Па
Пример VII. 18. Определить температуру кипения 30% раствора NaOH при
49,5 кПа с помощью правила Бабо.
Решение. Из .примера VI. 7 активность воды в этом растворе а = 0,570;
р° = р/а = 49,5/0,570 = 87 кПа (665 мм рт. ст.). По рис. VII. 1,а находим, что
этому р° соответствует t = 96,3 °C. Поправка по рис. VII. 11 при а = 0,570 и
р = 495 кПа (~380 мм рт. ст.) = 49,5 кПа; Д/ = +1,7°.
Тогда /кип = 96,3 + 1,7 = 98 °C = 371 К.
Пример VII. 19. Вычислить количество глицерина q (М = 92), необходимое
для понижения температуры замерзания водного раствора его на —3°;
^пл(Н2О) = 333’3 кДж/кг.
Решение. ДГПЛ =/?Г2л(7/1ООО£плМ; 3 = 8,314 • 103 • 2732<7/333,3 • 103 • 92; q =
= 15% (масс.) глицерина.
Пример VII. 20. Вычислить Ткип метанола при разных давлениях, зная, что
Ткип метанола и воды при Pi = 52 кПа равны 278 и 307, а при Р2 — 133 кПа —
294 и 325 К.
Решение. Воспользуемся формулой Т — ЛГ1 + В. Вычисление констант А нВ
по температурам кипения сравниваемых жидкостей при двух давлениях:
Pi — 278 = А (307) + В
Р2 -294 = А (325) + В
Л = 16/18 = 0,92, тогда 278 = 0,92 • 307 + В; В = —4,7
Следовательно, искомая Гкип СНз0Н = 0,92 ТКип Н20 - 4,7.
Пример VII. 21. Вычислить давление паров и температуру кипения 47,5%
(масс.) раствора NaOH при 1 атм (101,3 кПа), если при 0,2 атм (20 кПа) этот
раствор кипит при 100 °C*(373 К), а при 0,6 атм (60 кПа)—при 125 °C (398 К).
Решение. По рис. VII. 1,а температура кипения воды при 0,2 атм — 60 и при
0,6 атм — 87 °C. На рис. VII. 7 проводим через точки I и II с координатами 60
и 100, 87 и 125 °C линию 8,’на которой находим точку III (ее абсцисса 100°)
с ординатой искомой 1КИп — 140 °C = 413 К.
Пример VII. 22. Рассчитать плотность при 293 К раствора, содержащего (в
моль/л): 4,36 NaCI и 0,80 Na2SO4.
Решение. Значение 7 = по формуле (VII. 7) и табл. VII. 3:
I = 1,75 • 4,36 + 6,06 • 0,80 = 12,5; А = 44,0
Значение У, — p°4>j) Сг = 42,66 • 4,36 + 134,51 • 0,80 = 293,6. Плотность
воды при 293 К р° = 0,9982 г/см3. Плотность раствора по формуле (VII. 9):
Пример VII. 23. Вычислить плотность этанола и бензола при 298 К, зная Ткр
бензола 563 К и спирта 516 К-
162
Решение. Т®рНЗ = 293/563 = 0,52 и = 293/516 = 0,565. По формуле ГольД-
гаммера:
рбенз = (1 - гбеНз)0,з = (1 _ 0,52)°-3 = 0,872;
реп _ (] _ о,565)0,3 = 0,777 г/см3 (погрешность —1,5%)
Пример VII. 24. Вычислить плотность метанола при 293 К, зная коэффициент
преломления nD = 1,328.
Решение. По формуле Эйкмана:
р = (1,3282 — 1)/[0,6 (1,328 + 0,4)] = 0,75 г/см3 (погрешность —6%)
Пример VII. 25. Вычислить плотность амилового спирта (34 = 88,15) при
293 К, зная ГЕР = 500,6 К; VK₽ = 333,8 см3/мол.
Решение. Тар = 293/500,6 = 0,586. Воспользуемся формулой
р = [1 + 2,5 (1 - Т^р)0’364] = [1 + 2,5 (1 - О,586)0,364] =
' V кр 000,0
= 0,737 г/см3 (погрешность —0,1%)
Пример VII. 26. Смесь бензола с толуолом (эквимольная) полностью йена-,
ряется при Т = 363 К. Определить давление в начале и конце испарения.
Решение. Давления паров бензола и толуола при 363 К — по рис. VII. 4, а
1013 и 408 мм рт. ст. (134 и 54 кПа). Давление смеси в начале процесса pi =
= 0,5-1013 + 0,5-408 = 746 мм рт. ст.; давление в конце процесса:
1013-408 _,QO п
Р1~ 1013 —(1013 —408)-0,5 582 мм рт. ст. ~ 77 кПа
Пример VII. 27. Дана смесь нерастворимых гексана и воды при 323 К- Опре-
делить состав равновесного пара, зная при 323 К давления насыщенных паров
гексана и воды — 400 и 92 мм рт. ст. (53,4 и 12 кПа).
Решение. Общее давление смеси паров Р = 400 + 92 = 492 мм рт. ст.
(65,5 кПа). Искомая доля гексана в паре = РСоНн/^ = 400/492 = 0,81;
тогда рН2О = 0,19.
Пример VII. 28. Дана смесь из 40 бензола и 60% (мол.) толуола при 333 К.
Вычислить состав равновесного пара и состав смеси, кипящей под давлением
760 мм рт. ст. при 363 К.
Решение. Давления насыщенных паров при 333 К бензола и толуола по
рис. VII. 4, а 385 и 140 мм рт. ст. (51,5 и 18,6 кПа). Парциальные давления:
рв = 385-0,4 = 154 и р, = 140-0,6 = 84 мм рт. ст. (20,6 и 11 кПа). Общее дав-
ление: Р= 154 4-84 = 238 мм рт. ст. (31,8 кПа). Тогда искомый состав пара:
ув = рь1рч = 154/238 = 0,65 или 65 бензола и 35% (мол.) толуола.
Для определения состава смеси запишем уравнение:
Р = Рбхб + Р?хг 760 = Ю13хб 4- 408хт; хб 4- хт = 1
(1013 и 408 — давления насыщенного пара чистых бензола и толуола, мм рт. ст.
при 363 К). Решая систему уравнений, получим: хв — 0,58 и хт = 0,42.
Пример VII. 29. Установить расход водяного пара на перегонку 1 кг толуола
(М = 92) при Р = 9,9-104 Па и 356 К, зпая давление насыщенных паров то-
луола и воды при 356 К 4,2-104 и 5,5-104 Па.
Решение.
18р3 18-5,5-Ю4
= Ир° = 92-4,2 ДО4 = 0,26 КГ! 8в = °’Wt = 0,26 КГ
Пример VII. 30. * Вычислить К для бутана при 323 К и 25 атм (2,5 МПа),
зная Р — 4,9 атм = 0,5 МПа; Ткр = 426 К и Ркр = 36 атм (3,6 МПа).
* По примерам VII, 30—VII. 39 см. [21, 46, 85];
153
Решение. TBJ> = 323/426 = 0,75 и РПр = 25/36 = 0,7.
По рис. VI. 3 (стр. 103) fi/P = 0,52, откуда ft = 0,52-25 = 13 атм; Рпр =
= 4,9/36 = 0,14; по рис. VI.3 f2/P = 0,9, откуда f2 = 0,9-4,9 = 4,4.
Искомое К — f2ff\ — 4,4/13 — 0,34.
Пример VII. 31. Вычислить К для пентаиа (М = 72) при 10 атм (1 МПа) и
423 К, зная Ркр = 33 атм (3,3 МПа) и Гкр = 470 К; давление насыщенного
пара при 423 К 15,5 атм (1,6 МПа) и р = 0,46 г/см3.
Решение. К = /в/^в> определение фугитивности пара: Твр = 434/470 == 0,9 и
Рпр = 10/33 = 0,3. По рис. VI. 2, а или VI. 6 f/P — 0,83, откуда f = 0,83-10 =
= 8,3 атм = 0,83 МПа.
Для определения фугитивности жидкости при 10 атм находим /в при 423 К
и 14,5 атм; Тпр = 423/470 = 0,9, и Рдр = 15,5/33 = 0,47. По рис, VI. 2, а и
VI. 6 фугитивность пара и, следовательно, равновесного с ним жидкого пентана
/^ = 0,75-15,5=11,6 атм =1,15 МПа.
Определение фугитивности жидкого пентана: 1g (/в //в) = (К^РГ) (Р — Рв).
Мольный объем пентана:
72
Еж = 0,46-1000 =°-155 л/моЛЬ
Кроме того:
I
/в
.0,155
0,082 • 423 • 2,3
(10 - 15,5) = -0,01082;
=0.98; /в = 0,98-11,7 = 11,4 атм = 1,1 МПа
К = 11,6/8,3 =1,4
Таким образом, при 10 атм (1 МПа)'и 423 К концентрация пентана в паро-
вой фазе в 1,4 раза больше, чем в-жидкости.
Пример VII. 32. Вычислить фугитивность жидкого и газообразного пентана
при 20 атм (2 МПа) и 473 К, зная, что раствор пентана в гептане при этих
условиях содержит 50% (мол.) пеитаиа и находится в равновесии с паром [68%
(мол.) пентана]; Ркр = 26,8 атм и Ткр — 540 К.
Давление насыщенного пара при 473 К 9,6 атм = 0,96 МПа.
Решение. Коэффициент распределения гептана Кд = yijx^ =
= (1—0,68)/(1—0,5) =0,64
РПр = 9,6/26,8 = 0,36; Тпр = 473/540 = 0,88
По рис. VI. 2, о и VI. 6 /д/Р = 0,77; откуда /д = 0,77 • 9,6 = 7,4 атм=0,74 МПа
К = fO jf" = 0,64; /д = Ц /0,64 = 7,4/0,64 = 11,5 атм = 1,2 МПа.
То же значение найдем по рис. VI.3 (стр. 103) при Рпр = 20/26,8 = 0,75 и
Тпр = 473/540 = 0,88
f"/p = 0,58 и /д = 0,58 • 20 = И ,6 атм = 1,2 МПа
Пример VII. 33. Вычислить К гептана и пентана и равновесные составы жид-
кости х и пара у системы при 20 атм (0,2 МПа) и 473 К, зная Ркр = 33 атм
(3,3 МПа) и Ткр = 470 К для пентана, Ркр = 26,8 атм (2,7 МПа) и Тир = 540 К
для гептана.
Решение. Для пеитаиа (В) Рпр = 20/33 = 0,6; Тпр — 473/470 = 1. „По
рис. VI. 3 и VI. 5, а (стр. 104) фугитивность пентана /в/Р = 08 откуда /в —
= 0,8 • 20 = 16 атм = 1,6 МПа.
По рис. VI. 5, б при 473 К фугитивность жидкого пентана /в = 20,5 атм =
= 2 МПа. Тогда коэффициент распределения пентана при 473 К и 20 атм К —
154
Для гептана (А) Рпр = 20/26,8 = 0,75 и Тпр = 473/540 = 0,88.
Имеем:
по рис. VI. 3 - /д' / Р = 0,59: /д = 0,59 • 20 = 11,8 атм = 1,18 МПа;
по рис. VI. 5, б — при 473 К /д = 7,1 атм = 0,71 МПа;
Аа = 7,1/11,7 = 0,6
Тогда х =(1 —0,6)/(1,3 — 0,6)= 0,57 и у = Къх = 1,3-0,57 = 0,74.
Искомые составы жидкости — 57 пентана (и 43% (мол) гептана; пара — 74
пентана и 26% (мол.) гептана.
Пример VII. 34. Найти давление системы, содержащей 56 пентана и 44%
(мол.) гептана, равновесной с паром, содержащим 81% (мол.) пентана при 423 К.
Решение. Коэффициент распределения пентана К — х/у = 0,81/0,56 = 1,45.
По рис. VII. 17, а при 150 °C при А = 1,45 искомое Р = 9,9 атм = 0,99 МПа.
Пример VII. 35. Вычислить значение А = fi/fi (фазового равновесного рас-
пределения) для смеси бензол — толуол при 473 К и 9,2 атм, зная для бензола
Ркр = 49,5 атм (4,9 МПа); Гкр = 561,7 К; Pi = 14,5 атм (1,45 МПа); УМОл =
=0,119 м3/кмоль.
Решение. Тар = Гкр/Г = 473/561,7 = 0,84 и Рп₽ = Р/Ркр = 9,2/49,5 = 0,19.
По рис. VI. 6 fj/P = 0,88; ft = 0,88-9,2 = 8,1; Pi/P„p = 14,5/49,5 = 0,29 и
по рис. VI. 5, a fi/P — 0,83.
Тогда Л (при Р()= 0,83 14,5= 11,97 и К = х/у = fi/f2 = 11,97/8,1 = 1,47.
С учетом поправки по формуле:
. ИМол(Р-Р!) 0,119(9,2-14,5) _.RQ. . nnQK.
g ----23АТ-------= 2 3-0 0848 473 = ~0’068 (антилогарифм равен 0,985).
Тогда:
Л (при Pj) = 0,985-11,97 = 11,8; А = х/у = f\/f2 = 11,8/8,1 =1,45
Пример VII. 36. Вычислить коэффициент распределения пикриновой кислоты
между бензолом и водой, зная, что водный 0,02 М раствор пикриновой кислоты
находится в равновесии с 0,07 М раствором пикриновой кислоты в бензоле, при-
чем степень диссоциации пикриновой кислоты в воде а = 0,9.
Решение. К = 0,07/0,02(1 — 0,9) = 35.
Пример VII. 37. Определить количество иода, которое остается в 10~4 м3 (Vi)
водного раствора, содержащего 10-4 кг 12, при взбалтывании его с пятью от-
дельными порциями (по V2 = 10~6 м3 каждая) сероуглерода. Коэффициент рас-
пределения иода между водой и сероуглеродом А = 0,0017.
Решение
KVi
K.V, + av2
0,0017- IQ-4
0,0017-10-4 + 10~6
= 6,5-10~9
кг
Пример VII. 38. Вычислить константу равновесия А для гептана в смеси с
другими углеводородами при Р = 25 атм (2,5 МПа) и 473 К, зная Ркр=26,8 атм
(2,6 МПа); ГКР = 540 К и Р = 9,5 атм (0,95 МПа).,
Решение. При высоком давлении закон Рауля дает большие ошибки. Приме-
ним уравнение, фугитивности K — f'ilf":
рпр = р/ркР = 25/26>8 = °>93; Гпр = Г/Гкр = 473/540 = °>87
Тогда по рис. VI. 2, а фугитивность газовой фазы f'/Р = 0,51; f" =0,51 -25 =
= 12,7 атм = 1,27 МПа. '
По рис. VI. 5 фугитивность жидкой фазы {' — 7,1 атм (0,7 МПа).
Искомая А = 7,1/12,7 = 0,56; по закону Рауля А = 9,5/25 = 0,38.
155
Пример VII. 39. Вычислить константы распределения пропана и изопентана
и состав равновесных фаз при 30 атм (3 МПа) и 398 К, зная для пропана
Ркр = 42 атм (4,2 МПа); Гкр = 370 К и для изопентана РКр — 32,9 атм
(3,3 МПа); ГКР = 461 К.
Решение
Рпр = 30/42 = 0,71 и Гпр = 398/370 = 1,1 (пропан)
Рпр = 30/32,9 = 0,91 и Гпр = 398/461 = 0,86 (изопентан)
По рис. VI. 3:
(/Г/Р) = 0,8, откуда /г = 0,8 • 30 = 24 атм = 2,4 МПа (пропан)
(/Г/Р) = 0,5, откуда /г = 0,5 • 30 = 15 атм = 1,5 МПа (изопентан)
Тогда по рис. VI. 5, и VI. 6, а /ш = 36,5 (пропан); = 9,2 (изопентан).
Следовательно:
К] = 36,5/24 = 1,5 (пропан); = 9,2/15 = 0,6 (изопентан)
По уравнениям:
хж=ТуЕ%^ = 0'45; ^=1,5-0,45 = 0,67
Искомый состав жидкости — 45% пропана и 55% изопентана, а пара —67%
пропана и 33% изопентана.
Глава VIII
ЭНТАЛЬПИЯ И ЭНТРОПИЯ
[7, 21, 31, 33, 35, 39, 40, 61, 85]
§ 1. ОБЩИЕ ПОЛОЖЕНИЯ
Энтальпийные и энтропийные диаграммы широко применяют
при технических расчетах испарения, абсорбции, ректификации,
холодильных, тепловых и многих других процессов.
। Энтальпия — это функция состояния системы, равная величине
внутренней энергии (U), сложенной с произведением объема на
давление: H=U-[-PV. Внутренняя энергия системы есть пара-
метр состояния; она характеризует запас энергии системы и зави-
сит от вида и количества данного вещества и от условий его суще-
ствования; она прямо пропорциональна его количеству. Функции
Н и U измеряют в джоулях или калориях. Энтальпию (измене-
ние) процесса можно определить, например, путем измерения
теплоемкости при постоянном давлении, а внутреннюю энергию —
по теплоемкости при постоянном объеме.
Изменение функции А// — мера теплового эффекта при постоян-
ном давлении и определяется заданными начальным и конечным
состояниями системы.
Энтальпию рассчитывают в предположении, что в некотором
условно выбранном состоянии значение ее равно нулю. Таким
условным «нулевым» состоянием для газов приняты 273,2 К и
1 атм (0,1 МПа), а для водяного пара — жидкость при . 273,2 К
при давлении ее насыщенного пара. Например, если энтальпия
пара при 473 К и 1 МПа равна 2840 кДж/кг, то это число харак-
теризует увеличение энтальпии 1 кг Н2О, взятой под давлением
насыщения при 273,2 К, и переходящей из этого состояния в пар
с давлением I МПа, перегретый до 473 К.
Для изотермических процессов количество передаваемой теп-
лоты q выражается величиной q/T (приведенной теплотой). Для
обратимых процессов q/T не зависит от пути перехода и опреде-
ляется начальным и конечным состоянием системы.
157
Энтропия S — это функция состояния, изменение которой AS
для обратимого изотермического перехода теплоты равно приве-
денной теплоте процесса: AS — q/T, или в дифференциальной
форме для бесконечно малого количества теплоты:
dS = bq/T
Изменение энтропии процесса не зависит от пути протекания
процесса, а зависит только от начального и конечного состояний.
Для перехода из состояния 1 в состояние 2 изменение энтропии:
AS = S2 — Si. При обратимом переходе 1 *-> 2 (например, при
изотермических обратимых процессах — плавлении, испарении,
сублимации, аллотропических переходах): S2 — Si = Q/T, где Si
и S2 — мольные (удельные) энтропии конечных и начальных фаз;
Q и Т — теплота и температура фазового перехода 1 моль веще-
ства. Например, при испарении воды при 0,1 МПа и температуре
кипения 373 К жидкость равновесна с паром и процесс испарения
обратим (теплота испарения воды 40687 Дж/моль). В этих усло-
виях возрастание энтропии 1 моль НгО при переходе в пар равно:
AS = -4О6|7 = Ю9 Дж/(моль • К) = 26 кал/(моль • К).
Изменение энтропии:
при нагревании (при V = const) — AS » Ср In (Т2 — Г1)
при переходе п моль идеального газа из одного состояния в другое —
AS = 2,3nCp lg (T2/Tt) = - 2,3Rn lg (P2/Pj)
•Например, изменение энтропии при изотермическом расшире-
нии 2 моль метана (при Т = const) от Pi = 101 -10s Па до Р%~
= 1-105 Па: AS =-2,3-8,314-2 lg (1-105/101-105)= 76,5 Дж/К.
Значение энтропии зависит от массы системы. Так, сжатый газ
обладает меньшей энтропией, чем расширенный (при равной Т).
Смесь газов обладает большей энтропией, чем сумма энтропий
газов до их смешения (при равных Т и Р),
Таблица V1II.1
Константы А и В для некоторых типов твердых соединений
Тип соединения А В
Дж/(моль-К) кал/(моль-К) Дж/(моль-К) кал/(моль-К)
М2О 87,45 20.9 -87,45 -20,9
МО 60,67 14,5 -70,71 -16,9
М2О3 138,49 33,1 -227,61 -54,4
мо2 64,02 15,3 —68,62 -16,4
М2О5 133,05 31,8 -209,20 -50,0
MX 62,76 15,0 -38,07 -9,1
мх2 136,82 32,7 -185,35 -44,3
МХОз 35,98 8,6 68,20 16,3
MS 69,87 16,7 -73,22 ч -17,5
MNO3 90,79 21,7 -60,67 -14,5
* М —металл X —галоген.
158
Значение энтропии [Дж/(моль-К)] твердых неорганических ве-
ществ может быть вычислено по соотношению:
Sjgg = A lg М + В
(М — мольная масса, А, В — некоторые постоянные, см.
табл. VIII. 1).
Энтропия газообразных неорганических веществ подчиняется
выражению:
1е5°=Д!?Л1 + В (s° = BAf4)
Значения постоянных А и В, определяемые в основном числом
атомов, приведены в табл. VIII. 2.
Таблица VIII.2
Константы Лив для некоторых газов
Газ А В 1g в
ДжДмоль -К) кал/(моль*К) ДжДмоль-К) кал/(моль*К)
Двухатомные 0,136 124,68 29,8 2,096 1,474
Трехатомные 0,211 101,67 24,3 2,007 1,386
Четырехатомные 0,221 101,25 Г4.2 2,005 1,384
Пятиатомные 0,213 102,51 24,5 2,011 1,389
Шестиатомные 0,294 82,42 19,7 1,916 1,294
Энтропия органических веществ:
твердых — 5° = 4,6СР Дж/(моль • К) = 1,1СР калДмоль • К)
жидких — S0 = 5,9СР Дж/(моль • К) = 1,4СР калДмоль • К)
парафинов (тв.) — S° = 75,31 + 24,27п ДжДмоль • К) =
= 18 + 5,8п калДмоль • К)
парафинов (г) — S0 = 142,3 + 41,8п ДжДмоль • К) =
= 34 + 10п калДмоль • К)
(Ср — теплоемкость при Р == const; п — число атомов углерода).
Для вычисления изменения энтальпии при небольшом давлении
применимо уравнение:
Q DT / Т2 \
128-P^O-18^)P
§ 2. ЭНТАЛЬПИЙНЫЕ И ЭНТРОПИЙНЫЕ ДИАГРАММЫ
Для практических расчетов, особенно при повышенных давле-
ниях и температурах, удобно пользоваться различными термоди-
намическими диаграммами. Известны диаграммы: энтропия —
температура (S— Т); энтропия — энтальпия (S — H)-, давление —
энтальпия (Р — Н); энтальпия — температура (Н — Т) и другие.
Диаграммы позволяют определить изменения энтальпий и энтро-
пии вещества, если известны давление и температура, или энтро-
пию и давление при двух других известных свойствах и т. д.
159
В общем, энтальпия и энтропия реальных газов растут с тем-
пературой и уменьшаются с повышением давления (при постоян-
ной температуре). Для технологических процессов, протекающих
при постоянном давлении, следует для нахождения количества вы-
деляемой или поглощаемой теплоты вычесть значение энтальпии,
найденное по диаграммам или таблицам в начале процесса (Hi),
из его значения в конце процесса (Н^).
Рассмотрим вкратце S — ^-диаграмму (рис. VIII. 1,а). На ней
представлены кривые постоянного давления Pi — Pi (изобары) и
кривые Hi — Н3 постоянной энтальпии (изоэнтальпы). Погранич-
ная кривая АВ имеет максимум, который отвечает критической
точке К; координаты этой точки характеризуют критические пара-
метры газа (пара). Кривая АК отвечает жидкости, а КВ — пару.
Область АКВ отвечает влажному пару, а области правее и выше
КВ — перегретому пару, т. е. пару, находящемуся под давлением,
меньшим давления насыщения им при данной температуре. Об-
ласть левее АК отвечает жидкости, неравновесной с паром. В об-
ласти влажного пара сосуществуют две фазы — жидкость и пар.
Ветвь АК отвечает полной конденсации пара, т. е. полной сухости
пара (х — 0), где х—массовая доля пара в единице массы влаж-
ного пара, а ветвь КВ — полному испарению жидкости и образова-
нию сухого пара (х = 1). Слева от кривой АКВ область существо-
вания только жидкой фазы, а справа—только паровой фазы.
В области влажного пара построены линии постоянной влажности
(х = const).
Линии постоянных температур (изотермы) и энтропии парал-
лельны осям абсцисс и ординат (рис. VIII. 1,6). Изобары (Р—
= const) в области перегретого пара направлены круто вверх,
а в области влажного пара совпадают с изотермами (т. е. теплота
расходуется на испарение жидкости без изменения Т). В области
жидкой фазы изобары сливаются с пограничной кривой FKE
(рис. VIII. 1,в) (из-за малой сжимаемости жидкости).
Линии постоянной сухости пара х в области влажного пара
сходятся в критической точке К и делят изотермы — изобары на
части, пропорциональные значениям сухости. На линиях х — х ле-
жат точки, для которых относительные количества жидкости и
пара одинаковы. Так, если х = 0,8, то в 1 кг смеси содержится
0,8 кг пара и 0,2 кг жидкости. Все точки линии х = 0,8 отмечают
смеси с таким же соотношением двух фаз. В критической точке
состав обеих фаз будет одинаковым.
В области перегретого пара точка D указывает давление Pi
и энтальпию Н5. При изобарном охлаждении такого пара (пере-
мещение вдоль изобары Pi) изменение непрерывно до точки Е,
где пар становится насыщенным, и левее точки Е начнется выде-
ление жидкости («точка росы»). При отнятии теплоты состав си-
стемы изменяется по горизонтали EF до точки F и вместо пара
появится жидкость (100%). Когда система М расширяется без
теплообмена (адиабатно) и обратимо, то путь изменения изо-
бразится вертикальной линией. Если расширение продолжается
160
Рис. VIII. 1. S — T-Диаграммы:
а, б—общий вид; в—применительно к водяному пару.
в М. М, Викторов.
161
С уменьшением давления до Рь то система попадет в конце рас-
ширения в точку N. По диаграмме можно отметить температуру,
сухость, энтальпию данной системы.
При адиабатическом сжатии газа количество отводимой теп-
лоты q — 0 и AS = 0, т. е. процесс сжатия идет без изменения
энтропии (S = const) и изображается вертикальной линией 1—2
(рис. VIII. 1,6). Точка I для газа до сжатия лежит на пересече-
нии изобары Р\ и изотермы Л, а точка 2 для газа после сжатия
лежит на изобаре Р2.
При изотермическом сжатии газа процесс протекает при Т =
— const и изображается горизонтальной линией 1—2'. Точка 2'
(для газа после сжатия) лежит на изобаре Р2. Количество отво-
димой теплоты q выражается площадью заштрихованного прямо-
угольника, высота которого равна Л, а основание — изменению
энтропии AS (на этой диаграмме параметры газа отнесены к 1 кг
пара).
Энтальпийные диаграммы удобны для расчетов парообразова-
ния жидкостей при переменных температурах и давлениях. Раз-
ность энтальпий сухого насыщенного пара и жидкости, находя-
щейся при той же температуре и давлении, что и пар, дает теплоту
парообразования (испарения). Вычитание последней из энтальпии
пара дает энтальпию жидкости. Энтальпия (техническая) насы-
щенного пара равна сумме энтальпий жидкости и соответствующей
теплоты испарения.
Энтальпия пара — это разность между значениями энтальпий
насыщенного пара (1 кг) при определенном давлении и жидкости
в состоянии, условно принимаемом за нулевое.
Рассмотрим вкратце Н — S-диаграмму (рис. VIII.2). Кривые
жидкости и пара АК и KF сходятся в критической точке К, рас-
положенной в восходящей части кривой жидкости (рис. VIII.2,а).
Ортобарнаж кривая AKF ограничивает область влажного пара.
Области правее и выше KF отвечают перегретому пару, а ле-
вее АК~ неравновесной с паром жидкости. Изотермы и изобары
влажного пара изображены наклонными линиями вместо парал-
лельных оси S на диаграмме S — Т (рис. VIII. 1, в),. ибо сухой
насыщенный пар обладает большей против жидкости энтропией
(на величину q}T) и энтальпией (на величину q). Наклон изо-
терм— изобар отвечает температуре кипения при данном давле-
нии. Линии постоянной сухости х пара также сходятся в критиче-
ской точке К и делят изотермы — изобары на части, пропорцио-
нальные значению х. Штриховые линии отвечают изохорам.
Процесс истечения пара изображается вертикальной линией.
При истечении влажного пара сухость (х) уменьшается (процесс
рг); для перегретого пара уменьшается перегрев (процесс st). Пе-
регретый пар может стать насыщенным (процесс uw) и влажным
(процесс иг). На рис. VIII. 2, а дана шкала для определения ско-
рости истечения пара U в зависимости от изменения энтальпии.
Зная два параметра вещества, заключенного в резервуаре (на-
пример Р] и tj), и давление среды (Рг), можно найти по диа-
162- ...
Рис. VIII. 2. 5 — Я-Диаграммы:
s*
лез
грамме другие свойства в точке выпуска из резервуара. По ука- 1
занной диаграмме можно проследить процесс истечения газа, дрос- 1
селирования, установить дроссельный эффект. Дросселирование— ;
это процесс неравновесного расширения газа (жидкости) при рез- '
ком увеличении сопротивления (при протекании через узкие отвер-
стия) и падения давления. Изменение температуры в результате
дросселирования (без подвода к газу или отвода от него тепла)
будет дроссельным (интегральным) эффектом или эффектом
Джоуля — Томсона. Этот эффект уменьшается с повышением тем-
пературы. •!
Дросселирование при обычных температурах и давлениях со- ;
провождается охлаждением. Температура газа, при которой дрос-
сельный эффект обращается в нуль, называется инверсионной. |
С увеличением давления дроссельный эффект уменьшается и затем 1
проходит через нуль (инверсионная точка). Температура инвер- j
сии с повышением давления уменьшается; значение Типе « 2alRb j
(d и b — постоянные уравнения Ван-дер-Ваальса). '
Большинство газов имеют высокую инверсионную температуру •
и при дросселировании охлаждаются (кроме водорода и гелия,
которые нагреваются, а при достаточно низких температурах так-
же охлаждаются). Для сжижения водорода и гелия нужно до
дросселирования значительно их охладить.
Интегральный дроссельный эффект соответствует изменению
температуры ДГ при понижении давления газа от начального до
конечного. Изменение температуры при дросселировании:
ДТ 2a/RT - Ь
Ы>* Ср
Интегральный дроссельный эффект можно определить, напри-
мер, графически по S — Т-диаграммам (рис. VIII. 1, а) или S — H
• (рис. VIII. 2, а) по величинам Pi, t и Р2 (линия 1—2 или fg),
а также по таблицам Вукаловича. Точки изобары 1 и 2 (f и g)
характеризуют начальное и конечное состояние.
Дифференциальный дроссельный эффект ц на практике опре- •
деляется как изменение температуры, отвечающее понижению
давления на 1 атм. Этот эффект можно определить, например, пй
уравнениям:
ц = (дТ/дР)н и и = Т (аУ/дТ)р - V/Cp
Значение ц можно определить по рис. VIII. 3, используя зави-
симость a = РкрСрц/Гнр (а определяют по ординате, исходя из
значений Рпр и Тщ,). Кроме того, справедливо соотношение:
ц « (2а/RT) — Ь — (3abP/R2P2)/Cp
При низком давлении и высокой температуре:
‘ (2a/RT) - Ь
.164
денных давления и температуры.
Рис. VIII.4. Зависимость дифференциального дроссельного эффекта для ам-
миака от Г и Р.
165
3000 г
Татм» 0,033 МПа
К
Рис. VIII. б. Диаграммы Н—Т (а) и H—S (б) для аммиака и Н—Т (в) для смеси
N2—Н3—NHS (при 300 атм).
8}
5
500
Л
о
Л00°
л
ЛО
лА
^>0
\л
>
Н, кмл /кг
л
Рис. VIII. 5, а.
167
При низком давлении:
9RT ( т2 \
» = -18^)W
Уравнение для расчета интегрального эффекта:
/?Гг 1п(у7у')
- т т" -т'
\Ур}ср кр 'пр 'пр
Здесь (Ср)ср — средняя теплоемкость между начальной и конеч-
ной температурой газа при дросселировании; у' и у" — коэффи-
циенты активности, определяемые (по справочнику или по
рис. VI. 2, а) по значениям 7пр и Тпр» близким к Тар; при этом
принимается, что Тпр < Тпр и Тпр > Тпр.
Также применима упрощенная зависимость ДТ = ДЯ/(Ср)с£.
Дросселирование влажного пара приводит к увеличению его
сухости (линия ab, рис. VIII.2,а). При большом перепаде давле-
ний влажный пар перегревается, т. е. переходит через состояние
насыщения (линия cde). Дросселирование перегретого пара вызы-
вает перегрев, ибо температура насыщения при низком давлении
будет меньше, чем при высоком (линия fg). При высоком давле-
нии дросселирование перегретого пара может привести к конден-
сации (линия hi), а дросселирование влажного пара — к уменьше-
нию x(kl). Дросселирование жидкости вызывает ее частичное ис-
парение (линия по). Понижение температуры при равном перепаде
давления нагретого пара намного меньше, чем для влажного (срав-
нить линии ab и fg).
Рис. VIII. 4 показывает, что с ростом Т и Р ц для . аммиака
уменьшается. Приведенные на рис. VIII. 5 диаграммы (по данным
Казарновского и Карапетьянца) показывают, что значения Н и S
повышаются с температурой и уменьшаются с давлением.
При дросселировании воздуха (рис. VIII. 6), например при Т\
(205 К) и ?! (100 атм = 10 МПа), перед дросселированием по
диаграмме находим точку 1, а затем точку 2 на пересечении ли-
нии Н = const с изобарой, отвечающей конечному давлению Р2
(1 атм = 0,1 МПа). Точка 2 определяет конечную температуру
газа после дросселирования Т2 = 150 К, т. е. дроссельный эффект
равен Д7’ = 7\ — Т2 = 205 — 150 = 55 К.
Изоэнтальпический эффект расширения газа можно опреде-
лить в единицах энергии как разность энтальпии сжатого и рас-
ширенного газа при одинаковой начальной температуре Т\ газа
(перед дросселированием). Эта разность энтальпии определяет
количество теплоты, подводимой к расширенному газу для нагре-
вания его до температуры перед дросселированием. Дроссельный
эффект, выраженный в тепловых единицах, будет изотермическим
дроссельным эффектом (рис. VIII. 7).
Для вычисления изотермического теплового эффекта (см.
рис, VIII, 6) по изобаре Р2 = const поднимаются из точки 2 до
168
точки. 3 на изотерме Л. Точка 3 отвечает энтальпии газа
Яз = 100 ккал/кг = 4,19-10s Дж/кг. Тогда искомый эффект будет
разностью энтальпии в точках 2 и 3:
ЬН — Hi — /У3 = 86 — 100 = — 14 ккал/кг « — 58,7 • 103 Дж/кг
Холодопроизводительность Qo при дросселировании — это раз-
ность энтальпий газа до и после его изотермического сжатия.
Удельная холодопроизводительность (Дж/кг): g0 = Н\ — Hi (Hi и
Ряс. VIII. 6. S — Г-диаграмма для воздуха.
Hi — энтальпии 1 кг хладоагента после и до испарения, опреде-
ляемые по диаграммам Т — S).
Практически охлаждение наступает в результате совершения
хладоагентом (например, аммиаком) кругового процесса; при
уменьшении давления полученный после конденсации паров жид-
кий аммиак испаряется, «отнимая» от охлаждаемого телашеобхот
димую для его испарения теплоту, затем пары аммиака снова
сжижают.
При детандировании газа (расширение сжатого газа в детан-
дере, газовом двигателе) он охлаждается.
169
По 5 — Т-диаграмме можно определить количество отнимае-
мой от расширяющегося газа теплоты и понижение температуры
при детандировании (см. рис. VIII. 6). Например, параметры сжа-
того газа перед детандером Ti — 205 К и Pj = 100 атм = 10 МПа
(точка 1). Процесс адиабатического расширения газа проводится
при S — const. Поэтому опустив из точки 1 вертикаль до пересе-
чения с изобарой, отвечающей заданному конечному давлению
Р2= 1 атм (0,1 МПа), получим точку 4, характеризующую со-
стояние газа в конце детандирования — Т4 ж 83 К. Тогда пониже-
ние температуры газа АГ = Tj — Т4 = 205 — 83 = 122 К. Количе-
ство отнимаемой теплоты Q = Н\ — /Д = 86 — 58 = 28 ккал/кг =
Рис. VIII. 7. Интегральный и изотермический дроссель-
ный эффекты для воздуха.
= 11,7-104 Дж/кг. Это количество теплоты определяет работу
расширения газа.
Для повышения холодопроизводительности комбинируют ме-
тоды расширения газа в детандере и дросселирования его. Вместо
дросселирования можно расширять газ, заставляя его совершать
работу под поршнем компрессора. В способе Капицы поршневой
расширитель заменен быстроходной турбиной, что позволяет про-
цесс сжижения производить при небольших давлениях.
Расчет зависимости энтропии и энтальпии от приведенных тем-
пературы и давления можно выполнить по рис. VIII. 8 и VIII. 9.
Рассчитать можно и энтальпию газа при сжатии его до высокого
давления. При вычислении (На—Н) вводят поправочный коэф-
фициент к рис. VIII. 8, б: Ф = (7^/370)". Значение п зависит от
Гкр и дано слева. Отсчитанная по рис. VIII. 8, б поправка АД*,
умноженная на Ткр> вычитается из значений энтальпии при низком
170
А§,кал/(г-'Ку
Рис. VIII. 8, б, в.
AL1M ИДИ
давлении (Я* —энтальпия 1 моль вещества при низком дав-
лении) .
Диаграммы S—Т и Н—Т широко применяют для определения
теплоемкости и энтальпии газов и, следовательно, их теплот ис-
парения при различных температурах и повышенных давлениях
(рис. VIII. 10).
Тепловые расчеты упрощаются при использовании различного
рода таблиц (например, Вукаловича для энтальпии пара), а также
энтропийных или энтальпийных (Н—Т), (Н—Р) диаграмм, где
на одной оси отложены значения S или Н, а на другой — Т или Р.
Рис. VIII. 9. Обобщенный изотермический график разниц (ДЯ) энтальпий при
1 атм (0,1 МПа) и повышенном давлении (по изотерме).
В подобных случаях исключается вычисление значений теплоем-
кости соединений.
На диаграмме нанесенные кривые Р пересекают линии Н. Ино-
гда наносят также линии плотности, удельного объема и другие.
Для определения значения энтальпии находим точку пересечения
линии заданных Т и Р: Затем устанавливаем, какая линия Н про-
ходит через эту точку пересечения линий заданных Р и Т. Значе-
ние Н фиксирует искомое значение энтальпии газа при данных
условиях.
Например (рис. VIII.6), определение количества теплоты Q
для нагревания 1 кг воздуха от 276 до 330 К при 10 атм (1 МПа)
сводится к вычитанию известной энтальпии воздуха Ht при 330 К
и 10 атм из энтальпии Н2 при 276 К:
Q = 1 (Нг — Hi) =130—115 = 15 ккал/кг = 63 кДж/кг
173
8,ккал/(кг-К)
174
Для газовых смесей энтальпия определяется по принципу ад-
дитивности путем суммирования энтальпий компонентов
= ••• +^А)
где у, — содержание i-ro газа в смеси, % (об.); Н{ — энтальпия
i-ro газа по диаграмме на 1 кмоль или на 1 кг [тогда у % (масс.)].
Работа (как и теплота) —внешний эффект взаимодействия си-
стемы со средой, и на основе свойств системы, например газовой,
можно вычислить работу (теплоту) для идеального обратимого
процесса. Для реальных процессов вносятся поправки с учетом
необратимых эффектов.
Максимальную работу Лтах газ совершает тогда, когда в про-
цессе внешнее давление на ничтожно малую величину меньше
давления газа, т. е. когда процесс обратим.
Рассмотрим в общем виде че-
тыре вида процессов для идеаль-
ных газов — изобарный, изотер-
мический, адиабатный и изохор-
ный. Работа изобарного (Р =
— const) расширения газа (на-
пример, при инжекции) равна
произведению давления на увели-
чение объема: Ай» =-Р(У2—Vi);
учитывая равенство PV=RT, мо-
жно написать Апах = R(T2 — Л).
На рис. VIII. И работа представ-
лена площадью прямоугольника
V1EFV2. Уравнение изобары:
VlT2 = V2T1
Рис. VIII. И. Работа расширения
идеального газа.
Для изотермического процесса (Т — const) работа для 1 моль
газа: -Дтах 2,3RT\g (V2/Vi), зная, что при Т = const (Р1/Ря) =
= V2/Vi, можно написать:
Лтах = 2.3RT lg (PJP2) или 4тах = 2,ЗЯГ lg(f,/f2)
Для сжатия газа знак (—), для расширения (-[-).
Для изохорного процесса (V = const) А = 0.
При изотермическом сжатии идеального газа от него нужно
отнять то количество теплоты, которое эквивалентно затраченной
работе. На рис. VIII. 11 работа представлена площадью ViEF'V2,
а изотермический процесс — кривой CD. Уравнение изотермы:
PiVj = p2v2
При изохорном процессе работа А = 0; уравнение изохоры:
PiT2~P2Tt
Адиабатное расширение газа происходит при одновременном
изменении давления и температуры. Газ не получает теплоты из-
вне, поэтому работа расширения производится за счет внутренней
175
энергии, а это сопряжено с охлаждением. При адиабатном сжатии
вся работа превращается в энергию сжатого газа, т. е. повышается
его температура. Понижение температуры при адиабатном рас-
ширении связывается с произведенной газом работой:
^max = Cv (71 72)
Графически адиабатный процесс изображается кривой GH, ра-
бота— площадью Г1£Г"Г2. Уравнение адиабаты при Q = const:
k^Cp/Cv или k~Cp[(Cp-R)
Рис. VIII. 12 иллюстрирует повышение температуры при обра-
тимом адиабатном сжатии газа (или понижение — при расшире-
нии).
Для газовой смеси Ср вычисляют по правилу аддитивности.
Для данной массы сжимаемого газа работа зависит от отноше-
ний давлений, а не от их абсолютных значений. Тогда зависимость
изменения температуры выра-
жается:
Рис. VIII. 12. Температура адиабат-
ного сжатия.
Начальная температура 20 °C; Р1/Р2 —сте-
пень сжатия; k—CpICv-
fe-1
Г2/Г1=(Р2/Р1) k
Значение k = CPI(CP — R)
при обычных температурах для
одноатомных газов ~ 1,67, двух-
атомных ~ 1,4, трех-, 'четырех- и
пятиатомных ~1,3. В общем,
значение k уменьшается с темпе-
ратурой и увеличивается с дав-
лением, а при адиабатном про-
цессе постоянно.
Работа А при обратимом ади-
абатном сжатии или расширении
1 моль идеального газа при на-
чальном давлении Рг:
v,-v, (-£)*
Для реальных газов работу адиабатного процесса (или конеч-
ную температуру) определяют по S—Т-диаграмме, на которой про-
водят вертикаль от начального давления Pi до конечного Р2, т. е.
А = — ДЯ-f-PI/. Эти величины устанавливают по диаграмме. Зна-
чение V определяют по нанесенным изохорам, при их отсутствии —
по таблицам.
176
Рассмотрим диаграмму V—Р (рис. VIII. 13), характеризующую
происходящее при непрерывном сжатии (расширении) в идеальном
одноступенчатом компрессоре. При адиабатном сжатии темпера-
тура повышается и ход этого сжа-
тия изображается кривой BE; ади-
абатная работа А при этом несколь-
ко больше, чем изотермическая
(разность выражается площадью
ВЕС).
Работа адиабатного цикла для
идеального газа:
Рис. VIII. 13. Изменение Р и V
в идеальном одноступенчатом
компрессоре.
^ = -^(^^-^2):
Лц = -г^тУ/?(Т1-Г2)
ступени, а общий
Рис. VIII. 14. Трехступенчатое сжатие
двуокиси углерода (по S — Т-диа-
грамме).
Здесь N — число молей газа; Vt— объем забираемого газа за
цикл в одной
объем газа, засасываемого в ми-
нуту, Vino (п0 — число циклов в
минуту). Для двух ступеней зна-
чение А удваивается.
Для определения работы А
адиабатного цикла по энтропий-
ной диаграмме данного газа сни-
мают значения Н на концах изо-
энтропы — линии постоянной эн-
тропии, которая связывает две
точки, соответствующие началь-
ному и конечному давлениям Pi
и Р2-
Изотермическая работа цикла
1 моль реального газа А =
= (H2-Hi)-T(S2-Si). Эти
значения определяют по S—Т-
диаграмме. Последние приме-
няют и для вычисления работы А
в цикле, многоступенчатых ком-
прессоров (рис. VIII. 14): изоэн-
тропа 1—2 характеризует обрати-
мое адиабатное сжатие от на-
чальных Pi, Г] до конечных Рг, Рг!
по изобаре 2—3 происходит про-
а по изотропе 3—4 сжатие на
межуточное охлаждение до Т\,
II ступени (п = 2) и т. д.
Работа А для 1 кг или 1 моль газа на каждой из п ступеней
определяется разностью энтальпии И на концах соответствующих
изоэнтроп диаграммы.
177
По диаграмме рис. VIII. 15 можно определить работу А цикла
адиабатного сжатия любого газа при любых значениях k = CP!CV
(от 1,67 до 1) в расчете для одной температуры засасываемого
газа в одноступенчатом компрессоре. Для определения идеальной
работы в п ступенях надо вычислить отношение давлений на одну
га ___________________________
ступень по формуле а = ^/PAjP\ и результат затем умножить на п
(Рк — конечное давление).
Рис. VIII. 15. Работа сжатия идального газа в идеальном одноступенчатом
компрессоре.
Температура забора 20 °C; для любой другой температуры t в °C следует умножить на
(< + 293)/273. Рк— конечное давление.
Для тепловых расчетов в области растворов можно применить
также энтальпийные диаграммы рис. VIII. 16.
Энтальпия жидкости — это разность между значениями энталь-
пии 1 кг жидкости, находящейся в равновесии с паром при
определенном давлении, и значением энтальпии жидкости в со-
стоянии, условно принимаемом за нулевое (нулевое состояние для
технической энтальпии жидкости и насыщенного пара одина-
ково) .
Разность энтальпии сухого насыщенного пара и жидкости при
этой же температуре й давлении, как и для пара, будет искомой
теплотой испарения. Теплоту испарения вычисляют по одному из
методов, приведенных в гл. IX. Энтальпия жидкости равна разно-
сти энтальпии пара и,найденной теплоты испарения. Энтальпию
жидкости при давлениях выше критического можно установить,
178
7атм=0,О35М1Та
179
Рис. VIII. 17. Зависимость энтропии (а) и энтальпии (б) жидкости от Гпр и Рпр-
—коэффициент сжимаемости жидкости, определяемый по рис. V. 14 или из соотношений Р— (а (РкЛГ/ГКр) или р/р1=‘<а/<а1.
180
если плавно соединить нанесенные кривые для пара и кипящей
жидкости (см. штриховые линии иа рис. VIII. 16,5). Зависимости
энтальпии и энтропии жидкости от Твр и Рпр приведены на
рис. VIII. 17.
§ 3. ПРИМЕРЫ РАСЧЕТОВ
[7, 21, 31, 33, 61, 85J
Пример VIII. 1. Сколько теплоты необходимо для нагревания 30 кг СО2 от
300 до 373 К при 50 атм (5 МПа).
Решение. По энтропийной диаграмме СО2 (рис. VIII. 10) при заданных
условиях Hi — 59,6 (точка а) и Н2 = 80,7 ккал/кг (точка б). Тогда:
Q ~ 30 (80,7 — 59,6) = 63,3 ккал = 63,3 • 4,19 = 264 кДж
Пример VIII. 2. Вычислить количество теплоты, которое выделит 200 кг воз-
духа под давлением 80 атм (8 МПа), проходящие через холодильник, где воздух
охлаждается от Ti = 300 К до Т2 = 253 К.
Решение. По S — Т-диаграмме (рис. VIII. 6) для воздуха при заданных усло-
виях Ht — 118 (точка а) и Нг — 105 ккал/кг (точка &). Тогда:
. Q — 200 (118— 105) = 2 600 ккал = 109-102 кДж
Пример VIII. 3. Требуется охладить СО2 от 60 до —30 °C при помощи дрос-
селирования. Давление газа 80 атм (8 МПа). Определить конечное давление газа.
Решение. По рис. VIII. 10 энтальпия СО2 Н = 60,7 ккал/кг (точка Ь). Ли-
ния этой энтальпии пересекает линию заданной температуры —30 °C в точке с,
соответствующей Р = 10 атм, т. е. при 1 МПа температура газа достигнет почти
—30 °C.
Пример VIII. 4. Вычислить изменение энтропии при переходе 1 кг Н2О, взя-
той при 273 К, в состояние перегретого пара при Т = 473 К и 1 атм (0,1 МПа),
зная, что при 273 К теплота испарения воды 539,4 ккал/кг.
. Решение. Нагревание воды от 273 до 373 К [Ср = 1 ккал/(кг-К)Р AS( в
= I -2,31g (373/273) = 0,31 ккал/(кг-К).
Приращение энтропии при испарении воды при 373 К: AS2 = 539,4/373 =
= 1,45 ккал/(кг-К).
При перегреве пара от 373 до 473 К (см. рис. X. 4, стр. .218) теплоемкость
пара Ср = 8,45 ккал/(кмоль-К)= 0,47 ккал/(кг-К) и Д53=0,47-2,31g (473/373) ==
= 0,12 ккал/(кг-К).
Тогда
AS = 0,31 + 1,45 + 0,12 = 1,88 ккал/(кг-К) = 7,9 кДж/(дг • К)
Пример VIII. 5. Вычислить изменение энтропии для парообразования 1 моль
С2Н5С1 (М = 61,5) при Т = 286 К, зная теплоту парообразования 7-исп =
= 90 кал/г.
Решение. Парообразование — обратимый изотермический процесс, и к нему
применимо уравнение S2— Si = Q/Т. Тогда:
AS = Sr - 5Ж =ГИСП/ТКИП = (90-61Д)/286= 19,3 кал/(г-К) = 81 Дж/(г-К)
Пример VIII. 6. Вычислить изменение энтропии в процессе обратимого изо-
термического сжатия 1 моль СН« от Pi = 0,01 до Р2 = 0,1 МПа.
Решение. AS = R ln(Pt/P2) = 1,987-2,3 lg(0,01/0,1) = —4,575 кал/(моль-К) =
= —19,3 Дж/(моль-К).
Пример VIII. 7. В двух равных по объему сосудах содержится 28 г N*
(М = 14) и 32 г О2 (М = 16). Вычислить изменение энтропии при смешении
атих газов.
Решение. S=nR(\ti V(Vi + 1п V/V2)=8,314(ln 2+In 2) = 11,5 Дж/(моль-К) =
= 2,75 кал/(моль-К).
Пример VIII. 8. Вычислить изменение энтропии при переходе 100 кал теплоты
от тела с Т = 423 к телу с Т = 232 К. »
181
Решение. Изменение энтропии:
для теплоотдатчика — ASi = — 100/423 = — 0,236
для теплоприемника — AS2 = 100/323 = 0,31
Искомое изменение AS=0,31 +(—0,236) =0,074 кал/(кг-К) =0,31 Дж/(кг-К).
Пример VIII.9. Вычислить изменение энтальпии С5Н12 при сжатии 1 моль его
до 34 атм (3,4 МПа) при 511 К; зная Ткр = 33 атм (3,3 МПа).
Решение. Рпр = 34/33 = 1,03; Тпр = 511/471 = 1,1.
По рис. VIII. 8,6 &Н/Ткр = 2,8; следовательно, АЯ=2,8-471 = 1320 кал/моль.
Значение п — 0,26; поправка Ф = (471/370) °-2в = 1,1.
И окончательно: АЯ = 1,1-1320 = 1405 кал/моль = 5900 Дж/моль.
Пример VIII. 10. Вычислить изменение энтальпии при изотермическом сжа-
тии 1 кг (55,55 моль) водяного пара до 285 атм (28,5 МПа) при Т — 773 К,
зная Ткр = 647 К и Ркр — 218,5 атм (22 МПа).
Решение. Тпр = 773/647 = 1,2 и Рпр = 285/218,5 = 1,3.
По рис. VIII. 8, а:
ЬН/Ткр = 1,7, откуда
АЯ = 1,7 • 647 = 1100 кал/моль = 61 ккал/кг = 255 кДж/кг
Пример VIII. 11. Вычислить интегральный дроссельный эффект и изменение
энтропии при дросселировании насыщенного водяного пара от 15 до 2 атм (от
1,5 до 0,2 МПа) при 200 °C.
Решение. По рис. VIII. 2, 6 находим точку 1 исходного состояния.
Координаты этой точки: Я] = 667 ккал/кг и Si = 1,54 ккал/(кг-К).
Пересечение горизонтали через точку 1 с изобарой 2 атм дает точку 2 (ко-
нечное состояние); ей соответствует S2 = 1,75 ккал/(кг-К) иТи 160°С.
Следовательно, AS = 1,75—1,54 = 0,21 ккал/(кг-К), а понижение темпера-
туры при изменении давления от 15 до 2 атм составит: 200— 160 = 40°.
Пример VIII. 12. Вычислить понижение температуры при дросселировании
воздуха от Pt = 15 до Р2 = 0,1 МПа, если Ti = 273 К иС° = 26,19 ДжДмоль К);
Ркр = 3,65 МПа и Ткр = 132,3 К-
Решение. Рпр = 15/3,65 = 4,1; Тпр = 273/132,3 = 2,06.
Примем Т'р < Тпр = 2 и Т" > Тпр = 2,1.
По рис. VI. 2, а (стр. 102) значения коэффициента активности при Рпр = 4,1,
Т'пр = 2 и Т" =2,1 / = 0,93 и у" = 0,95.
Тогда по уравнению
. _ 7?Т2 In (Y'7y') 8,314 2732 In 2,31g (0,95/0,93)
AT = —5--------т,-----т— --------------------------------- o4,3 К
С?кр ’’пр-Т'пр 26,19-132,3(2,1 -2)
Пример VIII. 13. Вычислить дифференциальный дроссельный эффект для ме-
тана при Р = 50 атм и Т = 373 К, зная Рнр = 45,8 атм и Тир = 191 К, Ср =
= 9,8 кал/(моль-К).
Решение. По рис. VIII. 3 при Рпр = 5/4,5 = 1,09 и Тпр = 373/191 = 1,95.
Значение
РкрСрЦ 0,56 • 191
—=------= 0,56; откуда р = оя = 0,238 К/атм
1 Кр тг0,О * У,О
Пример VIII. 14. Вычислить энтальпию 1 кг водяного пара при 180°С и
7 атм.
Решение. По рис. VII. 1,6 находим температуру насыщения при 5 320 мм рт. ст.
(7 атм); она равна 164°C, т. е. пар перегрет на 16°C.
Энтальпия пара равна сумме теплот, расходуемых:
на нагревание 1 кг Н2О от 0 до 164 °C;
на испарение воды и нагревание образовавшегося пара до 180 °C.
Средняя теплоемкость воды от 0 до 164 °C равна 1,01, а пара между 164 и
180 °C при 7 атм —9,2 ккал/(кг-К).
Теплота испарения воды при 164 °C —494 ккал/кг.
182
Теплота жидкости при 164 °C — Qi =(164 — 0) -1,01 = 165 ккал/кг.
Теплота перегрева — Q2 = (180 — 164) (9,2/18) = 8,3 ккал/кг.
Откуда искомая энтальпия равна 165 + 494 + 8,3 =’667,3 ккал/кг =
= 2 800 кДж/кг.
Пример VIII. 15. Вычислить изменение энтальпии для 1 кг СО2 (М = 44)
при нагревании от 293 до 363 К и сжатия от 1 до 20 атм, зная (Ср)ср =
= 9,3 ккал/(кмоль-К), Ркр — 73 атм и Гнр = 304 К.
Решение. Рпр = 20/73 = 0,27 и Гпр = 363/304 = 1,2.
По рис. VIII. 9. \HfT = 0,45; что в пересчете на 1 кг дает АД =
363-1000
= 0,45-----—----= 3,7 ккал/кг.
44
70
Возрастание энтальпии при нагревании при 1 атм от 293 до 363 К: 9,3 — =
= 14,7 ккал/кг.
Искомое увеличение энтальпии при нагревании и сжатии 14,7 — 3,7 =
= 1,1 ккал/кг = 46 кДж/кг.
Пример VIII. 16. Вычислить энтальпию сухого насыщенного пара бензола
(М = 78) при 27 атм относительно энтальпии жидкого бензола, принятого при
293 К и 1 атм за нулевой (стандартный) уровень.
Известно: Ркр = 47,9 атм; Ткр = 562 К-
Решение. Определим энтальпию пара при 1 атм и 513 К. При 27 атм Ткип =
= 513 К, а при 1 атм — 353 К (см. рис. VII. 4, б); находим Тпр = 353/562 = 0,63.
По рис. X. 7, б(Ср)ср = 0,4 ккал/(кг-К)—для жидкого бензола при 1 атм в
интервале 293—353 К (А=9,8); энтальпия жидкости при 353 К равна 25,2 ккал/кг.
Для пара в интервале давлений и температур 1 атм (353 К)—27 атм (513 К)
по рис. X. 7, б (Ср)ср — 0,37 ккал/(кг-К); энтальпия пара 58,5 ккал/кг.
Теплота испарения при 353 К равна (а£Исп. кипП/Ткип =92 ккал/кг (а — по
рис. IX. 1).
Следовательно, энтальпия пара при 513 К и 1 атм: 25,2 4-92 4-58,5 =
..., ккал/кг
В нашем случае ТПР = 513/561 = 0,92 и Рпр — 27/47,9 = 0,56.
Тогда ЬН/Т = 2,7 (см. рис. VIII. 9); в пересчете на 1 кг при 513 К АД =
= 17,7 ккал/кг.
Искомая энтальпия пара при 513 К и 27 атм: 176— 17,7 = 158,3 ккал/кг =
= 645 кДж/кг.
Для нахождения энтальпии жидкости нужно вычесть из энтальпии пара
теплоту Испарения 48 ккал/кг при 513 К: 158,3 — 48 = 110,3 ккал/кг=455 кДж/кг
(см. пример IX. 11 и рис. IX. 1).
Пример VIII. 17. 5 кг воздуха при Р = 1 атм (0,1 МПа) и 290 К охлаж-
дается до температуры конденсации. Определить количество требуемой для этой
цели теплоты, а также холода, необходимого для сжижения 5 кг воздуха.
Решение. По рис. VIII. 6 энтальпия воздуха при 290 К Д = 120 ккал/кг.
Точка пересечения линии давления (Р = 1 атм) и линии конденсации па-
ров определит температуру конденсации Г = 82 К и Д = 68,4 ккал/кг =
= 287-103 Дж/кг.
Тогда искомое количество отнимаемой теплоты для конденсации 1 кг воз-
духа: Q = 120—68,4 = 51,6 ккал/кг = 216-103 Дж/кг, а для 5 кг воздуха:
Q = 258 ккал = 1080 кДж.
Для определения требуемого количества холода на 1 кг сжиженного воздуха
находим точку пересечения линии давления (Р = 1 атм) с линией конденсации.
Эта точка пересечения определит энтальпию 1 кг жидкого воздуха Д=22 ккал/кг.
Тогда искомое количество холода Q = 120 — 22 = 98 ккал/кг, а для 5 кг воздуха
Q = 490 ккал = 2060 кДж.
Пример VIII. 18. 20 кг СО2 под давлением 20 атм (2 МПа) и 295 К проходит
через холодильник, в котором у него отнимается 800 ккал тепла. Определить,
какая часть СО2 при этом конденсировалась.
Решение. По энтропийной диаграмме СО2 (рис. VIII. 10) энтальпия СО2 при
22 °C и Р = 20 атм до холодильника Д = 69,2 ккал/кг (точка d).
От 1 кг СОг в холодильнике отнимается 800/20 = 40 ккал/кг.
Тогда эитальция 1 кг СОг после холодильника Д = 69,2 — 40 = 29,2 ккал/кг.
183
Находим на диаграмме точку пересечения линии давления (Р = 20 атм) с
энтальпией Н — 29,2 ккал (точка е). Эта точка фиксирует температуру СО2 после
холодильника t = —20,5 °C, причем газ перешел линию конденсации паров, т. е.
часть СО2 конденсировалась. Точка е находится между линиями х = 0,5 и х =
= 0,6: хе = 0,57. Итак, массовая доля газа в паровой фазе 0,57, а в жидкой 0,43,
т. е. 0,43-20 = 8,6 кг — масса сжиженного газа.
Пример VIII. 19. 1400 м3 воздуха при 200 атм и 151 К охлаждаются в тепло-
обменнике, при этом отнимаются 12 300 ккал теплоты. Определить температуру
воздуха на выходе из теплообменника.
Решение. По рис. VIII. 6 при заданных условиях энтальпия воздуха Н =
= 56,4 ккал/кг.
Количество воздуха, проходящего через холодильник:
га = 4,^-= 62,5 кг/моль; 62,5-29= 1810 кг (А4ср = 29);
1400-1,293 = 1810 кг (р = 1,293 кг/м3)
Количество отдаваемого тепла в теплообменнике на 1 кг воздуха:
Q = 12300/1810 = 6,7 ккал/кг
Тогда энтальпия 1 кг воздуха после теплообменника: Н = 56,4 — 6,7 =
= 49,7 ккал/кг, что по диаграмме соответствует температуре Т =136 К, т. е.
воздух в теплообменнике охладится от 151 до 136 К.
Пример VIII. 20. 1000 м3 газа при 30 атм охлаждается в теплообменнике от
283 до 353 К- Состав газа, % (об.):
20 N2 (Л4 = 28); 60 Н2 (М = 2); 16 СН4 (М = 16) и 4 С2Н4 (М = 28)
Определить количество жидкого воздуха, необходимого для охлаждения
1000 м3 газа, зная, что воздух, выходящий из теплообменника, имеет температуру
288 К и давление 1 атм.
Решение. Газ содержит:
в
в
м3 - 600 Н2; 280 N2; 160 СН4 и 40 С2Н4
кмоль - 200/22,4 = 8,9 N2; 600/22,4 = 26,8 Н2; 160/22,4 = 7,1 СН«
и 40/22,4 = 1,8 С2Н4; У = 44,6 кмоль
кг - 8,0 • 28 = 250 N2; 26,8 • 2 = 53,6 Н2; 7,1 • 16 = 114,3 СН4 и
468 кг
в
1,8-28 = 50 С2Н4; £ =
Находим энтальпию каждого из газов при Р = 30 атм и 283 и 353 К-
283 К; Я, ккал/кмоль 353 К; Я, ккал/кмоль
n2 2580 2050
Н2 835 605
сн4 201 160
С2н4 57 -51
охлаждения
1000 м3 газа от 283 до 353 К (в ккал
Н2 ... 53,6 (835-605) = 12 335;
С2Н4\.. 50 [57—(—51)] =5410
Количество холода для
или фригориях):
N2 ... 8,9 (2 580-2 050) = 4 730;
СН?... 114,3 (201-160) = 4690;
У = 27 165 ккал (фригорий)
Определим количество жидкого воздуха для охлаждения газа. По рис. VIII. 6
энтальпия жидкого воздуха при 30 атм Я = 47 ккал/кг, а при 288 К и 1 атм
(при выходе из теплообменника) Н = 112 ккал/кп Количество холода от 1 кг
жидкого воздуха Q — 112 — 47 = 65 ккал. Следовательно, потребуется воздуха
27 165/65 = 418 кг или 418/29-22,4 =.323 м3 (при нормальных условиях).
184
Пример VIII. 21. Вычислить разность энтальпии для 1 кг пара (М = 18)
при 100 атм и 673 К и при 1 атм, зная ТИр = 647,3 К и Ркр = 218,2 атм.
Решение. Тар = 673/647,3 = 1,03; Рпр = 100/218,2 = 0,457.
По рис. VIII. 9 АН/Т = 1,2. Откуда
ди =Л2.-.6.^-1000 44,8 ккал/кг = 187 кДж/кг
1о
Пример VIII. 22. Вычислить работу (теоретическую) изотермического сжатия
1 кмоль СО2 при 293 К и 1 атм (0,1 МПа) до давления 35 атм (3,5 МПа).
Решение. По формуле А = 2,3 RT lg(P2/Pi) =—2,3-8,314-103-293 lg(35/l) =
= —8650 • 103 Дж = —8650 кДж.
Пример VIII. 23. Водород сжимается последовательно в четырех ступенях от
0,11 до 20 МПа. Вычислить давление между ступенями компрессора.
V20
д-р = 3,76. Тогда искомые промежуточные
давления равны:
I ступень — 3,76-0,1 =0,376 МПа; II ступень — 3,762 • 0,1 = 1,41 МПа;
III ступень - З,763 • 0,1 = 5,32 МПа
Г лава IX
ТЕПЛОТЫ ИСПАРЕНИЯ(ПАРООБРАЗОВАНИЯ
И ВОЗГОНКИ.
ТЕМПЕРАТУРЫ И ТЕПЛОТЫ ПЛАВЛЕНИЯ
[6, 7, 31, 33, 40, 46, 71, 85]
Парообразование — непрерывный процесс перехода вещества из
жидкого состояния в газообразное, а кипение — парообразование
при температуре, когда давление насыщенного пара равно внеш-
нему давлению. Переходы из одной модификации твердого состоя-
ния в другую называют полиморфными превращениями. Послед-
ние характеризуются тем, что каждому давлению соответствует
температура (точка перехода), в которой обе фазы равновесны.
Каждому из указанных процессов соответствует температура,
называемая температурой кипения, плавления и т. д.; температуры
эти зависят от давления.
Теплота, которую поглощает жидкость, равновесная с паром,
при изотермическом испарении есть теплота испарения (парообра-
зования). Теплота сжижения равна теплоте испарения (но с про-
тивоположным знаком).
В общем плане теплота фазового превращения (испарения,
плавления, возгонки) —это теплота, поглощаемая или выделяемая
в изотермическом процессе фазового превращения.
Из двух модификаций (состояний) соединения устойчивее при
более высокой температуре (при равном давлении) будет та, пе-
реход в которую сопровождается поглощением теплоты. Плавле-
ние и испарение связано с поглощением теплоты, и поэтому жид-
кое состояние соединения устойчивее, чем твердое, при более вы-
соких температурах, а газообразное — устойчивее, чем жидкое, при
более высоких температурах.
Известное уравнение Клаузиуса — Клапейрона выражает усло-
вие равновесного сосуществования двух фаз в однокомпонентных
системах, например кипящая жидкость и §е насыщенный пар, смесь
двух изоморфных модификаций, плавящееся кристаллическое ве-
щество (при сублимации) и отвердевающая жидкость (или равно-
весный пар). Для испарения и сублимации это уравнение связы-
186
вает изменение давления насыщенного пара с температурой, изме-
нение объема и тепловой эффект, а для плавления и фазового
превращения — изменение температуры перехода с давлением, из-
менение объема и тепловой эффект.
Общая зависимость температуры перехода вещества из одной
фазы в другую и значение теплоты фазового перехода по уравне-
нию Клаузиуса— Клапейрона: _
dP L - 41’31L
dT ’ dT T\V \V
где L — теплота фазового перехода (испарения, плавления, суб-
лимации, полиморфного превращения и т. д.); ДУ = V2 — У/— из-
менение объема в процессе; 41,31—коэффициент перехода от
см3-атм к калориям (1 кал = 41,31 см3-атм). Если L выражена
в кал/моль, то У1 и У2— мольные объемы пара и жидкости, если L
выражена в кал/г, то 1Л и V2 — удельные объемы (обратные плот-
ностям). Производная dPIdT связывает изменение температуры и
давления при сохранении равновесия двух фаз.
Так, для кипения воды при 1 атм и 373 К Еисп = 538,1 кал/г;
объемы пара и жидкости Уп = 1651 и Vm = 1 см3/г. Увеличение
Температуры кипения при увеличении давления составит
dT/dP = [373 (1651 - 1 )]/(41,31 • 538,1) == 27 К/атм
§ 1. ВЫЧИСЛЕНИЕ ТЕП ЛОТ ИСПАРЕНИЯ ЖИДКОСТЕЙ
Мольная теплота испарения (энтальпия испарения) — это теп-
лота, поглощенная при изотермическом и изобарическом процессе
перехода 1 моль жидкости в состояние насыщенного пара, или
разность энтальпий насыщенного пара и жидкости.
Если пар следует законам идеального газа, то внешняя ра-
бота испарения равна RTKan.
Для определения теплоты испарения при нормальной темпера-
туре кипения, а также и при любой вплоть до критической, пред-
ложены различные зависимости и методы, например зависимости
от приведенных параметров на основе соответственных состояний.
Зависимости для расчета теплоты (мольной) испарения и дав-
ления насыщенного пара по уравнению Клаузиуса — Клапейрона;
£исп в т (Уп — Уж) или упрощенно 1ИСП = TVn
, о'по 4 In Р (лг RT ' d lg Р Лисп ________ Рисп
Ьисп — R1 dT V р /’ dT 2,3-1,987Г2 4,575Г2
Здесь Уп и У®— объемы 1 моль пара и жидкости, см3/моль.
Разделив переменные, получим:
d In Р = -^2- dT
187
поправки
Рис. IX. 1. Температурные
к теплоте испарения.
Для расчета давления насыщенного пара:
п .... Диеп , |„ П . i-ИСП , />. Диеп _ ДЗкип
1Пр___-+С, IgP-^^+C, -----
(ДЗкип — изменение энтропии при испарении при Лиш).
Зная теплоту испарения и давление пара при одной темпера-
туре, можно вычислить С и тогда определить давление при других
температурах или рассчитать тем-
пературы кипения при различных
давлениях. В пределах от Ti до
Т2 и от Pi до Р2:
. Pi __ Р«СП ( I _ I А
1П Р1" Мт> т2)
Графики давлений линейны
тогда, когда рассматривают за»
висимость от обратной темпера-
туры (1/7').
По правилу Трутона мольная
теплота испарения при нормаль-
ной температуре кипения различ-
ных жидкостей прямо пропорцио-
нальна их температуре кипения;
отношение этой мольной теплоты
испарения к температуре кипения
есть величина постоянная:
Диеп. кип/Д кип 21,3 калДмоль • К) = 89,12 ДжДмоль • К)
Более точное выражение (для тех же жидкостей) дает Кистя-
ковский:
Диеп. кип/Дкип = 8,75 + 4,575 1g Ткип калДмоль • К) или
36,61 + 19,14 1g Ткип ДжДмоль- К)
Уравнение Ватсона для теплоты испарения полярных и
лярных жидкостей при любой температуре, если известны
Диеп, кип при какой-либо температуре Т:
Т
Диеп = аДисп. КИП "г
1 кип
Значение а приведено на рис. IX. 1.
Известна зависимость по Джиаколоне:
г по. Т- ^КР
^ИСП. КИП = RTкип^кп т т
1 кр 1 кип
Рис. IX. 2 позволяет графически с использованием указанной
зависимости определить значение энтропии испарения Диеп. кип/Лиш
при температуре кипения, если известны Ркр и 0=ТПр. кип= Гкип/^кр.
Значение 0 = 0,64 присуще многим органическим соединениям;
тогда:
Диеп. кип/Дкип » 21,3 калДмоль • К) = 89,12 ДжДмоль • К)
неполярных жидкостей
непо-
Ткр и
(IX. 1)
(IX. 2)
188
5
34
32-
30-
12-1
Рис. IX. 2 Различные варианты определения энтропии
испарения при температуре кипения.
189
По диаграмме рис. IX. 2, б вычисленную 0 соединяют прямой
с Ркр; точка пересечения продолжения этой прямой с осью
£исп. кип/^кип дает искомое значение энтропии испарения. Напри-
мер, штриховая прямая проведена для расчета энтропии испарения
бутена (Ткни — 267 К; Ткр = 420 К и Ркр — 39,7 атм):
0 = 7КЙП/ТКр = 267/420 = 0,64; откуда LHcn. кип/7кип — 20,1 калДмоль* К)
и /,Исп. кип = 20,1 • 267 = 5470 кал/моль
Помимо приведенных укажем еще зависимости:
0,95/гТ^п Гкр — 43
по Ватсону 7.нсп кип — — = — тй-
J кр 1 кип * кип
^-исп. кип 5 1g Ркр 2,17
по Риделю и Цедербергу-----=----— ---=----- (IX. 3)
1 кип и,Уои 1 пр. кип
Для расчета по Мейсснеру (рис. IX .3) необходимы критиче-
ские параметры и температуры кипения при каком-либо давлении.
Зная структуру соединения и температуру кипения, можно ис-
пользовать зависимость Риделя — Шервуда
/?Гкип1п[А4/(^АР + 0,34)2]
^исп. кип---------j _0 (1Л. 4)
где 0 и ДР — функции, определяемые аддитивно (см. вывод на
стр. 62 и табл. V. 1).
Мольная теплота испарения жидкости при температуре кипе-
ния может быть также вычислена по принципу аддитивности сум-
190
мированием составляющих для определения так называемого лио-
парахора X:
г Л / м Ч11,25
7-исп. кип— (фж. кип—g2 Qgy---J J М кал/моль (IX. 5)
(Рж. кип — ПЛОТНОСТЬ ЖИДКОСТИ При Ткип).
Приводим значения лиопарахора (ккал):
Водород 0,845 Связи
Углерод -1,120 двойная 1,670
Азот -0,112 тройная 3,344
Кислород в бензоле 5,789
в кетонах -2,206 в циклогексане 1,166
в эфирах 0,178 Циклогексан 2,860
в карбоксильной 0,66 Ответвление углево- -1,327
группе в ангидридах 1,331 дородной цепи
Хлор 0,874
Бром 0,217
Иод -0,0172
Кроме того:
7-ИСП. КИП = ТКИП (9,5 1g 7"кип 0,007Г кип)
7-исп. кип/ЛТ'кип — 1п 87,077 КИП
Приводим зависимости (по Кистяковскому) для неполярных
жидкостей (эмпирические, для большого интервала температур):
7-исп. кип ~ 1,987ТКИП In 82,07Гкип кал/моль
Лисп. кип “ 8,75Ткип + 4,575ГКИП 1g Ткип кал/моль
Изменение ДЛшп в зависимости от ДР при испарении описы-
вается соотношением:
' ЛТ — ГкипЛР(Уп—Иж)
КИП----------Г---------
^исп. кип
Из уравнения кривой давления насыщенного пара над чистой
жидкостью или твердым телом
1g (T’i/TM = (Lncn/4,575) (1/г2 - 1/Т.)
следует: /
, . 4,575Т,Т2
Ьисп =* ' --Т Т ЦА.
(Pi и ?2-“ давления насыщенных паров при Ti и Т2).
Для зависимости (IX. 6) составлена номограмма (рис. IX. 4).
Приводим уравнение, отражающее влияние температуры на
состав паровой фазы двойной системы:
In ”А/В — ^исп- А ~ ^исп. в / 1 1 \ .
„1 р I т Т I
геА/В \ I ] 7 2 /
Здесь Пд/В и — отношение числа молей компонентов А и В
в паровой фазе при Т\ и Т2; L„cn. а и LHcn. в — мольные теплоты
испарения тех же компонентов.
191
100 90 80 10 60 50 40 30 20 10 5 1
Р, мм рт. ст.
Рис. IX. 4. Номограмма для определения мольной теплоты испарения жидкости.
192
Зависимость теплоты испарения от приведенных параметров
по принципу соответственных состояний:
• п . RT In Рпр
по Джиаколоне — ьисп = —-----у—
* пр 1
£иеп Т' пп
по Чу и Чену - —— = - 28,05 1g Рпр --- - &
1 кр U 1 пр)
по Питцеру и Чену —
1Исп = Т (ЗЗДТпр - 32,74 - 29,77 1g Рпр)/(1,07 - Тпр) (IX. 8)
по Питцеру (использован фактор ацентричности <о) —
£ИСЛ/Г = ДЗ“ + ®Д5' (IX. 9)
Значения ДЗР и Д50 — функций от Т^р — см. в табл. IX. 1.
Таблица IX. 1
Значения AS° и As' при различных приведенных температурах
Гпр для расчета теплоты парообразования по методу Питцера
т пр Д3°о, Дж/(моль«К) Дз', Дж/(моль-К) т пр Д3°о. Дж/(моль-К) д<. Дж/(мольЖ)
1 0 0 0,80 41,74 54,43
0,99 10,76 11,85 0,78 44,25 58,20
0,98 14,15 16,37 0,76 46,89 62,38
0,97 16,75 19,76 0,74 49,57 66,99
0,96 - 18,92 22,57 0,72 52,29 71,18
0,95 20,93 24,95 0,70 55,22 75,78
0,94 22,78 27,26 0,68 58,15 80,81
0,92 26,08 31,57 0,66 61,21 85,83
0,90 29,10 35,71 0,64 64,31 91,27
0,88 31,74 39,31 0,62 67,49 97,13
0,86 34,29 43,12 0,60 70,84 103,0
0,84 36,80 46,89 0,58 74,27 109,7
0,82 39,23 50,66 0,56 78,04 116,4
Методы:
Нарсимхана —
1исп = 1,987Ткр 1g Ркр (1 “ Гпр)^/( 1,963 - 2,46ТПр. кип) (IX. 10)
Ватсона -- Ъисп =з Аисп, кип 1(1 пр)/( 1 Гпр. кип)1^’^ (IX. 11)
Теплота испарения жидкости уменьшается по мере увеличе-
ния Т и приближается к нулю в критической точке (рис. IX. 5).
Предполагается, что с увеличением РОбщ значение Laca умень-
шается.
Теплоты испарения родственных соединений изменяются зако-
номерно (рис. IX.6). Это позволяет найти зависимость теплоты
испарения от температуры для члена данного гомологического
ряда, используя, например, принцип соответственных состояний и
подобия свойств.
7 М. M. Викторов
193
Так, по Карапетьянцу Гисп. i/^исп. 2 — К = const; здесь ГИСп. i
"и ^исп. 2 теплоты испарения соединений 1 и 2 при температурах,
Равноудаленных от соответствующих критических температур, т. е.
•к». 1 — Т] — Ткр. 2 — Тг.
Для вычисления постоянной К надо знать LHCn. i какого-либо
эталона 1 (обычно воды) для некоторых температур, значения
Ткр. 1 и Ткр.2 и одно значение £иСп.2 соединения 2. Тогда можно
вычислить любое значение по зависимости Лисп. 2 = Лисп, i для
К
Рис. IX. 5. Зависимость теплоты испарения жидкости от температуры.
7"тр. т'-темпеРатУРа тройной точки; Ги т. к—температура нормальной точки кипения.
тех температур, для которых известны ЬИсп. ь Ниже (и на
рис. IX. 6, а) приведены К. для некоторых веществ (Кн2о — 1):
С12 0,272 GH3QH 1.01
со2 0,560 СН3СОСН3 0,856
NH3 0,678 С2Н5ОС2Н5 0,772
SO2 0,730 С2Н6С1 Q,725
сн4 0,354 СНзСООН 0,679
CeHs 0,827 СвН5С1 0,917
Зависимость по методу сравнения свойств данного соединения
(2) со свойствами стандартного (1):
^-ИСП. 1 Ткр. I lg Рп 1
^-ИСП. 2 ‘ кр. 2 1g Рп. 2
Для вычисления значения теплоты испарения в зависимости от
Температуры применяют разные зависимости (рис. IX. 7). Напри-
мер, по Ватсону эта зависимость имеет вид
Рисп. 1 /1 — Т пр. 1 \0,38
Тисп. 2 I 1 - Гпр. 2 ) (1Х-12)
где Гпр 1 = Т]/Ткр; —
194
Рис. IX. 6. Диаграммы для определения теплот испарения членов некоторых гомологических рядов (а) и углеводоро-
дов (б, в}; Be'— плотность в градусах Боме (см. стр. 139).
196
в
Т емпература ° С
Ж 273 313 353 393 433 473 513 553 573 633 673
К
Рис. IX. 6. б, в
Указанное соотношение применимо для вычисления, например,
Аисп. 2 при любой Тг, если известна Лисп, i при Т\ (рис. IX. 8).
Применима также зависимость для определения Лисп жидко-
сти при заданной температуре, если известны Твил и критические
параметры соединения (по Риду и Шервуду):
И __\0,38
LKcn = RTTKaa tn РКр — V—р
V ~ i кип, пр)
196
Зависимость теплоты парообразования (испарения) от темпе'
ратуры (поТейзену):
7-ИСП = k (7"кр Т)
(k и п — постоянные; п « 0,38).
Существует несколько правил для определения
испарения. Так, по Гильдебранту энтропии испарения
равны между собой при
температурах, при которых ^пр.?
мольные объемы насыщен- удар-
ного пара одинаковы; -|
при этом .Д5Исп=20— - -=4>0
22 кал/(моль-К) при Уг = _
•=з 49,5 л/моль. ' i 3’°
-11,0
£цсп.1
Ьисп.2
энтропии
жидкостей
Тпр.1
-^0,40
-1 0,50
= 0,60
-I 0,70
4 0,80
4 0,90
— 0,95
40,98
Рис. IX. 7. Зависимость теплоты испа- Рис. IX. 8. Номограмма Для определения
рения воды от температуры. изменений теплоты испарения жидкости
Кроме того
AS = 8,0 + R In Ткт
»кип кип
AS
—"n -= AS = k„ (8,75 + R In Г)
1 кип °кип Кип'
где kp — корректирующий коэффициент по справочнику.
Для замещенных ароматических соединений:
kp = 1 4- (2(1/100) (ji — дипольный момент в D)
' Теплота испарения смесей жидкостей зависит от состава смеси
и изменяется в процессе испарения (кроме азеотропных смесей).
По принципу аддитивности упрощенное уравнение для смесей:
L = £исп. 1 + ^-исп. гУг + • • • + ^исп. пУп
197
(Lисп. n s теплота испарения и-ного компонентаj его доля в
газовой фазе).
।---------1----------1_________и_________I_________I__________I
263 273 283 2S3 303 313 323
К
Рис. IX. 9. Мольное влагосодержание газов.
Более подробно о методах расчета теплот испарения см. в ра-
боте А. К. Пучкова *.
* Пучков А. К. Автореф. докт. дисс., Л., ЛТИ, 1975.
198
Влагосодержание газа—это масса водяного пара в единице
массы газа в смеси, кг/кг, моль/моль. Для водяного пара относи-
тельное насыщение есть относительная влажность. Точка росы
смеси достигается тогда, когда давление насыщения при пониже-
нии температуры становится равным парциальному давлению пара
в смеси, т. е. смесь делается насыщенной по пару; при этом тем-
пература смеси равна температуре точки росы.
L-----J---------------1------1-----_1______1_______t t I [ l '
213 283 293 303 323 333 343 353 353 373 383 393
К
Рис. IX. 10. Карта влажности по Хатту.
Равновесная температуры (температуры влажного термометра)
испаряющейся жидкости устанавливается такой, при которой ко-
личество теплоты, передаваемой от газа к жидкости, равно коли-
честву теплоты, затрачиваемому на испарение. Она всегда ниже,
чем температура газа, в среду которого происходит испарение
(«температура сухого термометра»).
На рис. IX. 9 и IX. 10 даны диаграммы влажности (по Хатту)
для расчетов сушилок, испарителей, конденсаторов при 1 атм.
На этих диаграммах кривая насыщения А описывает зависимость
между мольным влагосодержанием и температурой для газа, на-
сыщенного влажным паром, а кривые А'— ту же зависимость,
но для ненасыщенных смесей. Кривые В — линии постоянной тем-
пературы влажного термометра (для двухатомных газов) или
199
линии адиабатического охлаждений; х — мольная доля трехатом-
ного газа (СОг) в сухой смеси. Линия, проведенная параллельно
оси абсцисс, дает изменение состояния при постоянном влагосодер-
жании, что дает возможность определить точку росы воздуха, зная
температуру и влагосодержание.
Энтальпию испарения газов и сжиженных газов можно опре-
делить по S—Т- или Н—Т-диаграммам на основе разности зна-
чений энтальпий пара и Жидкости при температуре кипения.
Для этого на энтропийной диаграмме по заданному давлению
и, следовательно, температуре кипения определяют вначале зна-
чения энтальпии соединения на пограничной кривой жидкости и
пара. Затем находят разность значений энтальпий пара и жидко-
сти при температуре кипения, которая дает искомое значение теп-
лоты испарения соединений и сжиженных газов.
Рассмотрим, например, применение энтропийной диаграммы
для определения теплоты испарения воздуха (см. рис. VIII. 6,
стр. 169) при 1 атм (0,1 МПа). Вначале находим энтальпию жид-
кого воздуха при 7КИП; она равна 22 ккал/кг, а затем газообраз-
ного воздуха при 7КИП— 68,4 ккал/кг.
• Тогда искомая теплота испарения воздуха при 1 атм:
£ИСц = — Hv — 68,4 — 22 == 46,4 ккал/кг.
При 10 атм (1МПа): Лиоп = 72— 35,3 = 36,7 ккал/кг.
По диаграмме можно установить также количество теплоты,
необходимое для нагревания данного количества газа в заданном
интервале температур и, кроме того, температуры кипения.
§ 2. ВЫЧИСЛЕНИЕ ТЕПЛОТЫ ВОЗГОНКИ. ТЕМПЕРАТУРЫ
И ТЕПЛОТЫ ПЛАВЛЕНИЯ СОЕДИНЕНИЙ
16, 7, 40, 66, 71]
При возгонке твердое соединение переходит в пар, минуя плав-
ление. Температура этого процесса ниже температуры тройной
точки, т. е. температуры сосуществования твердой, жидкой и газо-
вой фаз. Мольную теплоту возгонки можно приближенно опреде-
лить по зависимости:
^-ВОЗГ “ ^"ИСП + 7Пл
(Лисп и Лпл — при одной и той же температуре).
Зависимость (весьма приближенная) между Лпл и 7КИП (по
Лоренцу):
7 пл/7кип = К
Значение —для неорганических веществ ~0,7183; Для орга-
нических ~ 0,5839; для простых веществ ~ 0,5583. Теплоты плав-
ления соединений:
простых — L^Tпл == 10,5 ± 2,1 Дж/(моль • К) “ 2,5 ± 0,5 калДмоль • К)
неорганических — Ьпл/Тпл = 25,1 ±4,2 Дж/(моль-К) = 6± 1 кал/(моль-К)
органических — Ьпл/Тпл = 54,4 ± 12,6 Дж/(моль-К) = 13± 3 кал/(моль-К)
200
Удельная теплота плавления:
?пл = 56,5ТПЛ/М, кДж/кг = 13,5ГПЛ/М ккал/кг
Соотношение между qiscn и <?Пл для органических соединений
7пл 0,356 ^исп-
Теплота плавления увеличивается с повышением “температуры.
Для определения теплоты плавления надо знать давление пара
соединения над твердой и жидкой фазами вблизи точки плав-
ления.
Зависимость теплоты плавления от давления
-^ = ДСР + Гпд/Г
где АСр = Ср(ж) - Ср(тв).
Приближенно теплоту плавления можно оценить по соотно-
шению
Д-5 — LU:JT пл
где AS — энтропия плавления, равная для чистых металлов
9,2 Дж/(моль-К) [Ag — 9,6; Ni, Al—10,5; Си — 8,4; Zn —
10 Дж/(моль - К)].
Энтропии плавления неорганических соединений по Туркдогану
и Пирсону:
Гпя, К 298 598 998 > 1600
ДГпл/Гпл, ДжДмоль • К) 8 10,5 12,6 13,4
Z-пл — (кЬал/Тпл) Т Плп (IX. 13)
(п — число атомов в соединении).
Для органических соединений (содержащих водород, углерод,
кислород) и органических кислот (по Гамбиллу):
Апл/Т’пл = 20,72 • 10°-ю324М
Кроме того, Гамбилл, привлекая парахор, приводит соотноше-
ние:
Ln.iTкрГмол, кр
AnJIPch = const; --5---------- const
пл сп -р2. г)
1 пл*сЬ
Для процессов плавления и возгонки
ЧЛ575°ЗГ)(Т--Т-) (1Х.14)
Р \ 4,575 \ 12 и/
где Pi и — давление паров соединения при температурах Г)
и Т2.
Формулы Бенке:
1600р2 п 1600ЛМ
Тпл =----; гпл = ~2----------- (IX. 15)
М ’'мол. кип
Здесь ркип — плотность при Ткип, г/см3; Гмол. кип — мольный
объем при Гкип, см3/моль.
Правило трех температур: ?дЛ та TKV — TKWa.
201
Изменение давления насыщенного пара Р с температурой при
плавлении описывается уравнением:
dP___ Д,ч
~dT~ T(Vx-V.a)
Здесь £Пд — мольная теплота плавления (возгонки); Уж и
Утв— удельные объемы (обратные плотностям) веществ в жидком
(парообразном) и твердом состояниях.
Уравнение Шредера:
1пх = -^-У1~Гпл). (IX. 16)
1 ПЛ
Здесь х — мольная доля растворенного вещества при образо-
вании насыщенного раствора; Тал и Дпл — температура и теплота
плавления чистого вещества; Т — температура, при которой твер-
дое вещество находится в равновесии с раствором этого же веще-
ства (при растворимости х).
Совместное решение уравнения (IX. 16) для двух веществ по-
зволяет определить координаты эвтектической точки. Это уравне-
ние дает зависимость между температурой кипения и концентра-
цией идеального раствора; оно применимо для расчета раствори-
мости газов (L и Т в этом случае — теплота и температура кон-
денсации) .
Зависимость изменения температуры плавления \ТЛЛ от из-
менения давления АР по эмпирической формуле Джонсона:
АГ пл _ Тпл
АГ* 7.плр
Увеличение давления на АР = 1 МПа вызывает понижение
температуры плавления на — 0,8 К, т. е. — 0,08 К при ДР =
= 1 атм. Здесь Ьпл — теплота плавления, Дж/кг; р — плотность
твердого соединения при Тпл, кг/м3.
Плотность жидкости в точке плавления:
1 — 0,48 (Гпл/Гкр)
Рпл - Р 1 _ о,48 (Г/Гкр)
§ 3. ПРИМЕРЫ РАСЧЕТОВ
£6, 7, 33, 66]
Пример IX. 1. Вычислить теплоту испарения этилового спирта при 373 К и
октана при 444 К, зная:
для спирта Гкр = 516 К и ш = 0,65; для октана Гкр = 568,6 К и ю = 0,394.
Решение. Применим формулу (IX. 9):
для спирта: ГПр = 373/516 = 0,723; по табл. IX. 1 AS3 =51,87 и AS'=
= 70,55; тогда LHca = 373(51,87 + 0,65-70,55)= 86 500 Дж/моль;
для октана: Тлр = 444/568,6=0,78; по габл. IX. 1 AS3 = 44,25 и AS' = 58,2;
тогда Лисп — 444(44,25 + 0,394-58,2)= 29 800 Дж/моль (опытные значения 36 800
и 30 300).
Пример IX. 2. Вычислить теплоту испарения фенола при ТКИп = 454,9 К и
Р — 0,1 МПа, зная Ткр = 694,3 К и Ркр = 6,05 МПа.
202
Решение. По формуле (IX. 8), используя Тпр “ 454,9/694,3 = 0,655 и Рпр —
= 6,05/0,1 = 60,5:
Рнсп. кип = 454,9 (33,1 • 0,655 - 32,74 + 29,77 1g 60,5)/( 1,07 - 0,655)] =
= 10990 кал/моль = 46000 Дж/моль (опытное значение 43000 Дж/моль)
Пример IX. 3. Вычислить теплоту испарения ТКИП = 362,7 К, зиая Tvl> =
= 535,4 К и РКр = 30 атм.
Решение. Вычисления можно вести по уравнениям (IX. 2) и (IX. 3).
Рисп. кип = 2,3 • 1,987 • 362,7 • 535,4 1g 30/(535,4 - 362,7) =
= 7600 кал/моль = 31800 Дж/моль (опытное значение 32100 Дж/моль)
Рисп. кип = 362,7 (5 1g 30 — 2,17)/(0,930 — 0,677) = 7490 кал/моль =
= 31400 Дж/моль; напомним, что Тпр. кип = 362,7/535,4 = 0,677
Пример IX. 4. Вычислить теплоту испарения бензола при 273 К, зная Ткр =
= 562,1 К и Ркр = 48,6 атм; ТКИп == 353,3 К.
Решение. По формуле (IX. 2):
Рисп. КИП = 2,3 • 1,987 • 562,1 • 353,3 1g 48,6/(562,1 - 353,3) =
= 7315 кал/моль = 30600 Дж/моль
Для вычисления Lsca при заданной температуре воспользуемся зависимостью
(IX. 12), определив внйчале:
Тпр. 2 = Т/Ткр = 353,3/562,1 = 0,628 и Тпр. i = 273/562,1 = 0,485
Тогда:
(1 _ о 485 \о,38
---- о I = 8290 кал/моль = 34800 Дж/моль
1 — 0,Ь2о z
Пример IX. 5. Вычислить теплоту испарения бутана при 373 К, зная Ркр =
— 36 атм; Ткр = 426 К и ТКИп — 272,5 К.
Решение. По зависимости (IX. 2):
7-исп. кип = 2,3 • 1,985 • 426 • 272,5 1g 36/(426 — 272,5) — 5400 кал/моль =
= 22400 Дж/моль
По зависимости (IX. 3):
, 272,5 (51g 36 — 2,17) ... л /
i-исп. кип -----930- о 638-----“ 5270 ‘ 4,19 = 22200 Дж/Моль
где 0,638 = 272,5/426 = Тпр. кип
При заданной Т = 373 К Laca находим по зависимости (IX. 12), определяя
вначале Тпр. i = Т/Ткр = 373/426 = 0,874 и Тпр. г = Т/Т„р = 272,5/426 = 0,638:
/ 1 — о 874 \0,38
L„сП 1 = 5400 ( - I =3590 кал/моль = 15000 Дж/моль
’ \ 1 — 0,boo /
Пример IX. 6. Вычислить теплоту испарения жидкой SO2, зная давления на-
сыщенного пара: при Ti = 261 К Pi = 0,914 атм, а при Т? = 265 К Р2= 1,09 атм.
Решение. По (IX. 6):
, 4,575 - 261-265 1g (1,09/0,914)
Рисп —------*---265 — 261----------= 6 °° кал/моль =
= 25600 Дж/моль (опытное значение 24700 Дж/моль)
Пример IX. 7. Вычислить мольную теплоту испарения ацетона при 333 К,
зная давления насыщенного пара: при 293 К Pi = 184,8, а при 333 К Рг —
= 860,8 мм рт. ст.
Решение. Определение можно вести по уравнению (IX. 6) или по рис. IX. 4;
воспользуемся им. Проводим две изобары до пересечения с изотермами 20 и
60 °C. Точки пересечения соединяем прямой и продолжаем ее до шкалы Риск, по
203
3
\
которой находим значение 7,5 ккал/моль =е 31,5 кДж/моль (опытное значение <
30,3 кДж/моль).
Пример IX. 8. Вычислить мольную теплоту испарения бутена, зная Т1(Яп = 5
= 267 К; 7’кр = 420 К и Ркр = 39,7 атм.
Решение. По номограмме рис. IX. 2, б, используя ТПр. кип = TKWV/TKV = I
= 267/420 = 0,636: . -
4
^-исп. кип/Т’кип = 20,1 кал/(моль • К); Диеп. кип = 20,1 • 267 =
= 5470 кал/моль = 23000 Дж/моль ’
Пример IX. 9. Вычислить теплоту испарения бутана (Л4 — 58), зная Гкип = '
272,5 К.
Решение. Применим формулы: 0 = 0,574 + У (ДО) и (IX. 4):
У (Д0) = 4 • 0,020; 0 = 0,574 + 4 • 0,020 = 0,654; ДР = 4 • 0,227 = 0.91
по формуле (IX. 4):
2,3-1,985-272,5 1g
£исп ---------------j q Q54’----:-----= 4920 кал/моль-20600 Дж/моль
Пример IX. 10. Определить ГКип этилбеизоната при 200 мм рт. ст., зная
Ткип = 486 К и £исп. кип == 10 564 кал/г.
D ГТ /TV СЧ 1 760 Ю 564 / 1 1 \ 486— 7’1
Решение. По уравнению (IX. 6): 1g — J------—; ;
№ГХ = 486 - Г15 Тх = 433 К.
Пример IX. 11. Установить теплоту испарения этилового спирта при 453 К, s
зиая Ткр = 516 К; Ткип = 351 К и Диск. кип = 204 кал/г. :
Решение. TKza/TKV = 351/516 = 0,68; Гпр = 453/516 = 0,9. .1
По формуле (IX. 1), используя а ж 0,5, иайдеииое по рис. IX. 1, определяем: (
Диеп = оДисп. кип (7’/7’Кип) = 0,5 • 204 (453/351) = 131 кал/г = 555 кДж/кг
Пример IX. 12. Вычислить теплоту Испарения С8Н8 прн 240 °C (513 К), зная
7’кип = 399 К- -
Решение. Ткр = 1,027 ТКИп + 159 = 1,027-399+159 = 568,6 К (295 °C); i
/кр - t = 295-240 = 55°.
По рис. IX. 6, а этой разности отвечает Диеп = 52,50 ккал/кг.
Пример IX. 13. Паровая фаза смеси гептана и воды при 373 К состоит из
55 гептана и 45% (мол.) воды. Определить состав пара и его равновесное дав- >
ление при 393 К, зиая теплоту испарения гептана — 7400 и воды 9700 кал/моль. ’’
Решение. Воспользуемся уравнением (IX. 7). В паровой фазе мольное отио- (
шение гептана и воды при 373 К: п1 = 55/45 = 1,22; и
«2 ' 7400 - 9700 ( 1 1 X , .
g 1,22 = 4,575 1373 273 ) ’ " = пон1в/н2п °-87
Кроме того: г
пс7н18 + rtH2o = пс7Н18 ~ О-87/1»87 “ 0,465 i
Таким образом, паровая фаза смеси воды и гептана при 393 К состоит из
46,5 гептана и 53,5% (мол.) воды.
Пример IX. 14. Вычислить теплоту испарения аммиака при 373 К и 61,8 атм,
зная Тир == 405,5 К и Ркр =х 111,5 атм.
Решение. Тлр — 373/405,5 = 0,92 и РПр = 61,8/111,5 = 0,6. По рис. IX. 3 для
указанных значений Дисп/7'кр = 7,4, откуда искомая LBca — 6-405,5 =
= 2433 ккал/моль = 1173 кДж/моль.
Пример IX. 15. Определить теплоту испарения воды при 68°C (331 К).
Решение. По рис. IX. 10 находим искомую £ИСп = 10 130 кал/моль.
Пример IX. 16. Вычислить теплоту испарения гексена [СН3(СН2)3СН=СН2]
(М = 84,2) при Ткип = 336,6 К, если рш. КИп = 0,634 г/см3.
204 I
Решение. Применим метод лиопарахора, суммируя составляющие, приведен-
ные на стр. 191:
X = 6 (С) + 12 (Н) + двойная связь »
= 6 (-1120) + 12 - 845 +1670 = 4649,5
По уравнению (IX. 5):
Лисп. кип = {(4649,5/84,2) [0,634 - 84,2/(82,06 • 336,5)1}1,25 =
= 91 кал/г или 91 • 84,2 = 7650 кал/моль или
32 кДж/моль (погрешность +6,3%)
Пример IX. 17. Вычислить теплоту испарения этана при 273 К (выше 7’кип),
зная Т Кр == 305,5 К; 7’кип = 184,5 К и Лисп. кип === 127 кал/г.
Решение. 7пр = 273/305,5 = 0,89; Тар. кип = 184,5/305,5 = 0,6.
По формуле Ватсона (IX. 11):
Лисп = 127 [(1 — 0,89)/(1 — 0,6)}°>38 = 79 кал/г (погрешность + 6,7%)
Пример IX. 18. Вычислить теплоту испарения метилацетата (М = 74,1) при
273 К, зная 7’кип = 329,5 К; Т’Кр = 506,9 К и Ркр = 46,2 атм.
Решение. Тпр = 273/506,9 *= 0,54; Гпр. кип = 329,5/506,9 = 0,65.
По формуле Нарсимхаиа (IX. 10):
, • 1,987-506,91g46,2 (1 - 0,54)’Л „„ . , , .
ЛИСп =------з 963 — 2~46 - б 65------- 2 каЛ/г (^грешность- 1,6%)
Пример IX. 19. Воздух при 40 °C (313 К) и температуре влажного термо-
метра 25 °C (298 К) проходит через испаритель и выходит при 48 °C (321 К);
температура влажного термометра 40°C (313 К). Вычислить влагосодержание,
точку росы и воздуха и вес испаряющейся воды на 1000 м3 поступающего воз-
духа.
Решение. По рис. IX. 9. Вертикаль с абсциссой 40° пересекает линию темпе-
ратуры влажного термометра В = 25°; этому значению соответствует относитель-
ное насыщение 30% и мольное влагосодержание 0,023. Горизонталь, проведенная
влево, дает на пересечении с кривой насыщения А = 20°, т. е. точку росы. По-
добным образом находим для уходящего воздуха относительное насыщение 60%
и мольное влагосодержание 0,073.
Поступает влажного воздуха 1 +0,023 кмоль. Его объем 1,023 • 22,4-^g-=
= 26,4 м’. Испаряется влаги 0,073—0,023 = 0,05 кмоль (0,09 кг), а на 1000 м3-
3,3 кг.
Пример IX. 20. В орошаемую водой башню поступает COj при 30 °C (303 К)
с мольным влагосодержанием 0,006. Установить температуру и мольное влагосо-
держание выходящего насыщенного газа.
Решение. По рис. IX. 9 находим температуру влажного термометра посту-
пающего газа (х = 1) 15 °C. Следуя вдоль кривой В, доходим до линии насы-
щения. При насыщении температура газа 15 °C, а мольное влагосодержание 0,018.
Для поступающего воздуха (вместо СО2) х == 0, t = 13 °C и мольное влаго-
содержание 0,015.
Пример IX. 21. Вычислить уменьшение температуры плавления льда при уве-
личении внешнего давления на 0,1 МПа при 273 К, если Лпл = 333,7-103 Дж/кг,
У„, = 10-3 и Ут в = 1,09 ПО-3 м3/кг.
Решение.
dT 7’(УЖ-УГВ) 273(103 — 1,09-IO"*3) _ п,к ,„-7 ^/п„
~dP---------ЦТ,-----------(-зззГМоГ3— = °>75’10 К/Па
Отсюда
ДГ = 44- &Р = 0,75 • 10“7 • 0,1 • 106 = 0,75 • 10“2 К
205
Пример IX, 22. Определить теплоту возгонки бензола при 278 К, зная Гкр =
s= 562,6 К; Ркр = 48,6 атм; ТКИп = 352,2 К; Гпл == 2350 кал/моль и Тал »
& 278,5 К.
Решение. Тпр, 2 = Тар. кип — 352,5/562,6 = 0,626. По рис. IX. 2, а указанным
значениям Гпр. кип И Ркр Соответствует Гисп. кип/Гкип === 20,7, тогда Расп, кип а=
*= 20,7-352,2 = 7300 кал/моль.
Для бензола при Г = 278 К ГПр. t — Гпр.ал — 278/562,6 = 0,495. По номо-
грамме IX. 8 значениям Тар. i = 0,495 и Гпр. а = 0,629 отвечает Лисп, i/7-исп. 2 =
Тогда Раса. 1 (278 К) == 1,1 -7300 == 8050 кал/моль, а Z-возг Раса. t + Ра л ==
= 8050 + 2350 = 10,4 ккал/моль.
Пример IX. 23. Установить теплоту возгонки иода при Тал = 387 К, если
давление паров твердого иода при 387 К Р — 89 мм рт. ст., а при увеличении
давления на 4,4 мм рт. ст. температура плавления иода увеличивается на 1°
(Р = 89 + 4,4 = 93,4 мм рт. ст.).
Решение. Применим уравнение (IX. 14):
. 8,314 - 2,31g (93,4/89)
возг (1/388)-(1/387)
== — 0,6 • 10s Дж/моль
Пример IX.24. Установить теплоту плавления NaCl, зная ГпЛ = 1074К и
число атомов в- молекуле п — 2.
Решение. Воспользуемся уравнением (IX. 13). Д£пл/Гпл = 13 (стр. 201, ин-
терполировано) и Дпл = Гппп-13,2 = 27 880 Дж/моль (опытное значение
30,2 кДж/моль).
Пример IX.25. Вычислить Тпл орто(\) и мета(2)-динитробензолов (Л'1 =
= 168,1), зная состав (в мол. долях) эвтектики: Xi = 0,65; х2 = 0,35; ГЭВт =
= 337 К; Раса. 1 = 130,2 и ГИСп.2 = 100,7 Дж/г.
Решение. Воспользуемся уравнением Шредера (IX. 16):
у ______ Гпл, 1ГЭВТ _________ 130,2'337-168,1 __390 К
пл-1 /?ГЭВ11п х1 + Гпл. j ~ 8,314 • 337 • 1п 0,65 + 130,2 • 168,1 *
У _ 100,7-337-168,1__________
пл'2 8,314 • 333 1п 0,35 + 100,7 • 168,1
Пример IX. 26. Вычислить Гпл этилацетата С4Н8О2 (М = 88,1); число атомов
в молекуле п = 14; ГМОл кип = 102,4 см3/моль.
Решение. По формуле Бенке (IX. 15): Гпл = (1600-88,1 • 14)/Ю2,42 = 188,3 К
(погрешность —1%).
Г лава X
ТЕПЛОЕМКОСТИ ГАЗОВ,
ЖИДКОСТЕЙ И РАСТВОРОВ
(7, 21, 31, 40, 66, 71, 85, 89]
§ 1. ОБЩИЕ МЕТОДЫ ВЫЧИСЛЕНИЯ
ТЕПЛОЕМКОСТЕЙ ВЕЩЕСТВ
Теплоемкость системы — это отношение количества сообщенной
ей теплоты к вызываемому этим повышению температуры. Разли-
чают истинную теплоемкость, соответствующую бесконечно малому
изменению температуры, и среднюю, относящуюся к конечному
изменению температуры, равную с — q)АД Теплоемкость, отнесен-
ную к 1 г (кг) вещества называют удельной: суд, Дж/(кг-К);
к 1 моль — мольной; Смол = Мс/1000; к 1 г-ат — атомной: Дсуд. Для
газов: Смол = 22,4 Сов', для жидкостей: Соб = судр Дж/(м3-К).
Эмпирическая зависимость для мольной теплоемкости при
Р = const
Ср = а + ЬТ + сГ2
где а, b и с — опытные постоянные по таблицам справочника; от-
ношение а/b для разных веществ примерно одинаково; для орга-
нических соединений, например, оно ~ 0,0022.
Мольная теплоемкость газа — функция температуры и давле-
ния. Для идеальных газов Ср > Cv (Cv — мольная теплоемкость
при V == const). Разность Ср— CV = R— есть внешняя работа
расширения при изменении температуры на 1°.
Для удельной теплоемкости справедливо: Ср — Cv = R/M.
Значение АС постоянно, поскольку не зависит от температуры,
давления и природы газа. Кроме того, газы со сходно построен-
ными молекулами имеют примерно одинаковые мольные теплоем-
кости.
Для идеальных газов:
одноатомных — Cv = Z/2R = 12,47 и Ср = Cv + R = =
= 20,78 ДжДмоль • К); Cp/Cv= 1,67
двухатомных (при невысокой температуре) — Cv = 5/гД = 20,79 и
Ср = Cu + R = 7RR == 29,1 ДжДмоль • К); Ср1Ср = 1,40
207
трёхатомных — CP!CV = 1,28
многоатомных — Cv = 6/2Д = 24,9 К и Ср — 8/2Д = 33,24 ДжДмоль-К)
Ср/Си = 1,33
Фактически же теплоемкость многоатомных газов (особенно
при высоких температурах) выше этих расчетных.
Теплоемкости Ср и Cv твердых веществ связаны соотношением
Ср = Ср + */2аТ
где а — опытный коэффициент, определяемый для известного Cv.
Упрощенное уравнение имеет вид:
СР~СР(1 +0,0214Си-/-)
х * пл /
При нагревании тела Ср неограниченно растет, a Cv стремится
к пределу 3/? для твердых элементов и к 3Rn для твердых соеди-
нений, молекулы которых состоят из п атомов.
Теплоемкость многих твердых и жидких веществ — величина
аддитивная и примерно равна сумме атомных теплоемкостей:
Ср = X ^tni'
(tit — число атомов данного вида в молекуле). Удельная теплоем-
кость Суд = TjCi/M (табл. X. 1, рис. X. 1).
Таблицах. 1
Атомная теплоемкость некоторых элементов
Теплоемкость Н Be В С Si N Р О S • F Остальные элементы
Ci твердых эле-
ментов
Дж/(г-ат • К) 9,62 15,9 11,72 7,53 20,08 11,3 23 16,74 22,59 20,92 25,94-26,78
кал/(г-ат-К) 2,3 3,8 2,8 1,8 4,8 2,7 5,5 4 5,4 5 6,2-6,4
Ci жидких эле-
ментов
Дж/(г-ат-К) 17,99 - 19,66 11,72 24,27 - 29,29 25,1 30,96 29,29 33,47
кал/(г-ат-К) 4,3 - 4,7 2,8 5,8 - 7 6,0 7,4 7 8
Атомная теплоемкость в твердом и кристаллическом состояниях
есть величина постоянная и близкая к 26 Дж/(г-ат-К) =
= 6,2 кал/(г-ат-К) (правило Дюлонга — Пти). Это справедливо
для элементов с А > 40 для теплоемкости Ср. Значение средней
атомной теплоемкости для жидких металлов и сплавов 31 (7,4),
а для расплавленных солей 34 (8,1) Дж/(г-ат-К) [кал/(г-ат-К)].
Для химически подобных кристаллических состояний мольная
теплоемкость примерно одинакова. При 273 К Сат чистых металлов
24,3—26 Дж/(г-ат-К). Как правило, теплоемкость соединений в
жидком состоянии выше, чем в твердом; в точке плавления они
почти равны.
208
Теплоемкость смеси твердых солей приближенно равна сумме
теплоемкостей составляющих смесь солей.
Средняя теплоемкость сухого воздуха при 0—80 °C 1 (0,24),
а водяного пара 0,467 (1,97) кДж/(кг-К) (ккал/(кг-К)]. Для
Рис. X. 1. Зависимость удельной теплоемкости некоторых веществ от температур.
влажного воздуха справедливо: С = 0,24 + 0,466х (х— количе-
ство пара, кг).
Среднюю теплоемкость различных соединений (газов, суспен-
зий, твердых тел и т. д.) можно вычислить по принципу
209
аддитивности. Теплоемкость газовых смесей:
объемная — Ср = (у£х + у2С2 + J/зСз)
мольная — Ср = х£р, t
Здесь у — содержание компонентов смеси, % (об. или мол.);
Х{ — мольная доля компонента; CPii — теплоемкости компонентов.
Мольная теплоемкость ароматических CrtH2n_6 и алифатиче-
ских углеводородов гомологических рядов С„Н2га и СяН2„+2 в твер-
дом или жидком состоянии (по Шелесту):
Сг = 0,993» (in 9^7 +1) -
Для расчета теплоемкости твердых веществ и газов применимы
принципы квантовой теории. Согласно последней теплоемкость
твердых, кристаллических веществ можно вычислить по известной
формуле Дебая, используя характеристическую температуру © и
частоты электромагнитных колебаний v, поглощаемых или излу-
чаемых атомами при переходе электрона с одной орбиты на
другую:
cB = ZcD(0/T)
Теплоемкость кристаллических веществ при низких температу-
рах пропорциональна третьей степени температур (закон кубов
Дебая):
Со = 464,5 (Г/0)3 = аТ3
Аргументы этих функций сокращенно обозначены через Со, зна-
чения которых при разных Q/Т находят по таблицам функции Де-
бая в справочниках [72].
Из формулы следует, что значение теплоемкости твердых, кри-
сталлических веществ растет пропорционально кубу температуры,
а также быстро падает и асимптотически стремится к нулю при
Т-+0.
Теплоемкость является однозначной функцией 7/0, т. е. при
равных значениях этой безразмерной величины теплоемкости раз-
ных твердых веществ должны совпадать. При выражении темпе-
ратуры в долях ее характеристической величины (770) получается
одна кривая для всех твердых веществ, подчиняющихся уравнению
Дебая (рис. X. 2). Значение ©:
,, о 6,6256 • 10~27 in-ч
0 = (kk) v = 8v = —-----v = 4,798 • 10 v
1,380-10-IS
Здесь h и k — постоянные Планка и Больцмана. Произведение
hv/k = 0 обозначается характеристической температурой (размер-
ность температуры) и дается в таблицах справочников. Отноше-
ние &/Т можно считать приведенной редуцированной температурой;
оно равно hv = kT = pv/Г = 4,798-10-11 v/T,
210
При отсутствии данных вычисление 0 можно выполнить при-
менительно к формуле Дебая (например, по Линденману)
9=135а/-^- (X. 1)
где М — атомная (молекулярная) масса; V—атомный (мольный)
объем вблизи точки плавления; Тпл — температура плавления эле-
мента или соединения.
Рис. X. 2. Зависимость теплоемкости некоторых твердых ве-
ществ от Т/0.
Теплоемкость простых полярных соединений с ионной решеткой
(NaCl, КС1, CaFa) примерно равна сумме атомных теплоемкостей:
со = Хсп(0/7’)
Таким образом, для вычисления теплоемкостей твердых тел
вначале определяются, при отсутствии данных, значения 0 по фор-
муле (X. 1). Затем находят для заданной Т теплоемкость Cv =
= Cd(Q/T) элемента или Cv = ^cDm соединения (как сумма
всех атомов), используя таблицы функций Дебая для разных
Q/Т по справочнику [72]. При Q/Т 16 справедливо CJ3R =
= 77,927 (У/©)3-
Для вычислений теплоемкости газов и твердых веществ приме-
нима также формула Эйнштейна:
Cv-Xce^' Cv~Y3ceWt) (X/2)
Коэффициент 3 используют при переходе от значений функций
Эйнштейна к функциям Дебая при расчете атомной теплоемкости
твердых веществ.
В формуле (X. 2) приняты постоянные частоты v и одина-
ковые для всех колебаний. Указанная формула применима и для
211
вычисления теплоемкости газов для каждой из пг' степеней сво-
боды линейных колебаний.
В применении к твердым веществам в формуле (X. 1) вместо
коэффициента 135 используют 100. Аргументы формулы (X. 2) со-
кращенно обозначены СЕ; их находят по таблицам функций Эйн-
штейна для разных значений ©/Г по справочнику [72], в которых
даны значения величин на одну степень свободы.
Расчеты теплоемкости многоатомных газов сложны, так как
теплота расходуется, помимо приращения кинетической энергии
поступательного движения, на приращение кинетической энергии
вращения молекулы, а также колебания атомов или их групп
внутри молекул. Иными словами: Cv = СП0Ст + Свр + Скол.
В свободном виде каждая из частиц газа обладает тремя сте-
пенями свободы поступательного движения, а в расчете на п ча-
стиц Зп. К этому присовокупляются вращательные степени сво-
боды т: 2 — для линейных молекул (включая двухатомные); 3 —
для нелинейных (многоатомных) молекул, т. е. всего 5 или 6.
Кроме этого, следует учитывать еще и степени свободы колеба-
тельных движений атомов молекул: на их долю для двухатом-
ных и линейных многоатомных молекул приходится т' — Зп —
— (3 4-2) = 3п — 5, а для нелинейных многоатомных молекул
т' = Зп — (3 + 3) = Зп — 6 степеней свободы.
Каждой колебательной степени свободы отвечает своя харак-
теристическая температура 0 и своя частота колебаний, числовые
значения которых определяются из анализа спектров молекул и
по линии спектров комбинационного рассеивания, а также путем
подбора, используя опытные значения Cv для нескольких темпе-
ратур. Приводим значения 0 и 0/Т для некоторых веществ
(табл. X. 2 и X. 3).
Таблица X.2
Характеристические температуры некоторых газов
Газ 81 в2 6з e4
СС14 341 (2) 440 (3) 630 1114(3)
сн4 1870(3) 2170 (2) 4320(3) 4400
cos 746 (2) 1230 2936 —
со2 960 (2) 1830 3380
cs2 568 (2) 939 2194
СС14 341 (2) 440 (3) 630 1114(3)
сн4 1870(3) 2170(2) 4320(2) 4400
HCN 1020 (2) 2290 4710
Н2О 2290 5730 5510 —
H2S 1810 3750(2) — —
NH3 1367 2336 (2) 4176 4776 (2)
n2o 844 (2) 1842 3195
so2 750 1650 1950 —
Примечание. В скобках приведены значения вырожденных колебаний, т. е. случай,
когда две (или более) частоты совпадают; тогда эти частоты в сумму входят со множителями
2, 3 и т. д.
212
Таблица X.3
Характеристические температуры некоторых элементов
0 = 4 (t'/sp2'3/A*’/6)'i А = 135—150, среднее 145
Элемент e Элемент e Элемент e
РЬ 88 К, Hg 100 Bi, Cd 120 In 129 Na 150 Au 170 Sb 200 Ag 215 Ta 225 Ca, Pt 230 Zn 234 Zr 250 Sn 260 As 285 W 310 Cu 315 Mg 318 Ni 375 Ti, Mo 380 Co 385 V 390 Al 394 Li, Mn 400 Fe 420 Cr 460 Si 625 Be 885-1000 В 1250 С (алмаз) 1840-1860
Мольную теплоемкость Ср идеальных газов для заданной тем-
пературы можно вычислить (по Эйнштейну):
т'
1
Здесь т — число вращательных степеней свободы (вращение
всей молекулы); т' — сумма степеней свободы колебательного дви-
жения атомов в молекуле т'= Зп — (З-j-m); п— общее число
атомов в молекуле газа. Для двухатомных и многоатомных газов
с линейной структурой т = Ч (СО2, HCN, С2Н2, CS2 и др.); для
прочих многоатомных газов т = 3.
Вычислим, например, теплоемкость линейной молекулы СО2 при
некоторой Т. Значение т'— Зп— 5 = 3-3 — 5 = 4; одно из коле-
баний в молекуле СО2 дважды вырождено. Тогда по справочнику
[72] или по табл. X. 2 (в общем виде):
Ср = у /? + /?+ 2С£ (960/Т) + Св (1830/7) + С£ (3380/Т)
(сумма СБ = 2 + 1 + 1 = 4, т. е. соответствует значению m'j
Для вычисления теплоемкости слоистых кристаллических струк-
тур- (плоских кристаллов — слюды, кварца, каучука и др.) и цеп-
ных (волокнистых) структур при низких температурах применимы
зависимости Тарасова;
/ Т V
для двухмерных структур — Со = 43,272/? ^-g-J = ЪТ2
для линейно-полимеризованных структур — Со = л2/? = сТ
Средняя энергия поступательного движения молекул 1 моль
идеального газа (три степени свободы) равна Е = 3/2$, следова-
тельно, на одну степень свободы приходится l/2RT. И изохорная
213
теплоемкость газов, обладающих поступательным движением, рав-
на Cv = 3/zR (для одноатомных газов).
Для двухатомных молекул газа, обладающих пятью степенями
свободы (3.степени свободы поступательного движения и 2 сте-
пени вращательного движения), изохорная теплоемкость Са = 5liR,
а изобарная теплоемкость Ср = Cv + R — 7/г/?-
Для нелинейных (многоатомных) молекул газа (по три сте-
пени свободы поступательного и вращательного движения) Cv =
== б/2/? = 3R, а Ср = a/2R = 4R.
Таблица X.4
Постоянные в уравнении мольной теплоемкости газов при
Р—»0 и Г = 300-1500 К
Вещество а 6-103 с-106 Вещество а 6-103 с-106
Н2 6,946 -0,196 0,4757 so. 6,945 10,01 —3,794
м2 6,457 1,389 —0,069 so3 7,454 19,13 -6,628
о2 6,117 3,167 -1,005 NH3 5,92 8,963 — 1,764
со 6,350 1,811 -0,2675 С12 7,653 2,221 —0,8733
NO 6,440 2,069 -0,4206 Воздух 6,386 1,762 -0,2656
Н2О 7,136 2,640 0,0459 СН4 3,381 18,044 -4,300
со2 6,339 10,14 -3,415
Таблица X.5
Групповые составляющие мольной теплоемкости по
Джонсону и Хуангу
Группа а 6-102 С-104 d -106
—СН3 0,427 2,183 -0,0863 0,00111
—СН2— -0,186 2,243 —0,1263 0,00274
=сн2 0,662 1,770 —0,0874 0,00167
=сн— -0,239 1,663 —0,1056 0,00260
6-членное кольцо -7,576 11,007 -0,729 0,01801
=СН 2,017 1,400 -0,1157 0,00352
—СН= -5,252 3,887 -0,4400 0,01521
1 —СН 1 —1,942 2,832 -0,2281 0,00661
-сн2- (5-членное кольцо) -2,137 2,473 -0,1195 0,00198
—СН2— (бгчленное кольцо) -2,318 2,471 -0,1294 0,00257
1 —С— 1 -4,655 3,682 -0,3551 0,00982
/С= -0,0535 1,342 -0,1019 0,00273
214
Для примерного вычисления теплоемкости газов предложены
также эмпирические структурные корреляции. Например, предло-
жены методы групповых составляющих для теплоемкости углево-
дородов в состоянии идеального газа (по Соудерсу,. Мэтьюзу и
Херду), аддитивно-групповой метод вычисления мольной теплоем-
кости газов (по Джонсону и Хуангу, Рихани и Дорэсвейму, Андер-
сону, Байеру и Ватсону и др.). Эти методы дают составляющие
для групп атомов и основаны на степенной эмпирической зависимо-
сти Ср = а + ЬТ 4- сТ2 4- dT3. Значения этих составляющих при-
ведены в табл. X. 4 и X. 5.
Г2,5
Р. атм
1_____।_____।_____।_____1_____।_____1_
О 20 40 ВО 80 100 120
МПа
Рис. X, 3. Зависимость теплоемкости азота
от давления и температуры.
Теплоемкости газа:
81 ^кп
Г* г* ____ __ , _КР р
р ° 32 РкрТ3
под давлением - Ср = Ср=1 4- (р ~ О
„ 2«4-3
примерная газов и паров — Ср >= —
Со ~ [ккал/(кг • К)] (п— число атомов в молекуле)
На рис. X. 3 приведена зависимость теплоемкости азота от дав-
ления и температуры, а на рис. X. 4 — то же, но для водяного
пара. Для него при повышенных давлениях Ср уменьшается с ро-
стом температуры по достижении весьма высоких температур.
215
Ср,ккал/(кг'К)
к
Рис. X. 4. Зависимость теплоемкости водяного пара от давления и температуры:
а—в области высоких давлений; б—в области критической точки.
216
Теплоемкость пара Ниже критической точки повышается Весьма
быстро по мере приближения к этой точке и становится бесконечно
большой в критической точке.
Из рис. X. 5 видно, что увеличение теплоемкости аммиака с
температурой небольшое, велико в критической области и почти
не зависит от давления и температуры при очень высоких давле-
ниях.
МПа
Рис. X. 5. Зависимость теплоемкости аммиака от давления и темпе-
ратуры.
Энтальпия газа под давлением:
9RTKD ( 18Т2
НР ~ НР-' + 128Ркр V Т*~J <р ~
На рис. X. 6 дана обобщенная зависимость АСР от Тпр и Рар.
Замечено, что чем выше температура, тем меньше влияние
давления на Ср; влияние же давления на Cv вообще слабее; при
температурах близких к критической увеличение Ср становится
весьма большим, ибо в критической точке Ср = оо.
Зависимость теплоемкости от давления: '
С — С9 4- ( 4- 1 Р
Gp“bPr т Т* J
(Ло и С — константы уравнения состояния газа по Битти — Бридж-
мену, см. табл. IV. 2, стр. 47).
Зависимость для средней удельной и мольной теплоемкости от
температуры
. Сср = а + 4хГ2 + Л)Н(Г2 + Г1Г2 + Г>)
217
300
0,2
218
Приводим зависимости для теплоемкостей, Дж/(кг-К):
антрацитные и битуминозные угли — Ср = 4190 (0,2 + 0,00088£ + 0,15х),
где х — доля летучего вещества
цемент, песок, камень — Ср = 4190 [0,18 + 0,00006 (9/5/ + 32)];
. ти г _ 4190 [0,388 + 0,00045 (9/6/ + 32)]
нефти —- ьр--------------—------------
ри,°
жидких нефтепродуктов —Ср = [0,7072 — 0,318р + (0,00147 — 0,00055p)J X
X (0.067ЛГ + 0,35); К =
паров нефтепродуктов — Ср =(l,8i + 702) (0,146/( — 0,41)
(р — плотность в жидком состоянии, г/см3)
В приведенных выражениях К — так называемый характери-
зующий фактор; если /С нефтепродуктов не равно 11,8, то теплоем-
кости, указанные на рис. X. 7, следует умножать на поправочный
коэффициент, указанный на тех же рис. X. 7.
На рис. X. 8 даны зависимости К от различных параметров.
Удельная теплоемкость жидкостей равна 1,6—2,5 Дж/(г-К),
кроме Н2О и NH3— ~4,2; Hg ~ 13; SiCl4 ~ 0,8, а галогенпроиз-
водных (алифатических и ароматических) 0,6—1,5 Дж/(г-К).
На рис. X. 9 и в табл. X. 6 приведены значения Ср различных
газов.
При вычислениях процессов, сопровождающихся переходом теп-
лоты от одного объекта к другому под давлением, обычно исполь-
зуют значения энтальпий, а не теплоемкостей.
§ 2. ВЫЧИСЛЕНИЕ ТЕПЛОЕМКОСТИ РАСТВОРОВ
[7, 11, 71]
Теплоемкость растворов уменьшается с повышением их концен-
трации. Удельная теплоемкость разбавленных растворов практиче-
ски равна теплоемкости воды этих растворов.
Теплоемкости растворов солей можно определять по таблицам
(например, СТЭ, т. VII, с. 303).
Приближенно удельную теплоемкость раствора соли можно
определить по формуле, основанной на аддитивности этой функции
_ mjCi + m2c2
Со-------;----'
mi + пг2
Здесь Ci, с2 — удельные теплоемкости поды и соли; пц и гп2 —
массы воды и соли.
Для определения теплоемкости смешанных растворов солей
можно применить способ Микулина [49, 50], основанный на том, что
теплоемкость смешанного раствора с объемными концентрациями
Ci, С2, ..., Сп (моль/л) складывается аддитивно из теплоемкостей
составляющих растворов с концентрациями Xi, х2, ..., хп, если эти
растворы имеют один и тот же парциальный объем воды. Микулин
219
Теплоемкость, ккаЛ£(кг' К )
Рис. Х.7, а, б.
220
л
8, 750 -----1-------1______L-_____। I । 11
-10 0 10 20 JO 40 50 60 70
Be'
Рис. X. 7. Теплоемкость жидких нефтепродуктов паров парафиновых угле-
водородов (б) и теплотворная способность Q (в) нефтепродуктов:
а, 6—К=11,8; для других К теплоемкость умножают на поправочный коэффициент; р—плот-
ность газов относительно плотности воздуха.
221
ю
ю
ю
mwwg^Mgi
Таблица X.6
Средняя (массовая) теплоемкость газов при постоянном давлении [кДж/(кг • К)]
i, °C т, к Н2 n2 о2 Воз- дух со со2 so2 NH3 С12 НС1 H2S so3 CH4 C2H4 H2O (r) NO
0 273 14,210 1,017 0,917 1,005 1,040 0,821 0,607 2,094 0,479 0,797 0,998 0,594 2,166 1,630 1,855 0,996 100 373 14,352 1,042 0,925 1,009 1,042 0,871 0,636 2,188 0,494 0,798 1,021 0,663 2,294 1,840 1,867 0,999 200 473 14,432 1,047 0,938 1,013 1,047 0,913 0,662 2,286 0,500 0,799 1,044 0,708 2,458 2,046 1,888 1,002 300 573 14,465 1,051 0,951 1,020 1,055 0,950 0,687 2,360 0,505 0,801 1,068 0,746 2,635 2,245 1,913 1,006 400 673 14,490 1,059 0,964 1,030 1,066 0,984 0,708 2,451 0,508 0,805 1,091 0,782 2,816 2,440 1,938 1,017 500 773 14,520 1,068 0,977 1,040 1,078 1,013 0,724 2,539 0,511 0,809 1,113 0,812 2,991 2,620 1,968 1,028 600 873 14,558 1,078 0,990 1,051 1,089 1,042 0,741 2,610 0,514 0,815 1,136 0,838 3,159 2,786 2,001 1,040 700 973 14,604 1,089 1,003 1,061 1,101 1,068 0,754 2,664 0,515 0,820 1,160 0,862 3,321 2,940 2,031 1,051 800 1073 14,658 1,100 1,017 1,071 1,111 1,089 0,766 2,842 0,517 0,826 1,249 0,883 3,485 3,084 2,064 1,062 900 1173 14,721 1,110 1,026 1,081 1,122 1,110 0,775 0,519 0,831 1,337 0,901 3,636 3,217 2,098 1,073 1000 1273 14,792 1,120 1,034 1,091 1,132 1,126 0,783 0,520 0,837 0,918 3,771 3,341 2,131 1,084 1100 1373 14,872 1,130 1,042 1,101 1,143 1,143 0,791 0,521 0,843 2,165 1200 1473 14,955 1,139 1,051 1,110 1,151 1,160 0,800 0,523 0,848 2,194 1300 1573 15,039 1,147 1,059 1,118 1,160 1,172 0,808 0,525 0,854 2,228 1400 1673 15,131 1,156 1,063 1,1£6 1,168 1,185 0,816 0,527 0,860 2,257 1500 1773 15,219 1,164 1,072 1,130 1,176 1,197 0,825 0,530 0,866 2,286 Ю ю со
предложил линейную зависимость для расчета теплоемкости Сс1й
смешанных растворов солей
Сем = Соб + Pi (J) С] + р2 (J)С2 + ... + Рп (7) Сп
где Соб — объемная теплоемкость воды при 20 °C, ккал/(л-К);
Рь ..., рп — коэффициенты, являющиеся функциями от J; J —
+ k™C2 + ... + k^Cn
(см. табл. VII. 1 — VII. 3 и
рис. X. 10).
Если на рис. X. 10 отсут-
ствует кривая для заданной
соли, ее можно построить на
основании данных справочни-
ков о теплоемкости и плотно-
стях растворов электролитов.
Зная объемную теплоем-
кость раствора С0о, можно
найти теплоемкость при посто-
янном давлении (ккал/(кг-К)]:
Ср = <S/p = Соб/р.
Теплоемкость смешанных
растворов солей по способу
Здановского [24, 25] опреде-
ляется в предположении, что
при смешении растворов с оди-
наковой активностью воды (или
с одинаковыми суммарными
концентрациями) теплоемкость
смешанного раствора склады-
вается аддитивно из теплоем-
костей исходных растворов:
К
Рис. X. 9. Зависимость теплоемкости
различных газов от температуры:
1 — СН4; 2—СОг: 3—НгО; 4 —газы от сжига-
ния дерева и угля; 5 —газы от сжигания торфа;
6—газы от сжигания кокса и антрацита;
7—коксовый газ; 8—Оя*, 0—N2; 10—сухой
воздух; //, 12— воздух с влажностью 1 и 1»1°/о;
/3 —водород (С 10"1).
Здесь Xi, х2, хп — кон-
центрации солей в исходных
растворах с одинаковой активностью воды, % (масс.); Ci, С2, ...
..., Сп — заданные концентрации солей в смешанном растворе, %
(масс.).
Теплоемкости Ср растворов солей при концентрациях хп опре-
деляют по таблицам, а концентрации хп — способом, описанным
выше (см. пример VII. 3).
Теплоемкость С разбавленных водных растворов:
С = 4,19 (1 - х/100) [х < 20% (масс.)]
Теплоемкость концентрированных растворов:
С — Cim.! + С2т2, где Ct — теплоемкость соли; С2 — теплоемкость воды;
mlt т2 — массовые доли соли и воды в растворе
224
Определять теплоемкости жидкостей сложнее, чем газов. Для
вычисления теплоемкостей жидкостей предложено несколько мето-
дов (Джонсона — Хуанга, Сакиадиса — Коутса, Ватсона, Собеллы
и др.). Так, аддитивно-групповой метод (Джонсона — Хуанга) для
приближенного вычисления Ср при 293 К основан на сложении
атомных и групповых теплоемкостей [кал/(моль-К)], приводимых
ниже:
Н— (муравьиная кис- 3,55 —CN 13,9
лота и ее эфиры) —ОН 11,0
СНз— 9,9 —nh2 15,2
—СН2— 6,3 —Cl 8,6
I —Br 3,7
—С—н 5,4 —no2 —О— (простые эфиры) 15,3 8,4
—S— 10,6
—соон 19,1 С6Н5- 30,5
—СОО— (сложные 14,5
эфиры)
\=О 14,7
Метод Ватсона:
с =_______________ЬМ__________
Р (0.1745 - 0,08357 пр)2-8
8 М. М. Викторов
225
Ниже приведены величины Ь-.
Анилин
Ацетон
Бензол
Бутиловый спирт
Гептан
Изоамиловый спирт
Изопропиловый спирт
Масляная кислота
0,00182
0,00162
0,00133
0,00187
0,00160
0,00194
0,00192
0,00186
Метиловый спирт
Пропиловый спирт
Простые эфиры
Толуол
Хлорбензол
Хлороформ
Четыреххлорнстый
углерод
Этиловый спирт
0,00184
0,00185
0,00140
0,00136
0,00112
0,00076
0,00067
0,00177
^пр
Рис. X. 11. Зависимость теплоемкости жидкостей от приведенных температуо и
давления.
Метод Шоу — Брайта:
Р I в
Ср (293 X) =
Значения А и В для гомологических рядов приведены в
табл. X. 7,
226
Таблица X.7
Постоянные для расчета теплоемкости при 293 Н
Жидкость А В Жидкость А В
Ароматические угле- 19,8 8,0 водороды Амины 17,8 45,0 Дихлориды 26,0 —21,0 Дихлорацетаты 20,6 — 76,0 Карбоновые кислоты 19,5 —5,8 Кетоны 15,8 —18,0 Монохлорнды 17,5 —37,0 Нитрилы 16,5 —20,0 Паракрезилэфиры 14,6 —88,0 Производные бен- 15,75 —97,0 зойной кислоты Предельные угле- 18,5 24,0 водороды Спирты 15,9 —5,8 Спирты-нзомеры 21,5 76,0 Сложные эфиры 20,25 —5,8 Трихлорацетаты 22,6 —94,0 Трнхлорнды 20,0 —89,0 Хлорацетаты 18,0 58,0 Фенилэфиры 16,75 —41,0
Зависимость теплоемкости жидкости от давления:
_ /г _ с \
Ркра1 ' РкР Р'т
Рис. X. 11 служит для перехода от РКр (Рпр = 1) к различным
значениям Рпр; ®i — коэффициент сжимаемости жидкости по
рис. V. 14 (стр. 87) или по зависимостям: р = а(РкрМ/Ткр) и
p/pi = й/(01.
§ 3. ПРИМЕРЫ РАСЧЕТОВ
Пример X. 1. Вычислить мольную теплоемкость СН4 при 1300 К при постоян-
ном давлении.
Решение. Воспользуемся уравнением
т'
1
Имеем т = 3; т' = Зп —(3 + т) = 3-5 — 6 = 9; 0 для СН< (см. табл. X. 2):
0! = 1870(3); 02 = 217О(2); 03 = 4320(3); 04 = 4400(1) (в скобках дано
число вырожденных колебаний в молекуле, т. е. имеющих одинаковые значения 0;
сумма £ = 3 + 24-34-1=9)
Тогда:
С - 5 + 3 8311 I ЗС 1870 4-2Г 2170 ! ЗС 4320 4- С 4400 . -
СР 2 8,314 + ЗС£ ]300 + 2С£ 1300 +ЗС£ 13М + С£ 130Q
= 33,3 + ЗСЕ (1,44) + 2Се (1,67) + ЗС£ (2,23) + С£ (3,38)
По индексам (в скобках) находим по таблицам функций Эйнштейна (по
справочнику [72] интерполяцией) значения каждой Св = 0/7. Тогда искомое:
Ср = 33,3 + 3 • 7,02 + 2 • 6,61 + 3 • 3,56 + 3,47 = 81,73 Дж/(моль • К)
Пример X. 2. Вычислить для воздуха мольные теплоемкости С» и Ср при 373
и 673 К (Ср/Св = 1,4), истинную удельную теплоемкость при 673 К; объемную
теплоемкость и среднюю теплоемкость в интервале 473—773 и 273—773 К, зная
общую зависимость Ср = 6,5 + 0,001 7 и М = 29.
8* 227
Решение
Ср (373 К) = 6,5 + 0,001 • 373 = 6,87; Ср (673 К) = 6,5 + 0,001 673 =
= 7,17 калДмоль • К)
Со (373 К) = = 4,91; Со (673 К) = ~ = 5,12 кал/(моль • К)
Удельная теплоемкость с — Ср/М:
с (373 К) = 6,87/29 = 0,24; с(673 К) = 7,17/29 = 0,25 кал/(г • К)
Объемная теплоемкость СОб = Ср/22,4:
Соб (373 К) = 6,87/22,4 = 0,31; Соб (673 К) = 7,17/22,4 = 0,32 ккалДм3 К)
Средняя мольная теплоемкость Сср — а + Ь/2(Тъ + 7\):
Сср (473 - 773 К) = 6,5 + (473 + 773) = 7,12;
Сср (273 - 773 К) = 6,5 + (273 + 773) = 7 калДмоль • К)
Пример X. 3. Вычислить мольную теплоемкость метана при 136 атм н 311 К,
зная С’ = 8,8 калДмоль • К); Гпр = 1,63 и />пР = 3.
Решение. По рис. X. 6, а: ДСР = 3,6; откуда искомая СР = 8,8 + 3,6 =
= 12,4 кал/(моль-К).
Пример X. 4. Определить СР СО2 при 373 К и 69 атм, зная Ркр = 73 атм и
Ткр = 304 К; Ср = 9,6 ккалДкмоль • К).
Решение. По рис. X. 6, а: ДСр =3,5; Ср = 9,6 + 3,5 =13,1 ккалДкмоль • К).
Пример X. 5. Вычислить теплоемкость смеси (13) азота (1) и водорода (2)
при 100 атм. Известны: С°, = 6.96 и С°2 = 6,89 калДмоль-К); Ркр. i = 33,5 и
Ркр. 2 = 20,8 атм; Гкр. i = 126,1 и Ткр. 2 = 41,2.
Решение. Рпр , = 100/33,5 — 3; Рпр.2 = 100/20,8 = 4,8; Гпр. i = 298/126,1 =
= 2,4; Т„р. 2 = 298/41,2 = 7,2.
По рис. X. 6, а:
ДСР1=СР1-СР1=О.9 и ДСр2 = Ср2 — Ср2 = 0,12; Ср1 = 6,96 +
+ 0,9 = 7,9; Ср2 = 6,89 + 0,12 = 7; Ср = £ xtCp { = 0,25 • 7.9 + 0,75 X
X 7 = 7,2 калДмоль • К)
Пример X. 6. Вычислить мольную теплоемкость медного колчедана CuFeSj,
зная атомные теплоемкости [в кал/(г-ат-К)]:
ССи = Ясуд = 0,094 • 63,5 = 6; CFe = 0,11 • 55,9 = 6,1; Cs = 5,4
Cn = £ пгС” = 1 • 6 + 1 • 6,1 + 2 • 5,4 = 23,9 калДмоль • К)
Пример X. 7. Определить удельную теплоемкость нафталина СюН8 (М =
= 128).
Решение. По табл. X. 1 атомные теплоемкости С = 1,8 и Н = 2,3;
С = 10 • 1,8 + 8 • 2,3 = 37,2 ккалДкмоль • К);
сУд = С/М = 37,2/128 = 0,29 ккалДкг • К)
Пример X. 8. Вычислить средние мольную, удельную и объемную теплоемко-
сти кислорода при постоянном давлении в интервале 0—1000 °C, зная среднюю
мольную теплоемкость СР = (7,06 + 0,000813/)-4,19 кДж/(кмоль-К).
Решение. СР = (7,06 + 0,000813-1000)-4,19 = 33 кДж/(кмоль-К); Суд —
= 33/32 =1,02 кДж/(кг-К); Соб = 33/22,4 = 1,47 кДж/(м3-К).
228
Пример X. 9. Вычислить удельную теплоемкость сплава состава [в % (масс.)]
50,7 Bi; 25 РЬ; 10,1 Cd и 14,2 Sn, эиая атомные теплоемкости Bi == 0,030; Pb =
= 0,0297; Cd = 0,0555 и Sn «= 0,0496 ккал/(г-ат-К).
Решение. 0,507 • 0,030 4- 0,25 • 0,0297 4- 0,101 • 0,0555 4- 0,142 • 0,0496 =
= 0,0354 ккал/(кг-К).
Пример X. 10. Вычислить удельную теплоемкость 15% раствора КС1 (А4 =
= 75,5), зная атомные теплоемкости К и С1 — 6,2 ккал/(г-ат-К).
Решение. Определим вначале удельную теплоемкость КС1 (тв.):
сКС1 = сат1м = (6>2 + 6,2)/75,5 = 0,16 ккалДкг • К)
И окончательно для раствора:
с = У giCj = (1 — 0,15) -1 4- 0,15 • 0,16 = 0,9 ккал/(кг • К)
Пример X. 11. Вычислить теплоемкость чис-1,2-диметилциклопентана
(СНз)2(СН2)з(СН)2 (как идеального газа) при 300 и 1000К.
Решение. Применим общую формулу СР = а 4- ЬТ 4- сТ2 4- dT3, используя
данные табл. X. 5.
а 5-102 с-104 d-106
—СН2— (в кольце) 3 (-2,137) 3 • 2,473 3 (-0,1195) 3-0,00198
-СП 2 (-1,942) 2 • 2,832 2 (—0,2281) 2 • 0,00661
—СН8 2 • 0,427 2-2,183 2 (-0,0863) 2-0,00111
-9,441 17,449 -1,1073 0,02148
Ср (300 К) == - 9,441 + 17,449 10“2 • 300 - 1,1073 • 10~4 • 3002 +
+ 0,02148 • 10-6 • ЗО0-3 = 33,50 и Ср (1000 К) = 75,74 калДмоль • К)
(опытные значения 32,34 и 85,57)
Пример X. 12. Дан состав газа [в % (масс.)]: 9 SO2, 11 О2 и 80 N2. Опреде-
лить теплоемкость газа, зная удельные теплоемкости: SO2— 0,15; О2— 0,22 и
N2— 0,25 кал/(кг-К).
Решение. Искомая теплоемкость С = 0,09-0,15 4- 0,11 -0,22 4- 0,8-0,25 =
= 0,237 ккал/(кг-К).
Пример X. 13. Установить теплоемкость аммиака при 60 МПа и 473 К.
Решение. По рис. Х.5 Ср = 19,5 ккал/(моль-К).
Пример X. 14. Составить уравнение температурной зависимости теплоемкости
МпС12 в области низких температур, зная зависимость теплоемкости от темпера-
. туры (по справочнику):
Т 14,97 17,53 20,81 23,94 25,13 27,2 29,29 32,5
Cv 0,558 0,78 1,11 1,44 1,57 1,87 2,16 2,65 ....
Решение. Применим формулу Тарасова.
При вычислении Т/С, Т2/С и Т31С получится, что только Г2/С постоянно и
равно « 396. Следовательно, МпС12 имеет слоистую структуру и зависимость
выражается С„ = 43,27 (7/0)2, откуда 8 — а Д43.’2^ Т Подставляя в уравие-
V Cv
ине значения С» и Г и вычисляя для всех температур, находим 8 «= 325. Следо-
вательно, искомая С„ = 43,27(Т/324)2 = 4,12-10_‘ Т2.
Пример Х.15. * Определить по способу Микулина удельную теплоемкость
при 293 К раствора, содержащего с2 = 2,67 NaCl; с2 = 1,31 MgCl2 (моль/л).;
р = 1,189 г/см3.
Решение. По табл. VII. 3: А$аС1 = 1,75 и 6мвс1 = 3,31; J — £ ~
= 1,75 • 2,67 4- 3,31 • 1,31 = 9.
* По примерам X. 15—X. 18 см. [7, 11, 71].
229
По рис. X. 10 определяем 0: 0NaCi = —0,012, 0Mgci = —0,052.
Соб = 0,998 - 0,012 • 2,67 - 0,052 • 1,31 = 0,9 ккал/(л • К)
Искомая удельная теплоемкость смешанного раствора:
Ср — Соб/р = 0,9/1,189 = 0,76 ккал/(кг К) (опытное значение 0,764)
Пример X. 16. Определить при 293 К теплоемкость раствора, в котором С, =
= 13,1 NaCl иС2 = 10,5 MgCl2 [% (масс.)].
Решение. Находим по способу Здановского (см. пример VII. 3, стр. 149):
Xi = 24,4%; х2 = 20,9%; а — 0,753. Теплоемкости [в ккал/(кг-К)] растворов со-
лей: 26,4% NaCl — 0,787; 20,9% MgCl2 - 0,737.
С„ • 0,787 4- • 0,737 = 0,76 ккал/(кг • К) (опытное значение 0,764)
ли>4 хи,У *
Пример X. 17. Вычислить теплоемкость жидкого 2-метилпентана (М = 86,2)
при 293 К.
Решение. Сумма атомно-групповых составляющих теплоемкости:
3 (—СН3) + 2 (— СН2—\ + 1 (—= 3 • 9,9 + 2 • 6,3 + 1 • 5,4 =
I I ) V I /
= 47,7 кал/(моль • К)
Ср = 47,7/86,2 = 0,555 кал/(г-К) (опытное значение 0,533)
Пример X. 18. Вычислить теплоемкость бензола (М = 78,1) при 298 К, зная
Ткр « 563,7 К.
Решение. Тпр = 298/563,7 = 0,53; Ь = 0,00133 (см. стр. 226).
По формуле Ватсона:
Ср = 0,00133 • 78,1/(0,1745 - 0,0835 • 0,53)2-8 = 31,4 калДмоль • К)
(погрешность —3,5%)
Глава XI
ВЯЗКОСТЬ ГАЗОВ И ИХ СМЕСЕЙ
16, 7, 11, 16, 40, 53, 92]
§ 1. ОБЩИЕ ПОЛОЖЕНИЯ
Вязкость (внутреннее трение) — это свойство оказывать сопро-
тивление перемещению одного слоя вещества относительно дру-
гого. При этом если первый слой стремится ускорить движение
второго, то второй стремится замедлить движение первого (сила
трения). В результате этого в первом слое возникает ускоряющая
сила F, а во втором — равная ей по величине замедляющая сила
трения. Считая, что F пропорциональна площади соприкосновения
слоев s и скорости перемещения их относительно друг друга (раз-
ности их скоростей Ди), можно написать: F = \is-~ — рас-
стояние между слоями).
Коэффициент пропорциональности ц называют динамическим
коэффициентом вязкости или вязкостью (внутренним трением); он
зависит от природы и состояния вещества (температуры и давле-
ния).
Передвижение потока газа или жидкости сопровождается поте-
рей энергии.
По уравнению Ньютона
г. dv
где dv/dl — grad v — градиент скорости, характеризующий ее из-
менение в направлении, перпендикулярном плоскости соприкосно-
вения слоев, 1/с.
Знак минус указывает на то, что касательное напряжение тор-
мозит слой, движущийся с относительно большей скоростью, а пе-
ренос количества движения происходит в направлении уменьшения
скорости. Векторы внутреннего трения и скорости имеют противо-
положное направление.
Используя формулу Ньютона, для ламинарного потока жидко-
сти, линейная скорость которого в направлении, перпендикулярном
231
плоскости сдвига, равна нулю, можно записать:
ц = F/(s grad о) Па/м2
Здесь F — сила сдвига (н), отнесенная к площади s (м2); F/s —
напряжение сдвига [Па (1 Па == 1 Н2/м)].
Между вязкостью, теплопроводностью и диффузией можно про-
вести аналогию, поскольку они связаны с процессами молекуляр-
ного переноса: вязкость — количества движения, диффузия — мас-
сы, теплопроводность — теплоты. Эти явления молекулярного пере-
носа необратимы; результат их действия — достижение равновес-
ного состояния.
Величина обратная вязкости — текучесть % = 1/р, Па-1-с-1
[10 Па-1-с-1 = 1 ре].
Помимо параметра ц вязкость можно характеризовать кинема-
тическим коэффициентом вязкости *:
V = ц/р м2/с
Условную вязкость (в градусах ВУ) определяют вискозиметром
Энглера; формулы пересчета показаний вискозиметра:
в единицы кинематической вязкости — v = 0,076
vt = 7,4. Ю~6 (ВУ), (ВУ < 16°)
в единицы динамической вязкости — ц = | 7,24Е--------4т- I —ттт
К Е J g • 10е
(Е — вязкость в градусах Энглера; g = 9,81 м/с2)
Вязкость неполярных газов при умеренном давлении и высоких
температурах можно вычислить по -уравнениям, использующим по-
тенциал Леннарда — Джонса ______________
Vмт
и = 0,0026693 } мПа • с (XI. 1)
a
в котором й<2’2)— функция переменной Т* = kT/tS'o (табл. XI. 1);
о и с?о — постоянные сил (см. табл. III. 3, стр. 29).
Приведенные на рис. XI. 1 параметры & и Т* можно определить
по следующим эмпирическим зависимостям (см. стр. 28):
^«0,75Гкр или 1,77 (Гкр)^, ИЦк« 1,39ГКИП или 1,15ГКИП или 1,9ГПЛ
а = 0,833VX. Лол. кр ~ см’/моль) или 0,561
ЙГ/^0=1,ЗЗГпр
Уравнение (XI. 1) применимо, согласно теории Чэпмена — Эн-
скота, для расчетов вязкости и при очень высоких температурах
(в плазме, например).
Более точные значения получаются при использовании попра-
вочного коэффициента /ц, зависящего от Т* (табл. XI. 2): р/ = |ДЙ.
* В дальнейшем динамический коэффициент вязкости ц для краткости будем
называть просто вязкостью, а кинематический коэффициент вязкости v — коэф-
фициентом вязкости.
232
Таблицах!. 1
Функции для расчета свойств неполярных газов
г* Q(I.I) q(2.2) Г* йП.О q(2,2) -
0,30 2,662 2,785 2,70 0,9770 1,069
0,40 2,318 2,492 2,90 0,9576 1,048
0,50 2,066 2.257 3,10 0,9406 1,030
0,60 1,877 2,065 3,30 0,8256 1,014
0,70 1,729 1,908 3,50 0,9120 0,9999
0,80 1,612 1,780 3,70 0,8998 0,9870
0,90 1,517 1,675 3,90 0,8888 0,9755
1,00 1,439 1,587 4,10 0,8788 0,9649
1,10 1,375 1,514 4,30 0,8694 0,9553
1,20 1,320 1,452 4,50 0,8610 0,9464
1,30 1,273 1,399 4,70 0,8530 0,9382
1,40 1,233 1,353 4,90 0,8456 0,9305
- 1,50 1,198 1,314 6,0 0,8124 0,8963
1,60 1,167 1,279 8,0 0,7712 0,8538
1,70 1,140 1,248 10,0 0,7424 0,8242
1,80 1,116 1,221 30,0 0,6232 0,7005
1,90 1,094 1,197 59,9 0,5756 0,6504
2,00 1,075 1,175 70,0 0,5464 0,6194
2,20 1,041 1,138 90,0 0,5256 0,5973
2,40 . 1,012 1,107 200,0 0,4644 0,5320
2,60 0,9878 1,081 400,0 0,4170 0,4811
Таблицах!. 2
функции для определения коэффициентов вязкости ц,
теплопроводности Х и диффузии D чистых неполярных газов
и их смесей (область умеренных давлений)
г» Л’ В* h. fD Т' Л* в* fn fx fD
0,3 1,046 1,289 1,0014 1,0022 1,0001 3 1,095 1,101 1,0034 1,0052 1,0037
0,5 1,093 1,284 1,0002 1,0003 1,0000 4 1,098 1,095 1,0049 1,0076 1,0050
0,75 1,105 1,233 1,0000 1,0000 1,0000 5 1,101 1,092 1,0058 1,0090 1,0059
1,0 1,103 1,192 1,0000 1,0001 1,0000 10 1,110 1,094 1,0075 1,0116 1,0076
1,25 1,099 1,165 2,0001 1,0002 1,0002 50 1,130 1,095 1,0079 1,0124 1,0008
1,5 1,097 1,143 1,0004 1,0006 1,0006 100 1,138 1,095 1,0080 1,0125 1,008Й
2 1,094 1,119 1,0014 1,0021 1,0016 400 1,154 1,095 1,0080 1,0125 1,0080
Пользование номограммой рис. XI. Г. на шкалы номограммы на-
носят определенные значения 0 и Т* и соединяют их прямой, пере-
сечение которой со шкалой у, дает искомое значение вязкости. Если
значение 0 неизвестно, но дана вязкость газа при одной темпера-
туре, то по номограмме можно определить значение 0, а затем
найти искомую вязкость при любой температуре.
Преобразованные уравнения (по Бромлею и Уилку):
р = 0,333. Ю-4 (ТкрМ)* V~^ кр (1,ЗЗТПР) мПа • с (XI. 2)
I* = 0,42а- \(Г3м'^Т~Ч>[ (1 ,ЗЗТпр) мПа • с (XI. 3)
233
Значения функции f (1,33 Тпр) приведены ниже (интерполяция
по Г*):
т* f Г* f т* f Г» f
0,3 0,1969 1,35 0,8449 2,8 1,5861 4,9 2,3926
0,4 0,2540 1,45 0,9036 3,0 1,6728 6,0 2,751
0,5 0,3134 1,55 0,9611 3,2 1,7573 8,0 3,337
0,6 0,3751 1,65 1,0174 3,4 1,8388 10 3,866
0,7 0,4384 1,75 1,0729 3,6 1,9186 30 7,880
0,8 0,5025 1.85 1,1264 3,8 1,9962 50 10,958
0,9 0,5666 1,95 1,1790 4,0 2,0719 70 13,615
1,0 0,6302 2,1 1,2558 4,2 2,1457 90 16,010
1,1 0,6928 2,3 1,3547 4,4 2,2180 200 26,80
1,2 0,7444 2,5 1,4501 4,6 2,2888 400 41,90
1,3 0,8151 2,7 1,5417 4,8 2,3583
Предложен ряд эмпирических и полуэмпирических зависимостей
на основе теории соответственных состояний, критических и приве-
1,0 --
200-хг
150^
100-. г
80~.:г
eoi:7
50--
40--
ЗО-.'г
20-.'-
15^.7
/,о
0,8
0,7
0,6
0,5
0,4'
700 т
ООО: -
SOO:;
400-.’-
Рис. XI. 1. Номограмма для определения вязкости газов.
денных параметров:
М'крЧ» Т'1а
по Лихту н Штехеру — цг = 29,6 • 10~12----------52—
Гкр ГпР + °.8
цкр = 1,65 Па-с
234
для полярных и неполярных соединений, не содержащих водорода —
Икр = 16 • Ю~1 Па • с
^ = Нкр^р965 (^пр<1)
Нт = НкрТ°пр71+0’29/ГпрПа.с(Тпр>1 и до 1200 °C)
. 27 lO^Atf’M2
р. = , мкПа • с
у'» it -4- 1,477 )
мол. кип V ~ кип'
<А₽ - па; ’'мол. кип - м3/кмоль).
Зная вязкость при одной температуре, можно вычислить вяз-
кость при другой, используя приближенную зависимость:
— /7 IT ТпР- 1 + 0,8
I* l1! (^пр/^пр. l) т +08
(pi — вязкость при приведенной температуре Тпр. i).
Зависимости:
по Фальковскому — ц = 1,286 • 10_4Л11^Р^р7’Пр мк”а с
Т1'2
по Арнольду — ц = 0,0027 —-----—-----------ЕВ-------мПа • с;
у/» 7 -L 1 477
* МОЛ. КИП пр Г пр. кип
т ~ кип
1 пр. КИП т
кр
Таблица XI.3
Интегралы столкновений Q для определения вязкости,
рассчитанные с помощью потенциала Стоккмайера
Г* б*
0 0,25 0,75 1,0 2,0 2,5
о,1 4,1005 4,266 5,742 6,729 10,34 11,89
0,2 3,2626 3,305 3,914 4,433 6,637 7,618
0,3 2,8399 2,836 3,168 3,511 5,126 5,874
0,4 2,5310 2,522 2,749 3,004 4,282 4,895
0,5 2,2837 2,277 2,460 2,665 3,727 4,249
0,6 2,0838 2,081 2,243 2,417 3,329 3,786
0,7 1,922а 1,924 2,072 2,225 3,028 3,435
0,8 1,7902 1,795 1,934 2,070 2,788 3,156
0,9 1,6823 1,689 1,820 1,944 2,596 2,933
1,0 1,5929 1,601 1,725 1,838 2,435 2,746
1,4 1,3551 1,365 1,461 1,544 1,989 2,228
1,8 1,2219 1,231 1,306 1,370 1,718 1,912
2,0 1,1757 1,184 1,251 1,307 1,618 1,795
2,5 1,0933 ' 1,100 1,150 1,193 1,435 1,578
3,0 1,0388 1,044 ' 1,083 1,117 1,310 1,428
3,5 0,99963 1,004 1,035 1,062 1,220 1,319
5,0 0,92676 0,9291 0,9473 0,9628 1,058 1,121
7,0 0,87272 0,8741 0,8845 0,8935 0,9505 0,9893
9,0 0,83795 0,8388 0,8456 0,8515 0,8895 0,9160
235
Значение коэффициента вязкости компонентов смеси, если из-
вестен коэффициент диффузии Dlt г:
544,^2 PDt 2
Р1, 2 =--------- —-----
3^ + М,) Al2RT
(й?,2 — функция; см. табл. XI. 2).
Зависимость для вязкости пара рп и жидкости цж при t бли-
зи /кР:
1/цп+1/цж = 6330+ 13(/кр-0
Для расчета вязкости полярных газов применяют ‘ потенциал
Стоккмайера (см. табл. III. 3, стр. 29)« Тогда вязкость описывается
соотношением
ц = 266,9 VmT/W2’2’^^
в котором S* = 72у,2/<!?0ст3 (у, — дипольный момент табл. XI. 3).
§ 2. ЗАВИСИМОСТЬ ВЯЗКОСТИ ГАЗОВ
ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ
Вязкость газов увеличивается
порционально ^Т) (рис. XI. 2)
газа, тем больше увеличивается
Рис. XI. 2. Зависимость вязкости га-
зов от температуры:
1—Ar: .2—Ог: t—Не; 4—воздух; 5 — N2;
е— СО2; 7— NHa; S~ Н2
с повышением температуры (про-
. Чем выше молекулярная масса
вязкость с повышением темпера-
туры. Принимается, что вязкость
пропорциональна Тп, где п при
низких температурах прибли-
жается к I, а при высоких темпе-
ратурах— к 0,5.
Если температура увеличи-
вается от 0 до 1000 °C, то вяз-
кость увеличивается в 3—4 раза
(табл. XI. 4).
Зависимости на основе соот-
ветствующих состояний
1g Уг = A 1g Рп + В;
1g Цг + A' 1g у' + В'
где — искомая вязкость раза
при Т; у'-—вязкость стандартно-
го газа; Рп — давление насыщен-
ного пара стандартного соедине-
ния при Т; А, В, А', В' — постоянные для пары искомый газ — стан-
дартное соединение. Приведенные уравнения решают графически,
откладывая на оси абсцисс температуры, соответствующие давле-
ниям насыщенного пара Рц стандартной жидкости (воды), а на оси
ординат — вязкость газа, -
236
Таблица XI.4
Вязкость газов ц • 10в, (Па с)
t. °C т. к Н2 n2 о2 Воз- дух СО СО2 Н2О SO2 NH3 С<2 на H2S
0 273 0,84 1,66 1,91 171 1,66 1,37 0,88 1 16 0,94 1,25 1,32 1,18
100 373 1,03 2,09 2,44 2,18 2,08 1,83 1,25 1,61 1,28 1,68 1,83 1,61
200 473 1,21 2,46 2,87 2,59 2.45 2,25 1,62 2.04 1,65 2,09 2,30 2,03
300 573 1,38 2,80 3,31 2,94 2,79 2,65 1,98 2,46 1,99 2,50 2,76 2,43
400 673 1,54 3,12 3,69 3,28 3,09 2,99 2,35 2,82 2,34 2,92 3,16 2,78
500 773 1,69 3,40 4,03 3,57 3,37 3,31 2,72 3,16 2,65 3,33 3,55 3,12
600 873 1,83 3,66 4,35 3,84 3,63 3,60 3,09 3,46 2,92 3,73 3.91 3,41
700 973 1,96 3.92 4,65 4,11 3,87 3,88 3,46 3,76 3,21 4,13 4,25 3,70
890 1073 2,10 4,16 4,94 4,36 4 10 4,14 3,82 4,04 3,48 4,52 4,55 3,97
900 1173 2,23 4,39 5,21 4,61 4,33 4,40 4.19 4,30 3,74 4,91 4,83 4,23
1000 1273 2,36 4,60 5,47 4,85 '4,53 4,66 4,56 4,54 3,99 5,29 5,07 4,45
1100 1373 2,48 4,84 5,73 5,07 4,73 4,91 4,93 4,76 4,24 5,66 5,29 4,66
1200 1473 2,60 5,С8 5,97 5,29 4,91 5,14 5,31 4,95 4,48 6,03 5,47 4,85
1300 1573 2,72 5,32 6,21 5,49 5,08 5,37 5,68 5,13 4,72 6,40 5,63 5,01
1400 1673 2,84 5,56 6,44 5,69 5,27 5,58 6,05 5,29 4,95 6,76 5,76 5,17
1500 1773 2,94 5,80 6,65 5,88 5,42 5,79 6,42 5,41 5,18 7.11 5,86 5,29
По Мейсснеру зависимость вязкости при температуре кипения:
т'1* М4’
I* . 10е = 0,128 —ки° ' Па • с
п'*
(п — число атомов в молекуле газа).
Зная значение вязкости при 273 К или другой температуре Т,
можно определить вязкость при заданной температуре. Например,
по зависимости Сатерленда:
„ 273 + С ( Т Х’Л
Н т + с { 273 )
Здесь рт — вязкость газа при температуре Т\ ц° — вязкость газа
при 273 К; С — постоянная Сатерленда, приводимая ниже:
Азот 113 Кислород 125
Аргон '169,9 МетаноЛ 487
Аммиак 465 Пар водяной 961
Водород 71,7 Метан 168
Воздух 122 Сернистый ангидрит 430
Гелий 80,3 Хлор 350
71,7 Хлористый метил 459
Двуокись углерода 239,7 Этилен 226
Окись углерода 118
Кроме того, С = 1,47 ТКИП-
Приводим также зависимости:
.. __V * кип т С . 275о0,5
Ну НКип Тккп ) Т | С ’ Нкип кип
Ш = / Т2 У/* Г 1 + 1,477кип
На к Т1 ) Т2 + 1,47Ткип
Среднее значение: Сср = 90 + 70
237
Когда известна вязкость газа pi при Т1( можно примерно опре-
делить значение ц2 при заданной Т2 по зависимости на основе по-
тенциала Леннарда— Джонса (по Бромлею и Уилку):
и, Т* /£2<ь') н
u2 T*J Q.™’ p2
JiL .)
~ /' (ЬЗЗГпр,2)
(XI. 4)
(XI. 4a)
(T'np. i — T'i/T'kp) T'np. 2 — Т’г/^'кр)
Значения вспомогательной функции f приведены на стр. 234:
^olk — в табл. III.2, стр. 27, а значения Q —в табл. XI. 1 в зави-
симости от того, является газ неполярным, характеризуемый потен-
циалом Леннарда — Джонса, или полярным, характеризуемый по-
тенциалом Стоккмайера»
Коэффициент вязкости насыщенного и перегретого пара:
1 ... 1
0,955 - 1,42- 10-3рн 1 — 4 -10~6 (/п — 120) рп
В области небольших значений давления вязкость газов почти
не зависит от него. По достижении некоторого предельного значе-
ния она возрастает с увеличением давления (или плотности), осо-
бенно при низких температурах.
Для вычисления вязкости газов, а также выявления влияния
давления и температуры на нее можно использовать зависимости,
следующие из соответственных состояний. При этом для газов
Нпр = ц/ркр есть функция от Рп₽ и Тир; для всех газов цПр пример-
но одинакова.
Установлено, что ц (ткр/МР1рУ!е = const; иными словами, этот
фактор для разных газов должен иметь одинаковые значения в со-
ответственных состояниях. Следовательно, р7УМол = f (7щ>, Лц»).
Для определения влияния давления и температуры на вязкость
газов большой плотности применим метод корреляции, когда отно-
шения ц/ц° и p/цкр могут быть выражены через приведенные пара-
метры.
Один из таких методов (Ватсона и Юэхара) сводится к опреде-
лению значения приведенной вязкости цПр = цр/|1кр, откуда
^Р = Нкрнпр (XI. 5)
где цр — вязкость газа под давлением Р. На рис. XI. 3 приведен
график зависимости цПр от 7пр и РПр; кривая 7 характеризует цПр,
не зависящую от давления.
Для двухатомных газов, в мкПа-с:
цКр « 61,6 • 10 3
уг1а
* мол. кр
цкр = 3,62 -10-4
м',2Рг1‘
1,1 Г кр
tVs
кр
(XI. 6)
(XI. 7)
238
Часто в расчетах используют ацентрический фактор со (соц'сог =
=Р1/рг). Зная УМол или pi жидкости при и Plt можно вычислить
Рис. XI. 3. Зависимость приведенной вязкости от приведенных темпера- -
туры н давления.
значение со: со = 0,1745 — 0,0838 Гпр; соНр = 0,044, поэтому при
VKp—м3/кмоль; Р— Па и <5—кг/м3:
ц =0,77.10-2—= 0,77 • 10~2 Гкр - мкПа • с (XI. 8)
(V ,со)7« М'1
I" мол. 1 /
По диаграмме рис. XI. 3 можно определить значение у,Пр. i для
7] и Р1г а из зависимости цпг>. i — щ/Цкр ~ Икр = Pi/Цпр.ь
239
На основе теории соответственных состояний вязкость можно
определять и из отношения вязкости газа при высоком давлении
к вязкости в области умеренных давлений; это отношение — од-
нозначная функция Тпр и Рпр: Цр/р0 = f(Tnp, Рпр).
На рис. XI. 4 кривые для разных газов сливаются: каждой паре
Тпр и Рпр соответствует одно примерно одинаковое для всех газов
значение цПр и Цр/р°. Когда для газа известны Ткр и Ркр, то при за-
данных Т и Р определяют Тпр и РПр, а затем по рис. XI. 4 устанав-
ливают отношение цр/р,0. Значение р° определяют по одному из
вышеуказанных способов (этот метод неприменим к водяному
пару)..
давлении к вязкости ц° при той же температуре, но при
умеренном давлении от ГПр и Рпр.
В критической точке диаграммы, когда Тпр = 1, РПр = 1 и
Рпр = 1, отношение цкр/ц°р = 2,2 — вязкость газа при Ткр).
Откуда Ркр = 2,2р,ор (для двухатомных газов — 2,14).
Рис. XI. 5 построен для условия Рпр < 4.
По Филиппову и Предводителеву для высоких давлений вяз-
кость рассчитывают на основе принципа подобия, используя «раз-
ность вязкостей»
Др = Ир, т ~ Рт
где цр, т — вязкость при Т и Р; р-р — вязкость при умеренном дав-
лении иТ
Значение Ар можно установить и из зависимости Филиппова и
Ишкина:
q=. Р кР
240
Обобщенная зависимость:
а = а — Р<о
(аир — безразмерные параметры; w = рТкр1Ркт,М).
Для N2, О2, СО, СО2, СН4, СН2, СНз, СН3СН2, С2Н4; а =
= 5,33—0,0387(0.
’,8т pVp"p^/Vnp
1,6--
1,5-z-
1,4^-
tji-
U-
i,ii-
7,0-= -
0,9 i-
40-=:
0,7-=-
0^|-
0,si-
0,4
Гпр
S’.5^W
’^4
OJS
0,65
0,55
0,45
0,35
3
o,e
0,7
Ofi
0,5
0,4
-1,4
-1,5
-1,6
-I,7
-1,8
-1,9
~2fi
-2,1
-2,2
0,3
-4,0
-4,5
-5,0
-5,5
Рис. XI. 5. Номограмма для определения поправок ьа
плотность для вязкости газов Цр/р0-
Корменс и Беенаккер приводят корреляцию:
и/и° == 1 + [о,55р’ + 0,96 (р’)2 + 0,61 (р*)3] (ГТ0,59
Здесь р — искомая вязкость; — вязкость газа при низком дав-
лении; р* = pb0 (р — моль/см3); Ьо — объем «твердой сферы», рав-
ный 2/3лМ)О3.
Зависимость вязкости рР от давления (по Энскогу):
241
Здесь у — функция от Ь0/Умол
у=+°-625 (-тЛ-)2+о>2869 (-Л-У+°>115 (-Л-)4 + • • •
К МОЛ X V МОЛ / X V мол / X V мол /
ИЛИ
{/ =2— 1
где Умол — мольный объем сжатого газа при Т и Р, см3/моль; z—
коэффициент сжимаемости газа.
Параметры у и z можно рассчитывать, пользуясь диаграммой
рис. XI. 6. Зная коэффициент сжимаемости z, можно определить
Рис. XI. 6. Зависимость 2 = у 4- 1 от приведенных температуры и давления.
мольный объем газа Умол в зависимости от Т и Р и вычислить зна-
чение Ьо, если известна постоянная сил о газа.
Упрощенная формула (по Гарднеру):
цр/цО = 1 + 0.175&Р + 0,8651 (6р)2
(р — плотность газа, г/см3; b — поправка, см3/г; b = 1,783 X
X 10-7 Г°'75р0 1.5^4-0,25).
Эта формула неточна для сложных газов.
На рис. XI. 7 приведены зависимости вязкости различных газов
от температуры и давления.
§ 3. ВЫЧИСЛЕНИЕ ВЯЗКОСТИ ГАЗОВОЙ СМЕСИ
По Уилку зависимость для многокомпонентных смесейз
фм = [1 +(h7h/)‘/4m//mJ'/?/{V8 [1 + (М(./М/)Р}
Значение Ф;, j (путем взаимной перестановки индексов)
ф^ = №)(^/М/)Ф/(/
242
Рис- XI. 7, а, б-
243
Рис. XL 7, в, г.
244
6г д
Рис. XI. 7. Зависимость вязкости от давления и температуры для различных
газов:
а—высокие давления; б—азот; в—вода и водяной пар (/—кривая насыщения; // и ///—об-
ласти воды перегретого пара); г—водяной пар; д—воздух; его составляющие и продукты
сгорания; для продуктов сгорания |Л=а|Л^, если они содержат 11% НгО и 13% (об.) СОг;
а—поправочный коэффициент.
ИЛИ
цси =-------------------Н-------------------+ ... (XI. 9)
Ц-^-Фьг+^Фьз 1+^-Ф2.>+^1Ф2,з
X} Xj Хд Х2
(i, j — компоненты смеси; Ф — функция вязкости; ц — вязкости
компонентов; х — мольные или объемные доли компонентов смеси).
Для бинарной смеси из компонентов 1 и 2, например:
[1 + (И1/И2)'а WmJW
2 V2 (1 + MJAh)'1*
и
[1 + (HL/H1)1/3
2^2 (\ + М2/М})'1г
(XI. 9a)
Приведенные соотношения иллюстрируем рис. XI, 8.
245
Рис. XI. 8, а, б.
Буденберг и Уилк приводят следующую эмпирическую зави-
симость:
цо 2-------Ь--------+---------Е2-------- (Xi. 10)
’ 1 + 1,385— —1 + 1,385— -
*1 Р1^1,2 Хг Pl^/1,2
(х— мольные доли газов 1 и 2; р — их плотности; О112 — коэффи-
циент диффузии газов).
Для приближенных расчетов вязкости газовой смеси рСм Хен-
нинг и Ципперер предложили эмпирическую формулу:
*ih ум,Гкр , +х.-ц2Л/М2гир 2 + ...
ЦС“ ^V^i7’kp.i + ^V^kP.2+ ••• ( ’
(х —объемные доли газов 1 и 2).
247
Значения Ркр и ГКр принимают средними; их определяют сум-
мированием значений для отдельных компонентов, умноженных на
их мольные доли.
Значения л/МТкр приведены ниже:
Н2 8,13 n2 59,5 С3Н8 128
Водяной пар 108 О2 70,2 С4Ню 157
Воздух 61,9 с2н4 89,0 С6н12 184
СО 61,4 сн4 55,1 свн14 209
со2 115,5 с2нв 95,6
Для определения вязкости газовой смеси при высоком давлении
следует по формулам (XI. 9) и (XI.11) найти значения р,см при
умеренном давлении и температуре Т. Затем вычислить псевдокри-
тические параметры газов аддитивно суммированием составляю-
щих критических параметров компонентов смеси:
^пкр Гкр. 1*1 + ГкрХ2 + Л1КР ^кр. 1Х1 + ^кр.2Х2 +
После чего вычислить приведенные параметры ГПр = Т/Тт? и
Агкр = Р/Рпкр, затем по обобщенной диаграмме рис. XI. 4 опреде-
лить значения цРсм/Цсм и окончательно р,Рсм.
Зависимость для вычисления вязкости двойных неполярных га-
зовых смесей Па-с
И1,2 = 266,93
^ЧМхМ2Т1(Мх + м2) -
где й<2-2) приведены в табл. XI. 1; Т* — кТ[&й — в табл. XI. 1, а
= и 01,2 = q‘ + °2- — в табл. III. 3, стр. 29.
Зависимости для неполярных газовых смесей при невысоком
давлении (не содержащих водород или гелий) по Дину и Стилу:
Немцем = 34 10-(Гпр<1,5)
Немцем = П6-8 •10-5 (°-1338Гпр - 0,0932)’/’ (Гпр > 1,5)
(XI. 12)
Значения параметров Гпкр.см, ^пкр.см определяются по модифи-
цированному правилу Праусница и Ганна (см. гл. V):
Т'пкр. см Zu х^кр. I’ 2пкр. см Zu XiZKp. I
2 РТ
v - Г rV • Р — ПКР-см ПКР‘ см
*пкр. CM Zu F кр. Р * пкр см. у
пкр
Зависимость для определения вязкости неполярных газовых
смесей цем при высоких давлениях и жидкостей при высоких тем-
пературах по методу остаточной вязкости (по Дину и Стилу):
(Пси - Н°сМ) ?ем = 10,8 • Ю~5[ехр (1,439рппр) — ехр (-1,11 Ip^)1-858]
248
Здесь ц°м — вязкость смеси при низком давлении; рПКр.см =
— Рпкр. см/^пкр. смЯТ’пкр. см — псевдокритическая плотность смеси; рппр=
=Рсм/рпКр. см - псевдоприведенная плотность; >см=см / Р£р. СМЛ1*.
Рис. XI. 9. Зависимость вязкости различных газовых
смесей при 400 К и атмосферном давлении от содержа-
ния с второго компонента.
Рис. XI. 10. Зависимость вязкости воздуха от температуры при раз-
личных давлениях.
На рис. XI. 9 и XI. 10 приведены вязкости газовых смесей и
воздуха.
249
§ 4. ПРИМЕРЫ РАСЧЕТОВ
[6, 7, 11, 16, 66]
Пример XI. 1. Вычислить рг водяного пара при 534,5, зиая вязкость пара
при 273 К Ц° = 0,0094 мПа-с; ГКип воды = 373 К.
Решение. Значение &olk = 1,39 Гнил == 1,39-373 = 519 К; Т0 = кТ1ёй =
273/519 = 0,526.
На рис. XI. 1 проводим прямую через точку — 0,0094 и TQ = 0,526 и по-
лучаем 6 = 10,2 и Т* = kT$0 = 534,5/519 = 1,028.
Теперь соединим найденное значение 0 = 10,2 с Т* = 1,028 и получаем:
Рг = 18-Ю-6 Па-с.
Пример XI. 2. Вычислить вязкость водяного пара при 534,5 К, зиая pi =
= 0,0094 мПа-с при 273 К.
Решение. Воспользуемся формулой (XI. 4а). Имеем: Гнр воды — 647,3 К?
Гпр. 1(273 К) = 273/647,3 = 0,422; Гпр. 2(534,5) = 534,5/647,3 = 0,826.
,-ЗЗГпр.1 = 1.33-0,422 = 0,561; 1,33 Гпр>2 = 1,33 • 0,826 = 1,1
Из данных, приведенных на стр. 234 (интерполяцией по Г*): /(0,561) =
= 0,3509; /(1,1)= 0,6928.
И окончательно:
1*2 == 1*1
/(ЬЗЗГпр,2)
= 0,0094
0,6928
0,3509
= 0,0185 мПа • с (опытное значение 0,019)
Пример XI. 3. Установить вязкость паров ацетона Л4 = 58,1 при 523 К и
0,1 МПа.
Решение. Данные для расчета по формуле (XI. 2):
Гкр = 508,7; Умол< кр = 216,7 сМз/моль; Г„р = Г/Гкр = 523/508,7 = 1,029
1,ЗЗГпр = 1,369; / (1,369) = 0,856 (см. стр. 234)
И окончательно:
0,00333 (58,1 • 508,7)'^ • 0,856 пп1ос „
ц =----------1------------------= 0,0136 мПа • с
(216,7-Ю-3)7*
Пример XI. 4. Определить вязкость СО2 (44 = 44) при 373 К и 0,1 МПа.
Решение. Воспользуемся формулой (XI. 1). По табл. III. 2 (стр. 27) найдем
значения Sa/k — 190 К и а = 3,996 А; тогда Г* = kT/&0 = 373/190 = 1,963. По
табл. XI. 1 £2(2-2> = 1,182.
И окончательно:
л/44.37
11 “ °-0026693 (3.996? 1,182 “ °-01813 ”Па ' С
Пример XI. 5. Вычислить вязкость гексана (М = 86,2) при 423 К.
Решение. Используя данные табл. III. 2, определяем значения:
VaWF V86,2-413;
----а2-----------ЗДР----= 6121 и kT,S0 = Т = 1,03
По номограмме рис. XL 1 находим р = 9,2 мкПа-с.
Пример XI. 6. Вычислить вязкость этанола (полярное соедииеиие; М = 46,1)
при 423 К.
Решение. Используем потенциал Стоккмайера и формулу (XI. 1).
По табл. III. 3 (стр. 29) = 431 К; а = 4,31 А; б = 0,3. Тогда Т* =
= kT/g0 = 423/431 = 0,981; по табл. XI. 1 Q<2-2> = 1,63.
И окончательно:
ц = 0,0026693-УлЙ7<Т2£2(212) = 0,002669 V46.1 • 423/4,312 • 1,63 =
= 0,0123 мПа-с (опытное значение 0,01232)
250
Пример XI. 7. Определить вязкость СОг при 1073 К, зная вязкость при
0,1 МПа и 273 К р2 = 0,01370 мПа-с; Ткр = 304 К.
Решение. Воспользуемся формулой (XI. 4).
Определим значение S’o/k = 0,75 ТКР = 0,75-304 = 228; Т* = kT/«S’о =
= 273,2/228 = 1,2.
Из данных вывода, стр. 234, имеем:
/(1,2)= 0,7444 при 273 К, а при заданной температуре 1073 К Т* = kTfSa =
= 1073/228 = 4,71; тогда /(4,71) = 2,327.
И окончательно:.
И. _ /(^,/<У0)________И. _ 2,327 . ц — 0 042 мПа • с
р2 f(kT2/^0) ~ 0,0137 ~ 0,7444 ’ И1 °’042 мП
Пример XI. 8. Определить вязкость паров хлороформа (М= 119,4) при 523 К.
Решение. Данные для расчета по формуле (XI. 3):
Т„п = 534,1 К; Р„п = 5,38 МПа; Т = 523/534,1 = 0,98
кр кр пр
Тогда 1,33 ТпР = 1,302 и /(1,302) = 0,8163 (стр. 234).
Окончательно:
р = 0,000423 • 119,4'1‘ 54,Э7* • 534,l~'/s • 0,8163 =
= 0,0191 мПа • с (погрешность + 7,3%)
Пример XI. 9. Вычислить вязкость толуола (М = 92,1) при 523 К, зная
Ткр = 592 К и РкР = 4,08 МПа.
Решение. Тпр = Т/Ткр = 523/592 = 0,883. По формуле (XI. 12):
£ = ^кр 1(м',2рк‘о) = 59277[(92,1)1/2 • 41,6!/‘] = 0,0252
И далее:
р = 34 • Ю-5Г^’ /? = 34 • 10-5 • 0,883!/’/0,0252 = 0,012 мПа • с
Пример XI.10. Установить вязкость азота М = 28 при 323 К и 742 атм, зиая
ТКР = 126 К и Ркр = 3,35 МПа.
Решение. Тпр = 323/126 = 2,54; Рпр = 742/33,5 = 24,3. По табл. III. 2
(стр. 27): = 91,5 К; о = 3,681 А.
Тогда Т* = kTI&0 = 323/91,5 = 3,52. По табл. XI. 1 при Т* = 5,52 Q<2-2> =
= 0,999.
И окончательно:
«•-«“^зЙНда"0-0187 “И""
Из рнс. XI. 4 при ТПр = 2,54 и РПр = 24,3 рР/р° = 2,38; откуда:
Рр = 0,0187 • 2,38 = 0,0445 мПа • с (опытное значение 0,0416)3;
Пример XI. 11. Определить вязкость СО (М = 28) при 393 К и 29,4 МПа.
Критические параметры: Ткр = 134,5 К; РКР = 3,39 МПа; ркр = 0,31 • 103 кг/м3;
Кмол.кр = 28/(0,31 103) = 90,5-10-3 м3/кмоль.
Решение. По формуле (XI. 6):
о оя1/» о 1ОД К*/1
р = 61,6 • 10~3 -р---- ’?„ = 18,6 мкПа • с
кр (90,5 • 10_3)/а
г.р -W-2®
По диаграмме рис. XI. 3 рпр = 1,46; по формуле (XI. 5) рр = 1,46-18,6 =
= 27,2 мкПа с (опытное значение по рис. XI. 6 27,4).
Пример XI, 12. Вычислить вязкость рк₽ СО2 (М = 44).
251
Решение. Данные для расчета по формуле (XI. 7): ГКр = 304,3; РКр —
= 7,16 МПа.
ц = 3,62 • IO”4 44^(7>!6-1°6)/'' = 34 2 мкПа - с
кр 304,3"’
Или иным способом: вязкость СО2 при 273 К по таблицам рр = 13,7 мкПа-с;
Гпр = 273/304,3 = 0,898. По рис. XI. 3 значение Гпр = 0,898 на иижней кривой
соответствует Цпр = 0,401.
По формуле (XI. 5):
А
кр
Нр
1*пр
137,5
= а = 34,3 мкПа • с
0,401
Пример XI. 13. Определить вязкость паров циклогексана (М = 84,2) в кри-
тической точке.
Решение. Данные для расчета по формуле (XI. 8): Гкр = 554,2 К; плотность
при 293 К р=0,7791-103 кг/м3; Гпр=293/554,2 = 0,53; <в = 0,1745 - 0,0838-0,53=
= 0,1301.
И окончательно:
цкр = 0,77 - IO"2
84,2,/в
= 28,5 мкПа- с (опытное значение 28,4)
Пример XI. 14. Определить вязкость цР для СО при 323 К и 68,6 МПа, зная
Тир = 134,5 К; Гкр = 3,39 МПа. Вязкость газа при 323 К И° = 18,64 мкПа-с.
Решение. Гпр = Г/ГКР = 323/134,5; Рпр = 68,6/3,39 = 20,2.
По рис. XI. 1 для этих значений цР = 2,35. Тогда:
цр = 2,35 • 18,64 = 43,8 мкПа • с ч
По рис. XI. 3: рР = 47,6 мкПа-с.
Пример XI. 15. Установить вязкость этилена цр при 5,44 МПа и 313 К, зная
р = 91 кг/м3.
Решение. Данные для расчета по номограмме рис. XI. 5: Гкр = 282,9; РКр =
= 5 МПа; ркр = 220 кг/м .
Вязкость этилена при 313 К ц°= 10,9 мкПа-c; Гпр = 313/282,9 = 1,106;
рпр = 91/220 = 0,414.
Проведем на рис. XI. 5 прямую через точки 0,414 на шкале рпр и 1,06 на
шкале Гпр. Эта прямая пересечется со шкалой рР/р° в точке 1,26. Искомое цР =
= 1,26-109,3 = 13,8 мкПа-c (опытное значение 14,1).
Пример XI. 16. Установить вязкость при 293 К газовой смеси состава:
Газ Z Содержание в смеси, ' % (об.) Доля компонентов Вязкость компонеита, мкПа-с м
VMirKp. i (см. стр. 2^8)
со2 4,8 0,048 14,72 44 115,5
о2 0,3 0,003 20,19 32 70,2
со 26,4 0,264 17,49 28 61,4
Н2 17,2 0,172 8,755 2 8,13
сн4 2,6 0,026 10,87 16 55,1
n2 48,2 0,482 17,81 28 59,5
С2Н6 0,5 0,005 9,09" 30 95,6
262
Решение. Указанные значения подставляются в формулу (XI. 11):
Газ V^/^кр. 1 xi V^Kp. *
со2 81,7 5,54
02 4,2 0,21
со 283,3 16,21
Н2 12,3 1,40
сн4 15,6 1,43
n2 510,8 28,68
С2Н6 4,3 0,48
912,2 53,95
Е Х&1 л/М1Ткр.1 912,2
u„„ = -===j---. . - =------= 16,9 мкПа • с
С“ £ *{ t 53,95
Пример XI. 17. Вычислить вязкость смеси, содержащей [в % (мол.)] 70 СН«
(All = 16) и 30 С4Н10 (М2 == 58,1) при 311 К и 0,1 МПа. Мольные доли х\=0,7;
х2 = 0,3; pi = 0,0115 ицг = 0,0078 мПа-с.
Решение. Применим формулу (XI.9 а).
Значения
/ 0,0115
I 0,00786
2 V2 (1
®I,2
- = 2,23
®2,1
0,00786 \ ’/2
0,0115 )
ИЛИ
^2,1
.«3-о.е
pi Af2 0,0115 58,1
Такие же результаты получаются по номограмме рис. XI. 8, в. И окончательно:
0,0115 0,00786
““-, + £3.мз + ,+£.ол2-
= 0,00987 мПа • с (опытное значение 0,00982)
Можно вести вычисления и по формуле (XI. 11) с привлечением данных вы-
вода, приведенного иа стр. 248:
^„.,=55,1 и VV^=157
Искомый коэффициент вязкости смеси:
0,7 • 0,0115 • 55,1 + 0,3 • 0,00786 • 157 nnnQO_ „
^см =--------0,7-55,1+073-157--------- °’00987 мПа ’С
Г лава XII
ВЯЗКОСТЬ ЖИДКОСТЕЙ,
ЭМУЛЬСИЙ И СУСПЕНЗИЙ
[6, 11, 20, 66, 80, 92]
§ 1. ВЫЧИСЛЕНИЕ ВЯЗКОСТИ ЖИДКОСТЕЙ
Вязкость жидкостей — это свойство оказывать сопротивление их
течению, т. е. перемещению одного слоя' жидкости относительно
другого. Вязкость характеризует возникающее при этом внутреннее
трение.
Зная значение вязкости при заданных условиях, можно вычис-
лить ее при других условиях.
Для приближенного вычисления вязкости жидкостей (кроме се-
русодержащих) можно применить, например, зависимость (по Сау-
дерсу):
lg(lglO|i) = yP»-2,9 (XII. 1)
На рис. XII. 1 приведена номограмма, построенная с привлече-
нием уравнения (XII. 1). В этом уравнении рж — ПЛОТНОСТЬ ЖИДКО-
сти;J — постоянная вязкости; ее определяют аддитивно путем сум-
мирования составляющих, приводимых ниже:
н 2,7 Двойная связь —15,5 —ОН 57,1
с 50,2 Кольцо СОО' 90
N 37,0 5-членное —24 СООН 104,4
0 29,7 6-членное —21 —no2 80
С1 60 Группы 6-член- —СН2— 55,6
Вг 79 ного кольца
I ПО М < 17 -9 М > 16 -17
Положение
орто-, пара-, 3 мета- 1 <
Между постоянной / и мольной рефракцией Rd существует за-
висимость (рис. XII. 2).
На рис. XII. 3 приведена точечная диаграмма (по Перри) для
определения вязкости жидкости при заданной температуре, если
известны вязкости при двух разных температурах. Точку пересече-
254
ния (координаты х и у) двух прямых pi (Л) и цг(^) соединяют с
заданной температурой. Продолжение полученной прямой до шка-
лы jx дает точку пересечения, отвечающую искомой вязкости. Для
некоторых веществ координаты х и у вычислены (табл. XII. 1).
р,,мПа-с
и,мПа-с |- 4,0
0,2- Г 0,2- - 3,75
0,19- „ 0,19 ~ - 3,35
-0,45 ’ -
0,18- 0,18 — -325
0,17- 0,17 — -3,0
2,55
2,75
0,15
0,16 - 0,15 — —0,50
0J4— 0,13- -0,55
•5 ч 0,12 —
см
£ 0,11 - —0,60
О. <-
0,10-
0,09— -0,65
0,06 —
0.07--0’70
0,14
0'3
0J2'
'*• о,»
О-
£ 0,10
0,03
о,ов-
0,07'
2,25
2,0
1,90
1,80
1,70
1,60
1,50
0,06—
0,05—
~ — 0,80
0,04 —
0,03 -~ °’85
0,02— -0,90
0,01 - —0,95
О 1-1,0
1,05
О->-1,0
Естественно, что построения в этом
случае упрощаются.
Более точные результаты полу-
чаются по методу сравнения
свойств искомого соединения со
свойствами стандартного (эталона)
(метод Отмеря).
Применяют также методы срав-
нительных расчетов, сравнивающие
одно и то же свойство для разных
соединений. Графически зависимо-
стям в этих случаях отвечают пря-
мые, позволяющие производить ин-
терполяцию и экстраполяцию. На-
пример, обобщение Павлова отно-
Ъ
704
204
30
404
504
so i
О -
р-700.
4-006
4-500
г- 400
4-300
4-200
-100
Рис. XII. 1. Номограмма для расчета
вязкости органических жидкостей.
Рис. XII. 2. Номограмма для опреде-
ления постоянной J (по Логеманиу):
/ — одноатомные спирты; 2—одноосновные
органические кислоты; 3—эфиры уксус-
ной кислоты; 4—алифатические кетоны;
5—этиловые эфиры; 6 —предельные угле-
водороды; 7—иодистые алкнлы).
сится к линейности некоторых химико-технологических функ-
ций, а правило Портера —к линейной зависимости между tA
и /в, при которых жидкости А и В имеют равные вязкости.
Если известны значения двух вязкостей жидкости А (щ и цг) при
температурах (ai и 7а2, а из таблиц вязкости эталонной жидко-
сти В (воды) можно найти температуры (bi и (в2, при которых
255
Таблица XII.1
Координаты точек диаграммы рис. XI 1.3
Вещество ' Координаты Вещество Координаты
X У X У
Аммиак 10,1 13,9 Кислота соляная (28%) 13 16,6
Ацетон 7,9 15 Масло льняное 7,5 27,2
Бром 14,2 13,2 Скипидар 11,5 14,9
Вода 10,2 13 Спирт метиловый 7.8 15,5
Глицерин 6,9 19,6 Спирт этиловый (96%) 9,8 14,3
Дихлорэтан 13,2 12,2 Фреон-11 14,4 9
Керосин 10,2 16,9 Фреон-22 17,2 4,7
Кислота азотная (56%) 10,8 17 Циклогексан 9,8 12,9
Кислота серная (94%) 7 24,8 Этиленгликоль 6 23,6
-вязкость эталонной жидкости равна также щ и цг, то отношение
постоянно. Значение К равно наклону прямой на рис. XII. 4; для
заданной (д определяют /в эталонной жидкости. По справочнику
по вязкости эталонной жидкости (воды) находят вязкость, отве-
чающую температуре /в. Такую же вязкость будет иметь искомая
жидкость А при температуре /д (диаграмма типа Дюринга). На-
пример, на рис. XII. 5 даны зависимости для жидкостей, вязкости
которых при температуре, указанной на оси ординат, равны тако-
вой эталона при t на оси абсцисс. Кривая изображает зависимость
вязкости эталона (воды) от температуры.
Для приближенных расчетов вязкости предложена формула (по
Томасу) (рж — г/см3; ц— мПа-с):
ig = в(—----------А (XII.2)
Рж к Тпр )
Коэффициент В определяют аддитивно сложением составляю;
щих, приводимых ниже:
Н 0,249 СО (кетоиы, эфиры) 0,105
с -0,462 CN (нитрилы) 0,381
О 0,054 Двойная связь 0,478
S 0,043 Фенил 0,385
С1 0,340 1 *
Вг 0,326
I 0,335
Метод расчета вязкости жидкости по коэффициенту преломле-
ния п: ц = С(п2—1) (п2 + 2) или по величине поверхностного
натяжения ц == Со2, мПа-с (С — концентрация вещества).
Зависимость на основе соответственных состояний (по Стилу и
Тодосу):
^ = /(гкрГпр); |i = l,6-lO-7r^/C (приТпр<1,5) (XII.3)
266
Рис. XII. 3. Номограмма для определения коэффициента
вязкости жидкости.
°C
353
333
3/3
293
273
273 293 313 333 353 373
Рис. XII. 4. Правило линейности.
{1, мПа-с
К
Рис. XII. 5. Диаграмма для опреде-
ления вязкости жидкости по эталон-
ной жидкости:
/ —C2H4CI2; 2-СН3ОН; 2-СаН16; 4-Н2О
(эталон).
9 М. М. Викторов
257
Значение g = /(Л1лРКр); ц — мПа • с; Ркр — Па.
На рис. XII. 6 дана обобщенная корреляция для определения
вязкости жидкости. Значения на рис. XII. 6 приведены для РКр>
выраженного в атм; если же давление выражено в Па, значения
следует умножить на 21,26-102.
Вязкость жидкости можно определить также с использованием
значений реохора (см. гл. III, стр. 31): '
_ М (10Икип)°-125.
^ch — X> И/Рж. кип — у МОл. кип
Рж. кип
КеЬ«(10Нкип)°’125'/мол.кип
Нкип « 0,1 (--Rc---Y (ХИ. 4)
х ’ мол. кип /
(Умол.кип — мольный объем при температуре кипения, см. стр. 33).
Для неассоциированных
жидкостей:
0,426 Рмол.кр
Вязкость неассоциирован-
ной жидкости (кроме спиртов,
органических кислот, воды,
ртути):
1/ц = — В; о = (й + С%
р
Здесь А, В, С — постоян-
ные; х= 1/и— текучрсть жид-
кости; и — 1/р— удельный
объем; ш = 0,307 1^мол.кр.
Величина 1/р характери-
Тпр
Рис. XII. 6. Обобщенная корреляция для
определения вязкости жидкостей.
зует текучесть; текучесть
жидкостей — линейная функция объема, она увеличивается с повы-
шением температуры.
Если известны зависимость плотности жидкости от температуры
и Умол.кр, то, зная вязкость при одной температуре, можно опре-
делить значение С.
Вязкость при нормальной температуре кипения (по Аррениусу):
Икнп~0,27б(45кип (XII. 5)
Кроме того, вязкость жидкостей при. температурах:
кипения — Цкип « 0,29 мПа • с
плавления — Цпл « 2; цпл = $р1*Т'1гМ',‘ (0 — колеблется в пределах
от 0,3 до 0,7; 0 = 0,058 для СН< и 2,78 для С3Н8)
§ 2. ЗАВИСИМОСТЬ ВЯЗКОСТИ ЖИДКОСТЕЙ
ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ
Вязкость жидкостей, в противоположность газам, существенно
уменьшается с повышением температуры. При низких температу-
рах у некоторых жидкостей она увеличивается настолько, что жид-
кости теряют текучесть.
258
При высоких давлениях вязкость жидкостей значительно уве-
личивается, причем чем сложнее структура молекулы жидкости,
тем больше влияние давления. Например, по данным Бриджмена,
по сравнению с нормальным давлением при 1200 МПа, вязкость
ртути увеличивается на 0,32, а изобутилового спирта на 790; вяз-
кость воды возрастает всего в два раза. Графически эта зависи-
Рис. XII. 7. Обобщенная диаграмма зависимости вяз-
кости жидкости от температуры.
шейных температурах и давлениях можно использовать, например,
номограмму рис. XI. 7, стр. 245 (при р/ркр < 1,8).
Для описания зависимости вязкости жидкости от температуры
предложено много уравнений. Более точные значения получаются
тогда, когда расчет ведут несколькими методами, а затем находят
среднее арифметическое.
Для неполярных жидкостей известна зависимость:
1гм = Л' + В7Т
(Л7 и В' — постоянные, определяемые из значений ц при двух раз-
ных температурах).
»•
259
По Торпу и Роджерсу:
= 1 + а/ + Р^2
(С, а и Р — постоянные).
Другая зависимость для ассоциированных жидкостей (по Жи-
рифалко):
lglx = ^+^- + Y (XII. 6)
Значения постоянных сс, р и у приведены в табл. XII. 2. Для
определения этих постоянных надо знать вязкость данной жидкости
при трех температурах.
Таблица XII.2
Постоянные а, р, у в уравнении (XII. 6)
а-10~4 V
Вода 23,611 -6,8922 -0,3908
Метанол 3,428 2,75 -1,567
Серная кислота 26,37 —4,69 —0,0977
Уксусная кислота -15,759 15,965 -3,521
Этанол -1,145 7,807 -2,459
При известном значении вязкости при температуре Л можно
определить вязкость неассоциированных жидкостей при другой
температуре Т2, пользуясь диаграммой Льюиса и Сквайрса
(рис. XII. 7). На оси ординат отмечают известное значение За-
тем проводят прямую до пересечения с кривой и из полученной
точки опускают перпендикуляр на ось абсцисс, т. е. определяют
температуру и температурный интервал. По этому интервалу мож-
но установить искомую вязкость при любой температуре, производя
все определения в обратном порядке.
Например, если вязкость жидкости равна 0,7 при 273 К, то при
373 К значение ее равно ~0,2 мПа-с.
Зависимость кинематического коэффициента вязкости жидко-
стей от температуры:
lg v = -Д- + .3
[А и В — постоянные; х — характерная величина для данной жид-
кости: 1—3 — для углеводородов; 3,5 — смеси их (смазочные мас-
ла); 2 — H2SO4; 1,5 — Hg и т. д.].
В области высоких давлений (100—400 МПа) вязкость жидко-
сти увеличивается линейно с давлением, а в области более высоких
давлений зависимость носит логарифмический характер. Влияние
давления и температуры на изменение вязкости тем больше, чем
сложнее структура молекулы жидкости. Практически повышение
давления на ~33 МПа увеличивает вязкость жидкости на вели-
чину, которая соответствует примерно понижению температуры на
260
Г, а вязкость воды при изменении давления от 0,1 до 1000 МПа
увеличивается всего в два с лишним раза (рис. XII. 8).
Для давлений до 200 МПа вязкость рР описывается по Андраде
соотношением
/ °i Pi с (»i —
Нр/Н1 = I — I I -о- ) ехр-т-----
где pi — вязкость жидкости при 1 атм; Oi и vp — удельные объемы
жидкости при 1 атм и Р; Pi, (ip — адиабатические коэффициенты
сжимаемости (S = const) при 1 атм и Р\ С — постоянная. Значе-
ние р = — 1/Уыоа(дУта/дР)-, постоянную С можно определить,
зная одно значение вязкости жидкости при нормальном давлении,
0 200 400 600 800 W00 1200 500 1000 1500
МПа МПа
Рис. XII. 8. Зависимость вязкости жид-
кости от давления (по Бриджмену):
/—глицерин; 2—уксусиоэтиловый эфир; 3 —
этиловый эфир; 4—этанол; 5—метанол; б—
ртуть.
Рис. XII. 9. Пример зависимости вяз'
кости жидкости от давления.
а другое — при высоком. Параметр (3 связан с мольной скоростью
звука с (см. стр. 32) соотношением: р = 1/с2р.
Для простого способа расчета вязкости в зависимости от давле-
ния нужно составить диаграмму типа Дюринга для искомой жидко-
сти стандартной (одинаковая вязкость цр при разных давлениях).
Для построения прямой нужно иметь два значения ц.' и ц"
(рис. XII. 9). Вязкость сравниваемой жидкости, например (СгНзЭгО,
при давлении (см. ось ординат) равна вязкости стандартного со-
единения CS2 при давлении, указанном на оси абсцисс. Так,
Ц(с2н5)2О п₽и ^00 МПа равна [tCSj при 1000 МПа: 3,5 мПа-с.
§ 3. ВЫЧИСЛЕНИЕ ВЯЗКОСТИ РАСТВОРОВ
Вязкость растворов органических соединений в органических
растворителях увеличивается с повышением концентрации раствора
(есть исключения). Вязкостр водных растворов неэлектролитов уве-
261
личивается с повышением концентрации и уменьшается с ростом
температуры, а электролитов — чаще всего увеличивается с повы-
шением концентрации раствора (кроме разбавленных растворов
аммонийных, литиевых и других соединений).
Зависимость вязкости для весьма разбавленных растворов элек-
тролитов (по Фалькенгагену):
рР/ро = 1 + А л/с
(цо, Цо— вязкости раствора и растворителя; С — концентрация;
А — постоянная). Значение А в случае бесконечного разведения /«.
при равенстве валентностей ионов г:
л __ 0<517z2
/00Н0
(ео — диэлектрическая постоянная растворителя).
Для более концентрированных растворов:
Рр/ро = 1 + л ^~с~ + ВС
Коэффициенты вязкости смешанных электролитов можно рас-
считывать по методу Здановского [25, 27], но при условии, во-пер-
вых, отсутствия взаимодействия между электролитами и, во-вто-
рых, если активности воды в смешиваемых электролитах одина-,
ковы:
V V1 v2 ” vn
b = X1£L + x ^2.+ ... +х -Рд. (XII. 7)
Р Pi Рг Рп
(хп — объемные доли раствора в смеси; = 1).
Погрешность расчёта по методу Здановского 1—2% для раство-
ров умеренных концентраций (до 15% в сумме молей); она увели-
чивается до 5—10% для очень концентрированных растворов, а
также для растворов, содержащих соли аммония или двойные соли
и комплексы.
Формулы Здановского для растворов невзаимодействующих
электролитов или для двух органических соединений
„ _ *1Р1 4~ ХгРг . __ Vмол. 1 ~Ь Vмол. 2
СМ Р1 I Рг ' СМ Умок. 1/Р1 + Умпл. г/Ц2
X)---f- Х2 -
Р-1 «2
где ц, Кмол и р — вязкости, мольные объемы и плотности чистых
компонентов 1 и 2. -
§ 4. ВЫЧИСЛЕНИЕ ВЯЗКОСТИ СМЕСЕЙ ЖИДКОСТЕЙ,
ЭМУЛЬСИЙ, СУСПЕНЗИЙ
Коэффициент вязкости смесей, жидкостей можно вычислять по
методу Здановского. Кроме того, если известны вязкости компонен-
тов смеси при t смеси, то полезно эмпирическое уравнение Арре-
ниуса:
1g Рем = *1 lg Pi + Х2 1g Ра
(х — мольные доли).
262
Для вязкости смеси двух органических соединений (или неассо-
циированных соединений) зависимость (по Кендаллу и Монроэ):
нсм=х1н;/,+х2^‘
(х — мольные доли компонентов).
Когда вязкости компонентов смеси неизвестны, то для расчета
Рем можно применить принцип аддитивности. Например, вязкость
смеси двух жидкостей (по Лиму)
lg (1g 10цсм) = Рсм ~ 2’9
Х1/И1 -f- Х2М2
где рсм — плотность смеси; х— мольные доли компонентов; J —
постоянные вязкости'компонентов смеси (стр. 254).
Способ на основе суммирования реохора Rcn компонентов смеси
(по Шукла и Бхатнагару):
V» "t" x2^ch2 + ••• + xn^ch„) Рсм
Ис. = _
(Мем — средняя молекулярная масса смеси).
Для вязкости суспензий, эмульсий (по Эйнштейну);
11 = Рж (1 + 2,5<р)
(ср — объемная концентрация твердой фазы в суспензии; более точ-
ные данные получаются, если вместо 2,5 брать 2,9; цж — вязкость
жидкости).
Вязкость разбавленных суспензий:
Р = Рж(1 + 4,5ф)
Зависимости:
по Кинтцу — ц/рж = (1 + 0,5<р) (1 — ф)4
по Гатчеку — ц/цж = 1 + 4»5<р (при ф 0,4)
р/рж = ---<для 0,5<ф<0,9)
1 — Ф '»
Вязкость суспензий по Бачинскому:
ц — Рж (1 + 4,5ф)
На рис. XII. 10 дана приближенная номограмма (по Дэвису)
для нахождения вязкости суспензий.
Известна формула Стокса для определения скорости s осажде-
ния шарика в вязкой среде жидкости:
F
S ------
6л цг
(F — сила, приложенная к шарику; г — рациус шарика).
Когда шарик падает под действием силы тяжести, то F равна .
его весу в жидкости, т. е.
F = Van/3 (Рш — Pc) g
263
(рш, Pc— плотности материала шарика и среды; g — ускорение
силы тяжести). Окончательно:
9 г2£(рш-Рс)
s_ 2
и
К
г-283
-293
-303
-313
-323
-333
-343
!1с,мПа-с
г-2,5
— 0,09
- 0,08
— 0,06
• -0,005
-кг3
-10'4
-10'5
t-0
Рис. XII. 10. Номограмма
для расчета вязкости суспензии.
Для одного и того же шарика в двух средах:
si__Рш Рс, Рг
s2 Рш Рсг Pi
Эта зависимость применяется для измерения вязкости среды.
Формула Стокса используется также для определения размеров
коллоидных частиц, радиусов взвешенных частиц по скорости их
осаждения в среде с известной вязкостью и т. д.
Скорость всплывания частиц, примесей, переходящих в шлак
при производстве стали:
_ _ gr2 (рмет Ршл)
9 риТ
264
(г — радиус частиц; рмет и рШл — плотность металла и шлака;
Цст — вязкость стали).
Вязкость жидкой стали зависит от добавок; углерод, кремний,
марганец и фосфор снижают вязкость стали, а хром, ванадий, мо-
либден и алюминий повышают ее. Для увеличения скорости всплы-
вания частиц и перехода их в шлак применяют раскислители, даю-
щие продукты малой плотности.
В основе применения вискозиметров, которые служат для изме-
рения времени истечения определенного объема жидкости из ка-
пилляра, лежит формула Пуазейля. Объемная скорость истечения
жидкости Q из капилляра связана с его радиусом г и длиной I
(для ламинарного потока):
Q = ^-t
У 8ц./
(Q — объем жидкости, вытекающей за время t из трубки длины I и
радиуса г при давлении Р).
Для двух жидкостей с плотностями pi и рг в одном и том же
сосуде согласно формуле Пуазейля:
Г2Р2
(так как давление столба жидкости пропорционально ее плотно-
сти).
При больших скоростях поток становится турбулентным.
Зависимость (безразмерная) R = 2rsp/p определяет переход по-
тока из ламинарного в турбулентный; этот переход наступает при
R = 1400—2400 (s — скорость потока; R— критерий Рейнольдса).
§ б. ПРИМЕРЫ РАСЧЕТОВ
[6, 11, 66]
Пример XII. 1. Определить вязкость уксусной кислоты СН3СООН (М = 60,1)
при 313 К, зная р = 1,027 г/см3.
Решение. По выводу, стр. 254, определяем:
] = (С) + 3(H) + (СООН) = 50,2 + 3 • 2,7 + 104,4 = 162,7
1 162 7
lg (1g Юр) = 2,782— 2,900 = — 0,118; |i = 0,578 мПа • с (опытное значе-
ние 0,91)
Пример XII. 2. Вычислить вязкость уксусноэтилового эфира при 413 К, зная
коэффициенты вязкости щ = 0,578 и р2 = 0,248 мПа-с при 273 и 353 К.
Решение. Воспользуемся рис. XII. 3.
Проводим на диаграмме прямые через значения щ = 0,578 и 273 К и
р2 = 0,248 и 353 К; точка - их пересечения имеет координаты х = 13,7 и у = 9,1.
Затем проводим прямую через эту точку и 413 К; продолжение ее дает точку
пересечения ц = 0,15 мПа-с (опытное значение 0,152).
Пример XII. 3. Найти вязкость октана при 303 К.
Решение. Проводим на номограмме рис. XII. 5 прямую через точку 303 К до
пересечения ее с линией октана 3. Затем опускаем перпендикуляр до пересечения
с кривой эталона 4. Ордината точки пересечения и есть искомая вязкость:
ц = 0,48 мПа - с.
265
Пример XII. 4. Определить вязкость орто-ксилола СбН«(СНз)г при 293 К,
зная р = 0,8812 r/см3 и М = 106,2.
Решение. Применим номограмму рис. XII. 1.
По данным вывода стр. 254, находим J:
J == 8(C) 4- 10(H) + 3 (двойные связи) +
+ 1 (6-членное кольцо) + 2 (боковые группы) + 1 (орго-положенне) =
= 8 • 50,2 + 10-2,7 + 3 (-15,5) -21 + 2 (-9) + 3 = 346,1
z = _^p-2,9 = -3g|.0,8812-2,9 = -0,03
По рис. XII. 1 при z = —0,03 искомая ца = 0,86 мПа-с (опытное значение —
0,807).
Пример XII. 5. Вычислить вязкость хлористого этилена C2H4CI2 при 293 К,
Решение. Воспользуемся формулой (XII. 2). Расчет В (см. стр. 256)!
В = 2(C) + 4(H) + 2(С1) = 2 (—0,462) + 4 • 0,249 + 2 • 0,340 = 0,824
1g 8*569^ = 0,824 f 561.6—Л „—0 744 мПа • с (опытное значение
1.25290-5 к 293 )
0,833)
Пример XII. 6. Определить вязкость метилэтилкетоиа С2Н5СОСН3 при тем-
пературе кипения.
Решение. Применим формулу (XII.4). Найдем RCh, используя данные, при-
веденные на стр. 31:
Rch = 4(C) + 8(H) + 1 (О кетона) = 4 • 12,8 + 8 • 5,5 + 13,2 = 108,4
Мольный объем +Мол. кип определим сложением составляющих, см. стр. 33:
Рмол. КИП = 4(C) + 8(H) + 1(0) = 4 • 14,8 + 8 • 3,7 + 7,4 = 96,2
/ 108 4 \8
Икип = 0,1 J = 0,244 мПа • с
Пример XII. 7. Вычислить вязкость дихлорбензола СвНчСЬ (ЛТ = 147) при
температуре кипения, зиая ркип =1,11 г/см3.
Решение. По формуле (XII.5):
Нкип ~ 0,2кип = 0,275 V1.I1 = 0,29 мПа • с (опытное значение 0,304)
266
М-кип
По формуле R h = ^<10Нкип).0-125.
Рж. кип
Rch = 1(С6Н5) + 2(0) - 1(H) = 101,7 + 2 • 27 3 - 5,5 = 150,8
’ж.кипУ 1 _ 1 ( 150,8-1,11 \8
М /10 10 \ 147 7
= 0,285 мПа • с (опытное значение 0,304)
Пример XII. 8. Установить вязкость СО» при 40 °C, зная = 1,68 мПа-с
при t\ = —10 °C.
Решение^ Проведем на рис. XII, 11 прямые и найдем искомую р = 0,7 мПа-с
(опытное значение 0,74).
Пример XII. 9. Вычислить вязкость жидкого гептана (Л4 = 100,2) при нор-
мальной температуре кипения Т = 372 К, зная критические параметры: Гвр =
= 540,3 К; Ркр = 27 атм; Умол. кр = 426 см3/моль; гкр = 0,259.
Решение. Воспользуемся формулой (XII. 3)
t l(M'kP^') = 540,3'/6/(100,21/j • 27'>>) =
= 0,0317; Гпр = Г/Гкр = 372/540,3 = 0.686
По рис. XII. 6 для ГПр = 0,686 = 0,0061; ц = 0,006/0,0317 = 0,192 мПа-с
(опытное значение 0,195).
Пример XII. 10. Определить вязкость смешанного раствора, содержащего
12% NaCl (ci) и 8% (масс.) MgCl2 (с2) при 25 °C.
Решение. По уравнению (VI. 1) для изопиестических растворов (см. гл. VI,
стр. 108):
Сп I С2 , 12 , 8 .
-------------------- 1 или = 1
Х1 *2-------------------------*1-Х-2
Далее (подробно см. пример VI. 12) определяем значения концентраций изо-
пиестических бинарных растворов NaCl («О и MgCl2(x2), которые при смешива-
нии дадут заданный раствор; находим: а = 0,817; хыаШ = 21,8% (m = 4,76);
XMgCi2=17,9% (m = 2,29). Доля раствора NaCl составит 12/21,8 = 0,55; доля
раствора MgCl2 8/17,9 = 0,45.
Плотности этих растворов рыаш = 1,160 и pMgci, = 1,149 г/см3, Определим
плотность заданного раствора:
— == 1 Гёл ' + у !.п • 0,45 = 0,866; р = 1,155 г/см3
р 1,160 1 149
По таблицам СТЭ (т. X, с. 94 л 95) вязкость бинарных растворов:
РыаС1 = 0-894 • 1,65 = 1,48 и = 0-894 • 2 48 =
= 2.22 мПа • с (0,894 — вязкость воды при 25 °C)
Вязкость заданного раствора ц может быть найдена из уравнения (XII. 7):
1,155 0,55-1,160 , 0,45-1,149 . 7. „ „
---------Е48~ +—2Д2------------°’664; И = 174 мПа-с
Г лава XIII
КОЭФФИЦИЕНТ ДИФФУЗИИ
(6, 11, 40, 66, 92]
Диффузия — это самопроизвольный перенос вещества из одной
области в другую. Возникает она из-за разности концентрации (бо-
лее строго — из-за различий химических потенциалов). При диффу-
зии поэтому перенос и обмен масс происходят в отсутствие переме-
шивания и конвекции.
Перенос возможен как в одном направлении (например, погло-
щение газа жидкостью), так и в двух. Диффузия в газах протекает
быстрее, чем в жидкости, поскольку в газах взаимодействие моле-
кул слабее.
Количество растворенного вещества п, которое может продиф-
фундировать из одного слоя (в нем мольная концентрация Ci) в
другой (при концентрации С2), прямо пропорционально площади
поперечного сечения F, времени t и АС = С\ — С2 и обратно про-
порционально расстоянию между слоями Ах:
n = -DiFt^-
Лх
Для бесконечно малых dx, d/, dn и dC по закону Фика:
dn = — DF^dt
dx
Здесь dCldx — градиент концентрации диффундирующего веще-
ства в направлении диффузии.
Для газовой фазы вместо мольной концентрации с удобнее при-
менять парциальное давление Р газа:
п = — DFt-^-
dx '
Закон Фика аналогичен закону Фурье (см. гл. XV) о переходе
теплоты за счет теплопроводности, и здесь аналогом градиента
температур будет градиент концентрации.
268
Параметр D назван коэффициентом диффузии: его размерность
в СИ м2/с.
Число молей «а вещества А, диффундирующего в двух направ-
лениях:
п dC*
”А А dx
При эквимолярной диффузии соединений А и В в противопо-
ложных направлениях зависимость для градиента концентрации:
Л?А
Величина
1 - о
А(Са + Св) Da-b
называется кинематическим коэффициентом диффузии (в дальней-
шем — коэффициент диффузии).
Коэффициент диффузии D относится к двум компонентам, на-
пример, при диффузии газа 1 в газ 2 и не является свойством
только одного компонента.
Уравнение однонаправленной диффузии компонента А
п СА + Св dcA
пь- D Св dxB
Коэффициент диффузии есть функция свойств среды, распреде-
ляемого вещества, температуры и давления.
Кроме1 коэффициента диффузии (молекулярной) D известен
коэффициент турбулентной диффузии От, который не является фи-
зической константой; он зависит от гидродинамических условий
процесса, определяемых скоростью потока и величиной турбулент-
ности.
Между диффузией, вязкостью и теплопроводностью можно про-
вести аналогию, поскольку они связаны с процессами молекуляр-
ного переноса: диффузия — массы; вязкость — количества движе-
ния, теплопроводность — теплоты.
§ 1, ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА ДИФФУЗИИ
ГАЗОВ
Коэффициент диффузии газов D обратно пропорционален об-
щему давлению, мольному объему, плотности газа и прямо пропор-
ционален температуре Тзь (диффузия в разреженных газах проте-
кает значительно быстрее).
Зависимость между диффузией и вязкостью выражается соотно-
шением D = ац/р (а — коэффициент, равный 1,3—1,5 в зависимо-
сти от рода газа).
Диффузия в газовой или жидкой смеси является взаимной и
Dt, 2 для смеси из компонентов 1 и 2 есть коэффициент взаимной
диффузии в двойной системе.
269
Самодиффузия — это диффузия молекул соединения через это
соединение (коэффициент Dlfi), например диффузия изотопов,
орто- и пара-водорода и т. п.
Высокие значения диффузии присущи газам с низким молеку-
лярным весом (например, водород, гелий).
Когда газ I диффундирует в газ 2, коэффициент диффузии зави-
сит от природы и концентрации этих двух газов (соответствующие
данные см. в таблицах справочников).
Для бинарных неполярных газовых смесей коэффициент диффу-
зии £>*2 (при давлении до 2 МПа) можно вычислить на основе
известного потенциала Леннарда — Джонса:
1,895 -Ю-12?7’^,+M))/(Ai1Ai2)]'/!Paf2QI, (XIII. 1)
Значения 01,2 и <Fi, 2 для пары газов:
<71,2—.—8 1,2= VS 182
8^/k kT/8^ = kT
V k k ' V^1^2
= 0,77ГКр; = Ы5ГКИП
^Т/^о=1.33Гпр
* = KP; <r = 1.18 • кип (V - см’/моль)
(XIII. 2)
Значения QD = f(kT/&0) = f(T*) приведены в табл. XI. 1.
Для диффузии двух неполярных газов 1 и 2 предложена
приближенная зависимость Гиршфельдера, Бирда и Куртисса.
(рис.XIII. 1), построенная с использованием постоянных сил о и <F0
на основе потенциала Леннарда — Джонса:
= °-02577 / 73 (Mi + Af2)
1,2 V 2ЛТ1М2
Зависимость эта применима также тогда, когда один из газов
полярный, а второй неполярный.
Более точна формула Уилка и Ли:
D = Д£3/г ( м, + м2\'/»
1,2 МЛ’ \ М1М2 )
(XIII. 3)
[в = 0,210 - 0,00482 ( ) Z,1
I k М1М2 J J
Для вычисления коэффициента диффузии при самодиффузии
газа предложена приближенная зависимость:
, _ 0,02577 /Г"
“ Pc^qO.i) Д/ М,
5 Нд*
Di.i = « ~р“ (1* ~ Па ’ с> Р ~ кг/м’)
* Здесь и далее в м2/с.
270
Значение А* приведено в табл. XI. 2 для рассчитанного значения
Т* = kTISo.
Если известен критерий Шмидта Sc, то (см. стр. 274):
Sc = -^ « 0,75
Рр
/атм»Э,в|-|04Па
Р, атм
3,0
900
Рис. XIII. 1. Номограмма для определения коэффициента диффузии.
И-104,^/с
-1,00
г 0.80
- 0,70
Г 0,60
- 0,50
- 0,40
£0^0
Ё- 0,20
- - 0,10
- 0,06
- Off!
- 0,06
“0,05
у 0,04
г 0,03
0,02
- 0,010
-0,006
Г о, 00 7
- 0,006
j- 0,ООН
г 0,004
-0,003
Предложена зависимость, выявляющая соотношение между вяз-
костью газов и коэффициентом диффузии:
Р1>( = 1,20 • 10~4 (RT/MP) (Qo/%) Ц
(р — мпа • с; Q„/Qd« 1,1).
Ибрахим и Кулоор для определения коэффициента диффузии
разных газов (1) и воздух (2) предложили зависимость
Di'2 ~ 0.122М —1,3 ^мол ~ см3/моль)
из которой следует, что коэффициент диффузии обратно пропор-
ционален давлению.
271
Известны полуэмпирические формулы для вычисления кинема-
тического коэффициента диффузии, например формула Гиллиленда
п_______________________0,04223/г______f ^1 + ^2 \‘А
1>2 +//г ) см/с (ХШ 4)
где Р— общее давление, Па; Гмол.кип— мольные объемы жидких
компонентов 1 и 2 при нормальной Тш, см3/моль; определяют их
суммированием составляющих, приведенных на стр. 33.
Корреляция Арнольда:
п _________________0,08217'"’__________( Mi+M2\'h
D'-2 р(у'/> +р‘/, у(Г+С И МуМ2 ) см/с (ХШ5)
1 V МОЛ. КИП. I 1 Г МОЛ. КИП. 2/ V i,z/ v I Z /
(более точные результаты получаются при замене 0,0821.на 0,0745).
Для определения постоянной Сатерлендера С предложено соот-
ношение
Cj,2 — F л/С\С2
где Ci ~ 1,47 Ткип. Г, 6^2= 1,47 Ткип. 2, a F
мольных объемов при Ткип:
1,0 0,98
зависит от соотношения
F
у
мол, кип. 1
^мол. кип. 1
Для двух диффундирующих газов Слеттери
мулу
0,953
0,92
0,875
0,838 0,805
8 10
предложил фор-
Alt + М2 \/2
см/с (XIII-6>
1 2
3
4
6
где Тпр = T/V^kp. iT’kp.z ! й> b — постоянные, значения которых
приведены ниже:
а-10’
два неполярных газа или самодиффузия 0,583
водяной пар — неполярный газ 0,772
ь
1,823
2,334
Если значения Mi и М2 диффундирующих газов сильно разнятся
(при 273 К), то по Андруссову (Р—атм, Гмол— см3/моль):
П 17,2 (1 + УТИ, + Л12 )
Р1'2 р(у‘/г +v'ls Ум'/гМ'^
Г V МОЛ, 1 г мол. 2/ /W1 zw2
По Отмеру и Чену:
Д''*+1,Т Г
’ I TZ0-4 -4- v0’4 I
L мол. кр. I ' мол. кр. 2 J
(р — вязкость воздуха при температуре диффузии, мПа-с).
Приводим эмпирическую корреляцию по Фуллеру, Шеттлеру и
Гиддингсу:
п . 0,01Г'-75 [(1/ЛГ,) + (1/ЛТ2)]‘^
272
С повышением температуры коэффициент диффузии увеличи-
вается, что может быть охарактеризовано примерной зависимостью:
ОГг = ОГ1(Т2]Т^
(при показателе степени ~ 1,8 результаты точнее).
Кроме того, по Сатерлендёру:
Dr _ ог
Г2У‘ Т’.+Са.в
Г1 ) Г2 + СА, В
(ХШ.7)
(Сд, в — постоянная Сатерлендера для пары газов А и В; опреде-
ляется по указанной корреляции Арнольда).
Если для пары газов А и В известен коэффициент диффузии
Dr, при Г1, можно определить коэффициент Dp, при Т2
°Т2 ~ &р,
\ 3/г /д(Гг)
^17 О?1,’0 (д(т,)
где Qr,’0 и йт2’!> — функции, см. табл. XI. 1 для 7"i и Т2 (т* и Т2\
fD(Ti] и fD(Ti} — поправочные коэффициенты; приведены в табл. XI. 2;
в некоторых случаях полагают f« 1.
При небольших давлениях коэффициент диффузии обратно про-
порционален давлению и произведение DP примерно постоянно.
При значительных давлениях и больших плотностях газов эта за-
висимость, однако, отсутствует.
Приведем в качестве примера значения отношения коэффициен-
та самодиффузии азота (/>1,1)р при 323 К к (£>i, i)p=i атм:
Р, атм 1 15,3 104,5 320 542 742 965
(Oi,i)p/(Oi,i)p=1 1 0,064 0,0084 0,0026 0,0016 0,0013 0,0011
По данным Кричевского, Хазановой и Липшица [45] коэффици-
ент диффузии газов вблизи критической точки уменьшается по
крайней мере в 103 раз.
Зависимость коэффициента диффузии при различных давлениях
и температурах:
р0 / т \ 65
для диффузии в газах — D = Da-p- J
для диффузии в жидкостях — D = D2o [(1 + b (t — 20)] (b = 0,064 Vjx/p ;
ц — мПа с, р — н/м3)
На рис. ХШ. 2 дана обобщенная диаграмма для определения
коэффициента самодиффузии при высоких давлениях Р (по Слет-
тери).
Зная диффузию при умеренном давлении и значение DP, можно
для требуемых значений Р иТ вычислить РПр и Тпр. Затем найти по
рис. XIII. 2 отношение (DP)P/(DP)° и вычислить значение D при
давлении Р.
273
Уилки для вычисления коэффициента диффузии в многокомпо-
нентных газовых системах предложил зависимость
А Ув/ДА, В + ydDK, С + • • • + УN
где Da — коэффициент диффузии компонента А в смеси газов
В, C...N; Уа-'-Ух — мольные доли компонентов; Da,b • • Da>n —
составляющая коэффициента диффузии для двойных смесей
А —В ... A —N.
Рис. XIII. 2. Зависимость отношения (DP)p/(DP)°
от приведенных давления и температуры.
Остановимся подроб-
нее на применении кри-
терия Шмидта Sc для вы-
числения коэффициента
диффузии газов, который
подобен критерию Пранд-
тля Рг, служащему для
анализа процессов тепло-
передачи. Между этими
критериями существует
зависимость: Sc = Рг л
« 1 (или, точнее, 0,83).
Для разных газов значе-
ние Рг = 0,65—0,9.
Для газа 1,диффунди
рующего в газ 2, критерий
Sc выражается в зависи-
мости от вязкости газа:
<- .Р2 . „ М2Р
Для диффузии растворенного газа 1
(при небольшой концентра-
ции) в газ 2:
а’1‘,20 ( у. р2
ОС1 2 — > I -- I -9\ I --------- I в -----
V *2 / } \М}+М2) p2DI>2
(XIII. 8)
Значения <и, г; ^1,2 определяют по уравнениям (XIII. 2) и
табл. III.2; Qi'i0 Для T* = kTI$\2 и й^2’2* для Т* = кТ1&2 по
табл. XL 1.
Для самодиффузии уравнение (XIII. 8) дает Sc = 0,83. Значе-
ние Sc изменяется в зависимости от состава смеси и Sci,2 отли-
чается от Scz, 1-
§ 2. ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА ДИФФУЗИИ В ЖИДКОСТЯХ
Коэффициент диффузии в жидкостях в 104—105 раз меньше,
чем в газах; выражается он в см2/сутки или 0,016-10~8 м2/с (СИ)
(1 см2/с = 86 400 см2/сутки).
Чем ниже концентрация диффундирующего соединения в рас-
творе, тем, в общем, выше значение этого коэффициента,
274
Коэффициенты диффузии в жидкости Di, 2 для бинарной систе-
мы 1 и 2 зависят от концентрации и от температуры.
Для взаимной диффузии зависимость Эйнштейна:
Рр ... 1 / Wo Y/a
kT 2it k ГМОл )
По Стоксу:
D ~ kT/Зпцг
Рис. XIII. 3. Диаграмма для определения фактора диффузии F.
Если диффундируют крупные молекулы, то при Т = 293 К
(в м2/сутки):
D = 1,84 • 10~4/|л.г; D = 2,74 • 10~9Л4~'/’ (г — А; ц — мПа • с)
Для вычисления коэффициента диффузии в жидкостях предло-
жены различные полуэмпирические зависимости.
Так, Уилк приводит соотношение, использующее фактор диф-
фузии F — TID^:
D = -^ (XIII. 9)
[F — (К-с)/(м2-мПа-с); F — функция от Умол.кип диффундирую-
щего соединения при 7’кип]- Отметим важное правило:
F = Т |/£>Щ| — Т-/D2P2
Фактор F можно определить по диаграмме Уилка (рис. XIII. 3);
каждая кривая пучка характеризует значение параметра Ф — фак-
тора растворителя (отношение коэффициента диффузии соединений
с одинаковым УМол. кип в данном растворителе и воде).
276
Для определения искомого О вначале вычисляют Умол. кип пу-
тем суммирования составляющих (стр. 33). Затем по значению
Умол. кип находят F. В зависимости от типа растворителя исполь-
зуют разные Ф: 1 — для воды; 0,7 — для бензола; 0,82 — для мета-
нола; 0,9 — для прочих растворителей (для других растворителей
0,3
р/Т, (мПа-с)/К
Т 0,050
- 0,040
г 0,030
'-0,020
^мол.кип'.Ю}м3/кмопь
0,4
0,5
0,6
0,7
0,8
0,9
1,0
-0,010
I 0,008
0.00В
г 0,005
5 0,004
I 0,003
г 0,002
хМ
Т-1,000
--600
-'-300
--200
-.7 50
0,001
0,0008
0/0006;
0,0005.
0,0004
0,0003
0£002
-1-10
т 1,000
: ООО
:: 600
: : 500
-7400
н ЛЮ ‘_
Л Г 200
- г 150
Г 100
2-50
- 40
-30
2-20
-10
2,0
3,0
4-4ft
^вр
--7,0
— эр
а
'-dpdof
Рнс. XIII. 4. Номограмма для расчета коэффициента диффузии (по Уилку —
Чангу).
Ф вычисляют, зная одно значение D). По найденному значению F,
зная и и Т, по формуле (XIII. 9) рассчитывают D.
Метод Уилка —Чанга (см. рис. XIII. 4):
D = 7,4 . Ю-12 (хм/» ткип) (XIII. 10)
Здесь х — параметр «ассоциации» растворителя; х = 1 (неассо-
циированные растворители); х = 2,6 (Н2О); х= 1,9 (СНзОН) и
х — 1,5 (С2Н5ОН); Л4р — мол. масса растворителя; V — см3/моль.
276
Заменяя х отношением удельных теплот испарения растворите
Ля Lp и растворенного вещества L (по Ибрагиму и Кулоору):
£>1,2 = 5,4 • 10“12
/ M'^TL^ Ч0-93
I iiR'A z_°>3 )
\ мол. кип1" /
[для неассоциированных жидкостей (растворителей) эфира, бензо-
ла и гептана х=1; х = 2,6 (НгО); х=1,9 (СН3ОН); х = 1,5
(С2Н5ОН)].
На рис. XIII. 5 дана зависимость T]\yD от Умол.кип соедине-
ния, отвечающая значению ординаты а при данном Ймол кип! тогда
D = T/a-107p.
Рис. XIII. 5. Зависимость T/\lD от мольного объема
диффундирующего вещества.
Шейбл приводит зависимость:
п о л .л-12 Т [1 + (ЗУМОЛ. 2/рмол. ,)2Ч
Ui п css o.Z • 1U —— - —
Уравнение неприменимо при Vмол. 1 < Умол. 2-
Приводим зависимости:
для Н2О при УмОл. I < Умол. 2 — D = 25,2 • 10“12 ——£-
РУмол. 1
19 Т
для СвНв при Умол. 1 < 2Г„ол. 2 — D — 18,9 • 10 -—г.-
иУмол. 1
для прочих растворителей при Умол.1^2,5Рмол.2 —
D = 17,5 • 10“12 ——--
РЧол. 1
277
Общая зависимость на основе критерия Шмидта (по Ибрагиму
и Кулоору):
с __ цУмол
Кроме того:
Sc' = аМ + Ь
(а и b — коэффициенты, зависящие от рода растворителя). Так,
для диффузии:
в водных растворах — Sc' = 1ЗМ — 100 и D = , 1
г 13м — 100
в бензоле — Sc' — 4,5Л4 и D »
4,5м
в метаноле — Sc' = 4Л4 — 75 и £> = :
4м — 75
Для определения коэффициента b для данного растворителя
нужно знать коэффициент диффузии какого-либо соединения в этом
растворителе. Значение b для Н2О—100; для СвН6 —0; для
СНдОН — 75. (Значение b для данного растворителя можно вы-
числить, зная D любого соединения в этом растворителе.)
Значение коэффициента а примерно пропорционально поверх-
ностному натяжению о растворителя. Для двух разных раствори-
телей 1 и 2:
Я1/Я2 = <Т1/<Ъ
Например, для растворителя-воды значение а:
Sc' — аМ + b = а- 18- 100= 13Л4- 100 =
= 13-18 — 100 = 134; откуда а = 13
Принимая воду за стандартное вещество, определим значение а
для СбН6 (1) и СН3ОН (2), зная о! = 29-10-3 и о2 = 23-10-3 Н/м:
а, 29-Ю-3 ..
ei-eH»O —- 13 72Д-10-3 ' а2~ ’
Так как коэффициенты диффузии для жидкостей весьма незна-
чительны, то Sc их много больше, чем у газов.
Для диффузии неорганических газов в воде предложена зависи-
мость:
П — Н^мол
6.5М + 30
Коэффициент диффузии D в разбавленном водном растворе при
Т по Отмеру и Текеру на основе принципа сравнения описывается
соотношением (рн2о — мПа • с):
л_».с9.
Н&о^’ол
(Кмол — мольный объем диффундирующего вещества, вычисляемый
суммированием составляющих, стр. 33).
Для диффузии в неводных растворах
D=_________________
у°>6 u ‘-1 (LrW
v мол^р^НгО
278
где цр и цН2О — вязкости растворителя (при 293 К) и воды (при Т)
в мПа-c; Lp и Лнго— мольные теплоты испарения при Т.
На рис. ХШ. 6 дана номограмма для определения коэффициен-
та диффузии в жидкостях. Для определения D в неводном рас-
творителе проводят прямую через точку температуры tp и точку.
LptLfyp до пересечения со вспомогательной осью I. Затем через
точку 1 и точку вязкости растворителя цр проводят вторую прямую
до пересечения со второй вспомогательной осью // (эта ось для
водных растворов служит осью температур воды /н2о)- Затем через
точку 2 и точку мольного объема Умол диффундирующего соедине-
ния проводят третью прямую, точка пересечения которой с осью D
D-10*, м7с
^100
г во
ж
Рис. XIII. 6. Номограмма
р.р,мПа'С tHlO,°C
для расчета коэффициента диффузии в жидкостях.
дает искомое значение коэффициента диффузии. В случае водного
растворителя на номограмме проводят прямую через точки, отве-
чающие заданным /н2о и Кмол до шкалы D.
Увеличение температуры ускоряет диффузию.
В небольших пределах температур эту зависимость можно при-
нять линейной:
+а(<2-<0]
Значение а в интервале Ю—20 °C заключено в пределах 0,03—
0,04. Кроме того, существуют формулы:
а = 0,026 - 0,021 lg D; а = 0,02p.‘zJ ej.p-,/’
(р —плотность растворителя, г/см3).
279
Если известны щ и Цг растворителя при Л и Т2, то можно при-
менять приближенную зависимость Уилка
£ 1 ^2 . р ^2Н1Д1
Z>1H1 D2fl2 ' 2 Гщг
Рис. XIII. 6 позволяет, если известны D{ и Л, определять £>2
и Т2.
Зависимость диффузии металлов в металлах от Т описывается
уравнением:
D = Do exp (— Q/RT)
(Q — энергия активации).
Если же в металле диффундирует газ, то
D = Do ± № exp (- Q/2RT)
где Do — объем (в см3) газа, диффундирующего через слой металла
1 мм площадью 1 см2 при О °C за 1 с; d — толщина слоя металла,
мм; Р— давление газа, мм рт. ст.
§ 3. ПРИМЕРЫ РАСЧЕТОВ
Пример XIII. 1.* Вычислить коэффициент диффузии в двойной системе (экви-
молярной) N2(l)— СО(2) для 288 и 373 К при 0,098 МПа, а также для 323 К
при 10,5 МПа, зная Гкр. i = 126 К; Ркр. i = 3,28 МПа и Гкр. 2 =134,5 К,
Ркр. 2 = 3,39 МПа.
Решение. Для 288 К применим формулу (XIII. 3). Силовые постоянные по
табл. III. 3:
#’1/й = 91,5; <Т!= 3,681; <Г2/Аг = 110К; <т2 = З.бэА
S,2lk = (^2/fe) = VlTo-91,5 = 100,4 К; T* = 2 =
= 288/100,4 = 2,87
При Т* = 2,87 по табл. XI. 1 Q(1.0 == 0,960; поправочный коэффициент /о =
= 1,0035 (см. табл. XI. 2).
И окончательно:
п______________0.02577 / 288Ц28 + 28) _
)>2 0,098 • 10е (3,635)2 • 0,960 "у 2-28-28 —
= 0,197- 10~4 м2/с (опытное значение 0,211 • 10-4)
Для 373 К применим зависимость (XIII. 1). Определим значения:
SJk = 0,75Гкр = 0,75 • 133 = 99,75; S2fk = 0,75 • 126,2 = 94,7
ffl = 5/5^мол. кр. 1 == 6/б ^90Т = 3,74 А; ОГ2 = 7» V93J = 3,78 А
Тогда:
^1,2/й = V(^iM) (^2/й) = л/99,75 • 94,7 = 97
Значение kTjSi,2 = 373/97 = 3,85.
По табл. XI. 1 интерполяцией при 3,85 величине = 0,8916.
* По примерам ХШ. 1— XIII. 5 см. [6, 66].
280
И окончательно:
<У1,2 = '/я (*1 + <т2) = ’/2 (3,78 + 3,74) = 3,76 А
О,,2 = 1,895 • 10-12 • 373’/! [(28 + 28)/(28 • 28)]‘/г • 0,0986 • 3,762 • 0,8916 =
= 0,285- 10-4 м2/с (опытное значение 0,318-10-4)
Для 323 К применим зависимость:
DTt = DTi = £>323 = 0,211 • Ю~4 • (323/288)3'2 = 0,235 • 10“4 м2/с
Для определения Dit2 при 10,5 МПа воспользуемся рис. XIII. 2.
Значения псевдокрнтических параметров для эквимолярной смеси при х} =
= х2 — 0,5:
Гпкр = ^кр. а + *ВГкр. В = 0.5 • 126 + 0,5 134,5 = 130,2 К
Лжр = *аЛ<р. а + ЛАр. в = 0.5 • 3,28 + 0,5 - 3,39 = 3,34 МПа
При 323 К и 10,5 МПа:
Гпр = Г/Гпкр = 323/130,2 = 2,5; Рпр = Р/Рпкр = 10,5/3,34 = 3,1
По рис. XIII. 2 (PP)P/(DPY> = 0,95.
Значение (ДР0) при 323 К и 0,098 МПа 0,235 • 10-4; но 10,5 Р/1Д° = 0,95,
следовательно:
п 1Д°-0,95 0,235 -10-4- 0,95 -0,098
- —105— =-----------------Щ-----------= 0,215 - 10 м2/с
Пример XIII. 2. Вычислить коэффициент диффузии в двойной системе (экви-
молярной) CHi(l) (М = 16) и СОг(2) (М = 44) при 323, 773 К и 0,1 МПа.
Решение. Для 323 К применим уравнение (XIII. 5). Определим вначале
Укол. кип При Ткип (СМ. СТр. 33):
У мол. кип. 1 = 1С + 4Н = 1 • 14,8 + 4 • 3,7 = 29,6; V мол. кип.: ~34 см3/моль
Далее:
17мол. кип. i/^Mon. кип. 2 = 34/29,6 = 1,13 и F = 0,99 (см. стр. 272)
Затем:
Гкип. 1 = Ш.6 К; ГКип. 2 = 194,7К
Cj = 1,47ГКип. 1 = 1.47- 111,6= 165; С2 = 1,47ГКНП. 2 = 1,47 - 194,7 = 286
С1>2 = F 7С]С2 = 0,99 V165-286 = 216
И окончательно:
О,.,---------, ..°;”8' <?>''•------------ (.!« + « У - 22 • 10-« «./е
0,1 • 10б (29,6 /s + 34 '•)2 - (323 4- 216) \ 16-44 )
Для 773 К воспользуемся зависимостью (XIII. 7):
п 09 1П-6 ( 773 Y'2 323 + 216 - 1 П7 1П-4 „2М
Дл = 22-10 ^ззз J 773 4-216 1,07 ’10 м/с
Пример XIII. 3. Вычислить коэффициент диффузии £>1,2 для системы
С6Н6(1)—СО2(2) при 318 К и 0,098 МПа, зная:
7кип. 1 = 353,3; Ткип. 2= 194,7 К
561,7» Т«р.г = ЗО4,ЗК
Ркр. 1 = 4,68; РКр. 2 = 7>16 МПа
Л4,=78.1; М2 = 44
281
Решение. Определим мольные объемы при Гкип (см. стр. 33):
Умол. кип. 1 = 6(C) + 6(О2) + 1 (6-членное кольцо) = 6 • 14,8 + 6 • 3.7 +
+ 1 • 15 = 96
Умол. кип. 2 = 34 см3/моль
По формуле (XIII. 4):
_ 0,0422 (318Д)3/»
1,2 = 0,098 • 106 (9б'/5 + 341/*)^
ТвЛ.+.Му» = 0>0748.10-4 Mj/c
78,1-44 J
Если воспользоваться формулой (XIII. 5), то Dt, 2 = 0,0678-10~4 м2/с.
Можно вести расчет и по соотношению (XIII. 6). Определим вначале:
Гпр = г/УГкр. ,7^.2 = 318,2/7561,7-304J = 0,77
По данным, приведенным на стр. 272, а = 0,583-10-4; Ь — 1,823.
И окончательно:
п .0,583 • 10~4 • 0.771’828 (4,68 • Ю8)7’ (7,16 • Ю6) • 5бГ/и • ЗО4‘Л’
= “ 0,098 -10е : =
=* 0,0665 • 10“4 м2/с (опытное значение 0,0715 • 10~4)
Пример XIII. 4. Рассчитать коэффициент диффузии в двойной системе
СО2(1)—СО(2) при 353 К и 2,15 атм.
Решение. Данные для расчета по рис. XIII. 1 возьмем из табл. III. 2:
о, = 3,996; SJk = 190;
<72 = 3,590 А; <У2/А! = 110К
Для смеси:
„ 3,996 + 3,590 .
<71,2------- -------= 3,79 А
- Vl^J-110 - 144 К; Г = kT/&i,3 - 353,2/144 - 2,45
Для Т* = 2,45 интерполяцией по табл. XI. 1 найдем QO> *> = 1,007
/ Afi + М2 л / 44 + 28
V 'ВДа V К44- Й = °’242
На рис. XIII. 1, соединяя точки Р « 2,15 и Т = 353, засечем точку 1 на
оси Q. Точку 1 соединяем с точкой а «= 3,79 и получаем точку 2 иа оси R, кото-
рую соединяемое точкой Q = 1,007 и засекаем точку 3 на оси S.
Затем прямой, проведенной из точки 3 в точку М = 0,242, определяется
искомое D = 0,103 см2/с (расчетное 0,103).
Пример XIII. 5.* Определить коэффициент диффузии изобутилового спирта
в разбавленном водном растворе при 288 К и 343 К, эиая, что для воды при 288
ц — 1,406, а при 343 К 0,406 мПа-с.
Решение. Для 288 К воспользуемся зависимостью D = Т/цР. Определим вна-
чале (см. стр. 33) Умол спирта:
Умол =» 4(C) + 10(H) + 1(0) = 4 • 14,8 + 10 • 3,7 + 12 - 108,2 см’/моль
По рис. XIII. 3 F для этого значения Умол и Ф = 1 (растворитель — вода)
равно 3,1 -10~14. И окончательно:
Di = 288/(1,406 10-3 • 3,1 • 10-14) = 0,81 • 10-9 м2/с (опытное
значение 0,77 • 10~9)
_______________________ к .
* По примерам XIII. 8—ХШ. 19 см. [6. II, 66].
282
Для 343 К определение ведем по формуле F = —== —рг-
|А]£7| Ц2*-'2
343-1,1406-0,81-10-9 э
°2 ---------288-0,40-------= 27 •10
Пример XIII. 6. Вычислить коэффициент диффузии бромоформа СНВга в бен-
золе (М = 78) при 291 К, зная цо = 0,669 мПа-c и х — 1.
Решение. Определим для бромоформа (см. стр. 33):
'''мол = 1(C) + 1(H) + 3(Вг) = 14,8 + 3,7 + 27 • 3 = 99,5 см3/моль
И по формуле (XIII. 10):
п 7,4-10-12 - 78v* • 291 1п_9 ,, /
и —--------------—-----= 1,79-10 3 м2/с (опытное
0,699 • 99°’6
значение 1,62-10-9)
Пример XIII. 7. Определить по рис. XIII. 4 коэффициент диффузии маннита
СвНцОб й разбавленном водном растворе при 343 К (70°C), зная вязкость рас-
твора 0,4061 мПа-с.
Решение. Определим (см. стр. 33):
'''мол = 6 (С) + 14 (Н) + 6(О)= 14,8 • 6 + 3,7 • 14 + 7,4 • 6 = 185 см3/моль
Для воды х == 2,6 и хМ = 2,6-18 = 46,8; ц/Г = 0,4061 (273,2+70) = 0,001185.
На рис. XIII. 4 соединяем прямой точки 0,001185 и 46,8; продолжение пря-
мой до пересечения со вспомогательной осью дает точку а; прямая через точку а
и точку 185 на оси Умол. кип дает D = 1,86-10“’ м2/с (опытная величина
1,56-10-’).
Пример XIII. 8. Установить коэффициент диффузии кофеина в воде при 283 К
(10 °C).
Решение. Данные для расчета по формуле £>=14- 10~5/цн!О'/моЛ:
Умол = 232 см’/моль; Рн2о = 1.3077 мПа • с
И окончательно:
D =------14 ii° 9 ов = 01397'10-9 м2/с
1,3077 1 • 2320,6
По рис. XIII. 6 Dt,2 = 0,40-10-’ м2/с.
Пример XIII. 9. Найти Оф фенола в метаноле при 288 К (Сф < 0,1%), если
цф = 0,62 мПа-c и радиус молекулы фенола Гф = 2,354 А.
Решение. По формуле D = (1,84-10-‘)/рг = 1,84-10_‘/(0,62-2,354) =
= 1,275 м2/сутки = 1,5-10-’ м2/с (опытное значение 1,4-Ю-’),
Глава XIV
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ ЖИДКОСТЕЙ
[6,11,40,66,71]
§ 1. ОБЩИЕ ПОЛОЖЕНИЯ
Причины возникновения поверхностного натяжения — неравно-
ценность энергетического состояния молекул, расположенных в по-
верхностном слое и в «глубине» объема. Первые взаимодействуют
не только с себе подобными (расположенными в объеме), но с мо-
лекулами пограничной среды. В результате этой неравноценности
возникает стремление к «втягиванию» молекул поверхностного слоя
в глубь жидкости, а это приводит к возникновению в поверхност-
ном слое некоторого избытка энергии.
Поэтому свойства поверхностных слоев вещества несколько от-
личаются от свойств его нижних слоев и оказывают влияние и на
другие свойства вещества. По мере увеличения поверхности влия-
ние поверхностных свойств проявляется все сильнее.
Для увеличения поверхности жидкости необходимо затратить
некоторую работу. Величина этой работы, отнесенная к 1 см2 по-
верхности вещества, и есть поверхностное натяжение; оно равно
максимальной полезной работе, затрачиваемой на образование
единицы поверхности.
С повышением температуры поверхностное натяжение умень-
шается.
Коэффициент поверхностного натяжения * о равен силе поверх-
ностного натяжения F (в Н), приходящейся на единицу длины /
(в м) поверхностного слоя жидкости и действующей в направле-
нии, перпендикулярном к этой длине: о = F/1, Н/м (или дин/см).
При увеличении поверхности вещества (при повышении его
дисперсности или пористости) увеличивается его стремление к вы-
делению из данной фазы; например, повышается растворимость,
давление насыщенного пара, химическая активность и др. Веще-
ство, имеющее плоскую поверхность, более устойчиво, нежели
имеющее выпуклую поверхность. Так, давление насыщенного пара,
над плоской поверхностью меньше, чем над выпуклой. Замечено,
* В дальнейшем — для краткости — просто поверхностное натяжение,
284
что температура плавления очень мелких кристаллов несколько
ниже температуры плавления обычных кристаллов.
Поверхностное натяжение для большинства органических со-
единений при 293 К колеблется в пределах (25—40) • Ю~3; НгО —
(72—75) • 10~3; у жидких металлов — (300—600) -10—3 Н/м.
Так называемое граничное натяжение, возникающее при сопри-
косновении несмешивающихся жидкостей, значительно меньше на-
тяжения на границе жидкость — газ. Граничное натяжение значи-
тельно влияет на диспергирование одной жидкости в другой (не-
Рис. XIV. 1. Номограмма для определения поверхност-
ного натяжения (последовательность соединения точек
АВС -> СОЕ).
смешивающихся) и сказывается на гидродинамических условиях
проведения процесса экстракции.
Чем выше концентрация молекул в приповерхностном слое, тем
меньше поверхностное натяжение.
Эмпирическая зависимость учитывает это положение
<Т = с (рж Рп)4
где с — постоянная, а рж и рп — мольные плотности жидкости и на-
сыщенного пара.
Приводим уравнение (приблизительное) для мольного поверх-
ностного натяжения:
G =
имол и ’ мол
285
Зависимость между о и Ткр, Кмол имеет вид
<^-ол = МГкр-0
или более точно:
^^’0Л = К(Гкр-6-Г); а = К(Гкр-7’)(Р^РЯ-)!/’
Здесь Умел — М/рж-, К — постоянная, равная:
для иеассоциированных 2,12 для ассоциированных 0,89
жидкостей жидкостей
бензол 2,1 вода 0,93
сероуглерод 2,0 метанол 0,93
четыреххлористый 2,21 Дифенилэтан 2,49
углерод ацетон, дифенил 2,57
азот (жидкий) 2 бензофенон 2,63
Значение К можно также вычислить, зная одно значение От при
любой температуре Т. Приближенное значение Умол вычисляются
Pch/Rjj
20v
18 г
16 L
И -
12-
10-
3-
& '-
4 -
е -
5 -
4 -
З-Ю^Н/м.
по принципу аддитивности (см.
и стр. 33). Кроме того, при темпе-
-.1800 ратуре кипения: 40,86-108 К =
- 1700 !== ^-исп. кип/7’кип (-^ ДЖ/КМОЛЬ) Ви-
1кпл неР дает следующее выражение для
предельных углеводородов нормаль-
- 1500 ного строения:
а = 0,0146 1g (я — 3) + 0,01152
1400 (п — число атомов углерода в мо-
лекуле).
Зависимость поверхностного на-
- 1300 тяжения от аддитивной величины
парахора (рис. XIV. 1):
Г Pch (Рж Рп) I4
(Т = 1 ——— - 1 I
Рис. XIV. 2. Номограмма для опре-
деления поверхностного натяже-
ния жидкостей.
Упрощенные зависимости:
В приближении идеального газа плотность пара при Гнил:
Рп.кип = МР//?7’кип- Кроме ТОГО, lg(Pn/pn.KHn) = 5 [(7’/7’КИп) 1].
Зная рж при любой Pi, можно вычислить приближенное значе-
ние рж при заданной Т (см. гл. VII).
Зависимость поверхностного натяжения от парахора и мольной
рефракции PD:
Г Pch (»2 — D I4
[ RD(n? + 2) J
(XIV. 2)
(n — показатель преломления).
Мольную рефракцию и парахор вычисляют по принципу адди-
тивности (см. стр. 25, 30 и рис. III. 2, стр. 30). Формула (XIV. 2)
286
применима и для вычисления а смеси жидкостей (неассоциирован-
ных, неполярных).
Поверхностное натяжение жидкостей можно определить по но-
мограмме рис. XIV. 2.
Корреляция на основе принципа соответственных состояний (по
Броку и Берду):
-^7^»= (0,0617-Ю’Чр-0.13-10-6)(l-7-np)'-22 (XIV. 3)
*кр
(аКр — коэффициент Риделя).
Для смеси жидкостей:
Г Рс<м(псм-ОТ
•см Kmk,+2)J
При высоких давлениях до 10 МПа (100 атм) для смеси жидко-
стей
-О* г> / Рж*1 Рп4Н ) | р ( Ржх2 PnI/2 ,
(х и у — мольные доли компонентов в жидкой смеси и в паре;
Рей — парахоры компонентов смеси).
§ 2. ЗАВИСИМОСТЬ ПОВЕРХНОСТНОГО НАТЯЖЕНИЯ
ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ
С повышением температуры поверхностное натяжение умень-
шается, причем для многих жидкостей эта зависимость оказывается
линейной вплоть до критической температуры, при которой о = 0.
Выше критической температуры соединение не может быть в жид-
ком состоянии.
Зависимость о от температуры описывается выражением:
’-’•О-тУ"
(сто и п — постоянные).
Для неассоциированных жидкостей п » 1,23. Для предельных
углеводородов нормального строения п ~ 1,259 и о0 = 54,292.
Сравнение значений поверхностного натяжения при двух темпе-
ратурах Л и Т2 позволяет записать:
= 5Г=[О-^пР.1)/(1-7’пр.2)]'’2 (XIV. 4)
(Показатель 1,2 присущ неполярным жидкостям, а вообще его
значение колеблется в интервале от 0,99 до 1,23; среднее значение
~ 1,16).
Вместо зависимости (XIV. 4) можно пользоваться номограммой
рис. XIV. 3. При Tt.= Ттп:
/ Т'кр Т X62 i-исп. кипРж. кип
’’“"“И'АТкр-Гкип/ } акип = 1,524-10s
287
Более точная зависимость (по Боудену):
( pch У ( <>69 10ФсЬГкип-4-103Гмол КИПГ у,
\ ^мол. кип КИП ' ЮЗРМОЛ. кип^кип /
Значения PCh и МОЛЬНОГО объема Емол. кип при Ткип вычисляют
суммированием данных, приведенных на стр. 30 и 33.
По принципу соответственных состояний и подобия свойств за-
висимость поверхностного натяжения от температуры:
Здесь Л и и ?2 и ?2 — температуры, при которых поверх-
ностное натяжение данной и стандартной жидкостей имеет одно и
500г
400-
300-
200
100-
80 -
60 -
50 —
40 -
30-
-рвО
--50
--30
--20
-'-10
--6
--4
-3
~2
-- 1
-.10
20
30
40
50
60
80
ЮО
20
200
300
400
500
10
Рис. XIV. 3. Зависимость поверхностного натя-
жения жидкостей от температуры.
то же значение — Oi и Ог- Это позволяет строить диаграмму типа
Дюринга. На оси переменных независимых откладывают темпера-
туры стандартной жидкости Ti, Т2, ..а на оси зависимых пере-
менных — температуры Ti, Т2,..., при которых о исследуемой жид-
кости имеет те же значения, что и для стандартной жидкости. На
диаграмме получается прямая линия. Для составления такой диа-
граммы нужно иметь значение Oi при Tt и <тг при Т2. Если известны
Ткр обеих жидкостей, то нужно иметь одно значение oi при Л (при
Ткр значение <тКр == 0).
На рис. XIV. 4 дана точечная номограмма (по Отмеру) для
определения поверхностного натяжения а жидкостей при различ-
ных температурах, а в табл. XIV. 1 — координаты х и у,
288
Расчет по плотности и давлению пара (в мм рт ст.):
0,5677 {4,795 + 1g (Гр,п/(^пМ)]}
Мри/'’
Рис. XIV. 4. Номограмма для определения поверхностного натяже-
ния жидкостей при разных температурах.
Мольный объем пара Умол. п вычисляют по уравнению:
1g (82,06Гкип/Имол. в) = 5 [(Г/Гкип) - И
1/210 м. М. Викторов 289
Таблица XIV. 1
Координаты х и у к номограмме рис. XIV. 4
Вещество X У Вещество X V
Аммиак 56,2 63,5 Сероуглерод 35,8 117,2
Анилин 22,9 171,8 Толуол 24 113
Ацетон 28 91 Фенол 20 168
Бензол 30 ПО Хлор 45,5 59,2
Гексан 22,7 72,2 Хлорбензол 23,5 132,5
л-Ксилол 20,5 118 Хлороформ 32 101,3
Окись азота Окись этилена 62,5 42 0,5 83 Циклогексан 42 86,7
Установлена приближенная зависимость между поверхностным
натяжением и теплотой испарения, критическими и другими пара-
метрами жидкостей. Эмпирические приближенные зависимости (по
Вальдену):
„ ^-ИСП ___ 1П9- . - Т-ИСП __ 385- Ю9<ТКИП .
Ркип ------150 • 10*<ткип; ркнп т =-----i^7K- - ;
< _ _ М(ТКип
РКИП“ 0,581'. 10-%нп
£нсп = 15,24 • 109Умолакип;. £исп = 75,37 • Ю8акнпУХ
Рпл = ““30,6.109опл
^»ОЛ<Т1?.ИП = 5,67 • 10»; Ркр =
*КИП 1g *кип
Более точную зависимость дают формулы:
О 63,8 • 107<Ткип ПИ'ТТ 1Л47. . р _ аКИП
7‘<Р----——-------------и, U ! < I и I кнп, ГКр — ,
1& Ткип 0,46 • 10
Умол. крРкип _ 8 1Q_6
Т кр
а = 6,3 • 10" ,орс’/,; рс4/’ = 2,53 • 10~7
(с — скорость звука в жидкости; р — изотермический коэффициент
сжимаемости).
Поверхностные свойства растворов отличаются от поверхност-
ных свойств чистых жидкостей. Самопроизвольно протекающим
процессом будет повышение содержания в поверхностном слое того
из компонентов раствора, прибавление которого понижает поверх-
ностное натяжение и тем самым уменьшает общую энергию си-
стемы.
Для некоторых растворов графическая зависимость поверхност-
ного натяжения от моляльности, найденная Дшкичевым [95], имеет
вид почти прямой линии (рис. XIV. 5).
290
Метод расчета поверхностного натяжения растворов электроли-
тов, например, дан Товбиным и Воевудской [78], которые устано-
вили существование тесной связи
между давлением пара раствора
и его поверхностным натяже-
нием. Предполагается, что элек-
тролиты, уменьшая давление на-
сыщенного пара воды над раство.
ром, понижают самоадсорбпию
воды в поверхностном слое рас-
твора, поэтому и происходит по-
вышение поверхностного натяже-
ния. Значит поверхностное натя-
жение растворов электролитов
не зависит от индивидуальных
свойств растворенного вещества,
а определяется давлением насы-
щенного пара воды над раство-
ром (рис. XIV. 6), т. е. актив-
ностью воды а в растворе
(рис. XIV. 7). Рис. XIV. 7 позво-
Рис XIV. 5 Зависимость поверхност-
ного натяжения растворов солей от
их концентрации при 20 °C
ляет рассчитать поверхностное
натяжение раствора, если известна (или вычислена способами,
описанными в гл. VI) активность воды а в растворе.
Для вычисления поверхностного натяжения разбавленных вод-
ных растворов органических соединений предложена зависимость
Рис. XIV. 6. Зависимость поверхност-
ного натяжения растворов некоторых
солей от давления насыщенного пара
воды нац ними при 45 °C.
Рис. XIV. 7. Зависимость поверхност-
ного натяжения раствора электроли-
тов от активности воды в раЬтворе.
(по Шишковскому):
—— = 1 -0,411 flgl +-1
стн2о L а J
Здесь х—мольная доля органического соединения; х < 0,01;
а — постоянная, приводимая ниже:
‘/,10*
291
a -10'
a-104
Кислоты Диэтилкетон 8,5
валериановая, изо- 1,7 Метил этилкетон 19
валериановая капроновая 0,75 Метилацетат Пропилацетат 26 3,1
масляная,изомасля- 7,0 Этилацетат 8,5
ная октановая 0,034 Метилпропионат Пропилпропионат 8,5 1,0
пропионовая 26 Этилпропиоиат 3,1
энаитовая 0,17 Пропиламин 19
Спирты амиловый изоами- ловый 1,7 Пропилформиат 8,5
бутиловый нзобу- 7,0
тиловый
пропиловый, изопро- 26
пиловый
Изменение содержания данного компонента в поверхностном
слое по сравнению с содержанием его в объеме характеризует ад-
сорбцию. Адсорбция газа или растворенного вещества на поверхно-
сти твердого вещества (адсорбента) является процессом, протекаю-
щим самопроизвольно, поскольку она уменьшает поверхностную
энергию.
На поверхности раздела двух фаз во многих системах адсорби-
руются (по Семенченко) преимущественно те вещества, которые
по своей полярности занимают промежуточное место между веще-
ствами, образующими эти фазы. Так, ионы солей адсорбируются на
металлах, но не адсорбируются на поверхности раздела вода —
воздух, а спирт адсорбируется на этой поверхности и слабо адсор-
бируется на поверхности раздела металл — вода. С повышением
температуры адсорбция уменьшается.
§ 3. ПРИМЕРЫ РАСЧЕТОВ
[6, 11, 66]
Пример XIV. 1. Вычислить поверхностное иатяжеиие этилацетата
СН3СО2С2Н5 (М = 88,1) при 293 К, зиая плотность рж = 900 кг/м3, коэффи-
циент преломления п = 1,37216.
Решение. Воспользуемся соотношением (XIV. 1). Величина парахора (см.
pch = 3 (С) + 6 (Н) + 1 (СН2)п<12 + (0-0) в
= (3-1,6 + 6 - 2,76 + 7,11 + 9,75)-10~3 =
= 38,22 • 10-3 Дж1’* • м*'« кмоль-1 =» 214,8 эрг'|/‘ • см'^’ • моль-1
Тогда:
о = [38,22 • 10-3 (900/88,1)]4 =
*= 23,25 • 10-3 Н/м (опытное значение 23,7 • Ю-3)
Если использовать уравнение (XIV. 2), то сначала необходимо вычислить
мольную рефракцию Rd (см. стр. 25):
Rd = 3 (С) + 8 (Н) + 1 (СОО—) = (3 • 2,418 + 8 1,1 + 6,154) • 103 =
= 22,21 • 10s м3/кмоль *
292
Тогда:
Г 38,22 • 10-3 (1,372162 — 1) "I4
ff L 22,21 103 (1.372162 + 2) J
= 23,35 • 10~3 Н/м (опытное значение 23,35- 10-3)
Пример XIV. 2. Вычислить поверхностное натяжение бензола СбН6 при 393 К,
зная РКр = 4,77 МПа, ТКР == 562,1 К и аКр = 6,83.
Решение. Тпр = Т/Ткр = 393/562,1 = 0,7.
Применим уравнение (XIV. 3):
or = (4,77 • IO6)’7* • 562,1 ~',г (0,617 • 10~б • 6,83 - 0,13 • 10е) (1 - 0,7)'122 =
= 15,73- 10-3 Н/м (опытное значение 16,42-10~3)
Пример XIV. 3. Вычислить поверхностное натяжение миристиновой кислоты
при 1з = 100°C (373 К), зная, что при t> = 56,8°C Oi == 28,6-10~3, а при h =
= 149,3°C а2 == 21,3-10-3 Н/м.
Решение. Воспользуемся рис. XIV. 4. Соединим прямыми точки 6 и ®i =
= 28,6-10-3 и /г с аг- Искомые координаты пересечения этих линий фиксируют
значения х = 6 и у = 144. Прямая, проведенная через найденную точку и точку
tz = 100, дает искомое значение сг.з — 25,5-10~3 Н/м.
Пример XIV. 4. Определить поверхностное натяжение при 298 К. (25 °C) вод-
ного раствора; содержащего [в % (масс.)] 20,4 NaCl и 11,1 КС1. Активность
воды в этом растворе а = 0,717 (см. пример VII. 1).
Решение. По диаграмме рис. XIV. 7 находим: а = 79,8-103 Н/м.
10 М. М. Викторов
Глава XV
ТЕПЛОПРОВОДНОСТЬ ГАЗОВ И ИХ СМЕСЕЙ
[6, 53, 66, 88, 92]
Между теплопроводностью, вязкостью и диффузией есть анало-
гия, поскольку все они обусловливают процессы переноса, а имен-
но: теплопроводность —теплота, вязкость — количество движения,
диффузия — масса.
Теплопроводность описывается уравнением Фурье: . Q —
«= V(—\t/x)x или в дифференциальной форме:
Здесь dQ — количество теплоты, передаваемой за время dv, F —
поверхность сечения, перпендикулярная к направлению теплового
потока; dt)dx— градиент температуры, т. е. изменение температуры
тела на единицу длины x; X — коэффициент теплопроводности (или
удельная теплопроводность)*.
§ 1. ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ГАЗОВ
(ТАБЛ. XV. 1)
Коэффициент теплопроводности газов можно вычислить различ-
ными методами, используя, например, данные по вязкости, удель-
ной теплоемкости, молекулярные характеристики газа или приме-
няя эмпирические и полуэмпирические зависимости.
Теплопроводность газов связана со средней длиной пути 1, сред-
ней скоростью молекул Ф, плотностью газа р и удельной теплоем-
костью cv соотношением
* Пересчет в СИ: 1 ккал/(м-ч-К) ==1,163 Вт/(м-К); 1 кал/(см-с-К)
= 419 Вт/(м-К) = 360 ккал/(м-Ч'К).
294
Таблица XV. 1
Теплопроводность газов 1-102, [Вт/(м К)]
т, к Н2 n2 02 Воз- дух СО СО2 н2о SO2 NH3 Cl2 НС1 H2S
273 17,42 2,43 2,47 2,44 2,15 1,37 1,62 0,81 2,15 0,72 1,25 1,20
373 21,60 3,15 3,29 3,21 2,75 2,14 2,37 1,43 2,97 0,99 1,73 1,65
473 25,79 3,85 4,07 3,94 3,29 2,88 3,35 2,05 4,31 1,24 2,18 2,06
573 29,98 4,49 4,80 4,60 3,84 3,67 4,42 2,66 5,61 1,50 2,65 2,46
673 34,16 5,07 5,50 5,20 4,41 4,43 5,59 3,28 6,90 1,71 3,06 2,80
773 38,35 5,58 6,15 5,74 4,95 5,13 6,84 3,90 8,14 1,91 3,43 3,12
873 42,58 6,03 6,74 6,23 5,49 5,79 8,18 4,51 9,46 2,11 3,87 3,44
973 46,77 6,43 7,28 6,71 6,02 6,45 9,56 5,13 10,77 2,29 4,18 3,74
1073 51,00 6,74 7,78 7,21 6,52 7,07 11,05 5,74 12,10 2,47 4,53 4,02
1173 55,18 7,00 8,21 7,62 6,98 7,66 12,55 6,36 13,41 2,63 4,85 4,28
1273 59,37 7,24 8,58 8,06 7,42 8,21 14,05 6,98 14,74 2,78 5,16 4,51
1373 63,59 7,42 8,91 8,37 7,84 8,72 15,54 7,59 16,05 2,92 5,44 4,72
1473 67,78 7,58 9,19 8,59 8,23 9,20 17,00 8,21 17,33 3,05 5,72 4,91
1573 72,01 7,71 9,41 8,79 8,61 9,64 18,43 8,83 18,61 3,16 5,98 5,07
1673 76,20 7,80 9,58 8,99 8,96 10,05 19,82 9,44 19,83 3,27 6,23 5,21
1773 80,39 7,86 9,75 9,09 9,28 10,42 21,15 10,06 21,05 3,36 6,42 5,33
где — коэффициент теплопроводности газа при умеренном давле-
нии. Если это уравнение разделить на аналогичное, но относящееся
к вязкости — ц° = 1/Зау/р —, то
Z0 = р°са
Кроме этого, сопоставление вязкости и теплопроводности по-
зволяет заключить:
(Л/и) (MICv) = XM-~/iiCp
Соотношение ХМ/ц = 157?/4 в предположении, что молекуле
присуще только поступательное движение, т. е. Cv = 3/zR, дает:
-^-^ = -Ц*|, = 2,5
JIG О
[Во всех вышеприведенных соотношениях: X — кал/(см-с-К); ц —
Пз; С„ и СР — кал/(моль-К); cv—кал/(г-К).]
Приведем приближенную зависимость
Х° =
Значение модуля Максвелла
атомов в молекуле газа:
многоатомные ~ 1,3
трехатомные ~ 1,72
двухатомные -v 1,9
К постоянно, но зависит от числа
одноатомные
гелий
аргон
~ 2,5
~ 2,503
~ 2,505
Эйкен, используя параметр f, предложил приближенную корре-
ляцию:
Ao = p<’(cp + ^-); К=Ср-С0 (XV. 1)
10*
295
По Эйкену модифицированное уравнение для повышенных тем-
ператур имеет вид:
ЛМ/р = 1,77 R + 1,32СО = [1,77- Ср
Удельная теплопроводность газов:
Л = ЛСрЦ
Здесь А = 0,25(9К— 5); К — CP!CV. Параметр А «2,5; 1,9 и
1,72 для одно-, двух- и трехатомных газов.
Зависимость для
нарда — Джонса:
теплопроводности на основе потенциала Лен-
(Т/М)'!г
105 = 8328
(о — постоянная по табл. III.2; Q<2’2>— функция по табл. XI. 1).
Приводим примерные зависимости между ц° и Х° для газов:
.. 3,75/?ц° .
одноатомных — л° =----= 2,5 с
м
многоатомных — = 3,75 р
М r \15 R 5 /
Зависимости теплопроводности двухатомных газов .(кроме Нг)
от приведенной температуры Тар = Т/Ткр (по Шеферу и Тодосу):
-о— = Гпр (Гпр < 1) (XV. 2)
пт
кр
10
=1,207Т°п’279 (Гпр>2,5) .(XV.3)
пт
* кр
Кроме того, при критической температуре:
р®Ае
4 = 3,05 • 10~5 ,тКЕ
1 Кр • м<>Т ls
Известны также следующие соотношения для критического со-
стояния [X — Вт/(м • К)]:
р0,223у0,13?
инертных - Лкр = 4,3 • 10’3 .
двухатомных — Лкв = 61-10-5 —
Зависимость (по Андруссову):
Ср
Кр « |1Ср --— (XV. 4)
cv
Коэффициент теплопроводности можно определять по номо-
грамме (рис. XV. 1), построенной с использованием уравнения
(XV. 1), если известны ср и р,°. На графике нанесены линии для
296
H20, H2S и газов с числом п атомов в молекуле. Пунктиром обо-
значена последовательность определения X.
Майзик и Тодос приводят следующие соотношения, позволяю-
щие определять к, если известны критические параметры:
метан, нафтеновые и ароматические углеводороды —
= 9,465 • 1(Г4ГПр (Гпр < 1,0)
любые углеводороды при любых температурах —
= 21,27 10~5'(14,52ГПр - 5,14)!/’ (0,6 < Гпр < 3,0)
Рис. XV. 1. Номограмма для расчета теплопроводности газов.
Здесь а=Т,&М',г1Р'£>.
Уточненная, но приближенная, зависимость по Миснару, ис-
пользующая некоторый модуль S == 18,73- 103/С„ + 1
, „ /18,73-10» . Л
Л = Sgcp — iicv -------М J (XV. 5)
[ц —Па-с; Сг —Дж/(кмоль-К).]
Получаемые по этой формуле результаты увеличивают на 2%’
для низших температур и на 3% —Для высоких. В случае поляр-
ных соединений результат уменьшают на 10%.
297
Миснар, кроме того, приводит следующую общую зависимость:
X = p,coS = [icv —|- 1
где А определяется числом атомов п в молекуле газа; при п 3
для неполярных газов с нелинейными молекулами А « [18,85 +
+ 1,26(п— 2)]-103; если же молекулы обладают значительным ди-
польным моментом, А т [6,28 + 1,26 (п — 2)]-103.
При 273 К S ~ 2,5; 1,9; 1,72 и 1,3 для одно-, двух-, трех- и мно-
гоатомных газов.
Для многоатомных газов:
„ „ 18,73-Ю3 , ,
линейные молекулы — S = ——-------1- 1
нелинейные молекулы с небольшим дипольным моментом —
_ [18,85+ 1,26 (п- 2)]-103 , . „ 25,14 • 103 . .
S =------------------------h 1 или S — —~-------+ 1
Gt>ns CVin
молекулы со значительным дипольным моментом —
_ [10,48 + 1,26 (я — 2)] • 103 . _ 14,67-103 .
о =------------------------(- 1 или о =--------- + 1
^278 Ч>С,27'!
Приближенно коэффициент теплопроводности газа можно оце-
нить, если известны его критические параметры и мольный объем
(по Эйкену) [X — в кал/(см-с-К)]
о т ( \°>5 + 4>47
Х° = 231 • IO"7 (-^2-J ---------f (1,ЗЗГпр)
Х° = 266,9 • 10~7 ДтлЙг + 4>47)
огй(2’2)
X0 = 333.10-7(7Kp/M)°-5V-TKp4l’337'np)(Cv + 4-47) <XV-6)
Здесь о — постоянная по табл. III. 2; Q<2-2> — функция перемен-
ной по табл. XI. 1; f — функция, значения которой приведены на
стр. 234.
Соотношения между теплопроводностью и вязкостью (по Бром-
лею) :
для одноатомных газов — Х°/ц0 = 2,5CV
для линейных (неполярных) молекул —
/ 2 93 • 103 \ 1
Л°/ц° = ( 1.32CV + 14,23 103 - -Ц;-(XV. 7)
\ * пр /
для нелинейных молекул —
А°/и° = (1 ,ЗС0 + 15,07 • 103 - 0,ЗСвн вр - 2,89 • 103Г- Зя) • 1/М
(XV. 8)
Здесь Свн. вр — составляющая энергии вращения в мольной теп-
лоемкости (табл. XV. 2); а — характеристика взаимодействия со-
ударяющихся полярных молекул
а = ЗрКИп/М (Д5ИСП - 36,64 • 103 — /? In Ткип) (X V. 9)
298
Таблица XV. 2 Составляющие для расчета Свн вр [в ДжДмоль • К)]
Группа Температура, К
200 400 500 600 700 800 900 1000
—сн2—сн2— 11,05 11,47 1,0 8,88 7,95 7,24 6,7 6,32
СНз—СН2— 7,26 9,09 8,75 8,21 7,62 7,08 6,66 6,32
1 . R—С—Н 1 3,37 9,17 8,88 8,37 7,74 7,16 6,78 6,49
U- 1 6,70 9,13 9,34 9,13 8,71 8,21 7,75 7,37
1 R—СН— 8,46 7,62 6,91 6,28 8,86 5,53 5,28 5,07
R—СН 6,20 4,86 4,64 4,48 4,40 4,35 4,31 4,27
=СН—СН= 8,75 13,6 12,39 11,18 10,22 9,38 8,75 8,21
=С—С= 3,39 3,18 2,51 2,0 1,63 1,46 1,34 1,30
R—С= 8,0 8,79 8,165 7,49 6,90 6,45 6,11 5,78
СН3—С=О 7,49 5,61 5,19 4,94 4,6 4,56 4,52 4,43
R
СНз—ОН 5,86 5,23 5,02 4,94 4,86 4,81 4,49 4,73
R—СН2—0—СН2—R 9,38 9,46 4,56 8,0 7,16 6,95 6,49 6,15
где Ркип—ПЛОТНОСТЬ ЖИДКОСТИ При Ткип', А5ИСП —^исп/Гкип — эн-
тропия испарения.
Приводим еще одну зависимость для вычисления теплопровод-
ности газов:
(3CD/CV — 5
Л = ВСоИ; В = --- (XV. 10)
Миснар предложил выражать зависимость теплопроводности
газа от его молекулярных характеристик. В этом случае входящие
в вышеприведенные формулы ц, Cv, S выражаются через М, Ткип и
число атомов в молекуле газа п.
Так, значение коэффициентов вязкости
a S можно заменить средним значением
Сср = 90 + 70(Т’кип/100)1’75
При 273 К для газов с п от 3 до 12 существует приближённая
зависимость
Св = o,85M'V’
299
Для интервала температур от 273 до 423 К:
С. _ 0.85Л-. { I + (1 + [(^)Ч- - I] V }
Приближенная зависимость по Миен ару
Т + с T3/t
Г + Сср
где Сер = 90 + 70(Ткип/100) *-7S; Л: = 4,06-10~3 для одноатомных и
k = 4,35-10~3 для двухатомных газов.
Для многоатомных газов при 273 К:
20 9 . 10~4
А.273 - —.----[18- (7 кип- 100)-0,0016] [2,60 + 0,067 (п. - 4)] (XV. 11)
М1г
Если дипольный момент р, значителен, искомую Л умножают на
поправочный коэффициент а — 1 —2/3р, -1019, где ц в ед. СГСЭ, или
а=1—2-10~8ц, если ц в Кл-м.
Для газов с п = 10—12 от 273 до 423 К:
20 9 • 10~4
х = -[18 - (Ткип - 100) • 0,0016] [2,60 + 0,067 (п - 4)] X
1 М '»
(XV-I2)
или
= Л273 [1 + (°’55 + 100 ) 100 ]
Кроме того, Миснар приводит следующие зависимости для
многоатомных газов:
п = 3 + 10 —
Л273 \2/о/ 1 “г Сер L \ Д “г 4 / J L \ о / J Ю
П=10, 11, 12 —
§ 2. ОПРЕДЕЛЕНИЕ КРИТЕРИЯ ПРАНДТЛЯ ДЛЯ ГАЗОВ
Й ИХ СМЕСЕЙ
Коэффициент теплопроводности жидкостей, газов и их смесей
можно вести, используя безразмерный критерий подобия Прандтля:
ц°
Рг“сРугг
где Ср — удельная теплоемкость; р° и %° — вязкость и теплопровод-
ность при умеренных давлениях.
Для газов Рг = 1/К; К ~ 2,5; 1,9 и 1,75 для одно-, двух- и трех-
атомных газов.
300
Для газов:
Рг = Срц°А°М = Ср (2,48 + Ср)
Рг = Срр/ЛМ = Ср (0,90 + 1,32Ср)
(XV. 13)
[СР — кал/(моль-К)].
Приведенное позволяет записать:
Рг М
При низких давлениях Ср — Cv = R, тогда:
___ С®Н С. R \___ с»н Ср
Рг-"Г\ + ’с7/ ~Г"с7
(Cv = cvM и Ср — срМ).
Зная cv и Ср, можно вычислить Рг и по известной вязкости
газа |i определить X.
Для газов и газовых смесей при высоком давлении значение Рг
определяется из найденных ц, Л и Ср. Так, для одноатомных газов
Ar, Не, Ne и других (при Cp/Cv — 5/3) Рг = Срц/7.М = 0,67; для
двухатомных газов Рг « 0,7; для газов с линейными неполярными
молекулами (О2, Cl2, С2Н2, CS2, СО2, N2O, NO и др.) Рг 0,73,
а для нелинейных неполярных (СН4, СеНе, С2Нб, ССЦ, СН2С12 и др.)
Рг « 0,79; для полярных газов Рг ~ 0,86; водяного пара и аммиа-
ка Рг л: 1 (табл. XV. 3); для полярных молекул (СН3ОН, СгНзОН,
SO2, H2S, НС1 и др.) Рг « 0,86.
Таблица XV. 3
Критерий Прандтля для водяного пара
Давление Рг (насыщенный пар) Рг (перегретый пар)
МПа атм 590 К 700 К 800 К
0,1 1 1,063 1,003 1,002 0,995
3,4 34 1,90 1,40 1,19 1,12
6,8 68 2,67 2*06 1,44 1,27
10,2 102 3,81 3,53 ' 1,73 1,42
. 13,6 136 5,27 —. 2,09 1,60
Если М газа > 15, то по Гильзенрату и Тулукяну:
1,204Ср+1,47
[Ср — кал/ (моль • К) ].
Зависимость критерия Рг от давления::
(Рг)Лр (ср)т>р 1/у+0,80 + 0,761 у
(Рг/у, 1 ^сР^т, 1 Щ "Р 1>20 + 0,755у
301
ч . .
Здесь (Pr)T,p и (Рг)г,1 — критерии Прандтля при Т, Р и Т, Р =
= 1 атм; y = z— 1; z— коэффициент сжимаемости по диаграмме
рис. XI. 6.
Значения критерия Рг для газов можно рассчитать по величи-
нам ср, ц, К при данном составе, давлении и температуре; для газо-
вых смесей следует вначале вычислить значения ср.см, цсм, Мсм и
^«см-
§ 3. ЗАВИСИМОСТЬ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ
ГАЗОВ ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ
При небольших давлениях теплопроводность газов (подобно
вязкости и теплоемкости) увеличивается примерно линейно с повы-
шением температуры (исключение составляют одноатомные газы,
теплоемкость которых постоянна). В общем случае кт изменяется
пропорционально Тп (n« 1). Для одно- и двухатомных газов из-
менение Хт пропорционально:
[1/(Т + Сср)1 Т3'1
В среднем теплопроводность этих газов увеличивается на 29%
при изменении температуры от 273 до 373 К на 55% —от 273 до
473 К и на 80% — от 273 до 573 К-
Общая зависимость коэффициента теплопроводности от темпе-
ратуры:
Значение ^кип ПрИ Т'кип в пределах 200—400 К при числе ато-
мов п в молекуле 5, 10 и 15:
0,5-10-’ /7\т\0’75 Л , п. \
Лкип-—лК"
По Андруссову зависимость X от температуры при постоянном
давлении Р имеет вид
ЛР = Л°С-£-У(л0-При 273 К) (XV. 14)
\ о J
где п — зависит от температуры:
п = А - В • 10~4/ + С 10~7/2
Значения постоянных А, В и С приведены в табл. XV. 4. Известна зависимость (по Сатерлендеру):
273,2 +С f Т Т л т + С 1 273,2 ) (XV. 15)
Значение постоянной С « 1,5 7’кип и равно:
Азот 113 Кислород 125
Бензол 114 Окиси
Водород 71,7 азота 195
Воздух 122 углерода 156
302
Общая зависимость теплопроводности газов от температуры:
0(1 +£'Г| УГ
1 + С/Т
(XV. 16)
Значения постоянных С, D и Е см. в табл. XV, 5.
Таблица XV. 4
Значения постоянных А, В и С
Газ А в | С Газ A В С •
н2 0,674 -0,336 n2 0,773 0,57 0,4
d2 0,678 -0,33 — n2o 1,21 2,88 0,8
со 0,792 0,51 0,5 NO 0,82 1,64 —
со2 1,192 2,38 0,56 о2 0,83 0,91 0,64
сн4 1,33 0,70 so2 1,31 3,2 9,9
С2н« 1,52 2,82 — H2S 1,13 1,74 —
с2нв 1,49 0,98 —, H2O 1,22 1,60 —
СзН8 1,75 4,98 — HC1 1,05 1,66 —
Таблица XV.б
Значение постоянных С, D и Е в уравнении (XV.16)
Вещество С. к E-10s, К-1 О-Юв, вт/(м.Ю8/2
Аргон 142 0 1503
Вода (пар) 673 0 3359
Водород 83 247 1250
Воздух 123,6 0 2114
Двуокись углерода 274 1026 1351
Метан 198 453 2780
Ртуть (пар) 960 0 1005
Если известен %rv при некоторой Т\, можно определить Кт, при
заданной Тг по зависимости
= .ЧЬЗЗТпр,2)(Ср+18,71-103)Г1
4, Ц1.33Тпр ,)(со +18,71.103)Г|
где Тпр. 1 = Л/Ткр-, Гпр. 2 = Тг/Гкр; Ш.ЗЗТпр)—функция приведен-
ной температуры, стр. 234.
Значение приведенной теплопроводности при изменении Тпр от
0,8 до 8 определяется зависимостью:
, 4.24 • 10-6
"р “ 1 + 1/Тпр
В общем виде: Лпр = Кр/Ккр; отсюда
= (XV 18)
Рис. XV. 2 иллюстрирует зависимость А.пр — f(TapPup).
303
Приводимые ниже формулы
-4Н —•(£)’
(XV. 19)
позволяют судить об изменении А. и ц с температурой (Х° и ц°—>
относятся к 273 К) (табл. XV. 6).
Рис. XV. 2. Обобщенная зависимость приведенной теплопроводности
газа от приведенных температуры и давления.
Таблица XV. 6
Значения п и т в уравнении (XV. 19)
Газ п т Газ п т
Азот 0,80 0,68 Двуокись уг- 1,23 0,82
Аргон 0,80 0,72 лерода
Вода (пар) 0,78 0,168 Кислород 0,87 0,69
Водород 1,48 1,20 Криптон 0,86 0,83
Воздух 0,82 0,68 Ксенон 0,91 0,89
Гелий 0,73 0,68 Неон 0,71 0,65
Расчетные формулы коэффициента Теплопроводности газов
(приближенные) в зависимости от температуры (табл. XV. 7):
\~V-t(aCp-b) (XV. 20)
Для паров воды — (400Ср — 1500)
304
Таблица XV.7
Значения а и b для газов в уравнении (XV. 20)
Параметр Азот Вода (пар) Воздух Двуокись углерода Кислород
а 215 400 155 147 195
ь 205 1500 -167 357 257
Зависимость теплопроводности от температуры и давления:
1 = kta
Температура
273 373 473 573 673 773 873 873 1073 1173 1273 1373
К
Рис. XV. 3. Теплопроводность продуктов сгорания и некоторых газов.
Приведена кривая для нормальных продуктов сгорания, т. е. содержащих (в % (об.)]: [НгО]=
= 11 и [СО21 = 13. Если же 11% > [НгО] > 11%, то определяемую К следует умножить на
приводимый коэффициент а.
Значение а (влияние давления)
, , 0,92-Ю3 /А 10~зУ
0 = 1+ ' pv2 /I1------v~)
(Р — давление пара, Па; V — удельный объем пара, м3/кг).
Помимо указанных приводим еще несколько зависимостей:
Предводителева — к = А0 + Вр
Цедерберга — к =,к° + Врп
(р — плотность, кг/м3; В — некоторый коэффициент; п=1,16 4-
. rf- 0,0024 /И).
305
Рис. XV. 3 — XV. 7 характеризуют значения X различных соеди
нений в зависимости от Т и Р.
К
273 373 473 573
К
Рис. XV. 5. Теплопроводность воды и водяного пара
I, II, III—кривые насыщения; воды и перегретого пара.
Приблизительное значение теплопроводности газов в критиче-
ской точке можно рассчитать по формулам, содержащим приведен-
ную вязкость цпр
и0
ЛКр = tF Икр (ср + 10,3 • 10W) (XV. 21J
^Др
306
(Ср — удельная теплоемкость газа)'
Лкр = 2,бО(А°)г
Кр
(XV. 22)
Последняя зависимость позволяет определить 7.Кр, если извест-
но V.
Кроме того:
= 0,3647'™ (XV. 23)
Апр — ^°Апкр> Я.пкр = 12,24 • 10 8 —г-
Л° = 0,364Т>’р786Лпкр
Если известно Л°, то > по Це-
дербергу:
Ар
-algT’pp + ZHgT’Sp+HgT8,,
(XV. 24)
Значения коэффициентов а, b
и с зависят от числа атомов п
(рис. XV. 8, табл. XV. 8).
В области умеренных давле-
ний теплопроводность газов почти
не зависит от давления, но увели,
чивается в области высоких
(>2 МПа) и низких [<2,6 кПа
(20 мм рт. ст)], особенно для мно-
Рис. XV. 6. Теплопроводности неко-
торых газов при высоких давлениях:
/ — азот, 100°С; 2—воздух, 20 °C; 3—угле-
кислый газ, 100 °C; 4—перегретый пар,
450 °C; 5—насыщенный водяной пар.
гоатомных газов.
Предводителев и Варгафтик предлагают следующее уравнение
зависимости между теплопроводностями газа при повышенном дав-
лении:
(XV. 25)
Таблица XV. 8
Значения коэффициентов а, Ь и с в уравнении (XV. 24)
Газы т пр а Ь С
Двухатомные < 1 1,0 0 0
> 1 0,934 -0,0323 -0,0511
Трехатомные < 1 1,325 -0,6311 — 1,540
> 1 1,440 0,0115 0,2141
307
Значения В и ft приведены в табл. XV. 9, а р — плотность, кг/м3.
Цедерберг определяет п так:
п == 1,16 + 0.0024М
Рис. XV. 7. Изменение теплопроводности с температурой:
1—этан; 2—пропан; 3—циклопропан; 4—вода; 5—метанол;
гекеаи; 7—окись этилена; 8 — ацетон: 9—хлорэтан; J0—-хлор-
метан; // — ацетонитрил; 12 —хлороформ; 13—эфир; 14—этнл-
формиат; 15—метилацетат; 16— этил-ацетат; 17 — диоксаи;
18— нитроэтан; 19—нитрометан; 20—днэтиламин; 21—триэтил-
амии; 22—циклогексан; 23—бензол; 24—уксусный альдегид;
25—1 Л-дихлорэтаи; 26— 1,2-дихлорэтан; 27—бромметан.
Таблица XV. 9
Значения постоянных В и п в уравнении (XV. 26)
Газ в 1 п
Азот 1,662-10"* 1,23
Водород 2,950 • 10"; 1,16
Двуокись углерода 1,380- 10"* 1,26
Кислород - 1,246-10"* 1,24
Метай 4,914-10" 1,20
300
Для определения постоянной В надо знать одно значение %Р.
Приведенная теплопроводность газа Хпр = ЛДкр аналогична
приведенной вязкости: цпр = |х/ц«р. Отношение теплопроводностей
газа при высоком и небольшом давлениях Хр/Х° есть функция при-
веденных параметров.
Значениям приведенных параметров Тпр и Рпр соответствует
приблизительно одинаковое для всех соединений значение ХПр и
одно значение ХРД°.
Экспериментально найдено, что Хпр/нпр = f(Tap):
Тпр 0,4 0,5 1,0 1,4 2,0 3,0 5,0 10 .40
1“р/ц°р 0,565 0,655 0,855 0,931 0,970 1,018 1,11 1,192 1,395'
Зависимость 7.Р = ХпрХкр позволяет найти КР, если известны Ткр,
Т’кр и Ср. Подстановка в уравнение (XV. 21) определенных соответ-
ствующим образом параметров
позволяет найти Напомним:
м'1гР!з
Икр = 3,62 • 10~4 -(XV. 26)
н т‘/б
кр
(Цкр — мкПа-с).
Затем по рис. XV. 2 находим 2.Пр
и, далее, Лр.
Теплопроводность Хр может
быть найдена для заданной Т по
рис. XV. 9. Здесь, однако, необ-
Рис. XV. 8. Зависимость а (/), b (2) и
с(3) от числа атомов п при Тпр < 1.
ходимо знать для заданнойТ
и каком-либо небольшом давле-
нии. Тогда по рис. XV. 9 находим
отношение (Кр/К°)т. Искомое ХР
вычисляем по соотношению Комингса — Натана:
\. = (ЧМ°М (XV. 27)
Для неполярных соединений Стил и Тодос приводят зависи-
мость [в кал/(см-с-К)]:
(Л - A0) yz^p « 13,1 • 10~8 (е0,67рпр - 1,069) (XV. 28)
(0,5 < рПр < 2)
Здесь е —функция Тпр и Рпр, а у == Ткр М'^/Ркр (рис. XV. 10).
§ 4. ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ
ГАЗОВЫХ СМЕСЕЙ
Теплопроводность газовой смеси увеличивается с повышением
температуры и давления (при давлениях >1 МПа). Допуская ад-
дитивность теплопроводности газовой смеси, можно написать:
^см “ 4“ 4" ^зхз 4" • * т (XV. 29)
309
Рис. XV. 9. Обобщенная зависимость при температуре Т от ГПр и РПр
в области высоких давлений (а) и в области Рпр = 0,1—1,0 (б).
где % и'х — теплопроводности и мольные доли компонентов смеси;
Xi -j- Х2 -j- Хз = 1.
Приведенная формула применима для смесей газов, молекулы
которых неполярны или малополярны.
Для смеси неполярных газов Брокау предложил зависимость:
Асм = 0,5 (^ср. 1 4" ^ср. 2)
В общем виде
310
рпр
Рис. XV. 10. Диаграмма для определения теплопроводности плотных газов.
Газ Точ- ка гкр / 7 = г‘/,Д11/!/р2к/з1 Газ Точ- ка гкр v=rVeA1'/2/pV,
Аргон 1 0,291 1,499 Нонан 15 0,250 4,192
Бутан 10 0,273 1,800 Окись угле- 5 0,294 1,127
Гексан 12 0,264 2,717 оода
Гептан 13 0,269 2,279 Октаи 14 0,258 3,634
Двуокись уг- 6 0,275 0,987 Пентан 11 0,269 2,279
лерода Толуол 17 0,271 2,312
Кислород 4 0,293 0,965 Циклогексан 16 0,272 2,240
Криптон 2 0,292 1,558 Этан 9 0,285 1,072
Ксенон 3 0,290 1,976 Этилен 8 0,267 0,989
Метан 7 0,289 0,751
311
где Хер — средние теплопроводности, определяемые по правилу сме-
шения:
Хср. 1 = Xj/u + х2Л2 + -г-"—+ •••
Лср. 2 Л] Л2
Для смесей при высоком давлении сначала устанавливают теп-
лопроводность при низком давлении Х°, а затем умножают на от-
ношение Хр/Х°, определяемое по рис. XV. 9. При этом вычисляют
псевдокритические давления и температуры для бинарных смесей
по зависимости:
Т'пкр кр. 1 + ЯгГкр. 2? ^пкр — ЛдРкр. 1 4" ^2^кр. 2
Предложены различные эмпирические формулы, в основу кото-
рых положены принципы аддитивности, например, логарифмов теп-
Рис. XV. 11. Зависимость коэффициента а
от Xi — мольной доли более легкого
компонента смеси (Н2 или Не).
лопроводности или величин,
обратных теплопроводности:
1 _- X1 г. Хг I Хз 1
%см Xj Х2 Хз
(XV. 30)
Приводим формулы Брокау
ЛсМ = <м + 0-«)С (XV. 31)
*сМ = *£хЛ + 0 --)•!/£ J
в которых Хсм и Лем — теплопроводности, получаемые по уравне-
ниям (XV. 29) и (XV. 30); а — коэффициент (рис. XV. 11), завися-
щий от Xi — мольной доли более легкого компонента смеси (Не
или Н2); Xi и X; —мольная доля и теплопроводность i-ro компонен-
та смеси. Указанные соотношения Брокау применимы в случае не-
больших давлений и неприменимы к очень полярным молекулам.
Леман дает следующую зависимость для смесей, содержащих
Не и Н2: ___ __________
. X]XlV-3fl + Х2Х2 ''j М2 + ... /yv on.
Лсм--------з/-—-----й/тт- (А V. М)
х I •у М\ -р х2 у М2 4* . •«
Он же для случая, когда в состав смеси входят газы с поляр-
ными и неполярными молекулами, рекомендует соотношение:
Хсм = (XiXi 4- х2Х2 + хгХз 4* ...) -)-g-g—
(Хпол — сумма мольных долей полярных компонентов смеси).
Васильевой выведено уравнение для смеси газов 1,2, ..., мо-
лекулы которых полярны:
Хсм =---------------------------4---------------------------- (XV. 33)
1 + ^1,2 4" Ai, з ~ 4- ••• 1 + А2 i —+ А2 з —— 4* •••
Л-1 ’
312
Здесь -41,2, 41,з, 42, i, ... — коэффициенты, зависящие от при-
роды газов, образующих смеси; Линдсей и Бромлей приводят для
них выражение:
1 ( Г Hi /MAW 1' + CJT до,5 V 1 + С1>2/Т
Л112--р + [— ! + С2/Т J / 1 + CJT
(XV. 34)
Здесь pi, рг — вязкости чистых компонентов; Ci, Сг — постоян-
ные Сатерленда [уравнение (XV. 15)]; С« 1,5ТКИП; С],г — f VС;С2;
f — 1 при условии, что оба газа полярны или неполярны; f » 0,733,
если в смеси присутствуют полярные и неполярные газы. В случае
постоянной Д2, t индексы 1 и 2 меняются местами. Отношение
Hi/pa = (AiA2)[’(CpI + 2,47)/(Ср2 + 2,47)]; Cpi, Ср2 — мольные тепло-
емкости компонентов.
Теплоемкости М и А2 можно определять по рис. XV. 9.
В методе Комингса, основанном на теории соответственных со-
стояний с применением псевдокритических параметров, для высо-
ких давлений вначале определяют А°м при небольшом давлении,
но при той же Т, при которой он должен быть вычислен для высо-
кого давления (см. рис. XV. 9, а). Затем по известным критическим
параметрам компонентов Ркр. ь Ткр. i и Ркр. 2 и Ткр. г вычисляют
псевдокритические параметры смеси:
7пкр. CM = Xl^Kp. 1 + Х2Ткр 2; Рпкр. см = Х1Ркр. 1 + Х1Ркр, 2
Для приведенных псевдокритических парамегров:
Т р
Т ппр = > Дшр —
1 пкр. CM OlKp. см
По диаграмме (рис. XV. 9) отсчитывают отношение Асм. РАсм, а за-
тем определяют искомую
_ Асм. р 0
Асм. р.-~о Асм
^СМ
Для определения теплопроводности газовых смесей при высоких
давлениях можно применить уравнение (XV. 28) или рис. XV. 10,
если рассматривать смесь как гипотетический компонент с соответ-
ствующими псевдокритическими параметрами, которые определяют
по правилу Праусница, Ганна или Кэя (см. гл. V), или же по фор-
мулам:
т — V* т • р — ZnKP-CM^nKP .
1 икр. CM £_txl1 кр. р ^пкр.см— >
2
пкр, см
¥кр.i
§ 5. ПРИМЕРЫ РАСЧЕТОВ
[6, 53, 66]
Пример XV. 1. Вычислить теплопроводность хлора (М = 70,9) при 273 К,
зная: ТКр = 417 К; р°=12-10-в Пас; С„ = 25,4 102 3 Дж/(кмоль-К) =
= 0,854 кал/(г-К).
313
Решение. По формуле (XV. 7)
Л = (1,32 • 25,4 • 103 + 14,23 • 103 - '4-17 =
70,9 \ о /
= 7,15- 10-3 Вт/(м-К)
Воспользуемся рис. XV. 1: приведенное на нем построение дает 1° =
= 19 10-в кал/(см-с-К) = 7,95-10-3 Вт/(м К).
Пример XV. 2. Установить теплопроводность паров этанола при 373 К, зная:
Ткр = 516,3 К; 7’кип = 351,7 К; Ркр = 6,18 МПа (63 атм); zKP = 0,248; р =
= 10,8510-в Па-с; С. = 68,7-Ю3 Дж/(кмоль-К); Х° = 208,7 Дж/(мс-К).
Решение. Применим формулы (XV. 8) и (XV. 9).
По рис. IX. 2 находим Д*$исп — Т-кип/Т’кип при Т’кип/Т’кр == 351,7/516,3 ^=
— 0,69: ASncn = 108,9-103 Дж/(кмоль-К).
При 7’кип Ркип = 0,73 кг/моль.
Тогда
а = - ' °’7- (108,9 • 103 — 36,64 • 103 - 8,314 • 103 In 351,7) =
4о,1
= 1,117 Дж/(кмоль-К)
По табл. XV.2: Сви. вр = 9-103+5,4-103 = 14,4-103 Дж/(кмоль-К).
Окончательно:
А = (10,85 • 10~6/46,1) {1,3 • 68,7 • 103 + 15,07 • 103 - 0,3 • 14,4 • 103 -
- [2,89 103/(373/516,3)] - 3 1,117 103} = 21,8 • 10~3 Вт/(м • К)
Пример XV. 3. Вычислить теплопроводность СО, при 273 К, зная р =
= 13,75-10-’ Па-с; С. =27,8-Ю3 Дж/(кмоль-К); с. = 0,632-10’ Дж/(кг-К);
сР = 0,84-Ю3 Дж/(кмоль-К).
Решение. По формуле (XV. 5):
Тогда:
Л = 1,67 • 13,75 • 10-6 • 0,632 • 103 = 14,5 • 10-3 Вт/(м • К)
Можно воспользоваться формулой (XV. 4):
Ср/Ср = 0,84/0,632 = 1,3; А = 1,3 • 13,75 • 10~б • 0,84 • 103 =
= 15 • 10-3 Вт/(м • К)
Пример XV. 4. Вычислить теплопроводности NO(1) и СО(2) при 573 и 123 К,
зная:
гкп 1 = 18°; гкп 2 =133; Ч = 16>03 • 10~3;
кр. 1 кр. 2 * кр , 1
= 11,68-10“3 Вт/(м-К)
гкр,2
Решение. ТПр. i = ]gQ = 3,17; Tnpi 2 = ।дд = 0,92
Для NO по формуле (XV. 3):
А° = 1,2077’°п’£2911Гк ] = 1,207 • 3,17й’™ 16,03 - 10-3 = 4,5 • 10~2 Вт/(м К)
Для СО по формуле (XV. 2):
Л° = ЛГ Т’ = 0.92- 11,68- 10_3= 10,75- 10”3 Вт/(м • К)
1 кр. 2 пр
Пример XV. 5. Определить теплопроводность метанола (М = 32), зная
7’кип = 338 К и п = 6.
314
Решение. Воспользуемся формулой (XV. 11):
20 9 • 10~4
Л:73 = —— [18 (338 - 100) • 0,016] [2,60 + 0,067 (6 - 4)] =
= 14,5 • 10-3 Вт/(м-К)
Пример XV. 6. Установить теплопроводность диоксана (CsHiOJs (М = 88)
при 393 К, зная 7’кип = 375 К и п = 14.
Решение. Применим формулу (XV. 12):
20 9•10“4
Л39з = — [18 - (375 - 100) • 0,016] [2,69 + 0,067 (14 - 4)] X
88'2
хН»4)^]-
= 18,1 • 10~3 Вт/(м • К) (опытное значение 17,8 • 10-3)
Пример XV. 7. Вычислить теплопроводность сухого воздуха при Т = 353 К,
зная удельную теплоемкость сР = 1,02 кДж/(кг-К); р = 0,021 10-3 Па-с и
Cp/Cv = 1,4.
Решение. Воспользуемся формулой (XV. 10).
Значения:
ЭСр/Ср —5 9-1,4 —5
В =----Р—^-------- -.-------= 1,9
4 4
Ср 1,02
Ср = г :л— = -ту = 0,729 кДж/(кг • К)
И окончательно:
Л = 1,9 • 0,729 • 103 • 0,021 • 10~3 = 0,408 Вт/(м • К)
Пример XV. 8. Вычислить теплопроводность СОз при 573 К, зная, что при
273 К 7° = 149-10-4 Вт/(м-К).
Решение. Применим формулу (XV. 14).
Значения постоянных по табл. XV. 4: А = 1,192; В — 2,38 и С = 0,56.
п = 1,192- 2,38- 10-4-300 4-0,56 10-7-3002 = 1,126
Л = Л° ( 273 )" = Н9 • IO’4 (-U)1’126 = 342 • 10^ Вт/(м • К)
_ \ £1 о J \ Z/О J
Пример XV. 9. Вычислить Л для NO (Л1 = 30) при 573 К и 0,1 МПа, зная
Ткр = 179,2 К; В° = 17,8- 10-а Па-с (при 273 К), ркр = 0,52-103 кг/м3.
Решение. Применим формулу (XV. 1).
Значения (см. табл. X. 4)
Ср = 6,461 + 2,358 • 10“3Т = 7,81 кал/(моль • К) = 32,8 кДжДкмоль • К)
Ср = Ср — R = 32,8 — 8,314 = 24,5 кДжДкмоль • К)
24 5
Ср/Ср = 32,8/24,5 = 1,34; Ср = = 0,816 кДж/(кг - К)
Значение вязкости прн 573 К по формуле (см. стр. 237):
_ 273 4-С ( Т V/2 6 273 4- 128 ( 573 V/,
90 г + с 273 J = 573 4- 128 к 273 ) =
= 32,7- 10~6 Па-с
Л = 9 1,3у ~• 0,816 103 - 32,7- 10~б =
4
== 4>6 • Ю-2 Вт/(м • К) (погрешность 3,3%)
316
Воспользуемся формулой (XV. 13):
ср = 32,8/30 = 1,08 кДж/(кг • К); Рг == - inT = 0,762
\О4,О “Г 1м,О^ * 1и
„ сяц° 1,08 • 103 • 32,7 • 10~6
Рг 0,762 "
= 4,7- 10-2 Вт/(м-К) (погрешность 4,2%)
Воспользуемся формулой (XV. 7). Находим Гпр = Г/Ткр = 573/179,2 = 3,2.
Искомая Л°:
Л° = (1,32 • 24,5 • 103 + 14,23 • 103 - 2,93 103/3,2) -32’7'J°— =
«5U
= 4,98-10~ Вт/(м-К) (погрешность 10,7%)
Если вести расчет по формуле (XV. 6), то сначала необходимо найти зна-
чение /(1,33 Тпр); оно равно 2,168 (стр. 234).
Затем Умол. кр = М/ркр — 30/0,52 = 57,7 см3/моль.
И окончательно:
А0 = 333 • 10~7 (57,7)~°>67 = 5,1 • 10~2 Вт/(м • К)
По формуле (XV. 17) при 273 К А° = 2,34-Ю-2 Вт/(м-К).
Для 573 К:
Т’пр 2 ~ 573/179,2 = 3,2; = 24,5 кДж/(кмоль • К)
Для 273 К:
ГПр. 1 — 273/179,2 = 1,53; С01 = 21,44 кДж/(кмоль • К)
По данным вывода на стр. £34:
/(1,33-1,53) = 1,214(273 К) и / (1,33 • 3,2) = 2,168 (573 К)
А0 —2 34 10-2 2’168 (24,5+ 18,71)-Ю3 2-
К 2,34 ° 1,214 (21,44 + 18,71)-103 -4>49'10 Вт/(м-К)
Решение по рис. XV. 1:
ср = 1,08 кДж/(кг - К) = 0,26 кал/(г • К);
р° = 32,7 • 10~6 Па • с = 0,0327 сПз и п = 2
А° = 11,5 • 10-5 кал/(см • с • К) = 4,8 • 10~2 Вт/(м • К)
Пример XV. 10. Вычислить теплопроводность метана при 24 МПа и 308 К,
зиая при 305 К и 0,1 МПа А° = 3,81-Ю-2 Вт/(м-К); Ткр= 191 К; Ркр = 4,5МПа.
Решение. Воспользуемся рис. XV. 2. ТПр = 308/191 — 1,7; Рпр = 24/4,5 = 5,3;
А/А° = 1,37. Следовательно:
А = 1,37 • 3,81 •10~2 = 52,2 • 10“2 Вт/(м • К) /
Пример XV. 11. Найти теплопроводность N2O (М = 44) при 378 К и Р =
= 136 атм, зная при 378 К и 0,1 МПа А° = 234-Ю-4 Вт/(м-К); 7„р = 309,7 К;
Р„р = 71,7 атм; VMOn. кр = 96,3 см3/моль; zKP = 0,271; при 105 К и 13.6 МПа
z = 0,63.
Решение. Воспользуемся формулой (XV. 28) и рис. XV. 10.
Y = Т'^м'1г/Р^р = 309,• 44Vi/71,7Vs = 1,01
Рмол = zRTjP = 0,63 • 82,06 • 378,2/136 = 144 см3/моль;
/ Рпр ж Гдаол, кр/Гмол = 96,3/144 = 0,668
316
По рис. XV. 10: (% — %0) yz5Kp = в,5 • 10 3 кал/(см • с • К).
По уравнению (XV. 28): (Z - Х°) yz‘p = 13,1 • 10“8 • (e0'67'0'668 - 1,069) =
= 6,5 • 10“8
Z - Л° = 6,5 • 10“8/( 1,01 0.2715) = 44 • 10~6; Л = (44 + 55,8) • 10“6 =
= 99,8 • 10~6 кал/(см • с • К) = 4,17 • 10-2 Вт/(м • К)
Пример' XV. 12. Найти Теплопроводность этилового эфира Л8 при 483 К,
Чр и Чкр> зная Гкр = 467 К и Л3 = 22,2 • IO"3 Вт/(м • К) при Т2 = 373 К.
Решение. Для использования формулы Лдр == 0,3647'J1p86 вначале определим
Тпр. ! == 483/467 = 1,04; тогда Л°р = 0,364 • 1,0411786.
И окончательно (Хпкр = 91,5-10~3):
= ЛпрЛпкр = 0,364 • 1,041,786 • 91,5 • Ю“3 = 35,6 • 10~3 Вт/(м • К)
Пример XV. 13. Вычислить различными способами теплопроводность метана
(М — 16) при 373 К и 38 МПа.
Решение. Справочные данные: вязкость р.° при 273 К и 0,1 МПа равна
10,2-10~6 Па-с; постоянная С = 164. Критические параметры:
Ткр — 190,7 К; Ркр = 4,6 МПа; ркр = 0,162 • 10-3 кг/м3;
Умол. кр = 16/0,162 = 98,8 см3/моль
. . При 273 К и 0,1 МПа табличное значение Л° = 30,5-10-3 Вт/(м-К). Кроме
того, Тпр = 1,955; Рпр = 38/4,5 — 8,46.
Коэффициент вязкости при 373 (см. стр. 237):
Далее, при 373 К:
Ср = 4,75 + 12 • 10~3 • 373 + 3,03 • 10~6 - 3732 - 2,63 • 10~6 • 3733 =
= 39,8 кДж/(кмоль • К)
Cv — Cp — R — 39,8 — 8,314 = 31,5 кДж/(кмоль • К)
Ср = Ср/М = 39,8/16 = 2,5; са =31,5/16 = 1,97 кДж/(кг • К);
ср/с0 = 2,5/1,97 = 1,26
Воспользуемся формулой (XV. 15):
По формуле (XV. 16): \
Л° = [2780• 10-6 (1 + 453• 10-6• 373)л/373]/(1 + 198/373) =
= 4,1 • 10~2 Вт/(м • К)
По формуле (XV. 17):
/(1,33-1,955) (31,5+ 18,71) • 103
“ /(1,33-1,432) (26,4+ 18,71)-103 “ 1Л4
Здесь 26,4-103 — Cv при 273 К, т. е. при Тпр = 1,432.
Далее: Л° = 30,5-10-3 -1,44 = 4,4-1 О*2 Вт/(м-К).
Определим при критической температуре и умеренном давлений ПО
формуле (XV. 17).-
817
' При Гкр Гпр. 2 = Г/ГКр = 1; при 273 К Гпр. i = 273/190,7 = 1,432.
Значение ср (по таблицам) 2,08 кДж/(кг-К). Это значение ср можно вы-
числить по разности энтальпий по энтропийной диаграмме СЬЦ.
Тогда:
Ср = 2,08 • 16 = 33,4; Со = 33,4 — 8,314 = 25,1 кДж/(кмоль • К)
По формуле (XV. 17):
10 ' ,
ЛГКР = /(1,33-1) (25,1 + 18,71)-103 = 0 7
4 /(1,33-1,432) (26,4+18,71)-103
И окончательно:
4 = 0,7 • 30,5 • 10~3 = 2,13 10“2 Вт/(м • К)
кр
Вычисление Хкр в критической точке.
По формуле (XV. 22):
4 =1,60 (4 'l = 2,60- 2,13 • 10~2 = 5,45 Вт/(м-К)
р \ 1 кр/
Воспользуемся рис. XV. 2. При ГПр i = 1,432 и Рпр = 0,1/4,6 = 0,02; Znp —
= 0,6.
Искомое
1кр = 4/4р = 28 ' Ю“3/0,6 = 5,06 • IO"2 Вт/(м • К)
Расчет можно вести и по формулам (XV. 21) или (XV. 26):
ц = 3,62 • 10“4 —/2 ^’5.~ 10-)- = 16,4 • 10-6 Па • с
кр 190,7/б
Интерполируя 4р/Рпр ПРИ Т =373 К, если Гпр = 1,955 (см. стр. 309), по-
лучаем 4Р/Рпр = °-97-
И окончательно:
л Г 0 /чО 1 ( 10,3-1 О’\
^кр LPnpMnp] Ркр 4 д/ J
= • 16,4 • 10“в ^2,49 + -1^-) • 103 = 4,95 • 10~2 Вт/(м • К)
Для определения при 373 К и 38 МПа выполним экстраполяцию по
рис. XV. 9, а; получаем Лр/Х° = 1,9. Напомним, что при 373 К и 0,1 МПа Х° ==
= 4,4-10-2 Вт/(м-К).
По формуле (XV. 27): = Л°-1,9-4,2-10-2 = 8,3 Вт/(м-К).
Воспользуемся рис. XV. 2: ?.пр = 1,7; тогда:
4 = ЛППЛКП = 1,7 • 4,25 • 10~2 = 8,38 • 10-2
р пр кр
Пример XV. 14. Вычислить теплопроводность газовой смеси, содержащей
[в °/о (об.)]: 40 СО (Mi = 28) и 60 Н2 (М2 = 2), при 453 К и 0,1 МПа. Из-
вестны:
4 = 2,22 • IO-2; 4 = 17,54-10-2 Вт/(м-К)
Постоянные Сатерленда: Ci == 156 и С2 = 94.
Решение. Воспользуемся формулой (XV.29), определив вначале по формуле
(XV. 15) %i и Х2:
Л' - 422 '»” йтта- (жГ -435 |0‘2 в"<" К)
=17-54 10‘’ Щ-й (ж Г -241 •'«” В’Л«
318
И окончательно:
Лсм = 3,35 • 10-2 • 0,4 + 25,1 • 10-2 • 0,6 = 16,46 • 10~2
— 2
Воспользуемся формулой (XV. 31). Содержание более летучего компонента
Ха = 0,6, и для этого х2 а = 0,5 (см. рис. XV. 11). Тогда Л'м = 16,46• 10~2
Вт/(м-К) [см, формулу (XV. 29)]. Далее, по формуле (XV. 30):
-4“ ==-----——2 +---——2 = °>143 ' 1()2; С = 7 JO-2 ВтДм • К)
Л", 3,35-10-2 25,1-10~2 > см
И окончательно:
%см = 0,5 • 16,46 10-2 + (1-0,5) • 7 • 10~2 = 11,73 • 10~2 Вт/(м • К)
Эмпирическая формула (XV. 32) дает:
0,4 • 3,35 • 10~2 ^28 + 0,6 • 25,1 • 10“2 ^2
СМ~ 0,4^8 4-0,6^2
= 11,72 Вт/(м • К) (опытное значение 11.39- 10-2)
Расчет можно вести и по формулам (XV. 33), (XV. 34). Определим вначале:
Cpi = 6,726 4-0,4- 10“3-453 4- 1,283 • 10~б • 4532 — 0,5307 • 10“9 • 4533 =
= 7,08 калДмоль • К) = 29,64 кДжДкмоль • К);
cpi = Ср /М — 0,253 калДг • К) = 1,06 кДж/(кмоль • К)
Срг = 6,952 - 0,4576 • 10-3 • 453 4- 0,9563 • 10~6 • 4532 - 0,2079 • 10~9-4533=
= 6,92 калДмоль • К) = 28,97 кДжДкмоль • К);
срг = 6,92/2 = 3,46 калДг • К) = 14,49 кДжДкмоль • К)
ц, =2388-10"5; = 1177 10-5 мПа с
Cit а = VcIcT = V156- 94 = 121
Далее:
1 ( Г2388 / 2 \'/г 1 4- 156/4531‘А V 1 + 121/453
Л1’2“ 4 t +L 1177 I 28 J 1 4-94/453 J J 1 4- 156/453 — 0,58
1 J Д.Г 1177 ( 28 Y/2j- 1 + 94/453 p V 1 4-121/453
42,1 “ 4 t + |_2388 V 2 J + 1 4- 156/453 J J 1 4-94/453
И окончательно:
Асм= ?’~'1Ооб- + 25’-'10бТ = 12’43 ’10"3 Вт/(м • К)
1+°’58> 1 + 2’5^
Пример XV. 15. Вычислить теплопроводность смеси, содержащей [в % (мол.)]:
40 СаН< (-Л4Г1 ='28) и 60 Na (М2 = 28), при 315 К и 20 МПа.
Известны: ХКр. i = 4,94-10~2 и Хнр. а = 3,29-10-2 Вт/(м-К); при 273 К и
0,1 МПа Л? = 1,67 • 10-2 и А“ = 2,39 • 10“2 ВтДм К); Ткр. i = 282,9 К; Ркр. ,=
= 5 МПа; ТКР.2 = 126,1 К; Ркр.г = 3,3 МПа; Ci = 241; С2 = 114.
Решение. Воспользуемся формулой (XV. 29), определив вначале по формуле
(XV. 15) теплопроводности компонентов при 315 К и 0,1 МПа:
4 г “ 1 °““-этН-ЯТ (-57Г)’'' “'|<Н в’«"' к>
319
И окончательно:
Хсм = 0,4 • 1,9 • 10-2 + 0,6 • 2,64 • 10~2 = 2,35 • 10~2 Вт/(м • К)
«Переход» к 20 МПа выполним по формуле (XV. 27). Определим сначала:
Гпкр = 0,4 • 282,9 + 0,6 • 126,1 = 189 К
Рпкр = 0,4 • 5 + 0,6 • 3,3 = 3,98 МПа
^пр. см = 315/189 ~ 1,67; Рпр см = 20/3,98 = 4,95
Для заданных Тир. см и Рпр. си по рис. XV. 9, а отношение Хр/Х° = 1,95.
Тогда:
Хсм = 1,95 • 2,35 • 10-2 = 4,58 • 10“2 Вт/(м • К)
По рис. XV. 2 для указанных Тпр. см и Рпр. см ^пр. си == 1,3, а Хкр си
= 0,4-4,94-10-2 + 0,6-3,29-10~2 = 3,94-10"2 Вт/(м-К).
И окончательно по формуле (XV. 18):
Лсм р = 3,94 • IO'2 • 1,3 = 5,1 • 10-2 Вт/(м • К)
Пример XV. 16. Вычислить теплопроводность газовой смеси, содержащей [в
% (мол.)]: 67,5 С2Н4 (Л4, = 28) и 32,5 N2 (М2 = 28) при 315 К и 10 МПа.
Известны: Тир. i = 293,1 К; Умел. кр. 1 = 124 см3/моль; гкр. t = 0,270;
7’кр.г= 126,2 К; Умел. кр. 2 = 90,1 см3/моль; гкр.2 = 0,291. Для этой смеси при
315 К и 0,1 МПа й°м = 2,35 • Ю~2 Вт/(м • К).
Решение. Воспользуемся формулой (XV. 28), определив псевдокритические
параметры смеси по принципу аддитивности, воспользовавшись для этого моди-
фицированным правилом Праусиица — Ганна (см. стр. 72):
7пкр. см = X Я/^кр. 1> ^пкр. си = S х«^кр. i
i i
2пкр. см = zEu *<2кр. i> ^пкр. см в 2пкр. см^7пкр. см/^пкр. см
Тпип гм = 0,675 • 293,1 + 0,325 • 125,2 = 232 К
HllLJt СМ
VnKp. см = °-675 •124 + О’325 • 90>1 = 113 см’/моль = 113-10-3 м3/кмоль
г.. = 0,675 • 0,270 + 0,325 • 0,291 = 0,277
пкр« CM
Рпкр см = 0>277 • 8-314 • Ю3 (232/113 • 10-3) = 4,57 • 106 Па = 4,57 МПа
Гпр. см = Г/Гпкр. см = 315/232 = 1,36; Рпр см = 10/4,57 = 2,19
Умол. СМ = гсм^/Р = 0,75 • 8,314 • 103 • 315/(10 • 106) = 190 • 10~3 м3/кмоль
Рпр. СМ = ^пкр. смЛмол. СМ = ПЗ/ЮО - 0-59
По рис. XV. 10 значение (X — Х°) = 5,4 -10~8; тогда
X _ л» = 5’4 ’ 10~8 - S.4-10-8___________=
уг3р (232’/s • 28l/2)/(46,6)*/' • 0,2775 =
= 33 • 10“6 кал/(см« с-К)
Хс„ = (33 + 56,3) • 10“6 = 89,3 • 10“6 кал/(см • с • К) =
= 37,4 • 10“3 Вт/(м • К) (опытное значение 37,5 • 10~3) ,
Глава XVI
ТЕПЛОПРОВОДНОСТЬ ЖИДКОСТЕЙ И ИХ СМЕСЕЙ
[6, 53, 66, 71, 88]
§ 1. ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ
ЖИДКОСТЕЙ
Коэффициент теплопроводности жидкостей в 10—100 раз пре-
вышает таковой газов и тем выше, чем больше удельная теплоем-
кость жидкости.
Зависимость теплопроводности жидкости от скорости звука с по
Бриджмену:
А = 4,04-10-16-^-; А = 20Яс(-£г),/’ (XVI. 1)
Здесь l — 'tfM/NqP ; No — число Авогадро.
Значение мольной скорости звука: Ra = A4^c/p и c=(Rap/A4)3;
ее можно вычислить аддитивно, суммируя составляющие Ra (см.
стр. 32).
Для идеальных растворов при постоянной температуре произве-
дение динамического коэффициента вязкости на коэффициент теп-
лопроводности принимается постоянным.
Для вычисления коэффициента теплопроводности жидкостей
применяются различные методы.
Предводителев и Варгафтик рекомендуют уравнение:
К = АСрр^^/М (XVI. 2)
Здесь А = 0,422-10~7 для неассоциированных жидкостей и
0,358-10-7 для ассоциированных. Также
А==АО_ооР
яро
где А0 = 0,422 • 10~7—Ау-р4^ — значение при 0°С; а0—МЬисп/(88Х
а0Л1/3
X Ю3 Гкр); а. > 1 для ассоциированных жидкостей и а = а0 = 1 —
для неассоциированных.
321
1
Приводим зависимости:
Рао — А = 8,776 • Ю5 А
Вебера — А = 0,86 • 10-3pcpV^’OJI
Смита - А = 46,1 • 10~4 + 36,8 10“12 (ср- 1,88- 103)3 + + 523-IO"4 (JL)'/S+19,43-ПТ2 (b)'/s (XVI. 3) (XVI. 4)
0,128 • 10-12p2’15c’’55M0’192 а г р ц°-12 (XVI. 5)
3,965- 10~3pCp(p/Af)'/8
Пальмера — А =-----------у---------------
•^исп/* кип
Коэффициент теплопроводности органических жидкостей можно
установить по зависимости, используя принцип соответственных со-
стояний (по Сакиадису и Котесу):
А = 2,260! - 1,2бе2.- 2,10 (Oi - 02) Гпр (XVI. 6)
Здесь А — коэффициент теплопроводности при приведенной тем-
пературе; 01 — постоянная, определяемая суммированием состав-
ляющих и прибавлением их к значению А0,в (Ао,в при Тщ, — 0,6):
®i — \),б+У, а; \>,б—fM
Здесь х — число атомов углерода в молекуле, увеличенное на пс 1 (табл. XVI. 1): х = п + пс, значения А приведены ниже: 1
А-104, Вт/(м-К) А-104, Вт/(М"К) J
—СОО— -121 Изомеры
—ОН 121 1-СН3 -105
—Вг -431 2-СН3 -180 (
—I 0 з-сн3 -247
Двойная связь 16,8 1
Значения функции f (х) = Ао,в приведены ниже:
X f (х)-104, Вт/(м-К) х fW-w* , Вт/(м-Ю
1 1775 6 1231
2 1541 7 1214
3 1419 8 1197
4 1344 9 1189
5 1281 10 1176
Параметр 02 характеризует тот или иной гомологический ряд,
для которого он постоянен (табл. XVI. 1),
322
Таблица XVl. 1
Данные для расчета х и постоянной 02
Соединение пс 02-ю4, Вт/(м-ю Соединение "с 02-10-1, Вт/(м-К)
Алифатические углеводороды 0 172 спирты 0 641 Эфиры сложные —2 88 Нитропарафины 0 381 Галогенпроиз- водные ал- килов хлор- 0 — бром- 1 — иод- 2 —
Рассмотренный метод неприменим для 0,7 < УД, < 0,5; он при-
меним к гомологическим рядам, помимо указанных в табл. XVI. 1,
если известны значения X — Т для одного из членов ряда.
Шеффи и Джонсон приводят приближенную эмпирическую за-
висимость:
А = 1,951 [1 - 0,00126 (Г - 7ПЛ)]/(Г“-Л216М')’3) (XVI. 7)
Миснар исходит из молекулярной характеристики жидкости,
т. е. из известных значений ТКШ! — температуры кипения; п— числа
атомов в молекуле; р — плотности:
^ = -^^-ГкиПРо)1/2сОР
(с°— удельная теплоемкость при 0°С).
По Варгафтику эмпирическая формула для определения коэф-
фициента теплопроводности воды такова:
А = 1,163 +Врп)
Здесь At — теплопроводность при Р — 1 атм; п — зависит от
плотности и изменяется в пределах 1,20—1,25:
р < 200 кг/м3; я = 1,25; В = 1,33 • Ю-’4
р > 500 кг/м3; п = 1,20; В = 1,60 • 10
200 < р < 500 кг/м3; я= 1,23; В = 1,43 • 10
Теплопроводность воды при различных температурах:
А/ = 3,58 • Ю-8?1,48
Для жидких топлив (если рго — 750—850 кг/м3):
А = 0,111 - (t - 20) - ,47'10 5
Р20
Коэффициент теплопроводности смеси нефтяных фракций и
масла:
при 293 К — Асм == 0,136;
при других температурах — Асм = °’^7 (1 — 0,000547)
Рем
Для жидкого кислорода (если р > 670 кг/м3):
А = 0,204 + 5р2,н • 10-8
323
Теплопроводность фреонов (по Даниловой):
фреон-11 (243 - 293 К) - Л = 1,163(0,091 - 10~4/)
фреон-12 (243 - 273 К) - Л = 0,092 - 4,65 • 10“4/
На рис. XVI. 1 приведены теплопроводности некоторых жидко-
стей.
а 20 40 60 8Q 100 120 140 10 20 30 40 50 60 10 80 "С
Температура
1-1__I_I-1—-I-1—1---1_а__I_I--1-1-1..—.1—1
273$13ЗЯ.393283313 333 353
К
Рис. XVI. 1. Теплопроводность различных жидкостей:
/—•глицерин безводный; 2—муравьиная кислота; 3—метанол; 4—этанол; 5—касторовое
масло; 6—анилин; 7—уксусная кислота; 8 — ацетон; 9—бутанол; 10—нитробензол; 11—изо-
пропан; 12—бензол; 13—толуол; 14—ксилол; 15—вазелиновое масло; 16 — вода; /7—СаС1г,
—NaCl, 25%; /9—этиловый спирт, 80%; 20—этиловый спирт, 60%; 21 — этиловый
спирт, 20%; 22—сероуглерод; 23 — четыреххлористый углерод; 24—глицерин, 50%; 25—гексан;
26—соляная кислота, 30%; '27—керосин; 28—этиловый эфир; 29—серная кислота, 98%;
30—серная кислота, 60%; 31—метиловый спирт; 40%; 32—октан; 33— аммиак, 26%#
§ 2. ЗАВИСИМОСТЬ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ
ЖИДКОСТЕЙ ОТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ
Теплопроводность большинства жидкостей уменьшается с повьь
шением температуры (кроме воды, серы и некоторых полигидрид-
ных соединений) (см. рис. XVI. 1). Теплопроводность воды макси-
мальна при 393 К.
С повышением температуры теплопроводность жидкостей обыч-
но уменьшается до критической точки; затем она увеличивается по
324
мере роста температуры. Теплопроводность жидкости при темпера-
туре плавления примерно в 3 раза выше теплопроводности в кри-
тической точке, т. е. Хпл « ЗХКр. При повышении температуры на
10° X уменьшается (в среднем) на 1%.
Теплопроводность жидкостей обычно изменяется линейно с тем-
пературой в узких пределах (за исключением соединений с высо-
кой полярностью):
Л = Аг [1+а (Г, - Г)]
Здесь Хт — теплопроводность при температуре Т; X — коэффи-
циент изменения теплопроводности в зависимости от температуры;
его значение колеблется в пределах от —0,0005 до —0,002; сред-
нее значение —0,0012.
Увеличение давления (до ~ 10 МПа) незначительно увеличи-
вает теплопроводность жидкостей. Однако при высоких давлениях
эффект воздействия значителен (особенно для более сжимающихся
жидкостей). По данным Бриджмена, степень возрастания теплопро-
водности замедляется с повышением давления. При Р > 300 МПа
теплопроводность жидкд^тей с повышением температуры умень-
шается и увеличивается при Р < 30 МПа. В среднем, принято, что
при повышении давления на 70 МПа коэффициент теплопроводно--
сти жидкости увеличивается примерно на 20%. а в интервале
10—50 МПа теплопроводность увеличивается на 5—10% и более.
Влияние давления на теплопроводность жидкости выражается
общей зависимостью:
Х2/Х1 = 62/^1 (XVI. 8)
Здесь Xi и %2 — теплопроводности жидкости при Т и Pi и Р2; et и
е2— функции приведенных температур и давления (рис. XVI. 2).
Для определения коэффициента теплопроводности жидкости под
давлением и при высокой температуре применима также графиче-
ская зависимость для газов (см. рис. XV. 10).
Миснар для интервала от —50 до 4-50 °C дает эмпирическую
упрощенную формулу:
(формула неприменима для воды и глицерина).
Для воды:
X = 5630 • 10-4 (1 + 0,22 )
Если известно Х°, то для t и высоких давлений (~ 1200 МПа)
можно определить по приближенной зависимости:
1 Г р Т1>
М"1+ (Г„,Р.1О-Т‘ bni2-2,S«).10.J |XVI 9)
Для воды уравнение (XVI. 9) приобретает форму
/ Р \О,85 / Т \0,25
»г!+2’94,10 Ы Goo)
Др
325
которая для 273 К имеет вид:
fA) =1 +_______J_____Г-АГ
Мк + (ГкипРо 10-3)‘/г *- И12 • ’°4 J
Рис. XVI. 2. Зависимость теплопроводности жидкостей
от давления
Ленуар для определения изменения X в зависимости от давле-
ния предложил формулу
— f Pi — g>
\ Аг / г \ рг / в2
в которой индексы 1 и 2 относятся к разным Pi и Р2, но при одина-
ковой Т\ т — —2,94 Тпр + 3,77; eit вг— коэффициенты, определяе-
мые по рис. XVI. 2.
Для жидкостей критерий Прандтля имеет вид
Рг = Ср (ц/А)
326
Критерий Прандтля для жидкостей изменяется в широких пре-
делах в зависимости от температуры, поскольку вязкость резко за-
висит от нее. Значения Рг меняются от 2 для воды и легких орга-
нических жидкостей до нескольких тысяч для тяжелых вязких орга-
нических жидкостей.
При большом значении Рг процессы переноса количества дви-'
жения оказываются более определяющими, чем процессы переноса
тепла. Вещества с малым Рг лучше передают тепло, чем количе-
ство движения (например, жидкие металлы, для которых значения
Рг находятся в пределах от 0,003 для калия до 0,07 для лития).
Денбиг приводит зависимость
lgPr = £^i
(XVI. 10)
где для воды а = 0,224 и
= 0,2 и Ь = —2,2.
Другая зависимость:
Ь=—1,8; Гамбилл дает значения а =
0,2 ДЗисп 7КИп
(значение Д5Исп = Ьисп/Ткип можно определить по рис. IX. 2,
стр. 189; относительно же Лисп более подробно см. гл. IX).
§ 3. ВЫЧИСЛЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ
СМЕСЕЙ ЖИДКОСТЕЙ
Филиппов и Новоселова приводят следующую зависимость для:
расчета теплопроводности бинарных смесей жидкостей
Хсм = А2Х2 4- Х| (1 — Xi) — 0,72 (А.2 — Xj) • Xi (1 — Х2) (XVI. 12)
где X — коэффициенты теплопроводности компонентов смеси; Х2 >
> Xi; Хг — мольная доля компонента с большей теплопроводностью.
Коэффициент теплопроводности суспензий и коллоидных раство-
ров составляет -~90% от коэффициента теплопроводности жидкой
фазы (по оценке), в которой содержится взвесь:
Хсм ” 0,9Хж
Для эмульсий минеральных ijacen в воде Ванг и Кнудсен при-
водят приближенную зависимость на основе принципа аддитивно-
сти
Хэм — ^вХв + ХМХМ
где Хэм, Х.в и Хм — коэффициенты теплопроводности эмульсии, воды
и масла; хв, хм — объемные доли воды и масла в смеси.
Для неполярных соединений, используя принцип аддитивности,
Цедерберг приводит соотношение:
^*СМ = ^1*1 + Х2Х2 (XVI. 13)
Здесь Хсм, Xi, Х2 — коэффициенты теплопроводности смеси и ком-
понентов 1 и 2; Xi, Хг — мольные доли компонентов 1 и 2.
327
Теплопроводность жидкостей и их смесей в большинстве слу-
чаев уменьшается с повышением температуры (кроме воды).
Эмпирическая зависимость для неполярных жидкостей
Я/См — XiXj "Ь Я.2Х2 ‘— С (%2 — М) ^1^2 (XVI. 14)
где х — массовые доли компонентов; )* > Х*. Для постоянной С
Филиппов и Новоселова приводят соотношение:
С = 0,72 (Л2 — Х1)
§ 4. ПРИМЕРЫ РАСЧЕТОВ
[6, 63, 66, 71]
Пример XVI. 1. Вычислить теплопроводность хлороформа (М = 119,4) при
293 К, зная сР = 0,963 кДж/(кг-К) и р = 1490 кг/м’,
Решение. По формуле (XVI. 2): .... . ..
Я. = 0,422 -10~7 • 0,963 • 103 X
З/ 1490
X 1490 = 0,14 Вт/(м • К) (погрешность 4-18%)
Пример XVI. 2. Вычислить теплопроводность этанола (М = 46) при 303 К,
зная сР = 2,219 кДж/(кг-К) и р = 780 кг/м’.
Решение. По формуле (XVI. 2):
Я, = 0,422 • 10~7 • 2,219 • 103 • 780 а / — °-19 Вт/(м - К)
V 4о
Пример XVI. 3. Вычислить теплопроводность бутанола при 293 К и 0,098 МПа.
Известны: TKf = 560,2 К; Лр == 4,75 МПа; р = 809,8 кг/м’; Ср =
= 183,4 кДж/(кмоль-К); р. = 2,95-10-’ Па-с; с = 1,285-10’ м/с; М = 74,12.
Решение. Применим формулу (XVI. 1):
Z= Л/ 6,02 • 10” • 809,8 “ 5,34' ’° 10 М
Я, = 4,04 • 10“16 . 1,285'1О."2 =. 0,183 Вт/(м • К)
(5,34.1О~10)2
Воспользуемся уравнением (XVI. 2):
ср = -j83^ =• 2,47 кДж/(кг • К)
Я, = 0,358 • 10~7 • 2,47 -103 • 809,8 А/4^1 в °>158 Вт/(м ‘ К>
V 74,12
Если же вести расчет по формуле (XVI. 4)» то:
Я. = 46,1 • 10~4 + 36,8 • 10"12 (2,47 -103 - 1,88 • 103)3 +
+ 523 • 10 ~1 dgl-y7’4- 19,43 • IO’2 ( 2,9|ogj-^)-0.J77 Вт/(м - К)
Формула (XVI. 5) дает:
Л = О-128 • Г12 • в°?>82’18 • gl55.^g » 0,190 Вт/(м - К)
(2,95 • Ю-3)0’12
Применим формулу (XVI. 6).
323
Находим вначале:
У, А = 121 10~4 Вт/(м К); га = 0 (табл XVI I); х = п + пс = 4 + 0=4
Хо,6 = 1344 • IO"4; 0, = (1344 + 121) 10-4 = 1465 • 10“4 Вт/(м • К)
02 = 641 • 10~4 Вт/(м • К) (табл XVI. 1); Тпр =s= 293/560,2 = 0,523
И окончательно:
Я, = 2,26 • 1465 • 10-4 - 1 26 • 641 • IO-4 -21- 10~4 (1465 - 641) • 0.523 =
= 160 • 10~3 Вт/(м • К) (опытное значение 159 -Ю-’)
Пример XVI. 4. Вычислить теплопроводность иодбензола (Л4 = 204) при
333 К, зная ср = 0,804 кДж/(кг-К) и р = 1770 кг/м9.
Решение. По формуле (XVI. 2):
Л = 0,358 • 10-7 • 0,804 • 103 • 1770 = 104 5 Вт/(м К)
Пример XVI. 5. Вычислить теплопроводность жидкого ацетона (М = 58) при
293 К, зная Тал = 178 К. ,
Решение. Применим формулу (XVI. 7): '
Л = 1 951 [1 — 0,00126 (293 - 178)]/(178°>216 • 58 I0’3) = 161 • 10“3 Вт/(м К)
Пример XVI. 6. Вычислить теплопроводность этилацетата Ш = 88)
CH3CO2C2HS при 313 К, зная Тк₽ = 523 К.
Решение. Применим формулу (XVI. 6).
Находим вначале:
Гпр = 363/523 = 0,59; 0, =^6 + £ 4; А = - 121 10“4 (см. стр. 322)
пс = — 2; х = га + гас = 4 — 2 = 2;
f (*) = Л0.в = / (2) = 1540 • 10~4 (см стр. 322)
9! = 1540 • 10~4 — 121 10“4= 1419- 10“4; 02 = 88- 10~4 Вт/(м-К)
И окончательно:
к = 2,26 • 1419 • 10“4 - 1,26 88 10“4 - 2,1 (1419 — 88) • 10“4 • 0,59 =
= 143 • 10~3 Вт/(м • К)
Пример XVI. 7. Вычислить теплопроводность Х2 жидкого пентана при 303 К
, аР2 = 26,7 МПа, зная, что при 303 К и Р2 = 0,17 МПа, Xi=136-10-8 Вт/(м К) J
Ткр = 475 К; Ркр = 3,2 МПа.
Решение. Воспользуемся рис. XVI. 2, но найдем вначале:
Гпр = 303/475 = 0,64; Рпр1 = 0,17/3,2 = 0,051; Рпр , = 26,7/3.2 = 8,35
Затем: et = 12 и е2 = 13,2; и окончательно:
, 13 2 1
Х2 = 136-10“3 = 151 • IO"3 Вт/(м • К)
Пример XVI. 8. Вычислить теплопроводность двуокиси азота Л2 при 311 К и
Р2 = 26,7 МПа, зная, что при 311 К и Pi = 2,1 МПа М = 1238-Ю-4 Вт/(м К);
Гнр = 431 К; Ркр = 9,81 МПа.
Решение. Воспользуемся формулой (XVI.8), но найдем вначале по рис.
XVI, 2 et и е2:
Тпр = 311/431 = 0,721; Рпр , = 2,1/9,81 = 0,02;
Р_„ ,= 26.7/9,81 = 2,72; тогда е. = 11,17; е„= 11,75
up. X • в
П М.М. Викторов 329
И окончательно:
Л2 = 1238-Ю-4-11,75/11,17 =
= 1302-10“4 Вт/(м-К) (опытное значение 1335 10~4)
Пример XVI. 9. Вычислить критерий Рг для этилового эфира при 303 К, зная
£исп — 26-Ю3 кДж/кмоль.
Решение. По формуле (XVI-10), полагая а — 0,224 и Ь = —1,8:
0 224 • 96 . 10-6
lgPr^~W-'i~03~ 303 + 1-8== 0’51; Рг = 3’2
Пример XVI. 10. Вычислить Рг для пропинола при 303 К, зная Гкр = 537 К
и Гкип = 369 К; РКр = 6 МПа.
Решение. Применим формулу (XVI. 11), определяя вначале ASHCn =
= 102,6-103 Дж/(кмоль-К) (см. рис. IX. 2, стр. 189):
. п 0,2 -102,6 • 103 369 , „ , „ „
tgPr 8,314-103 303 1.8—1,2; Рг — 15,5
Пример XVI. 11. Вычислить теплопроводность смеси этилформиат и 'четырех-
хлористого углерода при 288 К. Массовая доля эфира xt — 0,7 и, следователь-
но, х2 = 0,3. Известны:• Xi = 1591-Ю-4 иХ2 = 1046-Ю-4 Вт/(м-К).
Решение. Воспользуемся формулой (XVI. 12):
Хсм = 1591 • 10“4 • 0,7 + 1046 • 10“4 0,3 +
+ 0,72 (1591 - 1046) 10~4 • 0,7 • 0,3 = 1345 • 10"4 Вт/(м • К)
Формула (XVI. 13) дает:
Хсм = 0,7 • 1591 • 10~4+ 0,3- 1046-10-4 = 1430- 10-4 Вт/(м-К)
Пример XVI. 12. Вычислить теплопроводность смесей, содержащих по 50%'
(мол.): пропинола (М — 60) и воды; этилового эфира (М = 158) и хлороформа
(Af ~ 119). Известны:
Хпр = 1574 • IO"4; Хв = 6070 • Ю-4; Ххлф = 1222 • 10~4; .
Хэф = 1380-10~4 Вт/(м-К)
Решение. Воспользуемся формулой (XVI. 14).
Массовые доли: пропинола хпр = 0,77; воды хв = 0,23; хлороформа хХЛф
= 0,62; эфира хЭф — 0,38.
Находим:
С3Н7ОН—НгО - Хсм = 0,77 • 1574 • 10-4 +
+ 0,23 • 6070 • Ю-4 - 0,72 (1574 - 6070) • 10~4 = 2040 Вт/(м • К)
(С2Н6)2О—СН3С1 - Хсм = 0,38 • 1380 • Ю~4 +
+ 0,62 • 1222 • IO-4 - 0,72 (1380 - 1222) • 10~4 = 1260 • 10~4 Вт/(м • К)
Глава XVII
ТЕПЛОПРОВОДНОСТЬ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
16, 11, 53]
Коэффициент теплопроводности большинства растворов элек-
тролитов обычно понижается с увеличением концентрации (за иск-
лючением, например, NaOH) и увеличивается с повышением темпе-
ратуры. Однако для концентрированных растворов теплопровод-
ность с ростом температуры иногда понижается (например, HNO3).
Теплопроводность неводных растворов электролитов намного
ниже теплопроводности их водных растворов. Зависимость коэффи-
циента теплопроводности раствора (водного или неводного) от
мольной концентрации во многих случаях линейна; это позволяет
выполнять графические расчеты.
Для смешанных растворов электролитов коэффициент теплопро-
водности можно определить, например, по способу Риделя [66] в
предположении, что в водном растворе анион и катион влияют
аддитивно на теплопроводность раствора. Коэффициент теплопро-
водности раствора определяют по формуле
Ap“4o + S°A (XVII. 1)
где а — коэффициент, характеризующий изменение теплопроводно-
сти раствора при увеличении концентрации иона на 1 г-ион/л; С,—
мольная концентрация раствора; Хн2о — теплопроводность воды
при 20 °C.
Ниже приведены значения щ в предположении, что aNa+ = О
(/ = 20 °C):
Анион ai Катион ai
ОН' 0,0209 н+ -0,0091
F" 0,00269 Li+ -0,0035
СГ -0,0054? Na+ 0,0000
Вг- Г —0,0174 -0,274 К+ -0,00756
11*
331
Аниов al Катион ai
no; -0,0046 nh: -0,0016
NO” —0,007 Mg2+ 0,0093
Ca2+ 0,00058
сю; —0,0142 Ba2+ 0,0077
CIO* -0,0174 Sr2+ -0,00395
Ag+ -0,0105
BrOj —0,0142 Cu2+ -0,0163
СО2* -0,0076 Zn2+ -0,0163
Pb2+ -0,0093
Si°r —0,0093 Co2+ -0,0163
SOf -0,0023 Al3+ Th<+ -0,0326 -0,436
sof 0,0016
s,o’- -0,0081
CrOf -0,0016
CrjOj" -0,0159
PO’- 0,0209
Fe(CN)j“ -0,0186
CHjCOO’ —0,0229
(coo)a2- -0,0349
Поскольку принято, что aNa+ = 0, постольку приведенные выше
значения aj не абсолютны, но суммарное значение для катиона и
аниона верно,. Для температуры, отличной от 20 °C, используют по-
правочный коэффициент /т:
<, °C fr t, °C fT t, °C fT t, °C fT
-40 0,838 0 0,946 40 1,048 80 1,119
-30 0,865 10 0,973 50 1,069 90 1,130
-20 0,892 20 1,000 60 1,088 100 1,137
-10 0,919 30 1,025 70 1,105 110 1,141
Am. T = A:m. 20°A
Коэффициент теплопроводности водных растворов солей:
— Ai2o 0 ~ 0,8 2 *)
(£х— суммарная объемная концентрация растворенных солей).
Изменение коэффициента теплопроводности Д% растворов солей
..можно оценить по зависимости (для растворов, массовая концен-
трация которых меньше 40%):
Д ~ °>8 У, *
Так, коэффициент теплопроводности морской воды примерно на
2% ниже, чем у дистиллированной воды.
Осминин и Варгафтик приводят соотношение для определения
теплопроводности концентрированных растворов электролитов
А>л ~ %2о
ср, ЭЛ
СР. Н2о
(XVII. 2)
332
Здесь ср эл и с?. На0 — удельные теплоемкости раствора и воды;
рэл и рН2О—плотности раствора и воды; Л4Нг0 — молекулярная масса
воды; Мэл — мнимая молекулярная масса раствора электролита;
Мэл = Ю0/(хн о + хр); хНгО и хр. в — мольные доли воды и рас-
творенного электролита; М — молекулярная масса растворенного
электролита.
Теплопроводность водных растворов солей можно также рассчи-
тывать, используя:
%р — относительный (принимая Хн2о—1) коэффициент тепло-
проводности так называемого гипотетического 100%-ного раствора
(концентрация растворенной соли — объемная);
х — объемную долю соли в растворе, считая, что объем воды
остается неизменным.
Сказанное позволяет растворы солей рассматривать как смеси
двух жидкостей — воды и концентрированного 100%-ного раствора
с известной теплопроводностью Хр. Теплопроводности X раствора
солей находят из Хр в зависимости от х. Ниже приведены значения
Хр 100%-ных растворов солей:
Lil 0,25 K2CO3 0,52
LiBr 0,34 KNO3 0,56
LiCl 0,53 MgBr2 • 6H2O 0,57
Li2SO4 ’ Н2О 0,83 MgCl2 • 6H2O 0,77
Na I 0,28 MgSO4 • 7H2O 0,92
NaBr 0,34 CaBr2 0,22
NaCl 0,54 CaCl2 0,39
NaC104 H2O 0,64 CaCl2 • H2O 0,66
NaNO3 0,69 Ca(NO3)2 0,68
Na2S2O3 5H2O 0,88 SrCl2 0,38
Na2SO4- 10H2O 1,05 Sr(NO3)2 0,58
Na2CO3 • 10H2O 1,08 Ba(NO3)2 0,58
Na3PO4 • 12H2O 1,17 BaCl2 • 2НгО 0,62
KI 0,25 ZnCl2 0,25
KBr 0,32 Pb(NO3)2 0,50
KCl 0,42 (KOH) 0,68
KF 0,46 (H3PO4) 0,5
Миснор приводит следующее выражение для определения те-
плопроводности Хр раствора [Вт/(м-К)] со 100%-ной концентра-
цией соли
Хп = 0,00294п (XVH. 3)
р м1г
где п — число атомов в молекуле соли; Тпл — температура плавле-
ния соли.
Формула (XVII. 3) позволяет оценить Тпл соединения при нали-
чии теплопроводности 100%-ного раствора.
Объемную долю х соли в растворе можно определить, если из-
вестны плотности раствора рр и воды рНаО:
(100 —Л) р
У — 1 « I Г
100Рн2о
(А — массовая концентрация соли).
333
Рис. XVII. 1. Номограмма для определения коэффи-
циента теплопроводности раствора в зависимости от.
объемной концентрации соли х и коэффициента тепло-
проводности 100%-ного раствора.
Объемная доля х, в смеси
Рис. XVII. 2. График для определения коэффициента
теплопроводности бинарной смеси.
Относительная теплопроводность растворителя:
Ка = Лр/ЛН2О
Значения Хр можно находить и графически (рис. XVII. 1).
Описанные методы непригодны для расчета тогда, когда рас-
твор является смесью, например, разбавленных кислот. В этих
случаях используют график рис. XVII. 2, пример использования ко-
торого см. ниже (стр. 338).
Пример XVII. 1. Вычислить теплопроводность раствора 30% A1(NO3)3 (М =
= 213) при 353 К, зная р2о = 1,28 кг/м3 и ХН2о = 0,603 Вт/(м • К)-
Решение. Применим формулу (XVII. 1).
Мольная концентрация: С = (1280-30)/(100-213) = 1,8.
Значение а (см. стр. 331):
А13+---- 0,0326; NO'----9,007
Тогда:
Х20 = 0,603 • 10-4 - 1,8 (0,0326 + 3 • 0,007) = 0,506 Вт/(м • К)
Для 353 К значение fr = 1,119 (см. стр. 332); и окончательно:
= 0.506 -1,119 = 0,567 Вт/(м К)
Пример XVII.2. Вычислить теплопроводность 32%-ного раствора NaNOs
(М = 85) прн 293 К.
Известны: ср> Эл = 3,22 и ср, Нг0 = 4,187 кДж/(кг • К); Рэл = 1243 и рН20 =
= 998 кг/м3; XHjO = 0,599 Вт/(м • К).
Решение. Воспользуемся формулой (XVII. 2), определив вначале мол. доли
*Н2О = 68/18 = 3,78; *NaNO3 = 32/85 = °>386;
и мнимую мол. массу
М 100 94 1
^NaNOs “ з уд + 0,386 “ ’
И окончательно:
Пример XVII. 3. Вычислить при 288 К теплопроводность бинарного раствора,
содержащего 10,24% NaCl и 9,79% КС1: р= 11 425 кг/м3; ХН20 = 0,599 Вт/(м • К).
Решение. Воспользуемся формулой (XVII. 1):
10-10,24-1,1425 10-9,79-1,1425
CNaCi= 58,4 — скс!= 74,5 “*>»
Используя значения tx< (стр. 331), находим:
Х20 = 0,599 + 2 (j - 0,00547) + 1,5 (- 0,00756 - .-,00547) = 0,57 Вт/(м • К)
И окончательно с введением поправки /г = 0,986
Х15 = С,57 • 0,986 = 0,56 Вт/(м • К)
336
Пример XVII. 4. Вычислить теплопроводность 100%-ного раствора КС1 (М =
= 74,5), зная р = 2000 кг/м3; Гпл = 1050 и п = 2.
Решение. Воспользуемся формулой (XVII. 3):
% = 0,0029 • 2 °-‘.2392) - = 0>245 Вт/(м. К)
74,5'®
Пример XVII. 5. Вычислить теплопроводность 32%-ного раствора NaNOs при
393 К, зная PNaNO3 = 1243; рН2о == 998 кг/м31 Ан2о = °-599 Вт/(м • К).
Решение. Воспользуемся рис. XVII. 1, определив в-начале объемную долю:
х = 1 - [(ЮО - A) pNaNO3/(pH2O • ЮО)] = 0,152 (15,2%).
Значение Лр = 0,69 (см. стр. 333).
По рис. XVII. 1:
^рЛн2о = °-937;
Хр == 0,937 • 0,599 = 0,561 Вт/(м • К) (опытное значение 0,576)
Пример XVII.6. Вычислить теплопроводность. 65%-ной H2SO4 (р20 =
— 1553 кг/м3) зная ЛН20 = 0,599 и Я,Нг5О4(100%) = 0,285 Вт/(м К).
Решение. Воспользуемся рис. XVII. 2, определив вначале объемную долю:
х = 0,545 (54,5%) и ^h2o/'4i2SO4(100%) = 0,599/0,285 = 2,1
Этим координатам соответствует соотношение ^h2sO4(65%)/^h2so4(100%) = 1 >40.
И окончательно:
^H2SO4 (65%) = 1 '40 • 0,285 = 0,4 Вт/(м • К)
Глава XVIII
ТЕПЛОПРОВОДНОСТЬ НЕКОТОРЫХ МЕТАЛЛОВ,
СПЛАВОВ, ТВЕРДЫХ И ПОРИСТЫХ МАТЕРИАЛОВ
[53, 57, 88, 89]
§ 1. КОЭФФИЦИЕНТЫ ТЕПЛОПРОВОДНОСТИ МЕТАЛЛОВ
И СПЛАВОВ
Металлам присущи высокие теплопроводность и электропрово-
димость. С ростом температуры теплопроводность большинства чи-
стых металлов уменьшается (кроме Bi и Sb).
Между электропроводимостью и теплопроводностью металлов
существует зависимость (Видемана — Франца): 1/о « const.
Известно также, что отношение при различных температурах
теплопроводности к произведению электропроводимости на темпе-
ратуру металла примерно постоянно:
X .
—=Г = ь « const
аг
где L — число Лоренца, Вт/(См-К2) или (Вт-Ом)/К2; X—в
Вт/(м-К); а — удельная электрическая проводимость, См/м.
Для большинства металлов значение L при 300 К (2,1—2,8)-
• 10-8 Вт/(См-К2). Для расплавленных металлов Z, ~ 4-
• 10~8 Вт/(См-К2) или (0,6—0,8)-Ю"8 (кал-Ом)/(с-К2). Опытные и
теоретические значения L совпадают для электронных проводников,
обладающих высокой электропроводимостью (Си, Au, Ag, Al).
Теплопроводность чистых элементов зависит от их положения
в периодической системе элементов. Элементы с низкой валентно-
стью и с выраженными металлическими свойствами обладают по-
вышенной теплопроводностью (например, металлы I и II группы).
Лучшие проводники теплоты и электричества — элементы, атомы
которых имеют во внешней оболочке не более двух электронов, а
худшие — имеющие пять внешних электронов (мышьяк, сурьма и
висмут). Полупроводниками будут селен и теллур, имеющие по
8 внешних электронов.
337
чистых металлов при 300 К,
Теплопроводность весьма
Вт/(м-К):
Li Na К Be Mg
71 139 136 187 171
Ni Ir Pd Pt Cu
67 60 70 69 395
Hg Ga Sn Sb Bi
10,5 5,7 66 19 10
А1 Та
230 54,5
Ag Au
420 311
Mo W
136 169
Zn Cd
113 98
Fe Co
95 70
Для разных металлов, но имеющих одинаковые кристалличе-
ские структуры, отношения к/Та!1 близки, а %/(Тал/М'/с) почти по-
стоянны. Отсюда — общая приближенная эмпирическая зависи-
мость (по Мейсснеру):
Значение коэффициента В приведено в табл. XVIII. 1 и ниже:
В ЦО2, (Вт-моль'МЛм'С-К2) B-102, (Вт-моль!/6)/(м-с-к2)
Na, K, Cu, 62,8 Sn 38,9
Ag, Au Pb 13,8
Be, Mg, Zn, 29,7 Ti, Zr, Hf 2,1
Cd Nb, Sb, Bi 4,69
Hg 32,2 Cr, Mo, W 9,42
Al 37,7 Fe, Pd, Pt, 10,5
In 44 Ni, Rh, Ir
Коэффициент теплопроводности металлов зависит от количе-
ства примесей и от вида обработки. Закалка и обработка металлов
холодом уменьшает, а нагревание увеличивает теплопроводность
металла.
Таблица XVIII. 1
Значения коэффициента В 102, (Вт • моль,/6)/(м • с • К2)
Кристаллическая система Группа периодической системы
I П in IV V VI VII VIII
Кубическая Гексагональная 62,8 29,73 37,7 14,2 2,1 9,42 10,5
Ромбоэдрическая Квадратная 35,2 4,4 38,9 4,69
Теплопроводность большинства чистых металлов повышается
при охлаждении ниже 0° примерно по зависимости % = kT~3 (k =
коэффициент). Повышение температуры от ~2 до 100°C для меди
и ее сплавов, нержавеющей стали, графитов увеличивает’теплопро-
водность.
Теплопроводность расплавленных металлов:
я Т ., (Т/г)2 7 срр2
А = 2,61 10“8- 8,374 • 10-13----Ь 11,58 10-7 -~
г срр МТ
[г = 1/<т — удельное сопротивление, Ом/м; ср — теплоемкость,
Дж/ (кг • К); р — плотность, кг/м3].
338
220
Температура
273 373 573 773 973 1173 1273
К
Рис. XVIII. 1. Пределы изменения теплопроводности
твердых тел в зависимости от температуры.
Рис. XVIII. 2. Зависимость теплопроводности
чистых металлов от температуры.
339
Рис. XVIII. 3. Изменение теплопроводности сталей в зависимости от темпера-
туры и содержания углерода в них:
^7^\аЛЬЛкован®я: 2—отожженная лрн 900 °C; 3—закаленная в масле при 900 °C; 4—область,
“ которои термическая обработка и присутствие углерода мало влияют на К.
Рис. XVIII. 4. Изменение теплопро-
водности стали в зависимости от со-
держания добавок к ней.
Рис. XVIII. 5. Изменение теплопро-
водности сталей, отожженных при
900 °C (1) и 1100 °C (2), от содержа-
ния хрома в них.
340
Теплопроводность металлов с температурой уменьшается не-
значительно, и это изменение выражается линейной зависимостью
1г = 1°(1+а0- Здесь а — коэффициент температуропроводности.
При переходе из твердого состояния в жидкое или парообразное
значение 1 уменьшается скачкообразно. Изменения X происходят
также в точках полиморфных превращений металлов или при изме-
нении их структуры (закалка, фазовые превращения и др.)
(рис. XVIII. 1, XVIII. 2). Значительное понижение Л наблюдается
при добавлении к железу углерода до 0,2%. Стали с примесями
только углерода имеют теплопроводность выше сталей, содержа-
щих (кроме углерода) другие примеси; малоуглеродистые стали с
малыми примесями — наиболее теплопроводные (рис. XVIII. 3, см.
также рис. XVIII. 4—XVIII. 7).
Предложены эмпирические формулы для вычисления теплопро-
водности сталей в зависимости от массового содержания присадок: .
0 20 40 60 80 10i
[№],%(масс.>
Рис. XVIII. 6. Изменение теплопроводности
сплавов железа с хромом в зависимости
от содержания последнего:
1—прокатанная сталь при температурах от 50
до 500 °C; 2—медленно охлаждения от 900 °C;
3—быстро охлажденная в воде от 1000 °C.
Рис. XVIII. 7. Изменение тепло-
проводности сплавов железа
с никелем от содержания по-
следнего.
отожженные углеродистые стали ([С] — до 1,2%) —
Л = 1,163 (а + ЬВ + сВ2)
кованая сталь — Л = 1,163 [(85 — 48,6В — 29,2с)]
Здесь:
B = C + Si + Mn + P + S (сумма от 0,1 до 2%);
а = 66 - 5,74 • 10-2/; b = 29,4 - 8,5 • 10~2/ + 0,7 • 10~V;
с = 8 - 3,4 • IO-2/ + 0,36 • 10”V (f < 500 °C)
Неймарк рекомендует зависимости:
для сталей — Z = ЮОВгГ
для хромоникелевых сталей при Г00 — 900 °C —
к « 1,163 [(13,3 - а) + (L1 + Ь) • 10-24
341
Здесь г — удельное электрическое сопротивление, Ом-см; а = |
= 10(ст — 0,5); b = 1,15(0 — 0,5); I
__ С Si Мп . Сг Ni IV Nb Мо 1
а“-12 + 28 + 25 + 52 + 59 + 184 + 93 + 96 |
[числитель — содержание элемента % (масс.)]. 1
Коэффициенты теплопроводности и электропроводимости спла- J
bob значительно ниже, чем у образующих их металлов, т. е. тепло- 1
проводность сплавов всегда меньше, чем у основного, наиболее
теплопроводного компонента. Для многих сплавов минимум тепло-
проводности наблюдается при составе 1:1. j
Добавление к металлу с высокой теплопроводностью небольших ;
количеств менее теплопроводного металла резко снижает тепло- ;
проводность сплава. Наоборот, добавление к металлу с низкой теп-
лопроводностью долей высокопроводящего компонента не дает за- s
метного роста теплопроводности сплава. С повышением темпера- [
туры теплопроводность большинства сплавов и жидких металлов
понижается.
В случае одного и того же основного металла в сплаве число
Лоренца в известных пределах почти не зависит от природы при- 5
садочного металла, и теплопроводность может быть выражена че- J
рез электропроводимость. Теплопроводность сплавов, как и метал- $
лов, уменьшается после их термообработки или охлаждения и уве-
личивается с температурой (кроме железа и никеля). |
Коэффициенты теплопроводности расплавленных солей и ме- |
таллов теплоносителей значительно выше коэффициентов теплопро- |
водности жидких органических соединений. ®
Общая зависимость коэффициента теплопроводности сплавов ?
X = АаТ + В
(Л и В — характеристика основного металла сплава). S
Коэффициент теплопроводности [в Вт/(м-К)] для различных <
сплавов выражается следующими приближенными зависимостями: 1
сплавы меди - 1/Х = 0,349 • 10-3 + -- (при 273 < Т < 293 К); t
1/Х = 0,23 • 10~3 + —5^'-- ’2 (Т ~ 373 К); i
X =2,39- 10“8СгГ +7,54
железо “ 1 = 2,617-10~8огТ +25,1 магний — Л = 2,202 -10~8<тТ + 11,3
никель — X = 2,177-10-8<тГ+ 8,37 титан — Л =2,428- 10“8<тГ +272
алюминий — X = 2,219 10~8оГ + 10,47 цирконий - X = 2,512- 10-8<тГ +2,24
Здесь о — удельная электропроводимость, См/м.
Пример XVIII. 1. Вычислить теплопроводность ртути (М = 200,6) при 293 К,
зиая р = 13 500 кг/м3; ср = 138,2 Дж/(кг-К); г ='0,95-10~6 Ом м.
Решение.
Л _ 2,61 10~8 • 239 8,374- 10~13 - 2932
0,95 • 10~6 + (0,95 • 10“6)2 13 500 138,2 +
11,58-10“7-138,2-135002
+ 200,6 • 293 ~
9 Вт/(м К)
342
§ 2, КОЭФФИЦИЕНТЫ ТЕПЛОПРОВОДНОСТИ ТВЕРДЫХ
И ПОРИСТЫХ МАТЕРИАЛОВ
[8, 53, 56, 79, 89J
Твердые материалы по значению коэффициента теплопроводно-
сти [в Вт/(м-К)] можно условно разделить на три группы:
металлы — X = 416 — 720
строительные материалы — % = 0,23 — 18
теплоизоляционные материалы — Л = 0,05 — 0,14
Рис. XVIII. 8. Зависимость теплопроводности (примерной) строительных мате-
риалов от объемной массы:
/ — асботермит; 2—асбозурит; 3 — аэродоломит; 4—известняк (параллельно слоям); 5—кирпич
трепельный; 6— раствор теплый; 7—кирпич, глино—глпноторфяиой; 8 — глиногипс; 9—бетон
теплый; 10—кирпич алебастровый; II — штукатурка асбестовая; 12—кирпич из обожженной
глины; 13— ракушечник; 14—известняк (перпендикулярно слоям); 15 — глина; 16 — руда цемент-
ная; п—кирпич красный; 18 — кирпич силикатный; 10—известняк; 20—кирпич кислотоупор-
ный; 21 — песчаник,
343
Таблица X VIII. 2
ш
Эмпирические формулы для аычисления теплопроводности S
теплоизоляционных материалов в зависимости от температуры Я
Материал Объемная масса, кг/мЗ Коэффициент теплопровод- ности А,, Вт/(м-Ю
Асбест 500 0,107 + 0,00019*
Асбозурит (конструкции) 650 0,144 + 0,00014/
Асбослюда Вата 580-650 0,134 4- 0,00015*
шлаковая 200 0,06 + 0,000145*
стеклянная (засыпка) 180-250 0,047 + 0,00058/
Вермикулит 200 0(072 + 0,00029/
Вулканит 400 0,08 + 0,00021/
Диатомиты и трепелы 450 0,091 + 0,00028/
Кирпич диатомовый 500 0,113+ 0,00233/
Пенобетон 500 , 0,122/
Пробка на битумной основе 270—350 0,058 + 0,00076/
Пыовель Совелит 160-370 0,091 + 0,00007/
порошок 230—450 0,091 + 0,000087/
плиты 450 0,086 + 0,00019/
Торфоплиты 170 0,0465 + 0,00014/
Таблица VIII.3
Изменение теплопроводности влажного материала ДА.
при увеличении объемного содержания воды на 1%; / = 15’С
Материал р., КГ/мЗ Асух' Вт/(м-К) ДА/Х „ при увеличении объемного содер- суд жаняя воды на 1% для материалов с различным влагосодержаниём .;11 ii
2% 5% 10% . 20%
Бетой 2300 1,28 20 13 10 . . 1
Бетон легкий 1600 0,47 15 10 8 5
Пемзобетон 1200 0,26 15 12 10 8
800 0,19 15 12 10 8
600 0,12 15 12 10 8
Известняк 1800 0,76 20 15 10 6
1600 0,7 17 13 10 5
1400 0,47 15 12 9 5 ' $
Кирпич 1500 0,523 16 14 12 10 л
1800 0,64 14 12 11 9
2000 0,76 10 9 8 6
344
Теплопроводность большинства твердых материалов увеличива-
ется с повышением температуры; у пористых же материалов она
резко увеличивается с температурой (табл. XVIII. 2).
Для пористых, волокнистых и зернистых материалов она зави-
сит от структуры, пористости, размера пор и влажности
(табл. XVIII. 3, рис. XVIII. 8).
Расход цемента, кг/м3 р
j_____.___I________I______I______________1_
/О /5 20 25 30 35
Содержание цемента, % (о5.)
Рис. XVIII. 9. Номограмма для определения отношения тепло-
проводностей бетона и цемента Ag/Aa в зависимости от рас-
хода цемента и отношения теплопроводностей заполнителя и
цемента Аз/Ац.
Эмпирические формулы теплопроводности:
пеноматериалы — А = A.t — (1,17 — p/pt) (А| — 0,0244); А, р и
Ai, Pi — теплопроводность и плотность
пеноматериалов и твердой массы
древесина — А = 1,73 • 10-3р (0,1159 + 0,00233х) + 0,0236
(х — влажность, %)
древесина и волокнистые материалы
при измерениях
перпендикулярно волокнам— А = 0,0233 + 0,175р
параллельно волокнам — . в два раза выше
композиции органических материа-
лов
с минеральными связующими — А = 0,035 + 0,116р
без связующих — А = 0,035 -|- 0,046р
прессованные растительные волок-
на, пробки с органическими свя-
зующими — А — 0,035 + 0,08р
Для учета воздушных пустот (пор) значение X плотного мате-
риала умножают на примерную величину 1 — Уг/>, где V — объем-
ное содержание пустот. Повышение влаги в органических материа-
лах на 1% (относительно массы сухого материала) увеличивает
его теплопроводность на ~1%.
Для вычислений X плотного вещества необходима оценка его
пористости. Например, если плотность угля с 25%-ной пористостью
равна 1200, то действительная плотность р = 1200/0,75=1600 г/см3.
И если X плотного угля равна 0,59, то искомая к=0,59(1—0,252/з) =
= 0,42 Вт/(м-К).
Теплопроводность бетонов зависит от многих факторов: тепло-
проводности заполнителей; размера и формы их частиц; соотноше-
ния фракций; теплопроводности цементного камня и его объемного
Рис. XVIII. 10. Зависимость теплопроводности бетона от влажности.
содержания; конечной плотности бетона и т. д. Для получения бе-
тона с наибольшей теплопроводностью нужно обеспечить макси-
мальную его плотность, т. е. малую пористость.
На рис. XVIII. 9 дана номограмма для примерного определения
Хб плотного бетона в зависимости от расхода цемента и теплопро-
водности цементного камня. Для учета воздушных пустот резуль-
тат умножают на примерное значение (1 — ).
Установим, например, Zs плотного бетона, зная теплопровод-
ность заполнителя Z3 = 2,9 и цемента Хц = 0,93 Вт/(м-К), а расход
цемента 325 кг/м3. Определяем отношение Х3/Хц = 2,9/0,93 = 3,12;
откуда по номограмме Хб/Хц = 2,63. Искомая = 2,63-0,93 =
= 2,4 Вт/(м-К).
При наличии, например, 5% пустот, равномерно распределен-
ных в заполнителе и цементном камне: Хб = 2,4(1 — 0,52/з) =
= 2,12 Вт/(м-К).
Главные факторы, определяющие теплопроводность тяжелых
бетонов — вид породы заполнителя, влажность и плотность бетона,
346
Зависимость теплопроводности сухого бетона от его плотности:
Х== 0,63-106 рц2'13.
Зависимость теплопроводности тяжелых бетонов от температу-
ры, если заполнители имеют кристаллическую структуру типа гра-
нита, кварца: = Л25°с/(0,96 + 0,00141). Для сухого бетона с
рц = 2400 кг/м3 (на гравии или щебне из камня) X» 1,72, а це-
ментной пасты для портландцементов — 0,87—0,93 Вт/(м-К).
Коэффициент теплопроводности бетона зависит от его влажно-
сти (рис. XVIII. 10), Так, при влажности бетона до 5% его тепло-
проводность увеличивается на 30—35%. Линейная зависимость ме-
жду теплопроводностью и влажностью: (7ВлА— 1)= 0,69 [Н2О].
ЛИТЕРАТУРА
1. Аносов В. Я., Погодин С. А. Основные начала физико-химического анализа.
Изд. АН СССР, 1947. 730 с.
2. Абкин Г. Л. Методика решения задач по химии. М., «Просвещение», 1971.
199 с.
3. Батунер Л, М„ Позин М. Е. Математические методы в химической технике.
Л., Госхимиздат, 1960. 280 с.
4. Бадылкес И. С. Рабочие вещества холодильных машин. М., Госторгиздат.
1957. 201 с.
5. Бриджмен П. В. Новейшие работы в области высоких давлений. Госиноиз-
дат, 1948.
6. Бретшнайдер С. Свойства газов и жидкостей. М. — Л., «Химия», 1966. 535 с.
7. Бесков С. Техно-химические расчеты. М., Госхимиздат, 1950. 599 с.
8. Бродский А. И. Физическая химия. Т. I, И. М. — Л., Госхимиздат, 1948. 998 с.
^..Варгафтик Н. Б., Осминин Ю. П. «Теплоэнергетика», 1956, т. 3, № 7, с. 11.
10. Бурдун Г.-Д., Калашников Н. В., Стоцкий Л. Р. Международная система
единиц. М„ «Высшая школа», 1964. 274 с.
11. Викторов М. М. Графические расчеты в технологии неорганических веществ.
Л., «Химия», 1972. 262 с.
12. Виноградов Г. В., Красильников А. И. Атлас номограмм по физической хи-
мии. М., Гостехиздат, 1940. 95 с.
13. Вознесенская И. Е., Микулин Г. И. В кн.: Вопросы физической химии рас-
творов электролитов. Л., «Химия», 1968, с. 304—361.
14. Вукалович М. П., Новиков И. И. Уравнение состояния реальных газов. Суд-
промгиз, 1948. 190 с.
15. Вукалович М. П., Новиков И. И. Термодинамика. М., «Машиностроение»,
1972. 607 с.
16. Голубев И. Ф., Гнездилов Н. Е. Вязкость газовых смесей. М., Госстатиздат,
1971. 325 с.
17. Курс физической химии. Под ред. Я- И. Герасимова. Т. 1 и 2. «Химия», М.,
1963. 1280 с.
18. Грушвицкий В. Б. Физико-химический анализ в галургии. Л., ОНТИ, 1937.
200 с.
19. Герш С. Я- Глубокое охлаждение. Т. I и II. М., Госэнергоиздат, 1957—1960.
392 с.
20. Гамеева О. С. Сборник задач и упражнений по физической и коллоидной
химии. М., «Вусшая школа», 1966. 275 с.
21. Додж Б. Ф. Химическая термодинамика. М., ИЛ, 1950. 785 с.
348
22. Дмитрович А. Д. Определение теплофнзических свойств строительных мате-
риалов. М., Стройиздат, 1963, 243 с.
23. Здановский А. Б. Галургия. Л., «Химия», 1973. 527 с.
24. Здановский А. Б. Бюлл. ВИГ, 1938, № 4.
25. Здановский А. Б. Новый метод расчета растворимостей электролитов в мно-
гокомпонентных системах. Труды ВНИИГ, 1949, вып. 21, с. 26.
26. Здановский А. Б., Ляховская Е. И., Шлеймович Р. Э. Справочник по рас-
творимости солевых систем. Т. I и II. Л., Госхимиздат, 1953—1954. 1272 с.
27. Здановский А. Б. ЖФХ, 1955, т. 29, № 2, .с. 209—214.
28. Здановский А. Б., Иванова Ф. И. ЖФХ, 1965, т. 39, № 9, с. 310—314.
29. Здановский А. Б. Расчеты взаимных растворимостей солей в многокомпо-
нентных растворах электролитов. II Всесоюзный симпозиум по высаливанию
и всаливанию веществ из растворов. Каунас, 1970.
30. Каблуков И. А. Правило фаз в применении к насыщенным растворам солей.
Л., Госхимиздат, 1933. 230 с.
31. Карапетьянц М. X. Химическая термодинамика. М., «Химия», 1975. 589 с.
32. Карапетьянц М. X. Методы сравнительного расчета физико-химических
свойств. М., «Наука», 1965. 405 с.
33. Карапетьянц М. X. Примеры и задачи по химической термодинамике. М.,
«Химия», 1973. 300 с.
34. Карапетьянц М. X., Чэн Гуанг-Юе. ЖПХ, 1963, № 3, с. 32—37.
35. Касаткин А. Г. Основные процессы и аппараты химической технологии. Изд.
8-е. М., «Химия», 1971. 782 с.
36. Кашкаров О. Д. В кн.: Графические расчеты солевых систем. Труды ВНИИГ,
1960, вып. 38.
37. Кафаров В. В. Методы кибернетики в химии и химической технологии. М.,
«Химия», 1968. 379 с.
38. Кафаров В. В. Основы массопередачи. Изд. 2-е. М., «Высшая школа», 1972.
494 с.
39. Киреев В. А. Методы практических расчетов в термодинамике химических
реакций. М., «Химия», 1970. 519 с.
40. Киреев В. А. Курс физической химии. М., «Химия», 1975. 775 с.
41. Курнаков Н. С. Введение в физико-химический анализ. Изд. 4-е. М. — Л.,
АН СССР, 1940. 560 с.
42. Кричевский И. Р. Понятия и основы термодинамики. Изд. 2-е. М., «Химия»,
1970. 439 с.
43. Кричевский И. Р. Фазовые равновесия в растворах при высоких давлениях.
М. — Л., Госхимиздат, 1952. 168 с.
44. Кричевский И. Р., Хазанова Н. Е., Лесневская Л. С. и др. ЖПХ, 1962, т. 19,
с. 105—109.
45. Кричевский И. Р., Хазанова Н. Е., Липшиц Л. Р. Ииж.-физ. ж., 1960, т. 3,
№ 10, с. 117.
46. Киселева Е. В., Каретников Г. С., Кудряшов И. В. Сборник примеров и за-
дач по физической химии. М., «Высшая школа», 1976. 381 с.
47. Менделеев Д. И. Избранные сочинения. Т. IV. ОНТИ, 1938, с. 269.
48. Мищенко К- П., Полторацкий Г. М. Вопросы термодинамики строения рас-
творов электролитов и неэлектролитов. Л., «Химия», 1968. 354 с.
49. Микулин Г. И. Бюлл. ВХО им. Д. И. Менделеева, 1941, № 6, стр. 61—65.
50. Микулин Г. И. В кн.: Вопросы физической химии растворов электролитов.
Л., «Химия», 1968, с. 401—415.
51. Микулин Г. И., Вознесенская И. Е. Там же, с. 304—346.
52. Маг-Таггарт К. Плазмохимические реакции в электрических разрядах. Пер.
с англ. Под ред. И. Маслова. М., Атомиздат, 1972. 256 с.
53. Миснар А. Теплопроводность твердых тел, жидкостей, газов и их компози-
ций. М., «Мир»; 1968. 464 с.
54. Мельник Б. Д., Мельников Е. Б. Краткий инженерный справочник по техно-
логии неорганических веществ. М., «Химия», 1968. 432 с.
55. Михеев М. А., Михеева И. М. Основы теплопередачи. М., «Энергия», 1973.
319 с.
56. Низкотемпературная плазма и плазмохимические процессы в промышленно-
сти. Сб. НИИТЭХИМ, 1972, № 15, с. 127.
849
57. Пет ров-Денисов В. Г., Масленников Л. А., Моро А. Н. и др. «Бетон и же-
лезобетон», 1972, № 2, с. 19—21.
58. Перри Д. Справочник инженера-химика Л., «Химия», 1969. 639 с.
59. Панченков Г. М. Теория вязкости и жидкостей. М. — Л., Гостоптехиздат,
1947. 156 с.
60. Павлов К. Ф., Романков П. Г., Носков А. А. Примеры и задачи по курсу
процессов и аппаратов. Л., Госхимиздат, 1964. 633 с.
61. Плановский А. Н., Рамм В. М., Каган С. 3. Процессы и аппараты химиче-
ской технологии. М., Госхимиздат, 1962. 847 с.
62. Пейсахов И. Л. ЖПХ, 1955, т. 28, с. 637—641.
63. Позин М. Е. Технология минеральных солей. Т. I и II. Л., «Химия», 1970.
1556 с.
64. Позин М. E.t Копелев Б. А., Бельченко Г. В. и др. Расчеты по технологии
неорганических веществ. Л., «Химия», 1966. 638 с.
65. Предводителев А. С. ЖЭТФ, 1934, т. 4, Xs 8; с. 1; 1938, т. 8, Xs 3; Изв. ВТИ,
1946, Xs 9-10; ЖФХ, 1948, Хе 22, с. 339; Изв. АН СССР, Xs 4; Вести. МГУ,
1949, Xs 3.
66. Рид Р., Шервуд Г. Свойства газов и жидкостей. Л., «Химия», 1971. 702 с.
67. Рид Р., Шервуд Г. Свойства газов и жидкостей. Л., Гостоптехиздат, 1964.
334 с.
68. Рамм В. М. Абсорбция 'газов. М., «Химия», 1966. 767 с.
69. Семенченко В. К. Физическая теория растворов. Госхимиздат, 1941. 390 с.
70. Соколовский А. А. Основы графических расчетов по диаграммам раствори-
мости четырех компонентных систем. Труды ВЗПИ, 1960, вып. 23, с. 73—92.
71. Столяров Е. А., Орлова Н. Г. Расчет физико-химических свойств жидкостей.
Л., «Химия», 1976. 112 с.
72. Краткий справочник физико-химических величин. Под ред. А. А. Равделя и
К. П. Мищенко. Л., «Химия», 1974. 200 с.
73. Сыркин Я. К-, Дяткина М. Е. Химическая связь и строение молекул. М. — Л.,
Госхимиздат, 1946. 588 с.
74. Татевский В. М. Химическое строение углеводородов и закономерности в их
свойствах. М., Изд. МГУ, 1953. 320 с.
75. Терминология физико-химического анализа. М., Изд. АН СССР, 1951. 45 с.
76. Терминология термодинамики. М., Изд. АН СССР, 1952. 55 с.
77. Тамман Г. Руководство по гетерогенным равновесиям. Л., Химтеорет, 1935.
290 с.
78. Товбин М. В., Воевудская 3. Л. Укр. хим. ж., 1956, т. 22, Xs 2, с. 173—178.
79. Ткачев А. Г., Сигалова 3. В., Платонова С. Г. «Гидротехническое строитель-
ство», 1973, Хе 4, с. 19—21.
80. Флореа О., Смигельский О. Расчеты по процессам и аппаратам химической
технологии. Л., «Химия», 1971. 495 с.
81. Финдлей А. Правило фаз и его применение. Л., ОНТИ, 1935. 210 с.
82. Филиппова Г. П., Ишкин И. П. Инж.-физ. ж., 1961, Xs 4, с. 30—34.
83. Филиппов Л. П„ Новоселова Н. С. Веста. МГУ, 1955, т. 10, Xs 3, с. 37—39.
84. Хайдуков Н. И., Липецкая 3. Г. «Калий», 1935, № 8, с. 8—10.
85. Хоуген О., Ватсон К. Физнко-химическне расчеты в технике. М. — Л., Гос-
химиздат, 1941. 598 с.
86. Хоблер Т. Теплопередача и теплообменники. Пер. с польск. Под ред. П. Г. Ро-
манкова. Л., Госхимиздат. 1961. 820 с.
87. Хоблер Т. Массопередача и абсорбция. Пер. с польск. Под ред. П, Г. Ро-
манкова. Л., «Химия», 1964. 479 с.
88. Чиркин В. С. Теплопроводность промышленных материалов. Изд. 2-е. М.,
Машгиз, 1962. 247 с.
89. Чиркин В. С. Теплофизические свойства материалов. М., Физматгиз, 1959.
356 с.
90. Чернышев А. К, Поплавский К. Л., Заичко Н. Д. Сборник номограмм для
химико-технологических расчетов. Л., «Химия», 1969. 279 с.
91. Шатенштейн А. И. Сжиженные газы как растворители. М., Госхимиздат,
1934. 180 с.
92. Циборовский Я. Основы процессов химической технологии. Л., «Химия», 1967.
720 с.
360
93. Цедерберг И. В. «Теплоэнергетика», 1956, Ns 9; 1957, т. 4, № 1, с. 45; т. 3,
№ 7.
94. Элдаров Ф. Г. ЖФХ, 1958, т. 32, с. 2443—2445; 1960, т. 34, с. 1205—1208;
1962, т. 36, с. 1414—1418.
95. Яшкичев В. И. Ж- структ. химии. 1963, т. 4, № 6, с. 837.
96. Andrussow L. Chem. Proc. Eng., 1962, v. 43, p. 65.
97. Altenburg R. Z. Electrochem., 1962, Bd. 65, S. 801, 805; Chem. Ing. Techn.,
1962, v. 34, p. 13.
98. Bretsznajder S. Zagadnienia projektowania procesow przemystu chemicznego.
Warszawa, 1956.
99. Bretsznajder S. Wlasnosci gazow i cieczy. Warszawa, 1962.
100. Bridgman. The Physics of High Pressure. London, 1949.
101. Davis D. S. Chem. Eng. Nomographs. N. Y., 1944.
102. Davis D. S. Ind. Eng. Chem., 1941, v. 33, p. 1537; 1942, v. 34, p. 1231.
103. Comings E. W., Egly R. S. Ind. Eng. Chem., 1940, v. 32, p. 714.
104. Gordon A. R. J. Chem. Phys. 1937, v. 5, p. 522.
105. Gold Ph., Ogle Q. Chem. Eng., 1968, № 12, p. 152—154; Ns 23, p. 185-190;
1969, № 1, p. 119; Ns 5, p. 123; № 7, p. 130; Ns 14, p. 129; № 15, p. 121;
№ 17, p. 97; № 24, p. 170.
106. Gambill W. R. Chem. Eng., 1958, v. 65, Ns 3, p. 137; № 5, p. 147; Ns 8, p. 146;
№ 9, p. 143; № 17, p. 121; № 19, p. 169; Ns 21, p. 157; № 23, p. 156; 1959,
v. 66, № 1, p. 127; № 3, p. 123; № 5, p. 151; № 12, p. 181; № 14, p. 157;
№ 16, p. 129; № 25, p. 169.
107. Hecht G. Berechnung thermodynamischen stoffwerte von Gasen und Flussig-
keiten, DVGST. Leipzig, 1966.
108. Henning G. F. Warmetechnische Richtwerte. Berlin, 1938.
109. International critical tables, N. Y. — L., 1926—1933.
110. Jost W. Diffusion in Solids, Liquids, Gases. N. Y., 1952.
111. Ristikovski V. Z. phys. Chem., 1928, Bd. 107, S. 65; Bd. 137, S. 383.
112. Licht W., Stechert D. G. J. Phys. Chem., 1944, v. 48, p. 23.
113. Lehman H. Chem. Techn., 1957, Bd. 9, S. 530.
114. Leland Th. W., Mueller W. H. Ind. Eng. Chem., 1949, v. 51, p. 597.
115. Othmer D. F. Ind. Eng. Chem., 1942, v. 34, p. 1072; 1945, v. 37, p. 1112; 1946,
v. 38, p. Ill; 1953, v. 45, p. 589; 1957, v. 49, p. 124.
116. Pilar A. Linearni zawislosti v chemico-inzenyrstych vypoctech. Praha, 1957.
117. Partington J. An Advanced Treatise on Physical Chemistry. London, 1949.
118. Plank R. Chem. Ing. Techn., 1959, Bd. 31, S. 576.
119. Ranz W. E., Brodowsky H. A. Chem. Eng. Univ. Minnesota, 1962, v. 15.
120. Riedel L. Chem. Ing. Techn., 1951, Bd. 23, S. 59, 321; 1952, Bd. 24, S. 353;
1953, Bd. 26, S. 83, 259, 679; 1955, Bd. 27, S. 209, 475; 1956, Bd. 28, S. 419.
121. Smith R. H., Watson R. M. Ind. Eng. Chem., 1937, v. 29, p. 1408.
122. Vinograd J. R., McBain J. W. J. Am. Chem. Soc., 1941, v. 63, p. 2008.
123. Watson R. M. Ind. Eng. Chem., 1954, v. 35, p. 398, 679.
ПРИЛОЖИ НИЯ
I. Некоторые критерии подобия конвективной теплоотдачи (подробней см.
стр. 17—20)
Интенсивность теплообмена на границе лоток — стенка характеризует кри-
терий Нусельта:
NT а/
. Nu = —
‘ Ги
где а — коэффициент 'теплоотдачи, Вт/(м2 • К); I — определяющий геометриче-
ский размер*; Л — коэффициент теплопроводности, Вт/(м • К).
Физические свойства потока характеризует критерий Прандтля
где v = кинематический коэффициент вязкости, м2/с;
а = —-----коэффициент температуропроводности, м2/с;
СрР
Ср — теплоемкость при постоянном давлении, Дж/(кг • К); р — плотность, кг/м3;
ц — динамический коэффициент вязкости, Н • см2,.
Критерий фазового превращения
Е г
срМ
характеризует соотношение теплот, идущих иа фазовое превращение и на пе-
регрев (переохлаждение) одной из фаз (например, конденсата) при температуре
насыщения. Здесь г — теплота конденсации, Дж/кг; Д/ — разность между тем-
пературой насыщения и температурой стенки, град.
* Для каждого случая теплообмена указывают, какой именно размер яв-
ляется определяющим.
35g
II. Некоторые физические постоянные
Атомная единица массы (а. е. м.) ....
Объем одного моля идеального газа при
нормальных условиях (О °C н 101,325 кПа)
Постоянная Больцмана k .........
Универсальная газовая постоянная R . . .
Число Авогадро NA......................
(1,6605655±0,0000086) • 10“27 «г
(22,41383±0,0070) • 10-3 м3/моль
(1,380662 ±0,000045) • 10-23 Дж/К
(8,31441 ±0,00026) ДжДмоль-К)
(6,022045±0,000031) • 102в кмоль"1
III. Производные единицы СИ, имеющие собственные наименования
Величина Единица Выражение производной единицы
наименова- ние обо- значе- ние через другие еди- ницы СИ через основные единицы СИ
Частота герц Гц — с-1
Сила ньютон Н — м • кг • с~2
Давление паскаль Па Н/м2 м-1 • кг • с-2
Энергия, работа, количество тепло- джоуль Дж Н • м м2 • кг • с-2
ты
Мощность, поток энергии ватт Вт Дж/с м2 кг с~3
Количество электричества, электри- кулон Кл А-с с-А
ческий заряд
Электрическое напряжение, электри- ческий потенциал вольт В Вт/А м2 • кг с—3>А~1
Электрическое сопротивление ом ом Ом В/А м2 • кг • с-3 • А~2
Электрическая проводимость сименс См A/В м—2-кг“’-с3 • 71
IV. Соотношение между единицами силы
Единица н дин кге тс
Ньютон 1 103 0,102 1,02-10-4
Дина 10“3 1 1,02 • 10-3 1,02-10“9
Килограмм-сила 9,8067 9,8067- 105 1 10“3
Тониа-сила 9,8067 • 103 9,8067 • 103 103 1
353
Соотношение между единицами давления
354
VII. Соотношение между единицами количества теплоты >
Единица Дж кал кал (термохим.)
Джоуль 1 0,238846 0,230006
Калория (межд.) 4,1868 1 1,00067
Калория (термохим.) 4,1840 0,99933 1
VIII. Соотношение между единицами мощности
Единица Вт эрг/с КГС’М/с кал/с Л. с.
Ватт 1 107 0,102 0,239 1,36- 10~3
Эрг в секунду 10-7 1 1,02- 10~8 2,39- 10~8 1,36- IO-10
Килограмм-сила- метр в секун- ду 9,8067 9,8067-10-7 1 2,343 1,33 - 10-а
Калория в секун- ду 4,1868 4,1868- 107 0,427 1 5,69 • 10-3
Лошадиная сила 736 7,36-109 75 175,5 1
IX. Соотношение между единицами удельной теплоемкости
Единица Дж/(кг-К) эрг/(г-°С) ккал/(кг-°С) кал/(г-°С)
Джоуль на кило- грамм-кельвин 1 104 2,39- 10“4 2,39- 104
Эрг на грамм-гра- дус Цельсия 10-4 1 2,39 • 10“8 2,39- 10~8
Килокалория на килограмм-гра- дус Цельсия 4,187- 103 4,187-107 1 1
Калория на грамм- градус Цель- сия 4,187 -103 4,187-107 1 1
355
1 X. Соотношение меж'ду единицами коэффициента теплопроводности ж
Единица Вт/(м-К) Эрг/(с-см2-°С) Ккал/(ч-м-°С) Кал/(с*см*°С) Я
Ватт на метр-кельвин 1 105 0,86 2,39-10 3 Эрг в секунду на санти- 10-8 1 8,6-10—8 2,39 • 10-8 метр-градус Цельсия - ! Килокалория в час на 1,163 l,I63-10s I 2,78-10" метр-градус Цельсия Калория в секунду на 4,187 • 102 4,187 • 107 3,6 • 102 1 сантиметр-градус Цельсия
XI. Соотношение между единицами кинематической вязкости :
Единица М2/С Ст сСт М2/Ч
Квадратный метр на 1 104 10е 3600 J секунду 1 Стокс 10 4 1 100 0,36 Сантистокс 10 8 0,01 1 3,6-10 3 ' Квадратный метр за час 2,778-10-4 2,778 277,8 1 i
ХП. Соотношение между единицами динамической вязкости <
Единица Па’с п КГС-с/м2 '
Паскаль-секунда 1 10 0,102 Пуаз 0,1 1 1,02-Ю”2 Килограмм-сила-секунда на квадрат- 9,81 9,81 1 ный метр * . . XIII. Множители и приставки для образования десятичных кратных и дольных единиц и их наименований
Множитель - Приставки
_ международное t наименование русское обозначение обозначение
1 000 000= 108 мега М. М 1 000 = 103 кило к к 100 = 102 гекто г h 10 = 10' дека да da 0,1 = 10-1 деци д d ; 0,01 = 10~2 санти с с 0,001 = 10“3 миллн м ш 0,000001 = 10-8 микро мк Н 0,000000001 = 10~9 наио н п
356
XIV. Соотношение единиц СИ с другими единицами измерений
Величина Обозна- чение Единица измерения Коэффициент пересчета в систему СИ Единица измерения в системе СИ
Вязкость в П кг1 Па • с
сП ю~3 Па • с
Давление р атм 101,33 - 103 Па
мм рт. ст. 133,3 Па
Длина 1 см ю-2 м
А иг10 м
Коэффициент диф- D см2/с 10“4 м2/с
фузии
см2/сутки 0,116 • 10“8 _м2/с
Коэффициент ежи- Рад. риз см2/дин 10 Па 1
маемости атм-1 10-s Па-1
Мольная рефракция см3/моль ю-6 м3/моль
Мольный объем V см3/моль 10-в м3/моль
Парахор Pch дин''’4 • см"/4/моль 1,78-10-7 Дж'/4 • м’А
эрг1/1 см‘/2/моль 1,78-10-7 Дж'1'4 • мЕ/1
Плотность Р г/см3 103 кг/м3
г/л 1 кг/м3
кг/л 103 кг/м3
Поверхностное на- а дин/см Ю~3 Н/м
тяжеиие эрг/см2 10~3 Дж/м2
Энергия образова- до? кал/моль 4,19 Дж/моль
ния Гиббса
Скорость звука с см/с 10“2 м/с
Теплоемкость Ср калДмоль К) 4,19 ДжДмоль • К)
ккалДмоль • К) 4,19 • 103 ДжДмоль • К)
ккалДкг К) 4,19 103 ДжДкг К)
ДжДг • К) 103 ДжДкг • К)
Т еплопроводн ость X калДсм с • К) 419 Вт/(м-К)
ккалДм • ч • К) 1,16 ВтДм • К)
ВтДсм • К) 102 Вт/(м-К)
Энтальпия испаре- ^нсп Дж/г 103 Дж/кг
НИЯ кал/г 4,19-103 Дж/кг
кал/моль 4,19 Дж/моль
Энтальпия образо- дя^ кал/моль 4,19 Дж/моль
вания
Энтропия абсолют- sf калДмоль • К) 4,19 ДжДмоль • К)
ная
Энтропия образова- Д&° калДмоль • К) 4.19 ДжДмоль • К)
НИЯ
357
ОГЛАВЛЕНИЕ
Предисловие........................................................... 3
Глава I. Некоторые положения вычислений физико-химических величии . . 5
§ 1. Принципы аддитивности, конститутивности, подобия и равновесия 5
§ 2. Примеры расчетов.................'.............................9
Глава II. Принципы подобия и соответственных состояний.................12
§ 1. Применение принципа подобия...................................12
§ 2. Применение принципа соответственных состояний.................15
§ 3. Некоторые определяющие критерии...............................17
Глава Ш. Поляризуемость и дипольный момент. Парахор, ортохор, реохор.
Рефракция, мольный объем жидкости....................................» 21
§ 1. Вычисление значений поляризуемости и дипольного момента ... 21
§ 2. Вычисление мольной рефракции..................................25
§ 3. Межмолекулярные силы. Вычисление энергии взаимодействия ... 25
§ 4. Вычисление парахора, реохора, ортохора и мольной скорости звука 29
§ 5. Вычисление мольного объема и термического расширения жидкостей 33
§ 6. Примеры расчетов..............................................37
Глава IV. Газовые законы ..............................................41
§ 1. Уравнение состояния идеальных газов..............'............41
§ 2. Уравнение состояния реальных газов............................45
§ 3. Кинетическая энергия и скорость движения молекул газа.........48
§ 4. Процесс сжижения газов . .....................................50
§ 5. Примеры расчетов..............................................54
Глава V. Определение критических и приведенных параметров газов
и жидкостей ......................................................... .59
§ 1. Критические и приведенные давления, температура и объем .... 59
Общие положения................................................59
Вычисление критической температуры............................62
Вычисление критического давления..............................68
Вычисление критического мольного объема.......................70
§ 2. Вычисление псевдокритических параметров.......................72
§ 3. Вычисление параметров газов под давлением и коэффициента ежи1
маемости.........................................................73
§ 4. Примеры расчетов..............................................86
368
Глава VI. Фугитивность и активность. Определение некоторых свойств
растворов..............................................................97
§ 1. Фугитивность и активность........................................97
§ 2. Определение некоторых свойств растворов.........................106
§ 3. Вычисление растворимости солей в растворах другой соли и в рас-
творе двух солей ..................................................109
Раствор одной соли.............................................. 109
Раствор двух разных солей ........................................112
Раствор двух солей в других солях...............................113
§ 4. Примеры расчетов.................................................114
Глава VII. Давление паров. Температуры замерзания и кипения. Плотно-
сти растворов.........................................................116
§ 1. Вычисление давления паров........................................116
§ 2. Вычисление температур кипения и замерзания растворов.............131
§ 3. Вычисление плотности растворов...................................136
§ 4. Испарение и конденсация..........................................140
§ 5. Вычисление коэффициента распределения (фазового равновесия) . .145
§ 6. Примеры расчетов.................................................148
Глава VIII. Энтальпия и энтропия....................................... 157
§ 1. Общие положения . . ,...........................................157
§ 2. Энтальпийные и энтропийные диаграммы............................159
§ 3. Примеры расчетов.............................................181
Глава IX. Теплоты испарения (парообразования) и возгонки. Температуры
и теплоты плавления ................................................ .186
§ 1. Вычисление теплот испарения жидкостей...........................187
§ 2. Вычисление теплоты возгонки. Температуры и теплоты плавления
соединений.........................................................200
§ 3. Примеры расчетов.................................................202
Глава X. Теплоемкости газов, жидкостей и растворов ........ 207
§ 1. Общие методы вычисления теплоемкостей веществ....................207
§ 2. Вычисление теплоемкости растворов................................219
§ 3. Примеры расчетов ................................................227
Глава XI. Вязкость газов и их смесей.....................................231
§ 1. Общие положения..................................................231
§ 2. Зависимость вязкости газов от температуры и давления.............236
§ 3. Вычисление вязкости газовой смеси................................242
§ 4. Примеры расчетов.................................................250
Глава XII. Вязкость жидкостей, эмульсий и суспензий .....................254
§ 1. Вычисление вязкости жидкостей....................................254
§ 2. Зависимость вязкости жидкостей от температуры и давления . . .'258
§ 3. Вычисление вязкости растворов................................261
§ 4. Вычисление вязкости смесей жидкостей, эмульсий, суспензий . . . 262
§ 5. Примеры расчетов.............................................265
Глава XIII. Коэффициент диффузии......................................268
§ 1. Вычисление коэффициента диффузии газов.......................269
§ 2. Вычисление коэффициента диффузии в жидкостях.................274
§ 3. Примеры расчетов.............................................280
Глава XIV. Поверхностное натяжение жидкостей..........................284
§ 1. Общие положения..............................................284
§ 2. Зависимость поверхностного натяжения от температуры и давления 287
§ 3. Примеры расчетов.............................................. 292
359
Глава XV. Теплопроводность газов и их смесей......................294
§ 1. Вычисление коэффициента теплопроводности газов...........294
§ 2. Определение критерия Прандтля для газов и их смесей .... 300
§ 3. Зависимость коэффициента теплопроводности газов от темпера-
туры и давления...............................................302
§ 4. Вычисление коэффициента теплопроводности газовых смесей . . 309
§ 5. Примеры расчетов.........................................313
Глава XVI. Теплопроводность жидкостей и их смесей ................321
§ 1. Вычисление коэффициента теплопроводности жидкостей .... 321
§ 2. Зависимость коэффициента теплопроводности жидкостей от тем-
пературы и давления...........................................324
§ 3. Вычисление коэффициента теплопроводности смесей жидкостей 327
§ 4. Примеры расчетов..........................................328
Глава XVII. Теплопроводность растворов электролитов ...........331
Глава XVIII. Теплопроводность некоторых металлов, сплавов, твердых и
пористых материалов ........................................... . 337
§ 1. Коэффициенты теплопроводности металлов и сплавов . . . . ; 337
§ 2. Коэффициенты теплопроводности твердых и пористых материалов 344
Литература........................................................348
Приложения . ................................................... 352
Михаил Маркович Викторов
МЕТОДЫ ВЫЧИСЛЕНИЯ
ФИЗИКО-ХИМИЧЕСКИХ ВЕЛИЧИН
И ПРИКЛАДНЫЕ РАСЧЕТЫ
Редактор В. А. Станкевич
Технический редактор Ф. Т. Черкасская
Корректор Г. А. Рябинина
Переплет художника В. Б. Мартусевича
ИБ Я» 167
М-13077. Сдано в набор 31.01.77. Подписано в печать 23.05.77. Формат бу-
маги OOXWu. Бумага тип. № 2. Усл. печ. л. 22,5. Уч.-изд. л. 23,81.
Тираж 10600 экз. Заказ>77. Изд. № 534. Цена 1 р. 69 к.
Издательство еХимия*, Ленинградское отделение
191185, Ленинград, Д-185, Невский пр., 28
Ордена Трудового Красного Знамени Ленинградская типография № 2
имени Евгении Соколовой Союзполиграфпрома
при Государственном комитете Совета Министров СССР
по делам издательств, полиграфии и книжной торговли,
198052, Ленинград, Л-52. Измайловский проспект, 29,
ЗАМЕЧЕННЫЕ ОПЕЧАТКИ
Стр. Строка Напечатано Следует читать
12 14 снизу я,' — Ся л'/л" = Сл
n"jG" = Св G4Q" = са
19 34 9 сверху 16 сверху 39,4... 1 гкр 9,4...
37 19 снизу р = 1,33538. р = 1,3538.
45 7 снизу е = V кр/3 b = 1%/3
46 22 снизу Р=... Ао/Р р= ... a0/v2(i--£-)
210 13 снизу Т->0. Т -> 0, а при высоких Т/в _
к значению Со = 37?.
264 9 2
3 сверху s-"2 s_-
270 2 снизу 5 Ид. * о. а. <С> LO II
и — с • • • 6 р
272 0.042271 „ 0.0422Г’'1
формула £>1.2 =
V], 2
(XIII. 4) ...
272 5 снизу 01.2= ...
i/°-4 4-I/0,4 L * мол. кр. I 1 k мол. кр. 2 I (V0,4 ч-i/0,4 У L v мол. кр. 1 к мол. кр. J
278 „ 14-10“9 „ 14-Ю-5
1 снизу D =
296 формула _ т-0,279 • * *1 пр _ т0,729 — ••• 7 пр
(XV. 3)
297 6 сверху Ср Ха ср
Ха
8 сверху Ср Ср
321 формула (XVI. 1) K = 20Rc(... Х = 2/?с(...
322 2 сверху л / Т™ * / пл
• • • А / ъ ‘
V М4' у <м.МОЛ V MV /ч
333 формула (XVII. 3) Хр = 0,0029 ... Хр = 0,08 ...
Зак. 477