Author: Медведева М.В.
Tags: гинекология акушерство медицина патофизиология
ISBN: 5-900770-09-5
Year: 2000
Text
ЭНЦИКЛОПЕДИЯ
УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ
В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Главный редактор энциклопедии М.В. Медведев
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ВРОЖДЕННЫХ ПОРОКОВ РАЗВИТИЯ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
Под редакцией
М.В. Медведева
Российская ассоциация врачей ультразвуковой диагностики в перинатологии и гинекологии
ОГЛАВЛЕНИЕ
ЭНЦИКЛОПЕДИЯ
УДК 618.3-036.4-073.432.19(048.8)
ББК 57.16
М59
ЭНЦИКЛОПЕДИЯ УЛЬТРАЗВУКОВОЙ ДИАГНОСТИКИ
В АКУШЕРСТВЕ И ГИНЕКОЛОГИИ
Главный редактор энциклопедии Медведев М.В.
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ВРОЖДЕННЫХ ПОРОКОВ РАЗВИТИЯ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
Под редакцией Медведева М.В.
1-е изд. - М.: РАВУЗДПГ, Реальное Время, 2000. - 160 с.: ил.
ISBN 5-900770-09-5
ISBN 5-900080-11-0
В руководстве обобщен мировой опыт пренатальной ультразвуковой диагностики врожденных пороков развития в ранние сроки беременности. Подробно освещены вопросы скринингового ультразвукового исследования плода в 10 14 недель беременности и оценки ультразвуковой анатомии его вутренних органов. Особое внимание уделено описанию диагностического значения измерения толщины воротникового пространства плода для выявления разной врожденной и наследственной патологии. Отдельные главы энциклопедии посвящены допплеровскому исследованию плодово-плацентарного кровотока в 10—14 недель беременности при хромосомных аномалиях и методическим основам инвазивных методов пренатальной диагностики в ранние сроки беременности.
Для перинатологов, акушеров-гинекологов, неонатологов, генетиков, врачей ультразвуковой диагностики и специалистов по пренатальной диагностике.
ISBN 5-900770-09-5
ISBN 5-900080-11-0
© Российская ассоциация врачей ультразвуковой диагностики в перинатологии и гинекологии, 2000
© М.В. Медведев, 2000
Ни одна из частей этой книги не может быть перепечатана и воспроизведена в любом виде (электронном, механическом, фотографическом, письменном и др.), полностью или частями, без письменного разрешения редакции.
Подготовлено к печати в издательстве «Реальное Время»
Директор издательства Логвиненко Т.В.
Оформление обложки Касьяненко О.П.
Верстка Касьяненко О.П., Трушина К.В.
Технический редактор Харланова О.А.
Подписано в печать 28.12.2000. Формат 60x90/8. Бумага мелованная.
Отпечатано в полном соответствии с качеством предоставленных диапозитивов ОАО «Можайский полиграфический комбинат», 143200, г. Можайск, ул. Мира 93.
При оформлении обложки использовано изображение трехмерной реконструкции эмбриона с выделением структур головного мозга, полученное H.-G.K. Blaas. На четвертой странице обложки рисунок «Новый взгляд», любезно предоставленный художником А.В. Щегловым.
ОГЛАВЛЕНИЕ
ЭНЦИКЛОПЕДИЯ
Авторский коллектив
Алтынник Наталья Анатольевна сотрудник кафедры рентгенологии и ультразвуковой диагностики Института повышения квалификации врачей МБ и ЭН М3 РФ, Москва
Медведев Михаил Васильевич доцент кафедры рентгенологии и ультразвуковой диагностики Института повышения квалификации врачей МБ и ЭН М3 РФ, Москва
Юдина Елена Владимировна кандидат медицинских наук, заведующая Центром пренатальной диагностики при клиническом родильном доме № 27, Москва
Harm-Gerd ECarl Blaas MD PhD Consultant of National Center for Fetal Medicine University Hospital of Trondheim, Norway
ОГЛАВЛЕНИЕ
ЭНЦИКЛОПЕДИЯ
Содержание
Авторский коллектив 5
Прелйсловие 6
Глава 1.
Нормальная ультразвуковая анатомия плода в ранние сроки беременности
Н. - G.K. Blaas, М.В. Медведев 7
Глава 2.
Пренатальная ультразвуковая диагностика врожденных пороков развития в 10—16 недель беременности
М.В. Медведев 33
Глава 3.
Воротниковое пространство и хромосомные аномалии
Н.А. Алтынник, Е.В. Юдина, М.В. Медведев 73
Глава 4.
Воротниковое пространство и врожденные пороки развития
М.В. Медведев, Н.А. Алтынник 97
Глава 5.
Результаты допплеровского исследования плодово-плацентарного кровотока в ранние сроки беременности при хромосомных аномалиях
М.В. Медведев 112
Глава 6.
Инвазивные методы пренатальной диагностики в ранние сроки беременности
Е.В. Юдина 123
Глава 7.
Современная стратегия пренатальной диагностики в ранние сроки беременности
Е.В. Юдина, М.В. Медведев 152
ТИТУЛ
ЭНЦИКЛОПЕДИЯ
Предисловие
Пятый том «Энциклопедии ультразвуковой диагностики в акушерстве и гинекологии» посвящен различным аспектам скринингового ультразвукового исследования плода в ранние сроки беременности. Этот раздел пренатальной диагностики является достаточно новым для отечественных специалистов, так как всего несколько регионов нашей страны в последние два года начали проводить ультразвуковое исследование в 10—14 недель беременности в скрининговом режиме. Поэтому в этом томе в первую очередь подробно изложены основы ультразвуковой анатомии вутренних органов плода в ранние сроки. Так же как и в предыдущих томах для более полного освещения зарубежного опыта по этой теме в авторский коллектив приглашен консультант Национального Центра Медицины Плода из Норвегии Harm-Gerd Karl Blaas, который является признанным мировым лидером в области «ультразвуковой эмбриологии».
Особое внимание в книге уделено описанию диагностического значения измерения толщины воротникового пространства плода для выявления различной врожденной и наследственной патологии. Подробно изложены вопросы пренатальной ультразвуковой диагностики различных врожденных пороков развития в ранние сроки беременности. Не остались без внимания также вопросы допплеровского исследования плодово-плацентарного кровотока в 10—14 недель беременности при хромосомных аномалиях и методические основы инвазивных методов пренатальной диагностики в ранние сроки беременности.
Авторский коллектив сердечно благодарит представительство фирмы GE Ultrasound Europe за оказанную финансовую поддержку в издании этого тома энциклопедии и сотрудничество с Ассоциацией по программе повышения квалификации врачей ультразвуковой диагностики.
В заключение хотелось бы выразить надежду, что настоящая книга поможет совершенствованию пренатальной диагностики в ранние сроки беременности и станет настольным руководством у отечественных специалистов. Авторский коллектив будет признателен за высказанные пожелания, которые мы постараемся учесть в последующих томах энциклопедии.
Авторский коллектив выражает глубокую признательность художнику А.В. Щеглову, который специально для оформления обложки этого тома энциклопедии подготовил рисунок «Новый взгляд», который полностью отражает основное содержание книги — переход от рутинного подхода к осмысленному использованию скринингового ультразвукового исследования в ранние сроки беременности.
Главный редактор энциклопедии
М.В. Медведев
ОГЛАВЛЕНИЕ
ЭНЦИКЛОПЕДИЯ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
H.-G.K. Blaas, М.В. Медведев
Основой пренатальной диагностики врожденных пороков развития в ранние сроки беременности с помощью эхографии является четкое знание нормальной ультразвуковой анатомии разных органов и частей тела развивающегося плода. Поскольку в ранние сроки беременности происходит интенсивное развитие плода и соответственно изменение эхографической картины его внутренних органов, первостепенное значение имеет точное определение срока беременности.
В настоящее время среди различных биометрических показателей в ранние сроки наибольшее распространение получил копчико-теменной размер эмбриона/ плода. Для его правильного определения необходимо придерживаться следующих основных правил:
— измерение проводится при сагиттальном сканировании эмбриона/плода;
— за копчико-теменной размер принимается максимальное расстояние от его головного конца до копчика (рис. 1.1);
— при двигательной активности эмбриона/плода измерение проводится в момент его максимального разгибания.
Следует отметить, что копчико-теменной размер эмбриона/плода меньше под-
вержен индивидуальным колебаниям, чем средний внутренний диаметр плодного яйца и, следовательно, его использование для определения срока беременности дает лучшие результаты. Вычисление срока беременности на основании значений копчико-теменного размера обычно используется у пациенток с нерегулярным менструальным циклом. У пациенток с регулярным менструальным циклом срок беременности вычисляется от первого дня последней менструации и полученные значения копчико-теменного размера эмбриона/плода сопоставляются с нормативными показателями.
Рис. 1.1. Определение копчико-теменного размера.
ОГЛАВЛЕНИЕ
1
глава
Таблица 1.1. Нормативные показатели копчико-теменного размера эмбриона/плода
Срок беременности, нед/дни Процентильные значения KTP, мм Срок беременности, нед/дни Процентильные значения KTP, мм Срок беременности, нед/дни Процентильные значения KTP, мм
5 50 95 5 50 95 5 50 95
7/0 5 8 11 9/3 19 25 31 11/6 40 49 58
7/1 6 9 12 9/4 20 26 32 12/0 42 51 59
7/2 7 10 13 9/5 21 27 34 12/1 44 53 62
7/3 8 11 14 9/6 22 29 36 12/2 45 55 65
7/4 9 12 15 10/0 24 31 38 12/3 47 57 67
7/5 9 13 16 10/1 25 33 41 12/4 49 59 59
7/6 10 13 17 10/2 26 34 42 12/5 50 61 72
8/0 10 14 18 10/3 27 35 43 12/6 51 62 73
8/1 11 15 19 10/4 29 37 45 13/0 51 63 75
8/2 11 16 21 10/5 31 39 47 13/1 53 65 77
8/3 12 17 22 10/6 33 41 49 13/2 54 66 78
8/4 13 18 23 11/0 34 42 50 13/3 56 68 80
8/5 14 19 24 11/1 35 43 51 13/4 58 70 82
8/6 15 20 25 11/2 36 44 52 13/5 59 72 85
9/0 16 22 27 11/3 37 45 54 13/6 61 74 87
9/1 17 23 29 11/4 38 47 56 14/0 63 76 89
9/2 18 24 30 11/5 39 48 57 14/1 64 78 92
Учитывая отсутствие в отечественной литературе процентильных показателей копчико-теменного размера эмбриона/ плода, приводим собственные нормативные значения |1| (табл. 1.1).
В последние годы отмечается возрастающий интерес специалистов к изучению особенностей развития эмбриона/плода с помощью ультразвукового метода исследования. Это стало возможным благодаря бо-
лее широкому использованию высокоразрешающей трансвагинальной эхографии. В настоящее время можно с уверенностью утверждать, что «соноэмбриология» (термин предложен I. Timor-TritschncoaBT. в 1990 г. [2]) становитсянеотъемлемойчастью нашей специальности. В этойглаве мы попытались представить основные результаты, полученные в последнее десятилетие приультразву-ковом изучении эмбриона/плода.
ЦЕНТРАЛЬНАЯ НЕРВНАЯ СИСТЕМА
Оценка некоторых основных структур головного мозга эмбриона с помощью трансвагинальной эхографии возможна с 7 нед беременности. По мере возрастания гестационного срока увеличивается количество визуализируемых структур головного мозга, изменяются их размеры, топография и форма, а также само эхографическое изображение.
7 недель беременности (копчико-теменной размер эмбриона 9—14 мм)
Начиная с 7 нед беременности при ультразвуковом исследовании эмбриона становятся различимы основные ги-поэхогенные полости головного мозга
(ромбэнцефалон, мезэнцефалон, диэнцефалон), включая и разделенные полушария (рис. 1.2—1.5). Боковые желудочки головного мозга еще достаточно маленькие и четко не идентифицируются. Полость диэнцефалона (будущий III желудочек) удается четко лоцировать только в 59% случаев на протяжении 7-й недели [3]. Длина диэнцефалона в 7 нед беременности в среднем составляет 2,1 мм (0,8—3,4 мм), ширина — 1,2 мм (0,7—1,7 мм), высота — 1,1 мм (0,3—1,8 мм). Будущее отверстие Монро представлено достаточно широкой структурой в эти сроки. При сагиттальном сечении высота диэнцефалической
8
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.2. Схематическое изображение основных структур головного мозга эмбриона и их измерение в 7 нед беременности, а - сагиттальное сечение. Ромбэнцефалон, мезэнцефалон и диэнцефалон показаны в сагиттальной плоскости, полушарие — в парасагиттальной плоскости, б - увеличенное сагиттальное сечение с изображением измерений, в — горизонтальное сечение.
Рис. 1.3. Беременность 7 нед 5 дней (копчико-теменной размер 14 мм). Сагиттальное сечение. 1 — ромбэнцефалон; 2 — мезэнцефалон; 3 - диэнцефалон;
4 — пуповина [4].
Рис. 1.4. Беременность 7 нед (копчико-теменной размер 12 мм). Горизонтальное сечение. 1 ромбэнцефалон; 2 — мезэнцефалон; 3 желточный мешок. Стрелкой показан перешеек ромбэнцефалона [3].
полости выглядит несколько большей, чем мезэнцефалона, который имеет вид изогнутой трубкообразной структуры и идентифицируется в 57% случаев [4]. Его длина в среднем составляет 2,8 мм (1,7—3,9 мм), ширина — 1,3 мм (0,7—1,8 мм), высо
та— 1,2 мм (0,6—1,7 мм). Ромбэнцефалон виден практически у всех эмбрионов с 7 нед беременности. Свое название он получил ввиду характерной формы ромба. Длина ромбэнцефалона в эти сроки составляет в среднем 3,8 мм (2,2—5,3 мм),
9
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ ММ
1
глава
Рис. 1.5. Беременность 7 нед 2 дня (копчико-теменной размер 12 мм). Поперечное сечение головы эмбриона в косом направлении. 1 — ромбэнцефалон; 2 — диэнцефалон; 3 полушария; 4 — желточный мешок [4].
Рис. 1.6. Беременность 8 нед (копчико-теменной размер 18 мм). Сагиттальное сечение. 1 - ромбэнцефалон; 2 — мезэнцефалон; 3 - диэнцефалон. Стрелкой показаны первые признаки хороида [3].
ширина — 2,1 мм (0,6—3,7 мм), высота — 1,5 мм (0,4—2,6 мм).
8 недель беременности (копчико-теменной размер эмбриона 15—22 мм)
В 8 нед беременности при ультразвуковом исследовании эмбриона полости мозга определяются в виде больших гипоэхоген-ных образований (рис. 1.6). Отмечается увеличение размеров полушарий и становятся различимыми хороиды боковых желудочков в виде мелких эхогенных зон. Будущее отверстие Монро приобретает более отчетливые очертания, полость ди
энцефалона сохраняется достаточно широкой [5]. В горизонтальном сечении через ромбэнцефалон и мезэнцефалон можно увидеть первые признаки хорои-дов боковых желудочков и утолщений будущих полушарий мозжечка (рис .1.7). По мнению С.М. Воеводина |6], наблюдаемый в конце 8-й недели процесс разделения сосудистых сплетений боковых желудочков, по-видимому, не отражает процесса разделения конечного мозга на два полушария, который происходит гораздо раньше — приблизительно в конце 4-й недели. Длина ромбэнцефалона в эти сроки составляет в среднем 3,9 мм (2,3— 5,4 мм), ширина — 3,1 мм (1,5—4,7 мм), высота — 2,1 мм (1,0—3,2 мм) [3].
9 недель беременности (копчико-теменной размер эмбриона 23—31 мм)
С 9 нед беременности практически всегда видны боковые желудочки мозга, особенно в парасагиттальной плоскости. С этого же срока беременности четко идентифицируются эхогенные сосудистые сплетения боковых желудочков. Их ширина в среднем составляет 3,2 мм (1,8—4,6 мм), высота — 1,1 мм (0,6—1,6 мм). Полость мезэнцефалона сохраняется большой, особенно в задней части. При этом ее высота и ширина остаются приблизительно теми же. Начинают легко идентифицироваться полушария мозжечка (рис. 1.8). Их ширина в среднем составляет 4,8 мм (3,0—7,1 мм), высота — 1,4 мм (0,7—2,1 мм). Длина ромбэнцефалона в эти сроки достигает в среднем 4,0 мм (2,5—5,6 мм), ширина — 3,8 мм (2,2— 5,4 мм), высота —2,5 мм(1,5—3,6мм).
10 недель беременности (копчико-теменной размер плода 32—42 мм) и 11 недель беременности (копчико-теменной размер плода 43—54 мм)
К концу I триместра беременности толщина коры головного мозга составляет около 1 мм. Диэнцефалон располагается между полушариями мозга, мезэнцефалон продолжает движение в сторону
10 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.7. Беременность 8 нед (копчико-теменной размер 17 мм). Горизонтальное сечение. 1 мезэнцефалон; 2 — первые признаки хороидов; 3 — утолщения будущих полушарий мозжечка [3].
Рис. 1.8. Беременность 9 нед (копчико-теменной размер 25 мм). Коронарное сечение. 1 мезэнцефалон; 2 полушарие мозжечка; 3 сосудистое сплетение; 4 продолговатый мозг [3].
Рис. 1.9. Коронарное сечение головы плода на уровне тел боковыхжелудочков (а) и на уровне полушарий мозжечка (б). Большими стрелками показаны полушария мозжечка, маленькими сосудистые сплетения [31.
Рис. 1.10. Беременность 10 нед (копчико-теменной размер 33 мм). Сагиттальное сечение. 1 мезэнцефалон; 2 — диэнцефалон; 3 — гиперэхогенное сосудистое сплетение в области верхней стенки IV желудочка. Параллельными стрелками показаны задняя и передняя границы продолговатого мозга [3].
Рис. 1.11. Беременность 12 нед4дня. Поперечное сечение головы плода. Отчетливо видны гиперэхогенные сосудистые сплетения боковых желудочков.
11
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ ММ
1
глава
Рис. 1.12. Схематическое изображение основных структур головного мозга эмбриона и их измерение в 10 нед беременности при горизонтальном (а) и коронарном (б) сечении. Стрелками показаны соответствующие измерения. СС — сосудистое сплетение; М - мезэнцефалон; П полушарие; Д - диэнцефалон.
Перешеек про.зэнцефалона
Рис. 1.13. Схематическое изображение основных структур головного мозга плода и их измерение в 10 нед беремен-нести при сагиттальном (а) и парасагиттальном (б) сечении. Стрелками показаны соответствующие измерения.
Таблица 1.2. Средние значения объема мозговых полостей (в мм3) в зависимости от копчико-теменного размера эмбриона/плода
Копчико-теменной размер, мм Полушария Диэнцефалон Мезэнцефалон Ромбэнцефалон
10 0,6 1,7 1,1 7,3
15 6,8 4,4 3,6 13,3
20 26,2 6,7 6,6 18,8
25 66,1 7,6 9.3 22,6
30 134,1 6,8 11,4 23,9
35 239,0 4,5 12,3 22,5
39 351,2 2,4 12,2 19,6
12 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.14. Беременнэстъ 9 нед 5 дней. Позвоночник плода.
Рис. 1.15. Беременность 12 нед4дня. Позвоночникплода.
центра головы (рис. 1.9—1.13). Полушария мозжечка соединяются по средней линии между 11 и 12 нед. После 10 нед 3 дней становятся отчетливо видны сосудистые сплетения IV желудочка. Расстояние между сосудистыми сплетениями и мозжечком сокращается к 11 нед беременности за счет роста его полушарий. Их ширина в 11 нед в среднем составляет 6,9 мм (4,7—9,6 мм), высота — 2,1 мм (1,4—2,8 мм). К12 нед беременности сосудистые сплетения занимают большую часть боковых желудоч
ков, их длина достигает в среднем 12,7 мм (8,9—17,2 мм), ширина — 4,4 мм (2,8—6,3 мм), высота — 5,4 мм (3,7—7,3 мм) [7]. Размеры ромбэнцефалона практически не изменяются. В конце I триместра беременности отчетливо видна оссификация позвоночника (рис. 1.14, 1.15).
Для более полного представления о закономерностях изменения размеров полостей мозга H.-G. Blaas и соавт. [8] провели изучение их объемов с помощью трехмерной эхографии (табл. 1.2).
СЕРДЦЕ И ГЛАВНЫЕ АРТЕРИИ
Сердечная деятельность эмбриона реги-стрируетсяпритрансвагинальномультразву-ковом исследовании начиная с 6 нед беременности, когда его копчико-теменной размер составляет 2—3 мм [9, 10]. До 10 нед беременности практически невозможно различить интракардиальные структуры эмбриона и оценка его сердечной деятельности заключается только в измерении частоты сердечных сокращений. Проводяисследова-ние в ранние сроки, не всегда возможно четко увидеть сердечные сокращения эмбриона в В-режиме, поэтому в таких случаях целесообразно дополнительно использовать цветовое допплеровское картирование. Кроме этого, приприменении М-методаилиим-пульсной допплерографии без труда можно оценить частоту сердечных сокращений, что имеет важное прогностическое значение.
Частота сердечных сокращений у эмбриона/плода при неосложненном течении беременности постепенно возрастает от 6 нед беременности до 9—10 нед, а затем так же постепенно снижается к 14 нед. Согласно данным Н. Blaas и соавт. [ 11], в 7 нед беременности частота сердечных сокращений составляет в среднем 138 уд/мин (122—154), в 8 нед — 166 уд/мин (150—182), в 9 нед — 175 уд/мин (159—190), в 10 нед — 174уд/мин(158—190),в Пнед— 171уд/мин (155-187), в 12нед— 166 уд/мин (150-182).
Поданным B.-G. Hertzberg и соавт. [12], наиболее высока частота сердечных сокращений (144 уд/мин) в 8 нед беременности, тогда как Е. MerchiersncoaBT. [13] отметили наиболее высокие значения (157 уд/мин) в 10 нед. Полученные нами результаты полностью согласуются с данными Т. DuBose и
13
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
глава
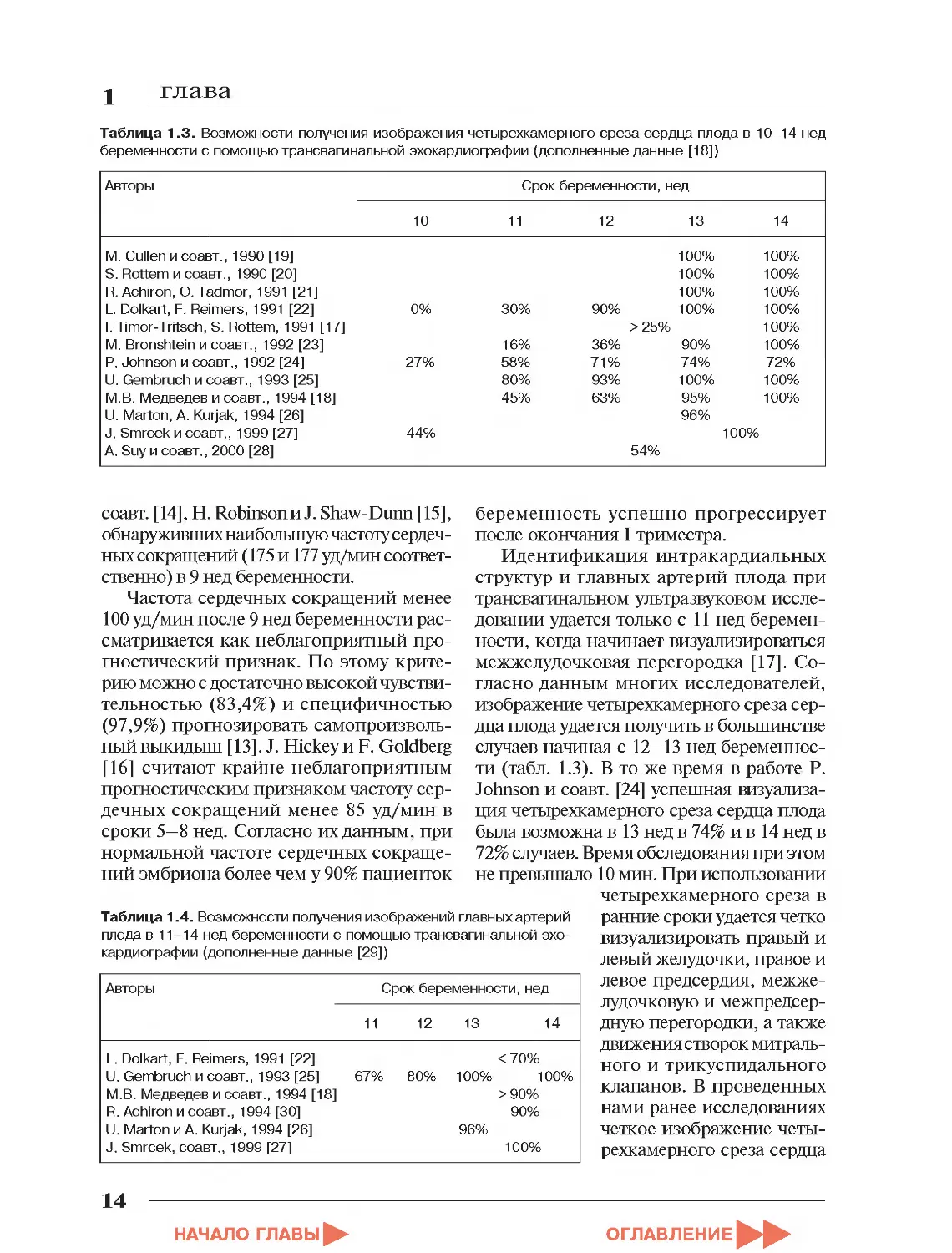
Таблица 1.3. Возможности получения изображения четырехкамерного среза сердца плода в 10-14 нед беременности с помощью трансвагинальной эхокардиографии (дополненные данные [18])
Авторы Срок беременности, нед
10 11 12 13 14
М. Cullen и соавт., 1990 [19] 100% 100%
S. Rottem и соавт., 1990 [20] 100% 100%
R. Achiron, О. Tadmor, 1991 [21] 100% 100%
L. Dolkart, F. Reimers, 1991 [22] 0% 30% 90% 100% 100%
I. Timor-Tritsch, S. Rottem, 1991 [17] > 25% 100%
M. Bronshtein и соавт., 1992 [23] 16% 36% 90% 100%
P. Johnson и соавт., 1992 [24] 27% 58% 71% 74% 72%
U. Gembruch и соавт., 1993 [25] 80% 93% 100% 100%
М.В. Медведев и соавт., 1994 [18] 45% 63% 95% 100%
U. Marton, A. Kurjak, 1994 [26] 96%
J. Smrcek и соавт., 1999 [27] 44% 100%
A. Suy и соавт., 2000 [28] 54%
соавт. [14]. Н. Robinson и J. Shaw-Dunn 115], обнаружившихнаибольшую частоту сердечных сокращений (175 и 177 уд/мин соответственно) в 9 нед беременности.
Частота сердечных сокращений менее 100 уд/мин после 9 нед беременности рассматривается как неблагоприятный прогностический признак. По этому критерию можно с достаточно высокойчувстви-тельностью (83,4%) и специфичностью (97,9%) прогнозировать самопроизвольный выкидыш [13]. J. Hickey и F. Goldberg [16] считают крайне неблагоприятным прогностическим признаком частоту сердечных сокращений менее 85 уд/мин в сроки 5—8 нед. Согласно их данным, при нормальной частоте сердечных сокращений эмбриона более чем у 90% пациенток
беременность успешно прогрессирует после окончания I триместра.
Идентификация интракардиальных структур и главных артерий плода при трансвагинальном ультразвуковом исследовании удается только с 11 нед беременности, когда начинает визуализироваться межжелудочковая перегородка [17]. Согласно данным многих исследователей, изображение четырехкамерного среза сердца плода удается получить в большинстве случаев начиная с 12—13 нед беременности (табл. 1.3). В то же время в работе Р. Johnson и соавт. [24] успешная визуализация четырехкамерного среза сердца плода была возможна в 13 нед в 74% и в 14 нед в 72% случаев. Время обследования при этом не превышало 10 мин. При использовании
Таблица 1.4. Возможности получения изображений главных артерий плода в 11-14 нед беременности с помощью трансвагинальной эхокардиографии (дополненные данные [29])
Авторы Срок беременности, нед
11 12 13 14
L. Dolkart, F. Reimers, 1991 [22] < 70%
U. Gembruch и соавт., 1993 [25] 67% 80% 100% 100%
М.В. Медведев и соавт., 1994 [18] > 90%
R. Achiron и соавт., 1994 [30] U. Marton и A. Kurjak, 1994 [26] 96% 90%
J. Smrcek, соавт., 1999 [27] 100%
четырехкамерного среза в ранние сроки удается четко визуализировать правый и левый желудочки, правое и левое предсердия, межжелудочковую и межпредсердную перегородки, а также движения створок митрального и трикуспидального клапанов. В проведенных нами ранее исследованиях четкое изображение четырехкамерного среза сердца
14 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.16. Беременность 12 нед 6 дней. Четырехкамерный срез сердпа плода.
Рис. 1.17. Беременность 14 нед. Четырехкамерный срез сердца плода.
плода было получено в 11 нед в 45 % наблюдений, в 12 нед — в 63%, в 13 нед — в 95%, в 14нед —в 100% (рис. 1.16, 1.17) [18].
Визуализация главных артерий сердца плода при трансвагинальной эхокардиографии ввиду их малых размеров представляет некоторые трудности в отличие от четырехкамерного среза, но также возможна у большинства плодов после 13 нед беременности (табл. 1.4).
По данным U. Gembruch и соавт. [25], визуализация главных артерий с помощью трансвагинальной эхографии возможна в 100% наблюдений, так же как и четырехкамерного среза, начиная с 13 нед беременности. В 11 нед аорта и легочный ствол четко идентифицировались в 67% случаев, а в 12 нед — в 80% наблюдений. Схожие результаты были получены R. Achiron и соавт. [30], которым удалось визуализировать с помощью трансвагинальной эхографии аорту и легочный ствол у 90% плодов в 13—15 нед беременности. В то же время L. Dolkart и F. Reimers [22], не смогли визуализировать магистральные сосуды в 13 нед беременности более чем у 30% плодов. Лучшие результаты, полученные U. Gembruch и соавт. [25], по-ви-димому, преимущественно обусловлены использованием трансвагинального цветового допплеровского картирования. Применение нами трансвагинальной эхокардиографии в начале 90-х годов по
зволило точно идентифицировать аорту и легочный ствол более чем в 90% наблюдений начиная с 13 нед беременности [18]. Использование с конца 90-х годов аппаратов с высокой разрешающей способностью дает возможность практически во всех случаях визуализировать главные артерии с 12 нед беременности.
Сравнительный анализ данных, полученных с помощью трансвагинальной и трансабдоминальной эхографии при изучении отдельных частей тела и органов эмбриона/плода в 9—13 нед, показал, что трансвагинальная эхография имеет существенные преимущества перед трансабдоминальным доступом. В исследованиях R. Achiron и О. Tadmor [31] было установлено, что в 9—11 нед с помощью трансвагинальной эхографии удается четко визу-ализировать большинство органов эмбриона/плода в 70% наблюдений, тогда как при трансабдоминальном доступе — только в 50%, а в 12—13 нед — соответственно в 95 и 65% наблюдений. В наших исследованиях было показано, что с помощью трансвагинальной эхографии идентификация органов плода возможна в среднем на 3—4 нед раньше, чем при использовании трансабдоминального сканирования [32].
Высокая разрешающая способность трансвагинальной эхографии в изучении частей тела и органов плода обусловлена
15
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ ММ
1
глава
Таблица 1.5. Нормативные значения эхокардиографических показателей плода (в мм) с учетом индивидуальных колебаний в 13-17 нед беременности [29]
Эхокардиографический показатель Срок беременности, нед
13 14 15 16 17
Конечный диастолический 1,9 2,4 3,0 3,6 4,3
размер левого желудочка 0,8-3,0 1,1-3,7 1,5-4,5 2,0-5,2 2,6-6,0
Конечный диастолический 2,0 2,5 3,1 3,7 4,4
размер правого желудочка 0,9-3,1 1,2-3,8 1,6-4,6 2,2-5,3 2,7-6,1
Внутренний диаметр аорты 1,4 1,6 2,0 2,2 2,4
0,9-1,9 1,2-2,0 1,5-2,5 1,7-2,7 1,9-2,9
Внутренний диаметр 1,6 1,9 2,2 2,4 2,7
легочной артерии 1,1-2,1 1,4-2,4 1,7-2.7 1,8-3,0 2,1-3,3
тем, что с учетом близкого подхода к плоду для нее используются датчики высокой частоты (5—7,5 МГц). С начала II триместра беременности разрешающая способность трансвагинальной эхокардиографиив оценке структур сердца плода постепенно снижается в связи с увеличением расстояния между датчиком и изучаемым объектом. По данным R. D’Amelioисоавт. [33], I. Shapiro и соавт. [34], до 18 нед беременности трансвагинальный доступ имеет некоторые преимущества перед трансабдоминальной эхографией, тогда как начиная с 18 нед с помощью трансабдоминальной эхокардиографии достигаются лучшие результаты. Поэтому трансвагинальную эхокардиографию для изучения сердца плода следует использовать до 18 нед беременности.
Желудочки и главные артерии сердца плода в 13—17 нед беременности имеют почти одинаковые размеры, которые увеличиваются прямо пропорционально сроку беременности (табл. 1.5). Только в отдельных наблюдениях отмечается незначительное превалирование размеров правого желудочка и легочной артерии.
Полученные нами данные о размерах желудочков сердца плода в ранние сроки беременности практически не отличаются от результатов I. Shapiro и соавт. [34], М. Bronshtein и соавт. [35], которые также установили отсутствие достоверных различий в размерах правого и левого желудочков до 17 нед беременности.
При анализе диаметров главных артерий выявлено следующее. Если полученные нами нормативные значения диаметра легочной артерии практически не отличаются от результатов других исследований [36, 37], то нормативные значения диаметра аорты оказались несколько меньшими по сравнению с данными I. Shapiro и соавт. [34], но незначительно превышали результаты R. Achiron и соавт. [36], т. е. заняли «золотую середину».
Наряду с оценкой размеров желудочков сердца и диаметров главных артерий плода важное значение имеет анализ показателей кровотока через атриовентрикулярные клапаны и клапаны главных артерий, оказывая дополнительную помощь в ранней диагностике врожденных пороков сердца. С помощью трансвагинального доступа и цветового допплеровского картирования изучать особенности внутрисердечного кровотока у плода удается после 11 — 12 нед. До этого срока оценка кровотока через атриовентрикулярные клапаны и клапаны главных артерий значительно затруднена. По данным М. Leiva и соавт. [37], в 7 нед беременности детектировать работу полулунных клапанов удается только в 10% наблюдений, а атриовентрикулярных клапанов — в 3%. В то же время в 12 нед беременности допплерэхокардиографи-ческое исследование возможно более чем у 90% плодов. В исследовании G. Rizzo и
16 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.18. Беременность 12 нед 3 дня. Четырехкамерный срез сердца плода. В режиме цветового допплеровского картирования отчетливо видно движение крови (красный цвет) из предсердий в желудочки.
Рис. 1.19. Беременность 12 нед 3 дня. Кривые скоростей кровотока через митральный клапан характеризуются двухфазностью. Отмечается выраженное превалирование второго пика.
Ш1ШШ111
. 10
Рис. 1.20. Беременность 12 нед 3 дня. Кривые скоростей кровотока через аортальный клапан. Отмечается однофазный систолический пик с относительно коротким временем акцелерации.
соавт. [38] получение качественных записей кривых скоростей кровотока через митральный и трикуспидальный клапаны в 11 — 13 нед оказалось возможным в 76,2% случаев, а через аортальный и легочный — в 66,6 и 61,9% соответственно.
В наших исследованиях регистрация кривых скоростей кровотока через атриовентрикулярные клапаны в 12—14 нед неосложненной беременности была успешной в 94,4% случаев (рис. 1.18,1.19),ачерез аортальный и легочный клапаны — в 91,2 и 89,6% соответственно (рис. 1.20).
Допплеровская оценка сердца и главных артерий плода в ранние сроки проводится так же, как во второй половине беременности. Регистрируемые кривые скоростей кровотока через атриовентрикулярные клапаны с 10 нед беременности характеризуются двухфазностью. Первый пик (Е) — ранний диастолический — отражает пассивное наполнение желудочков, второй пик (А) — поздний диастолический — соответствует активному сокращению предсердий и завершает фазу наполнения желудочков.
В ранние сроки беременности отмечается четкое различие между фазами пассивного диастолического наполнения и предсердного сокращения. По данным Ю.М. Владимирова и соавт. [39], соотношение волн Е/А в конце I— начале II триместра составляет приблизительно 0,5, тогда как в конце беременности — 0,8—0,9. Превалирование волны А на атриовентрикулярном уровне отражает функциональные особенности желудочков сердца плода в ранние сроки беременности. Постепенное возрастание волны Е с прогрессированием беременности может быть объяснено увеличением податливости желудочков и/или возрастанием фазы желудочковой релаксации. Аналогичная закономерность была установлена G. Rizzo и соавт. [38] при сравнении резуль-
НАЧАЛО ГЛАВЫ
-------------------- 17
ОГЛАВЛЕНИЕ
1
глава
татов, полученных в 11—13 и в 20 нед беременности. После 12 нед показатели кровотока через трикуспидальный клапан выше, чем через митральный [39].
Кривые скоростей кровотока в аорте и легочной артерии в ранние сроки беременности аналогичны таковым второй половины и характеризуются нали
чием однофазного систолического пика с относительно коротким временем ак-целерации по отношению к времени изгнания. По данным A. Sharkey и соавт. |40], скорости кровотока в восходящей аорте и легочной артерии достоверно не различаются в 13 нед, составляя в среднем 30,2 ±5,4 см/с.
ЖЕЛУДОК И КИШЕЧНИК
Желудок начинает определяться в брюшной полости эмбриона уже с 8-9 нед беременности, но его отчетливая визуализация достигается в большинстве случаев с 10 нед беременности. Он обнаруживается в виде образования округлой формы с анэхогенным содержимым, расположенного в верхнелевых отделах брюшной полости (рис. 1.21, 1.22).
Хотя по данным многих исследователей, в подавляющем большинстве случаев визуализация желудка при трансвагинальной эхографии достигается к 12 нед беременности [28, 41, 42], в наших исследованиях его удалось идентифицировать у 31 % плодов в 9 нед, у 76% в 10 нед и практически во всех случаях к 11 нед беременности (рис. 1.23) [11].
Согласно результатам исследований, проведенных S. Rottem [42], если в 10—11
нед беременности желудок четко идентифицировался приблизительно у 75% нормально развивающихся плодов, то в 11—12 нед — практически у всех плодов. По данным А. SuyncoaBT. [28], в 12—13 нед неосложненной беременности визуализация желудка плода удается в 97% случаев.
В наших исследованиях визуализация желудка эмбриона при трансвагинальной эхографии была достигнута ранее 8,5 нед беременности, хотя известно, что в эти сроки эмбрион еще не заглатывает амниотическую жидкость. По-видимому, жидкостное содержимое желудка в эти сроки беременности обусловлено продукцией эпителия кишечника. Поэтому выраженное скопление жидкости в желудке в ранние сроки беременности может указывать на возможные аномалии развития кишечного тракта,
Рис. 1.21. Поперечное сечение брюшной полости плода в 12 нед 1 день (а) и в 13 нед 3 дня (б). Стрелкой показан желудок.
18 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.22. Беременность 12 нед 6 дней. Поперечное (а) и продольное (б) сканирование туловища плода. Стрелкой показан желудок.
Рис. 1.23. Беременность И нед (копчико-теменной размер плода 53 мм). Коронарное сечение туловища плода. 1 — пищевод; 2 — желудок [11].
такие как атрезия кишечника или пищевода. G. Tsukerman и соавт. [43] приводят описание случая пренатальной диагностики атрезии пищевода и двенадцатиперстной кишки у плода в 12 нед беременности. В ходе ультразвукового исследования плода была обнаружена
выраженная дилатация желудка и двенадцатиперстной кишки. В нашем схожем клиническом наблюдении выраженная дилатация желудка и кишки была выявлена в 10 нед 6 дней [7]. После исчезновения физиологической кишечной грыжи отмечено спонтанное исчезновение дилатации кишки, желудок стал пустым и сохранялся таким на протяжении всей беременности. Высказанное подозрение на атрезию пищевода подтвердилось после рождения ребенка.
Для оценки размеров желудка в ранние сроки беременности обычно используется его поперечное сечение. В ходе проведен-ныхисследованийустановлено, что диаметр желудка в 9 нед беременности в среднем составил 1,2 мм (0,5—2,1 мм), в 10 нед — 1,5 мм (0,8—2,6 мм), в 11 нед — 1,9 мм (1,0—3,1мм), в 12нед — 2,4мм (1,4—3,7 мм) [11].
Физиологическая кишечная грыжа является нормальным вариантом развития кишечника. Она была описана многими исследователями, специализирующимися в области ранней ультразвуковой пренатальной диагностики. Так, I. Timor-Tritschи соавт. [44] установили, что наиболее ранний срок обнаружения физиологической кишечной грыжи составляет 8 нед. Согласно данным авторов, факт наличия грыжи устанавливается в случаях, когда диаметр пуповины в месте впадения ее в брюшную полость превышает диаметр периферического отдела пуповины в 1,5 раза и более.
19
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
1
глава
Рис. 1.24. Беременность 8 нед (копчико-теменной размер эмбриона 21 мм). Стрелками показана физиологическая кишечная грыжа.
Рис. 1.25. Беременность 9 нед (копчико-теменной размер эмбриона 27 мм). Стрелками показан кишечник в составе физиологической кишечной грыжи [Н].
Рис. 1.26. Беременность 10 нед. 1 — физиологическая кишечная грыжа; 2 место прикрепления пуповины к плаценте [П].
Рис. 1.27. Беременность 10 нед 3 дня. 1 - физиологическая кишечная грыжа; 2 — пуповина.
D. Сугисоавт. |45] при обследовании 10 эмбрионов в сроки от 7 до 10 нед беременности обнаружили физиологическую кишечную грыжу во всех случаях. При этом диаметр грыжи составил в среднем 6,3 мм (5—10 мм). В исследованиях W. Schmidt и соавт. |46] средний диаметр грыжи был наибольшим (6—9 мм) в 8 нед с последующим уменьшением до 5—6 мм в 9 нед.
Проведенные нами исследования показали, что изображение физиологической кишечной грыжи при трансвагинальном ультразвуковом исследовании удается получить уже с 7—8 нед беременности [11]. В этот срок грыжа определяется в виде тон
кой эхогенной зоны в месте прикрепления пуповины к передней брюшной стенке. С увеличением срока беременности эхогенность грыжи возрастает с одновременным увеличением ее размеров (рис. 1.24, 1.25), которые имеют наибольшие значения в 10 нед (рис. 1.26, 1.27) (табл. 1.6).
Возвращение петель кишечника в брюшную полость происходит обычно к 11 нед 5 дням [47, 48]. Начиная с 12 нед беременности кишечник определяется в брюшной полости плода в виде образования более высокой эхогенности в сравнении с другими абдоминальными органами (рис. 1.28, 1.29).
20
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.28. Беременность 13 нед 2 дня. Стрелкой показан кишечник плода, который располагается в его брюшной полости.
Рис. 1.29. Беременность 12 нед 6 дней. Стрелкой показан кишечник плода, который располагается в его брюшной полости.
Таблица 1.6. Средние значения и индивидуальные колебания длины физиологической кишечной грыжи и диаметра периферического отдела пуповины [11]
Срок беременности, нед Длина физиологической кишечной грыжи, мм Диаметр периферического отдела пуповины, мм
7 1,9 (0,2-3,6) 1,8 (1,0-2,7)
8 2,4 (0,7-4,1) 2,1 (1,3-3,0)
9 3,3(1,6-5,0) 2,4(1,6-3,3)
10 4,0 (2,3-5,7) 2,7 (1,9-3,6)
11 3,9 (2,2-5,6) 3,0 (2,2-3,9)
12 0 3,3 (2,5-4,2)
ПОЧКИ И МОЧЕВОЙ ПУЗЫРЬ
Согласно данным многих исследователей, визуализация почек плода с помощью трансвагинальной эхографии удается в большинстве случаев с 12—13 нед беременности (табл. 1.7).
Почкам плода в 10—11 нед беременности присуща достаточно высокая эхогенность. По мере прогрессирования беременности их эхогенность постепенно снижается (рис. 1.30). Используя ультразвуковые аппараты с высокой разрешающей способностью, с 11—12 нед беременности удается дифференцировать даже надпочечники как образования более низкой эхогенности в сравнении с почками плода.
Размеры почек плода прогрессивно увеличиваются на протяжении 11—16 нед неосложненной беременности. Согласно данным Р. Rosati и L. Guariglia [491, длина
почек в среднем увеличивается от 4,45 мм в 11 нед до 12,7 мм в 16 нед, переднезадний размер — от 3,57 до 9,8 мм, поперечный размер — от 3,5 до 10 мм, окружность — от 14,45 до 35,55 мм (табл. 1.8).
При использовании трансвагинальной эхографии визуализация мочевого пузыря плода обычно возможна после 10 нед беременности, но в большинстве случаев удается с 11—12 нед (табл. 1.9). Он визуализируется в виде анэхогенного образования округлой формы (рис. 1.31, 1.32). Поданным!. Braithwaite и соавт. [41], как при трансвагинальной, так и при трансабдоминальной эхографии мочевой пузырь можно визуализировать в 12— 13 нед беременности у 98% плодов. В наших исследованиях оценка мочевого пузыря в ходе ультразвукового исследования ока-
НАЧАЛО ГЛАВЫ
------------------- 21
ОГЛАВЛЕНИЕ
1
глава
Таблица 1.7. Возможности получения изображения почек плода в ранние сроки беременности при использовании трансвагинальной эхографии
Авторы Срок беременности, нед
11 12 13 14 15 16
S. Rottem, 1992 [42] 75% 100% 100%
J. Braithwaite и соавт., 1996 [41] 99%
Р. Rosati, L. Guariglia, 1996 [49] 79% 86% 92% 93% 97% 100%
A. Suy и соавт., 2000 [28] 75%
Собственные данные 78% 94% 97% 99% 100% 100%
Таблица 1.8. Нормативные значения размеров почек плода (в мм) в 11-16 нед беременности [49]
Показатель Срок беременности, нед
11 12 13 14 15 16
Длина 4,45 6,32 8,45 9,90 11,62 12,70
3,16-5,80 5,25-8,41 6,63-10,55 7,95-12,48 9,60-13,87 10,07-14,29
Переднезадний 3,57 4,90 6,20 7,45 8,52 9,80
размер 3,00-5,25 3,81-6,27 4,90-7,80 5,80-9,10 7,20-9,67 8,37-11,09
Поперечный 3,50 5,00 6,15 7,40 8,37 10,00
размер 2,45-5,45 3,41-6,19 5,10-7,35 5,90-9,10 6,83-9,81 7,84-11,95
Окружность 14,45 19,15 23,15 26,60 30,72 35,55
11,62-18,60 15,57-22,16 19,58-27,09 22,65-30,71 26,94-34,70 30,43-40,28
Рис. 1.30. Беременность 14 нед. Продольное сканирование туловища плода. Стрелками показаны почки.
залась возможной у большинства плодов с 12 нед беременности. Согласно результатам исследований, проведенных N. Sebire и соавт. [50], мочевой пузырь ви-
зуализируетсяувсехплодов,укоторыхкоп-чико-теменной размер превышает 67 мм.
Наряду с обязательной визуализацией мочевого пузыря необходимо для исключения случаев мегацистика проводить оценку его размеров, которые имеют важное прогностическое значение. N. Sebire и соавт. [50] при обследовании 300 нормальных плодов в 10—14 нед беременности было установлено, что продольный размер мочевого пузыря не превышал 6 мм. Этими исследователями был впервые предложен критерий мегацистика у плода в ранние сроки беременности, который в настоящее время получил широкое распространение в центрах пренатальной диагностики. Согласно предложенному критерию, мегацисти-ком в 10—14 нед беременности является увеличение продольного размера мочевого пузыря плода до 8 мм и более.
22 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.31. Беременность 12 нед 6 дней. Стрелкой показан мочевой пузырь плода.
Рис. 1.32. Беременность 13 нед. Стрелкой показан мочевой пузырь плода.
Таблица 1.9. Возможности получения изображения мочевого пузыря плода в ранние сроки беременности при использовании трансвагинальной эхографии
Авторы Срок беременности, нед
11 12 13 14 15 16
S. Rottem, 1992 [42] 75% 100% 100%
J. Braithwaite и соавт., 1996 [41] 98%
Р. Rosati, L. Guariglia, 1996 [49] 77% 87% 91% 92% 96% 100%
A. Suy и соавт., 2000 [28] 83%
Собственные данные 74% 92% 98% 100% 100% 100%
КОНЕЧНОСТИ
Конечности начинают идентифицироваться при ультразвуковом исследовании эмбриона с 8 нед беременности [51]. Кости же конечностей визуализируются после появления в них точек окостенения: бедренные и плечевые кости — с 9 нед, кости голени и предплечья — с 10 нед, кисти и стопы — с 11 нед беременности [52—54]. Согласно данным A. Zorzoli и соавт. [55], обследовавших 296 плодов в сроки от 9 до 16 нед беременности, измерение длины бедренной кости плода возможно в 90,9% наблюдений, плечевой — в 73,6%, лучевой и локтевой — в 59,5%, малой и большой берцовых — в 60,5%, длины стопы — в 51,7% случаев. В наших исследованиях и исследованиях, проведенных A. Suy и соавт. [28], визуализация всех длинных трубчатых костей конечностей плода в 12—14
нед беременности была достигнута в 94— 96% наблюдений (рис. 1.33, 1.34).
Начиная с 11 нед беременности можно оценить и число пальцев (рис. 1.35, 1.36), что необходимо для пренатальной диагностики различных синдромов, в частности синдрома Меккеля—Грубера. В 11—14 нед изучение пальцев кистей несколько проще при синдроме Меккеля—Г рубера ввиду того, что количество амниотической жидкости значительно уменьшается при этом синдроме во II триместре беременности. Кроме этого, пальцы плода легче оценить в ранние сроки, так как обычно они не собраны в кулак, что часто отмечается при ультразвуковом исследовании плода во II триместре беременности [56].
Измерение длинных трубчатых костей конечностей плода в ранние сроки
НАЧАЛО ГЛАВЫ
------------------- 23
ОГЛАВЛЕНИЕ
1
глава
Рис. 1.33. Беременность 10 нед 3 дня. Стрелками показаны руки плода.
Рис. 1.35. Беременность 12 нед 6 дней. Стрелкой показана кисть плода.
Рис. 1.34. Беременность 12 (а) и 13 (б) нед. Отчетливо видны ноги плода.
Рис. 1.36. Беременность 13 нед. Стрелкой показана
кисть плода.
беременности характеризуется высокой воспроизводимостью. Так, в исследованиях A. Zorzoli и соавт. 155] коэффициент вариабельности в среднем составил 5,1% (3,1—7,0%) у первого специалиста и 4,4% (3,4—5,5%) — у второго. Расхождение в измерениях, проведенных двумя специалистами у одного плода, составило в среднем 4,9% (1,2—8,4%).
Размеры длинных трубчатых костей конечностей плода приблизительно одинаковы в 11—14 нед и в среднем составляют 6 мм в 11 нед, 8 мм в 12 нед, 10 мм в 13 нед и 13 мм в 14 нед беременности [55].
24
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
ЭКСТРАЭМБРИОНАЛЬНЫЕ СТРУКТУРЫ
При ультразвуковом исследовании в ранние сроки беременности необходимо также уделять внимание оценке экстраэм-бриональных структур. Начиная с 6 нед беременности визуализируется желточный мешок, который осуществляет важнейшие функции по обеспечению нормального развития эмбриона.
Эхографически желточный мешок представляет собой округлое тонкостенное анэхогенное образование, расположенное в хориальной полости (рис. 1.37). Обычно его диаметр составляет 4—5 мм. При использовании высокоразрешающей трансвагинальной эхографии возможна визуализация желточного протока (рис. 1.38). К концу J триместра беременности наблюдается обратное развитие желточного мешка. При этом стенки его спадаются, утолщаются, и в конечном итоге он превращается в небольшой высокоэхогенный пристеночный компонент. После 12 нед беременности желточный мешок, как правило, не визуализируется [51]. Проведенные разными авторами исследования свидетельствуют о вариабельности значений диаметра желточного мешка в зависимости от использованных методических подходов и технических характеристик ультразвуковых аппаратов (табл. 1.10).
H.-G. Blaas [7] при динамическом эхографическом наблюдении за 29 эмбрионами и плодами в сроки от 7 до 13 нед беременности с интервалом исследований 7 дней (всего 142 исследования) обнаружили, чток Юнедпроисходитнекотороеувеличение диаметра желточного мешка. В интервале от 10 до 11 нед беременности форма желточного мешка несколько изменялась и его стенки становились тоньше.
В некоторых случаях наблюдается задержка редукции желточного мешка. Следует отметить, что при отсутствии эхографического изображения желточного мешка нередко беременность заканчивается самопроизвольным выкидышем в I триместре. Однако у этого критерия есть определенные ограничения: иногда при нормальном течении беременности желточный мешок не визуализируется; кроме того, его изображение может появляться позднее. В дополнение к этому возможна персистенция желточного мешка даже после гибели эмбриона, что было отмечено в 16% случаев [60] (рис. 1.39). При неразвивающейся беременности за желточный мешок может быть ошибочно принята киста пуповины, имеющая схожее эхографическое изображение. Дифференцировать их можно путем установления связи с пуповиной.
Рис. 1.37. Беременность 11 нед 5 дней. Стрелкой показан желточный мешок.
Рис. 1.38. Беременность 8—9 нед. Стрелкой показан проток желточного мешка.
НАЧАЛО ГЛАВЫ
------------------- 25
ОГЛАВЛЕНИЕ
1
глава
Таблица 1.10. Средний диаметр желточного мешка (в мм) по данным разных исследователей (дополненные данные [7])
A. Rempen, 1991 [57] D. Lindsay и соавт., 1992 [58] С. Stampone и соавт., 1996 [59] Г. Аллахбадиа и соавт., 1997 [60] H.-G. Blaas, 1999 [7]
Трансвагиналь- 5 МГц 6,5-7,5 МГц 6,5 МГц 5 МГц 7,5 МГц
ный транс дьюсер
Методика Наружный Внутренний Внутренний Внутренний Между срединными
измерения диаметр диаметр диаметр диаметр участками стенки
Метод Среднеариф- Среднеариф- Среднеариф- Среднеариф- Среднеариф-
измерения метическое из метическое из метическое из метическое из метическое из
трех измерений трех измерений двух измерений двух измерений трех измерений
7 нед 5,0 2,9 4,1 4,0 4,2
8 нед 5,5 3,1 4,5 4,0 4,3
9 нед 5,7 3,4 4,8 5,0 4,8
10 нед 5,8 3,8 4,9 5,2 5,3
11 нед 5,7 - 4,9 5,0 5,3
12 нед 5,3 - 4,7 - 4,3
Преждевременное исчезновение желточного мешка также является неблагоприятным прогностическим признаком и часто отмечается при самопроизвольных выкидышах в I триместре беременности. Некоторые исследователи обнаружили связь между размерами желточного мешка и исходом беременности [61 ]. Так, при диаметре желточного мешка менее 2 мм и более 5,6 мм в 5— 10 нед достаточно часто наблюдается самопроизвольный выкидыш или нераз-вивающаяся беременность.
Рис. 1.39. Неразвивающаяся беременность. Стрелкой показан персистирующий желточный мешок.
В работе Е. Lyons [62] в 6 из 15 случаев больших размеров желточного мешка установлена анэмбриония. Из остальных 9 наблюдений больших размеров желточного мешка при живом эмбрионе в 8 произошел самопроизвольныйвыкидыш в ранние сроки беременности и у одного плода была диагностирована трисомия 21 в 24 нед. J. Green и J. Hobbins [63] сообщили о группе пациенток с неблагоприятным исходом беременности, у которых при исследовании в сроки от 8 до 12 нед желточный мешок имел внутренний диаметр менее 2 мм.
Аномальная форма желточного мешка тоже относится к неблагоприятным прогностическим признакам. Однако преходящие изменения формы желточного мешка могут сопутствовать нормальному исход у беременности. Поэтому при любых отклонениях в развитии желточного мешка, выявленных при ультразвуковом исследовании, показано динамическое эхографическое наблюдение. В табл. 1.11 суммированы ультразвуковые диагностические критерии оценки желточного мешка.
В последние годы были проведены исследования гемодинамики в сосудах желточного мешка. Визуализация кровотока в них с помощью трансвагинального цветово-
26 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Таблица 1.11. Эхографические критерии оценки желточного мешка
Показатель Желточный мешок
нормальный аномальный
Форма Округлая Овоидная, неправильная
Внутренний диаметр 4-6 мм < 2 мм в 8-12 нед > 6 мм после 10 нед
Эхогенность Гипоэхогенный центр, гиперэхогенный контур Г иперэхогенный
Таблица 1.12. Показатели артериального кровотока в сосудах желточного мешка в ранние сроки беременности
Срок беременности, нед A. Kurjakи соавт., 1994 [64] Р. Joupilla, 1998 [65] процент ви- пульсационный процент ви- пульсационный зуализации индекс зуализации индекс
6 7 8 9 10 33,3 3,42 85,7 3,14 75 0,96 85,7 3,10 50 0,83 78,3 3,12 61,1 3,45 0
го допплеровского картирования не представляет трудностей. Однако следует заметить, что для этого должны использоваться ультразвуковые аппараты с высокими тех-ническимихарактеристиками. Полученные двумя группами исследователей — из Хорватии [64] и Финляндии [65] результаты изучения кровотока в желточном мешке существенно различаются (табл. 1.12).
В исследованиях A. Kurjak и соавт. 164] было отмечено отсутствие диастолического компонента артериального кровотока в желточном мешке во всех наблюдениях в сроки от 6 до 10 нед неосложненной беременности, максимальная скорость систолического кровотока составила в среднем 5,8 ± 1,7 см/с. В то же время при изучении кровотока в желточном мешке в случаях, завершившихся самопроизвольным выкидышем, авторами отмечены три варианта нарушений: нерегулярный характер кровотока, преходящий диастолический компонент и венозный тип кровотока.
В отличие от результатов, полученных А. Kurjak и соавт. [64], исследования, прове
денные Р. Joupilla [65], продемонстрировали непрерывный поступательный характер кровотока на протяжении всего сердечного цикла без нулевых значений диастолического компонента при неосложненном течении беременностив ранние сроки. При этом были получены существенно более низкие значения пульсационного индекса артериального кровотока. Значения максимальной систолической скоростикровото-ка также были существенно ниже (0,9—1,1 см/с) полученных A. Kurjak и соавт. [64]. Кроме этого, Р. Joupilla [65] установил в желточном мешке наряду с артериальным присутствие венозного кровотока, который был зарегистрирован в 5 нед беременностив 43,7% случаев, в 7 нед — в 25%, в 8 нед — в 37,5%. Максимальная скорость венозного кровотока в желточном мешке варьировала от 0,5 до 1,1 см/с. Не было отмечено существенных изменений этого показателя в зависимости от срока беременности. В 10 нед автор не зарегистрировал венозный кровоток в желточном мешке ни в одном из наблюдений.
НАЧАЛО ГЛАВЫ
------------------- 27
ОГЛАВЛЕНИЕ
глава
Существенные различия в этих двух сериях исследований Р. Joupilla [65] объясняет высокой чувствительностью использованного им ультразвукового аппарата, применение которого позволило регистрировать медленные потоки крови в стенке желточного мешка, в частности конечную диастолическую скорость. Однако по нашему мнению, для окончательного ответа на вопрос об особенностях кровотока в желточном мешке и прогностической ценности этого исследования необходимы дополнительные мультицентровые исследования.
При проведении трансвагинального ультразвукового исследования возможна визуализация амниотической оболочки в виде тонкой, нежной мантии вокруг эмбриона. Эмбрион, находящийся в полости плодного яйца, заключен как бы в дополнительную полость. Таким образом, при трансвагинальном сканировании в I триместре беременности визуализируютсядве полости — амниотическая и хориальная. Далее по мере увеличения срока беременности амниотическая полость увеличивается, а хориальная соответственно уменьшается. Этот процесс приводит ктому, что к кощу I триместра беременности амниотическая и хориальная оболочки сливаются. Следует отметить, что желточный мешок находится в хориальной полости, а эмбрион — в амниотической. Процесс слияния оболочек происходит одновременно с процессом обратного развития желточного мешка. Гипоплазия амниотической полости приводит к неразвиваю-щейся беременности (рис. 1.40). В этих случаях диаметр амниотической полости обычно не превышает 10—15 мм, а внутри полости может визуализироваться погибший эмбрион или структуры эмбриона вообще не определяются.
С помощью трансвагинальной эхографии стало возможно не только идентифицировать экстраэмбриональные образования, но и выявлять различия в эхо-структуре амниотической (целомической) и хориальной (экзоцеломической)
полостей. И.И. Рябовым и Л.Т. Николаевым [66] при использовании высокоразрешающей трансвагинальной эхографии (6,5 МГц) было отмечено, что хориальная полость отличается от амниотической неоднородностью внутренней эхоструктуры, т.е. содержит «нежную» мелкодисперсную «взвесь» (рис. 1.41).
О.Б. Панина и соавт. [67] указанную «взвесь» обнаружили лишь в 1% наблюдений. А.М. Стыгар [68] расценивает ее как ультразвуковой маркер воспаления хориальной полости и оболочки (хорионит), столь же редко выявляемый при исследовании. Однако И. И. Рябов и Л.Т. Николаев [66] не могут согласиться с этим, так как в их исследованиях «взвесь» визуализировалась в 100% случаев. Можно также предположить, оценивая снимки, представляемые в качестве иллюстраций в других работах, что они получены с помощью датчиков, возможно, с частотой менее 6,5 МГц, поэтому обе полости выглядят одинаково анэхогенными. К тому же на схемах строения плодного яйца, приводимых в литературе, прослеживается отличие внутренних структур амниотической, хориальной полостей и желточного мешка [69,70]. Упоминается, что желточный мешок содержит серозную, а полость амниона — прозрачную жидкость [70, 71]. Сам же экзоцелом является дериватом экстра-эмбриональной мезодермы [72].
Рис. 1.40. Неразвивающаяся беременность на сроке 10—11 нед. Стрелкой показана гипоплазированная амниотическая полость.
28 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
Рис. 1.41. Различия эхоструктуры полостей амниона и хориона [66].
Рис. 1.42. Беременность 9 нед. Отчетливо видно «сетчатое» строение хориальной полости.
И.И. Рябову и Л.Т. Николаеву [66] в режиме многократного увеличения удалось увидеть несколько иную картину внутренней эхоструктуры экзоцелома: множественные эхопозитивные сигналы различной конфигурации чем-то, напоминающие те, которые часто наблюдаются в лютеиновых кистах. Попытки провести амниоцентез с помотпъю игл Trophacan закончились неудачей: авторам не удалось перфорировать амниотическую оболочку, которая лишь смещалась при движениях иглы. По-видимому, для проведения амниоцентеза больше подошла бы металлическая игла с острым концом. Однако трансцервикальный доступ чреват осложнениями ввиду малой гибкости таких игл, особенно при положении тела матки в hyperante- и retroflexio. Особенности клеточной архитектоники, наличие между клетками аморфного межклеточного вещества в виде студневидной массы [73], возможно, объясняют возникшие определенные трудности и при попытках аспирации содержимого экзоцеломической полости. Суммируя вышеизложенное, можно предположить, что отличие эхоструктуры полостей амниона и хориона связано не с инфицированием, а с различием биохимического и клеточного состава.
В наших последних исследованиях при использовании высокоразрешающей трансвагинальной эхографии также отме
чено подобное строение хориальной полости практически в 100% случаев (рис. 1.42). Но нам представляется более корректным называть это строение не «мелкодисперсной взвесью», а «сетчатым», так как оно обусловлено фибриновыми нитями. Визуализация по-новому экзоцелома связана с использованием более совершенных технических характеристик современной ультразвуковой аппаратуры.
СПИСОК ЛИТЕРАТУРЫ
1. АлтынникН.А., Медведев М.В. Нормативные значения копчико-теменного размера и толщины воротникового пространства плода в ранние сроки беременности //Ультразвук. Диагн. Акуш. Тин. Педиат. 2001. Т. 9. № 1. С. 38-40.
2. Timor-Tritsch I.E., Peisner D.B., Raju S. Sonoembrynology: an organoriented approach using a high-frequency vaginal probe //J. Clin. Ultrasound. 1990. V. 18. P. 286-298.
3. Blaas H.-G., Eik-Nes S.H., Kiserud T., Hellevik L.R. Early development of the hindbrain: a longitudinal ultrasoud study from 7 to 12 weeks of gestation // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 151-160.
4. Blaas H.-G., Eik-Nes S.H. Normal first-trimester ultrasoud findings // The 11 14-week scan. The diagnosis of fetal abnormalties / Eds. Nicolaides K.H., Sebire N.J., Snijders R.J.M. N.Y., L.: The Parthenon Publ. Gr., 1999. P. 115-123.
НАЧАЛО ГЛАВЫ
------------------- 29
ОГЛАВЛЕНИЕ
глава
5. Blaas H.-G., Eik-Nes S.H., Kiserud T., Hellevik L.R. Early development of the forebrain and midbrain: a longitudinal ultrasoud study from 7 to 12 weeks of gestation // Ultrasound Obstet. Gynecol. 1994. V. 4. P. 183-192.
6. Воеводин C.M. Е1ормальная эхографическая анатомия мозговых структур эмбриона и плода в первом триместре беременности / / Ультразвук. Диагн. Акуш. Гин. Педиат. 1993. № 3. С. 51 -60.
7. Blaas EI.-G.K. The embryonic examination. Ultrasound studies on the development of the human embryo. Thesis. Trondheim: TARIP, 1999.
8. Blaas H.-G., Eik-Nes S.H., Berg S„ Torp H. In vivo three-dimensional ultrasound reconstructions of embryos and early fetuses // Lancet. 1998. V. 352. № 9135. P. 1182-1186.
9. Bernaschek G., Deutinger J., Kratochwil A. Endosonography in Obstetrics and Gyne cology. Berlin: Springer Verlag, 1990.
10. Стрижаков A.H., Медведев M.B., Давыдов А.И. Эхографическая трансвагинальная диагностика беременности в I триместре // Акуш. Гинек. 1989. № 9. С. 63 65.
11. Blaas H.-G., Eik-Nes S.H., Kiserud T., Hellevik L.R. Early development of the abdominal wall, stomach and heart from 7 to 12 weeks of gestation: a longitudinal ultrasound study // Ultrasound Obstet. Gynecol. 1995. V. 6. P. 240-249.
12. HertzbergB.S., Mahony B.S., Bowie J.D. First trimester fetal cardiac activity // J. Ultrasound Med. 1988. V. 7. P. 573-575.
13. Merchiers E., Dhont M., De Sutter P. et al. Evaluation of early embryonic cardiac activity by transvaginal sonography // Ultrasound Obstet. Gynecol. 1991. V. 1. Suppl. 1. P. 33.
14. DuBose T.J., Cunyus J.A., Johnson L.F. Embryonic heart rate and age // J. Diagn. Med. Ultrasound. 1990. V. 6. P. 151-157.
15. Robinson H.P., Shaw-DunnJ. Fetal heart rates as determined by sonar in early pregnancy // J. Obstet. Gynaecol. Br. Commonw. 1973. V. 80. P. 805-809.
16. Hickey J., Goldberg F. Ultrasound Review of Obsetries and Gynecology. NY.: Lippincott-Raven Publ., 1996.
17. Timor-Tritsch I.E., Rottem S. Transvaginal
Sonography. Secondedition. NY: Elsevier, 1991.
18. Медведев M.B., Скворцова M.H., Куница И.М. Трансвагинальная эхокардиография // Ультразвук. Диагн. Акуш. Гин. Педиат. 1994. № 3. С. 24-30.
19. Cullen М.Т., Green J., Whetham J. et al. Transvaginal ultrasonographic detection of congenital anomalies in the first trimester //Amer. J. Obstet. Gynecol. 1990. V. 163. P. 466-476.
20. Rottem S., Bronshtein M., Thaler I., Brandes J.M. First trimester transvaginal sonographic diagnosis of fetal anomalies // Lancet. 1990. № 1. p. 444-445.
21. Achiron R., Tadmor O. Screening for fetal anomalies during the first trimester of pregnancy: transvaginal versus transabdominal sonography // Ultrasound Obstet. Gynecol. 1991. V. 1. № 3. P. 186-191.
22. Dolkart L.A., Reimers F.T. Transvaginal fetal echocardiography in earlypregnancy: normative data //Amer. J. Obstet. Gynecol. 1991. V. 165. P. 688-691.
23. Bronshtein M., Siegler E., Eshcoli Z., Zimmer E.Z. Transvaginal ultrasound measurements of the fetal heart at 11 to 17 weeks of gestation // Amer. J. Perinat. 1992. V. 9. P. 38—42.
24. Johnson P., Sharland G., Maxwell D., Allan L. The role of transvaginal sonography in the early detection of congenital heart disease / / Ultrasound Obstet. Gynecol. 1992. V. 2. P. 248-251.
25. Gembruch U.. Knopfle G., Bald R.. Hansmann M. Early diagnosis of fetal congenital heart disease by transvaginal echocardiography // Ultrasound Obstet. Gynecol. 1993. V. 3. P. 310-317.
26. Marton U., Kurjak A. Early diagnosis of fetal congenital heart disease by transvaginal echocardiography // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. P. 106.
27. Smrcek J.M., Shi C., Gembruch U. Fetal heart biometry between 10 and 17 weeks of gestation // Ultrasound Obstet. Gynecol. 1999. V. 14. Suppl. 1. P. 24.
28. Suy A., Borrell A., Cayuela M. et al. First trimesterultrasound assessment of fetal anatomy // 10 International Conference on Prenatal Diagnosis and Therapy. Barcelona. June 19-21, 2000. P. 359.
30
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
НОРМАЛЬНАЯ УЛЬТРАЗВУКОВАЯ АНАТОМИЯ ПЛОДА В РАННИЕ СРОКИ
29. Медведев М.В., Алтынник Н.А., Никитин С.В. Трансвагинальная эхокардиография // Эхокардиография плода / Под ред. Медведева М.В. М.: РАВУЗДПГ, Реальное Время, 2000. С. 131-142.
30. Achiron R., Weissman A., Rotstein Z. et al. Transvaginal echocardiographic examination of the fetal heart between 13 and 15 weeks’ gestation in a low risk population //J. Ultrasound Med. 1994. V. 13. P. 783-789.
31. Achiron R., Tadmor O. Screening for fetal anomalies during the first trimester of pregnancy: transvaginal versus transabdominal sonography // Ultrasound Obstet. Gynecol. 1991. V. 1. № 3. P. 186-191.
32. Стрижаков A.H., Давыдов А.И., Медведев М.В. Трансвагинальная эхография. М., 1990.
33. D’Amelio R., Giorlandino С., Masala Т. et al. Fetal echocardiography using transvaginal and transabdominal probes during the first period of pregnancy: a comparative study // Prenat. Diagn. 1991. V. 11. P. 69-75.
34. Shapiro I., Degani S., Ueibovitz Z. et al. Fetal cardiac measurements derived by transvaginal and transabdominal cross-sectional echocardiography from 14 weeks of gestation to term // Ultrasound Obstet. Gynecol. 1998. V. 12. № 6. P. 404-418.
35. Bronshtein M., Sigler E., Zimmer E.Z. et al. Cardiac anomalies: detection and establishment of nomograms at 12—16 weeks gestation by a high frequency transvaginal probe // Proceedings of the Third World Congress of Vaginosonography in Gynecology. San Antonio, Texas, 1990. P. 6—7.
36. Achiron R., Golan-Porat N., Gabbay U. et al. In utero ultrasonographic measurements of fetal aortic and pulmonary artery diameters during the first half of gestation in a low risk population // Ultrasound Obstet. Gynecol. 1998. V. 11. № 3. P. 180 184.
37. Leiva M.C., Tolosa J.E., Binotto C.N. et al. Fetal cardiac development and hemodynamics in the first trimester // Ultrasound Obstet. Gynecol. 1999. V. 14. № 3. P. 169 174.
38. Rizzo G., Arduini D., Romanini C. Fetal cardiac and extra cardiac circulation in early gestation //J. Matern. Fetal Invest. 1991. V. 1. № 2. P. 73 -78.
39. Владимиров Ю.М., Хьюсман T.B., Стеварт П.А. Допплеровское изучение нормального кровообращения плода в ранние сроки беременности // Ультразвук. Диагн. Акуш. Гин. Педиат. 1993. № 1. С. 8 15.
40. Sharkey A., Tulzer G., Huhta J. Doppler blood velocities in the first trimester of pregnancy // Amer. J. Obstet. Gynecol. 1991. V. 164. P. 331.
41. Braithwaite J.M., Armstrong M.A., Economides D.L. Assessment of fetal anatomy at 12 to 13 weeks of gestation by transabdominal and transvaginal sonography // Brit. J. Obstet. Gynaecol. 1996. V. 103. P. 82-85.
42. Rottem S. Early malformation detected by transvaginal sonography // An Atlas of Ultrasonography in Obstetrics and Gynecology / Ed. Kurjak A. NY, L.: Parthenon Publ. Gr., 1992. P. 27-32.
43. Tsukerman G.L., Krapiva G.A., Kirillova LA. First-trimester diagnosis of duodenal stenosis associated with oesophageal atresia // Prenat. Diagn. 1993. V. 13. P. 371-376.
44. Timor-Tritschl.E., Warren W.B., PeisnerD., Pirrone E. First trimester midgut herniation: a high frequency transvaginal sonographic study // Amer. J. Obstet. Gynecol. 1989. V. 161. P. 466-476.
45. Cyr D.R., Mack L.A., Schoenecker S.A. et al. Bowel migration in the normal fetus: ultrasound detection//Radiology. 1986. V. 161. P. 119—121.
46. Schmidt W., Yarkoni S., Crelin E.S., Hobbins J.C. Sonographic visualization ofthe physiologic anterior wall hernia in the first trimester// Obstet. Gynecol. 1987. V. 69. P. 911 -915.
47. Snijders R.J.M., Brizot M.L., Faria M., Nicolaides K.H. Fetal exomphalos at 11 to 14 weeks of gestation//J. Ultrasound Med. 1995. V. 14. P. 569-574.
48. van Zalen-Sprock R.M., van Vugt J.M.G., van Geijn H.P. First-trimester sonography of phisiological midgut herniation and early diagnosis of omphalocele // Prenat. Diagn. 1997. V. 17. P. 511-518.
49. Rosati P., Guariglia L. Transvaginal sonographic assessment ofthe fetal urinary tract in early pregnancy // Ultrasound Obstet. Gynecol. 1996. V. 7. № 2. P. 95-100.
50. Sebire N.J., Von Kaisenberg C., Rubio C. et al. Fetal megacystis at 10-14 weeks of
НАЧАЛО ГЛАВЫ
------------------- 31
ОГЛАВЛЕНИЕ
1
глава
gestation // Ultrasound Obstet. Gynecol. 1996. V. 8. P. 387-390.
51. Скворцова M.H., Медведев М.В. Ультразвуковое исследование в ранние сроки беременности // Клиническое руководство по ультразвуковой диагностике / Под ред. Митькова В.В., Медведева М.В. II том. М.: Видар. 1996. С. 9-28.
52. Timor-Tritschl.E., FarineD., Rosen М. A close look at early embryonic development with the high-frequency transvaginal transducer // Amer. J. Obstet. Gynecol. 1988. V. 159. P. 676-681.
53. Timor-Tritschl.E., Monteagudo A, PeisnerD. B. High-frequency transvaginal sonographic examination for the potential malformation assessment of the 9-week to 14-week fetuses // J. Clin. Ultrasound. 1992. V. 20. P. 231-238.
54. vanZalen-SprockRM., Brons J.T.J., van Vugt J.M.G. et al. Ultrasonographic and radiologic visualization of the developing embryonic skeleton // Ultrasound Obstet. Gynecol. 1997. V. 9. P. 392-397.
55. Zorzoli A., Kusterman E., Carvelli E. et al. Measurement of fetal limb bones in early pregnancy // Ultrasound Obstet. Gynecol. 1994.V. 4.№1. P. 29-33.
56. Bronshtein M., Stahl S., Zimmer E.Z. Transvaginal sonographic diagnosis of fetal finger abnormalities in early gestation //J. Ultrasound Med. 1995. V. 14. № 8. P. 591—595.
57. Rempen A. Vaginale Sonographie im ersten Trimenon. II. Quantitative Parameter // Z. Geburtshilfe Perinatal. 1991. B. 195. S. 163 171.
58. Lindsay D.J., Lovett I.S., Lyons E.A. et al. Yolk sac diameter and shape at endovaginal US: predictors of pregnancy outcome in the first trimester//Radiology. 1992. V. 183. P. 115-118.
59. Stampone C., Nicotra M., Muttinelli C., Cosmi E.V. Transvaginal sonography of the yolk sac in normal and abnormal pregnancy // J. Clin. Ultrasound. 1996. V. 24. P. 3-9.
60. Аллахбадиа Г., Дизаи С., Дхунгат П., Тив-ревала С. Диаметр и форма желточного мешка при трансвагинальной эхографии: прогностические признаки исхода беременности в I триместре // Ультразвук. Диагн. 1997. № 3. С. 28-33.
61. Hickey J., Goldberg F. Ultrasound Review of
Obstetrics and Gynecology. N.Y.: Lippincott-Raven Publ., 1996.
62. Lyons E.A. Endovaginal sonography of the first trimester of pregnancy. Proceedings of the 3rd International Perinatal and Gynecological Ultrasound Symposium. Ottawa, Ontario, 1994. P. 1 25.
63. Green J.J., Hobbins J.C. Abdominal ulrasound examination of the first trimester fetus // Amer. J. Obstet. Gynecol. 1988. V. 159. P. 165-175.
64. Kurjak A., Kupesic S., Kostovi L.J. Vascularization of yolk sac and vitelline duct in normal pregnancies studied by transvaginal color and pulsed Doppler //J. Perinat. Med. 1994. V. 22. P. 433-440.
65. Joupilla P. Желточный мешок и пупочно-плапентарная гемодинамика в период раннего эмбрионального развития //Программа и материалы V Съезда Российской Ассоциации Ультразвуковой Диагностики в Перинатологии и Гинекологии и I Российского Семинара Международного Общества Ультразвуковой Диагностики в Акушерстве и Гинекологии (ISUOG). Санкт-Петербург, 15 17 июня 1998 г. С. 8 12.
66. Рябов И.И., Николаев Л.Т. Эхоструктура экзоцелома // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 3. С. 186-188.
67. Панина О.Б., Бугеренко Е.Ю., Сичинава Л.Г. Развитие эмбриона (плода) и оболочек плодного яйца в I триместре беременности по данным эхографии // Вестник Российской ассоциации акушеров-гинекологов. 1998. № 2. С. 59-64.
68. Сгыгар AM. Эхографические аспекты физиологии и патологии последа. Оболочки, пуповина, воды //Ультразвук. Диагн. 1996. № 2. С. 58.
69. Антипчук Ю.П. Гистология с основами эмбриологии. М.: Просвещение, 1983. С. 113—114.
70. Бодяжина В.И. Акушерство. Учебник. М.: Мединина, 1986. С. 22—27.
71. Гистология / Под ред. Елисеева В.Г., Афанасьева Ю.И., Юриной Н.А М.: Медицина, 1983. С. 107- 116.
72. Снайдере Р.Дж.М., Николаидес К.Х. Ультразвуковые маркеры хромосомных дефектов плода. М.: Видар, 1997. С. 169.
73. Хэм А, Кормак Д. Гистология. Пер. с англ. М.: Мир, 1983. Т. 2. С. 56-57.
32 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
2
ПРЕНАТАЛЬНАЯ УЛЬТРАЗВУКОВАЯ ДИАГНОСТИКА ВРОЖДЕННЫХ ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ БЕРЕМЕННОСТИ
М.В. Медведев
ЦЕНТРАЛЬНАЯ НЕРВНАЯ СИСТЕМА
Акрания/экзэнцефалия/анэнцефалия
Ультразвуковая пренатальная диагностика анэнцефалии во II и III триместрах беременности основывается на констатации отсутствия костей мозгового черепа и ткани мозга. Частота этого порока составляет в среднем 1 случай на 1000 новорожденных [ 11. В последние годы в связи с совершенствованием и широким распространением пренатальной диагностики отмечается снижение частоты рождения детей с таким пороком.
В ранние сроки беременности ультразвуковая диагностика анэнцефалии потенциально возможна с 11 нед, когда завершается оссификация костей свода черепа (рис. 2.1). До этого срока диагноз должен ставиться с осторожностью, так как кости свода черепа плода в 10—11 нед могут быть кальцифицированы лишь частично [2].
Проведенные динамические ультразвуковые исследования позволили установить, что акрания, экзэнцефалия и анэнцефалия являются фазами одного
порока. Этим объясняется тот факт, что частота экзэцефалии в ранние сроки беременности превалирует над частотой анэнцефалии, а во II и III триместрах беременности картина обратная. Так, R. Goldstein и соавт. [3] приводят описание клинического наблюдения, в котором при обследовании плода в 12 нед беременности не было отмечено дефектов развития головного мозга, а при повторном исследовании в 26 нед была диагностирована анэнцефалия. В другом наблюдении S. Rottem и соавт. [4] обнаружили в 9 нед беременности аномальную форму закладки головного и шейного отделов позвоночника плода, а в 11 нед диагностировали анэнцефалию и открытую форму spina bifida. К. Kennedy и соавт. [5] описывают случай акрании в 10 нед беременности, когда головной мозг имел нормальный объем, но измененные структуру и эхогенность. В 14 нед беременности исследователи обнаружили фрагментацию и дегенерацию головного
33
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.1. Беременность 12 нед. Продольное сканирование плода с анэнцефалией.
мозга, в связи с чем был установлен диагноз экзэнцефалии. М. Bronshtein и А. Огпоу [6] представили наблюдение, в котором отмечена нормальная ультразвуковая анатомия головного мозга развивающегося плода в 9 и 11 нед беременности, но в 12 нед был установлен диагноз акра-нии, а в 14 нед — анэнцефалии.
Пренатальная диагностика экзэнцефалии в ранние сроки беременности достаточно широко представлена какв зарубежной, так и в отечественной литературе. В нашей стране первое описание ультразвуковой диагностики экзэнцефалии в I три-местре беременности принадлежит В.Н. Демидову и соавт. [7]. В последующие годы еще несколько групп отечественных специалистов опубликовали данные об ультразвуковой диагностике экзэнцефалии в 10—14 нед беременности [8—11].
В.Б. ЦхайиА.А. Морозова [8] обнаружили акранию в 14 нед беременности. Порок выражался в полном отсутствии характерного костного контура головы плода, ткань мозга была представлена однородной гомогенной структурой (рис. 2.2). Некоторые колебания мозговой ткани при резких движениях плода также указывали на отсутствие костей свода черепа. Отличительной особенностью этого наблюдения являлся тот факт, что содержание аль-фа-фетопротеина, эстриола и плацентарного лактогена в крови беременной соот-
Рис. 2.2. Беременность 14 нед. Экзэнцефалия. а — аксиальная плоскость сканирования; б — продольное сканирование [8].
ветствовало нормативным показателям. Учитывая неблагоприятный прогноз, беременность прервали в 15 нед.
В наблюдениях, представленных О.В. Проскуряковойи соавт. [9], пренатальный диагноз экзэнцефалии был установлен в 13 и 14нед беременности. В первом наблюдении дополнительно было диагностировано расщепление позвоночника плодавшей-ном отделе. Кроме этого, авторами было отмечено наличие двух полостей — амниотической и хориальной, хотя обычно к 12 нед происходит их слияние.
О случаях наиболее ранней ультразвуковой диагностики акрании из отечественных исследователей сообщили Л.Т. Николаев и И.И. Рябов [10], И.М. Басист и И.В. Романовская [11], которым это удалось сделать с помощью трансвагинальной эхографии в 10—11 нед беременности. Для дифференциальной диагностики экзэнце-
34 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Рис. 2.3. Беременность 10—11 нед. Экзэнцефалия. Трансвагинальное сканирование плода (а). Обращают на себя внимание отсутствие мозгового черепа и наличие аномальной мозговой ткани, окруженной мягкими мозговыми оболочками, б — допплеровское исследование кровотока в мозговом сосуде [11].
Рис. 2.4. Беременность 15—16 нед. Трансвагинальное сканирование. Экзэнцефалия. а продольное сканирование; б — поперечное сканирование (видна аномальная ткань головного мозга); в — поперечное сканирование головы плода в режиме цветового допплеровского картирования; г - допплерограмма кривых скоростей кровотока в мозговом сосуде.
фалии и анэнцефалии И.М. Басист и И.В. Романовская [11] дополнительно провели допплеровское исследование, при котором выявили кровоток в мозговом сосуде
(рис. 2.3), а, как известно, при анэнцефалии отсутствует характерная картина с осу-дистой системы головного мозга [2]. В нашем наблюдении пренатальный диагноз
----------------------------------------------------- 35
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
2
глава
экзэнцефалии был установлен в 15—16 нед беременности. При этом в ходе ультразвукового исследования плода было хорошо видно наличие аномальной ткани головного мозга без костей свода черепа. В режиме цветового допплеровского картирования четко идентифицировались отдельные мозговые сосуды с характерными кривыми скоростей кровотока (рис. 2.4).
При скрининговом ультразвуковом исследовании в ранние сроки беременности акрания/анэнцефалия достаточно точно устанавливается уже при первом осмотре. Так, поданным М. СиИеписоавт. [12], при обследовании 622 пациенток высокого риска в 10—13 нед беременности все три случая акрании/анэнцефалии были точно диагностированы при первом же исследовании. В других двух сериях скрининговых исследований в 10—14 нед беременности, охватывающих 6861 пациентку, все 7 случаев анэнцефалии были диагностированы в конце I триместра [13, 14].
Особый интерес представляют результаты мультицентрового исследования, осуществленного в 7 акушерских клиниках Лондона. Всего в 10—14 нед было обследовано 53 435 пациенток с одноплодной беременностью и 901 — с двойней [15]. В ходе проведенных исследований отмечено 47 случаев анэнцефалии, включая 3 случая, обнаруженные у одного плода из двойни. Пренатальный ультразвуковой диагноз анэнцефалии был установлен при первом исследованиив 10—14 нед у 39 плодов, при повторном скрининговом исследовании во II триместре беременности — у 8. Следует подчеркнуть, что в первой фазе исследования при оценке анатомии 34 830плодовв 10—14 нед правильный диагноз был поставлен только в 23 (74%) из 31 случая анэнцефалии. Для повышения точности ранней диагностики анэнцефалии было проведено специальное дополнительное обучение врачей всех акушерских клиник, что позволило во второй фазе работы при обследовании 20 407 плодов установить правильный диагноз анэнцефалии во всех 16 наблюдениях.
Голопрозэнцефалия
Голопрозэнцефалия встречается в среднем с частотой 1 случай на 10 000 новорожденных и является пороком развития головного мозга, обусловленным неполным разделением эмбрионального переднего мозга в сочетании с неполным развитием срединных структур лица. В зависимости от степени сагиттального не-разделения коры, зрительных бугров и гипоталамуса выделяют алобарную, семилобарную и лобарную формы голопрозэнце-фалии. Алобарный тип является наиболее тяжелым поражением мозга, когда деление коры на два полушария полностью отсутствует.
Пренатальная ультразвуковая диагностика голопрозэнцефалии во II и III триместрах беременности обычно не вызывает затруднений и основывается на обнаружении характерных изменений головного мозга в зависимости от формы порока (табл. 2.1).
В случае алобарной голопрозэнцефалии визуализируется единственный желудочек мозга неправильной формы. Серп мозга и межполушарная борозда отсутствуют, таламус не разделен. Часто выявляется микроцефалия. При наличии вен-трикуломегалии размеры головы могут быть увеличены. При семилобарном типе голопрозэнцефалии в некоторых случаях можно выявить III желудочек и часть задних рогов боковых желудочков мозга. В случае лобарной формы порока зрительные бугры и боковые желудочки почти всегда разделены, за исключением лобных рогов, нередко отмечается умеренное расширение боковых желудочков, а также широкая коммуникация между лобными рогами и III желудочком.
Впервые о ранней ультразвуковой диагностике голопрозэнцефалии сообщили Z. Toth и соавт. [16] в 1986 г. (табл. 2.2). Ими при трансабдоминальном ультразвуковом исследовании была обнаружена флюктуирующая мембранозная структура в месте черепа плода в 11 нед беременности. В 12 нед авторы констатировали нали-
36 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Таблица 2.1. Эхографические критерии голопрозэнцефалии в зависимости от формы порока
Структуры головного мозга Форма голопрозэнцефалии
алобарная семилобарная лобарная
Желудочки Один Один; рудиментарные затылочные рога Почти всегда разделены, за исключением лобных рогов боковых желудочков; умеренное расширение боковых желудочков; широкая коммуникация между лобными рогами и III желудочком
Зрительные бугры Не разделены Не разделены Разделены
Полость прозрачной перегородки Отсутствует Отсутствует Отсутствует
чие акрании и флюктуирующей, баллонной формы мемранозной мозговой ткани, и только в 16 нед был окончательно установлен диагноз голопрозэнцефалии и циклопин, что было подтверждено при патологоанатомическом исследовании абор-туса после прерывания беременности в 18 нед.
Согласно опубликованным данным, уже более 15 случаев голопрозэнцефалии
Таблица 2.2. Пренатальная ультразвуковая диагностика голопрозэнцефалии в ранние сроки беременности
Авторы Срок беременности
Z. Toth и соавт., 1986 [16] 16 нед
D. Nyberg и соавт., 1987 [17] 14 нед
М. Bronshtein, Z. Wiener, 1991 [18] 14 нед
F. Gonzales-Gomes и соавт., 1992 [19] 10 нед
L. Nelson, M. King, 1992 [20] 10 нед 5 дней
E. Sakala, K. Gaio, 1993 [21] 13 нед
R. Achiron, A. Achiron, 1995 [22] 10 нед 4 дня
U. Gembruch и соавт., 1995 [23] 13нед3дня
R. van Zalen-Sprock и соавт., 1995 [24] 12 нед 1 день
О. Parant и соавт., 1997 [25] 14 нед
В. Thilaganathan и соавт., 1997 [26] 11 нед
С. Turner и соавт., 1999 [27] 10 нед
Н. Wong и соавт., 1999 [28] 10 нед 3 дня
Н. Wong и соавт., 1999 [29] 13 нед
10 нед
13 нед
H.-G. Blaas и соавт., 2000 [30] 9 нед 2 дня
T.-H. Lai и соавт., 2000 [31] 16 нед
были диагностированы в конце I — начале II триместра беременности. М. Bronshtein и Z. Wiener [18] впервые для диагностики голопрозэнцефалии в ранние сроки беременности использовали трансвагинальную эхографию. О случае наиболее ранней диагностики голопрозэнцефалии сообщили норвежские исследователи H.-G. Blaas и соавт. [30], которым удалось поставить точный диагноз в 9 нед беременности (рис.
2.5,2.6). Внаблюдении, представленном U. GembruchncoaBT. [23], голопрозэнцефалия сочеталась с синдромом Денди—Уокера.
Большинство исследователей приводят описание пренатальной ультразвуковой диагностики ало-барной формы голопрозэнцефалии в ранние сроки беременности. При этом наиболее отчетливо определяется одинжелудочекголовного мозга больших размеров (рис. 2.7).
В случае обнаружения при эхографическом исследовании плода голопрозэнцефалии большое внимание следует уделять оценке структур лица, поскольку этот порок развития часто сочетается с лицевыми аномалиями (циклопия, пробосцис, расщепление верхней губы и неба), боль-
НАЧАЛО ГЛАВЫ
------------------- 37
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.5. Беременность 9 нед 2 дня. Голопрозэнце-фалия [30].
Рис. 2.7. Беременность 12 нед. Голопрозэнпефалия.
Рис. 2.6. Голопрозэнцефалия. Фенотип абортуса [30].
Рис. 2.8. Голопрозэнпефалия. а — профиль плода (отчетливо видно отсутствие носа); б — поперечное сечение головы плода (видны один желудочек и левосторонняя анофтальмия).
шинство из которых могут быть выявлены уже в ранние сроки беременности (рис. 2.8).
Приведенные в табл. 2.2 клинические наблюдения выполнены преимущественно
в ведущих центрах пренатальной диагностики, поэтому особый интерес представляют результаты скрининговых ультразвуковых исследований в ранние сроки беремен
38
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
ности. Так, L. Hernadi и М. Torocsik [32] при проведении двукратного скринингового обследования 3991 пациентки в 11—14 и 18— 20 нед беременности отметили один случай голопрозэнцефалии, которая не была диагностирована в ранние сроки беременности. В аналогичном исследовании, выполненном в Италии при скрининговом ультразвуковом обследовании 2097 пациенток в 14 и 20—22 нед беременности, также голопрозэнцефалия была пропущена в 14 нед, но диагностирована в 20—22 нед [33]. В другом скрининговом исследовании в 12—14 нед, осуществленном в одной из акушерских клиник Лондона с охватом 1632 беременных, один случай голопрозэнцефалии был точно установлен в конце I триместра [34].
Энцефалоцеле
Этот порок представляет собой дефект костей черепа с выходом мозговых оболочек (цефалоцеле) и ткани мозга (энцефалоцеле). Приблизительно в 75% случаев дефекты располагаются в области затылка, но могут выявляться и в других отделах (лобном, теменном, назофарингеальном). Энцефалоцеле часто сочетается с микроцефалией, гидроцефалией, spina bifida, а также входит в состав синдрома Меккеля—Грубера [35].
В ранние сроки беременности энцефалоцеле нередко приходится дифференцировать с кистозной гигромой шеи. В этих случаях, учитывая схожесть эхографической картины самого образования, точный диагноз энцефалоцеле устанавливают на основаниивизуализацииде-фекта костей черепа. Он может быть очень маленьким, поэтому ультразвуковое исследование плода должно проводиться с особой тщательностью. Используя лицевые и мозговые структуры в качестве ориентиров, можно точно установить место расположения дефекта.
Пренатальный диагноз энцефалоцеле, как правило, невозможен до окончания оссификации костей черепа, т.е. до 10 нед беременности. Однако, по данным R. van Zalen-Sprock и соавт. [36], в некоторых слу
чаях энцефалоцеле сопровождается увеличением ромбэнцефалической полости, что проявляется уже в 9 нед беременности.
О случае наиболее ранней ультразвуковой диагностики энцефалоцеле сообщили И.М. Басист и И.В. Романовская [11]. В 11—12 нед беременности было обнаружено грыжевое образование диаметром 15 мм, неоднородной структуры, исходившее из головы плода. При сагиттальном сканировании визуализировался костный дефект размером до 5 мм в области теменных костей (рис. 2.9). При цветовом допплеровском картировании определялся кровоток в грыжевом образовании, что свидетельствовало о наличии мозговой ткани и помогло поставить окончательный диагноз энцефалоцеле. По желанию пациентки беременность была прервана в конце I триместра.
В наблюдении, описанном М. Bronshtein и Е. Zimmer [37], энцефалоцеле размером 8x9 мм в затылочном отделе черепа впервые было обнаружено в 13 нед беременности. В 14 нед при тех же размерах грыжевого образования в нем четко идентифицировалась ткань мозга. В 15 и 16 нед было отмечено полное исчезновение энцефалоцеле, а также констатирован нормальный уровень альфа-фетопротеина в сыворотке крови беременной. К удивлению исследователей, в 19 нед вновь отмечено появление энцефалоцеле, которое сохранялось до 24 нед, когда пациентка приняла решение прервать беременность. При патологоанатомическом исследовании был подтвержден пренатальный диагноз энцефалоцеле.
Синдром Меккеля—Грубера относится к заболеваниям с аутосомно-рецессивным типом наследования. Наиболее частыми синдромальными признаками являются затылочное энцефалоцеле, поликистоз почек и постаксиальная полидактилия.
A. Pachi и соавт. [38] впервые описали случай пренатальной ультразвуковой диагностики синдрома Меккеля—Грубера в ранние сроки беременности. На основании обнаружения затылочного энцефалоцеле и измененных, увеличенных, почек синдром
НАЧАЛО ГЛАВЫ
------------------- 39
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.9. Беременность 11—12 нед. Сканирование плода в сагиттальной плоскости. Стрелкой показано энцефалоцеле [11].
Меккеля—Грубера был заподозрен в 13 нед беременности. При патологоанатомическом исследовании была дополнительно выявлена полидактилия. В исследованиях W. Sepulveda и соавт. [39] правильный диагноз синдрома Меккеля—Грубера был установлен у 4 из 9 плодов пациенток группы высокого риска в 11—13 нед на основании характерной триады признаков. Аналогичные результаты были получены R. van Zalen-Sprock и соавт. [36] при обследовании 5 пациенток группы высокого риска в 11—14 нед беременности — правильный пренатальный диагноз поставлен во всех 3 случаях.
Синдром Меккеля—Грубера может быть выявлен в ранние сроки беременности не только при целенаправленном обследовании пациенток группы высокого риска по врожденной и наследственной патологии, но и при скрининговом ультразвуковом исследовании в 12—14 нед беременности. Так, D. Economides и J. Braithwaite [34] при скрининговом исследовании, осуществленном в одной из акушерских клиник Лондона с охватом 1632 беременных, диагностировали синдром Меккеля—Грубера в 12—13 нед.
Приведенные данные свидетельствуют, что синдром Меккеля—Грубера потенциально может быть диагностирован в
Рис. 2.10. Эхограммы кистей плода в 15 нед беременности в норме (а) и при полидактилии (б) [40].
ранние сроки беременности. В 11—14 нед диагноз установить гораздо проще ввиду нормального количества амниотической жидкости, объем которой значительно уменьшается при этом синдроме во II триместре беременности. Кроме того, пальцы плода легче оценить в ранние сроки, так как обычно они не собраны в кулак, что часто отмечается при ультразвуковом ис
40 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ ММ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
следовании плода во II триместре беременности (рис. 2.10) [40].
Иниэнцефалия
Иниэнцефалия представляет собой сложный порок развития, для которого характерны значительное укорочение шейного отдела позвоночника с патологическим усилением лордоза, незавершенное формирование основания черепа, особенно области большого затылочного отверстия, с эн-цефалоцеле или без него, рахишизис. Иниэнцефалия относится к очень редким порокам с неустановленной этиологией.
Нам удалось найти только две публикации, посвященные ранней пренатальной диагностике иниэнцефалии. В наблюдении, представленном D. Sherer и соавт. [41], в 13 нед беременности у плода были обнаружены акрания, резко запрокинутая голова и укорочение позвоночника. После прерывания беременности при патологоанатоми-ческомисследованиибылавыявленаполная форма краниорахишизиса с выраженными изменениями шейных позвонков.
В отечественной литературе о случае пренатальной ультразвуковой диагностики иниэнцефалии в начале II триместра беременности сообщили Е.В. Флоренсо-ва и М.С. Апарцин [42]. Уже в 12 нед беременности они отметили несоответствие копчико-теменного размера (КТР) плода сроку беременности. В 15 нед при детальном осмотре плода были обнаружены аномалия формирования свода черепа в затылочной области (отсутствие четкого изображения затылочной кости, наличие образования без четких контуров в области шейного отдела позвоночника) и расщепление позвоночника, что позволило окончательно сформировать диагноз иниэнцефалии (рис. 2.11). К 17 нед беременности энцефалоцеле приобрело более четкие контуры (рис. 2.12), деформация позвоночника стала еще очевиднее. Беременность была прервана в 21 нед, результаты патоморфологического исследования подтвердили данные ультразвуковой диагностики.
Рис. 2.11. Беременность 15 нед. Нарушение формирования свода черепа в затылочной области у плода с иниэнпефалией [42].
Рис. 2.12. Затылочное энцефалоцеле в 17 нед беременности у плода с иниэнцефалией (стрелка) [42].
Синдром Денди— Уокера
Синдром Денди—Уокера представляет собой порок развития, являющийся результатом нарушений формирования ромбовидного мозга и характеризующийся полной или частичной агенезией червя мозжечка, кистозным расширением IV желудочка и формированием кисты в области подпаутинного пространства задней черепной ямки [43]. Среди живорожденных детей частота встречаемости синдрома Денди—Уокера относительно невысока— 1 случай на 25 000—35 000 [2]. Согласно проведенному нами анализу обследования 36 405 беременных, частота синдрома Денди—Уокера составляет 0,038%, или0,4случая на 1000 плодов [44]. Аномалия Денди—Уокера возникает под
НАЧАЛО ГЛАВЫ
------------------- 41
ОГЛАВЛЕНИЕ
2
глава
воздействием самых разных факторов. Она может быть изолированной или сочетанной, то есть составляющей генных и хромосомных синдромов и синдромов множественных пороков развития [45].
Обычно ультразвуковая диагностика аномалии Денди—Уокера удается с 18—20 нед беременности и основывается в первую очередь на выявлении полной или частичной агенезии червя мозжечка. В случаях полной агенезии полушария мозжечка полностью разобщены, большая цистерна, как и IV желудочек, увеличены в размерах и визуализируются в середине задней черепной ямки [2]. В некоторых случаях пренатальная диагностика синдрома Денди-Уокера возможна в ранние сроки беременности. Согласно опубликованным данным, наиболее ранними сроками пренатальной диагностики аномалии Денди—Уокера при трансвагинальной эхографии были 12—14 нед беременности [23,33,46,47]. В наблюдении, представленном В. Ulm и соавт. [47], диагноз был установлен в 14 нед и в ходе пренатального кариотипирования была обнаружена триплоидия. U. Gembruch и соавт. [23] обнаружили сочетание синдрома Денди—Уокера с голопрозэнцефалией в 13 нед 3 дня (рис. 2.13).
При скрининговом ультразвуковом обследовании 3991 пациентки в 11—14 и 18— 20 нед беременности L. Hernadi и М. Torocsik [32] не удалось обнаружить единственный случай синдрома Денди-Уокера. В другом скрининговом исследовании в ранние сроки с охватом 1473 беременных один случай синдрома Денди-Уокера был точно установлен в конце I триместра [13]. G. D’Ottavio и соавт. [33] при скрининговом обследовании 2114 плодов в 14 нед беременности с помощью трансвагинальной эхографии также точно диагностировали один случай синдрома Денди—Уокера.
Гидранэнцефалия
Гидранэнцефалия относится к летальным состояниям и характеризуется наиболее тяжелой формой поражения, при ко-
Рис. 2.13. Беременность 13 нед 3 дня. Голопрозэнцефалия и синдром Денди Уокера, а поперечное сечение головы плода; б — продольное сканирование плода. Отчетливо видны один желудочек и анэхоген-ное образование задней черепной ямки [23].
торой полностью или почти полностью отсутствуют полушария головного мозга. Возникает гидранэнцефалия предположительно в результате двусторонней окклюзии внутренних сонных артерий, что вызывает массивные инфаркты коры головного мозга. Основное проявление гидра-нэнцефалии — наличие больших, заполненных жидкостью полостей и почти полное отсутствие коры головного мозга. Череп, срединные оболочечные структуры, ствол и средний мозг не изменены.
К настоящему времени гидранэнцефалия в ранние сроки беременности была диагностирована только в двух случаях. Y. Lin и соавт. [48] сообщили о пренатальной диагностике гидранэнцефалии в 12 нед. В ходе ультразвукового исследования были отмечены значительное увеличение размеров головы плода за счет интракраниальной жидкости, маленькие полушария и
42 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
отсутствие М-эхо головного мозга. При повторном ультразвуковом исследовании в 18 нед голова плода представляла собой одну кистозную полость, структуры мозга не визуализировались. Беременность была прервана, и при патологоанатомическом исследовании подтвержден пренатальный диагноз.
Y. Lam и М. Tang [49] удалось заподозрить порок развития головного мозга в 11 нед беременности ввиду отсутствия нормального изображения полушарий, сосудистых сплетений и боковых желудочков (рис. 2.14). За пациенткой осуществлялось динамическое эхографическое наблюдение, в ходе которого был установлен диагноз гидранэнцефалии (рис. 2.15).
Рис. 2.15. Беременность 28 нед. Гидранэнцефалия. Отчетливо видно выраженное скопление жидкости в полости черепа с небольшим количеством мозговой ткани в затылочной области (стрелки) [49].
Рис. 2.14. Беременность 11 нед. Поперечное сечение головы плода, а — отчетливое отсутствие нормального изображения боковых желудочков и сосудистых сплетений у пораженного плода; б — та же плоскость сканирования у нормального плода (для сравнения) [49].
Гидролетальный синдром
Гидролетальный синдром характеризуется наличием гидроцефалии, микрогнатии, косолапости и полидактилии. Впервые о ранней диагностике этого синдрома сообщили специалисты из Финляндии Р. Ammala и R. Salonen [50]. У пациентки 26 лет первая беременность была прервана в 18 нед в связи с обнаружением у плода гидролетального синдрома. В последующую беременность при трансвагинальном ультразвуковом обследовании плода в 11 нед 5 дней были выявлены атипичная гидроцефалия при отсутствии срединных структур головного мозга и косолапость. На основании полученных данных был поставлен диагноз гидролетального синдрома. В 14 нед произведено прерывание беременности. На аутопсии пренатальный диагноз полностью подтвержден.
Spina bifida
Spina bifida представляет собой аномалию развития позвоночного столба, возникающую в результате нарушения процесса закрытия нервной трубки. Выход через дефект оболочек спинного мозга называется менингоцеле. Если грыжевой мешок содержит нервную ткань, образование носит название менингомиелоцеле. Наиболее час-
НАЧАЛО ГЛАВЫ
------------------- 43
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.16. Беременность 16 нед. Поперечное сечение туловища плода Spina bifida (стрелка).
тое расположение дефекта — поясничный и крестцовый отделы позвоночника.
Частота встречаемости spina bifida зависит от географического региона. В некоторых районах Великобритании частота этого порока составляет 4 случая на 1000 новорожденных. В США этот показатель в среднем равен 0,5 на 1000, хотя он значи
тельно варьирует в зависимости от расовых и географических особенностей [51]. С внедрением в широкую практику пренатального скрининга частота случаев spina bifida при рождении значительно снизилась.
Пренатальное ультразвуковое обследование и биохимический скрининг оказались эффективными в выявлении spina
bifida во II триместре беременности. Начиная с 16 нед при эхографическом исследовании хорошо визуализируются задние центры оссификации позвоночника. В норме они располагаются параллельно друг другу или под незначительным углом. При наличии spina bifida остистые отростки позвонков при
поперечном сканировании не смыкаются, а имеютН- илиУ-образ-
ную конфигурацию (рис. 2.16). Грыжа может быть видна при продольном сканировании, однако маленькие дефектычаще диагностируются при тщательном исследовании позвоночника в поперечном сечении. При наличии менинго- или менингомиелоцеле в области дефекта определяется тонкостенный грыжевой мешок.
Наиболее типичными эхографическими признаками этой патологии служат изменения формы головы плода («лимон») и мозжечка («банан»), которые могут выявляться в ряде наблюдений уже в ранние сроки беременности (рис. 2.17) [52]. Следует помнить, что в некоторых случаях эти признаки могут встречаться и при абсолютно нормальной беременности. Например, голова в форме «лимона» отмечается у 1% нормальных плодов. Единственным абсолютным признаком патологии в этих ситуациях является наличие дефекта позвоночника. Изменения, выявленные при биохимическом скрининге, служат основанием к проведению детального ультра
звукового исследования.
Z.BlumenfeldHcoaBT. [53] впервые описали динамические изменения эхографических признаков spina bifida в ранние сроки беременности. При первом ультразвуковом исследовании в 10 нед была отмечена неоднородная эхоструктура в сакральном отделе позвоночного столба;
Рис. 2.17. Беременность 13 нед. Spina bifida, а - эхограмма головы плода («лимон»); б — поперечное сечение туловища плода (U-образный дефект позвоночника указан стрелкой) [52].
44
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Рис. 2.18. Коронарное сечение дистального отдела позвоночника нормального плода (а) в 9 нед 0 дней (КТР — 22 мм) и при spina bifida (б—г). 6 — 9 нед 1 день (КТР — 22 мм); в — 9 нед 4 дня (КТР — 24 мм); г — 9 нед 4 дня (КТР — 28 мм). Стрелкой показан спинальный дефект [55].
Рис. 2.19. Беременность 9 нед 4 дня. Трехмерная реконструкция коронарных плоскостей (а, б) из сагиттальной плоскости. Стрелкой показано миеломенингоцеле [55].
в 12 нед появился признак «банана»; в 15 нед выявлены признак «лимона» и сакральное менингоцеле. N. Sebire и соавт. [54] также обнаружили признак «лимона» у 3 плодов с пояснично-крестцовой spina bifida в 12—14 нед беременности.
О случаях наиболее ранней пренатальной ультразвуковой диагностики spina bifida сообщили Н. Blaas и соавт. [55]. Им удалось выявить порок у 3 плодов в сроки от 9 нед 1 дня до 9 нед 4 дней благодаря тщательному изучению анатомии плода у пациенток высокого риска с помощью трансвагинальной эхографии с использованием датчика 7,5 МГц (рис. 2.18, 2.19).
НАЧАЛО ГЛАВЫ
------------------- 45
ОГЛАВЛЕНИЕ
2
глава
При этом КТР эмбрионов составлял лишь 22—28 мм.
L. Hernadi и М. Torocsik [32] при проведении двукратного скринингового обследования 3991 пациентки в 11—14 и 18—20 нед беременности обнаружили 6 случаев spina bifida, в одном из них в сочетании с
экзэнцефалией, при этом 5 случаев были диагностированы в ранние сроки беременности. В двух других скрининговых ультразвуковых исследованиях в 12—14 нед (1632 пациентки) и 10—14 нед (1473 пациентки) оба случая spina bifida не были обнаружены в эти сроки беременности [13, 34].
СТРУКТУРЫ ЛИЦА И ШЕИ
Визуализация структур лица и выявление пороков их развития потенциально возможны уже с 11—12 нед беременности, однако в настоящее время это удается сделать преимущественно на приборах с высокой разрешающей способностью и специалистам, имеющим большой опыт работы в пренатальной диагностике. Но даже при таких условиях далеко не вс е случаи пороков развития лица могут быть обнаружены в ранние сроки.
В последние годы публикации по этому вопросу в основном были посвящены выраженным аномалиям, наблюдаемым при голопрозэнцефалии (циклопия, пробосцис и др.) и достаточно просто выявляемым как при трансвагинальном, так и при трансабдоминальном сканировании (рис. 2.20). Расщелины губы и неба, являясь наиболее
распространенными аномалиями лица, значительно реже диагностируются в ранние сроки беременности. G. D’Ottavio и соавт. [33] при осуществлении скринингового обследования 2114 плодов в 14 нед беременности с помощью трансвагинальной эхографии только 1 из 3 случаев лицевых расщелин обнаружили в ранние сроки. Наличие у плода с расщелинами верхней губы и неба деформации носа, которая обычно носит специфический характер, может упростить пренатальную диагностику этого порока. Так, С.М. Воеводину [56] удалось в 11—12 нед беременности определить двусторонний хейлогнатопалатосхизис.
Следует отметить, что в некоторых случаях в ранние сроки беременности на верхней губе плода могут визуализироваться структуры, схожие с изображением «усов»
Рис. 2.20. Голопрозэнпефалия. Фронтальная плоскость структур лица при левосторонней анофтальмии (стрелка).
Рис. 2.21. Беременность 15 нед. Сечение головы плода в поперечно-косой плоскости. 1 — верхняя губа; 2 и 3 — «усы»; 4 верхняя челюсть [57].
46 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ ММ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 1046 НЕДЕЛЬ
Рис. 2.22. Беременность 12 нед. Профиль плода с микрогнатией при цереброкостомандибулярном синдроме [58].
и создающая видимость расщелины (рис. 2.21). В работе М. Bronshtein и соавт. [57] при трансвагинальном ультразвуковом ис -следовании 3000 плодов в 14—16 нед беременности этот акустический феномен был зарегистрирован в 7 наблюдениях. При повторном исследовании в 20—22 нед отмечено его исчезновение во всех случаях. По мнению авторов, структура, напоминающая «усы», является нормальным вариантом развития верхней губы и не должна расцениваться как признак расщелины.
Чаще всего аномалии развития лица являются составным компонентом различных генетических и негенетических синдромов. К настоящему времени в литературе описано немало случаев их ранней пренатальной диагностики благодаря в первую очередь детальной оценке лицевых структур. Так, R. Ibba и соавт. [58] удалось в 12 нед беременности диагностировать цереброкосто-мандибулярный синдром. При этом первым выявленным признаком синдрома была микрогнатия (рис. 2.22).
L. De Catte и соавт. [59] приводят случай ультразвуковой диагностики окулоа-урикуловертебрального синдрома (синдром Гольд енхара) в 14—15 нед беременности. Среди аномалий лица у плода были обнаружены левосторонняя микрофтальмия (диаметр правой глазницы — 9 мм, ле-
Рис. 2.23. Беременность 14 -15 нед. Окулоаурикуло-вертебральный синдром, а - эхограмма поперечного сечения головы плода на уровне глазниц; б — фенотип абортуса [59].
вой — 4 мм) и левосторонняя расщелина верхней губы и неба со специфической деформацией носа (рис. 2.23).
В отдельных случаях возможна даже ранняя диагностика врожденных опухолей лицевых структур. I. Gull и соавт. [60] удалось осуществить наиболее раннюю диагностику эпигнатуса — в 15 нед беременности. Эпигнатус представляет собой
------------------- 47
ОГЛАВЛЕНИЕ ММ
НАЧАЛО ГЛАВЫ
2
глава
Рис. 2.24. Беременность 13 нед 4 дня. Кистозная гигрома шеи (стрелки).
Рис. 2.25. Беременность 15-16 нед. Кистозная гигрома шеи при синдроме Тернера (стрелки).
тератому, развивающуюся из полости рта и носоглотки, и при ультразвуковом исследовании плода определяется как образование, исходящее из полости рта.
Среди опухолевидных образований шеи наиболее часто встречается кистозная гигрома. Кистозная гигрома является врожденным пороком развития лимфатической системы и служит для обозначения жидкостной опухоли. Обычно она бывает представлена одиночными или множественными кистозными образованиями мягких тканей шейной области. Кистозные гигромы обнаруживаются у 1 из 200 спонтанных абортусов с КТР более 3 см [61].
Кистозная гигрома чаще всего бывает многокамерной двусторонней и локализуется кзади и сбоку от шеи (рис. 2.24). Нередко в кистозной гигроме обнаруживаются множественные тонкие перегородки. Размеры гипоэхогенных и анэхогенных полостей варьируют от 0,5 до 5 см. Отличительной чертой образования является наличие выраженного наружного контура [35, 62]. В сообщениях, посвященных пренатальной диагностике кистозной гигромы шеи, подчеркивается ее частое сочетание с
водянкой плода (40—100%) и врожденными пороками сердца (0—92%) [63, 64].
При кистозной гигроме часто обнаруживаются хромосомные аномалии и некоторые синдромы, включая синдромы Нунана, Робертса и множественных летальных птеригиумов. Кроме этого, в литературе сообщалось о выявлении кистозной гигромы при ахондрогенезе II типа и тератогенных воздействиях, таких как алкоголь, аминоптерин и триметадон. В работах Е.В. Юдиной [65], G. Azar и соавт. [66] хромосомные нарушения были обнаружены у 75% плодов с кистозной гигромой. При этом в подавляющем большинстве случаев был диагностирован синдром Тернера (рис. 2.25). Поэтому при выявлении кистозной гигромы следует провести тщательное изучение всей ультразвуковой анатомии плода для исключения сочетанных аномалий. Всем плодам показано эхокардиографическое исследование ввиду высокой частоты врожденных пороков сердца. Обязательно также пренатальное кариотипирование, поскольку даже при изолированной кистозной гигроме шеи высока частота хромосомных дефектов.
48 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
СЕРДЦЕ
Врожденные пороки сердца относятся к наиболее частым аномалиям и встречаются с частотой 5—10 случаев на 1000 новорожденных. Обычно эхокардиографическое исследование плода с целью пренатальной диагностики врожденных пороков сердца осуществляют с 20 нед беременности. В то же время применение высокоразрешающей трансвагинальной эхокардиографии с режимами цветового допплеровского картирования и импульсной допплерографии позволяет диагностировать многие серьезные врожденные пороки сердца начиная с 12 нед беременности. К настоящему времени опубликовано только одно наблюдение пренатальной диагностики врожденного порока сердца ранее 16 нед с помощью трансабдоминального доступа. G. DeVore и соавт. [67] выявили дефект межжелудочковой перегородки, гипертрофию стенок желудочков и перикардиальный выпот у плода в 14 нед беременности.
В последние годы было опубликовано достаточно большое количество наблюдений, посвященных пренатальной ультразвуковой диагностике врожденных пороков сердца в ранние сроки беременности (табл. 2.3).
О наиболее ранней диагностике врожденного порока сердца у плода с помощью трансвагинальной эхографии сообщили U. Gembruch и соавт. [70]. Им удалось выявить полную форму атриовентрикулярного канала с полной блокадой сердца и недостаточностью общего атриовентрикулярного клапана в 11 нед 4 дня. В наших исследованиях полная блокада сердца (ЧСС 62 в 1 мин) у плода с омфалоцеле диагностирована в ходе трансвагинальной эхографии в 12 нед беременности [69].
Впервые результаты скрининговых исследований по врожденным порокам сердца с помощью трансвагинальной эхокардиографии представили М. Bronshtein и соавт. [72]. Их выступление в Лондоне в
1991 г. на I Всемирном конгрессе Международного общества по ультразвуковой диагностике в акушерстве и гинекологии получило большой резонанс и послужило стимулом к дальнейшим исследованиям во многих центрах пренатальной диагностики Западной Европы и США. При трансвагинальном эхокардиографическом скрининге 4000 беременных в 12—16 нед был выявлен 21 врожденный порок сердца у 13 плодов. Чаще других пороков встречался дефект межжелудочковой перегородки, и наиболее ранний срок его выявления составил 12 нед 4 дня.
U. Gembruch и соавт. [73] опубликовали данные о пренатальной диагностике врожденных пороков сердца в 11—16 нед беременности у 13 из 114 пациенток группы высокого риска их возникновения. Абсолютное совпадение пренатального диагноза с данными патологоанатомического исследования отмечено в 3 наблюдениях (рис. 2.26, 2.27). У 8 плодов основные структурные изменения сердца были точно установлены, но дополнительные сердечные аномалии не были распознаны. В одном случае с полиспленией, декстрокардией, левосторонним изомеризмом и дефектом вторичной межпредсердной перегородки пренатальный диагноз полной формы атриовентрикулярного канала был неправильным. В другом наблюдении полная форма атриовентрикулярного канала с дефектом вторичной межпредсердной перегородки и двойным выходом из правого желудочка не быливыявлены в 12 нед 4 дня, но установлены при повторном трансабдоминальном исследовании в 21 нед 2 дня.
Единственное опубликованное наблюдение пренатальной диагностики общего артериального ствола в 12 нед беременности с помощью трансвагинальной эхокардиографии принадлежит С.В. Никитину [96]. Порок сердца сочетался с выраженной дилатацией мочевого пузыря и кистой пуповины. При проведении трансваги-
НАЧАЛО ГЛАВЫ
------------------- 49
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.26. Беременность 14 нед. Полная форма атриовентрикулярного канала. Красным цветом отображен поток крови через общий атриовентрикулярный клапан [73].
нального ультразвукового исследования были выявлены дефект межжелудочковой перегородки в мембранозной части и общий артериальный ствол, расположенный над обоими желудочками (рис. 2.28). Для проведения дифференциального диагноза с другими аномалиями желудочковоартериальных соединений, в первую очередь с тетрадой Фалло, было использовано цветовое допплеровское картирование, которое позволило выявить единый поток из желудочков в один общий для них сосуд диаметром 3,4 мм (рис. 2.29).
М. Rustico и соавт. [76] удалось в 14 нед беременности диагностировать дисплазию трикуспидального клапана и атрезию легочной артерии. При трансвагинальной эхокардиографии было выявлено следующее: правое предсердие и правый желудочек значительно дилатированы; створки трикуспидального клапана укорочены и утолщены, правое предсердно-желудочковое соединение расширено; легочная артерия сужена до 2 мм; клапан легочной артерии не визуализируется. В ходе цветового допплеровского картирования были обнаружены выраженная трикуспидальная регургитация и отсутствие потока крови из правого желудочка в легочную артерию.
В нескольких работах сообщалось о случаяхпренатальнойдиагностики гипоп
ластического синдрома левых отделов сердца в ранние сроки беременности. При этом основным диагностическим критерием являлось обнаружение выраженной диспропорции между размерами левого и правого желудочков сердца плода. Следует отметить, что в некоторых наблюдениях определяется выравнивание размеров желудочков во II и III триместрах беременности. Так, по данным М. Bronshtein и Е. Zimmer [83], обнаружившим маленькие размеры левого желудочка у 16 плодов в 14—16 нед, в 4 из 7 наблюдений, в которых пациентки решили пролонгировать беременность, была отмечена нормализация размеров левого желудочка сердца плода. Поэтому для исключения случаев ложноположительной диагностики гипоплазии левых отделов сердца плода необходимо наряду с трансвагинальной двухмерной эхокардиографией использовать цветовое допплеровское картирование в ранние сроки беременности. Диагностическим критерием гипопластического синдрома левых отделов сердца в ранние сроки беременности является, помимо выраженной диссоциации размеров желудочков, значительное доминирование потока крови через трикуспидальный клапан либо отсутствие потока крови через митральный клапан [2].
Наряду с представленными данными о достаточно высокой чувствительности и специфичности трансвагинальной эхокардиографии в диагностике врожденных пороков сердца следует привести и результаты других исследователей, которым не удалось обнаружить пороки сердца в ранние сроки беременности. Так, М. Cullen и соавт. [100] при трансвагинальном эхографическом обследовании 622 пациенток высокого риска по врожденным порокам развития обнаружили различные аномалии у 33 плодов. Однако врожденные пороки сердца выявлены не были. У одного плода четырехкамерный срез сердца был расценен как нормальный в 13 нед. Беременность была прервана по показаниям со стороны матери, и
50 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Рис. 2.27. Беременность 12 нед L день. Коарктация аорты, а — четырехкамерный срез сердца плода (выраженное превалирование потока крови через трикуспидальный клапан (стрелка); б — срез через выходной тракт правого желудочка с нормальным потоком крови в легочной артерии; в — срез через дугу аорты, суженной до 0,5 мм [73].
Рис. 2.28. Трансвагинальное сканирование. Четырехкамерный срез сердца плода с общим артериальным стволом.
Рис. 2.29. Цветовое допплеровское картирование, а — диастола желудочков; б - фаза систолы. Стрелкой показан общий артериальный ствол.
на аутопсии у плода обнаружен дефект межжелудочковой перегородки. В другом наблюдении транспозиция магистральных сосудов и стеноз легочной артерии не
были диагностированы в ходе трансвагинальной эхокардиографии в 10 и 13 нед, но обнаружены при трансабдоминальном доступе в 22 нед.
НАЧАЛО ГЛАВЫ
------------------- 51
ОГЛАВЛЕНИЕ
2
глава
Таблица 2.3. Пренатальная ультразвуковая диагностика врожденных пороков сердца в 10-17 нед беременности (дополненные данные [68])
Авторы Сроки беременности, нед Врожденный порок сердца
М.В. Медведев и соавт., 1989 [69] 12 Полная блокада сердца, ДМЖП
U. Gembruch и соавт., 1990 [70] 11-12 Полная блокада сердца, полная форма АВК
Т. Bennett и соавт., 1991 [71] 12 Эктопия сердца
М. Bronshtein и соавт., 1991 [72] 12-16 ДМЖП, ГСЛОС, ДВПЖ, полная форма АВК, тетрада Фалло, TEA, ЕЖ, единственное предсердие
U. Gembruch и соавт., 1993 [73] 11-14 Полная форма АВК, полная блокада сердца, ЕЖ, ГСЛОС, ДМЖП, гипоплазия дуги аорты, фиброэластоз эндокарда
W. Sepulveda и соавт., 1994 [74] 12 Эктопия сердца
М. Cullen и соавт., 1995 [75] 13 Аномалия Эбштейна
G. D’Ottavio и соавт., 1995 [33] 14 Тетрада Фалло
14 ДМЖП
14 ДМЖП, стеноз аорты
М. Rustico и соавт., 1995 [76] 14 Дисплазия трикуспидального клапана, АЛА
М. Rustico и соавт., 1995 [77] 14 Фиброэластоз эндо кар да+стеноз аорты
Е. Tegnander и соавт., 1995 [78] 16 Декстрокардия, ЕЖ, АЛА
16 Тетрада Фалло
17 Тетрада Фалло
R. van Zalen-Sprock и соавт., 1995 [79] 15 Тетрада Фалло
L. Allan и соавт., 1996 [80] 17 ГСЛОС
17 ГСЛОС
16 АМК, ДВПЖ
U. Gembruch и соавт., 1996 [81] 11 Полная форма АВК, ЕЖ, КА
12 КА, ДМЖП
13 Полная форма АВК
14 Полная форма АВК, ЕЖ, ГСЛОС, ДМЖП, ДМПП, ТГА, ТГА+АЛА
15 Полная форма АВК, ДВЛЖ+АМК, ДМЖП
16 ГСЛОС, КА
L. Hornberger и соавт., 1996 [82] 16 ГПЖ+стеноз легочной артерии
М. Bronshtein, Е. Zimmer, 1997 [83] 14-16 ГСЛОС
R. Chaoui и соавт., 1997 [84] 17 Желудочково-коронарная коммуникация с АЛА
J. Hyett и соавт., 1997 [85] 15 АМК+стеноз легочной артерии
16 ГСЛОС
16 АВК+атрезия аорты
R. Liang и соавт., 1997 [86] 10 Торакоабдоминальная форма эктопии сердца
J. Areias и соавт., 1998 [87] 12 Полная форма АВК
13 Полная форма АВК
М. Bronshtein, Е. Zimmer, 1998 [88] 14-16 КА
W. Henrich и соавт., 1998 [89] 14 АВК
Y. Lam и соавт., 1998 [90] 12 ДМЖП+АЛА
A. Matias и соавт., 1998 [91] 12 Полная форма АВК
52 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Окончание таблицы 2.3
Авторы Сроки беременности, нед Врожденный порок сердца
V. Bognoni и соавт., 1999 [92] 11-12 Торакоабдоминальная форма эктопии сердца
И.И. Рябов, 1999 [93] 12-13 Торакоабдоминальная форма эктопии сердца
М. Guschmann и соавт., 1999 [94] 13 Полная форма АВК
Y. Lam, М. Tang, 1999 [95] 13 ДМЖП
14 Тетрада Фалло
13 ДМЖП
14 ДМЖП
С.В. Никитин, 2000 [96] 12 Общий артериальный ствол
J. Martinez и соавт., 2000 [97] 13-16 Аномалия Эбштейна, тетрада Фалло, ЕЖ+ТГА, стеноз легочной артерии, ДМЖП+АТК, ДВПЖ+АМК, ДМЖП+АЛА
В. Puerto и соавт., 2000 [98] 14 АТК+ДМЖП
A. Yamasaki и соавт., 2000 [99] 15 Эктопия сердца+ДМЖП
Примечание. ДМЖП - дефект межжелудочковой перегородки; ГОЛОС - гипопластический синдром левых отделов сердца; ДВПЖ - двойной выход из правого желудочка; ДВЛЖ - двойной выход из левого желудочка; АВК - атриовентрикулярный канал; ЕЖ - единственный желудочек; ДМПП - дефект межпредсердной перегородки; ТГА - транспозиция главных артерий; КА - коарктация аорты; АЛА - атрезия легочной артерии; ГПЖ - гипоплазия правого желудочка; АМК - атрезия митрального клапана; АТК - атрезия трикуспидального клапана.
В исследованиях R. Achiron и О. Tadmor 1101] также ни один врожденный порок сердца не был диагностирован с помощью трансвагинального доступа в 9—13 нед. В одном наблюдении в 13 нед не была распознана гипоплазия правых отделов сердца, а в другом в 12 нед — аорта «наездника» и дефект межжелудочковой перегородки. Однако эти пороки были выявлены при повторном исследовании с помощью трансабдоминального доступа в 20 нед беременности. В другом исследовании — G. D’Ottavio и соавт. [33] — среди не диагностированных в 14 нед аномалий врожденные пороки сердца составили более одной трети (6 из 15), но они были выявлены при повторном ультразвуковом исследовании в 20—22 нед беременности.
Пренатальное кариотипирование, проведенное в случаях обнаружения врожденных пороков сердца в ранние сроки бере
менности, позволило установить наличие хромосомных аномалий в 53,8—57% наблюдений [72,81], тогда как их частота при обнаружении пороков сердца во II и III триместрах в среднем составляет 30,7% [102]. Приведенные данные литературы убедительно свидетельствуют о необходимости определения кариотипа плода во всех случаях обнаружения врожденных пороков сердца при ультразвуковом исследовании в ранние сроки беременности.
В заключение следует отметить, что применение трансвагинальной эхокардиографии для ранней диагностики врожденных пороков сердца у плода наиболее целесообразно в 13—14 нед. Для более полной оценки состояния сердечно-сосудистой системы плода в ранние сроки предпочтительнее использовать наряд у с двухмерной эхокардиографией цветовое допплеровское картирование.
НАЧАЛО ГЛАВЫ
------------------- 53
ОГЛАВЛЕНИЕ
2
глава
ОРГАНЫ ГРУДНОЙ КЛЕТКИ
Диафрагмальная грыжа
Врожденная диафрагмальная грыжа (ВДГ) является следствием замедления процесса закрытия плевроперитонеального канала. Обычно она развивается при недостаточности развития заднелатерального участка левой половины диафрагмы. Ввиду не-разделенности брюшной полости и грудной клетки желудок, селезенка, кишечник и даже печень могут перемещаться в грудную полость. Грыжевые органы обычно вызывают смещение средостения, что может приводить к сдавлению и нарушению развития легких. ВДГ встречается приблизительно у 1 из 2400 новорожденных [103].
Дефект центрального сегмента диафрагмы в сочетании с грыжей в перикардиальную полость является наиболее ранней формой ВДГ. Эта аномалия характеризуется наличием сообщения между перикардиальной и перитонеальной полостями ввиду дефекта поперечной перегородки.
В подавляющем большинстве случаев пренатальная ультразвуковая диагностика ВДГ удается после 22 нед, хотя возможна и в более ранние сроки беременности. Впервые о ранней ультразвуковой диагностике ВДГ сообщили М. Bocian и соавт.
Рис. 2.30. Беременность 12 нед. Поперечное сечение грудной клетки плода. 1 — четырехкамерный срез сердца; 2 — желудок [90].
[104]. Диагноз был установлен ими в 14 нед беременности у пациентки, родившей ранее ребенка с ВДГ. Y. Lam и соавт. [90] приводят описание случая пренатальной диагностики диафрагмальной грыжи в сочетании с врожденным пороком сердца (атрезия легочной артерии и дефект межжелудочковой перегородки) в 12 нед беременности (рис. 2.30).
Наряд у с пороками развития в ранние сроки беременности могут обнаруживаться выраженные изменения, которые затем спонтанно исчезают. Так, Е. Jauniaux и соавт. [105] приводят наблюдение, в котором
Рис. 2.31. Беременность 12 нед 3 дня. а продольное сканирование плода; б поперечно-косое сечение грудной клетки. В грудной клетке плода отчетливо видно анэхогенное образование (*); ж—желудок [105].
54 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ ММ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
у плода из двойни в 12 нед беременности наряд у с увеличением толщины воротникового пространства до 5 мм в грудной клетке было обнаружено кистозное образование размером 10 х 9 х 9 мм (рис. 2.31). Было проведено пренатальное кариотипи-рование обоих плодов, в ходе которого хромосомных дефектов обнаружено не было.
При динамическом эхографическом наблюдении в 20 нед беременности констатировано полное исчезновение кистозного образования. В доношенный срок родились здоровые новорожденные. При рентгенографии грудной клетки и эхокардиографии изменений не выявлено. Дети на 5-е сутки жизни выписаны домой.
ПЕРЕДНЯЯ БРЮШНАЯ СТЕНКА
Омфалоцеле
Омфалоцеле возникает в результате невозвращения органов брюшной полости из амниотической полости через пупочное кольцо и встречается с частотой 1 случай на 3000—6000 новорожденных [106,107]. В состав омфалоцеле могут входить любые висцеральные органы. Размеры грыжевого образования определяются содержимым грыжевого мешка. В ранние сроки беременности омфалоцеле диагностируется значительно чаще, особенно у плодов с расширенным воротниковым пространством, — в среднем у 7 из 4116 обследованных [108]. Почти в 70% случаев омфалоцеле может сочетаться с другими структурными аномалиями, хромосомными дефектами и наследственными синдромами.
Пренатальная ультразвуковая диагностика омфалоцеле основана на обнаруже
нии образования округлой или овальной формы, заполненного органами брюшной полости и примыкающего непосредственно к передней брюшной стенке (рис. 2.32, 2.33). Наиболее часто в состав грыжевого содержимого входят петли кишечника и печень. Пуповина прикрепляется непосредственно к грыжевому мешку.
Диагноз омфалоцеле может быть установлен уже в конце I триместра беременности [69, 109, ПО], хотя в большинстве наблюдений оно выявляется во II триместре. Во избежание установления ложноположительного диагноза следует помнить, что в 10—12 нед может наблюдаться физиологическая кишечная грыжа 1111].
Впервые о ранней ультразвуковой диагностике омфалоцеле в 13 нед беременности сообщили W. Schmidt и F. Kubli [112] в 1982 г. При последующем кариотипировании
Рис. 2.32. Беременность 14- 15 нед. Трансвагинальное сканирование. 1 — омфалоцеле; 2 — поперечное сечение брюшной полости плода.
Рис. 2.33. Беременность 14 15 нед. Трансвагиналь ное сканирование. Омфалоцеле.
НАЧАЛО ГЛАВЫ
------------------- 55
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.34. Беременность 12—13 нед. 1 - омфалоцеле;
2 поперечное сечение брюшной полости плода.
Рис. 2.35. Беременность 12 нед. Аномалия развития стебля тела [117].
плода была обнаружена трисомия 18. М. Pagliano и соавт. [109] удалось обнаружить омфалоцеле, содержащее печеньипетлики-шечника, в 10 нед беременности. В нашихна-блюдениях наиболее ранняя пренатальная диагностика омфалоцеле была осуществлена в 12—13 нед беременности (рис. 2.34) [69].
R. van Zalen-Sprock и соавт. [111] диагностировали 14 случаев омфалоцеле при скрининговом ультразвуковом исследовании в 11—14 нед беременности. Авторами было установлено, что при наличии в грыжевом содержимом только петель кишечника в 100% случаев имеются хромосомные аномалии, преимущественно трисомия 18, тогда как при вхождении в омфалоцеле печени у всех плодов обнаружен нормальный кариотип.
R. Snijders и соавт. 1113] при скрининговом ультразвуковом обследовании 15 726 пациенток в 10—14 нед беременности выявили 18 случаев омфалоцеле, из которых в 11 наблюдениях была диагностирована трисомия 18 и 13. В двух других скринин-говыхультразвуковыхисследованияхв 12— 14 нед (1632 пациентки) и 10—14 нед (1473 пациентки) все 4 случая омфалоцеле (по 2 наблюдения в каждом) были обнаружены в эти сроки беременности [13, 34].
Гастрошизис
Гастрошизис представляет собой эвен-трацию органов брюшной полости (чаще
кишечника) через параумбиликальный дефект передней брюшной стенки. Дефект обычно располагается справа от пупка, грыжевые органы не имеют мембраны. Гастрошизис встречается с частотой 0,94 случая на 10 000 новорожденных [114]. Частота порока у беременных моложе 20 лет выше — 7 случаев на 10 000 новорожденных.
Пренатальная ультразвуковая диагностика гастрошизиса обычно основывается на визуализации петель кишечника в амниотической жидкости вблизи передней брюшной стенки плода. В некоторых случаях, помимо петель кишечника, за пределами брюшной полости могут находиться и другие органы. Наиболее ранняя пренатальная ультразвуковая диагностика гастрошизиса с помощью трансвагинальной эхографии была осуществлена в 12,4 нед [115]. В большинстве случаев диагноз устанавливается во II триместре беременности, так как в ранние сроки (10—12 нед) возможна ложноположительная диагностика в связи с наличием у плода физиологической кишечной грыжи.
Аномалия развития стебля тела
Этот порок является летальным и характеризуется обширным дефектом передней брюшной стенки, выраженным кифосколиозом и рудиментарной пуповиной. Частота встречаемости аномалии составляет 1 случайна 14 000 новорожденных [116].
56 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
В ходе мультиценгрового скринингового ультразвукового обследования 106 727 пло-довв 10—14недбеременностианомалия развития стебля тела была выявлена в 14 наблю
дениях [117]. Во всех диагностированных случаях верхняя половина туловища располагалась в амниотической полости, тогда как нижняя часть — в целомической (рис. 2.35).
МОЧЕВЫДЕЛИТЕЛЬНАЯ СИСТЕМА
Агенезия почек
Возникновение этого порока обусловлено нарушением в последовательной цепи процессов нормального эмбриогенеза от пронефроса к метанефросу. Частота двусторонней агенезии почек составляетв среднем 1 случай на 4500 новорожденных [118].
Патогномоничная триада эхографичес-кихпризнаков агенезиипочекуплодапред-ставлена отсутствием их эхотени и мочевого пузыря, а также выраженным маловодием. Маловодие относится к поздним проявлениям и может обнаруживаться только после 16—18 нед беременности (рис. 2.36). Визуализация мочевого пузыря плода позволяет исключить диагноз двусторонней агенезии почек в любой срок беременности. При нормальном развитии плода его мочевой пузырь визуализируется после 12— 13 нед. Обычно двусторонняя агенезия почек сопровождается симметричной формой задержки внутриутробного развития.
Пренатальный диагноз агенезии почек вызывает серьезные сложности в ранние сроки беременности, так как в условиях
Рис. 2.36. Беременность 18 нед. Поперечное сечение туловища плода при двусторонней агенезии почек.
выраженного маловодия значительно затруднена визуализация внутренних органов плода. По данным разных исследователей, агенезию почек удается точно диагностировать при ультразвуковом исследовании плода в 69—73% случаев [119, 120]. В первую очередь агенезию почек следует дифференцировать с выраженной гипоплазией почек, при которой также отмечается маловодие и может не визуализироваться мочевой пузырь. Для дифференциальной диагностики в ранние сроки беременности целесообразно использовать при трансвагинальном сканировании цветовое допплеровское картирование, так как при агенезии почек отсутствуют почечные артерии [ 121—123]. В норме почечные артерии четко визуализируются при продольном сканировании туловища плода и отходят от аорты.
В литературе сообщалось, что агенезию почек у плода возможно диагностировать с помощью эхографии в 13—17 нед беременности. Так, М. Bronshtein и соавт. [124] приводят данные пренатальной диагнос-тикидвустороннейагенезиипочекв 14нед у 5 плодов. При этом авторы отметили во всех случаях нормальное количество амниотической жидкости в 14 нед беременности. У 2 плодов в месте обычной локализации мочевого пузыря визуализировалось кистозное образование, которое исчезло к 16—17 нед беременности. М. Valenzano и соавт. [125] приводят описание случая пренатальной диагностики си-реномелии в 16 нед беременности, когда в ходе трансвагинальной эхографии, помимо агенезии почек и выраженного маловодия, была обнаружена одна общая деформированная нижняя конечность.
НАЧАЛО ГЛАВЫ
------------------- 57
ОГЛАВЛЕНИЕ
2
глава
Инфантильная форма поликистозной болезни почек
При инфантильной форме поликистозной болезни почек (ИФПБП) отмечается вторичная дилатация и гиперплазия нормально сформированных собирательных канальцев почек. Почки поражаются симметрично, при этом кистозные поврежде-нияпредставлены образованиями размером 1—2 мм. Частота ИФПБП составляет 1,3—5,9 случая на 1000 новорожденных [126].
Основными эхографическими критериями ИФПБП являются увеличенные гиперэхогенные почки, отсутствие эхоте-ни мочевого пузыря и маловодие. Увеличение размеров почек иногда бывает настолько значительным, что они занимают большую часть поперечного сечения живота плода. Хотя обнаружение ИФПБП обычно возможно с середины II триместра беременности, некоторые исследователи приводят данные о более ранней пренатальной диагностике этого порока.
В литературе сообщалось о нескольких случаях, когда ИФПБП была заподозрена в конце I — начале II триместра беременности, но окончательный диагноз был установлен только в середине II — начале III триместра. В одном наблюдении она была заподозрена в 15 нед 4 дня беременности
Рис. 2.37. Беременность 14 нед. Поперечное сечение туловища плода при ИФПБП. Отчетливо видны «большие белые почки», занимающие большую часть брюшной полости [1291-
в связи с повышенной эхогенностью почек [127]. При этом почки плода были нормальных размеров. Только в 19 нед 4 дня, после появления всех патогномоничных эхографических признаков, был установлен окончательный диагноз. В другом наблюдении в 12 нед беременности почки плода имели высокую эхогенность и были несколько увеличены в размерах, но полная эхографическая картина ИФПБП появилась только в 28 нед [128].
А.Е. Волкову [129] удалось диагностировать ИФПБП в 14 нед беременности. При ультразвуковом исследовании на фоне умеренно сниженного количества околоплодных вод в брюшной полости плода «доминировали» его почки, которые имели вид крупнопористой гиперэхогенной губки (рис. 2.37). Размеры почек составили: правая — 21 х 19 х 20 мм, левая — 23 х 20 х 22 мм. Мочевой пузырь плода не визуализировался.
Мультикистозная дисплазия почек
Мультикистозная дисплазия почек является врожденной патологией и заключается в замещении почечной ткани несооб-щающимися кистами. Кисты обычно представляют собой терминальные отделы собирательных трубочек и могут быть окружены зонами соединительной и миксоматозной ткани. В большинстве случаев мультикистозной дисплазии почек патологический процесс носит односторонний характер и поэтому часто протекает латентно, что затрудняет оценку истинной частоты порока.
При мультикистозной дисплазии почка, как правило, значительно увеличена в размерах, привычная форма и нормальная ткань отсутствуют. Почка представлена множественными кистами с анэхогенным содержимым. Размеры кист варьируют в достаточно широком диапазоне и зависят от срока беременности. При двустороннем процессе, как правило, отмечается маловодие.
Пренатальная ультразвуковая диагностика мультикистозной дисплазии почек
58 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Рис. 2.38. Увеличение размеров мочевого пузыря плода при атрезии уретры в 12 нед (а) и 16 нед (б) беременности [132].
обычно осуществляется со второй половины беременности. Так, L. Hernadi и М. Torocsik [32] при двукратном скрининговом обследовании 3991 пациентки в 11— 14 и 18—20 нед беременности отметили 3 случая мультикистозной дисплазии почек, из которых ни один не был диагностирован в ранние сроки беременности: у двух плодов диагноз был установлен в 18—20 нед, а у третьего — только в 31 нед беременности.
Однако в некоторых случаях мультики-стозную дисплазию почек удается обнаружить в более ранние сроки беременности. М. Bronshtein и соавт. [130] выявили муль-тикистозную дисплазию почек у плода в 12 нед беременности. В другом наблюдении
Рис. 2.39. Беременность 15 нед. а - эхограмма продольного сканирования плода; б — фенотип аборгуса.
Рис. 2.40. Беременность 11 нед 6 дней. У плода отчетливо видны расширенный мочевой пузырь и асцит [147].
диагноз был установлен при скрининговом ультразвуковом обследовании 1632 пациенток в 12— 14 нед беременности [13].
Мегацистик и синдром Prune-belly
Дилатация мочевого пузыря в ранние сроки беременности встречается у 0,06% плодов. При этом мегацистик констатиру-
НАЧАЛО ГЛАВЫ
------------------- 59
ОГЛАВЛЕНИЕ
2 глава
Таблица 2.4. Пренатальная ультразвуковая диагностика синдрома Prune-belly в ранние сроки беременности
Авторы бер Срок еменности, нед Данные эхографии Перинатальный исход
М. Bulic и соавт., 1987 [135] 14 Мегацистик Прерывание беременности
A. Drugan и соавт., 1989 [136] 12,5 Кистозное образование малого таза Роды в 35 нед, ребенок жив
R. Stiller, 1989 [137] 13 Мегацистик, гидронефроз Прерывание беременности
A. Ragno и соавт., 1991 [138] 15 Анэхогенное образование брюшной полости Роды в 37 нед, ребенок жив
J. Odita, 1992 [139] 15 Кистозное образование, мегалоуретер, гидронефроз Роды в 31 нед, ребенок умер
T. Shimizu и соавт., 1992 [140] 14 Анэхогенное образование брюшной полости Внутриутробная гибель
S. Freid и соавт., 1995 [141] 13 Кистозное образование Прерывание беременности
О.Л. Мальмберг и соавт., 1995 [142] 15 Мегацистик Прерывание беременности
R. MacMahon и соавт., 1995 [143] 14 Анэхогенное образование брюшной полости Роды в 34 нед, ребенок умер
14 Анэхогенное образование брюшной полости Роды в 34 нед, ребенок жив
14 Мегацистик Роды в 36 нед, ребенок жив
М. Yoshida и соавт., 1995 [144] 13 Анэхогенное образование брюшной полости Роды в 38 нед, ребенок жив
Е. Cazorla и соавт., 1997 [145] 13 Анэхогенное образование брюшной полости Прерывание беременности
T. Hoshino и соавт., 1998 [146] 12 Анэхогенное образование брюшной полости Прерывание беременности
И.В. Романовская, С.В. Шелковникова, 1999 [147] 11 Мегацистик, асцит Прерывание беременности
Н.Ю. Стручкова, 2000 [148] 15 Мегацистик Прерывание беременности
ют при увеличении продольного размера мочевого пузыря свыше 8 мм [131].
Мегацистик в ранние сроки беременности чаще всего является признаком обструктивного поражения мочевыводящих путей (синдром задних уретральных клапанов, атрезия уретры), хотя может иметь преходящий характер. При исследованиях, проведенных N. Sebire и соавт. [1311, в 7 из 15 случаев мегацистика, обнаруженного в 10—14 нед беременности, произошла спонтанная нормализация размеров мочевого пузыря с благоприятным перинатальным исходом. В 5 случаях беремен
ность по желанию пациенток была прервана в — 3 с хромосомными аномалиями, в 2 с прогрессирующим увеличением размеров мочевого пузыря плода. В 3 оставшихся наблюдениях отмечено самопроизвольное прерывание беременности.
А.А. Авраменко и соавт. [132] приводят описание наблюдения, в котором атрезия уретры была заподозрена уже в 12 нед беременности на основании обнаружения увеличения размеров мочевого пузыря. Через 4 нед приповторном обследованиипло-да отмечено значительное увеличение размеров его живота за счет мочевого пузыря.
60 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Дополнительно были выявлены расширение лоханок почек и маловодие (рис. 2.38).
Сивдром Prune-belly представляет собой сочетание трех основныхпризнаков: большого атоничного мочевого пузыря, гипотензии мышц передней брюшной стенки и крипторхизма. Частота синдрома prunebelly составляет в среднем 1 случай на 35 000—50 000 новорожденных [133].
Пренатальная эхографическая диагностика синдрома Prune-belly основывается на визуализации выраженной дилатации и гипертрофии стенок мочевого пузыря, истонченной перерастянутой передней брюшной стенки плода. Результатом синдрома может явиться мочевой асцит. Ряд других эхографических признаков зависит от степени выраженности синдрома.
Диагностировать синдром Prune-belly возможно с начала II триместра беременности [134]. В эти сроки основным эхогра
фическим признаком синдрома является выраженное увеличение размеров мочевого пузыря, который может занимать большую часть брюшной полости плода (рис. 2.39). К настоящему времени нам удалось найти 16 публикаций с данными о пренатальной диагностике синдрома Prune-belly до 16 нед беременности (табл. 2.4).
Как видно из данных, представленных в табл. 2.4, только в 5 из 16 случаев отмечены благоприятные исходы, в остальных наблюдениях произведено прерывание беременности либо констатированы перинатальные потери.
И.В. Романовская и С.В. Шелковнико-ва [ 147] представили описание одного из случаев наиболее раннейпренатальнойди-агностики синдрома Prune-belly. При ультразвуковом исследовании в 11 нед 6 дней у плода были обнаружены расширение мочевого пузыря до 18 мм и асцит (рис 2.40).
ОПОРНО-ДВИГАТЕЛЬНЫЙ АППАРАТ
При использовании трансвагинальной эхографии уже с 10—11 нед беременности удается оценить длинные кости конечностей, но пренатальная ультразвуковая диагностика скелетных дисплазий в конце I — начале II триместра вызывает большие трудности и удается только в единичных случаях. Тем не менее к настоящему времени описано немало наблюдений скелетных дисплазий, которые были диагностированы в ранние сроки беременности (табл. 2.5).
В большинстве наблюдений ранней пренатальной ультразвуковой диагностики скелетных дисплазий окончательное заключение о предположительной форме порока было сделано либо через несколько недель при динамическом эхографическом наблюдении, либо после прерывания беременности. Следует сказать, что во многих случаях скелетных дисплазий вначале, в ранние сроки беременности было отмечено расширение воротнико
вого пространства и только затем выявились характерные эхографические признаки аномалий опорно-двигательного аппарата.
В качестве примера целесообразно привести наблюдение М. Ben-Ami и соавт. [157]. При скрининговом ультразвуковом исследовании в 14 нед было обнаружено значительное расширение воротникового пространства до 5,8 мм, длина бедренных костей соответствовала 5-му процентилю фетометрических показателей, кариотип плода был нормальным. Только при повторном ультразвуковом исследовании в 22 нед были обнаружены специфические изменения грудной клетки и укорочение костей конечностей ниже 5-го процентиля, что соответствовало асфиксической дистрофии грудной клетки (синдром Жена).
Наряду с измерением длинных трубчатых костей конечностей плода для более точной диагностики формы пораже-
НАЧАЛО ГЛАВЫ
------------------- 61
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.41. Беременность 14 нед. Гшюфосфатазия. а — сагиттальное сканирование плода; б — поперечное сечение головы плода. Выраженное снижение эхогенности костей [166].
Рис. 2.42. Беременность 16 нед. Несовершенный остеогенез, а — эхограмма верхней конечности плода; б — эхограмма плечевой кости плода (стрелка).
ния необходимо проводить оценку эхогенности костей и их формы. При комплексном подходе в ранние сроки беременности удается обнаружить сложные поражения. Так, Т. Tongsong и S. Pongsatha [166] при обследовании плода в 14 нед выявили укорочение бедренных костей до 10 мм, больших берцовых
— до 9 мм, плечевых — до 8 мм со снижением их эхогенности, а также уменьшение оссификации ребер, позвоночника и черепа (рис. 2.41). Деформаций костей не отмечено. В связи с обнаруженными изменениями была заподозрена скелетная дисплазия, предположительно гипофос-фатазия, и проведен кордоцентез. При
62 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
Таблица 2.5. Пренатальная ультразвуковая диагностика скелетных дисплазий в ранние сроки беременности
Авторы Срок беремен- Скелетная дисплазия Данные эхографии
ности, нед
N. Fisk и соавт., 11 Ахондрогенез II типа Укорочение
1991 [149] М. Bronshtein, 14 Несовершенный конечностей, РВП Укорочение и искривление
Z. Weiner, 1992 [150] остеогенез II типа конечностей, гипо-
М. Dimaio и соавт., 13 Несовершенный минерализация черепа Укорочение и искривление конеч-
1993 [151] остеогенез II типа ностей, гипоминерализация черепа
L. Otano и соавт., 13 Синдром Робертса Тетрафокомелия
1993 [152] 10 Синдром Робертса Укорочение конечностей
Р. Soothill и соавт., 12 Ахондрогенез II типа Укорочение конечностей, РВП
1993 [153] R. Ajayi и соавт., 12 Деформационная акинезия Множественные контрактуры
1995 [154] К. Leung и соавт., 14 Синдром ЭЭДРН Олигодактилия, РВП
1995 [155] М.В. Медведев и 16 Несовершенный остеогенез Укорочение конечностей
соавт., 1996 [156] II типа микромелического типа
М. Ben-Ami и 14 Синдром Жена Длина бедренной кости
соавт., 1997 [157] S. Eliyahu и соавт., 12 Синдром Ярхо-Левина на уровне 5-го процентиля, РВП Дезорганизация
1997 [158] J. Hyett и соавт., 12 Деформационная акинезия позвоночника, РВП Множественные контрактуры,
1997 [159] L. Hernadi, 13 Ахондроплазия РВП Укорочение конечностей, РВП
и соавт., 1997 [32] N. den Hollander и 12 Остеохондродисплазия Укорочение конечностей,
соавт., 1997 [160] G. D’Ottavio и 13-15 Г ипофосфатазия аномальная грудная клетка, РВП Укорочение и снижение
соавт., 1997 [161] В. Petrikovsky и 11 Синдром Робертса эхогенности костей, РВП Тетрафокомелия, РВП
соавт., 1997 [162] L. Hill, J. Leary, 13 Синдром «короткие Аномальная грудная клетка,
1998 [163] ребра-полидактилия» I типа укорочение конечностей,
N. Den Hollander и 17 Синдром «короткие полидактилия, РВП Маленькая грудная клетка,
соавт., 1998 [164] ребра-полидактилия» IV типа укорочение костей конечностей
S. Gabrielli и 13 Несовершенный остеогенез Укорочение костей конечностей,
соавт., 1999 [165] 13 Ахондрогенез гипоминерализация костей Укорочение и искривление
15 Несовершенный остеогенез костей конечностей, выраженная гипоминерализация позвоночника Укорочение костей конечностей,
M. Valenzano и 16 Сиреномелия гипоминерализация костей Аномальное строение
соавт., 1999 [125] Т. Tongsong, 14 Г ипофосфатазия пояснично-крестцового отдела позвоночника, одна аномальная нога Укорочение конечностей,
S. Pongsatha, 2000 [166] Т. Tongsong и 16 Синдром тромбоцитопении- снижение эхогенности костей Отсутствие лучевых костей,
соавт., 2000 [167] отсутствия лучевой кости косолапость
Примечание. РВП - расширенное воротниковое пространство; синдром ЭЭДРН - синдром эктродактилии - эктодермальной дисплазии - расщелины неба.
НАЧАЛО ГЛАВЫ
------------------- 63
ОГЛАВЛЕНИЕ
2
глава
Рис. 2.43. Беременность 17 нед. Кампомелическая дисплазия. Стрелкой показана укороченная, искривленная бедренная кость.
положением ребер. Беременность была прервана, пренатальный диагноз полностью подтвержден.
При целенаправленном использовании трансвагинальной эхографии некоторым центрам пренатальной диагностики удается диагностировать аномалии пальцев кистей в ранние сроки беременности. Так, специалистам центра пренатальной диагностики Хайфы (Израиль) в 13—17 нед удалось в 6 случаях точно ус -тановить полидактилию, в 3 — синдактилию, в 9 — клинодактилию и скрещенные пальцы, в 2 — эктродактилию, в 2 — адактилию и в 1 наблюдении — афалан-гию.
анализе крови плода щелочной фосфатазы выявлено не было, на основании чего выставлен окончательный диагноз гипо-фосфатазии. По желанию пациентки беременность была прервана, пренатальный диагноз полностью подтвердился.
В наших наблюдениях наиболее ранний диагноз скелетных дисплазий был установлен в 16 и 17 нед беременности. В первом случае в 16 нед было обнаружено укорочение костей конечностей плода: бедренные кости были длиной 12 и 13 мм, большие берцовые — 10 мм, малые берцовые — 9 мм, плечевые — 8 и 9 мм, локтевые - 6 и 7 мм, лучевые — 6 и 7 мм (рис. 2.42). Кроме этого, были выявлены макроцефалия, сниженная эхогенность поясничного отдела позвоночника и ребер. На основании полученных данных установлен диагноз выраженной скелетной дисплазии. В 20 нед беременности произошел самопроизвольный выкидыш. При детальном осмотре абортуса диагностирован несовершенный остеогенез II типа. Во втором наблюдении в 17 нед были обнаружены характерные признаки кампомелической дисплазии: микромелия всех конечностей, кампомелия бедренных костей (рис. 2.43), узкая гипоплазированная грудная клетка с горизонтальным рас-
СПИСОК ЛИТЕРАТУРЫ
1. Warkany J. Congenital malformations: notes and comments. Chicago: Year Book, 1971.
2. Врожденные пороки развития: пренатальная диагностика и тактика / Под ред. Пет-риковского Б.М.. Медведева М.В.. Юдиной Е.В. М.: РАВУЗДПГ, Реальное Время, 1999.
3. Goldstein R.B., Filly R.A., Callen P.W. Sonography of anencephaly: pitfalls in early diagnosis // J. Clin. Ultrasound. 1989. V. 17. P. 397-402.
4. Rottem S., Bronshtein M., Thaler I., Brandes J.M. First trimester transvaginal sonographic diagnosis offetal anomalies//Lancet. 1989. № 1. p. 444-445.
5. Kennedy K.A., Flick K.J., Thurmond A.S. First-trimester diagnosis of exencephaly // Am. J. Obstet. Gynecol. 1990. V. 162. P. 461 463.
6. Bronshtein M., Ornoy A. Acrania: anencephaly resulting from secondary degeneration of a cloed neural tube: two cases in the same family //J. Clin. Ultrasound. 1991. V. 19. P. 230-234.
7. Демидов B.H., Стыгар A.M., Воеводин C.M., Литовский Ю.Р. Ультразвуковая диагностика аномалий развития в I триместре беременности // Советская Медицина. 1991. № 12. С. 25-28.
8. Цхай В.Б., Морозова А.А. Пренатальная ультразвуковая диагностика акрании // Ультразвук. Диагн. 1995. № 3. С. 51—53.
64 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
9. Проскурякова О.В., Липман А.Д., Черная М.В. Пренатальная диагностика экзэнце-фалии в конце первого триместра беременности //Ультразвук. Диагн. 1998. № 4. С. 56- 59.
10. Николаев Л.Т., Рябов И.И. Пренатальная ультразвуковая диагностика акрании у плода в I триместре беременности // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 3. С. 233-234.
11. Басист И. М., Романовская И. В. Ультразвуковая диагностика врожденных пороков центральной нервной системы в I триместре беременности // Ультразвук. Диагн. Акуш. Гин. Педиат. 2000. Т. 8. № 2. С. 143 144.
12. Cullen М.Т., Green J., Whetham J. et al. Transvaginal ultrasonographic detection of congenital anomalies in the first trimester // Am. J. Obstet. Gynecol. 1990. V. 163. P. 466— 476.
13. Pajkrt E., van Eith Mol B.W.J. et al. Screening for Down’s syndrome by fetal nuchal translucency measurement in a general population // Ultrasound Obstet. Gynecol. 1998. V. 12. P. 163-169.
14. Chatzipapas I.K., Whitlow B.J., Economides D.L. The ‘Mickey Mouse’ sign and the diagnosis of anencephaly in early pregnancy // Ultrasound Obstet. Gynecol. 1999. V. 13. № 3. P. 196-199.
15. Johnson S.P.. Sebire N.J.. Snijders R.J.M. et al. Ultrasound screening for anencephaly at 1 fl-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1997. V. 9. № 1. P. 14-16.
16. Toth Z., Csecsei K., Szeifert G. et al. Early prenatal diagnosis of cyclopia associated with holoprosencephaly //J. Clin. Ultrasound. 1986. V. 14. P. 550-553.
17. Nyberg D.A, Mack L.A, Bronstein A. et al. Holoprosencephaly: prenatal sonographic diagnosis I I Am. J. Roentgenol. 1987. V. 149. P. 1051 1058.
18. Bronshtein M., Wiener Z. Early transaginal sonographic iagnosis of alobar holoprosencephaly // Prenat. Diagn. 1991. V. 11. P. 459-462.
19. Gonzales-Gomes F., Satamanca A, Padilla M.C. et al. Alobar holoprosencephalic embryo
detected via transaginal sonography // Eur. J. Obstet. Gynecol. Reprod. Biol. 1992. V. 47. P. 266 270.
20. Nelson L.H., King M. Early diagnosis of holoprosencephaly// J. Ultrasound Med. 1992. V. 11. P. 57-59.
21. Sakala E.P., Gaio K.L. Fundal uterine leiomyoma obscuring first-trimester transabdominal sonographic diagnosis of fetal holoprosencephaly// J. Reprod. Med. 1993. V. 38. P. 400-402.
22. Achiron R., Achiron A. Transvaginal fetal neurosonography: the first trimester of pregnancy // Ultrasound and the Fetal Brain / Eds. Chervenak F.A, Kurjak A, Comstock C.H. L.: Parthenon Publ., 1995. P. 95-108.
23. Gembruch U., Baschat AA, Reusche E. et al. First-trimester dagnosis of holoprosencephaly with a Dandy-Walker malformation by transvaginal ultrasonography //J. Utrasound Med. 1995. V. 14. P. 619 -622.
24. van Zalen-Sprock R., van Vugt J., Harten H. et al. First trimester diagnosis of cyclopia and holoprosencephaly// J. Ultrasound Med. 1995. V. 14. P. 631-633.
25. Parant O., Sarramon M.F., Delisle M.B., Fournie A. Prenatal diagnosis of holoprosencephaly. A series of twelve cases // J. Gynecol. Obstet. Biol. Reprod. 1997. V. 26. P. 687-696.
26. Thilaganathan B., Slack A., Wathen N.C. Effect offirst-trimester nuchal translucency on second-trimester maternal serum biochemical screening for Down’s syndrome //Ultrasound Obstet. Gynecol. 1997. V. 10. №4. P. 261 -264.
27. Turner C.D., Silva S., Jeanty P. Prenatal diagnosis of alobar holoprosencephaly at 10 weeks of gestation // Ultrasound Obstet. Gynecol. 1999. V. 13. P. 300-302.
28. Wong H.S.. Tang M.H.Y.. Yan K.W.. Cheung L.W.K. Histological findings in a case of alobar holoprosencephaly diagnosed at 10 weeks of pregnancy // Prenat. Diagn. 1999. V. 19. № 9. P. 859-862.
29. Wong H.S., Lam Y.H., Tang M.H.Y. et al. First-trimester ultrasound diagnosis of holoprosencephaly: three case reports // Ultrasound Obstet. Gynecol. 1999. V. 13. № 5. P. 356- 359.
НАЧАЛО ГЛАВЫ
------------------- 65
ОГЛАВЛЕНИЕ
2 глава____________________________________
30. Blaas H.-G.K., Eik-Nes S.H., Vainio T., Vogt Isaksen C. Alobar holoprosencephaly at 9 weeks gestation age visualized by two- and three-dimensional ultrasound // Ultrasound Obstet. Gynecol. 2000. V. 15. № 1. P. 62-65.
31. Lai Т.-H., Chang С.-H., Yu C.-H. et al. Prenatal diagnosis of alobar holoprosencephaly by two-dimensional and three-dimensional ultrasound// Prenat. Diagn. 2000. V. 20. № 5. p. 400-403.
32. Hernadi L., Torocsik M. Screening for fetal anomalies in the 12th week of pregnancy by transvaginal sonography in an unsele cte d population // Prenat. Diagn. 1997. V. 17. P. 753— 759.
33. D’Ottavio G., Meir Y.J.. Rustico M.A. et al. Pilot screening for fetal malformations: possibilities and limits of transvaginal sonography//J. Ultrasound Med. 1995. V. 14. № 8. P. 575- 580.
34. Economides D.L., Braithwaite J.M. First trimester ultrasonographic diagnosis of fetal structural abnormalities in low risk poulation / / Br. J. Obstet. Gynaecol. 1998. V. 105. P. 53-57.
35. Медведев M.B., Юдина E.B. Дифференциальная ультразвуковая диагностика в акушерстве. М.: Видар, РАВУЗДПГ, 1997.
36. vanZalen-SprockR.M.,vanVugt J.M.G.,van Geijn H.P. First-trimester sonographic detection of neurode ve lopmental abnormalities in some single-gene disorders//Prenat. Diagn. 1996. V. 16. P. 199-202.
37. Bronshtein M., Zimmer E.Z. Transvaginal sonographic follow-up on the formation of fetal cephalocele at 13 19 weeks’ gestation // Obstet. Gynecol. 1991. V. 78. P. 528-530.
38. PachiA., GiancottiA., TorciaF. etal. Meckel-Gruber syndrome: ultrasonographic diagnosis at 13 weeks’ gestational age in an at risk case // Prenat. Diagn. 1989. V. 9. P. 187 190.
39. Sepulveda W., Sebire N.J., Souka A. et al. Diagnosis of the Meckel-Gruber syndrome at eleven to fourteen weeks’ gestation // Am. J. Obstet. Gynecol. 1997. V. 176. P. 316-319.
40. Bronshtein M., Stahl S., Zimmer E.Z. Transvaginal sonographic diagnosis of fetal finger abnormalities in early gestation //J.
Ultrasound Med. 1995. V. 14. № 8. P. 591 -595.
41. Sherer D.M., Hearn-Stebbins B., Harvey W. et al. Endovaginal sonographic diagnosis of iniencephaly apertus and craniorachischisis at 13 weeks, menstrual age // J. Clin. Ultrasound. 1993. V. 21. P. 124-127.
42. Флоренсова E.B., Апарцин M.C. Случай пренатальной диагностики иниэнцефалии в начале второго триместра беременности // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 4. С. 332-334.
43. Russ Р., Pretorius D., Johnson М. Dandy-Walker syndrome: a review of 15 cases evaluated by prenatal sonography // Am. J. Obstet. Gynecol. 1989. V. 161. P. 401-406.
44. Юдина E.B., Медведева М.В. Перинатальные исходы при врожденных пороках развития. III. Синдром Денди-Уокера //Ультразвук. Диагн. Акуш. Гин. Педиат. 2000. Т. 8. №4. С. 266-271.
45. Murray J., Johnson J., Bird T. Dandy-Walker malformation: etiologic heterogeneity and empiric recurrence risks // Clin. Genet. 1985. V. 28. P. 272-283.
46. Achiron R., Achiron A. Transvaginal ultrasonic assessment of the early fetal brain // Ultrasound Obstet. Gynecol. 1991. V. 1. P. 336-344.
47. Ulm B., Ulm M., Deutinger J., BernaschekG. Dandy-Walker malformation diagnosed before 21 weeks of gestation: associated malformations and chromosomal abnormalities// Ultrasound Obstet. Gynecol. 1997. V. 10. P. 167 170.
48. Lin Y., Chang F., Liu C. Antenatal detection of hydranencephaly at 12 weeks, menstrual age //J. Clin. Ultrasound. 1992. V. 20. P. 62-64.
49. Lam Y.H., Tang M.H.Y. Serial sonographic features of a fetus with hydranencephaly from 11 weeks to term // Ultrasound Obstet. Gynecol. 2000. V. 16. № 1. P. 77-79.
50. AmmalaP., SalonenR. First-trimester diagnosis of hydrolethalus syndrome // Ultrasound Obstet. Gynecol. 1995. V. 5. № 1. P. 60- 62.
51. Greenberg F., James L., Oakley G. Estimates of birth prevalence rates of spina bifida in the United States from computer generated maps // Obstet. Gynecol. 1983. V. 145. P. 570-573.
52. Nicolaides K.H.. Sebire N.J.. Snijders R.J.M.
66 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
The 11 14-week scan. The diagnosis of fetal abnormalities. NY, T.: The Parthenon Publ. Gr., 1999.
53. BlumenfeldZ., Siegler E., Bronshtein M. The early diagnosis of neural tube defects // Prenat. Diagn. 1993. V. 13. P. 863-871.
54. Sebire N.J., Noble P.E., Thorpe-Beeston J.G. et al. Presence ofthe ‘lemonsign’ infetuseswith spina bifida at the 10-14 week scan // Ultrasound Obstet. Gynecol. 1997. V. 10. P. 403-405.
55. Blaas H.-G.K., Eik-Nes S.H., Isaksen C.V. The detection of spina bifida before 10 gestational weeks using two- and three-dimensional ultrasound // Ultrasound Obstet. Gynecol. 2000. V. 16. № 1. P. 25-29.
56. Voevodin S.M. Echographic diagnosis of chellognathopalatoschesis at the first trimester fetus I I Ultrasound Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 158.
57. Bronshtein M., Zimmer E.Z., Offir El., Blazer S. Fetal mustache in early pregnancy // Ultrasound Obstet. Gynecol. 1998. V. 12. № 4. P. 252-253.
58. Ibba R.M., Corda A., Zoppi M.A. et al. Cerebro-costo-mandibular syndrome: early sonographic prenatal diagnosis // Ultrasound Obstet. Gynecol. 1997. V. 10. № 2. P. 142 144.
59. De Catte L., Laubach M., Legein J., Goossens A. Early prenatal diagnosis of oculoauriculovertebral dysplasia or the Goldenhar syndrome // Ultrasound Obstet. Gynecol. 1996. V. 8. № 6. P. 422-424.
60. Gull I., Wolman I., Har-Toov J. et al. Antenatal sonographic diagnosis of epignathus at 15 weeks of pregnancy // Ultrasound Obstet. Gynecol. 1999. V. 13. №4. P. 271-273.
61. Byrne J., Blank W.A., Warburton D. et al. The significance of cystic hygroma in fetuses // Hum. Pathol. 1984. V. 15. P. 61.
62. Стыгар A.M. Пренатальная ультразвуковая диагностика патологии лимфатической системы плода Ц Ультразвук. Диагн. Акуш. Тин. Педиат. 1994. № 3. С. 31 -39.
63. Снайдере Р.Дж.М., Николаидес К.Х. Ультразвуковые маркеры хромосомных дефектов плода. М.: Видар, 1997.
64. Du J., Qu L.. Guo S. Prenatal diagnosis of fetal
nuchal cystic hygroma in 22 cases // Chung Hua Fu Chan Ko Tsa Chih. 1997. V. 32. № 7. P. 425-427.
65. Юдина Е.В. Роль эхографии в формировании показаний к пренатальному кариоти-пированию Ц Ультразвук. Диагн. 1998. № 1. С. 42-50.
66. Azar G., Snijders R.J.M.. Gosden С.М.. Nicolaides K.H. Fetal nuchal cystic hygromata: associated malformations and chromosomal defects//Fetal Diagn. Then 1991. V. 6. P. 46-57.
67. DeVore G., Steiger R.M., Larson E.J. Fetal echocardiography: prenatal diagnosis of a ventricular septal defect in a 14 week fetus with pulmonary artery hypoplasia // Obstet. Gynecol. 1987. V. 69. P. 494-497.
68. Медведев M.B., Алтынник H.A., Никитин C.B. Трансвагинальная эхокардиография / / Эхокардиография плода / Под ред. Медведева М.В. М.: РАВУЗДПГ, 2000. С. 131— 142.
69. Медведев М.В., Давыдов А.И. Эхографическая трансвагинальная диагностика омфалоцеле в первом триместре беременности // Ультразвуковая диагностика в перинатологии (тезисы докладов). М., 1989. С. 90.
70. Gembruch U., Knoptle G., Chatterjee M. et al. First-trimester diagnosis of fetal congenital heart disease by transvaginal two-dimensional and Doppler echocardiography // Obstet. Gynecol. 1990. V. 75. P. 496-498.
71. Bennett T.L., Burlbaw J., Drake C.K. et al. Diagnosis of ectopia cordis at 12 weeks gestation using transabdominal ultrasonography with color flow Doppler //J. Ultrasound Med. 1991. V. 10. P. 695—696.
72. Bronshtein M., Blumenfeld Z., Drugan A. et al. Detection of fetal cardiac malformations by transvaginal sonography in the first and early second trimester // Ultrasound Obstet. Gynecol. 1991. V. 1. Suppl. 1. P. 85.
73. Gembruch U., Knopfle G., Bald R., Hansmann M. Early diagnosis of fetal congenital heart disease by transvaginal echocardiography // Ultrasound Obstet. Gynecol. 1993. V. 3. P. 310-317.
НАЧАЛО ГЛАВЫ
------------------- 67
ОГЛАВЛЕНИЕ
2 глава_____________________________________
74. Sepulveda W., Weiner E., Bower B. et al. Ectopia cordis in triploid fetus: first-trimester diagnosis using transvaginal color Doppler ultrasonography and chorionic villus sampling //J. Clin. Ultrasound. 1994. V. 22. P. 573- 575.
75. Cullen M.T., Green J.J., Scioscia A.L. et al. Ultrasonography in the dete ction of aneuploidy in the first trimester //J. Ultrasound Med. 1995. V. 14. № 8. P. 559-563.
76. Rustico M.A., Benettoni A, Bussani R. et al. Fetal tricuspid valve dysplasia and pulmonary atresia at 14 weeks//J. Ultrasound Med. 1995. V. 14. № 8. P. 623-625.
77. Rustico M.A., Benettoni A, Bussani R. et al. Early fetal endocardial fibrooelastosis and critical aortic stenosis: a case report // Ultrasound Obstet. Gynecol. 1995. V. 5. № 3. P. 202-205.
78. Tegnander E., Eik-Nes S.EL, Johansen O.J., Linker D.T. Prenatal detection of heart defects at the routine fetal examination at 18 weeks in a non-selected population // Ultrasound Obstet. Gynecol. 1995. V. 5. № 6. P. 372-380.
79. van Zalen-Sprock R.M.. van Vugt J.M., van Geijn H.P. First and early second trimester diagnosis of anomalies of the central nervous system // J. Ultrasound Med. 1995. V. 14. № 8. P. 603-610.
80. Allan L.D., Anderson R.H., Cook AC. Atresia or absence of the left-sided atrioventricular connection in the fetus: echocardiographic diagnosis and outcome // Ultrasound Obstet. Gynecol. 1996. V. 8. № 5. P. 295-302.
81. Gembruch U., Baschat A.A., Knopfle G., Hansmann M. First- and early second-trimester diagnosis of fetal cardiac anomalies / / Ultrasound and the Fetal Heart / Eds. Wladimiroff J.W., Pilu G. NY, London: The Parthenon Publ. Gr., 1996. P. 39—46.
82. Hornberger L.K.. Need L., Benacerraf B.R. Development of significant left and right ventricular hypoplasia in the second and third trimester fetus // J. Ultrasound Med. 1996. V. 15. № 9. P. 655-659.
83. Bronshtein M., Zimmer E.Z. Early sonographic diagnosis of fetal small left heart ventricle with a normal proximal outlet tract: a medical dilemma//Prenat. Diagn. 1997. V. 17.
№ 3. P. 249-253.
84. Chaoui R., Tennstedt C., Goldner B., Bollmann R. Prenatal diagnosis of ventriculo-coronary communications in a second-trimester fetus using transvaginal and transabdominal color Doppler sonography // Ultrasound Obstet. Gynecol. 1997. V. 9. № 3. P. 194-197.
85. Hyett J.A., Perdu M., Sharland G.K. et al. Using fetal nuchal translucency to screen for major congenital cardiac defects at 10- 14 weeks of gestation: population based cohort study // Br. Med. J. 1997. V. 318. P. 81 85.
86. Liang R.L, Huang S.E., Chang F.M. Prenatal diagnosis of ectopia cordis at 10 weeks of gestation using two-dimensional and three-dimensional ultrasonography // Ultrasound Obstet. Gynecol. 1997. V. 10. № 2. P. 137-139.
87. Areias J.C., Matias A., Montenegro N., Brandao O. Early antenatal diagnosis of cardiac defects using transvaginal Doppler ultrasound: new perspectives? //Fetal Diagn. Then 1998. V. 13. P. 111-114.
88. Bronshtein M.. Zimmer E.Z. Sonographic diagnosis of fetal coarctation of the aorta at 14 16 weeks of gestation // Ultrasound Obstet. Gynecol. 1998. V. 11. № 4. P. 254-257.
89. Henrich W., Horstkamp B., Brauer M. et al. Prenatal color Doppler of cardiac anomalies in conjoined twins //Fetal Diagn. Ther. 1998. V. 13. Suppl. 1. P. 149.
90. Lam Y.H., Tang M.H.. Yuen S.T. Ultrasound diagnosis of fetal diaphragmatic hernia and complex congenital heart disease at 12 weeks’ gestation - a case report // Prenat. Diagn. 1998. V. 18. № H.P. 1159 1162.
91. Matias A, Montenegro N., Areias J.C., Brandao O. Anomalous fetal venous return associated with major chromosomopathies in the late first trimester of pregnancy // Ultrasound Obstet. Gynecol. 1998. V. 11. № 3. P. 209-213.
92. Bognoni V., Quartuccio A., Quanuccio A. First-trimester sonographic diagnosis of Cantrell’s pentalogy with exencephaly //J. Clin. Ultrasound. 1999. V. 27. № 5. P. Tib— 278.
93. Рябов И.И. Случай ранней пренатальной
68 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
диагностики эктопии сердца//Ультразвук. Диагн. Акуш. Гинек. Педиат. 1999. Т. 7. № 2. С. 152-153.
94. Guschmann М., Horn D., Gasiorek-Wiens А. et al. Ellis-van Greve Id syndrome: examination at 15 weeks’ gestation // Prenat. Diagn. 1999. V. 19. № 9. P. 879-883.
95. Lam Y.H., Tang M.H. Y. Sonographic features of fetal trisomy 18at 13 and 14 weeks: four case reports // Ultrasound Obstet. Gynecol. 1999. V. 13. № 5. P. 366-369.
96. Никитин C.B. Пренатальная трансвагинальная ультразвуковая диагностика обще -го артериального ствола в I триместре беременности Ц Ультразвук. Диагн. Акуш. Гинек. Педиат. 2000. Т. 8. № 1. С. 73—74.
97. Martinez J.M., Puerto В., BorrellA. etal. Early fetal echocardiography: a new challenge in prenatal diagnosis // 10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21, 2000. P. 272.
98. Puerto B., Martinez J.M., BorrellA. et al. Fetal echocardiography in chromosomlly normal fetuses with increased nuchal translucency. A preliminary report // Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 91.
99. Yamasaki A., Pedreira D.A.L., Muller R. et al. First trimester diagnosis of the Pentalogy of Cantrell //Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 91.
100. Cullen M.T., Green J., Whetham J. et al. Transvaginal ultrasonografic detection of congrnital anomalies in the first trimester // Am. J. Obstet. Gynecol. 1990. V. 163. P. 466— 476.
lOl. Achiron R., Tadmor O. Screening for fetal anomalies during the first trimester of pregnancy: transvaginal versus transabdominal sonography // Ultrasound Obstet. Gynecol. 1991. V. 1. № 3. P. 186-191.
102. Медведев M.B., Золотухина T.B., Мальм-бергО.Л. Эхографические маркеры хромосомной патологии // Ультразвук. Диагн. Акуш. Гинек. Педиат. 1993. № 2. С. 15—30.
103. Harrison M.R., Adzick N.S., Estes J.M., Howell I. J. Aprospective study of the outcome for fetuses with diaphragmatic hernia // JAMA. 1994. V. 271. P. 382-384.
104. Bocian M., Spence M.A., Marazita M.L. et al. Familial diaphragmatic defects: early prenatal diagnosis and evidence for major gene inheritance // Am. J. Med. Genet. 1986. V. 2. P. 163-166.
105. Jauniaux E., Hertzkovitz R., Hall J.M. First-trimester prenatal diagnosis of a thoracic cystic lesion associated with fetal skin edema // Ultrasound Obstet. Gynecol. 2000. V. 15. № 1. P. 74-77.
106. Snijders R.J.M., Nicolaides K.H. Ultrasound markers for fetal chromosomal defects. NY, L.: The Parthenon Publshing Gr., 1997.
107. Calzolari E., Bianchi F., Dolk H., Milan M. EUROCAT Working Group. Omphalocele and gastroschisis in Europe: a survey of 3 million births 1980-1990 //Am. J. Med. Genet. 1995. V. 58. P. 187-194.
108. Souka A.P., SnijdersRJ.M., NovakovA. et al. Defects and syndromes in chromosomally normal fetuses with increased nuchal translucency thickness at the 10-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1998. V. 11. №6. P. 391-400.
109. Pagliano M., Mossetti M., Ragno P. Echographic diagnosis of omphalocele in the first trimester of pregnancy // J. Clin. Ultrasound. 1990. V. 18. P. 658 660.
HO.Snijders R.J.M., Brizot M.L., Faria M., Nicolaides K.H. Fetal exomphalos et 11 to 14 weeksofgestation//J. Ultrasound Med. 1995. V. 14. P. 569-574.
Ill .van Zalen- Sprock R. M., van Vugt J. M. G., van Geijn H.P. First-trimester sonography of phisiological midgut herniation and early diagnosis of omphalocele // Prenat. Diagn. 1997. V. 17. P. 511 518.
112. Schmidt W., Kubli F. Early diagnosis of severe congenital malformations by ultrasonography //J. Perinat. Med. 1982. V. 10. P. 233-241.
H3.S nijders R.J.M., Sebire N.J., Souka A. et al. Fetal exomphalos and chromosomal defects: relationship to maternal age and gestation // Ultrasound Obstet. Gynecol. 1995. V. 6. P. 250- 255.
H4.C alzolari E., Bianchi F., Dolk H., Milan M. EUROCAT Working Group. Omphalocele and gastroschisis in Europe: a survey of 3
НАЧАЛО ГЛАВЫ
------------------- 69
ОГЛАВЛЕНИЕ
2
глава
million births 1980-1990//Am. J. Med. Genet. 1995. V. 58. P. 187-194.
115.Guzman E.R. Early prenatal diagnosis of gastroschisis with transvaginal ultrasonography // Am. J. Obstet. Gynecol. 1990. V. 162. P. 1253-1254.
Иб.Мапп L., Ferguson-Smith M.A., Desai M. et al. Prenatal assessment of anterior abdominal wall defects and their prognosis // Prenat. Diagn. 1984. V. 4. P. 427-435.
H7.Daskalakis G., Sebire N., Jurkovic D. et al. Body stalk anomaly at 10-14 weeks of gestation //UltrasoundObstet. Gynecol. 1997. V. 10. № 6. P. 416-418.
H8.Bernstein J., Risdon R.A., Gilbert-Barnes E. Renal system // Potters pathology of the fetus and infant / Ed. Gilbert-Barnes E. St. Louis: Mosby, 1997. P. 863-935.
119 .Reuss A., Wladimiroff J.W., Wijngaard J.A. et al. Fetal renal anomalies: a diagnostic dilemma in the presence of intrauterine growth retardation and oligohydramnios // Ultrasound Med. Biol. 1987. V. 13. P. 619.
120 . Scott J.E., Renwick M. Urological anomalies in the Northern Region Fetal Abnormality Survey // Arch. Dis. Child. 1993. V. 68 (Suppl.). P. 22.
121 .Wladimiroff J.W., Heydanus R., Stewart P.A. et al. Fetal renal artery flow velocity waveforms in the presence of congenital renal tract anomalies//Prenat. Diagn. 1993. V. 13. P. 545.
122 .DeVore G.R. The value of color Doppler sonography in the diagnosis of renal agenesis / /J. Ultrasound Med. 1995. V. 14. № 6. P. 443 449.
123 .Медведев M.B., Алтынник H.A. Применение допплерэхографии при экстракарди-альных аномалиях у плода // Допплерография в акушерстве / Под ред. Медведева М.В., Курьяка А., Юдиной Е.В. М.: РА-ВУЗДПГ, Реальное Время, 1999. С. ИЗ 144.
124 . Bronshtein М., Amit A., Archiron R. et al. The early prenatal sonographic diagnosis of renal agenesis: techniques and possible pitfalls // Prenat. Diagn. 1996. V. 14. P. 291—297.
125 .Valenzano M., Paoletti R., Rossi A. et al. Sirenomelia. Pathological features, antenatal
ultrasonographic clues, and a review of current embryogenic theories // Hum. Reprod. Update. 1999. V. 5. № 1. P. 82 86.
126 .Larroche J.C. Development pathology of the neonate. Amsterdam: Excerpta Medica, 1977.
127 .Wisser J., HebischG., FrosterU. et al. Prenatal sonographic diagnosis of autosomal recessive polycystic kidney disease during the early second trimester//Prenat. Diagn. 1993. V. 15. P. 686 871.
128 .Bronshtein M., Bar-Hava I., Brumenfeld Z. Clues and pitfalls in the early prenatal diagnosis of late onset infantile polycystic kidney // Prenat. Diagn. 1992. V. 12. P. 293—298.
129 .Волков A.E. Максимально ранняя ультразвуковая диагностика поликистоза почек инфантильного типа // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 4. С. 335 336.
130 .Bronshtein М., Yoffe N., Brandes J.M., Brumenfeld Z. First and early second-trimester diagnosis of fetal urinary tract anomalies using transvaginal sonography // Prenat. Diagn. 1990. V. 10. P. 653-666.
131 .Sebire N.J., Von Kaisenberg C., Rubio C. et al. Fetal megacystis at 10-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1996. V. 8. P. 387-390.
132 .Авраменко A.A., Петрова B.H., Молчанов B.B. Случай пренатальной диагностики атрезии уретры в конце I триместра беременности // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 4. С. 337-339.
133 .Sanders R.S., Nussbaum A.R., Solez К. Renal dysplasia: sonographic findings // Radiologi. 1988. V. 167. P. 623 626.
134 .Медведев M.B., Веропотвелян Н.П. Ультразвуковая пренатальная диагностика врожденных пороков мочеполовой системы //Клиническое руководство по ультразвуковой диагностике / Под ред. Митько-ва В.В., Медведева М.В. Т. II. М.: Видар; 1996. С. 205-226.
135 .Bulic М., Podobnik М., Korenic В., Bistricki J. First-trimester diagnosis of low obstructive uropathy: an indicator of initial renal function in the fetus // J. Clin. Ultrasound. 1987. V. 15. P. 537-541.
70
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ПРЕНАТАЛЬНАЯ ДИАГНОСТИКА ПОРОКОВ РАЗВИТИЯ В 10-16 НЕДЕЛЬ
136 .Drugan A., Zador I.E., Bhatia R.K. et al. First-trimester diagnosis and early in utero treatment of obstructive uropathy // Acta Obstet. Gynecol. Scand. 1989. V. 68. P. 645-649.
137 .Stiller R. Early ultrasonic appearance of fetal bladder outlet obstruction // Am. J. Obstet. Gynecol. 1989. V. 160. P. 584-585.
138 .Ragno AM., Maffioli G.F.. Ercoli A. et al. One case of prune belly syndrome: prenatal and prognostic evaluation // Clin. Exp. Obstet. Gynecol. 1991. V. 18. P. 153-157.
139 .Odita J.C. Megalourethra associated with complete urethral obstruction and seen on antenatal ultrasound as a cystic mass // Pediatr. Surg. Int. 1992. V. 7. P. 154-155.
140 . Shimizu T., Ihara Y.. Yomura W. et al. Antenatal diagnosis of prune belly syndrome // Arch. Gynecol. Obstet. 1992. V. 251. P. 211-214.
141 .Freid S., Appelman Z., Caspi B. The origin of ascites in prune-belly syndrome early sonographic evidence // Prenat. Diagn. 1995. V. 15. P. 876-877.
142 .Мальмберг О.Л., Шилова ELB., Мамченко С.И. и др. Пренатальная диагностика синдрома prune belly // Ультразвук. Диагн. 1995. № 3. С. 36-40.
143 .MacMahon R.A., Renou Р.М., Shekleton Р.А., Paterson Р. J. Severe urethral obstruction diagnosed at 14 weeks’ gestation: variability of outcome with and without drainage // Fetal Diagn. Then 1995. V. 10. P. 343- 348.
144 .Yoshida M., Matsumura M., Shintaku Y. et al. Prenatally diagnosed female prune belly syndrome associated with tetralogy of Fallot // Gynecol. Obstet. Invest. 1995. V. 39. P. 141 — 144.
145 .Cazorla E., Ruiz F., Abad A., Monleon J. Prune-belly syndrome: early antenatal diagnosis // Eur. J. Obstet. Gynecol. Reprod. Biol. 1997. V. 72. P. 31-33.
146 .Hoshino T., Ihara Y., Shirane H., Ota T. Prenatal diagnosis of prune belly syndrome at 12 weeks of pregnancy: case report and review ofthe literature //UltrasoundObstet. Gynecol. 1998. V. 12. № 5. P. 362-366.
147 .Романовская И.В., Шелковникова С.В. Дилатация мочевого пузыря плода в первом триместре беременности // Ультразвук.
Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 2. С. 157- 158.
148 .Стручкова Н.Ю. Значение эхографии в пренатальной диагностике патологии мочевыделительной системы: Дисс. ... канд. мед. наук. М., 2000.
149 .Fisk N.M., Vaughan J., Smidt M., Wigglesworth J. Transvaginal ultrasonound recognition of nucal oedema in the fisttrimester diagnosis of achondrogenesis //J. Clin. Ultrasound. 1991. V. 9. P. 588 590.
150 .Bronshtein M., Weiner Z. Anencephaly in a fetus with osteogenesis imperfecta: early sonographic diagnosis by transvaginal sonography // Prenat. Diagn. 1992. V. 12. P. 831-834.
151.Dimaio M.S., Bart R., Koprivnikar K. et al. First trimester prenatal diagnosis of osteogenesis imperfecta type 2 by DNA analysis and sonography//Prenat. Diagn. 1993. V. 13. P. 589-596.
152.Otano L., Matayoshi T., Lippold S. et al. Robetrs syndrome: first trimester prenatal diagnosis by cytogenetics and ultrasound in affected and non-affected pregnancies // Am. J. Hum. Genet. 1993. V. 53. P. 1445.
153.Soothill P.W., Vuthiwong C., Rees H. Achondrogenesis type 2 diagnosed by tansvaginal ultrasonound at 12 weeks of gestation//Prenat. Diagn. 1993. V. 13. P. 523— 528.
154.Ajayi R.A.. KeenC.E.. Knott P.D. Ultrasound diagnosis of the Pena Shokeir phenotype at 14 weeks of pregnancy // Prenat. Diagn. 1995. V. 15. P. 762-764.
155.Leung K.Y., MacLachlanNA., SepulvedaW. Prenatal diagnosis of ectrodactyly: the ‘lobster claw’ anomaly // Ultrasound Obstet. Gynecol. 1995. V. 6. P. 443-446.
156.Медведев M.B.. Мальмберг О. Л.. Железин-ская Л.С. и др. Пренатальная диагностика несовершенного остеогенеза II типа в начале второго триместра беременности // Ультразвук. Диагн. 1996. № 4. С. 58 61.
157.Ben-Ami М., Perlitz Y., Haddad S., Matilsky M. Increase d nuchal translucency is associate d with asphyxiating thoracic dysplasia // Ultrasound Obstet. Gynecol. 1997. V. 10. P.
НАЧАЛО ГЛАВЫ
------------------- 71
ОГЛАВЛЕНИЕ
2
глава
297-298.
158.Eliyahu S., Weiner E., Lahav D., Shalev E. Early sonographic diagnosis of Jarcho-Levin syndrome: a prospective screening program in one family // Ultrasound Obstet. Gynecol. 1997. V. 9. P. 314-318.
159-EIyett J., Noble P., Sebire N.J. et al. Lethal congenital arthrogryposis presents with increased nuchal translucency at 10-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1997. V. 9. P. 310-313.
160 .Den Hollander N.S., van der Harten H.J., Vermeij-Keers C. et al. First trimester diagnosis of blomstrand lethal osteochondro-dysplasia / /Am. J. Med. Genet. 1997. V. 73. P. 345-350.
161 .D’Ottavio G., Meir Y.J.. Rustico M.A. et al. Screening for fetal anomalies by ultrasound at 14 and 21 weeks // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. P. 375-380.
162 .Petrikovsky B.M., Gross B., Bialer M. et al. Prenatal diagnosis of pseudothalidomide syndrome in consecutive pregnancies of a consanguineous couple // Ultrasound Obstet.
Gynecol. 1997. V. 10. P. 425-428.
163 .Hill L.M., Leary J. Transvaginal sonographic diagnosis of short-rib polydactyly dysplasia at 13 weeks’ gestation // Prenat. Diagn. 1998. V. 18. № 11. P. 1198-1201.
164 .Den Hollander N.S., van der Harten H.J., Laudy J.A. et al. Early transvaginal ultrasonographic diagnosis of Beemer-Langer dysplasia: a report of two cases // Ultrasound Obstet. Gynecol. 1998. V. 11. № 4. P. 298-302.
165 .Gabrielli S., Falco P., Pilu G. et al. Can transvaginal fetal biometry be considered a useful tool for early detection of skeletal dysplasias in high-risk patients? // Ultrasound Obstet. Gynecol. 1999. V. 13. P. 107-111.
166 .Tongsong T.. Pongsatha S. Early prenatal sonographic diagnosis of congenital hypophosphatasia // Ultrasound Obstet. Gynecol. 2000. V. 15. № 3. P. 252-255.
167 .Tongsong T., Sirichotiyakul S., Chanprapaph P. Prenatal diagnosis of thrombocytopenia-absent-radius syndrome // Ultrasound Obstet. Gynecol. 2000. V. 15. № 3. P. 256-258.
72 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ХРОМОСОМНЫЕ АНОМАЛИИ
Н.А. Алтынник, Е.В. Юдина, М.В. Медведев
В начале 90-х годов в литературе стали мелькать сообщения о новом эхографическом признаке, характерном для I триместра беременности. Расширенная гипо-эхогенная зона в области шеи плода привлекла внимание врачей ультразвуковой диагностики потому, что была отмечена тесная связь между этим эхографическим феноменом и хромосомной патологией плода. В первых публикациях необычное явление авторы описывали как nuchal oedema (воротниковый отек), nuchal fluid (жидкость в области шеи), nuchal fluid accumulation (скопление жидкости в области шеи), nuchal fold (воротниковая складка), simple hygroma (простая гигрома), nuchal thickening (шейное утолщение) и т. д. Четвертый Всемирный конгресс по ультразвуковой диагностике в акушерстве и гинекологии, состоявшийся в октябре 1994 г. в Будапеште, положил конец неразберихе в терминах. Большинством голосов
участники Конгресса приняли предложение К. Nicolaides утвердить единое название этого признака — nuchal translucency (воротниковая прозрачность, просвет), которое с тех пор прочно вошло в лексикон врачей ультразвуковой диагностики разных стран.
В 1995 г. в первой отечественной публикации, посвященной этому эхографическому явлению [1], российским специалистам было предложено использовать термин «воротниковый отек», который, спустя год, был изменен на термин «воротниковое пространство» [2]. По мнению авторов публикации, последнее название более точно отражало суть эхографического симптома и было ближе по смыслу английскому аналогу. Сегодня в 43 странах мира оценка воротникового пространства у плода используется при скрининговом ультразвуковом исследовании в 10—14 нед беременности [3].
ПРАВИЛА ИЗМЕРЕНИЯ
Толщина воротникового пространства (ТВП) является критерием, позволяющим формировать среди беременных группу
риска по рождению детей с врожденной и наследственной патологией. ТВП — это область между внутренней поверхностью
73
ОГЛАВЛЕНИЕ
3
глава
Рис. 3.1. Беременность 10 нед 3 дня. ТВП — 2,2 мм.
кожи плода и наружной поверхностью мягких тканей, покрывающих шейный отдел позвоночника (рис. 3.1). Для того, чтобы повысить точность оценки ТВП и, соответственно, эффективность скринингового обследования, следует строго соблюдать два правила:
1) Оценка ТВП проводится в 10—14 нед беременности при численных значениях копчико-теменного размера плода от 45 до 84 мм.
2) Измерение ТВП осуществляется строго в сагиттальной плоскости сканирования.
Шейная область плода хорошо визуализируется при трансабдоминальном исследовании. По данным большинства ди-агностическихцентров, ТВП доступна для измерения в 95—100% наблюдений (табл. 3.1). Трансвагинальный доступ следует использовать только в тех случаях, когда оценка структур плода затруднена.
В. Whitlow и D. Economides [20] пришли к выводу, что оптимальными сроками для оценки ТВП является интервал от 10 до 13 нед, поскольку произвести корректные измерения этого параметра авторам удалось в 100,98,98 и 98% случаев соответственно. В 14 нед чувствительность эхографии уменьшалась и составляла 90%. Наиболее низкие показатели оценки ТВП (58 и 66%), полученные L. Komman и соавт. [9] и S. Bewley и соавт. [6], вероятно, объясняются большим количеством пациенток со сроком беременности менее 10 нед. В наших исследованиях оценка ТВП в 10—14 нед беременности оказалась возможной в 94% случаев [19]. Неудачи измерения (6%), на наш взгляд, можно объяснить неудобным положением плода, которое чаще встречалось в 10—11 нед беременности.
Таблица 3.1. Возможность оценки воротникового пространства плода в ранние сроки беременности при скрининговом ультразвуковом исследовании
Авторы Сроки Успешность измерения
обследования, нед воротникового пространства, %
Р. Pandya и соавт., 1995 [4] 10-14 100
J. Szabo и соавт., 1995 [5] 9-12 100
S. Bewley и соавт., 1995 [6] 8-13 66
S. Bower и соавт., 1995 [7] 8-14 100
J. Braithwaite и соавт., 1996 [8] 10-13 100
L. Kornman и соавт., 1996 [9] 8-13 58
R. Zimmerman и соавт., 1996 [10] 10-13 100
R. Kadir, D. Economides, 1997 [11] 10-13 100
Р. Taipale и соавт., 1997 [12] 10-16 99
В. Thilaganathan и соавт., 1997 [13] 10-14 91
Е. Hafner и соавт., 1998 [14] 10-14 100
Е. Pajkrt и соавт., 1998 [15] 10-14 96
Р. Theodoropoulos и соавт., 1998 [16] 10-14 100
R. Maymon и соавт., 1999 [17] 10-14 100
М. Muller и соавт., 2000 [18] 10-14 96
Н.А. Алтынник, М.В. Медведев, 2001 [19] 10-14 94
74 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ВЕЛИЧИНУ ТОЛЩИНЫ ВОРОТНИКОВОГО ПРОСТРАНСТВА
Что помогает избежать ошибок и достичь хороших результатов в оценке ТВП?
1. Правильный выбор величины изображения плода.
Для повышения точности измерения ТВП изображение плода на экране монитора должно занимать не менее 2/3 от общей площади эхографической картины (рис. 3.2). По данным А. Неппаписоавт. [21], величина изображения плода достоверно влияет на результат измерения ТВП (р < 0,02).
2. Оценка положения плода.
Численные значения ТВП увеличиваются при запрокинутой голове плода и уменьшаются в тех случаях, когда подбородок плода прижат к груди (рис. 3.3). I.
Chatzipapas и соавт. [22] доказали, что при разгибании головы величина ТВП оказывается в среднем больше на 0,62 мм (индивидуальные колебания — 0,53—0,70 мм) по сравнению с «нейтральным» положением, а при ее сгибании — меньше на 0,40 мм (0,34—0,47 мм).
Следует отметить, что положение позвоночника плода не оказывает существенного влияния на численные значения ТВП. По данным I. De Graaf и соавт. [23], которые обследовали 85 плодов в 10— 14 нед беременности, в положении «на спине» ТВП составляла в среднем 1,91 мм, а «на животе» — 1,93 мм (статистические различия не достоверны).
Рис. 3.2. Беременность 11 нед 1 день, а недостаточное увеличение изображения для точного измерения ТВП; б корректное изображение воротникового пространства у того же плода. ТВП -1,4 мм.
Рис. 3.3. Схема изображения ТВП в зависимости от положения головы плода, а — нейтральное положение; б при запрокинутой голове; в подбородок прижат к груди.
НАЧАЛО ГЛАВЫ
------------------- 75
ОГЛАВЛЕНИЕ
3
глава
а б в г д
Рис. 3.4. Схема правильного (а) и неправильного (б-д) расположения каллиперов при измерении ТВП.
3. Положение каллиперов.
Каллиперы необходимо устанавливать на линии внутреннего контура воротникового пространства, что является общепринятым стандартом в большинстве зарубежных центров пренатальной диагностики (рис. 3.4). Согласно исследованиям А. Herman и соавт. [24], различия абсолютных значений ТВП в зависимости отрасположе-ния каллиперов составляли в среднем 0,95 ± 0,14 мм, что является весьма существен
ным при оценке структуры, толщина которой в норме варьирует в пределах 2—3 мм.
4. Визуализация амниотической оболочки и пуповины.
В тех случаях, когда эмбрион прилежит спиной к амниотической оболочке, расстояние между стенкой амниотической полости и шеей плода может быть ошибочно принято за расширенное воротниковое пространство. Эго является основнойпричиной ложноположительных заключений об увеличении ТВП. Во избежание погрешностей в измерении необходимо дождаться эпизода двигательной активности плода или использовать трансвагинальную эхографию.
Расположение пуповины в области шеи плода также может увеличивать истинные значения ТВП. В исследованиях М. Schaefer и соавт. [25] такая локализация петель была зарегистрирована в 8,23% случаев (26 из 316 наблюдений), и величина погрешности составляла в среднем 0,8 мм. По мнению авторов, применение цветового допплеровского картирования уменьшает частоту ложноположительных результатов при скрининговой оценке ТВП благодаря четкой визуализации пуповины.
ВОСПРОИЗВОДИМОСТЬ ИЗМЕРЕНИЯ
Строгое соблюдение правил оценки ТВП и тщательный учет факторов, влияющих на конечный результат измерения, не могут полностью исключить элемент субъективности, присущий любому врачу, проводящему ультразвуковые исследования. Метод, с помощью которого каждый специалист может проверить надежность своих измерений, получил название воспроизводимости исследования. Воспроизводимость результатов — это разница меж-дучисленными значениями ТВП, полученными в ходе исследования одного и того же плода одним специалистом и несколькими врачами. Очевидно, что ошибка в 1 мм при оценке параметра, численные значения которого обычно не превышают 2—3 мм, может привести к серьезным последстви
ям, поэтому проблеме воспроизводимости измерений было посвящено несколько больших исследований (табл. 3.2).
Р. Pandya и соавт. [26] одними из первых провели изучение воспроизводимости измерения ТВП в 10—14 нед беременности. В их исследовании приняли участие 4 опытных специалиста, которые произвели 1200 измерений. В ходе анализа полученных результатов было установлено, что расхождение между измерениями ТВП, осуществленными одним врачом, составило в сред-н е м
0,27 мм, а между измерениями, выполненными двумя специалистами у одного плода, — 0,31 мм. В тех случаях, когда измерения проводились дважды и за окончательный результат принималось максимальное
76 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
Таблица 3.2. Воспроизводимость измерения толщины воротникового пространства у плода в ранние сроки беременности
Авторы Средние различия в повторных измерениях, мм
У одного исследователя У нескольких исследователей При разном расположении каллиперов
Р. Pandya и соавт., 1995 [26] 0,27 0,31 0,58
J. Braithwaite и соавт., 1996 [8] ТАС-0,40 ТВС - 0,24
L. Kornman и соавт., 1996 [9] 0,40
A. Herman и соавт., 1998 [21] 0,28 и 0,34 0,36
A. Herman и соавт., 2000 [24] 0,95
ТАС - 0,90, ТВС - 0,94
Е. Pajkrt и соавт., 2000 [27] 0,35 0,44
Примечание. ТАС - трансабдоминальное сканирование; ТВС - трансвагинальное сканирование.
значение ТВП, расхождение было меньше и составляло в среднем 0,22 мм. В 95% всех исследований различия между измерениями одного специалистане превышали ± 0,54 мм, между двумя врачами — ± 0,62 мм. Данные, полученные входе этой работы, позволили авторам сделать вывод о том, что опытные специалисты легко достигают высокой воспроизводимости результатов измерения ТВП, и что воспроизводимость измерения не зависит от абсолютной величины ТВП.
Исследование, проведенное другой группой специалистов из Великобритании, было посвящено изучению воспроизводимости измерения ТВП опытным специали-стомидвумя врачами, проходящими обучение ультразвуковому скрининговому обследованию в ранние сроки беременности [8]. В ходе работы было установлено, что опытному специалисту удалось измерить ТВП у плода в 10—13 нед при использовании трансабдоминального сканирования в 94% случаев, при трансвагинальной эхографии — в 93%, а при комбинированном применении обоих доступов — в 100% наблюдений. Коэффициент воспроизводимости составлял в среднем 0,40 ммпритрансабдоминаль-ном сканировании и 0,24 мм — при использовании трансвагинальной эхографии. Показатели врачей, проходящих обучение, были значительно хуже в начале исследования, но в последней серии (80 трансабдоми-нальныхи ЮОтрансвагинальныхультразву-
ковых исследований) была достигнута высокая воспроизводимость между измерениями опытного перинатолога и обучающихся специалистов. По мнению авторов статьи, врачи, осуществляющие скрининговые ультразвуковые исследования в ранние сроки беременности, должны проходить обязательную подготовку в центрах пренатальной диагностики и выполнить под контролем опытного специалиста не менее 100 измерений ТВП. Высокая воспроизводимость результатов является непременным условием допуска к работе врача, проводящего скрининговые исследования в ранние сроки беременности.
Основной задачей исследований, проведенных A. Herman и соавт. [24], было изучение факторов, влияющих на воспроизводимость определения ТВП. Эти авторы установили прямо пропорциональную зависимость между величиной ошибки и копчико-теменным размером плода. В отличие от Р. Pandya и соавт. [26], в этой работе был сделан вывод о влиянии абсолютной величины ТВП на воспроизводимость результатов.
Улучшение показателя воспроизводимости результатов измерения ТВП не является основнойцелью скринингового ультразвукового исследования, а имеет принципиальное значение для клинической практики. Повышение точности оценки ТВП позволяет более корректно сформи
НАЧАЛО ГЛАВЫ
------------------- 77
ОГЛАВЛЕНИЕ
3
глава
ровать среди пациентокгруппурискаисво-евременно провести соответствующее обследование. По данным Е. Pajkrt и соавт. [28], повышение надежности определения ТВП и, соответственно, воспроизводимо
сти измерения в течение трех лет позволило увеличить выявляемость синдрома Дауна в ранние сроки беременности с 50 до 86% (!). Полагаем, что дальнейшие комментарии будут лишними.
ЧАСТОТА ОБНАРУЖЕНИЯ
По мнению подавляющего большинства специалистов, расширение воротникового пространства является одним из самых зна-чимьгхэхографическихмаркеровхромосом-ной патологии плода. Данные о частоте встречаемости этого признака важны для определения объема инвазивных диагностических процедур с целью изучения кариотипа плода. Частота выявления расширенного воротникового пространства у плода в ранние сроки беременности, по данным разных авторов, варьирует в широком диапазоне — от 0,41 до 6,4% (табл. 3.3).
Цифры, полученные в нашей стране, также характеризуются достаточно высокой вариабельностью — 1,95 — 6,4% [37, 38]. Значительный разброс в показателях можно объяснить нарушениями в методике проведения обследования в разных клиниках и различиями в структуре потока пациенток, например, в количестве беременных старшей возрастной группы. Однако основной причиной, на наш взгляд, является отсутствие единого критерия оценки ТВП.
Таблица 3.3. Сроки и частота обнаружения расширенного воротникового пространства у плода в ранние сроки беременности
Авторы Сроки обследования нед Воротниковое пространство, мм Частота, %
К. Nicolaides и соавт., 1992 [29] 10-14 >2,5 6,0
М. Schutle-Valentin, 1992 [30] 10-14 >3,0 1,4
В. Brambati и соавт., 1994 [31] 10-12 >3,0 3,8
С. Comas и соавт., 1994 [32] 9-13 >3,0 1,5
L. Ovari и соавт., 1994 [33] 10-14 >3,0 0,5
Е. Pajkrt и соавт., 1994 [34] 10-15 >3,0 2,2
J. Duyos, 1994 [35] 10-13 >3,0 1,1
S. Bewley и соавт., 1995 [6] 8-13 >3,0 6
S. Bower и соавт., 1995 [7] 8-14 >3,0 2,0
Р. Pandya и соавт., 1995 [4] 10-14 >2,5 3,6
J. Szabo и соавт., 1995 [5] 9-12 >3,0 2,4
R. Zimmerman и соавт., 1996 [10] 10-13 >3,0 2,1
Р. Taipale и соавт., 1997 [12] 10-16 >3,0 0,8
A. Josefsson и соавт., 1998 [36] 10-14 >4,0 0,41
Е. Hafner и соавт., 1998 [14] 10-14 >2,5 1,7
А.В. Михайлов и соавт., 2000 [37] 10-13 >2,5 1,95
О.К. Русанова и соавт., 2000 [38] 10-14 >3,0 6,4
R. Maymon и соавт., 2000 [39] 10-14 >95-го процентиля 4,6
М. Muller и соавт., 2000 [18] 10-14 >95-го процентиля 1,4
Е. Pajkrt и соавт., 2000 [40] 10-14 >95-го процентиля 6,1
78 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ
Использование разных диагностических критериев существенно влияет на частоту обнаружения расширенного воротникового пространства у плода в ранние сроки беременности. Ярким примером является сравнение данных, полученных в разное время и в разных клиниках группами исследователей под руководством Е. Pajkrt [34] и М. Muller [18]. Приисполь-зовании одного и того же критерия (>3,0 мм) показатели частоты встречаемости расширенного воротникового пространства в разных клиниках были сопоставимы (2,2 и 1,4%). При переходе к оценке ТВП по процентильным кривым Е. Pajkrt и соавт. [40] получили увеличение этого показателя почти в 3 раза (6,1%).
В начале 90-х годов с самых первых шагов в изучении взаимосвязи ТВП и хромосомных аномалий плода в качестве критерия отбора в группу риска в большинстве работ использовался показатель 3 мм и более, который не потерял актуальность и в наши дни. Однако, согласно рекомендациям Fetal Medicine Foundation First Trimester Screening Group — международной организации, координирующей проведение скрининговых ультразвуковых исследований в I триместре беременности и имеющей опыт более 100 ООО исследований, — лучшие результаты достигаются при использовании процентильных кривых. Хорошо известно, что в
одномитомже сроке беременности у разных плодов значения фетометрических показателей отличаются. Колебания в пределах нормативных значений составляют основу для построения процентильных кривых. При измерении ТВП за критерий его оценки было предложено принять численные значения 95-го процентиля [3].
В соответствии с этими рекомендациями S. Yagel и соавт. [41] провели сравнение прогностической ценности двух методов оценки ТВП: по 95-му процентилю и по традиционному критерию >3,0 мм. Было установлено, что методы обладают одинаковой чувствительностью в диагностике хромосомных аномалий (85,7%), но специфичность процентильных кривых выше — 87,9 и 94,6% соответственно.
По мнению авторов, применение процентильных кривых может уменьшить число инвазивных процедур в ранние сроки беременности без снижения уровня выявляемое™ хромосомных аномалий. Основанием для такого вывода послужил факт увеличения ТВП в интервале 10—14 нед беременности с 1,2 мм до 1,9 мм [42]. Аналогичная закономерность была отмечена и в наших исследованиях, посвященных разработке отечественных процентильных кривых ТВП, но различия между группами в зависимости от срока беременности были недостоверными [19].
Таблица 3.4. Нормативные показатели (5-й, 50-й и 95-й процентили) толщины воротникового пространства плода в зависимости от срока беременности [19]
Срок беременности Толщина воротникового пространства, мм
5-й процентиль 50-й процентиль 95-й процентиль
10 нед 0 дней - 10 нед 6 дней 0,8 1,5 2,2
11 нед 0 дней - 11 нед 6 дней 0,8 1,6 2,4
12 нед 0 дней - 12 нед 6 дней 0,7 1,6 2,5
13 нед 0 дней - 13 нед 6 дней 0,7 1,7 2,7
НАЧАЛО ГЛАВЫ
------------------- 79
ОГЛАВЛЕНИЕ
3
глава
Рис. 3.5. Процентильные кривые ТВП. Сплошная линия Fetal Medicine Foundation First Trimester Screening Group [3]; прерывистая линия H.A. Алтынник, М.В. Медведев [19].
В 2000 г. впервые в России нами были получены нормативные показатели процентильных значений ТВП, которые, по нашему мнению, можно использовать в большинстве регионов страны (табл. 3.4) [19].
Следует отметить, чтонашипроцентиль-ныепоказателиинормативные кривые Fetal Medicine Foundation First Trimester Screening Group почти совпадают (достоверных отличий выявлено не было) (рис. 3.5).
Большое значение для практического здравоохранения имеют данные, полученные В. Thilaganathan и соавт. |43]. Изучая ТВП у беременных многих национальностей (1944 пациентки), эти авторы не на
шли достоверных отличий в численных значениях ТВП в разных этнических группах. Незначительные колебания некоторых показателей не потребовали внесения специальных поправок.
Подводя итог сказанному, можно сделать вывод о том, что методика измерения ТВП, сроки проведения скринингового ультразвукового исследования для его оценки и критерии увеличения воротникового пространства хорошо разработаны и могут эффективно использоваться в клинической практике в целях улучшения ранней диагностики и профилактики врожденной и наследственной патологии.
ХРОМОСОМНЫЕ АНОМАЛИИ
Первый случай выраженного расширения воротникового пространства у плода (11 мм) в ранние сроки беременности (12
нед) в наших исследованиях был зарегистрирован в октябре 1993 г. (рис. 3.6). Отсутствие опыта работы с такой патологи
80
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
ей привело к постановке ошибочного диагноза кистозной гигромы шеи. Пациентка отказалась от пренатального кариоти-пирования и приняла решение о прерывании беременности. При цитогенетическом исследовании материала, полученного при медицинском аборте, была выявлена трисомия 21. Этот диагноз не укладывался в клиническую картину кистозной гигромы, которая в большинстве случаев сопровождает синдром Тернера. Тщательный ретроспективный анализ эхограмм показал, что обнаруженное анэхогенное образование в области шеи не было похожим на кистозную гигрому: оно распространялось вдоль позвоночника и не имело характерных внутренних перегородок. Анализ литературы не позволил нам поставить точный диагноз, поскольку к тому времени во всем мире на эту тему были опубликованы лишь отдельные клинические наблюдения, не позволяющие сделать аргументированные выводы.
К1995 году нам удалось обобщить опыт разных зарубежных клиник и собрать сведения о 369 случаях расширенного воротникового пространства. Цитогенетические исследования доказали наличие тесной связи этого эхографического признака с аномалиями кариотипа: у каждого третьего плода была диагностирована патология хромосом [1]. Обзор литературы, проведенный в 2000 г. и включающий анализ кариотипа 1983 плодов с увеличенной ТВП, подтвердил высокую частотухромо-сомных аберраций в этой группе — 29,6% (табл. 3.5).
В структуре цитогенетических находок самой частой был синдром Дауна (50,5%). На синдром Эдвардса приходилось 23.9% всех хромосомных аномалий, на синдром Тернера — 9,9% и синдром Патау — 4,9%. Другие виды патологии кариотипа были диагностированы у 10,8% плодов.
Еще в середине 90-х годов английские исследователи отметили интересную закономерность: частота хромосомных аномалий находится в прямо пропорциональной зависимости от величины ТВП. По дан-
Рис. 3.6. Беременность 12 нед. ТВП — 11 мм (стрелка) у плода с синдромом Дауна.
ным Р. Pandya и соавт. [57], при ТВП 3 мм хромосомные дефекты были обнаружены у7% плодов, при4мм — у27%, при5 мм — у 53%, при 6 мм — у 49%, при 7 мм — у 83%, при 8 мм — у 70 %, при 9 мм — у 78%. Ана-логичнаые данные получили испанские специалисты: при ТВП от 3 до 4 мм частота хромосомных аберраций составляла 18%,от4до5мм— 19%,от5до6мм —29%, от 6 до 7 мм — 82%, от7 до 8 мм — 100%, от 8 до 9 мм — 67%, 9 мм и более — 100% [60].
В конце 2000 г. были подведены итоги первого Российского мультицентрового исследования, посвященного изучению феномена воротникового пространства. В нем приняли участие 7 диагностических центров, но в окончательный анализ были включены результаты только 4 центров пренатальной диагностики, которые выполнили все необходимые условия проведения исследования:
— Центр планирования семьи и репродукции, Астрахань (О.К. Русанова, О.В. Бунтова, В.Н. Грященко, М.В. Кархмазо-ва. С.В. Булычева);
— Республиканская клиническая больница М3 РТ, Казань (Л.Е. Терегулова, А.Ш. Латыпов, Л.И. Баязитова, Л.Н. Шайхутдинова, М.В. Ситарская, Л.Р. Самойлова);
— Центр пренатальной диагностики при роддоме №27, кафедра рентгенологии и ультразвуковой диагностики Института повышения квалификации М3 РФ, Мос-
НАЧАЛО ГЛАВЫ
------------------- 81
ОГЛАВЛЕНИЕ
3
глава
Таблица 3.5. Частота обнаружения хромосомных аномалий у плодов с расширенным воротниковым пространством в ранние сроки беременности
Авторы п Воротниковое ространство, мм п Хромосомные аномалии
Всего ТР21 ТР18 ТР13 45,X Другие
J. Szabo, J. Gellen, >3,0 8 7 (88%) 7 — — — —
1990 [44] М. Schutle-Vallentin, >4,0 8 7 (88%) 7 — — — —
Н. Schindler, 1992 [45] L. Shulman и >2,5 32 15 (47%) 4 4 3 4
соавт., 1992 [46] Y. Ville и соавт., >3,0 29 8 (28%) 4 3 1 —
1992 [47] R. Wilson и соавт., >3,0 14 3(21%) 1 2
1992 [48] R. van Zalen-Sprock >4,0 18 6 (28%) 3 1 — 1 1
и соавт., 1999 [49] M.Johnson и >2,0 68 41 (60%) 16 9 2 9 5
соавт., 1993 [50] В. Hewitt, 1993 [51] >2,0 29 12 (41%) 5 3 1 2 1
A. Nadel и соавт., >4,0 63 43 (68%) 15 15 1 10 2
1993 [52] G. Savoldelli и >4,0 24 19(79%) 15 2 1 1 —
соавт., 1993 [53] К. Nicolaides и >3,0 88 33 (38%) 21 8 2 — 2
соавт., 1992 [29] Р. Trauffer и >3,0 43 21 (49%) 9 4 1 4 3
соавт., 1994 [54] С. Comas и >3,0 51 9 (18%) 4 4 — — 1
соавт., 1995 [55] Е. Hafner и >2,5 26 8 (30%) 2 1 1 1 3
соавт., 1995 [56] Р. Pandya и соавт., 1995 [57] >3,0 1015 194(19%) 101 51 13 14 15
J. Szabo и >3,0 96 43 (45%) 28 10 — 2 3
соавт., 1995 [5] G. D’Ottavio и >4,0 34 13 (38%) 7 1 — 3 2
соавт., 1997 [58] J. Martinez и >3,0 142 35 (24%) 17 7 1 1 9
соавт., 1998 [59] A. Graneras и >3,0 115 44 (38%) 23 14 2 2 3
соавт., 2000 [60] Российское >3,0 80 26 (32,5%) 8 3 — 3 12
мультицентровое исследование, 2000 Всего 1983 587 (29,6%) 296 140 29 58 64
Примечание. ТР21 - трисомия 21; ТР18 - трисомия 18; ТР13 - трисомия 13; 45,X- синдром Тернера.
82 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
Таблица 3.6. Частота обнаружения синдрома Дауна при скрининговом ультразвуковом исследовании в ранние сроки беременности
Авторы Сроки обследования, Воротниковое Выявляемость
нед пространство, мм синдрома Дауна
S. Bewley и соавт., 1995 [6] 8-13 >3,0 1/3 (33%)
S. Bower и соавт., 1995 [7] 8-14 >3,0 4/8 (50%)
С. Comas и соавт., 1995 [55] 9-13 >4,0 4/7 (57%)
Р. Pandya и соавт., 1995 [4] 10-14 >2,5 3/4 (75%)
J. Szabo и соавт., 1995 [5] 9-12 >3,0 28/31 (90%)
L. Когптап и соавт., 1996 [9] 8-13 >3,0 2/4 (50%)
R. Zimmerman и соавт., 1996 [10] 10-13 >3,0 2/3 (57%)
G. D’Ottavio и соавт., 1997 [58] 13-15 >4,0 7/10 (70%)
F. Orlandi и соавт., 1997 [62] 9-14 >95-го процентиля 4/7 (57%)
Р. Taipale и соавт., 1997 [12] 10-16 >3,0 7/13 (54%)
В. Thilaganathan и соавт., 1997 [13] 10-14 >3,0 5/7(71%)
D. Economides и соавт., 1998 [63] 11-14 >95-го процентиля 6/8 (75%)
Е. Hafner и соавт., 1998 [14] 10-14 >2,5 4/7 (57%)
Е. Pajkrt и соавт., 1998 [15] 10-14 >3,0 6/9 (67%)
Всего 83/121 (68,6%)
ква (Н.А. Алтынник, Е.В. Юдина, М.В. Медведев);
— Перинатальный центр, Йошкар-Ола (Л.Т. Николаев, И.И. Рябов, Т.Л. Алексеева, Л.А. Титова).
Участниками Российского мультицентрового исследования было выявлено 80 случаев расширенного воротникового пространства (от 3 до 10 мм). Частота хромосомной патологии варьировала в пределах 23,8—42,9% и в среднем составляла 32,5%, что полностью согласуется с суммарными результатами исследований в других странах (29,6%). Спектр хромосомных дефектов несколько отличался от данных зарубежных авторов: на долю синдрома Дауна пришлось 34,6%, на синдром Эдвардса — 7,7%, на синдром Тернера — 11,5%. Синдром Патау (один из самых редких хромосомных синдромов) выявлен не был в связи с небольшим количеством наблюдений. В 46,2% были диагностированы другие хромосомные аномалии (деле-ции, несбалансированные транслокации, триплоидия и др.).
Российское мультицентровое исследование в очередной раз доказало, что расширенное воротниковое пространство является надежным эхографическим маркером хромосомных аномалий, в том числе и в нашей популяции, и этот признак можно эффективно использовать в формировании группы риска в ранние сроки беременности.
Синдром Дауна
Своевременное выявление синдрома Дауна продолжает оставаться одной из самых актуальных проблем пренатальной диагностики. Эта трисомия в большинстве случаев не сопровождается грубыми структурными изменениями, что резко затрудняет постановку диагноза во II триместре беременности при ультразвуковом исследовании [61]. Анализ данных, полученных при кариотипировании плодов с расширенной ТВП, показал, что трисомия 21 является в этой группе одной из наиболее частых находок. Этот факт послужил основанием для организации скринингового ультразвукового исследования в ран-
НАЧАЛО ГЛАВЫ
------------------- 83
ОГЛАВЛЕНИЕ
3
глава
Таблица 3.7. Выявляемость трисомии 21 при комбинированном определении р-ХГЧ и РАРР-А в сыворотке крови беременной при фиксированной 5%-й частоте ложноположительных результатов
Авторы Сроки обследования, нед Трисомия 21 Выявляемость, %
D. Krantz и соавт., 1996 [65] 10-13 22 63
N. Wald и соавт., 1996 [66] 8-14 77 62
Е. Berry и соавт., 1997 [67] 9-14 47 55
F. Orlandi и соавт., 1997 [62] 9-14 11 61
J. Haddow и соавт., 1998 [68] 9-15 48 60
D. Wheeler, М. Sinosich, 1998 [69] 9-12 17 67
I. De Graaf и соавт., 1999 [70] 10-14 37 55
К. Spencer и соавт., 1999 [71] 10-14 210 67
G. Tsukerman и соавт., 1999 [72] 8-13 31 69
J. Macri, 2000 [64] 10-14 50 74
X. Navarro и соавт., 2000 [73] 10-14 15 66
ние сроки беременности, направленного на формирование группы риска по рождению детей с синдромом Дауна. По данным многочисленных исследований, проведенных в клиниках разных стран, этот скрининг позволяет пренатально диагностировать в среднем 68,6% всех случаев трисомии 21 (табл. 3.6).
Выявляемость синдрома Дауна в ранние сроки беременности может возрасти при формировании группы риска не только по ТВП, но и возрасту пациентки. Большой интерес представляют данные исследований Fetal Medicine Foundation First Trimester Screening Group, в которых приняли участие 306 опытных специалистов из 22 центров пренатальной диагностики. В ходе этих исследований ТВП оценивалась в режиме скрининга у 100 311 плодов в 10—14 нед беременности [42]. Всем беременным проводился комбинированный расчет риска на основании возраста и ТВП >95-го процентиля. Показанием к пренатальному кариотипированию являлся риск 1:300. В ходе комплексного учета данных оценки ТВП и возраста пациентки удалось обнаружить 268 (82,2%) из 326 случаев синдрома Дауна, при этом у 234 (71,8%) плодов ТВП превышала нормативные значения. Расширение воротникового пространства было выявлено в 4444 (4,4%) наблюдений, но в группу риска с
учетом возраста вошли 7907 (8,3%) пациенток. Среди обследованных в режиме скрининга беременные старшей возрастной группы составляли 13,3%.
По данным другого мультицентрового исследования, в котором приняли участие 17 центров пренатальной диагностики США, Италии, Испании, Бразилии и Украины, расчет риска по возрасту пациентки и величине ТВП позволило диагностировать 81,8% случаев синдрома Дауна [64].
Комбинированная оценка возраста и ТВП позволяет не только улучшить диагностику трисомии 21, но и сократить количество инвазивных вмешательств. В большинстве стран мира возраст пациентки более 35 лет является одним из основных показаний к пренатальному кариотипированию. Количество беременных старшей возрастной группы в популяции зависит от социальных, экономических, религиозных и многих других факторов. В развитых странах, где доля беременных старше 35 лет, как правило, велика, проблема уменьшения количества инвазивных вмешательств является очень актуальной. Например, по данным Е. Pajkrt и соавт. [15], в Нидерландах пренатальное кари-отипирование по возрасту могло бы быть предложено 24% пациенток, проходящих скрининговые исследования в ранних сроках. В этих условиях реальная выявляемость синдрома Дауна составила бы только 79%.
84 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
Таблица 3.8. Выявляемость трисомии 21 при комбинированном определении р-ХГЧ, РАРР-А в сыворотке крови беременной и ТВП
Авторы Сроки обследования, нед Трисомия 21 Выявляемость, %
М. Brizot и соавт., 1995 [75] 10-14 80 89
F. Orlandi и соавт., 1997 [62] 9-14 11 87
Р. De Biasio и соавт., 1999 [76] 10-14 13 85
I. De Graaf и соавт., 1999 [70] 10-14 37 85
К. Spencer и соавт., 1999 [71] 10-14 210 89
С. Bach и соавт., 2000 [77] 11-14 6 90
Е. Casals и соавт., 2000 [78] 10-14 15 86
J. Macri, 2000 [64] 10-14 33 91
Оценка воротникового пространства у 1473 пациентоквскрининговом режиме позволила авторам пренатально диагностировать 67% случаев синдрома Дауна при частоте инвазивных процедур только 2,2%. Комбинированный расчет риска по возрасту и величине ТВП при границе риска 1:100 увеличил выявляемость синдрома Дауна до 78% причастотеинвазивныхпроцедур 8,1%. При смещенииграницырискадо уровня 1:300по-тенциальнаявыявляемостьтрисомии21 могла бы увеличиться до 100%, но частота инвазивных процедур составила бы уже 19,8%.
При внедрении комбинированного скрининга по ТВП и возрасту в клиническую практику следуетпомнить, что эти факторы успешно дополняют, но не заменяют друг друга. По данным Российского мультицентрового исследования, только 22,2% беременных с синдромом Дауна у плода относились к старшей возрастной группе, то есть у 77,8% увеличение ТВП было единственным фактором риска и, соответственно, поводом для кариотипирования.
Улучшения результатов скринингового обследования в I триместре беременности можно добиться путем внедрения определения уровней биохимических маркеров и комбинированного расчета риска по данным ТВП в сочетании с биохимическим скринингом.
В качестве биохимических маркеров I триместра чаще других используются р-ХГЧ и РАРР-А. Чувствительность биохимического скрининга на синдром Дауна
при использовании одного из этих маркеров не превышает 45—50% [3], что ниже, чем при скрининге по ТВП. Сочетание р-ХГЧ и РАРР-А увеличивает выявляемость трисомии 21 в среднем до 65% (табл. 3.7).
Залогом успеха биохимического скрининга в I триместре является выбор оптимального срока обследования. По данным Н. Cuckle и J. Van Lith [74], чувствительность биохимических маркеров в диагностике синдрома Дауна снижается с увеличением срока беременности, составляя в 9 нед — 72%, в 10 нед — 66%, в 11 нед — 58%, в 12 нед — 51% ив 13 нед — 46%.
Комбинированное определение р-ХГЧ, РАРР-А в сыворотке крови беременной и ТВП в настоящее время является одной из самых эффективных схем обследования в ранние сроки, посколькупозволяет диагностировать до 90% случаев трисомии 21 уже в конце I триместра беременности (табл. 3.8).
Приведенные факты убедительно доказывают актуальность и эффективность исследования ТВП в I триместре беременности в разных скрининговых режимах. Однако в литературе время от времени появляются публикации, подвергающие сомнению ценность скрининговой оценки этого параметра. Основным аргументом является хорошо известный факт о хромосомных аномалиях как основной причине прерываний беременностей в ранние сроки. Другими словами, авторы этих статей утверждают, что экономические затраты на проведение ультразвуковых
НАЧАЛО ГЛАВЫ
------------------- 85
ОГЛАВЛЕНИЕ
3
глава
и биохимических исследований в I триместре не обоснованы, поскольку рано диагностированные патологические беременности (особенно беременности с выраженным расширением воротникового пространства) в большинстве случаев закончатся самопроизвольными выкидышами, а не прерываниями по медицинским показаниям. Среди врачей, работающих в практическом здравоохранении, эта точка зрения не получила широкой поддержки.
По данным Р. Снайдере и К. Николаидес [79], при исследовании в I триместре 109 плодов с трисомией 21, выявленной благодаря увеличению ТВП, в 6 случаях родители решили сохранять беременность, тогда как в 103 случаях она была прервана. При динамическом контроле у 5 из 6 плодов расширенное воротниковое пространство спонтанно исчезло. При ультразвуковом исследовании во II триместре толщина шейной складки не была увеличена ни в одном наблюдении, у одного плода был диагностирован отек шеи, у двоих — гиперэхогенный кишечник, у троих — дефект межжелудочковой перегородки и у одного — умеренный гидронефроз. Все шесть детей с трисомией 21 родились живыми. Через 6 мес умер только 1 ребенок в связи с нарастанием сердечно-сосудистой недостаточности на фоне атриовентрикулярного септального дефекта.
Исследования, проведенные J. Hyett и соавт. [80], показали, что у плодов с трисомией 21 и расширенным воротниковым пространством риск внутритуробной гибели зависит от размера воротникового пространства. Так, при ТВП 3 мм частота наступления внутриутробной гибели составила 5,3%, тогда как при толщине > 7 мм — 23,5%. В целом, по данным авторов этой публикации, скрининговая оценка ТВП с учетом возраста матери может уменьшить частоту рождения детей с синдромом Дауна более чем на 70%.
В Российское мультицентровое исследование были включены два случая рож
дения детей с синдромом Дауна, когда родители отказались от проведения пренатального кариотипирования, несмотря на настойчивые рекомендации врачей в связи с увеличением ТВП до 3 и 4 мм. Беременности закончились рождением живых доношенных детей, у которых диагноз трисомии 21 был подтвержден уже постнатально . Эти наблюдения лишний раз доказывают, что далеко не все плоды с расширенным воротниковым пространством погибают внутриутробно.
Споры о подходах к организации обследования в ранние сроки беременности продолжаются и по сей день. Рождение истины происходит долго и трудно. По нашему мнению, усилия врачей должны быть направлены на максимально раннюю диагностику патологических состояний. Мы убеждены в том, что выявление аномалий в I триместре беременности дает семье больше времени на принятие взвешенного решения о судьбе будущего ребенка. Именно поэтому оценка ТВП в скрининговом режиме является обоснованной и целесообразной.
Синдромы Эдвардса и Патау
После синдрома Дауна трисомия 18 (синдром Эдвардса) является второй по частоте встречаемости среди новорожденных (0,16/1000). Трисомия 13 (синдром Патау) регистрируется значительно реже — 0,083/1000 новорожденных [79]. Увеличение размеров воротникового пространства в 10—14 нед беременности у плодов с трисомиями 18 и 13 встречается чаще, чем у плодов с синдромом Дауна. Согласно результатам исследований, проведенных под эгидой Fetal Medicine Foundation First Trimester Screening Group, ТПВ более 95-го процентиля была отмечена в 74,8% случаев синдрома Эдвардса и в 71,7% случаев синдрома Патау [3]. Группе, возглавляемой С. Comas [55], при использовании диагностического критерия >3 мм, удалось выявить 66,7% случаев синдрома Эдвардса, a F. Orlandi и соавт. [62] — 82%.
86 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
Особый интерес представляют данные N.TulHcoaBT. [81]иК. 8репсегисоавт. [82], которые приводят наибольшее количество наблюдений трисомии 18 и 13. Поданным К. Spencer и соавт. [82], из 42 плодов с трисомией 13 расширение воротникового пространства (>95-го процентиля) было отме-ченов62%наблюдений.N. Ти1исоавт. [81] при обследовании 50 плодов с трисомией 18 увеличение ТВП более 95-го процентиля зарегистрировали в 78% случаев.
Абсолютные размеры воротникового пространства при синдромах Эдвардса и Патау обычно выше, чем при синдроме Дауна, и в среднем составляют 7 мм, в отличии от трисомии 21 (5.9 мм) [60]. Как и при синдроме Дауна, при трисомии 18 и 13 отмечается зависимость увеличения частоты выявляемости от размеров воротникового пространства. По данным Р. Pandya и соавт. [57] при ТВП 3 мм в 10—14 нед бере
менности из 64 наблюдений синдрома Эдвардса и Патау было диагностировано 15,6% случаев, при 4 мм — 12,5%, при 5 мм —15,6%, апривеличине более 5 мм — 56,3%.
Помимо увеличения ТВП при трисомиях 18 и 13 нередко определяются дополнительные ультразвуковые признаки, которые могут помочь в проведении дифференциального диагноза. Для синдрома Эдвардса характерны брадикардия, омфалоцеле и несоответствие копчико-теменного размера сроку беременности. По данным К. Nicolaides и соавт. [3], при трисомии 18 численные значения копчико-теменного размера существенно отставали от нормативных значений. В среднем разница в размерах составляла 5,9 дня от средних показателей для данного срока беременности (рис. 3.7). В этой же работе было отмечено, что у каждого пятого плода (18,8%) с синдромом Эдвардса отмечалась брадикардия.
Рис. 3.7. Численные значения копчико-теменного размера плодов с трисомией 18 [31.
Рис. 3.8. Частота сердечных сокращений у плодов с трисомией 13 [3].
87
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
3
глава
Рис. 3.9. Беременность 12—13 нед. Расширение воротникового пространства до 7,5 мм (а) и 7,7 мм (б) у плодов с синдром Эдвардса.
Дополнительными эхографическими маркерами трисомии 13 является тахикардия, голопрозэнцефалия и омфалоцеле. Дефицит численных значений копчикотеменного размера, по данным К. Nicolaides и соавт. [3], несколько меньше, чем при трисомии 18 и составляет 3,1 дня от средних показателей для данного срока беременности. Реакция сердечно-сосудистой системы более выражена: тахикардия была отмечена в 68,8% случаев (рис. 3.8).
Опыт российских специалистов в раннем выявлении трисомий 18 и 13 пока невелик. В рамках Российского мультицентрового исследования синдром Патау диагностирован не был. Синдром Эдвардса зарегистрирован в 3 случаях. В двух из них помимо выраженного расширения воротникового пространства в 12—13 нед (7,5 и 7,7 мм) дополнительно придопплеровском исследовании были зафиксированы реверсные значения кровотока в фазу сокращения предсердий в венозном протоке (рис. 3.9) [83]. После получения результата цитогенетического исследования (трисомия 18) беременность была прервана.
Улучшение выявляемости синдромов Эдвардса и Патау в ранние сроки беременности может быть получено при комбинированном использовании оценки ТВП у плода и определения р-ХГЧ и РАРР-А в сыворотке крови беременной. По данным N. Tul и соавт. [81], чувствительность комбинированного скрининга при трисомии
18 составила 89%, а по данным F. Orlandi исоавт. [62] — 100%. Притрисомии Скомбинированный тест позволил диагностировать 90% случаев [82].
Другие хромосомные аномалии
Среди других хромосомных дефектов расширение воротникового пространства в 10—14 нед беременности было зарегистрировано при триплоидии, аномалиях половых хромосом, синдроме CATCH 22 и трисомии 10.
Полиплоидия — это аномалия кариотипа, возникающая при нарушении первого митотического деления или в результате оплодотворения яйцеклетки несколькими спематозоидами. Частота зачатий с трип-лоидиями составляет около 2%. Большинство этих беременностей прерывается в ранние сроки, поэтому среди новорожденных триплоидия встречается крайне редко [79]. По данным Fetal Medicine Foundation First Trimester Screening Group, более чем у половины (59,4%) плодов с триплоидиями в 10—14 нед беременности отмечается увеличение ТВП более 95-го процентиля [3].
Кроме расширенной воротниковой зоны при этой хромосомной патологии описаны такие эхографические изменения, как голопрозэнцефалия, кистозные образования задней черепной ямки, омфалоцеле и утолщение плаценты с изменением ее эхоструктуры («молярная» пла-
88 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
Срок беременности, дни
Рис. 3.10. Численные значения копчико-теменного размера плодов с триплоидией [3].
Рис. 3.11. Частота сердечных сокращений у плодов с синдромом Тернера [3].
цента) [3]. Дефицит численных значений копчико-теменного размера при трипло-идии велик и составляет 8,5 дня от средних показателей для данного срока беременности (рис. 3.10). Реакции сердечнососудистой системы чаще характеризуются брадикардией (35,7%).
По расчетам К. Spencer и соавт. [84], при использовании сочетания измерения ТВП и определения биохимических маркеров (р-ХГЧ, РАРР-А) в сыворотке крови беременной более 90% случаев трипло-идии могут быть диагностированы в ранние сроки.
Знание особенностей эхографического проявления триплоидии в I триместре беременности позволяет врачу своевременно провести полный комплекс обследования. Интересное клиничесокое наблюдение было представлено I. De Graaf и соавт. [85]. Пациентка 36 лет была обследована в режи
ме скрининга в 9 нед 6 дней. В связи с несоответствием копчико-теменного размера эмбриона сроку беременности было назначено повторное исследование. В12 нед было зарегистрировано более выраженное отставание копчико-теменного размера. ТВП не превышала 2,2 мм. Уровни РАРР-Аи р-ХГЧ в крови матери были снижены. В 13 нед 2 дня копчико-теменной размер плода выходил за границу 5-го процентиля (50 мм), ТВП увеличилась до 5 мм. При допплеровском исследовании кровотока в артерии пуповины были зарегистрированы реверсные значения диастолического компонента кровотока. В результате пренатального карио-типирования была выявлена триплоидия (69.ХХХ) и беременность прервана по медицинским показаниям.
А.В. Михайлов и соавт. [86] сообщили о пренатальной диагностике триплоидии на основании динамической оценки ТВП с 7
------------------- 89
ОГЛАВЛЕНИЕ ММ
НАЧАЛО ГЛАВЫ
3
глава
нед I дня до 11 нед 4 дня. Появление расширенного воротникового пространства (3 мм) в этом случае впервые было зафиксировано в 10 нед 6 дней. Через 5 дней его толщина увеличилась вдвое — до 6 мм, что послужило поводом для трансабдоминальной биопсии хориона и последующего прерывания беременности по медицинским показаниям в связи с выявленной триплоидией.
К настоящему времени накоплены убедительные данные об увеличении ТВП при патологииполовыххромосом, самойчастой из которых является синдром Тернера. Во II триместре беременности этот синдром в большинстве случаев сопровождается кистозной гигромой шеи [87—89]. В ранние сроки расширение ТВП при синдроме Тернера, по данным Fetal Medicine Foundation First Trimester Screening Group, встречается в 87% случаев [3]. Оценка ТВП в режиме скрининга является эффективным методом ранней диагностики синдрома Тернера. В исследованиях N. Sebire и соавт. [90] чувствительность эхографии в выявлении этого синдрома составила 87,9%.
В отличие от других хромосомных синдромов, синдром Тернера не сопровождается выраженным уменьшением размеров эмбриона. Отставание копчико-теменного размера от нормативных значений не превышает 1,8 дня [3]. ВI триместре беременности тахикардия сопровождает синдром Тернера более чем в половине наблюдений— 53,1% (рис. 3.11).
В Российском мультицентровом исследовании синдром Тернера был зарегистрирован в 3 случаях. В одном из наблюдений дополнительно при допплеровском исследовании в венозном протоке были зарегистрированы реверсные значения кровотока в фазу сокращения предсердий (рис. 3.12).
Помимо синдрома Тернера к аномалиям половых хромосом относятся синдром Клайнфельтера (47, XXY) и синдромы 47, XXX, 47 XYY, которые среди живорожденных встречаются с частотой 0,17% [91].
Проблеме ранней диагностики аномалий половых хромосом посвящена работа N. Sebire и соавт. [90]. Авторы установили что в 40% случаев при этой патологии регистрируется расширение воротникового пространства более 95-го процентиля.
К более редким хромосомным аномалиям, сопровождающимся увеличением ТВП, относится синдром CATCH 22 и трисомия 10 [92, 93]. Синдром CATCH 22 представляет собой сочетание множественных пороков [пороки сердца (С), лицевые аномалии (А), гипоплазию тимуса (Т), расщелину неба (С)], с гипокальциемией (Н) и делецией хромосомы 22. М. Lazanakis и соавт. [92] описали случай ранней пренатальной диагностики этого синдрома. Показанием к кариотипированию явилось увеличение ТВП в 12 нед беременности. Окончательный диагноз синдрома CATCH 22 был установлен в неонатальном периоде после обнаруже
Рис. 3.12. Беременность 12 нед. Расширение воротникового пространства (6 мм) у плода с синдромом Тернера (а); б - допплерограмма кривых скоростей кровотока в венозном протоке с реверсным компонентом в фазу сокращений предсердий.
90
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
ния у ребенка врожденного порока сердца и гипокальциемии.
Р. Schwarzler и соавт. [93] представили случай диагностики трисомии 10 в конце I триместра беременности. Помимо увеличенной ТВП (5 мм) в 12 нед, при трансвагинальном ультразвуковом исследовании и фетоскопии были выявлены множественные аномалии развития, а на последующей аутопсии подтверждено наличие лицевой расщелины, артрогрипоза верхних и нижних конечностей и двусторонней диафрагмальной грыжи. Дополнительно обнаружены гипоплазия легких, агенезия правой почки и комплекс сердечных аномалий.
Открытие феномена ТВП вооружило врачей новым эффективным маркером врожденной и наследственной патологии плода. Главное значение этого открытия состоит в том, что специалисты ультразвуковой диагностики получили возможность перенести обследование пациенток на ранние сроки беременности. Высокая чувствительность и специфичность скрининга по ТВП позволяет эффективно сформировать среди беременных новую группу риска и расширить рамки клинического обследования. Своевременная и методически правильная оценка ТВП позволяет обосновать применение инвазивных методов исследования уже в I триместре и исключить грубую патологию плода, требующую прерывания беременности по медицинским показаниям. Несомненным преимуществом метода является не только ранняя диагностика аномалий, приводящих в большинстве случаев к неблагоприятным перинатальным исходам или глубокой инвалидности детей, но и своевременное предоставление родителям информации о характере патологии. Во всех случаях основной груз принятия решения о судьбе будущего ребенка ложится на плечи родителей, поэтому ранняя диагностика патологии предоставляет им больше времени для обдумывания сложившейся ситуации и выхода из нее с учетом социальных, психологических и материальных ресурсов семьи.
СПИСОК ЛИТЕРАТУРЫ
1. Медведев М. В., Мальмберг О. Л. Новые пре -натальные эхографические маркеры хромосомной патологии // Ультразвук. Диагн. Акуш. Гин. Педиат. 1995. № 1. С. 13—21.
2. Клиническое руководство по ультразвуковой диагностике. Т. 2 / Под ред. Митькова В.В., Медведева М.В. М.: Видар, 1996.
3. NicolaidesК.Н., Sebire N.J., SnijdersJ.M. The 11 14-week scan. The diagnosis of fetal abnormalities. NY, L.: Tte Parthenon Publ. Gr., 1999.
4. Pandya P.P., Goldberg H., WaltonB. et al. The implementation of first-trimester scanning at 10-13 weeks’ gestation and measurement of fetal nuchal translucency thickness in two maternity units // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 20-25.
5. Szabo J., Gellen J., Szemere G. First-trimester ultrassound screening for fetal aneuploides in women over 35 and under 35 years of age // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 161-163.
6. Bewley S., Roberts L.J., MackinsonM., Rodeck C. First trimester fetal nuchal translucency: problems with screening the general population //Br. J. Obstet. Gynaecol. 1995. V. 102. P. 386-388.
7. Bower S., Chitty L., Bewley S. et al. First trimester nuchal translucency screening of the general population: data from three centres // 27th British Congress of Obstetrics and Gynaecology. Dublin. 1995.
8. Braithwaite J.M., Kadir R.A., Pepera T.A. et al. Nuchal translucency measurement: training of potential examiners // Ultrasound Obstet. Gynecol. 1996. V. 8. № 3. P. 192 195.
9. Kornman L.H., Morssink L.P., Beekhuis J.R. et al. Nuchal translucency cannot be used as a screening test for chromosomal abnormalities in the first trimester of pregnany in a routine ultrasound setting//Prenat. Diagn. 1996. V. 16. P. 797-805.
10. Zimmerman R., Hucha A., Salvoldelli G. et al. Serum parameters and nuchal translucency in first trimester screening for fetal chromosomal abnormalities // Br. J. Obstet. Gynaecol. 1996. V. 103. P. 1009-1014.
11. Kadir R.A.. Economides D.L. The effect of nuchal translucency measurement on second-
НАЧАЛО ГЛАВЫ
------------------- 91
ОГЛАВЛЕНИЕ
3
глава
trimester biochemical screening for Down’s syndrome //Ultrasound Obstet. Gynecol. 1997. V. 9. №4. P. 244 247.
12. Taipale P., Hiilesmaa V., Salonen R., Ylostalo P. Increased nuchal translucency as a marker for fetal chromosomal defects // N. Engl. J. Med. 1997. V. 337. P. 1654 1658.
13. ThilaganathanB., SlackA., WathenN.C. Effect of first-trimester nuchal translucency on second-trimester maternal serum biochemical screening for Down’s syndrome // Ultrasound Obstet. Gynecol. 1997. V. 10. № 4. P. 261-264.
14. Hafner E., Schuchter K., Liebhart E., Philipp K. Results of fetal nuchal thranslucensy measurement at weeks 10-13 in 4233 unselected pregnant women//Prenat. Diagn. 1998. V. 18. № 1. P. 29-34.
15. Pajkrt E., van Lith J.M.M., Mol B.W.J. et al. Screening for Down’s syndrome by fetal nuchal translucency measurement in a general population // Ultrasound Obstet. Gynecol. 1998. V. 12. P. 163-169.
16. Theodoropoulos P., Lolis D., Papageorgiou C. et al. Evaluation of first-trimester screening by fetal nuchal translucency and maternal age // Prenat. Diagn. 1998. V. 18. P. 133 137.
17. Maymon R., Dreazen E., Rozinsky S. et al. Comparison of nuchal translucency measurement and mid-gestation serum screening in assisted reproduction versus naturally conceived singleton pregnancies // Prenat. Diagn. 1999. V. 19. P. 1007—1011.
18. Muller M.A., BonselG.J., Bieker O.P., Bilardo C.M. Implementaion of nuchal translucency screening in the Dutch penatal care system: evaluation of screening performance and acceptance // Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 42.
19. Алтынник H.A., Медведев М.В. Нормативные значения копчико-теменного размера и толщины воротникового пространства плода в ранние сроки беременности //Ультразвук. Диагн. Акуш. Гин. Педиат. 2001. Т. 9. № 1. С. 35-37.
20. Whitlow B.J., Economides D.L. The optimal gestational age to examine fetal anatomy and measure nuchal translucency in the first trimester//Ultrasound Obstet. Gynecol. 1998.
V. 11. №4. P. 258-261.
21. Herman A., Maymon R., Dreazen E. et al. Image magnification does not contribute to the repeatability of caliper placement in measuring nuchal translucency thickness // Ultrasound Obstet. Gynecol. 1998. V. 11. № 4. P. 266—270.
22. Chatzipapas I., Spathopoulos Y., Whitlow B., Economides D. The effect of neck position on nuchal translucency measurement // Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 80.
23. De Graaf I.M., Muller M.A, Van Zuylen AA et al. The influence of fetal position on nuchal translucency thickness // Ultrasound Obstet. Gynecol. 2000. V. 15. № 6. P. 520-522.
24. Herman A. Dreazen E.. Samandarov A. et al. On-to-on versus on-to-out nuchal translucency measurements // Ultrasound Obstet. Gynecol. 2000. V. 15. № 2. P. 126-130.
25. Schaefer M., Laurichesse-Delmas H., Ville Y. The effect of nuchal cord on nuchal translucency measurement at 10-14 weeks // Ultrasound Obstet. Gynecol. 1998. V. 11. № 4. P. 271-273.
26. Pandya P.P., Altman D.G., Brizot M.L. et al. Repeatability of measurement of fetal nuchal translucency thickness // Ultrasound Obstet. Gynecol. 1995. V. 5. № 5. P. 334-337.
27. Pajkrt E., Mol B.W.J., Boer К et al. Intra- and interoperator repeatability of the nuchal translucency measurement // Ultrasound Obstet. Gynecol. 2000. V. 15. № 4. P. 297-301.
28. Pajkrt E., Mol B.W., van Lith J.M. et al. Screening for Down’s syndrome by fetal nuchal translucency measurement in a high-risk population // Ultrasound Obstet. Gynecol. 1998. V. 12. № 3. P. 156-162.
29. Nicolaides K.H., Azar G., Byrne D. et al. Fetal nuchal translucency: ultrasound screening for chromosomal defects in first trimester of pregancy // Br. Med. J. 1992. V. 304. P. 867-869.
30. Schutle-Valentin M. Unechogenic nuchal edema as a marker in trisomy 21 screening // Ultrasound Obstet. Gynecol. 1992. V. 2. Suppl. 1. P. 160.
31. Brambati B., Colombo U., Zuliani G. et al. Sonographic identification of nuchal
92
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
translcency in the first trimester in relation to fetal aneuploides // 7th International Conference on Early Prenatal Diagnosis. Jerusalem, Israel, May 22-27, 1994. A. 119.
32. Comas C., Ojuel J., Martinez J.M. et al. First-trimester nuchal edema as a marker in trisomy 21 screening // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. P. 64.
33. OvariL., JakabA., DitroiP. etal. First-trimester screening of fetal malformations by ultrasound // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. P. 113.
34. Pajkrt E., Bilardo C.M., MolB.W.J. et al. First-trimester ultrasound screening for fetal chromosomal anomalies // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. P. 58.
35. Duyos J. Fetal nuchal edema in the first-trimester: what if the karyotape is normal // Ultrasound Obstet. Gynecol. 1994. V. 4. Suppl. 1. P. 46.
36. Josefsson A, Molander E., Selbing A. Nuchal translucency as a screening test for chromosomal abnormalities in a routine first trimester ultrasound examination // Acta Obstet. Gynecol. Scand. 1998. V. 77. № 5. P. 497-499.
37. Михайлов A.B., Лебедев B.M., Кузнецова T.B., Коротеев АЛ. Значение определения толщины воротникового пространства у плода в группе беременных низкого риска по развитию хромосомной патологии // Ультразвук. Диагн. Акуш. Гин. Педиат. 2000. Т. 8. № 3. С. 239.
38. Русанова О.К., Бунтова О.В., Кархмазова М.В., Богодух Л. К. Роль ультразвукового скрининга беременных в ранней диагностике врожденных и наследственных заболеваний // Ультразвук. Диагн. Акуш. Гин. Педиат. 2000. Т. 8. № 3. С. 241-242.
39. MaymonR.. JauniauxE.. Holmes A. etal. Twin pregnancy follow-up and outcome following first trimester nuchal translucency assessment / /10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21, 2000. P. 317.
40. Pajkrt E., Muller M.A, Bieker O.P., Bilardo C.M. The clinical impact of increased nuchal translucency // Ultrasound Obstet. Gynecol.
2000. V. 16. Suppl. 1. P. 42.
41. Yagel S., Anteby E.Y., Rosen L. et al. Assessment of first-trimester nuchal translucency by daily reference intervals // Ultrasound Obstet. Gynecol. 1998. V. 11. № 4. P. 262-265.
42. Snijders R.J., Noble P„ Sebire N. et al. UK multicentre project on assessment of risk of trisomy 21 by maternal age and fetal nuchal-translucency thickness at 10-14 weeks of gestation. Fetal Medicine Foundation First Trimester Screening Group //Lancet. 1998. V. 352. P. 343-346.
43. Thilaganathan B., Khare M., Williams B., Wathen N.C. Influence of ethnic origin on nuchal translucency screening for Down’s syndrome //UltrasoundObstet. Gynecol. 1998. V. 12. №2. P. 112-114.
44. Szabo J., Ge lien J. Nuchal fluid accumulation in trisomy-21 detected by vaginal sonography infirst trimester // Lancet. 1990. V. 336. P. 1133.
45. Schutle-Vallentin M., Schindler H. Non-echogenic nuchal oedema as a marker in trisomy 21 screening // Lancet. 1992. V. 339. P. 1053.
46. Shulman L.P., Emerson D., Felker R et al. High frequency of cytogenetic abnormalities with cystic hygroma diagnosed in the first trimester // Obstet. Gynecol. 1992. V. 80. P. 80 82.
47. Ville Y., Lalondrelle C., Doumerc S. et al. First-trimester dagnosis of nuchal anomalies: significance and fetal outcome // Ultrasound Obstet. Gynecol. 1992. V. 2. P. 314-316.
48. Wilson R.D., Venir N., Faquharson D.F. Fetal nuchal fluid physiological or pathological? — in pregnancies less than 17 menstrual weeks // Prenat. Diagn. 1992. V. 12. P. 755—763.
49. van Zalen-Sprock R.M., van Vugt J.M.G., van Geijn H.P. First-trimester diagnosis of cystic hygroma — course and outcome // Amer. J. Obstet. Gynecol. 1992. V. 167. P. 94-98.
50. Johnson M.P., Johnson A, Holzgreve W. et al. First-trimester simple hygroma: cause and outcome // Amer. J. Obstet. Gyncol. 1993. V. 168. P. 156-161.
51. Hewitt B. Nuchal translucency in the first trimester//Aust. NZ. J. Obstet. Gynecol. 1993. V. 33. P. 389-391.
НАЧАЛО ГЛАВЫ
------------------- 93
ОГЛАВЛЕНИЕ
3 глава______________________________________
52. NadelA., Bromley В., BenacerrafB.R. Nuchal thickening or cystic hygromas in first- and early second-trimester fetuses: prognosis and outcome //Obstet. Gynecol. 1993. V. 82. P. 43 48.
53. Savoldelli G., Binkert F., Achermann J., Schmid W. Ultrasound screening for chromosomal anomalies in the first trimester of pregnancy // Prenat. Diagn. 1993. V. 13. P. 513 518.
54. Trauffer P.M.L., Anderson C.E., Johnson A. et al. The natural history of euploid pregnancies with first-trimester cystic hydromas // Amer. J. Obstet. Gynecol. 1994. V. 170. P. 1279-1284.
55. Comas C., Martinez J.M., Ojuel J. et al. First-trimester nuchal edema as a marker of aneuploidy // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 26-29.
56. Hafner E., Schuchter K., Philipp K. Screening for chromosomal abnormalities in an unselected population by fetal nuchal translucency // Ultrasound Obstet. Gynecol. 1995. V. 6. P. 330-333.
57. Pandya P.P., Kondylios A.. Hilbert L. et al. Chromosomal defects and autcome in 1015 fetuses with increased nuchal translucency // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 15 19.
58. D’Ottavio G., Meir Y.J., Rustico M.A et al. Screening for fetal anomalies by ultrasound at 14 and 21 weeks // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. P. 375-380.
59. Martinez J.M., Echevarria M., Borrell A. et al. Fetal heart rate and nuchal translucency in detecting chromosomal abnormalities other than Down syndrome // Obstet. Gynecol. 1998. V. 92. № 1. P. 68-71.
60. Graneras A., Galindo A., Moreno A. et al. Nuchal translucency and chromosomal defects //10 International Conference on Prenatal Diagnosis and Therapy. Barcelona. June 19-21, 2000. P. 353.
61. Юдина Е.В. Синдром Дауна: проблемы и ошибки диагностики в пренатальном периоде //Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 4. С. 272-278.
62. Orlandi F., Damiani G., Hallaban T.W. et al. First-trimester screening for fetal aneuplody:
biochemistry and nuchal translucency // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. P. 381-386.
63. EconomidesD.L., Whitlow B.J., Kadir R. et al. First trimester sonographic detection of chromosomal abnormalities in an unselected population // Br. J. Obstet. Gynaecol. 1998. V. 105. P. 58-62.
64. Macri J.N. First trimester serum screening // 10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21, 2000. P. 203-205.
65. Krantz D.A., Larsen J.W., Buchanan P.D., Macri J.N. First trimester Down syndrome screening: free в human chrorionic gonadotropin and pregnancy associated plasma protein A// Amer. J. Obstet. Gynecol. 1996. V. 174. P. 612-616.
66. Wald N. J., George L., Smith D. et al. On behalf of the International Prenatal Screening Research Group. Serum screening for Down’s syndrome between 8 and 14 weeks of pregnancy // Brit. J. Obstet. Gynaecol. 1996. V. 104. P. 407-412.
67. Berry E., Airken D.A., Crossley J.A. et al. Screening for Down’s syndrome: changes in marker levels and detection rates between first and second trimest er//Br. J. Obstet. Gynaecol. 1997. V. 104. P. 811-817.
68. Haddow J.E., PalomakiG.E., Knight G.J. et al. Screening of maternal serum for fetal Down’s syndrome in the first trimester // N. Engl. J. Med. 1998. V. 338. P. 955-961.
69. Wheeler D.M., Sinosich M.J. Prenatal screening in the first trimester of pregnancy // Prenat. Diagn. 1998. V. 18. P. 537—543.
70. De Graaf I.M., Pajkrt E., Bilardo C.M. et al. Early pregnancy screening for fetal aneuploidy with erum markers and nuchal translucency // Prenat. Diagn. 1999. V. 19. P. 458—462.
71. Spencer K., SouterV.,TulN. et al. A screening program for trisomy 21 at 10-14 weeks using fetal nuchal translucency? Maternal serum free p-human chrorionic gonadotropin and pregnancy-associated plasma protein A // Ultrasound Obstet. Gynecol. 1999. V. 13. P. 231-237.
72. Tsukerman G.L.. Gusina N.B.. Cuckle H.S.
94 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И XPOMOCOMHBIE АНОМАЛИИ
Maternal serum screening for Down syndrome in the first trimester: experience from Belarus // Prenat. Diagn. 1999. V. 19. P. 499-504.
73. Navarro X., Casals E., Puerto B. et al. First trimester Down’s syndrome screening. Evaluation of different marker combinations // 10 International Conference on Prenatal Diagnosis and Therapy. Barcelona. June 19-21. 2000. P. 359.
74. Cuckle H.S., Van Lith J.M.M. Appropriate biochemical parameters in first-trimester screening for Down syndrome // Prenat. Diagn. 1999. V. 19. P. 505 512.
75. Brizot M.L., Snijders R.J.M., Butler J. et al. Maternal serum hCG and fetal nuchal translucency thickness for the prediction of fetal trisomies in the first trimester of pregnancy // Brit. J. Obstet. Gynaecol. 1995. V. 102. P. 127— 132.
76. De Biasio P., Siccardi M., Volpe G. et al. First-trimester screening for Down syndrome using nuchal translucency measurement with free beta-hCG and PAPP-A between 10 and 13 weeks of pregnancy — the combined test // Prenat. Diagn. 1999. V. 19. № 4. P. 360—363.
77. Bach C., Cabrero D., Vila I., Sabria J. First-trimester fetal chromosomal defects screening in a low risk population by fetal nuchal translucency and maternal serum free в-hCG and PAPP-A//10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21, 2000. P. 297.
78. Casals E., Aibar C., Borrell A. et al. First-trimester Down’s syndrome screening: preliminar results // 10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21, 2000. P. 305.
79. Снайдере Р.Дж.М., Николаидес K.X. Ультразвуковые маркеры хромосомных дефектов плода. М.: Видар. 1997. С. 149—150.
80. Hyett J.A., Sebire N.J., Snijders R.J.M., Nicolaides K.H. Intrauterine lethality oftrisomy 21 fetuses with increased nuchal translucency thickness//Ultrasound Obstet. Gynecol. 1996. V. 7. №2. P. 101 103.
81. Tul N., Spencer K., Noble P. et al. Screening for trisomy 18 by fetal nuchal translucency and maternal serum free р-hCG and PAPP-A at 1 fl-
14 weeks of gestation // Prenat. Diagn. 1999. V. 19. № H.P. 1035-1042.
82. Spencer K., Ong C., Skentou H. et al. Screening for trisomy 13 by fetal nuchal translucency and maternal serum free р-hCG and PAPP-A at 10-14 weeks of gestation // Prenat. Diagn. 2000. V. 20. №5. P. 411-416.
83. Медведев M.B.. Юдина E.B.. Алтынник H.A., Цыпурская Г.Ю. Расширенное воротниковое пространство у плода: новые допплерографические критерии хромосомной патологии //Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 3. С. 235-237.
84. Spencer К., Liao A.W.L., Skentou Н. et al. Screening for triploidy by fetal nuchal translucency and maternal serum free p-hCG and PAPP-A at 10-14 weeks of gestation // Prenat. Diagn. 2000. V. 20. № 6. P. 495—499.
85. de Graaf I.M., van Bezouw S.M.C.A, Jakobs M.E. etal. First-trimester non-invasive prenatal diagnosis oftriploidy // Prenat. Diagn. 1999. V. 19. № 2. P. 175-177.
86. Михайлов A.B., Кузнецова T.B., Шелаева E.B. и др. Толщина воротникового пространства у плода как ультразвуковой маркер триплоидии в I триместре беременности // Ультразвук. Диагн. 1996. № 1. С. 43 45.
87. Du J., Qu L., Guo S. Prenatal diagnosis of fetal nuchal cystic hygroma in 22 cases // Chung Hua Fu Chan Ko Tsa Chih. 1997. V. 32. № 7. P. 425-427.
88. Юдина E.B. Роль эхографии в формировании показаний к пренатальному кариоти-пированию//Ультразвук, диагн. 1998. № 1. С. 42 50.
89. Azar G., Snijders R.J.M., Gosden С.М., Nicolaides K.H. Fetal nuchal cystic hygromata: associated malformations and chromosomal defects //Fetal Diagn. Ther. 1991. V. 6. P. 46— 57.
90. Sebire N.J., Snijders R.J., Brown R. et al. Detection of sex chromosome abnormalities by nuchal translucency screening at 10-14 weeks / /Prenat. Diagn. 1998. V. 18. № 6. P. 581-584.
91. Hsu L.Y.F., Kaffe S., Jenkins E.C. et al. Proposed quidelines for diagnosis of chromosome mosaicism in amniocytes based on
НАЧАЛО ГЛАВЫ
------------------- 95
ОГЛАВЛЕНИЕ
3
глава
data derived from chromosome mosaicism and pseudomosaicism studies // Prenat. Diagn. 1992. V. 12. P. 555-573.
92. LazanakisM.S., Rodgers K., Economides D.L. Increased nuchal translucency and CATCH 22 //Prenat. Diagn. 1998. V. 18. № 5. P. 507—510.
93. Schwarzler P., Moscoso G., Bernard J.P. et al. Trisomy 10: first-trimester features on ultrasound, fetoscopy and postmortem of a case associated with increased nuchal translucency // Ultrasound Obstet. Gynecol. 1999. V. 13. № 1. P. 67-70.
96 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
4
ВОРОТНИКОВОЕ ПРОСТРАНСТВО и ВРОЖДЕННЫЕ ПОРОКИ РАЗВИТИЯ
М.В. Медведев, Н.А. Алтынник
В последние годы достаточно часто появляются сообщения о том, что расширение воротникового пространства может отмечаться не только при хромосомных дефектах у плода, но и при различных врожденных пороках развития. Многие из этих пороков потенциально могут быть диагностированы только в более поздние сроки беременности. Поэтому расширенное воротниковое пространство у плода в 10—14 нед беременности рассматривается в настоящее время не только как маркер хромосомных аномалий, но и как признак, позволяющий формировать группу высокого риска по врожденным порокам развития, подлежащую динамическому эхографическому наблюдению.
Суммарный анализ опубликованных данных по этому вопросу свидетельствует, что у 303 (5,9%) из 5168 плодов с расширенным воротниковым пространством и нормальным кариотипом были отмечены различные врожденные пороки (табл. 4.1).
Следует отметить, что частота врожденных пороков развития возрастает с увеличением воротникового пространства. В исследовании A. Souka и соавт. [20] при ширине воротникового пространства до 3,4 мм врожденные пороки развития от
мечены у 2,4% плодов, от 3,5 до 4,4 мм — у 7,1%, от 4,5 до 5,4 мм — у 12,3%, от 5,5 до 6,4 мм — у 16,7%, а при 6,5 мм и более — в 35,6% наблюдений. Представленные данные могут быть использованы в ходе пренатального консультирования и для определения тактики динамического эхографического наблюдения в случаях обнаружения расширенного воротникового пространства у плодов с нормальным кариотипом.
Особого обсуждения заслуживает вопрос о сроках обнаружения врожденных пороков развития при наличии расширенного воротникового пространства. Согласно ранее проведенному нами анализу опубликованных данных, в 35,5% случаев пороки были обнаружены до 14 нед, в 50,9% — в более поздние сроки беремен-ностиив 13,6% — в постнатальном периоде илиприпатологоанатомическомиссле-довании [24]. Таким образом, почти в 2/3 наблюдений врожденные пороки развития были диагностированы после обнаружения расширенного воротникового пространства в ранние сроки беременности.
При врожденных пороках развития, сопровождавшихся расширением воротникового пространства в ранние сроки беременности, во многих случаях отмечены небла-
97
ОГЛАВЛЕНИЕ
4
глава
Таблица 4.1. Врожденные пороки развития у плодов с расширенным воротниковым пространством и нормальным кариотипом в 10-14 нед беременности
Авторы Ширина воротникового пространства, мм п Врожденные дефекты и генетические синдромы
п нозологические формы
Y. Ville и соавт., 1992 [1] >3,0 61 10 Лицевая расщелина (1), врожденные пороки сердца (3), мультикистоз почек (1), омфалоцеле (1), деформационная акинезия (2), неспецифические синдромы (2)
R. van Zalen-Sprock и соавт., 1992 [2] >3,0 13 3 Мегацистик (1), поликистоз почек (1), синдром Нунан (1)
В. Hewitt, 1993 [3] >3,0 10 1 Ахондрогенез (1)
М. Johnson и соавт., 1993[4] >2,0 32 5 Мегацистик (1), последствия амниотическихтяжей (1), синдром Нунан (1), неспецифические синдромы (2)
A.Nadel и соавт., 1993[5] >4,0 16 5 Лицевая расщелина (1), врожденные пороки сердца (1), диафрагмальная грыжа (1), омфалоцеле (1), синдром эктродактилии-эктодермальной дисплазии-расщелины неба (1)
Р. Pandya и соавт., 1994 [6] >4,0 177 22
L. Shulman и соавт., 1994[7] >2,5 32 1 Кистозная гигрома (1)
D. Salvesen, О. Goble, 1995 [8] >3,0 5 2 Голопрозэнцефалия (1), врожденные пороки сердца (1)
В. Hewitt и соавт., 1996 [9] >3,0 44 3 Сиреномиелия (1), аномалия стебля тела (1), кифоз (1)
М. Moselhi, B.Thilaganathan, 1996 [10] >4,0 8 3 Врожденные пороки сердца (2), spina bifida (1)
F. Sha’Ban и соавт., 1996 [11] >3,0 28 9
L. Hernadi, M.Torocsik, 1997 [12] >3,0 17 2 Ахондроплазия (1), аномалия стебля тела (1)
G. D’Ottavio и соавт., 1997 [13] >4,0 21 4
C. Reynders и соавт., 1997 [14] >3,0 35 3 Поликистоз почек (1), синдром Нунан (1), синдром Joubert (1)
В. Thilaganathan и соавт., 1997 [15] >4,0 30 10 Анэнцефалия (1), spina bifida (1), врожденные пороки сердца (2), омфалоцеле (1), косолапость (1), синдром Нунан (1), макроцефалия (1), неспецифические синдромы (2)
С. Bilardo и соавт., 1998 [16] >3,0 47 11 Аномалия Денди-Уокера (1), агнатия (1), врожденные пороки сердца (2), синдром эктродактилии-эктодермальной дисплазии-расщелины неба(1), атрезия пищевода (1), синдром Нунан (1), синдром Зельвегера (1), GM1-ганглиозидоз (1), миотоническая дистрофия (1), спинальная мышечная атрофия (1)
Y. Fukada и соавт., 1998 [17] >5,0 4 2 Врожденные пороки сердца (1), ахондроплазия (1)
Е. Hafner и соавт., 1998 [18] >2,5 72 7 Кампомелическая дисплазия (1), врожденные пороки сердца (2), омфалоцеле (1), пентада Кантрелла (1), синдром Ивемарка (1), синдром Toriello-Carey (1)
Е. Pajkrt и соавт., 1998 [19] >3,0 21 1 Врожденные пороки сердца (1)
98 -----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
Авторы п Ширина воротникового ространства, мм п Врожденные дефекты и генетические синдромы
п нозологические формы
A. Souka и соавт., 1998 [20] >3,0 4116 161 Анэнцефалия (5), энцефалоцеле (4), вентрикуломе галия (6), аномалия Денди-Уокера (1), голопроз-энцефалия (1), микроцефалия (1), лицевая расщелина (2), микрофтальмия (1), киста гортани (1), кистозная гигрома (1), врожденные пороки сердца (43), диафрагмальная грыжа (8), омфалоцеле (7), гастрошизис (1), обструкция кишечника (2), атрезия двенадцатиперстной кишки (1),гидронефроз (5), мультикистоные почки (4),агенезия почек (2), мегацистик (8), spina bifida (4), кифосколиоз (1), аномалия стебля тела (10), диастемато-миелия (1), косолапость (15), деформационная акинезия (6), синдром Ярхо-Левина (2),синдром Joubert (1), синдром Nance-Sweency (1), синдром Нунан (1), синдром Смита-Лемли-Опица (3), спинальная мышечная атрофия (1), танатоформная дисплазия (1), тригоноцефалия «С» (1), ассоциация VACTERL (2), неспецифические синдромы (6)
J. Van Vugt и соавт., 1998 [21] >3,0 63 8 Синдром Меккеля-Грубера (1), диафрагмальная грыжа (1), врожденные пороки сердца (2), атрезия двенадцатиперстной кишки (1), поликис-тоз почек (1), мегацистик (1), спинальная мышечная атрофия (1)
R. Maymon и соавт. 2000 [22] > 95-го процентиля 46 5 Врожденные пороки сердца (4), синдром задних уретральных клапанов (1)
Е. Pajkrt и соавт., 2000 [23] >3,0 270 25
гоприятные перинатальные исходы. Поданным мультицентровых исследований [20] (результаты работы 306 специалистов, прошедших специальное обучение особенностям проведения ультразвуковых исследований в 10—14 нед, из 22 центров пренатальной диагностики), при обнаружении врож-деннных пороков развития у плодов с расширенным воротниковым пространством в 47,8% случаев было произведено прерывание беременности, в 6,2% наблюдений имела место внутриутробная гибель, 7,5% детей умерли в неонатальном периоде, в живых осталось только 38,5% детей.
Более высокая частота неблагоприятных перинатальных исходов отмечается не только в случаях сочетания расширения воротникового пространстваиврожденньгхпоро-ков развития, но и в общей группе плодов с нормальным кариотипом и расширенным воротниковымпространствомвконце I триместра беременности (табл. 4.2).
Согласно суммарным данным литературы, при расширении воротникового пространства в ранние сроки беременности нормальные дети рождаются в 58,3— 92% (в среднем 87,6%) наблюдений.
При неблагоприятных перинатальных исходах наиболее часто отмечаются самопроизвольные выкидыши, внутриутробная гибель плода либо производится прерывание беременности в связи с обнаружением врожденных пороков развития.
По данным С. Bilardo и соавт. [ 16], частота неблагоприятных перинатальных исходов при расширении воротникового пространства у плодов с нормальным кариотипом составляет 32%, тогдакакпринормальных значениях воротникового пространства — только 7,5%, что соответствует популяционным данным. Схожие данные приводят Е. Pajkrt и соавт. [23] — 40 и 4,0% соответственно.
Кроме этого, отмечена прямая пропорциональная зависимость между частотой
НАЧАЛО ГЛАВЫ
------------------- 99
ОГЛАВЛЕНИЕ
4
глава
Таблица 4.2. Перинатальные исходы при расширении воротникового пространства у плодов с нормальным кариотипом [24]
Авторы Неблагоприятный перинатальный исход Благоприятный перинатальный исход
М. Johnson и соавт., 1993 [4] 3(11,5%) 23 (88,5%)
Р. Trauffer и соавт., 1994 [25] 6(31,6%) 13(68,4%)
Р. Pandya и соавт., 1995 [26] 44 (8%) 520 (92%)
J. Szabo и соавт., 1995 [27] 5(41,7%) 7 (58,3%)
N. Sebire и соавт., 1996 [28] 1 (25%) 3 (75%)
L. Hernadi, M.Torocsik, 1997 [12] 5 (35,7%) 9 (64,3%)
С. Reynders и соавт., 1997 [14] 7 (20,6%) 27 (79,4%)
С. Bilardo и соавт., 1998 [16] 15(31,9%) 32 (68,1%)
J. Van Vugt и соавт., 1998 [21] 11 (17,5%) 52 (82,5%)
Всего 97(12,4%) 686 (87,6%)
перинатальных потерь и степенью расширения воротникового пространства в ранние сроки беременности (табл. 4.3).
Несмотря на наличие прямой пропорци-ональнойзависимосгимеждучастотойхромо-сомных дефектов, врожденных пороков развития, неблагоприятных перинатальных исходов и расширением воротникового пространства у плода в ранние сроки беременности, этот эхографический маркер нельзя полностью отождествлять с понятием «неперспективная беременность» ирекомен-довать ее прерывание, таккак более чемв 80%
случаев рождаются здоровые дети. Расширенное воротниковое пространство является только показанием к расширенному прена-тальномудинамическому обследованию, вча-стности для своевременной диагностики врожденных пороков развития, которые могут проявиться позже обнаружения и исчезновения этого эхографического признака.
Врожденные пороки развития и различные синдромы, которые наиболее часто отмечаются при расширении воротникового пространства у плода в ранние сроки беременности, представлены в табл. 4.4.
Таблица 4.3. Перинатальные потери в зависимости от степени расширения воротникового пространства (дополненные данные [24])
Авторы Ширина воротникового пространства, мм
3 4-6 >7
Р. Pandya и соавт., 1995 [26] 3,3% 20,7% 64,3%
J. Hyett и соавт., 1996 [29] 5,3% 8,8% 23,5%
A. Souka и соавт., 1998 [20] 3,7% 11,5% 55,6%
Таблица 4.4. Врожденные пороки развития и синдромы, наиболее часто сочетающиеся с расширенным воротниковым пространством
Врожденные пороки сердца Цереброкостомандибулярный синдром
Диафрагмальная грыжа Синдром Меккеля-Грубера
Омфалоцеле Синдром Смита-Лемли-Опица
Мегацистик Синдром Нунан
Скелетные дисплазии Фето-фетальный трансфузионный синдром
Аномалия развития стебля тела Спинальная мышечная атрофия (тип I)
Гидролетальный синдром Синдром Зельвегера
100-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
Врожденные пороки сердца
Впервые о взаимосвязи расширенного воротникового пространства с врожденными пороками сердца и главных артерий сообщила в 1995 г. группа специалистов из Лондона [30—33]. Для оценки структур сердца плода ими была использована особая методика после прерывания беременности в 112 случаях аномального кариотипа, установленного на основании обнаружения расширенного воротникового пространства в 10—14 нед беременности. В ходе исследований выявлено, что при трисомии 21 чаще всего отмечаются атриовентрикулярные и септальные дефекты, при трисомии 18 — дефекты межжелудочковой перегородки и/или разнообразные аномалии клапанного аппарата, при трисомии 13 — атриовентрикулярные и септальные дефекты, разнообразные аномалии клапанов, сужение перешейка аорты или общий артериальный ствол, при синдроме Тернера — выраженные нарушения дуги аорты. Атриовентрикулярные и перимембранозные дефекты межжелудочковой перегородки были обнаружены в 56% случаев. При этом частота их встречаемости в среднем составляла 10% при ширине воротникового пространства 3 мм и 75% — при ширине более 4 мм.
Морфометрические исследования крупных сосудов выявили меньший диаметр перешейка аорты и более широкий аортальный клапан по сравнению с группой плодов с нормальной шириной воротникового пространства. Объяснением
Таблица 4.5. Частота выраженных врожденных пороков сердца при расширении воротникового пространства у плодов с нормальным кариотипом [34]
Ширина воротникового пространства, мм п Частота врожденных пороков сердца на 1000 обследованных
2,5-3,4 1102 5,4
3,5-4,4 188 26,6
4,5-5,4 56 53,6
>5,5 43 232,6
Всего 1389 17,3
этой зависимости, по-видимому, является тот факт, что закладка лимфатической системы яремной и подмышечной областей происходит вдоль дуги аорты. Поэтому аномалии дуги аорты часто сопровождаются аномалиями грудного лимфатического протока и соответственно расширением воротниковой зоны.
Особый интерес представляют данные J. Hyett и соавт. [34], полученные при исследовании 1389 плодов с нормальным кариотипом и расширением воротникового пространства в 10—14 нед (табл. 4.5). Согласно их результатам, частота выраженных врожденных пороков сердца составляет в среднем 17,3 на 1000 плодов, что в 2 раза выше популяционной частоты. Кроме этого, отчетливо видно значительное возрастание частоты врожденных пороков сердца с увеличением ширины воротникового пространства.
Группы исследователей из Германии и Израиля также сообщают о высокой частоте обнаружения расширенного воротникового пространства при врожденных пороках сердца в ранние сроки беременности. Так, согласно суммарным данным, полученным U. Gembruch и соавт. [35] и R. Achiron и соавт. [36], у 16 (80%) из 20 плодов с врожденными пороками сердца отмечалось расширение воротникового пространства.
Однако специалисты из Испании подвергают сомнению наличие существенной зависимости между расширенным воротниковым пространством и врожденными пороками сердца [37]. Ими в ходе динамического эхографического наблюдения за 104 плодами с расширенным воротниковым пространством (> 95-го процентиля) и нормальным кариотипом врожденный порок сердца (атрезия трикуспидального клапана в сочетании с дефектом межжелудочковой перегородки) быт диагностирован только в одном случае.
На отсутствие выраженнойкор-релятивной зависимости между
НАЧАЛО ГЛАВЫ
-------------------101
ОГЛАВЛЕНИЕ
4
глава
Таблица 4.6. Нозологические формы врожденных пороков сердца у плодов с расширенным воротниковым пространством [40]
Врожденные пороки сердца Общая группа — Ширина воротникового пространства
> 95-го процентиля > 99-го процентиля
Тетрада Фалло 9(18%) 2 (22%) 2 (22%)
Гипоплазия левых отделов сердца 3 (6%) 2 (67%) 1 (33%)
Транспозиция главных артерий 8(16%) 4 (50%) 3 (38%)
Коарктация, стеноз, атрезия аорты 10(20%) 10(100%) 8 (80%)
Атриовентрикулярные и септальные дефекты 8(16%) 4 (50%) 1 (13%)
Другие 12(24%) 6 (50%) 5 (42%)
Всего 50(100%) 28 (56%) 20 (40%)
расширением воротникового пространства в 10—14 нед беременности и врожденными пороками сердца указывают также исследователи из Великобритании. Р. Schwarzler и соавт. [38] при обследовании 4523 беременных установили, что только у одного из 9 плодов с выраженными пороками сердца воротниковое пространство превышало 2,5 мм в ранние сроки беременности.
Удивительным феноменом является то, что в большинстве случаев врожденныхпо-роков сердца отмечается исчезновение рас -ширенного воротникового пространства к 16—18 нед беременности. Это связано с дифференцированным ростом диаметра крупных сосудов: диаметр перешейка аорты увеличивается быстрее, чем диаметр аортального клапана [39]. Таким образом, при увеличении срока беременности гемодинамические нарушения вследствие сужения перешейка могут исчезнуть, что приводит к спонтанному исчезновению расширенного воротникового пространства.
Хотя увеличение ширины воротникового пространства наблюдается при всех формах врожденных пороков сердца и главных артерий, более существенная зависимость отмечена при дефектах левых отделов сердца, таких как гипоплазия левых отделов сердца и коарктация аорты (табл. 4.6).
По данным J. Hyett и соавт. [40], использование в качестве диагностического критерия расширенного воротникового пространства (> 95-го процентиля) позволяет выявить выраженные врожденные
пороки сердцау плода с чувствительностью 56,0%, специфичностью 93,8% припрогно-стической ценности положительного теста 1,5%, отрицательного теста 99,9%.
Таким образом, представленные данные позволяют рассматривать расширение воротникового пространства в качестве эхографического маркера врожденных пороков сердца. Учитывая, что в ходе пренатального скринингового обследования обнаруживается не более 30% выраженных врожденных пороков сердца, проведение целенаправленного эхокардиографического исследования в 20—24 нед у плодов с расширенным воротниковым пространством в 10—14 нед позволит значительно повысить дородовую выявляв-мость сердечных аномалий.
Диафрагмальная грыжа
Диафрагмальная грыжа встречается с частотой в среднем 1 случай на 2400 новорожденных. В то же время при расширении воротникового пространства частота диафрагмальной грыжи значительно возрастает: по данным A. Souka и соавт. [20], она составила 8 случаев на 4116 обследованных плодов.
Диафрагмальную грыжу в большинстве наблюдений удается диагностировать только во второй половине беременности. Нередко при врожденной диафрагмальной грыже отмечаются хромосомные аберрации и сочетанные аномалии [41]. Даже при изолированной диафрагмальной грыже выживаемость после хирургической кор
102 —
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
рекции, по данным мультицентрового анализа, составляет только 37% [41]. У 37% плодов с диафрагмальной грыжей в 10—14 нед беременности отмечается расширенное воротниковое пространство, хотя диагностировать ее в эти сроки не удается 142]. Следует отметить, что в 83% случаев диафрагмальной грыжи, сопровождавшихся расширением воротникового пространства в ранние сроки беременности, имела место гибель в неонатальном периоде.
D. Bulas и соавт. [43] сообщают о случае пренатальной диагностики Fryn синдрома у плода с расширенным воротниковым пространством в 12 нед беременности. Этот синдром обычно бывает летальным, встречается с частотой 1 случай на 15 000 новорожденных и характеризуется наличием диафрагмальной грыжи, дефектами дистальных отделов конечностей, лицевыми дизморфиями и укорочением шеи. В 16 нед отмечено частичное разрешение воротникового пространства и умеренное укорочение конечностей, желудок и сердце плода занимали обычное расположение. Кариотип плода нормальный. В 20 нед в ходе ультразвукового исследования были диагностированы диафрагмальная грыжа, смещение органов средостения, плевральный выпот, асцит и укорочение костей конечностей. В 24 нед отмечено многоводие. В 34 нед произошли преждевременные роды, ребенок умер в неонатальном периоде. При патологоанатомическом исследовании был установлен Fryn синдром: большая диафрагмальная грыжа, выраженное укорочение шеи, лицевой дизморфизм, гипертрихоз, гипоплазия дистальных отделов конечностей.
Омфалоцеле
Омфалоцеле встречается в среднем с частотой 1 случай на 4000 новорожденных и характеризуется наличием грыжевого образования, исходящего из пупочного кольца и содержащего органы брюшной полости. Образование имеет мембрану, к
которой прикрепляется пуповина. Пренатальная ультразвуковая диагностика омфалоцеле возможна с конца I триместра беременности при условии наличия печени в составе грыжевого содержимого, так как описаны случаи более позднего исчезновения физиологической эмбриональной грыжи.
В наблюдениях A. SoukancoaBT. [201 при расширении воротникового пространства омфалоцеле встречалось значительно чаще — у 7 из 4116 обследованных плодов, а в наблюдениях R. vanZalen-SprockncoaBT. [44] омфалоцеле было диагностировано у 14 плодов в 11—14 нед беременности. В 8 из 14 случаев отмечено расширение воротникового пространства в пределах от 3,5 до 10 мм. Следует подчеркнуть, что в большинстве таких случаев отмечаются хромосомные дефекты, преимущественно трисомии 18 и 13.
К настоящему времени в литературе представлены также описания наблюдений омфалоцеле в составе пентады Кантрелла (дистальный дефект грудины, омфалоцеле, диафрагмальная грыжа, неполноценность диафрагмальной части перикарда, интракардиальные дефекты), диагностированных в конце I триместра беременности, которые сопровождались расширением воротникового пространства [18,44,45].
Мегацистик
Критерием мегацистик в 10—14 нед является увеличение продольного размера мочевого пузыря плода более 8 мм [46]. Е. Zimmer и М. Bronshtein [47] описали наблюдение увеличенного мочевого пузыря (16 мм), двустороннего гидронефроза и эквиноварусной позиции стоп у плода с расширением воротникового пространства и аномальным кариотипом в 12 нед беременности. N. Sebire и соавт. [46] обнаружили расширение воротникового пространства у 6 (40%) из 15 плодов с увеличенным мочевым пузырем, что значительно ухудшало перинатальныйпрогноз. Из 6 наблюдений в 2 было произведено прерывание беременности в связи с аномальным кариотипом и в одном случае произошел выкидыш.
НАЧАЛО ГЛАВЫ
-------------------103
ОГЛАВЛЕНИЕ
4
глава
Скелетные дисплазии
Пренатальная ультразвуковая диагностика скелетных дисплазий в конце I — начале II триместра беременности вызывает большие трудности и удается в единичных случаях. Тем не менее к настоящему времени описано несколько наблюдений скелетных дисплазий, которые сопровождались расширением воротникового пространства в ранние сроки беременности (табл. 4.7).
В качестве примера целесообразно привести наблюдение М. Ben-Ami и соавт. [51]. При скрининговом ультразвуковом исследовании в 14 нед было обнаружено значительное расширение воротникового пространства — до 5,8 мм, длина бедренных костей соответствовала 5-му процентилю, кариотип плода был нормальным. Только при повторном ультразвуковом исследовании в 22 нед были обнаружены специфические изменения грудной клетки и укорочение костей конечностей ниже 5-го процентиля, что соответствовало асфиксическойдистрофии грудной клетки (синдром Жена).
Таким образом, при обнаружении расширенного воротникового пространства в ранние сроки беременности необходимо проводить динамическое эхографическое наблюдение за состоянием опорно-двигательного аппарата плода.
Аномалия развития стебля тела
Этот порок является летальным и характеризуется обширным дефектом передней брюшной стенки, выраженным кифосколиозом и рудиментарной пуповиной. В ходе обследования 4626 плодов с нормальным кариотипом и расширенным воротниковым пространством аномалия стебля тела была диагностирована в 12 случаях, что в несколько раз превышает встречаемость этого порока в популяции [9, 12, 20].
Во всех диагностированньгх случаях верхняя половина туловища располагалась в амниотической полости, тогда как нижняя часть — в целомической полости. Расширение воротникового пространства установ
лено в 71,4% случаев. Следуетподчеркнугь, что во всех этих наблюдениях кариотип плода был нормальным.
Гидролетальный синдром
Этот синдром является летальным, тип наследования — аутосомно-рецессивный. Он характеризуется гидроцефалией, отсутствием мозолистого тела, лицевыми расщелинами, микрогнатией, полидактилией, аномальной установкой стоп и дефектами сердечных перегородок. Р. AmmalanR. Salonen [57] сообщают об ультразвуковой диагностике гидролетально-го синдрома в 12 нед беременности у пациентки группы высокого риска. При этом в ходе ультразвукового исследования, помимо характерных изменений структур головного мозга, были обнаружены значительное расширение воротникового пространства и аномальная установка стоп.
Цереброкостомандибулярный синдром Цереброкостомандибулярный синдром (ЦКМС) относится к редкой врожденной патологии и характеризуется первичным нарушением развития костной системы. Кроме этого, при ЦКМС отмечается микрогнатия, а также приблизительно у 50% детей наблюдается задержка психомоторного развития [58].
R. Ibba и соавт. [591 удалось диагностировать ЦКМС в 18 нед беременности. В 11 нед ими было обнаружено расширение воротникового пространства до 4 мм. В связи с этим проведено пренатальное ка-риотипирование — патологии не обнаружено. В 12 нед при трансвагинальном ультразвуковом исследовании отмечена микрогнатия. При исследовании в 15 нед наблюдалось значительное уменьшение воротникового пространства, а в 18 нед диагностированы колоколообразная форма грудной клетки и умеренная двусторонняя дилатация почечных лоханок. На основании полученных данных был выставлен диагноз ЦКМС. По желанию пациентки беременность была прервана, на аутопсии пренатальный диагноз полностью подгвер-
104 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
Таблица 4.7. Пренатальная ультразвуковая диагностика скелетных дисплазий, сопровождавшихся расширением воротникового пространства в 10-14 нед беременности
Авторы Срок беременности, нед Скелетная дисплазия Данные эхографии
N. Fisk и соавт., 1991 [48] 11 Ахондрогенез II типа Укорочение конечностей, расширение воротникового пространства
Р. Soothill и соавт. 1993 [49] 12 Ахондрогенез II типа Укорочение конечностей, расширение воротникового пространства
К. Leung и соавт., 1995 [50] 14 Синдром эктродактилии-экто дермальной дисплазии-расщелины неба Олигодактилия, расширение воротникового пространства
М. Ben-Ami и соавт., 1997 [51] 14 Синдром Жена Длина бедренной кости на уровне 5-го процентиля, расширение воротникового пространства
S. Eliyahu и соавт. 1997 [52] 12 Синдром Ярхо-Левина Дезорганизация позвоночника, расширение воротникового пространства
J. Hyettn соавт., 1997 [53] 12 Деформационная акинезия Множественные контрактуры, расширение воротникового пространства
L. Hernadi, М. Torocsik, 1997 [12] 13 Ахондроплазия Укорочение конечностей, расширение воротникового пространства
N. den Hollander и соавт., 1997 [54] 12 Остеохондродисплазия Укорочение конечностей, аномальная грудная клетка, расширение воротникового пространства
G. D’Ottavio и соавт., 1997 [13] 13-15 Г ипофосфатазия Укорочение и снижение эхогенности костей, расширение воротникового пространства
В. Petrikovsky и соавт., 1997 [55] 11 Синдром Робертса Тетрафоком ел и я, расширение воротникового пространства
С. Bilardo и соавт. 1998 [16] 12 Синдром эктродактилии-эктодермальной дисплазии-расщелины неба Расширение воротникового пространства
Е. Hafner и соавт., 1998 [18] 12 Кампомелическая дисплазия Расширение воротникового пространства
L. Hill, J. Leary, 1998 [56] 13 Синдром «короткие ребра-полидактилия» 1типа Аномальная грудная клетка, укорочение конечностей, полидактилия, расширение воротникового пространства
A. Souka и соавт., 1998 [20] 11 Танатоформная дисплазия Расширение воротникового пространства
НАЧАЛО ГЛАВЫ
-------------------105
ОГЛАВЛЕНИЕ
4
глава
жден. Таким образом, ЦКМС был установлен спустя 7 нед после обнаружения расширенного воротникового пространства.
Синдром Меккеля—Грубера
Этот синдром с аутосомно-рецессивным типом наследования встречается с частотой 1 случай на 10 000 новорожденных. Синдромальными признаками являются затылочное энцефалоцеле, двусторонний поликистоз почек и постаксиальная полидактилия. J. Van Vugt и соавт. [21] сообщили об одном случае расширения воротникового пространства в ранние сроки у плода с синдромом Меккеля—Грубера, хотя в другом исследовании [60] у 5 плодов с этим синдромом не было отмечено расширения воротникового пространства.
Синдром Нунан
Синдром Нунан относится к врожденной патологии с аутосомно-доминантным типом наследования и встречается с частотой в среднем 1 случай на 2000 новорожденных. Синдромальные признаки: лимфедема, короткая шея, дисплазии лица (гипертелоризм, низко расположенные толстые ушные раковины), кожные складки на шее, выбухание грудной клетки в области грудины, пороки сердца (чаще всего стеноз клапана легочной артерии).
Согласно данным мультицентрового исследования 4116 плодов с расширенным воротниковым пространством и нормальным кариотипом, синдром Нунан был отмечен только в одном наблюдении [20]. Наряд у с этим в других исследованиях, охватывающих 510 плодов с расширенным воротниковым пространством и нормальным кариотипом, синдром Нунан был обнаружен в 5 случаях [2, 4, 14—16].
Синдром Смита—Лемли—Опица
Этот синдром с аутосомно-рецессивным типом наследования встречается достаточно редко: 1 случай на 20 000 новорожденных. Клинически синдром Смита-Лемли—Опица проявляется выраженной задержкой психомоторного развития, ха
рактерными малыми лицевыми аномалиями, расщелиной верхнего неба, полидактилией и синдактилией, пороками сердца, аномальным строением легких и нечеткостью половой принадлежности.
J. Hyett и соавт. [61] при скрининговом ультразвуковом исследовании в 11 нед беременности пациентки с неотягошенным наследственным анамнезом обнаружили у плода расширение воротникового пространства до 5 мм. В связи с этим была проведена биопсия хориона — кариотип нормальный мужской. При повторном исследовании в 20 нед отмечено исчезновение расширения воротникового пространства, но эхографическая картина наружных половых органов соответствовала женскому полу. В ходе кордоцентеза был подтвержден нормальный мужской кариотип, а при фетоскопии—наличие женских гениталий. Пациентка приняла решение прервать беременность, и при патологоанатомическом исследовании был установлен синдром Смита—Лемли—Опица. J. Hobbins и соавт. [62] также описывают наблюдение сивдрома Смита—Лемли—Опица, диагностированного в 11 нед беременности на основании обнаруженного расширения воротникового пространства до 4 мм и двусторонней полвдак-тилии, а в наблюдении, представленном А. Souka и соавт. [20], этот сивдром установлен только на основании расширения воротникового пространства до 6 мм.
Фето-фетальный трансфузионный синдром
Частота расширения воротникового пространства в 10—14 нед при дихориальной двойне и одноплодной беременности приблизительно одинакова (5.4%). но значительно выше при монохориальной двойне (13,7%) [63]. N. Sebireисоавт. [64] провели исследования по изучению частоты сочетания расширенного воротникового пространства и фето-фетального трансфузионного синдрома. Анализу были подвергнуты 143 наблюдения монохориальной двойни. В ходе проведенных исследований было установлено, что при
106-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
расширении воротникового пространства в 12% случаев развилась выраженная форма фето-фетального трансфузионного синдрома, что в 4 раза выше в сравнении с наблюдениями без расширенного воротникового пространства.
Спинальная мышечная атрофия (тип I) Различают несколько форм спинальной мышечной атрофии. Инфантильная форма Верднига—Гоффмана (тип I) относится к летальным аутосомно-рецессивным состояниям с частотой встречаемости 1 случай на 10 000—25 000 новорожденных и характеризуется дегенеративными изменениями в клетках передних рогов спинного мозга. В биоптате мышц определяются атрофия фибрилл, их дезорганизация и разрастание соединительной ткани, что приводит к мышечной гипотонии и атрофии. Поэтому при инфантильной форме уже пренатально отмечается выраженное снижение двигательной активности плода. Обычно смерть наступает в первые 1—2 года жизнииз-задыхательнойнедостаточности. К настоящему времени в литературе представлено описание 6 случаев спинальной мышечной атрофии, сопровождавшейся расширением воротникового пространства в ранние сроки беременности (табл. 4.8).
В двух случаях диагноз спинальной мы-шечнойатрофиибылустановленпренаталь-но в ходе плацентоцентеза в семьях с отягощенным анамнезом и беременности были прерваны [16, 65]. В остальных 4 наблюдениях дети умерли в неонатальном периоде.
Синдром Зельвегера
Этот синдром также относится к летальным аутосомно-рецессивным состояниям с частотой встречаемости 1 случай на 25 000 новорожденных и характеризуется мышечной гипотонией. При ультразвуковом исследовании плода могут быть обнаружены аномалии конечностей (эквиноварусная позиция стоп, стопа-качалка), колоколообразная грудная клетка, вентрикуломегалия, гипертелоризм, пороки сердца, гепатомегалия и задержка внутриутробного развития [67]. При установлении пренатального диагноза необходимо подтвердить дефицит дигидроксиацетонфосфатацилтрансфера-зы в клетках амниотической жидкости. Смерть обычно наступает в первые 2 года жизни, чаще всего от легочных инфекций и печеночной недостаточности. В литературе описано несколько случаев синдрома Зельвегера, сопровождавшихся расширением воротникового пространства в ранние сроки беременности (табл. 4.9).
Таблица4.8. Случаи спинальной мышечной атрофии, сопровождавшиеся расширением воротникового пространства в ранние сроки беременности
Авторы Ширина воротникового пространства, мм Сочетанные аномалии, выявленные при ультразвуковом исследовании Перинатальные исходы
A. Rijhsinghani 9 Вентрикуломегалия, агенезия Ребенок умер в
и соавт., 1997 [65] мозолистого тела, отек передней брюшной стенки неонатальном периоде
5,6 Неиммунная водянка Прерывание беременности
С. Bilardo и соавт., 1998 [16] >3 Не указано Прерывание беременности
A. Souka и соавт., 1998 [20] 3,5 Ребенок умер в неонатальном периоде
J. VanVugtn соавт., 1998 [21] 9,6 Г идроторакс Ребенок умер в неонатальном периоде
R. Stiller и соавт., 1999 [66] 7,5 Ребенок умер в неонатальном периоде
НАЧАЛО ГЛАВЫ
-------------------107
ОГЛАВЛЕНИЕ
4
глава
Таблица 4.9. Случаи синдрома Зельвегера, сопровождавшиеся расширением воротникового пространства в ранние сроки беременности
Авторы Ширина воротникового пространства, мм Сочетанные изменения, выявленные при ультразвуковом исследовании Перинатальные исходы
C. Bilardo и соавт., 1998 [16] >3 Перикардиальный выпот Ребенок умер
I. de Graaf и 6 Перикардиальный выпот, Ребенок умер в
соавт., 1999 [68] клубникообразная форма головы возрасте 5,5 мес
G. Christiaens 5,8 Прерывание беременности
и соавт., 2000 [69] 5.3 > 95-го процентиля 4,4 Прерывание беременности Прерывание беременности Прерывание беременности
СПИСОК ЛИТЕРАТУРЫ
1. Ville Y., Lalondrelle С., Doumerc S. et al. First-trimester diagnosis of nuchal anomalies: significance and fetal outcome // Ultrasound Obstet. Gynecol. 1992. V. 2. P. 314-316.
2. van Zalen-Sprock R.M., van Vugt J.M.G., van Geijn H.P. First-trimester diagnosis of cystic hygroma — course and outcome // Amer. J. Obstet. Gynecol. 1992. V. 167. P. 94-98.
3. Hewitt B. Nuchal translucency in the first trimester // Aust. NZ J. Obstet. Gynecol. 1993. V. 33. P. 389-391.
4. Johnson M.P., Johnson A., Ilolzgreve W. et al. First-trimester simple hygroma: cause and outcome // Amer. J. Obstet. Gyncol. 1993. V. 168. P. 156-161.
5. Nadel A., Bromley B., Benacerraf B.R. Nuchal thickening or cystic hygromas in first- and early second-trimester fetuses: prognosis and outcome // Obstet. Gynecol. 1993. V. 82. P. 43- 48.
6. Pandya P.P., Brizot M.L., KuhnP. et al. First-trimester fetal nuchal tianslucencythickness and riskfortiisomies // Obstet. Gynecol. 1994. V. 84. P. 420-423.
7. Shulman L.P., Emerson D.S., Grevengood C. et al. Clinical course and outcome of fetuses with isolated cystic nuchal lesions and normal karyotypes detected in the first trimester // Amer. J. Obstet. Gynecol. 1994. V. 171. P. 1278 1281.
8. SalvesenD.R., Goble O. Early amniocentesis and nuchal translucency in women requesting karyotyping for advanced maternal age // Prenat. Diagn. 1995. V. 15. P. 971-974.
9. Hewitt B.G., de Crespigny L., Sampson A. J. et al. Correlation between nuchal thickness and abnormal karyotype in first trimester fetuses // M.J.A. 1996. V. 165. P. 365-368.
10. Moselhi M., Thilaganathan B. Nuchal translucency: a marker for the antenatal dignosis of aortic coarctation // Brit. J. Obstet. Gynaecol. 1996. V. 103. P. 1044 1045.
11. Sha’Ban F.K., van Splunder P., Los F.J., Wladimiroff J.W. Fetal outcome in nuchal translucency with emphasis on normal fetal karyotype // Prenat. Diagn. 1996. V. 16. P. 537- 541.
12. Hernadi L., Torocsik M. Screening for fetal anomalies in the 12th week of pregnancy by transvaginal sonography in an unselected population // Prenat. Diagn. 1997. V. 17. № 8. P. 753-759.
13. D’Ottavio G., Meir Y.J., Rustico M.A. et al. Screening for fetal anomalies by ultrasound at 14 and 21 weeks // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. P. 375-380.
14. Reynders C.S., Pauker S.P., Benacerraf B.R. First trimester isolated fetal nuchal lucency: significance and outcome //J. Ultrasound Med. 1997. V. 16. № 2. P. 101-105.
15. Thilaganathan B., Slack A., Wathen N.C. Effect of first-trimester nuchal translucency on second-trimester maternal serum biochemical screening for Down’s syndrome //Ultrasound Obstet. Gynecol. 1997. V. 10. № 4. P. 261-264.
108-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
16. Bilardo С.М., Pajkrt Е., de Graaf I. Outcome of fetuses with enlarged nuchal translucency and normal karyotype // Ultrasound Obstet. Gynecol. 1998. V. 11. № 6. P. 401 406.
17. Fukada Y., YasumizuT., TakizawaM. et al. The prognosis of fetuses with trancient nuchal translucency in the first and early second trimester//Acta Obstet. Gynecol. Scand. 1998. V. 76. P. 913-916.
18. Hafner E., Schuchter K., Liebhart E., Philipp K. Results of fetal nuchal thranslusensy measurement at weeks 10-13 in 4233 unselected pregnant women//Prenat. Diagn. 1998. V. 18. № 1. P. 29-34.
19. Pajkrt E., van Lith J.M.M., Mol B.W.J. et al. Screening for Down’s syndrome by fetal nuchal translucency measurement in a general population // Ultrasound Obstet. Gynecol. 1998. V. 12. P. 163 169.
20. Souka A.P., Snijders R.J.M., NovakovA. et al. Defects and syndromes in chroomosomally normal fetuses with increased nuchal translucency thickness at the 10-14 weeks of gestation//Ultrasound Obstet. Gynecol. 1998. V. 11. №6. P. 391-400.
21. Van Vugt J.M.G., Tinnemans B.W.S., Van Zalen-Sprock R.M. Outcome and early childhood follow-up of chromosomally normal fetuses with increased nuchal translucency at 10-14 weeks’ gestation // Ultrasound Obstet. Gynecol. 1998. V. 11. № 6. P. 407-409.
22. Maymon R.. Jauniaux E.. Cohen O. et al. Pregnancy outcome and infant follow-up of fetuses with abnormally increased first trimester nuchal translucency // 10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21, 2000. P. 302.
23. Pajkrt E., Muller M.A, Bieker O.P., Bilardo C.M. The clinical impact of increased nuchal translucency // Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 42.
24. Медведев M.B., АлтынникНА. Воротниковое пространство у плодов в ранние сроки беременности: новые аспекты пренатальной диагностики // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 1. С. 19-26.
25. Trauffer P.M.L., Anderson С.Е.. Johnson A. et al. The natural history of euploid pregnancies
with first-trimester cystic hydromas // Amer. J. Obstet. Gynecol. 1994. V. 170. P. 1279 1284.
26. Pandya P.P., Kondylios A., Hilbert L. et al. Chromosomal defects and autcome in 1015 fetuses with increased nuchal translucency // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 15—19.
27. Szabo J., Gellen J., Szemere G. First-trimester ultrassoundscreening for fetal aneuploides in women over 35 and under 35 years of age // Ultrasound Obstet. Gynecol. 1995. V. 5. P. 161-163.
28. Sebire N.J., von Kaisenberg C., Rubio C. et al. Fetal megacystis at 10-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1996. V. 8. P. 387-390.
29. Hyett J.A., Sebire N.J., Snijders R.J.M., Nicolaides K.H. Intrauterine lethality oftrisomy 21 fetuses with increased nuchal translucency thickness//Ultrasound Obstet. Gynecol. 1996. V. 7. P. 101 103.
30. Hyett J.A, Moscoso G., Nicolaides K.H. First trimester nuchal transslucency and cardiac septal defects in fetuses with trisomy 21// Amer. J. Obstet. Gynecol. 1995. V. 172. P. 1411-1413.
31. Hyett J.A.. Moscoso G., Nicolaides K.H. Cardiac defects in first trimester fetuses with trisomy 18 // Fetal Diagn. Ther. 1995. V. 10. P. 381 386.
32. Hyett J.A., Moscoso G., Nicolaides K.H. Morphometric analysis of the great vessels in early fetal life// Hum. Reprod. 1995. V. 10. P. 3045-3048.
33. Hyett J.A., Moscoso G., Nicolaides K.H. Increased nuchal transslucency in trisomy 21 fetuses: relation to narrowing of the aortic isthmus // Hum. Reprod. 1995. V. 10. P. 3049-3051.
34. Hyett J.A., Perdu M., Sharland G.K. et al. Increased nuchal transslucency at 10-14 weeks of gestation as a marker for major cardiac defects // Ultrasound Obstet. Gynecol. 1997. V. 10. № 4. P. 242-246.
35. Gembruch U., Knophle G., Bald R., Hansmann M. Early diagnosis of fetal congenital heart disease by transvaginal echocardiography // Ultrasound Obstet. Gynecol. 1993. V. 3. P. 310-317.
36. Achiron R., Rotstein Z., Lipitz S. et al. First-trimester diagnosis of fetal congenital heart disease by transvaginal echocardiography // Obstet. Gynecol. 1994. V. 84. P. 69-72.
НАЧАЛО ГЛАВЫ
-------------------109
ОГЛАВЛЕНИЕ
4 глава___________________________________
37. Puerto В., Martinez J.M., BorrellA. et al. Fetal echocardiography in chromosomlly normal fetuses with increased nuchal translucency. A preliminary report // Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 91.
38. Schwarzler P., Carvalho J.C., Senat M.V. et al. Screening for fetal aneuploides and fetal cardiac abnormalities by nuchal translucency thickness measurement at 10-14 weeks of gestation as part of routine antenatal care in an unselected population // Brit. J. Obstet. Gynaecol. 1999. V. 106. P. 1029 1034.
39. Hyett J.A., Moscoso G., Nicolaides K.H. Abnormalities of the hart and great arteries in first trimester chromosomally abnormal fetuses // Amer. J. Med. Genet. 1997. V. 69. P. 207-216.
40. Hyett J.A.,PerduM., SharlandG.K.etal.Using fetal nuchal translucency to screen for major congenital cardiac defects at 10-14 weeks of gestation: population based cohort study // Brit. Med. J. 1999. V. 318. P. 81 85.
41. Медведев M.B., Юдина E.B., Сыпченко E.B. и др. Перинатальные исходы при врожденных пороках развития. I. Диафрагмальная грыжа // Ультразвук. Диагн. Акуш. Гин. Педиат. 2000. Т. 8. № 2. С. 98-104.
42. Souka А.Р., Nicolaides К.Н. Diagnosis of fetal abnormalities at the 10-14 week scan // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. p. 429-442.
43. Bulas D., Saal H., Allen J.F. et al. Cystic hygroma and congenital diaphragmatic hernia: early prenatal sonographic evaluation of Fryn’s syndrome // Prenat. Diagn. 1992. V. 12. P. 867-875.
44. van Zalen-Sprock R.M., van Vugt J.M.G., van Geijn H.P. First-trimester sonography of phisiological midgut herniation and early diagnosis of omphalocele // Prenat. Diagn. 1997. V. 17. P. 511-518.
45. Brown D.L., Emerson D.S., Shulman L.P., Carson S.A. Sonographic diagnosis of omphalocele during the 10th week of gestation //Amer. J. Radiol. 1997. V. 153. P. 825-826.
46. Sebire N.J., von Kaisenberg C., Rubio C. et al. Fetal megacystis at 10-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1996. V. 8. P. 387-390.
47. Zimmer E.Z., Bronshtein M. Fetal intrabdominal cysts detected in the fist and early second trimester by transvaginal sonography//J. Clin. Ultrasound. 1991. V. 19. P. 664 667.
48. Fisk N.M., Vaughan J., Smidt M., Wigglesworth J. Transvaginal ultrasonound recognition of nucal oedema in the fist-trimester diagnosis of achondrogenesis // J. Clin. Ultrasound. 1991. V. 9. P. 588-590.
49. Soothill P.W., Vuthiwong C., Rees H. Achondrogenesis type 2 diagnosed by tansvaginal ultrasonound at 12 weeks of gestation //Prenat. Diagn. 1993. V. 13. P. 523-528.
50. Leung K.Y., MacLachlan N.A, Sepulveda W. Prenatal diagnosis of ectrodactyly: the ‘lobster claw’ anomaly // Ultrasound Obstet. Gynecol. 1995. V. 6. P. 443-446.
51. Ben-Ami M., Perlitz Y., Haddad S., Matilsky M. Increased nuchal translucency is associated with asphyxiating thoracic dysplasia // Ultrasound Obstet. Gynecol. 1997. V. 10. P. 297-298.
52. Eliyahu S., Weiner E., Lahav D., Shalev E. Early sonographic diagnosis of Jarcho-Levin syndrome: a prospective screening program in one family // Ultrasound Obstet. Gynecol. 1997. V. 9. P. 314-318.
53. Hyett J., Noble P., Sebire N.J. et al. Lethal congenital arthrogryposis presents with increased nuchal translucency at 10-14 weeks of gestation // Ultrasound Obstet. Gynecol. 1997. V. 9. P. 310-313.
54. Den Hollander N.S., van der Harten H.J., Vermeij-Keers C. et al. First trimester diagnosis of blomstrand lethal osteochondrodysplasia // Amer. J. Med. Genet. 1997. V. 73. P. 345-350.
55. Petrikovsky B.M., Gross B., Bialer M. et al. Prenatal diagnosis of pseudothalidomide syndrome in consecutive pregnancies of a consanguineous couple // Ultrasound Obstet. Gynecol. 1997. V. 10. P. 425-428.
56. Hill L.M., Leary J. Transvaginal sonographic diagnosis of short-rib polydactyly dysplasia at 13 weeks’ gestation // Prenat. Diagn. 1998. V. 18. № 11. P. 1198 1201.
57. Ammala P., Salonen R. First-trimester diagnosis ofhydrolethalussyndrome //Ultrasound Obstet. Gynecol. 1995. V. 5. P. 60—62.
110-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ВОРОТНИКОВОЕ ПРОСТРАНСТВО И ВРОЖДЕННВ1Е ПОРОКИ РАЗВИТИЯ
58. Plotz F.B., van Essen A. J., Bosschaart AN., Bos A.P. Cerebro-costo-mandibular syndrome // Amer. J. Med. Genet. 1996. V. 62. P. 286-292.
59. Ibba R.M., Corda A., Zoppi M.A. et al. Cerebro-costo-mandibular syndrome: early sonographic prenatal diagnosis // Ultrasound Obstet. Gynecol. 1997. V. 10. № 2. P. 142-144.
60. SepulvedaW., Sebire N.J., Souka A, Nicolaides K.EI. Diagnosis of the Meckel-Gruber syndrome at eleven to fourteen weeks’ gestation // Amer. J. Obstet. Gynecol. 1997. V. 176. P. 316-319.
61. Elyett J.A., Clayton P.T., Moscoso G., Nicolaides K. El. Increased first trimester nuchal translucency as a prenatal manifestation of Smith-Lemli-Opitz syndrome //Amer. J. Med. Genet. 1995. V. 58. P. 374-376.
62. Hobbins J.C., Jones O.W., Gottesfeld S., Persutte W. Transvaginal sonography and transabdominal embryoscopy in the first-trimester diagnosis of Smith-Lemli-Opitz syndrome, type 2 // Amer. J. Obstet. Gynecol. 1994. V. 171. P. 546-549.
63. Sebire N.J., Snijders R.J.M.. Hughes K. et al. Screening for trisomy 21 in twin pregnancies by maternal age and fetal nuchal translucency thickness at 10-14 weeks of gestation // Brit. J. Obstet. Gynaecol. 1996. V. 103. P. 999-1003.
64. Sebire N.J., D’Ercole C., Hughes K. et al. Increased nuchal translucency thickness at 10-14 weeks of gestation as a predictor of severe twin-to-twin transfusion syndrome //Ultrasound Obstet. Gynecol. 1997. V. 10. № 2. P. 86-89.
65. Rijhsinghani A., Yankowitz J., Howser D., Williamson R. Sonographic and maternal serum screening abnormalities in fetuses affected by spinal muscular atrophy // Prenat. Diagn. 1997. V. 17. P. 166 169.
66. Stiller R.J., Lieberson D., Herzlinger R. et al. The association of increased fetal nuchal translucency and spinal muscular atrophy type I // Prenat. Diagn. 1999. V. 19. № 6. P. 587-589.
67. Медведев M.B., Юдина E.B. Дифференциальная ультразвуковая диагностика в акушерстве. М.: Видар, 1997.
68. de Graaf I.M., Pajkrt Е., Keessen М. et al. Enlarged nuchal translucency and low serum protein concentrations as possible markers for Zellweger syndrome // Ultrasound Obstet. Gynecol. 1999. V. 13. P. 268-270.
69. ChristiaensG.C.M.L., de Paper J.M., Stoutenbeek Ph. et al. First trimester nuchal anomalies as a prenatal sing of Zellweger syndrome // Prenat. Diagn. 2000. V. 20. № 6. P. 520-521.
НАЧАЛО ГЛАВЫ
-------------------Ill
ОГЛАВЛЕНИЕ
5
РЕЗУЛЬТАТЫ ДОППЛЕРОВСКОГО ИССЛЕДОВАНИЯ ПЛОДОВОПЛАЦЕНТАРНОГО КРОВОТОКА В РАННИЕ СРОКИ БЕРЕМЕННОСТИ ПРИ ХРОМОСОМНЫХ АНОМАЛИЯХ
Л/.В. Медведев
Из всех обширных полученных в последние годы данных о становлении маточно-плацентарного и плодового кровообращения в этой главе представлены только результаты допплеровского исследования плодово-плацентарного кровотока в ранние сроки беременности при хромосомных аномалиях, что отвечает основным задачам предлагаемого читателю тома энциклопедии.
В настоящее время при проведении допплеровских исследований в ранние сроки беременности особое внимание уделяется соблюдению основных принципов безопасности. В первом томе энциклопедии были подробно представлены эти принципы [1]. Осенью 1999 г. этот вопрос опять был поднят на страницах ведущего журнала по ультразвуковой диагностике в акушерстве и гинекологии (Ultrasound in
Obstetrics & Gynecology). Согласно решению Редакционного совета журнала, ни одна статья, посвященная применению допплеровских исследований в I триместре беременности, не будет опубликована без соблюдения следующих правил [2]:
1. Вся используемая аппаратура должна содержать на дисплее значения теплового (TI) и механического (MI) индексов или их модификаций. Численные значения этих индексовдолжны бытьвпределах, рекомендуемых FDA (Food and Drug Administration), для обеспечения безопасности допплеровских исследований (рис. 5.1).
2. Время экспозиции должно основываться на принципе A LARA (As Low As Reasonably Achieveble). При этом в статье должны быть приведены численные значения максимального, минимального и среднего времени экспозиции.
112------------------------------------------------------
ОГЛАВЛЕНИЕ
РЕЗУЛЬТАТЫ ДОППЛЕРОВСКОГО ИССЛЕДОВАНИЯ ПРИ ХРОМОСОМНЫХ АНОМАЛИЯХ
Tib ),5 MI 0,7
Рис. 5.1. Исследование кровотока в сосудах плода в ранние сроки беременности в режиме цветового допплеровского картирования. Значения теплового (Tib) и механического (MI) индексов составляют менее 1,0.
3. Необходимо пользоваться специальными акушерскими (плодовыми) предустановками при их наличии в аппаратах.
4. При проведении исследовательской работы необходимо письменное заключение Комитета по этике, рассматривающего вопросы безопасности допплеровских исследований в I триместре беременности.
5. При осуществлении исследовательской работы к статье должны быть приложены письменные согласия пациенток на проведение допплеровских исследований в I триместре беременности. Согласие дол
жно отражать знакомство с информацией о потенциальных биоэффектах ультразвука в I триместре.
При соблюдении основных требований безопасности допплеровские методы исследования могут использоваться для получения важной информации о состоянии маточно-плацентарно-плодового кровотока с самых ранних сроков беременности. В настоящее время для выделения плодов высокого риска по хромосомным дефектам среди изучаемых сосудов наибольшее распространение получили артерии пуповины и венозный проток.
АРТЕРИИ ПУПОВИНЫ
Визуализация пуповины при трансвагинальном ультразвуковом исследовании возможна в большинстве случаев уже с 7— 8 нед беременности (рис. 5.2). Наиболее отчетливо она определяется в режиме цве
тового допплеровского картирования. По мнению большинства исследователей, наибольшую ценность анализ кривых скоростей кровотока в артерии пуповины имеет только начиная с 10 нед беременно-
Рис. 5.2. Беременность 11 12 нед. Стрелкой указана пуповина.
Рис. 5.3. Беременность 12 нед. Видно отсутствие диастолического кровотока в артерии пуповины.
-----------------------------------------------------113
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
5
глава
14 нед, что напрямую связано со значительным сниже
Таблица 5.1. Частота регистрации диастолической скорости кровотока в артерии пуповины в ранние сроки беременности
Авторы Срок беременности, нед
10 11 12 13 14
R. Fay и соавт., 1994 [3] 82%
М. Predanic и соавт., 1994 [4] 0% 100%
М. van Zalen-Sprock и соавт., 1994 [5] 0% 0% 10% 80% 100%
R. Pooh и соавт., 1995 [6] 0% > 90%
М. Coppens и соавт., 1996 [7] 0% 0% 100%
Собственные данные 0% 0% 21% 85% 100%
нием резистентности маточных артерийв эти сроки. На самом деле постоянный диастолический компонент кровотока в артериях пуповины присутствует в большинстве случаев уже с 13 нед. Отсутствие его изображения при допплеровском исследовании в эти сроки беременности чаще всего обусловлено либо недостаточно высокой чувствительностью используемого
сти. В ранние сроки диастолический компонент кровотока в артериях пуповины может отсутствовать в отличие от II и III триместров беременности (рис. 5.3). Большинство исследователей сообщают об отсутствии диастолического компонента кровотока в артериях пуповины до 12 нед неосложненной беременности (табл. 5.1).
По данным R. Fay и соавт. [3], при исследовании кривых скоростей кровотока в артерии пуповины в 14 нед констатировано отсутствие конечной диастолической скорости у 18% беременных, а в 18 нед во всех наблюдениях было зарегистрировано ее присутствие. Согласно результатам R. Pooh и соавт. [6], конечная диастолическая скорость кровотока в артерии пуповины при неосложненном течении беременности после 14 нед выявляется более чем у 90% плодов, а исследования, проведенные М. vanZalen-SprockncoaBT. [5] и М. Coppens и соавт. [7], свидетельствуют о 100% выявля-емости диастолического компонента кровотока начиная с 14 нед. Никто из исследователей не отметил реверсных значений диастолического кровотока в артерии пуповины при неосложненном течении конца I -начала II триместра беременности.
В наших исследованиях постоянный диастолический кровоток в артериях пуповины при неосложненной беременности был зарегистрирован во всех случаях начиная с
допплеровского режима, либо несоблюдением основных правил исследования артериального плодово-плацентарного кровотока, включая установку частотного фильтра, угла инсонации и расположение пробного объема [8].
Тем не менее, учитывая возможность отсутствия диастолической скорости кровотока в артерии пуповины в ранние сроки беременности, для его оценки следует использовать расчет пульсационного индекса (ПИ), который обладает неоспоримыми преимуществами в ранние сроки беременности. Прежде всего он позволяет оценивать всю форму кривых скоростей кровотока и может использоваться в случаях отсутствия диастолической скорости, когда систолодиастолическое отношение теряет математический смысл, а индекс резистентности равен единице при любых значениях пиковой систолической скорости кровотока. С 8 до 14 нед неосложненной беременности отмечается некоторое снижение значений ПИ в артерии пуповины (табл. 5.2).
Проведенные исследования позволили установить высокую воспроизводимость оценки кривых скоростей кровотока в артериях пуповины. По данным К. Harrington и соавт. [9], различия численных значений ПИ в артерии пуповины в ранние сроки беременности между двумя измерениями с интервалом в 15 мин, осу
114 ----------------
НАЧАЛО ГЛАВЫ ►
ОГЛАВЛЕНИЕ ММ
РЕЗУЛЬТАТЫ ДОППЛЕРОВСКОГО ИССЛЕДОВАНИЯ ПРИ ХРОМОСОМНЫХ АНОМАЛИЯХ
ществленными одним исследователем, составили только 2,85%.
J. Martinez и соавт. [10] провели изучение как воспроизводимости оценки ПИ в артерии пуповины, так и влияния места регистрации кривых скоростей кровотока (место впадения пуповины в плаценту, свободно располагающиеся петли пуповины, место вхождения сосудов пуповины в брюшную полость плода) на численные значения ПИ у 60 пациенток в 10—13 нед беременности. Авторами не было установлено достоверных различий численных значений ПИ ни в зависимости от места регистрации кривых скоростей кровотока, ни при нескольких измерениях, осуществленных как одним исследователем, так и двумя специалистами.
Впервые о качественном изменении кривых скоростей кровотока в артерии пуповины у плодов с хромосомными аномалиями в ранние сроки беременности сообщили N. Montenegro и соавт. 111]. Они продемонстрировали реверсные значения диастолического кровотока в артерии пуповины в 11 нед беременности у плода с синдромом Тернера. К настоящему времени опубликовано 7 наблюдений реверсного диастолического кровотока в артерии пуповины, диагностированного в 10—13 нед беременности (рис. 5.4) 111— 14]. Во всех этих случаях в ходе пренатального кариотипирования были выявлены хромосомные аномалии. Подобные изменения кровотока в артерии пуповины в I триместре беременности являются высокоспецифичными, но одновременно характеризуются низкой чувствительностью при хромосомных аномалиях. Во всех наших наблюдениях хромосомные дефекты не сопровождались специфическими изменениями кривых скоростей кровотока в артерии пуповины в 12—13 нед беременности (рис. 5.5) [15]. Поэтому наибольшее внимание специалистов в последние годы было уделено изучению численных значений ПИ кровотока в артерии пуповины у плодов с хромосомными аномалиями.
Таблица 5.2. Значения ПИ (М ± 2ст) в артерии пуповины в 8-14 нед неосложненной беременности [7]
Срок беременности, нед/дни ПИ
8/0 - 8/6 3,60 ± 0,64
9/0 - 9/6 3,31 ± 0,53
10/0-10/6 3,00 ± 0,50
11/0-11/6 2,76 ± 0,48
12/0-12/6 2,42 ± 0,51
13/0-13/6 1,93 ± 0,40
14/0-14/6 1,69 ±0.35
J. Martinez и соавт. [16] установили, что в 5 (55%) из 9 случаев трисомии 21 численные значения ПИ кровотока в артерии пуповины были выше 95-го процентиля (верхняя граница нормативных значений). Следует отметить, что в нескольких случаях изменения кривых скоростей кровотока не сопровождались расширением воротникового пространства. По мнению авторов, одновременный учет толщины воротникового пространства и численных значений ПИ в артерии пуповины позволяет диагностировать до 89% случаев трисомии 21 в ранние сроки беременности.
Еще более весомые результаты были получены при трисомии 18. Согласно данным С. Comas и соавт. [ 17], использование численных значений ПИ (95-й процентиль) в артерии пуповины в 10—18 нед беременности позволяет выделить плодов с трисомией 18 с чувствительностью 88,8%, специфичностью 90,6% при прогностической ценности положительного теста 7,8%, отрицательного теста — 99,6%. Поэтому авторы считают необходимым включение анализа кривых скоростей кровотока в артерии пуповины с расчетом ПИ в обязательный комплекс обследования в ранние сроки беременности для формирования группы высокого риска по хромосомным аномалиям.
НАЧАЛО ГЛАВЫ
-------------------115
ОГЛАВЛЕНИЕ
5
глава
Рис. 5.4. Беременность 13 нед. Реверсные значения диастолического компонента кровотока в артерии пуповины у плода с трисомией 18.
Рис. 5.5. Беременность 12 -13 нед. Допплерограмма кривых скоростей кровотока в артерии пуповины у плода с трисомией 18. Видно присутствие диастолического компонента кровотока.
Однако полученные первые результаты не были подтверждены в исследованиях других авторов. Так, Е. Jauniaux и соавт. [18] не обнаружили достоверных различий численных значений ПИ в артерии пуповины у нормальных плодов и 11 плодов с трисомией 21. Кроме этого, ни в одном случае трисомии 21 численные значения ПИ в артерии пуповины не превышали 95-го процентиля. Схожие данные приводя-ти R. Brown и соавт. [19], которые при обследовании 418 плодов с нормальным кариотипом и 19 плодов с трисомией 21 в 11— 14 нед беременности также не отметили достоверных различий в значениях ПИ между этими группами. Толькоу2 (10,5%) плодов с трисомией 21 значения ПИ находились выше 95-го процентиля.
М. Zoppi и соавт. [20] провели оценку кривых скоростей кровотока в артерии пуповины у 89 плодов с нормальным кариотипом и у 20 плодов с трисомией 21 в 10—14 нед беременности. Превышение верхней границы нормативных значений ПИ (95-й процентиль) было зарегистрировано только у 2 (10%) из 20 плодов с синдромом Дауна. Кроме того, в группе плодов с нормальным кариотипом аналогичные изменения кровотока были обнаружены в 14 (15,7%) из 89 наблюдений. Исследователями не были получены достоверные различия численных значений ПИ у плодов с трисомией 21 и с нормальным кариотипом.
В этой связи авторы считают нецелесообразным использовать оценку кривых скоростей кровотока в артерии пуповины с расчетом ПИ в качестве пренатального критерия хромосомных аномалий в ранние сроки беременности.
Найти объяснение столь противоречивым результатам достаточно сложно, но одним из ответов может быть тот факт, что нормативные показатели ПИ в артерии пу-
Рис. 5.6. Верхняя граница нормативных значений ПИ кровотока в артерии пуповины в ранние сроки беременности по данным разных авторов: ------ М. Predanic и соавт. [4] — — М. van Zalen-Sprock и соавт. [5] — . — М. Coppens и соавт. [7]
116 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
РЕЗУЛЬТАТЫ ДОППЛЕРОВСКОГО ИССЛЕДОВАНИЯ ПРИ ХРОМОСОМНЫХ АНОМАЛИЯХ
повины в исследованиях разных авторов существенно различаются (рис. 5.6). Учитывая отсутствие единого мнения о реальной диагностической ценности анализа кривых скоростей кровотока в артерии пу
повины для выделения группы высокого риска по хромосомным аномалиям у плода, по-видимому, для окончательного ответа на этот вопрос необходимы дополнительные мультицентровые исследования.
ВЕНОЗНЫЙ ПРОТОК
Венозный проток представляет собой узкую трубкообразную вену с истмическим входом, являющуюся прямой коммуникацией между пупочной веной и центральной венозной системой, через которую в обход печеночной циркуляции формируется поток хорошо оксигенированной крови [21].
С конца I триместра беременности при нормальном развитии плода кровоток в венозном протоке характеризуется трехфазной кривой, обусловленной разными фазами сердечного цикла: желудочковой систолой, ранней желудочковой диастолой и предсердной систолой. Следует отметить, что при нормальном развитии плода кровоток в венозном протоке остается однонаправленным на протяжении всех фаз сердечного цикла [22]. В 11—13 нед беременности оценить кровоток в венозном протоке плода удается в 78% случаев [23]. Согласно результатам наших исследований, успешная регистрация кривых скоростей кровотока в венозном протоке в ранние сроки беременности возможна более чем у 90% плодов (рис. 5.7). Неудачи регистрации при допплеровском исследовании кривых скоростей кровотока в венозном протоке в ранние сроки беременности преимущественно бывают обусловлены либо недостаточно высокой чувствительностью используемого допплеровского режима, либо отсутствием опыта у врача.
Е. Mavrides и соавт. [24] провели изучение воспроизводимости оценки ПИ в венозном протоке в 10—14 нед беременности. Авторами были установлены адекватный коэффициент воспроизводимости (8,9%) между данными, полученными одним специалистом, и относительно низкая
воспроизводимость (11,5%) между исследованиями двух специалистов. Следует отметить, что численные значения ПИ кровотока в венозном протоке в настоящее время не являются критериями нарушений
Рис. 5.7. Беременность 11 нед 2 дня. Нормальные кривые скоростей кровотока в венозном протоке плода.
Рис. 5.8. Беременность 13 нед. Кривые скоростей кровотока в венозном протоке у плода с трисомией 18 характеризуются реверсным компонентом в фазу сокращения предсердий.
НАЧАЛО ГЛАВЫ ►
-------------------117
ОГЛАВЛЕНИЕ
5
глава
в ранние сроки беременности ввиду достаточно высокой вариабельности. Основное внимание специалисты уделяют качественному изменению спектра кривых скоростей кровотока в этом сосуде.
Впервые характерные изменения кривых скоростей кровотока в венозном протоке плода при хромосомном дефекте описали Т. Huisman и С. Bilardo [25] в 1997 г. Ими было отмечено наличие трехфазного спектра кровотока с реверсным компонентом в фазу сокращения предсердий у плода с расширением воротникового пространства до 8 мм и трисомией 18 в 13 нед беременности (рис. 5.8). A. Matias и соавт. [26] обнаружили сочетание увеличения толщины воротникового пространства у 3 плодов с трисомией 13,18 и 21 в 12—13 нед
Рис. 5.9. Беременность 12—13 нед. а — отчетливо видно расширенное воротниковое пространство у плода с синдромом Эдвардса; б — допплерограмма кривых скоростей кровотока в венозном протоке с реверсным компонентом в фазу сокращения предсердий.
беременности с регистрацией реверсных или нулевых значений кровотока в фазу сокращения предсердий. При этом не было выявлено изменений кровотока в артерии пуповины. У плода с трисомией 21 дополнительно был обнаружен врожденный порок сердца (общий предсердно-желудочковый канал), а у плода с трисомией 18, помимо аналогичного порока сердца, и омфалоцеле. У плода с трисомией 13 не было выявлено грубых структурных нарушений сердца, однако при гистологическом исследовании диагностированы утолщение эндокарда, а также участки ишемии и кальцификации миокарда, расположенные в основном субэндокарди-ально в стенке правого желудочка.
В наблюдении, представленном И.Ю. Коганом и соавт. [27], реверсные значения кровотока в венозном протоке в фазу сокращения предсердий были обнаружены в 12 нед беременности у плода с трисомией 21. В описанном нами случае аналогичные изменения кровотока в венозном протоке были выявлены у плода с расширенным воротниковым пространством (7,5 мм) и трисомией 18 в 12—13 нед беременности (рис. 5.9) [15].
N. Montenegro и соавт. [28] при обследовании 17 плодов с расширенным воротниковым пространством (3 мм и более) в 10— 13 нед беременности в 5 случаях диагностировали хромосомные аномалии. Во всех этих наблюдениях был зарегистрирован реверсный компонент кровотока в венозном протоке в фазу сокращения предсердий.
A Graneras и соавт. [29 ] из 61 плода с расширением воротникового пространства (3 мм и более) выявили хромосомные дефекты у 25. Толщина воротникового пространства при нормальных кривых скоростей кровотока в венозном протоке составила в среднем 4,4 мм, а при патологических — 5,2 мм. Хромосомные аномалии были обнаружены в 6 (16%) из 37 случаев нормальных кривых скоростей кровотока в венозном протоке и в 19 (79%) из 24 случаев реверсных значений кровотока в фазу сокращения предсердий. Если в первой группе все
118-----------------
НАЧАЛО ГЛАВЫ ►
ОГЛАВЛЕНИЕ
РЕЗУЛЬТАТЫ ДОППЛЕРОВСКОГО ИССЛЕДОВАНИЯ ПРИ ХРОМОСОМНЫХ АНОМАЛИЯХ
хромосомные дефекты были представлены трисомией 21, то во второй группе — широким спектром аномалий с превалированием трисомии 21 и 18.
Наибольшая серия исследований кровотока в венозном протоке в 11—14 нед беременности у плодов с аномальным кариотипом и расширенным воротниковым пространством принадлежит A. Matias и соавт. [30]. По данным этих авторов, при обследовании 63 плодов с хромосомными дефектами (38 случаев трисомии 21, 12 — трисомии 18, 7 — трисомии 13, 3 — синдрома Тернера, 3 — триплоидии) аномальные кривые скоростей кровотока в венозном протоке имели место в 90,5% (!) случаев. Нарушения характеризовались нулевым или реверсным потоком крови в фазу сокращения предсердий. Аналогичные изменения кровотока в венозном протоке при нормальном кариотипе были зарегистрированы только у 13 (3,1%) из 423 плодов. У 7 из 13 плодов с нормальным кариотипом и патологическими кривыми скоростей кровотока в венозном протоке при последующем ультразвуковом исследовании в 14—16 нед были диагностированы крупные врожденные пороки сердца. По данным авторов, если использовать оценку кривых скоростей кровотока в
венозном протоке в качестве показания к инвазивной пренатальной диагностике у беременных высокого риска рождения детей с хромосомными аномалиями (возраст матери, толщина воротникового пространства, биохимические тесты), то можно уменьшить общую частоту необходимых инвазивных процедур в 11— 14 нед с 5 % до менее 0,5%. При этом снижение чувствительности пренатального обследования в отношении хромосомных аномалий будет небольшим (5— 10%), и она может составлять до 90%.
Таким образом, представленные данные свидетельствуют о единодушном мнении исследователей, что изучение кривых скоростей кровотока в венозном протоке имеет важное диагностическое значение при хромосомных аномалиях у плода. Поэтому данный тест заслуживает широкого внедрения в центрах пренатальной диагностики, куда будутнаправлятьсяпациенткидляком-плексного пренатального обследования, в первую очередь при выявлении расширения воротникового пространства у плода. Однако, по нашему мнению, отбор пациенток дляпренатального кариотипирования только на основании анализа кривых скоростей кровотока в венозном протоке в настоящее время не оправдан, но этот вопрос требует всестороннего изучения.
ВЕНА ПУПОВИНЫ
В последние годы было опубликовано несколько работ, в которых проводился анализ характера кровотока в вене пуповины у плодов с хромосомными аномалиями. При нормальном развитии плода во II и III триместрах беременности кровоток в вене пуповины характеризуется низкочастотным немодулированным спектром, имеющим вид ровной полосы. Пульсирующий характер кровотока отмечается только в 7,3% случаев нормального развития плода ив 80% наблюдений перинатальных потерь [31]. По данным R. Pooh и соавт. [6], до 10
нед неосложненной беременности пульсирующий тип кровотока в вене пуповины регистрируется достаточно часто (рис. 5.10), а после 10 нед — значительно реже. В большинстве случаев форма кривых скоростей кровотока в вене пуповины в конце I триместра соответствует таковой во II и III триместрах беременности (рис. 5.11). Вис-следованиях, проведенных R. Brown и соавт. [32], в 11—14 нед беременности наличие пульсирующего типа кровотока в вене пуповины отмечено у 25% из 302 нормально развивающихся плодов.
НАЧАЛО ГЛАВЫ
-------------------119
ОГЛАВЛЕНИЕ
5
глава
Рис. 5.10. Беременность 9 нед 5 дней. Отмечается пульсирующий характер кровотока в вене пуповины.
Рис. 5.11. Беременность 10 нед 3 дня. Отмечается обычный характер кровотока в вене пуповины.
Рис. 5.12. Беременность 12—13 нед. Допплерограм-ма кривых скоростей кровотока в вене пуповины у плода с синдромом Эдвардса. Отчетливо виден пульсирующий характер кровотока.
Рис. 5.13. Синдром Эдвардса, а сагиттальное сканирование плода; б кривые скоростей кровотока в венозном протоке; в - кривые скоростей кровотока в вене и артерии пуповины.
A. Matias и соавт. [26] одними из первых описали пульсирующий тип кровотока в вене пуповины у плодов с хромосомными аномалиями. В их исследованиях пульсирующий тип кровотока в вене пуповины был зарегистрирован у 2 плодов с трисоми
ей 13 и 18 и сопровождался расширением воротникового пространства и реверсными значениями кровотока в венозном протоке в фазу сокращения предсердий (рис. 5.12). При этом не было выявлено изменений кровотока в артерии пуповины. R.
120-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
РЕЗУЛЬТАТЫ ДОППЛЕРОВСКОГО ИССЛЕДОВАНИЯ ПРИ ХРОМОСОМНЫХ АНОМАЛИЯХ
Рис. 5.14. Беременность 12 нед. Реверсные значения кровотока в интраабдоминальной части пупочной вены у плода с трисомией 9 [33].
Brown и соавт. [32] установили, что в 11—14 нед пульсирующий характер кровотока в вене пуповины отмечается у 90% плодов с трисомией 18 и 13, тогда как при трисомии 21 достоверного превалирования частоты пульсирующего характера кровотока в вене пуповины в сравнении с плодами без хромосомных аномалий выявлено не было.
В одном из наших наблюдений пульсирующий характер кровотока в вене пуповины был обнанужен у плода с синдромом Эдвардса, сопровождавшимся расширением воротникового пространства до 7,7 мм и реверсными значениями кровотока в венозном протоке в фазу сокращения предсердий (рис. 5.13).
С. Murta и соавт. [33] у плода с трисомией 9 и расширенным воротниковым пространством (9,1 мм) в 12 нед беременности обнаружили реверсные значения кровотока в интраабдоминальной части пупочной вены (рис. 5.14).
СПИСОК ЛИТЕРАТУРЫ
1. Зыкин Б.И. Современная оценка безопасности допплеровских исследований //Допплерография в акушерстве / Под ред. Медведева М.В., Курьяка А., Юдиной E.B. М.: РАВУЗДПГ, Реальное Время, 1999. С. 7-14.
2. Campbell S., Platt L. The publishing of papers on first-trimester Doppler // Ultrasound Obstet. Gynecol. 1999. V. 14. № 3. P. 159- 160.
3. Fay R.A., Ellwood D.A., Bruce S., Turner A. Color Doppler imaging of the uteroplacental circulation in the middle trimester: observations on the development of a low-resistance
circulation // Ultrasound Obstet. Gynecol. 1994. V. 4. №5. P. 391-395.
4. Predanic M., Zudenigo D., Funduk-Kurjak B. et al. Assessment of early normal pregnancy // AnAtlas ofTransvaginal Color Doppler. L.; NY: Parthenon Publ. Gr., 1994. P. 51—69.
5. van Zalen-Sprock M.M., van Vugt J.M.G., Colenbrander G.J.. Geijn H.P. First-trimester uteroplacental and fetal blood flow velocity waveforms in normally developing fetuses: a longitudinal study // Ultrasound Obstet. Gynecol. 1994. V. 4. № 4. P. 284-288.
6. Pooh R.K., Kobayashi T., Yuasa T., Okayama T. Umbilical artery and vein waveforms from 7 to 19 weeks in normal pregnancy // Ultrasound Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 159.
7. Coppens M., Loquet Ph., Kollen M. et al. Longitudinal evaluation of uteroplacental and umbilical blood flow changes in normal early pregnancy // Ultrasound Obstet. Gynecol. 1996. V. 7. №2. P. 114-121.
8. Медведев M.B., Юдина E.B. Артериальный плодово-плацентарный кровоток //Допплерография в акушерстве / Под ред. Медведева М.В., Курьяка А., Юдиной E.B. М.: РАВУЗДПГ, Реальное Время, 1999. С. 29-46.
9. Harrington К., Goldfrad С., Carpenter R.G., Campbell S. Transvaginal uterine and umbilical artery Doppler examination of 12-16 weeks and the subsequent development of pre-eclampsia and intrauterine growth retardation // Ultrasound Obstet. Gynecol. 1997. V. 9. № 2. P. 94 100.
10. Martinez J.M., Comas C., Ojuel J. et al. The influence of the site of Doppler recording on umbilical artery pulsatility index during the first trimester//Ultrasound Obstet. Gynecol. 1995. V. 5. № 5. P. 325-327.
11. Montenegro N., Beires J., Pereira Leite L. Reverse end-diastolic umbilical artery blood flow at 11 weeks’ gestation// Ultrasound Obstet. Gynecol. 1995. V. 5. № 2. P. 141-142.
12. Martinez J.M., Comas C., Borrell A. et al. Reversed end-diastolic umbilical artery velocity in two cases of trisomy 18 at 10 weeks’ gestation // Ultrasound Obstet. Gynecol. 1996. V. 7. № 6. P. 447-449.
13. Comas C., Carrera M., Devesa R. et al. Early detection of reversed diastolic umbilical flow:
НАЧАЛО ГЛАВЫ
-------------------121
ОГЛАВЛЕНИЕ
5
глава
should we offer karyotypin? // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. P. 400-402.
14. de Graaf I.M., van Bezouw S.M.C.A., Jakobs M.E. etal. First-trimester non-invasive prenatal diagnosis of triploidy // Prenat. Diagn. 1999. V. 19. № 2. P. 175-177.
15. Медведев M.B., Юдина E.B., Алтынник H.A., Цыпурская Г.Ю. Расширенное воротниковое пространство у плода: новые допплерографические критерии хромосомной патологии //Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 3. С. 235-237.
16. Martinez J.M., Borrell A, Antonin Е. et al. Combining nuchal translucency and umbilical Doppler veloimetry for detecting fetal trisomies in the first trimester of pregnancy // Br. J. Obstet. Gynaecol. 1997. V. 104. P. 11 14.
17. Comas C., Martinez J.M., Borrell A. et al. Umbilical artery pulsatility index in early pregnancies with trisomy 18 // Ultrasound Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 160.
18. Jauniaux E., Gavriil P., Khun P. et al. Fetal heart rate and umbilico-placental Doppler flow velocity waveforms in early pregnancies with a chromosomal abnormality and/or an increased nuchal translucency thickness // Hum. Reprod. 1996. V. 11. P. 435-439.
19. Brown R., Di Luzio L., Gomes C., Nicolaides K.H. The umbilical artery pulsatility index in the first trimester: is there an association with increased nuchal translucency or chromosomal abnormality? // Ultrasound Obstet. Gynecol. 1998. V. 12. № 4. P. 244-247.
20. Zoppi M.A, Ibba R.M., Putzolu M. et al. First trimester umbilical artery pulsatility index in fetuses presenting enlarged nuchal translucency //Prenat. Diagn. 2000. V. 20. № 9. P. 701-704.
21. БарковаC.H., Медведев М.В. Допплеровское исследование гемодинамики в венах плода // Ультразвук. Диагн. 1998. № 1. С. 24—34.
22. ДеВор Г.Р. Оценка кровотока в венах плода // Допплерография в акушерстве /Под ред. Медведева М.В., Курьяка А, Юдиной Е.В. М.: РАВУЗДПГ, Реальное Время, 1999. С. 63—76.
23. Huisman T.W.A., Stewart Р.А, Wladimiroff J.W. Ductus venosus blood flow velocity waveforms in human fetuses during late first, second and third trimester //J. Matern. Fetal Invest. 1991. V. l.№2. P. 131.
24. Mavrides E., Holden D., Hollis B. et al. Intra-observer and inter-observer variability of ductus venosus flow indeces in fetuses between 10 and 14 weeks of gestation // Ultrasound Obstet. Gynecol. 2000. V. 16. Suppl. 1. P. 48-49.
25. Huisman T.W.A., Bilardo C.M. Transient increase in nuchal translucency thickness and reversed end-dianslucencystolic ductus venosus flow in a fetus with trisomy 18 // Ultrasound Obstet. Gynecol. 1997. V. 10. № 6. P. 397-399.
26. Matias A., Montenegro N., Areias J.C., Brandao O. Anomalous fetal venous return associated with major chromosomopathies in the late first trimester of pregnancy // Ultrasound Obstet. Gynecol. 1998. V. 11. P. 209-213.
27. Коган И.Ю., Полянин AA, Лебедев B.M. и др. Особенности спектра кровотока в венозном протоке как маркера хромосомной патологии у плода: клиническое наблюдение и обзор литературы // Ультразвук. Диагн. Акуш. Гин. Педиат. 1999. Т. 7. № 3. С. 238—241.
28. Montenegro N., Matias A, Areias J.C. et al. Increased fetal nuchal translucency: possible involment of early cardiac failure // Ultrasound Obstet. Gynecol. 1997. V. 10. № 4. P. 265-268.
29. Graneras A., Galindo A., Gomes M.J. et al. Ductus venosus flow waveform as an early predictor of chromosomal abnormalities //10 International Conference on Prenatal Diagnosis and Therapy. Barcelona, June 19-21,2000. P. 352.
30. Matias A, Gomes C., Flack N. et al. Screening for chromosomal abnormalities at 11 -14 weeks: the role of ductus venosus blood flow // Ultrasound Obstet. Gynecol. 1998. V. 12. P. 380.
31. Баркова C.H. Значение допплерографии кровотока в венах плода при неосложненной беременности и при задержке внутриутробного развития плода: Дисс. ... канд. мед. наук. М., 1999.
32. Brown R.N., Di Luzio L., Gomes C., Nicolaides K.H. First trimester umbilical venous Doppler sonography in chromosomally normal and abnormal fetuses //J. Ultrasound Med. 1999. V. 18. P. 543-546.
33. Murta C., Moron A, Avila M. et al. Reverse flow in the umbilical vein in a case of trisomy 9 // Ultrasound Obstet. Gynecol. 2000. V. 16. P. 575.
122-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛЬНОЙ
ДИАГНОСТИКИ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
Е.В. Юдина
ИСТОРИЧЕСКАЯ СПРАВКА
Беременность - самое естественное и, наверное, самое физиологическое состояние здоровой женщины. Это аксиома, однако, не следует забывать, что природа человека не безупречна. Неблагоприятное воздействие окружающей среды, генети-ческидетерминированные факторы, мутации de novo, агрессивные инфекции влияют на течение беременности и развитие плода, нередко приводя к непоправимым последствиям. Стремление к раннему выявлению возможной патологии плода является естественным желанием не только пациенток, но и врачей.
Психологам хорошо известно, что с увеличением срока беременности в сознании женщины происходит глубокая перестройка. От «состояния беременности» будущая мать постепенно переходит в качественно новое для ее психики «состояние ожидания ребенка». Мнение большинства исследователей совпадает: чем позже выявлена патология, тем тяжелее последствия для психического здоровья женщины. Именно поэтому изучение течения беременности с
самых ранних сроков, оценка развития эмбриона, поиск маркеров патологических состояний являются основными задачами пренатальной медицины.
Несмотря на то, что жизнь человека на Земле продолжается несколько тысяч лет, до середины XX века возможности акушеров в обследовании беременных, в том числе и в ранние сроки, были очень ограниченными. Наличие патологии беременности можно было предположить только на основании пальпаторных и аускультативных данных. В таких условиях аномалии развития в ранние сроки были практически недоступны для диагностики.
Внедрение эхографии в практическое акушерство в середине XX века совершило революционный переворот в развитии пренатальной диагностики. Врачи получили возможность воочию наблюдать за этапами внутриутробного формирования плода. Следующим шагом должен был стать и стал переход от созерцания и констатации наличия какой-либо патологии к активному вмешательству в течение бе
------------------------------------------------------ 123
ОГЛАВЛЕНИЕ
6
глава
ременности. Созданию благодатной почвы для расширения пренатального обследования способствовали успехи в развитии других направлений в медицине и особенно в генетике.
Вторым после эхографии этапом в становлении пренатальной диагностики явилась возможность пренатального кариоти-пирования. В 1966 году М. Steel и W. Breg [1] сообщили о методе культивирования клеток амниотической жидкости, который позволял получать полноценные делящиеся плодные клетки и использовать их для оценки кариотипа плода. Успехи специалистов в области лабораторной генетики вдохновили акушеров на поиски безопасных методов получения плодного материала. Спустя короткое время, в конце 60-х — начале 70 годов, в практическое здравоохранение прочно вошел амниоцентез. Он стал методом выбора во II триместре бере-менностипри обследовании пациенток, угрожаемых по рождению детей с хромосомной патологией. Началась эра дородовой диагностики врожденных и наследственных заболеваний.
Несмотря на надежность, информативность и безопасность амниоцентеза, во всем мире продолжался активный поиск новых методов, позволяющих перенести обследование на более ранние сроки. Первые попытки получения ворсин хориона в I триместре беременности были предприняты в конце 70-хгодовв Скандинавии. В1968 году J. Mohr и N. Hahnemann предложили трансцервикальную биопсию хориона [2, 3], а спустя год увидела свет публикация этих же авторов, посвященная разработке усовершенствованной эндоскопической методике получения плодной ткани (трофобласта) путем биопсии хориона под контролем гистероскопа [4]. В основном экспериментальные операции проводились во II триместре перед прерыванием беременности по различным показаниям. Высокий уровень осложнений не позволил внедрить этот метод в широкую практику, но уже в те годы был сделан вывод о том, что биопсию можно применять и в ранние сроки.
В начале 70-х годов поиск возможностей получения материала для генетического обследования плода в I триместре активно продолжался, но неудовлетворительные результаты исследований не позволяли реко-мендоватьприменениеинвазивныхметодов в практическом здравоохранении [5, 6].
Первое сообщение об использовании инвазивной диагностики в целях практической медицины пришло в 1975 году из Китая. Выполняя социальный заказ правительства на решение проблемы демографической ситуации в стране, китайские врачи первыми в мире применили слепую трансцервикальную аспирацию плодного материала с помощью металлического катетера с целью определения пола плода по наличию полового хроматина в прямых препаратах хориона. Несмотря на то, что визуальный контроль отсутствовал, операции были успешными в 73% случаев, а частота самопроизвольного прерывания беременностей составила всего 4% [7].
Данные о высоком уровне осложнений после биопсии хориона под контролем эндоскопических приборов стимулировали поиск принципиально новых методик получения плодного материала. В 1975—1979 гг. была опубликована серия работ группы исследователей, возглавляемой S. Rhine, которые получали плодные клетки путем аспирации содержимого цервикального канала с помощью модифицированного пластикового катетера диаметром 3,5 мм [8]. Метод оказался достаточно безопасным, но неэффективным, поскольку плодные метафазные пластинки авторам удавалось получать лишь в 26—49% взятых образцов, а окончательный ответ — в единичных случаях из-за плохого качества препаратов.
Серьезным толчком к развитию инвазивных методов исследования в акушерстве в ранние сроки послужили открытия в области лабораторной диагностики. В 1981 году М. Niazi и соавт. разработали способ культивирования ворсин хориона, который позволял существенно расширить возможности и повысить точность
124
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
цитогенетических исследований [9]. В том же году группа под руководством R.Williamson впервые провела прямой анализ ДНК, что открыло путь к ранней диагностике многочисленных моноген-ных заболеваний (муковисцидоза, серповидно-клеточной анемии, миодистрофии Дюшенна и т.д.). [10]. Спустя 2 года был подробно разработан и описан усовершенствованный метод анализа прямых препаратов ворсин хориона [11].
Таким образом, уже в начале 80-х годов специалисты, работающие в области лабораторной генетики, былиполностью готовы к ранней пренатальной диагностике врожденной и наследственной патологии. Проблема состояла в отсутствии надежных и безопасных для матери и плода методов получения ворсин хориона. Удивительно, что идея о необходимости эхографического контроля при инвазивном вмешательстве при беременности витала в воздухе до 1979 года! Лишь спустя 11 лет от начала использования амниоцентеза в диагностических целях в акушерской практике эта идея материализовалась.
Внедрение ультразвукового контроля при проведении биопсии стало новым словом в развитии ранней пренатальной диагностики. Использование эхографии при трансцервикальной процедуре впервые было предложено нашими соотечественниками в 1979 году и сразу получило широкое распространение во многих клиниках мира [12—14].
До начала 80-х годов практически все ранние инвазивные исследования, которые разные клиники в разных странах проводили от случая к случаю, назывались биопсиями, что точно отражало характер вмешательства. В 1983 г. британскими учеными под руководством R. Wald впервые была применена аспирация ворсин хориона с помощью пластикового катетера с гибким металлическим мандреном, который вводился в полость матки по заданной траектории под ультразвуковымконтролем [15]. Первые результаты обнадежили медиков: новая техника аспирации хориона под контролем
эхографиипозволяла принебольшойчасто-те осложненийполучать адекватное количество чистого материала в 80% случаев, что значительно превышало все ранее опубликованные данные. Аналогичные результаты были достигнуты исследователями под руководством В. Brambati, которые работали в Италии в это же время [ 16].
Хорошо отработанная методика проведения амниоцентеза во II триместре беременности позволяла предположить возможность получения материала хориона не только трансцервикальным, но и трансабдоминальным путем. В 1984 году были опубликованы результаты работы датских исследователей S. Smith-Jensen и N. Hahnemann, которые попытались получить плодный материал путем пункции через переднюю брюшную стенку методом «игла в иглу». Передняя брюшная стенка и матка до хориальнойпластины пунктировались иглой диаметром 1,2 мм, по которой потом вводиласьигла диаметром 0,7 ммиас-пирировались ворсины. Инвазивные вмешательства проводились перед медицинскими абортами в сроки 9—10 нед и были успешными в 84,5% случаев [17]. В ходе этой работы впервые в мире при трансабдоминальной аспирации ворсин хориона был применен ультразвуковой контроль.
Вторая половина 80-х годов XX века характеризуется лавинообразным нарастанием количества публикаций, посвященных клиническому применению инвазивных методов исследования в I триместре беременности. За несколько лет — с 1983 года, когда аспирация ворсин прочно вошла в практику, до 1991 года — в Международный Регистр по инвазивным исследованиям в I триместре было внесено более 100 000 процедур [18]. Во многих клиниках аспирация стала ведущим инвазивным методом в связи с явными преимуществами перед амниоцентезом в скорости получения ответа и сроках обследования.
Стремительное развитие лабораторных методов работы с плодным материалом и, в частности, с околоплодными водами позволило исследователям предположить
НАЧАЛО ГЛАВЫ
-------------------125
ОГЛАВЛЕНИЕ
6 глава__________________________
возможность проведения в клинической практике раннего амниоцентеза. В конце 80-х годов появились первые сообщения о применении амниоцентеза с целью диагностики врожденных и наследственных заболеваний в I триместре [19, 20].
Таким образом, к началу 90-х годов в пренатальной диагностике сформировался прочный союз акушеров, врачей ультразвуковой диагностики и генетиков, способный решать главную задачу пренатальной медицины — раннее выявление врожденных и наследственных заболеваний плода. Споры о преимуществах и недо
статках различных методов получения плодного материала для исследования в ранние сроки беременности до сих пор активно ведутся на страницах специализированных изданий. В конечном итоге выбор метода зависит от возможностей генетической лаборатории, умения хирурга, желания пациентки и многих других факторов. Единых рекомендаций по применению той или иной методики не существует, поэтому каждая клиника должна самостоятельно определять стратегию и тактику обследования пациенток в ранние сроки беременности.
ВИДЫ ИНВАЗИВНЫХ ИССЛЕДОВАНИЙ
Существует несколько классификаций инвазивных методов исследования в ранние сроки беременности:
1. По характеру доступа: трансцервикальный, трансабдоминальный.
2. По технике получения материала: путем аспирации, путем биопсии.
3. По характеру контроля при проведении вмешательства: под ультразвуковым контролем, под контролем эндоскопических приборов.
4. По характеру получаемого материала: ворсины хориона, околоплодные воды, кровь из пуповины.
5. По основной задаче исследования: визуальная оценка структур плода (инт-ра- и экстраамниальная эмбриоскопия), получение материала для генетического исследования.
В настоящее время наиболее распространенными в клинической практике методами являются трансцервикальная или трансабдоминальная аспирация ворсин хориона. Другие инвазивные вмешательства, например, ранний амниоцентез, применяются значительно реже в связи с более высоким риском осложнений. Некоторые методы — эндоскопия, ранний кордо-центез — носят сугубо экспериментальный и научный характер. В конечном итоге вы
бор метода инвазивного исследования зависит от навыков оператора и возможностей конкретной генетической лаборатории.
Трансцервикальная аспирация ворсин хориона
Трансцервикальная аспирация ворсин хориона (ТЦ АВХ) — это первый инвазивный диагностический метод, вошедший в широкую клиническую практику. Техника проведения ТЦ АВХ хорошо известна и много раз описана. Процедура проводится в положении на гинекологическом кресле ине требует специальной подготовки беременной. Анестезия, как правило, не используется в связи с отсутствием у пациенток болевых ощущений.
Для успешного проведения ТЦ АВХ оператору требуется помощь не только медицинской сестры, но и ассистента, проводящего постоянный ультразвуковойконтроль. Использование конкретных датчиков не регламентировано. Задача ассистента — добиться оптимальной визуализации матки, хориона и вводимого катетера. Большинство исследователей проводит ТЦ АВХ при наполненном мочевом пузыре. Степень наполнения определяется индивидуальными особенностями беременной и должна обеспечивать лучшие условия длявизуализации.
126-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
Эхографический контроль во время процедуры позволяет оценить положение матки и заранее создать необходимый изгиб катетера в зависимости от расположения хориона. В настоящее время в основном используются катетеры фирмы Portex, созданные специально для ТЦ АВХ. Их гибкий металлический мандрен сохраняет заданную форму и помогает вводить катетер по оптимальной траектории.
После обработки слизистой влагалища и шейки матки любым антисептическим раствором передняя губа шейки фиксируется пулевыми щипцами и в цервикальный канал без предварительного расширения вводится катетер. Он движется по направлению к хориону вдоль амниотической оболочки, отслаивая ее, но не травмируя. Введение катетера по прямой траектории, то есть без учета естественного изгиба матки, недопустимо, поскольку может привести к травме амниотической оболочки и излитию вод.
После попадания катетера в толщу хориона мандрен удаляется, к катетеру присоединяется 20 мл шприц с 5—7 мл транспортной среды, поршень максимально выдвигается, создавая в шприце отрицательное давление, и, не снимая шприц, катетер удаляется. Ворсины под действием перепада давления попадают в шприц и затем переносятся во флакон с транспортной средой.
Полученное количество материала оценивается визуально. Ворсины имеют характерный вид небольших ветвящихся образований. Средний вес хориона, требующегося для проведения цитогенетического и биохимического исследований, должен составлять 10 мг. Меньшее количество материала не всегда позволяет провести адекватную оценку кариотипа или точное определение ферментативной активности, что делает необходимым повторное вмешательство. Для оценки ДНК количество материала может быть меньше в связи с особенностями его обработки при ДНК-анализе и техникой проведения лабораторного исследования. Успешность
получения материала при ТЦ АВХ достаточно высока. По данным группы исследователей, возглавляемой В. Brambati, частота удачных аспираций в 1991 г. составляла 90% при среднем весе образцов 30,6 мг (менее 10 мг — 5,0%) [21]. Спустя 7 лет, эти же авторы подтвердили получение материала трансцервикальным путем в 91% случаев при среднем весе образцов 31,2 мг. На маловесные образцы (менее 10 мг) приходилось 13,2% [22]. М. Айобаисоавт. сообщили о получении материала в 93,2% случаев [23]. По данным российского мультицентрового исследования (РМЦИ), посвященного инвазивным методам исследования (1998 год), успешность получения ворсин хориона при ТЦ АВХ составляла 94,9% [24]. По данным 7-летней работы Центра пренатальной диагностики (ЦПД) при клиническом родильном доме № 27 (Москва) — старейшего центра в России, занимающегося пренатальной диагностикой в рамках практического здравоохранения, — успешность получения адекватного количества ворсин хориона путем ТЦ АВХ была ниже — 86,1%.
Если в аспирате ворсины отсутствуют, может быть проведена еще одна попытка пункции. Доказано, что частота осложнений связана с количеством попыток инвазивного вмешательства, поэтому после второй неудачной попытки вмешательства проведение повторной процедуры целесообразно отсрочить на несколько дней.
Трансцервикальная биопсия ворсин хориона с помощью щипцов
Этот метод получения хориальной ткани для генетического исследования подразумевает использование специального инструмента — биопсийных щипцов, которые вводятся трансцервикаль-но и в большинстве случаев под ультразвуковым контролем.
Техника проведения этой манипуляции под контролем эндоскопических приборов канула в Лету на рубеже 70-х—80-х годов в связи с высоким риском осложнений и представляет скорее исторический, чем
НАЧАЛО ГЛАВЫ
-------------------127
ОГЛАВЛЕНИЕ
6
глава
практический интерес. В настоящее время публикации результатов инвазивных исследований в I триместре с помощью биопсии малочисленны [25], поскольку метод не сумел стать достойной альтернативой технике получения материала путем аспирации и не нашел широкого распространения в повседневной практике.
Исследователи, использующие технику трансцервикальной биопсии, в основном применяют щипцы диаметром 1,9 мм и длиной 25 см, которые были предложены С. Rodeckи соавт. [25] в 1983 году. При аккуратном и точном введении щипцов в толщу хориона хирург практически застрахован от получения недостаточного количества материала. Например, по данным одной из последних публикаций, посвященной этой технике, успешность биопсии составляла 98%. Эти же авторы сообщили о низкой частоте осложнений. Самопроизвольные прерывания, непосредственно связанные с биопсией, по их данным, не превысили 1,6%, что вполне сопоставимо с частотой осложнений после ТЦАВХ [26].
Пред- и послеоперационное ведение пациенток, обследованных с помощью трансцервикальной биопсии хориона, так же, как и сроки проведения исследования не отличаются от ТЦ АВХ. Проведение биопсии в повседневной практике вполне допустимо, хотя отсутствие в литературе результатов рандомизированных исследований не позволяет достоверно судить об осложнениях, что, безусловно, снижает клиническую значимость этого метода.
Трансабдоминальная аспирация ворсин хориона
Трансабдоминальная аспирация ворсин хориона (ТА АВХ) как самостоятельный метод инвазивной диагностики в ранние сроки беременности был описан и внедрен в клинику в начале 80-х годов практически одновременно с ТЦ АВХ. С тех пор эти методы получения плодного материала соседствуют друг с другом, со
перничая в основных показателях эффективности и безопасности.
ТА АВХ проводится в положении паци-енткилежа на спине. Подготовка беременной и послеоперационное ведение не отличаются от ТЦ АВХ.
Во время вмешательства осуществляется постоянный ультразвуковой контроль. Возможно использование конвек-сных, линейных и секторных датчиков в зависимости от комплектации ультразвукового прибора и навыков оператора. В отличие от ТЦ АВХ, трансабдоминальное вмешательство не требует обязательного присутствия ассистента, поскольку хирург может самостоятельно контролировать введение иглы.
После обработки кожи живота антисептическим раствором проводится местное обезболивание 2,0 мл 0,5% раствором новокаина. В некоторых клиниках введение анестетика не практикуется в связи с незначительными болевыми ощущениями, возникающими при введении инвазивной иглы. По нашему мнению, предварительная инъекция позволяет не только практически исключить неприятные ощущения, но и помогает наметить правильную траекторию движения пункционной иглы в обход мочевого пузыря и петель кишечника. В отличие от ТЦ АВХ при трансабдоминальном вмешательстве наполненный мочевой пузырь, как правило, затрудняет проведение процедуры, поскольку перекрывает доступ к матке. Если условия визуализации у конкретной пациентки требуют наполнения мочевого пузыря, во избежание травмы при проведении операции следует более внимательно следить за соотношением траектории движения иглы и положением пузыря.
Существуетнесколько методик ТААВХ. Основоположники этого исследования — S. Smidt-Jensen и N. Hahnemann — предложили применять метод «игла в иглу» [17]. Его принцип заключается в использовании двух разных игл, одна из которых (более короткая и толстая) играет роль проводника, а другая служит приспособлением для
128-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
аспирации материала. Короткая игла закрепляется в пункционном адаптере, расположенном на ультразвуковом датчике. Использование адаптера позволяет наметить траекторию движения иглы точно в соответствии с разметкой, появляющейся на экране ультразвукового аппарата, и не дает отклониться от этой линии.
Техника процедуры достаточно проста: короткой иглой пунктируется передняя брюшная стенка и матка. Более длинная и тонкая игла вводится внутрь первой иглы и проникает в толщу хориона. К внутренней игле присоединяется шприц с небольшим количеством транспортной среды, закрепленный в специальном держателе. Несколькими движениями поршня производится аспирация ворсин, и иглы удаляются одним движением.
Помимо метода «игла в иглу» в клинической практике широко известен метод «свободной руки». Суть его заключается в том, что без использования каких-либо приспособлений обычная спинальная игла диаметром 20 или 18 G вводится под контролем ультразвука через переднюю брюшную стенку и матку непосредственно в толщу хориона. После извлечения мандрена к ней присоединяется 20 мл шприц со средой, и взятие ворсин происходит описанным выше способом. Метод «свободной руки» требует несколько больших навыков в выборе траектории движения иглы к хориону и в четкой ее визуализации на всем протяжении, чем метод «игла в иглу». Однако он дает больше свободы в подходе к хориону, позволяет легко изменить траекторию введения иглы при возникновении такой необходимости и не требует дополнительного оборудования (пункционного адаптера).
Обе методики принципиально не отличаются по качеству и количеству аспирируемого материала и другим параметрам. Они получили практически одинаковое распространение в клинике, и выбор осуществляется в зависимости от навыков хирурга и традиций диагностического центра.
Несомненным преимуществом ТА АВХ перед ТЦ АВХ является высокое качество полученного материала. Ворсины, добытые путем трансабдоминальной аспирации, отличает чистота, практически полное отсутствие примеси материнских клеток и большой вес образцов. Например, родоначальники метода S. Smidt-Jensen и N. Hahnemann в исследованиях 1988 года методом «игла в иглу» получили материал в 100% случаев при средней массе аспирата 28 мг [27]. По их же данным, среднее время процедуры составило 3 мин, что меньше средней продолжительности ТЦ АВХ. По данным L. Bovicelli и соавт. [28]. которые также использовали технику «игла в иглу», пункция была успешной в 99,7% случаев, при этом с первой попытки — в 97%, со второй — в 2,8%, с третьей — в 0,2% наблюдений. Средняя масса образцов составляла 10—15 мг. Минимальное количество ворсин (менее 5 мг) было получено только в 9,4% случаев. В большой серии исследований (1159 наблюдений) , проведенных группой под руководством В. BrambatiB 1988 году, материал не удалось получить только у 0,3% пациенток, средний вес образцов при этом составлял 24 мг [29]. По данным К. Nicolaides и соавт. [30], успешность манипуляции составляет 99,3%. Как показало РМЦИ [24], отечественные специалисты для получения ворсин хориона в ранние сроки беременности предпочитают использовать метод «свободной руки» и получают адекватное количество материала в 99% случаев. По данным нашего ЦПД, этот показатель составляет 99,4%.
При неудачной попытке ТА АВХ повторное вмешательство проводится сразу. Третья пункция считается нежелательной, поскольку частота осложнений возрастает с количеством попыток введения иглы. Как и при ТЦ АВХ, в этом случае целесообразно отложить исследование на 2—3 дня.
Ранний амниоцентез
В конце 80-х годов ранний амниоцентез (РА) возник как метод, позволяющий
НАЧАЛО ГЛАВЫ
-------------------129
ОГЛАВЛЕНИЕ
6
глава
соединить информативность и безопасность позднего амниоцентеза с ранними сроками обследования, характерными для ТА АВХ и ТЦ АВХ. Условия проведения раннего амниоцентеза, ведение пациенток до и после процедуры ничем не отличаются от ТА АВХ.
Техника РА схожа с техникой традиционного вмешательства, проводимого во II триместре беременности. Процедура, как правило, проводится одним хирургом без ассистента. Нередко применяется местная анестезия раствором новокаина. Инвазивная игла вводится через переднюю брюшную стенку в амниотическую полость под постоянным ультразвуковым контролем. Количество аспирируемых околоплодных вод должно быть меньше, чем во II триместре, в связи с меньшим объемом плодного яйца. Рекомендации по объему удаляемых вод противоречивы (таблица 6.1).
В начале 90-х годов большинство авторов рекомендовали получать не менее 12— 15 мл из расчета 1 мл на каждую неделю беременности, что составляет 20—25% от общего объема вод и восстанавливается за 7—10 дней [40]. Еще в 1970 году A. Emery доказал, что с увеличением срока беременности количество клеток в водах увеличивается, но число жизнеспособных клеток уменьшается, поэтому объем равный 12— 15 мл практически гарантирует успешное культивирование в 98—99% случаев [41]. В
условиях РА удаление такого объема вод чревато более частыми осложнениями, поэтому в исследованиях конца 90-х годов количество аспирируемых вод стали ограничивать 8—10 мл, что в среднем составляет 11% от их общего объема в 12 нед беременности и восстанавливается за 3 дня.
Несмотря на кажущуюся легкость аспирации околоплодных вод в ранние сроки беременности, получить адекватное количество материала для исследования удается далеко не всегда. Например, в исследованиях М. Cederholm и О. Axelsson первая попытка была удачной только в 85,7% наблюдений [42].
Несомненным недостатком РА является длительность подготовки цитогенетического ответа. Это ограничивает применение метода в практике. Если исследование материала хориона позволяет дать ответ через 2—3 дня, то культивирование амниоцитов занимает от 7 до 17 дней и в 96,5% случаев окончательный анализ получают не ранее, чем через 2 недели [30, 31, 35—37, 42—45]. Рост культуры амниоцитов — процесс не только длительный, но и не всегда удачный, поскольку он зависит от многих факторов. В первых работах, посвященных РА, неудачи культивирования амниоцитов у некоторых авторов составляли 13,6% [46]. В настоящее время после усовершенствования методов лабораторной диагностики в
Таблица 6.1. Ранний амниоцентез
Автор п Объем вод, мл Неудачное культивирование, % Прерывание беременности, %
F. Hanson и соавт., 1987 [31] 541 25 0 3,6
J. Nevin и соавт., 1990 [19] 222 2-17 0 1,4
С. Penso и соавт., 1990 [32] 407 12-15 1,7 2,3
G. Hackett и соавт., 1991 [33] 106 12-15 0 1,8
В. Assell и соавт., 1992 [34] 300 15-20 1,7 2,2
G. Henry, W. Miller, 1992 [35] 1805 12-15 0,5 4,0
F. Hanson и соавт., 1992 [36] 879 12-15 - 2.9
К. Nicolaides и соавт., 1994 [30] 731 12-15 2,5 5,3
J. Johnson и соавт., 1996 [37] 349 12-15 0,6 1,8
С. Brumfield и соавт., 1996 [38] 314 12-15 1,0 2,2
S. Tharmaratnam и соавт., 1998 [39] 412 7 2,2 3,8
130-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
среднем культуру клеток околоплодных вод получают в 97—98% случаев при наилучшем показателе — 99,5% [35]. Однако и в настоящее время в отдельных работах авторы указывают на неудачи культивирования в 11—12% [42]. Для практического здравоохранения более привлекательным является быстрое выявление наиболее распространенных трисомий путем исследования некультивированных ам-ниоцитов [43], но этот метод чреват большей частотой диагностических ошибок.
Несмотря на перечисленные недостатки в некоторых клиниках РА продолжает оставаться методом выбора и успешно применяется для диагностики врожденной и наследственной патологии.
Эмбриоскопия
Эмбриоскопия — это исследование эмбриона с помощью оптического прибора в сроке до 12 нед беременности с целью визуальной оценки его органов. Первую попытку воочию увидеть плод с помощью гистероскопа в 1954 году предпринял J. Westin [47]. Почти за полвека, прошедшие с этого момента, оптическая техника претерпела существенные изменения. Сегодня медицина располагает миниатюрными приборами с высокой разрешающей способностью и великолепным качеством оптики.
Основным показанием к проведению эндоскопических исследований в ранние сроки беременности является высокийриск наличияуплодаврожденнойинаследствен-ной патологии, которая не может быть выявлена с помощью традиционной эхографии и не дает характерных изменений при цитогенетическом, биохимическом или ДНК анализах. Перед проведением эндоскопии все пациентки должны пройти генетическое консультирование для уточнения характера возможной патологии и ее вероятных фенотипических признаков у плода. Тщательное предварительное ультразвуковое исследование позволяет уточнить показания к эндоскопии и наметить оптимальный доступ и технику процедуры.
В литературе имеются отдельные сообщения об удачных эндоскопических исследованиях в ранние сроки беременности, в ходе которых был поставлен точный генетический диагноз. Например, в 1995 году М. Dommergues и соавт. [48] сообщили об эндоскопической диагностике синдрома Ван дер Вауда. ДНК анализ в этой ситуации оказался неинформативным в связи со значительной вариабельностью экспрессии гена. Эта же группа опубликовала данные о диагностике синдрома Меккеля-Грубера в 10— 11 нед на основании выявления постаксиальной полидактилии. В 1987 году в работе Y.Ville и соавт. |49] описаны случаи диагностики полидактилии, косолапости, энцефалоцеле, микрогении, расщелин и других аномалий лица в сроке от 8 до 13 нед. По мнению D. 8иЬгекисоавт. [50] в перспективе эндоскопия может применяться не только для визуальной оценки структур плода, но и для нужд генной терапии. Например, введение клеток костного мозга в I триместре может повлиять на течение заболеваний, вызванных повреждением лимфагематопоэза.
Определенный интерес в будущем может вызвать эндоскопическое исследование плодов с расширенным воротниковым пространством и нормальным кариотипом для исключения возможной структурной патологии в ранние сроки беременности.
При эндоскопических исследованиях плода может использоваться как трансцервикальный, так и трансабдоминальный доступы. Трансцервикальная эмбриоскопия проводится после обработки наружных половых органов и шейки матки антисептическим раствором и фиксации шейки матки пулевыми щипцами. Жесткий эндоскоп вводится через цервикальный канал строго перпендикулярно к оболочкам во избежание их отслаивания от маточной стенки. В настоящее время используются эндоскопы, диаметр которых составляет от 2 до 3,5 мм, а иногда не превышает 1,7 мм. Местная анестезия применяется по показаниям.
НАЧАЛО ГЛАВЫ
-------------------131
ОГЛАВЛЕНИЕ
6
глава
В отличие от трансцервикальных процедур трансабдоминальная эмбриоскопия проводится под местным обезболиванием. Иногда по желанию пациенток применяют спинномозговую анестезию или даже общий наркоз [50]. Диаметр современного трокара обычно не превышает 2 мм, а диаметр вводимого потом эндоскопа — 0,7—0,8 мм.
Оценка структур плода при эндоскопии может проводиться как при непосредственном контакте, так и через амниотические оболочки. При первом виде исследований оптический прибор вводится интраамни-ально, то есть через амниотические оболочки; при втором — экстраамниально в экзо-целомическую полость без повреждения амниона. Оптимальный срок для проведения экстраамниальной эмбриоскопии — 9— 12 нед, поскольку позже хориальная оболочка срастается с амнионом, что делает этот способ введения эндоскопа невозможным.
Интраамниальные эндоскопические процедуры могут использоваться не только для визуальной оценки органов и частей плода, но и с целью одновременного получения материала для генетического исследования. Например, D. Subrek и соавт. [50] сообщили о 3 из 14 удачных попыток кордоцентеза у пациенток, прошедших эндоскопическое обследование в I триместре. Для пункции пуповины авторы применяли иглы диаметром 25 и 27 G.
Очевидно, что эффективность процедуры и точность диагностики зависят от качества визуализации плода. Применение полужестких и мягких эндоскопических инструментов, вошедших в практику инвазивных исследований лишь в последнее десятилетие, позволяет получить хороший обзор матки иплода. Тем не менее, при проведении исследования следует помнить, что оценка анатомии эмбриона проводится частями, поэтому оптический прибор должен быть по возможности нацелен на пораженный орган. В 10—12% случаев хорошей визуализации может мешать кровотечение из поврежденной плаценты или стенки матки.
В 1997 году Y. Ville и соавт. [49] опубликовали статью, где подытожили международный опыт применения эмбриоскопии. В эту работу вошел анализ 270 случаев эмбриоскопии в I триместре беременности. В основном все исследования проводились с целью отработки методики перед прерыванием беременности в интервале от 5 до 13 нед. Удовлетворительная визуализация эмбриона была достигнута в большинстве случаев: от75до 100%. Осложнения после процедуры были отмечены в 4—12% и включали кровотечения, самопроизвольные прерывания беременности, разрыв плодных оболочек, мгновенную смерть эмбриона.
Работы, анализирующие итоги эмбриоскопий в ранние сроки у пациенток, пролонгирующих беременность, очень малочисленны. В 1992годуУ. DumezncoaBT. [51] проанализировали итоги эмбриоскопичес-ких исследований, которые были проведены беременным с отягощенным анамнезом (рождение детей с врожденной и наследственной патологией), пролонгирующих беременность. В основном это были пациентки с высоким риском аутосомно-доминантных генетических заболеваний, включающих аномалии конечностей и лица. В 6 случаях из 42 беременности были прерваны в связи с выявленными аномалиями развития. В 12,8% произошли самопроизвольные выкидыши в интервале от 13 до 23 нед. У 31 пациентки беременности закончились срочными родами без осложнений.
Высокий риск осложнений — это основной недостаток исследований в I триместре с применением оптических приборов. Например, Y. Ville и соавт. [49] сообщили о 35% прерываний беременности после этих процедур. Этот показатель сводит на нет все преимущества метода и делает его практически неприемлемым для широкой практики. Считается, что трансабдоминальный доступ при эмбриоскопии менее травматичен и дает меньшую частоту инфекционных осложнений.
До сих пор в литературе, посвященной эндоскопическим исследованиям при бере
132-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
менности, ведутся дискуссии о возможном поражении глаз плода ярким светом, который используется припроцедуре. Неблагоприятное воздействие эндоскопического света на зрительный анализатор показано в эксперименте [52], однако исследование детей, родившихся после эмбриоскопии [49], не подтвердило наличия каких-либо значимых анатомических изменений или функциональных отклонений в работе глаз.
Приведенные данные доказывают, что, несмотря на заманчивые перспективы в применении эндоскопических методик в ранние сроки беременности, в настоящее время они не нашли широкого применения в практической медицине и их использование носит если не экспериментальный, то эксклюзивный характер. Прежде всего это связано с большой частотой осложнений после этих вмешательств, а также с их высокой стоимостью. Однако наличие этих методов в арсенале современной пренатальной диагностики и быстрый прогресс техники позволяют надеяться на расширение их использования в повседневной практике.
Целомоцентез
Целомоцентез—это аспирация содержимого целомическойполости. Клетки, содержащиеся в аспирате, пригодны для проведения цитогенетического и ДНК анализов, а также для определения пола путем исследования методом FISH. Широкого распространения в клинической практике этот метод не получил в связи с наличием хорошо разработанных методик ТЦ и ТА АВХ.
Пункция может быть проведена трансвагинальным доступом без анесте
зии в интервале от 6 до 12 нед. Эхографический контроль теоретически позволяет ввести иглу, минуя хорион и амниотические оболочки, что делает процедуру более безопасной. Тем не менее частота осложнений после целомоцентеза очень высока. По данным J. Ross и соавт. [53 ]. потери плодов после процедуры составили 25%, тогда как в контрольной группе — 5%. Такие результаты позволяют сделать однозначный вывод о том, что применение целомоцентеза в качестве альтернативной диагностической процедуры в I триместре беременности в настоящее время нецелесообразно.
Кордоцентез
Кордоцентез является методом выбора для обследования плода во II триместре беременности. Широкий спектр анализов, который может быть получен при работе с плодной кровью, всегда привлекал внимание исследователей, изучающих плод в ранние сроки беременности. К настоящему времени накоплен небольшой положительный опыт применения кордоцентеза в конце I триместра беременности. Например, поданным F. Orlani и соавт. [54], при кордоцентезе в 12—14 нед потери плодов составляют 4,8%, что сопоставимо с частотой осложнений после других инвазивных методов исследования в ранние сроки. Тем не менее, широкое использование этого метода в клинической практике невозможно в связи с неизбежными техническими трудностями, возникающими при взятии крови из достаточно малых по диаметру сосудов пуповины в этом сроке беременности.
ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ
Показания к обследованию с применением инвазивных методов в I триместре мало отличаются от показаний во II триместре беременности. Согласно традиционным принципам формирования среди
беременных группы риска, угрожаемой по рождению детей с врожденной и наследственной патологией, инвазивные исследования следует предлагать:
— беременнымввозрасте 35 лети старше;
НАЧАЛО ГЛАВЫ
-------------------133
ОГЛАВЛЕНИЕ
6
глава
— пациенткам с отягощенным анамнезом (рождение детей с хромосомной патологией или с моногенным заболеванием, подлежащим дородовой диагностике);
— семьям, в которых один из супругов является носителем хромосомной перестройки или оба супруга — носителями генной мутации,
— беременным, у которых при эхографии выявлены ультразвуковые маркеры хромосомной патологии (расширение воротникового пространства);
— беременным, у которых при проведении скрининговых биохимических исследований зарегистрированы отклонения сывороточных маркеров крови.
Все перечисленные показания к обследованию с применением инвазивных методов в I триместре беременности хорошо известны и не нуждаются в комментариях. Более подробно следует остановиться лишь на изменениях сывороточных маркеров крови.
Биохимический скрининг в ранние сроки — относительно новое направление в пренатальной диагностике, о котором российские специалисты знают лишь по публикациям в специальных зарубежных изданиях. Ни в одной стране мира ранний биохимический скрининг пока не стал национальной программой и не вошел в практическое здравоохранение, несмотря на хорошие первые результаты. До сих пор он является предметом научных разработок больших клиник и лабораторий.
В конце 80-х годов постепенно стали накапливаться данные о характере изменений альфафетопротеина (АФП) и не-конъюгированного эстриола (НЭ) в ранние сроки беременности. Выяснилось, что при синдроме Дауна (СД) отклонения уровней этих маркеров можно зарегистрировать уже в 9—11 нед [55]. Было установлено, что при СД медианы традиционных биохимических маркеров практически не отличаются от медиан в сроки традиционного скрининга (15—22 нед) и составляют: для АФП — 0,75 МоМ (в 15— 22 нед - 0,72 МоМ), для НЭ - 0,73 МоМ (0,72 МоМ), для общего ХГЧ — 1,90 МоМ
(2,01 МоМ), для свободного р-ХГЧ — 2,69 МоМ (2,22 МоМ), для свободного р-ХГЧ — 1,28 МоМ (1,31 МоМ) [56].
Одновременно с изучением свойств хорошо известных биохимических соединений шел поиск других ранних маркеров хромосомной патологии. Особое внимание уделялось изучению РАРР-А (плазменный белок, ассоциированный с беременностью — pregnancy associated plasma proteinA), поскольку большинство фундаментальных исследований, проведенных в середине 90-х годов, доказали, что для I триместра основное значение в скрининге по СД имеют свободный р-ХГЧ и РАРР-А. Ретроспективный анализ продемонстрировал, что комбинация возраста матери и этих двух маркеров в I триместре позволяет выявить около 60—65% всех случаев СД.
В норме в интервале от 9 до 13 нед концентрация РАРР-А прогрессивно растет с 1,48 до 4,71 МоМ, а свободного р-ХГЧ сначала растет, а к концу I триместра — снижается. При СД уровень ХГЧ увеличивается (в среднем до 2,15 МоМ), а РАРР-А—падает до 0,43 МоМ. При СД медианы для РАРР-А в материнской сыворотке в зависимости от срока составляют: в 6—8 нед — 0,35 МоМ, в 9-11 нед-0,40 МоМ, в 12-14 нед — 0,62 МоМ. В среднем при СД медиа-надляРАРР-АлежитвпределахО,43 МоМ, а для свободного р-ХГЧ — в пределах 2,06 МоМ. Используя сочетание этих маркеров, D. Wheeler и соавт. [57] выявили 66,6% всех случаев СД при 5% ложноположительных результатов и 72,7% беременностей с числовыми аберрациями хромосом или беременностей, закончившихся выкидышами при 1,2% ложноположительных результатов. Учет возраста в этом исследовании увеличил выявляемость СД до 68,8%. Авторы публикации сделали вывод о том, что конец I триместра является оптимальным сроком для скрининга с применением РАРР-А и свободного р-ХГЧ и о том, что этот тест можно применять и для прогнозирования неперспективных беременностей.
Группыисследователейподруководством N. Waldn М. Macintosh подтвердили эти вы
134
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
воды и в том же 1998 году сообщили, что сочетание РАРР-А и возраста матери в I триместре позволяет выявить 60% СД при 5% ложноположительных результатах [58, 59].
Наиболее значимыми исследованиями стали работы К. Spencer и соавт. [60] и Н. Cuckle и J. Lith [61], опубликованные в 1999 году. В них авторы изучили чувствительность раннего биохимического скрининга при использовании различных маркеров и их сочетаний. Очень демонстративным является анализ, проведенный Н. Cuckle и J. Lith [61], в котором был обобщен опыт работы 44 крупных центров (табл. 6.2,6.3,6.4). Лучшие показатели выявляемое™ СД были получены в интервале от 9 до 11 нед беременности (таблица 6.5).
Обе группы исследователей пришли к выводу о том, что чувствительность скрининга повышается при одновременной оценке нескольких биохимических маркеров. Результаты обеих работ доказали, что выявляемость СД резко возрастает при использовании биохимического скрининга в сочетании с возрастом беременной и оцен
кой толщины воротникового пространства плода при ультразвуковом исследовании.
Таким образом, в настоящее время появилась возможность смещения границы биохимического обследования на конец I триместра. Любая клиника может выбирать собственную схему биохимического скрининга, исходя из своих потребностей и материальных возможностей, поскольку биохимический скрининг это очень дорогостоящий метод. Не следует забывать, что организация любого скрининга в ранние сроки сопряжена с большими трудностями в связи с тем, что значительная часть беременных встает на учет в медицинские учреждения в сроки, когда проведение ранних скрининговых исследований теряет смысл.
По данным РМЦИ, в 1998 году самой многочисленной группой (29%) из всех обследованных с применением инвазивных методов в ранние сроки по медицинским показаниям была группа беременных старшего возраста, 12% приходилось на пациенток с моногенной патологией у детей
Таблица 6.2. Выявляемость СД при 5% ложноположительных результатов [61]
Маркеры Выявляемость СД
Свободный р-ХГЧ 33%
РАРР-А 38%
Толщина воротникового пространства плода 64%
Возраст + свободный р-ХГЧ 46%
Возраст + РАРР-А 48%
Возраст + ТВП 73%
Возраст + свободный р-ХГЧ + РАРР-А 67%
Возраст + ТВП + свободный р-ХГЧ 81%
Возраст +ТВП+ РАРР-А 82%
Возраст + ТВП + свободный р-ХГЧ + РАРР-А 89%
Таблица 6.3. Выявляемость СД в зависимости от уровня ложноположительных результатов [61]
Выявляемость СД Свободный р-ХГЧ + РАРР-А ТВП+ свободный р-ХГЧ ТВП+ РАРР-А ТВП+ свободный р-ХГЧ + РАРР-А
90% 23% 12% 12% 6%
85% 16% 7% 7% 3,5%
80% 11% 5% 4% 2,1%
75% 8% 3% 2,7% 1,5%
70% 6% 2,2% 1,5% 1%
Примечание. Здесь и в таблицах 6.4 и 6.5 ТВП - толщина воротникового пространства.
НАЧАЛО ГЛАВЫ
-------------------135
ОГЛАВЛЕНИЕ
6 глава
Таблица 6.4. Чувствительность биохимического скрининга [61]
Маркеры Биохимия + ТВП
Свободный р-ХГЧ 41,8% 77,7%
РАРР-А 52,2% 81,2%
РАРР-А + свободный р-ХГЧ 64,6% 86,4%
РАРР-А + свободный р-ХГЧ + АФП 66,6% 87,2%
РАРР-А + свободный р-ХГЧ + НЭ 68,6% 87,9%
Все 4 маркера 70,1% 88,3%
ТВП без маркеров 72,7%
в анамнезе, и по 9% — на беременных с отягощенным анамнезом (рождение детей с хромосомной патологией) и на случаи расширенного воротникового пространства [24]. В нашем ЦПД в течение последних 10 лет вед ущей причиной для обследования в I триместре была диагностика моногенной патологии (34%), а второе место прочно занимали сочетанные показания (15,5%). В последние годы в России большое значение приобрелисоциальные аспекты планирования семьи. Поданным РМЦИ, определение пола плода было показанием к инвазивной диагностике в 31% случаев [24], а, по данным нашего центра, — в 42% наблюдений.
Абсолютных противопоказа-нийкинвазивным исследованиям в ранние сроки беременности нет. Проведение трансцервикальных процедур затрудняют выраженные загибы матки, требующие сложной траектории движениякатетера, миома с низким расположением узла, непроходимость цервикального канала. Трансабдоминальные пунк-
ции чаще всего бывают неудачными при ожирении, множественной миоме матки, неудобном расположении хориона (задняя стенка). Наполненный мочевой пузырь, как правило, закрывает доступ к матке, поэтому его наполнение при трансабдоминальном доступе не требуется [21].
Клинические признаки угрозы прерывания беременности (боли, повышенный тонус матки, кровяные выделения), также как и острый воспалительный процесс любой локализации, не являются противопоказанием к исследованию, но требуют переноса процедуры на несколько дней для проведения соответствующего лечения.
Таблица 6.5. Выявление СД при 5% ложноположительных результатов в зависимости от срока беременности [61]
Биохимические маркеры Биохимические маркеры + ТВП
Нед РАРР-А+ р-хгч +АФП +НЭ 4 маркера РАРР-А+ р-хгч +АФП +НЭ 4 маркера
9 71,6 73,1 74,6 75,8 89,1 89,7 90,2 90,5
10 65,6 67,5 69,3 70,8 86,8 87,6 88,2 88,6
11 58,2 60,4 63,0 64,9 84,0 84,9 85,7 86,4
12 50,9 53,7 57,3 59,4 81,2 82,4 83,5 84,2
13 46,4 49,3 53,9 56,1 79,5 80,8 82,2 83,0
СРОКИ ПРОВЕДЕНИЯ
Основная цель обследования в I триместре — быстрый и точный генетический диагноз с минимальным риском для плода и матери. Очевидно, что пренатальное обследование в ранние сроки складывается из двух равноценных частей: получение
материала для генетического анализа и собственно лабораторный анализ.
Какой материал может быть использован для оценки генетического статуса плода?
Человеческая жизнь начинается с мо-
мента оплодотворения, то есть слияния
136-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
яйцеклетки и сперматозоида и образования зиготы. К 3-ему даю после оплодотворения в результате 3—4 делений зигота превращается в морулу — структуру внешне очень похожую на малину. После попадания в матку морула видоизменяется. Внутри морулы постепенно образуется полость (бластоцеле), стенки которой в дальнейшем формируют трофобласт. Клетки внутреннего слоя концентрируются возле одного из полюсов и превращаются в эмбриобласт. Все образование на этой стадии развития носит название бластоцисты [62]. Этапы формирования человеческого организма до 3-й нед жизни от момента оплодотворения или до 5 нед от первого дня последней менструации можно представить в виде следующей схемы.
стоверности судить о генетическом статусе будущего ребенка не только по результату анализа непосредственно плодных тканей, но и по анализу ткани хориона, а также содержимого полостей. Очевидно, что различные генетические анализы могут быть проведены уже на стадии бластоцисты или даже на стадии морулы (3-й день после оплодотворения). Эти исследования лежат в сфере интересов так называемой предымплантационной диагностики, которая пока не нашла широкого распространения в практической медицине в силу трудоемкости, сложности, дороговизны и специфичности анализов. Вопросы предымплантационной диагностики не могут быть рассмотрены в рамках настоящего издания, поскольку основной целью этой книги яв-
Схема эмбрионального развития
Бластоциста
амниотическая полость
цитотрофобласт
син цитотрофобласт
вторичный желточный мешок
эндодерма эпи бласт---------мезодерма
эктодерма
гипобласт ----------► аллантоис
ворсины
органы и __► системы плода
экзоцеломическая полость или________ хориальная
первичный желточный мешок полость
Таким образом, к 5-й нед от первого дня последней менструации заканчивается формирование трех зародышевых листков (экто-, мезо- и эндодермы) и ворсин трофобласта. Интересно, что основу эмбриобласта составляют лишь 10% клеток бластоцисты, а 90% клеток формируют трофобласт [63, 64].
Единая генетическая основа формирования плода, плаценты и полостей плодного яйца позволяет с высокой степенью до-
ляется освещение проблем ранней пренатальной диагностики в области практической медицины.
Естественным препятствием к безопасному получению плодного материала на самых ранних стадиях развития являются небольшие размеры плодного яйца. Мировой опыт доказывает, что оптимальным сроком для проведения обследования с применением инвазивных методов в I триместре является интервал от 9 до 11 нед беременности.
НАЧАЛО ГЛАВЫ
-------------------137
ОГЛАВЛЕНИЕ
6
глава
Верхняя граница срока проведения ранних инвазивных вмешательств (11 нед) в основном определяется временем получения генетического ответа и возможностью прервать беременность путем медицинского аборта в случае выявления патологии.
Нижняя граница (9 нед) установлена экспериментально на основе оценки результатов многочисленных исследований, проведенных в разных странах. По данным В. В rambat i и соавт. [22], которые проанализировали 10 000 инвазивных процедур в I триместре, на срок 9— 11 нед приходится 5 8 % всех исследований, до 9 нед — 33%, после 12 нед — 9%. По данным РМЦИ, 93,7% инвазивных процедур в I триместре беременно-стиприходитсянаинтервал9—14недилишь 6,3% — на более ранние сроки [24].
Какие факторы являются определяющими в выборе нижней границы срока инвазивного вмешательства?
Во-первых, небольшие размеры плодного яйца делают процедуры в сроке менее 9 нед технически более трудными и, соответственно, более опасными.
Во-вторых, к 9-й нед развития (7 нед от момента оплодотворения) все структуры плодного яйца становятся хорошо различимыми при трансабдоминальном ультразвуковом исследовании. Хориальная пластина на этой стадии претерпевает существенные изменения и делится на chorion frondosum («ветвистый хорион») и chorion laeve («лысый хорион»). Chorion frondosum — это часть хориальной пластинки, в дальнейшем формирующая плаценту и расположенная непосредственно в области инвазии трофобласта. В 9—10 нед беременности chorion frondosum достигает толщины 3—6 мм и хорошо визуализируется при ультразвуковом исследовании, что делает возможным проведение инвазивного вмешательства. Chorion laeve — это остальная часть хориона, которая постепенно дегенерирует и истончается.
В-третьих, в 9—10 нед беременности матка достигает уровня лона и в большинстве случаев хорошо видна при ультразвуковом исследовании без наполненного
мочевого пузыря. Последнее обстоятельство делает более безопасными трансабдоминальные вмешательства.
В-четвертых, в 9—10 нед беременности еще отсутствует слияние между амниотической и хориальной оболочками, что позволяет в этом сроке проводить экстраам-ниальные эндоскопические исследования.
Однако основным фактором, окончательно определившим нижнюю границу проведения инвазивных вмешательств в ранние сроки беременности, стал результат исследований, посвященных редукционным поражениям конечностей плода. В конце 1991 года Н. Firth и соавт. сообщили об увеличении этого вида аномалий у плодов, прошедших АВХ. По данным авторов, частота ампутированных конечностей после АВХ составляла 1,8 на 1000 новорожденных, тогда как популяционная частота этой патологии — 1на 1000 [65,66]. Несмотря на то, что эти исследования были проведены на малых сериях и их результаты были статистически недостоверны, они оказали существенное влияние на врачей и общественность и послужили поводом к тщательному и планомерному анализу мирового опыта проведения инвазивных процедур в I триместре. Последующая работа на большом количестве наблюдений доказала, что потенциальная возможность возникновения редукционных поражений конечностей может реали-зоваться только при проведении АВХ в сроки менее 9 нед [67]. Кроме того, было продемонстрировано, что эти аномалии возникают не только после инвазивного обследования, проведенного в малых сроках, но и при травматичных процедурах в более поздние сроки беременности. Механизм развития этого осложнения до сих пор остается до конца неясным. Предположительно возникновение редукционных поражений конечностей связано со снижением уровня кровообращения в поврежденном хорионе, появлением в нем обширных зон с эмболиями сосудов, а также с выбросом вазоактивных веществ в ответ на травму [68].
138-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
В 1999 году были подведены итоги работы Европейской рабочей группы, которая на протяжении многих лет изучала вопросы редукционного пораже
Таблица 6.6. Частота редукционных поражений конечностей (РПК) после аспираций ворсин хориона [69]
Срок беременности, нед Количество случаев Количество РПК РПК на 10 000
8 3415 4 11,7
9 18 442 9 4,9
10 39 028 15 3,8
11 32 528 11 3,4
более 12 13 170 3 2,3
всего 106383 42* 1/2533
в популяции 1/1642
ния конечностей [69]. К этому времени в международный регистр были внесены 216 380 случаев АВХ с известными исходами беременностей, и было окончательно установлено, что АВХ, проведенные после 8 нед беременности не повышают риск редукционного поражения конечностей (табл. 6.6).
По нашему мнению, приведенные данные убедительно доказывают нецелесообразность расширения сроков обследований в I триместре и детально обосновывают временной интервал проведения инвазивных вмешательств 9—11 нед беременности.
Примечание: * - из 42 случаев зарегистрированных аномалий 71,3% пришлось на поражение верхних конечностей, 11,3% - на поражение нижних конечностей, 17,4% - на поражение верхних и нижних конечностей.
УСЛОВИЯ ПРОВЕДЕНИЯ И ПОДГОТОВКА ПАЦИЕНТКИ
Инвазивные исследования в ранних сроках беременности не относятся к урген-тным вмешательствам, поэтому перед процедурой желательно проведение клинического обследования. Требования медицинских учреждений к объему обследования различаются. В нашей стране перечень необходимых анализов пока не регламентирован , но здравый смысл подсказывает, что минимальный объем исследований должен совпадать с обследованием перед медицинским абортом и включать анализы крови на RWh ВИЧ, а при проведении трансцервикальных процед ур — мазки из влагалища на степень чистоты и флору.
Несмотря на широкое применение инвазивных методов в клинической практике, до сих пор в России отсутствуют методические рекомендации, регламентирующие проведение этих исследований. В подавляющем большинстве отечественных и зарубежныхклиник все инвазивные исследования, в том числе и в ранние сроки беременности, проводятся в амбулаторных условиях без специальной подготовки па
циентки. Поскольку инвазия всегда означает внедрение в полость (в данном случае амниотическую или хориальную), по нашему мнению, проводить эти операции можно только в специализированных центрах, расположенных на базе стационара. Излишне напоминать, что эти манипуляции требуют строгого соблюдения правил асептики и антисептики и, соответственно, специальных помещений (процедурных кабинетов).
В настоящее время любое инвазивное исследование в акушерстве начинается с проведения тщательного ультразвукового исследования с целью уточнения срока и характера развития беременности, локализации хориона, количества околоплодных вод, положения матки, наличия мио-матозных узлов, признаков угрозы прерывания беременности и другой патологии.
За 15—20 мин до процедуры, независимо от ее вида, целесообразно внутримышечно ввести 2,0—4,0 мл спазмолитиков (из расчета на кг массы пациентки) для нормализации тонуса матки. При по
НАЧАЛО ГЛАВЫ
-------------------139
ОГЛАВЛЕНИЕ
6
глава
вышенной эмоциональности беременной возможно применение легких седативных препаратов.
По окончании проведения любого инвазивного вмешательства обязательно оценивается сердечная деятельность плода, а также состояние плодного яйца и матки. При правильно проведенном вмешательстве в большинстве случаев никакого специфического лечения не требуется. Только при наличии клинических признаков угрозы прерывания или других осложне-нийназначается соответствующаятерапия.
После инвазивной диагностики до получения генетического ответа, который в основном бываетготов через 2—3 дня, пациентке рекомендуется соблюдать охранительный режим и общие гигиенические правила. В случае отсутствия патологии в генетическом заключении дальнейшая тактика ведения пациентки, обследованной с применением инвазивных методов в ранние сроки, не меняется, поскольку особенностей течения беременности и родов у таких беременных не существует.
ОСЛОЖНЕНИЯ И ФАКТОРЫ, ВЛИЯЮЩИЕ НА БЕЗОПАСНОСТЬ ИНВАЗИВНЫХ ПРОЦЕДУР
Клиническая значимость любого диагностического метода определяется не только его чувствительностью и специфичностью, но и его безопасностью для пациентов. Изучение безопасности инвазивных методов занимает важное место в любом исследовании, посвященном пренатальной диагностике в ранние сроки беременности. В таблице 6.7 приведена частота некоторых осложнений, встречающихся после инвазивных вмешательств в I триместре беременности.
Самым грозным осложнением любой беременности, несомненно, является потеря плода. Основной вопрос, который волнует исследователей на протяжении всего периода применения инвазивных методов исследования, — это риск прерывания, непосредственно связанный с вмешательством. До сих пор нет единых критериев оценки потерь беременностей после инвазивной диагностики. Время, в течение которого самопроизвольный выкидыш считается обусловленным процедурой, до сих пор точно не определено, поэтому в разных исследованиях этот период вводится произвольно: 1, 2, 3 нед после вмешательства, интервал от момента процедуры до 20 нед и даже до 28 нед беременности. Некоторые авторы пред
почитают приводить сведения об общих потерях плодов (total losses), не расшифровывая это понятие. Очевидно, что в таких условиях проводить сравнение результатов работ разных исследователей и сопоставлять эффективность и безопасность различных инвазивных методов очень сложно. Тем не менее, приведенные данные показывают, что трансцервикальные вмешательства наиболее травматичны и чаще приводят к прерыванию беременности, чем ранний амниоцентез и трансабдоминальные аспирации. Анализ случаев прерывания беременностей, которые произошли в течение 2 нед после различных инвазивных вмешательств, продемонстрировал, что из 30 самопроизвольных выкидышей, непосредственно связанных с инвазивной диагностикой и зарегистрированных в ходе РМЦИ, на ТЦ АВХ пришлось 46%, на кордоцентез — 18%, а на ТА АВХ - только 4% [24].
Примечательно, что после трансцервикальных процедур значительно чаще регистрируются не только ранние (1—2 нед после процедуры) выкидыши, но и общие потери, включающие поздние самопроизвольные прерывания. Интересная закономерность была отмечена в исследованиях В. Brambati и соавт. [21]: в структуре всех
140 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
Таблица 6.7. Осложнения, связанные с трансабдоминальной и трансцервикальной аспирацией ворсин хориона
Авторы Потери плодов, % Гематома, % Кровотечение, % ТА Боли, % ТЦ Перитонеальные Примечания
ТА ТЦ РА ТА ТЦ РА РА явления, %
ТА ТЦ РА
S.Smidt-Jensen 3,2 До 7,0
и соавт. [27]
L. Bovicelli 2,7 3,3 2,6
и соавт. [28]
B.Brambati 2,6 0,4 0,8 6,0 3,0 0,3
и соавт. [29]
М. Ahoda 3,9
и соавт. [23]
B.Brambati 4,0 4,8 1,9 1,6 0,3 0,3 Потери ТА+ТЦ 3,8%
и соавт. [21] Осложнения ТА+ТЦ 6,4%
S. Smith-Jensen 2,4 6,8 Общие потери при ТА 6,2%
и соавт. [70] приТЦ 10,1%
Canadian Общие потери при ТА 6,2%
Collaborative при ТЦ8,7%
Study [71]
В. Brambati 1,5 3,2 0,2 2,5 0,04 Потери ТА+ТЦ 3,5%
и соавт. [22]
М. Cederholm 1,7 6,8 5,4 5,7
и соавт. [42]
К. Nicolaides Общие потери при ТА
и соавт. [30] 4,7%, при РА 5,3%
A. Daniel 2,7 4,6 0 2,6 9,0 5,2 Общие потери при РА 2,6-4,7%
и соавт. [45]
Н. Nagel 3,8
и соавт. [43]
S. Tharmaratnam Общие потери при РА 5,1%
и соавт. [39]
В.А. Бахарев 6,5
и соавт. [44]
Данные РМЦИ, [24] 3,1 10,4 0 5,6 2,3 31,2 14,8 37,6
Собственные 0,4 6,5 Общие потери при ТЦ 13,8%,
данные [25] при ТА 1,0%, при ТА+ТЦ 6,1%
Средние значения 2,4 6,1 5,4 1,2 5,6 1,3 13,2 4,0 6,8 19,0 5,2 0,2
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
6
глава
Таблица 6.8. Структура потерь плодов после ТА и ТЦ АВХ в зависимости от времени, прошедшего после инвазивной процедуры [21]
Период после инвазивной диагностики ТА АВХ ТЦАВХ
1 -7 дней 6,9% 2,9%
8-14 дней 13,8% 0%
15-30 дней 27,6% 28,8%
более 30 дней 51,7% 68,6%
потерь после ТА АВХ 20,7% приходилось на первые две недели после инвазивной процедуры; после ТЦ АВХ этот показатель составлял только 2,9% (табл. 6.8).
Приведенные данные могут быть косвенным свидетельством активного воспалительного процесса, развивающегося в матке после трансцервикальной манипуляции. Исследования W. Holzgreve и Р. Miny доказали, что в каждом десятом случае (12%) после трансцервикальной аспирации с катетера высевается аэробная и анаэробная флора и еще в 6% регистрируется вторичное бактериальное загрязнение катетера [72]. В подавляющем большинстве случаев осложнения воспалительного характера протекают скрыто. По данным В. Brambati и соавт. [22], которые проанализировали 10 000 случаев ТЦ АВХ, острая восходящая инфекция была диагностирована только в 0,14% наблюдений. Отечественные исследования продемонстрировали значительно более высокий уровень воспалительных осложнений. По данным РМЦИ, клинически выраженный хориоамнионит после ТЦ АВХ был диагностирован в 4,5% случаев (8 из 176 процедур), а после ТА АВХ — в 1,3% наблюдений (4 из 302 процедур) [24].
Учитывая, что любая инвазивная манипуляция несет в себе риск обострения воспалительного процесса, наличие воспаления, независимо от его локализации, является противопоказанием к проведению инвазивной диагностики и требует переноса процедуры на более поздний срок. Особенно внимательно следует относиться к острым кольпитам, являющимся самым небла
гоприятным фоном для трансцервикальных вмешательств. Для трансабдоминальных процедур кольпиты имеют несравненно меньшее значение и практически не влияют на срок проведения манипуляции.
Многочисленные исследования доказали, что при отсутствии каких-либо осложнений после инвазивной диагностики дальнейшее течение беременности и родов особенностей не имеет. Частота преждевременных родов, задержки внутриутробного развития плода, перинатальных потерь в группе пациенток, обследованных с применением инвазивных методов, не увеличивается (табл. 6.9).
Обсуждая с пациенткой возможность проведения обследования с применением инвазивного метода в раннем сроке и вероятность осложнений, врач не должен забывать, что существует изначальный риск потерь плодов. По данным многих авторов [21, 22], частота прерываний беременностей до проведения инвазивных исследований колеблется от 3,0 до 3,5%. Риск прерывания связан не только с наличием отягощений в гинекологическом и соматическом анамнезе беременной, но и со сроком беременности. По данным популяционных исследований [22], частота самопроизвольных прерываний беременностей без инвазивного вмешательства в сроке до 8 нед достигает 9,2%, а в интервале от 9 до 12 нед уменьшается до 4,7%. Следует помнить, что инвазивные исследования — удел пациенток, относящихся к группе риска по многим факторам, поэтому у них вероятность прерывания может быть выше.
Несомненно, большое влияние на этот показатель оказывает возраст пациентки. По данным B.Brambati и соавт. [22], изолированный риск по возрасту в группе до 30 лет составляет 1,22%, в интервале 30— 34 года — 2,27%, после 35 лет — 2,7%. В исследованиях М. Ahoda и соавт. [23] частота прерывания беременности до 35 лет составила 3,1%, после 35 — 6,1%. В среднем «базовый» риск прерывания в старшей возрастной группе составляет 4,1—4,5%.
142 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
Таблица 6.9. Исходы беременностей после инвазивных вмешательств в ранние сроки
Авторы Прерыва- Прерыва- Поздний Мертво- Неона- Задерж- Прежде-
ние по ние по ВЫКИДЫШ, рождение, тапьная ка внут- временные
социапь- медицин- % % гибель, риутроб- роды, %
ным пока- ским пока- % ного раз-
заниям, % заниям, % вития,%
ТА ТЦ ТА ТЦ ТА ТЦ ТА ТЦ ТА ТЦ ТА ТЦ ТА ТЦ
B.Brambati 6,1 0,8 0,4 0,4 5,2 4,6
и соавт. [29] М. Ahoda и соавт. [23] B.Brambati 4,7 4,0 5,1 5,3 4.8 8,1 7,1
и соавт. [21] S.Smith-Jensen 0,8 0,5 1,9 1,6 0,6 0,4
и соавт. [70] В. Brambati 5,2 2,6 0,35 0,34
и соавт. [22] S. Tharmaratnam и соавт. [39] 0,8 (РА) 0,3 (РА) 0,3 (РА)
Рассказывая о критериях оценки успешности инвазивных вмешательств, мы упоминали общее количество полученных ворсин, подчеркивая, что масса менее 10 мг может быть недостаточной для проведения генетического анализа. Изучение факторов, влияющих на частоту прерывания беременностей после инвазивного вмешательства, показало, что прогрессивное увеличение количества аспирируемого материала ведет к увеличению частоты самопроизвольных выкидышей. Эта закономерность была открыта S. Smith-Jensen и соавт. [70] в 1991 г. (табл. 6.10).
Следует отметить, что при одинаковом весе полученного материала частота прерываний беременности при трансцервикальном доступе достоверно выше, чем при трансабдоминальных вмешательствах. Этот факт лишний раз доказывает, что ТА АВХ в опытных руках является более безопасным методом обследования в I триместре. Очень высокий показатель прерываний беременности (14%) при получении образцов массой до 10 мг при ТЦ АВХ можно объяснить тем, что малое количество материала, как правило, получаютпритехнически трудных и травматичных операциях.
Косвенным показателем травматичности инвазивных вмешательств может служить величина кровопотери. Этот показатель оценивается по уровню повышения АФП в материнской сыворотке сразу после процедуры. В том же исследовании [70] было показано, что частота прерываний прямо пропорциональна величине кровопотери (табл. 6.11).
Большое значение в успехе инвазивного исследования играет навык хирурга. Даже при ТЦ АВХ, которая, по нашему мнению, является наиболее опасной инвазивной методикой, с накоплением опыта врача частоту потерь плодов можно существенно уменьшить. По данным больших исследований, проведенных в разных
Таблица 6.10. Потери плодов в зависимости от количества взятых ворсин [70]
Масса, мг ТА АВХ ТЦАВХ
0-10 3,8% 14,0%
11-20 4,2% 6,3%
21-30 4,1% 6,6%
31-40 4,0% 7,4%
более 40 - 8,6%
НАЧАЛО ГЛАВЫ
-------------------143
ОГЛАВЛЕНИЕ
6
глава
Таблица 6.11. Потери плодов при инвазивных исследованиях в I триместре в зависимости от величины кровопотери [70]
Уровень АФП (kU/l) ТА АВХ ТЦАВХ
<20 2,6 7,2
21-40 2,2 5,5
41-60 3 20
более 60 16,1* 13,3*
Примечание. * - в связи с малым количеством наблюдений различия недостоверны.
странах, частота прерываний беременности в ранних сериях (обычно 100 первых процедур) составляла от 7,2 до 10,9%, но с течением времени сократилась вдвое (до 5,0%) [30,71,73-76].
Неблагоприятным фактором, влияющим на исход беременности после инвазивного вмешательства, является наличие клинических признаков угрозы прерывания до процедуры. Особое внимание следует обращать на симптом кровяных выделений до вмешательства. По данным М. Cederholm и соавт. [42], при наличии этого симптома до инвазивной диагностики частота прерываний составила 20,7%, тогда как при его отсутствии —3,4%. Необходимо подчеркнуть, что в группе с кровяными выделениями до процедуры все вы-кидыши произошли у пациенток, которым впоследствии был проведен РА. При ТА АВХ, даже при наличии кровяных выделений до вмешательства, самопроизвольных выкидышей зарегистрировано не было.
Обсуждая проблему эффективности и безопасности различных инвазивных процедур в I триместре беременности, следует подчеркнуть, что есть осложнения, специфичные только для определенного вида исследований. В середине 90-х годов было окончательно доказано, что РА приводит к достоверному повышению частоты эквиноварусной деформации стоп и к большему риску респираторных осложнений [76, 77]. Эти патологические состояния развиваются в связи с удалением слишком большого количества вод или подтекания вод. По данным разных исследователей, частота деформаций конечностей регистрируется в 0,5—3,2% случаев, составляя в среднем 1,1%. Осложнения со стороны дыхательной системы встречаются с такой же частотой (1 %), но варьируют в более широких пределах (0-6,1%) [19, 31-39, 78]. A. Daniel и соавт. [45] отметили, что частота подтекания вод при РАвозрастает с ростом срока беременности (10— 11 нед — 0,12— 1,4%, 12—13 нед — 1,3%, 14 нед — 2,1%), а частота прерываний беременности — уменьшается (10—11 нед — потери 1/33, 12 нед - 1/74, 13 нед - 1/78, 14 нед - 0).
В остальном РА не отличается от других методов исследований. Анализ приведенных данных показывает, что с точки зрения безопасности РА занимает промежуточное положение между ТА и ТЦ процедурами и активно применяется в практической медицине при обследовании пациенток в ранние сроки беременности.
ОСОБЕННОСТИ ЛАБОРАТОРНЫХ ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ
Цитогенетические исследования
Единая генетическая основа плода и плаценты позволяет с высокой степенью достоверности судить о кариотипе будущего ребенка по результату анализа хромосом хориальной ткани. В настоящее время в большинстве цитогенетических
лабораторий разных стран одновременно применяется прямой и непрямой анализ полученного материала, что существенно повышает точность анализа.
Прямой хромосомный анализ был описан в 1983 году G. Simoni и соавт. [11] Эта методика позволяет проводить прямое ка-
144 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
риотипирование на делящихся клетках цитотрофобласта, то есть не требует длительного культивирования ткани. В основе цитогенетического анализа хориальной ткани лежит высокая пролиферативная активность цитотрофобластического слоя и низкий митотический индекс децидуальной ткани. Если уровень спонтанных митозов в клетках хориона после 24-часо-вого инкубирования повышается до 40 %0, то в маточных клетках он составляет всего 0,05—0,08%о. Очевидно, что даже при попадании децидуальной ткани в аспират, при такой частоте спонтанных митозов на «прямых» хромосомных препаратах опасность диагностической ошибки невелика, однако для повышения точности цитогенетического исследования анализ следует проводить и на культуре клеток хориона.
Метод культивирования ворсин хориона был предложен в начале 80-х годов М. Niazi и соавт. [9]. В настоящее время этот метод претерпел значительные изменения и усовершенствования, что позволило существенно сократить время культивирования, ускорить получение окончательного цитогенетического ответа и сократить частоту неуспешного культивирования до 0,6—2,7% случаев [31,43].
Несмотря на высокую достоверность цитогенетических результатов, полученных на материале хориона, в литературе описаны случаи несовпадения кариотипа плаценты и плода в небольшом проценте наблюдений. В исследованиях A. Borrell и соавт. [79] этот показатель составил 0,3%, поданным D. Ledbetter исоавт. [80] —0,5%. Одним из объяснений этому явлению может служить ранний срок дифференциации клеток бластоцисты на эмбриобласт и трофобласт. Это разделение происходитуже на 4-й день после оплодотворения, и в дальнейшем структуры эмбриобласта и трофобласта развиваются практически независимо друг от друга.
Помимо ложноположительных и ложноотрицательных результатов при работе с хориальной тканью встречаются случаи мозаицизма, когда определенный
процент анализируемых клеток ворсин содержит аномальный клон. По данным многих исследователей, частота хромосомного мозаицизма является биологической константой и составляет 0,6— 1,7% [43, 70, 81—83]. В случае обнаружения мозаичного клона клеток в материале хориона требуется обязательная проверка полученного результата в более поздние сроки беременности на материале пуповинной крови или на культуре амниоцитов.
Немногочисленные наблюдения несовпадения кариотипов плаценты и плода не являются существенным препятствием к обследованию с применением инвазивных методоввранние сроки беременности. Тщательное соблюдение правил инвазивной диагностики и методик дальнейшей обработки материала позволяют сократить число случаев неполучения цитогенетического ответа. Тем не менее, отсутствие конечного цитогенетического заключения регистрируется, по данным разных авторов, в 0,5—5,2% наблюдений [30, 43, 70]. Опыт отечественных специалистов свидетельствует о том, что 4,6% пациенток, обследованных с применением инвазивных методов, не получают окончательного результата [24].
Во-первых, генетический ответ не удается получить при отсутствии ворсин хориона в аспирате. Основной причиной неудавшихся вмешательств является, как правило, недостаточный опыт хирурга. По данным РМЦИ, отсутствие ворсин в аспирате было зарегистрировано в 5,1% случаев при ТЦ АВХ и в 1% при ТА АВХ [24]; по данным нашего ЦПД — в 13,9% и 1,6% соответственно.
Во-вторых, цитогенетический ответ можно не получить при небольшой (менее 5 мг) массе аспирата или при недостаточной митотической активности клеток.
В-третьих, причиной отсутствия заключительного цитогенетического результата может быть неудача культивирования культуры клеток, связанная, в частности, с бактериальным загрязнением взятого образца.
В целом при анализе всех неудач при инвазивных вмешательствах, проведен
НАЧАЛО ГЛАВЫ
-------------------145
ОГЛАВЛЕНИЕ
6
глава
ных в рамках РМЦИ, выяснилось, что 33% при ТА АВХ были связаны с погрешностями лабораторного анализа, 25% — с неполучением материала, а в 42% требовалось уточнение диагноза, поставленного при первой инвазивной процедуре. В структуре неудач при ТЦ АВХ 60% приходилось на отсутствие ворсин хориона в аспирате и 40% — на погрешности лабораторного анализа [24].
В случае успешности обследования с применением инвазивных методов в ранние сроки беременности грубые хромосомные аномалии, требующие прерывания беременности, удается выявить в 1,2— 2,9% случаев, а общая частота патологии хромосом варьирует от 1,6 до 5,2%, составляя в среднем 3,4% [24, 26, 70].
ДНК-анализ
Ворсины хориона являются великолепным источником материала для ДНК-анализа. В случае подтверждения носительства патологического гена конкретного заболевания обоими супругами или матерью (при Х-сцепленном заболевании) и при наличии соответствующего лабораторного оборудования появляется возможность проведения ранней ДНК-диагностики конкретной моногенной патологии. В отличие от цитогенетического анализа исследование ДНК требует минимального количества ворсин. В настоящее время хорошо отработаны методы раннего выявления миопатии, аутосомно-доминантной формы поликистозной болезни почек, муковисцидоза, талассемии, гемофилии и ряда других заболеваний.
Биохимический анализ
Некоторые моногенные заболевания, сопровождающиеся нарушением обмена веществ, могут быть диагностированы на материале хориона в ранние сроки беременности на основании биохимического анализа. Этот анализ направлен на выявление патологического фермента в ткани хориона. В отличие от ДНК-диагностики и цитогенетического исследования, боль
шинство «биохимических» диагнозов требует подтверждения в более позднем сроке беременности на другом материале (воды, кровь). Ошибки диагностики заболеваний обмена в основном связаны с контаминацией материнскими клетками, поэтому следует тщательно отделять ворсины от децидуальных клеток.
Примерами заболеваний, подлежащих биохимической диагностике, являются нарушения сфинголипидного обмена (ганглиозидоз, болезни Фарбера, Гоше, Тея—Сакса, Краббе, Нимана—Пика, му-колипидоз, метахроматическая лейкодистрофия), нарушения липидного обмена (адренолейкодистрофия, маннозидоз, му-колипидоз, галактозиалидоз), а также нарушения мукополисахаридного обмена (мукополисахаридоз разных типов).
Заключение
Инвазивные методы исследования в ранние сроки беременности значительно расширяют возможностипренатальнойди-агностики врожденных и наследственных заболеваний плода. Подавляющее большинство беременных, которым показана инвазивная диагностика во II триместре, могут быть обследованы уже в I триместре, но каждый раз, обсуждая с пациенткой возможность инвазивного вмешательства, следует помнить о балансе между риском рождения больного ребенка в конкретной семье и риском потери беременности.
Законы естественного отбора, распространяющиеся и на природу человека, на самых ранних этапах развития существенно уменьшают частоту рождения больных детей. По данным R. Thompson и соавт. [84], половина зигот является неполноценными и погибает в течение 2—3 нед после оплодотворения, при этом 50% из них содержит аномальные хромосомы [85]. Естественная элиминация плодов с хромосомной патологией происходит и в более поздние сроки — в конце I триместра. Например, около 40% беременностей с синдромом Дауна, диагностированным до 12 нед, самопроизвольно прервутся до
146 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
родов, что существенно уменьшает эффективность скрининга [86]. Механизм естественных потерь позволяет регулировать рождение детей с врожденными аномалиями, поскольку благодаря ему частота врожденных пороков развития составляет среди новорожденных 2—3%, а не 12%, как этого следовало бы ожидать [85].
Инвазивная диагностика в ранние сроки позволяет углубить знания о врожденных и наследственных заболеваниях и предоставляет родителям возможность своевременно решить судьбу больного ребенка. К сожалению, пренатальная диагностика не может дать ответ на все вопросы, встающие перед семьей в ходе беременности, поэтому бесконечное расширение показаний к инвазивным вмешательствам в I триместре бессмысленно.
Для практического здравоохранения большое значение имеет проблема вынашивания беременности после инвазивной диагностики. Например, поданным Международного регистра, частота самопроизвольного прерывания беременностей до 28 нед после проведения ТЦ АВХ варьирует от 2,5 до 7,4% [87]. Беременные, относящиеся к группе невысокого риска по рождению детей с хромосомной или моноген-ной патологией, должны знать, что при расчетном риске 2% выявление 100 хромосомных аномалий приведет к потерям 66 нормальных плодов, при условии, что частота хромосомных аберраций в среднем составляет 1,5% [70]. Только семья должна решить, следует лив этихусловиях рисковать беременностью.
В большинстве стран мира формирование показаний к обследованию с применением инвазивных методов в ранние сроки является государственной задачей. Уменьшение срока проведения инвазивных процедур и расширение рамок обследования (например, уменьшение возраста обследуемых как показание к инвазивной диагностике) требует больших материальных затрат и должно соответствовать мощности лабораторной базы здравоохранения страны. Именно поэтому до сихпор возрастной
критерий отбора в группу риска в разных странах колеблется от 35 до 38 лет [18].
Без сомнения ранняя инвазивная диагностика является важной составной частью пренатального обследования в I триместре, но только умелое использование всех доступных методов лабораторного анализа и получения материала, правильное формирование показаний к инвазивным процедурам и всесторонние знания этого раздела дородовой диагностики позволяют реально уменьшить неблагоприятные последствия вмешательств и повлиять на частоту рождения детей с врожденной и наследственной патологией.
СПИСОК ЛИТЕРАТУРЫ
1. Steel М., Breg W. Chromosome analysis of human amniotic fluid cells //Lancet. 1966. V. 1. P. 383 385.
2. Mohr J. Foetal genetic diagnosis: development for techniques for early sampling of foetal cells // Acta Pathol. Microbiol. Scand. 1968. V. 73. P. 73.
3. Hahnemann N., Mohr J. Antenatal fetal diagnosis in the embryo by means of biopsy from extra embryonic membranes // Bull. Eur. Soc. Hum. Genet. 1968. V. 2. P. 23
4. Hahnemann N., Mohr J. Antenatal foetal diagnosis in genetic disease // Bull. Eur. Soc. Hum. Genet. 1969. V. 2. P. 23.
5. Kullander S., Sandahi B. Fetal chromosome analysis after transcervical placental biopsies during early pregnancy//Acta Obstet. Gynecol. Scand. 1973. V. 52. P. 355-359.
6. Hahnemann N. Early pregnancy diagnosis: a study of biopsy techniques and cell culturing from extraembryonic membranes// Clin. Genet. 1974. V. 6. P. 294-306.
7. Tietung Hospital of Anshan Iron and Steel Co: Fetal sex prediction by sex chromatin of chorionic villi cells during early pregnancy // Chin. Med. J. 1975. V. 1. P. 117.
8. Rhine S., Cain J., Cleary R., et al. Prenatal sex detection with endocervical smears: successful results using Y body fluorescence // Am. J. Obstet. Gynecol. 1975. V. 122. P. 155-160.
9. Niazi M., Coleman D., Loeffler F. Trophoblast sampling in early pregnancy. Culture of rapidly dividing cells from immature placental villi //
НАЧАЛО ГЛАВЫ
-------------------147
ОГЛАВЛЕНИЕ
6
глава
Br. J. Obstet. Gynaecol 1981. V. 88. P. 1081 1085.
10. Williamson R., Eskdale J., Coleman D. et al. Direct gene analysis of chorionic villi: a possible technique for first trimester antenatal diagnosis of haemoglobinopathies // Lancet. 1981. V. 2. P. 1125-1127.
11. Simoni G., Brambati B., Danesino C. et al. Efficient direct chromosome analyses and enzyme determinations from chorionic villi samples in the first trimester of pregnancy // Hum. Gen. 1983. V. 63. P. 349
12. Кази 3., Бахарев В.А., Стыгар AM. Ультразвуковые исследования при биопсии хориона, проводимой по генетическим показаниям //Акуш. Гинек. 1979. № 3. С. 51.
13. Kazy Z., Stygar AM., Bakharev V.A. Chorion biopsy under immediate realtime (ultrasonic) control // Orv. Hetil. 1980. V. 121. P. 2765.
14. KazyZ., Rozovskil.S., Bakharev V.A. Chorion biopsy in early pregnancy: a method of early prenatal diagnosis for inherited disorders // Prenat. Diagn. 1982. № 2. P. 39.
15. Wald R.H.T., Modell B.. PertrouM. A method of chorionic villus sampling in the first trimester of pregnancy under real-time ultrasonic guidance // Br. Med. J. 1983. V. 286. P. 1542
16. Brambati B., Simoni G. Fetal diagnosis of trisomy 21 in the first trimester of pregnancy // Lancet. 1983. V. 1. P. 586
17. Smith-JensenS., HahnemannN. Transabdominal fine needle biopsy from chorionic villi in the first trimester // Prenat. Diagn. 1984. V. 4. P. 163
18. Evans M., Johnson M., Holzgreve W. Chorionic Villus Sampling // J. Reprod. Med. 1992. V. 37. P. 389-394
19. Nevin J., Nevin N., Dornan J. et al. Early amniocentesis: experience of 222 consecutive patients(1987-1988)//Prenat. Diagn. 1990. V. 10. P. 79-83.
20. Hackett G.A., Smith J., Rebello M. Early amniocentesis at 11-14 week’s gestation for the diagnosis of fetal chromosomal abnormality. A clinical evaluation // Prenat. Diagn. 1991. V. 11. P. 311-315.
21. Brambati B., Terzian E., Tognoni G. Randomized clinical trial of transabdominal versus transcervical chorionicvillussamplingmethods//Prenat. Diagn. 1991. V. 11. P. 285-293.
22. Brambati B., Tului E., Cislaghi C. et al. First 10000 chorionic villus samplings performed on singleton pregnancies by a single operator // Prenat. Diagn. 1998. V. 18. P. 256-266.,
23. Ahoda M., Pijpers L., Reuss A. et al. Evaluation of transcervical chorionic villus sampling with a completed follow-up of 1550 consecutive pregnancies // Prenat. Diagn. 1989. V. 9. P. 621 628.
24. Юдина E.B., Сыпченко E.B., Варламова О.Л. и др. Инвазивные методы исследования в акушерской практике: итоги первого Российского мультицентрового исследования / /Пренат. Диагн. 2002. Т. 1. № 1. С. 11—16.
25. Rodeck С.Н., Morfman G., Nicolaides K.H., McKenzie C. A single operator technique for first-trimester chorion biopsy // Lancet. 1983. P. 1340-1341.
26. Borrell A, Fortuny A, Lazaro L. et al. First-trimester transcervical chorionic villus sampling by biopsyforceps versus mid-trimester amniocentesis: a randomized controlled trial project // Prenat. Diagn. 1999 V. 19. P. 1138-1142.
27. Smidt-Jensen S.. Hahnemann N. Transabdominal CVS for fetal genetic diagnosis: Technical and obstetrical evolution of 100 cases // Prenat. Diagn. 1988. V. 8. P. 123-129.
28. Bovicelli L., Rizzo N., Montacuti V. et al. Transabdominal chorionic villus sampling: analysis of 350 consecutive cases // Prenat. Diagn. 1988. V. 8. P. 495-500
29. Brambati B., Lanzani A. Oldrini A. Transabdominal chorionic villus sampling. Clinical experience of 1159 cases // Prenat. Diagn. 1988. V. 8. P. 609 617.
30. Nikolaides K., Brizot L., Patel F., Snijders R. Comparison of chorionic villus sampling and amniocentesis for Fetalkaryotypingat 10-13 weeks’ gestation // Lancet. 1994. V. 344. P. 435 439.
31. Hanson F., Zorn E.. Tennant F. et al. Amniocentesis before 15 weeks’ gestation: outcome, risks and technical problems // Am. J. Obstet. Gynecol. 1987. V. 156. P. 1524 1531.
32. Penso C., Sandstorm J., Benaceraff B. Early amniocentesis: report of407 cases with neonatal follow-up // Obstet. Gynecol. 1990. V. 76. № 6. P. 1032-1036.
33. Hackett G., Smith J.. Rebello M. et al. Early amniocentesis at 11-14 weeks’ gestation for the
148-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
diagnosis of fetal chromosomal abnormality -a clinical evaluation // Prenat. Diagn. 1991. V. 11. P. 311-315.
34. Assell B., Lewis S., Dickerman L. et al. Single operator comparison of early and mid-trimester amniocentesis //Am. J. Obstet. Gynecol. 1992. V. 167. P. 940-944.
35. Henry G.. Miller W. Early amniocentesis //J. Reprod. Med. 1992. V. 37. P. 395-402.
36. Hanson F., Tennant F., Hune S. et al. Early amniocentesis: outcome, risks and technical problemsat lessthanorequalto 12,8 weeks//Am. J. Obstet. Gynecol. 1992. V. 166. P. 1707-1711.
37. Johnson J., Wilson R., WinsorE. etal. The early amniocentesis study: a randomised clinical trial of early amniocentesis vs. mid-trimester amniocentesis//Fetal Diagn. Then 1996. V. 11. P. 85-93.
38. Brumfield C., Lin S., ConnerW. et al. Pregnancy outcome following genetic amniocentesis at 11-14 weeks vs. 16-19 weeks’ gestation // Obstet. Gynecol. 1996. V. 88. P. 114-118.
39. Tharmaratnam S., Sadek S., Steele E. et al. Early amniocentesis: effect of removing a reduced volume of amniotic fluid on pregnancy outcome //Prenat. Diagn. 1998. V. 18. P. 773-778.
40. Abramovich D. Fetal factors influencing the volume and composition of liquor amnii //J. Obstet. Gynecol. Brit. Comm. 1970. V. 77. P. 865-877.
41. Emery A. Change in the total number of cells and viable cells in amniotic fluid as gestation advances // Modern Trends in Human Genetics. London. 1970. V. 1. P. 267.
42. Cederholm M., Axelsson O. A prospective comparative study on transabdominal chorionic villus sampling and amniocentesis performed at 10-13 weeks’ gestation // Prenat. Diagn. 1997. V. 17. P. 311-317.
43. Nagel H.. Vandenbussche F.. Keirse M. et al. Amniocentesis before 14 completed weeks as an alternative to transabdominal chorionic villus sampling: a controlled trial with infant followup // Prenat. Diagn. 1998. V. 18. P. 465—475.
44. Бахарев B.A., Каретникова H.A, Полесте-ров Ю.А. и др. Значение раннего амниоцентеза для пренатальной диагностики в I триместре беременности // Акуш. Гинек. 1991. № 4. С. 9-10.
45. Daniel A, Kuah A, Reiha S., Malafiej Р. A study of early amniocentesis for prenatal cytogenetic diagnosis//Prenat. Diagn. 1998. V. 18. P. 21—28.
46. Jorgensen F., Bang J., Lind A. et al. Genetic amniocentesis at 7-14 weeks of gestation // Prenat. Diagn. 1992. V. 12. P. 277—283
47. Westin J. Hysteroscopy in early pregnancy // Lancet. 1954. V. 2. P. 872.
48. Dommergues M., Lemerrer M., Couly G. et al. Prenatal diagnosis of cleft lip at 11 menstrual weeks using embryoscopy in the Van Der Woude syndrome //Prenat. Diagn. 1995. V. 15. P. 378 381
49. Ville Y., Khalil A, Homphray T., Moscoso G. Diagnostic embryoscopy and fetoscopy in the first trimester of pregnancy // Prenat. Diagn. 1997. V. 17. P. 1237- 1246.
50. Subrek D., Tercanli S., Holzgreve W. Transabdominal first trimester embryofetoscopy as a potential approach to early in utero stem cell transplantation and gene therapy // Ultrasound Obstet. Gynecol. 2000. V. 15. P. 302-307
51. Dumez Y., MandeIbort L., Dommergues M. Embryoscopy in continuing pregnancies // Proceedings of the Annual Meeting of the International Fetal Medicine Society. Evian, France. May, 1992.
52. Deprest J., Lerut T., Vandenberghe K. Operative fetoscopy: new perspective in fetal therapy // Prenat. Diagn. 1997. V. 17. P. 1247—1260.
53. Ross J., Jurkovic D., Nicolaides K. Coelocentesis: astudyofshort-termsatety//Prenat. Diagn. 1997. V. 17. P. 913-917
54. Orlani F., Damiani G., Lauricella S. et al. The risks of early cordocentesis (12-21 weeks): analysis of 500 procedures // Prenat. Diagn. 1990. V. 10. P. 425-428.
55. Brambati B., Simoni G., Bonacchi 1., Piceni L. Fetal chromosomal aneuploidies and maternal serum alpha-phetoprotein levels in the first trimester // Lancet. 1986. V. 2. P. 165.
56. Cuckle H., Wald N., Barkai G. et al. First trimester biochemical screening for Down’s syndrome // Lancet. 1988. V. 2. P. 851.
57. Wheeler D., Sinosich M. Prenatal screening in the first trimester of pregnancy // Prenat. Diagn. 1998. V. 18. P. 537-543.
58. Wald N., Watt H.. Haddow J.. Knight G. Screening for Down syndrome at 14 weeks
НАЧАЛО ГЛАВЫ
-------------------149
ОГЛАВЛЕНИЕ
6
глава
of pregnancy // Prenat. Diagn. 1998. V. 18. P. 291-293.
59. Macintosh M., Brambati B., Chard T., Grudzinskas J. Predicting fetal chromosome anomalies in the first trimester using pregnancy associated plasma protein A: a comparison of statistical methods // Meth. Inform. Med. 1993. V. 32. P. 175-179.
60. Spencer K., Souter V., Tul N. et al. A screening program for trisomy 21 at 10-14 weeks using fetal nuchal translucency, maternal serum free b-human chorionic gonadotropin and pregnancy-associated plasma protein-A // Ultrasound Obstet. Gynecol. 1999. V. 13. P. 231-237.
61. Cuckle H., Lith J. Appropriate biochemical parameters in first-trimester screening for Downsyndrome//Prenat. Diagn. 1999. V. 19. P. 505 512.
62. Sandler T. Langman’s Medical Embryology. Sixth edition. Baltimore: Williams & Wilkins, 1990.
63. Lilford R. Chorion Villus Sampling // Clin. Obstet. Gynaecol. 1986. V. 13. P. 611-631.
64. Goldberg J.. Golbus M. Chorionic Villus Sampling//Hum. Genet. 1988. V. 17. P. 1-25.
65. Firth H.V., Boyd P.A, Chamberlain P.F. et al. Severe limb reduction abnormalities after chorion villus sampling at 56-66 days’ gestation // Lancet. 1991. V. 337. P. 762-763
66. Froster-Iskenius U.G., Baird P.A. Limb reduction defects in over one million consecutive livebirths//Teratology. 1989. V. 39. P. 127 135.
67. Mahoney M., Collaborative study Group: Limb abnormalities and CVS //Lancet. 1991. V. 337. P. 1422.
68. Rodeck C.H. Fetal development after chorionic villussampling//Lancet. 1993. V. 341. P. 468 469.
69. WHO/PAHO Consultation on CVS. Evaluation of Chorionic Villus Sampling Safety // Prenat. Diagn. 1999. V. 19. P. 97—99.
70. Smith-Jensen S., Permin M., Philip J. Sampling success and risk by transabdominal chorionic villus sampling, transcervical chorionic villus sampling and amniocentesis: a randomized study // Ultrasound Obstet. Gynecol. 1991. V. 1. P. 86-90.
71. Canadian Collaborative CVS - Amniocentesis Trial Group. Multicentre randomised clinical
trial of chorion villus sampling and amniocentesis // Lancet. 1989. P. 1 6.
72. Holzgreve W., Miny P. CVS with ecogenic catheter: experiences of the first 500 cases //J. Perinat. Med. 1987. V. 15. P. 235-240.
73. Rhoads G., Jackson L., Schlesslman S. et al. The safety and efficacy of chorionic villus sampling for early prenatal diagnosis of cytogenetic abnormalities // N. Engl. J. Med. 1989. V. 320. P. 609 617.
74. MRC Working Party on the evaluation of chorion villus sampling. Medical Research Council European Trial of chorion villus sampling // Lancet. 1991. V. 337. P. 1491-1499.
75. Smidt-Jensenn S.. Permin M.. Philip J. et al. Randomised comparison of amniocentesis and transabdominal and transcervical chorionic villus sampling // Lancet. 1992. V. 340. P. 1237- 1244.
76. Sundberg K., Bang J., Smidt-Jensen S. et al. Randomised study of risk of fetal loss related to early amniocentesis versus chorionic villus sampling//Lancet. 1997. V. 350. P. 697—703.
77. Nicolaides K., Brizot M., Patel F., Snijders R. Comparison of chorion villus sampling and early amniocentesis for karyotyping in 1492 singleton pregnancies // Fetal Diagn. Ther. 1996. V. 11. P. 9 15.
78. Wilson R., Johnson J., Windrim R. et al. The early amniocentesis study: a randomised clinical trial of early amniocentesis and midtrimester amniocentesis. H. Evaluation of procedure details and neonate congenital anomalies // Fetal Diagn. Ther. 1997. V. 12. P. 97-101.
79. Borrell A., Costa R., Delgado R. et al. Transcervical chorionic villus sampling beyond 12 weeks of gestation // Ultrasound Obstet. Gynecol. 1996. V. 7. P. 416-420.
80. Ledbetter D., Martin A., Verlinsky Y. et al. Cytogenetic results of chorionic villus sampling: high success rate and diagnostic accuracy in the United States collaborative study // Am. J. Obstet. Gynecol. 1990. V. 162. P. 495-501.
81. Барцева О., Кулешов H. Дородовая цитогенетическая диагностка с использованием хромосомных препаратов из нативного биоптата ворсинчатого хориона, куль
150 —
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
ИНВАЗИВНЫЕ МЕТОДЫ ПРЕНАТАЛВНОИ ДИАГНОСТИКИ В РАННИЕ СРОКИ
тивируемых клеток хориона и амниоцитов //Акуш. Гинек. 1991. № 8. С. 68—70.
82. Kennerknecht I., Barbi G., Djalali M. et al Falsenegative findings in chorionic villus sampling. An experimental approach and review of the literature //Prenat. Diagn. 1998. V. 18. P. 1276-1282.
83. Nicolini U. Invasive techniques of prenatal diagnosis // Obstet. Gynecol. 1992. V. 2. P. 77—75.
84. Thompson R., Moore-Smith D., Zamboni L. Fertilization of mouse ova in vitro: an
electron microscopic study // Fertil. Steril. 1974. V. 25. P. 222.
85. Warkany J. Prevention of congenital malformations//Teratology. 1981. V. 23. P. 175.
86. Snijders R., Sebire N., Nicolaides K. Maternal age and gestational age specific risk for chromosomal defects // Fetal Diagn. Ther. 1995. V. 10. P. 356-367.
87. MRC UK: MRC European! trial of chorion villus sampling//Eancet. 1991. V. 337. P. 1491.
НАЧАЛО ГЛАВЫ
-------------------151
ОГЛАВЛЕНИЕ
|Г
7
СОВРЕМЕННАЯ СТРАТЕГИЯ
ПРЕНАТАЛЬНОЙ
ДИАГНОСТИКИ В РАННИЕ
СРОКИ БЕРЕМЕННОСТИ
Е.В. Юдина, М.В. Медведев
Пренатальное выявление врожденной и наследственной патологии продолжает оставаться одним из самых актуальных вопросов медицины. В настоящее время специалисты в области дородовой диагностики все чаще предпринимают попытки перенести обследование на более ранние сроки беременности. Эта тенденция, в первую очередь, объясняется желанием врачей избавить пациенток хотя бы от части психологических проблем, неизбежно возникающих при выявлении грубой патологии во II триместре, не совместимой с жизнью и требующей прерывания беременности по медицинским показаниям. Разработка новых ультразвуковых маркеров, внедрение современных технологий, развитие диагностической аппаратуры позволяют многим клиникам добиться значительных успехов в раннем выявлении заболеваний плода.
В этой книге мы постарались рассказать о разных аспектах пренатальной диагностики врожденной и наследственной патологии в I триместре беременности. Читатели смогли убедиться в том, что к сегодняшнему дню в мире накоплено колос
сальное количество самых разных сведений о первых этапах внутриутробного развития человека. Многообразие научных фактов, пестрота теорий, полярность точек зрения исследователей затрудняют восприятие этой информации и не позволяют практическому врачу быстро ответить на простой, на первый взгляд, вопрос: «Какая схема обследования в I триместре является наиболее эффективной?» Другими словами, в настоящее время ни в одной акушерской клинике мира стратегия обследования пациенток в ранние сроки беременности в полном объеме не определена, поскольку до сих пор количество «белых пятен» в знаниях медиков о ранних этапах развития плода велико.
Первый вопрос, ответ на который врач должен получить, начиная обследование пациентки в I триместре беременности, удивительно банален: «Какой срок для ранней эхографии является оптимальным?» Здравый смысл подсказывает, что оптимальным в данном случае можно считать срок, в котором информация о развитии эмбриона будет максимально полной и точной.
152------------------------------------------------------
ОГЛАВЛЕНИЕ
СТРАТЕГИЯ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
Хорошо известно, что в условиях практического здравоохранения визуализация плодного яйца возможна уже с начала пятой недели от первого дня последней менструации или с начала третьей недели от момента оплодотворения, то есть практически на стадии имплантации плодного яйца в эндометрий. Эхографическое исследование, проведенное на этом этапе, лишь констатирует наличия беременности и практически не дает информации об эмбрионе. С началом регистрации сердечной деятельности эмбриона (шестая неделя от первого дня последней менструации) при ультразвуковом исследовании можно достоверно судить о характере беременности (развивающаяся или не-развивающаяся), но анатомия эмбриона в эти сроки продолжает оставаться тайной за семью печатями.
Мы хорошо знаем, что основной задачей пренатальной диагностики является своевременное выявление патологии, не совместимой с жизнью или приводящей к тяжелой инвалидности ребенка. Именно поэтому усилия эхографии в первую очередь направлены на диагностику грубых аномалий развития. Многочисленные данные отечественной и мировой литературы, а также собственный опыт работы в области пренатальной диагностики свидетельствуют о том, что во II триместре беременности для эффективной борьбы с тяжелыми формами врожденной и наследственной патологии плода ультразвуковое исследование следует проводить в интервале 20—24 нед. Несмотря на то, что формирование всех структур плода заканчивается значительно раньше, в это время достигается их оптимальная визуализация и диагностика аномалий развития существенно улучшается.
В I триместре не существует магического срока наилучшей оценки структур плода. Период эмбриогенеза (начало 5-й — конец 10-й нед от первого дня последней менструации) характеризуется исключи-тельной динамичностью. Ежедневно, если не ежечасно, возникают новые анатоми
ческие образования, идет активный рост эмбриона, его облик постоянно меняется. Очевидно, что в этих условиях невозможно проводить эффективную диагностику пороков развития.
На рубеже 10—11 нед от первого дня последней менструации заканчивается формирование внутренних органов и период эмбриогенеза сменяется плодовым периодом развития. Ультразвуковым маркером нового этапа является окончательное погружение кишечника в брюшную полость и исчезновение физиологической грыжи. Плодовый период характеризуется «созреванием» внутренних органов и увеличением их размеров. Несмотря на то, что после 10 нед новые анатомические структуры уже не возникают, при проведении ультразвукового исследования в ранние сроки (до 14 нед) можно в лучшем случае лишь констатировать наличие того или иного органа, но не оценивать его строение в связи с его небольшими размерами.
Приведенные выше данные свидетельствуют о том, что большинство органов и систем плода становятся доступными для визуализации лишь после 12 нед. Например, классическое изображение «бабочки» при оценке структур головного мозга можно получить не ранее 12—13 нед, изображение лица плода — после 14 нед, стабильно визуализировать четырехкамерный срез сердца, почки и мочевой пузырь — с 12—13 нед, желудок — не ранее 10—11 нед и т.д. Следует подчеркнуть, что речь идет не об эксклюзивных исследованиях соноэмбриологов, то есть специалистов по ультразвуковой эмбриологии (термин предложен I. Timor-Tritsch и соавт. в 1990 г.), а о традиционной эхографии, проводимой в практическом здравоохранении на ультразвуковых аппаратах среднего класса. Использование экспертных приборов в клиниках II и III уровня, безусловно, существенно повышает качество диагностики, но, к сожалению, такие исследования в настоящее время не доступны большинству пациенток.
153
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
7
глава
Таким образом, говорить о достоверной оценке анатомии плода в ранние сроки беременности (до 14 нед) на I этапе скрининга, по нашему мнению, бессмысленно. Речь может идти лишь о единичных удачных случаях выявления наиболее грубых пороков, а не о реальном скрининге на врожденные аномалии развития. Большинство пороков на этом этапе либо вовсе недоступны диагностике, либо нуждаются в тщательном подтверждении в более поздние сроки беременности, что сводит на нет все усилия первого скринингового обследования. Нельзя забывать, что, в отличие от ультразвукового исследования в 20—24 нед, диагноз, поставленный в ранние сроки, невозможно верифицировать. Желание не выйти за рамки срока, позволяющего прервать беременность путем медицинского аборта, в сочетании с отсутствием патологоанатомического подтверждения диагноза может привести к гипердиагностике аномалий развития и слишком активной тактике. Другими словами, во избежание неоправданных прерываний беременностей, выявление врожденного порока развития в ранние сроки требует обязательного консультативного подтверждения с оформлением соответствующихюридическихдоку-ментов.
Невозможность адекватной и надежной оценки анатомии плода до 12 нед (официального срока проведения медицинских абортов) и осуществления верификации диагноза позволяет сделать вывод о том, что диагностика пороков развития не является основной целью первого скринингового обследования. По нашему мнению, выявление аномалий развития может быть лишь удачным дополнением к главной задаче I этапа скрининга — формированию среди беременных группы риска по врожденной и наследственной патологии плода.
В настоящее время наиболее популярным ранним ультразвуковым маркером врожденной и наследственной патологии являетсятолщинаворотникового пространства (ТВП). Четкая связь между увеличени
ем этого параметра и хромосомными аберрациями, а также некоторыми формами пороков развития позволяет уже в ранние сроки легко выделять из общего потока беременных тех пациенток, которые нуждаются в пренатальном кариотипировании и тщательном динамическом контроле. Объективность этого критерия, то есть возможность точного измерения ТВП, высокая воспроизводимость результатов, наличие нормативных для срока беременности значений и процентильных кривых, делает его незаменимым компонентом I этапа скринингового ультразвукового исследования.
Особенность визуализации ТВП (появление не ранее 10 нед и исчезновение после 14 нед от первого дня последней менструации) является главным фактором, определяющим срок проведения I этапа скрининга — 10—14 нед. Очевидно, что в этом интервале с ростом срока качество оценки структур плода будет улучшаться, но время, отпущенное на обследование и принятие решения о тактике ведения беременности, катастрофически уменьшаться. По нашему мнению, каждая клиника должна самостоятельно определить оптимальный срок проведения I этапа скрининга, исходя из конкретных условий и особенностей региона, но не выходить за рамки интервала 10—14 нед.
В пользу организации I этапа скрининга в 10—14 нед говорит и возможность использования других методов исследования. Например, существенному повышению специфичности теста на ТВП может способствовать допплерографическая оценка кровотока в артериях пуповины и венозном протоке плода, корректное проведение которой в более ранние сроки практически невозможно из-за малого диаметра исследуемых сосудов.
Чувствительность скрининга по ТВП значительно возрастает при одновременном определении сывороточных маркеров крови. Доказано, что оптимальным сроком проведения биохимического скрининга в I триместре также является интервал 10—14 нед.
154 ----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
СТРАТЕГИЯ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
Во II триместре беременности биохимический скрининг в основном направлен на выделение группы риска по рождению детей с синдромом Дауна. В отличие от трисомии 21 в поздние сроки беременности другие патологические изменения кариотипа, как правило, имеют яркие фенотипические проявления, что позволяет диагностировать их с помощью эхографии и делает бессмысленным проведение биохимического скрининга. ВI триместре беременности ультразвуковые находки при всех хромосомных аномалиях немногочисленны, поэтому определение сывороточных маркеров крови теоретически может улучшить раннюю диагностику не только синдрома Дауна, но и других хромосомных аномалий.
К сожалению, в настоящее время в России нет ни одного диагностического центра, который бы использовал биохимические тесты в повседневной практике обследования беременных в ранние сроки. Данные зарубежныхисследователейпозволяют строить весьма оптимистичные прогнозы: измерение ТВП в сочетании с расчетом риска по возрасту и определением уровня нескольких биохимических маркеров позволяет достичь очень высокой (90%!) выявляемое™ синдрома Дауна.
Однако хорошие результаты, полученные отдельными группами исследователей, не должны являться поводом к мгновенному повсеместному внедрению раннего биохимического скрининга. Следует учитывать, что опубликованные данные, как правило, являются результатами ретроспективных исследований, а не итогами истинного биохимического скрининга в условиях практического здравоохранения. До сих пор ни в одной стране мира ранний биохимический скрининг не вошел в национальную скрининговую программу. Это объясняется не только отсутствием на сегодняшний день хорошо отработанных методик и популяционных нормативных значений биохимических маркеров, но и высокой стоимостью этих исследований. Без учета накладных расхо
дов и заработной платы цена реактивов для определения уровня одного маркера составляет в среднем около 5 долларов.
Помимо ультразвуковых, допплерографических и биохимических исследований, I триместр беременности является хорошим сроком для проведения инвазивных исследований. Ворсины хориона и амни-отическия жидкость — прекрасные источники материала для цитогенетических и биохимических анализов и для анализа ДНК плода. Показания к обследованию с применением инвазивных вмешательств в ранние сроки несколько шире, чем во II триместре. Помимо классических причин определения кариотипа плода (возраст, рождение детей с хромосомной патологией, семейная хромосомная транслокация) и результатов раннего биохимического скрининга, поводом к кариотипированию в I триместре в настоящее время все чаще и чаще становится расширенное воротниковое пространство. Кроме того, именно в ранние сроки беременности проводятся исследования ДНК для исключения моно-генной патологии у плода.
Подавляющее большинство моноген-ныхзаболеванийне имеет фенотипических проявлений как в ранние, так и в более поздние сроки беременности. Первые клинические симптомы развиваются в течение несколько месяцев, а то и лет после рождения ребенка, поскольку в основе этой патологии лежат не аномалии развития, а нарушения в разных звеньях обмена веществ.
В отличие от хромосомных аномалий стойкая связь между моногенными заболеваниями и ТВП не отмечена, что не позволяет использовать этот эхографический маркер для раннего формирования группы риска. Уровень известных сывороточных маркеров крови при наличии мо-ногенной патологии у плода не меняется, поэтому в настоящее время проведение пренатального биохимического скрининга на эти заболевания невозможно. Таким образом, единственным методом профилактики рождения детей с моногенной патологией становятся инвазивные исследо
155
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
7 глава____________________________
вания в ранние сроки беременности в тех семьях, где родители являются носителями известных генных мутаций.
Серьезным преимуществом ранних инвазивных исследований перед вмешательствами, проводимыми во II триместре беременности, является быстрое получение ответа. В течение 2—3 дней семье предоставляется достоверная информация о нали-чиинеизлечимогозаболеванияуплода, что позволяетпрерватьнеперспективную беременность наиболее щадящим методом.
Время проведения инвазивных исследований в I триместре совпадает с ультразвуковым скринингом — 10—14 нед, при этом оптимальным сроком для вмешательства является интервал 10—12 нед. В главе, посвященной инвазивным исследо-ваниям, мы постарались подробно рассмотреть вопросы безопасности инвазивных процедур в ранние сроки беременности. Позволим напомнить, что 9 нед — эта планка, ниже которой проводить вмешательства нецелесообразно и опасно.
Подводя итог сказанному, можно сделать однозначный вывод о том, что при правильной организации скринингового обследования и использовании всех доступных методов диагностики уже в I триместре можно получить неоценимую информацию о характере развития беременности, выделить группу риска для дальнейшего наблюдения и существенно улучшить выявляемость врожденной и наследственной патологии в регионе.
Тем не менее, время от времени на страницах специализированных изданий высказываются мнения о том, что повышенный интерес исследователей к ранним срокам беременности не совсем оправдан, а попытки смещения обследования на I триместр экономически не выгодны. Основным аргументом в пользу отказа от обследования в ранние сроки, как правило, является утверждение, что природа умнее человека и законы эволюционного отбора, действующие на первых этапах развития эмбриона, избавляют общество от неперспективных беременностей естествен
ным путем. В подтверждение этого утверждения далее обычно следуют экономические расчеты затрат на ранний ультразвуковой и биохимический скрининг в совокупности со стоимостью медико-генетического консультирования, инвазивных процедур и генетических исследований, а также показатели «базового» риска прерывания беременности в зависимости от состава обследуемого потока беременных.
Возьмем на себя смелость утверждать, что такая точка зрения вполне имеет право на жизнь. Действительно, пренатальная диагностика вообще и исследования в ранние сроки беременности в частности — очень дорогостоящая часть медицины. Правда, существуют и другие факты. По данным американских экономистов, каждый доллар, вложенный в пренатальную диагностику, приносит почти 10-кратную прибыль через 5 лет. В конечном итоге стратегию обследования в ранние сроки беременности, как впрочем, и скрининговую политику, должно определять государство в рамках национальных программ по здравоохранению, поскольку средства, потраченные на антенатальную охрану плода, оборачиваются здоровьем нации.
В реальных условиях практического здравоохранения при отсутствии правильно организованного обязательного скринингового обследования основной задачей врачей является предоставление пациенткам подробной информации о возможностях пренатальной диагностики, существующих методах исследования и их осложнениях, а также об общем риске потерь беременностей в ранние сроки. Мы глубоко убеждены в том, что нельзя жалеть времени на беседу с супругами об ограничениях диагностических возможностей дородового обследования и особенно эхографии в выявлении патологии плода в ранние сроки беременности. Превратные представления пациентов (а, впрочем, и некоторых врачей!) о волшебных свойствах ультразвукового исследования решать все проблемы беременностина самых ранних этапах должны быть изменены.
156-----------------
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
СТРАТЕГИЯ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
Несмотря на широкое повсеместное использование эхографии в ранние сроки беременности, в настоящее время в России отсутствует единый протокол ультразвукового исследования в I триместре. Эго не только затрудняет взаимопонимание врачей разных клиник, но и вносит диссонанс во взаимоотношения доктора и пациентки. Ниже мы приводим вариант протокола скринингового ультразвукового исследованияв 10—14 нед,
который явился итогом тщательного анализа данных мировой литературы и собственного опыта работы в области пренатальной диагностики в ранние сроки беременности. Этот протокол был единогласно принят участниками специализированного семинара «Ультразвуковая диагностика врожденной и наследственной патологии плода в ранние сроки беременности», который состоялся 20—27 января 2001 г.
Название лечебного учреждения, телефон
ПРОТОКОЛ СКРИНИНГОВОГО УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ В 10-14 НЕД БЕРЕМЕННОСТИ
”200______________г. № исследования
Ф.И.О. пациентки возраст лет
Первый день последней менструации срок беременности нед дн
Предполагаемая дата родов “”200_____________г.
Вид исследования: трансабдоминальный, трансвагинальный
В полости матки визуализируется, не визуализируется плод(а)
Копчико-теменной размер плода мм, соответствует, не соответствует менстру-
альному сроку беременности
Частота сердечных сокращений плода ударов в 1 мин
Толщина воротникового пространства мм
Желточный мешок: визуализируется, не визуализируется
Средний внутренний диаметр желточного мешка мм
Преимущественная локализация хориона: передняя, задняя, правая, левая боковая стенки, дно матки, область внутреннего зева
Структура хориона: не изменена, изменена
Особенности придатков матки______________________________________________
Особенности строения стенок матки________________________________________
Визуализация: удовлетворительная, затруднена
Особенности:_____________________________________________________________
Заключение:______________________________________________________________
Рекомендации:____________________________________________________________
Ультразвуковой контроль в нед
ФИО врача, подпись__________________________________
---------------------------------------------------------------------157
НАЧАЛО ГЛАВЫ ОГЛАВЛЕНИЕ
7
глава
Этот протокол, безусловно, не является универсальным. Разрабатывая его, мы пытались учесть реальные условия работы практических врачей и возможности ультразвукового оборудования, используемого на I уровне обследования. Протокол предназначен для использования на I этапе ультразвукового скрининга, который в настоящее время в большинстве случаев проводится врачами женских консультаций. Не вызывает сомнений тот факт, что передача всех трех этапов скрининговых исследований в центры пренатальной диагностики существенно улучшит и ускорит дородовое выявление врожденной и наследственной патологии и сократит расходы на эту область медицины, однако реальные условия практической медицины не позволяют рекомендовать эту схему организации скрининга для широкого применения.
Предлагаемый протокол включает описание эхографических параметров, доступных для изучения в сроки скринингового обследования (10—14 нед), которые имеют значение для прогностических оценок развития плода и формирования показаний к другим видам пренатального обследования.
Фетометрические параметры протокола включают только копчико-теменной размер и его соответствие менструальному сроку беременности, выраженному в полных неделях и днях. Несмотря на то, что к концу I триместра при эхографическом исследовании во всех случаях появляется возможность измерения бипариетального размера, диаметра живота, длины трубчатых костей и некоторых других параметров, эти показатели не были включены в протокол в связи с отсутствием на сегодняшний день отечественных процентильных нормативов развития плода до 14 нед.
Измерение толщины воротниковой зоны имеет принципиальное значение и должно проводиться во всех случаях согласно правилам, описанным в соответствующей главе этой книги. Протокол ог
раничивает оценку ТВП абсолютными значениями этого параметра, выраженными в мм. До сих пор среди исследователей нет единого мнения о том, какой критерий оценки ТВП является оптимальным. В широкой практике чаще других используются два метода: оценка ТВП с помощью процентильных кривых, когда за отклонение от нормы принимается значение, превышающее 95-й процентиль, и оценка по абсолютному значению, когда верхней границей нормы является 3 мм. Отсутствие данных отечественных популяционных исследований, посвященных изучению феномена ТВП, пока не позволяет однозначно рекомендовать один из этих методов, поэтому сегодня целесообразно внедрить в практику только обязательное измерение ТВП.
Оценка сердечной деятельности плода введена в протокол в качестве косвенного критерия отбора в группу риска по хромосомной патологии плода, поэтому при каждом ультразвуковом исследовании следует отмечать реальную частоту сердечных сокращений. Следует помнить, что во II триместре беременности этот показатель отличается высокой вариабельностью и нормативные значения находятся в пределах 120—160 уд/мин. Особенности сердечной деятельности в ранние сроки беременности также требуют дальнейших исследований и разработки отечественных нормативов этого параметра.
Измерение среднего внутреннего диаметра желточного мешка имеет принципиальное значение для составления прогностической оценки. Следует помнить, что в норме эта структура визуализируется до 12 нед, а затем исчезает. Известно, что при аномальных размерах желточного мешка вероятность неразвивающейся беременности возрастает, следовательно отклонения от нормативных значений требуют динамического ультразвукового и клинического контроля за пациенткой.
Необходимо подчеркнуть, что такие параметры, как абсолютные размеры матки, а также диаметр плодного яйца, не имеют
158
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ
СТРАТЕГИЯ ПРЕНАТАЛЬНОЙ ДИАГНОСТИКИ В РАННИЕ СРОКИ БЕРЕМЕННОСТИ
большого клинического значения, поэтому они были исключены из протокола.
Сложность оценки структур плода в ранние сроки, постоянно меняющаяся эхографическая картина, небольшие размеры внутренних органов не позволяют в подавляющем большинстве случаев в I триместре беременности точно диагностировать пороки развития. Объективные трудности визуализации в ранние сроки беременности составляют юридическую основу решения не включать в протокол скринингового обследования в I триместре обязательную анатомическую оценку органов и систем плода. Привыявлениитойилиинойаномалии развития подробное описание диагностированных изменений может быть представлено в разделе «Особенности».
В отличие от протокола скринингового обследования во II триместре, протокол ранних сроков содержит обязательную ре
комендацию о проведении следующего ультразвукового исследования с указанием конкретной даты или срока беременности. Эта графа является лишним напоминанием пациентке и лечащему врачу о том, что эхография в I триместре не заменяет комплексное пренатальное обследование в более поздние сроки. Как уже указывалось выше, пациентки должны быть подробно информированы о том, что I этап скринингового обследования направлен не столько на выявление пороков развития плода, сколько на формирование группы риска по врожденной и наследственной патологии.
С накоплением знаний о законах развития плода на ранних этапах жизни количество эхографических параметров, включенных в протокол I триместра для обязательной оценки, несомненно, будетрасши-ряться. Предлагаемый вариант не ограничивает исследовательскую работу
Алгоритм обследования в ранние сроки беременности
НАЧАЛО ГЛАВЫ
-------------------159
ОГЛАВЛЕНИЕ
7
глава
центров пренатальной диагностики. Следует подчеркнуть еще раз, что этот протокол рекомендуется к применению на I уровне обследования. Каждый пренатальный центр имеет возможность разработать собственный протокол обследования в ранние срокииизучать не только анатомию плода и провизорных органов, но и проводить функциональную оценку с использованием современных технологий.
Материал, который постепенно будет накапливаться в ходе ежедневной работы, в будущем должен послужить основой для разработки отечественных нормативов различных фетометрических параметров и лечь в основу фундаментальных исследований развития плода в I триместре. В настоящее время, к сожалению, приходится констатировать, что наука располагает слишком скудными знаниями и ограниченными возможностями в области изучения ранних сроков беременности. Именно поэтому для практической медицины особое значение приобретает алгоритм
работы в I триместре, который, не ограничивая творческий подход к исследованию в ранние сроки, позволяет в случае необходимости провести наиболее полное обследование плода для исключения врожденной и наследственной патологии.
В заключение хотелось бы еще раз подчеркнуть, что диагностика в I триместре беременности является одной из наиболее сложных задач пренатального обследования. Отсутствие в большинстве случаев четких эхографических критериев патологии и невозможность точной верификации диагноза переводит проблему патологии ранних сроков из медицинской в организационную и правовую. Диагноз, основанный на данных ультразвукового исследования, возлагает на врача большую ответственность, несмотря на то, что в конечном итоге только семья определяет судьбу будущего ребенка. Именно поэтому хорошо известная истина «семь раз отмерь...» должна быть основой пренатального обследования в I триместре беременности.
Подготовлено к печати в издательстве «Реальное Время».
113545Москва, Варшавское шоссе, 125, тел./факс: 381-94-83 Лицензия ЛР №065207 от 05.06.1997
Директор издательства Логвиненко Т.В. Оформление обложки Касьяненко О.П. Верстка Касьяненко О.П., Трушина К.В. Технический редактор Харланова О.А.
Энциклопедию распространяет
Российская ассоциация врачей ультразвуковой диагностики в перинатологии и гинекологии 125008Москва, Коптевский б-р, 5, тел./ факс: (095) 450-50-20
Подписано в печать 28.12.2000. Формат 60x90/8. Бумага мелованная.
«Можайский полиграфический комбинат», 143200, г. Можайск, ул. Мира 93. Заказ
160
НАЧАЛО ГЛАВЫ
ОГЛАВЛЕНИЕ