Author: Костюк П.Г.
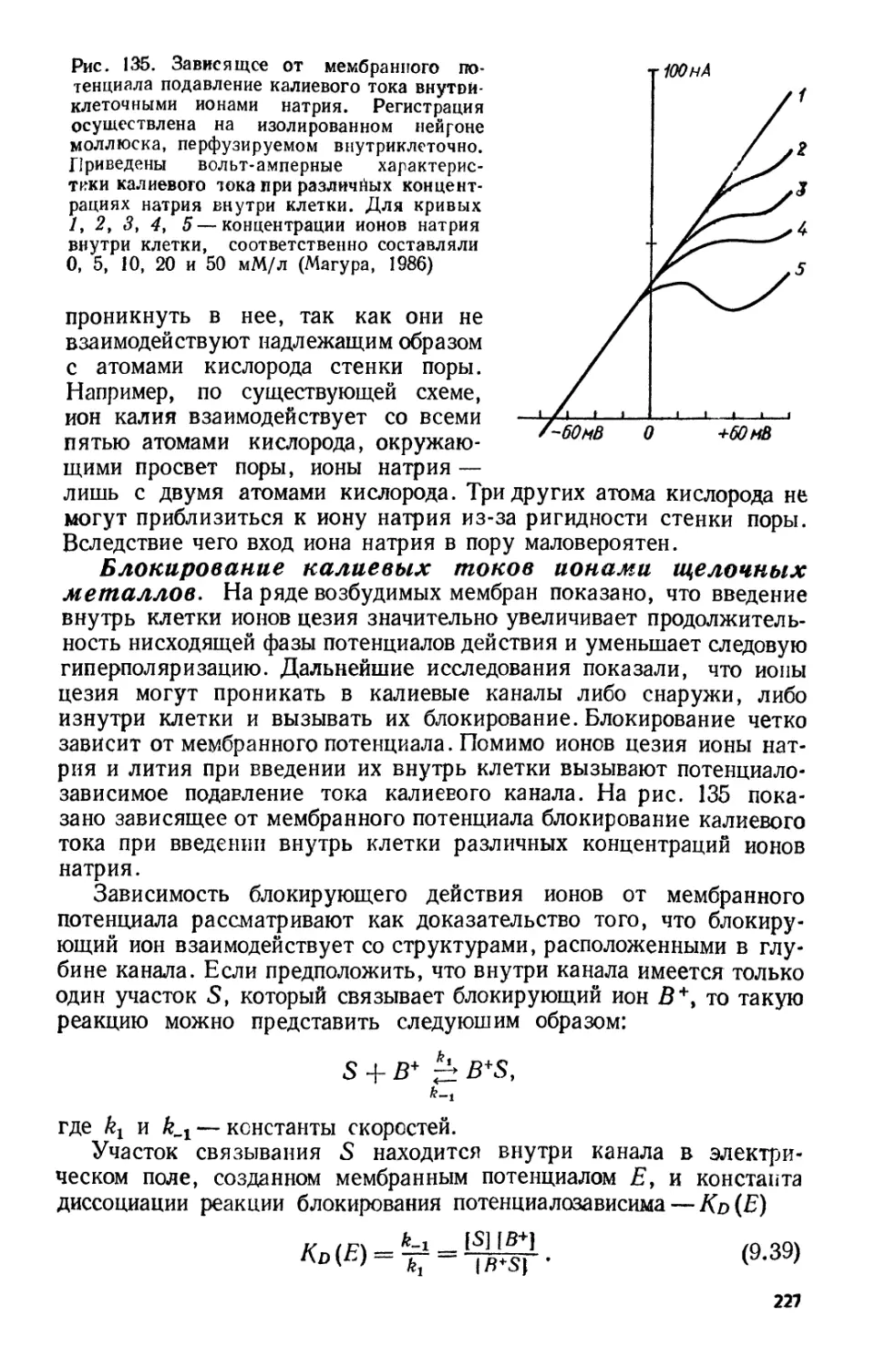
Tags: материальные основы жизни биохимия молекулярная биология биофизика общая биофизика термодинамика живые организмы структура биомакромолекул мембраны
ISBN: 5—11—
Year: 1988
п. г. костюк
Д.М.ГРОДЗИНСКИЙ
В. Л. ЗИМА
И. С. МАГУРА
Е. П. СИДОРИК
М. Ф. ШУБА
зика
Под общей редакцией академика
АН СССР П. Г. Костюка
Допущено Министерством высшего и среднего
специального образования СССР
в качестве учебника
для студентов
биологических специальностей
высших учебных заведений
Киев
Головное издательство
издательского объединения
«Выща шкоча»
1*>38
ббк звдн*?»-
Б63
УДК 577.3(075.8)
Авторы: П. Г. Костюк (тит. ред), Д. М. Гродзинский,
В. Л. Зима, И. С. Магура, Е. П. Сидорик, М. Ф. Шуба
Рецензенты: д-р биол. наук, проф. А. Б. Рубин
(Московский грсуниверситет им. М. В. Ломоносова), д-р биол. наук,
проф. Б. А. Ломсадзе (Тбилисский госуниверситет)
Редакция литературы по биологии, географии и экологии
Ъв, реляцией Аг Л, Москалюк
Биофизика/Под общ. ред. акад. АН СССР
Б63 П. Г. Костюка.-— К. : Выща шк. Головное изд-во,
1988.—504 с; 14 табл., 243 ил.— Библиогр.: 71 назв.
ISBN 5—11— 000094—8.
Представлены термодинамика биологических процессов,
молекулярная биофизика, биофизика клеточных процессов и
сложных систем. Рассмотрены вопросы, касающиеся структуры
биомакромолекул и мембран, молекулярных механизмов
клеточных процессов, действия физических факторов на живые
организмы, передачи информации, управления и регуляции
в биологических системах.
Для студентов биологических факультетов университетов.
Может быть использован студентами медицинских и
сельскохозяйственных вузов.
„ 2001040000—161
М211(04)-88—КУ-№2-290-1988 ББК 28.071я73
ISBN 5—11—000094—8
© Издательское объединение
«Выща школа», 1988
ВВЕДЕНИЕ
В познании природы жизненных процессов среди таких
фундаментальных биологических дисциплин, как цитология, генетика,
биохимия, физиология, важное место занимает также биофизика.
Биофизика — это наука, изучающая физические механизмы и
физико-химические процессы, которые лежат в основе
жизнедеятельности биологических объектов. Иными словами, это физика живых
систем на различных уровнях их организации — молекулярном,
мембранном, клеточном, органном, цопуляционном.
Хотя биофизика является одной из наиболее молодых
биологических дисциплин, ее становление проходило на протяжении
длительного времени. Началом биофизических исследований можно
считать работу Л. Гальвани (1791) о влиянии электричества на
мьцрцу. Важную роль в формировании биофизики как науки
в XIX в. сыграли работы Т. Юнга, в которых впервые была
высказана идея о гидродинамической природе сердечной деятельности
и природе цветного зрения. Большой вклад в обоснование закона
сохранения энергии в живых системах внесли работы Р. Майера
и Г. Гельмгольца. Крупнейший естествоиспытатель XIX в. Г. Гельм-
гольц внес также значительный вклад в разработку биофизики
зрения и слуха. Он впервые измерил с достаточной точностью
скорость распространения нервного импульса. Огромное значение для
развития биофизических подходов к жизненным процессам сыграло
создание в конце XIX в. С. Аррениусом теории электролитической
диссоциации солей в водных растворах, которая вскоре была
использована В. Нернстом для создания ионной теории
биоэлектрических явлений. На современном этапе огромную роль в понимании
природы физических процессов в живой материи сыграли работы
А. Хилла, К* Коула, Э. Эдриана, Д. Бронка,Х. ХартЛайна и
многих других,
Большой вклад в развитие биофизики внесли отечественные
ученые. И. М. Сеченов, изучая процесс дыхания у животных, вывел
закон растворимости газов в крови. В. Ю. Чаговец, исходя из теории
электролитической диссоциации, создал конденсаторную теорию
возбуждения нервных тканей. Представления об ионной црироде
процесса возбуждения затем интенсивно развивались П. П.
Лазаревым, по инициативе которого в 1919 г. в Москве был созд^р
Государственный биофизический институт. В дальнейшем развитие
з
биофизики в СССР связано с именами Г. М. Франка, Д. С.
Воронцова, Б. Н. Тарусова, А. М. Кузина и многих других
исследователей.
Как самостоятельная наука биофизика окончательно
утвердилась в 50-е годы XX в. Этому способствовало интенсивное
взаимопроникновение в биофизические исследования творческих подходов
физики и математики.
Биологические формы движения материи являются сложными,
но они включают более простые физические и химические формы,
которые проявляются в новых качественных сочетаниях. Исходя
из этих материалистических позиций, физика с ее методами
является очень важным ключом для решения многих проблем современной
биологии. Вместе с тем правильное использование законов физики
возможно только при наличии определенных границ системы, для
которой можно проводить исследования и расчеты.
Современная биофизика использует новейшие методы
исследования и строгие количественные доказательства каждого
положения. В ней широко применяются такие точные и чувствительные
биофизические методы исследования, как электрофорез,
ультрацентрифугирование, калориметрия, малоугловое рассеяние света,
рентгеноструктурный анализ, нейтроноскопия, спектрофотометрия,
рамановская спектроскопия, сиектрополяриметрия,
люминесцентный анализ, ядерный магнитный резонанс (ЯМР), электронный
парамагнитный резонанс (ЭПР), электронная микроскопия,
микроэлектродная техника и др. Они сочетаются с математическим
моделированием исследуемых систем с помощью
электронно-вычислительных машин. Поэтому биофизика наряду с другими науками
становится теоретической основой современной биологии. Но вместе
с тем она решает и важные практические задачи сельского
хозяйства и медицины; многие биофизические методы широко
используются в клинике для диагностики заболеваний (векторная
электрокардиография, ЯМР-томография и др.).
В 1961 г. был организован Международный союз чистой и
прикладной биофизики. С этого времени с определенной
периодичностью начали проводиться Международные биофизические
конгрессы: в Стокгольме (1961), Вене (1966), Мюнхене (1969), Москве (1972),
Копенгагене (1975), Киото (1978), Мехико (1981), Бристоле (1984).
В 1982 г. в Москве состоялся I Всесоюзный биофизический съезд,
где были представлены самые последние теоретические и
экспериментальные материалы по всем разделам современной биофизики.
В условиях, когда для решения многих проблем в биологии
используются сложнейшие современные биофизические методы
и физико-химические подходы, возникла необходимость в
подготовке специалистов по биофизике. В Советском Союзе первая
кафедра биофизики была создана в Московском госуниверситете
в 1953 г., а в Киевском госуниверситете — в 1963 г.
Основой настоящего учебника являются курсы лекций, которые
читались студентам на этой кафедре. Цель их — формирование
у студентов биофизического мышления, способности количествен*
4
ного описания сложных биологических явлений на основе точных
экспериментов. Особое внимание обращается на применение
точных и чувствительных биофизических методов исследования, на
умение оценивать биофизические параметры и правильно
использовать их для построения физических и математических моделей
биологических объектов.
* * *
Отдельные главы настоящего учебника написали: введение —
П. Г. Костюк, В. Л. Зима; главы 1, 2, 3, 4 и 5 — В. Л. Зима; главы
6, 7, 8, 9 и 10 —И. С. Магура; главу 11 — М. Ф. Шуба; § 4.9 главы
4 и главу 12 — Е. П. Сидорик; главы 13 и 14 — Д. М. Гродзинский;
главы 15, 16 и 17 —П. Г. Костюк.
Авторы выражают благодарность за критическое рассмотрение
рукописи и высказанные ценные замечания проф. А. Б. Рубину,
проф. Б. А. Ломсадзе, д-ру биол. наук А. П. Демченко.
Часть I
ТЕРМОДИНАМИКА БИОЛОГИЧЕСКИХ
ПРОЦЕССОВ
Жизнь в ее многообразных проявлениях связана с высокой
пространственной упорядоченностью молекулярных структур и строгой
временной координацией сложных физико-химических явлений
в клетках. Поддержание такого состояния зависит от непрерывного
обмена веществ, энергии и информации между клеткой или
организмом и окружающей средой. Это одно из характерных и
универсальных свойств живых образований.
Клетка — живая высокоорганизованная и сложная «машина»,
для работы которой необходима энергия. Энергия расходуется на
синтез биоорганических соединений и поддержание осмотических
и электрических потенциалов. Превращение одного вида энергии
в другой происходит в таких сложных физиологических процессах,
как зрение, слух, хеморецепция, биолюминесценция. При движении
организмов или при мышечном сокращении за счет химической
энергии выполняется механическая работа.
Термодинамика — это наука, изучающая наиболее общие
законы превращения различных видов энергии в системе. Она дает
макроскопическое описание энергетических изменений и
превращений, не рассматривая молекулярное строение системы. Законы
термодинамики, выведенные в результате повседневного опыта,
являются наиболее общими. Они имеют универсальный характер
и выполняются независимо от того, где происходит процесс — в
живой или неживой материи.
Термодинамическая система представляет собой часть
пространства с материальным содержимым, ограниченную оболочкой.
Область вне оболочки системы представляет окружающую среду.
В зависимости от того, как термодинамическая система связана
с окружающей средой, выделяют три типа систем: изолированные,
замкнутые и открытые.
Изолированная термодинамическая система не обменивается
с внешней средой ни веществом, ни энергией. Замкнутая (закрытая)
система обменивается энергией, но в ней нет обмена веществом.
В открытых термодинамических системах происходит обмен с
окружающей средой и веществом, и энергией.
Термодинамическая система характеризуется определенными
термодинамическими параметрами. Экстенсивные параметры
зависят от общего количества вещества в системе (например, масса т,
6
объем V)\ интенсивные не зависят от массы системы (давление р,
температура Г, молярная концентрация п). Изменение любого из
параметров вызывает изменение состояния системы. Переход
термодинамической системы из одного состояния б другое происходит
в результате различных процессов. Если в циклическом процессе
(переход системы из исходного состояния в конечное и затем возврат
в исходное состояние) состояние системы не изменяется, такой
процесс называется обратимым. Если в результате такой
последовательности переходов в системе происходят необратимые изменения,
процессы называются необратимыми. Реальные процессы в
природе всегда проходят как необратимые.
Глава 1. ТЕРМОДИНАМИКА РАВНОВЕСНЫХ
СОСТОЯНИЙ
Термодинамика возникла около 200 лет назад и с самого
начала своего становления использовала данные о теплопродукции
мелких животных, получаемые с помощью калориметрии.
Классическая термодинамика находит разности энергий и определяет
направление возможных изменений. Наиболее серьезное ограничение
при использовании классической термодинамики состоит в том, что
она имеет дело с равновесными состояниями и ничего не говорит
о кинетике процесса.
Термодинамика базируется на основных принципах — законах
термодинамики.
1.1. Первый закон термодинамики. Основная задача
термодинамики состоит в том, чтобы найти такие величины, которые бы
однозначно определяли изменение состояния термодинамической
системы при переходе из одного состояния в другое. Опыт показал,
что такой величиной является внутренняя энергия U. Она является
функцией состояния системы и зависит от термодинамических
параметров: U = / (т, р, V, Т). Ее изменение &U не зависит от пути
перехода из одного состояния в другое. Внутренняя энергия — это
сумма кинетической и потенциальной энергии всех атомов и
молекул термодинамической системы.
Изменение внутренней энергии AU в замкнутой системе можно
определить, измеряя поглощенную (выделившуюся) теплоту Q
и выполненную работу W. Экспериментально установлено, что
изменение внутренней энергии равно
AU= U2 — U1 = Q—W. (1.1)
Какими бы путями этот переход не осуществлялся и как бы не
варьировали по величине Q и W, всегда сохраняет постоянное
значение разность
Q' —W' =*Q" — W". (1 2)
Это значит, что в замкнутой системе изменение внутренней энергии
Д£/ = const.
7
Первый закон термодинамики (закон сохранения энергии)
гласит: в изолированной термодинамической системе полный запас
энергии — есть величина постоянная и возможны только
превращения одного вида энергии в другой в эквивалентных
соотношениях:
17 = const; Д(/ = 0. (1.3)
В замкнутой системе изменение внутренней энергии AU при
переходе из одного состояния в другое определяется количеством
переданной теплоты и величиной выполненной работы:
A[/-Q=t W. (1.4)
Знак (—) означает, что работа выполняется системой против
внешних сил, (+) — работа выполняется над системой.
В дифференциальной форме первый закон термодинамики
запишется в следующем виде:
dU = 8Q±6W. (1.5)
Значки б обозначают, что теплота Q и работа W не являются
функциями состояния и, следовательно, они не могут быть полными
дифференциалами.
Важное свойство функции состояния заключается в том, что для
циклических процессов
$Л/ = 0. (1.6)
В СИ энергия измеряется в джоулях (Дж). 1 Дж = 0,239 кал =
= 6,25 • 1018 эВ. 1 ккал = 4,19 кДж.
1.2. Энтальпия. Закон Гесса. При фиксированном давлении р
можно ввести вместо внутренней энергии U новую функцию
состояния, которая будет хорошо описывать термодинамическую
систему; она важна для изучения химических реакций в клетке, проте*
кающих при р = const. Работа по изменению объема V при
постоянном давлении р запишется как
Wp=pAV. (1.7)
Тогда запись первого закона термодинамики будет иметь вид:
Q = AU + pAV = A (U + pV) = АН. (1.8)
Новая функция состояния — энтальпия (Н) (от греч.—
«нагреваю»):
H=U + pV. (1.9)
Энтальпию называют теплосодержанием системы. В
дифференциальной форме
dH = dU + pdV, при р = const. (1.10)
Введенная таким образом новая функция состояния лежит
в основе закона Гесса: тепловой эффект химической реакции Q не
зависит от пути реакции от исходных веществ к продуктам ре*
8
акции, а определяется лишь разностью энтальпий конечных и
исходных веществ:
Q=AH=%Hitk-YHJtU, (1.П)
где YiHtk — сумма энтальпий всех продуктов реакции; $] Ниа —
сумма энтальпий исходных веществ.
Закон Гесса — прямое следствие первого закона термодинамики.
Следует отметить важное свойство этой новой функции состояния:
поскольку изменение энтальпии (теплосодержания) системы
соответствует величине поглощенной или выделенной теплоты, то ее
можно точно определить калориметром.
Пример:
Рассмотрим окисление (при постоянном давлении) 1 М
глюкозы:
С6Н12Ов + 602 -* 6С02 + 6Н20 - Q; (1.12)
Q » 6 (#со2 + #н2о) - (#c.hiA + 6Яо2) = -2810 кДж . моль"1.
Такое же количество теплоты выделяется при окислении
глюкозы в организме животных, когда в результате сложных
химических превращений образуется множество промежуточных
продуктов. Теплота сгорания Q веществ, в том числе пищевых продуктов,
определяется в калориметрических бомбах.
Если система переходит из состояния / в состояние 2 с
изменением объема AV при постоянном давлении р, то при этом, согласно
(1.7), будет выполняться работа Wp.
Полная работа
W=WP+W0, (1.13)
где W0—полезная работа. Она может представлять собой работу,
совершаемую в процессе мышечного сокращения или при переносе
зарядов через мембрану. Подставив (1.13) в (1.4), получим:
AU^Q — W^Q— Wp— W0^Q — pAV — W0\
AU + pAV = Q-W0;
AH = Q—W0. (1.14)
Уравнение (1.14) аналогично (1.4). Поскольку АН включает
«бесполезную» работу pAV и поскольку в клетках все процессы
выполняются при постоянном давлении, энтальпия более
используема для описания тепловых эффектов в биологических системах.
Как и внутренняя энергия (/, энтальпия Н является также
функцией состояния термодинамической системы.
1.3. Калориметрия. В настоящее время не вызывает сомнения
применимость закона сохранения энергии к биологическим
объектам. Первые экспериментальные попытки измерения
энергетического баланса организма были проведены в конце XVIII в. А.
Лавуазье и П. Лапласом. По скорости таяния льда была найдена
теплота, выделенная животным в изолированной камере. Наиболее
9
f f
Рис. 1. Дыхательный калориметр:
J и 2 — внутренний и внешний цилиндры калориметра; 3—электрическая спираль, 4 —
внешняя теплоизоляционная стенка калориметра, 5 — термопары, 6 — система с проточной
водой; 7— весы, 5— система подачи 02; 9— ловушка паров воды; 10 — ловушка Ш2; Е —
источник напряжения, Л—амперметр, R— реостат; Г — гальванометр
точные данные были получены при использовании дыхательного
калориметра (Этуотер, Бенедикт, Роз, 1904). Конструкция
калориметра (рис. 1) позволяет полностью устранить утечку через стенки
коаксиальных цилиндров (/ и 2) теплоты, которая выделяется
внутри калориметра при нахождении там человека или животного.
Согласно закону Фурье, поток теплоты составляет
^ = 4s(4-y, (1.15)
где k—коэффициент теплопроводности воздуха; d — расстояние
между цилиндрами 1 и 2\ S — площадь поверхности цилиндров;
10
h и h— температуры на стенках внутреннего (/) и внешнего (2)
цилиндров. Если оба цилиндра поддерживать при одинаковой
температуре ty= t2y то поток тепла через стенки калориметра будет
отсутствовать. Этого добиваются с помощью электрической
спирали 3, через которую пропускается электрический ток от
источника напряжения Е. Величина тока регулируется реостатом R
и измеряется амперметром А. Разность температур на стенках
цилиндров 1 и 2 регистрируется с помощью термопар 5 и
гальванометра Г.
Измерительная часть калориметра позволяет регистрировать
количество теплоты и оценивать дыхательный коэффициент (6)i
(i.i6)
1. Значение дыхательных
коэффициентов £ и энергетических
эквивалентов Q0 при окислении различных
питательных веществ
где [С02] — количество
выделившегося углекислого газа; [02] —
количество поглощенного
кислорода. Дыхательные
коэффициенты при окислении
питательных веществ следующие: для
глюкозы 6=1, белков 6 = 0,8
и для жиров 6 = 0,71. Каждому 8
соответствует свой
энергетический эквивалент Q° — количество
энергии, которое выделяется при поглощении 1 л 02 (табл. 1).
Основное количество теплоты, образующееся в калориметре,
уносится водой, которая втекает в калориметр при температуре
/' и вытекает при температуре Г. Поток воды (^\ через
калориметр измеряется весами 7. Поток теплоты, выделившейся в
калориметре, будет записываться в таком виде:
Вещества
Углеводы
Белки
Жиры
б
1,00
0,80
0,71
Q0
кДж/л
21,0
18,8
19,6
х кал/л
5,05
4,48
4,69
AQi
с (Г-Г)
Дот
дГ'
(1.17)
где с—удельная теплоемкость воды.
Кроме этой теплоты измеряется теплота, выделившаяся в виде
скрытой теплоты испарения воды:
Q2 = fonn, (1.18)
где„ ^ — удельная теплота парообразования; тп — масса
испарившейся воды. Пары воды улавливаются концентрированной серной
кислотой. Измерением массы колбы 9 после проведения
калориметрического эксперимента определяют тп.
Достаточную точность энергетического баланса можно
получить только при условии, когда организм не выполняет работу
пКьг\Да В °Рганизме не происходит накопления биомассы. Согласно
U.14), если не совершается работа (W0=Q), то АН == Q. Следорп-
тельно, в этих условиях (при р = const) энергетические изменения
в биологической системе АН можно точно регистрировать калори-
11
метрически, измеряя поглощенную или выделенную теплоту Q.
Если значение АН положительное, то теплота поглощается и
реакция называется эндотермической. Если АЯ отрицательное, то
система выделяет теплоту, а реакция называется экзотермической.
Большинство метаболических реакций являются
экзотермическими.
Значения теплот, выделяемых при полном окислении углеводов
и жиров до С02 и Н20, а также окислении белков до мочевины,
имеют важное значение для расчета калорического эквивалента
Q° пищевых продуктов. Калорический эквивалент представляет
количество выделившейся теплоты, отнесенной к единице массы
вещества: для жиров Q0 = 39000 кДж/кг (9,3 ккал/г), для
углеводов—17000 (4,1) и для белков—17000 кДж/кг (4,1 ккал/г).
Измерение теплопродукции в калориметре и использование данных
непрямой калориметрии позволяют с высокой точностью оценить
энергетический баланс для животных и человека (табл. 2).
Полученные данные подтверждают справедливость первого закона
термодинамики для биологических систем.
2. Энергетический баланс для человека (за 1 сутки)
Энергия, потребяяемая с питательными
веществами
питательные вещества, кг
Белки — 0,0568
Углеводы — 0,0799
Жиры—0,140
Всего.
I Q0, кДж/кг
17000
17000
39000
Q. кДж
965,8
1358,3
5460,0
7784,1
Теплота, измеренная
калориметром, Q, кДж
Выделенная теплота — 5743
Испарение через кожу — 949
Испарение через дыхание —
757
Выделенные газы — 180
Моча и кал — 96
Поправки — 46
7771
1.4. Второй закон термодинамики. Первый закон термодинамики
определяет энергетические преобразования и энергетический ба-^
ланс в закрытой системе, но он не позволяет установить, в каком
направлении проходят изменения в системе.
Необходим дополнительный принцип, который позволит судить
о направленности процессов. Именно второй закон термодинамики
позволяет оценивать способность термодинамической системы
изменяться в определенном направлении и определять эффективность
преобразования энергии в работу. На основании наблюдений и
повседневного опыта было предложено несколько эквивалентных
формулировок второго закона термодинамики:
1. Р. Клаузиус (1850): теплота не может самопроизвольно
передаваться от более холодного к более нагретому телу.
2. У. Томпсон (1851): невозможно построить периодически
работающее устройство, которое выполняло бы работу за счет теп-
12
ла, отбираемого из одного теплового резервуара, имеющего во всех
частях одинаковую температуру. Иначе говоря, невозможно
построить «перпетуум мобиле второго рода».
Оказалось, для обратимых процессов отношение теплоты dQ
к температуре Т есть постоянная величина и это отношение не
зависит от того, каким образом проходит процесс:
AS^-S^f^U-J^k (1,19)
1 1
Новая функция состояния системы есть энтропия (S) (от греч.—
«изменение», «превращение»).
При бесконечно малых изменениях состояния закрытой системы
изменение энтропии будет иметь вид
dS = °-^>^. (1.20)
В изолированной термодинамической системе 6Q = 0 и изменение
энтропии
dS>0, (1.21)
где знак (=) соответствует идеализированным обратимым
процессам, а знак (>) — реальным самопроизвольным необратимым
процессам. Для необратимых процессов в закрытых системах неравен-
,о АО
ство dS > -~ можно представить как
dS = f + ^, (1.22)
где дС}{ — теплота, возникающая в самой системе за счет
необратимых процессов.
Фактически уравнения (1.20) и (1.21) представляют
математическую запись второго закона термодинамики. Согласно этому
закону, в изолированной системе энтропия сохраняет постоянное
значение для обратимых процессов (S = const), возрастает при
необратимых процессах и достигает максимального значения при
термодинамическом равновесии (S-^max). Второй закон
термодинамики для необратимых процессов указывает направление
процесса: необратимые процессы всегда протекают в направлении
возрастания энтропии. Таким образом, энтропия является
количественным показателем способности системы к самопроизвольным
изменениям. Энтропия измеряется в Дж • К"1 или в энтропийных
единицах (э. ед.). Образное выражение Р. Эмдена (1933) отражает
сущность первого и второго законов термодинамики: «В гигантской
фабрике естественных процессов энтропия занимает место
директора, который предписывает характер и способ ведения всех сделок,
в то время как закон сохранения энергии — всего лишь
«бухгалтер», приводящий в равновесие дебет и кредит.
В чем же физическая сущность понятия энтропии?
Термодинамика имеет дело с макроскопическими системами, и поэтому она не
13
|o oi о Too
О lO Ol О
Рис. 2. Распределение молекул
между тремя отсеками:
__^__^ , . а —начальное состояние системы; б —
О о I 0 I \/ х равновесное состояние системы с мак-
оо ° К симальной энтропией Smax; в — нерав-
о о | о | |х новесное состояние системы с
минимальной энтропией 5Щ|П; / — самопроизволь»
ный процесс; 2 —несамопроизвольный
процесс
loool
ооо
|ооо|
->тГл
может дать никакой информации о молекулярных механизмах,
которые вызывают направленное изменение макроскопических
функций системы. Л. Больцман впервые дал физическую трактовку
энтропии исходя из понятий статистической физики. Энтропия
является мерой молекулярного хаоса, и закон возрастания ее отражает
возрастающую дезорганизацию системы. Больцману удалось это
доказать, предположив, что энтропия каждого макроскопического
состояния связана с вероятностью реализации этого состояния.
Одно и то же макросостояние реализуется огромным числом
микросостояний. Это число микросостояний называется
термодинамической вероятностью (со). В отличие от математической вероятности,-
термодинамическая вероятность — очень большая величина.
Для термодинамической вероятности справедливо соотношение
Ю = ^1!Л^3!...Л\!' (1,23)
где N «= Nx+ N2+ N3+ ... + N{ —общее число молекул в
системе; Nt — число молекул в i-м фазовом объеме.
Термодинамическая вероятность со — это число способов,
которыми N молекул можно расположить в i ячейках системы. Л.
Больцман связал энтропию с термодинамической вероятностью.
S=£0lnco; (1.24)
где k0—постоянная Больцмана (&0= 1,38 • 10"23 Дж • К"1;
газовая постоянная R = k0N0 = 1,38 • 10~23 . 6,02 • 1023 моль"1 =
= 8,31 Дж-моль-1. Кг1).
Рассмотрим идеальный газ в сосуде, разделенном
перегородками на три отсека. Представим, что в начальном состоянии
(рис. 2,а) молекулы газа распределены различным способом.
Схематически 9 молекул в начальном состоянии распределены в трех
отсеках так: 6, 2 и 1 молекула. Мы можем подсчитать, согласно
(1.23) и (1.24), термодинамическую вероятность (соа = gj^ffj =252J
и энтропию начального состояния. Возможны две крайние ситуации
для перехода системы из этого состояния: все молекулы равномерно
распределяются в трех отсеках (3, 3, 3) (рис. 2,6) и все молекулы
попадают только в один отсек (0,9,0) (рис. 2,в). Термодинамические
91
вероятности для этих двух ситуаций: соб = 313!3{ = 1680; сов =
= -^ = 1
0!9!0!
14
3. Абсолютные
1 М воды
значения энтропии
-
Различные состояния
воды
н2о
Твердое состояние
(лед)
Жидкое состояние
Газообразное
состояние МО2 кПа (1 атм)
5
кДжх
хК-1
41
70
189
э. ед.
9,8
16,7
45,1
Флуктуации
-if-
Рис. 3. Изменение энтропии S
изолированной системы при достижении
состояния термодинамического равновесия:
/ — время
В предельном случае, когда все молекулы распределены
равномерно по ячейкам, термодинамическая вероятность соб имеет
максимальное значение. Это равновесное состояние системы с
максимальной энтропией Smax- Переход (/) системы в равновесное
состояние будет самопроизвольным и наиболее вероятным процессом.
Вторая крайняя ситуация соответствует состоянию системы, когда
все молекулы сосредоточены только в одной ячейке.
Термодинамическая вероятность сов имеет наименьшее значение. Это наиболее
упорядоченное состояние с минимальной энтропией Smin,
самопроизвольный переход в которое менее всего вероятен.
Рассчитанные значения энтропии воды в различных агрегатных
состояниях представлены в табл. 3. Данные таблицы хорошо
показывают корреляцию энтропии с неупорядоченностью системы: чем
более неупорядоченная система (газообразное состояние), тем
больше ее энтропия.
Таким образом, энтропия, согласно трактовке Больцмана,
является мерой неупорядоченности системы. В результате
самопроизвольных процессов изолированная система переходит в состояние
термодинамического равновесия, которое характеризуется
максимальной энтропией (рис. 3). При равновесии происходят
флуктуации, которые вызывают локальное уменьшение энтропии dS < 0.
Но в системе возникают такие изменения, которые возвращают ее
назад в равновесное состояние с Smax. Следовательно, стремление
энтропии к Smax является главным эволюционным принципом
изолированной термодинамической системы.
Второй закон термодинамики указывает, что не все виды энергии
эквивалентны. Л. Бриллюэн разделил по качеству все виды
энергии и связал их с величиной энтропии. Энергиям, которые наиболее
эффективно превращаются в другие виды энергии, соответствует
наименьшее значение энтропии. Это энергии «высшего качества»
(класс А). В этот класс отнесены гравитационная, ядерная,
световая, электрическая энергии. В класс В отцесена химическая
энергия «среднего качества». Энергией «низкого качества» с
максимальной энтропией является тепловая энергия (класс С). Таким обра-»
15
зом, согласно трактовке Бриллюэна, второй закон термодинамики
для изолированной системы означает постоянную деградацию
энергий «высшего качества» в энергию «низкого качества», в тепловую
энергию.
1.5. Термодинамические потенциалы. Второй закон
термодинамики позволяет установить направленность изменений в системе,
однако по изменению термодинамических функций AU и AS нельзя
оценить величину производимой работы.
Объединим первый (1.5) и второй (1.20) законы термодинамики
следующим образом:
TdS = dU + dW. (1.25)
С учетом (1.13) мы получили
TdS =dU + dWp+ dW0, (1.26)
где dWp— pdV. Тогда полезная работа будет записываться как
—dW0= dU + pdV - TdS. (1.27)
Вводятся две новые функции состояния системы. Если процессы
осуществляются при постоянной температуре (Т = const) и
постоянном объеме (V = const), то максимальная полезная работа
в системе выполняется за счет изменения свободной энергии Гельм-
еольца (F) (изохорно-изотермический потенциал).
В этом случае pdV = 0 и
—dW0= dU — TdS = d{U — TS) = dF, (1.28)
где F=U—TS.
В дифференциальной форме изменение свободной энергии Гельм-
гольца запишется
dF^dU- TdS. (1.29)
Если Т = const ир = const, то максимальная полезная работа
выполняется за счет изменения свободной энергии Гиббса (G) (изо-
барно-изотермический потенциал) :
—dW0= dU + pdV — TdS = dH — TdS = d(H— TS) = dG, (1.30)
где G = H — TS. В дифференциальной форме
dG = dH — TdS. (1.31)
Новые термодинамические потенциалы позволяют сделать ряд
важных заключений.
1. Выполнение полезной работы при осуществлении
необратимых процессов всегда сопровождается рассеиванием энергии,
величину которой определяет TdS, Чем больше эта величина, тем
более необратим процесс. Таким образом, изменение энтропии
dS характеризует необратимость процесса. Только для абсолютно
обратимых процессов рассеивание энергии отсутствует: TdS =» 0.
16
2. По величине и знаку изменения термодинамического
потенциала можно судить о направленности процессов. Если в результате
определенных процессов термодинамические потенциалы понижаются
(dF <0 или dG<0), такие процессы являются
самопроизвольными. Они проходят с выделением энергии и называются экзергониче-
скими. Процессы, которые идут с увеличением термодинамических
потенциалов (dF >0 или dG >0), являются не самопроизвольны*
ми. Такие процессы называют эндергоническими; они требуют
поглощения дополнительной энергии из внешней среды.
3. При достижении равновесия термодинамические потенциалы
стремятся к минимальным значениям: F->min, dF = 0; G-*
-+ min, dG = 0.
В биологических системах процессы проходят при р = const,
поэтому в термодинамических оценках преимущественно
используется потенциал G. Поскольку все функции состояния являются
полными дифференциалами, то
где щ—число молей i-то компонента в реакции. Но исходя из
выражения О = Я — TS = U + pV — TS, получим
dG = dU + pdV + Vdp — TdS — SdT. (1.33)
Подставим выражение TdS = dU + pdV, которое справедливо
для равновесных процессов при отсутствии выполнения полезной
работы, в (1.33). Тогда
dG = TdS + Vdp— TdS— SdT = Vdp —SdT. (1.34)
Сравнивая (1.32) и (1.34) при условии щ = const, имеем
Кроме того, введем еще один термодинамический потенциал —
химический потенциал (\i), который представляет изменение любой
термодинамической функции (/, Я, F, G, отнесенное к количеству
молей вещества:
В случае изменения энтропии
Тогда изменение свободной энергии Гиббса (1.32) о учетом
химических реакций и (1.35) и (1.37) будет иметь вид
dG = Vdp — SdT+% \Xidnt. (1.38)
17
1.6. Изменение стандартной свободной энергии и константа
равновесия. Изменение свободной энергии AG зависит от условий
прохождения химических реакций (температуры, давления,
концентрации реагирующих веществ), и это затрудняет сравнение
химических преобразований различных веществ. Тогда изменение
свободной энергии AG представляют в стандартных условиях (рдя
1 М йодных растворов при давлении 1 • 102 кПа (1 атм), рН =7,0
и Т = 298 К) и эту величину называют изменением стандартной
свободной энергии (AG°).
Определим изменение свободной энергии для 1 М идеального
газа при постоянной температуре Т = const. Запишем уравнение
состояния идеального газа для 1 М:
pV = RT. (1.39)
RT
Тогда V =— подставляем в (1.35) и находим изменение свободной
энергии
dG = RTdl. (1.40)
Величину свободной энергии G получим, интегрируя (1.40) от рх
ДО /у
Рг
G = RT^ = RTlnp2-RT\nPl. (1.41)
pi
Если допустить, что исходное состояние системы находится в
стандартных условиях, т. е. при рг= 1 • 102 кПа, так, что оно
соответствует стандартному состоянию G°, тогда G2= G°+ RT\r\p2. В
общем виде величина свободной энергии будет
G = G°+RTlnp. (1.42)
С определенным приближением (для разбавленных растворов
давление р определяется концентрацией вещества с) уравнение (1.42)
можно представить как
G=G° + RT\nc. (1.43)
Рассмотрим простую химическую реакцию
где [А] и [В] — концентрации реагирующих веществ. Согласно (1.43),
изменение свободной энергии AG в этой реакции будет
AG = GB-GA = (G% + RT In [B])-(G°A + RT In [A]) =
= (Gb-G°a) + RT\n1^ = AG<> + WMnjfj. (1.44)
При достижении равновесия AG = 0, и тогда мы получаем
изменение стандартной свободной энергии
AG° = -/?rin]4^.
18
измеряя экспериментально /Ср,
Рис. 4. Зависимость дифференциальной
экстинкции химотрипсина от
температуры:
де — дифференциальный молярный
коэффициент экстинкции, измеренный на 293 нм
Отношение равновесных концен-
трации веществ \rjr-— = лР 1
называется константой
равновесия. Тогда
Д0° = — RT In /CP. (1.45)
Это — уравнение Вант-Гоффа.
Оно представляется чрезвычайно
важным, поскольку позволяет,
находить величину AG°.
Определение изменения стандартной свободной энергии AG0
белков и нуклеиновых кислот можно проводить с помощью спек-
трофотометрии. На рис. 4 представлена тепловая денатурация
химотрипсина. Процесс денатурации регистрируется на
дифференциальном спектрофотометре в виде S-образной кривой. Если
денатурация обратима и совершается в одну стадию, тогда можно
предположить, что происходит переход между двумя состояниями
химотрипсина'— нативным N (ниже 293 К) и денатурированным D (выше
323 К). Концентрации химотрипсина в этих состояниях обозначим,
как [N] и [D]. Тогда в температурной области, где происходит
резкое изменение дифференциального молярного коэффициента
экстинкции Де, будет наблюдаться равновесие двух форм химотрипсина
с константой
Разность Дег — Де^ будет пропорциональна [D]t a Aed — Дег —
концентрации нативного белка [Л/], где Дег — дифференциальный
молярный коэффициент экстинкции белка в области денатурации
при температуре Т. Тогда
Ap-[FJ-
[D] AeT — &eN
(1.46)
-1
При pH = 1,7 и температуре 316 К Дб°= -4,18 кДж . моль"
Для многих биохимических реакций определены изменения
стандартных величин. Для расчетов Д<3° измеряют разными
методами константу равновесия /Ср. Величину ДЯ° определяют из
калориметрических измерений. Ниже даны примеры некоторых
биохимических реакций, измеренных в стандартных условиях (1 М
водные растворы, Т = 298 К, рН = 7,0):
а) окисление глюкозы:
С*Н12Ов + 602->6С02 + 6Н20
Д#° = —2810 кДж • моль"1 (—673 ккал • моль'1);
AG0 а -2870 кДж . моль"1 (—687 ккал • моль""1);
19
б) реакции гидролиза фосфатных соединений, связанные с
переносом отщепленной фосфатной группы на воду:
АТФ + НаО->АДФ + Ф
AG°= —34,54 кДж • моль""1 (—8,2 ккал • моль"1).
Соединения, при гидролизе которых освобождается
значительное количество энергии, называют макроэргическими. Знак AG°
указывает на самопроизвольность этого процесса. В клетках
имеются другие фосфатные соединения с большой энергией переноса
фосфатных групп. При гидролизе креатинфосфата AG°= —43,1 кДж»
X моль"1 (—10,3 ккал • моль"1). Многие реакции гидролиза
фосфатных соединений проходят со значительно меньшим
уменьшением свободной энергии AG° по сравнению с гидролизом АТФ. При
гидролизе глюкозо-1-фосфата AG°=—20,9 кДж • моль"1. Именно
большая величина AG0 определяет АТФ как универсальный
источник энергии для многих сопряженных биологических реакций,
которые идут с использованием энергии.
1.7. Электрохимический потенциал. Подходы равновесной
термодинамики могут быть использованы при решений вопросов,
связанных с переносом заряженных и нейтральных веществ через
клеточные мембраны.
Как было показано в параграфе 1.5, изменение свободной
энергии AG выражается уравнением (1.38). В клетке химические
превращения и перенос веществ проходят при Т = const и р = const;
тогда (1.38) упрощается:
dG = £M"*- (1.47)
При одном обороте реакции количество молекул исходных веществ
и продуктов пропорционально соответствующим стехиометрическим
коэффициентам v так, что изменение числа молей An. = vr Это
справедливо, когда в результате одного оборота реакции число
превращенных молекул существенно меньше общего числа молекул
реагентов в смеси. Тогда выражение (1.47) запишется как
dG=S|im (1.48)
i
(Vi < 0 для исходных веществ и v,- > 0 для продуктов реакции).
Рассмотрим перенос вещества через мембрану из одной фазы
в другую, если фазы отличаются химическими потенциалами \ьд
й [хБ. Согласно (1.48), изменение свободной энергии запишется
AG = [iAvA + M^va. (1.49)
Гак как vA = —vB = v, то
AG = vA (\ia -7- M = vA[x. (1.50)
При равновесии AG == 0, а значит,
Afi = \ia — № = 0 или \iA = Ця. (1.51)
20
В более общем случае между двумя фазами, разделенными
мембраной, могут происходить перенос незаряженных частиц1
благодаря разности концентраций са и св (осмотическая работа) и
перенос ионов (электрическая работа). Тогда, в отличие от (1.50),
изменение свободной энергии определяется разностью электро-
химических потенциалов (Д[1):
AG-vAjlT, (1.52)
Электрохимический потенциал и — это полный потенциал,
учитывающий химический потенциал \i системы и электрическую
работу Ц7ад по переносу заряженных частиц:
\i==[i + W3Jl. (1.53)
По аналогии с выражением для G (1.43) химический потенциал
можно представить как
I* = pt°+ RT In с, (1.54)
где \i°—стандартный химический потенциал; с—концентрация
веще ства. Электрическг я работа
W3J1 = zF<p, (1.55)
где z — валентность иона; F = 96500 Кл — число Фарадея;
Ф — потенциал на границе раздела фаза — окружающая среда.
Для случая переноса через мембрану из фазы А в фазу В
нейтральных веществ и ионов изменение электрохимического потенциала
будет иметь вид
Aji = Ди + №эл = v°b - $ + RT In °£ + zFAy. (1.56)
СА
Условием равновесия является AG = 0. Тогда в общем случае,
когда имеется перенос нейтральных частиц и ионов, равновесие
будет определяться равенством электрохимических потенциалов
Д(ы = 0 или \хА = \лв- (1-57)
Г л а в а 2. ТЕРМОДИНАМИКА НЕОБРАТИМЫХ
ПРОЦЕССОВ
Классическая термодинамика разработана для закрытых и
изолированных систем и в основном имеет дело с равновесными
состояниями. В открытых системах непрерывно происходит обмен
с внешней средой энергией и веществом и вместо
термодинамического равновесия устанавливается стационарное состояние.
Сходство равновесия и стационарного состояния состоит в том, что
большинство параметров системы не изменяется во времени. Однако
имеются принципиальные отличия. При равновесии не происходит
изменения свободной энергии Гиббса (AG = 0), а энтропия
стремится к максимальному значению (S->max). В стационарном
2!
состоянии изменение свободной энергии поддерживается на
постоянном уровне (AG = const) и значение энтропии отличается от
максимального значения. В открытых системах приходится иметь
дело и с неравновесными состояниями, и с реальными необратимыми
процессами. Эти вбпросы рассматривает термодинамика
необратимых процессов.
2.1. Изменение энтропии в открытых системах. Основы
линейной неравновесной термодинамики были заложены Л. Онзагером
и в дальнейшем развиты И. Пригожиным. Линейная неравновесная
термодинамика рассматривает процессы вблизи равновесия, когда
между скоростями и силами, которые вызывают процессы, существуют
линейные зависимости.
Если в открытой системе проходят необратимые процессы, тогда
изменение энтропии представляется как в (1.22). Это значит, что
общее изменение энтропии в открытой системе, обменивающейся
с внешней средой энергией и веществом, можно представить как
dS = d£ + d-&=deS + dtS, (2.1)
где deS — изменение энтропии за счет обмена с внешней средой;
diS — продукция энтропии в самой системе вследствие необратимых
процессов. Согласно второму закону термодинамики, diS > 0. Для
адиабатических изолированных систем deS = 0 и
dS = dcS > 0. (2.2)
Вклад в продукцию энтропии дают только необратимые процессы —
теплопроводность, диффузия, химические реакции.
Определим величину продукции энтропии в системе, если в ней
проходят- химические реакции. Изменение массы /-го компонента
при химическом преобразовании запишется
dim = VfM/d£; dm = ^щ- = \idl, (2.3)
где vi — стехиометрический коэффициент; Mt- — молекулярная масса;
dm — число молей вещества; | — степень прохождения реакции
показывающая изменение количества молей вещества, приведенное
к стехиометрическому коэффициенту.
Энтропия является полным дифференциалом и для
определенного количества компонент nl9n29 ..., ni9 которые преобразуются в
химических реакциях, изменение энтропии запишется как
«=(fJ ""■+(ё) *■■ + • ■'• + (£)""' - 2 (£) **• <2-4>
i
Изменим запись (2.4) с учетом формулы для химического
потенциала (1.37):
AS = —у-^Мл*- (2.5)
i
22
Если подставить (2.3) в выражение (2.5), тогда
rf<s = -f SfW/g. (2.6)
i
Де-Донде ввел новое понятие — сродство химической реакции
А = 2 fw. (2J)
Подставив (2.7) в (2.6), получим выражение для продукции
энтропии, когда в системе проходят химические реакции:
dtS = j dl > 0. (2.8)
Общее изменение энтропии в открытой системе с учетом обмена
энергией с внешней средой имеет вид
dS = ^ + ^d%. (2.9)
2.2. Скорость продукции энтропии и диссипативная функция.
Одно из наибольших достижений термодинамики необратимых
процессов, в отличие от равновесной термодинамики, состоит в том,
что она вводит понятие времени и рассматривает изменение
энтропии во времени.
Скорость продукции энтропии для открытой системы
запишется в общем виде как
dS _deS , diS (су 10v
dt ~ dt ^1F' lz"lu'
Общая скорость продукции энтропии равна сумме потока энтропии
(deS\
через открытую систему I —-) и скорости продукции энтропии
в системе (-Ы в результате необратимых процессов. Для случая
химических реакций в системе
dt T dt T v* lZeil'
где v—скорость реакции.
Возникает вопрос, юзможно ли использование понятия
энтропии, введенное в равновесной термодинамике, для описания
процессов в неравновесных ситуациях. В термодинамике необратимых
процессов допускается, что хотя система в целом неравновесна,
каждая из подсистем, выделенная в элементарном объеме,
находится в состоянии равновесия (принцип локального равновесия).
Вводится важное понятие — локальная скорость продукции
энтропии о в адементарном объеме dV.
Тогда скорость продукции энтропии
d4=\adV- (2-,2>
v
23
Так как diS >0, то и локальная скорость продукции энтропии
будет
а>0. (2.13)
Перенесем в уравнении (2.11) температуру Т в левую часть и
получим
T^^Av. (2.14)
Правая часть этого выражения представляет произведение двух
величин, одна из которых является причиной или силой
(химическое сродство Л), вызывающей химическую реакцию, а вторая
представляет собой следствие (скорость реакции v) действия данной
причины.
Рассмотрим несколько конкретных примеров, подтверждающих
правильность заключения, что Т-^г- является универсальной
характеристикой и представляет всегда произведение двух величин —
силы на скорость процесса. При перемещении тела на расстояние х
под действием силы F выполняется механическая работа
W=Fx.
Мощность процесса
N = j = Fj = Fo, (2.15)
где / — время действия силы; v— скорость движения тела. При
прохождении электрического тока / мощность будет
N = Аф/, (2.16)
где Дф — разность потенциалов.
Таким образом, в наиболее общей феноменологической форме
любой процесс можно характеризовать произведением обобщенной
силы X (причина) на обобщенный поток J (скорость процесса).
В зависимости от процесса обобщенная сила X может иметь разную
природу: в химических реакциях — химическое сродство А, в
механических процессах — сила F> в электрических явлениях —
разность потенциалов Дф, в процессах диффузии — градиент кон-
о Ас
центрации -^ , в процессах теплопроводности — градиент темпера-
АТ
туры д^.
Следует отметить, что произведение двух величин XJ
представляет мощность процесса. Посмотрим, как передается мощность
в открытой системе при осуществлении необратимых процессов.
По аналогии с техническими устройствами в биологических
системах происходит преобразование одного вида энергии в другой —
химической в электрическую (нерв), в механическую (мышца) и в
световую (биолюминесценция светляка); световой в химическую
(хлоропласт) и в электрическую (сетчатка глаза); механической
24
в электрическую (улитка внутреннего уха). Важной
характеристикой любого преобразователя энергии, в том числе и
биологического, является изменение мощности на входе (Мвх) и выходе (NhUX)
открытой системы. В общем виде изменение мощности* можно
записать
Td-§ = NBX-NBblx=JX. (2.17)
Произведение Т-^- называется диссипативной функцией. Для
неравновесных систем основной характеристикой выступает
локальная продукция энтропии а, и поэтому диссипативная функция
запишется как
Яа=ЕЛХЛ, (2ЛЗ)
k
если в открытой системе проходит k процессов. Выражение (2.18)
показывает, что протекание необратимых процессов в открытой
системе всегда сопровождается диссипацией (рассеянием) энергии.
Во всех преобразователях входная мощность превышает выходную
мощность, а это значит, что происходит преобразование энергии
высокого качества (электрической, световой, химической) в
тепловую энергию. Диссипативная функция Та = 0 только в случае
идеальных обратимых процессов.
2.3. Основные положения линейной неравновесней
термодинамики. Возникает вопрос, какие причинно-следственные связи
существуют между потоками J и обобщенными силами X. В общем виде
можно считать, что поток J зависит от силы X:J =/(X).
Разложим J (X) в ряд Маклорена вблизи равновесия
J (X) = J (0) + J' В X + J-?M X2 + ... , (2.19)
где X = 0 и J (0) = 0 — точка равновесия. Производные в точке
равновесия обозначим постоянными феноменологическими
коэффициентами У (0) = L, J"(0) = V и т. д. С учетом этих обозначений
и пренебрегая членами выше первого порядка, получим
J = LX. (2.20)
В приближении, что система находится вблизи состояния
равновесия, получается линейная связь между потоком и силой.
Экспериментальным подтверждением основных положений
линейной неравновесной термодинамики является ряд эмпирических
законов, которые устанавливают линейные соотношения вида
(2.20). Поток вещества за счет диффузии описывается с помощью
закона Фика
dm _ nodc
df u*di*
а в обобщенной форме
25
(2.21)
где т — масса вещества; D — коэффициент диффузии; «S-— площадь
dc
переноса вещества; -^— градиент концентрации. Линейная связь
между потоком диффузии (Jc) и обобщенной силой Хс
осуществляется через феноменологический коэффициент LC = —DS.
Перенос тепла описывается законом Фурье:
f = ~*SS (JT = LTXT), (2.22)
где k — коэффициент теплопроводности; ^—градиент температуры.
Объемный поток жидкости через трубку выражается формулой
Пуазейля:
Ш =ЩАр (Jv = LvXv), (2.23)
где V — объем жидкости; г — радиус трубки; / — длина трубки;
т) — коэффициент вязкости; Ар — перепад гидростатического
давления.
Закон Ома устанавливает линейную связь между плотностью
электрического тока \е и напряженностью электрического поля Е:
je==aE = o^ (Je = LeXe)t (2.24)
где а — удельная проводимость вещества.
2.4. Соотношение взаимности Онзагера. В сложной
биологической системе протекают одновременно много процессов, которые
между собой могут быть взаимосвязаны. Рассмотрим два
взаимосвязанные потока jk и jn Если бы поток Jk не был сопряжен с потоком
/„, он бы зависел только от обобщенной силы Xk: Jk = LkkXk,
Но поскольку он сопряжен с потоком jnf он зависит также и от
силы ХП9 и эту связь устанавливает линейный коэффициент
взаимосвязи Lkn- Тогда для двух сопряженных потоков запишем
Jk = Lkk Xk + Lkn Xn\ (2.25)
Jn = Lnk Xk + Lnn Xn.
Если поток Jk взаимосвязан с п потоками, тогда в общем виде
Jk=VLknXn. (2.26)
п
В линейной неравновесной термодинамике особое значение
приобретает соотношение взаимности Онзагера:
Lkn = Lnk, (2.27)
показывающее, что если поток Jk, соответствующий необратимому
процессу k, испытывает действие силы другого необратимого про-
26
Рис. 5. Пассивный транспорт веществ через
мембрану М:
Ар — гидростатическое давление; Jc nJ6 «- потоки
растворенного вещества (сахарозы) и растворителя
(воды), соответственно; ^ — концентрация сахарозы;
с с> сс ; А и В — отсеки
цесса п, через посредство коэффициента
Lkn, то и поток Jn также испытывает
влияние силы Xk через тот же коэффициент
Lkn-
Подставив (2.26) в диссипативную
функцию (2.18), получим основное феноменологическое уравнение
линейной неравновесной термодинамики
Та -
ц_4
<гЛ J,
1- с? - -1
LL_" Л—
- в\
] - - °' - ]
—> —
м
То = 2j LknXkXn.
k,n
(2.28)
Рассмотрим пример применимости соотношения взаимности
Онзагера для анализа сопряженных необратимых процессов,
которые имеют место в биологических системах. Водный раствор
сахарозы находится в двух отсеках А и 5, разделенных мембраной
(рис. 5). Мембрана частично проницаема для молекул сахарозы
и полностью проницаема для молекул растворителя (воды). В
результате на мембране устанавливаются два потока — растворенного
вещества Jc и воды JB. Используя (2.18), запишем диссипативную
функцию для этих двух потоков как
То = Jс Хс -(- «/в Хв.
(2.29)
В изотермических условиях движущая сила для обоих потоков
будет состоять из двух составляющих
X = VAp + Afx, (2.30)
где Ар — разность гидростатических давлений в двух отсеках;
Afx — разность химических потенциалов вещества по обе стороны
мембраны; V — парциальный молярный объем вещества. Тогда
То = Jc(VcAp + Alio) + J в (VBAp + Ajxb)
(2.31)
или
To = JCVC Ар + JB VBAp + JcAiic + JBA\iB =
= (Jc Vc + JB VB) Ap + JcA\ic + JBA[iB. (2.32)
Разность химических потенциалов A\ic должна быть связана
с осмотическим давлением Дл, которое компенсирует разницу
в концентрациях растворов по обе стороны мембраны. Согласно
закону Вант-Гоффа,
An = RT(c?-c?)~RTAcc.
(2.33)
27
Найдем дифференциал от химического потенциала (1.54):
dp = dfi° + RTd (In с) = RT j , (2.34)
где d\i° = 0. Для нашего случая представим d\ic через небольшое
приращение химического потенциала
Д^ = #Г^> (2.35)
с
где Ъс — средняя концентрация сахарозы в системе
Подставим в уравнение (2.35) из формулы (2.33) Дя и получим
Д[лс = 4? . (2.36)
Связь двух сопряженных потоков, растворенного вещества и
растворителя, подчиняется уравнению Гиббса — Дюгема:
сс Д|яс + свА\хв = 0. (2.37)
Из этого уравнения находим, что
ДИв = -^ДИс. (2.38)
Подставив (2.36) в (2.38) и заменив VB = —, получим
св
Д^з = —КвДя. (2.39)
Теперь подставим Дц, (2.36) и Д(х8 (2.39) в (2.32):
То = (Jc Vc + JBVB) Ap + Jc^- JBVAn =
cc
- (JcVc + JBVB) Ap+(if>- JUVB) Дя. (2.40)
Таким образом, диссипативная функция То представлена новыми
обобщенными силами (Ар и Дя) и новыми потоками
Jp ss Jc*c "т" «в'в»
Ji=U-JBVB, (2.41)
сс
где /р — объемный поток; /д — диффузионный поток.
С учетом новых обозначений
То = JpAp + УдДя. (2.42)
28
Для сопряженных потоков Jp и Уд в соответствии с
феноменологическими уравнениями (2.25) имеем
jp = LppAp + LPAAn\
Уд = LAPAp + LAAAn. (2.43)
Определим смысл фономенологических коэффициентов в
предложенном модельном опыте.
1. Наложим следующее ограничение на нашу систему:
концентрация сахарозы одинакова по обе стороны мембраны: сА = св.
Значит, Ал = 0. Подставив в (2.43) Дл = 0, получим Jp = LppAp
и Уд = LppAp. Таким образом, разница в гидростатическом давлении
Ар вызывает объемный поток Jp и добавочный диффузионный поток
Уд, который приводит к перераспределению сахарозы. Появляется
снова разница в концентрациях сахарозы. Это явление известно
как ультрафильтрация. L^— коэффициент ультрафильтрации.
2. Выравниваем гидростатическое давление Ар = 0, тогда Jp =
= LPAAn и Уд = LAAAn. LAA соответствует коэффициенту гфоницае-
мости вещества через мембрану. Добавочный объемный поток Jp
называют осмотическим потоком, где LPA— коэффициент
осмотического потока. Используя соотношение взаимности Онзагера
(2.27), получим следующую связь между потоками:
Теперь мы можем из феноменологических коэффициентов
определить свойства мембраны. Рассмотрим возможное стационарное
состояние, когда объемный поток Jp= 0. Тогда из (2.43) находим
LpPAp = —LPAAn.
Вводится новая постоянная, которая называется коэффициентом
отражения (константой Ставермана):
о = — {25. (2.45)
Коэффициент отражения о зависит от свойств мембраны.
Запишем объемный поток с учетом коэффициента отражения:
Jp = LPp(Ap — oAji). (2.46)
Теперь можно определить идеальную полупроницаемую мембрану,
для которой а=1 и растворенное вещество совсем не проникает
через мембрану (полностью «отражается» на мембране): Jp =* Lpp x
X (Ар — Дя). Полностью проницаемая мембрана характеризуется
о = 0 и Jp = LPpAp.
Коэффициент отражения а в (2.45) показывает механизм
переноса вещества через мембрану. а = 0, когда £рд = 0. Это значит,
что нет сопряжения между потоками Jp и Уд — поток растворителя
29
совершается независимо
от потока растворенного
вещества. В реальных
ситуациях а < 1 и LPA ф О,
что указывает на связь
между потоками Jp и Л.
Это существенное
обстоятельство, которое часто
игнорируется, когда
рассматривают процессы
переноса воды и веществ
3 клетку независимо.
Только применение
положении линейной неравновесной термодинамики и использование
соотношения взаимности Онзагера к явлениям переноса через
клеточные мембраны позволяют правильно количественно описывать
транспорт веществ в клетку.
Измеренные коэффициенты отражения о представлены в табл. 4.
Данные показывают, что различные клеточные мембраны
значительно отличаются по проницаемости веществ.
2.5. Теорема Пригожина. Наиболее важным результатом
линейной неравновесной термодинамики явилось определение критерия
установления стационарного состояния. Как было показано в
параграфе 1.4, основным критерием равновесной термодинамики
является стремление энтропии к максимальному значению — Smax
(см. рис. 3).
Рассмотрим открытую систему, в которой проходят два
необратимых сопряженных потока — теплоты J± и вещества /2. Согласно
(2.28), с точностью до постоянного множителя Т локальная
продукция энтропии о запишется
о = JXXX + J2X2 > О, (2.47)
а сопряженные потоки
/x^Ln^ + ^X,; (2.48)
J2 == ^21^1 "I ^22^2*
Тогда
а = (LnXx + L12X2)Xt + {L21X1 + L22X2) X2 =
Учитывая соотношение взаимности Онзагера L12 = L21, получим
а - LnX] + 2L12X,X2 + L22X\ > 0, (2.49)
где Ln > 0, L22 > 0 и L12 > 0.
Допустим, что в открытой системе устанавливается
стационарное состояние и количество вещества, поступающее в систему,
равно количеству вещества, выходящего из системы, в результате
чего поток вещества /2= 0. Исследуем на экстремум величину о
4. Коэффициенты отражения а для различмях
мембран (по Качальскому, Курану, 1965)
Мембрана
эритроциты человека
^
Nltella translucens
К<0жа жабы
Вещество
Мочевина
Этиленгликоль
Этанол
Метанол
Мочевина
Ацетамид
Тиомочевина
а
0,62
0,63
0,44
0,50
1,00
0,89
0,98
30
в стационарном состоянии. Находим производную от о по Х2 при
Хг = const:
%L- = 2LX2XX + 2L22X2 = 2 (L12XX + L22X2) = 2/2 - 0.
Это соответствует экстремальной точке. Вторая производная от а
^ = 2L22 > 0. (2.50)
Таким образом, экстремальная точка соответствует минимуму
функции а.
Теорема Пригожина: в стационарном состоянии при
фиксированных внешних параметрах локальная продукция энтропии в открытой
системе стремится к минимальному значению
а-^min (2.51)
или для конечного объема V продукция энтропии в системе
стремится к минимальному значению:
|£->min. (2.52)
Теорема Пригожина о минимуме продукции энтропии в
стационарном состоянии представляет собой количественный критерий
эволюции открытой системы.
2.6. Устойчивость стационарного состояния. Системы в
термодинамическом равновесии или в стационарном состоянии являются
устойчивыми. В равновесной термодинамике хорошо известен
принцип устойчивости Ле-Шателье: всякая система, находящаяся в
состоянии химического равновесия и отклонившаяся от этого состояния
под воздействием внешнего возмущения, стремится самопроизвольно
вернуться в равновесное состояние за счет изменения параметров
в направлении, противоположном тому, которое вызвало возмущение.
Для анализа устойчивости вблизи равновесия подействуем на
систему небольшим возмущением, т. е. незначительно выведем
систему из равновесия. Математическая запись соответствует тому,
что мы производим разложение энтропии в ряд вблизи равновесия:
5 = Smax + 8S + I (62S) +.-... (2.53)
Поскольку разложение S происходит вблизи экстремальной точки
Smax, то член первого порядка малости 8S обращается в нуль и,
таким образом, устойчивость термодинамического равновесия
определяется знаком члена второго порядка малости (62S).
Переход закрытой системы в равновесное состояние определяется
стремлением энтропии к максимальному значению:
diS>0 и S/->max. (2.54)
31
Устойчивость термодинамического равновесия определяется так:
&S < 0 и I £ (VS) = ^ = 2 J*** > О- (2-55)
Основным критерием перехода открытой системы в стационарное
состояние есть стремление локальной продукции энтропии а к
минимальному значению:
gf <0 и a->min. (2.56)
dt
Устойчивость стационарного состояния определяется так:
п
Величина £ б/лбЯ^ называется избытком производства энтропии,
п
Величины б/„ и ЬХп — отклонения от значений Jn и Хп в
стационарном состоянии в результате действия внешнего возмущения.
Принцип о минимуме продукции энтропии определяет
авторегуляцию открытой системы: если открытая система в результате
внешнего возмущения выведена из стационарного состояния, то в ней
возникают силы, которые будут так изменять в ней процессы, пока
локальная продукция энтропии о не примет минимального значения,
т. е. пока система не перейдет в состояние наименьшей диссипации
энергии.
2.7. Нелинейная термодинамика необратимых процессов.
Большинство процессов в биологических системах проходит при
условиях, далеких от равновесия, когда отсутствуют линейные связи
между скоростями и силами. Для описания таких процессов
используется нелинейная термодинамика.
Напомним, что в равновесной термодинамике критерием
направленности эволюции есть увеличение энтропии (dS > 0)
изолированной системы и стремление S -> max в термодинамическом
равновесии. В линейной неравновесной термодинамике критерием служит
уменьшение продукции энтропии в системе (do < 0) и стремление
0->-min в стационарном состоянии.
Можно ли получить такой критерий для эволюции системы вдали
от равновесия? П. Глендсдорф и И. Пригожий расширили принцип
минимума продукции энтропии в нелинейную область, положив!
что стационарное состояние при постоянных потоках
характеризуется минимумом продукции энтропии.
Разложим локальную продукцию энтропии на две составляющие
da = d (Y J у \ Y r dX* mY X dif*
dt=di[L JkXk) ^LJk4T + 2jAkir'
do
dt
k
= d-£ + d4- (2-58)
dt ^ dt
Ы
Рис. 6. Изменение энтропии St в
открытой системе:
I и II — стационарные состояния; Я —область
неустойчивости системы; б — локальная
скорость продукции энтропии
Рис. 7. Зависимость скорости / процесса
от параметра системы Я:
а —простой тип бифуркации; t> —
суперкритическая бифуркация; в — субкритическая бифуркация; / — термодинамическая ветвь; 2 и 3 —
новые стационарные состояния; 4 —• область неустойчивости системы; %^ —
бифуркационная точка
При постоянстве потоков Ц£ = О
dJk
dt
Установлено, что
do
dt
dt
dt '
<0.
(2.59)
(2.60)
Это неравенство отражает наиболее универсальный эволюционный
критерий открытой системы вдали от равновесия. Знак равенства
соответствует стационарному состоянию.
Условие устойчивости стационарных состояний вдали от
равновесия запишется как
Ьха = £ 8JMk > 0.
k
(2.61)
Это соответствует положительным флуктуациям. В стационарном
состоянии положительные флуктуации (8ха >0) локальной
продукции энтропии быстро исчезают (рис. 6) вследствие принципа
минимума продукции энтропии. Система возвращается к исходному
стационарному состоянию (на рисунке показано стрелками).
Но возможны отрицательные флуктуации
Ь*о < 0,
2 8-616
(2.62)
33
которые свидетельствуют о неустойчивости стационарного-
состояния. Такие флуктуации будут нарушать его и в конечном счете
приводить к новому стационарному состоянию с уменьшенной
энтропией (AS,<0).
Рассмотрим ряд особенностей, которые проявляются при
использовании нелинейной термодинамики. Пускай имеется некоторый
параметр X (разность концентраций или другие величины), который
описывает отклонение от состояния равновесия (рис. 7)\ Равновесное
состояние характеризуется X = 0. При небольших отклонениях от
равновесия параметра X получаем набор устойчивых стационарных
состояний, которые образуют термодинамическую ветвь. Близко
от состояния равновесия термодинамическая ветвь устойчива, так
как она удовлетворяет условию 8хо >0. Но при значительном
удалении параметра X от равновесия термодинамическая ветвь
становится неустойчивой. Переход на новую, нетермодинамическую ветвь
происходит при определенном критическом значении параметра
X = Xk, когда флуктуации локальной продукции энтропии
изменяют знак: 6д;0Г < Q. Такую критическую точку называют
бифуркацией. В бифуркационной точке система теряет устойчивость и
переходит в новое состояние. На рис. 7 показаны различные тины
бифуркаций — простые и сложные. Для сложные бифуркаций
возможна проявление мж»гееет»еншети> стационарных» состояний
для одного и того же параметра, когда X >Xk. Экспериментально
это подтверждено для автокаталитических реакций при синтезе
полинуклеотидов в проточном реакторе.
Особый интерес вызывают бифуркации, когда* вдали1 от
равновесия в результате нарушения устойчивости системы (бхо< 0) мо-
иут возникать новые стабильные пространственные, временные
и пространственно-временные структуры. Неравновесность,
значительные флуктуации приводят к возникновению-
динамических упорядоченностей, называемых, диссипативными
структурами. Поддержание диссипативных структур достигается за счет
непрерывного обмена с окружающей средой энергией и веще-
втвот
Вовшжны различные тшы диссипативных структур*. Один класс
таких структур связан с бифуркациями, которые ведут к
спонтанному разрыву пространственной' гомогенности раствора, (нарушение
пространственной симметрии). Примером такого явления* является
реакция Белоусова — Жаботинского. Если в пробирку слить в
определенных пропорциях Ce2(S04)3, окислитель КВг03,
восстановитель СН2(С00Н)2 (малоновая кислота) и добавить несколько капель
ферроинац индикатора окислительцогвосстановительней реакции,
то» в гомогенном растворе образуются- четко разделенные зоны с
синей и красной окраской. Происходит спонтанное нарушение
пространственной симметрии?, ведущее к образовании^ упорядоченных
пространственных структур». При непрерывном подводе реагентов
и отводе продуктов в проточном реакторе продолжительное время
происходят циклические изменения цвета (от синего к красному
и наоборот) с частотой 0,01 Гц. Циклическое изменение окраски
34
детвора связано с попеременным изменением степени окисления
%рия (Се*+^Се*+).
Другой класс бифуркаций приводит к нарушению временной
симметрии (бифуркации Хопфа). В этом случае образуются новые
упорядоченные *в® времшн диссипативиые структуры. ТВ
особенности такие бифуркации характерны для многих биохимических
реакций. При определенном критическом значении X = Xk система
становится неустойчивой и возникает новое состояние, в котором
наблюдаются периодические во времени осцилляции концентраций.
К числу наиболее значительных колебаний относятся колебания
активностей ферментов в метаболитических процессах, в гликолити-
ческом цикле. Период таких колебаний составляет минуты и часы.
Молекулярные осцилляции представляют собой элементы
биологических часов., которые работают в отсутствие внешних датчиков
ритма.
Многие реакции идут как автокаталитические с наличием
обратных связей. В этом случае наблюдаются периодические изменения
концентраций в реакционной системе. Колебательные модели
широко используются в биологии. Поведение автокаталитической
реакции с обратной связью и динамика численности популяций
описываются системой нелинейных дифференциальных уравнений.
Рассмотрим это на примере наиболее хорошо изученной модели
Вольтер ра — Лотка, описывающей взаимодействие хищник —
жертва. Если X — число травоядных, a Y— число хищнике©, то
кинетические уравнения для этой модели записываются
следующим образом:
_ = kxX — k2XY\
^ = k2XY-k3Y, (2.63)
где kx— константа естественного размножения жертв; k2—
константа взаимодействия хищник — жертва; k3— константа
естественной смертности хищников.
Эго нелинейные дифференциальные уравнения. В стационарном
режиме левые части этих уравнений приравниваются к нулю и
находятся координаты стационарной точки
Г, и Г° _ F
Х0=3 „У, = £. (2.64)
Для линеаризации системы (2.63) представим решение в
следующем виде
X = Х0 + Х(Р* и Y =* У0 + уе<»*, .(2.65)
где л; и у — достаточно малые отклонения от стационарной точки
^о и Y0; х <^Х0 и у <с^о- Подставляя (2.65) в дифференциальные
Уравнения (2.63) и пренебрегая членами высоких порядков по # и у,
мы получим уравнения для со:
(ох -f- k3y = 0 и —kxx + coy = 0. (2.66)
35
%
т0
Рис. 8. Фазовая траектория изменения численности
жертв X и хищников Y:
О —особая точка (центр), определяющая стационарное
состояние системы
*.
Клеточные структуры
4. Биологическая эволюция
Характеристическое уравнение для
определения частоты со будет
- со2+ Мз= 0. (2.67)
Тогда решение уравнения дает
Таким образом, популяции жертв X и хищников Y изменяются
с одинаковой частотой со вокруг стационарной точки Х0 и Y0.
Изменения X и Y удобно представлять на фазовой плоскости
(рис. 8). Система вращается с частотой о на фазовой плоскости
вокруг особой точки, называемой центром, которая характеризует
стационарное состояние системы с Х0 и У0. Колебания
численности обусловлены взаимодействием между хищниками и жертвами.
Если хищники поедают много жертв, то численность жертв
уменьшается, что в конечном счете
приводит к сокращению популяции
хищников. В свою очередь, уменьшение
численности хищников
способствует росту жертв и т.д. Возникают
циклические колебания X и У,
смещенные по фазе друг относительно
друга. Близкие к модели Вольтер-
ра — Лотка фазовые траектории
будут наблюдаться для многих
автокаталитических реакций.
Возможны более сложные типы
диссипативных структур, когда в
результате временных изменений
концентраций и нарушения
пространственной гомогенности возникают
бегущие волны, распространяющиеся
в объеме. Такие волны могут
образовывать различной формы
вращающиеся спирали. Автоволновые
процессы проявляются во многих
активных биологических системах.
Первая простейшая модель
возбудимой среды была предложена Н.
Винером и Ф. Розенблютом
(1946).Передача волн возбуждения наблюдается
Рис. 9. Схематическое представление
четырех эволюционных этапов — от
простого неорганического материала к
биологическим системам
Гиперциклы
(РНК, ДНК, белки)
3. Самоорганизация
I----I
Биологические макромолекулы
(белки, нуклеиновые кислоты)
^
2. Химическая эволюция
\iLiA
Простейшие молекулы
(H2>N2,CH4| H20)
^ж~
Простейший материал
(атомы Н)
36
живой ткани, состоящей из возбудимых клеток. Возникновение
волн возбуждения и их распространение определяются
характерными свойствами элементов активной среды. Каждый из них может
находиться в трех состояниях: возбуждения, рефрактерное™ и
покоя. Каждый элемент имеет запас энергии (в виде мембранного
потенциала или энергии окисления), которая используется для
распространения возбуждения. Переход между этими состояниями
происходит с определенной периодичностью, что и определяет
автоволновой процесс в активной среде.
В литературе широко обсуждаются вопросы о возможной роли
диссипативных структур в эволюционных процессах биологических
структур. Согласно И. Пригожину, происхождение жизни может
быть связано с серией последовательных бифуркаций, которые
привели к созданию систем с повышенной упорядоченностью.
М. Эйген выдвинул гипотезу о специальных диссипативных
структурах, так называемых -гиперциклах, образование которых явилось
необходимым этапом в ходе эволюционного развития биологических
объектов (рис. 9). Гиперцикл — это объединение
самовоспроизводящихся единиц ограниченной длины в новую устойчивую систему,
способную к согласованной эволюции.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ К ЧАСТИ I
1. Энтальпия закрытой системы определяется соотношением Н = U +
+ pV. Как изменяется энтальпия в процессе расширения системы при
постоянном давлении?
2. Образование сахарозы из глюкозы и фруктозы идет с участием АТФ:
Глюкоза + Фруктоза + АТФ -> Сахароза + АДФ + Ф При 298 К
изменение стандартной свободной энергии составляет AG°= —6285 Дж • моль-1.
Найти константу равновесия этой реакции и оценить, будет ли эта реакция
самопроизвольной.
3. Открытая система обменивается с внешней средой потоком энергии
/i и потоком вещества Jг. Оба эти потока взаимосвязаны. Через
определенное время открытая система переходит в стационарное состояние, в
результате чего поток энергии /х«= 0. Определите, как изменяется продукция
энтропии в стационарном состоянии.
4. Определите термодинамическую вероятность и энтропию системы,
состоящей из четырех микрообъемов, в которых 20 частиц распределились
следующим образом: 3, 4, 8 и б. Оцените, какой из двух процессов будет
самопроизвольным, если в результате определенных изменений частицы
распределились в микрообъемах в одном случае — 6, 4, 4 и 6, а в другом — 1,
И, 7 и 1.
5. Найдите связь диссипативной функции с убыванием во времени
свободной энергии и с прохождением химических реакций в открытой системе.
о. На основании представлений термодинамики необратимых процессов
опишите типы диссипативных структур, которые возможны в биологических
системах.
37
Часть II
МОЛЕКУЛЯРНАЯ БИОФИЗИКА
Молекулярная биофизика изучает структуру биологически
важных макромолекул и физические процессы, лежащие в основе
их функционирования. Для изучения биологических макромолекул
используются физические подходы и широкий арсенал
биофизических методов. Основное внимание уделяется изучению
структурной организации белков и нуклеиновых кислот, так как эти
биологические макромолекулы играют важную роль во всех клеточных
процессах.
Глава 3. БИОЛОГИЧЕСКИЕ МАКРОМОЛЕКУЛЫ
В РАСТВОРЕ
Белки и нуклеиновые кислоты значительно различаются по
размеру и молекулярной массе, которая изменяется от Ю3 до 1010.
Молекула с молекулярной массой 10е состоит приблизительно иг
105 ковалентно соединенных атомных групп, что и определяет
макромолекулярность строения белков и нуклеиновых кислот.
Сложность строения на атомном уровне предъявляет свои
требования и особенности при изучении биологических макромолекул.
Только рентгеноструктурный анализ позволяет получить прямую
информацию о пространственной структуре макромолекул
(расположение всех атомов в трехмерном пространстве). Для этого
требуются- гомогенные, хорошо очищенные препараты, которые
образуют кристаллические структуры. В настоящее время это сделано
только для небольшого количества биомакромолекул.
Если получить хорошие кристаллы макромолекул не удается,
тогда используют непрямые методы исследования структурных
особенностей биологических макромолекул. R отличие от рентгено-
структурного анализа, эти методы позволяют изучать
макромолекулы в растворе в условиях, когда их состояние и поведение
приближаются к нативным макромолекулам в клетке. В табл. 5 приведены
наиболее важные биофизические методы, используемые для
изучения биологических макромолекул.
Следует заметить, что эффективность каждого из методов
возрастает, если этот метод используется в комплексе с другими
методами при изучении одной и той же макромолекулы. G помощью
38
Методы, используемые для изучения биологических макромолекул
Метод
Получаемая информация
Дифракция рентгеновских
лучей
Дифракция нейтронов
Электронная микроскопия
Спектрофотометрия
Дифференциальная
спектрофотометрия
ИК-спектроскошя
Раман-спектроскопия
Круговой дихроизм (КД)
и дисперсия оптического
вращения (ДОВ)
Флуоресценция
Миграция энергии
возбуждения
ЯМР
ЭПР
Электрофорез
Вискозиметрия
Диффузиметрия
Седиментационный анализ
Квазиупругое рассеяние
света
Пространственная структура макромолекут,
ориентация элементов вторичной стуктуры; форма
и размеры макромолекул
Пространственное расположение доменов в
макромолекуле и субъединиц в молекулярных ассоциатах
Форма и размер макромолекул: упаковка
субъединиц
Вторичная структура макромолекул, ионизация
отдельных групп
Доступность для молекул растворителя
хромофорных групп в макромолекуле, конформацисиные
состояния макромолекул
Вторичная структура и колебательная динамика
макромолекул
Конформационные изменения макромолекул в рас-
твэре, вторичная структура макромолекул
Вторичная структура макромолекул; степень
связывания с лигандами
Конформационные состояния макромолекул;
подвижность хромофорных групп и динамика
макромолекул
Расстояние между хромофорами в макромолекуле
Конформация макромолекул и отдельных групп;
динамические свойства, степень связывания лиган-
дов, доступность боковых групп и их окружение
Конформация макромолекул; локальная
подвижность структуры и гидратной оболочки
Молекулярная масса и субъединичный состав
макромолекул
Молекулярная масса и гибкость макромолекул
Молекулярная масса и форма макромолекул
Молекулярная масса и форма макромолекул
Коэффициенты диффузии; молекулярная масса
и размеры макромолекул
различных методических подходов удается получать богатую
информацию об изучаемом объекте.
Изучение структурной организации макромолекул — не
праздная самоцель. Наиболее важные вопросы, рассматриваемые в
молекулярной биофизике,— как связаны структура макромолекулы
и биологическая функция, какие особенности структурной
организации необходимы для выполнения данной функции, какие
структурные изменения происходят при функционировании биологических
макромолекул.
3.1. Конформации макромолекул. Разнообразие функций
макромолекул, в клетке в значительной мере определяется их
пространственной организацией. Одна из наиболее трудных задач
молекулярной биофизики — выяснение физических основ стабилизации
39
макромолекул, в результате чего они приобретают компактную
пространственную структуру, отличающуюся тонкой организацией
и высокой специфичностью. Эта задача приобретает особое значение
из-за того, что биологическая активность макромолекул
чувствительна к изменениям пространственной структуры.
Условно выделяют несколько уровней структурной организации
макромолекул. Наиболее низким уровнем является первичная
структура макромолекулы — последовательность звеньев в цепи
биополимера, связанных прочными ковалентными связями. В
нуклеиновых кислотах первичную структуру определяет
последовательность ковалентно связанных нуклеотидоввполинуклеотидных цепях;
в белках — последовательность ковалентно связанных аминокислот
в полипептидах. Ковалентные связи достаточно устойчивы. Свободная
энергия их образования составляет 200—800 кДж • моль""1.
Высшими уровнями организации макромолекул являются:
вторичная структура — локальное упорядочивание отдельных
участков полимерной цепи; третичная структура — пространственная
укладка всей цепи; четвертичная структура — пространственное
расположение нескольких компактно организованных полимерных
цепей с образованием надмолекулярного комплекса. На более
высоких уровнях организации важное значение приобретают некова-
лентные, слабые связи, которые стабилизируют пространственную
структуру макромолекул.
Вращения вокруг одинарных ковалентных, связей вызывают
образование различных поворотных изомеров или конформаций
полимерной цепи. Конформация макромолекулы — это способ
укладки полимерной цепи (без разрыва ковалентных связей) за счет
образования большого количества слабых связей, в результате чего
создается наиболее термодинамически выгодная и стабильная
пространственная структура макромолекулы. Энергия слабых связей
достаточна для стабилизации конформаций макромолекулы, так
как при комнатной температуре (Т = 300 К) она превышает
среднюю тепловую энергию молекул Wr~ 2,5 кДж • моль"1. Изменение
факторов окружающей среды (температура, рН, ионная сила),
добавление в водный раствор денатурирующих веществ (мочевина,
гуанидин гидрохлорид, спирты, детергенты) вызывают кон фор ма-
ционную перестройку макрохмолекулы с образованием новой
стабильной пространственной структуры. Конформационные
изменения в белках и нуклеиновых кислотах происходят на более
высоких, чем первичная структура, уровнях организации. Такие
изменения сопровождаются разрывом и образованием многих слабых
связей.
3.2. Силы, стабилизирующие пространственную структуру
макромолекулы. Кратко рассмотрим природу слабых связей,
стабилизирующих пространственную структуру макромолекул. Для
наглядности на рис. 10 схематически изображены нековалентные
взаимодействия между отдельными группами в полипептидной цепи:
электростатические взаимодействия между заряженными остатками
аминокислот, ван-дер-ваальсовые взаимодействия между незаря-
40
Рис. 10. Слабые связи в биологических макромолекулах:
/_ водородная связь между пептидными группами в а спирали; 2 — гидрофобные
взаимодействия неполярных остатков фенилаланина; 3 — дисперсионные взаимодействия
нсполярных остатков аланина; 4 — электростатические взаимодействия между
заряженными остатками лизина и аспарагиновой кислоты; 5 — диполь-дипольные взаимодействия
уежду остатками серина
женными аминокислотными остатками, водородные связи и
гидрофобные взаимодействия.
Электростатические и ван-дер-ваальсовые взаимодействия.
Энергия электростатического взаимодействия Wa между заряженными
группами выражается как
где qx и q2—электрические заряды групп; г — расстояние между
заряженными группами; е — диэлектрическая постоянная; е0=
= 8,85 • 10~12 Кл • В"1- м"1. Многие ионизированные боковые
группы в белках способны образовывать солевые мостики благодаря
электростатическим взаимодействиям. В области нейтральных рН
отрицательно заряжены аспарагиновая и глутаминовая кислоты,
а также С-концевые остатки полипептидной цепи;" положительно
заряжены боковые цепи лизина, аргинина, имидазольное кольцо
гистидина и N-концевые аминокислоты. Энергия электростатических
взаимодействий между группами зависит от микроокружения
заряженных групп в белковой глобуле. Вблизи поверхности белка,
где е ~ 80 (диэлектрическая проницаемость воды), энергия меньше.
Внутри белковой глобулы е значительно уменьшается (приближенно
е = 2—5) и тем самым приводит к увеличению W3. Энергия
электростатических взаимодействий составляет — 40.... — 400 кДж - моль"1.
Интерес вызывают очень короткодействующие
ван-дер-ваальсовые взаимодействия, которые включают дисперсионные и диполь-
дипольные взаимодействия.
41
Дисперсионные взаимодействия проявляются между
нейтральными или неиолярными группами. Для двух неполярных групп
энергия дисперсионных взаимодействий №дис имеет вид
\V/ 3 '1*2 ala2 /Q 9\
м^дис 2 ^q^ • —, \у.&)
где 1г и /2—потенциалы ионизации групп; ах и
а2—поляризуемости групп. Энергия связей благодаря дисперсионным
взаимодействиям между неполярными* группами в макромолекулах составляет
— 4... — 40 кДж • моль""1.
Взаимодействия диполь-дипольного типа имеют место между
полярными группами с постоянными дипольными моментами щ
и fi2- Энергия диполь-дипольных взаимодействий W^ выражается
в таком виде:
2 2
Гдд = ~б^л^^' (3,3)
где Т — абсолютная температура; k0—постоянная Больцмапа
(&0= 1,38 • 10"23 Дж • К""1). Постоянный диполь может
индуцировать дипольный момент в соседней неполярной группе, благодаря
чему возникают взаимодействия типа диполь —индуцированный
диполь с энергией:
где \i — постоянный диполь; а — поляризуемость неполярной
группы. Энергия взаимодействия типа диполь — диполь и диполь —
индуцированный диполь составляет — 0,4... — 4 кДж • моль "*.
Электростатические взаимодействия проявляются на больших
расстояниях (дальнодействующие взаимодействия),ван-дер-ваальсовые
взаимодействия—наблизких расстояниях между труппами (близко-
действующие взаимодействия).
Водородная связь. Две группы, донорная Д—Н и
акцепторная А, образуют водородную связь, когда особую роль играет атом
водорода донора. Наличие водородных связей в системах
экспериментально регистрируют с помощью спектральных методов (ИК-
спектроскопия и протонный магнитный резонанс). Об образовании
водородных связей в жидкостях судят по температурам
замерзания Т3 и кипения Гк жидкостей. Например, сравним Т3 и Тк для
двух жидкостей Н20 и H2S, молекулы которых близки по размеру:
для Н20 — 73= 273 К и Тк= 373 К; для H2S- Т3 = 190 К и 7К=
= 211 К. Значительные различия в этих показателях указывают на
сильные межмолекулярные взаимодействия в воде за счет
водородных связей.
Водородная связь образуется между полярными группами,
содержащими атом водорода (О—Н, N—H, S—Н), и такими
атомами, как О, N, S. Водородные связи имеют резко направленный
характер (так, при образовании связи все три атома должны быть
42
и
Рис. 11. Структура воды:
а — молекула воды; м- — диполъный
момент; б — тетрээдричесная структура
воды: 0, /, 2, 3 и. 4 — молекулы воды;
51— водородные связи-; 6 — ребро
тетраэдра; в —модель «мерцающих»
кластеров / — кластер, 2 — неассоциирован-
иые молекуляи воды: 2еи — валентный
угол
[d/1
\п\1\
\\\\
<?
3<Х^ 4
z/o~«\J
\
\у*
°-*
AH^ol
AG>Q\
A5<Q\
Рис. 12. Схематическое
изображение взаимодействия неполярных
молекул- в воде:
» —две молекулы (/ » 2) о большими
неполярными участками 3, 4 — упарядо-
ченная вода (кластер): б — гидрофобные
в>звямо действ и я> юетэлзярных, участков
коллинеарны) иобозначаются пунктирными линиям**: N—Н 0=
= С. Энергия водородных связей —4...—30 кДж • моль"1. Раньше
считалось, что водородная связь обусловлена в значительной мере
электростатическим притяжением, возникающим из-за наличия
некомпенсированного положительного заряда на водороде и
электроотрицательного заряда на атомах О, N, S. КвантоЕо-механиче-
ские расчеты показали, что наряду с электростатическим
взаимодействием определенный вклад в* энергию водородной связи вносит
дисперсионное взаимодействие между атомами. Водородные связи
играют главную роль в стабилизации вторичной структуры белков
(связь между пептидными группами (рис. 10) и вторичной
структурой ДНК (связь между основаниями Г—Ц и А—Т)>.
3.3. Гидрофобные взаимодействия и структура воды. Вода —
наиболее важный компонент в клетке. Она представляет среду,
в которой функционируют биологические макромолекулы.
Актуальным вопросом являются структура воды и ее роль в
формировании стабильной конформации макромолекул.
Молекула воды имеет следующее строение (рис. И,а): длина
связей ОН равна 0,096 нм и угол 2а = 104,52° В результате
асимметрии молекула воды обладает значительным дипольным
моментом, fx = 1,82 Д = 6,08 • 10~30 Кл • м (единица дипольного
момента — дебай [Д]). В СИ 1Д = 3,338 • 10"30 Кл • м. При
Т = 298,15 К диэлектрическая проницаемость воды 8= 78,54,
поверхностное натяжение о = 0,07275 Н • м-1 (72,75 дин • см _1).
43
Вода, как один из основных компонентов биологических систем,
обладает весьма необычными свойствами. В отличие от многих
других жидкостей, для воды характерно увеличение объема при
замерзании. При плавлении льда происходит уменьшение объема
и при 4°С вода имеет максимальную плотность: при 273,15 К р =
= 0,9167 • 103 кг . м"3, при 277,15 К р = 1 • Ю3 кг • м~3. Как уже
отмечалось раньше, вода имеет максимально высокие температуры
плавления и кипения и большую теплоемкость (С = 75,3 Дж х
X моль""1- К-1). Все эти аномалии связаны со структурой воды.
Каждая молекула воды может выступать донором и акцептором
водородных связей, в результате чего вода сильно ассоциирована
с координационным числом 4. Атомы кислорода молекул воды 1, 2,
3 и 4 располагаются в вершинах тетраэдра, в центре которого
размещается молекула воды «0» (рис. 11,6). Одновременно каждая
молекула тетраэдра связана водородными связями с соседними
молекулами воды. Это способствует образованию трехмерной сетки ео-
дородных связей. Если моделировать молекулы еоды в виде шариков
радиусом 0,14 нм, то структура льда не представляет плотную
упаковку. Образуется ажурная конструкция, скрепленная
водородными связями. В результате наличия внутренних пустот
кристаллическая вода представляет собой рыхлую структуру
с меньшей плотностью.
Структура жидкой воды менее изучена. В настоящее время
обсуждаются две группы моделей жидкой воды. В одной группе
моделей вода рассматривается как единая трехмерная структура тетра-
эдрически координированных молекул воды (модель непрерывной
структуры воды). Согласно этой модели, факторы внешней среды
(температура или давление) вызывают только деформацию
(растяжение х изгибание) водородных связей, но не их разрыв.
Вторая группа — это модели смесей, в которых вода
рассматривается как совокупность молекул, по-разному связанных
водородными связями. Наибольшее распространение получила модель
мерцающих кластеров (Франк, Уэн, 1957) (рис. 11,в). Кластеры —
это кратко живущие ассоциаты молекул воды (время жизни
кластера 10~10—10~и с). Они постоянно распадаются и вновь образуются
в виде кооперативного процесса: образование или разрыв одной
водородной связи значительно облегчает образование или разрыв
других связей. Г. Немети и X. Шерага оценили, что при 293 К
примерно 70 % молекул воды находятся в виде кластеров и только
30 % молекул не ассоциированы. С увеличением температуры
количество кластеров и их размер уменьшаются.
Молекулы воды влияют на конформацию макромолекул.
Например, в белках молекулы воды могут конкурировать за места
образования водородных связей с полярными аминокислотными
остатками. Но в белке есть большое количество неполярных
боковых групп. Возникает вопрос, как будут вести себя неполярные
вещества, которые слабо или почти не растворяются в воде.
Принимая во внимание аномальные свойства воды и слабую растворимость
в ней неполярных веществ, В. Каузман впервые ввел понятие гид*
44
рофобных взаимодействий. Следует отметить, что в данном случае
речь идет не о каких-то особых связях между неполярными
молекулами, а о неспецифических гидрофобных взаимодействиях,
определяемых изменением структуры воды при внедрении в нее
неполярных молекул. Рис. 12 упрощенно и схематически объясняет
физическую суть гидрофобных взаимодействий. Согласно
термодинамическим данным, внедрение неполярных молекул в воду
сопровождается существенным изменением термодинамических величин.
При растюрении неполярных молекул в юде суммарное изменение
энтальпии незначительное (АЯс^О), но при этом значительно
увеличивается свободная энергия (AG>0). Согласно (1.31), AG =
= АН—TAS, и увеличение свободной энергии без изменения
энтальпии будет связано с уменьшением энтропии (AS < 0)
(рис. 12,а). Эго значит, что система переходит в неустойчивое
состояние с увеличенной свободной энергией. Такой переход
энергетически невыгоден.
С чем связано уменьшение энтропии системы при растворении
неполярных молекул? Экспериментально показано, что такое
понижение связано с изменением структуры воды. Вблизи
неполярных участков уменьшается подвижность молекул воды, они
упорядочиваются в кластерные структуры. Таким образом, введение
неполярных молекул в юду сопровождается неблагоприятным
увеличением свободной энергии и значительным уменьшением
энтропии системы благодаря упорядочиванию молекул воды. Согласно
Каузману, гидрофобные взаимодействия состоят в благоприятном
сближении и взаимодействии неполярных молекул, чтобы
устранить или уменьшить невыгодные контакты с полярными молекулами
воды (рис. 12,6). В результате гидрофобных взаимодействий
значительно увеличивается энтропия системы. Поскольку таксе
изменение энтропии вносит наибольший вклад в уменьшение сБсбодной
энергии системы, это значит, что гидрофобные взаимодействия имеют
энтропийную природу.
Важной характеристикой при оценке гидрофобности
аминокислотных остатков в белках является свободная энергия переноса
AGr такого остатка из гидрофобного окружения в воду. В
результате экспериментальных исследований и расчетов определена
шкала гидрофобности у позволяющая оценивать AGr переноса
боковой группы аминокислоты из 100 % этанола в воду. Энергия
переноса боковой группы хорошо коррелирует с площадью S
поверхности аминокислоты, доступной молекулам воды. В этой
шкале наиболее гидрофобным является триптофан; для него AGr =
= 14 кДж • моль"1 и S = 2,0 нм2. Далее в шкдле гидрофобности
идут фенилаланин (AGr = 10,5 кДж • моль"1 и S = 1,3 нм2) и
тирозин (AGr = 9,6 кДж • моль"1 и S = 1,5 нм2). Внизу шкалы
гидрофобности располагаются аминокислотные остатки, проявляющие
гидрофильный характер: аланин (AGr = 2,1 кДж • моль"1 и S =
= 0,3 нм2) и серии (AGr = 1,25 кДж • моль"1 и S = 0,5 нм2).
3.4. Вязкость растворов макромолекул. Движение
макромолекул в растворе зависит от их формы и размеров. Гидродинамические
45
' 2 J ^^ U
Рис 13. Физические модели макромолекул:
/ — сфера, радиусом г; 2 — вытянутый эллипсоид вращения, а > Ь; 3— сплющенный
эллипсоид вращения, а < bi 4 — вытянутая, стерж необразна я макромолекула, а > Ь\ а и Ь —
— полуоси эллипсоида
методы (измерение «вязкости, диффузии, седиментации) позюляют
изучать определенные особенности движения и ориентации
макромолекул в растворителе и с помощью простых моделей определять
общую форму, эффективный размер и молекулярную массу
макромолекул. Для описания формы биологических макромолекул
-наиболее полезными моделями являются сфера, эллипсоид вращения,
жесткий стержень (рис. 13). Макромолекулы могут быть достаточно
гибкими, образуя или слабо упорядоченные клубни, или жесткие,
вытянутые структуры. Эти конформации аппроксимируются
соотношением полуосей эллипсоида вращения а\Ъ.
Вязкость раствора характеризует внутреннее трение,
обусловленное межмолекулярными взаимодействиями. Если выделить два
слоя жидкости, находящихся на расстоянии dy и движущихся
с разными скоростями в направлении ху то, согласно закону
Ньютона, сила трения между слоями будет
F=r,s|, (3.5)
где S — площадь соцрикосновения слоев; ~ — градиент скорости,
изменяющийся в направлении уу перпендикулярном движению
жидкости; Y] — коэффициент вязкости, который является
индивидуальной характеристикой раствора, зависящей от формы
макромолекул и температуры среды. В СИ он измеряется в Па • с (кг X
X м"1- с_1= 10 пуаз). Закон Ньютона выполняется при
небольших скоростях течения жидкости, когда поток имеет ламинарный
характер.
Вязкость определяют капиллярными вискозиметрами
Оствальда, измеряя время t вытекания раствора фиксированного объема V
(закон Пуазейля, (2.23)).
А. Эйнштейн впервые нашел связь удельной вязкости с
параметрами молекул:
%A~v/20l/ = vO, (3.6)
где п0— число макромолекул в единице объема; V — объем
макромолекулы; v — инкремент вязкости, или фактор формы
(коэффициент Симхи); Ф = n0V — объемная доля, занимаемая
макромолекулами в растворителе.
46
В (3.6) и0 можно выразить через концентрацию с макромолекул
«о = Л^, (3.7)
где М — молекулярная масса макромолекулы; N0— число Аво-
гадро. Тогда удельная вязкость
или для разбавленного раствора характеристическая вязкость
запишется, как
ltll = v[^], (3.8)
Это выражение показывает связь характеристической вязкости
с параметрами макромолекулы.
Экспериментально установлено, что [ц] слабо зависит от
молекулярной массы, а в большей мере — от формы макромолекулы,
что определяется коэффициентом Симхи v. Для жестких
сферических частиц А. Эйнштейн получил v = 2,5. Для макромолекул,
форма которых отлична от сферы, v >2,5. Чем больше вытянутость
или сплющенность эллипсоида вращения, т. е. чем отношениеа/Ь
больше или меньше I (рис. 13), тем больше для* таких
макромолекул v и тем большая величина [т]]. Для эллипсоидов вращения v
изменяется следующим- образом в зависимости от вытянутое™
a/&=1hv = 2,5; a/b = 5 и v = 5,806; a/b = 10 и v = 13,634; a/b=
= 100 и v = 593,7. Глобулярные белки (ри€о»уклеаэв А„ лизоцим,
гемоглобин и др.) имеют небольшую характеристическую вязкость,
[т]]=(2,7—3,7) 10"3 м3 -кг""1, и для них v изменяется от 3 до- 6,
Фибриллярные белки имеют большую характеристическую вязкость
и для них значительно увеличивается v: трон«шиози»[т1] =52 х
X КГ* м3 • кг"1, v = 74 и а/Ь = 29; миозин — [т]] = 217 •
. Ю-3 м* • кг1, v = 300 и а/Ь = 68.
Любая макромолекула имеет определенное количество
связанной воды (килограммы воды на 1 кг сухого вещества). Объем гидра-
тированной макромолекулы запишется
Vn«p = 7r(F8+ «?,), (3.9)
где б — степень гидратации макромолекулы; V\— парциальный
удельный объем чистой воды; V2—парциальный удельный объем
макромолекулы. Тогда из (3.8) и (3.9) находим
[л] = v (V2+ evi) (3.10)
и получаем связь характеристической вязкости с гидратацией
макромолекул .
3.5. Диффузия макромолекул. При движении макромолекул
в растворителе возникает сила трения
F,= -fv9 (3.11)
47
где v — скорость движения; / — коэффициент внутреннего трения
(фрикционный коэффициент).
Фрикционный коэффициент тесно связан с размерами и формой
молекул. Измеряя /, мы могли бы легко оценивать размер
макромолекул. Для случая сферических макромолекул по формуле
Стокса
/ = 6ят]Г. (3.12)
На поведение макромолекул в растворе основное влияние
оказывают столкновения с молекулами растворителя (1013—Ю15 стол<-
кновений за секунду для больших макромолекул), обусловленные
тепловыми движениями. Это определяет статистическое поведение
макромолекул — хаотичность движения (броуновское движение).
Согласно законам статистической физики, хаотическое
движение макромолекул можно характеризовать с помощью
среднеквадратичного смещения х2:
"*2 = 2^Д/, (3.13)
где Д£ — время наблюдения за хаотическим движением
макромолекул. Таким образом, измеряя х2, мы можем определить /, а
следовательно, и размеры макромолекулы. Но мы не можем следить
за поведением отдельной макромолекулы и, следовательно, ке
можем измерять х2. Поэтому нужны косвенные способы
определения /.
Поступательная диффузия. Диффузия — это
перемещение молекул из области с высокой концентрацией в область с низкой
концентрацией при отсутствии движущей силы, т. е. в результате
беспорядочного, хаотического движения. Поступательная
диффузия — самопроизвольный процесс.
Поток вещества из области с одной концентрацией в область
с другой концентрацией пропорционален градиенту концентраций
g-x (первый закон Фика):
где п — число молекул; А — площадь; D — коэффициент диффузии
(м2* с"1). Знак «минус» означает, что поток направлен в сторону
уменьшения концентрации.
Коэффициент диффузии D связан с х2 и / следующим
выражением:
Последнее выражение дает ответ на наш вопрос: измерив D, мы
сможем вычислить коэффициент внутреннего трения/, а затем
можно сделать заключение о форме макромолекулы.
48
Рис. 14. Измерение коэффициента
диффузии макромолекул:
0_ диффузия макромолекул на границе
раздела раствор — растворитель; б
—изменение ио времени концентрации (с)
макромолекул и градиента концентраций IjA на
границе раздела раствор — растворитель;
I — / = 0; 2 — tt; 3 — tt; H — высота пика
Для сферических
макромолекул радиусом г
D *
/ = 6яг,г = ^
и г =
бЯТ]
(3.16)
Масса макромолекулы с учетом
(3.16) запишется так:
4 ~ р (k0T\* 1
т = -зяг3Р = 1бЬ1т/ *•
Молекулярная масса
т — mi\Q — 1б2я!
№
(3.17)
(3.18)
Отсюда следует, что для сферических макромолекул молекулярная
масса обратно пропорциональна коэффициенту диффузии в кубе.
При экспериментальном определении величины D растворитель
наслаивают на концентрированный раствор макромолекул с
концентрацией с0 и измеряют размывание границы (рис. 14,а).
Размытые границы можно регистрировать оптическими методами:
1. По измерению поглощения света в УФ-области (поглощение
белков и нуклеиновых кислот).
2. По измерению показателя преломления п, который
пропорционален концентрации с.
Измеряя изменение во времени с (размытые границы) или
изменение градиента концентраций (рис. 14,6), можно найти D.
Измерение D облегчается, когда измеряют изменение градиента концен-
о дс
трации jr на границе раздела раствор — растворитель, т. е. в точке
* = 0:
!дс\ с
\дх)тах ~~ VI
Тогда (~ I = Н — высота пика,
\ОХ/тах
образом, мы получим
nDt
(3.19)
ас0 = Л- площадь пика. Таким
Я2 =
Л2
4nDf
(3.20)
По мере развития диффузионного процесса максимум Я
уменьшается, однако площадь А пика не изменяется. Отложив на графике зави-
49
симость Ijj) ==/(0> из наклона легко находится коэффициент
диффузии D.
Установленную экспериментальным путем величину
коэффициента диффузии обычно приводят к стандартным условиям
(бесконечное разбавление в воде w, при 293 К)< по формуле
D°2o,w = DL (3.21)
В табл. 6 представлены B%o,w ряда белков с различной формой и
размером, разной молекулярной массой. Видно, что при* увеличении
молекулярной массы в 450 раз (сравниваем гемоцианин с цито-
хромом сг) коэффициент диффузии уменьшается всего в 9 раз]
не выполняется закон М ~ 1/D3, полученный для сферических
макромолекул. Это свидетельствует о том, что форма молекул
значительно влияет на величину D.
6. Некоторые физические параметры белков: константа седиментации. S^q ш,
коэффициент диффузии D®Q w, парциальный удельный объем V и молекулярная
масса М.
Белок
Цятохром ох
Лизоцим
Рибонуклеаза
Мйоглобин
Сывороточный альбумин
человека* (САЧ)
Каталаза печени
Уреаза
Гемоцианшг
^ш-10^с
1Л
1,91
2,00
2,04
4,60
1 П,2
18,6
98,9
11,40.
11,20
13,10
11,3
6,1j0i
4,10
3,46
1,38
W л.вд-1
0^728
0,703
0,70Г
0,74
QJ33
0J35
0;73
0,73*
м
13370
13930
12640
16890
68460
250000
480000
6,6- 10е
Вращательная диффузия. С помощью поступательной
диффузии трудно получить данные о форме таких длинных и
асимметричных молекул, как миозин или ДНК.
Например, молекула миозина моделируется в виде вытянутого
эллипсоида вращения с отношением полуосей а/в = 68. Для таких
вытянутых макромолекул полезную информацию получают, изучая*
их вращение в растворе.
Рассмотрим распределение макромолекул п в телесном угле ср
в зависимости от ориентации вытянутой оси эллипсоида. Если
число молекул, направление осей которых лежит между углом ери
ф + dtp, равно dnt то плотность макромолекул на единицу телес-
1 dn
ного угла шр запишется р = -г-.
50
Скорость изменения ориентации макромолекул благодаря
градиенту плотности запишется как
dt — dtp9
(3.22)
где в — коэффициент вращательной диффузии, с"1; ^—градиент
плотности.
Так же, как и для поступательной диффузии, коэффициент
вращательной диффузии обратно пропорционален коэффициенту
трения при вращении />:
fr *
(3.23)
При вращении сферических макромолекул
/, = 8ят,г» и8=^. (3.24)
Определение 0 основано на использовании анизотропии
раствора, вызванной ориентацией вытянутых макромолекул (метод
двойного лучепреломления в потоке). Ориентация в потоке
жидкости создается за счет градиента скорости g = j .
Способ создания градиента скорости в потоке для получения
оптической анизотропии — помещение раствора макромолекул в
зазор между коаксиальными цилиндрами с разными радиусами.
Величина зазора намного меньше радиуса цилиндра (d<^r)y так чго
традиент можно считать постоянным. Существенно, чтобы
движение жидкости в зазоре, 'вызванное вращением одного из цилиндров,
было спокойным и создавался ламинарный поток. Для этого, как
правило, .вращают внешний цилиндр при неподвижном внутреннем
цилиндре. При скорости вращения 100 об/мин создается градиент
20 с-1.
На рис. J5 изображены схема установки для изучения двойного
лучепреломления и поперечное сечение коаксиальных цилиндров,
которые расположены между скрещенными поляризатором Р и
анализатором А. Если ориентация молекул совпадает с плоскостью
поляризатора или анализатора, то расщепление света на
компоненты не произойдет, и свет не будет проходить через систему. На
рисунке участки, где не проходит свет, образуют темный крест
изоклина. Свет не будет проходить в случае изотропного раствора,
когда нет градиента скорости.
Проницаемы для света только те места, где макромолекулы
ориентированы под углами к анализатору и поляризатору. Из
геометрического рассмотрения (рис. 15,6) видно, что углы (ри1|) при
перпендикулярных прямых будут равными: ф == яр. Таким образом,
определяя угол ориентации г|) креста изоклина, мы можем точно
знать угол ориентации ф макромолекул в растворе.
51
Для вытянутых эллипсоидов вращения
W = — •
12
в
(3.25)
Измеряя зависимость г|) =/(g), можно по наклону прямой
определить в. Преимущественная ориентация удлиненных макромолекул
в потоке может быть любой в интервале углов от 0 до 45°. Сравним
коэффициенты вращательной диффузии для небольшой
глобулярной молекулы гемоглобина и для стержнеподобной молекулы
миозина: гемоглобин — в = 6 • 10е с""1 и миозин — 6=7 с"1.
Вследствие очень большой вращате/ьнсй диффузии малых
макромолекул, даже при максимально дсстижимых градиентах, такие
молекулы слабо ориентируются, т. е. g/6->0.
3.6. Квазиупругое рассеяние света. Спектроскопия
светорассеяния недавно испытала новый подъем в связи с использованием
лазеров и применением специальной техники для спектрального
анализа сигналов. В то время как рэлеевское рассеяние света
макромолекулами обычно ограничивается измерением интенсивности
света, интегрированной по частотам, спектроскопия оптического
смешивания позволяет измерять интенсивность рассеянного света,
распределенную по частотам. Рэлеевское светорассеяние дает
информацию только о равновесных свойствах макромолекул
(молекулярная масса, радиус гиратации, оптическая анизотропия и др.).
Метод квазиупругого рассеяния света дает юзможность получать
Рис. 15. Схема установки для изучения
двойного лучепреломления в потоке:
а — прохождение линейно поляризованного СБета через
раствор макромолекул, находящийся между
коаксиальными цилиндрами J и 2', б —картина, наблюдаемая в
поле скрещенных анализатора А и поляризатора Р;
И — источник света; 3 — направление потока жидкости;
4 — макромолекула; ср—угол ориентации
макромолекул; ср — угол ориентации креста изоклина
Рис. 16. Блок-схема установки для изучения
квазиупругого рассеяния света:
/ — лазер; 2 — поляризаторы; 3 — линзы; 4 — кювета
с раствором макромолекул; 5 — термостатированный
кожух, 6 — фотоумножитель; 7 — анализатор спектра;
5 — регистрирующий прибор; <р — угол рассеяния света.
52
информацию о динамических свойствах макромолекул
(коэффициенты поступательной и вращательной диффузии, внутримолекулярные
времена релаксации и др.).
При динамическом рассеянии света измеряется рассеянное
излучение с длинами волн, немного отличающимися от длины волны
падающего пучка. Возникновение такого рассеяния может
объясняться несколькими причинами. Например, движущиеся молекулы
будут изменять длину волны излучения вследствие эффекта Доппле-
ра. Это будет приводить к некоторому распределению длин волн
рассеянного света. Спектральное распределение очень узкое, и для
его изучения требуется чрезвычайно монохроматический источник
света, а именно лазер (рис. 16).
Спектр рассеянного света, обусловленный случайной
диффузией, представляет собой распределение Лоренца для оптически
изотропных макромолекул в растворе, движение центра масс которых
хорошо аппроксимируется поступательной диффузией,
'<*">-М*$да]. (3-26)
где / — интенсивность рассеяного света; со — круговая частота,
со = 2jcv; v — частота света; N — среднее число макромолекул
4я cd
в исследуемом объеме; q = -=- sin-j — фактор рассеяния; D —
коэффициент поступательной диффузии; <р — угол рассеяния света; а —
молекулярная поляризуемость. Полуширина спектра будет иметь
следующее выражение:
Ао)1/2 ,= I = <7*D = D (i2)2 sin2 f . (3.27)
Итак, измеряя полуширину как функцию sin2^, можно получить
коэффициент диффузии D. Квазиупругое рассеяние света позволяет
прямо определять коэффициент диффузии макромолекул в
растворе.
Для оптически анизотропных макромолекул (моделируются
в виде вытянутых цилиндров), которые в растворе испытывают
независимую вращательную и поступательную диффузию, интенсивность
рассеянного света записывается как
«*») = &(**-* AtPn$+w]> (3-28)
где а л и а±— компоненты поляризуемости вдоль оси цилиндра
и перпендикулярно к ней, соответственно; в — коэффициент
вращательной диффузии.
Метод квазиупругого рассеяния позволяет с большой точностью
измерять коэффициенты поступательной и вращательной диффузии
макромолекул и сложных надмолекулярных комплексов.
Например, измерение квазиупругого рассеяния раствора вируса табачной
мозаики позволило измерить коэффициенты диффузии при 293 К:
53
D = (0,29 =t 0,01) • Ю-11 м2 • с-1 и в = 360 =ь 20 с"1. Метод
квазиупругого рассеяния более экспрессный и точный, чем
гидродинамические методы (см. параграф 3.5). С его помощью измерения
коэффициентов диффузию производятся достаточно быстро
(несколько минут) и-с большой точностью (около 1 %).
а.7. Седиментация макромолекул. В настоящее время одним из
наиболее распространенных методов для определения
характеристик макромолекул является метод седиментации. Седиментация —
это осаждение частиц в жидкости под действием силы тяжести.
Рассмотрим на небольшом примере, возможна ли реальная
седиментация в поле силы тяжести для макромолекул с молекулярной
массой Ю5. Энергия гравитации для такой макромолекулы между
двумя точками в> пробирке, отстоящими на расстоянии 10~2 м,
составляет Е = mgh. Если т = Ю5/6 • Ю26= 0,16 • 10~21 кг, то
Е = 0,16 • К)"21- 10 • 10~2= 1,6 . Ю"23 Дж. Величина тепловой
энергии составит
kQT= 1,38 • Ю"23. 2,93 • Ю2= 4 . Ю"21 Дж.
Видно, что тепловая энергия почти в 200 раз больше
гравитационной энергии. Таким образом, для макромолекул сила гравитации
настолько мала, что действие случайных соударений с молекулами
растворителя значительно превышает седиментацию макромолекул.
Возникшее затруднение можно преодолеть, увеличив
потенциальную энергию до величин, превышающих k0T. Это можно сделать
в ультрацентрифуге. За счет больших центробежных ускорений,
превышающих g в Ю4—Ю5 раз, создаются центробежные силы,
в результате которых легко происходит седиментация
макромолекул. Поэтому принято обозначать седиментацию как 350000 gf
когда указывают, во сколько раз ускорение в центрифуге превышает
ускорение земного тяготения. Для создания такихфантастическик
ускорений необходимы ультрацентрифуги, в которых ротор
совершает 60—70 тыс. оборотов в минуту.
С помощью оптических систем определяется скорость седимента-
dx
ции макромолекул v = щ. На рис. 17 схематически показано
смещение границы и пика седиментации. Измерив положение шлирен-
пика в зависимости от времени седиментации, легко определить
скорость седиментации макромолекул в ячейке.
Метод скорости седиментации. Метод используется
преимущественно для определения молекулярных масс
макромолекул с небольшим коэффициентом поступательной диффузии, когда
седиментация значительно преобладает над диффузией. Рассмотрим
состояние макромолекулы в ячейке (рис. 18). Через определенное
время макромолекулы седиментируют равномерно и с одинаковой
скоростью седиментации v. Это связано с тем, что силы,
действующие на макромолекулу, уравновешиваются:
/7ц = /гв + /7с (3.29)
54
Центробежная сила
Fn = nwflx = -о яг8р<о2л;,
(3.30)
где т — масса макромолекулы; г — радиус макромолекулы; >р —
плотность макромолекулы; х — расстояние от оси вращения ротора.
Угловая скорость
<o=-f[c-4, (3.31)
где п — скорость вращения ротора, об/мин.
Выталкивающая сила
FB = mQ(o2x = -«- jir3p00)2jc,
(3.32)
где m0 =■ масса вытолкнутой жидкости; р0 — плотность растворителя.
Разделим (3.30) на (3.32):
Сила сопротивления
^с = /у,
(3.33)
(3.34)
Мениск
х^ цмтробы- где / — коэффициент внутренне-
^ wp- IV^-V^y1 ^".УЧная си/ю го трения. Запишем (3.29) как
ш ttvVs::v^>vS:^:. VAv l^ momi Fh — Fb = Fc и выразим Fb че-
[си шипит 1ЛЩ1. ■..! а
В^
** I I I
| I let'
га
б
i
4х I
рез Fu, как в (3.33):
/v
Ро.
/г»
и F^l-^=fv. (3.35)
Рис. 17. Седиментация макромолекул
в кювете:
а — положение границы седиментации в
кювете (время седиментации t0, tlt ttt tz),
б — изменение концентрации с
макромолекул вдоль кюветы; в — перемещение шли-
рен пика при седиментации макромолекул
Рис. 18. Действие сил на
макромолекулу при центрифугировании:
00—ось вга цения ротора
0\
|_
-*г«
55
Подставив (3.30) для центробежной силы в (3.35), получим
т(\ — ^\<o*x*=fv. (3.36)
Отсюда масса макромолекулы запишется как
Вводится новая важная характеристика— коэффициент
седиментации s — отношение скорости седиментации v к угловому
ускорению со2лс:
v dx 1 l d(\nx) /Q oov
s~ S*i - Jt ' tib e ЙГ»-2Г" • (сЫ^
Размерность коэффициента седиментации — [с]. За единицу
коэффициента седиментации принят 1 сведберг (С) — Ю"18 с.
Вводится парциальный удельный объем
V =
т [б]- <339>
Он определяется как возрастание объема растворителя при
растворении 1 кг сухого вещества в фиксированном объеме
растворителя. Если подставить V и заменить / через коэффициент диффузии
D, получим массу макромолекулы
т = —Ы*-=.ш (3.40)
Молекулярная масса макромолекулы запишется как
М = RTs - . (3.41)
D(l-PoV)
Это — формула Сведберга. Для определения молекулярной массы
необходимо измерить на центрифуге s, определить заранее D и знать
V. Требуется высокая точность измерения V, так как для
биологических макромолекул он изменяется в небольших пределах (от 0,6
до 0,75). Ошибка при его измерении в 1 % дает ошибку в
определении М до 3 %.
Измеряют плотность раствора пикнометрическим способом
(взвешивание фиксированных объемов V растворителя и раствора).
В пикнометр заливаются одинаковые объемы растворителя и
раствора макромолекул с известной концентрацией с. Затем эти
пробирки точно взвешиваются и определяются плотности растворителя
р0 = ^ и раствора р = у. Парциальный объем находят по формуле
56
Необходимо иметь в виду следующее: для определения
молекулярной массы по формуле Сведберга (3.41) необходимо определять s
и D в одинаковых растворителях, при т одинаковых температурах,
экстраполируя полученные значения к бесконечному разбавлению.
Определяют константу седиментации slo.w Для этого в
полученное значение s вносят поправки на плотность р0 и вязкость г\:
S20, w = s —' —-=— . (3.43)
^20, w (1 — РоЮ
В табл. 6 приведены значения S2o,w и V для ряда белков и
полученные по ним молекулярные массы.
3.8. Электрофорез макромолекул. Движение частиц в жидкой
фазе под действием электрического поля называется
электрофорезом. На макромолекулы с суммарным зарядом q в электрическом
поле с напряженностью Е действует электрическая сила
^9 = qE. (3.44)
Под действием этой силы происходит ускоренное движение
макромолекул. В результате такого движения возникает сопротивление
вязкой среды с силой трения Fc=fv, где v—скорость движения
макромолекул. Через определенное время, когда силы
уравновешиваются (F9=* Fc), наступает стационарное состояние, и
макромолекулы движутся с постоянной скоростью и. При этом условии
qE=fv. (3.45)
Отношение v к напряженности электрического поля Е называется
электрофоретической подвижностью и. Из (3.45)
"=^=f• (3-46)
Электрофоретическая подвижность измеряется в м2* В"1 • с"1. Для
сферических макромолекул / = бпцг и тогда
где ц — вязкость среды; г — радиус макромолекулы.
Электрофоретическая подвижность дает информацию о форме и размерах
макромолекул. Однако (3.47) получено для идеальной ситуации,
когда макромолекула представлена в виде сферы и не учтено
влияние ионного окружения макромолекулы.
Наиболее ценным методом определения молекулярной массы
белков является электрофорез в присутствии додецилсульфата
натрия в полиакриламидном геле (Вебер и Осборн, 1969).
Экспериментально установлено, что только при определенных условиях
электрофоретическая подвижность зависит от молекулярной массы,
и на эту зависимость не влияет общий заряд макромолекулы. Для
этого белок обрабатывают 1 % раствором додецилсульфата натрия
(ДСН), который является детергентом и хорошим денатурирующим
57
^ -Рис. 19. Электрофорез в присутствии додецил-
2$ сульфата натрия (ДСН):
CJ а —комплекс полипептидной цепи (/) с молекулами
-• ДСН (2); б — полулогарифмическая зависимость моле-
ZZ кулярной массы М от относительной электрофорети-
-• ческой подвижности и, маркерные белки / — фосфо-
12 рилаза А, 2 — трансфсрин, 3 — каталаза, 4 — овальбу*
-• мин, 5 — пепсин, 5 — хдамотрипсияоген
—•
3 агентом белков. Кроме того, добавляют
Р-меркаптоэтанол для разрыва дисуль-
фидных связей. Додецилсульфат натрия
совершенно одинаково связывается со
всеми белками: 1,4 кг ДСН на 1 кг
белка. Каждая молекула ДСН несет один
отрицательный заряд и, таким образом,
общая плотность заряда примерно
одинаковая для разных белков. Таким
образом, поверхностная шуба из молекул ДСН устраняет зарядовые
различия, существующие в нативных белках. После денатурации
белка полипептидная цепь представляет вытянутый цилиндр
постоянного диаметра 1,8 нм. Длина таких стержней коррелирует с
молекулярной массой белков: чем длиннее цилиндр, тем больше
молекулярная масса (рис. 19, а).
В качестве носителя при электрофорезе используют полиакрил-
амидный гель в концентрации от 5 до 15 %. Экспериментально
установлена линейная связь между электрофоретической
подвижностью и логарифмом молекулярной массы:
и = Ь — algM, (3.48)
где а и Ь — постоянные, зависящие от свойств полиакриламидного
геля. Для определения молекулярной массы исследуемого белка
необходимо построить калибровочную кривую. В одинаковых
условиях проводится электрофорез маркерных белков с известной
молекулярной массой и строится зависимость и = f (IgM) (рис. 19, б).
По измеренной электрофоретической скорости ^на калибровочной
кривой с высокой точностью (до 5 %) находят молекулярную массу
исследуемого белка.
Второе важное преимущество электрофореза в присутствии
ДСН состоит в том, что этот метод позволяет определять
субъединичное строение сложных белков, имеющих четвертичную
структуру,
3.9. Взаимодействие между макромолекулами в растворе (теория
Дебая — Хюккеля). Биологические макромолекулы (белки,
нуклеиновые кислоты) содержат большое число ионизированных групп,
в результате чего на поверхности макромолекул имеется заряд.
Энергия взаимодействия между заряженными макромолекулами
в значительной мере будет зависеть от наличия ионов в окружающей
среде. Понимание взаимодействия между ионами и
макромолекулой представляет большой биологический интерес.
На расстоянии х определим потенциал г|), который создает
заряженная сферическая макромолекула в водном растворе с опреде-
58
Отталкивание
Рис. 20. Взаимодействие макромолекул в солевом растворе: .
а— зависимость электрического потенциала ф, создаваемого макромолекулой, от расстоя,»
ния х при: / — большой ионной силе раствор»; 2 — низкой ионной* силе раствора; х*—• де-
баевская длина; М — макромолекула; б — схема взаимодействия макромолекул при
высокой ионной силе (/) и при низкой ионной силе (2) солевого раствора
ленной концентрацией соли (рис. 20, а). Заряженная
макромолекула притягивает к себе ионы противоположного знака (противо-
ионы), в результате чего вблизи макромолекулы будет происходить
перераспределение ионов, Это должно сказаться на изменении t|)
в зависимости от расстояния х.
Используем уравнение Пуассона о непрерывном потоке
электрических зарядов в объеме:
аалр
(3.49)
где б — диэлектрическая постоянная среды; р — плотность заряда
в объеме. В растворе имеются разные типы ионов. Обозначим заряд
иона /-го типа et и количество ионов в единице объема п\. Тогда
плотность заряда
р = £ et nl.
(3.50)
На ориентацию ионов вблизи макромолекулы будут влиять
тепловые колебания, в результате чего количество ионов будет подчинять-
59
ся распределению Больцмана:
Ы^ще *«г, (3.51)
где т — среднее число ионов в единице объема; е^ —
электрическая энергия иона; k0T—тепловая энергия иона. Подставив в
уравнение Пуассона (3.49) уравнения (3.50) и (3.51), получим
t
П. Дебай и Е. Хюккель сделали ряд допущений, которые
позволили упростить (3.52):
1. Полный заряд системы равен нулю, т. е. раствор
электронейтральный:
£ etnt = 0. (3.53)
2. Электрическая энергия иона значительно меньше его тепловой
энергии:
efl<k0T. (3.54)
С учетом допущения 2 экспоненту можно разложить в ряд и
пренебречь членами второго и более высокого порядка малости:
Подставив (3.55) в (3.52) и использовав (3.53), получим
вИзЬЯ"? *)♦-«■
i
Обозначим выражение в скобках как р2\
P^^f^efm. (3.56)
i
Тогда мы получаем однородное дифференциальное уравнение
д-РЦ = 0. (3.57)
Решение этого уравнения имеет вид
г|) = yQe-p* (3.58)
(точное решение, учитывающее размер макромолекулы радиусом г,
имеет вид tf=*^e-*<*"-"r>) # Таким образом, потенциал
макромолекулы уменьшается с расстоянием по экспоненциальному закону.
Расстояние х0, на котором г|) падает в е раз (\}> = 0,37 %)t называется
60
дебаевской длиной (рис. 20, а). Это толщина ионной оболочки,
которая окружает в электролите каждую заряженную макромолекулу.
Влияние концентрации ионов на взаимодействие заряженных
макромолекул определяется важной характеристикой, которая
называется ионной силой раствори \х. Запишем (3.56) следующим
образом:
Р2 = 1'ЩТ^е'п'--^Т^ (3-59)
где ионная сила раствора
Тогда
-о = 7 = 1/"¥- <3-61>
При большой ионной силе или высокой концентрации соли
в водном растворе оболочка ионов становится тоньше, и все противо-
ионы прижимаются к поверхности макромолекулы. Расчеты
показали, что для одновалентной соли (например, NaCl или КС1)
значение х0 изменяется следующим образом от ионной концентрации
(или ионной силы): концентрированный раствор (10~^ М) — Хо=
= 3,04 нм, разбавленный раствор (10 ~4 М) — х'о= 30,4 нм
(рис. 20, а).
Представляет интерес оценка взаимодействия больших
заряженных макромолекул в солевом растворе. Результирующая сила,
которая определяет это взаимодействие,— сумма ван-дер-ваальсовой
силы притяжения (3.2) и электростатического отталкивания (3.1).
При значительном сближении макромолекул всегда преобладают
ван-дер-ваальсовые силы притяжения. На рис. 20, б схематически
показано влияние ионной силы раствора на взаимодействие
макромолекул. В разбавленных солевых растворах, когда ионная сила
небольшая, дебаевские длины х'о большие и между макромолекулами
имеют место силы отталкивания за счет больших оболочек проти-
воионов. Но при повышении концентрации соли (увеличивается jx)
дебаевская длина уменьшается. При определенной x'Q силы
притяжения начинают преобладать над силами отталкивания, и
макромолекулы ассоциируют. При высоких \х белок осаждается в растворе.
Это явление называется высаливанием. Оно широко используется
для экстрагирования и очистки белков. Явление высаливания
происходит при разных концентрациях соли в зависимости от размера,
формы и общего заряда белка.
Глава 4. БИОФИЗИКА БЕЛКОВ
Все процессы в клетке осуществляются при участии белков,
которые выполняют множество функций. Структурные белки
образуют соединительные ткани, входят в состав кожи, волос и др.
61
Невозможно представить работу генетического аппарата без участия
белков, осуществляющих репликацию, транскрипцию и
трансляцию информации. В регуляторных процессах важная роль
принадлежит гормонам, которые являются переносчиками различных
сигналов, и белкам-рецепторам, узнающим эти сигналы. Белки
осуществляют иммунологическую функцию, защищая организм от
чужеродных веществ. Транспортные белки отвечают за перенос
ионов и других веществ через мембрану. Специальный класс белков
осуществляет перенос электронов в мембранах митохондрий при
окислении. Клеточная подвижность и мышечное сокращение
связаны с функцией сократительных белков. Наиболее важная роль
принадлежит ферментам, которые катализируют и регулируют все
метаболические процессы.
Уникальные свойства белков определяются особенностями их
пространственной структуры, которая в зависимости от
последовательности одних и тех же аминокислотных остатков может быть
весьма разнообразной. Задача молекулярной биофизики состоит
в том, чтобы расшифровать структуру белков и таким образом
понять, как они осуществляют ту или иную функцию.
4.1. Первичная и вторичная структура белков. Белки не
являются статическими образованиями Это — динамические структуры,
которые могут претерпевать определенные конформационные
изменения в процессе биологического функционирования. Анализ
конформаций проводят исходя из различных уровней организации
белковых молекул. Еще в 1959 г. К. Линдерштрем-Ланг выделил
четыре уровня структурной организации белков — первичную,
вторичную, третичную и четвертичную структуру. Позже на
основании сопоставления данных рентгеноструктурного анализа,
калориметрии и других методов были выделены еще два уровня
организации — сверхвторичные структуры и домены белков (Шульц,
Ширмер, 1982).
Аминокислотную последовательность называют первичной
структурой белка. Изучение расположения аминокислот в белках
представляет важный этап в изучении структуры белка. В настоящее
время этот анализ проводится автоматически с помощью приборов
сиквенаторов. В последние годы используется новый метод
определения аминокислотной последовательности. Выделяют фрагмент
ДНК, содержащий структурный ген данного белка,
расшифровывают последовательность нуклеотидов и переводят ее согласно
генетическому коду в аминокислотную последовательность. Первичная
структура — это одномерное представление белковой молекулы.
Знание первичной структуры используется для предсказания
вторичной и третичной структуры белка. Одновременное использование
аминокислотной последовательности и кристаллографических карт
электронной плотности позволяет восстановить пространственное
расположение всех атомных групп в белке.
В полипептидной цепи пептидная группа является плоской и
жесткой. Полипептидную цепь можно представить как
последовательность однотипных плоскостей (пептидных групп), соединенных
62
-£ь-
-в
' ;-::-.v.-H;.i
L
- -2
-0~—-—ctO--
Рис. 21. Структурная организация* белковой молекулы.
Пер£ичная структуоа: 7 — / — последоватчьчость пептидных групп (заштрихованные
прямо угольники); <р и ф— торсионные углы, длина связен С — N — 0 132 нм, N — Са —•
0,147 нм и Са — С — 0,153 нм; вторичнал структ>ра 2 2 — водородные связи между
пептидными группами; третичная структура 3 3 слабые (нековалентные)
взаимодействия между боковыми радикалами R аминокислотных остатков
между собой одинарными связями N—Са и С—Са. Вращение вокруг
этих связей не является полностью свободным вследствие стериче-
ских ограничений. Угол поворота вокруг связей С—Са обозначают
—я|), а угол поворота вокруг связей N — С« обозначают —ср (рис. 21).
Г. Рамача-ндран провел расчеты конформационных состояний
полипептидной цепи с помощью электронно-вычислительных машин
и определил область возможных значений q> и i|) (графики Рамачан-
драна, или конформационные карты). На конформационных картах
значения углов ф и г|? в белках не являются произвольными, они
четко ограничены конкретными областями, что свидетельствует
о существовании ограниченного количества конформаций
полипептидной цепи.
Конформаций белковых молекул стабилизируются слабым
взаимодействием между пептидными группами (вторичная структура)
и боковыми- группами аминокислотных остатков (третичная
структура) (см. рис. 21).
Под вторичной структурой белка понимают упорядоченное
расположение полипептидной цепи, стабилизированное
водородными связями между пептидными группами. Рассматривая этот
структурный уровень, говорят о локальной конформаций участков
полипептидной цепи. Часто встречаемой и наиболее энергетически
и стерически выгодной вторичной структурой является правая
а-спираль (рис. 22), которая впервые была постулирована Л. По-
лингом и Р. Кори (1951). Наиболее важные характеристики а-спи-
рали: 1) число аминокислотных остатков на один шаг спирали
составляет 3,6; 2) шаг спирали d = 0,54 нм; 3) трансляция на один
остаток вдоль спирали -Ad = 0,15 нм; 4) радиус а-спирали г =
= 0,23 нм; 5) водородные связи (параллельные оси спирали) обра-
63
iff
с
-M lb-*1
!i •
Рис. 22. Правая а-спираль:
а—продольное изображение a-спирали; /, 2,
3, 4, 5 и 6 —. пептидные группы; 7 —
водородные связи; d — шаг спирали; Ad — расстояние
между пептидными группами вдоль оси а-спи-
рали; б — поперечное сечение а- спирали; D —»
диаметр ос-спирали
зуются между каждой первой и
четвертой пептидной группой; 6) для
a-спирали ф = —57° и г|) = —47°.
Как видно из поперечного среза
a-спирали (рис. 22), на каждом
обороте ее происходит сдвиг вправо
на 60°. В результате такого сдвига
только через 10 оборотов 1-я
пептидная группа точно будет
совпадать с 36-й пептидной группой.
Возможны и другие спиральные
конформации полипептидной цепи:
310- и я-спираль. В белках 310-спи-
раль встречается редко и на
довольно коротких участках
полипептидной цепи. Эта спираль более
скручена и ее радиус (г = 0,19 нм)
меньше радиуса a-спирали. Она
получила такое название по количеству
остатков (3) на шаг спирали и по
числу атомов (10) между одной
водородной свя зью.
Только теоретически возможна
я-спираль: в белках она не была
выявлена экспериментальными
методами. Эта спираль должна быть
менее скрученной и с большим радиусом (г = 0,28 нм) по
сравнению с a-спиралью. В я-спирали располагается 4,4 аминокислотных
остатка на шаг спирали.
Вторичными структурами белковых молекул являются
параллельные и антипараллельные ^-складчатые листы (или Р-структура)
(рис. 23). На конформационной карте Рамачандрана для р-слоя
с антипараллельными цепями <р = —139° и г|) = -J-135V для Р-слоя
с параллельными цепями ф =—119° и i|)==+H3°. Большинство
из них имеют не более шести полипептидных цепей,
стабилизированных водородными связями, и по шесть аминокислотных остатков
по длине каждой цепи. Размеры такого листа: ширина t = 2,5 нм,
длина / = 2,0 нм. Большинство складчатых листов имеют
скрученную форму. Скручивание идет перпендикулярно вытянутым цепям.
Следующим уровнем организации белковых молекул являются
сверхвторичные структуры. Примером таких структур являются
суперспиральные структуры. В них две a-спирали (в тропомиозинв|
легком меромиозине, парамиозине) или три a-спирали (в фибрино-
64
Н-конец
конец
Рис. 23. Антипараллельный р-складчатый лист:
/ —длина листа; / — ширина листа; в — водородные связи; d --
изгибами)
= 0,68 нм (расстояние между
Рис. 24. Сверхвторичные структуры:
а — суперспираль: d — шаг суперспирали; / — а спираль; б — поперечное сечение
суперспирали: гептапептид аминокислотных остатков 1, 2, 3, 4, 5, 6 и 7 (гидрофобные
аминокислотные остатки — 1,4 и 1,' 4" заштрихованы); в —# сочленение параллельных
Р листов (£ £ р-звёно); г — попеременное сочленение (3-листов и а-спиралей О а 0-звено)
3 8-616
гене) скручены друг относительно друга (рис. 24, а). Шаг
суперспирали в легком меромиозине составляет d = 18,6 нм. В результате
такой организации вместо меридионального рентгеновского
рефлекса 0,54 нм, характерного для а-спирали, регистрируется рефлекс
0,51 нм, характерный для суперспиральных структур. На примере
тропомиозина с известной аминокислотной последовательностью
сделан вывод о том, что суперспираль стабилизируется
гидрофобными взаимодействиями между отдельными а-спиралями. В
суперспиральных структурах найдены повторяющиеся структурные
единицы — гептапептиды. Несколько остатков в такой
повторяющейся единице гидрофобны. Таким образом, в суперспиральной
структуре тропомиозина два а-спиральных цилиндра
располагаются своими поверхностями так, чтобы гидрофобные остатки одной
а-спирали совпадали с гидрофобными остатками другой (рис. 24, б).
Располагаясь внутри суперспиральной структуры, неполярные
остатки уходят от неблагоприятных контактов с молекулами воды
и благодаря гидрофобным взаимодействиям стабилизируют
суперспиральную структуру.
Возможны другие типы сверхвторичной структуры белков. Это
комбинации Р-складчатых листов или комбинации (3-складчатых
листов и а-спиралей. Возможно сочленение двух параллельных Р-лис-
тов в виде р|(3-сверхвторичной структуры (рис. 24, в). Если
попеременно сочленяются р-листы и а-спирали, это сверхвторичные
структуры типа РаР-звеньев (рис. 24, г).
В настоящее время разработаны способы предсказания
вторичной структуры белка по его аминокислотной
последовательности. Они основаны на гипотезе о том, что конформации
полипептидных цепей определяются локальными, ближними взаимодействиями.
Рассмотрим метод П. Чоу и Г. Фасмана (1974). Эти авторы изучили
встречаемость аминокислотных остатков в той или иной
конформации, использовав данные рентгеноструктурного анализа многих
белков. Для предсказания вторичной структуры используется
два параметра: встречаемость f и конформационный параметр Р.
Встречаемость / = - , где я' — число аминокислотных остатков
данного типа в а-спирали, или в Р-структуре, или в неупорядоченном
клубке; п — общее число остатков данного типа во всех изученных
/
белках. Конформационный параметр для а-спирали Ра = ^, где
'а
/а — среднее значение /а, т. е. сумма всех /а, деленная на 20
(количество разных аминокислот в белке). Аналогично
конформационный параметр Р определяется для р-структуры и для клубка. Если
для какого-либо аминокислотного остатка Ра = 1» то такой остаток
может встречаться и в а-спирали, и в р-структуре, и в клубке.
Повышенная вероятность встретить аминокислотный остаток в а-
спирали будет только в случае, когда Ра > 1. Если Ра < 1,
аминокислотные остатки будут редко встречаться в а-спирали В табл.7
приведены значения / и Р, полученные на основании анализа 15 белков.
66
7. Встречаемость / и конформационный параметр Р различных аминокислот* ых
остатков в а-спиралях, ф-слоях и нерегулярных участках
Аминокислоты и их обозначения
Алании ALa A
Аргинин Arg R
Аспарагин Asn N
Аспарагиновая кислота Asp D
Цистеин Cys С
Глутамин Gin Q
Глутаминовая кислота Glu E
Глицин Gly G
Гистидин His H
Изолейцин Не I
Лейцин Leu L
Лизин Lys К
Метиоьин Met M
Фенилаланин Phe F
Пролин Pro Р
Серии Ser S
Треонин Thr T
Триптофан Trp W
Тирозин Tvr Y
Валин Val V
а-спираль
f
0,522
0,282
0,263
0,351
0,278
0,421
0,549
0,190
0,446
0,358
0,480
0,383
0,429
0,402
0,212
0,282
0,295
! 0,409
0,220
0,409
Р
1,45
0,79
0,73
0,98
0,77
1,17
1,53
0,53
1,24
1,00
1,34
1,07
1,20
1,12
0,59
0,79
0,82
1,14
0,61
1,14
0-слой
f
0,167
0,154
0,113
0,137
0,222
0,211
0,044
0,138
0,122
1 0,274
0,209
0,126
0,286
0,219
0,106
0,124
0,205
0,203
0,220
0,282
Р
0,97
0,90
0,65
0,80
1,30
1,23
0,26
0,81
! 0,71
1,60
1,22
0,74
1,67
1,28
0,62
0,72
1 1,20
1,19
1,29
1,65
Нерегулярный
участок
f I P
0,311
0,564
0,624
0,514
0,500
0,368
1 0,407
1 0,668
0,432
0,368
0,311
0,491
0,286
0,378
1 0,682
0,594
0,494
0,386
0,500
0,309
0,66
1,20
1,33
1,09
1,07
0,79
0,87
1,42
0,92
0,78
0.66
1,05
0,61
0,81
1,45
1,27
1,05
0,82
1,19
0,66
Предсказание вторичной структуры сводится к следующей
процедуре. Рассматривая известную аминокислотную
последовательность белка, каждому аминокислотному остатку приписывают
конформационный параметр Р. На основании данных табл. 7 можно
сделать вывод, что если в аминокислотной последовательности
будут расположены такие аминокислоты, как глутаминовая (Ра =
= 1,53), аланин (1,45), лейцин (1,34), то эта часть полипептидной
цепи будет принимать конформацию а-спирали. Метионин (1,67),
валин (1,65), изолейцин (1,60) всегда встречаются в р-структуре.
Неупорядоченные участки обязаны присутствию пролина (1,45)
и глицина (1,42).
4.2 Дисперсия оптического вращения и круговой дихроизм.
Для исследования вторичной структуры белков широко
используются такие методы, как дисперсия оптического вращения (ДОВ)
и круговой дихроизм (КД). В основе этих двух методов лежит
одно и то же физическое явление — взаимодействие
поляризованного света с оптически активными молекулами. Аминокислоты
содержат асимметричный атом углерода, вызывающий появление
оптической активности. Спектры ДОВ и КД регистрируются в
области поглощения пептидных групп (ультрафиолетовая область
спектра 180—230 нм). Это поглощение вызвано наличием двух
электронных переходов: интенсивного п -*- л;*-перехода при 190 им
С МОЛЯрНЫМ КОЭффИЦИеНТОМ ЭКСТИНКЦИИ 8тах = 7 • 105 МОЛЬ"1 • M"1
и слабогоп-> я*-переходапри210— 220нм ( етах — 10* моль"1 • м""1).
Рассмотрим взаимодействие оптически активного вещества с
линейно поляризованным светом. Линейно поляризованный свет
d?
можно представить как сумму двух циркуляр но поляризованных
волн с левовращающей (L) и правовращающей (/?) поляризацией.
Оптически активное вещество характеризуется разными
показателями преломления пь и nR для лево- и правовращающих компонент
света, в результате чего будет происходить вращение плоскости
поляризации. Угол поворота а^ будет пропорционален разности
пь — nR и толщине слоя оптического вещества d (толщина кюветы):
ак-
180°
■ nR)d.
Удельное вращение раствора с концентрацией вещества с [г
и толщиной й[дм] будет
а4
Молярное вращение
[М]к =
м
100 dc
а\,
(4.1)
см"3]
(4.2)
(4.3)
где М — молекулярная масса.
Угол поворота о^ зависит от длины волны света, который
поглощается в оптически активном веществе. Зависимость Ыя или
\М]\ от длины волны X называется спектром дисперсии оптического
вращения. Спектральные приборы, которые с высокой точностью
регистрируют спектры ДОВ, называются спектрополяриметрами.
Оптически активное вещество по-разному поглощает лево-
и правовращающую компоненты и поэтому имеет разные
коэффициенты молярной экстинкции 8/, и е#. В результате неодинакового
поглощения L- и ^-компонент линейно поляризованный свет
превращается в эллиптически поляризованный свет. Измеряют
эллиптичность вещества
Молярная эллиптичность
[©к==
м
\00dc
е*.
(4.4)
(4.5)
а-
5
4 6 7 в
Рис. 25. Блок-схема дихрографа:
; —источник УФ-света; 2 — монохроматор; 3 — поляризатор, 4 — криссталл,
пропускающий попеременно L- или ^-компоненту; 5 — модулятор; 6 —» кювета с оптически активным
веществом; 7 —фотоэлектронный умножитель (ФЭУ); 8-^ электронная система регистрации
спектров КД
68
Рис. 26 Конформационные перестрой- /ъ^-Л
ки поли-L-лизина: 1 *™ \
а—спектры кругового дихроизма (КД)
поли-L лизина в трех конформациях* / —
— а-спираль (рН = 12, 295К); 2 — 0-струк-
тура (рН = 12; нагревание до 325К, а
затем охлаждение до 295К); 3
—неупорядоченный клубок (рН = 5,7; 295К); б —
влияние рН на переход а-гпираль — клубок
для поли L-лизина
Часто молярную эллиптичность
представляют как
[в]х = 3300 Де, (4.6)
где Ае = bl— ед. Кривая,
показывающая зависимость [в]*, от Я,
называется спектром кругового
дихроизма. Приборы,
регистрирующие спектры КД, называются
дихрографами.
Наиболее широко
используется метод КД. Главное
преимущество его состоит в том, что он
позволяет получать хорошо
разделенные спектры для а-спирали, Р-структуры и неупорядоченной
формы. На рис. 25 представлена упрощенная блок-схема дихрографа.
Для изучения вторичной структуры белков используется
следующий эмпирический подход. Измеряются спектры КД для
модельных полипептидов, которые могут находиться в одной из кон-
формаций а-спирали, Р-структуры или неупорядоченного клубка.
Истинность такой конформации точно установлена с помощью
рентгеноструктурного анализа. В результате получают три
маркерных спектра КД для а-спирали, Р-структуры и клубка
(рис. 26, а).
Основные характеристики спектров:
( максимум X =* 190 нм, [в] = +71000 Г^~^~иГ' I
а-спираль J
I минимум X = 206 нм, [9] = — 36000
I минимум X = 222 нм, [6] = — 38000
о { максимум X = 195 нм, [9] = +35000
р-структура {
Р \ минимум Я= 215 нм, [9] = — 20000
клубок минимум X = 197 нм, [9] = — 25000
В первом приближении белковую молекулу можно
рассматривать как линейную комбинацию из конформации а-спирали,
Р-структуры и неупорядоченной формы. Если обозначить содержание
этих конформации как па, щ, я*, тогда для белка
[в]х = па [ва)к + лэ [вэ]х + nk [6*]ь (4.7)
69
где (ва]ь [вр]*, и [®kh — молярные эллиптичности для каждой
из конформаций. Практически по спектру КД белка определяют
вклады па> п$ и tiky т. е. делают разложение суммарного спектра
на три составляющие. Поскольку маркерные спектры сильно
отличаются (рис. 26, а), можно удачно выбрать три спектральные области
%v X2 и Х3, для которых можно записать три линейные уравнения
(4.7), решение которых позволит найти яа, п$ и я*.
С помощью методов ДОВ и КД показано, что белки значительно
отличаются по количеству регулярных структур. Фибриллярные
белки являются высоко упорядоченными структурами (например,
тропомиозин имеет 93 % а-спиралей). Глобулярные белки являются
менее упорядоченными и имеют большой процент неупорядоченных
структур. Например, в лизоциме 45 % а-спиралей, 20 % Р-структур
и 35 % неупорядоченных структур; в химотрипсине 14 %
а-спиралей, 45 % р-структур и 41 % неупорядоченных структур.
Изменение температуры, рН, добавление мочевины, хлорида
гуанидина вызывают переход полипептидной цепи от
упорядоченной конформаций (а-спираль, Р-структура) в конформацию
неупорядоченного клубка. Переходы спираль — клубок хорошо
изучены на простых модельных полипептидах. Поли-L-лизин в
широкой области рН не образует а-спираль, а находится в виде
неупорядоченного клубка. В щелочной области (рН = 12) происходит
резкое увеличение оптической активности и поли-Ь-лизин
переходит в упорядоченную конформацию со 100 % -й а-спиральностью
(рис. 26, б). S-образность экспериментальных кривых
свидетельствует о кооперативном характере конформационных перестроек
в белках. Кооператив ность связана с тем, что в упорядоченной
а-спирали пептидные группы взаимосвязаны, и освобождение одной
из них требует разрыва водородных связей соседних пептидных
групп.
4.3. Домены и третичная структура белка. Третичная структура
белка представляет собой термодинамически наиболее стабильную
форму свертывания и укладки полипептидной цепи. Возникает
вопрос, как происходит свертывание белка, каким образом
одномерная информация, заложенная в последовательности
аминокислот, реализуется в пространственную информацию? Эксперименты
по денатурации и ренатурации белков показали, что процессы
разрушения и образования компактной третичной структуры
проходят достаточно быстро: нуклеаза стафилококков повторно
свертывается за 1 с, метмиоглобин— за 10 с.
Для объяснения процесса свертывания используется нуклеаци-
онная модель. В этой модели допускается, что короткие сегменты
полипептидной цепи очень быстро свертываются независимо друг
от друга, а на втором этапе они сближаются, образуя компактную
трехмерную структуру (рис. 27). Сегменты белка образуют
а-спирали и р-слои с большой скоростью. Экспериментально показано,
что переходы спираль— клубок проходят за время от 10~6 до 10"8 с.
В последнее время в белках выделен еще один важный уровень
структурной организации. Анализ карт электронной плотности
70
Рис. 27. Нуклеациовная модель свертывания белка:
а — конформация неупорядоченного клубка; б — промежуточный этап свертывания и
обраование а-спиралей и |3 структур: в — компактная трехмерная структура белка
белков с молекулярной массой больше 20 000 показал, что белки
состоят из нескольких глобулярных областей, слабо связанных
между собой. Эти области получили название доменов.
Индивидуальные домены часто можно выделить из белка с помощью протеоли-
тических ферментов без потери ими функциональных свойств. Под
доменом подразумевают область одной полипептидной цепи,
заключенной в компактном объеме. Это такие участки цепи, которые
свертываются и развертываются в белке независимо друг от
Друга.
Домен можно рассматривать как относительно автономную
структурную единицу. С помощью сканирующей мнкрокалоримет-
рии П. Л. Привалов показал наличие в сложных белках отдельных
кооперативных блоков, для которых характерны скачкообразные
структурные переходы при тепловой денатурации. Оказалось, что
во многих случаях такие кооперативные блоки хорошо
соответствуют выделенным протеолитическим фрагментам белков. Это
позволило идентифицировать кооперативные блоки с доменами
белков. Часто выделенные протеолитические фрагменты имеют
структурные свойства, подобные кооперативным блокам, т. е.
совпадают их температуры плавления и энтальпии переходов, а также
они сохраняют функциональные характеристики нативных
белков. Домены связаны между собой очень ограниченным
количеством пептидных связей, которые сравнительно легко разрываются
под действием протеолитических ферментов.
В настоящее время с помощью сканирующей
микрокалориметрии, электронной микроскопии, протеолитического расщепления
установлено доменное строение в таких высокомолекулярных
белках, как иммуноглобулин G, миозин, фибриноген и др.
Домены могут представлять собой важные промежуточные
образования в процессе свертывания нативной структуры белков. Белки,
71
состоящие из доменов, должны иметь более гибкую структуру,
чем белки, в которых различные участки скреплены между собой.
По-видимому, обратимые конформационные изменения, влияющие
на функцию ферментов, связаны с междоменными перестройками
без изменения структурной стабильности самих доменов.
На основании изучения рекомбинантных ДНК было сделано
важное открытие. Гены эукариот являются не непрерывными,
а состоят из дискретных участков: из экзонов, кодирующих
отдельные участки аминокислотных последовательностей, и ишпронов,
некодирующих участков. Оказалось, что границы доменов в
полипептидной цепи белка точно соответствуют границам экзонов в гене.
Экзоны—это геномные эквиваленты белковых доменов.
4.4. Дифференциальная сканирующая микрокалориметрия.
Важную информацию о структуре белка дают термодинамические
исследования. Для этого используются дифференциальные
сканирующие микрокалориметры. В СССР Е. А. Андроникашвили
и П. Л. Приваловым разработан термодинамический подход и
сконструированы чувствительные микрокалориметры для изучения
белков и нуклеиновых кислот.
Принцип метода дифференциальной сканирующей
микрокалориметрии состоит в том, что измеряется тепло, необходимое для
увеличения температуры объекта на очень малую величину, при
непрерывном повышении температуры. Изменение энтальпии АЯ
при разворачивании
макромолекулы определяется путем
измерения количества тепла,
необходимого для поддержания одной
и той же температуры белково-
П
45 нм
I!
!7wr
ETddzbETd
\>;/М?777тт
|'~7 III T
Я
W//fl//////<fyl
У.
ш
V/sss///s7777A
11
тт
~з ю
LJ
Рис. 28. Блок-схема
дифференциального адиабатического сканирующего
микрокалориметра:
/, 2 — калориметрические ячейки; 3, 4 —
нагреватели ячеек; 5 — камера заполнения;
6, 7 — адиабатические экраны; 5—
термостат; 9— блок прогрева и компенсации
мощности; 10 — самописец; //— индикация
температуры Г-системы; AT — разность
температур между ячейками
J20 340 360
а
Рис. 29. Кривые плавления и
структурная организация фибриногена:
а — кривые плавления фибриногена Ф и его
фрагментов Д и Е; Ср — теплоемкость белка;
б — доменное строение молекулы
фибриногена, структурные домены LT\ и LT2, HT1 и
HT2, с — суперспиральные участки; П—
участки расщепления плазмином
12
го препарата и образца сравнения (буфера) при медленном
увеличении температуры обоих образцов. Благодаря присутствию
образца сравнения вносится поправка на вклад теплоемкости.
В дифференциальном микрокалориметре (рис. 28)
калориметрический узел представляет герметический сосуд, внутри
которого расположены две идентичные по массе и объему
калориметрические ячейки / и 2. Ячейки подогреваются нагревателями 3 и 4.
Заполнение ячеек растворами производится из камеры 5.
Калориметрический узел окружают два адиабатических экрайа 6 и 7.
Чувствительность микрокалориметра составляет 16 • 10 ~6 Дж •
• моль""1* град"1.
Кривые плавления белков представляются в виде температурной
зависимости теплоемкости Ср (рис 29, а). Для перехода из натив-
ного состояния (Н) в денатурированное состояние (Д) по схеме
Н^Д (модель двух состояний) максимум Ср соответствует
температуре плавления белка — Тп. Если в белке имеются структурные
домены с разной термоустойчивостью, на калориметрической кривой
имеется несколько пиков Ср. Например, для фибриногена
существуют два пика: низкотемпературный с Тп = 328 К и
высокотемпературный с Гп = 368 К.
Согласно П. Л. Привалову, кооперативность структурных
блоков белка может быть выяснена лишь количественным
анализом энтальпии системы. Для этого сопоставляют экспериментально
измеренную калориметрическую энтальпию А Нкал (по площади
под пиком теплопоглощения) с эффективной энтальпией Вант-
Гоффа А #Эфф, которую определяют по резкости денату рационного
перехода (по высоте пика АСР при температуре плавления Гп):
4RTI асо
Д#эфф = J-*, (4.8)
где Q— площадь пика теплопоглощения. В общем, должно
выполняться условие | А Яэфф | < | АНкал |. Экспериментально показано,
что для небольших белков (лизоцим, рибонуклеаза, миоглобин)
|Д#эфф| = | А Я кал |. Это свидетельствует о том, что денатурация
этих белков проходит как процесс перехода между двумя
состояниями, и такие белки представляют единые кооперативные системы.
В случае больших по молекулярной массе белков ситуация не так
проста. Для таких белков, как иммуноглобулин G, плазминоген,
фибриноген, тропомиозин, миозин | А Я5фф | < | А Нкал |. Зто
указывает на то, что в этих белках имеется несколько структурных
доменов.
Рассмотрим структурную организацию одного из важных
белков свертывания крови—фибриногена (М*= 340000). Фибриноген
является димерной молекулой, состоящей из двух идентичных
половин. Каждая половина молекулы содержит три неодинаковые
полипептидные цепи а, риу, которые соединяются вместе дисуль-
фидным узлом в N-концевой части фибриногена. На основании
электронно-микроскопических исследований (Холл, Слейтер,
1959) предложена трехузелковая модель фибриногена в виде трех
73
соединенных глобулярных структур. При плазминовом или трип-
синовом протеолизе эти структуры вычленяются как большие
структурные блоки, Д- и Е-фрагменты. Данные
микрокалориметрии показали, что они плавятся в фибриногене как независимые
структуры с различными температурами Ти (см. рис. 29, а). Эти
данные послужили основанием для представления пространственной
структуры фибриногена в виде одного центрального (Е) и двух
периферических (Д) структурно-функциональных доменов.
Дальнейшее детальное изучение плавления фибриногена и его
фрагментов показало, что в фибриногене существует большее
количество независимых структурных доменов с упорядоченной
компактной структурой. Основанием для такого утверждения явились
данные дифференциальной микрокалориметрии: в
высокотемпературной области Тп = 368 К, где плавится Е-домен, отношение
—^£~1,4, а при плавлении Д- доменов — *ал = 4. Таким обра-
зом, в центральном структурно-функциональном домене Е имеются
два сильно взаимодействующих термостабильных домена НТ1
(см рис. 29, б). В каждом периферическом структурно-функциональном
домене Д имеются по три термолабильных домена LT1 с Тп =
= 328 К и по одному термостабильному домену НТ2 с Тп = 373 К.
Термостабильным доменам НТ1 и НТ2 соответствуют
суперспиральные участки молекулы фибриногена. Еще два термолабильных домена
LT2 образуют С-концевые участки а-цепей.
Таким образом, в молекуле фибриногена имеются 12 более или
менее независимых структурных доменов. Такое доменное
представление фибриногена имеет большое значение для понимания
тонких механизмов образования фибриновых волокон при
свертывании крови.
4.5. Динамика белковой структуры. Наиболее прямым
методом, позволяющим изучать пространственное строение белковых
мадекул,, является рентгеноструктурный анализ. На основании
данных рентгеноструктурного анализа белковая молекула
представлялась статической системой, в которой неполярные
аминокислотные остатки образуют жесткое гидрофобное ядро,
приближающееся по свойствам больше к твердому телу, чем к жадности
Благодаря такой жесткости трудно ожидать заметных изменений
конформаций цри взаимодействие ферментов с субстратами.
Применение сиектральных методов (ИК-спектросксэдим, ЯМР*
флуоресцентного' анализа) для изучения белковых молекул
заставило критически оценить результаты рентгеноструктурного анализа.
Анализ данных водород-дейтериевого обмана в пептидных группах
и динамического тушения флуоресценции тринтофанилов
внутренних областей интактных белков свидетельствуете
несостоятельности статической? концепции белковой структуры и позволяет
сформулировать представление о динамических свойствах белков.
Наблюдаемая внутримолекулярная подвижность, спонтанные
флуктуации структуры, белков обусловлены различного рода
движениями атомов или групп атомов вблизи положения равновесия.
74
Для белков с известной пространственной структурой Ф.
Ричарде с помощью специальных расчетов нашел локальные йлот-
ности и сопоставил их с распределением полярных и гидрофобных
аминокислотных остатков по внутреннему объему белков.
Оказалось, что внутри белка плотность значительно изменяется: есть
области высокой плотности (р = 1,4 • Ю3 кг • м"3), которым
отвечают высоко упорядоченные участки с а-спиралями и р-структура-
ми, и области с низкой плотностью (р = 0,5 • 103 кг • м~3), куда,
как правило, попадают гидрофобные аминокислотные остатки.
На основании этих данных сделано заключение о неправомочности
понятия гидрофобного ядра для глобулярных белков.
По-видимому, правильнее говорить о гидрофобных кластерах, где
преимущественно локализованы гидрофобные аминокислотные остатки.
Участки с малой локальной плотностью (гидрофобные кластеры)
могут служить мягкой жидкоподобной прослойкой для
относительного смещения плотных упорядоченных структурных доменов.
Для разных белков внутренний интерьер значительно варьирует
и может иметь подвижную или более жесткую структуру.
Все внутримолекулярные движения в белках можно разбить на
два типа: быстрые спонтанные флуктуации, происходящие за время
меньше 10 ~7 с, и медленные движения за время больше Ю~7 с.
Быстрая подвижность (т < 10 ~7 с) имеет локальный характер
внутри макромолекул. Для таких движений характерна
зависимость т от размера атомных групп, что свидетельствует о наличии
диффузионных процессов. Время ориентационной подвижности
групп т обратно пропорционально коэффициенту вращательной
диффузии в. С увеличением размера группы т растет
пропорционально кубу радиуса группы. Большинство быстрых движений
проявляется на поверхности белковой молекулы; частично они
вовлекают релаксацию связанной воды.
Для примера приведем времена релаксации некоторых атомных
групп. Вращательная релаксация свободных молекул воды имеет
т~10~и—10~12 с; релаксация связанной воды—Ю~8—Ю""9 с;
вращательная релаксация боковых групп аминокислот— 10"9—
10 ~10 с; равновесные конформационные перестройки на уровне
соседних аминокислотных остатков происходят в мили- и микро*
секундном интервале.
Медленные движения (т > 10 "7 с) требуют более масштабных
изменений структуры и связаны с перемещением полипептидных
цепей или доменов белковых молекул. Например, время жизни
фермент-субстратных комплексов занимает интервал от 10 ~2 до
Ю-* с.
Какова физическая природа флуктуации белковых молекул?
В настоящее время обсуждаются различные модели динамической
структуры белков. Не вызывает сомнений, что атомы в молекуле
белка находятся в постоянном движении, и поэтому картина,
наблюдаемая яри рентгеноструктурном анализе, соответствует
некоторой усредненной структуре. Тепловой энергии достаточно,
чтобы обеспечить вращательные движения, которые обусловливают
75
атомные флуктуации в молекуле белка. Наиболее быстрые
локальные перемещения за 10~13 с связаны с вращением боковых групп
вокруг одинарных связей в полипептидной цепи. Эти вращения
(на угол от 20 до 60°) практически несогласованы и стерически
ограничены соседними группами. Такие локальные перемещения
боковых групп напоминают броуновское движение в жидкости.
На протяжении более длительного времени (10 ~12—10 "и с)
локальные хаотические движения сменяются
скоординированными перемещениями атомных групп. Величина таких движений
может давать существенный вклад в суммарные амплитуды
флуктуации атомов в молекуле белка, вызывая деформацию структуры
белка как целого. Значительные смещения в плотно упакованной
структуре белка возможны только в том случае, когда происходит
кооперативное смещение соседних атомов. Наибольшие смещения
(до 0,2 нм) атомных групп наблюдаются на поверхности белковой
глобулы.
Динамическая модель позволяет понять роль небольших
флуктуации в функции ферментов. Быстрые конформационные
изменения необходимые фермент-субстратных комплексах для
пространственной- подгонки функциональных групп в активном центре.
На примере алкогольдегидрогеназы печени показано, что
крупномасштабным информационным перестройкам, изменяющим
функцию фермента, предшествуют высокочастотные мелкие флуктуации
структуры. Алкогольдегидрогеназа состоит из четырех
структурных доменов, между которыми расположен активный центр
фермента. Доступность субстрата к активному центру регулируется
вращением доменов вокруг шарнирного соединения.
С помощью рентгеноструктурного анализа было установлено,
что алкогольдегидрогеназа может пребывать в двух конформациях:
открытой, с большим зазором между доменами, и закрытой. После
завершения химической реакции фермент принимает открытую
конформацию и освобождается от продуктов реакции. Спонтанный
переход между этими конформациями происходит за более
длительное время (10"9 с), чем время локальных флуктуации (10~12 с).
Нужно допустить, что осуществление такого относительно
медленного крупномасштабного перемещения доменов в ферменте
возможно только тогда, когда в результате небольших, достаточно
быстрых локальных флуктуации происходит снижение к минимуму
энергетического барьера вращения доменов.
Спектральные методы (дифференциальная спектрофотометрия,
флуоресцентная спектроскопия, ЯМР) являются конформаци-
онно-чувствительными и используются для изучения динамики
и конформационных перестроек белков.
4.6. Абсорбционная и дифференциальная спектрофотометрия
белков. Спектр поглощения белка в УФ-области (230—310 нм)
определяется поглощением ароматических аминокислот:
триптофана, тирозина и фенилаланина. УФ-свет поглощают
хромофорные группы этих аминокислот: индольное кольцо триптофана,
фенольное кольцо тирозина и бензольное кольцо фенилаланина.
76
^-m-Ts
Рис. 30. Блок-схема спектрофотометра:
/ — источник света; 2 — линза, 3 — монохроматор; 4 — полупрозрачное зеркало, 5 —
отражающие зеркала; 6 — кювета с раствором, 7 — кювета сравнения с растворителем, 5 —
призма; 9 — ФЭУ, W -— усилитель, // — самописец
Основным законом абсорбционной спектрофотометрии является
закон Ламберта— Бэра:
I = I0e-*i*9
(4.9)
где / — интенсивность света, прошедшего через-раствор
концентрацией с (моль • л"*1)» /0 — интенсивность света, падающего на кювету;
/ — толщина кюветы; е — молярный коэффициент экстинкции
(моль"1 х м"1).
Закон Ламберта—Бэра в логарифмической форме запишется
следующим образом:
D= elc, (4.10)
где D — оптическая плотность раствора.
Зависимость D или е от длины волны поглощенного света
называется спектром поглощения: D=f(k). Спектральные приборы,
которые измеряют спектры поглощения или пропускания
вещества, называются спектрофотометрами. На рис. 30 изображена
блок-схема двухлучевого спектрофотометра.
Спектр поглощения триптофана (рис. 31, а) имеет максимум
поглощения Ктах = 280 нм и небольшой пик 288 нм. Молярный
коэффициент экстинкции е280 = 5,6 • 105 моль"1 • м"1. Максимум
спектра поглощения тирозина Хтах = 275 нм и е275 = 1,25 • 10б моль_1х
хм"1. Наиболее слабое поглощение имеет фенилаланин: Ятах =
= 257,5 нм и 8257,5 = 0,19 • 105 моль"1 • м"1. Таким образом,
характерная полоса поглощения белка с Ктах = 280 нм представляет
в основном сложение спектров поглощения триптофановых и тиро-
зиновых остатков.
При конформационных перестройках белковых молекул
происходит небольшое смещение спектра (меньше 1,0 нм), которое
трудно регистрировать на спектрофотометрах. Для повышения
чувствительности метода используется дифференциальная спектра-
фотометрия. Под дифференциальным спектром понимают
разностный спектр, получаемый при автоматическом вычитании из
спектра поглощения вещества в измеряемой кювете спектра
поглощения вещества в кювете сравнения. Если спектр поглощения
в кювете сравнения D (Я), а при действии определенного фактора в
77
289
Г"
L
I
240 У
/Г
' 260
ч
л/
V
♦
285
|
ЪООг
/
♦
293
^Х,т
+0№
Рис. 31 Спектр поглощения (а) и температурно-пертурбационный
дифференциальный спекгр (б) триптофана в воде (рН = 7,0):
градиент температуры iaT = 10°, Д£> — дифференциальная оптическая плотность
измеряемой кювете наблюдается смещенный на Д Я спектр D (X +
+ ДА,), тогда дифференциальный спектр будет
AD (X) = D (X + AX) — D (X). (4.11)
Если разложить (4.11) в степенной ряд по малому параметру АХ
и пренебречь членами второго порядка малости, тогда
AD(X)&^AX.
(4.12)
В первом приближении дифференциальный спектр соответствует
первой производной ^ от спектра поглощения. Таким образом,
вместо регистрации небольших спектральных сдвигов АХ точно
измеряют интенсивность дифференциального поглощения AD на
чувствительных дифференциальных спектрофотометрах. Методы
абсорбционной и дифференциальной спектрофотометр и и широко
используются для определения различных констант равновесия
диссоциации низкомолекулярных лигандов, констант скорости
ассоциации субъединиц в белках, конформационных изменений
в белках, включая процессы денатурации и ренатурации белков
(см. рис. 4). Конформационное состояние белковой глобулы
оценивается определением доступности хромофорных групп (трипто-
фанилов и тирозилов) для внешних пертурбантов.
Темпе ратурно-пертурбационная
дифференциальная спектрофотометрия. Для получения температурно-пер-
турбационных дифференциальных спектров (ТПДС) раствор белка
одинаковой концентрации заливается в кварцевые кюветы, которые
располагаются в термостатированных ячейках спектрофотометра.
При создании разности температур между кюветами регистрируется
характерный температурно-пертурбационный дифференциальный
спектр, который состоит из вкладов поглощения триптофановых,
78
тирозиновых и фенилаланиновых остатков, доступных растворителю
и изменяющих спектры поглощения в результате изменения
структуры растворителя под влиянием температуры.
Каждый из хромофоров имеет свой характерный ТПДС. На
рис. 31, б представлен ТПДС триптофана, возникающий в
результате разности температур между кюветами, ДТ, = Ю°.
Дифференциальный спектр по форме близок к первой производной ^ от
С/А
спектра поглощения триптофана (см. рис. 31, а). Для ТПДС
триптофана характерно наличие ряда узких максимумов:
положительные 293 и 285 нм и отрицательные 289, 278 и 270 нм.
Аналогичным путем получены маркерные ТПДС тирозина и фенил-
аланина. В ТПДС тирозина—положительные максимумы 287
и 279 нм и отрицательные 282,5, 275 и 267 нм. В ТПДС фенилала-
нина наблюдается ряд узких положительных максимумов —
268,8, 265,5, 259,5, 253 и 247 нм.
Паспортной характеристикой хромофора является
температурный инкремент экстинкции и*;
X* = zr-Tf> (4ЛЗ)
max
где ADx—дифференциальная оптическая плотность; Dmax —
оптическая плотность хромофора в максимуме спектра поглощения; AT —
разность температур. Для триптофана и293 = 1,1 • 10~3 град""1; для
тирозина Xgg, = 2,12 • КГ3 град"1; для фенилаланина х265 = 3,09 х
х Ю~3 град"1
Доля температурно-пертурбируемых хррмофоров белка а
определяется как отношение температурного инкремента
экстинкции белка и6 к температурному инкременту экстинкции
хромофора км:
хб
« = г«- <4Л4>
%
ТПДС разных белков значительно отличаются между собой;
в то же время обычные спектры поглощения для разных белков
мало различаются. На рис. 32 представлены ТПДС химотрипсино-
гена А и сывороточного альбумина быка.
Сольвентно-пертурбационная дифференциальная
спектрофотометрия. При добавлении в раствор белка пертур-
бантов (метанола, d = 0,28 нм; этиленгликоля, d = 0,44 нм;
глицерина, d = 0,52 нм; глюкозы, d = 0,72 нм; сахарозы, d = 0,94 нм,
где d — эффективный размер пертурбанта) происходит небольшое
смещение спектра поглощения. Если кювету сравнения заполнить
раствором белка, а измеряемую кювету — раствором белка и пертур-
бантом, то на спектрофотометре регистрируется сольвентно-пертур-
бационный дифференциальный спектр (СПДС). Компенсация
поглощения пертурбанта производится использованием двух тандемных
кювет. Использование 20 % растворов пертурбантов не изменяет
конформацию белковых молекул.
79
£#&ышщы*тш*.
-0,01 \-
0
0,01
0,02
L
286
260
2Ь0
300
320 Х,нм
Рис. 32. Температурно-пертурбационные дифференциальные спектры (ТПДС):
а — химотрипсиногена А в 0.05М фосфатном буфере, рН « 6,8, б — сывороточного
альбумина быка в 0,25М КС1. рН =* 6,75; / — ТПДС изучаемых белков, 2 —ТПДС водных
растворов N — Ас — Туг—Oet и N—Ас — Тгр — NH2, взятых в молярном соотношении,
соответствующем содержанию тирозина и триптофана в исследуемых белках (а — 4 8, б —. 18 2);
^гЗО^8 ЬО; градиент температуры в кюветах 15°
Количество хромофоров в белке, доступных пертурбантам,
определяется по методу Т. Гершковича и М. Соренсона (1968).
4.7. Флуоресцентная спектроскопия белков. Флоуресцентная
спектроскопия благодаря высокой чувствительности используется
для изучения конформационных состояний белков в растворе.
Рассмотрим основные представления о физических основах
флуоресцентного метода. Молекулы вещества поглощают кванты
света, энергия Е которых определяется по формуле Планка
E = hv = h
(4Л5)
где v— частота света; X — длина волны светового кванта; с —
скорость света в вакууме (с = 2,9979 • 108 м • с^1); h— постоянная
Планка (А = 6,63 • 10~34 Дж • с"1). Поглощенные кванты возбу-
80
Рис. 33. Диаграмма уровней энергии:
S —синглетный уровень; Т — трип летный уровень; а —
абсорбция, / — флуоресценция; Р — фосфоресценция; п —
бсзызлучательные переходы; К — интеркомбинационная
конверсия, е— электрон
s;-
з.Щ
Ы
*■
*
ждают электроны молекул и переводят их
из основного, невозбужденного уровня S0
на более высокие, возбужденные уровни
St, S|, ..., в зависимости от энергии
кванта (рис. 33).
Возбужденное состояние молекулы
является Неравновесным, и молекула
переходит из него разными путями. Эти пути на схеме показаны
разными стрелками вниз. Один из путей— это безызлучатель-
ная диссипация энергии в виде тепловых колебаний
(волнистые стрелки). Другой путь сопровождается излучением
квантов света. Испускание кванта света при переходе электрона между
синглетными уровнями Sf->- S* называется флуоресценцией
(спины электронов не изменяются). Время жизни возбужденного син-
глетного состояния составляет 10"8-^10~9 с. При соударениях
возбужденных молекул с соседними молекулами возможна
переориентация спина, и возбужденный электрон переходит на три-
плетный уровень Т. Триплетное состояние является метастабиль-
ным с временем жизни от 10"7 с до нескольких часов. Переход
возбужденного электрона из триплетного состояния (7\-> S0)
сопровождается испусканием фосфоресценции, что наиболее
хорошо наблюдается в замороженных растворах.
Флуоресценцию веществ изучают на спектрофлуориметрах
(рис. 34). На них измеряют важные флуоресцентные
характеристики веществ. Спектр флуоресценции— зависимость
интенсивности флуоресценции от длины волны испускаемого света: // = / (Я,/).
Спектр возбуждения— зависимость интенсивности
флуоресценции от длины волны возбуждающего света: If=f(K)> Спектр
возбуждения по форме часто совпадает со спектром поглощения
вещества. Согласно закону Стокса, спектр флуоресценции вещества
всегда расположен в более длинноволновой области, чем спектр
поглощения.
Квантовый выход флуоресценции ср — отношение количества
испускаемых квантов щ к количеству поглощенных квантов па:
(4.16)
1
Для определения относительного квантового выхода вещества
используется метод Паркера и Риса. Измеряется на одном и том же
спектрофлуориметре, в одинаковых условиях спектр
флуоресценции неизвестного вещества и вещества-эталона с известным
квантовым выходом ф0. Квантовый выход флуоресценции вещества
будет
5 Dn
Ф-Фо^-тв*
(4Л7)
81
9
бЩЗ
\
в [
I
1 11 I
5
4 J 4
»I ? |«
1
1 ^ 1
5
а
Г
1 *
Рис. 34 Блок-схема спектрофлуориметра.
/ — источник УФ света; 2 — монохроматор возбуждения; 3 — кювета с исследуемым
веществом; 4 — фокусирующие линзы; 5 — монохроматоры флуоресценции; 6— ФэУ; 7 —
высоковольтные стабилизаторы напряжения; 8 — усилители; 9 — частотомер; Ю — цифропеч а тающее
устройство; И — самописец
где S и S0—площади под спектрами флуоресценции вещества
и эталона, соответственное и D0 — оптические плотности
вещества и эталона на длине волны возбуждения флуоресценции. В
качестве стандарта используются раствор хинина бисульфата в 1 н.
H2S04 с ф0= 0,55 или флуоресцеина в 0,1 н. NaOH с ф0= 0,92.
При возбуждении молекул линейно поляризованным светом
наблюдается частичная поляризация флуоресценции. Измеряется
степень поляризации
If+lj-
или степень анизотропии
Л =
Ч ч
(4.18)
(4.19)
где If и I/-— интенсивность флуоресценции при параллельном
и перпендикулярном расположении поляризатора по отношению
к анализатору. Измеряя деполяризацию флуоресценции, можно
определять внутримолекулярную подвижность хромофорных групп
в белковых глобулах.
Ф. Перрен нашел связь степени поляризации р с временем
вращательной релаксации хромофора р:
w-a-±)('+?). <4-2о)
где р0—предельная степень поляризации.
82
Флуоресцентная спектроскопия с временным раз-
решением.
В настоящее время ожидаются положительные результаты от
использования спектроскопии с временным разрешением. Метод
позволяет изучать быстрые вращательные движения хромофорных
групп или доменов в белке за время возбужденного состояния
хромофора. Движения измеряются в наносекундной области.
Фактически измеряется изменение степени анизотропии A (t) за время
затухания флуоресценции после мгновенного перекрывания
возбуждающего света:
A(t) = A0e~9 (4.21)
где А0—анизотропия флуоресценции в стационарном состоянии
до перекрывания возбуждающего света; р — время релаксации
хромофора.
Учитывая, что длительность жизни флуоресценции хромофора
составляет несколько наносекунд, время возбуждения
флуоресценции должно быть короче этой величины. В установках
используется возбуждение белковой флуоресценции от лазера, работающего
в импульсном режиме с длительностью импульса не больше
наносекунды. Возбуждение раствора белка производится линейно
поляризованным светом. Флуоресценция регистрируется через
поляризатор, который поворачивается с определенной частотой
для поочередной регистрации // и //• (4.19) Электронное устройство
автоматически рассчитывает анизотропию А, и на экране наносекунд-
ного осциллографа регистрируется кривая A(t) = f(t).
Собственная флуоресценция белка. Белки содержат
три собственных флуоресцирующих хромофора — триптофан,
тирозин и фенилаланин. Наиболее интенсивную флуоресценцию
имеют триптофан и тирозин. В водном растворе параметры
флуоресценции триптофана при возбуждении Хв = 295 нм
следующие: спектр флуоресценции с Х™ах = 353 нм, квантовый выход ф =
= 0,13 и время жизни %f = 3,1 не. Параметры флуоресценции для
тирозина при Хв = 275 нм: спектр флуоресценции *к™ах = 304 нм;
Ф = 0,14 и Tf = 3,6 не. Фенилаланин имеет очень слабую
флуоресценцию при %ъ = 260 нм: спектр флуоресценции Я™ах = 282 нм,
Ф = 0,02 ит| = 6,8 не.
Наиболее чувствительной к изменению конформации белка
является флуоресценция триптофановых остатков. Положение
kfa* спектра флуоресценции триптофановых остатков сильно
зависит от свойств микроокружения, в которых они находятся
в белковой глобуле. Если триптофановые остатки находятся на
поверхности белка в полярном окружении, а также при полной
денатурации белка, их спектр флуоресценции подобен спектру
флуоресценции триптофана в воде с А,™ад = 353 нм (рис. 35, кривая
/). Спектр флуоресценции триптофанилов, расположенных
внутри белковой глобулы, смещен в более коротковолновую область,
83
323нм
300 \,
\,нм
Рис. 35. Спектры флуоресценции
триптофана в воде (/) и альдолазы (2) в
фосфатном буфере (рН == 7,0; ионная сила — 0,2):
Г» 293 К; ^>280~°»2« Возбуждение флуорео
цёнции, Хв=280 нм; J — интенсивность
флуоресценции. Спектры нормированы
а его Я| варьирует в широких
пределах (от 342 до 320 нм) для
разных белков.
На рис. 35 представлен спектр
флуоресценции альдолазы мышц.
Такое коротковолновое положение спектра флуоресценции по
сравнению со спектром флуоресценции триптофана в воде
свидетельствует о высокогидрофобном микроокружении трипто-
фановых остатков в альдолазе. Наиболее коротковолновое
положение спектра флуоресценции наблюдается в азурине, Хтах =
308 нм. Конформационные перестройки в белках вызывают
изменения расположения триптофанилов и их микроокружения, что
естественно скажется на спектре триптофановой флуоресценции.
Таким образом, регистрируя изменения спектра триптофановой
флуоресценции белка, можно оценивать конформационные
перестройки в белке при действии факторов среды (температура,
рН и др.) или в процессе функционирования белков (ферментный
катализ, транспорт ионов и др.).
Имеется три подхода к анализу внутримолекулярной
динамики в белках по параметрам собственной флуоресценции:
1. Тушение флуоресценции триптофановых остатков,
спрятанных внутри белкового интерьера, молекулами тушителей (Cs+,
I"", акриламид, 02), диффундирующими в белковый матрикс
(рис. 36, а).
2. Анализ вращательных движений хромофоров с помощью
деполяризации флуоресценции с накосекундным временным раз-
Рис. 36. Схематическое представление физических явлений, которые изучаются
с помощью спектрофлуориметрии:
а — тушение флуоресценции; б — деполяризация флуоресценции; в — релаксация диполь-
ных групп, окру>ьаюших хромофор; / — белковая глобула, 2 —- индольное кольцо
триптофана, 3—молекулы тушителей; 4 — дипольнь>е группы
84
в
1,05
1,00
АТф
а
Но
200 400 600 t,C
Рис. 37. Изменение двухволнового
флуоресцентного параметра В миозина при гидролизе
АТФ:
Концентрация миозина—0,8 мкмоль, MgCl2—1 ммоль*
/ — 10 мкмоль АТФ; 2 — 20 мкмоль АТФ;
возбуждение флуоресценции миозина, Я,в == 297 нм; рН = 7,5,
Т = 293 К
Рис. 38 Диаграмма уровней и ориентация ядер во внешнем магнитном поле
напряженностью Н:
ЛЯ —разность энергетических уровней; а — хаотическое расположение ядер в
отсутствие внешнего магнитного поли (tf=0); б — преимущественная ориентация ядер во
внешнем магнитном поле напряженностью Н0
решением. Вращение хромофора приводит к уменьшению степени
поляризации флуоресценции (рис. 36, б).
3. Изучение реориентационной динамики дипольных групп,
окружающих хромофор. Подвижность дипольных групп приводит
к уменьшению энергии излучаемого кванта (сдвиг максимума
спектра флуоресценции) и к исчезновению эффектов красного
края (см. рис. 36, в).
Двухволновой флуоресцентный метод. Положение
максимума спектра флуоресценции — параметр, наиболее
чувствительный к конформационным изменениям белковых молекул. Для
регистрации небольших сдвигов спектра флуоресценции
разработан и используется двухволновой флуоресцентный метод. В этом
методе точно измеряется двухволновой параметр В = hjh2 —
отношение интенсивностей флуоресценции при двух фиксированных
длинах волн Ях и %2 (см. рис. 35). Из рисунка видно, что если трипто-
фановые остатки размещаются внутри белковой глобулы, то
параметр В" = llx /il2 имеет большее значение. При разворачивании
белковой глобулы, когда спектр флуоресценции триптофанилов
смещается в длинноволновую область, параметр В' = 1%х //£,
уменьшается.
В спектрофлуориметре, регистрирующем в автоматическом
режиме параметр В, используются два монохроматора
флуоресценции 5 (см. рис. 34).
Один монохроматор выделяет флуоресценцию на Ях= 315 нм,
а другой — А,2 = 370 нм.
Этот новый чувствительный метод используется для изучения
кинетики конформационных изменений ферментов при их функ-
8S
ционировании. При гидролизе АТФ миозин обратимо изменяет
свою конформацию, что регистрируется по изменению параметра
В (рис. 37).
4.8.Ядерный магнитный резонанс (ЯМР) широко используется
для изучения конформационных перестроек и динамики белков.
Все ядра с нечетным массовым числом имеют механический
момент спин I. Такие ядра, как XH, 18С, 19F, 31Р, имеют /= 1/2.
Ядра с четными массовыми числами либо вообще не имеют спина
(для 12С и 160 1 = 0) или имеют целочисленное значение спина
(для 2Н и 14N /= 1). Рассмотрим природу ЯМР для протона —
наиболее простого ядра со спином / = 1/2. Протоны наиболее
распространены в биологических системах (содержание их в
природных соединениях — 99, 98 %), и поэтому протонный ЯМР
широко используется для изучения белков, нуклеиновых кислот
и мембран. Хорошо разработан также 31Р-ЯМР (содержание 81Р
в природных соединениях фосфора — 100 %). Содержание в
природных соединениях углерода 13С очень мало (1,1 %), но благодаря
изотопному обогащению в последнее время изучается 13С-ЯМР.
Вращение заряженного ядра (протона) приводит к
возникновению ядерного магнитного момента
*хя = £я Ря / , (4.22)
где g*— ядерный g-фактор. Ядерный магнетон ря, равный 5,05 х
X Ю~27 Дж • TJ1, записывается как
Р- = пЬ <4-23>
где МП — масса ядра протона; е — заряд протона; h = ^-.
Если подставить (4.23) в (4.22), магнитный момент запишется
1*-= W„*/==V*/. (4.24)
где у — гиромагнитное отношение ядра.
Учитывая наличие у протона магнитного момента, мы можем
схематически представлять протоны как элементарные магнитные
стрелки. Если внешнее поле отсутствует, то протоны (магнитные
стрелки) имеют хаотическое распределение. При наложении
внешнего магнитного поля Н0 возникает взаимодействие между
магнитным моментом ря протона и Я0. Энергия взаимодействия
запишется как
£ = -|хя/У0 = -вГ.Ря/Яв. (4.25)
Для протона ядерное спиновое квантовое число может быть равно
или +1/2, или — 1/2. Во внешнем магнитном поле Я0 возможны
две ориентации протонов: магнитные стрелки ориентируются по полю
с Ег = — 1/2 ga ря Я0 и против поля с Е2 = + 1/2 #я |5Я #0
(рис. 38). Разность энергий между уровнями равна
АЕ = Е2-Ег = £ЯРя Я0. (4.26)
86
Рис. 39. Блок-схема ЯМР-спектрометра:
1— образец; 2 — магнит внешнего поля И\ 3 — генератор внешнего магнитного поля; 4 —»
генератор электромагнитного поля; 5 — катушка для передачи электромагнитного поля
частотой V, 6 — приемная катушка; 7—система регистрации сигнала ЯМР
Распределение протонов по уровням Е\ и £2 записывается согласно
больцмановскому распределению
AS
-2 = е V. (4.27)
В магнитном поле Н0= 10000 Гс при Т = 300 К, отношение—
составляет всего 1,000007. Это указывает на то,что при комнатной
температуре энергия взаимодействия протона с магнитным пол^м
мала по сравнению с разупорядочивающей тепловой энергией
k0T и поэтому наблюдается ничтожное число ядер,
ориентированных по полю (0,0007 %). Однако этот маленький избыток
ориентированных ядер будет создавать намагниченность вещества и
вызывать поглощение ЯМР.
Для того чтобы выявить разность двух энергетических
уровней АЕ, необходимо наложить переменное электромагнитное
поле определенной частоты v. Поглощение энергии этого поля будет
происходить при условии, что магнитный вектор переменного поля
перпендикулярен направлению постоянного магнитного поля
#о и частота поля v0 удовлетворяет условию ядерного магнитного
резонанса:
Ь0 = £яРя#0. (4.28)
Поглощенная энергия тратится на изменение одной ориентации
протонов в другую. Для изучения ЯМР используются ЯМР-спек-
тромепгры. На рис. 39 представлена упрощенная блок-схема ЯМР-
спектрометра. В ЯМР-спектрометрах используется постоянная
частота электромагнитного поля v0, а для получения резонанса
изменяется величина внешнего магнитного поля Н. Рассмотрим,
какие параметры измеряют с помощью ЯМР-спектросконии.
87
Спин-решеточная и спин-спиновая релаксация. В
результате существования преимущественной ориентации вдоль
направления внешнего магнитного поля появляется суммарная
намагниченность М ц. Это сумма проекций магнитных моментов
отдельных ядер на это направление. При включении внешнего
магнитного поля Н0 происходит переход ядер от хаотического
состояния к состоянию намагниченности по экспоненциальному
закону
__ t_
Л!в =Af„ (1— е Тг)$ (4.29)
где М\\—равновесное значение намагниченности; 7\—время
продольной релаксации, или спин-решеточной релаксации. При
включении магнитного поля Я0 наблюдается поперечная
релаксация с временем Т2, или спин-спиновая релаксация.
Окружение ядер называется решеткой. Релаксация
продольной составляющей М\\ к равновесию происходит под действием
флуктуирующих магнитных полей в решетке, что сильно влияет
на величину 7\. В твердых телах, где движение молекул
ограничено, Тх велико и достигает нескольких часов. В жидкостях
7\< 10 с.
Время поперечной релаксации Т2, или спин-спиновой релаксации,
определяет полуширину линий ЯМР: Avi/2 = 7р .
* 2
Химический сдвиг. Экспериментальные значения
резонансных линий в ЯМР для ядер в атомах и молекулах несколько
отличаются от теоретического значения g$Jt^ полученного
для свободного ядра. Это связано с так называемым эффектом
экранирования. Он происходит вследствие влияния локального
магнитного поля, создающегося внутри атома электронными токами,
которые индуцируются внешним магнитным полем. Эти
электронные токи образуют дополнительное поле на ядрах, которое по
величине пропорционально, а по направлению противоположно
полю Я0. Поэтому эффективное поле Н9, которое действует на
ядро (протон), будет меньшее, чем приложенное поле Я0:
Яэ==//0-аЯ0 и а= °Яо э, (4.30)
где а — постоянная экранирования. Это очень маленькая
поправка, ее Порядок составляет 10 "Л Ценность метода ЯМР именно
состоит в том, что резонансные линии будут значительно
отличаться в зависимости от того, в каких атомных группах находится
протон. Смещение резонансной частоты, обусловленное химическим
окружением, называется химическим сдвигом.
Для измерения химических сдвигов в большинстве случаев
вводят в кювету с исследуемым веществом стандарт, тетраметил-
силан (ТМС), (CH3)4Si. Это вещество имеет 12 эквивалентных
протонов, которые дают одну резонансную линию в более высоких
88
Рис. 40. Спектр ЯМР высокого
разрешения этанола:
5 — химический сдвиг. Резонансная полоса
стандарта тетраметилсилана (TMC) с 8=0
полях, чем большинство других
протонов. Шкала химических
сдвигов определяется тогда, как
б==^об^ст10б[м .д.ь(4.31)
где #0б и ^ст — резонансная напряженность магнитного поля для
образца и стандарта. Значение б выражают в миллионных долях
[м. д.] (англ. — ppm-parts per million).
За нулевое значение принимается б для ТМС, и по отношению
к ней откладываются резонансные полосы для изучаемых
соединений в шкале б (рис. 40). Например, спектр ЯМР для этанола
представляет три группы линий, связанные с нахождением
протона в различном окружении атомных групп ОН, СН2 и СН3.
В условиях высокого разрешения ЯМР-спектроскопия позволяет
получить разделение линий в атомных группах СН2 (на 4
компоненты) и СН3 (на три компоненты). Расстояние между линиями
в каждой группе дает константу спин-спиноеого взаимодействия.
Использование ЯМР для изучения структуры белка.
Анализ спектров ЯМР белков затруднен вследствие большого
количества атомов водорода. Наложение магнитных линий создает
уширенные полосы в спектре ЯМР белков. Большинство
резонансных полос для алифатических групп аминокислотных остатков
имеет б между 1 и 4,5 м. д., а для ароматических боковых групп
(гистидин, фенилаланин, триптофан, тирозин)— между 7 и 9 м. д.
По этим характерным полосам изучают развертывание белков при
действии различных факторов (температура, рН), взаимодействие
субстратов с активным центром фермента (по изменению сигналов
ЯМР гистидиновых и фенилаланиновых остатков, которые часто
находятся в активном центре), конформационные перестройки
белков и динамику белковой структуры.
ЯМР-томография. Вода — основная часть биологических
объектов, поэтому основным сигналом тканей есть сигнал протон-
нрго магнитного резонанса молекул воды. Поскольку частота
ЯМР пропорциональна напряженности внешнего магнитного поля,
то, создавая в ткани градиент магнитного поля, можно получить
спектр ЯМР, в котором интенсивность сигнала на данной частоте
будет характеризовать относительное количество воды в той части
ткани, которая находится в области определенного значения
магнитного поля. Биологический объект «просматривают» в разных
направлениях в магнитном поле. Затем с помощью компьютерного
анализа воссоздают изображения по полученным проекциям.
ЯМР-томография обеспечивает- возможность изучения различных
частей биологического объекта на основе различий амплитуды
сигнала ЯМР в разных частях образца. Таким методом
определяем
он
сн.
сн.
_JLi_
ТМС
д<-
89
ются размер и положение опухолей в организме. Поскольку
намагниченность (время продольной релаксации Тг) больше у
опухолевых, чем у нормальных, тканей сигнал ЯМР воды опухоли
насыщается более легко, чем сигнал нормальной ткани. Этот
метод имеет преимущество перед рентгенографией, так как
радиочастотное электромагнитное облучение не вызывает повреждений
биологического объекта. Этим методом легко получают
изображение органов внутри грудной клетки или области в полостях
черепа без хирургического вмешательства.
4.9. Электронный парамагнитный резонанс (ЭПР). Явление
ЭПР было открыто в СССР в 1944 г. Е. К. Завойским. В
парамагнитных полях им было обнаружено интенсивное резонансное
поглощение высокочастотной энергии при cfporo определенных
соотношениях напряженности постоянного магнитного поля и частоты.
Явление ЭПР состоит в резонансном поглощении энергии
электромагнитного поля парамагнитным веществом, помещенным в
постоянное магнитное поле. Однако не все электроны могут быть
исследованы при помощи метода ЭПР. Большинство химических
соединений состоит из комплексов с заполненными электронными
оболочками, в которых все электроны спарены вследствие
антипараллельной связи между ними. В соответствии с принципом
Паули в результате попарного взаимодействия электронов их
собственные спиновые магнитные моменты взаимно
скомпенсированы, а суммарный магнитный момент равен нулю.
ЭПР-поглощение определяется магнитными свойствами
вещества, т. е. магнитными свойствами электронов и ядер атомов.
Электрон, как движущийся заряд, создает вокруг себя магнитное
поле. Движение электрона по орбите приводит к появлению
орбитального магнетизма. Однако вклад орбитального электронного
магнетизма незначителен, возбужденные орбитальные состояния
лежат намного выше основного состояния, в результате чего
орбитальный магнетизм в этих атомах практически погашен.
Кроме орбитального движения электрон обладает и
собственным механическим вращением— спином и связанным с ним
магнитным моментом. Парамагнетизм вещества в твердой фазеобуслов-
лен в основном спиновым магнетизмом электронов.
Условием возникновения ЭПР является наличие у частиц
исследуемого образца некомпенсированных магнитных моментов,
обусловленных спином неспаренных электронов. В системах
с нечетным числом неспаренных электронов каждый электронный
уровень вырожден по спину по крайней мере дважды, т. е. уровни,
характеризующиеся положительным и отрицательным значением
магнитного квантового числа электрона ms (например, +1/2
и — 1/2), не отличаются по энергии.
В отсутствие внешнего магнитного поля все электроны
парамагнитного вещества имеют произвольную ориентацию спийа
и обладают одинаковыми энергиями, т. е. наблюдается
вырождение энергетического уровня (рис. 41, а). При помещении образца,
обладающего парамагнетизмом, в постоянное магнитное поле
90
♦ \н
Рис. 41. Схема ориентации магнитных
моментов электронов в отсутствие
внешнего магнитного поля (а) и при
помещении образцов в постоянное магнитное
поле (б):
Н — напряженность магнитного поля; Et и
£2 — энергетические уровни
№+}§№
E^o-jgfiH
Рис. 42. Схема расщепления
энергетических уровней одного нгспарен-
ного электрона при наложении
внешнего магнитного поля при
отсутствии сверхтонкого взаимодействия.
Объяснение в тексте
вырождение снимается, т. е. появляются энергетические уровни,
связанные с разрешенными ориентациями элементарных
магнитных моментов электронов (рис. 41, б). Промежуточные ориентации
спинов относительно магнитного поля запрещены условиями
квантования.
При наложении внешнего магнитного поля электронные уровни
расщепляются на два подуровня с квантовым числом +tns и —т<*
с разницей в энергии
AE = g$H, (4.32)
где Н — напряженность магнитного поля; р = -г магнетон
Бораf равный 9,274 • 10~24 Дж • 7V1 (е — заряд электрона — 1,6 х
X Ю"19 К л; те— масса электрона —9,1 • 10""31 кг; h — постоянная
Планка; с — скорость света); g— фактор спектроскопического
расщепления, определяющий величину эффективного магнитного
момента частицы.
На рис. 42 представлена схема расщепления энергетических
уровней одного неспаренного электрона (спиновое квантовое число
системы s= 1/2) при наложении внешнего магнитного поля.
При этом энергия частиц, спины которых ориентированы по полю,
на 1/2 gfiH меньше энергии частиц в отсутствие внешнего
магнитного поля (Et= E0— V2gfiH). Энергия частиц, спины которых
ориентированы против поля на 1/2 g$H, превышает значение
в нулевом поле(£2 = Е0 + V2gfiH). Следовательно, разность
энергий уровней равна g$H. Электроны в подсистемах Ег и £2,
возникших во внешнем магнитном поле, почти равномерно
распределяются по двум уровням энергии с незначительным преобладанием
электронов со спином, ориентированным по полю. Распределение
электронов по энергетическим уровням зависит от температуры
и описывается больцмановским распределением (см. (4.27)).
91
Рис. 43. Схема, иллюстрирующая
происхождение сигнала ЭПР в виде
производной (3) от истинной кривой (2)
поглощения при помощи модуляции (/)
электромагнитного поля:
J — интенсивность поглощения СВЧ-энергии
Между двумя уровнями
возможны энергетические
переходы, в результате которых
ориентация спинов будет
изменяться на противоположную.
Согласно основным принципам квантовой механики, переходы между
энергетическими состояниями могут быть вызваны поглощением
кванта hv. Если на спиновую систему, находящуюся в постоянном
магнитном поле, воздействовать переменным сверхвысокочастотным
(СВЧ) электромагнитным полем с частотой v и энергией квантов
hv9 то при условии резонанса
hv = Д£ = g$H
(4.33)
индуцируются переходы между указанными энергетическими
уровнями, т. е. происходит обращение спинов. При переходе с
нижнего уровня Ег на верхний Е2 происходит поглощение энергии
электромагнитного поля; одновременно с такой же вероятностью
осуществляются переходы с уровня Е2 на уровень Ех с
испусканием энергии. Как правило, поглощение превышает
индуцированную эмиссию. Общее число неспаренных электронов в системе
и разница в заселенности электронами двух энергетических
уровней определяют интенсивность наблюдаемого сигнала ЭПР.
Из условия резонанса hv=g$H очевидно, что наблюдение
спектра ЭПР вследствие резонансных переходов электронов можно
проводить двумя принципиально различными способами: 1)
изменять напряженность магнитного поля Я при фиксированном
значении частоты v; 2) изменять v при фиксированном значении Я.
На практике ЭПР-спектрометры работают на фиксированной
частоте v излучения при изменении Я. Запись спектра ЭПР
осуществляется в координатах /Пог=/(#) при v= const, где /ПОг —
интенсивность поглощения СВЧ-энергии. В целях повышения
чувствительности ЭПР-спектрометров регистрируется не
интенсивность поглощения энергии, а первая производная спектра
ЭПР— /пог, что достигается введением высокочастотной (ВЧ)
амплитудной модуляции магнитного поля. На рис. 43
представлена схема, иллюстрирующая возникновение сигнала ЭПР
в виде первой производной. При регистрации линии поглощения 2
ВЧ-модуляция магнитного поля / вызывает появление сигнала
ЭПР 3, амплитуда которого пропорциональна величине первой
производной поглощения при данном значении напряженности
магнитного поля Я.
На рис. 44 представлен общий вид ЭПР-спектрометра. Как
и ЯМР-спектрометр, он включает электромагнит, источник
92
Рис. 44. Исследовательский ЭПР-спектрометр РЭ-1307 (СССР)
СВЧ-излучения, электронную систему регистрации. Но поскольку
ядерный магнетон (4.23) более чем на три порядка меньше
магнетона Бора, то при данной напряженности магнитного поля Н
резонансная частота v для неспаренного электрона обычно в 103раз
превышает частоту, на которой работают ЯМР-спектрометры.
Если эксперименты по ЯМР проводятся на частотах в диапазоне
мегагерц, то ЭПР-спектрометры работают в диапазоне гигагерц.
Основными параметрами сигнала ЭПР являются фактор
спектроскопического расщепления (^-фактор), интенсивность
(количество неспаренных электронов в образце), ширина и форма
линии.
Фактор спектроскопического расщепления характеризует
положение линии в спектре ЭПР, определяемое тем, насколько
свойства неспаренных электронов, ответственные за поглощение
энергии в данном веществе, близки к свойствам свободного
электрона^ магнетизм которого обусловлен только спином, а g-фактор
равен 2,0023. Значение g-фактора, который используется для
идентификации парамагнитных центров, может быть определено
из уравнения hv = g$H при одновременном измерении
напряженности Н резонансного магнитного поля с помощью протонного
датчика и частоты v СВЧ-энергии, при которой происходит
поглощение. Для большинства парамагнитных центров g-фактор
отличается от значения 2,0023 в сторону как уменьшения, так и
увеличения.
В связи с тем, что оценка абсолютного количества спинов
в образце связана с ошибками, проводят сравнительные
определения амплитуды сигнала ЭПР или площади под кривой поглощения
по отношению к стандартам. Чувствительность ЭПР-спектромет-
93
ров составляет 5 • 1010 неспаренных электронов при ширине
линии ЭПР 1 Э.
Ширина линии ЭПР, зависящая от концентрации парамагнитных
центров и взаимодействия их с растворителем, позволяет
получить информацию о характере взаимодействия неспаренных
электронов друг с другом, с решеткой, о степени делокализации
неспаренных электронов на многих центрах. Ширина линии ЭПР,
измеряемая в эрстедах, определяется обычно сравнением с точно
известной шириной линии стандартного образца. Для ряда
парамагнитных комплексов металлов при комнатной температуре
наблюдается уширение сигнала ЭПР, вследствие чего его нельзя
зарегистрировать. Понижая температуру образца, можно за счет
ослабления спин-решеточной релаксации повысить время жизни
спина системы в возбужденном состоянии, что дает возможность
зарегистрировать сигнал ЭПР этой системы. Сигналы ЭПР
большинства парамагнитных комплексов в биологических объектах
регистрируются по этой причине при температуре жидкого азота
(77 К) и ниже.
Форма линий спектра ЭПР, характеризующаяся формулами
Гаусса или Лоренца, определяется функциональной зависимостью
интенсивности поглощения от частоты СВЧ-энергии или
напряженности магнитного поля.
Для парамагнитных центров, содержащих магнитные ядра,
в спектре ЭПР возможно наблюдение сверхтонкой структуры
(СТС), которая возникает в результате взаимодействия
неспаренных электронов с магнитными моментами ядер. Аналогично
электронным спинам ядерные магнитные моменты, подчиняясь
закону пространственного квантования, ориентируются в
магнитном поле дискретно (либо вдоль внешнего магнитного поля,
либо против него) (параграф 4.8). Ядра многих атомов обладают
спином и, следовательно, собственным магнитным моментом,
который по абсолютной величине на три порядка меньше магнитного
момента электрона. Количество компонентов сверхтонкой
структуры определяется значениями ядерного спина данного атома по
формуле 2/ + 1, где /— значение ядерного спина атома.
Следовательно, взаимодействие электрона с ядром приводит к
расщеплению каждого электронного уровня энергии на 2/+ 1 уровней.
Вследствие этого резонансное поглощение также расщепляется на
2/+1 равноудаленных линий одинаковой интенсивности.
Число компонентов сверхтонкой структуры, величина
расщепления, распределение интенсивностей между компонентами и
ширина отдельных компонент позволяют сделать вывод не только
о деталях строения молекулы, но и о распределении плотности
неспаренного электрона между различными атомами, об
электронной структуре атома с данным магнитным ядром, а также о
взаимодействии парамагнитной частицы с окружающей средой.
Следовательно, исследование сверхтонкой структуры спектров
ЭПР имеет значение для идентификации строения свободных
радикалов и парамагнитных комплексов. Анализ параметров сверх-
94
сн.
о
н3с
е- + Н*
ОуЛ^°-сн|з на
Н,
Гидрофобный
"углеводородный
хвост
,0-СНз
Убихинон
Убисемихинон
(свободный радикал)
Дигндроубихинон
Рис. 45. Схема ступенчатого восстановления убихинона до дигидроубихино-
на. При переносе электрона образуется свободно-радикальная форма —
убисемихинон. В убихиноне из митохондрий млекопитающих гидрофобный хвост,
который удерживает убихинон в мембране митохондрий, содержит 10 изо-
преноидных звеньев (кофермент Q10)
тонкой структуры позволяет судить о природе лигандов в
координационной сфере металлов переходной группы, а также о
характере связи этих лигандов с центральным атомом.
Сигнал ЭПР зависит от результирующего поглощения СВЧ-
энергии, которое возникает благодаря существующей разнице
в заселенности верхнего и нижнего энергетических состояний.
Однако продолжительное подкачивание системы СВЧ-энергией
в условиях резонанса уравнивает заселенности энергетических
уровней, приводя к уменьшению амплитуды сигнала ЭПР.
Процессы релаксации, которые устанавливают больцмановское
распределение в условиях высокой мощности Р СВЧ-излучения,
могут быть недостаточно быстрыми для его поддержания. Если
интенсивность сигнала ЭПР перестает изменяться
пропорционально УР, наступает насыщение Эффект насыщения следует
учитывать при исследовании в биологических образцах парамагнитных
металлоферментных центров и свободных радикалов семихинон-
ного типа. С помощью насыщения представляется еозможным
разделить два перекрывающихся сигнала ЭПР при условии,
что один из них не насыщается, а другой зависит от мощности
СВЧ-излучения.
С помощью метода ЭПР показано, что биологические системы
животного и растительного происхождения содержат свободные
радикалы, которые представляют собой молекулу или ее
компоненты, имеющие неспаренный электрон. Свободные радикалы
обладают парамагнитными свойствами благодаря
некомпенсированным магнитным моментам неспаренных электронов.
Схема ступенчатого биологического восстановления или
окисления с образованием промежуточной семихинонной формы,
содержащей нечетное число электронов, является теоретической
основой для объяснения образования свободно-радикальных
состояний в окислительно-восстановительных реакциях (рис. 45).
Семихинонами принято называть различные органические про-
95
Рис. 46. Флавосемихинон
межуточные свободнорадикальные формы. Основным
источником свободных радикалов в биологических системах являются семи-
хинонные формы убихинона Q10 и флавинов, структурные
формулы которых представлены на рис. 45 и 46.
Метод ЭПР нашел эффективное применение для изучения
молекулярных переносчиков электронтранспортнои цепи мембран
митохондрий* включающих НАДН, флавины, кофермент Q10,
железосерные центры, цитохромы в, си а> а также цитохром с-ок-
сидазу. В митохондриях различных органов при температуре
77 К регистрируется сигнал ЭПР с g-фактором 1,94, который
обусловлен комплексами негемового железа в восстановленной
форме. Применение температур ниже 30 К позволило
идентифицировать при использовании метода ЭПР различные железо-
серные (Fe*— S) центры электронтранспортнои цепи митохондрий.
Информация о железосерных центрах представлена в параграфе 12.2.
В ряде органов при температуре 77К наблюдаются сигналы
окисленной формы цитохрома Р-450 электронтранспортнои цепи
микросом. Сигналы ЭПР, обусловленные низкоспиновым
состоянием гемового железа цитохрома Р-450 имеют g2= 2,42, g2 = 2,^5
й §з = 1,91., Характерным свойством цитохрома Р-450 является
возможность перехода низкоспиновой формы в высокоспинов} ю
при его восстановлении, в этом случае регистрируется сигнал
ЭПР со значениями g± = 6,1 и g-ц =2,0. Сигнал ЭПР цитохрома
Ьь электронтранспортнои цепи микросом при 20 К имеет три
компонента с ^ = 3,05, g2 = 2,22, g3 = Ml-
ЭПР-спектроскопия получила дальнейшее свое развитие
вследствие применения спин-меток, т. е. синтезированных соединений,
содержащих парамагнитный центр. Спиновыми метками обычно
называют нитроксильные радикалы, которые ковалентно
связываются с биологически активными молекулами. Если связь
радикала обусловлена электростатическими силами или
гидрофобными взаимодействиями, то такая молекула называется
спиновым зондом. Наиболее широкое применение для биологических
исследований получили нитроксильные свободные радикалы,
характеризующиеся стабильностью благодаря низкому уровню энергии
основного состояния нитроксильной группы N" — О, которая
содержит неспаренные электроны (рис. 47). Принципиальным
свойством нитроксильных радикалов является способность к
взаимодействию без затрагивания свободной валентности.
96
Рис. 47. Стабильный нитроксильный свободный радикал— сн3
ссно&а спиновых меток и зондов: Т £Н
/?i в R9 — химические группы I/
ЯЦ—д
Спектр ЭПР нитроксильного радикала состоит иэ J
трех узких линий, эквивалентных по интенсивности /JJ"""^
и ширине которые являются сверхтонкой структурой сн3
вследствие взаимодействия неспаренного электрона £н
с ядром 14N. Константа сверхтонкого взаимодействия 3
изменяется в пределах 15—17 Э в зависимости от
природы растворителя и структуры остальной части молекулы спин-
метки.
Интерпретация интенсивности, ширины и формы линий спектра
ЭПР спиновой метки, введенной в биологическую структуру,
дает информацию о физических и физико-химических параметрах
микроокружения нитроксильного радикала. Уменьшение
скорости молекулярного движения приводит к уширению триплетного
спектра нитроксильного радикала, что свидетельствует об
увеличении вязкости среды. Кроме определения времени вращательной
корреляции т, которое пропорционально микровязкости мембран,
важнейшим является параметр упорядоченности S. Определение
этого параметра позволяет судить о фазовых переходах в ли-
пидном слое мембраны и других средах. Так, параметр
упорядоченности для липидов в жидком состоянии в несколько раз выше,
чем в твердом. При снижении вязкости мембран параметр
упорядоченности уменьшается.
Благодаря применению спиновых меток и зондов получены
новые данные о строении и функционировании субклеточных
структур, о липидах и белках, о липид-белковых взаимодействиях
в мембранах. Применение спиновых меток, обладающих различной
растворимостью в гидрофильной и гидрофобной фазах, открывает
-возможности для параллельного изучения структуры
молекулярных комплексов мембран. Разработаны методы синтеза жирных
кислот и фосфслипидов, меченкых в олределеннсм положении,
что находит применение для характеристики подвижности фосфо-
липидов в бислое мембраны. Актуально применение метода ЗПР
для изучения первичных и вторичных механизмов действия
ионизирующей радиации на клетки и ткани.
4.10. Ферментный катализ. В живом организме выполняется
огромное количество обратимых химических реакций: гидролиз,
расщепление химических связей, образование новых,
изомеризация, перенос электронов и др. Больших скоростей биологических
реакций невозможно достичь простым увеличением температуры
или давления. Ускорение химических превращений в клетке
связано с функционированием природных
катализаторов—ферментов, работающих при умеренных физиологических
температурах и рН.
Отметим ряд особенностей функционирования ферментов.
Необычным свойством ферментов является эффективность их катали-
4 8.616
97
тического действия. Катализируемые ферментами реакции лро-
текают со скоростями, в Ю8—1020 раз большими, чем
соответствующие некатализируемые реакции. Другая особенность ферментов
состоит в их специфичности действия. Фермент взаимодействует
и воздействует только на одам тип субстрата. В основном функция
ферментов состоит в снижении энергетических барьеров
химических реакций, которые имеют значительную величину при
неферментативном катализе. Например, при неферментативном
разложении перекиси водорода энергия активации большая —
75 кДж • моль"1. При участии фермента каталазы энергетический
барьер снижается до 8 кДж • моль"1, в результате чего происходит
увеличение скорости реакции в 3 • 1011 раз.
Как работают ферменты? Какой механизм взаимодействия
фермента с субстратом? Первоначально возникла идея Е. Фишера,
предполагающая очень жесткую подгонку субстрата к активному
центру фермента по типу ключ— замок. Со временем
накапливалось все больше фактов о неправомочности статической модели
Фишера. Так, оказалось, что малые молекулы, которые легко
проникают в активный центр, не присоединяются к его
поверхности, тогда как их аналоги большего размера легко присоединяются
и преобразуются в активном центре. Эти и другие факты, о
которых говорилось в параграфе 4.5, явились основанием для
представления ферментов как динамических флуктуирующих систем.
Д. Кошланд предложил теорию индуцированного структурного
соответствия фермента и субстрата. Согласно этой теории,
субстрат вызывает существенные изменения геометрии фермента
при проникновении в активный центр. В результате конформа-
ционной перестройки активного центра происходит точная
ориентация каталитических групп фермента. В теории Кошланда четко
разделяются два процесса — связывание субстрата и его
каталитическое преобразование. Каталитические группы / активного
центра свободного фермента не находятся в той ориентации, в
которой они осуществляют эффективный катализ (рис. 48, а). После
связывания субстрата с ферментом происходят конформационные
изменения в активном центре, в результате чего
каталитические группы занимают необходимую для катализа ориентацию
(рис. 48, б). Главная причина увеличения абсолютной скорости
реакции состоит в замене маловероятных реакций высокого
порядка, которые требуют соударений трех и больше числа молекул,
высокоэффективными реакциями низкого порядка. Теория
Кошланда основана на динамическом соответствии фермента и субстрата:
не только фермент влияет на структуру субстрата, но и сам
субстрат изменяет конформацию фермента.
В настоящее время преобладает точка зрения, что в
функционировании ферментов динамика белковой структуры играет
существенную роль. Если бы атомы белков находились в статических
положениях, то различные низкомолекулярные лиганды были бы
не в состоянии ни проникать в центры связывания, ни покидать
их пределы.
98
Рис. 49 Конформационные изменения,
вызванные связыванием лиганда.
а — локальные конформа-цисг-шые измене»-
ния в области активного центра; б —
крупномасштабные междоменные движения;
S-еубстрат, Е — фермент, ш — «шарнирное»
соединение, Е* —новая конформация
фермента после связывания субстрата
Рассмотрим конформационные изменения белков, вызываемые
связыванием низкомолекулярных лигандов. В отсутствие
связанного лиганда белок находится в равновесии с двумя (или больше)
разными конформационными состояниями, хотя часто одна из
конформации является наиболее предпочтительной. Связывание
лигандов изменяет равновесное распределение среди этих кон-
формаций таким образом, что уже другие конформации являются
предпочтительными для комплекса белок—лиганд. В настоящее
время с помощью рентгеноструктурного анализа высокого
разрешения обнаружено несколько типов конформационных
перестроек, вызываемых связыванием лигандов. Выделяют два типа
перестроек .
Первый тип—это небольшие, локальные конформационные
перестройки, которые затрагивают только область активного
центра. Для таких мелкомасштабных конформационных изменений
характерны небольшие локальные смещения— не больше 1,5 нм.
В ряде случаев конформационное изменение, вызванное
связыванием лигандов, проявляется локально в центре связывания и
может вовлекать только свертывание небольшого полипептида и
связанной с ним боковой группы аминокислотного остатка, как это
хорошо показано для карбоксипептидазы. Тирозиновый остаток
248 этого фермента смещается на 1,2 нм при конформационном
переходе из состояния, когда лиганд отсутствует, в состояние, когда
лиганд связан в активном центре (рис. 49, а).
Другой тип включает крупномасштабные конформационные
перестройкиу сопровождающиеся смещением отдельных
структурных блоков фермента на расстояния больше 1,5 нм. Такая конфор-
мационная перестройка может быть связана с относительным
движением структурных доменов (рис. 49, б). Для гексокинаэы
показано, что связывание лигандов вызывает существенную реориен-
Рис. 48 Механизм индуцированного
структурного соответствия фермента
Е и субстрата 5:
а — свободный фермент; б —
фермент-субстратный комплекс; / — каталитические
группы; 2 — группы, ответственные за
связывание субстрата
4*
9у
аацию относительного положения двух доменов, хотя
конференция самих доменов изменяется незначительно. Слабоупорядочен-
ная полипептидная цепь, связывающая два домена, выполняет
функцию шарнира.
Во многих сложных ферментах лиганды связываются в
глубокой щели, которая лежит между двумя доменами (рис. 49, б).
В результате конформационной перестройки лиганд «прячется»
между доменами. Это хорошо показано для алкогольдегидрогеназы
печени. Алькогольдегидрогеназа состоит из двух одинаковых
субъединиц, каждая из которых образована одной полипептидной
цепью, состоящей в свою очередь из двух доменов. С помощью
рентгеноструктурного анализа показано, что алкогольдегидроге-
наза может находиться в двух конформациях. Одна из них,
открытая конформация, свойственна апоферменту (отсутствует
кофермент). В закрытой конформации домены сомкнуты вследствие того,
что с одним из них связывается кофермент НАДН, определяющий
перенос электронов в электротранспортных процессах. Открытая
конформация позволяет коферменту проникнуть к центру
связывания, а возникшая в результате конформационной перестройки
закрытая структура создает особое окружение, изолирующее
кофермент и субстрат от внешней среды и обеспечивающее
эффективное взаимодействие между ними. После завершения химической
реакции фермент вследствие флуктуации снова принимает
открытую конформацию, т. е. домены раздвигаются и при этом
освобождаются продукты реакции.
Для понимания механизма взаимодействия фермента с
субстратом важное значение имеет молекулярно-динамическое
моделирование (Карплус, Мак-Каммон, 1983), позволяющее детально
описать движение белковой структуры, рассматривая а,томы
белка как частицы, подчиняющиеся законам механики. Процесс
моделирования состоит из множества небольших шагов
продолжительностью 10~15 с, на каждом из которых производится расчет
координат и скоростей для всех атомов. Удается .получить на
дисплее ЭВМ траектории атомов, отражающие динамику
белковой структуры на протяжении 10~9 с и больше. Для этого
требуется свыше миллиона шагов и несколько сотен часов машинного
времени современной ЭВМ.
Переход алкогольдегидрогеназы из открытой конформации
в закрытую моделируется вращением доменов вокруг гибкого
шарнира на угол 30°. Результаты моделирования показали, что
если бы домены имели абсолютно жесткую структуру, то для и*
вращения и сближения необходимо преодолеть чрезвычайно
большой энергетический барьер, порядка 4200 кДж • моль^1.
При физиологических температурах тепловой энергии атомов
было бы недостаточно для преодоления такого барьера. Однако
если вращение доменов сопровождается флуктуациями, то
энергетический профиль вращения становится более пологим, и
тепловой энергии атомов достаточно для совершения
крупномасштабного перемещения доменов. В результате множества мелких флук-
100
туирующих смещений атомов возможно постепенное снижение
энергетического барьера. Фермент представляет собой «дрожа-
щую», самонастраивающуюся структуру. Расчеты свидетельствуют,
что в растворе при комнатной температуре случайные броуновские
движения доменов обеспечивают молекулу фермента энергией,
достаточной для того, чтобы могли произойти спонтанные
переходы между открытой и закрытой конформациями за 10~9 с.
Флуктуации атомов и их релаксация в новое положение не превышают
0,05 нм, что сопоставимо с амплитудами колебаний атомов вблизи
равновесия. Длительность таких флуктуации (10~12 с) значительно
короче, чем длительность крупномасштабных перемещений и
вращений доменов.
Таким образом, небольшие высокочастотные флуктуации
белковой структуры играют важную роль в крупномасштабных
согласованных перемещениях доменов. Динамика белковой структуры
играет решающую роль в ферментативном катализе.
4.11.Кинетика ферментативных реакций. Кинетика изучает
динамику и временные характеристики реакций. Важной
количественной характеристикой для описания временных
процессов является скорость реакции. Представим простую химическую
реакцию
А + В-+Р. (4.34)
Скорость реакции v есть изменение во времени количества
продуктов реакции
-'-Р. (4.30)
где \Р\— концентрация продукта. Простейшее кинетическое
уравнение для этой реакции запишется как
v = d-P = k[A][B], (4.36)
где fe — константа скорости реакции.
Порядок реакции определяют по виду уравнения,
выражающего зависимость скорости реакции от концентрации
реагирующих веществ. Общий порядок равен сумме показателей степеней
концентрации веществ, участвующих в реакции. Реакции могут
быть нулевого, первого, второго и т. д. порядков. Реакция,
согласно (4.36), является реакцией второго порядка. Если скорость v
не зависит от концентрации, то это реакция нулевого порядка.
Ферментативные реакции, которые идут с избытком субстрата,
проходят как реакции нулевого порядка.
В (4.34) расход вещества А будет записываться как реакция
первого порядка:
ЦР = ЦА\. (4.37)
101
Рис. 50. Схематическое представление фермент-субстратного взаимодействия:
а — без участия ингибиторов; б—с участием конкурентного ингибитора; в — с участием
неконкурентного ингибитора; Et — свободный фермент; S — субстрат; Р — продукт,
/ —- ингибитор; /с — константа скорости реакции
Определим, как изменяется со временем концентрация вещества Л.
Разделим переменные в (4.37):
j$ = -kdt (4.38)
и проинтегрируем (4.38). Получим
1п[Л]—lnW0]=—«, (4 39)
где [Л0]—исходная концентрация вещества А. Изменение во
времени вещества А для реакции первого порядка будет иметь
следующий вид:
[A] = [A0]e-k>. (4.40)
Давно было отмечено, что скорость ферментативной реакции
не может превышать некоторого предельного значения. Зтот факт
был использован для создания теории ферментативных реакций
(Михаэлис, Ментен, 1913). В теории постулировалось образование
короткоживущего фермент-субстратного комплекса ES в простой
реакции
Et + sttES^E + P, (4.41)
где £x—свободный фермент; S —-субстрат; Р— продукт.
Схематическое представление такого взаимодействия дано на рис. 50, я.
Общая концентрация фермента [Е] запишется
IE] = \Ег] + [ES]. (4 42)
Кинетическое уравнение для скорости образования и
расщепления фермент-субстратного комплекса запишется следующим
образом:
vi = dJ§p = kx \EX\ [5] - (k_x + k2) [ES\. (4.43)
После запуска ферментативной реакции наступает стационарьсе
состояние, которое характеризуется ^=0. В условиях
стационарности
M^il IS] - [fc-i + h\ [ES] = 0. (4.44)
Подставив в (4.44) [EJ из (4.42), находим концентрацию фермент-
субстратного комплекса
*ES] kAE][S] = kllE]lS] (4 45)
/*-! +
ftl -Щ +[S]
Отношение констант скоростей называется константой Миха-
элиса
ЯМ = Ц±^2. (4.46)
Тогда (4.45) будет иметь вид
l£Sl = ^™- <4.47)
Скорость ферментативной реакции, согласно (4.41) и схеме на
рис. 50, а, запишется как
-*P-M*S|-jM?|3. (4.48,
Уравнение (4.48) можно записать как
у =
^м + [5Г
(4.49)
где vM = k2 IE]— максимальная скорость ферментативной реакции.
Уравнение (4.49) называется уравнением Михаалшй—Ментен.
Зависимость скорости ферментативной реакции v от концентрации
субстрата [S] представлена на рис. 51, а. При достаточно малых
концентрациях субстрата скорость v пропорциональна IS]:
v^^-[S], (4.50)
поэтому ферментативная реакция представляет реакцию первого
порядка. При очень больших концентрациях субстрата, когда [S] >
> /См, v = vM, и реакция идет как реакция нулевого порядка. На
рис. 51 видно, что константа Михаэлиса Км соответствует такой
V
концентрации субстрата, когда v = -^ .
Для определения двух важных кинетических характеристик
Км и vM предложена линеаризация уравнения Михаэлиса — Ментен
в следующем виде:
JL = I + *S 1 (4.51)
toa
х
V
>
/
/
/
/
/
/
/
/
/ ^
/ /7
1 ;/
/
/ V
/ л'
.' /
л
/
*' ^
' ~>°^
/ iP^
Д г<
V»
Г Крит
л2
/37
Рис. 51. Кинетические кривые фермент-с>бстратного взаимодействия
а — зависимость скорости v феруентативной реакции от концентрации субстрата S;
vmax — максимальная скорость ферментативной реакции, Км — константа Мичаэлиса;
б— график Лайнуивера Берка; / — без ингибитора; 2 — с конкурентным ингибитором;
8 — с неконкурентным ингибитором
1
1
Согласно (4.51), строится график зависимости 7 0T [si (гРаФик
Лайнуивера— Берка) (рис. 51, б). Из наклона прямой получаем
#м « 1
величину —, а отрезок, отсекаемый на оси ординат, равен — .
ум м
V
Параметр k2= .-J. называют числом оборотов прямой реакции.
Для ферментативных реакций число оборотов изменяется в
широких пределах от 102 до 106 с"1: для карбонатдегидрогеназы £2=
= 10е <г\ уреазы — 104, карбоксипептидазы — 102 с"1. Число
оборотов определяет нижний предел константы скорости реакции
первого порядка, так как каждая элементарная стадия должна
протекать со скоростью, не меньшей, чем максимальная скорость
общей реакции. Величина, обратная числу оборотов, определяет
верхний предел времени жизни любой промежуточной формы
ферментов. Если fe2==-~j== 102c~\ тогда промежуточная форма
существует не более 10~2 с.
Соединения, уменьшающие скорость ферментативной реакции,
называются ингибиторами. Наиболее распространенным типом
ингибирования является конкурентное ингибирсвание. В этом
случае ингибитор связывается с тем же самым активным центром
фермента, что и субстрат, с образованием неактивного комплекса El
(рис. 50, б). Согласно рис. 50, б, запишем кинетические уравнения:
vx = ^P = К [Ег] [S] - (/Li + *,) ES;
v^iim^htfJin-k^lElY,
dt
(4.52)
[E]^[E1]+[ES] +IEI].
104
Используя условия стационарности (^=0 и и2= 0), из (4.52)
находим концентрацию фермент-субстратного комплекса [ES] в
присутствии конкурентного ингибитора:
[ES] Щ^ , (4.53)
Ku + Ku[I]/Ki + lS]9 К '
где Ki — константа ингибирования. Скорость ферментативной
реакции
— "W-MWl- 'I'?,' ,,„■ ,4.54)
1
и
1 Кы0 + 1Ц/Кг) 1
"ы + «V. ' 13"!
На рис. 51, а представлена зависимость v от концентрации суб-
сграта [S] в присутствии конкурентного ингибитора [/]. Из рисуцка
видно, что конкурентный ингибитор увеличивает константу
Михаэлиса, и для достижения максимальной скорости необходимо
значительно увеличивать концентрацию субстрата IS]. В
координатах Лайнуивера— Берка (4.54) имеет вид
(4.55)
В присутствии конкурентного ингибитора увеличивается наклон
прямой и константа Михаэлиса увеличивается в (1 + М//С,) раз
(рис. 51, б).
В присутствии неконкурентного ингибитора образуется
неактивный комплекс ESI (рис. 50, в). Скорость ферментативной
реакции будет
v = г-Д^-! , (4.56)
(*M + [S])(i + [/]/*,) v
где К;— константа ингибирования. В координатах Лайнуивера —
Берка (4.56) запишется в следующем виде:
1
V
(1+ [/]/*,)
- «V,
*„ (1 + 1/1/*,) 1
' »« fSJ '
(4.57)
Неконкурентный ингибитор значительно уменьшает vM (рис. 51).
Часто для определения констант ингибирования кинетические
кривые представляют в координатах Диксона. Для конкурентного
ингибирования
W (1+га)+ (*&*.)"> <458>
и неконкурентного ингибирования
WO+pO + ^' + raH <"•>
Строится график зависимости — от концентрации ингибитора [/]
при фиксированных концентрациях субстрата [S] (рис. 52). Из
105
графиков Диксона легко определяются константы ингибирования
Kt или /С/ и тип ингибирования. При неконкурентном ингиби-
ровании прямые для разных [S] сходятся в одной точке на оси
абсцисс.
Методы измерения быстрых реакций. Химические
методы позволяют изучать ферментативные реакции в состоянии
стационарности, которое достигается достаточно быстра. Значительный
интерес вызывает исследование периода реакции, предшествующего
стационарному состоянию (так называемая переходная фаза).
Для исследования очень быстрых ферментативных реакций,
у которых время релаксации намного меньше 1 с, необходимо
применять новые экспериментальные методы, отличные от тех, которые
используются для изучения ферментативных реакций в
стационарном состоянии, когда время смешивания реагентов больше
нескольких секунд.
В методе остановленного потока используется механическое
устройство для быстрого смешивания фермента и субстрата, что
позволяет регистрировать кинетические кривые в переходную
фазу с временем*порядка Ю"3 с. На рис. 53 представлена
упрощенная блок-схема установки для изучения быстрых реакций
методом остановленного потока. Растворы фермента и субстрата
заполняют шприцы 4 и 5 и с помощью мотора 1 очень быстро
впрыскиваются в камеру смешивания 6>
из которой смешанный раствор по
капилляру попадает в камеру
наблюдения 7.
В этом методе не требуется
точного контроля скорости потока.
Рис. 52. График Диксона:
в—конкурентное ингибирование; б —
неконкурентное ингибирование; v —
скорость ферментативной реакции, [/J —
концентрация ингибитора, [S]—
концентрация субстрата
Рис. 53. Блок-схема установки для
изучения кинетики ферментативных
реакций методом остановленного потока.
/ —мотор; 2 — шток, 3 — пластинка для
вталкивания поршней; 4 — шприц для фермента;
5 — шприц для субстрата, 6 — камера смеши
вачия, 7 — камера наблюдения; 8 — источник
света; 9 — монохроматор, 10 — ФЭУ; 11 —
шприц для остановки потока; 12 — триггер'ая
контактная группа, 13 — осциллограф; 14 —
спуск триггера; 15 — время остановки потока
106
Решающее значение имеет быстрота смешивания фермента и
субстрата, чтобы интервал времени между смешиванием и
заполнением камеры наблюдения был значительно короче времени
переходной фазы. Непрерывный ход реакции регистрируется оптической
системой, включающей источник света 8, монохроматор 9 и
фотоумножитель 10. Кинетика ферментативной реакции регистрируется
на экране осциллографа 13 сразу же после остановки потока (на
кинетической кривой указано стрелкой 15). Быстрая остановка
потока осуществляется шприцем // и триггерной контактной
группой 12у с помощью которой отключается движение мотора.
С момента остановки потока триггерный механизм позволяет
записывать кинетику реакции. На смешивание растворов, заполнение
камеры наблюдения, остановку потока и спуск триггера уходит
всего несколько миллисекунд. Метод остановленного потока
позволяет изучать кинетику ферментативных реакций в миллисекундном
интервале.
Один из перспективных и плодотворных методов изучения
быстрых реакций состоит в регистрации процесса релаксации
системы к равновесию после очень быстрого и небольшого
возмущения. Для изучения быстрых ферментативных реакций
используется метод температурного скачка, в котором возмущение
происходит в результате резкого повышения температуры на 10° за
10 "6 с. Быстрый нагрев создается электрическим разрядом в реак-
цжшной ячейке. Так как большинство кинетических параметров
изменяется при повышении температуры, температурный скачок
сопровождается быстрой релаксацией к новому равновесию.
При использсвании метода температурного скачка все реагенты
смешаны еще до Еозмущения, и лимитирующим является только
время разогрева системы (около 10~6 с). Таким образом, метод
температурного скачка измеряет кинетику реакций в
микросекундном интервале. Из-за конвекционных эффектов этот метод
имеет верхнее ограничение; он не может измерять переходные
процессы больше Ю-1 с.
Использование быстрых методов регистрации имеет важное
значение для раскрытия механизма ферментативного катализа.
В отличие от простых моделей взаимодействия фермента и
субстрата, когда изучается только стационарное состояние реакции, в
реальных ситуациях взаимодействие фермента с субстратом
осуществляется через множество быстрых промежуточных стадий:
E + S*=±E'S*±E"P-*E + P, (4.60)
где £', Е" — промежуточное конформации фермента.
В заключение отметим, что функциональное поведение бел&ов
связано с внутримолекулярными движениями (параграф 4.5),
происходящими с различными скоростями, от быстрых пикосе-
кундных колебаний до медленных процессов, длящихся сотни
секунд. На рис. 54 в сравнительном аспекте схематически
представлены биофизические методы, позволяющие получать информацию
о биологических процессах в различных временных интервалах.
107
3
о
i
с
U
Деполяризация флуоресценции
Квазиупругое рассеяние света
I 1
Угловые корреляции f-лучей
Н- ,
Поглощение ультразвука
| Н
ЭПР
ЯМР
3
о
I
10"
10"
10"
Ю-0 10"" КГ2 1 КГ
Температурный скачок
I 1
Скачок давления
i 1
Метод остановленного потока
I 1
Ручные методы
Рис. 54. Методы и временные интервалы, в которых изучаются динамика
макромолекул и скорости различных процессов
4.12. Влияние teMnepaTypbi на скорость химических реакций.
Скорости химических реакций сильно зависят от температуры.
В общем виде скорость реакции записывается как
v==k(T)cn,
(4.61)
где k (Г) — постоянная скорости; с— концентрация; п— порядок
реакции. Влияние температуры на скорость процесса проявляется
через постоянную скорости k (Г). На основании экспериментальных
данных Я. Вант-Гофф, а затем С. Аррениус (1889) нашли
эмпирическую зависимость
£ = ЛГ^, (4.62)
где Еа— энергия активации; А — предэкспоненциальный
множитель. Уравнение (4.62) называется уравнением Аррениуса. Энергия
активации—это энергетический барьер, который преодолевают
молекулы для осуществления реакции (рис. 55).
Предэкспоненциальный множитель А представляет собой частоту столкновений
_ Ив
реагирующих молекул. Тогда экспоненциальный множитель е RT
108
Рис. 55. Энергетический профиль
для химической реакции:
Е — энергия; Еа — энергия активадаи;
— координата реакции, X* —- акт^иви*
ровагньй комплекс
Рис. 56. График Аррениуса:
к — постоянная скорости реакции?
Т — температура; а — угол наклона
прямой
(множитель Больцмана) определяет долю молекул, имеющих
энергию выше Еа и эффективно участвующих в реакциях.
Для определения энергии активации Еа экспериментальные
данные строятся в координатах Аррениуса (рис. 56):
In A
In Л — -^ --^.
(4.63)
Получают линейную зависимость ink = fly). Из наклона прямой
легко находится Еа:
х In k2 ■
tga = —p
TV
\nk1
7\
Ea
R •
Физический смысл температурной зависимости скорости
реакции был раскрыт в теории абсолютных скоростей реакций (теория
переходного состояния), разработанной X. Эйрингом (1935). Эта
теория связывает скорость реакции с термодинамическими
свойствами определенных состояний реагирующих молекул А и В.
При изменении координаты реакции г, когда молекулы сближаются
к критическому расстоянию г0, образуется активированный
комплекс X*, обладающий высокой энергией (рис. 55). Состояние с
максимальной энергией представляет собой неустойчивое, переходное
состояние.
Согласно теории переходного состояния, скорость реакции
определяется скоростью прохождения через вершину
потенциального барьера. Допускается, что в реакции
A + B+=*X*->P + Q
(4.64)
109
имеется определенная концентрация активированных комплексов
[X*], находящихся в динамическом равновесии с исходными
реагентами. Константа равновесия запишется как
Скорость прямой реакции будет определяться средней скоростью
в» прохождения через барьер шириной б (рис. 55). Согласно
распределению Максвелла, средняя скорость движения реагирующих
молекул (в направлении, указанном стрелкой) запишется в
следующем виде:
оо т(у')2
f vf ~ 2k0T dv,
V
оо m(v')*
С Г 2k°T dv'
- VS.. <466>
где т—масса молекулы; Т—температура; k0—постоянная
Больцмана. Среднее время т прохождения через барьер б
т « 4 . (4.67)
V
Квантово-механические оценки дают выражение для 6:
б = лГ h (4.68)
/2я mk0T ' v
где h—постоянная Планка. Тогда
т = £. (4.69)
В общем виде кинетическое уравнение для реакции (4.64) будет
иметь вид
о= k[A][B]. (4.70)
С другой стороны, скорость реакции—это изменение
концентрации активированного комплекса за время прохождения через
потенциальный барьер
[X*]
(4.71)
Если подставить в (4.71) уравнение (4.69), получим
v = [X*]*f: (4.72)
Сравнивая (4.70) и (4.72):
k[AllB] = [X4*f9
110
получим постоянную скорость реакций k
*- h [А][Ву I4"'*'
Так как отношение концентраций представляет константу
равновесия (уравнение 4.65), то (4.73) будет иметь следующий вид:
k = k-fKp. (4.74)
Согласно уравнению Вант-Гоффа (1.45),
где AG°— стандартная свободная энергия активации. Теперь мы
можем связать константу скорости реакции с изменением
термодинамических величин:
k = ^f-e ет . (4.75)
Так как
AG° = AH° — TAS°,
то (4.75) будет иметь вид
k = ?ff-e RT =^LeR e rt a ,(4.76)
Найдем связь Д#° с энергией активации Еа. Для этого
прологарифмируем, а затем найдем дифференциал по Т от уравнений
(4.62)
1п£ = 1пЛ-|^;
d In & Е,
а
и (4.76)
dJ. — RT2
1п* = 1п^ + 1пГ+Д5° АЯ°
(4.77)
h ' "** ' Я /?Г '
£lnjfe _ _i , АЯ_° _ RT+AHQ , ш
dT T ~*~ RT* ~~ RT2 ' * '
Сравнивая (4.77) и (4.78), получим
Ea = AH°+RT. (4.79)
Таким образом, с точностью до слагаемого RT энергия
активации Еа представляет энтальпию АН0 образования переходного
состояния. При Г= 300 К величина RT са 2,5 кДж • моль"1.
Уравнение (4.76) называется уравнением Эйринга.
Значения энтальпии АН0 и энтропии Д5° дают ценную
информацию о природе переходного состояния и указывают на то, что при
активации молекул происходит сильная деформация химических
111
связей. Для-многих химических реакций, которые проходят при
комнатной температуре, Д#° (и соответственно Еа) равно примерно
50 кДж • моль"1. Энтропия активации характеризует вероятность
образования переходного состояния. Когда величина AS0 большая
и отрицательная, это значит, что для образования переходного
состояния реагирующие молекулы должны принять строго
определенную конформацию и пространственную ориентацию. Молекулы,
участвующие в метаболических процессах, имеют большие размеры
и обладают достаточной гибкостью. Поэтому некаталитические
реакции между ними маловероятны, так как значение AS0 большое.
Фермент значительно изменяет Д#° и AS0, и, таким образом,
значительно увеличивается скорость реакции.
Несмотря на определенные успехи, теория абсолютных
скоростей реакций имеет серьезные ограничения, так как она была
разработана для реакций в газовой фазе. Теория абсолютных
скоростей реакций постулирует, что энергетический барьер является
статическим и его преодоление осуществляется только за счет
энергии соударений атомов. В теории не рассматривалось смещение
атомов. Но в белках энергетические барьеры возникают при
смещениях атомов больше 0,01 нм. В плотно упакованной глобуле
белка движение групп большого размера сопрягается с
коллективным смещением окружающих атомных групп. Движущаяся группа
подвергается столкновениям с другими группами, что приводит
к эффектам внутреннего трения и вызывает снижение скорости
перехода через барьер. Переход через активационный барьер
приобретает характер броуновского движения по системе локальных
потенциальных минимумов под действием случайных сил (параграф
4.10). В отличие от теории абсолютных скоростей реакций, была
предложена теория Крамерса (1940), основанная на модели
движения через барьер под действием случайной силы. Согласно этой
теории, постоянная скорости записывается как
k = (T, л)= (±)ег-*а/*т9 (4<80)
где т| — имеет смысл вязкости среды..
Что касается химических реакций в растворе с участием
белковых молекул, смысл переходного состояния еще больше
углубляется. Причина состоит в том, что, согласно теории Крамерса, система
может находиться более длительное время в' переходном
состоянии, чем предсказывала теория абсолютных скоростей реакций.
Так как скорость реакции может сильно зависеть от вязкости,
природа может использовать эту зависимость для регулирования
реакциями.
4.13. Аллостерические ферменты. Регуляция химических
реакций влслетке. Рассмотрим еще один важный класс ферментов,
регулирующих и контролирующих метаболические процессы в
клетке. Метаболиты должны создаваться в необходимых количествах
и с минимальными затратами энергии. Такая регуляция осущест-
112
^
w
Ь
\Дб
Е,
не
Рис. 57. Биологическая регуляция по типу обратной связи:
Тр — треонич, Кб —. кетобутират, Аб — ацетогидроксибутират, Дб — а, 0 дигидрокси-Р-
метилвалерат, Кв —* а-кето-З-метилвааерат, П3 -* изолейцин, Ех •*• треониндезаминаза,
£*а — синтегаза ацетогидроксикислот, £з — изочероредуктааа ацвтогиДроксикислот, £4 —
дегидра^а дегидроксикислбт} Е$ — трансаминаза В
вляется ферментами, катализирующими ключевые метаболические
реакции.
Синтез в клетке аминокислоты L-изолейцина начинается с L-тре-
онина и осуществляется через ряд промежуточных этапов (рис. 57)
Экспериментально установлено, что активность треониндезаминазы,
первого фермента Ег на биосинтетическом пути регулируется
конечным продуктом—L-изолейцином. Все другие ферменты Е2,
Е6 , £4 и Еь не ингибируются L-изолейцином. Ингибирование
треониндезаминазы высокоспецифическое:
L-лейцин в 100 раз менее эффективен, чемL-изолейцин, aD-изо-
лейцин вообще не ингибирует треониндезаменазу.
На основании этих данных был предложен механизм
регулирования биосинтеза L-изолейцина. В интактной клетке повышение
концентрации L-изолейцина ингибирует треониндезаминазу. Это
приводит к уменьшению скорости всех реакций синтеза
L-изолейцина. Понижение концентрации L-изолейцина устраняет эффект
ингибирования, что способствует увеличению скорости
образования из L-треонина конечного продукта, L-изолейцина. Таким
образом, конечный продукт служит химическим сигналом для
управления активностью первого фермента, треониндезаминазы. Это
пример регуляции активности фермента по типу отрицательной
обратной связи. Следует отметить, что треониндезаминаза не
регулируется по типу конкурентного ингибирования. Конечный продукт —
L-изолейцин не имеет структурного сходства с субстратом — L-тре-
онином. Треониндезаминаза кроме активного центра, где
катализируется превращение L-треонина, имеет специальные центры
связывания эффекторов (активаторов или ингибиторов), которые
пространственно удалены от каталитических центров.
" Хорошо изучена регуляция биосинтеза нуклеотидов у Е. coli.
В такой регуляции участвует сложный фермент аспартаттранскар-
бамоилаза (АТКаза). Увеличение концентрации ЦТФ служит
ингибирующим сигналом для уменьшения активности АТКазы
(отрицательная обратная связь). В npncyTCfBHH АТФ ингибиру-
ющее влияние снимается и происходит активация АТКазы
(положительная обратная связь). Таким образом, пиримидиновые или
пуриновые основания служат специфическими химическими
сигналами для тонкой регуляции активности АТКазы.
Регуляторные белки обладают рядом особенностей:
113
Рис. 58. Кривые насыщения кис- Рис. 59. Схематическое располо-
лородом миоглобина (/) и гемогло- жение субъединиц в аспартэт-
бина (2): транскарбамоилазе (АТКаза):
У— степень насыщения белка; [X]— ККК — каталитические тримеры; РР —
концентрация кислорода регуляторные димсры
1. Ингибирование или активирование метаболитическими
эффекторами происходит благодаря тому, что регуляторные ферменты
имеют специфические центры связывания для эффекторов, которые
пространственно удалены от каталитических центров. Центры
связывания эффекторов названы аллостерическими} а ферменты,
имеющие такие центры, называются аллостерическими
ферментами.
2. Многие ферменты, активность которых регулируется по
аллостерическому механизму, имеют графики зависимости
.активности от концентрации субстрата или эффектора S-подобиого
типа и, таким образом, обнаруживают кооперативную кинетику.
Свойство кооперативное™ хорошо иллюстрируется на
гемоглобине. Хотя гемоглобин не является ферментом, а представляет
собой белок-переносчик, он хорошо демонстрирует кооперативные
эффекты при связывании кислорода (рис. 58). Миоглобин, который
используется для запасания кислорода в мышце, не проявляет
кооперативных свойств,
3. Одна из характерных особенностей белков, обладающих
аллостерическими и кооперативными эффектами, состоит в ах
субъединичном строении. Миоглобин — мономерный белок, состоящий
из одной полипептидной цепи и одного центра связывания
кислорода. Гемоглобин состоит из четырех субъединиц (две а- и две
р-субъединицы), которые образуют тетрамерную структуру с
четырьмя гем-группами, связывающими кислород. Субъединичное
строение характерно и для других аллостерических белков: фосфо-
липаза b имеет две субъединицы, треониндезаминаза — четыре
субъединицы.
АТКаза (М = 300000) представляет собой мультисубъединич-
ный белок, состоящий из двух каталитических (К) тримеров (М =
= 100000) и трех регуляторных (Р) димеров (М = 34000) (рис. 59).
Трехмерная структура АТКазы определена методом рентгенострук-
турного анализа с разрешением 0,3 нм. В зоне контакта между
К- и Р-субъединицами находятся атомы цинка. В ферменте имеются
114
шесть каталитических и шесть аллостерических центров. В АТКазе
активатор АТФ и ингибитор ЦТФ связываются вР-субъединице,
и этот аллостерический участок находится на расстоянии 6 нм от
близлежащего каталитического центра в К-субъединице.
Следовательно, влияние АТФ и ЦТФ на активность фермента обусловлено
конформационными изменениями, которые передаются от Р- к К-
субъединицам, определяя аллостерические и кооперативные
эффекты.
Рассмотрим кооперативное связывание на гемоглобине и не
кооперативное связывание с миоглобином. Связывание лиганда
X с мономерным белком Е запишется как
E + xutEX, (4.81)
где К — константа ассоциации. В условиях равновесия
к=тт- <4-82)
Введем параметр Y—степень насыщения белка лигандом, т. е.
отношение числа занятых связывающих центров к общему числу
связывающих центров:
Y=wfm\- <4-83)
Подставляя [ЕХ] из (4.82), получим
У _ К IE] IX) _ КIX] и o4v
~[Е[ + К [Е] [X] "" 1 + КIX]' 1*'°*'
Уравнение (4.84) напоминает уравнение Михаэлиса — Ментен (4.49)
и представляет изотерму Ленгмюра. Экспериментально измеренная
степень насыщения Y миоглобина в зависимости от концентрации
кислорода [X] точно описывается уравнением (4.84) (рис. 58,
кривая 1).
В отличие от миоглобина, степень насыщения Y гемоглобина
описывается S-образной кривой (рис. 58, кривая 2). Для объяснения
таких кривых используется уравнение Хилла (1910):
у __ Kh[X] .4 ggv
1 + KhlXf' % ' '
Преобразуем это уравнение следующим образом:
1 _ 1 ■ * . * 1 _ 1 l—Y _ 1
Y + **[*]*' у КН[ХГ Y ~ Kkixf1
j^y^Kh[X]K (4Л6)
Прологарифмировав (4.86), мы получим линейную зависимость
lg 1 -| __ у\ от \g[X] (график Хилла) (рис. 60):
^[rrpJ-le^ + AlgW- (4^87)
115
UL+
2L +
1L +
2L +
3L +
4L +
Рис. 60. График Хилла.
Объяснение в тексте
Рис. 61. Модели функционирования ал-
лостерических ферментов:
а — симметричная (аллостерическая) модель
Моно — Уаймена — Шанже, б —
последовательная модель Кошланда — Немети — Филмера;
L — лиганд, Р — релаксированное состоя! ие;
Т — напряженное состояние фермента
Из графика Хилла легко
определяются два важных
параметра — константа
ассоциации Kh и h. Коэффициент Хилла h широко используется
как параметр, характеризующий степень неоперативности. Если
А=1, кооперативность отсутствует, и мы приходим к (4.84).
Если значение h > 1, то в этом случае наблюдается
положительная кооперативность. Для гемоглобина h = 2,8. Чем
больше Л, тем выше кооперативность. Под кооперативностью понимают
то, что связывание кислорода с одним из гемов облегчает дальнейшее
связывание кислорода с другими гем-группами. Если Л<1,
наблюдается отрицательная кооперативность.
Для объяснения функционирования аллостерических
ферментов и кооперативных эффектов используется несколько моделей.
Наиболее часто обсуждаются две из них.
Симметричная (аллостерическая) модель Моно—
У' аймена—Шанже (1965). Рассмотрим тетрамерный аллосте-
рический белок (четыре субъединицы). В модели постулируется, что
аллостерический фермент может существовать в двух
конформационных состояниях — напряженном (Т-состоянии) и релаксирован-
ном (Я-состоянии)(рис.61, а). В любой момент времени все
субъединицы белка имеют одну и ту же конформацию. В равновесии
аллостерический белок находится в двух конформациях: Т-состоянии
с низким сродством к лиганду L и Р-состоянии с высоким сродством
к L. В отсутствие L равновесие сдвинуто в сторону напряженной
конформации Т и преобладают 7-состояния. Когда L связываются
с тетрамером, равновесие постепенно смещается в сторону
Р-состояния. В этой модели аллостерический белок находится в виде смеси
двух конформационных состояний (в отсутствие L), и переход из
116
Г- в Р-состояние осуществляется согласованно, т. е. конформация
всех субъединиц изменяется одновременно. Эта модель хорошо
объясняет S-подобные кривые.
Последовательная модель К от ланд а — Немети —
Филмера (1966). Существенной особенностью этой модели
является предположение о том, что связывание лиганда вызывает
ряд последовательных структурных изменений в аллостерическом
белке. Связывание L с первой субъединицей индуцирует в ней кон-
формационные изменения, которые передаются на соседнюю
субъединицу. Индуцированное во второй субъединице конформационное
изменение обеспечивает более легкое связывание второй молекулы
L (рис. 61, б). После связывания второй молекулы L продолжается
влияние на конформацию других субъединиц. Таким образом, кон-
формационные изменения происходят последовательно, через ряд
промежуточных состояний с увеличивающейся или
уменьшающейся константой ассоциации. Последовательная модель имеет
преимущество в том, что она может объяснить отрицательную коопе-
ративность* связывание первой молекулы L индуцирует такое
конформационное изменение субъединицы, которое значительно
уменьшает вероятность связывания второй молекулы L.
Глава 5. БИОФИЗИКА НУКЛЕИНОВЫХ КИСЛОТ
В клетках присутствуют два типа нуклеиновых кислот: дезокси-
рибонуклеинрвая (ДНК) и рибонуклеиновая кислота (РНК). ДНК
содержится в прокариотических клетках и в ядрах, митохондриях
и пластидах эукариотических клеток. РНК эукариот синтезируется
в ядрах, но ее функция осуществляется в цитоплазме.
В результате транскрипции информация, записанная в ДНК,
переписывается в РНК и переносится к рибосомам. На них
происходит трансляция — синтез белка согласно информации, записанной
в матричной РНК (мРНК). Транспортная РНК (тРНК) «узнает»
свободные аминокислоты и присоединяет их к растущей на рибосоме
полипептидной цепи. Таким образом, РНК является посредником
между ДНК и белком.
Основная задача молекулярной биофизики состоит в изучении
структурных конформационных изменений нуклеиновых кислот.
До недавнего времени ДНК представлялась весьма жесткой и мало
изменчивой макромолекулой. В действительности, двойная
спираль ДНК обладает изменчивой и гибкой структурой, что очень
важно для выполнения биологических функций в клетке.
5.1. Первичная структура нуклеиновых кислот. ДНК и РНК
представляют собой длинные полимерные нити, состоящие из
нуклеотидов. Почти все РНК состоят из одной полинуклеотидной
цепи. Исключение составляют некоторые опухолеродные вирусы,
существующие в виде димеров из двух одинаковых цепей. Длина
цепей РНК изменяется в широких пределах —от 80 звеньев для
самых коротких тРНК до 2 • 105 звеньев в длинных РНК.
117
Рис. 62. Схематическое изображение комплементарных пар А—Т и Г—Ц в
ДНК:
Р — 3'— 5'— фосфодиэфириые связи, а— сахар, / — расстоягре, на котором
располагаются комплементарные пары, и—угол ориентации оснований. Пуриновые основания — аде-
нин (А) и гуанин (Г), пиримидиновые основания — тимин (Т) и цитозин (Ц)
Большинство молекул ДНК состоит из двух полинуклеотидных
цепей, закрученных одна вокруг другой. Цепи обладают
полярностью, т. е. в ДНК они расположены антипараллельно. Одни
природные ДНК являются кольцевыми, другие — линейными.
Самые короткие ДНК содержат несколько тысяч звеньев, тогда как
высокомолекулярные — до 108 звеньев.
Первичная структура нуклеиновых кислот — это
последовательность нуклеотидов в полинуклеотидной цепи. Мономерные единицы
нуклеиновых кислот называют нуклеотидами. Они состоят из
фосфата, сахара и пуриновых (аденин А и гуанин Г) или пирими-
диновых (тимин Т, цитозин Ц и урацил У) оснований. Нити
нуклеиновых кислот представляют непрерывную цепь ковалентно
соединенных фосфодиэфирными связями фосфатных групп с остатками
сахара. В каждом нуклеотиде сахар соединен с помощью гликозкд-
ной связи с азотистым основанием. Ориентация оснований к де-
зоксирибозе в ДНК описывается углом поворота х (рис. 62).
Возможно также вращение вокруг эфирной связи. Конформационная
подвижность в полинуклеотидной цепи сводится к вращению вокруг
этих связей. В результате такой подвижности создаются стерьче-
ские условия для регулярного расположения в пространстве
пуриновых и пиримидиновых оснований.
В настоящее время разработаны точные методы определения
первичной структуры, последовательности нуклеотидов в поли ну к-
леотиднои цепи. Для этого используется большое число недавно
открытых ферментов, рестриктаз, расщепляющих длинную ДНК
118
10
Ш
-6
4
2
"о
Рис. 63. Рентгенограмма ДНК:
К — кристалл ДНК; \ — ллина волны
рентгеновских лучей, Q1 и 02 — углы
рассеивания дифрагирующих лучей,
/ — 10 — слоевые линии
на короткие фрагменты, кото- —^-
рые легко поддаются анализу.
С помощью электрофореза ДНК
разделяется на фрагменты,
отличающиеся подлине даже на один
нуклеотид. Это позволяет точно
локализовать место расщепления
ДНК простым измерением длины получающихся фрагментов.
5.2. Двойная спираль ДНК. На основании данных рентгено-
структурного анализа и использования пространственных моделей
Дж. Уотсон и Ф. Крик (1953) предложили одну из возможных кон-
формаций ДНК на уровне вторичной структуры — двойную
спираль ДНК. Благодаря этому открытию стала понятна
биологическая роль нуклеиновых кислот в передаче генетической
информации.
Этому предшествовали важные экспериментальные
исследования. В начале пятидесятых годов Э. Чаргафф получил чистые
образцы ДНК и сделал тщательный анализ их нуклеотидного состава.
Были сформулированы правила Чаргаффа:
а) процентное содержание четырех оснований А, Т, Г и Ц в ДНК
от вида к виду очень сильно меняется;
б) но как бы сильно не отличался нуклеотидный состав, всегда
количество пуриновых оснований равно количеству пиримидино-
вых (количество А равно количеству Т, количество Г равно
количеству Ц).
Решающее значение для открытия пространственной структуры
ДНК имели рентгенографические исследования кристаллических
препаратов ДНК, проведенные М. Уилкинсом и Р. Франклин.
При облучении рентгеновскими лучами Я ориентированных
кристаллических нитей (К) ДНК на фотопленке регистрируется
рентгенограмма (рис. 63). Положение дифракционных максимумов
(дифракционных рефлексов) на рентгенограмме соответствует условию
Вульфа — Брэгга:
bsin@ = n%, (5.1)
где b — постоянная решетки (расстояние между упорядоченными
плоскостями); в — угол дифракции; п = 0, 1, 2, 3, ... — порядок
дифракции.
На рис. 63 представлена рентгенограмма В-формы ДНК.
Согласно (5.1), малым углам в соответствуют большие значения Ь. Для
В-формы можно выделить две постоянные решетки, которые
характеризуют упорядоченные структуры, располагающиеся
перпендикулярно оси кристалла ДНК. Первая упорядоченная структура
с постоянной Ьх обусловливает дифракционные максимумы под
углом ©х, которые располагаются на параллельных линиях, назы-
t19
Рис. 61. Двойная спираль ДНК в В-форме:
в\ —шаг спирали; в% — расстояние между комплемен*
тарными парами; d—диаметр двойной спирали; ф —
угол между двумя комплементарными парами, /—/0 —
число комплементарных пар на шаг спирали
ваемых слоевыми линиями. Расстояния
между слоевыми линиями отвечают
периоду &!= 3,4 нм. Второй
упорядоченный элемент ДНК связан с наличием
интенсивных меридиональных рефлексов,
первый из которых совпадает с 10-й
слоевой линией и наблюдается под
углом G2. Согласно (5.1), ему отвечает
период Ь2= 0,34 нм.
Применив правила Чаргаффа и
использовав молекулярные модели нуклео-
тидов, Уотсон и Крик просмотрели все
возможные комбинации четырех
оснований для того, чтобы получить
компактную и устойчивую пространственную
структуру ДНК. На основании этих
исследований они сделали важное
заключение, что ДНК представляет собой
двойную спираль — две полинуклеотидные
нити, идущие в противоположных на-
" правлениях и закрученные одна
вокруг другой. Главное достоинство модели Уотсона—Крика
состоит в установлении принципа комплементарности, или
дополнительности. Связь двух нитей ДНК осуществляется с помощью
комплементарных пар А—Т и Г—Ц (уотсон-криковские пары).
Таким образом, правила Чаргаффа получают строгое
объяснение. Благодаря принципу комплементарности всегда
выполняется равенство пуриновых и пиримидиновых оснований в ДНК.
Комплементарные пары А—Т и Г—Ц разрешены стеричес-
ки. В ДНК они располагаются на оптимальном расстоянии / =
= 1,085 нм, когда возможно «замыкание» между ними
водородных связей (рис. 62). Комплементарная пара А—Т
стабилизирована двумя водородными связями, пара Г—Ц— тремя водородными
связями.
На рентгенограмме рефлексы слоевых линий расходятся в виде
креста. Это указывает на то, что две противоположно направленные
полинуклеотидные цепи образуют правую двойную спираль с
нагом спирали &!== 3,4 нм. Расстояние между комплементарными
парами вдоль оси спирали ДНК соответствует Ь2= 0,34 нм. На
один шаг спирали в В-форме приходится 10 комплементарных пар
(рис. 64). Схематически двойная спираль представляет собой
винтовую лестницу. Угол скручивания двойной спирали (ср)
соответствует повороту двух комплементарных пар, следующих вдоль оси
спирали. Для В-формы ср= 360710= 36°.
120
/ \
Рис. 65. Конформации фуранозного кольца дезоксирибозы
а — атомы дезоксирибозы в плоскости рисунка, А — азотистое основание; и— угол
ориентации азотистого основания, б — С (2')-эндоконформация, в — С (З')-эндоконформация
5.3. Конформации ДНК. Конформационные перестройки в ДНК
возможны за счет небольших изменений в фуранозном кольце
дезоксирибозы (рис. 65, а). С помощью рентгеноструктурного анализа
установлено, что пятичленное кольцо сахара не является абсолют о
плоским. Атомы С2' и СЗ' могут отклоняться из плоскости "кольца на
0,03—0,06 нм. Если атом С2' отклоняется из плоскости кольца
в сторону С5', то образуется С2'-эндоконформация (рис. 65, б).
Отклонение СЗ' из плоскости кольца вызывает образование СЗ'-
эндоконформации (рис. 65, в). Такие небольшие конформационные
перестройки сахарного кольца вызывают изменение угла к и
ориентацию азотистых оснований по отношению к оси спирали.
Различают два семейства конформации ДНК. Если сахар
находится в С2'-эндоконформации, наблюдается В-семейство.
Характерная особенность его состоит в том, что угол кг= 2—6° и
комплементарные пары располагаются почти перпендикулярно к оси
спирали (рис. 64). К 5-семейству относятся В-, С-, Г-формы ДНК.
С СЗ'-эндоконформацией фуразного кольца связано А-семейство.
В этой конформации угол х увеличивается, и комплементарные
пары располагаются под углом примерно 20° коси спирали (рис. 65,в).
В Л-семейство попадают такие конформации нуклеиновых кислот:
Л-форма ДНК, Л-форма РНК, Л'-форма РНК.
Представленные выше результаты свидетельствуют о том, что
двойная спираль проявляет динамичные свойства. ДНК может
принимать разнообразные формы и взаимодействовать разными
способами с другими молекулами клетки. Фиксированная
структура уотсон-криковских пар оснований допускает большое
разнообразие форм дюйной спирали. В табл. 8 представлены параметры
ряда форм ДНК, которые были изучены с помощью
рентгеноструктурного анализа. Конформационный переход из семейства В в
семейство Л или конформационные изменения в одном семействе,
например переход от 5- к С- и У'-форме, можно вызвать изменением
121
8. Параметры двойной спирали ДКК: число комплементарных пар на шаг
спирали (п), шаг спирали (bj), расстояние между комплементарными парами
(Ь2), угол между двумя комплементарными парами (ср) и угол наклона
комплементарных пар (к)
Препарат ДНК
В-семейство
В -форма, Na+
£-форма, Li+
С-форма, Li+
Г-форма
А-семейство
Л-форма, Na+
Влажность, %
92
66
66
66
75
п
10
10
9,3
8
11
Ьи нм
3,36
3,37
3,10
2,72
2,81
Ь2, нм
0,336
0,337
0,332
0,34
0,255
Ф. град
36
С6
39
45
32,73
х, град
2
2
6
6
20
влажности кристаллических препаратов ДНК, как показаьо
в табл. 8. При добавлении в водный раствор этанола 5-форма ДНК
переходит в Л-форму. Конформационные перестройки ДНК
происходят при изменении концентрации соли в буфере.
Приведенные в табл. 8 конформации ДНК представляют правые
двойные спирали. В последнее время обнаружены более необычные
двойные спирали ДНК. При определенных условиях правая 5-фор-
ма ДНК может переходить в Z-форму, представляющую собой
левую двойную спираль. В этой форме сахаро-фосфатный остов ДНК
принимает зигзагообразную конформацию, что послужило
основанием для названия Z-формы ДНК. Вместо большой и малой
бороздок в Z-форме имеется одна глубокая бороздка, соответствующая
малой бороздке Б-формы.
5.4. Оптические характеристики нуклеиногых кислот.
Интенсивное поглощение нуклеиновых кислот в УФ-сбласти спектра
обусловлено пуриновыми и пиримидиновыми основаниями. Спектры
поглощения отдельных оснований сливаются в одну широкую
полосу и дают характерное поглощение нуклеиновых кислот с Ятах=
= 260 нм (рис. 66, а).
Квантово-механические расчеты показали, что интенсивное
поглощение света пуриновыми и пиримидиновыми основаниями
при 260 нм связано с л;-^ я*-переходами. Определенный вклад
в это поглощение вносят #-> л* -переходы. Коэффициент молярной
экстинкции е260 для нуклеиновых кислот почти на порядок больше,
чем 8280 для белков. Оптические свойства хромофорных групп
зависят от конформации ДНК. На рис. 66 представлены спектры
поглощения ДНК при комнатной температуре (298 К) и при температуре
355 К. После тепловой денатурации ДНК оптическая плотность D
увеличивается примерно на 30%. Явление, связанное с увеличением
оптической плотности нуклеиновых кислот, называется гиперхром-
ным эффектом. Уменьшенное поглощение нативных препаратов
ДНК есть гипохромный эффект.
На основании линейной зависимости температуры плавления
ДНК от содержания ГЦ-пар гиперхромный эффект пытались объяс-
122
Рис. 66. Спектры поглощения (а) и структурные перестройки (б) ДНК при
тепловой денатурации:
а —спектры поглощения ДНК при 298 К (/) и при 355 К (2); б — нативная (/) и
денатурированная (2) формы ДНК, Г — гиперхромный эффект; С — стэкинг-взаимодействия
оснований, D — оптическая плотность; X — длина волны света
нить разрывом водородных связей. Но исследования одноцепечеч-
ных полинуклеотидов показали, что стабилизацию двойной
спирали невозможно объяснить только горизонтальными
взаимодействиями комплементарных пар, стабилизированных водородными
связями. Оказалось, что спектры поглощения поли-А и АМФ в водном
растворе, содержащем одинаковое количество нуклеотидов,
значительно отличаются. Интегральное поглощение поли-А существенно
меньше, чем поглощение составляющих его мономеров АМФ, т. е.
для поли-А наблюдается гипохромный эффект, аналогичный и для
нативной ДНК. Для поли-А при увеличении температуры
наблюдается гиперхромный эффект.
В том же температурном интервале для АМФ не наблюдается
гиперхромного эффекта. На основании этих экспериментальных
данных сделано заключение, что наряду с горизонтальными
взаимодействиями имеют место вертикальные взаимодействия между
основаниями. Анализ упорядоченной структуры ДНК показывает,
что плоскости оснований, следующие друг за другом вдоль оси
спирали, практически параллельны. Компланарное расположение
(стэкинг) оснований обусловливает вертикальные взаимодействия
и вызывает гипохромный эффект в нативной ДНК и в модельном
полинуклеотиде (поли-А) при низкой температуре.
Наибольшая энергия вертикальных стэкинг-взаимодействий
связана с таким расположением вдоль оси спирали комплементарных
пар: |ЦГ и |ГЦ. Она составляет — 82,8 кДж • моль"1. Наимень-
123
шая энергия (—6,7 кДж • моль"1) отвечает стэкингу fAT- и ДА-
пар. В среднем энергия стэкинг-взаимодействий лежит в предела*
от —-20 до —50 кДж • моль"1. Участки ДНК, содержащие АТ-
пары, менее стабильны и быстрее денатурируются, чем
участки, содержащие ГЦ-пары. Гиперхромный эффект обусловлен
разрушением структуры ДНК и нарушением стэкинга оснований
(рис. 66, б).
Какова природа сил, обеспечивающих стэкинг-взаимодействия?
Во-первых, совершенно очевидно, что отчасти стэкинг обусловлен
взаимодействием между индуцированными диполями,
образованными я-электронами оснований. Во-вторых, экспериментально
установлено, что стопочные структуры оснований наиболее стабильны
в водных растворах. Водная среда играет важную роль в
стабилизации упорядоченных конформаций нуклеиновых кислот. Эти факты
свидетельствуют о том, что стэкинг оснований может быть
обусловлен гидрофобными взаимодействиями между неполярными
основаниями. В этом случае необходимо учитывать энергетический вклад,
который получается от взаимодействия с полярными молекулами
воды, когда они устраняются при образовании двойной спирали.
Гидрофобные взаимодействия имеют энтропийную природу.
Нуклеиновые кислоты, подобно белкам, могут денатурировать
при добавлении кислоты, щелочи, спиртов или при нагревании.
Процесс денатурации состоит в расхождении нуклеотидных цепей
двойной спирали ДНК илн спирал и зова иных участков РНК.
Процесс денатурации называют переходом спираль — клубок.
Структурные параметры ДНК изменяются в виде S-образных кривых,
что указывает на кооперативный характер перехода спираль —
клубок.
Зависимость оптической плотности D260 ДНК от температуры
(О2во=/ СП) называется кривой плавления Д///С.В области низких
температур для нативных молекул ДНК характерен гипохромный
эффект, обусловленный стэкинг-взаимодействиями между
основаниями. Тепловая денатурация ДНК происходит в узком
температурном интервале и сопровождается гиперхромным эффектом. Из
кривых плавления ДНК определяется важная характеристика —
температура плавления Тп. Это — температура, при которой
гиперхромный эффект составляет D2J2.
Оказалось, что температура плавления Ти является важным
показателем упорядоченности и температурной устойчивости ДНК.
Экспериментально установлено, что температура плавления ТП
линейно зависит от мольной доли (X) ГЦ-пар в ДНК (рис. 67):
Т„ = ТАТ + (Тгц-ТАТ)Х, (5.2)
где ГАт — температура плавления АТ-пар, 7>ц — температура
плавления ГЦ-пар. Экстраполяция линейной зависимости Тп = / (X)
к значению X = 0 дает Гдт = 342,3 К. Это значение близко к
температуре плавления модельного полинуклеотида, поли-AT с 7\, =-
= 337 К. Экстраполяция к значению Х=\ дает ГГц = 383 К.
Для поли-ГЦ температура плавления Тп = 377 К. Тепловая устой-
124
340
360
тп,к
Рис. 67. Зависимость температуры плавления Тп х
от нуклеотидного состава ДНК:
X — мольная доля ГЦ-пар; треугольник •— плавление по- 'Г
ли-AT, Тп—337 К, квадрат — плавление поли-ГЦ, Тп =
377 К 0,6
чивость ДНК хорошо коррелирует с коли- Щ
чеством ГЦ-пар: чем больше содержание 02\
ГЦ-пар, тем более устойчивая ДНК к
денатурации.
Рентгеноструктурный анализ позволяет
определять пространственную структуру двойной спирали ДНК в
кристаллическом состоянии препаратов, но этот метод не позволяет
изучать пространственную структуру ДНК, которая существуете
растворе. Оказалось, что наиболее перспективным методом, позволяющим
изучать конформации ДНК в растворе, является метод кругового
дихроизма (КД) (параграф 4.2). С помощью метода КД были
получены спектральные кривые КД пленск ДНК, поддерживаемых при
постоянной относительной влажности в условиях, близких к тем,
которые использовались при рентгеноструктурном анализе волокон
ДНК. Спектры КД ДНК в пленках и в водных растворах хорошо
совпали. Это позволило получить паспортные спектры КД для
каждой формы ДНК (рис. 68) и успешно изучать конформационные
изменения ДНК в растворе при изменении факторов внешней среды
(температура, рН и др.).
5.5. Третичная структура нуклеиновых кислот. Биологическая
функция нуклеиновых кислот осуществляется на более высоких
уровнях организации, чем вторичная структура. В настоящее
время достаточно хорошо изучена третичная структура дрожжевой
фенилаланиновой тРНК. Эта одноцепочечная структура состоит из
77 нуклеотидов и на уровне вторичной структуры имеет форму
клеверного листа, состоящего из спиральных участков и
расположенных между ними петель. С помощью рентгеноструктурного
анализа установлен способ укладки клеверного листа в третичную
структуру. Молекула тРНК имеет Г-образную форму. На концах
270
10]
ж
2
к
245
280 1
3
м
245
-1-""—*^_
' "I
220 260 300 220 260 300 220 260 \,НМ
Рис. 68. Спектры кругового дихроизма (КД) различных форм ДНК:
1 — Л-форма; 2 — В-форма; 3 — С-форма, [в] — молярная эллиптичность
125
Г-образной структуры находятся З'-акцепторный конец и антикодо-
новая петля, разделенные расстоянием примерно 7,5 нм.
Третичная структура тРНК стабилизируется водородными связями в
комплексах из трех азотистых оснований. В стабилизации третичной
структуры принимают участие ионы Mg2+ и полиамины.
Еще недостаточно полно изучена третичная структура и
компактная укладка длинной полимерной молекулы ДНК в хроматине.
Длина ДНК может иметь несколько сантиметров, а в хроматине
она уложена в структуры, имеющие размеры всего несколько
микрометров. В ядре эукариот ДНК взаимодействует с гистонами,
в результате чего образуется упорядоченная компактная структура.
Основной структурой хроматина является нуклеосома (рис. 69).
В каждой нуклеосоме имеется центральная часть — хроматосома.
В хроматосоме ДНК образует два сверхвитка длиной оксло 166 пар
оснований, накрученных на комплекс из 8 молекул гистонов (окта-
мер гистонов). Хрэматосомы соединяются сегментами относительно
ненапряженных ДНК, состоящих из 40 нуклеотидных пар. Таким
образом, нуклеосомный уровень организации представляет собой
первую стадию компактной укладки ДНК» На нуклеосоме ДНК
образует витки диаметром около 10 нм.
Следующий уровень организации хроматина — это
закручивание цепочки нуклеосом в длинный соленоид диаметром около ЗОнм.
В каждом витке соленоида находятся шесть хроматосом и на виток
приходится около 1200 пар оснований. Сверхспиральная структура
ДНК должна приниматься во внимание в сложных реакциях,
связанных с репликацией ДНК, а также при рассмотрении
механизма экспрессии генов.
5.6. Белково-нуклеиновое узнавание. Комплексы между
белками и нуклеиновыми кислотами значительно отличаются по
структурной организации и выполняют очень важные
биологические функции. Встречаются различные формы таких комплексов —
от простых, в которых ДНК выступает в качестве субстрата для
фермента РНК-полимеразы, и до
сложных высокоорганизованных
образований, как это проявляется
в хроматине, рибосомах и виру-
т
Рис. 70. Взаимодействие
РНК-полимеразы II с участком узнавания на
днк-
/ — РНК-полимераза II; 2 — часть
участка узнавания, 3 — старт транскрипции
Рис. 69. Компактная упаковка ДНК
в эукариотических клетках:
/ — РНК-полимераза, 2 — нить ДНК, 3—
нуклеосомы, 4 — «соленоид» ДНК; dt —
диаметр витков ДНК на нуклеосомах, йг —
диаметр «соленоида»
126
сах. В нуклеопротеидных комплексах белки и нуклеиновые кислоты
находятся в различных соотношениях. Нуклеосома хроматина
с молекулярной массой М = 2,4 • Ю5 содержит 45 % белка (по
массе); в ней одна молекула ДНК взаимодействует с 9 белками пяти
типов. В 705-рибосоме Е. coli (М = 2,6 • 106) содержится 33 % белка
и 3 молекулы РНК взаимодействуют с 57 различными белками.
В вирусе табачной мозаики (М = 4,0 • Ю7) содержится 95 % белка
и одна молекула РНК взаимодействует с 2130 молекулами белка
одного типа.
Общая черта таких нуклеопротеидных комплексов состоит
в том, что входящие в их состав белки связываются с определенными
участками нуклеиновых кислот. Возникает важный вопрос, как
белки узнают специфические последовательности нуклеотидов,
каков механизм нуклеинового узнавания. В настоящее время
хорошо изучены белково-нуклеиновые взаимодействия в модельных
системах синтеза РНК и белков.
Синтез РНК у эукариот осуществляют три различные РНК-
полимеразы. РНК-полимераза I синтезирует высокомолекулярную
рибосомную РНК; РНК-полимераза II транскрибирует гены,
которые затем транслируются в белки, и РНК-полимераза III
синтезирует разнообразные низкомолекулярные РНК, в том числе тРНК.
Все эти три фермента узнают в последовательностях нуклеотидов
ДНК различные сигнальные участки. РНК-полимераза II (рис. 70)
узнает последовательности ДНК, которые предшествуют началу
транскрипции. Участки узнавания включают две короткие
последовательности ДНК, одна из которых начинается за 50 нуклеотидов
до точки инициации (старт) транскрипции, а другая — за 25.
Удобной моделью, с помощью которой изучается белково-нук-
леиновое узнавание, являются различные комплексы нуклеиновых
кислот с белками, которые регулируют генную активность. Должны
существовать сотни и тысячи ДНК-связывающих белков, которые
специфически узнают определенные нуклеотидные
последовательности и регулируют транскрипционную активность генов. В
настоящее время выделено несколько белков-регуляторов генной
активности и изучены их свойства.
С помощью чувствительных биофизических методов установлено,
что при образовании нуклеопротеидного комплекса изменяются
физико-химические характеристики и белков, и нуклеиновых
кислот. Такие исследования проведены на комплексе белка gp32 с одно-
нитевой ДНК. Белок gp32 является продуктом функционирования
гена бактериофага Т4. Связывание gp32 вызывает гиперхромный
эффект в синтетических полинуклеотидах, таких как поли-(^А),
и уменьшает эллиптичность ДНК. Такие изменения происходят
благодаря способности gp32 изменять конформацию ДНК, вызывая
разъединение нуклеотидных оснований. Происходят определенные
изменения и в белке gp32: наблюдается химический сдвиг Ч^-ЯМР
нескольких ароматических остатков и значительно тушится трипто-
фановая флуоресценция в белке gp32. Число ароматических
протонов, вовлекаемых в химический сдвиг, увеличивается с длиной
127
олигонуклеотида. Изменение наблюдается до тех пор, пока длина
олигонуклеотида не достигнет 9 нуклеотидных оснований. Эти
данные доказывают, что связывающий участок на gp32 стерически
йодогнан к 9 основаниям. Химический сдвиг, который вызывается
в ароматической области спектра *Н-ЯМР белка gp32, обусловлен
гидрофобными взаимодействиями между боковыми цепями
ароматических аминокислот и основаниями однонитевой ДНК. Интерка-
ляция плоских ароматических аминокислотных остатков между
основаниями полинуклеотидной цепи является одним из
распространенных способов плотного взаимодействия белков и
нуклеиновых кислот.
Использование молекулярных моделей показало, что р-слой
белка хорошо размещается в одном из желобков ДНК.
Предполагается, что узнавание белком нуклеиновых кислот осуществляется
благодаря образованию максимального числа водородных связей
между боковыми группами аминокислотных остатков и
расположенными в определенной последовательности азотистыми основаниями.
Полученные данные и их анализ позволяют предполагать о
существовании простого кода, с помощью которого белок и
нуклеиновая кислота узнают друг друга. Для узнавания существенно сте-
рическое соответствие определенных структурных участков белка
и нуклеиновой кислоты. В предполагаемом коде последовательность
аминокислотных остатков в стереоспецифическом участке белка
должна быть комплементарной последовательности пар оснований.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ К ЧАСТИ II
<
1. Седиментация раствора белка осуществлялась со скоростью
вращения ротора п = 57000 об/мин при Т = 293К- Смещение (*) шлирен-пика от
оси вращения ротора фотографировали через фиксированное время (8 мин):
/i= 0, лгг= 6,55 см; t2— 8 мин, #2= 6,58 см; t3="\6 мин, лг8= 6,61см; /4=
= 24 мин, *4= 6,64 см. Определены удельный парциальный объем белка
(V = 0,7 • 10~3 м3/кг) и плотность буфера (р0= 1 • 103 кг/м3). С помощью
ультрацентрифуги определяли коэффициент диффузии белка на скорости
п = 12000 об/мин. Шлирен-пик фотографировался через фиксированные
интервалы времени после начала вращения ротора t. Высота (Я) и площадь
шлирен-пика (А) тщательно измерены для нескольких фиксированных
времен: tx = 1000 с, Нг = 0,5 см и Лх= 0,0453 см2; *2= 2000 с, Я2= 0,352 см
и Л2= 0,0453 см2; t2= 4000 с, Я3= 0,248 см и Л3= 0,0453 см2. Определите
молекулярную массу и коэффициент диффузии исследуемого белка.
2. Определите ионную силу раствора: 1) КС1, концентрация 10"1 М;
2) СаС12, концентрация 10~3 М.
3. Вторичная структура белка определена на дихрографе. Найдено, что
белок содержит 80 % а-спиралей и 20 % беспорядочного клубка.
Изобразите на графике наблюдаемый спектр КД для изучаемого белка.
4. На спектрофотометре регистрируется спектр поглощения белка.
Известно, что в молекуле белка имеется 2 триптофанила и 10 тирозилов.
Какую оптическую плотность на Я = 280 нм будут регистрировать на приборе,
если концентрация белка С = 5 • 10~- М? Молярные коэффициенты экстинк-
ции принять: для триптофана е = 5,6- 105 М"1 • м"1 и для тирозина е =
= 1,2 . \0*Мгг . м"1. Длина кюветы / = 0,01 м.
5. При повышении температуры на 10° скорость ферментативной реакции
увеличилась в 2 раза. Рассчитайте энергию активации этой реакции, если
оца вначале проходила при Т = 300К.
128
6 Ферментативная реакция идет с константой /См = 3 • 10""3 М и инги-
бируется конкурентным ингибитором с Kt = 3 • 10~бМ. Какая концентрация
ингибитора понадобится, чтобы подавить реакцию на 50 %, если
концентрация субстрата равна 3 • 10""4 М?
7. Последовательность аминокислот в гипотетическом полипепхиде
имеет следующий вид: N — Ala—Leu—Leu—Ala—Glu—Ala—-Leu—GIu —
-Gly—Pro—Met—Val—He—Val—Met—Val—Pro—Gly—С. Сделайте
Предсказание вторичной структуры этого полипептида и схематически представь-
те эту структуру на рисунке.
8. Электрофоретическая подвижность изучаемого белка увеличилась
в 1,2 раза по сравнению с электрофоретической подвижностью эталонного
белка В каком направлении и насколько изменится молекулярная масса
изучаемого белка, если молекулярная масса эталонного белка М = 6000СР
Для оценки молекулярной массы используйте графическую зависимость
на рис. 19, 6*.
9. Назовите все типы взаимодействий, которые стабилизируют
структуру ДНК.
10. На сколько градусов изменится температура плавления ДНК| если
число ГЦ-пар в ДНК увеличится от 20 % До 60 %?
Часть III
БИОФИЗИКА КЛЕТОЧНЫХ ПРОЦЕССОВ
Г л а в а 6. КЛЕТКА — СЛОЖНАЯ
ВЫСОКОУПОРЯДОЧЕННАЯ СИСТЕМА
Название «клетка» впервые употребил Р. Гук (1665) при
описании строения пробки, увиденного при помощи увеличительных
линз. Клеточная теория была создана в первой половине XIX ст.
ботаником М. Шлейденом (1838) и зоологом Т. Шванном (Ш9).
Наряду с теорией Ч. Дарвина она была важнейшим достижением
биологии девятнадцатого века. 20 лет спустя Вирхов сделал вывод,
что клетка может возникнуть только от предсуществующей
клетки. В современном виде клеточная теория утверждает, что все живые
существа — животные, растения и простейшие организмы —
состоят из клеток и их производных. Клетка является наименьшей
структурной и 'функциональной единицей живого. Она обладает
всеми свойствами живой системы: осуществляет обмен веществ
и энергии, растет, размножается и передает по наследству свои
признаки, реагирует на раздражение и способна двигаться. Она
может жить отдельно — изолированные клетки многоклеточных
организмов продолжают жить и размножаться в питательной
среде.
Все клетки способны к использованию и превращению энергии.
Эта способность имеет очень важное значение, так как она дает
возможность сохранять постоянство внутренней среды клетки и
целостность ее структуры. За счет превращения энергии
обеспечивается осуществление разнообразных механических,
электрических, химических и осмотических процессов, связанных с
жизнедеятельностью организма.
6.1. Микроскопические исследования клеток. При изучении
клеток исследователь сталкивается с проблемой адекватного
увеличения. Клетки, как правило, малы по размеру. Поперечный размер
типичной животной клетки составляет 10—20 мкм. Это
значительно меньше размеров мельчайшей видимой частицы. Разрешающая
способность невооруженного человеческого глаза равна
приблизительно 100—200 мкм. Разрешающая способность современных
световых микроскопов ограничивается видом используемого
освещения. Объекты, расстояние м°жду которыми меньше половины длины
волны луча света, используемого для освещения, уже нельзя ясно
различить при помощи светового микроскопа. Даже при
использовании безукоризненно отшлифованных линз и видимого света со
средней длиной волны 650 нм объектив с масляной иммерсией не
t30
дает возможности различить две дискретные точки, разделенные
расстоянием 0,27 мкм.
Поскольку многие компоненты клетки имеют более мелкие
размеры, чем разрешающая сила светового микроскопа, сам факт их
существования оставался неизвестным до тех пор, пока не был
найден способ достигнуть более высокого разрешения. Такой высокой
разрешающей способностью обладает электронный микроскоп,
в котором вместо светового пучка используется поток электронов.
Длина волны электрона (К) дается соотношением де Бройля
X = h/mevf (6.1)
!де те—масса электрона; v — скорость электрона; h —
постоянная Планка.
Если электроны ускоряются разностью потенциалов ф [В],
они приобретают кинетическую энергию mev2/2= ец (гдее—заряд
электрона), и длина волны записывается так:
Х = (1,23/|/~ф)нм. (6.2)
Длина волны электронов, ускоренных в поле 100000 В, близка
к 0,004 им. Это приблизительно на 5 порядков меньше средней
длины волны видимого света. Таким образом, электронный
микроскоп теоретически позволяет различать объекты, расстояние между
которыми меньше 0,004 нм. Вследствие аберрации магнитных линз
фактическая разрешающая способность современных
электронных микроскопов составляет 0,2—0,4 нм. Этого вполне достаточно
для наблюдения многих важных структурных особенностей
биологических макромолекул, а также элементов клеточной структуры.
На рис. 71 сопоставлены схемы оптической системы глаза человека
(а), светового микроскопа (б) и электронного микроскопа (в}.
Видимый свет легко проходит через интактные клетки или через
изготовленные на микротоме срезы толщиной 5—10 мкм. При
обычно используемых ускоряющих напряжениях электроны полностью
поглощаются в таких толстых срезах. Толщина срезов,
предназначенных для электронной микроскопии, не должна превышать
10 нм. Для их изготовления необходим ультрамикротом с алмазным
или стеклянным ножом, обеспечивающим прецизионное резание
материала. Изучаемые клетки заливают не в парафин, как при
световой микроскопии, а в особые пластмассы.
Контрастность электронно-микроскопических препаратов
создается благодаря тому, что одни структуры обладают более высокой
электронной плотностью, чем другие. Степень рассеяния
электронов пропорциональна квадрату атомного номера рассеивающего
атома. Легкие атомы, входящие в состав органических веществ —
водород, углерод, азот и кислород, обладают низкой рассеивающей
способностью. Те части клетки, которые подлежат исследованию,
можно избирательно окрасить тяжелыми металлами для того,
чтобы они стали контрастными. С этой целью используют осмий,
уран и марганец.
5*
t31
а
£h
Ш
7 «-^
6 \l
Ш J
7$щт
в
Рис. 71. Схема оптических систем глаза человека (а), светового микроскопа
(б) и электронного микроскопа (в) (Свенсон, Уэбстер, 1980):
о: J— объект, 2 —» хрусталик; 3— окончательное изображение; б' /—.источник света;
2 — конденсор, 3 — объект; 4 — объектив; 5 — промежуточное изображение; 6 ■— окуляр;
7—экран или фотопластинка; в: 1 — источник электронов; J?—магнитная
катушка-конденсор; 3 —объект; 4 — магнитная катушка-объектив, 5 — промежуточное изображение, 6-*
магнитная катушка-проектор; 7 — экран или фотопластинка
На рис. 72 представлены схематические изображения клетки
животного происхождения, созданные на основании данных
световой и электронной микроскопии. Здесь же показана растительная
клетка. Дифференцированные растительные клетки имеют одну
или несколько вакуолей, занимающих большую часть объема
клетки и содержащих раствор различных солей и органических
веществ— углеводов, аминокислот, белков. В цитоплазме
растительных клеток имеются специальные органеллы — пластиды. К ним
относятся и хлоропласта. Аппарат Гольджи представлен в
растительных клетках рассеянными по цитоплазме диктиосомами —
стопками дисковидных цистерн. В растительной клетке нет центри-
оли. Клеточные мембраны клетки растений, как правило, покрыты
твердой клеточной оболочкой.
132
Рис. 72. Сопоставление
изображения клетки,
полученного при помощи световой
микроскопии (а), с
изображениями животной (б) и
растительной клетки (б),
построенными на основании
электронной микроскопии.
Рибосомы показаны точками (Ал-
бертс и соавт., 1983)
а
Животная клетка Растительная клетка
10-30мкм l | | я 10-100мкм
б 3
Несмотря на многочисленные различия, клетки разных типов
обладают сходством в своих главных структурных особенностях.
Каждая клетка окружена плазматической мембраной, которая
характеризуется избирательной проницаемостью. Это ее свойство
позволяет необходимым питательным веществам и ионам
проникать внутрь клетки, а излишним продуктам выходить из нее.
Молекулярная организация плазматической мембраны у всех клеток
примерно одинакова: она состоит из двух слоев липидных молекул
со множеством включенных в нее специфических белков. Одни
мембранные белки обладают ферментативной активностью, другие
обеспечивают транспортные процессы. Внутреннее пространство
любой клетки заполнено цитоплазмой, в которой протекает
множество катализируемых ферментами реакций клеточного
метаболизма. В цитоплазме всех клеток присутствуют рибосомы, функция
которых состоит в обеспечении синтеза белков. Все живые клетки
содержат аппарат, в котором происходят редупликация
генетического материала и его хранение в виде дезоксирибонуклеиновой
кислоты (ДНК).
133
Микроскопия дает возможность определить взаимное
расположение юртанелл в клетке. Используя специальные методы
окрашивания, в ряде случаев можно локализовать в клетке определенные
молекулы. Детали же сложных внутриклеточных процессов на
молекулярном уровне изучают после разделения компонентов
клетки.
Видимый свет легко проходит через интактные клетки. Без
специальной обработки они плохо видны цри использовании
обычного светового микроскопа. Клетки обрабатывают фиксаторами —
веществами, убивающими клетки, а затем используют красители,
избирательно окрашивающие нужные части клетки. Трудно
исключить возможность потери или искажения некоторых компонентов
клетки в процессе фиксации или окраски. Наиболее надежный
сп(»соб показать существование в живых клетках той или иней
структуры состоит в том, чтобы исследовать под микроскопом живые
клетки, не подвергавшиеся'воздействию предварительной фиксации
И|ЛИ окрашивания. Такой подход требует использования оссбых
оптических систем — фазово-контрастного .и интерференционного
микроскопов.
6.2. Прокариотические клетки. Существуют два больших класса
клеток: прокариотические и эукариотические. Из известных клеток
прокариотические самые простые. Они не имеют ограниченного
мембраной ядра, митохондрий, хлоропластов и системы внутренних
мембран. Прокариотическим клеткам не свойственно митотическое
деление.
Прокариоты были первыми клетками, «возникшими в процессе
биологической эволюции более 3 млрд. лет .назад. Предполагают,
ЧТ(> в настоящее время три четверти всей живой материи на земле
приходится на долю микроорганизмов, большинство из которых
прокариоты. К современным прокариотам относятся около 3000 ви-
догьбактфий. Их разделяют на две группы: архебактерии и зубак-
терии,, или истинные бактерии.
Архебактерии по ряду физиолого-биохимических свойств резко
отличаются от эубактерий. Некоторые архебактерии (галсбакте-
ри*ь) обладают особым типом фотосинтеза, при котором свет
поглощается бакт^рвдродопсином. К архебактфиям относятся бактерии,
встречающиеся в горячих кислых источниках — термоацидофилы
(д^я их роста необходима высокая температура 80—90° С и кислая
Ср(да, рН-3); галофилы .(бактерии, для жизнедеятельности котсрых
необходимы высокие концентрации солей,); анаэробные бактерии,
.восстанавливающие С02 до метана (метаногейы).
К эубактериям относятся часто встречающиеся формы, насе-
лянщие почву, воду я организмы. Они представляют собой
сферические или удлиненные клетки обычно размером в несколько
микрометров. Клетка ограничена снаружи плазматической мембраной.
Клеточное содержимое включает ядерную область, в которой
имеется двухцепочечная молекула ДНК в виде очень длинной замкнутой
цеци. В цитоплазме прокариотических клеток содержатся также
рИросомы. У цианобактерий (синезеленых водорослей) имеются
134
слоистые мембраны, участвующие в фотосинтезе и, по-видимому,
образующиеся в результате выпячиваний плазматической
мембраны. У некоторых видов бактерий имеются жгутики, отличающиеся
по своему строению от жгутиков зукариотических клеток. Бактерии
делятся путем простого расщепления.
Бактериальные клетки окружены клеточной стенкой, которая
придает им определенную форму и служит механической опорой.
Одна клеточная мембрана не способна выдержать то высокое
осмотическое давление, которое создается в бактериальной клетке
вследствие большой концентрации метаболитов и которое может
достигать 20 • Ю2 кПа (20 атм). Бактериальные клетки, лишенные
клеточной стенки, в обычной среде лизируются.
Стенки бактериальных клеток представляют значительный
интерес для медицины. Именно клеточные стенки и связанные с ними
вещества определяют вирулентность бактерий, так как на них
находятся специфические антигены. Введением животному экстракта
клеточных стенок некоторых бактерий можно выработать у нежх
иммунитет к эшм бактериям. При подавлении синтеза клеточных
стенок бактерии погибают. Именно на этом основан механизм
действия пенициллила и некоторых других антибиотиков,.
Эубактерии* классифицируют на грамположительные и грамотри-
цательные в зависимости от их реакции на окраску по Граму.
Указанные классы бактерий различаются по типу клеточной
оболочки. Плазматическая мембрана грамположителышх бактерий
окружена массивной клеточной стенкой толщиной, около 25 нм,
состоящей из нептидогликана (муреина) и тейхоевой кислоты. Слой
пептидогликана можно рассматривать как одну гигантскую
мешковидную молекулу. В ней линейные полисахар идные цепи поперечно
сшиты короткими пептидами. Тейхоевая кислота представляет
собой полимер, состоящий из глицероловых и рибитоловых
остатков, которые связаны фосфодиэфирными связями. Тейхоевая
кислота связана со слоем пептидогликана фосфодиэфирными связями.
Она образует главную часть поверхностных антигенов грамполо-
жительных бактерий. Состав тейхоевой кислоты может изменяться
в зависимости от воздействия внешней среды, что влияет на пато-
генность бактерий.
У грамотрицательных бактерий клеточная оболочка устроена
более сложно. На рис. 73 показано, что плазматическая мембрана
окружена клеточной стенкой, состоящей из пептидогликана; далее
располагается наружная мембрана толщиной 8 нм, представляющая
собой мозаику белков, липидов и липосахаридов. Нити, показанные
на рисунке,— олигосахаридные цепи липополисахаридов (показано
несколько цепей). В наружной мембране бактериальной клетки
содержится трансмембранный белок — порин. Тримеры порина
формируют поры, по которым диффундируют небольшие полярные
Молекулы. Диаметр пор около 1 нм. Они пропускают молекулы
с молекулярной массой не более 600-. Особенностью
грамотрицательных бактерий является наличие водной прослойки между
плазматической, мембраной й пептидогликановым слоем.. В этом
133
Рис. 73. Клеточная оболочка грамотрицательной бактерии (Албертс и соавт.,
1983):
J — наруж1 ая мембрана, 2 — пептидогликан. 3 — периплазматическое пространство; 4—»
плазматическая мембрана, 5 — липополисахариды; 6 — белок, формирующий пору, 7 — рас-
гворимый белок в периплазматическом пространстве, Я — транспортный белок
периплазматическом пространстве содержатся белки,
участвующие в связывании и транспорте Сахаров и других питательных
веществ.
Бактерии обладают примитивной сенсорной системой. Их
привлекают определенные химические соединения, и бактерии
перемещаются по направлению к ним. Существуют вещества,
отталкивающие бактерии, и они движутся в противоположную сторону.
Такое направленное движение бактерий называется хемотаксисом.
Он начинается с обнаружения химических соединений
специфическими хеморецепторами на поверхности клетки. Информация от
этих сенсоров передается в систему преобразования, где
происходит анализ и интеграция большого числа стимулов. Далее
преобразующая система посылает сигналы к устройству, приводящему
в движение жгутик*. У Escherichia coli обнаружено около 20
различных хеморецепторов, содержащих узнающие и
сигнализирующие компоненты.
К прокариотам относятся самые мелкие, наиболее простые
современные клетки — микоплазмы. Это похожие на бактерии
маленькие организмы (0,1—0,25 мкм), обычно ведущие
паразитический образ жизни. Наследственная информация, хранящаяся
в ДНК микоплазм, достаточна для синтеза приблизительно 750
различных белков. Не исключено, что это минимальное жизненно
необходимое для клетки количество белка.
Имеются убедительные данные, что в эпоху образования земной
атмосферы, о.чрло 4,8 млрд. лет назад, в ней отсутствовал
кислород. Считают, что кислород появился в атмосфере в результате
деятельности фотосинтезирующих организмов, первыми из
которых были цианобактерии. До появления в земной атмосфере
кислорода единственными живыми существами на земле были
анаэробные бактерии. Постепенное накопление кислорода вызвало
последующее развитие аэробных организмов. Используя кислород в
качестве окислителя, аэробные клетки могли получить больше
энергии при окислении пищевых продуктов. Например, глюкоза в при-
136
сутствии кислорода полностью расщепляется ;о Н20 и С02, тогда
как без кислорода она расщепляется до молочной кислоты или эти-
лового спирта — конечные продукты анаэробного гликолиза.
Прокариоты играют важную роль в биологических
превращениях материи и энергии на Земле. Фотосинтезирующие бактерии,
обитающие как в пресной, так и в морской воде, поглощают
солнечную энергию и используют ее для синтеза углеводов и других
компонентов клеток, которые, в сбою очередь, служат пищей для
других организмов. Некоторые бактерии могут фиксировать
молекулярный азот из атмосферы, образуя биологически полезные
азотсодержащие соединения. Кроме того, прокариоты выполняют
функцию конечных потребителей, поскольку различные бактерии
осуществляют расщепление органических структур в мертвых
растениях и животных, возвращая тем самым конечные продукты
распада в атмосферу, почву и моря, где они вноёь используются в
биологических циклах углерода, азота и кислорода.
Прокариотические клетки важны для исследований в области
биофизики клетки, биохимии и молекулярной биологии. Их можно
легко и быстро выращивать в больших количествах. Механизмы
репродукции и передачи генетической информации у них
относительно просты; можно легко индуцировать образование
генетических мутантов прокариот. В цитоплазме большинства бактерий
содержатся мелкие кольцевые фрагменты ДНК — плазмиды. Плаз-
миды обладают способностью реплицироваться независимо от
клеточной хромосомы. Изучение плазмид привело к важным
достижениям в области генной инженерии.
6.3. Эукариотические клетки. Изучение палеонтологической
летописи показало, что первые эукариоты представляли собой
одноклеточные планктонные организмы и появились около 1,4 млрд. лет
назад. Типичные эукариотические клетки значительно крупнее,
чем прокариотические. Объем большинства их в 1000—10000 раз
больше, чем бактерий. Пропорционально больше в эукариоти-
ческих клетках разнообразных внутриклеточных макромолекул.
Так, клетка человека содержит приблизительно в 800 раз больше
ДНК, чем бактериальная. Для сохранения необходимого
соотношения площади поверхности и объема у больших эукариотических
клеток поверхность увеличена различного рода изгибами,
складками и другими усложнениями формы поверхности.
Одной из основных особенностей всех эукариотических клеток
является наличие внутренних мембран. Мембраны окружают ядро,
митохондрии, хлоропласты, материал, предназначенный для
выведения из клетки, лизосомы, пероксисомы. Мембраны образуют
лабиринт эндоплазматического ретикулума и аппарат Гольджи.
Главная особенность эукариотической клетки состоит в наличии
ядра. Ядро отделено от цитоплазмы двойной
мембраной—ядерной оболочкой; между двумя мембранами лежит перинуклеарное
пространство (рис. 74). Ядерная оболочка отсутствует лишь в
течение короткого времени в период клеточного деления. Наружная
мембрана ядерной оболочки часто переходит, не прерываясь, в
137
Рис. 74. Схематическое
изображение поперечного среза типичного
клеточного, ядра (Албертс и соавт., 1983):
7—хроматин; 2 — наружная ядерная
мембрана; 3 — внутренняя ядерная
мембрана, 4 — шероховатый эндоплазматический ре-
тикулум, 5 — рибосомы; 6 — ядрыогко; 7 —.
перинуклеарное пространство; 8 — ядерная
пора
мембраны эндоплазматического рети*
кулума. Цитоилазматическая
сторона ядра часто покрыта рибосомами,
что подчеркивает* взаимосвязь
между ядерной оболочкой н эндоплаз-
матическим ретикулумом.
В ядерных мембранах имеются
поры; в стенках этих пор
внутренняя мембрана, не прерываясь, переходит в наружную. В расти*
тельных клетках пор относительно немного, и они рассеяны'по
поверхности ядра беспорядочно, но, например, в таких клетках,
как ягца амфибий, эти поры (имеющие форму восьмиугольника)'
многочисленны и распределены весьма регулярно. Можно было бы
думать, что сквозь поры легко проходят даже крупные молекульь
Однако при большом увеличении на электронных
микрофотографиях видно, что ядерные поры, особенно в клетках животных, это
не просто отверстия в мембране: часто они бывают «запечатаны»
каким-то электронно-плотным материалом. Различия в- величине
рН между содержимым ядра и цитоплазмы также заставляют счи*
тать, что переход материалов'через мембрану совершается не столь
легко, как можно было ожидать исходя из описанной
структуры.
В ядре содержится почти вся ДНК эукариотической клетки.
Внутри ядра находится ядрышко, которое прокрашивается более
интенсивно благодаря высокому содержанию в нем
рибонуклеиновой кислоты (РНК). Ядрышко служит «фабрикой» РНК; здесь же
осуществляются первые этапы синтеза рибосом.
В остальной части ядра содержится хроматин, названный так
за его способность окрашиваться характерным образом. Хроматин
состоит в основном из ДНК, и ряда специфических белков.В
промежутках между делениями клеток хроматин распределяется
случайным образом по всему ядру, а непосредственно перед делением
собирается в дискретные гранулярные тельца — хромосомы. Эука-
риотические клетки данного вида содержат строго определенное
число хромосом; например, в соматических клетках человека
имеется 46 хромосом. После репликации образовавшиеся дочерние
хромосомы расходятся и попадают в дочерние клетки в результате
сложной последовательности событий — митоза.
Вееьма заметное место в цитоплазме эукариотических клеток
занимают митохондрии. Каждая из этих органелл окружена
собственной двойной мембраной. Митохондрии — почти
универсальный компонент эукариотических' клеток, тогда как хлоропласта
138
встречаются лишь в клетках, которые способны к фотосишезу,
т. е. в клетках' растений.
Митохондрии во многом похожи на свободноживущие прокариоти-
ческие организмы. Они содержат ДНК и размножаются делением.
Митохондрии ответственны за дыхание. Ни в каких других частях
клетки этот процесс не происходит. Механизм этого дыхания имеет
явное сходство у митохондрий и бактерий. Поэтому предполагают,
что эукариотические клетки являются потомками примитивных
анаэробных клеток, которые выжили в богатой кислородом среде,
поглотив аэробные бактерии. Они поддерживали их в состоянии
симбиоза ради присущей им способности потреблять кислород и
производить энергию.
Размеры, внешний вид, число митохондрий, а также место их
локализации могут варьировать в -очень широких пределах в
зависимости от вида клеток. В каледой клетке печени крысы
содержится около 1000 митохондрий. Их диаметр составляет примерно
0,5 мкм, т. е. по своим размерам митохондрии мало отличаются от
бактериальных клеток. Эукариотические ^клетки некоторых типов,
например сперматозооны или дрожжевые клетки, содержат лишь
несколько очень крупных митохондрий.
Митохондрии выполняют в клетке функцию «силовых
установок», поставляющих энергию. В них содержится большое число
ферментов, которые сообща катализируют 'окисление органических
питательных веществ клетки молекулярным кислородом до двуски-
си углерода .и воды (см. гл. 12). В процессе оштсления выделяется
большое количество энертии, которая используется для
образования .аденозинтрифосфата (АТФ) — главной молекулы, запасающей
энергию^ клетке. Образованные в митоховдрияхьмолекуяы А'ТФдиф-
фувдфуюпг во все4 части ^клетки, где > используются для'выполнения
необходимой работы.
Хлоропласты 'осуществляют фотосинтез в значительной
степени так же,-как циаиобактерии. Размножаются :они делением и
содержат ДНК. В связи*с :этам ^предполагают, <что хлоропласты
произошли шзщшнобатерий^шселшшихся в (свое время «в эукариоти-
чеашх клетках ^осуществлявших для кяеток->хозяев>фотосивтез.
.Митохондрии л* хлоропласты, проявляя • ©пределенное сходство
с современными аэробными бактериями ициансбактериями, В'то>же
время во многих отношениях отличаются от них. Например,
количество ДНК в этих ортанЕллах шало, большинство ; составляют их
их молекул синтезируется ?вне органелл>иплишь затем в них
транспортируется. Если считать, что митохондрии и хлоропласты
действительно возникли из симбиотических бактерий, то следует
признать, что-они ^претерпели значительные эволюционные изменения
и стали гвесьма зависимыми от своих хозяев.
В цитоплазме практически всех эукариотических клеток имеется
очень /сложный трехмерный лабиринт, образованный внутренними
мембранами — эндоплазматический ретикулум,
многочисленные складки и разветвления которого заполняют всю
цитоплазму. Пространства внутри эидоплазматического ретикулума
139
называют цистернами. Существуют два типа эндоплазматического
ретикулума: шероховатый и гладкий. Наружная поверхность
мембраны шероховатого эндоплазматического ретикулума усеяна
рибосомами, тогда как на гладком эндоплазматическом ретикулуме
рибосом нет. Рибосомы, связанные с шероховатым эндоплазматическим
ретикулумом, участвуют в биосинтезе белков. Эндоплазматический
ретикулум играет также определенную роль в биосинтезе липидов.
В эукариотических клетках различных типов он различается по
форме и выполняет разные функции. Так, в клетках скелетных
мышц эндоплазматический (саркоплазматический) ретикулум
участвует в процессе расслабления, обеспечивая активный захват
ионов Са2+ (см. гл. 11).
Органельная организация, или компартментализация клетки,
играет жизненно важную роль в ее функционировании, поскольку
иначе тысячи клеточных ферментов были бы перемешаны и
упорядоченная биохимическая активность была бы невозможна. Чтобы
избежать хаоса биохимических процессов, каждый из великого
множества новообразованных белков должен быть определенным
образом модифицирован, отсортирован и доставлен в сооиетству-
ющий компартмент. В настоящее время установлено, что аппарат
Гольджи функционирует как устройство, осуществляющее
модификацию и сортировку белков. Эта органелла, обнаруженная во всех
эукариотических клетках, с<эстоит из образованных мембранами
замкнутых мешочков. Они уплощены и «уложены в стопку». К
одному концу такой стопки поступают новообразованные белки.
Большинство их содержат олигосахариды и, следовательно, являются гли-
копротеинами. Проходя через аппарат Гольджи, белок
подвергается специфической химической модификации. На другом конце стопки
белок сортируется согласно своему предназначению и отправляется
по нужному адресу. Одни белки направляются в секреторные
гранулы, другие в лизосомы, а третьи—в плазматическую мембрану клетки.
Лизосомы представляют собой мелкие сферические
образования, окруженные мембраной. В лизосомах содержатся
гидролитические ферменты, которые способны участвовать в переваривании
материалов, поступающих в клетку, а также компонентов самой
клетки. По-видимому, лизосомы образуются из пузырьков,
создаваемых либо аппаратом Гольджи, либо гладким
эндоплазматический ретикулумом.
Как в растительных, так и в животных клетках имеются
микротельца, в которых находится ряд ферментов. Они отделены от цито-
золя мембраной. Считают, что микротельца возникают в результате
выпячиваний эндоплазматического ретикулума. Обнаружено два
типа микротелец. Одни из них — пероксисомы — содержат'
ферменты, катализирующие разнообразные окислительные
реакции, а также ферменты, участвующие в превращении
депонированных жиров в углеводы. Другой тип микротелец содержится в
растительных клетках — это глиоксисомы.
В цитоплазме эукариотических клеток существует сеть белковых
нитей (филаментов), образующих своего рода опорно-двигательную
140
ЖиЬотная хлема
\^
Рис 75. Схема участка клетки
животного с изображением клеточных ор-
ггнелл и элементов цитоскелета (Ал-
бертс и соавт , 1983) •
J — плазматическая мембрана; 2
—микротрубочка, 3— эндоплазматический ретику-
лум; 4 — митохондрия, 5— актиновые
волокна (микрофиламенты), 6 — рибосомы
систему, называемую цитоске-
летом. Благодаря цитоскелет^
клетки способны изменять свою
форму и расположение органелл,
а во многих случаях
передвигаться с места на место. Два
наиболее важных типа таких нитей —
актиновые филаменты, часто
называемые микрофиламентами (их
диаметр в среднем составляет
7 нм), и микротрубочки (их
диаметр около 24 нм). Те и другие
состоят из белковых субъединиц,
которые в клетке мсгут соединяться и разъединяться (рис. 75).
Существуют механизмы, контролирующие сбсрку этих полимерных
структур в цитоплазме из свободных субъединиц — мономеров.
Микрофиламенты участвуют в разных видах клеточной
подвижности, например, в миграции клеток в ходе развития, передвижении
макрофагов к поврежденным тканям (см. гл. 11).
В большинстве клеток имеются белковые нити третьего типа.
По своей толщине они занимают промежуточное положение между
актиновыми филаментами и микротрубочками — около 10 нм;
их называют промежуточными филаментами. Эти структуры
состоят из фибриллярных белковых субъединиц; они более стабильны,
чем микрофиламенты и микротрубочки; образующие их белки
различны в клетках разных типов.
Помимо трех основных типов белковых филаментов цитоскелет
включает также множество различных вспомогательных белков,
которые либо связывают филаменты друг с другом или с другими
клеточными структурами, либо влияют на скорость и степень
полимеризации филаментов.
Цитоплазматические органеллы погружены в цитозол&. Цито-
золь представляет собой водный раствор; его состав весьма слежен,
а консистенция приближается к гелю. В цитозоле растворены
многие ферменты и ферментные системы, а также другие белки,
обеспечивающие связывание, хранение и транспорт питательных
веществ, микроэлементов и кислорода. В цитоплазме в виде
растворов содержится также огромное число небольших биомолекул
разных типов, к которым относятся не только строительные блоки
биополимеров, такие как аминокислоты и нуклеотиды, но и сотни
небольших молекул органических соединений, так называемых
метаболитов — промежуточных продуктов, образующихся при био-
t41
синтезе или распаде макромолекул и их строительных блоков.
Например, превращение поступающей из крови глюкозы в молочную
кислоту в работающей скелетной мышце осуществляется в
результате последовательного образования 10 промежуточных продуктов,
причем только последний из них непосредственно превращается
в молочную кислоту.
К растворенным в цитозоле веществам относятся различные
коферменты, а также АТФ и АДФ — главные компоненты системы
переноса энергии в клетке. И наконец, в цитозоле содержатся
различные ионы неорганических солей, такие как К+, Mg2+, Ca2+,
С1-, НС07 и НР042-.
Составные части цитозоля поддерживаются в постоянных
концентрациях и сбалансированных пропорциях благодаря
функционированию систем, обеспечивающих их транспорт через
плазматическую мембрану.
6.4. Факторы, контролирующие синтез белков в клетке.
Упорядоченность процессов в живой клетке тесно связана с работой
внутриклеточного аппарата синтеза белка. Он производит огромное
количество разнообразных белков, которые обусловливают форму
клетки, катализируют биохимические реакции, осуществляют
регуляцию внутриклеточных процессов, обеспечивают извлечешь
энергии из питательных веществ, защиту клетки от внешних
воздействий и т. п.
Синтезируемые в клетке белки закодированы в генах, которые
передают наследственную информацию от одного поколения
другому и управляют жизнедеятельностью клетки. Поток генетической
информации в клетке идет в следующем направлении:
днк Транскрипция ^ рнк Трансляция^ Бел(Ж
Под транскрипцией понимают биосинтез молекул РНК, нук-
леотидная последовательность которых комплементарна какому-то
определенному участку молекулы ДНК. Трансляция — события,
связанные с синтезом белка. Существуют три типа молекул РНЮ
информационная (матричная) (мРНК), транспортная (тРНК), ри-
босомная (рРНК). Все клеточные РНК синтезируют РНК-полиме-
разы в соответствии с последовательностью нуклеотидов
ДНК-матрицы. Многие молекулы РНК подвергаются после транскрипции
расщеплению и химической модификации. У прокариот
подвергаются модификации молекулы тРНК и рРНК, а молекулы мРНК
почти не претерпевают изменений. У эукариот все транскрипты
РНК сильно модифицируются. Клеточная РНК всех типов, а
также рибосомы производятся в ядре, а затем экспортируются в цито-
золь, тогда как все белки, функционирующие в ядре, синтезируются
в цитозоле и должны импортироваться в ядро. Обмен веществ между
ядром и цитозолем, по всей видимости, осуществляется посредством
ядерных пор.
Один из наиболее существенных моментов в процессе биосинтеза
любого белка заключается в связывании мРНК с рибосомами.
142
Именно на рибосомах последовательность нуклеотидов мРНК
транслируется в соответствующую последовательность аминокислот.
Рибосома состоит из малой и большой субъединицы. В каждой из
них примерно две трети массы приходится на долю РНК и одна
треть — на белок.
Биосинтез белка зависит от координированного взаимодействия
более чем 100 макромолекул, к которым помимо рРНК относятся
мРНК, тРНК, активирующие ферменты и белковые факторы.
Синтез белка начинается с активации аминокислот аминоацил-
тРНК-синтетазами за счет энергии АТФ. Для каждой аминокислоты
имеется по меньшей мере один активирующий фермент. Кроме того,
для каждой аминокислоты имеется хотя бы одна специфическая
тРНК. Матричная РНК узнает антикодон тРНК, а не
присоединенную к тРНК аминокислоту. Кодон мРНК образует пары оснований
с антикодоном тРНК.
Синтез белка происходит в три этапа, называемых
соответственно инициацией у элонгацией и терминацией. Сигналом для начала
трансляции служит инициирующий кодон АУГ (аденин, урацил,
гуанин) в мРНК. Инициация приводит к связыванию инициатор ной
тРНК с сигналом начала трансляции и образованию инициаторного
комплекса рибосома — мРНК — тРНК. Инициация завершается
перемещением рибосомы вдоль цепи мРНК в направлении от 5'
к 3' концу. На каждом этапе последующей элонгации происходит
связывание аминоацил-тРНК (узнавание кодона), образование
пептидной связи и перемещение (трансляция) рибосомы. Рост
полипептидной цепи происходит в направлении от N-конца к С-концу.
Терминацию синтеза белка осуществляют факторы освобождения,
которые узнают терминирующие кодоны. Когда трансляция
заканчивается, происходит высвобождение полипептида. Образование
инициаторного комплекса, связывание аминоацил-тРНК с
рибосомой и транслокация рибосомы сопряжены с затратой энергии за
счет гидролиза гуанозинтрифосфата (ГТФ).
Синтез белка происходит в полирибосомных комплексах (поли-
сомах), состоящих из некоторого числа рибосом, прикрепленных
к молекуле мРМК; каждая из рибосом считывает мРНК и
синтезирует белок независимо. На образование каждой пептидной связи
расходуются по меньшей мере четыре высокоэнергетические
фосфатные связи. На рис. 76, а схематически изображена
полирибосома. Здесь показано, что синтез белка начинается со связывания
малой субчастицы рибосомы с соответствующим местом в молекуле
матричной РНК. Когда образование полипептидной цепи
заканчивается, субчастицы диссоциируют и таким образом освобождаются
от мРНК.
Секреторные и мембранные белки синтезируются рибосомами,
связанными с эндоплазматическим ретикулумом (ЭР). Многие из
этих белков содержат сильно гидрофобную N-концевую
последовательность, которая служит сигналом для прикрепления рибосомы
к мембране ЭР. Затем синтезирующаяся полипептидная связь
активно протягивается через мембрану ЭР, а сигнальная последова-
143
Законченная
пмипептидная
цепь
\ f Термин
/f~\ eOS-ci/ёчастица
Терминирующий \
ф~У нодон 1
•GD Ш-сурчаапица
I Инициирующий J Т
^ Отщепленный
сигнальный пептид
Законченная полипептидная
цепь с отщепленным
сигнальным пептидом
Рис. 76. Схемы синтеза белка (Албертс и соавт., 1983):
а — схематическое изображение полирибосомы (60 S — большая субчастица, 40 S —
малая субчастица), б — схема синтеза белка в шероховатом эндоплазматическом ретикулуме
тельность отщепляется на внутренней стороне. Основные этапы
такого синтеза показаны на рис. 76, б. Почти ко всем белкам,
синтезированным на связанных с мембранами полисомах, ковалентно
присоединяются один или несколько углеводных остатков. Глико-
протеины переносятся из ЭР в аппарат Гольджи в окаймленных
пузырьках. Эти пузырьки, сформированные мембраной, покрытой
144
белком клатрином, участвуют во многих процессах обмена между
мембранными структурами. В аппарате Гольджи происходит
укорачивание и окончательное гликозилирование олигосахаридных
остатков. Кроме того, здесь гликопротеины сортируются и
отправляются по назначению. Углеводные остатки, по видимому, играют
важную роль в этом процессе сортировки.
Почти любой этап белкового синтеза специфически подавляется
теми или иными антибиотиками. В экспериментальных
исследованиях их используют для изучения механизмов функционирования
клетки. Чаще всего используют антибиотики — хлорамфеникол,
циклогексамид, пуромицин, стрептомицин. Первые два подавляют
пептидилтрансферазу, рибосомный фермент, катализирующий
образование пептидной связи. Хлорамфеникол подавляет синтез белка,
осуществляемый прокариотическими и митохондриальными
рибосомами. Циклогексамид воздействует на рибосомы эукариотических
клеток, находящихся в цитозоле. Пуромицин представляет собой
структурный аналог молекулы тРНК, связанной с аминокислотой.
Он прерывает элонгацию полипептидной цепи, замещая собой
поступающую в рибосому аминоацил-тРНК. Это вызывает
преждевременную терминацию трансляции и отделение полипептида от
рибосомы. Пуромицин оказывает влияние на клетки как прокариот,
так и эукариот. Стрептомицин подавляет инициацию и вызывает
неправильное считывание мРНК у прокариот.
Все клетки многоклеточного организма являются потомками
одной и той же клетки — оплодотворенной яйцеклетки. В
результате дифференцировки разные типы клеток приобретают высокую
степень специализации, сохраняя при этом всю генетическую
информацию, содержащуюся в оплодотворенной яйцеклетке. В основе
специализации лежит не потеря или приобретение генов, а изменение
в выражении генов (экспрессии). У эукариотических клеток
имеются сложные механизмы контроля экспрессии генов. Как
внешние, так и внутренние сигналы активируют или подавляют группы
генов. Даже в отдельно взятой дифференцированной клетке
определенная информация может найти выражение в какой-то один
период времени, оставаясь невыраженной в другое время.
Выражение ее может изменяться при активации покоящихся клеток и при
стимуляции их специфическими гормонами. В обоих случаях
переключение генетической программы клетки вызывает сложные
изменения ее метаболизма.
Предполагают, что лишь малая часть ДНК кодирует
действительно образующиеся белкич В клетках человека она составляет,
возможно, около 1 %. В результате использования трансплантации
ядер были получены доказательства важной роли цитоплазмы в
регуляции активности ядра. После удаления из яйцеклетки лягушки
ядра или после его разрушения в яйцеклетку имплантировали ядро
из кишечного эпителия лягушки В результате соединения
цитоплазмы яйцеклетки с ядром дифференцированной клетки во многих
случаях развивалась совершенно нормальная лягушка, т. е.
использованное в данном случае ядро специализированных клеток содер-
145
жало всю информацию, необходимую для формирования
полноценного организма.
Изучение регуляторных механизмов у прокариот, у которых
геном устроен гораздо проще, чем у высших организме®, достигло
значительных успехов. Показано, что у кишечной палочки Е. coli
транскрипция отдельных генетических последовательностей в РНК
(синтез РНК) регулируется связыванием и высвобождением
специфических регуляторов в соответствующих участках ДНК.
В нормальных природных условиях гены и наборы генов
претерпевают рекомбинацию в ходе таких биологических процессов, как
трансформация и конъюгация бактерий, заражение клетки вирусом
и обмен генов при слиянии половых эукариотических клеток.
Новые комбинации генов можно создать и искусственным путем
в лабораторных условиях с помощью ряда ферментов. Чтобы
встроить чужеродный ген в геном клеток Е. coli, этот ген сначала
«пришивают» к вектору, которым служит либо плазмида Е. coli, либо
ДНК фага к. Полученная рекомбинантная ДНК может затем
попасть в клетку Е. coli, ковалентно включиться в ее хромосому и в
составе этой хромосомы реплицироваться. Если новый ген,
содержащийся в рекомбинантной ДНК, обладает подходящими
сигнальными последовательностями, указывающими начало я колец
транскрипции, то такой fch будет транскрибироваться и транслироваться
с образованием соответствующего белкового продукта. Многие
гены из животных клеток уже были введены в бактерий, а
бактериальные гены, в свою очередь, были «строены в эуяариотические
клетки. С помощью бактерий, в геномы которых -введены
соответствующие лены, можно получать такие применяемые в медицине
белковые препараты, как инсулин, гормон роста и интерфероны.
Глава 7. КЛЕТОЧНЫЕ МЕМБРАНЫ
Мем0раны являются высокоорганизованными структурами
клетки. Плазматическая мембрана отделяет клетку от
окружающей среды и лредставляет собой барьер с высокоизбирателькой
проницаемостью. В плазматических .мембранах имеются
молекулярные транспортные системы, регулирующие молекулярный и
ионный состав внутриклеточной среды. Внутриклеточные мембраны
формируют эндаплазматический ретикулум и аппарат Гольджи,
Благодаря наличию внутриклеточных мембран, содержимое эука-
риотической клетки разделено на отсеки (компартменты).
Мембраны осуществляют <эбмен информацией между клетками
« средой. В частности, в них имеются специфические рецепторы,
воспринимающие внешние сигналы Движение бактерий к
источнику пищи, ответ клетки-мишени на гормон, ответ клеток на
действие медиаторных веществ связаны с взаимодействием
химических веществ с мембраной. Плазматические мембраны
электрически возбудимых клеток содержат ионные каналы, связанные с
«сенсором» напряжения, реагирующим на изменение напряженности
электрического ноля в мембранах.
146
Такие важные процессы превращения энергии, как фотосгнгез
(процесс превращения энергии квантов света в энергию химических
связей), а также окислительное фосфор илирование, в ходе которого
за счет окисления органических субстратов образуется АТФ,
протекают соответственно во внутренних мембранах хлоропластов
и во внутренних мембранах митохондрий.
7.1. Молекулярная организация клеточных мембран. Состав
клеточных мембран зависит от их типа и функции, однако во всех
случаях их основными составляющими являются липиды и белки.
Мембранные липиды являются амфипатическими соединениями. Их
молекулы содержат полярную (гидрофильную) группу и более
протяженные гидрофобные группы. Когда липиды находятся на
поверхности воды, они формируют монослой, в котором полярные
головки молекул контактируют с поверхностью воды, а неполярные
углеводородные цепи ориентированы приблизительно под прямым
углом к поверхности. Этот монослой может быть сжат таким
образом, что молекулы липидов будут контактировать друг с
другом.
Е. Гортер и Ф. Грендель измерили минимальную площадь
монослоя, сформированного липидами, экстрагированными из
эритроцитов ацетоном, и сравнили ее с площадью поверхности клеток. Они
обнаружили, что площадь монослоя почти в два раза превышает
площадь поверхности клеток, и пришли к выводу, что липиды
в клеточной мембране формируют бимолекулярный слой. Е.
Гортер и Ф. Грендель допустили ошибку, экстрагируя липиды
ацетоном, который не извлекает их полностью. Кроме того, они дали
заниженную оценку площади поверхности эритроцитов,
использовав для ее определения высушенные клетки. Вывод оказался
правильным в связи с тем, что две ошибки случайно скомпенсировали
друг друга. Представление о том, что структурной основой
биологических мембран является бимолекулярный липидный слой, стало
общепринятым. Строгие доказательства его существования были
получены благодаря исследованию биологических мембран с
помощью дифракции рентгеновских лучей.
Липидный бислой мембраны состоит преимущественно из фосфо-
липидов. Как видно уже из названия, липиды этой группы
содержат фосфор (в виде остатков фосфорной кислоты). Роль основного
фосфолипидного компонента мембран играют фосфоглицериды,
в состав которых входят два остатка жирных кислот, этерифициру-
ющих первую и вторую гидроксильные группы глицерола. Третья
гидроксильная группа глицерола образует сложноэфирную связь
с фосфорной кислотой. Кроме того, фосфоглицериды содержат
остаток спирта, связанного сложноэфирной ^связью с, фосфорной
кислотой. Этот второй остаток локализуется в полярйой головке
молекулы фосфоглицерида. В зависимости от того, какой спирт
входит в состав полярной головки, различают несколько классов
фосфоглицеридов. Все молекулы фосфоглицеридов имеют два
неполярных хвоста из длинноцепочечных жирных кислот. Как правило,
одна из жирных кислот насыщенная, а вторая — ненасыщенная;
147
о
II
R-C-0-CH2
R'-C-O-CH
О
II
R-C-O-CH,
О Н R'-C-O-CH О
II I II I . II I II
О H2C-0-P-0-CH2-C-NHj O H2C-0-P-0-CH2-CH2-NH3
О" COO" О"
Фосфатидилсерин
Фосфатидилэтаноламин
О
II
R-C-0-CH2
I 2
R'-C-O-CH О
II I II +
О h2C-0-P-0-CH2-CH2-N(CH3)3
о-
Фосфатидилхолин
О
II
R-C-0-CH2
R'-C-O-CH
II I
О
It
О
II
н
о
II
H2C-0-C-R
)Н О HC-0-C-R
II I II
VA—ко-р-о-сн2 о
/н hv '
)HHj
н он
Фосфатидилинозитол
О
II
H2C-0-C-R
I
HC-O-C-R'
I
о н2с-о-р-о-сн2-с-сн2-о-р-о-сн2
II I
О"* ОН 0~
Дифосфатидилглицерол
Рис. 77. Формулы некоторых фосфоцилглицеролов
II
О
последняя при этом образует эфирную связь всегда со средней,
т. е. при С2, гидроксильной группой глицерола.
Названия различных типов фосфоглицеридов даны в
соответствии с названием спирта в их полярной группе (рис. 77).
Исходным для всех фосфоглицеридов соединением служит фосфатидная
кислота, в головке которой нет спирта. В свободном виде она
встречается в незначительных количествах, играя роль промежуточного
продукта в биосинтезе фосфоглицеридов. Самые распространенные
фосфоглицериды — это сходные между собой
фосфатидилэтаноламин и фосфатидилхолин, полярные головки которых содержат
соответственно спирты этаноламин и холин. Комбинации жирных
кислот в неполярной части этих соединений могут быть
разнообразными. К фосфоглицеридам относится также фосфатидилсерин,
полярная группа которого содержит остаток гидроксиаминокислоты
серина и фосфатидилинозитол, в состав которого входит
циклический спирт — инозитол. Локализованный главным образом во
внутренней мембране митохондрий кардиолипин, в отличие от
остальных фосфоглицеридов, является «двойным» фосфоглицеридом
(рис. 77).
148
н3счсн2),2-с=с-с-с-сн2-о-р-о-сн,
Н I I I
ОН ti-H О"
I
Остаток 0 = С
жирной кислоты ^£
Сфингомиелин
Рис. 78. Формула сфингомиелина
Таким образом, фосфоглицериды содержат группировки двух
разных типов, а именно: полярные гидрофильные головки и
неполярные гидрофобные хвосты. Вследствие этого фосфоглицериды и
обладают амфипатическими свойствами. При рН =7,0 остаток
фосфорной кислоты во всех фосфоглицеридах заряжен отрицательно.
Кроме того, при рН, близких к 7,0, спиртовые группы головок
также могут нести один или несколько электрических зарядов.
Фосфолипиды представляют собой не только структурные
элементы клеточных мембран, но и могут выполнять важные
физиологические и биохимические функции. Так, арахидоновая кислота,
состоящая из цепи с 20 атомами углерода и с 4 двойными связями
и входящая в состав фосфолипидных молекул, служит
предшественником мощных физиологических посредников — простагландинов,
тромбоксанов, лейкотриенов. В плазматической мембране имеются
три инозитолсодержащих фосфолипида. Один из них,
присутствующий в сравнительно небольшом количестве, фосфатидилинозитол-
4, 5-дифосфат играет важную роль в передаче сигналов от
рецепторов мембраны внутрь клетки.
Второй важный класс мембранных липидов — сфинголипиды;
они тоже имеют полярную головку и два неполярных хвоста, но не
содержат глицерола. Сфинголипиды построены из одного остатка
длинноцепочечной жирной кислоты, одного остатка длинноцепо-
чечного аминоспирта сфингозина (или его производного) и одного
остатка спирта полярной головки.
Сфингозин служит предшественником ряда длинноцепочечных
аминоспиртов, присутствующих в различных сфинголипидах.
В сфинголипидах полярная головка присоединена к гидроксильной
группе сфингозина, а жирная кислота образует амидную связь
с аминогруппой. Существуют три подкласса сфинголипидов: сфинго-
миелины, цереброзиды и ганглиозиды. Сфингомиелины содержат
фосфор, тогда как в цереброзидах и ганглиозидах его нет.
Сфингомиелины (рис. 78) — самые простые и самые
распространенные сфинголипиды. Их характеризует наличие фосфохолина
или фосфоэтаноламина в полярной головке. Тот факт, что
сфингомиелины содержат фосфор, дает основание отнести их вместе с фсс-
фоглицеридами к фосфолипидам. Действительно, по своим основным
свойствам сфингомиелины и такие фосфоглицериды как фосфати-
дилэтаноламин и фосфатидилхолин очень близки; 'электрический
заряд их примерно одинаков. Сфингомиелины присутствуют в боль-
+ /сн,
-CH2-N-CL
чсн3
Остаток
фосфорилхолина
149
j_j u Остаток сахара
H I I i
НзС-(СН2)12-С = С-С-С~СН2-0- Глюкоза или галактоза
Н I I
ОН N-H
I
0=С
I ^ Остаток жирной кислоты
R,
Цереброзид (гликолипид)
Рис, 79. Формула цереброзида
шинстве мембран животных клеток, особенно много их в миел и
новых оболочках нервных волокон.
Цереброзиды не несут электрического заряда, поскольку их
полярные головки образованы электронейтральными группами.
Из-за характерного признака цереброзидов — наличия одного или
нескольких остатков Сахаров в полярной головке — их называют
также гликосфинголипидами («глико» означает, что в соединении
есть углеводный компонент). Цереброзиды относятся к гликолипи-
дам (общее название липидов, содержащих остатки Сахаров). На
рис. 79 показано строение цереброзида, полярная головка которого
образована сахаром D-галактозой или D-глюкозой. Галактоцере-
брозиды содержатся главным образом в мембранах клеток мозга,
тогда как глюкоцереброзиды присутствуют в мембранах других
(не нервных) клеток.
Известны также цереброзиды, содержащие два, три или четыре
остатка Сахаров:,D -глюкозы, £Ьгалактозы или N -ацетил -£>-галакто-
замина. Эти более сложные цереброзиды локализуются .в основном
в наружном слое клеточных мембран <и являются важными
компонентами клеточной поверхности.
Наиболее ^сложные сфинголипиды — гинглиозиды (рис. 80). Их
очень крупные полярные тгаловки тэбразшвны .яезсишштми
остатками Сахаров. Для гаюглиозидов ;характ«рно *шшние в крайнем
положении одного или нескольких ^аога-Еков Ыгнцетилнейрамшю-
вой (сиаловой) кислоты, несущей;пригрН=7,0 ио-фицательный
заряд. Остл/гки .N-ацетилнейраминовой згшспоты встречаются также
в шгигосахаридных боковых цепях некоторых мембранных глико-
протеинов. В сером веществе мозга ганглиозиды ссстзрляют около
6 % мембранных липидов. Они обнаруживаются также, .хотя и в
меньших количествах,^ мембранах клеток других^тканей.
Ганглиозиды— ;шжнме /компоненты расположенных на поверхности
клеточных мембран -специфических рецепторных участков. Они
находятся в тех специфических участках нейронов, где'происходит
связывание молекул нейромедиатора в процессе химической передачи
импульса от одной нервной клетки к другой.
К числу важных липидных компонентов многих мембран
относится и холестерол (рис. 81). Он присутствует у эукариот, и его нет
у большинства прокариот. Как правило, холестеролом богаты
плазматические мембраны клеток эукариот, тогда как мембраны кле-
150
Ы-ацетил-О-галактозамин
СН2ОН
Н-
D-ra лактоза
СН2ОН
Неполярные хвосты
Рис. 80» Формула • санадиозида.
точных органелл содержат относительно мало этого нейтрального
липида. Присутствие холестерола в фосфолипидном бислое делает
мембраны несколько менее гибкими и еще менее проницаемыми.
Плазматические мембраны многих клеток, а также мембраны
ряда внутриклеточных органелл, например митохондрий и хлоро-
пластов, удалось выделить в свободном, виде и изучить их
молекулярный состав. Для каждого типа мембран любой живой клетки
характерен свой относительно постоянный липидный состав
(табл. 9).
СН3 Н
н-с-сн2-сн2-сн2-с-сн3
сны сн3
Холестерол
Рис. 81. Формула холестерола
151
9, Примерный липидный состав (%) клеточных мембран печени крысы
Мембрана
Плазматическая
Аппарата Гольджи
Эндоплазматического ре-
тикулума
Внутренняя митохондри-
альная
Ядерная
Фосфолипиды
57
57
85
92
85
Холестерол
15
9
5
0
5
Гликолипиды
6
0
0
0
0
Эфиры холес-
терола и
минорные
компоненты
22
34
10
8
10
7.2. Динамика липидов в мембране. Важнейшим физическим
свойством двухцепочечных амфифильных амфипатических молекул
является их склонность образовывать двойные слои в водной среде.
Слои имеют вид отдельных пузырьков (везикул) или пластинчатых
(ламеллярных) структур. Такие структуры показаны на рис. 82.
Амфифильные молекулы в них объединяются так, что полярные
головки контактируют с водной фазой, а углеводные хвосты собираются
вместе, образуя безводную фазу. Бислой играет роль мембраны,
отделяя содержимое пузырька от внешней среды.
Одноцепочечные амфифильные молекулы стремятся
образовывать в водной среде глобулярные мицеллы, а не бислойные
структуры (рис. 82).
Свойства липидных молекул в бислоях сильно зависят от
температуры (рис. 83). При достаточно низких температурах липидный
слой подобен твердому кристаллоподобному телу. В этом случае
липидные молекулы почти не перемещаются в плоскости мембраны.
По мере повышения температуры часто наблюдается резкое изме-
Рис. 82. Схематическое изображение некоторых амфифильных
(амфипатических) структур:
J и 2 — плоский и сферический бислой, соответственно, 3 — двухцепочечная амфифильная
молекула; 4 — мицепла, образованная одноцепочечными молекулами; б *- одноцепочечная
амфифильная молекула
152
QQQQOQ
I 11 i И I 1 "I i I I
УНУУУУ
Рис. S3. Схема, илл.острлруюдая фазовый переход фосфолипидного бислоя от
упорядоченного кристаллического состояния к жидкому при изменении
температуры
нение свойств бислоев. Изменения происходят в таком узком
температурном интервале, что напоминают фазовые переходы,
которые наблюдаются при плавлении твердого тела. Выше температуры
перехода бислой по своему поведению больше похож на жидкость.
Липидные молекулы в этом случае способны быстро перемещаться
в плоскости мембраны (латеральная диффузия). Температуры, при
которых происходят переходы, зависят от липидного состава
бислоя. При высокой концентрации ненасыщенных жирных кислот
температурные переходы происходят при более низких
температурах.
Чтобы получить представление о структуре бислоя на
молекулярном уровне и установить ее связь с функциями мембраны,
необходимо использовать методы, позволяющие понять особенное!и
упаковки отдельных углеводородных цепей и их динамических
свойств. Наиболее ценными методами являются рентгеноструктур-
ный анализ, электронный парамагнитный резонанс (ЭПР) и
ядерный магнитный резонанс. Результаты, полученные этими методами,
позволили построить детальную модель липидных биелсев.
Дифракция рентгеновских лучей — самый эффективный
современный метод изучения структуры больших молекул. Рентгенострук-
турный анализ был успешно использован для выяснения структуры
миелиновой оболочки, которая является слоистой структурой.
Она образуется путем накручивания плазматической мембраны
леммоцита (шванновской клетки) на аксон. На рис. 84 приведен
профиль электронной плотности
одного слоя миелина, рассчитанный
по данным дифракции
рентгеновских лучей. Эти данные хорошо
сопоставимы с результатами рент-
геноструктурного анализа
липидных бислоев и мультислоев.
Рис. 84. Распределение электронной
плотности по данным рентгеноструктур-
ного анализа поперек мембраны из
миелиновой оболочки (внизу показано
расположение молекул липидов) (Каспар, Кир-
шнер, 1971)
2 4 6
Длина, нм
153
с=о
h>V-h
в
г' н
н V н
"->./ н
Рис. 85. Спектры электронного парамагнитного резонанса двойного слоя ли-
пидов с введенными в него молекулами-зондами (Копальди, 1974):
Г—спектр «замороженного* двойного слоя, II-» спектр жидкого двойного слоя. Сиг*
иальная группа в молекуле-зонде выделена
Данные о структуре бислоев были получены также с помощью
метода ЭПР. Сигнал ЭПР дает только неспаренный электрон, и
у^фЪсфолипидного бислоя спектр ЭПР обычно отсутствует. Можно,
однако, ввести в бислой спиновые метки — молекулы, содержащие
иееиаренный электрон; спектр ЭПР этих молекул существенно
меняется при изменении структуры бислоя. Наиболее часто ис-
гашшзуемые зонды — нитроксильные радикалы, которые могут быть
присоединены к фосфолипидам и жирным кислотам. Некоторое
количество таких молекул вводят в двойной липидный слой
исследуемой мембраны.
Присоединенная сигнальная группа очень чувствительна к два
жению, и по форме сигнала в спектре ЭПР можно безошибочно
выявить перемещения того участка хвоста, к которому прикреплена
грунпа. На рис. 85 показано изменение спектра ЭПР при переходе
бислоя в жидкое состояние при повышении температуры.
Молекулой-зондом была стеариновая кислота с сигнальной нитроксильной
группой. Наименее гибким в молекулах липидов является тот
участок хвоста, который ближе к головке и, следовательно, к
поверхности мембраны. Наибольшая гибкость свойственна зоне,
ближайшей к середине двойного слоя. Методом ЭПР была определена
скорость латеральной диффузии фосфолипидов в мембранах пузырь^
154
ков (везикул). Был использован спин-меченый фосфатидилхолин.
При 298 К коэффициент диффузии составляет 1,8 • 10~8 см2-с"1.
Это соответствует частоте парных лерестановок соседних молекул
около Ю7 с"1.
При изучении перемещений фосфолипидных молекул между
поверхностями бислоя было обнаружено, что^дедескок^липидов
(<£лш^ и ЛК)бая
асимметрия в распределении фосфолипидов в мемЗране может
сохраняться достаточно долго. Препятствием для перехода фосфолипидов
из одного слоя мембраны на другой служит высокий уровень
энергии, необходимой для проталкивания заряженных полярных
головок через средний углеводородный слой мембраны. Поперечная
диффузия молекул фосфолипида на расстояние _5$~ нм заНргает
в Ю9 раз больше времени," чем диффузия на то же расстояние в ла-
Теральном ^направлении.""
Информацию о структуре бислоя можно получить также из
спектров протонного магнитного резонанса и спектров ЯМР на
ядрах 13С. Эти спектры позволяют обнаружить существенные
изменения в структуре бислоя при температурном переходе, при
котором фосфолипиды из упорядоченного кристаллообразного
состояния переходят в более или менее неупорядоченное.
7.3. Мембранные белки. Мембранные липиды создают барьеры
проницаемости и тем самым отграничивают отдельные участки <(ком-
партменты) клетки. Специфические белки опосредуют отдельные
функции мембран, такие как транспорт, передачу информации
и преобразование энергии. Мембранные липиды создают среду,
необходимую для действия этих белков.
Мембраны различаются между сббой по содержанию -белка.
Так, в миелине, который служит изолирующей оболочкой многих
нервных волокон, содержится мало белка «>(18'% массы мембраны).
Основной компонент миелина — липиды с ^прекрасными
изоляционными свойствами. С другой стороны, в большинстве клеток
плазматические мембраны обладают значительно>более высокой активностью
и содержат различные насосы, каналы, рецепторы, ферменты.
Количество белка в таких плазматических мембранах достигает,
как правило, 50'% массы мембраны. "Наиболее 'высоким
содержанием белка (до 75%) характеризуются мембраны,
функционирующие как преобразователи энергии, в частности внутренние
мембраны митохондрий и хлорошгастов.
С помощью электрофореза в полиакриламидном геле с додецил-
сульфатом натрия (ДСН) удается выявить основные мембранные
белки (см. параграф 3.8).
На рис. 86 показаны результаты гель-электрофореза трех
мембран: плазматической мембраны эритроцитов, фоторецептор ной
мембраны палочек сетчатки и мембраны саркоплазматического ре-
тикулума мышцы. Отчетливо видно, что белковый состав этих
трех мембран совершенно разный. Таким образом, мембраны,
выполняющие неодинаковые функции, также различаются по
белковому составу.
155
Рис. 86. Электрофореграммы различных
мембран в ДСН-полиакриламидном геле (Страйер,
1981):
а—плазматическая мембрана эритроцитов; 6 —•
мембранные диски палочек сетчатки; в — мембраны
саркоплазматического ретикулума
в
Многие мембранные белки были
солюГилизированы и получены в
очищенном виде. Некоторые из них
сохраняют активность в растворе с
детергентом. Например, фоторецептор-
ный белок родопсин дает одну и ту же
полосу поглощения при 500 нм
независимо от того, находится ли он в
растворе детергента или же в составе
мембраны сетчатки. Более того, в
обоих случаях простетическая группа
этого белка при освещении
претерпевает одинаковые структурные изменения. Из саркоплазматического
ретикулума был выделен кальциевый насос — белок,
осуществляющий-транспорт Ca2f (Са2+-АТФаза). Оказалось, что из смеси
фосфолипида и белка кальциевого насоса могут образовываться
функционально активные пузырьки, способные накапливать Са2 +
в присутствии АТФ как источника энергии. Реконструкция
функционально активных мембранных систем из очищенных
компонентов— перспективный подход к изучению мембранных процессов.
Некоторые мембранные белки удается выделить методами
мягкой обработки, например экстрагированием раствором высокой
ионной силы (например, 1 М NaCl). Другие белки оказываются более
прочно связанными с мембраной — их можно отделить лишь с
помощью детергента или органического растворителя. Исходя из
различий в прочности связи с мембраной, соответствующие белки
подразделяют на периферические и интегральные. Интегральные белки
образуют многочисленные связи с углеводородными цепями
мембранных липидов, и потому их можно выделить только с помощью
агентов, конкурентно участвующих в этих неполярных
взаимодействиях. Периферические белки, напротив, связаны с мембранами
электростатическими силами и водородными связями. Эти
полярные взаимодействия могут быть разрушены при добавлении солей
или! изменении рН. Согласно последним данным, периферические
белки мембран часто присоединяются к поверхности интегральных
белков.
Локализацию белков во внутренней части мембраны
определяют, используя главным образом электронно-микроскопический
метод замораживания — скалывания. Клетка или фрагменты
мембраны быстро замораживают при температуре жидкого азота.
Замороженную мембрану раскалывают далее толчком ножа микротома.
Скол обычно проходит продольно посередине бислоя. В результате
раскрывается значительная область внутренней части липидного
156
Рис. 87. Схема структуры плазматической мембраны, созданная на
основании данных электронной микроскопии Препараты мембран получены методом
замораживания — скалывания и глубокого травления (Сэтир, 1975):
Продолговатые тела — белки либо пронизывающие мембрану, либо находящиеся наев
поверхности, ветвящиеся цепи — сахара, сочетающиеся с белками или липидами
бислоя. Далее эту обнажившуюся поверхность покрывают путем
напыления слоя угля или платины, что дает реплику внутренней
части бислоя, которую затем рассматривают при помощи
электронного микроскопа.
Для изучения наружной поверхности мембраны метод
замораживания — скалывания используют в сочетании с методом глубокого
травления. При этом сначала путем скола обнажают внутреннюю
часть замороженной мембраны. Далее лед сублимируют на
прилежащей поверхности мембраны — это метод глубокого травления.
Сочетание двух методов позволяет получить картину внутренней
части мембраны и обеих ее поверхностей (рис. 87). Достоинство
рассматриваемого подхода состоит в том, что он не требует фиксации
и обезвоживания биологического материала.
В исследованиях методом замораживания — скалывания было
непосредственно доказано наличие интегральных белков во
многих биологических мембранах. Например, в мембране эритроцита
содержатся глобулярные частицы диаметром около 7,5 нм. Большое
число глобулярных частиц имеется также внутри мембраны сарко-
плазматического ретикулума. В отличие от этого искусственный
бислой из фосфатидилхолина имеет совершенно гладкую
поверхность скола. Оказались большей частью гладкими и
поверхности скола миелиновой мембраны, что и следовало ожидать от этой
относительно инертной мембраны, функционирующей главным
образом в качестве изолирующей поверхности.
Очень удобными для изучения мембранных белков являются
мембраны эритроцитов. Будучи лишены органелл, эритроциты
имеют только одну мембрану— плазматическую. Путем
осмотического лизиса можно получить тени эритроцитов, т. е. чистые
157
Рис. 88. Предполагаемая структура
гликофорина в мембране эритроцт?
(Сегрест, Кохи, 1973):
/ — олигосахаридные цепи гидрофильнс й
головки; 2 — полипептид; 8 — внутримем*
бранная часть молекулы; 4 — часть
молекулы гликофорина, контактирующая с ци-
тозолем
плазматические мембраны, без
цитоплазмы.
Изучение белков,
содержащихся в плазматической мембране
эритроцитов, позволило
сформулировать новые представления
о строении мембран. Возникло, в частности, предположение о том,
что, по крайней мере, некоторые мембраны имеют скелет. В
мембране эритроцита человека содержатся пять главных белков и
большое чи<£ло минорных. Большинство мембранных белков — глико-
протеины. К интегральным белкам в мембране эритроцита
относится гликофорин (рис. 88). Его молекулярная масса составляет30000;
гликофорин содержит 130 аминокислотных остатков и множество
остатков Сахаров, на долю которых приходится около 60 % всей
молекулы.
На одном из концов полипептидной цепи располагается
гидрофильная головка сложного строения, включающая в себя ©коло
15 олигосахаридных цепей, каждая из которых состоит
приблизительно ив W остатков Сахаров. На другом конце голипептиднсй
цепи гликофорина находится большое число остатков глутаминовсй
и аспарагиновоет кислот, которые при рН=7,0 несут отрицательный
заряд. В середине молекулы, между двумя гидрофильными
концами, располагается участок полипептидной цепи, содержащий около
30 гидрофобных аминокислотных остатков. Богатый сахарами конец
молекулы гликофорина локализуется на внешней поверхности
мембраны эритроцита. Считают, что расположенный в середине
молекулы гликофорина гидрофобный участок проходит сквозь липидный
бислой, а полярный конец с отрицательно заряженными остатками
аминокислот погружен в цитозоль. Богатая сахарами головка
гликофорина содержит антигенные детерминанты, определяющие
группу крови. Кроме того, на ней имеются участки, связывающие
некоторые патогенные вирусы.
На долю другого важного белка мембраны эритроцитов — спек-
трина — приходится до 20 % общего количества белков в мембране.
Этот периферический белок расположен на внутренней
поверхности мембраны; он легко поддается экстракции. Молекула спектрина
состоит из двух полипептидных цепей, молекулярная масса
которых составляет около 220000 и 2400СО, соответственно эти цени
образуют длинные гибкие стержни длиной 100—200 нм. Связываясь
с определенными белками и липидами на внутренней поверхности
мембраны эритроцита, молекулы спектрика формируют гибкую
решетку, которая, по-видимому, играет роль скелета мембраны.
158
Со спектрином связываются также микрофиламенты актина, и весьма
верогтно, что именно они соединяют стержни спектрина друг с
другом. Таким образом, можно говорить о том, что мембрана
эритроцита имеет скелет, или каркас, на котором крепятся
специфические лшшды и мембранные белки.
Из мембран эритроцитов выделен трансмембранный белок,
играющий важную роль в выполнении клеткой ее специализированной
функции. В пределах липидного слоя он находится в свернутой
(глобулярной) конформации. Его молекулярная масса около 100000.
Белок имеет небольшой углеводный остаток, выступающий на
наружной поверхности клетки. Основная функция эритроцитов
заключается в переносе 02 из легких ко всем тканям и С02 из тканей
к легким. Находясь в легких, эритроциты избавляются от С02
путем замены НС07 на С1"\ Рассматриваемый белок формирует
анионный канал для такого обмена.
Одним из наиболее изученных мембранных глобулярных белков
является бактериородопсин. Он содержится в специализированной
области клеточной мембраны (пурпурной мембране) бактерий На-
lobacterium halobium, обитающих в соленой среде, Бактериородопсин
играет роль протонного насоса (см. параграф 13.7).
На внешней поверхности клеток во многих плотных тканях
присутствует еще один важный гликолротенн — фибронектин,
обладающий высокой адгезивной способностью и, возможно,
обеспечивающий слипание однотипных клеток друг с другом.
7.4. Жидкостно-мозаичная структура мембран. Исходя из
результатов исследований, проведенных химическими и электронно-
микроскопическими методами, а также учитывая сходство в
свойствах синтетических фосфолнпидных бислоев и природных мембран,
JC. СингерлХ^ .Николгон„ сформулировали в 1972 г. теорию
строения мембран, получившую название^шйс^^яоз^за^^яой модели.
Согласно этой модели, основной нецрерывной частькГ^мШбраньгг
т. е. ее матриксом, служит липидный бислой. Цри обычной для
клетки температуре* матрикс находится в жидком состоянии, что
обеспечивается определенным соотношением между насыщенными
и ненасыщенными жирными кислотами в гидрофобных хвостах
полярных липидов. ^идкостно-мозаичная модель предполагает
также, что на поверхности 'расположенных в мембране интегральных
белков имеются гидрофобные группы аминокислотных остатков,
^за счет которых белки как бы «растворяются» в центральной
гидрофобной части бислоя. В то же время на поверхности
периферических, или внешних, белков имеются в ochqbjh^^
группы, которые притягиваются к поверхности мембраны за счет
электростатических сил. Интегральные белки, к которым относятся
ферменты и транспортные белки, обладают активностью только
в том случае, если находятся внутри гидрофобной части бислоя,
где они приобретают необходимую для проявления активности
пространственную конфигурацию. Следует подчеркнуть, что ни
между молекулами липидов в бислое, ни между белками и липида-
ми бислоя не образуются ковалентные связи.
159
Ркс» 89. Схема, иллюстрирующая молекулярную организацию мембраны (Ло-
днш, Рот van, 1976)
На рис. 89 показано, что плазматическая мембрана состоит
из белков, углеводов и липидов. Интегральные белки погружены
в липидный двойной слой; периферические белки связаны с
поверхностью мембраны. Углеводы присоединены к белкам и липидам.
Строение мембраны асимметрично: углеводы всегда находятся на
ее внешней поверхности. Согласно представленной схеме, каждый
вид интегральных белков имеет определенную ориентацию,
одинаковую у всех молекул данного белка.
Из жидкостно-мозаичной модели следует, что мембранные белки
могут свободно перемещаться в латеральной плоскости.
Периферические белки как бы плавают на поверхности бислойного «моря»,
а интегральные белки, подобно айсбергам, почти полностью
погружены в углеводородный срединный слой. Способность мембранных
белков передвигаться в латеральной плоскости может быть, однако,
ограничена вследствие притяжения между функционально
связанными белками и образования ими кластеров, что в конечном итоге
приводит к мозаичному распределению мембранных белков в
жидком липидном бислое.
Предполагают, что такие кластеры мембранных белков могут
латерально перемещаться в бислое. Этот процесс лежит,
по-видимому, в основе так называемого кэпинга, т. е. перемещения
определенных мембранных белков в специфические участки или зоны
мембраны, происходящего в клетках некоторых типов на
протяжении их жизненного цикла. Модель Сингера — Николсона позволяет
объяснить многие физические, химические и биологические сюйства
мембран, она получила широкое признание как наиболее
вероятный способ молекулярной упаковки липидов и белков в мембранах.
Быстрое движение белков мембраны выявляется с помощью
флуоресцентной микроскопии при следующей постановке опыта.
Культивируемые клетки человека и клетки мыши можно заставить
слиться друг с другом; образующаяся при этом гибридная клетка
называется гетерокарионом. Одна часть плазматической мембраны
160
>
Сл('яние
Гетерокарион
а/б
Рис. 90. Схематическое изображение слияния клетки мыши (а) и клетки
человека (б) с последующим перемешиванием в образовавшемся гетерокарионе
мембранных белков мыши и человека, маркированных зеленым {окружности) и
красным (точки) флуоресцирующими маркерами
гетерокариона происходит из клетки мыши, а другая — из клетки
человека. Остаются ли мембранные белки мыши и человека
разделенными в гетерокарионе или они смешиваются? Для ответа на этот
вопрос использовали маркеры, а именно антитела с флуоресцентной
меткой, и далее визуально наблюдали за ними с помощью светового
микроскопа. Антитело к мембранным белкам мыши имело зеленую
флуоресценцию, а антитело к мембранным белкам человека —
красную (рис. 90). В новообразованном гетерокарионе одна
половина поверхности светилась зеленым, а другая — красным. Однако
меньше чем через час (при 37 °С) участки зеленой и красной
флуоресценции полностью смешивались. Этот опыт показывает, что
мембранный белок способен диффундировать на расстояние порядка
нескольких микрометров примерно за 1 мин.
В отличие от липидов, белки очень неоднородны в отношении
латеральной подвижности. Некоторые белки почти так же
подвижны, как липиды, другие — практически неподвижны. Так,
фоторецепторный белок родопсин характеризуется очень высокой
подвижностью: его коэффициент диффузии равен 4 • 10~д см2- с"1.
С другой стороны, фибронектин (периферический гликопротеин,
участвующий во взаимодействии клетки с субстратом) имеет
коэффициент диффузии менее 10~12 см2 • с"1. Малая подвижность
некоторых белков, возможно, объясняется тем, что они закреплены
на субмембранных цитоплазматических структурах.
Мембраны асимметричны как по структуре, так и по функциям;
об этом свидетельствуют примеры ориентации гликофорина, а
также локализация углеводов на наружной поверхности мембран.
Наружная и внутренняя поверхности всех известных
биологических мембран различаются по составу и ферментативной
активности. Яркой иллюстрацией этого положения может служить белок,
регулирующий концентрации Na+ и К+ в клетках — (Na+ + К*)-
АТФаза. Эта транспортная система имеется в плазматических
мембранах почти всех клеток высших организмов. (Na++К+)-
АТФаза ориентирована в плазматической мембране таким образом,
что выводит Na+ из клетки и закачивает К+ в клетку. Для работы
(Na++ К+)-АТФазы требуется АТФ, которая должна
находиться на внутренней стороне мембраны. Специфический ингибитор
6 8-616
161
насоса уабаин эффективен только при воздействии с наружной
стороны мембраны (см. параграф 8.5).
Строго определенная ориентация мембранных белков
обусловлена тем, что они синтезируются и включаются в мембрану
асимметричным образом. Эта абсолютная асимметрия сохраняется
благодаря отсутствию трансмембранных перемещений белков на всем
протяжении их существования в мембране. Липиды также
распределены асимметрично, что обусловлено механизмом их биосинтеза,
однако эта асимметрия практически во всех случаях, кроме глико-
липидов, не является абсолютной. Например, в мембране
эритроцита сфингомиелин и фосфатидилхолин расположены
преимущественно в наружном слое бислоя, тогда как фосфатилэтаноламин
и фосфатидилсерии главным образом —во внутреннем. Холестерол
в большом количестве присутствует в обоих слоях бислоя.
Функциональное значение асимметрии липидов пока еще не ясно.
Асимметрия мембраны еще более выражена в распределении
углеводов. Олигосахаридные боковые цепи гликолипидов и глико-
протеинов в плазматических мембранах локализованы
исключительно на наружной поверхности. Содержание углеводов в
плазматических мембранах варьирует от 2 до 10 % по массе.
Остаткам сиаловой кислоты, находящимся обычно на концах
углеводных боковых цепей, принадлежит важная роль в создании
отрицательного заряда клеточной поверхности, характерного для
всех эукариотических клеток. Функция углеводов на поверхности
клетки не известна. Кажется вероятным, что, по крайней мере,
некоторые из олигосахаридных цепей принимают участие в процессах
межклеточного узнавания. Для обозначения обогащенной
углеводами периферической зоны на поверхности большинства
эукариотических клеток используют термин гликокаликс.
Г л а в а 8. МЕМБРАННЫЙ ТРАНСПОРТ
Биологические ^мембраны представляют собой
высокоизбирательные барьеры проницаемости. Поток молекул и ионов в клетку
и из клетки контролируется находящимися в плазматической
мембране специфическими системами транспорта. Транспортные
процессы в мембране регулируют объем клетки и поддерживают ионный
состав внутриклеточного содержимого в узких пределах колебаний,
что создает благоприятные условия для проявления активности
ферментов. Они создают ионные градиенты, необходимые для
создания мембранного потенциала, поддержания возбудимости, а также
транспорта некоторых молекул и ионов. Системы транспорта в
мембране экстрагируют из среды и концентрируют в клетке вещества,
являющиеся источниками энергии, а также необходимые для
построения компонентов клетки. Принято различать следующие типы
мембранного транспорта.
ОД Пассивный транспорт неэлектролитов и ионов через мембра-
нуГПри этом перенос неэлектролитов обусловлен градиентом
химического потенциала, а перенос ионов — градиентом электрохими-
16?
о
о
о
о io ol
о 1 °
Ю О
ol о
Рис. 91. Диффузия молекул через
мембрану:
а—начальное распределение
диффундирующего вещества: / — молекулы,
диффундирующие через мембрану; 2 — мембрана, проницаемая
для диффундирующего вещества, о —
распределение молекул после достижения равновесия
I и II — отсеки, разделенные мембраной
ческого потенциала. Пассивный
транспорт может осуществляться
путем диффузии через липидный бислой. Он происходит также
благодаря механизму облегченной диффузии — транспорту,
осуществляемому переносчиками, или каналами.
^2^) Активный транспорт — перенос неэлектролитов и ионов
против градиента химического или электрохимического потенциала.
Этоцвид транспорта сопряжен с энергетическими затратами.
ГЗуГранспорт, сопряженный с изменением архитектуры
мембраны ,— экзо- и эндоцитоз.
Является ли процесс транспорта активным или пассивным,
зависит от изменения свободной энергии транспортируемых
компонентов. Если транспортируется незаряженное растворенное вещество
из отсека / в отсек //, то свободная энергия его переноса
записывается как
AG = RT In -^ = 2,303 RT lg ^ , (8.1)
где AG — изменение свободной энергии; с\ и сц—концентрации
вещества в отсеке I и II, соответственно; R— газовая постоянная;
Т — абсолютная температура.
В случае транспорта ионов изменение свободной энергии имеет
вид
AG = RT In -^ + zFAcp, (8.2)
где z — заряд иона; Дер — трансмембранная разность потенциалов;
F — число Фарадея. Если AG — положительная величина, то
транспорт активный, если отрицательная, то транспорт
осуществляется пассивно.
8.1. Диффузия веществ через липидный бислой мембраны.
Основной термодинамический принцип, управляющий стационарным
распределением диффундирующих молекул в системе с мембраной,
состоит в том, что химические потенциалы данного компонента (ji)
по разные стороны мембраны должны быть равны (см. параграф
1.7). Рассмотрим систему, в которой мембрана разделяет два
отсека, содержащих раствор вещества В> которое легко проходит через
мембрану (рис.91). Для обозначения сторон мембраны
использованы индексы (I) и (II). Химический потенциал вещества В в отсеке (I)
равен \х]В> а в отсеке (II) — ция. Перенос dtis молей вещества из
отсека (I) в отсек (II) сопровождается изменением свободной
энергии системы на величину
dG = ([iuB — \>lib) dnB. (8.3)
в*
163
Спонтанный (пассивный) транспорт прекращается, и система
приходит в состояние термодинамического равновесия, когда
№в = fins. (8.4)
При термодинамическом равновесии С\в = Сив, т. е. концентрация
неэлектролита в двух растворах одинакова.
Для количественного описания диффузии веществ через
клеточные мембраны можно использовать Формулу Теорелла для потока
вещества: Поток = Подвижность X Концентрация X Полная
движущая сила. Поток (J) — количество вещества в молях, которсе
проходит в единицу времени через площадку, равную единице
площади, перпендикулярную направлению движения (размерность
потока — [моль / см2» с]).
' = *•£. <8-5>
где А — площадь; -тт-— число молей, переносимых через площадку
А за единицу времени. При описании простой диффузии в качестве
полной движущей силы в уравнение Теорелла следует ввести
градиент химического потенциала \х со знаком минус, который в
случае транспорта через мембрану равен производной -~ (х
откладывают по оси, перпендикулярной поверхности мембраны; на
внутренней поверхности мембраны х = О, а наружной х = d). Формула
Теорелла в этом случае примет вид
I •$—<"£' - <8.6)
где U — подвижность [см2 • с""1 • Дж""1 • моль]; с — концентрация
в точке х в момент времени /. Если использовать выражение для
химического потенциала jx, согласно (1.54), тогда (8.6) можно
записать в виде
I't--UcRTd-^. (8.7)
dc
Поскольку d In с = — , то
J'J—*™g. (8.8)
Обозначив RTU через коэффициент диффузии D (размерность —
см2 • с"1), получим первое уравнение диффузии Фика:
J-в ■—*>*• *>••»
При стационарном транспорте через мембрану, производную от
концентрации, заменяют разностью концентраций, отнесенной
к толщине мембраны — d:
J = -DCim~Cmi (8.10)
164
где Cim и сим — концентрации диффундирующего вещества на двух
поверхностях мембраны. Концентрации cm и dm заменяют
концентрациями вещества в водных растворах (с\ и Сц)э используя
коэффициент распределения р: cm = Рл и сщл = рсц,
j = -®{cn-ci) = ^(ci-cn) (8.11)
или
J = P(ci-cu), (8.12)
где Р — коэффициент проницаемости.
Проницаемость мембраны определяется двумя факторами:
коэффициентом распределения вещества между водным раствором
и мембраной (|J) и коэффициентом диффузии его через мембрану
(D). Коэффициент Р может быть определен, если измерен поток J
и известна разность концентраций (с\ — Сц),
Слои раствора, непосредственно прилегающие к мембране, не
перемешиваются достаточно интенсивно, и концентрация в них
диффундирующего через мембрану вещества отличается от
концентрации в глубине раствора. Это приводит к тому, что разность
концентраций для разных сторон мембраны оказывается меньшей,
чем для растворов по разные. стороны мембраны. В связи с этим
коэффициенты проницаемости, рассчитанные непосредственно из
величины потока и концентраций растворов, могут оказаться
ошибочными. На рис. 92 схематически показан профиль изменения
концентрации в примембранных пространствах и в мембране;
ах и а2—эффективная толщина неперемешивающихся слоев. Непе-
ремешивающийся слой, прилежащий к клеточной мембране, можно
рассматривать как дополнительный барьер. Его важность в
транспортном процессе зависит от соотношения проницаемости самсй
мембраны для транспортируемых молекул и проницаемости барьера
в виде неперемешивающегося слоя.
Перемещение многих неэлектролитов через клеточную мембрану
связано с их растворением в липидном бислое и последующей
диффузией. Это было показано при изучении способности различных
веществ проникать в гигантские клетки водорослей, в частности
в клетки Chara ceratophylla. P. Колландер обнаружил зависимость
проницаемости клеток водоросли от способности исследуемых
веществ растворяться в оливковом масле. Оливковое масло было
использовано как модель липидного бислоя мембраны (о
растворимости в оливковом масле судили по коэффициенту распределения
вещества между оливковым маслом и водой). Кроме того, было
показано, что при одинаковой способности растворяться в оливковом
масле вещества с меньшей молекулярной массой обычно
диффундируют в клетки водоросли быстрее.
На основании данных, полученных при изучении
проницаемости гигантских клеток водоросли для различных веществ, можно
предполагать, что оливковое масло является достаточно
адекватной моделью липидного бислоя мембраны. Важным фактором,
165
-■-.
2"
, * .
-^
1- Г
Мембрана ^
i_ % 1
i
i
1
i
1
1
PM?}
10,0
1,0
Г Вода •
Метанол у
Этанол •/
Пропилен- /
\ Формамид гяит%/Й
• у^Дизтилмочевина
Диметил- •/
мочебина /
\-* j
Мочебина/
/Глицерин
/• Этилмочевина
• Тиомочевина
i i
0,1 Ь
001
Коэффициент распределения между
оливковым маслом и водой
Рис. 93. Проницаемость
клеток водоросли Chara ceratophy-
Па для органических веществ,
отличающихся по своей
растворимости в оливковом масле.
Отложенная по оси ординат
величина РМ1/2 характеризует
проницаемость клетки (Р —
проницаемость — см • ч"-1, М — моле-
кулярная масса данного
вещества) (Колландер, 1949)
Рис. 92. Профиль концентрации
проникающего через мембрану вещества
в самой мембране и в примыкающих
к ней неперемешивающихся слоях
(Котик, Яначек, 1977):
6, и б2 — эффективная толщина
неперемешивающихся слоев по обе стороны
мембраны, / — толщина мембраны; (Д c)t и (А с)2 —
изменение концентрации в
неперемешивающихся слоях; с\ и сц — концентрации
проникающего через мембрану вещества в
глубине растворов, разделенных
мембраной Прерывистая линия — истинный
профиль изменения концентрации в примем-
бранных пространствах
влияющим на коэффициент диффузии в мембране, является размер
молекул проникающего вещества.
На рис. 93 представлен в упрощенном виде график,
опубликованный Р. Колландером. Приведена лишь часть испытанных веществ.
На оси ординат в логарифмическом масштабе приведено
произведение коэффициента проницаемости на корень квадратный из
величины молекулярной массы РМ1/2 . На оси абсцисс приведен
коэффициент распределения между оливковым маслом и водой (в
логарифмическом масштабе). График показывает, что для молекул,
обладающих хорошей растворимостью в липидах, характерно высокое
значение параметра РМ1/2. Исходя из этих данных, можно также
предсказать, что молекулы сходных размеров, отличающиеся
только своей растворимостью в липидах, должны проходить через
плазматическую мембрану и поступать в клетку с разными
скоростями. Так, пропиленгликоль и мочевина имеют одну и ту же
молекулярную массу и примерно одинаковые молекулярные размеры.
Однако пропиленгликоль диффундирует через мембрану
приблизительно в 20 раз быстрее, потому что он гораздо лучше растворим
в липидах.
Существуют, однако, неэлектролиты, поведение которых не
подчиняется этой простой закономерности. Из рис. 93 следует,
что аномальное поведение свойственно воде. По своей
растворимости в липидах вода и тиомочевина сходны, молекулярная масса
166
<b
б\-
L
г v
Л*
h 4*
5
г
1
•Вода
7V
9 \
1 1
\
-J
0 2 4 6
Число групп, образующих
бодородные сбязи
8
Рис. 94. Зависимость способности молекул
проникать в клетки водоросли Chara cera-
tophylla от числа групп, образующих
водородные связи (Штейн, 1981):
/ — метанол; 2 — этанол; 3 — диэтилмочевина, 4 —
формамид, 5 — диметил мочевина, в — этиленгли-
коль, 7 — этилмочевина, 8 — тиомочевина; 9 —
мочевина; 10 — глицерин; // —эритрол
тиомочевины в 4 раза больше
молекулярной массы воды. Величина же
Р для воды в 200 раз выше. Таким
образом, клеточная мембрана более
проницаема для воды, чем можно было
бы ожидать исходя из растворимости
воды в липидах. Известно еще
несколько таких «аномальных» веществ,
например, метанол, формамид. Во всех
случаях это малые молекулы. Р.Кол-
ландер высказал предположение, что плазматическая мембрана
пронизана порами. Размеры их таковы, что они пропускают мелкие
молекулы, но не пропускают крупные, поэтому эти последние могут
попасть в клетку только путем диффузии через липидную фазу
мембраны.
В водном растворе между молекулами растворенного вещества
и молекулами воды возникают водородные связи. Число их
определяется природой химических групп в молекуле данного вещества.
Переход молекул из водной фазы в липидную возможен при
разрушении всех водородных связей, образованных с молекулами воды.
Обнаружена корреляция между числом разрываемых водородных
связей и проницаемостью. На основании этих данных Штейн (1967)
построил график зависимости РУН1/2 от числа водородных связей,
образуемых данным веществом с водой (рис. 94). В этом случае
имеется лучшее совпадение со значениями проницаемости,
найденными в эксперименте, чем на рис. 93. Однако и в данном случае
Проницаемость клеточной мембраны для воды остается аномально
высокой.
В настоящее время предполагают существование двух путей
для перемещения воды и малых гидрофильных молекул через
плазматическую мембрану. Эти пути схематически показаны на
рис. 95. Один из них гидрофильный — молекулы воды проходят
через поры, сформированные интегральными белками мембраны.
Второй путь связан с возникновением лабильных структурных
дефектов в углеводородной области мембраны в результате тепловых
флуктуации. Эти подвижные структурные дефекты в углеводородной
области мембраны могут быть путями перемещения через мембрану
не только молекул воды, но и малых гидрофильных молекул;
они названы кинками.
В плазматической мембране эпителиальных клеток дистальных
отделов почечных канальцев и собирательных трубочек нефронов
почек млекопитающих имеются рецепторы, взаимодействующие
167
ш
Рис. 95. Схема, иллюстрирующая различные возможные пути
прохождения через мембрану молекул воды (1) и малых гидрофильных молекул (2)
(Шаафи, 1981)
с антидиуретическим гормоном (АДГ). АДГ вызывает рост
проницаемости мембраны для воды. Этот эффект происходит на фоне
увеличения внутриклеточной концентрации цАМФ, вызванным
активацией аденилатциклазы (см. параграф 10.3). Существует гипотеза,
что рост проницаемости мембраны для воды при действии АДГ
обусловлен формированием в мембране пор интегральными
белками.
Незаряженные молекулы транспортируются через
биологические мембраны либо путем простой диффузии, либо с помощью
различных механизмов опосредованного транспорта. В том случае,
когда опосредованный транспорт протекает без потребления
энергии, его называют облегченной диффузией. Она осуществляется
протеинами мембраны, обладающими способностью «узнавать»
определенные вещества и транспортировать их через мембрану. Для
облегченной диффузии характерна стереоспецифичность —
транспортируется только один из двух возможных стереоизомеров.
Гак, через биологические мембраны проникают только D-изомеры
Сахаров и L-аминокислоты.
Кроме специфичности для механизма облегченной диффузии
характерен феномен насыщения (рис. 96). Он проявляется в том,
что скорость транспорта увеличивается с ростом концентрации
транспортируемого вещества только до некоторой предельной
величины Vmax. Затем она становится независимой от концентрации.
Проникающий в клетку субстрат
S0 образует на внешней стороне
мембраны комплекс субстрат —
переносчик SX0i который
проникает через мембрану. На
внутренней поверхности мембраны
Рис 96 Кинетика диффузии через
мембрану веществ с участием белка-
переносчика*
Vmax — максимальная скорость
Диффузии прч насыщении белка-переносчика;
Кт — константа, соответствующая такой
Конивнтппппя тпгшгппп- концентрации транспортируемого вещества,
nt,n,;t!S? Ц шРшп°Р при которой скорость диффузии составляет
тируемых молекул vmax/2
J 68
Рис. 97. Схема, показывающая
предполагаемые коиформационные
изменения белка-переносчика,
транспортирующего незаряженные молекулы:
конформационное состояние I — участок
связывания открыт с наружной стороны
мембраны; конформационное состояние II — тот
же участок открыт с внутренней стороны
мембраны
происходит распад комплекса и
освобождение S. Приводим
реакции, описывающие перенос вещества S в комплекс с
переносчиком X:
$0 + ^о ^ SXQ\
SXt**St + Xt;
X^Xq.
Индексы 0 и / обозначают наружную и внутреннюю поверхности
мембраны, соответственно. Однонаправленный поток вещества в
случае облегченной диффузии описывается следующим уравнением:
J° = WTWv <8ЛЗ>
где Js— поток вещества; /тах — лимитирующий поток переноса
вещества; [S] —концентрация транспортируемого вещества; Кт —
константа.
Уравнение (8.13) тождественно уравнению Михаэлиса—Ментен,
используемому в ферментативной кинетике. Константа Кт
соответствует константе Михаэлиса. Она равна концентрации субстрата, при
КОТОРОЙ JS = Jmax/2.
Молекулярные механизмы работы белков-переносчиков не
известны. Белки-переносчики часто рассматривают как трансмембранные
белки, которые претерпевают обратимые коиформационные
изменения при переносе молекул через липидный бислой мембраны.
Схематическая модель того, как мог бы осуществляться такой перенос
при облегченной диффузии, показана на рис. 97.
В настоящее время достаточно полно изучена облегченная
диффузия глюкозы в клетки млекопитающих. Активность этого вида
транспорта особенно велика в эритроцитах человека.
8.2. Избирательная ионная проницаемость клеточных мембран.
Структурная основа биологических мембран — липидный бислой —
является эффективным барьером на пути перемещения малых ионов
из водной среды внутрь клетки. Изменение свободной энергии
AG при переходе иона из среды с диэлектрической проницаемостью
ei B среду с диэлектрической проницаемостью е2 ориентировочно
рассчитывают, используя электростатическую теорию Борна:
^-S^(i-i), <*">
169
°9>
ОО
v
О л
О
Рис. 98. Различные слособы управления ионными каналами (Хилле, 1983;
Албертс и соавт., 1983; Ланцет, 1983):
а — ионный канал, управляемый электрическим полем: / — липидный бислой; 2—
сенсор > реагирующий на напряженность электрического поля; 3 — «ворота» ионного канала,
4— пора, заполненная водой, 5 — фильтр избирательности (селективный фильтр), 6 —
протеин, осуществляющий фиксацию канала в мембране («якорный» протеин), 7 — углеводы,
б — ионный канал, непосредственно управляемый химическим сигналом: 1 — сигнальная
молекула; 2 — транспортируемые ионы, 3— градиент концентрации транспортируемых ионов;
в — ионный канал, опосредованно управляемый химическим сигналом: / — мембрана, 2 —
сигнальная молекула; 3 — углеводы; R — рецептор мембраны, взаимодействующий с
сигнальной молекулой; G — белок, С — аденилатциклаза, продуцирующая циклический аде-
нозинмонофосфат (цАМФ); 4 — фосфорилируемый белок, выполняющий функцию канала;
Р — фосфат
где Nb— число Авогадро; z—заряд иона; г — радиус иона; е —
единичный заряд; е0—электрическая постоянная. Теория Бор на
сформулирована для случая идеально поляризуемого диэлектрика,
и результаты расчетов отличаются от экспериментальных величин.
Диэлектрическая проницаемость воды составляет 80, а липидного
бислоя приблизительно равна 2. Работа, необходимая для переноса
ионов калия из водной среды в липидный матрикс мембраны,
согласно расчетам по (8.14), составляет 250 кДж/моль. Вместе с тем
энергетический барьер, который необходимо преодолеть ионам
калия при прохождении через плазматическую мембрану,
составляет только 20 кДж/моль. Это связано с тем, что ионная
проницаемость клеточных мембран обеспечивается ионными каналами,
представляющими собой интегральные белки мембраны.
Функцию ионных каналов сопоставляют с функцией ферментов.
Для большинства ионных каналов характерны специфичность
(избирательность), феномен насыщения при росте концентрации
субстрата (ионо©), конкурентное подавление аналогами субстрата
(ионами-блокаторами). Конформационные изменения каналов
переводят их из закрытого состояния в открытое и наоборот. Эти
переходы могут быть обусловлены изменениями мембранного
потенциала, взаимодействием с определенными химическими веществами,
170
Рис. 99. Молекулы воды и
гидратация иона (Хилле, 1984):
а — молекула воды, обладающая диполь-
ньш моментом (заряды атомов водорода и
кислорода обозначены соответственно 64- и
8~); б — гипотетическая структура
мгновенной ориентации молекул воды вокруг
иона Rb*K Отрицательный конец диполя
молекулы воды указан стрелкой. Показаны
водородные связи между соседними
молекулами воды
специфическим фосфорилирова-
нием. На рис. 98 схематически
изображены три способа управле- 6 ' '
ния ионными каналами. В одном
случае канал управляется электрическим полем мембраны.
Структура, реагирующая на изменение напряженности электрического
поля мембраны, несет электрические заряды и называется сенсором
напряжения. Ионные каналы могут быть связаны с рецепторами,
взаимодействующими с определенными химическими веществами.
Взаимодействие приводит к открыванию канала. Наконец,
взаимодействие химического вещества с рецептором мембраны может
вызывать появление в клетке вторичного посредника (в частности,
циклического аденозинмонофосфата цАМФ), активирующего про-
теинкидазу. Она катализирует присоединение к ионному каналу
фосфата, что приводит к его открыванию. Через различные типы
каналов в секунду может проходить Ю6—109 ионов.
Одной из особенностей ионной проницаемости клеточных
мембран является способность отличать ионы различного знака и
различной химической природы. Выяснение принципов, лежащих
в основе такой ионной избирательности мембраны, —
необходимое условие для понимания природы электрической активности
клеток.
Прежде чем перейти к рассмотрению современных
представлений об этом вопросе, необходимо кратко остановиться на
особенностях взаимодействия ионов с молекулами воды. Ввиду того что
молекула воды является диполем, в растворах электролитов на
взаимодействие растворителя с растворенным веществом
накладывается мощное электрическое поле. Если допустить, что
диэлектрическая проницаемость воды вблизи иона равна 80, то напряженность
поля на расстоянии 0,6 нм от центра одновалентного иона
составляет 0,5 • 10е В/см. Предполагают, что в реальных условиях
напряженность поля, действующего на первый слой молекул воды,
по крайней мере на порядок больше, так как при расчете энергии
взаимодействия иона с молекулами воды, расположенными
непосредственно возле него, нельзя пользоваться макроскопической
диэлектрической проницаемостью. На рис. 99 схематически
изображен гидратированный ион Rb.
Энергия гидратации при одинаковом заряде ионов большая
для ионов, имеющих меньший кристаллический радиус.
Кристаллические радиусы ионов были определены методом дифракции
рентгеновских лучей на кристаллах. У различных авторов они несколько
171
отличаются. При рассмотрении гидратации чаще всего используют
радиусы Полинга.
В табл. 10 сопоставлены радиусы одновалентных ионов по
Полингу и свободная энергия гидратации. Энергия гидратации для
галоген-ионов заметно выше, чем для катионов приблизительно
того же радиуса. Подвижность ионов в водных растворах зависит
от их эффективных радиусов в гидратированном состоянии. Ионы
с меньшим радиусом в гидратированном состоянии более подвижны.
При оценке эффективных радиусов гидратированных ионов нередко
используют расчеты по формуле Стокса — Эйнштейна:
10. Свободная энергия гидратации одновалентных ионов при 298 К (По
Робинсону и Стоксу)
Ион
Li+
Na+
К+
Rb+
Cs+
Кристаллические
радиусы (по
Полингу), нм
0,06
0,095
0,133
0,148
0,169
Свободная
энергия
гидратации,
кДж/моль
—481,3
—376,7
—309,7
—283,5
—255,4
Ион
С1-
Вг
1-
Кристалл11-
ческие
радиусы (по
Полингу), нм
0,136
0,181
| 0,195
0,216
Свободная
энергия
гидратации,
кДж/моль
—478,4
—353,6
—327,6
—294,0
где г — радиус; А0— постоянная Больцмана; Т — абсолютная
температура; D — коэффициент диффузии; г) — вязкость воды.
Результаты расчетов по этой формуле являются ориентировочными.
Основываясь на исследованиях катионной избирательности
коллодиевых мембран, Л. Михаэлис (1925) пришел к выводу, что
ионная проницаемость клеточной мембраны обеспечивается
каналами (порами), заполненными водой. Поры несут отрицательный
заряд, препятствующий проникновению в них анионов. Затем
Р. Бойль и Е. Конвей (1941) на основании изучения проницаемости
скелетных мышечных волокон амфибий для ионов калия и хлора
пришли к выводу, что поры не заряжены и проницаемость мембраны
зависит только от диаметра ионов в гидратированном состоянии.
В настоящее время как теория избирательности Михаэлиса, так
и теория сита для гидратированных ионов Бойля и Конвея
представляют исторический интерес. Теорию сита трудно согласовать
с некоторыми экспериментальными данными, в частности с тем,
что в состоянии покоя избирательность некоторых плазматических
мембран для ионов калия, рубидия и цезия характеризуется
следующей последовательностью: К > Rb >Cs. Эффективные радиусы
этих ионов в гидратированном состоянии приблизительно
одинаковы, и с позиций теории сита проницаемость мембраны для них не
должна заметно отличаться.
172
Определенный интерес представляет гипотеза Л. Мюллинса о
механизмах ионной избирательности биологических мембран, которая
также учитывает размер пор мембраны. Суть ее состоит в том, что
ион лишь тогда может пройти через пору, когда его радиус с одним
слоем гидратации равен радиусу поры. В таком случае стенки
поры, взаимодействуя с проникающим ионом, дополняют гидратную
оболочку, и ион может перейти из водного раствора в мембрану.
Особенности избирательной ионной проницаемости, согласно этой
точке зрения, определяются характером распределения пор по их
радиусам.
В настоящее время при рассмотрении проблемы ионной
избирательности нередко используют электростатическую теорию Эйзен-
мана. Для объяснения физико-химических механизмов, лежаших
в основе избирательности катионселективных стеклянных элек
родов, Эйзенман рассматривал энергетику ионного обмена. Если
ионы А+ и В + могут из раствора переходить в стекло и наоборот,
то ионообменную реакцию можно представить следующим образом:
А+ (в водной среде) + В* (в стекле)%=± Л+(в стекле) + В+ (в водной
среде). Эта реакция будет смещена вправо (предпочтительное
связывание катиона Л+ стеклом), если изменение свободной энергии
Гиббса AG для ионов А+ и В* будет следующим: AG а (водная
среда ->■ стекло) < AGB (водная среда -->• стекло). В рассматриваемой
модели для расчета изменений свободной энергии использовались
электростатическая энергия взаимодействия катиона с
отрицательно заряженной (анионной) группировкой в стекле и
энергия гидратации катионов. Анионная группировка рассматривалась
как сферическая. Энергия взаимодействия U «голого» катиона
с анионной группировкой обратно пропорциональна сумме радиусов
анионной группы г а и катиона гс:
ц = W*' (8.16)
4JT880 (ГА+ГС) > V
где N0— число Авогадро; е — элементарный заряд; е —
диэлектрическая проницаемость стекла; е0— электрическая постоянная,
е0=8,85- 10"1а- Кл • В^м"1.
Если значение гА весьма велико, то анионная группировка
создает слабое электрическое поле, и величина U будет мала для
всех катионов. В ионообменном процессе будет доминировать
энергия, необходимая для дегидратации. В этом случае из 5 ионов
щелочных металлов «большой» ион цезия наиболее предпочтителен,
так как он легче всего дегидратируется. Последовательность
избирательности ионообменной реакции будет соответствовать первому
ряду Эйзенмана. Она по сути соответствует последовательности
подвижности гидратированных ионов в водном растворе. Другой
крайний случай, когда г а мал. Анионная группировка теперь
создает сильное электрическое поле, и в этом случае более
предпочтительны катионы с малым кристаллическим радиусом. Последова-
телы:осгь избирательности ионообменной реакции соответствует
173
XI ряду Эйзенмана. Для промежуточных случаев имеется 9
последовательностей избирательности.
Таким образом, теория Эйзенмана предсказывает 11
последовательностей избирательности для 5 ионов щелочных металлов.
Именно такие последовательности обнаружены в природе.
I. Cs+ > Rb+ >K+ > Na+ > Li+;
II. Rb+ > Cs+ >K+ > Na+ > Li+;
III. Rb+ >K+ > Cs+ > Na+ > Li+:
IV. K+>Rb+>Cs+>Na+>Li+;
V. K+ > Rb+ > Na+ > Cs+ > Li+;
VI. K+ > Na+ > Rb+ > Cs+ > Li+;
VII. Na+>K+>Rb+>Cs+>Li+;
VIII. Na+ >K+ > Rb+ > Li+ > Cs+;
IX. Na+ >K+ >Li+ >Rb+ >Cs+;
X. Na+>Li+>K+>Rb+>Cs+;
XI. Li+ > Na+ > K+ > Rb+ > Cs+.
Для характеристики ионной избирательности мембран нередко
используют коэффициенты проницаемости, полученные при
расчетах, основанных на теории постоянного поля Гольдмана — Ходж-
кина — Кольца, а также расчеты проводимости мембраны для
различных ионов (см. гл. 9).
8.3. Мембранный потенциал. Между обеими сторонами
плазматической мембраны клетки поддерживается разность электрических
потенциалов — мембранный потенциал. Потенциал покоя
обусловлен тем, что внутренность клетки заряжена отрицательно по
отношению к наружной среде.
В 1902 г. Ю. Бернштейн выдвинул первую удовлетворительную
гипотезу о происхождении потенциала покоя в нервных и мышечных
волокнах. Из результатов химического анализа было известно,
что протоплазма нервных и мышечных волокон богата калием, но
содержит мало натрия и хлора, что в клетке есть анионы, для
которых клеточная мембрана в состоянии покоя непроницаема. Кроме
того, имевшиеся в то время данные позволяли думать, что мембрана
непроницаема и для ионов натрия. Поэтому Ю. Бернштейн
предположил, что трансмембранная разность потенциалов возникает
в результате неравномерного распределения ионов калия. Она
описывается уравнением Нернста (8.17). Это уравнение предсказывает,
что если мембрана проницаема только для одного вида ионов (в
данном случае для калия) и концентрации этих ионов по обе стороны
мембраны не равны, то возникнет трансмембранная разность
потенциалов. Для калия это уравнение имеет вид
£к = Т-1пЩ;, (8Л7)
где Ек — калиевый равновесный потенциал, т.е. такая
трансмембранная разность потенциалов, при которой нет преобладающего
перехода ионов калия через мембрану в каком-то одном
направлении, так что система находится в равновесии; [К% и \К % —
концентрация калия снаружи и внутри клетки, соответственно; R —-
газовая постоянная; Т — абсолютная температура; F — постоянная
174
Рис 100. Схема установки для
использования внутриклеточных стеклянных электродов:
/ — солевые мостлки на &гъ-ре„ 2 — стеклянный
электрон,' 3 — -раствор Рингера, 4 — исследуемая
Фарадея. При физиологических
значениях 1К+]0 и lK+]t величина £>< 0.
Ю. Бернштейн не мог
экспериментально проверить свою гипотезу, так
как в то время не было методов
точного измерения трансмембранного
потенциала. Для прямого измерения
мембранного потенциала нужно было
поместить электроды с обеих сторон
мембраны—один внутри клетки, а другой снаружи. До 1946 г.
эта трудная задача была решена только для имеющего большие
размеры гигантского аксона кальмара (до 1 мм в диаметре и несколько
сантиметров в дайну). А. Ходжкину и А. Хаксли (1939) и X. Керти-
су и К> Коулу (1942) независимо друг от друга удалось ввести в него
с торца тонкие стеклянные пипетки-электроды. Однако такая
методика, как правило, не применима к другим клеткам. Позднее
Дж. Грэм и Р. Джерард (1946) разработали способ изготовления
стеклянных капиллярных микроэлектродов с диазметром кончика
меньше 1 мкм. Кончик такого электрода настолько тонок, что его
можно вводить в различные клетки, вызывая лишь их минимальное
повреждение. Стеклянный капилляр наполняют
концентрированным солевым раствором (обычно ЗМ хлоридом калия), чтобы
обеспечить электропроводность, и соединяют с усилителем при помощи
неполяризующихся металлических электродов (обычно из
хлорированной серебряной проволоки). Затем изменения потенциала
регистрируют милливольтметром (рис. 100).
Для строгой проверки гипотезы Бернштейна нужно было
выяснить, каким образом влияет на мембранный потенциал
соотношение концентраций калия снаружи и внутри клетки. Согласно
уравнению Нернста (8.17), следовало ожидать, что при увеличении
или уменьшении внешней или внутренней концентрации калия
в 10 раз мембранный потенциал сдвинется на 58 мВ при температуре
около 20 °С. На рис. 101 представлен график зависимости
мембранного потенциала от логарифма наружной концентрации калия.
Точки, полученные в эксперименте, ложатся вблизи от
теоретической линии, за исключением области низких наружных
концентраций калия.
Если потенциал покоя действительно обусловлен
трансмембранным градиентом концентрации калия, то решающая проверка
могла бы состоять в том, чтобы изменить не только внешнюю, но
и внутреннюю концентрацию калия. Такой эксперимент был
успешно осуществлен на гигантском аксоне П. Бейкером, А. Ходжкином
и Т. Шоу. Толщина гигантского аксона достаточна для того, чтобы
можно было выдавить из него аксоплазму и с помощью канюли
175
10 50 100
[К0],мМ/д
Рис. 101 Зависимость
мембранного потенциала аксона кальмара от
внеклеточной концентрации ионов
калия (на оси абрисе—концентрация
калия приведена в
логарифмическом масштабе); жирная линия —
теоретическая прямая, рассчитанная
по уравнению Нернста
7 * f
~ТТ77Т>=г-
НГ7^ »
t*7>i*,l
Рис. 102 Схема, иллюстрирующая
удаление аксоплазмы из гигантского
аксона кальмара для последующей
ее замены раствором, находящимся
в пипетке (Ходжкин, 1964).
/ — пипетка, заполненная
2 — гигантский аксон; 3 -
валик
раствором;
- резиновый
наполнить его нужным раствором, не нарушая свойства
поверхностной мембраны (рис. 102). При нормальной концентрации калия
во внутриклеточном растворе (хотя в нем и не было белков) такие
аксоны при раздражении продолжали генерировать многие тысячи
нервных импульсов, если мембрана не была повреждена.
На таких перфузируемых аксонах было изучено влияние
различных внутриклеточных концентраций калия, и полученные
результаты соответствовали уравнению Нернста. Например, при
высокой наружной концентрации калия (540 мМ) и низкой внутренней
(100 мМ) (другими словами, когда отношение lK+]0/lK+]i равно
5,4 : 1 вместо 1 : 20) мембранный потенциал изменяет свой знак —
наружная сторона мембраны становится электроотрицательной по
отношению к внутренней. Далее уравнение Нернста предсказывает,
что при равенстве внешней и внутренней концентраций калия
мембранный потенциал упадет до нуля; опыты показали, что
мембранный потенциал покоя действительно исчезает, когда внешняя
концентрация калия равна внутренней (в диапазоне от 10 до 540 мМ).
Мембранный потенциал в случае ионного
равновесия. Основной термодинамический принцип, управляющий
распределением диффундирующих ионов в системе с мембраной, состоит
в том, что электрохимические потенциалы данного компонента по
разные стороны мембраны должны быть равны.
Рассмотрим следующий простой пример. Пусть мы имеем два
раствора КС1 с концентрацией 10 и 100 мМ, разделенные
проницаемой для катионов мембраной (рис. 103). Эта мембрана может
быть изготовлена, например, из катионообменной смолы и иметь
поры, вдоль которых расположены фиксированные отрицательные
заряды. Если поры достаточно узкие и плотность фиксированных
зарядов высока, через мембрану будут проникать только ионы
176
ч
-5вмВ
М-
I
111
Г5в\ И
юммка ! юоммка
Рис. 103. Измерение разности
электрических потенциалов в цепи при
наличии проницаемой для катионов ме.м-
браны М с помощью электродов
сравнения и мостиков:
/ — измерительный прибор; 2 —
каломельный электрод; 3 — солевой мостик
калия, перемещаясь от одного
отрицательно заряженного
участка поры к другому, тогда как
анионы хлора из-за
электростатического отталкивания не смогут войти в поры. В отсутствие внешней
цепи, соединяющей растворы через систему электродов и
металлических проводников, спустя некоторое время будет достигнуто ионное
равновесие. Вода находиться в равновесии не будет, поскольку
под действием осмотического давления она перемещается из
разбавленного раствора в более концентрированный. Однако такое
равновесие легко получить, если приложить соответствующее
гидростатическое давление к концентрированному раствору или ввести
в разбавленный раствор неэлектролит, для которого мембрана
непроницаема, скомпенсировав тем самым осмотическое давление.
Установление равновесия ионов калия является
термодинамическим процессом и обусловлено взаимным уравновешиванием
движущих сил в системе. В процессе установления равновесия
небольшое количество ионов калия проходит через мембрану,
заряжая ее и приводя к появлению разности электрических
потенциалов, которая «уравновешивает» градиент концентрации ионов
калия. Электрохимический потенциал ионов калия в условиях
равновесия должен быть одинаков для обоих растворов.
Выражение для электрохимического потенциала (J можно записать в виде
\i = |Л0 + RT \na + zFq>.
(8.18)
Здесь \i0 зависит только от природы растворителя и не зависит от
концентрации кона и электрического потенциала; R — газовая
постоянная, равная 8,31 Дж • моль*
X моль"1- К"1, поскольку 1 Дж = 1
- к-1
Кл
(или 8,31 Кл • В X
В); Т — абсолютная
температура; а — активность, равная а = /с, где / — коэффициент
активности; с — концентрация. В сильно разбавленных растворах
f равен единице (для обычных физиологических растворов / ~ 0,76);
z — валентность, или число элементарных зарядов, приходящихся
на один ион, с учетом знака заряда (для К+ z = +1, для С1~ 1,
для Са2+ Ь 2 и т. д.); F — число Фарадея, равное 96500 Кл на 1 М
одновалентного иона; ср—электрический потенциал.
Присвоив индекс Ф величинам, соответствующим
концентрированному раствору, а индекс «0» — величинам, относящимся к
разбавленному раствору, запишем условие^равновесия иона,
валентность которого равна z:
Ноо + RT ln ao + zF% ~= IV + RT In at + zFtpi.
(8.19)
177
Поскольку для обоих растворов растворитель один и тот же (вода),
Уо* = М-оо и
ъ-ъ = §гК = 2#*£К- (8-20)
Если считать, что коэффициенты активности для обоих растворов
одинаковы, (8.20) можно упростить, заменив активность
концентрацией:
<P<-<Po = 2,303|Jlg£. (8.21)
Произведение 2,303 — для комнатной температуры равно
приблизительно 58 мВ. Применительно к плазматической мембране cpj — ф0
заменяют мембранным потенциалом Е (в данном случае
равновесным). В этом случае потенциал наружного раствора рассматривают
как нулевой.
Равновесную разность потенциалов можно измерить с помощью
милливольтметра, соединенного с растворами посредством
электродов. Обычно для этого применяют электроды сравнения, т. е.
электроды, помещенные в среду постоянного состава (наиболее
распространенные из них — каломельные электроды) и соединенные
с исследуемыми растворами посредством солевых мостиков. Мостик
представляет собой концентрированный раствор такой соли,
которая при диссоциации дает ионы, имеющие одинаковую подвижность
(например, хлорид калия). Раствор иммобилизуют при помощи
агарового геля. Диффузионные потенциалы, возникающие в области
контактов между мостиками и растворами, очень малы, в
симметричной системе разность этих потенциалов еще меньше. Система,
схематически изображенная на рис. 103, позволяет измерить
истинную мембранную разность потенциалов.
Указанный принцип измерения разности потенциалов широко
применяется в биологии. Так, микроэлектроды представляют собой
микромостики из боросиликатного стекла, обычно заполняемые
ЗМ КС1. При помощи специальных микроманипуляторов эти
электроды вводят в живые клетки и измеряют разность электрических
потенциалов на клеточной мембране.
Для определения величины электрического заряда, которая
создает данный мембранный потенциал, можно воспользоваться
известной формулой, согласно которой заряд конденсатора равен
произведению его емкости на напряжение. Приняв мембранный
потенциал равным 100 мВ (10"1 В), а емкость мембраны — 1 мкФ-см"2
(Ю"6Ф • см"2), мы получим заряд 10"7 Кл • см"2, что
соответствует 10~12 М одновалентных ионов. Такое число ионов, конечно,
нельзя обнаружить экспериментально.
В системе, изображенной на рис. 104, устанавливается несколько
более сложное, чем в рассмотренном выше случае, равновесие Гибб-
са—Доннана. Система имеет два отсека. Правый отсек ограничен
жесткими упругими стенками (так что гидростатическое давление
в нем может превышать атмосферное) и содержит анионы А"', кото-
178
Рис. 104. Равновесие Гиббса—Донна на (Ко-
тык, Яиачек, 1977):
[А~] — концентрация непроникающих анионов; а —
активность ионов; ф — электрический потенциал; / —
мембрана, проницаемая для ионов К+ и С1~
рые не способны переходить в левый
отсек. Раствор в правой части иногда
называют доннановской фазой. В левом
отсеке находятся ионы, способные
диффундировать из одного отсека в
другой, катионы К+ и анионы С1~.
Для вывода равновесных соотношений можно записать условие
равенства электрохимических потенциалов в обеих фазах:
Иок+ + RT In ак + + Рщ = [хок* + RT In ак+ + Fqy, (8.22)
|лос1- + RT In аС\5 — F% = ^oci- + RT In aCi7 — Fq>,
и условие электронейтральности в каждой фазе:
якЗ— Яс15=0;
аК? — асп — [А"] = 0. (8.23)
Из (8.22) непосредственно следует, что
Я7\ «кЬ RT ,
Ф/-Фо = -7г1п—г = -^1п
или
акЬ
ак+
aci7
ас\Т
acio
(8 24)
(8.25)
где г— отношение Доннана.
Объединяя (8.23) и (8.25) и решая получившиеся квадратные
уравнения, можно найтиТсвязь между концентрациями
проникающих ионов в обеих фазах и концентрацией непроникающих
анионов в доннановской фазе:
аси = ±(У(АГ + К-[А-])9
(8.26)
где а0 = акЗ = Яс15-
Разность осмотического давления между двумя фазами можно
рассчитать, используя формулу Вант-Гоффа я = RTa:
An = RT ([А") + ак+ + асп- 2аХ
Объединяя (8.26) и (8.27), получим
An - RT ([A'] + V[A-)* + 4al-2al
(8.27)
(8.28)
179
Когда на ту же величину возрастет гидростатическое давление
в доннановской фазе, в системе будет достигнуто равновесие для
воды.
При выяснении ионных механизмов возникновения потенциала
покоя, а также различных изменений мембранного потенциала
необходимо учитывать как особенности ионной проницаемости
клеточной мембраны, так и характер распределения ионов между
внутренним содержимым клетки и наружной средой. В табл. 11
приведены данные о таком распределении для гигантского нервного
Еолокна кальмара, портняжной мышцы лягушки и эритроцитов
человека. Учитывая то, что плазматическая мембрана в состоянии
покоя проницаема не только для ионов калия, но также умеренно
проницаема для ионов натрия и хлора, эти ионы играют
определенную роль в возникновении потенциала покоя.
П. Внутриклеточные и внеклеточные концентрации ионов (ммоль/л клеточной
воды или внеклеточной среды); равновесные потенциалы и потенциал покоя
Параметры
Внутриклеточная концентрация
(ммоль/л)
Na+
К+
Mg2 +
Са2+
С1-
Внеклеточная концентрация (ммоль/л)
Na+
К+
Mg24
Са2+
С1-
Потенциал равновесия (мВ)
^Na
fK
£С1
Потенциал покоя (мВ)
Е
Гигантский
аксон
кальмара
78
392
11
0,4
104
462
22
56
11
286
+45
—73
—44
—60
Портняжная
мышца
лягушки
13
138
16
30
2
108
2,5
1,0
2
+53
-101
-92
—92
Эритроциты
человека
19
136
6
00
78
155
5
1,0
2,5
+55
-86
—9
—6 -.—10
Из данных, приведенных в табл. 11, видно, что потенциал
покоя в условиях, близких к физиологическим, заметно отличается
от равновесного потенциала для ионов калия. В мышечных
волокнах и в эритроцитах человека потенциал покоя близок к хлорному
равновесному потенциалу. Это обстоятельство связано с высокой
проницаемостью плазматической мембраны этих клеток для ионов
хлора.
В табл. 11 приведены данные о внутриклеточной концентрации
кальция. Внутриклеточный кальций находится преимущественно
в связанном состоянии и только 0,1 % его ионизирована.
180
В связи с тем, что потенциал покоя не соответствует
равновесному потенциалу для ионов калия, существует тенденция к
выходу ионов калия из клетки и замещению его ионами натрия. Для
сохранения постоянства внутриклеточных концентраций ионов
необходима работа механизмов, осуществляющих активный
транспорт ионов.
8.4. Пассивный поток ионов через клеточную мембрану.
Движущей силой для пассивного потока ионов через мембрану является
градиент электрохимического потенциала (см. 8.18). Он
представляет производную -~. (Ось х перпендикулярна поверхности
мембраны. Переменная х изменяется в пределах от 0 — на внутренней
поверхности мембраны до d — на наружной поверхности):
d£ = RT^ + zsF%. (8.29)
\r j I das d(fcs) f dcs dcs
Учитывая, что d In a, = —* = -77^ =* -7 -*= ~r » TorAa
as fcs 1 cs cs
^ = ^f^j_2ff*!E. (8.30)
dx cs dx ~*~ s dx
Плотность потока ионов J, через мембрану описывается
следующим образом:
'.--иг'(!8+^S). ^-31>
где us — электрофоретическая подвижность ионов [см2/(с • В)].
Выражение (8.31) представляет собой уравнение Нернста —
Планка.
Теория постоянного поля. Допускают, что градиент
электрического потенциала в мембране постоянен, т. е. ^=:'i(^ —
мембранный потенциал). В этом случае (8.31) приобретает вид
, RTus/dcs zscsFE\ /Я qo^
Если мембрана гомогенна и нейтральна, концентрацию ионов
на наружной и внутренней поверхности мембраны выражают через
концентрации ионов в наружном и внутреннем растворах,
используя при этом коэффициент распределения ps, т. е. cso = Ps[s]0 и csi=z
— $s[s\i> гДе cso и ^ — концентрации ионов s на наружной и
внутренней поверхностях мембраны соответственно, [s]0 и [s]l —
концентрации ионов в наружном и внутриклеточном растворе соответственно.
После интегрирования (8.32) и соответствующих подстановок
получают следующее выражение для плотности потока ионов s:
- __ zsiisEf>s [s]j - [s]0 exp (~zsFE/RT) R ооч
Js d [l-exp(-2sF£/#r)] • (b 'M)
181
Уравнение (8.33) умножают на zsF, получая при этом уравнение
для плотности тока /s. В уравнение обычно вводят коэффициент
n RT и&&
проницаемости Ps = -у • —^ и тогда плотность тока имеет вид:
<s - ffr -fir • \-.exp(-z8FE/RT) ' ^4'
Теория постоянного поля основана на принципе независимости.
Согласно формулировке А. Ходжкина и А. Хаксли, принцип
независимости состоит в том, что вероятность пересечения мембраны
ионом в рассматриваемом интервале времени не зависит от прис} т-
ствия других ионов.
Поток ионов, описываемый (8.33), можно разделить на два
разнонаправленных потока: Js — поток, входящий в клетку, и Js —
поток, выходящий из клетки
Т — Р * ££ [s]0 exp (—zsFE/RT) . я ,.,-v
J s - rsZs RT • j _ exp (_ZspEjRT) . \°^l
T — p у EL м< /я Qfi\
J s ~ rb*s RT 1 -exp (—zsFE/RT) ' *°OU;
Тогда отношение потоков запишется так:
TsIJ7-[^xp(zsFElRn (8.37)
Уравнение (8.37) представляет известное уравнение Уссинга.
Его широко используют в качестве критерия независимости друг
от друга противоположно направленных потоков ионов через
мембрану.
Теория постоянного поля используется и для описания
мембранного потенциала в условиях, когда мембрана проницаема для
нескольких видов ионов, и когда суммарный ионный ток равен нулю.
В качестве примера рассмотрим мембрану, проницаемую для ионов
натрия, калия и хлора. В том случае, когда / = 0==/ыа + /к +
+ /сь
0 = RTil-e^i-EF/RT)] ^ « + Р* ^ + ^ № ~
- (Л<а [Na]0 + Рк 1К]в + Pa [CI],)exp (-§£)}. (8.38)
Из (8.38) находим величину мембранного потенциала
P_RT} ^NatNab + ^K^lo + ^citClh (839)
Мембранный потенциал Е нередко называют потенциалом
нулевого тока, или же потенциалом реверсии, так как в его области
происходит изменение направления ионного тока, текущего через
мембрану.
132
Рис. 105. Теоретически
рассчитанные вольт-амперные
характеристики и эффект выпрямления (для
расчетов использовано уравнение
для тока из теории постоянного
поля) (Хилле, 1984):
а — вольт-амперная характеристика
при восьмикратном соотношении
концентраций ионов, переносящих ток:
штриховые линии — зависимость
однонаправленных потоков от мембранного
потенциала, тонкие сплошные — изменение
наклона вольт-амперной характеристики
при изменении направления тока; б —
вольт-амперные характеристики при
различных соотношениях концентрации
[S]0/[SJi (цифры возле кривых
обозначают величину соотношения)
Теория постоянного поля
предусматривает феномен
выпрямления для токов,
переносимых ионами, концентрация
которых внутри и снаружи
клетки отличается. На рис.
105, а представлена
теоретически рассчитанная
вольт-амперная характеристика тока,
переносимого одновалентными
катионами S+. Их
концентрация внутри клетки [S+], в 8 раз ниже, чем вне клетки
[S+VlS+h = 8. Ток, текущий в клетку,отрицателен, ток,
направленный из клетки, положителен. Прерывистыми линиями обозначены
однонаправленные токи.Обозначены также линии,иллюстрирующие
изменение крутизны вольт-амперной характеристики при изменении
направления тока. На рис. 105,6 показана зависимость крутизны
вольт-амперных характеристик и потенциала реверсии (точки
пересечения вольт-амперной характеристики с осью абсцисс) от [S+]0/[S+]t.
Теорию постоянного поля широко используют для описания
ионных токов, мембранного потенциала,, а также для оценки
избирательности ионных каналов. Вместе с тем нередко обнаруживается
ее несостоятельность. Впервые отклонение от принципа
независимости было обнаружено при изучении однонаправленных потоков
ионов калия через мембрану гигантского аксона каракатицы. Здесь
соотношение противоположно направленных потоков не
соответствовало расчетам по уравнению Уссинга. Для объяснения такого
отклонения высказано предположение, что калиевый канал
является длинной порой, в которой одновременно находится несколько
ионов. Перемещение их в канале происходит в один ряд. При
описании соотношения потоков правую часть уравнения Уссинга (8.37)
возводят в степень ri. Величина ri никогда не превышает того
максимального количества ионов, которое одновременно может
находиться в канале:
^ ^ '"" ' (8.40)
is-
Jo»
т. е.
7s/Ts = ^exp(zsFElRT)y.
183
При изучении зависимости натриевых токов в перехватах \злов
(перехватов Ранвье) миелинизированных нервных волокон амфибий
от наружной концентрации ионов натрия был обнаружен феномен
насыщения, который интерпретируют как результат связывания
ионов определенными участками канала во время их перемещения
через канал.
8.5.- Активный транспорт. Одна из наиболее важных и широко
распространенных активных транспортных систем в клетках
животных отвечает за перенос ионов Na+ и К+ через клеточную
мембрану. Эта система известна как Na++ К+-насос и отвечает за
поддержание высокой концентрации К+ и низкой концентрации Na +
внутри клетки по сравнению с окружающей клетку средой.
Активный транспорт Na+ и К+ имеет огромное физиологическое значение.
В состоянии покоя на этот процесс затрачивается более трети
образуемой в клетке АТФ. Активный транспорт Na+ и К+ необходим
для поддержания электрической возбудимости нервных и мышечных
клеток, служит движущей силой для транспорта Сахаров,
аминокислот, а также ионов кальция в процессе натрий-кальциевого
обмена.
В 1957 г. Я. Скоу обнаружил фермент, гидролизирующий АТФ
только при условии добавления Na+ и К+ в среду, содержащую
Mg2+. Этот фермент был назван Na++ К+-АТФазой:
АТФ + Н20 Na+'K+'Mg2+ > АДФ + Ф+Н+.
Я. Скоу предположил, что Na++ К+-АТФаза является
интегральной частью Na ++ К +-насоса и расщепление АТФ обеспечивает
энергией активный транспорт Na+ и К+. Это предположение было
подтверждено следующими экспериментальными данными: 1) Na++
+ К+-АТФаза обнаруживается во всех случаях, когда происходит
активный транспорт Na+ и К+; 2) уровень ферментативной
активности коррелирует с количеством транспортируемых ионов; 3) Na++
+ К+-АТФаза и насос прочно связаны с плазматической
мембраной; 4) Na++ К+-АТФаза и насос одинаково ориентированы в
плазматической мембране; 5) изменения концентрации Na+ и К+
оказывают одинаковое действие на АТФазную активность и скорость
транспорта этих ионов; 6) сердечные гликозиды (кардиотонические
стероиды, в частности, дигитоксин и уабаин) являются
специфическими ингибиторами и Na++ К+-АТФазы, и Na++ К+-насоса;
7) при обращении работы насоса в определенной ионной среде
происходит синтез АТФ из АДФ и Ф.
Исследование активного транспорта в тенях эритроцитов
позволило установить, как ориентированы Na ++ К +-АТФаза и Na++
+ К+-насос. В гипотонической солевой среде эритроцит набухает,
в его мембране появляются дефекты. Из эритроцита выходит
гемоглобин и образуется «тень» эритроцита. Содержимое набухшего
эритроцита можно уравновесить с наружной средой. Если наружный
раствор сделать изотоничным, то барьерные свойства мембраны
восстанавливаются. Таким образом можно изменять молекулярный
184
и ионный состав среды внутри теней
эритроцитов, а затем их «запечатывать» в
соответствующей среде.
Исследования процессов транспорта и
ферментативной активности, проведенные на
тенях эритроцитов, показали, что для
активации АТФазы и переноса Na+ и К + через
мембрану ионы Na +должны быть внутри, а ионы
К+—снаружи. Только находящаяся внутри ^ т \^ J ' ь
клетки АТФ служит эффективным субстратом z К* г
АТФазы и используется для работы насо- рис т Цикличес-
са. Кардиотонические стероиды ингибируют кие* изменения кон-
АТФазу только в том случае, если они нахо- формации Na+ +
Кадятся вне клетки (снаружи). Ванадат-ионы АТФазы во время
ингибируют перенос ионов и АТФазу только активного транспорта
при условии, что они находятся внутри клетки.
Каким образом АТФ обеспечивает активный транспорт Na*
и К+? Ключом к решению этого вопроса оказалось наблюдение,
что в присутствии Na+ и Mg2+ АТФ фосфорилирует Na++K+-
АТФазу. Участком фосфорилирования служит остаток аспартата.
Далее в присутствии К+ происходит гидролиз фосфорилированного
промежуточного продукта (Е— Р). Для реакции
фосфорилирования не требуется К+, а для реакции дефосфорилирования не
требуется ни Na +, ни Mg2 +:
Na+, Mg2+
£ + АТФ < > Е — Р + АДФ,
£_р + Н20— ->£ + Ф.
Na+-зависимое фосфорилирование и К+-зависимое дефосфорилиро-
вание — не единственные реакции, имеющие критическое значение.
В процессе функционирования насос принимает по крайней мере
две разные конформации, обозначаемые как Е1 и £2- Всего жев
транспорте Na+ и К+ и сопряженном с ним гидролизе АТФ
участвует не менее четырех конформационных форм фермента: Еъ
£Y- P, Е2— Ри£2 (рис. 106).
Структура натрий-калиевого насоса еще не настолько изучена,
чтобы можно было детально описать механизм его действия.
Согласно модели О. Ярдецкого, структура белка, функционирующего
в качестве насоса, должна удовлетворять трем условиям: 1) в белке
должна быть полость такой величины, чтобы в ней умещались
небольшая молекула или ион; 2) белок должен существовать в двух
конформациях; в одной из них полость должна быть открыта со
стороны, обращенной внутрь клетки, а в другой — со стороны,
обращенной наружу; 3) указанные конформации должны иметь
разное сродство к транспортируемым компонентам.
Рассмотрим эту модель применительно к транспорту Na+ и К +
(рис. 107). Две конформации белка — это формы Ех и £2, уже
описанные ранее. Постулировано, что: а) связывающая ионы полость
185
ВькЬобож- Изменение Дефосфори- С&языбание
дение конформации /шробание
Рис. 107. Модель функционирования Na+ + К+-АТФазы;
различные этапы транспортирования ионов Na+ + К+
на Ех обращена внутрь клетки, а на £2— наружу; б) Ег обладает
высоким сродством к Na+, а Е2— к К+. Модель исходит также из
двух установленных фактов, а именно: a) Na+ запускает
фосфорилирование, а К+—дефосфорилирование; б) фосфорилирование
стабилизирует форму Е2, а дефосфорилирование — форму Ег. На
рис. 107 Ег и Е2 изображены совершенно разными по конформа-
ции. Нужно, однако, подчеркнуть, что структурные различия
между этими двумя формами вовсе необязательно должны быть
большими. Сдвига нескольких атомов на расстояние 0,2 нм может
оказаться достаточно, чтобы изменить ориентацию полости и
сродство к Na+ или К+. Существует множество случаев, позволяющих
считать, что фосфорилирование способно вызывать изменения
такого масштаба.
При гидролизе одной молекулы АТФ происходит перенос трех
ионов Na* и двух ионов К+. Следовательно, работа насоса
генерирует электрический ток через мембрану. Другими словами, Na++
+ К*-насос электрогенен. Максимальное число оборотов АТФазы
составляет около 100 с"1.
Действие Na++ К+-насоса можно обратить так, чтобы он
приводил к синтезу АТФ. Суммарный синтез АТФ из АДФ и Ф
происходит в условиях резко увеличенных ионных градиентов. Это
достигается инкубацией эритроцитов в среде с очень высокой (по
сравнению с нормой) концентрацией Na+ и очень низкой
концентрацией К+.
Na++ К+-АТФаза представляет собой тетрамер а2р2 с
молекулярной массой 270000. Большая а-субъединица (М=95000) содержит
участок, осуществляющий гидролиз АТФ, и участок связывания
кардиотонических стероидных ингибиторов. Меньшая Р-субъеди-
ница (М=40000) содержит углеводные группы. Между двумя а-субъ-
единицами или между ос- и р-субъединицами (но не между двумя
Р-субъединицами) легко образуются поперечные мостики. В связи
с этим можно предположить, что а-субъединицы контактируют
друг с другом, тогда как р-субъединицы пространственно разделены.
186
Как уже упоминалось, гидролиз
АТФ протекает на той стороне
мембраны, которая обращена к ци-
тозолю, а участок связывания
стероидных ингибиторов
находится на наружной стороне
мембраны. Каждая а-субъединица
пронизывает мембрану насквозь (рис.
108). Углеводные цепи р-субъеди-
ницы расположены на наружной
стороне плазматической мембраны,
как это свойственно мембранным
гликопротеинам.
Транспорт кальция
осуществляется другой АТФазой. Этот
белок был впервые обнаружен в
эритроцитах X. Шацманом.
Затем было показано, что подобные белки-переносчики присутствуют
практически во всех типах тканей млекопитающих. В скелетной
мышце содержится сложная сеть связанных с мембраной трубочек
и везикул. Эта мембранная система, называемая саркоплазматиче-
ским ретикулумом, регулирует концентрацию Са2+ в среде,
окружающей сократительные мышечные волокна. В состоянии покоя
Са2+ закачивается в саркоплазматический ретикулум, так что
непосредственно вокруг миофибрил концентрация Са2+ бывает очень
низкой. Возбуждение мембраны саркоплазматического ретикулума
под влиянием потенциала действия мышечного волокна ведет
к мгновенному высвобождению больших количеств Са2+, и это
запускает мышечное сокращение. Другими словами, Са2+ служит
промежуточным звеном между потенциалом действия и сокращением
мышечного волокна.
Транспорт Са2+ в цистерны саркоплазматического ретикулума
происходит за счет энергии АТФ. В саркоплазматическом ретику-
луме имеется АТФаза, которую активирует Са2+. Са2+-АТФаза
также подвергается фосфорилированию в ходе гидролиза АТФ:
Са+, Mg2f
Е + АТФ с > £-Р + АДФ;
£-Р + Н20 —- Е + Ф.
Цикл конформационных изменений, обусловленных фосфорилирова-
нием и дефосфорилированием, обеспечивает перенос двух ионов
Са2+ при расщеплении одной молекулы АТФ. Благодаря очень
высокому сродству этой АТФазы к Са2+ (К ^ Ю"7 М), фермент
эффективно транспортирует Са2+ из цитозоля (где [Са2+] <
< 10~5 моль/л) в саркоплазматический ретикулум (где [Са2+] ~
~ 10~2 моль/л).
Плотность молекул Са2+-насоса в мембране
саркоплазматического ретикулума очень велика (около 20000 в расчете на 1 мкм2).
Участии сбязыбания Остатки
стероидного ингибитора f сахара
Участки
сбязыбания
АТФ
•
Поберхность
мембраны,
обращенная
к цитозолю
Рис. 108. Схематическое изображение
субъединичной структуры Na+ + К+-
насоса (а и Р — субъединицы) (Страйер,
1981)
187
Транспортируемая Котранспортируемый
молекула ион
НШ111}в-
Котранспорт
Рис. 109. Схема работы транспортных белков,
функционирующих по принципу унипорта, симпорта и антипорта
(Албертс и соавт., 1983)
В сущности Са2+-АТФаза составляет более 80 % общего количества
интегральных белков мембраны и занимает треть ее поверхности.
Из очищенной Са2+-АТФазы и фосфолипидов удалось
реконструировать функционально активный Са2+-насос. В этом эксперименте
Са2+-АТФазу выделяли из мембран саркоплазматического ретику-
лума после их солюбилизации детергентом холатом. Очищенный
солюбилизированный фермент добавляли к фосфолипидам из соеЕых
бобов. После удаления детергента путем диализа образовывались
мембранные везикулы. Эти реконструированные везикулы свысокой
скоростью накапливали Са2+ в присутствии АТФ и Mg2+.
Обеспечиваемый активным транспортом электрохимический
градиент ионов натрия обеспечивает энергией транспорт аминокислот
и Сахаров в животных клетках. Многие активные транспортные
процессы не зависят непосредственно от гидролиза АТФ, а
сопряжены с потоком ионов по электрохимическому градиенту. Такой
вид транспорта назван вторичным активным транспортом. Во
многих животных клетках захват глюкозы обеспечивается
одновременным входом натрия. Ионы натрия и глюкоза связываются со
специфическим транспортным белком и проникают в клетку
одновременно.
Согласованный перенос через мембрану двух компонентов
называют котранспоотом. Он подразделяется на два вида: симпорт и
антипорт. При симпорте имеет место перенос обоих компонентов
в одном направлении, а при антипорте — в противоположных
направлениях. Ионы натрия, которые входят в клетку с
транспортируемым веществом, выводятся из клетки Na++ К+-АТФазой. На
рис. 109 сопоставлены различные типы транспортных систем:
независимый транспорт-унипорт и два типа согласованного
транспорта (котранспорта) — симпорт и антипорт.
Зависящий от Na+ симцорт широко используется в животных
клетках для накопления аминокислот. В некоторых клетках,
например в микроворсинках щеточной каемки кишок, посредством
симпорта осуществляется транспорт Сахаров. При его энергетиче-
188
ской оценке рассмотрим условие равновесного состояния для
транспортной системы: A\xs = Л|я№+,
RT In ([S]tllS]0) - RT In ([Na]0/[Na|,) - EF (8.41)
или
[S],/[S]0 = ([Na]0'[Na]4)exp(-£F//?r)f (8.42)
где [S]0 и [S]t — соответственно наружная и внутриклеточная
концентрация сахара; [Na]0 и [Na], — наружная и внутриклеточная
концентрация натрия, соответственно.
Соотношение [Na]0/[Na]t для многих клеток составляет
приблизительно 10. Если мембранный потенциал равен —75 мВ, то
ехр (-EF/RT) ж 20. Следовательно, [S],/[S]0= 200. В
рассмотренном примере электрохимический градиент ионов натрия
теоретически способен создать внутри клетки концентрацию сахара,
которая в 200 раз превышает его концентрацию в наружной среде.
Кальциевая АТФаза плазматической мембраны реагирует на
малые повышения концентрации внутриклеточного кальция. Более
резкие колебания концентрации активируют в плазматической
мембране другую систему удаления Са.
Во многих клетках ионы натрия служат движущей силой в
процессе антипорта, направленного на перемещение ионов кальция
через плазматическую мембрану. Этот транспорт был назван
натрий-кальциевым обменом. Впервые он был описан X. Ройтером
и Н. Зейтцем применительно к сердечной мышце, а затем и на
других объектах, в частности на гигантском аксоне кальмара М. Блау-
шгейном и А. Ходжкиным. При рассмотрении энергетики Na/Ca
обмена используют следующее равенство:
- RT In ([Са]0/[Са]<) + 2EF = г [-RT In ([Na]e/[Na],) + EF]. (8 43)
В случае электронейтрального обмена два иона натрия
обмениваются на один ион кальция. В этом случае г = 2.
[Са]0/[Са], = ([Na]0/[NaU2. (8.44)
Соотношение [Ca]0/[Ca]t будет составлять 100. Согласно
результатам многочисленных исследований, это соотношение для многих
клеток в состоянии покоя составляет приблизительно 10000. В этой
связи г должно быть больше двух. Если г = 3, а Е = —75 мВ,
[Са]0/[Са], = ([Na]0/[Na]t)3exp(-£F/RT) = 2 . 10*. (8.45)
Следовательно, когда один ион кальция обменивается на три иона
натрия, может быть достигнута внутриклеточная концентрация
ионизированного кальция в 2 • Ю4 ниже внеклеточной.
В плазматической мембране многих клеток животных
содержится транспортная система, осуществляющая трансмембранный обмен
Na+ на Н+. Эта система обнаружена в яйцеклетках, сперматозо-
онах, эритроцитах,f лимфоцитах, эндотелиальных клетках
капилляров, скелетных мышечных волокнах, миокардиоцитах, нейронах,
клетках астроглии, фибробластах и многих других клетках. В фи-
189
Рис. ПО. Транспортные системы у
бактерий (Конингс и соавт., 1981).
В левой части представлены системы, созда
ющие протондвижущую силу на мембране
бактериальной клетки / — система дыка
тельных белков, сходная с подобной
системой митохондрий, 2 — бактериородопсин.
имеющийся в мембране галобактерий, 3 —
АТФазный компонент протонного насоса.
Справа представлены системы 4 — симпор-
та, 5 — унипорта, 6 — антипорта и 7 — па--
сивного транспорта
зиологических условиях
система Na+/Н+-обмена осуществляет
выведение из клетки Н+
против электрохимического
градиента, сочетающееся с притоком
ионов натрия в клетку.
Электрохимический протонный градиент играет важную роль
в транспорте веществ через мембрану бактериальных клеток. Все
бактерии поддерживают на мембране протонодвижущую силу
Ди<н+:
Арн* = FE +2,3 RTApH.
(8.46)
Различают следующие системы, создающие протонодвижущую
силу на мембране бактерий: связанный с цитохромами перенос
электронов, гидролиз АТФ, бактериородопсин, перекачивающий
при освещении протоны из клетки в наружную среду. На рис. 110
схематически показаны транспортные системы бактериальных
клеток. Сюда включены системы первичного активного транспорта
протонов, а также симпорт, антипорт, унипорт и пассивный
транспорт.
Наиболее изученная бактериальная система симпорта —
перенос лактозы у Eshenchia coli. У этой обитательницы нижних
отделов кишок млекопитающих выработался высокоэффективный
механизм концентрирования лактозы. Насос для этого дисахарида
представляет собой одиночную полипептидную цепь с
молекулярной массой 30000 и называется пермеазой для лактозы. Транспорт
молекул лактозы сопряжен с движением протонов в клетку. Другие
метаболиты также поступают в бактериальные клетки вместе с
одним или несколькими протонами при участии специальных белков-
переносчиков. Таким способом в клетку транспортируются многие
сахара и большинство аминокислот. Ионы натрия выносятся из
бактериальной клетки по механизму Na+—Н+-антипорта,
заменяющего здесь Na++ К+-АТФазу эукариотических клеток.
Симпорт — не единственный тип насосов, осуществляющих
транспорт Сахаров. У некоторых бактерий накопление углеводов
происходит путем сопряжения их входа в клетку с фосфорилирова-
нием. Например, у многих бактерий поступающая в клетки
глюкоза превращается в глюкозо-6-фосфат.
8.6. Эндо- и экзоцитоз. В клетках животных большая часть
необходимых для жизнедеятельности небольших молекул появляет-
190
ся либо благодаря синтезу, либо транспортируется из внеклеточной
среды. Транспорт осуществляется с помощью белков-перекосчиков
или через сформированные белками поры. Однако крупные
молекулы и частицы вещества могут проникать в клетки и посредством
совершенно иного процесса, известного под названием эндоцитоз.
В этом случае участок плазматической мембраны обволакивает
захватываемый клеткой материал, который в результате эндоци-
тоза попадает внутрь клетки. Он заключен в окруженный
мембраной пузырек. Существуют три варианта эндоцитоза.
Один из них — фагоцитоз. В этом случае с клеточной
поверхностью связываются частицы или большие молекулярные
комплексы. Они окружаются мембраной, впячиваются в клетку и,
наконец, оказываются внутри клетки, заключенные в пузырек. Путем
фагоцитоза клетки простейших захватывают бактерии и другие
пищевые частицы. У высших животных макрофаги поглощают
таким способом попавших в организм бактерий.
Неспецифический захват клетками внеклеточной жидкости
происходит благодаря эндоцитозу другого типа, называемому пиноци-
тозом. Заключается он в том, что мелкая капля жидкости
окружается участком впячивающейся мембраны и переходит таким
образом внутрь клетки в пузырьке. При этом внутри клетки
оказываются ионы и мелкие молекулы, которые были растворены в капле.
Третий вид эндоцитоза высоко специфичен. Он опосредуется
рецепторами — мембранными белками. В рецепторе есть участок
связывания, специально «подогнанный» для того или иного лиган-
да — белка или небольшой частицы. Путем опосредуемого
рецепторами эндоцитоза в клетку попадают самые разнообразные лиганды.
Впервые такой способ проникновения белка в клетки описали
в 1964 г. К- Портер и Т. Рот.
В клетки животных благодаря эндоцитозу проникают холесте-
рол, необходимый для синтеза мембран, и ионы железа, которые
используются для синтеза цитохромов. Оба эти вещества
переносятся кровью в виде крупных комплексов. Холестерол в форме
эфиров образует сердцевину частиц диаметром около 20 нм,
носящих название липопротеинов низкой плотности (ЛНП). Ионы
железа находятся в крови в связанном виде. Они заключены внутри
молекул транспортного белка — трансферрина. Путем эндоцитоза
внутрь клеток проникают белковые факторы роста, стимулирующие
пролиферацию клеток. На наружной поверхности клеток
животных располагаются специфические белковые рецепторы, которые
связывают ЛНП, трансферрин и другие крупные молекулы,
которые поступают в клетку. Такие комплексы перемещаются в
мембране благодаря латеральной диффузии.
Когда рецепторы погадают в окаймленные ямки, другие белки
плазматической мембраны оттуда вытесняются. Затем ямка
впячивается внутрь клетки, и этот участок отпочковывается в
цитоплазму, образуя окаймленный пузырек. Затем окаймленный пузырек
сбрасывает свою плотную оболочку. Утратившие оболочку
пузырьки сливаются, образуя более крупные пузырьки — эндосомы. Здесь
191
комплекс ЛНП—.рецептор диссоциирует, а ионы железа
отщепляются от трансферрина. Рецепторы для ЛНП и трансферрина
(последние при этом остаются связанными со своим лигандом трансфер-
рином) возвращаются на клеточную поверхность. Содержимое эндо-
сом переносится в лизосомы. Здесь холестерол освобождается из
ЛНП. Для того чтобы холестерол и ионы железа достигли
соответствующих участков в клетке, они должны пройти через мембрану
лизосомы. Рис. 111 иллюстрирует цикл эндоцитоза.
Одной из важнейших функций опосредуемого рецепторами
эндоцитоза является перенос внутрь клеток гормонов и других
белков, передающих те или иные сигналы определенным клеткам.
Оболочка окаймленных пузырьков представляет собой
решетчатую структуру, состоящую из субъединиц клатрина с молекулярной
массой 130000. Этот белок играет ключевую роль в переносе
фрагментов мембраны в пределах клетки. Окаймленные пузырьки
отпочковываются от эндоплазматического ретикулума и затем сливактся
с аппаратом Гольджи. Кроме того, они переносят мембранные
белки от аппарата Гольджи в лизосомы, к плазматической мембране
и в другие участки клетки.
Конечной стадией процесса секреции является экзоцитоз.
Путем экзоцитоза секретирующие клетки выделяют самые
разнообразные продукты. В частности, нервные терминали выделяют
медиаторные вещества, клетки пищеварительных желез — пищева-
Рис 111. Эндоцитоз,
опосредованный рецепторами мембраны (Албертс и
сонрт., 1983):
/ — белок рецептор, 2 — транспортируемые
частицы; 3— окаймленная ямка; 4— клат-
рин, 5 — окаймленный пузырек; 6 — эндосо-
ма 7 — отделение реиепторов от
транспортируемых частиц; 8 — пузырек с
рецепторами, возвращающимися в плазматическую
мембрану; 9 — лизосома; 10 ■—
гидролитические ферменты; // — лизосома, слившаяся с
пузчрьком, 12 — продукты расшепления
транспортируемых частиц
Рис 112. Секреторная клетка:
1 — ядро; 2 — внутренний сетчатый аппарат
(аппарат Гольджи); 3 — зимогенная
гранула. 4 — секрет, выделившийся в результате
экзоцитоза
рительиые ферменты, эндокринные клетки — соответствующие
гормоны. На рис. 112 показана схема процесса секреции в ацинарной
клетке поджелудочной железы. Такая клетка синтезирует
предшественников пищеварительных ферментов, содержащихся в соке
поджелудочной железы. Секретируемые продукты синтезируются
в шероховатом эндоплазматическом ретикулуме, затем они
переносятся в аппарат Гольджи, где упаковываются в окруженные
мембраной пузырьки, называемые зимогенными гранулами. Содержимое
гранулы выделяется в просветжелезы в результате слияния
мембраны гранулы с клеточной мембраной.
8.7. Моделирование ионной проницаемости клеточных мембран.
В качестве моделей для изучения механизмов проницаемости
клеточных мембран широко используют искусственные двуслойные
липидные мембраны. Исследования проводят на двух системах:
липидных пузырьках (липосомах) и плоских двуслойных
мембранах.
Липидные пузырьки представляют собой водную фазу,
окруженную липидным бислоем. Для получения липосом приготовляют
суспензию какого-либо подходящего липида, например, фосфат и-
дилхолина в водной среде. Далее смесь обрабатывают
ультразвуком. Липидные пузырьки можно также получить, быстро смешивая
с водой раствор липидов в этаноле. Этого можно достичь путем
введения раствора липидов через тонкую иглу, что приводит к обрасо-
ванию пузырьков почти правильной сферической формы с
диаметром около 50 нм. Для получения пузырьков большего размера
(порядка 1 мкм в Диаметре) из суспензии фосфолипидов в смешаньсй
системе растворителей медленно выпаривают органический
растворитель.
Если получать липосомы в присутствии каких-то растисренных
в воде иоков или молекул, то эти вещества окажутся в еодной фазе
липосом. Так, если липосомы диаметром 50 нм образуются в 0,1 М
растворе глицина, то внутри каждсй из них окажется примерно
2000 молекул глицина. Такие содержащие глицин липосомы можно
отделить от окружающего раствора глицина. Если требуется
определить проницаемость мембранного бислоя в отношении глицина,
то для этого нужно измерить скорость выхода глицина из
внутреннего компартмента липосом во внешнюю среду.
Липосомы представляют интерес не только в плане изучения
проницаемости. Оказалось, что они способны к слиянию с
плазматической мембраной различных клеток, а это открывает
возможность для введения в клетки самых разнообразных веществ, не
способных проникать через мембрану. Избирательное слияние
липосом с клетками определенных типов может быть успешно
использовано для контролируемой доставки лекарственного вещества к
клетке-мишени.
Плоские двуслойные мембраны (черные мембраны) получают
на отверстии диаметром около 1 мм обычно в тефлоновой
перегородке между двумя водными растворами. Такая мембрана очень
удобна для изучения электрических явлений в силу большого
7 8-616
193
Рис. По. Экспериментальная
установка для изучения электропроводности
плоских двуслойных мембран:
У —двуслойная мембрана; 2 — электроды»
3—устройство для электрических
измерений; 4 — источник прямоугольных
импульсов тока
Транспортируемый
WH
Подвижный
Кана/кюдраэуюйцЮ переносчик
онм/биояж ионод
Рис. 114. Схематическое изображение
различий между транспортными
антибиотиками-подвижными переносчиками
и каналообразователями (Албертс и
соавт., 1983)
размера и простой формы. Способ получения больших двуслойных
мембран разработали П. Мюллер и Д. Рудин. В раствор липида,
из которого хотят получить мембрану, например в раствор фосфа-
тидилхолина в декане, опускают тоненькую кисточку. Затем
концом кисточки делают взмах через отверстие в перегородке между
двумя водными растворами.В результате отверстие
перегораживается спонтанно образовавшейся тонкой липидной пленкой; избыток
липидов скапливается по краям отверстия. Формирование плоской
двуслойной мембраны из фосфатидилхолина занимает несколько
минут. Нетрудно определить электропроводность такого
макроскопического бислоя, поместив электроды в водную фазу по обе
стороны мембраны (рис. 113). Можно определить, например, и ионную
проницаемость мембраны, измеряя величину проходящего через
нее тока в зависимости от приложенного напряжения.
Исследование проницаемости мембранных пузырьков и
электропроводности плоских бислоев показало, что липидная
двуслойная мембрана обладает очень малой проницаемостью для ионов
и большинства полярных молекул. Исключение из правила
составляет вода, проникающая через такие мембраны. Экспериментально
полученные коэффициенты проницаемости варьируют в широких
пределах. Так, Na+ и К+ проходят через мембраны в Ю9 раз
медленнее, чем вода. Триптофан, который при рН = 7 является
биполярным ионом, проходит через мембраны в Ю3 раз медленнее, чем
индол, который сходен с триптофаном по структуре, но не несет
ионизированных групп.
Коэффициенты проницаемости для низкомолекулярных
соединений коррелируют с отношением их растворимости в неполярных
растворителях к растворимости в воде. Эта зависимость дает
основание думать, что низкомолекулярные соединения проходят сквозь
двуслойную мембрану следующим образом: сначала они теряют
194
окружающую их гидратную оболочку, затем растворяются в
углеводородном внутреннем слое мембраны, наконец диффундируют
через этот внутренний слой к другой стороне мембраны, где вновь
растворяются в воде.
В 60-х годах были обнаружены антибиотики, создающие ионную
проницаемость двуслойных липидных мембран. Они были названы
транспортными антибиотиками. В настоящее время известен ряд
как природных, так и синтетических соединений различных
классов, повышающих ионную проницаемость двуслойных мембран.
Существуют два совершенно различных механизма действия
транспортных антибиотиков на проницаемость мембран для ионов
(рис. 114). Антибиотики одной группы выполняют функцию
переносчиков ионов через углеводородную область мембраны.
Активность этих транспортных антибиотиков сопряжена с их собственной
диффузией. К этой группе принадлежат валиномицин, нигерицин,
нонактин, кальциевые ионофоры — А 23187 и иономицин, а также
ряд других антибиотиков. Ко второй группе транспортных
антибиотиков относятся каналообразователи. Они формируют канал,
пронизывающий мембрану. Ион входит через такой канал на одной
стороне мембраны, диффундирует по нему и выходит на другой
стороне. Стимуляция транспорта ионов по этому механизму не
сопряжена с движением самого антибиотика-каналообразователя.
К этой групле относятся грамицидин А, полиеновые антибиотики,
в частности нистатин и амфотерицин Б, аламецитин, моназомицин
и многие другие.
В эксперименте подвижные переносчики и каналообразователи
можно различить следующим образом. Измеряют температурную
зависимость ионной проводимости искусственной липидной
двуслойной мембраны, содержащей транспортный антибиотик. При
этом берут температурный интервал, включающий температуру
фазового перехода липида; в этом интервале углеводородная
середина мембраны переходит от практически затвердевшего состояния
до совершенно жидкого. Каналосбразователь, опосредуя транспорт
ионов через мембрану, сам не диффундирует. Следовательно,
застывание углеводородного слоя не окажет существенного влияния на
его способность транспортировать ионы. Иная ситуация
складывается с подвижным переносчиком ионов, который для проявления
активности должен диффундировать сквозь углеводородный слой
мембраны: его эффективность при затвердении углеводородного
слоя должна значительно уменьшиться. Данные экспериментов
с валиномицином и грамицидином* А действительно выявляют
различие между двумя рассматриваемыми механизмами. Проницаемость
содержащей валиномицин двуслойной мембраны возрастает при
ее разжижении более чем в 1000 раз. В то же время на
транспортную активность грамицидина А переход мембраны в жидкое
состояние почти не оказывает влияния.
Проводимость плоской двуслойной мембраны, содержащей
небольшое количество грамицидина А, не является постоянной. Как
показал Д. Хейдон, проводимость этой мембраны для Na+ измеияет-
7*
195
Один
открытый
канал
ш
Гидрофобная
боковая цепь
"7Г4
Рис 115. Ступенчатые изменения
проводимости липидной двуслойной
мембраны, содержащей молекулы
грамицидина А. Минимальное увеличение
проводимости обусловлено появлением
одного открытого канала (Страйер, 1981)
OD- гидроксииэобалерионобая
кислота
кислота
L- молочная кислота
Рис. 116. Молекула валиномицина,
связавшая в центре кольцевой структуры
ион К+ при помощи шести атомов
кислорода (Албертс и соавт., 1983)
©
балин
L-Валин
ся во времени ступенчато (рис. 115).Эти ступени (скачки)
определяются спонтанным образованием и диссоциацией образованных
грамицидином А каналов. В зависимости от состава растворов,
разделенных двуслойной мембраной, и липидов, используемых для
формирования двуслоя, время жизни грамицидинового канала
варьирует от 30 мс до 60 с. По такому каналу легко проходят
одновалентные катионы.
В течение секунды по одному каналу может пройти более 107
ионов. Такая скорость транспорта только на один порядок величины
ниже скорости диффузии в чистой воде. В отличие от этого
максимальная скорость транспорта, осуществляемого подвижным
переносчиком, составляет менее Ю3 ионов в 1 с, так как повороты и
перемещение подвижного переносчика в мембране занимают не менее
1 мс. Наличие ступенчатых флуктуации тока, которые
рассматривают как результат возникновения и исчезновения одиночных
каналов, является важным критерием формирования антибиотиком
ионных каналов в двуслойной мембране.
Подвижные антибиотики характеризуются определенной
общностью структуры. Они связывают ионы металлов путем ион-ди-
~польного взаимодействия с полярными группами, входящими в
состав их молекулы.Единственный связываемый ион металла образует
координационные связи с несколькими атомами кислорода,
окружающими центральную полость. Число таких атомов кислорода
(связывающих ион металла) обычно равно 6 или 8.
Периферическая часть структуры подвижного переносчика состоит из
углеводородных групп.
Функция центрально расположенных атомов кислорода,
окруженных углеводородным наружным слоем, вполне очевидна.^ В са-
196
мом деле, в водной среде ион металла, например К+, связывает
через кислород несколько молекул воды. Антибиотик-переносчик
конкурирует с молекулой воды за связывание иона, образуя с ним
хелатное соединение через несколько соответствующим образом
расположенных атомов кислорода в центральной полости.
Благодаря углеводородной периферической части переносчика, его комплекс
с ионом растворим в липидах мембран. По существу
каталитическое действие рассматриваемых антибиотиков на транспорт ионов
через мембраны и состоит в том, что они переводят ионы в
растворимую в липидах форму.
На рис. 116 показаны структуры валиномицина и его комплекса
с К+. Валиномицин имеет циклическую структуру, образованную
из повторяющихся три раза последовательностей четырех разных
остатков: L-лактата, L-валина, D-гидроксиизовалерианата и D-ва-
лина. Эти остатки соединены чередующимися эфирными и
пептидными связями. Ион калия координирован с шестью атомами
кислорода. Они принадлежат карбонильным группам шести остатков вали-
на в антибиотике. Метильные и изопропильные боковые цепи
формируют углеводородную наружную часть молекулы валиномицина.
В комплексе другого транспортного антибиотика-переносчика
нонактана К+ связан с восемью атомами кислорода в центре
молекулы. Четыре атома кислорода из восьми принадлежат
карбоксильным группам, а остальные четыре — эфирным связям.
Валиномицин связывает К+ в 1000 раз предпочтительнее, чем
Na+. Причина этой избирательности в том, что К+ слабее, чем
Na+, притягивает молекулы воды. Свободная энергия образования
гидрат ной оболочки у Na+ на 67 кДж/моль ниже, чем у К+ (см.
табл. 10). Валиномицин связывает предпочтительно К+ потому, что
отделение молекул воды от К+ требует меньшей затраты энергии,
чем их отделение от Na+.
Примечательна гибкость молекулы валиномицина. Хелатирова-
ние К+ представляет собой ступенчатый процесс, в ходе которого
молекулы воды гидратной оболочки иона последовательно
вытесняются кислородными атомами антибиотика. Активационный барьер
для связывания иона оказывается низким. Аналогичным образом
и энергия активации противоположного процесса —
высвобождения иона — также низка. В итоге валиномицин присоединяет и
высвобождает К+ множество раз на протяжении секунды. Важная роль
гибкости структуры в этом случае так же очевидна, как и при
действии ферментов.
Валиномицин является ценным инструментом для
экспериментальных исследований. Например, валиномицин препятствует
окислительному фосфорилированию в митохондриях путем повышения
проницаемости их внутренней мембраны для ионов калия. В
присутствии валиномицина митохондрии используют энергию,
генерируемую при транспорте электронов, не на синтез АТФ, а на
накопление К+.
При изучении клеточных ответов на повышение внутриклетон-
ной концентрации ионизированного кальция широко используют
197
1*1?
кальциевые ионофоры А23187 и иономицин.
Две молекулы А23187 формируют липофиль-
ный комплекс с одним ионом кальция.
Этот комплекс может мигрировать через
мембрану и переносить кальций внутрь
клетки. Избирательность А 23187 для ионов
щелочноземельных металлов выражается
следующей последовательностью: Са2 + >
>Mg2+= Sr2 + > Ba2+. Второй кальциевый
ионофор иономицин характеризуется более
Са
2 +
чем
Рис. 117. Схематическое
изображение канала,
образованного грамицидином
А (модель Урри)
высокой избирательностью для
А 23187.
Наиболее изученный транспортный анти-
II U j^0^ II 11 биотик-каналообразователь—грамицидин А.
ф W(cj ф (р Это гюлипептид с открытой цепью,
состоящий из 15 аминокислотных остатков.
Примечательна структура грамицидина А: в
нем чередуются D- и L-аминокислоты.
Кроме того, N- и С-концы полипептида
модифицированы. Грамицидин А очень
плохо растворяется в воде. Трансмембранный канал образуется из двух
молекул грамицидина А (рис. 117). Он имеет спиральную структуру.
Ступенчатое изменение проводимости, показанное на рис. 115,
соответствует процессу образования и диссоциации днмеров. Димер
формирует канал диаметром 0,4 нм, окруженный полярными
группами пептидов. Гидрофобные боковые цепи располагаются на
периферии канала и контактируют с углеводородными цепями фосфо-
липидов мембраны. Окружающие водную пору карбонильные
группы образуют кратковременные координационные связи с
катионом в момент его прохождения по каналу. Как показал рентгено-
структурный анализ, связавший катионы канал становится короче
и шире; это подчеркивает динамическую природу молекул,
обладающих транспортной функцией.
Грамицидиновые каналы катионселективны. При оценке их
избирательности по проводимости (см. гл. 9)была обнаружена
следующая последовательность: H+>Cs+~ Rb+> NHJ >ТГ >Na+ > Li+.
Такой порядок близок к последовательности для подвижности этих
катионов в водном растворе. Температурный коэффициент для
проводимости одиночного грамицидинового канала Qu= 1,35.
Аналогичная величина Q10 характерна для диффузии в водном растворе.
Через одиночный грамицидиновый канал может диффундировать
около 108 молекул воды в секунду. Проницаемость грамицидиновых
каналов для воды снижается, когда увеличивается вероятность
попадания в канал катионов. Для проводимости одиночных грамици-
диновых каналов характерен феномен насыщения при увеличении
концентрации проникающих катионе®.
С целью изучения молекулярной структуры транспортных
белков клеточных мембран и выяснения механизмов их
функционирования с конца 70-х годов начаты исследования по выделению инте-
198
тральных белков клеточных мембран, выполняющих функцию
каналов, их очистке и встраиванию в липидные двуслойные мембраны
с последующей регистрацией работы встроенных каналов. Здесь
также используют два типа мембранных систем: плоские
двуслойные мембраны и липосомы.
В настоящее время выделены и встроены в искусственные
двуслойные мембраны шесть классов каналов: каналы никотинового
ацетилхолинового рецептора; потенциалозависимые натриевые
каналы, выделенные из электрического органа угря Electrophorus
electricus, скелетных мышц и мозга млекопитающих; калиевые
каналы саркоплазматического ретикулума; Са2+-активируемые
калиевые каналы мышц; потенциалозависимые хлорные каналы из
электрического органа ската Torpedo; различные виды поринов —
транспортных белков, формирующих каналы, в наружной мембраье
бактерий и митохондрий.
Г л а в а 9. ЭЛЕКТРИЧЕСКАЯ ВОЗБУДИМОСТЬ КЛЕТОК
В плазматической мембране многих видов клеток имеются
ионные каналы, которые управляются мембранным потенциалом. Эти
каналы были названы потенциалозависимыми. Они обнаружены,
властности, в плазматической мембране нервных и различных видов
мышечных клеток. В ответ на деполяризацию мембраны
(положительное смещение мембранного потенциала) здесь происходит
активация (переход из непроводящего в проводящее состояние) потен-
циалозависимых ионных каналов. Открывание каналов приводит
к возникновению ионных токов и деполяризации ранее неЕозбу-
жденных ее участков. Таким образом, создается
самоподдерживающийся распространяющийся сигнал — потенциал действия.
Ионные механизмы возникновения потенциала действия в нервных
волокнах были выяснены благодаря исследованиям американских
и английских ученых К. Коула, X. Кертиса, А. Ходжкина, Б. Кат-
ца и А. Хаксли, проведенным на гигантских нервных волокнах
(аксонах) кальмара. Диаметр этих волокон нередко достигает 500—
800 мкм. Столь большие размеры позволили веодить в них
внутриклеточные электроды и измерять потенциал покоя, потенциал
действия, а также ионные токи, протекающие через плазматическую
мембрану при изменениях мембранного потенциала в условиях
фиксации потенциалов. Большие размеры гигантских аксонсв
позволяют точно анализировать химический состав цитоплазмы.
9.!. Потенциал действия возникает при смещении мембранного
потенциала до критической величины, называемой порогом.
Потенциал покоя гигантского нервного волокна кальмара
приблизительно равен — 60 мВ. Смещение мембранною потенциала до —45 мВ
приводит к возникновению потенциала действия. К. Коул и X. Кср-
тис (1939) обнаружили, что во время возникновения потенциала
действия в аксоне кальмара сопротивление мембраны уменьшается
в 25 раз, с 1000 до 40 Ом • см2, тогда как злектричеоая емкость
мембраны при этом практически не изменяется.
199
у^^ Увеличение
/ проницаемости
/ для натрия
Деполяризация \
мембраны I
\ мод натрия
Рис. 118. Схема взаимного усиления
деполяризации мембраны и повышения
ее проницаемости для ионов натрия
Рис. 119. Теоретически рассчитанные
кривые распространяющегося
потенциала действия (а) и изменения
проводимости мембраны для ионов натрия и
калия (б)
Затем А. Ходжкин и Б. Катц установили, что увеличение
проводимости мембраны во время потенциала действия обусловлено
повышением ее проницаемости для ионов натрия. Если в состоянии
покоя мембрана преимущественно проницаема для ионов калия и
потенциал покоя (—60 мВ) близок к равновесному потенциалу для
ионов калия (—75 мВ), то во время возбуждения повышается
проницаемость мембраны для ионов натрия и возникает натриевый ток,
направленный в клетку. Происходящее при этом изменение
мембранного потенциала носит регенеративный характер.
Деполяризация увеличивает проницаемость мембраны для ионов натрия,
что вызывает дальнейшую деполяризацию, которая, в свою очередь,
еще больше повышает проницаемость мембраны для ионов натрия
(рис. 118). Во время потенциала действия происходит изменение
знака мембранного потенциала.
По мере приближения мембранного потенциала к уровню
равновесного потенциала для ионов натрия (Е^а = +55 мВ) происходит
уменьшение входящего натриевого тока. Кроме того,
положительное смещение мембранного потенциала не только открывает
(активирует) натриевые каналы, но вызывает более медленный процесс,
называемый инактивацией и проявляющийся в уменьшении
количества функционирующих каналов. Во время потенциала действия
происходит также относительно медленное повышение калиевой
проводимости мембраны. Инактивация натриевой проводимости
мембраны и повышение калиевой проводимости ограничивают
продолжительность потенциала действия и приводят к реполяри-
зации мембраны.
Потенциалы действия в аксоне кальмара сопровождаются
следовой гиперполяризацией. Она обусловлена тем, что после
потенциала действия проводимость мембраны для ионов калия более
высокая, чем в состоянии покоя, в связи с чем мембранный потенциал
2 J
Время, мс
200
приближается к калиевому равновесному потенциалу. На рис. 119
показано развитие потенциала действия и следовой
гиперполяризации в гигантском аксоне кальмара, а также характер изменения
натриевой и калиевой проводимости мембраны во время потенциала
действия.
Важным следствием инактивации натриевых каналов является
рефрактерность. Наблюдается абсолютный рефрактерный период,
когда нервное волокно невозбудимо. За ним следует относительный
рефрактерный период, во время которого порог возникновения
потенциала действия значительно повышен.
Во время потенциала действия в нервное волокно проникает
определенное количество ионов натрия и из волокна выходит
эквивалентное количестю ионов калия. Гигантский аксон кальмара
с диаметром 500 мкм во время потенциала действия теряет около
одной миллионной части внутриклеточного калия. При полном
выключении механизма активного транспорта ионов натрия и калия
такое нервное волокно может генерировать около 5 • 105 нервных
импульсов. В волокне с диаметром 5 мкм один импульс вызывает
потерю одной тысячной доли внутриклеточного калия.
Минимальное количество ионов натрия, необходимое для
изменения мембранного потенциала до уровня максимума потенциала
действия, можно рассчитать, зная электрическую емкость мембраны
и амплитуду потенциала действия. Электрическая емкость мембраны
составляет 1 мкФ/см2, а амплитуда потенциала действия — около
100 мВ. Электрический заряд, необходимый для такого изменения
разности потенциалов на мембране, будет равен CU = 10 ~7 Кл • см~а
(где С — электрическая емкость мембраны, рассчитанная на 1 см2
площади; U — амплитуда потенциала действия). Разделив заряд на
число Фарадея, получают количество одновалентных ионов,
несущих такой заряд: CUIF = 10 "~12 моль • см"2.
Эксперименты показали, что во время потенциала действия
в нервное волокно фактически проникает в 3—4 раза больше ионов
натрия, чем следует из такого расчета. Это обусловлено тем, чтоео
время потенциала действия перекрываются периоды высокой
проводимости мембраны для ионов натрия и калия, несущих
противоположно направленные ионные токи через мембрану.
9.2. Распространение потенциала действия. Кабельная теория.
Нервные и мышечные волокна представляют собой цилиндрические
проводники. Их внутреннее содержимое, обладающее относительно
низким удельным сопротивлением (по данным разных авторов, оно
может быть в пределах от 30 до 200 Ом • см), изолировано от
наружной хорошо проводящей среды мембраной, являющейся
изолятором. Согласно ориентировочным расчетам А. Ходжкина, удельное
сопротивление комплекса структур, образующих мембрану,
достигает 2 • Ю9 Ом • см. В этом отношении свойства нервных и
мышечных волокон напоминают свойства морского подводного кабеля.
Электрическая емкость плазматической мембраны различных
клеток равна приблизительно 1 мкФ/см2. Электрическая емкость
чистого бимолекулярного липидного слоя составляет 0,8 мкФ/см2.
201
Зная диэлектрическую проницаемость той части липидного бислоя,
которая состоит из углеводородных цепей, можно рассчитать
толщину изолирующей части (d), использовав формулу плоского
конденсатора:
С = ^, (9.1)
где С — электрическая емкость; е — диэлектрическая
проницаемость изолирующей части бислоя; е0— электрическая постоянная;
А—площадь. Если С составляет 0,8 мкФ/см2, а е составляет 2,
то d будет равно 2,2 нм.
Электрическая емкость биологических мембран представляет
собой важный параметр, который необходимо учитывать при
количественной оценке электрических сигналов, регистрируемых на
мембране. Зная емкость мембраны, можно рассчитать минимальное
количество зарядов (ионов), необходимых для возникновения
рассматриваемого смещения мембранного потенциала. Измерение
электрической емкости плазматической мембраны позволяет
ориентировочно оценить площадь поверхности клетки, допуская, что емкость,
рассчитанная на единицу площади, составляет 1 мкФ/см2.
Волокно можно представить в виде электрической цепи с
рассредоточенными параметрами. Для удобства рассмотрения и
количественного описания такой цепи допускают, что если волокно
погружено в большей объем жидкости, то проводимость наружной
среды достаточно велика, и в эквивалентной электрической цепи
пренебрегают ее сопротивлением. На рис. 120 представлена схема
кабельной структуры. Сопротивление мембраны и цитоплазмы,
а также электрическая емкость мембраны представлены в схеме
в виде отдельных повторяющихся элементов. Потенциал
внеклеточной среды рассматривают как нулевой. Падение напряжения
(Е) на сопротивлении мембраны при пропускании тока через
кабельную структуру называют электротоническим потенциалом.
Используя закон Ома, можно записать следующее выражение
для тока, текущего по осевому цилиндру:
Щх = -'Л. (9.2)
где i2— ток, текущий по осевому цилиндру; х — расстояние от
источника тока, см; ^ — сопротивление аксоплазмы, рассчитанное
на единицу длины осевого цилиндра, Ом • см""1.
Ток, текущий через мембрану im9 рассчитанный на единицу
длины кабеля, может быть выражен следующим образом:
&' — '«• (9-3)
дх
Из (9.2) и (9.3) следует
1 дгЕ /г. л\
«. = ,7 • 5? • <М
20?
Наружная среда (большой объем, налое сопротивление)
\ \ \ /
1
Г
4= л\ ь± л\ с»± л\
Ег
vA/V4—'—уЛЛ/у—*—W—*
п
(малый диаметр,
большое сопротивление)
Внутренний1
тоновый электрод
ii
г
к
II
§ 1
Рис. 120. Кабельная структура (Катц, 1966):
а — электрическая схема, соответствующая распределенным сопротивлению и емкости
мембраны, а также сопротивлению аксоплазмы. В нижней части рисунка показан
внутриклеточный электрод Стрелки указывают направление тока. Голчок тока, и вызванные им
изменения мембранного потенциала (электротонический потенциал) на разных
расстояниях от электрода (б). Расстояния указаны возле каждой кривой. Они выражаются в
постоянных длины (Я.)
Ток im состоит из двух компонентов: емкостного тока ic и ионного
тока i{:
im = ic + h = С,
m dt
+ h
(9.5)
где Ст — электрическая емкость мембраны на единицу длины. Из
(9.4) и (9.5) получим
1 д*Е г дЕ . 0 .
r4i7a = tm5r + ^ (9.5)
дх*
Jfndt
Умножая обе части уравнения на гт9 получаем
Гт д*Е_ с дЕ
U "д^~^Гт mdt ^'«f<»
(9 7)
где гт — сопротивление мембраны кабельной структуры,
рассчитанное на единицу длины, Ом • см. Заменяем ^на А,2, г Ст = т, где
% — постоянная времени, и rm it = Е. В этом случае (9.7)
приобретает вид
(9.8)
%*№_ дЕ „
' dt
203
Если продолжительность прямоугольного толчка тока превышает
Зт Е практически достигает стационарного уровня; в этом случае
— = 0. При этом (9.8) приобретает следующий вид:
б/
(9.9)
Общее решение этого дифференциального уравнения имеет вид
Используем граничные условия для нахождения постоянных А
и В. Так как Е = 0 при х = оо, следовательно, 5 = 0. При х = 0
Е = Е0 и А = JSV Подставив постоянные Л и В в (9.10), получим
решение (9.9) как
Е = 2?0 ехр
(/'«/J'
(9.11)
Это выражение показывает, что электротонический потенциал Е
экспоненциально затухает с увеличением расстояния х. Длину
кабеля х, когда электротонический потенциал затухает в е раз,
называют константой длины и обозначают X
-V'?,-
При рассмотрении зависимости X от параметров кабельной
структуры гт выражают через Rm — сопротивление мембраны,
рассчитанное на единицу площади, а г* через Rt — удельное сопротивление
цитоплазмы:
Гт — я5!
п =
(9.12)
(9.13)
где D — диаметр волокна. Следовательно, константа длины равна
«2 уЧЕт, т. е. она пропорциональна корню квадратному из
диаметра волокна.
На табл. 12 приведены кабельные константы нервных волокон.
12. Кабельные константы нервных волокон (при Т ~ 293)
Волокно
Аксон кальмара
Аксон омара
Аксон краба
Диаметр
волокна, мкм
500
75
30
Константа длины
(при большом
объеме наружной
среды), мм
5
! 2,5
2,5
Постоянная
времени, мс 1
0,7
2
! 5
Сопротивление
мембраны.
Ом • см2
700
2000
5000
Емкость
мембраны С, мкФ/см2
1
1
1
Удельное
сопротивление
цитоплазмы, Ом • см
30
60
60
Удельное
сопротивление
наружной среды.
Ом • см
22
22
22
204
I 1 I
4 ——
Рис. 121. Изменение мембранного потенциала (£м) и натриевой и калиевой
проводимости мембраны вдоль кабельной структуры во время
распространяющегося потенциала действия, а также токи, текущие лерез различные участки
мембраны (Нобл, 1966) •
i( <— ток, текущий по ионным каналам, ic — емкостный ток, im — суммарный ток (tm = // -f»
Н- (С), На нижней диаграмме показаны локальные токи в области возбужденного участка.
Потенциал действия распространяется справа налево (направление его распространения
указано стрелкой). Штриховые вертикальные линии пооволяют сопоставить события,
происходящие в точках, где мембранный потенциал достиг нулевого уровня и максимума, а
также в точке, где изменяется направление мембранного тока im во время нисходящей фазы
потенциала действия
Распространение потенциала действия происходит благодаря
возникновению локальных токов между возбужденным и
покоящимися участками нервного или мышечного волокна. На рис. 121
приведена схема Д. Нобла, иллюстрирующая изменения мембранного
потенциала и локальные токи при проведении потенциала действия
в кабельной структуре (направление распространения — справа
205
налево). Здесь же представлены кривые, характеризующие
трансмембранные токи (ток, входящий в волокно,— отрицателен, а
выходящий из волокна — положителен), изменения мембранного
потенциала вдоль волокна и проводимости мембраны для ионов натрия
и калия в определенный момент потенциала действия. Длина
участка волокна, где существует потенциал действия, зависит от
скорости проведения. Участок между линиями А и Б полностью
возбужден. Входящий в волокно ток переносят ионы натрия. Он
вызывает не только изменение мембранного потенциала в месте
возбуждения, но и возникновение продольных токов, необходимых для
электротонической деполяризации мембраны ранее невозбужденных
участков до порога возникновения потенциала действия. Таким
образом, источником тока для электротонической деполяризации
является возбужденный участок около линии £. Электротоническая
деполяризация в начале потенциала действия достигает порогового
уровня, что приводит к увеличению gNa и возникновению
возбуждения.
В конце потенциала действия справа от линии В существует
также выходящий ток, который стремится деполяризовать мембрану.
В случае распространяющегося потенциала действия эта
деполяризация предотвращается высокой калиевой проводимостью
мембраны. Начальный период потенциала действия представляет
собой электротонический процесс. Чем больше внутреннее
сопротивление кабельной структуры, ее емкость и сопротивление
внешней среды, тем меньше скорость проведения. Внутреннее
сопротивление изменяется в обратной зависимости от квадрата диаметра
волокна. Скорость проведения возрастает пропорционально корню
квадратному от диаметра волокна.
В миелинизированных нервных волокнах потенциал действия
(нервный импульс) возникает только в перехватах узлов
(перехватах Ранвье). Между перехватами нервное волокно покрыто
миелином, образованным леммоцитами (швановскими клетками). Миелин
представляет собой изолятор, который дает возможность потенциалу
действия перескакивать от одного перехвата к следующему; такое
проведение нервного импульса названо скачкообразным (сальта-
торным).
9.3. Метод фиксации потенциала. Метод фиксации потенциала
позволяет непосредственно регистрировать ионные токи, текущие
через мембрану при заданном уровне мембранного потенциала. Он
был впервые применен К. Коулом (1949), а затем А. Ходжкиным,
А. Хаксли и Б. Катцом (1952). Метод состоит в том, что мембранный
потенциал на ограниченном участке мембраны смещают до
некоторой новой величины и удерживают его на этом уровне с помощью
электронной сх^мы с обратной связью. Ток, протекающий через
этот участок под влиянием приложенного напряжения, измеряют
отдельным усилителем. Из рис. 121 видно, что когда потенциал
действия распространяется по кабельной структуре, потенциал внутри
волокна зависит от времени и от расстояния, и через все элементы
кабоп<; текут изменяющиеся во времени токи.
206
Рис. Г22. Разновидности метода фиксации потенциалов (Хилле, 1984):
ф— фиксация потенциалов на гигантском аксоне кальмара £' — электрод для измерения
Мембранного потенциала, соединенный со входом предварительного усилителя с
коэффициентом усиления, равным единице, £" —устройство для измерения мембранного потенциала;
/' — электрод для пропускания через мембрану электрического тока; / — устройство длл
измерения тока, протекающего через мембрану, FBA — усилитель обратной связи,
осуществляющий фиксацию потенциала на мембране аксона на уровне, соответствующем потен-
ниалу, приложенному к одному из его входов (показан в виде прямоугольного импульса);
Л0— фиксация потенциалов на сферических клетках с использованием двух стеклянных
внутриклеточных электродов, <$Q- фиксация потенциала на изолированной клетке с
использованием присасывающейся пипетки^)— фиксация потенциала на микрофрагменте
мембраны («пэтч клзмп») с использованием микропипетки, образующей плотный контакт с
фрагментом мембраны (гигаомный контакт) Для фиксации используют только один электрод
Метод фиксации потенциала упрощает эту ситуацию. При
использовании его для гигантского аксона кальмара все участки
внутри аксона соединены металлической проволокой, так что в принципе
нет никаких осложнений из-за токов, распространяющихся вдоль
волокна (рис. 122, а). Следовательно, вместо того, чтобы иметь
дело с кабелем, Можно рассматривать нерв как изолированный
отрезок мембраны. Эквивалентная схема элемента возбудимой
мембраны нервного волокна представлена на рис. 123. Она представляет
электрическую цепь с четырьмя
параллельными ветвями. Одна
из них содержит электрическую
емкость, остальные ветви
представляют натриевую (g"Na) и
калиевую (#к) проводимости
мембраны, а также проводимость
утечки (gi). В каждую из этих
трех ветвей введены источники
электродвижущей силы: Еш, £к>
£/. Значения Е^а и Е
тывают, используя
рнста 1еш
CNa и £к рассчи- ■ t—-г—-* »——
эзуя уравнение Не- г
^IniMo- fv = NAAAAAAAAAAAAAAAAAA^
F [Na], ' к Аисоплазма
ss ^.]П1£ЬУ При описании ВОЗ- Рис. 123. Эквивалентная электрическая
* [К]*/ схема отрезка мембраны
207
будимой мембраны нервного волокна кальмара А. Ходжкин и-А. Хаксли
ввели понятие ток утечки. Это небольшой ток, обусловленный потен-
циалонезависимой проводимостью мембраны. Ионы-переносчики этого
тока не идентифицированы. Чаще всего Е{ принимают равным
потенциалу покоя. Проводимости мембраны для натрия, калия и
проводимость утечки записываются:
gm = j^ (914)
8к = Т=Ё^> (9Л5)
ь-rbwr (9-16)
Так же, как и соответствующие токи, g^ и gNa зависят от
мембранного потенциала и от времени.
В условиях фиксации потенциала ток, текущий через мембрану
1т, представляет собой сумму двух токов: тока 1{9 переносимого
ионами через проводящие пути, обозначенные как gNa, £к> gi> и
емкостного тока 1С, заряжающего или разряжающего электрическую
емкость мембраны:
lm = lt + lc = It + Cmfr (9.17)
Метод фиксации потенциала позволяет смещать мембранный
потенциал за несколько микросекунд, а затем удерживать его на
новом постоянном уровне. В результате ток течет через емкость
только в течение очень короткого времени. Как только потенциал
достигает стационарного уровня, весь ток, протекающий через
мембрану, переносится ионами, проходящими по ионным каналам.
Данные, полученные А. Ходжкиным и А. Хаксли (1952) на
гигантском аксоне кальмара, показали, что при деполяризации
мембраны натриевые и калиевые каналы ведут себя по-разному.
Проводимость мембраны для ионов натрия возрастает достаточно
быстро, достигая максимума, а затем снижается практически до
нуля по мере того, как устанавливается инактивация; проводимость
мембраны для ионов калия увеличивается более медленно и не
снижается при достаточно длительно поддерживаемой деполяризации.
На рис. 124 показаны ионные токи и изменение проводимости при
изменении мембранного потенциала в гигантском аксоне кальмара
при фиксации потенциала. -
На рис. 125 показаны вольт-амперные характеристики для
натриевого и калиевого токов. Точка пересечения вольт-амперной
характеристики для натриевого тока с осью абсцисс соответствует
мембранному потенциалу, который несколько ниже равновесного потенциала
для ионов натрия. Это отклонение связано с тем, что активация
натриевой проводимости мембраны происходит на фоне
проводимости мембраны для других ионов, создающих ток ч^рез мембрану по
калиевым каналам и каналам утечки.
208
Рис. 124 Ионные токи при фиксации потенциала на гигантском аксоне кальмара
(а) и характер изменения проводимости мембраны для ионов Na+ и К+ при
различных уровнях фиксации потенциала (б) (Ходжкин, Хаксли, 1952):
а: I — илшлй ток, зарегистрированный при фиксации потенциала на уровне 4- 9 мВ в нор-
мальном солевом растворе (близком по составу к морской воде); // — ионный ток,
зарегистрированной в безнатриейом растворе (ионы натрия замещено непроникающими ионами
холина) идентифицированный как калиевый ток; /// —кривая натриевого тока,
полученная путем вычитания из кривой / кривой 11,6 изменения проводимости мембраны для
ионов Nd+ (/) и для ионов К> (2) при различных уровнях фиксированного потенциала,
обозначенных возле каждой кривой
При изучении работы ионных каналов в условиях фиксации
потенциалов нередко возникает необходимость введения в клетку
веществ, взаимодействующих с ионными каналами, а также
изменений ионного состава внутриклеточной среды. Ряд исследователей
в Великобритании и США разработали метод внутриклеточной
перфузии гигантского аксона кальмара (П. Бейкер, Т. Шоу, А,
Ходжкин, Т. Ойкава, С. Спиропулус, И. Тасаки, Т. Теорелл). Он
заключается в удалении аксоплазмы и замещении ее раствором заданного
состава. Перфузированный гигантский аксон кальмара сохраняет
электрическую возбудимость и генерирует потенциалы действия. На
перфузированном аксоне успешно осуществлена фиксация
потенциалов Были подтверждены
высказанные ранее предположения о
механизмах возникновения потенциала
покоя и потенциала действия.
Внутриклеточная перфузия затем разработана
и на других гигантских нервных и
мышечных волокнах беспозвоночных
животных.
При изучении свойств ионных
каналов мембраны тела (сомы) нерв-
Рис. 125 Вольт-амперная характеристика для
натриевого (/^а) и калиевого (/к) тока.
Стрелкой обозначен исходный
(поддерживаемый) уровень мембранного потенциала
20*
ной клетки также широко используют метод фиксации
потенциалов. Особенно удобны для такого рода исследований гигантские
униполярные нейроны моллюсков. Форма тела этих нейронов
приближается к сферической, их диаметр достигает 200—800 мкм. От
тела отходит один отросток. Здесь используют точечный принцип
фиксации потенциалов. В тело нейрона вводят два кончика
микроэлектрода. Один из них служит для измерения мембранного
потенциала, второй — для пропускания тока (рис. 122, б). При фиксации
потенциалов на таких нейронах нередко наблюдается активность
неконтролируемых областей аксона, что вносит некоторую ошибку
в оценку ионных токов. В этой связи эксперименты стали проводить
на изолированном теле нейрона (Костюк и сотр.). Изоляция
осуществлялась после обработки препаратов протеолитическими
ферментами.
Для соматической мембраны тела нервных клеток характерно
наличие нескольких популяций потенциалозависимых ионных
каналов, в связи с чем токи, текущие через различные типы ионных
каналов, накладываются друг на друга во время деполяризации
мембраны. Для разделения токов часто возникает необходимость изменения
состава внутриклеточной среды. Те же исследователи разработали
метод перфузии изолированных нейронов. К изолированной клетке
подводится присасывающаяся пипетка, образуется плотный
контакт пипетки и мембраны клетки. Мембрана, прилегающая к
отверстию пипетки, разрушается и открывается доступ к внутреннему
содержимому клетки. Это создает возможность для внутриклеточной
перфузии и одновременной фиксации потенциалов (рис. 122, в).
Здесь были успешно выделены кальциевые токи и получены новые
данные о роли внутриклеточных обменных процессов в
деятельности ионных каналов. Метод перфузии применяют при изучении
ионных каналов мембраны тела нервных клеток моллюсков,
нейронов спинальных ганглиев млекопитающих, клеток нейробласто-
мы. Этот метод также использован на ооцитах, миокардиоцитах,
неисчерченных мышечных (гладкомышечных) клетках.
В последние годы получил широкое распространение метод
фиксации потенциалов на микрофрагменте клеточной мембраны
(метод «пэтч клэмпу>). Он позволяет регистрировать токи одиночных
ионных каналов. Первые такого рода регистрации были
осуществлены в ФРГ Э. Неером и Б. Сакманом в 1976 г. Размер
микрофрагмента находится на грани разрешения светового микроскопа. Основой
для создания метода послужило обнаружение того факта, что при
определенных условиях клеточная мембрана формирует
необычайно плотный контакт с кончиком стеклянной микропипетки (ги-
гаомный контакт). В результате образуется электрически
изолированный участок мембраны. Контакт мембраны со стеклом
механически весьма прочен. Находящийся под кончиком микропипетки
участок мембраны можно либо изолировать, либо разрушить и
проникнуть, таким образом, в клетку. Важным условием образования
гигаомного контакта между пипеткой и клеточной мембраной
является освобождение клеточной поверхности от соединительной ткани.
210
;- 1 1 1 l_ |
0 0,5 1,0 1,5 2,0 2,5
Время, с
Рис. 126. Регистрация токов, протекающих через одиночные каналы мембраны
эмбриональных мышечных волокон крысы в условиях «пэтч клэмпа».
Регистрации проводились после смещения мембранного потенциала до уровней, указанных
справа (Паллота и соавт., 1981):
/м_ регистрации тока; Еы■ — мембранный потенциал
Для метода «пэтч клэмп» используют ферментативно
диспергированные клетки или же клеточные культуры. Схема фиксации
потенциалов на микрофрагменте мембраны представлена на рис. 122, г.
Регистрации токов, протекающих через одиночные кальцийакти-
вируемые калиевые каналы мембраны эмбриональных мышечных
волокон крысы, показаны на рис. 126. Такого рода исследования
дают непосредственно информацию об особенностях
функционирования белковых макромолекул, выполняющих функцию ионных
каналов.
9.4. Воротные механизмы потенциалозависимых ионных
каналов. Активация потенциалозависимых ионных каналов связана
с перемещением в мембране подвижных зарядов, что создает
воротный ток. Регистрация этого тока сопряжена со значительными
трудностями. При открывании ионного канала в результате воздействия
электрического поля на сенсор напряжения перемещается лишь
несколько элементарных зарядов, тогда как возникающий при этом
ионный ток обусловлен прохождением через канал тысяч ионов за
одну миллисекунду. В условиях фиксации потенциалов в начальный
период смещения потенциала на воротный ток накладывается
значительный емкостный ток. Для выделения воротного тока
необходимо снизить до минимума ионные токи, протекающие через
мембрану. С этой целью проникающие через мембрану ионы заменяют
непроникающими. Используют также вещества, блокирующие
ионные токи, но не оказывающие влияния на воротные механизмы.
Несмотря на эти меры сохраняется ток утечки.
Воротные токи натриевых каналов впервые были
зарегистрированы на перфузируемом внутриклеточно гигантском аксоне
кальмара К. Армстронгом и Ф. Безаниллой, а также Р. Кейнсом иЕ.Ро-
хасом. Для подавления натриевого тока использовали тетродотоксин
(см. параграф 9.6). Ионы натрия в наружном растворе замещали
211
О мВ
\--70
440
г\
]ЮмкА/с
'CM'
f»f ч '
^**Шс
I'M'Mah.iK
| jpf 5mkA/cm2]
a 6
Рис. 127. Воротный ток натриевых каналов (Армстронг, Безанклла, 1974):
а — воротный ток, связанный с активацией натриевых каналов (oi-tok); Ем — мембранный
потенциал: в верхней части рисунка показаны симметричные смещения мембранного
потенциала; Ig — воротный тек; /jNa~~ натриевый ток; б — воротный ток, связанный с
закрыванием (деактивацией) натриевых каналов (o/f-ток). В нижней части рисунка показан «хвостэ
натриевого тока, характеризующий деактивацию натриевых каналов при исходном
(поддерживаемом) уровне мембранного потенциала —70 мВ. Стрелкой отмечен момент
возвращения потенциала к исходному уровню
крупными непроникающими катионами, внутрь аксона вместо ионов
калия вводили ионы цезия, которые блокируют калиевые каналы.
Для устранения тока утечки и линейного емкостного тока
производили многократные симметричные положительные и отрицательные
смещения мембранного потенциала. Регистрируемые токи
алгебраически суммировали. При этом был выделен асимметричный ток
смещения, который был идентифицирован как воротный ток
натриевых каналов. Асимметричный ток смещения называют также
нелинейным емкостным током. На рис. 127 показаны регистрации
асимметричного тока смещения и натриевого тока. Асимметричный
ток смещения был получен в результате суммирования токов при
50 симметричных положительных и отрицательных смещениях
мембранного потенциала. При изучении воротных токов натриевых
каналов К. Армстронг и Ф. Безанилла не обнаружили воротных
токов, которые могли быть связанными с процессом инактивации.
Все воздействия, которые вызывали инактивацию натриевых
каналов, вызывали уменьшение воротных токов вследствие
иммобилизации воротных зарядов.
Асимметричные токи смещения, которые идентифицированы как
воротные токи натриевых каналов, были зарегистрированы на
перехватах узлов (перехватах Ранвье) миелинизированных нервных
волокон лягушки, на гигантских нервных волокнах червя Mixicola.
На перфузируемых внутриклеточно нейронах моллюсков П. Г. Кос-
тюк и О. А. Крышталь зарегистрировали асимметричные токи
смещения, которые были идентифицированы как воротные токи
кальциевых каналов.
Важную роль в изучении молекулярных механизмов
деятельности ионных каналов сыграли исследования по изучению флуктуации
212
проводимости возбудимых мембран. Ионные каналы представляют
собой дискретные молекулы. Количество открытых каналов в
любой области мембраны флуктуирует даже в условиях равновесия.
Электрические измерения позволили обнаружить эти флуктуации.
Анализ флуктуации проводимости дает возможность определить
две важные характеристики каналов: среднее время жизни канала
в открытом состоянии и проводимость одиночного открытого
канала.
В последние годы появилась возможность непосредственно
регистрировать ионные токи одиночных каналов благодаря развитию
техники фиксации потенциалов на микрофрагментах мембраны
(см. параграф 9.3). В этом случае непосредственно наблюдают
события, связанные с функционированием одиночных молекул — ионных
каналов.
Для количественного описания свойств воротных механизмов
потенциалозависимых ионных каналов нередко используют
уравнения Ходжкина — Хаксли. Впервые они были использованы для
описания натриевой и калиевой проводимости мембраны
гигантского аксона кальмара:
gNa = gNaW3/l; (9.18)
g? = am(l-m)-pmm; (9.19)
2 = ал(1-А)-РЛ (9-20)
£к = £к"4; (9.21)
g = cUl-n)-P„n, (9.22)
где gm и gfc — натриевая и калиевая проводимости мембраны,
рассчитанные на единицу площади мембраны; gNa и g^ — константы,
представляющие максимум проводимости; тип— переменные
активации натриевых и калиевых каналов, соответственно; h—
переменная инактивации натриевых каналов (т, п и h в зависимости от
мембранного потенциала изменяются в пределах от 0 до 1); атУ ап,
ап> Рт> Рл и Рл — константы скоростей, зависящие от мембранного
потенциала, температуры и концентрации двухвалентных ионов в
наружном растворе, но не зависящие от времени. При
деполяризации мембраны ат9 ал и рл увеличиваются, a f$m, P„ и ан
уменьшаются. При описании процессов активации и инактивации ионных
каналов наряду с константами скоростей нередко используют
постоянные времени изменения т, h и п:
тт = 1/(оьт+Рт); (9.23)
тА=1/(а/| + рл); (9.24)
т„ = 1/(а„+р2). (9.25)
Стационарные значения переменных m, n и h выражаются
следующим образом:
am + Pm «/1 + Рл аЛ + Pa v
213
Рис. 128. Зависимость стационарных (установившихся) значений переменных
поо> ю«» &оо и постоянных времени тл, гт и ih от мембранного потенциала
(для аксона кальмара)
На рис. 128 представлены графики зависимости стационарных
значений я, m, Л (я,*, т* и Л*,) и постоянных времени тт, тпита
от мембранного потенциала.
Уравнения Ходжкина — Хаксли были использованы для
описания различных проявлений процесса возбуждения в аксоне
кальмара. С их помощью теоретически рассчитаны амплитуда и
кривые потенциалов действия, скорость их распространения,
влияние температуры на распространяющийся потенциал действия.
Результаты теоретических расчетов хорошо согласовывались с
данными экспериментов.
Уравнения Ходжкина — Хаксли с небольшими модификациями
были использованы для описания свойств воротных механизмов
потенциалозависимых ионных каналов многих возбудимых
образований, в частности, калиевых и кальциевых каналов соматической
мембраны нейронов моллюсков, ионных каналов перехватов узлов,
кальциевых каналов мембраны мышечных волокон речного рака.
Если рассматривать натриевый канал мембраны гигантского
аксона кальмара, то, исходя из модели Ходжкина — Хаксли, можно
предположить, что канал открывается при совпадении по времени
трех событий. Вероятность каждого из них равна т. Кроме того,
одно событие с вероятностью (1 —Л) блокирует (ииактивирует) канал.
События могут представлять движение трех активирующих частиц
и одной блокирующей (инактивирующей) частицы к определенным
локусам мембраны. Вероятность того, что канал открыт, равна
m3h. Аналогичным образом можно интерпретировать события в
других видах потенциалозависимых ионных каналов.
Для описания плотности общего ионного тока через мембрану
гигантского аксона кальмара использовано следующее выражение:
/, = gKn* (Е - Ек) + gNam*h (E - ENa) + gt(E- £,), (9.27)
где Ек> £^а и Et — равновесные потенциалы для токов, текущих
по калиевым и натриевым каналам, соответственно, и потенциал
214
реверсии для тока утечки; Е— мембранный потенциал. Под
каналами утечки подразумевают ионные каналы, проводимость которых
не зависит от мембранного потенциала.
9.5. Поверхностный потенциал клеток. Порог возникновения
потенциалов действия нервных и мышечных клеток обычно зависит
от концентрации двухвалентных катионов и рН наружного
раствора, в меньшей степени — от концентрации одновалентных
катионов. Эти же факторы влияют на вольт-амперные характеристики
ионных каналов, обеспечивающих электрическую возбудимость
клетки, и на зависимость от измеряемого мембранного потенциала
параметров m, n и hy используемых в модели Ходжкина — Хаксли.
Увеличение концентрации двухвалентных катионов оказывает
действие, подобное гиперполяризации мембраны (смещению
мембранного потенциала в отрицательном направлении), хотя измеряемый
мембранный потенциал при этом может заметно не изменяться.
Порог возникновения потенциалов действия увеличивается, а вольт-
амперные характеристики смещаются вдоль оси напряжения вправо.
Такое действие двухвалентных катионов названо стабилизирующим.
Рассматриваемые явления связывают с изменением поверхностного
потенциала клеток.
На наружной поверхности клеток находятся ионизированные
анионные группировки, несущие отрицательные заряды, а также
некоторое количество положительно заряженных протонированных
аминогрупп. Ввиду значительного преобладания анионных
группировок на поверхности мембраны создается отрицательный
поверхностный потенциал. При рассмотрении структур, несущих
электрические заряды, необходимо учитывать цвиттерионные и
отрицательно заряженные головки молекул фосфолипидов, а также остатки
сиаловой кислоты, входящие в состав углеводов, расположенных
на наружной поверхности мембраны.
Реакция ионизации кислоты Н — А *=* Н* + А" характеризуется
константой диссоциации Ка-
_ [Н+1 [А-]
В условиях, когда кислота ионизирована наполовину [Н — А] =
= W-], Ка = [Н+] (или рКа = рН), тогда рКа = - lgKa.
В случае протонироЕанной аминогруппы реакция может быть
представлена следующим образом: ВН++=±В + Н+.
Константу диссоциации Ка и рКа рассчитывают следующим
образом:
Л._ИЦ£1, (9.29)
p/C„ = lgif±P + pH. (9.30)
Поверхностный потенциал мембраны оказывает влияние на
примембранные концентрации ионов и на сенсоры напряжения
потенциалозависимых ионных каналов. При изучении влияния на
215
возбудимые мембраны изменений рН, ионной сплы растворов и
изменений концентрации ионов, в особенности двухвалентных,
необходимо учитывать возможность изменения поверхностного
потенциала.
Расстояние от мембраны, на которое распространяется
электростатическое действие поверхностных зарядов мембраны,
характеризуется дебаевской длиной (см. параграф 3.9), которая зависит от
ионной силы раствора. Дебаевская длина в растворе Рингера
составляет 0,9 нм, а в морской воде — 0,46 нм. Эти цифры
показывают, что электростатические взаимодействия между зарядами
в растворах распространяются ' на расстояния, которые меньше,
чем размер макромолекул.
Истинное значение мембранного потенциала (£м),
схематически показанное на рис. 129, может существенно отличаться от
измеряемого (Ем) из-за наличия поверхностного потенциала на
наружной (г|)0) и внутренней (i|)t) поверхностях мембраны. На рис. 129
схематически представлен профиль изменения потенциала в при-
мембранных пространствах и в мембране. Согласно этой схеме,
истинное значение трансмембранной разности потенциалов можно
рассчитать следующим образом:
Еы = Еы-Ъо + % (9.31)
Для количественного описания феноменов, связанных с
изменением поверхностного потенциала клеток и искусственных фосфоли-
пидных мембран, широко используют модель Гуи—Чапмена. Эта
модель рассматривает находящуюся в растворе электролита
плоскую поверхность, на которой равномерно распределен заряд.
На ионы, находящиеся в растворе электролита в примембранном
пространстве, действуют электростатические силы, благодаря
которым здесь создается двойной электрический слой. Тепловое
движение ионов обусловливает диффузный
характер распределения ионов в
двойном слое (рис. 130). Для математичес-
Наружная
сторона
мембраны
Изолирующая
часть Внутренняя
мембраны опоре -
Знм мембраны
-75мВ
©я?
• • •
е
е
©
е
J® ф
е
©
© ^
Рис. 129. Профиль изменения потенциала Рис. 130. Распределение
в примембранном пространстве и в мемб- ионов в электролите вбли-
ране при наличии фиксированных отрица- ей заряженной поверхно-
тельных зарядов на поверхности мембраны сти (Котык, Яначек, 1977)
(Хилле, 1983)
216
кого описания поверхностного потенциала использованы уравнение
Пуассона и распределение Больцмана.
В случае плоскости с равномерно распределенным зарядом
уравнение Пуассона имеет вид
d2ty _ 4яр
е0 '
dx*~~ ii7' <9-32)
где р — объемная плотность зарядов; 8 — диэлектрическая
проницаемость среды; е0 — электрическая постоянная.
Согласно распределению Больцмана, соотношение концентрации
ионов в заданной точке примембранного пространства (сх) и в
глубине раствора (с) выражается следующим образом:
^exp(-ztF^JRn (9.33)
где i — вид иона; х — расстояние рассматриваемой точки от мемб-'
раны; zl — валентность ионов; tyx — потенциал в точке х. При тем-
RT
пературе 295 К -тг = 25,3 мВ (потенциал на поверхности мембраны
обозначают как i|)0, а потенциал в глубине раствора — \f>o<>; когда
Модель Гуи — Чапмена предусматривает экранирование
поверхностного заряда ионами, находящимися в растворе
электролита. Согласно модели, ионы одинаковой валентности в равных
концентрациях оказывают аналогичное влияние на поверхностный
потенциал. Такие факторы, как ионные радиусы и энергия
гидратации, не учитываются при рассмотрении процесса экранирования.
В рамках рассматриваемой модели связь между плотностью
поверхностного заряда (а), поверхностным потенциалом (%) и
концентрациями ионов в растворе (^Дописывает уравнение Грехема:
о* = 2ее0/?Г£ ct [exp f=ffi* ) - l]. (9.34)
Эффективность экранирования поверхностного заряда
двухвалентными ионами значительно выше, чем одновалентными. Согласно
расчетам С. МакЛафлина, Дж. Сабо, Дж. Зйзенмана, при t|?0=
= 116 мВ и при наружной концентрации кальция, равной 10*"3моль/л,
примембранная концентрация кальция, рассчитанная по
уравнению (9.33), составит приблизительно 10 моль/л,т. е. онавЮОООраз
будет превышать концентрацию ионов кальция в глубине
раствора. Столь высокая примембранная концентрация кальция
маловероятна. Неадекватность расчета связана с тем, что в модели
Гуи — Чапмена ионы рассматриваются как точечные заряды.
Вместе с тем чистое экранирование поверхностных зарядов,
предусмотренное моделью Гуи — Чапмена, плохо согласуется
с экспериментальными данными, полученными на перехватах
узлов (перехватах Ранвье) миелинизированных нервных волокон
лягушки. Различные двухвалентные катионы в равных концен-
217
трациях оказывали неидентичное действие на поверхностный
потенциал (о влиянии на поверхностный потенциал судили по сдвигам
вольт-ампер ной характеристики для натриевого тока). По своей
эффективности исследуемые катионы располагались следующим
образом:
Zn2+ > Ni2+ > Mn2+ » Co2+ > Ca2+ > Mg2+ > Sr2+ = Ba2+.
Для объяснения этих экспериментальных данных Б. Хилле,
А. Вудхул и Б. Шапиро предположили, что наряду с
экранирующим действием двухвалентные катионы связываются с
поверхностными зарядами мембраны. При наличии связывания
поверхностная плотность зарядов составляет
о = ^ - % (9.35)
i
где о — максимальная величина о при полном отсутствии
связывания катионов; Kt — константа связывания (величина, обратная
константе диссоциации).
Это уравнение обычно комбинируют с уравнением Грехема:
^ 2 ={2ее0ЯГ V^[exp(—ztF%IRT) — 1]W*.
1 (9.36)
Рассмотренная теория поверхностного потенциала является
весьма упрощенной и не всегда согласуется с результатами
исследований. Так, факторы, вызывающие изменение поверхностного
потенциала, нередко вызывают различное действие на разные по-
тенциалозависимые параметры воротных механизмов ионных
каналов, в частности натриевых.
9.8. Свойства открытых яотенциалозависимых натриевых
каналов. Наиболее полная информация о свойствах этих каналов
получена в результате исследований на гигантском аксоне кальмара и на
перехватах узлов (перехватах Ранвье) миелинизированных
нервных волокон амфибий.
У. Чандлер и X. Мевес измерили проницаемость натриевых
каналов гигантского аксона кальмара для всех ионов щелочных
металлов и получили следующую последовательность: Li+ > Na + >
>K + >Rb + >Cs*. Она соответствует той, которую
предусматривает электростатическая теория избирательности Эйзенмана для
анионного локуса, создающего сильное электрическое поле (ряд
XI). Если принять проницаемость для конов натрия за единицу,
то относительная проницаемость для Li+, Na+, K+, Rb+, Cs+ будет
составлять соответственно 1,1 : 1 :0,083 : 0,025 :0,016. Ионы
аммония также могут переносить ток по натриевым каналам аксона
кальмара.
Некоторые небольшие органические катионы способны быть
переносчиками тока через натриевые каналы. В их присутствии сохра*
216
няется возбудимость нерва в безнатриевой среде. Исследования
с использованием фиксации потенциала показали, что так же, как
и для ионов натрия, проницаемость для малых органических
катионов быстро нарастает и относительно медленно инактивируется
на фоне деполяризации мембраны.
Модель Хилле. Данные, полученные при изучении
проницаемости натриевых каналов перехватов Ранвье нервных волокон
лягушки, были использованы Б. Хилле для создания модели
структуры натриевого канала. Относительную проницаемость
рассчитывали по уравнению, основанному на теории постоянного поля Гольд-
мана — Ходжкина — Катца, на основании данных о потенциале
реверсии тока, текущего по натриевым каналам:
в,.,-^-^-^. (Од
где Ег&—потенциал реверсии для тока, текущего по натриевым
каналам в безнатриевом растворе, содержащем катионы S; Ег,ш —
потенциал реверсии для натриевого тока; Ps и Р^а —
проницаемость мембраны для ионов S и ионов натрия, соответственно;
соотношение Ps/Рш характеризует селективность натриевых
каналов для катионов S; [S] и [Nal — концентрации в наружном
растворе исследуемых катионов и ионов натрия, соответственно.
Б. Хилле обнаружил следующую последовательность
избирательности натриевых каналов для органических катионов: натрий >
> гидроксиламин > гидразин > аммоний « формамидин « гу-
авидин а? гидроксигуанидин > аминогуанидин ^> метиламмоний.
Наибольшей способностью переносить ток по натриевым каналам
обладают наименьшие из них: гидроксиламин и гидразин.
Метиламин (CH3NHt), сходный по структуре и размерам с гидроксилами-
ном (OHNH^) и гидразином (NH2NH+), практически не проходит
через натриевые каналы. Проницаемость натриевых каналов для
метиламина почти в 100 раз ниже, чем для гидроксиламкна и
гидразина. Таким образом, замещение ОН- или ЫН2-группы метильной
(СН3) значительно снижает вероятность прохождения иона через
натриевый канал. Метильная группа отличается от гидроксильной и
аминогруппы тем, что она не может формировать водородные связи.
Согласно модели Хилле, вход в натриевый канал имеет
прямоугольную форму; его размер составляет приблизительно 0,3 X
X 0,5 нм. Это минимальный размер фильтра, который необходим
для того, чтобы рассматриваемые органические катионы, образуя
водородные связи с атомами кислорода, могли пройти через
натриевый канал. Согласно модели, фильтр окружен 8 атомами
кислорода.
На рис. 131, а дана схема Б. Хтле, изображающая
селективный фильтр натриевого канала, окруженный атомами кислорода.
В фильтре находится ион натрия е молекулой воды. Согласно
модели, молекула вода, связанная с ионом, образует водородные связи
с атомами кислорода. На рис. 131, б показаны ионы, способные
относительно легко проходить через натриевый канал. Неорганические
219
п Гидроксиламин Гидразин
Литий Натрий (hJ~OH) (fjU-Щ)
6 W
P.ic. 131. Селективный фильтр натриевого канала (Хилле, 1972):
в —ион натрия, находящийся в селективном фильтре с молекулой воды. Окружности
изображают атомы кислорода, сторона заштрихованного квадрата равна 0.! нм; о —.
неорганические и органические ионы, способные проходить через натриевый канал Ионы
лития и натрия связаны с молекулой воды. Справа расположен ион калия с молекулой
воды
ионы изображены с молекулой воды. Показаны также размеры иона
калия с молекулой воды, который обладает низкой способностью
проходить через натриевый канал.
Т1ри изучении проницаемости натриевых каналов перехватов
узлов (перехватов Ранвье) для ионов металлов Б. Хилле обнаружил
следующую последовательность: Na + > Li+ > Tl+ > К+.
Соотношение Рк/Рш составляло 1/12. Проницаемость натриевых каналов
для Rb+, Cs+, Ca2+ и Mg2+ была столь низкой, что не могла быть
измерена.
Согласно данным, полученным различными авторами, в
натриевом канале имеется кислотная группа. Ее р/Са, по данным Б. Хилле,
составляет 5,2. Предполагают, что эта кислотная группа является
карбоксильной. Она создает сильное электрическое поле и
обеспечивает последовательность избирательности, находящуюся на
границе между X (Na + > Li+) и XI (Li + > Na+) рядами по Эйзенману.
Последовательность избирательности натриевых каналов
перехватов узлов (перехватов Ранвье) по сути не отличается от
последовательности, установленной У. Чандлером и X. Мевесом для
натриевых каналов гигантского аксона кальмара.
В водном растворе катион полностью окружен атомами
кислорода молекул воды, составляющих гидратную оболочку. Б. Хилле
предположил, что в натриевом канале катион также окружен
атомами кислорода; одни из них принадлежат молекулам воды,
другие связаны с натриевым каналом.
Блока/поры натриевых каналов. Важную роль в
идентификации ионных каналов и в разделении ионных токов, текущих через
различные типы каналов, играют вещества, избирательно
подавляющие определенные виды ионной проводимости мембраны. Среди
эгих веществ особое место занимают тетродотоксин и сакситоксин
(рис. 132, У). Тетродотоксин содержится в яичниках и печени,
а иногда и в коже рыб семейства Tetraodontidae, а также в орга-
220
Тетродотоксин
Сакситоксин
РНз
^)-NH-C-CH2-N C3H?-^ V-C-0-CH2-CH2-N
СН3
СН3
Лидокаин
О
Тетракаин
М{*\=У~ c-o-ch2-ch2-n nh2-/~Y-c-o-ch2-ch
LnHr
Новокаин
Бензокаин
/*~~\ Анестетик,
/. \ ^ находящийся
I* \ пн\три клетки
Рис. 132. Вещества, блокирующие натриевые каналы (Хилле, 1974):
/ — структурные формулы тетродотоксина и сакситоксина, 2 — местные анестетики; 3 «*
предполагаемые механизмы их взаимодействия с натриевым каналом
низме некоторых видов тритонов (например, Taricha torosa).
Тетродотоксин, воздействуя на наружную поверхность мембраны,
подавляет возникновение потенциалов действия в нервах и мышцах.
Этот эффект обусловлен тем, что тетродотоксин в очень низких
концентрациях (порядка Ю"8 М/л) блокирует натриевый ток, не
оказывая заметного действия на калиевый ток и ток утечки.
Сакситоксин, содержащийся в жгутиковых Gonyaulax catanella,
также, как и тетродотоксин, и в тех же концентрациях подавляет
рост натриевой проводимости электрически возбудимых мембран.
Предполагают, что тетродотоксин и сакситоксин связываются
с наружным устьем натриевого канала.
221
Меченые тетродотоксин и сакситоксин используют в качестве
меток для натриевых каналов при определении плотности их
распределения в мембране, а также при идентификации молекул
каналов при их химической очистке. Блокирование ионных токов тетро-
дотоксином используют при регистрации асимметричных токов
смещения, идентифицируемых как воротные токи натриевых каналов.
На протяжении около 100 лет в медицинской практике
используют местные анестетики. Эти вещества, блокируя натриевые
каналы, препятствуют возникновению потенциалов действия в
нервных и исчерченных (поперечно-полосатых) мышечных волокнах.
(В меньшей мере местные анестетики подавляют потенциалозависи-
мые калиевые каналы.) Большинство местных анестетике»,
используемых в клинике, является третичными аминами (рис. 132, 2).
Они могут быть в нейтральной и заряженной формах. (Заряженная
форма возникает при протонировании аминогруппы.) Нейтральная
форма местных анестетиков растворима в липидах. Соотношение
концентраций этих двух форм местных анестетиков рассчитывают,
используя уравнение Хендерсона — Хассельбалха, если известен
рКа анестетика:
log^ = p/Ce-pH, (9.38)
где свн+ и ев — концентрации заряженной (протонированной) и
незаряженной форм, соответственно. Для большинства местных
анестетиков, используемых в клинике, рКа находится в пределах
7-9.
Согласно результатам многочисленных исследований, местные
анестетики в заряженной форме блокируют натриевые каналы лишь
тогда, когда они находятся внутри клетки и проникают во
внутреннее устье натриевого канала. Здесь они связываются с рецептором,
находящимся между воротами и селективным фильтром канала.
Следовательно, для взаимодействия заряженного анестетика с
натриевым каналом необходимо, чтобы канал был открыт
(активирован). Такой механизм блокирования объясняет феномен повышения
эффективности действия постоянно заряженных и протонированных
местных анестетиков при ритмической стимуляции нерва. В
нейтральной форме местные анестетики — третичные амины — могут
проникать внутрь нервного волокна, растворяясь в липидном мат-
риксе мембраны. Затем внутри волокна определенная часть
проникших нейтральных молекул протонируется. В экспериментах
часто используют постоянно заряженные местные анестетики,
которые вводят внутрь нервных волокон.
В нейтральной форме местные анестетики, растворяясь в
липидах мембраны, также могут достичь того же рецептора, не попадая
во внутреннее устье канала. В этом случае местные анестетики
взаимодействуют как с открытыми, так и закрытыми натриевыми
каналами.
На рис. 132, 2 приведена структурная формула местных
анестетиков третичных аминов. Здесь же (рис. 132, 3) приведена схема
222
предполагаемых путей проникновения молекул местных
анестетиков к месту их связывания в натриевом канале. Стрелки
показывают, что ионы водорода, находящиеся в наружном растворе, могут
пройти через селективный фильтр канала и взаимодействовать со
связавшейся молекулой местного анестетика. Ионы натрия, проходя
через селективный фильтр, из наружного раствора также могут
взаимодействовать со связавшейся молекулой местного анестетика.
Когда натриевый канал открыт, они способствуют удалению из него
местного анестетика. Понижение концентрации натрия в наружном
растворе способствует увеличению доли заблокированных натриевых
каналов.
Взаимодействие местных анестетиков с натриевыми каналами
приводит к их блокированию и развитию инактивации.
Рассмотренный механизм действия местных анестетиков был описан Б. Хилле и,
по-видимому, он не является единственно возможным. Согласно
модели модуляции рецептора, разработанной Б. Хилле, способность
рецептора связываться с местным анестетиком зависит от того,
находится ли канал в открытом, в закрытом или инактивированном
состоянии. Взаимодействие местных анестетиков с рецептором
изменяет кинетику воротных процессов натриевого канала.
Воздействия, устраняющие инактивацию
натриевых каналов. Протеолитические ферменты, будучи введенными
в аксоплазму нервных волокон, вызывают полное или частичное
подавление инактивации натриевых каналов. Для разрушения инак-
тивационных ворот часто используют проназу, являющуюся смесью
протеолитических ферментов. Проназа не оказывает влияния на
активацию натриевых каналов. Натриевые каналы теряют способность
инактивироваться и при введении в аксон N-брамацетамида, танни-
новой кислоты, йодата, глютаральдегида и ряда других веществ.
Многие токсины-пептиды при воздействии на наружную
поверхность мембраны замедляют инактивацию натриевых каналов.
Яды скорпионов и морских анемон содержат смесь полипептидных
токсинов, которые со стороны наружной поверхности мембрагы
воздействуют на воротные механизмы натриевых каналов, вызывая
замедление их инактивации. Различные токсины избирательны для
различных животных (для ракообразных, насекомых, позвоночных
и т. д.). Подобная избирательность указывает на структурные
различия натриевых каналов. Считают, что большинство токсинов
скорпионов и анемон обратимо и конкурентно связываются с одним
и тем же рецептором, расположенным в области наружного устья
натриевого канала. Константа диссоциации находится в пределах
от 5 нМ до 20 мкМ. Эти токсины увеличивают продолжительность
потенциалов действия нервных волокон в сотни раз вследствие
замедления инактивации натриевых каналов. Их обозначают как
ч-токсины.
В яде некоторых видов скорпионов содержатся токсины,
блокирующие калиевые каналы, а также токсины, воздействующие на
механизмы активации натриевых каналов (Q-токсины). При
воздействии р-токсинов на нервные волокна в условиях фиксации потен-
2П
Вератридин
НО,
хш
$н3| | —мн^д
о—'
СС13
Батрахотоксин ДДТ
Рис. 133. Растворимые в липидах активаторы натриевых каналов
циалов натриевые каналы остаются открытыми на протяжении сотен
миллисекунд после возвращения мембранного потенциала к
уровню потенциала покоя.
Растворимые в липидах активаторы натриевых
каналов. Ряд растворимых в липидах токсинов, заметно отличающихся
по структуре молекул, оказывает идентичное действие на натриевые
каналы. Они открыты при мембранном потенциале, равном
потенциалу покоя. В этой связи токсины были названы липидораствсри-
мыми активаторами натриевых каналов. Предполагают, что место
их взаимодействия с каналом — рецептор — находится в
гидрофобной области мембраны, возможно, на границе между липидами
мембраны и пептидными цепями молекулы натриевого канала.
К растворимым в липидах активаторам принадлежат
вератридин, аконитин, батрахотоксин — один из ядов, содержащихся в
секрете кожных желез южноамериканской лягушки (Phyllobates
aurotaenia), и ряд других веществ. На рис. 133 показана структура
молекул некоторых из липидорастворимых токсинов.
При изучении механизмов действия аконитина и батрахотокси-
на было обнаружено, что эти вещества вызывают также замедление
или полное устранение инактивации натриевых каналов. В
условиях регистрации активности одиночных натриевых каналов
обнаружено, что их открыюе состояние длится в 50 раз дольше, чем
224
Рис. 134. Расположение рецепторов на
макромолекуле натриевого канала (Хилле,
1984):
/— рецепторы для тетродотоксина и сакситокси-
на; 2 — рецепторы для растворимых в лип идах
активаторов натриевых каналов, 3 — рецептор
для а-токсинов яда скорпионов и анемон,
модифицирующих механизм инактивации, 4 —
рецептор, связывающийся с fl-токсином яда
скорпионов, модифицирующим механизм
активации натриевых каналов, МА — место
связывания местных анестетиков; а, б, в, г —
возможные места взаимодействия натриевого
канала с ионами водорода и кальция, д — место
действия на механизм инактивации проназы,
йодатов, Af-бромаиетамида
в нормальных условиях. Местные
анестетики не блокируют
модифицированные каналы столь
эффективно, как нормальные. Ионная
избирательность модифицированных
натриевых каналов изменяется
таким образом, что их проницаемость для ионов аммония
становится выше, чем для ионов натрия, значительно, возрастает
проницаемость каналов для К+, Rb+ и Cs+. Действие батрахотоксина
и аконитина наступает раньше, если нервное волокно ритмически
раздражают.
На рис. 134 приведена схема натриевого канала и указаны
предполагаемые места взаимодействия с каналом различных агентов.
9.7. Свойства потенциалозависимых калиевых каналов. Потен-
циалозависимые калиевые каналы играют важную роль в
разнообразных проявлениях электрической активности клеток: их
активация способствует реполяризации мембраны во время потенциала
действия и развитию гиперполяризации; они играют важную роль
в ритмоюдящей активности ряда возбудимых клеток. Существует
несколько разновидностей потенциалозависимых калиевых
каналов, отличающихся друг от друга потенциалозависимостью,
способностью инактивироваться, кинетикой активации и инактивации,
фармакологическими характеристиками. Обнаружены потенциало-
зависимые калиевые каналы, которые регулируются как
мембранным потенциалом, так и нейромедиаторами и гормонами. В
нейронах симпатических ганглиев амфибий найдены калиевые каналы,
которые деактивируются при воздействии на нейрон ацетилхолина,
вызывающего активацию мускариновых холинорецепторов. Зто
вызывает появление внутри клетки вторичного посредника и
подавление функции калиевых каналов, которые названы
М-каналами.
Данные о свойствах калиевых каналов получены
преимущественно на основании исследований на гигантском аксоне кальмара,
а также на перехватах узлов миелинизированных нервных волокон
лягушки.
На гигантском аксоне кальмара впервые было показано, что во
время деполяризации происходят относительно быстрый, но крат-
225
ковременный рост натриевой проводимости мембраны и более
медленный, стойкий рост калиевой проводимости. Рост калиевой
проводимости в ответ на деполяризацию является причиной
феномена, известного под названием задержанного выпрямления.
Натриевые и калиевые каналы возбудимых мембран йространственно
разобщены. В качестве доказательства этого утверждения обычно
приводят данные о возможности изолированного подавления как
натриевой, так и калиевой проводимости мембраны при действии
на мембрану таких веществ, как тетродотоксин, сакситоксин, тетра-
этиламмоний (ТЭА).
И, Тасаки и С. Хагивара впервые обнаружили, что ТЭА,
введенный в аксоплазму гигантского аксона кальмара, значительно
увеличивает продолжительность потенциала действия за счет
формирования плато. Его возникновение обусловлено
блокированием калиевых каналов ионами ТЭА. Структуры калиевых каналов,
взаимодействующие с ТЭА, находятся только на внутренней
стороне мембраны гигантского аксона кальмара.
На других экспериментальных объектах, в частности, на
перехватах узлов (перехватах Ранвье) миелинизированных нервных
волокон лягушки, на соме нейронов моллюсков они находятся как
на наружной, так и на внутренней поверхностях мембраны.
Объясняя механизм блокирующего действия ТЭА, К. Армстронг
рассматривал калиевый канал как пору. Активационные «ворота»
калиевого канала расположены на их внутреннем конце. Ионы ТЭА
блокируют только открытые калиевые каналы. Внутреннее устье
калиевого канала расширено. Сюда может зайти полностью гидра-
тированвый ион калия, а также ион ТЭА. За расширенным устьем
следует высоко избирательная узкая часть калиевого канала.
Селективность калиевых каналов. При изучении
избирательности калиевых каналов в перехватах узлов (перехватах
Ранвье) миелинизированных нервных волокон лягушки для небольших
катионов Б. Хилле обнаружил следующую последовательность:
Рп : Рк : Р* ъ: Pnh4 = 2,3 : 1,0: 0,92:0,13.
Проводимость калиевых каналов (так же как и натриевых)
блокируется при снижении рН наружного раствора. Блокирование
рассматривают как следствие протонирования кислотной группы,
находящейся в канале. По данным Б. Хилле, рК этой группы
составляет 4,4.
Диаметр узкой части калиевого канала составляет 0,3 нм. Она
проницаема для ионов с кристаллическим диаметром от 0,26 нм
(К+) до 0,296 нм (Rb+, NH4). Через нее не могут пройти как
большие ионы (Cs+—0,33 нм; ТЭА+— 0,8 нм), так и меньшие ионы
(Na+—0,19 нм; Li+— 0,14 нм). Ион, проходящий через пору,
должен потерять гидратную оболочку. Это возможно только в случае,
если дегидратированный ион будет взаимодействовать со стенками
поры, где, как предполагают, имеются атомы кислорода,
принадлежащие карбонильным группам.
Ион с большим диаметром, чем 0,3 нм, слишком велик, чтобы
войти в пору. Ионы с меньшим диаметром, чем 0,26 нм, не могут
226
ЮОнА
+60 MB
Рис. 135. Зависящее от мембранного
потенциала подавление калиевого тока
внутриклеточными ионами натрия. Регистрация
осуществлена на изолированном нейроне
моллюска, перфузируемом внутриклеточно.
Приведены вольт-амперные
характеристики калиевого тока при различных
концентрациях натрия внутри клетки. Для кривых
/, 2, 3, 4, 5—концентрации ионов натрия
внутри клетки, соответственно составляли
О, 5, 10, 20 и 50 мМ/л (Магура, 1986)
проникнуть в нее, так как они не
взаимодействуют надлежащим образом
с атомами кислорода стенки поры.
Например, по существующей схеме,
ион калия взаимодействует со всеми
пятью атомами кислорода,
окружающими просвет поры, ионы натрия —
лишь с двумя атомами кислорода. Три других атома кислорода не
могут приблизиться к иону натрия из-за ригидности стенки поры.
Вследствие чего вход иона натрия в пору маловероятен.
Блокирование калиевых токов ионами щелочных
металлов. На ряде возбудимых мембран показано, что введение
внутрь клетки ионов цезия значительно увеличивает
продолжительность нисходящей фазы потенциалов действия и уменьшает следовую
гиперполяризацию. Дальнейшие исследования показали, что ионы
цезия могут проникать в калиевые каналы либо снаружи, либо
изнутри клетки и вызывать их блокирование. Блокирование четко
зависит от мембранного потенциала. Помимо ионов цезия ионы
натрия и лития при введении их внутрь клетки вызывают потенциало-
зависимое подавление тока калиевого канала. На рис. 135
показано зависящее от мембранного потенциала блокирование калиевого
тока при введении внутрь клетки различных концентраций ионов
натрия.
Зависимость блокирующего действия ионов от мембранного
потенциала рассматривают как доказательство того, что
блокирующий ион взаимодействует со структурами, расположенными в
глубине канала. Если предположить, что внутри канала имеется только
один участок 5, который связывает блокирующий ион В+, то такую
реакцию можно представить следуюшим образом:
S + В+ £ B+S,
где kx и £_! — константы скоростей.
Участок связывания S находится внутри канала в
электрическом поле, созданном мембранным потенциалом £, и константа
диссоциации реакции блокирования потенциалозависима — Kd(E)
к if\ *-i - IS] т
(9.39)
227
Соотношение числа проводящих (п0) и заблокированных (пв)
каналов выражается следующим образом:
(9.40)
п0 k_
Вероятность пребывания каналов в незаблокированном
состоянии (Р0) будет определяться следующим соотношением:
Сочетая (9.39), (9.40) и (9.41), получаем
Р."
1 + -£
KD(E)
(9.42)
Если S расположен в канале таким образом, что только часть
мембранного потенциала (6) оказывает влияние на вероятность
блокирования канала ионом В+, то константа диссоциации будет
зависеть от мембранного потенциала следующим образом:
Ко (Е) = Ко (0) е-*6™'*7, (9.43)
где Kd(0) — константа диссоциации в отсутствие трансмембранной
разности потенциалов.
Учитывая (9.43), уравнение (9.42) записывается следующим
образом:
Яп =
о
1+^к^вмтТ- (9'14)
Кальцийактивируемые калиевые каналы. Во многих
типах клеток рост концентрации ионизированного кальция в
цитоплазме ведет к активации калиевой проводимости плазматической
мембраны. Этот феномен, впервые обнаруженный Дж. Гардосом
(1958) на эритроцитах, обусловлен Са2+-активируемыми калиевыми
каналами. Такие каналы широко распространены в различных
клетках. Они играют важную роль в механизмах секреции,
ритмической активности нервных клеток, в процессе реполяризации после
возникновения потенциала действия. Использование техники
фиксации потенциалов на ограниченном участке мембраны и техники
встраивания ионных каналов в плоские липидные мембраны
позволило обнаружить несколько классов Са2+-активируемых калиевых
каналов (Сак-каналов). Различные разновидности этих каналов
отличаются друг от друга проводимостью одиночных каналсв,
ионной избирательностью. Они могут быть потенциалозависимыми
(т. е. их воротные механизмы реагируют на изменение
напряженности электрического поля в мембране) и потенциалонезависимыми.
Проводимость одиночных Сак-каналов во многих клетках очень
высока и сочетается с высокой ионной избирательностью. Такие
каналы названы макси-Са^каналами. Они обнаружены, в
частности, в плазматической мембране хромаффинных клеток
надпочечника, в Г-системе исчерченных мышц кролика. В симметричных
228
условиях, когда состав растворов по обе стороны мембраны
идентичен и концентрация ионов калия по обе стороны мембраны
составляет 160 мМ/л, проводимость одиночных Сак-каналов
плазматической мембраны хромаффинных клеток быка достигает 265 пСм.
Близкие значения проводимости в идентичных условиях
характерны для макси-Сак-каналов других клеток. Макси-Сак-каналы, как
правило, потенциалозависимы.
Малые Са^-каналы обнаружены в мембране эритроцитов, в аци-
нарных клетках поджелудочной железы крысы, в соматической
мембране нейронов моллюсков и других клетках. Проводимость
одиночных малых Сак-каналов не превышает 50 пСм. Эти каналы
могут быть как потенциалозависимыми, так и потенциалонезависимыми.
9.8. Свойства потенциалозависимых кальциевых каналов.
Поступление ионов кальция в клетку происходит в основном через
кальциевые каналы. Различают два класса этих каналов: потенци-
алозависимые и рецептор-управляемые. Второй класс кальциевых
каналов связан с мембранными рецепторами, взаимодействующими
в основном с нейромедиаторами и гормонами. Этот класс
значительно меньше изучен и не будет рассматриваться. Потенциалозависи-
мые кальциевые каналы обнаружены в плазматической мембране
практически всех клеток, обладающих электрической
возбудимостью, в частности, клеток сердечной мышцы, неисчерченных
мышечных (гладкомышечных) клеток, эндокринных клеток, мышечных
волокон членистоногих, нервных клеток, клеток электрорецепторов
скатов и т. д.
Важную роль в выяснении свойств потенциалозависимых
кальциевых каналов возбудимых мембран сыграли исследования на
мышечных волокнах ракообразных. В нормальных условиях в
ответ на электрическое раздражение здесь, как правило, не
возникают распространяющиеся потенциалы действия. Для мышечных
волокон ракообразных характерна рассредоточенная двигательная
иннервация. Активация их сократительных элементов происходит
благодаря почти одновременному возникновению возбуждающих
постсинаптических потенциалов по всей длине волокна.
При введении в наружный раствор ионов тетраэтиламмония
(ТЭА) или тетрабутиламмония (соединений, подавляющих калиевые
токи) мышечные волокна ракообразных приобретают способность
генерировать распространяющиеся продленные потенциалы
действия. На них не влияет удаление из наружного растЕОра ионов
натрия. В связи с этим был сделан вывод, что потенциалы действия
возникают в результате роста проницаемости мембраны для
двухвалентных катионов (П. Фэтт и Б. Катц, 1953). Затем было
показано, что растет проницаемость мембраны для ионов кальция, но не
для магния. Потенциалы действия возникали без предварительного
воздействия ионами ТЭА в том случае, когда в наружном растворе
были только ионы Sr или Ва. Аналогичные результаты были
получены при исследовании мышечных волокон насекомых.
Наиболее полная информация о способности двухвалентных
катионов переносить входящий ток в мышечных волокнах ракооб-
22*
разных получена С. Хагивара и сотрудниками в исследованиях на
мышцах морского желудя. Диаметр этих волокон достигает 0,5—
2 мм, а длина — 5—6 см. Они приобретали способность
генерировать потенциалы действия по типу «все или ничего»
приуменьшении внутриклеточной концентрации ионизированного кальция
путем инъекций кальций-хелатирующих веществ: ЭДТА, ЭГТА,
цитрата. В нормальных условиях внутриклеточная концентрация
ионов кальция составляла 10~7—10"вМ. Потенциал действия
возникал, когда она была ниже 8 • 10 "8 М.
Повышение наружной концентрации кальция оказывало
стабилизирующее влияние на мембрану (это выражалось в повышении
порога возникновения потенциала действия). Кроме того, возрастал
уровень максимума потенциала действия. При относительно
низких концентрациях происходило его увеличение приблизительно
на 29 мВ при десятикратном росте концентрации ионов кальция.
Оно согласуется с расчетом по формуле Нернста:
£са = !?1пЩ, (9.45)
где £са — равновесный потенциал для ионов кальция; [Са24]0 и
[Са2+]* — наружная и внутриклеточная концентрации
ионизированного кальция, соответственно.
Вместе с тем изменение внутриклеточной концентрации ионоэ
кальция внутри мышечного волокна с 8 • 10 ~8 до 8 • 10 "9 М не
влияло на величину максимума потенциала действия, хотя ЕСа
должен увеличиться при этом на 29 мВ. В различных клетках
внутриклеточная концентрация ионизированного кальция в Ю5—
10е раз ниже внеклеточной. £са составляет приблизительно
+ 145 —+175 мВ.
Роль ионов кальция как переносчиков входящего тока во время
потенциала действия подтверждается измерениями входа
радиоактивного 4бСа в мышечные волокна морского желудя. Вход ионов
кальция во время потенциала действия мышечных волокон
морского желудя изучают также путем инъекций экворина. Экворин
является протеином с молекулярной массой около 31000. Его
выделяют из медузы Aequorea forskalea. При взаимодействии с
ионизированным кальцием экворин люминесцирует, что можно обнаружить
при очень низких концентрациях кальция (10 ~8 М). Эту
способность экворина используют для выявления небольших количеств
ионизирующего кальция внутри клетки, а также для выявления
изменений концентрации ионизированного кальция во время
активности возбудимых клеток. При измерении концентрации
ионизированного кальция в цитоплазме широко используют краситель
асеназо-Ш и ряд флуоресцирующих кальциевых хелаторов.
С. Хагивара и К. Такахаши предположили, что важным
промежуточным этапом в механизме проникновения ионов кальция через
мембрану является их связывание с определенной структурой
кальциевого канала. Переход ионов кальция из наружного раствора
230
внутрь клетки схематически был представлен следующим
образом:
X + Са2+ «* ХСа -> X + Са,2+,
где X — место связывания кальция; Са02+ и Са?+ — ионы кальция,
находящиеся вне и внутри клетки, соответственно. Согласно
представленной схеме, ионы кальция могут проходить через кальциевые
каналы только внутрь клетки. Последующие исследования ряда
авторов показали, что через открытые кальциевые каналы из клетки
могут выходить ионы калия и другие одновалентные катионы
(концентрация К+ внутри клетки приблизительно в 10е раз выше, чем
концентрация Са2+).
Повышение концентрации кальция в наружном растворе
вызывает увеличение кальциевого тока только в определенных
пределах изменений концентрации, затем наблюдается насыщение.
Такого рода зависимость выражается следующим образом:
ICa(E)= /Cam;^r (9.46)
где /са (£)» /са max (£) и Кса (Е) — зависящие от мембранного
потенциала соответственно кальциевый ток, предельное значение
кальциевого тока н константа диссоциации.
Через кальциевые каналы достаточно легко проходят ионы
Sr2+ и Ва2+. Токи, переносимые ионами бария, нередко значительно
превышают кальциевые токи. Ионы бария обладают также
способностью подавлять калиевые токи. В этой связи в присутствии
ионов бария более четко выделяются токи, текущие по кальциевым
каналам. Для кальциевых каналов плазматической мембраны
гигантских мышечных волокон морского желудя характерно
следующее соотношечие токов при эквимолярных концентрациях: Са2+,
Sr2f, Ва24 в наружном растворе: /cd: /sr: /ва = 1,0 • 1,05: 1,3.
Многие двухвалентные ионы подавляют токи, текущие по
кальциевым каналам. В основе такого действия лежит конкурентное
связывание кальциевым каналом блокирующих ионов. Весьма
эффективно конкурируют с ионами кальция ионы лантана. По
данным С. Хагивары и К. Такахаши, по способности связываться
с кальциевыми каналами мембраны мышечных волокон морского
желудя катионы располагаются следующим образом: La3+, U02 + >
>Zn2+, Co2+, Fe2 + >Mn2+ >Ni2 + > Ca2 + >Mg2+. Ионы Ni2+,
Cd2+, Co2+ и Мп2+ широко используют в качестве блокаторов
кальциевых каналов.
При наличии в наружном растворе наряду с Са2+ других
двухвалентных катионов (М2+) (9.46) приобретает следующий вид:
1+ [Са*
■л\х + К[Л(Е))
231
CN
CH3
<M»0>^^^^C4i)»NCH,CHK^^jt)CHJ
СНзО"'^^ CH3 CHe ^^T>CH,
ВерапамИл
CN СН3
СН
^сьСсн, "^" ^осн3
'xY
ЗСН;
'з
D600
СНзООС,
сн; "n сн3
3 н 3
2N(CH3)2
Дилтиазем Нифедипин
Рис. 136. Органические блокаторы кальциевых каналов
где 1Л12+]0 — концентрация ионов М2+ в наружном растворе; Км (Е) —
константа диссоциации.
Имеется значительное количество органических блокаторов
кальциевых каналов. Они широко используются в клинике как
антиаритмические и сосудорасширяющие средства. Наиболее
распространенными органическими блокаторами являются верапамил
и его производное Д-600, нифедипин и дильтиазем. Структурные
формулы этих препаратов представлены на рис. 136.
При изучении свойств кальциевых каналов нейронов моллюсков
П. Г. Костюк и О. А. Крышталь обнаружили, что в бескальциеЕом
растворе, содержащем кальциевые хелаторы ЭГТА или ЭДТА,
происходит модификация кальциевых каналов. Такие каналы
сохраняют свою потенциалозависимость, но обладают способностью
пропускать натриевый ток. Натриевый ток подавляется при
введении в раствор ионов кальция, а также при блокировании
кальциевых каналов верапамилом или Д-600. Этот феномен объясняют
тем, что происходит устранение селективного фильтра кальциевых
каналов, расположенного у их входа, благодаря чему в канал
могут заходить ионы натрия. Аналогичные результаты были
получены на других возбудимых клетках: на сердечной мышце лягушки,
на ней счерченных мышечных клетках.
232
400mM[Nq]0
7,5мВ 1
OmM[Nq]0 _75mB
~ -Ш'(-
-2mB
1 ]lOOnA
'20мс ' +вмВ
a 6 *5mc
Рис. 137. Кальциевые токи, зарегистрированные при фиксации потенциалов
(Костюк, Крышталь, 1977; Фенвик и соавт., 1982):
а: токи, зарегистрированные на перфузируемом внутриклеточно нейроне виноградной
улитки в присутствии ионов натрия и в безнатриевом растворе; б: кальциевые токи,
зарегистрированные на изолированной хромаффинной клетке надпочечника
Активация кальциевых каналов обычно осуществляется
медленнее, чем натриевых. На рис. 137 приведены регистрации
кальциевых токов перфузируемого нейрона моллюска и хромаффинной
клетки. Для выделения токов, текущих по кальциевым каналам,
нередко подавляют калиевую проводимость мембраны путем
инъекции внутрь клетки ТЭА и Cs+. Иногда регистрацию осуществляют
в бариевом растворе. В экспериментах на перфузируемых клетках
внутрь клетки вводят раствор, не содержащий ионов калия, и Са-
хелатирующие вещества.
Инактивация кальциевых каналов более сложна, чем натриевых.
В дополнение к потенциалозависимой инактивации в некоторых
клетках обнаружена инактивация, зависящая от силы входящего
в клетку кальциевого тока. Чем выше сила тока, тем быстрее
осуществляется инактивация. Зависящую от кальциевого тока
инактивацию кальциевых каналов рассматривают как результат
повышения внутриклеточной концентрации ионизированного кальция.
Выше было сказано, что необходимым условием для возникновения
кальциевых потенциалов действия в мышечных волокнах морского
желудя было значительное снижение внутриклеточной
концентрации ионизированного кальция путем инъекции Са-хелатирующих
веществ. Исследования на перфузированных нейронах моллюсков,
проведенные П. Г. Костюком и сотрудниками, а также и другими
исследователями, показали, что когда внутриклеточная
концентрация Са2+ превышает 10 ~7—10 ~6 М/л, функция кальциевых каналов
обратимо подавлена. Введение внутрь клетки Са-хелатирукщих
веществ препятствует инактивации кальциевых каналов, вызванной
притоком ионов кальция в клетку.
Кальциевые каналы регулируются и модулируются различными
физиологическими факторами. Впервые это было обнаружено Рой-
тером и Шольцем при изучении действия адреналина и норадренали-
на на кальциевые токи в миокарде млекопитающих и амфибий.
Предполагают, что эти вещества усиливают кальциевый ток,
взаимодействуя с (3-адренорецепторами. Их активация приводит к
повышению внутриклеточной концентрации циклического адекозин
монофосфата (цАМФ), что, в свою очередь, вызывает активацию
233
протеинкиназы, катализирующей обратимое фосфорилирование
кальциевых каналов. Это является необходимым условием для их
функционирования.
Роль внутриклеточного цАМФ в деятельности кальциевых
каналов плазматической мембраны тела нервных клеток моллюсков
и млекопитающих была детально изучена и на внутриклеточно
перфузируемых нейронах. На этом объекте были получены данные,
которые также интерпретированы с позиций гипотезы фосфорили-
рования кальциевых каналов.
9.9. Хлорные каналы. Распределение ионов хлора (см. табл. 12)
между внутренним содержимым клетки и внеклеточной средой
такою, что хлорный равновесный потенциал Еа может быть
близок к потенциалу покоя. Ранее указывалось, что калиевая
проводимость препятствует возникновению потенциалов действия в
мышечных волокнах членистоногих. В какой-то мере подобную функцию
в некоторых возбудимых клетках, по-видимому, может выполнять
хлорная проводимость мембраны. Клеточная мембрана фазных
(быстрых) скелетных мышечных волокон позвоночных в состоянии
покоя в 3—10 раз более проницаема для ионов хлора, чем дая
калия. Хлорная проницаемость здесь весьма слабо зависит от
мембранного потенциала. Хлорные каналы скелетных мышечных
волокон проницаемы для многих небольших анионов: Br", I", No",
SCN~. В связи с тем что проводимость мембраны в покое наиболее
значительна для ионов хлора, эти ионы распределены между клсч-
кой и наружной средой фактически в соответствии с состоянием
равновесия. Хлорная проводимость стабилизирует здесь
мембранный потенциал.
Хлорные каналы, обладающие хорошо выраженной потенциало-
зависимостью, были обнаружены при встраивании мембранных
цузырьков, полученных из ткани электрического органа ската
Torpedo в липидный двуслой, и регистрации токов одиночных
каналов Эти хлорные каналы обладают высокой избирательностью.
Из перечисленных выше анионов через них проходят только ионы
О" и Вг". Потеициалозависимые хлорные каналы обнаружены и в
некоторых других клетках, в частности эмбриональных мышцах
крысы в культуре.
9.10. Синтез ионных каналов плазматической мембраны.
Синтез мембранных белков, в частности ионных каналов, а также секре-
тируемых клеткой белков происходит на шероховатом эндоплазма-
тическом ретикулуме. Во время синтеза эти белки проникают в
цистерны эндоплазматического ретикулума. Перед транспортировкой
их в другие пункты они представляют собой гликопротеины. Затем
они транспортируются в аппарат Гольджи. Белки, гсступающие
в полость аппарата Гольджи, подвергаются разнообразным кова-
лентным модификациям, в результате которых они приобретают
свои конечные зрелые формы. Белки, выходящие из аппарата
Гольджи, направляются в многочисленные пункты назначения.
Правильная сортировка белков — одна из главных функций
аппарата Гольджи. В нейронах синтез ионных каналов осуществляется
234
в теле клетки. Они затем транспортируются в аксон, дендриты
и нервные окончания.
Динамический характер популяции ионных каналов легко
обнаружить при изучении тех изменений возбудимости, которые
происходят во время эмбрионального развития или после денервации.
Для фазных скелетных мышечных волокон позвоночных характерно
наличие холинорецепторов (ионных каналов, управляемых аце-
тилхолинбм) только в области синапсов (концевых пластинок).
Натриевые каналы плазматической мембраны характеризуются высокой
чувствительностью к тетродотоксину. После денервации
увеличивается скорость синтеза холинорецепторов, и они
распространяются по всей поверхности мышечного волокна, а не только в области
концевой пластинки, как до денервации. Они имеют меньшую
проводимость и большее время жизни в открытом состоянии, чем
нормальные холинорецепторы. Кроме того, в плазматической мембране
появляются натриевые каналы, которые в 1000 раз менее
чувствительны к блокированию тетродотоксином, чем нормальные.
Воротные процессы в этих каналах протекают значительно медленнее.
(Подобными свойствами обладают холинорецепторы и натриевые
каналы неиннервированных эмбриональных мышц в тканевой
культуре). После реиннервации исчезают холинорецепторы,
расположенные вне синап сеж, исчезают также натриевые каналы, мало
чувствительные к тетродотоксину.
Глава 10. МЕХАНИЗМЫ МЕЖКЛЕТОЧНЫХ
ВЗАИМОДЕЙСТВИЙ
У одноклеточных организмов единственная клетка осуществляет
все функции, необходимые для жизнедеятельности: она
передвигается, усваивает питательные вещества из окружающей среды,
в процессе обмена веществ извлекает из них энергию и синтезирует
молекулы. В многоклеточных организмах ситуация гораздо
сложнее. Эволюция многоклеточных организмов основана на
способности клеток поддерживать связь друг с другом. Эта способносчь
необходима для регуляции развития клеток и для их организации
в ткани, для контроля роста и деления клеток и для координации
их разнообразной активности. Та или иная задача решается силами
многих совершенно различных клеточных популяций, тканей и
органов, часто находящихся на значительном расстоянии друг от
друга. Для осуществления различных функций организма должны
существовать механизмы, посредством которых отдельные клетки
или их группы могли бы взаимодействовать между собой.
Между соседними клетками может поддерживаться
непосредственная связь при помощи высокопроницаемых контактов, которые
называют щелевыми соединениями» Основная роль в координации
функции клеток организма принадлежит нервной и
эндокринной системе Чаще всего нервные клетки, также как и
эндокринные, осуществляют химическую сигнализацию. Отличие
состоит в том, что нервные клетки передают сигналы значительно
235
быстрее, чем эндокринные. В виде потенциала действия
электрический сигнал быстро распространяется по нервному волокну. В
нервном окончании он преобразуется в химический сигнал. Здесь
происходит выделение нейромедиатора. Нейромедиатор достигает
клетки-мишени путем диффузии на микроскопически малое
расстояние, что обычно занимает менее одной миллисекунды.
Эндокринная система осуществляет секрецию многообразной
группы веществ, называемых гормонами. Гормоны доставляются
кровью к месту их действия. Они специфическим образом меняют
активность определенных чувствительных к ним клеток-мишеней.
Гормон, выделяемый эндокринными клетками, попадая в
кровоток, очень сильно разбавляется. Гормоны способны действовать
в чрезвычайно низких концентрациях (ниже Ю-8 М/л). Медиаторы
разбавляются незначительно. Их концентрация у определенного
участка клетки-мишени может быть велика. Например,
концентрация ацетилхолина в синаптической щели нервно-мышечного
соединения достигает приблизительно 5 • 10"4 М/л. В других отношениях
механизмы химической сигнализации с помощью гормонов и
медиаторов в общих чертах сходны, и многие сигнальные молекулы,
используемые эндокринными клетками, являются также и
медиаторами.
Способность клетки реагировать на определенные сигнальные
молекулы зависит от наличия у нее специфических
белков-рецепторов, которые связывают эти молекулы.
10.1. Щелевые соединения. Щелевые соединения между
клетками широко распространены в животном мире. Они позволяют
небольшим водорастворимым молекулам непосредственно
переходить из цитоплазмы одной клетки в цитоплазму другой и
обеспечивают электрическое и метаболическое сопряжение клеток.
Современное представление о структуре щелевого соединения основано на
данных электронной микроскопии и рентгеноструктурного анализа.
Как показано на рис. 138, щелевые соединения построены из белков,
выступающих из плазматической мембраны и образующих
структуры, называемые коннексонами. Они соединяют цитозоль двух
взаимодействующих клеток непрерывным водным каналом.
Каждый коннексон состоит из 6 белковых субъединиц. В результате
соединения двух коннексонов образуется канал, связывающий одну
клетку с другой.
Для определения внутреннего размера щелевых соединений
производили микроинъекции ряда флуоресцирующих веществ в
одни клетки и затем наблюдали, как распространяется
флуоресценция в соседние клетки. При этом выяснилось,что вещества с
молекулярной массойдо 1000—1500 могут переходить из клетки в клетку.
По щелевым соединениям из одной клетки в другую могут
поступать неорганические ионы, сахара, аминокислоты, нуклеотиды.
Судя по этим результатам, эффективный диаметр водного канала
составляет 1,5—2 нм.
Щелевые соединения, благодаря электрическому сопряжению,
обеспечивают синхронизацию сокращения клеток сердечной мышцы
236
ЦиШлазма
Ионы,
оминокислоты,
Сахара, <■
нухлеотиды
Рис. 138. Щелевое соединение (Бретчер, 1986)
и клеток гладкой мускулатуры. Электрические
синапсы,формируемые щелевыми соединениями, позволяют потенциалам действия
распространяться с клетки на клетку без задержки, происходящей
в химических синапсах.
Сопряжение клеток через щелевые соединения играет важную
роль в эмбриогенезе. У раннего эмбриона большинство клеток
электрически сопряжены друг с другом. Предполагают, что
имеющееся в этом случае и метаболическое сопряжение может служить
важным способом распределения питательных веществ до того,
как разовьется система кровообращения.
Проницаемость щелевых соединений регулируется ионами
кальция. Уменьшение межклеточных связей происходит при погружении
ткани в раствор с очень низкой концентрацией ионов кальция.
Что же касается внутриклеточной концентрации ионов кальция,
то межклеточные каналы полностью открыты при концентрации
Са2+ ниже 10 ~7 М/л и полностью закрыты при концентрации
кальция, превышающей 5 • 10~5 М/л. При гибели или повреждении
клетки необходимо, чтобы она быстро отсоединилась от своих
соседей. Это происходит в результате сильного повышения
внутриклеточной концентрации ионизированного кальция, который либо
входит в клетку через поврежденную плазматическую мембрану,
либо накапливается из-за того, что поврежденная клетка не
способна эффективно откачивать Са2+ из цитозоля. Экспериментальные
воздействия, снижающие рН внутри клетки, быстро и обратимо
уменьшают проницаемость щелевых соединений.
Потенциалозависимость проводимости щелевых соединений была
обнаружена при изучении выпрямляющего электрического
синапса в нервной системе речного рака. Потенциалозависимость
щелевых соединений затем была обнаружена при изучении связей между
клетками эмбриона амфибий на ранних стадиях развития.
237
10.2. Синаптическая передача. Нервные клетки образуют со
своими клетками-мишенями специализированные контакты,
которые названы синапсами. Название «синапс» было дано английским
нейрофизиологом Ч. Шеррингтоном в конце прошлого столетия.
У млекопитающих обычно встречаются химические синапсы. В
синапсах этого типа при поступлении потенциала действия к
окончанию аксона происходит освобождение химического вещества,
которое вызывает возбуждение или торможение в иннервируемой клетке.
Значительно реже встречаются электрические синапсы. Здесь
потенциал действия в нервном окончании вызывает в иннервируемой
клетке возбуждение или торможение без выделения химического
вещества. У некоторых организмов обнаружены синапсы
смешанного типа, в которых передача осуществляется как электрическим,
так и химическим путем. На рис. 139 схематически изображены три
типа синапсов.
Химические синапсы. Характерной особенностью
химических синапсов является присутствие в пресинаптической структуре
(нервном окончании) внутриклеточных синаптических пузырьксв
диаметром 20—80 нм. Они содержат высокие концентрации
медиаторов. В химических синапсах пресинаптическая и постсинаптиче-
ская области отделены друг от друга синаптической щелью
шириной 10—50 нм. Расчеты показывают, что при такой ширине щели
электрическая передача возбуждения практически невозможна
из-за значительного шунтирующего эффекта. В химических
синапсах сигналы передаются только в одном направлении — от
пресинаптического участка к постсинаптическому. Схема
химического синапса представлена на рис. 139.
Для химических синапсов характерна синаптическая задержка.
Она представляет собой интервал между возникновением
потенциала действия в нервном окончании и синаптическим потенциалом
в постсинаптической области синапса (постсинаптическим
потенциалом). Синаптическая задержка в синапсах млекопитающих
составляет приблизительно 0,3 мс. В некоторых случаях она может
быть значительно большей. Часть задержки связана с событиями,
вызывающими процесс секреции нейромедиатора; определенный
компонент задержки обусловлен диффузией нейромедиатора через
синаптическую щель и связыванием его с рецептором. В некоторых
синапсах взаимодействие нейромедиатора с рецептором вызывает
появление вторичного посредника, который, в свою очередь,
активирует ионные каналы, что вызывает появление постсинаптиче-
ского потенциала. Эти события также вносят определенный вклад
в синаптическую задержку.
Электрические синапсы. На рис. 139показано,что для
электрических синапсов характерно отсутствие синаптических
пузырьков. Ширина синаптической щели составляет приблизительно
2—3,5 нм. Непосредственная электрическая связь между
пресинаптической и постсинаптической структурой осуществляется
благодаря наличию щелевого соединения, и она чаще всего
двусторонняя. Изредка электрические синапсы обладают четко выраженньми
238
0 2 4 б д 10 12 14 16мс
Рис. 139. Химические и электрические синапсы:
а: елева — структура химического синапса, состоящего из нервного окончания, в котором
находятся синаптические пузырьки (пресинаптическая структура), синаптической щели
и субсинаптической мембраны, в которой находятся рецепторы, взаимодействующие с
«едиатором Стрелка указывает направление передачи сигнала Справа вверху показан
возбуждающий и внизу тирмозной псстсинаптические потенциалы. Показано nai равление
токов, текущих через активированную субсинаптическую мембрану и постсин^тическую
мембрану при возникновении возбуждающего и тормозного постеннаптических
потенциалов, б: схематическое изображение электрического синапса и синапса смешанного
1ипа, где синаптическая передача осуществляется электрическим и химическим путем;
/ — электрический синапс, 2 — синапс смешанного типа
выпрямляющими свойствами. В этом случае электрический синапс
передает сигнал только в одном направлении. Примером такого
рода синапса является гигантский двигательный синапс в нервней
системе речного рака.
Для электрических синапсов характерно практически полное
отсутствие синаптической задержки. Электрические синапсы
преимущественно возбуждающие.
Синапсы смешанного типа. Такого рода синапсам
свойственно наличие двух механизмов синаптической передачи: химического
и электрического (см. рис. 139). Синапсы смешанного типа впервые
были обнаружены на нейронах реснитчатого ганглия цыпленка.
Проведение через электрические синапсы происходит
значительно быстрее, чем через химические. Электрические синапсы
между нейронами нередко обеспечивают синхронизацию их
импульсной активности. Решающую роль в функции центральной
нервной системы играют химические синапсы. Одностороннее
проведение химических синапсов необходимо для упорядоченной
деятельности нервной системы. Эффективность химических синапсов
может подвергаться модификации. Так, при частом использовании
синапса передача происходит лучше, чем при более редком. Таким
239
образом, химические синапсы обладают определенной степенью
пластичности и участвуют в таких функциях, как обучение и
память. Химические синапсы являются местом приложения многих
фармакологических веществ, в частности психомиметических
(средств, оказывающих влияние на психическую деятельность
человека).
Секреция нейромедиаторов нервными окончаниями.
При изучении нервно-мышечного синапса лягушки было
обнаружено, что необходимым условием для выделения медиатора нервными
окончаниями является присутствие ионов кальция. Их
антагонистами являются ионы магния. Во время потенциала действия
в нервное окончание проникают ионы кальция, что вызывает
секрецию нейромедиатора.
При изучении химических синапсов нередко возникают
большие трудности при идентификации нейромедиаторов. Вещество
можно рассматривать как медиатор, если оно удовлетворяет
следующим критериям:
а) синтезируется в нейроне;
б) присутствует в пресинаптическом окончании и освобождается
в достаточном количестве, чтобы оказать соответствующее
воздействие на клетку-мишень;
в) когда прикладывается к области синапса в соответствующих
концентрациях, то имитирует действие освобождаемого из
окончания медиатора;
г) существует специальный механизм, удаляющий
рассматриваемое вещество из синаптической щели.
В настоящее время в качестве медиаторов достоверно
идентифицированы следующие вещества: ацетилхолин; катехоламины —
дофамин, адреналин и норадреналин; 5-гидрокситриптамин (серо-
тонин); гистамин; дикарбоновые аминокислоты — глутаминовая
и аспарагиновая (возбуждающие аминокислоты); у-аминомасляная
кислота (ГАМК) и глицин (тормозящие аминокислоты; рис. 140).
(Катехоламины и 5-гидрокситриптамин относят к группе веществ,
носящих название биогенные амины.)
Ферменты, катализирующие синтез перечисленных
низкомолекулярных нейромедиаторов, синтезируются на полирибосомах в теле
нейрона, а затем, благодаря системе аксонного транспорта, они
могут распространяться в нервные окончания. Здесь, в цитозоле,
могут синтезироваться нейромедиаторы.
В течение длительного времени было распространено мнение,
что все нервные окончания одного и того же нейрона выделяют
один и тот же нейромедиатор (принцип Дейла). В настоящее время
показано, что развивающиеся нейроны синтезируют и выделяют-
более одного нейромедиатора. Наряду с низкомолекулярными
медиаторами выделяются и нейроактивные пептиды. Имеются данные,
что подобные события происходят и в нервных окончаниях зрелых
нейронов.
Количество известных нейроактивных пептидов постоянно
увеличивается, и в настоящее время их описано около 50. Они обла-
240
ft сн3 но^ ^ ^ nh> но. ^ jL Ун*
СНгС-ОСН2СН2- N^CHa
1^
сн3- но' "^ но'
I 2
)Crtrv -ххт~" «;
СН2 (СН2)Л СН NH2 CH2 (СН2)Л NH2
соон соон соон
п =» 0-1 /1=0-4
7 8
Рис. 140. Нейромедиаторы:
/ — ацетилхолин; 2 — дофамин; 3 — иорадреналин; 4 — адреналин; 5 — 5-гидрокситриптамин
(серотонин); — 6 гистамин; 7 — возбуждающие дикарбоновые аминокислоты (глютамат,
аспартат); 8 — тормозящие аминокислоты (у-аминомасляная кислота, глицин)
дают высокой биологической активностью. Некоторые из них были
обнаружены вначале в пищеварительной системе, а затем в
нервной, например сосудоактивный кишечный пептид (вазоактивный
интестинальный пептид—ВИП), холецистокинин. Нейроактивные
пептиды выполняют функцию гормонов, нейромедиаторов и вейро-
модуляторов. В последнем случае они модулируют активность
не посредством взаимодействия с рецепторами субсинаптической
мембраны (область плазматической мембраны постсинаптическоГ*
структуры, непосредственно прилегающая к нервному окончанию),
а действуя на нейрон как гормоны.
Описан ряд сочетаний нейроактивных пептидов с
низкомолекулярными нейромедиаторами. Ацетилхолин может выделяться
нервными окончаниями совместно с сосудоактивным кишечным
пептидом; иорадреналин совместна с соматостатином, энкефалином
и нейротензином; дофамин может секретироваться совместно с
холецистокинином и энкефалином; адреналин — с энкефалином;
5-гидрокситриптамин может сочетаться с веществом Р.
Нейроактивные пептиды, как и другие секретируемые
протеины, синтезируются в теле нервной клетки на полирибосомах,
которые связаны с шероховатым эндоплазматическим ретикулумом
(см. параграф 6.3). Нейроактивные пептиды или их
предшественники покидают аппарат Гольджи в секреторных гранулах и
перемещаются к нервным окончаниям с помощью системы быстрого ак-
сонного транспорта.
Постсинаптические потенциалы. Взаимодействие нейро-
медиатора с рецепторами субсинаптической мембраны приводит
обычно к возникновению постсинаптического потенциала.
Постсинаптические потенциалы могут быть как деполяризующими, так
241
и гиперполяризующими. Деполяризующие потенциалы являются
возбуждающими, а гиперполяризующие — тормозящими, их
обозначают соответственно ВПСП и ТПСП. На рис. 139 показан ВПСП,
зарегистрированный с помощью внутриклеточного микроэлектрода
на мотонейроне кошки, и направление синаптических токов.
Возникновение ВПСП обычно связано с увеличением
проводимости субсинаптической мембраны для ионов Na+, К + и, возможно,
Са2+, обусловленное активацией ионных каналов, обладающих
низкой избирательностью. Потенциал реверсии (см. параграф 8.4)
для возникающего при этом синаптического тока приблизительно
равен 0 мВ. В рассматриваемом случае через активированные
каналы ионы калия выходят из клетки, а ионы натрия проникают в
клетку. Как показано на рис. 139, суммарный ток через субсинаптиче-
скую мембрану направлен в клетку. В некоторых случаях ВПСП
возникает в результате понижения проводимости мембраны для
ионов калия. При этом взаимодействие нейромедиатора с
рецептором приводит к появлению внутри клетки вторичного посредника,
который вызывает ряд событий, приводящих к закрыванию
(деактивации) калиевых каналов (см. параграф 10.3).
Нейромедиаторы, вызывающие возникновение ТПСП,
активируют либо хлорные, либо калиевые каналы. Равновесные
потенциалы для этих ионов в нервных клетках ЕС\ и £к составляют
соответственно —60 и —70 мВ. Потенциал покоя составляет
приблизительно —50 мВ. Активация как хлорных, так и калиевых каналов
вызывает гиперполяризацию мембраны. Направление
синаптического тока во время ТПСП показано на рис.139. Он течет через
активированные нейромедиатором каналы из клетки.
Для изучения свойств ионных каналов, активируемых нейроме-
диаторами, широко используют регистрацию токов, текущих через
одиночные ионные каналы в условиях фиксации потенциала на
фрагменте мембраны (пэтч-клэмп). На рис. 141 сопоставлены ответы
одиночных каналов ацетилхолинового рецептора (возбуждающие
ответы) и ответы одиночных каналов ГАМК рецептора при
различных значениях мембранного потенциала. Ответы на ацетилхолин
зарегистрированы на эмбриональной мышце крысы, а ответы на
ГАМК — на нейронах гиппокампа крысы. При смещении
мембранного потенциала в положительном направлении (при
деполяризации) входящие токи, текущие через канал ацетилхолинового
рецептора, уменьшались. При нулевом мембранном потенциале
(потенциале реверсии ВПСП) ток, текущий через открытый канал,
становился равным нулю. Дальнейшее смещение мембранного потенциала
до +20 мВ привело к изменению направления тока. (Отклонение
линии регистрации вниз соответствует входящему току, а
отклонение вверх — выходящему току.) Ток, текущий через канал,
активируемый ГАМК, при —60 мВ был равен нулю. Этот потенциал
соответствует потенциалу реверсии для ТПСП. Смещение
мембранного потенциала в положительном направлении вызывало
увеличение выходящего тока, текущего через канал, активируемый
ГАМК.
242
Ацетилхолин
+20 Mb
w\| ^фЧЛчМ/Л AwM \цЛи» К
ГАМК
а+»'амыЬ'ЧаА—^Ч/^""\;
ОмВ
>Л^и^vлyvлyv^^^VW^'Vv^
JDUA^Affiyyi
■ft
I—L
^f/r\f^j^m/f^I>^.
-ЗОмд *-f*r
-ИХПГ
VnSAV'^V
-/HN—
*VJ w
J^r
-60 мВ ***ъ*Ы*\
Ц)
I L. b^
a , I
20mc
5
J
/л4
Рис. 141. Токи одиночных каналов ацетилхолинового рецептора
(возбуждающий синапс эмбриональной мышцы крысы; а) и ГАМК рецептора
(тормозной синапс нейрона гиппокампа крысы; б), зарегистрированные при различных
значениях мембранного потенциала, указанных слева (регистрации Сакмана,
1983)
Наиболее изученным химическим возбуждающим синапсом
является нервно-мышечное соединение позвоночных (двигательная
концевая пластинка) на исчерченных скелетных мышечных волок-
н?х амфибий. Медиатором здесь служит ацетилхолин.
Пришедший к синапсу нервный импульс вызывает
высвобождение ацетилхолина в синаптическую щель. Далее молекулы ацетил-
хотина диффундируют через щель и достигают постсинаптической
мембраны, где связываются со специфическими рецепторными
молекулами. Это приводит к деполяризации постсинаптической
мембраны, и далее к возникновению в мышечном волокне
распространяющегося потенциала действия. На рис. 142 приведена
эквивалентная электрическая цепь, изображающая активированное
нервно-мышечное соединение. Стрелки указывают направление тока.
Ацетилхолин гидролизуется ацетилхолинэстеразой, и постсинапти-
ческая мембрана поляризуется вновь.
243
Синаптическая
мембрана
£
Наружная поверхность
Несинаптиг
чбСкая
мембрана
И060м
210*0м |-
^впсп
ОмВ
I
4=" Ф
Т
Внутренняя поверхность
Рис. 142. Эквивалентная электрическая цепь, иллюстрирующая направление
токов и изменение мембранного потенциала постсинаптической мембраны при
активации нервно-мышечного соединения. В ветвь, изображающую синап-
тическую мембрану, включены: источник электродвижущей силы ^впсп»
сопротивление, обозначенное как /?ВПсп и ключ С» замыкающий и размыка»
ющий цепь. Участок цепи, изображающий мембрану мышечного волокна,
содержит источник электродвижущей силы £м, сопротивление /?м и
электрическую емкость См. VM — мембранный потенциал в области активированного
нервно-мышечного соединения
Ацетилхолин синтезируется в области пресинаптического
окончания аксона путем переноса ацетильной группы от ацетил-КоА
на холин. Фермент, катализирующий эту реакцию, — холинацетил-
трансфераза (холинацетилаза). Далее часть образовавшегося
ацетилхолина попадает в синаптические пузырьки, а часть остается
в цитозоле. В одном холинергическом синаптическом пузырьке
(обычно 40 нм диаметром) содержится около 10 000 молекул
ацетилхолина.
Две молекулы ацетилхолина связываются с молекулой
рецептора, вызывая при этом такие изменения конформации, которые
открывают канал. Схематически кинетику процесса,
согласующуюся с экспериментальными данными, можно описать следующим
образом
2А + /?^А2#^А2Я*,
где А—молекула ацетилхолина; R — закрытый канал; /?*—
открытый канал. За полупериод жизни открытого канала, равный
всего лишь 1 мс, по нему проходит примерно Ю4 ионов.
Продолжительное воздействие ацетилхолина на рецептор приводит к его
десенситизации: канал закрывается и реакция на ацетилхолин
исчезает на длительный промежуток времени.
244
Проведенное Б. Катцем изучение передачи нервного импульса
в участках нервно-мышечного соединения показало, что ацетилхо-
лин высвобождается из пресинаптической мембраны порциями
(квантами) по 104 молекул. Доказательство квантового
высвобождения ацетилхолина было получено при анализе мембранного
потенциала двигательной концевой пластинки, которой свойственна
спонтанная электрическая активность даже в отсутствие
стимуляции нерва. Деполяризующие импульсы с амплитудой 0,5 мВ и
длительность около 20 мс возникают залпами. Это так называемые
миниатюрные потенциалы концевых пластинок; они возникают
случайно с вероятностью, сохраняющейся постоянной на протяжении
длительного времени. Миниатюрный потенциал концевой пластинки
вызывается спонтанным высвобождением одиночного синаптиче-
ского пузырька. Деполяризация концевой пластинки, создаваемая
потенциалом действия, обусловлена синхронным высвобождением
примерно 100 квантов ацетилхолина. Таким образом высвобождение
ацетилхолина представляет собой электрически регулируемую
форму секреции. Высвобождение ацетилхолина зависит от
присутствия Са2+ во внеклеточной жидкости. При деполяризации
пресинаптической мембраны происходит вход Са2+, что способствует
слиянию мембраны синаптических пузырьков с пресинаптической
мембраной.
В последние годы сделаны большие успехи в очистке
никотиновых ацетилхолиновых рецепторов и реконструировании
функционально активных мембранных пузырьков. Наиболее подходящий
исходный материал для таких исследований — электрический орган
ската Torpedo, который очень богат ацетил холи новыми
рецепторами.
Для того чтобы идентифицировать рецептор в смеси
макромолекул, его необходимо специфически пометить. Для этого
используют нейротоксины змей, в частности а-бунгаротоксин (токсин
из яда змеи с о. Тайвань) и кобратоксин (токсин из яда кобры).
Указанные нейротоксины блокируют нейромышечное проведение,
связываясь с рецепторами ацетилхолина на двигательных
концевых пластинках или на иннервируемой поверхности электрических
пластинок электрического органа. Нейротоксины представляют
собой небольшие основные белки с молекулярной массой около
7000, Их можно пометить радиоактивным изотопом с высокой
удельной радиоактивностью. Меченый кобратоксин прочно связывается
с ацетилхолиновым рецептором (константа диссоциации — порядка
Ю~9 М) и, что особенно важно, практически не связывается с
другими макромолекулами постсинаптической мембраны. Таким
образом, рецепторы ацетилхолина можно специфически пометить
радиоактивными атомами.
Путем обработки фрагментов мембраны неионным детергентом
(таким, как производное поликсиэтилена — твин-80) удалось со-
любилизировать рецепторы ацетилхолина электрического органа,
а затем их очистить. Ацетилхолиновый рецептор представляет собой
комплекс, состоящий из четырех типов субъединиц (а, р, у и 8)
245
с молекулярной массой, равной соответственно 40000, 50000,
60000 и 65000. В комплекс входят 2 а субъединицы, каждая из
которых обладает способностью связывать ацетилхолин. Удалось
получить мембранные пузырьки, содержащие очищенные рецепторы
ацетилхолина; для этого к раствору рецепторов добавляли фосфоли-
пиды и затем удаляли диализом детергент. Показано, что
радиоактивные ионы натрия (22Na+), включенные в процессе
реконструирования пузырьков в их внутреннее водное пространство,
высвобождаются при добавлении ацетилхолина или его аналогов,
например карбамилхолина или суберилхолина. Высвобождение ионов
натрия блокируют бунгаротоксин и обычные антагонисты
ацетилхолина; следовательно, оно опосредовано специфическим
взаимодействием ацетилхолина со связанным с мембраной рецептором.
Для восстановления возбудимости постсинаптической мембраны
необходимо выключение деполяризующего сигнала. Эту функцию
выполняет ацетилхолинэстераза, открытая Д. Нахманзоном в 1938 г.
Фермент гидролизует ацетилхолин до ацетата и холина. В
результате проницаемость постсинаптической мембраны возвращается
к исходному уровню и мембрана реполяризуется.
Ацетилхолинэстераза локализована в синаптической щели. Молекулярная масса
фермента — 260 000, субъединичная структура — <х2р2. Фермент
характеризуется поразительно высоким числом оборотов, а именно
25000 с*"1. Это означает, что одна молекула ацетилхолина
расщепляется за 40 мкс. Такое высокое число оборотов фермента имеет
очень важное значение для быстрого восстановления
поляризованного состояния постсинаптической мембраны. Синапсы способны
передавать тысячу импульсов в секунду только потому, что пост-
синаптическая мембрана восстанавливает свою поляризованность
за доли миллисекунды.
Ингибиторы ацетилхолинэстеразы, в частности физостигмин,
неостигмин, используются как лекарственные средства.
Терапевтические и токсические свойства ингибиторов ацетилхолинэстеразы
нашли широкое практическое применение.
Блокаторами нервно-мышечного проведения служат также
соединения, непосредственно воздействующие на ацетилхолиновый
рецептор. К ним относится кураре. Одним из активных компонентов
кураре является d-тубокурарин. Тубокурарин подавляет
деполяризацию концевых пластинок, конкурируя с ацетилхолином за
связывание с рецептором. Аналогичным путем действуютсс-бунгаротоксин
и кобратоксин. В отличие от этого такие вещества, как декаметоний
и сукцинилхолин, соединяются с рецептором ацетилхолина,
вызывая устойчивую деполяризацию концевой пластинки. В хирургии
в качестве препарата, вызывающего расслабление мышц,
используется аналог ацетилхолина — сукцинилхолин.
Существуют два основных типа ацетил холи новых рецепторов:
никотиновые и мускариновые. Оба типа связывают ацетилхолин,
но существуют агонисты (вещества, имитирующие действие
ацетилхолина)— никотин и мускарин, которые связываются
исключительно только с одним из типов рецепторов. Антагонист d-тубокурарин
246
связывается только с никотиновым рецептором. Два типа
рецепторов отличаются биохимически, и они выполняют различные фуньции
в нервной системе. Рецепторы, локализованные в двигательных
синапсах скелетных мышечных волокон, являются никотиновыми.
В симпатических нейронах и в некоторых нейронах гиппокампа и
коры мозга ацетилхолин взаимодействует с мускари новыми
рецепторами, Адаме и сотрудники обнаружили, что взаимодействие ацетил-
холина с мускариновыми рецепторами приводит к закрыванию
(деактивации) калиевых каналов, которые были названы М-кана-
лами. Они расположены по всей поверхности клетки. Действие
нейромедиатора на рецептор вызывает синтез внутриклеточного
вторичного посредника, который диффундирует внутри клетки и
вызывает события, которые приводят к деактивации калиевых
каналов, расположенных вдали от синапса. Закрывание калиевых
каналов приводит к деполяризации мембраны Мембрана умеренно
проницаема для ионов натрия, в связи с чем деактивация калиевых
каналов смещает мембранный потенциал в направлении натриевого
равновесного потенциала. Синапгическое действие, связанное с
деактивацией калиевых каналов, развивается медленно и длится
на протяжении секунд* а иногда и минут.
10.3. Эндокринная система. Функции нервной и эндокринной
системы тесно связаны; координирующим центром эндокринной
системы является участок мозга гипоталамус. Гипоталамус
расположен непосредственно над гипофизом и соединен с ним ножкой
гипофиза. Гипоталамус осуществляет свою посредническую функ-
. цию с помощью клеток, сочетающих особенности нейрона и
эндокринной клетки: у них есть отростки, способные проводить
электрические импульсы и в то же время выбрасывать сигнальные
молекулы в кровь. Такие клетки называются нейросекреторными. При
стимуляции нейросекреторной клетки гипоталамуса в кровеносные
сосуды гипофизарной ножки выделяются определенные пептид* ые
гормоны, которые затем специфически стимулируют или
подавляют секрецию гипофизом других гормонов. Многие из гормонов
гипофиза, секреция которых находится под контролем гипоталамуса,
стимулируют какую-либо из других эндокринных желез и
вызывают секрецию в кровь третьего гормона.
Гормоны, выделяемые эндокринными клетками, регулируют
обмен веществ, рост клеток и тканей, ритм сердца, артериальное
давление, работу почек, перистальтику кишок, выделение
пищеварительных ферментов, лактацию, работу репродуктивной системы
и т. п. По своей химической природе гормоны очень разнообразны.
Некоторые, например адреналин и тироксин, представляют собой
небольшие молекулы—производные аминокислот. Другие, в
частности окситоцин и инсулин,— полипептиды или белки. Третья
группа гормонов — стероиды—производные холестерола.
Различные типы химической сигнализации иллюстрирует
рис. 143. Сигнальные молекулы, секретируемые клеткой, могут
воздействовать на рецепторы этой же клетки. Такой вид секреции
назван аутокринной.
247
Рис. 143. Различные типы химической сигнализации в организме (Снайдер,
1985):
а — аутокринные воздействия -+ секретируемое вещество воздействует на ту же клетку,
которая его выделяет; б— паракринные воздействия — секретируемое вещество
воздействует на соседние клетки; в-— эндокринные воздействия —- секретируемые гормоны попадают
в кровь; с кровотоком они доставляются клеткам-мишеням; г — медиаторная
передача — связь между нейронами и между нейронами и иннервируемыми клетками других
типов; осуществляется с помощью нейромедиаторов, которые выделяются; д — нейро-
эндокринная секреция
Многие сигнальные молекулы секретируются во внеклеточную
жидкость и действуют только на ближайшие клетки. Такой вид
секреции называют паракринной. Такие локальные химические
посредники отличаются от гормонов тем, что они очень быстро
поглощаются клетками и (или) разрушаются и обычно не попадают
в кровь в сколько-нибудь значительном количестве. Некоторые
локальные посредники секретируются специально
приспособленными для этой функции клетками. Например, гистамин выделяют
главным образом тучные клетки. Эти клетки присутствуют в
соединительной ткани всего тела. Они накапливают гистамин в больших
секреторных пузырьках. В случае повреждения ткани, при местной
инфекции или при некоторых иммунных реакциях тучные клетки
быстро освобождают его путем экзоцитоза. Гистамин вызывает
местное расширение кровеносных сосудов и увеличивает их
проницаемость, что облегчает доступ к поврежденному участку
фагоцитирующим лейкоцитам и белкам сыворотки. Источниками локальных
химических посредников могут быть клетки различных типов.
Примером такого рода локальных посредников служат простаглан-
дины— семейство производных жирных кислот с 20 атомами
углерода. Они быстро расщепляются специальными ферментами вблизи
места своего синтеза. Простагландины вызывают сокращение
гладкой мускулатуры, агрегацию тромбоцитов и воспалительную
реакцию.
Все известные нейромедиаторы, большинство гормонов и
локальные посредники водорастворимы. Исключение составляют стероид-
248
ные и тиреоидные гормоны. Для переноса этих гормонов с кровью
их растворимость повышается путем связывания со специфическим
белком.
Многие гидрофильные гормоны, нейромедиаторы и локальные
посредники активируют белковые рецепторы на поверхности
клетки-мишени. Гидрофобные сигнальные молекулы, например
стероидные гормоны, проходят через плазматическую мембрану и
активируют рецепторный белок в цитоплазме клетки. *
Многие из белковых сигнальных молекул попадают внутрь
клетки-мишени путем эндоцитоза, опосредуемого рецепторами.
Например, инсулин связывается с рецепторами, диффузно
распределенными на поверхности фибробластов. За считанные минуты инсу-
лин-рецепторные комплексы концентрируются в окаймленных
ямках и переходят в цитоплазму в^ эндоцитозных пузырьках. Поэтому
вполне возможно, что белковые сигнальные молекулы (или
продукты их расщепления) непосредственно действуют внутри клетки
примерно таким же образом, как стероидные и тиреоидные гормоны.
Следует, однако, помнить, что опосредованный рецепторами эндо-
цитоз обычно приводит к переносу внеклеточных молекул в лизосо-
мы (см. параграф 8.6). Для того чтобы гидрофильные молекулы
затем могли попасть в цитозоль, им требуется специальный механизм
выхода из эндоцитозного пузырька или лизосомы.
Стероидные гормоны, будучи сравнительно небольшими
гидрофобными молекулами, проходят через плазматическую мембрану
путем простой диффузии. Оказавшись внутри клетки-мишени,
стероидный гормон каждого типа прочно, но обратимо связывается
со своим специфическим рецепторным белком, находящимся в
цитоплазме. Присоединение гормона ведет к аллостерическому
изменению конформации рецептор но го белка, что повышает его
способность связываться с ДНК. Гормон-рецепторные комплексы
проходят через ядерные поры и накапливаются в ядре. Стероидные
гормоны регулируют активность генов.
Гормоны щитовидной железы (тиреоидные гормоны) тоже
представляют собой небольшие гидрофобные молекулы,
присоединяющиеся к внутриклеточным рецепторам. Как полагают, по
механизму своего первичного действия они подобны стероидным
гормонам, но их рецепторы сконцентрированы в ядре еще до
присоединения гормона.
Подавляющее большинство поверхностных рецепторов для
гидрофильных сигнальных молекул, связав лиганд на внешней
стороне мембраны, претерпевает конформационные изменения. В ряде
случаев это приводит к появлению внутриклеточных сигнальных
молекул — вторичных посредников (первичным посредником
является внеклеточный лиганд).
10.4. Передача сигналов от рецепторов плазматической мембраны
внутрь клетки. В плазматической мембране клетки находятся
механизмы, преобразующие внешние сигналы во внутриклеточные.
Рецепторы распознают сигнальные молекулы и приводят в действие
внутриклеточные пути передачи информации, которые в конечном
249
счете ведут к регуляции клеточных процессов, например, секреции,
сокращения, метаболизма или роста. Внутриклеточные сигналы
передаются молекулами-посредниками— вторичными
посредниками.
На молекулярном уровне процесс передачи информации
обеспечивается цепочкой мембранных белков, последовательно
взаимодействующих друг с другом. Каждый раз взаимодействие вызывает
конформационную перестройку следующего в цепочке белка —
изменение его структуры, а следовательно, и функции. На
определенной стадии дальнейшая передача информации поручается
находящимся в цитоплазме малым молекулам или даже ионам. Они-то и
являются вторичными посредниками. Их диффузия обеспечивает
быстрое распространение сигнала по всей клетке. Число различных
вторичных посредников оказалось удивительно небольшим.
Иными словами, пути передачи внутриклеточных сигналов
универсальны и способны регулировать множество разнообразных
физиологических и биохимических процессов.
Сейчас известны два основных пути передачи сигналов. В одном
из них вторичным посредником служит циклический аденозинмо-
нофосфат (цАМФ). В другом действует комбинация трех вторичных
посредников: ионов кальция, инозитолтрифосфата и диацилглицеро-
ла. Последние два вещества образуются в самой плазматической
мембране. Два пути передачи сигналов имеют много общего. И в том,
и в другом случае элементы, получающие информацию от первого
звена — рецептора и передающие ее через мембрану внутрь-
клетки, представляют собой так называемые G-белки. Это мембранные
белки, активирующиеся при связывании гуанозинтрифосфата (ГТФ).
G-белки активируют усилительный фермент, находящийся на
внутренней стороне мембраны. Фермент превращает молекулы
вещества-предшественника в молекулы вторичного посредника. Так,
аденилатциклаза превращает аденозинтрифосфат (АТФ) в цАМФ,
а фермент фосфолипаза С расщепляет мембранный липид фосфа-
тидилинозитол-4,5-дифосфат на диацилглицерол и инозитолтрифсс-
фат. В обоих путях передачи сигналов сходны конечные стадии:
они состоят в том, что вторичные посредники вызывают изменения
структуры клеточных белков (В одной конформации белок
неактивен, в другой же он участвует в каком-либо клеточном процессе,
например, в секреции или в сокращении). Известны два основных
способа действия вторичных посредников. Один из них— прямой —
состоит в том, что посредник связывается с белком, а точнее с
регулятор ным компонентом белка, и вызывает конформационную
перестройку.
Классическим примером такого механизма является регуляция
сокращения скелетных мышц. В этом случае вторичный
посредник— кальций—связывается с белком тропонином С, что
вызывает конформационное изменение, ведущее к сокращению мышцы.
Более распространен непрямой механизм действия вторичного
посредника. В этом случае он активирует фермент, называемый про-
теинкиназой, который затем фосфорилирует белок (т. е. присоеди-
250
Рецептор
Химический
сигнал
Теофиллин__
Кофеин
ГДФ+-
. Адени/ющиклаэа
(неактивен)
АМФ+-
4-
цАМФ+А-киназа
ЯцАМФ+С
^Белок-Р _
(активен)
Клеточный
Фосфодиэстераза
Рис. 144. Пути передачи сигнала внутрь клетки с использованием
вторичного посредника циклического аденозинмонофосфата (цАМФ)
няет к нему фосфатную группу). Фосфорилирование приводит
к конформационной перестройке белка и активированию его
функции.
На рис. 144 показано схематически, что взаимодействие
молекулы-сигнала с рецептором активирует фермент аденилатциклазу,
катализирующую превращение АТФ в цАМФ. Этим этапом
управляет Gs-белок, который активируется при связывании гуанозин-
трифосфата (ГТФ) и теряет активность после гидролиза ГТФ
(превращения его в гуанозиндифосфат — ГДФ). Показано также, что
связывание цАМФ с регуляторной субъединицей (R) протеинкиназы
(А-киназы) приводит к отделению каталитической субъединицы
(С). Она катализирует присоединение фосфата Р к специальным
белкам, которые при этом активируются и определяют ответ клетки
на сигнал.
Показано, что холерный токсин препятствует потере активности
G-белка, в результате чего аденилатциклаза находится в активном
состоянии, и клетка производит цАМФ независимо от внешнего
сигнала. Активатором аденилатциклазы является форсколин —
вещество, выделенное из растения Coleus ГогекоИПьТеофиллин и
кофеин подавляют активность фосфодиэстеразы, превращающей цАМФ
в аденозинмонофосфат (АМФ).
Оказалось, что существуют G-белки двух типов:
стимулирующие и ингибирующие. Стимулирующий G-белок (Gs-белок)
связан с рецептором соответствующего типа, обозначенным символом
Rs. Взаимодействие внешней сигнальной молекулы с рецептором
вызывает изменение его конформации. Конформационная
перестройка передается через мембрану Gs-белку, в результате чего тот
приобретает способность связывать внутриклеточный ГТФ.
Вследствие связывания ГТФ конформация Gs-белка изменяется, причем
251
так, что он теперь может активировать аденилатциклазу и тем
самым вызывать образование цАМФ. Таким образом, в момент
образования комплекса Gs и ГТФ включается канал передачи
информации. Активность комплекса Gs-белок — ГТФ подавляется
путем гидролиза ГТФ до ГДФ. После гидролиза ГТФ Gs-белок
теряет способность активировать аденилатциклазу. Гидролиз
катализируется ферментом гуанозинтрифосфатазой (ГТФазой).
Токсин, выделяемый холерным вибрионом, подавляет функцию ГТФа-
зы. Это приводит к увеличению времени жизни комплекса Gs-белка
с ГТФ, вследствие чего клетка производит цАМФ постоянно,
независимо от побуждающего к этому внешнего сигнала. В клетках
кишок цАМФ вызывает сильную секрецию жидкости, чем и
объясняется тяжелая диарея, которой страдают больные холерой.
G-белки другого типа (G, -белки) участвуют в передаче
информации, подавляющей образование цАМФ. Взаимодействие внешней,
сигнальной молекулы с рецептором, обозначаемым символом Ri,
приводит к изменению конформации Gt-белка, после чего тот
связывает ГТФ, еще раз меняет конформацию и ингибирует
аденилатциклазу. В этом случае также известен бактериальный токсин,
блокирующий передачу информации. Он продуцируется
возбудителем коклюша. Показано, что коклюшный токсин препятствует
ингибированию аденилатциклазы. Бактериальные токсины
послужили ценным инструментом для изучения функции G-белков.
Конечные стадии и пути передачи сигнала с помощью цАМФ
осуществляются при участии А-киназы (протеинкиназы) (рис. 144),
которая фосфорилирует определенный белок только тогда, когда
она специфически активирована цАМФ. Молекула этого фермента
состоит из двух субъединиц: регуляторной и каталитической.
Циклический АМФ связывается с регуляторной субъединицей,
з'результате чего каталитическая субъединица отделяется. В
свободном состоянии она может фосфор илировать белок. В жировых
клетках таким способом регулируется активность липазы —
фермента, начинающего последовательность реакций, в которых
извлекается энергия, заключенная в молекулах липидов. Гормоны,
например адреналин, связываются с рецепторами, находящимися
на клеточной поверхности; рецепторы при посредстве G-белков
активируют аденилатциклазу, которая катализирует образование
цАМФ; цАМФ активирует А-киназу, а та фосфорилирует липазу.
и тем самым переводит ее в активное состояние.
Известны случаи, когда цАМФ, активируя А-киназу, инициирует
поступление в клетку из наружного раствора другого вторичного
посредника ионов кальция (например, в сердце).
Внеклеточная жидкость не является единственным источником
ионов кальция, осуществляющих роль вторичных посредников.
Кальций для внутриклеточной коммуникации может освобождаться
из внутренних резервуаров, что нередко наблюдается при
регуляции физиологических процессов гормонами и нейромедиаторами.
Поступивший извне сигнал достигает внутриклеточных
резервуаров кальция через ряд промежуточных звеньев: сигнал стимули-
252
рецептор
Химический
сигнал
Форболовыег\
эфиры п
BG4PS, 1>
-«иназУР Т^атиЬен)
* Белок-Р
ГДФ
•То "Инозитолтрифосфатаз1
1Н2
' Белок-Р
(активен)
1Эндоплазнатиче*
I ский ретикулум
Белок-Р ,
(активен) I
Клеточный
ответ
Белок• х
(неактивен)
Рис. 145. Инозитидный путь передачи сигнала внутрь клетки
рует гидролиз одного из липидов (фосфатидилинозитол-4,5-дифос-
фата), входящих в состав плазматической мембраны.
Каким же образом гидролиз одного мембранного липида может
вызвать увеличение внутриклеточной концентрации кальция?
Фосфолипиды в водной среде самопроизвольно образуют
упорядоченные двухслойные плоские структуры, которые составляют основу
биологических мембран. Согласно традиционной точке зрения,
липидный бислой функционирует как инертный барьер. Открытие
того, что фосфолипиды участвуют в передаче внутриклеточных
сигналов — неожиданность. Фосфатидилинозитол-4,5-дифосфат~ это
типичный фосфолипид, располагающийся преимущественно в
обращенном к цитоплазме слое двухслойной клеточной мембраны. В
ответ на внешний сигнал это вещество гидролизуется с образованием
диацилглицерола и инозитолтрифосфата. Для реакции необходим
ГТФ; здесь G-белок также сопрягает работу рецептора и
усилительного фермента (фосфолипазы С). На рис. 145 показано, что
взаимодействие молекулы-сигнала с рецептором при посредстве G-белка
активирует фосфолипазу С, которая расщепляет фосфатидилинози-
тол-4,5-дифосфат (Р1Р2) на инозитолтрифосфат (1Р3) идиацилгли-
церол (DG). Растворимый в воде 1Р3 диффундирует в цитоплазму и,
воздействуя на эндоплазматический ретикулум, вызывает
освобождение Са2+, который комплексируется с кальмодулином. Этот
комплекс активирует киназу, катализирующую присоединение
фосфата к неактивному белку, что приводит к его активации и
возникновению клеточного ответа.
Оставшийся в мембране DG активирует С-киназу. Для
активации необходимо присутствие фосфатидилсерина (PS) и Са2+. С-ки-
наза катализирует присоединение фосфата к неактивному белку,
что приводит к его активации и возникновению клеточного ответа.
Конечная стадия в цикле инозитолфосфатов — это превращение
инозитолмонофосфата в свободный инозитол, который катализи-
253
руется ферментом инозитол-1-монофосфатазой. Активность фермента
ингибируется ионами лития.
Форболовые эфиры (вещества, обнаруженные в масле,
выделяемом из семян древесного растения Croton tiglium), воспроизводят
эффект диацилглицерола, непосредственно воздействуя на С-кпназу.
В цитоплазме присутствует также циклический гуанозинмоно-
фосфат цГМФ. В отличие от цАМФ его функция в клетке не вполне
понятна. Е. Е. Фесенко и сотрудники, проводя исследования на
палочках сетчатки, обнаружили, что натриевые каналы
плазматической мембраны палочек поддерживаются в темноте в открытом
состоянии благодаря высокой концентрации внутри клетки цГМФ.
Это вещество, по-видимому, непосредственно открывает натриевые
каналы. Когда в палочку попадают фотоны, они поглощаются
родопсином, что приводит к его взаимодействию с одним из
представителей G-белков, трансдуцином. Последний приобретает споссбность
активировать фермент фосфодиэстеразу цГМФ. Это в свою очередь
вызывает резкое падение концентрации цГМФ в цитоплазме, в
результате чего натриевые каналы закрываются.
10.5. Роль ионов кальция в регуляции деятельности клетки.
В организме Са2+ является одним из важнейших вторичных
посредников. Он передает внутриклеточным биохимическим системам
сигналы, которые в форме электрических импульсов или
химических соединений поступают к клетке извне на ее мембрану. Чтобы
кальций эффективно управлял клеточными процессами, его
функционирование, в свою очередь, должно подвергаться регуляции.
В клетке в ходе эволюции возникла сложная система белков,
которые взаимодействуют с конами кальция, тем самым управляя
передачей и приемом внутриклеточных сообщений.
Белки, которые связывают кальций, делятся на два класса:
мембранные белки, которые управляют передвижением Са2+ через
мембрану внутрь клетки или клеточных органелл, и растворимые
белки, находящиеся в цитоплазме или внутри органелл. Белки
второго класса играют некоторую роль в регуляции концентрации
кальция в клетке. Одним из важнейших связывающих Са2+
белков является кальмодулин. Он содержит четыре участка
связывания кальция. Свойства молекулы кальмодулина зависят от того,
сколько участков связывания занято кальцием. Это могло бы
объяснить факт, что кальмодулин взаимодействует со множеством
различных белков.
Кальмодулин присутствует во всех клетках млекопитающих и,
по-видимому, является самым распространенным «переводчиком»
внутриклеточных кальциевых сигналов. Он действует на ферменты,
такие как протеинкиназы, которые фосфорилируют другие белки.
Фосфорилирование может вызывать как активацию, так и ингиби-
рование ферментов. Кальмодулин регулирует множество клеточьых
функций. Недавно было показано, что он участвует в секреции
гормонов из желез эндокринной системы. Он влияет на форму
клетки и на процесс ее деления, что, вероятно, связано с его
действием на микротрубочки (тонкие трубочки из белка тубулина,
254
образующие внутриклеточный каркас) (см. параграф 6.2). Кальмо-
дулин может в присутствии других регуляторных белков вызывать
разборку микротрубочек.
Хорошо изучена регуляторная роль кальмодулина в скелетных
мышцах. Повышение внутриклеточной концентрации кальция
инициирует при участии тропонина сокращение мышцы. Однако
кальций вызывает также долговременное изменение метаболизма,
зависящее от кальмодулина. Активируемый кальцием кальмодулин
стимулирует протеинкиназу. Она фосфорилирует фермент, который
в фосфорилированной форме расщепляет гликоген.
Большинство кальций-регулируемых процессов в клетке
(например, мышечное сокращение, секреция) осуществляется при
внутриклеточных концентрациях ионизированного кальция,
находящихся в пределах 10 ~7—10~5 М. Уменьшение внутриклеточной
концентрации ионов кальция может быть необходимо для окончания
клеточного ответа. Оно осуществляется различными
внутриклеточными механизмами. Вначале ионы кальция могут быть быстро
связаны белками, имеющими высокое сродство к кальцию. В
скелетных мышцах такими белками являются парвальбумины. Более
медленно осуществляется секвестрация (поглощение) кальция
клеточными органеллами: саркоплазматическим ретинулумом в мыш-
дах и эндоплазматическим ретикулумом в других клетках. В
секвестрацию кальция могут вовлекаться и митохондрии. Для
предотвращения излишнего накопления кальция внутри клетки
необходимы механизмы, выводящие ионы кальция наружу. Такими
механизмами являются активный транспорт, осуществляемый Са2+-
активируемой АТФазой, и натрий-кальциевый обмен.
Глава 11. БИОФИЗИКА СОКРАТИТЕЛЬНЫХ ПРОЦЕССОВ
Движение — одно из основных и общих свойств всего живого,
Однако биофизические механизмы, лежащие в основе движения,
весьма разнообразны. Все двигательные системы делят на
мышечные и немышечные формы подвижности. К последним относятся
все простейшие движения клеток и клеточных ультраструктур:
движения жгутиков бактерий, сокращение и расслабление мионем
простейших, амебоидное движение одноклеточных организмов,
сокращение хвостового чехла бактериофага, непрерывные смещения
цитоплазмы, сокращение мембран митохондрий и др. Наиболее
выраженной сократительной функцией обладают специализированные
мышечные клетки, в которых сократительные белки образуют
сложные высокоупорядоченные структуры, хорошо наблюдаемые с
помощью электронной микроскопии.
Мышечное сокращение является примером
высокоспециализированного движения, и механизмы этого движения здесь лучше
всего изучены на молекулярном уровне. Различные типы мышц
своими сокращениями создают и формируют движение конечностей,
всего тела и его частей (исчерченные мышцы), внутренних органов
и сосудов (гладкие мышцы), сердца (сердечная мышиа). В мышце
255
основная масда клеточного вещества специализирована для
выполнения сократительной функции. Два основных белка — актин и
миозин, выполняющие эту функцию, составляют около 80 %
структурного белца.
Актий-миозиновая система представляет собой важнейший
пример биологического преобразования химической энергии в
механическую работу. Кроме того, на примере мышечной клетки можно
хорадю изучить и проследить связь процессов в поверхностной
мембране (возбуждение) с активацией специфической функции
клетки, в данном случае с активацией сокращения, и роль в этом
процессе ионов Са*+. Актин и миозин встречаются во многих эукариоти-
ческих клетках. Эти белки участвуют в движении как самих клеток,
так и органелл внутри них.
11 Л. Исчерченные (скелетные) мышцы. Строение и
функция исчерченного мышечного волокна. Исчерченные
(скелетные) мышцы позвоночных состоят из клеток — мышечных
волокон. Каждое мышечное волокно — это многоядерная клетка
цилиндрической формы диаметром от 20 до 80 мкм и длиной от
нескольких миллиметров до десятков сантиметров, соответствующей длине
мышцы. Данные соматического миогенеза свидетельствуют о том >у что
многоядерные волокна исчерченных мышц образуются путем слияния
одноядерных клеток — миобластов. В мышце волокна объединены в
пучки по 20—40 волокон и разделены друг от друга с помощью тонкой
оболочки из соединительной ткани, состоящей из коллагеновых
и эластиновых волокон. Непосредственно к этой оболочке со
стороны мышечной клетки прилегает плазматическая мембрана —
сарколемма. Внутренняя часть мышечного волокна состоит из
ультраструктур клетки и саркоплазмы, содержащей водорастворимые
белки и низкомолекулярные соединения.
В каждом юлок не имеется большое количество (около. 2000)
миофибрилл диаметром 1—2 мкм, тянущихся от одного конца
волокна до другого. Миофибрилла —- это специализированная
функциональная структура исчерченных мышц. Характерной
особенностью строения миофибрилл является поперечная исчерченность,
видимая в оптическом и, особенно, в электронном микроскопе.
Она обусловлена высокой упорядоченностью расположения
толстых и тонких протофибрилл (рис. 146, а). Каждая миофибрилла
разделена с помощью Z-дисков (ширина0,1—0,3мкм) на множество
повторяющихся структур —- саркомеров. Длина capкомеров
составляет 2—3 мкм. Соседние миофибриллы расположены по отношению
друг к другу таким образом, что их Z-диски находятся на одном
уровне. Толстые протофибриллы образуют по центру саркомера
анизотропную Л-полосу шириной 1,6 мкм. Тонкие протофибриллы
образуют изотропную /-полосу; они связаны с Z-дисками и
располагаются симметрично по обе стороны от них. Посередине Л-полосы
имеется Я-зона, в центре которой находится М-полоса шириной
около 0,1 мкм.
Со структурно-функциональной точки зрения исчерченные
мышечные волокна можно разделить на две группы: фазные и тони-
256
рис. 146. Строение мышечного волокна
и саркомера исчерченной (скелетной)
мышцы:
а — основные структурные элементы
мышечного волокна; б — продольное
расположение толстых и тонких протофибрилл в
саркомере; в—поперечное сечение
саркомера в области перекрытия толстых и тонких
протофибрилл; г — поперечное сечение
саркомера в М-полосе; /—мышечное
волокно; 2 — плазматическая мембрана; 5 —
7-система; 4 — миофибрилла; 5— сарко-
плазматическии ретикулум; 6—-триада; 7 —
толстая протофибрилл а; 8—тонкая прото-
фнбрилла: 9— поперечные мостики: 10 —
М-нити: // — М-мостики
ческие. В свою очередь, фазные
волокна делятся на быстрые и
медленные. Фазные мышечные
волокна отвечают на
приходящее по двигательному нервному
волокну одиночное возбуждение
кратковременным сокращением,
тонические — длительным
градуальным сокращением.
Количественное соотношение
между этими типами волокон в
каждой мышце определяет функциональные свойства мышцы.
Фазное мышечное волокно имеет удлиненную, близкую к
цилиндрической, форму. Поэтому к нему применимы уравнения
кабеля, позволяющие рассчитать сопротивление и емкость мембраны
(см. гл. 9) Согласно этим расчетам, сопротивление мембраны Rm
фазного мышечного волокна находится в пределах 3000—5000 Ом X
X см2. Rm тонических мышечных волокон на порядок больше.
Поэтому константа длины волокна К этих волокон больше (4—8 мм),
чем а фазных волокон (2—3 мм) Эти различия прежде всего
связаны с относительно большой исходной хлорной проводимостью
мембраны фазных мышечных волокон (gC{/gK~2—10). Удельная
емкость мембраны фазного мышечного волокна составляет около
2,0 мкФ/см2. Потенциал покоя фазных мышечных волокон
достигает—80...90 мВ, тонических — 60 мВ.
Потенциал действия исчерченного мышечного волокна.
Внутриклеточно отведенный потенциал действия фазного
мышечного волокна имеет амплитуду 120—130 мВ, овершут (превышение
над нулевым уровнем мембранного потенциала)— от +30 до +50 мВ
и продолжительность — 3—5 мс (рис. 147). Пороговая
деполяризация для возникновения потенциала действия составляет 15—25 мВ.
В конце потенциала действия появляется следовая деполяризация
о амплитудой 15—30 мВ и временем полуспада 10—15 мс (рис. 147, а,
'). Это так называемая ранняя следовая деполяризация. Скорое ib
спада конечной части следовой деполяризации соответствует
постоянной времени мембраны.
257
Рис. 147. Потенциал действия
нормального (У) и обработанного
глицерином (2) фазного мышечного
волокна лягушки (а). Потенциал
покоя обоих мышечных волокон —
82 мВ; б — поздняя следовая
деполяризация потенциала действия,
возникающая после прекращения
тетании еского раздражения (15 имп. с
интервалом 10 мс). Вследствие
большого усиления и малой скорости
развертки отдельные потенциалы действия
и их амплитуда не видны на
электрограмме /. Это показано на ?лектрограм-
ме 2 при усилении, в 5 раз меньшем
и более быстрой развертке
После прекращения тетанического раздражения мышечного
волокна (рис. 147, б) появляется значительная и длительная
деполяризация, получившая название поздней следовой деполяризации
с амплитудой 10—15 мВ. В основе возникновения следовой
деполяризации лежит аккумуляция ионов К+ внутри Т-трубочек. После
разрушения Т-трубочек глицерином эта деполяризация исчезает
(рис. 147, а, 2).
В генерации потенциала действия фазных мышечных волокон,
как и нервных волокон, основное участие принимают ионы Na +
и К*. Амплитуда овершута потенциала действия близка к £Na-
Удаление наружного натрия или действие тетродотоксина (ТТХ)
полностью блокирует генерацию потенциала действия.
При помощи метода фиксации напряжения показано, что, как
и в нервных волокнах, в фазных мышечных волокнах в ответ на
ступенчатую деполяризацию возникает входящий натриевый ток,
зависящий от времени и потенциала. Порог активации этого тока
находится в области —65 мВ (при потенциале покоя—80 мВ).
При исходной величине потенциала покоя (—80 мВ) мышечного
волокна примерно 1/3 каналов инактивирована. Полная
инактивация этих каналов происходит при повышении потенциала покоя до
—-60 мВ. При ступенчатой деполяризации после начального
быстрого входящего натриевого тока появляется так называемый
задержанный выходящий ток, который состоит из двух
компонентов: начального инактивирующегося и последующего неинактиви-
рующегося. Задержанный выходящий ток имеет калиевую природу,
он эффективно блокируется тетраэтиламмонием (ТЭА), 4-аминопи-
ридином, ионами Ва2+ и Cs+.
Скорость распространения потенциала действия в мышечных
волокнах намного меньше (1—5 м/с), чем в нервных волокнах
такого же диаметра. Это связано в первую очередь с большой
емкостью мембраны, обусловленной тубулярной системой.
Тонические мышечные волокна не способны генерировать
потенциалы действия Эту способность они приобретают только после де-
нервации. В нормальных условиях мышечные волокна
ракообразная
5мс
,_к
I U
I
2J
\50мВ
ЮОмс
258
ных также не способны генерировать распространяющиеся
потенциалы действия. Однако после добавления к наружному раствору
ионов ТЭА, ионов Ва2+ или Sr2+ эти мышечные волокна
приобретают эту способность. Амплитуда потенциалов действия зависит от
наружной концентрации ионов Са2+, Sr2+ или Ва2+, но не Na+.
Сейчас накопилось достаточно экспериментальных данных, чтобы
утверждать, что в мембране всех исчерченных мышц имеются по-
тенциалозависимые кальциевые каналы, активация которых может
в определенных условиях привести к генерации кальциевых
потенциалов действия.
11.2. Сопряжение между возбуждением и сокращением в
исчерченных мышцах. Потенциал действия фазного мышечного
волокна сопровождается одиночным сокращением. Это сокращение
начинается, как правило, уже после окончания потенциала действия
и длится 200—300 мс. Время от начала возникновения потенциала
действия до начала появления сокращения называют латентным
периодом сокращения, который длится 5—10 мс.
Какова роль потенциала действия в активации сокращения?
Во-первых, сокращение, как уже упоминалось, начинается после
того, как потенциал действия и порожденные им ионные токи в
мембране практически уже закончились. Во-вторых, при прямом
действии электрического тока на миофибриллы не удается получить
их сокращения по всей длине. В то же время мышечное волокно
сокращается в ответ на деполяризацию его по всей длине,
например, гиперкалиевым раствором, когда исключаются условия
возникновения локальных кольцевых токов.
Ионы Na + , участвующие в генерации потенциала действия,
по-видимому, также не играют роли в активации сокращения, ибо
при полном их отсутствии в омывающем растворе или при
блокировании их входа в мышечное волокно ТТХ, а, следовательно, и
блокировании потенциала действия можно вызвать сокращение в ответ
на деполяризацию мышечного волокна гиперкалиевым раствором
или электрическим током.
Все эти факты говорят о том, что при возбуждении в активации
сокращения главным является сам факт деполяризации мембраны
мышечного волокна при генерации потенциала действия, а не
ионная природа этой деполяризации.
А. Хилл показал (1948), что внеклеточные ионы Са2+ не могут
прямо активировать миофибриллы, так как для диффузии этих
ионов от поверхности волокна к его центру требуется намного
больший период времени, чем фактический латентный период
сокращения. Кроме того, при обработке мышечного волокна глицерином
или гипертоническим раствором Риигера сокращение обратимо
угнетается, хотя волокно продолжает генерировать нормальные
потенциалы действия и отвечает деполяризацией на действие
гиперкалиевого раствора.
С другой стороны, кофеин вызывает сокращение мышечного
волокна, совершенно не влияя при этом на его мембранный
потенциал. Более того, кофеин активирует сокращение и в тех мышеч-
259
Рис. 148. Одновременная регистрация потенциала действия и сокращения фазного
мышечного волокна крысы (методика двойного сахарного мостика, а)
Схематическое изображение последовательности процесса возбуждения—сокращения в
исчерченном мышечном волокне (б — г):
а I—сокращение; 2 — потенциал действия; б — мышечное волокно в расслабленном
состоянии, поверхностная (/) и тубулярная (2) мембраны поляризованы, потенциал покоя
равен —90 мВ, внутриклеточная концентрация ионов Са*+ = 10~7М, АТФ — 5 • Ю-3 М, 3,
4 — терминальные цистерны и продольные трубочки саркоплазматического ретикулума,
соответственно. С — саркомер, в — во время потенциала действия разность потенциалов на
поверхностной и тубуляраой мембранах реверсирует и становится внутри положительной
(+30 мВ), происходит стимуляция выделения ионов Са*+ из цистерн саркоплазматического
ретикулума, г — к концу потенциала действия внутриклеточная концентрация ионов Са2+
достигает 10-6М, потенциал покоя почти восстанавливается до исходной величины (— 8f мВ)
ных волокнах, р которых деполяризация поверхностной мембраны
и потенциал действия уже не способны вызвать сокращение,
например в волокнах, обработанных глицерином.
Все эти наблюдения свидетельствовали о тем, что между
возбуждением в поверхностной мембране мышечного Еолокна и его
сокращением должна сушествовать более сложная
структурно-функциональная связь. А. Хаксли (1959) предположил, что эта связь
осуществляется при помощи системы поперечных трубочек
поверхностной мембраны (Т-системы) и внутриволоконного
саркоплазматического ретикулума. Деполяризация, вызываемая потенциалом
действия, распространяется на Т-систему и каким-то образом
стимулирует освобождение ионов Са2+ из полостей саркоплазматического*
ретикулума (рис. 148). Действительно, локальная деполяризация
мышечного волокна лягушки электрическим током, подводимым
к поверхности волокна при помощи микроэлектрода, приводит
к сокращению только тогда, когда микроэлектрод находится
в области Z-дисков, т. е. в области выхода Т-трубочек наружу. При
этом сокращение охватывает только прилегающие к данному Z-дис-
ку две половинки /-полос. С этой точки зрения разрыв связи между
возбуждением и сокращением под влиянием глицерина или
гипертонического раствора Рингера обусловливается нарушением про-
260
ведения деполяризации и возбуждения по 7'-системе вследствие
ее разрушения. Сокращение же, возникающее в этих условиях под
-влиянием кофеина, связано с прямым действием этого вещества на
саркоплазматический ретикулум, ведущим к освобождению из него
ионов Са2+, которые активируют сокращение.
Таким образом, необходима специальная система управления
сократительной деятельностью всех миофибрилл, которые
расположены, начиная от периферии, вблизи сарколеммы, и к центру
мышечного волокна. Возбуждение должно быстро передаваться в глубь
волокна на расстояние свыше 10 мкм и синхронизировать работу
всех миофибрилл. Эту роль выполняет специальная система
электромеханического сопряжения. Она включает сарколемму, Т-систе-
му, саркоплазматический ретикулум и регуляторные белки
миофибриллы. Т-система представляет собой большое количество
впячиваний плазматической мембраны внутрь волокна (рис. 146, а).
Это— система трубочек диаметром около 0,03 мкм, проходящих
поперечно к оси волокна и располагающихся в области Z-дисков или
вблизи перекрытия /- и Л-полос.
Полости Г-трубочек сообщаются с наружной средой. Площадь
поверхности мембран Г-трубочек в 4 фаза больше, чем площадь
поверхности наружной плазматической мембраны волокна
диаметром 50 мкм. Полноценный потенциал действия, возникающий в
мембране Т-системы, способен возбуждать всю толщу мышечного
волокна в радиальном направлении. Это ведет к генерации быстрого
сокращения по типу «все или ничего». Наряду с этим мембрана
Т-системы хорошо проводит и градуальную деполяризацию
поверхностной мембраны, которая сопровождается градуальным
сокращением фазного мышечного волокна, например, под влиянием
гиперкалиевого раствора или деполяризации электрическим
током в условиях фиксации потенциала.
Все это показывает, что деполяризация мембраны Т-трубочек
регулирует поступление сигнала к сарксплазматическому ретику-
луму, в результате чего стимулируется выделение из него конов
Са2+.
Саркоплазматический ретикулум (СР). Каждая
субъединица фазного мышечного волокна—саркомер — окружена сетью
СР (рис. 146, а), составляющего 10—15 % объема волокна .Площадь
мембран СР примерно в 100 раз больше площади поверхностной
мембраны. В полостях СР содержатся те же ионы, что и в миоплаз-
ме,— К+, Na+, C1" и Са2+ и его мембрана хорошо проницаема
для этих ионов.
В каждом саркомере ретикулум состоит из терминальных
цистерн, охватывающих миофибриллы в виде почти сплошных мгпжет
по обе стороны oi Z-диска, и продольных каналов, которые
посредине Л-полосы сливаются в плоскую цистерну, охватывающую
фибриллы со всех сторон. Эта структура получила название
продырявленного воротничка, или обруча, поскольку для нее характерны
небольшие круглые отверстия. СР двух соседних саркомеров одной
миофибриллы изолированы друг от друга Z-диском. Иногда эта
261
изоляция нарушается анастомозами между соседними цистернами
Все элементы СР и Г-трубочки являются общими для соседних
параллельно расположенных миофибрилл данного саркомера. СР
содержит, выделяет и реаккумулирует ионы Са2+, играющие
основную роль в активации сокращения.
Через мембрану терминальных цистерн ионы Са2+ выходят из
ретикулума в миоплазму, тогда как через мембрану продольных
трубочек происходит активный транспорт ионов Са2+ обратно
в ретикулум.
Структурно-функциональная связь между Т-систе-
мой и саркоплазматическим ретикулумом. Обычно на
продольных срезах волокна трубочки Г-системы и прилегающие
к ним терминальные цистерны СР выявляются как трехкомпонент-
ные структуры, получившие название триад (рис. 146, а). В тесном
контакте с терминальными цистернами находится примерно 80 %
поверхности Г-системы.
Наиболее характерными чертами области контакта Г-системы
с терминальными цистернами ретикулума являются: параллельное
расположение мембран этих структур на расстоянии 10—20 нм
друг от друга и наличие мостиков между двумя мембранами.
Крупномолекулярные маркеры—ферритин, пероксидаза хрена и
другие, хорошо проникающие в полости Т-трубочек, не проникают
в СР. В то же время опыты с калиевой деполяризацией и
деполяризацией в условиях фиксации потенциала свидетельствуют о
надежном и точном контроле мембранным потенциалом мышечного
волокна силы сокращения.
В настоящее время нет удовлетворительного объяснения
передачи сигнала от Т-системы к СР и активации освобождения ионов
Са2+ из последнего. Предполагается, что в этом процессе большую
роль играет смещение отрицательных зарядов в мембране Г-трубо-
чек во время возбуждения и деполяризации. Эти заряды или
механически смещают мостики в триадах, что ведет к открыванию
Са-каналов в мембране ретикулума (механическая модель), или, проходя
через мостики, деполяризуют мембрану ретикулума, что, в свою
очередь, вызывает открывание кальциевых каналов мембраны
ретикулума (электрическая модель). Согласно химической модели,
при возбуждении передача сигнала от Т-системы к СР
осуществляется или посредством ионов Са2+, входящих в мышечное волокно
через Са-каналы мембраны Г-трубочек, или посредством инозитол-
трифосфата, образующегося в мембране Г-трубочек. Ионы Са2 +
и инозитолтрифосфат, в свою очередь, активируют освобождение
ионов Са2+ из цистерн СР.
Освобождение ионов Са+2 из саркоплазматического
ретикулума (СР). Наиболее эффективным методом исследования
освобождения ионов Са2+ из СР является использование скиниро-
ванных (лишенных мембраны) мышечных волокон. Этот метод
позволяет прямо стимулировать СР различными агентами, минуя
поверхностную мембрану Показателем же количества освободившегося
кальция служит напряжение, развиваемое скицированным волок-
262
рис. 149. Изменение внутриклеточной
концентрации ионов Са*+,
обнаруживаемое с помощью арсеназы (а, б) и
экворина {в) в фазном мышечном волокне
лягушки в ответ на одиночную и частую
стимуляцию:
На электрограммах о, б*/— потенциал действия;
2 — арсеназный сшнал; 3 — сокращение На
электрограммах б частота стимуляции — 3 Гц
(слева) и 7 Гц (справа); в — одновременная
регистрация экворинового сигнала (/) и
фазных сокращений (2) Частота раздражения —
5 Гц
f JLLjUJUL
\50mB
5№мс
6
.АЛМЛЛДЛАЛЛЛЛ.
6
IF
ном, и выход 45Са из ретикулума.
Эти исследования показали, что
выход кальция из СР стимулируется:
а)деполяризацией мембраны ретику-
лума электрическим током; б)
ионами Са2+ (кальцийиндуцируемое
освобождение кальция) или инозитол-
трифосфатом, добавляемыми к
омывающему волокно раствору; в)
уменьшением в омывающем волокно
растворе концентрации ионов Mg2+;
г) добавлением в омывающий
раствор кофеина.
Опыты на скинированных волокнах позволили точно определить
соотношение между концентрацией ионизированного кальция и
напряжением, развиваемым сократительными белками волокна.
Оказалось, что: а) пороговой концентрацией ионов Са2+ для активации
сокращения является 10 "7—10 ~8 М; б) сокращение сохраняется
до тех пор, пока имеется повышенная концентрация ионов Са2 +
в омывающем растворе; в) соотношение между концентрацией ионов
Са2 + и напряжением мышцы имеет форму классической S-образной
кривой.
Применение в последние годы кальцийчувствительных
красителей (арсеназо III, антипирилаза III, квин-2, мурексид и др.)
и фотопротеина экворина позволило прямо определять
внутриклеточную концентрацию ионов Са2+ в процессе сопряжения между
возбуждением и сокращением.
Как видно из рис. 149, а, между началом действия (без учета
препотенциала) и началом арсеназного сигнала имеется латентный
период около 2 мс. Это как раз то время, которое идет на
сопряжение возбуждения и сокращения. Само же сокращение начинается
тогда, когда, судя по арсеназному сигналу, внутриклеточная
концентрация ионов Са2+ приближается к своему максимуму.
Уменьшение арсеназного сигнала, а следовательно, и
внутриклеточной концентрации свободного кальция происходит по простой
экспоненте. Это значит, что в данном процессе участвует,
по-видимому, только один механизм, а именно, активный транспорт4
ионов Са2+ в СР.
263
По данным арсеназного метода, одиночный потенциал действия
освобождает около 1/3 всего кальция из СР. Если бы не работал
механизм обратного активного транспорта ионов Са2+ в СР, то того
количества кальция, которое имеется в ретикулуме (около 1 мМ
на 1 л воды), хватило бы только на 3—4 следующих друг за другом
одиночных сокращений.
При частой стимуляции мышечного волокна арсеназный сигнал
уже на второй стимул заметно уменьшается, хотя амплитуды
потенциалов действия и фазных сокращений при этом остаются
постоянными. Одновременно уменьшается, по-видимому, и работа
насосного механизма обратного накачивания ионов Са2+ в ретику-
лум. В итоге общий уровень свободного кальция при тетанусе
остается таким же, как и на первый стимул, или даже немного
увеличивается (рис. 149, б, в).
Интересные данные получены в исследованиях связи между
деполяризацией и сокращением фазных мышечных волокон,
сводной стороны, и между деполяризацией и внутриклеточной
концентрацией ионов Са2+— с другой. Стойкую и длительную
деполяризацию мышечных волокон можно получить либо увеличением
наружной концентрации ионов К+, либо сдвигом мембранного
потенциала в условиях фиксации напряжения. В обоих случаях
деполяризация сопровождается сокращением мышечного волокна, которое
характеризуется следующими особенностями (рис. 150, а, б):
а) при длительной деполяризации мышечного волокна после
начального сокращения происходит самопроизвольное
расслабление его, которое наступает тем раньше, чем больше степень
деполяризации;
б) амплитуда максимального сокращения находится в S-образ-
ной зависимости от степени деполяризации мышечного волокна;
в) пороговая деполяризация дяя активации сокращения состав-
ляег 30—35 мВ, максимальное сокращение наблюдается при
деполяризации, равной 40 мВ.
г) повторная деполяризация мышечного волокна
сопровождается уменьшением амплитуды сокращения;
д) отсутствие в омывающем растворе ионов Са2+ не препятствует
развитию сокращения в ответ на деполяризацию.
Эквориновый сигнал, отражающий концентрацию свободного
внутриклеточного кальция, также увеличивается с увеличением
степени и продолжительности деполяризации мышечного волокна.
При этом и сокращение, и эквориновый сигнал (рис. 149, а, в) инак-
тивируются по мере продолжающейся деполяризации. Отсюда
следует, что самопроизвольное расслабление мышечного волокна при
калиевой контрактуре обусловливается исключительно
инактивацией освобождения ионов Са2+ из СР.
Особенности активации сокращения в тонических
мышечных волокнах. Характерным свойством тонических
мышечных волокон является то, что в нормальных условиях они не
генерируют потенциалы действия и в ответ на деполяризацию в них
возникает контрактурное сокращение, которое длится до тех пор,
264
J
[100 мг
2с
ЮОмВ
1С
1Y
0,5
_i_
JLL-
JL
J_
-во -so -40 -jo -zo мв
б
-80 -40 0 40 80 MB
Рис. 150. Сокращение (а) изолированного фазного мышечного волокна (нижняя
кривая) в ответ на фиксированную ступенчатую деполяризацию (верхняя
кривая) и зависимость амплитуды сокращения от величины ступенчатой
фиксированной деполяризации (б). Зависимость формы (в) и величины (г) эквори-
нового сигнала от амплитуды фиксированной ступенчатой деполяризации
изолированного мышечного волокна лягушки; б. длительность деполяризации— 1 с.
Поддерживаемый потенциал — 100 мВ. Ось ординат — относительная
амплитуда сокращения (максимальное сокращение принято за единицу), ось абсцисс —
мембранный потенциал в милливольтах; г: ось ординат — величина эквори-
нового сигнала (в относительных величинах), ось абцисс — амплитуда
фиксированной ступенчатой деполяризации. Поддерживаемый потенциал —90 мВ.
Потенциалы действия угнетены тетродотоксином (ТТХ)
пока сохраняется деполяризация. Максимально активированное
тоническое волокно укорачивается или развивает напряжение
примерно в 10 раз медленнее, чем фазное волокно, и во столько же раз
медленнее расслабляется. Г-система и саркоплазматический рети-
кулум (СР) у тонического волокна развиты слабее, контакты между
ними могут быть не только по типу триад, но и диад, а площадь
контакта составляет только 63 % . Тем не менее ряд амплитудно-
кинетических характеристик сокращения в тонических и фазных
волокнах сходны между собой. Это сходство выражается в том,
что обработка тонического волокна глицерином (хотя и в большей,
чем в случае фазных волокон, концентрации) разобщает
электромеханическую связь, а порог активации и латентный период
сокращения, вызываемого деполяризацией в условиях фиксации
напряжения, одинаковы.
Механизмы активации освобождения ионов Cg2+ из СР фазных
и тонических волокон идентичны, и разница заключается только
265
а
LfCM
Рис. 151. Активные и пассивные характеристики исчерченной мышцы:
а; зависимость между напряжением (Р) и длиной (L) мышцы (кривая длина — сила); / <—
кривая пассивного напряжения, 2 — кривая активного изометрического напряжения В
точке X общее изометрическое напряжение состоит из активного (А) и пассивного (П)
компонентов (Сила Р выражена в ньютонах); б — аналоговая модель мышцы; /, 2 —
последовательный и параллельный упругие пассивные элементы; 3 — сократительный
элемент
в отсутствии в тонических волокнах потенциало- и времязависимой
инактивации освобождения ионов Са2+ из ретикулума.
Небольшая же скорость развития напряжения в тонических
волокнах обусловливается, в первую очередь, более медленными
процессами взаимодействия ионов Са2+ с тропонин-тропомиозино-
вым комплексом, активации актомиозиновой АТФазы, образования
поперечных мостиков, взаимодействия кальция с внутриклеточными
буферами и обратного активного транспорта ионов Са2+ в СР.
11.3. Механика и энергетика сокращения.
Амплитудно-временная характеристика сокращения отражает активность
сократительного аппарата мышцы. Однако на развитие силы и укорочения
мышцы при ее активности сильно влияют также пассивные свойства
ее элементов. Действительно, если укрепить концами
расслабленную мышцу в миограф при длине в состоянии покоя, то,
естественно, мы не обнаружим никакого напряжения в мышце. Но если
затем, отсоединив один конец, растягивать мышцу, то в ней появится
определенное пассивное напряжение. С увеличением натяжения
мышцы это напряжение будет расти, но не линейно, как это происходит
при растяжении резины. Откладывая на графике зависимость
напряжения мышцы от ее длины, мы получим кривую напряжения
покоя (рис. 151, а). Таким образом, мышца в покое обладает
определенной упругостью. На это свойство мышцы не влияют ни ее
состояние (покой, активность), ни фармакологические воздействия.
Структурной основой упругости мышцы являются: а)
поперечные мостики; б) Z-диски саркомеров; в) участки прикрепления
концов миофибрилл к сухожильным элементам мышечного волокна;
г) наружные (сухожильные, коллагеновые и другие
соединительнотканные) элементы мышцы и ее волокон; д) места крепления мышц
к костям или к прибору в опытах на изолированных мышцах;
е) продольная система саркоплазматического ретикулума; ж)
сарколемма мышечного волокна. Первые пять элементов создают так
называемую последовательную упругость мышцы, поскольку они
266
соединены последовательно с сократительным элементом,
остальные же соединены параллельно и образуют параллельную упругость.
Таким образом, механическая модель мышцы представляет собой
систему, состоящую из трех элементов: активного сократительного
и пассивных, последовательного и параллельного, упругих
элементов (рис. 151, б).
Сократительный элемент, состоящий из протофибрилл и
поперечных мостиков, в расслабленном состоянии не оказывает
сопротивления расслаблению мышцы. В этом состоянии актиновые и мио-
зиновые протофибриллы не связаны между собой поперечными
мостиками и могут свободно перемещаться. Но при активном состоянии
(сокращении) мышцы определенная податливость поперечных
мостиков вносит свой вклад в величину последовательного упругого
элемента мышцы. Оценка свойств последнего в целой мышце
затруднена, ибо вклад, например, сухожилия в общую длину
различных мышц неодинаков. Так, в мышцах крысы последовательный
упругий элемент составляет 7% оптимальной длины мышцы, а в
портняжной мышце лягушки—только около 2%. Это различие
связано с неодинаковым содержанием и различиями в упругих
свойствах сухожилия в этих мышцах.
В зависимости от того, фиксированы ли неподвижно оба конца
мышцы или только один, различают соответственно
изометрический и изотонический режимы сокращения. При изометрическом
сокращении развитие напряжения активированной мышцы не
сопровождается ее укорочением. Следовательно, длина мышцы при
изометрическом сокращении остается постоянной. При
изотоническом же сокращении мышца укорачивается. К свободному концу
мышцы подвешивается определенный груз Р, и тогда произведение
величины груза на степень укорочения мышцы (высоту поднятия
груза) дает механическую работу, выполненную мышцей при
сокращении.
В естественных условиях, как правило, ни один из этих
режимов сокращения мышцы не встречается в чистом виде. Мышца,
сокращаясь, одновременно и укорачивается, и развивает
определенное напряжение. Такой режим сокращения называется
промежуточным, или ауксотоническим.
Изометрическое сокращение. В изометрическом режиме
одиночное супрамаксимальное прямое раздражение мышцы
электрическим током (прямоугольный импульс длительностью 0,2—
0,5 мс, рис. 152, а) вызывает быстрое нарастание напряжения
мышцы, которое, достигнув своего максимума, так же быстро затем
спадает до нуля. Однако даже в изометрических условиях, когда
Длина активированной мышцы не меняется, длина саркомеров не
остается постоянной. При увеличении активного напряжения
мышцы миозиновые головки сократительного элемента через
поперечные мостики, Z-диски, места крепления миофибрилл и т. д.
сообщают силу сухожилиям. В результате последовательный упругий
элемент растягивается, а саркомеры, наоборот, укорачиваются
примерно на 1 %. Поэтому даже в эксперименте на изолированной
267
Рис. 152. Установка для регистрации изометрического сокращения и форма
кривых при различных способах стимуляции
а —элементы установки, /-—устройство для создания исходного натяжения мышцы, 2—
стимулятор, 3 — мышца, 4 — измеритель изометрического напряжения мышцы, б —
одиночное изометрическое сокращение (/) и активный компонент (2) сократительною элемента
при одиночном изометрическом сокращении мышечного волокна, в — суммация и слияние
одиночных сокращений (/) в зубчатый i2) и слитый (<?) тетанус Сила сокращения Р —
в ньютонах
мышце сокращение имеет до некоторой степени ауксотоническии
характер, поскольку за счет саркомеров происходит небольшое
укорочение мышечных волокон.
Таким образом, развитие во времени изометрического
напряжения мышцы отражает не только состояние активности
сократительного элемента, но и изменение напряжения в пассивном
последовательном упругом элементе (рис. 152, б). В этой связи реально
оценить степень активности сократительного элемента можно только
путем вычитания напряжения упругого элемента из общего
изометрического напряжения. Для этой цели пользуются так
называемым методом быстрого освобождения.
Суть метода состоит в следующем. В различные моменты
времени развития изометрического напряжения один конец мышцы
быстро освобождается, благодаря чему она получает возможность
укорачиваться в изотоническом режиме. При этом мышца должна
быть под меньшей нагрузкой, чем изометрическое напряжение в
момент освобождения. Переход от одного режима сокращения к
другому сопровождается укорочением мышцы в две фазы: сначала
быстро, затем медленно. Быстрое укорочение заканчивается через
несколько миллисекунд, и его связывают с укорочением ранее
растянутого последовательного упругого элемента мышцы.
Последующая медленная фаза отражает укорочение
сократительного элемента Скорость' такого укорочения зависит только от
интенсивности активного состояния сократительного элемента в
момент быстрого освобождения мышцы и поэтому является его мерой. т
После вычитания напряжения упругого элемента из общего
изометрического напряжения получим кривую развития активного
состояния в сократительном элементе (рис. 152, б). Видно, что
активное состояние после раздражения нарастает очень быстро,
оно больше по амплитуде и меньше по продолжительности, чем
полное изометрическое напряжение,
268
Тетанус. Если наносить повторное одиночное раздражение
на vibiumy еще до того, как она успеет расслабиться от предыдущего
изометрического сокращения, то возникает новое напряжение.
Последнее накладывается на предыдущее, благодаря чему общее
напряжение мышцы становится больше, чем в случае одиночного
сокращения (механическая суммация). Многоразовое повторное
раздражение с данной частотой также сопровождается
сокращениями, которые накладываются друг на друга. В результате общее
напряжение мышцы состоит из определенной величины
тонического компонента (вследствие частичной суммации одиночных
сокращений) и повторяющихся фазных сокращений (рис. 152, в).
Такой тип сокращения называется зубчатым тетанусом.
С увеличением частоты раздражения зубчатый тетанус
постепенно переходит в слитный тетанус, когда отдельные фазные
сокращения уже не проявляются. Амплитуда тетанического
сокращения, особенно при слитном тетанусе, всегда значительно больше,
чем амплитуда одиночного сокращения (рис. 152, в). Отношение
напряжения одиночного изометрического сокращения к тетаниче-
скому для большинства мышц конечности млекопитающих
составляет 0,2—0,3. Для медленных мышц это отношение немного
больше, чем для быстрых.
Пока нет удовлетворительного объяснения значительному
увеличению амплитуды тетанического сокращения в сравнении с
одиночным сокращением. При той частоте раздражения мышц,
которая необходима для получения слитного тетануса (25*—50 имп/с),
амплитуда потенциалов действия мышечных волокон не меняется,
а концентрация свободного кальция в волокне остается примерно
такой же, как и при одиночном раздражении. Следовательно, ни
потенциалы действия, ни внутриклеточная концентрация
свободного кальция не могут быть причиной увеличения амплитуды
тетанического сокращения.
Причину этого надо искать, по-видимому, в самом
сократительном элементе. Полагают, что при одиночном раздражении только
часть поперечных мостиков активируется и вступает в связь с ак-
тиновыми протофибриллами. При повторных же раздражениях
количество соединенных мостиков увеличивается и тем самым
увеличивается сила втягивания актиновых протофибрилл в
промежутки между миозиновыми протофибриллами.
Связь длина —напряжение при изометрическом
сокращении. Эта связь является одной из важнейших характеристик
сократительного элемента мышцы, дающей наиболее обоснованные
в функциональном отношении доказательства теории скольжения.
Прежде всего было обнаружено, что для всех мышц имеется
определенная оптимальная исходная длина (L0), при которой
развивается максимальное изометрическое напряжение (рис. 151, а). Эта
Длина находится в пределах 100—120 % длины в покое, что' обычно
соответствует нормальной длине мышцы in situ. Уменьшение или
Увеличение длины мышцы от L0 всегда сопровождается уменьшением
титанического напряжения.
269
%
100
so\-
з *
oVjl
i
%ZZZZZZZZZZZ2
USSS/SS/S&M
1,5
2,2 2,9 3,6 t,MKM
0J5 1 1,25 1,5 1,75 L/L0
a
\-
ZZZZZZZZZZZ2 BZZZ
I
vvwwwga
Рис. 153. Зависимость величины напряжения мышечного волокна — а (в
процентах, ось ординат) и степени перекрытия протофибрилл — б от исходной
длины саркомера /:
а: штриховая л и ния — зависимость напряжения, развиваемого портняжной мышцей лягушг
ки от исходной ее длины L
Откладывая по оси ординат величину тетанического
напряжения (силу), а по оси абсцисс — длину мышцы, получаем кривую
длина —напряжение (рис. 151, а). Однако эта кривая отражает
и активное, и пассивное напряжение мышцы. Для того чтобы
получить кривую длина — напряжение для сократительного элемента
активной мышцы, необходимо вычесть пассивное напряжение из
общего изометрического напряжения. Не всегда удается получить
кривую для всех длин мышцы, ибо увеличение длины мышцы
больше, чем на 1,3 L0, часто вызывает необратимые изменения, и мышца
в этих условиях не способна отвечать на раздражение.
Наиболее ценные сведения по связи длина — напряжение были
получены в опытах, в которых изучалась зависимость величины
тетанического напряжения от длины саркомера мышечного волокна
(рис. 153). Однако в изометрическом режиме при тетаническом
сокращении саркомеры волокна не в одинаковой степени
укорачиваются по всей его длине.
Для того чтобы избежать этого, необходимо проводить опыты
в режиме изотонического тетанического сокращения. На рис. 153
показана графическая зависимость между длиной саркомера и
напряжением. Видно, что при минимальной длине саркомера (до
1,25 мкм, точка / на рис. 153, а) в ответ на раздражение в нем не
развивается напряжение, так как взаимное скольжение
протофибрилл невозможно из-за исходного полного их перекрытия. Этому
скольжению мешает также «упирание» протофибрилл в Z-диски,
поскольку длина их больше, чем исходная длина саркомера. Па
мере увеличения длины саркомера от 1,25 до 1,65 мкм (точка 2)
напряжение увеличивается линейно. Затем крутизна кривой
длина—напряжение уменьшается, и при длине саркомера от 2 до
2,2 мкм наблюдается максимальное напряжение — стационарный
режим работы мышцы (между точками 3 и 4). В таком режиме
происходит максимальное перекрытие миозиновых и актиновых
протофибрилл и напряжение Р не зависит от длины мышцы.
ЯГО
При дальнейшем увеличении длины саркомера происходит
линейное уменьшение напряжения, пока при длине саркомера 3,65 мкм
(точка 5 на рис. 153, а) оно не станет равным нулю. Нетрудно
заметить, что при данных длинах саркомера напряжение
пропорционально степени перекрытия толстых и тонких протофибрилл
(рис. 153, б). При длине саркомера 3,65 мкм и больше актиновые
протофибриллы выходят из промежутков миозиновых
протофибрилл, и поэтому образование связи между ними, а следовательно
и взаимное скольжение при помощи тянущей силы поперечных
мостиков становятся невозможными.
Сравним кривую длина—напряжение для саркомера с
аналогичной кривой для мышцы (рис. 153). По форме эти кривые
довольно близки между собой, и максимальное перекрытие протофибрилл
совпадает с максимальным изометрическим напряжением (Л>)> кото
рое соответствует оптимальной длине мышцы (L0). Однако
кривая длина — напряжение для саркомера не является плавной,
а имеет выраженные изгибы, которые соответствуют критическим
значениям длины саркомера.
Таким образом, результаты опытов по изучению связи длина —
напряжение на уровне саркомеров подтверждают теорию
скольжения, согласно которой максимальное тетаническое напряжение
соответствует максимальному перекрыванию толстых и тонких
протофибрилл. Мышечная же сила может генерироваться только
при взаимодействии актиновых и миозиновых протофибрилл через
поперечные мостики.
Изотоническое сокращение. При изотоническом
сокращении происходит укорочение мышцы при постоянном напряжении или
нагрузке. Для регистрации этого укорочения один конец
изолированной мышцы укрепляется неподвижно, а другой — к рычагу под
нагрузкой, конец которого перемещается на величину,
пропорциональную степени укорочения мышцы (рис. 154).
Подобные исследования показали, что при одинаковой исходной
длине мышцы: а) степень и скорость укорочения тем больше, чем
меньше нагрузка; б) укорочение достигает своего максимума тем
раньше, чем больше нагрузка; в) чем больше нагрузка, тем позже
после раздражения начинается укорочение и тем раньше оно
оканчивается. Эти особенности изотонического сокращения мышцы
объясняются следующим образом. После нанесения одиночного
раздражения мышца вначале сокращается в изометрическом
режиме. В это время сократительный элемент, укорачиваясь, растягивает
последовательный упругий элемент. После того как
изометрическая сила мышцы (активное напряжение) достигает массы груза,
мышца начинает укорачиваться, поднимая груз. Чем больше груз,
тем меньше изотоническое укорочение мышцы. И если величина
груза будет равна максимальному изометрическому напряжению,
то никакого укорочения мышцы не произойдет. Таким образом,
подбором груза можно при данной длине мышцы определить ее
максимальное изометрическое напряжение (Р0)-
Окончание укорочения мышцы не означает полного завершения
271
4r-
2*
3,5 L,CM
Рис. 154. Изотоническое сокращение
мышцы:
а— установка для ретырации изогониче-
ского сокращения. / — мышца; 2 —
стимулятора -I- показатель длины мышцы, 4 — груз,
5 — ось крепления рычага, 5— винт,
ограничивающий натяжение мышцы, 6 — запи-
симость между нагру кой Р и длиной L
мышцы / — кривая Пс-сс.много напряжения
(исходная длина мышцы -— 2,5 см); 2 —
кривая изотонических максимумов, 3 — кривая
постнагр>зочных изотонических максимумов
и %
\ 20
\\ 10
г \
\ °
л
г \
Щ Б
Шш
у
У^'
£г
200
i
Зг
^-^о
9г>У
400
а
\
\\.
t,MC
Ччч> 1
б
100
200 Р
Рис. 155. Одиночное изотоническое
укорочение и кривая сила — скорость:
а — одиночное изотоническое укорочение
мышцы при различных нагрузках Р
^изотоническое укорочение в % ог исходной
длин->1), б — зависимость скорости (v)
укорочения мышцы or величины нагрузки Р при
изо.оническом сокращении (кривая сила-
скороегь), V — M'C"1; P — Н. Площадь
ОАБВ— оптимальная мощность мышпы при
скорости укорочения 2,5 м-с*"1
расслабления, ибо остаточная релаксация ее продолжается в
изометрическом режиме, и она тем больше, чем больше груз. При
изотоническом сокращении мышцы она, укорачиваясь, поднимает
груз и, таким образом, выполняет внешнюю работу. Величина
этой работы равна произведению степени укорочения мышцы AL
на величину поднимаемого груза Р: W — PISL.
Кривую укорочение — нагрузка можно получить двумя путями.
В первом случае мышца предварительно растягивается грузом и,
таким образом, исходная ее длина будет различной в зависимости
от величины груза. Это показано на рис. 154 кривой напряжения
покоя (/). Предположим, что при нагрузке 120 г на кривой / длина
мышцы соответствует точке А. При тетаническомраздражении мыш
цы она укорачивается до длины, показанной на рис. 154 точкой
Б. Подвешивая к мышце различные грузы, получаем кривую '2
изотонических максимумов.
Во втором случае исследуекя укорочение мышцы при
различных нагрузках^ но исходная длина мышцы сохраняется
постоянной—метод постнагрузочного сокращения Пассивное растяжение
мышцы под влиянием груза предотвращается стопорным вингом,
как это показано в верхней части рисунка 154. Таким путем
получаем кривую 3 постнагрузочных изотонических максимумов. При
каждой нагрузке в мышце в ответ на раздражение развивается сна-
272
чала изометрическое напряжение. Когда последнее достигает
величины груза, мышца начинает укорачиваться, производя работу. Как
видно из рис. 154, при нагрузке, например, 90 г выполненная
мышцей работа будет равна площади фигуры ОВВТ. При нагрузках
160 и 30 г работа мышцы будет равна площади фигур ОДД'Е
и ОЖЖ'З соответственно. Площадь ОВВТ больше, чем площадь
ОДД'Е или ОЖЖ'З.
Таким образом, максимальную работу мышца выполняет при
умеренной и средней нагрузках. Увеличение или уменьшение
нагрузки ведет к уменьшению работы, а при максимальной (равной
изометрическому напряжению) и нулевой нагрузках работа,
выполненная мышцей, будет стремиться к нулю.
Важной характеристикой изотонического сокращения является
скорость укорочения мышцы v. Оказалось, что при одинаковой
исходной длине мышцы скорость укорочения при изотоническом
сокращении тем больше, чем меньше нагрузка (рис. 155). При
нулевой нагрузке скорость максимальна, а при максимальной нагрузке
(когда она равна максимальному изометрическому напряжению-—
Р0) укорочение мышцы отсутствует, поэтому и скорость его равна
нулю.
Если откладывать по оси абсцисс нагрузку, а по оси ординат
скорость укорочения мышцы в изотоническом режиме сокращения,
получим кривую сила (нагрузка) — скорость, которая имеет форму
гиперболы (рис. 155).
Так как укорочения последовательно соединенных между собой
саркомеров в мышечном волокне суммируются, то при сокращении
длинные мышечные волокна будут укорачиваться быстрее, чем
короткие. Например, портняжная мышца лягушки укорачивается со
скоростью 0,2 м/с, и каждый саркомер длиной 2 мкм укорачивается
на 1 мкм за 50 мс. Более длинные мышцы конечностей крупных
животных укорачиваются со скоростью 8 м/с и больше.
Энергетика сокращения. При сокращении мышцы
химическая энергия превращается в механическую и тепловую.
С помощью чувствительных термопар А. Хилл впервые измерил
малые количества выделенной теплоты. При одиночном
изометрическом сокращении мышцы выделяется энергия, равная 12,54 Дж X
х кг*41. При изотоническом сокращении- общее изменение энергии
в мышце можно разбить на несколько компонент. Быстрое
начальное выделение теплоты происходит на самой ранней стадии
активации сокращения, когда еще отсутствует заметное укорочение мыш-
цгл Это — теплота активации А. Она выделяется в результате
освобождения ионов Са2+ из саркоплазматического ретикулума.
По мере укорочения мышцы выделяется основное количество
теплоты, которая называется теплотой укорочения Qy. Небольшая
часть теплоты выделяется или поглощаегся при расслаблении
мышцы =t:Qp. С учетом выполняемой механической работы W общий
энергетический баланс (Е) для мышцы будет
E = A + Qy + W±Q». (11.1)
273
А. Хилл установил важный факт, что при изотоническом
сокращении теплота укорочения Qy пропорциональна величине
укорочения AL мышцы:
Qy = aAL, (11.2)
где а — коэффициент теплоты укорочения. Так как W = PAL,
(11.1) можно записать в следующем виде:
Е = А + аМ + PAL ± QP - А + (Р + а) М ± Qp. (11.3)
Продифференцировав по времени (11.3), находим мощность мышцы
N = W = ip + °)tf = P + *)v> О1-4)
где v—скорость укорочения мышцы.
При одинаковом изменении длины мышцы скорость выхода на
новый изометрический уровень уменьшается с увеличением
нагрузки Р; при этом избыточная мощность по сравнению с
изометрической была пропорциональна Р0—Р. На основании этого А. Хилл
получил выражение
N = b(P0-P), (11.5)
где Ь — константа; Р0— максимальное изометрическое
напряжение мышцы. Сравнивая (11.4) и (11 5), получим
(P + a)v = b{P«-P). (П-6)
Таким образом, уравнение Хилла (11.6), полученное из
термодинамических экспериментов, устанавливает связь между напряжением
и скоростью укорочения мышцы в изотонических условиях. Оно
справедливо в стационарном режиме работы мышцы.
Преобразуем (11.6) следующим образом:
Pv + av = ЬР0 — ЬР
и перенесем переменные величины Р и v в левую часть уравнения.
Получим
Pv + av + bP = ЬР0.
Добавим слева и справа уравнения произведение постоянных Хилла
ab:
Pv + av + bP + ab = bP0+ ah.
Получим преобразованное уравнение Хилла в следующем виде:
(Р + a)(v + b)=b (P0+ a) = const. (11.7)
Эта гиперболическая зависимость хорошо подтверждена
экспериментально биомеханическими экспериментами (рис. 155). При
нагрузке Р = Р0 мышца вообще не сокращается и у = 0. Ненагру-
женная мышца (Р = 0) сокращается с максимальной скоростью
v0 и
*=£»•• (П.8)
274
Для портняжной мышцы лягушки §■ =0,25. Такое же значение
было получено для исчерченных мышц крысы, кошки, жабы и др.
В более точных экспериментах А. Хилл установил, что параметр
а не является константой, а зависит от Р:
а = 0,16- Р0+0,18. Р. (11.9)
Это значит, что мощность сокращения мышцы зависит от Р
нелинейно.
11.4. Молекулярные механизмы мышечного сокращения. В
настоящее время из миофибрилл исчерченных мышц выделены десятки
различных сократительных белков, которые составляют около 12 %
сухого веса мышечной клетки. Основная часть его приходится на
два главных белка мышц: миозин (55 %) и актин (20 %). Другие
белки представлены в мышце в меньшем количестве: тропомиозин
(7 %), тропонин (2), а-актинин (10), р-актинин (2), С-белок (2),
М-белок (2%). "
Тонкая и толстая протофибриллы. Данные
электронной микроскопии и дифракции рентгеновских лучей явились
основополагающими для представления о миофибриллах как о высоко-
упорядоченных сократительных ультраструктурах с точным
расположением двух типов протофибрилл. В мышечном волокне
протофибриллы сохраняют активное состояние и выполняют
сократительную функцию при физиологических значениях ионной силы (0,1—
0,15). Понижение или повышение ионной силы раствора нарушает
структурную организацию протофибрилл. Это явление
используется для избирательного выделения сократительных белков из
миофибрилл. Растворы с низкой ионной силой (меньше 0,05) приводят
к разрушению тонкой протофибриллы до отдельных белков актина,
тропомиозина, тропонина, актинина. При экстракции растворами
высокой ионной силы (более 0,25) происходит исчезновение толстой
протофибриллы и выделяется миозин и ряд минорных белков
толстой протофибриллы.
Каждый саркомер состоит из перекрывающихся толстых миози-
новых (длиной 1,6 мкм и диаметром 16 нм) и тонких актиновых
(длиной 1 мкм и диаметром 8 нм) протофибрилл (рис. 146, б).
В области перекрытия протофибриллы образуют гексагональную
структуру (рис. 146, в). Взаимодействие между толстыми и тонкими
протофибриллами осуществляется с помощью поперечных
мостиков, которые выступают из миозиновых протофибрилл.
Толстые протофибриллы соответствуют Л-полосе саркомера, тонкие —
/-полосе. Свободная от тонких протофибрилл центральная часть
саркомера обозначается Я-полосой. В центре Л-полосы находится
М-полоса. Вблизи Z-диска заметны две N-полосы. Они
располагаются oTZ-диска на расстоянии 0,1 мкм (^-полоса) и 0,3 мкм (Af2-no-
лоса). С помощью электронной микроскопии показано, что
сокращение мышцы сопровождается уменьшением длины /- и Я-полос без
изменения длины Л-полосы. Эти изменения были объяснены
275
74 ни
5,5нм
Рис. 156. Схема, показывающая организацию и взаимодействие тонкой и толстой
протофибрилл:
а — продольный разрез саркомера, 6 — поперечное сечение тонкой протофибриллы (слева —
в присутствии ионов Са2+ образуется замкнутый поперечный mojthk, развивающий тянущую
силу; справа — в отсутствие ионов Са*+ — разомкнутый мостик), / — тонкая протофибрилл а;
2 — толстая протофибрилла; 3 — тропомиозин (ТМ); 4 — тропонин (ТН), 5 — головка
миозина (субфрагмент С-1); 6 — субфрагмент С-2; А — актиновые глобулы; субъединицы
тропонина' Г-ТН-Т; У-ТН-У; Г-ТН-С
относительным смещением к центру саркомера тонких протофибрилл
по отношению к толстым — модель скольжения протофибрилл.
Основным белком тонкой протофибриллы является актин в
фибриллярной форме, F-актин. Дифракционная картина тонкой
протофибриллы показывает характерный рефлекс 5,5 нм, связанный
с рассеянием рентгеновских лучей на отдельных глобулах G-актина
(рис. 156, а). Мономерные глобулы G-актина изучают в растворах
с низкой ионной силой меньше 0,1. Диаметр таких глобул 5,5—
6,0 нм. В настоящее время полностью установлена первичная
структура G-актина, состоящего из 374 аминокислотных остатков.
Молекулярная масса G-актина составляет 42000.
При повышении ионной силы раствора до физиологических
значений в присутствии ионов Mg2+ и АТФ G-актин поли^еризуется
в F-актин:
ttG-актин + АТФ —> /7-актин-(АДФ)п+ пФ. (11.10)
Полимеризация актина представляет многоступенчатый процесс.
Длительное время считалось, что актин является наиболее
консервативной структурой, которая неизменна для различных в
эволюционном плане подвижных систем. Детальный сравнительный
276
анализ актиновых молекул мышечных и немышечных клеток выявил
небольшие различия в аминокислотном составе, в Af-концевой части
молекулы. Из немышечных клеток и эмбриональной мышечнсй
ткани выделяется f}- и у-актин. В исчерченных мышцах зрелых
животных содержится а-актин. В гладких мышцах содержится
^-актин.
Нити F-актина образуют двухтяжевую структуру, две
скрученные нити с периодом 73—74 нм (рис. 156, а). Кроме актина тонкая
протофибрилла содержит фибриллярный белок тропомиозин, ТМ
(М = 68000) и глобулярный белок тропонин, ТН (М = 70000).
Три белка в тонкой протофибрилле находятся в определенном
соотношении: на 7 глобул актина приходится по одной молекуле тропо-
миозина и тропонина. Стержнеподобные молекулы тропомиозина
длиной около 40 нм располагаются в бороздках актиновой
суперспирали и взаимодействуют конец к концу. С каждой молекулой
тропомиозина связывается молекула тропонина, состоящая из трех
субъединиц: тропомиозин-связывающей субъединицы, ТН-Т (М =
'-=30500), ингибиторной субъединицы, TH-I (М == 20700) и Са2+-
связывающей субъединицы, ТН-С (М = 17850). ТН-С имеет четыре
Са2+-связывающих центра: два центра с высоким сродством,
которые кроме Са2+ могут связывать и ионы Mg2+, и два центра с низким
сродством, которые связывают только ионы Са2+. Участок
связывания тропонина на тропомиозине находится на расстоянии 13 нм от
С-конца ТМ молекулы.
В тонкой протофибрилле находятся также другие белки. На
свободных концах тонких нитей в центре саркомера находится
§-актшшн. Он влияет на полимеризацию растущей нити F-актина.
Из Z-диска выделены а-актинин (М = 180000), филамин (М =
= 240000), десмин (М = 50000). Филамин и а-актинин обнаружены
внутри Z-дисков. Эти белки образуют поперечные мостики между
актиновыми нитями, собирая их в пучки и крепя их к Z-диску.
Десмин локализован по периферии Z-дисков и обнаружен также
в местах, где Z-диски примыкают к сарколеме.
Толстые протофибриллы состоят из молекул миозина и
представляют собой вытянутые цилиндрические структуры длиной
1,6 мкм и диаметром 16 нм (рис. 156, а). В центральной части
(длиной 160—180 нм) протофибрилла не имеет поперечных мостиков,
в результате чего образуется «голая зона» протофибриллы (рис. 146,
б), в которой миозиновые молекулы соединены хвостом к хвосгу.
Далее по обеим сторонам от центра протофибриллы молекулы
миозина агрегируют полярно по типу хвост к головке. Головки миозина
выступают наружу в виде поперечных мостиков с шагом спирали
42,9 нм и субъединичным периодом 14,3 нм (рис. 156, а). В толстой
протофибрилле обнаружены также минорные белки, С-, Х-, Н-
и /-белки с молекулярными массами 140000, 133000, - 64000 и
50000.
Важную роль в функционировании толстой протофибриллы
выполняет М-полоса шириной 0,08—0,1 мкм. Она состоит из 4 или
5 узких линий, расположенных на расстоянии 20—22 нм друг от
277
Друга. На микрофотографиях поперечных срезов УИ-полосы
просматривается гексагональная сетка из поперечных мостиков (М-мос-
тики диаметром 4 нм), соединяющих протофибриллы (рис. 146, в).
М -мостики пересекаются тонкими продольными М-нитями
диаметром 5 нм, идущими параллельно толстым протофибриллам сарко-
мера. М-полосе отводится определяющая роль в поддержании
правильной решетки толстых протофибрилл. В Л4-полосе обнаружены
три белка: креатинкиназа (М = 80000), М-белок (М = 165000)
и миомезин (М = 185000). М -белок и миомезин локализованы
в М-нитях; креатинкиназа — в М-мостиках.
Регуляция взаимодействия толстых и тонких про-
тофибрилл. В основе мышечного сокращения лежит
взаимодействие между толстой и тонкой протофибриллами, регулируемое ионами
Са2+. Была предложена стерическая модель регуляции сокращения.
Ионы Са2+, связываясь с ТН-С, вызывают ряд изменений в
структуре и организации белков тонкой протофибриллы так, что
информация передается через тропомиозин и актин к АТФазному центру
миозина.
Тропомиозин на актиновом филаменте изменяет свое положение
в зависимости от функционального состояния мышцы. В
расслабленной мышце, когда концентрация ионов Са2+ в саркомере ниже
10 "8 М, тропомиозин ориентируется под углом 50° по отношению
к центру тонкой протофибриллы, в результате чего TH-I ингиби-
рует взаимодействие головки миозина с актиновой протофкбриллой
(рис. 156, б). При возбуждении мышцы ионы Са2+ связываются
с ТН-С и вызывают такие конформационные изменения в ТН—ТМ
комплексе, в результате которых тропомиозин «сползает» в бороздку
актиновой суперспирали, ориентируясь под углом 70°. При этом
TH-I освобождает центр связывания на актине, и головка миозина
взаимодействует с тонкой протофибриллой, развивая активную
тянущую силу.
Согласно предложенной модели, регуляция сокращения
исчерченной мышцы всецело связана с ТН—ТМ-комплексом, который
локализован на тонкой актиновой протофибрилле, и поэтому такую
регуляцию называют актин-связанной регуляцией.
Несмотря на признание стерической модели, имеется ряд фактов
(например, наличие определенного количества замкнутых мостиков
в релаксированной мышне), которые она не может полностью
объяснить. Высказана гипотеза, в которой ТН—ТМ-комплекс в
отсутствие Са2+ блокирует кинетическую стадию АТФазной реакции,
на которой происходит освобождение неорганического фосфата Ф
(стадия АМ*А^Ф ^ AM • АДФ + Ф, рис. 158).
Миозин и АТФазная реакция. Миозш — один из главных
белков мышечных клеток (рис. 157). Он представляет собой
комбинацию ковалентно связанных глобулярных и фибриллярных
структур. В результате действия протеолитических ферментов (трипсина
и папацна) миозин расщепляется на фрагменты: легкий меромиозин
(ЛММ), тяжелый меромиозин (ТММ), субфрагмент 2 (С-2) и два
278
пмм
80нм
Трипсин
Рис. 157. Молекула миозина исчерченной мышцы:
ТММ — тяжелый меромиозин; ЛММ — легкий меромиозин; С-1—головка миозина,
субфрагмент С-1, С-2 — субфрагмент C-2; / — щелочные легкие цепи, 2— ДТНБ-лег-
кие цепи
субфрагмента i (С-1). Физико-химические характеристики миозина
и его фрагменте®: миозин—М = 480000, длина 160 нм; ТММ —
М = 340000, длина 60 нм; ЛММ — М = 140000, длина 80 нм;
С-2 — М = 62000, длина 47,5 нм; С-1 (головка миозина) — М =
120000, длина 19 нм, толщина 9 нм.
Отдельные фрагменты (домены) миозина выполняют
определенные физиологические функции. Так, ЛММ имеет важное значение
в образовании толстых протофибршиь В субфрагменте С-1 (головке
миозина) локализованы АТФазные центры и центры связывания
с актином. Головки миозина образуют поперечные мостики, которые
создают активную тянущую силу в саркомере при сокращении
мышцы.
Молекула миозина имеет субъединичное строение. При
обработке мочевиной или хлоридом гуанидина молекула миознна
диссоциирует на две тяжелые цепи с М =200000 и четыре легкие цепи:
£ь gz и £з- Дэе одинаковые £2-цепи (М = 18500) отщепляются
при обработке миозина 5,5-дитиобис-2-нитробензойной кислотой
(ДТНБ). Поэтому их называют еще ДТНБ-легкими цепями
(рис. 157). Две другие легкие цепи gx(M = 20700) и gs <M = 16500)
диссоциируют в щелочной среде (рН = 11), и поэтому их называют
щел&чными легкими цепями. ДТНБ-легкие цепи локализованы
вблизи «шарнирного» соединения С-1 — С-2 (рис. 157). Связывание ионов
Са2+ с ДТНБ-легкими цепями приводит к конформационньш
изменениям, которые способствуют переориентации поперечных
мостиков. Таким образом, ДТНБ-легкие цепи могут выполнять регуля-
торную функцию.
Для выполнения механической работы мышцей используется
энергия, освобождающаяся при гидролитическом расщеплении
АТФ в активных центрах миозина. Поэтому АТФазная активность
миозина является тлавной его функциональной характеристикой.
Миозиновая АТФаза была открыта советскими учеными В. А. Эн-
гельгардтом и М. Н. Любимовой в 1939 г. Миозиновая АТФазная
реакция не подчиняется простой кинетике Михаэлиса — Ментен
(4.49), а проходит через ряд стадий, на которых образуются проме-
279
Медленная
М* • АТФ J±~. М**. АДФ Jh м* • АДФ _^
А IJ II А
АМ+АТФ 3» AM • АТФ 3t AM* АТФ AM*- £Д(МаМ* ^ДФ^;АМ-АДФ+Ф
Быстрая АМ+АДФ
Рис. 158. Гидролиз АТФ акюмиозиновой системой*
AM — лктомиозин; М — миозин, А — актин, М*. М** — интермедиатные конформации
миозина, обогащенные энергией
жуточные (интермедиатные) конформации миозина М* и М**„
обогащенные энергией (рис. 158). Начальные стадии —
присоединение АТФ к миозину (к2 = 400 с"1) и расщепление АТФ с
образованием наиболее обогащенного энергией интермедиата М**фДФ
(к3 = 160 с"1) — достаточно быстрые. В отсутствие актина стадия,
связанная с переходом М**фДФ в низкоэнергетическую форму М*фДФ,
является наиболее медленной (к4 = 0,04 с""1) и представляет ско-
рость-лимитирующую стадию в АТФазной реакции миозина.
При взаимодействии актомиозина (AM) с АТФ образуется интер-
медиат АМ*фДФ, после чего актин очень быстро диссоциирует.
В отсутствие актина происходит преобразование М* • АТФ ^
^ М** • &ДФ. Затем актин быстро ассоциирует с М**фДФ и
значительно ускоряет распад этого комплекса. В присутствии актина
стадия АМ**фДФ ^ АМ*фДФ ускоряется на несколько порядков
(к5 = 20 с"1) по сравнению с преобразованием М**фДФ ^ М*фДФ.
Таким образом, характерной особенностью рассмотренного механизма
являются диссоциация и рекомбинация актомиозинового комплекса
для каждого оборота АТФазного цикла. Поведение простой акто-
миозиновой модели может хорошо подгоняться к структурной
модели мышцы, требующей присоединения и размыкания мостика
в механохимическом цикле.
Чувствительные биофизические методы — дифференциальная
спектрофотометрия и УФ-флуоресценция — позволяют
регистрировать конформационные изменения миозина при гидролизе АТФ.
При взаимодействии АТФ с миозином регистрируется изменение
собственной флуоресценции миозина у-100% (рис. 159), где А/ =
'о
= I — 10 — изменение интенсивности флуоресценции после
добавления АТФ; /0 — стационарный уровень флуоресценции миозина до
добавления АТФ. Кинетическая кривая у-100% состоит из
быстро
рого увеличения и медленного спада флуоресценции со скоростью,
равной скорости гидролиза АТФ в лимитирующей стадии АТФазной
реакции. Такой характер изменения флуоресценции отражает
образование и исчезновение интермедиатнои конформации миозина
м**£дф.
280
оооо
2k 28
t.MUH
Рис. 159. Изменение интенсивности
флуоресценции {^-— Ю0% ) миозина
исчерченной мышцы при добавлении
АТФ и двухвалентных ионов:
у — Mg*+; 2 — Са*+
Рис. 160. Различные структурные
состояния миозинового мостика;
а — ригорный молик, б, в, г —
циклическая работа мостика б — разомкнутыЛ
мостик (конформация миозина М*-АТФ); в —
замкнутый мостик перед развитием тянущей
силы, под углом 90° (обогащенная энергией
конформация миозина М** А^Ф), г —
замкнутый мосшк, развивающий тянущую
силу при повороте на 45°, / — тонкая прото-
фибрилла, 2 — толстая протофибрилла, 3 —
головка миозина С-1; 4 — АТФазный центр;
5 — субфрагмент С-2
Энергия, которая выделяется
при расщеплении АТФ, запаса-
хд** АДФ
ется в интермедиате М** ф
в форме конформационной перестройки головки миозина.
Актин действует как акцептор этой энергии, благодаря чему
ускоряется АТФазная реакция и увеличивается скорость
диссоциации продуктов реакции. Как видно из кинетической
схемы (рис. 158), продукты реакции поступают в среду в
следующей последовательности: вначале неорганический фосфат (Ф),
а затем АДФ. Скорость изменения флуоресценции миозина зависит
о,- природы двухвалентного иона, участвующего в АТФазной
реакции. Ионы Са2+ значительно ускоряют исчезновение интермеди-
ата М** ф (рис. 159), что способствует увеличению АТФазной
активности миозина. Ионы Mg2+ выполняют роль релаксирующего
фактора, замедляющего распад интермедиатов миозина.
Теории мышечного сокращения. Любая теория
мышечного сокращения должна удовлетворять уравнению Хилла (11.6).
Первая кинетическая теория сокращения мышц была предложена
А. Хаксли (1957). Фактически, это модель скольжения двух типов
протофибрилл. В основу модели положены важные факты,
полученные на основании электронно-микроскопических и
рентгенографических исследований. Толстые и тонкие протофибриллы способны
смещаться одни относительно других. Во время сокращения длина
и структура протофибрилл не изменяются; наблюдается только
281
изменение направления движения поперечных мостиков. Сила,
развиваемая саркомером при постоянной длине, пропорциональна
числу мостиков в зоне перекрытия толстых и тонких протофибрилл.
Дальнейшее развитие теория скольжения получила в
кинетической модели сокращения В. И. Дещеревского (1968). Здесь также
моделируется взаимное скольжение двух жестких протофибрилл:
толстой и тонкой. На толстых протофибриллах расположены
мостики, которые замыкаются с тонкими протофибриллами. Рабочий
цикл мостика определяется тремя состояниями мостика: свободный
мостик, замкнутый мостик, развивающий тянущую силу /, и
замкнутый мостик, развивающий тормозящую силу —/. Обозначим
общее число мостиков в зоне перекрытия протофибрилл а,
количество активных тянущих мостиков п и тормозящих мостиков — т.
Запишем кинетические уравнения для скорости изменения
количества мостиков в разных состояниях как
g- = ft, (a — n — m) — j n\
jf = j-n — k2m, <U.ll)
где a — n — m — количество свободных мостиков; kx— постоянная
скорости перехода мостика из свободного состояния в тянущее;
/ —расстояние, на котором мостик развивает активную тянущую
силу; v—скорость относительного движения толстой и тонкой
протофибрилл; &2— постоянная скорости перехода мостика из
тормозящего в свободное состояние.
Согласно закону Ньютона, запишем в общем виде движение
массы М иод действием сил, развиваемых в саркомере, и внешней
нагрузки Р:
Ma^fn — fm — P. (11Л2)
где а = £? — ускорение. Тогда
M§ = f(n-m)-P. (11.13)
Рассмотрим стационарный режим работы, т. е, сокращение с
постоянной скоростью v в условиях изотонической нагрузки Р = const
при длинах мышцы, близких к ее длине в организме, когда а = а0,
В этих условиях ijrr = О, -тг = 0"> $ = 0J получим три
алгебраических уравнения:
К ia* — п — т) —^п — О*
■j-n — k2m = 0,
f(n — m) — Р = 0, (П.14)
282
которые легко решаются относительно и и Р. Связь между этими
двумя параметрами будет иметь следующий вид:
Введя следующие постоянные
получим выражение
(P + a)v = b(fa0-P). (11.17)
Для выяснения смысла /а0 рассмотрим работу мышцы в
изометрическом режиме, когда v = 0. Тогда
f*o=Po> (И .18)
где Р0— сила изометрического сокращения мышцы. Подставив
выражение (11.18) в (11.17), получим
(P + a)v = b(P0-P). (11.19)
Исходя из циклической работы мостика, Дещеревский пришел к
макроскопическому уравнению Хилла, что указывает на правильность
кинетической теории.
В настоящее время наибольшее распространение получила
модель скользящий филамент—вращающийся мостик (Хаксли,
Симмонс, 1971). Для осуществления вращения мостика в
стержневой части миозина имеются гибкие шарнирные участки (рис. 157):
один соединяет головку с субфрагментом С-2 (шарнир С-1—С-2),
другой соединяет С-2 с ЛММ (шарнир С-2 — ЛММ). Поперечные
мостики выполняют циклические движения на протяжении
сокращения мышцы. С помощью электронной микроскопии и дифракции
рентгеновских лучей изучены различные состояния мостика. При
нормальных физиологических условиях в саркомере содержится
примерно 5 мМ АТФ. Если при отмывании концентрация АТФ
значительно уменьшается, образуются жесткие нерастяжимые мио-
фибриллы, в которых мостики жестко связаны с тонкой прото-
фибриллой. Мышца переходит в состояние ригора. Ригорные
мостики ориентируются под углом 45° к тонким протофибриллам
(рис. 160). Экспериментальною факты говорят о том, что ригорное
состояние мостика фактически моделирует окончание цикла
тянущего мостика (рис. 160, г).
Три другие состояния мостика (рис. 160, б, б и г) изучены в
физиологических условиях работы мышцы и соответствуют
циклической работе мостика. В релаксированной мышце были замечены
разомкнутые мостики (рис. 160, б). Они ориентированы
перпендикулярно (угол 90°) к тонкой протофибрилле, а конформация миози-
новой головки соответствует интермедиату М* • АТФ, который
образуется при гидролизе АТФ (рис. 158). Перед развитием
тянущей силы мостик замыкается под углом 90 и в результате активации
283
актином образуется обогащенный энергией интермедиат М** ф
(рис. 160, в). Запасенная энергия расходуется на вращение мостика
(переход 90°—45°), в результате чего создается тянущая сила,
которая смещает тонкую протофибриллу на небольшое расстояние около
10 *нм (рис. 160, г).
Микроскопическое смещение тонкой протофибриллы на 10 нм
должно быть связано с обратимыми конформационными
перестройками в определенном участке мостика. Данные рентгеновской
дифракции свидетельствуют о том, что основная часть головки,
которая образует мостик, не изменяет ориентацию во время сокращения,
но возможно изменение положения только части головки. Головка
состоит из трех доменов (23К, 50К и 27К), которые могут смещаться
при гидролизе АТФ. Относительное движение доменов миозиновой
головки может быть основой генерации тянущей силы.
Несмотря на большое количество работ, которые обосновывают
модель скольжения протофибрилл, остается неясным главный
вопрос — как преобразуется энергия гидролиза АТФ на
молекулярном уровне в перемещение протофибрилл друг относительно
друга. Интересная гипотеза предложена А. С. Давыдовым (1977),
согласно которой энергия гидролиза АТФ (33 кДж • моль"1)
достаточна для возбуждения внутримолекулярных колебаний в белке.
Такими колебаниями могут быть С—О-колебания пептидных групп
(Амид 1) с частотой 1650—1660 см""1 (энергия 20,5 кДж • моль -1).
Благодаря правильному расположению пептидных групп в а-
спиральной части миозиновой молекулы, колебания имеют
коллективный характер. Возбуждение перескакивает от одной пептидной
группы к другой и быстро захватывает тем больше групп, чем
сильнее резонансное взаимодействие между ними. В результате
расстояние между пептидными группами, на которых локализовано
возбуждение в данный момент, уменьшается. Происходит
локальная деформация шага а-спирали. Локальная деформация вместе
с возбуждением перемещается вдоль спиральной структуры
стержневой части миозина. Такие возбужденные состояния были назвагы
солитонами. Таким образом, энергия гидролиза АТФ превращается
в солитонные возбужденные состояния, которые
распространяются по суперспиральной части миозина. При движении солитона
в миозине создается деформация в виде «распухшей» спирали,
благодаря чему происходит микроскопическое смещение толстой
протофибриллы по отношению к тонкой. В этой теории большая
роль отводится не только головке, но и стержневой части миозина.
i 1.5. Сердечная мышца. Структурные особенности
миокарда, В состав миокарда входит несколько типов клеток,
отличающихся структурой и функцией. Это мышечные клетки рабочего
миокарда — предсердий и желудочков, выполняющие
сократительную функцию миокарда, волокна проводящей системы и клетки си-
нусно-предсердного и предсердно-желудочкового узлов.
Мышечные клетки рабочего миокарда — кардиомиоциты —
облаяло г поперечном исчерченностью, они ветвятся и отделены друг
284
Рис. 161. Типы миокардиальных клеток:
а — мышечные клетки рабочего миокарда, б — проводящие ролокна (волокна Пуркинье);
в — клетки синусно-предсердного узла, г — клетки предсердно-желудочного угла; / —•
ядра; 2 — поперечная исчерченность, 3 — интеркалярные диски
от друга вставочными пластинками, или дисками, что говорит
о клеточном, а не синцитиальном строении миокарда. Вставочные
диски образованы плазматическими мембранами соседних клеток,
которые разделены межклеточной щелью около 20 нм (рис. 161).
Кардиомиоцит окружен плазматической мембраной толщиной
7,5 нм, к которой снаружи примыкает базальная мембрана
Толщиной 50 нм. Вместе они образуют наружную оболочку мышечной
клетки — сарколемму. Сарколемма имеет пальцевидные впячива-
ния — поперечные трубочки, или Т-систему.
Кардиомиоцит содержит одно или несколько ядер. Важными
структурами кардиомиоцитов являются миофибриллы, митохондрии
и саркоплазматический ретикулум, имеющие прямое отношение
к сокращению кардиомиоцитов. Мышечные клетки предсердий
характеризуются рядом структурных особенностей, отличающих их
от мышечных клеток желудочков. Они меньше размерами (диаметр—
5—6 мкм вместо 10—12 мкм кардиомиоцитов желудочков), Т-систе-
ма развита слабо.
Электрические свойства миокардиальной ткани.
Морфологическая обособленность кардиомиоцитов не исключает
тесного функционального взаимодействия ме^кду ними, благодаря
электрической связи между клетками посредством вставочных
дисков (электрический синцитий). Электрические параметры этого
синцития имеют важное значение для понимания природы
возникновения и распространения возбуждения в сложной и гетерогенной
в структурно-функциональном отношении системе, какой является
миокард.
285
Электрические параметры миокарда как синцития
(электрического) существенно влияют на физиологические характеристики
самого миокарда. Во-первых, миокардиальную ткань трудно
возбудить, если стимулирующее воздействие является точечным,
локальным. Действительно, благодаря тому что входное
сопротивление (Rln) синцития очень мало, для создания на таком
сопротивлении пороговой деполяризации требуется сильный раздражающгй
электрический ток. Во-вторых, крутой спад потенциала при
удалении от возбужденной точки приводит к тому, что возбуждением
будет охвачена лишь малая область и оно не сможет перерасти в
регенеративный распространяющийся процесс. Все это делает
миокард помехоустойчивым, и при ограниченных нарушениях в нем
ритмическая работа его не нарушается. Надежность же и
синхронность распространения возбуждения с проводящей системы
на рабочий миокард, например, желудочков осуществляется
развитой сетью проводящих сердечных миоцитов (волокон Пур-
кинье).
Потенциал покоя и потенциал действия клеток
миокарда. Потенциал покоя клеток рабочего миокарда лягушки
составляет — 90 ...— 95 мВ, теплокровных животных —75... —
— 85 мВ. Эта величина является стабильной, не обнаруживает
спонтанных колебаний и близка к калиевому равновесному
потенциалу (Ек).
Потенциал покоя клеток — водителей ритма, как правило,
заметно выше (—60 мВ), проявляет спонтанные колебания и
намного меньше калиевого равновесного потенциала. Это связано
главным образом с большой исходной натриевой проводимостью
мембраны этих клеток (Рк : PNa: PCi = 1,0 :0,58 : 0,02). Поэтому
нормальная ритмоводящая активность относительно слабо
чувствительна к ' изменению наружной концентрации ионов К+.
Миокардиальные волокна способны генерировать два
принципиально различных вида потенциалов действия: 1. Быстрые
потенциалы действия проводящих сердечных миоцитов и рабочего
миокарда желудочков и предсердий. 2. Медленные потенциалы
действия специализированных волокон сердца (синусно-предсердного
и предсердно-желудочкового узлов) и деполяризованных волокон
рабочего миокарда (рис. 162, а).
Конфигурация быстрых потенциалов действия проводящих
миоцитов считается «типичной» формой потенциала действия
миокарда. Проводящие миоциты характеризуются большим потенциалом
покоя (от —80 до —90 мВ) при максимальной диастоле и начальной
быстрой фазой нарастания потенциала действия (фаза 0). Как видно
на рис. 162, А, а, эта фаза потенциала действия имеетовершут
{+ 30 мВ), за которым следует преходящая ранняя фаза быстрой
реполяризации (фаза /), продленная фаза плато медленной реполя-
ризации (фаза 2) и конечная фаза быстрой реполяризации (фаза
<?). После окончания потенциала действия в проводящих миоцитах
часто наблюдается спонтанная деполяризация во время диастолы
(фаза 4).
286
Рис. 162. величина и форма потенциалов действия {А), а также входящие
ионные токи (Б) миокардиальных клеток:
А: быстрые потенциалы действия проводящих волокон (волокон Пуркинье) (а; и
желудочков рабочего миокарда (б); медленные потенциалы действия синусно-предсердкого
узла кв) Цифры обозначай! отдельные фазы потенциалов действия; Ь: разделение
входящих ионных токов ! изолированном миокардиоците желудочка. Потенциал покоя
поддерживается на уровне — 0 мВ; а — деполяризующее ступенчатое смещение потенциала
до • мВ верхняя кривая) сопровождается возникновением начального быстрого (/дга) и
последующего медленного {/(а> входящего тока (нижняя кривая); б — первое ступенчатое
деполяризующее смещение потенциала до—50 мВ сопровождается возникновением быстрого
входящего натриевого <ока (/js^), который быстро инактиЕируется и поэтому
последующее смещение потенциала до 0 мВ вызывает только медленным входящий кальциевый
ток; в—быстрый выходящий натриевый ток заблокирован тетрод от оксином и не возникает
в ответ на первую ступенчатую деполяризацию
В быстрых потенциалах действия волокон желудочков фаза /
менее выражена, а фаза 4 не обнаруживает спонтанную диастоли-
ческую деполяризацию (рис. 162, А, б).
Медленные потенциалы действия возникают при меньшей
исходной диастолической величине потенциала покоя (около —60 мВ),
фаза их нарастания (фаза 0) очень медленная, фаза 1 отсутствует,
а фаза 2 обычно не выражена (рис. 162, Л, в), в фазе 4 появляется
спонтанная диастолическая деполяризация.
Ионная природа возбуждения. В рабочем миокарде
начальный быстрый компонент потенциала действия (фаза 0) имеет
натриевую, тогда как последующее плато (фаза 2) — кальциевую
природу. Поэтому удаление из омывающего раствора ионов Na
или действие тетродотоксина угнетает фазу 0, а удаление
наружных ионов кальция или действие блокаторов кальциевого тока
(ионы Cd2+, Со2+, верапамил, Д6С0) угнетает плато потенциала
Действия. Ионы К+ в основном лишь модулируют форму, амплитуду
и продолжительность потенциала действия.
В условиях фиксации потенциала в проводящих сердечных
миоцитах и рабочем миокарде в ответ на сверхпороговую ступенча-
287
тую деполяризацию гозникает сложный трансмембранный ионный
ток, состоящий из нескольких компонентов. В начале
деполяризации' появляется кратковременный ток, называемый быстрым
входящим током (рис. 162, Б). Пороговая деполяризация для
активации этого тока составляет около 15 мВ, достигает своего максимума
он при потенциале на мембране —20 мВ (рис. 163) и потенциале
на мембране, равном примерно + 50мВ (потенциал реверсии), он
становится равным 0. Имеется ряд доказательств того, что
рассматриваемый ток имеет натриевую природу: его амплитуда
зависит от концентрации ионов Na+ в наружном растворе, а тетро-
дотоксин эффективно и обратимо блокирует этот ток. С
функциональной точки зрения наиболее важным является то, что
натриевые каналы полностью инактивируются уже при уменьшении
потенциала покоя миоцитов рабочего миокарда и проводящих миоци-
тов до —40 мВ.
Как видно из рис. 162, £, спад быстрого входящего тока в конце
замедляется, что связано с развитием так называемого медленного
входящего тока. Этот ток можно обнаружить в чистом^виде,
зафиксировав предварительно быстрый входящий натриевый ток.
Порог активации медленного входящего тока составляет —45...
—40 мВ (рис. 163). Этот ток
достигает максимума при потенциале
около 0 мВ и стремится к 0 при
+50... + 60мВ (потенциал
реверсии). Медленный входящий гок
нечувствителен к тетродотоксину^
Его амплитуда зависитот наружной
концентрации ионов Са2+, угнета-
ЮОмс
-щ
-80 \-
Рис. 163. Вольт-амперные (t.) и
стационарные активационно-инактивацион-
ные (б) характеристики
трансмембранных ионных токов мышечных клеток
рабочего миокарда:
а — вольт-амперные характеристики для
JNz
Са
о •
■ стационарная активация
(moo) и инактипаиш. (**„) входящего
натриевого тока; стационарные активация (d^)
и инактивация (}00) входящего кальциевого
гока. На оси абсцисс отложена величины
потенциала покоя
Рис. 164. Изменение частоты
возбуждения в водителе ритма сердца:
а—изменение частоты (увеличение частоты
показано стрелкой), связанное с различной
скоростью нарастания медленной диастоли-
ческой деполяризации: / — медленное
нарастание деполяризации: 2 — быстрое
нарастание деполяризации; 0 — изменение
частоты в результате изменения величины
порога возбуждения. Порог обозначен
прерывистой линией (изменение порог?
показано стрелкой): I — выше порог
возрождения, 2 — ниже порог возбуждения. 7 —
период возбуждения сердечного ритма
288
-ется неорганическими (Со2+, Cd2+) и органическими (верапамил,
Д600) блокаторами кальциевого тока, но сохраняется при замене
наружных ионов Са2+ ионами Ва2+ или Sr2+. Следовательно,
медленный входящий ток имеет преимущественно кальциевую природу.
Важным свойством медленного входящего тока является его
высокая чувствительность к медиаторам и физиологически
активным веществам. Так, норадреналин и гистамин увеличивают
амплитуду медленного входящего тока в проводящих сердечных миоци-
тах и рабочем миокарде, тогда как ацетилхолин и аденозин,
наоборот, уменьшают ее. Усиливающий эффект норадреналина
осуществляется через активацию р-адренорецепторов. Полагают, что
модулирующее действие всех этих веществ на кальциевый ток
происходит через сложную цепь биохимических процессов в клетке с
участием циклических нуклеотидов.
Во время ступенчатой деполяризации в кардиомиоцитах
наряду с входящими натриевым и кальциевым токами появляется также
большой выходящий калиевый ток (/к) (рис. 163). Этот ток имеет
сложную природу и кинетику. В нем можно выделить, по крайней
мере, три компонента, а именно: задержанный потенциалозави-
симый, кальцийиндуцируемый и ранний инактивирующийся
выходящий ток. Выходящие калиевые токи блокируются ионами ТЭА,
Cs+, Ba2+ и 4-аминопиридином.
Автоматик и проводящая система сердца.
Автомашин — это способность клеток спонтанно деполяризоваться до порога
генерации потенциала действия (рис. 164). Эта способность присуща
лишь относительно малодифференцированным (атипичным)
мышечным волокнам сердца. Эти волокна богаты саркоплазмой, бедны
миофибриллами, в них плохо выражена поперечная исчерченность.
Атипичные мышечные клетки сосредоточены в главных очагах
автоматии — синусно-предсердном и предсердно-желудочковом
узлах — и рассеяны в миокарде предсердий и желудочков
(проводящие сердечные миоциты). Они являются водителем ритма, т.е.
генератором автоматических импульсов, распространяющихся по
миокарду и вызывающих в нем возбуждение.
Возникшее в синусно-предсердном узле возбуждение
распространяется на мышечную ткань предсердий и по
специализированным проводящим путям переходит к предсердно-желудочковому
узлу, откуда распространяется по предсердно-желудочковому пучку
и проводящим сердечным миоцитам к волокнам сократительного
миокарда желудочков. В проводящих миоцитах пейсмекерная
деполяризация (рис. 162,Л, а) генерируется неспецифическим
входящим током и главное участие в переносе этого тока принимают
ионы Na+.
* В волокнах синусно-предсердного узла пейсмекерная
деполяризация обусловливается, главным образом уменьшением
задержанной калиевой проводимости мембраны. Чем больше скорость
этой деполяризации, тем быстрее достигается порог генерации
медленного потенциала действия и тем, следовательно, выше частота
возбуждения и наоборот (рис. 164, а).
289
На частоту возбуждения в пейсмекерных клетках влияет также
величина порога при одинаковой скорости нарастания диастоли-
ческоф деполяризации. Чем выше порог, тем больше времени
требуется для его достижения. В этом случае период возбуждения
водителя ритма Tt увеличивается, а следовательно, уменьшается
частота возбуждения (рис. 164, б). Если порог снижается, это
вызывает уменьшение периода Т2 и увеличение частоты возбуждения
сердечного ритма. Скорость распространения возбуждения в синус-
но-предсердном узле составляет 0,1—0,2 м/с.
Из синусно-предсердного узла возбуждение распространяется
на правое предсердие, затем по специальному пучку — в левое
предсердие и одновременно по межузловому тракту к предсердно-
желудочковому узлу. Отсюда возбуждение переходит на предсерд-
но-желудочковый пучок и его ножки, которые образуют связи с
проводящими сердечными миоцитами (волокнами Пуркинье),
расположенными субэндокардиально в левом и правом желудочках.
Проводящие миоциты в различных участках желудочков проводят
возбуждение к клеткам рабочего миокарда. Так обеспечивается
строгая синхронность возбуждения во всей массе ткани желудочков.
В желудочках скорость распространения возбуждения составляет
от 0,5 до 1 м/с.
11.6. Биомеханика и энергетика сердечной мышцы. Как и в
скелетных мышцах, в миокарде миозин и актин являются
собственно сократительными белками, а тропомиозин и тропонин выполняют
модуляторную функцию по отношению к сократительным белкам.
Тропомиозина в сердечной мышце в два раза меньше, чем в
скелетной, хотя их свойства сходны. Стехиометрия взаимодействия между
молекулами миозина и актина сердечной и скелетной мышц
одинакова и составляет 3,7: 1. Взаимодействие между актином и^миози-
ном в миокарде, как и в скелетной мышце, регулируется
количеством Са2+, которое доступно для связывания тропонином.
Сопряжение возбуждения — сокращения. Структурные
элементы сопряжения возбуждение — сокращение — Г-система и
саркоплазматический ретикулум развиты неодинаково в миокарде
разных видов животных и даже в разных частях миокарда
животных одного и того же вида. В рабочем миокарде млекопитающих
Т-система и саркоплазматический ретикулум развиты хорошо
и характеризуются строгой упорядоченностью. Одна Т-трубочка
образует с цистернами саркоплазматического ретикулума диады
и триады. В волокнах предсердия млекопитающих Т-трубочек либо
вообще нет, либо очень мало. Нет Т-трубочек и в проводящих
сердечных миоцитах, а также, по-видимому, в миокарде лягушки.
В миокарде желудочков млекопитающих саркоплазматический
ретикулум занимает около 3 % объема клетки и представляет собой
широко ветвящуюся сеть, продолжающуюся от одного саркомера
к другому.
Как и в скелетных мышцах, локальная деполяризация
сарколеммы миокардиального волокна электрическим током в области
проекции Z-диска сопровождается сокращением. Но, в отличие от
290
РисЛбб.Зависимость амплитуды фазного
сокращения (нижняя кривая) от
продолжительности плато потенциала
действия (верхняя кривая) (а — в)
и от повторного возбуждения (г):
а—контроль; б, в—соответственно, под
влиянием адреналина и аяетилхолина Для
сравнения показало сокращение
исчерченного мышечного волокна при повторном
возбуждении с малым интервалом времени
(д)
скелетных мышц, здесь сокращение захватывает не два соседних,
а несколько саркомеров, что связано с ветвлением
саркоплазматического ретикулума, проходящего через несколько саркомероб,
Обнаружена тесная корреляция между амплитудой и формой
потенциала действия, с одной стороны, и величиной сокращения,
С другой. Увеличение или уменьшение длительности плато
потенциала действия сопровождается соответствующим изменением
амплитуды одиночного фазного сокращения (рис. 165, а, о, в). Если
Прервать развитие плато потенциала действия, то он не
сопровождается сокращением. В отличие от скелетной мышцы, при
повторных раздражениях с малым интервалом времени сокращения не
суммируются, и в ответ на повторные раздражения потенциал
действия и сокращение всегда меньше, чем на первое раздражение
(рис. 165, г). Это связано с большой длительностью рефрактерного
периода в миокарде и объясняет, почему в миокарде невозможно
получить тетаническое сокращение.
При ступенчатой фиксированной деполяризации сокращение
появляется тогда, когда потенциал покоя уменьшается до —50 мВ.
Именно при этой деполяризации активируется медленный
входящий ток. При увеличении деполяризации сокращение растет
линейно с медленным входящим током. Увеличение сокращения при
высоких наружных концентрациях Са2 +или в присутствии норадрена-
лина также сочетается с увеличением медленного входящего тока.
Однако количества ионов Са2+, входящих в мышечные клетки при
медленном входящем токе во время потенциала действия,
недостаточно для активации сокращения. Поэтому должно освобождаться
дополнительное количество ионов Са2+ из саркоплазматического
ретикулума. Предполагается, что освобождение Са2+ из ретикулума
активируется ионами Са2+, вошедшими в кардиомиоцит во время
потенциала действия (кальцийиндуцируемое освобождение
кальция). Процесс расслабления в миокарде связывается с активным
поглощением ретикулумом ионов Са2+ при помощи кальциевого
насоса и выведением его из мышечных клеток наружу при помощи
Na—Са-обмена и кальциевого насоса.
Механика сокращения сердечной мышцы. Сложная
Структурно-функциональная организация миокарда сильно
затрудняет применение к нему тех принципов и методов, которые
используются для изучения механики скелетных мышц. В отличие
от скелетных мышц, в которых мышечные волокна имеют удлинен-
10*
291
ную форму и параллельное расположение, в миокарде они имеют
малые размеры и разнонаправленное расположение, часто ветвятся
и при помощи множества контактов посредством вставочных дисков
объединены как бы в одну большую клетку.
Сердечная мышца, в отличие от скелетной, обладает
сравнительно высоким напряжением покоя, ее сократительные ответы
очень лабильны и чувствительны к параметрам раздражения,
особенно к интервалу между раздражениями, к хроно- и инотропным
воздействиям. В скелетной мышце, как известно, сила сокращения
зависит от числа вовлеченных в реакцию мышечных волокон и от
частоты возбуждения в двигательных нервных волокнах, иннерви-
рующих мышцу. В миокарде, являющемся как бы большой
двигательной единицей, каждая мышечная клетка обладает собственным
механизмом регуляции силы сокращения.
Для описания механического поведения сердечной мышцы
наиболее часто применяется классическая трех компонентная модель,
состоящая из одного активного сократительного и двух пассивных
упругих элементов (рис. 151). Как и в скелетной мышце, один
пассивный элемент подключен последовательно, другой параллельно
сократительному элементу. Последовательная упругость создается
податливостью концов мышечного препарата и мест его крепления,
а также миозиновых мостиков. Параллельная упругость связана
с наличием коллагена, которого в сердечной мышце в 5—6 раз
больше, чем в скелетной, механическими свойствами самой
мембраны и некоторой податливостью сократительного элемента.
Параметры изометрического и изотонического сокращения
сердечной мышцы заметно отличаются от таковых скелетной мышцы.
Так, в миокарде латентный период изометрического сокращения
(время от действия стимула до начала сокращения) примерно в 7—
10 раз больше, чем в скелетной мышце, а фаза нарастания
напряжения в миокарде сравнительно медленная. Скорость нарастания и
спада изометрического напряжения в предсердиях в 2—3 раза
больше, чем в желудочках.
С помощью различных методов показано, что при
изометрическом режиме сокращения происходит значительное внутреннее
укорочение мышцы, которое в 3—6 раз больше, чем в скелетной
мышце. Это вносит большую неопределенность в оценку силы,
развиваемой сократительным элементом сердечной мышцы.
Развитие изотонического сокращения в миокарде качественно
не отличается от такового в скелетной мышце. И здесь чем больше
нагрузка, тем позднее начинается укорочение мышцы после ее
раздражения и тем меньше скорость и степень укорочения. При
максимальной нагрузке Р0, равной максимальному
изометрическому напряжению, укорочение мышцы не происходит. И наоборот,
при нулевой нагрузке (Р = 0) скорость укорочения мышцы будет
максимальной (vmax).
Для описания связи сила — скорость применяют уравнение
Хилла (11.6). Однако в сердечной мышце при больших и малых
нагрузках скорость укорочения v отклоняется от гиперболы. Кро-
292
Рис. 166. Зависимость длина — напряже- />
ние (сила) для скелетной (/) и сердеч- уо
ной (2) мышц; / —длина саркомера
ме того, в сердечной мышце, в
отличие от скелетной, довольно
трудно определить vmax из-за
большого напряжения покоя. К тому же ; ^ J 1>тИ
на связь сила — скорость сильно
влияют инотропные воздействия (ионы Са2+, строфантин, катехо-
ламины), которые увеличивают Р0 и vmax. Предполагается, что в
миокарде связь сила — скорость имеет ту же природу, что и в
скелетной мышце, и отражает механо-химические процессы
взаимодействия актина и миозина.
В соответствии с теорией скольжения, при укорочении
сердечной мышцы миозиновые мостики циклически открепляются и
прикрепляются к актиновым протофибриллам, втягивая последние
в промежутки между миозиновыми протофибриллами.
Максимальной скорости укорочения соответствует максимальная скорость
оборота мостиков. В свою очередь, скорость оборота мостиков
зависит, по-видимому, от скорости гидролиза АТФ.
Согласно закону Франка — Старлинга, чем больше сердце
растянуто во время диастолы, тем сильнее оно сокращается во время
систолы. Иначе говоря, сила мышечного сокращения зависит от
исходной длины мышечных волокон миокарда. На рис. 166
схематически представлена зависимость активного напряжения от длины
саркомера в миокарде и в скелетной мышце. Видно, что в
миокарде «рабочий» диапазон длин саркомеров очень узкий, активное
напряжение растет круто при увеличении длины саркомеров от
1,8 до 2,2 мкм, плато на кривой длина — сила отсутствует и
напряжение круто падает, когда длина саркомеров превышает
2,2 мкм.
При нулевом диастолйческом давлении длина саркомеров
составляет 1,9 мкм. При возрастании давления в желудочках до
верхнего предела (16—19 кПа, т е. 12—15 мм рт. ст.) длина
саркомеров увеличивается до оптимальной (/ = 2,2 мкм), при которой
мышца развивает максимальную силу. Таким образом, в
нормальных условиях серце работает на восходящей ветви связи длина-
сила (рис. 166). Отсутствие же при /0 плато на кривой длина —
сила и резкое падение активного напряжения уже при
незначительном превышении /п свидетельствует о небольшом
сократительном резерве миокарда.
Энергетика сокращений сердечной мышцы. В миокарде
происходят превращения больших количеств химической энергии
в механическую работу. Механические параметры мышцы,
определяемые в эксперименте, позволяют рассчитать и оценить работу W
и мощность N мышцы при изотоническом сокращении. Как и в
скелетной мышце, W и N по мере увеличения груза Р растут, достигая
максимума при Р = 0,4—0,5 Р0. При дальнейшем увеличении
293
груза W и N уменьшаются, а при Р = Р0 они падают до нуля.
Инотропные воздействия увеличивают W и N при любом грузе Р.
Общая работа мышцы (W) при ее сокращении равна сумме
внутренней (Wi) и внешней (We) работ. В сердечной мышце ввиду того,
что вязкоупругий элемент составляет в ней значительный
компонент, большая часть механической энергии расходуется на
совершение внутренней работы. При изометрическом, сокращении №,=
= W0 (W0— максимальная внешняя работа, при которой нагрузка
на мышцу (Р) равна 0,5 Р0'-
Учитывая то, что внутренняя работа Wt в сердечной мышцедо-
вольно большая, коэффициент полезного действия (г\) в ней заметно
ниже, чем в скелетной мышце. Как известно, т] можно рассчитывать*
зная We и общее количество тепла, выделяемого мышцей (Q):
W
Л-Tfrf*" (и-2°)
Для сердечной мышцы т) in vitro с учетом исходного метаболизма
равен 10 %, а при физической нагрузке он растет до 20—30 %.
Напомним, что в скелетной мышце т) достигает 45 %. Абсолютная
сила сокращения в сердечной мышце также намного меньше, чем
в скелетной мышце. Так, в портняжной мышце лягушки при L0
и полном тетанусе абсолютная сила сокращения составляет около
0,018 кг/м2, тогда как в миокарде кошки — только 0,008—0,01 кг/м2.
В покое и при нулевой нагрузке теплопродукция сердечной
мышцы в 5—10 раз больше, чем в скелетной мышце. Эта
теплопродукция связана преимущественно с синтезом макроэргических
соединений в митохондриях, которых в кардиомиоцитах в четыре
раза больше, чем в скелетных мышечных волокнах,
Теплопродукция хорошо коррелирует с количеством кислорода, поглощаемого
неактивным сердцем. Пассивное натяжение мышцы или
увеличение нагрузки сопровождается значительным возрастанием
теплопродукции в миокарде.
В отличие от скелетной мышцы, в активной сердечной мышце
трудно выделить две фазы теплопродукции (начальную и
восстановительную) вследствие их частичного перекрытия. При одиночном
сокращении сердечной мышцЫ вслед за быстрым выделением
теплоты (начальная фаза) следует фаза восстановительного
тепловыделения, которая выше, чем в скелетной мышце, и составляет 20 %
начальной теплопродукции.
При изометрическом сокращении сердечной мышцы выделяемая
суммарная теплота растет почти линейно с увеличением ее
напряжения. Естественно, что теплота активации, входящая в суммарную
теплоту и связанная, по-видимому, с процессом
электромеханического сопряжения, не зависит от изометрического напряжения
мышцы. В сердечной мышце теплота активации меньше, чем в
скелетной мышце.
Механическая активность сердечной мышцы линейно связана со
скоростью поглощения кислорода. Это объясняемся тем, что в
нормальном сокращающемся сердце энергия в аэробных условиях вы-
294
рабатывается вследствие окисления глюкозы и жирных кислот.
В скелетной же мышце при умеренной механической активности
АТФ, как источник энергии, образуется в результате анаэробного
гликолиза. В миокарде гликолитический путь образования
энергии усиливается только при гипоксии и ишемии.
11.7. Неисчерченные (гладкие) мышцы. Строение неисчер-
ченной мышечной клетки. Неисчерченные мышцы входят в
состав внутренних органов и своим сокращением обеспечивают
двигательную функцию этих органов (пищеварительный канал,
мочеполовая система, кровеносные сосуды, миометрий матки и т. д.).
В отличие от скелетной и сердечной мышц, которые развиваются из
мезодермы, неисчерченные мышцы позвоночных животных
развиваются из мезенхимы.
Основной структурной единицей неисчерченной мышечной
ткани является мышечная клетка, имеющая обычно веретенообразную
форму. Длина одной мышечной клетки может быть от нескольких
десятков до 200 мкм. Диаметр в утолщенной средней части клетки
составляет 5...10 мкм.
Снаружи неисчерченная мышечная клетка покрыта
плазматической мембраной, в которой под электронным микроскопом виднУ
своеобразные впячивания, так называемые кавеолы. Кавеолы имеют
простую колбовидную форму и посредством узкой части (шейки)
сообщаются с наружной средой. На 1 мкм2 клеточной поверхности
приходится около 30—35 кавеол. Функциональное значение кавеол
в деятельности неисчерченных мышц пока не ясно. Снаружи
плазматическая мембрана покрыта базальной мембраной. Она имеет
толщину 20 нм и отделена от плазматической мембраны электронио-
бветлым пространством. С внешней части к базальной мембране
примыкают коллагеновые волокна, которые иногда проникают через
нее к плазматической мембране. Плазматическую мембрану вместе
с базальной мембраной и прилегающими коллагеновыми волокнами
часто называют сарколеммой.
Основными внутриклеточными элементами неисчерченной
мышечной клетки являются: ядро, митохондрии, микротрубочки, ли-
зосомы, сократительные протофибриллы и саркоплазматический
ретикулум.
В некоторых участках мембраны соседних мышечных клеток
очень сближены и, как полагают, эти участки — нексусы служат
для функциональной связи между клетками. В нексуса* щель
между контактирующими мембранами соседних клеток очень узкая и
составляет 2...3 нм.
В нексусах между отдельными мышечными клетками
предполагается электрическая связь с малым переходным сопротивлением.
С этой точки зрения неисчерченная мышечная ткань представляет
собой электрический синцитий, а мембраны многих ее клеток —
как бы непрерывная в электрическом отношении мембрана одной
большой клетки.
Потенциал покоя неисчерченных мышечных кле-
ток составляет —50...—70 мВ. В некоторых мышцах (пищеваритель-
295
Рис. 167. Потенциалы действия неисчерчен-
ных мышечных клеток кишок (а) и
мочеточника (б) в нормальном растворе (/), в
бескальциевом растворе (а, 2) под влиянием
5 мМ ТЭА (б, 2) и гистамина (б, 3) в
концентрации 10"" * М
ный канал, некоторые сосуды, матка)
потенциал покоя обнаруживает
спонтанные колебания в виде коротких
пейсмекерных потенциалов и
медленных волн, на которых при достижении
порога деполяризации возникают
потенциалы действия. Как и в других
мышечных и нервных клетках, в
образовании потенциала покоя неисчерчен-
ных мышечных клеток участвуют
главным образом ионы К+, Na+ и CI".
Особенностью ионного состава неисчер-
ченных мышц является большая
внутриклеточная концентрация ионов С1~ и Na+.
Потенциалы действия неисчерченных мышц. Все
неисчерченные мышцы по их способности генерировать потенциалы
действия в ответ на пороговую и сверхпороговую стимуляцию условно
делятся на фазные и тонические. Первые в ответ на раздражение
генерируют полноценный потенциал действия по правилу «все или
ничего», вторые, в крайнем случае, локальную деполяризацию.
Потенциалы действия различных неисчерченных мышц имеют
форму от простых потенциалов действия длительностью 20—50 мс
(миометрий, воротная вена, кишки) до потенциалов действия с
выраженным плато (рис. 167) длительностью до 1 с и больше
(мочеточник). Ионы Са2+ и К+ играют главную роль в генерации простых
потенциалов действия.
Потенциалы действия, состоящие из начального быстрого
пикового компонента и последующего плато (рис. 167, б), имеют
более сложную ионную природу. В неисчерченных мышцах,
например , мочеточника начальный пиковый компонент потенциала
действия имеет преимущественно кальциевую природу, тогда как
последующий медленный компонент плато — преимущественно
натриевую.
Исследования при помощи метода фиксации напряжения на
внутриклеточно диализируемои изолированной мышечной клетке
показали, что при ступенчатой деполяризации трансмембраиные
токи имеют форму, показанную на рис. 168.
Опыты с применением соответствующих блокаторов ионных
токов показали, что начальный входящий ток имеет кальциевую
природу, тогда как последующий выходящий — калиевую Когда
весь внутриклеточный ионизированный калий заменяется ионами
Cs+, то при ступенчатой деполяризации возникает только входящий
кальциевый ток, который состоит из начального инактивирующегося
296
6 ЮОмс
Рис. 168. Трансмембранные ионные токи изолированной неисчерченной
мышечной клетки кишки морской свинки, Еозниканлиие в ответ на ступенчатую
деполяризацию:
а — начал» ныц входящий кальциевый и последующий выходящий калиевый токи в
присутствии ионов К+ внутри и снаружи мышечной клетки, б — входящий кальциевый ток
после замены ионов К+ внутри и снаружи мышечной клетки ионами Cs+ и ТЭА, в —
волы-амперная характеристика для выходящего калиевого /j^ и входящего кальциевого
J qb тсков. Цифры на злектрограммах ионных токов (а, б) обозначают Е^личину (и знак)
мембранного потенциала, к которой qh смещался прямоугольным импульсом электричес-
к< го тока от поддерживаемого потенциала, равного —60 мВ
и последующего неинактивирующегося компонентов (рис. 168, 6).
На рис. 168, в представлена вольт-амперная характеристика,
построенная для максимумов выходящего калиевого и входящего
кальциевого токов. Порог активации кальциевого тока находится
в области —30 мВ, максимум тока приходится на +10...+ 15 мВ,
а потенциал реверсии его выше чем +80 мВ.
Опыты в режиме двухступенчатой деполяризации показывают,
что в неисчерченных мышцах инактивация входящего кальциевогй
тока зависит не столько от величины мембранного потенциала,
сколько от концентрации ионов Са2+ внутри мышечной клетки
(рис. 169) (кальцийзависимая инактивация).
11.8. Активация сокращения в неисчерченных мышцах. Общим
в цепи событий, ведущих к активации сокращения в исчерченных
и неисчерченных мышцах, является разве только то, что в обоих
случаях обязательным условием для активации является
увеличение концентрации ионизированного кальция в миоплазме. Это было
797
200nAL_
ЮОмс
UL>MB
Рис. 169. Зависимость инактивации входящего кальциевого тока от
кондиционирующего смещения мембранного потенциала:
с — электрограммы входящего в ответ на кондиционирующее и последующее
тестирующее ступенчатое смещение мембранного потенциала. Величима, до которой
смещался мембранный потенциал кондиционирующим импульсом, указана в начале
электрограммы цифрами. Поддерживаемый потенциал был равен—50 мВ {верхняя электро*
грамма) Тестирующим импульсом мембранный потенциал смещался до + 15 мВ; б —•
зависимость относительной инактивации входящего кальциевого тока (///тах) от
кондиционирующей величины мембранного потенциала Е. /тах — амплитуда входящего
тока (принята за единицу) без кондиционирующего смещения мембранного потенциала
(верхняя электрограмма на а); / — относительная величина тестирующего входящего
тока, которому предшествуют кондиционирующее смещение мембранного потенциала
убедительно показано в исследованиях на скинированных
сапонином неисчерченных мышечных клетках. Оказалось, что пороговой
концентрацией ионов Са2+, необходимой для активации сокращения
в данных клетках, является 10~7 М. Максимальное сокращение
наблюдается при концентрации ионов Са2+ 10 ~5 М.
Структурная основа сопряжения возбуждение — сокращение
в неисчерченных клетках существенно отличается от таковой
в исчерченных мышцах. Прежде всего, в них полностью отсутствует
Г-система, а саркоплазматический ретикулум составляет только
2—7 % объема цитоплазмы. Некоторые исследователи усматривают
прямую связь между степенью развития саркоплазматического ре-
тикулума и способностью неисчерченных мышц сокращаться в
бескальциевом растворе. Способность саркоплазматического ретикулу-
ма неисчерченных мышечных клеток аккумулировать
двухвалентные катионы является важным доказательством того, что, как и в
Скелетных мышцах, он является запасником внутриклеточных
ионов Са2+.
Сократительный аппарат неисчерченной мышцы.
Толстые протофибриллы неисчерченных мышц состоят из миозиновых
молекул. Морфологически миозиновые протофибриллы
неисчерченных мышц отличаются от таковых исчерченных мышц.
Предполагается, что в миозиновых протофибриллах поперечные мостики
расположены по спирали, как в скелетных мышцах, однако пока
нет четкого доказательства этого. В неисчерченных мышцах харак-
£98
тер расположения молекул миозина в протофибриллах
окончательно не выяснен. Толщина миозиновых протофибрилЛ 12—15 нм,
длина —2,2 мкм.
Хотя размеры и молекулярная масса миозиновых молекул из
двух типов мышц одинаковые, имеются различия в субъединичном
строении молекул. Миозин неисчерченных мышц состоит из двух
тяжелых цепей (М = 200000) и четырех легких цепей (две с М =
*= 20000 и две с М = 16000).
Легкая цепь (М = 16000) аналогична щелочной легкой цепи
миозина исчерченных мышц, которую называют существенной
легкой цепью, так как ее диссоциация вызывает потерю АТФазной
активности миозина. Легкая цепь (М = 20000; Л20) имеет значение
для регуляции. Субъединица Л20 служит субстратом для
специфической Са2+-зависимой киназы, которую называют киназой
легких цепей миозина (КЛЦМ). КЛЦМ фосфорилирует Л20> а
специфическая фосфатаза (Ф) дефосфорилирует Л20. Так как Л20 может
фосфорилироваться и дефосфорилироваться, эту цепь часто
называют Р-легкой цепью. Миозин неисчерченных мышц отличается от
миозина исчерченных мышц большой лабильностью,
аминокислотным составом, высокой растворимостью, чувствительностью к
ферментам, солям и денатурации, а также иммунологическими
свойствами. Его АТФазная активность ниже, чем миозина исчерченных
мышц, что коррелирует с медленным нарастанием сокращения.
Главным компонентом тонких протофкбрилл является актин
с М~= 42000. Так же, как и в исчерченной мышце, G-актин не-
исчерченной мышцы полимеризуется в фибриллярный F-актин.
В тонкой протофибрилле F-актин образует супер спиральную
структуру. Кроме актина в тонкой протофибрилле имеется тропомиозин,
структура которого близка к структуре тропомиозина исчерченных
мышц В тонкой протофибрилле неисчерченных мышц отсутствует
регуляторный белок тропонин. Это существенно изменяет способ
регуляции сокращения — расслабления в неисчерченной мышце
от исчерченной мышцы.
В исчерченных мышцах отношение толстых протофибрилл к
тонким равно 1 :2. В неисчерченных мышцах это соотношение
колеблется от 1 :5 до 1 :27. При этом даже в различных неисчерченных
мышцах одного и того же животного содержание актина, в отличив
от миозина, может быть неодинаковым.
Предполагается, что актиновые и миозиновые протофибриллы
объединены в миофибриллы, простирающиеся на относительно
небольшое расстояние под углом к длинной оси мышечной клетки.
Своими концами миофибриллы прикреплены к плотным тельцам
плазматической мембраны, являющимся аналогами Z-дисков
исчерченных мышечных волокон. При изотоническом сокращении нена-
груженной или малонагруженной мышцы миофибриллы
располагаются почти поперек длинной оси мышечной клетки.
К настоящему времени имеются только качественные и
непрямые данные относительно компартментализации кальция внутри
и снаружи неисчерченных мышечных клеток. Судя по тому, что
299
Рис. 170. Связь между возбуждением и сокращением в неисчерченных мышцак:
а—потенциал действия мышечных клеток кишки (/) и мочеточника (2) сопровождается
фазным сокращением мышечной полоски; 6 — гиперкалиевый раствор Кребса (IOOmMKCI)
вызывает большую и стойкую деполяризацию мышечных клеток кишки,
сопровождающуюся фазно-тоническим сокращением. Анэлектротоническая ступенчатая реполяризаци*
(Ан) мышечных клеток вызываег соответствующее уменьшение тонического сокращения.
Начало действия гиперкалиевого раствора отмечено стрелкой
пороговая концентрация ионизированного кальция, необходимого
для активации сокращения, находится в пределах 10~7 М, в мио-
плазме неисчерченных мышечных клеток расслабленной мышцы его
концентрация должна быть ниже 10~7 М. Концентрация кальция
в гладком саркоплазматическом ретикулуме мышечных клеток
неизвестна. Небольшая часть кальция, видимо, адсорбирована и
связана во внутреннем примембранном слое.
Сопряжение возбуждения и сокращения.
Одновременная регистрация электрической и сократительной активности
мышечных клеток указывает на тесную связь между потенциалом
действия и фазным сокращением (рис. 170, а). При частых
потенциалах действия отдельные фазные сокращения могут суммироваться
в зубчатый или слитный тетанус.
В отношении неисчерченных мышц пока нет надежного и
универсального приема, при помощи которого можно было бы
добиться разрыва связи между возбуждением, т. е. генерацией
потенциалов действия в плазматической мембране, и сокращением.
Действительно, удаление ионов Са2+ из омывающего растЕора или
добавление к последнему блокатора кальциевого тока угнетает и
потенциалы действия, и сокращение в неисчерченных мышцах. Действием
в этих условиях на поверхностную мембрану импульсами
деполяризующего тока не удается вызвать сколько-нибудь заметного
сокращения. Следовательно, фазное сокращение, возникающее в
неисчерченных мышцах при генерации потенциалов действия,
активируется в основном теми же ионами Са2+, которые участвуют в гене-
300
Рис. 171. Действие верапамила (10~5 М) на электрическую и сократительную
активность мышечных клеток воротной вены:
/—действие норадреналина На в контроле; 2 — эффект норадреналина на 15 минуте
действия верапамила; 3 — эффект норадреналина после добавления к раствору с
верапамилом 100 мМ КС1. Продолжительность деГгстьия норадреналина и КС1 отмечена
жирной линией. Прерывистая линия отмечает исходную величину мембранного потен ци$-
ла и сокращения. ФиТ- фазный и тонический компоненты норадреналинового сокращения
рации потенциалов действия. Расчеты показывают, что при
генерации одиночного потенциала действия амплитудой 50—60 мВ в не-
исчерченные мышечные клетки входит достаточное количество
ионов Са2+ для активации фазного сокращения. Эти ионы кальция
входят в мышечные клетки через потенциалозависимые кальциевые
каналы мембраны, ответственные за генерацию потенциалов
действия .
Опыты с калиевой деполяризацией неисчерченных мышц,
сопровождающейся значительным сокращением мышечной полоски
(калиевая контрактура), являются удобной, хотя и весьма
приближенной, моделью для исследования природы электромеханической
связи при деполяризующем действии на мышцы медиаторов и
физиологически активных веществ. Установлено, что при калиевой
деполяризации сокращение активируется преимущественно
внеклеточными ионами Са2+, которые входят в мышечные клетки через
потенциалозависимые неинактивирующиеся кальциевые каналы
(рис. 170, б). Анэлектротоническая ступенчатая реполяризация
мышечных клеток постоянным электрическим током сопровождается
уменьшением тонического сокращения. Расслабление мышцы
обусловлено закрыванием потенциалозависимых неинактивирующихся
кальциевых каналов.
Норадреналин (На) вызывает в клетках воротной вены
значительную деполяризацию, в результате чего учащаются спонтанные
потенциалы действия. Весь этот комплекс электрических изменений
сопровождается фазно-тоническим сокращением мышечной полоски
(рис. 171). Норадреналиновое сокращение неисчерченных мышц
воротной вены состоит из фазного компонента (Ф), активируемого
внеклеточными ионами Са2+, входящими в мышечные клетки через
потенциалозависимые инактивирующиеся кальциевые каналы, и
тонического компонента (Т), тоже активируемого внеклеточными иона-
Ми Са2+, входящими в клетки через хемоуправляемые и
потенциалозависимые неинактивирующиеся кальциевые каналы. Верапамил
301
(10 ~5 М) угнетает потенциалы действия и фазный компонент норад-
реналинового сокращения и только частично уменьшает
последующий тонический компонент этого сокращения (рис. 171, 2). Вера-
памил полностью угнетает калиевую контрактуру (рис. 171, 3).
В наиболее общей форме цепь событий, развивающихся в неис-
черченных мышцах в ответ на возбуждающее действие медиатора
или физиологически активного вещества, имеет такую
последовательность. 1. Активация хеморецепторов мембраны мышечной
клетки медиатором или физиологически активным веществом. 2.
Открывание хемоуправляемых натриевых и (или) хлорных, либо
закрывание калиевых каналов мембраны. 3. Деполяризация мембраны
мышечных клеток. 4. Открывание потенциалозависимых кальциевых
каналов и генерация потенциалов действия. 5. Увеличение
внутриклеточной концентрации ионов Са2+, активирующих сокращение.
В клетках некоторых неисчерченных мышц событие 4 и даже
события 2 и 3 могут отсутствовать (т. е. отсутствует
электромеханическая связь) и тогда большое значение приобретает активация
хемоуправляемых кальциевых каналов мембраны, вносящих свой вклад в
увеличение внутриклеточной концентрации ионизированного
кальция (фармакомеханическая связь).
Степень участия потенциалозависимых и хемоуправляемых
кальциевых каналов в активации сокращения различных
неисчерченных мышц под влиянием медиатора и физиологически активного
вещества, по-видимому, неодинакова. Она зависит от относительной
плотности этих каналов в мембране, концентрации медиатора или
физиологически активного вещества и тех электрофизиологических
изменений, которые при этом возникают в мышечных клетках.
Определенный вклад в активацию сокращения, вызываемого
медиаторами и физиологически активными веществами, могут вносить
и ионы Са2+, освобождаемые из внутриклеточных запасников. Одна^
ко сокращение, вызываемое этими веществами, в бескальциевой
среде всегда меньше сокращения в присутствии во внеклеточной
среде ионов Са2+; оно кратковременное, а при повторном действии
медиатора или физиологически активного вещества уже не
возникает.
Исходное тоническое сокращение (базальный или миогенный
тонус) ряда неисчерченных мышц, и особенно сосудистых, также
активируется внеклеточными ионами Са2+. Эти ионы входят в
мышечные клетки через потенциалозависимые кальциевые каналы,
ответственные за генерацию спонтанных потенциалов действия,
а также через стационарно открытые потенциалозависимые и хемо-
управляемые кальциевые каналы. Первые формируют тетанический
компонент тонуса, вторые и третьи — тонический.
Медиаторы и физиологически активные вещества могут
вызывать понижение исходного тонуса или путем гиперполяризации,
ведущей к угнетению спонтанных потенциалов действия и
закрыванию стационарно открытых потенциалозависимых кальциевых
каналов, или путем закрывания хемоуправляемых кальциевых каналов
через активацию хеморецепторов.
302
Механика сокращения неисчерченной мышцы.
Характерными чертами фазного сокращения неисчерченных мышц является
большой латентный период его возникновения (рис. 170, а) и
медленная кинетика развития. Считается, что в этих мышцах, как и В
исчерченных, сократительные белки уложены в миофибриллы.
Поэтому по аналогии с исчерченными мышцами можно ожидать, что
степень перекрытия актиновых и миозиновых протофибрилл,
а следовательно, и актиновое напряжение (сокращение) будет
зависеть от длины мышцы. Кривая актиновое напряжение—длина для
неисчерченных мышц качественно похожа на таковую исчерченных
мышц. Поэтому надо полагать, что сокращение неисчерченных мышц
также происходит по типу взаимного скольжения протофибрилл.
Однако теория скольжения применительно к этим мышцам
встречает и ряд затруднений. Во-первых, в исчерченных мышцах
корреляция между актиновым напряжением и степенью перекрытия
протофибрилл обнаруживается только на изолированных мышечных
волокнах при условии фиксации длины саркомера. Относительно
свободное расположение протофибрилл в неисчерченных мышечных
клетках позволяет не применять эту предосторожность.
Во-вторых, неисчерченные мышечные клетки очень малы, они находятся
в своеобразной сети ткани, и нет возможности поддерживать
постоянную их длину при активации. В третьих, в большинстве
работ по установлению связи актиновое напряжение—длина
исследовались длины меньшие, чем L0 (длина максимального актинового
напряжения). Это связано с тем, что при длинах больших, чем L0,
мышца повреждается.
В неисчерченных мышцах рабочий диапазон больше, чем в
исчерченных. Так, если исчерченные мышцы при максимальной
активации укорачиваются до 0,5 L0, сосудистые полоски
укорачиваются до 0,3—0,4 L0. Висцеральные же мышцы еще больше могут
укорачиваться —до 0,2 L0. Об этом говорит почти такое же
укорочение изолированных мышечных клеток. Однако рабочий
диапазон при длинах больше L0 в неисчерченных мышцах детально не
изучали. Дело в том, что при длинах больше L0 пассивное
напряжение очень большое, и оно маскирует активный ответ мышцы
(полоски). Однако имеющиеся данные говорят о том, что активное
напряжение при длинах больших, чем L0 в сосудистых мышцах
падает быстро. Таким образом, в этих областях рабочий диапазон
у них меньше, чем в исчерченных мышцах, которые все еще
проявляют активное напряжение вплоть до длин 1,8 L0.
В исчерченных мышцах связь активное напряжение — длина
полностью объясняется в терминах структуры саркомера и
протофибрилл. В целой мышце это отношение такое же, как и в отдельном
волокне, и напряжение пропорционально степени перекрытия
протофибрилл. Хотя в настоящее время имеются структурные
доказательства того, что в неисчерченных мышцах сократительные белки
уложены в миофибриллы, однако гетерогенная морфология и
ультраструктура этих мышц не позволили определить характер
взаимодействия между протофибриллами. Вот почему пока нет возможно-
303
сти объяснить связь активное напряжение — длина в
неисчерченных мышцах в структурных терминах.
При длинах больших, чем L0 сильное влияние на активное
напряжение оказывает большой пассивный компонент
напряжения. Ведь изолированная мышечная клетка обладает очень малым
сопротивлением к пассивному натяжению и она может удлиняться
в три раза длины ее «покоя». Поэтому надо полагать, что пассивное
напряжение создается в основном внеклеточной соединительной
тканью, содержащей в основном коллаген и эластин. Значит,
активное и пассивное напряжение в неисчерченных мышцах создаются
двумя независимыми параллельными структурными образованиями—
соответственно мышечными клетками и межклеточным
соединительно-тканным материалом. Хотя расположение протофибрилл
в мышцах не такое упорядоченное, как в исчерченных мышцах,
считается, что генерация силы в них происходит в поперечных
мостиках миозиновых протофибрилл при взаимодействии их с
соответствующими активными участками актиновых протофибрилл.
По крайней мере в качественном отношении основные принципы
механики сокращения, развитые для исчерченных мышц,
применимы и к неисчерченным мышцам. Так, у всех неисчерченных мышц
скорость укорочения является максимальной при тех длинах, при
которых изометрическое сокращение также является
максимальным. При любой длине мышцы активное укорочение будет тем
медленнее, чем больше нагрузка. Нагрузки, которые превышают
величину активного напряжения мышцы, предотвращают ее
укорочение, и в этих условиях мышца работает в изометрическом
режиме. Связь между нагрузкой и скоростью укорочения количественно
описывается гиперболическим уравнением Хилла.
Регуляция сокращения — расслабления в неисчерчен-
ной мышце. Многие факты о регуляции в неисчерченных мышцах
получены на таких сократительных моделях, как актомиозин и ски-
нированные мышцы. Актомиозин исчерченных мышц, очищенный
от ТН — ТМ-комплекса, всегда имеет высокую АТФазную
активность, которая не зависит от концентрации ионов Са2+. В
натуральном неочищенном актомиозине ТН—ТМ-комплекс ингибирует
АТФазу. Только после связывания Са2+ к тропонину снимается это
ингибирование. Как было рассмотрено раньше, это пример актин-
связанной регуляции. Очищенный актомиозин неисчерченных
мышц, напротив, является неактивным и в отсутствие тропонина.
Необходимо допустить существование какого-то Са2+-зависимого
активатора для регуляции АТФазной активности. Выяснение
природы такого активатора является главным вопросом регуляции в
неисчерченных мышцах.
В настоящее время рассматриваются две модели регуляции
в неисчерченных мышцах. Предпочтение отдается модели, в
которой в регуляцию вовлекается фосфор ил ирование легкой
субъединицы миозина Л20. Этот тип регуляции называют миозинсвязанной
регуляцией. Киназа легких цепей миозина (КЛЦМ) катализирует
перенос конечного фосфата от АТФ на легкую цепь миозина Л20-
304
Рис. 172. Регуляция сокращения —
расслабления гладкой мышцы:
Р — адоенорецептор; АЦ — аденилатциклаза;
нПК и аПК — неактивная и активная формы
протеинкиназы; Ф — фосфатаза; КЛМЦ —
киназа легких цепей миозина, 17К — каль-
модулин, 125К—каталитическая субъединица
КЛЦМ, А — актин, М — миозин; Л2(, —
легкая цепь миозина, ~ — фосфорилирован-
ный миозин. М* *АДф — интермедиатная
конформация миозина, обогащенная
энергией
Этот фермент состоит из
высокомолекулярного компонента с
М = 125000 (125К) и
низкомолекулярного компонента с М =
- 17000 (17К) (рис 172). Обе
эти субъединицы необходимы для
активной КЛЦМ. Легкая
субъединица 17К идентифицирована
как Са2+-связывающий белок —
Регуляция
АДФ+Ф
Сокращение
кальмодулин.
Активация КЛЦМ происходит только при взаимодействии
субъединицы 125К с кальмодулином 17К, который связал ионы
Са2+(Са2+—17К). Таким образом, увеличивающаяся концентрация
ионов Са2+ в ней счерченной мышце служит сигналом для
активации КЛЦМ. В активном состоянии КЛЦМ фосфорилирует
легкую цепь миозина Л20 (рис. 172). Процесс активации миозиновой
АТФазы при физиологических условиях происходит с помощью
актина только тогда, когда Л20 фосфор ил ирована. Активированный
актомиозин AM гидролизует АТФ, в результате чего происходи^
сокращение неисчерченной мышцы. Инактивация актомиозиновой
АТФазы достигается дефосфорилированием миозина с помощью
миозиновой фосфатазы.
В неисчерченных мышцах важная роль принадлежит
циклическому нуклеотиду, цАМФ, увеличение концентрации которого
в мышце вызывает ее релаксацию. Вещества, которые вызывают
релаксацию неисчерченных мышц, взаимодействуют с (3-адреноре-
цепторами, в результате чего активируется аденилатциклаза (АЦ)
'(рис. 172). С ее помощью увеличивается количество цАМФ, которые
активируют протеинкиназу (аПК). Активированная ПК
фосфорилирует КЛЦМ, переводя ее в неактивную форму (нКЛЦМ), и таким
образом уменьшает вероятность фосфор ил ирования Л20- Эти
процессы ингибируют активацию неисчерченной мышцы.
Предложена другая гипотеза, исключающая фосфор ил ирова-
ние Л20. Авторы этой гипотезы исходят из механизма актинсвя-
занной регуляции сокращения. Главная роль в такой регуляции
принадлежит белку лейотонину, выделенному в небольших
количествах из тонкой протофибриллы неисчерченных мышц. Лейото-
нин состоит из двух субъединиц: регуляторной сМ = 80000 (лейото-
нин А) и Са2^-связывающей субъединицы с М= 17000 (лейотонин
С). Таким образом, по-видимому, в неисчерченных мышцах позво-
305
Рис. 173. Вращающийся жгутик грамотрицательной бактерии E.coli (а) и
схематическое изображение базального тела («мотора») жгутика (б):
? — жгутик; 2 — базальное тело жгутика; 3 — тело бактерии; 4 — филамент жгутика; 5 —
крюк; 6 — кольцо Р; 7 — кольцо L; 8 — ось; 9 — кольцо S; 10 — кольцо М; // —
наружная мембрана, 12 — пептидогликановый слой; 13 — плазматическая мембрана; А, —длина
волны филамента
ночных возможны несколько путей регуляции сокращения —
расслабления: и через фосфорилирование легких цепей миозина (мио-
зинсвязанная регуляция), и через лейотониновую систему (актин-
связанная регуляция). Преобладание того или иного типа регуляции
зависит от типа мышцы.
11.9. Немышечная форма подвижности клеток. Способность
двигаться—одно из неотъемлемых свойств всего живого. На
клеточном уровне подвижность проявляется в разных формах: это,
во-первых, движение клетки как целого в пространстве и,
во-вторых, движение внутри клетки ее органелл и других компонентов.
Подвижность прокариотических организмов. У
прокариот подвижность проявляется главным образом в движении клетки
как целого. Движение осуществляется с помощью специальных
структур—ресничек и жгутиков.
Жгутик представляет собой нитевидный вырост, исходящий из
тела бактерии. Он может быть одиночным, в виде пучка или
покрывать всю поверхность клетки (в виде ресничек). Длина жгутика
больше тела бактериальной клетки. В среднем длина жгутика
составляет от 10 до 100 мкм. Из-за малого диаметра (120-—250 нм)
жгутики трудно рассматривать в оптическом микроскопе. Обычно
используют вещество танин, которое покрывает всю поверхность
жгутика и увеличивает его диаметр, что позволяет наблюдать
работу жгутика в оптическом микроскопе. Нормальные жгутики
волнообразно изогнуты. Важным параметром такого жгутика является
длина волны филамента К (рис. 173, а). Для нормальных жгутиков
А, = 2,5 мкм. Существуют бактерии с аномальными жгутиками
(«курчавые» жгутики, с А, в 2 раза меньшей, чем у нормальных
жгутиков, и прямые жгутики), для которых характерны слабая
подвижность или вообще отсутствие такой подвижности.
306
Электронная микроскопия позволила выявить детали строения
жгутика бактерий. Жгутик состоит из трех частей: филамента
жгутика (флагеллы), крюка и базального тела (рис. 173, б). Наиболее
изучен филамент жгутика. Он построен из единственного белка
флагеллина. В мономерной форме флагеллин представляет собой
глобулу диаметром 4,5 нм с молекулярной массой 53000.
Информационное состояние глобулы характеризуется 25 % ос-спиралей.
Химическая структура флагеллина специфична для каждого штамма
бактерий.
Флагеллиновые глобулы способны ассоциировать in vitro с
образованием фибриллярйых структур (филаментов), аналогичных
филаментам интактных жгутиков. Такие филаменты имеют диаметр
10—15 нм. При самосборке флагеллина происходят конформацион-
ные изменения в глобулах и в фибриллярной форме субъединицы
флагеллина имеют более упорядоченную структуру с 45 % а-спи-
ралей. Филамент жгутика состоит из нескольких флагеллиновых
тяжей, закрученных в левую спираль. Это вызывает вращение
флагеллы против часовой стрелки.
Крюк служит гибким связывающим звеном между базальным
телом и филаментом. Он состоит из белковых глобул с
молекулярной массой 43000.
Базальте тело представляет собой сложную структуру,
ответственную не только за крепление жгутика в теле бактерии, ной,
самое главное, за генерацию движения. В его состав входят 11
полипептидных цепей. Ультратонкая структура базального тела грам-
отрицательной бактерии Е. coli (рис. 173, б) характеризуется
наличием 4 колец, которые контактируют с различными
структурными элементами мембраны бактерии. В наружную мембрану
вмонтировано кольцо L, в пептидогликановом слое мембраны находится
кольцо Я, а кольцо М расположено в плазматической мембране
бактериальной клетки. Только кольцо S не контактирует с
мембранными структурами и расположено в межмембранном пространстве.
Экспериментальные данные указывают на то, что только с кольцом
М связано вращение жгутика. Все другие кольца выполняют
структурную роль. Они фиксируют ось филамента, проходящую
через бактериальную стенку.
Длительное время считалось, что движение бактерий связано
с биением жгутиков (аналогия с работой жгутиков эукариотических
клеток), происходящим за счет гидролиза АТФ специфической
АТФазой, локализованной во флагелле или базальном теле.
Экспериментальные попытки выявить АТФазную активность во флагелли-
не и элементах базального тела не увенчались успехом. С другой
стороны, наблюдения над клетками Е. coli, прикрепленными фла-
геллами к поверхности стекла, полностью отбросили идею биения
жгутиков и подтвердили гипотезу X. Берга (1973) о том, что
движение бактерий создается благодаря вращению флагеллы со
скоростью около 50 оборотов в секунду.
Что же является источником энергии, необходимой для
вращения флагеллы? Экспериментально установлено, что полное
307
истощение АТФ в бактериальной клетке не останавливало ее
движения. Для объяснения этого феномена была предложена модель,
согласно которой быстрое вращение жгутика происходит за счет
трансмембранного протонного градиента. Согласно хемиосмотической
теории Митчелла, величина электрохимического потенциала
протонов Лцн+ определяется двумя составляющими — электрическим
потенциалом Дф и градиентом рН (АрН) (см. параграф 12.4;
уравнение (12.9)). Таким образом, если каким-либо способом уменьшить
величину А^н+, можно замедлять движение бактерий. Оказалось,
совместное введение валиномицина (рассеивает Аф) и ацетата
(снижает АрН) полностью прекращало движение бактерий. В модели
вращения бактериального «мотора» предполагается наличие
протонного канала и Н+-связывающих групп на кольце М. В
результате протонирования таких групп (например, NH2 + H + ->NH3)
создается вращающееся электрическое поле между «статором»
(отрицательно заряженными группами плазматической мембраны)
и «ротором», которым является кольцо М.
В ответ на химические стимулы (изменение концентрации
веществ в среде) изменяется движение бактериальных клеток. Это
явление называется хемотаксисом. В среде бактерии движутся
к тем областям, где концентрация атрактанта повышена или
репеллента понижена.
Изменение концентрации ионов Са2+ в цитоплазме
бактериальной клетки регулирует переключение движения «мотора». При
концентрации ионов Са2+5- 10~8 М и выше флагеллы вращаются по
часовой стрелке, понижение концентрации Са2+ ниже 10~8 М
вызывает реверсию движения флагеллы, вращение происходит против
часовой стрелки. Ионы Са2+, по-видимому, регулируют работу
протонного канала.
Мощность флагеллярного «мотора» запишется так:
N = F - v, (11.21)
где F—сила; v—скорость движения бактерии. Если
бактериальную клетку принять в виде сферы радиуса г, то
^ = 6яг]гу. (11.22)
Тогда мощность запишется так:
N = 6ny)rv\ (11.23)
Выразим линейную скорость v через угловую скорость со:
0= (ог = 2ппг, (11.24)
где п — число оборотов в секунду. Подставив (11.24) в (11.23),
получим tf.MnVW. (11.25)
Сделаем оценку мощности флагеллярного «мотора», принимая,
что г = 1 мкм == 10-в-м; ц = 1,005 • 10~3 Па • с и п = 10 об/с:
# = 24(3,14)31,005 • Ю-3- Ю"18- 102~76,3- Ю-18Дж/с.
зоа
Энергия, освобождаемая при прохождении одного протона с
зарядом q = 1,6 • 10~19 Кл в электрическом поле с Аф = 200 мВ, будет
равна
Е = Дф<7 = 0,2. 1,6- Ю-19 = 3,2- Ю-20Дж. (11.26)
Число протонов, движущихся по электрохимическому градиенту
и необходимых для вращения «мотора» на один оборот, будет равно
_ _/V_ _ 76,3 ■ IP-is __
Шн+ ~~ Еп~~~ 3,2 . 1(Г20 • 10 ~~ 24U'
Несмотря на достигнутые успехи, молекулярный механизм
преобразования электрохимической энергии в механическую работу
вращающегося жгутика требует дальнейшего выяснения.
Подвижность эукариотических клеток. Форма эука-
риотических клеток, их перемещение в пространстве, движение
внутриклеточных структур и компонентов цитоплазмы всецело
определяются развитой сетью белковых филаментов, которые образуют
опорно-двигательный аппарат клетки, называемый цитоскелетом.
С функциональной точки зрения цитоскелет представляет собой
совокупность специфических фибриллярных структур, которые
ответственны за пространственную организацию эукариотических
клеток и их подвижность. Цитоскелет состоит из трех типов
филаментов: микротрубочек (тубулиновые филаменты) диаметром 25 нм,
промежуточных филаментов диаметром 10 нм и микрофиламентов
(актиновые филаменты) диаметром 6 нм (рис. 75).
Создаваемое микротрубочками и микрофиламентами движение
всей клетки может реализоваться в основном двумя способами:
либо движением ресничек и жгутиков, либо амебоидным
движением.
Движение ресничек и жгутиков — одна из наиболее
распространенных форм подвижности, свойственной одноклеточным
простейшим, сперматозоонам, продвигающейся клетке по яйцеводу.
Реснички эпителиальных клеток постоянно продвигают жидкость
вдоль поверхности клеток. Реснички и жгутики — это
миниатюрные волосковые образования диаметром около 0,25 мкм на
поверхности клеток. Генерация движения в ресничках и жгутиках
осуществляется микротрубочками, представляющими собой
стабильные морфологические структуры. Несмотря на сходство
ультраструктуры микротрубочек, жгутики и реснички разных организмов
различаются по характеру осуществляемых ими движений. Жгутик
сперматозоонов и многих простейших производит волнообразные,
ундулирующие движения (следует отличать от вращения жгутика
бактерий). По всей длине жгутика распространяются симметричные
волны изгибания в направлении от базального тела к вершине
жгутика. Каждая ресничка совершает гребное движение. Различают
две фазы биения реснички: активный упругий удар, во время
которого ресничка в выпрямленном состоянии проталкивает жидкость
вдоль поверхности клетки, и возвратный удар, при котором
ресничка расслабляется и, изгибаясь, возвращается в исходное
положение. Каждый цикл реснички длится от 0,1 до 0,2 с.
309
Рис. 174. Строение аксонемы жгутика:
а — продольный разрез; б — поперечное сечение жгутика; в— схема, показывающая взаим*
ное скольжение периферических дублетов микротрубочек аксонемы (дублет к скользит
вдоль дублета п за счет движения динеиновых ручек); / — центральные одиночные
микротрубочки; 2 — центральная оболочка; 3 — динеиновые ручки; 4 — радиальная спица; 5 —»
субфибрилла А; 6—субфибрилла В; 7 — нексиновый мостик; 5—плазматическая мембрана
Участок реснички и жгутика, где происходит генерация силы,
называется аксонемой. На рис. 174, а и б дано схематическое
изображение аксонемы жгутика, представляющий собой сложный комплекс
взаимосвязанных микротрубочек. В центре аксонемы находится
пара микротрубочек (центральный дублет, /), окруженная
центральной оболочкой 2. На периферии аксонемы располагаются
9 пар микротрубочек. В каждом периферическом дублете
микротрубочек одна (основная, или субфибрилла А) представляет собой
полностью замкнутый цилиндр, а другая микротрубочка
(субфибрилла В) имеет серповидную форму и открытой частью примыкает
к субфибрилле А. Все 9 периферических дублетов соединены с
помощью стабильных поперечных нексиновых мостиков 7 (состоят из
белка нексина). Каждая субфибрилла А имеет двойной ряд
боковых динеиновых ручек 3 (состоят из белка динеина) длиной около
14 нм, и из нее выступают в сторону центральной оболочки
радиальные спицы 4. Все эти выросты расположены вдоль субфибриллы А
на определенном интервале: динеиновые ручки—24 нм,
радиальные спицы — 29 и нексиновые мостики—86 нм.
Основание жгутика прикреплено к базальному телу,
находящемуся в цитоплазме клетки. По структуре и функции базальное тело
похоже на центриоль животных клеток; оно объединяет
микротрубочки в аксонему.
Микротрубочки — главные сократительные структуры
ресничек и жгутиков эукариотических клеток. Они представляют собой
длинные, в несколько микрометров полые цилиндры, наружный
диаметр которых равен 25 нм, а внутренний — 15 нм.
Микротрубочки состоят из белка тубулина, который выделяется в виде диме-
ров с молекулярной массой 110000. В свою очередь, димеры
тубулина распадаются на мономерные глобулы а- и Р-тубулина сМ =
= 55000. Подобно актину или флагеллину, при определенных
условиях мономеры тубулина полимеризуются, образуя длинные щюто-
310
фибриллы. Полимеризация начинается с образования димеров тубу-
^лина, а затем р-тубулин одного димера связывается с а-тубулином
следующего димера. Образуются ленты из 13 тубулиновых прото-
фибрилл, которые затем сворачиваются в замкнутые цилиндры,
как это имеется в субфибрилле Л. Незамкнутые микротрубочки
(субфибрилла В) содержат 10 протофибрилл.
С тубулином микротрубочек взаимодействует ряд белков,
которые участвуют в генерации и регуляции движения. Белок динеин
сМ = 400000 обладает АТФазной активностью и играет основную
роль в активном скольжении дублетов друг относительно друга.
Нексин с молекулярной массой 165000 получил такое название,
так как он связывает соседние дублеты микротрубочек. Он
ограничивает степень смещения двух соседних дублетов при их
скольжении друг - относительно друга, при этом жгутик только
изгибается.
Выделяют две группы белков, связанных с цитоплазматиче-
скими микротрубочками, которые обозначают БСМ. Первая
группа — высокомолекулярные Б CM-J (М=350000) и БСМ-2 (М = 270000),
которые присутствуют в основном в микротрубочках клеток
головного мозга. Вторая группа низкомолекулярных БСМ называется
may-белками (М = 70000). Все эти белки способствуют
полимеризации тубулиновых глобул.
Аксонема генерирует движение жгутика с помощью активного
скольжения микротрубочек. Прямые доказательства этому были
получены на изолированной аксонеме, обработанной ферментом
трипсином. При такой обработке избирательно разрушались лекси-
новые мостики и радиальные спицы, но оставались интактными
динеиновые ручки. Такая аксонема при добавлении в раствор АТФ
и ионов Са2+ удлиняется и становится тоньше. В отсутствие некси-
новых мостиков микротрубочки могут скользить друг относительно
друга (рис. 174, в). Каждая динеиновая ручка (подобно головкам
миозина) образует поперечный мостик с соседним дублетом
микротрубочек. При гидролизе АТФ мостик разрывается и динеиновая
ручка изменяет ориентацию.
Попеременное колебание динеиновых ручек вызывает взаимное
скольжение микротрубочек до тех пор, пока они не разделятся.
Если же микротрубочки скреплены нексиновыми мостиками, как
в интактной аксонеме, то при работе динеиновых ручек происходит
только изгибание аксонемы и жгутика. Избирательное
экстрагирование динеина из аксонемы вызывает полное прекращение
движения. О том, что динеин ответствен за генерацию движения,
свидетельствуют исследования сперматозоонов человека при одной из
форм бесплодия (синдром Картагенера). Такие спермйтозооны не
способны двигаться. Электронно-микроскопические исследования
показали, что в них периферические дублеты не имеют динеиновых
ручек.
Кроме того что микротрубочки имеют прямое отношение к
движению клеток, они являются и основными компонентами цитоске-
лета, поддерживающего форму клетки. Микротрубочки в цитоске-
311
лете являются лабильными структурами. Митотическое веретено —
пример такой лабильной структуры. Во время интерфазы
микротрубочки организуются из клеточного центра и пронизывают всю
цитоплазму. Однако на самых начальных этапах формирования
веретена цитоплазматические микротрубочки распадаются.
Движение хромосом осуществляется путем полимеризации и
деполимеризации тубулиновых глобул. Такие вещества, как колхицин и кол-
цемид, связываются с тубулиновыми димерами и препятствуют
полимеризации. Обработка делящихся клеток такими алкалоидами
приводит к исчезновению митотического веретена. Образование
микротрубочек ингибируется также винбластином и винкристи-
ном. Вещество таксол активирует полимеризацию тубулиновых
глобул и стабилизирует микротрубочки.
Кроме чисто структурной функции цитоплазматические
микротрубочки играют главную роль в цитоплазматическом транспорте.
Каждая микротрубочка поддерживает транспорт в обоих
направлениях. В нервных клетках микротрубочки транспортируют си-
наптические пузырьки, содержащие нейромедиатор, к синапсу.
Мембраны пузырьков, освободившиеся после выброса медиатора,
собираются в мультивезикулярные тельца и движутся вдоль
микротрубочек в сторону тела нервной клетки, где они разрушаются
в лизосомах. Митохондрии передвигаются вдоль микротрубочек
в обоих направлениях. Транспорт вдоль микротрубочек
осуществляется с помощью боковых выростов, которые располагаются
с определенной периодичностью и содержат АТФазу (аналоги
динеиновых ручек в аксонеме). В ходе гидролиза АТФ происходит
конформационное изменение боковых выростов, в результате чего
осуществляются активный взмах выроста и перемещение
транспортирующей частички. В расслабленном состоянии выросты
возвращаются в исходное состояние.
Амебоидное движение характер но для многих клеток, таких
как амебы и фибробласты. Этот тип движения охватывает все формы
перемещения клеток с помощью временно образующихся на
поверхности клетки выростов, называемых псевдоподиями. У фиброблас-
тов они называются ламеллоподиями. Амебоидное движение
возможно только в том случае, когда у перемещающегося организма
есть возможность прикрепляться к субстрату, к плотной опоре.
В случае амебоидного движения основная роль в генерации силы
принадлежит микрофиламентам (актиновым филаментам). Следует
отметить, что, в отличие от ресничек и жгутиков, где
сократительный аппарат представляет собой стабильную структуру, микрофи-
ламенты при амебоидном движении являются динамичными
структурами, которые обратимо изменяются. Амебоидное движение
требует координированной деятельности многих компонентов цито-
скелета.
При амебоидном движении происходит изменение внутреннего
строения цитоплазмы, известное как переходы гель ^ золь.
Центральная часть цитоплазмы находится в жидком состоянии л
называется эндоплазмой (золь). Периферическая часть цитоплазмы
i12
находится в состоянии геля и называется эктоплазмой. Она
образует утолщенный кортикальный слой клетки. Жидкая эндоплазма
направляется в сторону образующейся псевдоподии и
преобразуется в гелеобразную эктоплазму.
Амебоидное движение создается сокращением кортикального
слоя; оно связано с функционированием микрофиламентов,
которые образуются в -эктоплазме. Молекулярный механизм такого
движения включает несколько этапов: полимеризацию актина
и образование микрофиламентов, прошивание актиновых фила-
ментов и образование геля. При взаимодействии с миозином в
присутствии АТФ и ионов Са2+ происходит скольжение актиновых
филаментов, прикрепленных к мембране, в результате чего
кортикальный слой сокращается. После сокращения происходит
деполимеризация актиновых филаментов, и цикл повторяется снова.
Микрофиламенты в цитоплазме амебы представляют собой
динамичные структуры. Переходы гель ^= золь в цитоплазме обусловлены
полимеризацией и деполимеризацией актиновых филаментов.
Микрофилйменты немышечных клеток состоят в основном
из актина (М = 42000), который составляет значительную часть белка
в эукариотических клетках (например, в фибробластах до 10 %).
В большинстве изученных немышечных клетках актин находится
в Р- и у-формах. С актиновыми филаментами взаимодействует ряд
белков. Миозин (М = 480000) агрегирует стержневой частью и
образует короткие миозиновые протофибриллы длиной 300 нм. Такие
протофибриллы взаимодействуют с микрофиламентами при генерации
движения. Кроме того, из почвенной амебы Acanthamoeba castellani
был выделен миозин 1. Его молекула содержит одну тяжелую цепь
(М = 140000) и две легкие цепи (М = 160С0 и М = 14000).
Миозин 1 не образует биполярных протофибрилл. Он активируется
актином только в присутствии специфической киназы, которая
фосфорилирует легкую цепь (аналогия с миозином неисчерченных
мышц, см. рис. 172).
В микрофиламентах находится немышечный тропомисзин.
Белки а-актинин и филамин образуют гибкие связи между
микрофиламентами, в результате чего формируется трехмерная сетчатая
структура. Фимбрин сшивает отдельные микрофиламенты в пара-
лельные пучки. Белки виллин и гельзолин вызывают
Са2"'"-зависимую фрагментацию микрофиламентов. Белок профилин (М = 160000),
связываясь с актиновыми глобулами, препятствует полимеризации
актина.
Некоторые химические реагенты могут влиять на полимеризацию
и деполимеризацию актина. Вещество цитохалазин В (метаболит,
выделяемый плесневыми грибами) вызывает деполимеризацию
микрофиламентов, в результате чего ингибируются многие формы
подвижности: фагоцитоз, цитокинез, локомоция. Фаллоидин, в
противоположность цитохалазину В, стабилизирует микрофиламенты.
Цитоплазматические микротрубочки и микрофиламенты
обладают структурной полярностью, два противоположных конца
филамента наращиваются и деполимеризуются с разной скоростью.
313
Это имеет важное значение для закрепления филаментов на
мембране и различных структурах клетки. Полимеризация и
деполимеризация контролируются на обоих концах филамента кэпирующими
белками.
В ряде клеток микрофиламенты образуют ^табильные
структуры, например, микроворсинки эпителиальных клёпок кишок
или почек, где обеспечивается наибольшая площадь всасываяйя.
Сердцевина микроворсинки образуется пучком из 40 актиновых
филаментов. Жесткость такого пучка обеспечивается поперечными
сшивками с помощью фимбрина. На поверхности волосковых
клеток улитки внутреннего уха имеются микроворсинки, называемые
стереоциллями. Сердцевина стереоциллий также состоит из пучка
актиновых филаментов. Небольшие механические колебания в сте-
реоциллях преобразуются в электрические сигналы, которые
передаются в мозг. На волрсковой клетке имеются стереоциллий
различной длины, что позволяет различать звуковые колебания
разной частоты.
Наиболее стабильными в цитоскелете являются промежуточные
филаменты, которые выполняют главным образом структурную
функцию. Существует несколько типов промежуточных
филаментов. Эпителиальные клетки содержат кератиновые филаменты.
Основными компонентами их являются кератиноподобные белки
с молекулярной массой от 40000 до 65000. Нервные клетки содержат
нейрофиламенты. Они состоят из трех белков с молекулярными
массами 68000, 145000 и 220000. Фибробласты содержат виментин-
содержащие филаменты, состоящие из белка виментина (М =*
= 55000).
Микротрубочки, микрофиламенты и промежуточные филаменты
образуют динамическую взаимосвязанную сеть, которая находится
под определенным контролем и обеспечивает изменение формы
клеток, различные виды клеточной подвижности и
внутриклеточный транспорт веществ.
Глава 12. БИОЭНЕРГЕТИКА
Как было показано в предыдущих главах, энергия,
необходимая для выполнения различных функций живой клеткой,
утилизируется последней в трансформированном виде после ее
превращения в энергию АТФ. Благодаря открытиям советских учены*
В. А. Энгельгардта и В. А. Белицера, установлено, что такая
трансформация энергии осуществляется в процессе окислительного фоб-
фор илирования, биологическое значение которого заключается в
ресинтезе АТФ из АДФ и Ф. Впервые ресинтез АТФ, сопряженный
с внутриклеточным дыханием, был обнаружен в 1930—1932 гг.
В. А. Энгельгардтом, и тем самым было доказано существование
окислительного фосфорилирования. В 1939 г. В. А. Белицером^ыл
сделан теоретический вывод о том, что окислительное фосфорили-
рование имеет место при переносе электронов в дыхательной цепи,
а в 1949 г. американские исследователи А.Ленинджер и Е. Кеннеди
S14
Рис. 175. Схематическое изображение
митохондрии:
/ — внутренняя мембрана; 2 — внешняя
мембрана; 5— межмембранное пространство;
4 —кристы; 5 — матрикс
установили, что цикл
окислительного фосфорилирования
протекает в митохондриях.
12.1. Структура митохондрий.
Митохондрии, обнаруженные в
цитоплазме различных клеток, представляют собой органеллы
размером 0,5—3 мкм, форма которых варьирует от
палочкообразной до эллипсоидальной. Для одного и того же типа клеток
количество митохондрий относительно постоянно, однако оно может
меняться в зависимости от энергетических потребностей и размера
клетки.
Благодаря электронно-микроскопическим исследованиям
установлено, что митохондрия ограничена внутренней и внешней
мембранами, толщина которых составляет около 7 нм. В митохондриях
имеются два внутренних пространства (компартмента): между
внутренней и внешней мембранами и пространство матрикса,
ограниченное внутренней мембраной, которая имеет
многочисленные складки и выступы, направленные поперек митохондрии,
называемые кристами (рис. 175). Благодаря кристам значительно
увеличивается поверхность внутренней мембраны. Различие числа
крист в митохондриях связано с количеством синтезируемого
АТФ.
Во внутренней мембране митохондрий локализуются
молекулярные переносчики электронов, составляющие дыхательную цепь,
и ферменты, катализирующие синтез АТФ из АДФ и Ф.
Главная функция внутренней мембраны митохондрий — преобразование
энергии, что отражается на составе белков мембраны. Основные
компоненты электронтранспортной цепи митохондрий следующие:
комплекс I (НАДН: убихинон-оксидоредуктаза) — 0,06—
0,13 нмоль/мг белка; комплекс II (сукцинат:
убихинон-оксидоредуктаза)— 0,19 нмоль/мг белка; комплекс III (убихинол: цитохром
с-оксидоредуктаза) —0,25—0,53 нмоль/мг белка; комплекс IV
(цитохром с: кислор од - оксид ор еду ктаза)—0,6—1,0 нмоль/мг
белка; цитохром с — 0,8—1,02 нмоль/мг белка; АТФ-синтетаза —
0,52—0,54 нмоль/мг белка; АДФ — АТФ-транслоказа — 3,4 —
4,6 нмоль/мг белка; убихинон — 6—8 нмоль/мг белка. Комплексы
электронтранспортной цепи митохондрий находятся в следующих
стехиометрических соотношениях: 1 комплекс 1:2 комплекса II :
: 3 комплекса III: 6 комплекса IV. АДФ — АТФ-транслоказа и
АТФ-синтетаза составляют 2/3 белков внутренней мембраны
митохондрий. На каждый комплекс IV приходится 1 молекула АТФ-
синтетазы и 3—5 молекул АДФ — АТФ-транслоказы.
Основная масса белков комплекса II расположена на М-сторо-
не внутренней мембраны, которая обращена в матрикс; комплексы
315
н* и
и+ пи* и* митдхондриальная
u+L и+ мембрана
п * п
Матрикс
УУУУУУХ
У/////Л
Матрикс
пН+-
•АТФАТФ\
АТФ АТФ
Рис. 176. Схематическое изображение АТФ-синтетазы, как обратимого
сопрягающего устройства (Албертс и соавт., 1987).
а —АТФ-синтетаза использует энергию потока протонов по электрохимическому градиенту
для синтеза АТФ; б — АТФ-синтетаза использует энергию гидролиза АТФ для
перекачивания протонов Н+ через внутреннюю мембрану митохондрий; F\ —каталитический
компонент АТФ-синтетазы (митохондриальный сопрягающий фактор I); Fq —протон-проводящий
ко-шонент АТФ-синтетазы
I, III и IV, АТФ-синтетаза расположены поперек внутренней
мембраны митохондрий.
АТФ-синтетазный комплекс (М = 500000), главная
биологическая функция которого состоит в синтезе АТФ из АДФ и Ф,
включает два основных компонента: Ft и F0 (рис. 176). Компоненты
электронтранспортной цепи внутренней мембраны митохондрий
связаны с фактором фосфор ил ирования Fl9 который можно наблюдать
с помощью электронной микроскопии при негативном
контрастировании фосфовольфраматом. Внутренние поверхности крист,
обращенные к матриксу, содержат выступающие структуры (Fj—
каталитические единицы АТФ-синтетазы), состоящие из сферических
головок диаметром около 9 нм, соединенных с мембраной тонкими
перемычками. АТФ синтезируется и гидролизуется на М-стороне
внутренней мембраны, куда выступают сферические головки.
АТФ-синтетаза работает как обратимая система: она синтезирует
АТФ за счет электрохимического потенциала протонов (рис. 176, а)
и гидролизует АТФ, в результате чего протоны переносятся через
мембрану (рис. 176, б).
Сопрягающий фактор Fx является полифункциональным белком,
имеющим четвертичную структуру. Он состоит из девяти
субъединиц пяти разных видов (а, р, «у, 8, s), содержащих несколько
связывающих участков для АТФ и АДФ (рис. 177). В изолированном
виде Fx АТФаза не обладает способностью синтезировать АТФ из
АДФ и неорганического фосфата Ф, но может гидролизовать АТФ.
1 М F, при 298 К расщепляет 104 М АТФ в минуту.
Часть АТФ-синтетазы, которая состоит из гидрофобных белков,
встроенных во внутреннюю мембрану митохондрий и пронизыва-
316
рис. 177. Возможная модель расположения
субъединиц в АТФ-синтетазе:
р. _ каталитический компонент (митохондриальный
сопрягающий фактор /); Fq — протон-проводящий
компонент; а, 0, у» 6 и е — субъединицы АТФ-
синтетазы; OSCP — белок, сообщающий
чувствительность к олигомицину
ющих ее, обозначается F0 (рис. 177).
В АТФ-синтетазном комплексе
компонент F0 обеспечивает протонную
проводимость между Fx и внешней средой.
Изолированный фактор сопряжения Fx
не может связываться
непосредственно с F0 в отсутствие белковой
субъединицы, которая была названа белком,
сообщающим чувствительность к
олигомицину (обозначается —
субъединица OSCP: oligomycin sensitivity
conferring protein). Олигомицин — это антибиотик, который
специфически связывается с OSCP-субъединицей и блокирует транспорт
протонов через F0. Это приводит к тому, что АТФ-синтетаза не
синтезирует АТФ.
Особенности структуры внутренней мембраны митохондрии
в значительной степени обусловлены природой ее липидного бислоя.
Отношение фосфолипидов и белков имеет низкое значение — 0,27,
содержание липидов во внутренней мембране составляет 0,33—
0,44 мг липидов/мг белка. Почти все эти липиды являются фосфоли-
пидами и располагаются бислойно. Фосфатидилхолин в процентах
фосфора от общей фосфолипидной фракции во внутренней мембране
митохондрий составляет 33—45 %, фосфатидилэтаноламин — 28—
39, дифосфатидилглицерин (кардиолипин) —13—23%. Выявлена
асимметрия липидного бислоя с преобладанием фосфатидилэтано-
ламина с М-стороны и фосфатидилхолина со стороны
межмембранного пространства (С-сторона). Кардиолипин также располагается
асимметрично, 75 % этого фосфолипида локализовано на стороне,
которая обращена в матрикс. Во внутренней мембране
митохондрий содержится достаточное количество ненасыщенных жирных
кислот, что обеспечивает ее высокую текучесть.
Транспорт через внутренние мембраны митохондрий таких
молекул, как АТФ, АДФ, осуществляется с помощью белковых
переносчиков— транслоказ. Белки-носители функционируют по
принципу антипорта, когда движение веществ через внутреннюю
мембрану реализуется путем обменной диффузии. Внутренняя мембрана
митохондрий содержит высокоспецифичный переносчик — АДФ —
АТФ-транслоказу, которая катализирует перенос одной молекулы
АДФ в матрикс с одновременным переносом одной молекулы АТФ
в цитоплазму клетки.
Для осуществления фосфорилирования необходимо обеспечить
доставку фосфата в матрикс митохондрий, что выполняется путем
обмена электронейтральным переносчиком Ф на ОН" с одновремен-
317
ным транспортом Ф и Н+ в одном направлении. Данная система
обеспечивает проникновение в матрикс фосфата в результате
процессов, зависящих от мембранного градиента рН. Благодаря
гидролизу АТФ обусловлена возможность входа Са2+ в матрикс
митохондрии за счет механизма Са2+/2Н+-обмена.
Первый этап энергетического цикла в митохондриях
осуществляется ферментами цикла Кребса, которые находятся в матриксе
митохондрий, представляющем собой гелеобразную фазу с тонкой
Структурой, содержащей около 50 % белков. Образованные в
результате реакций цикла трикарбоновых кислот НАДН и флавины
подвергаются дальнейшему окислению в электронтранспортной
цепи внутренней мембраны митохондрий.
Существенное влияние на матрикс оказывает изменение кон-
формации внутренней мембраны. Митохондрии могут находиться
в двух конформационных фюрмах: ортодоксальной и
конденсированной в зависимости от скорости дыхания и содержания АДФ.
При дыхании в состоянии покоя в условиях минимального
содержания АДФ конформация митохондрий носит название
ортодоксальной; при максимальной скорости дыхания и при максимальном
количестве АДФ конформация становится конденсированной.
Большая часть ферментов цикла лимонной кислоты
локализована в матриксе, за исключением сукцинатдегидрогеназы, которая
связана с М-стороной внутренней мембраны. Матрикс митохондрий
содержит также ферменты, катализирующие окисление жирных
кислот в р-положении. Одним из кардинальных ферментов в ком-
партменте между внутренней и внешней мембранами является
аденилаткиназа, участвующая в поддержании равновесия между
АТФ, АДФ и АМФ.
Внутренняя мембрана митохондрий отделена от цитоплазмы
клетки внешней мембраной, которая проницаема для большинства
молекул и ионов с молекулярной массой 10 000 и ниже. Внешняя
мембрана митохондрий характеризуется высоким соотношением
фосфолипид/белок, равным 0,82, низким содержанием кардиоли-
пина и значительным содержанием фосфоинозита. Во внешней
мембране локализованы АТФ-зависимая ацил-КоА-синтетаза,
система удлинения цепи жирных кислот, НАДН-дегидрогеназа, мо-
ноаминоксидаза.
Митохондрии содержат молекулы ДНК, РНК, рибосомы, что
обеспечивает синтез части митохондриальных белков. При этом
ДНК митохондрий имеет кольцевое строение.
Большинство ферментных систем^ принимающих участие в
трансформации энергии, оказываются доступными как для субстратов,
так и для ингибиторов в субмитохондриальных частицах, которые
образуются при разрушении митохондрий ультразвуком.
12.2. Перенос электронов в мембранах митохондрий. А.Лещда-
джер в 1949 г. в экспериментах на митохондриях показал, что
перенос электронов по цепи переносчиков от НАДН на молекулйр-
ный кислород сопровождается синтезом АТФ. Было обнаружено,
чт© электронтранспортная цепь включает три звена, где освобожда-
318
Сукцинат
I
ФАД цитохром 6557
Fe-S (S-1)
Fe-S (S-2)
Fe-S (S-3)
Комплекс I
НАДН
ФМН
Fe-S(N-la)
Fe-S{N-1b)
'Fe-S(N-3)
Fe-S(N-4)
Fe-S(N-5}\
Fe-S(N-2)
Комплекс II
Комплекс III
Комплекс IV
Убихинон'
цитохром 65б.2
цитохром 656б
Fe-S
цитохром сь
цитохром с
цитохром а
цитохром1 лж|
геи
-Of
АДФ+Ф АТФ
АДФ+Ф АТФ
АДФ+Ф АТФ
Рис. 178. Молекулярные переносчики электронов внутренней мембраны
митохондрий
ющаяся при дыхании энергия трансформируется в энергию
фосфатной связи АТФ. Существенный вклад в решение центральных
проблем биоэнергетики был сделан Д. Кейлином, который открыл
цитохромы, осуществляющие перенос электронов от водородсодер-
жащих доноров к02. В дальнейшем было осуществлено выделение
молекулярных переносчиков электронов дыхательной цепи,
локализованы и идентифицированы три ее фосфорилирующих звена.
Атомы водорода, отщепляемые дегидрогеназами от пирувата,
жирных кислот, аминокислот во время расщепления этцх
соединений до ацетил-КоА и других продуктов, а также поставляемые
вследствие реализации цикла лимонной кислоты, передают
электроны в дыхательную цепь. НАД+/НАДН имеет окислительно-
восстановительный потенциал —0,32 В и выполняет функцию
подвижного переносчика электронов между дегидрогеназами матрик-
са митохондрий и компонентами дыхательной цепи внутренней
мембраны. Меньшая часть электронов попадает прямо в
дыхательную цепь при окислительно-восстановительном потенциале
субстратных пар, близких к О В благодаря сукцинатдегидрогеназе.
Последовательность функционирования молекулярных
переносчиков электронов (рис. 178) установлена благодаря применению
метода двухволновой спектрофотометрии, позволившего
наблюдать состояние окисления или восстановления переносчика
электронов в митохондриях; методов разделения мембран митохондрий
на фрагменты, сохраняющие способность катализировать отдельные
319
НАДН
L .
Комплекс f
-~АТФ(1)
ФМН
(Fe-S)n
Ш-производное . _
жирной кислоты сукцинат
Глицерофосфат\\ / Другие флабинзави-
4 И * ^ \ \ I / симые дегидрогеназы
Цитохромы
Комплекс Ш
АТФ(П)
Комплекс JV
- АТФ(Ш)
Рис. 179. Коллекторная функция уби-
хинона (кофермента Q). Он собирает
электроны от НАДН-дегидрогеназы и
от различных субстратовТ на которые
действуют другие флавинзависимые
дегидрогеназы
реакции электронтранспортной
цепи; специфических
ингибиторов (ротенона, блокирующего
перенос электронов на участке от
НАДН до убихинона; антимици-
на А —от убихинона нацито-
хром с\ цианида, блокирующего
процесс восстановления
кислорода, который катализируется
цитохромами а и а3).
Значительный вклад в
развитие современных представлений
о дыхательной цепи принадлежит
исследованиям мембран
митохондрий с использованием метода ЭПР и техники
низкотемпературной стабилизации. Каждое звено электронтранспортной цепи
митохондрий специфично в отношении определенного донора и акцетора
электронов. Компоненты дыхательной цепи расположены по
степени возрастания их окислительно-восстановительных потенциалов,
от отрицательных к положительным значениям по мере
приближения к кислороду. Скорость переноса электронов по цепи между
переносчиками митохондрий равна 10—100 электронов в секунду.
Связь между комплексами НАДН: убихинон-оксидоредукта-
зой и убихинол-цитохром с-оксидоредуктазой (комплексами I и III),
сукцинатдегидрогеназой и убихинол i цитохром с-оксидоредукта-
зой (II и III) обеспечивается с помощью убихинона, растворимого
в липидах мембраны митохондрий (рис. 178). На рис. 179 схематически
показана коллекторная функция убихинона. Между комплексами
убихинол: цитохром с-оксидоредуктазой и цитохром с: кисдород-
оксидоредуктазой (комплексами III и IV) такую же роль выполняет
цитохром с, который диффундирует вдоль поверхности мембраны.
Молекулярные переносчики (НАДН, флавопротеины,
.содержащие ФМН и ФАД в качестве простетических групп, и убихинон)
акцептируют и отдают по два электрона. Негемовые железосерные
белки и цитохромы, имеющие порфириновые простетические
группы, работают как одноэлектронные переносчики.
В четырех мультиферментных комплексах сохраняется их элек-
тронтранспортная активность, а после встраивания в
искусственные бислойные мембраны восстанавливается протонпереносящая
способность.
Комплекс I катализирует перенос двух электронов от НАДН
к убихинону, он способен переносить протоны. Комплекс I
содержит ФМН, а также ряд железосерных центров с типом кластера
320
R\ /\ /SR RS\A ^?
us V Ns* rc\s/?
Рис. 180. Схематическое представление железосерных
кластеров в белках
2Fe—2S и 4Fe—4S. На рис. 180 дано схематическое представление
железосерных кластеров в белках.
Железосерные центры митохондрий парамагнитны в
восстановленном состоянии и обнаруживаются при температуре ниже 77 К,
так как для них характерно сильное спин-решеточное
взаимодействие. Модели электронной и пространственной структуры центров
в негемовых железосерных белках представляют собой полиядерные
комплексы железа, ковалентно связанные с неорганической серой
и RS-группами цистеиновых остатков белка. Обнаружение и
идентификация негемовых железосерных белков электронтранспортной
цепи митохондрий стало возможным благодаря
низкотемпературной технике ЭПР при температурах, близких к 4,2К.
Значения компонентов g-тензора сигналов ЭПР железосерных
центров первого комплекса электронтранспортной цепи митохондрий
следующие: NAa (^=2,03; £2,3=1,93); NAb (^=2,022; g2=
- 1,938; g3= 1,923); N-2 (£„ = 2,054; gl= 1,922); N-3 (^2,10;
g2= 1,886; g3= 1,862); AM (g = 2,103 и 1,864).
Центр N-2 I комплекса, который является наиболее
высокопотенциальным, может непосредственно взаимодействовать с убихи-
ноном.
Комплекс II катализирует окисление сукцината убихиноном,
система не может переносить протонов. Комплекс сукцинатдегидро-
геназа содержит ФАД, два железосерных центра Fe—S (S—1),
Fe—S (S—2) с типом кластера 2Fe—2S и один железосерный центр
Fe—S (S—-3) с типом кластера 4Fe—4S. Комплекс II включает также
низкопотенциальный цитохром Ь557.
При исследовании железосерных центров комплекса II
электронтранспортной цепи митохондрий в окисленных субмитохондриаль-
ных частицах сердца обнаружена корреляция между появлением
в них свободнорадикального сигнала ЭПР с полушириной 10 Э,
регистрируемого при 240К, и компонентов сигнала ЭПР
высокопотенциального железосерного центра S—3 при g — 2,04 и g~ 1,99,
который регистрируется при 12К.
Убихинон (коэнзим Q — KoQ) в митохондриях животных
представлен в форме Q10, т. е. его молекула содержит цепь из 10 пяти-
углеродных изопреновых мономеров, что определяет высокую гид-
рофобность KoQ. Присоединяя два электрона и два протона,
убихинон восстанавливается и превращается в убихинол QH2.
Комплекс III катализирует перенос электронов от убихинола
(восстановленного убихинона) к цитохрому с, он способен осу-
321
ществлять перенос протонов. Комплекс убихинол: цитохром с-окси-
доредуктаза содержит цитохромы b и с19 железосерный центр Rieske
с типом кластера 2Fe—2S. Цитохромы b представлены
высокопотенциальной (цитохром fe562) и низкопотенциальной (цитохром &56в)
формами.
В комплексе III электронтранспортной цепи митохондрий
регистрируется спектр ЭПР железосерного белка (центр Rieske),
соответствующий ромбической симметрии (£г= 2,026, g2= 1 >887 и
^з= 1,81).
Сигналы ЭПР цитохромов Ь5в2, 6бвв, сх соответствуют значениям
^-факторов 3,5; 3,7; 3,3. Спектр ЭПР цитохрома с, осуществляющего
перенос электронов от III к IV комплексу, характеризуется gx=*
'=3,06; gy^ 2,26; g3= 1,25. Низкоспиновая форма спектра ЭПР
цитохрома с зарегистрирована при температуре 1,6К.
Ингибирование переноса электронов в митохондриях антимици-
ном увеличивает восстановленность убихинона и цитохромов Ь%
в то же время уменьшая восстановленность цитохромов си^.
Комплекс IV является терминальным компонентом
электронтранспортной цепи митохондрий, переносящим электрон от
цитохрома с к кислороду. Комплекс цитохром с-оксидаза содержит два
гема в цитохромах аиа3и два атома меди. Окисленная форма (Fe3+)
системы цитохромов а и а3 может принимать электроны от
восстановленного цитохрома с, переходя в восстановленную форму (Fe2+),
которая затем вновь окисляется молекулярным кислородом,
переходя в Ре3+-форму. Цитохром b катализирует окисление ферроцито-
хрома су а цитохром а3 катализирует восстановление 02. В
цитохромах а, как и в гемоглобине, имеется одна свободная
координационная связь, вследствие чего гем цитохрома а3 может связывать
молекулярный кислород, а также взаимодействовать с
ингибиторами. Благодаря присоединению кислородом протонов образуется
вода, при этом в процессе восстановления 02 до Н20 используются
ионы водорода, переносимые в матрикс через АТФ-синтетазу.
В комплексе IV электронтранспортной цепи митохондрий
выявлены низкоспиновый (g = 3,03; 2,21; 1,45) и высокоспиновый
(g = 6,2) сигналы ЭПР, обусловленные ферроцитохромами а
и а3.
Комплекс IV аналогично I и III расположен трансмембранно И|
в отличие от остальных комплексов электронтранспортной цепи
митохондрий, комплекс IV катализирует реакцию только в одном
направлении. Комплексы I, III и IV способны генерировать
трансмембранную разность электрохимических потенциалов ионов
водорода, сопрягающих перенос электронов с трансмембранным
переносом протонов.
Значительная часть свободной энергии, которая выделяется4
по мере продвижения электронов по цепи от одного молекулярного
переносчика к другому, запасается в форме АТФ на участках
сопряжения биологического окисления с фосфорилированием. Участки
сопряжения расположены между НАДН-дегидрогеназой и
цитохромом 6 (I), между цитохромом b и цитохромом с (II) и между
322
цитохромом с и кислородсвязывающим участком в комплексе IV
(III; рис. 179). На трех таких этапах количество выделяющейся
свободной энергии приблизительно совпадает с количеством
свободной энергии образования АТФ.
12.3. Окислительно-восстановительные потенциалы. Электрон-
транспортные цепи митохондрий и фотосинтетической мембраны
функционируют как последовательность реакций переноса
электронов от одного компонента к другому. Реакции, при которых
происходит перенос электронов от одних атомов, молекул или ионов
к другим, называются окислительно-восстановительными. Каждая
редокс-система (окислительно-восстановительная) характеризуется
соответствующим соотношением активностей окисленной и
восстановленной форм (Ox/Red).
Молекула, отдающая электрон, является донором
(восстановителем), молекула, принимающая электрон,— акцептором
(окислителем). Например:
Fe2+ — e~^Fe3+; Fe3+ + *T^Fe2+. (12.1)
В уравнениях указывается изменение степени окисления атомов
и количество электронов, отданных восстановителем и принятых
окислителем. Окислительно-восстановительные реакции
представляют собой единство двух противоположных процессов: окисления
и восстановления. Процесс передачи электрона сопровождается
окислением донора и восстановлением акцептора.
Восстановление всегда связано с окислением, а окисление всегда
сопровождается восстановлением. В окислительно-восстановительных реакциях
число электронов, отдаваемых восстановителем, равно числу
электронов, присоединяемых окислителем.
Способность донора в сопряженной
окислительно-восстановительной паре отдавать электрон сопряженному акцептору
характеризуется окислительно-восстановительным потенциалом Е'0У
который выражается в вольтах и может быть как положительным, так
и отрицательным.
На каждом этапе переноса электрона в митохондриях
осуществляется его переход при понижении свободной энергии от одной
молекулы к другой. При окислительно-восстановительных реакциях
электроны переносятся от донора к акцептору. Чем выше потенциал
системы, тем сильнее выражены ее окислительные свойства; чем
ниже окислительно-восстановительный потенциал, тем в большей
степени молекулярный переносчик электронов является
восстановителем. Окислительно-восстановительный потенциал характеризует
относительное изменение свободной энергии системы при переносе
электронов между компонентами
окислительно-восстановительных пар. При этом соединение может отдавать свои электроны
другому компоненту, обладающему более высоким потенциалом,
что определяет расположение молекулярных переносчиков в элек-
тронтранспортной цепи митохондрий. Зная величины Е'0 для
окислительно-восстановительных пар, можно предсказать направление
транспорта электронов.
ЗЯ
Несмотря на то что окислительно-восстановительные реакции
описываются термодинамически с помощью изменения свободной
энергии, при их рассмотрении обычно используют
электрохимические параметры, так как в этих реакциях происходит перенос
электронов. Электрохимическое описание
окислительно-восстановительной реакции представляет возможность оценивать весь ре-
докс-процесс в виде суммы двух полуреакций, включающих
присоединение и отдачу электронов. Так же, как и изменение
свободной энергии, окислительно-восстановительные потенциалы зависят
от соотношения концентрации реагентов.
В процессах клеточного дыхания на одном конце цепи
находится сильный восстановитель Н2, на другом — мощный окислитель
02, который восстанавливается до Н20. Количественная оценка
окислительных и восстановительных свойств сопряженных редокс-
пар проводится путем измерения электрондвижущей силы при
использовании электродных потенциалов. Электрохимический
элемент имеет два электрода, и полная реакция является суммой двух
полуреакций. Для измерения редокс-потенциала необходим
стандартный электрод сравнения. В качестве такого используется
водородный электрод, представляющий собой платиновую пластинку,
покрытую тонкодисперсной платиной. Электрод частично погружен
в 1М раствор Н+, находящийся в равновесии с газообразным Н2
при давлении в МО2 кПа (1 атм). На поверхности платинового
электрода происходит обратимая диссоциация адсорбированного
водорода, и система функционирует в качестве водородного
электрода. Потенциал стандартного водородного электрода условно
принимают равным нулю в растворе с активностью ионов водорода,
равной единице.
В другой ячейке электрохимического элемента содержится
смесь двух соединений, из которых одно является окисленной
формой другого. В качестве стандартных условий,
обеспечивающих оценку окислительно-восстановительной реакции, являются
следующие постоянные величины: температура — 298К,
концентрация раствора — 1 М. Платиновые электроды присоединяют
к вольтметру и мостиком из геля, насыщенного электролитом КС1,
обеспечивают электропроводность между ячейками.
В каждой из ячеек устройства для измерения электродных
потенциалов протекают реакции, которые могут быть
представлены в виде следующих уравнений:
Н2^2Н+ + 2<Г;
Л+2Н+ + 2<Г«=*АН2, (iZZ)
где А — смесь двух соединений, из которых одно является
окисленной формой другого. А у реагируя с Н2, восстанавливается до ЛН2,
Н2 окисляется до Н+.
Вольтметр фиксирует не только направление тока, но и
разность электрических потенциалов между двумя ячейками, которая
является мерой различия в способностях к отдаче электронов
обеими частями электрохимического элемента.
324
Если электродвижущая сила электродной системы, в которую
входит стандартный водородный электрод, оказывается
положительной, то потенциал сопряжения пары А/АН2 также считается
положительным. Положительный окислительно-восстановительный
потенциал является показателем более высокого, чем у Н2, сродства
данного вещества к электронам, и наоборот, отрицательный ре-
докс-потенциал свидетельствует о том, что данное вещество имеет
меньшее сродство к электронам по сравнению с водородом. НАДН
является сильным восстановителем с отрицательным
окислительно-восстановительным потенциалом, в то время как 02
обладает положительным редокс-потенциалом.
Если известны концентрации доноров и акцепторов электронов,
то величина окислительно-восстановительного потенциала Е'0
может быть вычислена по формуле
E°=E« + wlntmr <12-3)
где Е0— стандартный редокс-потенциал; R — универсальная
газовая постоянная, равная 8,315 Дж/град • моль; Т— абсолютная
температура; п — число электронов, участвующих в реакции;
F—число Фарадея (96500 Кл, или 0,0965 кДж • моль -1 • мВ ~х);
Ох и Red— концентрации, соответственно, окисленной и
восстановленной форм соединения.
Из (12.3) следует, что при эквимолярных количествах
окисленной и восстановленной форм данного соединения в растворе, т. е.
при Ox/Red = 1, Е'0— Е0, называемая стандартным
редокс-потенциалом, характеризует способность изучаемой редокс-системы
функционировать в качестве окислителя или восстановителя по
отношению к водородному электроду.
В биоэнергетике окислительно-восстановительные потенциалы
определяют обычно при рН = 7,0, поэтому величина Е0 для редокс-
реакции в клетке не представляется эффективной, так как
стандартный электрод имеет рН-=0. Для определения истинныхредокс--
потенциалов при рН, отличном от нуля, используется уравнение
£* = £m + 2,3glg|j, (12.4)-
где Ет—потенциал полувосстановления (стандартный
редокс-потенциал при данном рН).
Если происходит две окислительно-восстановительные
реакции, то из разности окислительно-восстановительных потенциалов
может быть вычислено изменение стандартной свободной энергии
AG0 редокс-реакции. Согласно (12.3) запишем для 1-й реакции
Е« = Еог + % In Jg- и для 2-й реакции Е± - Ем + § In Jg|.
Разность окислительно-восстановительных потенциалов будет Д£9'«
= Е01 - E0i - - (Eol - ЕЛ) + g in (igjj- / ig|.). При равнове-
325
сии АЯ0 =0 и тогда разность стандартных редокс-потенциалов
Д2?0 = Е02 — EQl запишется как
ДЯ0=^1п/(р,
(12.5)
где Кр = istft / L*4) константа равновесия. Согласно (1.45)
С константой равновесия связано изменение стандартной свободной
энергии AG0 = — RT !n /СР.
Из вышеприведенных уравнений вытекает, что изменение
стандартной свободной энергии AG° связано с разностью
стандартного окислительно-восстановительного потенциала А£0:
_AG°= nFAE0. (12.6)
Соединения с большим значением —AG° являются хорошими
восстановителями. Например, Н2, для которого AG° при рН = 7,0
равно — 237 кДж • моль *"1.
В табл. 13 приведены окислительно-восстановительные
потенциалы молекулярных переносчиков электронов. В табл. 14
представлены значения редокс-потенциалов железосерных центров
электротранспортной цепи митохондрий. НАДН и сукцинат-молеку-
Лярные переносчики имеют самый низкий редокс-потенциал среди
Компонентов электронтранспортной цепи, а кислород—наиболее
высокий.
К?. Окислительно-восстановительные потенциалы молекулярных переносчиков
электронов
Молекулярный переносчик электронов
Восстановленная форма
НАДН
ФМННа
ФАДНа
Убихинон (KoQ Red)
Цитохром Ь (Fe2+)
Цнтохром сг (Fe2+)
Цитохром с (Fe2+)
Цитохром a(Fe2+)
Цитохром «aCFe^)
н2о
Окисленная форма
НАД*
ФМН
ФАД
Убихинои (KoQ Ox)
Цитохром b (Fe3+)
Цитохром, сг (Fe8+)
Цитохром с (Fe3+)
Цитохром a (Fe3+)
Цитохром %(Ре**")
1/202 + 2Н*
Ео, В
-0,32
—0,12
-0,06
0,10
0,07
0,21
0,25
0,29
' 0,38
, 0,82
При транспорте электронов с участием молекулярных
переносчиков возникают разности потенциалов, причем они должны быть
достаточно велики на определенных участках доя обеспечения
синтеза АТФ из АДФ и неорганического фосфата Ф. При
окислительном фосфор ил ирова нии потенциал переноса электронов,
соответствующий молекулярным переносчикам электронтранспортной
цепи митохондрий, преобразуется в потенциал переноса фосфатной
группы, присущий АТФ. Потенциал переноса фосфата выводится из
AG0 гидролиза концевой макроэргической фосфатной группь*
326
АТФ, величина которой
составляет 34, 54 кДж • моль""1 при
298К и рН=7,0.
Поскольку от каждой пары
атомов водорода переносится 2 вщ}
разность потенциалов,
соответствующая AG°= —34,54 кДж X
X моль"1, равна
Л£0 = -^ = 0,18 В. (12.7)
14. Скислительно-восстановительние
потенциалы железосерных центра©
электронтранспортной дели
митохондрий
I
II
III
N \а
N \Ь
N 2
N 3
N 4
S 1
5 2
3 3
Rieske
2Fe-2S
2Fe-2S
4Fe—4S
4Fe—4S
4Fe—4$
2Fe-2S
2Fe—5S
4Fe—4S
2Fe--2S
Я0, В
Следовательно, для синтеза
одной молекулы АТФ из АДФ
и фосфата необходимо около
34,54 кДж/моль, что
соответствует изменению редокс-потен-
диала приблизительно на0,18В.
Величина
окислительно-восстановительного потенциала элек-
тронтрансгортной цепи митохондрий составляет 1,14 В, что
эквивалентно 220 кДж.
12.4. Теории сопряжения биологического окисления и фосфори-
лирования. Существует несколько теорий механизма превращения
энергии в процессе переноса электронов. Различия между теориями
сопряжения биологического окисления и фосфор ил ирования
касаются в основном этапа, на котором накапливается энергия
окислительно-восстановительного процесса.
В основе химической гипотезы окислительного фосфорилирова-
ния, предложенной в 1953 г. X. Слейтером, находится
представление о существовании высокоэнергетических продуктов,
образующихся при переносе электронов по цепи биологического окисления.
Предполагается, что образование макроэргического
промежуточного продукта обусловлено взаимодействием компонента, который
не является переносчиком электрона, с молекулярным
переносчиком электронов в процессе сопряженной
окислительно-восстановительной реакции. Как полагают, фермент, катализирующий
образование АТФ, получает высокоэнергетические фосфатные
группы от всех трех пунктов сопряжения биологического окисления
с фосфорилированием и служит непосредственным донором фосфата
Для АДФ с целью последующего синтеза АТФ. Возникающий в
процессе сопряженной окислительно-восстановительной реакции
промежуточный продукт, содержащий высокоэнергетические свяйй,
является общим для реакций окисления — восстановления и
образования АТФ.
Последовательность реакций можно представить в следующей
. схематической форме:
АН2 + В + С*±А~С + ЯН2; (12.8)
Л~С + Ф^Л+С~Ф;
С ~ Ф + АДФ <=* С + АТФ,
327
где Л и В — молекулярные переносчики электронов; С —
гипотетический высокоэнергетический промежуточный продукт.
В соответствии с одной из возможных форм химического
сопряжения при переходе электронов от молекулярного переносчика
АН2, находящегося в восстановленной форме, к следующему за
ним по цепи молекулярному переносчику В высокоэнергетическая
связь образуется не между ЛН2 и В, а между ЛН2 и компонентом С,
который не является переносчиком электронов. Механизм реакции
не предполагает прямого взаимодействия молекулярных
переносчиков электронов с неорганическим фосфатом. Высокоэнергетическая
связь в образующемся соединении С ~ Ф становится
предшественником макроэргической фосфатной связи АТФ.
В пользу данной гипотезы сопряжения биологического
окисления с фосфорилированием свидетельствует действие разобщителя
(2,4-динитрофенола) и ингибитора (олигомицина) на отдельные
стадии процесса окислительного фосфорилирования. При
разобщении биологического окисления и фосфорилирования под влиянием
2,4-динитрофенола молекулярные переносчики могут
взаимодействовать друг с другом в отсутствие неорганического фосфата.
В окислительно-восстановительной реакции, катализируемой гли-
церальдегид-3-фосфатдегидрогеназой, используются макроэргиче-
ские тиоэфиры в качестве общих промежуточных продуктов.
Однако существуют факты, которые не представляется
возможным объяснить в соответствии с гипотезой химического сопряжения
биологического окисления с фосфорилированием. Несмотря на
многочисленные попытки, не удалось выделить и охарактеризовать
постулированные высокоэнергетические промежуточные продукты.
Конформационные теории окислительного фосфорилирования
основаны на предположении, что взаимосвязь биологического
окисления и фосфорилирования в митохондриях обусловлена
посредством конформационных изменений ферментов, участвующих
в переносе электронов. Экспериментальные данные, в частности
конформационные изменения цитохрома с при его окислении и
восстановлении, свидетельствуют о структурных изменениях
внутренней мембраны митохондрий при ее энергизации. Предполагается,
что накопленная энергия при переходе от напряженной к исходной
конформации используется при синтезе молекул АТФ.
Существует возможность передачи конформационного
изменения, индуцированного в электротранспортной цепи, на фактор
сопряжения Fx через молекулярные переносчики внутренней
мембраны митохондрий в силу их непосредственной связи с этим
фактором.
В соответствии с конформационными теориями синтез АТФ
возможен благодаря высокоэнергетическому характеру тиоэфирной
связи, образующейся в результате реакции между сульфгидрильной
и карбоксильной группами при значительных конформационных
изменениях белка.
На основе результатов электронно-микроскопических
исследований высказано предположение, что существует связь между
328
энергизацией, деэнергизацией и структурой митохондрий. Энергия,
освобождающаяся в процессе переноса электронов, используется
непосредственно для перевода внутренней мембраны митохондрий
в новое, высокоэнергетическое конформационное состояние,
которое является определяющим условием окислительного фосфорили-
рования.
В одном из вариантов конформационных гипотез П. Бой ера
предполагается, что перенос электронов может индуцировать
конформационные изменения, вызывающие освобождение
синтезированного АТФ из АТФазы. Акт образования АТФ из АДФ и Ф
на гидрофобном участке каталитического центра АТФазы
митохондрий в соответствии с гипотезой не требует значительной
энергии.
Однако на основании конформационных гипотез сопряжения
также не представляется возможным удовлетворительно объяснить
механизмы окислительного фосфорилирования. В частности,
следует учитывать, что конформационные изменения сопутствует
функционированию всех ферментов, и поэтому не могут быть
отнесены к специфическим свойствам ферментов сопряжения
биологического окисления с фосфорилированием.
В 1961 г. П. Митчелл предположил, что процессы транспорта
электронов в мембранах энергопреобразующих органелл клетки
и синтеза АТФ обеспечиваются трансмембранным перекосом
протонов. Этот принцип энергетического сопряжения переноса электронов
с фосфор илированием получил название хемиосмстического.
Основной постулат хемиосмотической теории сопряжения
окисления и фосфорилирования, состоящий в утверждении, что переьос
электронов создает, а АТФ-синтетаза использует трансмембранкую
разность электрохимических потенциалов ионов Еодорода Ар1н+,
опирается на большой экспериментальный материал. В частности,
он получил свое подтверждение в опытах советского исследователя
В. П. Скулачева, продемонстрировавших, что перенос электронов
и синтез АТФ сопряжены через мембранный потенциал.
Первая стадия процесса окислительного фосфорилирования
в соответствии с теорией Митчелла состоит в превращении химиче:
ской энергии переноса электронов в энергию, связанную с
разностью электрохимических потенциалов протонов АДн+ в результате
сопряжения транспорта электронов по дыхательной цепи и
переноса протонов через мембрану.
Эту идею иллюстрирует схема, приведенная на рис. 181.
Донор водорода £)Н2 окисляется переносчиком электронов во
внутренней мембране митохондрии. Перенос электронов по
дыхательной цепи приводит к созданию градиента концентрации ионов
Н+ в направлении, перпендикулярном поверхности мембраны. На
трех участках транспорта электронов (НАДН-дегидрогеназа; уби-
хинол: цитохром с-оксидоредуктаза; цитохром с-оксидаза) в пунктах
сопряжения окисления с фосфор илированием происходит выброс
протонов из матрикса в межмембранное пространство. Так как
молекулярные переносчики расположены и функционируют
329
Межмзмбранное пространство
Н+ Н+ Н+
Мембрана
Н,20/Н20/Н2^
ОН" ОН" ОН
Матрикс
Рис. 181. Схема процессов при хемиосмотическом сопряжении окисления и
фосфорилирования. Объяснение в тексте
однонаправленно, то это обеспечивает транслоцирование протонов
в одном направлении.
Транслокация протонов из митохондрий наружу против
градиента концентрации приводит к появлению мембранного
электрического потенциала Дер, причем внутренняя сторона мембраны
оказывается заряженной отрицательно, а внешняя — положительно.
В результате переноса ионов Н+ из митохондриального матрик-
са в межмембранное пространство рН матрикса повышается,
образуется избыток ОН ~. В компартменте между внутренней и внешней
мембранами возрастает концентрация Н+, вследствие чего кроме
мембранного потенциала возникает еще и градиент рН (ДрН).
Градиент рН, возникший в связи с перекачкой ионов Н+ из
матрикса, поддерживается за счет уменьшения свободной энергии,
сопровождающего процесс переноса электронов.
Направление и интенсивность потока протонов определяются
как отрицательным зарядом на внутренней стороне мембраны, так
и разностью концентраций протонов на обеих сторонах мембраны.
Трансмембранная разность электрохимических потенциалов ионов
водорода А\хв+ запишется как:
Д£н+ = fA<p + 2,ЗЯГДрН, (12.9)
где R — газовая постоянная; Г —абсолютная температура; Т7 —
число Фарадея.
Протонный градиент, генерируемый в каждом из пунктов
сопряжения окисления с фосфорилированием при переносе пары
электронов от НАДН, используется для синтеза одной молекулы
АТФ.
Вторая стадия процесса окислительного фосфорилирования
в соответствии с хемиосмотической теорией состоит в трансформа*
ции энергии, определяемой разностью электрохимических
потенциалов протонов, в энергию фосфатной связи. Одновременно с
синтезом АТФ из АДФ и фосфата Ф осуществляется осмотическая
работа при транспорте соединений через мембраны.
330
Ионы Н+, выведенные в межмембранное пространство за счет
энергии переноса электронов, направляются по
электрохимическому градиенту через специальные протонные каналы в
ферментных комплексах АТФ-синтетазы. Переход ионов Н+ из зоны с.более
высокой концентрацией в область с более низкой сопровождается
выделением свободной энергии, которая используется
ориентированной АТФ-синтетазой для синтеза АТФ.
Существует предположение, что управление образованием АТФ
с участием АТФ-синтетазы осуществляется по типу «флип-флопая
с использованием двух площадок связывания субстрата. Изменение
ферментного белка, индуцированное протонами, вызывает синтез
АТФ на одной площадке и гидролиз АТФ на другой.
АТФ-синтетаза обеспечивает синтез АТФ при взаимодействии
активированного Ф с АДФ, при этом АДФ теряет протон, а фосфат-
ион—ОН "-группу. Ионы Н+ транспортируются в матрикс, где
рН имеет относительно высокое значение, и там связываются
избыточным количеством гидроксильных ионов с образованием молекул
воды. ОН" перемещается в межмембранное пространство, где
значение рН является сравнительно низким, и связывается с
избыточным количеством протонов с образованием воды. В целом процесс
фосфорилирования АДФ осуществляется за счет свободной энергии
при нейтрализации иона ОН-в кислой среде, иона Н +—в щелочной
среде.
При обратном процессе гидролиза АТФ с помощью АТФазы
химическая энергия фосфатной связи трансформируется в
электрическую энергию заряженной мембраны. Асимметричность в
действии АТФазы заключается в том, что Н+ и ОН"" при гидролизе
АТФ транслоцируются по разные стороны мембраны. Гидролиз
АТФ может поддерживать на мембране более 200 мВ.
Механизм действия многих разобщителей окислительного
фосфорилирования, как, например, 2,4-динитрофенола, может быть
достаточно объяснен с позиций хемиосмотической теории. В
присутствии протонных ионофоров, т. е. молекул, переносящих ионы через
мембраны, синтез АТФ не происходит. Последнее связано с тем, что
такие ионофоры, перенося протоны через мембраны, приводят к
выравниванию градиента рН и мембранного потенциала.
Несмотря на то что хемиосмотическая теория Митчелла в
основном является обоснованной и объясняет принципиальные звенья
окислительного фосфорилирования, имеется ряд сторон этого
процесса, которые требуют дальнейшей расшифровки. Так,
окончательно не решен вопрос, является ли протонный электрохимический
градиент достаточным условием сопряжения окисления с фосфорили-
рованием. Необходимы дальнейшие исследования по изучению
механизма сопряжения переноса электронов с трансмембранным
перемещением протонов, в частности по выяснению, каким образом
электронтранспортная цепь заряжает мембрану митохондрий.
12.5. Биолюминесценция и биохемилюминесценция.
Биолюминесценция живых организмов видимой области спектра встречается
у представителей около 50 типов животных и растений, в том числе
331
у бактерий, простейших, глубоководных морских рыб,
ракообразных, насекомых. В результате биолюминесцентных реакций,
которые являются высокоэффективными ферментативными процессами,
происходит высвобождение энергии порядка 167—334 кДж/моль.
Различные биолюминесцентные реакции протекают при участии
ферментативно окисляемых восстановленных субстратов (люцифе-
ринов), переходящих при окислении в электронно-возбужденное
состояние, и ферментов люцифераз. Наличие люциферин-люцифе-
разной системы было впервые установлено в 1952 г. Е. Гарвеем
у светляков. Люминесцентная система многих организмов
оказывается более сложной, включающей ряд компонентов. Применение
современных методов очистки и разделения молекулярных
комплексов дало возможность идентифицировать состав основных
ингредиентов биолюминесцентных реакций светящихся организмов.
Для осуществления большинства биолюминесцентных реакций,
протекающих в несколько стадий, кроме кислорода, люциферина
и люциферазы, катализирующей образование эмиттера,
необходимы такие соединения, как АТФ, альдегиды, пиридиннуклеотйды,
флавины, перекиси, ионы металлов. Ферменты, участвующие в био-
люминесценТной реакции, выполняют качественно различные
функции, являясь биокатализаторами реакции, приводящей к
излучению, и участвуя в акте излучения кванта. Квантовый выход
(выражается отношением числа испущенных фотонов к числу
прореагировавших молекул), характеризующий эффективность хемилю-
минесцентных люциферазных реакций, является высоким и
варьирует в диапазоне 0,1—1,0.
В зависимости от молекулярного механизма генерации света,
состава компонентов, которые принимают участие в процессе,
биолюминесценцию разделяют на несколько типов. Так, для
насекомых характерна адениннуклеотидная реакционная система. Для
осуществления данного типа биолюминесцентной реакции в
качестве компонентов участвуют люциферин, люцифераза, аденозинтри-
фосфат, некоторые ионы, преимущественно Mg2+, и молекулярный
кислород. Анализ кинетики реакции адениннуклеотидного типа
показал, что вначале образуется фермент-субстратный комплекс,
затем осуществляется окисление люциферина кислородом (рис. 182).
На первой стадии восстановленный люциферин реагирует
с АТФ при участии люциферазы и ионов магния. При этом
образуются люцифериладенилат, связанный каталитическим центром
люциферазы, и пирофосфат:
Mg2+
ЛН2 + АТФ + Е—> ЛН2АМФ-Е + ПФ, (12.10)
где ЛН2 — восстановленный люциферин; АТФ — аденозинтрифос-
фат; Е — люцифераза; ЛН2АМФ-Е — комплекс люцифериладени-
лат-люцифераза; АМФ — аденозинмонофосфат; ПФ —
пирофосфат.
На второй стадии люцифериладенилат (ЛН2АМФ),
являющийся активным компонентом биолюминесцентной реакции, взаимодей-
332
J\^ ^COOH
АТФ + Г II \ Г Y + о2 ^юцифераза
* jLjk /—\ 1^АМФ+Пирофо^
Рис. 182. Реакция окисления люциферина при биолюминесценции светляка!
/ — восстановленный люциферин, //— оксилюциферии
ствует с молекулярным кислородом (на этом этапе АТФ и ионы
магния участия в реакции не принимают). Продукты окисления
переходят в электронно-возбужденное состояние, и возврат их в
основное состояние сопровождается биолюминесценцией в видимой
области спектра (А, = 562 нм):
Л Н2АМФ-Е + 02 -> АМФ + оксиЛ + С02 + Н20 +
+ биолюминесценция, (12.11)
где оксиЛ — оксилюциферии.
Бактериальная биолюминесценция осуществляется в пиридин-
нуклеотидной системе реакций при взаимодействии следующих
компонентов: флавинмононуклеотида, люциферазы, никотинамида-
дениндинуклеотида или никотинамидадениндинуклеотидфосфата,
алифатического альдегида, молекулярного кислорода:
Оксидоредук-< за
НАДН + Н+ + ФМН«. НАД+ + ФМНН2; (12.12)
Люцифераза
ФМНН2 + R СНО + 02 - ФМН + R СООН + Н20 +
+ биолюминесценция,
где НАДН — восстановленный никотинамидадениндинуклеотид;
ФМНН 2 — восстановленная форма флавинмононуклеотида;
RCHO — алифатические альдегиды с длиной цепи Сю —С14;
RCOOH — жирная кислота.
Продуктами ферментативной биолюминесцентной реакции
бактерий, последовательно протекающей в несколько этапов, являются
флавинмононуклеотид и жирная кислота.
ФМН восстанавливается в ФМНН2 на первом этапе в реакции,
катализируемой НАДН—ФМН-оксидоредуктазой, при участии
НАДН. Бактериальная люцифераза (флавинмонооксигеназа)
обладает высокой специфичностью по отношению к ФМННа и длин-
ноцепочечному алифатическому альдегиду, которые являются
субстратами на втором этапе биолюминесцентной реакции бактерий.
Бактериальная биолюминесценция наблюдается в голубой области
спектра (X = 490 нм), и интенсивность ее зависит от количества
люциферазы и субстратов (ФМНН2 и ЯСНО). На каждый квант
ззз
биолюминесценции используются две молекулы ФМНН2 и одна
молекула алифатического альдегида.
В отличие от биолюминесценции насекомых и бактерий,
биолюминесценция гидромедуз протекает при полном отсутствии
молекулярного кислорода. Биолюминесценция возникает при
взаимодействии фотопротеина, экворина с ионами Са2+. Световая сумма и
скорость биолюминесцентной реакции не изменяются при насыщении
реакционной смеси кислородом.
Биологическое значение биолюминесценции организмов,
учитывая разнообразие механизмов их свечения и неравномерность
распределения видов по филогенетическому ряду, не
представляется окончательно расшифрованным. Организмы, имеющие
специализированный фото генный орган, используют биолюминесценцию
для сигнализации между особями или для защиты. Обладая
высоким сродством к кислороду, люциферазная система бактерий
сохраняет способность функционировать при его концентрации ниже
10"8 М, когда цитохромная цепь не обеспечивает транспорта
электронов к кислороду.
К новым явлениям, открытым благодаря достижениям
радиоэлектроники, относится биохемилюминесценция тканей животных
и растений. В 1954 г. Л. Коли и сотр. на установке, работающей
в режиме счетчика фотонов, обнаружили сверхслабое излучение
в видимой части спектра корней проростков растений. В СССР
Б. Н. Тарусовым и сотрудниками в 1961 г. в условиях
охлаждения фотоэлектронного умножителя при температуре жидкого
азота (77К) и использовании квантометрического режима
регистрации в области 360—800 нм был открыт феномен биохемилюминес-
ценции тканей различных органов животных. На рис. 183
представлена блок-схема серийного хемилюминометра, крторый
предназначен для проведения исследований медико-биологического профиля.
Биохемилюминесценция сопровождает окислительные реакции
экзотермического характера цепного типа, развивающиеся по
свободнорадикальному механизму. Спонтанное сверхслабое
свечение тканей животных связано с непрерывным окислением липи-
дов и возникает в результате свободнорадикального окисления
ненасыщенных жирных кислот фосфолипидоз. Рекомбинация пере-
кисных свободных радикалов липидов R02 приводит к образованию
продуктов в электронно-возбужденном состоянии. При этом
реакция сопровождается испусканием квантов хемилюминесценции.
В соответствии со схемой перекисного окисления липидов
свободнорадикальные процессы начинаются с реакции
инициирования. Ненасыщенные жирные кислоты, например линолевая, лино-
леновая или арахидоновая, взаимодействуют с активными формами
кислорода с образованием нейтрального радикала липида
RU + (О;, Ю2)-*#- + НО;, (12.13)
где RH — молекула углеводорода (жирнокислотный остаток);
О; — супероксидный радикал; Ю2 — синглетный кислород; R- —
алкильный свободный радикал; НО^ — протонированный
супероксидный радикал кислорода.
334
т
тЛг
Т
J llll I
й-
Рис. 183. Блок-схема автоматизированной системы «Хемилюми-
нометр медицинский ХЛМЩ-01 -мини-ЭВМ» для измерения
сверхслабого свечения биологических и химических объектов:
/ — биостат; 2 — блок кювет; 3 — фотоэлектронный умножитель (ФЭУ);
4 — блок питания ФЭУ; 5 — счетчик фотонов, 6 — транскриптор; 7 —
цифропечатающее устройство; 8 — самопишущий потенциометр; 9 — блок
управления перфоратором; 10 — перфоратор; // — мини-ЭВМ «СМ-3*
Развитие цепной реакции свободнорадикального окисления
проявляется в реакции взаимодействия радикала липида R' с
кислородом с образованием перекисного свободного радикала R02i
R- + 02-*R02
(12.14)
и реакции взаимодействия перекисного свободного радикала R02
с ненасыщенным липидом с образованием гидроперекиси #ООН
и радикала липида R':
R02 + RH-+ROOH + R
(12.15)
Стационарная концентрация перекисных радикалов
ненасыщенных жирных кислот R02 невелика. Концентрация
накапливающихся в процессе неразветвленной цепной реакции липидных
гидроперекисей ROOH служит в этот период одним из критериев
интенсивности перекисного свободнорадикального окисления.
Гидроперекись ROOH способна распадаться и давать начало
новому образованию свободных радикалов, что приводит к
разветвлению цепи
ROOH
ROOH-
»RO' +OH;
.RO +ОгГ,
(12.16)
где 'ОН—гидроксильный радикал. Не все радикалы R02 или
R' продолжают участвовать в цепной реакции, часть их рекомбини-
рует друг с другом с образованием неактивных продуктов.
335
Спонтанный обрыв цепи возможен при взаимодействии активных
короткоживущих радикалов R':
R + R-+RR (12.17)
и при взаимодействии перекисного радикала R02 с радикалом
липида R':
R02 +R -+ROOR. (12.18)
В результате реакции диспропорционирования перекисных
радикалов R02 возникают молекулярные продукты в возбужденном
состоянии Р*. Переход Р* в основное состояние Р сопровождается
излучением квантов света ftv, регистрируемым на хемилюмино-
метре:
R02 + R02-+P*-+P + hv. (12.19)
Интенсивность биохемилюминесценции определяется скоростью
рекомбинации перекисных радикалов ненасыщенных жирных
кислот. На скорость-реакции свободнорадикального окисления в
тканях влияют также скорость образования перекисных радикалов,
эффективность возбуждения, эффективность излучения эмиттера.
Число фотонов, излучаемых в единицу времени в ходе реакции
диспропорционирования перекисных радикалов, равно
/хл = (^)=^Ф(/?02)2, (12.20)
(dP*\
—тг\ — скорость
образования возбужденных продуктов; ф — квантовый выход
люминесценции возбужденных продуктов; k9 — константа скорости обрыва
цепи в реакции (12.19).
Регулирующую роль в перекисном окислении липидов играют
ионы металлов переменной валентности; в частности,
каталитическое воздействие на переокисление липидов в мембранах клетки
оказывают ионы двухвалентного железа. Fe2+ участвует в реакции
инициирования цепи
Fe2+ + 02 + H + Fe3++H02;
H02 + RH-+R' + Н202, (12.21)
в реакции разветвления цепи с разложением гидроперекисей,
образовавшихся в цепной реакции,
Fe2+ + ^OOH^Fe3+ + ^0 -fOH~ (12.22)
и в реакции обрыва цепи при взаимодействии двухвалентного
железа со свободными радикалами RO\ и R', ведущими цепь
Fe2+ + R02 (R ) ->- Fe3+ + молекулярные продукты. (12.23)
В клетках скорость реакции разветвления цепи находится в
зависимости от концентрации ионов железа, которое в тканях
животных входит в состав железосерных центров электронтранспорт-
336
*ИО,имп/с
2
I-Ю'имп/с
1h
рг^
Рис. 184. Кинетика спонтанной
биохеми люминесценции органелл
клеток печени:
J — гомскенат; 2 — митохондрии; 3 —
микросомы, 4 — ядра
О 4 8 12 16 20 мин
Рис. 185. Кинетика биохемилюми-
несценции суспензии митохондрий
печени при введении ионов
двухвалентного железа
ной цепи митохондрий в качестве негемового железа, включается
в состав гемоглобина, миоглобина, цитохромов, пероксидазы,
катала зы в виде гемового железа и т. д.
Процессы перекисного окисления липидов обнаружены в
мембранах эндоплазматического ретикулума, митохондриях и других
органеллах клетки. На рис. 184 представлена кинетика спонтанной
биохемилюминесценции органелл клеток печени. Установлено
двухфазное усиление спонтанной биохемилюминесценции в
митохондриях при введении в суспензию ионов двухвалентного железа
(рис. 185). Первый, быстро развивающийся максимум усиления
хемилюминесценции, связан с катализом разложения
гидроперекисей в системе с образованием свободных радикалов RO'. Вторая
вспышка сверхслабого свечения, которая развивается медленно,
вызвана инициированием свободных радикалов при взаимодействии
двухвалентного железа с кислородом. Представляется возможным
оценивать уровень гидроперекисей по амплитуде первого максимума
и содержание биоантиоксидантов по длительности латентного
периода до возникновения второго максимума биохемилюминесценции.
В микросомах тканей животных обнаружены две системы
перекисного окисления ненасыщенных жирных кислот: ферментативная
(НАДФ • Н-зависимое перекисное окисление) и неферментативная
(аскорбатзависимое перекисное окисление). Одно из различий
между этими системами перекисного окисления липидов состоит
в использовании различных восстановителей железа: в первом
случае—НАДФ-Н, во втором— аскорбата, глутатиона. Благодаря
прооксидативному действию аскорбиновой кислоты, глутатиона
и других восстановителей, в липидных системах обеспечивается
многократное участие ионов Fe2+ в актах катализа:
2Fe3+ + 2/?SH-*2Fe2++/?S — S/?. (12.24)
Как при ферментативном, так и неферментативном перекисном
окислении липидов в первую очередь окисляются полиненасыщен-
337
ные жирные кислоты с 6, 4 и 2 двойными связями, причем при
НАДФ • Н-зависимом перекисном окислении липидов в
микросомах избирательно окисляются ненасыщенные жирные кислоты ли-
пидного окружения цитохрома Р450. Установлена связь НАДФ X
X Н-зависимого перекисного окисления липидов с окислительным
гидроксилированием с участием молекулярных переносчиков элек-
тронтранспортной цепи эндоплазматического ретикулума.
Исследование стехиометрии реакций НАДФ • Н- и аскорбатза-
висимого перекисного окисления в микросомах, проведенное
методом хемилюминесценции, указывает на их различие на стадии
инициации, что обусловлено центрами радикалообразования.
Ферментативная и неферментативная системы перекисного окисления
липидов зависимы от изменений в составе компонентов окисления
(фосфолипидов и ненасыщенных жирных кислот), концентрации
активаторов и ингибиторов окисления.
Стационарность свободнорадикального окисления липидов
клетки обусловлена взаимодействием ненасыщенных жирных кислот,
кислорода, катализаторов и биоантиоксидантов. Низкий уровень
перекисного окисления липидов в функционирующих тканях
свидетельствует о сбалансированности реакций образования и
расходования перекисей. Продукты перекисного окисления липидов
являются эффекторами некоторых ферментативных реакций и
используются организмом для синтеза, например, простагландинов
и стероидных гормонов.
В клетках животных реализуется несколько механизмов,
которые осуществляют регуляцию скорости перекисного окисления
липидов на различных стадиях, включающие регуляцию фосфоли-
пидного и жирнокислотного состава липидов, ферментативные
системы (супероксиддисмутазу, глутатионпероксидазу, каталазу и
др.), липид-белковые взаимодействия и биоантиоксиданты.
Вещества, обладающие антиокислительными свойствами, могут
ингибировать активные свободные радикалы, разрушать
гидроперекиси, блокировать катализаторы, участвовать в реакциях,
конкурируя с субстратом за присоединение молекулярного кислорода.
Антиокислительная защита в клетках может быть обеспечена за
счет жирорастворимых биоантиоксидантов, включающих
токоферолы и убихиноны, водорастворимых биоантиокислителей, например
глутатиона, аскорбиновой кислоты* антиоксидантных ферментных
систем (супероксиддисмутазы, каталазы), стероидных гормонов
и медиаторов. Существенную роль в реализации эффективности
системы биоантиоксидантов играют вещества-синергисты.
Установлен синергизм между двумя природными антиоксидантами —
альфа-токоферолом и аскорбиновой кислотой.
Кардинальная функция антиокислительной ферментативной
системы в регуляции перекисного окисления липидов заключается
в дезактивации крайне реакционноспособных промежуточных
продуктов окисления (супероксидных, рщроксильных и свободных
радикалов, синглетного кислорода, перекисей). Одно из основных
звеньев антиокислительной ферментативной системы — суперок-
338
свддисмутаза — обеспечивает ферментативную дисмутацию супер-
оксид-анион-радикалов кислорода 02 без образования
радикальных форм:
сод сод
О; + 07 + 2Н+ — HOj + НО- —Н202+ 02, (12.25)
где СОД—супероксиддисмутаза. Влияя на стадию
инициирования свободнорадикального окисления, супероксиддисмутаза также
препятствует возникновению синглетного кислорода Ю2.
Глутатионпероксидаза на стадии разветвления цепи свободно-
радикального окисления ненасыщенных липидов обезвреживает
органические перекиси, которые образуются вследствие
взаимодействия активных форм кислорода с биосубстратами клетки:
ROOH + 2ГБН -► ROH + TSSr + H20, (12.26)
где TSH — глутатион. Как каталаза, так и глутатионпероксидаза
обеспечивают распад перекиси водорода Н202.
Действие природных биоантиоксидантов, как регуляторов пере-
кисного окисления липидов, неспецифично и осуществляется ими
наряду с выполнением специализированных функций в качестве
витаминов, гормонов и др. В большинстве случаев влияние
биоантиоксидантов на скорость перекисного окисления липидов
проявляется во взаимодействии ингибитора свободнорадикальных
реакций с радикалами, ведущими цепи окисления липидов, с
последующим обрывом или замедлением цепного процесса:
МН + R02 ^>1п + ЯООН, (12.27)
где МН — антиоксидант; R02 —перекисный свободный радикал:
k7 — константа скорости реакции, являющаяся показателем
активности ингибитора; In — радикал антиоксиданта; ROOH —
гидроперекись.
Ослабление интенсивности хемилюминесценции, обусловленной
продуктами в электронно-возбужденном состоянии,
свидетельствует об ингибировании перекисных радикалов антиоксидантами.
Образующиеся в результате реакции радикалы антиоксиданта
In в дальнейшем могут взаимодействовать с RO^ и между собой
Ih + ROi-+ROOIh,
Ih + Ih-+Ihtn. (12.28)
Однако в силу их малой активности процессы их
взаимодействия с перекисными радикалами и рекомбинации между собой
недостаточно экзотермичны и не приводят к хемилюминесценции.
Кроме образования неактивных продуктов в результате протекания
вышеуказанных свободнорадикальных реакций существует
вероятность инициирования новых цепей радикалами антиоксидантов
In + RH-+InH + R\ (12.29)
339
От концентрации вводимого антиоксиданта и от его
способности реагировать с перекисными радикалами (величины константы
k7) зависит первоочередность расходования экзогенного или
эндогенного ингибитора. В связи с этим представляет ценность подход,
основанный на тушении хемилюминесценции, позволяющий
определять количество природных антиоксидантов в липидах.
Концентрация биоантиоксидантов в липидах может быть
определена из кинетических кривых изменения интенсивности
хемилюминесценции
со
п (fnH)Jwt = j (1 - III,) dt = ^=^, (12.30)
где п — число цепей окисления, обрываемых одной молекулой
ингибитора; (/лН)0 — концентрация антиоксиданта; wt — скорость
инициирования; ///0—относительная интенсивность
хемилюминесценции; S0 и S — площадь под кривой хемилюминесценции в
отсутствие ингибитора и в его присутствии, соответственно.
Величина скорости инициирования определяется концентрацией
инициатора и температурным режимом.
Большие перспективы открываются в использовании
биолюминесцентного и хемилюминесцентного анализа ферментов и их
субстратов. Биохемилюминесцентные реакции с люциферазой
светляков применяются для определения АТФ, АДФ, циклического АМФ,
аденилаткиназы, креатинкиназы. При этом представляется есз-
можиым определение АТФ в концентрации до 10~17 М. Разработаны
биолюминесцентные методы, основанные на применении
бактериальной люциферазы для количественного определения НАДН,
НАДФН, ФМН. Перспективен биолюминесцентный метод анализа,
основанный на использовании светящихся бактерий, для индикации
кислорода. Осуществляется, основанное на биолюминесценции,
количественное определение феромонов насекомых альдегидной
природы. С помощью Са2+-чувствительного фотсбелка экворина,
позволяющего в биолюминесцентной системе определять ионы-
кальция в концентрации до 10~17 М, измеряется внутриклеточное
его содержание.
Целесообразно применение хемилюминесцентной реакции лю-
минола (рис. 186). Метод используется для определения 10~14 М
глюкозооксидазы, Ю"15 М каталазы, Ю"17 М пероксидазы.
Эффективность хемилюминесцентной информации установлена
при оценке повреждения тканей под воздействием различных видов
ионизирующей радиации; при определении жизнеспособности
тканей и органов с целью последующей их трансплантации и для
оценки критического состояния отторжения трансплантируемых
органов; при определении сроков сохранности крови и ее компонентов;
в исследованиях по контролю загрязненности биосферы
различными ксенобиотиками, в том числе химическими канцерогенами;
в комплексной диагностике различных патологических состояний;
при определении концентрации металлосодержащих ферментов,
340
о
L II 'H + H<A* * [I + N2 + ROH + Хемилюми-
^V^V (R00H) IV S^COOH несценция
NH2 О NH2
I II V
Рис. 186. Хемилюминесцентная реакция, возникающая при окислении люмино-
ла перекисью водорода или другими перекисями в присутствии пероксидазы и
гемина:
/ — люминол; // — перекись водорода или другие перекиси: /// — гемин; IV — перокси-
даза; V — аминофталат
ряда водо- и жирорастворимых витаминов. Метод хемилюминесцен-
ции целесообразен в космических исследованиях и для оценки
адаптации систем организма к условиям окружающей среды
Глава 13. ФОТОБИОЛОГИЧЕСКИЕ ПРОЦЕССЫ
Под действием поглощенных фотонов, ультрафиолетовой,
видимой и инфракрасной областей спектра, в живых организмах
протекают процессы, которые называют фотобиологическими. Они
свойственны организмам всех царств живой природы от прокариот,
низших и высших растений до высших животных и человека.
Фотобиологические процессы начинаются поглощением. фотонов
света. В ходе биохимической эволюции сформировались
специальные поглощающие свет вещества — пигменты, роль которых
связана с выполнением полезных для жизнедеятельности организмов
светозависимых функций. Вместе с тем в состав веществ,
обнаруживаемых в живых клетках, входят как обязательные их
компоненты белки и нуклеиновые кислоты, которые поглощают свет
ультрафиолетовой области спектра. При этом могут развиваться
фотобиологические процессы отрицательного для
жизнедеятельности организма характера, что проявляется фотоинактивацией
клеток, обусловленной повреждением биомакромолекул
ультрафиолетовыми лучами. В ходе эволюции возникли пигментные системы,
тем или иным способом защищающие клетки или сложный
многоклеточный организм от фотоинактивации.
К настоящему времени исследовано большое разнообразие
пигментов биологического происхождения и связанных с их участием
фотобиологических процессов, которые могут быть простыми одно-
этапными и очень сложными, охватывающими многоэтапные
реакции клеток и тканей.
13.1. Типы фотобиологических процессов. Фотобиологические
процессы по их биологическому значению разделяют на
фотофизиологические и фотодеструктивные.
Фотофизиологические процессы обеспечивают протекание
связанных со световым воздействием физиологических функций
организма. Их можно разделить на процессы энергозапасания, при
которых энергия поглощенных фотонов превращается в иные формы
свободной энергии (например, энергию химических связей восста-
341
новленных соединений, градиента концентрации ионов), и на
процессы регуляции, при которых свет определяет напряженность
ряда физиологических функций. Выделяют также фотобиосинтети-
ческие процессы, вызывающие образование на свету ряда
биологически важных веществ.
В фотобиологических процессах энергозапасания поглощается
и подвергается превращениям значительное количество энергии
света. В фотобиологических информационных процессах, напротив,
обычно физиологически значимыми оказываются весьма небольшие
количества поглощаемой энергии.
Среди фотобиологических процессов, происходящих на нашей
планете, безусловно, ведущее место принадлежит фотосинтезу.
Запасаемая в ходе фотосинтеза энергия солнечных лучей служит
главнейшим источником энергии для всего гетеротрофного мира.
Фотосинтез определяет облик всей биосферы, газовый состав
атмосферы, климат, эволюцию видов.
Принимающие участие в фотобиологических процессах
ультраструктурные элементы клеток и их метаболические системы* в ходе
эволюции приобрели настолько специализированную организацию,
что в норме при поглощении фотонов не происходит каких-либо
повреждений макромолекул.
Фотодеструктивные процессы, состоящие в возникновении под
влиянием света повреждений биомакромолекул (белков,
нуклеиновых кислот, других соединений, обладающих хромофорными
группами), относятся к патологическим явлениям. Они могут
сопровождаться гибелью клеток, возникновением мутаций, нарушением
физиологических функций организма. Для защиты от
отрицательных последствий фотодеструкции биологически важных веществ
многие организмы обладают специальными приспособлениями —
экранированием светочувствительных компонентов клетки
особыми пигментами, дезактивацией возникающих фотшродуктов,
восстановлением повреэвденных молекул.
13.2. Пигменты биологических систем. Разнообразные по
химической природе окрашенные соединения (пигменты),
обнаруживаемые в живых органи змах, можно классифицировать по
функциональному значению, выделив их в следующие группы.
1. Пигменты, принимающие участие в фотобиологических
процессах, являющихся функционально значимыми в
жизнедеятельности организма. К этой группе относятся фотосинтетические
пигменты— хлорофилл зеленых растений, бактериохлорофиллы
фотосинтетических бактерий, вспомогательные фотосинтетические
пигменты— каротиноиды, ксантофиллы, фнкобилины, зрительный
пигмент — родопсин, регуляторные пигменты — фитохром и крип-
тохромы.
2. Пигменты, биохимическая функция которых связана с
функционально значимыми фотобиологическими процессами не
непосредственно, а благодаря наличию в их молекулах хромофорных
групп, избирательно поглощающих свет в видимой области спектра.
К этой группе относятся пигменты, окрашенные в красный цвет
342
(пигмент крови — гемоглобин, хромопротеид мышц — миогло-
бин, окислительно-восстановительные ферменты — каталаза, пе-
роксидаза, цитохромы растительных и животных тканей), темно-
голубые или зеленовато-синие гемоцианины и зеленый хлорокри-
арин (осуществляют у беспозвоночных функцию дыхательных
пигментов), продукты распада гемоглобина (желчные пигменты) и др.
3. Пигменты, выполняющие функцию экранирования
светочувствительных клеток и тканей. Наиболее распространенными
пигментами этой группы у животных являются вещества
ароматического строения — меланины. У растений во многих случаях
экранирующую функцию выполняют каротиноиды и флавоноиды-.
4. Пигменты морфолого-приспособительного значения.
Придавая определенную окраску тем или иным частям организма,
обеспечивают для животных маскировку, а для растений —
привлечение насекомых-опылителей. Благодаря половому отбору, у многих
видов животных появилась очень яркая окраска перьев у птиц,
хитинового покрова у насекомых и т. д. К этой группе пигментов
относятся флавины, птеридины, цианидины, меланины,
встречающиеся в животном мире, антоцианы — у растений.
Для многих пигментов характерно близкое химическое строение
пигментов (рис. 187). Например, основу фотосинтетических
пигментов, дыхательных цитохромов, окислительно-восстановительных
ферментов составляет порфирин — замкнутый цикл из четырех
пиррольных колец. Хромофорная группа фитохрома такая же,
как и у фикобилинов,— линейный тетрапиррол. Желтые,
оранжевые и красные растительные пигменты — производные
ароматических соединений типа флавонона.
В филогенетическом плане многие пигменты являются очень
древними компонентами клеток, в связи с чем одни и те же
пигменты часто можно обнаружить у отдаленных друг от друга видов.
Например, каротиноиды имеются у бактерий и высших растений,
хлорофилл а — у высших растений и цианобактерий.
13.3. Общие закономерности фотобиологических процессов.
Фотобиологические процессы в основном сходны по своей общей
схеме и состоят из нескольких этапов. Процесс начинается с
поглощения кванта света веществами. Далее следует
внутримолекулярный размен энергии — миграция электронно-возбужденного
состояния по молекуле и локализация этого состояния в
определенных участках молекулы. Этот процесс происходит очень быстро,
и одновременно с ним осуществляется межмолекулярный перенос
энергии электронно-возбужденного состояния — миграция от
молекулы к молекуле. Этапы поглощения кванта света и миграции
энергии электронного возбуждения составляют фотофизическую
стадию фотобиологического процесса.
Фотофизическая стадия в соответствующих условиях может
сопровождаться фотохимическими реакциями, химическими
превращениями веществ, приводящими к возникновению первичных
фотопродуктов. Эти фотопродукты обычно бывают нестабильными,
в связи с чем продолжаются их превращения, завершающиеся обра-
343
Не!
;н»
^На H3J
СН*
р-ка ратин
Лютеин
НООС СООН
СНз £Н2 С^2 СН2
2Н2 СИз СНз СН
Фикоэритробилин
Фикоцианобилин
Рис. 187. Структурные формулы некоторых пигментов растительного
происхождения с характерным наличием сопряженных двойных связей
зованием относительно стабильных молекул. Химические
превращения, индуцированные фотофизической стадией процесса,
составляют фотохимическую стадию.
Фотопродукты, принимая участие в биохимических или моле-
кулярно-биологических явлениях, определяют биологическую
реакцию клетки или многоклеточного организма на действие света.
Таким образом, началом фотобиологического процесса следует
считать поглощение определенными молекулами кванта света и
возникновение электронно-возбужденного состояния. Это означает,
что фотобиологические процессы могут вызываться только такими
квантами, энергия которых соизмерима с энергией связи
электронов в молекуле, но не превышает ее. Такие кванты принадлежат
сравнительно узкому участку спектра электромагнитных волн
видимого света. При больших энергиях квантов может происходить
ионизация и распад молекул, при меньших — не возникают
электронно-возбужденные состояния.
344
Физические законы, описывающие поглощение света,
возбужденные состояния и флуоресценцию вещества, кратко рассмотрены
в гл. 4 (параграфы 4.6 и 4.7).
В многоатомных молекулах электроны локализованы воз!ле
отдельных ядер, другие дело кал изованы между ядрами.
В поглощении молекулами света большое значение имеют я-элек-
троны так называемых я-орбиталей. Если при поглощении кванта
света возбуждению подвергается электрон я-орбитали, то говорят
о (я, я*)-переходе, где я* обозначает орбиталь возбужденного
электрона. Происходят и (/г, я+)-переходы.
Внутренняя энергия молекулы £м равна сумме энергий:
электронов— ^эл, колебаний ядер в молекуле — Екол и вращательных
движений — Евр:
где энергии Екол, Евр и Еэл квантованы, а следовательно, могут
принимать лишь определенные дискретные эначения. Однако
энергии колебательных и вращательных переходов, связанных с
тепловыми движениями молекулы, в сравнении с энергией электронных
переходов малы. Для колебательных переходов энергия имеет
порядок 0,1 эВ (0,16 • 10~19 Дж), для вращательных еще меньше —
0,01 эВ (0,16 • 10"20 Дж), их энергетический барьер преодолевается
тепловым воздействием очень длинноволновых квантов, не
принадлежащих видимой области спектра.
13.4. Механизмы миграции энергии электронного
возбуждения. Энергия электронно-возбужденного состояния может
передаваться от поглотившей свет молекулы к другой молекуле того же
или иного вещества. Этот процесс называют миграцией энергии
электронного возбуждения. Передающая энергию молекула
является донором (Д), а воспринимающая — акцептором (А). Миграцию
энергии электронного возбуждения можно описать таким сб-
разом:
д* + А->А*+Д. (13.2)
Если энергия электронного возбуждения у А* подвергается
внутренней конверсии: А*-*-А + тепло, то А выступает в качестве
фактора, обусловливающего тушение возбужденного состояния
Д*. Экспериментально тушение возбужденного состояния
устанавливают по ослаблению флуоресценции при добавлении к
флуоресцирующему веществу тех или иных примесей.
Если акцепторное вещество из возбужденного состояния в
основное переходит путем испускания фотонов, то миграцию энергии
электронного возбуждения Д*+ А -*■ Д + А* выявляют по
спектру флуоресценции А*, если спектральная полоса А* отличается
от спектральной полосы флуоресценции Д. Естественно, что свет
флуоресценции акцептора характеризуется обычно большей длинен
волны, чем кванты света, поглощаемого донорными молекулами.
345
Отличают межмолекулярную миграцию энергии электронного
возбуждения от внутримолекулярной миграции энергии, при
которой происходит перенос энергии в пределах одной молекулы внутри
ее хромофорной группы, двумя сопряженными либо
несопряженными хромофорными группами.
Известно несколько механизмов межмолекулярной миграции
энергии электронного возбуждения. Простейший случай переноса
энергии состоит в повторном поглощении квантов света, излучаемых
возбужденными молекулами. Это явление выявляют по ослаблению
флуоресценции в концентрированных растворах. Называют его
реабсорбцией. Реабсорбционная передача энергии может
происходить на предельно больших расстояниях.
В фотобиологических процессах более важными являются
безызлучательные механизмы переноса энергии электронного
возбуждения: обменно-резонансный, индуктивно-резонансный и экси-
тонный.
Обменно-резонансная миграция энергии
электронно-возбужденного состояния осуществляется при прямом перекрывании
электронных орбиталей молекул донора и акцептора. При этом донор и
акцептор могут обмениваться своими электронами, различающимися
энергией- Для того чтобы этот механизм миграции мог
осуществляться, необходимо весьма сильное сближение молекул. С
удалением молекул донора и акцептора друг от друга вероятность
переноса энергии электронно-возбужденного состояния убывает
пропорционально шестой степени межмолекулярного расстояния.
По обменно-резонансному механизму происходит триплет-триплет-
ный перенос энергии электронного возбуждения.
Индуктивно-резонансная миграция энергии электронного
возбуждения осуществляется при больших расстояниях между
молекулами донора и акцептора — порядка 2,0—10,0 нм и обусловлена
резонансным взаимодействием между возбужденной молекулой
донора и молекулой акцептора. В квантовомеханической трактовке
индуктивно-резонансный механизм миграции энергии
рассматривается как слабое межмолекулярное взаимодействие посредством
электромагнитного поля, связывающего индивидуальные пары
молекул-осцилляторов, способных колебаться с близкими
значениями частот. В этой трактовке молекулы рассматриваются как
электрические диполи. Поэтому резонансный механизм миграции
энергии электронно-возбужденного состояния описывают как ди-
поль-дипольные взаимодействия.
Для эффективной миграции энергии по
индуктивно-резонансному механизму необходимо, чтобы донор Д* был способен к
флуоресценции, и его спектр флуоресценции должен перекрываться со
спектром поглощения акцептора А. Впервые Т. Ферстер (1948)
предложил формулу расчета вероятности переноса энергии по
диполь-дипольному взаимодействию:
Рд-*А=="^Ь"1/о,еА$» (13-3)
346
где v — волновое число; г а — коэффициент экстинкции акцептора;
fD* — спектральное распределение испускания донора; R —
расстояние между Д* и А*; %% — время жизни возбужденного состояния
донора; k — экспериментальная константа; п — показатель
преломления; х2 — фактор ориентации диполей донора и акцептора.
Наиболее сильным диполь-дипольное взаимодействие бывает
в случае разрешенности переходов в молекуле Д*, а этому
соответствуют синглет-синглетные и триплет-триплетные
переходы.
Отметим, что при обсуждении вопросов, связанных с
возбуждением электронов в молекулах и миграцией энергии электронного
возбуждения, не рассматривалось влияние на этот процесс
колебаний ядер в молекулах. Это объясняется тем, что электронные
переходы являются значительно более быстрыми процессами, чем
движение ядер, и поэтому за время электронного перехода ядра не
успевают изменить ни скорости, ни взаимного расположения. Это
положение составляет смысл принципа Франка—Кондона.
Экситонная миграция энергии электронного возбуждения
наблюдается в кристаллических структурах. Вследствие делокализации
возбужденных электронных уровней в кристалле возникает
возбуждение коллективных состояний, одновременно охватывающее
тысячи молекул. Коллективное возбуждение целого ансамбля
молекул возможно за счет быстрого движения квазичастицы экситона.
Время «скачка» экситона (тэ ~ 10 ~13 с) от одной молекулы к другой
значительно меньше времени жизни возбужденного состояния
молекулы (тЪ~ Ю~* с). Поэтому экситон осуществляет более Ю4
«скачков», в результате чего энергия возбуждения передается на
расстояние, значительно превышающее расстояние между молекулами.
Описано несколько типов экситонов: в молекулярных
кристаллах образуются экситоны Френкеля] в кристаллах
полупроводникового типа экситон представляет собой связанную пару
электрон— дырка (экситон Ваннье — Momma).
В биологических системах наиболее частой является миграция
энергии электронно-возбужденного состояния по индуктивно-ре-
занансному механизму.
13.5, Общая характеристика фотохимических процессов.
Поглощая квант света, молекула приобретает дополнительную
энергию, и на ее орбиталях появляются одиночные электроны, что
придает молекуле повышенную химическую активность. Благодаря
этому свет может индуцировать реакции, которые в темноте не
происходят. Такие реакции называют фотохимическими.
Фотохимическая активация отличается высокой
селективностью, так как квант света активирует отдельную связь или группу
атомов в молекулах, поглощающих свет данной длины волны.
Законы фотохимии. Основные законы фотохимии таковы:
1. Фотохимические изменения происходят только под влиянием
света, поглощаемого химической системой. Этот закон называют
законом Гротгуса — Дрепера.
347
2. Каждый поглощенный в первичном акте квант света
способен активировать только одну молекулу. Этот закон,
сформулированный А. Эйнштейном, называется законом фотохимической
эквивалентности:
3. При поглощении кванта света молекулой органического
вещества имеется определенная вероятность возникновения самого
нижнего возбужденного синглетного состояния либо самого
нижнего триплетного состояния.
4. В преобладающей части реакций органических соединений
в растворах фотохимические процессы происходят с участием
самого нижнего возбужденного синглетного или самого нижнего
триплетного состояния.
Удобно в качестве единицы энергии света использовать
количество энергии, присущее числу квантов, равному числу молекул
в одном моле, т. е. 6,02 • 1023. Эта единица энергии названа
Эйнштейном. При поглощении энергии света в 1 Эйнштейн
фотохимическому превращению подвергается соответственно 1 М молекул
поглощающего кванты света вещества. Один Эйнштейн по
абсолютному значению энергии зависит от длины волны или частоты света.
Действительно, 1 Эйнштейн = N0hvc, где N0—число Авогадро,
равное 6,02 • 1023; h — постоянная Планка; с—скорость света;
V—волновое число. Подставив значение констант, получим:
1 Эйнштейн = 1,19 • 10 "^v.
Квантовый выход фотохимической реакции.
Эффективность фотохимических реакций характеризуют квантовым выходом
фотохимической реакции Ф, показывающим, сколько молекул
подвергалось превращению на один поглощенный квант света.
Численно Ф совпадает с числом молей вещества, подвергшихся
превращению при поглощении одного Эйнштейна света. Если в
реакционной системе имеются процессы, конкурирующие с
фотохимическими, квантовый выход меньше единицы. Квантовый выход обычно
рассчитывают для первичного фотохимического процесса, хотя
такой расчет имеет смысл и для конечных продуктов
фотохимической реакции.
Величиной, обратной квантовому выходу фотохимической
реакции, является квантовый расход, показывающий, сколько
квантов света в данной фотохимической реакции расходуется на
превращение одной молекулы. Квантовый расход выражает также
число эйнштейнов, израсходованных на превращение в
фотохимическом процессе одного моля вещества.
Значения квантовых выходов варьируют в очень широких
пределах. При одностадийных фотохимических реакциях в случае
значительной дезактивации первичных активных центров
квантовый выход реакции может быть очень малым. Так, квантовый выход
фотовосстановления метилеиового голубого составляет всего 1,6 X
X 10-*. В случае же многостадийных реакций, когда первичная
фотореакция индуцирует цепной характер протекания вторичных
превращений веществ, квантовый выход конечных продуктов может
348
Рис. 188. Спектры поглощения и действия фитохрома Фкс и Фдкс :
/ — спектр поглощения красной формы фитохрома, Ф^ф 2 — спектр поглощения дальней
красной формы фитохрома, Фдкс » 3 — спектр действия фотоиндукции прорастания
семян салата латука; 4—» спектр действия ингибирования прорастания семян латука
быть значительно больше единицы. Например, в индуцируемой
hv
светом реакции Н2 + С12 —* 2НС1 квантовый выход Ф = 105.
Спектры действия фотохимических реакций.
Относительная эффективность различных длин волн света в индукции
определенного фотохимического процесса характеризуется спектром
действия — зависимостью квантового выхода фотохимической
реакции от длины волны поглощенного света. Спектр действия в
простейших случаях должен быть комплементарным спектру поглощения
фотохимически активного вещества, в чем отражается первый закон
фотохимии. Для построения спектра действия исследуют выход
фотохимического процесса при воздействии на реакционную
систему одного и того же потока квантов света разных длин волн.
Поскольку в основе любого фотобиологического процесса
лежит первичный этап фотохимического превращения, то по
сопоставлению спектра действия того или иного фотобиологического
явления со спектрами поглощения разных фотоактивных веществ,
содержащихся в клетках организма, можно выявить природу
фоторецепторов, ответственных за фотобиологический процесс.
В качестве примера приведен спектр действия и спектр поглощения
фоторегуляторного пигмента растений, фитохрома (рис. 188).
Элементарные фотохимические реакции. Скорость
дезактивации электронно-возбужденного состояния молекул велика
в сравнении со скоростями обычных химических реакций. Поэтому
химические реакции возбужденных молекул должны
осуществляться с достаточно высокими скоростями, чтобы конкурировать с
дезактивацией их возбужденных состояний.
Известно весьма широкое разнообразие типов фотохимических
реакций. Простейшими из них являются структурные перестройки
349
в молекуле, поглотившей квант света, в результате чего
происходят фотодиссоциация и фотоионизация:
(А-В)-(А-В)*^А+ + бЛ (13.4)
ЧА + В
Свет индуцирует перегруппировки в электронно-возбужденной
молекуле. К этому типу фотохимических реакций относят фотосте-
реоизомеризацию и фототаутомеризацию. При стереоизомериза-
ции энергия возбуждения расходуется на поворот связей в молекуле,
а при таутомеризации — на внутримолекулярное перемещение
водорода.
Первичными фотохимическими реакциями являются также
реакции фотоприсоединения и фотопереноса электрона. Перенос на
фотовозбужденную молекулу электрона составляет
фотовосстановление. При переносе электрона от фотовозбужденной молекулы
происходит фотоокисление. Обе эти элементарные фотохимические
реакции имеют очень большое значение в фотобиологических
процессах. Перенос электрона может иметь место между двумя
молекулами в триплетном состоянии, что сопровождается образованием
первичновосстановленной и первичноокисленной молекул:
Ат + Ат-+А+ + А-. (13.5)
Первичновосстановленная молекула присоединяет водород, в
конечном счете образуя обесцвеченную лейкоформу фотоактивной
молекулы АН2.
Фотоокисление — это реакция возбужденных при поглощении
света молекул с акцепторами (катионами, кислородом),
приводящая к образованию первично окисленного продукта и
восстановленного акцептора. Например, под влиянием квантов света в
присутствии бензохинона, выступающего в качестве акцептора
электрона, хлорофилл претерпевает обратимое фотоокисление.
При фотоприсоединении электрона может происходить фотоди-
меризация — присоединение к возбужденной молекуле другой
невозбужденной молекулы, что приводит к образованию димера.
Если в реакции фотоприсоединения объединяются две разные
молекулы, то говорят о возникновении эксимера, а при образовании
связи между возбужденной молекулой и молекулой растворителя —
об эксиплексе.
Фотооксидирование представляет собой присоединение
молекулярного кислорода к фотовозбужденной молекуле. В результате
этой реакции образуется лабильный продукт — мольоксид или
стабильный продукт — оксид.
При взаимодействии фотовозбужденных молекул с водой может
происходить фотогидролиз. Например, под влиянием
ультрафиолетового света многие аминокислоты, подвергаясь дезаминированию,
превращаются в оксикислоты.
Фотосенсибилизация. В химических системах, содержащих
поглощающие свет вещества и способных к обратимому фотовосста-
350
новлению или фотоокислению, могут осуществляться
окислительно-восстановительные процессы с участием фотоактивных молекул,
которые при этом выступают в роли агентов, передающих электрон
от окисляемого нефотоактивного донора к восстанавливаемому,
нефотоактивному акцептору, в конечном счете оставаясь
неизменными. Такой процесс называют фотосенсибилизацией, а
участвующее в нем фотоактивное вещество — фотосенсибилизатором.
В реакции фотосенсибилизации в зависимости от условий среды
и от окислительно-восстановительных потенциалов доноров и
акцепторов возбужденный фотосенсибилизатор С может вступать
в реакции с молекулами либо восстановителей ДН2, либо
окислителей О:
С-С*. С* + ДН2->С- + ДН+ С- + 0-+С + СГ;
6- + ДН+ -+ ОН + ДН, 20Н -+ ОН2 + О;
ОН + ДН->ОН2 + Д, 2ДН->ДН2 + Д. (13.6)
Если С* взаимодействует с О, то протекает реакция С*+ ()->■
->- С+ + 6", С+ + ДН2 -> ДН* + С и далее взаимодействуют ион-
радикалы 6" и ДН*.
В процессе фотосенсибилизированных реакций может
происходить запасание энергии, поступающей в систему в форме
поглощенных квантов света.
13.6. Фотосинтез. Пигменты растений, поглощая кванты
солнечных лучей, преобразуют их энергию в энергию разделенных
электрических зарядов, что, в конечном счете, приводит к
формированию химических связей высокоэнергетических органических
соединений. Этот процесс составляет важнейший на Земле
фотобиологический процесс — фотосинтез. Помимо того, что в ходе
фотосинтеза запасается свободная энергия, процесс этот
сопровождается выделением в атмосферу молекулярного кислорода,
образующегося при фоторазложении воды. Благодаря фотосинтезу, в атмосфере
поддерживается постоянное нужное для живых существ
содержание кислорода. Мир гетеротрофных организмов — преобладающая
часть бактерий, животные и человек — потребляют для своей
жизнедеятельности свободную энергию, запасаемую фотоавтотрофными
организмами, способными осуществлять фотосинтетический процесс.
Масштабы фотосинтеза на Земле грандиозны: за один год
растения суши из С02 атмосферы создают до 2,4 • Ю10 т органического
углерода. Еще выше продуктивность фотоавтотрофов Мирового
океана, синтезирующих до 1,55 • Ю11 т углерода в составе
органических веществ. Для сравнении укажем, что современный земной
расход энергии человеком, который для этой цели использует пока
преимущественно продукты фотосинтеза отдаленных геологических
эпох — нефть и каменный уголь, существенно ниже — 3,4- 109 т
органического углерода.
Попадающая на Землю энергия солнечных лучей огромна —
20,9 • Ю20 кДж/мин (5 • 1020 ккал/мин). Зеленые растения усваива-
351
ют до 2 % энергии солнечных лучей, достигающих земной
поверхности.
фотосинтез — процесс сложный, многостадийный. Для его
осуществления необходима структурная организация
молекулярных и клеточных структур, наличие специальных биохимических
систем, возникших и достигших высокой степени совершенства
в ходе эволюции живого мира.
Суммарная реакция фотосинтеза. Фотосинтез зеленых
растений описывается такой итоговой реакцией:
Свет
С02 + Н20— (СН20) + 02 + AG, (13.7)
где AG — запасаемая свободная энергия, равная для этого процесса
470,0 кДж/моль; (СНаО) — соединение (восстановленный атом
углерода Н—С—ОН), являющееся элементом более сложных молекул
углеводов, возникающих при фотосинтезе. Так, синтез стабильных
продуктов фотосинтеза шестиуглеродных соединений — гексоз опы-
сывается уравнением
Свет
6С02 + 6Н80—' С6Н1206 + 602 + 2820 кДж/моль. (13.8)
За этим общим выражением скрываются многие элементарные
реакции, которые можно сгруппировать в три этапа:
а) собственно фотохимический этап фотосинтеза, охватывающий
поглощение кванта света пигментом, миграцию энергии
электронного возбуждения к веществам-«ловушкам», способным к обратимым
окислительно-восстановительным реакциям;
б) этап переноса (транспорта) электрона и сопряженный с этим
переносом синтез высоковосстановленных соединений, а также
формирование лабильных химических связей, отличающихся
большим значением свободной энергии, вследствие чего называемых
макроэргическими. Наличие этих двух типов продуктов —
восстановителей и макроэргических соединений необходимо для
осуществления процессов, составляющих третий этап фотосинтеза;
в) этап биохимических, уже непосредственно не требующих
поглощения света темновых реакций, в ходе которых происходит
восстановление С02 до
и ряд других процессов
Н-С—ОН
дальнейшего превращения^ возникших первичных продуктов
фотосинтеза и восстановления компонентов биохимической системы,
ответственной за вовлечение С02 в сферу фотосинтетических
превращений.
Термодинамика фотосинтетического процесса.
Рассчитаем двумя способами энергетические характеристики
фотосинтеза.
1. При фотосинтезе в конечном счете энергия ^квантов света
расходуется на преобразование химических связей Н20 и СОа
352
в связи НСОН и 02. Поскольку энергии этих связей известны,
можно рассчитать общее приращение энергии при фотосинтезе:
I 347
+ 0 = 0 +AG. (13.9)
Цифрами указаны значения энергии связей (кДж/моль).
Энергия квантов света расходуется на замену суммарно более
прочных ковалентных связей на суммарно менее прочные связи.
Подсчитав сумму энергий химических связей для левой и правой
сторон реакции, получим для Н20и С02—2520 кДж/моль, для
IHCOH] и 02 — 2042 кДж/моль. Отсюда AG = 478 кДж/моль.
2. Поскольку в ходе фотосинтеза реализуется энергия
первоначально разделенных в фотохимическом этапе процесса
электрических зарядов, можно рассчитать значение энергии, израсходованной
на восстановление С02 по разности окислительно-восстановительных
потенциалов исходных продуктов фотосинтеза.
Для большей части известных веществ, способных к
окислительно-восстановительным реакциям,
окислительно-восстановительные потенциалы (редокс-потенциалы) определены и являются
табличными величинами (параграф 12.3).
Итоговую реакцию фотосинтеза можно представить в виде
таких сопряженных между собой окислительно-восстановительных
реакций:
2Н20-^4Н+ + 4<Г + 02 I,
С02 + 4Н+ + 4е- -> [НСОН] + Н20 II. (13.10)
Редокс-потенциал для полуреакции I Е0 = +0,82 В, а для
полуреакции II Е0= —0,4 В. Как видим, для осуществления реакции
фотосинтеза необходимо перенести 4 электрона в электрическом
поле с разностью потенциалов Дер = 0,82 — (—0,4) = 1,22 В,
для чего требуется энергия, равная W3 — Мер = 4 • 1,22 = 4,88 эВ,
что составляет 470 кДж/моль.
Сопоставим это значение энергии с энергетическим
эквивалентом кванта красного света, поглощаемого фотосинтетическим
пигментом, хлорофиллом: 1 Эйнштейн фотонов света длиной волны
650 нм составляет 184 кДж. Следовательно, одного кванта света
данной длины волны явно недостаточно, чтобы осуществилась
фотосинтетическая реакция восстановления молекулы С02.
Фотосинтетические пигменты. У высших растений
основными пигментами, поглощающими свет и принимающими
участие в фотосинтезе, являются хлорофиллы а и Ь и каротиноиды.
Хлорофилл а — основной пигмент растений эукариот и прокариот,
способных к фотосинтетическому разложению воды.
Хлорофиллы относятся к порфиринам, в основе которых лежит
порфин — структура, состоящая из четырех пиррольных колец,
объединенных метиновыми мостиками в общую систему
циклического строения (рис. 189).
353
В центре тетрапиррола
включен атом магния.
Помимо тетрапиррольного
кольца хлорофиллы имеют
присоединенный к
остатку пропионовой кислоты,
имеющемуся при IV пир-
рольном кольце,
высокомолекулярный спирт фитол.
Благодаря липофильным
свойствам фитола
хлорофилл может встраиваться
в липидный слой мембран.
У хлорофилла а в
положении атома углерода 3
второго пиррольного
кольца присоединена группа
СН3, а у хлорофилла
Ь -СОН.
Молекул яр ное соотно-
шение хлорофилла а к
хлорофиллу b у высших
растений обычно близко к 1:3,
хотя варьирует в
зависимости от условий
освещения. Известны мутанты,
лишенные хлорофилла Ъ> но
сохра н я ющи е способность
к фотосинтезу при повышенных интенсивностях света.
На рис. 190 доказаны спектры поглощения и флуоресценции
хлорофилла в растворе. Две полосы поглощения хлорофилла
соответствуют переходам S0->-S* и S0-^S*. Первый переход наблю-
Рис. 189. Молекула хлорофилла а
Рис. 190. Спектры поглощения (1) и флуоресценции (2), хлорофилла а в
эфирном растворе:
8»—молярный коэффициент экстинкции (л • М"*1 • см-1)
354
дается в синей области, и ему соответствует так называемая полоса
Соре, второй происходит в красной области спектра.
Межмолекулярные взаимодействия хлорофилла с его
окружением определяют характер электронных переходов, в связи с чем
спектры поглощения и флуоресценции хлорофилла в растворах
и в нативном состоянии различаются. По этим различиям спектров
поглощения и флуоресценции судят о состоянии пигмента в связи
с его функцией.
Кроме наиболее широко распространенных хлорофиллов а и Ь,
известны и другие фотосинтетические пигменты: хлорофилл с (хло-
рофуцин, или хлорофилл-гамма), извлеченный из диатомовых
и бурых водорослей, характеризуется максимумом поглощения при
447 нм и флуоресценцией при 628 нм; из красных водорослей
выделен хлорофилл d, поглощающий синий свет при 447 нм и
флуоресцирующий при 688 нм; из золотистой водоросли Tribonema bom-
bicum получен хлорофилл е.
У цианобактерий и красных водорослей, не имеющих
хлорофилла Ь, содержатся особые пигменты фикоцианины и фико-
эритрины. Эти пигменты придают организмам специфическую
свойственную им окраску, по которой они и получили свои
названия.
Структура фикоцианинов и фикоэритринов включает линейный
тетрапиррол, который является хромофорной группой пигмента,
присоединенной к молекуле белка.
К более простому фотосинтезу, не связанному с
фоторазложением воды, способны бактерии, получившие название фототроф-
ных. Фотосинтетическим пигментом фототрофных бактерий
является бактериохлорофилл. Различают четыре группы бактериохлоро-
филла. У пурпурных фотобактерий имеется бактериохлорофилл а,
сходный по сйоему строению с хлорофиллом а высших растений.
Полосы поглощения находятся в области 370 нм, 590 805 нм и между
830 и 890 нм. Бактериохлорофилл Ь встречается реже. Он найден
в Rhodopseudomonas viridis и характеризуется полосами
поглощения 400, 840 и 1020 нм. Как видим, бактериохлорофилл поглощает
свет преимущественно в красной области спектра. Фотосинтез
у фотобактерий идет с участием энергетически менее ценных
квантов, чем у высших зеленых растений. Бактериохлорофиллы cud
содержатся в зеленых серобактериях. В отличие от бактериохлоро-
филла а, эти пигменты не имеют циклопентанового кольца, а вместо
фитола содержат остаток фарнезила. Иногда эти пигменты называют
хлорофилл-хлоробиум — по наименованию бактерии Chlorobium.
Известно несколько видов этих пигментов, различающихся
максимумами поглощения света. Их и обозначают, присоединяя к
названию пигмента хлорофилл-хлоробиум длину волны максимума
поглощения: хлорофилл-хлоробиум-660, хлорофилл-хлоробиум-
780 и т. п.
Кроме основных фогосинтетических пигментов в этом
процессе принимают участие каротиноиды — 40-углеродные терпе-
ноиды или изопреноиды, состоящие из 8 изопреноидных единиц
355
Ряс. 191. Тилакоиды в клетках разных фотосинтезирующих организмов:
а — Rhodosplrlllum rubrum; б — Nostoc muscorum; в — Cblaraidomonas moewusii; г —. ало»
рояласт высшего растения; д — разрез через тилакоидную мембрану
и шестиуглеродных ионоловых колец на
Г—НС=С-~СН==СН—
I СН8
концах молекулы. К этим пигментам относятся а- и р-каротин,
ксантофиллы (лютеин, перидинин, зеаксантин, фукоксантин). Каро-
тиноиды поглощают свет в синей области спектра и способны
передавать энергию электронно-возбужденного состояния хлорофиллу а.
Таким образом, эти пигменты выполняют функцию светосборщиков.
Обратный процесс — передача энергии от хлорофилла каротино-
идам — невозможен. Каротиноиды не обладают способностью к
флуоресценции. Кроме поглощения света и его передачи хлорофиллу
каротиноиды защищают фотосинтетический аппарат от повреждения
действием сильного света. Как видим, каротиноиды играют как бы
вспомогательную роль в фотосинтезе, в связи с чем их называют
дополнительными пигментами.
У цианобактерий функцию дополнительных пигментов
выполняют фикобилины, представляющие собой протеины, содержащие
хромофорные группы в виде линейного тетрапиррола.
Организация фотосинтетического аппарата.
Фотосинтетические пигменты сосредоточены в специальных мембранных
образованиях в виде уплощенных пузырьков, формирующихся из
двойной липидной мембраны, содержащей белки. &ги пузырьки
называются тилакоидами. У прокариот-фототрофов
фотосинтетический аппарат организован самым простым образом, ограничиваясь
индивидуальными тилакоидами или их скоплениями (рис. 191).
У эукариотических фототрофов фотосинтетический аппарат
организован более сложным образом: тилакоиды объединены в сложную
систему, включенную в специальную органеллу клетки —
хлоропласт. Хлоропласты содержатся в фотосинтетических клетках
растений, объединенных в фотосинтезирующие ткани листа, иногда
356
стебля. Число хлоропластов в зеленых клетках растений зависит
от вида растений и от условий роста. Варьирует это число от
нескольких хлоропластов до нескольких сот этих органелл на
клетку. Основной поглощающей свет поверхностью является мембрана
тилакоидов. Обычно общая площадь тилакоидных мембран очень
велика, во много раз превышает поверхность листьев растения.
Конечно, к фотосинтезу причастны не только молекулярные
структуры тилакоидов и содержащих их хлоропластов, но и остальная
часть клетки также выполняет важные биохимические и
транспортные функции, обеспечивающие фотосинтетический процесс На
уровне тканей листа также имеется много приспособлений,
нужных для выполнения листом фотосинтетической функции:
транспорт С02 к фотосинтезирующим клеткам, выведение из фотосин-
тезирующих клеток продуктов фотосинтеза и т. д.
Фотофизическая и фотохимическая стадии
фотосинтеза. Спектр поглощения фотосинтезирующей клетки или
хлоропласта является наложением спектров поглощения входящих
в их состав пигментов— хлорофиллов а и ft, каротиноидов. Кроме
того, в хлоропластах вследствие взаимодействия пигментов с
белками и липидами, а также между собой отмечается уширение полос
поглощения со сдвигом в красную область. Важную информации
несут спектр флуоресценции и значения квантовых выходов
флуоресценции, поскольку эти характеристики позволяют судить о
процессах, происходящих в светопоглощающем комплексе
хлоропласта. Тот или иной способ реализации возникающей при поглот
щении кванта света энергии электронно-возбужденного состояния
зависит от соотношения констант скоростей: чем выше скорость
данного процесса, тем больше вероятность его осуществления/
Обозначим константы скоростей: испускания квантов
флуоресценции — kf, безызлучательной внутренней конверсии — kiCi перехода
в триплетное состояние—kts, индуктивнорезонансной миграции
энергии электронного возбуждения от одной молекулы к другой—г
kt, гашения электронно-возбужденного состояния гасящим
веществом— &q, использования Б^состояния для фотосинтетического
процесса — kp. Квантовый еыход флуоресценции <р/ зависит от
соотношения констант скоростей возможных процессов размена энерч.и
электронно-возбужденного состояния, согласно следующему
соотношению:
*»- kf + kic + kis + kt + kQ + kp • <18-Ч)
Очевидно, максимальная эффективность фотосинтетической
функции хлоропластов может достигаться максимизацией значения
kp за счет других каналов дезактивации электронно-возбужденных
состояний фотосинтетических пигментов.
Ингибируя процессы переноса электронов, т. е. уменьшая
значение kp> удается существенно увеличивать квантовый выход
флуоресценции. Это говорит о том, что в объединении молекул
пигментов имеется возможность миграции энергии электронно-
351
возбужденного состояния к молекулам, участие которых
определяет «утечку» энергии по каналу фотохимических превращений
веществ. Логичным наименованием таких молекул является
«ловушка», или «сток». Такова, примерно, логика рассуждений при
исследовании спектров флуоресценции сложных систем
фотосинтетического аппарата.
Очевидно, в фотосинтезирующей системе происходит миграция
энергии электронно-возбужденного состояния от дополнительных
пигментов, хлорофилла Ь к хлорофиллу а и между молекулами
хлорофилла ау что, в конечном счете, завершается попаданием
энергии электронно-возбужденного состояния в «ловушку», где
происходит ее реализация в реакции окисления-восстановления
соответственно доноров и акцепторов электрона. При этом Еозникгют
более долгоживущие продукты фотохимических превращений.
Таким образом, совокупность молекул пигментов
энергетически скооперирована в функции сбора квантов света и передачи
энергии электронного возбуждения к «ловушке», обеспечивающей
реакцию окисления-восстановления.
В качестве ловушки выступает тот же хлорофилл, что было
показано советским ученым А. А. Красновским, открывшим фото-
обратимое восстановление хлорофилла. В результате возбуждения
возникает бирадикал хлорофилла: Хл + /iv-* Хл*-> Хл , который,
взаимодействуя с донором электрона, присоединяет электрон и
превращается в анион-радикал: Хл + ДН->- Хл" + ДН+.
Присоединяя протон, анион-радикал образует полу
восстановленную форму Хл" + Н+ -> ХлН. При полном восстановлении
радикала возникает восстановленный хлорофилл, имеющий красную
окраску. Реакция, получившая название реакции Красновского,
требует строго анаэробных условий, так как при наличии кислорода
может происходить необратимое фотоокисление пигмента.
В системах in vitro в качестве доноров электрона используют
восстановленную аскорбиновую кислоту, фенил гидразин, цистеин,
днтохром с, диенолы, соединения двухвалентного железа.
Пигментами-сенсибилизаторами являются хлорофиллы а и Ъу бакте-
риохлорофилл, феофитин (продукт отщепления магния от
хлорофилла), протохлорофилл, разные тюрфирины и фталоцианины,
содержащие в центре молекулы Mg, Си или Н.
В фотоокислении как акцепторы электрона проявляют себя 02*
метиловый красный, другие азокрасители, хиноны, рибофлавин,
никотинамиддинуклеотид (НАД), никотинамиддинуклеотидфосфат
(НАДФ), метилвиологен.
Советским ученым В. Б. Евстигнеевым было показано, что
хлорофилл, нанесенный на металлический электрод, способен при
действии света взаимодействовать с донорами и акцепторами
электронов, сообщая электроду соответствующий заряд.
Приведенные факты указывают на то, что хлорофилл как
фотосенсибилизатор может явиться центром утечки энергии
электронно-возбужденного состояния по пути образования восстановленных
и окисленных веществ, принимающих в последующем участие
358
Рис. 192. Эффект «красного падения». Спектры поглощения и действия
(прерывистые кривые) у Ulva taeniata (а) и Chlorella pyrenoidosa (б).
В области 680-700 нм отмечается резкое снижение эффективности фотосинтетнческого
действия света
в транспорте электрона от высоковосстановленных к глубокоокис-
ленным соединениям. Такую функцию хлорофилла связывают с
реакционным центром, локализованным в группе молекул пигмвнтга,
улавливающих кванты света и передающих анергию электронного
возбуждения к реакционному центру. Собирающие свет молекулы
пигментов представляют собой антенноидный хлорофиллг который
в объединении с реакционным центром образует
фотосинтетическую единицу.
Фотохимические системы фотосинтеза. Указание на
то, что в фотосинтезе функционирует не одна, а не менее двух
фотохимических систем, в неявном виде содержалось в особенностях
спектров действия фотосинтеза. В этом спектре имеется
существенное ослабление эффективности действия света в области 690—710 нм,
где кривая спектра действия идет существенно ниже кривой спектра
поглощения (рис. 192). Это расхождение спектров действия и
поглощения называют эффектом красного падения. Исследования
интенсивности фотосинтеза при освещении растений
монохроматическими лучами при их раздельном или комбинированном действии
обнаружили, что для некоторых комбинаций длин волн при
совместном влиянии света эффективность его действия существенно выше,
чем сумма интенсивностей фотосинтеза, регистрируемых при
облучении растений светом данных длин волн порознь. Так, если h%9
h2 и ht + h2 — интенсивности фотосинтеза при действии света
длин волн Klt Я2 и совместном их влиянии, то
1к + 1к<1к1+к- (13.12)
Данная закономерность составляет второй эффект Эмерсона.
В спектре действия, где проявляется эффект Эмерсона, имеются
участки спектра с наибольшим синергизмом: области 680 и 700 нм.
Близким к эффекту Эмерсона является эффект Блинкса. Этот
эффект состоит в том, что при чередовании освещения зеленой
водоросли лучами 688 и 640 нм наблюдалось резкое усиление
интенсивности фотосинтеза в момент замены длинноволнового света
более коротковолновым.
559
Одно из наиболее реальных объяснений описанных эффектов
ваключается в том, что полный процесс фотосинтеза осуществляют
две системы с разным спектром действия. Так возникло
представление о фотосистеме I с реакционным центром, поглощающим
более длинноволновое излучение в области 700 нм (что послужило
основанием назвать пигмент реакционного центра фотосистемы I
Р700), и о фотосистеме II, реакционный центр которой представлен
пигментом, поглощающим в области 680 нм (и вследствие этого
названным Р680).
Методами сравнительно мягкой фрагментации хлоропластов
и дифференциального центрифугирования удается выделять легкие
фрагменты хлоропластов, осаждающиеся при 144 000 g, и тяжелые
фрагменты, выпадающие уже при 24 000 g. Легкие фрагменты
содержат Р 700 и, следовательно, в Них содержится
фотосистема I, тяжелые фрагменты включают Р 680 и содержат
фотосистему II.
Химический состав легких и тяжелых фрагментов хлоропластов
различен: в сравнении с тяжелыми фрагментами легкие содержат
меньше хлорофилла Ь, лютеина, общего пластохинона, марганца,
цитохромов группы Ьу но больше филлохинонов (вит. К).
Испытание ряда веществ, являющихся донорами и акцепторами
электронов, позволило очертить круг эндогенных и искусственных
экзогенных доноров и акцепторов, эффективных в системах,
содержащих легкие или тяжелые фрагменты хлоропластов. В результате
была предложена схема взаимодействия фотосистем I и II. Обычно
эта схема изображается в таком виде, что напоминает повернутую
на 90° букбу Z, в связи с чем ее обычно называют Z-схемой
фотосинтеза (рис. 193).
Суть описываемых Z-схемой процессов состоит в следующем.
Поглощение кванта света в системе антенноидного хлорофилла
фотосистемы II сопровождается миграцией энергии электронного
возбуждения к реакционному центру. Возникающая в реакционном
центре вакансия характеризуется большим сродством к электрону,
в связи с чем она может взаимодействовать с донорами электронов,
отличающимися большими положительными значениями редокс-
потенциалов. Фотовосстановление реакционного центра
происходит за счет электрона, отрываемого от молекулы воды. Вода
является донором электрона в реакционном центре фотосистемы II.
Электрон в возбужденном состоянии используется для
восстановления ближайшего к нему по значению редокс-потенциала
акцептора.
При возбуждении пигмента реакционного центра фотосистемы I
возникающая вакансия обладает сродством к электрону близкого
к ней по значению редокс-потенциала донора, который и
обеспечивает фотовосстановление реакционного центра. Электрон,
находящийся в возбужденном состоянии, через соответствующие
акцептор но-донор ные связи передается ферредоксину Фд, а затем —
НАДФ. Образованием восстановленной формы НАДФ • Н2
завершается функционирование фотосистемы I.
Э60
Рис 193. Z-схема фотосинтеза
Покачаны переносчики электронов, связанные с мембраной тнлакоида:
пигмент центра фотосинтетической системы Л — Р о80 и феофитин (Ph),
жинонные переносчики (<?д , Qg ), железосерный белок (FeS), цитохро-
мы в, /, пигмент центра фотосистемы I — Р 700, неидентифицированный
переносчик — X, железосерный белок Фд — ферредоксин. Окисляющий
воду марпнецсодсржащий кластер (5-состояния); Пц — пластоцианин;
А — пластохгнон
Первый акцептор электрона, находящегося в возбужденном
состоянии реакционного центра фотосистемы II, связан с
ближайшим донором электрона, используемого при фотовосстановлении
реакционного центра фотосистемы I рядом переносчиков, в
совокупности представляющих фотосинтетическую электронтранспорт-
ную цепь.
Переносчики электронов в электронтранспортной цепи,
расположенные по уменьшению электроотрицательности редокс-потен-
циала, таковы: первый акцептор (феофитин) — цитохром Ь559 —
пластохинои А — цитохром / — пластоцианин — вакансия
реакционного центра фотосистемы I.
Как можно видеть из схемы фотосистем и электронтранспортной
цепи, транспорт отнятого от воды электрона имеет путь,
направленный против термодинамического потенциала: от большого
положительного значения редокс-потенциала молекулы воды до
существенно электроотрицательного значения редокс-потенциала фер-
редоксина и НАДФ • Н2. Именно в этом и заключается основной
смысл фотосинтеза, в ходе которого запасается свободная энергия
поглощенных квантов света.
Путь электрона от воды к НАДФ • Н2 называется
нециклическим: в ходе его необратимо расходуется первичный донор
электронов — вода и необратимо накапливается конечный продукт
фотореакций— восстановленные ферредоксин и НАДФ • Н2. Кроме
нециклического пути может происходить и циклический путь
электрона, когда электрон в состоянии возбуждения в реакционном
центре фотосистемы I передается ферредоксину, а от последнего
через цитохром Ь, пластохинону А и далее через соответствующие
переносчики электронтранспортной цепи к вакансии пигмента
реакционного центра фотосистемы I, совершая при этом
циклический путь. Восстановления НАДФ при этом не происходит.
Выделяют также псевдоциклический путь электрона, когда в
результате передачи электрона на кислород последний восстанавли-
ваегся, образуя молекулу воды, и маскирует тем самым фотолиз
воды в фотосистеме II.
В Z-схеме фотосинтеза можно выделить сильный окислитель —
вакансию в реакционном центре фотосистемы II, сильный
восстановитель— возбужденный электрон в реакционном центре
фотосистемы I, слабый окислитель — первый акцептор возбужденного
электрона в реакционном центре фотосистемы I и слабый
восстановитель — ближайший донор электрона для вакансии реакционного
центра фотосистемы I.
Фотосинтетическое фосфорилирование. С
уменьшением энергии электронов в процессе их переноса в системе
нециклического, циклического или псевдоциклического транспорта
сопряжено формирование макроэргической связи при фосфори-
лировании АДФ. Следовательно, теряемая электроном энергия
запасается в форме макроэргов АТФ.
Фосфорилирование, сопряженное с фотоиндуцированным
транспортом электронов, называют фотосинтетическим фосфорилирова-
Ш
нием. В соответствии с тем, с каким из путей электронного
транспорта сопряжено фосфор ил ирование, различают нециклическое
и циклическое фотосинтетическое фосфорилирование.
Предположив, что энергия окисления определенного продукта
непосредственно используется для активации химической группировки,
ведущей к возникновению химической макроэргической связи, без
промежуточного превращения ее в какую-либо нехимическую
фюрму (например, конформационные изменения макромолекул или
образование концентрационного градиента протонов) можно
рассчитать, на каком участке электронтранспортной цепи может
происходить фосфорилирование. Эти участки называют пунктами
сопряжения фотосинтетического фосфорилирования.
В пунктах сопряжения энергия окисления должна превышать
энергию макроэргической связи. Расчеты сЕсбоднсй энергии
окисления можно выполнить по (12.6): AG =— nFAE0.
Свободная энергия, соответствующая переносу электронов
в электронтранспортной цепи, связывающей фотосистемы II и I,
от первичного донора (+ 0,82 В) до конечного акцептора (—0,32 В),
т. е. для Аф = —1,14 В и я = 2 составляет AG0 = 220 кДж-
Известно, что свободная энергия одной макроэргической связи
АТФ составляет 34,54 кДж/моль. Согласно (12.7) этому значению
соответствует разность редокс-потенциалов донорно-акцепторной
пары, равная 0,18 В. Очевидно, термодинамическая возможность
образования макроэргической связи возникает в случае перепада
редокс-потенциалов в донорно-акцепторной паре, равного или
превышающего указанные выше значения. В ряду переносчиков
электронтранспортной цепи такому условию удовлетворяют следующие
донорно-акцепторные пары:
пластохинон А (0,36 В) и цитохром / (0,11 В), АЕ0= 0,25 В;
цитохром ЬЪЬ9(0,06 В) и Р700 (0,43 В), АЕ0= 0,37 В;
Н20^=Цо2 + Н2 (0,82 В) и Р 680+ (—0,05 В), АБ0 = 0,87 В.
С этими участками электронтранспортной цепи и связывают
пункты сопряжения фосфорилирования.
Экспериментально установлено, что на каждые 2 электрона,
переносимых от Н20 к НАДФ, образуется 2 молекулы АТФ.
Для восстановления С02 до [НСОН] требуются 3 молекулы АТФ
и 2 НАДФ • Н2. По 2 молекулы АТФ и НАДФ • Н2 возникает
на 4 электрона, прошедших нециклическим путем. Поскольку для
переноса каждого электрона требуется возбуждение каждой
фотосистемы, то процесс фотосинтеза должен быть 8-квантовым. 8-кван-
товость фотосинтеза следует также из уравнения: С02 + 4Н + +
+ 4е~->- [НСОН] -f H20, поскольку для переноса каждого из этих
4 электронов требуется поглощение 2 квантов.
8-квантовость следует рассматривать как предельно малый
квантовый расход фотосинтеза. В действительности, при
экспериментальном определении квантовых расходов фотосинтетического
образования кислорода при оптимальных условиях этого процесса
363
у растений получены значения 12—20 квантов на 1 молекулу 02,
образующуюся при фотолизе воды.
Скооперированность функций фотосистем II и I в
осуществлении Z-схемы фотосинтеза требует соблюдения численного
соотношения между этими системами как 1 : 1 и объединения их в общую
структуру, которая обеспечивает достаточно близкое размещение
реакционных центров. Такая ситуация названа спилловером(англ.
spillover — переливание) — переливанием, распределением
энергетического потока между фотосистемами II и I. Оказалось,что
ожидаемый баланс между фотосистемами не соблюдается, и
численное соотношение реакционных центров обеих систем может
варьировать в весьма широких пределах, в чем проявляется
адаптация фотосинтетического аппарата к условиям освещения и другим
факторам.
Ультраструктурная организация фотосистем. Фо:
тосистемы I и II являются компонентами внутренней мембранной
системы хлоропластов — тилакоидов. Пигменты, принимающие участие
в функционировании фотосистем, образуют комплексы соспецифи*
ческими белками. Эти пигмент-белковые комплексы
фотосинтетических мембран выделяют путем солюбилизации, фрагментации
хлоропластов действием детергентов и последующего разделения
с помощью электрофореза в полиакриламидном геле.
Исследованием спектров поглощения, флуоресценции, кругового дихроизма,
поляризованной флуоресценции пигмент-белковых комплексов
получают их подробную характеристику, на основе которой
формируется представление о роли отдельных комплексов в общей
организации фотосинтетического аппарата тилакоидных мембран.
Оказалось, что тилакоидная мембрана содержит три основных
компонента фотосинтетического аппарата: главный антенный све-
тособирающий комплекс — ЬНа/ъ (Light — harvesting chlorophyll
a/b protein) и хлорофилл-белковые комплексы, несущие
реакционные центры либо фотосистемы I (комплекс I—CP-I), либо
фотосистемы II (комплекс II — СР-П). Состав комплексов I и II во
многом зависит от способа выделения, так как, помимо
полипептидов и фосфолипидов, имеющих непосредственное отношение к
реакционному центру, они содержат и части антенны.
Светособирающий комплекс LHa/b* Эти комплексы содержат
около 50 % общего белка, обнаруживаемого в тилакоиДах, и до
60 % общего количества хлорофилла. Спектр поглощения LHa]b
при комнатной температуре имеет максимумы в красной области
672 и 652 нм, а в синей — 438 и 471 нм, отвечающие
соответственно хлорофиллам а и Ь. Плечо в области 475 нм обязано наличию
каротиноидов (рис. 194). Соотношение между хлорофиллами а и Ь
варьирует от 1,1 до 1,4. Комплекс способен к флуоресценции и
испускает свет с длиной волны 681 нм. Из^ комплекса выделяют до
пяти полипептидов с молекулярной массой 24000—28000. На
каждый полипептид приходится 7—13 молекул хлорофилла.
Хлорофилл, связанный с полипептидами, имеет ряд форм, различающихся
максимумами поглощения,—Xл 670, 676, 647, 649, 664.
364
Ьцепиткоибное пространство
собирающего комплекса LHaJb ВнутршшлакоиШ просшрансшбо
Рис. 195. Молекулярная модель фотосистемы II.
Выделены включенные в мембрану белковые компоненты фотосистемы; Z — вторичный
донор электронов. Другие обозначения, как на рис. 193
Изучение оптического дихроизма комплексов выявляет
определенную ориентированность молекул хлорофилла.
В светособирающем комплексе энергия
электронно-возбужденного состояния мигрирует от хлорофилла Ь к хлорофиллу а, далее
к его длинноволновым формам и к реакционным центрам фотосистем.
Пигмент-белковый комплекс фотосистемы I, содержащий
реакционный центр фотосистемы I — P700, имеет элементы антенны.
Поэтому рассматривают два компонента фотосистемы I: собственно
комплекс с Р 700 и антенну фотосистемы I, содержащую хлорофилл
аббЗ и его более длинноволновые формы: хл 670, 681, 686, 691 и 698.
Полагают, что в этих комплексах хлорофилл связан с
полипептидами, имеющими молекулярную массу 70 000. Полипептиды несут
на себе по 7—13 молекул хлорофилла, сгруппированных в
кластеры. Если в этот кластер входит Р700, то он и играет роль
реакционного центра фотосистемы I.
Пигмент-белковый комплекс фотосистемы II. Пигмент-белковые
комплексы фотосистемы II ориентированно расположены в
мембране тилакоидов. Строение их более сложное, чем у комплексов
фотосистемы I. На рис. 195 изображена одна из моделей структуры
фотосистемы II. Для этих комплексов характерно наличие не менее
7 полипептидов, различающихся по молекулярной массе. С
полипептидом 47 000 связан реакционный центр. При извлечении из
"препаратов фотосистемы II отдельных полипептидов отмечается
блокирование тех или иных реакций, свойственных этой системе.
Например, при удалении белка молекулярной массы 33 000
прекращается выделение кислорода. По-видимому, арсенал
полипептидов, принимающих участие в функционировании фотосистемы II,
не исчерпывается изображенными на рисунке. Так, к полипептиду
с молекулярной массой 3^000 примыкают белки с молекулярной
массой 22000, 24 000 и 10000. Пока установлена роль не всех по*
343
липептидов, обнаруживаемых в пигмент-белковом комплексе.
Кроме полипептидов, в функционировании реакционных центров боль*
шую роль играют липидные компоненты, особенно те из них,
которые составляют ближайшее окружение реакционного центра
фотосистемы.
Механизм реакционного центра фотосистемы II. Фотоокислен-
ная форма Хл 680—Р+ 680, возникающая в реакционном центре
фотосистемы II, характеризуется большим положительным
значением окислительно-восстановительного потенциала для пары Р680/
Р+680 (1120 мВ), что делает возможным окисление воды. Процесс
начинается с возбуждения входящего в реакционный центр Р680
в синглетное состояние Sf. Полагают, что эта форма хлорофилла а
в реакционном центре представлена двумя комплементарно
расположенными по отношению друг к другу молекулами Р680.
Возбужденный электрон мигрирует на феофитин Ph, который является
его первичным акцептором. При этом возникают окисленная
форма Р+ 680 и восстановленный феофитин.
Окислительно-восстановительный потенциал для пары Фео/Фео+ составляет —610 мВ.
Электрон с восстановленного феофитина очень быстро передается
на акцептор хинонной природы QA, от которого уже намного
медленней движется к Qb и к пулу пластохинонов. Qa, как и QB,
относится к пластохинонам, но, в отличие от второго, связан
с железом и белком. Qb — форма, обмениваемая с пулом
пластохинонов, однако после присоединения одного электрона Qb прочно
связана с реакционным центром и лишь после второго
восстановления, завершающегося образованием восстановленного пластохинона
PQH2, происходит диссоциация этого вещества с реакционным
центром. Благодаря этому PQH2 выступает в роли подвижного
носителя электронов к комплексу bjf и фотосистеме I. Для
образования восстановленного пластохинона используется два протона,
которые должны переноситься через тилакоидную мембрану.
Р + 680 восстанавливается, отбирая электрон от вторичного
донора Z. Окисление Z обнаруживается с помощью метода ЭПР.
С этим донором связан так называемый «быстрый сигнал II»
ЭПР. Полагают, что Z + является семихинонным катионом ОНг ,
В восстановлении Z принимает участие наименее исследованная
окисляющая воду кислородвыделяющая система — L. Б. Кок
предложил четырехэтапную схему функционирования этой
системы. Каждому этапу соответствует определенное ее состояние 51-4:
Sft Н+ Sx S2 Н+ S3 S4
Н20 {НО НО \ НО .2Н+
г / ^ / - г I
Н20 е~ Н20 е" Н20 ег НО
2Н20 02
(13.13)
366
Окисление воды достигается в результате четырехкратного
отнимания электрона от молекул воды и выделения четырех
протонов во внутреннюю среду тилакоида. Переходы S0~+Slt S!->S2>
S2->S39 S3 ->• S4 -> SQ являются фотохимическими по своей природе.
Данная схема находит подтверждение в том, что на выделение 02
требуется четыре импульса света.
Исследования дифференциальных спектров в режимах
импульсного освещения части фотосистемы II, содержащих кислородвыде-
ляющую систему L, обнаруживают совпадение с
дифференциальными спектрами синтетических соединений с МпП1/Мпп и Mnrv/Mnm.
В препаратах фотосистемы II в ее донорной части,действительно,
имеется Mn-содержащий центр, в котором имеются 4 атома Мп.
То, что на схеме (13.13) обозначено как L, представляет собой
молекулярную структуру (кластер) с тесно сближенными между собой
четырьмя атомами Мп, способную, отдавая последовательно 4
электрона, достигать высокой степени окисленности, благодаря которой
происходит постепенное окисление воды, завершающееся
выделением молекулярного кислорода. Предложена такая схема этого
процесса:
S S S S
Мп2+Мп3+ -> Мп3+Мп3+ — Мп3+Мп4+ — Мп4+Мп4+ -*
* * + I
ё~ ё~ 54 ё~ е"
->А+Мп4+Мп4+«АМпб+Мп4+. (13.14)
Гипотезы энергетического сопряжения. Мембраны ти-
лакоидов, содержащие компоненты фотосистем I и II, называют энер-
гопреобразующими, так как они способны конвертировать энергию
поглощаемых квантов света в энергию макроэргических связей
АТФ и высоковосстановленных соединений. С транспортом
электронов в мембране сопряжено образование АТФ, в связи с чем
мембрану тилакоидов называют также сопрягающей мембраной.
В этом отношении мембраны тилакоидов сходны с уже
рассмотренными в гл. 12 сопрягающими внутренними мембранами
митохондрий, где также с переносом электронов сопряжено формирование
макроэргической связи АТФ.
Как указывалось, особым вниманием в последнее время
пользуется хемиосмотическая гипотеза, сформулированная П. Митче-
лом (см. параграф 12.4). В соответствии с ней в энергопреобразу-
ющих биомембранах потоку электронов сопутствует формирование
разности электрохимического потенциала протонов между
разделяемыми мембраной пространствами — внутритилакоидным и
стромальным. Эта разность электрохимического потенциала Д[хн
зависит от разности электрических потенциалов Дер и разности кон-4
центраций водородных ионов АрН.
Прямыми измерениями показано, что в стационарном состоянии
Дф для тилакоидов не превышает 50 мВ. При таком значении Дф
разность ДрН, необходимая для синтеза АТФ, составляет 3,2.
В митохондриях Дф значительно выше —до 200 мВ и, следова-
367
теЛьно, ДрН, обеспечивающая синтез макроэргической связи,
здесь меньше.
Имеются многочисленные экспериментальные доказательства
правомерности хемиосмотического механизма сопряжения.
Например, вследствие того, что тилакоидная мембрана слабо
проницаема для пассивной диффузии протонов, при помещении изолиро-
эанных хлоропластов в раствор со значением рН=4 в темноте можно
искусственно создать достаточный градиент рН, что
сопровождается синтезом АТФ без действия света.
Естественно, в случае действия хемиосмотического механизма
сопряжения теряет свой первоначальный смысл понятие пунктов
сопряжения, так как сопряжение обеспечивается целостностью
мембранного процесса — переносом электронов вдоль мембраны,
а протонов — поп ер ек ее.
Фотосинтетический цикл углерода. С участием
возникающих в фотохимических реакциях АТФ и высоковосстановленных
соединений происходят темновые реакции фотосинтеза, состоящие
в восстановлении С02 до уровня Сахаров. Этот процесс состоит из
последовательности реакций акцептирования С02, последующего
восстановления карбоксильной группы и превращений ряда трех-,
четырех-, пяти- и семиуглеродных углеводов, завершающихся
восстановлением акцептора углекислоты — рибулезобисфосфата и
синтезом шести углеродного углевода и, далее, сахарозы как
основного продукта фотосинтеза. Полный цикл ферментативных
реакций, начинающихся с акцептирования С02 и заканчивающихся
образованием шестиуглеродного углевода, называется циклом
Кальвина. Цикл Кальвина поставляет все исходные продукты для
биосинтеза веществ в растении.
Имеется ряд дополнительных биохимических реакций, которые
позволяют осуществляться фотосинтетическому углеводному
метаболизму в экологически сложных условиях существования
растений. Например, первичное акцептирование С02 может происходить
путем присоединения карбоксильной группы к фосфоенолпирувату,
в результате чего первичным продуктом усвоения углекислоты
являются четырехуглеродные органические кислоты — щавелево-
уксусная или яблочная. Эти вещества являются поставщиками
карбоксильных групп для цикла Кальвина.
АТФ и НАДФ • Н2 фотосинтетического происхождения могут
извлекаться из фотосинтетического аппарата для использования
В клеточном метаболизме. Такое извлечение производится путем
выноса макроэргических и восстановительных эквивалентов из
хлоропластов в цитоплазму. При этом происходит не
непосредственный транспорт этих веществ через оболочку хлоропластов, а вынос
легко проникающих через нее триозофосфатов, которые в
сопряженных реакциях окисления-восстановления обеспечивают
возникновение АТФ и НАДН2. Экспорт восстановительных эквивалентов
возможен также посредством циклического переноса из
хлоропласта в цитоплазму малата и щавелевоуксусной кислоты.
Фотозащитная роль каротиноидов. Обычно кароти-
368
ноиды, содержащиеся в фотосинтетическом аппарате, передают
хлорофиллу до 50 % поглощаемой ими энергии света. Помимо участил
в сборе квантов света, каротиноиды защищают хлорофилл от
фотоокисления очень активной формой кислорода — синглетным
кислородом — Юа.
Например, р-каротин осуществляет такую реакцию в
фотодинамическом эффекте:
1Хл*а-^8Хл*а;
3Хл* а + 302 -> Хл а + Ю2; (13.15)
Ю2 + р-каротин-> 3Р-каротин + 302.
Верхние индексы 1 и 3 означают соответственно синглетное
и триплетное состояния молекул.
Скорость реакции синглетного кислорода с хлорофиллом а
в 104 раз меньше, чем скорость взаимодействия Ю2 с р-каротином.
Это и обусловливает полноту защиты хлорофилла. 3р-каротин
рассеивает приобретенную энергию путем внутренней конверсии.
Защита хлорофилла от фотодинамического разрушения настолько
важна, что в условиях действия света могут выживать только
обладающие каротином зеленые растения.
Коэффициент полезного действия фотосинтеза.
Энергетическая эффективность фотосинтеза велика. Это объясняется
высоким квантовым выходом первичных продуктов световой фазы
фотосинтеза и малым рассеянием попадающей в хлоропласт энергии.
Исходя из того что для осуществления реакции
фотосинтетического усвоения С02 требуются 4 электрона, на перенос каждого
из которых расходуется по два кванта света, и, следовательно,
процесс является 8-квантовым, можно х рассчитать максимально
возможный энергетический коэффициент полезного действия
фотосинтеза.
Так, при усвоении 1 М С02 запасается в продуктах фотосинтеза
471 кДж энергии. Среднее значение 1 Эйнштейнафотосинтетически
активной реакции (ФАР) составляет 209,34 кДж, цена же 8
эйнштейнов — 1674,7 кДж. Отсюда коэффициент полезного действия
фотосинтеза зеленых растений составляет 471/1674,7 = 28%. В
природных условиях, когда эффективность фотосинтеза
ограничивается действием ряда экологических факторов, коэффициент полезного
действия фотосинтеза значительно ниже.
Бактериальный фотосинтез. У прокариотических фото-
трофов — фотосинтетических бактерий — фотосинтетический процесс
носит упрощенный характер, так как он, не обладая системой
фотоокисления воды, лишен фотосистемы II. Цианобактерии (синезе-
леные водоросли) способны к фоторазложению воды. В этом
отношении они близки к эукариотическим фототрофам.
Нециклический транспорт электрона у прокариотических фо-
тотрофов осуществляется за счет использования доноров
электрона, отдающих электрон более легко в сравнении с водой. Это
соединения, которые имеют редокс-потенциалы в электроотрицательной
области, иначе говоря, первичные доноры являются восстановлен-
369
ными соединениями. Так, фотосинтетические бактерии в качестве
окисляемых ими субстратов используют H2S, Н2 и т. п.
К прокариотическим фототрофам относят пурпурные и зеленые
бактерии. Пурпурные бактерии — морфологически различные
одноклеточные организмы—объединены в порядок Rhodospirillales,
разделенный на два семейства: Rhodospirillaceae— несерные
пурпурные бактерии и Chromatiaceae— серобактерии. Несерные
пурпурные бактерии ведут фотоорганогетеротрофный образ жизни:
они не могут использовать в качестве источника углерода С02,
а питаются простыми органическими соединениями, потребляя
в качестве доноров электрона восстановленные соединения серы,
водород, тиосульфат. Серобактерии относятся к фотолитоавто-
трофам, которые могут использовать С02 как источник углерода,
а сульфид либо иные формы восстановленной
серы—молекулярную серу, тиосульфат и Н2— в качестве доноров электрона.
В процессе роста клеток пурпурных бактерий в цитоплазматиче-
ской мембране образуются многочисленные инвагинации, в
результате чего возникают везикулы диаметром околобО нм.Эти
везикулы и представляют собой хроматофоры пурпурных бактерии.
Мембрана этого хроматофора—это упорядоченный двойной слой
липидов, в который погружены белковые молекулы, неков^.ченг-
ными, гидрофобными связями объединенные с пигментом бактерио-
хлорофиллом. Светособирающий пигмент—белковый аппарат
пурпурных бактерий— состоит из двух типов антенноидных
комплексов, различающихся по максимумам поглощения бактериохлоро-
филла ВСЫ: ВСЫ 800—850—белок, ВСЫ 890— белок. Комплекс
ВСЫ 900—белок встречается почти у всех пурпурных бактерий.
Кроме длинноволновой формы ВСЫ, он содержит также ВСЫ 875
и ВСЫ 880. Структурно и функционально этот комплекс связан
с реакционными центрами (рис. 196). В результате определенной
упорядоченности пигмент-белковых комплексов возникает
структура, отличающаяся тем, что к реакционным центрам прилегают
более длинноволновые формы бактериохлорофилла, благодаря чему
поддерживается направленность, векторность миграции электронно-
возбужденного состояния к реакционному центру. Комплекс
ВСЫ 880—белок в светособирающем аппарате называют свето-
фокусирующим.
Зеленые бактерии составляют порядок Chlorobiales,
насчитывающий в настоящее время 8 родов бактерий, распределенных по
двум семействам: зеленых одноклеточных серобактерий СЫого-
biaceae и нитчатых форм, способных использовать в качестве
доноров электронов при фототрофном образе жизни органические
вещества,— Chloroflexaceae.
Зеленые серобактерии — облигатные фотолитоавтотрофы,
анаэробы. Для фотоассимиляции С02 они используют в качестве
доноров электронов H2S, молекулярную серу, тиосульфат и водород.
Светособирающие комплексы сосредоточены в специальных
мембранных образованиях, образующих везикулярные структуры— j
хлоросомы, содержащие бактериохлорофиллы ct d или е, а также
370
Рис. 196. Организация светособирающего комплекса в
мембране Rhodospirillum rubrum.
Комплекс BChl 8 00-850 — белок — светособирающий
комплекс, ВСЫ 890 — белок — светофокусирующиЯ комплекс;
РЦ— реакционный центр
бактериохлорофилл. Более длинноволновые формы последнего
(ВСЫ 805 и 865) содержатся в фотосинтетической мембране,
примыкающей к хлоросоме. Эти формы окружают реакционный центр.
Как и у пурпурных бактерий, энергия электронно-возбужденного
состояния мигрирует от более коротковолнового бактериохлоро-
филла ВСЫ 742 через ВСЫ 792, ВСЫ 805 к длинноволновым формам
этого пигмента и реакционному центру. Таким образом, в доменах
светособирающих комплексов осуществляется фокусирование
транспорта энергии электронно-возбужденного состояния.
В отличие от пурпурных, в фотосинтезе зеленых бактерий
восстановитель образуется в световой реакции транспорта электрона
от первичного акцептора реакционного центра к НАД+, в связи
с чем необходимо поставлять в цепь электронного транспорта
электроны от экзогенного донора. Следовательно, в этом случае
могут иметь место и циклический, и нециклический транспорт
электрона.
13.7. Галобактерии и свойственные им фотопроцессы. В начале
70-х годов было обнаружено явление прямого превращения энергии
света, поглощаемого пигментом бактериальной клетки, в энергию
макроэргической связи АТФ. Этот процесс способны осуществлять
галофильные бактерии Halobacterium halobium, живущие в
природных соленых водоемах. Эти бактерии можно выращивать в
растворах NaCl с концентрацией от 2 до 5,2 М. Единственным
пигментом, ответственным за бесхлорофильный фотосинтез у
галобактерии, является бактериородопсин. Это хромопротеид с
молекулярной массой около 27 000, состоящий из полипептидной цепи
(248 аминокислотных остатков) и связанного с ней хромофора —
С20-каротиноида, ретиналя (рис. 197).
Белковая часть бактериородопсина вмонтирована в цитоплазма-
тическую мембрану, образуя семь пронизывающих мембрану
371
Транс-изомер а
т.
^ ( Ретиналь
б *-\
Рис. 197. Хромофор родопсина- 1-цш>ретиналь (а) и предполагаемая
организация бактериородопсина в пурпурной мембране (б).
Семь спиралей белка пронизывают мембрану, по обе стороны которой размещаются
петли белковой молекулы
тяжей. Ретиналь, будучи связанным с лизином полипептида
посредством шиффова основания— N=CH—, в темноте находится в прото-
ндрованной форме—N=CHh размещен параллельно мембране.При
поглощении кванта света изменяется конформация ретиналя (цис-
изомер переходит в транс-юомер) и от шиффова основания
отщепляется протон, который переходит во внеклеточное пространство.
Депротонированное шиффово основание вновь присоединяет
протон, но уже из внутриклеточного пространства. В результате
функционирования такого механизма, получившего наименование бак-
териородопсиновой протонной помпы, возникает градиент
протонов Дин+, и при участии протонной АТФ-синтетазы образуется
АТФ.
13.8. Фоторегуляторные системы. У многих видов ^ растений
выявлена фоторегуляторная система, действие которой
распространяется на очень многие физиологические процессы. В качестве
примеров, раскрывающих многообразие контролируемых этой
фитохромной системой физиологических реакций, укажем на
следующие: индукция прорастания семян, синтез ряда ферментов,
рост растений растяжением, заложение листовых зачатков,
дифференциация устьиц, трансмембранный транспорт ионов, никтина-
стические движения листьев, образование пластид, синтез анто-
цианов, образование хлорофилла, синтез рибосомальной РНК,
индукция цветения и многие другие.
Проявление фитохромной регуляторной системы заключаете^
в том, что светозависимые процессы растения индуцируются све-
ж
372
том с длиной волны 660 нм (красный свет), но прекращаются при
действии света с длиной волны 73Q нм (дальний красный свет).
Фитохромная система действует как низкоэнергетическая система,
что означает необходимость поглощения совсем малых количеств
энергии для проявления реакции.
Фитохромная система является обратимой в том смысле, что
воспринятый ею сигнал красного света может быть полностью
аннулирован воздействием дальнего красного света, если промежуток
времени между импульсами красного и дальнего красного света
не превышает определенной величины, называемой временем
убегания. При межсветовых интервалах времени, меньших времени
убегания, чередовать красный и дальний красный свет можно
много раз, причем качество последнего импульса света полностью
определяет состояние фитохромной системы и проявление
соответствующей физиологической реакции.
Время убегания зависит от того, насколько быстро после
действия красного света, активизирующего фитохромную систему,
наступает фотофизиологическая реакция. Для большей части
физиологических реакций, регулируемых фитохромной системой,
происходит более или менее значительное время между восприятием
сигнала красного света и проявлением реакции. Однако известны
и быстро наступающие ответы на красный свет. Например,
наступление цветения как реакция на действие красного света
наступает спустя неделю после активации фитохромной системы.
Прорастание светочувствительных семян наблюдается спустя несколько
часов или дней после активации фитохромной системы. Движение
хлоропластов изменяется через несколько минут после освещения
клеток красными лучами. Изменение трансмембранных потенциалов
у клеток корней изменяется в течение немногих секунд после
активации фитохромной системы. Такое существенное варьирование
лаг-фазы регулируемых фитохромной системой реакций
свидетельствует о том, что реализация светового сигнала, по-видимому,
осуществляется разными путями — как затрагивающими активацию
определенных генов, так и более быстро осуществляющимися из*
менениями свойств клеточных мембран.
Фитохром выделен из многих растительных объектов. Он
представляет собой хромопротеин сине-зеленого света, существующий
в виде двух взаимообратимых форм: поглощающей красный свет
660 нм— Фкс и дальний красный свет 730 нм— Фдкс. На рис. 198
показаны спектры поглощения обеих форм фитохрома.
Превращения форм фитохрома обнаруживают, исследуя разностные спектры
(рис. 199) этиолированных органов растений.
Молекулярная масса мономера фитохрома—124 000.
Хромофорная группа его—линейный тетрапиррол, который связан
с полипептидной цепью через кислород и серу.
Фитохром (рис. 200) очень похож по структуре на пигмент
антенны цианобактерий — С-фикоцианин, у которого в билитриено-
вом хромофоре в IV пиррольном остатке при С—18 вместо
виниловой группы в качестве заместителя выступает этил—СН2—СН3.
373
0,5 Ю5
Х,нм
Рис. 193. Спектры поглощения
красной (/) и дальней красной формы
фитохрома (2).
е — молярный коэффициент экстинкцик
(л • М-1 • см-1)
Рис. 199. Дифференциальный спектр
раствора фитохрома, выделенного из
листьев проростков ячменя,
выращенных в темноте:
/ — дальний красный свет; 2 — красный
свет; 3 —темнота; ДО —
дифференциальная оптическая плотность
Син-анти-
конформеры
СН=СН2
Z-E -изомеры
Рис. 200. Молекула фитохрома
374
10 мкс
Рис. 201. Схема превращений фитохрома:
/—-промежуточные формы (с указанием длины волны поглощаемого ими света).
Волнистые линии — переходы, происходящие при поглощении света, прямые линии— тем-
новые переходы. У стрелок указаны периоды полупревращения веществ
Билитриеновые хромофоры могут иметь порфириноподобную
спирально свернутую или развернутую структуру, возникающую
в результате вращения вокруг одиночной метиновой связи у С—15
либо вокруг двойной метиновой связи. В первом случае
возникают син-антиконформеры, во втором—Z—£-изомеры. При
возникновении того или иного конформера или изомера изменяется
и конформация протеиновой части молекулы—апопротеина.
Полагают, что конформационные изменения апопротеина следуют за
конформационными изменениями билитриена с некоторым
запаздыванием.
При поглощении света фитохромом происходит его Z—£-изоме-
ризация, в чем и выражается фотообратимость изменений форм
этого пигмента. При действии на фитохром красного света
происходит реакция
Я.= 660 нм
Фкс "Фдкс,
а под влиянием дальних красных лучей происходит реакция
А,=730 нм
Фдкс * Фкс-
Спектры действия фотохимической конверсии Фкс и Фдкс
отражают характер этих реакций. Превращение Фдкс в ФКс может
происходить также в темноте.
Фототрансформация форм фитохрома осуществляется через
промежуточные интермедиа™— I, среди которых
непосредственным предшественником Фдкс является обесцвеченная форма 10бс.
Скорости превращения промежуточных форм неодинаковы,
различаясь на 1—2 порядка, что видно из схемы этого процесса (рис. 201).
375
Механизмы фитохромной системы. Фотохимические и
физиологические этапы формирования конечных результатов фоторегуля-
торного действия фитохромной системы во многом еще не раскрыты.
Можно допускать, что имеется несколько каналов связи между
быстрыми реакциями фотоконверсии фитохрома и механизмами
исполняющих систем, завершающими фоторегуляцию. При этом
начало фоторегуляции связано с реакциями функционального
фитохрома— комплекса этого пигмента с периферическими
мембранными белками. Общая схема, поясняющая функционирование
фитохромной системы, такова:
/jv мс реакции функционального Ф
—*Фкс—*Фдкс * синтез вторичных
секунды
мессенджеров: реакции 1 . Реакция 1
часы
реакции 2 *. Реакция 2
i . . (13.16)
ДНИ
реакции п *. Реакция п
Реакции функционального фитохрома распространяются на
мембранные явления, с которыми, по-видимому» сопряжено
формирование определенных передатчиков сигналов, вторичных мессен-
♦джеров, природа которых в последнее время интенсивно изучается.
Выделяют два класса вторичных мессенджеров: связанных
непосредственно с отдельными системами мембран или метаболизма
и действующих непосредственно на генетические управляющие
системы клетки. События, индуцируемые мессенджерами второго
типа, требуют ббльших промежутков времени, чем фоторегуляция,
осуществляющаяся без непосредственного участия генома.
Влияние фитохромной регуляции посредством активации
генома нашло отражение в гипотезе Г. Мора, который предположил,
что Фдкс через определенный медиатор, названный им
сигнальной цепью, активирует «потенциально активные гены», переводя vx
в состояние, обусловливающее экспрессию. Не исключено, чтбо
фитохромная система способна и репрессировать группы генов, что
сопровождается исчезновением соответствующих генных продуктов.
К реакциям такого типа относится контролируемый
фитохромной системой фотоморфогенез. Светоиндуцируемыми генами
оказались гены малой, субъединицы рибулозобисфосфаткарбоксилазы,
НАДФ • Н-зависимой протохлорофиллидредуктазы.
Быстрые реакции, контролируемые фитохромной системой и
связанные с изменением трансмембранного потенциала и ионных
потоков, можно объяснять светоиндуцированными изменениями
конформации в области ионных каналов (рис. 202).
Фитохром взаимодействует с рецепторным участком у белка,
входящего в состав ионного канала. При Z—£-изомеризации
фитохрома канал открывается, что сказывается на диффузии ионов.
Полагают, что рассмотренный или сходный мембранный
процесс, осуществляемый функциональным фитохромом, составляет
Э76
Рис. 202. Схема действия фитохрома, Рис. 203. Примерный спектр ультра-
включенного в состав кальциевого фиолетовых лучей у поверхности
ионного канала. При изменении кон- Земли
формации молекулы пигмента,
сопровождающего переход Ф кс в Фд^с
канал открывается, и ионы кальция общее звено большей части фото-
проходят через мембрану регуляторНЫХ эффектов фито-
хромной системы. В частности,
фотоактивированный фитохром, несомненно, оказывает большое
влияние на интенсивность трансмембранного переноса ионов Са2+.
Криптохромы. У ряда высших растений, грибов, водорослей
и микроорганизмов фоторегуляция обусловлена восприятием
синего света. Природа фоторецепторов систем, чувствительных к синему
свету, исследована еще слабо. Вследствие того, что эти системы
обнаружены у криптогамных растений и сами пигменты имеют
скрытую природу, фоторецепторы синего света назвали крипто-
хромали. По спектрам действия физиологические реакции на
синий свет напоминают спектр поглощения флавинов и каротино-
идов, характеризуясь наличием максимумов поглощения в
области 370 и 450 нм. Однако ростовую реакцию растений на действие
синего света обнаруживают не только у нормальных организмов,
но и у мутантов, лишенных каротиноидов. Поэтому полагают» что
в данном случае в роли криптохромов выступают флавины: флавин-
мононуклеотид и флавинадениндинуклеотид.
На примере нейроспоры показано, что реакция на синий свет
обусловлена функционированием локализованного в плазмалемме
комплекса флавин— цитохром b и другой фоторецепторной
системой, возможно, флавином, каротиноидами, а может быть и
фоторецепторами иной природы. У зеленых водорослей фоторегул я
торное действие имеет острый максимум в спектре действия,
который существенно отличается от спектров поглощения флавинов
и каротиноидов.
У цианобактерий, красных водорослей светорегуляция
развития контролируется, по-видимому, фотообратимыми
превращениями фотохромных пигментов, названных фикоморфохромами и
адаптох ромами.
Фотообратимость спектров поглощения, имеющая, возможно,
отношение к фоторегуляторным явлениям, обнаружена у билипро-
377
теинов-фикохромов^а, Ь, с, d, хромофорной группой roicpux
является, как уже ранее отмечалось, линейный тетрапиррол,
аналогичный билитриену фитохрома.
13.9 Действие ультрафиолетовых лучей на биологические
системы. Ультрафиолетовые лучи представляют собой очень
важный природный фактор, действие которого обусловливает в живых
клетках фотохимические реакции. В широкой полосе
ультрафиолетовых лучей выделяют три области: УФ-А— излучение в области
400—325 нм, УФ-В— излучение в области 325—280 нм и УФ-С —
в области 280—200 нм. Более коротковолновые лучи лежат в
области глубокого вакуума. Энергия квантов ультрафиолетовых лучей
УФ-С настолько значительна (3,1—6,8 эВ), что способна вызывать
диссоциацию и ионизацию молекул большинства веществ »
При прохождении солнечного света через атмосферу поток
ультрафиолетовых лучей сущесгвенно ослабляется. В этом
ослаблении особо существенную роль играет озоновый слой атмосферы,
находящийся на высоте 20—25 км. В атмосфере наиболее сильно
поглощаются более коротковолновые лучи УФ-Q в связи с чем
у поверхности земли регистрируется только так называемый
экологический ультрафиолет, к которому относится УФ-А и более
длинноволновая часть УФ-В, и спектр ультрафиолетового
излучения имеет вид, показанный на рис. 203.
Основная часть ультрафиолетового света поступает в виде
рассеянного излучения от неба, а не в прямых лучах солнца. С
повышением над уровнем моря интенсивность ультрафиолетовых лучей
возрастает. Разумеется, в ясные дни поток ультрафиолетового
излучения возрастает в сравнении с пасмурными днями.
Действие ультрафиолетовых лучей на живой организм изучают,
прибегая обычно к искусственным источникам этого излучения:
ртутным, водородным, ксеноновым и другим газоразрядным
лампам. Сконструированы и лазерные источники ультрафиолетовых
лучей.
Значения коэффициентов поглощения большей части
прозрачных для видимого света веществ достаточно велики для
ультрафиолетовых лучей и обеспечивают сильное поглощение этого
излучения в покровных тканях животных и человека, в клетках
эпидермиса растений. Поэтому биологическое действие
ультрафиолетового излучения в природных условиях ограничивается только теми
клетками, которые не экранированы от попадания в них квантов
ультрафиолетовых лучей. Организмы, живущие в толще воды,
полностью экранированы от действия ультрафиолетовых лучей.
Бактериальные клетки в аэрозольной части воздуха подвергаются
сильному действию ультрафиолетового излучения.
4 В связи с тем что вследствие сильного поглощения
ультрафиолетовых лучей в веществе поглощенные дозы быстро убывают с
толщиной слоя клеток, чаще пользуются не поглощенными, а
экспозиционными дозами, измеряемыми энергией, падающей на
поверхность облучаемого объекта излучения, в Дж-м~2. Мощность
экспозиционной дозы №Уф выражают в Дж • м"*2 • с"1. Тогда суммар-
378
Рис. 204. Спектры действия ультра-
фжмктовых лучей'
/ — развитие эритемы кожи у человека.
2 — повреждение растительной клетки,
3 — инактивация ДНК
8*4
I
1
Г j*—%w
\\
■ Л
1 i 1 i 1 1 1
280 290 300 310 320 330 Х,т
ная доза запишется так: £>уф =
= ИРуф/, где /—-время
облучения. Соблюдается правило
взаимозаменяемости мощности и
времени действия (правило Бун-
зена— Роско, в соответствии с
которым эффект облучения
зависит только от дозы и,
следовательно, может достигаться при
разных мощностях облучения W± и W2) при выполнении
условия: WitL= W2t2. Фотоинактивация ферментов in vitro следует
правилу взаимозаменяемости при варьировании мощности дозы
ультрафиолетовых лучей в 105 раз.
Биологическая эффективность ультрафиолетовых лучей
возрастает с уменьшением длины волны, что видно по спектрам действия
разных форм повреждения биологических систем действием
ультрафиолетового излучения (рис. 204). Как видно, максимальные
значения эффективности излучения характерны для УФ-В.
В основе биологического действия ультрафиолетовых лучей
лежат повреждения биологически важных макромолекул, прежде-
всего белков и нуклеиновых кислот. В связи с этим часто
выявляется прямая связь между спектром действия повреждения
биологической системы и спектром поглощения тех веществ, повреждение
которых влечет за собой наблюдаемую реакцию на облучение.
В области длин волн 200—400 нм сильным поглощением
характеризуются соединения с сопряженными двойными связями, с
кольцевыми структурами. Высокие значения коэффициентов
поглощения имеют биологические макромолекулы— нуклеиновые
кислоты и белки. У нуклеиновых кислот хромофорами, отвечающими за
поглощение в области 260 нм, являются их гетероциклические
мономеры—пуриновые и пиримидиновые основания, у белков —
ароматические аминокислоты, поглощающие в области 280 нм.
У микроорганизмов, клеток человека, животных и растений
в культуре ультрафиолетовые лучи вызывают гибель и
образование мутаций. Спектр действия этих двух эффектов совпадает со
спектрами поглощения ДНК и РНК (рис. 205).
У многоклеточных растений под влиянием ультрафиолетовых
лучей обнаруживаются весьма разнообразные ответные реакции!
нарушения ультра структуры и функции фотосинтетического
аппарата, понижение общего содержания липидов в мембранах,
развитие хлороза, торможение роста и т. п. У простейших нарушаются
двигательные реакции. Животные обычно шерстным покровом
хорошо защищены от попадания в живые клетки ультрафиолето-
379
220 250 240 250 260 270 260 \,нм
а
I
I
Выход
2
-
20
Ss—-г
•
230
/
*Г
i i
240 250
5
~х
1 t
260 270
Н
\
,N
280 Х,НМ
I
л
Рис. 205. Спектры действия и поглощения ультрафиолетовых лучей:
а — инактивация вируса табачной мозаики (BTM); прерывистая линия — спектр
Поглощения информационной РНК вируса; б— выход мутаций при облучении пыльцы кукурузы}
прерывистая линия — спектр поглощения выделенной из пыльцы ДНК
вых лучей, однако при больших дозах излучения повреждается
роговица глаз (фотоофтальмия).
У человека малые дозы ультрафиолетовых лучей способствуют
накоплению витаминов группы D, образующихся из эргостерина
и дигидрохолестерина при облучении ультрафиолетовыми лучами.
При поглощении ультрафиолетовых лучей развивается эритема —
покраснение кожи, что обычно приводит к появлению загара—,
накоплению в поверхностных слоях клеток кожи меланинов, что
является защитной реакцией организма. Наблюдаются и тяжелые
поражения клеток, сопровождающиеся развитием рака кожи.
Фотоканцерогенез проявляется как процесс кумулятивный,
требующий хронического длительного облучения.
В последние десятилетия защитный озоновый слой атмосферы
ослабляется в результате взаимодействия озона с попадающими
ь атмосферу загрязнениями антропогенного происхождения —
испарениями фреонов, продуктами сгорания ракетного топлива
и т. п. Вследствие этого возрастает угроза отрицательных послед-
380
Рис. 206. Структура пиримидиновых димеров, образующихся в ДНК при
облучении УФ-лучами.
а — про тонирование тимина, приводящее к образованию свободнорадикальногосостояния;
<5 — димер T — О — T, б — димер Ц — N — T, г — циклобутановый днмер Т — T
ствий увеличения потока ультрафиолетовых лучей, достигающих
биосферы. Подсчитано, что ослабление способности озонового слоя
поглощать ультрафиолетовые излучения на 1 % приводит к
увеличению частоты заболевания раком кожи на 2 %.
Фотохимические реакции, вызываемые
ультрафиолетовыми лучами. Поглощение ультрафиолетовых лучей
нуклеиновыми кислотами обязано я—я-переходам в я-электронной
системе пуриновых и пиримидиновых колец. Время жизни син-
глетного электронного возбуждения очень мало. Триплетное
состояние более долгоживущее, что позволяет осущесавляться меж-
нуклеотидной миграции энергии, обнаруживаемой методом ЭПР.
Основным типом фотохимической реакции нуклеиновых кислот
является образование пиримидиновых димеров циклобутановой
структуры, возникающей путем фотохимической сшивки
прилегающих друг к другу пиримидиновых оснований, например, тиминов,
тиминового и цитидилового остатков и т. д. (рис. 206).
Меньшие квантовые выходы свойственны другим
фотохимическим реакциям, индуцируемым ультрафиолетовым излучением.
Тем не менее и эти повреждения играют важную роль в
инактивации клеток, мутагенезе и канцерогенезе.Так,в результате
разрывов полинуклеотидной цепи возникают однонитевые и реже двуни-
тевые разрывы ДНК. Образование разрывов приводит к
уменьшению молекулярной массы ДНК. Квантовый выход разрывов
примерно на три порядка ниже, чем для образования пиримидиновых
димеров. Еще меньшие значения квантовых выходов характерны
для образования внутри- и межмолекулярных сшивок в ДНК,
а также сшивок ДНК—белок.
Повреждения ДНК отличаются тем, что они сопровождаются
нарушениями генетического кода, затрудняют осуществление
38!
таких важнейших для жизнедеятельности клеток процессов, как
репликация и транскрипция. Пиримидиновые димеры отличаются
высокой стабильностью, и в клетках, где они возникают, ДНК
не может подвергаться репликации. Поскольку большая часть
клеточных эффектов при действии ультрафиолетового излучения
наблюдается при тех дозах радиации, при которых выходы
разрывов и сшивок пренебрежимо малы, основное значение имеют
фотопродукты в виде пиримидиновых димеров, в первую очередь
димеры тимина.
Повреждение ультрафиолетовыми лучами белковых молекул
обязано фотохимическим превращениям прежде всего остатка
триптофана, а также других ароматических
аминокислот—тирозина и фенилаланина.
В результате фотофизических процессов, сопровождающих
поглощение квантов указанными аминокислотами, образуются
свободные катион-радикалы, которые, подвергаясь диссоциации,
превращаются в нейтральные радикалы. Возникающие при этом
сольватированные электроны отличаются высокой реакционной
способностью и участвуют в ряде химических реакций, например,
с их участием происходит разрыв дисульфидных связей в белке:
/^—S-S—Ra + Г-+Ri — (S — S) -— R2 -+ Rx -S~ + S — Rt.
(13.17)
Катион-радикал триптофана может подвергаться окислению,
что приводит к образованию кинуренина либо иных стабильных
продуктов фотолиза этой аминокислоты.
Фотоинактивация ферментов обычно обусловлена
фотохимическими превращениями триптофана и цистина. Поскольку в этом
процессе основное значение имеет фотолиз аминокислотных
остатков в области активного центра фермента, квантовые выходы
инактивации ферментов имеют сравнительно невысокие значения
порядка десятитысячных долей единицы. Некоторые белки не содержат
остатков триптофана, и их инактивация обусловливается
фоторазложением тирозиновых и цистановых остатков.
Липиды поглощают ультрафиолетовые лучи в коротковолновой
области ультрафиолета. Для ненасыщенных жирных кислот
максимум поглощения находится в области около 200 нм. Основным
фотохимическим эффектом действия ультрафиолетовых лучей
является окисление липидов. Первичным относительно стабильным
продуктом фотоокисления являются гидроперекиси жирных
кислот. Квантовый выход этой реакции может значительно превышать
единицу, поскольку ультрафиолетовые лучи индуцируют цепную
реакцию окисления липидов, осуществляющуюся по свободнора-
дикальному механизму. Первичный свободный радикал,
возникающий в реакции RH + ftv-> R', взаимодействуя с кислородом,
превращается в перекисный радикал R02' При взаимодействии
последнего с RH происходит регенерация радикала и возникает
перекись. Далее этот процесс продолжается до тех пор, пока не
произойдет инактивация свободного радикала путем его реакции
382
г
с * веществом, относящимся к так называемым антиоксидантам.
К антиоксидантам относится, например, а-токоферол.
Гидроперекиси претерпевают химические превращения,
приводящие к появлению разных продуктов окисления, среди которых
основное место принадлежит альдегидам. Типичным представителем
такого конечного продукта фотохимических превращений веществ
липидной природы является малоновый диальдегид, по выходу
которого судят о фотохимическом действии ультрафиолетовых
лучей на биологические системы.
Перекисное окисление липидов сопровождается нарушением
функции мембран, так как с молекулярными повреждениями
липидов дезорганизуется структура мембран. Кроме того, продукты
окисления липидов представляют собой токсичные для клетки
соединения.
Фотоинактивация биологических систем действием
ультрафиолетовых лучей. При действии ультрафиолетовых
лучей на пролиферирующие клетки основной повреждаемой мишенью
является ДНК- Если поврежденные нуклеотиды входят в состав
участков ДНК, кодирующих жизненно важные гены, то клетка
может погибнуть в результате попадания только одного кванта.
Совокупность таких нуклеотидов в геноме и представляет собой
мишень лучевой инактивации клетки. Попадание кванта в эту
мишень характеризуется определенной вероятностью, и по
аналогии с законом ослабления света при его поглощении, когда в
качестве мишени выступают хромофорные группы вещества, процесс
инактивации клеток, обусловленный попаданием кванта
ультрафиолетового излучения в ДНК, можно описать с помощью уравнения
ND==N0e-°Dy (13.18)
где N0— исходное число клеток; Nd— число клеток, сохранивших
пролиферативную способность после облучения в дозе D.
Константа о равна произведению квантового выхода на поперечное
сечение поглощения излучения и называется поперечным сечением
инактивации. Из такой кинетики инактивации вытекают простые
экспоненциальные дозовые кривые выживаемости клеток, облучаемых
ультрафиолетовым излучением. Такие кривые получаются в
предположении, что для инактивации клеток достаточно одного
попадания в мишень. В связи с этим они и называются одноударными
дозовыми кривыми.
Однако не всегда инактивацию клеток удается
охарактеризовать столь просто, поскольку во многих случаях взаимодействие
излучений с мишенью носит более сложный характер, а кроме того,
на форме дозовых кривых сказываются процессы восстановления
клеток от поражения. Эти особенности инактивации клеток и
природы дозовых кривых отражены в теории мишени, разработанной
количественной радиобиологией (см. гл. 14).
Инактивация ферментов описывается одноударной кривой, и по-
ражаемость молекул белков можно характеризовать значениями
поперечного сечения инактивации. В качестве мишени выступает
383
10'
iO-
Ю-4
Ю~*
АО 80
Экспозиция на УФ-сдету, с
120
Рис 207. Дозовые зависимости
выживаемое ги клеток кишечной палочки
(Escherichia col 0 при действии
УФ-л учен
/ — в темноте; 2 — при действии видимого
фотореактивирующего света
активный центр фермента.
Выход мутаций, как и
выживаемость клеток, описывается
экспоненциальными кривыми в
соответствии с теорией мишени.
Нарушения физиологических
функций при действии
ультрафиолетовых излучений
характеризуются более сложными
кривыми, так как инактивация тех
или иных клеточных систем
может повлечь за собой изменение
компенсаторных и
восстановительных процессов.
Фото реактивация. ДНК в
клетке способна
восстанавливаться от основного индуцированного
ультрафиолетовыми лучами
повреждения— пиримидиновых димеров. Этот процесс происходите
темноте и называется темновой реактивацией. Происходит он и на
свету путем фотореактивации. Сущность фотореактивации состоит
в том, что под влиянием видимого света происходит распад
пиримидиновых димеров ДНК, и клетки таким путем восстанавливаются
от поражения. Фотореактивация отличается очень высокой
эффективностью, о которой косвенно можно судить по увеличению
выживаемости клеток, облученных ультрафиолетовым излучением, а
затем подвергнутых действию фотореактивирующего света (рис. 207).
Под влиянием света происходит прямое фоторасщепление
пиримидиновых димеров — это так называемая неферментативная
фотореактивация. Для клеток более существен процесс
ферментативной реактивации — расщепления пиримидиновых димеров под
влиянием светозависимого фермента, называемого фотореактиви-
рующим ферментом, фотолиазой. Фотолиаза способна находить
в ДНК пиримидиновые димеры и образовывать с ними комплекс.
При поглощении кванта фотореактивирующего света этот комплекс
распадается, и освобождающаяся при этом ДНК уже не содержит
димера. Полагают, что роль фотолиазы состоит в обеспечении
миграции энергии электронного возбужденного состояния на один из
пиримидинов в димере, что облегчает мономеризацию,
происходящую в соответствии с реакцией
PPfftv»PP*-^P + P,
где Р — пиримидиновое основание; РР— его димер.
(13.19)
*4
Рассматривается и другой, более вероятный механизм мономе-
ризации димеров, состоящий в том, что фотолиаза с пиримидино-
вым димером образует комплекс с переносом заряда, чем и
облегчается распад димера.
Фотореактивация клеток—очень широко распространенное
явление, обнаруживаемое у бактерий, дрожжей, в клетках
высших растений, животных и человека. Дефекты фотореактивиру-
ющей системы летальны для клетки в условиях действия ультра»
фиолетовых лучей.
. Фотолиазы, выделяемые из тех или иных биологических
объектов, не идентичны. Например, у дрожжей этот фермент состоит из
двух белковых субъединиц, у бактерий это— полипептид и аденин-
содержащий кофактор. Природа хромофорной группы фотолиаз
еще окончательно не установлена: полагают, что ею является
производное диазофлавина. Спектры действия фотореактивации имеют
широкий максимум поглощения в области 330—340 нм.
Темнсвая реактивация клеток от повреждений
ультрафиолетовым излучением сходна с темновой репарацией, обнаруживаемой
при действии ионизирующих излучений (см. гл. 14).
Фотозащита. Устойчивость клеток к ультрафиолетовым
лучам повышается, если перед облучением их подвергнуть действию
видимого или длинноволнового ультрафиолетового света. Такое
действие света называют фотозащитой. Фотозащита чаще всего
наблюдается у микроорганизмов. Спектр действия фотозащиты
представляет довольно узкую полосу с максимумом 310—340 нм.
Механизм фотозащиты, по-видимому, связан с торможением
деления клеток, обусловленным фотодеструкцией веществ хинонной
природы. У эукариотических клеток обнаружен эффект
фотозащиты без торможения деления клеток. Связывают его с фотоинду-
цированным синтезом серотонина из триптофана. Поскольку серо-
тонин является соединением, взаимодействующим с ДНК путем
интеркалированиЯу он стерически изменяет условия
фотообразования пиримидиновых димеров, уменьшая их квантовый выход.
Бактерицидное действие ультрафиолетовых лучей. Летальное
действие ультрафиолетовых лучей на клетки микроорганизмов
используется для обеззараживания помещений, хирургических
инструментов, посуды, воздуха и пр. Для этой цели
приспосабливают искусственные источники ультрафиолетовых лучей большой
мощности—бактерицидные лампы. Дозы бактерицидного
действия ультрафиолетовых лучей должны быть настолько
значительными, чтобы исключалась возможность выживания даже
единичных клеток.
13.10. Фотосенсибилизация. Многие организмы содержат
природные пигменты, поглощающие свет определенных длин волн,
что придает им повышенную чувствительность к солнечным лучам.
Такая фоточувствительность клеток может приводить к сильным
световым повреждениям, в то время как клетки, не содержащие
этих пигментов, без какого-либо ущерба переносят действие света.
Если фотосенсибилизирующие пигменты синтезируются непосред-
385
ственно в содержащих их клетках, то
говорят об эндогенных фотосенсибилиза-
торах; в случаях, когда пигменты
попадают в клетки извне, например при
питании, то говорят об экзогенных фото-
сенсибилизаторах. Изучены 4 класса
естественных фотосенсибилизирующих
веществ: гиперицшюв, хлорофиллов,
порфир и нов и псораленсв.
Гиперицины получили свое название
Рис. 208. Структура глице- 0т рода растений Hypericum (зверобой),
Рина у многих видов которого эти вещества
являются продуктом нормального
метаболизма. Гиперицины образуются также у некоторых видов
грибов и у простейших.
Собственно гиперицин представляет собой ароматическое
.соединение (рис. 208).
Другие соединения этой группы имеют иные заместители вместо
метальных групп либо представляют собой соединенные
водородными связями агрегаты гиперицина, каким является, например,
красный пигмент простейшего Blepharisma — зоопурпурин. На
свету этот пигмент приобретает голубую окраску.
Пигменты группы гиперицинов являются
фотоокислительными сенсибилизаторами, и при наличии кислорода они
служат причиной гибели клеток под воздействием сильного
<даета.
Хлорофиллы обусловливают фотодинамический эффект у му-
тантных клеток, лишенных каротиноидов.
Порфирины—циклические соединения, состоящие из четырех
пиррольных колец, соединенных метиновыми мостиками.
Порфирины довольно широко распространены в клетках аэробного
метаболизма, так как они являются основой цитохромов и ряда иных
веществ, содержащих гем. При поедании животными зеленых
растений из хлорофиллов может образовываться его производное пор-
фиринового типа—филлоэритрин. Если филлоэритрин попадает
с кровью в клетки кожи, то может наблюдаться фотодинамический
эффект в форме заболевания. Светочувствительность клеткам кожи
придает и гем атопорфирин, вызывающий у людей заболевание»
называемое порфириазом.
Псоралены (фурокумарины) представляют собой трицикличе-
ские соединения, являющиеся спаренными кумариновыми и фура-
новым кольцами (рис. 209). Псоралены находят в растениях
семейства зонтичных (петрушка), рутовых (лимон), тутовых (фиговое
дерево), бобовых. Попадание экстракта из
таких растений на кожу сопровождается
появлением ожогов при облучении светом. Эти
так называемые фотодерматиты наблюдают
при поедании животными многих растений, рис 204. Структура
например, лютиков, вьюнка полевого, лебеды псоралена
ах/
386
и пр. Псоралены, присоединяясь к пиримидинам, выступают
в качестве фотосенсибилизаторов ДНК, чем объясняется их
канцерогенное действие.
Глава 14. БИОЛОГИЧЕСКОЕ ДЕЙСТВИЕ
ИОНИЗИРУЮЩЕЙ РАДИАЦИИ
Ионизирующая радиация вызывает в живой клетке различные
физические, физико-химические и химические процессы,
которыми начинается сложная цепь клеточных событий, приводящих
к развитию радиобиологических эффектов. Вследствие того, что
энергия квантов жестких электромагнитных излучений или
тяжелых ускоренных частиц значительно больше энергии любых
химических связей, под влиянием ионизирующей радиации происходят
сильные повреждения молекул, входящих в состав веществ живой
ткани, чем и обусловлены биологические нарушения — гибель
клеток, инактивация отдельных биохимических систем,
наследственные изменения, торможение ростовых и
формообразовательных функций. Отрицательным последствиям облучения
противостоят восстановительные реакции организма, охватывающие
молекулярные, клеточные и тканевые уровни. В сочетании процессов
развития лучевого поражения и восстановительных реакций
формируется сложная ответная реакция организма на действие
ионизирующей радиации.
Значение радиационной биофизики, раскрывающей механизмы
биологического действия ионизирующей радиации, определяется
тем, что все живые существа на Земле подвержены действию
естественного радиоактивного фона—космических лучей и радиации,
природных радиоактивных элементов, рассеянных в почвах,
породах, водах. В давние геологические «эпохи становления жизни на
Земле уровень радиоактивности был очень высоким, и
ионизирующая радиация могла играть определенную роль в эволюции.
С созданием искусственных источников ионизирующей
радиации—рентгеновских аппаратов, ускорителей, ядерных
реакторов— важное значение приобрело исследование действия более
высоких доз излучений в связи с использованием ионизирующей
радиации в качестве диагностических и терапевтических средств.
Развитие ядерной энергетики и использование источников
ионизирующей радиации в технических и научных целях выдвинули
еще одну задачу— оценку степени риска для человека и биосферы
от облучения.
Продукты деления, образующиеся при взрывах атомных
устройств, повышают фон облучения всех живых организмов, что
также требует глубоких исследовании возможных соматических и
отдаленных генетических последствий облучения.
Выход человека в космос связан с облучением тяжелыми
ускоренными частицами, в связи с чем требуется обстоятельное
изучение механизмов взаимодействия этого типа излучений с живыми
клетками.
387
14.1. Природа ионизирующей радиации. К ионизирующим
излучениям относят излучения разных типов, способные при
прохождении через вещество в актах дискретной передачи энергии
вызывать ионизацию и возбуждение атомов и молекул. Передача
энергии на ионизацию атомов и молекул обусловлена
взаимодействием излучения с электронными оболочками атомов вещества.
В процессе ионизации нейтральных частиц—атомов или
молекул— возникают заряженные ионы обоих знаков — положительные
и отрицательные. Ионизация обычно происходит путем отрыва
электрона из внешних орбиталей. Следовательно, взаимодействие
излучения с веществом обеспечивает передачу электрону энергии
в количестве, достаточном для полного его отрыва от атома.
Такое количество энергии называется ионизационным
потенциалом.
Возбуждение атомов или молекул состоит в переводе их в более
высокое энергетическое состояние путем передачи им энергии,
переводящей электроны в возбужденное состояние. В результате
возбуждения атомы или молекулы приобретают повышенную
реакционную способность благодаря появлению у них неспаренных
электронов. Состояние атомов и молекул, сопряженное с наличием
неспаренных электронов, называют свободнорадикальным,
Выделяют два типа ионизирующих
излучений—корпускулярное и некорпускулярное электромагнитное излучение.
Корпускулярные излучения характеризуются тем, что частицы излучения
обладают массой покоя. Основными физическими характеристиками
корпускулярного излучения являются масса частицы, ее
электрический заряд и начальная энергия. Электромагнитные излучения
характеризуются частотой либо длиной волны, с которыми
связана величина энергии отдельных квантов. Оба типа излучений
характеризуются также энергетическими спектрами. Так,
корпускулярные излучения могут быть такими, что все частицы имеют
одно и то же значение начальной энергии, либо характеризуются
несколькими значениями начальной энергии (дискретными или
описываемыми определенным непрерывным распределением).
Электромагнитные излучения также могут быть потоком квантов
одинаковой энергии, нескольких дискретных значений энергии
или характеризоваться непрерывным распределением энергий.
Указанные параметры ионизирующих излучений называют их
спектральным составом.
В радиобиологических исследованиях наиболее часто
рассматривают излучения следующих видов: из некорпускулярных —
рентгеновское, гамма-излучение и синхротронное излучение; из
корпускулярного— электроны и позитроны, протоны (ядра атомов
водорода), а-частицы, я-мезоны и ускоренные ядра элементов,
вплоть до ядер 92U. К ионизирующей корпускулярной радиации
относят также нейтроны — элементарные частицы, не имеющие
заряда. В процессе взаимодействия нейтронов с веществом
возникают заряженные частицы, которые и обусловливают ионизацию
и возбуждение атомов и молекул.
388
Рентгеновское излучение представляет собой
электромагнитное излучение с длиной волны от 10 до 0,601 нм,что
соответствует энергии квантов от 0,12 до 1237 кэВ. Энергия квантов
рентгеновских лучей связана с их длиной волны соотношением
Л^кэВ1=га- (141>
Рентгеновское излучение образуется при торможении
получаемых, в вакууме быстрых электронов в веществе. В рентгеновских
аппаратах чаще всего для торможения электронов используют
мишени из вольфрама или молибдена. При торможении электронов
возникает рентгеновское излучение с непрерывным
энергетическим спектром. Чем выше поддерживается напряжение на лучевой
трубке для ускорения электронов, тем короче длины волн
образуемых рентгеновских лучей. Жесткими называют лучи с более
короткими длинами волн, а мягкими—с более длинными волнами.,
Как и световые лучи, рентгеновское излучение подвергается
преломлению, отражению, дифракции и интерференции.
Гамма-лучи— электромагнитное излучение, испускаемое
ядрами радиоактивных веществ в ходе радиоактивного распада.
Кроме того, гамма-кванты генерируются при аннигиляции электрон-
позитронной пары и при распаде некоторых частиц, например,
я°-мезона. В отличие от рентгеновских лучей, имеющих
непрерывный спектр энергий, гамма-лучи, испускаемые атомами
радиоактивных элементов, представлены квантами одного или нескольких
уровней энергии.
Чаще всего в качестве источников гамма-лучей используют
изотопы 60Со и 137Cs, имеющие следующие характеристики:
Период полураспада, годы
Энергия квантов, МэВ
Слой половинного ослабления, см РЬ
б°Со
5,3
Y2=U7
5
^Cs
30
0,66
2
Гамма-кванты большей энергии можно получить при
торможении электронов высоких энергий, получаемых на ускорителях
заряженных частиц.
Синхротронное излучение представляет собой
электромагнитное излучение ускоренных релятивистских электронов в
синхротроне. Характеризуется непрерывным спектром энергии от
глубокого вакуумного ультрафиолета, переходящего в
рентгеновские лучи. Взаимодействие данного вида излучения с веществом
отличается высокой эффективностью.
389
Бета-частицы—ускоренные электроны, возникающие при
распаде ядер радиоактивных изотопов. Характеризуются
непрерывным спектром энергий. Проникающая способность бета-частиц
значительно слабее, чем гамма-лучей такой же энергии. Чаще
всего исследуют биологическое действие бета-излучения от
инкорпорированных в ткани изотопов, распадающихся по типу бета-
распада.
Нейтроны — частицы, не имеющие заряда. Могут обладать
кинетической энергией от сотых долей до многих миллионов элек-
тронвольт; являются составной частью проникающей радиации
атомного взрыва. Для экспериментальных целей потоки нейтронов
получают в ядерных реакторах и в специальных нейтронных
генераторах, на основе ядерных реакций 9Ве(а, я)12С, при
использовании в качестве источника а-частиц 226Ra или 210Ро. Используют
также реакцию 3Т (р, я)3Не и 2D (d, я)3Не.
Замедленные нейтроны, находящиеся в тепловом равновесии
с окружающими атомами, называют тепловыми нейтронами. При
комнатной температуре их наиболее вероятная энергия— около
0,025 эВ. Источником тепловых нейтронов служит тепловая
колонна ядерного реактора, замедлитель быстрых нейтронов.
Заряженные частицы получают на ускорителях разных
типов. Чаще всего используют потоки ускоренных протонов, дейте-
ронов (ядер дейтерия), альфа-частиц (ядер гелия 8Не или 4Не),
а также ядер многих элементов. Энергии ускоренных частиц могут
быть доведены до очень больших значений — порядка десятков
миллиардов электронвольт (ГэВ). Изучают действие л;-мезонов —
неустойчивых частиц с массой около 270 электронных масс. Время
жизни я-мезонов—около 2,5 • 10~8 с. Наиболее
распространенный вид распада— на [г-мезон и нейтрино; fx-мезон очень быстро
также распадается, образуя два гамма-кванта.
14.2. Дозы ионизирующих излучений. Облучение объектов
ионизирующей радиацией достигается тем, что объекты на
определенный промежуток времени помещают в пространство
сосредоточения ионизирующей радиации. Это пространство называют полем
излучения. Для характеристики поля излучения необходимо знать,
сколько частиц или квантов, с какой энергией и с какого
направления попадают в каждую точку среды в каждый момент времени.
В связи с тем что поле излучений чаще всего создается в воздухе
или другой среде, в нем происходят взаимодействия квантов или
частиц излучения с атомами, в результате чего изменяются
первоначально заданное направление движения частиц и квантов и их
энергия. Поэтому полная характеристика поля излучений
представляет собой в общем случае сложную задачу, и чаще используют
интегральные характеристики, которые не охватывают
направления частиц или квантов, ограничиваясь значениями
пространственного распределения энергии и потока излучения.
Энергетическую характеристику поля получают, оценивая
в каждой точке его возможный эффект взаимодействия излучения
с веществом.
390
В качестве интегральной энергетической характеристики поля
излучений, в которой отражается возможность в данной точке
паля осуществиться определенному радиационному эффекту
взаимодействия излучения с веществом, принята экспозиционная доза
излучения. Экспозиционная доза^ (D3Kc) характеризует качество
поля излучения вне зависимости от того, облучается ли какой-либо
конкретный объект. Экспозиционная доза является мерой
ионизационного действия излучений. Ее единицей является кулон на
килограмм (Кл • кг"1). 1 Кл • кг"1— экспозиционная доза
рентгеновского или гамма-излучения, при которой излучение в сухом
атмосферном воздухе производит ионы, несущие электрический
заряд каждого знака, равный 1 Кл. Широкое распространение
имела внесистемная единица экспозиционной дозы—рентген
(Р):
1Р= 2,58- 10"4 Кл . кг"1.
Скорость приращения экспозиционной дозы в поле излучения
называется мощностью экспозиционной дозы (РЭкс)'
/^--^[Кл-кг-^с-1]. (14.2)
Поскольку эффект облучения определяется энергией,
поглощенной объектом, помещенным в поле излучения, то в качестве
энергетической характеристики облучения используют
поглощенную дозу (£>погл)- Отметим, что поглощенная доза относится не
к полю излучения, а к облученному объекту, и в ней отражается
отнесенная к единице массы облучаемого объекта поглощенная им
энергия ионизирующего излучения. Единицей поглощенной дозы
является доза, равная Дж - кг"1. Называется эта единица грэй
(Гр).
Скорость накопления поглощенной дозы называется мощностью
поглощенной дозы излучения (Люгл):
/>погл = %^[Гр.с-Ч. (14.3)
Ранее широко использовалась внесистемная единица
поглощенной дозы— рад, равная поглощенной дозе, при которой на 1 г
вещества приходится 100 эрг поглощенной энергии. Легко видеть»
что
1 рад= Ю-2 Гр.
Соответственно внесистемная единица мощности поглощенной дозы—
рад -с"1, что равно 10"2 Гр • с"1.
Для расчета поглощенной дозы по экспозиционной используют
соотношение
отоя = (|^)ч0». О4-4)
где \if?z — коэффициент передачи энергии излучения веществу с
данным эффективным атомным номером; ^а — коэффициент передачи
391
энергии воздуху; ц — энергетический эквивалент экспозиционной
дозы, зависящей от энергетического состава излучений. Коэффици-
енты \ikz и \ika определяют экспериментально. Для имитации живых
тканей используют композиции веществ, образующие тканеэквива-
лентный материал.
Поскольку биологическое действие излучений зависит не
только от поглощенной дозы, но и от качества излучения, их
относительной биологической эффективности, в литературе по радиационной
защите используют понятие эквивалентной дозы излучения. Доза
данного типа излучения, оказывающая такое же биологическое
действие на данный биологический объект, как доза в 1 рентген,
составляет 1 биологический эквивалент рентгена—бэр. Эту
единицу использовали до введения по СИ новой единицы
эквивалентной дозы— зиверта (Зв.). 1 Зв равен дозе данного типа излучения,
при которой эффект биологического действия излучений такой же,
как и при действии 1 Гр рентгеновских лучей либо
гамма-излучений; 1 Зв = 1 Дж • кг"1. Эквивалентные дозы носят весьма
условный характер, основываясь на упрощениях сложных по сво«й
природе понятий качества излучений.
Поле излучений может создаваться источниками,
расположенными вне облучаемого объекта, а также источниками, которые
находятся в самом объекте. Например, облучение опухолей
производят как от внешнего источника излучений, так и введением в
опухолевую ткань иглы, содержащей радионуклид. Особый случай
облучения наблюдается при попадании в ткань радионуклидов,
например, при включении в ДНК ядер 8Н-тимидина, в костную
ткань 45Са, 90Sr и т. п. В этом случае говорят об облучении от
инкорпорированных радионуклидов и рассчитывают дозу и мощность
дозы облучения по значению активности инкорпорированного
вещества, энергии излучений и коэффициенту его поглощения.
Дозиметрия. Для регистрации доз и мощностей доз
ионизирующей радиации используют дозиметры разнообразной
конструкции, основанные на разных принципах учета излучений: по
ионизации газовой среды, по световому излучению, образующемуся
в специальных составах-сцинтилляторах при прохождении
через них частиц или квантов, по действию излучения на
фоточувствительные материалы, по выходу некоторых радиационно-хи-
мических реакций. Из химических методов дозиметрии чаще всего
применяют при регистрации доз гамма-лучей раствор FeS04
в H2S04. Под влиянием излучения Fe2+ ионы окисляются до
Регионов, что определяют по изменению оптической плотности
раствора при 304 нм.
Для регистрации поглощенных доз в биологических объектах
используют тканеэквивалентные детекторы излучений.
14.3. Взаимодействие ионизирующих излучений с веществом
Ионизация и возбуждение атомов и молекул являются
результатом взаимодействия излучений с веществом. Очевидно,
ионизованные молекулы и электроны, а также молекулы в возбужденном
состоянии в начальные моменты сосредоточены в объеме вещества,
392
Рис. 210. Схема взаимодействия рентгеновского излучения и гамма-лучей с
атомами веществ:
/ — фотоэлектрический эффект. Квант излучения поглощается веществом, электрон при*
обретает энергию, равную энергии поглощенного кванта за вычетом энергии связи
электрона в атоме; 2 — эффекг Комптона, неуиругое рассеяние. При взаимодействии кванта
излучения с атомами выделяется квант излучения с меньшей энергией и свободный
электрон, 3 — в поле атома гамма-квант с энергией, превышающей 1,022 МэВ, образует пасу
е- и е+, Последние могут подвергаться аннигитяциил сопровождающейся образованием
гамма-квантов
окружающем траекторию проходящей ионизирующей частицы.
Этот объем называют треком. Радиус трека зависит от вида
излучения и природы облучаемого вещества. Например, в водных
растворах для электронов с энергией до 100 кэВ трек имеет радиус
около 2 нм.
Взаимодействие излучений с веществом, приводящее к передаче
энергии, идущей на ионизацию и возбуждение молекул,
осуществляется посредством ряда механизмов. Для рентгеновского и
гамма-излучения такими механизмами являются (рис. 210):
1. Фотоэлектрический эффект, при котором квант излучения
полностью передает свою энергию электрону. В результате
энергия кванта расходуется на разрыв энергии связи W и придание
электрону кинетической энергии Якин^
hv = EKliH + W. (14.5)
Вероятность фотоэлектрического эффекта тем выше, чем ближе
значение hv к W и возрастает с увеличением числа г (среднеечисло
электронов в атоме).
2. Эффект Комптона, при котором только часть энергии
кванта передается вылетающему электрону. При этом рассеянный
квянт с уменьшенной энергией изменяет направление движения.
Эффект Комптона, неупругое рассеяние квантов, обусловливает
для излучения б0Со выход более 90 % электронов, высвобождаемых
в воде при ее облучении. Обычно в повторных неупругих соударе-
393
ниях гамма-квант ступенчато передает свою энергию до тех пор,
пока остаток ее, близкий по значению к W, не будет вызывать
фотоэффект.
3. Образование пары электрон—позитрон. Это явление имеет
место только в том случае, когда энергия гамма-кванта больше
1,02 МэВ.
В веществах, состоящих из атомов с низкими массовыми
числами, характерных для биополимеров, при энергии
гамма-квантов от 15 кэВ до 20 МэВ наибольшее значение в поглощении их
анергии имеет эффект Комптона; при меньших энергиях квантов —
фотоэлектрический эффект, а при больших — образование пар.
Для нейтронов взаимодействие с веществом происходит с
ядрами чаще всего в форме упругих соударений, в результате чего
образуются ядра отдачи. В материалах биологического
происхождения вследствие совпадения массы нейтрона и ядер водорода
наиболее частыми событиями являются передача энергии нейтронов
протонам, которые передают свою энергию на ионизацию и
возбуждение атомов и молекул как заряженные частицы. Кроме
водорода ядра отдачи образуются из азота, углерода, кислорода.
Помимо упругого рассеяния тепловые нейтроны подвергаются
поглощению ядрами атомов азота, водорода и других элементов.
При этом происходят ядерные реакции, сопровождающиеся
возникновением гамма-квантов либо заряженных частиц. Таковы,
например, ядерные реакции:
ХН (я, y)2D + 2,2 МэВ (гамма-квант); .
uN(nt /?)14С+660 кэВ (протон). ( '
Эти процессы сопровождаются появлением заряженных
частиц— электронов, положительных ионов, ядер отдачи, которые,
в свою очередь, продолжают процесс ионизации и возбуждения
атомов и молекул по механизмам, свойственным заряженным
частицам.
Заряженные частицы представляют собой перемещающиеся
среди атомов и молекул вещества источники электрического поля.
Если частица проходит вблизи от орбитальных электронов, она
может, отрывая электрон, ионизировать молекулу или атом либо
переводить их в возбужденное состояние. В результате этих
взаимодействий заряженная частица тормозится веществом, полностью
растрачивая свою энергию. Дифференциальная потеря энергии
наряженной частицы представляет собой производную ее энергии
dE <
но длине трека —-р.
По уравнению Бете — Блоха
-dT = 1^[Inx~ln(1~p2)-p2]* (14-7)
где т — масса электрона; е — заряд электрона; v — скорость
частицы; z — заряд частицы; N — число электронов в 1 см3 вещества;
394
о - Ионизация
• -Возбуждение
..*--о".
.л о
<£ д- излучение
Длина пробега частицы, усл.ед.
а 5
/
Рис. 211. Линейная передача энергии по пути пробега (трека) ионизирующей
частицы
а — зависимость плотности ионизации (количества пар ионов на единицу пути) от длины
пробега При определенной длине пробега рэзко возрастает линейная передача энергии
и плотность ионизации что проявляется пиком Брэгга; б — стохастический характер
распределения ионизированных и возбужденных форм атомов и молекул в момент
прохождения ионизирующей частицы через вещество. От трека ответвляются
дополнительные треки вторичных ускоренных частиц — дельта-излучения
Z — среднее число электронов в атоме; 10 — средний потенциал
ионизации или возбуждения атома; |3 = — (с — скорость
распространения света). Из приведенной формулы следует, что при
определенных скоростях значение -р достигает максимума, который
называют пиком Брэгга.
Таким образом, при прохождении излучений через вещество
в результате первичных взаимодействий возникает вторичное
излучение, которое также осуществляет ионизацию и возбуждение
молекул и атомов. Этот процесс продолжается до полного исчерпания
энергии вторичного излучения, которое называют еще дельта-
лучами. В результате ионизации и возбуждений атомов и молекул,
производимых первичным и вторичным излучением,
формируются треки частиц или квантов в веществе (рис. 211). Расчеты
структуры трека очень сложны, так как помимо электрических
взаимодействий приходится рассматривать и динамику
плазменных шнуров, образующих трек.
Передачу энергии ионизирующим излучением веществу
характеризуют средними значениями энергии, приходящимися на
единицу длины трека. Эта величина называется линейной передачей
энергии (ЛПЭ) и измеряется в джоулях на квадратный метр на
килограмм (внесистемная единица—Мэв • см2* г""1). Часто
используют также единицу ЛПЭ в форме эВ • нм"1. Обычно ЛПЭ
относят не к конкретному треку, а к любому направлению в
облучаемом веществе. Поэтому ЛПЭ является усредненной величиной,
не отражающей гетерогенности начального распределения ионов
и возбужденных молекул.
Энергия, расходуемая ионизирующей частицей или квантом на
образование одной пары ионов, зависит от вещества. Для воды она
колеблется от 30 до 50 эВ. Для того чтобы из единиц ЛПЭ в эВ X
X нм-1 перейти к числу пар ионов на 1 нм, используют величину,
равную 34 эВ на 1 пару ионов. Из этой энергии непосредственно
395
на ионизацию расходуется около 1/3, остальная тратится на
возбуждение и тепловую конверсию. В биополимерах средняя
передача энергии на ионизацию выше (до 60 эВ).
Для наиболее широко используемых в радиобиологии видов
излучения значения ЛПЭ для воды таковы:
Рентгеновское излучение и гамма-
лучи с энергией от 0,01 до 104 МэВ
а-частицы 2,5 МэВ
4 МэВ
Дейтроны 3 МэВ
4Не 8 МэВ
12С 3 Ms В
4«Аг 1,5 МэВ
10—0,2 эВ/нм (1,6-0,3 х
X 10~18 Дж • нм"1)
165 эВ/нм (2,6 • 10"17 Дж . нм-1)
110 эВ/нм (1,7 . 10"17 Дж • нм"1)
20 эВ/нм (3,2 • 10~18 Дж • нм^1)
22 эВ/нм (3,5 . Ю-18 Дж • нм"1)
410 эВ/нм (6,5 '. К)-" Дж . нм"1)
3000 эВ/нм (4,8 • Ю-16 Дж - нм"1)
Действие ионизирующих излучений на молекулы.
Каждый радиобиологический эффект начинается с актов
взаимодействия ионизирующих излучений с молекулами. Возникающие при
этом ионизированные атомы, ионизированные и возбужденные
молекулы претерпевают дальнейшие изменения, которые могут
завершаться образованием новых химических соединений, а в
случае макромолекул— изменениями отдельных участков молекул,
получившими название радиационных повреждений. Радиационные
повреждения молекул могут явиться результатом прямого
попадания в них гамма-кванта или частицы. Такой тип действия
радиации на молекулы называют прямым действием излучений.
Если радиационные нарушения молекул являются результатом
их взаимодействия с радиационно-химическими продуктами,
возникающими при прямом действии излучений на молекулы
сопутствующих веществ, то говорят о непрямом действии излучений на
молекулы. Непрямое действие радиации изучают путем использования
растворов или смесей веществ.
В связи с тем что биологические системы в преобладающей
части случаев содержат воду, при действии радиации на вещества
живых клеток приходится рассматривать прямое и непрямое
действие излучений. При этом непрямое действие излучений
преимущественно обусловлено участием в радиационно-химических
реакциях продуктов радиолцза воды.
Радиационная химия воды. При действии ионизирующие
излучений на воду происходит образование свободных радикалов
и сольватированных электронов:
Н20 - Н20< + е-;
Н20 ^Н4+ОН ;
в" -> e~aq — сольватированный электрон; (14.8)
196
**V-H +0H-;
H20+e-^H20-;
н2о--*н*+он-.
Между радикалами происходит рекомбинация, приводящая
к возникновению более устойчивых форм молекул;
^ + ^-*Н2 + 20Н-;
Н+Н->Н2; (14.9)
ОН+ОН->Н202.
При наличии в среде кислорода, Н', е"ац могут образовывать
отличающиеся высокой реакционной способностью свободные
радикалы:
^ + 02->02;
Н* +02->Н02;
ОН" + Н02 ~> Н20 + О"*; (14.10)
он +нсоо--*со; + н20;
со2- + о2->со2 + о;.
Супероксидный радикал кислорода O.J может наносить очень
серьезные повреждения биологически важным молекулам, как и
радикал Н02.
Возбужденные молекулы воды могут образовывать радикалы
Н и ОН', но вследствие незначительной быстро расходуемой
в столкновениях энергии они, не удаляясь друг от друга на
большие расстояния, быстро рекомбинируют. Радиационно-химические
реакции в водных растворах происходят преимущественно с
участием таких продуктов радиолиза воды: е~ац, 02 , Н02 и Н202.
Радикал ОН реагирует в основном как окислитель, Н' и^ —
как восстановители, Н02 выступает и как окислитель, и как
восстановитель.
Имеются существенные различия в радиационно-химических
реакциях водных растворов при облучении их радиацией с низким
или высоким значением ЛПЭ. При низких значениях ЛПЭ
радикалы возникают на больших расстояниях друг от друга, что
благоприятствует их участию в атаках на растворенные молекулы.
Если же излучение имеет большое значение ЛПЭ, то в плотном
треке происходят ради кал-радикальные взаимодействия, и их
участие в радиационно-химических реакциях становится менее
существенным.
Действие радиации на нуклеиновые кислоты. В
связи с тем что ДНК и РНК выполняют очень важную функцию в
клетке, действие ионизирующих излучений на эти биологические
макромолекулы исследовано довольно обстоятельно. При действии
излучений наблюдается повреждение нуклеиновых кислот в
отдельных нуклеотидах и в углеводной части молекулы. Радиолиз
397
пуриновых оснований может
сопровождаться размыканием пи-
римидинового или имидазольного
кольца, происходит дезаминиро-
вание цитозина, аденина и
гуанина. В дезаксирибозе
наблюдается окисление спиртовых групп,
разрывы углерод-углеродных
связей. Нарушают структуру
молекулы ДНК разрывы поли-
нуклеотидных цепей,
происходящие с образованием 3' ОН- и
5'Р04-концов, 3'Р04- и 5'
ОН-концов, разрывы свыщепле-
нием аниона фосфорной
кислоты, нуклеотидов, нуклеозидов.
Облучение сопровождается
разрывом водородных связей на
отдельных участках двунитевых
ДНК, частичной ее
денатурацией. Возможны ковалентные
сшивки — продольные между
основаниями и поперечные между
Выходы радиационно-химических
реакции и характер возникающих при них продуктов во многом
зависят от состояния нуклеиновой кислоты и наличия кислорода.
Все радиационно-химические превращения нуклеиновых кислот
можно сгруппировать в такие типы повреждений, затрагивающих
функции этих макромолекул: повреждения нуклеотидов, однони-
тевые и двунитевые разрывы (рис. 212). Информацию о
возникновении свободнорадикальных состояний, их природе и локализации
получают с помощью метода ЭПР. О разрывах водородных связей,
локальной денатурации судят по гиперхромизму— увеличению
поглощения света в области 262 нм растворами ДНК- Разрывы
нитей ДНК определяют по уменьшению молекулярной массы
молекул, что регистрируется с помощью дифференциального
центрифугирования в градиенте плотности или измерением микровязкости
растворов. Даже при незначительных выходах
радиационно-химических превращений ДНК последствия их могут быть очень
значительными, поскольку как бы ни было малым число повреждений
в одной молекуле ДНК с огромной молекулярной массой, ее
целостность при этом нарушится, что неизбежно скажется утратой
биологической функции.
Действие ионизирующего излучения на белки. При
действии ионизирующих излучений на белки происходят
изменения в составляющих макромолекулу аминокислотных остатках.
Эти изменения начинаются с возникновения продуктов
отщепления карбоксильной группы с разрывом связи С—С, аминогруппы
с разрывом связи С—N или атома водорода от атома азота или угле-
Рис. 212. Основные типы
повреждения молекул ДНК в хроматине
двумя нитями в двойной спирали.
3*8
рода в положении а. В сер у содержащих аминокислотах основные
радиационно-химические превращения затрагивают серу.
В радиационно-химических превращениях белковых молекул
в водных растворах существенную роль играют радикалы ОН*
и ё~ад. В результате первичного размена энергии возникают свобод-
норадикальные состояния, которые принимают участие в реакциях
второго порядка, или, как их называют, второго поколения.
Вследствие того что в полипептидной цепи первоначально возникшие
возбужденные состояния электрона могут мигрировать вдоль
молекулы, в конечном счете свободнорадикальные состояния
локализуются в определенных местах молекулы. Через промежуточные
соединения, возникающие по местам локализации свободноради-
кальных состояний, белки расщепляются с образованием амидов
и карбонильных соединений. В результате возникают фрагменты
белковых молекул. Вместе с тем одновременно могут происходить
и процессы полимеризации, инициируемые свободнорадикальными
состояниями. Под влиянием облучения нарушается система
водородных связей, что сопровождается денатурацией белковых
молекул, их переходом в нерастворимое состояние.
Многообразие радиационно-химических эффектов в облученном
белке обусловливает нарушение функциональной активности этих
макромолекул, что в случае ферментов обнаруживается их
инактивацией. Дозовые кривые инактивации ферментов симбатны
с кривыми выхода вторичных свободных радикалов, следуя
экспоненциальной зависимости. Причины радиационной инактивации
ферментов обусловливают не только прямое поражение
аминокислот, входящих в состав активного центра молекулы, но и нарушение
аллостерического ее центра и изменение конформации всей
молекулы.
С утратой свойственных неповрежденной белковой молекуле
конформационных состояний связано еще одно очень важное для
биологических систем явление — ослабление способности белка
к молекулярному узнаванию, определяющему самосборку
надмолекулярных структур.
Действие ионизирующего излучения на липиды. В
запуске радиобиологических процессов существенную роль могут
играть радиационно-химические превращения жирных кислот
и липидов. Жирные кислоты при облучении в чистом виде
подвергаются декарбоксилированию с образованием углеводородного
радикала. При облучении в водных эмульсиях образуются
дополнительные радикалы с неспаренными электронами в карбоксильной
и углеводородной частях молекулы. Эти нестабильные радикалы
претерпевают еще ряд превращений, взаимодействуя с
неповрежденными молекулами, между собой и с кислородом. В последнем
случае возникает очень активный перекисный радикал, который,
взаимодействуя с исходной карбоновой кислотой, приводит к
образованию гидроперекиси и нового радикала:
fry
RH —* R (инициация);
399
R' + Qa -* #0-2 (окисление радикала);
R02 + RH->R02H + R (цепная реакция); (14.11)
2R02 -+ P (образование стабильного продукта).
Здесь RH — липид. Как видим, в этих реакциях возникают
свободные радикалы, и процесс превращения жирных кислот
в присутствии кислорода приобретает цепной характер.
Конечными продуктами радиационно-химических превращений
жирных кислот являются карбонильные соединения, альдегиды,
кетоны, спирты, С02. Цепной процесс обрывается
конкурирующими реакциями.
В ненасыщенных жирных кислотах происходят преобразования
двойных связей —С=С— по механизму, сходному с автоокисле-
вием. Вследствие наличия среди продуктов радиолиза жирных
кислот свободных радикалов возможны реакции сшивок, в связи
с чем могут появляться вещества, молекулярная масса которых
выше, чем у исходного соединения.
В случае развития цепных реакций выходы
радиационно-химических превращений могут быть очень большими, составляя
несколько сотен, что намного превышает суммарный выход всех
продуктов реакции первого поколения.
Радиолиз липидов сопровождается накоплением продуктов
радиационно-химического превращения, входящих в состав их
молекул ненасыщенных жирных кислот. Среди этих продуктов
имеются перекиси и гидроперекиси, получившие название липидных
перекисей. Радиационно-химические выходы липидных перекиеей
могут составлять несколько сотен молекул на 100 эВ (1,6 • 10 ~17 Дж)
поглощенной энергии.
В живой клетке имеются и другие- вещества—мономерные
и полимерные углеводы, свободные нуклеотиды, витамины,
вещества порфириновой природы, ионы неорганических веществ,
иногда пигменты, лигнин, вещества фенольного происхождения и др.
Все они, конечно, также подвергаются радиационно-химическим
превращениям, обусловливая свой вклад в общее радиационное
поражение клеток соответственно своей концентрации в клетке,
биологической значимости и токсичности образующихся из них
продуктов радиолиза.
Радиационно-химические процессы в сложных
системах. В живых клетках, подвергающихся действию
ионизирующего излучения, одновременно происходят многие радиационно-
химические реакции разнообразных веществ, подвергающихся как
прямым, так и непрямым превращениям, давая продукты разногб
порядка. Продукты радиолиза, инициирующие дальнейшие
вторичные радиационно-химические превращения, образуются очень
быстро—в момент прохождения кванта или частицы излучения.
Дальнейшие превращения продуктов описываются уравнениями
кинетики химических реакций. Важное значение в этих процессах
имеют неравномерность распределения первичных продуктов
радо
диолиза по трекам, ограничения диффузии свободных радикалов
и иных продуктов реакций, химическая сложность облучаемой
системы и ее состояние.
Основной количественной характеристикой радиационно-хи-
мических процессов является величина радиационно-химического
выхода продукта (G). Эта величина измеряется числом
превратившихся в ходе радиационно-химической реакции молекул на 100 эВ
поглощенной энергии излучения. Часто при символе G указывают
продукты соответствующих реакций. Например, для радиолиза
воды определяют G -, Gh , Сон , Gho2, Gq- и т. д. Суммарный
aq *
выход радиационно-химического разложения воды Сн.о составляет
около 4. С увеличением дозы облучения обычно возрастает и число
поврежденных молекул, и в большей части случаев эта зависимость
носит экспоненциальный характер. Характеристики таких экспонент
позволяют количественно оценивать и повреждаемость тех или
иных молекул, и радиационно-химические выходы тех или иных
реакций.
Полное описание радиационно-химических процессов в клетках
и тканях организма представляет собой очень сложную задачу,
в связи с чем обычно ограничиваются упрощенным подходе»*
обращая внимание на повреждения молекул, выполняющих
наиболее важные в жизнедеятельности клетки функции.
14.4. Действие ионизирующих излучений на живые организмы.
В результате прямого и непрямого действия излучений на
вещества живых клеток возникают повреждения биологически важных
молекул и структур клеток, что влечет за собой развитие лучевого
поражения, которое проявляется в разных формах в зависимости
от дозы радиации, особенностей клетки и ряда сопутствующих
облучению условий, способных влиять на течение
радиобиологической реакции. Обычно лучевая реакция клетки на облучение имеет
много проявлений, которые могут быть зарегистрированы
соответствующими методами. Например, с помощью метода ЭПР
определяют выход свободно-радикальных состояний в клетке, после
облучения.
Изменение проницаемости наружной мембраны облученной
клетки можно оценить, исследуя выброс ионов калия. Нарушения
ультраструктуры клетки изучают, прибегая к электронной
микроскопии и т. д. При таких исследованиях обычно выявляют
промежуточные этапы формирования интегральной реакции клетки на
облучение, что имеет большое значение в раскрытии механизмов
радиационного поражения. В качестве интегральных реакций
клетки на облучение—- конечного результата развития многоэтапного
радиобиологического процесса — обычно рассматривают
генетические и соматические эффекты.
Радиобиологические клеточные эффекты. Реакции
клетки на облучение могут проявляться изменением ее наследственных
свойств. В таком случае говорят о генетических эффектах
облучения. Если облученные клетки обнаруживают нарушение нормы
401
реакций, которые не передаются из поколения в поколение, то
такие эффекты называют соматическими. Часто соматические
эффекты в своей основе имеют нарушения генетических
управляющих систем.
Выделяют два типа мутаций: генные, или точковые, и
хромосомные. Генные мутации возникают при повреждении отдельных
нуклеотидов в молекуле ДНК, когда нарушается генетический
код определенного признака, за проявление которого ответствен
ген, в области которого возникло молекулярное повреждение.
Появление генной мутации тестируется по возникновению дефектов
наследственного характера. Хромосомные мутации— изменения
структуры хромосом. Проявляются изменением плоидности, числа
наборов хромосом и структурными перестройками хромосом —
хромосомными аберрациями.
При генных мутациях происходят такие структурные изменения
в ДНЮ замена основания, изменение числа нуклеотидов путем
вставки новой для данного гена последовательности, удЕоения
участка (дупликации), потери одного или нескольких нуклеотидов
(делеции) и поворотом участка гена (инверсий).
При хромосомных мутациях наблюдают выпадения участка
хромосомы (делеции), удвоения участка хромосомы
(дупликации), повороты участка хромосомы (инверсии) и перенос части
хромосомы в другую хромосому (транслокации).
Как видим, при генных и хромосомных мутациях процессы
сходны, различаясь лишь размерами структурных единиц,
принимающих участие в формировании мутации.
Помимо хромосомных мутаций выделяют ряд структурных
перестроек, относящихся к хромосомным аберрациям, возникновение
которых, в отличие от хромосомных мутаций, препятствует
делению клеток. Это— структурные повреждения хромосом, которые
разделяют на две группы: хромосомных и хроматидных аберраций.
К хромосомным аберрациям относят образование дицентрических
хромосом, ацентрических колец и др. К хроматидным—
сестринский хроматидный обмен, изохроматидные делеции, возникновение
дицентриков и т. п. Хромосомные аберрации выявляют по
нарушению митоза, наблюдаемого в мета- или анафазе. С увеличением дозы
радиации наблюдается возрастание частоты появления этих
нарушений генетического аппарата клетки.
Наиболее полно исследованной интегральной реакцией клетки
на облучение является ее гибель. Несмотря на то что в начальные
моменты после облучения характер молекулярных повреждений
сходен для всех клеток, гибель их может протекать по-разному.
Различают интерфазную и пролиферативную (или репродуктивную)
гибель клетки.
Интерфазная гибель характерна для неделящихся
клеток/Репродуктивная гибель свойственна клеткам, способным к делению.
Чаще всего она определяется по утрате способности клетки
делиться. Например, у бактерий пролиферативную гибель выявляют,
оценивая способность клеток после облучения образовывать мак-
402
роколонии при посеве на питательный агар. Репродуктивная гибель
клетки может проявиться при первом после облучения делении,
а также после того, как потомки облученной клетки совершат
некоторое количество делений. По такому ограниченному числу
делений судят о формах инактивации клеток.
Меры радиобиологических эффектов. Количественная
оценка радиобиологического эффекта производится по степени
проявления тех или иных реакций, выбор которых определяется
задачей исследования, свойствами облучаемой системы и
экспериментальными возможностями. Реакция системы на облучение,по
которой судят о дозовой зависимости эффекта, представляет собой
меру радиобиологического эффекта, его тест-эффект,
тест-реакцию. Например, при изучении радиобиологической реакции
одноклеточных организмов, клеток человека в культуре, клеток
растений, дрожжей, способных образовывать макроколонии, чаще всего
в качестве тест-реакции используют потерю способности клетки
образовывать макроколонию после облучения. Неспособность
клетки к этому процессу свидетельствует о ее пролиферативной
гибели.
В качестве меры повреждения макромолекул может
использоваться процент молекул, нарушенных при действии облучения.
Так, при действии излучений на ДНК в клетке в качестве меры
эффекта можно использовать выход двойных или одиночных
разрывов нитей ДНК- В качестве тест-эффекта для многоклеточных
сложных организмов используют выживаемость после облучения
спустя определенное время. В случае изучения действия радиации
на те или иные физиологические или метаболические процессы
определяют степень угнетения или активации интенсивности
соответствующих процессов.
Лозовые зивисимости радиобиологических эффектов.
Зависимость между дозой и степенью выраженности
радиобиологического эффекта характеризуют графически построением дозовой
зависимости. Обычно по оси абсцисс откладывают значения доз,
а по оси ординат—меру радиобиологического эффекта:
выживаемость клеток, выход хромосомных аберраций, интенсивность
дыхания и т. п.
Если кривая доза—эффект может быть описана каким-либо
аналитическим выражением, то последнее используют как
эмпирическую математическую модель радиобиологического эффекта.
Кривые дозовых зависимостей радиобиологических эффектов
бывают весьма разнообразной формы. Так, для выхода генных
мутаций чаще всего обнаруживают прямо пропорциональную
зависимость эффекта от дозы. Выход хромосомных аберраций
удовлетворительно описывается квадратичной кривой. Выживаемость
клеток в области малых доз хорошо интерполируется линейной
зависимостью. В большей же части случаев выживаемость клеток
следует экспоненциальной функции или описывается сигмоидаль-
ной кривой. Во многих случаях удобно пользоваться
полулогарифмическим масштабом, нанося на ось ординат значение логариф-
26*
403
I
I 0t037\.
1
12Dfp
Рис. 213. Кривые выживаемости
клеток хомячка линии У — 79 (/) и
клеток карциномы человека HeLa (2).
В системе полулогарифмических координат
обе кривые выживаемости характеризуются
наличием прямолинейного участка и
начальными изгибами кривых; D — доза
радиации
\fo
L
j-
TTV
А
——*
0t1\
0,01\
0,0037\—
0,001 V-
Рис. 214. Основные параметры
логарифмической дозовой зависимости
выживаемости клеток:
п — экстра пол я ционное число, Dq —
квазипороговая до*а
ма выживаемости. На рис. 213 изображена кривая выживаемости
в полулогарифмической системе координат. Так как такой тип
кривой наиболее часто встречается в радиобиологических
явлениях, его следует рассмотреть более подробно.
Поскольку кривая имеет экспоненциальный участок,
аналитическое выражение для него представляет собой экспоненту. Если
обозначить через N число выживших клеток, а через N0— общее
число облученных клеток, D — дозу радиации, то
"о
o-kD
(14.12)
где —k — коэффициент, отражающий радиочувствительность
клеток.
Определим значение дозы D0> при которой выживаемость
уменьшается в враз, т. е. станет рабной 36,7 % от исходного
количества клеток. Очевидно, это случится, если kD0~ 1 и,
следовательно, k = -g-.
Если дозовая кривая не имеет плеча, D0 равна так называемой
37 % -й дозе D87, при которой выживает примерно 37 % исходного
количества клеток. Для дозовых зависимостей, описываемых
кривой с плечом, DZ1 равна D0 только для прямолинейного участка
кривой (рис. 214). Экстраполируя прямолинейный участок
дозовой кривой до пересечения с осью ординат, получаем такие
параметры кривой: значение ординаты в месте пересечения экстра-
404
Рис. 215. Кривые выживаемости
клеток при действии химических
токсических веществ (/) и ионизирующих
излучений (2):
/ — сигмоида, описывающая пороговую
реакцию: до определенного значения
концентрации токсина клетки сохраняют экизне-
способность, следуя закону «все или
ничего»; 2 — логарифмическая кривая,
пороговые значения доз не выявляются
полированным прямолинейным
участком — экстраполяциоНное D,ycn.eQ.
число п. Значения экстраполя-
ционного числа зависят от характера плеча— его ширины и
наклона прямолинейного участка дозовой кривой. Величину плеча
кривой характеризует другой параметр— квазипороговая дозаDqr
которой соответствует точка пересечения экстраполированного
прямолинейного участка с прямой, параллельной оси абсцисс на
уровне 100 % -й выживаемости клеток.
Наличие плеча у дозовой кривой логично связывать со
способностью клеток ликвидировать с помощью репараций последствия
облучения при действии малых доз ионизирующей радиации.
Величины Dq и п характеризуют эту способность клетки.
Из экспоненциального характера дозовых кривых
выживаемости следует вывод о том, что даже при самых малых дозах
излучений обнаруживаются погибшие клетки; так же, как и при самых
высоких дозах, часть клеток сохраняет способность к делению.
Поэтому понятие абсолютно летальной дозы для клеток не имеет
достаточно корректного содержания. Обычно уровень
радиоустойчивости клеток характеризуют значением полулетальной дозы
D50, при которой выживает 50% клеток. Очевидно, такие
особенности дозовых кривых приводят к мысли о вероятностном
характере повреждения клеток.
14.5. Принципы количественной радиобиологии. Принципы,
попадания у мишени и усилителя. Формы кривых дозовых
зависимостей выживаемости клеток от облучения существенно
отличаются от концентрационных зависимостей гибели клеток при
действии токсических веществ (рис. 215). Если при действии
ионизирующей радиации проявляется экспоненциальная зависимость,
то гибель клеток от концентрации яда следует пороговой кривой.
Иногда пороговая кривая имеет черты сигмоидальности, что
объясняют колебаниями индивидуальной клеточной резистентности
к токсину. Поэтому для объяснения специфичности формы дозовых
кривых радиобиологических эффектов потребовались иные
подходы.
Еще в 20-е годы текущего столетия такой подход наметился
в работах Дж. Кроутера и X. Дессауера, нашедших дальнейшее
развитие в исследованиях Н. В. Тимофеева-Ресовского, К- Цимме-
ра и Д. Ли, которые сформулировали основные принципы
количественной радиобиологии. Эти принципы— попадания, мишени
и усилителя — основаны на том, что передача энергии излучения
405
характеризуется дискретностью и статистичностью взаимодействия
излучений с веществами клетки и, кроме того, биологические
структуры, которым передается энергия излучений, отличаются
неодинаковым значением в жизнедеятельности клетки.
Принцип попадания утверждает, что физической основой
пусковых процессов лучевого поражения клетки является
дискретный и статистический по своей природе акт взаимодействия
ионизирующего излучения с веществами клетки. Принцип мишени
утверждает, что клетка отличается структурно-функциональной
гетерогенностью, в связи с чем лишь попадание— передача
энергии в'определенные^структуры, от которых существенно зависят
функции клетки, будет приводить к развитию лучевого поражения.
Такие структуры получили название мишеней. Принцип усилителя
утверждает, что в результате попадания в мишень развиваются
процессы, усиливающие во много раз начальное поражение
клеточной структуры, приводя к появлению вторичных массовых
нарушений клеточных процессов.
В общем случае принципы попадания и мишени рассматривают
некую условную тест-реакцию клетки как реализацию
повреждения определенной клеточной мишени. В таком случае говорят,
что единицей реакции на облучение является единичное
проявление тест-эффекга. Каждой единице реакции соответствует
поражение определенной мишени. Чаще всего принципы попадания и
мишени используют для описания пролиферативной гибели клеток.
В качестве единицы реакции в данном случае выступает гибель
клетки, а в качестве мишени— совокупность ядерных структур,
повреждение которых влечет за собой пролиферативную гибель
клетки.
Принцип усилителя связывают с тем, что в процессе репликации
поврежденных молекул ДНК происходит нарастание числа
молекулярных повреждений самой ДНК- Кроме того, в ходе
транскрипции несущих повреждения матриц возникают транскрипты
с ошибками. Последние, в свою очередь, при трансляции
передают ошибку белкам. Потерявшие вследствие нарушения структуры
функциональную способность молекулы белков не обеспечивают
соответствующие потребности клетки, в связи с чем индуцируются
повторные транскрипции и трансляции, что в итоге приводит к
усилению первоначального единичного повреждения. Принцип
усилителя объясняет основной парадокс радиобиологии, заключающийся
втом, что эффект облучения непропорционально велик в сравнении
с поглощенной в акте попадания энергией ионизирующего
излучения. Например, при получении организмом животного средней'
радиочувствительности летальной дозы ионизирующей радиации
порядка 10 Гр тепловой эквивалент поглощенной энергии таков,
что позволил бы нагреть 1 г живой ткани всего лишь на 0,002 °С.
В соответствии с принципом попадания отдельные акты
взаимодействия излучения с веществом не зависят друг от друга и
подчиняются распределению Пуассона. Эти положения вполне
естественны по физической сущности явлений. Обозначив объем мишени
406
через vy дозу облучения через £>, вероятность точного попадания
в мишень через Р (п) и использовав уравнение распределения
Пуассона, получим
РМ-Ы^. (14.13)
В предположении, что для проявления тест-реакции
облучаемого объекта требуется не менее п попаданий и, следовательно,
любая клетка, получившая п— 1 или меньше попаданий в
мишень v, не проявит тест-реакции, для расчета части клеток, не
проявляющих тест-реакции, необходимо просуммировать все
клетки, получившие менее п попаданий в мишень. Если обозначить
число таких клеток через N, а исходное число клеток через N0t
как легко видеть, выживаемость клеток в популяции равна N/N0,
если тест-реакцией является гибель клетки. В результате
суммирования получим
п—\
ад, = *>-«"> ££g£. (14.14)
Если число попаданий, вызывающее тест-реакцию, равно
единице, то уравнение приобретает вид
N/N0^e-vD. (14.15)
Это— экспоненциальная кривая, и, как было показано ранее,
многие кривые выживаемости клеток имеют именно такой характер,
который называют одноударным процессом инактивации клеток.
Если число попаданий, инактивирующих клетку, больше
единицы, то кривые, описываемые (14.14), приобретают сигмо-
идальный характер. В полулогарифмической системе координат
эти кривые обладают плечом, нарастающим по мере возрастания
числа попаданий, необходимых для проявления тест-реакции. Это
число получило название ударности мишени.
Логарифмируя (14.15), получаем
1п(ЛВД = — vD. (14.16)
Для случая выживаемости 37 % клеток vDs~ 1 и, следовательно»
объем мишени равен: v= l/D37.
Для расчетов размеров мишени нужно выбрать
соответствующие размерности используемых величин. Так, при дозе 1 Гр
поглощенная энергия составляет 6,24 • 1015 эВ • г"1 клеточной
массы. Если принять, что средняя энергия, расходуемая на
поражение мишени, составляет 60 эВ, то поглощенная доза в числе
попаданий равна -—^—= 1,04* 1014 г""1, и тогда можно
рассчитать массу мишени в граммах.
Если D37 близка к 10 Гр, то мишень имеет массу порядка
Ю~1а г, что близко к массе ядра клеток.
407
Для инактивации молекул ферментов, фагов, ДНК-содержа-
щих вирусов, некоторых гаплоидных клеток применение уравнения
для определения размеров мишени, ответственной за инактивацию,
дает вполне удовлетворительное совпадение с данными,
получаемыми иными способами, например прямым определением
молекулярной массы фермента, ДНК вируса, клетки.
В том случае, когда облучение производят плотноионизиру-
ющей радиацией с высокими значениями ЛПЭ и плотность
ионизации настолько велика, что не удается выделить одно ударный
процесс поражения мишени, попадание определяется не объемом
мишени, а ее поперечным сечением. Развитие математического
аппарата теории мишени привело к нахождению способа для
определения не только размеров, но и формы мишени. Для этого
необходимо изучить дозовые зависимости радиационного эффекта
при облучении радиацией с разными. значениями ЛПЭ. Метод
определения размера и формы мишени, предложенный Д. Ли,
получил название метода присоединенных объемов.
Кроме одноударных и многоударных мишеней рассматриваются
и более сложные модели лучевого поражения клеток. Из них
часто используется модель клеточной гибели, зависящей от
поражения некоторого числа п одноударных мишеней. Тест-реакция
на облучение проявляется согласно этой модели тогда, когда
в каждую из п мишеней произойдет, по крайней мере, одно
попадание. Эта ситуация описывается уравнением
N/N0= l-(\—e-vD)n. (14 17)
При больших значениях доз уравнение приближается к такому ,
виду:
N/N0 = ne~vD. (14.18)
Логарифмируя (14.18), получаем
InN/N^ \nn— vD. (14.19)
Из (14.19) следует, что при D = О в полулогарифмической
системе координат экстраполяция прямолинейного участка дозо-
вой кривой пересекает ординату в точке, значение которой равно
числу мишеней. Это число, как уже ранее отмечалось, называют
экстраполяционным числом я.
При полной выживаемости
N/N0 = 1 =пГ*°*% (14 20)
откуда
D, = i£j2 = D0lnn и D37 = D0 + Dq. (14.21)
Поскольку в преобладающей части случаев клеточная гибель
от облучения определяется повреждением генетического аппарата
клеток, то, очевидно, полиплоидные клетки, обладающие
несколькими наборами хромосом я, каждая из которых несет некоторое
число генов /, должны отличаться большей радиоустойчивостью,
408
чем диплоидные. Поэтому известный интерес представляет модель
клеточного поражения, обусловленного одноударностью п
наборов^/ мишеней. Такую модель предложили американские
радиобиологи Циркл и Тобайес. Уравнение модели таково:
NLN0 = [1 — (1 — e-»D)n]1. (14.22)
Если доза облучения очень велика, то уравнение может быть
упрощено:
N/N0 = nler*lD. (14.23)
Кривые выживаемости имеют сигмоидальную форму, а экстра-
поляционное число в этом случае равно п1 и D0 = -j .
Линейно-квадратичная функция выживаемости. Одна
из широко распространенных молекулярных моделей пролифера-
тивной гибели клеток основывается на предположении, что
критическим событием, определяющим наступление гибели клетки,
являются двойные разрывы,, ДНК. Действительно, однонитевые
разрывы ДНК, как будет показано в дальнейшем, подвергаются
восстановлению, репарации, в связи с чем они могут и не играть
существенной роли в развитии лучевого поражения клетки.
Двунитевые разрывы молекулы ДНК теоретически могут
возникать двояким способом: при прохождении одной ионизирующей
частицы через двойную спираль ДНК, составляющей при этом
энергию в двух близко расположенных нуклеотидах, либо при
попадании в близкие нуклеотиды двойной нити двух независимых
квантов или частиц излучения. В первом случае число двунитевых
разрывов ДНК прямо пропорционально поглощенной дозе aD,
во втором — пропорционально квадрату дозы (Ю2. Среднее число
двунитевых разрывов при облучении клеток в дозе D составляет
n = aD + pD2. (14.24)
Коэффициенты аир отражают процессы, происходящие после
поглощения энергии в окрестности молекулы ДНК и реализации
повреждения в форме двойных разрывов.
Принимая, что распределение летальных событий в клетках
облученной популяции следует распределению Пуассона, и
обозначая вероятность пролиферативной гибели клетки,
обусловленной двойным разрывом, через /?, получаем выражение
N/N0 = e-rtaD+&Di\ (14.25)
где N — число выживших клеток; N0— исходное число клеток.
Как видим, показатель степени зависит от дозы и,
следовательно, в системе полулогарифмических координат дозовая зависимость
не имеет прямолинейного участка (рис. 216). Очевидно, по этой
криволинейности кривой можно определять значения параметров
предложенной модели.
Стохастическая концепция радиобиологии. Принципы
попадания и мишени находятся в полном соответствии с экспери-
409
O.lV
\
^ 0,01
0,001
0,0001
Рис. 216. Кривые выживаемости тетра-
плоидных (а) и диплоидных клеток (б):
D — доза радиации
10
15 ЦГр
ментальными результатами только
в случае весьма простых систем,
обнаруживающих одноударные иод-
номишенные радиобиологические
реакции. Такие реакции
встречаются не очень часто, и в большей
части случаев дозовые кривые
эффектов существенно отличаются от
простых экспонент. В связи с этим
наметился иной, отличный от
теории мииГени подход к анализу до-
зовых зависимостей эффектов
биологических систем. В этом подходе рассматривается не прямая
связь между первичным попаданием в мишень и выражением тест-
эффекта, а учитываются последовательные события, которые
могут сказаться на проявлении тест-эффекта.
Вследствие множественности элементарных событий,
отражающихся на переходах системы из одного состояния в другое,
возникновение тест-эффекта носит вероятностный характер. В теории
попадания и мишени вероятностный характер имеет лишь акт
первичного поглощения энергии мишенью. В данной же модели
вероятностный характер свойствен всем этапам становления
тест-эффекта. Такова основная идея подхода к анализу дозовых
зависимостей радиобиологических эффектов, получившего название
стохастической концепции. В качестве математического аппарата
стохастической концепции используется теория марковских
процессов и операции над многомерными матрицами и векторами
состояния биологической системы.
Поскольку сложность экспериментального исследования всех
мыслимых переходов в биосистеме очень велика, часто
рассматривают простейший случай, объединяя lcj состояния изучаемого
объекта в одну точку состояния. От дозы облучения зависит
значение вероятности отклонения системы от определенной кормы
реакции, в связи с чем коэффициент перехода рассматривается
как зависящий от дозы. Этот коэффициент перехода называют
реактивностью системы (R(D)). Полагают при этом, что изме-
d ( n\
пение выживаемости клеток с изменением дозы
онально числу выживших клеток и реактивности R(D):
-R(D)N/N0.
_d/_yv
dD\N0
(14.26)
В случае, когда реактивность системы не зависит от дозы,
кривые дозовых зависимостей радиобиологических эффектов имеют
экспоненциальный вид, в противном случае они сигмоидны. Как
410
видно, предельный случай в стохастической концепции вновь
приводит к принципу попадания и мишени.
Теории количественной радиобиологии клетки не
противоречат друг другу, а отличаются взаимной дополнительностью. Теория
мишени достаточно точно описывает ситуацию, когда тест-эффект
практически однозначно определяется одноударным
повреждением уникальной невосстанавливаемой ультраструктуры клетки.
Линейно-квадратичная модель вполне корректно интерпретирует
дозовые зависимости эффектов, зависящих от радиационного
выхода двунитевых разрывов ДНК. Стохастическая концепция
раскрывает вероятностную природу промежуточных явлений,
разделяющих акт первичного молекулярного повреждения и конечный
тест-эффект.
Теории количественной радиобиологии, как правило,
рассматривают в качестве тест-эффекта гибель клеток либо выход
мутаций. В том же случае, когда формирование лучевого поражения
захватывает более высокие уровни организации — ткани, органы
и организм в целом со всеми присущими им взаимодействиями
составляющих частей — приходится наталкиваться на весьма
сущестэенные отклонения дозовых зависимостей эффектов от
количественных закономерностей, вытекающих из рассмотренных выше
теорий количественной радиобиологии.
14.6. Кислородный эффект в радиобиологических явлениях.
Как уже было отмечено, развитие радиационно-химических
реакций при облучении многих типов соединений существенно зависит
от наличия свободного кислорода в реакционной среде. Этот
эффект объясняется взаимодействием 02 со свободнорадикальными
состояниями, которые индуцируются радиацией в молекулах
облучаемых веществ. Действие кислорода на выход радиационных
повреждений макромолекул сходно с его влиянием на
радиобиологические эффекты в сложных биологических системах — клетках,
тканях, многоклеточных организмах. Как правило,
модифицирующее влияние кислорода состоит в усилении лучевого поражения,
названном кислородным эффектом.
Кислородный эффект обнаруживается в реакциях
радиационной инактивации ферментов, повреждениях макромолекул,
живых клеток, тканей, многоклеточных сложных организмов. Он
проявляется при облучении биологических объектов в атмосфере,
содержащей кислород. При этом кислородный эффект выявляют
как при облучении оводненных систем, так и в веществах, не
содержащих веды.
Кислородный эффект обусловлен взаимодействием кислорода
со свободными радикалами R', которое приводит к образованию
перекисных радикалов ROO . В воде кислород с продуктами ради -
олиза воды образует ряд очень активных радикалов Н02, 0~*
и др.
Количественной оценкой кислородного эффекта является ко-
эффициент кислородного усиления (ККУ), показывающий, во
сколько раз усиливается лучевое поражение при облучении в дан-
411
ной дозе, если в среде был кислород, в сравнении с облучением
в аноксических условиях. Используют также отношение доз,
вызывающих одинаковый радиобиологический эффект при
облучении в аноксических условиях и при наличии кислорода в среде.
При облучении сухих препаратов нуклеиновых кислот ККУ
составляет 1,5—2,2.
Л. X. Эйдус обнаружил явление кислородного последействия,
состоящее в том, что инактивация биологических макромолекул,
облученных в аноксических условиях, может усиливаться под
влиянием кислорода, вводимого в среду уже после облучения.
Кислородное последействие свидетельствует о возникновении в
макромолекулах долгоживущих кислородчувствительных
повреждений, которые следует оценивать как потенциальные повре*
ждения; они могут в последующем проявиться либо не
проявиться—в зависимости от условий их реализации. Потенциальные
повреждения представляют собой стабильные свободнорадикаль-
ные состояния, регистрируемые с помощью метода ЭПР.
В водных растворах проявление кислородного эффекта
зависит от многих факторов, среди которых важную роль играет
наличие радиопротекторных соединений, в частности, содержащих
сульфгидрильные группы. Кислород выступает в качестве
конкурентного ингибитора этих соединений.
Механизмы кислородного эффекта при облучении живых
клеток не йашли еще полного объяснения. Достаточно четко
прослежена прямая связь между содержанием сульфгидр ильных
соединений в клетках и значением ККУ облучения, что указывает на
роль в проявлении кислородного эффекта конкурентных
отношений между кислородом и радиопротекторными веществами.
Изменениями в содержании сульфгидрильных соединений в клетках
объясняют варьирование значения ККУ.
ККУ при облучении живых организмов зависит от дозы
радиации, концентрации кислорода в клетках, качества питательной
среды, определяющей физиологическое состояние клеток, и т. п.
С возрастанием ЛПЭ значение ККУ уменьшается. Для
объяснения этого явления предложены гипотезы кислорода в треке и
взаимодействующих радикалов. Эти гипотезы сформулированы на
основе особенностей кинетики реакций 02 о продуктами радиолиза
тех или иных веществ при разной плотности их пространственного
распределения, времени жизни и эффективных диффузионных
пробегов.
Большие значения ККУ характерны для редкоионизирующих,
излучений.
Феноменология кислородного эффекта воспроизводится с боль*-
шой точностью. С этим эффектом связано ослабление
эффективности облучения клеток, пребывающих в состоянии гипоксии. В
радиотерапии опухолей специальной задачей является изыскание
специфических радиосенсибилизаторов гипоксивных клеток.
Одна из схем, поясняющих механизм кислородного эффекта,
имеет следующий вид:
412
R H химическая реституция
/ взаимодействие с 62 или
с сенсибилизатором,
отличающимся сродством
к е- — PC
RQO-+ROOH
Л-PC
фиксация
повреждения (14.27)
4
клеточная
гибель
14.7» Сублетальные и потенциально летальные повреждения
клеток. Количественное проявление того или иного клеточного
эффекта облучения зависит не только от значения дозы, но и от
ряда сопутствующих облучению факторов, в том числе от способа
облучения и от уровня обеспеченности клеток в момент облучения
и после него питательными веществами.
При фракционировании дозы ионизирующего излучения, когд?,
например, D50 разделяют на две полудозы, разделенные некоторым
промежутком времени А/, можно подобрать такие значения А/,
при которых после суммарного облучения выживаемость клеток
будет больше 50 %. Очевидно, эффект фракционирования,
проявляющийся уменьшением эффективности облучения при
фракционировании дозы (рис. 217), указывает на то, что повреждения,
возникающие в клетке в результате получения первой полудозы,.
должны провзаимодействовать с повреждениями,
индуцированными второй полудозой, прежде чем произойдет формирование тест-
реакции.
Со временем способность повреждений, нанесенных первой
фракцией дозы, взаимодействовать с поражениями, вызванными
второй полудозой, уменьшается. Если бы такого взаимодействия
вообще не было и повреждения независимо друг от друга
реализовались в тест-реакции — гибели клетки, то трудно было бы
ожидать проявления эффекта фракционирования. Выявляемые таким
способом повреждения названы сублетальными, а уменьшение со
временем числа сублетальных повреждений считают их
репарацией.
Конечно, понятие о
сублетальных повреждениях в сделанном
выше определении носит несколько
условный характер, как, впрочем,
и.утверждение о взаимодействиях
сублетальных повреждений и их
репарации. Тем не менее, если
перейти на языкрадиационно-хими-
чесяих событий, реализующихся
Рис. 217. Кривые выживаемости клеток 0,001\
млекопитающих при фракционировании
дозы гамма-лучей:
/ — доза дана сразу без фракционирорания;
2 — фракционирование дозы с интервалом меж- 00001
АУ полудозами 1ч; 3 » то же. 4 ч; 4 *-то '
!ке, 6 ч i
§ ш
I
ком
fi,rP
41»
в тест-реакции, можно находить определенные связи между
сублетальными повреждениями и конкретными типами
молекулярных радиационных повреждений.
Если облученные клетки некоторое время выдерживать на
водопроводной воде (когда ухудшенные трофические условия
тормозили деления клеток), то выживаемость последних
существенно возрастала. Этот факт истолковывают таким образом, что в
клетках при облучении возникают повреждения, которые в
зависимости от условий, созданных для клеток, могут проявляться либо
не проявляться соответствующей тест-реакцией. Такие
повреждения названы потенциально летальными. Повышение выживаемости
клеток на голодной среде связывают с репарацией потенциально
летальных повреждений.
Сублетальные и потенциально летальные повреждения не
тождественны по характеру обусловленных ими клеточных
радиобиологических эффектов и по типу относящихся к нимрадиацион-
но-химическим нарушенияхМ молекул. Сублетальные повреждения
связывают с однонитевыми, а потенциально летальные — с дву-
нитевыми разрывами молекул ДНК.
Не все сублетальные и потенциально летальные повреждения
подвергаются репарации даже при самых благоприятных условиях
для этого восстановительного процесса. Нерепарабельность
повреждений находит отражение в наличии необратимой компоненты
лучевого повреждения и обусловлена, по-видимому, ошибочной
репарацией сублетальных и потенциально летальных
повреждений, что наблюдается при большом числе повреждений,
приходящихся на клетку. При небольших значениях поглощенных доз
радиации, когда даже одно повреждение на клетку в клеточной
популяции является редким событием, выявить нерепарабельные
повреждения весьма трудно.
Кинетика восстановления клеток от сублетальных повреждений
подчиняется экспоненциальной зависимости: q = е т, где q —
среднее число сублетальных повреждений на клетку; t — интервал
времени между двумя фракциями дозы; т — среднее время жизни
сублетального повреждения.
Влияние мощности дозы на радиобиологический
эффект. Восстановление клеток от сублетальных повреждений
проявляется при пролонгированном облучении, когда наблюдаемый
эффект слабее, чем при однократном облучении в той же дозе при
высокой мощности дозы радиации. Очевидно, с уменьшением
мощности дозы при облучении уменьшается вероятность взаимодействия
сублетальных повреждений вследствие их репарации. Этим
объясняют зависимость радиобиологического эффекта от мощности дозы
излучения, обнаруживаемого с помощью разных тест-реакций —
клеточной гибели, отсрочки вступления клеток в митоз, выхода
мутаций и др. Для выявления зависимости степени проявления
радиобиологического эффекта от мощности дозы излучения
следует варьировать мощности дозы в довольно широких пределах.
414
14.8. Прямые и непрямые эффекты облучения клеток. При
облучении живых клеток ионизирующим излучением
радиобиологический эффект начинается с появления вдоль трека частиц или
квантов возбужденных и ионизированных молекул, атомов и соль-
ватированных электронов. Дальнейший этап развития лучевого
эффекта связан с превращениями этих первично возникших
активных форм вещества, их диффузией из области трека и атакуемо-
стью соответствующих молекул-мишеней, от которых зависит
проявление тест-эффекта. При этом, как и в случае влияния
радиации на модельные системы в форме чистых веществ, их смесей
и растворов, следует различать прямые и непрямые эффекты
облучения.
Прямые эффекты состоят в том, что повреждение биологически
важной молекулы-мишени происходит вследствие прямого
попадания в нее частицы или кванта излучения, вызвавшего ионизацию
или возбуждение, которое влечет за собой формирование
биологически значимого молекулярного повреждения. Непрямой эффект
облучения обусловлен тем, что повреждение биологически
важных молекул, от которых зависит проявление тест-реакции,
наносится в ходе вторичных радиационно-химических реакций с
участием химически активных форм вещества, возникающих во
втором и последующих поколениях радиационно-химического
процесса. Поскольку развитие вторичных реакций во многом
определяется физико-химическими условиями среды — наличием
способных к окислительно-восстановительным реакциям примесей,
кислорода, кислотности и т. д., то в сфере непрямых эффектов
облучения можно ожидать реальной возможности воздействовать на
радиационный эффект теми или иными факторами.
Вклад прямых и непрямых эффектов в биологически значимое
повреждение макромолекул и ультраструктур клетки оценивают
подробным выяснением характера радиационно-химических
превращений в клетке, возникающих в ходе этих превращений
активных форм молекул, в частности свободных радикалов, времени
ях жизни, условий диффузии, происходящей без диссипации
энергии ниже требуемого для проявления активности уровня. В таких
исследованиях существенное значение имеют установление природы
промежуточных продуктов реакций, нахождение в сфере реакций
радиопротекторных или радиосенсибилизирующих соединений.
Раскрытие конкретной радиационно-химической природы
явлений, относящихся к прямым и непрямым эффектам облучения,
придает реальный смысл формализованным понятиям теории
мишени и другим конценциям количественной радиобиологии. Так,
тест-реакции, в которых выражается радиобиологический
клеточный эффект, зависят от нарушений функций определенных
клеточных органелл. Например, мутация возникает при нарушенной
функции генома, изменение мембранного потенциала отражает
нарушение функции плазмалеммы и т. д. Поэтому логично выделять
повреждения отдельных ультраструктур клетки, ответственные
за тест-реакцию на облучение.
415
Молекулярные повреждения компонентов этих
ультраструктур клетки происходят в том случае, когда акт передачи энергии
веществу происходит в объеме, в пределах которого возможна
диффузия свободных радикалов и других активных форм молекул
к повреждаемой структуре. Этот объем и является эффективным.
Размеры и топография эффективных объемов клеточных структур
определяются конкретным типом тест-реакции на облучение и
состоянием клетки в момент облучения и развития лучевого
поражения. Потеря ультраструктурой клетки функциональной
активности зависит от молекулярных нарушений ее компонентов. Эти
компоненты и представляют собой мишень. В мембранах мишенью
могут быть липиды и отдельные белки, в хромосоме—молекулы
ДНК и т. д. Естественно, тест-реакция на облучение проявится
в том случае, когда в клетке не имеется возможности
компенсировать ущерб, обусловленный потерей активности соответствующей
структуры. Поэтому отличают повреждения массовых структур
клетки от .повреждений ее уникальных структур.
К уникальным структурам относят ДНК ядра клетки, так как
многие гены не дублируются и их повреждение неизменно
проявится соответствующей тест-реакцией. О том, что повреждение ядра
клетки более опасно, чем нарушение цитоплазматических
массовых структур, говорят результаты экспериментов, в которых
достаточно тонким пучком быстрых дейтронов или альфа-частиц
облучали отдельные зоны клетки.
14.9. Линейная передача энергии (ЛПЭ) и относительная
биологическая эффективность облучения. Воздействие разными видами
ионизирующего излучения при одних и тех же поглощенных
дозах может сопровождаться разными по интенсивности проявления
радиобиологическими реакциями. Это свойство ионизирующего
излучения называют его качеством и количественно
характеризуют величиной относительной биологической эффективности
(ОБЭ). ОБЭ определяют, сравнивая дозу данного излучения,
вызывающего определенный тест-эффект, с дозой стандартного
излучения, при которой наблюдается такой же радиобиологический,
эффект. В качестве стандартного излучения обычно используют
рентгеновское излучение с энергией 180—250 кэВ. Применяют
также для сравнения и гамма-лучи в0Со, ОБЭ которых по
отношению к рентгеновским лучам близка к 1.
Значения ОБЭ удобно рассчитывать, используя кривые дозо-
вых зависимостей радиобиологического эффекта для данного
излучения и стандартной радиации. Если обозначить дозу
рентгеновских лучей, при которых наблюдается определенный
радиобиологический эффект, через Dl, а дозу данного излучения, вызывающую
количественно такой же эффект, через D£, to ОБЭ рассчитывают
по соотношению:
ОБЭ = Drk!Dl i (14.28)
Для клеток бактерий и млекопитающих в культуре связь
между ОБЭ и ЛПЭ определяется характером микрораспределения
416
Рис. 218. Схематическое изображение способов облучения клеток,
приводящих к различным плотностям ионизации (обозначено цифрами) в клетке (а)>
Сравнительное распределение ионизации вдоль треков плбтноионизирующ^
радиации (1) и редкоионизирующего излучения (2)(б)
поглощенной энергии в генетических структурах и эффективностью
репарации (рис. 218). С увеличением ЛПЭ до определенного
предела выход дв^нитевых разрывов достигает максимума, ОБЭ
уменьшается. Для тяжелых ионов высокой энергии ОБЭ приближается
к единице.
14.10. Модификация радиобиологических эффектов.
Проявление радисЛСиблогического эффекта может изменяться под
влиянием факторов физической и химической природы, получивших
наименование модификаторов лучевого поражения.
Модификация радиобиологического эффекта достигается
разными путями: изменением выходов первичных радиационно-хими-
ческих реакций, дезактивацией свободных радикалов и других
активных продуктов радиолиза, активацией или ингибированием
4*7
репарационных, восстановительных процессов, переводом
клетки в состояние, при котором устраняются потенциально летальные
повреждения и т.п. Как видно из этого далеко не полного перечня
причин модификации, этот процесс осуществляется на разных
уровнях организации клетки, охватывая разные этапы формирования
лучевого поражения. В зависимости от механизма модификации
радиационного эффекта, действие модификатора окажется
наиболее эффективным в определенные моменты относительно облучения.
Модификатор, влияние которого проявляется при воздействии на
биосистему до облучения, является модификатором
профилактического действия. Если же его эффективность проявляется после
облучения, то его относят к модификаторам терапевтического
действия.
Многие из веществ-модификаторов лучевого поражения должны
находиться в сфере радиационно-химических реакций в момент
их зарождения, чтобы обеспечивались взаимодействия
модификатора с продуктами первичных превращений. Вещества,
ослабляющие проявление лучевой реакции, называют
радиопротекторами, а усиливающие тяжесть лучевого поражения— радиосен-
сибилизатор ами.
В основе радиопротекторного действия веществ могут лежать
многие механизмы. Из них наиболее полно изучены механизмы,
изменяющие ход первичных реакций прямого и непрямого
действия радиации. Так, защита может достигаться путем перехвата
радиопротектором активных радикалов (что ослабляет атаку-
емость с их стороны биологически важных макромолекул), путем
восстановления протектором радикальных состояний
макромолекул, а также перехватом и дезактивацией
радиосенсибилизаторов.
Сильным радиопротекторным действием отличаются сульфгид-
рильные соединения: цистеин, декарбоксилированный цистеин —
цистеамин, его дисульфид—цистамин, который раз в 5 более
эффективен, чем цистеин. Высокая эффективность свойственна
получившему широкое распространение в медицинской практике
аналогу цистеамина — (3-аминопропиламино)-этил фосфотио новой
кислоте, проявляющей селективную защиту от лучевого
поражения нормальных клеток, но не опухолей, что имеет очень большое
значение их в радиотерапии. К радиопротекторам относятся
также вещества, повышающие уровень эндогенных тиолов в
клетках либо индуцирующие на момент облучения гипоксивность.
Многие физиологически активные вещества также оказались
радиопротекторами, растягивая период клеточного гЩкла, в
пределах которого клетка отличается повышенной радиоуТ?гойчивостью,
либо активируя репарационные процессы.
Радиосенсибилизаторы, проявляющие свою активность на
уровне радиационно-химических процессов, усиливают радиационное
поражение, активируя малоактивные радикалы, конкурируя с на-
тивными соединениями радиопротекторного действия,
предотвращая рекомбинацию свободных радикалов. Радиосенсибилизиру-
418
ющее влияние оказывают соединения, способствующие
проявлению кислородного эффекта либо оказывающие сходное действие
с кислородом, обладая сродством к электрону. Усиливают
лучевое поражение вещества, понижающие содержание эндогенных
тиолов.
Среди радиосенсибилизаторов очень многие оказываются
токсическими сами по себе для клетки. Между тем, для медицинских
целей необходимо иметь радиосенсибилизаторы низкой
токсичности, избирательно действующие на гипоксивные опухолевые
клетки. К таким относятся соединения, понижающие в клетках
содержание сульфгидрильных соединений, в частности глутати-
она — бутионинсульфоксимин, диэтилмалеат. На гипоксивные
клетки опухоли избирательно действует мизонидазол (1-(2-нитро-1-
имидазолил)-3-метокси-2-пропано), ингибирующий
восстановление потенциально летальных повреждений. По изменению дозо-
вых кривых при сенсибилизирующем действии мизонидазола
можно заключить, что его влияние сказывается на значении
коэффициента а, отражающего выход двунитевых разрывов в уравнении
линейно-квадратичной модели.
Радиосенсибилизирующее действие оказывают разобщители
окислительного фосфорилирования и вещества, понижающие
содержание циклических мононуклеотидов. Некоторые соединения,
усиливающие индуцированную облучением деградацию ДНК,
также оказываются радиосенсибилизаторами. К ним, например,
относится гидроксамовая кислота. Радиосенсибилизирующие
свойства характерны также для веществ, подавляющих
восстановление повреждений ДНК, ингибирующих ферменты
репарации, репликации, транскрипции и трансляции. Поэтому среди
радиосенсибилизаторов встречаются антибиотики (актиномицин
Д) и аналоги нуклеозидов и азотистых оснований (фтордезоксиури-
дин, бромдезоксиуридин). Ингибитором репарации является
кофеин.
Как видно, радиопротекторы и радиосенсибилизаторы
клеточных процессов более многообразны, чем выявленные для модельных
радиационно-химических систем.
Количественную оценку эффективности модификаторов
лучевого поражения получают, рассчитывая отношение /С, которое
называется фактором изменения дозы (ФИД):
Доза излучения, обусловливающая определенное
„ проявление тест-реакции
^ Доза излучения, вызывающая такое же проявле- (14.29)
ние тест-реакции при наличии модифицирующего
фактора
В качестве количественной меры лучевого эффекта (тест-
реакции) используют, например, значения D50 или D0. Могут
использоваться не только показатели выживаемости клеток,
но и количественные значения других радиобиологических
эффектов, таких как выход мутаций, хромосомных аберраций, частота
трансформаций клеток, образования катаракт и т. п.
419
0,1
4o,oi
г
V
l
^Чччч/
1 1 1
Рис. 219. Графический расчет фактора
уменьшения дозы (ФУД):
/ — кривая выживаемости клеток, подвергнутых
радиопротектору, 2 — кривая выживаемости клеток в
контроле; Дх и Д2 — дозы Д37 для первой и второй
кривой, ФУД = Д1/Д2
Для радиопротекторов К < 1, для
радиосенсибилизаторов К > 1. Для ра-
ппп1\ i , i , диопротекторов применяют также ве-
D2 D1 я,усл.ед. личину — фактор уменьшения дозы
(ФУД) (рис. 219) и коэффициент
защиты (КЗ). Последний рассчитывают как соотношение между
значениями DS7 при добавлении радиопротектора и без него.
Значения ФИД зависят от дозы излучения, мощности дозы,
ЛПЭ, фазы клеточного цикла, в которой пребывают клетки в
момент облучения, характера питательной среды и т. п. Наиболее
высокие значения ФИД для животного организма близки к 2,
для растений могут быть значительно выше.
Радиомиметики — вещества, которые оказывают на живые
клетки такое же действие, как и облучение, как бы имитируя
лучевое поражение. Радиомиметические вещества оказывают
мутагенное и канцерогенное действие, вызывают гибель клеток. К ра-
диомиметикам относятся алкилирующие соединения — иприт, эти-
ленимин и др. Очевидно, радиомиметики действуют синергично
с радиосенсибилизаторами.
В радиопротекторных эффектах и в радиосенсибилизации
следует учитывать синергизм и аддитивность действия
содержащихся в облучаемой системе соединений, обладающих радиосен-
сибилизирующими или радиопротекторными свойствами.
14.11. Восстановление клеток от лучевого поражения. Живые
клетки способны восстанавливаться от молекулярных
повреждений, индуцированных облучением, благодаря чему повышается их
жизнеспособность. Избавление от молекулярных повреждений
называется репарацией клетки. Если устраняются повреждения
ДНК, то говорят о репарации ДНК. Этот тип репарации
представляет собой важнейший для жизнедеятельности процесс, благодаря
которому поврежденная радиацией ДНК вновь приобретает
ненарушенную структуру.
Репарационные процессы осуществляются специальными
системами, называющимися репарационными. Специальные системы,
способные устранять повреждения, нанесенные ионизирующими
излучениями, возникли в процессе эволюции вовсе не для того,
чтобы защищать клетки от поражающего действия ионизирующей
радиации: они служат исправлению компонентов клетки от
спонтанно возникающих в них повреждений.
Наиболее подробно изучена репарация ДНК, менее раскрыты
механизмы репарации мембран клетки. Молекулярные
повреждения множественных структур, по-видимому, не требуют
специальных механизмов репарации, так как вследствие нарушения
молекулярного узнавания макромолекулы с нарушенной структурой
420
5'\ |
J'l 1
/
J'l J 1
2
Ь\ I 1
л'1 1 1
J
5 1 1 1
т 1 1 1
и
з'| 1 |
j'L I
/<^Г\
1 11 1 1 1 11 1 1 1 1 1 1 11
\ uvrABC
1 1 1 1 1 1 1 I I I l 1 1 1 1 1
ттт ' W
И 1 м 11111111111
1 Poll
1 <
1 | | 1 1 1 1 1 1 1 и | ! I |
1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1
1 Лигаза
iiij;
i (ij
1 1 \s'
11 Н:
1 1 lJ'
I 1 Iv
1 1 |J'
[lis'
Рис. 220. Схема эксцизионной
репарации ДНК:
/ — продукты генов uvr ABC делают надрезы
с обей* сторон участка нити ДНК, несущей
повреждение (пиримидиновый димер Р), 2 — под
влиянием экзонуклеазы возникает брешь;
3 — полимераза (Pol I) застраивает брешь в
нити ДНК, используя в качестве матрицы
неповрежденную сестринскую нить; 4 — происходит
лигазная сшивка синтезированного фрагмента
о 3' и б'-концами
выпадают из соответствующих
надмолекулярных ассоциаций и
подвергаются гидролизу; на их место
вводятся неповрежденные
молекулы, синтезированные de novo.
Поврежденные низкомолекулярные
соединения элиминируются из
участия в метаболических процессах.
Установление самого факта существования специальных
систем репарации явилось событием, чрезвычайно важным для
биологии, так как обнаружилось функционирование систем коррекции
генетического управляющего аппарата клетки. С репарацией ДНК
оказались связанными процессы мутагенеза, старения и ряд
других явлений, свойственных клетке.
Оказалось, что репарация устраняет молекулярные
повреждения ДНК, как спонтанно возникающие, так и индуцированные
действием ионизирующих излучений, химических агентов,
ультрафиолетовыми лучами, канцерогенами. При существенных
различиях механизмов повреждающего ДНК действия перечисленных
факторов, вызываемые ими молекулярные повреждения ДНК
оказываются в определенной мере сходными. Эти повреждения
являются субстратом действия репарирующих систем клетки и
поэтому сходные механизмы устраняют повреждения ДНК,
индуцированные разными агентами.
К настоящему времени способность к репарации ДНК по тому
или иному механизму установлена в клетках млекопитающих и
человека, растений, бактерий. Однако наиболее подробно механизмы
репарации изучены у бактерий, и большая часть сведений об этом
уникальном процессе относится к бактериальным системам.
Эксцизаонная репарация. Как уже ранее отмечалось,
под влиянием ультрафиолетовых лучей в ДНК возникают
фотопродукты в виде циклобу та новых димеров пиримидиновых
оснований. Эти продукты расщепляются путем фотореактивации.
Ферментативная фотореактивация расщепляет пиримидиновые
димеры при действии видимого света.
Пиримидиновые димеры и ряд иной природы повреждений ДНК
могут подвергаться репарации без участия фотореактивирующего
фермента, в темноте с помощью механизма эксцизионной репарации
(рис. 220). Этот тип репарации состоит из этапов разрыва связи
у повреждения (инцизия), выщепления фрагмента ДНК,
содержащего повреждение (эксцизия), репаративного синтеза в месте уда-
421
ленного фрагмента ДНК с использованием в качестве матрицы
неповрежденного участка оппозиционной нити ДНК (репаративная
репликация) и воссоединения концов ресинтезированного участка
ДНК с концами бреши репарируемой нити.
Инцизию осуществляют ферменты — эндонуклеазы. В
экспозиционной репарации пиримидиновых димеров принимает участие
специфическая УФ-эндонуклеаза, которая расщепляет нить ДНК
со стороны б'-конца от димера. Репарацию депуринизованной ДНК
начинают специфические апуриновые эндонуклеазы (АП-эндонук-
леазы), разрывающие нить ДНК со стороны 3'-или 5'-концовот
дефекта. Эндонуклеолитические разрывы происходят и при
появлении дефектов ДНК, индуцированных ионизирующими
участками. Участник инцизии в этом случае — 7"ЭНД°НУК"
леаза.
Эксцизия —выщепление некоторого числа нуклеотидов вместе
с повреждением — приводит к появлению в нити ДНК пробелов,
брешей. Эксцизия осуществляется под влиянием экзонуклеазной
активности, которой, например, обладает ДНК-полимераза I,
принимающая участие в эксцизионной репарации пиримидиновых
димеров у бактерий. Известно, кроме того, еще несколько эндо-
нуклеаз. Удаление части нуклеотидов —- образование бреши —
необходимо для того, чтобы могло осуществиться взаимодействие
разорванных концов ДНК с репарирующими ДНК-полимеразами.
Размер брешей, возникающих в результате деградации ДНК,
различен: в клетках дикого типа кишечной палочки (Е. coli) на один
выщепленный димер удаляется около 30 нуклеотидов; в некоторых
случаях бреши оказываются настолько обширными, что
затрудняют дальнейшие этапы репарации.
Бреши в нити ДНК застраиваются синтезируемыми на
комплементарном неповрежденном участке оппозитной нити ДНК-
Этот репаративный синтез у бактерий осуществляют ДНК-поли-
меразы I, II и III, а в клетках млекопитающих, видимо, (3-ДНК-
полимераза. Различают пути репаративного синтеза короткими
и длинными фрагментами.
Репаративный синтез можно выявить, наблюдая включение
меченых предшественников (например, 3Н-тимидина) в состав
ДНК в фазы клеточного цикла, когда не происходит репликации
ДНК, либо при ингибировании репликативного синтеза. В этих
случаях включение меченых предшественников в ДНК называют
внеплановым синтезом.
Эксцизионная репарация завершается воссоединением
ресинтезированного фрагмента с нитью ДНК* Этот процесс
обеспечивается ДНК-лигазой.
Репарация однонитевых разрывов ДНК. При
изучении разрывов молекулы ДНК обнаруживают такие типы
повреждений: истинные однонитевые разрывы; ферментлабильные
участки, которые в ходе эксцизионной репарации могут образовать
однонитевой разрыв; однонитевые бреши, образующиеся в
результате обширной деградации ДНК; метастабильные состояния, возни-
422
кающие в случае, если на оппозитных нитях ДНК развиваются
однонитевые бреши. Эти состояния при инструментальном
исследовании ДНК выявляются как двунитевые разрывы; прямые дву-
нитевые разрывы, возникающие в оппозитных участках обеих
нитей ДНК в первичном акте передачи энергии ионизирующего
излучения; энзиматические двунитевые разрывы, возникающие энзи-
матическим путем из метастабильных состояний. J'
Центрифугирование денатурированной ДНК, выделенной из
клеток в разное время после облучения, проводят в градиенте
плотности сахарозы при щелочной реакции среды.
Центрифугирование показывает, что число однонитевых разрывов (сумма
прямых однонитевых разрывов и депуринизованных участков,
ведущих себя в щелочи как однонитевые разрывы и потому
называемых щелочелабильными повреждениями) может уменьшаться, что
говорит о репарации однонитевых разрывов ДНК, различающейся
по скорости,— сверхбыстрой, быстрой и медленной.
Сверхбыстрая репарация однонитевых разрывов не зависит
от состава питательной среды. Представляет собой радиационно-
химическую реакцию. При 273К требует 2 мин. Быстрая
репарация происходит по механизму, схожему с идущими после инцизии
этапами эксцизионной репарации, завершающейся лигазной
сшивкой ресинтезированного фрагмента. Медленная репарация
требует до 1 ч при 310К и происходит на полной питательной среде.
В этом этапе репарации принимают участие ДНК-полимераза III
и некоторые факторы белковой природы.
Репарация двунитевых разрывов ДНК. О количестве
двойных разрывов ДНК судят по скорости седиментации ДНК
при центрифугировании в градиенте плотности сахарозы с
нейтральной реакцией среды, в которой ДНК сохраняет двухспи-
ральность, вследствие чего при центрифугировании не
проявляются одиночные разрывы. В летальном эффекте ионизирующего
излучения именно двунитевым разрывам отводится решающая
роль. Оказалось, что и данный тип повреждения ДНК
подвергается репарации.
Имеются сведения о том, что у ДНК бактерий, дрожжей и
клеток млекопитающих, облученных рентгеновскими лучами, после
инкубации молекулярная масса ДНК восстанавливается. Для*
репарации двунитевых разрывов необходимо наличие
неповрежденных участков гомологичной ДНК. Поэтому репарация двунитевых
разрывов не может"происходить в гаплоидных клетках,
находящихся в Gx-фазе, но происходит в клетках, обладающих кратным
набором гомологичных молекул ДНК. Полагают, что репарация
двунитевых разрывов осуществляется путем генетической
рекомбинации, в ходе которой формируется временный гетеродуплекс,
раскрываются однонитевые участки, на которых происходит ре-
паративный синтез ДНК.
Высокую радиоустойчивость некоторых бактерий, например,
Micrococcus radiodurans объясняют способностью его клеток
к активной репарации двунитевых разрывов ДНК.
и*
423
Пострепликативная репарация ДНК. Если
повреждения отдельных нуклеотидов, пиримидиновые димеры не подверглись
репарации до наступления репликации и если эти повреждения
не блокируют движения вилки репликации, то дочерние нити
характеризуются пониженной молекулярной массой, так как
напротив повреждений при репликации возникают пробелы. Оказалось,
что при инкубации облученных клеток в питательной среде
молекулярная масса дочерних нитей может возрастать, что указывает
на проявление репарационного процесса. Репарация пробелов
в дочерних нитях ДНК в постсинтетическую фазу цикла называют
пострепликативной репарацией.
Пострепликативная репарация может происходить путем ре-
комбинационных обменов между сестринскими дуплексами,
репарационной репликации пробелов, непрерывного синтеза новой
ДНК на неповрежденных матрицах. Перечисленные модели
процесса требуют еще экспериментальных подтверждений.
Индуцибельная репарация, SOS-репарация.
Имеются основания считать, что в пострепликативной репарации ДНК
принимают участие индуцируемые возникшими повреждениями
ДНК генные продукты, в норме не содержащиеся в клетке. Отсюда
и название этого типа репарации, механизм которой еще не
раскрыт, SOS-репарация. Поводом для предположения об индуцибель-
ной SOS-репарации послужили результаты опытов с вирусами,
выживаемость которых после облучения ультрафиолетовыми лучами
резко повышалась в том случае, когда клетки хозяина также
подвергались воздействию ультрафиолетовой радиации. При этом
наблюдается и повышенная мутабильность вируса, что,
по-видимому, указывает на то, что SOS-репарация проходит с допущением
ошибок в исправлении ДНК.
Одноэтапные способы репарации ДНК. Известны
совсем простые способы репарации некоторых типов повреждений
ДНК. Так, апуриновые участки могут непосредственно заполняться
соответствующим основанием под влиянием фермента инсертазы.
Модифицированное основание может быть выщеплено без
последующей деградации ДНК. Осуществляет этот процесс фермент N-гли-
козилаза. После действия N-гликозилазы следует инсертазный
путь включения требуемого нуклеотида.
По-видимому, могут подвергаться репарации и поперечные
сшивки ДНК — очень опасные повреждения, которые
препятствуют движению вилки репликации. Предполагают также, что
возможны репарационные устранения сшивок ДНК — белок и ДНК —
РНК.
Таким образом, живые клетки обладают разнообразными
способами избавления от повреждений ДНК. Тем не менее, далеко
не всегда удается обнаружить четкую связь между эффективностью
репарационных систем и восстановлением выживаемости клеток.
Это указывает на то, что собственно репарация ДНК представляет
собой один из этапов восстановления клетки, который должен
дополняться .другими восстановительными процессами.
424
При репарации ДНК как ошибки репарации иногда возникают
нерепарабельные повреждения. Этот процесс называют ошибочной
репарацией.
В результате при выявлении повреждений ДНК обнаруживают
собственно радиационные повреждения, не подвергшиеся
репарации, и вторичные повреждения, возникшие в результате
ошибочной репарации.
Гены, контролирующие репарацию ДНК. Основную роль
в установлении механизмов репарации ДНК сыграло
использование мутаций бактерий и клеток человека, дефектных по генам,
продукты которых контролируют тот или иной этап
репарационного процесса.
Известно значительное количество мутантных форм, двойных
и тройных мутантов ряда организмов, резко различающихся по
устойчивости к действию ультрафиолетовых лучей и
ионизирующей радиации. Например, в клетках человека этап инцизии
в эксцизионной репарации контролируют продукты более 7 генов.
С особой полнотой подсбран ряд мутаций бактерии кишечной
палочки, использование которых позволило воссоздать картину
механизмов репарации ДНК в бактериальной системе.
Идентифицировано большое число генов, продукты которых имеют
отношение к репарации, число промоторов и областей гомологии,
выяснена локализация генов у бактерий.
В раскрытии механизмов репарации ДНК в клетках человека
большое значение имели исследования клеток с дефектами генов,
контролирующих отдельные этапы эксцизионной репарации.
Репарация мембран клетки. После облучения клеток
ионизирующей радиацией нарушаются мембранные процессы:
изменяется мембранный потенциал, проницаемость мембран, активность
связанных с мембранами ферментов. Со временем эти изменения
не регистрируются, так как мембрана возвращается к норме.
Эти факты можно рассматривать как результат репарации
мембран, восстановления их структурной и функциональной
активности. Репарация мембран состоит в устранении повреждений ее
компонентов, что достигается обновлением состава мембранных
структур. Такое обновление постоянно происходит и в норме.
/Это необходимо вследствие того, что при обычных температурах
в клетке имеют место спонтанные события автоокисления липидов,
повреждения молекул белков, сказывающиеся на функциях
мембраны. Этому негативному явлению противодействует процесс
обновления мембран, состоящий в том, что из мембраны в цито-
золь отчленяются участки с поврежденными молекулами. Такое от-
членение обусловлено распадом молекулярных сборок. На место
устраненных участков мембраны встраиваются новые компоненты
мембран, поставляемые внутренним сетчатым аппаратом
(аппаратом Гольджи) или иными элементами эндоплазматического рети-
кулума. В результате в клетке постоянно осуществляется
мембранный поток, который количественно характеризуют временем
половинного обновления того или иного компонента мембраны.
425
При .облучении клеток в определенном интервале доз
ионизирующего излучения скорость мембранного потока возрастает, чему
соответствует и увеличение скорости синтезов отдельных
компонентов мембраны. Такое ускорение обновления мембранной
системы клеток обеспечивает ее репарацию.
14.12. Действие ионизирующего излучения на многоклеточный
организм. Исследование действия ионизирующего излучения на
многоклеточный организм имеет большое значение, так как,
в конечном счете, основная задача радиобиологии заключается
в изыскании способов защиты человека, животного и
растительного мира от поражающего влияния излучений.
С усложнением структуры биологической системы изменяется
и характер тест-реакций на облучение. В многоклеточном
организме облучение инициирует ряд процессов, которые в своей
совокупности составляют радиационный синдром. Если при
облучении клеток основными тест-реакциями являются клеточная
гибель, трансформация или появление точковых или хромосомных
мутаций, то при облучении многоклеточных организмов в качестве
тест-реакции приходится использовать более сложные
характеристики лучевого поражения, так как даже гибель организма
после облучения является результатом наложения многих
патологических проявлений лучевой болезни.
Многоклеточный организм в сравнении с клеткой и клеточной
популяцией имеет дополнительные уровни организации —
тканевой, органный и целостного организма. Если в клеточной
популяции облучение приводит к гибели части клеток, что
регистрируется в значении выживаемости клеток, то в случае
многоклеточного организма гибель отдельных клеток в ткани маскируется
многообразным наслоением патофизиологических процессов
радиационного синдрома. Разные ткани организма отличаются не^
одинаковой радиоустойчивостью, что объясняется особенностями
составляющих ткань клеток. При облучении организма его
выживаемость и степень проявления радиационного синдрома
определяются выходом за пределы нормы функционирования наиболее
повреждаемых тканей и органов, играющих определяющую роль
в жизнедеятельности организма. Такие ткани, и органы относят
к. критическим.
У многоклеточных растений критической тканью является
меристема, клетки которой отличаются значительно меньшей
радиоустойчивостью, чем клетки других тканей. В то же время
деления клеток меристемы образуют основу морфогенеза.
Естественно поэтому, что поражение меристем растения как его критической
ткани является причиной гибели всего организма.
У животных и человека радиационное поражение имеет
системный характер, по-разному проявляясь в зависимости от /
уровня доз облучения. По клинической картине проявления
острой лучевой болезни выделяют три патогенетических механизма
лучевого поражения: 1) при меньших дозах в качестве
критической ткани выступает костный мозг, поражение которого сказывает-
426
ся на гемопоэзе; 2) при более высоких дозах гибель наступает
в результате поражения ткани кишок; 3) при еще более высоких
дозах — вследствие церебральных нарушений.
Разумеется, в отношении разных тест-реакций на облучение
организма критическими могут оказаться разные ткани.
Например, если в качестве тест-реакции выступает генетическое
поражение, проявляющееся накоплением мутаций в ряду поколений, то,
естественно, критическими тканями животных являются гонады.
Если же тест-реакцией являются соматические эффекты, то
критические ткани — иные.
Радиочувствительность тканей организма следует широко
известному правилу Бергонье и Трибондо, сформулированному
еще в 1906 г. Это правило гласит: радиочувствительность клеток
в ткани тем выше, чем больше их полиферативная активность
и меньше степень дифференциации. Поэтому понятно, почему
критическими тканями оказались клетки кроветворения и
эпителия кишок у животных и меристемы — у растений. Ведь это —
делящиеся клетки стволовых тканей.
Основными характеристиками стволовых тканей являются
скорость митозов, время обновления клеточной популяции ткани,
способность клеток к миграции, размеры клоногенной фракции
клеточной популяции, соотношение клеточной пролиферации
и дифференциации.
Способствует высокой радиочувствительности стволовых
клеток состояние хроматина их ядер и деления, в ходе которых может
проявиться репродуктивная гибель. Кроме того, в ходе
последовательных делений стволовых клеток возможно выделение
отдельных мутантных дефектных клеток, что может проявиться
в форме отдаленных последствий облучения.
В норме численность клеточной популяции стволовых тканей
изменяется, следуя строгим количественным закономерностям.
Если под влиянием облучения часть клеток погибает, то
сохранившие способность к делению клетки ускоряют продвижение по
циклу и путем увеличения нормы делений восполняют ущерб,
нанесенный облучением клеточной популяции. Это явление
называется репопуляцией, а способ восстановления стволовой ткани
путем репопуляции — репопуляционным восстановлением. В
период репопуляционного восстановления стволовых тканей может
замедлиться образование производных тканей или интенсивность
иной выполняемой стволовой тканью функции. Все эти процессы
находят отражение в симптоматике лучевой болезни.
Радиочувствительность клеток в разные фазы кле»
точного цикла. Радиочувствительность делящихся клеток
изменяется с продвижением их по клеточному циклу. Клеточный
митотический цикл состоит из ряда фаз — пресинтетической Gt,
синтетической, или репликативной, S (на протяжении которой
происходит репликация ДНК), пострепликативной G2 и митоза.
Каждая из перечисленных фаз характеризуется
специфическими метаболическими процессами. Эукариотическая клетка
427
joo j) j-p Рис. 221. Радиоустойчивость хлореллы
■ —— в разные фазы клеточного цикла:
D — доза радиации
диплоидна в пресинтетическую
фазу, тетраплоидна —в
постсинтетическую. Существенно
изменяется в ходе цикла и
состояние хроматина. В синтетическую
фазу образуется новый набор
молекул ДНК, а к концу постреп-
ликативной фазы формируется
аппарат деления клетки. Клетки
могут задерживаться в одной из фаз, чаще всего в Gx-фазе, как бы
выходя из цикла. Такие клетки называют Go-клетками.
Облучая клеточную популяцию на разных фазах клеточного
цикла, выявляют существенные различия радиочувствительности,
приуроченные к определенным фазам цикла: наиболее
радиочувствительны клетки в конце Gx— начале S-фазы. Это объясняется
тем, что повреждения, нанесенные в этот момент, не успевают
подвергнуться репарации, и в ходе репликации в дочерней нити ДНК
возникают пробелы (рис. 221).
14.13. Отдаленные эффекты облучения. Если при облучении
клеточной популяции не произошло гибели клеток, это еще не
означает, что в ней не произошли нарушения структур, которые
непосредственно не связаны с делением. В таком случае
радиационные эффекты могут проявиться спустя длительное время
после действия радиации. При этом радиационный эффект
проявляется не у облученных клеток, а у их отдаленных потомков.
Такие радиобиологические эффекты относят к отдаленным
последствиям облучения.
Отдаленные эффекты обусловлены появлением
множественных мутантных, но жизнеспособных форм клеток, что приводит
к генетической нестабильности. Эта нестабильность проявляется
в том, что спустя много клеточных поколений после облучения
наступает гибель клеток, их трансформация, утрачивается
способность проявлять свойства стволовой ткани и-т. п. Генетическая
нестабильность обусловлена накоплением в геноме клеток
мутационных, предмутационных изменений, затрагивающих регуля-
торные участки отдельных генов.
Отдаленные последствия у многоклеточных организмов
проявляются в форме возникновения злокачественных опухолей,
сокращения продолжительности жизни, раннего наступления
симптомов старения, ослабления иммунитета. У человека
проявление отдаленных эффектов может наступать спустя много лет
после получения повышенной дозы радиации. Например, массовое
образование опухолей у подвергшихся облучению ионизирующей
радиацией при взрыве атомных бомб в Хиросиме и Нагасаки
наступило спустя 7—8 лет после взрывов.
428
Радиационный канцерогенез. Под влиянием ионизирую-
ющей радиации весьма часто происходит перерождение тканей
и развитие злокачественных опухолей. Это явление называется
радиационным канцерогенезом.
Вероятность проявления радиационного канцерогенеза
является существенной по своему значению характеристикой, которую
необходимо учитывать при оценке степени опасности отоблучения
живых организмов радиацией внешних источников либо
инкорпорированных в тканях радионуклидов.
Частота проявления канцерогенеза Y количественно
описывается следующим выражением, предложенным нидерландским
ученым Барендсеном:
У = (А, + PiD + P2D2) е-"^-^Тимм (D) х
xFTOpu{D)'Frm(D)9 (14.30)
где /?о, ръ Ръ— параметры, характеризующие вероятность чиндук-
ции опухоли; аъ а2— константы вероятности клеточной гибели
от однонитевых и двунитевых разрывов ДНК; F — функции,
количественно характеризующие непрямое действие радиации на
формирование опухоли посредством иммунной реакции, влияния
гормонов и ускорения репопуляции тканей.
Как уже отмечалось, механизмы радиационного
канцерогенеза, по-видимому, исходно связаны с нарушением генома клеток.
Причины гибели организмов от облучения бывают разными.
Однако используя дозовые кривые выживаемости, можно
сравнивать радиочувствительность разных видов. К настоящему времени
исследована радиочувствительность многих видов
микроорганизмов, простейших, дрожжей, грибов, цианобактерий,
одноклеточных и многоклеточных водорослей, высших растений,
беспозвоночных и позвоночных животных. Оказалось, что
радиочувствительность разных видов варьирует в очень широких пределах,
так что уровень полулетальных доз для более чувствительных и
более устойчивых к радиации организмов отличается на несколько
порядков.
Наиболее высокая радиоустойчивость характерна для
цианобактерий. Для ряда видов этих существ полулетальные дозы
достигают 12 кГр.
Среди бактерий наиболее высокой радиоустойчивостью
отличаются Micrococcus radiodurans, M. radiofilus, которые способны
переносить облучение в дозах порядка 10 кГр. Среди бактерий
имеются и мутантные формы, которые, напротив, имея дефекты
репарирующих систем, проявляют очень большую
радиочувствительность.
Высшие растения сильно различаются по
радиочувствительности. Очень высокой чувствительностью к облучению
характеризуются некоторые голосеменные растения. Высокая
радиоустойчивость у крестоцветных растений. Следует отметить, что вегети-
рующие растения на 1—2 порядка более радиочувствительны,
чем их сухие семена.
429
Беспозвоночные животные обычно устойчивы к облучению
ионизирующей радиацией. Естественно, что половые клетки
беспозвоночных и их личиночные стадии проявляют повышенную
радиочувствительность.
Позвоночные животные наименее радиоустойчивы. При этом
самой большой радиочувствительностью отличаются
млекопитающие и человек, для которых Db0 варьируют в пределах 3,5—
7 Гр.
При широком варьировании" уровней радиочувствительности
видов, принадлежащих разным филогенетическим группам,
выявляется общая тенденция понижения радиоустойчивости
таксонов более позднего происхождения. Это наблюдение носит
условный характер, так как в пределах каждой филогенетической
группы можно обнаружить как высокоустойчивые к радиации
виды, так и отличающиеся низкой радиоустойчивостью.
Предпринимались попытки связать уровень
радиочувствительности видов с суммарным объемом' хромосом их клеток.
Американский радиобиологvА. Спэрроу, сопоставив объем хромосом
в интерфазе с радиоустойчивостью вирусов, бактерий, клеток
растений и животных, выделил восемь групп организмов, каждая
из которых характеризуется наличием явной регрессионной
зависимости между рассматриваемыми параметрами. Такие группы
организмов были названы радиотаксонами. В пределах
радиотаксонов виды не связаны между собой с точки зрения классической
таксономии и различны по генетической сложности.
14.14. Концепция-риска в радиобиологии. В связи с тем, что
любой живой организм в течение всей жизни пребывает в поле
излучений естественной радиоактивности Земли, а человек, кроме
того, подвергается дополнительным воздействиям ионизирующих
излучений от искусственных источников, например, при
рентгеноскопических обследованиях, имеется необходимость определить,
какой уровень облучения является безопасным для организма.
Способы расчета уровней облучения, признаваемых как
безопасные для определенных условий, получили название нормировки
ионизирующих излучений при облучении организма.
При экстраполяции дозовых кривых генетического эффекта
излучений, выживаемости организмов или проявления отдаленных
эффектов в форме канцерогенеза и т. п. в область малых доз,
видно, что нельзя выделить такого участка доз радиации, которые
можно было бы считать совершенно безопасным, не связанным
с проявлением хотя бы очень редких лучевых эффектов. Поэтому
при нормировке излучений приходится устанавливать допустимый
уровень проявления лучевых эффектов, избежать которых
вообще невозможно, так как радиационные эффекты являются
беспороговыми. Этот уровень определяется допустимым риском. Риск
количественно оценивается как вероятность нроявления эффекта
облучения, например, значением вероятности индукции опухолей
облучением на 100 000 населения. Выбор количественной оценки
риска зависит от многих предпосылок, определяясь, в первую
430
очередь, сопоставимостью со значениями риска от действия
распространенных и наносящих вред привычек, например, от
курения.
По данным МАГАТЭ, количественные характеристики
различных факторов, создающих риск смерти, равный одному случаю
на миллион, составляют: поездка на автомашине — 100 км; полет
на самолете —650 км; курение —0,75 сигареты; употребление
алкогольных напитков — 0,5 бутылки вина; отрезок жизни
человека в возрасте 60 лет — 20 мин; доза ионизирующего
излучения — 10 мбэр.
Уровень предельнодопустимых доз облучения для
соматических эффектов значительно выше, чем для генетических
последствий. В свою очередь, при установлении уровня генетически
значимой дозы необходимо учитывать, подвергаются ли облучению
отдельные лица или обширная популяция. В последнем случае
предельно допустимая доза должна быть значительно ниже, тдк
как при облучении популяции возрастает вероятность появления
гомозиготности. Соответственно этому выделяют предельно
допустимые дозы облучения для лиц, работающих с источниками
ядерных излучений или с радиоактивными веществами, и
предельно допустимые дозы для всего населения.
При нормировке ионизирующих излучений необходимо
учитывать все источники внешнего и внутреннего облучения: природную
радиоактивность, радиоактивное загрязнение среды, космическое
излучение, облучение, связанное с профессиональной
деятельностью. Вместе с тем нельзя пренебрегать и тем, что между
радиобиологическими эффектами и воздействием ряда химических
агентов антропогенного загрязнения вод, воздуха, продуктов
питания может проявляться синергическое действие, повышающее
степень риска.
14.15. Природный фон радиоактивности. Во всех частях
биосферы— атмосфере, горных породах, почвах, природных водах,
6 любых тканях живых организмов содержатся радиоактивные
вещества, что обусловливает природный уровень облучения,
который можно характеризовать уровнями мощностей доз
ионизирующей радиации. Распространенные в биосфере радиоактивные
вещества принадлежат к естественным радиоактивным элементам,
входящим в радиоактивные семейства урана и тория; к ним
относятся также радиоактивные изотопы таких широко
распространенных элементов, как калий — 40К, углерод — 14С и тритий —
3Н. С развертыванием испытания ядерного оружия к естественным
радиоактивным веществам присоединились продукты деления
урана, среди которых основными излучателями являются стронций
90Sr, цезий 137Cs и ряд других радионуклидов.
Естественные радиоактивные элементы семейства урана и тория
находятся в рассеянном состоянии, обнаруживаясь во всех
природных образованиях в незначительных концентрациях. Однако
известны некоторые районы земного шара, где горные породы,
являясь рудными телами урана или тория, содержат очень высо-
431
кие концентрации этих радиоактивных элементов. Уровни
естественной радиоактивности тканей животных и растений
преимущественно обусловлены радиоактивным изотопом калия.
Природные радиоактивные элементы являются источниками
гамма-излучения, альфа- и бета-частиц. Ткани живых организмов
постоянно- подвергаются также действию радиации от внешних
источников. К фону естественной радиоактивности
присоединяются космические лучи.
Общая накапливаемая в течение года поглощенная доза для
тканей человека обычно невелика, что можно проиллюстрировать
следующими данными:
Внешнее облучение (мГр):
от ионизир)ющей составляющей космического излучения — 0,28;
от нейтронной составляющей космического излучения — 0,35 • 10~2;
от земного гамма-излучения — 0,32.
Внутреннее облучение (мГр):
от 3Н примерно 1 • 10~5;
14С - 0,5 . 10-2;
4ок — 0,15 — 0,27.
Продукты семейств урана и тория, являющиеся источниками
альфа-излучения, наибольшую дозу создают в тканях легких,
где одни лишь радон и полоний обусловливают дозу до 0,3 мГр.
Округленные дозы облучения тканей человека от естественных
источников облучения в год таковы (мГр): гонады —0,78;
легкие— 1,10; костная ткань — 0,87; красный костный мозг —
0,92.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАЧИ К ЧАСТИ III
1. Рассчитать потенциал покоя аксона кальмара, находящегося в
морской воде При расчетах использовать такие концентрации ионов: в аксо-
плазме кальмара — 400 мМ [К+], 50 мМ [Na+] и 100 мМ [С1~], в морской
воде — 10 мМ [К+], 460 мМ [Na+] и 540 мМ [С1~] Соотношение констант
проницаемости ионов через мембрану принять следующим: Рк: PNa: РС1 = 1 :
: 0,04 : 0,45; Т = 300 К.
2. Некоторые клетки, функция которых состоит в поглощении
питательных веществ из окружающей среды (например, клетки, выстилающие просвет
тонких кишок), приспособлены к этой роли благодаря тому, что площадь их
поверхности, соприкасающаяся с питательными веществами, увеличена за
счет микроворсинок Предположим, что эпителиальная клетка,
расположенная в просвете тонкой кишки, имеет форму сферы диаметром 20 мкм.
Поскольку лишь часть клетки обращена в просвет кишки, будем считать, что
микроворсинки покрывают участок, площадь которого составляет 25 %
площади поверхности клетки Предположим также, что микроворсинки имеют
форму цилиндров высотой 1,0 мкм и диаметром 0,1 мкм и располагаются
в виде регулярной решетки с расстоянием 0,2 мкм между центрами двух
соседних микроворсинок. Площадь поверхности сферы равна 4яг2. Исходя из
этих данных, рассчитайте: а) число микроворсинок на покрытом ими участке;
б) площадь поверхности участка с учетом микроворсинок; в) на сколько
процентов увеличивается поглощающая способность (определяемая отношением
площади поверхности клетки к ее объему) благодаря наличию
микроворсинок?
3. Содержащаяся в ДНК генетическая информация закодирована
линейной последовательностью кодонов. Каждый кодон представляет собой
432
специфическую последовательность трех нуклеотидов (три пары нуклеотидов
в двухцепочечной ДНК) и соответствует одному аминокислотному остатку
в белке. ДНК бактерии Е. coli имеет молекулярную массу, равную
приблизительно 2,5 • 109. Средняя молекулярная масса пары нуклеотидов равна
660. Подсчитайте, чему равно максимальное число белков, которое может
быть закодировано в молекуле ДНК Е. coli, если предположить, что
белковая молекула состоит в среднем из 400 аминокислот.
4. Сколько молекул фосфолипидов содержится в I мкм2 фосфолипидной
двухслойной мембраны? Предположим, что одна молекула фосфолипида
занимает площадь 0,7 нм2.
5. Липидные бислои, сформированные на границе двух водных фаз,
обладают следующими важными свойствами: они образуют двумерные
пленки; края этих пленок замыкаются сами на себя: в результате образуются
замкнутые структуры — липосомы. Объясните: а) какими свойствами липидов
обусловлены эти свойства бислоев; б) каково биологическое значение этих
свойств и как они связаны со структурой биологических мембран.
6 Какое в среднем расстояние проходят мембранные липиды за 1 с?
Коэффициент диффузии можно принять равным 10~8 см2 • с"1.
7. Для нормального функционирования мембран составляющие их
липиды должны быть в жидком состоянии. Соотношение жирных кислот в
бактериальных мембранах зависит от условий роста бактерий. Так, если
бактерии растут при пониженной температуре, у них увеличивается относительное
содержание ненасыщенных жирных кислот (по отношению к насыщенным).
И наоборот, если бактерии растут при повышенной температуре, уровень
ненасыщенных жирных кислот (по отношению к насыщенным) оказывается
ниже нормы. Объясните, почему обнаруженные изменения в соотношении
насыщенных и ненасыщенных жирных кислот в зависимости от температуры
подтверждают гипотезу о текучем состоянии мембран.
8 Каким образом разобщающие агенты и ионофоры подавляют
окислительное фосфорилирование?
9 При освещении зеленого растения светом с длиной волны 680 и 700 нм
скорость фотосинтеза, измеряемая по выделению 62, в первом случае
оказывается выше Однако освещение растения светом с той и другой длиной волны
одновременно обеспечивает более высокую скорость фотосинтеза, чем
освещение каждым светом в отдельности. Объясните причину этого.
10. Для разрыва химической связи в некоторой фотохимической реакции
требуется энергия 428,3 кДж . моль"1. Какова должна быть длина волны
излучения?
11. Тело массой т = 70 кг в течение t = 24 ч поглотило энергию
ионизирующего излучения Е — 10 Дж. Найдите поглощенную дозу и мощность
поглощенной фазы.
Часть IV
БИОФИЗИКА СЛОЖНЫХ СИСТЕМ
Глава 15. ПЕРЕДАЧА ИНФОРМАЦИИ В СЕНСОРНЫХ
СИСТЕМАХ ОРГАНИЗМА
Живые организмы функционируют в условиях постоянно
изменяющейся внешней среды, и основой их выживания является
наличие у них способности реагировать на изменения последней
соответствующей перестройкой своей жизнедеятельности,
позволяющей определить и захватить пищевые вещества, избежать
повреждения, осуществить воспроизводство новых организмов
и т. д. Начальным звеном во всех этих реакциях,обеспечиваемых
у многоклеточных организмов в первую очередь деятельностью
нервной системы, является превращение внешнего воздействия
(обозначаемого обычно как раздражение, или стимул) в
определенный физиологический процесс, который содержит в себе
информацию об этом воздействий.
Раздражение может заключаться в действии на организм
самых различных видов энергии (механической, тепловой,
химической, гравитационной, электрической, электромагнитной); в
организме же сведения об этом действии передаются одним и тем же
механизмом — сигнальной деятельностью нервных клеток;
трансформация внешней энергии в эту деятельность обеспечивается
особыми структурами, обозначаемыми как рецепторы внешних
раздражений.
Рецепторы обладают свойством не только отмечать сам факт
действия раздражителя, но и отражать определенные
характеристики последнего, осуществляя, таким образом, функцию
перекодирования таких характеристик в определенные характеристики
сигнальной деятельности нервных клеток. Этот процесс
кодирования, передачи и обработки информации о внешних
раздражениях обозначается как сенсорная (афферентная) деятельность
организма, а структуры, его осуществляющие,— как
чувствительные (сенсорные, афферентные) системы. Он является,
очевидно, тем биофизическим процессом, который должен быть
рассмотрен в первую очередь при жизнедеятельности организмов как
сложных биофизических систем.
15.Ь Основные понятия теории информации. Согласно К. Ше-
нону, информация — это мера той неопределенности, которая
исчезает после получения сведений о системе.
В теории информации вводится важная величина —
количество информации. Рассмотрим простой пример. Каждый раз, когда'
подбрасывается шестигранный кубик, мы получаем сведения
434
о цифрах на гранях кубика. Таким способом уменьшается
неопределенность или наше незнание о системе. Для кубика число
равновероятных событий N = 6. Чем больше число N, тем
большая неопределенность системы до получения сведений о ней. При
получении сведений о системе количество информации
суммируется. Для обеспечения условия аддитивности необходимо
допустить, что количество информации / является логарифмической
функцией от числа событий или микросостояний N. Для
равновероятных событий
/ = lg2W. <15.1)
При определении количества информации выбран логарифм
по основанию 2; при этом представление количества информации
производится в двоичном (или бинарном) коде. Источник
информации производит выбор между двумя возможностями «да» — «нет*
или «/» — «О». В двоичном коде любое число микросостояний N
можно представить как
N = 2n и / = lg22n, (15.2)
где п — количество двоичных ячеек. Единица количества
информации в бинарном представлении выбирается следующим
образом. Если система имеет всего два микросостояния (N= 2) и для
получения полной информации достаточно одного сведения (п =
= 1), тогда количество информации составляет один бит.
Количество информации оценивается в битах. Для передачи однога
двоичного символа необходима информация в один бит. Если
N = 8 (т. е. N = 23), тогда количество информации / = 3 бит.
Если N = 2", тогда информационное содержимое системы
составляет п бит.
Двоичная система широко используется в ЭВМ для записи
информации в памяти машины. Минимальной единицей
информации, адресуемой и обрабатываемой в машине, является байт —
восемь двоичных разрядов, порядковые номера которых
располагаются от нуля до семи (слева направо). Одна ячейка памяти
имеет 1 бит, т. е. можно выбрать 0 или 1. Значит п = 1, а N — 2.
Если имеется две ячейки (N = 2), тогда мы можем получить
большее число комбинаций в двоичной системе: 00, 01, 11, 10.
Таким образом, получаем N = 22= 4 микросостояния и / =
= 2 бит. Байт имеет 8 бит информации, а это значит, что числа
микросостояний N = 256.
Каждое из микросостояний системы мы можем получить в
результате одного из возможных сообщений. Вероятность р
появления любого из таких сообщений, если все они равновероятны>
запишется как
Р=7Г- (15-3>
Тогда количество информации будет равно
/=■!«. £«=-!& Р. (15.4)
435
?Рис. 222. Шеноновский канал
передачи информации:
X — источник информации; У —
приемник информации; / — кодирующее уст*
ройство. 2 — канал передачи информа-
I Г~ I I I ции; 5— декодирующее устройство;
X Ч \ Ч 2 Ч 3 Ч Y \ 4 — источник искажений информации
Если события не равновероятные, тогда, по К. Шенону,
определится среднее количество информации Н (X) источника
информации с N микросостояниями:
H{X) = -%p(Xl)lgip(Xt). (15.5)
Это количество называется энтропией, так как оно формально
эквивалентно термодинамической энтропии. Максимальное значение
Н (X) будет в том случае, если p(Xt) = -^ \
#(X)max = lg2/V. (15.6)
Величину lg2N называют количеством решений. Оно показывает
среднее число бинарных решений, необходимых для выбора одной
из N ситуаций.
Общая теория связи развита Шеноном. В шеноновском
информационном канале (рис. 222) есть источник (X) и приемник
(Y) информации. Информация поступает в информационный канал
2 через кодирующее устройство 1. Приемник принимает
информацию после декодирования 3. Наличие источника шумов 4
искажает информацию в канале передачи информации. Если
обозначить энтропию источника информации как #(Х), а приемника
как Н (К), связь приемника с источником информации
характеризуется количеством трансформации (Т):
Т = Н(Х)+Н (Y)—H (X, У), (15.7)
где #(Х, Y) — энтропия связи.
Рассчитывается максимальное значение 7\ так называемая
мощность канала, т. е. максимальная величина возможной
информации, протекающей через канал:
С = (т") > О5-8)
\ Т /max v
где т — среднее время передачи на один информационный
символ. В случае аналоговых каналов мощность канала рассчитывают
на основании ширины полосы 5, мощности сигнала S и мощности
шума т на приемнике:
C = 25lg2|/^. (15.9)
Максимальный поток информации называют пропускной
способностью канала.
436
Некоторые типичные значения мощности каналов при
передаче технической информации.
телевизионный канал — С = 7 • 107 бит • с"1;
телефонный канал — С = 5 • 104 бит ♦ с""1;
телеграфный канал — С = 5 • 101 бит • с"1.
Мощность технических каналов больше или меньше
приближается к информационной мощности наших органов чувств:
глаз — С = 3 • 10е бит • с"1;
ухо — С = 4 • 104 бит • с"1.
По сравнению с этими значениями величина мощности усвоения
информации человеком заметно ниже:
чтение про себя — С = 4,5 • 101 бит • с"1;
чтение вслух — С = 3 • 101 бит • с"1;
печатание — С = 1,6 • 101 бит • с"1;
подсчеты — С = 3 бит -с"1.
15.2. Общие принципы функционирования сенсорных систем.
С деятельностью сенсорных систем связана вся наша
сознательная жизнь, поскольку конечным ее результатом у находящегося
в сознании человека является возникновение ощущений —
субъективных образов внешних раздражений. Сопоставление
характеристик этих ощущений с объективными свойствами вызвавших их
раздражений ранее всего было использовано для определения
общих принципов функционирования сенсорных систем; оно часто
обозначается как психофизическое направление.
При оценке сенсорных ощущений в первую очередь обращает
на себя внимание субъективно переживаемое сходство их в
случае активации одной чувствительной системы и качественное
отличие—в случае активации различных. Эта особенность
обозначается как модальность ощущений, отражающая, очевидно,
качественное различие соответствующих внешних раздражителей.
«Классическими» модальностями являются зрение, слух,
осязание, вкус, обоняние, отражающие действие на рецепторы
соответственно световых лучей, звуковых колебаний, механических
воздействий, растворенных и газообразных химических веществ.
К сенсорным модальностям необходимо отнести также ощущения
тепла и холода, вибрации, положения тела в пространстве и боли,
а также «внутренние» ощущения, отражающие изменения во
внутренней среде организма, являющиеся раздражителями для
рецепторов внутренних органов.
Очевидно, что качественная особенность ощущений каждой
модальности — явление субъективное, переживаемое каждым
индивидуумом и непередаваемое другому индивидууму.
Правильное отражение в ней объективных различий внешних
раздражителей проверяется всей ответной деятельностью'организма, и
возможные нарушения соответствия между качеством раздражителя
и его субъективным отражением, возникающие, например, при
некоторых заболеваниях, обычно быстро определяются и
корректируются в поведении индивидуума.
437
Следующей основной . характеристикой ощущения является
его интенсивность, отражающая количественные показатели
раздражителя. В общем, чем больше сила стимула, тем выше
интенсивность ощущения. Однако эта зависимость не является
линейной и также отражает субъективный характер нашего
отражательного процесса. Во всех сенсорных системах ощущение
возникает только после достижения раздражением определенной
критической величины, называемой абсолютным порогом
ощущения. Затем интенсивность ощущения увеличивается с усилением
силы стимула, однако до определенных пределов; при слишком
сильных раздражениях повышение интенсивности ощущения
прекращается (верхний порог ощущения); при этом, как правило,
наступают нарушения функции соответствующей сенсорной
системы. В наших ощущениях мы можем оценить изменения их
интенсивности, сопоставив с объективными изменениями силы
раздражителя. Однако в связи с наличием порога ощущения для
измерения его интенсивности приходится проводить отсчет от порогового
уровня раздражителя и определять эту интенсивность как
кратное порогового ощущения.
Сопоставления субъективной оценки изменения интенсивности
ощущения с объективным изменением силы раздражителя были
проведены в ряде психофизических экспериментов на различных
сенсорных системах. Если силу раздражителя и интенсивность
ощущения представить в логарифмических единицах, то
соотношения между ними довольно хорошо совпадают с прямой, наклон
которой может варьировать. Математическим выражением такой
зависимости является степенная функция
/ = *(S-Soy\ (15.10)
в которой / — интенсивность ощущения; S0— пороговая и S —
действующая сила раздражения; k—константа. Описываемая
зависимость по имени ее открывателя получила название закона
Стивенса. Показатель степени п в этой функции для различных
сенсорных систем и различных видов раздражений может
отличаться от единицы как в большую, так и в меньшую сторону. На
рис. 223 приведен пример эксперимента с вкусовыми ощущениями
от различных химических веществ, который хорошо
иллюстрирует сказанное.
Важные сведения относительно общих принципов оценки силы
стимула получаются и в психофизических экспериментах по
определению минимально-определяемых изменений в интенсивности
ощущения при усилении раздражения. Как это было впервые
отмечено Э. Вебером еще в 1834 г., такое
минимально-определяемое изменение (дифференциальный порог) находится, как
правило, в постоянном отношении к исходной силе раздражения (закон
Вебера)\
^ = const. (15.11)
438
/ 2 U 6 8 10 20 60 100 200 600 1000
Рис. 223. Сравнение изменений интенсивности субъективного вкусового
ощущения (/) и частоты разрядов в волокнах вкусового нерва (2) человека как
функции концентрации лимонной кислоты (А) и сахара (Б) в мМ/л (Цоттерман
и соавт., 1967)
В последствии Г. Фехнер провел генерализацию этой
закономерности, интегрировав уравнение Вебера; в такой форме
интенсивность ощущения должна соответствовать логарифму силы
стимула (закон Вебера — Фехнера):
/ = *lgS. (15.12)
Однако экспериментально обнаруженные Э. Вебером
закономерности оказываются действительными лишь в сравнительно
узких пределах, а для некоторых сенсорных систем вообще не
подтверждаются. Тем более ограниченное значение имеет их
математическая генерализация. В этом отношении установленная
С. Стивенсом закономерность имеет значительно более широкую
область применения и, как будет видно дальше, может быть более
успешно перенесена на нейрофизиологические процессы, лежащие
в основе кодирования и передачи информации в сенсорных системах.
Наряду с качественными и количественными
характеристиками ощущения имеют также пространственные и временные
характеристики. Пространственные особенности ощущения могут
быть измерены дифференциальным пространственным порогом—
наименьшим расстоянием между раздражителями, при котором
последние воспринимаются как раздельные. Вместе с тем, площадь
стимула оказывает влияние на характер ощущения и в том
случае, если последнее является слитным: ощущаемая интенсивность
возрастает при увеличении площади органа чувств, на которую
действует раздражитель. Очевидно, в общем смысле это явление
можно рассматривать как пространственную суммацию эффектов
элементарных раздражений в процессе формирования ощущения;
в идеальном случае произведение силы стимула на его площадь
должно было быть постоянным при вызове ощущения:
ISA = const. (15.13)
20
10
8
6
2
1
439
Длительный Короткие Рис. 224. Адаптация к запаху (Маркс, 1974).
стимул стимулы Вверху — предъявления стимула (сероводорода)
" 'в концентрации 6,5 10-6 ц0 объему. Внизу —из*
менения интенсивности субъективного ощущения Jt
оцениваемые четырьмя различными испытуемыми
Однако и для этой характеристики
в эксперименте наблюдаются
существенные вариации, и указанная
зависимость подтверждается лишь в опре-
' +* деленных пределах изменения пло-
70 L.MUH х у-,
щади раздражения. Положение
осложняется наличием
противоположных эффектов — ослаблением интенсивности ощущения в случае
одновременного раздражения соседнего участка воспринимающей
поверхности; такое явление получило название контраста. Оно
хорошо знакомо по зрительным ощущениям, однако имеет место
и в других сенсорных системах и способствует пространственному
различению раздражений.
По аналогии с эффектом увеличения площади раздражения,
увеличение длительности последнего также влияет на
интенсивность ощущения; в этом случае мы встречаемся с временной сумма-
щей актов раздражений в процессе формирования ощущений.
В ряде случаев можно показать постоянство произведения силы
раздражения и времени его действия в определении интенсивности
ощущения:
Ist = const. (15.14)
Это положение справедливо лишь для определенных длитель"
ностей стимула: когда последняя превышает некоторую критиче"
скую величину, интенсивность ощущения перестает зависеть от
нее. Более того, при дальнейшем увеличении длительности
стимула наступает противоположное изменение—интенсивность
ощущения начинает ослабевать; такое ослабление получило название
адаптации. На рис. 224 приведен пример адаптационных
изменений ощущения запаха, полученный в психофизическом опыте;
как видно, после прекращения действия раздражения
адаптационное снижение интенсивности восстанавливается также
постепенно. Ход восстановления можно определить кратковременными
предъявлениями раздражителя той же интенсивности. Явления
адаптации чрезвычайно сильно проявляются в деятельности всех
сенсорных систем (кроме болевой) и играют важную роль в
восприятии организмом внешних раздражений, существенно
расширяя диапазон воспринимаемых интенсивностей последних. Так,
в зрительной системе в ходе адаптации пороговая сила света,
вызывающая минимальное ощущение, может измениться в десятки
тысяч раз.
Хотя приведенные выше общие характеристики
функционирования сенсорных систем получены на основании отчетов
испытуемых о своих субъективных ощущениях, они носят вполне объек-
440
тивный характер, поскольку подтверждаются на всех испытуемых.
На протяжении длительного времени такие психофизические
данные были основой нашего понимания принципов восприятия
организмом действующих на него внешних раздражений. Поскольку
мы не можем получить отчетов о субъективных ощущениях,
возникающих у животных, то о функционировании сенсорных систем
у последних можно было делать заключения лишь по аналогии.
Эта принципиальная трудность была в значительной мере
преодолена путем использования условно-рефлекторного метода,
открывшего возможности объективно регистрировать способность
животного отличать один раздражитель от другого на основе диф-
ференцировки выработанных на них условных рефлексов.
Использование условно-рефлекторного метода показало, что
распространение установленных в результате психофизических измерений
общих принципов функционирования сенсорных систем человека
на аналогичные системы животных вполне правомочно.
Прямое исследование процессов, происходящих в различных
звеньях той или иной сенсорной системы, стало возможным с
введением в практику регистрации и анализа электрических явлений,
возникающих в этих звеньях и отражающих, как это уже было
показано в предыдущих главах, течение-нервных процессов,
которые являются материальным носителем сенсорной информации.
В ходе таких исследований, как это будет видно из последующего
изложения, удалось в большинстве случаев точно определить те
процессы, которые лежат в основе описанных общих
характеристик функционирования сенсорных систем.
15.3. Трансформация раздражений в рецепторах. Первичным
звеном в деятельности любой сенсорной системы является
трансформация энергии раздражения (стимула) в распространяющийся
сигнал — нервный импульс (см. гл. 9). Рецепторные структуры,
в которых происходит эта трансформация, оказываются
приспособленными к реагированию на раздражения определенного рода,
которые обозначаются как адекватные для данных рецепторов.
Однако эта приспособленность не является абсолютной, и в
некоторой степени рецепторы могут активироваться и
неадекватными стимулами. Специализация рецепторов определяется наличием
у них особых механизмов, позволяющих реагировать на очень
слабые адекватные раздражители; чувствительность при этом
может достигать в некоторых случаях практически предельно
возможной по физическим законам величины.
По адекватной энергии все рецепоры могут быть разделены на
механо-, термо-, хемо- и фоторецепторы. У некоторых водных
животных имеются также электрорецепторы, для которых
.адекватным раздражителем является изменение электрического поля
в проводящей внешней среде. Внутри каждой из этих групп
имеется ряд подразделений, рецепторы в которых приспособлены
для реагирования на те или иные более узкоограниченные
характеристики соответствующих раздражений. Несмотря на такую
специализацию, у всех рецепторных структур есть общий механизм,
441
if
лшш
Рис 225. Схема трансформации
внешнего раздражения в нервный процесс в
рецепторе растяжения рака*
а — схема рецептора* J — мышечные волокна,
2 — дендриты, 3 — нервная клетка; 4 — аксон;
б — последовательные этапы трансформации:
/ — внешний стим,ул (растяжение на 2 мм);
2 — рецепторныП потенциал; 3 — разряд
импульсов в аксоне
наличие которого определяется
общей конечной задачей каждого
я 6 рецептора — вызвать
распространяющийся нервный импульс. Как
уже указывалось в гл. 9, единственным путем вызова
последнего является деполяризация поверхностной мембраны нервного
окончания чувствительной нервной клетки. Поэтому во всех
рецепторах внешняя энергия должна быть трансформирована в этот
электрический процесс, который обозначается как рецепторныи
(иначе—генераторный) потенциал.
В небольшой части рецепторов такая трансформация
происходит непосредственно в мембране нервных окончаний. Такие
рецепторы обозначаются как первичные. Однако в подавляющем
большинстве рецепторов существуют дополнительные клетки не
нервного происхождения, в которых и происходит первичная
трансформация внешнего стимула в клеточный процесс; лишь затем
эти клетки передают сигнал на чувствительные нервные окончания
(как правило, путем выделения химического вещества —
медиатора). Такие рецепторные структуры получили название
вторичных. Первичных рецепторов сравнительно немного; их примером
могут быть свободные нервные окончания в коже, реагирующие
либо на механические, либо на термические раздражения, а
также хеморецептивные окончания обонятельных нервных клеток
в обонятельном эпителии носовой полости. Большинство же
рецепторов относится к категории вторичных, как, например, рецепторы
наших слуховых, зрительных, вкусовых органов.
Прямая регистрация рецепторного потенциала осуществлена
не во всех рецепторных структурах; в ряде случаев она
затрудняется техническими причинами (например, в свободных нервных
окончаниях — очень малым их размером). Однако некоторые
рецепторы представляют исключительное удобство для
регистрации и анализа такого потенциала, и на их примере можно хорошо
представить себе основные закономерности трансформации
внешнего раздражения.
К ним относится рецептор растяжения у ракообразных,
структура которого показана на рис. 225. При растяжении мышечных
волокон происходит деформация контактирующих с ними
дендритных отростков рецепторной нервной клетки, и в них возникает
деполяризация мембраны — рецепторныи потенциал, которая элек-
тротонически распространяется на сому клетки, приводя в
последней к активации электроуправляемых ионных каналов и
генерации распространяющихся потенциалов действия. Хараюери-
442
стики всех звеньев этого процесса могут быть точно измерены
путем регистрации самого растяжения мышцы и отведения
электрических реакций клетки с помощью внутриклеточного микроэлектрода.
Как видно на этом же рисунке, рецепторный потенциал
представляет собой аналоговое отражение раздражения, повторяющее
амплитудные и временные характеристики последнего. Такое
отражение, которое часто обозначается как трансдукция
внешнего раздражения, имеет ряд особенностей. Амплитуда и
длительность раздражения преобразуются в амплитуду совершенно иного
физического процесса — изменения мембранного потенциала.
Соотношения между этими изменениями являются линейными,
однако лишь в определенных пределах; это соотношение
претерпевает изменение во времени, постепенно уменьшаясь
(адаптация). Наконец, после прекращения раздражения появляется
преходящее изменение мембранного потенциала в
противоположную (гиперполяризационную) сторону. Как видно, в отмеченных
особенностях рецепторного потенциала мы сталкиваемся с
чертами, отмеченными выше при характеристике субъективных
ощущений (например, адаптацией).
Появление генераторного потенциала, в свою очередь, дает
начало следующему процессу — ритмическому разряду
потенциалов действия, которые далее распространяются в
соответствующие нервные центры и в которых «в закодированном виде
переносится информация о характеристиках предыдущих процессов.
При этом интенсивность раздражения и соответственно
интенсивность рецепторного потенциала трансформируется в частоту
разряда импульсов, а его длительность, соответственно — в
длительность такого разряда. Поскольку интенсивность рецепторного
потенциала в связи с наличием адаптации снижается несмотря
на постоянство раздражения, частота разряда также
соответственно урежается.
Преобразование рецепторного потенциала в разряд нервных
импульсов вносит свои ограничения в процесс трансформации.
Возникновение потенциала действия требует пороговой
деполяризации мембраны; соотношение между интенсивностью
деполяризации и частотой разряда является линейным лишь в ограниченной
области и ограничивается сверху наличием рефрактерности после
каждого распространяющегося импульса. В связи с
дискретностью импульсации возникают ограничения и в передаче
изменений интенсивности раздражения; при очень коротких сигналах
такая передача вообще должна быть невозможной в связи с тем,
что при этом возникает одиночный импульс, подчиняющийся
правилу: «все или ничего»; по мере удлинения сигнала возможный
объем передаваемой информации будет возрастать. Подобную
за ко юм ер ность в передаче сенсорных сигналов мы также уже
отмечали при анализе характеристик интенсивности субъективных
сенсорных ощущений.
Описанные принципы трансформации внешнего раздражения
в нервные процессы являются общими для всех сенсорных систем
443
организма, и различия между ними связаны лишь с различиями
клеточных механизмов, определяющих процесс трансдукции и
обеспечивающих максимальное повышение чувствительности
рецептора к внешнему воздействию. Ниже мы познакомимся с
особенностями этого процесса в различных сенсорных системах.
Механорецепторы. Приведенная выше в качестве хорошо
проанализированного примера первичная трансформация
механического стимула в активность нервной клетки является среди
других типов механорецепторов скорее исключением, чем правилом.
У высших животных первичные механорецепторы сравнительно
редки; сюда относятся, например, свободные нервные окончания
в коже, оплетающие корни волос, а также рецепторы растяжения
в особых чувствительных структурах скелетных мышц —
мышечных веретенах, где нервные окончания оплетают мышечные
волокна. В большинстве случаев механорецепторы представляют собой
вторичные рецепторы, в которых механическое воздействие
воспринимается первоначально особыми клеточными структурами.
В коже сюда относятся так называемые инкапсулированные меха-
норецепторы, в которых нервное окончание расположено внутри
капсулы из соединительно-тканных клеток (осязательное
тельце — тельце Мейсснера, пластинчатое тельце — тельце Фатера —
Паччини). Электронно-микроскопические исследования
показывают, что такая капсула не представляет собой просто
поддерживающую структуру; между обкладочными клетками и нервным
окончанием существуют синаптоподобные соединения.
О природе процессов, происходящих в клетках капсулы и
непосредственно в нервном окончании, пока нет каких-либо
прямых сведений; на существенные отличия в характеристиках этих
процессов в различных типах механорецепторов указывают
особенности той импульсной активности, которая распространяется
от них по нервному волокну. В одних случаях эта активность
длится на протяжении всего времени действия механического
раздражителя, лишь медленно урежаясь в связи с адаптацией.
Такие рецепторы, очевидно, передают информацию относительно
силы (а также длительности) стимула и могут быть обозначены
как пропорциональные. Сюда относится осязательный мениск
(тельце Меркеля).
В других же случаях разряд импульсов возникает лишь
в начале стимула; рецепторы адаптируются очень быстро, и им-
пульсация сразу прекращается, несмотря на продолжающееся
действие стимула. Зато она оказывается очень зависимой от
скорости нарастания раздражения: при увеличении последней число
импульсов в начальном разряде возрастает. Иными словами,
рецептор передает информацию скорее о скорости изменения, чем
об интенсивности стимула, и, может быть, поэтому обозначен
как дифференциальный (т. е. реагирующий на производную от
стимула). Некоторые механорецепторы занимают по этим
характеристикам промежуточное положение и соответственно могут
быть названы пропорционально-дифференциальными.
444
Рис. 226. Импульсная активность различных
механорецепторов кожи кошки:
а — медленно адаптирующийся (пропорциональный)
рецептор. Вверху указана сила давления на кожу,
б — быстро адаптирующийся (дифференциальный)
рецептор, реагирующий на скорость надавливания
на кожу; в — вибрационный рецептор (рецептор
ускорения) Вверху указана частота вибрации •
Наг рис. 226 представлены
примеры регистрации активности
различных типов кожных механорецепторов.
Наконец, существуют механорецеп-
торы, которые приспособлены для
оптимальной передачи сигналов о
синусоидальных механических
колебаниях (т. е. вибрациях). Сюда
относятся пластинчатые тельца (тельца
Паччини), располагающиеся в
подкожной жировой клетчатке. Эти
рецепторы относятся к быстроадаптирующимся, поскольку при
непрерывном механическом раздражении они всегда отвечают
на него лишь одним начальным импульсом. Однако при
синусоидальном раздражении такой импульс появляется в ответ на
каждое колебание, причем минимальная (пороговая) амплитуда
таких колебаний оказывается зависящей от их частоты; при
увеличении последней в определенных пределах порог снижается
пропорционально квадратичной степени увеличения частоты. По
существу рецептор оказывается реагирующим на ускорение
прогибания расположенной над ним кожной поверхности и 'поэтому
может быть обозначен как рецептор ускорения.
Приведенный анализ характеристик активности различных
кожных механорецепторов иллюстрирует второй важнейший
принцип, на котором строятся в организме кодирование, передача
и последующий анализ информации о внешних раздражителях.
Различные стороны одного и того же по своей физической природе
стимула оказываются воспринимаемыми различными рецептор-
ными структурами, и информация о них передается дальше по
различным проводникам. Эти рецепторы и связанные с ними
проводники могут быть обозначены как детекторы
соответствующих свойств раздражителя, сведения о которых поступают и
кодируются пространственным перераспределением активности
в разных сенсорных путях. Этот принцип пространственного
кодирования, наряду с упомянутым выше частотным кодированием,
является основой всей сенсорной деятельности.
Специальным видом механических раздражений являются
звуковые колебания воздуха, восприятие которых играет очень
важную роль в жизнедеятельности организма, поскольку
позволяет обнаруживать источник раздражения не только при
непосредственном контакте с ним, но и на расстоянии (так называемая
дистанционная рецепция). Звуковые колебания характеризуются
силой, частотой, а также направлением, откуда они исходят;
, . 0,6Н/см*
smt Щ Г\
ми м пни JIB1L,
J Hill IHII III
6
110 Гц &Ги
UlUHHU 111 I II-
6
445
9~
7 в
Рис 227. Поперечный срез улитки:
/ — вестибулярная лестница, 2 — пред-
двсрная мембрана (рейснерова
мембрана), 3 — средняя лестница, 4 — текто-
риальная мембрана, 5 — базилярная мем
брана, 6 — барабанная лестница, 7 — во-
лосковые клетки, 8 — синатические
соединения; 9 — афферентные волокна
Рис. 228 Структура
вестибулярного аппарата:
/ — височная кость, 2 — вертикальные
полукружные каналы, 3 — юризонталь-
ный полукружный канал, 4 — купула;
5 —М1кулы вестибулярного аппарата,
6 — улитка, 7 — полость среднего уха
для трансдукции всех этих характеристик в физиологический
процесс необходимы особо сложные преобразовательные
механизмы.
Звуковые рецепторы у позвоночных животных сосредоточены
в полости височной кости черепа (внутреннем ухе), в которую
звуковые колебания проникают через специальный
звукопроводящий аппарат — наружное и среднее ухо, разделенный
барабанной перепонкой. В отличие от наружного и среднего уха,
внутреннее ухо заполнено не воздухом, а жидкостью (эндолимфой),
поэтому воздушные колебания еще до попадания к рецепторам
трансформируются в колебания этой жидкости. Столь глубокая
изоляция рецепторного аппарата звуковых колебаний, очевидно,
оправдана функционально, поскольку она ограждает его от
действия каких-либо иных, неадекватных раздражителей.
На рис. 227 схематически показан поперечный срез улитки
внутреннего уха. Важной структурой ее является поперечно
натянутая базилярная мембрана, на которой располагаются
собственно рецепторные волосковые клетки, прикрытые сверху текто-
риальной мембраной. Волосковые клетки располагаются на ба-
зилярной мембране по всей ее длине от входа в улитку (которая
у человека делает 2,5 оборота) до ее вершины. В связи с
изменением по ходу улитки ее поперечного сечения меняется и ширина
натянутой поперек нее базилярной мембраны. Как это впервые
предположил Гельмгольц, последняя может представлять собой
структуру, резонирующую на поступающие во внутреннее ухо
звуковые колебания; при этом место максимальных резонансных
колебаний должно смещаться в зависимости от частоты звука.
Колебания мембраны будут передаваться на различные
волосковые рецепторные клетки, и таким образом частота звука будет
446
отражаться в активации пространственно различно
расположенных рецепторов.
Основные положения этой резонансной теории слуха в
настоящее время точно проверены экспериментально и подвергнуты
существенным уточнениям.
Поступающие во внутреннее ухо звуковые колебания
действительно вызывают ответные колебания базилярной мембраны,
которые имеют характер бегущей волны. Амплитудный максимум
этой волны перемещается при изменении частоты звука — при
высоких частотах он находится у входа в улитку, а при низких —
у ее вершины. Сенсорные клетки раздражаются соответственно
наиболее сильно там, где амплитуда колебаний максимальна,
поэтому при действии разных частот возбуждаются различные
сенсорные клетки.
Непосредственным раздражающим фактором для последних
является сгибание их волосков, выступающих во внутреннюю
полость улитки; по-видимому, эта деформация усиливается
движениями текторальной мембраны, покрывающей волосковые
клетки. Волосковые клетки представляют собой вторичные рецеп-
торные структуры; окончания сенсорной нервной клетки подходят
к их основаниям и образуют с ними типичные синаптические
контакты. Как и в других рецепторных клетках, механическое
действие — сгибание волосков — трансформируется в рецепторный
потенциал; физико-химические механизмы такой трансформации
пока неизвестны. Однако суммарный рецепторный потенциал
может быть зарегистрирован без труда даже макроэлектродом,
помещенным в улитку. Он носит характер электрических колебаний,
воспроизводящих по частотным характеристикам звуковые
колебания — так называемый микрофонный эффект улитки. Если
их усилить и подать на громкоговоритель, то можно
воспроизвести те звуки, которые поступали в ухо.
Появление рецепторного потенциала приводит, судя по
структуре связи волосковых клеток с нервными окончаниями, к
выделению какого-то (пока неидентифицированного) химического
медиатора, деполяризующего нервные окончания и приводящего
в итоге к генерации в них разряда распространяющихся
импульсов. Важно отметить, что наряду с такой «прямой» синаптической
передачей волосковые клетки получают и какие-то обратные
синаптические влияния: на них располагаются синаптические
окончания эфферентных волокон, поступающих во внутреннее
ухо из центральной нервной системы.
Таким образом, в звуковой рецепции также имеет место
пространственно-временное кодирование характеристик внешнего
раздражителя, причем оба принципа сложным образом
переплетаются. При изменениях амплитуды и частоты звуковых
колебаний изменяются как пространственная структура активности
рецепторов, так и частота разрядов в каждом из них.
Извлечение информации об этих характеристиках производится
соответствующими нервными центрами за счет сложного взаимодействия
44;
в них процессов синаптического возбуждения и торможения,
как это будет показано ниже. На процессах в вышележащих
центрах строится и анализ направления звука, требующего
слушания двумя ушами (бинауральный слух) и сопоставления
скрытых периодов сигналов, поступающих от рецепторов
каждого уха.
Механорецепторные клетки используются в организме еще
для одной специальной цели — определения положения и
перемещения тела в пространстве, основанном на определении
направления действия линейного или вращательного ускорения. При этом,
как и в случае звуковой рецепции, действуют особые механизмы
трансформации внешней силы в механическое воздействие на
мембрану рецептор ной клетки. Эти механорецепторы
расположены также во внутреннем ухе — в его полостях, называемых
преддверием и полукружными каналами.
Устройство этих полостей и расположение в них рецепторных
волосковых клеток показано на рис. 228. В преддверии (вестибу-
луме) рецепторные клетки собраны в особом участке
перепончатой выстилки — макуле и их волоски направлены внутрь
заполненной эндолимфой полости, где они погружены в желеобразную
массу, заключающую в себе кристалики солей (отолиты). При
наклоне головы под действием силы, земного притяжения
происходит смещение отолитов, что ведет к сгибанию волосков;
сгибание волосков, как у других механорецепторных клеток, каким-
то образом передает сигнал на контактирующие с рецепторной
клеткой нервные окончания. Регистрация активности последних
показала, что ритмическая импульсная активность генерируется
рецептором и в том случае, когда волоски выпрямлены; при
сгибании их в одну сторону она прекращается, а при сгибании в
другую— учащается. Так как макул в каждом преддверии две и они
расположены в разных плоскостях — одна примерно в
горизонтальной, а другая — в вертикальной, то при любом положении
головы в пространстве будет иметь место особое сочетание
импульсной активности в иннервирующих их афферентных нервных
волокнах, передающих в нервные центры информацию об этом
положении.
Полукружные каналы, отходящие от преддверия в трех
взаимно перпендикулярных плоскостях, также содержат
механорецепторы в виде волосковых клеток, которые собраны в виде гребешка
в расширении одной из ножек каждого канала (ампуле).
Погруженные в желеобразную массу, они перегораживают канал
подвижной перегородкой (купулой). Как показали прямые
наблюдения, смещение купулы и, следовательно, сгибание или разгибание
волосков происходит при появлении тока эндолимфы в канале,
в свою очередь, такой ток возникает в случае ускорения или
замедления вращения головы в плоскости, в которой расположен
соответствующий канал (вследствие инерции эндолимфы). При
переходе вращения в равномерное купула медленно возвращается
в свое исходное положение.
448
Таким образом, эта рецепторная система оказывается
сенсором вращательного ускорения. Она сигнализирует о таком
ускорении разрядом импульсов, частота которого уменьшается и
приобретает стационарный характер при переходе к равномерному
вращению или к покою. В физиологических условиях ускореьия
вращения являются постоянно встречающимися раздражителями,
возникающими при каждом движении головы. Равномерное же
вращение—состояние, как правило, искусственное,
возникающее в связи с развитием техники, поэтому оно и не является
адекватным раздражителем для сенсорных клеток полукружных
каналов.
Хеморецепторы. Способность реагировать на различные
химические воздействия — важнейшая функция организма,
осуществляемая с помощью специализированных хеморецепторных
клеток. С одной стороны, она позволяет определить источник
химического воздействия на расстоянии путем восприятия
летучих веществ из воздуха (обоняние)', такая химическая
чувствительность является не только способом поиска пищи, но и
широко используется в коммуникации организмов, например для
привлечения особей противоположного пола при половом поведении
или при отпугивании врагов. С другой стороны, она служит для
оценки химических веществ при непосредственном контакте с
ними (вкус). Наконец, химическая чувствительность широко
распространена во внутренних органах (например, в стенках сосудов),
где она воспринимает изменения химического состава
внутренней среды организма.
В связи с такими различиями в принципах функционирования
клеточные механизмы хеморецепции также оказываются очень
различными.
Обонятельные рецепторы расположены на небольшой
площади слизистой оболочки носовой полости, в области верхней
носовой раковины. На рис. 229 показана схема структуры этой
части слизистой, на которой среди эпителиальных клеток видны
биполярные нервные клетки. Дистальный короткий и толстый их
отросток направляется в сторону поверхности слизистой и
заканчивается утолщением, несущим погруженные в слой слизи
ворсинки. Второй тонкий центральный отросток представляет
собой афферентное волокно; множество таких волокон (не
сливаясь, в отличие от других органов чувств, в один ствол)
проходит через микроскопические отверстия решетчатой кости в
полость черепа и направляется к высшим обонятельным центрам.
Среди собственно обонятельных клеток находятся так называемые
базальные клетка, которые также имеют центральный отросток,
но не имеют периферического. По-видимому, они представляют
собой незрелые обонятельные клетки, которые могут
дифференцироваться в истинные рецепторные нейроны.
Как видно из описанной структуры, обонятельные
хеморецепторы представляют собой первичные рецепторы. Пахучие
вещества после растворения в покрывающей обонятельный эпителий
449
Рис. 229. Структура обонятельных Рис. 230 Структура вкусового ре-
рецепторов:
1 — слой слизи, 2 — реснички, 3 —
поддерживающая клетка, 4— обонятельная
(рецепторная) клетка; 5 — базальная
клетка; 6 — афферентные волокна
цептора (вкусовой луковицы)*
/ — пора, 2 — эпителий; 3 —
микроворсинки, 4 —. первичные чувствительные
клетки, 5 — синаптические соединения;
6 — базальные клетки; 7 — афферентные
волокна
слизи взаимодействуют прямо с окончанием специализированной
нервной клетки, вызывая в ней после соответствующей
трансформации разряд нервных импульсов. Биофизические механизмы
функционирования этих рецепторов являются до сих пор
невыясненными. Прямое их изучение чрезвычайно затруднено в связи
с ничтожными размерами и трудной доступностью обонятельных
рецепторов. Имеются лишь сведения о том, что при действии
пахучих веществ в обонятельном эпителии возникают медленные
электрические колебания (ольфактограмма), которые
представляют собой, по-видимому, суммарные рецепторные потенциалы
хеморецепторных окончаний; на ольфактограмму накладываются
разряды импульсов отдельных обонятельных нейронов.
Психофизические наблюдения дают мало материала для
предположений о возможных типах обонятельных рецепторов в связи
с исключительным многообразием обонятельных ощущений,
трудно группируемых в определенные классы. Примерно они могут
быть сгруппированы в цветочные, эфирные, мускусные,
камфорные, сладкие, гнилостные и жгучие запахи. Ясно, что при этом
в один и тот же класс попадают вещества совершенно различной
химической структуры; с другой стороны, сходные вещества
могут давать ощущения различного типа либо вообще быть лишены
запаха.
В настоящее время с химической стороны достигнут
определенный прогресс в направлении определения химических
группировок (осмофоров), которые индуцируют пахучее свойство при
введении их в различные молекулы; это позволяет думать, что
в основе обонятельной чувствительности лежит наличие в
мембране сенсорных окончаний рецепторных структур, способных
специфически реагировать с соответствующими осмофорами. Даль-
450
нейший анализ затрудняется тем, что подавляющее большинство
запахов представляет собой смешанные ощущения, возникающие
в результате сложных комбинаций эффектов различных
пахучих веществ; парфюмерия является хорошим примером
использования в практических целях исключительной способности
обонятельной системы к такому смешению.
В этом отношении более удобными для анализа могут быть
обонятельные рецепторные клетки некоторых беспозвоночных
животных, которые исключительно специфически реагируют
только на определенные химические вещества (используемые
в качестве коммуникативных сигналов либо сигналов для поиска
пищи). О вероятном наличии в нашей обонятельной системе ре-
цепторных клеток, специфически реагирующих на определенные
осмофоры, говорят встречающиеся у определенного процента
людей явления частичной аносмии, т. е. выпадения или резкого
снижения чувствительности только к определенной группе
запахов.
Характерной особенностью обонятельной рецепции является
исключительно высокая ее чувствительность, лежащая в ряде
случаев на пределе физической вероятности. У человека ряд
пахучих веществ воспринимаются в разведении порядка 1: К1',
а у беспозвоночных — еще на несколько порядков выше. Для
обоняния характерна хорошо выраженная адаптация к действию
пахучих веществ, которая носит избирательный характер;
последнее обстоятельство также указывает на наличие в
обонятельной системе раздельных рецепторов к различным* пахучим
веществам.
Вкусовые рецепторы, как и обонятельные, сосредоточены
у высших животных и человека на ограниченной поверхности —
на особых выростах (сосочках) слизистой оболочки языка.
Рецепторные клетки в количестве нескольких десятков собраны
в особые структуры — вкусовые луковицы (рис. 230) и
представляют собой вторичные рецепторы, соединенные с нервными
окончаниями афферентного нервного волокна синаптическими
контактами. Воспринимающая поверхность рецепторных клеток
образует ворсинки, обращенные в сторону углубления на вершине
луковицы, открывающегося на поверхность слизистой (так
называемая пора). Химическое вещество поэтому должно сначала
попасть в растворенном виде внутрь поры и лишь затем может
взаимодействовать с рецептор_ами этой поверхности.
В отличие от обонятельных рецепторов, вкусовые рецепторные
клетки четко разделяются на типы, которые по характеру
возникающего в результате их раздражения ощущения обозначаются
как рецепторы соленого, кислого, сладкого и горького.
Остальные вкусовые ощущения представляют собой комбинации этих
основных модальностей (необходимо иметь в виду, что то, что мы
понимаем под вкусом пищи, является еще более сложным
ощущением и представляет собой сочетание вкусовых,
обонятельных и тактильных ощущений).
451
Эти типы рецепторных клеток неравномерно распределены по
поверхности языка, и поэтому вкус различных химических
веществ неодинаково воспринимается разными его участками.
Однако соответствия между структурой химического вещества и
типом реагирующей на него рецепторной клетки и в этом случае
нет. Так, «сладкими» являются многие сахара, но также и
синтетические вещества, не имеющие ничего общего по своей структуре
с сахарами (сахарин); «горькими» — многие алкалоиды
растительного происхождения, но также и хлорид калия.
В связи с тем что вкусовые рецепторные клетки являются
относительно большими, в последнее время удалось осуществить
внутриклеточное отведение их потенциалов и зарегистрировать
возникающие в них при химическом раздражении деполяриза-
ционные рецепторные потенциалы. При этом оказалось, что
такие клетки являются не очень специфичными и отвечают на
вещества, относящиеся ко всем четырем группам раздражителей,
однако вещества одной из групп оказывают при этом
значительно более сильное раздражающее действие, чем остальные.
Соответственно при отведении импульсной активности одиночных
афферентных волокон также не отмечается полной специфичности,
однако выделяются волокна, в которых вещества одной из групп
вызывают значительно более сильный разряд импульсов, чем
вещества других групп.
Таким образом, окончательное определение модальности
раздражителя, как и в ряде рассмотренных выше сенсорных систем,
должно происходить в последующих звеньях вкусовой системы
на основании оценки пространственных особенностей
поступающего к ним по различным афферентным волокнам импульсного
разряда.
Терморецепторы. Восприятие температуры внешней среды
и ее изменений — также весьма важный фактор, определяющий
реакции организма, в особенности теплокровного. Как
показывают психофизические наблюдения, при этом речь идет о двух
различных рецепторных системах — рецепторах тепла и
рецепторах холода; при локальном температурном раздражении кожной
поверхности можно легко показать различное их
пространственное расположение, так называемые тепловые и холодовые точки.
Биофизические механизмы трансформации температурного
воздействия в нервное возбуждение неизвестны; пока нет даже
убедительных данных о том, какие именно рецепторные
структуры кожи ответственны за терморецепцию. Возможно, они
представляют собой свободные нервные окончания и являются, таким
образом, первичными рецепторами. Однако особенности
импульсного разряда, несущего информацию о температурном
воздействии, изучены веоьма обстоятельно. Он характеризуется
наличием двух компонентов — статического и динамического. При
постоянной температуре кожи в афферентном волокне возникает
разряд постоянной частоты. Для Холодовых волокон эта частота
увеличивается по мере снижения температуры до определенного
452
Рис. 231. Структура сетчатки:
/ — пигментный эпителий; 2 — колбочки и палочки
(фоторецепторы), 3 — горизонтальная клетка; 4 —
биполярная клетка- 5 —амакриновая клетка:
б — ганглионарная клетка, 7 — глиальная (мюлле-
ровская) клетка, 8 — зрительный нерв Стрелкой
указано направление падения света
максимума, а затем снижается; для
тепловых, наоборот, увеличивается по
мере нагревания также до
определенного максимума. В промежуточной
области (примерно 31— 36 °С) импуль-
сация возникает как в Холодовых,
так и в тепловых волокнах; это
соответствует субъективно нейтральной
зоне, при которой не ощущается
ни тепла, ни холода. При резком
изменении температуры появляется
динамический ответ — быстрый разряд,
частота которого зависит не только от величины
температурного сдвига, но и от его скорости. Такой ответ в тепловых
волокнах возникает при повышении температуры, а в Холодовых — при
ее снижении.
Фоторецепторы. Фоторецепторная система является самой
сложной по своей организации среди других сенсорных систем;
эта сложность определяется особенностями ее онтогенетического
развития, в ходе которого она закладывается как часть
центральной нервной системы и затем выдвигается на периферию, где
дифференцируется в световоспринимающую структуру глаза —
сетчатку.
Собственно фоторецепторные клетки — палочки и
колбочки — находятся в самом глубоком по направлению хода
световых лучей слое сетчатки, граничащем с пигментным эпителием
(рис. 231), поэтому свет до попадания к ним должен пройти
несколько слоев нервных элементов (так называемый
инвертированный глаз, характерный для всех позвоночных животных).
Колбочки являются рецепторными клетками центральной части сетчатки,
на которой проецируется оптическая ось преломляющих сред
глазного яблока, палочки — клетками более периферических
ее частей.
В основе трансформации световой энергии как в колбочках,
так и в палочках лежит фотохимическая реакция, возникающая
в особых макромолекулярных соединениях — зрительных .
пигментах. Эта трансформация наиболее детально изучена в
палочках, зрительным пигментом которых является зрительный
пурпур — родопсин. Родопсин находится в особых внутриклеточных
структурах палочек — так называемых мембранных дисках, где
он встроен в липидный бислой. Он интенсивно поглощает свет
и имеет два максимума поглощения — в видимой области (500 нм)
и в ультрафиолетовой (350 нм).
453
При поглощении кванта света происходит химическое
превращение родопсина, основным моментом которого является
фотоизомеризация хромофорной группы (ретиналя) — переход ее из
цис- в транс-форму (см. рис. 197, а). Этот переход происходит
в несколько этапов и заканчивается отщеплением ретиналя от
белка-носителя. Восстановление исходной конформации
родопсина происходит в темноте при участии ферментов пигментного
эпителия. При различных уровнях освещенности происходит
сдвиг равновесия этих реакций в ту или иную сторону;
соответственно изменяются концентрация светочувствительного пигмента
и чувствительность рецептора к свету (адаптация).
Химическая структура зрительных пигментов колбочек
изучена менее подробно. Однако точно установлено (при помощи
микроспектрофотометрических измерений спектров поглощения
отдельных рецепторных клеток), что они могут быть разделены
на три типа в зависимости от наиболее эффективно поглощаемой
длины световой волны (соответствующей красной, зеленой и
синей областям спектра).
Отдельные колбочки содержат только какой-либо один из
этих типов пигментов; эта важная особенность лежит в основе
способности зрительного аппарата различать длину световой
волны (цвет). Содержащие родопсин палочки одинаковы по своим
спектрам поглощения, поэтому они не могут служить для
определения длины световой волны и являются детекторами лишь ее
интенсивности. В связи с высотой чувствительности они могут
реагировать на очень слабые световые раздражители (аппарат
сумеречного зрения). Пигменты колбочек отличаются от родопсина
значительно меньшей чувствительностью к свету и служат для
дневного зрения.
Конформационные изменения молекул зрительного пигмента
путем сложных внутриклеточных процессов приводят в конечном
итоге к изменению мембранного потенциала палочки или
колбочки, длительность и интенсивность которого отражают
соответственные характеристики светового раздражения. В отличие
от всех прочих рецепторов, этот рецепторный потенциал носит
не деполяризационный, а гиперполяризационный характер,
прямые внутриклеточные отведения показали, что мембранный
потенциал рецепторнои клетки под действием света может возрастать
от —25 до —40 мВ.
Механизм сопряжения между процессами превращения
зрительного пигмента, проходящими во внутриклеточных дисках,
и изменениями потенциала поверхностной мембраны еще не
полностью выяснен; несомненно, он включает несколько звеньев,
одним из которых может быть освобождение из дисков ионов
кальция, а другим — образование определенных циклических
нуклеотидов. Эти внутриклеточные посредники диффундируют
внутрь рецепторнои клетки и приводят путем воздействия на
внутреннюю сторону поверхностной мембраны к изменению ее
ионной проводимости — очевидно, к закрыванию натриевых ка-
454
налов. В результате потенциал на мембране сдвигается ближе
к калиевому равновесному потенциалу.
Такой механизм возможен, если принять, что мембрана фото-
рецепторных клеток, в отличие от других возбудимых клеток,
в отсутствие раздражения имеет значительную натриевую
проводимость. Возникновение рецепторных потенциалов может быть
зарегистрировано и от поверхности глаза с помощью
макроэлектродов (электроретинограмма); однако в этом случае они
осложняются электрическими эффектами, возникающими в других
клетках сетчатки (пигментном эпителии, нервных и глиальных
клетках), и поэтому имеют весьма сложное временное течение.
С помощью синаптических соединений электрические
изменения на мембране рецепторных клеток передаются на связанные
с ними собственно нервные элементы сетчатки — биполярные
клетки. Последние, в свою очередь, при помощи синаптических
соединений связаны с ганглиозными клетками, центральные
отростки которых образуют волокна зрительного нерва.
Рецептор ные клетки образуют также соединения с горизонтальными
клетками, которые, в свою очередь, контактируют с соседними
рецепторными клетками.
По-видимому, синаптическая передача в этих синаптических
соединениях также имеет принципиальное отличие от таковой
в других синапсах — в связи с гиперполяризационным типом
рецепторного потенциала при световом раздражении здесь
происходит не освобождение медиатора, а торможение фонового его
выделения, которое имеет место в темноте Лишь в биполярных
клетках характер синаптической передачи сменяется на
обычный — в ганглиозных клетках в ответ на световое раздражение
развивается обычный деполяризационный ВПСП,
генерирующий разряд импульсов в волокнах зрительного нерва
В то же время в биполярных клетках механизм генерации
распространяющихся потенциалов действия, по-видимому,
вообще отсутствует. В связи с очень небольшой длиной этих
клеток (несколько сотен микрометров) электрический сигнал от
одного отростка к другому может передаваться у них
электротоническим путем, без участия регенеративного электрогенеза.
В связи с описанной сложностью структуры сетчатки,
представляющей собой вынесенный на периферию нервный центр,
в ней происходит сложная переработка информации,
поступающей от собственно рецепторных элементов; общие принципы
такой переработки рассматриваются ниже.
Важной особенностью фоторецептор ной системы является
ее способность различать не только интенсивность и длину
световой волны, но и пространственное расположение источников
светового излучения; благодаря этой особенности зрение
оказывается ведущей сенсорной системой, позволяющей организму
ориентироваться в пространстве Пространственное зрение
возможно благодаря наличию в глазе особой оптической системы,
создающей на сетчатке изображение внешней среды. Основными
455
элементами этой оптической системы являются преломляющие
среды — роговица и хрусталик, характеристики которых в
нормальном глазе таковы, что они фокусируют параллельные лучи
(т. е. лучи, исходящие от удаленных предметов) на поверхности
сетчатки. Важной характеристикой линзы является преломляющая
сила RP = -т, где / — фокусное расстояние. Если / дается
в метрах, то единицей преломляющей силы линзы будет диоптрия
(D). Общая преломляющая сила* диоптрического аппарата глаза,
которая определяется преломляющими силами хрусталика и
роговицы, 58,61).
Особую важность имеет способность глаза изменять степень
преломления за счет изменения кривизны хрусталика
(аккомодации), которая происходит благодаря наличию у него
внутреннего эластического напряжения, освобождаемого при сокращении
круговой ресничной мышцы, к которой при помощи особой связи
прикреплен хрусталик. Благодаря аккомодации глаз может
создавать на сетчатке сфокусированное изображение не только
удаленных, но и близких предметов, световые лучи от которых
имеют расходящееся направление. Однако с возрастом
происходит неизбежное ухудшение эластических свойств хрусталика и
способность к аккомодации ослабевает (старческаядальнозоркость).
Важным элементом устройства оптического аппарата глаза
является также диафрагма (радужная оболочка) с отверстием
(зрачком). Благодаря наличию в радужной оболочке систем
кольцевых и радиальных мышечных волокон, иннервируемых
соответственно симпатическими и парасимпатическими нервными
волокнами, диаметр зрачка может рефлектор но регулироваться,
изменяя в зависимости от освещенности количество света,
поступающего к сетчатке. При суженном зрачке одновременно
существенно улучшаются оптические свойства глаза за счет
уменьшения явлений сферической и хроматической аберраций. При
низкой освещенности расширяющийся зрачок пропускает к
сетчатке значительно больше света, однако при этом неизбежно
ухудшаются оптические свойства глаза.
Созданное оптическим аппаратом изображение на сетчатке
затем анализируется рецепторными элементами, которые
представляют собой растровую систему. Разрешающая способность
последней определяется рядом анатомических и биофизических
факторов. В первую очередь сюда относятся размер рецепторных
клеток и способ их связи с последующими звеньями зрительной
системы. В центральной ямке —области сетчатки, на которой
фокусируются лучи от фиксируемого зрением предмета, размеры
колбочек минимальны; кроме того, каждая из* них соединена
с одной ганглиозной клеткой, посылающей волокно в
зрительный нерв. Поэтому острота зрения (измеряемая тем
минимальным углом, под которым должны попадать на сетчатку лучи от
двух точек для того, чтобы они воспринимались как раздельные)
здесь максимальны.
456
В стороны от центральной ямки основными рецепторными
элементами становятся палочки; их связи с последующими
нервными элементами характеризуются широкой конвергенцией,
т. е. схождением к одному передающему каналу. Острота зрения
в этой области существенно снижается. Одновременно, однако,
происходит повышение чувствительности системы за счет сумма-
ции при такой конвергенции слабых сигналов от отдельных рецеп-
торных клеток.
С другой стороны, на разрешающей способности сказываются
физические характеристики оптической системы. Всякое
нарушение четкости изображения вследствие усиления аберрации,
изменения преломляющих свойств, помутнения будет, в свою
очередь, снижать остроту зрения.
Ясно, что возникающее на сетчатке изображение внешней
среды весьма отличается от самой среды в первую очередь
своими очень уменьшенными размерами; кроме того, оно
оказывается перевернутым. Тем не менее в наших зрительных ощущениях
мы оцениваем характеристики среды правильно. Эта способность
строится на последующей переработке сигналов от
фоторецепторов, происходящей в высших центрах зрительной системы, и
вырабатывается в ходе индивидуального опыта организма.
Огромные возможности перестройки этих процессов можно
иллюстрировать известными опытами с испытуемыми,
надевавшими очки, переворачивающие изображение на сетчатке глаз.
В течение некоторого времени зрительная ориентация в
пространстве у таких людей была полностью нарушена; однако через
некоторое время они вновь приобретали способность видеть
окружающий мир правильно ориентированным.
Существенным фактором в зрительном восприятии
окружающей среды является виденье двумя глазами — бинокулярное
зрение, в результате которого предметы не двоятся, а
воспринимаются как разноудаленные. Как легко убедиться, при переходе
на зрение одним глазом восприятие взаимной удаленности
предметов (глубины) резко ухудшается. Физической основой
бинокулярного зрения является перекрытие полей зрения каждого
глаза, которое достигается за счет высокосогласованной
деятельности множества глазодвигательных мышц.
При фиксации какого-либо предмета двумя глазами его
изображение в обоих глазах строится на идентичных точках
сетчатки (в области центральной ямки). Изображения же ближе
или дальше расположенных предметов при этом оказываются
удаленными от центральной ямки на различные расстояния и
попадают на несоответствующие (диспаратные) точки.
Пространственное несоответствие сигналов, поступающих в высшие
зрительные центры по зрительным волокнам от таких точек
сетчатки, и является носителем информации о различной удаленности
источников световых лучей.
Ноцицепторы (болевые рецепторы). Болевые
рецепторы представляют собой совершенно особую группу рецепторных
457
структур, характеризующуюся отсутствием специфичной
чувствительности к какому-либо определенному типу внешней
энергии. Основным условием активации таких рецепторов является
большая интенсивность внешнего воздействия, которая может
повредить организм. Функциональная роль этого типа рецепции
совершенно очевидна — она сигнализирует об опасности
воздействия и вызывает комплекс реакций, направленных на устранение
такой опасности. Болевые рецепторы широко распространены на
внешних поверхностях организма — коже и слизистых
оболочках; кроме того, они многочисленны и в ряде внутренних
органов— в основном в их оболочках (плевра, перикард, твердая
мозговая оболочка и др.).
Вопрос о структуре болевых рецепторов до сих пор является
дискуссионным. До последнего времени значительной
поддержкой пользовалась гипотеза, согласно которой ноцицептивные
сигналы возникают не в специальных высокопороговых, а в
обычных низкопороговых рецепторах; сигналом о повреждающем
воздействии является особый характер разряда, который каким-то
образом оценивается в центральных нервных структурах как
болевой.
Однако в настоящее время наличие особых ноцицепторов
не вызывает сомнения; так, в коже при точечном раздражении
острым предметом четко выделяются болевые точки, воздействие
на которые не вызывает никаких иных ощущений, кроме боли.
С наибольшей вероятностью к ноцицепторам можно отнести
свободные нервные окончания, представляющие собой первичные
рецепторные структуры. Особенно четко принадлежность
свободных нервных окончаний к ноцицепторам видна в роговице —
поверхности, обладающей самой высокой болевой
чувствительностью в организме.
Свободные нервные окончания являются в ней единственным
видом рецепторных структур, а также единственными
окончаниями в ряде внутренних органов, раздражение которых может
вызывать сильные болевые ощущения. Вероятно, среди
ноцицепторов есть все же некоторая специализация: определенные
болевые точки эффективнее раздражаются сильными
механическими, а другие — сильными термическими воздействиями;
некоторые в равной мере чувствительны к тем и другим.
В связи с ничтожными размерами ноцицепторов не
представляется пока возможным определить биофизические механизмы
трансформации в них раздражения в соответствующий сигнал.
Возможно, что по крайней мере в некоторых случаях в этом
процессе принимают участие промежуточные механизмы в виде
химических изменений в окружающих окончание тканях (изменение
рН, выделение особых биологически активных веществ), которые
затем активируют соответствующие мембранные рецепторные
группировки.
Характерной особенностью ноцицепторов является отсутствие
в них выраженной адаптации; более того, в ряде случаев отме-
458
чается противоположное явление — повышение эффективности
раздражения при длительном его действии (сенситизация). Эта
особенность соответствует функциональному назначению
болевой чувствительности — предупреждению об опасности, которая
ни в коей мере не ослабевает при повторении повреждающего
раздражения.
15.4. Передача и переработка информации в нервных
центрах. После трансформации внешней энергии в нервные процессы
в каждой сенсорной системе происходит сложная
последовательность превращений этих процессов, захватывающая ряд
надстроенных друг над другом нервных центров и заканчивающаяся
в самом высшем из них — коре большого мозга, в котором на
основе пространственно-временного распределения активности
нервных клеток возникает качественно новое явление —
субъективный образ раздражителя. Каждая сенсорная система имеет
свои промежуточные и высшие нервные центры, отличающиеся
по расположению и организации; изучение их
функционирования представляет собой предмет нейрофизиологии, и сведения
о нем можно найти в соответствующих руководствах. Здесь будут
рассмотрены лишь общие принципы передачи и переработки
информации в сенсорных системах, составляющие предмет
биофизики сложных систем.
Сенсорные пути, передающие сигналы от рецепторных клеток
до коры полушарий большого мозга, всегда состоят из нескольких
последовательно соединенных нейронов. При этом нейроны
каждого последующего звена собраны в структуру, которая имеет
аналогию с экраном: поступающие от различных рецепторных
клеток афферентные волокна образуют синаптические соединения
с определенными клетками этой структуры, так что
пространственная организация рецепторов оказывается как бы
спроецированной на нейроны следующего звена. Количество таких экранных
структур варьирует у различных сенсорных систем. Особенно
велико оно у зрительной системы, поскольку два
последовательных переключения, как уже описывалось выше, имеют место
еще в сетчатке.
Благодаря такой организации сенсорных систем, в них
возможна передача информации по принципу пространственного
кодирования, необходимая для отражения целого ряда
характеристик внешних раздражителей. Однако в каждом переключении
в действие включаются дополнительные механизмы, которые
существенно влияют на передачу через них сенсорных сигналов.
1. Каждое поступающее в переключающее звено афферентное
волокно заканчивается синаптическими окончаниями не на одном
нейроне, а охватывает ряд клеток (дивергенция). В результате
участок возбуждения после переключения оказывается
расширенным, «размытым».
2. В свою очередь, в результате дивергенции к каждому
нейрону поступают синаптические влияния не от одного
афферентного волокна, а сразу от нескольких (конвергенция). Вслед-
459
1X1X1X1X1X1X1 ,
ф • • • • • • 2
1X1X1X1X1X1X1
♦ ф # # #
Рис. 232. Схема конвергенции и дивергенции
афферентных волокон в последовательных синаптических
/ переключениях афферентных путей:
У— рецепторы; 2 — первое переключение; 3 — второе
переключение
ствие этого даже слабые влияния от какого-
либо афферента получают возможность
суммироваться с влияниями других афферен-
тов; возникает пространственная суммация
передаваемых сигналов. Схематически обе
возможности представлены на рис. 232.
Очевидно, при отсутствии какого-то
дополнительного контроля явлений дивергенции
и конвергенции на нескольких
последовательных звеньях переключения возможность
пространственного кодирования информации
свелась бы к нулю. Однако этому
противодействуют ограничивающие механизмы, которые
также присутствуют во всех переключающих структурах.
Ограничение распространения возбуждения осуществляется с
помощью местных тормозящих нейронов, которые активируются
поступающими афферентными сигналами и, в свою очередь,
затормаживают активность переключающих нейронов. Такое
торможение может осуществляться несколькими способами:
1. Опережающее торможение (рис. 233, а). В этом случае
тормозящие нейроны активируются прямо коллатералями
афферентных волокон и торможение в переключающем звене
возникает одновременно с возбуждением передающих клеток;
оно не зависит от уровня активности последних, а отражает
активность рецепторных клеток или предыдущего
переключающего звена (feed-forward inhibition).
2. Возвратное постсинаптическое торможение (рис. 233, б).
В этом случае тормозящие клетки активируются коллатералями
аксонов, отходящих от переключающих нейронов, и создают
в этих же нейронах ТПСП. Чем сильнее возбуждаются эти ней-
II i
га?
Рис. 233. Различные виды торможения:
а — опережающее торможение; б — возвратное постсинаптическое торможение; в — воз
вратное пресинаптическое торможение, J — входящие афферентные волокна; 2 •—
тормозящие нсйроныг 3 — выходящие нейроны
460
Рис. 234. Эффект латерального
торможения на пространственную передачу
сигналов через синаптические переключения.
Справа показана схема возбуждающих синап-
тических связей между рецепторами и
вставочными нейронами. Черные— тормозяшие
вставочные нейроны. Частоты импульсации F в
возбужденном участке вокруг места стимуляции
на уровне рецепторных клеток (/), после
первого переключения (2) и после второго
переключения (3)
роны, тем сильнее будет и воз-
вратйое их торможение; иными
словами, осуществляется
отрицательная обратная связь (feed-back
inhibitor!).
3. Возвратное пресинаптичес-
кое торможение. В этом случае
тормозящие клетки также
активируются коллатералями аксонов переключающих нейронов, но
их действие направлено не на сами нейроны, а на терминали
контактирующих с ними афферентных волокон (рис. 233, в).
Деполяризуя их через посредство аксо-аксональных синапсов, такие
клетки снижают эффективность синаптической передачи
возбуждения через переключающие нейроны.
Поскольку степень активации каждого из этих механизмов
может быть самой различной, как и степень охвата
соответствующим торможением переключающих нейронов, то в результате
создается исключительно динамичная система регуляции
передаточных функций соответствующего переключающего звена
Количественное описание такой регуляции пока не
представляется возможным, поскольку мы не имеем точных характеристик
организации и активности каждой тормозящей системы.
Качественно наиболее определенно роль торможения выявляется
в форме так называемого латерального торможения, которое может
создаваться за счет как пост-, так и пресинаптических
возвратных тормозящих влияний.
Поскольку тормозящие нейроны обладают обычно широко
ветвящимися отростками и устанавливают синаптические
контакты со многими переключающими нейронами, то при
поступлении по какому-либо афферентному входу волны возбуждения
наряду g активацией соответствующих нейронов возникает более
широко распространенное торможение, которое может
ограничивать «размывание» возбуждения после переключения, связанное
с описанной выше дивергенцией возбуждающих влияний.
Схематически эффект такого действия торможения представлен на
рис. 234. Явления контраста, описанные выше при изложении
данных психофизических экспериментов, несомненно, являются
отражением латерального торможения.
Таким образом, при передаче информации через каждое
последующее переключающее звено в сенсорной сис^меПроисходит
461
взаимодействие двух противоположных тенденций — потери
точности пространственного кодирования в связи с дивергенцией
возбуждения и восстановления этой точности за счет
латерального торможения. Такая система передачи является весьма
динамичной и допускает, в зависимости от интенсивности
поступающего сигнала и уровня активности тормозящих нейронов,
широкие изменения в передаточных функциях каждого
переключающего звена. Более того, если представить себе, что
пространственная организация тормозящих связей в переключающем звене
может быть не случайной, а ориентированной, то в результате
в нем возникнут возможности для преимущественной передачи
сигналов, имеющих определенные пространственные
характеристики.
Особенно четко эти особенности передачи сигналов через
переключающие звенья можно проследить в зрительной системе,
в которой легко наносить на рецептивное поле (сетчатку)
стимулы любой пространственной ориентации. При этом в
соответствующих переключающих звеньях при помощи
микроэлектродного отведения можно точно определить характеристики
возбуждения нейрона в ответ на приложенные стимулы. Наряду
с клетками, имеющими простые рецептивные поля,
обнаруживаются клетки, отвечающие импульсным разрядом только на
определенную ориентацию стимулирующего засвета либо на
движение стимула по сетчатке в определенном направлении
и пр.
Таким образом, в переключающих звеньях образуются
нейронные структуры, являющиеся детекторами соответствующих
сложных характеристик внешнего стимула. Они позволяют
проводить дополнительный анализ сигналов, поступающих от ре-
цепторных клеток, и выделять определенные их характеристики
на основании перекодирования пространственной и временной
структуры передаваемой импульсации.
Активный характер переработки передаваемых от рецепторов
сигналов в переключающих звеньях сенсорных систем
проявляется и в том, что эти звенья находятся под контролем влияний,
поступающих к ним из высших мозговых центров. В составе
сенсорных путей имеются не только центростремительные,
афферентные, волокна, но и центробежные, эфферентные,
устанавливающие синаптические связи с различными нейронами
переключающих звеньев.
В результате нисходящих влияний может происходить целый
ряд изменений в передаточных функциях переключающего звена.
Если в результате активации тормозящих нейронов произойдет
общее повышение порога синаптическои передачи, то это будет
равноценно ослаблению внешнего стимула, действующего на
рецепторы; такой эффект может быть одним из механизмов
широко известного психологического явления внимания, когда при
сосредоточении усилия на восприятии какого-то одного типа
раздражителей другие их типы перестают замечаться. Но изме-
462
нения могут быть и более специфическими, заключаясь,
например, в сужении или расширении рецептивного поля
переключающего нейрона или даже изменении модальности нейрона, на
котором конвергируют различные типы афферентных волокон.
В высшем отделе головного мозга —- коре полушарий
большого мозга — различные сенсорные системы представлены в
пространственно-разграниченных областях Так, у человека сома-
тосенсорная чувствительность локализована в основном в
постцентральной извилине (зона S1), зрительная—в затылочной
доле (поля 17, 18, 19), слуховая — в верхней части височных
долей (поле 41), вкусовая — также в постцентральной извилине,
обонятельная — на внутренней поверхности полушарий (пири-
формная область). Кроме этих первичных сенсорных областей
для большинства сенсорных систем характерно наличие
дополнительных (вторичных и третичных) областей, пространственно
отдаленных от первичных.
В сенсорных областях коры сохраняется пространственная
организация представительства соответствующей рецептор ной
поверхности, характерная для переключающих звеньев. Наряду
с клетками, отличающимися простыми рецептивными полями,
здесь имеются нейроны со сложными и сверхсложными
рецептивными полями, в активности которых отражаются самые
различные характеристики действующих на рецепторы раздражителей.
Каким образом в коре происходит объединение активности
различных типов нейронов, дающее в результате цельное
восприятие внешнего воздействия, мы пока не знаем. Ясно, что
предпосылкой для этого является исключительно сложная
структурная организация коры большого мозга, представляющая собой
слоистую структуру, в которой строго ориентированные клетки
связаны между собой системой тангенциальных и вертикальных
связей, допускающих практически беспредельные возможности
межнейронных контактов.
О том, чю в основе высшего анализа сенсорных сигналов
лежит активация сложных объединений корковых нейронов,
говорит, в частности, то обстоятельство, что появление
сенсорных ощущений можно вызвать и путем прямого раздражения
сенсорных областей большого мозга электрическим током у боль
ных при нейрохирургических операциях, проводимых пой
местной анестезией.
Вместе с тем для возникновения субъективного ощущения
необходим, очевидно, определенный уровень такой активации,
поскольку определенные сенсорные сигналы могут оставаться
неощущаемыми, несмотря на то, что, судя по
электрофизиологическим показателям, они несомненно поступают в корковые
структуры. Существенную роль играет и общий уровень
активности коры большого мозга, поддерживаемый неспецифическими
влияниями из подкорковых структур, в первую очередь из
ретикулярной формации мозгового ствола. При снижении этого
уровня способность к сознанию обратимо исчезает.
463
Глава 16. УПРАВЛЕНИЕ ДВИГАТЕЛЬНОЙ ФУНКЦИЕЙ
ОРГАНИЗМА
В результате анализа и оценки в нервной системе
информации, которую организм получает через свои сенсорные структуры,
возникает та или иная деятельность организма; являясь
закономерным ответом последнего на внешнее воздействие,
осуществляемым через посредство нервной системы, она обозначается как
рефлекторная реакция. Основным компонентом такой реакции
является мышечное сокращение, посредством которого организм может
приблизиться к раздражителю, если он представляет для него
интерес, уйти от раздражителя, если последний может причинить
вред, и т. д.
Биофизические механизмы мышечного сокращения уже
рассматривались в гл. 11. В настоящей главе мы рассмотрим
биофизические характеристики системной двигательной деятельности
высших организмов, лежащей в основе самых различных их
рефлекторных реакций.
16.1. Скелетная мышца как саморегулирующаяся система.
Любая мышца, рассматриваемая изолированно от иннервиру-
ющих ее нервных центров, ведет себя как пассивная эластическая
структура, растягивающаяся при растяжении. Однако, если oija
включена в систему афферентных и эфферентных связей с этими
центрами, биофизические характеристики мышцы оказываются
существенно измененными, и она приобретает свойства
саморегулирующейся системы, меняющей свое состояние в зависимости от
степени растяжения.
Эта способность обеспечивается за счет так называемых
собственных рефлексов мышц, рецептивные структуры которых
находятся в них самих и которые являются сенсорами (датчиками)
физических характеристик их состояния (длины и напряжения).
Наличие этой способности позволяет мышцам при любых
положениях и движениях конечностей или туловища сохранять
определенное исходное состояние, от которого затем могут быть
осуществлены те или иные двигательные реакции.
Рецепторный аппарат мышц. Сенсорами состояния
скелетной мышцы являются два типа мышечных рецепторов —
мышечные веретена и сухожильные органы. Мышечные веретена
представляют собой более тонкие и короткие мышечные волокна,
собранные в веретенообразные пучки и покрытые снаружи
соединительно-тканной капсулой. Основной особенностью таких ин-
трафузальных мышечных волокон является то, что наряду с
двигательной иннервацией, обеспечиваемой особыми тонкими
двигательными волокнами (обозначаемыми как гамма-волок на,
поскольку они, по классификации Эрлангера и Гассера, по
диаметру относятся к волокнам группы А 7), они несут на себе
также механорецептивные чувствительные нервные волокна.
Концевые разветвления последних в виде спирали обвивают ин-
трафузальные мышечные волокна.
464
■ Mill MIL ЛИШИ III IN. mi mm "iiiiihm..
- IIIHI MM мни i | | 2
a 6 6 г
Рис. 235. Схема импульсной активности афферентов
мышечных веретен (/), и сухожильных рецепторов (2) в
покое (а), при растяжении мышцы (б), при
изотоническом сокращении мышцы (в) и при сокращении интрафу-
зальных мышечных волокон (г); 3 — изменение
напряжения мышцы
По своей тонкой структуре эти рецепторы разделяются на
два типа. Одни из них образованы афферентными волокнами
большого диаметра (так называемые группы 1а) и оплетают
центральную часть мышечного волокна (первичные, или аннуло-
спиральные окончания), другие — афферентными волокнами
меньшего сечения (группа II); последние располагаются на интра-
фузальных волокнах более периферично (вторичные окончания).
Мембранные механизмы активации этих чувствительных
структур, как и других механорецепторов, пока неясны; вероятно,
они связаны с растяжением их мембраны при растяжении
мышечных волокон, на которых они располагаются (см. гл. 15).
Однако характер преобразования сигнала, которое в них
происходит, изучен совершенно точно при помощи отведения
возникающей в афферентных волокнах импульсации. Примеры таких
сигналов представлены на рис. 235, б. В первичных окончаниях
растяжение мышцы вызывает разряд, частота которого зависит
как от степени растяжения, так и от его скорости, т. е. такие
окончания являются пропорционально-дифференциальными
датчиками длины мышцы. Во вторичных же окончаниях, которые
являются значительно менее чувствительными к растяжению,
разряд отражает лишь степень последнего (пропорциональные
датчики длины мышцы).
Характеристики этих датчиков хорошо выявляются в том
случае, если мышцу не растягивать, а наоборот, вызывать ее
сокращение посылкой сигнала по двигательным волокнам. При этом
разряд мышечных рецепторов, если он был вызван предварительным
натяжением, исчезает на период сокращения (рис.235, в) —
очевидное следствие того обстоятельства, что интрафу зальные мышечные
волокна располагаются параллельно обычным волокнам, и поэтому
при сокращении мышцы их длина уменьшается.
Совершенно особые изменения афферентного разряда
происходят в том случае, когда к мышце поступает сигнал по гамма-
волокнам, иннервирующим интрафузальные мышечные волокна.
Так как количество последних в общей массе мышцы невелико,
465
то изменений ее натяжения при этом не происходит. Однако
возникает повышение чувствительности ее рецепторного
аппарата к растяжению, так что при одной и той же степени
последнего частота афферентного разряда оказывается увеличенной
(рис. 235, г). Причиной этого эффекта является, очеврщно,
сокращение интрафу зальных мышечных волокон, сопровождающееся
их укорочением. При этом растяжение мышцы будет, естественно,
более эффективно раздражать такие рецепторы.
Таким образом, в рецепторах мышечных волокон оказывается
заложенной система настройки их чувствительности,
управляемая сигналами из центральной нервной системы; эта система
может компенсировать те изменения в чувствительности
рецепторов, которые будут происходить при укорочении мышцы и
соответственно уменьшении натяжения интрафузальных волокон.
Точность такого контроля усугубляется тем обстоятельством,
что влияния гамма-волокон могут быть двух типов*
динамическими и статическими. Первые изменяют чувствительность
мышечных рецепторов к скорости растяжения но мало влияют на их
статическую чувствительность; другие же эффективно изменяют
частоту афферентного разряда именно при постоянном
растяжении мышцы. Таким образом, регулированию оказываются
подчиненными как пропорциональные, так и дифференциальные
характеристики мышечных рецепторов.
Сухожильные органы Гольджи, как показывает название,
расположены среди сухожильных нитей, при помощи которых
мышцы присоединяются к точкам прикрепления, и представляют
собой концевые разветвления афферентных волокон группы lb.
Характеристики их как датчиков четко выявляются при
исследовании возникшего в них импульсного разряда в ответ на
растяжение или сокращение мышцы. При растяжении частота этого
разряда возрастает, как и у пропорциональных рецепторов
мышечных веретен; однако при сокращении разряд не только не
исчезает, но еще дальше учащается — пропорционально силе
сокращения (см. рис. 235). Это указывает на расположение таких
рецепторов последовательно с мышечными волокнами, а
непараллельно им; соответственно они служат датчиками сведений не
о длине мышцы (как мышечные веретена), а о ее напряжении.
Механизмы саморегуляции состояния мышцы.
Наличие описанного выше рецепторного аппарата лежит в основе саморе-
гуляторных механизмов, важных для успешного
функционирования мышечного аппарата. Кроме рецепторного аппарата и идущих
от него афферентных волокон эти механизмы включают
соответствующий сегмент спинного мозга, в который поступают
афферентные волокна и где они соединяются синаптическими
соединениями с двигательными нейронами, посылающими эфферентные
(двигательные) волокна к той же мышце. Образованная таким
образом рефлекторная дуга от рецепторов мышечных веретен
отличается удивительной простотой и представляет собой
последовательное соединение всего двух нервных клеток — афферент-
460
ной (чувствительной) и эфферентной (двигательной), и поэтому
она обозначается как двухнейронная (моносинаптическая).
Когда при растяжении мышцы происходит активация
рецепторов мышечных веретен, возникающий рефлекс растяжения
приводит в действие двигательные нейроны и связанные с ними
мышечные волокна. Мышца сокращается и уменьшает
возникшее растяжение. Напротив, при сильном сокращении мышцы
происходит ослабление или прекращение разряда от мышечных
веретен: синаптическое воздействие на двигательные нейроны
ослабевает, и интенсивность сокращения падает.
Таким образом, по принципу сервомеханизма осуществляется
автоматическая компенсация изменений нагрузки мышцы,
направленная на сохранение ее постоянной длины. При этом
основную роль играют обратные влияния от первичных окончаний
мышечных веретен, которые имеют остронаправленный характер
и сказываются в основном на мотонейронах той же самой (гомо-
нимной) мышцы. Рефлекторные влияния от вторичных окончаний
оказываются более распространенными и захватывают ряд мышц;
функциональный смысл этих влияний менее ясен.
Афферентные волокна от сухожильных рецепторов не
устанавливают прямых синаптических контактов с мотонейронами,
а связываются с ними посредством вставочных клеток. Характер
влияний сигналов, возникающих в этих волокнах, на
мотонейроны мышцы противоположен описанному выше: в
мотонейронах развиваются тормозящие постсинаптические потенциалы
(ТПСП — см. гл. 10), угнетающие их возбуждающее действие
на мышцу. В связи с тем что торможению при этом подвергается
та же мышца, рецепторы которой раздражаются, это торможение
обозначается как аутогенное.
Поскольку сухожильные рецепторы представляют собой,
как показано выше, датчики напряжения, то очевидно, что такое
обратное влияние направлено на снижение напряжения мышцы
при ее сокращении; наоборот, при снижении мышечного тонуса
будет иметь место растормаживание мотонейронов и повышение
их активности. Таким образом, создается сервомеханизм,
компенсирующий изменения напряжения мышцы и способствующий
поддержанию постоянства ее напряжения.
Естественно, что при естественной деятельности мышцы
сохранить постоянными как ее длину, так и напряжение не
представляется возможным. При этом оба сервомеханизма
оказываются по-существу противодействующими. По-видимому, на
постоянном уровне поддерживается скорее не длина или
напряжение мышцы, а ее жесткость (stiffness) — отношение
изменения напряжения мышцы к изменению длины. Обычно это соот-
ношение составляет около 75 (т. е. для удлинения мышцы вдвое
необходимо приложить силу, в 75 раз превышающую силу,
развиваемую при тетаническом сокращении).
Жесткость мышцы имеет большое значение, так как именно
она определяет поведение последней при малых изменениях
467
длины. В частности, при поддержании позы жесткость мышц
обеспечивает стабилизацию взаимного положения отдельных
звеньев тела при различных отклоняющих воздействиях.
Поэтому такое регулирование состояния мышцы обозначается
точнее как поддержание короткодиапазонной жесткости.
16.2. Скелетная мышца как эффектор. Описанная выше
саморегулирующаяся система является одновременно эффекторной
системой, осуществляющей самые разнообразные двигательные
реакции организма. Выполнение таких реакций происходит под
влиянием нервных импульсов, поступающих от соответствующих
групп мотонейронов (мотонейронных пулов) к мышечным
волокнам; каждый мотонейрон вместе с иннервируемыми
разветвлениями его аксона мышечными волокнами образует двигательную
единицу.
Для выполнения движения используются 2 механизма.
Первый является функцией одной двигательной единицы и
базируется на изменении частоты (и последовательности) импульсации,
генерируемой мотонейроном. При этом одиночные сокращения
сливаются сначала в зубчатый, а затем в сплошной тетанус;
соответственно сила сокращения возрастает. Второй заключается
в вовлечении в активность (рекрутировании) новых
двигательных единиц, возможном благодаря различиям в пороге
возбуждения различных мотонейронов и эффективности синаптиче-
ского воздействия на них. Относительная роль этих двух
механизмов варьирует в зависимости от того, какой процент
мотонейронов данного ядра уже рекрутирован.
Существенной особенностью рекрутирования мотонейронов
является зависимость его порога от размера клетки —
маленькие мотонейроны (отличающиеся более тонким аксоном)
вовлекаются в активность раньше, чем большие с толстыми быстро-
проводящими аксонами (Хеннеман и сотр., 1965). Поскольку
между диаметром аксона и характером иннервируемых им
мышечных волокон также имеется определенная зависимость
(тонкие аксоны иннервируют медленносокращающиеся и в то же
время малоутомляющиеся волокна, в то время как толстые —
быстросокращающиеся, но подверженные утомлению), то такой
механизм может обеспечивать рациональный выбор
двигательных единиц в соответствии с характером двигательного акта.
При слабой синаптической активации, характерной для
длительных поздних сокращений, происходит рекрутирование
«маленьких», медленных, но неутомляющихся двигательных единиц;
при сильной же активации, связанной с вызовом быстрых
фазных сокращений, подключаются соответственно хотя и легко
утомляющиеся, но сильные и быстрые «большие» двигательные
единицы.
Выполнение любого движения под влиянием двигательной
команды, зародившейся в той или иной мозговой структуре и
поступившей к эффекторам — мотонейронам, связано с
неизбежным взаимодействием его с описанными выше саморегуляюрными
468
Рис. 236. Схема взаимодействия нисходящей
двигательной команды и собственного рефлекторного
механизма мышцы:
1 — нисходящие двигательные пути спинного мозга;
2 — мотонейроны, 3 — экстра- и интрафузальные
мышечные волокна
рефлексами (рис. 236). Последние должны
быть перенастроены на другую «рабочую
точку», и такая перенастройка
осуществляется за счет изменений в ряде звеньев
механизма саморегуляции. Изменение
частоты импульсации в тех путях, которые
передают двигательную команду к
мотонейронам, вызывает соответствующее
изменение в частоте импульсации как а-, так и 7"мотоней-
ронов; последние, в свою очередь, изменяют возвратную
афферентную импульсацию мышечных веретен, сдвигая частотную
характеристику последних и меняя их коэффициент усиления.
В результате система управления продолжает функционировать
таким образом, чтобы поддерживать новую длину (или
жесткость) мышцы.
При естественных движениях происходит регулирование
длины не одной какой-либо мышцы; в осуществлении движения
любого сустава задействованы минимум две, а то и значительно
больше мышц. Между ними возникают сложные отношения
сопряжения: с одной стороны, механического (поскольку сокращение
одной мышцы будет вызывать растяжение мышцы,
осуществляющей противоположное движение в суставе) и, с другой,
рефлекторного. Последнее основано на синаптическом торможении
мотонейронов мышцы-антагониста при помощи включения в
активность тормозящих нейронов. По своей направленности оно
представляет собой опережающее торможение (см. параграф
15.4), а по функциональной значимости обозначается как ре-
ципрокное. Группы мышц, сопряженные таким образом,
образуют единые системы, управляющие положением сустава.
Такие системы сложным образом переплетаются между собой
при обеспечении координированных движений конечностей
и тела. В этой координации участвует множество систем
обратной связи, которые передают в нервные центры, ответственные
за инициацию движений, сигналы от мышечных веретен,
сухожилий и связок, кожи, а также вестибулярного аппарата.
Количественное описание этой сложнейшей системы пока не
представляется возможным, хотя иерархическое соподчинение различных
ее уровней можно себе представить уже довольно подробно.
469
Глава 17. ПОСТОЯНСТВО ВНУТРЕННЕЙ СРЕДЫ
ОРГАНИЗМА И ЕГО РЕГУЛЯЦИЯ
В предыдущих главах мы рассмотрели биофизические
аспекты функционирования двух сложных систем высших
организмов—чувствительной и двигательной, обеспечивающих их
взаимодействие с изменяющейся внешней средой и позволяющих
им приспосабливаться к этим изменениям либо использовать
их для своих нужд. Важнейшим свойством живых организмов
является, наряду с непрерывным реагированием на внешние
воздействия, способность поддерживать свое внутреннее
постоянство (гомеостаз). Это постоянство выражается в первую очередь
в поддержании строго сохраняемой активной реакции
внутренних сред, их температуры, содержания в них кислорода и
углекислого газа, основных энергетических и строительных веществ
(углеводов, белков, жирных кислот).
Нормальное функционирование всех клеточных структур
организма является в высшей степени зависимым от указанных
факторов, и сдвиг их показателей даже в небольшой степени
может привести к глубоким нарушениям жизненных функций.
Вместе с тем клеточные процессы характеризуются образованием
ряда побочных продуктов, могущих привести к нарушениям
жизнедеятельности, и их удаление из организма также является
жизненно необходимым.
Поэтому в основе способности высших организмов к
длительному существованию лежит мощная система регулирования
своего внутреннего постоянства, основой которой является
система кровообращения и связанная с ней система лимфообращения.
17.1. Характеристики внутренней среды организма. Кровь
представляет собой именно ту внутреннюю среду,
физико-химические характеристики которой поддерживаются на строго
регулируемом уровне; через кровь происходит поступление к тканям
кислорода, энергетических и строительных веществ, через нее
происходит удаление из тканей продуктов жизнедеятельности.
Эти важнейшие функции крови выполняются при сравнительно
небольшом объеме, составляющем всего 6—8 % общей массы
тела. На рис. 237 в схематической форме представлены эти
функции крови.
Жидкая часть крови (плазма) содержит (мМ/кг воды):
электролиты— катионы (Na+ — 153, К+ — 5, Са2+— 3, Mg2+ — 1) и анионы
(СГ—ПО, СОз~ -28, РС>4~—1, SO~~— 1) и неэлектролиты
(глюкоза —5, белки — 2, мочевина— 1),
Осмотическое давление — 745 кПа (7,3 атм),
коллоидно-осмотическое давление (онкотическое) — 3 кПа.
Важнейшим компонентом крови являются форменные
элементы, подразделяющиеся на красные кровяные тельца
(эритроциты), белые кровяные тельца (лейкоциты), в свою очередь
подразделяющиеся на ряд форм, и кровяные бляшки
(тромбоциты). У человека и высших животных эритроциты представля-
470
-^- Желудок ^Кишки. —-
Лйж? . _ ____! __^_ |_______п
"" 'Межклеточная
-- жидкость - -
Юл
Верхние
отделы тела
жидкость
' 30л
Рис. 237. Схема жидкостных
пространств во внутренней среде
организма.
Объемы их представляют собой
округленные значения для человека массой 70 кг
Стрелками указаны направления обмена
между жидкостными пространствами и
внешней средой
Рис 238. Схема сердечно-сосудистой
системы.
Сосуды, содержащие насыщенную
кислородом кровь, заштрихованы, а сосуды,
содержащие обедненную кислородом кровь —
изображены светлыми линиями
Лимфатическая система, образующая
дополнительную систему оттока жидкости от органов,
показана черными линиями
Нижние
отделы тела
ют собой безъядерные сравнительно короткоживущие (100—
120 суток) клеточные структуры, около 90 % сухого веса
которых составляет гемоглобин и которые служат основным
посредником в переносе кровью кислорода. Ядерные
клетки—лейкоциты — являются основой защитной функции крови,
позволяющей организму бороться с микробными и вирусными
инвазиями. Наконец, тромбоциты — также безъядерные элементы —
благодаря наличию в них определенных ферментов существенно
важны для свертывания крови при повреждениях сосудистого
русла.
Если газы, неорганические и органические вещества могут
в большей или меньшей степени свободно проходить через стенку
сосудов и обмениваться с таковыми в тканевой жидкости,
полостях пищеварительного и выделительного каналов и воздушной
среде легочных альвеол, то форменные элементы — постоянные
компоненты крови и в свою очередь обмениваются своими
ингредиентами с ее плазмой (хотя лейкоциты могут покидать сосудистое
русло за счет амеб идных движений).
Гомеостатическая функция крови возможна лишь
благодаря ее непрерывному движению (циркуляции) в сосудах, поддер-
471
живаемой ритмическими сокращениями сердечной мышцы
(миокарда). У высших организмов (млекопитающих и птиц)
циркуляция крови происходит через полностью разделенные большой
(«левое сердце») и малый («правое сердце») круги
кровообращения и четырехкамерное сердце с двумя желудочками (рис. 238).
Оттекающая от тканей венозная кровь поступает в правое
предсердие и оттуда в правый желудочек. При его сокращении она
выбрасывается в легочную артерию. Протекая через капилляры
легких, оплетающие концевые структуры воздушных путей —
альвеолы, кровь отдает углекислый газ и насыщается
кислородом. Обогащенная кислородом кровь из легких по легочным
венам поступает в левое предсердие и из него в левый желудочек.
При сокращении последнего она нагнетается в аорту и затем
распределяется по артериям, артериолам и капиллярам всех
органов и тканей с тем, чтобы затем вновь собраться в венозную
систему.
17,2. Регуляция кругооборота крови. Очевидно, что
кругооборот крови является именно тем основным регулируемым
переменным, которое позволяет организму приспособляться к
изменяющимся потребностям его органов и систем и поддерживать
в каждый данный момент необходимый для них уровень
кровотока. Такая регуляция осуществляется, с одной стороны, за счет
изменения насосной деятельности сердца, и с другой — за счет
регуляции периферического кровотока. Управляющими же
параметрами являются те изменения физических и химических
характеристик внутренней среды, которые возникают в ходе
жизнедеятельности.
Внутрисердечные механизмы регуляции кровотока
обеспечивают в первую очередь изменение интенсивности
деятельности сердечной мышцы (миокарда). Основной из них известен
как закон сердца Франка — Старлинга. Суть его заключается
в зависимости силы сокращения миокарда от количества
притекающей к сердцу крови. Основой такой зависимости служит
связь силы сокращения сердечных мышечных волокон и их
исходной длины, т. е. степени их растяжения во время фазы
расслабления (диастолы). Более сильное растяжение .сердца при
диастоле соответствует усиленному притоку крови к сердцу;
при этом соответственно возрастает сила его сокращения (систола).
В результате сердце каждый раз перекачивает в артериальную
систему то количество крови, которое притекает к нему из
вен.
В последнее время получены данные, что наряду с этим
мышечным регуляторным механизмом' в сердце функционирует
также нервный механизм, замыкающийся через внутрисердечные
(интрамуральные) нервные узлы. Эта система включает
афферентные нейроны, дендриты которых образуют рецепторы
растяжения на мышечных волокнах сердечной стенки, а также
вставочные и эфферентные нейроны, аксоны которых иннервируют
миокард и неисчерченные (гладкие) мышечные волокна венечных
472
(коронарных) сосудов. Наличие таких внутрисердечных
нервных связей может быть установлено на функционирующем
пересаженном сердце, у которого все экстракардиальные нервные
элементы дегенерируют. За счет внутрисердечных рефлекторных
влияний при увеличении растяжения стенки предсердия также
происходит усиление сокращения желудочков; она затрагивает
не только тот отдел сердца, который непосредственно
растягивается притекающей кровью, но и другие его отделы.
Оба внутрисердечных механизма, таким образом,
обеспечивают стабильность кровенаполнения артериальной системы и
создают тем самым важнейшее условие для успешного ее
функционирования.
Внесердечные нервные (рефлекторные) регулятор-
ные механизмы кровотока осуществляются (в отличие от
скелетной мускулатуры) за счет двух систем обратной связи. Одна
из них образована симпатической, другая —
парасимпатической нервной системой (подробно об их организации см. в
руководствах по физиологии). Это разделение первоначально
сложилось на основе анатомических критериев, однако затем было
подтверждено также функциональными и фармакологическими
различиями. Центральные структуры симпатической нервной
системы располагаются в грудных и верхних поясничных
сегментах спинного мозга, а ее эфферентные волокна разветвляются
фактически по всему телу, проходя в основном вдоль кровеносных
сосудов. Центральные структуры парасимпатической нервной
системы локализованы в стволе головного мозга и крестцовом
отделе спинного мозга.
Наиболее значительным парасимпатическим эфферентным
путем является блуждающий нерв, спускающийся от ствола мозга
в грудную и брюшную полости и иннервирующий там большинство
внутренних органов. Парасимпатические волокна имеют более
ограниченное распространение; так, в конечностях они
отсутствуют. Функциональное разделение заключается, как правило,
в противоположных (антагонистических) влияниях на
эффектор ные органы, при которых одна система приводит к усилению
их функции, а другая — к ее ослаблению. Однако в ряде
случаев обе системы могут вызывать сходные эффекты,
отличающиеся лишь некоторыми качественными особенностями.
Для упрощения анализа механизма рефлекторной регуляции
кровотока можно не учитывать легочное кровообращение
(малый круг), которое регулируется лишь в небольшой степени,
а также принять постоянным венозное давление, которое всегда
остается относительно стабильным. В этом случае:
„~л«л,«™ артериальное давление
кровоток = -г= —~ -.
г общее периферическое сопротивление
Это соотношение аналогично закону Ома, связывающему
электрический ток, напряжение и сопротивление в электрической
цепи.
473
Основными переменными в системе регуляции артериального
давления оказываются выброс крови левым желудочком
(сердечный выброс) и сопротивление трения, создаваемого сосудистым
руслом большого круга кровообращения. Сердечный выброс
является произведением частоты сокращений сердца на ударный
объем. Как указывалось выше, ударный объем регулируется
внутрисердечными механизмами. Вместе с тем он подвержен
мощной внесердечной регуляции, увеличиваясь под влиянием
симпатической импульсации и уменьшаясь под влиянием
парасимпатической (поступающей к сердцу по волокнам
блуждающего нерва).
Регулируемой переменной является и второй
фактор,определяющий артериальное давление — сопротивление сосудистого
русла большого круга кровообращения. Оно зависит в основном
от диаметра прекапиллярных сосудов — мелких артерий и арте-
риол. Они имеют в своей оболочке слой неисчерченных мышц,
клетки которого иннервируются симпатическими нервными
волокнами. Сокращение этих клеток приводит к сужению сосудов
и соответственно к повышению периферического сопротивления.
Однако, в отличие от регуляции сердечного выброса, в этом
случае отсутствуют антагонистические парасимпатические влияния,
поскольку большинство сосудов не имеет парасимпатической
иннервации.
Расширение сосудов становится возможным благодаря тому,
что и в условиях покоя по симпатическим волокнам к
сосудам поступает периодическая импульсация, поддерживающая их
мышечные клетки в состоянии некоторого постоянного
(тонического) напряжения. При таких условиях расслабление сосудистой
мускулатуры и расширение сосуда можно вызвать посредством
уменьшения частоты фоновой импульсации, поступающей из
мозга.
Таким образом, меняя сердечный выброс и периферическое
сопротивление, организм может в широких пределах
варьировать давление в кровеносной системе; для того, чтобы
гарантированно поддерживать его в заданных пределах, необходима,
очевидно, тщательная координация тех рефлекторных влияний,
которые действуют на сердце и сосудистую систему. Обязательным
условием для осуществления такой координации является
наличие постоянной информации об уровне давления в сосудах.
Эта информация обеспечивается системой рецепторов давления
(барорецепторов), расположенных в различных участках
сосудистого русла (в стенке дуги аорты, месте разветвления общей
сонной артерии — сонном (каротидном) синусе и др.). Бароре-
цепторы представляют собой вторичные механорецепторы,
которые по афферентным волокнам посылают в ствол мозга импульса-
цию, частота которой отражает уровень артериального
давления (рис. 239).
В продолговатом мозге существует несколько нейронных
структур («центров»), которые на основе информации, поступа-
474
Рис. 239. Импульсная активность в
афферентных волокнах сииокаротидного
нерва, отражающая активацию
сосудистых барорецепторов:
/ — при пониженном; 2 — при нормальном;
3— при повышет ном ар!ериальном давлении
ЬГУ^Ч/
Артериальное ^дабпение
J.L .. IlllLlHUlJUl
Синокаротидный церв
кмдеи от сосудистых
барорецепторов, а также из ряда других
источников формируют команды к
эффекторным элементам (сердцу
и сосудам). Одна из них обозначается как сосудодвигательный
(вазомоторный) центр, ответственный, как следует из названия,
в основном за регуляцию сократительной деятельности мышц
сосудистой стенки посредством активации симпатической нервной
системы. Проведенные к настоящему времени микроэлектродные
исследования импульсной активности отдельных нейронов,
входящих в эту структуру, показали, что они четко разделяются на
две группы. Одна из них дает разряд импульсов при повышении
артериального давления, другая, наоборот, при его
снижении.
Эти результаты дают основание полагать, что
сосудодвигательный центр состоит из двух частей — прессорной и депрессорной,
которые находятся между собой в реципрокных
взаимоотношениях. Нейроны, входящие в прессорную группу, через
нисходящие пути активируют симпатические нейроны спинного мозга
и таким образом индуцируют сокращение сосудистых мышц и
повышение артериального давления. Наоборот, нейроны депрес-
сорной группы тормозят активность симпатических клеток и тем
самым приводят к расслаблению сосудистых мышц и падению
давления. В зависимости от характера информации, поступающей
к сосудодвигательному центру от барорецепторов, происходит
перераспределение активности между нейронами прессорной
и депрессорной групп, что и является основой формирования
соответствующей регулирующей команды.
Наряду с сосудистыми реакциями при активации сосудодви-
гательного центра происходит также изменение в симпатической
регуляции деятельности сердечной мускулатуры. При
возбуждении депрессорных нейронов симпатическая стимуляция
сердца ослабевает, и сердечный выброс соответственно
уменьшается; при возбуждении прессорных, наоборот, усиленная
активность симпатической нервной системы стимулирует сердечную
деятельность и увеличивает сердечный выброс, что вносит свой
вклад в повышение артериального давления.
Особой нейронной структурой продолговатого мозга, также
принимающей непосредственное участие в формировании
указанной команды, является относящееся к парасимпатической
Нервной системе ядро блуждающего нерва. Активация нейронов
этого ядра угнетает сократительную функцию сердца и уменьшает
сердечный выброс (тормозящий центр сердца).
475
Артериальное
давление
-
Барорецепторы
сонного синуса
и дуги аорты
у Уменьшение
Сердечный 1
выброс 1
Увеличение |
Буферные нервы
(тоническая
активность)
Повышение
Общее
периферическое
сопротивление
Понижение 1
Центры
продолговатого
мозга
Тормозящий
центр
сердца
Прессорная
часть
Депрессорная
часть
*- а.
II
Рис. 240. Общая схема прямых и обратных связей, участвующих в регу*
ляции артериального давления
Все указанные структуры и взаимодействия между ними
в процессе стабилизации артериального давления схематически
представлены на рис. 240. Снижение давления в сосудах
уменьшает частоту разряда барорецепторов, тем самым активируя
прессорный центр путем снятия его фонового торможения.
Одновременно ослабление возбуждающих влияний от барорецепто-
ров на депрессорную часть сосудодвигательного центра и
тормозящий центр сердца угнетает активность последних. В результате
происходят увеличение сердечного выброса и повышение
периферического сосудистого сопротивления, приводящие к
восстановлению сниженного давления. Наоборот, повышение давления
тормозит прессорный центр, но возбуждает депрессорный и
сердечно-тормозящий; сердечный выброс и периферическое
сопротивление падают, и артериальное давление снижается до
исходного уровня.
Такая генеральная схема регуляции кровотока не
исключает, естественно, и участия в последней региональных
механизмов, перераспределяющих в определенных пределах общий
кровоток между различными органами и системами в зависимости
от потребности последних при данной деятельности организма.
Локальными факторами, которые могут вызывать расширение
сосудов, являются снижение рН и парциального давления
кислорода, повышение парциального давления С02, выделение
ряда продуктов метаболизма.
Гуморальные механизмы регуляции кровотока.
Описанный ауторегуляторный гомеостатический механизм,
использующий рефлекторные обратные связи, долгое время
рассматривался как основной механизм регуляции кровотока. Однакд
в результате работ последних лет стало ясно, что он представляет
собой лишь первое самое быстрое звено этого механизма. Кроме
47*
него в поддержании сердечно-сосудистого гомеостаза участвуют
и другие механизмы длительного действия, строящиеся на
использовании не рефлекторного, а гуморального пути передачи
сигналов (т. е. на использовании физиологически активных
соединений, которые выделяются в кровь при изменении
параметров кровотока, разносятся кровью по организму и достигают
таким образом тех органов-мишеней, которые обладают к ним
специфической чувствительностью). Одним из них является ре-
нин-ангиотензиновый механизм, сущность которого в общих
чертах заключается в следующем.
Ключевым компонентом этого механизма является фермент
ренин. Ренин вырабатывается в юкстагломерулярных клетках,
расположенных в приносящих артериолах почечных клубочков
(почечным клубочком называется шаровидный начальный отдел
основной функциональной единицы почки — нефрона). В
покое он хранится в этих клетках, однако при уменьшении
артериального давления в почечных артериях (и при некоторых
других обстоятельствах) выделяется из них в кровоток. В крови
ренин расщепляет вырабатывающийся в печени полипептид
ангиотензиноген. В результате образуется меньший полипептид
ангиотензин I, который далее превращается в ангиотензин II.
Этот небольшой полипептид обладает мощным
сосудосуживающим действием. Кроме того, он возбуждает центральные и
периферические симпатические структуры. В результате
периферическое сопротивление и артериальное давление повышаются.
Эффект этот развивается медленно (десятки минут) и длится
долго без значительного ослабления.
Совсем недавно обнаружен еще один гуморальный фактор,
принимающий участие в функционировании этой системы.
Оказалось, что мышечные клетки предсердий сердца также обладают
гуморальной активностью, синтезируя и накапливая
полипептид, получивший название предсердного натрийуретического
фактора (ПНФ). Этот пептид выделяется в кровоток при
растяжении мышечных волокон в связи с переполнением предсердий
кровью. Попав в кровь, он переносится по артериям к
различным органам-мишеням, в том числе к почкам. Поступая к
последним, этот гормон каким-то образом тормозит выработку ренина,
т. е. противодействует появлению связанной с последним
сосудосуживающей реакции. Кроме того, ПНФ оказывает прямое
сосудорасширяющее действие путем расслабления гладких
мышц крупных артерий. В результате обеспечивается ускорение
оттока крови от сердца и предотвращается развитие в нем
застойных явлений.
Таким образом, гуморальный механизм регуляции кровотока
оказывается, в свою очередь, состоящим из контролирующих
друг друга подсистем, что и позволяет организму эффективно
регулировать его на протяжении длительного
функционирования организма и поддерживать его даже при таких
патологических ситуациях, как значительная кровопотеря. Гуморальные
477
факторы, участвующие в регуляции кровообращения,
одновременно эффективно влияют на экскреторную функциюпочек —
выведение ими воды и солей. Тем самым регуляторные механизмы
длительного действия могут изменить еще одну
переменную в кровообращении, которую мы пока рассматривали как
постоянную, а именно: объем циркулирующей крови (см.
ниже).
17.3. Регуляция газового состава крови. Как указывалось
выше, важнейшей функцией кровотока является снабжение
тканей кислородом и избавление их от С02. Потребности тканей
в кислороде чрезвычайно меняются в ходе жизнедеятельности,
так же как и количество образующегося СО^. Поэтому
поддержание постоянства парциальных давлений этих газов является
важнейшим компонентом гомеостатической функции
кровообращения. Поскольку поступление кислорода в кровь и выведение
из нее С02 происходит через конечные разветвления
воздухоносных путей легких — альвеолы, то основным механизмом в
поддержании такого постоянства оказывается именно поддержание
постоянства состава альвеолярного воздуха.
Альвеолы вентилируются притоком и оттоком воздуха при
ритмическом расширении и сжатии легких в результате
увеличения и уменьшения объема грудной клетки за счет сокращения
диафрагмы и межреберных мышц. В отличие от ритмической
деятельности сердечной мышцы, которая основана на внутренней
способности к автоматии и регулируется реципрокными
влияниями со стороны симпатических и парасимпатических
эфферентных волокон, ритм дыхания имеет центральное
происхождение и порождается командами из особой системы нейронов
продолговатого мозга (дыхательного центра); эти команды
передаются по соматическим эфферентным путям, аналогичным путям
активации других типов скелетных мышц.
Частота дыхания и глубина каждого вдоха (дыхательный
объем) зависят от активности этого центра, которая, таким
образом, определяет состав альвеолярного воздуха и,
следовательно, парциальное давление 02 и С02 в артериальной крови. При
этом обеспечивается огромный диапазон регулирования такого
постоянства: во время максимальной физической нагрузки
площадь альвеол может обеспечивать перенос кислорода со
скоростью до 5000 мл/мин, а в покое — всего около 250 мл/мин.
При регуляции артериального давления задающий входной
сигнал формируется в специальных барорецепторных структурах
артериального русла. В случае дыхания ситуация сложнее,
так как речь может идти по меньшей мере о двух кандидатах на
роль регулируемой переменной (ро2 и рсо2в крови),
регистрация изменений которых может происходить различными рецеп-
торными структурами как на периферии, так и в центральной
нервной системе. Кроме того, роль каждой из этих переменных
может существенно изменяться в зависимости от условий
функционирования организма.
478
Рис. 241. Изменения вентиляции легкир
у человека при снижении концентрации
Оа или повышении концентрации С02
во вдыхаемом воздухе
Заштрихованная полоса вверху —
максимальная произвольная вентиляция, на которую был
способен испытуемый
%f80
%
I
I
I
I
№8888888^
Мйксимальная Ъентиляция
со*у///'^
1. ^ iu 1 1 1
РаСОг *0
Рав 90
50
70
60
50
70
30
кПа
В условиях покоя и
нормального атмосферного давления из
указанных двух переменных
основную роль, как показывают
эксперименты, играет вторая —
парциальное давление в крови С02.
Это хорошо видно из приведенной
на рис. 241 схемы, на которой
представлены изменения дыхания
(его минутного объема) при
снижении во вдыхаемом воздухе
концентрации 02или повышении концентрации С02. Как видно,
минутный объем дыхания не изменяется практически до тех пор, пока
содержание 02 не сократится до половины нормального уровня.
Таким образом, гипоксия (снижение ро2 в артериальной крови)
оказывается в этих условиях крайне малоэффективным стимулом для
усиления дыхания. Наоборот, повышение содержания С02 во
вдыхаемом воздухе (гиперкапния) стимулирует дыхание сразу же,
как только оно превысит нормальный уровень.
На первый взгляд такая ситуация может показаться
парадоксальной, так как именно недостаток кислорода является
тем основным фактором, который может быстро привести к
нарушениям жизненных процессов4, сам по себе избыток С02к таким
нарушениям не приводит. Однако дело в том, что в естественных
условиях функционирования организма оба параметра не
являются независимыми, и их изменения всегда тесно
связаны—недостаточная вентиляция легких приводит как к накоплению
углекислоты, так и к нехватке кислорода. По-видимому, с точки
зрения биофизических механизмов использование датчиков
изменения уровня углекислоты является более надежным, чем
датчиков изменения уровня кислорода, и именно они в ходе
эволюции закрепились как основные источники информации
в системе регуляции дыхания.
При подъеме на большую высоту положение меняется.
Такой подъем сопровождается нарастающей гипоксией и
одновременно гипокапнией (снижением уровня углекислоты в крови) за
счет снижения общего барометрического давления. В этом
случае стимулирующее влияние гипоксии на дыхание приобретает
первостепенное значение, и поддержание уровня кислорода во
вдыхаемом воздухе приобретает ведущую роль в поддержании
газового гомеостаза крови.
Что же представляют собой соответствующие датчики?
Наибольшее значение имеют рецепторы, расположенные прямо над
479
вентральной поверхностью продолговатого мозга и реагирующие
на изменения /?со2 спинномозговой жидкости (в свою очередь точно
отражающие изменения рСо2 в артериальной крови). Эти рецепторы
могут быть отнесены к хеморецепторам; при этом pCot и рН
артериальной крови оказывают на их активность неодинаковый эффект
(первое более эффективно). Это не значит, что на поверхности
мозга имеются два различных типа хеморецепторных образований,
чувствительных либо к С02, либо к Н+. Возможно, такие хеморе-
цепторы являются именно рецепторами протонов, а действие СОа
связано с образованием последних в ходе диссоциации угольной
кислоты. В этом случае разница в эффекте рсо2 и рН может быть
связана с различной скоростью их транспорта в тканях. Известно,
что С02 очень быстро диффундирует из крови через клеточные
мембраны, тогда как для переноса ионов Н+ необходимы особые
мембранные структуры — ионные каналы или переносчики.
Рецепторы изменений газового состава крови имеются и
непосредственно в сосудистой стенке, в частности в сонном (каро-
тидном) синусе. Эти хеморецепторы реагируют именно на
снижение артериального давления и в меньшей степени на повышение
рсо2 или снижение рН. Поэтому реакция дыхания на повышение
рсо2 оказывается почти целиком зависящей от рецепторов самого
мозга, более слабая же реакция на снижение /?о2 — от
периферических хеморецепторов.
Комплекс нейронов, идентифицируемый как дыхательный
центр, имеет в своей функциональной организации много общего
с рассмотренным выше сосудодвигательным центром — он
состоит из двух связанных нейронных сетей, одна из которых
приходит в активность во время вдоха, а другая — во время выдоха.
Эти нейронные системы при помощи нисходящих путей связаны
с мотонейронами соответствующих дыхательных мышц, и
возникающие в них команды приводят к периодическому сокращению
последних. Две системы нейронов в дыхательном центре
находятся между собой в реципрокных тормозящих отношениях;
когда одна из них приходит в состояние активности,
другая тормозится. Затем каким-то образом активность первой
системы ограничивается и торможение ослабевает, что
создает возможность для появления активности в другой
системе.
Эта способность к периодическому переключению активности
из одной системы в другую сохраняется даже в изолированном
продолговатом мозге: однако для стабилизации ритмической
деятельности и ее согласования с газовым составом крови
необходимо поступление к ней информации от описанных выше
центральных и периферических хеморецепторов, приводящей либо
к усилению и учащению дыхательных движений и
соответственно к повышению минутного объема дыхания, либо, наоборот,
к его снижению.
Кроме описанных систем обратной связи, функционирующей
на основе сигналов о химическом составе артериальной крови,
480
важную роль в регуляции дыхания играют и обратные связи,
использующие сигналы от механорецепторов, расположенных
непосредственно в легких. Если слишком раздуть легкие при
вдохе, последний рефлекторно тормозится, и начинается выдох.
Напротив, если существенно уменьшить объем легких, то это
стимулирует глубокий вдох (рефлексы Геринга — Брейера).
Основой указанных рефлексов являются меха нор ецеп торы,
расположенные непосредственно в легочной паренхиме, а также
в трахее, бронхах и бронхиолах. Некоторые из этих рецепторов
являются позиционными и реагируют на степень растяжения
легочной ткани пачками импульсов, другие же являются
скорее дифференциальными и возбуждаются лишь при уменьшении
или увеличении растяжения.
Таким образом, нервная система получает постоянную
информацию как об уровне растяжения легких, так и об
изменениях этого растяжения. Афферентные волокна от таких
рецепторов поступают в спинной мозг и оказывают свое влияние на
деятельность нейронных систем дыхательного центра. При
пересечении этих афферентных путей дыхание становится редким и
глубоким; следовательно, в физиологических условиях их влияния
ограничивают дыхательные экскурсии и делают работу
дыхательной системы более экономной.
На схеме (рис. 242) суммированы описанные выше главные
системы обратных связей, ответственных за поддержание
газового гомеостаза крови.
17.4. Регуляция уровня энергетических веществ в крови.
Все живые клетки нуждаются в непрерывном снабжении
веществами, которые могут быть для них источником метаболической
энергии. Эта потребность, ка^ и потребность в кислороде,
меняется в зависимости от функциональной активности клетки.
У млекопитающих энергия поступает из крови в клетку в
основном в виде глюкозы, и поэтому поддержание ее гомеостаза в
крови является необходимым условием поддержания жизни.
Регулирование этого гомеостаза обеспечивается высокосовершенной
системой, в которой управляющие сигналы передаются
гуморальным путем — через выделяемые в ток крови физиологически
активные соединения.
Рассмотрим принцип поддержания в крови необходимого
уровня глюкозы в самой общей форме. Этот уровень
определяется, во-первых, притоком глюкозы периодически из кишок после
каждого приема пищи в результате расщепления в них
углеводов и всасывания образовавшихся моносахаридов, и более
постоянного — в результате расщепления печеночного гликогена
(представляющего собой внутреннее депо углеводов).
Во-вторых, он зависит от постоянного потребления глюкозы тканями
для покрытия их энергетических трат. Несмотря на эти
процессы, в норме уровень глюкозы в крови оказывается весьма
постоянным (около 5 мМ/кг воды плазмы). Лишь сразу после
приема пищи во время всасывания он может возрастать до 6,1—
481
Рис. 242. Общая схема прямых и обратных связей, участвующих в
регуляции дыхания
6,7 мМ/кг, а во время умеренного голодания снижаться до
3,5 мМ/кг.
При пищевом повышении уровня глюкозы (алиментарной
гипергликемии) активируется синтез гликогена в печени (ели-
когенез) и уровень ее в крови вскоре стабилизируется за счет
пополнения этого депо углеводов. Наоборот, при снижении
уровня глюкозы ниже нормы активируется противоположный
процесс распада гликогена (гликогенолиз), пополняющий такой
дефицит. Направление перемещения глюкозы и является той
регулируемой переменной, которая управляется выделением
в кровь физиологически активных соединений (гормонов).
Поступление глюкозы из крови в клетки большинства
тканей (в том числе и в клетки печени) определяется гормоном
инсулином, вырабатываемым Я-клетками панкреатических
островков (островков Лангерганса) поджелудочной железы. Если
уровень глюкозы в крови ниже 3,3 мМ/кг, то инсулин вовсе не
выделяется; по мере превышения этого порога он выделяется во все
больших количествах за счет прямой стимуляции глюкозой
секреторной функции 5-клеток Вследствие этого во время
дефицита глюкозы последняя не может попасть в клетки инсулин-
чувствительных тканей, однако она сберегается для таких
тканей, в которых утилизация глюкозы не зависит от инсулина
(нервная ткань). Инсулинчувствительные ткани при этом могут
покрывать свои энергетические потребности только за счет
других источников (жиров или белков). Инсулин, помимо влияния
на поступление глюкозы в клетки, стимулирует также гликогенез
(еинтез гликогена) и угнетает гликогенолиз (его распад).
Таким образом, именно выделение инсулина оказывается
тем механизмом гуморальной обратной связи, который
обеспечивает снижение уровня глюкозы при появлении ее избытка в крови
(еипогликемизирующее действие). Лишь при очень значитель-
4*2
ном повышении этого уровня глюкоза начинает выводиться
почками в мочу (глюкозурая). Инсулин является единственным
гормоном в организме, обладающим таким действием; наоборот,
существует ряд гормонов, которые стимулируют расщепление
гликогена и тем самым способствуют повышению уровня глюкозы
(гипергликемизирующее действие). К ним относятся глюкагон
(вырабатываемый D-клетками поджелудочной железы),
адреналин, глюкокортикоиды (гормоны коры надпочечников), тироксин
(гормон щитовидной железы), гипофизарный гормон роста.
Выброс этих гормонов в кровь стимулируется недостатком в ней
глюкозы (гипогликемией), и они представляют собой
функционально антагонистическую систему обратных связей, которая
в сочетании с инсулиновой системой обеспечивает эффективный
гомеостаз глюкозы в организме.
Аналогичные регуляторные системы участвуют в гомеостазе
других возможных источников энергии — продуктов
расщепления жиров и белков, которые через специальные биохимические
механизмы могут превращаться в глюкозу. Жиры составляют
самый обширный резерв метаболической энергии и могут
включаться в циркуляцию в виде триглецеридов и свободных жирных
кислот; для энергетических целей в крайнем случае могут
расходоваться и аминокислоты. Как и в случае мобилизации и
запасания глюкозы, расходование жировых и белковых запасов
также регулируется системой гормональных обратных связей,
действие которых состоит в регуляции функции специфических
ферментов. В частности, инсулин способствует образованию
жировых запасов и подавляет липолиз; он способствует также
синтезу белков. Наоборот, глюкагон, адреналин и гормон роста
стимулируют липолиз.
Все сказанное можно наглядно представить себе на схеме,
на которой уровни соответствующих энергетических веществ
представлены в виде уровней жидкости в баках, обладающих
системами притока и оттока (рис. 243).
Ясно, что в ходе жизнедеятельности происходит постепенное
исчерпание имеющихся в организме энергетических веществ,
и нормальное ее продолжение возможно только в случае
постоянного поступления их из внешней среды в виде пищи. Этот
процесс также эффективно регулируется за счет активации высших
мозговых центров, ответственных за поведенческие реакции
поиска и поедания пищи. Датчиками сигналов, включающих такое
поведение, являются те же уровни энергетических веществ (в
первую очередь глюкозы) в крови, поступающей к
соответствующим центрам. Снижение их вызывает чувство голода и тем
самым побуждает организм к пополнению запасов
энергетических веществ.
17.5. Регуляция температуры крови. У высших животных —
птиц и млекопитающих— с высокой точностью
поддерживаются также температура внутренней среды, и нормальное
протекание важнейших жизненных процессов очень критично за-
483
пи тмин Свободные жирные
Рис. 243. Общая схема регуляции уровней углеводов, жиров и белков в
организме.
Гормоны, стимулирующие отдельные превращения, обозначены знаком «-{-»,
угнетающие — знаком «—*
висит от такого постоянства. Трудность выполнения этой задача
связана с тем, что подавляющее большинство химических
реакций в организме являются экзотермическими, и поэтому даже
в условиях покоя в нем непрерывно образуется тепло; в то же
время температура окружающей среды часто оказывается выше
поддерживаемой температуры тела.
Основой гомеостаза внутренней температуры также является
кругооборот крови, который обеспечивает равновесие между
двумя механизмами — теплопродукции и теплоотдачи.
Хотя теплопродукция, как указывалось выше, происходит
в организме и в состоянии покоя, существует ряд способов ее
повышения. Сюда относится, в первую очередь, мышечная работа,
при которой выделение тепла резко увеличивается. Одной из ее
форм является дрожь — непроизвольные мышечные сокращения
часто наступающие при значительном охлаждении организма
Кроме того, как уже указывалось выше, некоторые гормоны
могут непосредственно влиять на обменные процессы в тканях
усиливая деятельность катаболических ферментов (адреналин
тироксин и др.).
Отдача тепла происходит через наружную поверхность орга
низма (кожу и слизистые) путем излучения и конвекции (и в
меньшей степени — проведения). Кроме того, теплоотдача осу
ществляется за счет испарения воды, что имеет особенно боль
шое значение при температуре окружающей среды выше темпе
ратуры тела. Усиление теплоотдачи путем испарения происходит
при потении — усилении деятельности кожных потовых желез
й также при тепловой одышке — учащенном дыхании, сопрово
484
ждающемся обильным слюноотделением. Теплоотдача через кожу
Может быть в широких пределах регулируема путем изменения
кожного кровообращения — расширения или сужения кожных
сосудов.
Отдача тепла с кожной поверхности может быть также
изменена с помощью шерстяного и перьевого покрова. Так как
волосы и перья могут приподниматься за счет особых пучков неис-.
черченных мышц, то и этот механизм может быть регулируемым.
Ощетинившаяся шерсть удерживает более значительный
малоподвижный слой воздуха и тем самым затрудняет теплоотдачу
путем конвекции.
Мы рассмотрим лишь основные принципы работы такого го-
меостата. Датчики температуры крови локализованы
непосредственно в головном мозге — в его гипоталамическом отделе.
Наличие таких центральных датчиков температуры было
показано остроумными опытами со вживлением в область
гипоталамуса микроскопических металлических шариков; если животное
затем помещалось в высокочастотное электрическое поле, то
шарики нагревались, и это сопровождалось развитием у
животного комплекса реакций, направленных на снижение
кажущегося повышения температуры крови.
Сейчас прямо показано, что определенные нейроны передней
части этой области изменяют свою активность при повышении
температуры притекающей в гипоталамус крови. При этом
стимулируются все виды активности, способствующие отдаче
тепла организмом: потоотделение, расширение кожных сосудов,
одышка. Одновременно угнетается активность другой группы
нейронов, расположенных в задней части гипоталамуса и
стимулирующих теплопродукцию (выброс соответствующих гормонов,
появление дрожи и др.).
Таким образом, и в этом случае, как и при регуляции
кровотока и дыхания, в основе соответствующих обратных связей
лежат две реципрокно связанные системы командных нейронов,
которые в зависимости от смещения температуры крови в ту или
иную сторону от поддерживаемого уровня включают
соответствующие компенсирующие механизмы. Информация от
периферических терморецепторов (кожи), главным образом Холодовых,
также поступает в гипоталамус и участвует в установке
температуры крови. Эфферентные пути этих механизмов очень сложны;
конечными их звеньями являются симпатический отдел
вегетативной нервной системы, а также соматические мотонейроны
(в случае появления холодовой дрожи).
17,6. Регуляция осмотического давления крови. В
заключение рассмотрения вопроса о механизмах поддержания
постоянства физических характеристик внутренней среды организма мы
коротко остановимся на принципах Поддержания ее
осмотического гомеостаза. Эта сторона гомеостатической функции
отличается особенной сложностью и включает в себя целый ряд
нервных и гуморальных механизмов.
485
В основе поддержания постоянства осмотического давления
крови лежат два тесно связанных регуляторных механизма —
поддержание постоянства объема крови (и межклеточной
жидкости) и поддержание постоянства ее электролитного состава.
Обе величины сохраняют при нормальной жизнедеятельности
поразительное постоянство, несмотря на воздействие внешних
и внутренних факторов, стремящихся его нарушить.
Объем крови зависит от поступления воды через
пищеварительный канал при питье и ее потери с мочой, потом и калом. Обе
переменных, в свою очередь, связаны между собой, поскольку
избыточное поступление или потеря воды будут изменять
концентрацию электролитов крови, а нарушение электролитного
состава повлечет осмотические изменения соотношения между
объемами крови и тканевой жидкости. Между всеми этими
процессами поступления и потери должно поддерживаться строгое
равновесие, регулируемое, как и в рассмотренных выше
случаях, сигналами от соответствующих внутренних датчиков.
Как и в случае регуляции ряда других характеристик крови,
основными датчиками нарушения электролитного баланса крови
(осморецепторами) являются центральные структуры
(определенные группы нейронов гипоталамуса), расположенные в
области его супраоптического ядра. Кроме того, осморецепторы
имеются также на вентральной поверхности головного мозга
возле третьего желудочка. Осморецепторы гипоталамической
области реагируют на изменения осмолярности крови,
поступающей в эту область, а осморецепторы мозговой поверхности --
на аналогичные изменения спинномозговой жидкости. Регуля-
торные сигналы могут исходить также от уже упоминавшихся
барорецепторов сосудистого русла, а также внутрисердечных
барорецеп торов, которые реагируют на растяжение стенки
крупных артериальных сосудов и сердца, сопровождающее
увеличение объема циркулирующей крови. Напротив, при
уменьшении объема крови активность этих барорецепторов и
соответственно интенсивность поступающих от них в центральную
нервную систему сигналов снижаются.
Регуляция потерь воды осуществляется главным образом
почками; другие перечисленные механизмы играют менее
существенную роль и могут здесь не рассматриваться. Особенностью
функции почки является двухстадийный процесс образования
мочи. Сначала практически вся вода плазмы крови, проходящей
через сосуды почечного клубочка, фильтруется в его просвете,
образуя первичную мочу. Однако затем, по мере прохождения
последней по извитым канальцам, она частично всасывается
в кровь. Этот процесс обратного всасывания регулируется
особым антидиуретическим гормоном (АДГ), вырабатываемым
задней долей гипофиза.
При увеличении содержания в крови этого гормона процесс
реабсорбции воды усиливается, вплоть до почти полного
прекращения образования мочи. Наоборот, при недостатке гормона
№
реабсорбция подавляется, и организм теряет воду в виде
избыточного мочеотделения. Очевидно, что основная роль сигналов,
возникающих в осморецепторах (а также сосудистых барорецеп-
торах) при изменениях осмолярности крови или ее объема,
заключается в подавлении или стимуляции секреции АДГ;
речь идет, таким образом, о смешанном нейро-гормональном
эффектор ном механизме.
Наряду с регуляцией потери воды особый механизм
регулирует и потерю электролитов (натрия), также происходящую
в^ основном через почки. Фильтрующийся в первичную мочу
натрий также реабсорбируется в почечных канальцах; однако
этот процесс регулируется раздельно, в основном посредством
гормона коры надпочечников альдостерона. Секреция альдосте-
рона, в свою очередь, подвержена гормональной регуляции
через посредство уже упоминавшейся выше ренин-ангиотензино-
вой системы, которая включается при снижении артериального
давления и уменьшении объема крови, протекающего через
почки, а также при недостатке натрия в крови. В результате
усиливается выброс в кровь альдостерона и уменьшается потеря
натрия в связи с усилением его реабсорбции.
^то касается регуляции противоположного механизма —
поступления воды и электролитов в организм, то датчиками для
него являются те же осморецепторы (и, возможно, барорецеп-
торы), сигналы от которых используются для регуляции потерь
воды и электролитов. Как и при регуляции потребления
энергетических веществ, при этом возникают ощущение жажды и
активация соответствующих нервных центров, ответственных за
поведенческие реакции поиска воды. Вероятно, по крайней мере
у ряда животных следует специально выделять и «натриевый
голод» — комплекс реакций, возникающих при недостатке
в пище соли и направленных на ее поиск. Человек же, как
правило, потребляет избыточное количество соли по сравнению
с физиологической потребностью, и у него такие реакции
отсутствуют.
КОНТРОЛЬНЫЕ ВОПРОСЫ К ЧАСТИ IV
1. Какое количество информации (в битах в расчете на одну букву)
содержится в произвольном сообщении на русском языке, если все буквы (32)
передаются с одинаковой вероятностью?
2 Каковы общие принципы восприятия живыми организмами внешних
воздействий и передачи информации об этих воздействиях?
3 Какие типы рецепторов Вы знаете и в чем заключаются биофизические
механизмы трансформации ими внешней энергии в нервные импульсы?
4 Каким образом поток нервных импульсов может передавать в нервной
системе информацию о количественных и качественных характеристиках
внешнего воздействия?
5 Что дают психофизические эксперименты для понимания деятельности
сенсорных систем и особенностей субьективного отражения в человеческой
психике внешнего мира?
487
6. На каком, расстоянии человек с нормальным зрением четко видит
предметы, когда преломляющая сила его хрусталиков увеличена на 4D при
аккомодации на ближнюю точку?
7. Каким образом в организме происходит регулирование длины и
напряжения скелетной мышцы, обеспечивающее наиболее эффективное
выполнение ею своей функции?
8. Каковы механизмы регуляции силы мышечного сокращения?
9. Что представляет собой внутренняя среда высших организмов и какие
физико-химические ее характеристики поддерживаются в процессе жизни на
постоянном уровне?
10. Какие биофизические закономерности лежат в основе регуляции
кругооборота крови в организме?
11. Какие изменения в газовом составе крови используются в организме
как сигналы при регуляции дыхания?
12. Каковы механизмы поддержания постоянства осмотического
давления крови и содержания в ней веществ — источников энергии для
организма?
ОТВЕТЫ НА ЗАДАЧИ
Часть 1. 1. Приращение энтальпии при р = const запишется: Д# == Д£/ +
+ р (Va— Vi) = Д£/ + рД1Л Согласно первому закону термодинамики,
ки = Q — W или так как W = /?Д К, то &U = Q — pAV. Подставляя это
выражение в Д#, получаем Д# = Q — /?ДУ + рДК = Q. Следовательно,
приращение энтальпии при постоянном давлении равно теплоте Q, передан-
ной закрытой системе. 2. Кр= 12,6. 3. -^ -► min 4. со ~ 3,5 • 10е, S =
= 26,1446 . Ю-23 Дж • К"1.
Часть II. 1. Коэффициент диффузии D » 6,6 • 10~7 см2 • с-1; молекулярная
масса М = 28000. 2. I) \0'\ 2) 3 • 10"3 4. D = 1,16. 5. Еа^ 53,3 кДж X
X моль"1. 6. [/] = 3,3 • 10"3 М. 8. Белок с меньшей молекулярной массой
примерно на 18000. 10. 16,28е.
Часть III. 1.— 56,5 ntB. 2. 7850 микроворсинок; 2778,9 мкм2, на 785%. 4.
2860000 молекул. 6. 210-*см 10.^=278 им. 11. 0,143 Гр; 1,65- Ю"6 Грс"1.
Часть IV. 1. 5 бит. 5. 0,25 м.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Основная
I.Биофизика/Ю. А. Владимиров, Д. И. Рошупкин, А. Я.
Потапенко, А. И. Деев.— М. : Медицина, 1983.— 272 с.
2. Биофизика рака / Н. М. Эмануэль, Р. Е. Кавецкий, Б. Н. Та-
русов, Е. П. Сидорик.— К.: Наук, думка.*1976.— 295 с.
3. Б э г ш о у К. Мышечное сокращение.— М.: Мир, 1985.— 128 с.
4. Волькенштейн М. В. Биофизика.— М.: Наука, 1981 .—
575 с.
5. Гродзинский Д. М. Биофизика растения.— К.:Наук. думка,
1972.— 250 с.
6. Д а в и д Р. Введение в биофизику.— М.: Мир, 1982.— 207 с.
7. Каппучч и-н е л л и П. Подвижность живых клеток.—М.: Мир>,
1982.— 124 с.
8 Клейтон Р. Фотосинтез. Физические механизмы и химические
модели.—М.: Мир, 1984.—350 с.
9. Конев С.В.,Волотовский И. Д. Фотобиология.— Минск:
Изд-во Белорус, ун-та, 1979.— 383 с.
10. Костюк П. Г. Кальций и клеточная возбудимость.—М.: Наука,
1986.— 255 с,
11. Костюк П. Г., Крышталь О. А. Механизмы электрической
возбудимости нервной клетки.— М.: Наука, 1981.— 204 с.
12. Котляр Б.И.,Шул ьговский В.В. Физиология
центральной нервной системы.— М.: Изд-во Моск. ун-та, 1979.— 340 с.
13 Кудряшов Ю.Б.,Беренфельд Б. С. Основы
радиационной биофизики.— М.: Изд-во Моск. ун-та, 1982.— 302 с.
14. К э н д е л Э. Клеточная основа поведения.— М.: Мир, 1980.—
598 с.
15. Магура И. С. Проблемы электрической возбудимости нейро-
нальной мембраны.— К-: Наук, думка, 1981.— 208 с.
16. Молекулярная биология клетки / Б. Албертс, Д. Брей,
Дж. Льюис и др.— М.: Мир, 1986 — 1987.— Т. 1—3.
17. Николе Д. Дж. Биоэнергетика. Введение в хемиосмотиче-
скую теорию.— М.: Мир, 1985.— 190 с.
18. Р у б и н А. Б. Биофизика,— М.: Высш. шк., 1987.— Кн. 1—2.
19. С к о к В. И., Шуба М. Ф. Нервно-мышечная физиология.—
К.: Вища шк. Головное изд-во. 1986.— 224 с.
20. С к у л а ч е в В. П. Трансформация энергии в биомембранах —
М.: Наука, 1972.— 203 с.
£1. Тимофеев-Ресовский Н.В., Савич А.В.,Шаль-
н о Й' М. И» Введение в молекулярную радиобиологию. Физико-химические
основы»— М.: Медицина, 1981.— 231 с.
22. Ярмоненко СП. Радиобиология человека и животных.—
М.: Высш. шк., 1984.— 357 с»
48?
Дополнительная
1. А ж и п а Я. М. Медико-биологические аспекты применения метода
электронного парамагнитного резонанса.— М.: Наука, 1983.— 257 с.
2. Бендолл Дж. Мышцы, молекулы и движение.— М.: Мир,
1970.—256 с.
3. Биологическая кибернетика / Под ред. А. Б. Когана,—
М,: Высш. шк., 1972.— 256 с.
4. Блюменфельд Л. А. Проблемы биологической физики.—
М.: Наука, 1977.—336 с.
5. Б о р г Д. Применение электронного парамагнитного
резонанса в биологии//Свободные радикалы в биологии.— М., 1979.— Т. 1.—
С. 88—177.
6. Вереников А, А,. Марахова И. И. Транспорт ионов
у клеток в культуре.— Л.: На>ка, 1986.— 291 с.
7. Владимиров Ю. Ам А р ч а к о в А.И. Перекисное окисление
липидов в биологических мембранах.— М.: Наука, 1972.—252 с.
8. Г р о д з е н с к и й Д. Э. Радиобиология. Биологическое действие
ионизирующих излучений.— М.: Атомиздат, 1966.— 231 с.
9. Гродзинский Д. М., Гудков И. Н. Защита растений от
лучевого поражения.— М.: Атомиздат, 1973.— 232 с.
10. Г у р ф и н к е л ь В. С, К о ц Я. М., Ш и к М. Л. Регуляция
позы человека.— М.: Наука, 1965.— 255 с.
И.Давыдов А. С. Солитоны в биоэнергетике.— К-: Наук, думка,
1986.— 159 с.
12. Д е м ч е н к о А. П. Люминесценция и динамика структуры
белков.— К.: Наук, думка, 1988.— 290 с.
13. Дертлинтер Р., Юнг X. Молекулярная радиобиология.—
М.: Атомиздат, 1973.— 248 с.
14. Дещеревский В. И. Математические модели мышечного
сокращения.— М.: Наука, 1977.— 160 с.
16. Жестеников В. Д. Репарация ДНК и ее биологическое
значение.—Л.: Наука, 1979.—285 с.
16, И в а н о в В. И., Лысцов В. Н. Основы микродозиметрии.—
М.: Атомиздат, 1979.— 192 с.
17* Кантор Ч., Шимм«лП. Биофизическая химия.— М.: Мир,
1984.— 1985.— Т. 1—3.
18. Капульцевич Ю. Г. Количественные закономерности
лучевого поражения клеток.— М.: Атомиздат, 1978.— 231 с.
9. Коган А- Б. Электрофизиология.— М.: В«сш. шк., 1969.—369 с*
0. Корниш-Боуден Э. Основы ферментативной кинетики.—-
М.:Мир, 1979.—280 с.
21. Ко с тюк П. Г. Физиология центральной нервной системы.—
К*: Вища шк. Головное изд-во, 1977.— 319 с.
22. К о т ы к А., Я н а ч е к К. Мембранный транспорт.— М.: M«f,
1980.— 341 с.
23. К о э н Ф. Регуляция ферментативной активности,— М.: Мир,
1986.— 144 с.
24. Красновский А.А. Преобразование энергии света при
фотосинтезе. Молекулярные механизмы.— М : Наука, 1974.— $6 с.
25. Кузин А. М. Структурно-метаболическая гипотеза в
радиобиологии.—М.: Наука, 1986.—284 с.
- 26. М е д в е д ь Л. В. Структурная организация молекулы
фибриногена // Укр. <5иохим. журн.— 1985.— Т. 57, № 5.— С. 36—49.
27. Н емы ш еч ны е двигательные системы.—М.: Наука, 1981.—180о*
28. О к с С. Основы нейрофизиологии.— М.: Мир, 1969.— 448 с,
29. Ор м-Джонсон В. X. Ферредоксины и другие жечезо-cepveo-
держащие белки // Неорганическая биохимия // Под ред!! Г. Эйхгорн.— М»,
1976.— Т* 2t—С. 116—156.
30. Основы сенсорной физиологии / Под ред. Р. Шмидта.— М.: Мир,
1984.— 285 с.
490
31. П о г л а з о в Б. Ф., Левицкий Д. И. Миозин и
биологическая подвижность.—М.: Наука, 1982.— 160 с.
32. Р э к е р Э. Биоэнергетические механизмы : новые вз1ляды —
М,: Мир, 1979.— 216 с.
33. Свенсон К., Уэбстер П. Клетка.—М.: Мир, 1980.—
303 с.
34. Сетлоу Р., Поллард Э* Молекулярная биофизика.— М.:
Мир, 1964— 436 с.
35. С к о к В. И., С е л я н к о А. А., Д е р к а ч В. А. Нейрснальные
холинорецепторы.— М.: Наука, 1987.— 405 с.
36. С м и т К., X енеуол т Ф. Молекулярная фотобиология.— М.:
Мир, 1972.— 272 с.
37. С о м ь е н Д ж. Кодирование сенсорной информации.— М.: Мир,
1975.— 350 с.
38. С т р а й е р Л. Биохимия.— М.: Мир, 1985,—Т. 1.— 362 с;
Т. 3.—397 с.
39. Т а р ч е в с к и й И. А. Основы фотосинтеза.— М.: Высш. шк.,
1977.-253 с.
40. Т у р р о Н. Молекулярная фотохимия.— М.: Мир, 1967.— 328 с.
41. Филенко А.М, Зима В.Л. Двухволновой метод регистрации
малых спектральных сдвигов флуоресценции белков // Молекулярная
генетика и биофизика.— К., 1981.— Вып. 6.— С. 126—135.
42. Фрайфельдер Д. Физическая биохимия.— М.: Мир, 1980.—
582 с.
43. X о д о р о в Б. И. Общая физиология возбудимых мембран.—
М.: Наука, 1975.— 406 с. &ш
44. Ч а н г Р. Физическая химия с приложениями к биологическим
системам.— М.: Мир, 1980.— 662 с.
45. III у л ь ц Г., Ш и р м е р Р. Принципы структурной организации
белков.— М.: Мир, 1982.— 354 с.
46. Biophysics/ Ed. by W. Hoppe et al.— Berlin; Heidelberg;
N. Y.; Токуо; Springer — Verlag, 1983.—941 p.
47. Hill B. Ionic channels of excitable membranes — Sunderland
Mass: Sinauer Assoc, ins., 1984.— 426 p.
48. P r i n с i p 1 e s of neural science/ Ed. by E* R. Kandel,
I. H. Schwartz.— N. Y.: Elsevier, 1985.— 979 p.
49. P r i v a l о v P. Heat capacity studies in biology // Biological micro-
calorfmefry/ Ed. by A. E. Breezer.— L., 1980.—J>. 413—451.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Аберрации хромосом 402
Автоволновые процессы 36
Автоматия сердца 289
А-вторегуляция открытой системы 32
Адаптация 440
Адаптохромы 377
Адениннуклеотидная система
биолюминесцентной реакции 332
АДФ — АТФ-транслоказа 317
Аккомодация глаза 456
Аконитин 224
Аксонема 310
Активаторы натриевых каналов 224
Актин 256, 276, 277, 290, 299, 313
а- и Р-Актинин 277
Акцептор электрона 323
Амебоидное движение 312
Аминоэтилизотиуроний (АЭТ) 418
Амфипатические соединения 147
Анемонотоксин 223
Аннигиляция пары электрон —
позитрон 394
Антибиотики транспортные 195, 196,
197
Антипорт 188
Антоцианы 343
Аппарат Гольджи 140
Na+ + К+ - АТФаза (Na+ + К-насос)
161. 184,185, 186
Са2+-АТФаза (Са**- насос) 187
АТФ-синтетазный комплекс 316
Байт 435
Базальное тело 307, 308, 309
Базальный тонус 302
Бактериородопсин 134, 159, 371
Бактериохлорофилл 342, 355, 370
Бактерицидное действие
ультрафиолетовых лучей 385
Бактерии 134, 137
Барорецепторы сосудов 474
Белка домены 62, 71
— сверхвторичйая структура 62, 64
— а-спираль 63
— степень насыщения лигандом 115
—Р-структура 64
— суперспиральные структуры 64
Белки мембранные
интегральные 156
периферические 156
Белково-нуклеиновое узнавание 126
Бета-частицы 390
Билитриеновые хромофоры 375
Бинауральный слух 448
Бинокулярное зрение 457
Биоантиоксиданты 338, 339, 340
Биолюминесценция 331
Биофизические методы 39
Бифуркация 34
— Хопфа 35
Биохемилюминесценция 334
Бит 435 '
Блокирование калиевых каналов 226,
227, 289
— кальциевых каналов 231, 232
— натриевых каналов 220, 223
Броуновское движение 48
Бэр 392
Валиномицин 196, 197
Взаимодействия ван-дер-ваальсовые
41
— гидрофобные 44, 66, 124
— диполь-дипольные 42, 346
— диполь-индуцированный диполь 42
— дисперсионные 42
— электростатические 41
Вестибулярный аппарат 446
Внутренняя конверсия 345, 357
Внутренняя среда организма 470
Водители ритма 286, 289
Водородная связь 42, 44
Вольт-амперная характеристика 183,
288, 297
Вращательные переходы 345
Время вращательной корреляции 97
— вращательной релаксации
хромофора 82, 83
— жизни вобужденного состояния 81,
83, 347, 381
— жизни сублетальных повреждений
414
— убегания 373
Вторичные посредники {цАМФ, Ca2f*
492
инозитолтрифосфат, диацилглице-
рол) 250, 251, 252, 253, 263
Второй закон термодинамики 12
Выживаемость клеток 384
Высаливание 61
Высокочастотная модуляция
магнитного поля 92, 93
Выход радиационно-химической
реакции 400, 401
Вязкость 45
— характеристическая 47
Галобактерии 371
Гамма-лучи 389
Ганглиозиды 150
Гемоглобин 343
Гетерокарион 160
Гидроксильный радикал 335
Гиперицины 386
Гиперциклы 37
Гиперхромный эффект 122
Гипотеза Мора 376
— энергетического сопряжения 367
Гипохромный эффект 122
Гиромагнитное отношение 86
Гликокаликс 162
Гликофорин 158
Глиоксисомы 140
Гомеостаз 470
Грамицидин А 198
График Диксона 105, 106
— Лайнуивера — Берка 104
-.Хилла 115, 116
Грей 391
Двигательная единица 468
Движение ресничек и жгутиков 309,
310
Дебаевская длина 61, 216
Дебай 43
Дейтроны 326
Деполяризация пейсмекерная 2di?
— поздняя следовая 258
— ранняя следовая 257
Десмин 277
Диастола 472
Дивергенция в нервных центрах 459,
460
Динамика белковой структуры 74, 98
Динеиновые ручки 310
Диоптрия 456
Дисперсия оптического вращения
(ДОВ) 39, 67
Диссипативная структура 34
— функция 25
Дифракция нейтронов 39
Дифференциальная потеря энергии
394
Дифференциальный пространственный
порог 439
Диффузия 48
— латеральная 153
— облегченная 163, 168
Дихрограф 69
ДНК внеплановый синтез 422
— двунитевые разрывы 381, 398, 409
— двойная спираль 119
— конформации 121
—кривая плавления 124
— однонитевые разрывы 381, 398, 409
— рентгенограмма 119
— репаративный синтез 422
— Л-семейство 121, 122
— Б-семейство 121, 122
Доза ионизирующих излучений 390
— квазипороговая критическая 405
— поглощенная 391
— эквивалентная 392
— экспозиционная 391
Дозиметрия ионизирующих излучений
392
Дозовая кривая 383, 403, 404
Донор электронов 323
Донорно-акцепторная пара 345
Дополнительные фотосинтетические
пигменты 356
Естественная радиоактивность
природной среды 431
Жгутик 306, 307
Железосерные кластеры 321
Задержанное выпрямление 226
Закон Вебера — Фехнера 439
— Гесса 8
— Гротгуса — Дрепера 347
— Ламберта — Бэра 77
— Ньютона 46
— Ома 26
— Пуазейля 26, 46
—Стивенса 438
— Стокса 81
— Фика 25,48, 164
— Франка — Старлинга 293, 472
— Фурье 10, 26
— Эйнштейна 348
Заряженные частицы 390
Зеаксантин 356
Зеленые бактерии 370
— серобактерии 370
Зиверт 392
Зоопурпурин 386
Инактивация каналов 200
— ферментов 399
Инверсия 402
Инвертированный глаз 453
Ингибирование конкурентное 104
—неконкурентное 105
Ингибиторы 104
—электронтранспортной цепи
митохондрий 320
Индуктивно-резонансная миграция
энергии 346
Индуцибельная репарация 424
Инициация 143
Инкремент вязкости (коэффициент
Симхи) 46
Интеркаляция 128, 385
493
Интермедиатные конформации
миозина 280
Интерфазная гибель клетки 402
Интрон 72
Инцизия 421
Информации количество 434, 435
— передача и переработка в нервных
центрах 459
Ионизирующие излучения 387
корпускулярные 388
электромагнитные 388
Ионная сила раствора 61
Ионные каналы 146, 170, 199
потенциалозависимые 199,211
калиевые 208, 213, 225, 226
калиевые кальцийактивируемые
211,228
кальциевые потенциалозависимые
212, 229, 230, 231, 259
кальциевые рецепторуправляемые
229
натриевые 200, 213, 214, 218, 219,
225
хлорные 234
Кавеолы 295
Калориметр дыхательный 10
Калориметрическая бомба 9
Калорический эквивалент 12
Кальмодулин 253, 254, 305
Каналы полукружные 448
Канцерогенез радиационный 429
Кардиотонические стероиды
(сердечные гликозиды) 184
Каротиноиды 342, 343, 344, 359, 369
Квазиупругое рассеяние света 39, 52
Квантовый выход флуоресценции 81,
357
фотохимической реакции 332, 348
Кинетика ферментативных реакций
101, 102
Кинк 167
Кислородный эффект 411
Клетки биполярные 455
—волосковые 314, 446
— ганглиозные 455
Клетки прокариотические 134, 306
Клетки эукариотнческие 137, 309
Кодирование пространственное 445
Колбочки сетчатки 453
Колебательные переходы 345
Компартментализация клетки 140
Комплекс с переносом заряда 385
Конвергенция в нервных центрах 459,
460
Коннексоны 236
Константа длины 204, 257
—ингибирования 105
— Михаэлиса 103
— равновесия 19, 111
Контраст 440
Конформационная карта (график Ра-
мачандрана) 63, 64
Конформационные теории
окислительного фосфорилирования 328
Конформационные перестройки
фермента 99
Конформационный параметр 66, 67
Конформация внутренней мембраны
митохондрии 318
— макромолекулы 40, 62, 63
Кооперативная кинетика 114
Кооперативность 70, 73, 114
— положительная 116
— отрицательная 116
Кортикальный слой 313
Котранспорт 188
Кофеин 419
Коэффициент взаимности 26
— внутреннего трения (фрикционный)'
48,55
— вращательной диффузий 51
— диффузии 26, 48
— дыхательный 11
— защиты (КЗ) 420 \
— полезного действия фотосинтеза
369
— осмотического потока 29
— отражения (константа Ставермана)
29,30
— проницаемости 165
—распределения 165
— седиментации 56
— стехиометрический 20, 22
— ультрафильтрации 29
— Хилла 116
Криптохром 342, 377
Кристаллические радиусы ионов 172
Критические ткани 426
Круговой дихроизм (КД) 39, 67
Ксантофилл 356
Кэпинг 160
Кэпирующие белки 316
Лаг-фаза фитохромной системы 373
Легкие цепи миозина 279, 299
Лейкоциты 470, 471
Лейкоформа фотоактивных молекул
350
Лизосомы 140
Линейная передача энергии (ЛПЭ)
395, 416
Липиды 147, 148, 149, 150, 151
Липидный бислой 317
Липидные перекиси 400
Липосома 193
Локальная скорость продукции
энтропии 23
Лучевая болезнь 426
Лучевое поражение организма 401
Лютеин 344, 356
Люцифераза 332
Люциферин 332
Магнетон Бора 91
Магнитное квантовое число 90 .
Магнитные свойства электронов 90
494
Макромолекулы биологические 38
Макроэргическая связь 20, 352, 362
Марганецсодержащий кластер
фотосистемы II 361
Меланин 343
Мембраны 133, 135, 146, 157
— емкость 201, 202, 203, 257
— ионная избирательность 171, \~?2
— искусственные двуслойные липид-
ные 193
— клеточные 146
— поры 135, 167, 176
— сопротивление 202, 203, 204, 257
Мембранные диски 453
Мембранный электрический потенциал
330
Метод внутриклеточной перфузии 209
— двойного лучепреломления в пош-
ке 51
— двухволновой флуоресцентный 85
— замораживания — скалывания 156
— остановленного потока 106
— Паркера — Риса 81
— присоединенных объемов 408
— «пэтч клэмп» 207, 210
— скорости седиментации 54
— температурного скачка 107
— фиксации потенциала 206, 207, 208
— Чоу — Фасмана 66
Механизмы фитохромной регуляции
376
Механорецепторы 444
Миграция электронно-возбужденного
состояния 343, 345, 346
Микоплазмы 136
Микрокалориметрия
дифференциальная сканирующая 72
Микротрубочки 141, 309, 310, 311
Микрофиламенты 141, 309, 312, 313
Микрофонный эффект 447
Микроэлектродная техника 175, 178
Миозин 256, 278, 279, 280, 290, 299,
313
Миозинсвязанная регуляция 304
Митохондрия 138, 315
Многоударные мишени 408
Модель Вольтера — Лотка 35
— Гуи —Чапмена 216
— Кошланда — Немети — Филмера
(последовательная) 117
— линейно-квадратичная
выживаемости клеток 409
— мерцающих кластеров 44
— Моно — Уаймена — Шанже
(симметричная) И 6
— непрерывной структуры воды 44
—нуклеационная 70
— скольжения протофибрилл 271, 276,
282, 283
-г-Хилле 219
Модификатор лучевого поражения
418
Модификация радиобиологического
эффекта 417
Молекулы-мишени 383
Молекулярно-динамическое
моделирование 100
Молекулярные переносчики
электронов митохондрий 315
Молярная эллиптичность 68
Молярное вращение 68
Молярный коэффициент экстинкции
77
Мольоксид 350
Мощность дозы облучения 391, 414
— канала связи 436
— СВЧ-излучения 95
Мутации генные 402
— хромосомные 402
Мышечное веретено 464
Мышца исчерченная (скелетная) 256
— неисчерченная (гладкая) 295
— сердечная 284, 285
Мышцы ауксотоническое сокращение
267
— изометрическое сокращение 267, 292
— изотоническое сокращение 267, 271,
272, 292
— метод быстрого освобождения 268
— миофибрилла 256, 257
— М-нити и М-мостики 257
— коэффициент полезного действия
294
— кривая длина — напряжение 269,
270, 293
— кривая сила — скорость 273, 293
— параллельная упругость 267
— пассивное напряжение 266
— последовательная упругость 266
— потенциал действия 257, 258
— саркомер 256, 257
— саркоплазматический ретикулум
257, 261, 262, 265
— скорость сокращения 273 ,
— стерическая модель регуляции
сокращения 278
— теплота активации 273
— теплота укорочения 273
— тетанус 269
— толстые протофибриллы 256, 257,
270, 275, 276, 277, 298
— тонкие протофибриллы 256, 257,
270, 275, 276, 299
— триада 262, 265
— Т-система (Т-трубочки) 257, 258,
262, 265, 285
Напряженность магнитного поля 89,
91, 92
Негемовые железосерные белки 320
Нейромедиаторы 240, 241
Нейроны-детекторы 462
Нейротоксины 245
Нейтральный радикал липида 334
Лейтроны 388, 390
495
Некеиновые мостики 310
Нексусы 295
Необратимая компонента лучевого
поражения 414
Непрямое действие ионизирующих
излучений 396, 415
Неферментативное аскорбатзависимое
окисление 337, 338
Низкоэнергетическая система фитохро-
ма 373
Нитрозильные комплексы негемового
железа 96
Нитроксильные радикалы 96, 97
Нормировка ионизирующего
излучения 430
Ноцицепторы (болевые рецепторы)
457
Нуклеиновых кислот первичная
структура 118
— третичная структура 126
Нуклеосома 126
Обмен натрий-кальциевый 189
Обменно-резонансная миграция
энергии 346
Обобщенная сила 24
Обобщенный поток 24
Образование пары
электрон—позитрон 394
Одноударная дозовая кривая 383
Окислительное фосфорилирование 314
Окислительно-восстановительный
потенциал (редокс-потенциал) 319,
323, 360, 362, 363
переносчиков электронов 326,
327
Ольфактограмма 450
Осмофоры 450
Орбиталь электронная 346
Отдаленные последствия облучения
428
Относительная биологическая
эффективность (ОБЭ) 416, 417
Ошибочная репарация 425
Ощущения интенсивность 438
— модальность 437
— пороги 438
Палочки сетчатки 453
Параметр упорядоченности 97
Парциальный удельный объем 27, 56
Пептидогликаны 135, 306, 307
Первый закон термодинамики 7
Перекисное окисление липидов 334
399
ненасыщенных жирных кислот
337
Перекисный радикал 335, 382
Переменное сверхвысокочастотное
(СВЧ) электромагнитное поле 92
Перенос электронов 314, 318, 319
Перенос энергии внутримолекулярный
343, 346
межмолекулярный 346
496
Переходы гель —золь 312, 313
Перидинин 356
Пероксисомы 140
Пигмент-белковые комплексы 370
Пигменты биологические 341, 342
— фотосинтетические 353
Пик Брэгга 395
Пиноцитоз 191
Пиридиннуклеотидная система
биолюминесцентной реакции 333
Пиримидиновые димеры 381
Плазмида 137
Пластоцианин 361
Пластохиноны 360, 361, 366
Поле излучения 390
Полоса Соре 355
Порин 135
Порфирины 343, 358, 386
Поры ядерные 138
Порядок реакции 101
Пострадиационное восстановление
клеток 420, 421 ^
Пострепликативная репарация 415
Потенциал действия 199
— возбуждающий постсинаптический
(ВПСП) 239, 241, 242
— изобарно-изотермический 16
— изохорно-изотермический 16
— мембранный 174
— поверхностный 215
— покоя 174
— полувосстановления 325
— реверсии 182, 183
— рецепторный (генераторный) 442,
454
— термодинамический 16
— тормозной постсинаптический
(ТПСП) 239, 241, 242
— химический 17, 20, 22, 27
— электротонический 202, 204
— электрохимический 21, 177
Потенциально летальные повреждения
412, 413, 414
Правила Чаргаффа 119
Правило Бергонье — Трибондо 427
— Бунзена — Роско 379
Принцип мишени 405
— локального равновесия 23
— Паули 90
— попадания 406
— усилителя 406
— устойчивости Ле-Шателье 31
— Франка — Кондона 347
Природный фон облучения 430
Продукция энтропии 22
Полирибосомные комплексы
(полисомы) 143, 144
Пролиферативная гибель клетки 402
Промежуточные филаменты 141, 309.
314
Протонный градиент 330
— насос 372
Протон-проводящий компонент АТФ-
синтетазы 316, 317
Процесс необратимый 7
— обратимый 7
— экзергонический 17
—эндергонический 17
Прямое действие ионизирующих
излучений 396
Псевдоподия 312
Псорален 386
Птеридин 343
Пункты сопряжения окисления и фос-
форилирования 90, 320, 321, 322, 363
Пурпурные бактерии 370
Работа осмотическая 21
— электрическая 21
Равновесие Гиббса — Доннана 178,
179
— термодинамическое 15, 17
Рад 391
Радиационная химия воды 396, 397
Радиационный синдром 426
Радиационное повреждение молекул
396
Радиационно-химический выход
реакции 400
Радикал антиоксиданта 339
Радиобиологический парадокс 406
Радиомиметик 420
Радиопротектор 418
Радиосенсибилизатор 418
Радиотаксон 430
Радиоустойчивость 428, 429
Радиочувствительность 427
Раздражение 434
Распределение Пуассона 406
Реабсорбция света 346
Реакционный центр фотосистемы I
359, 360, 365
— фотосистемы II 360, 365, 366
Реакция Белоусова — Жаботинского
34
— экзотермическая 12
— эндотермическая 12
Регуляция газового состава крови 478
— осмотического давления крови 483
— по типу обратной связи 113
— температуры крови 483
— уровня энергетических веществ 481
—кровотока гуморальная 476
рефлекторная 473
Ренин-ангиотензиновый механизм 477
Рентген (Р) 391
Рентгеновское излучение 389
Репарация двухнитевых разрывов
ДНК 423
— мембран 425
— иидуцибельная 424
— однонитевых разрывов ДНК 422,
423
—пострепликативная 424
—эксцизионная 421
Репарирующая система клетки 420
Репопуляция 427
Ретиналь 372, 454
Рефлекторная реакция 464
Рефрактерность 201
Рецептивное поле 462
Рецептор ацетилхолиновый
(никотиновый и мускариновый) 245, 246, 247
— вкусовой (вкусовая луковица) 450,
451
— обонятельный 449, 450
Рецепторы 434, 441
Рибосома 143
Ригор 283
Риск от облучения 430, 431
Родопсин 342, 453
Рэлеевское рассеяние света 52
Ряды Эйзенмана 174
Сальтаторное проведение 206
Сарколемма 256, 285
Сверхтонкая структура 94
Светособирающий комплекс 363
Светофокусирующий комплекс 364
Свободный радикал 94, 95, 382, 388,
399
Седиментация 54
Семихиноны 95, 96
Сенсорные системы 136, 434, 437
Сетчатка глаза 453
Сечение инактивации молекулы 383
Симпорт 188
Синапсы смешанного типа 239
— химические 238
— электрические 238
Синглетный кислород 334, 369
Синглет-синглетный переход 347
Синхротронное излучение 389
Систола 472
Скицированные мышечные волокна
262, 263
Скорость реакции 101
Собственные рефлексы мышц 464
Солитон 284
Сольватированный электрон 396
Соматические эффекты облучения 402
Соотношение взаимности Онзагера
26,29
Сопрягающая мембрана 367
Спектр возбуждения 81
— действия фотосинтеза 359, 385
— действия фотохимических реакций
349
— действия ультрафиолетовых лучей
379
— поглощения 77
— флуоресценции 81
Спектрин 158
Спектрополяриметр 81
Спектрофотометр 77
Сфинголипиды 149
Спектрофотометрия абсорбционная 76
— дифференциальная 77
497
— сольвентно-пертурбационная
дифференциальная (СПДС) 79
— температурно-пертурбационная
дифференциальная (ТПДС) 78
Спилловер 364
Спин электрона 86, 90
Спиновая метка 96, 97
Спиновое квантовое число 91
Спиновый зонд 96
Спин-решеточная релаксация 88
Спин-спиновая релаксация 88
Спираль-клубок переход 70, 124
Среднеквадратичное смещение 48
Сродство химической реакции 23
Стандартный редокс-потенциал 325
Стационарное состояние 21, 30, 36
Степень анизотропии 82
— гидратации макромолекулы 47
—кооперативности 116
— поляризации 82
— прохождения реакции 22
тенка бактериальная 135
тэкинг-взаимодействия 123
Стереоциллии 314
Стимул 434
т- адекватный 441
Стохастическая концепция в
радиобиологии 409
Структура макромолекул вторичная
40, 63
первичная 40, 62
третичная 40, 70
1 четвертичная 40
Сублетальные повреждения клеток
413
Сульфгидрильные радиопротекторы
412
Суммация временная 440
— пространственная 439, 460
Супероксидный радикал 334, 397
Супероксиддисмутаза 338, 339
Сухожильные органы 464, 466
Сшивки ковалентные 398, 400
Темновая реактивация 384
Темный крест изоклина 51
Температурный инкремент экстипкции
79
Теорема Пригожина 31
Теория Борна 169
— Дебая — Хюккеля 58
— кабельная 201, 202, 203, 204
— клеточная 130
—-Крамерса 112
— мишени 383
— переходного состояния 109
— постоянного поля 174, 182
— хемиосмотическая Митчелла 308,
329, 367
Терминация 143
Термодинамика 6
— линейная неравновесная 22, 25, 27
•—нелинейная 32
Термодинамическая вероятность 14
— ветвь 34
— система 6
Термодинамические параметры 6
Терморецепторы 452
Тест-эффект в радиобиологии 403
Тетрапиррол 354
Тилакоид 356, 364
Тиолы эндогенные 418
Ток воротный 211, 212
— емкостной 203, 205
— ионных каналов 203, 205, 208
— локальный 205
— смещения асимметричный 212
а- и р-Токсины 223
Торможение аутогенное 467
— возвратное 460
—латеральное 461
— опережающее 460
— постсинаптическое 460
— пресинаптическое 461
Торсионные углы 63
Траксдукция 443
Транскрипция 117, 142
Транслокация протонов 330
Трансляция 117, 142
Трансмембранный перенос протонов
320, 321, 322, 329
Триада 262, 265
Транспорт мембранный 162
— активный 163
— вторичный активный 188
— пассивный 162
Триплет-триплетный перенос энергии
346
Тромбоциты 470, 471
Тропомиозин 277, 278, 290, 299, 313
Тропонин 250, 277, 278, 290
Тубулин 310,311
Тушение флуоресценции 82
Тяжелые цепи миозина 279
Ударность мишени 407
Улитка 446
Ультрафильтрация 29
Уравнение Аррениуса 108
— Бете — Блоха 394
— Вант-Гоффа 19
— Гиббса — Дюгема 28
— Грехема 217
— Михаэлиса — Ментен 103
—Нернста 174
— Нернста — Планка 181
— Пуассона 59
— Уссинга 182
— Хилла 274
— Ходжкина — Хаксли 213, 214
— Эйринга 111
Устойчивость стационарного состояния
32
— термодинамического равновесия 32
Ухо внутреннее 314, 446
Фагоцитоз 191
49В
Фазовая плоскость 36
— траектория 36
Фактор изменения дозы (ФИД) 419
— спектроскопического расщепления
У1, 93
— увеличения дозы (ФУД) 420
— фосфорилирования 316
Феофитин 358, 366
Ферментный катализ 97
Ферменты аллостерические 112, 114
Фермент-субстратные взаимодействия
98, 99, 102
Фибриноген 72
Фибронектин 159, 161
Фикобилин 342, 356
Фикоцианин 355
Фикоцианобилин 344
Фикоэритрин 355
Фикоэритробилин 344
Филамин 277
Фитол 354
Фитохром 342, 373, 374, 375, 376
Фитохромная регуляторная система
372
Флавины 343, 377
Флавоноиды 343
Флагелла 307
Флагеолин 307
Флип-флоп 155
Флуоресценция 81
— белка 83
Флуоресцентная спектроскопия с
временным разрешением 83
Формула Вант-Гоффа 27, 179
— Перрена 82
— Планка 80
— Сведберга 56
— Стокса 48
— Стокса — Эйнштейна 171'
— Теорелла 164
Фосфолипиды 147
Фосфоресценция 81
Фотогидролиз 350
Фотодеструктивные процессы 342
Фотодинамический эффект 369, 386
Фотодиссоциация 350
Фотозащита 385
Фотоинактивация ферментов 341, 379,
382, 385
Фотоионизация 350
Фотолиаза 384
Фотолиз воды 361, 362, 364, 367
Фотолитоавтотрофы 370
Фотоморфогенез 376
Фотоокисление 350
Фотоперенос электрона 350
Фотоприсоединение электрона 350
Фотореактивация 384
Фоторегуляторные системы 372
Фоторецепторы 453
Фотосенсибилизация 350, 351, 385, 386
Фотосинтеза Z-схема 360
— кислородвыделяющая система 366
— суммарная реакция 352
— термодинамика 352, 363
— фотохимический этап 352, 357
Фотосинтетическая единица 359
Фотосинтетический цикл углерода 368
Фотосинтетическое фосфорилировапие
нециклическое 363
псевдоциклическое 363
циклическое 363
Фотосистемы I и II 360
Фототаутомеризация 350
Фототрофы прокариотические 355, 369
Фотохимические реакции 381
Фотоэлектрический эффект 393
Фукоксантин 356
Хеморецепторы 136, 449
Хемотаксис 136, 308
Химическая гипотеза окислительного
фосфорилирования 327
Химический сдвиг 88, 89, 127
Хлоропласт 139, 356
Хлоросома 370
Хлорофилл антеноидный 359
Хлорофилла спектр поглощения я
флуоресценции 354
— триплетное состояние 348
Хлорофилл-белковый комплекс 364
Хлорофуцин 355
Хроматин 138
Хроматофоры пурпурных бактерий 370
Центр дыхательный 478, 480
— сосудодвигательный 475
— тормозящий сердце 475
Цепные реакции окисления липидов
382, 399, 400
Цереброзиды 150
Цианидин 343
Цикл Кальвина 368
— Кребса 317
— миозинового мостика 281, 282, 283,
284
Цистеамин 418
Цитозоль 141
Цитоскелет 141, 309, 311
Число оборотов реакции 104
Шеноновский канал связи 436
Шкала гидрофобности 45
Шлирен-пик 54
Щелевые соединения 236
Эволюционный критерий открытой
системы 33
Эйнштейн 348
Экворин 230, 263, 265, 334, 340
Экзон 72
Экзоцитоз 163, 192
Эксимер 350
Эксиплекс 350
Экситон 347
Экспрессия 145
Эктоплазма 313
Зкстраполяционное число 405, 408
499
Эксцизия 421
Электрический синцитий 285
Электронно-возбужденное состоя н ие
344, 345
я-Электроны 345
Электрон движущая сила 324
Электрофорез 57
Электрофоретическая подвижность 57
Элонгация 143
Электромеханическое сопряжение 259,
260, 261, 290
Эндоплазма 312
Электро- и фармакомеханическая
связь 302 -
Эндоплазматический ретикулум 139
Эндоцитоз 163, 191, 192
Энергия активации 108
— внутренняя 7
— квантов 92
— свободная Гельмгольца 16
— свободная Гиббса 16, 17, 20
— стандартная свободная 18,20
— свободная гидратации ионов 172
Энергетические уровни 90, 91
Энергетический эквивалент 11
Энтальпия 8
Энтропия 13, 436
— открытой системы 23
ЭПР сверхтонкая структура спектров
90,95
— сигналы цитохрома Р450 и цито-
хрома Ьь 96
— спектрометр 93
— форма линии 94
— ширина линии 94
Эритроциты 470, 471
Эффект Блинкса 359
— выпрямления 183
— Допплера 53
— Комптона 393
— красного края 85
— красного падения 359
— насыщения 95
—фракционирования 413
— экранирования 88
Эффективный объем 416
Ядерный магнетон 86, 94
Ядерный магнитный момент 86
Ядра отдачи 394
Ядро 137
ЯМР-спектрометр 86, 87
—томография 89
ОГЛАВЛЕНИЕ
Введение ...... 3
Часть I. Термодинамика биологических прсцесав 6
Глава 1. Термодинамика равновесных состояний . . • 7
1.1. Первый закон термодинамики . . . 7
1.2. Энтальпия. Закон Гесса • 8
1.3. Калориметрия 9
1.4. Второй закон термодинамики 12
1.5. Термодинамические потенциалы 16
1.6. Изменение стандартной свободной энериы и константа
равновесия 18
1.7. Электрохимический потенциал 20
Глава 2. Термодинамика необратимых процессов 21
2.1. Изменение энтропии в открытых системах 22
2.2. Скорость продукции энтропии и диссипативная функция ... 23
2.3. Основные положения линейной неравновесной термодинамики . 2>
2.4. Соотношение взаимности Онзагера 26
2.5. Теорема Пригожина 30
2.6. Устойчивость стационарного состояния 31
2.7. Нелинейная термодинамика необратимых процессов ...» 32
Часть II. Молекулярная биофизика 38
Глава 3. Биологические макромолекулы в растворе 38
3.1. Конформации макромолекул 39
3.2. Силы, стабилизирующие пространственную структуру
макромолекулы ••••«•40
3.3. Гидрофобные взаимодействия и структура воды 43
3.4. Вязкость растворов макромолекул «4$
3.5. Диффузия макромолекул 47
3.6. Квазиупругое рассеяние света .52
3.7. Седиментация макромолекул • 54
3.8. Электрофорез макромолекул 57
3.9. Взаимодействие между макромолекулами в растворе (теория Дв-
бая — Хюккеля) 58
Глава 4. Биофизика белков .61
4.1. Первичная и вторичная структура белков «63
4.2. Дисперсия оптического вращения и круговой дихроизм . . • 67
4.3. Домены и третичная структура белка • . 70
4.4. Дифференциальная сканирующая микрокалориметрия « • . 72
4.5. Динамика белковой структуры 74
4.6. Абсорбционная и дифференциальная спектрофотометрия белков 76
4.7. Флуоресцентная спектроскопия белков ........ 80
4.8. Ядерный магнитный резонанс (ЯМР) . 86
4.9. Электронный парамагнитный резонанс (ЭПР) ... . . 90
4.10. Ферментный катализ 97
501
4.11. Кинетика ферментативных реакций 1(М
4.12. Влияние температуры на скорость химических реакций . . » 108
4.13. Аллостерические ферменты. Регуляция химических реакций
в клетке 112
Глава 5. Биофизика нуклеиновых кислот 117
6.1. Первичная структура нуклеиновых кислот 117
б.?. Двойная спираль ДНК 119
5.3. Конформации ДНК 121
5.4. Оптические характеристики нуклеиновых кислот 122
$.5. Третичная структура нуклеиновых кислот 125
о.о. Белково-нуклеиновое узнавание 126
Часть III. Биофизика клеточных процессов 130
Глава 6. Клетка — сложная высокоупорядоченная система 130
6.1. Микроскопические исследования клеток ........ 130
6.2. Прокариотические клетки 134
§.3. Эукариотические клетки 137[
6.4. Факторы, контролирующие синтез белков в клетке .... 142
Глава 7. Клеточные мембраны 146
7.1. Молекулярная организация клеточных мембран 147
7.2. Динамика липидов в мембране 152
7.3. Мембранные белки . • ........ 155
7.4. Жидкостно-мозаичная структура мембран 159
Глава 8. Мембранный транспорт 162
8.1. Диффузия веществ через липидный бислой мембраны .... 163
8.2. Избирательная ионная проницаемость клеточных мембран . 169
8.3. Мембранный потенциал 174
8.4. Пассивный поток ионов через клеточную мембрану . . . .181
8.5. Активный транспорт 184
8.6. Эндо- и экзоцитоз 190
8.7. Моделирование ионной проницаемости клеточных мембран 193
Глава 9. Электрическая возбудимость клеток 1S9
9.1. Потенциал действия ....... • ...... 199
9.2. Распространение потенциала действия. Кабельная теория . 201
9.3. Метод фиксации потенциала 206
9.4. Воротные механизмы потенциалозависимых ионных каналов .211
9.5. Поверхностный потенциал клеток 215
9.6. Свойства открытых потенциалозависимых н-атриевых каналов . 218
9.7. Свойства потенциалозависимых калиевых каналов .... 225
9.8. Свойства потенциалозависимых кальциевых каналов . . . 229
9.9. Хлорные каналы 234
9.10. Синтез ионных каналов плазматической мембраны .... 234
Глава 10. Механизмы межклеточных взаимодействий ....... 235
10.1. Щелевые соединения 236
10.2. Синаптическая передача 238
10.3. Эндокринная система 247
10.4. Передача сигналов от рецепторов плазматической мембраны
внутрь клетки 249
10.5. Роль ионов кальция в регуляции деятельности клетки . . .254
Глава 11. Биофизика сократительных процессов 255
11.1. Исчерченные (скелетные) мышцы 256
11.2. Сопряжение между возбуждением и сокращением в
исчерченных мышцах . 259
11.3. Механика и энергетика сокращения 266
11.4. Молекулярные механизмы мышечного сокращения .... 275
11.5. Сердечная мышца 284
11.6. Биомеханика и энергетика сердечной мышцы ..... 290
11.7. Неисчерченные (гладкие) мышцы 295
11.8. Активация сокращения в неисчерченных мышцах .... 297
11.9. Немышечная форма подвижности клеток •«»»*•» 306
501
Глава 12. Биоэнергетика 314
12.1 Структура митохондрий 315
12.2. Перенос электронов в мембранах митохондрий 318
12.3. Окислительно-восстановительные потенциалы 323
12.4. Теории сопряжения биологического окисления и фосфорилиро-
вания 327
12.5. Биолюминесценция и биохемилюминесценция 331
Глава 13. Фотобиологические процессы 341
13.1. Типы фотобиологических процессов 341
13.2. Пигменты биологических систем 342
13.3. Общие закономерности фотобиологических процессов . . . 343
13.4. Механизмы миграции энергии электронного возбуждения • 345
13.5. Общая характеристика фотохимических процессов .... 347
13.6. Фотосинтез 351
13.7. Галобактерии и свойственные им фотопроцессы 371
13.8. Фоторегуляторные системы 372
13.9. Действие ультрафиолетовых лучей на биологические системы 378
13.10. Фотосенсибилизация 385
Глава 14. Биологическое действие ионизирующей радиации « . . . 387
14.1. Природа ионизирующей радиации 388
14.2. Дозы ионизирующих излучений 390
14.3. Взаимодействие ионизирующих излучений с веществом . . 392
14.4. Действие ионизирующих излучений на живые организмы . 401
14.5. Принципы количественной радиобиологии 405
14.6. Кислородный эффект в радиобиологических явлениях .411
14.7. Сублетальные и потенциально летальные повреждения
клеток 413
14.8. Прямые и непрямые эффекты облучения клеток .... 415
14.0. Линейная передача энергии (ЛПЭ) и относительная
биологическая эффективность облучения 416
14.10. Модификация радиобиологических эффектов 417
14.11. Восстановление клеток от лучевого поражения 420
14.12. Действие ионизирующего излучения на многоклеточный
организм 426
14.13. Отдаленные эффекты облучения 428
14.14. Концепция риска в радиобиологии 430
14.15. Природный фон радиоактивности ......... 431
Часть IV. Биофизика сложных систем . ♦ . , 434
Глава 15. Передача информации в сенсорных системах организма . . . 434
15.1. Основные понятия теории информации . 434
15.2. Общие принципы функционирования сенсорных систем . . . 437
15.3. Трансформация раздражений в рецепторах 441
15.4. Передача и переработка информации в нервных центрах . 459
Глава 16. Управление двигательной функцией организма 464
16.1. Скелетная мышца как саморегулирующаяся система . . . .464
16.2. Скелетная мышца как эффектор .......... 468
Глава 17. Постоянство внутренней среды организма и его регуляция .470
17.1. Характеристики внутренней среды организма . .... .470
17.2. Регуляция кругооборота крови ........ . 472
17 3. Регуляция газового состава крови 47S
17А. Регуляция уровня энергетических веществ в крови . . . 481
17.5. Регуляция температуры крови 483
17.6. Регуляция осмотического давления крови . 485
Ответы на задачи 488
Список рекомендуемой литературы 489
Предметный указатель . . ♦ . • 492
503
Учебник
Костюк Платон Григорьевич
Гродзинский Дмитрий Михайлович
Зима Валентин Леонидович
Магура Игорь Сильвестрович
Сидорик Евгений Петрович
Шуба Михаил Федорович
БИОФИЗИКА
Редактор Н. И. Ромась
Обложка и художественное
редактирование И. Г. Сухенко
Технический редактор Г. Б. Верниы
Корректоры И. Я. Бойко, Н. Я. Кунцевская
ИБ № 12085
Сдано в набор 22.12.87. Подписано в печать
12.08.88. БФ 03142. Формат 60x90/16. Бумага типо-
графская № 2. Гарнитура литературная. Высокая
печать. Усл.-печ. л. 31,5. Усл.-кр.-отт. 31,5,
Уч.-изд. л. 34,87. Тираж 10000 экз. Изд. № 6160.
Зак. № 8*616. Цена 1 р. 60 к.
Головное издательство издательского объединения
«Выща школа», 252054, Киев-54, ул. Гоголевская, 7
Книжная фабрика им. Ми В. Фрунзе, 310057, Харь*
ков-57, Донец-Захаржевского, 6/8