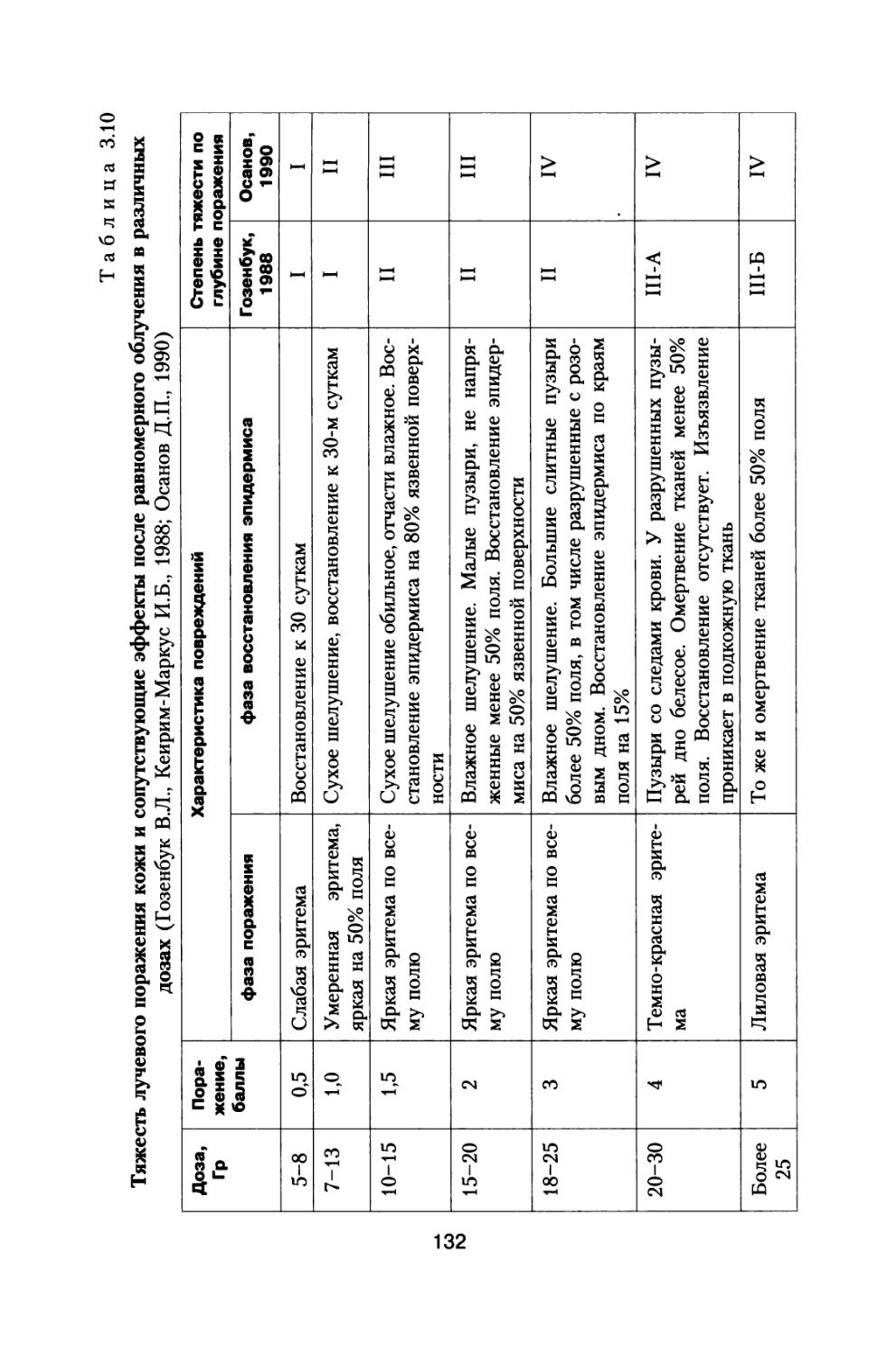
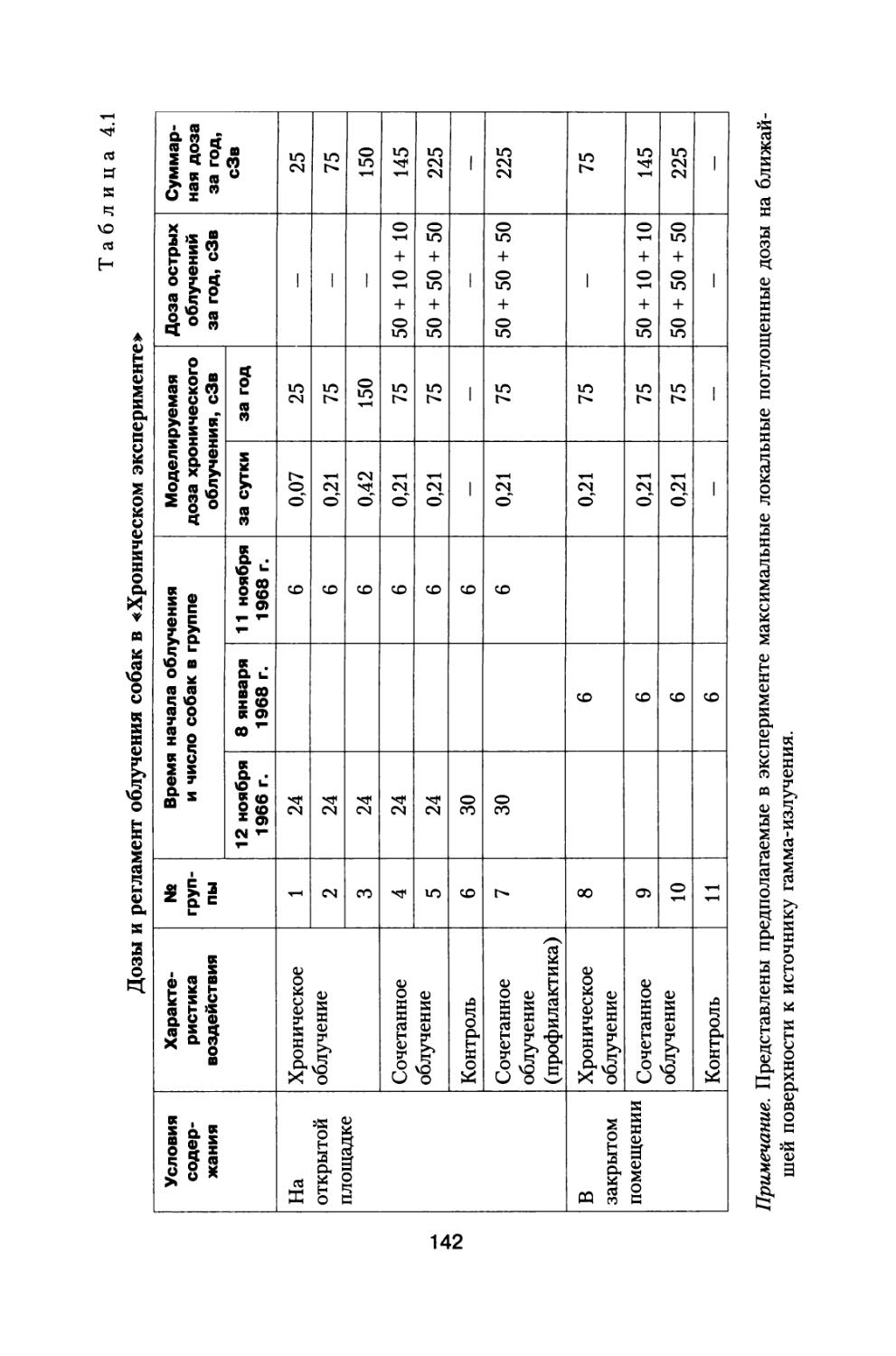
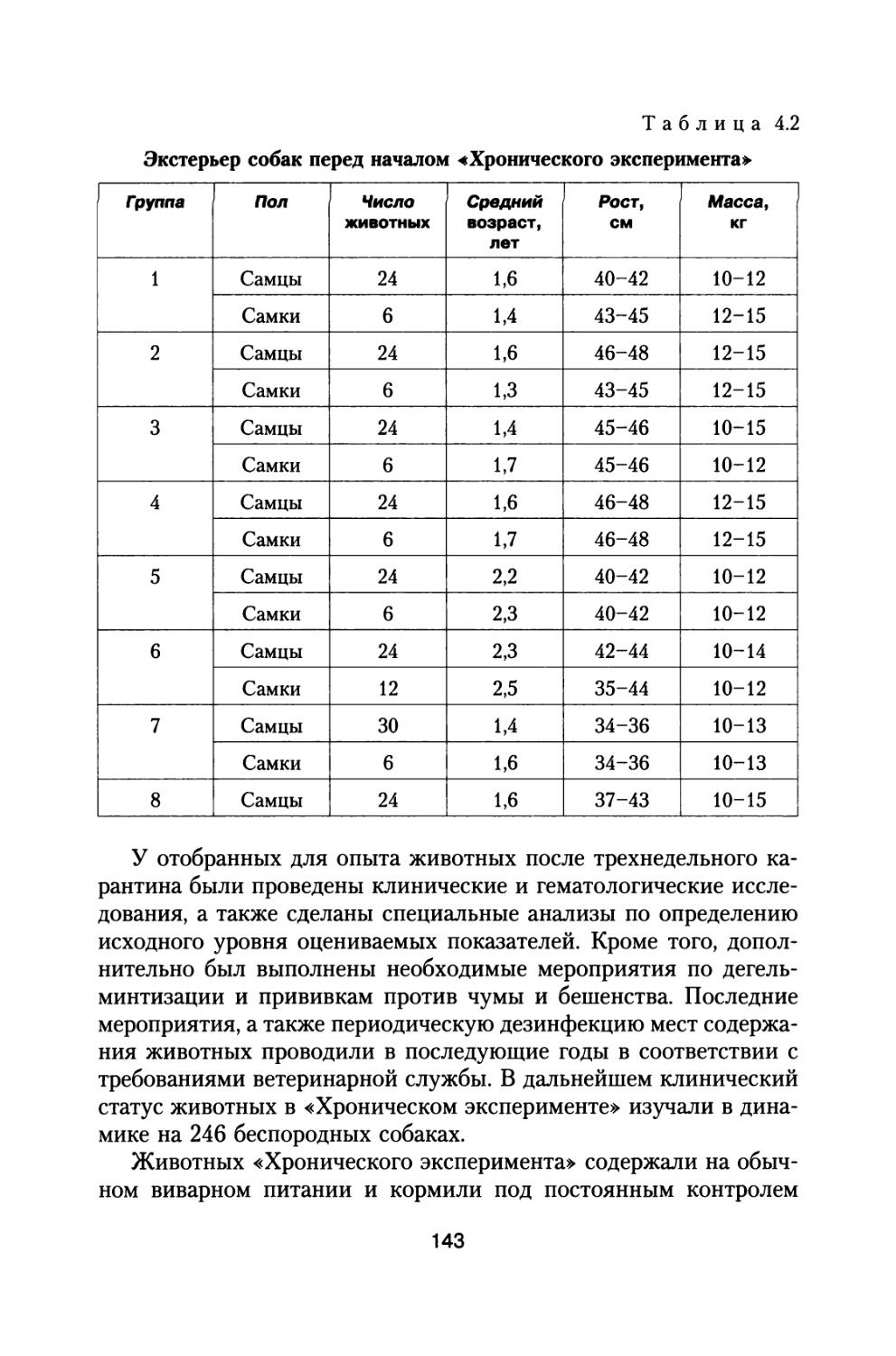
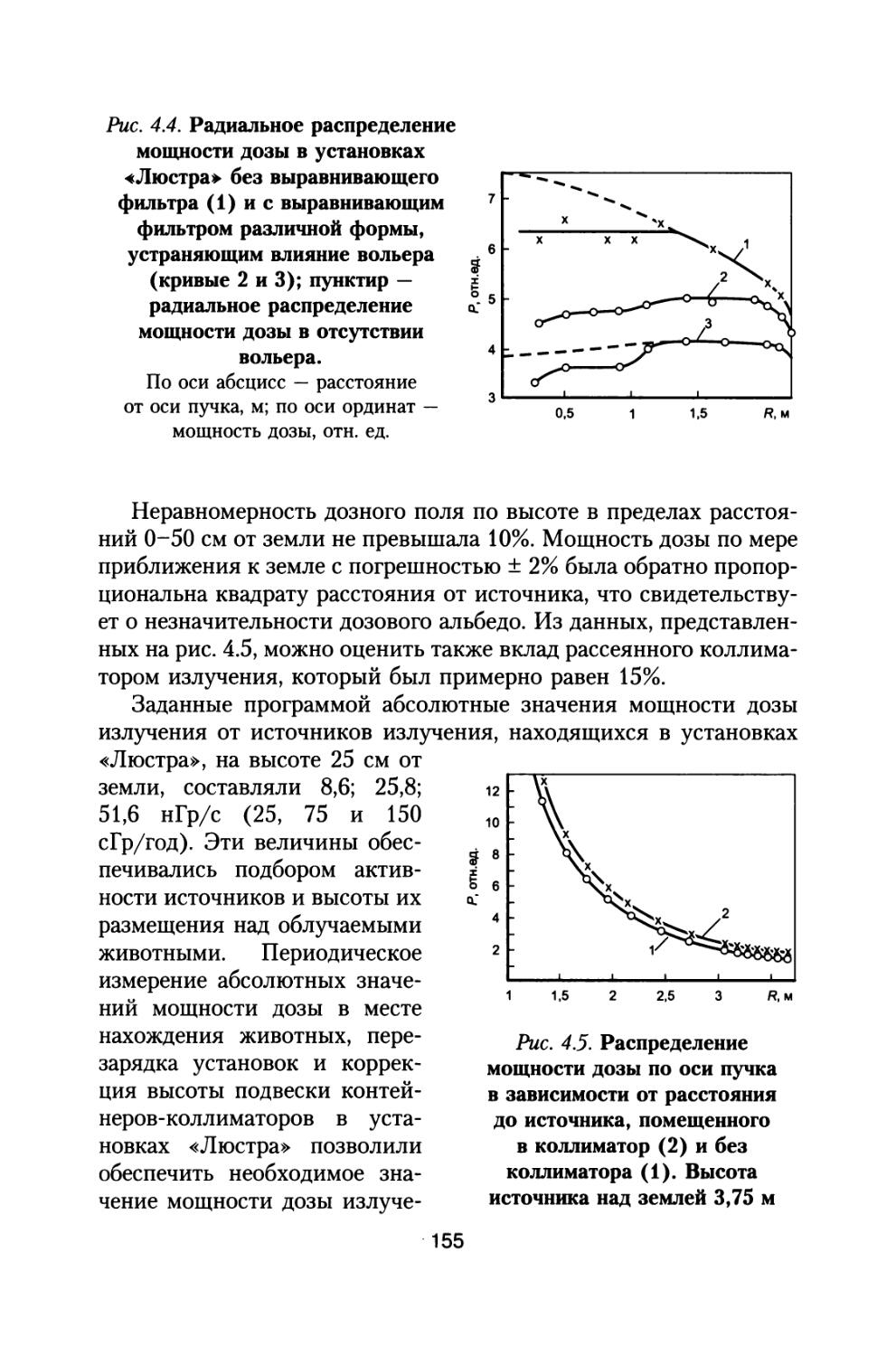
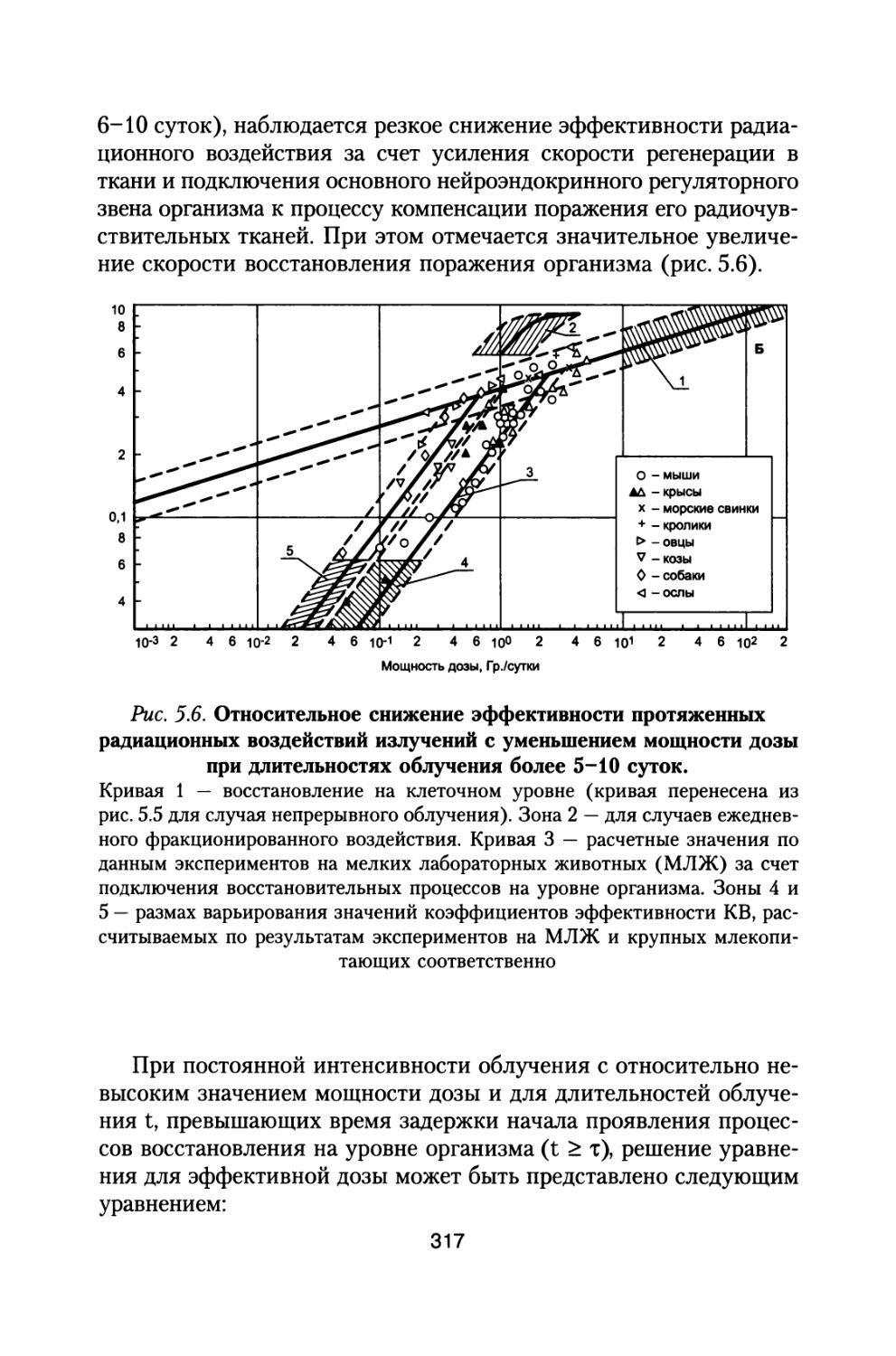
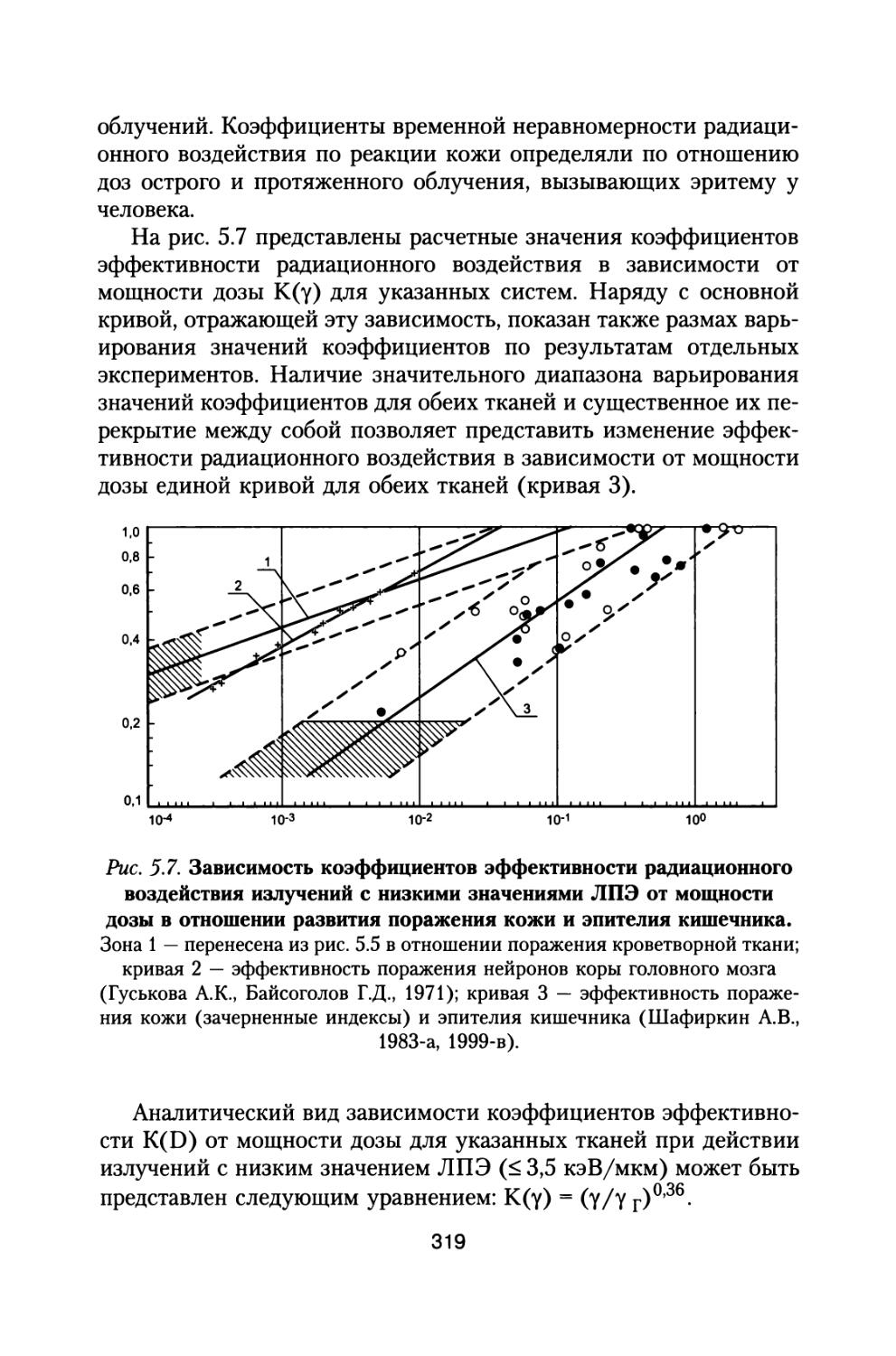
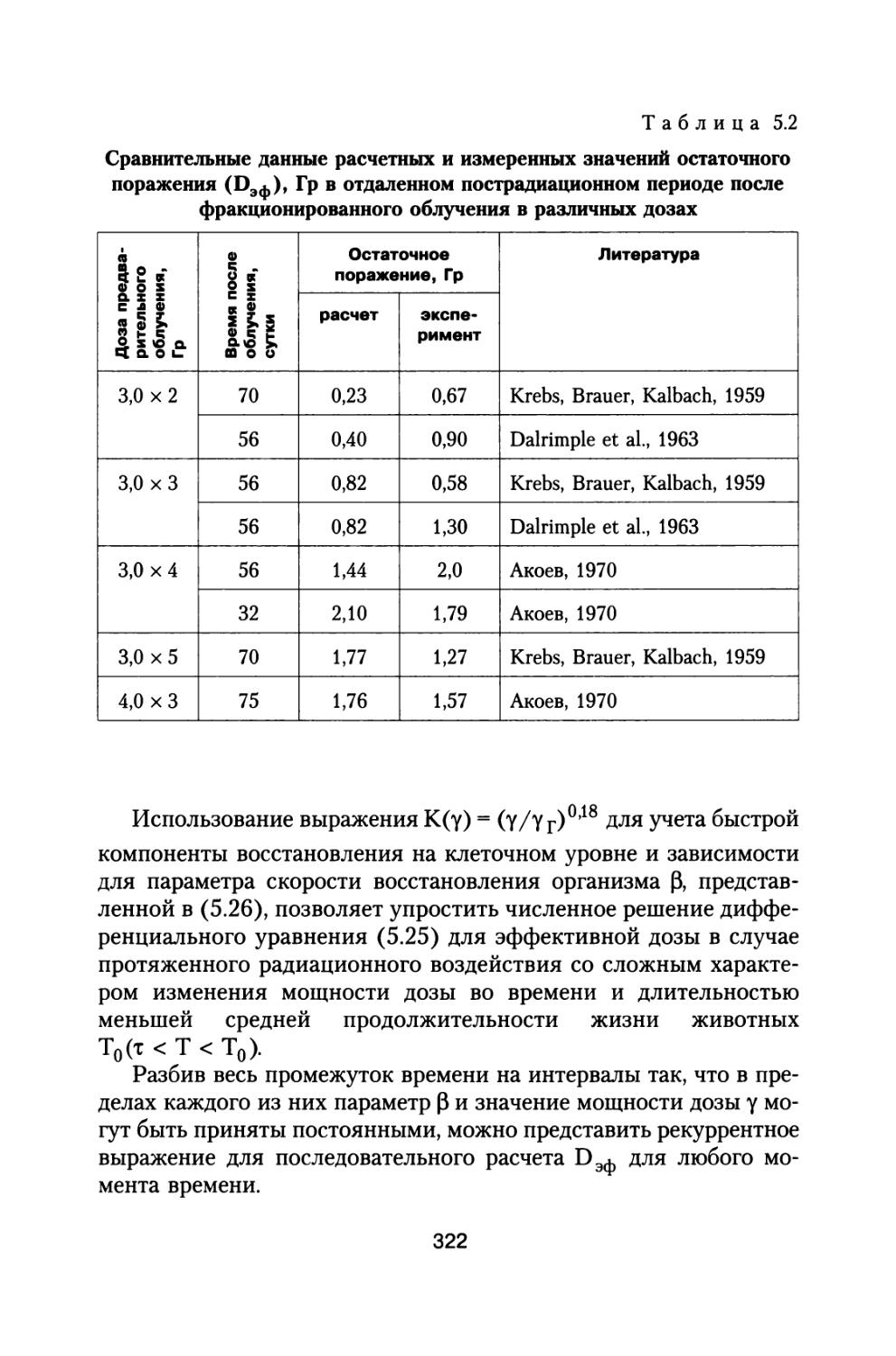
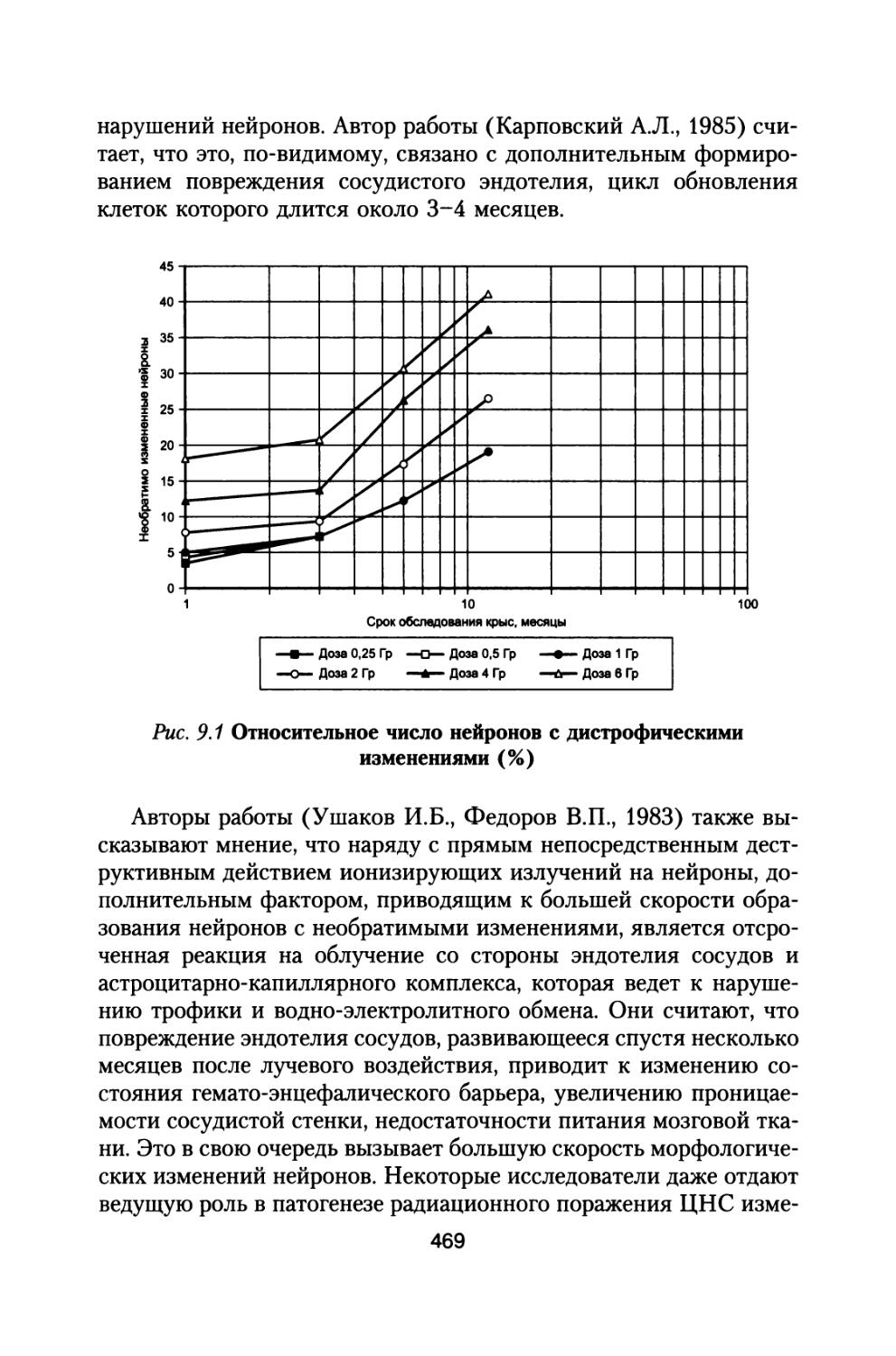
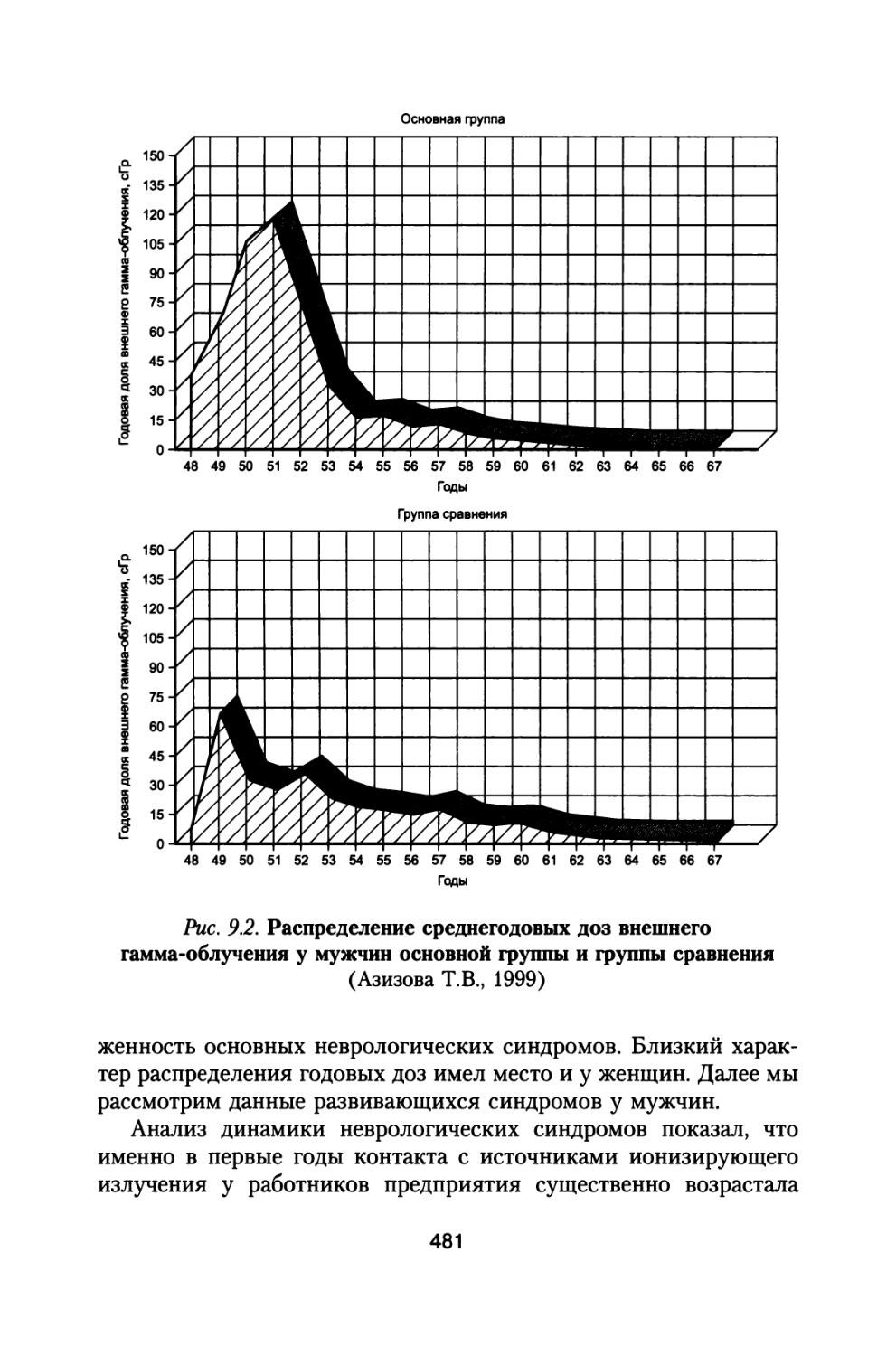
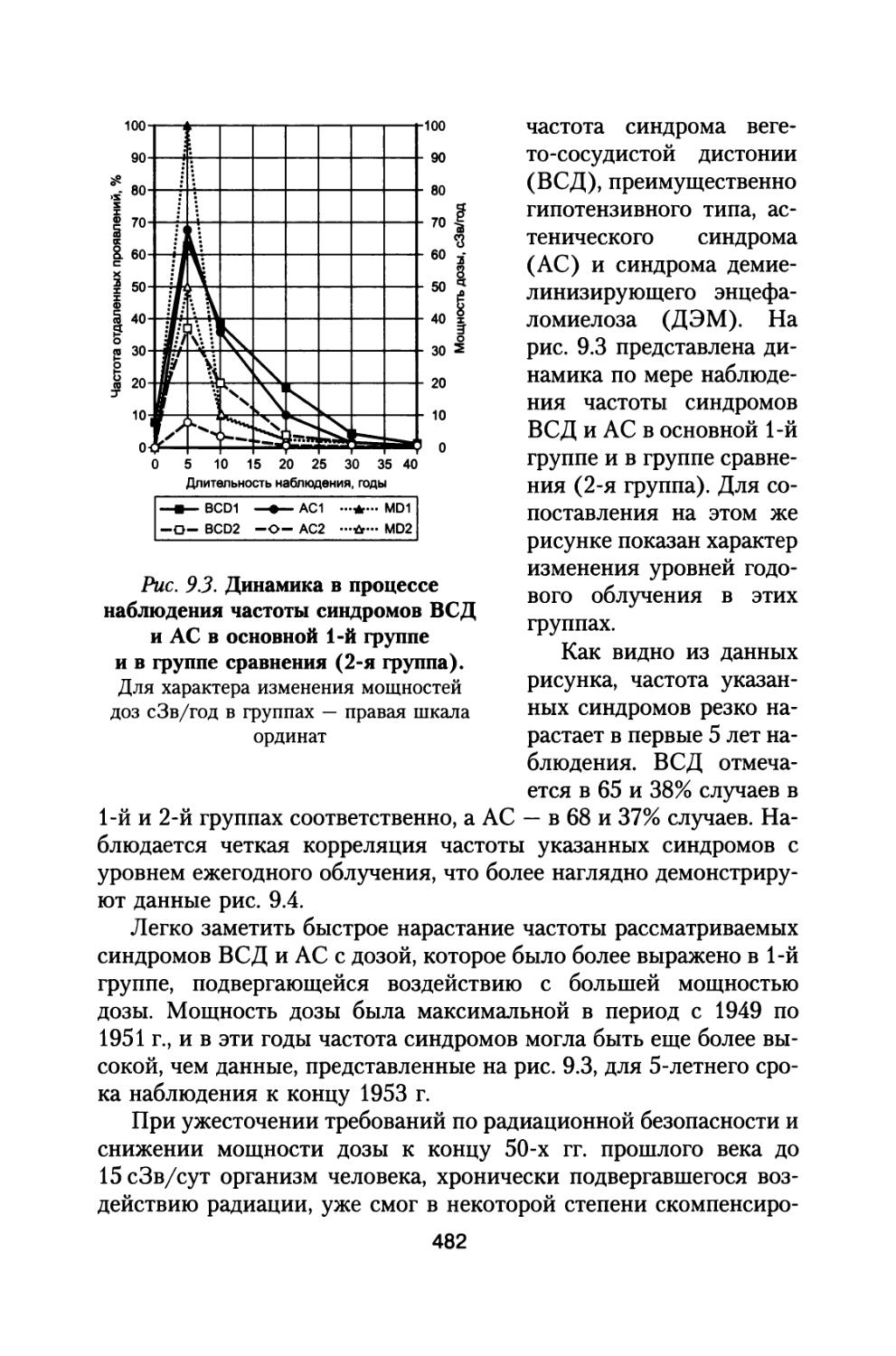
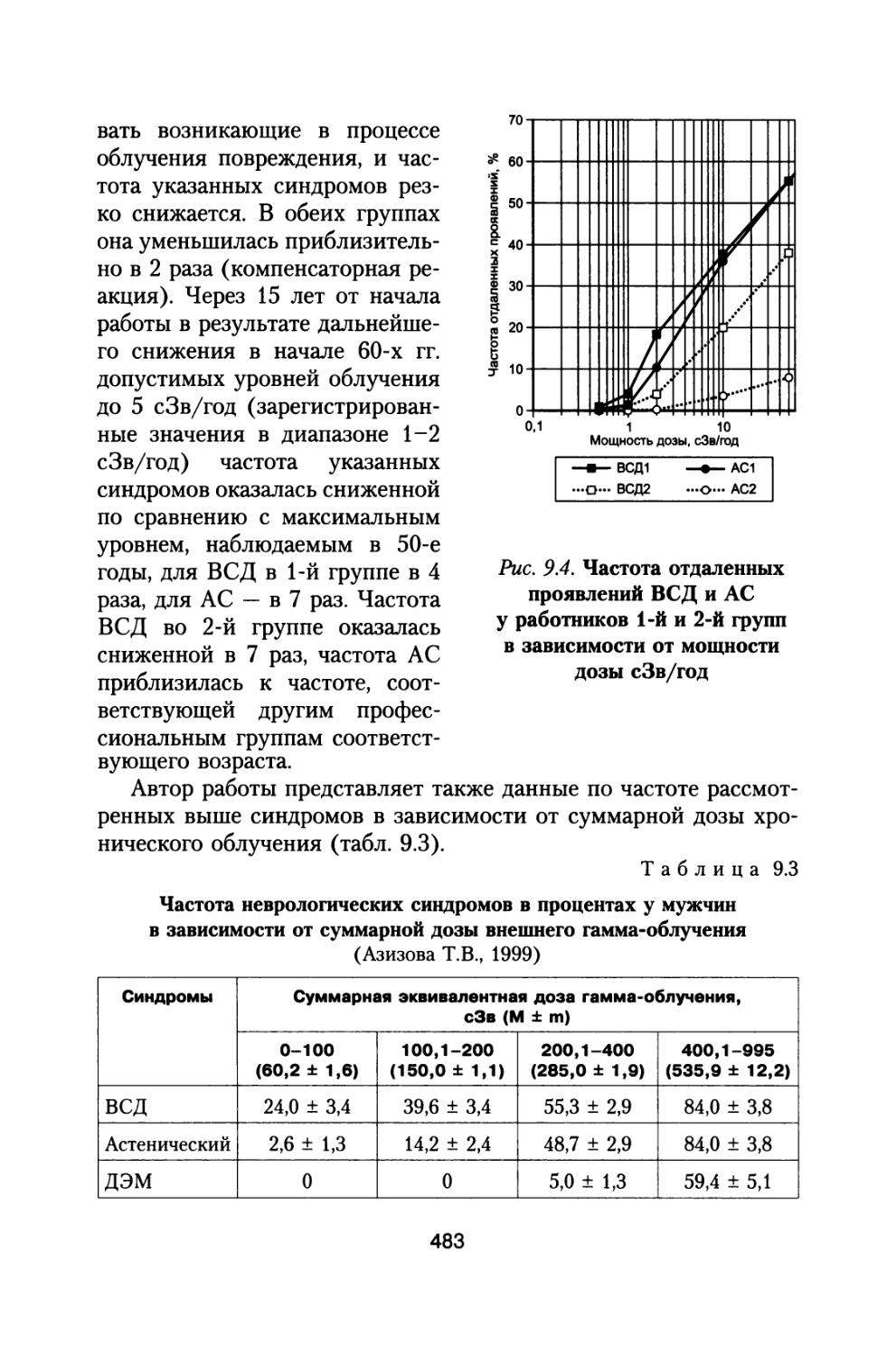
Author: Григорьев Ю.Г. Шафиркин А.В.
Tags: авиация и космонавтика летательные аппараты ракетная техника космическая техника астрономия астрофизика исследование космического пространства геодезия междупланетные соединения (междупланетные полеты) космонавтика (аэронавтика) космонавтика
ISBN: 978-5-282-02948-2
Year: 2009
А.В. Шафиркин. Ю.Г. Григорьев
МЕЖПЛАНЕТНЫЕ И ОРБИТАЛЬНЫЕ КОСМИЧЕСКИЕ ПОЛЕТЫ. РАДИАЦИОННЫЙ РИСК ДЛЯ КОСМОНАВТОВ
Радиобиологическое
РОССИЙСКАЯ АКАДЕМИЯ НАУК ФЕДЕРАЛЬНОЕ МЕДИКОГОСУДАРСТВЕННЫЙ БИОЛОГИЧЕСКОЕ АГЕНТСТВО
НАУЧНЫЙ ЦЕНТР РФ - ИНСТИТУТ ФГУ "ФЕДЕРАЛЬНЫЙ МЕДИЦИНСКИЙ МЕДИКО-БИОЛОГИЧЕСКИХ БИОФИЗИЧЕСКИЙ ЦЕНТР
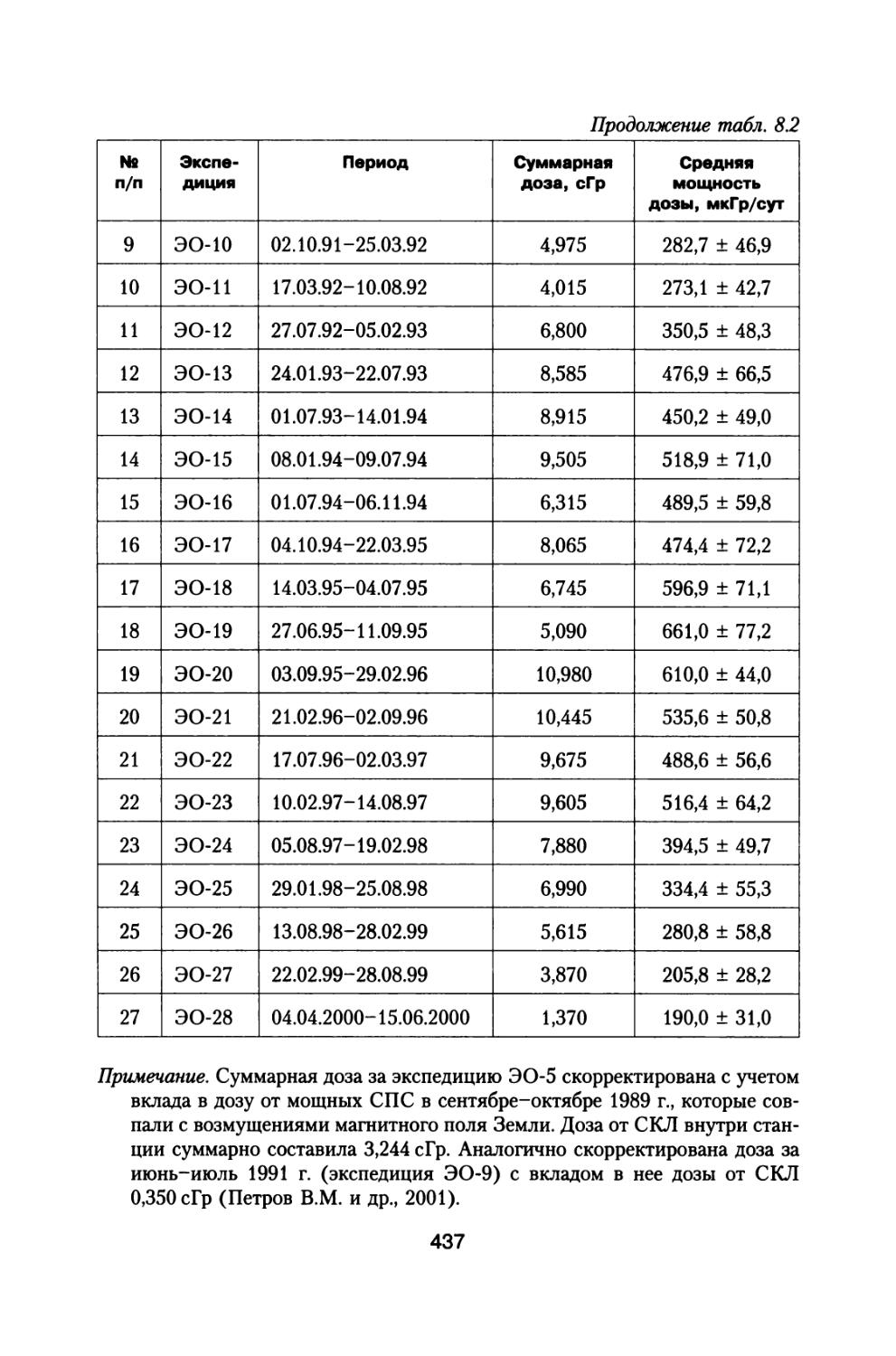
ПРОБЛЕМ ИМЕНИ А.И. БУРНАЗЯНА"
А. В. Шафиркин, Ю.Г. Григорьев
МЕЖПЛАНЕТНЫЕ И ОРБИТАЛЬНЫЕ КОСМИЧЕСКИЕ ПОЛЕТЫ. РАДИАЦИОННЫЙ РИСК ДЛЯ КОСМОНАВТОВ
Радиобиологическое обоснование
ЭКОНОМИКА
www.economizdat.ru
УДК 629.783:52-7
ББК 39.6+22.63
ШЗО
Шафиркин А.В.
ШЗО Межпланетные и орбитальные космические полеты. Радиационный риск для космонавтов (радиобиологическое обоснование) / А.В. Шафиркин, Ю.Г. Григорьев; Государственный научный центр Российской Федерации — Институт медико-биологических проблем РАН; ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна». — М.: ЗАО «Издательство «Экономика», 2009. — 639 с.
ISBN 978-5-282-02948-2
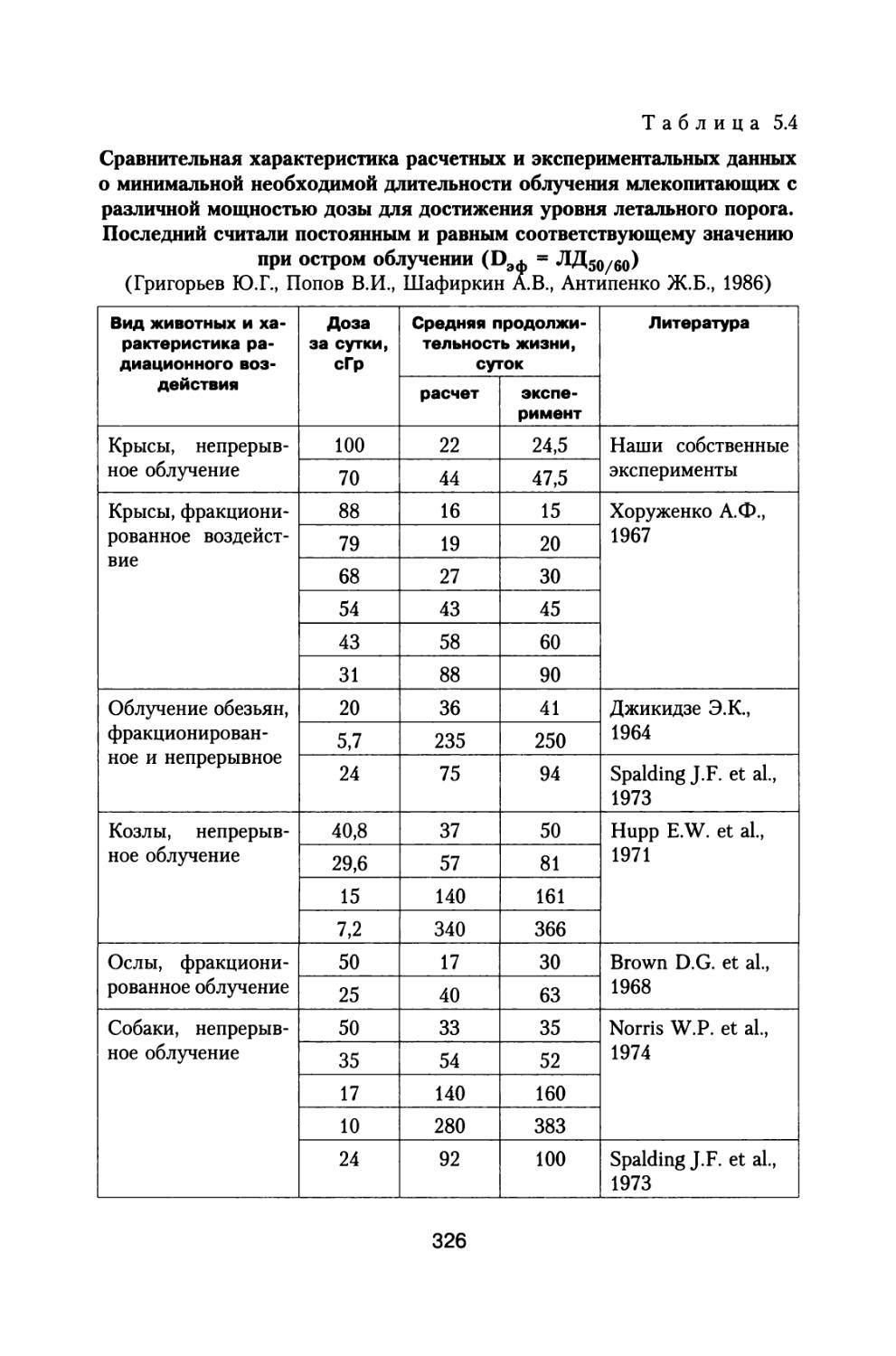
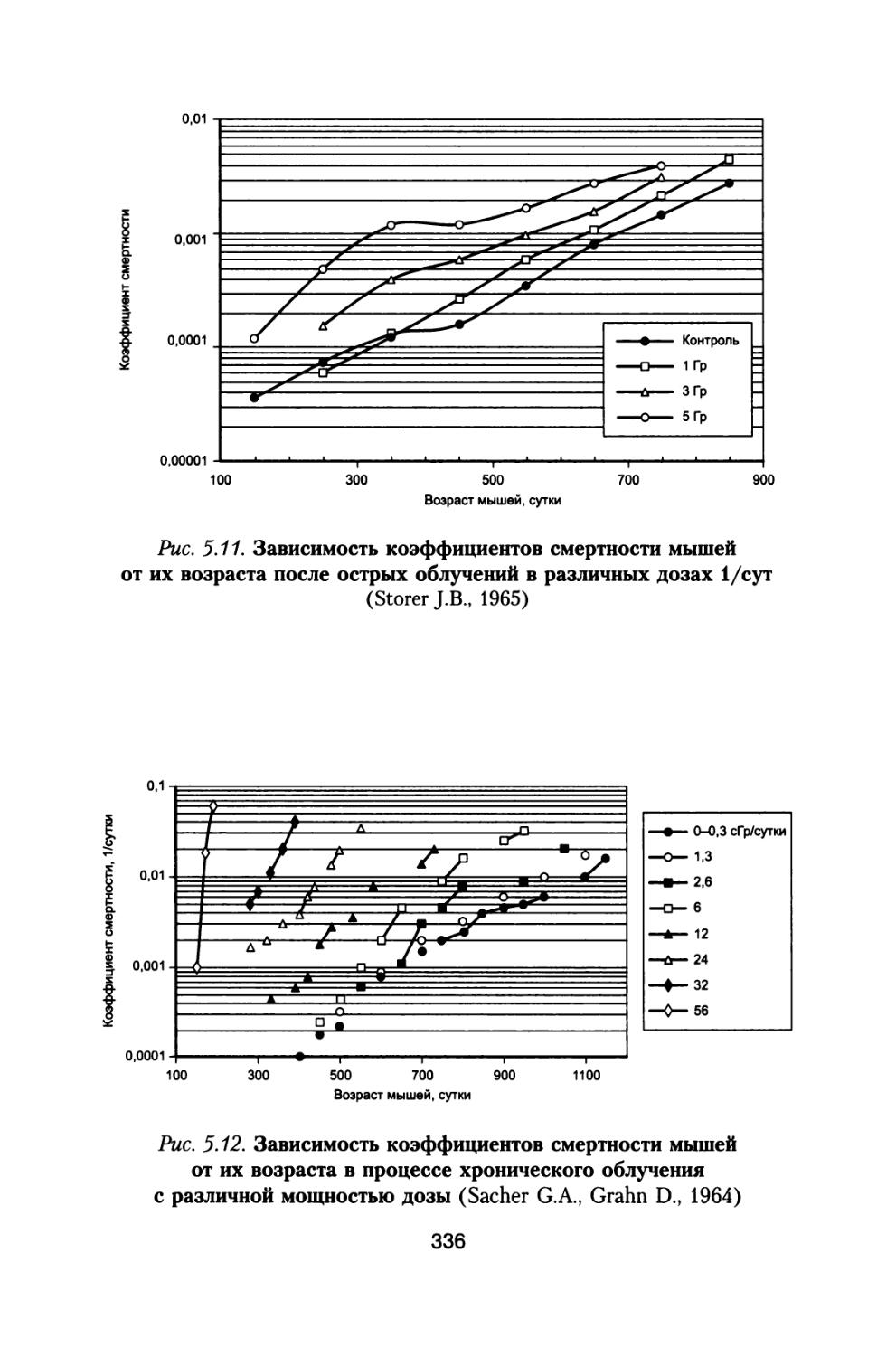
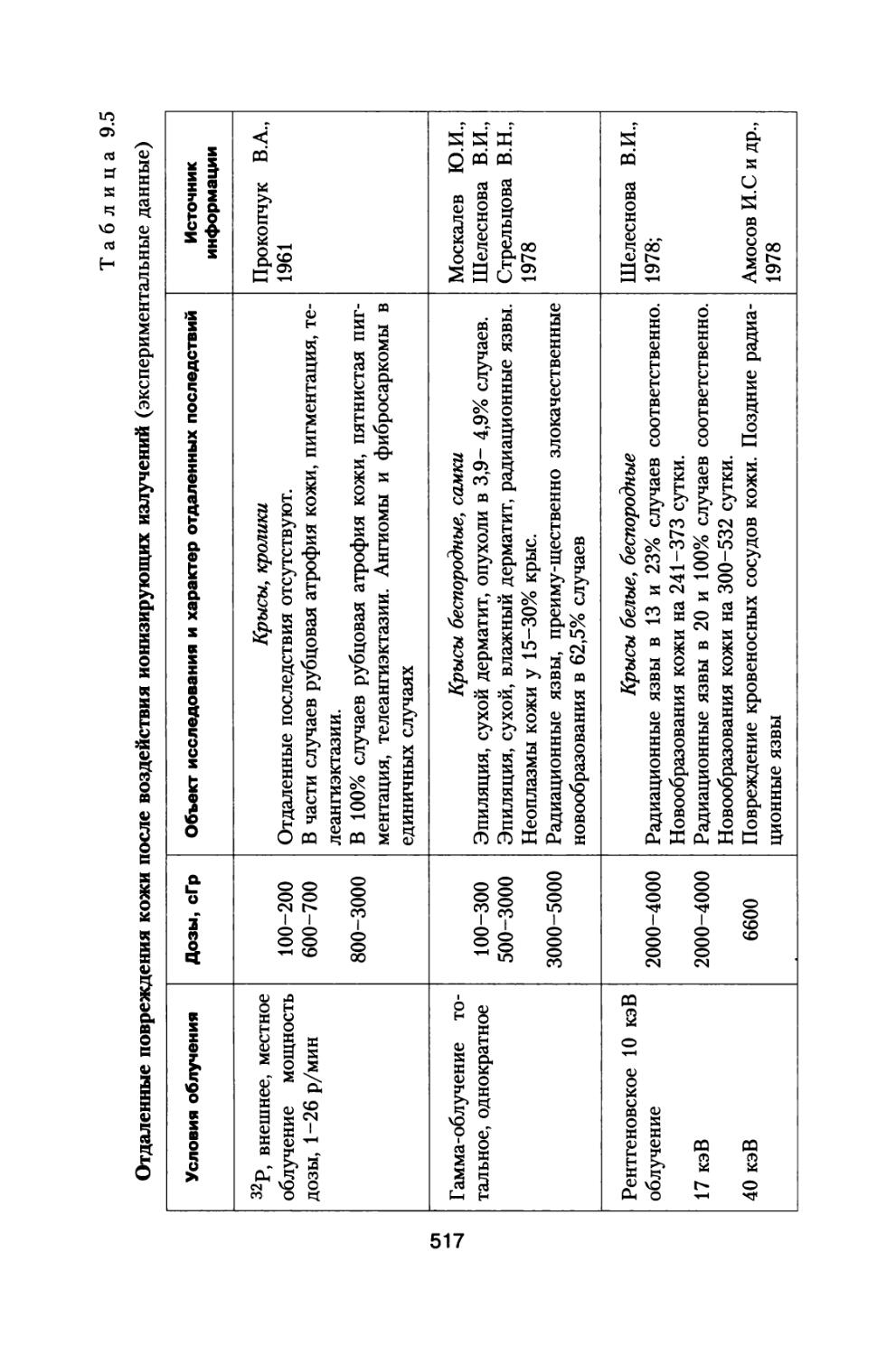
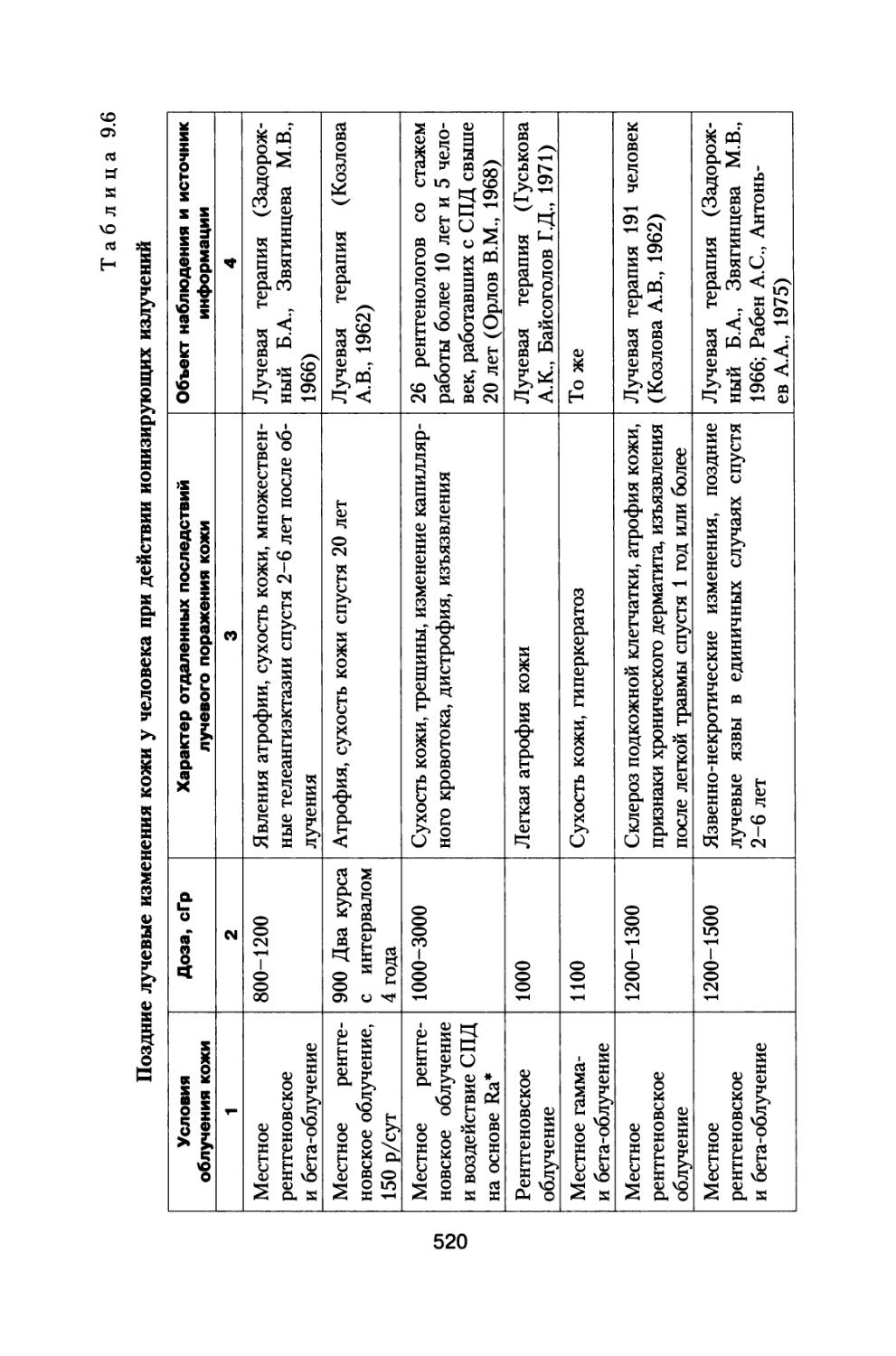
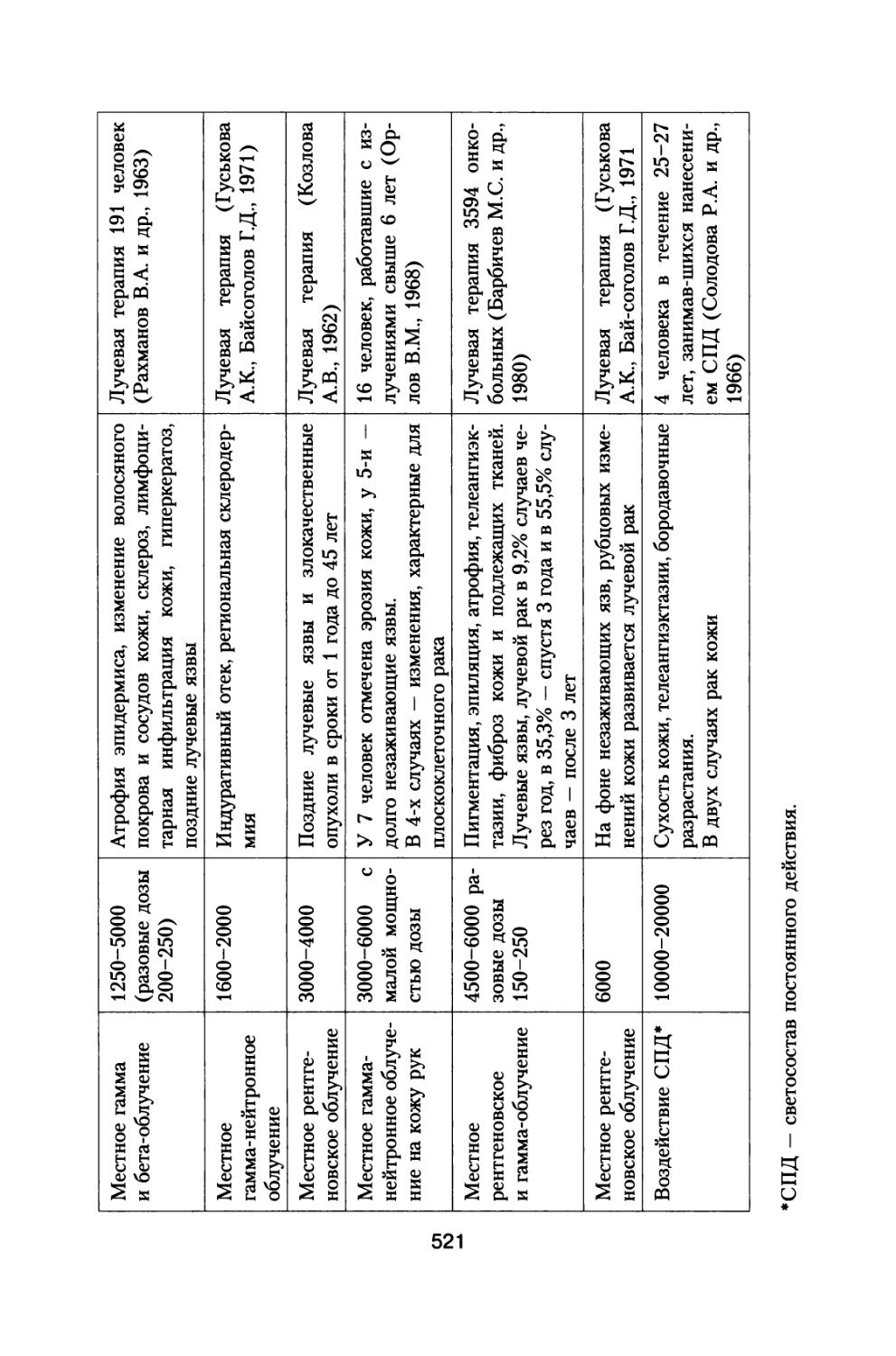
Книга освещает достаточно широкий круг материалов, касающихся источников космических излучений, воздействующих на космонавтов при осуществлении межпланетных и орбитальных космических полетов, величинах дозовых нагрузок, реакциях отдельных систем и целостного организма животных и человека, а также изменении его устойчивости при сложном характере радиационного воздействия в условиях космического пространства.
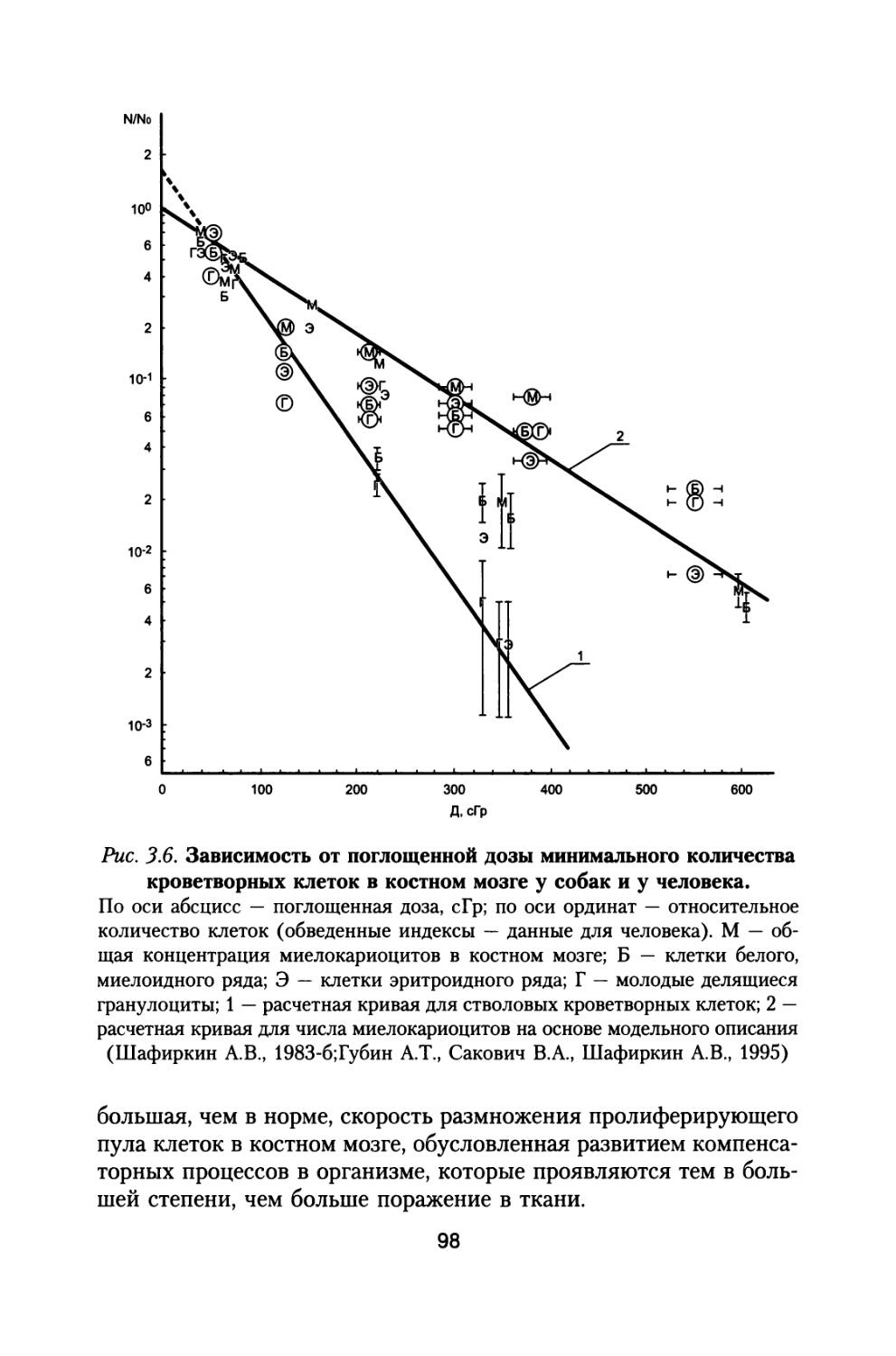
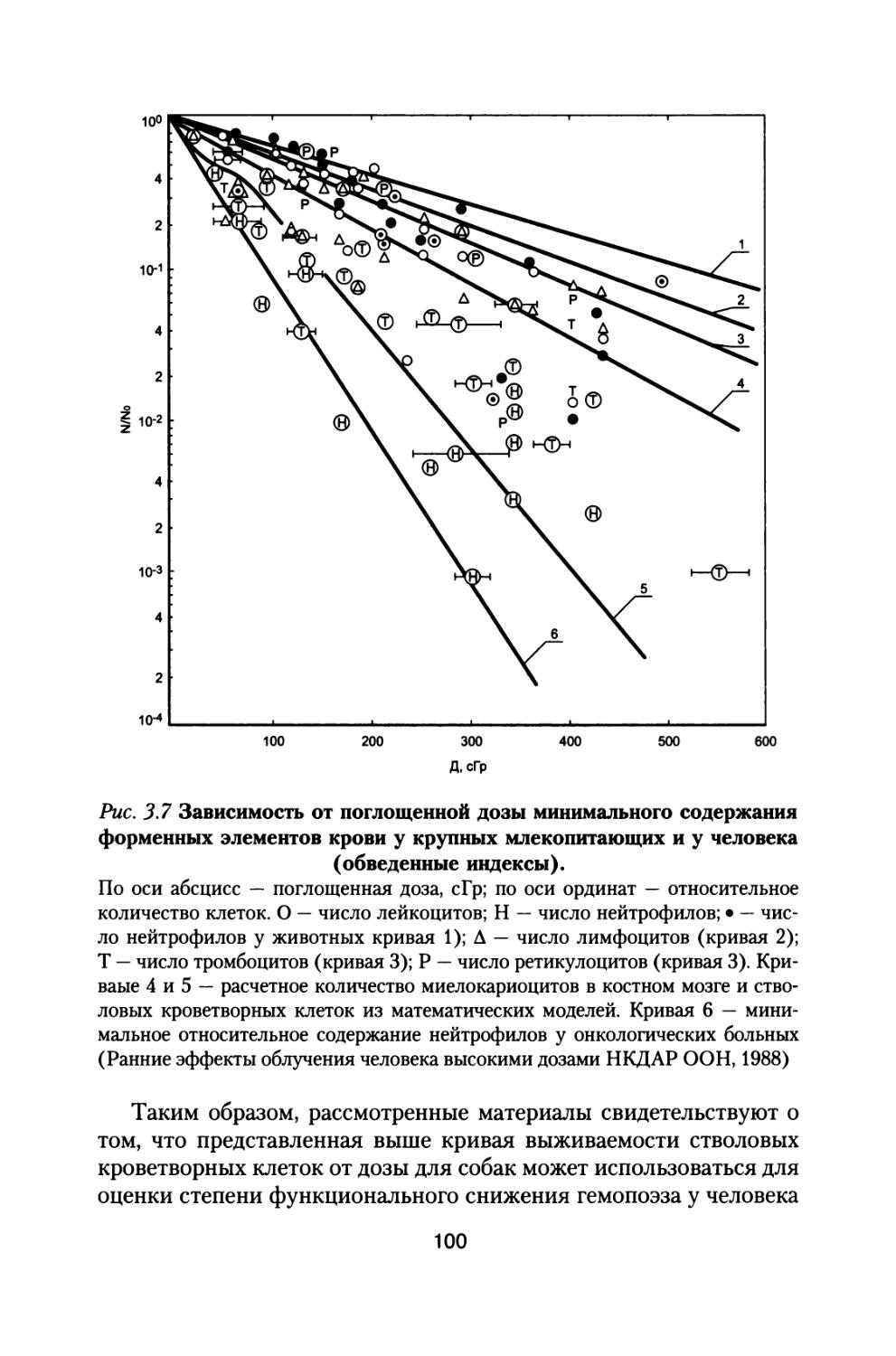
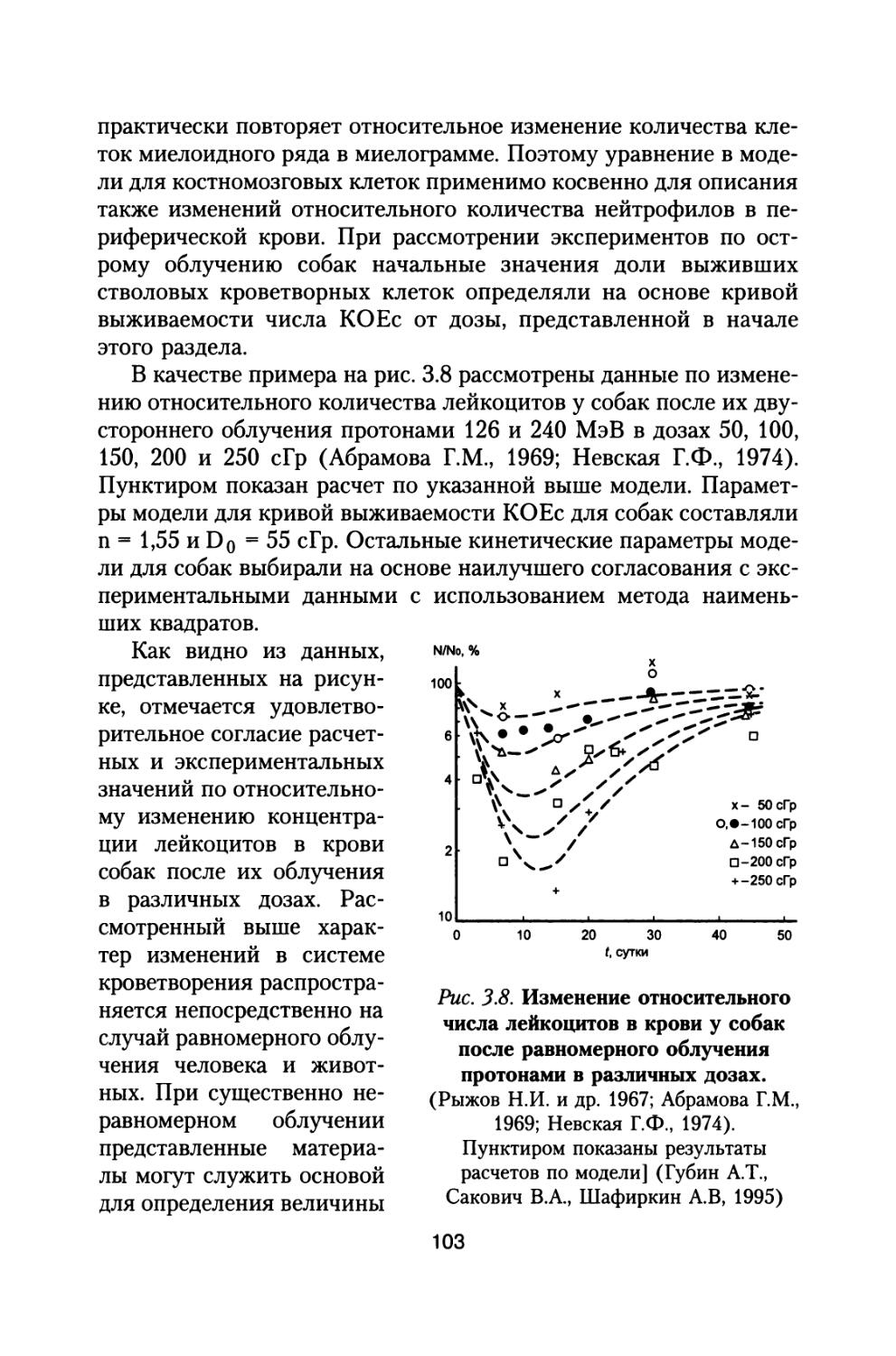
Приведены результаты 14-летнего эксперимента на большой партии собак с моделированием величин дозовых нагрузок и характера распределения дозы во времени, которые будут воздействовать на космонавтов при полете к Марсу. Рассмотрены модели формирования радиационного поражения в системе кроветворения и на уровне организма при протяженных облучениях с различной мощностью дозы, а также модель радиационной скорости смертности млекопитающих, описывающая ускоренное старение и изменение возрастных коэффициентов смертности в зависимости от дозы и мощности дозы радиационного воздействия.
В книге представлены алгоритмы и результаты расчетов радиационного риска в процессе межпланетных и орбитальных полетов, в течение всей жизни космонавтов, а также данные о возможном сокращении предстоящей продолжительности жизни. Предложены новые подходы к нормированию радиационных воздействий и обоснованы новые более низкие допустимые дозы на космонавтов как в процессе полетов, так и за всю профессиональную деятельность.
Книга может представлять большой интерес для преподавателей вузов, аспирантов, специализирующихся в области биофизики, медицинской физики, научных сотрудников НИИ и КБ космического, авиационного и оборонного профилей, которые интересуются вопросами биофизики, радиобиологии, космической радиобиологии и хотели бы иметь представление о радиационной опасности для космонавтов в процессе проведения межпланетных и орбитальных космических полетов. Она может быть полезной для гигиенистов, экологов, занимающихся вопросами сохранения профессионального здоровья, работников опасных профессий, деятельность которых связана с постоянным воздействием экстремальных факторов, а также для социологов и журналистов для правильного понимания и освещения в печати реальных рисков действующих неблагоприятных экологических и социальных факторов.
УДК 629.783:52-7
ББК 39.6+22.63
© Шафиркин А.В., Григорьев Ю.Г., 2009
© Государственный научный центр Российской Федерации — Институт медико-биологических проблем РАН, 2009
© ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна», 2009
ISBN 978-5-282-02948-2 © ЗАО «Издательство «Экономика», 2009
RUSSIAN ACADEMY OF SCIENCE BURNASYAN FEDERAL MEDICAL STATE CENTRE OF SCIENCE BIOPHYSICAL CENTER
OF RUSSIAN FEDERATION - INSTITUTE OF FEDERAL MEDICAL OF MEDICAL-BIOLOGICAL PROBLEMS BIOLOGICAL AGENCY
A.V. Shafirkin, Y.G. Grigoryev
INTERPLANETARY AND ORBITAL SPACE FLIGHTS. THE RADIATION RISK TO ASTRONAUTS
Radiobiological Basis
ECONOMICA
www.economizdat.ru
Interplanetary and Orbital Space Flights: The Radiation Risk to Astronauts (Radiological Basis) / A.V. Shafirkin, Y.G. Grigoryev. — Publishing house «Economica», Moscow, 2009. — 639 hh.
The book deals with a wide range of issues relating to sources of cosmic radiation that affect astronauts during interplanetary and orbital space flights: the values of absorbed doses, effects on individual systems and whole bodies of animals and humans, as well as changes in the resistance of astronauts in the complex condition of radiation exposure in outer space, the prognosis potential adverse effects of the health of astronauts after long space flights.
For the first time ever, results are introduced of a unique, 14-year biological experiment on 260 dogs, modelling the impact of space radiation on the crew of a space shuttle flight to Mars. It details observations made on the animals throughout the course of the dogs’ lives, both during and six years after radiation exposure. It includes data on dose dependence, threshold levels of radiation causing adverse health effects, as well as on the nature of radiation reactions as they develop in different organs and body systems chronically exposed to larger doses. This multi-year experiment was conducted by scientists of the State Research Center Institute of Biomedical Problems (Russian Academy of Sciences) with the active participation of the Institute of Biophysics (now Bumasyan Federal Medical Biophysical Center of Federal Medical Biological Agency).
The book presents models of the development of radiation injury in the blood and in the whole body given extensive exposure to different dose rates, as well as a model for the rapidness of radiation death of mammals. These models describe accelerated aging and changes in age of mortality, depending on the dose and dose rate of radiation exposure. The models can help predict potential adverse effects on the health of astronauts, and will be useful in developing appropriate standards.
The book provides algorithms and a calculation of radiation risk during interplanetary and orbital missions, as well the lifespan of the astronauts, and includes data on potential reduction in longevity. It offers new approaches to regulating radiation exposures, and justifies the need for a lower permissible dose for cosmonauts and others in the profession who are involved in long-term orbital and interplanetary space flight. The authors of this monograph have many years of work experience related to the problem of radiation safety in space flight, as well as in the field of radiobiology of ionizing radiation.
Shafirkin A.V. — Doctor of Biological Sciences, a leading researcher of the State Research Center Institute of Biomedical Problems (Russian Academy of Sciences), and a specialist in the field of biophysics, radiobiology, space biology and medicine. From 1994 to 2002 Dr. Shafirkin was the supervisor involved in establishing a rationale for limits on the impact of ionizing radiation on astronauts during (in the implementation of) long-term orbital and interplanetary flights. He is a member of the Russian National Committee on Non-Ionizing Radiation Protection, and the author of 174 scientific works.
Grigoryev Y.G. — Doctor of Medical Sciences, Professor, and State Prize Laureate. During his 10 years as head of the Radiation Protection Service, Dr. Grigoryev led the research on space radiobiology, and was directly involved in ensuring the radiation safety of space flight. Within 5 years he was chairman of the Medicine and Biology sections of COSPAR (Committee on Space Researh). He is a member of the Russian Scientific Commission for Protection against Ionizing Radiation, chairman of the Russian National Committee on Non-Ionizing Radiation Protection, and the author of 15 books on radiobiology, space radiobiology and radiation protection in manned space flight.
Светлой памяти Сергея Павловича Королева, Норайра Мартиросовича Сисакяна, Василия Васильевича Парина и Аветика Игнатьевича Бурназяна — выдающихся деятелей нашей страны, руководителей научных и технических проектов, беззаветно служивших процветанию нашей Родины, своим трудом способствующих обеспечению ее безопасности от ядерной угрозы, а также завоеванию передовых позиций нашей страны в освоении космического пространства, ПОСВЯЩАЕТСЯ.
Они мечтали и всецело приближали то время, когда длительные орбитальные полеты животных и человека стали повседневной реальностью, и уже в 1960-х годах работали над проектами дальних пилотируемых полетов к Марсу и к другим планетам Солнечной системы.
Сергей Павлович Королев
Выдающийся конструктор и ученый, дважды Герой Социалистического Труда, лауреат Ленинской премии, академик Академии наук СССР, создатель отечественного стратегического оружия средней и межконтинентальной дальности, основоположник практической космонавтики.
Он по праву является отцом отечественной ракетно-космической техники, обеспечившей стратегический паритет и сделавшей наше государство передовой ракетно-космической державой.
Норайр Мартиросович Сисакян Выдающийся ученый биохимик, один из основоположников космической биологии, лауреат Государственных премий СССР, академик Академии наук СССР.
В 1964 г. он избран Президентом XIII сессии Генеральной конференции ЮНЕСКО.
Н.М. Сисакян являлся действительным членом и вице-президентом Международной академии астронавтики. При его участии велись работы по отбору и подготовке первой группы космонавтов, разработке мер безопасности в полете и при возвращении на Землю.
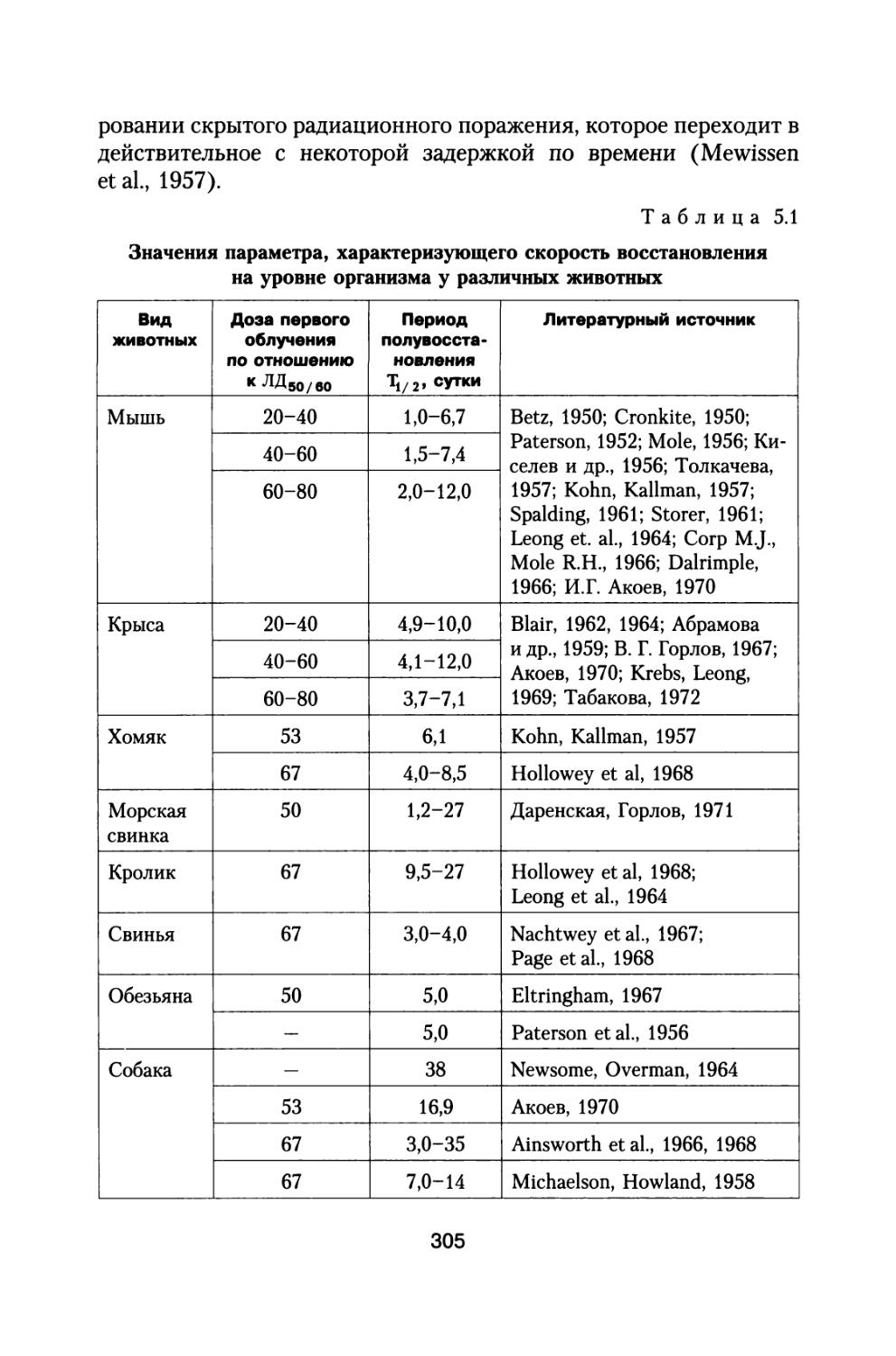
5
Василий Васильевич Парин
Один из выдающихся ученых в области физиологии и патологии кровообращения, действительный член АМН СССР и фактический ее организатор, вице-президент АМН в 1963-1966 гг., Академик Академии наук СССР.
В. В. Парин один из основателей космической физиологии, а также авиакосмической биологии и медицины.
Будучи директором Института медико-биологических проблем (1965-1968), он был одним из руководителей научных медицинских программ, осуществлявшихся на космических кораблях «Восток» и «Союз» и ряде биоспутников.
Аветик Игнатьевич Бурназян
Герой Социалистического Труда, лауреат Ленинской и Государственных премий СССР, кавалер шести орденов Ленина, генерал-лейтенант медицинской службы, заместитель министра здравоохранения СССР, выдающийся организатор здравоохранения во время ВОВ, при работах по атомному проекту с Курчатовым И.В., а с началом космической эры — с Королевым С.П.
По его инициативе были созданы Институт биофизики М3 СССР, Институт медико-биологических проблем М3 СССР и др., решающие вопросы радиационной безопасности в атомной промышленности и медицинского сопровождения пилотируемых космических полетов.
ПРЕДИСЛОВИЕ
После первых орбитальных космических полетов в конструкторском бюро С.П. Королева начинают осуществляться технические проекты пилотируемых полетов на Луну и на Марс. В 1963 г. по предложению Генерального конструктора С.П. Королева и при поддержке академиков А.В. Лебединского и В.В. Парина был образован Институт медико-биологических проблем М3 СССР (ИМБП М3 СССР) на основе Института биофизики М3 СССР и Института авиационной и космической медицины МО СССР, перед которым была поставлена задача медицинского обеспечения длительных космических полетов.
В структуре ИМБП в феврале 1964 г. создается специальное крупное научное подразделение (сектор № 3), возглавляемое доктором медицинских наук Григорьевым Юрием Григорьевичем, физический отдел которого возглавил кандидат физико-математических наук Ковалев Евгений Евгеньевич для решения вопросов радиационной опасности и обеспечения радиационной безопасности длительных полетов. Возникла необходимость создания и была создана Служба радиационной безопасности, которая осуществляет до настоящего времени оперативное обеспечение радиационной безопасности всех орбитальных пилотируемых космических экспедиций.
Совместно с НИИЯФ МГУ, Институтом космических исследований и др. был осуществлен целый ряд физических исследований в космосе на шарах-зондах с целью изучения источников радиационной опасности и спектров частиц на трассах орбитальных и межпланетных полетов. Были выполнены также экспериментальные работы на ускорителях протонов и многозарядных ионов на базе Объединенного института ядерных исследований (ОИЯИ) в г. Дубне по изучению прохождения первичного и вторичных излучений через различные защитные материалы. Параллельно для оценки радиационной опасности и биологической эффективности космических излучений был выполнен на ускорителях комплекс экспериментальных исследований на животных и биологических системах по их облучению в различных дозах.
Была осуществлена также большая кооперация научных исследований с Институтом биофизики Минздрава СССР, Институтом биофизики академии наук СССР в г. Пущино, Институтом авиационной и космической медицины Министерства обороны СССР, Институтом
7
медицинской радиологии АМН СССР в г. Обнинске, Центральным научно-исследовательским рентгенорадиологическим институтом в Санкт-Петербурге по изучению влияния различных характеристик радиационного воздействия и присущих космическому полету факторов полета на радиобиологический эффект.
Уже в 1964 г. была поставлена задача научного обоснования необходимой компоновки и требуемых толщин защиты космического марсианского корабля (МК), а также оценок величин радиационного риска для экипажа, который будет осуществлять полет к Марсу. В СССР был начат широкий спектр предварительных исследований по этим программам. Перед научным коллективом ИМБП М3 СССР академиком С.П. Королевым была поставлена научно-практическая задача — провести многолетний эксперимент по облучению животных во временнбм режиме и в дозах, моделирующих радиационное воздействие на космонавтов при полете на Марс. Целью этого эксперимента должно было быть получение необходимых данных к обоснованию допустимых уровней радиационного воздействия на космонавтов при осуществлении этого длительного межпланетного полета. Это предложение было активно поддержано заместителем министра М3 СССР А.И. Бурназяном и со стороны АН СССР академиком Н.М. Сисакяном.
Масштабный, не имеющий аналогов в мире, эксперимент по облучению в течение 3-х и 6-ти лет большой партии собак был начат в 1996 г. и продолжался в течение 14 лет. Научная программа этого эксперимента была одобрена академиком В.В. Лариным. В эксперименте принимали участие коллективы нескольких институтов СССР: Института медико-биологических проблем Минздрава СССР, Института биофизики Минздрава СССР (ныне ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна») в Москве, Центрального научно-исследовательского рентгенорадиологического института в Санкт-Петербурге, а также ученые биологи и медики Польши, ГДР, Чехословакии, Венгрии и Болгарии.
Работа координировалась специально созданным Научным Советом, в который входили ведущие радиобиологи страны: С.Н. Александров, Ю.Г. Григорьев, А.К. Гуськова, Г.Д. Байсоголов, Ю.И. Москалев, В.В. Шиходыров, Е.Д. Гольдберг, Ю.К. Кудрицкий, Н.Г. Дарен-ская, Л.С. Черкасова, Е.А. Савина, В.И. Яковлева и др. Программа эксперимента подробно обсуждалась на научных совещаниях. Это был уникальный эксперимент, результаты которого освещались в журнале Советский Союз и были представлены на Выставке достижений народного хозяйства в павильоне «Космос».
Результаты исследований были изложены в монографии Григорьева Ю.Г. с соавторами («Соматические эффекты хронического гам
8
ма-облучения», Энергоатомиздат, 1986). Она вышла ограниченным тиражом 860 экземпляров, пользовалась большим спросом и стала поистине бестселлером из-за содержащегося в ней анализа экспериментальных материалов и обобщений результатов радиобиологических исследований на животных, проводившихся также в других лабораториях в СССР и в мире.
Фактически эта книга впервые давала четкие представления о степени радиационной опасности длительного воздействия малых ежедневных доз облучения, имитирующих воздействие галактических космических лучей и относительно острых облучений, моделирующих возможную лучевую нагрузку от солнечных протонных событий. Она предвосхищала и прокладывала дорогу к Марсу и свидетельствовала, что радиация может быть одним из мощных факторов, лимитирующих полеты человека к этой далекой планете в условиях недостаточности защиты.
В 1986 г., в связи с аварией на Чернобыльской АЭС, эта книга обрела новое рождение и новый спрос на результаты исследований, представленные в этой монографии. В ней четко изложены результаты планомерно поставленного хронического эксперимента, которые отвечали на интересующий всех вопрос: что же это такое «малые дозы облучения» и к каким отдаленным последствиям они могут привести в отношении ухудшения здоровья человека. Мы приветствуем то, что эти данные будут переизданы в этой монографии, так как эти эксперименты повторить невозможно, они очень сложны, дорогостоящие и, по-видимому, не смогут быть повторены в мире. Расширенное переиздание этих уникальных данных сделано с учетом новых накопленных данных радиобиологических экспериментов, результатов санитарно-гигиенических и эпидемиологических исследований.
В изложенной ниже монографии рассмотрены в обобщенном виде результаты всех материалов «Хронического эксперимента» по изменению состояния различных систем организма собак при длительном сочетанном облучении, моделирующем характер радиационного воздействия на космонавтов при полете на Марс, а также ряда других хронических экспериментов по облучению мелких лабораторных животных в широком диапазоне доз и мощностей доз.
В ней представлены оригинальные модели формирования радиационного поражения и восстановления организма при хронических и сочетанных радиационных воздействиях, модель радиационной скорости смертности млекопитающих, определяющая закономерное снижение компенсаторных резервов организма и ускоренное старение, а также увеличение возрастных коэффициентов смертности животных
9
в результате радиационных воздействий. На основе этих моделей представлены алгоритмы и проведены расчеты радиационного риска для космонавтов в процессе проведения длительных орбитальных и межпланетных полетов за различными толщинами защиты космического аппарата и впервые приведены расчеты суммарного радиационного риска в течение всей жизни космонавтов в результате осуществления этих полетов.
В книге проведено серьезное обобщение также литературных материалов по неблагоприятным ближайшим и отдаленным эффектам воздействия ионизирующих излучений в различных дозах. Значительное внимание обращено на новые критерии оценки радиационной опасности для космонавтов при проведении длительных космических полетов и дозовые функционалы, определяющие эту опасность, как в процессе космических полетов, так и в отдаленном периоде после их завершения.
В монографии дан ретроспективный анализ нормативных документов по обеспечению радиационной безопасности космонавтов, разрабатываемых в СССР и России с участием авторов монографии, а также аналогичных документов в США, Японии, Канаде. В ней проведено подробное обоснование критериев и положений по радиационной безопасности экипажей пилотируемых орбитальных станций и представлены пределы среднетканевых доз и доз на отдельные критические органы космонавтов в зависимости от длительности орбитальных полетов, а также доз за весь период профессиональной деятельности космонавтов. Последний нормативный документ — Методические указания МУ 2.6.1.44-03-2004 «Ограничение облучения космонавтов при околоземных космических полетах» — были разработаны большим коллективом исследователей при активном участии авторов монографии.
В книге приводятся материалы о величинах суммарных эквивалентных доз за различными толщинами космического аппарата и предельных значений суммарного радиационного риска для космонавтов при осуществлении различных сценариев полета к Марсу с использованием жидкостных реактивных двигателей и ядерно-энер-гетических двигательных установок при длительностях полета от 600 до 720 суток. Кроме того, рассмотрен вариант более длительного полета к Марсу в течение 2-3-х лет с использованием более безопасных и экономичных электрореактивных двигателей малой тяги. При этом, кроме оценок величин доз от ГКЛ и СКЛ, рассмотрены также дополнительно дозы от радиационных поясов Земли и вклад этого компонента в величину суммарного радиационного риска. В этой работе представлены оптимальные толщины защиты космического корабля
10
и предельно допустимые значения доз для космонавтов при полете к Марсу.
Книга освещает достаточно широкий круг материалов, касающихся источников космических излучений, воздействующих на космонавтов при осуществлении межпланетных и орбитальных космических полетов, величинах дозовых нагрузок, реакциях отдельных систем и целостного организма животных и человека при облучении в различных дозах, а также изменении его устойчивости при сложном характере радиационного воздействия в условиях космического пространства.
В заключении считаем целесообразным отметить личное участие авторов в постановке и проведении экспериментов по оценке биологической эффективности космических излучений, хронических экспериментов на различных видах животных с целью изучения влияния мощности дозы и временнбго распределения дозы на радиобиологические эффекты. Они были участниками исследований по изучению эффективности локальной защиты и комбинированного действия радиации и других факторов космического полета, включая эксперименты на искусственных спутниках Земли, непосредственно участвовали в разработке нормативных документов и обеспечении радиационной безопасности пилотируемых космических полетов.
Вице-президент РАН, академик РАМН А.И. Григорьев
Член-корреспондент РАН, академик РАМН
И.Б. Ушаков
ВВЕДЕНИЕ
Наиболее широкий масштаб радиобиологических исследований был начат в СССР и в мире в 40-60-е годы прошлого столетия после испытания в июле 1946 г. атомной бомбы в США (штат Нью-Мексико) и атомных бомбардировок Хиросимы и Нагасаки, проведения разработок и испытаний термоядерного оружия, широкого развития атомной энергетики. Он был обусловлен необходимостью обеспечения здоровья персонала первых предприятий атомной промышленности и решения вопросов радиационной безопасности населения в связи с гонкой ядерных вооружений, наземными и воздушными испытаниями ядерного оружия сравнительно большой мощности.
Поэтому в 40-50-е годы в США, Европе и на других континентах начали создаваться крупные исследовательские и клинические центры. Радиобиологические исследования проводились в сотнях оснащенных по последнему слову техники лабораториях США, Великобритании, Германии, Франции, Голландии, Швеции, Японии и Канады. В Советском Союзе крупные исследовательские центры были созданы в Москве и Подмосковье, Ленинграде, Киеве, Минске, Свердловске, Челябинске, Новосибирске, Томске, Алма-Ате и др.
Руководители «Атомного проекта»: И.В. Курчатов, Ю.Б. Харитон, Я.Б. Зельдович, А.А. Бочвар осознавали, какую потенциальную опасность для персонала представляют атомные технологии, хотя в то время знания о действии радиации на человека были крайне скудны. Организация работ по созданию научных центров и координации работ по исследованию биологического действия ионизирующих излучений в различных дозах на животных и человека была поручена Аветик Игнатьевичу Бурназяну — генерал-лейтенанту медицинской службы, который во время Великой Отечественной войны занимал ряд руководящих должностей в медицинских подразделениях Красной Армии: был начальником санитарной службы Южного, Калининского, а в июне 1945 г. начальником Санитарного управления Дальневосточного фронта.
С 1946 г. он проводил большую работу по организации специальной лаборатории и способствовал началу проведения радиобиологических исследований в СССР с целью медико-биологического и санитарно-гигиенического обеспечения безопасности персонала, работающего по «Атомному проекту». В 1948 г. на базе этой лаборатории по инициативе А.И. Бурназяна был создан Институт биофизики
12
Минздрава СССР (в настоящее время ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна»).
Талант организатора, высокий профессионализм, масштабность мышления, необычайное чувство ответственности за сохранение здоровья работников, активная гражданская позиция позволили А.И. Бурназяну создать в кратчайшие сроки единую систему медико-санитарного обеспечения безопасности персонала атомной отрасли, включая кроме атомных станций, атомные ледоколы и подводные лодки. Эта система обеспечила единство функционирования центрального аппарата управления и подчиненных ему специализированных научно-исследовательских организаций, лечебных учреждений, службы государственного санитарно-эпидемиологического надзора.
Основные исследования по действию в широком диапазоне доз и мощностей доз от источников ионизирующих излучений на различные виды животных, анализ мировых данных об аварийных случаях облучения людей и последствиях атомных бомбардировок, материалов клинических наблюдений за здоровьем людей, подвергавшихся лучевому воздействию в связи с онкологическими заболеваниями, были проведены сотрудниками Института биофизики Минздрава СССР и Института авиационной и космической медицины МО СССР. Следует отметить выдающуюся роль руководителей подразделений в этих институтах: академиков АНСССР Франка Г.М., Ливанова М.Н., Лебединского А.В., Ильина Л.А,. профессоров Горизонто-ва П.Д., Домшлака М.П., Краевского Н.А., Москалева Ю.И., Гуськовой А.К., Даренской Н.Г., а также Саксонова П.П., Антипова В.В., Давыдова Б.И., Жеребченко П.Г., которые организовали широкий фронт радиобиологических исследований в этих институтах и за короткий исторический период ими проведено широкое обобщение экспериментальных данных, полученных в мировых исследовательских центрах, в других научных подразделениях страны, клинических материалов, а также результатов исследований, возглавляемых ими коллективов.
Создавая ракетно-ядерный щит и занимаясь совершенствованием боевых баллистических ракет, два ведущих конструктора нашей страны Сергей Павлович Королев и Валентин Петрович Глушко постоянно стремились к большему — к покорению космического пространства и созданию условий для космических полетов человека. С этой целью Сергей Павлович еще в 1949 г. совместно с учеными АН СССР начал исследования с использованием модификаций ракеты Р-1А путем их регулярных вертикальных запусков на высоты до 100 км, а затем с помощью более мощных ракет Р-2 и Р-5 на высоты 200 и 500 км соответственно.
13
50-60-е годы прошлого столетия являются фактически началом космической эры и периодом зарождения новых научных направлений — космической радиобиологии и космической физиологии, целью которых было обоснование возможности пребывания биологических объектов в условиях космического пространства, нормального функционирования основных физиологических систем животных и переносимости чрезвычайных воздействий: значительных перегрузок, невесомости, повышенных доз радиации и др.
Целью запусков ракет на высоты от 100 до 500 км — были изучение параметров ближнего космического пространства, солнечных и галактических излучений, магнитного поля Земли, исследование поведения высокоразвитых животных в космических условиях (невесомости, перегрузок, больших вибраций и акустических нагрузок), а также отработка средств жизнеобеспечения и возвращение животных на Землю из космоса. Было произведено около семи десятков таких пусков. Этим были заложены серьезные основы для штурма космоса человеком.
Академик-секретарь Отделения биологических наук АН СССР Н.М. Сисакян участвовал в разработке и широком обсуждении наиболее актуальных программ биологических исследований, способствовал реализации различных проектов и, в том числе, в области исследования космического пространства. Он являлся одним из основоположников космической биологии и радиобиологии, привлек к работам по космонавтике блистательных ученых — академиков В.А. Энгельгардта, А.И. Опарина и других ученых. В Академии наук он создал 14 лабораторий, Пущинский биологический центр АН СССР. К работам по космической биологии были подключены отраслевые институты, международный центр в Дубне. Норайр Мартиросович совместно с академиком АН СССР Василием Васильевичем Лариным участвовали в разработке программ по космической биологии и космической физиологии. Это были программы подготовки сначала животных, а потом человека к космическому полету, программы по отбору и обучению космонавтов, программы проведения биологических и физиологических экспериментальных исследований.
Биологические и физиологические эксперименты на ракетах и космических кораблях-спутниках (ККС) готовили и проводили, главным образом, специалисты Института авиационной и космической медицины МО СССР: В.И. Яздовский, О.Г. Газенко, А.М. Генин, А.А. Гюрджиан, Р.М. Баевский, В.С. Шашков, Е.М. Юганов и др. Экспериментальное изучение комбинированного действия нерадиационных факторов полета и ионизирующих излучений, а также решение
14
ряда вопросов радиационной безопасности первых пилотируемых космических полетов было начато и осуществлялось также в рамках подразделений этого института. Основоположниками исследований по космической радиобиологии являлись профессора П.П. Саксонов, В.В. Антипов и Б.И. Давыдов.
Кроме экспериментов на Земле по изучению комбинированного действия ионизирующих излучений и отдельных физических факторов, присущих космическому полету: ускорений, вибрации, шума, электромагнитных излучений, проводились также исследования влияния невесомости при размещении биообъектов на космических биоспутниках. Было подвергнуто воздействию большое число различных млекопитающих: собаки, морские свинки, белые крысы, мыши различных линий; растительные объекты (семена гороха, пшеницы, кукурузы, гречихи и др.); культуры различных тканей человека (фибробласты, костный мозг, легкие и др.); культуры кишечной палочки, фаги, ферменты, биопрепараты. Для дифференцировки эффектов космической радиации от эффектов невесомости, некоторые биообъекты размещались на борту космического корабля в свинцовых контейнерах.
В указанных выше радиобиологических лабораториях Института авиационной и космической медицины ВВС МО СССР, в подразделениях Института биофизики Минздрава СССР, возглавляемых академиком А.В. Лебединским, профессорами Ю.Г. Нефедовым, Г.Д. Го-ризонтовым, М.П. Домшлаком, Н.Г. Даренской, А.К. Гуськовой., Г.Д. Байсоголовым, Л.Б. Козновой, Р.В. Петровым, В.В. Шиходыро-вым, и лабораториях Института биофизики АН СССР под руководством академика АНСССР Г.М. Франка, члена-корреспондента АНСССР А.М. Кузина и профессора И.Г. Акоева проводился широкий спектр исследований по космической радиобиологии. Эти исследования проводились на клеточном, тканевом, органом и организменном уровне на большом числе экспериментальных животных.
В начале 1961 г. сотрудники лабораторий Н.И. Рыжова и И.Б. Кеирим-Маркуса Института биофизики Минздрава СССР начали проводить работы в Объединенном институте ядерных исследований в Дубне по изучению биологической эффективности воздействия на биологические объекты высокоэнергетичных протонов, позже и ионов высоких энергий. Там же проводили исследования и сотрудники Института авиационной и космической медицины МО СССР и сотрудники Института гигиены труда и профзаболеваний АМН СССР С.П. Ярмоненко, Г.А. Аврунина, Р.Д. Говорун и др. В создании условий для облучения биообъектов на пучках ускорителя активно помогал академик АН СССР В.П. Джелепов.
15
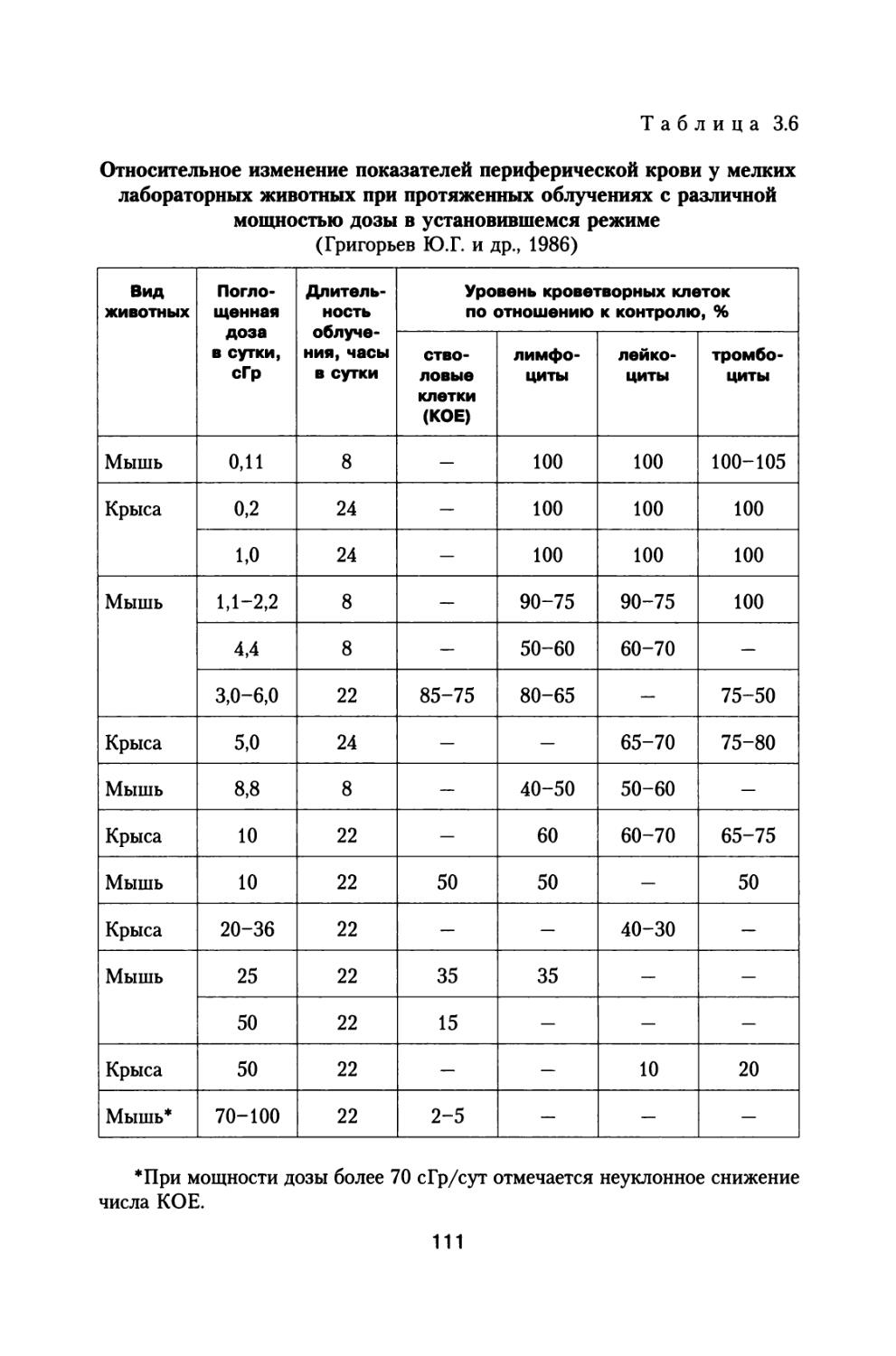
В указанных выше лабораториях Института биофизики Минздрава СССР и Института биофизики АН СССР, а также Института авиационной и космической медицины и радиобиологических лабораториях ряда других научных центров проводится широкий спектр работ по изучению влияния мощности дозы и характера распределения дозы во времени на радиобиологические эффекты. Подробно исследовались также вопросы эффективности локальной защиты и влияния глубинного перепада доз по телу на снижение степени поражения отдельных тканей и всего организма.
По инициативе С.П. Королева, при поддержке и активном участии А.И. Бурназяна, кроме Института Биофизики М3 СССР и Института авиационной и космической медицины МО СССР на их базе создается в 1963 г. Институт медико-биологических проблем М3 СССР, задачей которого ставится медицинское сопровождение длительных пилотируемых космических полетов. В этом институте успешно продолжались также исследования по изучению потоков и спектров космических излучений, по эффективности защиты космических аппаратов от этих источников, а также теневой защиты от нейтронного излучения реактора на борту космического аппарата. Продолжался широкий спектр исследований по радиобиологии и космической радиобиологии и физиологии.
Уже в период 1964-1968 гг. выходят сборники статей и монографии, обобщающие большой спектр радиобиологических исследований по космической радиобиологии (Сисакян Н.М., Антипов В.В., Саксонов П.П., Яздовский В.И., 1964; Антипов В.В., Добров Н.Н., Саксонов П.П., 1964; Парин В.В., Антипов В.В., Давыдов Б.И., 1965; Антипов В.В., Конопляников А.Г., Кудряшов Ю.Б., 1967; Биологическое действие протонов высоких энергий, 1967; Саксонов П.П., Антипов В.В., Давыдов Б.И., 1968; Даренская Н.Г., Кознова Л.Б., Акоев И.Г., Невская Г.Ф., 1968). Кроме того, представлен серьезный анализ пороговых уровней воздействия радиации на человека в отношении возможных ранних и отдаленных неблагоприятных эффектов у человека и проведено обоснование допустимых доз облучения космонавтов применительно к кратковременным орбитальным космическим полетам (Саксонов П.П., Антипов В.В., Давыдов Б.И., 1968; Давыдов Б.И., Антипов В.В., Саксонов П.П., 1968).
На международной конференции в Афинах советскими учеными представлен доклад с обоснованием допустимых значений доз, при которых обеспечивается нормальная работоспособность космонавтов при кратковременных космических полетах (длительностью до 30 суток). Приведены значения допустимой дозы, дозы оправданного риска и критической дозы, которая уже должна служить основанием для
16
досрочного прекращения полета (Григорьев Ю.Г., Гуськова А.К., Домшлак М.П. и др., 1965).
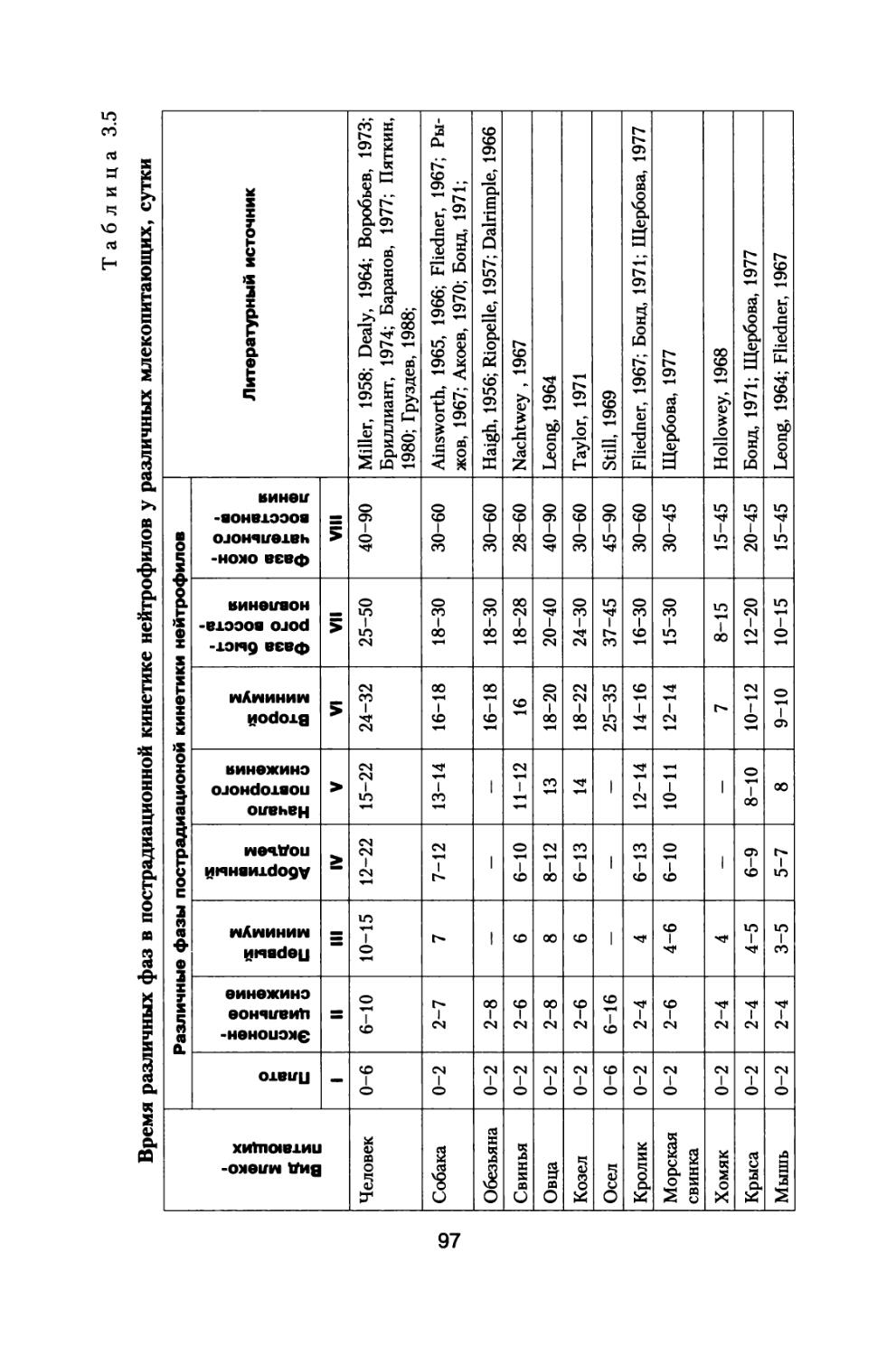
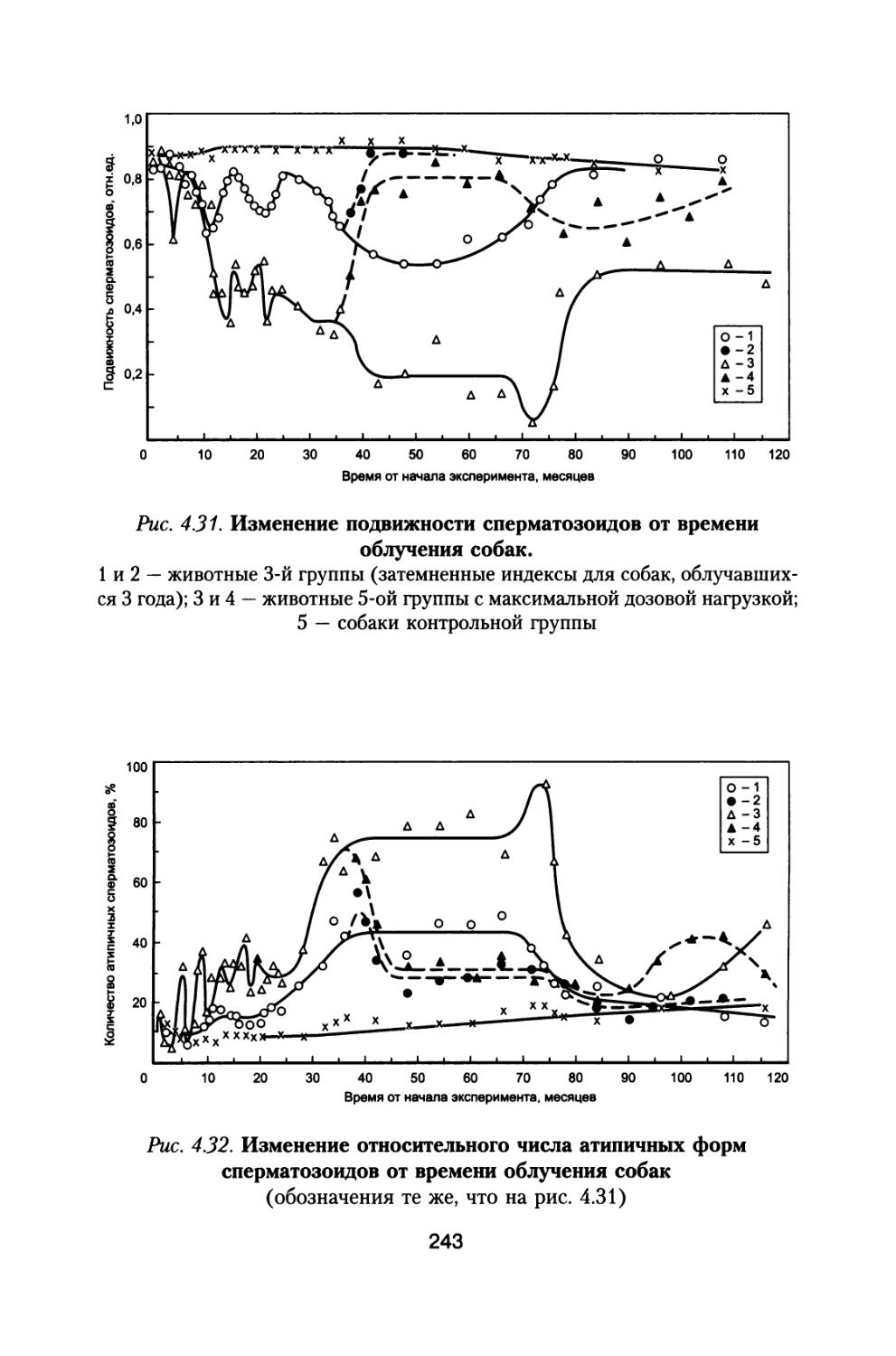
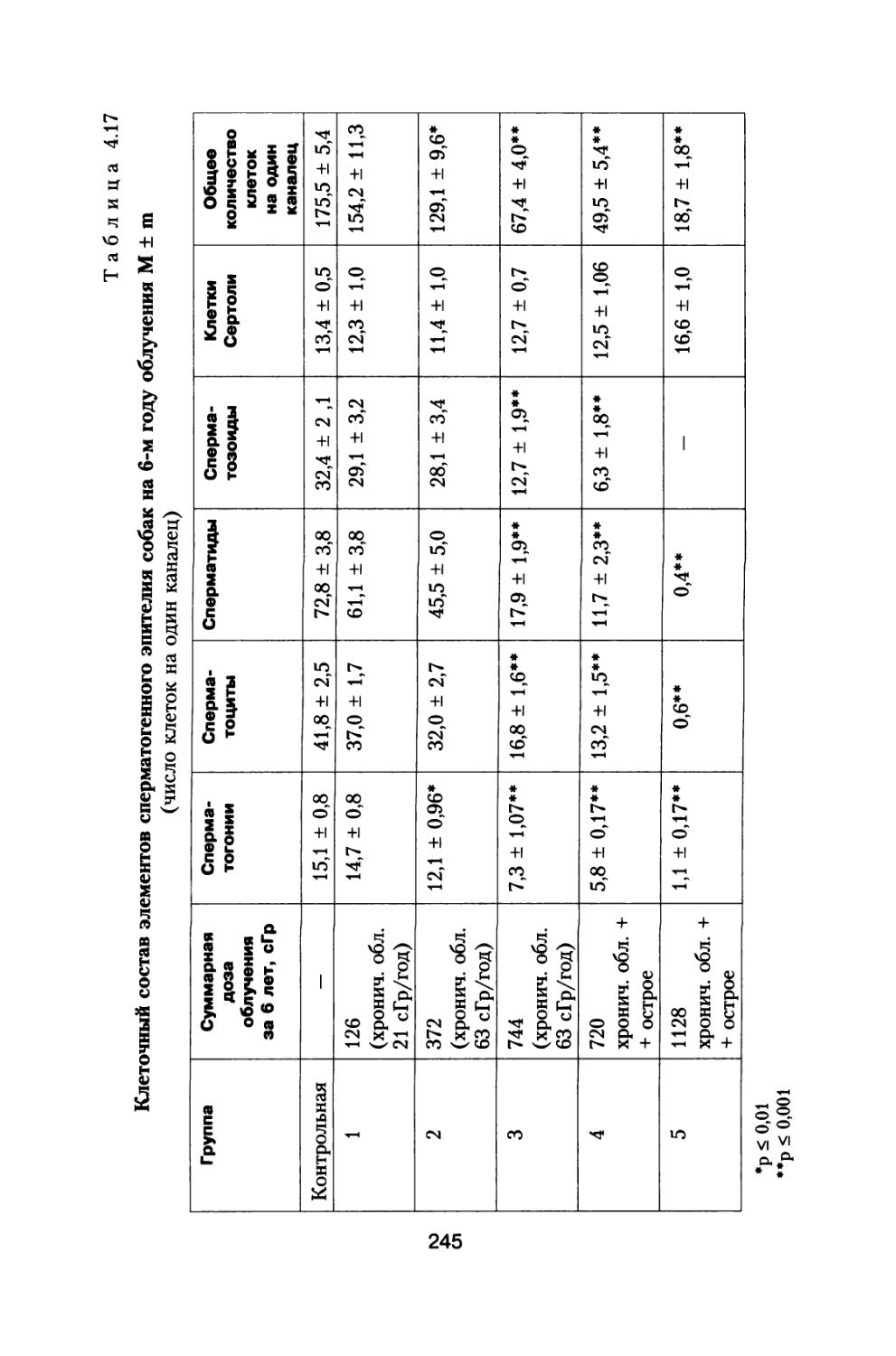
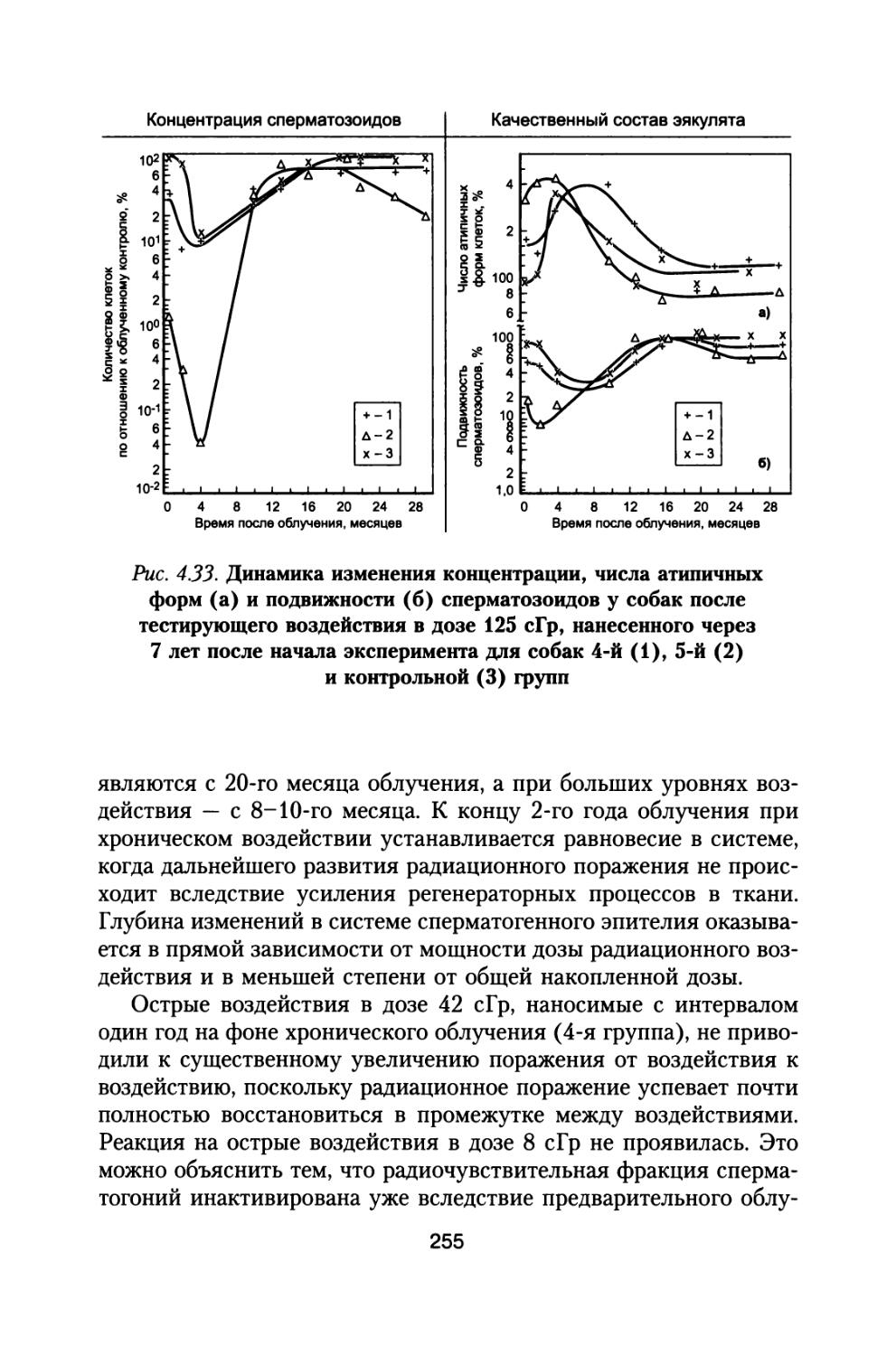
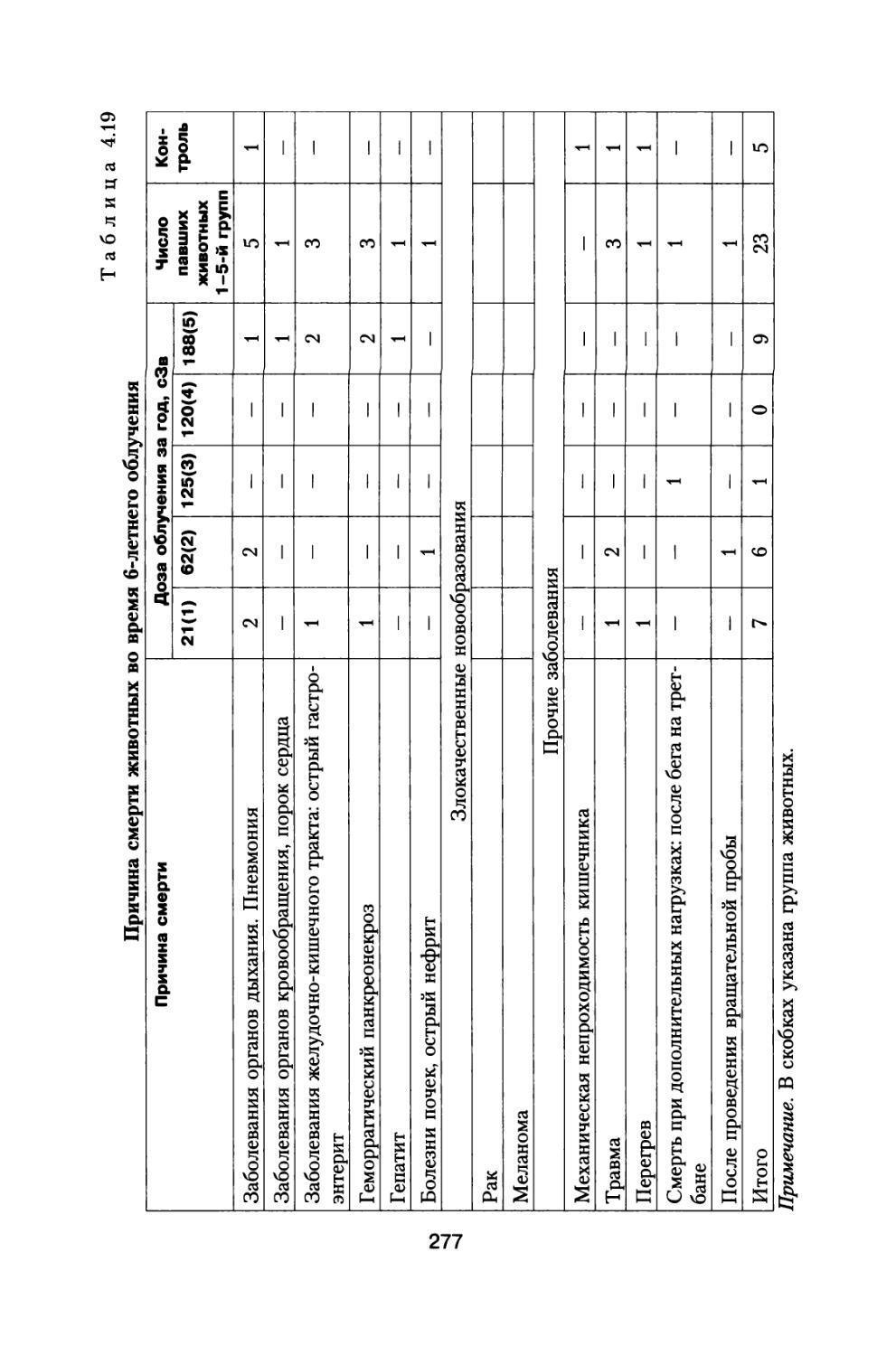
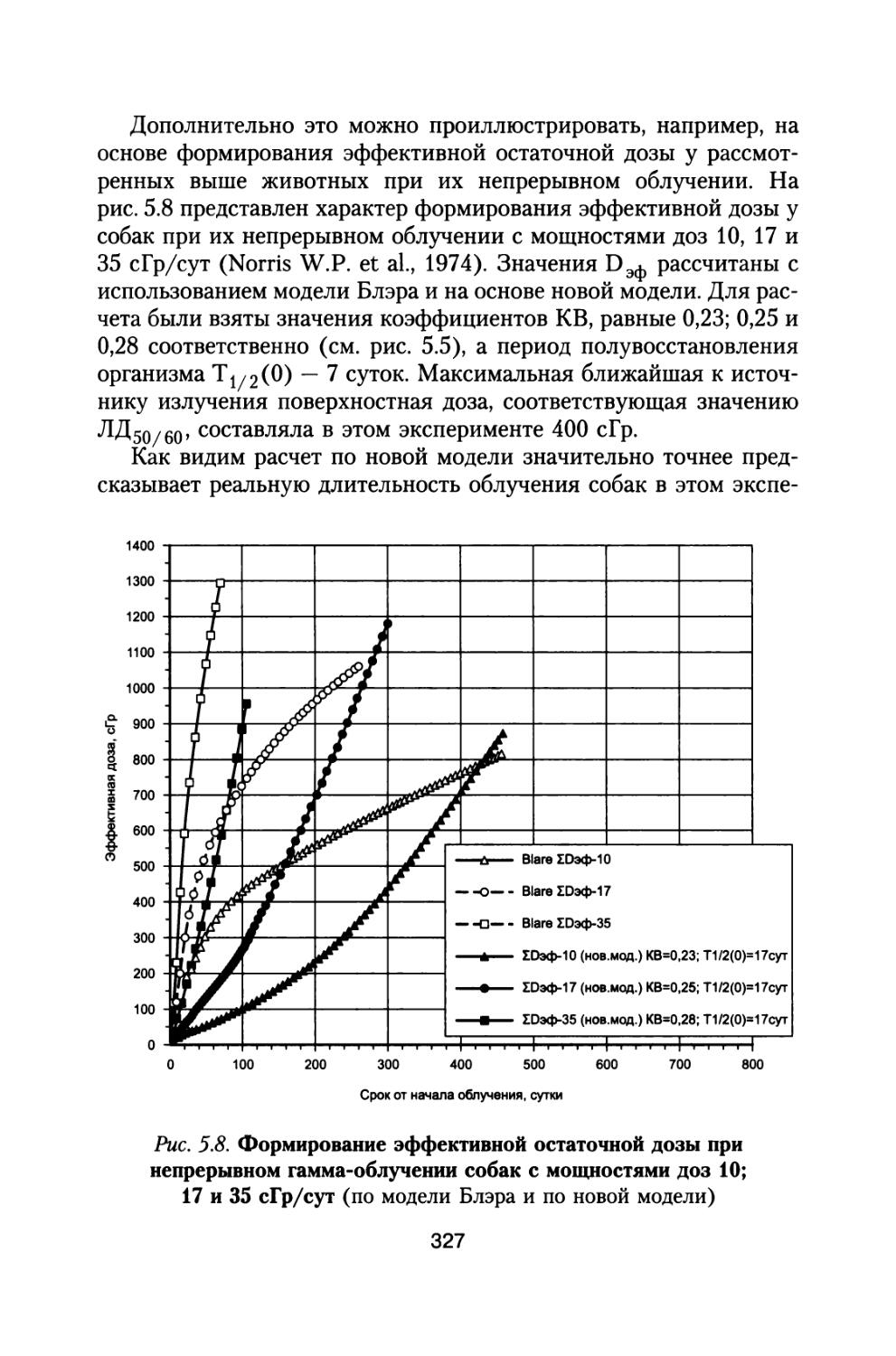
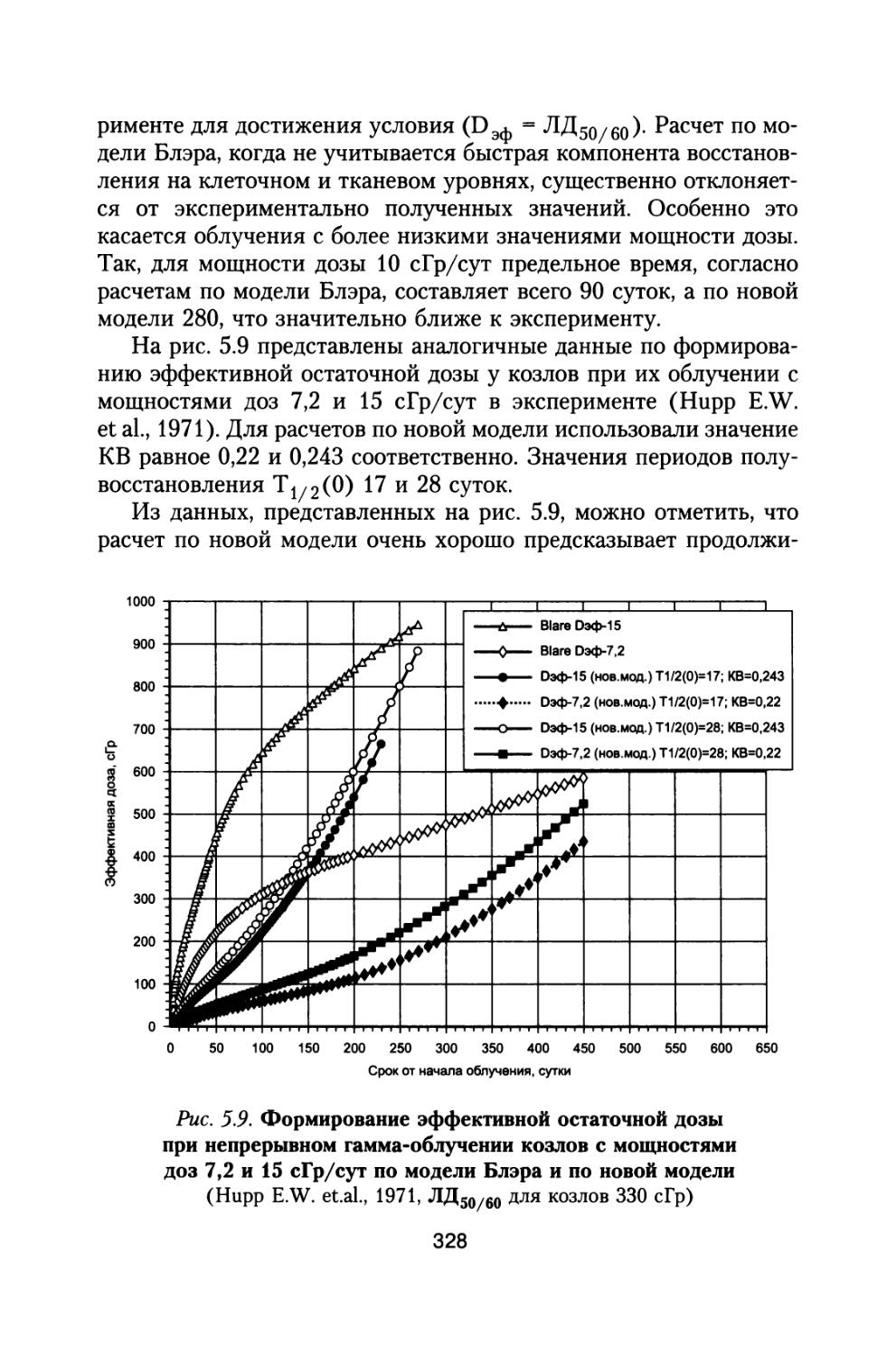
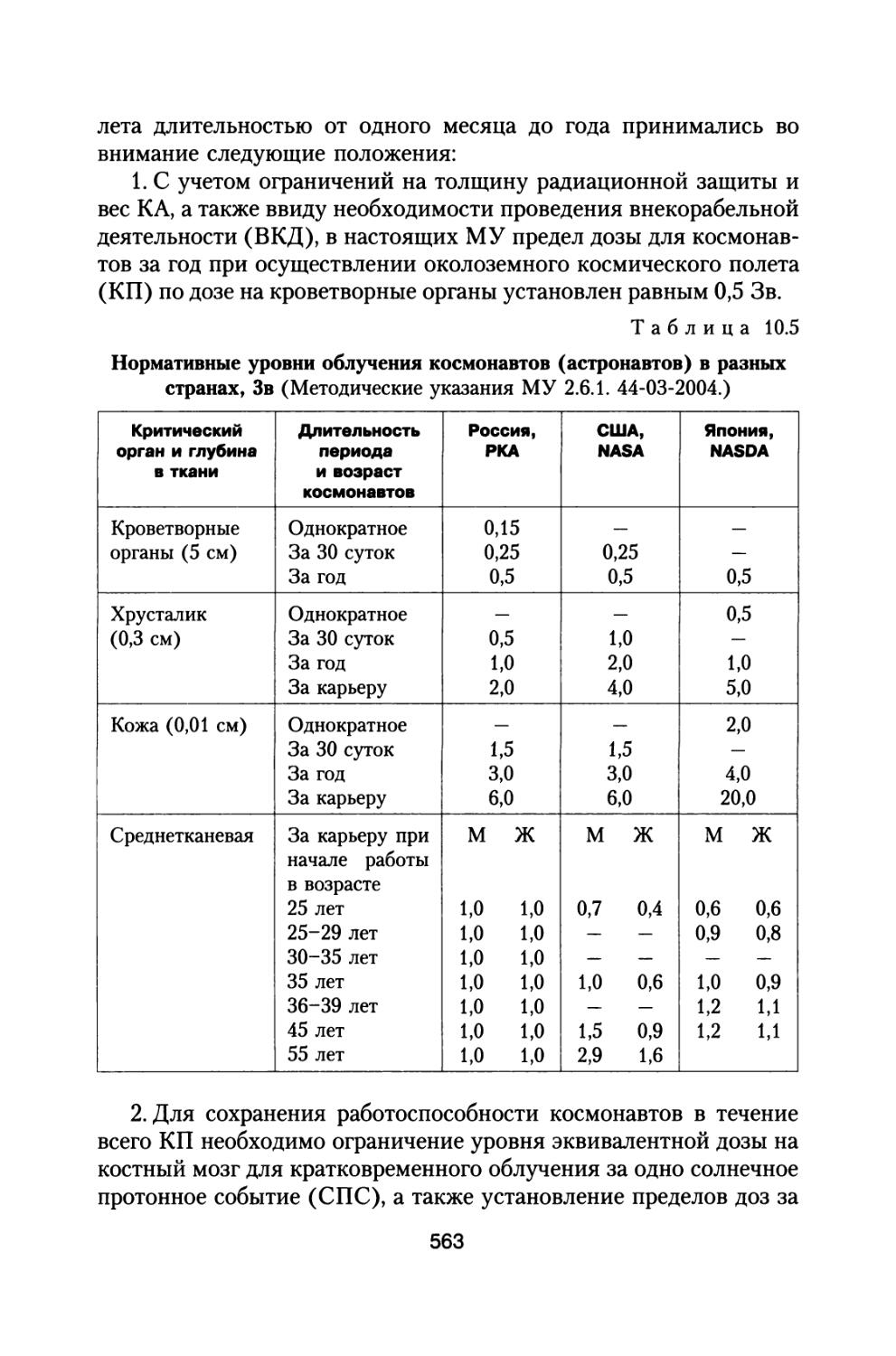
По предложению С.П. Королева, поддержанного организационно и финансово А.И. Бурназяном, часть лабораторий радиобиологического сектора ИМБП Минздрава СССР успешно осуществили постановку и проведение уникального «Хронического эксперимента» по многолетнему облучению большой партии собак, моделирующему дозовые нагрузки и характер распределения дозы во времени при полете к Марсу. Материалы этого исследования подробно обсуждены в настоящей монографии (раздел 4).
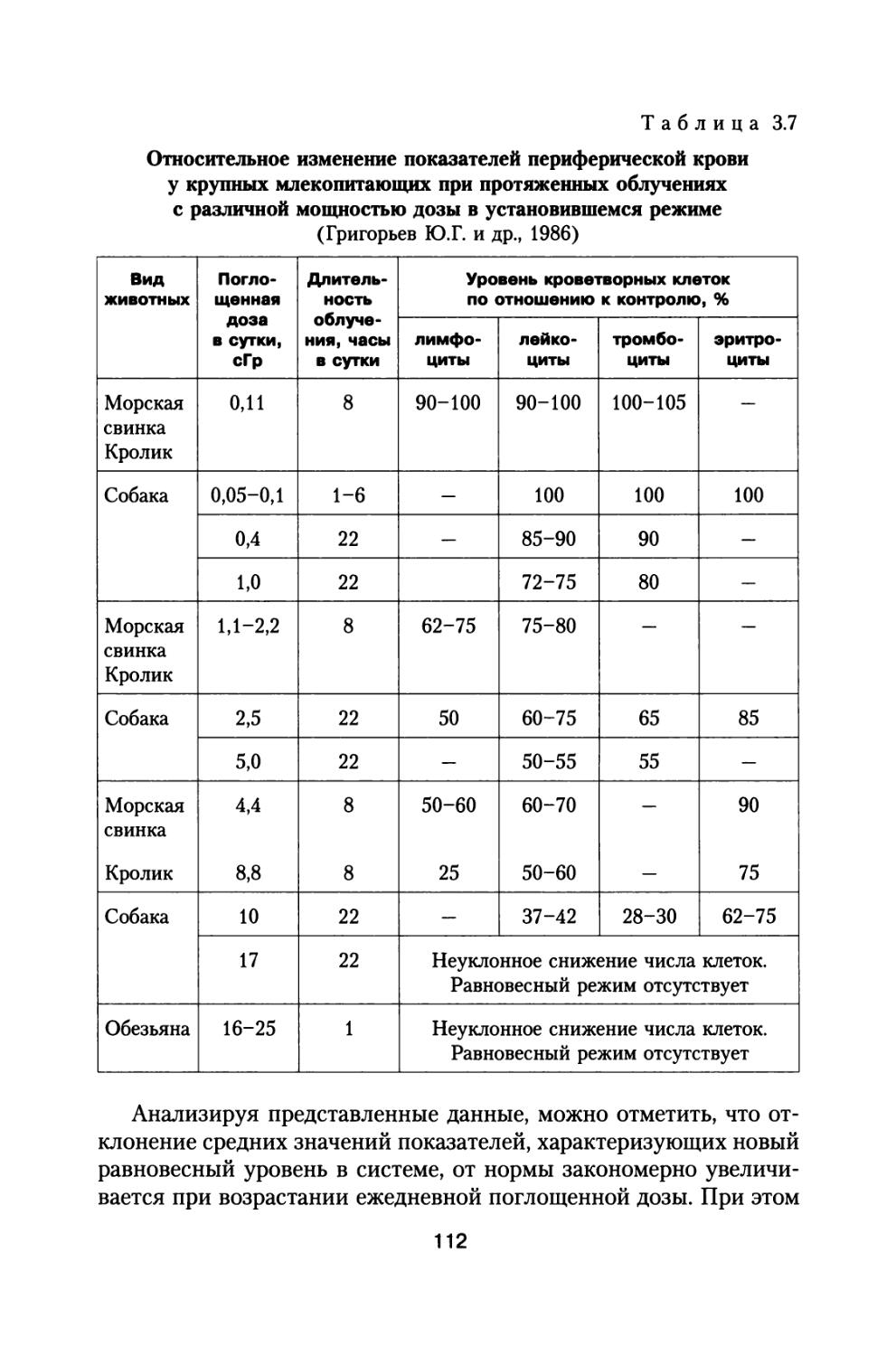
В 70-80-е годы прошлого столетия в Институте медико-биологических проблем проведен очень широкий комплекс исследований по изучению спектров космических излучений, по исследованию закономерностей формирования поглощенных и эквивалентных доз в фантомах, представляющих модель тела человека, за защитой космических аппаратов с учетом первичных потоков частиц и вторичных излучений от галактических космических лучей (ГКЛ), излучений радиационных поясов Земли (РПЗ) и солнечных космических лучей (СКЛ).
Параллельно с «Хроническим экспериментом» по облучению большой партии собак продолжали осуществляться также исследования на ускорителях протонов и тяжелых заряженных частиц по изучению зависимости относительной биологической эффективности излучений от линейной передачи энергии. Проводился широкий спектр исследований на мелких лабораторных животных по хроническому гамма-облучению в широком диапазоне мощностей доз, а также эксперименты с последовательным рядом повторных острых радиационных воздействий с целью разработки модели формирования радиационного поражения у млекопитающих с учетом восстановительных процессов. Продолжались исследования по изучению эффективности локальной защиты в отношении снижения поражения кроветворной ткани и повышения устойчивости организма, а также исследования по модифицирующему действию различных физических факторов на радиационный ответ организма, включая исследования непосредственно на борту искусственных спутников Земли, в том числе и с источником гамма-излучения (Космос 690).
Материалы этих исследований опубликованы в ряде монографий (Григорьев Ю.Г., 1975, 1982; Григорьев Ю.Г. и др., 1986; Ковалев Е.Е., 1986; Антипов В.В., Давыдов Б.И., Ушаков И.Б., Федоров В.П., 1989), в серии обобщающих статей в сборнике Проблемы космической биологии. Т.60, под. ред. академика А.М. Уголева, 1989; и в серии нормативных документов ГОСТов и Методических указаний за 1983-
17
1990 гг. по проблеме «Безопасность радиационная экипажа космического аппарата в космическом полете».
За совокупность работ по обоснованию нормативных документов и созданию системы радиационной безопасности космических полетов группе исследователей Антипову В.В., Григорьеву Ю.Г., Ковалеву Е.Е. и Петрову В.М. была в 1978 г. присуждена Государственная премия (Давыдов Б.И., 2007).
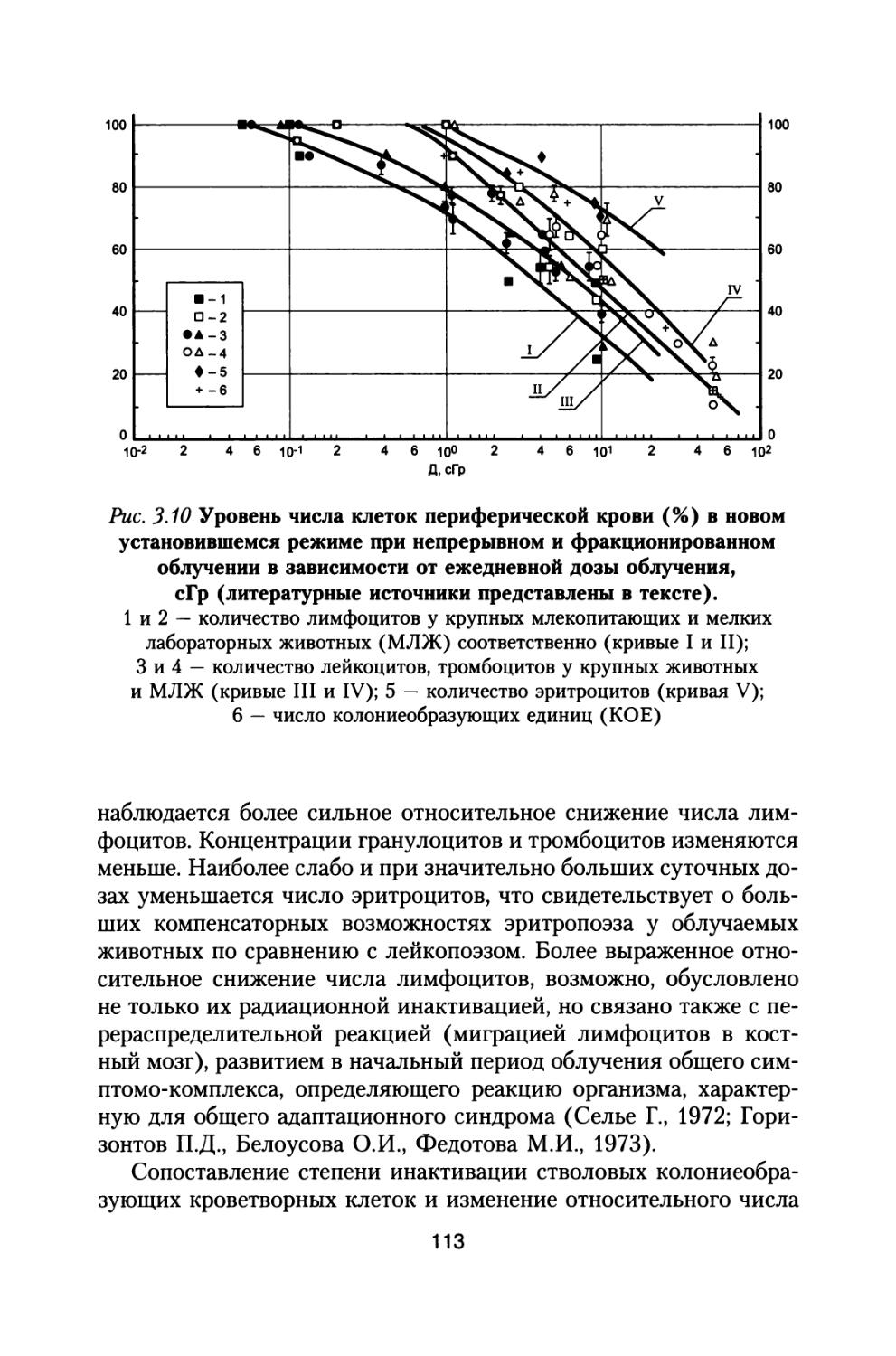
В 90-е годы получены новые данные о более высоком уровне радиационного риска для людей, профессионально работающих с источниками ионизирующих излучений, что привело к тому, что новые рекомендации Международной комиссии по радиационной защите (МКРЗ) и новые нормы по радиационной безопасности в нашей стране НРБ-96 снизили уровни ежегодного облучения персонала на Земле в 2,5 раза до 2 сЗв/год. При этом за всю профессиональную деятельность (длительностью до 40-50 лет) суммарная доза может составить 80-100 сЗв.
Как показала практика орбитальных полетов последних лет на станции «Мир», космонавт — профессия, при которой достигается самый высокий уровень радиационного воздействия в ходе выполнения профессиональных обязанностей. Доза облучения, ежесуточно получаемая космонавтом в ходе полета, в несколько раз превышает контрольные значения ежедневного облучения работников атомных производств. Перспективные программы освоения космического пространства связаны с расширением масштабов космической деятельности, с осуществлением межпланетных полетов на Луну, к Марсу и другим планетам, что ведет к увеличению продолжительности полетов и длительности действия космических факторов и существенным образом увеличивает радиационную опасность для космонавтов.
Дозы за год полета будут существенно превышать нормативные уровни, которые установлены на Земле, что вызывает необходимость решения вопросов защиты космических аппаратов более тщательно и оценок величин радиационного риска как в процессе полетов так и в течение всей жизни космонавтов.
Эти расчеты необходимо выполнить еще на стадии предварительного проектирования космического аппарата (КА). Конечная надежность обеспечения радиационной безопасности закладывается в проектные разработки с учетом выполнения также требования оптимального расходования ресурса (масса, энергия). При возможном увеличении высоты орбитальных полетов в будущем повышается также уровень радиационной и общей опасности. Это требует проведения более тщательного анализа характера изменения уровней радиационного воздействия космических излучений на критические органы и
18
ткани космонавтов при нахождении членов экипажа в различных отсеках КА. Снижение этих доз до приемлемых значений осуществляется на основе анализа радиационной ситуации, реализующейся в конкретном полете, и выдаче необходимых рекомендаций экипажу по изменению циклограммы их работы в условиях ухудшения радиационной ситуации.
При решении задач обеспечения радиационной безопасности орбитальных космических полетов и сопоставлении уровней радиационного воздействия космических излучений на человека и отдельные критические ткани с предельными значениями, установленными в нормативных документах, важное место наряду с системой дозиметрии на борту КА принадлежит расчетным методам определения поглощенных и эквивалентных доз. Значительную актуальность для обеспечения радиационной безопасности представляют расчетные методы определения дозовых нагрузок на критические органы и ткани космонавтов при их нахождении внутри КА и при внекорабельной деятельности, ввиду ограниченности экспериментальных данных по дозиметрии от различных источников космических излучений при орбитальных полетах с различной высотой и наклонением плоскости орбиты. Имеется также недостаточное число подробных экспериментальных данных о характере распределения поглощенных и эквивалентных доз в различных отсеках космического аппарата и внутри фантомов, представляющих модели тела человека.
Расчетные методы позволяют определить наиболее защищенные зоны в космическом корабле, которые могут быть использованы в качестве радиационного убежища при ухудшении радиационной обстановки при возникновении мощных солнечных протонных событий (СПС). Для проведения расчетов должны быть приняты модельные описания радиационной обстановки на трассе полета, модель защищенности космического аппарата, модель тела космонавта, а также выбран функционал, характеризующий меру радиационного воздействия. В качестве меры радиационного воздействия приняты поглощенная и эквивалентная дозы в представительных точках тела космонавта, которые являются основой для вычисления значений среднетканевой и обобщенной доз, определяющих величину радиационного риска в процессе полета и в отдаленном периоде.
В условиях единичных экспериментальных материалов по фантомным измерениям поглощенных доз в различных отсеках космического аппарата при осуществлении полетов различного назначения расчетные методы являются единственным надежным средством для вычисления основных дозиметрических функционалов, определяю
19
щих радиационную опасность и величину радиационного риска как в процессе полета, так и в отдаленном послеполетном периоде.
В настоящей книге представлено подробное радиобиологическое обоснование возможных неблагоприятных эффектов воздействия космических излучений в процессе полетов, снижающих работоспособность космонавтов и выполнение ими программы полетов. Проведен тщательный анализ результатов специального «Хронического эксперимента», поставленного по предложению С.П. Королева по 3- и 6-летнему облучению большой партии собак, в котором промоделированы дозовые нагрузки на космонавтов от источников космических излучений при длительном межпланетном полете к Марсу. Наблюдение за животными осуществляли и после хронического облучения в течение всей их последующей жизни. Наряду с этим рассмотрены результаты других экспериментов на различных млекопитающих при их протяженном облучении с различной мощностью дозы.
В книге представлены алгоритмы и проведены расчеты радиационного риска для космонавтов в процессе осуществления межпланетных и орбитальных космических полетов, расчеты суммарного радиационного риска за всю жизнь космонавтов, а также проведены оценки возможного сокращения предстоящей продолжительности жизни космонавтов после завершения конкретных полетов и всей их карьеры.
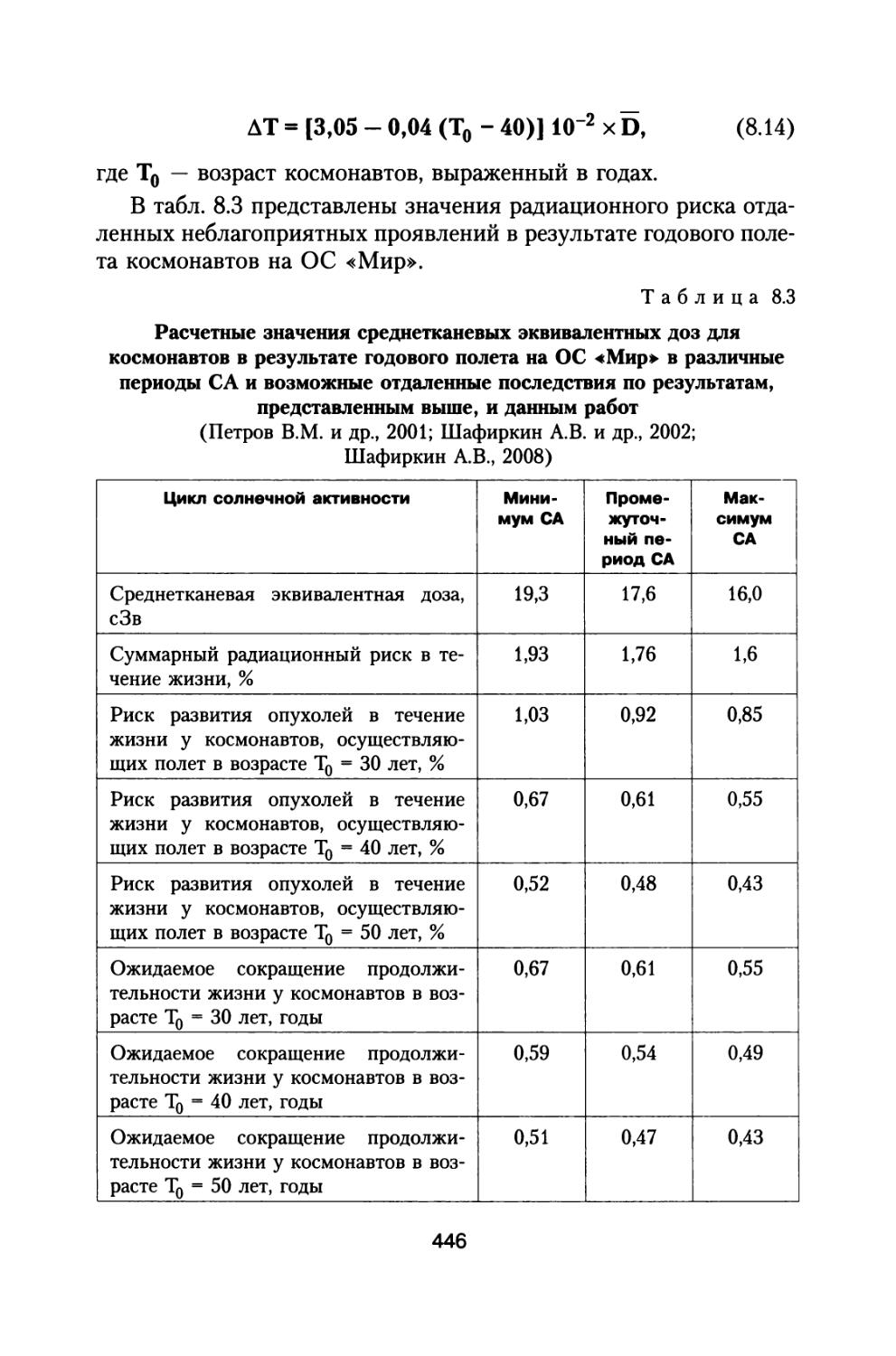
Подробно проанализированы в зависимости от величин среднетканевых эквивалентных доз возможные неблагоприятные отдаленные эффекты в основных регуляторных системах организма, количественно оценено снижение общего объема его компенсаторных резервов. Рассмотрены возможные нарушения в центральной нервной и сердечно-сосудистой системах, коже, эпителии роговицы при воздействии излучений с различной плотностью ионизации и разной линейной передачей энергии (ЛПЭ), что является важным для решения вопросов нормирования воздействия космических излучений. На основе анализа экспериментальных данных оценены риски помутнения хрусталика и развития катаракт у космонавтов и предложены предельные значения доз на хрусталик за всю их профессиональную деятельность.
В работе уделяется также внимание обоснованию социально приемлемых значений радиационного риска. Для этого он сопоставляется с уровнями рисков других профессий и видов деятельности, с демографическим риском, с риском длительного воздействия других экологических и социальных факторов. Это является необходимым для обоснования новых норм радиационной безопасности при осуществлении межпланетного полета к Марсу и установления предельных суммарных уровней радиационного воздействия на космонавтов за их карьеру.
ИСТОЧНИКИ РАДИАЦИОННОЙ
<| ОПАСНОСТИ И ДОЗОВЫЕ НАГРУЗКИ I НА КОСМОНАВТОВ
LLa ПРИ МЕЖПЛАНЕТНЫХ КОСМИЧЕСКИХ
ПОЛЕТАХ
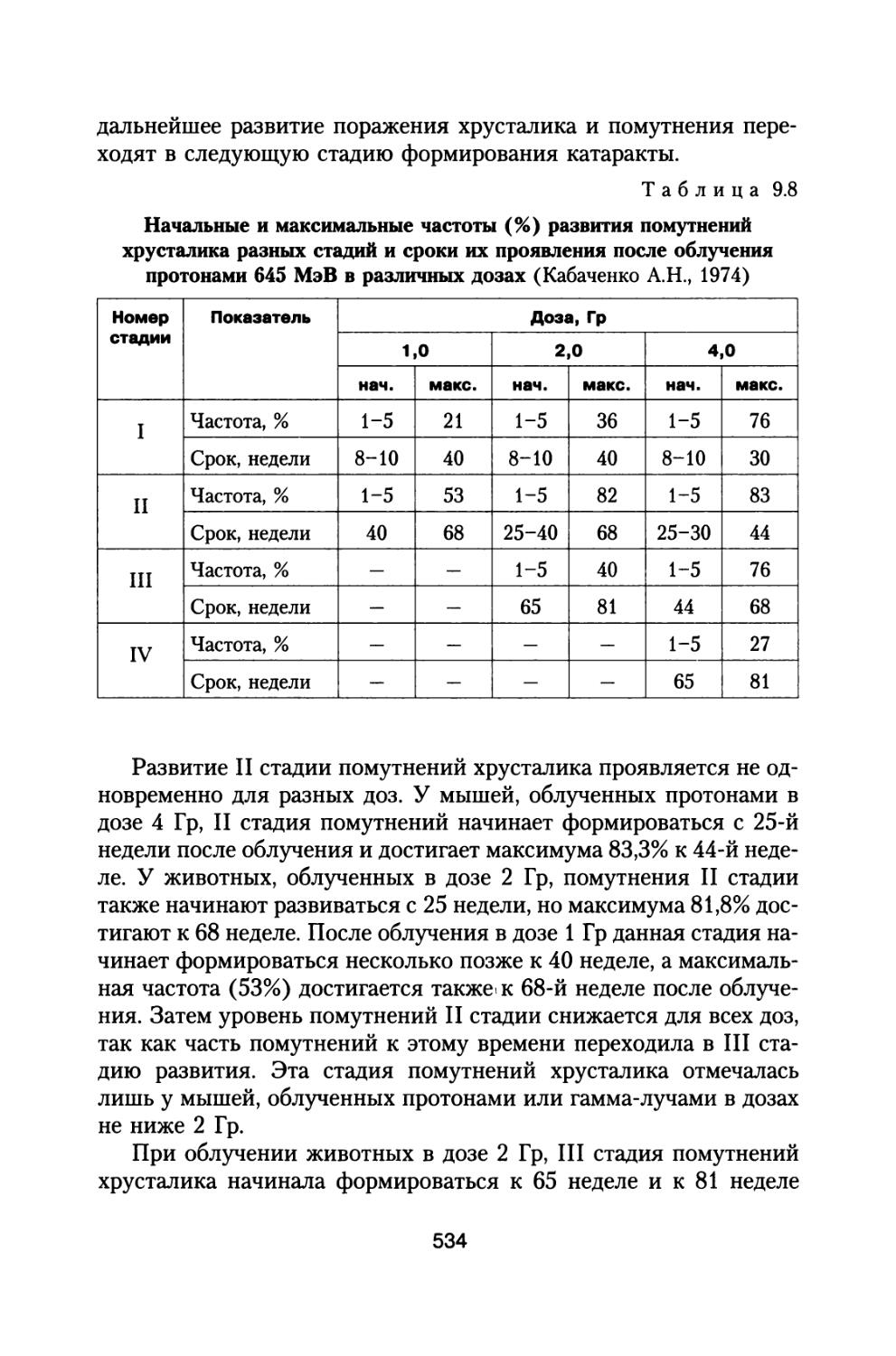
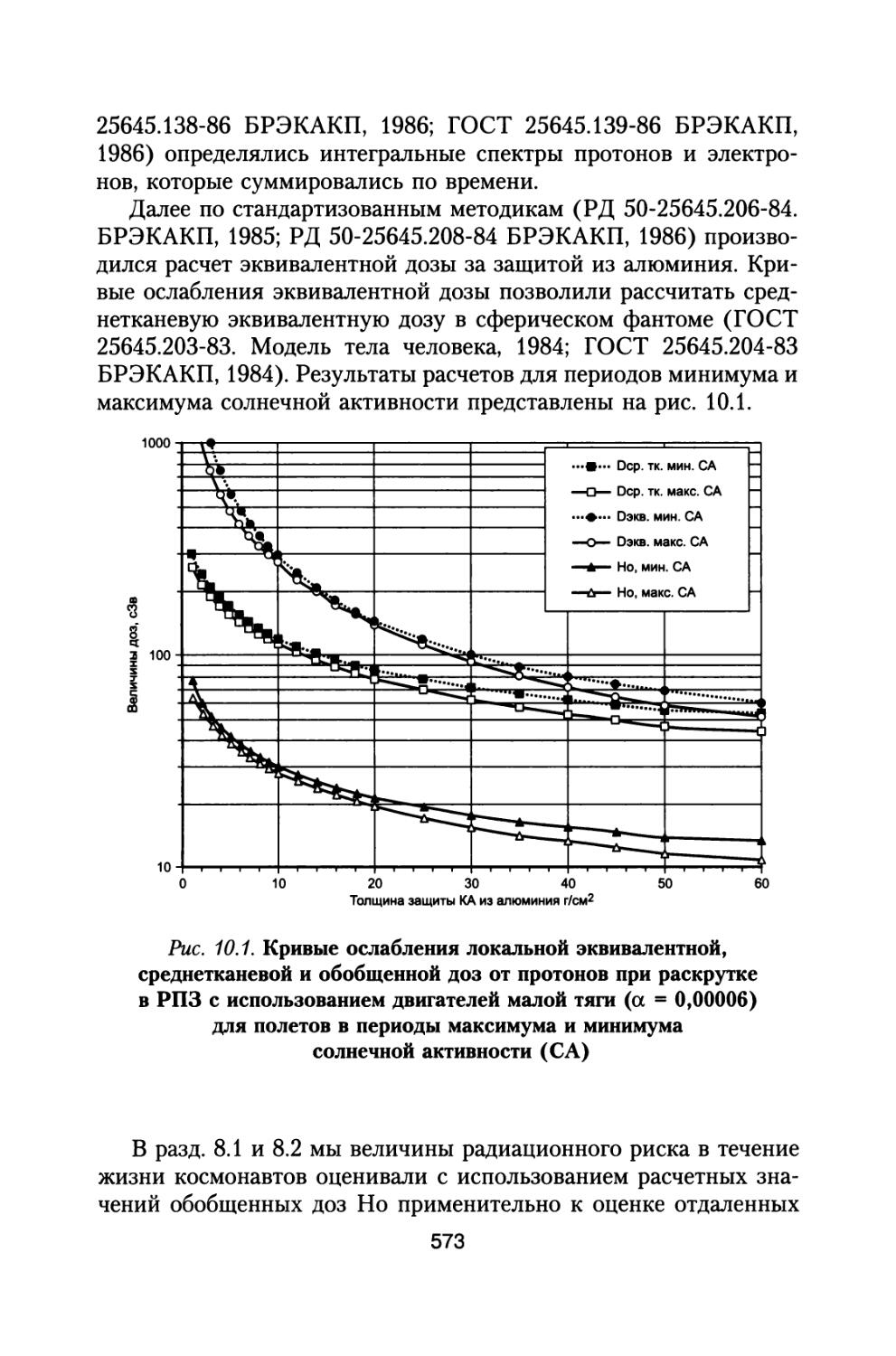
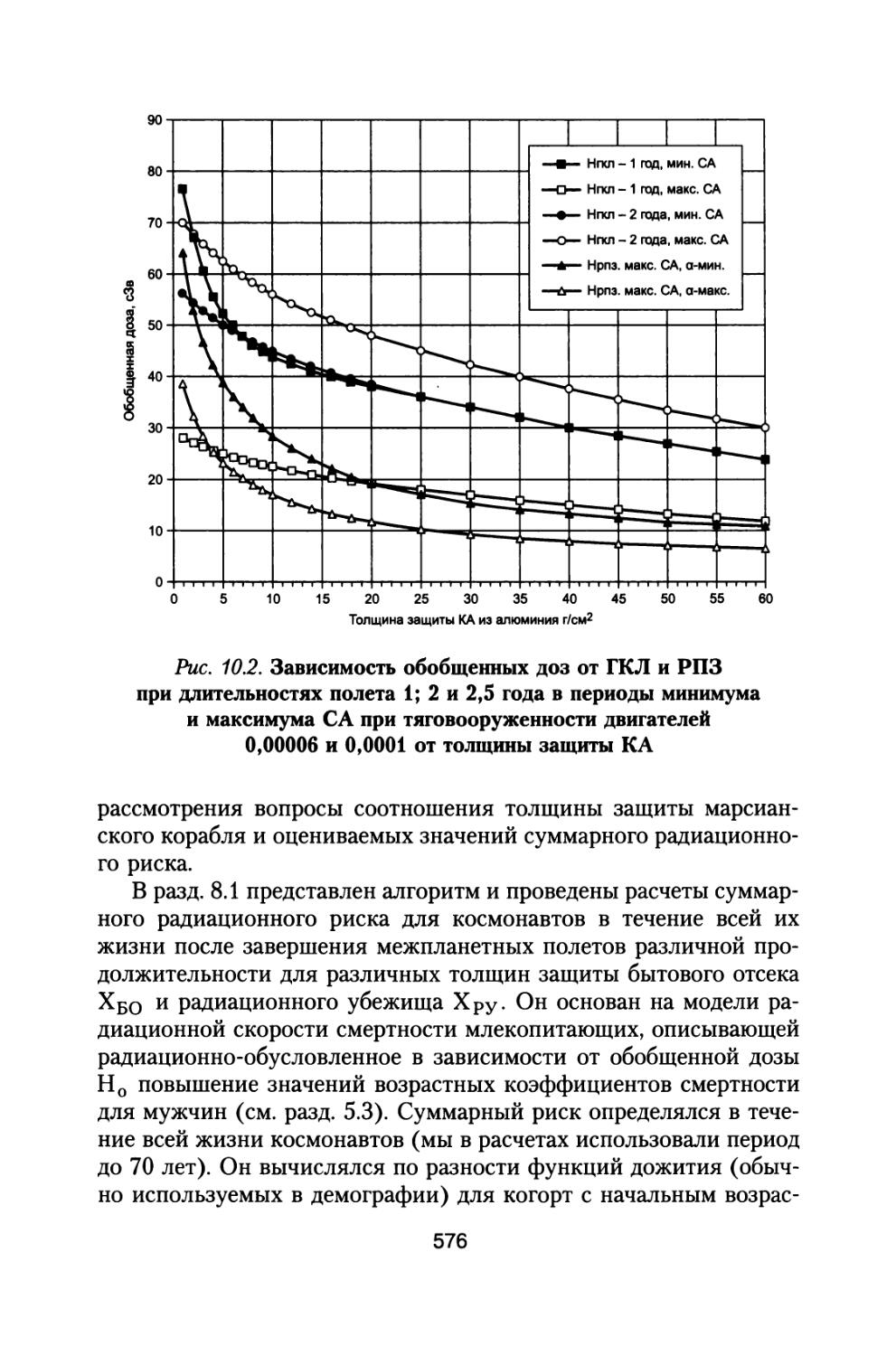
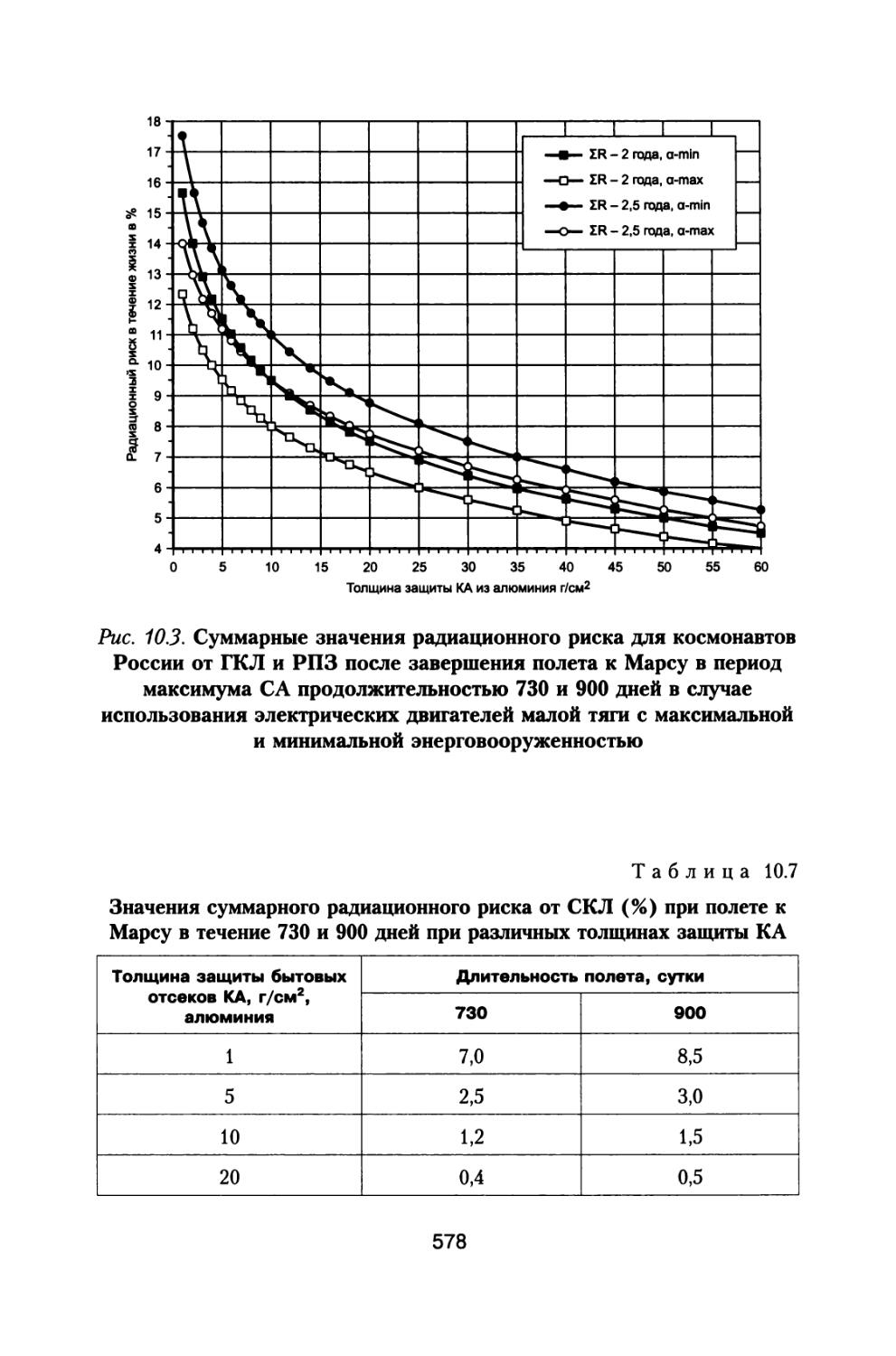
1.1. Анализ радиационной обстановки при межпланетном космическом полете в различные периоды солнечной активности
При полете к Марсу с использованием двигательного комплекса, состоящего из модулей большой и малой тяги, включающего жидкостной реактивный двигатель (ЖРД) и ядерно-энергетическую двигательную установку (ЯЭРДУ) на начальной стадии полета, можно значительно сократить время пребывания корабля с экипажем в радиационных поясах Земли (РПЗ), и продолжительность всей экспедиции заметно сокращается до 530-615 суток (Демин В.П. и др., 1993; Шафиркин А.В., 1999в; Шафиркин А.В., Григорьев Ю.Г. Коломенский А.В., 2004). При полете с комбинированной схемой двигателей с использованием ЖРД и ЯЭРДУ радиационную опасность для экипажа в основном представляют галактические космические лучи (ГКЛ) и солнечные космические лучи (СКЛ) во время осуществления солнечных протонных событий (СПС). В этом случае дозами от протонов и электронов РПЗ и вкладом от них в радиационный риск, с учетом малости их величины можно пренебречь. При осуществлении межпланетных полетов в период максимума солнечной активности (СА) на экипаж космического аппарата (КА) воздействуют ГКЛ и СКЛ во время развития СПС. В случае использования более простых и дешевых электрореактивных двигателей малой тяги длительность экспедиции может составить 2-2,5 года (Демин В.П. и др., 1993; Глушко В.П., Семенов Ю.П., Горшков Л.А., 1988; Семенов Ю.П., Горшков Л.А., 1990; Горшков Л.А., 2006) и при решении вопросов радиационной безопасности необходимо учитывать дополнитель
21
ный достаточно высокий вклад в суммарную дозу от протонов радиационных поясов Земли.
ГКЛ относятся к так называемым детерминированным источникам излучения, т.е. они действуют постоянно все время полета. РПЗ — только на начальном и возможно частично на заключительном этапе полета. СКЛ относятся к классу стохастических (вероятностных) источников, так как их появление в процессе полета КА носит случайный характер и обусловлено солнечными протонными событиями, связанными с активными процессами в магнитосфере Солнца.
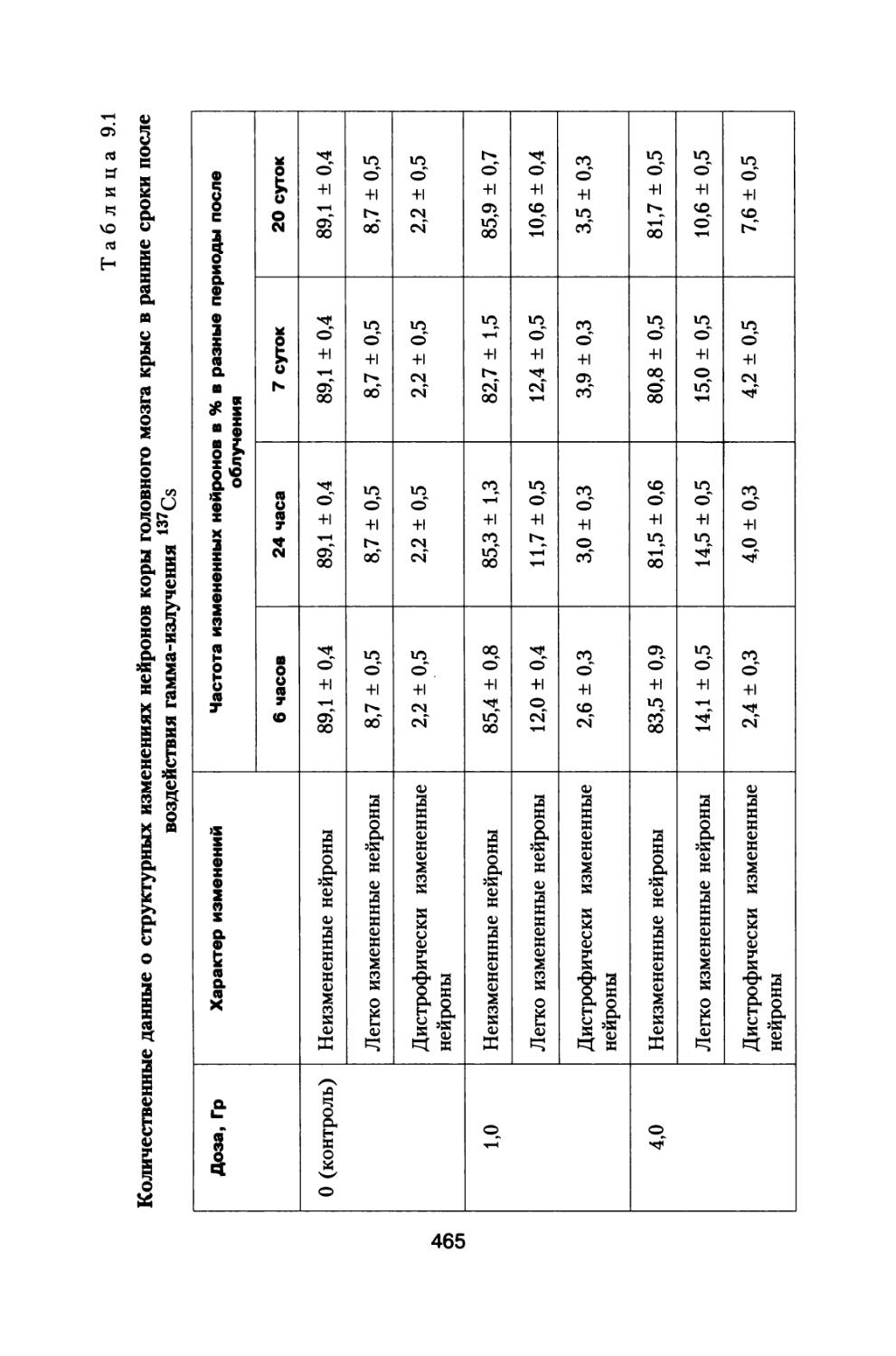
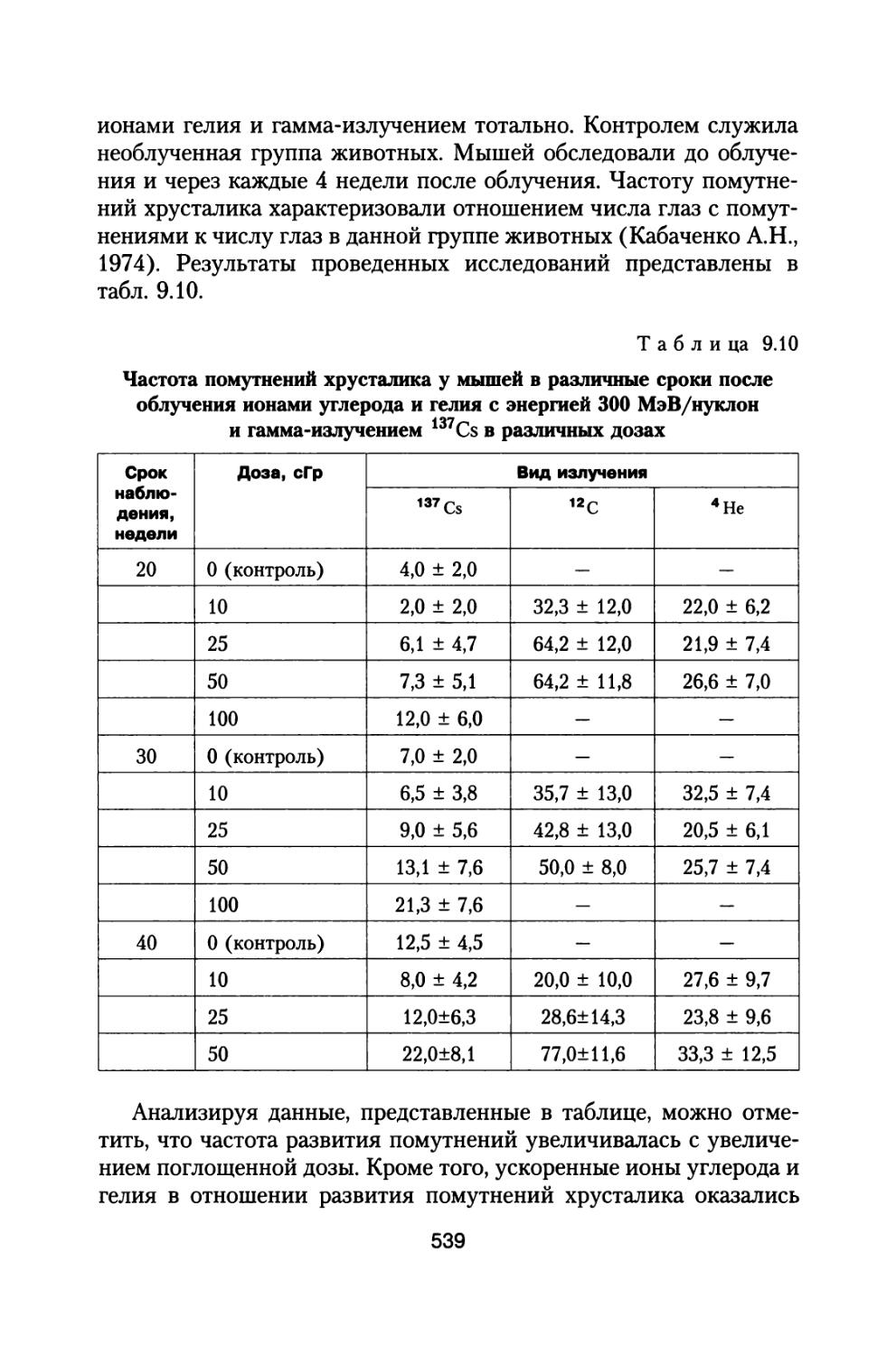
ГКЛ состоят из заряженных частиц, обладающих большой проникающей способностью и высокой биологической эффективностью. К настоящему времени у нас в стране выпущен и функционирует ряд нормативных документов (ГОСТ 25645.212-85 БРЭКАКП, 1986; ГОСТ 25645.122-85, 1986; ГОСТ 25645.123-85, 1986; ГОСТ 25645.124-85, 1986; ГОСТ 25645.144-88, 1989), устанавливающих состав, энергетические спектры и другие параметры и функционалы этих частиц вне магнитосферы Земли в минимумах и максимумах СА. Классификация частиц ГКЛ по зарядовому составу согласно (ГОСТ 25645.212-85 БРЭКАКП, 1986) представлена в табл. 1.1.
Т а б л и ц а 1.1
Классификация частиц ГКЛ по группам
Заряд 1 2 3-5 6-9 10-19 >20
Обозначение групп Р а L М LH VH
Среднее ядро 1Н1 4Не2 9Ве4 14n7 28Si14 56 he26
Примечание', р — протоны; а — альфа-частицы; L — группа легких ядер; М — группа средних ядер; LH — группа тяжелых ядер; VH — группа очень тяжелых ядер.
Энергетические спектры ядер ГКЛ характеризуются числом ядер с кинетической энергией Е, приходящейся на один нуклон ядра в единичном энергетическом интервале, пересекающих за единицу времени в единице телесного угла единичную площадку, нормальную к вектору скорости ядер. На орбите Земли вне ее магнитосферы угловые распределения потоков ядер ГКЛ принимаются изотропными. Диапазон энергий частиц ГКЛ — от 10 до
22
106 МэВ на нуклон. В области энергий свыше 104 МэВ на нуклон энергетические спектры частиц ГКЛ для периодов минимума и максимума С А совпадают. В области энергий ниже 103 МэВ/нук-лон энергетические спектры отличаются не только в минимуме и максимуме, но и в минимумах четных и нечетных циклов СА. В минимумах нечетных циклов интенсивность ГКЛ в области низких энергий заметно выше.
Для «спокойных» промежутков времени энергетические дифференциальные спектры ГКЛ FZ(E) [частиц м-2 сек-1, стер-1 (МэВ/нуклон)-1] в минимумах и максимумах СА вычисляют по формуле
D Eaz
Fz <Е) = .V + С* ехР(-Е/Ео), (1.1)
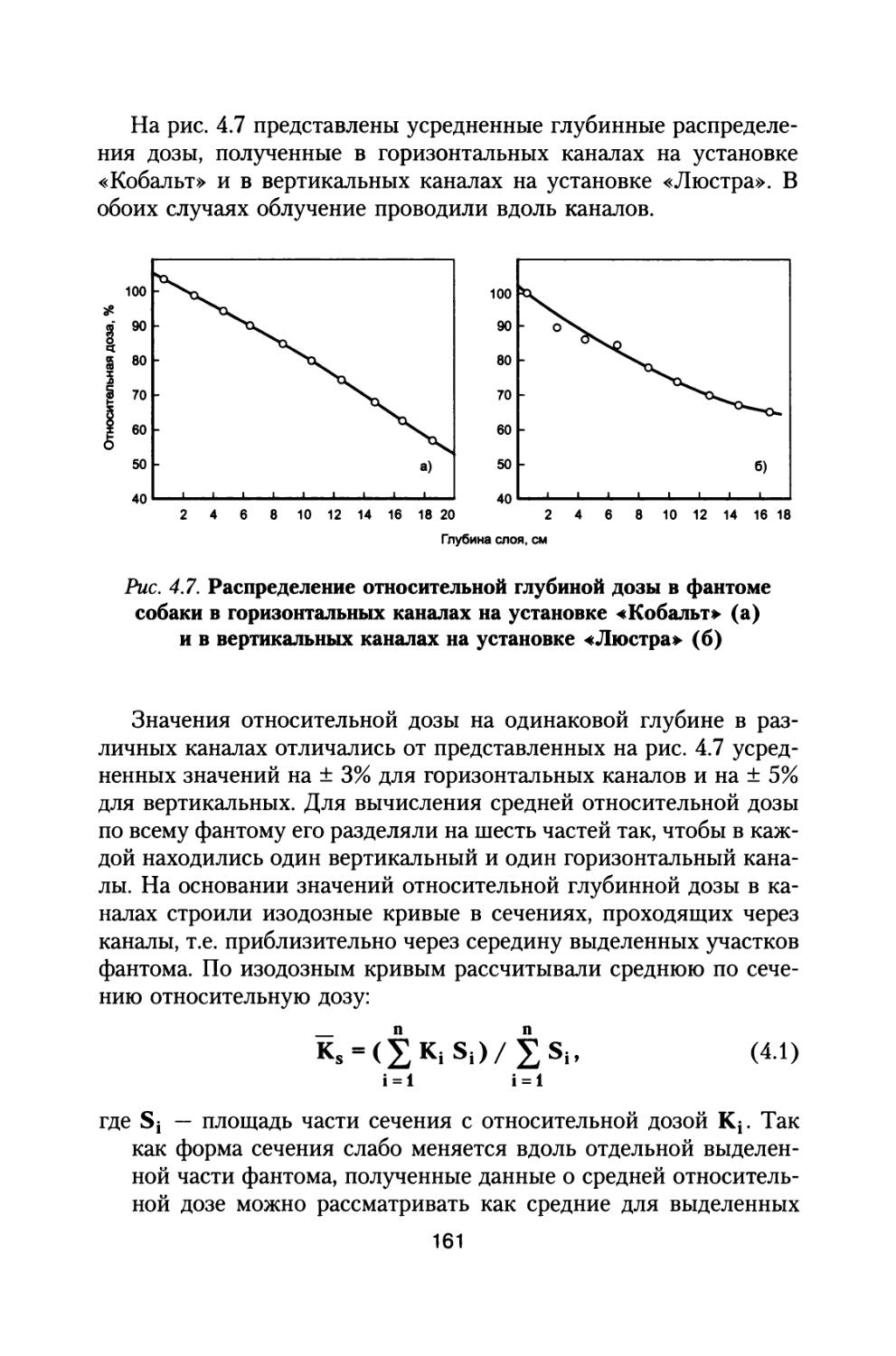
(10-2 Е + BZ)Y*
где z — заряд частиц, Е — кинетическая энергия, МэВ/нуклон, Dz, Bz, Cz, az, Yz, Eo — параметры, зависящие от заряда частиц и от фазы цикла СА. Значения этих параметров приведены в (ГОСТ 25645.122-85, 1986; ГОСТ 25645.123-85, 1986; ГОСТ 25645.124-85, 1986; ГОСТ 25645.144-88, 1989).
В США используются аналогичные модельные описания ГКЛ-CREME модель (Adams J.H., Swerberg J.R. and Tsao C.H., 1986). Во время прохождения космических лучей через вещество физические характеристики обусловленных ими полей излучения меняются за счет электромагнитных и ядерных взаимодействий. Ядра с высокой энергией, входящие в состав ГКЛ, в актах столкновения с ядрами защиты меняют свой состав в результате ядер-ного расщепления (фрагментация) и электромагнитных диссипа-ционных процессов. Эти излучения и их вторичные продукты реакций, пройдя через защиту, конструкции и оборудование космического аппарата, будут воздействовать на космонавтов.
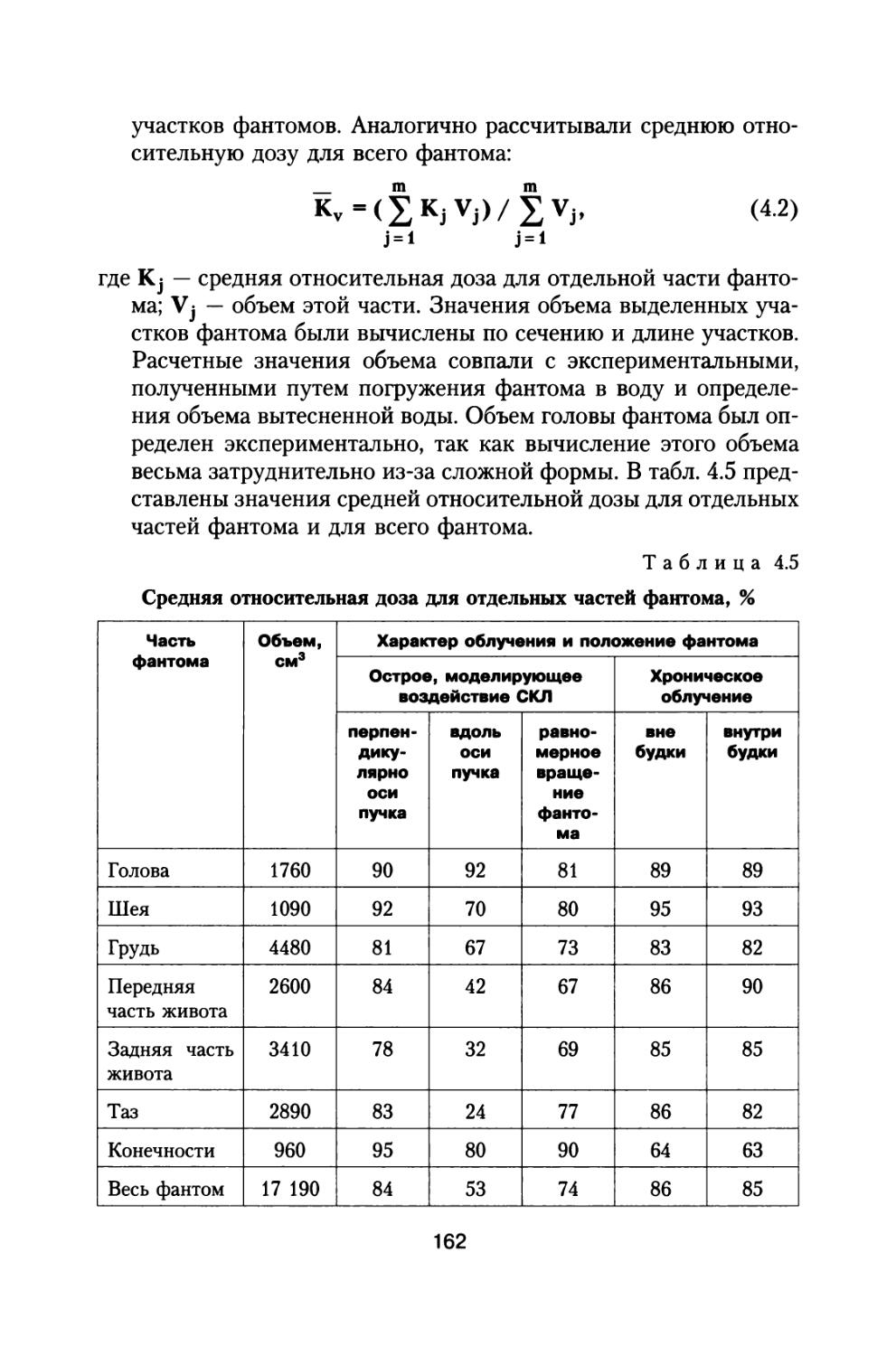
1.2. Алгоритм расчета и определение дозовых нагрузок от ГКЛ на различные органы космонавтов
при межпланетном космическом полете в период минимума солнечной активности
При межпланетном полете космического аппарата в период минимума СА основным источником радиационной опасности яв
23
ляются ГКЛ. Как правило, процессы прохождения излучения через вещество описываются так называемой транспортной моделью (Tawnsend L.W. et al, 1992; РД 25645.207-85 БРЭКАКП, 1986). Ядерное расщепление является особенно важным, так как фрагменты, образовавшиеся в результате ядерных реакций, являются основными продуктами, изменяющими состав полей излучения за поглотителем. Кроме фрагментов первичного ядра в акте столкновения образуются другие компоненты вторичного излучения (вторичные протоны, нейтроны, тс-мезоны и т.д.), также изменяющие картину первичного поля излучения и влияющие на суммарную радиационную обстановку внутри космического аппарата. Как правило, расчеты доз частиц ГКЛ проводятся для условий «стандартной геометрии» (на плоский полубесконечный слой вещества толщиной X нормально падает широкий пучок частиц ГКЛ). При этом суммарная эквивалентная доза частиц ГКЛ Н(х) за произвольной толщиной защиты определяется по формуле, представленной в работе (Dudkin V.E. and Potapov Yu.V., 1992):
Ещах
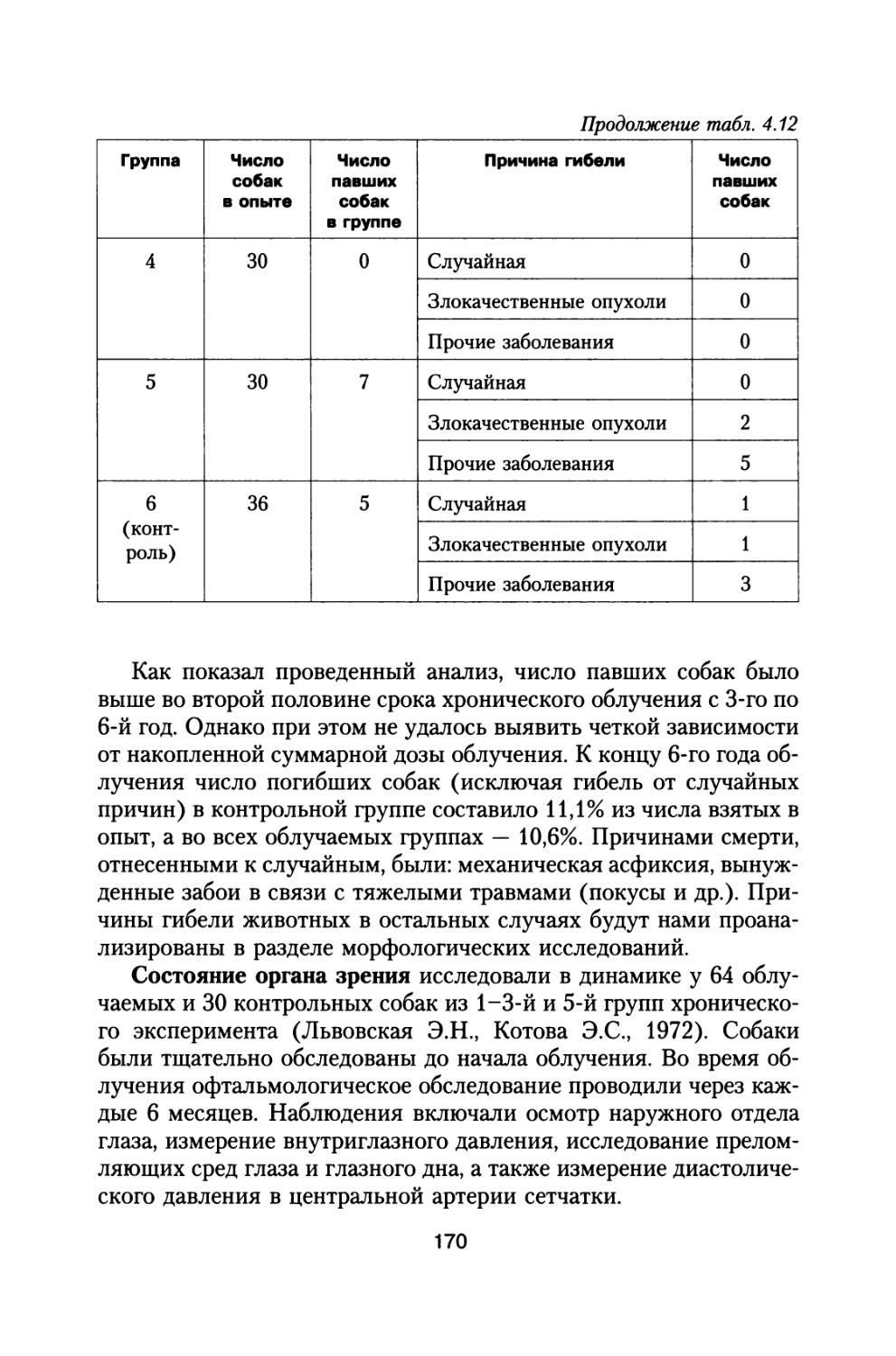
H(x) = S J (pi(E)Hj (x,E)dE, (1.2)
* Emin
где <Pi(E) — суммарный дифференциальный энергетический спектр ядер, принадлежащих группе (i), т.е. сумма спектров частиц, входящих в группу i (i = р, a, L, М, LH и VH (см. табл. 1.1)); Hj — эквивалентная доза за защитой толщиной х от представительного ядра группы i и его фрагментов с учетом вторичного излучения:
Н‘ (х, Е) = Hj (х, Е) + £ Hj (х, Е) + Н1вт(х, Е), (1.3)
j = i
где Н1 (х, Е) и Н! (х, Е) — эквивалентные дозы на глубине х, обусловленные ионизационными потерями представительных ядер группы (i) и их фрагментов (j), j = 1, 2 ... i - 1; Нвт — доза, обусловленная вторичными частицами, возникающими в столкновениях с ядрами поглотителя, от представительного ядра группы i.
В работе (Dudkin V.E. and Potapov Yu.V., 1992) проведены расчеты эквивалентных доз от ГКЛ вне магнитосферы Земли, а также
24
детальный анализ результатов расчетов, выполненных за рубежом до 1991 г. Расчеты проведены по методике, изложенной в (РД 25645.207-85 БРЭКАКП, 1986). В качестве тормозящего вещества было выбрано тканеэквивалентное вещество. В качестве исходных данных приняты характеристики спектров ГКЛ для минимума и максимума солнечной активности, регламентированные в работах (ГОСТ 25645.122-85, 1986; ГОСТ 25645.123-85, 1986; ГОСТ 25645.124-85, 1986; ГОСТ 25645.144-88, 1989). При этом были приняты следующие основные предположения и допущения:
• фрагменты первичного ядра летят из точки столкновения в том же направлении и с той же энергией на нуклон, что и первичное ядро;
• флуктуации ионизационных потерь и многократное кулоновское рассеяние на концах пробегов ионов не учитываются;
• выход и форма энергетических распределений вторичных нейтронов полагаются такими же, как и для протонов;
• вторичные частицы (нейтроны, л-мезоны и т.п.) вылетают из точки их образования по направлению движения первичного ядра;
• спектры частиц, вылетающих из ядра мишени, принимаются независящими от энергии первичного ядра;
• при вычислении доз от вторичных короткопробежных заряженных частиц, предполагается, что они локально поглощаются в точке их образования.
В табл. 1.2 представлены результаты расчетов эквивалентных доз ГКЛ в зависимости от толщины защиты, выполненные российскими учеными. В ней же для сравнения представлены результаты расчетов эквивалентных доз, выполненных в работах (AdamsJ.H., James Н., 1986; Badhwar G.D., O’Neill Р.М., 1992; Badhwar G.D., Cucinotta F.A., O’Neill P.M., 1993) для стандартной геометрии.
В работе (Dudkin V.E. and Potapov Yu.V., 1992) расчеты проведены для защиты из тканеэквивалентного материала, в то время как в работах (Adams J.H., James Н., 1986; Badhwar G.D., O’Neill Р.М., 1992; Badhwar G.D., Cucinotta F.A., O’Neill P.M., 1993) в качестве материала защиты использовали алюминий. В этих работах эквивалентную дозу считали для точки на расстоянии 5 см от поверхности в тканеэквивалентном фантоме. Предполагалось, что глубина залегания кроветворных органов расположена на расстоянии 5 см от поверхности фантома. Поэтому ре
25
зультаты расчета дозы в табл. 1.2 начинаются с толщин защиты 5 г/см2.
Таблица 1.2
Значения мощности эквивалентных доз частиц ГКЛ в зависимости от толщины защиты х в период минимума СА, сЗв/год
Толщины защи-ты, г/см2 Литературный источник
Dudkin V.E. and Potapov Yu.V., 1992 Adams J.H., James H., 1986 Badhwar G.D., et al., 1992,1993
0 120 115 —
0,1 101 100 —
1,0 89 90,2 —
5,0 63,5 64,0 60,2
10 49,6 49,8 50,0
20 36,8 38,5 39,1
30 32,5 31,3 34,2
40 28,6 — 30,4
50 25,2 — 29,0
Результаты расчетов эквивалентных доз в работах (Dudkin V.E. and Potapov Yu.V., 1992; Adams J.H., James H., 1986; Badhwar G.D., O’Neill P.M., 1992; Badhwar G.D., Cucinotta F.A., O’Neill P.M., 1993) проводились с использованием зависимости коэффициента качества излучения от линейной энергии, рекомендованной в (Recommendation of the ICRP Publication 26, 1977).
Из табл. 1.2 видно, что значения доз, полученных разными авторами, близки между собой. Некоторые отличия можно объяснить различием моделей ГКЛ принятых в России (ГОСТ 25645.122-85, 1986; ГОСТ 25645.123-85, 1986; ГОСТ 25645.124-85, 1986; ГОСТ 25645.144-88, 1989) и в США (Adams J.H., Swerberg J.R. and Tsao C.H., 1986), а также, возможно, некоторыми различиями в допущениях, принятых при применении транспортной модели в расчетах прохождения излучения через вещество защиты.
26
При толщинах защиты свыше 40 г/см2 в работах (Dudkin V.E. and Potapov Yu.V., 1992) и (Badhwar G.D., et al., 1992, 1993) расхождение результатов заметнее. По-видимому, это можно объяснить тем, что тканеэквивалентное вещество является более эффективной защитой для вторичных излучений, возникающих при взаимодействии первичных ядер ГКЛ с веществом поглотителя. Потому на больших толщинах защиты значения доз в работах (Badhwar G.D., et al., 1992, 1993) выше, чем в работе (Dudkin V.E. and Potapov Yu.V., 1992). Тем не менее расхождения в оценках доз не превышают 15%, что для сложных расчетов, по-видимому, допустимо.
Таким образом, анализ литературных источников показывает,
что в настоящее время существуют достаточно надежные данные для оценок радиационной опасности от ГКЛ при пилотируемых межпланетных полетах в период минимума СА.
В 1991 г. были опубликованы документы (ГОСТ 25645.218-90 БРЭКАКП, 1991; Recommendation of the ICRP Publication 60,
1991), рекомендующие при расчетах защиты использовать новую
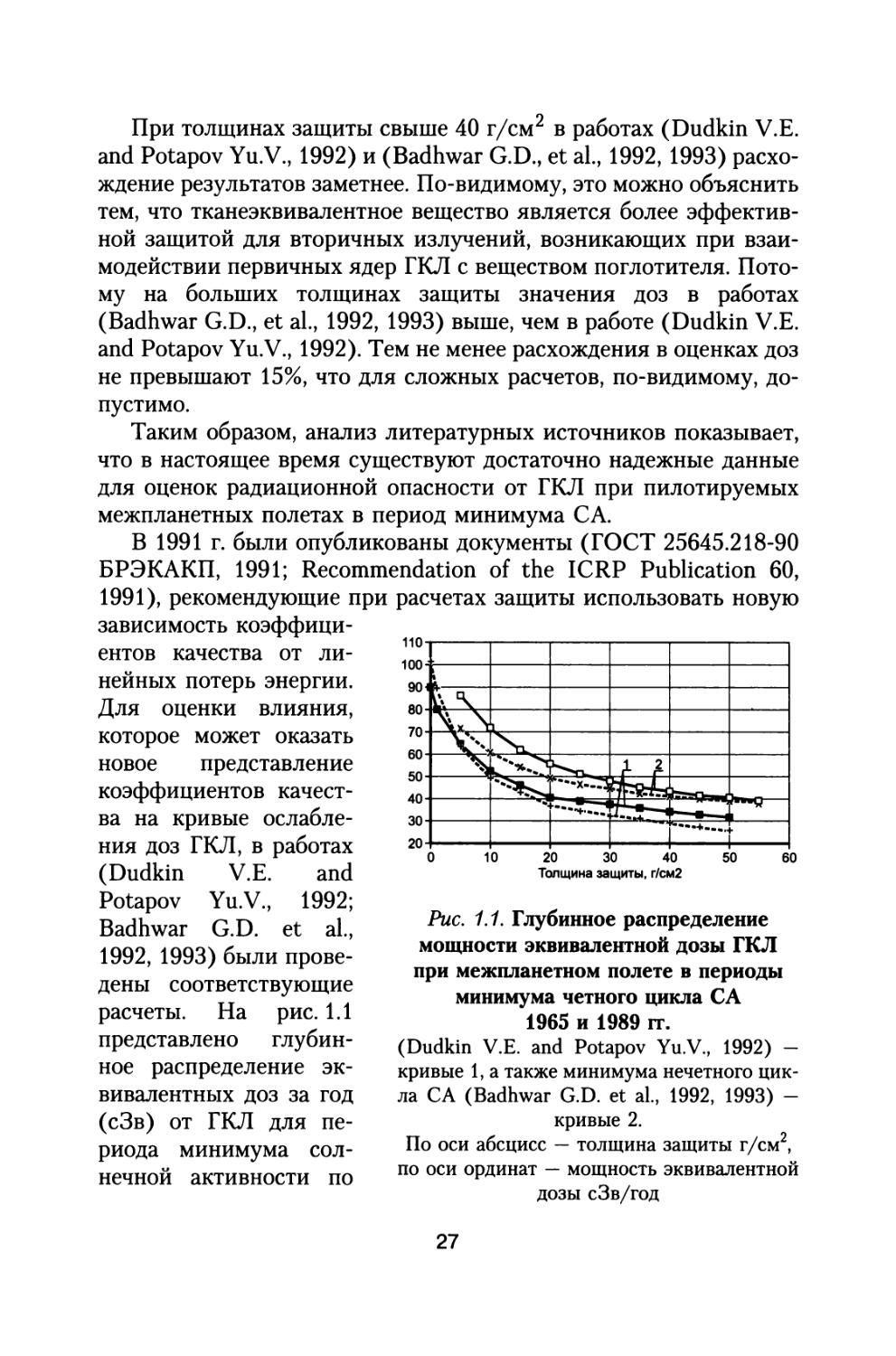
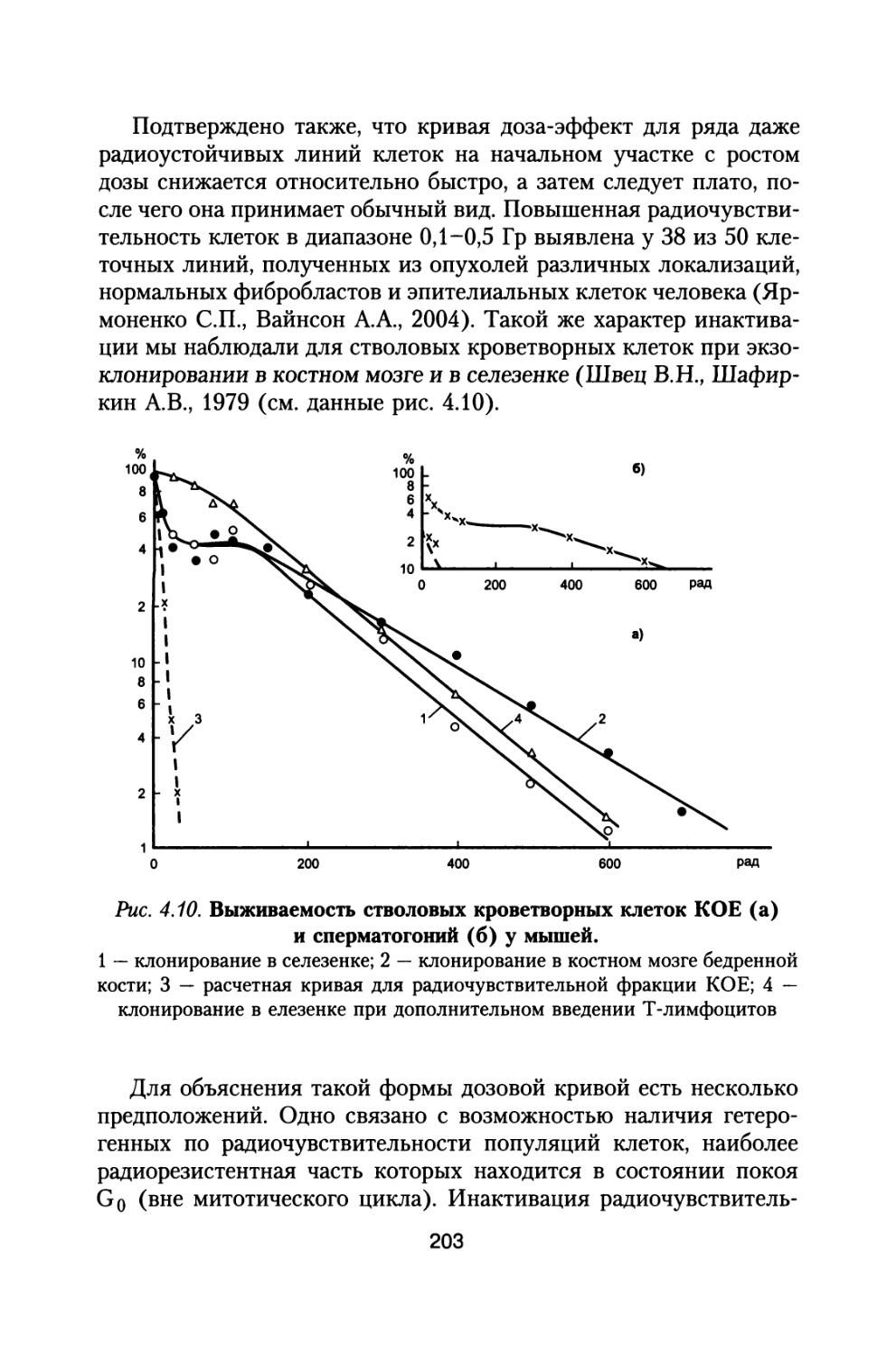
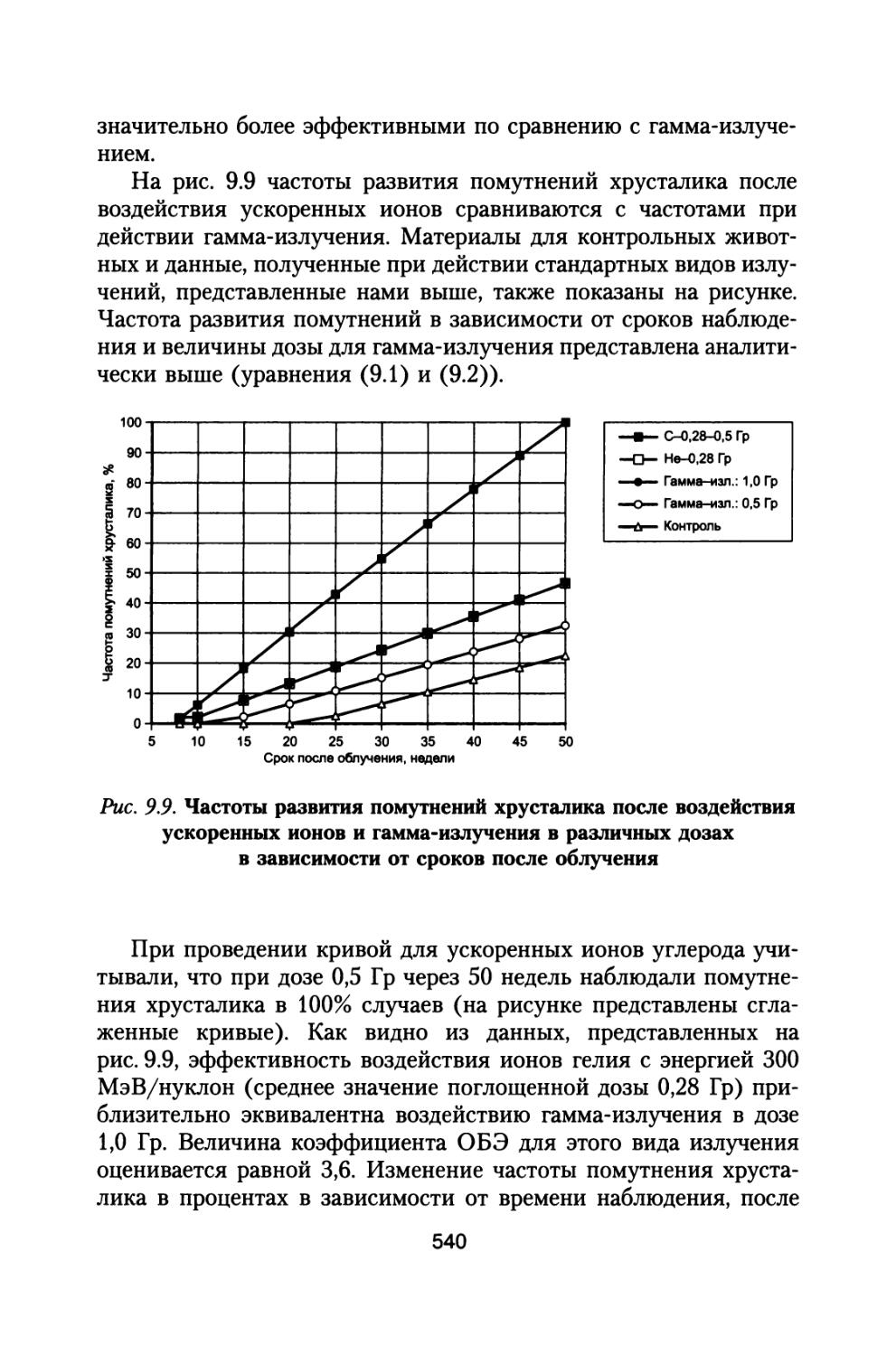
зависимость коэффициентов качества от линейных потерь энергии. Для оценки влияния, которое может оказать новое представление коэффициентов качества на кривые ослабления доз ГКЛ, в работах (Dudkin V.E. and Potapov Yu.V., 1992; Badhwar G.D. et al., 1992, 1993) были проведены соответствующие расчеты. На рис. 1.1 представлено глубинное распределение эквивалентных доз за год (сЗв) от ГКЛ для периода минимума солнечной активности по
Рис. 1.1. Глубинное распределение мощности эквивалентной дозы ГКЛ при межпланетном полете в периоды минимума четного цикла СА 1965 и 1989 гг.
(Dudkin V.E. and Potapov Yu.V., 1992) — кривые 1, а также минимума нечетного цикла СА (Badhwar G.D. et al., 1992, 1993) — кривые 2.
По оси абсцисс — толщина защиты г/см2, по оси ординат — мощность эквивалентной дозы сЗв/год
27
данным этих работ с использованием новой и старой зависимости коэффициентов качества от ЛПЭ (верхние и нижние кривые соответственно).
Для получения глубинных распределений мощности эквивалентной дозы от толщины защиты в качестве исходных данных использованы в работе (Dudkin V.E. and Potapov Yu.V., 1992) спектры ядер ГКЛ для периода минимума четного цикла солнечной активности 1965 и 1989 гг. (кривые 1). По спектрам ГКЛ для нечетного минимума С А 1976-1977 гг. построены зависимости мощности эквивалентной дозы от толщины защиты (кривые 2) в работах (Badhwar G.D. et al., 1992, 1993).
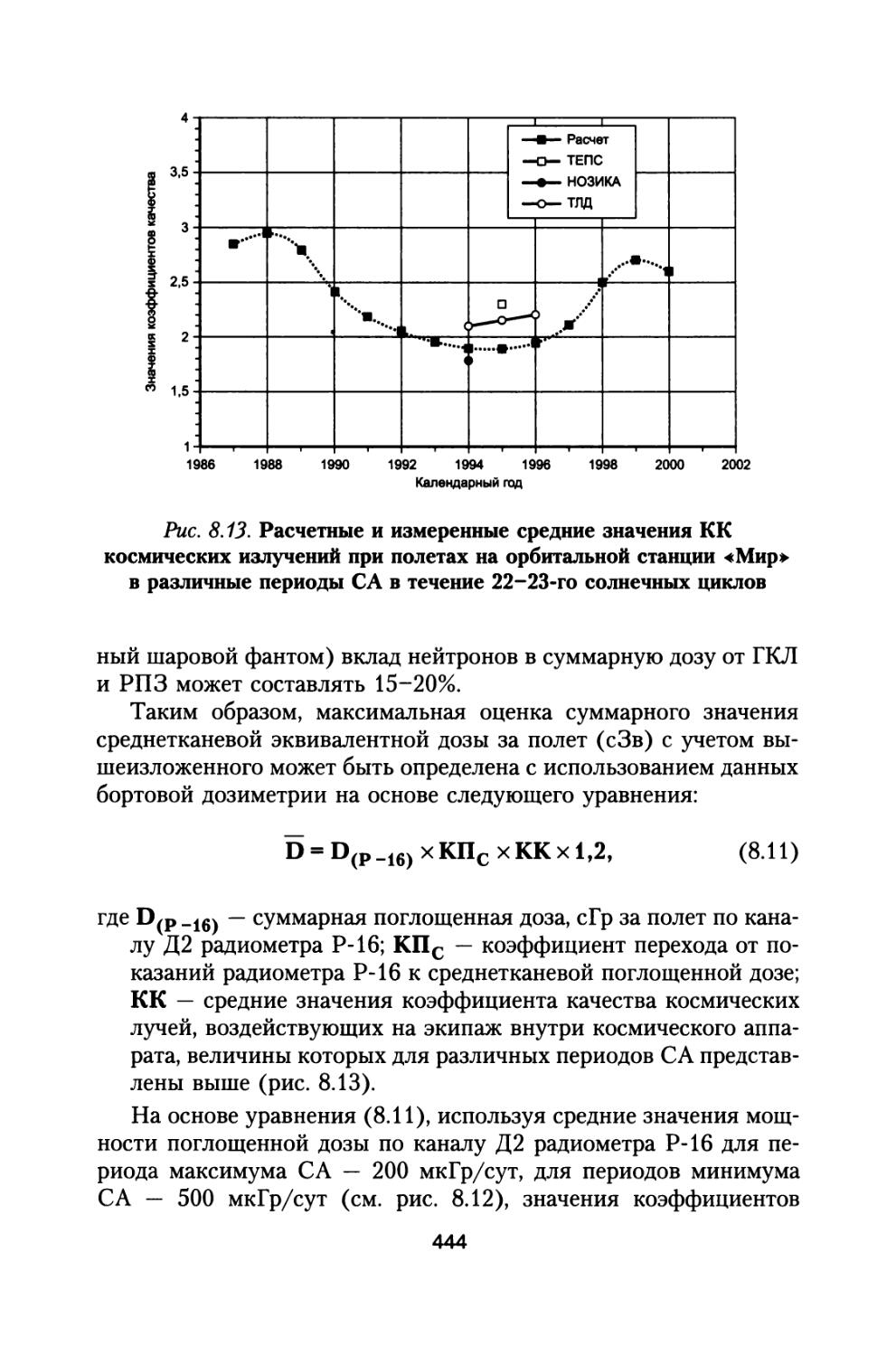
Сравнивая зависимости, представленные кривыми 1 и 2, можно видеть, что для нечетных минимумов СА эквивалентная доза на 25-30% выше, чем для периодов четных минимумов в диапазоне толщин защиты вплоть до 40г/см2. При использовании новых значений коэффициентов качества расчетные величины эквивалентных доз за год полета также оказываются выше на 5-10%.
Расчеты поглощенной и эквивалентной доз от ГКЛ в представительных точках стандартизованного фантома модели тела человека (ГОСТ 25645.203-83 Модель тела человека, 1984), размещаемого в отсеках космического аппарата КА, состоит из трех последовательных процедур (РД 50-25645.208-84. Методика расчета поглощенной и эквивалентной дозы, 1986):
• расчета глубинного распределения дозы заданного спектра заряженных частиц, нормально падающих на плоский слой тканеэквивалентного вещества;
• расчета функции экранированности представительной точки в фантоме внутри КА;
• интегрирования произведения функции экранированности представительной точки на глубинное распределение дозы.
Доза D(r) в представительной точке фантома г определяется по формуле
D(r) = J D(x) W(x, г) dx, (1.4)
в которой D(x) — зависимость дозы космических лучей (КЛ) от толщины плоского слоя алюминия; W(x, г) — функция экранированности в расчетной точке г определяется по формуле (операция свертки функций):
28
X
W(x,r) = J W1(y,r)xW2(y-x, r)dx, (1.5) 0
где Wi(y, r) — функция экранированное™ критического органа телом человека; W2(y, г) — функция экранированности защитой КА.
Предполагается случайная ориентация фантома внутри КА. При этом выбранная точка внутри защищаемой зоны космического аппарата и точка внутри фантома совмещаются. Для учета различия в защитных свойствах тканеэквивалентного вещества и веществ, входящих в защиту, для каждого из таких веществ вводится коэффициент эквивалентности Yk> который вычисляется по формуле
Yk=SK(Eo)/S(Eo), (1.6)
где SK(E0) и S(E0) — ионизационные потери в данном веществе и в тканеэквивалентном веществе при энергии Ео s 50 МэВ. При этом функция экранированности фантома преобразуется по формуле
W1(y,f) = (l/Yk)W1(Yky,?). (1.7)
Зависимости (1.4) и (1.5), по существу, являлись основой для разработки алгоритмов вычисления доз в фантоме, которые сводились к алгоритмам вычисления интегралов. Специфика заключалась в согласовании форматов задания функций экранированности фантома и защиты космического аппарата. В настоящее время задача определения функций экранированности космического аппарата не вызывает принципиальных трудностей. Для этих целей используется алгоритм расчета функций экранированности, изложенный в (ГОСТ 25645.204-83. Методика расчета экранированности, 1984).
Алгоритм основан на использовании метода Монте-Карло. Сущность метода заключается в следующем. Из точки с заданными координатами внутри космического аппарата с помощью случайного числа задается направление луча, пересечение которого с поверхностями и зонами определяет суммарную толщину вещества защиты в заданном направлении. Полученный набор толщин сортируется по заданной сетке толщин и таким образом формируется функция экранированности. Для получения корректных результатов рекомендуется задавать не менее 10 000 историй.
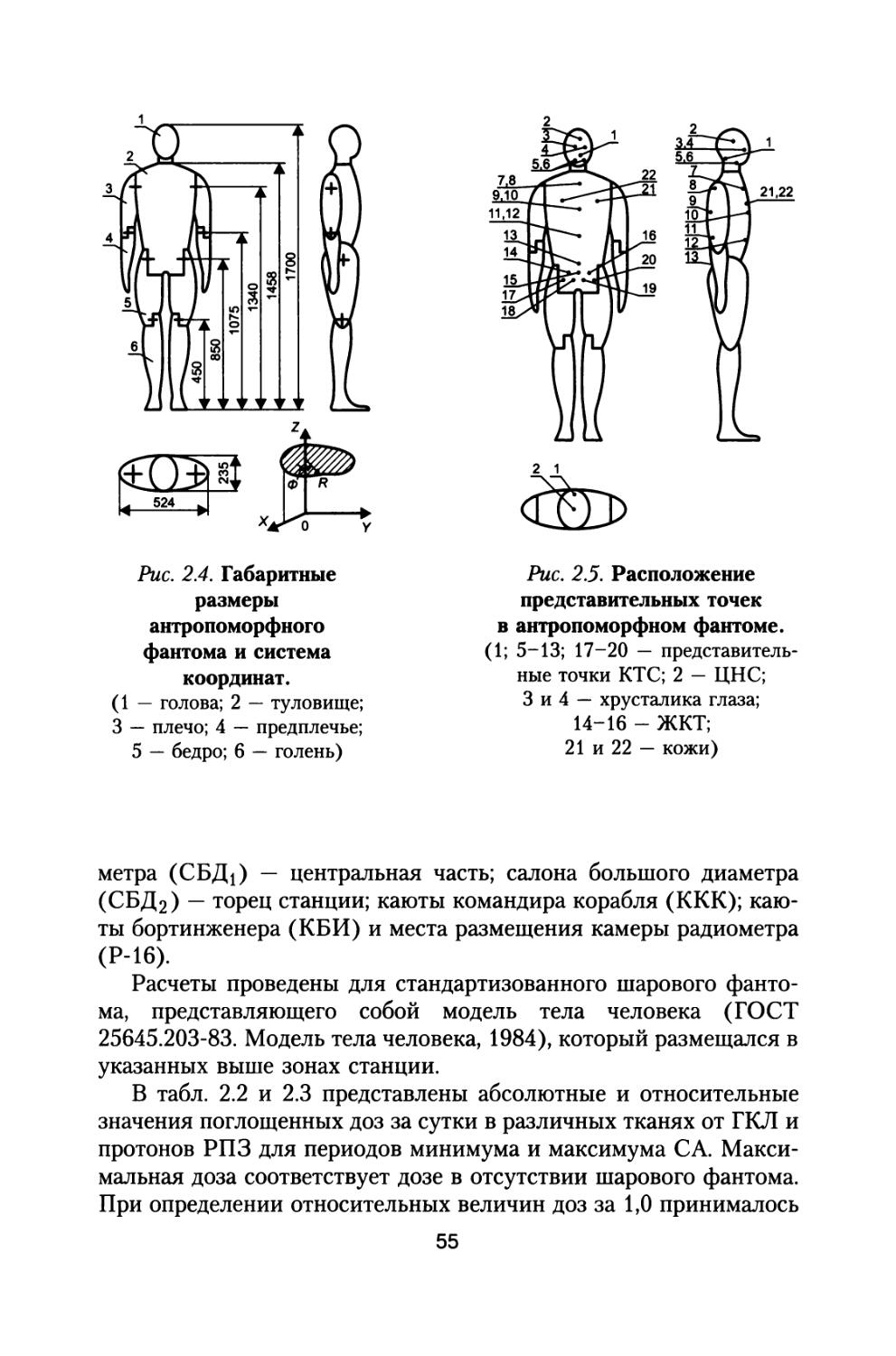
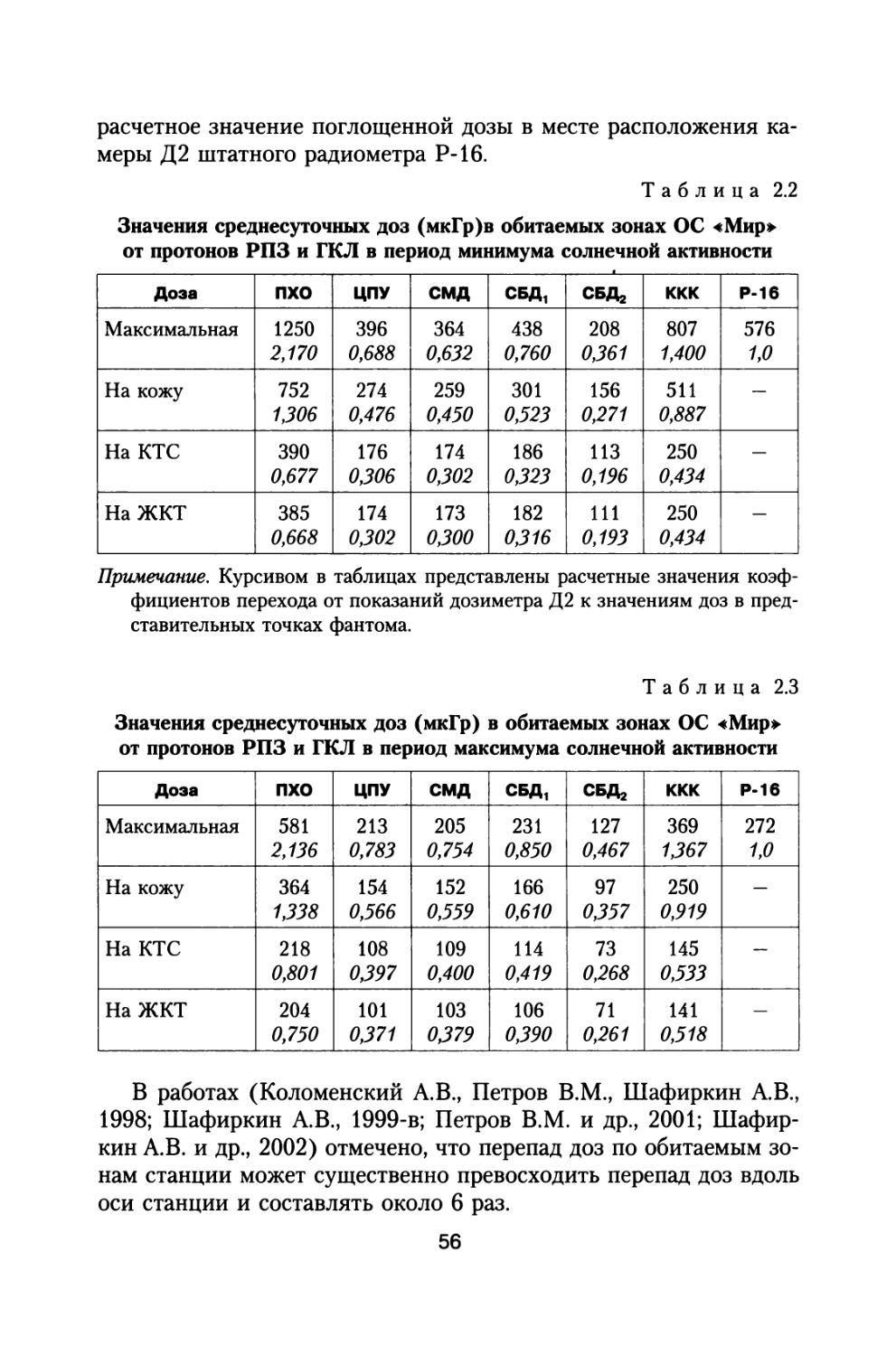
29
В качестве модели тела космонавта в данной работе приняты шаровой и антропоморфный фантомы (ГОСТ 25645.203-83 Модель тела человека., 1984). Представительные точки фантома моделируют расположение жизненно важных органов человека. Точка на глубине 0,1 см от поверхности в шаровом фантоме моделирует кожный покров. Точка на глубине 0,3 см моделирует хрусталик глаза. Точки на глубине 5 и 9 см моделируют соответственно кроветворную систему (КТС) и желудочно-кишечный тракт (ЖКТ). Расчет функций экранированности веществом ткани относительно представительных точек в фантоме может производиться также с помощью алгоритма (ГОСТ 25645.204-83. Методика расчета экранированности, 1984). Координаты точки задаются в сантиметрах в декартовой системе координат, в которой задана геометрия космического корабля. Предполагается, что функция экранированности уже рассчитана для некоторой обитаемой зоны КА. При расчетах доз в точке с заданными координатами используются зависимости «доза — толщина защиты». Это глубинные распределения поглощенной и эквивалентной доз ГКЛ.
Зависимость (1.5) была реализована в виде программы SVERTKA. Исходными данными для задания модели КА обычно служат геометрические данные и данные по распределению масс, получаемые из конструкторской документации. Поскольку использование конструкторской документации для КА марсианской экспедиции в настоящее время пока еще не представляется возможным, в качестве модели КА принята сферическая оболочка с постоянной защитой во всех направлениях.
В нормативно-технических документах (ГОСТ 25645.214-85. БРЭКАКП, 1986; ГОСТ 25645.215-85. БРЭКАКП, 1986; ГОСТ 25645.219-90. БРЭКАКП, 1991) показано, что радиобиологические эффекты в ближайшем пострадиационном периоде, в том числе радиационный риск в процессе полета определяются не столько среднетканевой эквивалентной дозой D, сколько равноценной эквивалентной дозой G, алгоритм вычисления которой представлен в работе (ГОСТ 25645.219-90. БРЭКАКП, 1991). Были проведены расчеты равноценной дозы для стандартизованных шарового и антропоморфного фантомов, представляющих модели тела человека (ГОСТ 25645.203-83 Модель тела человека, 1984). Как указывалось в работе (ГОСТ 25645.219-90. БРЭКАКП, 1991), при воздействии с малыми значениями мощностей доз до 5 сЗв/сут величина равноценной дозы совпадает со среднекостно
30
мозговой дозой DKM. Расчеты среднекостномозговой дозы для антропоморфного фантома проводили на основе вычисления эквивалентных доз в представительных точках кроветворной ткани (ГОСТ 25645.203-83 Модель тела человека, 1984) с учетом относительной доли активного красного костного мозга, представленной в (ГОСТ 25645.219-90. БРЭКАКП, 1991).
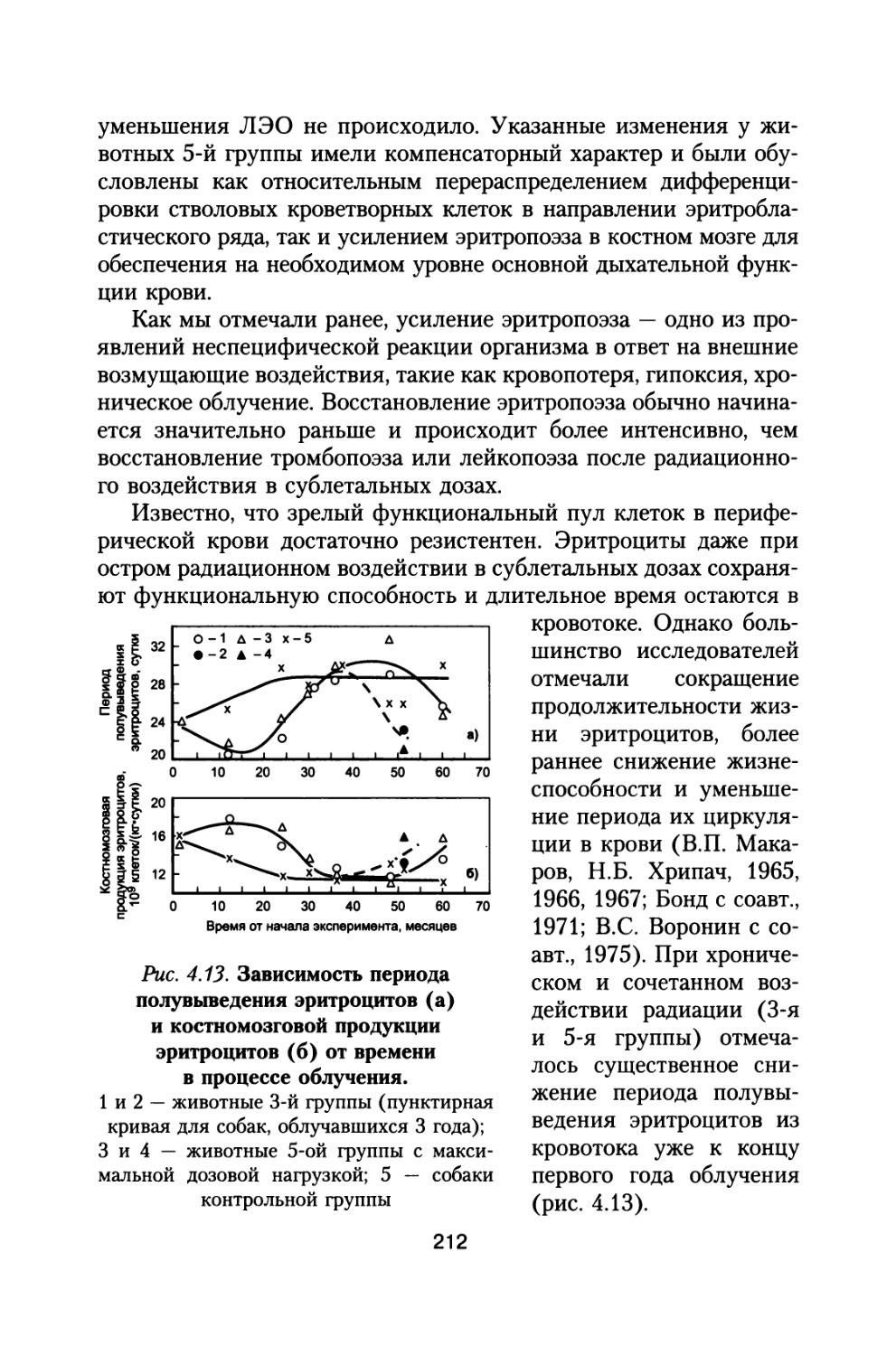
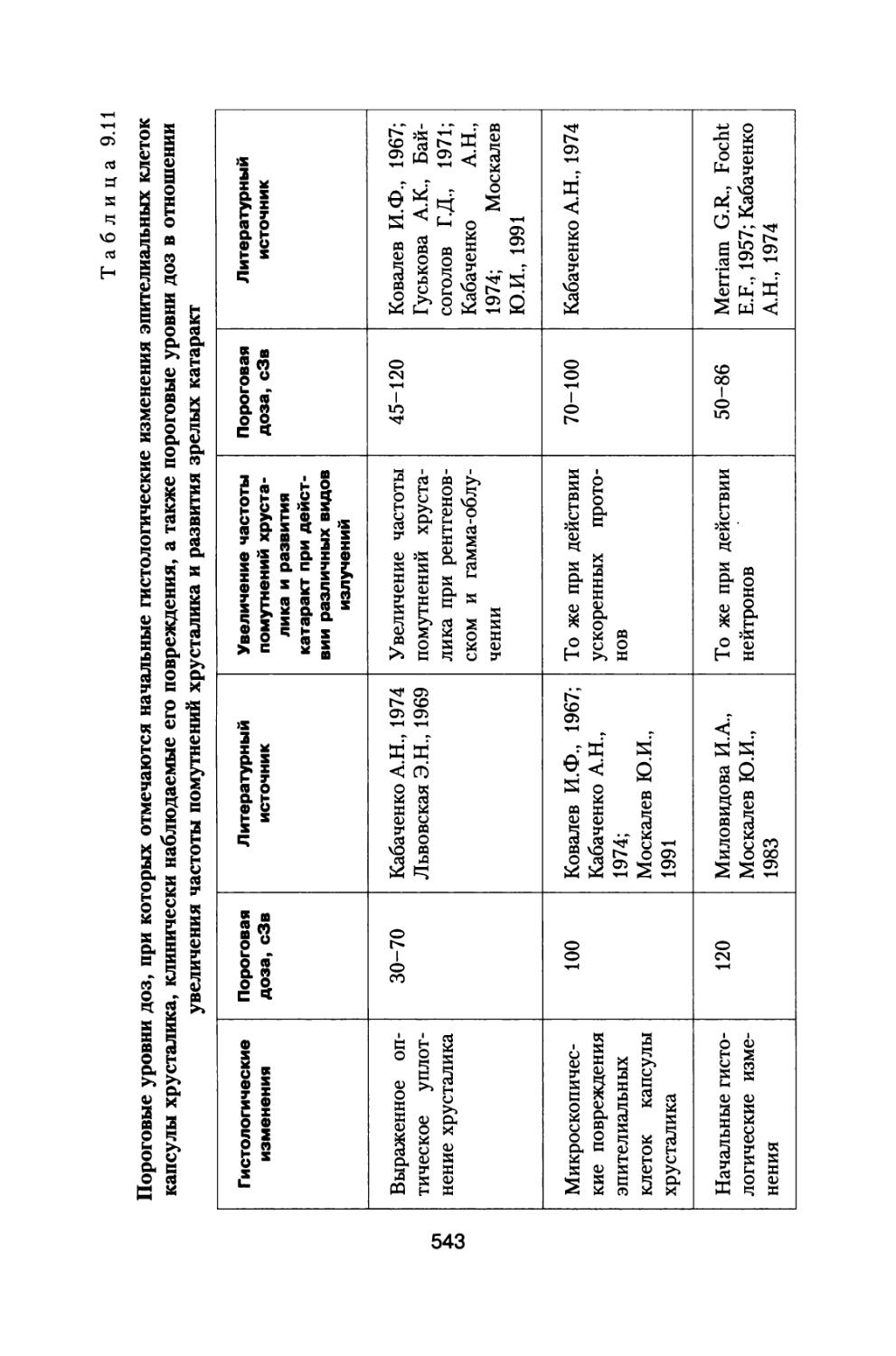
На рис. 1.2 представ
лены рассчитанные за различными толщинами защиты КА величины эквивалентных доз на кожу, костный мозг и среднетканевые дозы от ГКЛ в период минимума СА при использовании шарового и антропоморфного фантомов по отношению к ло
—х— Dn (локальная) a Qk (кожа)
—+— Dkm (шаровой фант.)
—ж— Gkm (антроп. фант.) D (среднеткан.)
—о— D/Dkm
Рис. 1.2. Эквивалентные дозы на кожу, костный мозг для шарового и антропоморфного фантомов и среднетканевая доза по отношению к локальной эквивалентной дозе в отсутствии фантома при межпланетном полете в период минимума СА.
По оси абсцисс — толщина защиты КА, г/см2, по оси ординат — эквивалентные дозы в относительных единицах
кальным эквивалентным дозам в отсутствии фантомов. Кроме того, представлено также отношение среднетканевой и среднекостномозговой мощностей доз.
Как видно из данных, представленных на рисунке, значения равноценной эквивалент
ной дозы для антропо-
морфного фантома не-
сколько превышают аналогичные величины для шарового фантома, однако это превышение для всех толщин защиты не более, чем на 10%. Следует также отметить, что значения мощности среднетканевой эквивалентной дозы отличаются не более, чем на 10% от
мощности дозы в костном мозге для шарового фантома. В дальнейшем среднетканевые дозы от различных источников космических излучений используется нами для определения обобщенных доз и расчетов суммарного радиационного риска в течение всей жизни космонавтов (см. разд. 6 и 8).
31
При проведении этих расчетов (Шафиркин А.В., Венедиктова В.П., 1999а; Шафиркин А.В., 1999в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004) была использована зависимость среднетканевой эквивалентной дозы ГКЛ от толщины защиты для межпланетного полета в период минимума СА, полученная для стандартизованного шарового фантома в работе (Dudkin V.E., Kovalev Е.Е., Kolomensky A.V. et al., 1992. Эта зависимость имеет вид
D(x) = Т [41,5 ехр(-х/2,8) + 48 ехр(-х/85,5)], (1.8)
где D(x) — среднетканевая эквивалентная доза, сЗв; Т — длительность полета, годы; X — толщина защиты из алюминия, г/см2.
1.3. Алгоритм расчета и определение дозовых нагрузок от ГКЛ на различные органы космонавтов при межпланетном космическом полете
в период максимума СА
В разд. 1.2 представлены глубинное распределение мощностей эквивалентных доз от ГКЛ в свободном пространстве в периоде минимума СА за плоской защитой в отсутствии фантома, представляющего модель тела человека, методика расчета мощностей доз на критические органы и ткани при использовании стандартизованных фантомов (сферического и антропоморфного), а также мощности среднетканевой эквивалентной дозы от ГКЛ. Эти дозиметрические функционалы необходимы для определения обобщенной дозы и радиационного риска как в процессе полета, так и в отдаленном послеполетном периоде.
Поскольку величины эквивалентных доз для различных тканей в случае использования антропоморфного фантома не очень отличались от значений для стандартизованного шарового фантома, в настоящем разделе проведены расчеты мощностей доз на критические органы и системы организма космонавта от источников космического излучения в межпланетном пространстве в периоде максимума СА при использовании наиболее простой сфе
32
рической формы защиты космического аппарата и шарового стандартизованного фантома в качестве модели тела человека.
В соответствии с методикой расчета поглощенных и эквивалентных доз от ГКЛ, представленной выше, используя глубинное распределение мощностей локальных доз за защитой из алюминия для периода максимума СА, были рассчитаны для этого периода значения мощности эквивалентной дозы на кроветворную ткань (представительная точка на глубине 5 см), мощности эквивалентной дозы на кожу (глубина 0,1 см), а также мощности среднетканевой эквивалентной дозы. Расчеты показали, что при использовании стандартизованного шарового фантома значения мощности эквивалентной дозы на хрусталик глаза (глубина 0,3 см) практически совпадают со значениями мощностей доз для кожи. В табл. 1.3 представлены рассчитанные значения мощности локальной эквивалентной дозы, мощностей эквивалентных доз для указанных органов и тканей, а также мощность среднетканевой эквивалентной дозы за различными толщинами защиты космического аппарата. В числителе представлены абсолютные значения (сЗв/сут), в знаменателе — относительные величины.
Как видно из данных, представленных в табл. 1.3, при реальных толщинах защиты космического аппарата (более 10 г/см2) доза на кожу (и хрусталик глаза) составляет в среднем 0,83 от локальной дозы, а доза на кроветворную ткань соответственно 0,75 от локальной дозы. В разд. 1.2 нами показано, что значение среднетканевой дозы от ГКЛ незначительно отличается от среднекостномозговой дозы (различие менее 10%). Эта же закономерность наблюдается и при полетах в периоды максимума СА.
При проведении последующих расчетов с целью получения максимальных оценок радиационного риска для космонавтов в процессе полета и в течение жизни нами была использована зависимость среднетканевой эквивалентной дозы от ГКЛ для межпланетного полета в период максимума СА, полученная для стандартизованного шарового фантома (Dudkin V.E., Kovalev Е.Е., Kolomensky A.V. et al., 1992). Эта зависимость имеет вид
D(x)= Т [5 ехр(-х/6,45) + 24 ехр(-х/85,5)], (1.9)
где D(x) — среднетканевая эквивалентная доза, сЗв; Т — длительность полета, годы; X — толщина защиты из алюминия, г/см2.
33
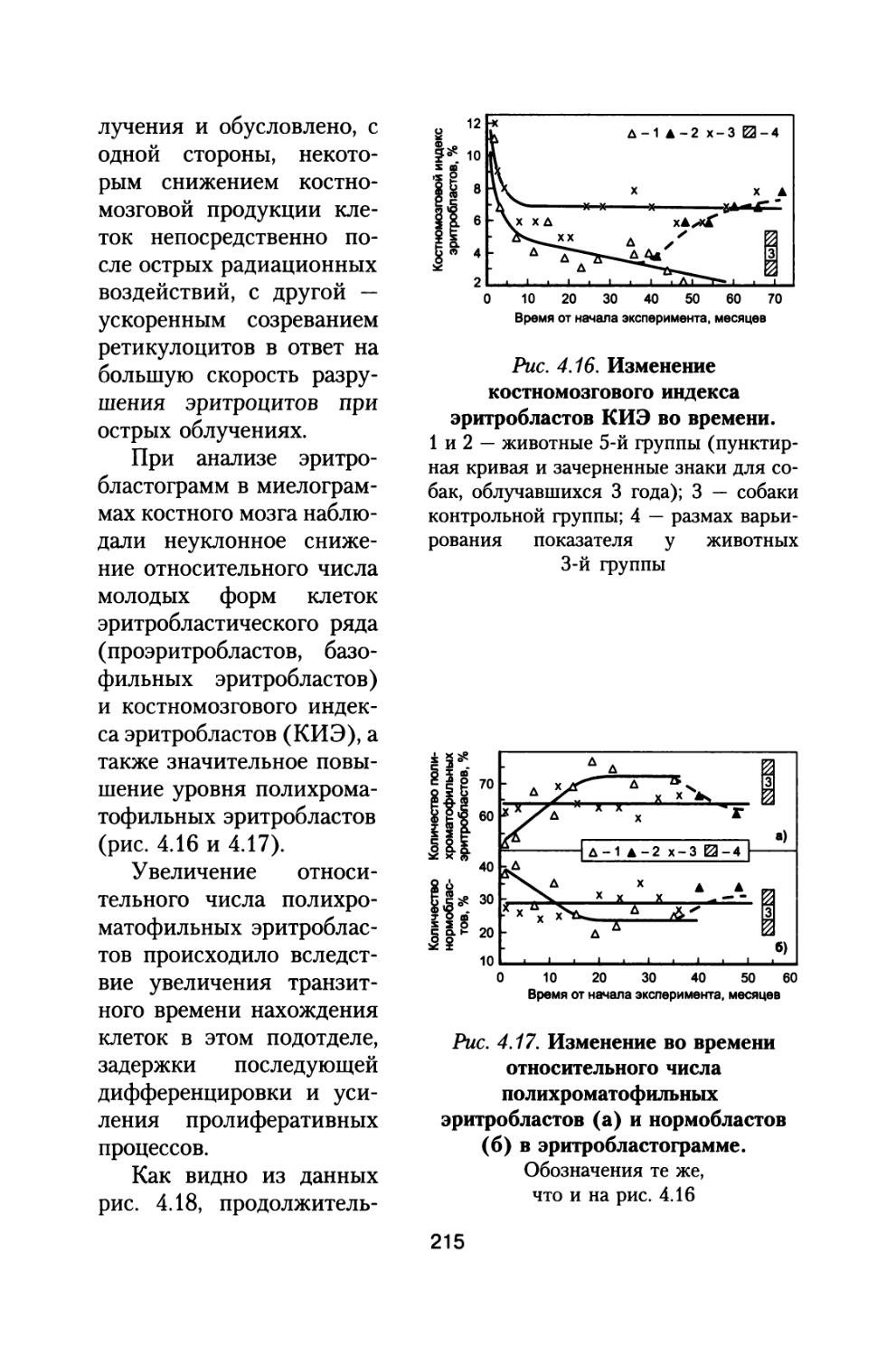
Таблица 1.3
Абсолютные (сЗв/сут) значения мощностей локальных эквивалентных доз от ГКЛ, а также мощностей доз на кожу и кроветворную ткань для различных толщин защиты космического аппарата при осуществлении межпланетного полета в период максимума СА
Доэовый функционал Толщина защиты, г/см2
1 5 10 20 30 50
Мощность локальной эквивалентной дозы (сЗв/сут), относительная 0,0822 1 0,0696 1 0,0606 1 0,0490 1 0,0427 1 0,0296 1
Мощность эквивалентной дозы на кожу абсолютная (сЗв/сут), относительная 0,0646 0,786 0,0567 0,815 0,0502 0,828 0,0411 0,839 0,0356 0,835 0,0246 0,831
Мощность эквивалентной дозы на кроветворную ткань абсолютная (сЗв/сут), относительная 0,0518 0,630 0,0479 0,688 0,0437 0,721 0,0372 0,759 0,0322 0,755 0,0223 0,753
Примечание. Курсивом представлены величины доз по отношению к локальной дозе.
При полете в этот период при небольших толщинах защиты космического аппарата основную опасность могут представлять стохастические солнечные протонные события. Для решения вопросов обеспечения безопасности полетов необходимо осуществить также расчеты дозовых нагрузок на различные органы и ткани от СКЛ.
1.4. Определение дозовых нагрузок на различные органы космонавтов при межпланетном космическом полете в период максимума СА от солнечных космических лучей (СКЛ)
Процедура расчета поглощенной и эквивалентной дозы от СКЛ в представительных точках фантома, размещаемого в различных от
34
секах космического аппарата, состоит, как было описано выше, из трех последовательных процедур:
• расчета глубинного распределения дозы заданного спектра заряженных частиц, нормально падающих на плоский слой тканеэквивалентного вещества;
• расчета функции экранированности представительной точки в фантоме внутри КА;
• интегрирования произведения функции экранированности представительной точки на глубинное распределение дозы (РД 50-25645.208-84. Методика расчета поглощенной дозы, 1986).
Доза D(r) в представительной точке фантома г определяется по формуле (1.4), в которой D(x) — зависимость дозы СКЛ от толщины плоского слоя алюминия; W(x, г) — функция экранированности в расчетной точке г, определяется по формуле (1.5) (операция свертки функций), где W^y, г) — функция экранированности критического органа телом человека; W2(y, г) — функция экранированности защитой КА. Предполагается также, как описано выше, случайная ориентация фантома внутри КА. При этом выбранная точка внутри защищаемой зоны космического аппарата и точка внутри фантома совмещаются. Для учета различия в защитных свойствах тканеэквивалентного вещества и веществ, входящих в защиту, для каждого из таких веществ вводится коэффициент эквивалентности который вычисляется по формуле (1.6). Алгоритм расчета поглощенной дозы протонов с учетом продуктов ядерных взаимодействий изложен в руководящем документе Госстандарта (РД 50-25645.208-86. Методика расчета поглощенной дозы.., 1986).
Эквивалентная доза Н(х) за защитой толщиной х, на которую падает единичный спектр протонов солнечных космических лучей (протон/см2), определяется следующим образом:
Н(х) = Ф J F(x, Е) х G(E') х Q[S(E')] dE', (1.10)
где Е' — энергия протона на глубине х; Е — энергия протона, падающего на защиту; Ф — флюенс протонов; G(E') = = 1,6х1О“10 xS(E') — коэффициент перехода от потока к поглощенной дозе, Гр/МэВ х г/см2; S(E') — ионизационные потери протонов;
35
F(x, E ) = [S(E)/S(E')J x F(0, E),
(1-11)
где F(0, E) — дифференциальный спектр протонов, падающих на поверхность слоя, нормированный на единичный протон; Q[S(E')] — зависимость коэффициента качества от ионизационных потерь протонов (ГОСТ 25645.218-90).
Были проведены расчеты эквивалентных доз в шаровом и антропоморфном фантомах в зависимости от характеристической жесткости спектра протонов и толщины защиты из алюминия. Использована модель спектра СКЛ, изложенная в (ГОСТ 25645.134-86 Лучи космические солнечные, 1986). Расчеты проведены для значений характеристической жесткости 50; 80; 100; 150 и 200 МВ. Эти значения охватывают практически весь диапазон солнечных протонных событий, которые будут воздействовать на экипажи КА при межпланетном полете. Значения толщины защиты приняты равными 1; 5; 10; 20; 30 и 50 г/см2.
Расчеты доз на хрусталик глаза, кожу, кроветворную ткань и желудочно-кишечный тракт (ЖКТ) проводили по методике, описанной выше. Для определения среднекостномозговых и равноценных доз использовали соотношения, представленные в нормативном документе (ГОСТ 25645.219-90 БРЭКАКП, 1991). Там же представлены данные по относительному распределению активного красного костного мозга по скелету человека.
Поскольку стационарные и переносные бортовые дозиметры и другая аппаратура, входящая в систему радиационного мониторинга внутри КА, в значительной степени могут контролировать лишь локальную поглощенную и эквивалентную дозы за защитой КА (в условиях отсутствия фантома), важно установить, в какой степени расчетные дозы в различных органах и тканях соотносятся с локальной дозой.
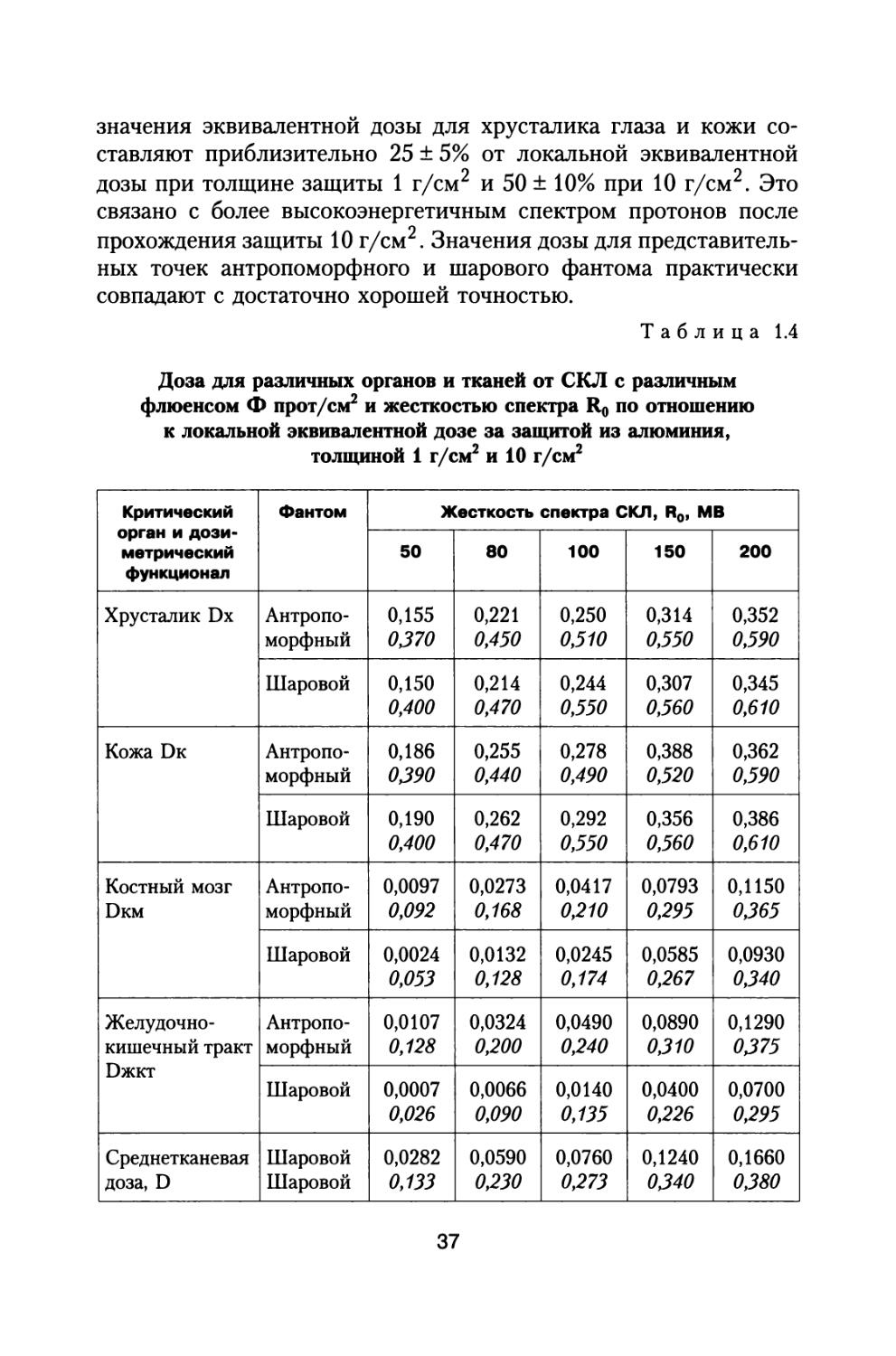
В табл. 1.4 представлены рассчитанные значения доз для различных органов и тканей от СКЛ с различным флюенсом Ф прот/см2 и жесткостью спектра Ro при использовании антропоморфного (А) и шарового (Ш) фантомов модели тела человека по отношению к локальной эквивалентной дозе за защитой из алюминия, толщиной 1 и 10 г/см2.
Как видно из данных, представленных в табл. 1.4, для наиболее вероятных значений жесткости спектра Ro (в диапазоне 80-100 МВ (ГОСТ 25645.134-86 Лучи космические солнечные, 1986)
36
значения эквивалентной дозы для хрусталика глаза и кожи составляют приблизительно 25 ± 5% от локальной эквивалентной дозы при толщине защиты 1 г/см2 и 50 ± 10% при 10 г/см2. Это связано с более высокоэнергетичным спектром протонов после прохождения защиты 10 г/см2. Значения дозы для представительных точек антропоморфного и шарового фантома практически совпадают с достаточно хорошей точностью.
Таблица 1.4
Доза для различных органов и тканей от СКЛ с различным флюенсом Ф прот/см2 и жесткостью спектра Ro по отношению к локальной эквивалентной дозе за защитой из алюминия, толщиной 1 г/см2 и 10 г/см2
Критический орган и дозиметрический функционал Фантом Жесткость спектра СКЛ, Ro, МВ
50 80 100 150 200
Хрусталик Dx Антропоморфный 0,155 0370 0,221 0,450 0,250 0,510 0,314 0,550 0,352 0,590
Шаровой 0,150 0,400 0,214 0,470 0,244 0,550 0,307 0,560 0,345 0,610
Кожа Dk Антропоморфный 0,186 0390 0,255 0,440 0,278 0,490 0,388 0,520 0,362 0,590
Шаровой 0,190 0,400 0,262 0,470 0,292 0,550 0,356 0,560 0,386 0,610
Костный мозг Dkm Антропоморфный 0,0097 0,092 0,0273 0,168 0,0417 0,210 0,0793 0,295 0,1150 0,365
Шаровой 0,0024 0,053 0,0132 0,128 0,0245 0,174 0,0585 0,267 0,0930 0,340
Желудочно-кишечный тракт Эжкт Антропоморфный 0,0107 0,128 0,0324 0,200 0,0490 0,240 0,0890 0,310 0,1290 0375
Шаровой 0,0007 0,026 0,0066 0,090 0,0140 0,135 0,0400 0,226 0,0700 0,295
Среднетканевая доза, D Шаровой Шаровой 0,0282 0,133 0,0590 0,230 0,0760 0,273 0,1240 0340 0,1660 0,380
37
Продолжение табл. 1.4
Критический орган и дозиметрический функционал Фантом Жесткость спектра СКЛ, Ro, МВ
50 80 100 150 200
Равноценная доза G, Ф = 2 х 108 Антропоморфный 0,0097 0,092 0,00273 0,168 0,0417 0,0793 0,1150
2 х 109 Антропоморфный 0,0086 0,092 0,0243 0,168 0,0340 0,210 0,0611 0,295 0,0870 0,565
5 х 109 Антропоморфный 0,0064 0,092 0,0160 0,168 0,0244 0,210 0,0495 0,230 0,0750 0,280
1 х 1О10 Антропоморфный 0,0044 0,0132 0,0215 0,185 0,0463 0,195 0,0720 0,242
5 х 1О10 Антропоморфный 0,0026 0,0094 0,0173 0,0360 —
1 х 1011 Антропоморфный 0,0018 — — — —
Примечание. Для 10 г/см2 значения представлены курсивом.
Значение среднекостномозговой дозы Dkm для антропоморфного фантома для наиболее вероятной жесткости спектра протонов при малой толщине защиты почти в 2 раза превышает значение дозы для представительной точки КТС шарового фантома. По-видимому, точка на глубине 5 см в шаровом фантоме недостаточно точно представляет среднекостномозговую дозу от СКЛ за малыми защитами. Реально представительная точка кроветворной ткани в шаровом фантоме при воздействии СКЛ должна располагаться ближе к поверхности фантома на глубине приблизительно 3 см.
При толщине защиты 10 г/см2, в связи с большей жесткостью спектра протонов, значения среднекостномозговых доз, рассчитанные для антропоморфного фантома, по отношению к локальной дозе превышают расчетные значения для шарового фантома лишь на 20-30%. В этом случае представительная точка для кроветворной ткани в шаровом фантоме находится на глубине около 4 см.
38
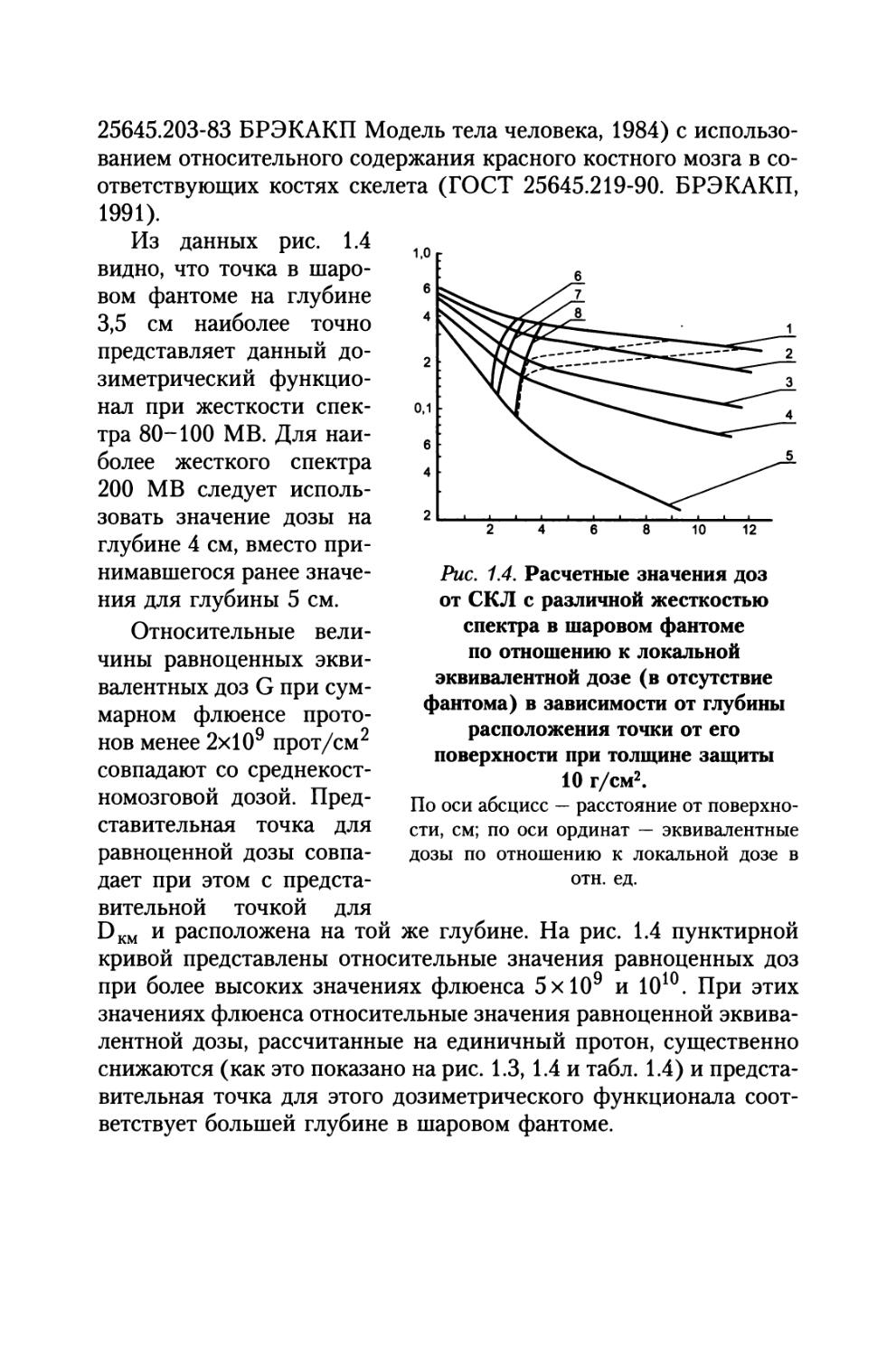
Расчетные значения дозы для представительной точки желудочно-кишечного тракта, в случае использования антропоморфного фантома являются значительно более высокими (точка N 14), чем при использовании представительной точки в шаровом фантоме на глубине 9 см при обеих толщинах защиты (ГОСТ 25645.203-83 Модель тела человека, 1984). Различие составляет 2-2,2 раза при толщине защиты 10 г/см2 и 3-5 раз за малой толщиной защиты. Вопрос представительства этой точки для ЖКТ требует дальнейшего исследования.
Среднетканевая доза для наиболее вероятного спектра СКЛ и более вероятной толщины защиты 10 г/см2 составит приблизительно 25% от локальной эквивалентной дозы. Она превышает значение среднекостномозговой дозы в 1,6-1,8 раза. Представительная точка для среднетканевой дозы и стандартизованного шарового фантома соответствует глубинам 2-2,5 см.
Равноценная эквивалентная доза G, приводящая эффекты неравномерного распределения доз по телу к условиям равномерного облучения (ГОСТ 25645.219-90. БРЭКАКП, 1991), для флюенсов протонов < 2 х 108 прот/см2 совпадает со среднекостномозговой дозой и является меньшей, чем среднетканевая доза. Поэтому значение коэффициента равноценности радиационного воздействия КР = G/D является меньшим единицы. Для солнечных вспышек с большим интегральным флюенсом по мере увеличения его значения, как видно из данных табл. 1.4, величина равноценной дозы относительно локальной дозы уменьшается. Снижаются также значения коэффициентов равноценности радиационного воздействия КР. Это находится в полном соответствии с данными, представленными в указанном выше нормативно-техническом документе.
На рис. 1.3 представлена зависимость коэффициента равноценности радиационного воздействия, равного отношению равноценной к среднеткавневой дозе (КР = G/D).
Отчетливо можно видеть снижение значений коэффициентов КР при увеличении значений флюенсов протонов, начиная с некоторого граничного потока 108 прот/см2. В наибольшей степени это относится к СПС с малыми величинами жесткости спектра. При увеличении толщины защиты КА, как показано на рисунке, значения коэффициента равноценности радиационного воздействия увеличиваются и приближаются к 1,0.
39
Рис. 1.3. Зависимость коэффициента равноценности радиационного воздействия КР = G/D от величины флюенса протонов СКЛ и РПЗ.
По оси абсцисс — число протонов на 1 см2; по оси ординат — значения КР, отн. ед. Кривые 1, 2, 3, 4 и 5 для протонов с характеристической жесткостью спектра Ro, равной 50, 80, 100, 150 и 200 МВ. Сплошные кривые для толщины защиты 1 г/см2, пунктирные — для 10 г/см2
На рис. 1.4 представлен характер изменения расчетных значений доз от СКЛ с различной жесткостью спектра по отношению к локальной эквивалентной дозе в зависимости от глубины расположения рассматриваемой точки от поверхности шарового фантома при толщине защиты КА, равной 10 г/см2. Кривые 1, 2, 3, 4 и 5 представляют дозы от СКЛ с характеристической жесткостью спектра Ro, равной соответственно 200, 150, 100, 80 и 50 МВ.
Кривая 6 представляет относительное значение
среднетканевой эквивалентной дозы D. Для наиболее вероятного спектра СКЛ представительная точка на глубине 2,5 см может, по-видимому, в наибольшей степени представлять этот дозиметрический функционал. Точки шарового фантома, соответствующие глубине 0,1 и 0,3 см, достаточно точно соответствуют относительным до
зам для кожи и хрусталика, рассчитанным для представительных точек этих тканей в антропоморфном фантоме.
Кривая 7 представляет относительное значение дозы для желудочно-кишечного тракта ЭЖКт> рассчитанное для представительной точки N 14 антропоморфного фантома (ГОСТ 25645.203-83. БРЭКАКП Модель тела человека, 1984). Представительная точка для этих тканей в шаровом фантоме должна располагаться на глубине 2,5-3 см вместо 9 см.
Кривая 8 представляет относительное значение среднекостномозговой дозы DKM, рассчитанное на основе 14 представительных точек кроветворной ткани в антропоморфном фантоме (ГОСТ
40
25645.203-83 БРЭКАКП Модель тела человека, 1984) с использо-
ванием относительного содержания красного костного мозга в соответствующих костях скелета (ГОСТ 25645.219-90. БРЭКАКП, 1991).
Из данных рис. 1.4 видно, что точка в шаровом фантоме на глубине 3,5 см наиболее точно представляет данный дозиметрический функционал при жесткости спектра 80-100 МВ. Для наиболее жесткого спектра 200 МВ следует использовать значение дозы на глубине 4 см, вместо принимавшегося ранее значения для глубины 5 см.
Относительные величины равноценных эквивалентных доз G при суммарном флюенсе протонов менее 2х109 прот/см2 совпадают со среднекостномозговой дозой. Представительная точка для равноценной дозы совпа-
Рис. 1.4. Расчетные значения доз от СКЛ с различной жесткостью спектра в шаровом фантоме по отношению к локальной эквивалентной дозе (в отсутствие фантома) в зависимости от глубины расположения точки от его поверхности при толщине защиты 10 г/см2.
По оси абсцисс — расстояние от поверхности, см; по оси ординат — эквивалентные дозы по отношению к локальной дозе в
дает при этом с предста- отн. ед.
вительной точкой для
DKM и расположена на той же глубине. На рис. 1.4 пунктирной кривой представлены относительные значения равноценных доз при более высоких значениях флюенса 5х109 и 1010. При этих значениях флюенса относительные значения равноценной эквивалентной дозы, рассчитанные на единичный протон, существенно снижаются (как это показано на рис. 1.3, 1.4 и табл. 1.4) и представительная точка для этого дозиметрического функционала соответствует большей глубине в шаровом фантоме.
ОСНОВНЫЕ ИСТОЧНИКИ РАДИАЦИОННОЙ ОПАСНОСТИ И ДОЗОВЫЕ НАГРУЗКИ
□ НА КОСМОНАВТОВ ПРИ ПОЛЕТАХ НА ОРБИТАЛЬНЫХ СТАНЦИЯХ «МИР» И МКС
2.1 Основные источники радиационной опасности при орбитальных космических полетах
На экипаж космического аппарата в космическом полете воздействует излучение сложного состава, преимущественно состоящее из заряженных частиц (протоны, электроны, ядра гелия, лития, бериллия и т.д. вплоть до ядер урана). Важная особенность космических излучений — широкий энергетический спектр заряженных частиц, простирающийся от десятков кэВ до тысяч ГэВ. Основными источниками радиационной опасности в космическом пространстве (естественного происхождения) для орбиты станций «Мир» и МКС (наклонение орбиты 52°, высота орбиты около 400 км) являются ГКЛ, радиационные пояса Земли и солнечные космические лучи особенно при выходах в открытый космос и возмущениях магнитного поля (Мирошниченко Л.И., Петров В.М., 1985; Авакян С.В., Вдовин А.И., Пустарнаков В.Ф., 1994). Для описания потоков частиц этих излучений, необходимого для последующей оценки их радиационной опасности, используются следующие основные понятия:
• зарядовый состав, отражающий процентное содержание частиц данного типа в суммарном потоке частиц разных типов;
• энергетический спектр частиц, характеризующий распределение частиц космических излучений данного типа по различным энергетическим диапазонам;
• угловое распределение частиц, описывающее распределение потока частиц космических излучений по различным направлениям прихода к облучаемому объекту;
• спектр линейной передачи энергии (ЛПЭ-спектр), характеризующий в данном случае эффективность поражения биологи
42
ческой ткани (коэффициент качества излучения определяется как функция от ЛПЭ).
Следует учитывать, что определенный вклад в поглощенную и эквивалентную дозу вносит также вторичное излучение (нейтроны, протоны, вторичные ядра), возникающее в защите космического аппарата и в теле космонавтов.
Галактические космические лучи
Как отмечалось в разд. 1.1, ГКЛ являются постоянно действующим источником космической радиации. Они состоят на 98% из тяжелых частиц (протоны и частицы с зарядом z > 2) и на 2% из электронов. Протоны (Z = 1) составляют 85% от полного состава частиц ГКЛ, ядра гелия (Z = 2) — 14%, ядра с Z > 3 — около 1% (Дорман Л.И., 1975).
Ядра с Z > 3 разделяются на группы: группа легких ядер (3<Z< 5, представительное ядро 4Вед), группа средних ядер (6< Z < 9, представительное ядро 7N14), группа тяжелых ядер (10 < Z < 19, представительное ядро 14 Si28) и группа очень тяжелых ядер (Z>20, представительное ядро 26Fe56). Наиболее изучен интервал энергий ГКЛ от нескольких десятков МэВ/нуклон до десятков ГэВ/нуклон, максимум спектров ГКЛ находится в области 200-500 МэВ/нуклон. Интегральный поток ГКЛ в межпланетном пространстве изменяется под действием солнечной модуляции и вблизи орбиты Земли составляет (1,8-4,5) см“2 с"1. В околопланетном пространстве из-за экранирующего действия тела планеты и планетарного магнитного поля эти величины могут быть существенно меньше. Поток частиц ГКЛ на орбите Земли вне ее магнитосферы считается изотропным.
Средний коэффициент качества частиц ГКЛ оценивается в 2,5-3,5 в зависимости от толщины защиты и условий облучения (Badhwar G.D. et al., 1994). Дифференциальные энергетические спектры ГКЛ вне магнитосферы Земли для заданного момента времени 22-летнего цикла солнечной активности могут быть представлены в аналитическом виде. Спектры частиц ГКЛ в момент времени t в жесткостном представлении вычисляют в соответствии с (ГОСТ 25645.150-90. БРЭКАКП Лучи космические галактические, 1991) по формуле
43
Fi (R, t) = {[Di x (P)«i) ] / (R)Yi} x {R / [R + R0(t)]}д < <*>, (2.1)
где R — жесткость частиц, ГВ; t — момент времени, для которого проводят расчет, год; Р — отношение скорости частицы к скорости света в вакууме; Dj, a j, Yi, Aj (t) — параметры для каждого вида частиц, определяемые по таблицам и соотношениям из (ГОСТ 25645.150-90. БРЭКАКП Лучи космические галактические, 1991). Характерные значения показателя жесткостного спектра Yi = 2,6-2,9.
На низких околоземных орбитах (h < 500 км) уровень радиационного воздействия, обусловленный ГКЛ, зависит в основном от наклонения орбиты КА и в меньшей степени от высоты. Влияние геомагнитного поля на ГКЛ описывается вероятностью того, что частица с заданной жесткостью может проникнуть через магнитное поле Земли и достигнуть КА (Дорман Л.И., 1975). По разным оценкам (Дудкин В.Е., Ковалев Е.Е., Коломенский А.В., Сакович В.А., 1989), поглощенная и эквивалентная дозы от ГКЛ в тканеэквивалентном веществе на орбитах станций «Мир» и МКС за защитой 10 г/см2 А1 составят в период минимума С А, около 60-90 мкГр/сутки и 150-200 мкЗв/сутки соответственно, а в период максимума СА 40-60 мкГр/сутки и 100- 150 мкЗв/сутки. Как следует из приведенных выше оценок, дозы от ГКЛ на околоземных орбитах в период минимума С А приблизительно в 1,5 раза больше, чем в период максимума СА.
Современные методы расчета (Дудкин В.Е., Ковалев Е.Е., Коломенский А.В., Сакович В.А., 1989; ГОСТ 25645.150-90. Лучи космические галактические, 1991; Badhwar G.D. et al., 1994), основанные на транспортной барионной модели, позволяют надежно предсказывать среднесуточные дозы ГКЛ на околоземных орбитах при условии корректного задания функции экранированности рассматриваемой точки.
Радиационные пояса Земли
Радиационные пояса Земли образованы заряженными частицами с энергиями от 50 кэВ до 1000 МэВ, захваченными геомагнитным полем. Из них 98% составляют электроны и протоны. Энергетический спектр протонов РПЗ для характерной орбиты станций «Мир» и МКС может быть аппроксимирован в следующем виде (Авакян С.В., Вдовин А.И., Пустарнаков В.Ф., 1994):
44
Jp(>E) - (E)-Y,
(2.2)
где у = 1,2 для 1 МэВ < Ep < 15 МэВ
и у = 0,43 для 15 МэВ < Ер < 100 МэВ.
Характерной особенностью частиц РПЗ является резкая анизотропия их углового распределения. Превалируют потоки частиц, направленные преимущественно перпендикулярно вектору магнитной индукции:
<U/dQ = (Sina)k, (2.3)
где a — питч угол частицы (угол между вектором магнитной индукции и вектором скорости частицы); к = (5 4-15). Кроме того, на высоте полета орбитальных станций имеет место западно-восточная асимметрия потоков захваченных протонов: поток протонов, приходящий с западного направления, может в несколько раз превышать поток с восточного направления (Бенгин В.В., Петров В.М., Шуршаков В.А., 1993.)
Потоки частиц РПЗ подвержены вариациям от десятков процентов до двух-трех порядков величины в зависимости от типа частиц, их энергии и степени возмущенное™ магнитосферы (Авакян С.В., Вдовин А.И., Пустарнаков В.Ф., 1994), характеризуемой, например, Кр-, Ар- или Dst-индексами. Потоки частиц РПЗ сильно зависят от высоты орбиты. Кроме того, из-за смещения центра геомагнитного диполя относительно центра Земли и наличия геомагнитных аномалий поток частиц РПЗ сильно меняется вдоль трассы полета орбитальных станций «Мир» и МКС (на фиксированной высоте полета), достигая максимума в районе Южно-Атлантической аномалии (ЮАА).
Средний коэффициент качества частиц РПЗ внутри станций оценивается в 1,4+ 2,0 для разных участков траектории полета. Снаружи станции значения коэффициентов качества могут быть выше.
Систематизация данных по энергетическим спектрам частиц в магнитосфере Земли проведена в созданных в США модельных описаниях АР8 и АЕ8 (Sawyer D.W., Vette J.I., 1976; Bilitza D., 1987) и в аналогичных им российских моделях (ГОСТ 25645.138-86. Пояса Земли радиационные естественные, 1986; ГОСТ 25645.139-86. Пояса Земли радиационные естественные, 1986). В этих моделях плотность потока электронов и протонов J
45
определяется для фазы минимума и максимума солнечной активности в зависимости от трех переменных: энергии частицы Е, индукции геомагнитного поля В и параметра магнитной оболочки L, отображающих потоки захваченных частиц в «естественной» геомагнитной системе BL — координат (McIlwain С.Е., 1966). К серьезным недостаткам используемых моделей можно отнести то, что угловое распределение частиц в них принимается изотропным, а потоки—независящими от уровня геомагнитной возмущенное™.
Характеристики моделей радиационных условий в РПЗ, разработанных в России и в США сопоставляются в табл. 2.1. Как следует из таблицы, модель США несколько шире описывает данные по параметру L, чем модель России. На высоте полета МКС в фазе максимума цикла солнечной активности потоки протонов РПЗ в 1,5-2 раза меньше, чем для фазы минимума. Для потоков электронов РПЗ имеет место обратная зависимость: в фазе максимума СА поток электронов максимален и в фазе минимума — минимален. В отсеках МКС на высоте полета 400 км в отсутствие солнечных протонных событий поглощенная доза, обусловленная РПЗ, составляет 55-75% суммарной и достигает 150-300 мкГр/ сутки.
Отметим, что основной особенностью дозиметрии частиц РПЗ является необходимость учета резкой анизотропии их угловых распределений, сильной пространственной неоднородности потоков частиц вдоль трассы полета станций и наличие вариаций потоков частиц РПЗ, обусловленных возмущенностью магнитосферы.
Таблица 2.1
Характеристики моделей радиационных условий в РПЗ, разработанных в США и в России
Параметры США, электроны Bilitza D., 1987 США, протоны Sawyer D.W., Vette J.I., 1976 Россия, электроны ГОСТ 25645.139-86 Россия, протоны ГОСТ 25645.138-86
L 1,1-11 1,1-7 1,2-6,6 1,2-6,6
Е, МэВ 0,04-7 0,1-400 0,04-4 0,1-1000
В/Во 1-100 1-100 0,005-0,62 0,05-0,38
Примечание. Во — магнитное поле на заданной L-оболочке в экваториальной плоскости.
46
Солнечные космические лучи
Солнечные космические лучи (СКЛ) генерируются в процессе развития вспышек на Солнце (Мирошниченко Л.И., Петров В.М., 1985). Частицы, ускоренные при солнечной вспышке, включают электроны, протоны, альфа-частицы и более тяжелые ядра. Потоки тяжелых ядер пренебрежимо малы по сравнению с потоками протонов. Содержание альфа-частиц значительно меняется от вспышки к вспышке и составляет от 2 до 10% потока протонов СКЛ. По оценкам (Letaw I.R., Clearwater S., 1986) вклад в эквивалентную дозу тяжелых ядер СКЛ и создаваемого ими вторичного излучения за защитой больше 10 г/см2 А1 может существенно превысить вклад первичных протонов, поэтому требуется дальнейшее изучение состава СКЛ и необходимы измерения спектров ЛПЭ СКЛ.
При моделировании радиационной опасности солнечных вспышек обычно учитывают только протоны СКЛ с энергией больше 30 МэВ и события с относительно большим флюенсом протонов за вспышку. Средний коэффициент качества частиц СКЛ по данным измерений на станции «Мир» оценивается в 1,5-2,5 (Petrov V.M. et al., 1993). На распространение протонов СКЛ оказывает влияние плазма и магнитное поле в нижней короне Солнца и межпланетном пространстве, поэтому временной профиль потоков частиц часто бывает очень сложным. Время достижения частицами СКЛ расстояний 1 а.е. составляет в зависимости от их энергии и положения вспышки на Солнце от нескольких десятков минут до нескольких часов. Поток протонов достигает максимума между двумя часами и одними сутками после вспышки и спадает до уровня фона в период от нескольких дней до одной недели.
Динамика и величина потоков СКЛ существенно меняются от события к событию и зависят как от мощности солнечного протонного события (СПС), так и от расстояния по гелиодолготе от координаты вспышки до основания силовой линии регулярного межпланетного магнитного поля, соединяющей КА с поверхностью Солнца (долготное ослабление). Важнейшей характеристикой СПС являются энергетические спектры СКЛ. Наиболее распространенной формой представления энергетического спектра СКЛ является экспоненциальная зависимость в виде:
F(> R) = FR3o exp [(R30 - R)/Ro], (2.4)
47
где R = у Е2 + 1876Е, MB; Ro — характеристическая жесткость спектра; R30 — жесткость при энергии протона 30 МэВ.
Другой довольно распространенной формой представления спектра является степенная зависимость от жесткости в виде:
F(> R) = FR30 [R/R3o1~y- (2.5)
Предполагается, что характеристическая жесткость не зависит от величины флюенса СПС, а плотность распределения СПС по характеристической жесткости представляется логнормальной функцией в интервале значений Ro от 30 до 220 МВ.
На расстоянии 1 а.е. от Солнца (орбита Земли) дозовые нагрузки от вспышек изменяются в пределах от сотых долей до нескольких тысяч сГр за защитой 1 г/см2 А1. Однако вероятность того, что поглощенная доза от солнечной вспышки составит тысячи сГр, не превышает одного процента (Петров В.М., Коломенский А.В., Зиль М.В., 1979). Магнитосфера Земли препятствует проникновению потоков частиц СКЛ на околоземную орбиту. Проникновение СКЛ определяется, как и в случае с ГКЛ, главным образом наклонением орбиты и слабо зависит от ее высоты. Для орбиты станций «Мир» и МКС коэффициент ослабления дозы СКЛ (определяемый как отношение дозы СКЛ вне магнитосферы к поглощенной дозе на орбите) составляет 2 х 102 - 104 в зависимости от характеристической жесткости СКЛ и состояния магнитосферы (Зиль М.В., Коломенский А.В., Петров В.М., 1986). Необходимо также отметить, что для рассматриваемых орбит существуют «опасные» и «защищенные» витки в смысле радиационного воздействия СКЛ, что позволяет в принципе предпринимать специальные меры по защите космонавтов.
В настоящее время отсутствуют методики, позволяющие с требуемой точностью прогнозировать моменты возникновения вспышек на Солнце и обусловленные ими потоки СКЛ, поэтому при прогнозировании уровней радиационного воздействия СКЛ на экипаж при длительных космических полетах используются статистические оценки, основанные на уже имеющихся наблюдениях СПС. Наиболее развитой методикой долгосрочного прогноза радиационной опасности солнечных вспышек является методика, в основе которой лежит статистическая модель, принятая в качестве одного из действующих в России государственных стандартов
48
по радиационной безопасности космических полетов (ГОСТ 25645.134-86 Лучи космические солнечные, 1986. Основными компонентами модели являются функции распределения СПС по флюенсу протонов за событие, по характеристической жесткости спектра СКЛ и функция распределения СПС по времени. Эта модель будет использоваться нами при расчете радиационного риска в процессе межпланетного космического полета к Марсу (см. разд. 7).
Как отмечалось выше, при оценке радиационной опасности
солнечных и галактических космических лучей на околоземных орбитах необходимо учитывать защитный эффект геомагнитного поля. Как показано в работе (Зиль М.В., Коломенский А.В., Петров В.М., 1986), для орбиты станции «Мир» коэффициент ослабления дозы, который равен отношению дозы на орбите к дозе в
межпланетном пространстве при спокойном геомагнитном поле
изменяется от 10~4 для СКЛ с малой характеристической жесткостью (Ro = 40 МВ) до 10"2 при Ro > 150 МВ. Во время умеренных и сильных геомагнитных возмущений дозы от СКЛ возрастают и коэффициент геомагнитного ослабления может составлять от 0,1 до 0,05 (см. рис. 2.1).
В проводимых ранее
Рис. 2.1. Зависимость коэффициента ослабления дозы от СКЛ (К) от интенсивности геомагнитного возмущения U для круговой орбиты высотой 400 км с наклонениями 51 и 65° для толщин защиты 1 и 3 г/см2 (пунктирная кривая).
Кривые 1, 2, 3 и 4 для жесткостей спектров СКЛ 40, 100, 200 и 300 МВ (Зиль М.В., Коломенский А.В., Петров В.М., 1986)
расчетах поглощенных доз и рисков их превышения для случаев межпланетного и орбитального космических полетов для различных толщин защиты космического аппарата и наклонений орбиты методом Монте-Карло разыгры
49
вались моменты возникновения вспышек на Солнце, сопровождающиеся генерацией потока протонов, величины суммарного флюенса за вспышку Ф и характеристическая жесткость спектра Ro. Кроме того, в случае орбитальных полетов разыгрывались также вероятность совпадения момента вспышки и магнитного возмущения (магнитной бури), а также интенсивность магнитной бури (Петров В.М., Коломенский А.В., Зиль М.В., 1979; Зиль М.В., Коломенский А.В., Петров В.М., 1986). В этих расчетах использовали модельные представления, касающиеся радиационной опасности от СКЛ, проводились оценки возможных значений доз при осуществлении межпланетных космических полетов, а также анализировались данные расчетов и экспериментальных измерений среднесуточных доз при орбитальных полетах.
Анализируя результаты расчетов опасности от солнечных вспышек, представленные в этих работах, о зависимости рисков превышения различных доз, изменяющихся в широких пределах: от 10"1 до 103 сГр, для полетов в свободном космическом пространстве и орбитальных космических полетов, можно было оценить для одних и тех же значений рисков степень снижения дозовых нагрузок при переходе от полетов вне магнитосферы Земли к орбитальным полетам с различным наклонением орбиты. В частности, для орбит, соответствующих полетам станций «Мир» и МКС, для высоты 400 км и угла наклона плоскости орбиты 51°, кратность снижения дозы при переходе от межпланетного полета к орбитальному составляет более чем 60-100 раз и даже более.
Как показали расчеты, представленные в работах (Шафиркин А.В., 1999-в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004; Шафиркин А.В., 2008) в случае межпланетного космического полета, увеличение толщины защиты радиационного убежища от 1 до 20 г/см2 приводит к уменьшению величины среднетканевой поглощенной дозы от СКЛ за полет в 16,5 раза и к существенному снижению величины радиационного риска. Учитывая существенное снижение дозы от СКЛ за реальной толщиной защиты бытового отсека КА (Хбо > 10 г/см2) при межпланетных полетах, а также то, что при переходе от межпланетного полета к орбитальному кратность ослабления дозы составляет 60-100 раз, можно при расчетах обобщенной дозы и радиационного риска для орбитальных полетов пока не рассматривать вклад СКЛ.
50
Нейтроны
При прохождении высокоэнергетичных частиц космической радиации через поглотитель (защита космического аппарата, тело космонавта, атмосфера Земли и т.д.) они участвуют в двух основных процессах — ионизация окружающей среды и образование ядерных реакций при столкновении с частицами, входящими в состав поглотителя. При этом во втором процессе образуется вторичное излучение, сложное по составу, энергии и с различными углами вылета из точки столкновения. Среди этого вторичного излучения выделяется нейтронный компонент, который, по предварительным оценкам, вносит значительный вклад в суммарную эквивалентную дозу космической радиации за защитой.
Верхние оценки эквивалентной дозы нейтронов для условий полета на станции «Мир» по данным расчетов и экспериментальных измерений в различном диапазоне энергии нейтронов расходятся существенно от 10 до 100 и более процентов от дозы заряженных частиц космической радиации (последнее значение для больших толщин защиты 40 г/см2 и более). Однако подобные оценки требуют дальнейшего уточнения в связи с неопределенностью в возможных зависимостях коэффициента качества от Л ПЭ и с различными условиями защищенности в различных отсеках станции «Мир». Для уточнения оценки вклада нейтронов необходимы подробные измерения ЛПЭ — спектра в области 103 кэВ/ мкм (при взаимодействии нейтронов с веществом ткани образуются ядра отдачи с ЛПЭ 103 кэВ/мкм, имеющие высокую биологическую эффективность радиационного поражения). Измеренные значения доз нейтронов в защищенных отсеках станции «Мир» и сопоставление с результатами расчетов будет проведено позже.
2.2. Расчетные значения дозовых нагрузок от космических излучений на различные органы и ткани космонавтов
Расчет глубинного распределения поглощенной и эквивалентной дозы от толщины защиты от протонов РПЗ и СКЛ и многозарядных ионов ГКЛ на орбите станции «Мир» производился в соответствии с методиками, изложенными в (РД 25645.207-85
51
БРЭКАКП, 1986; РД 50-25645.208-86. БРЭКАКП, Методика расчета поглощенной дозы, 1986). На рис. 2.2 представлены глубинные распределения суточных доз протонов РПЗ и ГКЛ в зависимости от толщины защиты из алюминия на круговой орбите высотой 400 км и наклонением 51,6° для периода минимума и максимума СА.
ГКЛ - поглощенная А РПЗ - поглощенная —О— ГКЛ - эквивалентная -Д- РПЗ - эквивалентная
Рис. 2.2. Поглощенные и эквивалентные дозы за сутки на орбите станции «Мир» в зависимости от толщины защиты из алюминия
Задолго до полетов на разных стадиях проектирования возникает необходимость на основе проектной документации построения моделей защищенности КА для оценки радиационных воздействий на космонавтов в предстоящих полетах. Такие модели, в частности были построены для базового блока орбитальной станции (ОС) «Мир». Эти модели различаются степенью детализации оборудования и, следователь
но, точностью в определении функций экранированности.
До полета на МКС анализ проектной документации показал, что базовые блоки ОС «Мир» и МКС по геометрической форме и габаритным размерам одинаковы. Близки сначала были и массовые характеристики изделий. Поэтому для анализа распределения доз космических лучей (КЛ) в изделиях в данной работе на начальном этапе была использована модель защищенности ОС «Мир», разработанная ранее и использовавшаяся в работе (Коломенский А.В., Петров В.М., Шафиркин А.В., 1998). Для расчетов принимали также, что высота орбиты МКС составит около 400 км. В последующем в процессе уточнения конструкторской документации, изменения компоновки оборудования в процессе эксплуатации и после проведения специальных дозиметрических исследований было проведено уточнение модели защищенности раз
52
личных отсеков МКС. Эти материалы будут представлены в разд. 7 и 8 при расчетах радиационного риска для космонавтов в процессе проведения межпланетного полета к Марсу и при орбитальных полетах на станциях «Мир» и МКС, а также расчетах суммарного радиационного риска для космонавтов в течение всей их жизни.
Исходными данными для задания станции «Мир» служили геометрические данные и материалы по распределению масс, полученные из конструкторской документации (Демин В.П. и др., 1994). На рис. 2.3 представлена изометрическая схема объекта.
Рис. 23. Изометрическая схема станции «Мир» с изображенными на ней в разрезе: переходным отсеком (ПХО); центральным пультом управления (ЦПУ); салоном малого диаметра (СМД); салоном большого диаметра (СБД); каютой командира корабля (ККК) и штатным дозиметром Р-16
Всего потребовалось задать 48 поверхностей и 73 геометрические зоны. Для задания поверхностей потребовалось использовать 6 цилиндрических поверхностей, параллельных оси X, 2 конические поверхности, параллельные оси X, 5 поверхностей эллипсоида, 17 плоскостей, перпендикулярных оси X, 10 плоскостей, перпендикулярных оси Y, 6 плоскостей, перпендикулярных оси Z.
53
Вычисления функций экранированности производилось для мест, характерных для пребывания членов экипажа: переходной отсек (ПХО); ценральный пульт управления (ЦПУ); салон малого диаметра (СМД) — центральная часть; салон большого диаметра (СБД^ — центральная часть; салон большого диаметра (СБД2) — торец станции; каюта командира корабля (ККК); каюта бортинженера (КБИ); место размещения камеры радиометра (Р-16).
Расчет функций экранированности веществом ткани относительно представительных точек в фантоме проводили по методике, изложенной в (ГОСТ 25645.204-83 БРЭКАКП. Методика расчета экранированности, 1984). В качестве модели тела космонавта в данной работе принят сферический и антропоморфный фантомы (ГОСТ 25645.203-83 БРЭКАКП. Модель тела человека, 1984). Представительные точки шарового фантома моделируют расположение жизненно важных органов человека.
Точка на глубине 0,01 см от поверхности моделирует кожный покров (КП). Точка на глубине 0,3 см моделирует хрусталик глаза (ХГ). Точки на глубинах 5, 7 и 9 см моделируют соответственйо кроветворную систему (КТС), центральную нервную систему (ЦНС) и желудочно-кишечный тракт (ЖКТ). Состав и геометрические размеры антропоморфного фантома представлены на рис. 2.4. Расположение представительных точек в фантоме представлено на рис. 2.5.
На первом этапе для анализа закономерностей распределения дозовых нагрузок на экипаж во время полета нами проведены расчеты поглощенных и эквивалентных доз в представительных точках шарового фантома при его расположении вдоль оси X станции (Y = Z = 0). Радиус шарового фантома составляет 17 см. При расположении центра фантома на центральной оси станции представительные точки шарового фантома расположены на расстоянии от центра: 8 см для ЖКТ; 10 см для ЦНС; 12 см для КТС; 16,7 см для ХГ; 16,99 см для КП.
В работах (Коломенский А.В., Петров В.М., Шафиркин А.В., 1998; Шафиркин А.В., 1999-в; Петров В.М. и др. 2001; Шафиркин А.В. и др., 2002) проведены расчетные оценки значений среднесуточных поглощенных доз от ГКЛ и РПЗ в различных органах и тканях космонавтов для 8 зон станции «Мир»: переходного отсека (ПХО); центрального пульта управления (ЦПУ); салона малого диаметра (СМД) — центральная часть; салона большого диа-
54
Рис. 2.4. Габаритные размеры антропоморфного фантома и система координат.
(1 — голова; 2 — туловище; 3 — плечо; 4 — предплечье; 5 — бедро; 6 — голень)
Рис. 2.5. Расположение представительных точек в антропоморфном фантоме. (1; 5-13; 17-20 — представительные точки КТС; 2 — ЦНС; 3 и 4 — хрусталика глаза; 14-16 - ЖКТ;
21 и 22 — кожи)
метра (СБД0 — центральная часть; салона большого диаметра (СБД2) — торец станции; каюты командира корабля (ККК); каюты бортинженера (КБИ) и места размещения камеры радиометра (Р-16).
Расчеты проведены для стандартизованного шарового фантома, представляющего собой модель тела человека (ГОСТ 25645.203-83. Модель тела человека, 1984), который размещался в указанных выше зонах станции.
В табл. 2.2 и 2.3 представлены абсолютные и относительные значения поглощенных доз за сутки в различных тканях от ГКЛ и протонов РПЗ для периодов минимума и максимума СА. Максимальная доза соответствует дозе в отсутствии шарового фантома. При определении относительных величин доз за 1,0 принималось
55
расчетное значение поглощенной дозы в месте расположения камеры Д2 штатного радиометра Р-16.
Таблица 2.2
Значения среднесуточных доз (мкГр)в обитаемых зонах ОС «Мир» от протонов РПЗ и ГКЛ в период минимума солнечной активности
Доза пхо ЦПУ смд СБД, СБДг ккк Р-16
Максимальная 1250 2,170 396 0,688 364 0,632 438 0,760 208 0,361 807 1,400 576 1,0
На кожу 752 1,306 274 0,476 259 0,450 301 0,523 156 0,271 511 0,887 —
На КТС 390 0,677 176 0,306 174 0,302 186 0,323 ИЗ 0,196 250 0,434 —
На ЖКТ 385 0,668 174 0,302 173 0,300 182 0,316 111 0,193 250 0,434 —
Примечание. Курсивом в таблицах представлены расчетные значения коэффициентов перехода от показаний дозиметра Д2 к значениям доз в представительных точках фантома.
Таблица 2.3
Значения среднесуточных доз (мкГр) в обитаемых зонах ОС «Мир» от протонов РПЗ и ГКЛ в период максимума солнечной активности
Доза ПХО ЦПУ смд С БД, СБДг ККК р-16
Максимальная 581 2,136 213 0,783 205 0,754 231 0,850 127 0,467 369 1,367 272 1,0
На кожу 364 1,338 154 0,566 152 0,559 166 0,610 97 0,357 250 0,919 —
На КТС 218 0,801 108 0,397 109 0,400 114 0,419 73 0,268 145 0,533 —
На ЖКТ 204 0,750 101 0,371 103 0,379 106 0,390 71 0,261 141 0,518 —
В работах (Коломенский А.В., Петров В.М., Шафиркин А.В., 1998; Шафиркин А.В., 1999-в; Петров В.М. и др., 2001; Шафиркин А.В. и др., 2002) отмечено, что перепад доз по обитаемым зонам станции может существенно превосходить перепад доз вдоль оси станции и составлять около 6 раз.
56
Наиболее защищенным местом является зона в хвостовой части станции. Большой перепад доз объясняется заметным влиянием участков с ослабленной защитой (ПХО, ЦПУ, ККК и КБИ). Анализируя данные, представленные в табл. 3.1 и 3.2, можно видеть также, что перепад дозы от представительной точки — «кожа» до наиболее защищенной — «ЖКТ» для сферического фантома, помещаемого в разные обитаемые зоны, в основном не превышает коэффициента 3. Поглощенная доза на кожу составляет в среднем приблизительно 0,5 ±0,1 от расчетного значения дозы в месте расположения радиометра Р-16. Среднее значение поглощенной дозы на КТС и ЖКТ составляет лишь 35 ± 5 и 33 ± 5% соответственно от расчетной величины для радиометра Р-16. Следует отметить, что расчетные среднесуточные значения доз удовлетворительно согласуются с результатами измерений с помощью штатного прибора (камера Д2 радиометра Р-16), которые представлены в работе (Бондаренко В.А., Митрикас В.Г., Цет-лин, 1995). Анализ результатов измерений, проведенный в этой работе, показал, что среднесуточное значение поглощенной дозы в период максимума СА (1986—1990 гг.) составляло приблизительно 200 мкГр (20 мрад), а в период минимума СА — 500 мкГр (50 мрад).
До проведения полетов на международной космической станции были проведены сравнительные расчеты среднесуточных поглощенных и эквивалентных доз от ГКЛ и РПЗ в критических органах и тканях космонавтов при их нахождении в различных отсеках орбитальной космической станции «Мир». Как уже отмечалось выше, мы ранее предполагали, что они применимы и для расчетных оценок доз в отсеках МКС. В расчетах использованы в качестве модели тела человека стандартизованные шаровой и антропоморфный фантомы (ГОСТ 25645.203-83. БРЭКАКП Модель тела человека, 1984). Расчеты для антропоморфного фантома проведены для 4 зон орбитальной станции (ЦПУ, СБД2, KKKt и ККК2), в которых космонавты проводят достаточно значительное время. Дополнительно проведены расчеты максимальных значений поглощенных и эквивалентных доз в условиях отсутствия фантома в тех же отсеках станции, а также в месте расположения ионизационной камеры Д2 бортового радиометра Р-16.
В табл. 2.4 представлены значения среднесуточных поглощенных и эквивалентных доз в представительных точках шарового и антропоморфного фантомов от ГКЛ, РПЗ и суммарных доз в пе
57
риоды максимума и минимума СА на орбитальной станции «Мир» при наклонении орбиты 52° и высоте 400 км. В таблице не приведены значения доз для каюты бортинженера, поскольку они достаточно хорошо совпадают с соответствующими данными для каюты командира корабля, но представлены две разные точки в каюте командира корабля KKKj и ККК2, а также в ЦПУ и СВД2.
Анализируя представленные в этой таблице расчетные значения доз от ионизирующих излучений на критические ткани раздельно от ГКЛ и РПЗ, можно сделать ряд выводов. Для отсека каюты командира корабля (ККК) с относительно слабой защитой вклад в суммарную поглощенную дозу от ГКЛ для хрусталика глаза и кожи для периода минимума СА составляет 8%. В то же время для наиболее защищенного отсека (СВД2) вклад ГКЛ существенно возрастает и составляет 26%. Для кроветворной ткани в ККК вклад ГКЛ составляет 12,7% а в СВД2 — 27,4%. Мало изменялись представленные выше значения при переходе от минимума СА к периоду максимума СА.
Вклад ГКЛ в суммарную эквивалентную дозу (по сравнению с поглощенной дозой) в отсеках с относительно малой защитой на станциях «Мир» и МКС возрастает и составляет для кожи и кроветворной ткани 18,3 и 22,7%. В отсеках с относительно большой защитой вклад в ГКЛ в суммарную эквивалентную дозу остается приблизительно таким же, как и в поглощенную (24-25%). Анализируя данные, представленные в табл. 2.4, можно отметить, что расчетные значения поглощенных и эквивалентных доз в критических органах и тканях в представительных точках шарового фантома достаточно хорошо совпадают с соответствующими значениями доз для антропоморфного фантома (расхождение для большинства представительных точек не превышало 10%).
Это доказывает возможность использования фантома более простой формы при расчетах дозовых нагрузок на органы.
Ввиду значительного перепада расчетных среднесуточных значений поглощенных и эквивалентных доз в различных отсеках КА, важно для определения реальных величин среднесуточных (среднемесячных) поглощенных и эквивалентных доз в различных органах и тканях космонавтов учитывать реальную усредненную циклограмму по времени их нахождения в конкретных отсеках орбитальной станции. В первом приближении, предполагая, что 8 часов (во время сна) космонавты находятся в ККК, а остальное время их пребывания равномерно распределено между ЦПУ и
58
Таблица 2.4
Расчетные значения среднесуточных поглощенных (П), мкГр/сут и эквивалентных (Э) доз (мкЗв/сут) в представительных точках шарового (Ш) и антропоморфного (А) фантомов от ГКЛ, РПЗ и суммарные значения при полетах на станции «Мир* в периоды максимума и минимума СА
Критический орган, ткань Вид фантома Источник излучения ЦПУ СБДг ККК1 КККг
Мин. СА П/Э Макс. СА П/Э Мин. СА П/Э Макс. СА П/Э Мин. СА П/Э Макс. СА П/Э Мин. СА П/Э Макс. СА П/Э
Без фантома - ГКЛ 37,6/(98,2) 22,3/(69,5) 22,7/(42,6) 14,1/(28,4) 50,6/(216) 30,1/(142) 50,0/(160) 26,7/(109)
РПЗ 214/(300) 128/(173) 67,4/(124) 43,7/(74,6) 780/(1071) 339/(449) 505/(691) 238/(315)
S 252/(398) 150/(243) 90,1/(167) 57,8/(103) 831/(1287) 369/(591) 555/(851) 265/(424)
Хрусталик Ш ГКЛ 32,4/(78,0) 19,4/(54,1) 18,8/(34,4) 12,1/(23,3) 41,8/(154) 24,9/(102) 37,6/(117) 22,4/(80,2)
РПЗ 158/(232) 96,2/(136) 53/ (104) 34,6/(62,1) 491/(676) 227/(303) 329/(457) 165/(222)
Е 191/(310) 116/(190) 72,0/(138) 46,7/(85,4) 533/(830) 252/(405) 367/(574) 187/(302)
А ГКЛ 32,3/(77,9) 19,2/(54,0) 19,2/(35,0) 12,3/(23,7) 41,3/(150) 25,0/(101) 37,3/(116) 22,0/(80,0)
РПЗ 157/(229) 95,8/(135) 54,1/(105) 35,2/(63,1) 467/(639) 219/(292) 317/(439) 161/(217)
Е 189/(307) 115/(189) 73,3/(140) 47,5/(86,8) 508/(789) 244/(393) 354/(555) 183/(297)
Продолжение табл. 2.4
Критический орган, ткань Вид фантома Источник излучения ЦПУ СБДа ККК1 КККг
Мин. СА П/Э Макс. СА П/Э Мин. СА П/Э Макс. СА П/Э Мин. СА П/Э Макс. СА П/Э Мин. СА П/Э Макс. СА П/Э
Кожа Ш ГКЛ 32,4/(78,0) 19,4/(54,1) 18,8/(34,4) 12,1/(23,3) 41,8/(154) 24,9/(102) 37,6/(117) 22,4/(80,2)
РПЗ 158/(232) 96,2/(136) 53,2/(104) 34,6/(62,1) 451/(676) 227/(303) 329/(457) 165/(222)
Е 191/(310) 116/(190) 72,0/(138) 46,7/(85,4) 493/(830) 252/(405) 367/(574) 187/(302)
А ГКЛ 30,8/(75,6) 19,4/(54,0) 17,3/(31,7) 11,2/(21,5) 40,0/(146) 23,9/(96,9) 36,0/(111) 23,0/(80,0)
РПЗ 149/(220) 90,6/(129) 49,2/(96,1) 31,9/(57,4) 470/(651) 216/(290) 314/(439) 156/(212)
Е 180/(296) 110/(183) 66,5/(128) 43,1/(78,9) 510/(797) 240/(387) 350/(550) 179/(292)
Кроветворная ткань Ш ГКЛ 29,3/(63,9) 17,6/(42,5) 16,8/(29,4) 11,2/(20,2) 34,4/(95,1) 20,4/(67,5) 32,2/(81,3) 19,2/(56,6)
РПЗ 104/(165) 72,2/(107) 43,8/(92,8) 28,6/(55,1) 225/(310) 127/(170) 174/(250) 102/(142)
Е 133/(229) 89,8/(150) 60,5/(122) 39,8/(75,3) 259/(405) 147/(238) 206/(331) 122/(199)
А ГКЛ 27,8/(60,0) 17,6/(43,0) 15,4/(27,1) 10,2/(18,8) 34,0/(96,6) 20,3/(66,9) 31,3/(79,8) 19,0/(57,0)
РПЗ 107/(170) 67,8/(102) 40,7/(85,3) 26,4/(50,8) 235/(328) 127/(174) 176/(254) 101/(141)
£ 135/(230) 85,4/(145) 56,1/(112) 36,6/(69,6) 269/(425) 147/(241) 207/(334) 120/(198)
Примечание. Для точки размещения дозиметра Р-16 расчетные значения поглощенных доз за сутки от ГКЛ и РПЗ составили для периода минимума С А 41,2 и 553 мкГр/сут, для периода максимума С А — 24,8 и 247 мкГр/сут, а эквивалентные дозы — 167 и 759 мкЗв/сут и 109 и 331 мкЗв/сут для периодов минимума и максимума СА соответственно.
СБД2, на основе вышеприведенных данных можно оценить, что среднесуточная поглощенная доза на кожу космонавтов для орбитальных станций «Мир» и МКС составит в период минимума СА 40% от показаний ионизационной камеры Д2 радиометра Р-16, а в период максимума СА (для невозмущенной радиационной обстановки) — 46%. Среднекостномозговая доза при этих условиях составит для периодов минимума и максимума СА соответственно 24 и 31% от показаний радиометра Р-16.
2.3. Оценка дополнительного вклада излучения вторичных нейтронов в среднесуточную величину эквивалентной дозы при осуществлении орбитальных космических полетов на станции «Мир* на основе экспериментальных измерений
При расчете дозовых нагрузок на космонавтов при орбитальных полетах помимо частиц ГКЛ необходимо учитывать протоны, образующие внутренний пояс Земли. При этом расчет доз от этих источников и их вторичного излучения значительно усложняется ввиду необходимости учета прохождения частиц через защиту космического аппарата, но и через магнитное поле Земли, экранирующее ее. Кроме того, при оценке доз от вторичных нейтронов следует учитывать не только нейтроны, возникшие в конструкции корабля (так называемые локальные нейтроны), но и вторичные нейтроны, образующиеся в реакциях космического излучения с ядрами атмосферы Земли (альбедные нейтроны). В настоящее время расчетным путем полностью учесть вклады в суммарную дозу этих двух основных источников нейтронов — достаточно сложная задача.
Другим методом получения информации о вторичных нейтронах при полете космических аппаратов на околоземных орбитах является экспериментальный метод, где, как правило, в качестве дозиметров использовались пассивные детекторы (слои ядерной фотоэмульсии, делящиеся фольги и т.д.), не требующие телеметрии и имеющие малые веса и габариты. Такие исследования за последние 20 лет были проведены на различных космических аппаратах, имеющих разные параметры орбит (высота полета, угол наклона плоскости орбиты к плоскости экватора), полеты проводились при разных фазах солнечной активности, детекторы были
61
расположены за разными толщинами защиты. Среди таких аппаратов отметим ИСЗ серии «Космос», биологические спутники, а в последние годы — американские корабли многоразового пользования типа «Спейс-Шаттл» (Dudkin V.E. et al., 1990, 1992; Badhwar G.D. et al., 1995).
В течение нескольких лет внутри орбитальной пилотируемой станции ОС «Мир» были измерены дифференциальные энергетические спектры нейтронов в широком диапазоне энергий. Измерения проводились с использованием независимых экспериментальных методик (Дудкин В.Е., Мелкумян Л.В., Плющев В.А., Потапов Ю.В., 1993; Севастьянов В.Д., Тарновский Г.Б., Лягушин В.И., 1997). Для определения значений дифференциальных энергетических спектров нейтронов использовались два экспериментальных метода — метод делящихся фолы (ДФ) и метод ядерных фотоэмульсий (ЯФЭ).
Для изучения спектров был разработан набор детекторов на основе реакции деления. Для формирования энергетической чувствительности детекторов были применены экраны из различных материалов. В качестве трековых регистраторов осколков деления использовалась слюда-мусковит. Принимались во внимание возникающие при этом трудности, связанные с учетом деления нуклидов не только от нейтронного, но и от протонного излучения, а также учет спонтанного деления нуклидов. Восстановление спектра нейтронов было проведено с использованием программы «Проспект», неоднократно апробированной ранее при решении аналогичных задач. Диапазон спектра нейтронов, измеренный этим методом, простирается от 10-8 до 104 МэВ. Набор указанных детекторов экспонировался внутри модуля «Квант», при эффективной толщине защиты более 20 г/см2 А1 в период времени с 27 сентября 1990 г. по 10 августа 1992 г. Аналогичный набор детекторов нейтронов был использован при измерении спектра нейтронов, генерируемых протонным пучком с энергией 70 МэВ на изохронном циклотроне У-240 института ядерных исследований г. Киев (Севастьянов В.Д., Тарновский Г.Б., Лягушин В.И., 1997).
Другим экспериментальным методом определения энергетического спектра нейтронов являлся метод ядерных фотоэмульсий (ЯФЭ). В области быстрых нейтронов (с Е > I МэВ) измерения проводились по методу протонов отдачи, возникающих при упругом рассеянии нейтронов на свободном водороде, входящем в со
62
став ЯФЭ. Учет выхода треков протонов отдачи из объема слоя ЯФЭ осуществлялся введением соответствующих поправок в аппаратурный спектр. В области энергии промежуточных нейтронов с Е < 1 МэВ их спектр определялся с использованием ЯФЭ с добавлением солей лития, что давало возможность регистрировать нейтроны по реакции Li6(n, Не4)Н3. В слоях ЯФЭ отыскивались «вилки» (следы ядер гелия и трития, вылетающих из одной точки), в которых затем проводились измерения длин следов ядер и угол их разлета. По этим данным, с учетом сечения реакции, определялись кинетические энергии нейтронов, имитирующих развалы ядер лития. В результате применения этих двух методов, связанных с использованием слоев ЯФЭ, были определены энергетические спектры нейтронов в диапазоне от 10“2 до 15 МэВ. Эти детекторы экспонировались внутри ОПС «Мир», в контейнере, где хранятся кинофотоматериалы экспедиций. По оценкам, эффективная толщина защиты этого места составляла более 40 г/см2 А1, время экспозиции — с 06 июня 1991 г. по 16 октября 1991 г.
Из литературы (Armstrong T.W. et al., 1973) известно, что величина плотности потока вторичных нейтронов, образованных в атмосфере Земли под действием частиц галактического космического излучения с энергией от тепловых до 20 МэВ, растет с увеличением глубины атмосферы, по крайней мере, до 50-70 г/см2 (расчеты, подтвержденные экспериментально). По-видимому, следовало ожидать аналогичное явление возрастания плотности потока нейтронов при увеличении величины эффективной толщины защиты космического аппарата на околоземной орбите, т.е. ожидалось, что величина потока нейтронов, полученная методом ЯФЭ (при защите более 40 г/см2 ) будет превышать аналогичные величины, полученные методом делящихся фолы при меньшей эффективной толщине защиты. Это предположение подтвердилось во всем измеряемом диапазоне энергии нейтронов.
Результаты измерений, полученные с помощью пассивных детекторов сравнивались с литературными данными (Богомолов А.В. и др., 1995) при энергиях нейтронов Еп от 20 до 400 МэВ. Измерения в этом исследовании проводились с помощью неорганического сцинтилляционного детектора на борту орбитального комплекса (ОК) «Салют-7 — Космос-1686», имеющего близкую к ОС «Мир» орбиту полета. В работе (Богомолов А.В. и др., 1985) приведена зависимость величины потоков нейтронов, измеренных
63
в эксперименте на ОС «Мир», от места измерения и пороговой магнитной жесткости для пяти интервалов энергий нейтронов: 20-40; 40-60; 60-100; 100-200 и 200-400 МэВ.
Отметим дополнительно, что по данным работы (Севастьянов В.Д., Тарновский Г.Б., Лягушин В.И., 1997) полная плотность потока нейтронов с энергией от 1О“10 до 104 МэВ составляет 5,21 нейтр/см2 сек, и вклад нейтронов с энергией ниже 10 кэВ составляет лишь 7% от полной плотности потока. Полный флюенс нейтронов равен 3,1 х 108 нейтр/см2.
В упомянутых выше работах (Dudkin V.E. et al., 1990, 1992; Badhwar G.D. et al., 1995) показано, что значение мощности эквивалентной дозы нейтронов с энергией от 1,0 до 15 МэВ не превышает 50% от эквивалентной дозы, обусловленной заряженными частицами. В этих работах отмечалось, что величина эффективной толщины защиты, окружавшей детекторы, не превышала 20 г/см2 А1. В данном эксперименте детекторы ЯФЭ были расположены в контейнере, эффективная толщина защиты которого составляла около 40 г/см2 А1. Это обстоятельство, а также отмеченные факты увеличения выхода вторичных нейтронов с ростом толщины защиты, позволяют предположить возможность существенного увеличения вклада в суммарную эквивалентную дозу нейтронного компонента при больших толщинах защиты. С использованием полученных экспериментальных данных о спектрах и суммарных флюенсах нейтронов в различных диапазонах энергий были проведены расчеты значений эквивалентных доз нейтронов в рассматриваемых диапазонах энергий.
В последние годы система дозиметрических единиц для радиационной защиты значительно изменилась. Главной единицей, рекомендованной для использования ее в исследованиях с проникающей радиацией, является амбиентная эквивалентная доза Н(10), которая определена как эквивалентная доза на глубине 10 мм на главной оси сферы диаметром 30 см, облученной пучком частиц, параллельным главной оси сферы (Sannikov A.V. and Savitskaya E.N., 1993). Результаты расчетов плотностей потоков нейтронов в различных диапазонах их энергий, а также доз нейтронов, полученные в работе (Дудкин В.Е. и др., 1998), представлены в табл. 2.5.
64
Таблица 2.5
Значения плотности потоков нейтронов (Р, нейтр/см2 сек) и мощности эквивалентной амбиентной дозы нейтронов (Н, мкЗв/сутки), измеренные внутри ОС «Мир*
Энергия нейтронов, МэВ Экспериментальные методы
делящиеся фольги, 8 = 20 г/см2 Ядерные фотоэмульсии, 8 = 40 г/см2
Р н Р н
«гЧо-1 0,7 2,3 1,18 3,3
кгЧо0 1,35 15 2,08 23
юЧо1 1,40 32 1,86 50
юЧо2 1,40 28 — 36*
юЧо4 0,1 13 — 18*
Е 4,95 90 — 130
Примечание. * — экстраполированные по энергии данные на основе дифференциальных энергетических спектров.
Анализ данных, приведенных в табл. 2.5, позволяет сделать следующие основные выводы:
• наибольший вклад в суммарную плотность потока нейтронов и обусловленную ими мощность эквивалентной дозы составляют частицы с энергией от 100 кэВ до 100 МэВ;
• превышение числа нейтронов при толщине защиты 40 г/см2 над числом нейтронов при толщине защиты 20 г/см2 составляет 30-40% во всех диапазонах измеренных энергий нейтронов;
• при проведении оценок эквивалентных доз лишь от нейтронов с энергией от 1 МэВ до 15 МэВ (как это делалось в более ранних работах, например, в (Dudkin V.E. et al., 1990, 1992; Badhwar G.D. et al., 1995) определялось лишь около 30% эквивалентной дозы от суммарной дозы нейтронов, что указывает на необходимость при проведении последующих экспериментов осуществлять измерения в более широком диапазоне энергии нейтронов (от 100 кэВ до 100 МэВ).
Сравнение значений эквивалентных доз ионизирующих излучений (суммарно ГКЛ и РПЗ), которые представлены в табл. 2.4
65
для различных отсеков станции «Мир» при осуществлении полетов в периода максимума СА, с данными, представленными в табл. 2.5, показывает, что при больших толщинах защиты суммарная эквивалентная доза нейтронов (Н) может быть соизмерима или даже превышать значение эквивалентной дозы от ионизирующих излучений. Так, при толщине защиты 40 г/см2 А1 оценка величин Н для нейтронов составляет 130 мкЗв/сутки и превышает суточную среднекостно-мозговую эквивалентную дозу от ионизирующих излучения ГКЛ + РПЗ. Для салона большого диаметра (СБД2) эта доза составляет в шаровом фантоме 75,3 мкЗв/сут, а в антропоморфном 69,6 мкЗв/сут.
На основании вышеизложенного следует сделать вывод о существенности вклада вторичных нейтронов в суммарную эквивалентную дозу, обусловленную космическим излучением, особенно на околоземных орбитах при увеличении толщины защиты. Кроме того, очевидна необходимость проведения дальнейших экспериментальных исследований нейтронного компонента на борту ОС «Мир», а в последующие годы на международной космической станции.
2.4. Сравнительный анализ результатов расчета дозовых нагрузок на космонавтов и данных дозиметрических и спектрометрических измерений
на орбитальных станциях «Мир* и МКС
С целью проверки результатов расчетов по представленным в литературе моделям ГКЛ и РПЗ и их верификации мы провели сравнение вышеприведенных расчетных значений поглощенных доз с результатами измерений поглощенных доз на станции штатными дозиметрами (ионизационные камеры прибора Р-16 с датчиками Д1 и Д2 и ТЛД, входящие в сборки индивидуальных дозиметров), прибором ИПД-2, спектрометрами НОЗИКА, тканеэквивалентным пропорциональным счетчиком (ТЭПС) и сборками пассивных термолюминесцентных дозиметров.
Анализ современных данных экспериментальных измерений на борту орбитальной станции «Мир» за последние годы, когда использование спектрометров с высоким временным разрешени
66
ем позволило производить измерения уровней доз отдельно от ГКЛ и РПЗ показало, что вклад ГКЛ в суммарную мощность дозы является на самом деле существенно большим. В разных сериях измерений за период 1995-1996 гг. с помощью приборов Доза А1 и ТЭПС получено, что мощность поглощенной дозы от ГКЛ заключена в диапазоне 110,6 +135,0 мкГр/сут (Badhwar G.D., Atwell W., Cash В et al., 1996; Badhwar G.D., Konrady A., Atwell W. et al., 1996; Черных И.В., Бенгин В.В., Иванов Ю.В. и др., 1998), что значительно выше, чем расчетное значение по модели для различных отсеков станции «Мир» (22,6-50,6 мкГр/сут). Применительно к точке размещения бортового дозиметра Р-16 измеренные значения превышали расчетное значение (40 мкГр/сут) в 3,4 раза. С целью максимальной оценки радиационной опасности для космонавтов при последующих расчетах радиационного риска расчетные величины мощностей доз от ГКЛ были увеличены в 3,4 раза. Для орбиты станции «Мир» при полетах в период минимума С А значение мощности поглощенной дозы от ГКЛ было принято равным 135 мкГр/сут.
С другой стороны анализ показал, что расчетные значения среднесуточных поглощенных доз на станции «Мир» от излучения РПЗ по модели АР-8 MIN для периода минимума СА в 1,85-2 раза превышают фактически измеренные значения мощностей доз от РПЗ с помощью бортовых спектрометров и превышают суммарные значения мощностей доз по показаниям практически всех активных и пассивных дозиметров, размещенных на борту станции за период 1994-1997 гг. (Badhwar G.D., Atwell W., Cash В et al., 1996; Badhwar G.D., Konrady A., Atwell W. et al., 1996; Черных И.В., Бенгин В.В., Иванов Ю.В. и др., 1998).
Выбрав максимальное значение мощности дозы от ГКЛ, которое представлено выше, и уменьшив в 2 раза расчетное по модели АР-8 MIN среднесуточное значение дозы от излучения РПЗ, мы получили, что суммарное значение поглощенной дозы на борту станции «Мир» от ионизирующих излучений ГКЛ и РПЗ для периода минимума СА должно составлять 412 мкГр/сут (применительно к точке размещения бортового дозиметра Р-16). Это значение в максимальной степени коррелирует с результатами измерений на борту станции «Мир» за экспедиции ЭО-18 ч ЭО-22, проходившие в период минимума СА (Бондаренко В.А., Митри-кас В.Г., Цетлин В.В., 1995; Badhwar G.D., Atwell W., Cash В et al., 1996; Badhwar G.D., Konrady A., Atwell W. et al., 1996; Benghin V.V.,
67
Petrov V.M., Ivanov Yu.V. et al., 1996; Черных И.В., Бенгин В.В., Иванов Ю.В. и др., 1998; Петров В.М. и др., 2001).
Используя значения коэффициентов качества излучений, которые использовались ранее в расчетах, были получены также среднесуточные значения мощностей локальных эквивалентных доз на станции «Мир» и МКС для периода минимума СА.
С целью установления максимального верхнего предела радиационного риска для космонавтов при проведении орбитальных космических полетов на основе литературных данных провели также оценку вклада в поглощенную и эквивалентную дозу вторичных нейтронов (см. подразд. 2.3). Мы проанализировали также результаты измерения спектров ЛПЭ вторичных нейтронов, возникающих в конструкции корабля (так называемые локальные нейтроны), и нейтроны, образующиеся в реакциях космического излучения с ядрами атмосферы (альбедные нейтроны). Были сопоставлены среднесуточные значения доз на орбите станции «Мир», полученные авторами как в отдельном узком диапазоне, так и для широкого спектра нейтронов. Максимальные оцененные значения эквивалентных доз за сутки от нейтронов для орбиты станции «Мир» при полете в период максимума С А составили: при толщине защиты 50 г/см2 — 180 мкЗв/сут, при толщине защиты 40 г/см2 — 130 мкЗв/сут, при толщине защиты 20 г/см2 — 90 мкЗв/сут (Дудкин В.Е., Мелкумян Л.В., Плющев В.А., Потапов Ю.В., 1993; Севастьянов В.Д., Тарновский Г.Б., Лягушин В.И., 1997; Дудкин В.Е. и др., 1998).
Рассматривая среднюю толщину защиты станции равной 20 г/см2 и среднюю экранирующую толщину для представительной точки кроветворной ткани в стандартизованном шаровом фантоме при изотропном падении равной 10 г/см2, мы оценили вклад нейтронов в суммарную мощность эквивалентной дозы равным 110 мкЗв/сут. Вклад нейтронов в локальную эквивалентную дозу за сутки при отсутствии фантома может быть принят равным 90 мкЗв/сут.
Уточненные расчетные значения среднесуточных поглощенных и эквивалентных доз при орбитальных полетах на станциях «Мир» и МКС от ГКЛ, РПЗ и суммарные величины доз от ионизирующих излучений (DH), дозы от нейтронов (DH), суммарные среднесуточные дозы для плотноионизирующих излучений (DnH) представлены в табл. 2.6.
68
Таблица 2.6
Значения мощностей поглощенных (мкГр/сут) и эквивалентных (мкЗв/сут) доз от ГКЛ, РПЗ, мощности дозы суммарно от ионизирующих излучений DH (ГКЛ + РПЗ), мощности дозы от нейтронов (DH) и суммарно для плотноионизирующих излучений с высокими ЛПЭ (Dnm + DH), а также суммарной дозы на орбитальных станциях «Мир» и МКС (Шафиркин А.В., 1999в)
Источники излучений Максимум СА Минимум СА
Поглощенная доза, мкГр/сут Эквивалентная доза, мкЗв/сут Поглощенная доза, мкГр/сут Эквивалентная доза, мкЗв/сут
Фло«) (D«p) (Ц»>) (D^,) Фло.) Ф«р>
ГКЛ 80,0 53 350 137 135 90 545 205
РПЗ 123,5 36 165 53 277 60 380 90
Dm (ГКЛ+РПЗ) 203,5 89 515 190 412 150 925 295
Нейтроны (DH) — — 90 110 — — 200 250
Опи (Огкл + DH) — — 440 247 — — 745 455
Ds — — 605 300 — — 1125 545
Огкл / Ои, % 39 60 68 72 33 60 59 70
^ПИ / Dp % — — 73 83 — — 67 80
Примечание. Представлены локальные дозы (Влок) в отсутствии фантома для точки размещения бортового дозиметра Р-16 и средние значения за сутки для кроветворной ткани в шаровом фантоме (DKp) в предположении равномерного нахождения космонавтов по циклограмме в основных отсеках станции, включающих центральный пульт управления (ЦПУ), салон большого диаметра (СБД2) и каюту командира корабля (ККК).
Это локальные дозы (Элок) в отсутствии фантома для точки размещения бортового дозиметра Р-16 на станции «Мир» и для кроветворной ткани в шаровом фантоме (DKp) для варианта равномерного времени нахождения в различных отсеках станции. В
69
этой таблице представлен также относительный вклад ГКЛ от дозы ионизирующих излучений DH, %, а также вклад плотно-ио-низирующих излучений ГКЛ и нейтронов в суммарную эквивалентную дозу, что было важно для последующих расчетов радиационного риска.
Еще до полетов на международной космической станции мы ранее предполагали, что базовые блоки ОС «Мир» и МКС по геометрической форме, габаритным размерам приблизительно одинаковы и что близки массовые характеристики изделий. Поэтому для анализа распределения доз космических лучей в базовом блоке МКС временно была использована модель защищенности ОС «Мир», разработанная ранее. Поэтому значения доз на станциях «Мир» и МКС предполагали, что будут теми же самыми.
Из данных табл. 2.6 легко отметить, что значения мощности эквивалентной дозы для кроветворной ткани за счет протонов РПЗ существенно снижаются по сравнению с данными, рассчитанными для локальной дозы в отсутствии фантома в области размещения дозиметра Р-16, но увеличивается вклад в дозу от вторичного излучения и нейтронов.
В табл. 2.7. проводится сравнение среднесуточных значений поглощенных доз, измеренных на станции «Мир» различными детекторами в период минимума СА (экспедиции ЭО-18 и ЭО-22), по отношению к расчетному значению поглощенной дозы от ионизирующих излучений DH (ГКЛ + РПЗ), равному 412 мкГр/сут, которое представлено в табл. 2.6. В случае нескольких серий экспериментов представлен диапазон изменения измеренных величин по отношению к данному расчетному значению (Шафиркин А.В., 1999в).
Данные табл. 2.7 показывают, что расчетное значение суммарной мощности поглощенной дозы от ГКЛ и РПЗ на орбите станции «Мир» для периода минимума СА, представленное в табл. 2.6, достаточно хорошо соответствует экспериментально измеренным значениям российскими, американскими, французскими и другими исследователями. Основной массив измеренных данных не отличается от расчетных значений более чем на 20%. Результаты, полученные на основе штатного дозиметра Р-16 и данные более подробных исследований с использованием спектрометров с хорошим временным разрешением, позволяющие раздельно определять мощность дозы от ГКЛ и РПЗ, практически совпадают с расчетными значениями.
70
В разд. 6 при обосновании понятия обобщенная доза и учете характера распределения дозы по телу будет показано, что при воздействии с относительно малым значением мощности дозы среднекостномозговая эквивалентная доза совпадает с равноценной эквивалентной дозой и незначительно отличается от среднетканевой дозы. Значение коэффициента пространственной неравномерности радиационного воздействия КРБ применительно к оценкам ближайших в процессе полета неблагоприятных эффектов в этом случае может быть близко к 1,0.
Таблица 2.7
Измеренные значения мощностей поглощенных доз активными и пассивными детекторами на станции «Мир* при полетах в период минимума СА (значения по отношению к расчетной величине
412 мкГр/сут)
Методы дозиметрии и детекторы Отношение измеренных доз к расчетной величине, Оизм / Орасч
Среднее значение по данным штатного прибора Р-16 (датчики Д1 и Д2 за период 1994-1997 гг. 0,99-1,03
Спектрометр с использованием тканеэквивалентного пропорционального счетчика (ТЭПС) 0,99-1,01
Термолюминесцентные сборки (среднее значение по отсекам станции и по сериям экспериментов). Эксперименты по программе «Мир-Шаттл» и индивидуальные дозиметры экипажей за экспедиции основные ЭО-18 — ЭО-23 0,77-0,85
Прибор Доза А1 0,75
Прибор «Пиле» 1,1
Спектрометр «Нозика» 1,2
Для вычисления обобщенной дозы от детерминированных источников и расчетов радиационного риска (разд. 7 и 8) принимали
71
указанные в табл. 2.6 значения среднесуточных среднекостномозговых эквивалентных доз на орбитах станции «Мир». Среднекостномозговые дозы для плотноионизирующей компоненты DniI (ГКЛ + нейтроны) для орбиты станции «Мир» для периодов минимума и максимума СА оценены равными 455 и 247 мкЗв/сут (45,5 и 24,7 мбэр/сут) соответственно. Среднекостномозговые среднесуточные дозы от РПЗ для указанной орбиты и периодов СА оценены равными 90 и 53 мкЗв/сут (9,0 и 5,3 мбэр/сут). Суммарные значения эквивалентной дозы на костный мозг будут для периодов минимума и максимума СА составлять 545 и 300 мкЗв/ сут (54,5 и 30 мбэр/сут).
АНАЛИЗ СУЩЕСТВУЮЩИХ ПОДХОДОВ К ОЦЕНКЕ РАДИАЦИОННОЙ
А) ОПАСНОСТИ ДЛЯ КОСМОНАВТОВ
в ПРОЦЕССЕ МЕЖПЛАНЕТНЫХ И ОРБИТАЛЬНЫХ КОСМИЧЕСКИХ ПОЛЕТОВ.
КЛИНИКО-ЭКСПЕРИМЕНТАЛЬНОЕ ОБОБЩЕНИЕ ВОЗМОЖНЫХ БЛИЖАЙШИХ НЕБЛАГОПРИЯТНЫХ ЭФФЕКТОВ
К периоду начала орбитальных космических полетов в радиобиологической литературе как в СССР, так и за рубежом за 60-летний период были представлено большое число клинических материалов по практическому применению ионизирующих излучений для лечения злокачественных опухолей различных органов и тканей. Использовалось, как правило, локальное ограниченное по площади рентгеновское или гамма-облучение в больших дозах. С целью сохранения кожи при глубоко расположенной опухоли применяли различные режимы многократного фракционированного облучения. В редких случаях по необходимости осуществляли фракционированное облучение почти всего тела. При этом по мере увеличения дозы отмечалось в первые часы после облучения ухудшение самочувствия пациентов, связанное с развитием первичной лучевой реакции. Материалы по частоте и времени проявления различных ближайших неблагоприятных эффектов в зависимости от дозы нашли свое отражение в литературе. Представлены практически все редкие случаи облучения людей в различных, в том числе больших дозах при авариях на реакторах, ускорителях и при работе с источниками ионизирующих излучений в атомной промышленности. Описаны подробно реакции организма и методы лечения лучевых поражений (Гуськова А.К., Байсоголов Г.Д., 1971).
В связи с гонкой ядерных вооружений в 1940-1950-е годы и широким развитием атомной промышленности с целью устране
73
ния ядерной угрозы и обеспечения безопасности населения в разных странах создаются радиобиологические центры и лаборатории для изучения ближайших реакций организма млекопитающих и оценки возможных отдаленных последствий при облучении в различных дозах. Были изучены изменения в различных системах организма млекопитающих после острых однократных и повторных облучений в сравнительно больших дозах. На ряде крупных млекопитающих и на большом числе мелких лабораторных животных ставилось значительное число экспериментов по хроническому их облучению с различной мощностью дозы в течение всей жизни с целью изучения формирования радиационного поражения и определения возможного сокращения продолжительности их жизни. Были представлены в литературе ряд моделей эффективной остаточной дозы, описывающих с учетом восстановительных процессов закономерности формирования радиационного поражения и изменение устойчивости организма животных после острых радиационных воздействий в различных дозах и в процессе протяженных облучений (Блэр X., 1958; Девид-сон Г.О., 1960; Blair Н.А., 1962, 1964; Mewissen DJ. et.al., 1957; Sacher G.A., Grahn D., 1964; Grahn D., Sacher G.A., 1968; Акоев И.Г., 1970; Григорьев Ю.Г., 1975).
Основные изменения в период разгара лучевой болезни, определяющие ее тяжесть и возможность благоприятного исхода, а также вероятность гибели в ближайшие 30-60 суток, связаны со степенью поражения стволовых кроветворных клеток и глубиной аплазии клеток в костном мозге и периферической крови. Поэтому целью подавляющего числа работ было исследование характера развития поражения в системе кроветворения (как основной критической системы организма), а также разработка методик по снижению глубины цитопенических реакций в системе и увеличению скорости восстановления числа лейкоцитов и тромбоцитов в крови.
Значительное число исследований посвящено также изучению степени поражения и восстановления в системе сперматогенеза, а также в ряде других радиочувствительных быстро обновляющихся тканей организма: желудочно-кишечном эпителии и эпидермисе.
В разд.1 нами было показано, что воздействие солнечных космических лучей при развитии мощных СПС может представлять значительную опасность для космонавтов при осуществлении
74
межпланетных космических полетов. Дозы за малыми толщинами защиты космического аппарата могут быть очень высокими, что не только может привести к серьезному нарушению работоспособности и жизнеспособности космонавтов за счет развития первичной лучевой реакции (ПЛР), но имеется значительный риск развития тяжелой степени лучевой болезни и даже смертельного исхода при этих дозах.
Применительно к проблеме обоснования допустимых доз и обеспечения радиационной безопасности космических полетов в обобщающих работах проведен всесторонний анализ материалов по зависимости от дозы ПЛР и характера развития лучевой болезни при действии рентгеновского и гамма-излучений, а также протонов высоких энергий (Блэр X., 1958; Langham W.H., Brooks F.M., Grahn D., 1965; Radiobiological factors in manned space flight., 1967; Биологическое действие протонов высоких энергий, 1967; Григорьев Ю.Г., Раевская С.А., Аврунина Г.А., 1970; Акоев И.Г., 1970; Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975; Григорьев Ю.Г., Тобайес К., 1975 и др.). В этих работах, как и в большинстве других рассматривались в основном ближайшие неблагоприятные эффекты, которые могли бы иметь место у человека в результате облучения в различных дозах, которые могли бы приводить к ухудшению состояния различных систем организма животных и их устойчивости к экстремальным нагрузкам, а также работоспособности и жизнеспособности человека в условиях космического полета.
В настоящем разделе книги проводится обобщение проводимых в СССР и за рубежом исследований, касающихся именно ближайших неблагоприятных последствий для работоспособности человека и изменения его жизнеспособности после облучения в различных дозах. Эти материалы составляли основу для разработки первых и последующих, вплоть до 1985 г., нормативов, ограничивающих уровни облучения космонавтов в процессе осуществления космических полетов различной продолжительности.
3.1. Вероятность и характер развития первичной лучевой реакции в результате острых облучений в различных дозах
В условиях кратковременного и длительных космических полетов определенную опасность, как нами было показано, представляют солнечные космические лучи (СКЛ) при развитии солнечных
75
протонных событий (СПС). При дозах, превышающих 25 сЗв, серьезную опасность в отношении работоспособности и жизнеспособности членов экипажа космического аппарата может представить первичная лучевая реакция (ПЛР). Степень ее проявления в значительной мере связана с индивидуальной радиочувствительностью человека. Это обусловливает необходимость дополнительного внимания к вопросу индивидуального отбора космонавтов.
В реакции организма после острого кратковременного облучения в сублетальных дозах 25-250 сГр и при более высоких уровнях воздействия можно выделить несколько стадий развития процесса. Первичная лучевая реакция (ПЛР) включает симптомы, проявляющиеся в ближайшие часы после облучения. Она является отражением отклика периферических отделов нервной системы и характеризуется желудочно-кишечными симптомами: отказом от пищи, тошнотой, рвотой, диареей, кишечными спазмами, а также нервно-мышечными симптомами, к которым относятся: усталость, апатия, общая слабость, повышенное потоотделение, лихорадка, головные боли.
Данный спектр проявлений ПЛР в значительной степени соответствует симптомам известной болезни движения, которые наблюдаются у отдельных членов экипажа в начальной фазе осуществления космического полета и могут приводить к значительному снижению их работоспособности. Поэтому изучение механизмов их возникновения имеет большое значение для обеспечения безопасности полетов, для изыскания методов и средств уменьшения тяжести их проявления. Хотя нет единого мнения в отношении механизма развития ПЛР, тем не менее показано, что вероятность появления различных симптомов и их выраженность обусловлены в значительной степени размером облучаемой поверхности тела и величиной дозы. Они существенно усиливаются при тотальном равномерном облучении всего тела. В отношении указанных проявлений туловище является критической частью тела. Чувствительность его максимальна при облучении эпигастральной области (в области желудка) и падает по направлению к голове так же, как и по направлению к конечностям. Облучение живота, грудной клетки, головы и конечностей в одной и той же дозе приводило к выраженной первичной реакции в 50, 33, 25 и 0% случаев соответственно (Langham W.H., Brooks F.M., Grahn D., 1965; Radiobiological factors in manned space flight., 1967).
76
Для установления нормативных допустимых уровней радиационного воздействия с целью обеспечения безопасности космонавтов при осуществлении космических полетов и сохранения необходимого уровня работоспособности членов экипажа большое значение имеет установление количественных соотношений между вероятностью и тяжестью выраженной первичной лучевой реакции и величиной поглощенной дозы. Дозовые зависимости для
различных проявлений ПЛР установлены на основе данных атомных бомбардировок, клинических обследований лиц, пострадавших от ядерных аварий и больных раком, облучавшихся с терапевтическими целями (Раевский Б, 1959 Gerstner Н.В., 1960; Langham W.H., Brooks F.M., Grahn D., 1965; Radiobiological factors in manned space flight., 1967; Григорьев Ю.Г., Раевская C.A., Авру-
нина Г.А., 1970; Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975; Ранние эффекты облучения человека высокими дозами, НКДАР ООН, 1988).
На рис. 3.1 представлена зависимость вероятности развития различных симптомов первичной лучевой реакции от дозы (Radiobiological factors in manned space flight. Ed. W.H. Langham, 1967). Как видно из данных, представленных на рисунке, зависимость вероятности симптомов ПЛР в пробитах может быть представлена прямолинейной зави
Рис. 3.1 Зависимость первичной лучевой реакции от дозы.
По оси абсцисс — поглощенная доза, с Гр; по оси ординат — вероятности развития различных симптомов
1 — потеря аппетита; 2 — тошнота;
3 — рвота; 4 — диарея
симостью от дозы:
y = ai+biD. (3.1)
В табл. 3.1 представлены значения коэффициентов а^ и bj для таких видов проявлений, как потеря аппетита, тошнота, рвота, диарея.
77
Таблица 3.1
Значения коэффициентов а} и bj для определения вероятности развития различных симптомов первичной лучевой реакции и величины среднеэффективных доз у 50% пациентов
(Radiobiological factors in manned space flight. Ed. W.H. Langham, 1967).
Симптомы ai bi D(50%) ± d
Потеря аппетита 3,71 0,0107 121 ± 37
Тошнота 3,50 0,0087 172 ± 42
Рвота 3,33 0,0078 214 ± 68
Диарея 3,30 0,0084 238 ± 55
Проведенный анализ ПЛР у большого количества людей обнаружил значительную вариабельность степени ее проявления у отдельных индивидуумов и самой частоты при переходе от одного контингента к другому. Частично сказывается несколько различающийся характер радиационного воздействия, но в большей степени это обусловлено индивидуальными вариациями радиочувствительности различных людей, которая в свою очередь зависит от здоровья индивидуума, исходного состояния организма на
Рис. 3.2 Зависимость времени проявления продромальных симптомов ПЛР от дозы.
По оси абсцисс — поглощенная доза, сГр; по оси ординат — время наступления симптомов, часы
момент облучения и его психологического статуса. Вариабельность несколько усиливается при малых и больших уровнях доз по сравнению с D(50%). Так, для доз, соответствующих частотам проявлений 10 и 90%, она составляет почти 100% по дозе.
На рис. 3.2 представлена зависимость между временем начала проявления продромальных симптомов и поглощенной дозой (Ранние эффекты облучения человека высокими дозами,
78
Рис. 33. Характер изменения частоты наиболее тяжелых проявлений ПЛР (тошноты и рвоты) от времени после острого облучения в различных дозах.
По оси абсцисс — время после облучения; по оси ординат — частота симптомов ПЛР, в %: 1 — 300 сГр;
2 - 200 сГр; 3 - 150 сГр; 4 - 100 сГр
НКДАР ООН, 1988). Как видно из рисунка, с увеличением дозы отмечается более раннее начало первичной реакции. Она при этом носит более выраженный характер и продолжается дольше.
Нарастание относительной частоты первичной реакции в отношении наиболее тяжелых проявлений (тошноты и рвоты) и ее продолжительность для различных доз показана на рис. 3.3 по данным работы (Gerstner Н.В, 1958, 1960).
После короткого бессимптомного латентного периода начинается нарастающее ощущение слабости, которое может сопровождаться психической депрессией и эмоциональными расстройствами. Почти одновременно наступают желудочно-кишечные расстройства, которые сопровождаются тошнотой, позывами на рвоту и самой рвотой.
Максимум развития проявлений по их тяжести и частоте приходится на 6-8 часов после облучения. Затем в течение 1-2 суток состояние постепенно улучшается. Степень расстройства и длительность восстановительного периода зависят от величины поглощенной дозы и индивидуальной чувствительности субъекта. В случае ПЛР средней тяжести слабость, приступы тошноты и рвоты могут продолжаться и на второй день после облучения. Следует отметить, что повышенная утомляемость и слабость при дозах в диапазоне 1,0-2,0 Гр могут сохраняться в течение нескольких недель.
По клиническому течению авторы исследований (Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975) отмечают 4 степени тяжести первичной реакции. Эти данные представлены в табл. 3.2.
79
Таблица 3.2
Степени тяжести первичной лучевой реакции
Доза, сГр Степень ПЛР Характерные проявления Работоспособность
25-100 1 Слабовыраженные симптомы: слабость, головная боль, снижение аппетита, легкое головокружение Не нарушена
100-150 2 Общая слабость, стойкая тошнота (может сопровождаться однократной рвотой), выраженное снижение аппетита, головная боль, головокружение, нарушения сна Заметно снижена
150-250 3 Комплекс симптомов, включающий: сильную общую слабость, отсутствие аппетита, резкую тошноту, многократную рвоту, апатию, выраженное извращение вкуса и обоняния, резкое головокружение, сильную головную боль, бессонницу Выраженное снижение работоспособности в первые двое суток после облучения
Более 250 4 Комплекс симптомов при третьей степени и дополнительно развиваются понос, озноб, судороги Невозможность осуществления какой-либо деятельности
К реакциям первой степени относятся единичные по частоте и слабовыраженные симптомы: слабость, головная боль, снижение аппетита, легкое головокружение. Работоспособность при этом не нарушена. Этим реакциям соответствуют уровни воздействия доз 25-100 сГр. Реакции второй, третьей степени при дозах 100-150 и в диапазоне 150-250 сГр, как это видно из данных табл. 3.2, характеризуются уже заметным и выраженным снижением работоспособности. При дозах более 250 сГр уже с большой вероятностью могут дополнительно к прежним симптомам развиться диарея, озноб и даже судороги. При этом невозможна какая-либо физическая деятельность.
80
Из-за существенной вариации индивидуальной радиочувствительности возможно в отдельных случаях некоторое перекрытие дозовых диапазонов. Представленные границы доз, соответствующие разной степени проявления ПЛР, характерны для основной части рассматриваемого контингента лиц. В то же время в 10% случаев (у наиболее радиочувствительных индивидуумов) уже при дозах 25-50 сГр может развиться первичная реакция второй степени тяжести (Radiobiological factors in manned space flight. Ed. W.H. Langham,1967; Гуськова A.K., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975).
Таким образом, рассмотренные материалы свидетельствуют, что в ранние сроки после возможного острого облучения в условиях длительного космического полета в дозах, превышающих 25 сЗв, серьезную опасность для экипажа космического аппарата может представить первичная лучевая реакция.
Степень ее проявления в значительной мере связана также с индивидуальной радиочувствительностью. Это обусловливает необходимость дополнительного внимания к вопросу индивидуального отбора космонавтов. При этом следует учитывать близость рассмотренных симптомов первичной лучевой реакции и симптомов болезни движения, отмечаемых в начальной фазе полета. Люди, наиболее чувствительные и в наибольшей степени страдающие от вестибулярных расстройств при применении ускорений (у которых наиболее отчетливо проявляются симптомы болезни движения), по-видимому, будут в большей степени радиочувствительными, и проявления ПЛР у них будут более частыми и тяжелыми уже при сравнительно небольших величинах доз острого облучения 25-100 сГр.
3.2. Характеристика клинических проявлений и изменение жизнеспособности организма в ближайшем пострадиационном периоде в зависимости от поглощенной дозы
После первых двух суток основные симптомы лучевой реакции сменяются периодом так называемого «мнимого благополучия», продолжительность которого сокращается по мере увеличения поглощенной дозы. В этот период улучшается общее состояние облученных, однако выявляются некоторые неврологические симптомы и изменения в системе гемопоэза.
81
В следующем за ним периоде «разгара лучевой болезни» развивается общая слабость, повышается температура тела, отмечаются максимально глубокие изменения в системе кроветворения, могут развиваться инфекционные осложнения, геморрагические проявления, функциональные изменения со стороны центральной нервной, а также сердечно-сосудистой систем. В случае преимущественного повреждения кожи при неравномерных облучениях возможно развитие эритемы, эпиляции.
Развивающиеся позже в период разгара болезни реакции также были классифицированы по степени тяжести на три категории (Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975). Острая лучевая болезнь (ОЛБ) I степени тяжести развивается при облучении в диапазоне доз 100-250 сГр. Острая лучевая болезнь II степени имеет место в диапазоне доз 250-400 сГр, а лучевые реакции III степени при дозах, превышающих 400 сГр.
Остановимся на симптомах, характерных для доз, не превышающих 250 сГр, поскольку при развитии лучевой болезни II и III степени тяжести имеется высокая вероятность смертельного исхода, и в нормативных документах эти уровни доз однократного облучения не допускаются.
Для решения вопросов нормирования и определения допустимых уровней доз для экипажей космических аппаратов, применительно к кратковременным радиационным воздействиям СКЛ во время развития солнечных протонных событий (СПС), важно проанализировать более подробно степень нарастания тяжести радиобиологических проявлений по мере увеличения поглощенной дозы. Эти данные представлены в табл. 3.3.
Диапазон доз 15-25 сГр является пограничным, ниже которого не выявляются никакие клинически обнаруживаемые симптомы поражения. При этих дозах отмечается лишь достоверное снижение концентрации лимфоцитов и увеличивается лабильность числа лейкоцитов, которая может продолжаться в течение нескольких лет. Эти изменения могут быть выявлены только в результате эпидемиологического обследования больших контингентов людей (The Effects of Atomic Weapons,1950; Козлова A.B., Воробьев Е.И, 1956; Защита работников от ионизирующих излучений, 1958; Раевский Б., 1959; Петров Р.В. и др., 1963; Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975). Как считают авторы указанных работ, повреждения организма при этих дозах не возникают, а указанные изменения носят скорее перераспределительный характер.
82
Таблица 3.3
Клинические проявления, развивающиеся в организме человека после облучения в различных дозах
Доза, сГр Реакции в ближайшем пострадиационном периоде
15-25 Достоверно снижается концентрация лимфоцитов и увеличивается лабильность числа лейкоцитов.
25-50 В единичных случаях (1-5%) развивается первичная лучевая реакция в выраженной форме. Уменьшаются концентрации лейкоцитов и тромбоцитов в периферической крови, относительное число лимфоцитов снижается на 25%. В дальнейшем наблюдаются длительные в течение трех лет колебания их числа
50-100 Первичная лучевая реакция в острой форме имеет место у 5-10% индивидуумов. Отмечается умеренная аплазия костного мозга, происходит дальнейшее снижение концентрации лейкоцитов и тромбоцитов в крови до 60-70%. Число лимфоцитов снижается вдвое. Лимфопения может отмечаться на протяжении до двух лет.
100-150 Признаки ПЛР в тяжелой форме имеют место у 19-20% людей. Число миелокариоцитов в костном мозге снижено до 25-30% при верхнем граничном значении дозы. Эритроидный и миелоидный ростки снижены в 3-4 раза. Концентрация нейтрофилов и лимфоцитов в крови уменьшается в 2 раза. Развиваются аутоаллергические реакции. Отмечаются единичные смертные случаи (< 1%)
150-200 Выраженная ПЛР и средняя степень тяжести острой лучевой болезни у 30-50% людей. Лейкопения достигает 10-30%, лимфопения — до 6-12%, тромбоцитопения — 10-20% от нормы. Число эритроцитов оказывается сниженным до 60%. Отмечаются смертельные исходы в 1-5% случаев
200-250 Лучевая болезнь имеет место у 100% людей. Наблюдается аплазия костного мозга, резковыраженная лейкопения, включая лимфопению, нейтропению и эозинопению. Кроме того, отмечают тромбоцитопению с выраженными геморрагическими проявлениями. Число лейкоцитов уменьшается до 1500 в 1 мм3 с развитием относительной и абсолютной нейтропении (до 500 в 1 мм3). Количество тромбоцитов падает до уровня 5104 в 1 мм3. В этом дозовом диапазоне приблизительно в 5-20% случаев возможно более тяжелое течение болезни и летальный исход
83
В интервале доз 25-50 сГр в единичных случаях (1-5%) развивается первичная лучевая реакция в выраженной форме (Gerstner Н.В, 1958, 1960; Radiobiological factors in manned space flight, 1967; Гуськова A.K., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975). Отмечаются начальные признаки угнетения костно-мозгового кроветворения: уменьшается концентрация лейкоцитов и тромбоцитов в периферической крови, относительное число лимфоцитов снижается на 25%. Серьезные повреждения отсутствуют. За первоначальным в первые часы лейкоцитозом и последующим снижением числа лейкоцитов в дальнейшем наблюдаются длительные в течение 3 лет колебания их числа.
В диапазоне 50-100 сГр первичная лучевая реакция в острой форме имеет место у 5-10% индивидуумов. Отмечается умеренная аплазия костного мозга, происходит дальнейшее снижение концентрации лейкоцитов и тромбоцитов в крови до 60-70%. Число лимфоцитов снижается вдвое. Изменения достаточно стабильны. Лимфопения может отмечаться на протяжении до 2 лет. Кроме того, при верхнем граничном значении дозы наблюдается снижение гемоглобина (Gerstner Н.В, 1958; Петров Р.В. и др., 1963; Груздев Г.П., 1988).
При облучении в дозах 100-150 сГр признаки ПЛР в тяжелой форме имеют место у 19-20% людей. Число миелокариоцитов в костном мозге снижено до 25-30% при верхнем граничном значении дозы. Эритроидный и миелоидный ростки снижены в 3-4 раза. Концентрация нейтрофилов и лимфоцитов в крови уменьшается в 2 раза. Отмечаются единичные смертные случаи (<1%). Экспериментальные исследования, проведенные на уровне целого организма и на клеточном уровне, показали, также, что облучение в дозе, превышающей 100 сГр, приводит к снижению устойчивости к инфекции (снижается фагоцитарная активность лейкоцитов) и изменяется ряд показателей иммунитета. Имеет место ухудшение миграционных свойств лимфоцитов, развиваются аутоаллергические реакции.
Облучение в диапазоне доз 150-200 сГр приводит к выраженным первичным лучевым реакциям и средней тяжести острой лучевой болезни у 30-50% людей. Лейкопения достигает 10-30%, лимфопения — до 6-12%, тромбоцитопения — до 10-20% от нормы. Число эритроцитов оказывается сниженным до 60%. Отмечаются смертельные исходы в 1-5% случаев. При больших дозах лучевая болезнь имеет место у 100% людей. Наблюдается аплазия
84
костного мозга, выраженная лейкопения, включая лимфопению, нейтропению и эозинопению. Кроме того, отмечают тромбоцитопению с выраженными геморрагическими проявлениями и аплазию. Число лейкоцитов уменьшается до 1500 в 1 мм3 с развитием относительной и абсолютной нейтропении (до 500 в 1 мм3). Количество тромбоцитов падает до уровня 5 х 104 в 1 мм3. Отмечаются общая вялость, утомляемость, усиление головных болей, наблюдается ухудшение аппетита, несколько снижается или становится более лабильным артериальное давление. Из неврологических симптомов имеют место нерезкое снижение рефлексов, умеренная мышечная гипотония. Восстановление начинается постепенно с 45-50-го дня и происходит достаточно медленно. Астенические явления наблюдаются в течение длительного времени, сохраняется также умеренная артериальная гипотония. В этом до-зовом диапазоне приблизительно в 5-20% случаев возможно более тяжелое течение болезни и смертельный ее исход. Рассмотренные проявления при дозах 100-250 сГр относятся по классификации к острой лучевой болезни (ОЛБ) I степени (Gerstner Н.В., 1958; Miller L.S., et al., 1958; Раевский Б., 1959; Гуськова А.К., Байсоголов Г.Д., 1971; Белоусова О.И., Трушина М.Н., 1974; Григорьев Ю.Г., 1975; Ранние эффекты облучения человека, Доклад НКДАР ООН, 1988; Груздев Г.П., 1988; Калан-дарова М.П., 1988).
Для установления характера изменения общей устойчивости организма и определения радиационного риска в пострадиационном периоде важно проанализировать вероятность выживания человека в зависимости от дозы радиационного воздействия. В радиобиологических исследованиях установление кривых доза-эффект и определение вероятности смертности животных в зависимости от дозы острого равномерного облучения в ближайшем пострадиационном периоде (в течение 30-60 суток) является основным методическим приемом для оценки изменения состояния организма и его устойчивости при предварительном воздействии какого-либо химического препарата или физического фактора. Этот подход используется также для определения величины остаточного поражения на любой момент времени после предварительного воздействия ионизирующих излучений с произвольным характером распределения дозы во времени. Он применяется для определения модифицирующего действия радиопротекторов, гипоксии, других физических факторов на радиобиологический эффект.
85
Наиболее часто в радиобиологической литературе при анализе и сравнении экспериментальных данных используют величины среднелетальных доз О5о/зо-бо> представляющие собой дозы, вызывающие 50%-ю гибель млекопитающих в ближайшем пострадиационном периоде (30 суток для мелких лабораторных животных и 60 суток для крупных млекопитающих), когда ведущей причиной гибели является поражение кроветворения (костно-мозговой синдром).
Нами проведен анализ значений среднелетальных доз для различных видов животных по большому числу экспериментальных исследований (Paterson Е., Gilbert C.W., Haigh В., 1956; Norris W.P., Fritz Т.Е., Renfeld C.E., Poole C.M., 1968; Page N.P., Ainsworth EJ., Taylor J.F., 1968; Даренская Н.Г., 1970; Акоев И.Г., 1970; Бонд В., Флиднер Т., Аршамбо Д., 1971; Taylor J.F., et al., 1971; Бонд В., 1974; Берикашвили В.Ш., 1975; Шафиркин А.В., 1997, 1999в) с целью осуществления экстраполяции величин D50 применительно к человеку. Рассмотрены различные представленные в литературе подходы по экстраполяции от животных к человеку на основе основного обмена, веса тела, продолжительности жизни животных, периода водного обмена, продолжительности жизни эритроцитов, времени максимального снижения концентрации лейкоцитов, периода полувосстановления показателей периферической крови и периода восстановления устойчивости организма к последующим острым облучениям.
В табл. 3.4 представлены значения среднелетальных доз D до/зо -60 Для различных млекопитающих. В ней указаны среднетканевые поглощенные дозы при равномерном остром облучении и локальные тканевые лощенные дозы в центре размещения биологического объекта.
Как видно из данных таблицы, в том случае, когда ведущей причиной гибели является поражение системы кроветворения, все виды животных по величине О50/з0_60 можно подразделить на две большие группы. Все крупные млекопитающие характеризуются высокой радиочувствительностью и имеют низкие значения среднелетальных среднетканевых доз в пределах 155-260 сГр, а мелкие лабораторные животные являются относительно радиоре-зистентными (доза D50/30 находится в диапазоне 850-940 сГр). Морские свинки и обезьяны являются исключениями при такой классификации.
86
Таблица 3.4
Значения среднелетальных доз D50/30-60 для различных млекопитающих
Вид животных Среднетканевая доза, сГр Локальная тканевая доза, сГр Литературный источник
Мышь, крыса 900-940 850 900-940 850 Бонд В., 1974; Даренская Н.Г, 1970; Шафиркин А.В., 1997, 1999
Хомяк 900-936 900-936 Бонд В., 1974; Даренская Н.Г, 1970
Кролик 840-890 — Бонд В., 1974; Даренская Н.Г, 1970
Морская свинка 255 — Бонд В., 1974; Даренская Н.Г, 1970
Овца 155 251 237 Бонд В., 1974; Даренская Н.Г, 1970 Page N.P., et al., 1968
Коза 230 331 327 Бонд В., 1974; Даренская Н.Г, 1970 Taylor J.F., et al., 1971
Свинья 195 400 Бонд В., 1974; Даренская Н.Г, 1970
Собака 255 258 319 330 Бонд В., 1974; Даренская Н.Г, 1970 Norris W.P., et al., 1968
Обезьяна 400 623 550 Бонд В., 1974; Даренская Н.Г, 1970 Paterson Е., et al., 1956
Человек 225-270 225-250 315-350 400 356-381 Бонд В., 1974; Даренская Н.Г, 1970 Langham W.H., 1967 ДокладНКДАР ООН, 1988
Интересно отметить, что аналогичная классификация по выделению двух групп животных отмечена в работе (Fliedner Т.М., 1967) при анализе времени максимальных изменений в системе
87
кроветворения и скорости восстановления после облучения в дозах (1/2—2/3) D50/30. По результатам работ (Даренская Н.Г., 1970; Берикашвили В.Н., 1975) такое же разделение групп может быть проведено по показателям продолжительности жизни эритроцитов, периоду полувосстановления организма после радиационного воздействия, времени максимальной лейкопении и периоду полувосстановления концентрации клеток в периферической крови.
Таким образом, получено, что на основе данных по среднелетальным дозам у различных млекопитающих (табл. 3.4) ни по одному из представленных в литературе методов не удается провести надежную экстраполяцию к человеку и получить сравнительно точную оценку величины среднелетальной дозы для человека. Еще более трудно на основе экспериментальных данных получить кривую доза-эффект для человека, определяющую зависимость риска смертности от поглощенной дозы.
Тем не менее делались серьезные попытки установить данную функциональную зависимость на основе гибели людей в результате ядерных бомбардировок, испытаний ядерного оружия, несчастных случаев и облучения больных при радиотерапевтических процедурах. Следует, однако, заметить, что при анализе результатов атомных бомбардировок или аварийного облучения оценки значений поглощенных доз существенно различаются. При этом радиационное воздействие является в большинстве случаев неравномерным и отягощенным иногда повреждениями кожи.
Более точные значения поглощенных доз могут быть получены в клинике при облучении пациентов в терапевтических целях, однако конечные эффекты всегда модифицированы предварительным лечением, а также защитными лечебными и терапевтическими процедурами, применяемыми после облучения. Кроме того, следует учитывать, что облучению подвергаются уже заведомо больные люди и результаты могут быть перенесены на здоровых людей с большой осторожностью и дополнительной коррекцией.
Зависимость процента гибели от дозы для человека и животных соответствует нормальному распределению Гаусса. Она имеет сигмоидную форму, но при выражении в пробитах превращается в прямолинейную зависимость. На основе анализа результатов равномерного облучения большого количества пациентов в клинике (Radiobiological factors in manned space flight. Ed. W.H. Langham, 1967) представлена зависимость вероятности гибели в пробитах
88
от дозы, которая имеет следующий вид: у = 3,06 + 0,0077 D, где D — поглощенная доза, выраженная в сГр. Соответственно кривая, описывающая выживаемость пациентов от дозы, может быть записана следующим образом: у = 6,94 - 0,0077 D.
Как указывалось в работах (Radiobiological factors in manned space flight. Ed. W.H. Langham, 1967; Ранние эффекты облучения человека. Доклад НКДАР ООН, 1988), у необлученных пациен
тов смертность за период 60 суток составляла 4% (выживаемость 96%). Эта величина хорошо соответствует экстраполированному значению, полученному из уравнения. При дозе, равной нулю, пробит равен 6,94, а выживаемость 97%. На рис. 3.4 представлена указанная
выше зависимость выживаемости человека от дозы для больных раком, облучавшихся с терапевтической целью (пунктирная кривая).
На этом же рисунке показаны данные по выживаемости для случаев
Рис. 3.4. Вероятность выживания человека в ближайшем периоде после рентгеновского и гамма-облучения в различных дозах. По оси абсцисс — среднетканевая поглощенная доза, сГр; по оси ординат — вероятность выживания в течение 60 суток, пробиты
атомных бомбардировок, испытаний ядерного оружия и несчастных случаев для людей, здоровых до воздействия (Козлова А.В., Воробьев Е.И., 1956; Раевский Б., 1959; Бонд В., 1974; Ранние эффекты облучения человека. Доклад НКДАР ООН, 1988).
При проведении сплошной кривой для здоровых людей в работах (Шафиркин А.В., 1997; Шафиркин А.В., Венедиктова В.П., 1999-а; Шафиркин А.В., 1999в) учитывали, что при стремлении дозы к нулю вероятность гибели должна соответствовать известным из демографических данных коэффициентам смертности для мужчин соответствующего возраста. Применительно к решению задачи обеспечения безопасности космических полетов для оценки значения риска выбирали значение коэффициента смертности в нашей стране для мужчин в возрасте 25 лет, которое в 1993-
89
1996 гг. в пересчете для периода 60 суток составило 7,0 хЮ-4 (пробит 1,8). Соответствующее значение выживаемости равно 99,93% — пробит 8,2 (Российские статистические ежегодники 1994-1997 гг.; Россия в цифрах. Краткий статистический сборник 1996-1997 гг.)
Таким образом, уравнение прямой, определяющее зависимость выживаемости в пробитах для здоровых мужчин в возрасте 25 лет от дозы при остром равномерном облучении может быть записано в виде
y(D) = 8,2 - 0,97 D х 10"2, (3.2)
В то же время уравнение, определяющее вероятность гибели в пробитах от дозы, имеет следующий вид:
yt(D) = 1,8 + 0,97 D х 10-2, (3.3)
где D — поглощенная среднетканевая доза в сГр при кратковременном, равномерном облучении от источников стандартного излучения с коэффициентом качества, равным 1.
Таким образом, для мужчин в возрасте 25 лет величины доз, приводящие к 1,0, 10, 50 и 90% гибели за ближайший период (60 суток) после облучения, оказываются соответственно равными 90, 200, 330 и 460 сГр.
Предполагая, что радиочувствительность здоровых взрослых мужчин в возрасте 25-55 лет сохраняется одинаковой (одинаковый наклон кривых вероятности гибели от дозы), а изменяется только зависимая от возраста вероятность гибели при нулевой дозе, мы можем получить семейство параллельных кривых, аналогичных уравнению (3.3), определяющих зависимость смертности (за 60 суток) от дозы для людей различного возраста. Характер смещения кривых, определяющих гибель в пострадиационном периоде в зависимости от дозы для людей различного возраста, может быть установлен на основе смещения точки (пробита) при нулевой дозе, отражающего изменение вероятности гибели за 60 суток у мужчин различного возраста. Изменение пробита при нулевой дозе в зависимости от возраста может быть описано на основе анализа демографической ситуации в стране за период 1993-1996 гг.
У1(0) = 1,8 + 0,019(т - 25) (длят >25), (3.4)
где т — возраст в годах
90
Следует заметить, что величина среднелетальной дозы с увеличением возраста будет несколько снижаться, отражая снижение жизнеспособности организма с увеличением возраста. Расчеты, проведенные нами с учетом указанных допущений, показывают, что при увеличении возраста мужчин на каждые 10 лет величина среднелетальной дозы будет уменьшаться на 20 сГр. Это предположение находится в соответствии с данными радиобиологических экспериментов, в которых исследователи изучали изменение величин среднелетальных доз при облучении половозрелых животных разного возраста (Горлов В.Г., 1981; Шафиркин А.В., 1983а, 1999в).
Представленные соотношения (3.3) и (3.4), определяющие вероятность гибели человека в зависимости от дозы в ближайшем пострадиационном периоде, могут непосредственно использоваться для определения радиационного риска для космонавтов в процессе полета при установленном характере изменения обобщенной дозы от источников космического излучения.
3.3. Экспериментальные и медико-гигиенические материалы о формировании поражения и восстановлении кроветворения после острого и в процессе хронических воздействий ионизирующих излучений
Как уже отмечалось выше, характер ответных реакций организма при радиационных воздействиях, тяжесть протекания лучевой болезни и вероятность благоприятного ее исхода в значительной степени обусловлены состоянием кроветворения, одной из радиочувствительных обновляющихся тканевых систем организма. Продукция кроветворных клеток осуществляется непрерывно в течение всей жизни за счет пролиферации и дифференцировки, стволовых кроветворных клеток в направлении эритропоэза, ми-элопоэза, тромбопоэза и составляет за час у человека около (3-7) 108 клеток на 1 кг массы тела (Илюхин А.В. и др., 1976).
В работах (Till J.E., McCulloch Е.А., 1961; Kalina I., Praslicka M., Petrovicova J., 1977; Швец B.H., Шафиркин A.B., 1979; Коноплян-ников А.Г., 1984; Фабер Ю.В., Табакова Л.А., Шафиркин А.В., 1978; Шафиркин А.В., 1999в) подробно исследованы вопросы радиочувствительности стволовых кроветворных клеток у мышей и представлены кривые выживаемости этих клеток от дозы. На
91
основе анализа данных можно придти к заключению, что около 30-40% клеток имеют высокую радиочувствительность и их инактивация происходит в основном уже при 50 сГр (число клеток уменьшается по экспоненциальному закону с параметром DOi, равным 10 сГр). Оставшаяся часть клеток также инактивируется по экспоненциальному закону, причем при малых дозах начальный наклон кривых выживаемости от дозы у мышей характеризуется параметром DOh, равным 210-240 сГр, а конечный участок кривой при больших дозах определяется уравнением f(D) = n exp (-D/Do), где параметры п и Do соответственно равны 2,4 и 100 сГр.
Таким образом, общий вид кривой выживаемости стволовых кроветворных клеток может быть представлен следующим образом:
f(D) = 0,35 exp{-D/D01} + 0,65 exp{-D/DOlI}, D < 180сГр
(3.5)
f(D) = 0,35 exp{-D/D01} + 0,65 n exp{-D/D0}, D > 180сГр.
На основе анализа экспериментальных данных по выживаемости собак от дозы при их равномерном облучении, их выживаемости при субтотальном облучении с экранированием различной доли костного мозга (ГОСТ 25645.219-90, 1991), а также материалов, представленных в работах (Слепчонок О.Ф., 1989; Шафиркин А.В., 1999в), нами были определены параметрыОоь DOh и Do соотношения (3.5) для собак, которые оказались равными 10, 120 и 55 сГр. Значения экстраполяционного числа было тем же самым, что и для мышей, а граничное значение дозы, когда начальный наклон кривой сменяется на конечный, составляет 80 сГр вместо 180 сГр.
Поскольку величины среднелетальных доз для собак и человека являются достаточно близкими 260 и 330 сГр соответственно (см. разд. 3.2), можно предположить, что данная кривая выживаемости стволовых клеток от дозы с представленными параметрами для собак будет применима и для случаев острого равномерного облучения человека.
Процессы, происходящие во всех отделах системы кроветворения после острого облучения в сравнительно небольших и средних дозах (не приводящих еще к летальному эффекту) к настоящему времени широко изучены на разных видах животных
92
(HaighM.V., Paterson E„ 1956; Riopelle AJ„ Ades H.W., Morgan F.E., 1957; Leong G.F., Wisecup W.G., Grisham J.W., 1964; Ainsworth E.A. et al., 1965; Ainsworth E.J., Leong G.F., 1966; Dalrimple G.V. et al., 1966; Fliedner T.M., 1967; Nachtwey D.S; Рыжов Н.И. и др., 1967; Norris W.P. et al., 1968; Still E.T. et al., 1969; Абрамова Г.М., 1969; Акоев И.Г., 1970; Бонд В., Флиднер Т., Ар-шамбо Д., 1971; Белоусова О.И., Трушина М.Н., 1974; Груздев Г.П., 1968, 1988; Каландарова М.П., 1970; 1988; Невская Г.Ф., 1974; Щербова Е.Н., Груздев Г.П., 1977; Пяткин Е.К., Баранов А.Е., 1980; Fritz Т.Е. et al., 1982; Моничев А.Я., 1984).
Систематизированы также результаты клинических наблюдений (Dealy J.B., Tubiana М., 1964; Гуськова А.К., Байсоголов Г.Д., 1971;. Воробьев А.И., Бриллиант М.Д., Баранов А.Е., 1973; Бриллиант М.Д., Воробьев А.И., Баранов А.Е., 1974; Баранов А.Е. и др., 1977; Груздев Г.П., 1988; Ранние эффекты облучения человека высокими дозами, НКДАР ООН, 1988). Показано, что картина клеточного опустошения в костном мозге и в периферической крови в пострадиационном периоде в основном определяется гибелью части пролиферирующего пула клеток и снижением продукции клеток предшественников. В костном мозге отмечены более ранние и более глубокие изменения в красном ростке (уменьшение числа эритробластов), но в этом ростке имеет место и более раннее восстановление (Груздев Г.П., 1968, 1988; Каландарова М.П., 1970; Белоусова О.И., Трушина М.Н., 1974; Мосягина Е.Н. и др., 1976).
Наоборот, в периферической крови ранние и более сильные цитопенические реакции наблюдаются по числу лейкоцитов из-за гибели лимфоцитов и сравнительно малой продолжительности жизни гранулоцитов в кровотоке. Изменение числа тромбоцитов начинается несколько позже и практически повторяет динамику числа нейтрофилов в крови. Концентрация эритроцитов снижается в более позднем периоде при облучении в сравнительно больших дозах (400 сГр и выше) из-за сравнительно длительного времени их жизни в кровотоке.
К наиболее важному показателю, определяющему тяжесть протекания острой лучевой болезни и, следовательно, необходимость осуществления тех или иных медицинских мероприятий, следует отнести концентрацию нейтрофилов в крови. Изменение этого показателя во времени после облучения широко изучено в экспериментальных исследованиях и в клинике. На рис. 3.5 представлена
93
Рис. 3.5. Качественная картина изменения числа нейтрофилов в периферической крови в пострадиационном периоде.
По оси абсцисс — время после облучения, сутки (I; II; III; IV; V; VI; VII и VIII -различные фазы пострадиационной кинетики клеток)
качественная картина относительного изменения числа нейтрофилов в периферической крови в пострадиационном периоде у млекопитающих.
Начальный первый участок-плато (или лаг-фаза) связан с сохранением концентрации нейтрофилов в крови в ближайшем периоде после облучения, длительность его обусловлена временем созревания и депонирования зрелых гранулоцитов в костном мозге. Участок II
кривой характеризуется экспоненциальным снижением числа нейтрофилов. Этот процесс связан с частичным уменьшением продукции клеток предшественников, коммитированного и морфологически идентифицируемых отделов костного мозга. Скорость изменения числа клеток в пределах данного участка зависит от относительной доли сохранившихся предшественников и, следовательно, от поглощенной дозы.
Первый минимум числа нейтрофилов, наблюдаемый в пределах участка III, определяется, с одной стороны, наклоном экспоненциальных кривых на участке II, с другой — началом временной фазы «абортивного подъема» (участок IV). Время достижения первого минимума у человека, как показано в работах (Пяткин Е.К., Баранов А.Е., 1980; Груздев Г.П., 1988), может быть вычислено на основе соотношения: Tt = 12,65 exp(-0,0007D), где Tj — время, сут.; D — доза, сГр. Глубина уменьшения количества нейтрофилов описывается при этом следующей зависимостью: У! = 3,27 х 103 ехр (-0,0023 D), где yt — количество нейтрофилов в 1 мкл крови.
«Абортивный подъем» (участок IV) связан с компенсаторным усилением пролиферативных процессов в костном мозге. Максимально он проявляется при среднем уровне воздействия от 1,5 до 2,5 сГр. При меньших и слишком больших дозах он менее выражен или не выявляется совсем. «Абортивный подъем» у человека
94
начинается примерно с 12-х и длится до 22-х суток после облучения. Фаза вторичного опустошения (участок V) наступает непосредственно после «абортивного подъема» и связана с истощением возможности миелобластов и молодых делящихся гранулоцитов временно поддерживать необходимый более высокий уровень миелопоэза. Данная фаза вторичного опустошения переходит в участок VI, характеризующийся максимальной аплазией кроветворной ткани и минимальным количеством нейтрофилов и тромбоцитов в крови. Этот период соответствует разгару протекания лучевой болезни. От глубины снижения количества клеток и длительности рассматриваемой фазы зависят степень тяжести развивающегося костномозгового синдрома и исход заболевания. Минимальное количество нейтрофилов зависят от дозы и может быть определено из уравнения: у2 = 12,78 х 103ехр(-0,0231 D), где у 2 — число нейтрофилов в 1 мкл крови во втором минимуме; D — поглощенная доза, сГр (Пяткин Е.К., Баранов А.Е., 1980; Груздев Г.П., 1988). Концентрация тромбоцитов, соответствующая этой фазе, определяется уравнением у2 T=l,6xl05exp(-0,00925D).
Число нейтрофилов во втором минимуме (фаза VI), как и последующее быстрое и более медленное восстановление в фазах VII и VIII, непосредственно связаны с относительно сохраненной долей стволовых кроветворных клеток и последующим быстрым восстановлением их численности и продукции кроветворных клеток. Начало фазы быстрого восстановления числа нейтрофилов (участок VII) также зависит от дозы и сдвигается к более ранним срокам с увеличением дозы радиационного воздействия. Так, после облучения в дозе 150 сГр восстановление у человека начинается с 37-х суток, а при 450 сГр — с 26-х суток. Число тромбоцитов начинает восстанавливаться при этих дозах соответственно с 30-х и 22-х суток (Пяткин Е.К., Баранов А.Е., 1980; Груздев Г.П., 1988; Ранние эффекты облучения человека высокими дозами. Доклад НКДАР ООН, 1988).
Более раннее восстановление, по-видимому, связано с более сильным разрушением нейтрофилов и уменьшением периода их полувыведения из кровотока при больших дозах радиационного воздействия, что способствует последующему усилению пролиферативных процессов в стволовом, коммитированном и морфологически идентифицируемых отделах. Это может также объясняться снижением времени пребывания зрелых гранулоцитов в кост-
95
ном мозге (Мосягина Е.Н., 1976; Илюхин А.В. и др., 1982; Мони-чев А.Я., 1984 Григорьев Ю.Г. и др., 1986).
В табл. 3.5 представлено время проявления различных фаз в пострадиационной кинетике нейтрофилов у млекопитающих по данным экспериментальных исследований и клиническим наблюдениям. Из данных таблицы следует закономерное увеличение времени проявления рассмотренных выше фаз при переходе от мелких лабораторных животных к более крупным, что особенно выражено для времени достижения второго минимума.
Разница во времени у отдельных видов животных в пределах такого разделения групп является незначительной. Время проявления разных фаз для человека в 2-3 раза больше, чем у мышей и крыс, и в 1,5-2 раза больше, чем у обезьян и собак.
Значительный интерес представляет сопоставление глубины поражения стволовых кроветворных клеток от дозы, определяемой кривой выживаемости, представленной выше (см. уравнение (3.5)), и глубины поражения клеток в костном мозге и в периферической крови.
На рис. 3.6 представлены зависимости от дозы минимальных относительных количеств миелокариоцитов, клеток эритробластического и миелоидного рядов, а также молодых делящихся гранулоцитов в костном мозге у собак (Рыжов Н.И. и др., 1967; Белоусова О.И., Трушина М.Н., 1974; Каландарова М.П., 1970, 1988) и у человека (Груздев Г.П., 1988).
Из представленных на рисунке данных можно сделать вывод о близком характере изменений относительного числа клеток различных ростков в костном мозге у собак и человека при облучении в дозах до 200 сГр. Причем картина изменений относительного количества молодых делящихся гранулоцитов, а также клеток эритробластического ряда достаточно хорошо совпадает с относительным изменением числа стволовых кроветворных клеток (кривая 1).
При описании модели формирования поражения в системе кроветворения нами показано, что минимальное количество миелокариоцитов в костном мозге всегда является несколько большим, чем минимальное содержание стволовых кроветворных клеток (Шафиркин А.В., 19836, 1999в; Губин А.Т., Сакович В.А., Шафиркин А.В., 1995). Это имеет место как при хронических облучениях с небольшим значением мощности дозы, так и при острых воздействиях. Объяснением этому может служить относительно
96
Таблица 3.5
Время различных фаз в пострадиационной кинетике нейтрофилов у различных млекопитающих, сутки
Вид млекопитающих Различные фазы пострадиационой кинетики нейтрофилов Литературный источник
Плато 1 Экспоненциальное снижение Первый минимум Абортивный подъем Начало повторного снижения Второй минимум Фаза быстрого восстановления Фаза окончательного восстановления
1 II III IV V VI VII VIII
Человек 0-6 6-10 10-15 12-22 15-22 24-32 25-50 40-90 Miller, 1958; Dealy, 1964; Воробьев, 1973; Бриллиант, 1974; Баранов, 1977; Пяткин, 1980; Груздев, 1988;
Собака 0-2 2-7 7 7-12 13-14 16-18 18-30 30-60 Ainsworth, 1965, 1966; Fliedner, 1967; Рыжов, 1967; Акоев, 1970; Бонд, 1971;
Обезьяна 0-2 2-8 — — — 16-18 18-30 30-60 Haigh, 1956; Riopelle, 1957; Dalrimple, 1966
Свинья 0-2 2-6 6 6-10 11-12 16 18-28 28-60 Nachtwey , 1967
Овца 0-2 2-8 8 8-12 13 18-20 20-40 40-90 Leong, 1964
Козел 0-2 2-6 6 6-13 14 18-22 24-30 30-60 Taylor, 1971
Осел 0-6 6-16 — — — 25-35 37-45 45-90 Still, 1969
Кролик 0-2 2-4 4 6-13 12-14 14-16 16-30 30-60 Fliedner, 1967; Бонд, 1971; Щербова, 1977
Морская свинка 0-2 2-6 4-6 6-10 10-11 12-14 15-30 30-45 Щербова, 1977
Хомяк 0-2 2-4 4 — — 7 8-15 15-45 Hollowey, 1968
Крыса 0-2 2-4 4-5 6-9 8-10 10-12 12-20 20-45 Бонд, 1971; Щербова, 1977
Мышь 0-2 2-4 3-5 5-7 8 9-10 10-15 15-45 Leong, 1964; Fliedner, 1967
Рис. 3.6. Зависимость от поглощенной дозы минимального количества кроветворных клеток в костном мозге у собак и у человека.
По оси абсцисс — поглощенная доза, сГр; по оси ординат — относительное количество клеток (обведенные индексы — данные для человека). М — общая концентрация миелокариоцитов в костном мозге; Б — клетки белого, миелоидного ряда; Э — клетки эритроидного ряда; Г — молодые делящиеся гранулоциты; 1 — расчетная кривая для стволовых кроветворных клеток; 2 — расчетная кривая для числа миелокариоцитов на основе модельного описания (Шафиркин А.В., 1983-б;Губин А.Т., Сакович В.А., Шафиркин А.В., 1995)
большая, чем в норме, скорость размножения пролиферирующего пула клеток в костном мозге, обусловленная развитием компенсаторных процессов в организме, которые проявляются тем в большей степени, чем больше поражение в ткани.
98
На рис. 3.6 представлены также рассчитанные на основе моделей формирования радиационного поражениия в системе кроветворения (Шафиркин А.В., 19836, 1999в; Губин А.Т., Сакович В.А., Шафиркин А.В., 1995) минимальные количества миелокариоци-тов в костном мозге у собак в зависимости от дозы (кривая 2). Из рисунка видно, что расчетные значения минимального числа мие-локариоцитов достаточно хорошо соответствуют данным эксперимента на собаках и материалам клинических обследований людей, подвергнутых лучевой терапии.
На рис. 3.7 представлены зависимости от дозы минимального содержания форменных элементов в крови у крупных млекопитающих на основе представленных выше экспериментов, выполненных на крупных млекопитающих (Haigh M.V., Paterson Е., 1956; Leong G.F. et al, 1964; Ainsworth E.A., et al., 1965; Dalrimple G.V. et al., 1966; Nachtwey D.S. et al., 1967; Рыжов Н.И. и др., 1967; Still E.T. et al., 1969; Абрамова Г.М., 1969; Акоев И.Г., 1970; Белоусова О.И., Трушина М.Н., 1974; Каландарова М.П., 1970,1988; Невская Г.Ф., 1974; и материалов клинических наблюдений (Dealy J.B., Tubiana М., 1964; Гуськова А.К., Байсоголов Г.Д., 1971; Воробьев А.И., Бриллиант М.Д., Баранов А.Е., 1973; Бриллиант М.Д., Воробьев А.И., Баранов А.Е., 1974; Баранов А.Е. и др., 1977; Груздев Г.П., 1988; Ранние эффекты облучения человека высокими дозами. Доклад НКДАР ООН, 1988).
Для сопоставления на рисунке приводятся также кривые доза-эффект для относительного числа стволовых кроветворных клеток и минимального количества миелокариоцитов (соответственно кривые 5 и 4).
Можно видеть, что относительное изменение концентрации форменных элементов крови от дозы у крупных животных и у человека являются достаточно близким и соответствует характеру изменения общего количества миелокариоцитов в костном мозге. Относительное уменьшение количества нейтрофилов у онкологических больных, подвергавшихся терапевтическому облучению, в большей степени коррелирует с изменением числа стволовых кроветворных клеток (кривая 5). Эти данные для больных людей существенно отличаются и не соответствуют зависимости числа нейтрофилов от дозы, представленной в работе (Ранние эффекты облучения человека высокими дозами. Доклад НКДАР ООН, 1988) для случаев аварийного облучения.
99
100
100
200 300 400 500 600
Д. СГр
Рис. 3.7 Зависимость от поглощенной дозы минимального содержания форменных элементов крови у крупных млекопитающих и у человека (обведенные индексы).
По оси абсцисс — поглощенная доза, сГр; по оси ординат — относительное количество клеток. О — число лейкоцитов; Н — число нейтрофилов; • — число нейтрофилов у животных кривая 1); А — число лимфоцитов (кривая 2); Т — число тромбоцитов (кривая 3); Р — число ретикулоцитов (кривая 3). Кри-ваые 4 и 5 — расчетное количество миелокариоцитов в костном мозге и стволовых кроветворных клеток из математических моделей. Кривая 6 — минимальное относительное содержание нейтрофилов у онкологических больных (Ранние эффекты облучения человека высокими дозами НКДАР ООН, 1988)
Таким образом, рассмотренные материалы свидетельствуют о том, что представленная выше кривая выживаемости стволовых кроветворных клеток от дозы для собак может использоваться для оценки степени функционального снижения гемопоэза у человека
100
при равномерных острых радиационных воздействиях в дозах до 150-200 сГр. Расчетная по модели кривая изменения относительного количества миелокариоцитов у собак с увеличением поглощенной дозы (кривая 2, рис. 3.6) удовлетворительно описывает характер изменения количества клеток в костном мозге и в периферической крови у человека при дозах до 600 сГр. Эта кривая описывается экспоненциальной зависимостью от дозы с параметром Do равным 120 сГр: f(D) = exp(-D/120).
Для оценки опасности воздействия протонов солнечных космических лучей большое значение имеет сравнение радиобиологической эффективности воздействия ускоренных протонов и стандартных видов излучения в различных дозах, в частности по отношению к развитию поражения в системе кроветворения. С этой целью проанализированы материалы экспериментальных исследований, касающиеся радиобиологических эффектов на крысах, обезьянах и собаках, после однократных и повторных воздействий протонов с энергиями 126-730 МэВ и стандартных видов излучений.
В работах (Даренская Н.Г. и др., 1966, 1968; Рыжов Н.И. и др., 1967; Рыжов Н.И., 1982; Шафиркин А.В., Федоренко Б.С., 1998; Федоренко Б.С., 2006) показано, что облучение собак протонами 126, 240 и 510 МэВ привело к развитию лучевых реакций, аналогичных по характеру и глубине проявлений тем, которые имели место после рентгеновского и гамма-излучения. Расчеты, проведенные на основании результатов исследований, показали, что по смертности животных, срокам их гибели и глубине изменений в системе кроветворения величина коэффициента относительной биологической эффективности (ОБЭ) ускоренных протонов не превышает 1,0. Аналогичные данные получены в экспериментах на обезьянах, облученных протонами с энергией 138, 400 и 730 МэВ (Dalrimple G.V. et.al., 1966). Авторы этой работы считают эффективность воздействия протонов равной эффективности стандартных излучений.
В экспериментах на мелких лабораторных животных по отдельным ближайшим проявлениям лучевых реакций отмечена меньшая или равная эффективность воздействия ускоренных протонов по сравнению с гамма-излучением. В этих экспериментах при воздействии гамма-излучения получено меньшее значение периода Т50 полууменьшения числа кариоцитов костного мозга крыс, более выраженная степень максимальной аплазии крове
101
творной ткани. Более медленным было и восстановление клеточ-ности в пострадиационном периоде. Величины коэффициентов ОБЭ как по данным поражения в системе кроветворения, так и по смертности животных находились в диапазоне 0,7-1,0 (Рыжов Н.И., Дербенева Н.Н., Серая В.М. и др., 1967; Серая В.М., 1970; Рыжов Н.И., 1982; Шафиркин А.В., Федоренко Б.С., 1998; Федоренко Б.С., 2006).
Значительное число экспериментов выполнено по изучению эффективности воздействия быстрых нейтронов по сравнению с гаммаоблучением. Эти материалы могут в настоящее время позволить оценить сравнительную эффективность воздействия излучений с высокими значениями ЛПЭ, в том числе и ускоренных многозарядных ионов, поскольку экспериментальных данных по воздействию этих частиц пока недостаточно. Материалы обзорного исследования по изучению биологической эффективности быстрых нейтронов реакторного спектра (Свердлов А.Г., 1974), результаты наших собственных экспериментальных исследований (Ульянова В.А., Шафиркин А.В., Фарбер Ю.В., Маркелов Б.А., 1987) и проведенный нами анализ воздействия на различные ткани млекопитающих быстрых нейтронов (Шафиркин А.В., Федоренко Б.С., 1998) показывают, что в условиях равномерного облучения животных значение коэффициента ОБЭ таких нейтронов заключено в диапазоне от 3,0 до 4,0 (по реакциям тканей и выживаемости мелких лабораторных животных в ближайшем пострадиационном периоде).
Материалы этих исследований показывают, что по отношению к ближайшим радиационным проявлениям в быстро обновляющихся тканевых системах организма величина коэффициента ОБЭ воздействия быстрых нейтронов после однократных и повторных воздействий не меняется и составляет для кроветворной ткани значение, равное 3,0 ± 0,3. Можно считать, что это значение возможно использовать и при оценке ближайших радиобиологических эффектов ускоренных многозарядных ионов.
Представленная в работе (Губин А.Т., Сакович В.А., Шафиркин А.В., 1995) математическая модель формирования радиационного поражения в системе кроветворения была апробирована нами для описания кинетики относительного количества костномозговых клеток после острых радиационных воздействий. Поскольку период полувыведения гранулоцитов из кровотока в ткани составляет несколько часов, динамика их изменения во времени
102
практически повторяет относительное изменение количества клеток миелоидного ряда в миелограмме. Поэтому уравнение в моде
ли для костномозговых клеток применимо косвенно для описания также изменений относительного количества нейтрофилов в периферической крови. При рассмотрении экспериментов по острому облучению собак начальные значения доли выживших стволовых кроветворных клеток определяли на основе кривой выживаемости числа КОЕс от дозы, представленной в начале
этого раздела.
В качестве примера на рис. 3.8 рассмотрены данные по изменению относительного количества лейкоцитов у собак после их двустороннего облучения протонами 126 и 240 МэВ в дозах 50, 100, 150, 200 и 250 сГр (Абрамова Г.М., 1969; Невская Г.Ф., 1974). Пунктиром показан расчет по указанной выше модели. Параметры модели для кривой выживаемости КОЕс для собак составляли п = 1,55 и Do =55 сГр. Остальные кинетические параметры модели для собак выбирали на основе наилучшего согласования с экс
периментальными данными ших квадратов.
Как видно из данных, представленных на рисунке, отмечается удовлетворительное согласие расчетных и экспериментальных значений по относительному изменению концентрации лейкоцитов в крови собак после их облучения в различных дозах. Рассмотренный выше характер изменений в системе кроветворения распространяется непосредственно на случай равномерного облучения человека и животных. При существенно неравномерном облучении представленные материалы могут служить основой для определения величины
с использованием метода наимень-
Рис. 3.8. Изменение относительного числа лейкоцитов в крови у собак после равномерного облучения протонами в различных дозах.
(Рыжов Н.И. и др. 1967; Абрамова Г.М., 1969; Невская Г.Ф., 1974).
Пунктиром показаны результаты расчетов по модели] (Губин А.Т., Сакович В.А., Шафиркин А.В, 1995)
103
равноценной эквивалентной дозы радиационного воздействия в случае известного характера распределения дозы по костному мозгу, в соответствии с нормативно-техническим документом
(ГОСТ 25645.219-90, 1991).
t, сутки
Рис. 3.9. Изменение относительного количества лейкоцитов в крови у собак после их субтотального облучения протонами в дозе 350 сГр с экранированием различных частей тела и сохранением различной доли костного мозга, выраженной в процентах. Пунктиром показаны результаты расчетов по модели.
(Губин А.Т., Сакович В.А., Шафиркин А.В, 1995)
На рис. 3.9 показаны данные по динамике числа лейкоцитов у собак после их двустороннего облучения протонами 240 Мэв в дозе 350 сГр с экранированием различных частей тела животных (Абрамова Г.М., 1969; Невская Г.Ф., 1974).
В этом эксперименте при экранировании переднего отдела живота сохранялось 5-6% костного мозга, при экранировании головы и заднего отдела живота 7,5-8% костного мозга, при экранировании груди и таза — 12,6-14% костного мозга. В случае экранирования передней половины тела оставалось жизнеспособным приблизительно 30% костного мозга. Пунктиром на рисунке представлены расчетные по модели значения относительного количест
ва клеток в пострадиационном периоде для указанных начальных значений доли жизнеспособных стволовых кроветворных клеток S/S*.
Как видно из представленных рисунков (рис. 3.6-3.9), с помощью данной математической модели удается удовлетворительно описать изменение относительного количества стволовых кроветворных клеток, дифференцированных клеток костного мозга и клеток в периферической крови после острых равномерных и неравномерных радиационных воздействий.
104
Даная простая математическая модель, конечно, не описывает в достаточной степени точно динамический процесс в периферической крови во времени после острого облучения (начальный нейтрофилез при больших дозах, временный абортивный подъем числа клеток, явление перерегулирования при окончательном восстановлении), тем не менее она характеризует изменения в системе кроветворения в целом в обобщенном виде, позволяет оценивать степень напряженности функционирования гемопоэза, определяет изменение продукции костномозговых клеток интегрально за достаточно большой промежуток времени. Это имеет большое значение для обобщенной оценки состояния системы кроветворения, определения устойчивости организма при воздействии факторов радиационной и нерадиационной природы, установления значений равноценных доз при неравномерном облучении и расчетов радиационного риска.
Выше на рис. 3.6 и 3.7 продемонстрировано, что данная модель может быть использована для описания глубины изменений в костном мозге и в периферической крови после облучения человека в различных дозах. При этом параметры инактивации стволовых кроветворных клеток п и Do могут быть приняты теми же самыми, что и для собак (1,55 и 60 сГр соответственно), поскольку величины ЛД 5о/зо для собак и человека являются достаточно близкими.
Нами показано также, что с помощью относительно простых математических моделей с одним или двумя дифференциальными уравнениями можно достаточно хорошо описывать характер изменения относительного числа клеток в костном мозге и в периферической крови в процессе хронического облучения с различными значениями мощности дозы (Шафиркин А.В., 19836; Григорьев Ю.Г. и др., 1986; Губин А.Т., Сакович В.А., Шафиркин А.В., 1995; Шафиркин А.В., 1999в).
Проведенный в работах (Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999в) анализ экспериментальных данных при протяженном непрерывном или фракционированном облучении мелких лабораторных животных (МЛЖ) в дозе за сутки более 100 сГр и крупных млекопитающих в суточной дозе 20 сГр и выше показал, что общая картина развития радиационного поражения организма, в том числе и кроветворной ткани, подобна той, которая наблюдается при остром облучении в летальном диапазоне доз в пределах костномозгового синдрома. Основными причинами ги
105
бели животных являются развитие сепсиса и геморрагических проявлений, а также анемии в более поздний период, что связано с наличием глубокой аплазии костного мозга и панцитопеничес-кими реакциями в периферической крови. Общая продолжительность жизни животных не превышает 30 и 60 суток соответственно.
При меньшей интенсивности радиационного воздействия, когда мощность дозы или поглощенная доза за сутки у мелких лабораторных животных составляет 20-85 сГр, а у крупных млекопитающих — (2,5-15) сГр/сут, продолжительность жизни экспериментальных животных становится выше, чем при остром облучении в летальном диапазоне доз. Она возрастает по мере уменьшения мощности дозы вследствие развития в системе кроветворения состояния временного относительного равновесия, когда радиационная инактивация стволовых кроветворных клеток и делящихся клеток морфологически идентифицируемых отделов костного мозга компенсируется существенным возрастанием относительной доли пролиферирующих клеток и скорости их деления (Lamerton L.F. et al., 1960; Spalding J.F. et al,1969; Hupp E.W. et al., 1971; Norris W.P. et al., 1971; Norris W.P., Fritz T.E., 1974; Kalina I., Praslicka M., Petro vicova J., 1975; Прасличка M.A., Калина И., 1976; Зухбая Т.М., 1979; Джикидзе Э.К., Косиченко Л.П., Куксова М.И., 1980; Fritz Т.Е. et al., 1982).
В начальный период облучения, когда доза за сутки не превышает у МЛЖ 50 сГр, а у крупных млекопитающих 12 сГр после первоначального уменьшения числа клеток в костном мозге и периферической крови наблюдается последующее увеличение количества клеток, несмотря на продолжающееся облучение. Этот период некоторого клинического благополучия и относительной компенсации в кроветворной ткани, характеризуемый существенным повышением уровня регенерации в ней, отмечали у собак при их ежедневном фракционированном облучении в дозе 5-10 сГр в сутки в течение 3-4 месяцев (Лаптева-Попова М.С., 1959), у обезьян при аналогичном воздействии в дозе 5,7 сГр в сутки в течение 5,5-6 мес (Джикидзе Э.К., 1964), у морских свинок при их облучении в дозе 12 сГр в сутки в течение 2-3 месяцев (Колмогорова Л.А., 1980), когда поглощенная доза не превышала 750-1000 сГр.
В этот период значительно увеличивалось количество делящихся форм клеток, особенно эритробластического ряда, повыша
106
лась их митотическая активность, увеличивалось общее количество эритроидных элементов всех степеней зрелости при незначительном снижении общего количества миелокариоцитов. В периферической крови увеличивалось число ретикулоцитов и эритроцитов при несколько сниженном и волнообразно изменяющемся числе лейкоцитов и тромбоцитов. Автор работы (Колмогорова Л.А., 1980) отмечала у морских свинок при облучении в дозе 250-750 сГр снижение длительности клеточного цикла эритробластов с 15 до 11,6 часа и увеличение митотического индекса клеток на 34%, при этом почти в 2,5 раза повышался уровень пронор-мобластов и на 94% возрастало содержание эритробластов. Наблюдалось также повышение уровня костномозговой продукции эритроцитов на 21% и уменьшение периода полувыведения эритроцитов из кровотока на 14%. Эти изменения, свидетельствующие о существенном возрастании интенсивности эритропоэза и скорости обновления эритроцитов, вместе с изменением вероятности дифференцировки стволовых кроветворных клеток в направлении эритрона и увеличением продукции предшественников отражают проявление компенсаторных реакций организма, направленных на поддержание необходимого уровня эритроцитов и гемоглобина для выполнения основной дыхательной функции крови.
Как показали авторы в работах (Муксинова К.Н., Суходеев В.В., Мурзина Л.Д., 1979; Муксинова К.Н., 1985), при облучении крыс с мощностью дозы 50 сГр/сут при дозе менее 1000 сГр наблюдается период относительного клинического благополучия и временной компенсации в кроветворной ткани, который характеризуется значительным повышением уровня клеточной регенерации в ней. Имеет место существенное усиление регенерации как в эритроидном ряду, так и миелопоэза. Значительно в 2-3 раза возрастает количество делящихся форм клеток и особенно миелобластов, несмотря на их продолжающуюся радиационную инактивацию и значительное в 2-6 раз сокращение притока клеток из менее дифференцированных отделов. Повышение продукции гранулоцитов в 1,8 раза достигалось увеличением как количества пролиферирующих нейтрофилов, так и скорости их деления. Длительность цикла в миелоидном ряду укорачивалась на 20-30%.
Эти изменения интенсивности гемопоэза, несмотря на продолжающееся облучение и инактивацию части стволовых кроветворных клеток, отражены в постулатах указанной выше модели (Гу
107
бин А.Т., Сакович В.А., Шафиркин А.В., 1995), что позволило с ее помощью описать характер формирования поражения в кроветворной системе.
В более позднем периоде, когда поглощенная доза у собак, обезьян и морских свинок превышала 750-1000 сГр, активация кроветворения сменялась постепенным угнетением вследствие снижения пролиферативного потенциала и продукции клеток предшественников, а также компенсаторных возможностей организма и регенераторной способности системы кроветворения. Наблюдалось снижение количества эритробластов, миелоидных элементов, мегакариоцитов, увеличивалось содержание плазматических и ретикулярных клеток в костном мозге. Происходило также прогрессирующее снижение числа лейкоцитов, тромбоцитов, ретикулоцитов и эритроцитов в периферической крови. В среднем гибель собак наблюдалась через 6 месяцев, при этом патогистоло-гический анализ показал наличие аплазии костного мозга, атрофию лимфоидного аппарата селезенки и лимфоузлов. Срывы в системе гемопоэза, приводящие животных к гибели, были обусловлены нарушением регуляторных процессов в системе. У одних собак в большей степени выражена анемия, у других — агранулоцитоз (число лейкоцитов менее 500 в 1 мм3). При дозах 1200-1500 сГр агранулоцитоз был преобладающей причиной гибели. У животных, погибших в более поздние сроки (7-13 мес.) при дозах 1600-2800 сГр, такой причиной была анемия. Следует отметить значительную гетерогенность животных по способности осуществлять компенсацию радиационного поражения в системе кроветворения. Некоторые собаки гибли от лучевой болезни через 2,5-5 лет (суммарная доза 2600-8600 сГр), но в основном такой продолжительный срок жизни собак наблюдался при облучении их в дозе 5 сГр в сутки (Лаптева-Попова М.С., 1959).
При непрерывном облучении собак с мощностями доз 2,5, 5 и 10 сГр/сут также отмечена гетерогенность собак по жизнеспособности (Norris W.P. et al., 1971; Norris W.P., Fritz T.E., 1974; Fritz T.E. et al., 1982 ). Первый пик гибели был обусловлен развитием аплазии костного мозга и существенным снижением клеток в периферической крови. Сроки гибели варьировали от 209 до 730 сут. Второй пик гибели связан с нарушениями регуляторной способности организма и системы крови и развитием миелопролиферативной болезни, что было более присуще облучению с меньшей мощностью дозы. Сроки гибели также существенно
108
варьировали и для указанных значений мощностей доз были соответственно равны 1360 (840-1840); 1460 (990-1950) и 850 (380-1620) суткам.
При фракционированном облучении обезьян с дозой за сутки 5,7 сГр и суммарных дозах более 800 сГр после относительного благополучия в период выраженных клинических проявлений автор исследования (Джикидзе Э.К., 1964), наблюдала у обезьян ухудшение общего состояния организма, понижение аппетита, агрессивность, снижение массы тела, появление кровоизлияний на коже. Число лейкоцитов в крови сначала изменялось волнообразно с чередованием фаз угнетения и компенсации, в дальнейшем неуклонно снижалось. Так же постепенно снижалось и содержание тромбоцитов и эритроцитов. В конце концов животные погибали с симптомами хронической лучевой болезни, осложненной инфекционными проявлениями. Гибель обезьян, как и собак, наблюдалась в широком диапазоне доз (795-2800 сГр), что также свидетельствовало о гетерогенности животных по способности компенсировать радиационные нарушения в системе кроветворения.
У морских свинок при облучении уже в дозах 4,4 и 8,8 сГр в сутки (Lorenz Е., 1950; Lorenz Е. et al., 1954) отмечалось прогрессирующее снижение числа эритроцитов в периферической крови, особенно выраженное при облучении с большей мощностью дозы, а также прогрессирующее снижение числа тромбоцитов. Начальный период характеризовался максимальной скоростью снижения концентрации клеток, которая в дальнейшем изменялась более медленно. В этих экспериментальных исследованиях фазы относительного благополучия, связанной с активацией эритропоэза и увеличением числа эритроцитов, не наблюдали. Постепенно развивалась тяжелая анемия, ставшая причиной гибели животных при дозах 500-1400 сГр.
Причину различия в реакции эритрона у морских свинок в рассмотренных случаях можно объяснить на основе данных экспериментального исследования (Тетерина В.И., Сорокина В.А., 1962), в котором также изучалась реакция системы кроветворения у морских свинок при их ежедневном облучении в дозах 10-12 сГр. На основании полученных ими материалов можно сделать вывод, что ведущим в поражении гемопоэза является вызванное облучением нарушение регуляторных связей в системе кроветворения. При анализе миелограмм авторы выделили два вида реак
109
ции кроветворной системы у различных животных. В первом случае отмечали увеличение числа гемоцитобластов и незрелых форм миелоидного ряда, существенное увеличение их митотической активности и скорости пролиферации при уменьшении количества зрелых гранулоцитов. Количество эритробластических клеток при этом резко снижалось. В конечном счете отмечали резко выраженный ретикулез и гемацитобластоз. Во втором случае, наоборот, наблюдали существенное увеличение количества проэритробластов, базофильных и полихроматофильных эритробластов. Белый же росток был значительно угнетен. Гибель животных так же, как в других экспериментах, наблюдали в период 5-16 мес. при дозах 1300-3200 сГр в результате резко выраженных анемии либо агранулоцитоза.
При облучении мелких лабораторных животных с мощностью дозы в пределах 1-20 сГр/сут, а крупных млекопитающих в дозах 0,2-4 сГр в сутки после первоначального снижения числа лимфоцитов, гранулоцитов и тромбоцитов в крови также наступал период относительного устойчивого равновесия, существенно более длительный, чем при вышерассмотренном диапазоне мощностей доз. Изменение концентрации клеток носило, как правило, волнообразный характер, когда периоды относительного угнетения сменяются периодами усиления регенераторных процессов в ткани, несмотря на продолжающееся облучение (Lorenz Е. et al., 1954; Ingram М., Mason W.B., 1954; Макарченко А.Ф. и др., 1963; LajthaJ.G. et al., 1969; Norris W.P. et al., 1971; Praslicka M., Chlebovsky O., 1973; Горлов В.Г., Шафиркин A.B., Попов В.И. и др., 1975; Запольская Н.А. и др., 1976; Прасличка М.А., Калина И., 1976; Kalina I., Praslicka М., Petrovicova J., 1977; Зухбая Т.М., 1979; Швец В.Н., Шафиркин А.В., 1979; Джикидзе Э.К., Косичен-ко Л.П., Куксова М.И., 1980; Fritz Т.Е. et al., 1982).
В табл. 3.6 и 3.7 систематизированы данные различных исследований на мелких лабораторных животных (МЛЖ) и крупных млекопитающих и представлены средние значения показателей периферической крови в новом установившемся режиме при облучении животных в различных дозах за сутки.
На рис. 3.10 представлен характер изменения средних значений указанных показателей периферической крови по отношению к контролю в зависимости от мощности дозы или от поглощенной дозы за сутки.
110
Таблица 3.6
Относительное изменение показателей периферической крови у мелких лабораторных животных при протяженных облучениях с различной мощностью дозы в установившемся режиме
(Григорьев Ю.Г. и др., 1986)
Вид животных Поглощенная доза в сутки, сГр Длительность облучения, часы в сутки Уровень кроветворных клеток по отношению к контролю, %
стволовые клетки (КОЕ) лимфоциты лейкоциты тромбоциты
Мышь 0,11 8 — 100 100 100-105
Крыса 0,2 24 — 100 100 100
1,0 24 — 100 100 100
Мышь 1,1-2,2 8 — 90-75 90-75 100
4,4 8 — 50-60 60-70 —
3,0-6,0 22 85-75 80-65 — 75-50
Крыса 5,0 24 — — 65-70 75-80
Мышь 8,8 8 — 40-50 50-60 —
Крыса 10 22 — 60 60-70 65-75
Мышь 10 22 50 50 — 50
Крыса 20-36 22 — — 40-30 —
Мышь 25 22 35 35 — —
50 22 15 — — —
Крыса 50 22 — — 10 20
Мышь* 70-100 22 2-5 — — —
*При мощности дозы более 70 сГр/сут отмечается неуклонное снижение числа КОЕ.
111
Таблица 3.7
Относительное изменение показателей периферической крови у крупных млекопитающих при протяженных облучениях с различной мощностью дозы в установившемся режиме
(Григорьев Ю.Г. и др., 1986)
Вид животных Поглощенная доза в сутки, сГр Длительность облучения, часы в сутки Уровень кроветворных клеток по отношению к контролю, %
лимфоциты лейкоциты тромбоциты эритроциты
Морская свинка Кролик 0,11 8 90-100 90-100 100-105 —
Собака 0,05-0,1 1-6 — 100 100 100
0,4 22 — 85-90 90 —
1,0 22 72-75 80 —
Морская свинка Кролик 1,1-2,2 8 62-75 75-80 — —
Собака 2,5 22 50 60-75 65 85
5,0 22 — 50-55 55 —
Морская свинка 4,4 8 50-60 60-70 — 90
Кролик 8,8 8 25 50-60 — 75
Собака 10 22 — 37-42 28-30 62-75
17 22 Неуклонное снижение числа клеток. Равновесный режим отсутствует
Обезьяна 16-25 1 Неуклонное снижение числа клеток. Равновесный режим отсутствует
Анализируя представленные данные, можно отметить, что отклонение средних значений показателей, характеризующих новый равновесный уровень в системе, от нормы закономерно увеличивается при возрастании ежедневной поглощенной дозы. При этом
112
Рис. 3.10 Уровень числа клеток периферической крови (%) в новом установившемся режиме при непрерывном и фракционированном облучении в зависимости от ежедневной дозы облучения, сГр (литературные источники представлены в тексте).
1 и 2 — количество лимфоцитов у крупных млекопитающих и мелких лабораторных животных (МЛЖ) соответственно (кривые I и II);
3 и 4 — количество лейкоцитов, тромбоцитов у крупных животных и МЛЖ (кривые III и IV); 5 — количество эритроцитов (кривая V);
6 — число колониеобразующих единиц (КОЕ)
наблюдается более сильное относительное снижение числа лимфоцитов. Концентрации гранулоцитов и тромбоцитов изменяются меньше. Наиболее слабо и при значительно больших суточных дозах уменьшается число эритроцитов, что свидетельствует о больших компенсаторных возможностях эритропоэза у облучаемых животных по сравнению с лейкопоэзом. Более выраженное относительное снижение числа лимфоцитов, возможно, обусловлено не только их радиационной инактивацией, но связано также с перераспределительной реакцией (миграцией лимфоцитов в костный мозг), развитием в начальный период облучения общего сим-птомо-комплекса, определяющего реакцию организма, характерную для общего адаптационного синдрома (Селье Г., 1972; Горизонтов П.Д., Белоусова О.И., Федотова М.И., 1973).
Сопоставление степени инактивации стволовых колониеобразующих кроветворных клеток и изменение относительного числа
113
зрелых клеток в периферической крови у МЛЖ на основе данных, представленных на рис. 3.10 и в табл. 3.6, показывает их достаточно хорошее совпадение, что подчеркивает ведущую роль в снижении концентрации зрелых функциональных клеток уменьшения числа и продукции стволовых кроветворных клеток.
Как видно из данных, представленных на рис. 3.10, при облучении мелких лабораторных животных в диапазоне мощностей доз 1-10 сГр/сут и крупных млекопитающих в диапазоне 0,2-2,5 сГр/сут, максимальное отклонение указанных средних показателей не превышает 50% от нормы, а число эритроцитов уменьшается лишь у крупных млекопитающих не более, чем на 15%, что свидетельствует о значительных компенсаторных возможностях системы кроветворения и ее способности длительное время в этих условиях поддерживать достаточно высокий уровень функциональных клеток в периферической крови.
В случае облучения МЛЖ с мощностью дозы менее 1 сГр/сут, а крупных млекопитающих менее 0,1 сГр/сут не удается отметить значимых изменений в системе кроветворения в течение всей жизни. Продолжительность жизни мелких лабораторных животных при данных уровнях радиационного воздействия не уменьшается (Lorenz Е. et al., 1954; Grahn D., Sacher G.A., 1968; Upton A.C., 1960; Григорьев Ю.Г., Попов В.И., Шафиркин A.B., Антипенко Ж.Б., 1986).
При снижении мощности дозы еще в 10 раз (около 0,1 сГр/сут) возможно проявление стимулирующего эффекта для части животных и увеличение средней продолжительности жизни (Lorenz Е. et al., 1954; Кузин А.М., 1977).
Как следует из данных рис. 3.10 и табл. 3.7, пороговое значение мощности дозы для начальных изменений в периферической крови у крупных млекопитающих заключено в диапазоне 0,1-0,4 сГр в сутки.
Обзор данных по характеру изменения числа клеток различных генераций в наиболее радиочувствительном сперматогенном эпителии при облучении в различных дозах представлен в разд. 3.4, а также в работе (Григорьев Ю.Г., Попов В.И., Шафиркин А.В., Антипенко Ж.Б., 1986). Подробно материалы по изменению концентрации, подвижности и числа атипичных форм сперматозоидов в эякуляте у собак при их облучении, моделирующем уровни облучения космонавтов при осуществлении длительных межпланетных полетов, а также их оплодотворяющей способно
114
сти и состоянии потомства будут рассмотрены при описании результатов «Хронического эксперимента» в разд. 4.
В условиях межпланетного космического полета при развитии мощных СПС с большим флюенсом и относительно мягким (низ-коэнергетичным) спектром протонов при наличии значительного перепада доз по телу, критичным с точки зрения нарушения работоспособности космонавтов будет развивающееся в ближайшие сутки после облучения поражение кожи. Эти материалы о неблагоприятных эффектах при облучении кожи в различных дозах будут рассмотрены в разд. 3.5.
3.4. Состояние сперматогенеза и воспроизводительной способности животных после острых и протяженных облучений в различных дозах
Известно, что повреждения, вызываемые ионизирующим излучением, особенно отчетливо проявляются в тканях с высокой пролиферативной активностью. К числу таких тканей относится зародышевый эпителий гонад. Морфологическое строение семенника млекопитающих имеет определенную специфику. Паренхима состоит из семенных канальцев, между которыми расположена межуточная ткань из богатой сосудами рыхлой соединительной ткани и интерстициальных клеток Лейдига. Базальная мембрана вместе с клетками Сертоли образует стенку канальца, внутри которого располагаются сперматогенные клетки. Клетки Сертоли, как установлено в настоящее время, обеспечивают нормальный рост и развитие сперматогенного эпителия, и их функциональный цикл тесно связан с циклом сперматогенного эпителия. Спермато-гонии, расположенные в ближайшем к мембране слое канальца, являются камбиальными элементами и служат основой для процесса постоянного обновления сперматогенного эпителия, применительно к которым использован термин «стволовые клетки».
Выделены сперматогонии типа А, Б и промежуточных стадий последовательного перехода от А к Б. В результате дифференцировки сперматогоний промежуточного типа и типа Б образуются сперматоциты 1-го порядка, которые путем мейотического деления образуют сначала сперматоциты 2-го порядка, и затем сперматиды. Сперматиды, созревая, формируются в сперматозоиды. Кле
115
точная кинетика сперматогенного эпителия свидетельствует о сложном характере процесса клеточного обновления. Цикл сперматогенеза — время между состояниями, характеризуемыми одинаковым возрастным и структурным распределением клеток в рассматриваемой клеточной ассоциации, — у разных видов в основном сходен, меняется лишь продолжительность отдельных стадий. Для каждого вида в норме длительность цикла является постоянной величиной.
Накопленные к настоящему времени экспериментальные данные указывают на то, что острое или пролонгированное облучение в больших и средних дозах приводит к глубоким изменениям в сперматогенезе (Н.И. Нуждин 1962; Г.М. Роничевская, 1958; Oakberg, 1955; Oakberg, Clark 1964; Заликина Ж.Г. 1977; Григорьев Ю.Г. и др., 1986).
Наиболее радиочувствительными половыми клетками являются сперматогонии. Уменьшение числа сперматогоний происходит в результате как блокирования митозов и нарушения процесса деления клеток, так и деструкции и гибели сперматогоний. Популяция сперматогоний гетерогенна и по составу, и по радиочувствительности. Наиболее радиочувствительными являются сперматогонии типа Б и промежуточного типа. Доза, вызывающая 50%-ю гибель их (ЛД50), составляет 20-24 сГр. Сперматогонии типа А более резистентны, но и они гетерогенны по радиочувствительности. Часть их инактивируется при облучении в дозах 20-100 сГр, другая часть сохраняется и при облучении в дозе 1000 сГр, что связано с их различной физиологической активностью. Как и в системе кроветворения, часть клеток участвует в процессе сперматогенеза и активно обновляется, другая находится в состоянии покоя — резервные стволовые клетки Ао (Oakberg, Clark 1964; Dym, Clermont, 1970).
Радиоустойчивость половых клеток возрастает по мере их созревания. Сперматоциты более резистентны, чем сперматогонии. Существенной гибели сперматид и зрелых сперматозоидов не наблюдается при их облучении в относительно высоких дозах. Они продолжают развиваться и не теряют способности к оплодотворению, несмотря на заметное поражение митохондрий и аппарата Гольджи. Однако точный учет позволил отметить небольшое снижение числа сперматид через 6-12 суток после облучения, по-видимому, в результате нарушения мейотического деления сперма-тоцидов. Многие авторы объясняют высокую радиорезистент
116
ность сперматид и сперматозоидов состоянием ДНК их ядер. Показано, что у этих клеток по сравнению с делящимися предшественниками значительно подавлены процессы синтеза нуклеиновых кислот и белка.
Параллельно с «Хроническим экспериментом» динамику клеточного состава сперматогенного эпителия подробно изучала Ж.Г. Заликина (1977) в эксперименте по длительному непрерывному облучению мышей с различной мощностью дозы (2,5, 10,100 и 300 сГр/сут). Исследовали содержание сперматогоний типа Б, сперматоцитов, сперматид и сперматозоидов в семенных канальцах. Данные по относительному содержанию клеток (в процентах) в зависимости от дозы облучения для различных значений мощности дозы показаны на рис. 3.11.
Анализируя представленные данные, можно выделить три фракции сперматогоний, различающихся по радиочувствительности. Минимальная исследуемая доза 5 сГр (при всех значениях мощности дозы) приводила приблизительно к 40% инактивации числа сперматогоний типа Б, что свидетельствовало о наличии сверхрадиочувствительной фракции (явление, отмеченное нами ранее в системе кроветворения). Параметр Do для этой группы клеток был равен 5-10 сГр. Кроме того, можно отметить наличие резистентной фракции, составляющей около 30% клеток. Кривые инактивации для этой группы клеток имели значительное плечо Dq, примерно равное 400-500 сГр, и характеризуются относительно большим значением параметра Do на экспоненциальном участке 240, 410 и 970 сГр при облучении соответственно с мощностями доз 100-300, 10 и 2,5 сГр/сут. У промежуточной по радиочувствительности фракции отсутствует плечо на кривой выживаемости, и она характеризуется параметром Do, равным 50 и 70 сГр соответственно для мощности дозы 100-300 и 2,5- 10 сГр/сут.
Данные, представленные на рис. 3.11, свидетельствуют о существенном снижении эффективности поражения семяродного эпителия при уменьшении мощности дозы. Характер инактивадии последующих в процессе созревания клеток определяется относительным снижением числа сперматогоний и в значительной степени повторяет его. Можно отметить несколько большую степень инактивации сперматоцитов и сперматид на экспоненциальном участке, что объясняется, по-видимому, кроме снижения продукции клеток предшественников дополнительной гибелью клеток в
117
Рис. 3.11 Относительное изменение числа клеток сперматогенного эпителия: сперматогоний (а), сперматоцитов (б), сперматид (в) и сперматозоидов (г) в зависимости от дозы при облучении мышей с различной мощностью дозы.
1-3 — экспериментальные данные работы (Заликина Ж.Г., 1977) для мощностей доз 2,5, 10 и 100-300 сГр/сут; 4 и 5 — экспериментальные данные работы (Окберг Е.Ф., Кларк Э., 1963) для мощностей доз 13 сГр/сут и 3,8 сГр/мин соответственно
результате нарушения процесса мейоза. Плечо Dq для радиоус-тойчивой фракции сперматоцитов примерно равно 300 сГр, а параметр Do уменьшен и равен 80, 165 и 620 сГр для мощности дозы 100-300, 10 и 2,5 сГр/сут. Степень снижения количества сперматогоний при протяженном облучении согласуется с данными работы (Окберг Е.Ф., Кларк Э., 1963), авторы которой наблюдали подобный характер изменений при облучении мышей с мощностью дозы 13 сГр/сут. Опустошение эпителия оказалось значительно меньшим, чем в случае острого облучения с мощностью дозы 3,8 сГр/мин. Эти же авторы показали, что снижение радиобиологической эффективности воздействия на репродуктивную систему наблюдается, начиная с мощности дозы 0,8 сГр/мин (1150 сГр/сут) и проявляется значительно сильнее при более низких значениях мощности дозы 0,009 сГр/мин (13 сГр/сут).
Авторы работы (Eschenbrenner А.В., Miller Е., Lorenz Е., 1948) также отмечали уменьшение эффективности воздействия на се
118
менники при значительном снижении мощности дозы. Они пришли к выводу, что при малых значениях мощности дозы устанавливается равновесие между радиационной инактивацией клеток и регенеративным увеличением их продукции и что при оценке глубины поражения именно мощность дозы, а не общая доза является основным определяющим фактором.
При фракционировании облучения, когда отдельные дозы малы, например 2,5 сГр в сутки или меньше, происходит также отчетливое снижение радиобиологической эффективности облучения на семяродный эпителий по сравнению с однократным острым облучением, что выражалось в сохранении оплодотворяющей способности у мышей при их облучении в сравнительно высоких дозах 400-800 сГр (Заликина Ж.Г., 1977; Григорьев Ю.Г. и др., 1986).
Таким образом, меньший повреждающий эффект на семенники характерен для непрерывного облучения при снижении мощности дозы и при фракционированном воздействии, когда доза делится на малые фракции. Это объясняется, с одной стороны, увеличением вероятности восстановления радиационных повреждений в клетках, с другой — компенсаторными изменениями в организме по поддержанию сперматогенеза.
Для нормирования профессиональных облучений актуальны и важны результаты хронических экспериментов. В табл. 3.8 сделана попытка систематизировать отклонения показателей сперматогенеза и характера изменения сперматогенного эпителия по мере увеличения интенсивности и длительности радиационного воздействия. Как следует из данных таблицы, при облучении животных в дозе 0,02-0,1 сГр в сутки изменения сперматогенеза отсутствуют или не проявляются при морфологическом и гистологическом исследованиях. Начиная с мощности дозы 0,32 сГр/сут и выше концентрация клеток в канальцах снижается, увеличивается число дегенеративных атипичных форм сперматозоидов, снижается масса семенников и даже наблюдается их полная атрофия, увеличивается относительное число стерильных животных. Наиболее выраженное опустошение семенников и серьезные морфологические изменения семенных канальцев наблюдаются при ежедневной дозе облучения 0,5-1,0 сГр и выше.
У собак изучали сперматогенез после двухлетнего рентгеновского облучения в широком диапазоне мощности дозы: 0,1, 0,5 и 1,0 сГр/сут (Boche, 1954). Исследование спермы было начато на
119
Таблица 3.8
Сперматогенез в условиях хронического облучения (Григорьев Ю.Г. и др,1986)
Вид животных Доза облучения в сутки, сГр Длительность облучения, сут Характеристика сперматогенеза и воспроизводительной способности
Мышь 0,02 180 Изменения отсутствуют
Крыса 0,05 180 То же
Собака 0,1 720 То же
Крыса 0,1 250 Количество сперматогоний 93%, сперматозоидов несколько снижено
Мышь 0,32 150 Увеличение числа стерильных самцов
Крыса 0,5 50 Количество клеток в семенных канальцах 95%
240 65%
360 46%
Собака 0,065-0,13 Посале 5 лет Число сперматозоидов снижено на 10-20%. Число атипичных форм 45-80%
0,65 После 1 год Число сперматозоидов снижено на 90-95. Стерильность у 80% животных
0,5-1,0 После 2 лет Аспермия у 50% животных (после облучения в дозе 620 сГр полная атрофия зародышевого эпителия
1,1-8,8 После 1,5 лет Глубокие морфологические изменения в семенниках и атрофия зародышевого эпителия
8-м месяце облучения, и наблюдения продолжались спустя 5 мес. после окончания лучевого воздействия. На основе проведенных исследований авторы делают выводы, что содержание спермато-
120
зондов в эякуляте было без изменений у животных контрольной и подопытной групп собак, облученных с мощностью дозы 0,1 сГр/ сут. При лучевом воздействии 0,5 сГр/сут около половины животных имели аспермию. Кроме того, авторы отмечали снижение содержания спермы у всех животных этой группы. При мощности дозы 1,0 сГр/сут на 9-й месяц от начала облучения у 50% собак развилась аспермия. Выраженное поражение сперматогенеза в этой группе животных оставалось и на протяжении 3 мес. после окончания облучения.
Воздействие с мощностью дозы 1 сГр/сут вызывало к концу первого года стерильность собак. При той же мощности дозы, но при достижении общей дозы 622 сГр, отмечалась полная атрофия зародышевого эпителия, в то время как снижение мощности дозы наполовину (0,5 сГр/сут) после достижения соответственно половины общей дозы вызывало лишь умеренную атрофию (Metcalf etal., 1954).
Важными являются результаты (Casarett, Hursh, 1964), которые провели многолетние исследования сперматогенеза у собак при их ежедневном облучении в дозе 0,06, 0,13 и 0,6 сГр, 5 суток в неделю в течение 10 лет. В первых экспериментах было использовано 60 собак (четыре группы) в возрасте 1,5 года, ежедневно подвергавшихся острому рентгеновскому облучению в течение 2-4 лет. Группы были распределены по величине суммарной дозы (табл. 3.9).
Таблица 3.9
Распределение животных по группам в экспериментах (Casarett, Hursh, 1964)
Группа Количество собак Ежедневная доза, сГр Доза за неделю, сГр Годовая доза, сГр Время облучения (наблюдения), нед. Общая суммарная доза, сГр
1 20 0,065 0,325 16,9 141-250 42-75
2 10 0,130 0,650 33,8 139-238 83-142
3 10 0,650 3,250 169,0 139-218 417-654
4 20 — — — 141-250 —
121
Сперму получали ежемесячно посредством мастурбации собак. Определяли объем эякулята, концентрацию и подвижность сперматозоидов, pH спермы, жизнеспособность и морфологическую характеристику клеток. Авторы осуществляли пробные спаривания.
На протяжении 2-4 лет наблюдения авторы не установили каких-либо достоверных изменений в сперматогенезе у собак 1-й и 2-й групп (0,3 и 0,6 сГр в неделю). Однако в течение 18 последних месяцев облучения в различные сроки было обнаружено устойчивое возрастание количества сперматозоидов с закрученными хвостами: у 80% собак, получивших дозу 0,6 сГр в неделю, у 45% собак при дозе 0,3 сГр в неделю при 5-10% в контрольной группе.
У собак 3-й группы, получавших дозу 3,2 сГр в неделю, было установлено прогрессирующее понижение абсолютного числа сперматозоидов. Это снижение начиналось при суммарной дозе 60-90 сГр (на 20-30-й неделе облучения). Далее абсолютное число сперматозоидов уменьшалось до 6-10% при суммарной дозе 120-180 сГр (на 40-60-й неделе облучения). После этого число сперматозоидов оставалось таким же или продолжало снижаться. Этому сопутствовало умеренное или более значительное увеличение количества неподвижных и мертвых сперматозоидов, а также сперматозоидов с морфологическими аномалиями, особенно с закрученными хвостами, отделенными от тела головками и цитоплазматическими отростками.
При спаривании восьми собак из 3-й группы шесть животных оказались стерильными, а две собаки, не захотевшие спариваться, по-видимому, были также стерильными, так как имели крайне низкое число сперматозоидов. Спаривание собак 1-й и 2-й групп не дало достоверных отклонений от контрольных данных.
Таким образом, авторы этой работы приходят к выводу, что ежедневное облучение собак в дозе 0,6 сГр приводит к начальным изменениям сперматогенеза при суммарной дозе 60-90 сГр, а более выраженное поражение развивается при достижении дозы 120-180 сГр. Если разовые дозы острого ежедневного облучения были равны 0,06 и 0,12 сГр, то даже при достижении суммарных доз 42-142 сГр достоверных изменений в сперматогенезе не наступает.
122
5.5. Изменение состояния кожного покрова в ближайшем пострадиационном периоде в зависимости от дозы
Как указывалось выше, в случае равномерного облучения человека в дозах, не превышающих 500 сГр, тяжесть лучевой болезни в основном определяется поражением системы кроветворения. При осуществлении межпланетных космических полетов возможны обстоятельства, когда космонавт может находиться вне космического корабля, и в случае развития стохастического солнечного протонного события с относительно большой плотностью потока низкоэнергетичных протонов и величиной флюенса возможно его неравномерное облучение с очень высокой дозой на кожу. При перепаде поглощенных доз по телу, превышающем 10 раз, ведущие проявления в основном будут обусловлены поражением кожи (Аветисов Г.М., 1975; Григорьев Ю.Г., 1975). В связи с этим важно установить тяжесть клинических симптомов поражения кожи в зависимости от дозы и характера ее распределения по глубине тела и особенно в ее поверхностных структурах.
Для понимания характера развития поражения и восстановления в системе обновления кожи в зависимости от дозы, важно об
ратить внимание на ее строение и нормальную клеточную кинети-
ку. Кожа имеет сложное строение (рис. 3.12).
Верхний слой толщиной 30-150 мкм — эпидермис отделен тонкой базальной мембраной из межклеточного вещества от дермы (собственно кожи), которая сосочковидными выростами высотой приблизительно 50 мкм вдается в слой эпидермиса. Толщина дермы на большей части тела составляет 1,5-2,5 мм, на ла
Рис. 3.12. Строение кожи человека (Осанов Д.П., 1990)
донях и подошвах около 3 мм, на спине может достигать 4,5 мм. Ниже дер
123
мы расположен нерезко ограниченный от нее слой подкожной ткани, включающей дольки жировой ткани, достигающей до 30 мм и более. Эпидермис — многослойная ткань, имеющая сложную иерархическую структуру.
К базальной мембране эпидермиса прикреплены базальные клетки, которые покрывают ее в один ряд. Это вытянутые цилиндрические клетки диаметром 6 мкм и длиной 9 мкм. Часть из них является стволовыми клетками, поддерживающими клеточную кинетику. На 100 мкм вдоль базальной мембраны насчитывается 18-20 базальных клеток. Следующий ближе к поверхности слой кожи состоит из 3-6 рядов дифференцированных шиповидных клеток размером 5x7 мкм. На расстоянии 100 мкм находится приблизительно 60-80 таких клеток. За этим слоем располагается от 3 до 5 рядов зернистых клеток. Ближе к поверхности кожи клетки лишаются ядер. Они состоят в основном из кератина, содержание воды в них снижается до 10% по массе. Несколько десятков рядов таких плоских отмерших клеток, плотно примыкающих друг к другу, образуют роговой слой эпидермиса, толщиной около 10-15 мкм (на подушечках пальцев — 350-650 мкм, на подошвах 900-1400 мкм). Наружная поверхность рогового слоя непрерывно слущивается и за сутки вновь образуется 0,5-1,0 г рогового вещества.
В дерме располагаются основные придаточные образования кожи — волосяные сумки (фолликулы), сальные и потовые железы, которые имеют каналы, выходящие на поверхность кожи. Базальные клетки вокруг придатков меньше по размерам, но расположены значительно плотнее, чем между каналами придатков. На границе с подкожной тканью находится глубокая сосудистая сеть, питающая базальные клетки, луковицы волос, клубочки потовых желез и дольки жировой ткани. От артериальной сети отделяются артериолы, которые подходят к группе сосочков и ветвятся на капилляры диаметром 8-10 мкм, образующие клубочки в каждом сосочке непосредственно под базальной мембраной эпидермиса. Эпидермис сосудов не содержит, его клетки питаются из внутриклеточной жидкости, поступающей через базальную мембрану эпидермиса и межклеточные промежутки. Обычно в коже мало крови (около 65 мл), но при расширении сосудов дермы они могут вместить до 1 л крови (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988).
Система клеточного обновления эпидермиса аналогична системе обновления других активно регенерирующих тканей, но ско
124
рость ее обновления в норме существенно ниже по сравнению с кроветворной тканью и эпителием кишечника. Если кинетика последних характеризуется суточными периодами, то эпидермиса — недельными, а для большинства сосудов дермы период обновления определяется месяцами. Делящиеся базальные клетки эпидермиса образуют сплошной извилистый слой, лежащий в его основании и продолжающийся в глубь дермы вдоль стенок волосяных фолликулов. Они после ряда делений, последующей дифференцировки и созревания поступают в поверхностный функциональный роговой слой.
Длительность митотического цикла базальных клеток эпидермиса в норме составляет 8 ± 2 сут, а усредненная по всем базальным клеткам, включая фазу покоя Go, достигает 16 суток. Выходя из фазы Go, клетка испытывает 1-2 деления и снова переходит в фазу Go (или Gj). Часть делений (до 12%) осуществляется базальными клетками, отделившимися от базальной мембраны в слое шиповидных клеток. Стволовые клетки в основном находятся в фазе Go и изредка, вступая в цикл, делятся, поддерживая пул базальных клеток. Последние в свою очередь делятся в среднем один раз в 2 недели. После ряда делений базальные клетки дифференцируются и переходят в компартмент созревающих шиповидных клеток, затем зернистых клеток. Цитоплазма постепенно замещается кератином и клетки отмирают, образуя роговой слой, а затем и слущиваются. Минимальное время перехода из базального слоя в роговой, как показали экспериментальные исследования на коже свиней с использованием радиоактивной метки, составляет 14-16 суток, время прохождения по роговому слою также около 14 суток. Полное время обновления эпидермиса немного менее месяца 26-28 суток. (Осанов Д.П., 1990).
Процесс обновления клеточной популяции эпидермиса регулируется по принципу обратной связи. Уменьшение численности базальных клеток и клеток созревающего компартмента снижает концентрацию кейлона — химического фактора, выделяемого клетками и ингибирующего скорость пролиферативных процессов, что ускоряет выход базальных клеток из состояния покоя Gq и способствует увеличению скорости их размножения. Этому способствует также ряд факторов, стимулирующих клеточную пролиферацию, выделяемых продуктами массовой гибели клеток при распаде ткани в случае травмы, при ожоге или радиационном поражении. Так при нанесении травмы деление базальных клеток
125
через сутки резко ускоряется. Клеточный цикл сокращается в 2-4 раза, а время удвоения числа базальных клеток может сократиться в 30 раз (от 10-16 суток до 14 часов). Соответственно время обращения клеток эпидермиса снижается до 7 суток, что способствует восстановлению базальных клеток эпидермиса, его придатков и быстрому заживлению раны (Волохова Н.А., 1964).
При радиационном поражении эпидермиса с уменьшением численности стволовых, делящихся и дифференцирующихся клеток, усиливаются пролиферативные процессы в ткани и скорость размножения способных к делению клеток. Восстановление при преимущественном местном поражении может идти за счет выживших клеток на облученном участке и вследствие миграции клоногенных клеток из менее облученной пограничной зоны.
Характер и клиническое течение болезни при радиационном поражении кожи, возможные отдаленные рецедивы его проявления и конечный результат зависят от степени повреждения как эпидермиса, так и дермы, кровеносных сосудов и других тканей. При этом деструктивные процессы, развивающиеся в последних более глубоких поверхностных слоях, могут вносить вклад во все компоненты системы клеточного обновления кожи. Процесс же восстановления целиком определяется состоянием пролиферативного пула базальных клеток. Следует при этом отметить, что наибольшей поражаемостью отличаются базальные клетки эпидермиса и клетки эндотелия сосудов дермы. Созревающие и функциональные клетки эпидермиса, фибробласты и мышечные клетки дермы, клетки нервной ткани повреждаются существенно меньше при относительно невысоких дозах и в сроки, характерные для острого периода лучевого поражения кожи.
Данные о радиочувствительности стволовых клоногенных клеток эпидермиса в настоящее время очень ограничены. Гистологически показано, что в эпидермисе свиней образуется три типа клеток, дающих малые, большие и гигантские колонии, «островки». Радиочувствительность соответствующих клоногенных клеток существенно различна. Параметр Dq, определяющий конечный наклон кривых выживаемости клеток от дозы, оказался для этих клеток равным 270, 560 и 1600 сГр соответственно. Кривые выживаемости клеток, имеющие плечо, описываются уравнением: S/S0 = l- [l - exp(-D/D0]n. Если построить единую для всех клоногенных клеток кривую, то усредненное значе
126
ние параметра Do окажется равным 340 сГр, а экстраполяционное число — п = 6,6. Величина плеча Dq при этом составит величину 500-600 сГр (Осанов Д.П., 1990). Большая величина плеча, характерная для базальных клеток как и для клеток эпителия кишечника, свидетельствует о значительных возможностях указанных клеток восстанавливать сублетальные повреждения при фракционированных воздействиях в промежутках между облучениями (Ко-ноплянников А.Г., 1984; Ярмоненко С.П., Вайнсон А.А., 2004).
Для прогнозирования степени поражения кожи и оценки выжившей доли стволовых клеток при неравномерном облучении важное значение имеют характер глубинного распределения дозы и распределение базальных клеток в эпидермисе и дерме. В работах (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988; Осанов Д.П., 1990) показано распределение базальных клеток по глубине кожи. В слое толщиной до 70 мкм расположено до 50% клеток, в срезе от 70 до 1000 мкм — 30% и на глубинах от 1000 до 2000 мкм расположено 20% клеток.
После облучения поступление новых клеток в базальный слой и слой шиповидных клеток прекращается на период блокирования деления базальных клеток. При дозах 15-25 Гр деление базальных клеток прекращается примерно на 15 часов на 1 Гр поглощенной дозы (на 10-15 суток), и эта задержка возрастает с увеличением дозы. После окончания блока скорость размножения сохраненной части базальных клеток, за счет развития указанных выше авторегуляторных процессов в ткани, а также компенсаторных процессов, существенно возрастает и значительно превосходит ту, которая присуща им в норме. Однако отмечаемое в эксперименте восстановление базальных клеток еще дополнительно задерживается, поскольку при больших дозах и сильном опустошении пула стволовых клеток они на первом этапе делятся только гомоморфно, восстанавливая свою численность.
Созревающие и функциональные клетки сохраняются после облучения. Сохраняется и их скорость продвижения к поверхности кожи и слущивания клеток рогового слоя. В то же время убыль базальных клеток из-за их дифференцировки не компенсируется своевременным их пополнением (ввиду блока митозов). Их число падает почти до нуля. Эпидермис отслаивается, и оголяется дерма.
Анализ кинетики поражения и восстановления численности базальных клеток кожи поросят после рентгеновского облучения
127
в дозах 16-26 Гр (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988) показывает начальное линейное снижение числа клеток в период блока их размножения со скоростью независимой от дозы и определяемой нормальной кинетикой убыли клеток за счет их дифференцировки. Убыль базальных клеток составляет 3,3% в сутки. Восстановление числа клеток начинается при дозе 16,5 Гр с 10 суток после облучения, при дозах 22-26 Гр — с 20-25 суток соответственно. После облучения в дозе 16,5 Гр клеточность базальных клеток восстанавливается сравнительно быстро к норме (к 30 суткам), а после доз 22 и 26 Гр отмечается повторное глубокое снижение числа клеток к 50-60 суткам, что свидетельствует о напряженном характере регенерации в ткани и волнообразности протекания компенсаторных процессов, определяющих временное усиление скорости размножения клеток, как это отмечалось нами при анализе кинетики стволовых кроветворных клеток при радиационном воздействии (Швец В.Н., Шафиркин А.В., 1979).
Восстановление эпидермиса, как и при тепловых ожогах, происходит за счет сохраненных базальных клеток сначала в местах расположения придатков кожи очагами по всей пораженной поверхности кожи. Благодаря ускоренной пролиферации базальных клеток, слой вокруг придатков за время нескольких суток способен дорасти до границы раздела дермы и эпидермиса, начать покрывать обнаженную дерму и восстанавливать слой базальных и дифференцированных клеток эпидермиса. Восстановление слоя базальных клеток эпидермиса может происходить также и за счет размножения части сохраненных клеток и смещения их на пораженные соседние участки ткани (у поросят скорость такого процесса восстановления составляет 1 мм за 6-7 суток). После лучевого воздействия в дозе 16 Гр базальный слой восстанавливается за время около 30 суток, а после больших доз, как указывалось выше, восстановление протекает гораздо медленнее.
Изменения, возникающие в коже под влиянием ионизирующего излучения, выражаются последовательно эритемой, пигментацией, эпиляцией, отторжением эпидермиса, изъязвлениями и последующим восстановлением кожного и волосяного покровов. Эти изменения относятся к ранним реакциям в пределах 0-60 суток после облучения. Поздние проявления имеют место через 6 месяцев и более. Они связаны с развитием атрофии кожи и повторными изъязвлениями.
128
Как ранние эффекты, связанные с развитием эритемы и воспалительными процессами в коже, так и отдаленные изменения кожного покрова могут сказаться на работоспособности космонавтов и на выполнении ими полетной программы. Поэтому уровни радиационного воздействия на кожу при действии стохастических источников излучения в космосе — СКЛ и возможные неблагоприятные проявления должны оперативно устанавливаться службой радиационной безопасности в процессе осуществления полетов.
Также должен контролироваться характер накопления суммарных доз на кожу в процессе полета и степень их соответствия допустимым уровням воздействия. Первой наиболее характерной реакцией кожи на облучение является эритема в течение первых часов. Она имеет иногда волнообразное клиническое течение. Именно возникновение эритемы у членов экипажа может служить предвестником более тяжелых повреждений кожи. В качестве примера следует отметить, что если бы экипаж космического аппарата во время космического полета вне магнитосферы Земли находился за защитой 1 г/см2 во время СПС типа 10-16 июля 1959 г., поглощенная доза на кожу составила бы 650 сЗв и эритема могла бы возникнуть на 3-и сутки (Григорьев Ю.Г., 1975).
Из представленных данных видно, что развитие радиационного поражения в эпидермисе и восстановление его клеточности происходит аналогично характеру процесса в других обновляющихся тканях. В то же время кожа является более устойчивой тканью по сравнению с кроветворной. В связи с этим реакция кожи имеет отчетливый порог для начала видимых проявлений. Так эпиляция и слабая эритема возникают у наиболее радиочувствительных индивидуумов при дозе на кожу 200-400 сГр. Эпиляция имеет меньшее значение с точки зрения безопасности членов экипажа космического аппарата, но она является одним из ранних признаков возможного серьезного радиационного повреждения кожи. При дозе 200 сГр может иметь место временная эпиляция, которая начинается через 13-17 дней. С увеличением дозы она может прогрессировать до стойкого облысения. Рост волос может быть восстановлен через 3-6 месяцев, если доза на кожу не превышала 20 Гр.
После облучения кожи в дозах 4-7 Гр в ближайшем периоде возникает первичное покраснение (первичная эритема), являющееся следствием раздражения нервных рецепторов кожи, расши
129
рения просвета сосудов и притока крови к коже. Истинная эритема, сопровождающаяся покраснением и воспалением кожи, наблюдается при более высоких дозах. Она появляется через 10 суток, к 15 суткам достигает максимума и к 20-30 суткам постепенно ослабевает. При больших дозах она может вновь проявиться даже через 2 месяца (Волохова Н.А., 1964; Гозенбук В.Л., Кеирим-Маркус И.Б., 1988). Эритема сопровождается значительным усилением кровообращения в коже.
В работе (Radiobiological factors in manned space flight, 1967) показано, что 10%-я, 50%-я и 90%-я вероятность появления эритемы имеет место при дозах на кожу (на глубине 0,1 мм) 400, 575 и 750 сГр соответственно. Следует отметить, что для характера течения лучевой реакции кожи имеет значение присутствие дополнительных факторов, таких как повышение температуры окружающей среды, наличие травм, раздражающих веществ. Поэтому при осуществлении космических полетов даже умеренная эритема на сравнительно небольшой поверхности тела при давлении и трении от космического костюма (скафандра) может вызывать болевые неприятные ощущения у космонавтов и привести к заметному снижению работоспособности (Григорьев Ю.Г., 1975).
С увеличением дозы ионизирующих излучений эпиляция и эритема переходят в сухой эпидермит (реакция второй степени тяжести), который характеризуется возникновением небольших пузырей и сопровождается шелушением кожи. Порог реакции второй степени составляет 1000-1200 сГр. При больших дозах сухой эпидермит переходит во влажный, мокнущий эпидермит, сопровождающийся разрывом пузырей, образованием эрозий и поверхностных язв. Установлено, что время наступления влажного эпидермита соответствует времени прохождения клеток из базального слоя в роговой слой. Это говорит о преимущественном поражении базальных клеток и уменьшении их продукции. Время наступления пика данных кожных реакций совпадает со временем обновления эпидермиса. В работе (Radiobiological factors in manned space flight, 1967) показано, что 10%-я, 50%-я и 90%-я вероятность возникновения влажного эпидермита имеет место при дозах 1400, 2000 и 2600 сГр.
При воздействии относительно мягкого излучения характер отмеченных кожных реакций в значительной степени зависит от распределения дозы в поверхностных слоях кожи как в эпидермисе, так и в более глубоко расположенных слоях: дерме,
130
подкожной клетчатке. Излучение, не проникающее в эпидермис, не будет оказывать влияния на основные структуры системы обновления кожи и не приведет к отмеченным выше изменениям.
В случае поражения эпидермиса (глубина 70-100 мкм), может иметь место эпидермальный некроз, степень которого зависит от дозы. Могут отмечаться ранние указанные выше реакции кожи, такие как эритема, сухой и влажный эпидермит, обусловленные нарушением системы обновления эпидермиса. При более глубоком поражении кожи и формировании нарушений в дерме, включающих повреждения кровеносных сосудов (капилляров) и других структур, развивается трансдермальный некроз, сопровождающийся шелушением и изъязвлением, захватывающим все слои кожи. В этом случае возникают глубокие язвы, являющиеся основой отдаленных хронических воспалительных реакций, развиваются атрофия кожи и ее некроз. Когда воздействию подвергается кожа по всей толщине, первичным процессом поражения оказывается потеря эпидермиса в сроки, зависящие от указанной выше кинетики клеточной популяции. Затем при больших дозах развитие поражения сосудистой сети существенно усугубляет тяжесть дермальной формы острого лучевого поражения и вероятность последующих рецидивов поражения кожи, в том числе указанных выше проявлений.
Пороговые величины доз для ранних повреждений кожи, таких как сухой и влажный эпидермит, обусловленных нарушением клеточной кинетики в эпидермисе, составляют 1200-1700 сГр. Порог же для трансдермальных повреждений кожи, затрагивающих более глубокие слои и приводящих к развитию хронических воспалительных реакций, атрофии и некрозу кожи составляет 2180-2500 сГр (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988).
Таким образом, в то время как острая лучевая реакция эпидермиса связана главным образом с прямым действием радиации на систему его клеточного обновления, этиология поздних эффектов наталкивает на мысль, что в их основе лежат нарушения других структур, расположенных в дерме и последующих глубинных слоях, в частности сосудистые нарушения и изменение кровоснабжения в этих участках ткани. Это подтверждается тем, что в клинике при проведении радиотерапевтических процедур и в экспериментальных исследованиях отдаленных поражений кожи свиней было показано отсутствие корреляции между тяжестью острой реакции эпидермиса и степенью поздней
131
132
Таблица 3.10
Тяжесть лучевого поражения кожи и сопутствующие эффекты после равномерного облучения в различных дозах (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988; Осанов Д.П., 1990)
Доза, Гр Пора* жение, баллы Характеристика повреждений Степень тяжести по глубине поражения
фаза поражения фаза восстановления эпидермиса Гозенбук, 1988 Осанов, 1990
5-8 0,5 Слабая эритема Восстановление к 30 суткам I I
7-13 1,0 Умеренная эритема, яркая на 50% поля Сухое шелушение, восстановление к 30-м суткам I II
10-15 1,5 Яркая эритема по всему полю Сухое шелушение обильное, отчасти влажное. Восстановление эпидермиса на 80% язвенной поверхности II III
15-20 2 Яркая эритема по всему полю Влажное шелушение. Малые пузыри, не напряженные менее 50% поля. Восстановление эпидермиса на 50% язвенной поверхности II III
18-25 3 Яркая эритема по всему полю Влажное шелушение. Большие слитные пузыри более 50% поля, в том числе разрушенные с розовым дном. Восстановление эпидермиса по краям поля на 15% II IV
20-30 4 Темно-красная эритема Пузыри со следами крови. У разрушенных пузырей дно белесое. Омертвение тканей менее 50% поля. Восстановление отсутствует. Изъязвление проникает в подкожную ткань Ш-А IV
Более 25 5 Лиловая эритема То же и омертвение тканей более 50% поля Ш-Б IV
атрофии дермы при использовании различных режимов фракционирования дозы. Все перечисленные эффекты лучевого поражения кожи наблюдаются и при других — тепловых, световых и химических ожогах кожи.
Эти эффекты принято оценивать по тяжести проявлений в бальной шкале (табл. 3.10).
Анализируя данные, представленные в таблице, следует дополнительно отметить, что при равномерном по глубине облучении кожи в дозах более 15 Гр пузыри образуются на 17 сутки и проходят на 32-36 сутки, если клеточность базального слоя восстанавливается. При дозах 20 Гр с 50 суток наблюдается повторное повреждение, вызванное образованием язв и омертвлением кожи (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988; Осанов Д.П., 1990). Из данных таблицы следует, что после облучения в дозах до 15 Гр кожа практически всегда восстанавливается. При воздействии в дозе 22 Гр она восстанавливается в 50% случаев, а при дозе, большей 26 Гр, восстанавливается очень редко.
Следует отметить, как указывалось выше, что кривые выживаемости стволовых клоногенных клеток эпидермиса от дозы имеют сравнительно большое плечо 500-600 сГр. Это свидетельствует о значительной их способности восстанавливать сублетальные повреждения. Поэтому эффективность повреждения системы обновления кожи существенно снижается в случае радиационного воздействия с малыми значениями мощностей доз и при фракционированных облучениях.
Исследование эффективности радиационного поражения кроветворной ткани, желудочно-кишечного эпителия, кожи при снижении мощности дозы радиационного воздействия подробно рассмотрено в работах (Шафиркин А.В., 1983-а, 1999-в) и в разд. 6.
Для решения вопросов нормирования воздействия на космонавтов космических излучений и обоснования предельных уровней облучения при осуществлении длительных орбитальных и межпланетных полетов необходимо кроме знания ближайших неблагоприятных эффектов, снижающих работоспособность и жизнеспособность космонавтов в процессе полетов, иметь также четкое представление о суммарном риске в течение всей жизни ухудшения здоровья космонавтов и о возможном снижении продолжительности их жизни. Поэтому материалы, представленные в последующих разделах, в значительной своей части касаются именно этих вопросов.
ХРОНИЧЕСКИЙ ЭКСПЕРИМЕНТ
ПО з- и 6-ЛЕТНЕМУ ОБЛУЧЕНИЮ СОБАК L С МОДЕЛИРОВАНИЕМ ДОЗОВЫХ
НАГРУЗОК НА КОСМОНАВТОВ
В УСЛОВИЯХ Д ЛИТЕЛЬНОГО ПОЛЕТА
К МАРСУ
4.1. Методология постановки эксперимента
Уже на первых этапах освоения космического пространства в СССР, после запуска первого искусственного спутника Земли и первого полета пилотируемого космического корабля, генеральный конструктор космической программы академик С.П. Королев
выдвинул новую перспективную программу: осуществить пилотируемый полет к Марсу.
В СССР был начат широкий спектр предварительных исследований по этой программе. Перед научным коллективом Института медико-биологических проблем (ИМБП) М3 СССР академиком С.П. Королевым была поставлена научно-практическая задача — провести многолетний эксперимент по облучению животных во временном режиме и в дозах, моделирующих радиационное воздействие на космонавтов при полете на Марс, и получить необходимые данные к обоснованию допустимых уровней радиационного воздействия на космонавтов при осуществлении этого длительного межпланетного полета. Это
предложение было активно поддержано заместителем министра М3 СССР А.И. Бурназяном, академиками А.В. Лебединским и В.В. Лариным.
Заместитель министра здравоохранения СССР Аветик Игнатьевич Бурназян
134
В эксперименте принимали участие коллективы нескольких институтов СССР и зарубежные ученые: ИМБП Минздрава СССР, Института биофизики Минздрава СССР (ныне
Первый директор ИМБП, академик Андрей Владимирович Лебединский
ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна») в г. Москве, сотрудники лаборатории профессора Александрова С.Н. из ЦНИИРРИ Санкт-Петербурга, а также биологи и медики
Польши, ГДР, Чехосло-
вакии, Венгрии и Болгарии.
Работа координировалась специально созданным Научным советом, в который входили ведущие радиобиологи страны: С.Н. Александров, А.К. Гуськова, Г.Д. Байсоголов, Ю.И. Москалев, В.В. Шиходыров, Е.Д. Гольдберг, Ю.К. Кудрицкий, Н.Г. Да-
ренская, Л.С. Черкасова, Е.А. Савина, В.И. Яковлева и др. Программа эксперимента подробно обсуждалась на научных совещаниях, одно из которых представлено на фото.
Это был уникальный эксперимент, результаты которого освящались в журнале «Советский Союз» и были представлены на Выставке достижений народного хозяйства в павильоне «Космос».
В президиуме академик В.В. Парии, профессор Г.Д. Байсоголов, научный руководитель радиобиологических исследований профессор Ю.Г. Григорьев и профессор А.К. Гуськова
135
Необходимо было проанализировать имеющуюся литературу по постановке радиобиологических исследований по хроническому (длительному) облучению животных с различной мощностью дозы и поставить собственный эксперимент по многолетнему облучению животных, моделирующему временной характер и дозо-вые нагрузки на космонавтов во время межпланетного полета.
В хронических исследованиях существенную роль играет выбор вида животных. Известное преимущество при постановке хронических экспериментов имеют мелкие лабораторные животные (мыши, крысы). Учитывая малую продолжительность их жизни, продолжительность хронического облучения до их гибели относительно невелика. Количество животных в эксперименте может быть достаточно большим, минимальна трудоемкость работ по уходу за животными, просты условия и устройства для облучения мелких лабораторных животных. Однако информативность таких экспериментов весьма ограничена, усложнена экстраполяция полученных данных на человека.
Использование крупных лабораторных животных в хронических экспериментах требует длительного многолетнего наблюдения, особенно при изучении сокращения продолжительности жизни. Усложняются условия и устройства для облучения. Для организации такого эксперимента необходимы большие площади, возрастает трудоемкость работ по уходу за животными. Постановка таких экспериментов требует специального методологического подхода. По этим причинам к моменту постановки требуемого эксперимента имелась обширная радиобиологическая литература по хроническому облучению мелких лабораторных животных (непрерывному и ежедневному фракционированному) с различной дозой за сутки, но лишь единичные публикации по изучению эффектов хронического радиационного воздействия на крупных лабораторных животных (собаках).
Выбор в качестве объекта исследований именно собак объясняется тем, что собаки по своей радиочувствительности наиболее близки к человеку. При изучении кривых выживаемости в разных исследованиях среднелетальные среднетканевые дозы ЛД50/60 при остром равномерном облучении для собак заключены в диапазоне 260-300 сГр, а у человека 285-330 сГр (Блэр X., 1958; Alpen E.L. et al., 1958; Blair H.A., 1964; Langham W.H. et al., 1965; Григорьев Ю.Г. и др., 1986). Кроме того, у собак многие физиологические и патологические процессы протекают так же, как у че
136
ловека, а основные эффекты радиационного поражения достаточно полно отражают изменения, происходящие в организме человека во время и после воздействия ионизирующих излучений. Близкими являются и параметры скорости восстановления организма в процессе хронического облучения и после острых радиационных воздействий. Многолетний опыт радиобиологов показал, что имеется возможность прямой экстраполяции результатов, полученных на собаках, на человека.
Учитывая трудоемкость и длительность эксперимента, было важно обоснованно выбрать диапазон используемой мощности дозы. Этот выбор обусловлен задачами эксперимента. Существенным фактором в методологии постановки хронических экспериментов является режим облучения. Если предусматривается хроническое круглосуточное облучение, то время прекращения лучевого воздействия для кормления животных и уборки должно быть минимальным.
Установки для хронического облучения больших партий крупных лабораторных животных (собак) должны обеспечивать:
1) нормальную жизнедеятельность одновременно большого количества животных в течение нескольких лет;
2) простоту и удобство обслуживания животных (кормление, уборку, вывод животных на обследование);
3) групповое размещение животных из расчета не более 2-3 м2 площади на одно животное с соблюдением норм радиационной безопасности для обслуживающего персонала и населения.
При оценке эффектов хронического облучения существенное значение имеют методы исследования, адресованные как к наиболее радиочувствительным, критическим системам организма (кроветворная система, сперматогенный эпителий), так и к основным регуляторным системам организма (нервная, эндокринная и сердечно-сосудистая системы).
При хроническом облучении организма в малых дозах в течение года и более развитие лучевого поражения имеет ярко выраженную дозовую зависимость. При длительном облучении с мощностью дозы излучения более 2 сГр/сут может развиться типичная картина хронической лучевой болезни (Гуськова А.К., Байсо-голов Г.Д., 1971), При меньшей мощности дозы (0,01-0,5 сГр/сут) общее состояние организма в течение длительного времени может оставаться удовлетворительным и лишь применение тонких специальных методов исследования и дополнительных функцио
137
нальных нагрузок позволяет выявить начальные признаки лучевого поражения, снижение реактивности, различную возможность компенсаторных реакций.
Оценка биологического действия хронического облучения осложняется тем, что во время такого облучения может изменяться радиочувствительность самого организма, причем это изменение может носить фазный характер. Кроме того, во время хронического воздействия снижается общая реактивность организма, ограничивается возможность организма к компенсации возникших изменений и в связи с этим приобретают важное значение так называемые нагрузочные пробы (Григорьев Ю.Г., 1963) Поэтому важно было организовать исследования таким образом, чтобы получить динамическую картину развивающихся сдвигов в организме по мере накопления поглощенной дозы в течение многолетнего облучения.
Возникшие в организме изменения при хроническом многолетнем облучении очень стойки, и восстановление нарушенных функций происходит медленно. Для отдаленных последствий характерны более высокая частота выхода лейкозов, опухолей, несколько ускоренное старение организма. Необходимо было также учитывать возможное развитие общесоматических заболеваний более широкого спектра. Важно было четко оценить основные признаки ускоренного старения в возможное сокращение продолжительности жизни при облучении в различных дозах.
Нами предварительно были оценены характер радиационной обстановки при полете к Марсу, величины доз, которые реально могли воздействовать на экипаж во время экспедиции к Марсу за счет галактических космических лучей (ГКЛ), и солнечных космических лучей (СКЛ) во время развития солнечных протонных событий (СПС). В дальнейшем полученные характеристики возможных источников облучения и уровней воздействия были подтверждены как в исследованиях советских ученых, так и в совместной работе с учеными США (Бобков В.Г. и др., 1964; Григорьев Ю.Г., 1975; Григорьев Ю.Г., Тобайес К.А., 1975; Ковалев Е.Е., 1976; Коломенский А.В., 1989; Dudkin V.E. et al., 1992; Шафиркин А.В., 1999в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004).
Как показали расчеты, возможные значения эквивалентной дозы ГКЛ за различными толщинами космического аппарата лежат в диапазоне 15-100 сЗв за год. Такой большой диапазон доз
138
обусловлен вариацией потока частиц галактического излучения, неопределенностью относительной биологической эффективности (ОБЭ) для многозарядных ионов ГКЛ и вклада в поглощенную дозу вторичного излучения, образующегося в защите корабля и в теле космонавта. Галактические космические лучи будут оказывать непрерывное воздействие на космонавтов в течение всего времени полета к Марсу с постоянной мощностью дозы. Воздействие солнечных космических лучей носит стохастический характер как по времени реализации, так и по величине флюенса и жесткости спектра. Доза излучения СКЛ во время развития СПС может быть различной. Солнечные протонные события подразделяются на классы в зависимости от интенсивности и энергии частиц. Моделирование всего многообразия солнечных вспышек невозможно. В настоящем эксперименте была поставлена задача моделирования дозовых нагрузок и временных факторов для мощных СПС, таких как события 23 февраля 1956 г., 10 мая 1959 г. и 12 ноября 1960 г. Эквивалентная среднетканевая доза от данных вспышек составляет 5-15 сЗв за защитой 30 г/см2 и 40-50 сЗв за защитой 10 г/см2. Имеется значительная вероятность появления двух вспышек такого класса в год (10%). Кроме того, в аварийной ситуации, когда экипаж по какой-либо причине не сможет укрыться в радиационное убежище во время менее интенсивной солнечной вспышки, имеется конечная вероятность трех острых радиационных воздействий в год.
Характер радиационного воздействия и возможные значения эквивалентных доз при полете к Марсу легли в основу программы облучения животных в «Хроническом эксперименте». Возникла проблема определения величин доз и соответственно количество соответствующих групп животных, что существенно могло повлиять на объем проводимых исследований, а главное, должно было гарантировать получение результатов, позволяющих оценить степень радиационной опасности полета к Марсу для экипажа этой экспедиции и обосновать допустимые уровни радиационного воздействия.
После длительного обсуждения и анализа уже существующего опыта и данных, как экспериментальных, так и относящихся к профпатологии и результатам многолетних эпидемиологических наблюдений за населением, проживающих на территориях, загрязненных продуктами радиоактивного распада, коллективом ве
139
дущих исполнителей «Хронического эксперимента» было принято следующее окончательное решение.
Было решено использовать три группы животных только с хроническим облучением (моделирование трех уровней хронического облучения от ГКЛ за год), в которых облучение осуществлялось непрерывно по 22 часа в сутки. Первый уровень — минимальный, который не должен был привести к развитию каких-либо патологических проявлений, как во время шестилетнего облучения, так и в периоде последействия (до естественной гибели опытных собак). Суммарная годовая локальная доза на поверхности животных, ближайшей к источнику гамма-излучения, была выбрана равной 25 сЗв (первая группа животных).
Второй уровень мощности дозы должен быть достаточно большой и привести к патологическим проявлениям уже во время шестилетнего облучения собак и развитию отдаленных последствий — суммарная годовая доза 150 сЗв (третья группа животных).
Третий уровень мощности дозы был выбран как промежуточный между двумя первыми — суммарная годовая доза 75 сЗв. У собак этой группы мы ожидали развитие выраженных компенсаторных реакций, преходящих неблагоприятных проявлений, прежде всего в наиболее радиочувствительных обновляющихся тканях: кроветворной ткани и сперматогенном эпителии. Ожидаемыми могли быть значимые нарушения гемопоэза и сперматогенеза, как основных критических органов (вторая группа животных).
Четвертая группа опытных собак подвергалась сочетанному облучению: относительно острому облучению трижды в год, моделирующему воздействие СКЛ в дозах за сутки 10, 10 и 50 сЗв на фоне хронического облучения, моделирующего воздействие ГКЛ в суммарной годовой дозе 75 сЗв. Продолжительность острого радиационного воздействия была выбрана равной 18-20 ч в соответствии с данными о продолжительности солнечных протонных событий (тот период, за который реализуется значительная часть суммарной дозы от СПС).
Пятая группа собак с максимальной дозовой нагрузкой, животные которой подвергались также сочетанному хроническому облучению в дозе 75 сЗв за год и острому радиационному воздействию трижды в год в дозах 50 сЗв.
Результаты наблюдений за животными групп с сочетанным облучением позволяли оценить также значимость периодической серии острых облучений, воспроизводящих воздействие СПС на
140
фоне хронического облучения, моделирующего уровни доз от ГКЛ. Кроме того, мы ожидали получить на основе реакции животных этих двух групп данные для обоснования коэффициента гигиенического запаса для определения величин предельно допустимых уровней (ПДУ) для экипажей при длительных межпланетных космических полетах.
Так как основной опыт проводился в вольерах вне помещений, на «открытом воздухе», небольшое количество животных основных групп содержалось в теплом помещении, в котором осуществлялось аналогичное облучение (группа «биологического атмосферного контроля»).
Кроме чисто хронического облучения (три группы собак) и сочетанного воздействия, была группа животных с оценкой эффективности средств профилактики и терапии, а также две группы животных физиологического контроля.
Облучение основной партии животных было начато 12 ноября 1966 г. Для увеличения общего количества животных и статистической надежности результатов вводилось дополнительное количество животных в более поздние сроки. Регламент облучения, характеристика опытных групп и количество собак в этих группах, а также суммарные дозы за сутки и за год представлены в табл. 4.1.
Планировалась общая длительность облучения большинства животных в течение 6 лет. Часть животных через 3 года от начала облучения в соответствии с программой должна была быть выведена из облучения для наблюдения за дальнейшим развитием возникших изменений и характером процессов восстановления организма.
В качестве подопытных животных в «Хроническом эксперименте» были использованы беспородные собаки, отловленные в центральных областях страны. Всего было отловлено более 1000 собак. Перед введением в эксперимент все собаки были обследованы и из них отобраны абсолютно здоровые животные со следующими показателями экстерьера: масса тела 10-15 кг, рост 32-51 см, возраст 1,5-3 года. Соотношение самцов и самок составляло 4:1. Придавая большое значение подбору собак перед хроническим опытом в целом и в каждой подопытной группе, основные показатели экстерьера подопытных собак мы приводим в табл. 4.2.
141
Таблица 4.1
142
Дозы и регламент облучения собак в «Хроническом эксперименте>
Условия содержания Характеристика воздействия № группы Время начала облучения и число собак в группе Моделируемая доза хронического облучения, сЗв Доза острых облучений за год, сЗв Суммарная доза за год, сЗв
12 ноября 1966 г. 8 января 1968 г. 11 ноября 1968 г. за сутки за год
На открытой площадке Хроническое облучение 1 24 6 0,07 25 — 25
2 24 6 0,21 75 — 75
3 24 6 0,42 150 — 150
Сочетанное облучение 4 24 6 0,21 75 50 + 10 + 10 145
5 24 6 0,21 75 50 + 50 + 50 225
Контроль 6 30 6 — — — —
Сочетанное облучение (профилактика) 7 30 6 0,21 75 50 + 50 + 50 225
В закрытом помещении Хроническое облучение 8 6 0,21 75 — 75
Сочетанное облучение 9 6 0,21 75 50 + 10 + 10 145
10 6 0,21 75 50 + 50 + 50 225
Контроль И 6 — — — —
Примечание. Представлены предполагаемые в эксперименте максимальные локальные поглощенные дозы на ближайшей поверхности к источнику гамма-излучения.
Таблица 4.2
Экстерьер собак перед началом «Хронического эксперимента»
1 Группа Пол Число животных Средний возраст, лет Рост, см Масса, кг
1 Самцы 24 1,6 40-42 10-12
Самки 6 1,4 43-45 12-15
2 Самцы 24 1,6 46-48 12-15
Самки 6 1,3 43-45 12-15
3 Самцы 24 1,4 45-46 10-15
Самки 6 1,7 45-46 10-12
4 Самцы 24 1,6 46-48 12-15
Самки 6 1,7 46-48 12-15
5 Самцы 24 2,2 40-42 10-12
Самки 6 2,3 40-42 10-12
6 Самцы 24 2,3 42-44 10-14
Самки 12 2,5 35-44 10-12
7 Самцы 30 1,4 34-36 10-13
Самки 6 1,6 34-36 10-13
8 Самцы 24 1,6 37-43 10-15
У отобранных для опыта животных после трехнедельного карантина были проведены клинические и гематологические исследования, а также сделаны специальные анализы по определению исходного уровня оцениваемых показателей. Кроме того, дополнительно был выполнены необходимые мероприятия по дегельминтизации и прививкам против чумы и бешенства. Последние мероприятия, а также периодическую дезинфекцию мест содержания животных проводили в последующие годы в соответствии с требованиями ветеринарной службы. В дальнейшем клинический статус животных в «Хроническом эксперименте» изучали в динамике на 246 беспородных собаках.
Животных «Хронического эксперимента» содержали на обычном виварном питании и кормили под постоянным контролем
143
2 раза в сутки. Общий объем корма составлял 1,3—1,5 л. Дневной рацион животных состоял из мяса, молока, хлеба, крупы, овощей, рыбьего жира, сухих дрожжей, мясо-костной муки, ежедневный рацион таким образом содержал 24% белков, 22% жиров, 53% углеводов. По общей энергоемкости в летне-осенний период животные получали с пищей 7000 кДж, а в зимне-весенний — 8200 кДж в сутки. Такое питание соответствовало правилам и рекомендациям кормления экспериментальных собак. Все данные объективных наблюдений и основную часть результатов инструментальных определений клинического состояния подопытных животных документировали в индивидуальных и специально разработанных журналах — индивидуальных протоколах на каждую собаку.
Всех собак содержали в специальных вольерах типа «звездочка» (по 6 собак в каждой «звездочке») на открытой площадке, кроме 24 собак, находившихся в четырех звездочках в отапливаемом помещении. Эти собаки были своеобразным «климатическим» контролем по отношению к основной группе животных. При распределении собак в вольерах учитывали их рост и массу. За собаками был установлен ежедневный ветеринарный контроль в течение всего периода облучения и во время последующего периода жизни. Общее клиническое состояние изучали у собак всех экспериментальных групп.
Для оценки клинического статуса животных в «Хроническом эксперименте» за животными вели ежедневные наблюдения: осматривали шерстяной покров, кожу, обращали внимание на состояние видимых слизистых оболочек, скелета, мышц, суставов, следили за сроками линьки. Наблюдали за стиранием зубов (для этого были сделаны фотографии зубов до начала облучения, а затем через 3 года от начала облучения). На протяжении всего эксперимента один раз в 2 месяца, а после 3 лет облучения через каждые 4 месяца собак взвешивали, измеряли ректальную температуру, регистрировали пульс, определяли частоту дыхания, детально обследовали сердечно-сосудистую систему, оценивали реакцию организма на физическую и тепловую нагрузки.
Гематологические исследования проводили у всех собак. В качестве показателей использовали: количество эритроцитов, лейкоцитов, ретикулоцитов, тромбоцитов и эозинофилов, РОЭ, содержание миелокариоцитов в 1 мм3 пунктата костного мозга. При этом подробно оценивали лейкограмму и миелограмму. Определение гематологических показателей производили по общеприня
144
тым методикам. Для выяснения гематологической равноценности групп животных до начала облучения сравнивали основные показания крови при помощи критерия %2. При этом существенных различий между группами собак не было выявлено.
Оценку функциональной способности гемопоэтической системы, в частности ее миелоидного ростка, проводили с помощью пи-рогеналовой пробы. Реакцию гемопоэтической системы на функциональную нагрузку оценивали по изменению костномозгового резерва гранулоцитов. Последний определяли расчетным путем как разность между их числом в периферической крови до и после введения пирогенала.
Состояние хромосомного аппарата изучали анафазным и ме-тафазным методами. В первом случае хромосомные аберрации анализировали в поздних анафазах и ранних телофазах. Учитывали хромосомные и хроматидные мосты, простые и парные ацентрические фрагменты. Просматривали в каждом препарате по 100 ана-телофаз. Материалом для исследования служили те же препараты, на которых производили подсчет митотической активности клеток костного мозга. Тестами для суждения о хромосомных нарушениях служили число хромосом, их структура и форма, а также взаимное расположение их в метафазной пластинке.
Иммунологическую реактивность определяли у собак по фагоцитарной активности нейтрофилов, титра комплемента нормальных антител, бактерицидной активности кожи, зева и др. Состояние функции репродуктивной системы оценивали по состоянию спермы, овогенеза, клинике течения щенности после плановых вязок, жизнеспособности потомства и характеру последующего развития щенков.
Биохимические исследования включали определение содержания белков, липопротеидов, холестерина и сахара по известным методикам. Так, содержание общего белка сыворотки крови измеряли рефрактометром, а содержание белковых фракций и липопротеидов — с помощью электрофореза на бумаге. Общий холестерин определяли по методу Ильке, сахар — антроновым методом, оксипролин — по методу Нейман и Логан.
Оценивали состояние нейроэндокринного статуса животных. Состояние сердечно-сосудистой системы определяли в состоянии покоя и при применении физической и тепловой нагрузки. Способность выполнять дозированную физическую нагрузку характеризовали на основе объективных данных электрокардиограмм у
145
собак при применении дозированной пробежки животных в течение 15 мин на третбане со скоростью 5,2 км/ч. Изучали также состояние высшей нервной деятельности у животных с помощью оценки цепных условных рефлексов по двигательной методике с пищевым подкреплением. Результаты всех исследований подвергали статистической обработке.
4.2. Радиационно-физические условия проведения «Хронического эксперимента*
Возможности моделирования радиационного воздействия
Проблема моделирования радиационного воздействия космических излучений в наземных условиях, как и предполагалось, оказалась достаточно сложной. Применительно к длительным космическим полетам необходимо было моделировать радиационное воздействие протонов, а-частиц и тяжелых ионов. Наряду со специфичностью состава и спектра воздействующего на космонавта ионизирующего излучения необычно и распределение дозы облучения во времени. В межпланетном полете ГКЛ воздействуют на космонавта непрерывно в течение всего времени полета. Это время может составлять несколько лет. На фоне хронического облучения при случайном возникновении вспышек на Солнце происходит острое распределенное во времени облучение.
Процесс моделирования заключался в воспроизведении условий и характеристик радиационного воздействия, наблюдающихся при космическом полете. Для этого должны быть воспроизведены основные физические параметры, определяющие биологический эффект воздействия радиации, — параметры радиационного моделирования, к которым относятся:
1) поглощенная доза;
2) временное распределение поглощенной дозы;
3) пространственное распределение поглощенной дозы;
4) линейная передача энергии (ЛПЭ).
Для моделирования воздействия космических излучений необходимы ускорители заряженных частиц. Действующие в настоящее время ускорители высокоэнергетических заряженных частиц по виду частиц и характеристикам пучков позволяют производить
146
Таблица 10.8
584
Значения риска смертности на человека в год для различных профессий и видов деятельности и их распределение по степени опасности по данным работ
(Ковалев Е.Е., 1976; Шафиркин А.В., 1999-в; Шафиркин А.В., 2001; Шафиркин А.В., 2003)
Номер класса профессии Характеристика степени опасности Величины риска на человека в год абсолютные и относительные Профессии, отрасли промышленности и виды профессиональной деятельности Виды непрофессиональной деятельности (в пересчете на 40 часов в неделю)
1 Пренебрежимо малый уровень риска SKT4 < 0,01 Rdemo Швейная, обувная, текстильная, бумажная, пищевая, обрабатывающая промышленности, типографские рабочие —
2 Относительно невысокий уровень риска (относительно безопасный) 10"4-10“3 (0,01-0,1) Rdemo Экипажи гражданской авиации, пожарники, полицейские, боксеры профессиональные, гончары, работники в атомной промышленности, рабочие в большом числе отраслей промышленности Велосипед, бокс
3 Относительно высокий уровень риска 10-3—5 10'3 (0,1-0,5) Rdemo Углекоксование, вулканизация, рабочие угольных шахт, строители, экипажи гражданской авиации (условия максимального риска), экипажи реактивных бомбардировщиков, экипажи орбитальных космических станций в процессе полета Охота, лыжи
4 Исключительно высокий уровень риска 5 10-3-10"2 (0,5-1,0) Rdemo и более Некоторые производства в химической промышленности, верхолазы, трактористы, летчики-испытатели, пилоты реактивных истребителей, экипажи межпланетных космических аппаратов в процессе полета за защитой от 10 до 20 г/см2 Мотоциклетный спорт, гребля, альпинизм, скачки с препятствиями
Среди технических требований к гамма-установкам для хронического облучения прежде всего следует выделить требование к размещению животных: оно должно быть групповым и, как уже указывалось выше, должно обеспечивать минимальную затрату времени на кормление животных и уборку с тем, чтобы свести к минимуму время прекращения облучения. Необходимо было также обеспечивать соблюдение норм радиационной безопасности для обслуживающего персонала.
С учетом этих требований был создан специальный вольер типа «звездочка» с перегородками высотой 170 и длиной 200 см для одновременного содержания шести собак. В плане вольер представляет круг площадью 12,6 м2, разделенный на шесть секторов. Если при содержании собак в будках площадь, занимаемая одним животным, может составлять в среднем 6 м2, то в вольере «звездочка» эта площадь была равна 2,1 м2. Конструкция вольера обеспечивала простоту и удобство как для обслуживания животных, так и для их хронического облучения. Вольеры «звездочка» с расположенными над ним облучателями «Люстра» представлены на рис. 4.1.
Рис. 4.1. Вольеры «звездочка» с размещенной над ними гамма-облучательскими установками «Люстра»
Для моделирования радиационного воздействия было использовано гамма-излучение 60 Со, имеющее коэффициент качества, равный 1. С его помощью удобно моделировать значение эквивалентной дозы любого вид излучения, а также рас-
пределение дозы во времени. Кроме того, глубинное распределение дозы у-излучения 60 Со в теле животного близко к глубинному распределению дозы ГКЛ и излучения жестких солнечных вспы-
шек. Активность источников излучения, определялась необходимыми дозами хронического воздействия, а также выбранной начальной высотой расположения источников над животными, рав
148
ной 3,5 м. Она составляла в установках для облучения животных 1-й; 2-й и 3-й групп 1,2, 3,6 и 7,2 ГБк соответственно.
Конструкция гамма-установки «Люстра» для хронического облучения собак разработана в соответствии с предъявляемыми к такого рода установкам требованиями. Она представляла собой жесткую сварную ферму высотой 4,5 м, в верхней части которой были размещены свинцовый контейнер-коллиматор и механизм изменения высоты его подвески (рис. 4.2).
В контейнере-коллиматоре находился вращающийся стальной ротор, в диске которого в специальном гнезде был размещен источник гамма-излучения. Система управления позволяла источнику находиться в контейнере в двух положениях: «облучение», когда источник расположен в отверстии коллиматора, и «хранение», когда диск ротора повернут на 180°.
Ротор вращался пропорциональным исполнительным электрическим механизмом. Поворот на 180° производился за 30 с. В положение против отверстия коллиматора источник устанавливался с погрешностью не более 0,5-0,7 мм, что исключало искажение дозного поля в пределах вольера «звездочка». Механические стопоры и микровыключатели фиксировали положение диска ротора и указывали положение источника на мнемосхеме на пульте управления.
Дозное поле с заданной неравномерностью по радиусу «звездочки» и по высоте (+10%) можно было бы создать, подняв контейнер-коллиматор на высоту 6,5 м. Однако из конструктивных соображений было нецелесообразно поднимать его выше 3-4 м.
Рис. 4.2 Конструкция гамма-облучательской установки «Люстра» 1 — опорная ферма;
2 — контейнер-коллиматор с источником у-излучения;
3 — механизм вертикального перемещения контейнера-коллиматора
149
При этом неравномерность дозного поля по радиусу достигала 34%, а по высоте не превышала 10% на уровне 0-45 см над землей.
Для практически полного выравнивания дозного поля по радиусу «звездочки» использовали стальной выравнивающий фильтр, который крепился на внутренней поверхности коллиматора. Рассеянное выравнивающим фильтром излучение по сравнению с первичным давало вклад в дозу не более 2%.
В связи с распадом радионуклида 60 Со, мощность дозы в устройствах для хронического облучения за 3 года при неизменной высоте подвески контейнера уменьшилась бы на 33%. Для исключения значительного снижения мощности дозы контейнер-коллиматор периодически опускали с помощью механизма изменения высоты его подвески. При снижении высоты контейнера, коллиматор которого составлял 66°, облучаемая зона уменьшалась. В начале эксперимента зона облучения была несколько больше размеров «звездочки», а в конце, через 3 года, — несколько меньше. При этом радиус облучаемой зоны в начале эксперимента составлял 2,3 м, а по истечении 3 лет — 1,95 м. Таким образом, животные все время находились в поле облучения. По истечении 3 лет облучения производили дополнительную дозарядку установок и повышали высоту подвески контейнера.
Конструкция гамма-установки «Люстра» предусматривала защиту ее важнейших деталей от прямого попадания влаги. Отдельные детали конструкции были защищены антикоррозионным покрытием, что обеспечило многолетнюю надежную работу установки на открытой площадке при различных погодных условиях.
Коллиматор облучательской установки «Люстра» ограничивал поле облучения периметром вольера и исключал возможность взаимного влияния нескольких расположенных рядом устройств для хронического облучения. При этом обеспечивалась радиационная безопасность обслуживающего персонала, находящегося на площадке с хронически облучаемыми животными, безопасность окружающей территории. Все работы внутри вольера по обслуживанию животных (кормление, уборка и т.д.) выполняли при нахождении источника в положении «хранение». Ежедневный перерыв в хроническом облучении составлял суммарно за сутки 2 ч. Вывод источников из рабочего положения в положение «хранение» производился дистанционно с центрального пульта управления.
Облучаемый комплекс для проведения «Хронического эксперимента» представлял собой открытую площадку, снабженную
150
52 устройствами для хронического облучения 312 собак и разделенную на шесть отдельных изолированных плотным забором отсеков общей площадью 2300 м2 (рис. 4.3).
Рис. 43 Экспериментальные площадки для хронического облучения собак (общий план)
Каждый отсек имел самостоятельную систему стоков для удаления жидких экскрементов и ливневых вод. Такое размещение животных предупреждало распространение инфекций в случае их возникновения.
Отдельным сооружением, вынесенным за пределы этого облу-чательского комплекса, была специальная площадка, по периметру огороженная бетонными стенами и защитной стальной дверью, для проведения однократных острых облучений, моделирующих воздействие СКЛ. Эта площадка была снабжена необходимой сигнализацией о выведении источников гамма-облучения в рабочее положение.
Для острых воздействий был также выбран способ облучения точечным источником гамма-излучения, но только в горизонтальных пучках. Гамма-облучательская установка «Кобальт» для однократных воздействий рассчитана на одновременное облучение 20 собак в дозах от 0,5 до 50 сГр при продолжительности острого воздействия 10-20 ч. В связи с тем, что продолжительность острого воздействия значительно меньше времени хронического
151
облучения, условия содержания животных при остром воздействии отличались от условий при хроническом облучении. Собак размещали в будках обычного типа на расстоянии 10 м от точечного источника излучения. Поток излучения с помощью коллиматора был ограничен в вертикальном и горизонтальном сечениях таким образом, что не выходил за пределы защитной бетонной стенки.
В соответствии с предполагаемыми дозами острых воздействий и выбранным расстоянием для размещения будок, равным 10 м, активность четырех источников гамма-излучения 60 Со составляла 0,14, 1,44, 2,9 и 14,4 ТБк. Такой способ облучения отличается определенной универсальностью. При изменении расстояния мощность дозы излучения могла изменяться в широких пределах. Так, при расположении объекта на расстоянии 2 м от источника максимальной активности мощность дозы становилась равной 125 сГр/ч. Кроме того, набор источников позволял в принципе производить ступенчатое острое воздействие с переменной мощностью дозы, моделировать нарастание или спад радиационного воздействия определенного типа.
Конструкция установки «Кобальт» также обеспечила ее бесперебойную работу в различных погодных условиях. Следует заметить, что в случае временного выхода из строя системы автоматического управления источниками излучения или отключении электросети перемещение источников могло быть осуществлено с помощью дублирующего аварийного ручного привода.
Контрольную группу животных без облучения размещали в вольерах «звездочка» также на отдельной открытой площадке рядом с площадками для облучения животных. Отапливаемое и вентилируемое помещение для климатического контроля (18 хронически облучаемых и 6 необлучаемых собак) находилось недалеко от открытой площадки.
Таким образом, комплекс облучателей состоял из 52 гамма-установок «Люстра» (рис. 4.3) и гамма-установки «Кобальт». Этот комплекс управлялся централизованно с единого пульта управления. Пульт управления содержал мнемосхему, на которой были расположены тумблеры переключения режимов работы установок и сигнальные устройства, регистрирующие работу исполнительных механизмов комплекса и положение источников излучения. На панели пульта были установлены также блоки сигнально-дозиметрической системы УСИД-12, так что работа комплекса кон-
152
трестировалась двумя независимыми системами — дистанционного управления и дозиметрической.
Датчик положения источника, балансовое реле, исполнительный механизм и магнитный пускатель в системе дистанционного управления установки «Кобальт» исключали ошибку в выведении заданного источника в положение «облучение», т.е. ошибку при облучении животного в заданной дозе. Система блокировки установки «Кобальт» обеспечивала ее безопасную эксплуатацию, исключая возможность выведения источника в положение «облучение» при открытой двери на площадку для размещения животных. Сигнально-дозиметрическая система УСИД-12 дистанционно измеряла мощность дозы излучения в любом вольере и на площадке установки «Кобальт», а также могла сигнализировать о превышении или уменьшении заданного уровня мощности дозы.
Более подробно конструкции гамма-облучательской установки «Люстра» для хронического облучения собак, а также установки «Кобальт» для острого облучения животных, моделирующего воздействие СКЛ, представлены в работах (Гладилкин А.Н. и др., 1981; Григорьев Ю.Г. и др., 1986).
Характеристика дозных полей на гамма-установках
Радиационное воздействие, осуществляемое с помощью гамма-установок, может быть достаточно полно охарактеризовано таким параметром, как поглощенная доза в воздухе, выраженная в Гр. При подготовке и создании базы для хронического облучения учитывалось, что животные должны свободно перемещаться в поле облучения. Среднетканевые поглощенные дозы, полученные животными в одинаковых условиях облучения, могли быть различными в зависимости от ряда факторов, влияние которых оценить предварительно не представлялось возможным. Так, перемещение животных в поле облучения (вертикальное перемещение и изменение положения туловища собаки по отношению к пучку гамма-излучения) существенным образом зависит от индивидуального характера животного. Поведение животных определялось также климатическими условиями и временем года. Неконтролируемое свободное перемещение животных в процессе облучения могло приводить к неопределенности значений накопленных среднетканевых поглощенных доз, которая возрастает, если облу
153
чаются животные различных размеров. В связи с этим условия радиационного воздействия в «Хроническом эксперименте» характеризовали поглощенной дозой в воздухе, равной 25, 75 и 150 сГр в год для различных групп хронически облучаемых животных. Эта доза численно фактически совпадала с максимальной поглощенной дозой на поверхности животных, ближайшей к источнику излучения.
Дозные поля в установках измеряли с помощью конденсаторных ионизационных камер, термолюминесцентных и других дозиметров. Эти дозиметры градуировали на разработанном нами стенде «Эталон» (Гладилкин А.Н. и др., 1981) с эталонными источниками 60 Со и 137 Cs первого и второго разрядов, которые были получены в г. Санкт-Петербурге во Всесоюзном научно-исследовательском институте метрологии ВНИИМ им. Д.И. Менделеева. Эти источники аттестовывались по эталону рентгена и обеспечивали очень высокую точность воспроизведения абсолютных значений экспозиционной дозы.
Погрешность определения активности источников была менее 4%. Они были переданы Институту медико-биологических проблем Минздрава СССР в 1964 г., с учетом того, что предназначались для проведения уникального эксперимента, направленного на обеспечение радиационной безопасности космонавтов при полете на Марс. Это обеспечило высокую точность градуировки наших дозиметрических приборов и измеряемых абсолютных значений поглощенных доз с неопределенностью не выше 5-7%.
Измерения дозных полей в установках «Люстра» проводили по оси пучка и по радиусу с выравнивающим фильтром и без него, а также в отсутствие вольера. Радиальное распределение мощности дозы излучения представлено на рис. 4.4, откуда видно, что неравномерность дозного поля с вольером и без него составляло около 15 и 20% соответственно. При наличии фильтра неравномерность уменьшалась и становилась равной 2,7 и 3% соответственно. Для компенсации экранирующего влияния вольера был подобран фильтр специального профиля. Распределение мощности дозы с этим фильтром представлено кривой 2 на рис. 4.4. Неравномерность в этом случае составляла ±3%.
Можно считать, что поле по радиусу вольера при наличии фильтров становится практически равномерным. Распределение мощности дозы излучения по оси пучка с коллиматором и без него представлено на рис. 4.5.
154
Рис. 4.4. Радиальное распределение мощности дозы в установках «Люстра» без выравнивающего фильтра (1) и с выравнивающим фильтром различной формы, устраняющим влияние вольера (кривые 2 и 3); пунктир — радиальное распределение мощности дозы в отсутствии вольера.
По оси абсцисс — расстояние от оси пучка, м; по оси ординат — мощность дозы, отн. ед.
Неравномерность дозного поля по высоте в пределах расстояний 0-50 см от земли не превышала 10%. Мощность дозы по мере приближения к земле с погрешностью ± 2% была обратно пропорциональна квадрату расстояния от источника, что свидетельствует о незначительности дозового альбедо. Из данных, представленных на рис. 4.5, можно оценить также вклад рассеянного коллиматором излучения, который был примерно равен 15%.
Заданные программой абсолютные значения мощности дозы
излучения от источников излучения, находящихся в установках «Люстра», на высоте 25 см от земли, составляли 8,6; 25,8;
51,6 нГр/с (25, 75 и 150 сГр/год). Эти величины обеспечивались подбором активности источников и высоты их размещения над облучаемыми животными. Периодическое измерение абсолютных значений мощности дозы в месте нахождения животных, перезарядка установок и коррекция высоты подвески контейнеров-коллиматоров в установках «Люстра» позволили обеспечить необходимое значение мощности дозы излуче-
Рис. 4.5. Распределение мощности дозы по оси пучка в зависимости от расстояния до источника, помещенного в коллиматор (2) и без коллиматора (1). Высота источника над землей 3,75 м
155
Рис. 4.6. Распределение мощности дозы по дуге относительно оси пучка на расстоянии 10 м от источника на установке «Кобальт» на высотах 150 (□), 100 (х) и 50 (о) см от земли
ния в течение всего эксперимента по хроническому облучению животных. Максимальное отличие мощности дозы от заданной за весь эксперимент не превышало 10%; среднеквадратическое отклонение составляло ±3%.
На установке «Кобальт» одновременно проводили облучение 12-15 собак на расстоянии 10 м от источника излучения при расположении будок с животными в два яруса. Мощность дозы излучения на таком расстоянии для каж-
дого из четырех источников составляла 0,112, 0,94, 1,68 и 11,0 мкГр/с. При этом за 20 часов тканевые поглощенные дозы были равны 0,8-80 сГр. Распределение мощности дозы относительно пучка на расстоянии 10 м от источников представлено на рис. 4.6. Мощность дозы на краю пучка была несколько ниже, чем в центре, что объясняется поглощением излучения в роторе установки. Животных располагали в пределах ±4 м от оси пучка, при этом неравномерность поля облучения не превышала ±5%.
Индивидуальная дозиметрия животных
Животные находились в неизотропном и неравномерном по оси пучка поле излучения, и индивидуальный характер их поведения в этом поле был различным. В связи с этим проводили индивидуальную дозиметрию животных при помощи дозиметров интегрального типа. На основании показаний индивидуальных дозиметров судили о степени различия локальных поглощенных доз у животных, учитывая различное их поведение, и о соответствии этих доз расчетным дозам облучения.
Продолжительность облучения и климатические условия проведения эксперимента предъявляли к индивидуальным дозиметрам ряд требований: широкий диапазон измеряемых доз (от 0,1 до
156
1000 сГр) с погрешностью не более ± 10%; независимость показаний от мощности дозы и энергии излучения; возможность регистрации и сохранения информации в течение длительного времени (до года и более) в диапазоне рабочих температур от -30 до +40рС и влажности до 98%; автономность, минимальные размеры и масса, химическая инертность и механическая прочность. Таким требованиям удовлетворяли дозиметры из термолюминесцентного стекла (ТЛС). Основной пик термовысвечивания этих дозиметров имеет температуру около 320рС, что обусловливает хорошую сохранность информации в течение длительного времени в различных температурных условиях.
В эксперименте использовали дозиметры цилиндрической формы диаметром 5 и высотой 15 мм. По два дозиметра размещали в специальной кассете на ошейнике собаки. Их показания характеризовали локальную поглощенную дозу в области головы животных. Смену дозиметров и снятие их показаний проводили каждые 2 месяца. Периодическое измерение индивидуальной дозы позволяло осуществлять оперативный мониторинг как за абсолютными значениями мощности дозы в установках, так и за степенью однородности облучения животных на каждой установке «Люстра».
Чтобы установить степень «спада» определяемой дозы за 2 месяца, в условиях хронического облучения, была проведена специальная градуировка дозиметров ТЛС. Три партии дозиметров по 10 штук облучали в одной дозе, причем первая партия дозиметров была облучена в первые сутки, вторая — на 50-е сутки, а третья — дробно равными дозами через каждые 10 суток. Облучение проводили с помощью эталонного источника 60 Со 1-го разряда. Дозиметры в процессе градуировки хранили в естественных условиях на открытых площадках. Через 60 суток все три партии дозиметров были одновременно измерены. Полученные средние значения градуировочных коэффициентов для каждой партии различались не более чем на ±2% при среднеквадратическом отклонении показаний дозиметров в партии ±5%. Эти данные указывают на отсутствие спада информации в течение 60 сут.
Измерение поглощенных доз термолюминесцентными дозиметрами проводили в течение всего времени облучения (3 и 6 лет). Разброс показаний дозиметров внутри каждой группы животных не превышал ± 10%, и наблюдалось хорошее совпадение результатов индивидуальной дозиметрии с результатами измере
157
ния дозных полей ионизационным методом. Для всех групп животных значения дозы, измеренной с помощью ТЛС, были на 5—10% меньше значений, рассчитанных по мощности дозы излучения, что объясняется частичной экранировкой индивидуальных дозиметров шеей собаки.
Ввиду малых размеров дозиметров весьма перспективным оказалось вживление их под кожу. В связи с этим двум собакам вживляли по шесть дозиметров в области лба, живота, спины (между лопаток и в поясничной области), бедра и груди. Вживленные дозиметры находились на собаках 147 суток и не доставляли животным беспокойства. После извлечения дозиметров признаков воспалительной реакции не было обнаружено. Соединительно-тканые капсулы вокруг дозиметров были тонкие, проросшие кровеносными сосудами. Извлеченные дозиметры полностью сохраняли свои оптические и физические свойства.
Распределение доз по телу животного, полученное с помощью вживленных дозиметров, показано в табл. 4.3. Результаты измерения индивидуальных доз с помощью вживленных дозиметров совпадали с данными, полученными по измерениям ТЛС, расположенным в кассете на ошейнике собаки.
Таблица 4.3
Результаты измерения доз с помощью вживленных дозиметров ТЛС
Место расположения дозиметра Измеренная доза, сГр
Лоб 9,0
Спина между лопатками 8,8
Спина в поясничной области 8,8
Левое бедро 8,5
Грудина в области мечевидного отростка 6,8
Живот 6,5
Результаты индивидуальной дозиметрии животных за шесть лет эксперимента представлены в табл. 4.4.
158
Таблица 4.4
Локальные поглощенные дозы по данным дозиметров на ошейнике собак в «Хроническом эксперименте», сГр
(данные индивидуальной дозиметрии при облучении на установках «Люстра», усредненные по группам)
Время из-мерения, мес. Номера групп
1 2 3 4 5
6 И 30 61 32 29
12 25 72 145 75 70
18 37 105 205 108 103
24 50 140 275 142 137
30 65 178 350 184 175
36 80 215 420 222 213
42 95 255 500 260 250
48 110 285 560 295 280
54 120 315 620 380 315
60 135 350 690 370 350
66 148 385 770 410 390
72 158 415 870 440 425
Из данных таблицы видно, что локальные поглощенные дозы близки к дозам, предусмотренным программой эксперимента, т.е. 25, 75 и 150 сГр за год. Среднеквадратическое отклонение показаний дозиметров у животных одной группы не превышало ± 10% в каждом измерении и уменьшалось по мере накопления дозы. Данное значение отклонения включает как среднеквадратическую погрешность измерения самих дозиметров, так и различие в поведении животных в поле облучения, а также неодинаковую экранировку дозиметров шеей животного. Среднеквадратическое отклонение за год не превышало 5%. Из данных таблицы видно, что у животных 2-й, 4-й и 5-й групп, облученных в одинаковой дозе, средние значения локальной поглощенной дозы очень близки между собой (за 6 лет различие от среднего значения составило ме-
159
нее 3%). Таким образом, результаты индивидуальной дозиметрии свидетельствуют о хорошей однородности облучения животных и адекватности выбранного нами способа хронического облучения собак в эксперименте.
Для определения перепада доз по глубине животного и вычисления среднетканевых поглощенных доз были проведены фантомные измерения при облучении собак на установках «Люстра» и «Кобальт». Для измерений был изготовлен гетерогенный кост-но-парафиновый фантом собаки массой 15 кг, в котором для размещения дозиметров имелось шесть вертикальных и шесть горизонтальных каналов. Каждая пара каналов приходилась на определенную часть тела (голова, шея, грудь, передняя и задняя части живота и таз).
В качестве дозиметров использовали ионизационные камеры и ампулы с термолюминесцентным порошком LiF. Ампулы помещали в пазы цилиндрических трубок, изготовленных из полиэтилена, которые вставляли в каналы фантома. Расстояние между пазами в трубках составляло 20 мм. Ближайший к поверхности фантома термолюминесцентный дозиметр располагали на глубине 5 мм. Всего одновременно в фантоме размещали 96 термолюминесцентных дозиметров. Кроме термолюминесцентных дозиметров, использовали малые конденсаторные ионизационные камеры, которые последовательно помещали в глубь каналов через 20 мм. Свободное пространство в каналах заполняли вкладышами из полиэтилена.
На установке для острого облучения «Кобальт» фантом устанавливали на месте расположения будок с животными в центре пучка излучения, и фантомные измерения проводили для трех положений фантома относительно пучка (перпендикулярно пучку, вдоль пучка и равномерно вращали относительно пучка). На установке «Люстра» фантомные измерения проводили для двух положений фантома (вне и внутри будки). Для уменьшения экспериментальных погрешностей измерения для каждого положения фантома проводили несколько раз. При этом осуществляли контроль дозы облучения в точке вне фантома, соответствующей геометрическому центру, и значения поглощенной глубинной дозы D(h) относили к поглощенной дозе Do в воздухе в этой же точке. Усредненные по нескольким измерениям значения относительных доз К = (D(h) / Do) 100 в процентах были использованы для построения глубинного распределения доз для каждого канала.
160
На рис. 4.7 представлены усредненные глубинные распределения дозы, полученные в горизонтальных каналах на установке «Кобальт» и в вертикальных каналах на установке «Люстра». В обоих случаях облучение проводили вдоль каналов.
Глубина слоя, см
Рис. 4.7. Распределение относительной глубиной дозы в фантоме собаки в горизонтальных каналах на установке «Кобальт» (а) и в вертикальных каналах на установке «Люстра» (б)
Значения относительной дозы на одинаковой глубине в различных каналах отличались от представленных на рис. 4.7 усредненных значений на ± 3% для горизонтальных каналов и на ± 5% для вертикальных. Для вычисления средней относительной дозы по всему фантому его разделяли на шесть частей так, чтобы в каждой находились один вертикальный и один горизонтальный каналы. На основании значений относительной глубинной дозы в каналах строили изодозные кривые в сечениях, проходящих через каналы, т.е. приблизительно через середину выделенных участков фантома. По изодозным кривым рассчитывали среднюю по сечению относительную дозу:
_ п п
K^cjKjS^/JSj, (4.1)
i=l i=l
где Sj — площадь части сечения с относительной дозой Кр Так как форма сечения слабо меняется вдоль отдельной выделенной части фантома, полученные данные о средней относительной дозе можно рассматривать как средние для выделенных
161
участков фантомов. Аналогично рассчитывали среднюю относительную дозу для всего фантома:
Kv=(£KjVj)/£vj, (4.2)
j=i j=i
где Kj — средняя относительная доза для отдельной части фантома; Vj — объем этой части. Значения объема выделенных участков фантома были вычислены по сечению и длине участков. Расчетные значения объема совпали с экспериментальными, полученными путем погружения фантома в воду и определения объема вытесненной воды. Объем головы фантома был определен экспериментально, так как вычисление этого объема весьма затруднительно из-за сложной формы. В табл. 4.5 представлены значения средней относительной дозы для отдельных частей фантома и для всего фантома.
Таблица 4.5
Средняя относительная доза для отдельных частей фантома, %
Часть фантома Объем, см3 Характер облучения и положение фантома
Острое, моделирующее воздействие СКЛ Хроническое облучение
перпендикулярно оси пучка вдоль оси пучка равномерное вращение фантома вне будки внутри будки
Голова 1760 90 92 81 89 89
Шея 1090 92 70 80 95 93
Грудь 4480 81 67 73 83 82
Передняя часть живота 2600 84 42 67 86 90
Задняя часть живота 3410 78 32 69 85 85
Таз 2890 83 24 77 86 82
Конечности 960 95 80 90 64 63
Весь фантом 17 190 84 53 74 86 85
162
Значения среднетканевой поглощенной дозы для всех вариантов фантомных измерений рассчитывали по полученным выше значениям средней относительной дозы:
D = KVDO, (4.3)
где D — среднетканевая поглощенная доза, сГр; Do — поглощенная доза в воздухе в точке, в которую помещали геометрический центр фантома, сГр; Kv — средняя относительная доза для фантома.
Распределение глубинной относительной дозы, полученное в эксперименте на гетерогенном фантоме собаки, оказалось близким к глубинному распределению дозы, полученному на гамма-терапевтическом аппарате в гомогенной тканеэквивалентной среде. Отсутствие различий в глубинном распределении дозы в отдельных каналах и хорошее совпадение с распределением дозы в гомогенной среде показало, что форма и гетерогенность фантома слабо влияют на глубинное распределение относительной дозы. Это позволило рассчитать среднетканевую дозу для животных «Хронического эксперимента», отличающихся по размерам и массе от принятых для фантома. Для расчетов выбрали фантом простой геометрической формы в виде параллелепипеда.
В табл. 4.6 представлены переходные коэффициенты от поглощенной дозы в воздухе к среднетканевой при различных вариантах облучения, полученные путем обработки результатов фантомных измерений и рассчитанные для простой формы фантома того же объема. Как и следовало ожидать, наблюдалось хорошее совпадение данных, полученных двумя расчетными методиками. В дальнейшем для животных с максимальной массой 17 кг при расчетах использовали параллелепипед размером 17x17x70 см3, для животных с минимальной массой 9 кг — 14 х 14 х55 см3. Отличие рассчитанных значений переходных коэффициентов для животных максимальной и минимальной массы от значений для животных средней массы составило ± 4% при облучении на установке «Кобальт» и ± 3% при облучении на установке «Люстра».
Среднетканевые дозы, полученные животными при хроническом и остром облучении, представлены в табл. 4.7 и 4.8. Из данных табл. 4.8 видно, что при остром облучении наблюдается неопределенность в распределении среднетканевой дозы в зависимости от положения животного относительно пучка излучения. Было проведено дополнительное исследование. Собак помещали в буд
163
ки в жилетках с термолюминесцентными дозиметрами, равномерно расположенными по поверхности тела животных. Показания дозиметров оказались одинаковыми в пределах 20%. Это свидетельствовало о том, что животные за время облучения несколько раз поворачивались относительно оси пучка. Следовательно, значение среднетканевой дозы для случая равномерного вращения фантома является наиболее верным. Таким образом, среднетканевые поглощенные дозы при острых облучениях были равны 42 и 8сГр.
Таблица 4.6
Коэффициенты перехода поглощенных доз в воздухе к среднетканевым поглощенным дозам
Характер облучения Положение фантома Расчетные значения для простой формы фантома Значения, полученные по результатам фантомных измерений
Острое Перпендикулярно пучку излучения 0,81 0,81
Вдоль пучка 0,43 0,51
Равномерное вращение 0,69 0,71
Хроническое Вне будки 0,825 0,83
Внутри будки 0,825 0,82
Т а б л и ц а 4.7
Среднетканевые поглощенные дозы, полученные животными в течение года при хроническом облучении
Трупа 1 2 3 4 5
Среднетканевая доза 21 ± 1 62 ± 3 125 ±5 62 ±3 62 ±3
164
Таблица 4.8
Поглощенные дозы при остром облучении животных на установке «Кобальт», сГр
Модели* руемая доза, сГр Поверх* ностная доза, сГр Среднетканевая поглощенная доза для различных положений фантома, сГр
перпендикулярно пучку вдоль пучка равномерное вращение
50 60 49 ± 2 30 ± 2 42 ± 2
10 12 9,7 ± 0,5 6,0 ± 0,5 8,0 ± 0,5
8
Рис. 4.8. Схема к расчету количества активного костного мозга в скелете собаки
5
6
7
Зная расположение и размеры отдельных органов и тканей животных, на основе измеренных изодозных распределений вычисляли среднюю относительную дозу для различных органов (табл. 4.9), которую затем использовали для расчета поглощенной дозы в этих органах. В основу расчета средней дозы для костномозговой ткани положены данные, представленные в работе (Кор-жуев П.А. и др., 1968) о распределении активного костного мозга в скелете собаки (рис. 4.8), и данные фантомных измерений. Условно скелет разбивали следующим образом: череп на три части, шейная часть позвоночника составляла 4-ю часть, другие части позвоночника — 5-ю часть и остальные участки скелета составляли соответственно 6-ю; 7-ю и 8-ю части скелета.
Для каждой части рассчитывали количество костного мозга и определяли среднюю глубинную относительную дозу. Затем вычисляли среднее значение для всей костномозговой ткани. Подробно иллюстрация схемы расчета представлена в работе (Григорьев Ю.Г. и др., 1986).
165
Таблица 4.9
Средняя относительная доза в различных органах собак при хроническом и остром облучении, %
Орган или ткань Хроническое облучение Острое облучение
Костный мозг 88 80
Гонады 65 90
Хрусталик 100 95
Головной мозг 90 85
Печень 70 65
В табл. 4.10 приведены сравнительные данные о дозе, поглощенной отдельными органами за один год облучения.
Таблица 4.10
Поглощенная доза в различных органах собак за один год облучения, сГр
Орган Группа Доза острого облучения, сГр
1 2 3 4 5
Кожа (поверхностная доза) 25 75 150 160 255 60 и 12
Все тело (среднетканевая доза) 21 62 125 120 190 42 и 8
Костный мозг 22 65 130 135 210 48 и 10
Гонады 16 50 100 125 210 54 и И
Хрусталик 25 75 150 155 245 57 и И
Головной мозг 23 70 140 140 225 51 и 10
Спиной мозг 24 73 150 145 225 51 и 10
Печень 18 52 105 110 170 40 и 8
166
4.3. Клинико-физиологическая характеристика состояния собак в процессе 3* и 6-летнего облучения с различной мощностью дозы
Общее клиническое состояние
Общее клиническое состояние собак за 3-летний период облучения было вполне удовлетворительным. Собаки сохраняли хорошую пищевую возбудимость, живо реагировали на окружающую обстановку. Кожа у животных была эластичной, шерстяной покров развит хорошо. В летний период ежегодно у собак наблюдали линьку. Видимые слизистые оболочки ротовой полости и глаз были розового или бледно-розового оттенка. Изменения массы тела животных носили волнообразный характер (рис. 4.9).
Периодические подъемы массы тела отмечали в весенне-летние месяцы, ее снижение — в осенне-зимние. Данные, представленные на рисунке, свидетельствуют о близком характере увеличения веса собак в процессе 6-летнего облучения в контрольной и опытных группах. Сопоставление исходных данных массы тела облученных собак с результатами в конце 6-летнего облучения свидетельствует о слабом нарастании веса животных и малом отличии массы тела облученных и контрольных животных.
Состояние зубов у животных всех групп изучали при каждом клиническом осмотре, стирание зубов у всех собак происходило в соответствии с возрастными изменениями.
Продолжительность облучения, месяцев
...<>... 4-я группа —О— 5-я группа д Контрольная группа
Рис. 4.9. Масса тела животных 4-й, 5-й и контрольной групп в течение 6-летнего облучения
167
Ректальная температура у всех собак почти во все сроки исследования находилась в пределах физиологической нормы (37,5-39,(ГС). Однако средняя температура тела по группам у животных в ряде случаев на первом и втором годах облучения превышала норму на (0,2-0,6)°С. Кратковременное повышение температуры тела было отмечено лишь у некоторых животных, что, очевидно, связано с их индивидуальными особенностями. К концу третьего года облучения у животных всех групп, включая контрольную, температура была в пределах физиологической нормы. Частота пульса и дыхания у облученных и контрольных собак колебалась в пределах исходных значений на всем протяжении исследования.
Результаты клинического наблюдения в течение 3 лет не выявили повышенной заболеваемости у собак, подвергнутых облучению, по сравнению с собаками контрольной группы. Из отмеченных заболеваний наиболее часто встречались: кратковременные расстройства желудочно-кишечного тракта, конъюнктивит, заболевания кожи, травматические повреждения. Все эти заболевания как у облученных, так и у контрольных животных протекали кратковременно и не оказывали в дальнейшем влияния на здоровье собак.
За трехлетний период хронического воздействия по различным причинам было выведено из опыта восемь облученных собак и две из контрольной группы. При патологоанатомическом исследовании у павших и забитых животных не было обнаружено изменений, непосредственно указывающих на радиационное повреждение, кроме, возможно, собаки из 5-й группы, у которой был обнаружен на 3-м году от начала облучения рак легких с метастазами (табл. 4.11).
В период 6-летнего облучения животные страдали следующими заболеваниями, течение которых завершилось выздоровлением: энтероколит, конъюнктивит и различного рода травматические поражения. Причем заболеваемость среди облученных животных не превышала заболеваемости животных в контрольной группе. Из 186 собак из шести групп к концу шестого года эксперимента осталось 95 собак. Сокращение количества собак произошло вследствие плановых забоев для морфологических исследований, а также гибели 26 собак от различных причин (табл. 4.12).
168
Таблица 4.11
Данные о причине гибели собак в течение первых трех лет эксперимента
Группа Порядковый номер павшей собаки Доза облучения к моменту гибели, сГр Причина гибели
1 1 28 Пневмония
2 35 Пневмония
2 3 17 Острый нефрит
3 4 220 Острая сердечная слабость
5 5 300 Геморрагический энтероколит
6 450 Рак легких с метастазами
6 (контроль) 7 0 Механическая асфиксия
8 0 Копростаз
Таблица 4.12
Данные о причинах гибели и вынужденном забое собак на протяжении шести лет эксперимента.
Группа Число собак в опыте Число павших собак в группе Причина гибели Число павших собак
1 30 7 Случайная 2
Злокачественные опухоли 1
Прочие заболевания 4
2 30 6 Случайная 3
Злокачественные опухоли 0
Прочие заболевания 3
3 30 1 Случайная 1
Злокачественные опухоли 0
Прочие заболевания 0
169
Продолжение табл. 4.12
Группа Число собак в опыте Число павших собак в группе Причина гибели Число павших собак
4 30 0 Случайная 0
Злокачественные опухоли 0
Прочие заболевания 0
5 30 7 Случайная 0
Злокачественные опухоли 2
Прочие заболевания 5
6 (контроль) 36 5 Случайная 1
Злокачественные опухоли 1
Прочие заболевания 3
Как показал проведенный анализ, число павших собак было выше во второй половине срока хронического облучения с 3-го по 6-й год. Однако при этом не удалось выявить четкой зависимости от накопленной суммарной дозы облучения. К концу 6-го года облучения число погибших собак (исключая гибель от случайных причин) в контрольной группе составило 11,1% из числа взятых в опыт, а во всех облучаемых группах — 10,6%. Причинами смерти, отнесенными к случайным, были: механическая асфиксия, вынужденные забои в связи с тяжелыми травмами (покусы и др.). Причины гибели животных в остальных случаях будут нами проанализированы в разделе морфологических исследований.
Состояние органа зрения исследовали в динамике у 64 облучаемых и 30 контрольных собак из 1-3-й и 5-й групп хронического эксперимента (Львовская Э.Н., Котова Э.С., 1972). Собаки были тщательно обследованы до начала облучения. Во время облучения офтальмологическое обследование проводили через каждые 6 месяцев. Наблюдения включали осмотр наружного отдела глаза, измерение внутриглазного давления, исследование преломляющих сред глаза и глазного дна, а также измерение диастолического давления в центральной артерии сетчатки.
170
В течение первого года облучения у всех облученных собак никаких патологических признаков в состоянии защитного и двигательного аппаратов глаза, в преломляющих средах, а также в сетчатой оболочке и зрительном нерве не наблюдали.
На втором году облучения прослеживалась тенденция к понижению диастолического давления в центральной артерии сетчатки у собак, облучаемых в дозах по 125 и 190 сГр в год (3-я и 5-я группы). На третьем году облучения у многих собак появились продолжающиеся длительное время конъюнктивиты со слизисто-гнойным отделяемым и выраженной гиперемией слизистой. Эти явления наблюдали преимущественно у собак, суммарная доза облучения которых была относительно большой (350-660 сГр). Частота заболевания конъюнктивитами к пяти годам облучения составляла 18,8% у облучаемых собак и 6,7% у контрольных.
При исследовании оптических сред глаза через три-четыре года от начала облучения выявлены помутнения в хрусталике у 11 собак из 64 облучаемых и у 4 из 30 контрольных. По клинической картине эти изменения оценивались специалистами как старческая катаракта. Однако старческая катаракта встречалась в 9 из И случаев преимущественно у собак, получавших максимальную дозу сочетанного облучения (5-я группа). Помутнения возникали в корковом слое на периферии, распространяясь на более глубокие слои, а в других случаях — в зоне ядра. Помутнения прогрессировали медленно, и только у двух собак 5-й группы к шестому году катаракта достигла полной зрелости.
При осмотре глазного дна каких-либо деструктивных изменений в сосудистой или сетчатой оболочках выявлено не было; зрительный нерв сохранялся в удовлетворительном состоянии. К концу шестого года облучения почти у всех собак диагностирован артериосклероз сетчатки, и именно в этот период стало появляться большое количество старческих катаракт всех четырех стадий как у контрольных, так и у облученных собак. Мелкие помутнения, вакуоли и другие проявления были отмечены у 19 из 24 облученных собак (80%) и у 5 из 8 контрольных собак (63%).
Проведенные исследования позволяют предполагать, что длительное (в течение 6 лет) хроническое и особенно сочетанное облучение в дозах 21-190 сГр за год может приводить к ускорению по сравнению с контролем темпа помутнении хрусталика, разви
171
тию артериосклероза сетчатки и являться некоторым свидетельством повышения темпа старения.
Состояние сердечно-сосудистой системы исследовали с использованием наиболее распространенных методик. Применяли электрокардиографию в трех классических отведениях, проводили объективную регистрацию артериального давления (бескровный метод) в бедренной артерии, записывали частоту пульса и дыхания (Корчемкин В.И., 1972). Исследовали:
1) состояние сердечно-сосудистой системы в условиях хронического и сочетанного облучений;
2) влияние физической нагрузки (дозированный 15-минутный бег на третбане со скоростью 5,2 км/ч) на работу сердца;
3) реакция сердечно-сосудистой системы (ССС) на внутривенное введение адреналина;
4) работа сердца после острых облучений.
Определение максимального артериального давления у облученных и контрольных животных не выявило различий. В среднем артериальное давление у животных равнялось 16,0-21,3 кПа. Частота сокращений сердца, Ритмичность, интервал PQ и QT, зубцы Q, R, S у животных в течение 18 месяцев облучения не отличались от данных контрольных собак. Имелось некоторое повышение вольтажа зубца Т у собак 3-й группы (125 сГр за год). Интервал ST, который в норме должен быть изоэлектричным, у облученных собак всех групп в большинстве случаев был несколько деформирован и расположен на 1-1,5 мм ниже изоэлектрической линии.
Исследования ЭКГ после физической нагрузки производили сразу после бега на третбане и 12 раз в течение 90 мин после прекращения бега. С увеличением длительности облучения и накопленной дозы имело место удлинение периода восстановления показателей частоты сердечных сокращений.
Зубцы Р и Т в большой степени изменились также у собак 3-й группы, и эти изменения сохранялись через 60 и 90 мин после функциональной пробы. Если в контрольной группе животных зубец Т имел колебания 0,1-0,15 мВ, то у животных 3-й группы изменения вольтажа зубца Т достигали 0,25-0,4 мВ. Следует также отметить, что у 50% животных, подвергнутых хроническому облучению, во всех исследуемых группах по сравнению с контрольной изменялись форма и положение относительно изоэлек
172
трической линии интервала ST после нагрузки. Однако эти изменения мы считали незначительными.
После физической нагрузки были также отмечены изменения дыхания. Это было очевидно у собак 3-5-й групп. Дыхание облученных животных по сравнению с дыханием животных контрольной группы становилось более частым, приобретало в ряде случаев характер тяжелой и длительной одышки.
Исследование состояния сердечно-сосудистой системы после острого облучения в дозе 0,42 Гр было проведено у собак 5-й группы через 1,5 года от начала хронического облучения (суммарная доза к этому времени составила 310 сГр). У облученных животных частота ритма изменилась незначительно.
У большинства животных предсердно-желудочковая проводимость (PQ), электрическая система желудочков (QT), зубцы ЭКГ Р, О, R, S почти не изменились. Однако заметные изменения, как и следовало ожидать, претерпевал зубец Т и отчасти интервал ST. Зубец Т был заметно увеличен (0,25-0,3 мВ). Интервал ST на ЭКГ был отрицательным у половины обследованных собак после острого облучения. Все перечисленные выше изменения нивелировались на 2-3-и сутки после острого облучения в дозе 42 сГр и не отличались от тех же показателей у контрольных животных. Существенных изменений ЭКГ у собак после острого облучения в меньшей дозе (8 сГр) не отмечалось.
Применение функциональных проб после облучения в течение 3 лет у животных всех облученных групп не выявило резких нарушений в состоянии сердечно-сосудистой системы. Проведенные наблюдения показали, что острое облучение в дозе 42 сГр на фоне хронического облучения при накопленной суммарной дозе 500 сГр не вызывало резких сдвигов в ЭКГ у облученных животных. Имелось некоторое различие в скорости распространения пульсовой волны, что можно рассматривать как показатель некоторого снижения общей реактивности организма под влиянием острого облучения на фоне хронического. У части животных 3-й и 5-й групп наблюдались заметное отклонение изоэлектрической линии и изменение формы интервала ST, что могло указывать на начальные дистрофические изменения в сердечной мышце.
Более отчетливые изменения были зарегистрированы у облученных собак при физической нагрузке. У собак через 36 и 60 месяцев облучения наиболее выраженные изменения были отмечены у животных 3-й и 5-й групп. Через 60 месяцев облучения фи
173
зическая нагрузка вызывала у облученных собак, как правило, более резкие изменения, чем после 36 месяцев облучения. Степень изменения показателей ЭКГ на физическую нагрузку зависела от суммарной накопленной дозы. Удлинялись сроки восстановления функциональных сдвигов у облученных животных после физической нагрузки.
Фармакологическая нагрузка — внутривенное введение адреналина была применена через 30 месяцев хронического облучения к собакам 1-й, 5-й и 6-й групп (2,5 мг на 1 кг массы тела животного в разведении 1:10 000, введение адреналина осуществляли с постоянной скоростью). Почти все элементы ЭКГ у собак 1-й и 5-й групп мало отличались от тех изменений, которые возникали у контрольных животных на введение адреналина. Однако необходимо отметить, что у отдельных животных 5-й группы развивалась атриовентрикулярная блокада, регистрировалась экстрасистолия.
На 47 собаках, 10 из которых составляли контрольную группу, оценивали общую реакцию организма на физическую и тепловую нагрузки (Изергина А.Г., Петровнин М.Г., 1972). В качестве физической нагрузки использовали бег на третбане в течение 15 мин со скоростью 5,2 км/ч. Об изменении реактивности организма под влиянием физической нагрузки судили на основе некоторых физиологических и гематологических показателей (частота пульса, дыхания, ректальная температура, температура кожи уха и носа, а также число лейкоцитов и лейкоцитарная формула). Исследования проводили до начала бега и через 5, 30, 45, 60 и 180 мин после его окончания. Чтобы избежать влияния тренировки на характер реакции, опыты ставили не чаще одного раза в 5-6 месяцев.
Все контрольные животные удовлетворительно переносили физическую нагрузку в течение всего 6-летнего периода наблюдения; отказов от бега не было, лишь у отдельных собак усиливалась вегетативная реакция. Сразу после бега у контрольных животных пульс учащался примерно в 2 раза, а дыхание в 5-6 раз, температура тела повышалась на 0,4-0,8°С, а на открытых участках кожи на 1,5-2,5°С. Через 30-60 мин связанные с бегом изменения по указанным параметрам приходили к исходному (до бега) уровню.
В периферической крови интактных собак после физической нагрузки развивалась «перераспределительная» реакция, выражающаяся в увеличении числа лейкоцитов и нейтрофилов и уменьшении числа лимфоцитов. Для облученных животных, осо
174
бенно в поздние сроки, были характерны увеличение индивидуального разброса показателей и появление инвертированных реакций. Заслуживает внимания тот факт, что реакция кроветворной системы у облученных животных на физическую нагрузку через 2,5 года после начала эксперимента проявлялась значительно раньше, чем до облучения или в предыдущие сроки исследований. В это время резкий лейкоцитоз, нейтрофилез и лимфопения были отмечены не через 1-3 ч после бега, а уже через 5-30 мин. Аналогичная реакция у контрольных собак отмечалась через 3,5 года.
Подопытные животные в течение первых 1,5 лет облучения переносили физическую нагрузку без видимых затруднений. По мере накопления поглощенной дозы в период между 2,5-5 годами эксперимента увеличивалось число собак, которые бегали с трудом или вообще прекращали бег через 2-3 мин после его начала. Температурная реакция тела собак на физическую нагрузку в течение полутора лет хронического облучения, как правило, не изменялась по сравнению с контрольными животными. Позднее, через 2,5-3 года, у облученных животных появилась тенденция к усилению, а иногда к извращению температурной реакции, особенно у собак, которые с трудом справлялись с физической нагрузкой и были подвергнуты облучению с максимальной мощностью дозы (5-я группа). Это свидетельствовало о нарушении процесса терморегуляции у ряда животных.
Первым признаком изменения реактивности облученного организма явилась тенденция к усилению некоторых сдвигов, возникающих после физической нагрузки (бег на третбане в течение 15 мин со скоростью 5,2 км/ч.). Через 6-12 месяцев хронического облучения у собак 1-й и 2-й групп углублялась лимфо- и эозино-пения, увеличивался нейтрофилез. У некоторых собак 3-й и 4-й групп наблюдали извращение лимфоцитарной и нейтрофильной реакции на физическую нагрузку. Одновременно отмечали и удлинение длительности восстановительного периода. У животных 3-5-й групп, облучаемых с большими уровнями доз, в это же время отмечалась тенденция к ослаблению реакции кроветворной системы на физическую нагрузку, что может быть связано со снижением костномозгового резерва гранулоцитов. Это будет продемонстрировано в разд. 4.8 при рассмотрении состояния гемопоэза у животных в процессе облучения. По мере увеличения сроков и накопления суммарных доз облучения не наблюдалось четкой направленности в изменении клеточного состава крови под влияни
175
ем физической нагрузки. Процесс протекал волнообразно. Фазы повышения реактивности организма сменялись фазами снижения или частичной нормализацией.
Тепловую нагрузку у собак проводили через 4,5 года после начала облучения (Петровнин М.Г., 1972). Температуру в камере от 22 до 45°С повышали за 45 мин. «Тепловую площадку» с температурой в камере 45°С выдерживали в течение 1 ч. Снижение температуры с 45 до 26~28°С осуществляли за 1 ч 30 мин. Исследование проводили в летний период. Во время опытов у собак регистрировали ректальную температуру, частоту дыхания и сердечных сокращений, а в камере — содержание во вдыхаемом воздухе кислорода и углекислоты, относительную влажность и температуру воздуха. Регистрацию биологических параметров у собак производили через каждые 15 мин в первые 105 мин опыта, а в период снижения температуры в камере, т.е. в последние 90 мин опыта, — через каждые 30 мин.
Реакция всех собак на тепловую нагрузку была однотипной. В период повышения температуры в камере до 45°С у всех собак вначале незначительно снижалась температура тела, что сопровождалось снижением частоты сердечных сокращений и выраженным повышением частоты дыхания. В дальнейшем с повышением температуры в камере от 30-35 до 45°С температура тела у всех собак заметно и непрерывно повышалась. При этом увеличивалась частота сердечных сокращений, но более выраженно учащалось дыхание (тепловая одышка). Пребывание собак на «тепловой площадке» (45°С) сопровождалось повышением частоты дыхания, но, как правило, дыхание постепенно замедлялось, ускорялся темп прироста температуры тела. Наиболее выраженное снижение частоты дыхания наблюдалось у собак 5-й группы, получавших максимальную суммарную дозу за год (190 сГр). Снижение температуры в камере сопровождалось одновременным снижением температуры тела, сокращением частоты дыхания и сердечных сокращений. Пять облучаемых собак из этой трупы пришлось вывести из опыта досрочно, в связи с опасным для жизни ухудшением их состояния. У всех досрочно выведенных из опыта животных наблюдалось замедленное и затрудненное дыхание, ускорение темпа повышения температуры тела, а у некоторых — нарушение координации. Все 6 собак контрольной группы удовлетворительно перенесли тепловую нагрузку.
176
44. Результаты биохимических клинических исследований
У собак исследовали белковый состав сыворотки крови (Ахунов, А.А., 1972). Содержание общего белка в сыворотке крови определяли рефрактометрически, фракции белка — методом электрофореза на бумаге. На протяжении первых 3 лет облучения содержание общего белка и белковых фракций не претерпевало существенных изменений. При определении содержания белковых фракций наиболее стабильным был уровень у-глобулина сыворотки крови. Содержание аь а2 и Р-глобулинов на протяжении всех лет облучения волнообразно колебалось, однако изменения у облученных животных не отличались достоверно по сравнению с соответствующими показателями у контрольных собак.
У облученных собак исследовались также фракции белков после функциональной нагрузки чужеродным антигеном, после антирабической прививки, а также после других функциональных проб. Известно, что наиболее важной фракцией белков сыворотки крови являются у-глобулины, содержание которых находится в прямой зависимости от уровня антител. При иммунизации животных возрастает содержание у-глобулинов в сыворотке крови. Вместе с тем имеются сведения об уменьшении их количества при различных патологических состояниях организма, что при некоторых заболеваниях считается показателем их неблагоприятного течения. У 6 собак из 3-й группы и у 4 контрольных животных через 29 месяцев хронического облучения было проведено исследование белков крови после введения антирабической вакцины. Установлено, что в сыворотке крови подопытных животных после введения вакцины несколько больше увеличилось содержание фракций (3- и у-глобулинов.
Через 31 месяц от начала эксперимента части облученных и контрольных собак был введен чужеродный белок — эритроциты барана. Отмечено увеличение уровня у-глобулинов в крови у контрольных животных, в то время как у облученных собак такая реакция на внутривенное введение эритроцитов барана отсутствовала.
В эти же сроки изучали содержание общего белка и белковых фракций у собак после 15-минутного бега на третбане. Отмечены различия в содержании общего белка в ответ на физическую нагрузку. Через 5 мин у собак 1-й и 6-й групп содержание общего белка в крови увеличилось, в это же время у животных 3-й группы наблюдали уменьшение содержания общего белка в крови. Даль
177
нейшее исследование в течение 5 лет не выявило отклонений в содержании белков у животных, облученных в наибольших дозах (3-5-я группы). Исследования белкового спектра крови после применения дополнительных нагрузок (острые облучения по 42 сГр, введение чужеродного антигена, вращение на центрифуге, кровопускание) показали, что реакция облученных собак на эти воздействия, судя по характеру изменений содержания альбуминов и глобулинов, выражена менее отчетливо, чем у интактных собак.
Углеводный обмен исследовали у собак всех групп «Хронического эксперимента» (Ахунов А.А., 1972, 1978). Содержание сахара в крови животных определяли антроновым методом по Д.Н. Сахибову. Для выявления изменений, носящих скрытый характер, были проведены исследования с применением дополнительных нагрузок (бег на третбане, тепловые воздействия, острое облучение на фоне хронического). На 1-м году облучения, как правило, у животных уровень сахара в крови был неустойчивым. Продолжение радиационного воздействия в течение 2-4 лет не вызывало существенных сдвигов. Лишь после 5-6-летнего облучения содержание сахара в крови уменьшилось у животных 3-й и 4-й групп по сравнению с контрольными на 10-14 мг%.
В опытах с физической нагрузкой на 10-м месяце облучения у собак 2-й, 4-й и 5-й групп была выявлена гипергликемия. Наибольшее увеличение сахара после физической нагрузки выявлено у животных 2-й группы. У этих животных через 5 мин после бега концентрация сахара увеличилась на 19 мг%. У собак 3-й и контрольной групп после бега развилась гипогликемическая реакция. Кроме того у контрольных собак после физической нагрузки уровень сахара нормализовался в течение первого часа отдыха, а у облученных — только через 3 ч.
С увеличением продолжительности облучения до 3 лет характер сахарной кривой после нагрузки несколько изменился и сдвиги были более глубокими. Наиболее выраженные изменения наблюдали через 3 и 5 ч после бега. Так, у собак, облученных в суммарной дозе 190, 380 и 360 сГр, концентрация сахара увеличилась после бега на 32, 34 и 56 мг% соответственно (р < 0,05; р < 0,001). После 5-6 лет облучения реакция на нагрузку была уже ослабленной, а у контрольных животных через 6 лет содержание сахара в крови после бега оставалось почти без изменения.
Исследования с применением нагрузочной пробы-гипертермии также выявили разнонаправленность изменений в содержа
178
нии сахара у облученных собак по сравнению с контрольными. У собак подопытных групп, как правило, преобладала гипогликемия, тогда как у контрольных реакция носила гипергликемический характер. Наиболее отчетливые отклонения были отмечены через 4,5 года облучения у животных 3-й группы при накопленной дозе 560 сГр. У животных этой группы после теплового воздействия количество сахара уменьшилось на 15-18 мг%, а у контрольных собак после кратковременного повышения сахара на 9-17 мг% его уровень снизился до исходного.
Липидный обмен у животных «Хронического эксперимента» изучали с использованием следующих биохимических показателей крови: общий холестерин, эфиросвязанный холестерин, свободный холестерин, коэффициент эстерификации холестерина, прочно связанный с белками холестерин, рыхло связанный с белками холестерин, коэффициент прочности связи белка с холестерином, Р-липопротеиды, неэстерифицированные жирные кислоты, общие липиды (Антипенко Д.Б., 1972; Ахунов А.А., 1972). После начала хронического облучения систематически 1 раз в 2 месяца определяли содержание общего холестерина крови у всех подопытных и контрольных собак одновременно. Выявлены статистически достоверные изменения содержания общего холестерина у собак по сравнению с исходными данными. У животных подопытных групп под влиянием облучения уровень холестерина в крови по сравнению с контрольными животными был незначительно повышенным.
Уровень эфиросвязанного холестерина у хронически облученных собак через 1 год облучения был несколько выше, чем у контрольных животных. Увеличенное содержание эфиросвязанного холестерина продолжало сохраняться у собак 1-й, 2-й и 3-й групп до 22 месяцев облучения включительно, а далее концентрация его снижалась и не выходила за пределы границ среднеквадратического отклонения, определенного для контрольных животных.
Содержание рыхло связанного холестерина (PCX) у облученных животных 1-3-й групп было подвергнуто колебаниям на всем протяжении исследований. Причем размах варьирования концентрации у хронически облучаемых животных 1-3 групп был выше. Наибольший подъем данного показателя был отмечен у собак 2-ой группы через 18 месяцев хронического облучения (до 83,5 мг%), у контрольных животных в этот срок концентрация PCX была равна 45,9 мг%. У животных 3-й группы на 14-й и 16-й
179
месяцы облучения содержание PCX достоверно было ниже по сравнению с контрольным уровнем. Такой же характер более выраженных колебаний концентрации в этих группах по сравнению с контролем отмечен по содержанию прочно связанного холестерина (ПСХ). Концентрация ПСХ изменялась почти в 2 раза. Она достоверно была повышена в 1-й группе на 16-й месяц облучения 140,6 мг% (р = 0,05). У собак 2-й группы максимум наблюдался через 14 месяцев и был выражен еще в большей степени, концентрация ПСХ достигла еще большего уровня 164,1 мг%. У животных 3-й группы уровень ПСХ в сыворотке крови колебался более чем в 2 раза от 53,6 до 135,9 мг%. Через 14 и 16 месяцев хронического облучения уровень ПСХ был достоверно увеличен по сравнению с контрольным, но на 30-м месяце облучения концентрация ПСХ достоверно снизилась до 53,6 мг%.
Изменения коэффициента прочности связи белка с холестерином также имели фазный характер. У собак 1-й группы в течение всех 3 лет облучения концентрация Р-липопротеидов колебалась от 99,9 ± 11,8 до 195,8 ± 2,6 мг%. Наибольший подъем уровня показателя был отмечен через 1,5 года облучения. Сопоставление полученных данных по содержанию Р-липопротеидов и общего холестерина в сыворотке крови собак 1-й группы показало, что имелась корреляция между этими показателями.
Уровень Р-липопротеидов в сыворотке крови животных 2-й группы колебался в этих же пределах от 103,0 ±5,3 до 195,5 ±14,1 мг%. Наибольший подъем наблюдался через 24 месяцев исследований. Через 14 месяцев и через 2 года эксперимента уровень Р-липопротеидов был достоверно увеличен по сравнению с контрольным. Анализ данных по содержанию Р-липопротеидов и общего холестерина в сыворотке крови собак 2-й группы показал, что в ранние сроки исследований у собак сохранялась естественная корреляция этих показателей; однако через 24 месяца было выявлено нарушение корреляции. Максимальное расхождение этих показателей наблюдалось через 30 месяцев хронического облучения, когда уровень Р-липопротеидов был повышен, а содержание холестерина крови достигло минимального значения.
Концентрация Р-липопротеидов в сыворотке крови собак 3-й группы (суммарная доза за 3 года — 372 сГр) изменялась от 137 ±9,1 до 251,3 ± 5,8 мг%. У животных данной группы был отмечен наибольший подъем уровня Р-липопротеидов, чем у животных 1-2-й групп и у контрольных животных. Максимальное увеличе
но
ние уровня Р"липопротеидов в крови у собак было отмечено через 28 месяцев от начала облучения. Статистический анализ полученных данных показал, что через 28 и 30 месяцев облучения уровень Р-липопротеидов в крови был достоверно повышен по сравнению с контрольным (р = 0,025). В ранние сроки исследований вплоть до двухлетнего периода хронического воздействия корреляция содержанием общего холестерина и Р-липопротеидов сохранялась, однако через 28 месяцев наблюдалось резкое различие в колебаниях данных показателей. Уровень Р-липопротеидов с 28-го до 34-го месяца был резко повышен, в то время как уровень общего холестерина стремился к нижней границе нормальных показаний. Выше представленные данные свидетельствуют о более напряженном характере регуляции липидного обмена у животных.
В то же время содержание неэстерифицированных жирных кислот (НЭЖК) в течение всех 6 лет облучения у животных 1-3-й групп существенно не отличалось от контрольных значений. У животных 4-й и 5-й групп оно было снижено на 20-25%. Исследования концентрации общих липидов в сыворотке крови хронически облученных животных показали, что в среднем значения этого показателя не выходили за пределы колебаний данного показателя у здоровых собак.
Антипенко Д.Б. (1972) и Ахунов А.А. (1972) определяли у подопытных собак в крови также содержание ацетилхолина (АЦХ) и уровень активности холинэстеразы (ХЭ), альдолазы (А), аспартатаминотрансферазы (ACT) и аланинаминотрансферазы (АЛТ). Непрерывное облучение собак 1—3-й групп в течение 2 лет не привело к выраженным изменениям соответствующих биохимических показателей. Ни в одной из групп животных, получивших к этому сроку наблюдения суммарную дозу 42, 125, 200 и 250 сГр, не обнаружено статистически достоверного нарушения ферментного спектра. Уровень активности ХЭ и А вообще практически не отличался от уровня активности этих показателей у контрольных собак. Только коэффициент АСТ/АЛТ у облученных животных имел выраженную тенденцию к снижению. В группе собак, которых на фоне хронического облучения повергали острому воздействию (4-я и 5-я группы), существенных изменений активности ХЭ и А также отмечено не было. Отношения АСТ/АЛТ и у этих животных было ниже контрольного.
181
Непрерывное и сочетанное облучение собак в течение первых 3 лет не вызывало существенного изменения содержания ацетилхолина и активности ферментов ХЭ, A, ACT и АЛТ. Однако в условиях продолжающегося облучения отмечена тенденция возрастания активности ХЭ. Она увеличивалась у животных 3-й группы на 12%, а у животных 5-й группы на 21%.
У животных 3-5-й группы не было отмечено достоверного изменения активности ACT. Лишь у животных 2-й группы уровень активности после 6-летнего облучения достоверно был снижен и составил 10,5 ± 0,5 усл. ед., тогда как в контроле — 17,2 ± 3,0 (р < 0,05).
У животных всех групп 6-летнее облучение привело к изменению активности АЛТ, содержание которой было увеличено по сравнению с контролем. Наиболее отчетливые сдвиги были установлены у животных 1-й, 3-й и 4-й групп, у которых активность составила соответственно по группам: 29,4 ± 5,2, 24, 9 ± 2,1 и 26,2 ±4,1 усл. ед., в то же время у животных контрольной группы 16,5 ±1,3. У животных 2-й группы различий активности АЛТ по сравнению с контрольными собаками не выявлено. Активность альдолазы у опытных животных к 6-му году эксперимента существенно не отличалась от контрольного уровня.
Дополнительная нагрузка — «тестирующее острое облучение» в дозе 1,25 Гр, которое использовали после 6 лет хронического воздействия, вызывала у собак всех групп изменения холинэрги-ческих процессов, характеризовавшиеся заметным отклонением активности ферментов. Реакция на острое облучение, оцениваемая по уровню холинэстеразы (ХЭ), у хронически облученных животных была несколько иной, чем у контрольных. Различия между ними проявлялись в неодинаковых сроках возникновения изменений и их глубине. Так, активность фермента у хронически облученных собак заметно снизилась в первые 3 суток, тогда как у контрольных сдвига активности ХЭ не отмечалось. В последующем у контрольных животных было выявлено снижение активности фермента, однако этот сдвиг был менее выражен, чем у ранее облученных животных. На 7-21-е сутки у контрольных собак активность ХЭ уменьшилась на 12-15%, у животных 1-й группы — на 26-37%, у животных 2-й группы — на 32-36%.
По характеру изменений активности ацетилхолина (АЦХ) на острое облучение также выявились различия между группами. У животных контрольной группы уже через сутки после облучения
182
активность АЦХ увеличилась на 29%, тогда как у собак 1-й и 2-й групп изменения произошли позднее. Были выявлены различия между группами животных и по направленности изменений. У контрольных собак сдвиги активности фермента были направлены только в сторону повышения, тогда как у хронически облученных стимуляция чередовалась с угнетением. Так, на 7-е сутки активность АЦХ у контрольных животных была выше исходного уровня, тогда как у собак 1-й и 2-й групп она уменьшилась на 40 и 26% соответственно.
Состояние азотистого обмена характеризовали по содержанию в тканях и органах аммиака, глютамина, глютаминовой кислоты (ГК), аспарагиновой кислоты (АК), у-аминомасляной кислоты (ГАМК), глицина, фенилаланина, суммы пиридоксаль- и пиридоксаминфосфатов, активности АЛТ и ACT (А.Т. Пикулев). По содержанию аммиака в головном мозге у собак, подвергающихся сочетанному хроническому и острому облучению (4-я и 5-я группы), имелась тенденция к большим изменениям, чем у хронически облучаемых животных (1-3) группы. Изменение содержания аммиака в печени было менее выражено.
Обращает на себя внимание резкое повышение количества глютамина в головном мозге при накоплении суммарных доз 63-105 сГр (1-я группа через 3-5 лет эксперимента) и 190 сГр (2-я группа через 3 года). В этих случаях количество амида ГК возрастало почти в 2 раза по сравнению с уровнем у животных контрольной группы. В дальнейшем, при накоплении больших доз (до 360-940 сГр), отмечено снижение содержания глютамина в головном мозге. В печени у животных 1-3-й групп через 5 лет эксперимента содержание глютамина также снижалось. При этом в головном мозге и печени повышалась активность глютаминазы. В головном мозге скорость ферментативного расщепления глютамина у всех облученных собак увеличивалась. В печени изменения в активности этого фермента были менее выражены.
С обменом глютамина тесно связан метаболизм ГК, а также других кислот, примыкающих к циклу трикарбоновых кислот. Количество ГК в мозге, печени, в сердечной и скелетной мышцах при суммарной дозе 360 и 800 сГр уменьшалось. Уровень ГАМК в мозге, начиная с накопленной дозы 360 сГр, снижался, а при дальнейшем облучении (суммарная доза 940 сГр) наблюдалась тенденция к увеличению уровня ГАМК. У собак всех подопытных групп под влиянием лучевого воздействия повышалось содержание АК
183
в головном мозге, в то же время в печени, скелетной и сердечной мышцах количество этой аминокислоты у большинства облучаемых собак уменьшалось по сравнению с контрольными. У всех облученных собак в течение 5 лет облучения количество глицина в головном мозге, печени и сердечной мышце увеличивалось, а аланина — уменьшалось.
Определяли активность основных ферментов обмена аминокислот — аминотрансфераз, в частности АЛТ и ACT. Активность ACT в головном мозге значительно уменьшалась у всех облученных животных, а в сердечной мышце и печени скорость ферментативного трансаминирования почти во всех случаях возрастала. В печени наблюдали торможение скорости ферментативного трансаминирования, катализируемого ферментом АЛТ; в скелетной мышце отмечены сдвиги в активности АЛТ лишь у собак 2-й группы при накоплении суммарной дозы 190 сГр к 3-му году облучения.
Черкасова Л.С. и др., (1972) оценивали относительную устойчивость окислительно-восстановительных процессов в головном мозге и миокарде у облученных животных всех групп. Характеризовали активность фермента обмена глюкозы гексокиназы в головном мозге и сердечной мышце, а также содержание гликогена, глюкозо-фосфата (Г-1-Ф), глюкозо-6-фосфата (Г-6-Ф), аденозин-трифосфорной (АТФ) и креатинфосфорной (КФ) кислот. Кроме того, определяли содержание гликогена в печени и сиаловых кислот в мозговой ткани, миокарде и печени. Содержание гликогена в мозговой ткани снижалось через 2-4 года облучения, однако через 5 лет хронического воздействия четко проявлялось включение в реакцию компенсаторных механизмов, в результате чего уровень гликогена в мозге возвращался к исходному. Аналогичные изменения были выявлены в содержании Г-1-Ф в головном мозге. Включение глюкозы в процессы биоэнергетики, о чем судили по уровню Г-6-Ф, как и синтез АТФ в мозговой ткани, оставалось на уровне, близком к установленному у контрольных животных. Содержание гликогена в скелетной мышце в первые годы облучения было устойчивым, а через 5 лет облучения имело тенденцию к повышению. Большой разброс данных установлен при исследованиях содержания гликогена в печени, однако низких значений этого показателя не было отмечено.
Изучение содержания в тканях сиаловых кислот показало, что при хроническом облучении в течение 6 лет наиболее устойчива
184
мозговая ткань. Снижение содержания сиаловых кислот в головном мозге было обнаружено лишь через 5 лет хронического облучения, а наибольшие изменения в содержании сиаловых кислот наблюдали в тканях печени.
4.5. Иммунологическая реактивность животных
С целью оценки иммунологической реактивности животных «Хронического эксперимента» исследовали аутоиммунную реакцию, антиинфекционную устойчивость организма собак, а также проводили другие иммунологические обследования (Зуева ВА., 1972, 1978). При исследовании у собак аутоиммунной реакции использовали три методики: прямую пробу Кумбса, выявляющую неполные аутоантитела, фиксированные на эритроцитах; реакцию потребления комплемента в модификации А.А. Иванова с антигенами тканей почки и печени, выявляющую компплементфикси-рующие свободно циркулирующие в крови противотканевые антитела; реакцию агглютинации Райта с бруцеллезным антигеном для обнаружения неспецифических серологических реакций, которые могут являться признаком сенсибилизации организма. Для определения напряженности антимикробной устойчивости организма определяли количественный и качественный состав аутофлоры кожи бока тела собаки и кончика носа методом пластинок-отпечатков по Н.Н. Клемпарской и О.Г. Алексеевой. С этой же целью исследовали наличие кишечной палочки в ротовой полости по методу Г.А. Шальновой. Оценивали фагоцитарную активность крови.
Хроническое облучение собак 1-3-й групп вызывало вначале увеличение количества аутоантител, фиксированных на эритроцитах. Начальные этапы усиления аутоиммунной реакции отмечались уже на 8-м месяце эксперимента у собак всех трех подопытных групп при суммарной дозе соответственно 12, 73 и 78 сГр. Количество фиксированных неполных аутоантител на эритроцитах увеличилось более чем у 50% собак. При этом агглютинабель-ность эритроцитов облученных собак наблюдали в антиглобули-новой сыворотке (АГС), разведенной соответственно в 150 ± 16,4; 213 ±12,9 и 153 ± 6,4 раза, а в контрольной группе у собак при разведениях АГС в ИЗ ± 6,4 раза (р < 0,05). В последующие месяцы
185
эксперимента повышенные количества неполных аутоантител отмечали постоянно у собак 3-й группы. Однако при дальнейшем облучении, особенно у животных с большой накопленной суммарной дозой, интенсивность прямой пробы Кумбса не отличалась статистически значимо от контрольных значений, т.е. по степени нарастания титров аутоантител процесс не углублялся в течение последующих лет облучения. Этот характер изменений, возможно, объясняется тем, что при рассматриваемых условиях хронического облучения циркулирующие в периферической крови эритроциты могли аккумулировать эти антитела в количествах, достаточных для их выявления.
При постановке реакции потребления комплемента начало достоверного увеличения уровня противотканевых антител к антигенам тканей почки и печени было отмечено у собак 2-й группы при накопленной дозе 73 сГр (на 8-м месяце облучения) и на 12-м месяце облучения у собак 3-й группы при дозе 140 сГр. В это время уровень противотканевых антител к антигенам ткани почки у собак 2-й группы был выше среднего уровня контрольной группы в 2 раза, к антигенам ткани печени в 3 раза. У собак 3-й группы уровень антител к антигенам ткани печени был выше контрольного в 2 раза. В дальнейшем эти изменения носили фазовый характер. У собак, подвергавшихся хроническому облучению в наименьшей дозе (1-я группа), статистически значимое повышение интенсивности реакции потребления комплемента отмечено только на 28-м месяце в отношении антигенов ткани почки.
Известно, что в процессе аутосенсибилизации может происходить образование антител различной направленности, в том числе и к микробным антигенам, даже тем, с которыми организм ранее не встречался. Причем чем длительнее и интенсивнее процесс аутоиммунизации, тем чаще наблюдаются неспецифические серологические реакции. Можно предположить, что в условиях хронического облучения возможное постепенное образование продуктов тканевого распада может привести со временем к появлению неспецифических серологических реакций у подопытных собак. Поэтому начиная со 2-го года облучения ставили реакцию агглютинации сыворотки собак с бруцеллезным антигеном. Однако частота случаев неспецифических реакций у животных подопытных и контрольных групп существенно не различалась.
186
Незначительному усилению аутоиммунной реакции в первые 8-28 месяцев облучения соответствовали изменения антиинфекци-онной устойчивости собак, о чем судили по состоянию аутофлоры кожи. На коже облученных собак 3-й и 4-й групп, начиная с накопленных доз 135 и 195 сГр (срок облучения 14 мес.) и до конца 3-го года облучения, отмечали небольшое, но закономерно повторяющееся нарастание числа микробов, устойчивых к ингибитору бромтимолбляу и гемолитических форм. Показатели аутофлоры кожи собак, облученных в меньшей дозе (1-я и 2-я группы), за весь 3-летний период наблюдений почти не отличались от контрольных. Лишь на 6—8-м месяцах облучения у собак наблюдали пониженное по сравнению с контрольным количество гемолитических форм микробов. Так как все четыре группы собак находились в одинаковых условиях, то это явление можно объяснить известным из литературы фактом возможного стимулирующего воздействия излучения в малых дозах на антимикробную защиту организма. Изучение состояния аутофлоры кожи контрольных животных выявило сезонные колебания, наиболее четко прослеживаемые по глубокой аутофлоре в отпечатках на среде Коростелева. Нарастание числа микробов наблюдали в марте, июле, ноябре и снижение — в январе, мае, сентябре. Сезонные колебания аутофлоры кожи собак, облученных с большой мощностью дозы, были более интенсивными, чем в контрольной группе, до 6—8 месяцев облучения. Далее сезонные изменения в динамике гемолитической флоры собак 2-й и 3-й групп сглаживались. Сезонные колебания аутофлоры, вырастающей на среде Коростелева, у собак 2-й группы с 8-го месяца облучения сдвигались во времени относительно изменений в контрольной группе, у собак 2-й группы усиливались по сравнению с контрольными и прослеживались до конца 3-го года облучения.
При исследовании аутофлоры кожи носа и ротовой полости собак кишечная палочка не была обнаружена в течение всего многолетнего периода исследования. Таким образом, гуморальные факторы иммунологической реактивности (титр комплемента и нормальных антител, бактерицидные свойства кожи) показали большую устойчивость и соответствующие показатели не претерпевали достоверных изменений на протяжении 6 лет облучения. Не было получено статистически значимых изменений при оценке фагоцитарной активности крови.
187
4.6. Состояние нервной системы
Имеются весьма разноречивые данные о реакциях центральной нервной системы (ЦНС) в условиях хронического облучения в относительно малых дозах. Однако в фундаментальных работах (Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1958, 1963) описан ряд неблагоприятных реакций ЦНС в результате длительного многолетнего облучения профессионалов в малых дозах. Изменения со стороны нервной системы наблюдались у пациентов после гамма-облучения в терапевтических целях (Григорьев Ю.Г., 1958). Анализ многочисленных экспериментальных данных показал высокую функциональную радиочувствительность ЦНС при воздействии малых доз ионизирующего излучения (Григорьев Ю.Г., 1963).
В «Хроническом эксперименте» на И собаках самцах были проведены исследования, направленные на оценку состояния ВНД облученных животных (Е.П. Сизан, 1972). Изучали цепные двигательные условные рефлексы. Пять собак облучали непрерывно в течение 3 лет при мощности дозы излучения 0,34 сГр/сут. Суммарная доза за год составила 125 сГр. Остальные шесть собак были контрольными.
За 2 месяца до начала облучения у отобранных собак начали вырабатывать условные цепные двигательные рефлексы при пищевом подкреплении. Животных во время опыта не фиксировали и они свободно передвигались по камере размером 1,6 х 2м. Для оценки условно-рефлекторной деятельности использовали оригинальную установку, состоящую из специально оборудованного щита, расположенного в камере, и полуавтоматического пульта управления. В нижней части щита были укреплены четыре педали, над каждой из которых располагались электрические лампочки, а на высоте 165 см — кормушки. Цепной условный рефлекс вырабатывали путем последовательного подключения нового условного раздражителя перед выработанным одиночным рефлексом или участком цепи. Во время последовательного включения слева направо каждой из четырех лампочек собака нажимала лапой по одному разу на соответствуюшую педаль. После правильного выполнения цепи из четырех движений животное получало мясо из кормушки. Дифференцировочным раздражителем служил мелькающий 4 раза в 1 с свет неоновой лампочки, расположенной на щите выше остальных. Стереотип составляли из 10 положи
188
тельных и 2 дифференцировочных раздражителей. Опыты проводили раз в неделю. Состояние условно-рефлекторной деятельности оценивали по числу правильных реакций на положительный и дифференцировочный раздражители и латентному периоду первого нажима педали. Облучение было начато в то время, когда выработка цепных условных рефлексов еще не завершилась. Поэтому среднее количество правильных реакций в 1-й месяц облучения было небольшим и составляло в опытной группе 65%, а в контрольной 68%. Эти незначительные различия недостоверны. Средний латентный период первого условнорефлекторного движения отличался большой продолжительностью и был одинаковым в обеих группах (1,4 с).
Ко 2-му месяцу эксперимента, когда накопленная доза облучения составила 8 сГр, проявилось различие в показателях условных рефлексов. Как у облученных, так и у контрольных собак постепенно увеличивалось количество правильных реакций, что было связано с тренировкой. Однако у облученных животных в течение первых 2 месяцев влияние тренировки было выражено значительно слабее, а к 3-му месяцу облучения число правильных реакций даже снизилось. Это расхождение статистически достоверно (р = 0,01). Одновременно наблюдали различие в длительности латентного периода первого условнорефлекторного движения у собак подопытной и контрольной групп. По мере тренировки длительность латентного периода уменьшалась, но у облученных собак это сокращение было менее выраженным. К 3-му месяцу воздействия при дозе 20 сГр различие между продолжительностью латентного периода облученных и контрольных животных стало достоверным (р = 0,01).
На 4-6-м месяцах эксперимента были проведены пробы на сохранение сигнального значения отдельными звеньями условной цепи. Для этого в конце опыта включали отдельно один или последовательно два-три вместе условных раздражителя, составляющих звенья цепного условного раздражителя. Эта проба не выявила нарушений процесса синтезирования отдельных раздражителей в единую цепь после облучения собак в течение первых 6 месяцев до суммарной дозы 60 сГр. Начиная с 4-го месяца воздействия число правильных реакций у подвергаемых облучению собак увеличилось, тогда как у контрольных животных наблюдалась тенденция к снижению. С 5-го месяца различий по этому показателю между группами не отмечалось. К 8-му месяцу воз
189
действия (накопленная доза 83 сГр) число правильных ответов у животных обеих групп снизилось. Латентный период с 4-го месяца воздействия у животных как подопытной, так и контрольной групп постепенно увеличивался. Однако еще до 6-го месяца различие между облученными и интактными собаками было достоверным. На 7-м месяце это различие стало статистически недостоверным, а на 8-м месяце латентный период у контрольных животных стал даже больше, чем у облученных животных. Следует отметить, что в этот период максимальные изменения, наблюдаемые в основном у необлученных животных, приходились на весенне-летние месяцы. Можно предположить, что эти явления связаны с сезонной ритмикой у собак.
В течение 2-го года эксперимента количество адекватных реакций на цепной раздражитель в обеих группах оставалось одинаковым. Однако с 21-го месяца (доза 212 сГр) число правильных реакций у животных опытной группы начало увеличиваться и превосходило контрольный уровень на протяжении почти всего 3-го года облучения. Латентный период условной двигательной реакции у облученных животных на 2-м году опыта был больше, чем у контрольных. Эти изменения сохранялись до 17-го месяца воздействия (р<0,05). Начиная с 18-го месяца эксперимента (апрель—май), отношение между латентным периодом у животных подопытной и контрольной групп становилось обратным, т.е. скрытое время первого условнорефлекторного движения у облученных животных уменьшалось, тогда как у контрольных скрытое время увеличивалось.
На 3-м году облучения, по-видимому, благодаря непрерывной длительной тренировке, средний латентный период у собак обеих групп был меньше, чем в предыдущие годы. Увеличение латентного периода у облученных животных по сравнению с контрольными собаками наблюдалось до 31-го месяца эксперимента (доза 322 сГр) . Однако в дальнейшем, к концу 3-го года облучения, отмечалось снижение латентного периода у собак подопытной группы до уровня контрольных.
Дифференцировочный условный рефлекс на мелькающий свет у собак начали вырабатывать в 1-й месяц облучения. Поэтому среднее число правильных ответов на дифференцировочный раздражитель (отсутствие условного пищедобывательного движения) во 2-м месяце было низким у собак обеих групп. У контрольных животных уже на 3-м месяце показатели дифференцировки
190
превысили 90%, тогда как у облученных к 8-му месяцу составляли лишь 70-85%. В отдельных месяцах различие между контролем и опытом было статистически достоверным. К 8-му месяцу радиационного воздействия, когда суммарная доза превышала 70 сГр, количество адекватных реакций на мелькающий свет у животных подопытной группы достигло уровня контрольной. В дальнейшем дифференцировка была прочной у собак обеих групп и сохранялась в пределах 90—100% в течение всего периода облучения.
Для проверки силы и подвижности тормозного и отчасти возбудительного процессов проводили пробы с удлинением времени действия дифференцировочного раздражителя до 3 минут вместо обычных 10 с, а также угашение и восстановление цепного условного рефлекса. После первого удлинения дифференцировки на 14-м месяце эксперимента (суммарная доза 145 сГр) у облученных собак увеличилось количество ошибочных реакций и удлинился латентный период последующих положительных условных рефлексов. После второй пробы, проведенной на 26-м месяце (суммарная доза 270 сГр), изменения условных рефлексов были менее значительными.
Другой вид внутреннего торможения — угашение — испытывался на 16-м и 27-м месяцах облучения (дозы 166 и 280 сГр). Условный раздражитель применяли без пищевого подкрепления до получения отсутствия условнорефлекторного движения 1, 3 и 5 раз подряд. Наблюдалось увеличение скорости угашения сигнального значения цепного раздражителя у облученных собак по сравнению с контрольными (табл. 4.13). У контрольных собак по сравнению с облученными для получения однократного или подряд 3- и 5-кратного отсутствия рефлекса требовалось в среднем большее число применений условного раздражителя без пищевого подкрепления. Количество применений условного раздражителя для восстановления цепного условного рефлекса у собак подопытной и контрольной групп было одинаковым.
Через 31 месяц эксперимента, когда суммарная доза облучения достигла 322 сГр, была использована функциональная нагрузка — собаки подвергались воздействию перегрузки на центрифуге (Си-зан Е.П., 1972). Общая продолжительность вращения 5 мин, из них с ускорением 4 g — 2 мин и 6 g — 3 мин. В качестве исходных данных были взяты средние значения по трем предшествующим опытам.
191
Таблица 4.13
Среднее число применений положительного (условного) раздражения без пищевого подкрепления до получения отсутствия рефлекса подряд 1, 3 и 5 раз
Условие опыта 1 раз 3 раза 5 раз
опыт контроль опыт контроль опыт контроль
1-й опыт угашения (16 месяцев облучения) 6,3 16,7 10,7 17,3 10,7 22,3
2-й опыт угашения (27 месяцев облучения) 9,7 19,7 10,3 22,7 10,3 22,7
Условные рефлексы исследовали через сутки после воздействия. В результате установлено, что у облученных животных проявилась значительная разнонаправленность изменений. Количество ошибочных реакций в ответ на действие перегрузки у двух собак уменьшилось на 20%, у одной увеличилось на 16,3%, и у одной — не изменилось.
В среднем у облученных животных количество ошибок уменьшилось, но эти изменения были недостоверны. У большинства не-облученных собак реакция на перегрузку проявилась в увеличении количества ошибочных реакций на цепной раздражитель на 20-30%. У одной собаки наблюдали уменьшение их на 13%. В среднем по группе увеличение количества ошибочных реакций по сравнению с исходным было достоверным (р = 0,04) . При сопоставлении средних показателей количества ошибочных реакций обеих групп было обнаружено статистически достоверное различие (р = 0,04).
Во время обследования через 3-5 суток после воздействия перегрузки у большинства животных количество ошибочных реакций почти сравнялось с исходным. Латентный период условно-рефлекторного движения у трех облучаемых собак на первый срок обследования уменьшился, а у одной увеличился. В среднем у животных подопытной группы наблюдалось статистически достоверное уменьшение латентного периода. У четырех контрольных собак этот показатель увеличился по сравнению с исходным, а у одной уменьшился. В среднем у собак контрольной группы че
192
рез сутки после вращения латентный период увеличивался, хотя статистически и недостоверно. При сравнении латентного периода у собак облучаемой и контрольной групп обнаружены противоположно направленные изменения. Уровень значимости различий составлял 0,04. Изменение латентного периода у облучаемых животных на 3-5-е сутки после вращения на центрифуге оказалось более продолжительным, чем у контрольных. Только у одной собаки в подопытной группе латентный период ко второму сроку обследования начал возвращаться к исходному уровню. У остальных изменения латентного периода сохранялись либо продолжали нарастать. У четырех контрольных собак латентный период к этому времени достиг исходного уровня.
В течение одного года после прекращения облучения цепные условные рефлексы у собак продолжали исследовать. Количество правильных реакций у облученных животных оставалось на уровне 90-95%, тогда как у контрольных собак — на уровне 80-90%. Латентный период условных рефлексов в среднем был одинаковым в обеих группах. Дифференцировка была достаточно прочной и у контрольных, и у подопытных собак. Как и в предыдущие годы, длительность четырех движений в цепи у облученных собак оставалась вдвое короче, чем у контрольных. У гашение цепного рефлекса, проведенное через год после прекращения облучения, у облученных собак происходило быстрее, чем у контрольных, т.е. так же, как и во время облучения.
После 4 лет исследования ВНД собак с применением световых раздражителей была предпринята попытка выработать такой же цепной двигательный условный рефлекс на звуковые раздражители. У облученных животных выработка нового цепного рефлекса происходила несколько медленнее, чем у контрольных, по-видимому, вследствие ослабления в результате облучения ориентировочной реакции и силы нервных процессов.
Таким образом, хроническое облучение при мощности дозы 0,34 с Гр/сут при достижении в течение месяца суммарной дозы 10 сГр задерживало у собак стабилизацию неупроченных цепных двигательных, условных рефлексов, вырабатываемых на пищевом подкреплении. У облученных животных отмечено большее, по сравнению с контрольными, количество неправильных реакций и достоверное увеличение латентного периода условных реакций. Выработка дифференцировочного торможения при использовании пищевой методики у облученных собак задерживалась. Уве
193
личение количества ошибочных реакций и длительности латентного периода условного двигательного рефлекса в начале облучения, по-видимому, можно объяснить развитием запредельного торможения вследствие суммации возбуждения, обусловленного усилением ориентировочной реакции в процессе выработки условных рефлексов, с возбуждением, вызываемым действием на нервную систему ионизирующего излучения в малых дозах. Обнаруженное в начале облучения замедление выработки дифферен-цировочного торможения к пищевым условным рефлексам у собак, очевидно, связано с различием в механизмах тормозных рефлексов при разнородных подкреплениях (Григорьев Ю.Г. и др., 1986).
Важным является факт, что у облученных собак цепные условные рефлексы достигли контрольного уровня к 4-8-му месяцу лучевого воздействия при достижении суммарных доз 40-80 сГр и сохранились на этом уровне в течение последующего года облучения. После достижения суммарной дозы хронического облучения 200 сГр количество правильных реакций на цепной условный раздражитель у собак облучаемой группы стало стабильно больше, чем у собак контрольной группы. Видимое улучшение условных рефлексов, вероятно, происходило в результате мобилизации компенсаторных процессов. Можно предположить, что под действием облучения имелось активирующее влияние на кору головного мозга ретикулярной формации, о чем свидетельствовало ослабление ориентировочно-исследовательской реакции. В ряде случаев это предотвращало развитие запредельного торможения.
На протяжении почти всех 3 лет облучения при хроническом облучении собак латентный период двигательной реакции оставался более длительным, чем у контрольных. Это, вероятно, свидетельствовало о снижении лабильности и проводимости рефлекторных дуг. По-видимому, в условиях нашего эксперимента с определенного периода устанавливалось характерное для хронического облучения динамическое равновесие, между восстановительными процессами и эффектами повреждающего действия облучения. В это время радиобиологический эффект можно было выявить лишь при условии применения специальных функциональных проб. Между тем сохранение изменений условных рефлексов в течение года после прекращения облучения указывает на некоторое ослабление компенсаторных возможностей нервной системы в результате 3-летнего облучения в суммарной дозе
194
374 сГр. Угашение условных рефлексов, проведенное после облучения в дозах 166 и 280 сГр, у облученных собак происходило быстрее, чем у контрольных. Восстановление угашенных условных рефлексов на 2-м году эксперимента у облученных собак было замедленным. После угашения, а также после продления действия дифференцировочного раздражителя у облученных животных наступало более сильное последовательное торможение, чем у контрольных.
Полученные результаты могут свидетельствовать о снижении силы и подвижности возбудительного процесса, об увеличении инертности тормозного процесса и о нарушении координации этих процессов в цепном двигательном рефлексе в результате 3-летнего непрерывного облучения. Отсутствие сезонных изменений у облученных животных также может свидетельствовать о существенной перестройке их ВНД. Наблюдалось увеличение по сравнению с контрольными среднего за месяц количества правильных реакций, которое сохранялось при воздействии специальных проб (угашение, удлинение дифференцировочного раздражителя, перегрузки). Увеличение правильного выполнения заданий при облучении одни авторы объясняют ослаблением функций коры и в связи с этим уменьшением двигательной активности и снижением ориентировочно-исследовательских реакций. Другие исследователи считают, что во время повышения условных рефлексов могут происходить увеличение силы возбудительного и тормозного процессов и улучшение работоспособности коры.
О высоких компенсаторно-приспособительных свойствах ЦНС свидетельствует возможность выработки цепного условного рефлекса у обезьян после 5 лет хронического облучения до суммарной дозы 1452 сГр (Джикидзе Э.К., 1964) Однако автор отметила ослабление возбудительного процесса и углубление тормозных реакций с явлениями инертности. Это выражалось в ускоренном угашении положительных условных рефлексов и в увеличении латентного периода двигательной реакции у облученных животных, что наблюдалось и в «Хроническом эксперименте».
Вестибулярный анализатор
В литературе полностью отсутствуют сведения об изменениях функций вестибулярного анализатора при соответствующих условиях лучевого воздействия. Функциональное состояние вестибу
195
лярного анализатора изучал в динамике у животных «Хронического эксперимента» 2 раза в год в течение 3 лет Кумец П.И. (1972). В качестве раздражителя использовали угловое ускорение, воспроизводимое на электровращающейся установке ВУ-2 по принципу купулометрии (Григорьев Ю.Г., Фарбер Ю.Б., Волохова Н.А., 1970). Животных помещали на специальную платформу, которая обеспечивала прочную фиксацию головы и тела при сохранении физиологической позы. Время остановки вращения станка для создания отрицательного углового ускорения (так называемого стоп-стимула) соответствовало 2 с. Величина адекватного раздражителя выражалась в единицах угловой скорости вращения, предшествующей остановке.
Проведенные нами ранее физиологические эксперименты показали, что наиболее информативными и удобными критериями оценки функционального состояния вестибулярного анализатора являются его возбудимость и реактивность. О возбудимости судили по минимальной величине отрицательного углового ускорения, возникающего при остановке станка после равномерного вращения, при которой появляется первая нистагменная реакция (пороги нистагма). Животных начинали вращать с подпороговым ускорением 0,2 град/с до угловой скорости 5 град/с. Остановку станка производили в тот момент, когда на записи в течение 2 мин не было нистагменных ударов глазного яблока. Величина угловой скорости, предшествующая остановке кресла, считалась пороговой в том случае, когда после стоп-стимула регистрировались 1-2 нистагменных движения. Если после скорости движения 5 град/с нистагма не было, то через 3 мин вращение повторяли со скоростью на 2 град/с больше, чем предыдущая, и т.д. Исследование реактивности (реакции вестибулярного анализатора на возрастающий стимул) проводили после определения порогов нистагма. Для этого применяли поочередно вращения со скоростями 30, 60, 90, 120, 180 град/с с последующим стоп-стимулом и оценкой длительности нистагма.
Влияние хронического облучения на функцию вестибулярного анализатора изучали в течение первых трех лет облучения на 23 животных первых трех групп. Возбудимость вестибулярного анализатора собак, подвергнутых хроническому облучению в течение 36 месяцев, не изменялась. Порог нистагма находился в диапазоне 7,7 ± 0,5 - 9,0 ± 0,6 град/с (табл. 4.14).
196
Таблица 4.14
Порог нистагма при хроническом облучении в течение трех лет (град/с)
Годовая суммарная доза, сГр Количество собак Время исследования, мес.
6 12 18 24 30 36
21 6 — 8,4±0,3 8,6±0,1 8,3±0,2 8,8±0,4 8,5±0,2
62 И 9,7±0,2 7,7±0,5 8,3±0,3 8,04=0,4 9,5±0,7 8,5±0,1
125 । 6 0 7,6±0,4 7,3±0,5 7,5±0,4 8,1±0,5 9,0±0,3
Примечание. У контрольных собак на протяжении всего периода наблюдений (3 года) порог нистагма составлял 9,2 ± 0,3 град/с.
Исследование реактивности вестибулярного анализатора подопытных животных показало, что хроническое облучение в суммарных дозах 63, 186 и 375 сГр (1-3-я группы животных соответственно) так же не изменяло характера ответных вестибулосома-тических реакций.
Функции вестибулярного анализатора у животных, подвергнутых хроническому облучению в сочетании с повторными острыми воздействиями, изучали у 10 животных, которых на фоне хронического воздействия с мощностью дозы 62 сГр/год облучали остро и повторно 3 раза в один год в дозе 42 сГр. Сочетанное облучение животных и изучение состояния вестибулярного анализатора проводили в течение 5 лет. Исследование возбудимости вестибулярного анализатора у этих животных показало, что по мере увеличения суммарной дозы сочетанного облучения у собак в первые 2 года облучения наблюдали значительные изменения порогов нистагма.
К 12-му месяцу облучения (суммарная доза 188 сГр) порог нистагма снизился и составлял 5,2 ± 0,25 град/с. В последующий год облучения (до суммарной дозы 376 сГр) возбудимость вестибулярного анализатора оставалась высокой, порог нистагма по-прежнему составлял 5,0 ± 0,2 град/с. При дальнейшем облучении животных возбудимость начинала снижаться. Через 32 месяца облучения при суммарной дозе 499 сГр порог нистагма повысился до 11,9 ± 0,3 град/с. Однако к 3 годам облучения возбуди
197
мость анализатора несколько повысилась, порог нистагма снизился и не отличался от соответствующих показателей контрольных собак. В последующие 2 года облучения достоверных изменений со стороны возбудимости вестибулярного анализатора не отмечалось (Григорьев и др., 1986).
Реактивность вестибулярного анализатора у животных к 24-му месяцу сочетанного облучения достоверно снизилась. В последующие сроки (через 2,5 и 3 года) реактивность вестибулярного анализатора начала нормализоваться и достигла исходной величины. В течение 4-5 лет облучения уровень реактивности соответствовал показателям контрольных животных.
Часть животных 5-й группы облучали только 3 года и затем в течение одного года после облучения проводили наблюдение. Важно отметить, что через 24 месяца после прекращения 3-летнего облучения порог нистагма и реактивность у собак группы сочетанного облучения существенно не отличались от соответствующих показателей хронически облучаемых животных.
Таким образом, хроническое облучение собак в течение 3 лет в дозах 21, 62 и 125 сГр в год не вызывало сколько-нибудь существенных нарушений физиологических функций вестибулярного анализатора. В течение каждого года 3-кратное острое облучение в сочетании с хроническим сопровождалось волнообразными изменениями возбудимости и реактивности анализатора. При этом максимум изменений наблюдали на 18-24-й месяцы сочетанного облучения. Через 3-5 лет облучения достоверных изменений функционального состояния вестибулярного анализатора не отмечалось.
4.7. Состояние кроветворения у собак в процессе и после 3 и 6 лет облучения
Система кроветворения представляет собой сложную многоуровневую многофункциональную систему, в которой поддержание нормальных концентраций клеток и соотношений между ними обеспечивается множеством регуляторных звеньев, охватывающих по принципу обратной связи все отделы системы. Так, имеется авторегуляторный механизм, управляющий пролиферацией и дифференцировкой стволовых, коммитированных и морфологически распознаваемых клеток, который основан на учете числен
198
ности клеток в костном мозге и периферической крови. В настоящее время показано, что продукты жизнедеятельности зрелых гранулоцитов содержат определенное вещество (гранулоцитарный кейлон), которое угнетает пролиферацию предшественников и способствует их дифференцировке. Введение экспериментальным животным взвеси эритроцитов также тормозит эритропоэз. Следовательно, увеличение концентрации зрелых клеток в крови и костном мозге тормозит пролиферативные процессы в кроветворной ткани. Авторегуляторный механизм учитывает также концентрацию, общее число стволовых кроветворных клеток и регулирует скорость их размножения.
Между тем продукты распада зрелых клеток содержат стимуляторы кроветворения, вызывают увеличение концентрации эритропоэтина, лейкопоэтина, тромбопоэтина в крови, которые способствуют ускорению дифференцировки соответствующих коммитированных отделов и последующему усилению пролиферативной активности стволовых кроветворных клеток. Открытый академиком А.А. Богомольцем основной закон регенерации основан на том, что стимуляция роста тканей осуществляется после их частичного разрушения. Он предположил, что возрождению ткани предшествует частичное ее отмирание, сопровождающееся образованием веществ (аутокатализаторов), стимулирующих регенераторные процессы в ней. Показано (Ужанский Н.Г., 1968), что разрушение эритроцитов является неотъемлемой частью эритропоэза и что эритродерез предшествует последующему нарастанию пролиферативных процессов в красном ростке. Лейкоцитоз и гиперплазия костного мозга, сопровождающие воспалительный процесс, также обусловлены действием продуктов распада лейкоцитов, образующихся в очаге воспаления. Лейкоцитозу, развивающемуся под действием воспалительного экссудата, как правило, предшествует кратковременная лейкопения. В воспалительном очаге обнаруживаются факторы, стимулирующие гранулоците- и тромбопоэз у животных (Илюхин А.В., Зубенкова Э.С., Кахете-лидзе М.Г., 1976).
Авторегуляторные механизмы компенсации обусловливают усиление регенерации при наличии существенного дополнительного распада функциональных клеток и, наоборот, угнетение пролиферативных процессов в ткани в случае повышения концентрации зрелых клеток в костном мозге и периферической крови.
199
В костномозговой ткани находится большое количество нервных окончаний, обусловливающих тонкую реакцию гемопоэза на различные внешние воздействия, которые в одних случаях вызывают стимуляцию пролиферативных процессов и процессов созревания, а также выхода в кровь клеточных элементов, в других — угнетают их. Влияние нервной системы на функцию кроветворения может осуществляться также нейрогуморальным путем (изменение гормонального баланса и тканевого обмена и др.). Наряду с этим непосредственное влияние на гемопоэз оказывают витамины В12, В6, электролиты Fe, Си и другие вещества.
Таким образом, рассматриваемая система является сложнейшим механизмом со множеством последовательно связанных звеньев, охваченных глубокой обратной связью. Процессы кроветворения и кроворазрушения в этой системе находятся в строгой координации. Они взаимообусловлены, регулируются различными путями (гуморальным, гормональным, нервным), что обеспечивает относительное постоянство клеточного состава в нормальных условиях и его изменение, адекватное функциональным потребностям организма при внешних воздействиях (изменение среды обитания).
Система кроветворения является очень чувствительной при действии различных факторов. Она рассматривается как одна из критических систем при воздействии ионизирующих излучений на организм. Процессы, происходящие во всех отделах системы кроветворения после острого облучения в сублетальных и летальных дозах, широко исследованы и изучены на разных видах животных, систематизированы также результаты соответствующих клинических наблюдений. В настоящее время известно и в разд. 3 нами показано, что картина клеточного опустошения в костном мозге и периферической крови в пострадиационный период определяется гибелью части пролиферирующего пула клеток и снижением продукции клеток предшественников. В костном мозге отмечены более ранние и более глубокие изменения в красном ряду (уменьшение числа эритробластов), но в этом ряду происходит и более раннее восстановление. Наоборот, в периферической крови ранние и более сильные цитопенические реакции наблюдали по числу лейкоцитов вследствие гибели лимфоцитов и сравнительно малой продолжительности жизни гранулоцитов в кровотоке. Изменение числа тромбоцитов начиналось несколько позже и практически повторяло динамику гранулоцитов в крови. Концентра
200
ция эритроцитов снижается в более поздний период и при облучении в сравнительно больших дозах (300-400 сГр и выше) вследствие сравнительно длительного периода выведения их из периферического русла (Груздев Г.П., 1968, 1988; Бонд В., Флид-нер Т., Аршамбо Д., 1971).
В разд. 3, в котором рассмотрен характер изменения клеток костного мозга и периферической крови после острых и протяженных облучений в различных дозах, показано, что как максимум аплазии клеток в костном мозге и цитопении гранулоцитов и тромбоцитов в периферической крови (второй минимум пострадиационной динамики клеток), так и характер последующего истинного восстановления числа клеток в основном определяются уровнем опустошения стволовых кроветворных клеток, снижением продукции предшественников и кинетикой их восстановления. В радиобиологических экспериментах и в клинике продемонстрировано, что мероприятия, способствующие сохранению большего относительного числа стволовых кроветворных клеток или их более раннему восстановлению (экранирование или трансплантация костного мозга), значительно снижают проявления лучевой болезни в диапазоне костномозгового синдрома и увеличивают вероятность положительного исхода заболевания (Гуськова А.К., Байсоголов Г.Д., 1971; Воробьев А.И., Бриллиант М.Д., Чертков И.Л., 1974; Стрелин Г.С., Шмидт Н.К., 1978). В ряде работ обосновывается представление о полной детерминированности тяжести лучевой реакции и вероятности гибели животных определенным уровнем сохранения относительного числа стволовых кроветворных клеток (Robinson С., 1968; А.Г. Коноплянников, 1980, 1984).
О радиочувствительности стволовых кроветворных клеток при различных условиях радиационного воздействия судят на основе анализа кривых выживаемости, определяющих зависимость вероятности сохранения колониеобразующих клеток от дозы. При этом подразумевается сохранение способности совершить более 20 митозов и образовать макроскопически видимую колонию в селезенке за 8-9 суток. (При анализе агаровых колоний in vitro клоны более 50 клеток, соответственно 6 и более митозов.)
В настоящее время известно, что кривые выживаемости стволовых кроветворных клеток, образующих колонии в селезенке (КОЕс), почти экспоненциальны при воздействии рентгеновского и гамма-излучений (имеют малое плечо Dq в пределах 0-50 сГр и экстраполяционное число п = 1,5), что свидетельствует о низкой
201
способности клеток к восстановлению сублетальных повреждений. Параметр Do, определяющий дозу, снижающую число клеток в е раз, и характеризующий радиочувствительность стволовых клеток КОЕс, составляет 100 сГр в случае облучения с большой мощностью дозы (более 10 сГр/мин). Радиочувствительность клеток, образующих колонии в костном мозге, или клеток, дающих колонии на агаре in vitro (КОЕ)к — ниже. Для них Do приблизительно в 2 раза больше (Till J.E., McCulloch Е.А., 1963, 1964; Швец В.Н., Шафиркин А.В., 1979; Конопляников А.Г., 1980, 1984).
Обращает на себя внимание факт наличия очень радиочувствительной фракции стволовых колониеобразующих клеток с параметром Do, близким к 10 сГр (Швец В.Н., Шафиркин А.В., 1979). Он получен по тестам клонирования КОЕ в селезенке и в костном мозге. Показано, что дозы в диапазоне 25-150 сГр приводят к одинаковому (приблизительно 50%) уровню числа жизнеспособных колониеобразующих клеток. В более раннем исследовании степени инактивации клеток костного мозга получен аналогичный характер дозовой зависимости относительно числа молодых форм клеток миелоидного и эритробластического рядов и числа лимфоцитов при облучении в том же диапазоне доз (Груздев Г.П., 1968). Исследования в значительной степени соответствуют одно другому и свидетельствуют, что характер изменения относительного количества молодых делящихся форм клеток в костном мозге в указанном диапазоне доз практически определяется уменьшением продукции стволовых кроветворных клеток, связанным со снижением их числа. Радиочувствительная фракция клеток с небольшим значением параметра Do отмечена также для стволовых клеток эпителия тонкого кишечника (Конопляников А.Г., 1980, 1984) и в сперматогенном эпителии по числу сперматогоний (Заликина Ж.Г., 1977).
В последнее десятилетие большое внимание исследователей привлечено к изучению формы кривой доза-эффект в области малых доз до 1 Гр. Этот диапазон наиболее интересен с позиции обеспечения радиационной безопасности, так как при профессиональном облучении на Земле, при ликвидации радиационных аварий наибольшее число лиц подвергается воздействию именно в малых дозах. Эти же дозы характерны и при радиационном воздействии космических излучений на космонавтов при длительных орбитальных полетах.
202
Подтверждено также, что кривая доза-эффект для ряда даже радиоустойчивых линий клеток на начальном участке с ростом дозы снижается относительно быстро, а затем следует плато, после чего она принимает обычный вид. Повышенная радиочувствительность клеток в диапазоне 0,1-0,5 Гр выявлена у 38 из 50 клеточных линий, полученных из опухолей различных локализаций, нормальных фибробластов и эпителиальных клеток человека (Яр-моненко С.П., Вайнсон А.А., 2004). Такой же характер инактивации мы наблюдали для стволовых кроветворных клеток при экзоклонировании в костном мозге и в селезенке (Швец В.Н., Шафиркин А.В., 1979 (см. данные рис. 4.10).
Рис. 4.10. Выживаемость стволовых кроветворных клеток КОЕ (а) и сперматогоний (б) у мышей.
1 — клонирование в селезенке; 2 — клонирование в костном мозге бедренной кости; 3 — расчетная кривая для радиочувствительной фракции КОЕ; 4 — клонирование в елезенке при дополнительном введении Т-лимфоцитов
Для объяснения такой формы дозовой кривой есть несколько предположений. Одно связано с возможностью наличия гетерогенных по радиочувствительности популяций клеток, наиболее радиорезистентная часть которых находится в состоянии покоя Go (вне митотического цикла). Инактивация радиочувствитель
203
ной части клеток мобилизует процессы активации клеточного размножения и способствует большей скорости восстановления численности клеток в пострадиационном периоде.
Другое объяснение связано с предположением об индукции активности системы репарации ДНК в клетках. Высокая радиочувствительность при малых дозах связывается рядом авторов с наличием некоторого порога для стимуляции и более активного включения систем репарации. Предполагается, что активированная система репарации через 2 часа возвращается к норме. В экспериментах при облучении культур опухолевых клеток с интервалами между облучаемыми фракциями 3-4 часа (в течение 5 суток) гиперчувствительность воспроизводится вновь.
С уменьшением мощности дозы в диапазоне 1-10 сГр/мин радиочувствительность стволовых клеток уменьшается, параметр Do увеличивается приблизительно в 1,5 раза (Puro Е.А., Clark G.M., 1972). При более низкой мощности дозы (менее 70 сГр/сут) возможно установление несколько сниженного, но равновесного уровня стволовых кроветворных клеток, когда процесс радиационной инактивации компенсируется повышенным уровнем пролиферативной активности клеток (Juraskova V., 1967; Hupp E.W. etal., 1971; Лайта Л.Г., 1974; Chu-tse W.U., Lajtha L.G., 1975; Шафиркин A.B., 1983).
В разд. 3 представлены данные об изменении содержания клеток костного мозга и периферической крови при длительных непрерывных и фракционированных облучениях мелких лабораторных животных и крупных млекопитающих с различной дозой за сутки. Однако рассмотренные в этом разделе материалы свидетельствуют об ограниченном количестве подробных исследований по влиянию хронического облучения в дозе менее 1 сГр в сутки на систему кроветворения у экспериментальных животных с подробным анализом морфологических и цитокинетических показателей. Особенно мало работ с оценкой продукции клеток различных ростков кроветворения и качественных характеристик зрелых клеток в периферической крови при длительном непрерывном облучении. Практически отсутствуют наблюдения о воздействии на организм и систему кроветворения сочетанного воздействия, когда на фоне хронического облучения экспериментальные животные подвергались бы острым радиационным воздействиям в относительно больших дозах.
204
При постановке «Хронического эксперимента» перед нами стояла задача детального изучения изменений в системе кроветворения в организме собак при сочетанном радиационном воздействии хронического и острых облучений с получением подробной дозиметрической информации. Необходимо было проводить совокупный анализ изменений показателей, связанных с процессами кроветворения и кроворазрушения с учетом взаимного влияния и зависимости между ними. С этой целью изучали большое число морфологических и цитокинетических показателей. Исследовали изменение числа ядросодержащих клеток костного мозга всех уровней дифференцировки, соотношение красного и белого ростков, молодых и зрелых клеток в костном мозге (костномозговые индексы нейтрофилов и эритробластов), определяли митотический индекс способных к делению клеток и их пролиферативную активность, продолжительность клеточного цикла, распределение его по стадиям и скорость обновления клеток. Контролировали процессы созревания клеток и выход клеток в периферическое русло, оценивали костномозговой резерв зрелых клеток. Кроме того, анализировали изменение концентрации зрелых клеток в крови, их функциональную способность и скорость ухода из кровотока. Определяли продукцию клеток красного и белого рядов. Результаты подвергали тщательной статистической обработке.
Ввиду отсутствия однонаправленных изменений большинства показателей в костном мозге у разных животных в ответ на острые радиационные воздействия в дозе 42 сГр, а также закономерных изменений их в динамике у отдельных животных на каждое облучение, полученные данные на 7—60-е сутки после воздействия усредняли, чтобы увеличить объем выборки и снизить ошибки, обусловленные воздействием случайных факторов и методических погрешностей. Полученные средние данные в динамике от облучения к облучению служили характеристикой отклонения в системе от исходных и контрольных значений. С этой же целью (уменьшение дисперсии) результаты по некоторым показателям периферической крови (число эритроцитов и ретикулоцитов) обрабатывали с использованием метода скользящей средней.
Гематологические исследования проводили у всех собак «Хронического эксперимента». До начала облучения в течение года трехкратно исследовали периферическую кровь и двукратно кост
205
ный мозг. В качестве показателей были взяты: РОЭ, количество эритроцитов, гемоглобина, ретикулоцитов, лейкоцитов, эозинофилов, тромбоцитов, лейкограмма, число гематокрита, содержание миелокариоцитов и мегакариоцитов в 1 мм3 пунктата, миелограм-ма, парциальные нейтрофило- и эритробластограммы. В процессе облучения периферическую кровь обследовали 1 раз в 2 месяца, костный мозг один раз в 4 месяца. Для изучения реакции системы кроветворения на острые радиационные воздействия в дозе 42 сГр у 12 собак каждой группы исследовали периферическую кровь на 3-и, 7-е, 14-е, 21-е, 28-е и 60-е сутки после каждого облучения. Костный мозг для исследования забирали на 7-е, 28-е и 60-е сутки. Для выяснения гематологической равноценности групп к началу облучения проведено сравнение распределений основных показателей крови при помощи критерия X*. При этом существенных различий между группами собак не выявлено. Суммарные результаты 2—3-кратного обследования 150 животных до эксперимента позволили получить по каждому показателю достаточно представительную норму.
Цитокинетические исследования проводили на 54 собаках из общего числа обследуемых (по 6 собак в 1-й, 2-й и 4-й группах и по 12 собак в 3-й, 5-й и контрольной группах) в основном два раза в год. Обследование здоровых собак до начала облучения и собак контрольной группы в течение эксперимента позволило определить исходную физиологическую норму для собак и характер изменения цитокинетических показателей во времени.
Показатели периферической крови: количество эритроцитов, ретикулоцитов, содержание гемоглобина, величину гематокрита и диаметра эритроцитов, число тромбоцитов, лейкоцитов и лейко-грамму определяли с помощью принятых в радиационной гематологии методов. Методика забора костного мозга и принятые в радиационной гематологии методические приемы для исследования костного мозга и периферической крови подробно представлены в монографии (Григорьев Ю.Г. и др., 1986). Поэтому в настоящей книге мы на них останавливаемся кратко. Более подробно будут рассмотрены методические вопросы, связанные с точностью методик и с исследованием цитокинетических соотношений.
Костный мозг аспирировали, как правило, из грудины. Подсчет миелокариоцитов проводили в камере Горяева. Для общей миелограммы просматривали в мазках 500 клеток, а для парциальной — 200-300 клеток. Определяли следующие показатели: аб
206
солютное число ядросодержащих клеток в 1 мм3 пунктата, количество миелоидных и эритроидных элементов, общую миелограм-му и парциальные нейтрофило- и эритробластограммы.
Длительность генерационного цикла миелоидных и эритроидных элементов и отдельных его периодов определяли на основе цитофотометрического измерения количества ДНК в ядрах излучаемых клеток по их плоидности. Плоидность клеток костного мозга определяли путем отношения общей плотности окрашивания ядер к плотности окрашивания мазков сперматозоидов, имеющих гаплоидный набор хромосом. По плоидности ядер судили о периоде генерационного цикла, в котором находится данная клетка. Диплоидное (2п), тетраплоидное (4п) и промежуточное значения плоидности соответствовали Gj, G2 и S-периодам митотического цикла. Отношение числа клеток, имеющих то или иное значение плоидности, определяет относительную продолжительность Gj, G2 и S-периодов жизненного цикла клеток. Исходя из продолжительности митоза tM (относительно стабильный показатель), равного 0,8 ± 0,1 ч, и митотического индекса клеток I, выраженного в процентах, определяли общую продолжительность генерационного цикла Т = t м/1 х 100.
Продолжительность Gj, G2 и S-периодов рассчитывали на основе относительного (%) числа клеток в этих периодах tG1 G2>s = = Т х NG1 G2 s/100. Пролиферативную активность клеток костного мозга определяли с помощью авторадиографического метода. Клетки метили 3 Н-тимидином in vitro. Для клеток красного и белого рядов подсчитывали число меченых и немеченых костномозговых клеток различных стадий дифференцировки и вычисляли их соотношение в процентах (индекс меченых клеток). Кроме того, оценивали пролиферативную активность костномозговых клеток путем подсчета их митотического индекса.
Относительную величину костномозгового резерва гранулоцитов определяли на основе изменения количества лейкоцитов в периферической крови после выхода клеток из костного мозга в ответ на внутримышечное введение собакам пирогенала (очищенный липополисахарид). Кровь брали у животных из краевой вены уха до введения препарата и через 2, 4, 5, 6, 7 и 24 ч после введения. Об относительной величине костномозгового резерва судили по приращению концентрации гранулоцитов в периферической крови в максимуме по сравнению с ее исходным значением.
207
Величину костномозгового резерва эритроцитов оценивали на основе выхода их из костномозгового депо после бега собак на третбане в течение 15 мин со скоростью 5,2 км/ч. Для этого в периферической крови определяли концентрацию эритроцитов и ретикулоцитов, объем циркулирующей крови, плазмы крови и эритроцитарной массы до физической нагрузки и через 3~5 мин после нее. Для определения изменения объема циркулирующей крови использовали радиоактивную метку эритроцитов 51 Сг in vitro. Эту же методику применяли для определения периода полувыведения эритроцитов из периферического русла. На основе значений концентрации эритроцитов и их периода полувыведения Tj/2 из кровотока рассчитывали общую потерю эритроцитов за сутки V3 = 0,693 х М/Т1/2, гДе М — число эритроцитов в 1 мкл крови. В условиях эритроцитарного баланса, когда скорость разрушения эритроцитов компенсируется их продукцией, можно оценить также суммарную величину костномозговой продукции эритроцитов на 1 кг массы тела на основе соотношения G3 = 0,693 х М х V х 103/Т1/2, где V — объем крови на 1 кг массы тела (в расчетах его принимали равным 74 мл/кг).
Для оценки функциональной полноценности гранулоцитов определяли их функциональную активность путем подсчета количества фагоцитирующих клеток (в процентах) и их переваривающую способность (микробное число). Кроме того, определяли осмотическую стойкость гранулоцитов к гипо-тоническому раствору NaCl по методу Сторти в модификации В.А. Алмазова и Л.В. Головкиной по относительному числу сохранившихся клеток через 30, 60, 90 и 120 мин после начала гемолиза клеток в 0,2%-ом растворе NaCl. Жизнеспособность гранулоцитов оценивали также на основе исследования характера их флуоресценции под действием ультрафиолетового излучения, используя суправильную окраску акрихином оранжевым. Метод основан на способности красителя включаться в ДНК и РНК клеток при прохождении через клетку ультрафиолетовых лучей и давать характерное для этого красителя свечение. Под люминесцентным микроскопом МЛ-2 просматривали 100 гранулоцитов с различным характером флуоресценции (зеленый, оранжевый, красный), присущим соответственно нормальным клеткам, клеткам со сниженной и полностью утраченной жизнеспособностью.
Определение периода полувыведения гранулоцитов из центрального кровотока, циркулирующего и капиллярного гранулоци
208
тарных пулов и костномозговой продукции гранулоцитов проводили с использованием метки in vivo флуоресцирующим красителем — акрихином. Акрихин в количестве 4-5 мг на 1 кг массы тела животного вводили внутривенно в 15-20 мл физиологического раствора. Краситель обеспечивал мгновенную метку циркулирующих в центральном кровотоке гранулоцитов, причем гранулоциты капиллярного депо и костномозгового резерва оставались немечеными. Образцы крови по 0,2-0,5 мл брали из вены, в которую акрихин не вводили, через 3-5 мин, затем через каждые 30 мин. Каплю взвеси лейкоцитов после гемолиза эритроцитов и центрифугирования наносили на предметное стекло. Гранулоциты подсчитывали под люминесцентным микроскопом МЛ-2. В каждом образце крови подсчитывали 200 лейкоцитов. Количество меченых гранулоцитов через 3 мин после введения акрихина принимали за исходное, а в остальные сроки выражали по отношению к исходному в процентах. На основе динамики изменения относительной доли меченых гранулоцитов во времени, используя экспоненциальный участок кривой после равномерного перемешивания циркулирующего и капиллярного пулов клеток, определяли период полувыведения гранулоцитов Tt/2 из кровотока в ткани.
Циркулирующий пул гранулоцитов подсчитывали на основе концентрации лейкоцитов в 1 мкл крови (М), объема крови V на 1 кг массы тела: № = (М х V х К)103, где К — коэффициент поправки на содержание лимфоцитов, равный 0,76 (V = 74 мл/кг). Используя данные о степени снижения количества меченых гранулоцитов к моменту их равномерного перемешивания п (%), определяли общий гранулоцитарный пул крови: № = № х 100/п, а также число гранулоцитов, депонированное в капиллярах, — капиллярный гранулоцитарный пул (КГП): NK = № - №ч Полученные данные об общем гранулоцитарном пуле крови № и удельной скорости выведения клеток из кровотока, равной 0,693/1^/2, позволяли вычислить среднюю скорость оборота гранулоцитов Vr = 0,693 х №/Ti/2 и определить их продукцию за сутки Q г = 0,693 x№/Ti/2 в условиях поддержания равновесного общего количества гранулоцитов (Илюхин А.В., Зубенкова Э.С., Кахетелидзе М.Г., 1976; Илюхин А.В., Шашков В.С., Бурков-ская Т.Е. и др. 1982).
209
Состояние хромосомного аппарата клеток костного мозга изучали анафазным и метафазным методами. В первом случае хромосомные аберрации анализировали в поздних и ранних телофазах. Учитывали хромосомные и хроматидные мосты, простые и парные ацентрические фрагменты. В каждом препарате просматривали по 100 анателофаз. Материалом для исследования служили препараты, которые использовали для подсчета митотической активности клеток костного мозга. Определяли число хромосом, их структуру и форму, а также взаиморасположение в метафазной пластинке, учитывали так называемые ассоциации хромосом в метафазной пластинке, когда расстояние между их центральными участками было в несколько раз меньше расстояния между центромерами остальных хромосом данной метафазной пластинки.
Морфологические исследования показателей крови и костного мозга выполнены Т.Е. Бурковской. Длительность клеточного цикла и его отдельных стадий, а также пролиферативную активность клеток в миелоидном и эритро-бластических рядах определяли А.В. Илюхин и В.С. Путилов (Илюхин А.В., Бурковская Т.Е., Путилов Б.С., 1972). Митотическую активность клеток костного мозга и их цитогенетические изменения исследовали Т.М. Зухбая и Т.П. Цессарская. Период полувыведения эритроцитов из периферического русла и костномозговую продукцию эритроцитов определяли А.В. Илюхин и Л.Л. Семашко, цитокинетические показатели зрелых гранулоцитов, костномозговую продукцию гранулоцитов и их функциональную способность — А.В. Илюхин и Э.С. Зубенкова. Эти материалы представлены в работах (Цессарская Т.П., Бурковская Т.Е., Зубенкова Э.С. и др., 1972; Зубенкова Э.С., 1972; Зухбая Т.М., 1972а; Семашко Л.Л., 1972; Илюхин А.В. Шашков В.С., Бурковская Т.Е. и др., 1982).
Оценивая изменения в системе кроветворения, наблюдаемые у подопытных животных, следует подчеркнуть, что наиболее выраженные отличия от контрольных показателей наблюдали у животных 5-й группы, подвергнутых облучению в максимальных дозах. У животных этой группы отмечали снижение общего числа миело-кариоцитов максимально на 27% к 18-му месяцу облучения, которое сохранялось до конца 3-го года облучения. В последующие сроки имела место активация пролиферативных процессов и число миелокариоцитов приближалось к уровню контрольных животных.
У животных других групп среднее число миелокариоцитов оставалось в пределах изменения значений у собак контрольной
210
Рис. 4.11. Абсолютное содержание миелоидных(а) и эритроидных (б) клеток у собак 3-й группы (1); 5-й группы (2) и контрольной группы (3)
группы, и лишь у животных 3-й группы отмечена тенденция к снижению этого показателя начиная с 25-го месяца облучения. Это снижение у собак 3-й и 5-й групп, наблюдаемое в период 2-го и 3-го года облучения, связано в основном с относительным уменьшением числа клеток белого ряда, что максимально выражено к 30-му месяцу облучения (рис. 4.11). В то же время число клеток эритробластического ростка в костном мозге со временем на
растало параллельно с изменением этого показателя у животных контрольной группы и даже с несколько большей скоростью.
Такой характер изменения в системе кроветворения приводил к неуклонному и существенному уменьшению лейкоэритробластического отношения (ЛЭО) в костном мозге, которое изменялось у животных 5-й группы от 1,59 до 0,95 к концу 3-го года облучения (рис. 4.12).
В то же время у хронически облучаемых животных (1-3-я группы) и у собак 4-й группы заметного
О 10 20 30 40 50 60 70 80 Время от начала эксперимента, месяцев
Рис. 4.12. Изменение во времени лейкоэритробластического отношения у животных в процессе хронического и сочетанного облучения.
1 и 2 — данные для животных 5-й группы (пунктирная кривая для собак, облучавшихся 3 года); 3 — данные для контрольных животных; 4 — размах варьирования значений показателя у отдельных животных 3-й и 5-й групп
211
уменьшения ЛЭО не происходило. Указанные изменения у животных 5-й группы имели компенсаторный характер и были обусловлены как относительным перераспределением дифференцировки стволовых кроветворных клеток в направлении эритробластического ряда, так и усилением эритропоэза в костном мозге для обеспечения на необходимом уровне основной дыхательной функции крови.
Как мы отмечали ранее, усиление эритропоэза — одно из проявлений неспецифической реакции организма в ответ на внешние возмущающие воздействия, такие как кровопотеря, гипоксия, хроническое облучение. Восстановление эритропоэза обычно начинается значительно раньше и происходит более интенсивно, чем восстановление тромбопоэза или лейкопоэза после радиационного воздействия в сублетальных дозах.
Известно, что зрелый функциональный пул клеток в периферической крови достаточно резистентен. Эритроциты даже при остром радиационном воздействии в сублетальных дозах сохраняют функциональную способность и длительное время остаются в
кровотоке. Однако большинство исследователей отмечали сокращение продолжительности жизни эритроцитов, более раннее снижение жизнеспособности и уменьшение периода их циркуляции в крови (В.П. Макаров, Н.Б. Хрипач, 1965, 1966, 1967; Бонд с соавт., 1971; В.С. Воронин с соавт., 1975). При хроническом и сочетанном воздействии радиации (3-я и 5-я группы) отмечалось существенное снижение периода полувыведения эритроцитов из кровотока уже к концу первого года облучения (рис. 4.13).
О 10 20 30 40 50 60 70
Время от начала эксперимента, месяцев
Рис. 4.13. Зависимость периода полувыведения эритроцитов (а) и костномозговой продукции эритроцитов (б) от времени в процессе облучения.
1 и 2 — животные 3-й группы (пунктирная кривая для собак, облучавшихся 3 года);
3 и 4 — животные 5-ой группы с максимальной дозовой нагрузкой; 5 — собаки контрольной группы
212
Через 30-36 месяцев период полувыведения приближался к контрольным значениям, что отчасти можно объяснить относительно более молодой возрастной структурой эритроцитов в условиях усиленного эритропоэза и большей скоростью обновления эритроцитов. Однако в дальнейшем (через 5 лет) устойчивость эритроцитов вновь снижалась. Хотя уменьшение периода полувыведения эритроцитов в периферической крови указывает на их меньшую функциональную полноценность и жизнеспособность, тем не менее общее количество гемоглобина и количество гемоглобина в одном эритроците у облученных животных находилось в пределах физиологической нормы. Не изменялся и диаметр эритроцитов.
Таким образом, даже максимальное радиационное воздействие (5-я группа) не нарушало гемоглобин образовательных процессов. Возможно, не следует считать уменьшение периода полувыведения эритроцитов и несколько большую скорость их разрушения только как вредное проявление облучения, поскольку это есть одно из начальных звеньев, необходимых для увеличения интенсивности эритропоэза, в соответствии с современными схемами его регуляции, рассмотренными выше (Я.Г. Ужанский, 1968; С.И. Рябов, Г.Д. Шостка, 1973; Е.Н. Мосягина с соавт., 1976).
Несмотря на большую скорость разрушения эритроцитов у животных облучаемых групп (3-я и 5-я группы), концентрация эритроцитов в крови этих животных была постоянно выше, чем у контрольных собак, а у животных 5-й группы к 4-5-му году облучения значительно (на 0,7106 клеток в 1 мм3) превышала контрольные значения (рис. 4.14).
Повышение количества эритроцитов при хроническом облучении в небольших дозах в сутки наблюдали также в работах (Лаптева — Попова М.С., 1959; Джикидзе Э.К., 1964; Колмогорова Л.А., 1980). Повышение концентрации эритроцитов свидетельствует о значительном возрастании интенсивности эритропоэза у подопытных животных. Это подтверждают данные об увеличении костномозговой продукции эритроцитов уже к концу 1-го года облучения у животных 3-й и 5-й групп (рис. 4.13-6). Такое утверждение подчеркивается также значительным (почти в 2 раза) и длительным возрастанием концентрации ретикулоцитов у животных 2-й и 3-й групп (рис. 4.15).
У животных 5-й группы подобного увеличения числа ретикулоцитов не отмечалось, что связано с сочетанным характером об-
213
Рис. 4.14. Динамика изменения концентрации эритроцитов во времени. Обозначения те же, что на рис. 4.13
Рис. 4.15. Динамика изменения концентрации ретикулоцитов во времени.
1 и 2 —животные 2-й группы (пунктирная кривая и зачерненные знаки для собак, облучавшихся 3 года); 3 и 4 — животные 3-ей группы; 5 и 6 — животные 5-й группы; 7 — животные контрольной группы
214
лучения и обусловлено, с одной стороны, некоторым снижением костномозговой продукции клеток непосредственно после острых радиационных воздействий, с другой — ускоренным созреванием ретикулоцитов в ответ на большую скорость разрушения эритроцитов при острых облучениях.
При анализе эритробластограмм в миелограм-мах костного мозга наблюдали неуклонное снижение относительного числа молодых форм клеток эритробластического ряда (проэритробластов, базофильных эритробластов) и костномозгового индекса эритробластов (КИЭ), а также значительное повышение уровня полихроматофильных эритробластов (рис. 4.16 и 4.17).
У величение относительного числа полихроматофильных эритробластов происходило вследствие увеличения транзитного времени нахождения клеток в этом подотделе, задержки последующей дифференцировки и усиления пролиферативных процессов.
Как видно из данных рис. 4.18, продолжитель-
Время от начала эксперимента, месяцев
Рис. 4.16. Изменение костномозгового индекса эритробластов КИЭ во времени.
1 и 2 — животные 5-й группы (пунктирная кривая и зачерненные знаки для собак, облучавшихся 3 года); 3 — собаки контрольной группы; 4 — размах варьирования показателя у животных 3-й группы
Время от начала эксперимента, месяцев
Рис. 4.17. Изменение во времени относительного числа полихроматофильных эритробластов (а) и нормобластов (б) в эритробластограмме.
Обозначения те же, что и на рис. 4.16
215
Время от начала эксперимента, месяцев
Рис. 4.18. Изменения во времени длительности митотического цикла миелоидных (а) и эритроидных (б) клеток костного мозга.
1 и 2 — животные 3-й группы (пунктирная кривая для собак, облучавшихся 3 года); 3 и 4 — животные 5-й группы с максимальной дозовой нагрузкой; 5 — собаки контрольной группы
ность клеточного цикла эритробластов у животных 3-й группы значительно снижалась уже к 4-му месяцу облучения.
У животных 5-й группы наблюдалось в среднем постепенное снижение данного показателя. При этом отмечалась определенная закономерность, проявляющаяся в сокращении продолжительности генерационного цикла на 8-12% к 7-м суткам после острых радиационных воздействий. Затем к 60-м и 120-м суткам (началу следующего облучения) происходила частичная нормализация длительности цикла. Максимально выраженное снижение данного показателя у животных 5-й группы отмечали, начиная с 18-го месяца облучения.
Фотометрический метод определения плоидности клеток позволил определить изменение продолжительности Gj, G2 и S-периодов жизненного цикла клеток. Сокращение продолжительности цикла эритробластов в основном определялось сокращением продолжительности Gt и G 2-периодов.
216
Полученные данные о характере изменений эритропоэза согласуются с данными других исследователей (Лаптева-Попова М.С., 1959; Джикидзе Э.К., 1964; Джикидзе Э.К. и др., 1980; Колмогорова Л.А., 1980), которые в начальной фазе при хроническом облучении животных в относительно высоких суточных дозах (5-12 сГр) также отмечали повышение числа ретикулоцитов и эритроцитов в крови, клеток эритроидного ряда всех степеней зрелости в костном мозге на фоне постепенного уменьшения общего числа миелокариоцитов. В работе (Колмогорова Л.А., 1980) отмечалось увеличение числа проэритробластов, базофильных и полихроматофильных эритробластов при облучении морских свинок в дозе 12 сГр в сутки.
Усиление эритропоэза как в «Хроническом эксперименте» на собаках, так и в указанных исследованиях происходило в основном путем усиления пролиферативной активности эритробластов в результате сокращения длительности клеточного цикла. Но при больших уровнях радиационного воздействия усиление гемопоэза в начальной фазе хронического облучения осуществляется в результате замедления дифференцировки, увеличения транзитного времени пребывания клеток в делящемся пуле и увеличения пролиферативной активности всех делящихся клеток.
В рассматриваемом эксперименте в условиях хронического и сочетанного облучения собак в относительно небольших дозах в сутки компенсаторное усиление эритропоэза осуществлялось в основном путем повышения пролиферативной активности и сокращения продолжительности клеточного цикла полихроматофильных эритробластов, а также увеличения времени пребывания клеток в этом подотделе. Значительное уменьшение количества молодых клеток эритробластического ряда и костномозгового индекса эритробластов может быть связано как с радиационной инактивацией этих клеток, так и с уменьшением времени пребывания клеток в этих отделах при данных режимах радиационного воздействия. То, что, возможно, происходит не только радиационное опустошение указанных отделов, подтверждается значительной способностью сохранения численности этих отделов и даже ее увеличения при более высоких уровнях радиационного воздействия в сутки (Лаптева-Попова М.С., 1959; Колмогорова Л.А., 1980).
Как отмечалось выше, в костном мозге наблюдали постепенное уменьшение количества миелокариоцитов, особенно выраженное у собак 3-й и 5-й групп. Это изменение происходило в результате
217
снижения концентрации клеток белого ряда, которая к 30-му месяцу уменьшилась до уровня 70% по отношению к контролю (см. рис. 4.11). Анализ парциальных нейтрофилограмм показал, что происходит неуклонное снижение количества молодых делящихся клеток и костномозгового индекса нейтрофилов (КИН) у животных 5-й группы (рис. 4.19). К концу 3-го года облучения эти показатели уменьшились почти в 2 раза.
Наиболее выражен
Рис. 4.19. Изменение
> времени количества молодых форм клеток белого ряда
в костном мозге (а) и костномозгового индекса нейтрофилов (б) в процессе облучения
(обозначения те же, что на рис. 4.16)
ное снижение отмечали в отделах миелобластов и промиелоцитов при относительном сохранении количества миелоцитов. Уменьшение концентрации молодых форм клеток в миелобластичес-ком ростке, так же как и в эритробластическом, связано не только с их
радиационной инактивацией, но и с уменьшением времени нахождения клеток в этих подотделах, что подтверждается данными, полученными в работе (Муксинова К.Н., Суходеев В.В., Мурзина Л.Д., 1979). Авторы наблюдали существенное (в 2-3 раза) увеличе-
ние количества клеток в этих подотделах у крыс в начальный период хронического облучения при значительно большей дозе радиационного воздействия в сутки (50 сГр).
Относительное сохранение концентрации миелоцитов в костном мозге у собак связано с некоторой задержкой дифференцировки клеток на этой стадии и усилением их пролиферативной активности. В эксперименте отмечали существенное возрастание митотического индекса у животных 5-й группы начиная с 20-го месяца облучения, а у животных 3-й группы — с 25-го месяца. Длительность клеточного цикла при этом снижалась с 27 до 11-
218
14 ч (см. рис. 4.18). В результате указанных процессов миелоциты успевали совершить одно или два дополнительных деления, скомпенсировав снижение продукции менее дифференцированных отделов. Анализ данных, представленных на рис. 4.18, показал, что у животных 5-й группы острое облучение в дозе 42 сГр не вызывало закономерных изменений генерационного цикла миелоидных элементов костного мозга в пострадиационный период в отличие от эритроидных. Незначительное колебание длительности цикла после острых облучений связано с разной направленностью изменений отдельных периодов цикла.
В начальный период облучения это может быть связано с отсутствием существенных стимулов миелопоэза вследствие сравнительно небольших изменений в костном мозге и периферической крови, вызываемых острыми облучениями. В более поздний период каждое острое облучение проходило уже на фоне значительного усиления процессов клеточного обновления в миелоидном ряду. Продолжительность клеточного цикла была постоянно сниженной в целях поддержания продукции гранулоцитов на необходимом уровне и не изменялась от воздействия к воздействию. Отмеченный характер изменения концентрации молодых малодифференцированных клеток в эритробластическом и миелоидном рядах (их значительное опустошение) может быть одним из механизмов регуляции гемопоэза, стимулирующим дополнительную дифференцировку и размножение стволовых кроветворных клеток для поддержания продукции клеток красного и белого ростков при рассматриваемых режимах радиационного воздействия.
Таким образом, поддержание на повышенном уровне продукции клеток эритробластического ряда и на нормальном или на несколько сниженном уровне белого ряда обеспечивается усилением пролиферативной активности соответственно полихроматофильных эритробластов и миелоцитов. Данное положение находится в согласии с современными схемами регуляции гемопоэза. Известно, что при неблагоприятных условиях клетки указанного уровня дифференцировки способны некоторое время выполнять функции стволовых клеток (Lajtha, 1969, 1971).
Следует отметить, что значительное опустошение молодых форм клеток красного и белого рядов можно было бы связать со снижением продукции менее дифференцированных предшественников, если предполагать инактивацию радиочувствительной фракции стволовых кроветворных клеток, о чем говорилось выше.
219
Однако в работе (Муксинова К.Н., Суходеев В.В., Мурзина Л.Д., 1979). показано, что при более высоком уровне радиационного воздействия (50 сГр в сутки) у крыс, несмотря на снижение притока клеток со стороны менее дифференцированных предшественников в 6 раз, число миелобластов возрастает более чем в 2 раза, промиелоцитов — в 1,4 раза, а продукция миелобластов, промиелоцитов и миелоцитов — соответственно более чем в 3, 2 и 1,5 раза, что свидетельствует о значительных возможностях пролиферирующих отделов в отношении увеличения продукции клеток белого ряда. Тем не менее следует учитывать, что при высоких уровнях радиационного воздействия компенсаторные процессы организма мобилизуются почти полностью и пролиферативные процессы в кроветворной ткани значительно усиливаются. В условиях рассматриваемого эксперимента при ежесуточном облучении собак в относительно малых дозах и при небольшой стимуляции гемопоэза (в период 0-20-го месяца облучения продолжительность клеточного цикла слабо отличалась от контрольной) возможно, что начальное опустошение малодифференцированных отделов в костном мозге связано также со снижением продукции предшественников вследствие инактивации радиочувствительной фракции стволовых кроветворных клеток.
Уменьшение концентрации малодифференцированных клеток белого ряда обусловило относительное увеличение количества зрелых клеток в парциальной нейтрофилограмме и индекса созревания нейтрофилов в костном мозге. Анализ парциальных ней-трофилограмм позволил обнаружить у животных 3-й и 5-й групп снижение относительного количества палочкоядерных нейтрофилов и увеличение сегментоядерных нейтрофилов по сравнению с животными контрольной группы (рис. 4.20).
По-видимому, это обусловлено ускорением процесса созревания клеток данного уровня дифференцировки в условиях снижения костномозгового резерва гранулоцитов и уменьшения концентрации функционального пула в периферической крови.
Для определения резервных возможностей миелопоэза у подопытных и контрольных животных определяли величину костномозгового резерва гранулоцитов (рис. 4.21).
В ответ на введение пирогенала у животных отмечали лейкоцитоз, обусловленный быстрым выбросом гранулоцитов из костного мозга. У контрольных животных (96 измерений) приращение концентрации лейкоцитов в крови составило (7,2 ± 0,2)103 в
220
1 мкл и слабо уменьшалось с возрастом в процессе многолетнего обследования животных. В то же время по этому тесту удалось четко выделить реакцию животных отдельных групп с различной дозовой нагрузкой. Лишь собаки 1-й группы, получавшие годовую дозу 21 сГр, практически не отличались от контрольных животных. У вел ичение дозовой нагрузки во 2-й, 3-й и 5-й группах вызывало все большее снижение костномозгового резерва гранулоцитов уже к 6-му месяцу облучения. У животных 3-й и 5-й групп он уменьшался соответственно в 2,1 и 2,8 раза.
В дальнейшем костномозговой резерв гранулоцитов постепенно восстанавливался. Его увеличение в период 10-20 месяцев, по-видимому, связано с задержкой дифференцировки миелоцитов и увеличением числа делений клеток в этом от
Рис. 4.20. Изменение во времени индекса созревания нейтрофилов (а) и относительного количества зрелых клеток (б) в нейтрофилограмме.
I и II — для палочкоядерных нейтрофилов, III и IV — для сегментоядерных (остальные обозначения те же, что на рис. 4.13)
Время от начала эксперимента, месяцев
Рис. 4.21 Изменение костномозгового резерва гранулоцитов во времени.
1, 2, 3 и 4 — экспериментальные данные для животных 2-й; 3-й, 5-й и контрольной групп
деле, а также с ускоренным созреванием метамиелоцитов и палочкоядерных нейтрофилов. В более поздний период оно обусловлено также существенным усилением пролиферативной активности
221
миелоцитов. Тем не менее, у животных 5-й группы костномозговой резерв гранулоцитов оставался сниженным в период 20-36 месяцев эксперимента, а к концу облучения он еще больше уменьшился.
На рис. 4.22 представлена динамика изменения концентрации лейкоцитов, нейтрофилов и лимфоцитов в периферической крови у подопытных и контрольных животных в процессе многолетнего наблюдения.
Рис. 4.22. Динамика изменения абсолютного числа лейкоцитов (а), нейтрофилов (б) и лимфоцитов (в).
1 и 2 — животные 5-й группы, облучавшиеся 3 и 6 лет соответственно (пунктиром показаны данные у выведенных животных после 3-х летнего облучения); 3 — контрольные животные; 4 — размах варьирования концентраций клеток у животных 3-й, 5-й и контрольной групп.
Подробное исследование данных показателей в первые 3 года эксперимента позволило отчетливо выявить динамику их изменения после каждого очередного острого воздействия у животных 5-й группы. Анализируя данные, представленные на рис. 4.22, легко заметить начальное снижение концентрации указанных показателей уже к первому полугодию приблизительно на 20-22%. Сниженные в среднем показатели сохранялись приблизительно на постоянном уровне в процессе дальнейшего облучения.
222
Снижение числа лейкоцитов и нейтрофилов наблюдалось также у животных 2-й и 3-й групп в среднем на 10%. При этом характер изменения показателей в обеих группах был близким. Отчетливых достоверных изменений у животных 1-й группы не отмечалось. Отклонение концентрации лейкоцитов у собак 4-й группы было промежуточным между 3-й и 5-й группами, причем максимально оно составляло 15-20% после острых облучений в дозе 42 сГр.
Более подробно характер изменения числа лейкоцитов у животных 5-й группы после первых девяти острых облучений в дозе 42 сГр представлен на рис. 4.23.
Лейкоцитоз в начальный пострадиационный период отмечен лишь после первого облучения. К моменту второго облучения костномозговой
Рис. 4.23. Изменение числа лейкоцитов у собак 5-й группы после первых 9 острых облучений в дозе 42 сГр по отношению к исходному до облучения значению, %
резерв гранулоцитов оказался сниженным почти в 3 раза и при последующих облучениях лейкоцитоза практически не наблюдалось. Максимальное снижение концентрации лейкоцитов после острых воздействий не превышало 20%.
Восстановление исходного до воздействия числа лейкоцитов после первых пяти вспышек происходило в течение 30 суток. Процесс восстановления после 6-9-го воздействий несколько замедлялся и не завершался после 60 суток, что свидетельствовало о некотором снижении регенераторного потенциала кроветворной ткани при поглощенных дозах 380-700 сГр.
Представляет интерес наблюдение, сделанное на основе анализа характера изменения числа лейкоцитов у животных 5-й группы после острых воздействий. Если очередное воздействие происходило в период возрастания числа лейкоцитов (некоторого усиления процессов регенерации) после предыдущего облучения, то глубина последующего снижения числа клеток была более значительной (около 20%; 4-е, 6-е и 7-е облучения). Если облучение
223
проводили в момент уменьшения или сохранения уровня лейкоцитов (2-е, 3-е, 5-е и 9-е воздействия), то глубина лейкопении после него была незначительной (5-10%). Большая глубина поражения в первом случае связана, по-видимому, с несколько большей радиочувствительностью в условиях активации регенераторных процессов
Следует отметить, что разброс значений концентрации лейкоцитов и нейтрофилов у животных 3-й группы, начиная со 2-го и до 6-го года облучения, был меньшим, чем у животных контрольной группы. Также меньше подвержено колебаниям исходное до вспышек значение этих показателей у животных 5-й группы. У облученных собак были меньшими дисперсии и значения коэффициентов вариации индивидуальных величин по отношению к средним, что связано с уменьшением в этих группах костномозгового резерва и тканевого капиллярного депо клеток. Меньшая изменчивость средних значений и меньший разброс индивидуальных значений свидетельствуют о снижении реактивности лейко-поэза у облученных собак 3-й и 5-й групп, уменьшении костно-
мозгового и тканевого резерва клеток.
Время от начала эксперимента, месяцев
Рис. 4.24. Изменение циркулирующего (а) и капиллярного (б) пулов гранулоцитов в крови в зависимости от времени.
1 и 2 — животные 3-й группы (затемненные индексы для собак, облучавшихся 3 года); 3 и 4 — животные 5-й группы с максимальной дозовой нагрузкой; 5 — собаки контрольной группы
На рис. 4.24 представлена динамика изменений циркулирующего и капиллярного (тканевого) пулов гранулоцитов, полученных с использованием флуоресцирующего красителя — акрихина в качестве метки in vivo.
Циркулирующий гранулоцитарный пул, вычисляемый по концентрации лейкоцитов, повторяет практически характер изменения их числа в периферической крови. В то же время можно отметить, что у животных 3-й и 5-й групп уже к первому полугодию снижается по отношению к контрольному
224
и тканевый капиллярный пул гранулоцитов, который остается почти вдвое меньшим в течение 4 лет облучения, свидетельствуя об уменьшении тканевого резерва гранулоцитов. При последующем облучении разница между контрольными и подопытными
животными по этому показателю уменьшается, что связано со
снижением тканевого резерва гранулоцитов и у контрольных жи
вотных с возрастом.
Фагоцитарную активность нейтрофилов оценивали в первые 3 года эксперимента по количеству активных нейтрофилов в процентах и их переваривающей способности (микробному числу). Изменение указанных показателей во времени у животных 3-й, 5-й и контрольной групп показано на рис. 4.25.
Из представленных данных следует, что фагоцитарная активность нейтрофилов у подопыт
0 4 8 12 16 20 24 28 32 36
Время от начала эксперимента, месяцев
Рис. 4.25. Изменение фагоцитарной активности во времени у контрольных животных (кривая 1); у животных 3-й и 5-й групп — кривые 2 и 3 соответственно; а) — относительное количество фагоцитирующих нейтрофилов; б) — микробное число
ных и контрольных животных различается незначительно. Можно отметить лишь небольшое ее снижение у подопытных собак в период 16-24-го месяца облучения. Вариации показателей в различных группах проходили почти синхронно и обусловлены были в большей степени сезонным фактором.
Общую жизнеспособность лейкоцитов оценивали по их осмотической стойкости и гипотоническому раствору NaCl и характеру флуоресценции при суправильном окрашивании in vivo акрихином оранжевым. Исследование осмотической стойкости у здоровых животных показало, что через 120 мин после начала гемолиза остаются неповрежденными 24 ± 0,8% клеток. Это значение у контрольных животных мало изменялось с возрастом. У собак 3-й и 5-й групп к концу первого года и после 3 лет облучения стойкость лейкоцитов снижалась (неповрежденных клеток было менее 10%). Исследование флуоресценции гранулоцитов показало, что
225
максимум свечения у собак контрольной группы приходился на зеленую часть спектра (98% клеток), клетки с желтым свечением составляли 2,0 ± 0,5% и отсутствовали клетки с красным свечением (клетки, полностью утратившие жизнеспособность).
У подопытных собак всех групп в процессе облучения отмечено относительное увеличение числа гранулоцитов в периферической крови, частично или полностью утративших жизнеспособность. Наибольшее увеличение числа гранулоцитов с желтым и красным свечением ядра наблюдали у собак 3-й и 5-й групп. После 3 лет облучения у животных таких клеток было соответственно 8,0 и 12,5%, что достоверно превышало уровень контрольных собак. Таким образом, радиационное воздействие с максимальной дозовой нагрузкой 125 и 190 сГр в год вызывает значительное увеличение доли нейтрофилов со сниженной жизнеспособностью.
На рис. 4.26 представ
0 10 20 30 40 50 60 70 80
Время от начала эксперимента, месяцев
Рис. 4.26. Изменение периода полувыведения гранулоцитов (а) и их костномозговой продукции (б) во времени.
1 и 2 — животные 3-ей группы (пунктирная кривая для собак, облучавшихся 3 года); 3 и 4 — животные 5-ой группы с максимальной дозовой нагрузкой; 5 — собаки контрольной группы
лены данные по изменению во времени параметров кинетики гранулоцитов: периода полувыведения гранулоцитов из кровотока Tt/2 и костномозговой продукции гранулоцитов Qr, рассчитанной для равновесного
режима по скорости оттока гранулоцитов в ткани.
Анализируя полученные материалы, можно заметить, что уже к б-му месяцу у животных 3-й и 5-й групп существенно снижается период полу
выведения гранулоцитов в крови, который остается на сниженном уровне практически до конца облучения, за исключением временного подъема к 4-му году облучения. Повышенная скорость оттока гранулоцитов в ткани Vr в условиях пониженного уровня общего гранулоцитарного пула в крови (ОГПК) и некоторого снижения их жизнеспособности, по-видимому, носит
226
компенсаторный характер и способствует поддержанию практически исходного уровня фагоцитирующей функции. Действительно, за счет этого в первые 30 месяцев облучения абсолютная скорость оттока гранулоцитов в ткани Vr (расчетная величина костномозговой продукции) у животных 3-й и 5-й групп остается практически на исходном уровне и не отличается от контрольной. Вместе с этим остается на исходном уровне и абсолютная скорость поступления гранулоцитов из костного мозга.
• Восстановление костномозгового резерва в период с 6-го по 30-й месяц облучения и сохранение скорости поступления гранулоцитов из костного мозга, несмотря на уменьшение концентрации малодифференцированных клеток белого ряда, обеспечивается задержкой дифференцировки миелоцитов и увеличением в более поздний период скорости их пролиферации. Однако уже к концу 3-го года облучения и в течение 4-го года отмечено снижение абсолютной скорости оттока гранулоцитов в ткани и, следовательно, скорости выхода из костного мозга в кровь, что, по-види-мому, связано со снижением продукции клеток костного мозга и свидетельствует о недостаточности компенсаторных реакций организма в отношении поддержания необходимого уровня миело-поэза. К б-му году облучения разница в показателях у подопытных и контрольных животных уменьшается вследствие снижения продукции гранулоцитов у контрольных собак с возрастом.
Количество мегакариоцитов в костном мозге и тромбоцитов в периферической крови у собак всех подопытных групп существенно не отличалось от контрольного уровня в течение всего эксперимента. В первые 2 года эти показатели даже несколько превышали контрольный уровень (на 5-10%).
Анализ цитогенетических эффектов хронического облучения показал, что число хромосомных аберраций у собак 2-й и 3-й групп возрастало в основном в течение 1-го года эксперимента и в дальнейшем стабилизировалось на несколько повышенном уровне, зависящем от мощности дозы. Повышение количества аберрантных клеток у животных 1-й группы отмечено к концу 2-го года облучения. У собак 1-й, 2-й и 3-й групп доля клеток с аберрациями составила соответственно Об, 1,5 и 3,6% при отсутствии аберраций у животных контрольной группы. Мутагенный эффект радиационного воздействия у животных 5-й группы выражен меньше, чем у животных 3-й группы (в среднем 1,5%), что связано с удалением поврежденных клеток в условиях усиления регенера
227
торного процесса после острых облучений. Следует отметить, что с увеличением мощности дозы у собак повышается относительная доля стойких нарушений. Так, через 3 года после начала облучения у животных 3-й группы преобладали транслокации. У одной из собак после 2 лет облучения (250 сГр) было обнаружено стойкое повреждение в виде атипичной хромосомы. Клетки с микрохромосомой образовали клон, который вытеснил все другие клоны костномозговых клеток, очевидно, в связи с ускорением клеточного цикла, явившимся следствием этой аберрации. Анализ спектра поврежденных хромосом показал, что у облученных животных встречались преимущественно аберрации хроматидного типа: одиночные мосты и ацентрические фрагменты.
Данные цитогенетических исследований в отдаленном периоде после длительного облучения обезьян (Джикидзе Э.К., Косичен-ко Л.П., Куксова М.И., 1980) также свидетельствуют о возможности длительного сохранения эффекта последействия, выражающегося в повышенном числе аберраций хромосом и в сохранении аномальных клонов клеток в отдаленном периоде. У всех обследованных обезьян через 4—8 лет после облучения обнаружено по 2-3 аномальных клона клеток. Новые клоны имели маркеры в виде аномальных субметацентрических, акроцентрических или метацентрических хромосом. Частота однотипных перестроек в клоне была относительно невысока (в среднем 2-3%). Только у одной обезьяны через 8 лет после облучения в дозе 1600 сГр был обнаружен один аномальный клон клеток с частотой однотипных перестроек 13%. Длительное сохранение цитогенетических эффектов относится к наиболее важным последствиям проявления лучевого воздействия. Наличие селективных преимуществ в отношении скорости размножения аберрантных клонов клеток может быть одним из ведущих факторов для развития патологических процессов у облученных животных в отдаленный постлучевой период, в том числе определяющих возникновение предлейкозных и гипопластических состояний в кроветворной ткани.
4.8. Восстановление системы кроветворения после облучения и применения дополнительных воздействий
Для более глубокого исследования состояния системы кроветворения изучались скорость восстановления гемопоэза после пре
228
кращения облучения и характер реакции на дополнительные воздействия. У животных, выведенных после 3-летнего облучения, в 1-е полугодие периферическую кровь исследовали каждые 2 месяца, а в последующем кровь и костный мозг брали у собак через полгода. Параметры эритро- и лейкокинетики исследовали через 4 и 12 месяцев после окончания облучения. В каждой группе было 6 собак. Данные о восстановлении показателей системы кроветворения приведены на рис. 4.11-4.26 (зачерненные значки и пунктирные кривые).
Анализируя характер изменения гемопоэза после прекращения облучения, можно заметить, что показатели системы кроветворения возвращаются к контрольному уровню и удаляются от значений у животных, которых подвергали дальнейшему облучению. Это дополнительно подчеркивает достоверность отклонений и их выраженность в системе кроветворения у облученных животных. Из более ранних реакций по восстановлению гемопоэза следует отметить снижение (возвращение к норме) числа эритроцитов уже через 2-4 мес. после прекращения облучения у животных 3-й и 5-й групп (см. рис. 4.14). Затем через полгода вновь наблюдается тенденция к возрастанию числа эритроцитов у животных этих групп по сравнению с контрольными животными. При этом характер изменения концентрации во времени повторяет характер изменений у животных контрольной группы. Повышенный уровень эритроцитов сохранялся у животных 3-й группы в течение последующих 9 лет. У животных 5-й группы окончательное восстановление числа эритроцитов наблюдалось лишь через 3 года после прекращения облучения. В костном мозге рано (к 4-му месяцу) восстанавливалось относительное количество полихроматофильных эритробластов в парциальной эритробластограмме. Однако основная масса показателей, общее количество миелокариоцитов, лейкоэритробластическое отношение, относительное число молодых форм клеток красного и белого рядов, длительность генерационного цикла эритробластов и миелоидных элементов в костном мозге, костномозговой резерв гранулоцитов, абсолютное количество лейкоцитов, нейтрофилов в периферической крови, объем циркулирующего и капиллярного пулов гранулоцитов и их продукция восстанавливались лишь через год. К 15-му месяцу после прекращения облучения оставался сниженным период полувыведения эритроцитов (см. рис. 4.13). Восстановление числа лейкоцитов и нейтрофилов через год было временным, затем отме
229
чался повторный спад этих показателей и окончательное восстановление их наблюдали лишь через 4 года после прекращения облучения.
Таким образом, восстановление системы кроветворения после хронического и сочетанного облучения у собак 3-й и особенно 5-й групп было замедленным по сравнению с восстановлением после острых однократных воздействий в равноэффективных по глубине изменений дозах (Акоев И.Г., 1970; Григорьев Ю.Г. и др., 1975; Ульянова В.А. и др., 1987). Это свидетельствует о снижении восстановительного потенциала кроветворной ткани в условиях ускоренного обновления ее и длительного напряженного характера процессов регенерации, об ухудшении качества регуляции в ней и уменьшении компенеаторных возможностей организма по поддержанию гомеостаза жизненно важных систем организма.
Дополнительным специфическим воздействием на гемопоэз являлось проведенное после 3 лет облучения кровопускание. Исследование проводили на пяти собаках 5-й группы и 6 животных контрольной. Кровь брали из бедренных вен в количестве 25 мл на 1 кг массы тела. У собак 5-й группы к 5-м суткам отмечали усиление пролиферативной активности эритроидных элементов костного мозга. Количество меченых эритробластов (индекс меченых клеток) увеличилось почти в 2 раза. К 28-м суткам происходила нормализация данного показателя. На 20-е сутки период полувыведения эритроцитов уменьшился с 27,5 до 16,5 сут, возросла костномозговая продукция эритроцитов с 12 х 109 до 20,6 х 109 кле-ток/кгсут. Восстановление показателей происходило к 60-м суткам. Изменение кинетических параметров гемопоэза у контрольных собак было практически таким же, как и у облученных животных. Однако у подопытных собак было более выражено снижение числа эритроцитов к 5-м суткам после кровопускания и восстановление числа эритроцитов было более медленным и проходило с большим напряжением. Так, следующий за начальной ретикулоцитопенией постгеморрагический ретикулоцитоз отмечен у облученных животных в более ранние сроки (3-и сутки), чем у контрольных животных (5-е сутки), и он был более выраженным. Число ретикулоцитов увеличивалось в 3,1 раза, у контрольных собак в 2,5 раза.
Реакция со стороны костного мозга также свидетельствует о большем напряжении процессов регенерации у подопытных жи
230
вотных. У облученных собак на 5-е сутки количество молодых форм клеток (проэритробластов, базофильных эритробластов) возросло приблизительно в 1,5-2 раза по сравнению с контрольными животными, но через месяц эти различия сгладились. Изучение кинетических параметров миелоидного кроветворения (клеточного состава миелоидного ростка костного мозга и количества лейкоцитов периферической крови) не выявило реакции на кровопускание ни у облученных, ни у контрольных животных.
Таким образом, различия проявились в более выраженном гемолизе эритроцитов и уменьшении их количества в крови, более выраженной активации регенераторных процессов в костном мозге у облученных собак. Эффект компенсации у облученных животных обеспечивался мобилизацией более глубоких резервов системы кроветворения. Тем не менее число эритроцитов восстанавливалось медленнее, что также свидетельствует о снижении регенераторных возможностей гемопоэза.
Дальнейшее снижение компенсаторно-восстановительного потенциала кроветворной ткани обнаруживается при анализе восстановления показателей периферической крови после прекращения 6-летнего облучения собак (см. рис. 4.14, 4.15 и 4.22). Восстановление числа лейкоцитов и нейтрофилов у животных 5-й группы протекает так медленно, что эти значения приближаются к контрольному уровню лишь через 4 года после прекращения облучения (см. рис. 4.22). Практически у животных 5-й группы или не происходило или происходило очень медленно восстановление числа эритроцитов, концентрация которых оставалась на существенно более высоком уровне, чем у контрольных животных. Число ретикулоцитов при этом оставалось несколько ниже, чем в контроле.
Изменения у животных 3-й группы к концу б-летнего облучения менее значительны. Однако число эритроцитов у них оставалось выше, чем у контрольных животных во все сроки обследования в пострадиационный период, а число ретикулоцитов было сниженным приблизительно в 2 раза. У животных 2-й группы также отмечали тенденцию к снижению числа ретикулоцитов по сравнению с контрольными животными в пострадиационный период. Вероятно, общим для животных подопытных групп в отдаленный период после длительного 6-летнего облучения является снижение уровня ретикулоцитов, что, по-видимому, связано с ус
231
коренным их созреванием (при этом наблюдается повышенный уровень эритроцитов).
В целях более полного изучения состояния гемопоэза и восстановительной способности кроветворной ткани группа собак, содержащихся в помещении, через год после 6-летнего сочетанного облучения была подвергнута острому тестирующему облучению на гамма-установке «Старт» (Гладилкин А.Н. и др., 1981) в дозе 125 сГр. На рис. 4.27 и 4.28 представлена динамика изменения числа лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов в периферической крови после тестирующего облучения собак 4-й, 5-й и контрольной групп.
У собак 5-й группы отмечено достоверное снижение первоначальной реакции. Число лейкоцитов, нейтрофилов в первые часы после облучения возрастало очень слабо (5-15% против 20-80% в контрольной группе). Число лимфоцитов уменьшалось также в меньшей степени, чем у собак контрольной группы (соответственно на 20 и 40%).
Представленные данные свидетельствуют об изменении общей реактивности кроветворной ткани, несколько сниженном костномозговом резерве гранулоцитов, изменении характера протекания
Рис. 4.27. Изменение количества лейкоцитов (а) и тромбоцитов (б) после острого тестирующего облучения собак 4-й (1), 5-й-(2) и контрольной (3) групп в дозе 125 сГр
232
Время после облучения, сутки
Рис. 4.28. Изменение количества нейтрофилов (а) и лимфоцитов (б) после острого тестирующего облучения собак 4-й (1), 5-й-(2) и контрольной (3) групп в дозе 125 сГр
общей неспецифической реакции организма в ответ на воздействие радиации в указанной дозе. У животных 4-й группы степень проявления первичной реакции была ближе к степени проявления реакции у контрольных животных.
Степень уменьшения числа лейкоцитов, нейтрофилов, лимфоцитов и тромбоцитов по отношению к исходному до облучения уровню у животных 5-й группы оказалась несколько большей, что свидетельствует о наличии остаточного поражения в системе после сочетанного облучения. Представив поражение в кроветворной системе логарифмическим показателем |lg(N/N0)| по методике, предложенной в работе (Григорьев Ю.Г., Каландарова М.П., Попов В.И. и др., 1975), мы определили период полувосстановления поражения в системе кроветворения по изменению числа лейкоцитов и тромбоцитов (табл. 4.15).
Данные, представленные в табл. 4.15, подтверждают вывод о снижении компенсаторного восстановительного потенциала кро-233
ветворной ткани в 2—2,7 раза в результате предварительного сочетанного воздействия радиации в суммарной дозе 1140 сГр. Следует отметить, что скорость восстановления гемопоэза у контрольных собак в возрасте 7—9 лет, облученных в такой же дозе (125 сГр), оказывается значительно ниже, чем у молодых животных (Акоев И.Г., 1970; Григорьев Ю.Г., Каландарова М.П., Попов В.И. и др., 1975; Ульянова В.А. и др., 1987).
Таблица 4.15
Период полувосстановления количества лейкоцитов и тромбоцитов в периферической крови у животных 4-й, 5-й и 6-й групп, сутки
Группа Лейкоциты Тромбоциты
6(контроль) 150 78
4 290 100
5 410 150
Таким образом, у собак, получивших максимальную дозовую нагрузку (5-я группа), несмотря на то что изменения в периферической крови носили неглубокий функциональный характер и поддерживались приблизительно на постоянном уровне в течение 6 лет облучения, в костном мозге существенно снижалось количество молодых малодифференцированных форм клеток и лейкоэритробластическое отношение. Поддержание повышенной продукции клеток в красном ростке и сохранение на исходном уровне в белом осуществлялись путем замедления дифференцировки и усиления пролиферативной активности полихроматофильных эритробластов и миелоцитов. Отмечен более напряженный характер регенерации миелопоэза по сравнению с эритропоэзом. Длительность клеточного цикла в белом ростке уменьшается более значительно и приближается к минимально возможной, что свидетельствует о почти максимальном включении компенсаторных систем организма в усиление регенераторных процессов кроветворной ткани.
Длительная и напряженная работа компенсаторных систем организма для ускорения процессов регенерации и поддержания продукции клеток кроветворной ткани на необходимом уровне и компенсации изменений в других системах могла привести и, как
234
показано в последующих разделах, приводила к снижению компенсаторных возможностей организма. Как будет показано далее (в разд. 4.9 и 4.10) в «Хроническом эксперименте» отмечены признаки дегенеративных изменений и истощения в системе гипоталамус — гипофиз — кора надпочечников, в щитовидной и половых железах. Это, по-видимому, могло быть причиной того, что в системе миелопоэза, несмотря на существенное усиление скорости регенерации, снижается продукция грануло-цитов после 30-го месяца облучения и костномозговой резерв после 4-го года облучения, т.е. отмечали начальные признаки недостаточной компенсации в системе миелопоэза.
Экспериментальные данные по изучению восстановления после 3 лет облучения и кровопускания свидетельствовали о существенном замедлении регенераторной способности кроветворной ткани у собак 5-й группы при накоплении дозы 570 сГр в отношении как миелопоэза, так и эритропоэза. Облучение же в течение 6 лет (1140 сГр) приводило к значительному снижению компенсаторных возможностей организма по поддержанию гомеостаза жизненно важных систем организма, в том числе к значительному снижению восстановительного потенциала кроветворной ткани.
Радиационное воздействие на собак 3-й группы, как видно из данных, представленных на рис. 4.11-4.25, приводило в целом к меньшим изменениям гемопоэза. По сравнению с собаками 5-й группы у них отмечали:
1) такие же количественные изменения числа молодых малодифференцированных клеток эритробластического ряда и костномозгового индекса эритробластов (КИЭ), длительности генерационного цикла эритробластов, относительного количества палочко-и сегментоядерных нейтрофилов в костном мозге, величины капиллярного пула гранулоцитов, периода полувыведения гранулоцитов из кровотока и продукции гранулоцитов;
2) несколько меньшие изменения концентрации эритроцитов в крови, относительного количества полихроматофильных эритробластов, общего количества миелоидных клеток в костном мозге, длительности цикла клеток миелобластического ряда, костномозгового резерва гранулоцитов (КМРГ), абсолютного числа лейкоцитов, нейтрофилов и лимфоцитов в периферической крови;
3) отсутствие изменений по сравнению с контролем по количеству миелокариоцитов, лейкоэритробластическому отношению
235
(ЛЭО) и концентрации малодифференцированных клеток белого ряда в костном мозге.
Облучение собак 4-й группы приводило также к меньшей глубине изменения гемопоэза по сравнению с собаками 5-й группы. Степень отклонения значений показателей от контрольных была близкой к изменениям, наблюдаемым у животных 3-й группы. Радиационное воздействие на собак 1-й и 2-й групп не вызывало серьезных сдвигов в системе кроветворения в течение всех 6 лет облучения. Показатели гемопоэза находились в среднем в пределах колебаний тех же показателей контрольных животных. Можно только отметить больший размах варьирования как индивидуальных значений у подопытных животных указанных групп на каждый срок обследования, так и несколько большую лабильность средних значений во времени в процессе длительного наблюдения по сравнению с контрольными животными.
Значительный интерес представляет сопоставление полученных результатов с данными работы (Джикидзе Э.К., Косичен-ко Л.П., Куксова М.И., 1980), в которой исследовали отдаленные последствия длительного фракционированного облучения обезьян в дозе 1,0-4,9 сГр в сутки. Отмечен близкий характер изменений, как и в рассмотренном «Хроническом эксперименте». В отдаленный период (через 4-8 лет) после облучения в дозах 826-1600 сГр авторы наблюдали снижение числа молодых и зрелых клеток в миелоидном ряду и костномозгового индекса нейтрофилов, уменьшение молодых форм клеток красного ростка и увеличение относительного количества полихроматофильных эритробластов в миелограммах.
В рассматриваемом эксперименте на собаках у выведенных после 3 лет облучения животных отмечали восстановление ряда ци-токинетических и морфологических показателей в костном мозге через год после прекращения облучения. Приближались к норме лейкоэритробластическое отношение, число молодых форм клеток красного и белого рядов, костномозговой резерв гранулоцитов, относительный уровень полихроматофильных эритробластов. Однако, по-видимому, возможны повторные осложнения лучевых проявлений в отдаленный период и отклонение перечисленных показателей от нормы, о чем свидетельствуют результаты эксперимента, проведенного на обезьянах, и что подтверждается также повторной волной осложнений, наблюдаемых нами в периферической крови у собак в более поздние сроки. Доказательством этого
236
является то, что после 6 лет облучения восстановление числа лейкоцитов у животных 5-й группы протекает слишком медленно (через 4 года после прекращения облучения) и практически не наблюдается восстановление числа эритроцитов, количество которых остается на повышенном уровне.
Указанные факты свидетельствуют о повышении лабильности в системе кроветворения, нарушении нормальной ее регуляции и снижении компенсаторных возможностей организма по поддержанию его гомеостаза после облучения в дозах 570 сГр и выше.
4.9. Сперматогенез и воспроизводительная способность животных в процессе и после 3 и 6 лет облучения
В рассмотренном выше многолетнем эксперименте по хроническому и сочетанному облучению собак с различным уровнем радиационного воздействия количественно и качественно спермо-продукцию и оплодотворяющую способность собак изучали Н.Л. Федорова и Б.А. Маркелов, гистоморфологические исследования проводили Г.И. П лахута-Плаку тина, Е.А. Савина, В.И. Яковлева, цитокинетические и цитохимические исследования семенников — В.Г. Кондратенко и Л.Ф. Ганзенко. Эти исследования отражены в работах (Федорова Н.Л., 1972; Кондратенко В.Г., Федорова Н.Л., 1972; Плахута-Плакутина Г.И., 1972; Савина Е.А., Яковлева В.И., Панкова А.С., 1972).
В работе использовано 36 беспородных собак самцов и 42 самки массой 10-14 кг в возрасте 1,5-2 лет. Все животные были подразделены на 6 групп (5 подопытных и одна контрольная) в каждой группе по б самцов и самок. Распределение самцов по группам, а также мощность дозы и суммарные дозы облучения представлены в табл. 4.16.
Общее время облучения 6 лет. Обследование собак в течение одного-двух лет эксперимента проводили ежемесячно. На 3-м году облучения исследовали собак по показаниям, но не реже одного раза в 4 месяца. Далее, в последующие 6 лет животных обследовали ежемесячно. Состояние функциональной активности семенников оценивали по количественным и качественным показателям спермы. При этом учитывали объем эякулята, концентрацию сперматозоидов в 1 мл и их абсолютное число в эякуляте, подвижность сперматозоидов и число атипичных форм клеток с учетом частоты и характера разных видов их структурных повреждений.
237
Таблица 4.16
Условия облучения при изучении воспроизводительной способности собак в « Хроническом эксперименте*
Г руппа Мощ-ность ДОЗЫ, сГр/сут Суммарная среднетканевая поглощенная доза, сГр
За один год За 3 года За 6 лет
хроническое облучение повторные острые облучения всего
1 0,06 21 — 21 63 126
2 0,17 62 — 62 186 372
3 0,34 125 — 125 375 750
4 0,17 62 42; 8 и 8 120 360 720
5 0,17 62 42; 42; 42 188 524 1128
6 — — — — — —
Для оценки оплодотворяющей способности спермы самцов, подвергаемых хроническому лучевому воздействию в дозе 125 сГр в год и комбинированному облучению в дозе 188 сГр в год, их спаривали с самками. Вязки проводили в следующих вариантах: 1) не облучаемые самцы и самки; 2) облучаемые самцы и не облучаемые самки; 3) облучаемые самцы и облучаемые самки. О воспроизводительной способности самцов судили по срокам развития беременности, а также массе щенков при рождении.
На рис. 4.29 представлена динамика изменения концентрации сперматозоидов (млн/мл) у собак контрольной и хронически облучаемой групп в процессе 3- и 6-летнего облучения, а также после его окончания.
Как видно из рисунка, облучение с наименьшей мощностью дозы 21 сГр/год (0,06 сГр/сут) уже приводило к снижению концентрации сперматозоидов, начиная с 20-го месяца эксперимента, хотя отклонение от контроля не превышало размаха варьирования значений у животных контрольной группы и степени изменения показателя у них во времени. Как свидетельствуют данные настоящего эксперимента и результаты работы (Casarett G.F.,
238
6
4| । 1 । | i i i i । i i.i i i । i । I _ t ,
0 10 20 30 40 50 60 70 80 90 100 110
Время от начала эксперимента, месяцев
Рис. 4.29. Динамика изменения концентрации сперматозоидов в эякуляте у собак при хроническом облучении.
1 и 2 — животные 1 и 2-й групп соответственно; 3 и 4 —животные 3-й группы (пунктирная кривая и зачерненные знаки для собак, облучавшихся 3 года);
5 — контрольная группа
1964), абсолютное количество сперматозоидов и их концентрация являются достаточно лабильными показателями, в норме изменяющимися в 1,5-2 раза и даже более.
Увеличение мощности дозы до 62 сГр/год (0,17 сГр/сут) приводило к значительному отклонению концентрации сперматозоидов от контроля, начиная с 8 10-го месяца облучения. Глубина изменений была лишь несколько большей, чем у животных 1-й группы. При облучении в суммарной дозе 125 сГр/год (0,34 сГр/сут) происходило существенное снижение концентрации сперматозоидов, которое отмечалось приблизительно в те же сроки, т.е. начиная с 8-10-го месяца облучения, затем нарастало со временем и достигало к концу 2-го года приблизительно 25-30% уровня концентрации у контрольных животных.
Характер изменений концентрации сперматозоидов с начальным отклонением от значений у контрольных животных и выходом на новый, зависимый от мощности дозы уровень, может быть
239
объяснен развитием равновесного состояния, когда процессы инактивации клеток компенсируются усилением регенерации в ткани и увеличением продукции клеток. Данный характер изменений является общим для обновляющихся тканей в организме и в значительной степени согласуется с изменениями в системе кроветворения, отмеченными нами выше в разд. 4.8. Достоверность гипотезы подтверждается изменениями концентрации сперматозоидов в зависимости от мощности дозы и возвращением показателей к норме у собак всех групп в случае прекращения облучения после 3 и 6 лет облучения.
На рис. 4.30 представлена динамика изменения концентрации сперматозоидов у животных 4-й и 5-й групп с сочетанным облучением. У собак 4-й группы не удается отметить реакцию системы
Рис. 4.30. Динамика изменения концентрации сперматозоидов в эякуляте собак 4-й и 5-й групп, подвергающихся сочетанному облучению. Стрелками указано время нанесения острых воздействий. 1 — животные 4-ой группы; 2 и 3 — животные 5-ой группы (пунктирная кривая и зачерненные знаки для собак, облучавшихся 3 года); 4 — животные контрольной группы
240
на повторные воздействия в дозе 8 сГр, наносимые с интервалом 4 месяца. Однако кинетика изменений в ответ на острые воздействия в дозе 42 сГр, осуществляемые один раз в год, проявилась достаточно четко и степень изменений при каждом следующем воздействии оказалась приблизительно одинаковой.
Воздействие в указанной дозе приводило, как правило, к начальному уменьшению концентрации сперматозоидов через 2 месяца после облучения. Усиление дегенеративных процессов происходило в последующие 4 месяца, так что минимальный уровень концентрации клеток приходился на 6-й месяц после очередного облучения.
Уменьшение количества клеток в ответ на каждое облучение было приблизительно 8-10-кратным, что свидетельствовало о высокой радиочувствительности сперматогенного эпителия. Через полгода после облучения отмечено начало восстановления концентрации сперматозоидов. Это связано с усилением регенераторных процессов в эпителии, в результате которых через полгода к началу следующего воздействия происходило восстановление численности сперматозоидов.
Кинетика развития поражения в сперматогенном эпителии в значительной степени связана с указанными различиями в радиочувствительности отдельных стадий сперматогенеза и длительностью нахождения клеток под облучением. Многократное повторение однотипной картины изменения концентрации сперматозоидов позволило оценить некоторые цитокинетические параметры сперматогенеза. Длительность сперматогенного цикла в норме у собак может, по-видимому, достигать 180 суток, причем стадии от сперматогоний типа Б до сперматозоидов клетки происходят за период, приблизительно равный 60 суток. Время полуобновления сперматозоидов, полученное на основе анализа скорости уменьшения их концентрации, оказалось равным приблизительно 40 суткам.
Восстановление концентрации сперматозоидов от воздействия к воздействию замедлялось. Период полувосстановления поражения в ткани, которое выражали логарифмическим показателем в виде | lg(N/N0) |, где No — концентрация сперматозоидов перед текущим облучением у собак контрольной группы после 1-го, 2-го, 3-го и 5-го воздействий был соответственно равен 69, 77, 90 и 138 суткам (Григорьев Ю.Г. и др., 1975, 1986). Тем не менее существенного увеличения поражения в этой группе не происходило,
241
так как к началу следующего воздействия (через 365 суток) поражение от предыдущего воздействия успевало практически восстановиться. Средняя величина поражения у собак 4-й группы определяется снижением концентрации сперматозоидов на 78-80% и незначительно отличается от поражения у собак 3-й группы. Максимальная величина поражения у животных 4-й группы с сочетанным облучением была большей, чем при только хроническом облучении приблизительно в той же дозе за год, что обусловлено в основном острыми воздействиями в дозе 42 сГр. Концентрация сперматозоидов в эти периоды составляет 7-10% от контроля.
В 5-й группе острые радиационные воздействия в дозе 42 сГр проводили через 4 месяца. Каждое последующее облучение соответствовало по времени периоду развития радиационного поражения от предыдущего. Поражение в системе аккумулировалось от воздействия к воздействию. В связи с этим у животных этой группы наблюдалось неуклонное снижение концентрации сперматозоидов через 3 года приблизительно в 30 раз, а к концу 6-го года до уровня менее 1% (в 300 раз и более).
Наряду с количественными изменениями сперматозоидов у облучаемых животных отмечали качественные нарушения свойств спермы. Как показано на рис. 4.31 и 4.32, начиная с 8-10-го месяца облучения, наблюдается значительное снижение подвижности сперматозоидов и увеличение числа атипичных патологических форм клеток у собак 3-й и особенно 5-й групп.
Подвижность сперматозоидов снизилась у животных 3-й и 5-й групп к концу 4-го года облучения соответственно в 1,6 и 4,5 раза, а число атипичных форм клеток увеличилось к этому сроку в 3,5 и 6,2 раза и оставалось затем приблизительно постоянным. При этом преобладало число клеток с множественными структурными изменениями. По мере развития радиационного повреждения в системе сперматогенеза виды структурных нарушений становились разнообразнее, и число их постепенно нарастало. Отмечали различные уродливые формы клеток. Кроме клеток с завитым жгутиком и жгутиком, закрученным вокруг соединительной части, имелись повреждения головки и соединительной части.
Количественное изучение спермопродукции и анализ спермо-грамм у животных 4-й группы показали значительно более выраженные нарушения как числа сперматозоидов, так и качества спермы по сравнению с животными 3-й группы, несмотря на приблизительно одинаковый уровень доз за год (120 и 125 сГр/год),
242
Рис. 431. Изменение подвижности сперматозоидов от времени облучения собак.
1 и 2 — животные 3-й группы (затемненные индексы для собак, облучавшихся 3 года); 3 и 4 — животные 5-ой группы с максимальной дозовой нагрузкой; 5 — собаки контрольной группы
Рис. 4.32. Изменение относительного числа атипичных форм сперматозоидов от времени облучения собак (обозначения те же, что на рис. 4.31)
243
что связано с сочетанным характером облучения и обусловлено в основном острыми воздействиями в дозе 42 сГр.
При хроническом облучении с мощностью дозы 63 сГр/год (2-я группа), начиная с 10-го месяца, параллельно со снижением концентрации сперматозоидов уменьшалась также подвижность сперматозоидов приблизительно на 20-40% и увеличивалось число атипичных форм клеток. Количественные и качественные изменения спермы у животных этой группы были значительно меньше выражены, чем у животных 3-й группы. Облучение с мощностью дозы 21 сГр/год (1-я группа) не вызывало достоверного изменения качественного состава спермы. Гистоморфологи-ческое исследование тестикул у подопытных и контрольных собак показало, что у животных 1-й группы (21 сГр/год) облучение в течение 6 лет не привело к видимым гистологическим изменениям в семенниках (табл. 4.17).
В семенных канальцах 1-й группы был отмечен высокий уровень активности герминативного эпителия. Число различных клеточных элементов, приходящихся на один каналец, достоверно не отличалось от контрольных значений. Количество клеток уменьшалось не более чем на 10%.
В семенниках животных, облучавшихся в дозе 62 сГр в год (2-я группа), уже через год облучения обнаружились отдельные признаки дистрофических изменений, выразившиеся в разрежении клеточных элементов сперматогенного эпителия, пикнозе ядер сперматогоний, скоплении клеточного детрита в просветах канальцев, набухании цитоплазмы фолликулярных клеток. По мере накопления дозы указанные изменения прогрессировали и к концу облучения (через 6 лет) отмечали достоверное снижение как общего количества клеточных элементов, приходящихся на каналец, так и числа клеток различных стадий развития от сперматогоний до сперматозоидов, хотя указанное снижение, за исключением числа сперматид, не превышало 20%.
Гистологические исследования показали, что облучение животных с мощностью дозы 125 сГр/год (3-я группа) приводило к начальным признакам структурных изменений семенников в виде дископлексации рядов, уменьшения количества сперматозоидов и увеличения числа их атипичных форм, набухание цитоплазмы клеток Сертоли и скопление клеточного детрита в просветах (Г.И. Плахута-Плакутина, 1972).
244
245
Таблица 4.17
Клеточный состав элементов сперматогенного эпителия собак на 6-м году облучения М ± m (число клеток на один каналец)
Группа Суммарная доза облучения за 6 лет, сГр Сперматогонии Сперматоциты Сперматиды Сперматозоиды Клетки Сертоли Общее количество клеток на один каналец
Контрольная — 15,1 ± 0,8 41,8 ± 2,5 72,8 + 3,8 32,4 ± 2 ,1 13,4 ± 0,5 175,5 ± 5,4
1 126 (хронич. обл. 21 сГр/год) 14,7 ± 0,8 37,0 ± 1,7 61,1 ± 3,8 29,1 ± 3,2 12,3 ± 1,0 154,2 ± 11,3
2 372 (хронич. обл. 63 сГр/год) 12,1 ± 0,96* 32,0 ± 2,7 45,5 ± 5,0 28,1 ± 3,4 11,4 ± 1,0 129,1 ± 9,6*
3 744 (хронич. обл. 63 сГр/год) 7,3 ± 1,07** 16,8 ± 1,6** 17,9 ± 1,9** 12,7 ± 1,9** 12,7 ± 0,7 67,4 ± 4,0**
4 720 хронич. обл. + + острое 5,8 ± 0,17** 13,2 ± 1,5** 11,7 ± 2,3** 6,3 ±1,8** 12,5 ± 1,06 49,5 ± 5,4**
5 1128 хронич. обл. + + острое 1,1 ± 0,17** 0,6** 0,4** — 16,6 ± 1,0 18,7 ± 1,8**
*р < 0,01
**р < 0,001
У животных 3-й и 4-й групп уже на 1-м году эксперимента (на 8-10 месяцах) определяли начальные признаки нарушения процесса сперматогенеза. При этом комбинированное воздействие хронического и повторных острых облучений вызывало более выраженные изменения герминативного эпителия. Семенные канальцы были деформированы, часто лишены просвета и уменьшены в размерах. В большинстве канальцев определяли только один-два ряда половых клеток. Уже к этому сроку отмечалось снижение количества клеток на 40%, приходящихся на один каналец. Встречались единичные сперматогонии с пикнотичным ядром и ярко эозинофильной цитоплазмой. В небольшом количестве сперматоцитов были видны измененные кариокинетиче-ские фигуры. Сперматиды не имели четких контуров, ядра их были светлые с небольшим количеством хроматина и крупным ядрышком. В клетках Лейдига увеличивалось содержание липидов по сравнению с количеством липидов у контрольных собак и животных 3-й группы.
Серьезные гистоморфологические нарушения уже на 1-м году облучения были отмечены и у животных 5-й группы. Структурные изменения выражались в распространенном запустевании семенных канальцев с сохранением в них только клеток Сертоли и единичных сперматогоний, образовании клеточного детрита и семенных шаров. Лишь в отдельных канальцах сохранились очаги немногочисленных сперматогоний и клеток последующих стадий развития с небольшим количеством сперматозоидов. Наряду с деструктивными изменениями начинали развиваться и атрофические, о чем свидетельствовало появление большого числа запустевших канальцев.
Выраженные морфологические изменения у собак 3-5-й групп сохранялись и на 2-м году облучения. Отмечено статистически достоверное снижение массы семенников собак (на 44% ниже контрольной), которое сопровождалось резким запустеванием семенных канальцев с редукцией большинства клеток разных генераций и сохранением только клеток Сертоли. Увеличение дозы облучения приводило к значительно большему, чем у контрольных животных, накоплению липидов и ШИК-положительного материала в интерстициальной ткани, базальных мембранах и оставшихся элементах сперматогенного эпителия.
На 3-4-м годах эксперимента оставались те же морфологические изменения, которые возникли в предыдущие годы облуче
246
ния. Однако по мере увеличения дозы степень атрофических и склеротических изменений в половых железах усиливалась. Весовой индекс семенников — снизился на 53-75% по сравнению с контрольным. Через 4 года облучения у животных 5-й группы отмечали запустевание семенных канальцев с редукцией поздних клеточных генераций, сохранялись лишь клетки Сертоли, а также единичные сперматогоний типа А. Нарастали склеротические процессы: разрастание соединительной ткани вокруг семенных канальцев, коллагенизация, склероз стенок сосудов.
К концу 6-го года облучения у собак 3-й группы (суммарная доза 750 сГр), как и у животных 4-й группы, подвергавшихся сочетанному облучению в суммарной дозе 720 сГр, было отмечено параллельное снижение массы половых желез (более чем в 2 раза) и нарушение сперматогенного цикла, что проявилось в изменении количественного соотношения разных форм клеточных элементов и уменьшении числа клеток в канальцах. Гистологическая картина свидетельствовала о неравномерном созревании сперматоген-ных клеток. В большинстве канальцев отмечалось уменьшение количества всех элементов семяродного эпителия, особенно клеточных генераций поздних стадий развития, очаговое запустевание отдельных канальцев или их групп.
У животных 3-й и 4-й групп через 6 лет облучения, несмотря на значительную редукцию клеток эпителия, в канальцах сохранялся определенный резерв сперматогоний (соответственно 7,3 ± 1,07 и 5,8 ± 0,8 на один каналец), а в 5-й группе сперматого-нии были единичными.
При накоплении значительной суммарной дозы к концу 6-го года эксперимента (1140 сГр) у собак этой группы была резко выражена атрофия половых желез. Масса последних уменьшена по сравнению с контрольной в 3 раза. В большинстве канальцев сохранялись лишь клетки Сертоли и единичные сперматогоний. Атрофические изменения сперматогенного эпителия сопровождались уменьшением размеров канальцев и утолщением базальных мембран, а также выраженным склерозом межуточной ткани и гиперплазией клеток Лейдига. (Плаху та-Плаку тина Г.И, 1972; Федорова Н.Л, 1972).
Анализируя данные табл. 4.17, можно сделать вывод, что к концу 6-го года облучения у собак 1-й и 2-й групп сохраняются возможности для репаративной регенерации ткани семенников за счет сохранения значительного количества сперматогоний, спо
247
собных к делению и образованию клеток последующих стадий развития. У животных 3-й и 4-й групп, несмотря на большое снижение числа клеток сперматогенного эпителия, отмечено наличие существенного «резерва» сперматогоний (соответственно 7,3 и 5,8 сперматогоний на один каналец). У животных 5-й группы при выраженном угнетении процесса сперматогенеза, приведшем к стерильности, число сперматогоний типа А сохраняется на сравнительно высоком уровне от 1-го до 6-го года облучения (6,3 и 7,2% контроля соответственно). Одновременно с атрофическими изменениями сперматогенного эпителия у собак 5-й группы отмечали гипертрофию и прогрессивное увеличение количества клеток Лейдига, образование доброкачественных опухолей из этих клеток (лейдигомы). Значительно увеличилось количество липидных включений.
Согласно расчетам, дифференцировка сперматогоний типа Б у человека возможна, если относительное число сперматогоний типа А (стволовых клеток) составляет не менее 2-3% нормы. Таким образом, на основании проведенного «Хронического эксперимента» можно сформулировать важный вывод, что даже у животных 3-й, 4-й и 5-й групп в течение 6 лет облучения в высоких дозах за год отмечали относительную сохранность стволовых клеток, что обеспечивает возможность восстановления сперматогенного эпителия при прекращении облучения.
Цитокинетические исследования, проводимые в работах (Кондратенко В.Г., Ганзенко Л.Ф., 1972, 1975), показали, что при хроническом облучении животных 1-3-й групп происходит стимуляция деления сперматогоний типа А. Авторы наблюдали даже увеличение их числа у животных 1-й и 3-й групп через 2 и 4 года после начала облучения, что свидетельствует об увеличении скорости регенерации в ткани. Однако, несмотря на сохраняющуюся потенцию к обновлению сперматогоний, процесс их дифференцировки у собак 2-й и 3-й групп был заметно нарушен, что приводило к прогрессирующему снижению числа клеток последующих генераций, особенно выраженному у собак 3-й группы.
Наряду со снижением числа клеток в более поздних стадиях изменялась продолжительность стадий сперматогенного эпителия, хотя общая длительность цикла сперматогенеза, по мнению исполнителей, не нарушалась. Отмечены также нарушения в процессе деления сперматогоний при хроническом облучении животных 2-й и 3-й групп. Ядра увеличивались в объеме, хромосомы
248
подвергались фрагментации. Сперматоциты второго порядка поражались чаще всего в начале профазы мейоза и погибали путем хромолизиса. В отдельных канальцах образовывались многоядерные клетки с ядрами сперматид. Анализ состояния ядерных нуклеопротеидов в клетках, которые не имели видимых морфологических изменений, показал, что прочность связи ДНК с белком у них нарушена. Хотя при всех значениях мощности дозы не было отмечено изменения характера накопления гистонов и их локализации в хроматине клеточных ядер, а также в синтезе специфических для половых клеток гистоновых белков, стабилизирующих хромосому, тем не менее их связь с нуклеиновыми кислотами нарушалась.
Цитологические исследования семенников у собак с сочетанным характером облучения (4-я и 5-я группы) показали дальнейшее более выраженное нарушение процесса дифференцировки клеток сперматогенного эпителия. Большую часть канальцев представляли канальцы с единичными половыми клетками: спер-матогониями (до 10% контроля) и диплотенными сперматоцитами, более зрелые клетки отсутствовали. Можно было наблюдать, что процесс дифференцировки половых клеток доходил лишь до стадии молодых сперматид. Данный феномен, по мнению авторов, является специфичным для сочетанного облучения (Кондратенко В.Г., Федорова Н.Л., 1972; Кондратенко В.Г., Ганзенко Л.Ф., 1975; Кондратенко В.Г., 1977).
Для оценки воспроизводительной способности облученных собак проводили ежегодные спаривания подопытных и контрольных животных в различных вариантах. В 1-м варианте спаривались необлученные животные, во 2-м — облученными были только самцы, в 3-м варианте спаривались облученные самцы и самки. В течение первого года облучения у подопытных собак все 11 вязок закончились нормальной беременностью и родами. Количество щенков в помете находилось в пределах нормы. Потомство было вполне жизнеспособным. В дальнейшем наиболее подробно были изучены данные по первым двум вариантам спаривания. В табл. 4.18 представлены материалы по изменению воспроизводительной способности собак самцов в процессе их 6-летнего облучения и в пострадиационный период. Материалы обследования обработаны методом скользящей средней.
Анализируя данные табл. 4.18, можно отметить, что в контрольной группе каждое спаривание заканчивалось беременно-
249
250
Таблица 4.18
Воспроизводительная способность собак самцов в процессе их 6-летнего облучения и в пострадиационный период
Группа Суммарная доза, сГр Время от начала облучения, год Число Общее количество щенков Количество щенков в помете Нежизнеспособное потомство, %
спари-ваний беременных самок
абс. %
6 (контроль) 0 2 12 12 100 73 6,1 4,1
0 3 15 15 100 93 6,2 4,3
0 4 14 14 100 86 6,2 3,5
0 5 13 13 100 69 5,3 4,4
0 6 И И 100 51 4,6 3,9
0 7 10 10 100 42 4,2 0
3 40-300 2 13 13 100 57 4,4 14
260-430 3 16 13 81 52 4,0 15,4
290-590 4 16 И 69 51 4,6 7,8
430-700 5 14 9 64 43 4,8 2,3
590-750 6 И 8 73 42 5,3 9,5
750 7 10 9 90 52 5,8 13,5
5 150-480 2 9 8 89 31 3,9 6,5
330-680 3 12 7 58 27 3,9 7,4
480-870 4 13 3 23 9 3,0 11,1
680-1050 5 14 0 00 — — —
1050 6 5 0 0 — — —
1140 8 24 6 25 25 4,2 40
стью, а в подопытных группах количество беременных самок заметно снижалось со 2-го и 3-го года, что наиболее выражено в 5-й группе. В 3-й группе этот показатель снизился приблизительно на 35%. В 5-й группе в течение 5-6-го года эксперимента беременности не наблюдали, что связано со значительным снижением (в 300 раз) концентрации сперматозоидов в эякуляте (была полная стерильность самцов). Кроме того, из табл. 4.18 видно, что по мере накопления суммарной дозы количество щенков в помете снижалось и заметно увеличилось относительное число нежизнеспособного потомства (имеется в виду мертворожденность или гибель потомства в ближайший период постнатального развития).
Следует отметить, что в пострадиационный период количество беременных самок и среднее число щенков в помете в 3-й группе быстро, а в 5-й группе медленнее приближались к значениям показателей контрольной группы. В то же время количество нежизнеспособного потомства, наоборот, имело тенденцию к увеличению в 3-й группе и резко возросло в 5-й группе. Это, по-видимо-му, связано с процессами преждевременного старения облучаемых животных и в значительной степени относится к собакам 5-й группы, получившим максимальную дозовую нагрузку.
Для полноты характеристики воспроизводительной способности необходимо отметить, что беременность и роды у собак, как и параметры развития потомства (кратность прибавления массы, сроки прорезывания зубов и др.), протекали во все сроки эксперимента так же, как и у животных контрольной группы, без заметных отклонений от нормы.
Таким образом, при исследовании воспроизводительной способности собак не обнаружено существенных отклонений в течение первого года облучения. Начальные признаки нарушения генеративной функции проявились на 2-м году облучения и нарастали по мере увеличения суммарной дозы. Восстановление показателей в пострадиационный период у животных 5-й группы протекал очень медленно. Наблюдалось значительное возрастание вероятности развития нежизнеспособного потомства в поздний период. Как показано выше, у животных с максимальной дозовой нагрузкой (5-я группа) к концу облучения сохранялось достаточное количество стволовых клеток (сперматогоний типа А составляли 7,2% контроля), что является благоприятным признаком, позволяющим предполагать значительные возможности восстановления сперматогенного эпителия.
251
В отношении восстановления сперматогенеза у разных видов животных известно, что у мышей после облучения в дозах 100-300 сГр рост числа сперматогоний типа А начинается уже через 5 сут после облучения и почти завершается к 20-м суткам (77% уровня контроля). Приблизительно в те же сроки наблюдается восстановление сперматогоний у крыс (Кондратенко В.Г., 1977). Проведенное в работе (Заликина Ж.Г., 1977) изучение скорости восстановления сперматогенеза у мышей после протяженного облучения в дозе 300 сГр показало наличие двухфазной кривой восстановления числа сперматогоний, сперматоцитов, сперматид и сперматозоидов, характеризуемой двумя значениями периода полувосстановления поражения. Восстановление численности указанных групп клеток семяродного эпителия отмечали с конца 2-й, 3-й, 4-й и 5-й недели соответственно. В начальный период оно характеризовалось большей скоростью с периодом полувосстановления 1,5-5 суток, что связано, по-видимому, с развитием ав-торегуляторных процессов в ткани, определяющих скорость размножения и дифференцировки сперматогоний. Затем при достижении уровня клеточности, соответствующего 50-70% контроля, скорость восстановления существенно замедлялась. Периоды полувосстановления увеличивались почти на порядок и составляли 30-50 суток. К 90-м суткам у мышей еще не удалось наблюдать окончательного восстановления количественного состава семяродного эпителия.
Изучение восстановления сперматогенеза и функциональной способности семенников у собак в «Хроническом эксперименте» проводили после 3 и 6 лет облучения. Восстановление концентрации сперматозоидов, их подвижности и качественного состава у животных 3-й и 5-й групп после 3 лет облучения представлено на рис. 4.29-4.32 зачерненными значками. Скорость начального быстрого восстановления, связанного с развитием авторегуляторных процессов в ткани, определяется в основном уровнем опустошения эпителия и является тем выше, чем больше исходное поражение. Максимальная скорость восстановления в начальном периоде отмечена по концентрации сперматозоидов (см. рис. 4.29 и 4.30) как раз у животных 5-й группы с наибольшей глубиной изменений. Это согласуется и с данными по восстановлению в других обновляющихся тканевых системах, например в системе кроветворения, где также отмечено наличие большей начальной скорости восстановления при большем исходном уровне лучевого по
252
ражения системы (Воробьев А.И., Бриллиант М.Д., Чертков И.Л., 1974; Щербова Е.Н., Груздев Г.П., 1977; Груздев Г.П., 1988).
Быстрые процессы восстановления у собак в нашем эксперименте завершились к 4-му месяцу по достижении 30% уровня клеток по отношению к норме. Далее процесс восстановления, который в основном уже обусловлен интегративными реакциями организма, протекал более медленно и, как видно из рис. 4.29-4.32, проходил в две стадии. Первая стадия, характеризуемая для животных 3-й и 5-й групп периодами полувосстановления клеточно-сти, равными 300-350 суткам, завершалась через 2 года после окончания облучения (к 60-му месяцу). Окончательное восстановление у собак 3-й и 5-й групп наблюдалось через 4-6 лет после окончания 3-летнего облучения.
У забитых собак 5-й группы через 4,5 года после окончания 3-летнего облучения при микроскопическом исследовании обнаруживали нормализацию гистологической структуры семенных канальцев. Несмотря на наличие отдельных дистрофических изменений, в большинстве канальцев определяли, как правило, 4-6 рядов клеток сперматогенного эпителия, в просветах канальцев встречалось значительное число сперматозоидов. Представленные данные подтверждают значительные возможности восстановления сперматогенеза у собак в отдаленные сроки после длительного облучения с различной мощностью дозы.
После 6 лет облучения также отмечали быструю компоненту восстановления, особенно выраженную у животных 5-й группы. Восстановление концентрации сперматозоидов у собак этой группы начиналось через 4 месяца после прекращения облучения, что связано с глубоким опустошением эпителия к 6-му году облучения, но уже через 8 месяцев концентрация сперматозоидов достигала 30% нормы (уровня контрольной группы), и в дальнейшем скорость восстановления существенно замедлялась (см. рис. 4.30). По-видимому, указанный граничный уровень концентрации клеток является физиологически значимым. Он не выходит за пределы нижней границы размаха варьирования показателя у контрольных животных и совпадает с минимальным значением показателя при нормальной регуляции у контрольных животных, поскольку уже с этого уровня отмечаются начальные признаки нарушения генеративной функции. При более сильном опустошении эпителия интенсивно включаются процессы регенерации для
253
поддержания необходимого уровня клеточности в рассматриваемой ткани.
Более медленные процессы восстановления, начиная приблизительно с 30% уровня клеток, протекали после 6-летнего облучения в одну стадию и характеризовались у животных 3-й и 5-й групп периодом полувосстановления, равным соответственно 240 и 600 суткам. Таким образом, можно отметить некоторое замедление скорости восстановления у животных 5-й группы с максимальной дозовой нагрузкой. Вместе с восстановлением концентрации сперматозоидов в те же сроки и с аналогичной скоростью восстанавливались качественные показатели спермы (см. рис. 4.31 и 4.32). Характер процесса восстановления по указанным показателям практически совпадал и соответствовал описанному выше.
Значительные возможности восстановления рассматриваемой ткани у животных 4-й и 5-й групп подтвердились при изучении ее реакции на острое тестирующее воздействие в дозе 125 сГр, нанесенное животным подопытных и контрольной групп через год после завершения 6-летнего облучения. Изменение концентрации сперматозоидов и качественных показателей спермы у животных 4-й, 5-й и контрольной групп в результате указанного радиационного воздействия представлено на рис. 4.33.
Максимальное развитие поражения и снижение концентрации сперматозоидов происходило в те же сроки, что при острых воздействиях в процессе эксперимента на 4-6-й месяц после облучения. Затем отмечали быстрое восстановление этого показателя у животных 5-й группы так, что к 10-му месяцу концентрация сперматозоидов у собак этой группы не отличалась от нее у животных 4-й и 6-й (контрольной) групп. Можно отметить только более замедленный дальнейший характер восстановления у животных 5-й группы, с наличием повторной волны усиления поражения через 2-2,5 года после тестирующего облучения. Замедление восстановления поражения и повторное его усиление были отмечены также по качественным показателям спермы: подвижности сперматозоидов и числу патологических форм.
Таким образом, анализ представленных материалов позволяет сделать следующие выводы. При хроническом лучевом воздействии постепенно нарастают изменения в сперматогенном эпителии, выражающиеся в снижении числа клеток всех стадий зрелости, в качественном изменении состава спермы. При облучении животных с мощностью дозы 0,06 сГр/сут (1-я группа) изменения про-
254
Рис. 4.33. Динамика изменения концентрации, числа атипичных форм (а) и подвижности (б) сперматозоидов у собак после тестирующего воздействия в дозе 125 сГр, нанесенного через 7 лет после начала эксперимента для собак 4-й (1), 5-й (2) и контрольной (3) групп
являются с 20-го месяца облучения, а при больших уровнях воздействия — с 8-10-го месяца. К концу 2-го года облучения при хроническом воздействии устанавливается равновесие в системе, когда дальнейшего развития радиационного поражения не происходит вследствие усиления регенераторных процессов в ткани. Глубина изменений в системе сперматогенного эпителия оказывается в прямой зависимости от мощности дозы радиационного воздействия и в меньшей степени от общей накопленной дозы.
Острые воздействия в дозе 42 сГр, наносимые с интервалом один год на фоне хронического облучения (4-я группа), не приводили к существенному увеличению поражения от воздействия к воздействию, поскольку радиационное поражение успевает почти полностью восстановиться в промежутке между воздействиями. Реакция на острые воздействия в дозе 8 сГр не проявилась. Это можно объяснить тем, что радиочувствительная фракция сперматогоний инактивирована уже вследствие предварительного облу-
255
чения, а более резистентные клетки практически сохраняют свою жизнеспособность. В среднем характер изменений у животных 4-й группы оказывается близким к характеру изменений животных при хроническом облучении в той же суммарной дозе за год (3-я группа).
Острые радиационные воздействия в дозе 42 сГр, наносимые с интервалом 4 месяца (5-я группа), вызывают неуклонное нарастание радиационного поражения, приводят практически к полному опустошению эпителия зрелыми форменными элементами, атрофии семенников и стерильности собак уже со 2-3-го года облучения. Однако сохранившийся уровень стволовых клеток (6-7% сперматогоний типа А) обеспечивает быструю скорость восстановления эпителия после прекращения облучения, что является благоприятным прогностическим признаком.
4.10. Патоморфологические и гистологические исследования собак в «Хроническом эксперименте*
Часть собак в «Хроническом эксперименте» забивалась в различные периоды хронического облучения для патоморфологиче-ских и гистологических исследований, которые были проведены под руководством профессора В.В. Шиходырова.
Исследование патоморфологии сосудов внутренних органов проведено на 18 собаках (Гаврилов В.А., 1972). У животных, облученных в течение года в суммарной дозе 21 сГр, не отмечалось морфологических отличий в сосудистой стенке по сравнению с контрольными животными. В группе животных, облученных за год в большей суммарной дозе (62 сГр), наблюдали признаки повышенной сосудистой проницаемости, утолщение и гомогенизацию стенки мелких венозных сосудов, вокруг некоторых из них имелось скопление отечной жидкости. В кровеносных сосудах собак, облученных в течение года в дозах 125 и 188 сГр, указанные изменения нарастали. Стенка мелких венозных стволов становилась без четкого структурного рисунка, набухшая, эозинофильная, а сосудистый просвет сужен. Коллагеновые волокна адвентиции были разволокненные, пропитаны отечной жидкостью, среди них и в окружающей ткани располагались в большом количестве лимфоидные, плазматические клетки. В артериях определялись ограниченные разрастания внутренней оболочки. У животных, под
256
вергнутых облучению в суммарной дозе 564 сГр (5-я группа, облучение 3 года), нарушения были выражены еще более сильно. В периваскулярной соединительной ткани встречались гранулематозные клеточные скопления из округлых клеточных элементов и вытянутых клеток типа фибробластов. Обнаруживали вакуоли в набухшей стенке кровеносных сосудов. Характерным являлось сегментарное или циркулярное разрастание интимы артерий и в некоторых случаях крупных вен, приводящее к стенозу сосудистого просвета.
У облученных животных в кровеносных сосудах легких и печени отмечалась картина васкулитов, носящих преимущественно инфильтративно пролиферативный характер с не резко выраженными в ряде случаев явлениями переваскулярного склероза. Однако необходимо отметить, что у облученных животных наряду с дегенеративными изменениями в сосудистой стенке развивались и репаративные процессы.
Электронно-микроскопические исследования миокарда выполнены на 34 облученных собаках (Беспалова Л.А., 1972) . Электронно-микроскопическое исследование проб миокарда собак, забитых через год и получивших суммарную дозу 21, 62, 120, 125 сГр, не выявило каких-либо изменений в ультраструктурной организации миокардиальных клеток. Миофибриллы сохраняли обычное строение и состояли из множества тонких нитей протофибрилл. Во всех продольных срезах хорошо видны Z- и М-по-лоски. На поперечных срезах отмечали отчетливо сохранившуюся структуру ядер мышечных клеток, которая была весьма вариабельной по характеру распределения зерен хроматина в нуклеоплазме. Только у животных 5-й группы наблюдалось неравномерное изменение субмикроскопических структур кислот, которые касались внутриклеточных органелл-митохондрий. Митохондрии, расположенные между миофибриллами под сарколеммой, отличались значительной вариабельностью размеров, формы, плотности матрикса и характера расположения крист. В большинстве случаев отмечали набухание митохондрий, просветление матрикса, уре-жение крист. При накоплении суммарной дозы облучения до 300 сГр встречали делящие митохондрии, а также митохондрии, у которых внутренняя структура была с выраженным полиморфизмом митохондрий.
Через 2 года облучения степень увеличения полостей агранулярного саркоплазматического ретикулума была неодинаковой,
257
иногда находили расширенные диеты гранулярного саркоплазматического ретикулума. В миокарде собак после 4 лет облучения встречались по-прежнему митохондрии с миелиноподобными профилями. В отличие от контрольных у облученных собак мышечные клетки характеризовались большим разнообразием в строении лизосом, которые располагались в различных количествах в миокардиальных клетках. У собак 5-й группы отмечен значительный полиморфизм митохондриального аппарата, а также расширение полостей агранулярного ретикулума, что в настоящее время можно объяснить как структурное выражение функционального напряжения клетки.
Морфологическое исследование желудочно-кишечного тракта было проведено на 14 собаках (Лебедева Г.А., 1972). У собак 1-й, 2-й и 3-й групп морфологических изменений через 1-3 года хронического облучения отметить не удалось. При накоплении суммарной дозы у животных 5-й группы через 3 года отмечено снижение пейеровых бляшек в кишечнике. При микроскопическом исследовании было обнаружено уменьшение количества лимфоидной ткани в области перехода привратника в двенадцатиперстную кишку, а также уменьшение размеров лимфатических фолликулов пейеровых бляшек тонкой кишки и солитарных фолликулов толстого кишечника. В строме слизистой оболочки проксимального отдела тощей кишки иногда происходило увеличение количества плазматических клеток. Отмечены и некоторые отложения в структуре слизистой оболочки желудка: увеличение числа двуядерных обкладочных клеток или перераспределение в их ядрах хроматина, увеличение коллагеновых волокон в строме слизистой желудка. Описанные изменения имели очаговый характер. Некоторые структурные нарушения в слизистой оболочке желудка можно трактовать как состояние функционального напряжения. Общая направленность развития отмеченных изменений у облученных собак в определенной степени сходна с изменениями, возникающими у старых животных.
Морфологические исследования печени проведены у 46 собак (Яковлева В.И, 1972). Через 2 года облучения грубых морфологических изменений в печени не было обнаружено, через 3 года облучения изменения наблюдались у животных 4-й группы (суммарная доза 375 сГр). Они выражались в увеличении размеров печеночных и купферовских клеток, вариабельности размеров ядер, нарастании количества двуядерных клеток. У животных 4-й и 5-й
258
групп через 3 года облучения начинали развиваться дистрофические изменения, в цитоплазме гепатоцитов появились множественные мелкие вакуоли, не дающие положительной реакции на липиды (гидропическая дистрофия), отмечалось отчетливое снижение содержания гликогена. У животных 4-й и 5-й групп через 3 года были выражены склеротические изменения сосудов перипор-тальной ткани и центральных вен. Через 4 года у животных 5-й группы количество липидов в гепатоцитах увеличилось. Мелкие капли липидов определяли не только по ходу желчных капилляров, но и в цитоплазме периферических отделов клеток. Тенденция к развитию дистрофических изменений в печени (вакуольная дистрофия) появлялась через 4 года при накоплении дозы 500 сГр, при увеличении суммарной дозы у животных 4-й и 5-й групп степень и распространенность дистрофических изменений нарастали.
Морфологические исследования почек проведены на 36 собаках (Шиходыров В.В., Шувырина И.Д.; Панкова А.С., Савина Е.А., 1972). В почках животных через 3 года облучения отмечено набухание клеток эпителия наружного листка капсулы клубочков, некоторое утолщение капиллярных мембран. В полостях клубочков определяли выпот, иногда имеющий вид полулуния. Мелкие артерии и артерии среднего калибра выглядели отечными, набухшими, с утолщенными стенками и узким просветом. Склерозированные клубочки встречали чаще у животных 4-й и 5-й групп. С увеличением суммарной дозы облучения до 560 и 760 сГр отмечали запустевание значительного числа клубочков, гиалиноз мелких артерий. Проведенные исследования показали, что в почках наиболее пораженной оказалась сосудистая часть нефрона (клубочки).
Морфологические изменения в щитовидной железе показали, что у облученных животных через год происходила активация тиреоидной паренхимы с уменьшением просветов фолликулов, увеличением высоты эпителия, с разжижением коллоида и вакуолизацией его (Плахута-Плакутина Г.И., 1972). При накоплении суммарной дозы облучения характер реакции щитовидной железы изменялся. Через 2 года облучения при суммарных дозах 240-380 сГр наступало гипофункциональное состояние щитовидной железы. Фолликулы имели низкий уплотненный эпителий с округлыми или слегка вытянутыми ядрами, размеры фолликулов варьировали от мелких до гигантских. При дозе облучения
259
380 сГр происходили углубление коллагеновой и ретикулярной тканей сосудов и стромы, нарушение конфигурации фолликулов, что сочеталось с участками разрастания фолликулярного эпителия в виде тяжей и нарушением типичной структуры железы: коллоид изливался в строму, образуя неправильной формы лакуны. Через 3-4 года облучения в ткани щитовидной железы, наряду с сохранением гипофункционального состояния, в большей степени проявлялись дистрофические нарушения в виде склероза стромы и сосудов, периваскулярного отека, излияния коллоида в интерстициальную ткань, резорбции его, десквамации эпителия и распада отдельных фолликулов. Проведенное исследование свидетельствовало о том, что в щитовидной железе, как в одном из звеньев, принимающем участие в регуляции компенсаторно-приспособительных реакций организма, развивались гистоморфоло-гические изменения, указывающие на нарушение ее активности.
Кора надпочечных желез и ее состояние исследовалось в работах (Шиходыров В.В., Шувырина И.Д.; Панкова А.С., Савина Е.А., 1972). Их морфолого-функциональное состояние характеризовали по массе, «толщине» коркового вещества и его отдельных зон, осуществляли также микроскопические и гистохимические исследования. У 8 собак 1-й группы при макроскопическом исследовании было установлено, что масса надпочечных желез увеличивалась лишь к 5-му году облучения (у контрольных 11,8 ± 0,7 мг, у подопытных животных на 2-м, 3-м и 4-м годах облучения 13,4, 13,5 и 13,6 мг соответственно, на 5-м году — 16,7 мг). У собак 2-й группы увеличились размеры надпочечных желез, на их поверхности наблюдались мелкие узелковые разрастания. Масса надпочечных желез несколько увеличилась (13,4 + 0,5 мг) после 4 и 5 лет хронического облучения. При макроскопическом исследовании у всех обследованных животных 3-й группы надпочечные железы были также несколько увеличены в размерах, плотные на ощупь, на поверхности отмечали аденоматозные узелки. Масса надпочечников в течение 5 лет облучения статистически значимо не изменилась.
У животных, подвергавшихся сочетанному хроническому и многократному острому облучению (4-я группа), надпочечные железы обычных размеров, более плотные на ощупь, чем у контрольных животных. Масса надпочечных желез была ниже контрольного уровня, после первых 3 лет сочетанного облучения, в последующие 2 года она несколько возрастала, приближаясь к
260
контрольным значениям (9,4 ± 1,2; 8,4 ± 1,4; 11,3 ± 0,9 и 11,6 ± 7,5 мг соответственно на 2-й, 3-й, 4-й и 5-й годы облучения). У животных 5-й группы надпочечные железы были увеличены в размерах, нередко с неровной бугристой поверхностью и довольно плотные на ощупь. На поверхности желез встречались небольшие аденоматозные узелки. Масса надпочечных желез еще больше уменьшилась в течение 3-го года облучения, но потом увеличилась после 4 и 5 лет облучения (7,3, 17,1 и 14,6 мг соответственно на 3-й 4-й и 5-й год наблюдения)
При микроскопическом исследовании коры надпочечников у животных 1-й группы отмечалось, что соединительно-тканная капсула надпочечных желез была склерозирована. Начиная со 2-го года облучения в ней постоянно встречались аденоматозные узелки, состоящие из клеток клубочковой и пучковой зон. Как правило, в цитоплазме этих клеток содержалось небольшое количество липидов и РНК. Количество и размеры узелков нарастали по мере увеличения времени облучения и соответственно поглощенной дозы ионизирующего излучения. Субкапсулярная бластема после первых 3 лет облучения была расширена с массой малодифференцированных клеток во всех исследованных случаях. Однако после 4 и 5 лет облучения субкапсулярная бластема была расширена меньше и была намного беднее клеточными элементами, чем после первых 3 лет облучения. Расширение коры надпочечников во всех случаях шло за счет увеличения сетчатой и пучковой зон, а сужение коркового вещества происходило за счет пучковой и клубочковой зон.
Клетки клубочковой зоны через год после облучения были обычных размеров, но с более тесной (чем в контроле) ячеистой цитоплазмой. Ядра были крупными и в большинстве случаев вытянутыми. Встречались клубочки, бедные ядрами, но некоторые участки клубочковой зоны утратили свое нормальное строение вследствие скопления массы ядер различной величины и формы. Почти все клетки были богаты РНК. После 2 лет облучения клетки несколько уменьшались в размерах; часть клеток была с темной ячеистой цитоплазмой, часть — со светлой пенистой. Ядра вытянутые и круглые. Клетки с темной цитоплазмой весьма богаты РНК. Через 3 и 4 года облучения клетки клубочковой зоны были небольшими со светлой пенистой цитоплазмой и круглыми или чуть вытянутыми ядрами. Клубочки бедны ядрами. Цитоплазма клеток содержала небольшое количество РНК в виде мелкой пи-
261
ронинофильной зернистости. Местами клубочковая зона полностью исчезала. Межклубочковые соединительно-тканные перегородки были склерозированы. После 5 лет облучения клетки клубочковой зоны крупные со светлой пенистой цитоплазмой и округлыми или несколько вытянутыми ядрами. Иногда встречались участки резкого расширения клубочковой зоны (очаговая гиперплазия).
Промежуточная зона ярко выражена у животных после 2 лет облучения. Она была представлена скоплениями мелких клеток с крупными темными ядрами, значительно проникающими вглубь коркового вещества. В остальных случаях промежуточная зона была еле выражена или вообще отсутствовала (после 4 лет облучения).
Клетки пучковой и сетчатой зон после первых 2 лет облучения — небольших размеров с темной ячеистой цитоплазмой и крупными ядрами, эти клетки были богаты РНК, почти не содержали липидов. Довольно часто встречались двуядерные клетки. В сетчатом слое (после года облучения) имелись единичные небольшие жировые кисты. Нередко около этих кист локализовались группы погибших клеток с пикнотичными ядрами. После 2-летнего облучения количество и размеры жировых кист несколько увеличивались.
В сетчатом слое также встречались скопления мелких клеток с довольно крупными, темными ядрами. В наружном отделе пучковой зоны был обнаружен участок очаговой гиперплазии клеток. Клетки эти весьма крупных размеров, богатые липидами, но бедные РНК. Синусы пучково-сетчатой зоны расширены и заполнены кровью. В более крупных сосудах коры надпочечника и капсулы отмечалась мышечная гиперплазия стенки сосудов. Причем при окраске по Ван-Гизону в мышечном слое сосудов окрашивались в значительном количестве соединительно-тканные волокна. Через 3 года облучения клетки пучковой и сетчатой зон были небольшими со светлоячеистой цитоплазмой, РНК содержали немного меньше, чем клетки описанных выше желез. В сетчатом слое чаще встречались клетки с пикнотичными ядрами: мелкие жировые кисты. После 4-летнего облучения описанные выше изменения нарастали. Часто обнаруживались клетки, цитоплазма которых не ячеистая, а состоящая из крупных вакуолей. В сетчатой зоне встречались ядра с краевым расположением хроматина (пузырьковидные ядра) Через 5 лет в пучково-сетчатой зоне, кро
262
ме описанных выше изменений, в наружном отделе пучковой зоны часто отмечали небольшие очажки «расплавления» клеток.
Микроскопические исследования у собак 2-й группы показали, что наружная соединительно-тканная капсула надпочечных желез значительно утолщена, с узелковыми разрастаниями. В капсуле желез после года облучения узелки были весьма небольшими и состояли преимущественно из клеток клубочковой зоны. С увеличением суммарной дозы количество узелков и их размеры нарастали. Через 3-4 года облучения они состояли в основном из клеток пучковой и сетчатой зон. Некоторые узелки настолько укрупнились, что как бы «прорывали» истонченные в этих местах волокна соединительно-тканной капсулы и сливались с клубочковой зоной. Узелки в капсуле надпочечных желез после 5-летнего облучения были крупными, состоящими из клеток, подобных клеткам клубочковой зоны со светлой пенистой цитоплазмой. При гистохимических исследованиях установлено, что большинство клеток этих узелков содержали небольшое количество липидов, РНК; активность кислой фосфатазы в них значительная, активность сукцинатдегидрогеназы (СДГ) — умеренная. Субкапсулярная бластема в надпочечных железах после 1, 2 и 3 лет облучения расширялась, нередко внедрялась в клубочковую зону, и здесь она была особенно богата скоплением малодифференцированных клеток. После 4 и 5 лет облучения субкапсулярная бластема едва выражена.
В интервале от года до 3 лет облучения ширина коры надпочечников оставалась в пределах контрольных значений, но наблюдалось некоторое перераспределение ширины отдельных зон коркового вещества. Наиболее отчетлива динамика изменения ширины сетчатой зоны. После 2 и 3 лет облучения в надпочечных железах происходило расширение сетчатой зоны. Расширение пучковой зоны отмечалось лишь у животных после 2-летнего облучения. После 4 и 5-и лет облучения ширина коры надпочечных желез уменьшалась в основном вследствие пучковой и клубочковой зон.
Клетки клубочковой зоны (после года облучения) мелкие, с оксифильной ячеистой протоплазмой. Ядра вытянутые крупные и клубочки буквально «нафаршированы» ими. После 2 лет облучения клетки клубочковой зоны были небольшими со светлой пенистой цитоплазмой и круглыми ядрами, встречались клубочки, где цитоплазма клеток темная, а ядра резко вытянуты. Иногда клу
263
бочковая эона резко расширялась и образовывала большие скопления клеток с вытянутыми ядрами, иногда она исчезала. После 3-5 лет хронического воздействия клетки клубочковой зоны были средних размеров со светлой пенистой цитоплазмой и небольшими круглыми ядрами. Изредка встречались клубочки с большим количеством вытянутых ядер. Эти клетки, как правило, были богаты РНК, липидов почти не содержали. Нередко клубочковая зона исчезала или резко нарушалась структура клубочка из-за обильного скопления клеток с крупными округлыми ядрами. Промежуточная зона обнаруживалась лишь в корковом веществе надпочечников животных после 4 и 5-летнего облучения. Она была выражена очень слабо и в основном была представлена в виде отдельных небольших скоплений мелких клеток с округлыми темными ядрами, проникающими в глубь коркового вещества.
Клетки пучковой и сетчатой зон после года облучения были довольно крупными с темной ячеистой цитоплазмой и крупными округлыми ядрами. После 2-4 лет хронического облучения клетки пучковой и сетчатой зон были небольших размеров с более светлой цитоплазмой. Встречалось много двуядерных клеток. В цитоплазме клеток пучкового слоя нередко можно было наблюдать образование крупных вакуолей. Часто встречались и пикно-тичные ядра. После 2 лет облучения обнаруживались небольшие локальные участки клеточной гиперплазии в наружном отделе пучковой и в сетчатой зонах. Клетки очаговых гиперплазий были светлые с крупными ядрами, не содержали РНК, были богаты липидами. По мере облучения количество описанных выше изменений нарастало, достигая максимума к 5 годам. В сетчатой зоне коры надпочечников у всех животных обнаружены жировые кисты. Если после 1-го года облучения их число и размеры были невелики, то с увеличением времени облучения увеличивалось количество жировых кист в сетчатом слое и их размеры. После 4- и 5-летнего облучения небольшие жировые кисты обнаруживались и в пучковой зоне. В сетчатом слое между клетками появлялись пространства, заполненные слабооксифильной коллоидной массой, встречались аденоматозные узелки. Кроме того, в корковом веществе надпочечных желез после 5-летнего облучения в пучковой и сетчатой зонах обнаружены участки темноклеточной узелковой гиперплазии.
При выявлении ряда гистохимических показателей в корковом веществе надпочечных желез собак этой серии установлено обед
264
нение коркового вещества липидами во всех наблюдавшихся случаях, причем после первых 2 лет облучения липиды содержались в основном в наружном отделе пучковой зоны, через 3 года они обнаруживались в отдельных клетках клубочковой, сетчатой зон и клетках наружного отдела пучковой зоны; через 4 года — в клетках наружного отдела пучковой зоны; через 5 лет липиды выявлены лишь в отдельных небольших группах клеток пучковой и сетчатой зон. При выявлении РНК обнаружено, что после 1-го года облучения клетки всех зон коры богаты РНК; через 2 года облучения РНК содержится в цитоплазме ряда клеток клубочковой зоны, в клетках внутреннего отдела пучковой и сетчатой зон в обычном (для контроля) количестве. После 3-5 лет облучения РНК практически содержалась только в цитоплазме клеток сетчатого слоя.
Активность щелочной фосфатазы эндотелия сосудов, СДГ и кислой фосфатазы в клетках коры надпочечников через год после облучения была несколько выше, чем в контроле. Следует отметить значительное повышение активности этих ферментов в сетчатой зоне. В последующие годы облучения (2-5 лет) активность ферментов в клетках коры надпочечников снижалась, оставаясь, однако, довольно высокой в клетках сетчатого слоя.
Микроскопические исследования у собак 3-ей группы показали, что у всех животных наружная соединительно-тканная капсула была склерозирована с массой узелковых разрастаний. Узелки различных размеров состояли из клеток, подобных клеткам клубочковой и пучковой зон. Клетки были богаты РНК и содержали небольшое количество липидов. Довольно часто отдельные даже небольшие узелки как бы «пробуравливали» ходы в капсуле и опускались в клубочковую зону. Помимо узелковых разрастаний, в капсуле желез встречались и аденомы. Одни аденомы постепенно «выходили» на поверхность желез, другие опускались в корковое вещество. Аденомы были гормонально активны, клетки аденомы содержали РНК, липиды, холестерин. Активность СДГ, щелочной и кислой фосфатазы была такая же, как и ткани надпочечной железы.
Наблюдалось уменьшение размеров коркового вещества надпочечников у всех животных, особенно выраженное после 5-летнего облучения. Уменьшение ширины коркового вещества происходило вследствие сужения всех зон. Клетки клубочковой зоны коры надпочечников у всех обследованных животных мелкие, со
265
слабооксифильной ячеистой или пенистой цитоплазмой, вытянутыми и округлыми ядрами. Местами клубочковая зона исчезала или нарушалась структура клубочков вследствие обильного скопления ядер. Клубочки весьма богаты ядрами лишь у животных после года облучения. При дальнейших исследованиях содержание ядер в клубочках обычное, лишь после 4 лет облучения встречались участки клубочковой зоны с резко выраженной очаговой гиперплазией и гипертрофией клеток. Цитоплазма клеток клубочковой зоны с увеличением времени экспериментального воздействия из слабооксифильной и ячеистой становилась светлой пенистой с небольшими темными ядрами.
Клетки пучково-сетчатой зоны во всех исследуемых случаях мелкие с круглыми или несколько овальными ядрами. И если после первых 2 лет эксперимента цитоплазма клеток ячеистая, оксифильная, то по мере увеличения времени облучения часть клеток наружного отдела пучковой зоны имела пенистую, светлую цитоплазму; клетка сетчатого слоя — темную и гомогенную. Во всех случаях в этих зонах обнаружены двуядерные клетки. Встречались погибающие клетки с остатками ядер и мутной цитоплазмой, много мелких и крупных жировых кист. С увеличением времени хронического облучения все чаще попадались клетки с краевым расположением хроматина в ядрах (пузырьковидные ядра). Особенно их много было в сетчатой зоне коры надпочечников после 3 и 5 лет облучения. В это же время в наружном отделе пучковой зоны встречались небольшие участки распада ткани и мелкие локальные кровоизлияния.
В корковом веществе у части животных обнаружена диском-плексация клеток пучковой и сетчатой зон с образованием аденоматозных узлов. Эти узлы были гормонально активны, клетки узлов содержали РНК, липиды. Аденомы коркового вещества были обнаружены у всех исследованных животных. Локализация их была самая различная: клубочковая зона, наружный отдел пучковой и сетчатой зоны. Узелки, состоящие из клеток коркового вещества, постоянно встречались и в мозговом веществе. Изменения в сосудистой сети были аналогичны изменениям в сосудистой сети животных 2-й группы. Это — гиперплазия мышечной оболочки.
При определении ряда гистохимических показателей выявлено: обеднение коры липидами во всех наблюдавшихся случаях. Так, после первых 2 лет облучения липиды содержались в неболь
266
шом количестве лишь в клетках наружного отдела пучковой зоны. В последующие сроки облучения (3-й, 4-й и 5 год) липиды в небольшом количестве содержались в отдельных участках пучковой и сетчатой зон. Причем в цитоплазме клеток липиды находились в виде крупных или более мелких капель неправильной формы. Через год облучения РНК в большом количестве обнаруживалась в цитоплазме клеток клубочковой, внутреннего отдела пучковой и сетчатой зонах. В последующие сроки РНК в основном находилась в цитоплазме клеток сетчатой зоны.
Активность СДГ и кислой фосфатазы в клетках клубочковой и сетчатой зон после 1-го облучения была высокой. Наблюдалась высокая активность и щелочной фосфатазы эндотелия сосудов сетчатой и внутреннего отдела пучковой зон. В последующие сроки исследования (2-5 лет) активность всех исследуемых ферментов в корковом веществе постепенно снижалась, оставаясь, однако, довольно высокой в клетках сетчатой и в отдельных группах клеток внутреннего отдела пучковой зон. Узелки, обнаруженные в мозговом веществе надпочечников, состоящие из клеток коркового вещества, были гормонально активны. Отмечали умеренную активность СДГ и кислой фосфатазы в них.
Исследование коры надпочечников у собак 4-й группы, подвергнутых сочетанному хроническому и многократному острому облучению, наружная капсула надпочечных желез была склерозирована, с довольно большим количеством узелков различной величины. Узелки состояли из клеток клубочковой и пучковой зон. Клетки узелков содержали небольшое количество РНК и липидов. Субкапсулярная бластема расширена с большим количеством малодифференцированных клеток. Корковое вещество увеличивалось в размере после 2-летнего облучения в результате расширения пучковой и сетчатой зон. После 4 и 5 лет облучения уменьшались размеры коркового вещества вследствие уменьшения пучковой и сетчатой зон. Клубочковая зона уменьшалась в размерах во всех случаях. В сетчатой зоне встречались мелкие жировые кисты. После 2- и 3-летнего облучения клетки пучковой и сетчатой зон были мелкими с более светлой ячеистой цитоплазмой. Ядра небольшие круглые. В пучковой зоне нередко наблюдалась диском-плексация клеток с образованием аденом. В наружном отделе пучковой зоны часто встречались очаговые гипертрофии клеток этой зоны. Клетки участков очаговой гипертрофии богаты липидами, РНК не содержат. В наружном и внутреннем отделах пучковой
267
зоны иногда встречались небольшие очажки распада клеток. В сетчатой зоне много мелких жировых кист.
Гистохимическое исследование коры надпочечников показало, что после года облучения происходит резкое обеднение коркового вещества липидами, после 2 лет наблюдалось незначительное содержание липидов в основном в наружном отделе пучковой зоны, липиды появлялись и в отдельных клетках клубочковой зоны, но в весьма небольшом количестве. После 3 лет облучения корковое вещество обеднено липидами, в основном липиды содержатся в цитоплазме клеток пучковой зоны в виде пылевидной зернистости, реже в виде крупных капель неправильной формы. После 4 лет облучения содержание липидов несколько нарастало в наружном отделе пучковой зоны. Клетки клубочковой зоны липидов не содержали. После 5 лет облучения кора надпочечников была бедна липидами. Они локализовались в основном в наружном отделе пучковой зоны и в отдельных группах клеток сетчатой зоны. При выявлении РНК в клетках коры надпочечников через год после экспериментального воздействия обнаружено, что клетки всех зон коры содержат значительное количество РНК. Особенно богата РНК цитоплазма клеток сетчатой и клубочковой зон. Через 2 и 3 года хронического облучения РНК появлялась также в цитоплазме клеток всех зон коркового вещества, но содержание ее в клетках было одинаково низким. Через 4 и 5 лет РНК в значительном количестве присутствовала только в цитоплазме клеток сетчатой зоны.
При выявлении активности СДГ, щелочной и кислой фосфатазы в коре надпочечников собак этой группы обнаружено значительное повышение активности этих ферментов после первого года облучения. В последующие 3~5 лет облучения активность СДГ и кислой фосфатазы в корковом веществе снижалась. Активность щелочной фосфатазы эндотелия сосудов также несколько подавлялась (особенно в пучковой зоне), однако в сетчатой зоне, в отдельных участках, она была довольно высокой. У одной собаки 4-й группы после 5 лет облучения обнаружена феохромоцитома.
При микроскопическом исследовании у собак 5-й группы наружная соединительно-тканная капсула надпочечных желез была резко расширена с большим количеством узелков, состоящих из клеток то пучковой, то клубочковой зон. Клетки узелков содержали небольшое количество липидов и РНК. Во всех исследованных опухолях в капсуле желез обнаружены довольно крупные адено
268
мы. Клетки аденом содержали значительное количество РНК и умеренное количество липидов. Выявлена сравнительно высокая активность СДГ и кислой фосфатазы. Субкапсулярная бластема была увеличена у всех исследованных облученных собак, но наиболее выражено расширение бластемы после 4 лет радиационного воздействия. Ширина коры надпочечников была уменьшена у всех облученных собак, причем уменьшение коры происходило вследствие сокращения всех зон. После 3 лет облучения клетки клубочковой зоны несколько уменьшались в размерах, цитоплазма их была пенистой, реже гомогенной, ядра небольшими. Клетки пучково-сетчатой зоны в надпочечных железах животных после 3 лет хронического облучения оказались небольших размеров, с темной ячеистой цитоплазмой и довольно крупными круглыми ядрами. В сетчатом слое, реже в пучковом, обнаружено множество мелких жировых кист. Синусы сетчатой и пучковой зон несколько расширены и заполнены кровью. Выражены склеротические изменения синусов сетчатого слоя.
После 4 лет хронического облучения клетки наружного отдела пучковой зоны стали крупными с темными ядрами. Цитоплазма клеток наружного отдела пучковой зоны пенистая, светлая. После 5 лет клетки пучково-сетчатой зоны были мелкие с небольшими ядрами и темной цитоплазмой. Границы между клетками в сетчатой зоне едва различимы, а зачастую и отсутствуют. У всех исследованных животных в сетчатой зоне встречались жировые кисты различных размеров, в коре надпочечников — многоядерные клетки. В синусах пучково-сетчатой и реже в сосудах клубочковой зоны обнаружены небольшие скопления клеток мозгового вещества. Участки узелковой гипертрофии и аденомы встречались в коре надпочечников у всех животных этой группы. Аденомы, образовавшиеся в корковом веществе, гормонально активны, содержат небольшое количество РНК, липидов. Активность кислой фосфатазы и СДГ в них такая же, как и в клетках коры надпочечников. У одной из собак в корковом веществе после 3 лет облучения обнаружен крупный узелок — добавочный надпочечник. По своему строению он ничем не отличался от обычной надпочечной железы. В мозговом веществе надпочечников после 2-4 лет хронического облучения у собак обнаружены небольшие узелки, состоящие из клеток коркового вещества.
При проведении ряда гистохимических реакций выявлено следующее: кора надпочечных желез бедна липидами, наибольшее
269
обеднение липидами наблюдается после 5 лет облучения. В корковом веществе после 3 лет облучения цитоплазма во всех зонах не обнаруживает реакции на кетостероиды и холестерин. При выявлении содержания РНК в клетках коркового вещества обнаружено, что все клетки богаты РНК, а клетки аденом лишены РНК. После 5 лет облучения РНК содержится только в клетках сетчатой зоны и в небольшом количестве.
При выявлении активности ряда ферментов установлено, что активность СДГ и кислой фосфатазы в клетках коры после 1-го года облучения высокая. Наиболее высокая активность ферментов наблюдается в клетках сетчатой и клубочковой зон. В последующие годы хронического облучения собак активность СДГ и кислой фосфатазы в коре надпочечников снижается. На фоне общего снижения ферментативной активности в коре, в клетках сетчатой зоны активность ферментов остается повышенной. Активность щелочной фосфатазы эндотелия сосудов после 3 лет облучения у собак 5-й группы довольно высокая, подавляется активность фосфатазы лишь в участках гипертрофии клеток коры надпочечников. С увеличением времени облучения активность щелочной фосфатазы сосудов снижается, однако необходимо отметить, что в отдельных участках сетчатой зоны остается весьма высокой.
Таким образом, проведенные исследования реакции коры надпочечников на хроническое облучение показали, что система гипофиз-кора надпочечников весьма радиочувствительна. Облучение животных в течение нескольких лет (годовые дозы 21, 62 и 125 сГр) вызывает ряд морфологических и гистохимических изменений, свидетельствующих о повышенном функциональном состоянии железы: корковое вещество расширено, полнокровно, бедно липидами и холестерином, повышена активность ряда ферментов в клетках коры надпочечников. Наряду с явлениями активации функции железы в пучковой и сетчатой зонах в большем количестве, чем у контрольных животных, обнаруживаются дистрофически измененные и погибшие клетки. В сетчатой зоне встречались небольшие жировые кисты. Капсула и строма железы несколько склерозированы. Вероятно, повышенная деятельность паренхимы железы, наблюдавшаяся через год хронического облучения, компенсирует гормональную недостаточность, развившуюся вследствие частичного поражения кортикальной, ткани, а так
270
же обеспечивает повышение гормональной секреции при увеличенной потребности организма в гормонах.
С увеличением длительности облучения (2—5 лет) и накопленных доз нарастают дистрофические и атрофические процессы в железе. При суммарной дозе облучения свыше 375 сГр в корковом веществе превалируют дистрофические и атрофические процессы. Необходимо отметить, что процессы репарации во всех случаях были достаточно выражены. По-видимому, при более длительном сроке облучения, по мере нарастания первоначальных изменений, компенсаторные функции включаются более интенсивно и развиваются репаративные процессы, связанные с гипертрофией, гиперплазией клеток и увеличением вследствие этого всей массы коры. Постоянно обнаруживали участки очаговой гипертрофии клеток пучково-сетчатой зоны у животных после 2-5 лет хронического облучения. Изменения, представленные «репарацией узелкового типа» (по классификации И.И. Финкель), были обнаружены у всех облученных животных. Полученные данные в «Хроническом эксперименте» дают основание считать, что узловая гиперплазия надпочечников с образованием в капсуле или снаружи от нее аденом находится в непосредственной связи с продолжительным функциональным напряжением секретных клеток коркового вещества.
Чаще всего узелки и аденомы у собак «Хронического эксперимента» обнаруживали в капсуле надпочечных желез и за ее пределами. Образование подобных узелков большинство исследователей связывают с дифференциацией незрелых элементов, с отделением клеток и небольших их групп от основной массы. Кроме того, малодифференцированные клетки субкапсулярной бластомы также служат материалом для образования аденом. Следует заметить, что немаловажное значение в выходе клеток коры за пределы железы имеют дезорганизация соединительнотканных волокон капсул, нарушение их прочности и эластических свойств. В отношении функции узелковых образований (аденом) в литературе имеются различные взгляды. Одни исследователи считают, что узелковая гиперплазия — это полноценная регенерация коры надпочечников с компенсаторным значением, другие отмечают, что узелки функционируют более или менее параллельно с остальной частью коры надпочечников, но в ряде случаев могут оказаться носителями всей функции коры надпочечников. Исследования, проведенные в «Хроническом эксперименте», показывают,
271
что аденоматозные образования, где бы они ни находились, функционируют в большинстве случаев синхронно с корой надпочечника. Однако при более длительном облучении животных (3-5 лет), когда в корковом веществе отсутствуют холестерин и липиды, была установлена высокая концентрация этих предшественников стероидных гормонов в узелках, расположенных как в толще самой коры, так и за ее пределами.
Следует особо отметить такие изменения, как очаговая гипертрофия и гиперплазия клубочковой зоны коркового вещества, были обнаружены почти у всех облученных животных через 3-5 лет хронического воздействия. Подобные изменения в надпочечных железах могут привести к первичному альдостеронизму. Полученный материал дает основание заключить, что в коре надпочечников собак при хроническом облучении, начиная с суммарной дозы 105-375 сГр, возникают изменения, напоминающие изменения, связанные со старением органа. Встречается ряд изменений, которые можно расценить как морфологическое выражение процессов компенсации утраченных функций: повышение функции отдельных участков коры надпочечников, выявленное рядом гистохимических реакций, образование аденоматозных структур в коре и за ее пределами.
4.11. Характеристика отдаленных последствий при хроническом облучении
После 2-3-летнего облучения в результате проведенных гистологических исследований были обнаружены отчетливые структурные изменения в ряде органов и тканей у облученных животных по сравнению с контрольными. Из структур центральной нервной системы наиболее отчетливые изменения обнаружены в коре головного мозга и гипоталамусе. Было увеличено как количество измененных нервных клеток, так и степень их изменений. Наряду с гиперхромией нейронов и сморщиванием единичных нервных клеток нередко встречались клетки с выраженным расплавлением хроматофильного вещества вплоть до появления единичных клеток теней. В супраоптических и паравентрикулярных ядрах гипоталамуса отмечали большое количество несколько увеличенных набухших нервных клеток, в которых содержалось ограниченное число нейросекреторных гранул. Изменения в лобной и затылоч
272
ной долях коры головного мозга, в гипоталамусе оказывались более выраженными у собак с большей дозовой нагрузкой (3-5-я группы) и нарастали во времени. Наблюдали некроз отдельных нервных клеток. Указанные изменения свидетельствовали о функциональной напряженности нейронов (Лебедев Б.И., 1972).
Эти результаты находятся в согласии с данными другого исследования (Федоренко Б.С., Шафиркин А.В., Буденная Н.Н., 1998), в котором показано развитие нарушений в ЦНС у крыс в результате облучения в дозах 100-400 сЗв. Продемонстрировано значительное увеличение числа нейронов с дегенеративными изменениями в отдаленные сроки после облучения, причем они прогрессировали со временем.
Как свидетельствуют данные работы (Александров С.Н , 1978). нарушения в гипоталамусе в результате хронического облучения могут проявляться также в снижении нейросекреторной активности, что выражается уменьшением содержания гипофизотропных гормонов и может приводить к снижению адаптационной способности организма и реактивности гипофиз-адреналовой системы на внешние нагрузки
В системе гипоталамус-гипофиз-кора надпочечников, в щитовидной железе, как указывалось выше, в начале облучения отмечали активацию нейросекреции и гормональной активности желез, сопровождаемую их гиперплазией, которая к концу 2-го и в течение 3-го года облучения в 3-5-й группах сменялась истощением и снижением функциональной активности желез. В надпочечниках в различных зонах коркового вещества встречались некротические участки и участки дегенеративно измененных клеток. У собак 5-й группы через 3 года обнаружено значительное утолщение капсулы, разрастание соединительно-тканной стромы желез. С увеличением накопленных доз и времени хронического облучения (2-5 лет) нарастали дистроические и атрофические процессы в железе. При суммарной дозе облучения свыше 375 сГр в корковом веществе дистрофические и атрофические процессы уже превалировали. Эти материалы дают основание заключить, что в коре надпочечников собак при хроническом облучении, начиная с суммарной дозы 105-375 сГр, возникают изменения, напоминающие изменения, связанные со старением органа.
В щитовидной железе уже к концу 2-го года облучения при дозах 240-380 сГр в большинстве случаев наступало гипофункцио-нальное состояние железы. По мере нарастания суммарных доз,
273
наряду с сохранением гипофункционального состояния, в большей степени проявлялись дистрофические изменения в виде склероза стромы и сосудов.
Такой характер изменений в отношении секреторной активности и структурных перестроек в гипофизе, надпочечниках, щитовидной и половых железах отмечен в целом ряде работ (Акоев И.Г., 1970; Шиходыров В.В., Шувырина И.Д., 1972; Савина Е.А., и др., 1976; Александров С.Н., 1978). Он является отражением развития неспецифической реакции организма в ответ на хронический стресс и находится в полном согласии с концепцией Г. Селье об общем адаптационном синдроме (Селье Г., 1972).
Выше показано, что в гепатоцитах нарастало количество двуядерных клеток развивались дистрофические изменения (появлялись множественные мелкие вакуоли, не дающие положительной реакции на липиды). При увеличении суммарной дозы степень и распространенность дистрофических изменений нарастали. Прогрессировали также склеротические изменения сосудов перипор-тальной ткани и центральных вен (Яковлева В.И., 1972).
Проведенные морфологические исследования почек показали, что наиболее пораженной оказалась сосудистая часть нефрона. Стенки мелких и средних артерий почек выглядели набухшими, с утолщенными стенками и узким просветом. Склерозированные клубочки чаще встречались у животных 4-й и 5-й групп. Изменения прогрессировали, отмечалось дальнейшее утолщение базальных мембран капилляров, оголение капиллярных мембран и склероз клубочков. Нарастание сосудистых нарушений и развитие склеротических изменений отмечали также в сосудах легких и сердца (Панкова А.С., Савина Е.А., 1972).
Применение дополнительных функциональных нагрузок позволило вскрыть некоторые нарушения процессов регуляции и недостаточность компенсаторных возможностей организма облученных собак. Показатели ЭКГ облучаемых животных до применения физической нагрузки (бег на третбане) были мало изменены, однако у части собак 3 и 5-ой групп спустя 3 года облучения на ЭКГ отмечали начальные признаки дистрофических явлений в сердечной мышце. В последующие после 3-летнего облучения сроки происходило прогрессирующее ухудшение реакции сердечно-сосудистой системы на физическую нагрузку по сравнению с контролем, регистрируемое как по величине отклонений показателей ЭКГ, так и по удлинению сроков восстановления. Кроме
274
того, у животных 3-5-й групп отмечалось значительно более существенное учащение дыхания при выполнении физической нагрузки. Начиная с 20-го месяца, собаки этих групп плохо переносили физическую нагрузку. Количество таких животных после 3 лет облучения достигло 40%, некоторые из них (до 15%) вообще отказывались от бега, тогда как все собаки контрольной группы легко переносили физическую нагрузку в течение всего эксперимента.
Анализ температурной реакции в процессе физической нагрузки обнаружил большую ее лабильность у опытных животных по сравнению с контрольными. Облученные животные реагировали на бег большим повышением температуры тела и кожи, у них отмечали более значительную интенсивность процессов теплопродукции и теплоотдачи. Однако в ряде случаев нарушалось равновесие между этими процессами, и изменения носили разнонаправленный характер по сравнению с контролем, т.е. у облученных животных проявились признаки нарушения терморегуляции. Это подтверждалось также тем, что облученные собаки 3-5-й групп тяжелее переносили тепловую нагрузку. Около 17% облученных собак были выведены из опыта с тепловой нагрузкой досрочно в связи с опасным ухудшением их состояния (быстрое снижение частоты дыхания в сочетании с резким повышением температуры тела). Указанные факты свидетельствуют о существенном нарушении процессов терморегуляции у облученных собак (Изерги-на А.Г., 1972; . Петровнин М.Г., Попова Н.А., 1972).
Морфологические изменения внутренних органов и тканей у облученных животных: в структурах центральной нервной системы, железах внутренней секреции, почках, печени, эндотелии сосудов указывают на более раннее развитие возрастных изменений, более быстрое истощение компенсаторных возможностей организма, что особенно выражено у собак 5-й группы. Уменьшение компенсаторных возможностей со стороны нейроэндокринной и сердечно-сосудистой систем, развитие дегенеративных и склеротических изменений в органах и тканях приводит к заметному снижению жизнеспособности организма, возрастанию частоты заболеваний и скорости смертности собак в последние годы облучения и в отдаленном периоде.
Таким образом, в целой совокупности систем, принимающих участие в регуляции физиологических функций организма и осуществлении его компенсаторно-приспособительных реакций, раз
275
виваются гистоморфологические изменения, указывающие на уменьшение функциональных возможностей этих систем и уменьшение их активности с увеличением мощности дозы и времени облучения. Это находит свое выражение в недостаточности компенсаторных реакций организма, наблюдаются неадекватные реакции на дополнительную физическую и тепловую нагрузку. Как уже отмечалось выше, имело место уменьшение резервных возможностей в белом ростке системы кроветворения (уменьшение величины костномозгового и капиллярного депо гранулоцитов и выраженности лейкоцитарных реакций в крови при действии факторов внешней среды и использовании дополнительных функциональных нагрузок). Все указанное выше свидетельствует о более ускоренном развитии процессов старения у опытных животных, особенно это касается собак 3-5-й групп с максимальными дозовыми нагрузками.
Определенный интерес представляет анализ причин гибели собак опытных и контрольной групп, особенно частоты развития злокачественных опухолей в зависимости от мощности дозы и длительности облучения. Следует сразу отметить, что начальная, более ранняя гибель собак в группах не была связана с развитием опухолей у животных, а была обусловлена в основном развитием воспалительных процессов, уменьшением сопротивляемости организма развитию инфекционных процессов. Наиболее часто в качестве ведущей причины гибели отмечали воспаление легких. Кроме того, наблюдали нарушения со стороны желудочно-кишечного тракта у собак. В большей степени это было присуще собакам контрольной группы. Подобное распределение причин гибели во времени отмечали и другие исследователи при хроническом облучении мелких лабораторных животных с различной мощностью дозы (Голощапов П.В., Бойцова В.П., Воробьева М.И., 1987).
На протяжении 6 лет эксперимента пала 21 собака из групп, подвергнутых облучению, и 5 из контрольной группы. Патологоанатомическому вскрытию были подвергнуты все 26 животных для установления причин смерти. Распределение причин смерти собак, павших в ходе эксперимента, представлено в табл. 4.19. Как показывает анализ данных, причинами смерти были: пневмония (5 собак 1-й, 2-й и 5-й групп); заболевания желудочно-кишечного тракта — гастроэнтерит, панкреатит, гепатит (5 животных 1-й и 5-й групп); 3 собаки погибли от злокачественных новообразований — рак легкого (суммарная доза 490 сГр) и рак печени (сум-
276
277
Таблица 4.19
Причина смерти животных во время 6-летнего облучения
Причина смерти Доза облучения за год, сЗв Число павших животных 1-5-й групп Контроль
21(1) 62(2) 125(3) 120(4) 188(5)
Заболевания органов дыхания. Пневмония 2 2 — — 1 5 1
Заболевания органов кровообращения, порок сердца — — — — 1 1 —
Заболевания желудочно-кишечного тракта: острый гастроэнтерит 1 — — — 2 3 —
Геморрагический панкреонекроз 1 — — — 2 3 —
Гепатит — — — — 1 1 —
Болезни почек, острый нефрит — 1 — — — 1 —
Злокачественные новообразования
Рак
Меланома
Прочие заболевания
Механическая непроходимость кишечника — — — — — — 1
Травма 1 2 — — — 3 1
Перегрев 1 — — — — 1 1
Смерть при дополнительных нагрузках: после бега на третбане — — 1 — — 1 —
После проведения вращательной пробы — 1 — — — 1 —
Итого 7 6 1 0 9 23 5
Примечание. В скобках указана группа животных.
марная доза 680 сГр), одна — от меланомы глаза с метастазированием.
Остальные животные погибли от различных других причин: порок сердца, нефрит, травмы и т.д. Смерть 5 контрольных животных наступила в результате развившейся пневмонии, рака молочной железы, механической непроходимости кишечника, коллапса вследствие перегревания тела и травмы. Установить какую-либо зависимость между частотой смерти от пневмонии у облученных собак, суммарной дозой и продолжительностью облучения к 6-му году облучения не удается.
От злокачественных новообразований пало 3 собаки, 2 из них погибли от рака печени и рака легкого (собаки 5-й группы), у одной была меланома глаза (собака 1-й группы). Гепатоцеллюлярный рак печени обнаружен у собаки после 3,5-летнего облучения (суммарная доза 680 сГр). Опухоль отличалась большой злокачественностью (распад, множественные метастазы и т.д.). Альвеолярно-клеточный рак легкого с множественными метастазами во внутренние органы был выявлен у собаки через 2,5 года облучения (доза 470 сГр). Меланома глаза развилась у собаки на 6-м году облучения (доза около 110 сГр).
Особую группу составляли животные, подвергавшиеся хроническому облучению и погибшие при предъявлении к ним дополнительных нагрузок, Так, одна собака (2-я группа) через 4 года облучения погибла внезапно во время воздействия отрицательного углового ускорения при исследовании функции вестибулярного аппарата. На основании данных клинического наблюдения и вскрытия можно было предположить, что смерть животного наступила от сосудистого коллапса, приведшего к резкой анемии и набуханию головного мозга. При вскрытии были отмечены резко выраженные атрофические изменения коркового и мозгового вещества надпочечника, лимфатических узлов и селезенки. Неблагоприятный исход сосудистого коллапса, возможно, был обусловлен изменениями, обнаруженными в надпочечниках, обеспечивающих, как известно, адаптационные реакции организма при различных стрессовых воздействиях. Одна собака (3-я группа) погибла через 2 года облучения от острой сердечной недостаточности после 1-минутного бега на третбане.
Анализируя эти данные, можно отметить, что смертность среди облученных животных кроме 5-й группы к 6-му году облучения достоверно не увеличилась по сравнению с контрольными, однако
278
более подробный анализ кривых выживаемости во времени и в зависимости от дозы будет проведен позднее. Там же будут проведены оценки сокращения продолжительности жизни собак в зависимости от поглощенной дозы.
Проблема развития отдаленных соматических эффектов после многолетнего хронического облучения остается одной из кардинальных проблем в оценке опасности воздействия ионизирующего излучения в малых дозах на организм. Особую ценность приобретают результаты фактически проведенных экспериментов в тех или иных условиях хронического облучения. В этой связи мы считали целесообразным специально описать состояние животных после 3- и 6-летнего облучения, которое осуществлялось в рамках «Хронического эксперимента».
Изучение отдаленных эффектов было проведено на 46 подопытных собаках и 16 контрольных (всего 62 животных). Данные общих клинических обследований после прекращения облучения на протяжении 7-10 лет облучения свидетельствовали об удовлетворительном состоянии подопытных животных. Температура, масса тела, частота пульса и дыхания у всех ранее облученных собак находились в пределах физиологической нормы. Через 3-5 лет после 6-летнего облучения были отмечены незначительные изменения в белковом, липидном и минеральном обмене. Как указано в разд. 4.8, в системе гемопоэза после прекращения облучения наблюдается чрезвычайно медленное восстановление показателей периферической крови и костного мозга. Некоторые из них, такие как концентрация эритроцитов, лейкоцитов, нейтрофилов, не были восстановлены и через 3 года после прекращения облучения. После тестирующего острого облучения в дозе 125 сГр восстановление показателей периферической крови (лейкоцитов и тромбоцитов) у собак 4-5-й групп протекало в 2-2,5 раза медленней, чем у животных контрольной 6-й группы.
К 6-му году облучения, особенно у собак 5-й группы отмечали значительное уменьшение компенсаторных возможностей организма, что выражалось в развитии склеротических и некротических дегенеративных изменений и снижении функциональных способностей системы гипоталамус-гипофиз-кора надпочечников. Гипофункциональные сдвиги и истощение наблюдали в щитовидной и половых железах. В течение длительного времени после окончания облучения снижалась физическая работоспособность собак 3-й и особенно 5-й групп. Сразу после окончания об
279
лучения в 46% случаев собаки с трудом выполняли предъявляемую нагрузку (бег на третбане), а через 3 года таких животных было 27%.
Во время наблюдения за животными после 3—б-летнего хронического облучения отмечали формирование специфических для лучевого воздействия отдаленных последствий. У части животных развились опухоли. Сокращалась продолжительность жизни облученных собак по сравнению с контрольными животными. За 8 лет после прекращения облучения пали 22 собаки подопытных групп. Чуть больше половины из них (59%) пали от злокачественных новообразований через 1-5 лет после окончания облучения. Злокачественные опухоли и их локализация оказались отличными от спонтанных опухолей. Ни у одной из подопытных собак не был диагностирован лейкоз. По-видимому, мощность дозы была недостаточной, чтобы вызвать соответствующий эффект. Описаны случаи возникновения лейкозов при облучении собак с мощностью дозы 5, 10, 17 и 35 сГр/сут (Norris W.P., Fritz Т.Е., RehfeldC.E., Brennan P.C., 1971; Norris W.P., Fritz T.E., 1974; Fritz T.E. et al, 1982).
У облученных животных в «Хроническом эксперименте» развились рак печени, мочевого пузыря, предстательной железы, злокачественная феохромацитома надпочечника, злокачественная аденома гипофиза, рак подчелюстной железы, меланома глаза. По данным зооонкологической клиники Онкологического центра АМН СССР на основании изучения 240 случаев возникновения опухолей у собак спектр спонтанных опухолей был иным: опухоли молочных желез до 43%, венерическая саркома — 21,6%, опухоли скелета — 3,7%, встречались липомы, миосаркомы, лимфомы, эпулиды (Григорьев Ю.Г. и др., 1986). Частота спонтанных случаев рака и саркомы по данным этой работы составляет 5%. В рассматриваемом эксперименте в контрольной группе из 10 собак лишь 2 пали от злокачественных опухолей (рак молочной и предстательной желез). Отчетливо выявлена зависимость развития опухолей от суммарной дозы. Так, у собак 3-й и 5-й групп опухоли развивались в 2-3 раза чаще, чем у животных других групп.
Характерной особенностью опухолеобразования у облученных животных явилось развитие первично множественных опухолей. Спонтанные опухоли, как правило, возникают в одном органе и исключительно редко одновременно в нескольких. Таким образом, проведенный нами сравнительный анализ лучевого и спон-
280
тайного опухолеобразования у собак позволил выявить тенденцию к значительному повышению частоты развития опухолей после длительного облучения (в течение 3—6 лет в широком диапазоне мощности дозы), а также отметить существенные изменения спектра новообразований и некоторые особенности бластомогенного роста у облученных животных.
4.12. Сокращение продолжительности жизни у собак в «Хроническом эксперименте*
Для решения вопросов нормирования радиационных воздействий
на космонавтов важным является анализ кривых выживаемости и изучение сокращения продолжительности жизни собак, хронически облучаемых с различной мощностью дозы (1-3-я группы), а также с сочетанным хроническим и острым облучением, имитирующим воздействие детерминированных источников (ГКЛ, РПЗ) и солнечных вспышек (4-я и 5-я группы) при полете к Марсу. Для анализа использовали кривые выживаемости животных
подопытных и контрольных групп в зависимости от возраста собак. Следует при этом отметить, что основной массив эксперимен
тальных данных получен на самцах.
На рис. 4.34 и 4.35 представлены кривые выживаемости собак опытных групп, облучавшихся в течение 3 и б лет, а также животных контрольной группы (6 группа) в зависимости от их возраста.
Можно выделить, по
крайней мере, два пика гибели животных, соответствующих ранней и более поздней гибели. Данные, представленные на рисунках показывают, что облучение собак 1-й группы с наименьшей мощностью дозы 0,06 сГр/сут (21 сГр/ год) приводит на начальном участке кривой выживаемости даже к некоторому увеличению продолжи-
40 60 80 100 120 140 160 180 200
Возраст собак, месяцев
Рис. 434. Выживаемость собак самцов 1-5-й и контрольной (6-й) групп, облучавшихся 6 лет по отношению к исходному числу собак в «Хроническом эксперименте»
281
40 60 80 100 120 140 160 180 200
Возраст собак, месяцев
Рис. 4.35. Выживаемость собак самцов 2-5-й и контрольной (6-й) групп.
1 —животные 2-й группы (372 сГр); 2 и 3 — животные 3-й группы (зачерненные знаки — собаки, облучавшиеся 3 года (375 и 750 сГр)); 4 и 5 — собаки 5-й группы (564 и 1128 сГр); 6 — собаки контрольной группы
Рис. 4.36. Выживаемость собак самцов в зависимости от возраста в «Хроническом эксперименте»» при объединении групп с близкой величиной дозы.
1 — данные для собак 1-й и 6-й групп + собак 2-й группы, облучавшихся 3 года (доза в пределах (0-186 сГр); 2 — данные для собак 2-й, + 3-й и 4-й групп (доза 360-375 сГр); 3 — данные для собак 3-й и 4-й групп (доза 720-750 сГр);
4 — данные для собак 5 группы, доза (564-1128 сГр)
тельности жизни для части собак (больший уровень выживаемости, чем в контрольной группе). У другой части животных этой группы, которых можно условно отнести к категории «долгожителей» (гибель на 160-200-м месяце), продолжительность жизни все же несколько сокращалась на 1,0-1,5 года из-за радиационного воздействия.
Поскольку количество животных в опытных и контрольной группах невелико (от 6 до 13 собак), с целью количественного анализа сокращения продолжительности жизни животных от величины поглощенной дозы было проведено объединение групп животных с близкими значениями доз.
На рис. 4.36 представлены кривые выживаемости собак в результате такого объединения групп с близкой величиной среднетканевой поглощенной дозы, а в табл. 4.20 представлены данные о средней продолжительности жизни собак, облученных в различных дозах.
Как свидетельствуют данные табл. 4.20 и рис. 4.36, хроническое облучение животных с мощ
282
ностью дозы 62 сГр/год в течение 6 лет (2-я группа) и облучение в течение 3 лет собак 3-й и 4-й группы (доза 360-372 сГр/год) приводит к снижению продолжительности жизни приблизительно на 7 месяцев (на 5%).
Таблица 4.20
Средняя продолжительности жизни собак самцов Т в зависимости от суммарной дозы облучения
Группы животных и среднетканевые поглощенные дозы, сГр Число собак Параметры, характеризующие среднюю продолжительность жизни собак (То / Тк>, %
(Т±т), месяцы а, месяцы
Контроль (0) 13 154 ± И 37 100
1 + 1* (63-126) 9 154 ± 10 28 100
1 + 1* + 6 (0-126) 22 154 ± 7 32 100
1 + 2* (126-189) И 150 ± И 36 97,5
2 + 3* + 4* (369-378) 16 147 ± 5 19 95,5
5* (567) 6 116 ± 9 19 75,5
3 + 4 (720-750) 12 125 ± 8 26 81?5
5(1128) 9 108 ± 15 42 70
* — группы собак, облучавшиеся 3 года
6-летнее облучение животных 3-й и 4-й групп в дозе 720-750 сГр приводит уже к значительному снижению продолжительности жизни собак. По ближайшему пику гибели продолжительность жизни снижается более чем на 3 года (приблизительно на 30%). Для относительно устойчивых животных (второй пик гибели в возрасте 130-150 месяцев) продолжительность жизни уменьшается приблизительно на 2 года (15-17%). Максимальное сокращение продолжительности жизни отмечено у собак 5-й группы.
283
После 3 лет облучения (доза 564 сГр, включая 9-кратное острое фракционированное облучение в дозе 42 сГр за фракцию) продолжительность жизни снижается по данным первого и второго пиков гибели на 3-4 года (25-30%). После б лет облучения (доза 1128 сГр) продолжительность жизни, оцениваемая по менее жизнеспособным животным (первый пик гибели), снижается в 2,5 раза и составляет 40% от продолжительности жизни собак контрольной группы.
Анализируя данные, представленные на рисунках 4.34-4.36, можно отчетливо отметить гетерогенность популяции животных по жизнеспособности. Уже при использовании 6-12 собак в группе в ней удается выделить по крайней мере два пика гибели животных, характеризуемых относительно высокой скоростью гибели как в контрольной, так и в подопытных группах. Причем с увеличением дозовой нагрузки гетерогенность усиливается, пики гибели расходятся во времени.
Как видно из данных, представленных на рис. 4.34-4.36, облучение собак с мощностью дозы 21 сГр/год (1-я группа) приводит на начальном участке кривой выживаемости (для первого пика гибели) даже к несколько большей продолжительности жизни. О стимулирующем действии ионизирующих излучений с низким значением мощности дозы на ряд биологических процессов на различных уровнях биологической организации (от простейших до высокоорганизованных организмов) указывалось в обзорном исследовании (Кузин А. М., 1977). В этом исследовании отмечалось в частности наличие стимулирующего действия на иммунную систему животных. Увеличение средней продолжительности жизни мышей при их облучении с мощностью дозы 0,11 сГр/сут наблюдали также исследователи в работах (Lorenz et.al., 1954; Andersen А.С. and Rosenblatt L.S., 1969).
Данные на рис. 4.34-4.36, свидетельствуют, что это явление, по-видимому, характерно и для собак при их облучении с мощностью дозы 0,06 сГр/сут (1-я группа), однако лишь для наиболее слабой части животных 1-й группы (первый пик гибели в пределах возраста 130-160 месяцев). У живоных этой же группы, которых можно условно отнести к категории долгожителей (гибель через 160-200 месяцев), продолжительность жизни все же снижается, приблизительно на 1,0-1,5 года (6-9% по отношению к контрольным животным).
284
Рис. 437. Выживаемость самок гончих собак в зависимости от возраста.
1 — контрольные животные; 2 и 3 — животные после острого облучения в дозах 100 и 300 сГр соответственно (Andersen А.С. and Rosenblatt L.S., 1969)
Исследование (Andersen А.С. and Rosenblatt L.S., 1969) подтверждает высказанное выше положение о разной направленности изменения продолжительности жизни у собак, различающихся по жизнеспособности и соответствующих различным участкам кривой выживаемости. В этой работе изучалось изменение продолжительности жизни у самок гончих собак при фракционированном и однократном остром облучении в дозах 100 и 300 сГр. На рис. 4.37 представлены кривые выживаемости контрольных и подопытных животных, однократно облученных в указанных дозах.
Как видно из рисунка, для наиболее слабой части популяции действительно наблюдается стимулирующий эффект облучения, максимально выраженный при облучении в дозе 100 сГр. Средняя продолжительность жизни этих собак значительно увеличивается (приблизительно на 4-5 лет). Это вполне может объясняться стимуляцией иммунной системы у этой части животных и уменьшением смертности от инфекционных заболеваний и воспаления легких. В то же время у собак, относящихся к категории долгожителей (смертность в диапазоне 11-15 лет), у которых был высокий статус иммунной системы до облучения, продолжительность жизни сокращается в среднем на 1,5-2,5 года.
На рис. 4.38 и в табл. 4.21 представлены кривые выживаемости и данные о продолжительности жизни собак (самок) в «Хроническом эксперименте».
Как видно из этих материалов, средняя продолжительность жизни собак объединенных контрольной и 1-й групп (доза 0-126 сГр) ниже, чем у самцов. Но в то же время радиационно обусловленное снижение продолжительности жизни также заметно
285
Рис. 4.38. Выживаемость собак самок 3-й группы (1), 4-й группы (2), 5-й группы (3) и контрольной 6-й группы (4) в зависимости от возраста
меньше, чем у самцов, так что средние значения продолжительности жизни самок и самцов в группах с максимальной дозовой нагрузкой (3-5-я группы) оказываются уже близкими.
Анализируя характер
кривых выживаемости собак самок в зависимости от возраста, представленный на рис. 4.38, можно также отметить наличие гетерогенности распределения
животных по их жизнеспособности (наличие по крайней мере двух пиков гибели). Кроме того, у самок более выражен стимулирующий эффект (увеличение продолжительности жизни) для части животных, который наблюдается даже при облучении в дозах 720-750 сГр (3-я и 4-я группы). У наиболее слабых животных при этом продолжительность жизни увеличивалась почти на 2 года, у более устойчивых животных (долгожителей), наоборот, продолжительность жизни снижалась на 1-2 года. Следует также отметить менее выраженное сни-
Таблица 4.21
Средняя продолжительности жизни собак самок Т в зависимости от суммарной дозы облучения
Группы животных и среднетканевые поглощенные дозы, сГр Число собак Параметры, характеризующие среднюю продолжительность жизни собак (То / Тк), %
(Т±т), месяцы а, месяцы
1 + 6 (0-126) 12 131 ± И 38 100
3 + 4 (720-750) 12 125 + 6 18 95
5(1128) 5 108 ± 15 34 87,5
286
жение продолжительности жизни при облучении в дозе 1134 сГр (5-я группа) у самок, чем у самцов, что наиболее сильно проявляется у наиболее слабых животных, погибающих в более ранние сроки (первый пик гибели).
Итоги «Хронического эксперимента» оказались уникальными и очень значимыми не только для космической радиобиологии, но, например, и для оценки радиационной опасности населения после аварии на ЧАЭС.
Все этапные результаты «Хронического эксперимента» публиковались в ведущих журналах страны и за рубежом. По материалам «Хронического эксперимента было опубликовано более 50 работ, защищено 2 докторских и более 15 кандидатских диссертаций. Результаты этого исследования были отражены на выставке достижения народного хозяйства, в журнале «Советский Союз», в журнале «Life Sciences and Space Research».
Результаты 3-летнего эксперимента были предметом подробного обсуждения на Всесоюзном симпозиуме «Хроническое действие внешнего гамма-облучения на организм собак», проходившем в г. Истре 16-20 октября 1972 г. На этом симпозиуме было представлено более 50 докладов по итогам «Хронического эксперимента», включая зарубежные доклады из ВНР и ЧССР. Предисловие к материалам этого симпозиума было написано заместителем министра здравоохранения СССР Аветиком Игнатьевичем Бурназяном.
В этом симпозиуме приняло участие большое число ведущих радиобиологов страны С.П. Александров, Е.Д. Гольдберг, Н.Г. Да-ренская, С.А. Кейзер, Ю.К. Кудрицкий, Н.Н. Лившиц, В.И. Стрельцова, Е.А. Черкасова, В.В. Шиходыров и др.
На фотографиях представлен сборник тезисов докладов на этой конференции и основные участники исследований из ведущих институтов Москвы и Санкт-Петербурга в перерыве между заседаниями.
В результате обобщения всех материалов «Хронического эксперимента» по изменению состояния различных систем организма собак при длительном сочетанном облучении, моделирующем характер радиационного воздействия на космонавтов при полете на Марс, а также ряда других хронических экспериментов по облучению мелких лабораторных животных в широком диапазоне доз и мощностей доз были разработаны модели формирования радиационного поражения млекопитающих в системе кроветворе-
287
чмннсткгствй адрлайохрАнгпия охр
BSSBWWS < a®er no *ада ►бшмюлыя
Ажлдейим fcm <X€P
Мяо™, ^^кг^ийзнагичвйжвж проблем М3 СССР
СОМАТИЧЕСКИЕ ЭФФЕКТЫ ХРОНИЧЕСКОГО ОБЛУЧЕНИЯ
ТЕЗИСЫ ДОКЛАДОВ НА ВСЕСХЖЗИОМ СИМПОЗИУМ! ^ХРОНИЧЕСКОЕ ДЕЙСТВИЕ ВНЕШНЕГО ГАММА ОБЛУЧЕНИЯ НА ОРГАНИЗМ СОБАК“ Г. Истра JS—?‘i ОД’ЛТРЯ !Ш f
Sm-ийм
Расширение работ по освоению космнческого пространства и использование длительно летающих а Космосе нссле-домтгльсхих лабораторий настоятельно требуют решения рам актуальных вопросов радиационно* безопасмстп при космических полетах.
Ученые Советского Союза провели широкое научное исследование (условно названное «хронически* эксперимент») многодетного действия проникающей радиация на оргаияаи большого числа собак. При этом был смоделирован ряд возможных радиационных ситуаций в кабине корабля при длительном полете в Коемоее.
Материалы данного сборника содержат результаты мпо-пметжто исследовательского труди ряда слецмлдистоа (клиницистов, гематологов, цитологов, биохимиков, физиологов, иммунологов И'морфологов) — ученых нэ раааых инстутутоя
Публикуемые результаты работ свидетельствуют о том, что исследованные радиобиологические эффекты обнаруживают опрсделеиую доаону» зависимость. Тщательный анализ полученных материалов позволит специалистам полисе оценить значимость радиационного фактора от изотропного га-лактичесмого космического мвзучения и корпускулярного излучения солнечных вспышек, а также создать аффективные меры по организации системы радиационно* безопасности при полетах человека в Космосе.
Несомненно, что результаты, полученые при выполнении «Хронического эксперименте» н публикуемые в данном сборнике. предстанет интерес для ькспершимтаторов-радвобно-логов, радиологов и гигиенистов.
Зал. министра здравоохранения СССР
А. И. Бурназян
Результаты трехлетней работы. Материалы симпозиума с предисловием зам. министра здравоохранения СССР А.И. Бурназяна. 1972 г.
Участники симпозиума в г. Истре, 1972 г.
288
ния и на уровне целостного организма. Эти модели легли в основу оценок радиационного риска для космонавтов при осуществлении орбитальных и межпланетных полетов.
Первое такое обобщение представлено нами в 1986 г. в книге Григорьев Ю.Г., Попов В.И., Шафиркин А.В. Антипенко Ж.Б.»Со-матические эффекты хронического гамма-облучения». Энерго-атомиздат, 1986 г.
Считаем своим долгом выразить большую признательность и благодарность: Т.П. Цессарской, А.Г. Изергиной, А.В. Илюхину, Т.Е. Бурковской, Т.М. Зухбая, Э.С. Зубенковой, Л.Л. Семашко, Н.Л. Федоровой, М.Г. Петровнину, А.А. Ахунову, Е.П. Си-зану, В.И. Корчемкину, Д.Б. Антипенко, З.А. Виноградовой, В.А. Зуевой, В.Л. Янкелевич, П.И. Кумцу, Ж.Г. Заликиной, Л.А. Беспаловой, Г.А. Лебедевой, И.Д. Борисенко, Г.И. Плаху-та-Плахутиной, Е.А. Савиной, В.И. Яковлевой, В.Г. Кондратенко, В.В. Юргову, а также отметить большой вклад научных сотрудников, наших коллег, в успешное проведение «Хронического эксперимента» и получение очень важных уникальных результатов. Хотим особенно поблагодарить руководителей биологической и физической лабораторий за их большую роль и подвижническую работу в организации эксперимента. Они, сочетая свои научные возможности и характеристические качества (внимательность, твердость, настойчивость и умение организовать работу большого коллектива), обеспечили проведение этого сложного эксперимента на протяжении 16 лет без единого срыва.
Немалая роль в успехе «Хронического эксперимента» зависела от лаборантского состава. Работа с собаками всегда вызывает большие трудности, а в наших условиях требовались героические усилия: сам эксперимент проводился на загородной базе «Планерная», более 240 собак содержались на улице, зимой в мороз. Животных надо было накормить 2 раза в день горячей пищей, расчистить снег перед их будками, привести собак на обследование, вместе с научными сотрудниками провести это обследование и т.д.
Низкий поклон лаборантам Смеловым Светлане и Нине, Кряквиной Гале, Гуровановой Вале, Калининой Зине, Барановской Людмиле, Ромадиной Вале, Комраковой Гале, Самусевой Лене и многим другим помощникам.
289
Медико-биологическая лаборатория и физики в гостях у Б.Л. Маркелова 12 ноября 2001 г. на 35-ю годовщину от начала «Хронического эксперимента»
Очень трудоемкая работа и идеология самого «Хронического эксперимента» сплотила коллектив. На протяжении последующих лет коллектив торжественно отмечал «День начала эксперимента».
МАТЕМАТИЧЕСКИЕ МОДЕЛИ РАДИАЦИОННОГО ПОРАЖЕНИЯ ОРГАНИЗМА ПОСЛЕ ОСТРЫХ □ ПОВТОРНЫХ И ПРОТЯЖЕННЫХ
ОБЛУЧЕНИЙ С РАЗЛИЧНОЙ МОЩНОСТЬЮ ДОЗЫ
5.1. Модельное описание закономерности формирования поражения в системе кроветворения при протяженном облучении и после острых радиационных воздействий
Как было показано нами в разд. 3.3 и 4.7, система кроветворения представляет собой сложную многоуровневую многофункциональную систему, в которой поддержание нормальных концентраций клеток и соотношений между ними обеспечивается множеством регуляторных звеньев, охватывающих по принципу обратной связи все отделы системы. Имеется авторегуляторный механизм, управляющий пролиферацией и дифференцировкой стволовых, коммитированных и морфологически идентифицируемых клеток, который основан на учете численности клеток в костном мозге и в периферической крови.
Исследование кинетических соотношений в системе кроветворения, представленное в разд. 4.7, показало, что процессы кроветворения и кроворазрушения взаимно обусловлены, находятся в строгой координации. Система кроветворения охвачена множественными авторегуляторными и более глубокими звеньями обратной связи. Процессы пролиферации и дифференцировки регулируются нейрогормональным путем, обеспечивая относительное постоянство клеточного состава в нормальных условиях и необходимое его изменение при внешних воздействиях, адекватное функциональным потребностям организма.
Нами было показано ранее, что характер и глубина изменений в системе гемопоэза практически обусловлены степенью поражения пула стволовых кроветворных клеток. При построении модели инактивации стволовых клеток мы рассмотрели вначале режим
291
хронического облучения с различной величиной мощности дозы. Использовали при построения модели современные представления и кинетические схемы регуляции размножения и дифференцировки стволовых кроветворных клеток с учетом межклеточного конкурирующего взаимодействия.
Мы предположили, что некоторая часть полипотентных стволовых клеток qS находится в митотическом цикле, а остальная (l-q)S — в стадии покоя Go, из которой клетки с некоторой удельной скоростью (3 трансформируются в коммитированные предшественники, дающие начало нескольким рядам дифференцированных клеток. В условиях хронического облучения с мощностью дозы у дифференциальное уравнение для изменения числа стволовых клеток, как показано в работах (Шафиркин А.В., 1983-а., б; Григорьев Ю.Г. и др., 1986), может быть записано в виде:
dS/dt = amqS - Р(1 - q)S - yd0S, (5.1)
где a m — удельная скорость размножения клеток, находящихся в митотическом цикле; Р — удельная скорость дифференцировки клеток; d0 — сечение радиационной инактивации стволовых кроветворных клеток — величина, равная обратному значению параметра Do, который для кроветворной ткани в случае облучения мелких лабораторных животных и редкоионизирующего излучения примерно равен 1 Гр. Первый член уравнения (5.1) характеризует скорость размножения популяции стволовых клеток, второй определяет их убыль за счет дифференцировки, а последний обусловлен некоторой средней скоростью гибели клеток, пропорциональной мощности дозы г и сечению радиационной инактивации d0.
В предположении, что величина q максимальна и равна 1 в условиях отсутствия конкурирующего взаимодействия клеток и что она убывает линейно с увеличением числа клеток по закону q = 1 - aS, где а — некоторый коэффициент конкурирующего взаимодействия клеток, выражение (5.1) принимает вид:
dS/dt = (am -Yd0)S-(am +₽)aS2. (5.2)
Полученное выражение представляет собой уравнение Фер-хюльста-Пирла, называемое часто логистическим уравнением, ис
292
пользуемым для описания кинетики размножения либо биологических видов, либо отдельных клеточных клонов при наличии конкурирующего взаимодействия между отдельными особями или клетками (Н. Бейли 1970).
Интегрирование уравнения (5.2) дает следующее решение для зависимости от времени числа стволовых кроветворных клеток при протяженном облучении с различной мощностью дозы:
S=l/
(«т +Р)а (% - Ydo>
1
8н
(gm +р)а (% “ Ydo>
ехр[-(ат _Ydo)t]p
(5.3)
где SH — начальное число стволовых клеток. Из уравнений (5.1) и (5.2) для равновесного режима в отсутствие облучения легко получить, что ат» Р, поскольку q « 1, а равновесное значение определяется из выражения:
So =am/(«m +Р)а = 1/а.
В случае, когда SH = So и с учетом представленных выше соотношений выражение (5.3) можно переписать в виде:
8 = 8оЛ--^-7
1 - Ydo/
exp [-(«m -Ydo)t]
(5.4)
Анализ уравнения (5.4) показывает, что при t = 0 число стволовых клеток равно исходному равновесному значению S = So. При малых значениях времени t или выражения (am - yd0, раскладывая экспоненту в ряд и ограничиваясь линейным членом, получаем: S = S0/l+yd0. В случае, когда величина y d01 также мала так, что у d01 « 1, то S = S0(l - у d01).
На начальном участке получим линейный характер уменьшения числа стволовых кроветворных клеток со временем, причем скорость уменьшения относительного числа оказывается пропорциональной мощности дозы, что согласуется с экспериментальными данными, представленными на рис. 5.1.
При больших значениях t логистическая кривая, являющаяся решением уравнения (5.2), выходит на новый равновесный уро-
293
Рис. 5.1. Изменение относительного числа стволовых кроветворных клеток КОЕС у мышей при хроническом гамма-облучении с различной мощностью дозы в пределах 0,01-0,8 Гр/сут.
По оси абсцисс — длительность облучения, сут; по оси ординат — число КОЕС, %. Пунктирная кривая — расчет по модели (Шафиркин А.В., 1983а, б; Григорьев Ю.Г. и др., 1986)
вень, глубина отклонения которого от исходного стационарного значения является также пропорциональной мощности дозы:
SP =So(l-Y<io/am)-
(5.5)
Это наблюдается лишь в определенном диапазоне мощности дозы, когда выполняется соотношение Y d0 < am. Данные, представленные на рис. 5.1, вполне соответствуют модели. Однако для более точного согласования расчетных и экспериментальных данных пришлось дополнительно предположить компенсаторное возрастание удельной скорости размножения стволовых кроветворных клеток, находящихся в митотическом цикле при увеличении
294
мощности дозы (сокращение длительности митотического цикла). Удельная скорость размножения оказалась зависимой от мощности дозы ат(у).
Сам факт ускорения процесса клеточного деления и сокращения длительности митотического цикла при протяженном облучении подтвержден в целом ряде работ, показан нами в разд. 4.7 и связывается как с авторегуляторными процессами в ткани, выходом части клеток из состояния покоя и переходом их к размножению, так и с активацией процесса размножения стволовых и коммитированных клеток, обусловленной действием компенсаторных систем организма.
Значения параметра am подбирали для каждой мощности дозы методом наименьших квадратов для наилучшего согласования расчетных и экспериментальных данных. Расчет проводили для двух случаев: в первом считали популяцию клеток гомогенной по радиочувствительности; во втором принимали ее гетерогенной и считали, что часть клеток около 15% составляют очень устойчивую фракцию, с учетом имеющихся литературных данных. При этом параметр Do для основной фракции принимали равным 1 Гр, а для радиоустойчивой от 5 до 10 Гр (Шафиркин А.В., 1983-а, б; Григорьев Ю.Г. и др., 1986).
В случае близости значений am и yd0, так что (am - yd0) = 0, получим неуклонное уменьшение числа стволовых клеток с увеличением времени и накопленной дозы:
S = So / (1 + Y d01) = S0/(l + d0D) = So / [1+ am (Y >t]. (5.6)
Характер изменения числа стволовых клеток в этом случае представлен на рис. 5.2. Как видно из данных, представленных на рисунке, скорость инактивации стволовых кроветворных клеток во времени при облучении с мощностью дозы 1-10 Гр/сут пропорциональна мощности дозы. Однако зависимость от дозы доли выживших клеток практически не зависит от мощности дозы и подчиняется единой кривой, соответствующей представленному уравнению (5.6).
Мы рассмотрели наиболее простую математическую модель изменения числа стволовых кроветворных клеток при хроническом облучении с различной мощностью дозы в широком диапазоне ее изменения. При этом принимали, что имеет место саморегуляция доли клеток, находящихся в митотическом цикле, кото-
295
Рис. 5.2 Относительное изменение числа стволовых кроветворных клеток КОЕС у мышей при их гамма-облучении с большими значениями мощностей доз 1,0; 3,0; 6,0 и 10 Гр/сут.
Верхний рисунок — зависимость от длительности облучения, сут; нижний рисунок — зависимость от общей накопленной дозы, Гр. Пунктирная кривая — расчет по модели.
(Шафиркин А.В., 1983; Григорьев Ю.Г. и др., 1986)
рую считали обусловленной конкурирующим взаимодействием самих клеток q = 1 - aS. Кроме того, предположили компенсаторное усиление скорости размножения стволовых клеток при больших значениях мощности дозы, связанное с регуляцией со стороны организма. Удельная скорость размножения оказалась зависимой от мощности дозы бш(г) по степенному закону (Шафиркин А.В., 1983-а, б; Григорьев Ю.Г. и др., 1986).
Однако уже эта простая модель позволила достаточно удовлетворительно описать характер инактивации пула стволовых кроветворных клеток по мере увеличения мощности дозы и наглядно представить качественный переход, когда компенсация оказывается уже недостаточной и наблюдается неуклонное снижение кон
296
центрации стволовых клеток, приводящее в ближайший период к гибели животных.
В дальнейшем сделана попытка доработки модели для описания характера изменения как стволовых, так и числа клеток в костном мозге и периферической крови (Губин А.Т., Сакович В.А., Шафиркин А.В., 1995). При этом предполагали те же постулаты модели для размножения и дифференцировки стволовых клеток, только добавляя дополнительно конкурирующее воздействие на скорость их размножения также пула всех костномозговых клеток М в виде: q = 1 - a(lnS/lnS*) - Ь(1пМ/1пМ*), где а и b — постоянные, определяющие долю клеток в митотическом цикле для нормальных условий, когда концентрации стволовых клеток и клеток костного мозга равны S* и М*, a q* = 1 - а - Ь.
При снижении количества клеток, вызванном радиационным или другим воздействием, в обновляющихся системах и в организме в целом развиваются компенсаторные процессы, приводящие к усилению скорости пролиферации (размножения) клеток костного мозга. Имеет место увеличение коэффициента размножения способных к делению морфологически идентифицируемых клеток костного мозга за счет значительного сокращения длительности клеточного цикла и частично некоторой задержки дифференцировки и переходу клеток к дальнейшему созреванию. Влияние указанных процессов формально можно учесть, если коэффициент размножения представить в виде к = к*[1 - 1п(М/М*)], т.е. зависимым от общего числа клеток костного мозга.
Дифференциальные уравнения для изменения числа стволовых клеток S и суммарного количества клеток костного мозга М при протяженном облучении могут быть представлены в виде:
dS/dt = S{a[l - a(lnS/lnS*) - b(lnM/lnM*) -
- (P/а) a(lnS/lnS*) + b(lnM/lnM*)] - y/D0}, (5.7)
dM/dt = P S[a(lnS/lnS*) + (5.8)
+ b(lnM/lnM*)]k*[l - ln(M/M*)] - M/T.
Здесь а — удельная скорость размножения стволовых клеток, Р — коэффициент, определяющий вероятность перехода в дифференцировку, у — мощность дозы радиационного воздействия, Т —
297
среднее время жизни костномозговых клеток до выхода в кровь, а Do — параметр, характеризующий инактивацию стволовых кроветворных клеток. Величина y/D0 имеет размерность 1/сут. При начальных условиях и равновесном режиме S(0) = S* и М(0) = м*.
При отсутствии радиационного воздействия в норме имеют место равенства: (1 - а - Ь) = 0 (а + Ь)/ст и М* = S* 0 (а + b) k* Т.
Если осуществить замены (М/М* = m, a S/S* = s), то выражение для изменения относительного числа костномозговых клеток будет иметь вид:
dm / dt = {0S [a(lnS / InS*) + (5.9)
+ b(lnM / lnM*)]k*[l - In (m)]} / S*0(a + b) k*T - m / T = = {s [a(lnS / InS*) + b(lnM / InM*)] x
x [1 - ln(m)]} / (a + b) T - m/T.
Из первого уравнения для равновесного режима вытекают следующие соотношения: а/(а + b) = а (1 + 0/ст) и Ь/(а + Ь) = = Ь (l+0/о).
Заменяя первое равенство на V, (второе будет равным 1 - v), группируя члены, отражающие содержание стволовых клеток и клеток костного мозга и переходя к относительным содержаниям клеток s и ш, дифференциальные уравнения могут быть переписаны в виде
ds / dt = s{o [1 - v(lnS / InS*) - (5.10)
-(1-v) (InM/lnM*)] ~y/D0},
dm/dt = {s[v(lnS/lnS*)+ (5.11)
+ (1 - v) (InM / InM*)] [1 - In (m)]} / T - m / T.
Поскольку s = S/S*, InS = ln(s) + InS* и аналогично InM = = ln(m) + InM*, уравнения 5.10 и 5.11 можно выразить в виде
ds/dt = —s {a [v (In s/InS*) + (5.12)
+ (1 - v) (In m / InM*)] + у / Do},
dm/dt = {s[l + v(ln s /InS*) +
+ (1 - v) (In m /InM*)] [1 - In (m)]}/T - m/T. (5.13)
298
Значения параметров q, Т, S* и М* в принципе могут быть установлены независимо от радиобиологических экспериментов. Причем значения двух последних параметров достаточно знать лишь приближенно из-за логарифмической зависимости от них. Параметр Do известен относительно хорошо, так что остается лишь один свободный параметр v для подбора методом наименьших квадратов для согласования с экспериментальными данными.
При воздействии с не очень большими значениями мощностей доз (до 0,5 Гр/сут для мелких лабораторных животных и до 0,1 Гр для крупных млекопитающих), приравнивая производные к нулю, получаем выражения для новых равновесных концентраций стволовых клеток sp и клеток костного мозга шр.
о (lnsp /InS*) + (1 - v) In (mp) /InM* = -у/a Do (5.14) и
Sp [1 - y/cf Do] x [1 - In (mp)] = mp. (5.15)
Нетрудно видеть, что если ингибирование скорости пролиферации стволовых клеток определяется только количеством этих клеток v = 1, то при любой мощности дозы, удовлетворяющей условию у < gD0, равновесная концентрация как и в предыдущей модели зависит от мощности дозы и уменьшается при ее увеличении: sp = exp [-у InS / a Do]. Реально v < 1.
В работе (Губин А.Т., Сакович В.А., Шафиркин А.В., 1995) показано, что эта модель удовлетворительно описывает относительные изменения миелокариоцитов в костном мозге и содержание лейкоцитов в периферической крови. Подтвердилась правомерность включения компенсационного члена, увеличивающего число делений клеток костного мозга и коэффициент их размножения до начала их созревания, что позволило более точно описать равновесные значения шр, которые превысили равновесные относительные значения для стволовых клеток sp. Следует заметить, что относительное увеличение числа костномозговых клеток (по сравнению с числом стволовых клеток) наблюдается, несмотря на гибель и снижение репродуктивной способности части делящихся клеток. Это происходит за счет значительного сокращения длительности клеточного цикла у оставшихся жизнеспособных клеток, что свидетельствует о более напряженном характере функционирования системы кроветворения. Это мы наблюдали при анализе изменений в системе кроветворения у собак в процес
299
се их многолетнего облучения в «Хроническом эксперименте» (разд. 4).
Модель была использована нами также для описания кинетики кроветворения в случае острых облучений, когда скорость радиационной инактивации очень высокая. Имеет место резкое снижение числа жизнеспособных стволовых кроветворных клеток в зависимости от дозы, что мы наблюдали ранее. Картина в костном мозгу и периферической крови сразу измениться не может, и наблюдается определенная динамика с постепенным снижением сначала числа клеток костного мозга, а затем периферической крови. Для кратковременных острых облучений можно использовать те же уравнения (5.12) и (5.13), считая, что начальное относительное число стволовых клеток s соответствует доле выживших клеток, определяемой на основе кривых выживаемости. Мощность дозы в этом случае отсутствует.
Модель была применена также для описания кинетики гранулоцитов в периферической крови. Поскольку период полувыведения гранулоцитов из кровотока обычно составляет всего несколько часов, то изменение их концентрации во времени в крови должно повторять изменение числа клеток миелоидного ряда в миелограмме. Для собак это справедливо и по отношению к лейкоцитам, так как основную часть их составляют нейтрофилы. Это мы подробно рассматривали в разд. 3.3.
5.2. Модели эффективной остаточной дозы для описания поражения организма и его восстановления после острых повторных и хронических облучений с различной мощностью дозы
С 60-х гг. прошлого столетия в радиобиологических исследованиях широко использовалась для описания закономерностей изменения поражения организма во времени простая модель, предложенная Н. Блэром в 1952 г. (Блэр X., 1958; Blair Н.А., 1962, 1964). Разработанная автором модель сначала была предназначена для описания эффектов радиационно обусловленного сокращения продолжительности жизни биологических объектов, но нашла также широкое применение для описания кинетики поражения в пострадиационном периоде после острых облучений (модель эф
300
фективной остаточной дозы). Несколько позже она была апробирована сначала им, а затем большим числом исследователей в лабораториях мира, в том числе Советского Союза для описания результатов формирования поражения в процессе протяженных облучений. Модель основывалась на следующих постулатах:
• общее поражение, вызванное облучением, — пропорционально поглощенной дозе I = AD;
• часть поражения является необратимой и накапливается пропорционально общей дозе, в то время как оставшаяся часть поражения восстанавливается со скоростью пропорциональной ее величине;
• смертельный исход имеет место, когда суммарное поражение достигает определенной пороговой величины, эквивалентной поражению от смертельной дозы острого облучения, причем величина порогового поражения пропорциональна ожидаемому сокращению продолжительности жизни животного.
В соответствии с этими постулатами автор записывает два дифференциальных уравнения для необратимой и обратимой 1г частей поражения:
dIr/dt = (A-a)y-pIr, d Ij / dt = ay,
где A — коэффициент, связывающий суммарное поражение с дозой; a — коэффициент, определяющий накопление необратимого поражения с дозой; у — мощность дозы; Р — коэффициент, определяющий скорость восстановления организма.
Решения для представленных дифференциальных уравнений будут иметь следующий вид:
Ir = [(А - a) / fl у [1 “ exp (~Р t)], (5.17)
li =ayt.
Учитывая линейный характер между дозой и поражением (постулат 1), разделив почленно представленные выражения на коэффициент А и сложив их, получим выражение для накопления со временем эффективной остаточной дозы:
вэф = [(1 - О / Р1У [1 - ехр(-р t)] + f у t, (5.18)
301
Рис. 53 Качественный характер зависимости эффективной остаточной дозы при хроническом облучении с постоянным значением мощности дозы в соответствии с моделью Н. Блэра.
1 — эффективная остаточная доза; кривая 2 — обратимая часть поражения; 3 — необратимая часть поражения; 4 — суммарная накопленная доза
где f = а/А — коэффициент, определяющий скорость накопления необратимой части поражения.
На рис. 5.3 представлен качественный характер зависимости эффективной остаточной дозы от времени в процессе облучения с постоянным значением мощности дозы. Кривые 1, 2, 3 и 4 соответствуют суммарному значению эффективной дозы в соответствии с уравнением (5.18), ее обратимой и необратимым частям и суммарному значению поглощенной дозы соответственно.
При кратковременном облучении, определяемом минутами и часами при 01 « 1 восстановительные способности на уровне организма не успевают проявиться, и суммарное поражение определяется суммарной накопленной дозой I = А у t и Ээф = y t = D. Увеличение длительности радиационного воздействия до нескольких суток и более приводит к экспоненциальному характеру накопления поражения и величины эффективной остаточной дозы Ээф согласно уравнению (5.18). В случаях, когда время облучения превысит величину 4/0, обратимая часть эффективной остаточной дозы становится постоянной, равной [(1 - f)/P]Y (кривая 2) и дальнейшее увеличение поражения характеризуется линейной функцией, связанной с реализацией необратимой части поражения.
Значение эффективной остаточной дозы в этих случаях всегда оказывается меньше суммарной накопленной дозы за счет реализации восстановительных процессов и значение коэффициента эффективности радиационного воздействия КВ, равного отношению эффективной к общей накопленной дозе будет меньше 1,0.
КВ = Оэф / D = [(1 - f) / Р t] [1 - ехр(-р t)] + f. (5.19)
302
Наличие в модели Блэра сравнительно простых дифференциальных и интегральных выражений с двумя постоянными параметрами для описания характера развития поражения во времени позволяло относительно легко проводить расчеты эффективных доз для случаев облучения с переменой во времени мощностью дозы или при осуществлении повторных острых радиационных воздействий. Из модели следует также простой экспоненциальный закон восстановления обратимой части поражения и эффективной дозы в пострадиационном периоде после острых радиационных воздействий или хронических облучений с некоторой длительностью т. Это способствовало широкому распространению модели для анализа результатов радиобиологических экспериментов в различных лабораториях в мире, поставленных на большом числе мелких лабораторных животных (МЛЖ) и на крупных млекопитающих.
Так, после протяженного облучения с некоторой длительностью т выражение для Ээф имеет следующий простой вид:
вэф = [(1 - О / Р] Y [1 - ехр(-р т)] е-₽ <* ’ + f у т. (5.20)
Таким же простым оно является для описания эффективной остаточной дозы после острых радиационных воздействий в дозе Do:
Оэф= Do[ f + (1 - f) exp (-₽ t)]. (5.21)
Однако, сведение сложного комплекса восстановительных и компенсаторных процессов, протекающих на разных уровнях биологической интеграции, лишь ко второму постулату является достаточно грубым приближением, отражающим реакцию организма, как реакцию простой линейной системы регулирования с постоянным во времени параметром скорости восстановления организма р. Это сравнительно часто приводило к возникновению значительных расхождений расчетных значений и экспериментальных данных, особенно в подробно проводимых опытах с большим числом доз и сроков обследования животных.
Так, например, модель не учитывает различия в биологической эффективности непрерывного облучения и ежедневных кратковременных фракционированных воздействий в одинаковых суточных дозах. Автору модели при анализе результатов ряда других
303
исследователей при одинаковой суточной дозе 0,5 Гр не удалось объяснить снижение эффективности радиационного воздействия при непрерывном облучении почти в 3 раза по сравнению с фракционированным режимом облучения.
Попытки автора модели и других исследователей согласовать с помощью модели продолжительность жизни животных в процессе протяженных облучений с различной мощностью дозы или после острых радиационных воздействий оказались неудачными, поскольку при анализе результатов различных исследователей оцениваемые значения доли необратимой части поражения различались почти на порядок от 0,04 до 0,4 и даже более при действии нейтронов и альфа-излучений (Шафиркин А.В., 1983-а; Григорьев Ю.Г. и др., 1986).
При исследовании скорости восстановительных процессов и величин остаточного поражения на различные моменты времени после острых радиационных воздействий с использованием метода повторных воздействий в различных дозах было получено, что периоды полувосстановления поражения Tt 2 = 0,693/ 0 также широко варьировали для МЛЖ в пределах от 2 до 12 суток, а для крупных млекопитающих от 2,0 до 60 сут. Данные о параметрах, характеризующих скорость восстановления на уровне организма у различных животных представлены в табл. 5.1. Подробно анализ материалов о методах определения остаточного радиационного поражения и параметрах, определяющих скорость восстановления организма у различных животных представлен в обобщающих работах (Шафиркин А.В., 1983-а; Григорьев Ю.Г. и др., 1986).
В большом числе экспериментов с хроническим облучением животных в широком диапазоне мощностей доз до их гибели для согласования с моделью Блэра пришлось признать еще больший диапазон изменения коэффициента в. Причем значения этого коэффициента снижались по экспоненциальному закону с увеличением длительности облучения и суммарных доз.
Столь широкий диапазон изменения параметров модели не позволял оценивать величины эффективных остаточных доз с необходимой точностью например для решения задач обеспечения радиационной безопасности на Земле и особенно для космонавтов при осуществлении космических полетов. Поэтому делались попытки построения более точных моделей, учитывающих ряд процессов формирования поражения на разных уровнях биологической интеграции. Рассматривались в частности модели о форми
304
ровании скрытого радиационного поражения, которое переходит в действительное с некоторой задержкой по времени (Mewissen etaL, 1957).
Таблица 5.1
Значения параметра, характеризующего скорость восстановления на уровне организма у различных животных
Вид животных Доза первого облучения по отношению к ЛДво/во Период полувосста* новления Т1/2, сутки Литературный источник
Мышь 20-40 1,0-6,7 Betz, 1950; Cronkite, 1950; Paterson, 1952; Mole, 1956; Киселев и др., 1956; Толкачева, 1957; Kohn, Kailman, 1957; Spalding, 1961; Storer, 1961; Leong et. al., 1964; Corp M.J., Mole R.H., 1966; Dalrimple, 1966; И.Г. Акоев, 1970
40-60 1,5-7,4
60-80 2,0-12,0
Крыса 20-40 4,9-10,0 Blair, 1962, 1964; Абрамова и др., 1959; В. Г. Горлов, 1967; Акоев, 1970; Krebs, Leong, 1969; Табакова, 1972
40-60 4,1-12,0
60-80 3,7-7,1
Хомяк 53 6,1 Kohn, Kailman, 1957
67 4,0-8,5 Hollowey et al, 1968
Морская свинка 50 1,2-27 Даренская, Горлов, 1971
Кролик 67 9,5-27 Hollowey et al, 1968; Leong et al., 1964
Свинья 67 3,0-4,0 Nachtwey etaL, 1967; Page etaL, 1968
Обезьяна 50 5,0 Eltringham, 1967
— 5,0 Paterson etaL, 1956
Собака — 38 Newsome, Overman, 1964
53 16,9 Акоев, 1970
67 3,0-35 Ainsworth et al., 1966, 1968
67 7,0-14 Michaelson, Howland, 1958
305
Продолжение табл. 5.1
Вид животных Доза первого облучения по отношению « ЯД50/60 Период полувосста* новления 11/2, сутки Литературный источник
Овца 67 2,0-60 Page et al., 1965
67 2,0-30 Page et al., 1968
67 18-23 Hanks et al., 1966
67 60 Leong et al., 1964
Коза 67 2,0-30 Taylor et al., 1971
67 60 Leong et al., 1964
Осел 67 25-40 Still et al., 1969
— 20-28 Дэвидсон, 1960
Концепция о наличии скрытого поражения получила наиболее глубокое развитие в Институте биофизики АН СССР (г. Пущино) в работах И.Г. Акоева, (1970, 1976). Автор представлял радиационное поражение организма как суммарное повреждение различных физиологических систем. Он рассматривал последовательный и взаимообусловленный характер развития поражения на молекулярном, клеточном, тканевом уровнях, на уровне физиологических систем и на уровне организма. При этом он предполагал, что действительное поражение на одном из указанных уровней начинает проявляться спустя некоторую задержку, когда достигает определенного порога величина поражения на предыдущем уровне, которое выступает в качестве скрытого поражения для более высокого уровня.
Автор предполагал также, что одновременно с развитием поражения пропорционально его величине осуществляются восстановительные процессы, которые протекают на всех уровнях с соответствующими этим уровням скоростями. Это справедливое положение, так как, например:
• физическая стадия развития повреждений после острых воздействий характеризуется временами 10-13-10-8 секунд;
• физико-химическая стадия от 10"8 секунд до нескольких секунд;
306
• биологическая стадия (клеточный уровень) характеризуется минутами и часами;
• тканевой уровень включает реакции продолжительностью от нескольких часов до нескольких месяцев;
• организменный уровень — это реакции от суток до нескольких лет и даже в течение всей жизни.
Им была представлена система из достаточно большого числа линейных дифференциальных уравнений с большим числом кинетических параметров. Решения дифференциальных уравнений для молекулярного, клеточного и тканевого уровней, уровня физиологических систем являлись основой для определения действительного поражения на уровне организма.
Автор получил аналитическое выражение для изменения во времени величины радиационного поражения организма. Однако для количественных оценок величины повреждения при протяженных радиационных воздействиях и сопоставления их с экспериментальными данными оказывается необходимым иметь в своем распоряжении значительное число параметров и функциональных зависимостей в конкретной форме, для получения которых, как признается сам автор, требуется значительный критический анализ имеющихся экспериментальных фактов и проведение большого объема дополнительных специальных экспериментальных исследований. В связи с этим автор предположил ряд допущений и рассмотрел лишь некоторые из приложений.
Так, для описания пострадиационной кинетики в случае однократного острого облучения он предположил, что развитие поражения на вышестоящем уровне начинается в момент максимального развития поражения на предыдущем уровне и представил следующее выражение для действительного поражения на i-м уровне:
-a;(t -1?1^) -pi(t -t™*
Fj(D)[l-e 11 ]e 11
(5.22)
и соответственно для уровня целого организма:
IE = FE(D) [ 1 - е “E(t to“)je Эе0 (5.23)
где 0Cj и аЕ — параметры развития поражения на i-м уровне и на уровне организма (уровень Е); t!11** и t™ах — времена развития
307
максимума поражения на предыдущих уровнях (второе значение на уровне физиологических систем); 0j и 0Е — параметры, определяющие скорость восстановления на i-м уровне и на уровне организма.
Представление, развитое в работах И.Г. Акоева, объясняет разницу во времени проявления различных наблюдаемых реакций:
• первичной реакции, связываемой автором с развитием поражения на нижних уровнях биологической интеграции;
• более удаленной по времени реакции, соответствующей разгару заболевания и времени выраженности основных лучевых синдромов, связанных с поражением радиочувствительных тканей (кишечного эпителия, кроветворной ткани и др.);
• развитие поздних симптомов поражения, связанных со структурными и функциональными изменениями в ЦНС, эндокринной системе, эндотелии сосудов и в других тканях и органах. Для определения большого числа параметров, определяющих характер нарастания поражения и восстановления на разных уровнях биологической интеграции, требовалась постановка большого числа специальных экспериментальных исследований. Поэтому автору с сотрудниками для анализа уже представленных в литературе и собственных проведенных исследований пришлось пойти на определенные упрощения.
При рассмотрении эффектов протяженного облучения (Акоев И.Г., 1970; Акоев И.Г., Тяжелова В.Г., 1976; Акоев И.Г., Максимов Г.К., Тяжелова В.Г., 1981) они использовали, по сути, то же дифференциальное выражение для формирования эффективной дозы, что и в модели Блэра, исключив из нее необратимую часть поражения, посчитав ее малой. Вместе с тем они справедливо полагали, что параметр 0, определяющий скорость восстановления на уровне организма, зависит от мощности дозы и суммарной поглощенной дозы:
dD3<t,/dt = Y-p(Y,D)D3<t,. (5.24)
В их новом представлении отсутствовало описание наблюдаемого в значительном числе экспериментов необратимого радиационного поражения в отдаленном периоде, не было представлено и конкретного вида зависимости параметра, определяющего скорость восстановления организма от мощности дозы и длительности облучения. Кроме того, формирование радиационного пора
308
жения организма и развитие сложного комплекса восстановительных и компенсаторных процессов на разных уровнях биологической интеграции описывалось автором также с помощью одного параметра 0, что приводило также к существенному разбросу значений параметра при описании различных экспериментальных данных.
Для решения вопросов обеспечения радиационной безопасности в случаях протяженного облучения человека со значительно более низкими значениями мощности дозы экспериментальных данных по формированию поражения было недостаточно. Двойная экстраполяция результатов от экспериментов с животных на человека и от высоких значений мощности дозы к более низким приводит к значительной потере точности расчетов. Трудности экстраполяции усугубляются тем, что сами значения параметров восстановления организма в пределах каждого вида при близких условиях радиационного воздействия имеют существенный разброс (табл. 5.1). Поэтому являлось актуальным дальнейшее уточнение модели формирования поражения организма при протяженных воздействиях радиации; экспериментальное изучение процесса накопления поражения организма при протяженном облучении с низкими значениями мощности дозы и его восстановления в пострадиационный период; уточнение значений параметров, характеризующих восстановление организма, и их зависимости от мощности дозы и длительности радиационного воздействия; определение эффективности протяженных радиационных воздействий со сложным характером распределения дозы во времени.
При разработке модели формирования поражения организма при протяженных воздействиях ионизирующих излучений сделано несколько предположений.
1. Зависимость между первичным поражением, вызываемым облучением, и поглощенной дозой, а также между поражением организма в любой момент времени и эффективной остаточной дозой является линейной: I(t) = А • Ээф(1).
2. Поскольку скорость протекания восстановительных и компенсаторных процессов в организме, а также скорость формирования радиационного поражения на различных уровнях биологической интеграции различаются на много порядков (Акоев И.Г., 1970; Акоев И.Г., Тяжелова В.Г., 1976; Горизонтов П.Д., 1977; Акоев И.Г., Максимов Г.К., Тяжелова В.Г., 1981; Шафиркин А.В., 1983а; Григорьев Ю.Г. и др., 1986), мы условно рассматривали две
309
группы восстановительных и компенсаторных процессов. Быстро протекающие восстановительные и компенсаторные процессы на клеточном и тканевом уровнях с характеристическим временем проявления от нескольких десятков часов и менее учитывали введением коэффициента при мощности дозы, зависящего от нее К(у). Данный коэффициент определяет снижение эффективности непрерывного протяженного воздействия за счет данной быстрой компоненты восстановления.
3. Медленная компонента восстановительных и компенсаторных процессов на уровне организма с характеристическим временем проявления от нескольких суток, недель и даже месяцев (различные физиологические системы организма) включается через некоторое время т от начала облучения, связанное с реализацией обратной связи в рассматриваемой критической системе организма. Поэтому в начальный период облучения для t < т характер накопления эффективной дозы согласно п. 2 и 3 можно описать простым соотношением: dD^/dt = К(у)у(О-
4. Для времени облучения t > т восстановление радиационного поражения происходит со скоростью, пропорциональной некоторому компенсаторно-восстановительному потенциалу организма Р(у, t), зависящему от относительного изменения общего объема компенсаторных резервов организма в процессе длительного облучения Q(y, t), и величины поражения Вэф(1 - т) на момент времени t - т.
Результаты проведенного «Хронического эксперимента», представленные в разделе 4, по длительному облучению собак, моделирующему радиационное воздействие в условиях космического полета показали, что в коре головного мозга, в системе гипотала-мус-гипофиз-кора надпочечников, в других эндокринных органах отмечается значительное снижение функциональной активности этих систем со временем в процессе протяженного облучения. Подобный характер изменений секреторной активности и морфологических изменений в органах и тканях, как показано ранее, свидетельствовал об ускорении процессов старения у экспериментальных животных. В системах, осуществляющих регуляцию и компенсацию нарушенных функций в организме, при протяженных облучениях развивались гипофункциональные и морфологические изменения, свидетельствующие о снижении возможностей этих систем и, следовательно, об относительном уменьшении ком
310
пенсаторных резервов организма Q (у, t) с течением времени. Скорость данного процесса превышает естественную скорость, обусловленную старением, в отсутствие радиационного фактора. Поэтому в отличие от модели Блэра, в которой постулировалось постоянство репаративных и компенсаторных возможностей организма (постоянство параметра Р), в рассматриваемой новой модели предполагали неуклонное ослабление компенсаторно-восстановительных возможностей организма в процессе жизнедеятельности (в процессе старения) и в результате протяженного облучения.
Окончательно в дифференциальной форме выражение для накопления эффективной дозы в процессе протяженного облучения может быть записано в виде:
d D3./dt = K(Y) у (t), для t < т,
(5.25) d D^/dt = K(y) Y (0 - Po e’IX° + X₽(Y’t)]t D^t - т) для t > t,
где у — мощность дозы, сЗв/сут; К(у) — зависимый от мощности дозы коэффициент эффективности протяженного радиационного воздействия, обусловленный реализацией быстрых процессов восстановления на клеточном уровне; т — время задержки процессов восстановления на уровне организма; Ро, Хо и Хр— экспериментально получаемые параметры, определяющие скорость процессов восстановления на уровне организма. Параметр Хо определяет снижение скорости восстановления поражения в организме за счет процессов старения, а функционал Хр(у, t) характеризует радиационно-обусловленное снижение скорости восстановления. Обоснование параметров в представленной выше модели эффективной дозы подробно проводилось на основе согласования с экспериментальными данными большого числа экспериментов после острых и в процессе хронического облучения различных животных.
Экспериментальные факты увеличения периода полувосстановления поражения в системе кроветворения и на уровне организма по мере увеличения поглощенной дозы неоднократно отмечался и обсуждался в литературе (В. А. Резонтов, 1963; Н. Г. Даренская и др., 1968; И. Г. Акоев, 1970). Проведенный нами анализ в отношении параметров скорости восстановления на уровне ор-
311
ганизма у различных животных после острых и в процессе хронических облучений (Григорьев Ю.Г. и др., 1975; Шафиркин А.В., 1983а, 1999в; Григорьев Ю.Г. и др., 1986; Ульянова В.А. и др., 1987) показал, что при облучении в относительно невысоких дозах 100-200 сГр значение периода полувосстановления поражения Ту 2 У мелких лабораторных животных составляет 10 ± 2 суток, а параметр 0О = 0,693 /Ту2 равен 0,07. Для крупных млекопитающих значение периода Ту 2 оказывается равным 35 ± 10 суток. В случаях облучении в более высоких уровнях доз, скорость восстановления на уровне организма снижается, а период полувосстановления Ту 2 увеличивается по экспоненциальному закону в соответствии с уравнением (5.26):
Р = РО ехр (-0,0009 D),
Т1/2-Т»
/2
(5.26)
ехр (0,0009 D),
где D — поглощенная доза, сГр.
Проверку модели проводили на основе экспериментального изучения закономерности формирования поражения организма в процессе протяженного облучения крыс (Шафиркин А.В., Горлов В.Г., 1978; Шафиркин А.В., 1983-а: 1999в; Григорьев Ю.Г. и др., 1986). В опытах использовали 3500 белых беспородных половозрелых крыс самок, которых облучали непрерывно в течение 22 ч в сутки на гамма-установках «Енот» и «Старт» с источниками излучения 60 Со и 137 Cs в широком диапазоне мощности дозы (5-300 сГр/сут). Исследовали формирование поражения организма в процессе непрерывного облучения животных по изменению способности переносить острые тестирующие воздействия радиации в летальном диапазоне доз (аналогично методике определения остаточного радиационного поражения, широко используемой в радиобиологии). Тестирующие острые воздействия в различных дозах наносили через каждые 300 сГр накопленной дозы протяженного облучения. Величину поражения организма на момент нанесения тестирующего воздействия определяли в терминах эффективной остаточной дозы по разности среднелетальных доз ЛД50/30 в контрольной и подопытных группах животных.
Данные по формированию поражения организма в процессе протяженного радиационного воздействия, выраженного в терми
312
нах ВЭф, представлены на рис. 5.4. Сплошные линии — расчетные данные по новой модели, пунктирные — по модели Блэра.
Т, сутки
Т, сутки
Рис. 5.4. Зависимость эффективной остаточной дозы от длительности облучения крыс с различной мощностью дозы.
1, 2, 3, 4 и 5 — значения Вэф для мощностей доз 300, 100, 50, 10 и 5 сГр/сут соответственно; 6 — значения ЛД50/з0 для острого облучения у относительно молодых крыс; 7 — изменение величины ЛД50/30 у животных соответствующего возраста (Шафиркин А.В., Горлов В.Г., 1978; Шафиркин А.В., 1983а, 1999в; Григорьев Ю.Г. и др., 1986)
Результаты расчетов по предложенной новой модели представлены для наилучших значений параметров, которые определяли методом наименьших квадратов, исходя из минимума функционала по разности расчетных и экспериментально полученных значений эффективной остаточной дозы:
L [К(у), р0, Хо, Хр, т] = £ (Оэф р - Оэф>э)2. (5.27) 1=1
Как видно из рис. 5.4, наблюдается лучшее совпадение расчетных значений с экспериментальными данными при использовании новой модели, что наиболее отчетливо выражено для мень
313
ших значений мощности дозы и при большой длительности воздействия.
Представленный на рис. 5.4 последовательный характер изменения поражения на уровне организма можно подразделить на три стадии: первоначального линейного накопления поражения со скоростью, определяемой коэффициентом К(у), последующего снижения скорости накопления поражения, обусловленного включением дополнительных механизмов восстановления и компенсации поражения. В более позднем периоде имеет место неуклонное нарастание скорости развития поражения, связанное с истощением компенсаторных возможностей организма.
Отмеченные изменения очень напоминают по форме характер накопления цитогенетических повреждений клеток в зависимости от дозы (А.В. Севанькаев, Н.В. Лучник, 1977), что связывалось авторами также с наличием нескольких последовательных механизмов репарации повреждений клетки и снижением при больших дозах репарационной способности.
Из постулатов модели следует, что для малых значений времени Т накопление эффективной дозы определяется только зависимостью коэффициента К(у) от мощности дозы и самим характером изменения мощности дозы во времени. Коэффициент эффективности протяженного радиационного воздействия (коэффициент времени КВБ в отношении ближайших неблагоприятных эффектов) определяется как отношение эффективной и общей накопленной дозы КВБ = Вэф/В и выражается в этом случае средним значением коэффициента К(у):
т
Da4>(T)-JY(t)-K(Y)dt, (5.28)
О т т ____
КВБ = J у (О • K(Y) d t / J Y (t) d t = 1C(Y).
0 0
Для случая облучения с постоянной мощностью дозы коэффициент эффективности радиационного воздействия КВБ совпадает со значением коэффициента К(у). На этой основе определяли зависимость К(у) в широком диапазоне мощности дозы К(у) = КВБ.
Зависимость коэффициента К(у) от мощности дозы в широком диапазоне ее изменения (10-2-103 Гр/сут) для излучений с низким значением ЛПЭ (< 3,5 кэВ/мкм) представлена на рис. 5.5.
314
Рис. 55. Зависимость коэффициента эффективности радиационного воздействия КВБ = К(у) от мощности дозы при непрерывном облучении при t < т (менее 5 суток).
1 — данные для мышей; 2 и 3 — расчет по собственным экспериментальным данным, полученным на крысах; 4 и 5 — данные для морских свинок и кроликов; 6, 7, 8 и 9 — данные соответственно на собаках, овцах, ослах и козлах;
10 — размах варьирования расчетных данных по всем млекопитающим (Шафиркин А.В., 1983а, 1999в; Григорьев Ю.Г. и др., 1986)
Для этой цели использовали значения коэффициента К(у), полученные в представленном выше эксперименте по непрерывному облучению крыс, значения коэффициентов К(у) при протяженном облучении овец в течение первых нескольких суток (Ainsworth ЕJ., 1968), а также значения коэффициентов эффективности, рассчитанные на основе многочисленных литературных данных по изменению среднелетальных доз ЛД50/30 при облучении животных с различной мощностью дозы в течение нескольких суток (менее 5-10 суток). В работах (Шафиркин А.В., 1983а, 1999в; Григорьев Ю.Г. и др., 1986) показано, что для МЛЖ параметр t < т = 5 сут, для крупных млекопитающих t < т = 10 сут.
Анализ данных, представленных на рис. 5.5, а также литературных материалов показывает, что при облучении с мощностью дозы выше 140 Гр/сут (10 рад/мин) восстановительные процессы на уровне организма, оцениваемые по изменению среднелеталь
315
ных доз ЛД50/зо в пределах костномозгового синдрома, не проявляются. Значение коэффициента эффективности радиационного воздействия постоянно, максимально и равно 1 при изменении мощности дозы в широком диапазоне (на несколько порядков).
При меньших значениях мощности дозы коэффициент эффективности КВБ = К(у) уменьшается при снижении мощности дозы по степенному закону К(у) = (Y/Yr)°’18’ где (Y < Yr = 140 Гр/сут). При этом следует отметить, что размах варьирования значений коэффициентов К(у), рассчитанных по результатам отдельных экспериментов, представленных в литературе, в пределах одного вида животных существенно превышает межвидовые различия, что позволяет высказать предположение о возможности использования представленной зависимости К(у) от мощности дозы для расчетов эффективных доз применительно к человеку. Однако при решении задач радиационной безопасности следует выбирать максимальную оценку значений коэффициента К(у), для чего необходимо использовать верхнюю пунктирную кривую, представленную на рис. 5.5, которой соответствует пороговое граничное значение мощности дозы Yr = 140 Гр/сут (около 3 сГр/мин).
Выше рассматривались материалы непродолжительных облучений, не превышающих по длительности 5 суток. Более медленные процессы восстановления на тканевом и организменном уровне включаются с задержкой спустя некоторое время т от начала облучения, что связано, с одной стороны, с временным блокированием митозов быстро обновляющихся радиочувствительных тканей, с другой стороны — с наличием авторегуляторных процессов и реализацией отрицательной обратной связи в этих тканях. Кроме того, с некоторой задержкой активно включаются регуляторные и компенсаторные процессы на уровне организма. Задержка восстановления на тканевом и организменном уровне у мелких лабораторных животных составляет 4-5 суток, а у крупных млекопитающих 8-10 суток (Шафиркин А.В., 1983а, 1999в; Григорьев Ю.Г. и др., 1986). Указанное время согласуется со временем задержки начала восстановления на уровне организма после острых радиационных воздействий. Временные параметры, характеризующие процесс восстановления на уровне организма, составляли от нескольких суток до месяца.
В случае, когда длительность облучения т мелких лабораторных животных превышает 4-5 суток (у крупных млекопитающих
316
6-10 суток), наблюдается резкое снижение эффективности радиационного воздействия за счет усиления скорости регенерации в ткани и подключения основного нейроэндокринного регуляторного звена организма к процессу компенсации поражения его радиочувствительных тканей. При этом отмечается значительное увеличение скорости восстановления поражения организма (рис. 5.6).
Рис. 5.6. Относительное снижение эффективности протяженных радиационных воздействий излучений с уменьшением мощности дозы при длительностях облучения более 5-10 суток.
Кривая 1 — восстановление на клеточном уровне (кривая перенесена из рис. 5.5 для случая непрерывного облучения). Зона 2 — для случаев ежедневного фракционированного воздействия. Кривая 3 — расчетные значения по данным экспериментов на мелких лабораторных животных (МЛЖ) за счет подключения восстановительных процессов на уровне организма. Зоны 4 и 5 — размах варьирования значений коэффициентов эффективности КВ, рассчитываемых по результатам экспериментов на МЛЖ и крупных млекопитающих соответственно
При постоянной интенсивности облучения с относительно невысоким значением мощности дозы и для длительностей облучения t, превышающих время задержки начала проявления процессов восстановления на уровне организма (t > т), решение уравнения для эффективной дозы может быть представлено следующим уравнением:
317
°эф = [1 - exp (-Ро t)], (5.29)
Ро
где значения коэффициента К(у), определяющего снижение эффективности радиационного воздействия за счет быстрой компоненты восстановления для рассмотренных тканей, вычисляются на основе выше представленных уравнений, а параметр Ро, характеризующий скорость восстановления на тканевом уровне и на уровне организма, для крупных млекопитающих, в том числе и для человека, равен 0,02 1/сут.
Из уравнения (5.29) можно получить выражение для расчета коэффициента временной неравномерности радиационного воздействия КВБ:
КВБ = Оэф/В = М [i - exp (~РО t)] = K(Y) K(t). (5.30) Ро*
Как видно из представленного выражения, коэффициент временной неравномерности радиационного воздействия КВБ равен произведению коэффициента К(у), определяемого быстрой компонентой восстановления на клеточном уровне и коэффициента K(t), зависящего от длительности облучения и связанного с реализацией более медленных процессов восстановления на уровне организма за время t.
С целью выявления общей закономерности, определяющей зависимость эффективности протяженных радиационных воздействий от мощности дозы в широком диапазоне ее изменения, представляется целесообразным рассмотреть указанную зависимость для ряда других быстро обновляющихся радиочувствительных тканей. В работах (Шафиркин А.В., 1983а, 1999в) были рассчитаны коэффициенты временной неравномерности протяженных радиационных воздействий при облучении с различной мощностью дозы на основе литературных данных по лучевому поражению эпителиальных клеток желудочно-кишечного тракта (ЖКТ), а также кожи. Для первой группы тканей расчет коэффициентов проводился по отношению среднелетальных доз ЛД50/5, вызывающих кишечную форму гибели у 50% животных, либо на основании анализа дозовых кривых выживаемости стволовых клеток эпителия тонкого кишечника по отношению параметров Do для этих клеток, определяющего снижение числа жизнеспособных клеток в е раз в случае соответственно острого и протяженного
318
облучений. Коэффициенты временной неравномерности радиационного воздействия по реакции кожи определяли по отношению доз острого и протяженного облучения, вызывающих эритему у человека.
На рис. 5.7 представлены расчетные значения коэффициентов эффективности радиационного воздействия в зависимости от мощности дозы К(у) для указанных систем. Наряду с основной кривой, отражающей эту зависимость, показан также размах варьирования значений коэффициентов по результатам отдельных экспериментов. Наличие значительного диапазона варьирования значений коэффициентов для обеих тканей и существенное их перекрытие между собой позволяет представить изменение эффективности радиационного воздействия в зависимости от мощности дозы единой кривой для обеих тканей (кривая 3).
Рис. 5.7. Зависимость коэффициентов эффективности радиационного воздействия излучений с низкими значениями ЛПЭ от мощности дозы в отношении развития поражения кожи и эпителия кишечника.
Зона 1 — перенесена из рис. 5.5 в отношении поражения кроветворной ткани;
кривая 2 — эффективность поражения нейронов коры головного мозга (Гуськова А.К., Байсоголов Г.Д., 1971); кривая 3 — эффективность поражения кожи (зачерненные индексы) и эпителия кишечника (Шафиркин А.В., 1983-а, 1999-в).
Аналитический вид зависимости коэффициентов эффективности K(D) от мощности дозы для указанных тканей при действии излучений с низким значением ЛПЭ (< 3,5 кэВ/мкм) может быть представлен следующим уравнением: К (у) = (у/Y г) 0,36 •
319
Граничное значение мощности дозы у г для начала проявления восстановительных процессов для указанных тканей составляет 0,55 Гр/мин (800 Гр/сут). Облучение с мощностью дозы выше указанного граничного значения в отношении реакции этих тканей может считаться острым и в значительном диапазоне мощностей доз (на 2-3 порядка больших) коэффициент эффективности равен 1 и не зависит от мощности дозы. При уменьшении мощности дозы ниже граничного значения эффективность облучения и значения коэффициента временной неравномерности радиационного воздействия снижаются по закону КВ = К(у) = (Y/Yг)°’36-
На рис. 5.7 показаны для сравнения также данные, представленные выше для кроветворной ткани (кривая 1 на основе изменения величин ЛД50/30 перенесена из рис. 5.5), а также зависимость эффективности поражения нейронов коры головного мозга от мощности дозы (кривая 2) по данным работы (Гуськова А.К., Байсоголов Г.Д., 1971).
Из данных, представленных на рисунке, видно, что эффективность облучения при снижении мощности дозы в отношении развития некроза клеток коры головного мозга близко совпадает с кривой 1 для поражения клеток кроветворной ткани и эндотелиальных клеток сосудов головного мозга. По-видимому, развитие некрозов нейронов в отдаленные сроки после облучения в значительной степени связано с нарушением функциональной способности кроветворных клеток и изменением характера кровоснабжения клеток коры головного мозга. Это подчеркивалось также в работе (Гуськова А.К., Байсоголов Г.Д., 1971).
Граничное значение мощности дозы у г для начала снижения эффективности радиационного воздействия в отношении поражения стволовых клеток эпителия кишечника и базальных клеток кожи, как указывалось выше, составляет 0,55 Гр/мин. Это значение в 5-6 раз превышает пороговое значение у г для кроветворной ткани, что связано с существенно большими возможностями восстановления сублетальных повреждений в указанных клетках в процессе облучения за сравнительно короткие промежутки времени (минуты и часы). Об этом же свидетельствует также более крутой характер снижения эффективности радиационного воздействия при уменьшении мощности дозы и увеличении длительности облучения. Показатель степени в уравнении равен 0,36 и в 2 раза превышает показатель для кроветворной ткани.
320
Следует отметить, что при оценке уровня радиационной опасности применительно к человеку в отношении развития поражения кожи и кишечного эпителия и установлении значения коэффициента КВ, надо также использовать верхнюю кривую из представленного коридора, определяемого размахом варьирования. Для этой цели в качестве порогового значения мощности дозы у г следует использовать значение 20 сГр/мин (290 Гр/сут). При меньшей мощности дозы следует учитывать снижение эффективности облучения в отношении реакции указанных тканей.
Рассмотренные выше закономерности о влиянии мощности дозы и режима фракционирования на степень поражения кроветворной ткани, кожи и эпителия кишечника получены при действии стандартных видов излучений. При действии плотно ионизирующего излучения с ЛПЭ выше 10 кэВ/мкм и низкой мощностью дозы длительностью до 4 суток, восстановление радиационного поражения в процессе облучения отсутствует, поскольку блокируется восстановление сублетальных повреждений клеток. Эффективная доза при этом совпадает с общей накопленной дозой, а коэффициент временной неравномерности радиационного воздействия КВБ не зависит от мощности дозы и равен 1,0. При более протяженных облучениях эффективность радиационного воздействия также не зависит от мощности дозы, а определяется только общей его продолжительностью и параметром восстановления на уровне организма (коэффициент K(t), уравнение (5.30)).
Следует отметить, что представленная модель принципиально различает непрерывное протяженное облучение и ежедневное острое фракционированное воздействие, осуществляемые в одинаковых суточных дозах. С помощью этой модели удалось существенно лучше описать характер формирования радиационного поражения у различных животных в процессе длительного облучения в широком диапазоне доз (0-25) Гр и мощностей доз, а также после острых радиационных воздействий.
В табл. 5.2 приведены сравнительные данные расчетных и измеренных значений остаточного поражения БЭф, (Гр) в отдаленном пострадиационном периоде после фракционированного облучения в различных дозах. Из данных таблицы видно удовлетворительное согласие расчетных и экспериментально полученных значений эффективных остаточных доз.
321
Таблица 5.2
Сравнительные данные расчетных и измеренных значений остаточного поражения (Оэф), Гр в отдаленном пострадиационном периоде после фракционированного облучения в различных дозах
Доза предварительного облучения, Гр Время после облучения, сутки Остаточное поражение, Гр Литература
расчет эксперимент
3,0 X 2 70 0,23 0,67 Krebs, Brauer, Kalbach, 1959
56 0,40 0,90 Dalrimple et al., 1963
3,0 хЗ 56 0,82 0,58 Krebs, Brauer, Kalbach, 1959
56 0,82 1,30 Dalrimple et al., 1963
3,0 х 4 56 1,44 2,0 Акоев, 1970
32 2,10 1,79 Акоев, 1970
3,0 х 5 70 1,77 1,27 Krebs, Brauer, Kalbach, 1959
4,0x3 75 1,76 1,57 Акоев, 1970
Использование выражения К(у) = (Y/Y г)°’18 для Учета быстрой компоненты восстановления на клеточном уровне и зависимости для параметра скорости восстановления организма Р, представленной в (5.26), позволяет упростить численное решение дифференциального уравнения (5.25) для эффективной дозы в случае протяженного радиационного воздействия со сложным характером изменения мощности дозы во времени и длительностью меньшей средней продолжительности жизни животных Т0(т < Т < То).
Разбив весь промежуток времени на интервалы так, что в пределах каждого из них параметр Р и значение мощности дозы у могут быть приняты постоянными, можно представить рекуррентное выражение для последовательного расчета Вэф для любого момента времени.
322
Так, эффективная доза на момент времени облучения, соответствующий концу i-ro участка тр выражается через конечное значение на предыдущем участке следующим образом:
°эф(тi) = оэф<тi -1) exp ("Pi Д т) + (5.31)
+ К(у) Уi [1 - exp (-pj Д т)] / Pi.
Среднее значение коэффициента эффективности протяженного радиационного воздействия с некоторым сложным законом изменения дозы во времени, учитывающего влияние восстановительных и компенсаторных процессов в организме (коэффициент времени КВ), можно, как показано выше, вычислить на основе отношения эффективной дозы к суммарной дозе на данный момент времени КВ = Вэф( Tj)/D.
Таким образом, получены выражения для вычисления эффективных остаточных доз и коэффициентов эффективности радиационных воздействий в случае протяженных облучений со сложным законом распределения дозы во времени, определены параметры модели формирования поражения организма при протяженных облучениях и характер их зависимости от мощности дозы и общей поглощенной дозы в широком диапазоне изменения последних.
Кроме представленного выше эксперимента по протяженному облучению крыс с различной мощностью дозы, в котором показано удовлетворительное согласие экспериментальных и расчетных значений Вэф, был сделан еще ряд попыток проверить полученные соотношения для расчета эффективных остаточных доз на основе других экспериментальных исследований по протяженному облучению животных с различным характером распределения дозы во времени.
В случае непродолжительного облучения, используя представленную выше зависимость коэффициента К(у) от мощности дозы в виде К (у) = (Y/Yr)018’ можно сравнительно просто рассчитать эффективную дозу при облучении животных в переменном во времени поле облучения, например, при уменьшении мощности дозы по степенному закону: y(t) = Yo(^/t0)-z (рассматриваемый в литературе случай облучения животных по следу радиоактивного облака). Накопление эффективной и общей поглощенной дозы при облучении длительностью Т в этом случае описывается следующими уравнениями:
323
v148t
D^=(Tr^ll-l,l8zll<T/t°)‘~1№-11; (5'32>
1 - z
При равномерном облучении с постоянной мощностью дозы получаются более простые выражения:
рэф = ; - ;6i8 <Т~М; и p = Y(T-t0). (5.33)
(Yr) ’
В табл. 5.3 представлены экспериментально полученные и рас-четные значения поглощенных доз, вызывающих среднелетальный эффект Вэф = ЛД50/30 при 4-суточном облучении с переменной и постоянной мощностью дозы. Можно видеть хорошее совпадение представленных экспериментальных и расчетных данных. Это подтверждает возможность использования представленных соотношений для оценки радиационной опасности непродолжительных воздействий со сложным характером изменения мощности дозы во времени.
Таблица 5.3
Расчетные и экспериментально полученные данные о поглощенной дозе (сГр), вызывающей среднелетальный эффект при 4-суточном облучении с переменной и постоянной мощностью дозы
Форма представленных результатов Переменная мощность дозы при различных t0, ч Постоянная мощность дозы Литература
6 10 24
Расчет 1300 1390 1480 1450 Кознова Л.Б., 1971
Эксперимент 1326 ± 50 1280 ± 50 1400 ± 40 1520 ± 30
Расчет 1120 — — 1135 Backer et al., 1958
Эксперимент 1120 — — 1120
В работе (Гуськова А.К., Байсоголов Г.Д., 1971) рассмотрен случай равномерного облучения человека в результате перорального одномоментного поступления в организм трития. Облучение происходило с уменьшающейся мощностью дозы вследствие био
324
логического выведения трития из организма (Tt/2=7 суток). Суммарная доза за месяц составила примерно 1200 сГр, причем 75% дозы (900 сГр) было получено за 2 недели. Наблюдали форму лучевой болезни, близкую к острому поражению при внешнем гамма-облучении с отсутствием первичной реакции. Отмечена резкая аплазия костного мозга. Клеточность костного мозга снижалась приблизительно до 2%, концентрация лейкоцитов и тромбоцитов — до 5% к 27-м суткам, а с 32-х суток число клеток постепенно восстанавливалось.
По реакции гемопоэтической ткани оценка тяжести поражения соответствовала общему равномерному гамма-облучению в дозе 400-500 сГр. Расчет эффективных доз на основе представленных соотношений К(у) = (у/Уг)°’18 и (5.27)-(5.29) к концу 1-й, 2-й, 3-й и 4-й недели дал соответственно значения 304, 407, 435 и 431 сГр, что в большей степени соответствует наблюдаемой клинической картине развития поражения, чем при сопоставлении ее с общей накопленной дозой к указанным срокам (630, 920, 1070 и 1140 сГр) или с эффективной дозой, рассчитанной по модели Блэра с параметрами доли необратимого поражения f = 0,1 и Т1/2 = 28 сут (580, 770, 790 и 745 сГр).
Как указывалось выше (табл. 5.2), удовлетворительно совпадают расчетные и экспериментальные данные, представленные по оценке остаточного поражения в отдаленный период после ряда последовательных острых облучений при использовании представленных соотношений для изменения эффективной дозы во времени. В табл. 5.4 приведены расчетные и экспериментальные данные о необходимой длительности облучения млекопитающих с различной мощностью дозы для достижения уровня летального порога. Последний считали постоянным и равным соответствующему значению при остром облучении (Вэф = ЛД50//60).
Как видно из табл. 5.4, экспериментальные значения на несколько суток превышают расчетные значения, что связано с тем, что развитие лучевой болезни до летального исхода может составлять от 15 до 30 суток в случае больших значений мощностей доз и доходить до 3-х месяцев при облучении с малыми значениями мощности дозы. В целом наблюдается хорошее соответствие расчетных и экспериментальных данных, что свидетельствует о возможности использования представленных в работе уравнений для расчета эффективных остаточных доз в случае протяженного облучения в суммарной поглощенной дозе до 25 Гр.
325
Таблица 5.4
Сравнительная характеристика расчетных и экспериментальных данных о минимальной необходимой длительности облучения млекопитающих с различной мощностью дозы для достижения уровня летального порога. Последний считали постоянным и равным соответствующему значению при остром облучении (Вэф = ЛД50/60)
(Григорьев Ю.Г., Попов В.И., Шафиркин А.В., Антипенко Ж.Б., 1986)
Вид животных и характеристика радиационного воздействия Доза за сутки, сГр Средняя продолжительность жизни, суток Литература
расчет эксперимент
Крысы, непрерыв-ное облучение 100 22 24,5 Наши собственные эксперименты
70 44 47,5
Крысы, фракциони-рованное воздейст-вие 88 16 15 Хоруженко А.Ф., 1967
79 19 20
68 27 30
54 43 45
43 58 60
31 88 90
Облучение обезьян, фракционирован-ное и непрерывное 20 36 41 Джикидзе Э.К., 1964
5,7 235 250
24 75 94 Spalding J.F. et al., 1973
Козлы, непрерыв-ное облучение 40,8 37 50 Hupp E.W. et al., 1971
29,6 57 81
15 140 161
7,2 340 366
Ослы, фракциони-рованное облучение 50 17 30 Brown D.G. et al., 1968
25 40 63
Собаки, непрерыв-ное облучение 50 33 35 Norris W.P. et al., 1974
35 54 52
17 140 160
10 280 383
24 92 100 Spalding J.F. et al., 1973
326
Дополнительно это можно проиллюстрировать, например, на основе формирования эффективной остаточной дозы у рассмотренных выше животных при их непрерывном облучении. На рис. 5.8 представлен характер формирования эффективной дозы у собак при их непрерывном облучении с мощностями доз 10, 17 и 35 сГр/сут (Norris W.P. et al., 1974). Значения Вэф рассчитаны с использованием модели Блэра и на основе новой модели. Для расчета были взяты значения коэффициентов КВ, равные 0,23; 0,25 и 0,28 соответственно (см. рис. 5.5), а период полувосстановления организма — 7 суток. Максимальная ближайшая к источ-
нику излучения поверхностная доза, соответствующая значению ЛД50/60, составляла в этом эксперименте 400 сГр.
Как видим расчет по новой модели значительно точнее предсказывает реальную длительность облучения собак в этом экспе-
Срок от начала облучения, сутки
Рис. 5.8. Формирование эффективной остаточной дозы при непрерывном гамма-облучении собак с мощностями доз 10;
17 и 35 сГр/сут (по модели Блэра и по новой модели)
327
рименте для достижения условия (Иэф = ЛД50/60). Расчет по модели Блэра, когда не учитывается быстрая компонента восстановления на клеточном и тканевом уровнях, существенно отклоняется от экспериментально полученных значений. Особенно это касается облучения с более низкими значениями мощности дозы. Так, для мощности дозы 10 сГр/сут предельное время, согласно расчетам по модели Блэра, составляет всего 90 суток, а по новой модели 280, что значительно ближе к эксперименту.
На рис. 5.9 представлены аналогичные данные по формированию эффективной остаточной дозы у козлов при их облучении с мощностями доз 7,2 и 15 сГр/сут в эксперименте (Hupp E.W. et al., 1971). Для расчетов по новой модели использовали значение КВ равное 0,22 и 0,243 соответственно. Значения периодов полувосстановления Т^зСО) 17 и 28 суток.
Из данных, представленных на рис. 5.9, можно отметить, что
Срок от начала облучения, сутки
Рис. 5.9. Формирование эффективной остаточной дозы при непрерывном гамма-облучении козлов с мощностями доз 7,2 и 15 сГр/сут по модели Блэра и по новой модели (Hupp E.W. et.al., 1971, ЛД50/60 для козлов 330 сГр)
328
тельность жизни для достижения условия (Вэф = ЛД50/60). Для малой мощности дозы 7,2 сГр/сут прогноз составляет 340 суток, а в эксперименте 366 суток. Расчет по модели Блэра дает значительно отличающуюся оценку 120 суток.
Наиболее показательным является также сравнительный эксперимент, проведенный на собаках и обезьянах (Spalding J.F. et al., 1972), которых облучали сначала в течение 10 суток с мощностью дозы 66 сГр/сут. К концу облучения все животные выжили и на 94 сутки от начала эксперимента они были подвергнуты тестирующему непрерывному облучению с мощностью дозы 25 сГр/ сут.
На рис. 5.10 представлен характер изменения эффективной остаточной дозы в этом эксперименте, согласно расчетам по модели Блэра и по новой модели. Среднелетальные дозы при остром облучении у собак и обезьян составляли 330 для собак и 570-630 для обезьян.
На конец первого облучения значение Вэф составило около 600 сГр по модели Блэра и 280 сГр по новой модели. Значение
Рис. 5.10. Формирование эффективной остаточной дозы в процессе облучения собак и обезьян в течение 10 суток с мощностью дозы 66 сГр/сут и на 94 сутки с мощностью дозы 25 сГр/сут до гибели по модели Блэра и по новой модели (ЛД50/б0 = 330 сГр для собак и 570-630 сГр для обезьян) (Spalding J.F. et al., 1972)
329
дозы 280 сГр вполне соответствовало клинической картине тяжелого лучевого поражения у животных, более выраженное у собак и менее у обезьян. Ни одно животное в пострадиационном периоде не погибло, что никак не соответствует значению Вэф, равному 600 сГр, согласно расчету по модели Блэра. В процессе тестирующего непрерывного облучения животных с мощностью дозы 25 сГр/сут, повышенная скорость смертности собак, начала отмечаться к периоду 135-145 суток от начала эксперимента, что вполне соответствует расчетам по новой модели.
Таким образом, представленные выше данные показывают хорошие возможности новой модели для оценок величин эффективной остаточной дозы после острых повторных и протяженных облучений с различной длительностью и мощностью дозы.
Представленные выражения (5.25)-(5.33) для накопления эффективной дозы и зависимости коэффициента эффективности радиационного воздействия КВ от мощности дозы, обусловленного быстрой компонентой восстановления организма, позволяют решать некоторые задачи оперативного обеспечения радиационной безопасности космических полетов для отдельных воздействующих факторов со сложным характером изменения мощности дозы во времени, например, в случае развития хромосферной вспышки на Солнце или при прохождении пилотируемых аппаратов через радиационные пояса Земли.
Прямая задача при этом подразумевает вычисление эффективной остаточной дозы на момент окончания облучения после каждого конкретного воздействия, что позволяет сделать более точную оценку степени радиационной опасности каждого отдельного или группы следующих друг за другом событий для экипажа космического корабля. Решение обратной задачи позволяет на основе известных нормативных предельно допустимых значений эффективных доз получить оценку возможного предельного значения поглощенной дозы для каждого отдельного СПС.
Согласно существующим представлениям развитие хромосферной вспышки на Солнце сопровождается выбросом корпускулярного излучения, изменение потока которого во времени происходит по закону
dF / dt = At ехр(-Л t). (5.34)
Длительность каждой отдельной вспышки составляет приблизительно 36 ч, причем максимум плотности потока частиц прихо
330
дится на 9 ч от начала вспышки (Хафнер Д., 1971). Из последнего условия вытекает, что параметр X равен 0,11, а из условия нормировки полного потока за вспышку можно получить значение коэффициента А, который оказывается равным Ф/75. Переходя от плотности потока и потока протонов соответственно к мощности дозы и дозе, получаем следующее уравнение для изменения мощности дозы во времени:
Y(t) = (D/75) t ехр(-0,111), (5.35)
где t — время от начала развития вспышки, ч.
На основе данного уравнения и уравнений (5,25) и (5.28) можно записать выражение для эффективной дозы:
36
Оэф= JY(t)K(Y)dx= (5.36)
о
= f -5-Г3 d т= > j т118 ехр (-0,13 т) d т.
{ (Yr)0,18 (Yr)0’18 {
Для решения задач радиационной безопасности, как было указано выше, следует применять максимальные значения коэффициентов К(у) (верхняя пунктирная кривая на рис. 5.5), для чего использовать граничное значение мощности дозы ур Равное 1,7 Гр/ч, или 40 Гр/сут. Можно воспользоваться упрощенным выражением для эффективной дозы, предполагая, что вся вспышка характеризуется некоторой постоянной средней мощностью дозы и завершается за время, равное 1 суткам. Таким образом, суммарная доза за вспышку одновременно может быть принята в качестве значения мощности дозы, выраженного в Гр/сут.
Уравнение для эффективной дозы Вэф в этом случае будет иметь совершенно простой вид:
Оэф = (D/Yr)°’18xDxl = (D1,18) / (Yr)0’18. (5.37)
Сделанные предположения приводят к несколько завышенным значениям эффективной дозы, что является оправданным при решении задач обеспечения радиационной безопасности. В табл. 5.5 представлены рассчитанные значения Вэф для солнечных вспышек с различным интегральным потоком (суммарные поглощенные дозы приводятся из работы (Ковалев Е.Е., 1976)).
331
Данные, представленные в табл. 5.5, показывают достаточно хорошую точность приближенного расчета и одновременно свидетельствуют о том, что распределенное за 36 ч событие, при котором мощность дозы изменяется по закону: у(0 = = (D/75) t exp(-0,llt), приводит к снижению эффективной дозы в 2-3 раза по сравнению с суммарной поглощенной дозой за вспышку. Если рассматривать значения дозы и мощности дозы, которые могут быть в радиационном убежище за биологической защитой 5-10 г/см2, то значения эффективных доз окажутся меньше значений поглощенных доз за вспышку в 3-5 раз, что необходимо учитывать при оперативной оценке радиационной опасности каждой в отдельности или группы следующих друг за другом вспышек.
Таблица 5.5
Значения суммарных и эффективных доз за защитой 1 г/см2 от излучений солнечных вспышек с различным интегральным потоком
Дозиметрический показатель Интегральный флюенс
10’ 10е ю7 10е
Эквивалентная доза, сЗв (бэр) (Ковалев Е.Е., 1976) 665 66,5 6,7 0,67
Эффективная доза Вэф, сЗв (приближенный расчет) 480 32 2,2 0,14
Эффективная доза Вэф, сЗв (точный расчет по уравнению (5.36)) 439 29,4 1,9 0,13
5.3. Модель радиационной скорости смертности млекопитающих для описания изменения возрастной зависимости коэффициентов смертности от дозы и мощности дозы радиационного воздействия
Один из основных постулатов в рассмотренной выше модели формирования радиационного поражения у млекопитающих при длительных облучениях, который непосредственно вытекал из материалов «Хронического эксперимента» по многолетнему облучению собак (разд. 4) и значительного числа экспериментов по ост
332
рому повторному и хроническому облучению других крупных и мелких лабораторных животных, заключался в том, что скорость восстановления организма снижалась по экспоненциальному закону в результате процессов старения и также по экспоненциальному закону с увеличением мощности дозы и длительности облучения, а следовательно, и с увеличением суммарной поглощенной дозы.
Данные «Хронического эксперимента», представленные в разд. 4, неопровержимо свидетельствовали о снижении общего объема компенсаторных резервов организма, ускоренном старении и напряженном характере регуляторных механизмов у собак тем более выраженном, чем выше был уровень радиационного воздействия в эксперименте. Отмечено было и существенное снижение скорости восстановления показателей в системе кроветворения и в системе сперматогенного эпителия.
Все это позволило предположить о прямой зависимости между объемом компенсаторных резервов организма и скоростью восстановления показателей систем после чрезвычайных воздействий и легло в основу модели радиационной скорости смертности млекопитающих, позволившей удовлетворительно описать характер изменения возрастных коэффициентов смертности животных после острых и при протяженных воздействиях радиации. С помощью этой модели удалось также удовлетворительно описать большое число экспериментов, ставивших целью установления зависимости продолжительности жизни различных животных от мощности дозы радиационного воздействия.
Один из постулатов модели, который подробно обоснован в работе (Шафиркин А.В., 19996), заключался в том, что изменение компенсаторно-восстановительного потенциала организма (суммарный объем компенсаторных резервов организма) Q(t), определяющего его адаптационные возможности и его жизнеспособность в условиях протяженного воздействия радиации, может быть записано следующим образом:
dQ(t) / dt = -с Jm Fi + Fp(y)] Q(t), (5.38)
где первый член в квадратных скобках представляет собой сумму функционалов от интенсивности возмущающих факторов внешней среды нерадиационной природы, определяющих степень включения и истощения компенсаторного резерва Q(t) в процессе
333
жизнедеятельности организма с возрастом. Второй член отражает включение компенсаторных процессов по отношению к повреждениям организма, вызванным радиационным фактором, и является функцией мощности дозы (у). Величина Jm обусловлена различной скоростью метаболизма у млекопитающих, а коэффициент с связан с размерностью.
Из уравнения (5.38) следует, что скорость изменения компенсаторного резерва организма пропорциональна интенсивности внешних возмущающих факторов, интенсивности метаболических процессов и самому текущему значению компенсаторного резерва. Выделяя в настоящем рассмотрении радиационный фактор отдельно и предполагая в первом приближении постоянным значение суммы функционалов от других внешних воздействий, уравнение (5.38) можно переписать в виде:
dQ(t) / dt = -с Jm [А + Fp (у)] Q(t). (5.39)
Решение уравнения для зависимости компенсаторного резерва организма от времени будет иметь следующий вид:
Q(t) = Qo ехр { -[Хо + Хр (у, t)] t}, (5.40)
где Qo — детерминированный генотипически, достигший к периоду половой зрелости максимального развития объем компенсаторных резервов организма, обусловливающий его гомеостатические возможности; Хо — параметр, определяющий снижение компенсаторных возможностей организма с возрастом в процессе старения при совокупном действии других факторов с низкой интенсивностью, исключая радиационный, который является превалирующим; Хр(у, t) = | Fp(y)dx — член, оп-
1 о
ределяющий снижение компенсаторных резервов организма за счет облучения; Fp(y) — функционал, зависящий от мощности дозы, характеризующий интенсивность радиационной нагрузки.
В предположении, что функционал Fp(y) представляет собой степенную функцию от мощности дозы и что облучение осуществляется с постоянной мощностью дозы, получим:
Q= Qo ехр { -Ro + В (у)8] t} = (5.41)
= Qo ехр {-[Ло t + BD(y)8"1]}.
334
Таким образом, степень снижения суммарного объема компенсаторных резерва организма определяется как величиной поглощенной дозы, так и мощностью дозы. Лишь в определенном диапазоне мощностей доз, при которых показатель степени d близок к 1,0, выполняется соотношение Q = Qo exp {-Хо t - BD}.
Если предположить, что вероятность гибели для половозрелых животных обратно пропорциональна величине компенсаторного резерва организма, то для коэффициента смертности ц рад (t) облученных животных в зависимости от времени получим в общем виде следующее выражение:
Црад (t) -ц (0) ехр [Хо + В (Y)5] t = (5.42)
= ц (t) ехр [ В D (у)51]
и в частном случае при 8 ~ 1 и использовании значений обобщенных доз Но
цРад (t) = ц (0) ехр [Xot + ВН0] = ц (t) ехр [ В Но], (5.43)
где p(t) = ц(0) ехр (Хо t) — показатель смертности для контрольных, необлученных животных в зависимости от возраста t; Хо — показатель, определяющий экспоненциальный закон нарастания скорости смертности от возраста (закон Гомперца).
С помощью этой модели (Шафиркин А.В., 1999-6) оказалось возможным описать экспериментально установленные факты увеличения для всех возрастов значений коэффициентов смертности млекопитающих после острых облучений в различных дозах. При этом (см. рис. 5.11) удалось предсказать параллельное смещение кривых, определяющих зависимость логарифмов коэффициентов смертности от возраста, в сторону больших значений, тем более сильное, чем выше доза (Fursh J., Upton А.С., Kimball A.W., 1959; Storer J.B., 1965).
Удалось также предсказать наблюдаемое в эксперименте (Sacher G.A., Grahn D., 1964) увеличение наклона кривых, определяющих зависимость логарифмов коэффициентов смертности мышей от возраста при их длительном хроническом облучении с различной мощностью дозы (рис. 5.12).
С использованием модели радиационной скорости смертности млекопитающих удалось удовлетворительно описать результаты радиобиологических экспериментов, в которых авторы исследова-
335
Рис. 5.11. Зависимость коэффициентов смертности мышей от их возраста после острых облучений в различных дозах 1/сут (Storer J.B., 1965)
Коэффициент смертности, 1/сутки
Рис. 5.12. Зависимость коэффициентов смертности мышей от их возраста в процессе хронического облучения с различной мощностью дозы (Sacher G.A., Grahn D., 1964)
336
ли зависимость продолжительности жизни различных животных от мощности дозы в широком диапазоне ее изменения, а также от дозы радиационного воздействия (Шафиркин А.В., 19836, 19996; Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 2008).
Если предположить, что имеется некоторое граничное значение величины компенсаторного резерва организма Qr, при дальнейшем уменьшении которого становится уже невозможным поддержание устойчивости его внутренней среды, гомеостаза в одной или в нескольких наиболее важных системах, то данное значение Q г может быть принято в качестве величины, определяющей продолжительность жизни индивидуума при данной мощности дозы радиационного воздействия.
Используя равенство граничных значений Qr, определяющих летальный порог, для описания случаев обычного процесса старения в отсутствие радиационного фактора и при наличии его, из уравнения (5.40) легко получить выражение для продолжительности жизни млекопитающих Т при протяженном облучении до их гибели:
т = (Ло То) / [Ло + хр (Y, t>] = То / [1 + (В (у)8 ) / Хо], (5.44)
где То — продолжительность жизни контрольных животных; 8 — показатель степени при мощности дозы; В — коэффициент, определяемый размерностью.
Анализ большинства данных, представленных в литературе, показал, что продолжительность жизни при облучении мелких лабораторных животных с мощностью дозы ниже 0,05 Гр/сут практически не отличается от продолжительности жизни контрольных животных. Из уравнения (5.44) также следует, что при (Ву5) « Хо средняя продолжительность жизни не должна существенно меняться Т = То.
Однако при мощности дозы 0,1 Гр/сут и выше наблюдается существенное снижение продолжительности жизни. По-видимому, в этом случае, особенно при более высоких значениях мощностей доз, можно считать, что значение В у5 становится уже существенно больше Хо, и уравнение для зависимости продолжительности жизни от мощности дозы приобретает еще более простой вид:
Т = С/у5, (5.45)
lg Т = IgC - 51gy,
337
Таким образом, на основе модели радиационной скорости смертности млекопитающих получено простое уравнение для предсказания средней продолжительности жизни млекопитающих в зависимости от мощности дозы облучения.
На рис. 5.13 в двойном логарифмическом масштабе представлена зависимость продолжительности жизни различных животных от мощности дозы в широком диапазоне ее изменения по результатам наших собственных экспериментальных исследований на крысах с мощностями доз 0,05; 0,1; 0,5; 0,8; 1,0 и 3,0 Гр/сут
Рис. 5.13. Зависимость продолжительности жизни млекопитающих(А) и показателя степени 8 = | АlgT/Дlgy| — (Б) при хроническом их облучении до гибели.
1 — эксперименты на мышах; 2 — на крысах; 3 — на крупных млекопитающих. Кривая 4 — отражает зависимость среднелетальных доз Вл мышей (правая шкала) от мощности дозы радиационного воздействия в широком диапазоне ее изменения (Шафиркин А.В., 1983а, 1999в; Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 2008
338
(Шафиркин А.В., Горлов В.Г., 1978; Горлов В.Г., 1981 Шафиркин А.В., 1983-а), а также данных, представленных в литературе на мышах (Lorenz, 1954; Mole and Thomas, 1961; Neary et al, 1962; Sacher and Grahn, 1964), на крысах (Chlebovsky and Praslicka, 1967; Lamerton etaL, 1960) и на крупных млекопитающих: собаках, козлах, овцах и обезьянах (Джикидзе, 1964; Hupp etal., 1971; Norris, 1970; Norris etal., 1971, 1974; Spalding et al., 1973; Withers and Nason, 1974)
Теоретическая зависимость согласуется с экспериментальными данными, если предположить дополнительно, что показатель степени 8 в уравнениях (5.44-5.45), характеризующий скорость истощения компенсаторных резервов организма, также зависим от мощности дозы.
Как следует из уравнения (5.45), показатель степени 8 может быть определен путем графического дифференцирования кривой dlgT/dlgy, представленной на рис. 5.13 А. Зависимость коэффициента 8 от мощности дозы отражена на рис. 5.13 Б.
Из данных рисунка, видно, что по мере нарастания мощности дозы и развитии нарушений в одной из критических систем организма (система кроветворения), показатель 8 постепенно увеличивается, достигая некоторого предела, связанного с максимальной мобилизацией его компенсаторных процессов. Этому значению мощности дозы соответствует максимальная скорость снижения компенсаторных резервов организма и снижения продолжительности жизни, что следует из уравнения (5.45) и данных рис. 5.13.
При дальнейшем увеличении мощности дозы показатель 8 уменьшается, по-видимому, из-за снижения способности восстановительных и компенсаторных возможностей организма по отношению к рассматриваемой критической системе. Уменьшение значения показателя 8 определяет снижение скорости снижения продолжительности жизни по мере увеличения мощности дозы. Резкое нарастание степени включения компенсаторных процессов, наблюдаемое в первом пике, обусловлено процессами компенсации повреждения в кроветворной ткани.
Второй пик при значительно больших значениях мощности дозы связан с дополнительным нарастанием интенсивности процессов компенсации для снижения скорости нарушений эпителиальных клеток желудочно-кишечного тракта (ЖКТ). Третий пик обусловлен включением механизмов компенсации функциональных нарушений в центральной нервной системе.
339
Соответственно первый спад и следующий за ним минимум в величине 8 обусловлены срывом процессов компенсации в системе кроветворения у все большего числа особей, уменьшением возможности скомпенсировать возрастающую скорость нарастания дегенеративных изменений в ней при данных значениях мощностей доз. Это сопровождается относительным постоянством продолжительности жизни, длительность которой обусловлена временем развития вторичных проявлений, связанных с развитием инфекции и кровоизлияниями.
Второй минимум величины 8 и относительное постоянство продолжительности жизни связаны с развитием острых нарушений в ЖКТ. Время развития патологии при желудочно-кишечном синдроме составляет от 3 до 5 суток. Это продолжается в широком диапазоне мощностей доз от 10 до 120 Гр/сут. При мощности дозы около 500 Гр/сут опять имеет место максимальная скорость дальнейшего снижения продолжительности жизни, поскольку интенсивно проходят процессы компенсации нарушений в ЦНС и увеличивается скорость снижения компенсаторных резервов.
С использованием модели радиационной скорости смертности млекопитающих удалось также удовлетворительно объяснить характер зависимости общей накопленной дозы при облучении вплоть до гибели от мощности дозы в широком диапазоне ее изменения от 0,01 до 103 Гр/сут. Действительно из уравнения (5.45), путем умножения обеих его частей на величину мощности дозы, можно получить зависимость суммарной дозы, необходимой для получения среднелетального эффекта, от мощности дозы:
Dl = C/Y5-‘, (5.46)
lg Dl = IgC - (3- 1) lgY.
На рис. 5.13-A (кривая 4, правая шкала ординаты на рисунке) представлена указанная зависимость на основе данных одного из подробных экспериментов Блэра (Blair Н.А., 1962, 1964). Можно отметить, что возрастание суммарной дозы с увеличением мощности дозы происходит лишь в диапазоне мощности дозы, при котором выполняется условие 8 < 1. В противном случае, когда 8 > 1, значение суммарной дозы уменьшается при увеличении мощности дозы. Эти выводы вытекают и из уравнения (5.46). Самому автору прежней модели удалось объяснить характер зависимости
340
продолжительности жизни от поглощенной дозы лишь в очень узком диапазоне изменения мощности дозы от 0,32 до 1,2 Гр/сут.
Таким образом, модель радиационной скорости смертности позволила успешно описать значительное число экспериментов по изменению возрастных коэффициентов смертности животных в случае их хронического облучения или острых радиационных воздействий в различных дозах. На основе этой модели удается удовлетворительно объяснить характер изменения продолжительности жизни животных в зависимости от мощности дозы в широком диапазоне ее изменения. Как будет показано далее в разд. 8, эта модель составила основу для определения суммарного радиационного риска для космонавтов к концу их профессиональной деятельности и за всю жизнь после завершения орбитальных полетов и в случае осуществления межпланетного полета на Марс.
МЕТОДИКА УСТАНОВЛЕНИЯ ОПАСНОСТИ СЛОЖНОГО РАДИАЦИОННОГО ВОЗДЕЙСТВИЯ а НА КОСМОНАВТОВ В УСЛОВИЯХ
ДЛИТЕЛЬНОГО КОСМИЧЕСКОГО ПОЛЕТА НА ОСНОВЕ ОБОБЩЕННОГО ДОЗИМЕТРИЧЕСКОГО ФУНКЦИОНАЛА
6.1. Развитие концепции обобщенного дозиметрического функционала для количественного определения опасности сложного по характеру радиационного воздействия на человека
В отличие от характера радиационного воздействия на Земле, которое в основном обусловлено излучениями с низким значением линейной передачи энергии (ЛПЭ) и является в большинстве случаев равномерным, радиационное воздействие в условиях космического полета на орбите и вне магнитосферы Земли характеризуется сложным составом излучений и их энергетического спектра, простирающегося от нескольких кэВ до сотен ГэВ, которые различаются в значительной степени по своей биологической эффективности.
Это воздействие обусловлено как детерминированными источниками излучения, включающими ГКЛ и РПЗ, так и стохастическим воздействием корпускулярного излучения при развитии солнечных протонных событий (СПС). Оно характеризуется значительной неравномерностью распределения доз как по глубине тела, так и во времени. Максимальная радиационная нагрузка может приходиться на различные фазы полета и состояния адаптированное™ организма космонавтов к факторам полета, что определяет возможное снижение радиационной устойчивости космонавтов к острым радиационным воздействиям во время развития солнечных вспышек.
В настоящее время в радиобиологии достаточно подробно изучены дозово-временные зависимости непосредственных и отда
342
ленных эффектов после стандартных радиационных воздействий (острое, равномерное облучение от источника ионизирующего излучения с коэффициентом качества, равным 1,0). В большинстве случаев это воздействие рентгеновского излучения с граничной энергией 250 кэВ или гамма-излучения. Эти данные могут использоваться для оценки вероятности и тяжести ближайших и отдаленных неблагоприятных эффектов у космонавтов на основе разработанных принципов приведения сложного характера облучения в космическом пространстве к условиям стандартного радиационного воздействия на Земле. При разработке данных принципов возникает необходимость обоснования специфического до-зового функционала в качестве критерия и количественной меры радиационной опасности, определяющей возможные ближайшие и отдаленные радиобиологические эффекты.
Для решения задач радиационной безопасности и радиационной защиты в условиях сложного характера радиационных воздействий на Земле, Международная комиссия по радиологическим единицам и измерениям в 1963 г. предложила использовать понятие дозового эквивалента, или эквивалентную дозу (Report of the RBE Committee to the International Commission on radiological protection and on radiological units and measurements, 1963).Чис-ленно эквивалентную дозу D3 следовало вычислять на основе выражения:
D3 [бэр] = ОхФКхФР1 хФР2, (6.1)
где D — поглощенная доза, выраженная в сГр (рад); ФК — фактор качества, определяемый на основе регламентированной его зависимости от линейной потери энергии ЛПЭ для ионизирующих излучений с различной плотностью ионизации; ФР — факторы распределения, учитывающие влияние характера распределения дозы по глубине биологического объекта и во времени, а также другие возможные физические характеристики радиационного воздействия.
По аналогии с этим определением в работе (Григорьев Ю.Г., Раевская С.А., Аврунина Г.А., 1970) при обосновании допустимых доз для космонавтов при осуществлении космических полетов представлено выражение для дозового эквивалента в виде:
D3 [бэр] = О[рад] х КК х КР х КВ, (6.2)
343
где КК — коэффициент качества излучения, определяемый на основе регламентированной его зависимости от ЛПЭ; КР — коэффициент распределения дозы, учитывающий характер распределения дозы по телу и приводящий эффекты неравномерного облучения к условиям равномерного радиационного воздействия; КВ — коэффициент времени — временной неравномерности радиационного воздействия, учитывающий влияние мощности дозы и характера распределения дозы во времени на радиобиологический эффект, приводящий эффекты протяженных и фракционированных воздействий к однократному острому облучению.
Данный подход и понятие «обобщенная доза» для приведения сложного характера облучения в космическом пространстве к условиям стандартного радиационного воздействия составил основу нормативно-технического документа (ГОСТ 25645.201-83. Термины и определения, 1984) в целой системе ГОСТов и руководящих документов (РД) по проблеме «Безопасность радиационная экипажа космического аппарата (КА) в космическом полете» (БРЭКАКП), вышедшей в период 1993-1991 гг. с описанием моделей источников излучений космического пространства, моделей прохождения излучений через вещество защиты КА и биологическую ткань с учетом вклада в суммарную дозу вторичных излучений, ГОСТов, включающих описание моделей ряда биологических эффектов и нормативные предельные дозы для космонавтов при длительных полетах.
Обобщенная доза Н представлялась в этом документе как доза стандартного радиационного воздействия, вызывающая такой же спектр ближайших проявлений и отдаленных последствий, как и рассматриваемый сложный характер радиационного воздействия. Алгоритм ее вычисления записывался в виде:
Н[3в] = Г)[Гр] х КК х КВ х КР, (6.3)
где Н — обобщенная доза; D — среднетканевая поглощенная доза; КК — коэффициент качества излучения; коэффициенты КВ и КР имеют тот же смысл, который указан выше.
Специфические условия космического полета, когда кроме ионизирующих излучений на космонавтов воздействуют перегрузки, невесомость, гиподинамия, длительное психологическое напряжение, требуют также введения коэффициентов модификации
344
радиационного воздействия за счет нерадиационных факторов (КМ). Поэтому в настоящее время мы предложили использовать следующее выражение для вычисления обобщенной дозы:
Н[3в] = ( £ Ё>[Гр]i х KKj X KBj х KPj) KM, (6.4) i = l
где DpKKpKBpKPj — соответствующие значения среднетканевой дозы и коэффициентов для i-ro источника радиационной опасности; КМ — коэффициент модификации радиационного воздействия за счет нерадиационных факторов космического полета.
Поскольку выход непосредственных, ближайших радиационных эффектов в процессе осуществления полета с одной стороны, а также возможных неблагоприятных отдаленных последствий с другой стороны связан с формированием патологии в существенно различных критических системах организма, отличающихся временем развития поражения, его локализацией, скоростью протекания восстановительных процессов, значение обобщенной дозы следует вычислять отдельно на основе своего набора коэффициентов соответственно для ближайших эффектов НБ и отдаленных последствий Но (Шафиркин А.В., 19996 и в). Поэтому в окончательном виде обобщенные дозы применительно к оценке радиационного риска процессе полета и риска отдаленных неблагоприятных последствий вычисляли с использованием двух самостоятельных выражений:
НБ = (£ Dj xKKBi xKBEi xKPgj) КМБ; (6.5) i = 1
n _
но = ( X Di X KKOi x KBOi x KPOi) KMO. i = 1
Этот новый дозиметрический функционал позволяет осуществить переход от сложного характера облучения в условиях космического пространства к условиям стандартного радиационного воздействия. Переход осуществляется на основе расчетных значений среднетканевых эквивалентных доз от каждого источника радиационной опасности в космическом пространстве и коэффициентов перехода, учитывающих влияние сложного макропростран-ственного и временного распределения дозы по телу космонавтов
345
на радиобиологический эффект. Кроме воздействия ионизирующих излучений, учитывается также влияние нерадиационных факторов, присущих космическому полету.
Нам представляется, что использование данного дозового функционала в качестве критерия для оценки опасности радиационного воздействия в условиях космического полета и методического подхода для учета влияния сложного пространственно-временного режима облучения на радиобиологические эффекты в условиях комбинированного действия радиационных и нерадиационных факторов должно привести объединяющее начало во все многообразие проблемы оценки радиационной опасности длительных космических полетов, позволит установить алгоритм расчета радиационного риска и определить значения риска ближайших и отдаленных радиобиологических эффектов для различных программ космических полетов и стохастических моделей радиационной обстановки.
6.2. Зависимость коэффициентов относительной биологической эффективности и коэффициентов качества излучений от линейной передачи энергии тканям
Значения коэффициентов ОБЭ зависят от многих факторов: исследуемой ткани, выбранного критерия (уровня инактивации клеток), условий облучения (мощности дозы, режима фракционирования, степени оксигенации ткани и др.). На рис. 6.1 прослежена зависимость коэффициентов ОБЭ от ЛПЭ в широком диапазоне ее изменения применительно к выживаемости клеток в ближайшем пострадиационном периоде.
Видно, что заметный рост коэффициентов ОБЭ имеет место, начиная с 10 кэВ/мкм, достигает максимума при 100 кэВ/мкм, а затем круто падает. Причина такого характера зависимости связана с тем, что в диапазоне ЛПЭ отЮ до 100 кэВ/мкм увеличивается плотность ионизации на единице длины и возрастает число поврежденных структур ДНК и других клеточных органелл, что обусловливает повышение эффективности излучений в отношении вероятности гибели клеток. После этого предельного значения ЛПЭ наступает насыщение, и каждая последующая частица теряет энергию уже в убитой (летально поврежденной клетке), а
346
ОБЭ
Рис. 6.1. Зависимость коэффициентов ОБЭ от ЛПЭ и дозы излучения по данным выживаемости клеток почки человека.
1 — уровень выживаемости — 80%; 2 — 10%; 3 — 1,0% (Ярмоненко С.П., Вайнсон А.А., 2004)
менее пораженными остаются другие клетки, которые не подверглись воздействию. Эффективность слишком плотной избыточной ионизации и выделение очень большой энергии в конкретном микрообъеме оказывается по отношению к поражению ткани существенно сниженной. Это определяет снижение значений коэффициентов ОБЭ при ЛПЭ более 100 кэВ/мкм. Эффект избыточного поражения отдельных клеток (overkill) и снижение эффективности поражения ткани в целом можно отчетливо наблюдать из данных рис. 6.1.
Обобщение данных по относительной биологической эффективности излучений с различной величиной ЛПЭ по отношению к ближайшим радиобиологическим проявлениям подробно рассмотрено нами в работе (Шафиркин А.В., Федоренко Б.С., 1998). В ней на основе анализа цитогенетических эффектов на клеточном уровне, глубины изменений в радиочувствительных тканях: кроветворной, желудочно-кишечном эпителии, эпидермисе, а также выживаемости экспериментальных животных проведено сравнение действия протонов, ускоренных многозарядных ионов и нейтронов с воздействием стандартных видов излучений. Это дало возможность оценить максимальные значения коэффициентов ОБЭ и установить их зависимость от ЛПЭ.
347
Максимальные значения коэффициентов ОБЭ могут использоваться в качестве величин коэффициентов качества по ближайшим эффектам ККБ, которые необходимы для вычисления соответствующих значений обобщенной дозы НБ и определения риска снижения жизнеспособности и работоспособности космонавтов после возникновения мощных солнечных протонных событий и других радиационных воздействий в процессе осуществления длительных полетов.
На рис. 6.2 в качестве примера представлена часть данных из работ (Шафиркин А.В., Федоренко Б.С., 1998; Шафиркин А.В., 1999в), о зависимости коэффициентов относительной биологической эффективности от ЛПЭ в широком диапазоне ее изменения при действии быстрых нейтронов в диапазоне энергий 10-15 МэВ, а также ускоренных ионов на клетки кроветворной ткани, желудочно-кишечного тракта, а также данные по хромосомным аберрациям в лимфоцитах человека и в эпителии роговицы хрусталика. На этом же рисунке представлены для сравнения зависимости коэффициентов качества излучений от ЛПЭ, которые рекомендованы в работах (Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978 и ГОСТ 25645.218-90 БРЭКАКП,
Рис. 6.2. Зависимость относительной биологической эффективности излучений с различной линейной передачей энергии, определяемой на основе поражения различных тканей в ближайшем пострадиационном периоде и нормативные зависимости коэффициентов качества (КК) излучений от ЛПЭ
348
1991) для определения эквивалентных доз при действии этих излучений на биологические объекты.
Обычно представленные в литературе зависимости коэффициентов качества различных видов излучений от ЛПЭ (ГОСТ 25645.218-90 БРЭКАКП, 1991; Нормы радиационной безопасности НРБ-76/87, 1988; Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978; Рекомендации МКРЗ 1990 г., Публикации № 60 и 61, 1994) относятся к расчету защиты и определению риска отдаленных эффектов при хроническом облучении с малой мощностью дозы. Они непосредственно применимы для получения значений коэффициентов качества ККО.
На основе данных рис. 6.2 можно отметить, что максимальные значения коэффициентов относительной биологической эффективности (ОБЭ) излучений с различной линейной передачей энергии (ЛПЭ) для ближайших эффектов, связанных с развитием первичной лучевой реакции, с возможным поражением критических тканей в остром периоде, таких как костный мозг, ЖКТ, кожа и др., являются в несколько раз меньшими, чем значения ККо, установленные на основе отдаленных эффектов.
Анализ результатов экспериментальных исследований биологической эффективности протонов (Ярмоненко С.П., Коноплян-ников А.Г., 1965; Taketa S.T., 1965; Dalrimple G.V. et.al., 1966; Антипов B.B. и др., 1967; Даренская Н.Г. и др., 1968; Рыжов Н.И., 1982; Шафиркин А.В., Федоренко Б.С., 1998) показал, что среднее значение коэффициента ОБЭ протонов с энергией в пределах 50-730 МэВ (ЛПЭ = 0,24 4-1,25 кэВ/мкм) по отношению к стандартному рентгеновскому излучению 180-250 кВ на основе данных по смертности мелких лабораторных животных составило 0,70 ± 0,02, а для крупных млекопитающих — 0,77 ± 0,03. По радиационно-обусловленным изменениям в клетках различных тканей коэффициенты ОБЭ протонов составили также значение, равное 0,70 ± 0,03. Из представленных данных видно, что эффективность воздействия протонов указанных энергий заметно ниже, чем облучение рентгеновским излучением с напряжением на трубке 180-250 кВ и не превышает эффективности воздействия гамма-излучения 60Со и 13'С&
В обзорных работах (Ярмоненко С.П., Коноплянников А.Г., 1965; Антипов В.В. и др., 1967; Даренская Н.Г. и др., 1968; Рыжов Н.И., 1982; Шафиркин А.В., Федоренко Б.С., 1998) показана полная качественная и количественная идентичность радиобиоло
349
гических эффектов этих видов излучений по показателям тяжести развития острой лучевой болезни, вероятности гибели млекопитающих, их продолжительности жизни, по характеру и глубине изменений в различных органах и тканях, по частоте и характеру цитогенетических нарушений в клетках животных и человека. В этих работах продемонстрирована идентичность характера протекания первичных радиационно-химических процессов и изменения радиобиологической эффективности при применении гипоксии, а также в случае использования радиопротекторов.
Наличие количественной тождественности характера изменений на клеточном, тканевом, органном и организменном уровнях при действии ускоренных протонов и гамма-излучений непосредственно на животных или на культуры клеток млекопитающих, культивируемых in vitro, показывает, что значение коэффициента ОБЭ протонов с энергией 50-730 МэВ по отношению к гамма-излучению 60Со может быть принято равным 1,0. Эффективность же протонов по отношению к стандартному рентгеновскому излучению с максимальной энергией 180-250 кэВ является сниженной на 20-30%.
Рассмотренные материалы показывают, что значение коэффициента ККБ в отношении прогноза тяжести ближайших непосредственных эффектов воздействия на космонавтов протонов РПЗ и СКЛ может быть принято равным 1,0. Эта оценка является несколько завышенной, что позволяет прогнозировать несколько больший уровень опасности рассматриваемых воздействий и обеспечить большую безопасность космонавтов путем принятия соответствующих рекомендаций в случае ухудшения радиационной обстановки, связанной с развитием мощных солнечных протонных событий.
С целью обоснования значений коэффициентов качества космических излучений (ККБ), входящих в выражение для обобщенной дозы (уравнение (6.5)), важно уточнить также зависимость коэффициентов ОБЭ от ЛПЭ для изучений с высокой плотностью ионизации на основе сопоставления ближайших радиобиологических эффектов.
Анализ основного массива данных по смертности мелких лабораторных животных и изменениям в критических тканях, определяющих их жизнеспособность при действии нейтронов, показывает, что по этим показателям максимальное значение коэффициента ОБЭ составляет для кроветворной ткани например 3,0 ± 0,5,
350
для эпителия кишечника и кожи 4,0 ± 0,5. При этом следует отметить, что значения коэффициентов ОБЭ быстрых нейтронов, представленные в литературе по смертности животных в ближайшем пострадиационном периоде, для крупных млекопитающих, являются существенно более низкими: для морских свинок и кроликов они заключены в диапазоне (1,8 4-1,92); для собак — (0,8-s-l,57); для свиней — (1,0 4-1,2); для овец — (0,74 4-1,0); для обезьян — (1,0 4-1,1) (Даренская Н.Г. и др., 1968; Саксонов П.П., Антипов В.В., Давыдов, 1968; Свердлов А.Г., 1974; Carsten A.L., Bond V.P., Thompson К., 1976; Макарова Г.В, 1976; Летов В.Н. и др., 1976; Сайкова В.А. и др., 1977; Жербин Е.А. и др., 1978; Коно-плянников А.Г. и др., 1980; Коноплянников А.Г., 1984; Шафиркин А.В., Федоренко Б.С., 1998). Меньшие значения коэффициентов ОБЭ для крупных млекопитающих (по смертности животных) связаны с дополнительным влиянием значительного глубинного перепада доз по телу животных и ослаблением по этой причине эффективности радиационного воздействия.
Коэффициенты ОБЭ, полученные на тканевом уровне по реакции кожи человека, свиньи, а также данным культивирования in vitro колониеобразующих клеток КОЕф фибробластов, составляют те же значения 2,5 4- 3,0, что и для мелких лабораторных животных при энергии нейтронов в диапазоне 0,5 4-1 МэВ (ЛПЭ 60-78 кэВ/мкм). Указанные значения совпадают и с величинами, полученными по смертности мелких лабораторных животных, и по реакции критических тканей, что подтверждает точность полученных оценок и доказывает, что именно эти значения определяют эффективность радиационного воздействия быстрых нейтронов по сравнению с действием стандартных видов излучений. Они в большей степени определяются именно качеством излучения быстрых нейтронов и величиной ЛПЭ (Шафиркин А.В., Федоренко Б.С., 1998).
При изучении эффективности воздействия ускоренных заряженных частиц в зависимости от ЛПЭ в экспериментах, как правило, использовали широкий набор легких и тяжелых частиц от ионов гелия до аргона с энергией до 500 Мэв/нуклон. В исследованиях использовались модельные биологические системы, включающие дрожжевые и бактериальные клетки, а также клетки млекопитающих и отдельные органы лабораторных животных, размеры которых не превышали величины пробегов ионов в ткани. Культуры клеток располагали за тонкими поглотителями на раз-
351
личных участках кривой поглощения, соответствующих плато кривой и пику Брега. Результаты исследований по инактивации клеток под действием ускоренных ионов сопоставлялись с изменениями при рентгеновском или гамма-облучении, что позволяло определять значения коэффициентов ОБЭ тяжелых ионов (Рыжов Н.И., 1982; Шафиркин А.В., Федоренко Б.С., 1998; Федоренко Б.С., 2006).
В этих работах показано, что эффективность воздействия излучения ускоренных заряженных частиц возрастает с увеличением ЛПЭ в диапазоне 10-?-200 кэВ/мкм. Максимальное значение коэффициентов ОБЭ, равное 6,0 ± 0,5, получено при 166 кэВ/мкм по данным выхода хромосомных аберраций в клетках эпителия роговицы мышей. Несколько меньшая величина 4,8 отмечена на клетках китайского хомячка по данным цитологических и цитогенетических исследований. Максимум эффективности воздействия для этих клеток имел место при ЛПЭ 200 кэВ/мкм. Коэффициенты ОБЭ для опухолевых клеток ЕМТ-б и RL не превышали значения, равного 3,1. Еще меньшие величины получены на основе данных цитогенетических исследований на лимфоцитах человека. Коэффициенты ОБЭ заключены в диапазоне 1,0-2,0.
Анализ зависимости коэффициентов ОБЭ от ЛПЭ применительно к ближайшим радиобиологическим эффектам, проведенный в работе (Шафиркин А.В., Федоренко Б.С., 1998) показал, что эффективность радиационного воздействия неуклонно возрастает, начиная приблизительно с (3,0 -s- 5,0) кэВ/мкм, достигает максимума при 100-200 кэВ/мкм, а затем снижается при дальнейшем возрастании величины ЛПЭ.
В работе (Ворожцова С.В., Шафиркин А.В., Федоренко Б.С., 2006) проведен анализ литературных материалов и полученных нами новых экспериментальных данных, касающихся развития поражения и восстановления клеток эпителия роговицы мышей в ближайшем и отдаленном периодах после облучения различными источниками излучений. Рассмотрены данные по однократному и частично фракционированному воздействию гамма- и рентгеновского излучений, ускоренных протонов, ионов гелия, ионов углерода и бора, а также быстрых нейтронов реакторного спектра в большом диапазоне доз со значениями линейной передачи энергии (ЛПЭ) в широком диапазоне ее изменения. Рассмотрены новые методические приемы для определения значений коэффициентов относительной биологической эффективности (ОБЭ) ука
352
занных видов излучений применительно к оценке отдаленных цитогенетических нарушений. Большие значения коэффициентов ОБЭ ускоренных ионов и нейтронов, полученные на основе данных об отдаленных нарушениях регенераторного процесса в клетках эпителия роговицы представлены в этой работе впервые. Они почти на порядок превышают значения, оцениваемые на ближайшие сутки после облучения.
В табл. 6.1 представлены значения коэффициентов ОБЭ по инактивации клеток эпителия роговицы и изменения числа аберрантных митозов после действия различных видов излучений, представленные в литературе ранее (Ворожцова С.В., 1973; Григорьев Ю.Г. и др., 1971; Рыжов Н.И., Ворожцова С.В., Красавин Е.А., 1980; Рыжов Н.И., 1982), и полученные в цитируемой работе как по ближайшим пострадиационым проявлениям, так и по отдаленным последствиям к 180-м суткам.
Таблица 6.1
Значения коэффициентов ОБЭ, представленные в литературе, по числу аберрантных митозов в клетках эпителия роговицы мышей после облучения источниками излучения с различной ЛПЭ
Характеристика источника излучения ЛПЭ, кэВ/мкм Значения ОБЭ ближайшие эффекты (литературные источники) Значения ОБЭ ближайшие эффекты (Ворожцова С.В. и др., 2006) Значения ОБЭ отдаленные эффекты (Ворожцова С.В. и др., 2006)
Гамма-излучение 60Со 0,3 1 1 1
Ионы гелия 4 МэВ/нуклон 37 3,3-5 1,6-2,75 8
6 МэВ/нуклон 27,3 2,7-3,5 — —
9,7 МэВ/нуклон 19,7 2,0-2,9 1,3-2,2 —
4 ГэВ/нуклон 0,22 — 1,3-2,2 —
Ионы бора 7-7,5 МэВ/ нуклон 140 4,5-5,5 1,9-3,4 44
Ионы углерода 2,5 МэВ/ нуклон 430 3,2-5,1 1,6-2,75 28-44
Нейтроны деления 1 МэВ 80 — 3,45-4,55 16-20
353
На основе этих материалов на рис. 6.3 построены зависимости коэффициентов ОБЭ от ЛПЭ в широком диапазоне ее изменения. Они построены отдельно для минимальных и максимальных оцененных значений коэффициентов ОБЭ, представленных в литературе и в цитируемой работе. Кроме того, впервые представлены зависимости ОБЭ от ЛПЭ, полученные при оценке процента аберрантных митозов в клетках эпителия роговицы мышей в отдаленном периоде на 180-е сутки (Ворожцова и др., 2006).
100
ЛПЭ, кэВ/мкм
Рис. 6.3. Зависимость коэффициентов ОБЭ различных видов излучений от ЛПЭ на основе цитогенетических изменений в клетках эпителия роговицы в ближайшем и отдаленном периодах.
По оси абсцисс — линейные потери энергии, кэВ/мкм; по оси ординат — коэффициенты ОБЭ — отн. ед.
1 и 2 — расчетные кривые, соответствующие минимальным и максимальным оценкам значений ОБЭ по данным литературы на основании ближайших последствий; 3 и 4 — расчетные кривые, соответствующие минимальным и максимальным оценкам значений ОБЭ, полученным нами на основании отдаленных последствий (Ворожцова С.В., Шафиркин А.В., Федоренко Б.С., 2006)
Как видно из данных табл. 6.1 и рис. 6.3, оцененные значения коэффициентов ОБЭ в этой работе на основе отдаленных последствий в 3-15 раз превышают значения коэффициентов по цитогенетическим нарушениям в роговице мышей в ближайшем пострадиационном периоде. Однако следует заметить, что они вполне
354
соответствуют представленным в целом ряде работ оценкам величин ОБЭ применительно к отдаленным эффектам при действии в малых дозах быстрых нейтронов и ускоренных многозарядных ионов.
В отчете Научного комитета ООН по действию атомной радиации 2000 г. Генеральной Ассамблее ООН приводятся еще большие значения коэффициентов ОБЭ нейтронов спектра деления на основе цитогенетических исследований культуры лимфоцитов человека 34-53, по индукции опухолей 16-59 (Источники и эффекты ионизирующих излучений. Отчет НКДАР ООН-2000, 2002).
В работе (Григорьев Ю.Г., и др., 1986) на основе анализа сокращения продолжительности жизни у различных животных в зависимости от дозы после облучения нейтронами спектра деления получено значение коэффициента ОБЭ равное 30.
В ряде исследований представлены еще большие значения коэффициентов ОБЭ. Это касается исследований, посвященных изучению структурных нарушений в коре головного мозга у крыс, а также определению частоты помутнений хрусталика и развития катаракт у мышей, в которых для малых доз представлены значения коэффициентов ОБЭ в диапазоне от 50 до 100 (Worgul В. etaL, 1987; Brenner D.J., Medvedovsky С., Huang G., etaL, 1991; Федоренко Б.С., Шафиркин A.B., Буденная Н.Н., 1998; Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000).
В представленных выше материалах продемонстрировано, что значения коэффициентов ОБЭ, определенные на основе ближайших эффектов после облучения, оказываются существенно меньшими, чем значения коэффициентов качества, полученные с использованием данных по отдаленным радиобиологическим проявлениям, которые регламентированы в нормативно-технических документах (Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978; ГОСТ 25645.218-90. БРЭКАКП, 1991).
По-видимому, при оценке риска снижения жизнеспособности космонавтов или их работоспособности в процессе полета при протяженном воздействии ГКЛ и особенно при кратковременном ухудшении радиационной обстановки в результате развития интенсивных СПС, более точным и правильным было бы выбирать значения коэффициентов эффективности излучений с различными ЛПЭ с использованием данных по ближайшим радиобиологическим эффектам. В связи с этим нами предлагается простая зависимость коэффициентов качества ККБ от ЛПЭ (табл. 6.2) для вы
355
числения средних значений коэффициентов качества космических излучений (Шафиркин А.В., Федоренко Б.С., 1998).
Таблица 6.2
Зависимость коэффициентов ККБ от ЛПЭ применительно к оценке риска ближайших в процессе полета радиобиологических эффектов
ЛПЭ, кэв/мкм L<3 3 < L < 70 L > 70
ККБ 1 (L / З)0'56 6
В связи с наличием широкого энергетического и зарядового спектров частиц ГКЛ, существенного их изменения при прохождении через защиту и ткани организма важно разработать надежный и оперативный метод определения среднего значения коэффициента качества ККБ для этого компонента радиационного воздействия в условиях космического пространства. Для целей радиационной безопасности нам представляется необходимым использовать максимальные оценки коэффициентов ОБЭ для различных групп ядер ГКЛ при оценке риска ближайших неблагоприятных эффектов. Для этой цели использовать представленную выше зависимость коэффициентов ККБ от ЛПЭ. Проведенные нами оценки средних значений коэффициентов ОБЭ для галактического космического излучения при межпланетных космических полетах в отношении риска ближайших радиобиологических проявлений оказались более чем в 2 раза меньшими, чем представленные в литературе значения.
В диапазоне возможных доз ионизирующих излучений при осуществлении орбитальных и межпланетных космических полетов за реальной защитой космического аппарата ведущей системой организма, изменения в которой могут в первую очередь определять существенное снижение жизнеспособности и работоспособности космонавта в процессе полета, является система кроветворения и система обновления кожи. Поэтому при разработке алгоритма вычисления обобщенной дозы, применительно к оценке ближайших неблагоприятных эффектов НБ (уравнение (6.5)), использованы радиобиологические представления о формировании радиационного поражения на уровне организма и в системе кроветворения у млекопитающих, в том числе у человека.
356
Коэффициенты качества различных видов космических излучений по отношению к ближайшим эффектам ККБ, входящие в выражение для расчетов обобщенной дозы, могут в настоящее время быть получены на основе анализа зависимости коэффициентов относительной биологической эффективности излучений от ЛПЭ в отношении ближайших радиобиологических эффектов для таких критических радиочувствительных систем, как кроветворение, система обновления кожи и система регенерации эпителия кишечника. Подробно характер зависимости коэффициентов ККБ от ЛПЭ на основе реакции на уровне организма и отдельных тканей после воздействия различных видов излучений рассмотрен выше. В отношении отдаленных эффектов в настоящее время до выпуска новых нормативных документов рекомендовано пока использование прежних зависимостей коэффициентов качества от ЛПЭ, представленных в нормативно-технических документах (Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978; ГОСТ 25645.218-90. БРЭКАКП, 1991). Их мы и использовали при определении эквивалентных доз в разделах 1 и 2 и в последующих разделах для определения значений обобщенных доз и радиационного риска для космонавтов при осуществлении орбитальных и межпланетных полетов.
Оценки риска ближайших неблагоприятных эффектов сочетанного воздействия излучений ГКЛ, РПЗ и СКЛ на космонавтов на основе изложенного будут несколько завышенными, что вполне допустимо с целью сохранения хорошей работоспособности космонавтов в процессе полета (имеется некоторый запас). Однако реальные значения суммарного дополнительного радиационного риска смертности в течение жизни космонавтов и риска развития опухолей из-за меньших нормативных значений коэффициентов качества могут быть в несколько раз выше, что требует дальнейшего более тщательного анализа биологической эффективности излучений с различными ЛПЭ после воздействий малых доз на основе накопленных новых данных, а также необходима разработка соответствующего нового нормативно-технического документа по зависимости КК от ЛПЭ и уточнение существующих предельных дозовых нагрузок на космонавтов в процессе их профессиональной деятельности.
Значения коэффициентов временной неравномерности радиационного воздействия КВБ и КВ0, учитывающих влияние мощности дозы и характера распределения дозы во времени, опреде
357
ляли на основе новой модели формирования радиационного поражения (модель эффективной остаточной дозы), представленной в разд. 5. Там приведены необходимые соотношения для вычисления этих коэффициентов в случае протяженного облучения и при повторных острых радиационных воздействиях.
6.3. Методические подходы к установлению значений коэффициентов пространственной неравномерности радиационного воздействия для расчетов обобщенной дозы применительно к ближайшим радиобиологическим эффектам
В данном разделе проводится обоснование ведущей роли поражения гемопоэза в характере и тяжести лучевой реакции организма и вероятности его выживания в ближайшем периоде после радиационного воздействия. В нем представлена модель равноценной дозы для учета влияния пространственной неравномерности радиационного воздействия на радиобиологический эффект и приведения эффектов неравномерного облучения к условиям стандартного равномерного облучения. Представлен также алгоритм для вычисления значений равноценной дозы и коэффициентов пространственной неравномерности радиационного воздействия КРБ космических излучений, которые необходимы для расчетов обобщенных доз и радиационного риска для космонавтов в процессе осуществления длительных космических полетов.
Равноценная доза и коэффициент равноценности радиационного воздействия КРБ предназначены для приведения биологических эффектов при неравномерном макропространственном распределении поглощенных доз по телу биологического объекта к эффектам стандартного равномерного облучения. Под равноценной эквивалентной дозой, согласно (ГОСТ 25645. 201-83 БРЭКАКП., 1984; ГОСТ 25645.219-90 (БРЭКАКП)., 1991; Шафиркин А.В, 1999-а,с), понимается среднетканевая эквивалентная доза равномерного радиационного воздействия, вызывающая тот же радиобиологический эффект, что и среднетканевая эквивалентная доза при неравномерном облучении. Коэффициенты пространственной неравномерности радиационного воздействия КРБ, равные отношению равноценной эквивалентной дозы G к
358
среднетканевой эквивалентной дозе при рассматриваемом неравномерном облучении, входят в выражение для расчетов обобщенных доз и величины радиационного риска для космонавтов в процессе осуществления космических полетов.
С целью вычисления коэффициента равноценности радиационного воздействия была осуществлена дальнейшая разработка модели равноценной дозы и ее обоснование на основе экспериментальных данных с неравномерным и равномерным облучением биологических объектов. Наиболее плодотворной идеей, давшей начало количественному сопоставлению эффектов равномерного и неравномерного радиационных воздействий, являлась гипотеза о ведущей роли выжившей части стволовых кроветворных клеток в тяжести развития лучевого поражения организма и вероятности его выживания при облучении в дозах, вызывающих костномозговой синдром (Bond V.P., Robinson C.V., 1967 а, б; Jammet Н.Р. et al., 1968; Gilbert C.W., 1969).
Авторами в указанных работах предпринимались попытки продемонстрировать правильность данного утверждения путем сопоставления расчетных значений доли выживших стволовых кроветворных клеток при одностороннем и двухстороннем облучении собак. Они предполагали, что концентрация стволовых кроветворных клеток по всем участкам кроветворной ткани одинакова и сами участки эквивалентны по радиочувствительности и кроветворной способности.
Хотя при расчетах применялось относительно грубое разделение фантома всего на три участка и использовалась кривая выживаемости стволовых кроветворных клеток от дозы для мышей, представленная в литературе, они получили, тем не менее, достаточно близкие значения доли выживших клеток при облучении собак в среднелетальных дозах. Этот результат, по-видимому, явился побудительной причиной дальнейших попыток проверки указанной гипотезы другими авторами и стимулом для создания математических моделей, описывающих выживаемость организма от дозы на основе предположения о наличии граничного порогового количества выживших стволовых кроветворных клеток, необходимого для успешного восстановления системы кроветворения и организма в целом (Конопляников А.Г., 1980, 1984), а также эмпирических моделей, связывающих вероятность выживания организма с определенной долей выживших стволовых кроветворных клеток (Gilbert C.W., 1969).
359
Следует отметить, что авторам указанных работ удавалось согласовать расчетные модели с отдельными проведенными опытами на животных, однако широкой проверки моделей на основе большого числа экспериментальных исследований ими проведено не было. Не учитывалось также возможное изменение параметров кривой выживаемости стволовых кроветворных клеток от дозы при переходе от одного вида животных к другому.
Мы также исследовали возможность использования наиболее простого экспоненциального вида функции выживаемости стволовых кроветворных клеток от дозы для описания вероятности выживания собак при неравномерных и равномерных радиационных воздействиях. Для этого была сделана попытка обосновать значение параметра кривой выживаемости стволовых клеток от дозы для собак и рассмотреть как можно более точно характер распределения дозы по костному мозгу у собак на основе тщательного приближения формы фантома к реальной модели тела животного при описании результатов экспериментов с неравномерным облучением собак.
На рис. 6.4 показаны данные по выживаемости собак в зависимости от среднетканевой дозы для большего числа экспериментов с равномерным облучением животных. Коэффициент неравномерности поглощенной дозы не превышает в большинстве из них 10%. Поэтому среднетканевую дозу можно принять в качестве дозы на костный мозг (Шафиркин А.В., 1999а, в).
Уравнение, определяющее выживаемость животных в пробитах от дозы, для этой большой группы экспериментов имеет следующий вид:
у = 11 - 2,34 х 10"2 xD, (6.6)
где D — поглощенная доза, сГр.
Среднетканевая доза ЛД50/30, определенная по этим данным, оказалась равной 257 ± 3 сГр, а диапазон доз, при которых выживаемость изменяется от 97,5 до 2,5%, составляет 171 + 342 сГр. Можно отметить маленькую величину дисперсии среднелетальных доз при равномерном облучении собак, полученную на основе представленных выше работ. Близкие значения среднелетальных доз получены в ряде других исследований, в которых авторы анализировали эксперименты с большим количеством животных и доз облучения. Так, среднелетальная доза ЛД50/30, оцененная по
360
Рис. 6.4. Выживаемость собак после острых равномерных облучений в зависимости от дозы.
1-10 — данные работ: Norris W.P. et.al., 1968; Нелюбов А.А., 1972; Дарен-ская Н.Г., 1970; Alpen E.L., 1967; Короткевич А.О., 1987; Зяблицкий В.М. и др., 1978; Ainsworth EJ. etal., 1965; Рыжов Н.И. и др., 1967; Alpen E.L. etaL, 1958; Bond V.P. et al., 1957 соответственно
результатам других 6-ти экспериментов, составила 259 сГр (Bond V.P. et al., 1957), а в работе (Norris W.P. et al., 1968) приводится значение 258 сГр.
Нами дополнительно были проанализированы результаты экспериментов, в которых использовалась выживаемость собак при субтотальном их облучении с экранированием различных участков тела, включая эксперименты с экранированием передних или задних конечностей животных, содержащих в норме малоактив
361
ный желтый костный мозг. Известно, что желтый костный мозг является резервным, но при чрезвычайных обстоятельствах он может начинать активное кроветворение. Стволовые клетки, находящиеся там в норме в стадии покоя (Go), за счет регуляторных процессов, осуществляемых в организме, могут переходить к активной пролиферации и дифференцировке и частично в очень слабой степени мигрировать через кровоток в другие отделы костного мозга, вызывая их репопуляцию. Эксперименты с аутотрансплантацией клеток костного мозга из этих участков, способствующей расселению стволовых кроветворных клеток и приводящей к увеличению выживаемости животных, подтверждают вышесказанное (Стрелин Г.С., 1978).
На рис. 6.5 показаны зависимости выживаемости собак от модуля логарифма сохраненной доли стволовых кроветворных клеток на основе экспериментов по облучению животных с использованием локальной защиты тела (Шафиркин А.В., 1999 а, с).
При расчете доли выживших стволовых клеток мы использовали представленные в работах данные по защищенной части тела собак, находящейся под экраном, и материалы по относительному распределению красного и желтого костного мозга в костях скелета собаки (Коржуев П.А. и др., 1968).
Зависимость выживаемости животных в пробитах от логарифма доли выживших стволовых клеток | IgS/S* |, как это видно из данных рис. 6.5, также может быть представлена линейной функцией:
у = 11 - 3,31 lg S/S*|. (6.7)
При проведении прямой линии использовали то же значение пробита, которое получено при анализе выживаемости от дозы для дозы равной нулю (рис. 6.4), соответствующее исходной концентрации клеток до облучения S = S*.
Из сопоставления уравнений (6.6) и (6.7) легко получить, что доля выживших стволовых кроветворных клеток от дозы может быть определена на основе выражения S/S* = exp(-D / 60,5), откуда следует, что значение параметра Do для описания выживаемости стволовых кроветворных клеток у собак равно 60,5 сГр и близко к значению 60 сГр, полученному в работе (Слепчонок О.Ф., 1989).
362
Рис. 6.5. Зависимость в пробитах и процентах выживаемости собак от модуля логарифма относительной доли сохраненных стволовых кроветворных клеток 11g S / S*|.
1 — данные работ (Абрамова Г.М., 1969; Невская Г.Ф., 1974); 2 — (Cole LJ., Haire Н.М., Alpen E.L., 1967); 3 — (Богатырев А.В. и др., 1970); 4 — (Балуда В.П. и др., 1973); 5-7 — (Клестова О.В. и др., 1977; Стрелин Г.С., 1978); 8 — (Балуда В.П. и др., 1973; Зяблицкий В.М. и др., 1978); 9 — (Зяблицкий В.М. и др., 1978; Стрелин Г.С., 1978); 10 — (Ефимов В.И. и др., 1973).
Рассмотренные материалы показали, что действительно имеется взаимно однозначное соответствие между уровнем выживаемости животных и долей жизнеспособных стволовых кроветворных клеток. Уровень среднелетального эффекта соответствует приблизительно 1,45% выживших стволовых кроветворных клеток, а диа
363
пазону летальности 2,5 и 97,5% соответствует уровень сохраненных клеток 6,2 и 0,4%.
Полученные материалы легли в основу интерпретации экспериментальных результатов неравномерного одностороннего облучения собак гамма-излучением с коэффициентами перепада поглощенных доз по телу 1,16; 3 и 5 раз (Акоев И.Г., 1970; Нелюбов А.А., 1972. Аветисов Г.М., 1975).
При создании костно-парафинового фантома собаки, показанного в разд. 4 при описании результатов «Хронического эксперимента» (Григорьев Ю.Г. и др., 1986), нами были тщательно измерены линейные размеры животных, охват тела в области плечевого пояса, поясницы и тазового пояса при сгруппированном состоянии животных в положении лежа. Средние параметры, соответствующие средней массе собак 16 кг, были взяты за основу при изготовлении гетерогенного фантома. При этом его толщины в области, соответствующей плечевому поясу, пояснице и тазовому поясу, составили соответственно 22, 17 и 24 см.
В рассматриваемом выше эксперименте с односторонним боковым облучением собак (Акоев И.Г., 1970; Нелюбов А.А., 1972. Аветисов Г.М., 1975) использовались животные со средней массой 18,5 кг (масса отдельных собак превышала 20 кг). Поэтому при проведении расчетов была принята модель тела собаки, состоящая из двух цилиндров с диаметрами 120 и 180 мм, моделирующих голову и торс животного, с приставленными с обеих сторон к плечевому и тазовому поясу прямоугольными пластинами высотой 160 мм, длиной 150 и 200 мм и толщиной 35 и 50 мм соответственно. Таким образом, максимальная толщина собаки в плечевом поясе составила 250 мм, в тазовом поясе — 280 мм.
Для получения распределения массы костного мозга по дозе использовали глубинные распределения дозы, представленные в работе (Нелюбов А.А., 1972), а также материалы по относительному содержанию костного мозга в различных костях скелета собак (Коржуев П.А. и др., 1968). При проведении расчетов наиболее протяженные кости черепа, ребер, лопатки, таза и плечевые кости разбивались на 3 или 4 участка, каждый из которых характеризовали определенной глубиной залегания и своей относительной дозой.
На основе расчетных значений доли выживших стволовых кроветворных клеток при использовании экспоненциальной зависимости S/S* = ехр (-D/60), а также материалов рис. 6.5, опреде
364
ляли вероятность выживания животных для каждой из максимальных поверхностных доз и коэффициентов перепада поглощенных доз К=1;К = ЗиК = 5.
На рис. 6.6 представлены экспериментально наблюдаемые и расчетные значения выживаемости собак при их неравномерном облучении с коэффициентами перепада дозы по телу К = 1; К = 3 и К = 5. Как видно из данных, представленных на рисунке (кривая 4), расчетные значения выживаемости достаточно хорошо соответствуют экспериментальным результатам (Акоев И.Г., 1970; Нелюбов А.А., 1972. Аветисов Г.М., 1975) при неравномерном облучении собак.
Следовательно, использование более точного представления фантома собаки и простого экспоненциального вида функции выживаемости стволовых кроветворных клеток собак от дозы позволяет удовлетворительно описывать зависимость выживаемости животных от дозы в случае равномерных и неравномерных радиационных воздействий не хуже, чем при использовании более сложного двухкомпонентного вида функции активности костномозгового кроветворения (АКК) в зависимости от дозы, предложенного в работе (Слепчонок О.Ф., 1989, кривая 2, рис. 6.6).
Рассмотренные экспериментальные материалы показали, что концепция, выдвинутая в работах (Bond V.P., Robinson C.V., 1967а, б; Jammet Н.Р. et al., 1968; Gilbert C.W., 1969), оказалась подтвержденной при рассмотрении экспериментов с неравномерным облучением животных, что позволяет сравнивать по эффективности данное облучение со стандартным равномерным радиационным воздействием и определять значения равноценной дозы.
С целью проведения расчетов равноценных доз необходимо рассмотреть более подробно характер инактивации стволовых кроветворных клеток при облучении в широком диапазоне доз и мощностей доз, включая вопросы экстраполяции в область малых доз и малых значений мощностей доз. Для этой цели необходимо использовать более общий вид кривой выживаемости стволовых клеток от дозы:
f(D) = 1 - [1 - exp(-D/D0)]n (6.8)
или другое представление функции f(D), также широко используемое в радиобиологической литературе:
f(D) = exp(-aD-bD2) (6.9)
365
Рис. 6.6. Зависимость выживаемости собак в процентах от максимальной поверхностной поглощенной дозы при одностороннем их гамма-облучении с коэффициентами перепада доз по телу 1,16; 3,0 и 5,0.
Сплошные кривые 1 — линейные зависимости в пробитах от дозы, перенесенные на данный масштаб; кривые 2 и 3 — расчетные значения выживаемости в работе (Слепчонок О.Ф., 1989) для двухкомпонентной и однокомпонентной экспоненциальных кривых активности костномозгового кроветворения (АКК); кривая 4 — расчет выживаемости собак, проведенный нами (Шафиркин А.В., 1999а, в) для простой экспоненциальной зависимости выживаемости стволовых кроветворных клеток и использовании более точной формы фантома собаки
Известно, что сигмоидная кривая выживаемости стволовых кроветворных клеток, соответствующая уравнению (6.8), характеризуется малым экстраполяционным числом п< 1,6, величиной плеча Dq= [ln(n)]D0, меньшей 30 сГр. При больших дозах она превращается в простую экспоненциальную зависимость f(D) = n exp (~D/D0) с конечным наклоном, определяемым параметром Do. С другой стороны известно, что эти кривые выживаемости для клеток млекопитающих in vivo, а также культивируемых in vitro, с уменьшением мощности дозы, начиная с некоторого граничного ее значения, постепенно выпрямляются и характеризуются меньшим значением экстраполяционного числа и меньшим наклоном (большим значением параметра Do). Как показано в работах (Губин А.Т., Минаев Ю.Л., Сакович В.А., 1989; Хуг О., Келлерер А., 1969; Ярмоненко С.П., Вайнсон А.А., 2004),
366
изменение наклона кривых выживаемости клеток связано с развитием и большей возможностью реализации быстрых восстановительных процессов в клетках с уменьшением мощности дозы и увеличением длительности воздействия радиации.
Было принято при обосновании нормативно-технического документа (ГОСТ 25645.219-90 (БРЭКАКП), 1991), что в случае дальнейшего снижения мощности дозы, кривые выживаемости клеток от дозы становятся экспоненциальными. Экстраполяционное число п становится равным 1, а параметр D0H оказывается равным 1/а и соответствует начальному наклону кривой доза-эффект, определяемому линейным членом уравнения (6.9). Данному виду кривой выживаемости соответствует максимальная реализация восстановительных и репаративных процессов в клетках, так что при последующем снижении мощности дозы кривые доза-эффект практически не меняются и значение параметра остается постоянным и равным D0H.
В случае радиационного воздействия с мощностью дозы менее 0,05 сГр/мин (70 сГр/сут), длительностью несколько десятков часов или несколько суток, наклон кривых выживаемости клеток от дозы становиться еще меньшим и характеризуется значением параметра D0npOT большим, чем D0H, что связано с тем, что время облучения становится соизмеримым с длительностью клеточного цикла стволовых клеток рассматриваемой обновляющейся клеточной системы. В этом случае, наряду с максимально возможным восстановлением повреждений в клетках, реализуются также наиболее быстрые авторегуляторные компенсаторные процессы в кроветворной ткани, приводящие к более ускоренной регенерации клеток (ГОСТ 25645.219-90 БРЭКАКП, 1991; Шафиркин А.В., 1999 а, в).
Проведенный в этих работах анализ кривых выживаемости стволовых кроветворных клеток мышей от дозы в широком диапазоне мощностей доз показал, что при мощности дозы ниже 10 сГр/сут параметр D0H, соответствующий начальному наклону кривой выживаемости клеток, в 2,1-2,4 раза превышает параметр для конечного наклона кривой выживаемости клеток при остром облучении (мощность дозы выше 10 сГр/мин), при котором параметр Do равен 100 сГр. Предполагая аналогичное соотношение параметров и для кривой выживаемости стволовых клеток от дозы для собак, получили, что начальный наклон кривой выживаемости клеток для собак должен быть >120 сГр.
367
С учетом рассмотренных выше материалов может быть получена кривая выживаемости стволовых кроветворных клеток у собак в зависимости от дозы при остром равномерном их облучении. Начальный участок кривой выживаемости при малых дозах D < D п определяется экспоненциальной зависимостью с параметром D0H, соответствующим начальному наклону и равным 120 сГр. При больших дозах кривая выживаемости клеток (6.8), как указывалось выше, также превращается в экспоненциальную зависимость, характеризуемую экстраполяционным числом п=1,55 и параметром, соответствующим конечному наклону Do = 55 сГр. Параметры п и Do установлены на основе того, что при среднелетальной дозе радиационного воздействия ЛД50/30, равной 257 ± 3 сГр, выживает 1,45% клеток (см. рис. 6.4 и о.5). Указанные значения параметров соответствуют также данным, представленным в работах (Слепченок О.Ф., 1989; ГОСТ 25645.219-90 БРЭКАКП, 1991).
Таким образом, в нормативном документе (ГОСТ 25645.219-90 БРЭКАКП, 1991) было принято, что кривая выживаемости стволовых кроветворных клеток для собак от дозы в случае равномерного острого облучения имеет следующий вид:
f(D) = exp(-D/D0H ) при D < 50 сГр; (6.10) f(D) = n exp(-D/D0) при D > 50 сГр.
Поскольку величины среднелетальных доз для собак (257 сГр) и человека (285 сГр) являются достаточно близкими (Langham W.H. et al., 1965; Radiobiological factors in space, 1967; Norris W.P., et al., 1968), мы предположили, что данная кривая выживаемости для стволовых кроветворных клеток применима и для случаев острого равномерного облучения человека. В разд. 3.3 на основе анализа миелограмм собак после их острого облучения в различных дозах показано, что минимальное общее количество миелокариоцитов, минимальное число клеток эритробластического и миелоидного ряда, а также молодых делящихся гранулоцитов в костном мозге у животных достаточно точно соответствует минимальному количеству аналогичных клеток у человека после облучения в одинаковых дозах. При этом относительное уменьшение числа клеток в костном мозге согласуется с расчетными данными об уменьшении числа стволовых кроветворных клеток на основе уравнения (6.10). Это подтверждает также возможность
368
использования этого уравнения для описания степени инактивации стволовых кроветворных клеток у человека после острых облучений.
При острых радиационных воздействиях с мощностью дозы выше 4000 сЗв/сут параметры кривой выживаемости стволовых кроветворных клеток Do и п, как указывалось выше, равны 55 сЗв и 1,55 соответственно.
Нами в разд. 5.2 на основе анализа данных по изменению величин среднелетальных доз у различных животных отмечено снижение эффективности радиационного воздействия по мере уменьшения мощности дозы ниже 10 сГр/мин. Как показано в нормативно-техническом документе (ГОСТ 25645.219-90 (БРЭКАКП, 1991), снижение эффективности радиационного воздействия при протяженных облучениях по мере уменьшения мощности дозы в основном определяется уменьшением наклона экспоненциальных кривых выживаемости стволовых кроветворных клеток при малых значениях мощности дозы. При этом параметр инактивации клеток D 2 (у) превышает параметр Do, а экстраполяционное число п(у) соответственно является более низким, чем для острого облучения. Они могут быть установлены на основе соотношения
D2(y) = 55 (4000/у)048 при 50 < у 4000 сЗв/сут; (6.11) п(у) = 1,55(y/4OOO)0,18.
При дальнейшем снижении мощности дозы (при у < 50 сГр/ сут) будет наблюдаться экспоненциальное снижение числа стволовых кроветворных клеток с параметрами D0H и п, равными соответственно 120 сЗв и 1.
В нормативном документе (ГОСТ 25645.219-90 (БРЭКАКП, 1991) представлены выражения для расчета величин равноценных доз и коэффициентов равноценности радиационного воздействия КРБ от космических излучений на основе рассмотренных соотношений и значений параметров, определяющих относительную долю сохраненных стволовых кроветворных клеток. В нем показано, что при невысоких уровнях протяженного облучения, когда мощность эквивалентной дозы на отдельные элементы костного мозга не превышает 5 сЗв/сут, равноценная доза G численно совпадает со среднекостномозговой дозой Dkm и может быть вычислена на основе выражения:
369
G = Dkm = £ тцЩп), (6.12)
i
где Tij — относительное распределение красного костного мозга в представительных точках скелета антропоморфного фантома, представляющего собой стандартизованную модель тела человека (ГОСТ 25645.203-83. БРЭКАКП, Модель тела человека, 1984). D(rj) — эквивалентная доза в i-й представительной точке, которая согласно нормативному документу (ГОСТ 25645.219-90 (БРЭКАКП, 1991) определяется из уравнения:
Lmax
D(rj)= jD(5)0(5,ri)A5, (6.13)
1=1
где A 8 — эквивалентная доза за слоем ткани d при нормальном падении на него радиации; ф(8, q ) — функция экранированности для этой i-й точки. Следует дополнительно отметить, что при воздействии с малой мощностью дозы излучений с относительно жестким спектром равноценная и средне-костномозговая дозы незначительно отличаются от среднетканевой дозы.
Распределение костного мозга согласно (ГОСТ 25645.219-90 (БРЭКАКП, 1991) представлено в табл. 6.3);
Таблица 6.3
Относительное распределение красного костного мозга щ по представительным точкам кроветворной системы для антропоморфного фантома модели тела человека, %
(ГОСТ 25645.203-83. БРЭКАКП Модель тела человека, 1984;
ГОСТ 25645.219-90 БРЭКАКП, 1991)
Номер представительной точки Содержание активного костного мозга т||, % Номер представительной точки Содержание активного костного мозга r|j, %
1 14,4 И 5,0
5 и 6 1,3 12 2,5
7 5,4 13 17,7
8 14,2 17 и 20 15,7
9 7,6 18 и 19 12,2
10 4,0
370
Коэффициент пространственной неравномерности радиационного воздействия КРБ, согласно (ГОСТ 25645.219-90 (БРЭКАКП, 1991), может быть определен на основе выражения:
KPB=G/D = G/ 'J^mCDJ-D-dD, Dinin
(6.14)
где m(D) — относительная часть массы тела с эквивалентной дозой в диапазоне от D до D + dD.
При более высоких уровнях радиационного воздействия, например, при развитии СПС, однако, когда эквивалентная доза в представительных точках кроветворной ткани не превышает 50 сЗв, равноценную эквивалентную дозу, согласно этому же документу следует определять на основе выражения:
G = D, {- 1п£ П| exp [_D(rj )/D, ]}, (6.15)
i
где D(rj) — эквивалентная доза в i-й представительной точке; Df — параметр, равный 120 сЗв.
В случаях, когда эквивалентная доза в отдельных представительных точках кроветворной системы превышает 50 сЗв, равноценную дозу вычисляют по формуле
G = D0{-ln £ тцп[у(1|)] exp [--^2-]}. (6.16)
Параметры D2[Y(rj)] и n[y(ri)] устанавливаются из соотношения (6.11).
Таким образом, представленные в настоящем разделе выражения для равноценной дозы могут быть использованы для вычисления значений коэффициентов пространственной неравномерности радиационного воздействия КРБ, определения значений обобщенной дозы для различных источников космического излучения и установления величин радиационного риска для космонавтов в процессе осуществления межпланетных и орбитальных космических полетов. Эти материалы подробно рассматриваются ниже в разд. 7.
371
6.4. Степень модификации радиационного ответа организма за счет действия нерадиационных факторов космического полета
К настоящему времени проведено значительное число экспериментальных исследований по изучению модифицирующего влияния нерадиационных факторов на вероятность и выраженность радиобиологических эффектов в ближайшем пострадиационном периоде. При этом нерадиационные факторы, такие как ускорения, перегрузки, вибрация, гипокинезия, гипертермия, физические нагрузки, постоянное магнитное поле, электромагнитные излучения сантиметрового и дециметрового диапазона применялись исследователями в виде однократных, повторных, непрерывных воздействий с различными интенсивностями и длительностями.
Значительную ценность представляют целенаправленные, обширные экспериментальные исследования по изучению комбинированного действия радиационного и нерадиационных факторов, которые могут иметь место в условиях длительного космического полета. Наиболее изученным является сочетанное воздействие на организм ускорений (перегрузок), вибрации и ионизирующего излучения. Результаты исследований (Давыдов Б.И., 1966; Саксонов П.П., Антипов В.В., Давыдов Б.И., 1968; Антипов В.В. и др., 1975; Давыдов Б.И., Тихончук В.С., Антипов В.В., 1984; Ушаков И.Б. и др., 1997; Шафиркин А.В., 1999в; Шафиркин А.В., Григорьев Ю.Г., 2004) показали, что предварительное действие ускорения увеличивало выживаемость облученных животных на 15-23%. Анализ кривых доза-эффект позволил авторам сделать заключение об увеличении среднелетальной дозы ЛД50//30 в среднем на 100 сГр (10-15%).
С целью оценки значений коэффициентов модификации радиационного воздействия применительно к ближайшим неблагоприятным эффектам в процессе полета КМБ для расчетов обобщенной дозы и радиационного риска, нами проведен анализ представленных в литературе результатов экспериментальных исследований по комбинированному действию радиации и нерадиационных факторов (Шафиркин А.В., 19996, в; Шафиркин А.В., Григорьев Ю.Г., 2004). В табл. 6.4 в обобщенном виде представлены эти данные. В ней отражены материалы по воздействию ускорений, перегрузок, постоянного магнитного поля (ПМП), физиче-
372
Таблица 6.4
Коэффициенты модификации реакции организма и его устойчивости при комбинированном действии ионизирующего излучения и нерадиационных факторов (НФ) КМБ = [Врад/Вкомб]
373
Воздействующий нерадиационный фактор (НФ) и вид животных Длительность воздействия НФ до облучения Отмечаемые изменения КМБ = “ ^радД^комб!
Выживаемости (В) Смертности (С) Среднелетальной дозы
Ускорения, перегрузки (мыши) Часы (В) выше на 15-23% Выше на 100 сГр 0,87-0,91
Вибрация (мыши) Часы (В) выше на 10-20% — < 1,0
Длительное вращение (мыши) 21 сутки (В) выше на 40-70% Выше на 130 сГр 0,85
(кролики) 10-15 суток (В) выше на 20% — < 1,0
Постоянное магнитное поле (ПМП) 1 сутки (С) ниже в 1,1 раза — < 1,0
(крысы) 7 суток (С) ниже в 1,41 раза — < 1,0
10 суток (С) ниже на 50% — < 1,0
17 суток (С) ниже в 2 раза — < 1,0
30 суток (С) ниже в 2,5 раза — < 1,0
374
Продолжение табл. 6.4
Воздействующий нерадиационный фактор (НФ) и вид животных Длительность воздействия НФ до облучения Отмечаемые изменения КМБ = П^рад/Окомб]
Выживаем. (В) Смертности (С) Среднелетальной дозы
Температура окружающей среды 16-26° и 37-42° (крысы) Несколько суток Кратковременно (С) выше на 20-80% (С) выше — > 1,0 1,6
Гипокинезия нежесткая жесткая (крысы) 11-60 суток десятки суток (В) выше на 40-60% (В) ниже на 30-56% Выше на 10-15% Снижена < 1,0 > 1,0
Физическая нагрузка легкая ФН тяжелая (крысы) Кратковременная Часы (В) выше (В) ниже на 17-44% — < 1,0 1,3
ЭМИ СВЧ с ППМ 10 мВт/см2 40 мВт/см2 40 мВт/см2 100 мВт/см2 (мыши, крысы) 25 суток Десятки минут 1,0-1,5 месяца 14 суток (С) ниже в 3 раза (С) выше в 1,5-2,0 раза (С) выше (С) ниже на 35% — Л V V Л о о о о
ЭМИ СВЧ с ППМ 100 мВт/см2 (собаки) 3-6 часов Длительно (С) ниже в 4 раза (С) ниже в 1,5 раза — < 1,0 < 1,0
ской нагрузки, повышенной температуры окружающей среды, гипокинезии, по действию неионизирующих электромагнитных излучений (ЭМИ) с различной частотой (длиной волны) и плотностью потока мощности (ППМ).
Из данных таблицы видно, что предварительное воздействие на мышей вибрации за 4-24 часа до облучения в дозах 400-750 сГр также снижало смертность на 10-20%. При этом отмечали увеличение средней продолжительности жизни у павших животных. В случае увеличения интервала между воздействиями и величины дозы ионизирующего излучения, наблюдали уменьшение защитного эффекта. Действие вибрации в период разгара острой лучевой болезни приводило к ее утяжелению (Саксонов П.П., Антипов В.В., Давыдов Б.И., 1968; Ушаков И.Б. и др., 1997; Шафиркин А.В., 19996; Шафиркин А.В., Григорьев Ю.Г., 2004).
В наших исследованиях получен также защитный эффект предварительного длительного воздействия ускорений (Фабер Ю.В., Табакова Л.А., Шафиркин А.В., 1978), гипоксии (Григорьев Ю.Г., 1982) и гипокинезии.
Неоднократно отмечался факт увеличения радиорезистентности различных животных к радиационному воздействию, наносимому спустя 14-90 суток после начала действия нерадиационного фактора, что связывалось нами с развитием неспецифической защитной реакции организма в ответ на предварительное воздействие.
Характер изменения радиорезистентности организма к тестирующему радиационному воздействию в большинстве случаев соответствовал определенным стадиям процесса адаптации к предварительному стрессорному воздействию, развитию общего адаптационного синдрома (Селье Г., 1972; Горизонтов П.Д., Белоусова О.И., Федотова М.И., 1983; Шафиркин А.В., 19996 и в).
Практически во всех рассмотренных выше экспериментальных исследованиях после длительного предварительного воздействия различных умеренных раздражителей отмечали повышение устойчивости организма по отношению к радиационным воздействиям в летальном диапазоне доз. Максимально смертность животных снижалась в несколько раз (в абсолютном выражении на 20-75%). Отмечались меньшая глубина поражения кроветворной ткани и большая скорость восстановления числа лейкоцитов в периферической крови.
375
Следует подчеркнуть, что смещение кривых доза-эффект во всех рассмотренных случаях не превышало 100-150 сГр (или 10-17%). Эффективность комбинированного действия нерадиационных факторов и ионизирующего излучения по отношению к действию только радиации была меньше 1,0, и значение коэффициента модификации КМ составляло 0,85-0,9.
Когда рассмотренные физические факторы умеренной интенсивности действовали непродолжительное время и незадолго до радиационного воздействия, в ряде случаев отмечали эффект усиления поражения организма после облучения, однако он не был выражен сильно. Смертность животных увеличивалась не более чем на 20-30%, а смещение кривых доза-эффект по дозе не превышало 10%.
Нами отмечено, что при предварительном действии различных физических факторов умеренной интенсивности, как правило, имеет место ослабление радиационного ответа организма, и наоборот, в случае предварительного действия гипертермии, чрезмерной физической нагрузки, жесткой гипокинезии последующее облучение приводит к синергическому эффекту, и глубина радиационного поражения увеличивается. Значение коэффициента модификации КМБ при относительно равномерном облучении может в этом случае составить 1,3. Лишь в случае чрезвычайного повышения температуры окружающей среды КМБ может достигнуть значения, равного 1,6.
При действии нерадиационных факторов после ионизирующего излучения, особенно в период разгара лучевой болезни, как правило, тяжесть радиационного поражения увеличивается, замедляется начало пострадиационного восстановления организма, снижается скорость восстановления, увеличивается вероятность его гибели. Коэффициент модификации по дозе в этом случае также может составить значения от 1,2 до 1,3.
Таким образом, на основе рассмотренных данных можно сделать заключение, что усиливающее модифицирующее действие рассмотренных факторов по отношению к ближайшим эффектам не превышает по дозе 30%, и коэффициент модификации КМБ находится в диапазоне 1,0-1,3.
РАДИАЦИОННЫЙ РИСК ДЛЯ КОСМОНАВТОВ В ПРОЦЕССЕ ! ОСУЩЕСТВЛЕНИЯ МЕЖПЛАНЕТНЫХ J □ И ОРБИТАЛЬНЫХ КОСМИЧЕСКИХ
ПОЛЕТОВ
7.1. Разработка алгоритма для расчета радиационного риска при межпланетных космических полетах
Основными детерминированными источниками радиационной опасности при осуществлении полета к Марсу являются галактическое космическое излучение (ГКЛ) и излучение радиационных поясов Земли (РПЗ). Кроме того, в периоды максимума солнечной активности (СА) космонавты будут подвергаться кратковременным стохастическим воздействиям от солнечных космических лучей (СКЛ). Материалы по дозовым нагрузкам от различных источников космических излучений за различными толщинами защиты космического аппарата представлены в разд. 1.
Как мы отмечали в разд. 4, уже после осуществления первых пилотируемых орбитальных полетов в конструкторском бюро С.П. Королева в 1963-1964 гг. начинают разрабатываться проекты межпланетных полетов на Луну и на Марс. Имелось несколько вариантов осуществления экспедиции к Марсу и соответствующих конструкторских разработок межпланетного корабля (МК) для полета на Марс. Общая предполагаемая длительность полета в разработках варьировала от 2 до 3 лет. В одном из рассматриваемых вариантов, в случае использования двигательного комплекса, состоящего из модулей большой и малой тяг, включающего жидкостной реактивный двигатель (ЖРД) и ядерно-энергетическую двигательную установку (ЯЭРДУ), можно было значительно сократить время пребывания в РПЗ и продолжительность всей экспедиции с 745 до 530-615 суток (Демин В.П. и др., 1993). При полете с использованием комбинированной схемы ЖРД + ЯЭРДУ радиационную опасность для экипажа в основном представляют ГКЛ и СКЛ. Протоны и электроны РПЗ в этом случае перестают
377
представлять существенную опасность ввиду быстрого пересечения марсианским кораблем РПЗ.
Как уже отмечалось в разд. 6, в радиобиологии достаточно хорошо изучены дозо-временные зависимости непосредственных и отдаленных эффектов после стандартных радиационных воздействий (кратковременное, равномерное воздействие от жесткого рентгеновского или гамма-излучений). В отличие от возможных вариантов облучения на Земле, воздействие в условиях космического полета на орбите и вне магнитосферы Земли характеризуется сложным составом излучений и их энергетического спектра, простирающегося от нескольких кэВ до сотен ГэВ, которые различаются в значительной степени по своей биологической эффективности. Оно характеризуется значительной неравномерностью распределения доз как по глубине тела, так и во времени.
Для приведения сложного характера радиационного воздействия при межпланетном полете к условиям стандартных радиационных воздействий в разд. 6 введено понятие обобщенной дозы применительно к оценкам ближайших неблагоприятных проявлений в процессе полета НБ, а также отдаленных последствий в течение последующей жизни Но (уравнение (6.5)).
На основе расчетных значений обобщенной дозы можно оценить величину радиационного риска для космонавтов в процессе полета и за весь период их профессиональной деятельности. Под радиационным риском понимается радиационно обусловленное увеличение вероятности ближайших в (процессе полета) и отдаленных неблагоприятных последствий, снижающих работоспособность и жизнеспособность космонавтов. В настоящем разделе будет рассмотрен алгоритм для расчета радиационного риска при осуществлении межпланетных космических полетов вне магнитосферы Земли на основе определения степени снижения жизнеспособности космонавтов.
В настоящем разделе мы будем рассматривать риски радиационно обусловленного снижения работоспособности и жизнеспособности космонавтов в процессе полета, поэтому для их определения необходимо оценить значения обобщенной дозы НБ. Применительно к ближайшим неблагоприятным последствиям выражение для вычисления обобщенных доз НБ имеет вид
п __
НБ = (£ Dj xKKBi xKBBi xKPBi)KMB. (7.1) i “1
378
Обобщенная доза определяется на основе значений среднетканевых доз от различных источников космических излучений, умноженных на соответствующие значения коэффициентов качества излучений KKBi, коэффициентов времени KBBi, учитывающих влияние мощности дозы и характер распределения дозы во времени на радиобиологический эффект, коэффициентов распределения KPBi, учитывающих макропространственное распределение дозы по телу, а также коэффициентов модификации радиационного ответа организма за счет других факторов космического полета. Алгоритм вычисления этих коэффициентов подробно рассмотрен в разд. 6.
Для последующих расчетов обобщенных доз и риска для космонавтов делается два допущения: коэффициент модификации радиационного поражения КМБ за счет нерадиационных факторов принимался равным 1,0, и не учитывалось возможное утяжеление радиационных эффектов (сдвиг по дозе в сторону увеличения в 1,3 раза, разд. 6.4). С другой стороны, пока в настоящей работе при расчетах обобщенных и среднетканевых эквивалентных доз от космических излучений использовали регламентированную зависимость коэффициентов качества КК0 от ЛПЭ, полученную на основе анализа отдаленных эффектов (ГОСТ 25645.218-90. БРЭКАКП,1991; Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978), хотя для более точной оценки риска ближайших пострадиационных эффектов следовало бы использовать зависимость ККБ от ЛПЭ, представленную нами в разд. 6.2.
Характер изменения устойчивости организма в ближайшем пострадиационном периоде в основном обусловлен степенью поражения кроветворной ткани (ГОСТ 25645.219-90., 1991; Конопляников А.Г., 1984; Шафиркин А.В., 1999в). Значения ККБ применительно к поражению системы кроветворения являются существенно более низкими, чем значения ККО (см. разд. 6.2). Например, среднее значение ККБ для ГКЛ по усредненному спектру ЛПЭ оказывается в 2-3 раза меньше, чем полученные средние оценки ККО на основе зависимостей КК от ЛПЭ согласно (ГОСТ 25645.218-90. БРЭКАКП, 1991; Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978),
Таким образом, принимая указанные допущения, мы несколько преувеличиваем в расчетах реальные величины обобщенных доз и величину риска для космонавтов в процессе полета, что до
379
пустимо при оценке радиационной опасности и нормировании радиационного воздействия на космонавтов. Подчеркнем, что полученные таким образом величины уровня радиационной опасности являются верхними оценками.
В разд. 3.2 нами на основе анализа материалов атомных бомбардировок, испытаний атомного оружия, аварийного облучения людей, а также материалов по облучению пациентов с терапевтической целью в клиниках представлено уравнение, определяющее вероятность гибели человека в ближайшие 60 суток после стандартного радиационного воздействия в зависимости от дозы. Эти материалы подробно проанализированы также в работах (Шафиркин А.В., 1997; Шафиркин А.В., 1999в). Показано, что уравнение прямой в пробитах, определяющее вероятность гибели для здоровых мужчин в возрасте 25 лет от дозы при остром равномерном облучении, может быть записано в виде
У1 = 1,8 +0,97 xlO2 D, (7.2)
где D — поглощенная доза, сГр.
Из этого уравнения, вытекающего из предположения нормального закона распределения индивидуумов по радиочувствительности легко установить, что для мужчин данного возраста значения доз, приводящих к 1, 10, 50 и 90% гибели за ближайший период (60 суток) после облучения, оказываются соответственно равными 90, 200, 330 и 460 сГр. В разд. 3.2 представлена эта зависимость графически (рис. 3.4). При проведении сплошной кривой для здоровых людей учитывали, что вероятность гибели, при дозе равной нулю, должна быть равна коэффициенту смертности для мужчин соответствующего возраста, полученному из демографических данных, отнесенному к периоду 60 суток. Значение коэффициента смертности в нашей стране для мужчин в возрасте 25 лет для периода 1993-1996 гг. в пересчете к 60-ти суткам составило 7,0 х 10“4 (Российские статистические ежегодники 1994-1997гг.; Россия в цифрах, 1995). Пробит, соответствующий этому риску, составляет 1,8.
Аналогично выражению (7.2), можно представить соотношение риска смертности в ближайшем пострадиационном периоде в зависимости от обобщенной дозы НБ при кратковременном радиационном воздействии в условиях космического пространства:
380
у, = 1,8 + 0,97 х 10-2 НБ,
(7.3)
где НБ — обобщенная доза, сЗв.
Соотношения (7.2) и (7.3) предполагают нормальный закон распределения индивидуумов по своей радиочувствительности от дозы. По своему смыслу пробит yt представляет смещенное на 5 единиц значение верхнего предела (х = yt - 5) интеграла вероятности, определяющего долю погибших радиочувствительных индивидуумов при облучении в дозе НБ,
1 х ——tz
Ф(х) = —== f е 2 d t, V2tc Д
(7.4)
где t — нормированное отклонение от среднелетальной дозы Н50/б0, определяемое на основе соотношения: t = (НБ -“ н50/60 ) / а-
Предполагая, что радиочувствительность взрослых людей в возрасте 25-55 лет сохраняется постоянной (одинаковый наклон кривых вероятности гибели от дозы), а изменяется только зависимая от возраста вероятность гибели при нулевой дозе, мы можем получить семейство параллельных кривых, аналогичных уравнению (7.3), определяющих зависимость смертности (за 60 суток) от дозы для людей различного возраста. При этом величина среднелетальной дозы с увеличением возраста будет несколько снижаться, отражая некоторое снижение общей резистентности организма с увеличением возраста. Это предположение находится в соответствии с данными радиобиологических экспериментов, в которых исследовался характер изменение величин среднелетальных доз при облучении половозрелых животных разного возраста (Горлов В.Г., 1981; Шафиркин А.В., 1983а, 1999в). Расчеты, проведенные нами с учетом указанных допущений, показывают, что при увеличении возраста мужчин на каждые 10 лет величина среднелетальной дозы уменьшается на 20 сГр. Таким образом, среднелетальная доза Н50/30 для мужчин в возрасте 25, 35, 45 и 55 лет составляет соответственно 330, 310, 290 и 270 сЗв. Величина среднеквадратического отклонения о, как это следует из уравнения (7.3), оказывается равной 103 сЗв.
381
Для вычисления вероятности гибели в ближайшем пострадиационном периоде в зависимости от возраста космонавта и дозы кратковременного радиационного воздействия верхний предел интеграла в уравнении (7.4) можно представить в виде
X = х0 (т) + 0,97 х 10~2 НБ. (7.5)
При дозе радиационного воздействия, равной нулю, вероятность гибели за 60 суток и соответствующее значение верхнего предела интеграла вероятности х0(т) устанавливается на основе демографических материалов о коэффициентах смертности для мужского населения данной возрастной группы для соответствующего периода исследования. Нами проведены расчеты вероятности гибели для мужчин Российской Федерации различного возраста за период 60 суток на основе значений коэффициентов смертности за 1993-1996 гг. (Российские статистические ежегодники 1994-1997гг.; Россия в цифрах, 1995). Полученные значения вероятности гибели для людей различных возрастов т, в условиях отсутствия радиационного фактора, позволили с использованием уравнения (7.4) получить соответствующие значения х0(т) в выражении (7.5). Зависимость х0(т) для возрастов космонавтов, превышающих 25 лет, описывалась следующим уравнением:
х0(т) = -3,200 + 0,019 (т - 25). (7.6)
При осуществлении длительных межпланетных полетов вне магнитосферы Земли, как уже отмечалось, основную опасность представляют галактические космические лучи и солнечные космические лучи. При невысоких уровнях протяженного облучения, когда мощность эквивалентной дозы на отдельные элементы костного мозга от рассматриваемого источника радиационной опасности не превышает 5 сЗв/сут, равноценная доза G (см. разд. 6.3) численно совпадает со среднекостномозговой дозой DKM (ГОСТ 25645.219-90. БРЭКАКП, 1991; Шафиркин А.В., 1999 а, в) и может быть вычислена на основе выражения:
С = О,„-£П|П(Г,), (7.7)
i
где Т|| — относительное распределение красного костного мозга в представительных точках скелета антропоморфного фантома
382
(ГОСТ 25645.203-83. Модель тела человека, 1994; ГОСТ 25645.219-90. БРЭКАКП, 1991; Шафиркин А.В., 1999а, в); D(rj) — эквивалентная доза в i-й представительной точке, алгоритм вычисления которой указан в этих же работах (см. разд. 6.3).
Как показывают расчеты, различие между среднетканевой, равноценной и среднекостномозговой дозой для ГКЛ не превышает 10%, поэтому при оценках обобщенных доз от ГКЛ можно вместо равноценной эквивалентной дозы использовать значения среднетканевой эквивалентной дозы и соответственно мощности дозы, которые широко представлены в литературе.
В разд. 6.2 подробно рассмотрены модели формирования радиационного поражения организма при протяженных облучениях с различной мощностью дозы. Там показано, что коэффициенты временной неравномерности радиационного воздействия КВБ могут быть определены на основе соотношения эффективной остаточной и общей накопленной дозы за рассматриваемый период полета КВБ = Вэф/В. Учитывая большую плотность ионизации и высокую биологическую эффективность частиц ГКЛ и то, что быстрые процессы восстановления поражения на клеточном уровне при воздействии плотноионизирующего излучения практически отсутствуют, выражение для эффективной дозы и коэффициента временной неравномерности КВБ от ГКЛ, согласно также материалам работ (Шафиркин А.В., 1998; 1999в) будет иметь следующий вид:
DTI(t) = “----(i-e"pt);
эф v ' Р V '
KBrKJI(t) = (l-e-Pt)/pt,
(7.8)
где у1™ — мощность среднекостномозговой (или среднетканевой) эквивалентных доз, сЗв/сут от ГКЛ; Р — постоянная восстановления, равная 0,02 1/сут.
Таким образом, на основе материалов раздела 6.2 и данных работ (ГОСТ 25645.219-90 БРЭКАКП., 1991; Шафиркин А.В., 1998, 1999в) выражение для обобщенной дозы от ГКЛ с учетом влияния пространственной и временной неравномерности радиационного воздействия (уравнения (7.7) и (7.8)) может быть записано следующим образом:
383
v * A, i IV/1
=^y- (1-e"pt)=^-p— (1-е"₽‘), (7.9)
где Y^ и Y11^ — мощности среднекостномозговой и среднетканевой эквивалентных доз соответственно, сЗв/сут.
При рассмотрении реальной защиты космического аппарата (КА) следует использовать зависимости мощности среднетканевой эквивалентной дозы ГКЛ от толщины защиты КА для периодов минимума и максимума СА, представленные в работе (Dudkin V.E., Kovalev Е.Е., Kolomensky A.V. et al., 1992). Для периода максимума и минимума СА выражения для мощности среднетканевой эквивалентной дозы (сЗв/сут) имеют соответственно следующий вид:
уГКЛ = 1/365 [5 ехр (-Х / 6,45) + 24 ехр (-Х / 85,5)], (7.10) угкл = 1/365 [41,5 ехр (-Х/2,8 + 48 ехр (-Х/85,5)], (7.11) где X — толщина защиты КА из алюминия, г/см2.
Максимальные оценки мощности среднетканевой эквивалентной дозы за год могут быть получены из этих выражений для периодов минимума и максимума СА за малыми толщинами защиты (-1 г/см2). Эти значения составляют соответственно 77 и 29 сЗв/ год. Обобщенная доза от ГКЛ, согласно выражению (7.9), сначала возрастает, а через 70 суток полета выходит на плато и сохраняется постоянной, равной за защитой 1 г/см2 для периодов максимума и минимума С А соответственно 4 и 10,5 сЗв.
Анализируя кривые ослабления мощности эквивалентной дозы ГКЛ для периодов минимума СА для четного и нечетного циклов по данным работ (Dudkin V.E., Potapov Yu.V., 1992; Badhwar G.D., O’Neill P.M., 1992; Badhwar G.D., Cucinotta F.A., O’Neill P.M., 1993), можно сделать вывод, что для нечетного цикла СА, соответствующего периоду 1976-1977 гг., в диапазоне толщин защиты вплоть до 40 г/см2 величины мощностей эквивалентных доз на 25-30% выше, чем для четных циклов (1965 и 1988 г.). Поэтому для нечетных циклов СА значения мощностей среднетканевой эквивалентной дозы, соответствующие уравнению (7.11), необходимо увеличить в 1,3 раза.
384
Степень опасности воздействия СКЛ можно представить на основе расчетов локальных эквивалентных доз за различными толщинами защиты от ряда СПС 19-22 солнечного цикла, а также среднетканевых эквивалентных доз, оцененных по данным работ (Ковалев Е.Е., 1976; Шафиркин А.В., 1999в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004), которые представлены в табл. 7.1.
Как следует из данных таблицы, при малой толщине защиты КА величины доз для наиболее мощных солнечных протонных событий (СПС) могут достигать высоких значений и представляют большую опасность для космонавтов. Однако СПС являются кратковременными и спектр СКЛ оказывается более мягким по сравнению с ГКЛ. Поэтому защита от протонов, как это следует из данных табл. 7.1, может быть успешно обеспечена с помощью использования специального радиационного убежища (РУ).
Для соблюдения принятых в России норм по радиационной безопасности, изложенных в документе НРБ-99, а также норм по радиационной безопасности космических полетов, которые действовали до 2004 г. и подробно рассматривались в работах (Шафиркин А.В., 1999-в; Шафиркин А.В., Григорьев Ю.Г., Петров В.М., 1999; Шафиркин А.В., 2007), толщина защиты радиационного убежища должна приближаться к 20 г/см2 алюминия и превышать прежние оценки, предлагавшиеся в работе (Демин В.П. и др., 1993).
При оценке радиационной опасности от солнечных вспышек при осуществлении межпланетных космических полетов использовали стандартизованную стохастическую модель радиационной обстановки, представленную в нормативно-техническом документе (ГОСТ 25645. 134-86 Лучи космические солнечные, 1986), которая основана на анализе более 90 СПС 19-го и 20-го солнечных циклов. Она включает следующие вероятностные характеристики радиационной обстановки:
• распределение интервалов между двумя последующими солнечными протонными событиями (СПС);
• распределения СПС по сопровождающему их потоку протонов (флюенсу);
• распределение СПС по характеристической жесткости.
385
Таблица 7.1
Локальные и среднетканевая эквивалентные дозы от интенсивных СПС 19-22 солнечных циклов за различными толщинами защиты, сЗв
386
Дата СПС Характеристика СПС Толщина защиты из алюминия, г/см2 Среднетканевая доза (шаровой фантом)
жесткость, МВ флюенс 0,5 1 3 5 10 20
23.02.1956 196 109 750 443 186 120 62 33 61
31.08.1956 144 2,5 х 107 25 13,9 5,0 2,9 1,3 0,8 1,7
16.07.1959 106 9,1 х 108 1360 680 187 94 33 10,3 51
12.11.1960 124 109 1200 645 204 111 44 16,5 60
04.08.1972 85 7,8 х 109 15500 6800 1560 700 200 51 458
07.08.1972 54 4,0 х 108 1600 540 67 19,4 3,6 0,4 17
19.10.1989 104 2,3 х 109 4000 1750 470 235 82 26 126
Плотность распределения интервалов между СПС <р(Д t) различной интенсивности подчиняется экспоненциальному закону вида:
ср(Д t) = Л ехр (X At). (7.12)
Плотность распределения по флюенсу протонов с энергией больше 30 МэВ в интервале значений 1О5-1О10 прот/см2 и плотность распределения по характеристической жесткости спектра протонов Ro, МВ в интервале значений 30-220 МВ должны описываться логнормальным распределением (распределением Гаусса):
г/ \ lg е г (Igx - m)21 f(x) = —— ехр [- * 7 ]
л/2лох 2ст2
(7.13)
с параметрами для суммарного потока: пц =lgN30 = 7ио1 = 1 и для характеристической жесткости R0:m2 = 1g Ro = 1,9 и о 2 = 0,2.
Таким образом, плотность распределения полного потока протонов должна описываться следующим уравнением:
fi(N30) = (0,173/N30) ехр [-0,51g2 (N30 /107)]. (7.14)
Плотность распределения характеристической жесткости Ro, МВ должна определяться по формуле:
f2(R0) = (0,866 / Ro) ехр [-12,51g2 (Ro / 80)]. (7.15)
Для набора значений флюенсов протонов за вспышку Ф, характеристической жесткости спектра протонов Ro и различных толщин защиты космического аппарата 8 нами были рассчитаны значения равноценных GCKJI и среднетканевых эквивалентных доз за вспышку D на основе соотношений, представленных в работе (ГОСТ 25645.219-90 (БРЭКАКП,1991) и в разд. 6.3.
В результате проведенной работы получены аппроксимационные выражения для вычисления значений обобщенной, равноценной и среднетканевой доз, а также коэффициентов равноценности радиационного воздействия КРскл в зависимости от суммарного флюенса протонов за событие Ф, характеристической жесткости
387
спектра Ro и толщины защиты из алюминия 5 в г/см2, которые имеют следующий вид:
HB=G = DxKP; (7.16)
D = Ф 7,3 х 108{1 - exp [-(Ro/5O) + 0,17]} х (7.17) х ехр {-8,0 х 10’2 (5 - 1) - 3,05 (Ro/5O)-149lg 5;
КР = КР* (Ф/Фп)10,43 " °’016(б " 1),(Ro/50) при Ф > Фп, (7.18)
КР = КР* приФ<Фп;
КР* = [0,85 + 0,2 lg(Ro/lOO)J х (7.19)
х {1 - ехр[-(3/4) - (0,8 + 1,7 lg(R0/100)]};
Фп - 108’9 + 311 ’ exp(-5/10)l х (Ro/5O)-<0-32 + °.2в6) у 20)
где Фп — пороговое значение флюенса, ниже которого значение коэффициента КР постоянно и равно КР* (Шафиркин А.В., 1999в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004).
Методика оценки среднего значения радиационного риска за полет основана на анализе результатов большого числа разыгрываемых методом Монте-Карло полетов и реализаций радиационных ситуаций. В пределах одного из вариантов полета длительностью Т на основе вышеуказанной статистической модели определялись для каждого отдельно разыгрываемого полета последовательный ряд предполагаемых СПС, случайным образом распределенных во времени. Разыгрываются также значения флюенса и характеристической жесткости спектра протонов. На основе указанных выше апроксимационных выражений (7.16)-(7.20) рассчитывали значения среднетканевой эквивалентной дозы Dj за каждое событие, равноценной дозы Gt, а также коэффициента равноценности радиационного воздействия КР| для данной вспышки KPi = Gi/D^
388
Следует отметить, что в рассматриваемых выше уравнениях (7.16)-(7.20) представлены величины среднетканевой эквивалентной дозы D, равные произведению среднетканевой поглощенной дозы на значения коэффициентов качества КК. Кроме того, в модели равноценной дозы (ГОСТ 25645.219-90 (БРЭКАКП, 1991; Шафиркин А.В., 1999-а, в), применительно к воздействию протонов СКЛ, уже учитывалось снижение эффективности радиационного воздействия с уменьшением мощности дозы в процессе СПС. Поэтому значение коэффициента КВБ применительно к воздействию каждой вспышки можно считать равным 1. Значение равноценной эквивалентной дозы Gj от каждого события в этом случае численно совпадает со значением обобщенной дозы HBi. В промежутках между воздействиями после i - 1 события обобщенная доза HB(t) уменьшается (см. разд. 6.2) в связи с реализацией восстановительных процессов по экспоненциальному закону:
Н™ (t) = Н™ (ti ) ехр [-P(t - ti _х)]. (7.21)
После реализации i-ro события обобщенная доза возрастает на величину обобщенной дозы от этого события:
Н™ (ti) = Hc™ (ti ) exp [-₽(ti - tj )] + H™. (7.22)
К рассчитанным значениям обобщенной дозы от СКИ следует добавить обобщенную дозу от ГКЛ (выражение (7.9).
Математические выражения (7.12)-(7.22) представляют собой полную систему уравнений для последовательного определения значений обобщенной дозы в процессе осуществления полета вне магнитосферы Земли.
С целью максимальной оценки величины возможного радиационного риска гибели космонавтов за полет продолжительностью Т, весь промежуток может быть разбит на ряд последовательных 60-и суточных интервалов, в каждом из которых выбирали максимальное значение обобщенной дозы HBi. Далее на основе выражений (7.4)-(7.6) определяли риск смертности в пределах каждого 60-суточного i-ro интервала в условиях воздействия радиационного фактора в дозе HBi. Из этого значения следует вычесть постоянную величину риска Rdem, обусловленную воздейст
389
вием обычных демографических факторов. Эта величина вычисляется для периода 60 суток на основе демографических данных для мужского населения страны соответствующего возраста. Она может быть оценена также на основе уравнения (7.4), где в качестве верхнего предела интеграла вероятности использовались величины х0(т), определяемые из уравнения (7.6). Разница в оцениваемых величинах риска смертности в условиях воздействия радиационного фактора и при его отсутствии определяет добавочную величину риска, непосредственно обусловленную именно облучением при осуществлении космического полета. Полученные значения радиационного риска за каждый из последовательных периодов по 60 суток затем суммируются за весь полет. В том случае, когда последний отрезок имел меньшую длительность, для максимальной оценки риска можно принять его также равным 60 суткам.
При розыгрыше методом Монте-Карло одной из историй полета с реализацией рассмотренных выше солнечных протонных событий на фоне хронического воздействия ГКЛ в пределах рассматриваемой продолжительности полета Т может быть определен характер распределения во времени обобщенной дозы в процессе полета и величина радиационного риска за полет. После розыгрыша методом Монте-Карло 104 историй полета рассчитывали среднее значение радиационного риска за полет и его среднеквадратичное отклонение.
7.2. Радиационный риск для космонавтов при осуществлении межпланетных космических полетов в различные периоды солнечной активности
На основе предложенного выше алгоритма на языке Фортран составлена программа и проведены расчеты методом Монте-Карло (104 историй) средних значений радиационного риска для космонавта в возрасте 40 лет при осуществлении полетов вне магнитосферы Земли различной продолжительности за различными толщинами защиты космического аппарата.
На рис. 7.1 представлены зависимости средних значений радиационного риска для космонавтов в возрасте 40 лет от длительности полета (в пределах 0,5-3 года) для различных толщин за-
390
Длительность полета, сутки
Рис. 7.1. Демографический и радиационный риск для космонавтов в возрасте 40 лет в процессе межпланетного полета в период максимума СА в зависимости от его продолжительности при толщине защиты радиационного убежища 1-50 г/см2 алюминия
щиты радиационного убежища (РУ) космического аппарата (в пределах 1-50 г/см2) в случае осуществления межпланетного полета вне магнитосферы Земли в период максимума СА. Толщина защиты бытового отсека космического аппарата (КА) в расчетах принималась равной 1 г/см2.
Из данных, представленных на рис. 7.1, видно, что при полете за минимальной толщиной защиты общий риск гибели для космонавтов в возрасте 40 лет, в условиях дополнительного воздействия радиационного фактора, увеличивается приблизительно в 1,55 раза по сравнению с демографическим риском Rdem и линейно нарастает с увеличением длительности полета. Использование специального радиационного убежища в момент развития СПС с толщиной защиты до 20 г/см2 приводит к существенному снижению величины радиационного риска. Дальнейшее увеличение толщины защиты радиационного убежища практически уже мало
391
влияет на значение радиационного риска, поскольку он определяется уже не столько воздействием СКЛ, а в значительной степени обусловлен обобщенной дозой от ГКЛ.
Данные, представленные на рис. 7.1, свидетельствуют, что радиационный риск практически можно считать линейно зависящим от длительности полетов. Эти зависимости для различных толщин защиты радиационного убежища КА могут быть выражены следующими уравнениями:
R-raj = 5,41 х 104 Т при X = 1 г/см2;
Rrad = 2,89 xlO4 Т при X = 5 г/см2;
Rrad = t93 xlO4 Т при X = 10 г/см2; (7.23)
Rrad = t42 xlO4 Т при X = 20 г/см2;
Rrad = t29 х 104 Т при X = 50 г/см2;
где Т — длительность полета в месяцах.
Верхняя кривая представляет собой демографический риск смертности для мужчин в возрасте 40 лет за указанный период времени в условиях отсутствия радиационного фактора. Он рассчитывался на основе значений коэффициентов смертности для мужчин за 1993-1996 гг. (Российские статистические ежегодники 1994~1997гг.; Россия в цифрах, 1995-1997).
В алгоритме расчета радиационного риска в процессе полета, представленном в разд. 7.1, также как и в нормативно-технических документах (ГОСТ 25645.214-85. БРЭКАКП, 1986; ГОСТ 25645.215-85. БРЭКАКП, 1986), величины радиационного риска зависят непосредственно от вероятности гибели в отсутствии радиационного фактора и, следовательно, от характера зависимости коэффициентов смертности от возраста и самого возраста космонавтов. Изменение демографической ситуации в стране к 1993-1996 гг. по сравнению с периодом подготовки вышеуказанных нормативных документов, привело к значительному возрастанию коэффициентов смертности (Российские статистические ежегодники 1994-1997 гг.; Россия в цифрах, 1995-1997) и увеличению значений демографического Rdem и радиационного
392
Rrad рисков в процессе полета. Представленная зависимость радиационного риска от длительности полета (уравнение (7.23)) даже при защите радиационного убежища 50-100 г/см2 не может соответствовать предложенной зависимости в нормативном документе «Нормы безопасности при продолжительности полетов до трех лет» (ГОСТ 25645.215-85. БРЭКАКП, 1986). Величина радиационного риска более чем в 2 раза превышает значения, указанные в этом документе.
На рис. 7.2 представлены величины радиационного риска для космонавтов в возрасте 40 лет в процессе осуществления межпланетных полетов в различные периоды солнечной активности (СА) в зависимости от его продолжительности для гипотетического случая минимальной защиты космического аппарата (1 г/см2). Для промежуточного периода СА использовали те же стохастические модели СПС, которые соответствовали максимуму СА, а величина мощности среднетканевой эквивалентной дозы в выражении для обобщенной дозы от ГКЛ была выбрана средней между значениями для минимума и максимума С А (уравнения (7.10)-(7.11) и составила 53 сЗв/год.
Из данных рис. 7.2 видно, что в случае минимальной толщины защиты Хру = 1 г/см2 максимальное значение радиационного риска (приблизительно 70% от риска демографического) имеет место в случае полета, осуществляемого в промежуточный период СА. Более низкие значения радиационного риска, составляющие 0,54; 0,5 и 0,37 от Rdem, наблюдаются при проведении полета в период максимума СА, нечетного и четного минимума СА соответственно.
На рис. 7.3 представлены аналогичные зависимости для более реальной средней защиты бытовых отсеков КА, равной 10 г/см2. Значения радиационного риска в этом случае являются существенно меньшими. Максимальное значение, составляющее приблизительно 25% от демографического риска, имеет место уже не в случае полета в промежуточном периоде СА, а для периода нечетного минимума СА, что связано при данной толщине защиты КА с относительно большим вкладом ГКЛ (по сравнению с СКЛ) в величину обобщенной дозы и радиационного риска. Минимальное значение риска (17% от Rdem) наблюдается при межпланетном полете в период максимума СА.
393
Рис. 7.2. Демографический и радиационный риск для космонавтов в возрасте 40 лет в процессе межпланетного полета в различные периоды СА в зависимости от его продолжительности при минимальной толщине защиты бытовых отсеков КА (1 г/см2 алюминия)
Рис. 73. Демографический и радиационный риск для космонавтов в возрасте 40 лет в процессе межпланетного полета в различные периоды СА в зависимости от его продолжительности при толщине защиты бытовых отсеков КА 10 г/см2 алюминия
394
Величина радиационного риска в процессе полета, как указывалось выше и следует из алгоритма его расчета, зависит также и от возраста космонавтов. На рис. 7.4 показаны зависимости демографического и радиационного рисков от длительности межпланетного полета, осуществляемого в период максимума СА, для космонавтов в возрасте 30, 40 и 50 лет (при толщине защиты бытовых отсеков КА, равной 10 г/см2).
Как видно из данных, представленных на рис. 7.4, отмечается существенная зависимость демографического риска от длительности полета и возраста космонавтов. Этот риск для 50-летнего космонавта более чем в 3 раза превышает риск для 30-летнего. Можно отметить также, что радиационный риск при этом существенно ниже демографического. При толщине защиты космического аппарата, равной 10 г/см2, радиационный риск Rrad составляет 17% OTRdem.
Рис. 7.4. Демографический и радиационный риск для космонавтов в возрастах 30, 40 и 50 лет в процессе межпланетного полета в период максимума СА в зависимости от его продолжительности при толщине защиты бытовых отсеков КА 10 г/см2 алюминия
Проведенные в настоящее время расчеты радиационного риска для космонавтов различного возраста в процессе осуществления полета показали, что зависимость радиационного риска от возрас-395
та космонавтов То может быть представлена следующим уравнением:
Rrad(T°) = Rrad(4°) еХР [0,062 (То - 40)], (7.24)
где То — возраст космонавтов, годы.
Таким образом, риск для космонавтов в возрасте 25-55 лет может быть установлен на основе представленных выше зависимостей радиационного риска для космонавтов в возрасте 40 лет.
Анализируя данные рис. 7.1 и 7.4, можно отметить, что отношение радиационного риска к демографическому Rrad/Rdem практически не зависит от длительности полета и возраста космонавтов, а является функцией только толщины защиты космического аппарата. Поэтому при анализе различных вариантов защиты КА и степени опасности при проведении полета следует в большей степени ориентироваться не на абсолютные, а на относительные значения радиационного риска.
7.3. Радиационный риск для космонавтов при орбитальных космических полетах на станциях «Мир* и МКС
В этом разделе мы подробно остановимся на расчетах радиационного риска в процессе осуществления большого числа длительных пилотируемых полетов на станции «Мир». Оценки радиационного риска для полетов на МКС также могут быть представлены, но они будут значительно ниже с учетом более насыщенного оборудования и большей защищенности отсеков станции. Материалы расчетов риска для МКС подробно будут рассмотрены позже в разд. 8.3.
Алгоритм вычисления радиационного риска для орбитальных полетов несколько изменяется по сравнению с алгоритмом для межпланетных полетов, который рассматривался в разд. 7.1. Во-первых, кроме воздействия ГКЛ на орбите станции «Мир» добавляется определенный вклад от протонов радиационных поясов Земли РПЗ. При оценке радиационной опасности солнечных и галактических космических лучей на околоземных орбитах необходимо учитывать защитный эффект геомагнитного поля.
396
Как было показано в разд. 2, вкладом в величину радиационного риска от СКЛ в первом приближении можно пренебречь, поскольку он является относительно малым из-за защитной роли магнитного поля Земли и самой защиты орбитальных станций. В частности, для орбиты, соответствующей полету станции «Мир», для высоты 400 км и угла наклона плоскости орбиты 51°, кратность снижения дозы при переходе от межпланетного полета к орбитальному составляет более чем 60-100 раз и даже более. Кроме того, как показали представленные выше расчеты для межпланетного космического полета, увеличение толщины защиты радиационного убежища от 1 до 20 г/см2 приводит к уменьшению величины среднетканевой поглощенной дозы за полет в 16,5 раза и к существенному снижению величины радиационного риска. Дальнейшее увеличение толщины защиты радиационного убежища не приводило к заметному снижению значения радиационного риска, поскольку он определялся в основном радиационным воздействием ГКЛ, а вклад СКЛ при данной кратности ослабления был уже пренебрежимо малым. На орбите станции «Мир» величина мощности дозы от ГКЛ также является несколько сниженной. Подробные данные расчетов доз в шаровом и антропоморфном фантомах, представляющих стандартизованную модель тела человека (ГОСТ 25645.203-83. БРЭКАКП Модель тела человека, 1984), а также результаты измерений доз, проводившиеся на орбитальной станции «Мир» приведены нами в разд. 2 (см. табл. (2.2-27).
Для вычисления обобщенной дозы от детерминированных источников и расчетов радиационного риска принимали указанные в табл. 2.6 значения среднесуточных среднекостномозговых эквивалентных доз при полетах на станции «Мир» и пересчитанные величины для МКС. В табл. 7.2 представлены значения среднекостномозговых эквивалентных доз (мкЗв/сут) от РПЗ, от плотнои-онизирующих излучений DnM с высокими значениями ЛПЭ (ГКЛ + нейтроны) и суммарные значения доз при полетах на орбитальных станциях «Мир» и МКС в периоды максимума и минимума СА.
Среднекостномозговые дозы для плотноионизирующей компоненты DnH (ГКЛ + нейтроны) для орбиты станции «Мир» для периодов минимума и максимума СА оценены равными 455 и 247 мкЗв/сут (45,5 и 24,7 мбэр/сут) соответственно. Для МКС
397
пока принимали значения в 1,5 раза меньшими. Среднекостномозговые среднесуточные дозы от РПЗ при полетах на станции «Мир» и указанных периодов С А оценены равными 90 и 53 мкЗв/сут (9,0 и 5,3 мбэр/сут), а для полетов на МКС — 60 и 36 мкЗв/сут (6,0 и 3,6 мбэр/сут).
Таблица 7.2
Среднекостномозговые эквивалентные дозы за сутки (мкЗв/сут) от РПЗ, от излучений с высокими значениями ЛПЭ (ГКЛ и нейтронов) и суммарные значения при полетах на орбитальных станциях «Мир» и МКС в периоды максимума и минимума СА
Источники излучений Максимум солнечной активности Минимум солнечной активности
«Мир» МКС «Мир» МКС
РПЗ 53 36 90 60
^пифгкл + Вн) 247 164 455 304
и Q 300 200 545 364
Опи/Dx (%) 82 82 83,5 83,5
Ранее было показано, что при воздействии с относительно малым значением мощности дозы, среднекостномозговая эквивалентная доза совпадает с равноценной эквивалентной дозой и незначительно отличается от среднетканевой дозы. Значение коэффициента пространственной неравномерности радиационного воздействия КРБ для рассматриваемых источников излучения может быть принято равным 1,0.
В разд. 5.2 и в работах (Григорьев и др., 1986; Шафиркин А.В., 1998, 19996, в) показано, что эффективность радиационного воздействия излучений с низкими значениями ЛПЭ (стандартных видов излучений и протонов с энергией в диапазоне 25-730 МэВ) существенно снижается при уменьшении мощности дозы ниже граничного значения Yr = 40 Гр/сут за счет реализации быстрых восстановительных процессов на клеточном уровне. Степень снижения эффективности радиационного воздействия в отношении повреждения кроветворной ткани в зависимости от мощности дозы может быть установлена на основе следующего уравнения: К(у) = (Y/Y г)0,18-
398
На основе этих материалов можно считать, что при радиационном воздействии протонов РПЗ с рассмотренными выше малыми значениями мощности дозы (табл. 7.2) эффективность такого воздействия будет более чем в 4 раза ниже, чем в случае острого радиационного воздействия. Таким образом, можно считать, что эффективные среднесуточные значения равноценной (среднекостномозговой) и среднетканевой эквивалентных доз от протонов РПЗ в период минимума и максимума СА будут приблизительно в 4 раз ниже и составят для орбиты станции «Мир» для периодов минимума и максимума СА соответственно 22,5 мкЗв/сут и 13,25 мкЗв/сут. Аналогичные значения для МКС оцениваются равными 15 и 9,0 мкЗв/сут.
Суммарные среднесуточные значения равноценной (среднекостномозговой) или среднетканевой эквивалентных доз от детерминированных источников ГКЛ, РПЗ и нейтроны (мощность обобщенной дозы) при осуществлении космического полета на станции «Мир» в периоды минимума и максимума С А будут равны 478 мкЗв/сут (17,4 сЗв/год) и 260 мкЗв/сут (9,5 сЗв/год) соответственно. При полетах на МКС в периоды минимума и максимума СА суммарные среднесуточные значения указанных доз составят 320 мкЗв/сут (11,6 сЗв/год) и 173 мкЗв/сут (6,3 сЗв/ год).
Радиационный риск в процессе орбитальных космических полетов, осуществляемых в периоды минимума, максимума и в промежуточном периоде СА, может быть вычислен на основе алгоритма для межпланетного космического полета, который изложен в разд. 7.1, с использованием вышеуказанных суммарных значений среднесуточных среднекостномозговых (или среднетканевых) доз от детерминированных источников космических излучений. При расчетах радиационного риска в промежуточном периоде СА можно использовать среднее значение мощности дозы для периодов минимума и максимума СА, хотя в принципе можно применять и другие приближения.
Следует отметить, что характер формирования эффективной остаточной дозы во времени в процессе полета может быть установлен на основе уравнения (7.9), где вместо мощности дозы от ГКЛ (угкл ) следует использовать представленные выше суммарные значения мощностей обобщенных доз. Эквивалентной дозой от СКЛ при этом, как указывалось выше можно пренебречь.
399
На рис. 7.5 представлены рассчитанные на основе вышеуказанного алгоритма значения радиационного риска для космонавтов в возрасте 40 лет в процессе полета на орбитальных станциях «Мир» и МКС в различные периоды С А в зависимости от длительности полета.
Рис. 75. Радиационный риск для космонавтов мужчин в возрасте 40 лет в процессе полетов на станциях «Мир» и МКС в различные периоды СА в зависимости от длительности полета
Максимальные значения радиационного риска имеют место в период минимума СА. Минимальные значения соответствуют периоду максимума СА, что связано с минимальными значениями обобщенных доз от источников космического излучения. Выраже-
ния для расчета радиационного риска в зависимости от длительности полета Т для периодов максимума и минимума СА имеют соответственно следующий вид:
Rrad = М5 X10-5 Т
R . = 4,30 X105 Т rad ’
Rr , - 3,48 х 105 Т
R н = 2,30 х 105 Т rad ’
(•«Мир*, мин. СА), (МКС, мин. СА), («Мир>, макс. СА), (МКС, макс. СА),
(7.25)
400
где Т — длительность полета, месяцы.
Как указывалось выше, демографический риск Кдем для космонавтов этого возраста является существенно большим, чем радиационный риск в процессе полета:
Кдем = 9д2 х 10-4 т (7.26)
Радиационный риск в полете для космонавтов на станции «Мир» в периоды минимума и максимума С А составит соответственно 7,1 и 3,8% от величины демографического риска. При полетах на МКС эти значения будут несколько ниже — 4,8 и 2,5% соответственно. Сравнивая эти результаты с данными, представленными в разд. 7.2, можно отметить, что при осуществлении орбитальных полетов на станции «Мир», радиационный риск в процессе полета оказывается меньшим, чем в случае осуществления межпланетных полетов с той же толщиной защиты КА в 4-4,5 раза, а при полетах на МКС в 6-7 раз.
Полученные выше величины радиационного риска для орбитальных полетов почти на порядок превышают значения, вычисленные на основании (ГОСТ 25645.214-85. БРЭКАКП, 1986), по которому рассчитывался радиационный риск для космонавтов в процессе полета в нормативном документе по радиационной безопасности космических полетов, действовавшем до 2004 г. (ГОСТ 25645.215-85, БРЭКАКП, 1986), что в значительной степени связано с уточнением алгоритма расчета и увеличением коэффициентов смертности для мужского населения нашей страны за период с 1972 по 1996 гг.
Проведенные в настоящее время расчеты радиационного риска в процессе орбитальных полетов для космонавтов различного возраста показали (как и в случае межпланетных полетов), что радиационный риск для космонавтов России в возрасте 25-55 лет может быть установлен на основе представленной выше зависимостей радиационного риска для космонавтов в возрасте 40 лет, используя уравнение (7.24).
РАДИАЦИОННЫЙ РИСК
ДЛЯ КОСМОНАВТОВ В ТЕЧЕНИЕ
ВСЕЙ ИХ ЖИЗНИ ПОСЛЕ ЗАВЕРШЕНИЯ □ МЕЖПЛАНЕТНЫХ И ОРБИТАЛЬНЫХ
КОСМИЧЕСКИХ ПОЛЕТОВ
8.1. Суммарный радиационный риск для космонавтов к концу их профессиональной деятельности и за всю жизнь после завершения межпланетных полетов
В разд. 7 рассмотрен алгоритм и приведены расчеты радиационного риска для космонавтов в процессе осуществления длительных межпланетных и орбитальных космических полетов. Однако при нормировании радиационных воздействий на космонавтов необходимо также учитывать вероятность и тяжесть отдаленных неблагоприятных радиобиологических проявлений. Среди них следует определить прежде всего возможное увеличение возрастных коэффициентов смертности и увеличение общего риска гибели за оставшийся период жизни от всех причин, а также оценить возможное сокращение средней предстоящей продолжительности жизни. Кроме того, необходимо оценить увеличение риска развития опухолевых заболеваний и возможной смертности по этой причине за весь период жизни космонавтов.
В качестве дозиметрического критерия для определения опасности воздействия космических излучений на членов экипажей космических аппаратов и проведения оценок риска рассматриваемых отдаленных проявлений следует использовать обобщенную дозу Но, которая позволяет привести сложный характер облучения в космическом полете к условиям стандартного радиационного воздействия (разд. 6).
Эта доза может быть установлена на основе значений поглощенной или эквивалентной среднетканевой дозы, суммарно накопленной за весь период профессиональной деятельности конкретного космонавта (ЭД которая может быть получена на основе расчетных методов определения поглощенной и эквивалентной
402
доз от космических излучений в фантоме, представляющем модель тела человека, помещенном в различных отсеках космического аппарата (КА). С другой стороны она может быть уточнена на основании данных мониторинга радиационной обстановки на борту КА и данных индивидуальной дозиметрии. Это осуществляется, в частности, на основе установленных значений переходных коэффициентов (Коломенский А.В., Петров В.М., Шафиркин А.В., 1998; Шафиркин А.В., 1999в; Шафиркин и др., 2002).
В алгоритмах расчета радиационного риска в процессе осуществления межпланетных и орбитальных полетов (разд. 7) при вычислении методом Монте-Карло значений радиационного риска предусматривается программой расчета выведение дополнительной информации о суммарных значениях за полет среднетканевых эквивалентных доз для каждой реализации и в среднем за 104 историй, отражающих различные реализации полета и возможные воздействия стохастически распределенных солнечных протонных событий на фоне детерминированного воздействия от ГКЛ и РПЗ. На основе значений среднетканевых эквивалентных доз может быть проведен расчет обобщенных доз Но (см. разд. 6) применительно к оценке риска отдаленных радиобиологических эффектов.
При вычислении величин обобщенных доз Но принимали значение коэффициента пространственной неравномерности радиационного воздействия КР0 равным 1,0, предполагая максимально опасный с точки зрения прогноза отдаленных последствий случай равномерного облучения. Значение коэффициента модификации радиационного воздействия КМ0 также принималось равным 1,0, поскольку в настоящее время имеется недостаточное количество экспериментальных данных о модифицирующем действии нерадиационных факторов, присущих космическому полету, в отношении утяжеления отдаленных радиационных последствий. При расчетах величин обобщенных доз Но, учитывали снижение эффективности протяженных облучений за счет развития восстановительных процессов при действии излучений с низкими значениями ЛПЭ. Для этих целей вводили коэффициент временной неравномерности радиационного воздействия КВ0, характеризующий снижение эффективности протяженных радиационных воздействий в отношении развития отдаленных радиобиологических проявлений, равный обратному значению коэффициента ре
403
дукции, введенному в последних рекомендациях МКРЗ (Рекомендации международной комиссии по радиологической защите, 1990. Публикации № 60 и 61, 1994).
На основе анализа данных об эффективности радиационных воздействий с различной мощностью дозы при действии излучений с различным значением ЛПЭ в отношении отдаленных последствий, которые рассмотрены в работах (Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1998, 1999в), можно оценить значение коэффициента редукции дозы при воздействии на человека космических излучений с малой мощностью дозы. Эти материалы рассмотрены также в разд. 5.2. При исследовании выживаемости животных в отдаленном периоде и анализе эффектов сокращения продолжительности жизни показано, что эффективность протонов высоких энергий не превышает эффективности воздействия стандартных видов животных. Отдаленные эффекты в одинаковой степени модифицировались при снижении мощности дозы и увеличении длительности облучения, свидетельствуя о близком характере протекания восстановительных процессов в организме. С учетом этих данных и материалов, представленных в разд. 5.2, можно принять, что при воздействии протонов СКЛ и РПЗ с мощностью дозы ниже 20 сГр в сутки коэффициент редукции составляет 2 раза (Рекомендации международной комиссии по радиологической защите, 1990. Публикации № 60 и 61, 1994; Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999в). Коэффициент временной неравномерности радиационного воздействия КВ0 = 0,5.
При облучении с мощностью дозы ниже 2 сГр/сут коэффициент редукции может быть принят равным 4 (коэффициент эффективности радиационного воздействия КВ0 = 0,25). Снижение эффективности радиационного воздействия в 4 раза при воздействии излучений с низкими значениями ЛПЭ и малыми значениями мощностей доз показано нами ранее при анализе эффектов сокращения продолжительности жизни млекопитающих (Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999-в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004) и в разд. 5.2 и 5.3.
В противоположность этому при воздействии излучений с высокой плотностью передачи энергии (нейтроны, многозарядные ионы), восстановительные процессы на клеточном уровне практически блокированы и не отмечается снижения эффективности воздействия при уменьшении мощности дозы. Отсутствовали
404
проявления восстановительных процессов на клеточном уровне в отношении развития ближайших радиационных проявлений при кратковременном облучении (длительностью менее 5 суток). Кроме того, не отмечено уменьшения вероятности проявления отдаленных радиобиологических эффектов, в том числе риска смертности и сокращения продолжительности жизни при длительном хроническом облучении, поскольку эти эффекты также не модифицировались при уменьшении мощности дозы (Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999в). В связи с этим при воздействии на космонавтов ГКЛ и вторичных нейтронов их эффективность принимается максимальной и приравнивается к острому облучению (КВ0 = 1).
Таким образом, при вычислении обобщенных доз Но и расчете риска отдаленных неблагоприятных эффектов можно использовать следующие коэффициенты редукции для определения значений коэффициентов КВ0 космических излучений:
• при воздействии протонов РПЗ и СКЛ с мощностью дозы менее 20 сГр в сутки, среднетканевая эквивалентная доза должна быть снижена в 2 раза, а в случаях облучения с мощностью дозы < 2 сГр — в 4 раза, при этом значения коэффициента КВ0 составят 0,5 и 0,25 соответственно;
• при действии ГКЛ и вторичных нейтронов коэффициент редукции не применяется (КВ0 s 1).
В разд. 5.3 нами представлена модель радиационной скорости смертности млекопитающих, обосновывающая характер изменения их возрастных коэффициентов смертности после острых и хронических радиационных воздействий, которая позволила достаточно хорошо описать результаты значительного числа экспериментов с различным характером распределения дозы во времени. На основе этой модели могут быть представлены математические выражения для расчетов суммарного радиационного риска в течение жизни космонавтов и возможного сокращения их продолжительности жизни.
Из демографических данных известно, что зависимость коэффициентов смертности для людей от возраста может быть в общем виде представлена уравнением Мейкхема: p(t) = А + ц(0) х х exp(Xot). Для оценки характера изменения выживаемости когорты населения с начальным возрастом 25 лет можно просто использовать экспоненциальную зависимость p(t) = ц(О)ехр(Хо t)
405
(Болеславски Лех., 1977; Андреев Е.М., Добровольская В.М., 1979; Кардаш А.Ю., 1979).
Для последующих расчетов использовали зависимость коэффициентов смертности от возраста для мужчин нашей страны для периода 1993-1996 гг. на основе опубликованных демографических данных (Российские статистические ежегодники 1994-1997гг.; Россия в цифрах, 1995-1997). Параметр Хо для указанной выше экспоненциальной зависимости коэффициентов смертности от возраста оказался для указанного периода равным 0,062 1/год, а значение ц(0) составило 9,0 х 10"4 1/год.
В разд. 5.3 показано, что после радиационного воздействия коэффициенты смертности для различных возрастов увеличиваются на один и тот же сомножитель ехр (В D). Кривые, определяющие зависимость логарифмов коэффициентов смертности от возраста, для различных доз являются параллельными кривой для контрольных животных, но сдвинутыми в сторону более ранних сроков. Продемонстрировано, что характер нарастания логарифмов коэффициентов смертности от возраста в процессе облучения существенно зависит также от мощности дозы. Эта зависимость в первом приближении является линейной. После окончания облучения наклон кривой от возраста остается таким же, как и для контрольных животных, но значения коэффициентов смертности оказываются также увеличенными на постоянный сомножитель. Показано кроме того, что эффективность хронического облучения с малой мощностью дозы значительно ниже, чем острого воздействия (значение коэффициента В оказывается меньшим почти в 4 раза).
В разд. 5.3 и в работах (Шафиркин А.В., 19996, в) при рассмотрении модели радиационной скорости смертности млекопитающих на основе экспериментальных данных были оценены значения коэффициента В. После острых облучений для мышей этот коэффициент оказался равным 0,36 1/Гр, а для собак 0,41 1/Гр. Можно было бы предположить, что полученные значения коэффициента В для собак возможно использовать и при характеристике радиационно обусловленного изменения зависимости от возраста коэффициентов смертности человека. Однако более правильно, по-видимому, принять для параметра В максимальное значение, полученное в экспериментах с использованием большого количества мелких лабораторных животных, поскольку точ
406
ность его установления значительно выше, чем на основе экспериментов с собаками, и считать его равным 0,36 1/Гр.
Эффективность хронического облучения с малыми значениями мощностей доз в отношении эффектов сокращения продолжительности жизни, как отмечалось в работах (ГОСТ 25645.214-85. БРЭКАКП, 1986; Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999-в) и в разд. 5.2, является в 4-5 раз более низкой. Поэтому для установления величин риска неблагоприятных эффектов в отдаленном периоде для человека, значение коэффициента В , в случае хронического облучения с мощностью дозы ниже 1 сГр/ сут, можно было бы принять равным 0,09 1/Гр.
В алгоритме для расчетов радиационного риска было принято одно значение параметра В, равное 0,36 1/Гр, соответствующее острому облучению с высокой мощностью дозы. Для оценки характера изменения зависимости коэффициентов смертности от возраста следует в этом случае, как было указано выше, выбирать не сами значения среднетканевой дозы от различных источников радиационной опасности в космосе, а использовать расчетные значения обобщенных доз Но от этих источников, применительно к определению риска рассматриваемых в настоящей работе отдаленных эффектов. Для этой цели применять коэффициенты редукции и рассчитанные по ним коэффициенты временной неравномерности радиационного воздействия КВ0 для различных источников излучения в космическом пространстве.
С учетом вышеизложенного и данных, представленных в разд. 5.3, можно представить выражение для зависимости коэффициентов смертности для человека от возраста после радиационного воздействия в обобщенной дозе Но:
Црад(О = и (0) ехр [Хо t + В Но) = и (t) ехр (В Но). (8.1)
С использованием уравнения (8.1) и значений коэффициентов В, указанных выше, можно представить ряд соотношений для вычисления радиационного риска и других характеристик отдаленных последствий радиационного воздействия. Выражение, описывающее вероятность выживания в отдаленном периоде, начиная с возраста t0, при отсутствии радиационного воздействия аналогично функции дожития, используемой в демографических исследованиях для выбранной когорты населения:
407
V(T) = exp {- J n(t) dt} = (8.2)
= exp{-fp(0) eX()t dt} = exp (eX° <T-to> -1)}. to
Функция дожития после радиационного воздействия в дозе Но может быть представлена в виде
т
УРад(Т) = ехр {- J цРад(О dt} = (8.3)
to т
= ехр {-евн° | ц(0) eXotdt} = to
-Ир (-!!£!!> х0
W|i(t0) =р(0) ехр (Хо t0).
На основе выражений (8.2) и (8.3) определяется дополнительный риск смертности, обусловленный действием радиационного фактора в отдаленном пострадиационном периоде (к возрасту Т):
ЯРад(Т) = V(T) - Урад(Т). (8.4)
С использованием соотношений (8.2)-(8.4) возможно рассчитать величину радиационного риска для космонавтов к концу их профессиональной деятельности (к 55 годам) или за всю жизнь. В последнем случае верхний предел интегрирования в этих уравнениях может быть принят равным 70 годам.
Сокращение средней предстоящей продолжительности жизни, обусловленное радиационным воздействием, может быть вычислено из уравнения:
ДТРад =Т“ ТРад, (8.5)
где Т и Трад — величины средней предстоящей продолжительности жизни без воздействия радиации и при облучении в дозе Но. Выражения для определения этих величин имеют следующий вид:
408
оо
Т= J V(t) dt; (8.6)
*о
ТР“ - f VP*“(t) dt - f exp (-^*£«2 e»H0(el0 <T"'0> - 1)} dT. .. 4 '»
Таким образом, на основании представленных выше соотношений, вытекающих из модели радиационной скорости смертности млекопитающих, удается прогнозировать в зависимости от дозы и мощности дозы характер трансформации кривых, определяющих зависимость коэффициентов смертности человека от возраста, и оценивать дополнительный радиационно-обусловленный риск его смертности для любого определенного периода жизни.
Выше представлены выражения для расчета суммарного радиационного риска и сокращения продолжительности жизни для человека после облучения в обобщенной дозе Но. Риск указанных отдаленных последствий может быть установлен и для космонавтов, начинающих свою профессиональную деятельность в различном возрасте, на основе рассчитанных значений обобщенных доз Но за каждый отдельно взятый полет и за всю профессиональную деятельность. Радиационный риск, согласно этому алгоритму, может быть рассчитан к любому выбранному отдаленному периоду после завершения полета, в том числе к моменту окончания профессиональной деятельности и за всю жизнь. При расчете риска к моменту окончания карьеры (к возрасту 55 лет) значения суммарного радиационного риска для космонавтов, совершающих первые полеты в возрастах 30-50 лет, существенно зависели от начального возраста t0 и являлись более высокими для лиц более молодого возраста t0 = 30 лет. Расчетные значения суммарного радиационного риска за всю жизнь космонавтов (к 70 годам) уже слабо зависели от их начального возраста и составили при полете длительностью 2 года 14,6 и 15,9% для возрастов t0 соответственно 30 и 50 лет. Поэтому в дальнейшем мы проводили расчеты суммарного радиационного риска для космонавтов в течение всей их жизни (к возрасту 70 лет).
На рис. 8.1 А и 8.1 Б представлены зависимости суммарного радиационного риска в течение жизни и возможного сокращения продолжительности жизни (СПЖ) для космонавтов в возрасте 40 лет от длительности межпланетного полета, осуществляемого в
409
Радиационный риск, отн.ед.
0,25
' Хру=1г/см2 —о— Хру=5г/см2 —•— Хру=10г/см2 —О— Хру=20г/см2 —А— Хру=50г/см2 —Д— Хбо=50г/см2
Рис. 8.1. Суммарный радиационный риск в течение жизни (А) и возможное сокращение ее продолжительности (Б) для космонавтов в возрасте 40 лет после межпланетного полета различной продолжительности в период максимума СА при толщине защиты радиационного убежища ХРУ от 1 до 50 г/см2 и толщине бытовых отсеков ХБО = 1 г/см2, а также при ХБО = 50 г/см2
410
период максимума СА за различными толщинами защиты КА. Легко отметить, что величины суммарного радиационного риска практически линейно зависят от длительности полета и при увеличении толщины защиты радиационного убежища (Хру) в пределах 1-20 г/см2, отмечается существенное уменьшение величин радиационного риска.
При дальнейшем увеличении толщины защиты радиационного убежища (Хру) и минимальной толщине защиты бытовых отсеков (ХБО = 1 г/см2) величина суммарного радиационного риска почти не изменяется, что при данных больших толщинах защиты связано с преобладающим вкладом в суммарную величину обобщенной дозы излучения ГКЛ.
В случае увеличения общей толщины бортового отсека до 50 г/см2 и отсутствии специального радиационного убежища, величины радиационного риска за жизнь снижаются еще в большей степени (более чем в 4 раза по сравнению с минимальной защитой КА), хотя следует отметить, что при этом происходит значительное увеличение веса защиты КА. Важно отметить еще, что значения суммарного радиационного риска почти в 10-20 раз превышают оценки радиационного риска в процессе полета (см. разд. 7.2). Поэтому именно они должны рассматриваться при решении вопросов нормирования и установлении предельных значений доз для космонавтов.
На рис. 8.1 Б представлены аналогичные зависимости для сокращения средней предстоящей продолжительности жизни для космонавтов, начинающих полет в возрасте 40 лет. Анализируя результаты, показанные на рисунке, можно отметить те же закономерности, которые рассмотрены выше при обсуждении данных рис. 8.1 А.
На основе данных рис. 8.1 А можно отметить, что при осуществлении межпланетного космического полета в течение 2 лет за толщиной защиты радиационного убежища Хру =20 г/см2 из алюминия реальный суммарный радиационный риск в течение жизни космонавтов, связанный с ’ дополнительной радиационно-обусловленной гибелью как за счет развития опухолей, так и за счет неопухолевых заболеваний, составит около 8%. Это почти в Зраза выше, чем тот, который установлен нормативными документами для американских астронавтов (Rail J.F., et al., 1985; Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received
411
in space activities. NCRP Report № 98, 1989; Weyland M., et al., 1991). В этих документах устанавливаются предельные значения доз за карьеру астронавтов, при которых риск развития радиационно-обусловленных опухолей в течение жизни не должен превышать 3%.
Определенный интерес представляет сопоставление суммарного радиационного риска в течение жизни и возможного сокращения продолжительности жизни у космонавтов при осуществлении межпланетного космического полета в различные периоды солнечной активности. Эти данные для межпланетных полетов различной продолжительности при толщине защиты бытовых отсеков ХбоКА, равной 30 г/см2, и начальном возрасте космонавтов 40 лет представлены на рис. 8.2 А и рис. 8.2 Б соответственно.
Как следует из данных, представленных на рисунках, максимальные значения радиационного риска за жизнь и сокращения продолжительности жизни имеют место при осуществлении межпланетного полета в период минимума СА для нечетных циклов СА. Минимальные — соответственно при осуществлении космического полета в период максимума СА.
Следует отметить, что даже при проведении межпланетного полета в период максимума СА, длительностью, превышающей 2 года (наилучший из рассмотренных вариантов случай), значения радиационного риска за жизнь и возможного сокращения продолжительности жизни являются достаточно высокими. Радиационный риск значительно превышает 3%, величину, установленную в нормативных документах для астронавтов США за всю их профессиональную деятельность (Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received in space activities. NCRP Report N 98, 1989; Weyland M., et al., 1991).
Как уже отмечалось ранее в разд. 7.1, рассчитывались значения радиационного риска для каждой i-й из 104 разыгрываемых методом Монте-Карло историй полета. Затем эти значения усреднялись и определялось среднее значение радиационного риска и среднеквадратичное отклонение. Отдельно в программе представлялись средние значения среднетканевых доз и их среднеквадратичные отклонения. Для целей нормирования представляют интерес и были рассмотрены частотные распределения величин доз и риска при разных толщинах защиты радиационного убежища.
412
Мин. СА нечет. —о— Мин. СА чет. —•— Пром. СА —О— Макс. СА
Рис. 8.2. Суммарный радиационный риск в течение жизни (А) и возможное сокращение ее продолжительности (Б) для космонавтов в возрасте 40 лет после межпланетного полета, совершаемого в различные периоды СА при толщине защиты ХБО = 30 г/см2 в зависимости от продолжительности полета
На основе анализа частотных распределений среднетканевых доз можно было заключить, что наиболее вероятное значение среднетканевой эквивалентной дозы находится в пределах 50-70 сЗв. В то же время при малых толщинах защиты со значительной вероятностью могут реализовываться достаточно опасные со
413
бытия, угрожающие здоровью и жизни космонавтов в процессе полета. Данные о риске превышения различных значений эквивалентных среднетканевых доз в межпланетном полете длительностью 2 года при минимальной толщине защиты бытовых отсеков ХБ0 = 1 г/см2 и разных толщинах защиты радиационного убежища (Хру) представлены на рис. 8.3.
Рис. 83. Вероятность превышения различных значений среднетканевых эквивалентных доз за межпланетный полет длительностью 2 года в период максимума СА при толщинах защиты радиационного убежища ХРУ 1; 5; 10 и 20 г/см2 (ХБО - 1 Г/см2)
Как видно из данных, показанных на рисунке, при малой толщине защиты РУ возможны в отдельных реализациях большие уровни доз, в случае развития СПС с высокими значениями суммарного флюенса. Однако указанные реализации являются чрезвычайно редкими. Из данных рис. 8.3 можно отметить, что среднетканевая доза 250 сЗв, при которой возможно серьезное нарушение работоспособности и жизнеспособности организма, может
414
иметь место при значениях толщины защиты 1; 5; 10 и 20 г/см2 с вероятностями 0,1; 0,008; 0,002 и 0,0004.
В последнем нормативном документе по радиационной безопасности космических полетов (Методические указания МУ 2.6.1.44-03 — 2004,) предельное значение среднетканевой дозы в течение всего периода работы космонавтов не должно превышать 100 сЗв, а предельно допустимое значение суммарного радиационного риска — 10%.
На основе данных рис. 8.3 можно видеть, что при толщинах защиты радиационного убежища 5; 10 и 20 г/см2 риски превышения предельной величины дозы составят 10; 4,5 и 1%. По-видимо-му, толщина защиты РУ в 20 г/см2 может считаться еще допустимой, а при меньших толщинах защиты (и при вероятностях превышения 0,01) возможны более высокие значения доз, что может привести к нарушению работоспособности космонавтов (см. разд. 9).
На рис. 8.4 и рис. 8.5. представлены материалы частотного распределения суммарного радиационного риска и вероятности превышения некоторого заданного его значения для космонавтов в возрасте 40 лет при различных толщинах защиты ХРУ после завершения 2-летнего межпланетного полета в период максимума СА.
Как видно из данных, представленных на рисунках, при малой толщине защиты РУ в значительном количестве случаев возможны большие уровни риска от 20 до 40%. При более реальной толщине защиты радиационного убежища — 20 г/см2 превышение социально приемлемого уровня риска 10% может иметь место с относительно небольшой вероятностью — 0,03 (рис. 8.5.)
Анализ частотных распределений сокращения средней предстоящей продолжительности жизни (СППЖ) после завершения рассматриваемого межпланетного космического полета в период максимума СА продолжительностью 2 года при тех же значениях толщины защиты Хру показал, что соответствующие наиболее вероятные значения сокращения СППЖ при толщине защиты 20 г/см2 варьируют в интервале 2,5-5 лет.
На рис. 8.6 представлены значения сокращения СППЖ космонавтов и вероятность их превышения после осуществления данного межпланетного полета.
Из данных рисунка следует, что столь большое и социально значимое сокращение СППЖ, как 3 года, может быть превышено
415
Радиационный риск за жизнь
dN/dR(Xpy=1r/cM2) —□— dN/dR(Xpy=5r/cM2)
- ♦ dN/dR(Xpy=1 Or/см2) —о— dN/dR(Xpy=20r/cM2)
Рис. 8.4. Частотное распределение суммарного радиационного риска для космонавтов в возрасте 40 лет после завершения 2-летнего межпланетного полета в период максимума СА при различных толщинах защиты ХРУ
при толщинах защиты Хру менее 10 г/см2 с вероятностью, превышающей 10%. Относительно приемлемой толщиной защиты радиационного убежища может быть 20 г/см2 алюминия, при которой риск снижения СППЖ больше 3 лет составит 3%, а сокращения на 4 года и более — 1%.
В уравнениях для функций дожития мужчин с исходным возрастом t0 и расчета суммарного радиационного риска (8.2)-(8.4) использовали зависимости коэффициентов смертности мужчин России от возраста. Функции дожития для мужчин России определяются состоянием здоровья населения России. Для периодов 1993, 1996 и 2005 гг. для вычисления функции дожития использовали, как указывалось выше, следующие значения параметров: ц(0) = 9,0 х 10“4; Ло= 0,062 1/год.
416
—— W>Rr(1r/cM2) —□— W>Rr(5r/cM2) —•— W>Rr(10r/cM2) —o— W>Rr(20r/cM2)
Puc. 8.5. Вероятности превышения некоторого заданного значения суммарного радиационного риска для космонавтов в возрасте 40 лет после завершения 2-летнего межпланетного полета в период максимума СА при различных толщинах защиты ХРУ
Состояние здоровья мужчин в США и Японии является существенно лучшим. Продолжительность жизни мужчин в этих странах для указанных периодов на 15-17 лет больше. Зависимость коэффициентов смертности от возраста для мужского населения США в возрастах 25 лет и выше описывается следующими параметрами ц(0) = 1,0 х 10"4; Хо = 0,0837 1/год, а для населения Японии — ц(0) = 5,0 х 10"5; Хо = 0,0885 1/год. Для астронавтов Европейского союза параметры в среднем близки к параметрам для астронавтов США (Ежегодники мировой санитарной статистики ВОЗ, Женева, 1970, 1994; Российские статистические ежегодники 2004-2007 гг.).
При расчетах радиационного риска более правильно выбирать значения верхнего предела в интеграле (уравнения (8.2) и (8.3)), соответствующего приблизительно средней продолжительности жизни. В этом случае выживаемость когорты мужчин в возрастах 30-50 лет V(T) будет близка к 0,5 и величины радиационного риска могут быть определены с лучшей точностью. Мы в своих
417
—W>dT(Xpy=1r/cM2) —о— W>dT(Xpy=5r/cM2)
—W>dT(Xpy=10r/cM2) —о— W>dT(Xpy=20r/cM2)
Рис. 8.6. Сокращение СППЖ космонавтов и вероятность превышения указанных значений после осуществления данного межпланетного полета.
По оси абсцисс — сокращение средней продолжительности предстоящей жизни; по оси ординат — вероятности превышения их возможных значений.
расчетах, представленных выше, выбирали значение верхнего предела в интеграле для космонавтов России — 70 лет. По-видимому, точнее использовать в качестве верхнего предела для космонавтов России — 65 лет, а для астронавтов США или Японии — 75 лет.
На рис. 8.7 представлены рассчитанные значения суммарного радиационного риска для космонавтов России, астронавтов США и Японии в зависимости от величины обобщенной дозы при значениях верхнего предела в интеграле для космонавтов России 65 и 70 лет, а для астронавтов США и Японии — 75 лет. При этом функции дожития V(T) оказывались близкими к значению, равному 0,5.
Как видно из данных, представленных на рисунке, суммарный радиационный риск линейно зависит от величины обобщенной дозы в рассматриваемом интервале доз. Максимальная оценка суммарного радиационного риска для космонавтов России составляет 13% на 1 Зв. Близкое значение риска в расчете на 1 Зв обоб-
418
0,25
1 0,15
—- Россия 40-70; V(t)=0,391
—Россия 40-65; V(t)=0,52
§ 0,05
—•— США 40-75; V(t)=0,548
—О- Япония 40-75; V(t)=0,663
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2
Обобщенная доза, Зв
Рис. 8.7. Зависимость суммарного радиационного риска для космонавтов России, астронавтов США и Японии в возрасте 40 лет от величины обобщенной дозы
щенной дозы имеет место и для американских астронавтов — 12,5%, а для астронавтов Японии не превышает 11%.
Конечно, космонавты и астронавты по своему здоровью и социальному статусу находятся на более высоком уровне, чем в среднем по стране. Для них величина радиационного риска будет меньше. Но для целей максимальной оценки радиационной опасности и обеспечения большего уровня радиационной безопасности мы ранее и в дальнейшем будем использовать именно верхнюю оценку радиационного риска 13% в расчете на 1 Зв. Эта оценка представлена нами ранее в работах (Шафиркин А.В., 1999в; Шафиркин А.В. и др., 2002; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004).
В работе американских исследователей Колумбийского университета (Geard C.R., Jenkins-Baker G., Grabham P. et al., 2006) авторами для жителей Хиросимы и Нагасаки представлена близкая оценка риска суммарной дополнительной смертности в результате атомных бомбардировок — 14% на 1 Зв.
Рассмотренные выше материалы дают представление о масштабе радиационной опасности для экипажа межпланетной экспедиции в результате ее выполнения, который выражен в количе
419
ственных значениях радиационного риска в процессе полета и в течение всей жизни. Результаты расчетов риска для различных конструкторских вариантов создания радиационной защиты экипажа позволяют оценивать влияние па уровень радиационной безопасности космонавтов оптимального использования имеющихся на борту масс вещества и выбора периода осуществления полета.
Приведенные значения сокращения средней продолжительности предстоящей жизни демонстрируют реальный ущерб космонавту, наносимый воздействием радиации в результате полета. Наряду с оценками радиационного риска эта величина позволяет более полно представить количественную характеристику радиационной опасности, учитывающую к тому же возраст космонавтов на начало полета и предысторию его облучения в процессе профессиональной деятельности. Представленные выше характеристики радиационной опасности, безусловно, должны быть учтены при разработке и создании системы радиационной безопасности межпланетной экспедиции, разработке радиационных лимитов, регламентирующих облучение экипажа во время ее проведения.
8.2. Радиационно-обусловленный риск образования злокачественных опухолей у космонавтов за период их жизни после завершения межпланетных космических полетов
Значительная реальная опасность воздействия ионизирующих излучений в отношении увеличения вероятности развития неопластических заболеваний была осознана сравнительно недавно после почти 40-летнего наблюдения за людьми, оказавшимися жертвами атомных бомбардировок или испытаний ядерного оружия. Кроме того, значительные материалы об увеличении вероятности выхода рака при больших уровнях доз были получены в результате терапевтического использования ионизирующих излучений в клинике.
Основная сложность в отношении определения риска выхода опухолей разных органов и тканей и общего канцерогенного риска для случаев воздействия в меньших дозах связана с точностью экстраполяции в область малых доз и малых значений мощностей
420
доз для излучений с различной плотностью ионизации и биологической эффективностью. При такой экстраполяции необходимо использовать основные закономерности, полученные к настоящему времени о действии излучений с различной величиной ЛПЭ, с различной мощностью дозы на клеточном, тканевом и организменном уровнях. Прежде всего это относится к наиболее часто встречающимся, относительно простым подходам по прогнозу вероятности раковых заболеваний, связанным с использованием модельных представлений о развитии первичных генетических повреждений и вероятности бластомогенной трансформации клеток. При этом подразумевается пропорциональная связь между выходом первично измененных клеток и вероятностью последующего развития новообразований. В этих подходах уже включается в анализ взаимодействие между собой первично возникающих повреждений в клетке, приводящих либо к возникновению необратимо измененных клеток, либо к восстановлению повреждений.
Более сложные модельные представления дополнительно включают, при рассмотрении данной проблемы, вопросы гибели предканцерогенных клеток в более позднем периоде либо за счет продолжающегося облучения, в связи с их высокой радиочувствительностью, либо в результате воздействия эндогенных факторов, обусловленных активацией защитных систем организма.
Из-за сложности самого процесса канцерогенеза: наличия длительного латентного периода до момента развития самой опухоли, вероятностного характера ее формирования, действия многих факторов и аспектов еще недостаточно изученных, более громоздкие модельные представления в настоящее время не могут быть убедительно ни доказанными, ни опровергнутыми. Они, как правило, выдвигаются для объяснения характера наблюдаемой зависимости выхода опухолей от дозы в экспериментальных исследованиях. Однако, во-первых, эти исследования осуществляются на недостаточно большом статистическом материале (в отличие от эпидемиологических данных) и среднеквадратическая погрешность для каждого значения дозы является значительной, во-вторых, используется недостаточно большое количество доз, что затрудняет обоснование вида зависимости как в области малых доз, так и при больших дозах. В-третьих, зависимость выхода опухолей для различных органов и тканей от дозы носит неодинаковый характер, что связано с различной радиочувствительностью кле
421
ток этих тканей, разной скоростью пролиферации и способностью восстановления.
Все вышеуказанное обусловливает то, что в настоящее время получил максимальное распространение лишь первый, более упрощенный подход, когда прогноз вероятности развития неопластических заболеваний связывается с числом образовавшихся и сохраненных бласттрансформированных клеток в ближайшем пострадиационном периоде (The Effect on Population of Exposure to Low Level, 1980; Dose-Response Relationship for Radiation-Induced Cancer, 1984; Rail J.F., et al., 1985; Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989; Филюшкин И.В., Пе-тоян И.М., 1989; Радиация. Дозы, эффекты, риск, 1990; Weyland М., et al., 1991; Рекомендации международной комиссии по радиологической защите. Публикация МКРЗ № 60 и 61,1994). Общепризнанной также является в настоящее время концепция о беспороговом бластомогенном действии ионизирующих излучений, предполагающая, что даже незначительное увеличение космического фона излучений и увеличение уровней радиационного воздействия приведут к конечному, отличному от нуля, увеличению выхода рака по сравнению с нормальным обычным уровнем. Этот принцип впервые был сформулирован в работе (Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978) и используется в значительном числе публикаций, посвященных оценке риска развития новообразований при радиационных воздействиях, в том числе и в указанных выше работах.
На основе данных длительных наблюдений за лицами, подвергавшихся атомным бомбардировкам, облучению по следу радиоактивного облака, при испытаниях атомного оружия, а также анализа клинических материалов терапевтического использования ионизирующих излучений, получены оценки по выходу опухолей различных органов и тканей для людей различного возраста, которые систематизированы в соответствующие эпидемиологические таблицы. Эти данные постоянно корректировались с учетом уточнения доз, поглощенных при ядерных взрывах.
В настоящее время в исследованиях (Dose-Response Relationship for Radiation-Induced Cancer, 1984; Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989; Nachtwey D.S., 1989; Weyland M., et al., 1991) при вычислении радиационно
422
го риска используются материалы, разработанные рабочей группой Национального института здоровья США с уточненными ра-диоэпидемиологическими данными (Rail J.F., et.al., 1985).
Имеется, как правило, неопределенность в установлении риска развития опухолей при малых уровнях доз и малых мощностях дозы для излучений с низкими значениями ЛПЭ. Для излучений с высокими значениями ЛПЭ сравнительно точную оценку можно получить с помощью простой линейной экстраполяции значений риска с больших уровней доз в область малых. Вопрос экстраполяции для редкоионизирующих излучений более сложен и связан с выбором какой-либо модели, описывающей образование относительной доли предканцерогенных клеток, о которых говорилось выше. В наиболее общем виде зависимость выхода бласттранс-формированных клеток от дозы на основе данных работы (Dose-Response Relationship for Radiation-Induced Cancer, 1984) может быть представлена в виде
1(D) = (а0 +atD + a2D2) ехр - (PtD + ₽2D2), (8.7)
где первый сомножитель определяет образование первичных предканцерогенных клеток в результате облучения, а экспоненциальный член — их последующую гибель. Коэффициент а 0 определяет долю спонтанно образующихся клеток в отсутствии радиации, коэффициента! характеризует среднюю долю первично образующихся бласттрансформированных клеток при облучении редкоионизирующим излучением с низкими значениями мощностей доз. Он же определяет предельный наклон сигмоидной кривой выхода опухолей в области малых доз. Квадратичный член связан с увеличением эффективности образования первично измененных клеток при воздействии с более высокими значениями мощностей доз вплоть до острых воздействий и в более высоких дозах. Экспоненциальный член во многих исследованиях либо опускают, либо ограничиваются линейным членом в показателе экспоненты. В более простых случаях рассматривают просто линейную модель выхода предканцерогенных клеток 1(D) = aD.
В табл. 8.1 представлены материалы по выходу рака различных органов и тканей в течение года на 105 человек в расчете на 1 с Гр поглощенной дозы на основе радиоэпидемиологических данных, опубликованных в работе (Rail J.F., et al., 1985), которые исполь-
423
424
Таблица 8.1
Выход опухолей на 105 человек за год для различных органов и тканей мужчин (М) и женщин (Ж) для излучений с низкими значениями ЛПЭ в расчете на 1 сГр при наблюдения после облучения от 5 до 35 лет
Орган Возраст начала облучения
0-9 лет 10-19 лет 20-34 лет 35-49 лет 40-49 лет 50 и более
М ж М ж М ж М ж М ж М ж
Кроверворная ткань 0,173 0,110 0,085 0,054 0,0845 0,054 0,105 0,067 — — 0,156 0,099
Слюнные железы и пищевод 0,001 0,001 0,001 0,001 0,0052 0,005 0,008 0,008 — — 0,022 0,022
Желудок 0,016 0,016 0,016 0,016 0,031 0,031 0,051 0,051 — — 0,134 0,134
Толстый кишечник — — — — 0,021 0,021 0,034 0,034 — — 0,089 0,089
Печень — — — — 0,028 0,028 0,028 0,028 0,028 0,028 0,028 0,028
Поджелудочная железа — — — — 0,018 0,018 0,030 0,030 — — 0,079 0,079
Легкие — — 0,030 0,030 0,560 0,560 0,086 0,086 — — 0,120 0,120
Мочевой пузырь — — — — 0,020 0,020 0,037 0,037 — — 0,065 0,065
Щитовидная железа 0,15 0,500 0,150 0,500 0,050 0,150 0,050 0,150 0,050 0,150 0,050 0,150
Грудь, молочные железы — 0,380 — 0,760 — 0,490 — 0,490* — 0,130 — 0,080
*Для возраста 30-39.
зуются большинством исследователей при оценке риска радиационно обусловленного выхода опухолей.
В работе (Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989) подобные расчеты проводились как по линейной модели I = aD/2,5 , где D — поглощенная доза, Гр, так и по линейно-квадратичной модели I =aD(l + + D/l,16)/2,5.
Коэффициент а основывается на линейной беспороговой концепции и может непосредственно использоваться для оценки выхода опухолей при действии излучений с высокими значениями ЛПЭ. Его значение выбиралось на основе данных работ (The Effect on Population of Exposure to Low Level, 1980; Rail J.F., et al., 1985; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989) и равно 0,1 [1/Гр] (при расчете риска на 103 человек). При действии ионизирующего излучения линейная модель дает верхнюю завышенную оценку риска для малых доз, в то время как линейно-квадратичная более точно отражает вероятность образования опухолей при малых значениях доз и мощностей доз для излучений с низкими значениями ЛПЭ.
Значение линейного коэффициента для линейно-квадратичной модели получено путем деления коэффициента для линейной беспороговой модели на коэффициент 2,5, определяющий снижение эффективности образования опухолей при малой мощности дозы (Dose Rate Reduction Factor (DRRF), or Dose Rate Effectiveness Factor (DREF).
При расчетах канцерогенного риска в работе (Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989) рекомендовано использовать этот фактор при мощности доз ниже 5 сГр/сут.
Следует отметить, что указанный подход по учету влияния мощности дозы применяется и в других работах, однако оценки значений коэффициентов редукции, определяющих степень снижения радиационно обусловленного выхода опухолей, лежат в диапазоне от 2,0 до 5,0 (Dose-Response Relationship for Radiation-Induced Cancer, 1984; Григорьев Ю.Г. и др., 1986; Рекомендации международной комиссии по радиологической защите Публикации № 60 и 61, 1994). Коэффициент 4,0 получен при анализе изменений коэффициентов смертности животных после острых и хронических облучений, а также эффектов сокращения продол
425
жительности их жизни (разд. 5.3) и в работах (Григорьев Ю.Г. и др., 1986; ГОСТ 25645.214-85 БРЭКАКП, 1986).
Граничное значение мощности дозы, ниже которого рекомендуется использовать этот коэффициент, пока также не является общепризнанным. В работе (Рекомендации международной комиссии по радиологической защите Публикации № 60 и 61, 1994). рекомендуется пороговое значение мощности дозы 10 сГр/час и коэффициент редукции, равный 2,0. Это же значение рекомендовано нами в разд. 8.1 для описания снижения эффективности радиационных воздействий при дозе ниже 20 сГр и действии излучений с низкими значениями ЛПЭ.
В табл. 8.1 представлены значения коэффициентов риска на единицу дозы в отношении развития опухолей в течение года для различных возрастных групп мужчин и женщин. Учет вероятности реализации предканцерогенных изменений в клетках во времени и превращения их в опухоли, с учетом обобщенного влияния факторов на тканевом и организменном уровнях, производится на основе представления о том, что имеется некоторое распределение вероятности возникновения опухоли вокруг среднего значения латентного периода Т (50%) для каждого органа или ткани, которое принимают обычно в виде логнормального распределения.
Общая вероятность образования опухоли к моменту времени Т вычисляется на основе произведения вероятности выхода бласт-трансформированных клеток при рассматриваемой дозе радиационного воздействия на значение интеграла вероятности для указанной плотности распределения событий образования опухоли от момента начала облучения до рассматриваемого времени Т. Выход определенного вида рака для отдельного органа к моменту времени Т в зависимости от длительности облучения Т представлен в работе (Dose-Response Relationship for Radiation-Induced Cancer, 1984) в наиболее общем виде
I(T1,T,D)= (8.8)
= f nxpc xy xMxO,5 {1 + erf1°————}dz, t0 V2 x a
где t0 — время начала облучения (возраст, годы); Рс — вероятность бласттрансформации клетки на 1 дозы; у — мощность дозы радиационного воздействия; Tj — длительность облуче
426
ния; n — число клеток в единице массы данного органа; М — масса органа; Т — текущий возраст, для которого определяется вероятность развития новообразования;
ц = 1пТ(50%);
функция erf — интеграл ошибки.
Для расчета суммарных значений вероятностей радиационно обусловленного риска развития опухоли к определенному возрасту, необходимо проинтегрировать вероятность за весь промежуток времени от возраста t0, при котором облучение было начато, до исследуемого промежутка времени Т. Подобная модель распределения вероятности образования опухолей во времени для различных органов и тканей представлена в работе (Boice J.D., Day N.E., Andersen A. et al., 1985). Она была использована при расчетах канцерогенного риска в течение жизни космонавтов в работе (Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989). Подход установления канцерогенного риска за всю жизнь является более простым, поскольку выражение в фигурных скобках стремиться к 2,0 и вероятность выхода определяется лишь долей бласттрансформированных клеток (вероятность выхода рака на клетку). Он является более удобным для сравнения различных режимов облучения с отличающимся характером распределения дозы во времени. Подобный подход применялся рядом исследователей для оценки опасности радиационного воздействия в условиях космического пространства в отношении риска развития опухолей, а также при обосновании нормативных значений доз за всю профессиональную деятельность астронавтов (Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989; Nachtwey D.S., 1989; Weyland M., et al., 1991).
Часть выражения (8.8.) вместе с сомножителем 0,5 может рассматриваться как некоторый коэффициент К(Т0), определяющий вероятность образоваться опухоли в течение жизни из бласттрансформированных клеток. Следует при этом отметить, что при непродолжительном облучении в относительно молодом возрасте этот коэффициент стремится к единице и мы наблюдаем развитие опухоли в течение жизни:
K(t0) = °f 0,5 {1 4- erftln(T~Д° ~ ~ }dx ~ 1. (8.9) т\ V2 x о
427
На основе данных, представленных в работе (Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989), нами рассчитаны значения коэффициента К(Т0, t) при облучении людей в течение года, 5, 10 и 20 лет с различным начальным возрастом То от 25 до 55 лет. Зависимость этих коэффициентов, отражающих вероятность развития опухоли в течение жизни, от начального возраста То представлена на рис. 8.8.
Начальный возраст облучения То, годы
t облучения 1 под
—О— t облучения 5 лет
< t облучения 10 лет
—О— t облучения 20 лет
Рис. 8.8. Вероятность развития опухолей в течение жизни у космонавтов из бласттрансформированных клеток при различной длительности облучения в условиях космического полета в зависимости от возраста начала полетов
Как видно из данных, представленных на рисунке, при кратковременном облучении людей старших возрастных групп или при протяженном профессиональном облучении с малой мощностью дозы, но в течение многих лет, лиц, начинающих карьеру в молодом возрасте, этот коэффициент существенно меньше единицы, поскольку из-за протяженного латентного периода развития опухолей они могут и не развиться за оставшийся промежуток жизни.
Анализируя значения риска выхода опухолей за год на единицу дозы, представленные в работе (Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989) и в табл. 8.1, можно обнаружить более высокие величины, чем в ранее опубликованных радиоэпидемиологических таблицах (Rail J.F.,
428
et al., 1985), что, по-видимому, связано с последующим уточнением значений риска развития опухолей различных органов и тканей и более широким спектром учитываемых опухолей.
На основе рассмотренных материалов нами были рассчитаны значения риска развития опухолей в течение жизни на 1 Зв эквивалентной дозы для космонавтов (астронавтов), начинающих свою деятельность в различном возрасте. Проведены два расчета на основе данных, представленных американскими исследователями в работах (Rail J.F., et al., 1985; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989). Первый расчет был основан на использовании эпидемиологических данных (табл. 8.1) о рисках выхода опухолей различных органов и тканей на единицу дозы, представленных в работе (Rail J.F., et al., 1985). Второй осуществлен на основе данных, которые представлены в более поздней работе Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989). Рассматривали различные варианты длительности профессионального облучения 1, 10, 20 лет. Риск развития опухолей определяли к 65 годам. Сравнительные данные расчетов представлены на рис. 8.9 А.
Как видно из этих данных, радиационный риск на единицу дозы, рассчитанный на основе более современных данных является существенно более высоким, особенно для молодых возрастных групп. Если руководствоваться принципом недопущения риска развития опухолей у космонавтов (астронавтов) в течение жизни выше 3% — критерий, который используется в нормативах США (Fry RJ.M. and Nachtwey D.S., 1988; Nachtwey D.S., 1989; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989), то предельные значения доз за всю их профессиональную деятельность должны быть значительно снижены.
Максимальные значения доз для астронавтов (космонавтов) за их карьеру на основе расчетов радиационного риска развития опухолей на единицу дозы (рис. 8.9 А) и использовании указанного выше предельного значения риска, равного 3% при длительностях профессиональной работы 1, 10 и 20 лет, представлены на рис. 8.9 Б.
Из этого рисунка видно, что при реальной длительности работы в условиях космических полетов в пределах 1-3 года, допустимые дозы не должны превышать 75 сЗв для астронавтов, начинаю-
429
—Т=1 год (NCRP, Report N98) —О— Т=10 лет (NCRP, Report N98) —Т=20 лет (NCRP, Report N98) Т=1 год (Rail J.F., 1985) .*.• Т=10 лет (Rail J.F., 1985) •••*••• Т=20 лет (Rail J.F., 1985)
Рис. 8.9. Радиационный риск выхода опухолей у космонавтов в течение жизни на 1 Зв (Л) и предельное значение допустимой эквивалентной дозы за карьеру (Б) в зависимости от возраста начала космических полетов при различной продолжительности карьеры Т. Предельное значение радиационного риска канцерогенеза — 3%
щих карьеру в возрасте 25 лет, и 250 сЗв для астронавтов в возрасте 55 лет (расчет по данным работы Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989). При расчетах для длительной карьеры 10 лет эти значения выше примерно на 30 сГр.
Выше рассмотрен гипотетический случай равномерного облучения человека в течение всего профессионального периода с некоторой средней мощностью дозы. Представляет также определенный интерес на основе рассмотренной методики проведение расчетов риска образования опухолей у космонавтов после завершения некоторых вариантов межпланетных полетов.
Для наиболее точного определения риска образования опухолей у космонавтов можно было бы применить подход, предложенный в работах (Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978; Рекомендации международной комиссии по ра
430
диологической защите 1990 года, Публикации № 60 и 61, 1994) с использованием концепции эффективной эквивалентной дозы. Для этого необходимо знать распределение эквивалентных доз по отдельным органам от различных источников радиационной опасности за каждый отдельный этап профессиональной деятельности космонавтов, предшествующий рассматриваемому полету и в течение его. В условиях отсутствия данных по фантомным измерениям поглощенных доз различными органами при размещении фантомов внутри отсеков космических аппаратов указанный подход, с успехом применяемый в наземных условиях, не может пока быть использован при определении риска развития опухолей у космонавтов.
Поэтому в настоящее время приемлемым дозиметрическим функционалом для расчета канцерогенного риска может служить суммарная за всю предшествующую профессиональную деятельность и в течение рассматриваемого полета величина среднетканевой эквивалентной дозы. Предполагается при этом, что все органы и ткани оказываются подвержены воздействию в данной дозе. Для полноты оценки дозовой нагрузки на космонавтов следует учитывать также радиационное воздействие при рентгенодиагностических процедурах. Эффективная эквивалентная доза, определяемая по данным рентгенологических процедур согласно нормативно-техническому документу (РД.50-25645.209-85. БРЭКАКП., 1986), может быть использована в качестве верхней оценки исходного значения среднетканевой эквивалентной дозы до проведения первого космического полета.
Для оценки суммарной величины риска канцерогенеза за жизнь следует использовать суммарное по данным рассмотренных выше исследований (Rail J.F., et al., 1985; Guidance on radiation received in space activities. Recommendation NCRP Report № 98, 1989) значение риска выхода опухолей всех локализаций на единицу дозы. В представленных выше разд. 7 и 8.1 приведены алгоритмы и материалы расчетов риска в процессе полета и суммарного радиационного риска в отдаленном послеполетном периоде. В алгоритме и программе расчета радиационного риска предусмотрена подпрограмма расчета суммарного среднего значения среднетканевой эквивалентной дозы от различных источников радиационной опасности в космосе в случаях межпланетного и орбитального полетов.
431
На основе вышепредставленных материалов по расчету среднетканевых доз при проведении межпланетных и орбитальных полетов, а также данных работы (Rail J.F., et al., 1985), в которой анализируются данные по зависимости риска образования опухолей от дозы и мощности дозы радиационного воздействия, можно представить выражение для расчета радиационного риска развития опухолей в течение жизни у человека при воздействии излучений с низкими значениями ЛПЭ с небольшими величинами доз и мощности дозы:
I = ^K(T0,t), (8.10)
Г
где коэффициент а равен 0,1 [1/Зв] (значение его установлено выше на основе данных работ (Rail J.F., et al., 1985; Guidance on radiation received in space activities. Recommendation NCRP Report № 98., 1989); D — среднетканевая эквивалентная доза; K(T0, t) — функционал от возраста начала облучения То и его продолжительности t, представляющий собой вероятность развития опухоли в течение жизни (уравнение (8.9) и рис. 8.8); F — фактор, определяющий снижение эффективности образования опухолей при малой мощности дозы (DREF — Dose Rate Effectiveness Factor), значение которого принималось равным 2,5 (Rail J.F., et al., 1985).
Расчеты радиационного риска развития опухолей у космонавтов на основе данных о суммарных значениях среднетканевых эквивалентных доз с использованием уравнения (8.10) могут служить его нижней оценкой.
При описании эффектов радиационно-обусловленного сокращения продолжительности жизни в работах (Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999в) и в разд. 5.2 и 6.2 отмечено отсутствие зависимости указанных эффектов от мощности дозы в условиях воздействия излучений с высокой плотностью ионизации (воздействие быстрых нейтронов реакторного спектра и ускоренных ионов ГКЛ с ЛПЭ в пределах 60-78 кэВ/мкм). При действии этих излучений, в отличие от гамма-излучения, не наблюдали снижения радиобиологической эффективности со снижением мощности дозы. Для этих видов излучений в указанном диапазоне мощностей доз не отмечается также уменьшения эффективности бласттрансформации клеток и вероятности образования опухолей
432
с уменьшением мощности дозы. Поэтому при определении риска выхода опухолей у человека после воздействия излучений с высокими ЛПЭ значение коэффициента F в уравнении (8.10) следует принять равным 1,0.
В этом случае будет получена максимальная оценка радиационного риска выхода опухолей в течение жизни. Именно этот подход мы применяли далее для получения верхней оценки радиационного риска выхода опухолей у космонавтов в течение жизни.
Зависимость радиационного риска развития опухолей у космонавтов различного возраста в течение жизни от длительности межпланетного полета, осуществляемого в период максимума СА при толщине защиты бытовых отсеков КА ХБ0 = 30 г/см2, показана на рис. 8.10.
Рис. 8.10. Радиационный риск развития опухолей у космонавтов в течение жизни после межпланетного полета различной продолжительности в период максимума СА для различных возрастов членов экипажа в начале полета
Можно отметить существенную зависимость риска развития опухолей после полета от возраста космонавтов. Более высокие значения радиационного риска развития опухолей имеют место для космонавтов, осуществляющих полет в более молодом возрасте.
433
На рис. 8.11 представлены значения суммарного радиационного риска, рассчитанного на основе материалов, представленных в разд. 8.1, и риска развития опухолей в зависимости от возраста космонавтов на начало межпланетного полета (рассматривается межпланетный полет в период максимума солнечной активности, продолжительностью 2 года при толщине защиты бытовых отсеков космического аппарата, равной 30 г/см2). На рисунке представлены две кривые риска развития опухолей, соответствующие максимальной (F = 1) и минимальной (F = 2,5) расчетной оценке, о которых говорилось выше.
Рис. 8.11. Суммарный радиационный риск и риск развития опухолей в течение жизни для космонавтов различного возраста после завершения 2-годичного межпланетного полета, осуществляемого в период максимума СА (ХБ0 = 30 г/см2)
Как видно из данных, представленных на рисунке, суммарный радиационный риск для космонавтов в результате всех причин гибели в течение всей жизни (к 70 годам) существенно превышает риск развития опухолей, особенно для лиц старших возрастных групп. Риск развития опухолей, для космонавтов, начинающих полет в возрасте 25 лет, составляет большую часть суммарного радиационного риска. В то же время для космонавтов, начинающих свою профессиональную деятельность в возрасте 45-55 лет, он в 3-9 раз ниже. Ведущими причинами гибели в отдаленном перио
434
де для космонавтов указанной возрастной группы, по-видимому, являются неопухолевые заболевания, поскольку вероятность развиться опухоли в течение жизни у них существенно ниже, чем для космонавтов более молодого возраста. В разд. 9 будут рассмотрены риски серьезных неопухолевых заболеваний в отдаленном периоде после радиационных воздействий в различных дозах, которые необходимо учитывать при решении вопросов нормирования радиационного воздействия применительно к осуществлению полета на Марс.
8.3. Определение суммарного радиационного риска и риска образования опухолей в течение всей жизни космонавтов после осуществления орбитальных космических полетов в различные периоды СА
В разд. 2 нами представлены основные данные о радиационной обстановке при полетах на орбитальных станциях «Мир» и МКС, а в разд. 7.3 приведены значения риска для космонавтов в процессе проведения полетов в различные периоды солнечной активности. Эти значения риска при орбитальных полетах являлись почти в 6 раз меньше, чем в процессе межпланетных полетов. Нам важно определить значение суммарного радиационного риска, риска опухолей в течение жизни, а также возможное сокращение средней предстоящей продолжительности жизни космонавтов после завершения орбитальных полетов, поскольку эти величины более чем на порядок выше, чем риск в полете, и могут более адекватно определять истинную радиационную опасность в отдаленном периоде. Они должны рассматриваться в первую очередь при решении вопросов нормирования и обеспечения здоровья и нормальной работоспособности космонавтов после завершения полетов.
Для получения более точных оценок суммарного радиационного риска целесообразно было более подробно провести сопоставительный анализ результатов расчета, представленных в разд. 2, и данных дозиметрии за все 28 основных экспедиций на станции «Мир». Дозиметрия осуществлялась с помощью штатной прямо показывающей аппаратуры (ионизационной камеры дозиметра Р-16, тканеэквивалентного пропорционального счетчика ТЭПС, приборов «Доза-А», «Нозика» и др.) и индивидуальных сборок интегральных термолюминесцентных дозиметров, что позволяло
435
регистрировать среднесуточные величины поглощенных и эквивалентных доз.
Эти сборки находятся в течение всей длительности полета на поверхности тела космонавтов и регистрируемый уровень доз в максимальной степени соответствует средней величине поглощенной дозы на кожу космонавтов за весь период длительного полета.
В работах (Бондаренко В.А., Митрикас В.Г., Цетлин, 1995; Петров В.М. и др., 2001; Шафиркин А.В. и др., 2002) представлены значения радиационных нагрузок на космонавтов (суммарные локальные в отсутствии фантома поглощенные дозы за 2 + 28-ю экспедиции основные — ЭО. Это длительные экспедиции, что позволяло на основе данных камеры Д2 прибора Р-16 при исключении всплесков дозы за счет небольшого вклада СКЛ установить с хорошей точностью среднесуточную величину мощности локальной поглощенной дозы от ГКЛ и РПЗ. Эта была усредненная величина среднесуточной дозы для различных положений космонавтов относительно оси станции и нахождение их в различных отсеках. Величины суммарных доз за все 27 ЭО, проводившиеся в период с 08 февраля 1987 г. по 15 июня 2000 г. и среднесуточные значения мощностей доз за эти периоды представлены в табл. 8.2.
Таблица 8.2
Радиационные нагрузки на экипажи основных экспедиций на станции «Мир»
№ п/п Экспедиция Период Суммарная доза, сГр Средняя мощность дозы, мкГр/сут
1 ЭО-2 08.02.87-29.12.87 7,740 238,2 ± 58,1
2 эо-з 21.12.87-20.12.88 6,495 177,5 ± 27,3
3 ЭО-4 26.11.88-26.04.89 3,020 198,7 ± 73,9
4 ЭО-5 06.09.89-19.02.90 3,731* 224,2 ± 19,8
5 ЭО-6 11.02.90-09.08.90 3,240 180,0 ± 37,6
6 ЭО-7 01.08.90-10.12.90 2,600 197,0 ± 46,5
7 ЭО-8 01.12.90-26.05.91 4,285 242,1 ± 178
8 ЭО-9 18.05.91-10.10.91 4,650* 320,0 ± 180
436
Продолжение табл. 8.2
№ п/п Экспедиция Период Суммарная доза, сГр Средняя мощность дозы, мкГр/сут
9 эо-ю 02.10.91-25.03.92 4,975 282,7 ± 46,9
10 ЭО-11 17.03.92-10.08.92 4,015 273,1 ± 42,7
И ЭО-12 27.07.92-05.02.93 6,800 350,5 ± 48,3
12 ЭО-13 24.01.93-22.07.93 8,585 476,9 ± 66,5
13 ЭО-14 01.07.93-14.01.94 8,915 450,2 ± 49,0
14 ЭО-15 08.01.94-09.07.94 9,505 518,9 ± 71,0
15 ЭО-16 01.07.94-06.11.94 6,315 489,5 ± 59,8
16 ЭО-17 04.10.94-22.03.95 8,065 474,4 ± 72,2
17 ЭО-18 14.03.95-04.07.95 6,745 596,9 ± 71,1
18 ЭО-19 27.06.95-11.09.95 5,090 661,0 ± 77,2
19 ЭО-20 03.09.95-29.02.96 10,980 610,0 ± 44,0
20 ЭО-21 21.02.96-02.09.96 10,445 535,6 ± 50,8
21 ЭО-22 17.07.96-02.03.97 9,675 488,6 ± 56,6
22 ЭО-23 10.02.97-14.08.97 9,605 516,4 ± 64,2
23 ЭО-24 05.08.97-19.02.98 7,880 394,5 ± 49,7
24 ЭО-25 29.01.98-25.08.98 6,990 334,4 ± 55,3
25 ЭО-26 13.08.98-28.02.99 5,615 280,8 ± 58,8
26 ЭО-27 22.02.99-28.08.99 3,870 205,8 ± 28,2
27 ЭО-28 04.04.2000-15.06.2000 1,370 190,0 ± 31,0
Примечание. Суммарная доза за экспедицию ЭО-5 скорректирована с учетом вклада в дозу от мощных СПС в сентябре-октябре 1989 г., которые совпали с возмущениями магнитного поля Земли. Доза от СКЛ внутри станции суммарно составила 3,244 сГр. Аналогично скорректирована доза за июнь-июль 1991 г. (экспедиция ЭО-9) с вкладом в нее дозы от СКЛ 0,350 сГр (Петров В.М. и др., 2001).
437
Наглядно характер изменения мощности дозы по показаниям камеры Д2 радиометра Р-16 на станции «Мир» в течение всех экспедиций, проходящих в период 23-го солнечного цикла, можно увидеть на рис. 8.12.
Рис. 8.12. Характер изменения среднего значения мощности дозы за 27 основных экспедиций на станции «Мир» по показаниям ионизационной камеры Д2 радиометра Р-16
Как видно из данных табл. 8.2 и рисунка, при полетах в период максимума СА (экспедиции ЭО-2 + ЭО-8 и ЭО-27 ч- ЭО-28) значение мощности дозы в среднем составляет 200 мкГр/сут, а при полетах в период минимума СА (экспедиции ЭО-13 4- ЭО-24) — в 2,5 раза больше (500 мкГр/сут).
В работе (Петров В.М. и др., 2001) специально подчеркивается, что впервые в мировой практике с помощью аппаратуры бортового дозиметрического контроля получен многолетний ряд однородных данных о суточных поглощенных дозах внутри отсеков орбитальной станции за время, превышающее длительность цикла солнечной активности. Представленные результаты измерений доз на
438
борту станции «Мир» в течение всего периода ее функционирования и их анализ позволили сделать ряд выводов, существенных для понимания закономерностей радиационного облучения человека в условиях полета в околоземном космическом пространстве.
Нам важно было дополнительно проанализировать, насколько величина показаний камеры Д2 прибора Р-16 соответствует представленным в разд. 2 значениям локальных поглощенных доз в отсутствии фантома в различных отсеках станции «Мир» с учетом реальной циклограммы нахождения космонавтов (табл. 2.2 и 2.3 для периодов минимума и максимума СА). Это было сделано в работе (Шафиркин А.В. и др., 2002).
Для оценок радиационного риска и расчетов величин обобщенных доз (см. разд. 6-7) необходимо определить среднесуточные значения среднетканевых поглощенных доз в различные периоды СА. В табл. 2.2 и 2.3 нами были представлены расчетные среднесуточные значения поглощенных доз (мкГр) для периодов минимума и максимума СА для 6 зон станции (мест преимущественного пребывания экипажа во время полета и для места расположения ионизационной камеры Д2 штатного бортового дозиметра Р-16. Эти данные представлены также в работах (Коломенский А.В. и др., 1998; Шафиркин А.В., 1999в). Максимальная доза соответствовала локальной поглощенной дозе (в отсутствии фантома). При определении относительных величин доз за 1,0 принимали расчетное значение поглощенной дозы в месте расположения ионизационной камеры Д2 радиометра Р-16. Курсивом в таблицах представлены расчетные значения коэффициентов перехода от показаний дозиметра к значениям доз в представительных точках фантома, которые использовались при оценочных расчетах уровней радиационных воздействий на кожу, кроветворные органы, желудочно-кишечный тракт космонавтов, совершивших полет на ОС «Мир».
Данные этих таблиц свидетельствовали, что перепады доз по обитаемым зонам станции имеют существенное значение и в максимальном случае могут достигать 6 раз. Наиболее защищенным местом является зона в хвостовой части станции. Большой перепад доз объясняется заметным влиянием участков с ослабленной защитой: переходной отсек (ПХО), центральный пост управления (ЦПУ), кабина командира корабля (ККК) и кабина бортинженера (КБИ).
439
Для установления среднесуточного значения локальной поглощенной дозы в периоды максимума и минимума СА нужно учесть в среднем циклограмму работы космонавтов на станции. Нами было проведено исследование влияния циклограммы на расчетную величину среднесуточной поглощенной дозы. В первом варианте предполагали, что космонавты находились в течение дня в отсеках ПХО; ЦПУ; салоне малого диаметра (СМД); в салонах большого диаметра (СБД^ и (СБД2); в ККК в среднем 2; 2; 2; 3; 7 и 8 часов соответственно. Во втором варианте время составляло 0,5; 2,5; 1; 8; 4 и 8 ч.
В первом варианте расчета средняя локальная поглощенная доза по отсекам станции составила по отношению к показанию камеры Д2 радиометра Р-16 значения 1,0 и 0,96 для периодов максимума и минимума СА. Во втором варианте расчета для другой циклограммы получены величины 0,97 и 0,92 для этих же периодов СА. Из этих данных следует, что среднесуточная доза по показаниям радиометра с хорошей точностью соответствует средней локальной поглощенной дозе по станции «Мир».
Аналогичные расчеты, проведенные для представительных точек кожи и кроветворных органов в стандартизованном шаровом фантоме (ГОСТ 25645.203-83. БРЭКАКП. Модель тела человека, 1984), показали, что поглощенная доза на кожу составила для первого варианта расчета значения 0,63 и 0,7 от показаний ионизационной камеры Д2 радиометра Р-16 для периодов минимума и максимума СА соответственно. Во втором варианте получены близкие значения 0,61 и 0,68. Среднекостномозговая доза для этих же периодов С А составила 0,36 и 0,44 от значений радиометра Р-16 в первом варианте расчета и 0,34 и 0,43 — при втором варианте циклограммы. Таким образом изменения циклограммы мало сказываются на относительных оценках доз на кожу и кроветворные органы космонавтов.
Следует отметить, что представленные в табл. 2.2 и 2.3 абсолютные значения доз рассчитаны с точностью 30-40%. Это обусловлено некоторой неопределенностью моделей источников космических излучений, неопределенностью модели защищенности станции и характера глубинных распределений доз от этих источников, неопределенностью, возникающей при учете вклада вторичных излучений. Однако при вычислении отношения абсолютных величин доз в различных отсеках станции и внутри фантома исключается возможная систематическая ошибка расчета, и отно
440
сительные величины доз имеют меньшую погрешность, которая находится в пределах 10-20%.
С целью проверки результатов расчетов они были сопоставлены с результатами проведенной индивидуальной дозиметрии членов экипажей основных экспедиций, осуществленных на станции «Мир». Показания индивидуальных термолюминесцентных дозиметров (при условии их постоянного ношения) соответствуют поглощенной дозе на кожу космонавтов с учетом реальной усредненной циклограммы их работы на станции за весь период работы. Всего проанализировано 53 индивидуальные сборки термолюминесцентных дозиметров (ТЛД) за все экспедиции. Отмечено достоверное различие индивидуальных доз, полученных членами экипажей за экспедиции в периоды максимума и минимума СА, по отношению к показаниям штатного радиометра Р-16. Поэтому мы проанализировали раздельно относительные значения доз за экспедиции для периодов максимума и минимума СА.
Для периода минимума С А (средние данные, начиная с 14-й по 21-ю основные экспедиции в период 1993-1996 гг.) отношение индивидуальных доз за экспедицию (поглощенная доза на кожу по 18 сборкам) к поглощенным дозам, оцениваемым по показаниям ионизационной камеры Д2 радиометра Р-16, (М ± с) составило 0,53 ± 0,10. Поглощенная доза на кожу космонавтов в период минимума СА оказывается приблизительно в 2 раза меньшей, чем по показаниям камеры Д2 дозиметра Р-16 (средняя локальная доза по станции «Мир»). Указанная величина отношения доз, полученная в результате измерений на станции «Мир», находится в достаточно хорошем согласии с результатами расчетов по данным табл. 2.2. Выше было показано, что расчетные значения дозы на кожу для двух вариантов циклограмм составили 0,63 и 0,61. Различие находится в пределах указанной точности расчетов доз (10-20%) и в пределах ошибки отношения доз по показаниям дозиметров ТЛД и камеры радиометра Р-16, которая также может заключаться в пределах 20%.
Для периода максимума СА (средние данные со 2-й по 8-ю основные экспедиции за периоды 1987-1991 гг. и за 24-27 основные экспедиции в течение 1997-1999 гг.) отношение доз по показаниям термолюминесцентных дозиметров ТЛД (21 сборка) к поглощенным дозам, оцениваемым по показаниям ионизационной камеры Д2 радиометра Р-16, (М ± с), оказалось в два раза большим— 1,07 ± 0,20, чем для периода минимума СА. Увеличились
441
среднеквадратичное отклонение и вариабельность показаний дозиметров ТЛД по отдельным членам экипажей. В пределах указанной точности с учетом также некоторой неопределенности в циклограмме можно принять, что при полетах в период максимума СА поглощенная доза на кожу была равна дозе по показаниям камеры Д2 радиометра Р-16.
При полетах на станции «Мир» в период максимума СА полученное отношение поглощенных доз по измерениям ТЛД и по показаниям радиометра Р-16 (равное 1,0) достоверно отличается от расчетных относительных значений дозы на кожу для различных вариантов циклограммы, которые, как показано выше, изменялись в пределах (0,68-0,70). Большие отношения доз, отмечаемые по результатам измерений за экспедицию, по сравнению с результатами расчетов (табл. 2.3), могут быть объяснены большим относительным вкладом ГКЛ в среднесуточную поглощенную дозу и большей жесткостью спектра излучений в этот период СА (Мит-рикас В.Г., 2000; Badhwar G.D. и др., 1996). Наблюдается меньшее ослабление излучения телом космонавта, и показания индивидуальных дозиметров приближаются к значениям доз, отмечаемым по ионизационной камере Д2 радиометра Р-16. Выявленное различие расчетных оценок относительных величин доз на кожу и результатов измерений указывает на необходимость уточнения моделей источников космических излучений на орбите станции «Мир», уточнения глубинных распределений поглощенных доз, а также вклада вторичных излучений в поглощенную дозу при полетах в периоды максимума СА.
Таким образом, на основе результатов измерения индивидуальных доз космонавтов, совершивших полет на станции «Мир», можно считать, что коэффициент перехода КПк от показаний камеры Д2 радиометра Р-16 к дозе на кожу составлял 0,5 и 1,0 для фаз минимума и максимума СА соответственно.
Среднесуточая поглощенная доза для кроветворной ткани с учетом расчетных данных, представленных в табл. 2.2 и 2.3, составляет 0,6 ± 0,05 от дозы на кожу. Анализ глубинного распределения доз по данным, представленным в этих таблицах, показывает, что среднетканевая поглощенная доза для стандартизованного шарового фантома (ГОСТ 25645.203-83 БРЭКАКП. Модель тела человека, 1984) приблизительно на 10-15% выше, чем среднекостномозговая доза и может составить значение, равное 0,7 ± 0,05 от дозы на кожу (Шафиркин А.В. и др., 2002).
442
Таким образом, коэффициент перехода от показаний канала Д2 радиометра Р-16 к среднетканевой поглощенной дозе КПС в фазы минимума и максимума СА составит соответственно 0,35 и 0,70 от дозы, установленной по показанию камеры Д2 радиометра Р-16. Для периодов перехода от фазы минимума С А к фазе максимума СА и обратного перехода можно принять среднее значение коэффициента перехода КПС, равное 0,52.
Для расчетов величин суммарного радиационного риска необходимо установление значений обобщенных доз применительно к оценкам отдаленных радиобиологических эффектов (уравнение (6.5), разд. 6), для вычисления которых необходимо иметь значения среднетканевых эквивалентных доз и оценить значения коэффициентов качества КК0. В работе (Митрикас В.Г., 2000) представлены рассчитанные средние значения КК от детерминированных источников ГКЛ и РПЗ, воздействующих на космонавтов при орбитальных полетах на ОС «Мир» в различные периоды солнечной активности в в течение 22-23-го солнечных циклов. Мы сопоставили эти значения со средними значениями КК космических излучений, оцененными на основе измерения спектров ЛПЭ на ОС «Мир» и кораблях «Спейс шаттл» в 1994-1996 гг. Измерения спектров ЛПЭ были проведены с использованием тканеэквивалентного пропорционального счетчика ТЭПС (Badhwar G.D. et al., 1996), спектрометра «Нозика» (Benghin V.V. et al., 1996), a также специальной методики на основе термолюминесцентных дозиметров (Vana N. et al., 1999).
При расчетах средних значений коэффициентов КК в этих работах авторы использовали в основном зависимость КК от ЛПЭ, представленную в 26-й публикации МКРЗ (Радиационная защита. Рекомендации МКРЗ, Публикация 26, 1978). В работе (Benghin V.V. et al., 1996) дополнительно проведены расчеты на основе зависимости КК от ЛПЭ, установленной в нормативном документе (ГОСТ 25645.218-90 БРЭКАКП, 1991). Сравнительные данные КК, полученные в результате расчетов и на основе измерений спектров ЛПЭ, показаны на рис. 8.13.
В работах (Badhwar G.D., Atwell W., Cash В et al., 1996; Шафиркин A.B., 1999в) проведены оценки дополнительного вклада локальных и альбедных нейтронов в величину суммарной эквивалентной дозы при полетах на станции «Мир» (см. разд. 2.3). Применительно к определению эквивалентной дозы на кроветворные органы или среднетканевой эквивалентной дозы (стандартизован-
443
4
Рис. 8.13. Расчетные и измеренные средние значения КК космических излучений при полетах на орбитальной станции «Мир» в различные периоды СА в течение 22-23*го солнечных циклов
ный шаровой фантом) вклад нейтронов в суммарную дозу от ГКЛ и РПЗ может составлять 15-20%.
Таким образом, максимальная оценка суммарного значения среднетканевой эквивалентной дозы за полет (сЗв) с учетом вышеизложенного может быть определена с использованием данных бортовой дозиметрии на основе следующего уравнения:
D = D(P_16)xKncxKKxl,2, (8.11)
где D(P_16) — суммарная поглощенная доза, сГр за полет по каналу Д2 радиометра Р-16; КПС — коэффициент перехода от показаний радиометра Р-16 к среднетканевой поглощенной дозе; КК — средние значения коэффициента качества космических лучей, воздействующих на экипаж внутри космического аппарата, величины которых для различных периодов СА представлены выше (рис. 8.13).
На основе уравнения (8.11), используя средние значения мощности поглощенной дозы по каналу Д2 радиометра Р-16 для периода максимума С А — 200 мкГр/сут, для периодов минимума СА — 500 мкГр/сут (см. рис. 8.12), значения коэффициентов
444
КПС — 0,7 и 0,35 для указанных периодов, значения КК — 2,6 и 2,1 (см. рис. 8.13), можно оценить значения среднетканевых эквивалентных доз космонавтов за сутки на ОС «Мир» в различные периоды солнечной активности. Эти значения за полет в период максимума и минимума СА составили соответственно 437 и 529 мкЗв/сут. Соответствующие значения доз за годовой полет оцениваются в 16,0 и 19,3 сЗв, соответственно. Для промежуточного периода СА можно принять среднее значение среднетканевой эквивалентной дозы 17,6 сЗв/год.
В разд. 8.1 при анализе зависимости суммарного радиационного риска от обобщенной эквивалентной дозы было получено линейное соотношение между ними (см рис. 8.7). При этом максимальная оценка суммарного радиационного риска на 1 Зв составляла 13%. Таким образом, данную зависимость можно представить в виде:
Rs = 0,13х10-2 хН, (8.12)
где Н — обобщенная эквивалентная доза, сЗв.
Расчеты поглощенных доз внутри орбитальной станции «Мир», проведенные в работе (Митрикас В.Г., 2000), показывают, что вклад ГКЛ в поглощенную дозу максимален в период максимума СА и может составить до 45%. С учетом дополнительного воздействия нейтронов вклад плотно ионизирующих излучений в эквивалентную дозу может достигать 65%. Выше в разд. 2 (см. табл. 2.6) нами оценен вклад плотно ионизирующего излучения в суммарную эквивалентную дозу даже выше (до 80%). В этом случае на основе данных работ (Шафиркин А.В., 1999в; Шафиркин А.В. и др., 2002) можно представить уравнение для максимальных оценок величин суммарного радиационного риска в течение жизни космонавтов от излучений, воздействующих на экипаж в условиях полетов на станции «Мир», непосредственно на основе среднетканевой эквивалентной дозы за полет:
Re = 0,10 х 102D, (8.13)
где D — среднетканевая эквивалентная доза, сЗв.
На основании этих же работ можно представить также уравнение для оценки возможного сокращения предстоящей продолжительности жизни в годах для космонавтов, начинающих полеты в разном возрасте То:
445
ДТ = [3,05 - 0,04 (То - 40)] IO"2 х D, (8.14)
где То — возраст космонавтов, выраженный в годах.
В табл. 8.3 представлены значения радиационного риска отдаленных неблагоприятных проявлений в результате годового полета космонавтов на ОС «Мир».
Таблица 8.3
Расчетные значения среднетканевых эквивалентных доз для космонавтов в результате годового полета на ОС «Мир» в различные периоды СА и возможные отдаленные последствия по результатам, представленным выше, и данным работ
(Петров В.М. и др., 2001; Шафиркин А.В. и др., 2002;
Шафиркин А.В., 2008)
Цикл солнечной активности Минимум СА Промежуточный период СА Максимум СА
Среднетканевая эквивалентная доза, сЗв 19,3 17,6 16,0
Суммарный радиационный риск в течение жизни, % 1,93 1,76 1,6
Риск развития опухолей в течение жизни у космонавтов, осуществляющих полет в возрасте То = 30 лет, % 1,03 0,92 0,85
Риск развития опухолей в течение жизни у космонавтов, осуществляющих полет в возрасте То = 40 лет, % 0,67 0,61 0,55
Риск развития опухолей в течение жизни у космонавтов, осуществляющих полет в возрасте То = 50 лет, % 0,52 0,48 0,43
Ожидаемое сокращение продолжительности жизни у космонавтов в возрасте То = 30 лет, годы 0,67 0,61 0,55
Ожидаемое сокращение продолжительности жизни у космонавтов в возрасте То = 40 лет, годы 0,59 0,54 0,49
Ожидаемое сокращение продолжительности жизни у космонавтов в возрасте То = 50 лет, годы 0,51 0,47 0,43
446
Как указывалось выше, при оценке радиационной опасности длительных космических полетов в качестве главных дозиметрических функционалов для расчетов суммарного радиационного риска в течение жизни космонавтов, риска развития опухолей, возможного сокращения продолжительности жизни космонавтов и других отдаленных неблагоприятных проявлений использовалась обобщенная и среднетканевая эквивалентные дозы.
Основные представления о радиационной опасности в отдаленном пострадиационном периоде связывались авторами исследований до 1990 г. в основном с серьезными морфологическими, структурными и функциональными изменениями в основных регуляторных системах организма. В качестве ведущих интегральных критериев развития поражения в организме использовали изменение возрастных коэффициентов смертности, показатели ускоренного старения и возможное сокращение продолжительности жизни. Эти материалы подробно рассмотрены в разд. 3-6 и в следующем разд. 9.
Как указывалось в разд. 6 для оценки сложного многокомпонентного радиационного воздействия международными комиссиями по радиологической защите и измерениям МКРЗ и МКРЕ предлагалось использовать понятие дозового эквивалента, учитывающего различия относительной биологической эффективности излучений, различия временной и пространственной неравномерности радиационного воздействия на радиобиологические эффекты. Этот же принцип реализован в нормативно техническом документе (ГОСТ 25645.201-83. БРЭКАКП, Термины и определения, 1984) и в понятии обобщенная доза (разд. 6).
В отличие от норм радиационной безопасности НРБ-76/87 и основных санитарных правил ОСП-72/87 в новых нормах НРБ-99 концепция оценки отдаленных последствий была изменена. В качестве основного и единственного неблагоприятного эффекта в отдаленном периоде принимался увеличенный риск канцерогенеза, который следовало вычислять на основе нового функционала — эффективной дозы, которая не поддается непосредственному измерению и рассчитывается на основе дозовых нагрузок, приходящихся на различные органы и ткани. Как показано в разд. 8.1-8.2, суммарный радиационный риск в течение жизни, определяемый на основе модели радиационной скорости млекопитающих, в 3,5-9 раз превышает расчетные оценки риска развития опухолей, поскольку учитывает снижение общего объе-
447
ма компенсаторных резервов организма, ускорение процессов старения и развития неопухолевых отдаленных проявлений. В частности, имеет место увеличение частоты сердечно-сосудистых заболеваний и отмечаются серьезные нарушения в системе кровообращения, сопровождающиеся повышением частоты инфарктов и инсультов (см. разд. 9).
Мы в предыдущем разделе рассмотрели возможность оценки риска развития опухолей на основе значений среднетканевой эквивалентной дозы, предполагая, что все органы и ткани подвержены одинаковому воздействию в этой дозе. Мы рассматриваем эту оценку как дополнительную, а не основную. Чрезвычайная трудоемкость определения эффективной дозы при очень сложном характере радиационного воздействия в условиях космического полета еще раз подчеркивает, что ведущим дозовыми функционалами для определения риска неблагоприятных отдаленных последствий могут быть среднетканевая эквивалентная и обобщенная дозы.
Выше было показано, что на станции «Мир» имеет место существенный перепад поглощенных доз по рабочим отсекам станции и в теле космонавта. Среднесуточная эквивалентная доза зависит также от цикла солнечной активности. Ввиду ограниченности данных измерений доз в фантомах, представляющих модель тела человека, в настоящее время трудно экспериментально определить дозы в различных органах и тканях космонавтов и, следовательно, установить даже с удовлетворительной точностью значение эффективной эквивалентной дозы.
Предварительные оценки по результатам фантомных измерений на корабле «Спейс шаттл» (орбита станции «Мир») за 10 суток полета (Yasuda Н et al., 1999) показали, что эффективная эквивалентная доза на 5-12% выше, чем среднекостномозговая доза, и на 10-15% ниже оцениваемой нами величины среднетканевой эквивалентной дозы. При проведении расчетов риска опухолей на основе среднетканевой дозы мы получаем чуть более высокие оценки риска, что вполне допустимо при решении вопросов радиационной безопасности. С помощью величин среднетканевых доз мы можем также определять величины суммарного радиационного риска в течение жизни космонавтов, которые, как уже упоминалось, в 3,5-9 раз выше, чем риск канцерогенеза, и оценивать возможное сокращение продолжительности жизни космонавтов. Эти соображения убедительно показывают, что для оценки опас
448
ности воздействия ионизирующих излучений на космонавтов в условиях космического полета и для решения вопросов нормирования среднетканевая эквивалентная доза и обобщенная доза являются наилучшими дозиметрическими функционалами.
Опыт проведения расчетов доз на ОС «Мир» и большой цикл дозиметрических и спектрометрических измерений в процессе осуществления длительных 28 основных экспедиций, а также уже значительный опыт проведения полетов на российском сегменте (PC) международной космической станции позволяют нам оценить в первом приближении радиационную опасность для членов экипажей МКС. В целях установления величин среднетканевых эквивалентных доз для членов экипажей при полетах на PC МКС очень полезным оказалось наличие экспериментальных данных измерения поглощенных доз ионизационными камерами Д2 радиометра Р-16, установленных на ОС «Мир» и МКС, в условиях совместных полетов в 2000 г. на близких по высоте орбитах. Среднесуточные значения поглощенных доз на PC МКС в течение сентября-октября 2000 г. оказались в 1,33 раза меньшими, чем показания камеры Д2 радиометра Р-16 на станции «Мир», что частично могло быть связано с большей насыщенностью оборудованием на МКС и большей защищенностью отсеков (Шафиркин А.В. и др., 2002).
Измерения, проведенные на МКС в последующих 2-11-й экспедициях с помощью ионизационной камеры Д2 радиометра Р-16, датчиков приборов ДБ-8 и «Пиле», расположенных в различных отсеках станции, спектрометрического оборудования, включая тканеэквивалентный пропорциональный счетчик ТЭПС и прибор «Люлин», подтвердили на основе построения функции экранированное™ различных отсеков станции, что в связи с добавлением оборудования, защищенность PC МКС увеличилась. Мощность поглощенной дозы по каналу Д2 радиометра Р-16 в период максимума С А (1-7-я экспедиции МКС) в среднем составила 173 мкГр/сут с учетом вычета некоторого вклада в дозу за счет воздействия СКЛ (Цетлин В.В. и др., 2005, 2006). Это на 14% ниже значения, которое представлено выше при полетах на станции «Мир» для периода максимума СА.
В последующие 8-11-ю экспедиции по данным работы (Цетлин В.В. и др., 2006) среднее значение мощности поглощенной дозы, регистрируемое с помощью этой камеры радиометра Р-16 составило 147 мкГр/сут (приблизительно на 30% ниже, чем на
449
станции «Мир»). Меньшие значения мощности дозы, как указывалось выше, связаны с большей насыщенностью оборудования, которая несколько увеличилась в период 8-11-й экспедиции. Это
Номера экспедиций
Рис . 8.14. Средние значения мощностей поглощенных доз за 1-11-ю экспедиции МКС и за 1-8-ю экспедиции на станции «Мир» в период максимума СА по каналу Д2 радиометра Р-16
Отношение индивидуальных доз, полученных космонавтами при полетах на МКС в период максимума С А к суммарным дозам по каналу Д2 радиометра Р-16 составило значение 0,9 ± 0,1 и соответствует такому же соотношению при полетах на станции «Мир». Защищенность от космических излучений внутренних отсеков космического аппарата определяется не только толщиной оболочки, но и массой вещества оборудования, запасами воды и пищевых контейнеров. Анализ функций экранированности по другим отсекам станции показывает, что защищенность увеличивается в большей степени, чем на станции «Мир» и в среднем по оценкам, представленным нами ранее, а также в работе (Цет-лин В.В. и др., 2006), она в 1,4 раза выше.
450
Увеличение толщины защиты на Российском сегменте МКС с неизбежностью приведет к увеличению вклада в суммарную эквивалентную дозу от нейтронов уже не на 20%, как мы принимали для полетов на станции «Мир», а уже по крайней мере на 30%. Кроме того, данные, представленные в работах (Бондаренко В.А., 2008; Митрикас В.Г., 2008), показывают, что расчетные и измеренные значения коэффициентов качества также являются более высокими и превышают ранее представленные значения для стан-ции»Мир» приблизительно на 20% (см рис. 8.15).
Рис. 8.15. Динамика среднемесячных значений коэффициента качества в различных местах PC МКС. Сплошная жирная линия — канал D1 радиометра Р-16; тонкая линия — около стола; пунктирная линия — около центрального поста; точки — в правой каюте (Бондаренко В.А., 2008)
Таким образом, расчетные на основе уравнения (8.11) значения среднетканевой эквивалентной дозы составят 0,93 от значений для станции «Мир». Поэтому значения рисков отдаленных неблагоприятных последствий для космонавтов после завершения годового полета на МКС будут практически теми же самыми, которые представлены в табл. 8.3.
ОТДАЛЕННЫЕ НЕБЛАГОПРИЯТНЫЕ ПОСЛЕДСТВИЯ РАДИАЦИОННЫХ ВОЗДЕЙСТВИЙ НА ЖИВОТНЫХ
□ И ЧЕЛОВЕКА В РАЗЛИЧНЫХ ДОЗАХ (К ПРОБЛЕМЕ НОРМИРОВАНИЯ РАДИАЦИОННЫХ ВОЗДЕЙСТВИЙ НА КОСМОНАВТОВ)
9.1. Отдаленные нарушения в системе кроветворения у млекопитающих после острых и хронических радиационных воздействий с различной мощностью дозы
В разд. 3.3 и 5.1 нами представлены данные о формировании поражения в системе кроветворения в ближайшем периоде после острых радиационных воздействий и хронического облучения с различной мощностью дозы. Подробно рассмотрен характер изменений концентрации стволовых кроветворных клеток, клеточности различных ростков костного мозга, а также концентрации клеток в периферической крови. Рассмотрены также вопросы изменения скорости регенерации в ткани, степень напряжения в системе гемопоэза при увеличении мощности дозы. Продемонстрировано удовлетворительное согласие экспериментально наблюдаемых изменений в системе кроветворения различных животных и расчетных значений, характеризующих динамику изменения концентрации клеток на основе предложенных простых математических моделей.
При обсуждении экспериментальных результатов по хроническому облучению животных (разд. 3.3)' показано, что начальные достоверные изменения, наблюдаемые в костном мозге и периферической крови, имеют место при облучении с мощностью дозы, превышающей 0,1 сЗв/сут. При более низких мощностях доз не удается отметить значимых изменений в системе кроветворения в течение всей жизни. Материалы по хроническому облучению собак, моделирующему дозовые нагрузки при полете на Марс, также подтверждают этот вывод (разд. 4.7). Заметное снижение концен
452
трации лейкоцитов в крови обнаруживается при мощности дозы 0,17 сЗв/сут, а при мощности дозы 0,058 сЗв/сут изменения в крови были связаны лишь с увеличением лабильности концентрации клеток.
Результаты медико-гигиенических исследований, осуществляемые в период 1960-1970-х гг., связанные с регулярными профилактическими обследованиями людей, профессионально работающих с источниками ионизирующих излучений, основанные на большом статистическом материале, показали, что при строгом соблюдении условий безопасности и непревышении допустимых уровней радиационного воздействия (нормативные уровни до 1996 г. составляли 0,017 сЗв/сут, или 5 сЗв/год) отсутствовали значимые изменения в организме, приводящие к достоверным сдвигам в системе кроветворения. Они не приводили к снижению жизнеспособности и работоспособности организма. При длительном наблюдении во времени отдельные авторы отмечали несколько большую лабильность показателей в периферической крови и тенденцию к периодическому снижению числа лейкоцитов и тромбоцитов до нижней границы нормы (Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г., 1975; Григорьев Ю.Г. и др., 1986; Шафиркин А.В., 1999в).
Применительно к решению задачи обоснования нормативных уровней радиационного воздействия для членов экипажа космического аппарата при осуществлении длительных космических полетов большое значение имеют более ранние данные по медицинскому обследованию и анализу заболеваемости персонала, работающего с источниками ионизирующих излучений, которые получены в исследованиях в 1930-1950-е гг. при более высоких допустимых уровнях радиационного воздействия 0,05 сЗв/сут (15 сЗв/год). Следует отметить, что эти уровни воздействия могли превышаться в несколько раз, в связи с недостаточно жестким соблюдением условий и норм радиационной безопасности в те годы.
В работе (Москалев Ю.И., 1991) при анализе эпидемиологических данных по профессиональному облучению отмечено, что начальные сдвиги в системе кроветворения, выражающиеся в некотором снижении продукции кроветворных клеток и снижении числа лейкоцитов (в том числе лимфоцитов) имеют место при уровнях воздействия, превышающих 0,4 Зв/год (0,1 сЗв/сут). При облучении с мощностью дозы 1 Зв/год и выше (> 0,3 сЗв/сут) отмечается уже существенная аплазия костного мозга.
453
Результаты более длительных и подробных исследований показывают, что длительное многолетнее воздействие с мощностями доз 0,05-0,1 сЗв/сут уже приводило к развитию хронической формы лучевой болезни разной степени выраженности в зависимости от стажа работы при накоплении суммарных доз от 100 до 400 сЗв. Заболевания характеризовались медленным развитием и определенной периодичностью течения, связанной с усилением различных проявлений в периоды максимальной радиационной нагрузки и их ослаблением при снижении интенсивности воздействия, что обусловлено развитием восстановительных процессов (Гуськова А.К., Байсоголов Г.Д., 1971).
В системе кроветворения, одной из наиболее радиочувствительных и быстрообновляющихся тканевых систем организма, уже при относительно небольших суммарных дозах происходило раннее повреждение части камбиальных элементов и снижение продукции кроветворных клеток, что вызывало уменьшение количества форменных элементов периферической крови. В последующем оно компенсировалось за счет повышения митотической активности способных к делению костномозговых клеток как стволового и коммитированного отделов, так и морфологически идентифицируемых клеток, что приводило к некоторому новому равновесному пониженному уровню зрелых клеток в костном мозге и периферической крови, несмотря на продолжающееся облучение. Повышенный уровень митотической активности клеток свидетельствует о более напряженном характере гемопоэза.
По мере увеличения длительности радиационного воздействия и поглощенной дозы увеличивалась доля работников, у которых отмечали лейкопению и тромбоцитопению, а также более глубокое относительное снижение численности этих клеток в периферической крови. При увеличении мощности дозы до верхнего указанного предела количество лейкоцитов снижалось на 30%, а тромбоцитов на 20%. Отмечался также ретикулоцитоз, свидетельствующий о компенсаторном усилении напряжения эритропоэза. Однако в последующем периоде (7-14 лет работы) дальнейшего нарастания первоначально наблюдаемых изменений не происходило из-за активации компенсаторных процессов в организме и усиления пролиферативных процессов в системе гемопоэза. Следует отметить при этом серьезное напряжение регенераторных процессов в ткани (Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г. и др., 1986).
454
Близкий эффект по характеру развития поражения в системе кроветворения и его глубине мы отмечали в эксперименте по многолетнему облучению собак при уровнях радиационного воздействия 0,34-0,5 сЗв/сут (разд. 4.7). Возможно, уровни радиационного воздействия у отдельных групп лиц, работавших с источниками ионизирующих излучений в 1930-1950-е гг. могли превышать предельно допустимые значения и достигать близких к указанным в эксперименте значениям мощностей доз.
Следует отметить, что оценка значимости наблюдаемых изменений в системе кроветворения различными авторами существенно различается. Большинство из них подчеркивает достоверность указанных изменений, поскольку они получены при обследовании значительных контингентов людей, профессионально работающих с источниками ионизирующих излучений, что исключает случайную ошибку результатов. Кроме того, наблюдается закономерное нарастание изменений во времени по мере увеличения длительности облучения и суммарных поглощенных доз.
Некоторые исследователи считают при этом отмеченные изменения нормальной физиологической реакцией системы кроветворения в ответ на радиационное воздействие и допускают некоторое снижение клеточности в периферической крови в пределах среднеквадратичного отклонения а. В то же время другие с цито-кинетических позиций фиксируют внимание на развитии радиационного поражения, подчеркивая усиление напряженности функционирования системы гемопоэза. Косвенным доказательством этого могут служить результаты экспериментальных исследований, в которых обнаруживаются деструктивные очаговые изменения в кроветворных органах при близком уровне поглощенных доз (Гуськова А.К., Байсоголов Г.Д., 1971). Усиление напряженности функционирования отдельных систем и напряженности регуляторных механизмов может приводить к большей скорости снижения компенсаторных резервов, ускорению процессов старения и к сокращению продолжительности жизни, что следует из данных, представленных в разд. 4, и из модели радиационной скорости смертности млекопитающих (разд. 5.3). Это подтверждено нами в ряде работ при хроническом действии ряда экологических факторов и длительном действии социального стресса (Шафиркин А.В. и др., 2005).
Нами рассмотрены также проявления и патогенез в системе крови при действии более интенсивного хронического или по
455
вторного облучения при дозах от 0,1 до 10 сЗв/сут. Воздействию в этом диапазоне мощностей доз посвящено значительное число клинических наблюдений при тотальной и субтотальной лучевой терапии, а также большое число экспериментальных данных, которые подробно рассмотрены в разд. 3.3. Установлены характер формирования поражения в системе кроветворения во времени в ближайшем и отдаленном периодах, а также некоторые закономерности количественных изменений в различных ростках костного мозга от мощности дозы и величины поглощенной дозы.
Результаты клинических обследований показывают, что уже при мощностях доз 0,05 сЗв/сут и выше происходит закономерное зависимое от мощности дозы уменьшение количества лейкоцитов в периферической крови, преимущественно за счет нейтрофилов, при этом отмечается некоторая тенденция к увеличению относительного числа незрелых форм (палочко-ядерных нейтрофилов) в лейкоцитарной формуле. В связи с общим уменьшением числа нейтрофилов несколько снижается по сравнению с контролем общая фагоцитарная емкость крови. При мощности дозы 0,1-0,5 сЗв/сут это наблюдается у 2/3 обследованных. Параллельно с наступлением лейкопении или несколько позже происходит уменьшение числа тромбоцитов в периферической крови с возрастанием относительного числа старых дегенеративных форм, а также макроформ тромбоцитов, что приводит к снижению функциональной способности свертывающей системы крови. Значительное снижение числа тромбоцитов, которое может явиться основой выраженного геморрагического синдрома, имеет место при интенсивностях облучения, превышающих 0,5 сЗв/сут. Указанные изменения по мере увеличения длительности облучения сначала возрастают, а затем стабилизируются на уровне поражения тем более высоком, чем выше мощность дозы. Анемия развивается в более позднем периоде при мощности дозы свыше 5,0 сЗв/сут (Гуськова А.К., Байсоголов Г.Д., 1971; Григорьев Ю.Г. и др., 1986).
Описанные изменения в периферической крови обусловлены сдвигами, происходящими в кроветворных органах. Наиболее характерным является постепенное обеднение клеточными элементами получаемого при пункции костного мозга. При мощностях дозы 1-10 сЗв/сут количество ядросодержащих клеток в 1 мм3 пункта может быть сниженным в 5-10 раз. Существенно то, что в течение длительного времени уменьшение общего количества
456
миелокариоцитов определяется в основном снижением числа клеток белого ростка (миелобластического ряда) и в крайне тяжелых случаях при больших значениях мощности дозы уменьшается и абсолютное число клеток эритроидного ряда (эритробластов, нор-мобластов). При интенсивном облучении отмечается уменьшение молодых элементов в гранулоцитарном ростке (снижение индекса созревания нейтрофилов), а также увеличение ретикуло-плазма-тических и некоторых других недифференцированных клеток.
При этом наблюдается постепенное снижение также числа мегакариоцитов в костном мозге, чему соответствует развитие выраженной тромбоцитопении. Известным подтверждением характера изменений в кроветворной системе людей могут служить данные морфологических исследований в экспериментах при соответствующем уровне мощностей доз, которые подробно рассмотрены в разд. 3.3. Динамическое наблюдение кроветворных органов выявляет нарастающую очаговую гипоплазию костного мозга, селезенки, лимфотических узлов, сопровождающуюся очаговой гиперплазией, развитием эктопического кроветворения и существенной активацией пролиферативных процессов (Гуськова А.К., Байсоголов Г.Д., 1971).
С целью оценки возможной скрытой патологии и необратимых изменений в системе кроветворения при указанных уровнях радиационного воздействия мы провели оценку скорости восстановления поражения в системе после прекращения облучения, а также рассмотрели реакцию системы на ряд дополнительных физиологических нагрузок: кровопускание, введение адреналина, пиро-генала и дополнительное острое тестирующее облучение в небольшой дозе. Тщательное изучение резервов кроветворения в ответ на применение различных функциональных нагрузок в восстановительном периоде после перенесенной подострой лучевой болезни в условиях эксперимента или при хроническом облучении персонала показало, что реакция картины крови и костного мозга на нагрузку в основном соответствует нормальной. Особенно это относится к характеру ответной реакции эритроидного ростка. Отмечено лишь отставание во времени восстановления в гранулоцитарном ростке костного мозга и снижение скорости восстановления числа нейтрофилов после кровопускания и введения адреналина. Последнее указывает на более длительное восстановление структурных повреждений, а возможно, и на некоторое скрытое снижение резервов гранулопоэза.
457
При сравнительно длительном предварительном облучении и заметном уменьшении продукции гранулоцитов, применение пи-рогеналовой пробы в восстановительном периоде не дает обычной для нормы отчетливой реакции первоначального выброса числа лейкоцитов в периферическую кровь из костномозгового резерва, что свидетельствует о значительном снижении его величины (Гуськова А.К., Байсоголов Г.Д., 1971). Это нашло свое подтверждение также в многолетнем экспериментальном исследовании, выполненном на собаках (разд. 4.7). Уже в течение первого года непрерывного облучения с мощностью дозы 0,058-0,5 сЗв/ сут, у животных также отмечали выраженное снижение реакции на пи-рогеналовую пробу. В этом разделе кроме снижения костномозгового резерва гранулоцитов отмечали дополнительно уменьшение лейкоэритробластического отношения и общего количества клеток белого ряда при анализе миелограмм у собак.
При исследовании процессов восстановления после 3-летнего облучения животных, когда поглощенные дозы в группах с максимальной дозовой нагрузкой (0,34-0,5 сЗв/сут) составили 360-570 сЗв, обнаружено существенное замедление регенераторной способности кроветворной ткани как в отношении миелопоэза, так и эритропоэза. Это подтвердилось также при изучении реакции гемопоэза на кровопускание. После 6-летнего облучения собак скорость восстановления показателей системы кроветворения становится еще более низкой (см. разд. 4.8).
Напряженный характер регенерации в кроветворной ткани при высоких уровнях радиационного воздействия заключает в себе возможность нарушения регуляции в системе кроветворения, увеличивает вероятность развития различных неблагоприятных отдаленных проявлений Москалев Ю.И., 1991).
Эти изменения можно подразделить на 4 типа:
• формирование резкой лейкопении при абсолютной нейтропении и лимфопении;
• развитие апластической анемии;
• формирование миелоидной или лимфоидной лейкемии;
• развитие выраженного геморрагического синдрома.
Известно, что кроветворная ткань относится к структурам, в которых ослабление мощности дозы или полное прекращение облучения приводит к преобладанию репаративных процессов над дегенеративными. Это делает понятным крайнюю редкость тотальных апластических состояний в отдаленные сроки в клиниче
458
ских наблюдениях за людьми, подвергавшимися хроническому или повторному внешнему облучению. Даже при более высоких уровнях радиационного воздействия, которые рассмотрены в экспериментальных исследованиях (Лаптева-Попова М.С., 1959; Тетерина В.И. и др., 1974; Муксинова К.Н., Суходеев В.В., Мурзина Л.Д., 1979; Джикидзе Э.К., Косиченко Л.П., Куксова М.И., 1980; Колмогорова Л.А., 1980) и представлены в разд. 3.3, анемия была не столько отдаленным последствием, сколько синдромом, непосредственно возникавшим в периоде формирования заболевания, когда резервы всех ростков костного мозга были в значительной степени истощены. Однако по данным патоморфологиче-ского исследования при гибели животных от анемии, изменения в кроветворных органах обычно не носили характера тотальной аплазии. В работе (Гуськова А.К., Байсоголов Г.Д., 1971) сообщалось о том, что в 90% случаев относимые клиницистами гипо- и апластические состояния при внимательном изучении оказались алейкемическими вариантами лейкозов.
Формирование резкой лейкопении при абсолютной нейтропении и лимфопении отмечено нами в экспериментальных исследованиях при облучении животных с мощностью дозы, близкой к верхней рассмотренной границе 12,5 сЗв/сут (разд. 3.3). При облучении профессионально работающих с источниками ионизирующих излучений с мощностью дозы 0,1-0,5 сЗв/сут у 2/3 обследованных параллельно с наступлением лейкопении или несколько позже происходит уменьшение числа тромбоцитов в периферической крови с возрастанием относительного числа старых дегенеративных форм, а также макроформ тромбоцитов, что обусловливает снижение функциональной способности свертывающей системы крови. Значительное снижение числа тромбоцитов является основой выраженного геморрагического синдрома, который имеет место при интенсивностях облучения, превышающих 0,5 сГр/сут.
При высоких уровнях радиационного воздействия, как указывалось выше, могут иметь место нарушения регуляции в системе кроветворения. При этом увеличивается возможность перехода к рассматриваемым патологическим формам, в том числе увеличивается вероятность возникновения лейкозов. Важным моментом является то, что лейкемия представляет собой биологический эффект радиации, для которого наибольшее значение имеет не очаговая, а среднекостномозговая или даже интегральная доза, погло
459
щенная всей массой кроветворной ткани. Поэтому равномерное облучение является наиболее неблагоприятным по сравнению с неравномерным в отношении индукции лейкоза (Гуськова А.К., Байсоголов Г.Д., 1971).
С точки зрения вероятности выхода лейкоза большое значение имеет и мощность дозы радиационного воздействия. При непрерывном облучении собак с мощностями доз 2,5; 5,0 и 10 сЗв/сут первый пик гибели животных был обусловлен развитием аплазии костного мозга и существенным снижением числа клеток в периферической крови (Norris W.P., Fritz Т.Е., Rehfeld С.Е., Brennan Р.С., 1971; Norris W.P., Fritz T.E., 1974 Fritz T.E. et al., 1982). Сроки их гибели варьировали от 209 до 730 суток. Второй пик гибели связан с нарушениями регуляции в кроветворной ткани и развитием миелопролиферативной болезни, что было более присуще облучению с меньшей мощностью дозы. Сроки гибели животных также существенно варьировали и для указанных мощностей доз были в среднем равны 1360 (840-1840); 1460 (990-1950) и 850 (380-1620) суток. В экспериментальном исследовании, выполненном позже, при снижении мощности дозы до уровня 0,5 сЗв/сут, миелопролиферативную болезнь не отмечали (Norris W.P., Fritz Т.Е., 1974).
В проведенном нами исследовании, при 6-летнем облучении собак с мощностями доз 0,06-0,5 сЗв/сут (разд. 4.8), мы также не наблюдали ни одного случая развития лейкоза, хотя в группе животных, получивших суммарную дозу 1140 сЗв, развивались радиационно-обусловленные опухоли различных органов и тканей: рак печени, мочевого пузыря, предстательной железы, злокачественная феохромацитома надпочечников, злокачественная аденома гипофиза, рак подчелюстной железы, меланома глаза. По-видимо-му мощность дозы в большей степени, чем сама величина дозы при протяженном облучении, оказывает влияние на степень напряженности гемопоэза, на вероятность нарушения регуляции в системе кроветворения, приводящего к развитию агранулоцитоза либо анемии и лейкозов.
Значительный интерес при обосновании допустимых доз ионизирующих излучений для космонавтов представляет анализ отдаленных эффектов, отмеченных при обследовании людей, пострадавших при атомных бомбардировках, испытаниях атомного оружия, при авариях на ядерно-энергетических установках, клинических материалов об отдаленных последствиях лучевой тера
460
пии, а также эпидемиологических данных обследования людей, работающих с источниками ионизирующих излучений.
У переживших взрыв атомной бомбы в первые годы после облучения, так же как и у работавших в условиях повышенных уровней радиации по роду своей профессиональной деятельности, наблюдали апластическую анемию. Частота выявления данной патологии кроветворения после облучения в дозах более 1 Зв оказалась в 10 раз выше, чем у облученных в дозах < 0,01 Зв (Москалев Ю.И., 1991).
Данные клинических наблюдений при лучевой терапии свидетельствуют о том, что в отдаленном периоде после радиационного воздействия имеют место лейкопения и лимфопения. По данным миелограмм (пункция облученного участка грудины), в 80% случаев отмечается аплазия костного мозга, в 16% — гипоплазия и лишь в 4% случаев изменений со стороны костного мозга не наблюдали (Москалев Ю.И., 1991).
Многочисленными исследованиями доказано, что ионизирующая радиация может ускорять развитие лейкозов у животных и человека. Минимальное время для появления лучевого лейкоза равняется одному году. Максимальную частоту лейкозов у лиц, подвергшихся воздействию излучения в результате атомных бомбардировок в Японии, наблюдали через 4-8 лет. В эти сроки диагностируют различные виды лейкозов (гранулоцитарный, гемоцитобластный, монобластный и лимфолейкоз). В условиях хронического облучения некоторые исследователи в редких случаях отмечали и развитие эритролейкоза (1-3% от всех видов лейкозов). Обнаружено, что продолжительность латентного периода зависит от формы лейкоза и возраста человека в момент облучения (Москалев Ю.И., 1991).
Из литературных данных следует, что среди различных форм преобладает хроническая миелоидная и реже лимфоидная лейкемия. Показано, что при облучении в молодом возрасте чаще развивается острый миелолейкоз, чем хронический. Последний развивается после больших доз облучения, в то время как для возникновения острого лимфолейкоза достаточно значительно более низких доз излучения. Эпидемиологические данные свидетельствуют также о более значительном риске развития лейкозов у мужчин по сравнению с женщинами (Darby S.C., Nakashima Е., Kato Н., 1985; Москалев Ю.И., 1991).
461
Естественная частота выхода лейкозов составляет приблизительно 50 случаев лейкемии на 1,0 106 населения в год. Дополнительный радиационно-обусловленный риск образования лейкозов за год составляет (1-2) 10-6 на 1 сЗв. Таким образом, доза 1 сЗв увеличивает выход лейкозов на (1,6-3)% по отношению к спонтанному уровню, а доза 30-60 сЗв приводит к удвоению частоты их развития (Григорьев Ю.Г., 1975).
Обследования японцев, переживших взрыв атомной бомбы, указывают на повышение относительного риска развития множественной миеломы с увеличением поглощенной дозы на костный мозг. В отличие от лейкоза минимальный латентный период для множественной миеломы составляет 20 лет. Радиационный риск оценивается равным 48 случаям на 10 000 человеко-лет. Увеличение частоты этой формы патологии отмечено также среди радиологов (Москалев Ю.И., 1991).
Представленные материалы показывают, что при существовавших прежде до 2004 г. нормативных уровнях радиационного воздействия за карьеру космонавтов (Временные нормы радиационной безопасности при космических полетах ВНРБ-75,1976; ГОСТ 25645.215-85 (БРЭКАКП), 1986) и при рассмотренных в разд. 7 и 8 величинах мощностей доз за реальной защитой космического аппарата другие рассмотренные неблагоприятные отдаленные проявления в системе кроветворения, такие как апластическая анемия или геморрагический синдром, не будут развиваться. Можно было ожидать лишь возникновения преходящих цитопе-нических реакций в костном мозге и в периферической крови и увеличения лабильности гематологических показателей. В новом нормативном документе предельные дозы за карьеру космонавтов снижены в 4 раза с 4 до 1 Зв. (Методические указания МУ 2.6.1.44-03 — 2004.) Поэтому изменения в системе кроветворения ожидаются умеренными.
9.2. Морфологические и функциональные изменения в центральной нервной системе и нарушения работоспособности в зависимости от дозы радиационного воздействия
В связи с увеличением длительности полетов и участием космонавтов в повторных экспедициях оценка радиационного риска
462
и риска от всех компонентов их специфической деятельности не может ограничиваться определением только острых детерминированных эффектов в процессе полета, а необходимо рассматривать риски отдаленных проявлений в течение всей их профессиональной деятельности. Увеличивается и возраст космонавтов с присущим этому изменениям структуры заболеваемости и причин смерти. Вклад в этот естественный процесс специфических факторов и требований, предъявляемых к профессии космонавта, заставляет обратить особое внимание на оценку состояния здоровья космонавтов в течение всей их карьеры. При этом прежде всего необходимо проанализировать функциональное состояние центральной нервной системы (ЦНС), церебральной гемодинамики, а также состояние сердечно-сосудистой системы (ССС). Поэтому основное внимание при установлении допустимых предельных уровней радиационного воздействия следует уделить состоянию двух указанных выше систем.
При оценке влияния ионизирующих излучений на ЦНС большое значение имеют вопросы количественного анализа возникающих морфологических изменений нейронов. К сожалению, в большом количестве исследований описывается совершенно различный спектр изменений, отсутствует стандартная классификация признаков развивающейся патологии нейронов. Субъективное описание признаков деструкции нервных клеток и отсутствие количественных методов затрудняют проведение анализа зависимости степени повреждения нейронов от дозы и времени после облучения.
В работе (Федоренко Б.С., Шафиркин А.В., Буденная Н., 1998) показано, что более объективную оценку изменений в нейронах у экспериментальных животных можно провести, используя классификацию тяжести изменений клеток и количественный учет частоты рассматриваемых проявлений. В этой работе при оценке морфологических изменений у облученных животных, выделяли три основные группы развивающихся нарушений:
• морфо-функциональные изменения нейронов, характеризующиеся умеренным хроматолизом и гиперхроматозом, вакуолизацией цитоплазмы, изменением размеров клетки и ядра;
• изменения компенсаторно-приспособительного характера, выражающиеся в гипертрофии нейрона, складчатости и гипер-хромном окрашивании ядерной мембраны, укрупнении глыбок
463
нисслевского вещества, увеличении количества двухъядрышковых и «сближенных» нейронов;
• дистрофические изменения, проявляющиеся в виде тотального хроматолиза, выраженной вакуолизации, набухания цитоплазмы и ядра, тотального гиперхроматоза, когда клетка принимает веретенообразную форму, а ядро не контурируется (к этой группе изменений добавляли клетки с необратимыми изменениями: «ишемические» нейроны и клетки-тени).
При морфологическом анализе нейронов условно эти три категории изменений авторы обозначали как неизмененные нейроны, нейроны с наличием легких и репарируемых морфофункциональных изменений и дистрофически измененные нейроны с необратимыми структурными повреждениями.
Использование этой классификации, несмотря на отсутствие стандартизации метода обследования, и наличие субъективизма при визуальной оценке структурных нарушений показали, что результаты количественного анализа серьезных деструктивных изменений нейронов у разных авторов близки между собой.
В работе (Федоренко Б.С., Шафиркин А.В., Буденная Н., 1998) проведен качественный и количественный анализ дистрофических изменений нейронов сенсомоторной коры больших полушарий головного мозга крыс в различные сроки после облучения гамма-лучами. Для этой цели анализировали состояние 1000 нейронов у каждого животного и учитывали характер изменения процентного соотношения неизмененных нейронов, нейронов с признаками легко обратимых изменений и дистрофически измененных нейроцитов, включая и необратимые изменения клеток.
Характеризуя качественные изменения нейронов, учитывали состояние базофильного вещества цитоплазмы и ядер клеток. В первой серии экспериментов животные, облученные гамма-лучами 137 Cs в дозах 1,0 и 4,0 Гр, были обследованы через 6 часов, на 1-е, 7-е и 20-е сутки после облучения.
Сопоставление морфологических изменений в нейронах коры головного мозга, возникающих после облучения крыс (табл. 9.1), показывает усиление поражения с увеличением дозы и сроков обследования.
Уже спустя 6-24 часа после гамма-облучения в дозе 1,0 Гр выявлены ранние морфофункциональные изменения корковых нейронов, а через 7 суток доля нейронов с дистрофическими измене-
464
Таблица 9.1
Количественные данные о структурных изменениях нейронов коры головного мозга крыс в ранние сроки после воздействия гамма-излучения 137Cs
465
Доза, Гр Характер изменений Частота измененных нейронов в % в разные периоды после облучения
6 часов 24 часа 7 суток 20 суток
0 (контроль) Неизмененные нейроны 89,1 ± 0,4 89,1 ± 0,4 89,1 ± 0,4 89,1 ± 0,4
Легко измененные нейроны 8,7 ± 0,5 8,7 ± 0,5 8,7 ± 0,5 8,7 + 0,5
Дистрофически измененные нейроны 2,2 + 0,5 2,2 ± 0,5 2,2 ± 0,5 2,2 ± 0,5
1,0 Неизмененные нейроны 85,4 ± 0,8 85,3 ± 1,3 82,7 + 1,5 85,9 ± 0,7
Легко измененные нейроны 12,0 ± 0,4 11,7 ± 0,5 12,4 ± 0,5 10,6 ± 0,4
Дистрофически измененные нейроны 2,6 ± 0,3 3,0 ± 0,3 3,9 ± 0,3 3,5 ± 0,3
4,0 Неизмененные нейроны 83,5 ± 0,9 81,5 ± 0,6 80,8 ± 0,5 81,7 ± 0,5
Легко измененные нейроны 14,1 ± 0,5 14,5 ± 0,5 15,0 ± 0,5 10,6 ± 0,5
Дистрофически измененные нейроны 2,4 ± 0,3 4,0 ± 0,3 4,2 ± 0,5 7,6 ± 0,5
ниями увеличилась в 1,7 раза по сравнению с контролем. После облучения в дозе 4,0 Гр к 7 суткам доля необратимо измененных нейронов увеличилась в 1,9 раза, а к 20 суткам — в 3,5 раза. Были отмечены нейроны с тяжелыми изменениями: тотальным хроматолизом, вакуолизацией цитоплазмы и распадом ее базофильного вещества, обеднением ядра хроматином. Единичные нервные клетки погибали.
Во второй серии экспериментов (Федоренко Б.С., Шафиркин А.В., Буденная Н., 1998) прослежено формирование структурных нарушений нейронов у крыс в период 1-3 месяца после гамма-облучения в дозах от 0,25 до 4 Гр. Результаты анализа степени тяжести структурных изменений нейронов коры головного мозга у крыс представлены в табл. 9.2.
Таблица 9.2
Структурные изменения нейронов сенсомоторной коры головного мозга крыс через 1 и 3 месяца после облучения гамма-лучами 137Cs
Доза, Гр Неизмененные нейроны, % Легко измененные нейроны, % Нейроны с дистрофическими изменениями, %
0 (контроль) 1м Зм 89,1 ± 0,6 91,6 ± 1,0 8,7 ± 0,5 5,4 ± 0,4 2,2 ± 0,5 3,0 ± 0,7
0,25 1м Зм 86,5 ± 1,0 77,6 ± 0,5 10,6 ± 1,0 12,4 ± 1,1 2,9 ± 0,5 6,5 ± 0,5
0,5 1м Зм 88,7 ± 0,6 77,5 ± 0,5 8,0 ± 0,5 7,4 ± 0,7 3,3 ± 0,5 7,0 ± 0,4
1,0 1м Зм 86,5 ± 0,7 79,4 ± 0,6 9,0 ± 0,5 13,6 ± 1,0 4,5 ± 0,6 7,0 ± 0,5
2,0 1м Зм 81,8 ± 1,2 78,2 ± 1,2 11,0 ± 1,1 12,6 ± 2,0 7,2 ± 0,7 9,2 ± 1,0
4,0 1м Зм 76,7 ± 1,5 75,3 ± 1,2 12,6 ± 1,5 12,2 ± 2,0 10,7 ± 1,1 12,5 ± 1,0
Материалы исследования показали, что дозы 0,25 и 0,5 Гр не приводят к возникновению заметных изменений структуры нейронов через месяц после облучения. При этих дозах не отмечено изменения количественного соотношения измененных и неизмененных нейронов по сравнению с контролем. Эти дозы оказывали
466
некоторое стимулирующее воздействие, вызывая умеренную гипертрофию нейрона и глии при хорошо выраженных внутриклеточных структурах. Однако следует отметить, что уже при столь небольших дозах через 3 месяца отмечаются более глубокие структурные изменения клеток и достоверное увеличение процента дистрофически измененных нейронов.
Более выраженные структурные изменения характерны для дозы 2 Гр. Уже через месяц после облучения животных в этой дозе размеры цитоплазмы и ядер нейронов уменьшались по сравнению с облучением в малых дозах, что может свидетельствовать о некотором снижении компенсаторных возможностей клеток. Ядра клеток были богаты хроматином. Встречались двухъядрышковые и сближенные нейроны. Увеличивалось количество ядер свободной глии, а в ядре глии в субкортикальном веществе подвергались пикнозу, атрофии и деформации. Количество клеток с дистрофическими изменениями через 1-3 месяца было в 3 раза выше, чем у контрольных животных.
С увеличением дозы излучения до 4,0 Гр нарастало число атро-фически измененных нейронов и так называемых клеток-теней. Это свидетельствует о прогрессировании дистрофических изменений. Развивающиеся изменения приводили к пространственной реорганизации коры. Появлялись очаги ганглиозно-клеточных за-пустений, а также комплексы из нескольких нейронов. За счет гиперплазии ядер свободной и перинейрональной глии повышался глио-нейрональный индекс. К концу 3 месяца после облучения количество клеток с дистрофическими изменениями увеличивалось по сравнению с контрольной группой животных в 4,2 раза.
Данные табл. 9.2 показывают, что количество нейронов с необратимыми серьезными изменениями увеличилось через 3 месяца в 1,5-2 раза по сравнению с их числом через месяц после гамма-облучения. Из этого следует, что для реализации лучевого повреждения в нейронах головного мозга необходимо определенное время. Происходит не только своеобразная «консервация» повреждений, но и постепенное нарастание глубины изменений, приводящее к снижению полноценных в функциональном отношении клеток и увеличению числа клеток с дистрофическими изменениями (Александров С.Н., 1976). Рассмотренные результаты, характеризующие степень тяжести структурных изменений нейронов коры головного мозга у крыс через 1-3 месяца после облучения, подтверждают зависимость развивающихся нарушений от ве
467
личины дозы гамма-излучения и срока обследования. Они заметно возрастают с увеличением поглощенной дозы и времени после облучения.
Анализ результатов более длительных экспериментальных исследований еще более отчетливо показал, что для развития структурных изменений клеток ЦНС требуется определенное время (не менее 3-4 недель), когда деструктивные изменения на первом этапе достигают максимального развития. К этому сроку в других системах организма уже наступает период восстановления. Согласно обзору литературных данных Научного комитета ООН по действию атомной радиации при воздействии ионизирующих излучений в дозах 1-6 Гр, дегенеративные изменения нейроцитов коры головного мозга сохраняются и через несколько месяцев после облучения. Проявляется отчетливая зависимость не только от дозы излучения, но и от длительности постлучевого периода (Карповский А.Л. и др., 1981, 1982; Карповский А.Л., 1985; Ионизирующее излучение: источники и биологические эффекты Т. II НКДАР ООН, 1982).
С целью определения возможного ухудшения состояния здоровья и работоспособности космонавтов в отдаленном послеполетном периоде, и учитывая постоянное увеличение во времени числа клеток с дистрофическими изменениями, важно оценить динамику повреждения нейронов в более отдаленном периоде. К сожалению, имеется ограниченное число подобных экспериментальных исследований на животных. На рис. 9.1 представлена динамика числа дистрофически измененных нейронов у крыс в течение года после облучения в дозах 1-6 Гр по результатам исследования, представленного в работе (Карповский А.Л., 1985). На этом же рисунке представлены для сравнения и данные, рассмотренные выше для доз 0,25-0,5 Гр.
Из данных, представленных на рис. 9.1, видно, что количество необратимо измененных нейронов коры головного мозга прогрессивно нарастало с увеличением дозы и сроков обследования после облучения. Кроме того, из этих данных следует, что процесс развития структурных изменений нейронов носит фазный характер и состоит из двух периодов.
Первый из них (1-3 месяца после облучения) характеризуется замедленным развитием нарушений и относительно невысокими уровнями повреждений. Начиная с 3-го месяца и далее наблюдается резкое увеличение скорости нарастания морфологических
468
нарушений нейронов. Автор работы (Карповский А.Л., 1985) считает, что это, по-видимому, связано с дополнительным формированием повреждения сосудистого эндотелия, цикл обновления клеток которого длится около 3-4 месяцев.
Срок обследования крыс, месяцы
Доза 0,25 Гр —о— Доза 0,5 Гр • Доза 1 Гр
—О—Доза 2 Гр — А— Доза 4 Гр й Доза 6 Гр
Рис. 9.1 Относительное число нейронов с дистрофическими изменениями (%)
Авторы работы (Ушаков И.Б., Федоров В.П., 1983) также высказывают мнение, что наряду с прямым непосредственным деструктивным действием ионизирующих излучений на нейроны, дополнительным фактором, приводящим к большей скорости образования нейронов с необратимыми изменениями, является отсроченная реакция на облучение со стороны эндотелия сосудов и астроцитарно-капиллярного комплекса, которая ведет к нарушению трофики и водно-электролитного обмена. Они считают, что повреждение эндотелия сосудов, развивающееся спустя несколько месяцев после лучевого воздействия, приводит к изменению состояния гемато-энцефалического барьера, увеличению проницаемости сосудистой стенки, недостаточности питания мозговой ткани. Это в свою очередь вызывает большую скорость морфологических изменений нейронов. Некоторые исследователи даже отдают ведущую роль в патогенезе радиационного поражения ЦНС изме
469
нениям эндотелия мозговых сосудов (Court L., Bassant М., Gourmelon Р. et al., 1986).
Таким образом, с увеличением длительности наблюдения скорость деструкции нервных клеток ЦНС возрастает. В патологический процесс вовлекаются нарушения со стороны сосудистого эндотелия, ухудшающие кровоснабжение нервных клеток, и изменения глиальных элементов, что приводит к увеличению скорости образования нейронов с дистрофическими изменениями. Из данных табл. 9.2 и рис. 9.1 следует, что при действии гамма-излучения в дозах 0,25-1,0 Гр уже отмечается более высокая скорость формирования необратимо измененных нейронов по сравнению с контрольными необлученными животными. Следовательно, с учетом отдаленной реакции со стороны нейронов можно говорить о достаточно высокой радиочувствительности нервной ткани.
Для космической биологии и медицины большой интерес представляют исследования функциональных и морфологических изменений в ЦНС после протяженного с малой мощностью дозы и фракционированного воздействия ионизирующих излучений и сравнение их с эффектами, возникающими в результате однократного облучения. К настоящему времени анализ литературных данных позволяет прийти к заключению, что характер и глубина развивающихся функциональных и морфологических изменений в ЦНС в ближайшем и отдаленном периоде после облучения практически не изменяется при фракционированном облучении или уменьшении мощности дозы радиационного воздействия. Количественные характеристики возникающих изменений зависят лишь от общей поглощенной дозы и длительности периода до начала обследования. Следует, однако, иметь в виду, что в ряде исследований отмечено даже усиление радиационного поражения в ЦНС при фракционированном облучении по сравнению с однократным облучением, однако таких исследований пока недостаточно для достоверной количественной характеристики степени усиления реакции ЦНС при данном режиме радиационного воздействия.
Для решения вопросов обеспечения радиационной безопасности космических полетов большое значение имеет изучение особенностей биологического действия излучений с высокой плотностью ионизации и с высокими значениями линейной передачи энергии (ЛПЭ) на нейроны коры головного мозга. Данные о влиянии космической радиации на ткани ЦНС животных и человека очень ограничены. В большей степени изучены структурные изме
470
нения в ЦНС экспериментальных животных в результате воздействия быстрых нейтронов. Имеется ряд публикаций по действию ускоренных тяжелых заряженных частиц.
Анализ литературных данных затруднен тем, что, как указывалось выше, отсутствует единая классификация отмечаемых изменений при сравнении воздействия различных видов излучений в различных дозах и не использовались количественные методы оценки изменений. Радиобиологические исследования по воздействию ускоренных протонов и тяжелых заряженных частиц (ТЗЧ) пока малочисленны. При составлении базы радиобиологических данных по воздействию излучений с высокими значениями ЛПЭ в настоящее время возможно использовать также экспериментальные результаты по воздействию быстрых нейтронов различной энергии.
В работе (Федоренко Б.С., Шафиркин А.В., Буденная Н., 1998) проведен анализ литературных данных и представлены результаты экспериментальных исследований по изучению структурных нарушений в нейронах коры головного мозга под воздействием различных видов излучений, в том числе нейтронов различных энергий и тяжелых заряженных частиц. В этой работе использовали количественный и качественный анализ морфологических изменений нейронов в ближайшем и отдаленном периодах. Как и при анализе результатов действия стандартных видов излучений, выделяли те же три основные группы развивающихся нарушений, которые были рассмотрены выше. На основе морфологического анализа 1000 клеток сенсомоторной коры оценивали процентное соотношение неизмененных нейронов, нейронов с легкообратимыми изменениями (признаки структурно-функциональных и компенсаторно-приспособительных изменений) и дистрофически измененных нейроцитов. В этой работе на основе данных морфологических изменений в нейронах оценено, что при действии быстрых нейтронов значение коэффициента ОБЭ составило 7,5, а при облучении ионами кислорода с энергией 250 МэВ/нуклон (ЛПЭ 190 кэВ/мкм) оно возросло до 10,0.
Как указывалось выше при воздействии гамма-излучения цезия (137Cs) в дозах 0,25-0,5 Гр, нами не отмечено заметных клеточных изменений спустя месяц после облучения. Эти дозы явились как бы стимулятором, вызывая умеренную гипертрофию нейрона при хорошо выраженных внутриклеточных структурах.
471
После воздействия же ионов углерода с энергией 300 МэВ/ну-клон в дозе 0,1 Гр наблюдали набухание тел и отростков нейроци-тов, хроматолиз, вакуолизацию цитоплазмы, существенное увеличение количества нейронов с дистрофическими изменениями. Облучение в столь малой дозе ионами углерода вызывало в коре головного мозга такой же процент дистрофически измененных нейроцитов, как и гамма-облучение в дозе 2,0 Гр. Коэффициент ОБЭ оценивается равным 20. При увеличении дозы ионов углерода до 0,25 Гр эффективность их воздействия несколько снижалась (ОБЭ = 16). При дальнейшем увеличении дозы ионов углерода до 1,0 Гр коэффициент ОБЭ снижается с 20 до 4 (Федоренко Б.С. и др., 1987; Федоренко Б.С., Шафиркин А.В., Буденная Н., 1998).
Обращает на себя внимание, что уже при воздействии малых потоков ионов углерода и кислорода 104-105 частиц/см2 (энергия 300 МэВ/нук), а также в дозе 0,01 Гр, в коре головного мозга отмечались нарушения цитоархитектоники, связанные с появлением очагов клеточного опустошения во II и III слоях коры, отмечались дистрофически измененные нейроциты, в том числе и клетки с необратимыми изменениями. Так, через месяц после облучения крыс ионами углерода и кислорода в дозе 0,01 Гр количество нейронов с дистрофическими изменениями у крыс в 2 раза превышало уровень у необлученных животных и в 1,5 раза уровень у животных, облученных гамма-излучением в дозе 1,0 Гр. Кроме того, отмечались изменения профильных полей нейронов и их ядер, ядерно-цитоплаз-матическое отношение и другие показатели. Коэффициент биологической эффективности превысил значение, равное 100.
Таким образом, проведенные исследования свидетельствуют об очень высокой биологической эффективности воздействия ускоренных заряженных частиц на нейроны по сравнению с гамма-излучением. На основании полученных данных с облучением крыс малыми потоками ионов углерода и кислорода можно предположить отсутствие пороговой дозы для воздействия тяжелых заряженных частиц. Оцененные значения коэффициентов ОБЭ по количеству нейронов с дистрофическими изменениями почти в 5 раз превысили предельные значения коэффициентов качества ККО применительно к оценкам неблагоприятных отдаленных эффектов, регламентированных нормативными документами (Рекомендации МКРЗ, Публикация 26, 1978; ГОСТ 25645.218-90, БРЭКАКП, 1991). Это свидетельствует о возможной более высо
472
кой опасности воздействия на космонавтов излучения ГКЛ, что следует учитывать при обеспечении радиационной безопасности космических полетов.
Кроме рассмотренных морфологических изменений нейронов коры головного мозга для установления нормативных уровней радиационного воздействия на космонавтов, важно проанализировать также характер функциональных расстройств со стороны центральной нервной системы (ЦНС) и оценить возможное нарушение работоспособности космонавтов в отдаленном периоде после облучения в различных дозах.
В наиболее общем виде работоспособность оператора определяется как функция четырех основных аргументов: физического состояния оператора, его психического статуса, сложности выполняемой работы и условий, в которых она протекает. Существенно усложняется оценка состояния работоспособности в условиях космического полета, когда качество работы космонавтов в значительной степени зависит также от величины и характера распределения поглощенной дозы во времени от источников ионизирующего излучения, от интенсивности и длительности воздействия большого числа нерадиационных факторов полета, включая длительное эмоциональное напряжение. При этом сам характер работы является в высшей степени сложным, требует максимального профессионализма, постоянного сосредоточенного и напряженного внимания.
Главной особенностью количественных оценок опасности ближайших непосредственных проявлений при воздействии ионизирующих излучений в условиях космического полета является необходимость установления вероятности возникновения различных проявлений, степени их тяжести и продолжительности. При наличии стохастического характера радиационного воздействия в условиях космического полета как ближайшие, так и отдаленные проявления будут, как правило, носить вероятностный характер. Это следует учитывать при оценке изменения работоспособности космонавтов. Однако в настоящее время отсутствуют систематизированные данные по количественной оценке работоспособности космонавтов и тем более необходимые вероятностные показатели уровня работоспособности. Отсутствуют материалы об изменении работоспособности при воздействии нерадиационных факторов полета как в отдельности, так и в сочетании с ионизирующей радиацией.
473
Метод косвенной оценки работоспособности после острых облучений по данным клинических исследований находит применение ввиду того, что прямых данных по работоспособности облученного человека крайне мало. Итогом клинических обследований облученных людей, материалы которых представлены в литературе (Григорьев Ю.Г., 1958; Григорьев Ю.Г., 1975; Langham W.H., Brooks F.M., Grahn D., 1965; Radiobiological factors in manned space flight, 1967; Саксонов П.П., Антипов B.B., Давыдов Б.И., 1968; Гуськова А.К., Байсоголов Г.Д., 1971; Ранние эффекты облучения человека, НКДАР ООН, 1988), является многообразная картина симптомов, которые, безусловно, имеют непосредственное отношение к физической и психической работоспособности человека. Главный интерес, с точки зрения оценки работоспособности космонавта, представляют ранние соматические эффекты общего острого облучения.
Начальная фаза включает симптомы первичной лучевой реакции, появляющиеся в первые часы после облучения. Эта реакция является отражением отклика периферических отделов нервной системы и характеризуется желудочно-кишечными симптомами: отказом от пищи, тошнотой, рвотой, кишечными спазмами, диареей, а также нервно-мышечными симптомами, к которым относятся общая слабость, апатия, безразличие, утомляемость, головокружение, головные боли, нарушение сна, потоотделение, лихорадка, гипотензия, парастезия конечностей. Следует отметить, что в условиях невесомости перечисленные выше симптомы, снижающие работоспособность, могут усиливаться. Вероятность возникновения ряда симптомов, в максимальной степени влияющих на работоспособность человека, время их проявления, продолжительность и выраженность, зависят в основном от поглощенной дозы излучения, индивидуальной радиочувствительности, размеров облучаемой части тела и сопутствующих факторов.
Показано, что при дозах облучения 25-50 сГр (нормативные уровни для однократного облучения) выраженная реакция в ближайшие несколько часов после облучения может иметь место лишь у наиболее радиочувствительных индивидуумов (в 1-2% случаев). Учитывая индивидуальный отбор космонавтов, в очень редких случаях могут отмечаться лишь очень слабые симптомы первичной лучевой реакции (ПЛР) и работоспособность после указанных доз практически не будет претерпевать изменений. При более высоких дозах увеличивается частота и тяжесть ПЛР.
474
Подробно материалы по первичной лучевой реакции изложены в разд. 3.1.
Большое значение при оценке работоспособности оператора имеет состояние сенсорных систем (функции анализаторов). Установлено, что функционирование почти всех анализаторов существенно изменяется под влиянием облучения. Уже в ранних исследованиях отмечались изменения ряда анализаторов человека (кожный, вкусовой, обонятельный) в различные сроки после воздействия (Григорьев Ю.Г., 1958). При острой лучевой болезни средней и тяжелой степени обнаружено изменение зрачковых рефлексов, сосудистые нарушения на глазном дне, повышение порогов возбудимости, извращенная реакция на корковые стимуляторы. Выявлено нарушение взаимодействия анализаторов: усиление, ослабление и извращение реакции на раздражитель (Глазунов И.С., Благовещенская В.В., 1968).
Изучение зрительно-моторной координации позволяет оценить точность движений, способность координировать движения в заданном темпе, коррегировать их под контролем зрения, а также судить об утомляемости двигательного анализатора. В работе (Payn R., 1963) изучалось влияние общего острого облучения на выполнение трех известных сенсомоторных тестов: комплексный координационный, двуручный координационный и тест компенсаторного слежения. Получено существенное ослабление скорости движения испытуемых после облучения в дозах 100-200 сГр.
Для обоснования допустимых доз для членов экипажа космического аппарата в процессе длительного полета и за всю профессиональную деятельность, а также прогноза возможного изменения состояния здоровья космонавтов и их работоспособности как в ближайшем, так и в отдаленном периодах важное значение могут иметь данные периодического обследования лиц, непосредственно работающих с источниками ионизирующих излучений и подвергающихся хроническому радиационному воздействию в различных дозах. Для достижения этой цели плодотворным оказалось рассмотрение материалов работ (Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971), в которых, с одной стороны, представлены результаты диспансерных наблюдений за большими группами людей с выявлением наиболее часто встречающихся отклонений со стороны ЦНС, с другой — данные углубленных клинико-физиологиче
475
ских исследований на строго отобранных, но ограниченных по численности группах.
В работах показано, что начальные обратимые функциональные сдвиги высшей нервной деятельности (ВНД), не выходящие значительно за пределы физиологической вариабельности, обнаруживаются с достаточно большей частотой, чем в контроле, уже через несколько лет при облучении с мощностью дозы в пределах допустимых в то время значений или несколько их превышающих 0,01-0,1 сЗв/сут (5-15 сЗв/год). Оказалось, что при суммарных дозах 50-70 сЗв статистически достоверно увеличивается в основной группе (3200 человек) число легких сдвигов нейрососудистой регуляции. Эти изменения носят адаптивный характер и не сказываются на работоспособности. Отмечено лишь некоторое увеличение числа случаев невротических состояний, но оно не было статистически достоверно (Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971).
При воздействии с мощностью дозы, превышающей предельно допустимые значения, до 0,1-0,2 сЗв/сут и достижении за несколько лет суммарных поглощенных доз 70-150 сЗв в 37% случаев развивался неспецифический неврологический синдром нарушения нервно-висцеральной регуляции. При этом более часто, чем в контрольной группе, наблюдаются сомато-вегетативные нарушения: общая слабость, повышенная утомляемость, головные боли, головокружение, раздражительность, расстройства сна, забывчивость, боли и неприятные ощущения в области сердца, вазомоторные расстройства (Голодец Р.Г., 1963). Следует отметить, что перечисленные выше неврологические симптомы вместе с рядом других проявлений в различных системах организма соответствуют I стадии хронической лучевой болезни.
Частота синдрома нейроциркуляторной дистонии закономерно увеличивается до 60-70% при облучении с более высокими значениями мощностей доз 0.1-1.0 сЗв/сут (10-25 сЗв/год) и обследовании спустя 7-15 лет работы при накоплении суммарных доз 150-400 сЗв. Это имело место у лиц некоторых профессиональных групп при неблагоприятных в прошлом условиях труда и несоблюдении норм радиационной безопасности. При облучении с указанными высокими значениями мощностей доз развиваются проявления, характерные для II и III стадий хронической лучевой болезни. Кроме отмеченного значительного увеличения частоты синдрома нейроциркуляторной дистонии, сопровождающейся об
476
щими гемодинамическими сдвигами и серьезными нарушениями периферического кровообращения, в том числе и в головном мозге, наблюдаются нарушения компенсаторных механизмов в ЦНС, выявляются структурные изменения (Гуськова А.К., Байсоголов Г.Д., 1971). При исследовании состояния сферы двигательной иннервации по данным электромиографии имели место нарушения координационных отношений мышц и умеренное снижение амплитуды биоэлектрической активности при произвольном их сокращении. Сама же двигательная функция не нарушалась.
У пациентов, облучавшихся с мощностью дозы, в 7-18 раз превышающей предельно допустимый уровень суточного облучения (до 0,1-0,3 сЗв/сут) в течение 7-10 лет, развивался характерный симптомокомплекс астенического синдрома, при котором отмечается снижение функциональных возможностей высших отделов ЦНС, проявляющихся в повышении психической утомляемости, снижении внимания, памяти, нарушении взаимодействия анализаторов. Больные с астеническим синдромом, подвергавшиеся облучению, делают в несколько раз больше ошибок, чем в контрольной группе при выполнении заданий, связанных с запоминанием, вычислительной и двигательной работой. У них наблюдаются неадекватные вегетативные сдвиги и рефлекторное повышение мышечного тонуса. Эти пациенты производят дополнительные двигательные акты, не связанные с раздражением, причем латентный период моторных реакций отличается большей продолжительностью (Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971; Сумина М.В., Юрков Н.Н., Ларионова И.К., 1983; Окладникова Н.Д., Пестерникова В.С., Сумина М.В. и др., 1992; Азизова Т.В., 1999).
В работах (Голодец Р.Г., 1963; Глазунов И.С., Благовещенская В.В., Мартынова Г.Н., 1969; Глазунов И.С. и др.1971; Азизова Т.В., 1999) отмечается, что общее состояние больных с астеническим синдромом (АС), развившегося в результате длительного облучения, характеризуется: вялостью, снижением двигательной активности, общей физической слабостью, понижением мышечного тонуса, нарушением статической и двигательной координации, кожной чувствительности, изменением вегетативных рефлексов зрачков на свет. Авторы рассматривают этот синдром как состояние нервно-психической слабости, которая проявляется в нарушении тонуса нервной системы, более быстрой ее истощае-мости.
477
У этих людей наблюдалась неспособность к длительной непрерывной напряженной умственной и мышечной работе, отмечались снижение всех форм психической активности, снижение порогов и повышение чувствительности к обычным световым, звуковым и особенно обонятельным и вкусовым раздражителям, повышенная психическая ранимость, колебания настроения, тревожность, сужение круга интересов, расстройства памяти, снижение активного внимания. Аффекторные реакции были нестойкими и лишенными экспрессии, поскольку развивались на фоне общей вялости организма.
Изменения корковой нейродинамики больных при астеническом синдроме могут быть выражены: во-первых, в ослаблении внутреннего торможения при относительной сохранности возбудительного процесса; во-вторых, в ослаблении возбуждения; в-третьих, в нерезком ослаблении обоих нервных процессов. Кроме того, наблюдаются усиление, извращение или ослабление взаимодействия анализаторов, ослабление концентрации нервных процессов, удлинение латентных периодов двигательных реакций, замедление запоминания (Глазунов И.С., Благовещенская В.В., Мартынова Г.Н., 1969; Глазунов И.С. и др., 1971).
У лиц, подвергавшихся профессиональному облучению, при развитии астенического синдрома с помощью речедвигательной методики были обнаружены отчетливые изменения условных рефлексов (УР), свидетельствующие о нарушении подвижности и уравновешенности основных корковых процессов: замедление образования временных связей, удлинение и неустойчивость латентных периодов (УР), затруднение их переделки (Морозов А.Л. и др., 1957). С помощью этой методики отмечено ослабление возбудительного процесса и недостаточность тормозных процессов у большинства обследованных (Глазунов И.С. и др., 1971).
Указанные выше нарушения ВНД и работоспособности при хроническом облучении сопровождаются изменениями биоэлектрических процессов в ЦНС. Так, на фоне астенического синдрома происходят стойкие изменения альфа-активности в электроэнцефалограмме (ЭЭГ), которые в одних случаях имеют форму гиперсинхронизации, в других — депрессии. Возникают спонтанные кожно-гальванические реакции, отражающие неустойчивость состояния нервной системы (Голодец Р.Г., 1963).
Для всех обследованных с АС было характерно ослабление функциональной подвижности зрительного и слухового анализа
478
тора после соответствующей нагрузки. Использование методики по изучению взаимодействия зрительного и двигательного анализаторов, основанной на исследовании координации точности движения (умении испытуемого координировать их в заданном темпе и коррегировать под контролем зрения), показало, что продолжительность работы у больных с астеническим синдромом была значительно меньше, чем у практически здоровых лиц. При применении корректурной пробы получено уменьшение уровня внимания и усиление утомляемости по отношению к однообразным зрительным раздражениям. Показатели объема выполняемой работы, точность и скорость ее выполнения у лиц с астенизацией были значительно хуже (Глазунов И.С. и др., 1971).
Более подробные исследования, связанные с полиэффектор-ным электрофизиологическим обследованием испытуемых, когда производится одномоментная запись биопотенциалов мозга, двигательных реакций и вегетативных показателей в процессе выполнения поставленной задачи, которая требует напряженного внимания, вычислительной и двигательной работы, а также предварительной тренированности, показало значительное увеличение числа ошибок у лиц с астеническим синдромом (в 7 раз более частых, чем в контроле), увеличение и нестабильность латентных периодов двигательных ответов. Отмечалось кроме того тоническое напряжение мышц в покое, появление ложных тревог, наблюдали выраженные вегетативные проявления (тахикардию, аритмию, поверхностное дыхание и др.). У лиц с астенизацией более чем в 50% случаев был ослаблен или полностью подавлен a-ритм в ЭЭГ, что свидетельствовало о снижении концентрации внимания и рабочих возможностей испытуемых (Глазунов И.С. и др., 1971).
Удлинение сроков наблюдения за лицами, имевшими проявления синдрома вегетососудистой дистонии (ВСД) или нейроциркуляторной дистонии и астенического синдрома после прекращения контакта с источниками излучения или перехода к работе в условиях низкой интенсивности воздействия (< 1,0-1,5 сГр в год) позволило наблюдавшим их врачам (Юрков Н.Н., Ларионова И.К., 1977; Юрков Н.Н., 1983; Сумина М.В., Юрков Н.Н., Ларионова И.К., 1983; Гуськова А.К., 1992; Окладникова Н.Д., Пес-терникова В.С., Сумина М.В. и др., 1992; Азизова Т.В., Сумина М.В., Мусаткова О.Б., 1993; Азизова Т.В., 1999) вернуться к проблеме клинико-дозиметрической соотношений для указанных синдромов как в периоде формирования заболевания, так и в от-
479
даленном периоде, а также отметить ряд других неврологических синдромов, проявляемых в основном в отдаленном периоде. Авторами анализировалась и связь синдромов раннего периода с соматическими заболеваниями сердечно-сосудистой и нервной систем в отдаленные сроки.
В работе (Азизова Т.В., 1999) представлены результаты ретроспективного аналитического исследования состояния нервной системы в динамике за 35-45 лет наблюдения у работников первого в стране атомного предприятия, подвергшихся в процессе своей трудовой деятельности хроническому внешнему гамма-облучению в различных дозах и с различной мощностью дозы. Задачами данного исследования являлось изучение с учетом исходных показателей здоровья и уровней облучения работников частоты, тяжести и характера течения неврологических синдромов у них в динамике в процессе хронического облучения и после его окончания, а также определение зависимости частоты синдромов от дозы и мощности дозы радиационного воздействия. На рис. 9.2 представлено распределение среднегодовых доз внешнего гамма-облучения у мужчин основной группы и группы сравнения.
Исследована представительная когорта лиц (1090 человек, включая 500 больных хронической лучевой болезнью (ХЛБ)), начинавших работу в наиболее неблагоприятный период пуска и освоения первого в стране предприятия атомной промышленности и подвергшихся хроническому воздействию с относительно высокими уровнями доз годового облучения.
Больные, перенесшие ХЛБ (500 человек), составили основную группу, а остальные работники (590 человек), подвергавшиеся облучению с меньшей мощностью дозы, — группу сравнения. На период предварительного медицинского осмотра число лиц в возрасте 18-24 года составляло от 60 до 70%, в возрасте 25-29 лет — 20-25%. Остальные работники были в возрасте 30-42 года. Основная группа и группа сравнения были близки по полу, возрасту, профессиональной структуре, характеру работы, условиям жизни, но отличались по уровню радиационного воздействия.
Как видно из данных, представленных на рисунке, сравнительно высокие уровни ежегодного облучения имели место в первое десятилетие в период с 1948 по 1958 г. Уровни облучения в основной группе за этот период были в среднем приблизительно в 2 раза выше, и именно у лиц основной группы развивалась ХЛБ различной степени тяжести и отмечена большая частота и выра-
480
Основная группа
Годы
Годы
Рис. 9.2. Распределение среднегодовых доз внешнего гамма-облучения у мужчин основной группы и группы сравнения (Азизова Т.В., 1999)
женность основных неврологических синдромов. Близкий характер распределения годовых доз имел место и у женщин. Далее мы рассмотрим данные развивающихся синдромов у мужчин.
Анализ динамики неврологических синдромов показал, что именно в первые годы контакта с источниками ионизирующего излучения у работников предприятия существенно возрастала
481
Длительность наблюдения, годы
—— BCD1 —•— АС1 * MD1
-О- BCD2 -О- АС2 * MD2
Рис. 9.3. Динамика в процессе наблюдения частоты синдромов ВСД и АС в основной 1-й группе и в группе сравнения (2-я группа). Для характера изменения мощностей доз сЗв/год в группах — правая шкала ординат
частота синдрома веге-то-сосудистой дистонии (ВСД), преимущественно гипотензивного типа, астенического синдрома (АС) и синдрома демиелинизирующего энцефаломиелоза (ДЭМ). На рис. 9.3 представлена динамика по мере наблюдения частоты синдромов ВСД и АС в основной 1-й группе и в группе сравнения (2-я группа). Для сопоставления на этом же рисунке показан характер изменения уровней годового облучения в этих группах.
Как видно из данных рисунка, частота указанных синдромов резко нарастает в первые 5 лет наблюдения. ВСД отмечается в 65 и 38% случаев в
1-й и 2-й группах соответственно, а АС — в 68 и 37% случаев. Наблюдается четкая корреляция частоты указанных синдромов с уровнем ежегодного облучения, что более наглядно демонстриру-
ют данные рис. 9.4.
Легко заметить быстрое нарастание частоты рассматриваемых синдромов ВСД и АС с дозой, которое было более выражено в 1-й группе, подвергающейся воздействию с большей мощностью дозы. Мощность дозы была максимальной в период с 1949 по 1951 г., и в эти годы частота синдромов могла быть еще более высокой, чем данные, представленные на рис. 9.3, для 5-летнего срока наблюдения к концу 1953 г.
При ужесточении требований по радиационной безопасности и снижении мощности дозы к концу 50-х гг. прошлого века до 15 сЗв/сут организм человека, хронически подвергавшегося воздействию радиации, уже смог в некоторой степени скомпенсиро
482
вать возникающие в процессе облучения повреждения, и частота указанных синдромов резко снижается. В обеих группах она уменьшилась приблизительно в 2 раза (компенсаторная реакция). Через 15 лет от начала работы в результате дальнейшего снижения в начале 60-х гг. допустимых уровней облучения до 5 сЗв/год (зарегистрированные значения в диапазоне 1-2 сЗв/год) частота указанных синдромов оказалась сниженной
70
—— ВСД1 —•— АС1
...О- ВСД2 -О... АС2
Рис. 9.4. Частота отдаленных проявлений ВСД и АС у работников 1-й и 2-й групп в зависимости от мощности дозы сЗв/год
по сравнению с максимальным уровнем, наблюдаемым в 50-е годы, для ВСД в 1-й группе в 4 раза, для АС — в 7 раз. Частота ВСД во 2-й группе оказалась сниженной в 7 раз, частота АС приблизилась к частоте, соответствующей другим профес
сиональным группам соответствующего возраста.
Автор работы представляет также данные по частоте рассмотренных выше синдромов в зависимости от суммарной дозы хронического облучения (табл. 9.3).
Таблица 9.3
Частота неврологических синдромов в процентах у мужчин в зависимости от суммарной дозы внешнего гамма-облучения (Азизова Т.В., 1999)
Синдромы Суммарная эквивалентная доза гамма-облучения, сЗв (М ± т)
0-100 (60,2 ± 1,6) 100,1-200 (150,0 ± 1,1) 200,1-400 (285,0 ± 1,9) 400,1-995 (535,9 ± 12,2)
ВСД 24,0 ± 3,4 39,6 ± 3,4 55,3 ± 2,9 84,0 ± 3,8
Астенический 2,6 ± 1,3 14,2 ± 2,4 48,7 ± 2,9 84,0 ± 3,8
дэм 0 0 5,0 ± 1,3 59,4 ± 5,1
483
Следует отметить, что при предельном уровне ежегодного облучения в условиях космического пространства (66 сЗв), который предусмотрен прежним нормативным документом, выпущенным в 1986 г. (ГОСТ 25645.215-85, БРЭКАКП, 1986), и при 50 сЗв в новом документе (Методические указания МУ 2.6.1.44-03 — 2004), частота рассмотренных синдромов ВСД и АС вполне может соответствовать, представленным на рис. 9.3 и рис. 9.4, частотам для 2-й группы. При этом в 8-10% случаев может иметь место некоторое снижение работоспособности космонавтов, учитывая сложный характер их операторской деятельности. На основе данных табл. 9.3 можно сделать вывод, что суммарная допустимая доза для космонавтов за их профессиональную деятельность не должна превышать 100 сЗв, поскольку в случае превышения этого значения отмечается резкое увеличение частоты рассмотренных синдромов.
Несмотря на снижение в последующие годы частоты рассмотренных выше ближайших проявлений, которые в основном связа-
Длительность наблюдения, годы
—ДЭ1 МД1
—ДЭ2 -О- МД2
Рис. 9.5. Частоты дисциркуляторной энцефалопатии (ДЭ) у работников 1-й и 2-й групп.
Правая шкала для сопоставления с характером изменения мощностей доз в группах
ны с мощностью дозы радиационного воздействия, в отдаленные сроки отчетливо обнаружилась тенденция усиления ряда других неврологических расстройств и заболеваний по мере увеличения суммарной эквивалентной дозы (рис. 9.5 и 9.6).
Как видно из данных, представленных на рисунках, цереброваскулярные расстройства, наблюдаемые в основном в отдаленном периоде наблюдения, не столько связаны непосредственно с уровнем ежегодного облучения, но в большей степени коррелируют с величиной суммарной дозы облучения и возрастом обследуемых. С
484
увеличением времени наблюдения от начала облучения, возрастом обследуемых и суммарного значения дозы облучения постепенно нарастала частота цереброваскулярных болезней (ЦВБ). Из данных рис. 9.5 и 9.6 видно неуклонное возрастание по мере наблюдения частот дисциркуляторной энцефалопатии (ДЭ), начальных признаков недостаточности мозгового кровообращения (НПНМК) и церебрального атеросклероза (ЦА) в рассматриваемых группах, несмотря на снижение мощности дозы радиационного воздействия. Особенно резко увеличивается частота ЦА, которая
Длительность наблюдения, годы
—в— ЦА1 —НПНМК1 -+••• МД1 — О . ЦА2 -О- • НПНМК2 МД2
Рис. 9.6. Частоты начальных признаков недостаточности мозгового кровообращения (НПНМК) и церебрального атеросклероза (ЦА) в рассматриваемых группах
может приводить к учащению случаев мозгового инсульта (МИ).
Выявлено, что у мужчин основной группы до 45-летнего возраста частота НПНМК составила 27,2% против 1,6% у мужчин группы сравнения, у женщин 26,0 и 0,6% соответственно. Это подчеркивает значимость именно радиационного фактора. Увеличение мощности дозы радиационного воздействия и суммарной дозы приводит к заметному возрастанию частоты НПНМК. В клинике НПНМК наиболее частыми жалобами были головная боль с преимущественной локализацией в шейно-затылочной либо лобно-теменной областях (98%), головокружение несистемного характера (81%), шум в голове (75%), снижение памяти (91%), плохой сон (90%), повышенная утомляемость и снижение работоспособности (89%), повышенная раздражительность (66%).
Начальные клинические проявления ЦА у лиц основной группы диагностировались в более молодом возрасте, чем у лиц группы сравнения. Одинаковый уровень частот ЦА у лиц основной группы наблюдался раньше, чем у группы сравнения приблизи
485
тельно на 5 лет (рис. 9.6). Отличительной особенностью формирования ЦА у лиц подвергающихся хроническому облучению было то, что в преобладающем большинстве случаев (72-76%) начальные клинические проявления развивались на фоне стойкой сосудистой гипотензии, сформировавшейся в период максимального радиационного воздействия. Кроме того, течение ЦА, диагностированного до 45 лет, было менее благоприятным, так как в этой группе частоты мозгового инсульта и ДЭ II степени тяжести составили 21,9 и 56%, против 12,6 и 21% у лиц, не имевших клинических проявлений ЦА.
Автор работы (Азизова Т.В., 1999) при обзоре литературы отмечает, что в ряде других работ также наблюдали увеличение частоты цереброваскулярных и сердечно-сосудистых заболеваний в отдаленном периоде у лиц, подвергавшихся как острому, так и хроническому облучению в рассматриваемом диапазоне доз, по сравнению с одновозрастным контролем (Юрков Н.Н., Ларионова И.К., 1977; Юрков Н.Н., 1983; Качанова Е.М., Солдатова В.А., Смирнов М.И., 1981; Сумина М.В., Юрков Н.Н., Ларионова И.К., 1983; Гуськова А.К., 1992; Окладникова Н.Д., Пестерникова В.С., Сумина М.В. и др., 1992; Азизова Т.В., Сумина М.В., Мусаткова О.Б., 1993; Азизова Т.В., 1999). Эти заболевания наряду с новообразованиями являются основными причинами смерти (Поздние неопухолевые последствия НКДАР при ООН, 1979; Robertson T.L., Shimizu Y., Kato H. et al., 1979; Mine M., Nakamara T., Mori H. et al., 1980; Kadama K., Shimizu Y., Sawada H. et al., 1984).
У лиц, подвергавшихся профессиональному хроническому облучению в больших дозах, по данным клинических, морфологических, биохимических и функциональных исследований отмечено увеличение частоты церебрального атеросклероза (ЦА) и то, что данные проявления отмечаются в более молодом возрасте (Юрков Н.Н., Ларионова И.К., 1977; Юрков Н.Н., 1983; Сумина М.В., Юрков Н.Н., Ларионова И.К., 1983; Азизова Т.В., Сумина М.В., Мусаткова О.Б., 1993; Азизова Т.В., 1999). Так, в работе (Сумина М.В., Юрков Н.Н., Ларионова И.К., 1983) при изучении динамики неврологических синдромов у 239 больных ХЛБ показано существенное нарастание частоты церебрального атеросклероза в возрастных группах 40-49 и 50-59 лет.
В другом исследовании (Азизова Т.В., Сумина М.В., Мусаткова О.Б., 1993) при обследовании 1090 профессионалов в широком диапазоне доз также подчеркивается, что частота церебрального
486
атеросклероза в группе профессионалов в возрасте 40-59 лет с суммарными дозами более 300 сЗв была значительно выше, чем в контрольной группе сравнения. Кроме того, выявлено увеличение частот начальных проявлений недостаточности мозгового кровообращения НПНМК и инсультов по типу тромбоза у этой же группы лиц (Юрков Н.Н., 1983).
В последние годы некоторые исследователи выделяют ионизирующие излучения среди экзогенных факторов риска ЦВБ, в связи с отмечаемой более высокой частотой развития дисциркуляторной энцефалопатии, церебрального атеросклероза и мозгового инсульта в отдаленные сроки после облучения.
С целью изучения поздних эффектов в Японии в 1950 г. были начаты наблюдения за большими популяциями людей, подвергшихся воздействию атомной радиации в Хиросиме и Нагасаки. В ранних отчетах с 1950 по 1966 г. не было найдено связи между облучением и смертностью от ЦВБ и других болезней системы кровообращения. Однако уже в следующих отчетах, охвативших 25-летний период наблюдений, впервые было отмечено влияние облучения на смертность от болезней системы кровообращения. Сообщается, в частности, об увеличении смертности от мозгового инсульта (МИ) при дозах 150-250 сЗв (Robertson T.L., Shimizu Y., Kato H. etal., 1979; Mine M., Nakamara T., Mori H. etal., 1980; Kadama K., $himizu Y., Sawada H. etal., 1984). В последующих отчетах при оценке смертности от неопухолевых заболеваний за период 35 лет с 1950 по 1985 г. эти исследователи отмечали увеличение смертности от болезней системы кровообращения среди популяции, облученной в дозе более 200 сЗв (Азизова Т.В., 1999).
Конечно, оценка связи цереброваскулярных и сердечно-сосудистых заболеваний с имевшим место радиационным воздействием необычайно сложна, так как эти заболевания являются поли-этиологическими и различные факторы могут способствовать их развитию. К наиболее значимым эндогенным факторам риска ЦВЗ относят возраст, наследственность, патологию сосудов, артериальную гипертензию, ожирение, а также ряд экзогенных факторов — курение, алкоголь, длительный эмоциональный стресс. В работе А.Ю Бушманова и др. (1994) исследовалось влияние хронического профессионального облучения работников атомной промышленности в Челябинске и Томске (доза у 2/3 около 100 сГр) на частоту, форму и исходы мозговых инсультов. Авторами показано, что частота и структура мозговых инсультов (ише
487
мический, геморрагический, недифференцированный) не отличается от соответствующих показателей региональных групп населения Сибири, Урала и средних значений по СССР. У небольшой части лиц с максимальными дозами и большей стойкостью симптомов дисциркуляторных и метаболических нарушений (дисциркуляторная энцефалопатия, рассеянный энцефаломиелоз) отмечено формирование клинических признаков церебрального атеросклероза в относительно более молодом возрасте — до 45 лет. Такой же результат мы уже отмечали выше (см. рис. 9.5 и рис. 9.6) при анализе результатов работ (Азизова Т.В., Сумина М.В., Му-саткова О.Б., 1993; Азизова Т.В., 1999).
В работе (Азизова Т.В., 1999) подчеркивается, что комбинированное действие факторов может значительно увеличивать риск развития ЦВБ. Это важно учитывать при обосновании допустимых доз для космонавтов, поскольку кроме действия ионизирующих излучений в процессе полета действует целый комплекс других нерадиационных факторов, определяющих значительную активацию компенсаторных процессов и серьезное напряжение адаптационных систем организма. Эти факторы могут сами являться весьма значимыми для формирования заболеваний центральной нервной и сердечно-сосудистой систем, а при наличии сочетанного действия с источниками ионизирующих излучений вероятность ЦВБ может существенно возрасти и может быть усилена выраженность синдромов. Это мы также отмечали в наших работах (Шафиркин А.В., 2003; Шафиркин А.В. и др., 2005).
Для целей нормирования радиационного воздействия на космонавтов определенное практическое значение имеет рассмотрение данных клинического обследования людей, работавших по ликвидации последствий аварии (ЛПА) на Чернобыльской АЭС (Вороновская В.И., Чайка Г.В., Халявка И.Г., Дубровина Г.В., 1995; Мешков Н.А. и др. 1995; Мешков Н.А., Куликова Т.А., 2006; Торубаров Ф.С., Чинкина О.В., 1989; Чинкина О.В., Торубаров Ф.С., 1991; Ушаков И.Б., Арлащенко Н.И., Должанов А.Я., Попов В.И., 1997). Результаты проведенных наблюдений за больными с лучевой болезнью различной степени тяжести, которые участвовали в ликвидации аварии на ЧАЭС, являются уникальными и с нашей точки зрения требуют особого внимания и анализа.
Наблюдаемые неврологические проявления у людей после острых и в процессе хронических облучений (особенно в отдаленном периоде) могут служить основой для прогноза вероятности таких
488
проявлений в условиях космического полета при ухудшении радиационной обстановки и возникновении солнечных протонных событий (СПС) с большим флюенсом протонов. Эти материалы представляют определенный интерес наряду с данными клинических проявлений при профессиональных обследованиях лиц, работающих с источниками ионизирующих излучений.
Через 4-6 месяцев у ликвидаторов последствий аварии (ЛПА) после перенесения лучевой болезни I, II и III степени (дозы оценены равными 80-200; 200-400 и 420-600 сГр соответственно) отмечены: снижение эффективности простой и сложной сенсомоторной деятельности, уменьшение ее продуктивности и надежности, динамические нарушения работоспособности, снижение уровня активности и быстрая истощаемость. Наблюдали также личностную тревожность, резкие изменения самочувствия, настроения, что указывает на глубину астенического состояния. В указанные сроки особенности психического состояния и умственная работоспособность пострадавших, структура и глубина имеющихся нарушений находились в тесной связи со степенью тяжести перенесенной острой лучевой болезни.
Спустя 2,5-3 года после аварии нарушение умственной работоспособности, выраженную истощаемость, развитие неблагоприятных психических состояний чаще отмечали у людей более старших возрастов, перенесших острую лучевую болезнь в более тяжелой форме (при дозах 200-600 сГр). Анализ нарушений при исследовании памяти, внимания, различных видов сенсомоторной деятельности показал, что все выявленные изменения в основном обусловлены чрезмерно быстрым наступлением истощаемости. Характерными в этом отношении были раздражительность, жалобы больных на ухудшение памяти, трудности в концентрации внимания, часто наступающую усталость, необходимость длительного отдыха и частых перерывов в работе.
У пациентов отмечали сниженную продуктивность и надежность работы. Они не могли длительно поддерживать определенный достигнутый уровень. Через 15-20 минут работы возникали признаки напряжения, появлялись жалобы на усталость, головную боль, головокружение, сердцебиение, нежелание продолжать работу. Быстрое угасание побудительной силы рабочего мотива является свидетельством низкой работоспособности и быстрого истощения со стороны ЦНС, лежащего в основе астенического синдрома. Через 3 года наибольшее влияние на снижение работо
489
способности и развитие неблагоприятных психических состояний оказывали отдаленные последствия облучения. Так, изменения психического статуса и других проявлений астенического синдрома у лиц, перенесших лучевую болезнь I, II, III степени тяжести наблюдали соответственно в 34, 71 и 82% случаев (Торубаров Ф.С., Чинкина О.В., 1989; Чинкина О.В., Торубаров Ф.С., 1991; Ушаков И.Б., Арлащенко Н.И., Должанов А.Я., Попов В.И., 1997).
Значительные нарушения умственной работоспособности сохраняются у ликвидаторов аварии на Чернобыльской АЭС и в настоящее время. У 72 человек в возрасте 28-56 лет исследовали функциональную подвижность нервных процессов, сенсомоторную реактивность, кратковременную зрительную память, умственную работоспособность (Мешков Н.А., Рыжов Н.И., Рыжов Б.Н. и др., 1995). Выявлено существенное понижение сенсомоторной реактивности у 40% обследованных. Понижение функциональной подвижности нервных процессов отмечено у 26% прошедших обследование, а продуктивности запоминания — у 36%. Наиболее характерными для большинства участников были значительное снижение умственной работоспособности и быстрая утомляемость. Резкий спад в работе, лавинообразное повышение числа допущенных ошибок наблюдалось уже на 3~5-м выполнении задания при обработке информации, подаваемой в умеренном темпе.
В другом исследовании (Вороновская В.И., Чайка Г.В., Халяв-ка И.Г., Дубровина Г.В., 1995) также отмечено снижение продуктивности работы (50% от нормы) по показателям счетно-логической деятельности, что свидетельствует о преимущественном ослаблении функций кратковременной памяти и оперативного мышления. Наблюдали также повышенную истеричность, эмоциональную лабильность, снижение самоконтроля. Авторы предположили у обследованных наличие синдрома «преждевременного старения», который они связывали с поражением сосудистых капилляров головного мозга.
Особенно настораживают данные, полученные на основе объективных аппаратурных исследований коры головного мозга у Л ПА, проводивших работы в 1986 г. и зарегистрированные поглощенные дозы у которых не были высокими (менее 30 сГр). Отмечаемые у них неврологический и нейропсихологический синдромы указывали на возможность развития патологических изменений глубинных областей коры головного мозга. Это нашло свое морфофункциональное подтверждение по данным исследований с
490
помощью эмиссионной однофотонной компьютерной томографии (ЭОКТ) и магнитно-резонансной томографии (МРТ). На сцинти-граммах различных срезов выявлены гипометаболические очаги, локализованные в глубинных отделах лобных, височных, теменных и затылочных долей (Иванов В.К., Максютов М.А., Чекин С.Ю. и др., 2001; Мешков Н.А., Куликова Т.А., 2006).
В работе (Головченко Ю.И., 1993) автор исследовал церебральную гемодинамику 460 ликвидаторов аварии на ЧАЭС в возрасте до 45 лет. Отмечено, что в первые два-три года после радиационного воздействия в основном регистрировались функциональные нарушения сердечно-сосудистой регуляции в виде ВСД по данным ЭЭГ, РЭГ, доплерографии. В последующем у этих лиц достоверно определялась хроническая недостаточность мозгового кровообращения на фоне нарастающей системной артериальной гипертензии. Развитие дисциркуляторной энцефалопатии в своих этапах и симптоматике соответствовало ее возрастному варианту, связанному с атеросклерозом сосудов головного мозга. При этом лучевая энцефалопатия характеризовалась значительным ускорением ее развития и почти на 20 лет опережала календарные сроки развития ее возрастного варианта. Автор в результате изучения направленности дисциркуляторных изменений мозга у исследуемых больных выделяет лучевую модель ускоренного старения.
С 1986 г. большие контингенты людей длительное время подвергаются облучению из-за загрязнения территории их проживания 137 Cs в результате авариии на ЧАЭС. Более чем у 90% населения районов с загрязнениями от 5 до 120 Ки/км2 выявлены пограничные нервно-психические расстройства. Преобладают астенический, неврозоподобный, психопатоподобный и вегетососудистый синдромы, при которых отмечаются резко повышенная эмоциональная напряженность, тревожность, чувство психического дискомфорта, страх и угнетенное настроение (Ушаков И.Б., Карпов В.Н., 1997; Ушаков И.Б., Арлащенко Н.И., Должанов А.Я., Попов В.И, 1997).
Сопоставление состояния здоровья облучаемой и контрольной групп населения показало, что в опытной группе значительно чаще предъявлялись жалобы на постоянные или периодические головные боли, головокружение, шум в голове, снижение памяти, быструю утомляемость, раздражительность, расстройство сна. Однако использование этих данных для целей нормирования радиа
491
ционного воздействия не представляется возможным, поскольку подавляющее большинство исследователей считают, что отмеченные изменения здоровья носят психогенный характер.
В подробных обзорах, посвященных указанной проблеме (Ушаков И.Б., Карпов В.Н., 1997; Ушаков И.Б., Арлащенко Н.И., Должанов А.Я., Попов В.И., 1997), выделяются и основные причины психологической напряженности: социально-экономические трудности и низкое качество жизни населения загрязненных территорий, биологическая и медицинская некомпетентность населения, непродуманные действия средств массовой информации. Все эти причины обусловливают серьезный и длительный психо-эмоциональный стресс, который в основном и определил указанные изменения здоровья населения загрязненных территорий. Кроме того, следует учитывать, что период с 1991 г. по настоящее время — период революционных политико-экономических преобразований и социально-экономических потрясений в стране. Оценить количественно вклад малых доз радиационного воздействия на население рассматриваемых территорий в условиях столь мощного психогенного стрессорного воздействия не представляется возможным.
Таким образом, рассмотренные материалы показали, что как при остром кратковременном, так и при хроническом облучении с мощностью дозы 0,1 сЗв/сут и более, при дозах, превышающих 100 сЗв, наблюдается достоверное повышение частоты астенического синдрома, а после доз 400 сЗв она достигает 70% (более чем в 2 раза превышает контрольный уровень у необлученных индивидуумов). При указанных дозах, которые допускались нормативными документами для космонавтов до 2004 г. (Временные нормы радиационной безопасности при космических полетах — ВНРБ-75, 1976; ГОСТ 25645.215-85, БРЭКАКП, 1986) показано, с одной стороны, возможное существенное увеличение доли нейронов с дистрофическими изменениями и гипометаболические очаги, локализованные в глубинных отделах коры головного мозга, а с другой — отмечено значительное возрастание частоты нейроцир-куляторной дистонии и астенического синдрома. При этом перечисленные выше проявления свидетельствовали о необратимых органических (структурных и функциональных) изменениях в ЦНС, которые определили существенное снижение тонуса и компенсаторных возможностей системы и быструю ее истощаемость. Указанные факты убедительно свидетельствуют также о значительном снижении работоспособности человека в отдаленные сро
492
ки после облучения в рассмотренном диапазоне доз. Это является очень важным для профессии космонавтов, учитывая сложный характер их операторской деятельности и большой комплекс факторов, воздействующих на них в процессе полета.
Представленные в этом разделе данные показывали необходимость снижения допустимых значений доз для космонавтов за всю их карьеру до значений 100 сЗв, чтобы исключить заметное снижение уровня их здоровья и работоспособности к концу профессиональной деятельности. Это было реализовано в последнем нормативно-техническом документе (Методические указания МУ 2.6.1.44-03-2004).
9'3' Оценка состояния сердечно-сосудистой системы в ближайшем и отдаленном периодах после воздействия на организм ионизирующих излучений в различных дозах
Для оперативной количественной оценки степени изменения здоровья космонавтов, а также прогнозирования различных градаций нормы и патологии может успешно быть использовано состояние сердечно-сосудистой системы. Изменения в системе кровообращения могут служить количественной мерой (индикатором) адаптационных реакций целостного организма и состояния резервов регуляторных систем. Это связано с тем, что система кровообращения, наряду с нейроэндокринной системой, играет существенную роль в процессах адаптации, что связано прежде всего с функцией транспорта питательных веществ и кислорода, основных источников энергии для клеток и тканей организма (Баевский Р.М., 1979; Григорьев А.И., Баевский Р.М., 2001).
Исследование зависимости радиационных нарушений в сердечно-сосудистой системе в зависимости от дозы является важным, поскольку ее состояние в значительной степени определяет самочувствие человека в отдаленном периоде, а нарушения в системе кровообращения существенно снижают адаптационные возможности организма и вносят ведущий вклад в общую структуру смертности, что продемонстрировано в работах (Фарбер Ю.В., Шафиркин А.В., 1999; Шафиркин А.В., 1999-а, 2003).
Имеющиеся в настоящее время клинические и экспериментальные данные свидетельствуют о том, что сердечно-сосудистая система (ССС) является существенным звеном в патогенезе наи
493
более важных синдромов лучевой болезни. Наибольшее признание получили теоретические представления, рассматривающие нарушения со стороны сердечно-сосудистой системы как важное ключевое звено в развитии многих патологических эффектов в облученном организме. При этом имеется в виду, что повреждение стенки сосудов (крупных и мелких), наряду с нарушениями гемодинамики и свойств крови, обусловливают или усиливают первоначальные деструктивные процессы, являются причиной нарушения барьерной функции эндотелия и патологических сдвигов в ге-матотканевом обмене, а также причиной поздних нарушений в различных органах и тканях (Воробьев Е.И., Степанов Р.П., 1985). В дополнение к сказанному, следует учесть, что работоспособность человека при выполнении им различных видов работ, в том числе в условиях космического полета и в отдаленном послеполетном периоде, существенным образом зависит от функционального состояния сердечно-сосудистой системы. Не случайно данной области физиологических и патофизиологических исследований уделяется особое место в клинических и экспериментальных работах (Надарейшвили К.М., 1966; Кирсанова Г.И., 1968; Денисова Е.А., 1970; Воробьев Е.И., 1971; Гуськова А.К., Байсоголов Г.Д., 1971; Воробьев Е.И., Степанов Р.П., 1985).
Важным представляется рассмотрение радиочувствительности различных структур сердечно-сосудистой системы и последовательный характер развития нарушений в ней в зависимости от дозы. В частности, на основании экспериментальных данных, высказано мнение об особой чувствительности эластической ткани, изменяющейся уже при облучении в дозах порядка 0,1 Гр. При этом утверждается, что именно поражение этих структур, а не эндотелия, лежит в основе всех патологических процессов, развивающихся в сосудистой стенке после лучевого воздействия (Воробьев Е.И., Степанов Р.П., 1985). Авторы приводят данные, свидетельствующие о том, что общее облучение в дозах 0,5-3,0 Гр, а также фракционированное воздействие (суммарно 5 Гр, ежедневно по 0,5 Гр) вызывают снижение численности крупноядерных клеток с резким гиперкомпенсаторным увеличением их числа в отдаленном периоде. Присутствие определенного постоянного количества крупноядерных (полиплоидных) клеток в составе эндотелиальной выстилки рассматривают как пролиферативный резерв, уже подготовленный для немедленного восполнения дефектов ткани в случае быстрого и значительного ее повреждения.
494
Под действием облучения отмечаются также изменения эндо-телиоцитов, вызывающие дальнейшее углубление нарушений в сосудистом ложе и изменение сосудистой проницаемости. Количество измененных клеток в эндотелии капилляров после общего облучения уже в дозах 0,5 Гр оказывается значительной (до 40-50% популяции). При этом установлено, что от 50 до 95% (в зависимости от дозы) клеток с первичными патологическими изменениями потенциально способны к репарации (Воробьев Е.И., Степанов Р.П., 1985).
Исходом развития частных патологических процессов в эндотелии являются гибель клеток и их удаление с образованием в эндотелиальном слое временных дефектов. Это приводит в свою очередь к потенциальному ослаблению прочности капиллярной стенки и увеличению вероятности ее разрыва при механических нагрузках и иных функциональных стимулах в экстремальных ситуациях (Воробьев Е.И., Степанов Р.П., 1985). Немногие патологические изменения эндотелиального слоя сосудов способствуют нарушению микроциркуляции в капиллярах. К ним следует отнести закупорку или сужение просвета капилляров поврежденными эндотелиоцитами, чрезмерно увеличивающими свой объем, что вызывает прекращение кровотока и создает условия для тромбо-образования. Другой причиной тромбогенеза в этих условиях может служить десквамация гибнущих эндотелиоцитов с сопутствующим разрывом базального слоя капилляра при достаточной эффективности гемостаза.
В работе (Geard C.R., Jenkins-Baker G., Grabham P. et al., 2006) также отмечена высокая радиочувствительность эндотелиальных клеток человека, культивируемых in vitro. В исследованиях этих авторов при дозе 1 Гр число хромосомных аберраций увеличивалось в 100 раз. Часть из них (транслокации с измененным порядком азотистых оснований в структуре ДНК) могут сохраняться в течение многих лет, что было показано нами в работе (Ворожцова С.В., Шафиркин А.В., Федоренко Б.С., 2006) на примере сохранения аберраций в эпителии роговицы мышей в течение 180 суток после их облучения ускоренными многозарядными ионами и гамма-излучением. Это приводят в течение длительного периода к синтезу измененных белков, образованию белковых комплексов, что ведет к активации аутоиммунных процессов и более раннему снижению иммунологического статуса в отдаленном периоде. В эндотелии сосудов могут при этом развиваться патологи
495
ческие процессы. Авторы работы (Geard C.R., Jenkins-Baker G., Grabham P. et al., 2006), рассматривая увеличение частоты смертности у жителей Хиросимы и Нагасаки из-за нарушений в системе кровообращения (увеличение числа инфарктов и инсультов) через 35-50 лет после бомбардировок, делают предположение, что это может быть обусловлено развитием патологических процессов в эндотелии капилляров. Они сделали оценки, что в случае радиационного воздействия радиационный риск дополнительной смертности в течение жизни человека может составить 14% на 1 Зв. Это практически совпадает с нашими оценками суммарного радиационного риска в течение жизни космонавтов, проведенными в разд. 8. В наших расчетах при обобщенной дозе 1 Зв суммарный радиационный риск оценен равным 11,5-13% для космонавтов России, США и Японии.
В пострадиационных условиях в стенке капилляров развиваются изменения вторичного порядка, независимые от повреждения эндотелия. Одни из них определенно связаны с гемодинамическими и микроциркуляторными эффектами, влияющими на степень расширения мелких сосудов, другие являются результатом активации литических процессов в экстраклеточном пространстве. Указанные дефекты снижают прочность сосудистой стенки и предопределяют возможность дальнейших микроцирку-ляторных нарушений.
Спецификой радиационного поражения клеточных структур сосудистой стенки является последующее более глубокое развитие серьезных повреждений в отдаленные и поздние сроки пострадиационного периода, что связывается с существенным ослаблением репарационных процессов. Эта неполноценность обнаруживается быстрее при соответствующих функциональных нагрузках на систему (Воробьев Е.И., Степанов Р.П., 1985). Подавляющая часть пострадиационных изменений в сосудах связана с отклонениями уровня функциональной активности. Авторы указанной работы связывают зависимость этих сдвигов с регуляторными влияниями со стороны окружающих тканей и нейро-регуляторными механизмами, определяющими общий фон функциональной активности мелких сосудов, соответствующий запросам ткани, органа, организма.
Следует отметить наличие изменений в ряде реакций сердечно-сосудистой системы уже после воздействия небольших уровней доз. Анализ материалов 5-летнего наблюдения за кроликами,
496
содержавшимися в условиях непрерывного гамма-облучения с постоянной мощностью дозы в воздухе 8,33 мкГр/час, позволил высказать предположение о том, что ослабление компенсаторных возможностей сердечно-сосудистой системы проявляется уже при суммарной дозе 8-12 сГр спустя 1-2 года после облучения. Оно выражалось в изменении величины ряда реакций системы на действие раздражителей. С увеличением накопленной дозы отмеченные отклонения возрастали. Так, в частности, 15%-я кровопотеря, не вызывавшая гибели ни одного контрольного кролика, оказалась непереносимой для 43% животных облученных в дозе 36 сГр (Сельцер В.К., Лосева Н.В., 1971).
Серьезное снижение функциональной способности со стороны сердечно-сосудистой системы обнаружены также при многолетнем облучении собак в дозах, моделирующих возможные уровни радиационного воздействия на космонавтов при полете к Марсу. Это хроническое облучение в дозах 21-125 сГр за год и сочетанное хроническое и острое облучение в суммарной дозе за год 188 сГр (Григорьев и др., 1986). У собак удлинялись сроки восстановления функциональных нарушений. При этом более резкие сдвиги в деятельности сердечно-сосудистой системы были обнаружены по мере увеличения дозы при предъявлении дополнительной физической, фармакологической и тепловой нагрузки (см. разд. 4).
Анализ опубликованных данных (Фарбер Ю.В., Шафиркин А.В., 1999) показывает, что большинство исследователей считает сердце относительно менее поражаемым, чем сосудистая система, а нарушения его функций проявляются в более поздние сроки после воздействия ионизирующих излучений. Сведения такого характера получены в основном в экспериментах на животных и данных радиотерапии, проводившейся в радиологических отделениях. В то же время в опытах на мышах получены данные, свидетельствующие о тяжелых нарушениях в мышце сердца при облучении передней половины тела в дозах 0,2-3,2 Гр (Москалев Ю.И., 1971). Кроме того, имеются указания на то, что в отдаленном периоде после радиационного воздействия могут иметь место функциональные нарушения в сердечной деятельности человека при изменении внешней среды обитания или при предъявлении повышенных нагрузок (Воробьев Е.И., 1971).
Имеющиеся клинико-физиологические данные по данному вопросу свидетельствуют о том, что изменения сердечной деятельности характеризуются весьма умеренными сдвигами по прекра
497
щении лучевого воздействия в дозах менее 50 сГр. При анализе частоты различных отклонений со стороны сердечной деятельности у лиц, работающих в условиях воздействия ионизирующих излучений по мере увеличения суммарной поглощенной дозы до 70-150 сГр и более, накопленной в течение 8 лет, отмечается некоторое возрастание жалоб на отдышку и болей в области сердца при нагрузке, как правило, в сочетании с общими жалобами невротического характера (Воробьев Е.И., 1971; Гуськова А.К., Байсоголов Г.Д., 1971).
Очевидно, целесообразно сопоставить экспериментальные данные с клиническими наблюдениями за лицами, подвергавшимися воздействию ионизирующих излучений либо в результате ядер-ных взрывов, либо после облучения с лечебной целью, либо в связи с их профессиональной деятельностью. Последняя группа данных имеет особую ценность при обосновании допустимых уровней облучения для космонавтов за весь период их профессиональной деятельности, который в достаточной степени сопоставим с трудовым стажем лиц указанной категории.
В материалах об отдаленных последствиях лучевого поражения лиц, пострадавших во время атомного взрыва в Хиросиме и Нагасаки и получивших относительно небольшую дозу общего облучения, имеются указания на то, что у лиц, пострадавших при атомных взрывах, спустя 8-15 лет развивался комплекс отдаленных лучевых повреждений, среди которых наиболее отчетливо проявились симптомы, отражающие повреждения сосудов (Aleksandrow S.N., 1982). В ряде публикаций (Защита работников от ионизирующих излучений, 1958; Tsuya A., Wakano Y., Otake М., 1971) отмечается, что в 50% случаев у этих лиц обнаруживаются рецидивы геморрагического диатеза, механизмы которого связаны со структурными дефектами в сосудистой стенке. При этом указанные структурные изменения в сосудах отмечены у пострадавших лиц спустя 10 лет после общего облучения в дозе порядка 1 Гр.
Изучение радиационной патологии у людей в отдаленные сроки после лучевой терапии позволило авторам работы (Дом-шлак М.П., Даренская Н.Г., Терещенко Н.Я., 1971) прийти к заключению о том, что схема развития клинических проявлений отдаленных последствий лучевого воздействия принципиально однотипна для общих и различных по локализации обширных местных облучений. Сроки формирования тех или иных симпто
498
мов и их выраженность определяются суммарной поглощенной дозой, длительностью и частотой курсов лучевой терапии.
В частности, при проведении лучевой терапии (общее облучение, разовая доза 25-50 сГр, суммарная 100-400 сГр) через 2 года у пациентов (возраст 30-60 лет) наблюдали различные функциональные нарушения, в том числе вегетативно-сосудистые, которые сопровождались повышенной потливостью, неприятными ощущениями в области сердца, снижением АД, которое нормализовалось через 5-10 лет после курса лучевой терапии (Дом-шлак М.П., Григорьев Ю.Г., Даренская Н.Г. и др., 1962). Показано, что в измененных условиях внешней среды или при предъявлении повышенных нагрузок у пациентов, прошедших курс лучевой терапии в указанном диапазоне доз, может проявиться срыв компенсаторно-приспособительных механизмов.
Наиболее детальное внимание было уделено нами данным клинико-физиологических наблюдений за людьми, работающими в условиях контакта с радиационным фактором. Длительные диспансерные наблюдения и особенно клинические подробные обследования с использованием различных методов (электрокардиографические исследования с нагрузкой, сфигмография, пьезо-пульсография, реография, осцилография, капилляроскопия, электротермометрия, офтальмодинамометрия, калиброметрия сосудов сетчатки и др.), позволили исследователям оценить состояние кровообращения в различных сосудистых областях.
В работах (Гуськова А.К. и др., 1966, 1967) систематизирован материал по клинико-гигиенической оценке условий труда и состояния здоровья работающих на ускорителях в Объединенном институте ядерных исследований (г. Дубна) в течение 6 и более лет. Существенное место в них занимают сведения, касающиеся состояния сердечно-сосудистой системы обследованных лиц. Для оценки биологического эффекта суммарных уровней доз облучения основная группа (500 человек) была подразделена на две подгруппы А и Б:
А (59,5% обследованных) — с дозой облучения до 15 бэр (сЗв); Б (40,5% обследованных) — с дозой облучения 15-100 бэр (сЗв). Адекватный контроль включал группу лиц, состоявшую из 180-220 человек в разные годы наблюдения.
Авторы отмечали, что при рассмотрении показателей заболеваемости в основной группе в зависимости от дозы облучения выявляется некоторая тенденция к увеличению случаев заболеваний
499
сердечно-сосудистой системы функционального характера. Так, в подгруппе А существенных изменений по сравнению с контрольной группой не отмечено, в подгруппе Б (доза облучения 15-100 сЗв) чаще наблюдали случаи сосудистой дистонии гипотонического типа. Они пришли к заключению, что одной из ранних реакций организма на воздействие общего внешнего проникающего излучения в дозах, превышающих допустимые, являются вегетативно-сосудистые изменения.
В основной группе (Б) гипотензия наблюдалась в 25% случаев против 6% в контрольной и была выражена более отчетливо. Гипотензия наблюдалась также в центральной артерии сетчатки у 21% лиц основной группы (в контроле — 7%). В основной группе чаще отмечалась брадикардия (45% против 25% в контроле), большая лабильность пульса и артериального давления при функциональных пробах в ортоклиностатике после физической нагрузки (38% случаев против 6% в контроле). Отмечена тенденция к повышению артериального давления с возрастом (Гуськова А.К. и др., 1966, 1967).
Результаты исследований сердечно-сосудистой системы осци-лографическим, сфигмографическим, реографическим и ЭКГ-методами свидетельствовали, что воздействие ионизирующих излучений в диапазоне доз 15-100 сЗв (основная группа) приводит к неустойчивости сосудистого тонуса и вызывает нерезкие нарушения нейрорегуляторных механизмов, о чем свидетельствовали:
• большая частота асимметрии осцилляций на конечностях;
• изменение вида осциллографических кривых (уплощение, наличие плато);
• нарушение обычных соотношений в показателях АД по слуховому (акустическому) и осциллографическому методам;
• увеличение частоты лабильности показателей и скорости распространения пульсовой волны по сосудам мышечного типа.
В пределах доз 15-50 сЗв (первая половина вышеприведенного диапазона), как отмечала автор исследований (Денисова Е.А., 1962, 1970), наблюдались повышенная реактивность и функциональная неустойчивость сердечно-сосудистой системы и тесно связанной с ней вегетативной нервной системы. Наблюдаемые изменения функциональной деятельности сердечно-сосудистой системы были нестойкими, умеренными, часто находились в границах физиологической нормы. Длительность первоначальной реакции составляла 1-2 года, после чего изменения сглаживались.
500
Когда суммарная доза воздействия приближалась к 50 сЗв, изменения вегетативно-сосудистой регуляции были несколько более часты и отчетливее выражены. Выявленные регуляторные отклонения (наклонность к компенсированной гипотензии, брадикардии при несколько расширенной амплитуде сосудистых реакций на нагрузку) авторы склонны относить к сдвигам, носящим адаптивный характер на новый для человека комплекс профессионального воздействия (Денисова Е.А., 1962, 1970; Гуськова А.К. и др., 1966, 1967).
Вместе с тем, исходя из представленных данных, нельзя не отметить тот факт, что при дозах, превышающих 50 сЗв, у 50% лиц основной группы установлены изменения, связанные с нарушениями вегетативной иннервации, обнаружена тенденция к снижению сосудистого тонуса преимущественно сосудов мышечного типа. Статистически достоверными отклонениями по сравнению с субъектами контрольной группы являлись признаки нейроцирку-ляторной дистонии гипотонического типа (регионарная и общая гипотензия, изменение кровообращения в отдельных сосудистых областях). Отмеченные отклонения в вазорегуляции заметно не ухудшали общего самочувствия обследуемых лиц, существенно не нарастали при динамическом наблюдении и не сказывались на работоспособности. Все это отличало обследованных лиц от больных гипотонической болезнью.
Среди лиц, контактировавших с ионизирующим излучением, при дозе в диапазоне 50-100 сЗв, несколько чаще наблюдали изменения, свидетельствующие о функциональных расстройствах сердечной деятельности, связанных с нарушением вегетативной регуляции и возбудимости сердечной мышцы. Вместе с тем частота заболеваний (явная патология) сердечно-сосудистой системы в основном соответствовала общеизвестным статистическим данным (Денисова Е.А., 1962, 1970; Гуськова А.К. и др., 1966, 1967).
Обследование 170 работников рентгеновских кабинетов (Багда-саров А.А. и др., 1958, 1959) в возрасте от 20 до 60 лет со стажем работы от 5 до 20 лет в условиях профессиональной вредности (0,05 сГр за рабочий день) позволило установить, что воздействие в дозах от 25 сГр до 100 сГр (за весь период работы) может привести в небольшом числе случаев (порядка 8%) к определенным функциональным нарушениям в отдаленном периоде. Среди отмечаемых нарушений, наряду с изменениями крови, наиболее час
501
тыми являются астенизация, гипотония, нервные нарушения, сопровождающиеся вегето-сосудистой дистонией.
Результаты исследований (Денисова Е.А., 1962, 1970; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971) свидетельствовали, что при дозах в пределах 50-100 сЗв увеличивается число относительно легких сдвигов нейрососудистой регуляции, которые касаются в основном лабильности при физических нагрузках таких показателей, как частота пульса и АД. При суммарных дозах 50-70 сЗв указанные изменения наблюдаются у 20-30% обследованных лиц. Основными причинами развития астенического синдрома при этих дозах являются эндогенные и экзогенные факторы (соматические заболевания, психотравмы, нарушения ритма жизни, работы) те же, что и в контрольной группе. Частота синдрома при статистической обработке в основной и контрольной группах одинакова. Следует отметить, что в доклинической стадии заболевания, после суммарных доз порядка 15-70 сЗв развивающиеся отклонения со стороны сердечно-сосудистой системы весьма сходны с изменениями, возникающими у лиц, подвергающихся действию других неблагоприятных факторов внешней среды и наиболее адекватны понятию синдрома вегетативно-сосудистой дистонии или нейроциркуляторной дистонии. При дальнейшем увеличении суммарной дозы частота астенического синдрома и более разнообразных проявлений нейроциркуляторной дистонии увеличивается (Денисова Е.А., 1970; Гуськова А.К., Понизовская А.И., Денисова Е.А. и др., 1967; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971).
Как показано в работах (Денисова Е.А., 1962, 1970), при накоплении суммарных доз в пределах 70-100 сЗв у 17% обследованных лиц наблюдали синдром нейроциркуляторной дистонии гипотонического типа, который не имел существенных патогенетических отличий от такового у лиц контрольной группы. На основании проведенных обследований автор работ исключила возможность органических поражений сердечно-сосудистой системы у человека в пределах доз 0-100 сЗв.
При диспансерном обследовании профессионально работающих с излучением уже при облучении в диапазоне доз 50-130 сЗв, отмечено уже увеличение частоты атеросклероза и гипертонической болезни на 6,3-14% по сравнению с контрольной группой. Эти изменения были стойкими в течение длительного времени. В этой группе наблюдали расширение границ физиологической ла
502
бильности вегетативно-сосудистой регуляции с формированием синдрома вегетативно-сосудистой дистонии гипертонического типа (Гуськова А.К., 1980). Автор работы оценивает указанные отклонения преимущественно как неспецифическое расширение физиологической лабильности по типу адекватной реакции напряжения адаптивных систем ко всему комплексу влияний внешней среды, включая профессиональное облучение в изучаемом диапазоне доз ионизирующего излучения.
При дозах облучения в диапазоне 70-150 сЗв в 37% случаев формируется неврологический синдром нарушения нейро-висцеральной регуляции, компенсированная нейроциркуляторная дистония гипотонического характера, которая в сочетании с определенными изменениями в других органах и системах может считаться составной частью I-й стадии хронической лучевой болезни (Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971).
При облучении в более высоких дозах (150-400 сЗв) резко возрастает частота нейроциркуляторной дистонии, усугубляются сосудистые изменения и нарушения периферического кровообращения, нарастают изменения в других органах и системах, присущие хронической лучевой болезни П-й и Ш-й стадиям. Отмечалось снижение функциональных возможностей высших отделов ЦНС, выражающееся в повышении психической утомляемости, снижении внимания, памяти, нарушении взаимодействия различных анализаторов. Эти проявления, характерные для астенического синдрома, нарастали с увеличением дозы. При максимальной дозе астенический синдром наблюдали у 70% обследуемых (Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971).
Наиболее типичными изменениями со стороны сердечно-сосудистой системы при действии ионизирующих излучений в дозах, приводящих к развитию хронической лучевой болезни (суммарные дозы порядка 50-400 сЗв, мощность дозы в пределах 0,1-1,0 сЗв/сут), являются не общие, а региональные нарушения периферического кровообращения в коже, конечностях, реже в головном мозгу (Солодова Р.А. и др., 1966; Солодова Р.А., 1967; Байсоголов Г.Д., Гуськова А.К., 1966; Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971). При этом первоначальные сдвиги при дозах 50-100 сЗв не имеют строгой направленности и характеризуются
503
большей неустойчивостью основных гемодинамических показателей особенно при функциональных пробах. Отмечаются лабильность пульса и артериального давления, возрастание систолического и минутного объема, увеличение скорости распространения пульсовой волны, явления сосудистой дистонии при реогра-фическом исследовании, понижение общего периферического сопротивления. При физической нагрузке выявляются преходящие нарушения нервно-рефлекторной регуляции деятельности сердца.
С нарастанием суммарной дозы облучения (100-150 сЗв) сдвиги приобретают более однонаправленный характер. Наблюдались брадикардия, артериальная гипотензия и сосудистая гипотония в различных областях. Вид капилляров ногтевого ложа свидетельствовал о признаках спастико-атонического состояния. Температура кожи в дистальных отделах тела снижалась. Отмечались боли, онемения, парастезия кожи рук и ног. Указанные признаки формируют синдром нарушения периферического кровообращения в конечностях. Офтальмодинамометрические исследования обнаружили закономерное снижение давления в центральной артерии сетчатки у лиц уже при дозах, превышающих 50 сЗв. Указанные явления подтверждались как общими клиническими симптомами, так и типичной капилляроскопической картиной (Брагина В.А., Кирсанова Г.И., 1968), изменениями сосудистой сети глазного дна (Львовская Э.Н., 1969), нарушениями обычной термотопографии, сдвигами суммарного кровенаполнения и изменениями реактивности сосудов соответствующей области, особенно при адекватных нагрузках (Жмуркин В.П. и др., 1965; Орлов В.М., 1968).
Один из характерных вариантов синдрома регионарной недостаточности кровообращения проявлялся в жалобах на боли в конечностях, чаще ног (остеальгия), которые иногда являются ведущими в субъективной картине хронического лучевого заболевания (Гуськова А.К., Ларионова И.К., 1963). Многообразные расстройства кровообращения в костных структурах при воздействии радиации показаны рядом патоморфологических, физиологических и рентгеноморфологических исследований при дозах порядка 70-400 сЗв (Соловьев Ю.Н., 1959 Литвинов Н.Н., 1962; Макарычева Р.И., 1962), соизмеримых с допустимыми до 2004 г. дозами для космонавтов за период их профессиональной деятельности.
504
На основании имеющихся публикаций по данному вопросу автор работы (Москалев Ю.И., 1971) указывает, что в отношении усиления склеротических поражений кровеносных сосудов ионизирующие излучения являются одним из факторов риска, ответственных за развитие сосудистой патологии. Помимо регионарных циркуляторных нарушений с большим постоянством выявляется наклонность к общей артериальной гипотонии (до 13,3 кПа и менее). Нейроциркуляторная дистония может сохраняться до 10 лет после прекращения облучения. Через 15-20 лет частота гипотензивных состояний у лиц, получивших в профессиональных условиях суммарно за 10 и более лет дозы до 4,0 Зв, уменьшается, но повышается риск развития атеросклеротических изменений с развитием гипертонического статуса.
Недостаточность церебрального кровообращения при воздействии ионизирующих излучений проявляется в двух основных синдромах в зависимости от преимущественного понижения или повышения тонуса артерий и вен мозга (Гуськова А.К., Юрков Н.Н., Кирюшкин В.И., 1961). Исследования мозгового кровообращения методом реографии, плетизмографии по Вотчалу и пьезографии установили предрасположенность внутримозговых сосудов к дистонии преимущественно гипотонического типа с развитием в более поздние сроки признаков венозного застоя при накоплении больших суммарных доз. Затруднения венозного оттока становятся ведущими в клинической картине региональных нарушений мозгового кровообращения и в общем синдроме нейроциркуляторной дистонии (Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А., 1971).
Как показал анализ рассмотренных выше работ, при дозах 50-70 сЗв изменения сердечной деятельности могут характеризоваться весьма умеренными сдвигами преимущественно регуляторного характера и незначительными нарушениями в обмене самой сердечной мышцы по типу нерезко выраженных явлений миокардиодистрофии. При анализе частоты различных отклонений сердечной деятельности по мере увеличения суммарной дозы облучения до 70-150 сЗв и более отмечается некоторое возрастание жалоб на отдышку и боли в области сердца, как правило, в сочетании с общими неврологическими жалобами. По прекращении лучевого воздействия на фоне отчетливо выраженных приспособительных реакций в гемодинамике признаки структурных изменений сердца и сосудов, если они возникали, отличались значительной
505
устойчивостью (Гуськова А.К., Байсоголов Г.Д., 1971; Воробьев Е.И., 1971; Воробьев Е.И., Степанов Р.П., 1985).
Имеющиеся материалы показывают последовательное усиление изменений в сердечно-сосудистой системе и развитие нарушений кровообращения в различных отделах по мере увеличения суммарных поглощенных доз при хроническом многолетнем профессиональном облучении. Нами сделана попытка ранжирования изменений в сердечно-сосудистой системе и в ее регуляции со стороны центральной нервной системы по мере увеличения дозы ионизирующих излучений с целью обоснования суммарных допустимых доз за всю профессиональную карьеру космонавтов. Обобщающие данные по этому разделу представлены в табл. 9.4.
Из данных таблицы видно, что при хроническом облучении в эквивалентных дозах 15-100 сЗв идет формирование неспецифической адаптивной реакции организма на новый комплекс профессионального воздействия. Изменения сходны с реакцией на другие неблагоприятные факторы внешней среды и находятся в границах физиологической нормы. Имеет место начальная фаза синдрома нейроциркуляторной дистонии гипотонического типа. Частота астенического синдрома такая же как в контрольной группе обследованных, не подвергающихся профессиональному облучению. Формирование синдрома обусловлено эндогенными и экзогенными факторами: соматическими заболеваниями, психотравмами, нарушением ритма жизни и работы. При облучении в этом диапазоне доз исключается возможность органических поражений ССС, не ухудшаются общее самочувствие и работоспособность человека.
При дозах ионизирующих излучений в диапазоне 100-150 сЗв имеет место напряжение адаптивных систем ко всему комплексу влияний внешней среды, включая профессиональное облучение. Имеет место расширение границ физиологической лабильности, особенно при применении дополнительной нагрузки. Отмечается увеличение частоты астенического синдрома и разнообразных проявлений нейроциркуляторной дистонии. Наблюдаются брадикардия, артериальная гипотензия и сосудистая гипотония в различных областях, снижение суммарного кровенаполнения сосудов, их реактивности. У пациентов наблюдаются общая слабость, повышенная утомляемость, головные боли, головокружение, раздражительность, расстройства сна, забывчивость, боли в области
506
Таблица 9.4
Характер развития нарушений в сердечно-сосудистой системе (ССС), а также регуляции ее со стороны ЦНС по мере увеличения дозы хронического профессионального облучения
507
Диапазон доз, сЗв Характер проявлений в отдаленном периоде Частота проявлений Клиническая оценка Литературные источники
1 2 3 4 5
15-100 Сосудистая дистония гипотонического типа В том числе в артерии сетчатки 25% случаев (в контроле 6%) 21% случаев (в контроле 7%) Формирование неспецифической адаптивной реакции организма на новый комплекс профессионального воздействия. Изменения сходны с реакцией на другие неблагоприятные факторы внешней среды и находятся в границах физиологической нормы Гуськова А. К. и др., 1966, 1967; Денисова Е.А., 1962, 1970
Чаще выражена брадикардия 45% случаев (в контроле 25%)
Большая лабильность пульса и АД при функциональных пробах 38% случаев (в контроле 6%)
50-100 Астенический синдром Как в контроле Формирование синдрома обусловлено эндогенными и экзогенными факторами, как в контроле (заболевания, психотравмы, нарушение ритма жизни, работы) Денисова Е.А., 1962, 1970; Гуськова А. К. и др., 1971
508
Продолжение табл. 9.4
1 2 3 4 5
Нарушение вегетативной иннервации, снижение сосудистого тонуса, увеличение частоты региональной и общей гипотензии. Легкие сдвиги нейрососудистой регуляции (лабильность пульса и АД при нагрузках) 20-30% случаев (в контроле 6%) Отклонения не ухудшали общего самочувствия и не сказывались на работоспособности. Все это отличало обследованных от больных гипотонической болезнью Гуськова А.К. и др., 1966, 1967, 1971; Денисова Е.А., 1962, 1970
Преходящие нарушения периферического кровообращения в коже, конечностях, сетчатке, нарушения мозгового кровообращения и венозного оттока. Нарушение регуляции деятельности сердца со стороны ЦНС при физических нагрузках Исключается возможность органических поражений ССС. При верхней границе доз отмечается увеличение частоты АС и разнообразных проявлений нейроциркуляторной дистонии. Частота явной патологии ССС не увеличена и соответствует норме Гуськова А.К., Байсоголов Г.Д. 1971; Гуськова А.К. и др., 1966, 1967, 1971; Денисова Е.А., 1962, 1970; Кирсанова Г.И., 1968; Качанова Е.М. и др., 1966, 1981; Солодова Р.А., 1967
Чаще расстройства сердечной деятельности, связанные с нарушениями вегетативной регуляции и возбудимостью сердечной мышцы. Нерезко выраженные явления миокардиодистрофии
60S
50-130 Увеличение частоты атеросклероза и гипертонической болезни в течение длительного времени Повышение на 6-14% по отношению к контролю Неспецифическое расширение лабильности по типу реакции напряжения адаптивных систем ко всему комплексу влияний внешней среды, включая профессиональное облучение Гуськова А.К., Байсоголов Г.Д., 1971;
Расширение границ физиологической мобильности с формированием синдрома ВСД гипертонического типа Воробьев Е.И., 1971; Воробьев Е.И., Степанов Р.П., 1985
70-150 Возрастание жалоб на одышку в области сердца в сочетании с общими неврологическими жалобами. Признаки структурных изменений сердца и сосудов, отличающиеся значительной стойкостью Повышение на 6-14% по отношению к контролю Гуськова А.К., Байсоголов Г.Д., 1971; Воробьев Е.И., 1971; Воробьев Е.И., Степанов Р.П., 1985
Выраженные проявления синдрома нейроциркуляторной дистонии. Наблюдаются чаще общая слабость, повышенная утомляемость, головокружение, раздражительность, расстройство сна, забывчивость, головные боли и боли в области сердца В 37% случаев Наряду с радиационными проявлениями в других органах и тканях они являются составной частью I стадии хронической лучевой болезни Гуськова А.К., Байсоголов Г.Д., 1971; Гуськова А.К. и др., 1971
510
Продолжение табл. 9.4
1 2 3 4 5
100-150 Чаще наблюдаются брадикардия и сосудистая гипотония в различных областях, снижение суммарного кровенаполнения сосудов, их реактивности, нарушения терморегуляции (снижение температуры кожи в дистальных отделах). Учащение жалоб на боли в конечностях, онемения, па-растезия кожи рук и ног То же То же Гуськова А.К., Ларионова И.К., 1963; Жмуркин В.П. и др., 1965; Брагина В.А., Кирсанова Г.И., 1968; Орлов В.М., 1968; Львовская Э.Н., 1969; Гуськова А.К. и др., 1971
150-400 Резкое увеличение частоты нейроциркуляторной дистонии. Усугубление сосудистых изменений и нарушений периферического кровообращения До 70% случаев Нарастающие радиационные эффекты в органах и системах, присущие хронической лучевой болезни II и III стадий
Увеличение частоты нарушений церебрального кровообращения (затруднение венозного оттока). Ухудшение здоровья и работоспособности человека (особенно операторской деятельности). Соловьев Ю.Н., 1959; Гуськова А.К., и др., 1961;
511
Увеличение жалоб на боли в конечностях, онемения. Многообразные расстройства кровообращения в костных структурах Ионизирующие излучения в этих дозах являются одним из факторов риска развития серьезной сосудистой патологии Литвинов Н.Н., 1962; Гуськова А.К., Ларионова И.К., 1963
150-400 Повышение реактивности и функциональной неустойчивости ССС к дополнительным нагрузкам и патогенным воздействиям Снижение функциональных возможностей высших отделов ЦНС, выражающееся в повышении психической утомляемости, снижении памяти, нарушения взаимодействия анализаторов, значительное увеличение спектра и количества жалоб на плохое самочувствие То же Нейроциркуляторная дистония сохраняется до 10 лет после прекращения облучения. Через 15-20 лет при дозе 400 сЗв увеличивается риск развития атеросклеротических изменений с развитием гипертонии Жмуркин В.П. и др., 1965; Брагина В.А., Кирсанова Г.И., 1968; Орлов В.М., 1968; Львовская Э.Н., 1969; Гуськова А.К. и др., 1966, 1967, 1971; Москалев Ю.И., 1991
Резкое увеличение частоты астенического синдрома До 60-70% случаев
сердца. Указанные проявления свидетельствуют уже о некотором снижении работоспособности человека.
В отдаленном периоде имеет место увеличение частоты атеросклероза и гипертонической болезни. В то же время частота явной патологии ССС не увеличена и соответствует средним статистическим данным. Рассмотренные проявления наряду с радиационными изменениями в других органах и тканях являются составной частью I стадии хронической лучевой болезни. Несмотря на напряженный характер работы со стороны регуляторных систем, изменения в этом диапазоне доз носят компенсированный характер и при прекращении дальнейшего облучения значительная часть неблагоприятных проявлений может устраняться. Однако при этом признаки структурных изменений сердца и сосудов характеризуются значительной стойкостью.
В диапазоне доз 150-400 сЗв отмечается более резкое увеличение частоты и тяжести различных проявлений, определяющих синдром нейроциркуляторной дистонии, свидетельствующих о серьезных нарушениях в системе кровообращения, которые наряду с нарушениями вегетативно-висцеральной регуляции приводят к заметным сдвигам в сердечной деятельности, особенно выраженным в ответ на действие дополнительных нагрузок на организм. Отмеченные нарушения возрастают с увеличением длительности профессиональной работы и общей поглощенной дозы. Наряду со значительными морфологическими изменениями структуры нейронов, снижением тонуса сосудов коры головного мозга и нарушениями мозгового кровообращения появляются признаки хронического истощения компенсаторно-приспособительных реакций, и наблюдается развитие вследствие этого дистрофических процессов в ЦНС. Отмечается снижение функциональных возможностей высших отделов ЦНС, выражающееся в повышении психической утомляемости, снижении внимания, памяти, нарушении взаимодействия анализаторов. Эти проявления, характерные для астенического синдрома, нарастают с увеличением дозы.
При приближении к верхнему пределу доз значительно увеличивается частота развития астенического синдрома (до 70%), обусловливающего увеличение спектра и количества жалоб на ухудшение самочувствия и серьезное ослабление работоспособности человека. Эти изменения вместе с другими радиационными проявлениями в радиочувствительных системах организма при дозах,
512
превышающих 150 сЗв, приводят к развитию последующих более тяжелых стадий хронической лучевой болезни.
Таким образом, анализ представленных материалов свидетельствует о развитии глубоких изменений со стороны центральной нервной и сердечно-сосудистой систем после радиационных воздействий в дозах 150-400 сЗв. В то же время известно, что этот диапазон доз находился до 2004 г. в пределах допустимых уровней радиационного воздействия на космонавтов за всю их карьеру. Отмеченные изменения в ЦНС и ССС могут серьезно сказаться на увеличении числа ошибок космонавтов в процессе полета и снижении надежности успешного выполнения программы полета, с одной стороны, а с другой — свидетельствуют о возможном существенном снижении здоровья и работоспособности космонавтов к концу их профессиональной деятельности, снижении компенсаторных возможностей организма и его способности адаптации к действию факторов окружающей среды. Это необходимо учитывать при обосновании предельных допустимых доз для космонавтов за всю их профессиональную карьеру. По нашему мнению, предельное значение среднетканевой эквивалентной дозы за всю карьеру космонавтов для сохранения социально приемлемого уровня их здоровья и работоспособности должен не превышать 100 сЗв. Это обоснование и материалы, представленные в разд. 8, где приведены оценки суммарного радиационного риска для космонавтов в течение их жизни, легли в основу выпущенных при нашем участии методических указаний (Методические указания МУ 2.6.1.44-03-2004.) по ограничению облучения космонавтов при околоземных космических полетах, включая ограничение суммарных величин доз за весь период их работы в отряде космонавтов.
94. Отдаленные последствия лучевых поражений кожи в зависимости от дозы радиационного воздействия
Как указывалось в разд 3.5, пороговые величины доз для ранних повреждений кожи, таких как сухой и влажный эпидермит, обусловленных нарушением клеточной кинетики в эпидермисе, составляют 1200-1700 сГр. Порог же для трансдермальных повреждений кожи, затрагивающих более глубокие слои и
513
приводящих к развитию хронических воспалительных реакции, атрофии и некрозу кожи, составляет 2180-2500 сГр (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988). Таким образом, в то время как острая лучевая реакция эпидермиса связана главным образом с прямым действием радиации на систему его клеточного обновления, этиология поздних эффектов в основном связана с нарушениями других структур, расположенных в дерме и в более глубоких слоях. В частности, это обусловлено сосудистыми нарушениями и изменением кровоснабжения в облученных участках ткани.
При указанных сравнительно высоких дозах на кожу отмечаются серьезные поражения во всех поверхностных структурах: эпидермисе, дерме, включая повреждения кровеносных сосудов (капилляров) и других образований, развивается диффузный некроз, сопровождающийся шелушением и изъязвлением абсолютно во всех слоях кожи. Отмечаются серьезные нарушения кровоснабжения ткани, приводящие к существенному замедлению ее восстановления. В этом случае возникают глубокие язвы, являющиеся основой отдаленных хронических воспалительных реакций, развиваются атрофия кожи и ее некроз.
Основные клинические наблюдения прежде всего касаются изменений соединительной ткани, и в частности эндотелия капилляров. Известно, что соединительная ткань одинакова во всем организме, а сосудистые реакции являются частой причиной отдаленных осложнений лучевой терапии. Поскольку поздние лучевые реакции кожи, за которыми легче проводить наблюдения в клинических условиях, связаны именно с поражением соединительной ткани и сосудистой сети, то закономерности, установленные при изучении лучевых реакций кожи, могут быть применены и к ряду других тканей. Действительно, время появления поздних лучевых реакций кожи, таких как фиброз, изъязвления, некроз, близко по срокам к развитию поражения в слизистой ЛОР-органов, мочевого пузыря, тонкого кишечника, прямой кишки, альвеолярной ткани легкого (Ярмоненко С.П., Вайнсон А.А., Календо Г.С., Рампан Ю.И., 1976).
Радиочувствительность эндотелиальных клеток сосудов достаточно высока. Для клеток эндотелия капилляров кожи мышей в литературе приводится значение параметра Do, равное 1,7-2,4 Гр, экстраполяционное число в диапазоне 2-6,6 и величина плеча Dq, равная 1,8-3,4 Гр (Гозенбук В.Л., Кеирим-Маркус И.Б., 1988; Осанов Д.П., 1990). Эти параметры получены на основе анализа ра
514
диочувствительности и кинетики клеток в макроколониях in vitro, находящихся в митотическом цикле. Поэтому они оказываются значительно более радиочувствительными, чем в ткани и даже превышают радиочувствительность базальных клеток. После облучения в стадии покоя эндотелиальные клетки сохраняются даже при больших дозах, однако при их вступлении в цикл проявляется их скрытое радиационное поражение, что приводит к отсроченному поражению капиллярной сети.
По данным работы (Archambeau J.O., Jones A., Fajardo L.F., 1985), полученным при исследовании кожи поросят, в течение 4 недель после облучения в стенках микрососудистой сети не наблюдается заметных изменений. Через месяц число эндотелиальных клеток в капиллярах начинает снижаться. Поскольку стенки капилляров содержат один слой плоских клеток, гибель даже единичных клеток может нарушить их целостность, привести к разрушению капилляров и нарушению микроциркуляторной сети, что вызывает ухудшение питания эпидермиса и снижает компенсаторные возможности по усилению регенерации ткани.
Параллельно со снижением клеточности уменьшается суммарный просвет капилляров, увеличивается также расстояние между эндотелиальными клетками в стенке капилляров. Микроциркуля-торная сеть разрушается. Восстановление капиллярной сети происходит обычно путем прорастания уцелевших сосудов. Однако потенциальная способность восстановления капилляров существенно снижается с увеличением дозы. Уже при дозе 1 Гр отмечено снижение способности сосудов к прорастанию, а при дозах 2-7 Гр скорость их удлинения снижается примерно в 2 раза. При дозах более 7 Гр значительно уменьшается также число эндотелиальных клеток, сохраняющих способность возвращаться в митотический цикл из стадии покоя Go, рост капиллярной сети резко замедляется. При дозах 20 Гр и более ее восстановление оказывается невозможным. Дополнительной причиной поражения дермы при столь высоких дозах является также непосредственное поражение соединительной ткани (Archambeau J.О., Jones A., Fajardo L.F., 1985; Гозенбук В.Л., Кеирим-Маркус И.Б., 1988).
Мы проанализировали характер поздних лучевых повреждений кожи на основе результатов экспериментальных исследований по мере увеличения поглощенной дозы. Особый интерес для нас представляли сведения в том случае, когда максимальные значения поглощенной дозы приходились на эпидермис и дерму. Так,
515
опыты с местным внешним облучением кожи крыс и кроликов в широком диапазоне доз с мощностями доз от 1 до 26 сГр/мин показали, что поздние лучевые изменения кожи отсутствовали при воздействии в дозах 100-200 сГр. Они проявлялись в диапазоне доз 600-700 сГр, а при дозах, превышающих 800 сГр, имели место в 100% случаев. При этом регистрировали рубцовую атрофию кожи, пятнистую пигментацию, телеангиэктазии, доброкачественные опухоли (ангиомы) и в единичных случаях злокачественные новообразования (фибросаркомы). Отдаленные повреждения кожи представлены в табл. 9.5.
При однократных острых, тотальных гамма-облучениях крыс в широком диапазоне доз, незначительные поздние лучевые изменения кожи (эпиляция, сухой эпидермит) отмечали при облучении животных в дозах 100-300 рад.
Более существенные изменения имели место при более высоких дозах (500-3000 сГр). В этом случае у 15-30% крыс на фоне радиационных язв развиваются злокачественные опухоли кожи. С увеличением дозы от 3000 сГр до 5000 сГр зарегистрировано возникновение радиационных долго незаживающих язв и отмечали возникновение злокачественных новообразований в 62,5% случаев (Москалев Ю.И., Шелеснова В.И., Стрельцова В.Н., 1978). При местном воздействии рентгеновских лучей в дозах 2000-6600 сГр на область спины зафиксированы повреждение кровеносных сосудов кожи, появление радиационных язв, новообразования при дозах 2000 и 4000 сГр в 20 и 100% случаев соответственно (см. табл. 9.5).
Данные, представленные в таблице, свидетельствуют о зависимости поздних лучевых изменений кожи от поглощенной дозы ионизирующего излучения. С возрастанием дозы утяжеляется характер клинических проявлений отдаленных последствий лучевого поражения кожи. Некоторые поздние лучевые изменения кожи и увеличение вероятности образования рака кожи при разных вариантах облучения следует ожидать при действии доз, превышающих 250-300 сГр. Как показали результаты экспериментальных исследований, развитие относительно тяжелых осложнений (незаживающих язв и неоплазм кожи) вероятно при этих дозах в 3-4% случаев. Тяжелые последствия с большей вероятностью (15-30% случаев) могут иметь место при облучении кожных покровов в дозах, превышающих 500 сГр.
Имеются указания (Либерман А.Н., Бронштейн И.Э., Сафронов М.В., 1976) на то, что бластомогенный эффект при облуче-
516
517
Таблица 9.5
Отдаленные повреждения кожи после воздействия ионизирующих излучений (экспериментальные данные)
Условия облучения Дозы, сГр Объект исследования и характер отдаленных последствий Источник информации
32Р, внешнее, местное облучение мощность дозы, 1-26 р/мин 100-200 600-700 800-3000 Крысы, кролики Отдаленные последствия отсутствуют. В части случаев рубцовая атрофия кожи, пигментация, телеангиэктазии. В 100% случаев рубцовая атрофия кожи, пятнистая пигментация, телеангиэктазии. Ангиомы и фибросаркомы в единичных случаях Прокопчук В.А., 1961
Гамма-облучение тотальное, однократное 100-300 500-3000 3000-5000 Крысы беспородные, самки Эпиляция, сухой дерматит, опухоли в 3,9- 4,9% случаев. Эпиляция, сухой, влажный дерматит, радиационные язвы. Неоплазмы кожи у 15-30% крыс. Радиационные язвы, преиму-щественно злокачественные новообразования в 62,5% случаев Москалев Ю.И., Шелеснова В.И., Стрельцова В.Н., 1978
Рентгеновское 10 кэВ облучение 17 кэВ 40 кэВ 2000-4000 2000-4000 6600 Крысы белые, беспородные Радиационные язвы в 13 и 23% случаев соответственно. Новообразования кожи на 241-373 сутки. Радиационные язвы в 20 и 100% случаев соответственно. Новообразования кожи на 300-532 сутки. Повреждение кровеносных сосудов кожи. Поздние радиационные язвы Шелеснова В.И., 1978; Амосов И.С и др., 1978
нии кожи человека, белой крысы и мыши наблюдается при воздействии практически идентичных доз (различия в пределах 30%). Необходимо отметить, что эти изменения имели место при облучении животных с высокой мощностью дозы. Однако для определения допустимых доз ионизирующих излучений применительно к человеку следует проанализировать также клинические данные об отдаленных последствиях лучевого поражения кожи, накопленные в результате наблюдения за пациентами радиологических клиник, а также материалы периодических медицинских осмотров лиц, имевших в течение длительного времени контакт с ионизирующими излучениями по роду профессиональной деятельности.
Отдаленные или поздние проявления лучевых поражений кожи у человека обычно выражаются развитием телеангиэктазий (стойкое локальное расширение мелких сосудов, главным образом капилляров), гиперкератозов (чрезмерное утолщение рогового слоя эпидермиса), атрофией тканей, включая ногтевые пластинки, появлением трофических язв с возможным перерождением в раковую опухоль. Кроме того, могут иметь место явления индуративного отека и регионарной склеродермии (очаговый склероз пораженных участков кожи без признаков системности, т.е. без генерализованного прогрессирующего склероза кожи и внутренних органов). Наиболее частой формой профессиональных повреждений кожи ионизирующими излучениями, прежде всего рентгеновскими лучами, является хронический лучевой дерматит в сочетании с выпадением волос и девитализацией («старением») кожи, на которой в пораженном участке образуются трещины и язвы.
Хронический лучевой дерматит развивается чаще всего в результате многократного облучения кожи в сравнительно малых дозах. Он характеризуется в начале атрофическим процессом. Появляются участки гипер и депигментации, телеангиэктазии, возникают зуд и нарушения чувствительности. Кожа легко травмируется, образуются трещины. Постепенно присоединяются гиперпластические процессы — образуются бородавчатые разрастания, очаги гиперкератоза, которые рассматривают как предраковые состояния.
Материалы, относящиеся к отдаленным последствиям воздействия ионизирующих излучений на кожу пациентов радиологических клиник и отделений больниц, а также лиц, профессионально
518
работающих с источниками ионизирующих излучений, представлены в табл. 9.6. Анализируя данные таблицы, можно отметить существенную зависимость поздних лучевых реакций кожи человека от суммарных доз радиационного воздействия на нее.
Так, в частности, явления атрофии, сухости кожи, развитие множественных телеангиэктазий, индуративного отека, гиперкератоза, регионарной склеродермии отмечены спустя год и более после воздействия ионизирующих излучений в суммарных дозах в диапазоне 800-2000 сГр. Наряду с указанными клиническими проявлениями поздних лучевых изменений кожи у человека при данном уровне доз, накопленных за несколько недель и месяцев, зарегистрированы единичные случаи хронического дерматита, язвенно-некротических изменений кожи спустя 2-6 и более лет после облучения (табл. 9.6).
По некоторым данным, относящимся к 50-м годам прошлого века, латентный период профессиональных раковых заболеваений кожи вследствие длительного контакта с ионизирующими излучениями колеблется от одного года до 12 лет и в среднем равен 7 годам (Шанин А.П., 1969). В работе Гуськова А.К., Байсоголов Г.Д., 1971) приводятся сведения об увеличении частоты рака кожи, главным образом базально-клеточных карцином лица у шахтеров урановых рудников, проработавших в шахте более 10 лет, при куммулятивной дозе за счет альфа-излучения на базальный слой кожи около 1 Гр. Выявленная частота опухолей оказалась выше ожидаемой в 4,6 раза. Средний латентный период от начала работы на шахте до постановки диагноза составлял 14,2 ± 4,3 лет. Преобладала локализация опухолей на открытых частях тела.
Анализ клинических материалов, проведенный нами, показал, что если суммарная доза на кожу человека, полученная за год и более лет, превысит 800-1000 сЗв, можно ожидать неблагоприятные отдаленные последствия в виде клинически выраженных проявлений хронического лучевого поражения кожи. При воздействии в меньших дозах (особенно в случае облучения с малыми значениями мощностей доз) серьезных нарушений в системе обновления кожи не наблюдается.
В связи с изложенным выше, в последних нормативно-технических документах России по радиационной безопасности космических полетов, разработанных при нашем участии (Методические указания МУ 2.6.1.44-03 — 2004), предельное значение дозы на кожу для космонавтов за всю их профессиональную деятель-
519
520
Таблица 9.6
Поздние лучевые изменения кожи у человека при действии ионизирующих излучений
Условия облучения кожи Доза, сГр Характер отдаленных последствий лучевого поражения кожи Объект наблюдения и источник информации
1 2 3 4
Местное рентгеновское и бета-облучение 800-1200 Явления атрофии, сухость кожи, множественные телеангиэктазии спустя 2-6 лет после облучения Лучевая терапия (Задорожный Б.А., Звягинцева М.В., 1966)
Местное рентгеновское облучение, 150 р/сут 900 Два курса с интервалом 4 года Атрофия, сухость кожи спустя 20 лет Лучевая терапия (Козлова А.В., 1962)
Местное рентгеновское облучение и воздействие СПД на основе Ra* 1000-3000 Сухость кожи, трещины, изменение капиллярного кровотока, дистрофия, изъязвления 26 рентгенологов со стажем работы более 10 лет и 5 человек, работавших с СПД свыше 20 лет (Орлов В.М., 1968)
Рентгеновское облучение 1000 Легкая атрофия кожи Лучевая терапия (Гуськова А.К., Байсоголов Г.Д., 1971)
Местное гамма-и бета-облучение 1100 Сухость кожи, гиперкератоз То же
Местное рентгеновское облучение 1200-1300 Склероз подкожной клетчатки, атрофия кожи, признаки хронического дерматита, изъязвления после легкой травмы спустя 1 год или более Лучевая терапия 191 человек (Козлова А.В., 1962)
Местное рентгеновское и бета-облучение 1200-1500 Язвенно-некротические изменения, поздние лучевые язвы в единичных случаях спустя 2-6 лет Лучевая терапия (Задорожный Б.А., Звягинцева М.В., 1966; Рабен А.С., Антонь-ев А.А., 1975)
521
Местное гамма и бета-облучение 1250-5000 (разовые дозы 200-250) Атрофия эпидермиса, изменение волосяного покрова и сосудов кожи, склероз, лимфоцитарная инфильтрация кожи, гиперкератоз, поздние лучевые язвы Лучевая терапия 191 человек (Рахманов В.А. и др., 1963)
Местное гамма-нейтронное облучение 1600-2000 Индуративный отек, региональная склеродермия Лучевая терапия (Гуськова А.К., Байсоголов Г.Д., 1971)
Местное рентгеновское облучение 3000-4000 Поздние лучевые язвы и злокачественные опухоли в сроки от 1 года до 45 лет Лучевая терапия (Козлова А.В., 1962)
Местное гамма-нейтронное облучение на кожу рук 3000-6000 с малой мощностью дозы У 7 человек отмечена эрозия кожи, у 5-и — долго незаживающие язвы. В 4-х случаях — изменения, характерные для плоскоклеточного рака 16 человек, работавшие с излучениями свыше 6 лет (Орлов В.М., 1968)
Местное рентгеновское и гамма-облучение 4500-6000 разовые дозы 150-250 Пигментация, эпиляция, атрофия, телеангиэктазии, фиброз кожи и подлежащих тканей. Лучевые язвы, лучевой рак в 9,2% случаев через год, в 35,3% — спустя 3 года и в 55,5% случаев — после 3 лет Лучевая терапия 3594 онкобольных (Барбичев М.С. и др., 1980)
Местное рентгеновское облучение 6000 На фоне незаживающих язв, рубцовых изменений кожи развивается лучевой рак Лучевая терапия (Гуськова А.К., Бай-соголов Г.Д., 1971
Воздействие СПД* 10000-20000 Сухость кожи, телеангиэктазии, бородавочные разрастания. В двух случаях рак кожи 4 человека в течение 25-27 лет, занимав-шихся нанесением СПД (Солодова Р.А. и др., 1966)
СПД — светосостав постоянного действия.
ность было снижено с 1200 сГр до 600 сГр, поскольку при 1200 сЗв (действовавший норматив 1985 г.) в отдаленном периоде могли наблюдаться неблагоприятные отдаленные проявления, связанные с серьезными поражениями кожи.
В новых нормативах дозовые пределы за месяц, год и за всю карьеру приняты такими же, как и в современных американских нормативах. Предельное значение дозы на кожу за всю профессиональную деятельность космонавтов не должно превышать 600 сЗв. При этом исключаются ближайшие и отдаленные неблагоприятные проявления со стороны кожи, которые могли бы снизить работоспособность космонавтов.
9.5. Анализ катарактогенной эффективности воздействия излучений с различной плотностью ионизации
Известно, что хрусталик глаза обладает высокой радиочувствительностью и относится к категории критических органов при нормировании радиационного воздействия на человека на Земле и в условиях космического пространства. Поэтому нами на основе литературных данных проведен анализ материалов об изменении вероятности развития помутнений хрусталика и образования катаракт у животных и человека в зависимости от дозы радиационного воздействия и времени после воздействия излучений с различной плотностью ионизации. Рассмотрены также вопросы влияния мощности дозы и режима фракционирования на развитие помутнений хрусталика при действии стандартных видов излучений. Проанализированы экспериментальные данные на различных животных, материалы облучения людей при рентгенотерапии опухолей век, данные осложнений у лиц, подвергнутых атомным бомбардировкам, немногочисленные материалы по профессиональному облучению.
Наиболее чувствительной является экваториальная часть эпителия хрусталика, который в норме медленно пролиферирует в течение всей жизни. Первичные изменения в облученном хрусталике, которые можно обнаружить при помощи гистоморфологиче-ских методов исследования, проявляются в нарушении процессов митоза и гибели отдельных эпителиальных клеток капсулы хрусталика, преимущественно в так называемой герминативной зоне. В экспериментальных исследованиях микроскопические повреж
522
дения таких клеток можно обнаружить в течение нескольких минут после острого облучения излучением с низкой ЛПЭ в дозе около 1 Гр (Ковалев И.Ф., 1967; Кабаченко А.Н., 1974; Москалев Ю.И., 1991).
Позднее обнаруживают различные атипичные и патологические формы эпителиальных клеток (клетки с дополнительными микроядрами, полиморфизм ядра, гигантские и двуядерные клетки). Поврежденные клетки и продукты их дегенерации из ростковой зоны мигрируют и образуют аномальные волокна, которые скапливаются под капсулой около заднего полюса хрусталика, в результате чего искажается кривизна его задней поверхности. При накоплении достаточного количества таких волокон их можно обнаружить офтальмологически, как точечное субкапсулярное помутнение в центре на задней поверхности. На этой стадии оно не оказывает существенного влияния на зрение.
На следующем этапе проявляются нарушения процессов дифференцировки эпителиальных клеток в клетки волокна коркового слоя хрусталика (перемещение ядер дуги экватора, появление утолщенных и недифференцированных эпителиальных клеток у экватора, миграция пузыревидных и недифференцированных клеток по направлению к задней капсуле). Наконец, последним этапом в формировании лучевой катаракты является скопление пузыревидных и недифференцированных эпителиальных клеток у заднего полюса с последующей их дегенерацией и распадом (Кабаченко А.Н., 1974).
Рентгеновское облучение в дозе 15 сГр уже вызывает появление помутнений хрусталика у мышей. Выраженность помутнений увеличивается с дозой и временем, прошедшим после облучения. При облучении в дозе 45 сГр частота помутнений достигает 100% к 33-м суткам. При облучении хрусталика кролика клинические проявления повреждений были отмечены после рентгеновского облучения в дозе 25-45 сГр. Пороговая доза для образования катаракт у 40 недельных кроликов составляла 250 сГр, для взрослых животных 550 сГр или несколько выше (Кабаченко А.Н., 1974).
Следует отметить, что зрелая катаракта формируется только после облучения всего хрусталика или его периферии. Вероятность развития катаракты снижается приблизительно в 6-7 раз, если облучена только центральная часть хрусталика. Частичная защита хрусталика свинцовым экраном ингибирует развитие полной катаракты после рентгеновского облучения кроликов в дозе
523
1000 сГр. Защищенная площадь хрусталика оставалась прозрачной, а облученная часть мутнела. Причем часть таких помутнений регрессировала со временем. У незащищенных кроликов развивалась полная катаракта (Кабаченко А.Н., 1974). Облучение герминативной зоны хрусталика кролика рентгеновским излучением в дозах 600-1000 сГр (диаметр пучка 16 мм) приводило к образованию помутнений 1-7 степени. Если облучение было более локальным (диаметр 3 мм), возникали помутнения лишь 1-4 степени (Geeracts W.J., Ham W.T., Muller Н.А., et al., 1971).
В работе (Кабаченко А.Н., 1974) показано, что фракционированный режим облучения хрусталика также может приводить к снижению степени его поражения. При облучении кроликов двумя дозами по 500 сГр с интервалом в одну неделю у них развивались полные катаракты. Когда интервал был увеличен до 3 недель, полные катаракты не развивались. Как показал анализ результатов аналогичных исследований по облучению хрусталика с различным временным характером распределения дозы, длительный, фракционированный режим облучения может уменьшать степень поражения хрусталика приблизительно в 2-5 раз.
Следует, однако, отметить, что в ряде более продолжительных наблюдений после фракционированного облучения рентгеновскими или гамма-лучами с различными интервалами между фракциями получены данные лишь об увеличении латентного периода образования помутнений у мышей. К 40-й неделе после последнего воздействия эффект фракционирования выравнивался с эффектом однократного облучения. При обследовании животных в более отдаленные сроки число случаев с повреждениями хрусталика, относящимися к начальным I и II стадиям, может уменьшаться, но это связано с развитием более тяжелых осложнений и увеличением процента повреждений следующих стадий развития катаракты в последующие сроки. С увеличением дозы и длительности наблюдения повреждения могут прогрессировать и постепенно захватывать переднюю кору и ядро хрусталика, что может привести к тяжелому расстройству зрения (Кабаченко А.Н., 1974).
Для обоснования допустимых доз для космонавтов при осуществлении длительных космических полетов большой интерес представляют исследования по изучению поражения в хрусталике и развитию катаракт при хроническом облучении. Экспериментальные наблюдения, касающиеся этого вопроса, довольно ограничены. Показано, например, что при длительном облучении мы
524
шей малыми дозами рентгеновского и гамма-излучения в результате развития репаративных процессов возникающие первоначальные повреждения стабилизируются и дальнейшее прогрессирование процесса прекращается, несмотря на продолжающееся облучение (Кабаченко А.Н., 1974).
В работе (Бузини П.А., Калашников Б.П., 1965) авторы исследовали глаза кроликов, которых подвергали непрерывному гамма-облучению в течение 5 лет с мощностями доз 4,3 и 1,2 сГр/сут. Они получили, что при облучении с более высоким значением мощности дозы поражение хрусталика развивается более интенсивно и количество животных с катарактой было в 2 раза большим, чем в группе с меньшей мощностью дозы. В опытах на собаках, непрерывно облучавшихся с меньшими значениями мощностей доз 25, 75, 150 и 225 сЗв/год (Львовская Э.Н., 1969), через 13 месяцев обнаружены точечные помутнения в ядерном слое хрусталика в 20 случаях из 48. К этому сроку наблюдения зрелые катаракты еще не развивались.
Имеется значительное число публикаций по возникновению лучевых катаракт у человека, однако сведения о величине катарактогенной дозы довольно противоречивы. Часть авторов полагает, что при действии рентгеновского излучения она находится в пределах 500-600 сГр. Другие исследователи считают, что уровень катарактогенной дозы является более низким и равен приблизительно 200 сГр. Это, по-видимому, частично связано с различным временным распределением дозы. Так, для однократного острого рентгеновского облучения минимальная катарактогенная доза, как считает ряд исследователей, равна 200 сГр. При облучении в течение 3 месяцев она составит 300-400 сГр. Приблизительно такая же величина дозы получена при фракционированном облучении с интервалом до 3 месяцев. При более длительном облучении значение катарактогенной дозы возрастало до 550-600 сГр, а в том случае, когда использовали интервалы между облучениями больше 3 лет, она достигала 800 сГр (Кабаченко А.Н., 1974).
Близкие уровни пороговых доз представлены в обзорном исследовании (Москалев Ю.И., 1991). По минимально различимым помутнениям хрусталика в самой большой группе больных, подвергавшихся радиотерапии, а затем обследованных на наличие таких повреждений, порог дозы рентгеновского излучения изменялся от 2 Гр при однократном облучении до 5,5 Гр при фракционировании дозы в течение 3-13 недель. Наименьшая доза, вызываю
525
щая прогрессирующую катаракту у этих больных, наблюдавшихся в течение 35 лет, составила 5 Гр. Частота повреждений хрусталика достигала 100% после однократного облучения в дозе 7,5 Гр или фракционированного облучения в дозе 14 Гр. Катарактогенные дозы при воздействии излучений с низкой ЛПЭ и с низкой мощностью дозы превышали 8 Гр (Москалев Ю.И., 1991). На основе этих наблюдений в публикации № 41 МКРЗ (Дозовые зависимости нестохастических эффектов, 1987) предполагается, что для возникновения катаракты, нарушающей зрение, в условиях сильно протяженного воздействия, характерного для профессионального облучения, доза излучения с низкой ЛПЭ должна быть более 8 Гр.
Следует однако отметить, что при длительном, профессиональном облучении в малых дозах порядка 1 Гр уже отмечается локальная артериальная гипотензия и усиление проницаемости сосудов глаза, а при дозах 1,5-4,0 Гр наблюдаются признаки структурных нарушений (Гуськова А.К., Байсоголов Г.Д., 1971). Кроме того, ряд авторов приводит более низкие значения пороговых доз, выше которых уже отмечается увеличение частоты возникновения старческих катаракт. Так, в работе (Львовская Э.Н., 1969) показано, что при хроническом рентгеновском облучении в течение 5-30 лет в дозах 30-400 сГр или гамма-облучении в дозах 100-500 сГр, наблюдали учащение случаев старческих катаракт до 9,6 и 10,5% соответственно при 1,6% в контроле. Увеличение частоты старческих катаракт при воздействии ионизирующих излучений отмечали и другие исследователи (Волкова К.В., 1959; Быстрова Ю.А., 1960).
Развитию лучевой катаракты предшествует сравнительно длительный скрытый, или латентный, период. Как показано в работе (Кабаченко А.Н., 1974), латентный период у животных может изменяться в широких пределах: от месяца до года. Его длительность зависит от вида животных, их возраста, величины дозы и режима облучения. Длительность латентного периода развития лучевой катаракты у человека также может варьировать в широких пределах: от 2-3 месяцев до 10-12 лет и более. Это многостадийный процесс, причем он может порой останавливаться на отдельных стадиях или последовательно переходить из одной стадии в другую. Оценка вероятности различных по характеру повреждений разными авторами в отдельные периоды после облучения
526
приводит к некоторому разбросу оцениваемых величин пороговых доз (Кабаченко А.Н., 1974).
Кроме исследования скорости образования помутнений хрусталика, представляет также интерес рассмотрение возможных особенностей развития повреждений хрусталика при действии излучений с высокой плотностью ионизации. В подробном обзоре (Кабаченко А.Н., 1974), посвященном изучению указанных вопросов, показано, что ни в одном из многочисленных исследований не было отмечено каких-либо качественных особенностей действия на хрусталик тех или иных видов внешнего излучения. Выявленные количественные отличия для излучений с различной ЛПЭ заключаются в длительности латентного периода, скорости формирования помутнений хрусталика и величинах доз, необходимых для получения эквивалентного действия.
Анализ литературных данных показал, что значение коэффициента ОБЭ по критерию образования катаракт у мышей и крыс для гамма-излучения, по сравнению со стандартным рентгеновским излучением с напряжением на трубке 180-250 кВ, по данным различных исследователей находится в диапазоне от 0,8 до 1,0 (Кабаченко А.Н., 1974; Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000). При изучении биологического действия быстрых нейтронов было отмечено, что хрусталик глаза существенно более чувствителен к их действию по сравнению со стандартными видами излучений. В многочисленных исследованиях показано, что нейтроны приблизительно в 10 раз эффективнее рентгеновского и гамма-излучений (Кабаченко А.Н., 1974; Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000). Биологическая эффективность быстрых нейтронов в отношении действия на хрусталик максимальная для нейтронов реакторного спектра, убывает с увеличением энергии нейтронов и уменьшением величины ЛПЭ. Это находится в полном соответствии с обобщающей работой по действию нейтронов различных энергий на организм млекопитающих, оцениваемому на основе реакции целостного организма и отдельных его тканей (Свердлов А.Г., 1974).
В табл. 9.7 представлены значения коэффициентов ОБЭ нейтронов разных энергий, полученные на основании частоты помутнений хрусталика (Merriam G.R., Biavati B.J., Bateman J.L. et al., 1965). Величина коэффициента ОБЭ для нейтронов 14 МэВ (ЛПЭ равно 18 кэВ/мкм) оценивается в диапазоне 1,6-4,5 (Merriam G.R., Biavati BJ., Bateman J.L. et al., 1965; Кабачен-
527
ко А.Н., 1974). Авторы смогли определить значения коэффициентов ОБЭ только для 1-й и 2-й стадий развития катаракты, поскольку животные погибли раньше, чем у них могли бы сформироваться более поздние стадии, определяющие зрелую катаракту.
После фракционированного облучения мышей нейтронами с энергией 0,43-1,8 МэВ с интервалом в 22 часа эффект был такой же, как и после однократного облучения в той же дозе. Показано, что частота помутнений хрусталика после нейтронного облучения, в отличие от действия стандартных видов излучений, не зависит ни от режима фракционированного облучения, ни от мощности дозы радиационного воздействия. Это присуще воздействию излучений с высокими значениями ЛПЭ (Merriam G.R., Focht E.F., 1957; Кабаченко А.Н., 1974; Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000).
Таблица 9.7
Значения коэффициентов ОБЭ быстрых нейтронов различных энергий в отношении развития начальных стадий катаракты
Энергия нейтронов, МэВ ЛПЭ, кэВ/мкм Значение коэффициентов ОБЭ
1-я стадия помутнения хрусталика 2-я стадия помутнения хрусталика
0,43 70 7,3 8,9
1,0 62 6,1 7,5
1,5-1,8 46-50 5,1 5,9
Немногочисленные данные, полученные на людях, подвергшихся воздействию ионизирующей радиации в результате несчастных случаев, а также выживших после атомной бомбардировки в Хиросиме и Нагасаки, также свидетельствуют о большей катарактогенной эффективности нейтронов по сравнению с рентгеновскими лучами. По данным, представленным в работе (Merriam G.R., Focht E.F., 1957), коэффициент относительной биологической эффективности нейтронов примерно равен 5,0. Величина минимальной катарактогенной дозы нейтронов определена в пределах 70-100 сЗв (бэр). Однако помутнения в хрусталике могут возникать и после облучения нейтронами в более низких дозах. Анализ литературных данных, проведенный в работе (Кабаченко А.Н.,
528
1974), показал, что уже при поглощенной дозе нейтронов в хрусталике 8,6 сГр частота помутнений хрусталика увеличивается. Возникшие изменения в хрусталике сохраняются в течение длительного времени. У людей, подвергавшихся внешнему гамма-нейтронному облучению в течение 5-10 лет в суммарных дозах 30-70 бэр, наблюдали выраженное оптическое уплотнение хрусталика по сравнению со здоровыми хрусталиками у лиц контрольной группы (Львовская Э.Н., 1969).
Определенный интерес представляет также информация о последствиях аварии на Чернобыльской АЭС. Однако следует учитывать некоторую неопределенность в оценке поглощенных доз и сравнительно небольшие сроки (13 лет после аварии) для проявления отдаленных последствий лучевой патологии в отношении развития зрелых катаракт. Кроме того, обследуемые контингенты относительно малочисленны. Результаты офтальмологического обследования, представленные в работе (Лазаретник Б.Ш., Бак-бардин Ю.В., Гребенник А.В., 1993), тем не менее показывают, что уже при относительно малых дозах 3-38 сГр у 32 из 96 ликвидаторов обнаруживались мелкоточечные помутнения хрусталика. Значительно меньшая частота помутнений наблюдалась у лиц летного состава, не принимавших участия в ликвидации аварии на ЧАЭС. Авторы этого исследования отмечают, что, возможно, немаловажную роль для образования катаракты имеет стрессовое состояние человека (психологический фактор). В контрольной группе лиц (32 человек), не имевших контакта с радиоактивными веществами и не проживавшими на загрязненной местности, изменений в хрусталике не обнаружено.
При обследования 6895 детей, проживающих в Житомирской и Донецкой областях, в 24,5% случаев обнаруживались точечные помутнения хрусталика в кортикальных слоях и облаковидные помутнения капсулы хрусталика. Такая же частота помутнений хрусталика (24%) отмечалась при наблюдении 537 взрослых, участвовавших в ликвидации аварии на ЧАЭС (Сухина Л.А., Смирнова А.Ф., Чубарь С.В., Али 3., 1993).
Авторы работ (Айтмагометов М.Т., Деев А.И., Владимирова Ю.А., 1991; Деев А.И. и др., 1997) полагают, что пусковые механизмы образования катаракты включают не столько расстройство обмена веществ в тканях глаза, сколько связаны с состоянием метаболического статуса в организме — нарушениями липидного, углеводного, белкового, минерального обменов веществ. В частно
529
сти, показано, что ранние стадии катаракты сопровождаются изменениями белков с образованием высокомолекулярных агрегатов, рассеивающих свет (Айтмагометов М.Т., Деев А.И., Владимирова Ю.А., 1991). Наблюдается также нарушение регулярности укладки мембран хрусталика, возникающее вследствие сорбции на их поверхности недостаточно фосфорилированных белков, что вызвано нарушением ц-АМФ зависимого фосфорилирования (Деев А.И. и др., 1997). За последние 5 лет вырос показатель заболеваемости катарактой в радиационно-загрязненных районах (2-5 Ки/км2). При этом отмечено 37,2% корковых изменений, 23,4% — ядерных, и 16,72% — смешанных (Шкромида М.И. и др., 1993).
Большое практическое значение для решения вопросов безопасности космических полетов и нормирования уровней радиационного воздействия на космонавтов, имеют результаты экспериментальных исследований по изучению воздействия на хрусталик глаза пучков ускоренных заряженных частиц и их сравнение с данными рентгеновского и гамма-облучений. Показано, что при воздействии протонов средних энергий 35, 55 и 60 МэВ (ЛПЭ в диапазоне 1,0-1,7 кэВ/мкм) их биологическая эффективность по характеру развития поражения хрусталика у мышей и по критерию образования катаракт оказалась одинаковой по сравнению со стандартными излучениями (Darden Е.В., Christenberry K.W., Beanchamp JJ., et al., 1970). В другом исследовании после облучения обезьян протонами 55 МэВ в дозе 200 сГр через 6 лет после него развились фокальные помутнения хрусталика. Отдельные точечные нарушения прозрачности хрусталика, которые можно рассматривать в качестве начальной стадии развития помутнений, появились у животных, облученных в дозе 100 сГр (Kirk J.H., Casey H.W. and Traynor J.E., 1972).
На основе анализа результатов экспериментов, полученных в длительном исследовании на большом количестве мышей (Кабаченко А.Н., 1974), удается частично ответить на вопросы о характере дозовой зависимости выхода помутнений хрусталика и величине пороговой дозы, а также биологической эффективности протонов средней и высокой энергии. Эти экспериментальные исследования выполнены на 2200 мышах линии F1(CBAxC57BL6) обоего пола массой 14-16г, которых подвергали общему или локальному (на голову) облучению протонами с энергией 25, 50 и 645 МэВ на синхроциклотроне Объединенного Института ядер-
530
ных исследований (ОИЯИ), а также рентгеновскому (180 кВ) и гамма-облучению 60 Сов дозах 50, 100, 200, 400, 500 и 600 сГр. Изучалось также влияние мощности дозы и двукратного фракционирования дозы на характер развития нарушений в хрусталике.
Отмеченная в этой работе частота образования помутнений хрусталика у мышей в зависимости от сроков обследования животных после воздействия протонов 645 МэВ (р), рентгеновского (X) и гамма-излучения (у) в различных дозах от 0,5 до 4,0 Гр представлена на рис. 9.7.
Рис. 9.7. Частота образования помутнений хрусталика у мышей (%) в зависимости от сроков обследования животных после воздействия протонов 645 МэВ (р), рентгеновского (X) и гамма-излучения (у) в различных дозах от 0,5 до 4,0 Гр
531
Анализируя данные, представленные на рисунке, можно отметить, что скорость нарастания частоты помутнений хрусталика после облучения в основном зависит от поглощенной дозы. Процент выхода помутнений хрусталика после облучения протонами 645 МэВ не отличается от частоты помутнений после воздействия рентгеновского и гамма-излучений. Поэтому при описании характера зависимости частоты помутнений от дозы и времени после облучения мы использовали одни и те же уравнения для указанных видов излучений.
Уравнение спонтанного увеличения частоты помутнений хрусталика (%) в зависимости от времени начала наблюдения, в группе необлученных контрольных животных, имеет следующий вид:
P(0,t) = 0,77(t - 22,5), (9.1)
где t — время наблюдения в неделях от начала эксперимента (обычно начальный возраст животных составлял 60-70 суток).
Как видно из данных рис. 9.2 и уравнения (9.1), первичные изменения хрусталика отмечаются спустя 30 недель от начала эксперимента. Возраст животных при этом составляет приблизительно 40 недель.
После облучения протонами 645 МэВ рентгеновским или гамма-излучением в дозах 0,5; 1,0; 2,0 и 4,0 Гр, уравнения, определяющие вероятность в процентах образования помутнений хрусталика у мышей, имеют вид
Р(0,5; t) = 0,80 (t - 12,5);
Р(1,0; t) = 1,08 (t - 6,0); (9.2)
Р(2,0; t) = 1,76 (t - 6,0);
P(4,0; t) = 3,60 (t-6,0).
Как видно из рис. 9.7, начальные стадии помутнения хрусталика после облучения в дозе 0,5 Гр проявляются несколько раньше, чем в контроле (спустя 20 недель). При облучении в более высоких дозах они наблюдаются еще раньше (спустя 6-8 недель). С увеличением дозы отмечается увеличение скорости нарастания частоты помутнений хрусталика.
Наклон кривых, определяющих скорость развития помутнений хрусталика со временем, составил 1,08; 1,76 и 3,6% в неделю после облучения в дозах 1,0; 2,0 и 4,0 Гр соответственно. При облучении
532
в дозе 0,5 Гр наклон достоверно не изменялся. Зависимость коэффициента наклона кривых увеличения вероятности развития помутнений хрусталика со временем от дозы определяется уравнением:
K(D) = 0,77 + 0,83(D - 0,7), (9.3)
где D — поглощенная доза в Гр.
Величина дозы 0,7 Гр, в случае острого кратковременного облучения, может считаться пороговой дозой в отношении радиационно-обусловленного увеличения скорости развития катаракт у мышей. При облучении в дозах, меньших или равных пороговой, скорость нарастания частоты помутнений хрусталика со временем сохраняется на уровне контрольных животных. При дозе 1,0 Гр она увеличивается по сравнению с контрольными животными на 30%, а при дозах 2,0 и 4,0 Гр превышает скорость нарастания частоты помутнений хрусталика у контрольных животных в 2 и 4,5 раза соответственно.
Как указывалось выше, образование катаракт представляет собой многоступенчатый процесс последовательного развития поражения от первоначально диагностируемых начальных стадий помутнений хрусталика до зрелой катаракты. В рассматриваемом исследовании (Кабаченко А.Н., 1974) автором показано, что в соответствии с классификацией (Christenberry K.W. and Furth J., 1951) I стадия развития помутнений хрусталика реализуется в период 56-70 дней (8-10 неделя), II стадия — в период 175-280 дней (25-40 неделя), III стадия — через 370-455 дней (53-65 недель) и IV, заключительная стадия формирования зрелой катаракты, имеет место спустя 455-565 дней (на 65-81 неделе).
В табл. 9.8 представлены данные о начальных сроках обнаружения различных стадий помутнения хрусталика у мышей (Кабаченко А.Н., 1974), а также максимальные значения частот помутнений и сроки их проявления после облучения протонами 645 МэВ в различных дозах.
Как видно из данных рис. 9.7 и табл. 9.8, первая стадия помутнений развивается у мышей не ранее, чем через 8-10 недель после облучения протонами 645 МэВ в дозах 1, 2 и 4 Гр и достигает максимальных значений 21, 36, и 76% соответственно к 30-40 неделям. В более поздние сроки частота помутнений хрусталика I стадии снижается для всех указанных доз, поскольку происходит
533
дальнейшее развитие поражения хрусталика и помутнения переходят в следующую стадию формирования катаракты.
Таблица 9.8
Начальные и максимальные частоты (%) развития помутнений хрусталика разных стадий и сроки их проявления после облучения протонами 645 МэВ в различных дозах (Кабаченко Л.Н., 1974)
Номер стадии Показатель Доза, Гр
1,0 2,0 4,0
нам. макс. нам. макс. нам. макс.
I Частота, % 1-5 21 1-5 36 1-5 76
Срок, недели 8-10 40 8-10 40 8-10 30
II Частота, % 1-5 53 1-5 82 1-5 83
Срок, недели 40 68 25-40 68 25-30 44
III Частота, % — — 1-5 40 1-5 76
Срок, недели — — 65 81 44 68
IV Частота, % — — — — 1-5 27
Срок, недели — — — — 65 81
Развитие II стадии помутнений хрусталика проявляется не одновременно для разных доз. У мышей, облученных протонами в дозе 4 Гр, II стадия помутнений начинает формироваться с 25-й недели после облучения и достигает максимума 83,3% к 44-й неделе. У животных, облученных в дозе 2 Гр, помутнения II стадии также начинают развиваться с 25 недели, но максимума 81,8% достигают к 68 неделе. После облучения в дозе 1 Гр данная стадия начинает формироваться несколько позже к 40 неделе, а максимальная частота (53%) достигается также» к 68-й неделе после облучения. Затем уровень помутнений II стадии снижается для всех доз, так как часть помутнений к этому времени переходила в III стадию развития. Эта стадия помутнений хрусталика отмечалась лишь у мышей, облученных протонами или гамма-лучами в дозах не ниже 2 Гр.
При облучении животных в дозе 2 Гр, III стадия помутнений хрусталика начинала формироваться к 65 неделе и к 81 неделе
534
частота этой стадии достигала 40%. При дозе 4 Гр помутнения хрусталика III стадии развивались раньше (начиная с 44 недели), а максимальная их частота составила 76% к 68 неделе. Приблизительно с этого периода начинают формироваться помутнения хрусталика IV стадии, и к 81-й неделе после облучения частота зрелых катаракт достигала 27% . К этому времени количество облученных животных резко сократилось (в связи с их гибелью), и поэтому проследить последующее увеличение частоты зрелых катаракт не представлялось возможным.
При воздействии рентгеновского излучения (180 кВ) локально на голову в дозе 400 сГр с мощностью дозы 60 сГр/мин максимальная частота помутнений хрусталика I стадии к 30-й неделе достигла 50% и быстро снижалась, поскольку с 30-й недели у мышей резко возрастал процент помутнений II стадии. Максимальное значение частоты помутнений II стадии составило 75% к 55-й неделе после облучения, но уже с 35-й недели начинают формироваться повреждения, характерные для III стадии, и к 80-й неделе частота помутнений III стадии достигает 58%. У отдельных животных этой группы через 40 недель после облучения была зарегистрирована зрелая катаракта (1,2%). Позже, к 80-й неделе после облучения, частота зрелой катаракты достигала 30%. Характер изменения стадий помутнения хрусталика по частоте и срокам наступления не отличались от изменений, возникающих под действием протонов 645 МэВ (табл. 9.7) и гамма-излучения. Однако можно отметить более низкие максимальные значения частоты помутнений хрусталика по стадиям после рентгеновского облучения, что, по-видимому, связано с локальным характером облучения.
Проведен анализ развития отдельных стадий помутнения хрусталика у животных, локально облученных протонами средних энергий 25 и 50 МэВ (ЛПЭ соответственно равны 2,18 и 1,25 кэВ/ мкм) в дозе 400 сГр с мощностью дозы 24 сГр/мин. Он показал, что образование помутнений хрусталика у мышей этих групп проходило одинаково, но с более низкой скоростью, чем после рентгеновского облучения. Повреждения хрусталика носили качественно однотипный характер, отличаясь лишь в количественном выражении, что, по-видимому, обусловлено более низкой величиной мощности дозы.
Материалы, полученные при фракционированном воздействии гамма-излучения, позволили заключить, что двукратное облуче
535
ние в дозе по 3,0 Гр с интервалами 3, 7, 14 и 30 суток приводило к заметному снижению скорости нарастания помутнений хрусталика, чем после однократного облучения в дозе 6 Гр. Интервал между облучениями, равный 7 суткам, оказался вполне достаточным периодом для проявления процессов репарации части лучевых повреждений в эпителии хрусталика. Увеличение длительности интервала между облучениями не оказывало уже существенного влияния на частоту помутнений (Кабаченко А.Н., 1974).
Эксперименты с двукратным фракционированным облучением с интервалом 7 суток протонами 645 МэВ в суммарных дозах 2, 4 и 6 Гр, а также протонами 50 МэВ в суммарной дозе 6 Гр подтвердили вывод, полученный при фракционировании гамма-облучения. Фракционирование замедляло образование помутнений хрусталика и формирование катаракт. В частности, при фракционировании дозы протонов 645 МэВ частота помутнений хрусталика в течение 30-45 недель была в 1,5-2 раза ниже по сравнению с однократным облучением в одинаковых суммарных дозах. Задерживалось также образование зрелых катаракт на 14 недель. Фракционированное облучение мышей протонами 50 МэВ в суммарной дозе 6 Гр приводило также к существенной задержке развития помутнений хрусталика уже на начальных стадиях. Отмечалось замедление скорости нарастания частоты помутнений. У этих животных в течение 70 недель после лучевого воздействия отмечалось лишь развитие помутнений хрусталика I и II стадиий, тогда как при однократном облучении формировалась более зрелая катаракта III стадии.
Скорость развития поражения хрусталика и возможность восстановление на начальных стадиях его помутнения существенно зависят не только от дозы, но в значительной степени от мощности дозы радиационного воздействия. Поэтому для более обоснованного определения пороговых уровней радиационного воздействия и установления нормативных значений доз на хрусталик, необходимо по результатам описанного исследования дополнительно рассмотреть влияние мощности дозы радиационного воздействия на вероятность образования первичных повреждений (начальных стадий помутнения хрусталика), возможность их восстановления или закрепления радиационного поражения с образованием зрелых катаракт.
На рис. 9.8 представлен характер нарастания частоты помутнений хрусталика у мышей в зависимости от времени после облуче
536
ния протонами 645 МэВ в дозах 0,5-2,0 Гр с мощностями доз 700 и 70 сГр/мин.
В этом эксперименте были использованы мыши с несколько большим начальным возрастом (120-150 дней). Поэтому нарастание частоты помутнений хрусталика начинается во всех группах животных, в том числе и в контрольной группе, спустя 8 недель после облучения. При дозе облучения 0,5 Гр с меньшим значением мощности дозы, скорость нарастания частоты помутнения хрусталика близка к контрольной группе. Изменение вероятности развития помутнений хрусталика (%) в зависимости от времени после начала эксперимента в этих группах определяется уравнением
P = 0,46xt, (9.4)
где t — срок от начала наблюдения в неделях.
В табл. 9.9 представлены аналогичные зависимости для других значений доз и мощностей доз,
10 20 30 40 50
t, недели
Рис. 9.8. Характер нарастания частоты помутнений хрусталика у мышей в зависимости от времени после облучения протонами 645 МэВ в дозах 0,5-2,0 Гр с мощностями доз 700 и 70 сГр/мин.
1, 2 и 3 — облучение в дозах 2; 1 и 0,5 Гр соответственно с мощностью дозы 700 сГр/мин; 4, 5 и 6 — облучение в тех же дозах с мощностью дозы 70 сГр/мин
полученные на основе данных рис. 9.8.
Анализируя данные рис. 9.8 и табл. 9.9, можно видеть, что эффективность облучения в дозах 50, 100 и 200 сГр при более низких значениях мощности дозы по сравнению с воздействием с высокой мощностью дозы, оказывается приблизительно в 4, 3 и 2
раза ниже соответственно.
Таким образом, исследование частоты и динамики формирования отдельных стадий помутнения хрусталика выявили одинаковый характер развития лучевой катаракты при действии протонов средних и высоких энергий, а также стандартного излучения. От
537
носительная биологическая эффективность воздействия протонов 645 МэВ по критерию образования лучевых помутнений хрусталика равна 1,0. Эффективность протонов с энергией 25 и 50 МэВ была несколько ниже, чем при воздействии рентгеновского излучения и ниже, чем при облучении протонами 645 МэВ, хотя частично это может быть связано с локальным облучением головы животных. При фракционированном режиме облучения отмечено снижение частоты помутнения хрусталика и скорости образования катаракт. Снижение мощности дозы существенным образом уменьшало скорость развития помутнений хрусталика и приводило к неполному созреванию катаракт.
Таблица 9.9
Зависимости, определяющие изменение частоты помутнения хрусталика (Р, %) от времени после облучения протонами 645 МэВ в различных дозах и с различной мощностью дозы
Мощность дозы сГ р/мин Величины поглощенных доз, сГр
0 50 100 200
70 Р = 0,46 х t Р = 0,46 х t Р - 1,05 х t Р = 1,75 xt
700 Р = 0,46 х t Р = 1,8 xt Р = 3,0 х t Р = 3,8 х t
Для обоснования биологической эффективности космических излучений, особенно воздействия ГКЛ, в отношении развития помутнений хрусталика у космонавтов в отдаленном послеполетном периоде важно проанализировать также результаты радиобиологических исследований по действию на хрусталик животных ускоренных многозарядных ионов. С этой целью было проведено сравнительное изучение биологического действия ионов углерода и гелия с энергией 300 МэВ/нуклон (ЛПЭ равна 12 и 1,36 кэВ/мкм соответственно) и гамма-излучения 137 Cs (ЛПЭ 0,3 кэВ/мкм).
Эксперименты выполнены на мышах линии (CBAxC57BL6) с начальным возрастом 2 месяца и массой 14-16 г. Облучение заряженными частицами проводили на синхрофазотроне (ОИЯИ, г. Дубна). Мощность дозы излучения составляла 0,003 Гр/с. Неравномерность дозного поля не превышала 10%. Вклад сопутствующего излучения по флюенсу был менее 1%, а по дозе меньше 5%. Животных облучали ионами углерода локально на голову, а
538
ионами гелия и гамма-излучением тотально. Контролем служила необлученная группа животных. Мышей обследовали до облучения и через каждые 4 недели после облучения. Частоту помутнений хрусталика характеризовали отношением числа глаз с помутнениями к числу глаз в данной группе животных (Кабаченко А.Н., 1974). Результаты проведенных исследований представлены в табл. 9.10.
Т а б л и ца 9.10
Частота помутнений хрусталика у мышей в различные сроки после облучения ионами углерода и гелия с энергией 300 МэВ/нуклон и гамма-излучением 137Cs в различных дозах
Срок наблюдения, недели Доза, сГр Вид излучения
137 Cs 12с 4 Не
20 0 (контроль) 4,0 ± 2,0 — —
10 2,0 ± 2,0 32,3 ± 12,0 22,0 ± 6,2
25 6,1 ± 4,7 64,2 ± 12,0 21,9 ± 7,4
50 7,3 ± 5,1 64,2 ±11,8 26,6 ± 7,0
100 12,0 ± 6,0 — —
30 0 (контроль) 7,0 ± 2,0 — —
10 6,5 ± 3,8 35,7 ± 13,0 32,5 ± 7,4
25 9,0 ± 5,6 42,8 ± 13,0 20,5 ± 6,1
50 13,1 ± 7,6 50,0 ± 8,0 25,7 ± 7,4
100 21,3 ± 7,6 — —
40 0 (контроль) 12,5 ± 4,5 — —
10 8,0 ± 4,2 20,0 ± 10,0 27,6 ± 9,7
25 12,0±6,3 28,6± 14,3 23,8 ± 9,6
50 22,0±8,1 77,0±11,6 33,3 ± 12,5
Анализируя данные, представленные в таблице, можно отметить, что частота развития помутнений увеличивалась с увеличением поглощенной дозы. Кроме того, ускоренные ионы углерода и гелия в отношении развития помутнений хрусталика оказались
539
значительно более эффективными по сравнению с гамма-излучением.
На рис. 9.9 частоты развития помутнений хрусталика после воздействия ускоренных ионов сравниваются с частотами при действии гамма-излучения. Материалы для контрольных животных и данные, полученные при действии стандартных видов излучений, представленные нами выше, также показаны на рисунке. Частота развития помутнений в зависимости от сроков наблюдения и величины дозы для гамма-излучения представлена аналитически выше (уравнения (9.1) и (9.2)).
Срок после облучения, недели
-К- С-0,28-0,5 Гр
—□— Не-0,28 Гр
Гамма-изл.: 1,0 Гр
—О— Гамма-изл.: 0,5 Гр
6 Контроль
Рис. 9.9. Частоты развития помутнений хрусталика после воздействия ускоренных ионов и гамма-излучения в различных дозах в зависимости от сроков после облучения
При проведении кривой для ускоренных ионов углерода учитывали, что при дозе 0,5 Гр через 50 недель наблюдали помутнения хрусталика в 100% случаев (на рисунке представлены сглаженные кривые). Как видно из данных, представленных на рис. 9.9, эффективность воздействия ионов гелия с энергией 300 МэВ/нуклон (среднее значение поглощенной дозы 0,28 Гр) приблизительно эквивалентна воздействию гамма-излучения в дозе 1,0 Гр. Величина коэффициента ОБЭ для этого вида излучения оценивается равной 3,6. Изменение частоты помутнения хрусталика в процентах в зависимости от времени наблюдения, после
540
воздействия ионов углерода с энергией 300 МэВ/нуклон в средней дозе 0,28 сГр, может быть описано следующим уравнением:
Рс (0,28; t) = 2,3(t - 6,0), (9.5)
где t — время наблюдения в неделях.
Данная скорость формирования помутнений во времени при действии гамма-излучения (на основании уравнения (9.3)) имеет место при дозе стандартного излучения 2,5 Гр. Таким образом, эффективность ионов углерода оказывается в 9,0 раз большей, чем гамма-излучения, и приближается к эффективности воздействия быстрых нейтронов. Такого же порядка получены значения коэффициентов ОБЭ в работе (Jose J.G., Ainsworth EJ., 1983) при изучении катарактогенеза у мышей, облученных ионами 40 Аг, 20 Ne, 12 С в дозах 0,05-0,90 Гр.
Следует отметить, что эксперименты с воздействием более низких доз ускоренных ионов показывают, что их эффективность по сравнению со стандартными видами излучений может быть в 2-4 раза выше, чем представленные выше значения коэффициентов ОБЭ для доз 0,1-0,5 Гр. Это мы наблюдали в экспериментах на мышах при их облучении в дозах 0,01-0,1 Гр. Коэффициенты ОБЭ ионов углерода, рассчитанные непараметрическим методом, были более высокими после дозы 0,03 Гр. Они составили значения равные 33 и 67 при оценке частоты помутнения хрусталика к 30-й и 50-й неделям. При дозе 0,1 Гр оценки коэффициента ОБЭ к рассматриваемым срокам составили 10 и 20 (Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000).
К такому же выводу приходят авторы работы (Brenner DJ., Medvedovsky С., Huang G. et al., 1991) в эксперименте по облучению крыс ионами 40 Аг. При облучении в поглощенной дозе 0,25 Гр получены оценки коэффициента ОБЭ в диапазоне 4-8. При дозе 0,05 Гр они существенно более высокие от 10 до 50. При совсем маленьких дозах (0,01 Гр) коэффициент ОБЭ оценивается в диапазоне 50-100.
Статистический анализ результатов позволил А.Н. Кабаченко с соавторами, (1990) установить пороговую дозу ионов углерода, равную 0,05 Гр. На этом же уровне определена пороговая доза для индукции катаракт у мышей ускоренными ионами железа с энергией 600 МэВ/нуклон (Brenner D.J., Medvedovsky С., Huang G.
541
etal., 1991). С учетом установленных значений коэффициентов ОБЭ пороговое значение эквивалентной дозы может быть заключено в диапазоне 50-150 сЗв.
Следует отметить, что фракционирование дозы 400 Гр ионов углерода с энергией 225 МэВ/нуклон не снижало катарактогенного эффекта у мышей (Ainsworth Е., Jose J., Berkley L., 1982. В экспериментах с ускоренными ионами железа с энергией 450 МэВ/ нуклон фракционирование приводило даже к усилению эффекта (Worgul В., Merriam G., Medvedovsky С., Brenner D., 1989).
Таким образом, рассмотренные материалы свидетельствуют о чрезвычайно высокой катарактогенной эффективности ускоренных ионов. Это заставляет при обосновании допустимых доз для космонавтов при оценке опасности воздействия космических излучений и особенно ГКЛ на хрусталик несколько пересмотреть существующие рекомендации в сторону более низких уровней допустимого облучения.
В табл. 9.11 представлены в обобщенном виде пороговые уровни радиационного воздействия на хрусталик глаза, при которых отмечаются начальные гистологические изменения эпителиальных клеток капсулы хрусталика, клинически наблюдаемые его повреждения, а также пороговые уровни доз в отношении увеличения частоты помутнений хрусталика и развития зрелых катаракт.
Как видно из данных, представленных в табл. 9.11, начальные признаки развития повреждений в эпителии хрусталике, увеличение частоты его помутнений и развития катаракт имеют место при дозах около 50-100 сЗв, а при фракционированном и хроническом режиме облучения пороговое значение дозы может составить 150-200 сЗв.
Как указывалось выше, при действии гамма-излучения и протонов, величина дозы 0,7 Гр, в случае острого кратковременного облучения, может считаться пороговой дозой в отношении радиационно-обусловленного увеличения вероятности развития катаракт у мышей. При облучении в более низких дозах или равных пороговой скорость нарастания частоты помутнений хрусталика со временем сохраняется на уровне интактных животных. Близкое к этому граничное значение получено и при действии на людей излучений ядерных взрывов.
При дозе 1,0 Гр острого облучения скорость нарастания частоты помутнения хрусталика увеличивается по сравнению с контрольными животными на 30%. При дозах 2,0 и 4,0 Гр она превы-
542
543
Таблица 9.11
Пороговые уровни доз, при которых отмечаются начальные гистологические изменения эпителиальных клеток капсулы хрусталика, клинически наблюдаемые его повреждения, а также пороговые уровни доз в отношении увеличения частоты помутнений хрусталика и развития зрелых катаракт
Г истологические изменения Пороговая доза, сЗв Литературный источник Увеличение частоты помутнений хрусталика и развития катаракт при действии различных видов излучений Пороговая доза, сЗв Литературный источник
Выраженное оптическое уплотнение хрусталика 30-70 Кабаченко А.Н., 1974 Львовская Э.Н., 1969 Увеличение частоты помутнений хрусталика при рентгеновском и гамма-облучении 45-120 Ковалев И.Ф., 1967; Гуськова А.К., Байсоголов Г.Д., 1971; Кабаченко А.Н., 1974; Москалев Ю.И., 1991
Микроскопические повреждения эпителиальных клеток капсулы хрусталика 100 Ковалев И.Ф., 1967; Кабаченко А.Н., 1974; Москалев Ю.И., 1991 То же при действии ускоренных протонов 70-100 Кабаченко А.Н., 1974
Начальные гистологические изменения 120 Миловидова И.А., Москалев Ю.И., 1983 То же при действии нейтронов 50-86 Merriam G.R., Focht E.F., 1957; Кабаченко А.Н., 1974
Продолжение табл. 9.11
Гистологические изменения Пороговая доза, сЗв Литературный источник Увеличение частоты помутнений хрусталика и развития катаракт при действии различных видов излучений Пороговая доза, сЗв Литературный источник
Локальная артериальная гипотензия и усиление проницаемости сосудов 100 Гуськова А.К., Байсоголов Г.Д., 1971 Увеличение частоты развития катаракт при рентгеновском и гамма-облучении 120-200 Миловидова И.А., Москалев Ю.И., 1983
Клинические проявления повреждений 45-240 Geeracts WJ. et al., 1971; Кабаченко 1974; Миловидова И.А., 1978 То же при действии нейтронов 70-100 Merriam G.R., Focht E.F., 1957; Кабаченко А.Н., 1974
Признаки структурных нарушений 150-400 Гуськова А.К., Байсоголов Г.Д., 1971 То же при действии ионов углерода 300 МэВ/нуклон 90 Кабаченко А.Н., 1974 Otake М., Schull WJ., 1991
То же при действии ионов аргона 50-100 Кабаченко А.Н., 1974 Otake М., Schull W.J., 1991; Лазаретник Б.Ш., 1993
шает скорость нарастания частоты развития катаракт у интактных животных в 2 и 4,5 раза соответственно.
Данные, представленные в обзоре (Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000), и приведенные выше результаты экспериментальных исследований подтверждают, что, по-видимо-му, в качестве порогового значения дозы, не приводящего еще к заметному увеличению частоты развития помутнений хрусталика и образованию катаракт, следует принять значение дозы 50 сЗв (бэр). Учитывая длительный характер облучения космонавтов со сравнительно низкими значениями мощностей доз в качестве предельной дозы за год полета, можно было бы допустить дозу на хрусталик 100 сЗв. Предельное же значение дозы на хрусталик за всю карьеру космонавтов, по нашему мнению, не должно превышать 200 сЗв.
Это значение в 3 раза ниже существовавшего ранее предела доз, согласно нормативно-техническому документу 1985 г. (ГОСТ 25645.215-85. БРЭКАКП, 1986) и в 2 раза ниже предельного значения дозы на хрусталик в нормативных документах национального космического агенства NACA США для американских астронавтов. Предельное значение дозы на хрусталик за весь период карьеры космонавтов (200 сЗв) установлен в России в новом документе, утвержденном в 2004 г. (Методические указания МУ 2.6.1.44-03 — 2004). Данный предел дозы на хрусталик за всю профессиональную деятельность в 2 раза превышает предел дозы для кроветворных органов (среднекостномозговой дозы) и в 2 раза превышает предел среднетканевой эквивалентной дозы за все полеты (100 сЗв), установленный в этом документе. Можно распространить такое же соотношение пределов доз и для различных контрольных периодов в процессе полета.
Таким образом, если допустимое значение дозы на костный мозг при однократном остром воздействии, согласно (Григорьев Ю.Г. и др., 1965; Григорьев Ю.Г., 1975; Методические указания МУ 2.6.1.44-03 — 2004) и материалам, представленным в разд. 10, составляет 15 сЗв, то допустимая доза однократного острого воздействия на хрусталик глаза должна равняться 30 сЗв. Соответственно допустимые дозы на хрусталик за месяц и год полета составят 50 и 100 сЗв.
Целесообразна регламентация данных более низких пределов доз, поскольку, как указывалось выше, значения коэффициентов ОБЭ при действии ускоренных тяжелых заряженных частиц мо
545
гут существенно превышать величины коэффициентов качества, установленные МКРЗ и существующими нормативными документами. Данные пределы дозы на хрусталик позволят членам экипажей активно участвовать в космических полетах в общей сложности в течение 2-3 лет. При этом будут отсутствовать нежелательные проявления, которые могли бы ухудшить самочувствие и снизить работоспособность космонавтов в процессе полета и к концу их профессиональной деятельности.
Гл
ПРОБЛЕМА НОРМИРОВАНИЯ РАДИАЦИОННЫХ ВОЗДЕЙСТВИЙ НА КОСМОНАВТОВ ПРИ ОРБИТАЛЬНЫХ И МЕЖПЛАНЕТНЫХ
КОСМИЧЕСКИХ ПОЛЕТАХ
10.1. Анализ существующих подходов к нормированию радиационных воздействий в процессе космических полетов
Рекомендации международной и национальных комиссий по радиационной защите (МКРЗ и НКРЗ) при обосновании нормативных уровней воздействия ионизирующих излучений в наземных условиях исходят из следующих предпосылок:
• принятие мер, направленных на ограничение доз острых облучений персонала и населения уровнями ниже пороговых, с высокой вероятностью исключающих возникновение острых нестохастических радиационных эффектов, и сведение к минимальным значениям риска ближайших стохастических проявлений, определяющих возможное снижение работоспособности человека;
• снижение ежедневных, годовых уровней хронического облучения персонала и населения до значений, которые практически исключают риск ухудшения здоровья в отдаленном периоде и не приводят к заметному увеличению вероятности отдаленных стохастических проявлений в течение жизни по сравнению с их естественным уровнем.
До 1994 г. рекомендациями МКРЗ и НКРЗ допускались уровни облучения на Земле для работающих с источниками ионизирующих излучений меньшие или равные 5 сЗв/год и около 200 сЗв за всю профессиональную деятельность. В публикациях № 8 и 9 и ряде последующих публикаций (№ 22, 26 и 60) МКРЗ указывает, что всякое облучение ионизирующей радиацией связано с определенной степенью риска и что не существует абсолютно безопасных уровней воздействия. Комиссия рекомендует избегать
547
любого облучения, не вызванного необходимостью, и поддерживать дозы облучения на таких низких уровнях, каких только реально можно достигнуть с учетом экономических и социальных соображений. Этот принцип, известный как принцип ALARA (сокращенная абревиатура английского выражения «as low as is reality achievable»), получил широкое признание и им следует руководствоваться в практической деятельности.
В связи с появлением новых радиобиологических данных и углублением представлений о степени опасности радиационных воздействий в нормативных документах МКРЗ и НКРЗ осуществляется периодический пересмотр допустимых доз для населения и людей, подвергающихся более высоким уровням радиационного воздействия по роду своей деятельности, в сторону меньших значений доз. В материалах последнего пересмотра уровней радиационной опасности, осуществленного недавно МКРЗ (Рекомендации МКРЗ 1990 года. Публикации № 60 и 61,1994), рекомендовано ограничивать годовые уровни облучения персонала дозой 2 сЗв вместо принятого ранее значения 5 сЗв/год. Соответственно в 2,5 раза уменьшаются и допустимые уровни доз за всю профессиональную деятельность (в течение 40-50 лет) для работников атомной промышленности на Земле. Эти уровни не должны теперь превышать 80-100 сЗв. Эти дозовые пределы относятся к величинам доз на все тело при равномерном облучении или к дозам на красный костный мозг, гонады в условиях неравномерного облучения.
Нормативы, действовавшие до 1999 г. в России (Нормы радиационной безопасности НРБ-76/87, 1988), ограничивали облучение персонала уровнем 5 сЗв в год. Это относилось к облучению всего тела, красного костного мозга и гонад. Предельно допустимые уровни для других отдельных органов (кроме перечисленных выше) превышали дозы на все тело или на костный мозг в 3 раза. Введенные в 1999 г. «Нормы радиационной безопасности (НРБ-99)» установили более жесткие нормативные уровни радиационного воздействия для персонала. Средний допустимый уровень радиационного воздействия на все тело и на костный мозг составляет согласно этому документу 2 сЗв в год, на хрусталик — 15 сЗв в год, на кожу — 50 сЗв в год.
При разработке норм, регламентирующих предельные уровни радиационного воздействия на космонавтов и обеспечении радиационной безопасности в космосе, существует определенная специ
548
фика. Необходимо, с одной стороны, избегать неоправданного занижения допустимых доз и, следовательно, увеличения веса пассивной защиты, с другой — не допускать значений доз, которые могли бы привести к снижению работоспособности космонавтов в процессе полета. При установлении норм радиационной безопасности при космических полетах должны быть учтены также следующие обстоятельства:
• характер и значимость совершаемого полета в отношении национальной и международной программ исследования космоса;
• возрастной состав участников полета и возможность их отбора с учетом предшествующего уровня радиационной нагрузки;
• возможность возвращения на Землю и замены отдельных членов экипажа.
Необходимо также:
• установление допустимых уровней радиационного воздействия в штатной ситуации и оптимального характера распределения доз во времени в течение месяца, квартала, года, всей длительности полета и в послеполетном периоде с учетом восстановительных процессов в организме;
• установление предельных уровней кратковременного облучения (например, за одно солнечное протонное событие), в случае ухудшения радиационной обстановки и развития аварийной ситуации, а также обоснование пределов доз, при которых сохраняется необходимый для выполнения полетной программы удовлетворительный уровень работоспособности космонавтов в течение полета и не превышается регламентированное значение радиационного риска;
• установление предельных значений доз за всю карьеру, при которых сохраняется удовлетворительный уровень здоровья космонавтов к моменту прекращения их основной работы и при которых общий уровень риска их профессиональной деятельности не превышает социально приемлемых значений. Действующие на начальной фазе освоения космоса нормативные документы регламентировали допустимые дозы для кратковременных орбитальных полетов, а также для полетов на трассе Земля-Луна-Земля с общей продолжительностью до 30 суток. Эти рекомендации были основаны на анализе большого объема радиобиологических данных по острому облучению крупных млекопитающих в различных дозах, данных по аварийному облуче
549
нию людей. При их разработке был обобщен также большой клинический материал, касающийся осложнений при лучевой терапии (Григорьев Ю.Г. и др., 1965; Radiobiological factors in manned space flight, 1967; Radiation Protection Guides and Constraints for Space Mission,1970; Григорьев Ю.Г., 1975; Григорьев Ю.Г., Тобайес К., 1975). Эти материалы подробно освещены нами в разд. 3.1.
При нормировании радиационного воздействия применительно к кратковременным полетам основная задача сводилась к ограничению уровня острого облучения за счет протонов солнечных космических лучей (СКЛ) с целью недопущения сколько-нибудь значимого снижения работоспособности космонавтов и возможности развития у них первичной лучевой реакции средней степени тяжести в процессе полета.
В 1965 г. в качестве допустимой дозы для кратковременных полетов в России была рекомендована доза 15 сЗв. При воздействии в этой или меньших дозах будут отсутствовать какие-либо соматические эффекты, а могут отмечаться лишь минимальные кратковременные сдвиги в системе кроветворения. Ввиду стохастического характера воздействия протонов солнечных вспышек и жестких ограничений по толщине и весу защиты космического аппарата вводилось также понятие дозы оправданного риска (ДОР). В качестве ДОР рекомендовали дозу 50 сЗв на костный мозг (на глубине 5 см ткани), при которой лишь в единичных случаях могут иметь место легкие проявления первичной лучевой реакции (Radiobiological factors in manned space flight, 1967; Григорьев Ю.Г., 1975).
Было рекомендовано использовать также понятие «критическая доза», равная 125 сЗв, которая устанавливалась как критерий для решения вопроса о возможности дальнейшего продолжения полета в условиях ухудшенной радиационной ситуации (Григорьев Ю.Г. и др., 1965; Григорьев Ю.Г., 1975). Указанные ограничения доз должны были использоваться на всех этапах разработки и эксплуатации космических кораблей.
В США применяли близкие к российским регламенты доз. Во-первых, это дозы, предназначенные для проектировщиков и лиц, разрабатывающих программу полета, и, во-вторых, это оперативные дозы (критерии) для использования во время полета. Для программы «Аполлон» утверждена допустимая (планируемая) доза 25 сЗв на глубине 5 см (точка, соответствующая средней глубине для кроветворной ткани) и максимальная оперативная доза
550
50 сЗв на глубине 5 см, а также 400 сЗв для кожи на глубине 0,1 мм (Radiobiological factors in manned space flight, 1967; Григорьев Ю.Г., 1975; Григорьев Ю.Г., Тобайес К., 1975).
По мере увеличения длительности полетов возникла необходимость учитывать реакцию организма в процессе полета на относительно кратковременные стохастически распределенные во времени воздействия протонов СКЛ на фоне хронического облучения от детерминированных источников радиационной опасности ГКЛ и РПЗ. Этот учет основывался на модели формирования радиационного поражения (Блэр X., 1958; Blair Н.А., 1962, 1964) с учетом восстановительных процессов в организме (модель эффективной остаточной дозы Вэф, которая подробно рассмотрена в разд. 5.2). Именно этот подход был применен в России в последующие годы при регламентации нормативных уровней радиации для длительных полетов до одного года (Временные нормы радиационной безопасности при космических полетах ВНРБ-75, 1976). В этом документе при установлении допустимых доз в зависимости от длительности полета руководствовались принципом, чтобы эффективная остаточная доза к концу полета любой продолжительности достигала одного и того же уровня и не превышала 32 сЗв.
В табл. 10.1 представлены нормативные уровни радиации (НУР) в сЗв за полет в зависимости от длительности полета на основе данных нормативно-технического документа (ВНРБ-75, 1976). Значения НУР относились к воздействию на костный мозг.
Таблица 10.1
Нормативные уровни радиации для полетов различной продолжительности согласно нормативному документу (Временные нормы радиационной безопасности при космических полетах (ВНРБ-75, 1976))
Т, месяцы НУР, сЗв Т, месяцы НУР, сЗв
1 50 6 110
2 65 8 125
3 80 10 140
4 90 12 150
5 100
551
Однократное кратковременное воздействие от протонов СКЛ ограничивалось уровнем 50 сЗв. Ввиду случайного характера распределения моментов возникновения СПС, а также характеристик потоков и спектров протонов СКЛ и ограниченности наших знаний о закономерностях формирования этих величин, выдвигалось дополнительное требование к надежности защиты: ограничивалась вероятность превышения указанного значения дозы уровнем не более 1%. Этот уровень воздействия, как и предельные уровни, представленные в таблице, относились к облучению кроветворной ткани (принималась модель локальной дозы за плоским слоем ткани на глубине 5 см).
Предельно допустимая доза (ПДД) за всю профессиональную деятельность от всех видов радиационного воздействия была установлена в этом документе, равной 4 Зв. Этот предел основан на допущении, что суммарная величина риска развития опухолей различных органов и тканей за карьеру космонавтов не должна превышать спонтанный уровень более чем в 2 раза. Этот же предел был установлен и в нормативных документах США (Radiation Protection Guides and Constraints for Space Mission, 1970). Таким образом, в этих нормативах была использована относительная модель радиационного риска.
Для других критических органов: кожи, хрусталика глаза, гонад в России были установлены следующие множители 3; 1,5 и 0,5 соответственно. Таким образом, предельные годовые дозы для указанных органов и тканей, исключающие неблагоприятные радиобиологические проявления в процессе полета, составили соответственно 450; 225 и 75 сЗв. Пределы доз облучения этих органов за всю карьеру космонавтов не должны были превышать 1200; 600 и 200 сЗв.
В табл. 10.2 для сравнения представлены предельные значения доз на различные органы и ткани астронавтов для различных временных отрезков полета и за всю их карьеру для исключения неблагоприятных радиобиологических эффектов в процессе полета и рассмотренных выше стохастических эффектов в отдаленном периоде. Эти нормативы вступили в действие в США начиная с 1970 г. (Radiation Protection Guides and Constraints for Space Mission, 1970).
Как видно из данных табл. 10.1 и табл. 10.2, в нормативах России допустимая доза на костный мозг (в предположении одинаковых эффективных остаточных доз к концу полета различной про
552
должительности) в 2 раза превышала норматив США. Поскольку соотношение допустимых доз для упомянутых выше критических органов и тканей было одинаково в нормативах обеих стран, допустимые годовые дозы на гонады, хрусталик и кожу для космонавтов России также были выше в 2 раза. В то же время предельные дозы за карьеру в нормативных документах обеих стран совпадали.
Дальнейшее совершенствование принципов и методов обеспечения радиационной безопасности космических полетов в нашей стране связано с разработкой системы нормативно-технических документов — ГОСТов и Методических указаний по проблеме «Безопасность радиационная экипажа космического аппарата в космическом полете» (БРЭКАКП).
Таблица 10.2
Пределы допустимых доз для астронавтов США за различные периоды полета и за всю карьеру, сЗв
(Radiation Protection Guides and Constraints for Space Mission, 1970)
Рассматриваемый период Основной рекомендуемый предел дозы на глубине 5 см Доза на костный мозг на глубине 5 см Доза на гонады Доза на хрусталик на глубине 0,3 см Доза на кожу на глубине 0,01 см
30-суточный максимум — 25 13 37 75
Квартальный максимум — 35 18 52 105
Годовой максимум — 75 38 112 225
Профессиональный предел дозы 400 400 200 600 1200
Общий комплекс разработанных стандартов включает 4 направления исследований. К стандартам 1-го направления относились нормативно технические документы, определяющие модель
553
ные описания основных источников радиационной опасности в космосе. К нормативно-техническим документам 2-го направления относилась группа документов, необходимых для описания прохождения космических излучений через защиту, а также расчетов поглощенных и эквивалентных доз за защитой космического аппарата (КА) и в тканеэквивалентных фантомах, представляющих модели тела человека. Эти документы использованы при описании источников радиации в космосе и расчетах дозовых нагрузок для космонавтов в разд. 1 и 2.
Нормативно-технические документы 3-го направления посвящены установлению характера радиационного воздействия на членов экипажа КА в длительном космическом полете, определению ближайших в процессе полета и отдаленных неблагоприятных радиобиологических эффектов, обоснованию величин радиационного риска и допустимых доз для полетов различной продолжительности. Эти документы тесно связаны с документами 2-го направления, в которых устанавливаются величины поглощенных доз от космических излучений за защитой КА внутри фантома в представительных точках для различных критических тканей: для кожи — 2 точки, хрусталика глаза — 2 точки, кроветворной ткани — 14 точек, центральной нервной системы — одна точка, желудочно-кишечного тракта — 2 точки (ГОСТ 25645.203-83. БРЭКАКП. Модель тела человека, 1984.
В нормативах радиационной безопасности 1985 г. (ГОСТ 25645.214-85 БРЭКАКП, 1986; ГОСТ 25645.215-85 БРЭКАКП, 1986) за определяющую величину, характеризующую в обобщенном виде меру радиационной опасности за время осуществления длительного космического полета, был принят радиационный риск, под которым подразумевалось увеличение риска гибели членов экипажа КА вследствие соматических радиобиологических эффектов в процессе полета (Методические указания РД 50-25645.205-83 БРЭКАКП, 1984; ГОСТ 25645.214-85 БРЭКАКП, 1986; ГОСТ 25645.215-85 БРЭКАКП, 1986).
Радиационный риск для космонавтов в процессе полета предполагали вычислять на основе нормативного документа (ГОСТ 25645.214-85 БРЭКАКП, 1986), который устанавливал математическую модель обобщенного радиобиологического эффекта в зависимости от характера распределения во времени мощности обобщенной дозы H(t) и самой величины обобщенной дозы H(t). Следует отметить, что в этом документе представлен упрощенный
554
алгоритм определения величины обобщенной дозы по сравнению с алгоритмом, рекомендуемым нормативно-техническим документом (ГОСТ 25645. 201-83 БРЭКАКП. Термины и определения, 1984) и наиболее общим алгоритмом расчета обобщенной дозы, представленным нами в разд. 6.
Радиационный риск или обобщенный радиобиологический эффект F(H), согласно (ГОСТ 25645.214-85 БРЭКАКП, 1986), вычисляется из уравнения:
F(H) =ц(т0 + О {[1 +gH(t)] exp[YogH(t)] - 1}, (10.1)
где ц(т0 + t) — коэффициент смертности для человека в зависимости от возраста, определяемый на основе демографических данных; т0 — возраст космонавта в начале космического полета; t — текущая длительность полета; у о — постоянная времени .экспоненциального роста коэффициента смертности, которая в этом документе принята равной 2,52 х 10“4 (сут)"1; g — коэффициент, равный 1,3 х 103 сут/Зв.
Значения обобщенной дозы H(t) и мощности обобщенной дозы H(t) вычисляются на основе зависимости мощности равноценной дозы G(t) от времени (дозиметрический функционал, характеризующий эффективную меру радиационного воздействия при неравномерном облучении на кроветворную систему с распределенным содержанием костного мозга по скелету), которая, в свою очередь, определяется для источников космического излучения в соответствии с нормативно-техническим документом (ГОСТ 25645.219-90 БРЭКАКП, 1991). Указанные дозиметрические величины и характер их изменения во времени описываются согласно этому документу следующими уравнениями:
t
H(t) = J Н(т) dr; (10.2)
о
H(t) = 0,25 J G(t) [e~₽1(t ~T) - e~p2(t-t)j dx (103)
где Pi = 8,6 x 10"2 сут"1 и p2 = 2,8 x 10"1 сут-1— коэффициенты, характеризующие динамику развития радиационного поражения в системе гемопоэза — одной из ведущих критических сис
555
тем, определяющих жизнеспособность организма в процессе полета.
Согласно этому документу обобщенный радиобиологический эффект количественно характеризует увеличение возрастных коэффициентов смертности в течение времени полета вследствие соматических радиобиологических эффектов и дополнительной радиационной нагрузки на организм в связи с поражением гемопоэза (ГОСТ 25645.214-85 БРЭКАКП, 1986; ГОСТ 25645.219-90 БРЭКАКП, 1991).
Модель обобщенного радиобиологического эффекта была принята в качестве основы при дальнейшем обосновании допустимых доз облучения при длительных космических полетах (ГОСТ 25645.215-85 БРЭКАКП, 1986). Нормативные значения радиационного риска за полет устанавливались пропорциональными длительности полета на основе выражения
R(T)= 0,6 х 10"4 Т, (10.4)
где Т — длительность полета в месяцах.
Соответствующие значения допустимых эквивалентных равноценных доз в зависимости от длительности полета устанавливались следующим уравнением:
G (Т) = 0,05 + 4 [1 - ехр(- Т/72)]. (10.5)
Необходимо отметить, что в соответствии с общей тенденцией к снижению допустимых уровней радиационного воздействия для профессионально работающих с источниками ионизирующих излучений на Земле, в нормах по радиационной безопасности при длительных космических полетах, принятых в России в 1985 г (ГОСТ 25645.215-85 БРЭКАКП, 1986), допустимые дозы для космонавтов были снижены по сравнению с предыдущими нормативами (ВНРБ-75). В табл. 10.3 представлены значения допустимых уровней доз для полетов продолжительностью до 3 лет. Можно видеть, что они существенно ниже, чем рекомендованные более ранними документами (табл. 10.1).
В этой таблице показаны также регламентируемые значения радиационного риска за полет и контрольная часовая мощность равноценной дозы для оперативного контроля радиационной ситуации в отношении установления соответствия радиационной обстановки нормативным уровням радиационного воздействия.
556
Этим документом, как и в прежних нормативах, ограничивается доза однократного воздействия от излучения солнечных вспышек (< 50 сЗв) и доза за всю профессиональную деятельность космонавтов (< 4 Зв).
Таблица 10.3
Значения предельных величин доз для полетов различной длительности в нормах радиационной безопасности, принятых в настоящее время в России (ГОСТ 25645.215-85 БРЭКАКП, 1986)
Длительность полета T, мес Нормативный уровень радиационного риска, Rh х 10"4 Предельно допустимая равноценная доза, Gh, сЗв Контрольная часовая мощность равноценной дозы, Gh, мкЗв/час
1 0,60 10,5 146
3 1,80 21,5 100
6 3,60 37,0 85
12 7,2 66,5 76
18 10,8 93,5 71
24 14,4 118,5 68
30 18,0 140,5 65
36 21,5 162,5 62
Дозы годовые и за всю профессиональную деятельность на другие критические органы: гонады, хрусталик и кожу в данном документе не изменялись. Таким образом, для этих органов и тканей сохранялись дозовые пределы, указанные выше и представленные в прежнем нормативном документе (ВНРБ-75).
В табл. 10.4 представлены предельные уровни радиационного воздействия на критические органы и ткани в измененных в более позднем периоде нормативах США (Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received in space activities. Recommendation NCRP Report № 98, 1989; Melkonian G., Bourrieau J., 1990). В скобках для сравнения приведены старые нормативы 1970 г. (Radiation Protection Guides and Constraints for Space Mission, 1970).
557
Таблица 10.4
Пределы допустимых доз для астронавтов за различные периоды полета и за всю карьеру (сЗв), действовавшие после 1990 г.
(прежние значения представлены в скобках)
Рассматриваемый период Основной рекомендуемый предел на глубине 5 см Доза на костный мозг на глубине 5 см Доза на гонады Доза на хрусталик на глубине 0,3 см Доза на кожу на глубине 0,01 см
30-суточный максимум — 25 (25) 25 (13) 100 (37) 150 (75)
Годовой максимум — 50 (75) 50 (38) 200 (И2) 300 (225)
Профессиональный предел за карьеру D = F(T0) (400) D = F(T0) (400) 150 (200) 400 (600) 600 (1200)
Примечание. Профессиональный предел доз на костный мозг и на все тело устанавливался в зависимости от возраста космонавта в начале своей карьеры То.
Следует отметить, что в новых нормативах, установленных в США, также отмечается тенденция к снижению величин допустимых доз для астронавтов (пределы годовых доз для кроветворной ткани и предельные уровни доз за карьеру астронавтов). В то же время предельные годовые уровни доз на другие критические органы и ткани (гонады, хрусталик, кожа) повысились приблизительно в 1,5-2 раза и приблизились к нормативным значениям, установленным в России. Учитывая ряд возможных неблагоприятных отдаленных радиобиологических проявлений, пределы доз на хрусталик глаза и кожу за всю профессиональную деятельность были снижены в 1,5-2 раза.
Основной дозовый предел за всю профессиональную карьеру астронавтов в новых нормативах (Fry RJ.M. and Nachtwey D.S., 1988; Guidance on radiation received in space activities. Recommendation NCRP Report № 98, 1989; Melkonian G., Bourrieau J., 1990). установлен зависимым от возраста и пола ас
558
тронавта в начальном периоде его деятельности. Он основан на допущении, чтобы суммарный дополнительный радиационно-обусловленный риск образования злокачественных опухолей в течение жизни не превышал бы 3%. Предельные значения дозы за карьеру в зависимости от начального возраста То для мужчин и женщин определялись в этих документах в соответствии со следующими уравнениями:
для мужчин: D = 2,0 + О,О75(То - 30) (10.6)
для женщин: D = 2,0 + О,О75(То - 38). (10.7)
Из представленных уравнений (10.6) и (10.7) следует, что предельные значения эффективных эквивалентных доз за карьеру для астронавтов-мужчин, начинающих свою деятельность в возрасте 25, 35, 45 и 55 лет, должны были быть равными соответственно 1,5; 2,5; 3,2 и 4,0 Зв, а для женщин соответственно 1,0; 1,75; 2,5 и 3,0 Зв.
Таким образом, на основе рассмотренных выше материалов, включая нормативные документы, действовавшие в России с 1985 г. (ГОСТ 25645.215-85 БРЭКАКП, 1986) и в США с 1990 г., допустимые дозы за год полета для кроветворной ткани, гонад, хрусталика глаза и кожи различались не очень сильно (менее чем в 1,5 раза). В то же время основные принципы, на которых основаны оценки радиационной опасности для экипажей космических аппаратов в процессе полета, различаются существенно.
В нормативах США основополагающей регламентируемой дозиметрической величиной является значение эффективной эквивалентной дозы за всю профессиональную деятельность астронавтов, при которой предельное значение дополнительного риска канцерогенеза за жизнь не должно превысить 3%. Критерий не-превышения этого значения риска является одинаковым для астронавтов различного пола и возраста, что обусловило снижение допустимых доз для лиц молодого возраста с 4,0 Зв до 1,0-1,5 Зв. Этот критерий, наряду с заботой о сохранении состояния здоровья астронавтов в отдаленном периоде и уменьшении риска отдаленных неблагоприятных радиационных проявлений, определяет снижение предельных уровней доз за карьеру для хрусталика глаза и кожи в 1,5 раза. Они составили теперь значения 4,0 и 6,0 Зв. В то же время указанные нормативы в регламентирующих документах нашей страны оставались до 2004 г. неизменными.
559
Принципиальное расхождение обусловлено тем, что ведущим критерием в оценке радиационной опасности в нормативных документах России выступал радиационный риск смертности космонавтов в процессе полета и его зависимость от длительности полета (ГОСТ 25645.215-85 БРЭКАКП, 1986), в то время как в документах США — риск отдаленных неблагоприятных радиационных последствий.
В настоящее время, в связи с созданием международной орбитальной космической станции, необходимо было согласование принципов и критериев оценки радиационной опасности для экипажей космических кораблей. При разработке новых нормативно-технических документов по радиационной безопасности космических полетов следовало исключить возможность ближайших проявлений, снижающих работоспособность космонавтов (астронавтов) в процессе полета, а также обеспечить сохранение удовлетворительного уровня их здоровья и работоспособности в отдаленном периоде и непревышение некоторого предельного значения суммарного радиационного риска в течение жизни космонавтов.
10.2. Совершенствование подходов к нормированию и обоснование новых предельно допустимых уровней радиационных воздействий на космонавтов при орбитальных космических полетах
В последующем периоде в наших работах получила дальнейшее развитие концепция обобщенной дозы (см разд. 6). Поскольку выход непосредственных, ближайших радиационных эффектов в процессе осуществления полета, с одной стороны, а также возможных неблагоприятных отдаленных последствий, с другой стороны, связан с формированием патологии в существенно различных критических системах организма, отличающихся временем развития поражения, его локализацией, скоростью протекания восстановительных процессов, было предложено значение обобщенной дозы вычислять отдельно на основе своего набора коэффициентов соответственно для ближайших эффектов НБ и отдаленных последствий Но.
На основе концепции обобщенной дозы и разработки алгоритмов оценок значений коэффициентов KBBi; KPBi для космиче
560
ских излучении, которые учитывают неравномерный характер распределения дозы во времени и по глубине тела космонавтов, нами в разд. 7 были проведены расчеты радиационных рисков в процессе межпланетных полетов, продолжительностью до 3 лет, осуществляемых в различные периоды СА за различными толщинами защиты радиационного убежища, а также в процессе осуществления орбитальных полетов на станции «Мир» и МКС.
Нами в разд. 8 показано, что расчетные значения суммарного радиационного риска в течение жизни космонавтов более чем в 20 раз превышают представленные в разд. 7 значения радиационного риска в процессе полета, поскольку в этом случае рассматривается, во-первых, существенно более длительный срок, а во-вторых, — учитывается развитие патологии в основных регуляторных системах организма, а не только в системе кроветворения, которая определяет лишь устойчивость организма во время полета к повторным кратковременным воздействиям СКЛ на фоне хронического облучения от ГКЛ.
В книге на основе значений обобщенных и среднетканевых эквивалентных доз в разд. 8 впервые проведены расчеты суммарного радиационного риска в течение жизни космонавтов, риска развития опухолей и возможного сокращения средней предстоящей продолжительности жизни космонавтов (СППЖ). Было показано, что при предполагаемой толщине защиты радиационного убежища 20 г/см2 алюминия и длительности межпланетного полета к Марсу в течение 2 лет наиболее вероятное значение среднетканевой дозы составит 80 сЗв, суммарный радиационный риск в течение жизни космонавта не превысит 8%, а СППЖ составит менее 2,5 лет.
Нами отмечалось, тем не менее, что могут иметь место существенно большие значения коэффициентов ОБЭ космических излучений, чем принятые в расчетах значения КК, согласно нормативному документу (ГОСТ 25645.218-90 БРЭКАКП, 1991), о чем говорилось выше в разд. 6.1. Могут быть и явно большие, чем 1,0, значения коэффициентов модификации КМО за счет нерадиационных факторов полета применительно к риску отдаленных неблагоприятных последствий. При уточнении в будущем значений этих коэффициентов реальные оценки рисков могут возрасти и реальная защита бытовых отсеков Марсианского корабля, по-видимому, может оказаться большей.
561
Данными, представленными в разд. 7 и 8, убедительно продемонстрировано, что суммарный радиационный риск в течение жизни космонавтов превышает оценку риска развития опухолей в старших возрастных группах в 3,5-9 раз и практически не зависит от их возраста. Он почти в 20 раз превышает радиационный риск в процессе проведения полета. С учетом этих данных становится очевидным, что суммарный радиационный риск в течение жизни космонавтов, а также возможное сокращение средней предстоящей продолжительности жизни являются наилучшими показателями для оценки опасности радиационного воздействия, которое имеет место в условиях длительных космических полетов. Поэтому именно эти значения принимались за основу в новом документе при решении вопросов нормирования и обеспечения безопасности космонавтов и обосновании новых значений пределов доз для космонавтов за всю их профессиональную деятельность.
Было принято решение в условиях совместных полетов космонавтов и астронавтов на МКС в первую очередь обосновать необходимые нормативы применительно к орбитальным космическим полетам. Большим коллективом сотрудников ГНЦ РФ — ИМБП РАН; ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна» и ГНИИИ Военной медицины МО при нашем участии разработаны и в 2004 г. утверждены новые Методические указания МУ 2.6.1. 44-03-2004 «Ограничение облучения космонавтов при околоземных космических полетах».
Более высокие оценки радиационного риска, представленные в литературе в последнее время, а также наличие комплекса нерадиационных факторов, действующих на космонавтов в полете, привели к пересмотру дозовых пределов за период профессиональной деятельности космонавтов. Величина суммарной среднетканевой дозы за период профессиональной деятельности космонавтов в новых нормативах по обеспечению радиационной безопасности орбитальных космических полетов в Методических указаниях МУ 2.6.1. 44-03-2004 ограничена величиной, равной 1 Зв. Она снижена в 4 раза по сравнению с прежним нормативом (ГОСТ 25645.215-85 БРЭКАКП, 1986).
В табл. 10.5 представлены в сравнительном аспекте нормативные уровни доз облучения космонавтов (астронавтов) в разных странах в процессе полета различной продолжительности и за всю карьеру. При установлении пределов доз, регламентирующих уровни радиационного воздействия в процессе космического по
562
лета длительностью от одного месяца до года принимались во внимание следующие положения:
1. С учетом ограничений на толщину радиационной защиты и вес КА, а также ввиду необходимости проведения внекорабельной деятельности (ВКД), в настоящих МУ предел дозы для космонавтов за год при осуществлении околоземного космического полета (КП) по дозе на кроветворные органы установлен равным 0,5 Зв.
Таблица 10.5
Нормативные уровни облучения космонавтов (астронавтов) в разных странах, Зв (Методические указания МУ 2.6.1. 44-03-2004.)
Критический орган и глубина в ткани Длительность периода и возраст космонавтов Россия, РКА США, NASA Япония, NASDA
Кроветворные Однократное 0,15 — —
органы (5 см) За 30 суток 0,25 0,25 —
За год 0,5 0,5 0,5
Хрусталик Однократное — — 0,5
(0,3 см) За 30 суток 0,5 1,0 —
За год 1,0 2,0 1,0
За карьеру 2,0 4,0 5,0
Кожа (0,01 см) Однократное — — 2,0
За 30 суток 1,5 1,5 —
За год 3,0 3,0 4,0
За карьеру 6,0 6,0 20,0
Среднетканевая За карьеру при начале работы м ж м Ж М Ж
в возрасте 25 лет 1,0 1,0 0,7 0,4 0,6 0,6
25-29 лет 1,0 1,0 — — 0,9 0,8
30-35 лет 1,0 1,0 — — — —
35 лет 1,0 1,0 1,0 0,6 1,0 0,9
36-39 лет 1,0 1,0 — — 1,2 1,1
45 лет 1,0 1,0 1,5 0,9 1,2 1,1
55 лет 1,0 1,0 2,9 1,6
2. Для сохранения работоспособности космонавтов в течение всего КП необходимо ограничение уровня эквивалентной дозы на костный мозг для кратковременного облучения за одно солнечное протонное событие (СПС), а также установление пределов доз за
563
30 суток и год полета. При превышении установленных в настоящих МУ значений доз возможно кратковременное снижение работоспособности, связанное с первичной лучевой реакцией непосредственно после развития мощного СПС, а также с увеличением вероятности астенизации организма при полетах длительностью около года и выше (Radiobiological factors in manned space flight, 1967; Григорьев Ю.Г., 1975; Шафиркин A.B., 1999в).
3. Учитывая внекорабельную деятельность (ВКД) космонавтов — производственную необходимость периодической работы космонавтов на внешней поверхности станции при меньшем уровне радиационной защиты, а также стохастический характер возникновения СПС, пределы доз за год на хрусталик и кожу в МУ 2.6.1.44-03-2004 установлены в 1,5 раза выше, чем для планируемого повышенного облучения в соответствии с НРБ-99.
Из данных табл. 10.5 видно, что для космонавтов России разного возраста предельное значение среднетканевой дозы установлено одинаковым 1,0 Зв, поскольку было показано, что суммарный радиационный риск практически не зависит от возраста начала космической деятельности (разд. 8). В то же время для астронавтов разного пола и возраста в нормативных документах США, Японии представлены разные пределы доз за карьеру, поскольку в основу положен только риск развития опухолей, который не должен превышать 3% и недооценен суммарный радиационный риск.
Основной предел дозы для хрусталика — предельное значение эквивалентной дозы на хрусталик за всю карьеру космонавтов установлен в настоящих МУ равным 2,0 Зв. При превышении этого значения дозы возможно увеличение скорости образования помутнений хрусталика и увеличение частоты образования катаракт, о чем свидетельствуют данные экспериментальных работ и эпидемиологических исследований (Абросимова А.Н., Шафиркин А.В., Федоренко Б.С., 2000). Это подробно рассмотрено в разд. 9.5.
При обосновании этого предельного значения дозы на хрусталик для космонавтов России за всю их профессиональную деятельность учитывались полученные в экспериментальных работах высокие значения коэффициентов ОБЭ для ускоренных тяжелых ионов, достигающие при низких уровнях дозы значений в интервале 40-67, а при совсем малых значениях дозы — до 100 (Worgul В. et al., 1087; Brenner DJ., Medvedovsky C., Huang G., etal., 1991). Принимались во внимание также полученные недав
564
но данные об увеличении частоты ухудшения прозрачности хрусталика и развитии начальных стадий катаракт у американских астронавтов при существенно меньших 2,0 Зв дозах на хрусталик, накопленных ими за весь период их профессиональной работы (Cucinotta F.A., Manuel F.K., Jones J. et al., 2001).
Основной предел дозы для кожи — предельное значение эквивалентной дозы на кожу за карьеру космонавтов, учитывая воздействие галактического и солнечного космических излучений, установлен в настоящих МУ равным 6 Зв. При превышении этого уровня дозы возможны неблагоприятные отдаленные последствия в виде сухости кожи, образования трещин, изменения капиллярного кровотока, дистрофических проявлений, изъязвлений (см. разд. 9.4). Этот нормативный уровень соответствует нормативному уровню, установленному в NASA США (табл. 10.5).
В табл. 10.6 приведены значения риска отдаленных радиационных последствий при нормативных значениях доз за карьеру, принятых космическими агентствами разных стран, участниц программы МКС. Значения пределов доз в США утверждены национальной комиссией по радиологической защите NCRP (National Council on Radiation Protection and Measurement. Report 132, 2000). Как уже говорилось выше, в США, Японии критерием радиационной безопасности (РБ) является предельный уровень радиационного риска смертности в течение жизни от опухолей (3%). Предельные значения эффективных доз существенно различаются для космонавтов, начинающих карьеру в разных возрастах.
Предельное значение среднетканевой эквивалентной дозы за весь период профессиональной деятельности для космонавтов России, начинающих карьеру в разных возрастах, одинаково и равно 1 Зв. Согласно расчетам при этой дозе значение суммарного радиационного риска в течение жизни не превысит 10%, риск смертности от опухолей для космонавтов, начавших карьеру в возрасте 30, 40 и 50 лет, составит 4,6; 3,1 и 2,4% соответственно, а возможное сокращение продолжительности жизни оценивается равным 3,4; 3,1 и 2,7 года.
Проведенные нами расчеты (см. данные табл. 10.6) показывают, что при предельном значении доз для американских астронавтов в возрасте 55 лет — (2,9 Зв) суммарный радиационный риск в течение жизни может быть очень высоким (около 30%). Об этом же свидетельствуют недавно представленные данные американских исследователей (Geard C.R., Jenkins-Baker G., Grabham P.
565
566
Таблица 10.6
Суммарный радиационный риск в течение жизни космонавтов, астронавтов (%), риск развития опухолей (%), ожидаемое сокращение продолжительности жизни в годах при предельных значениях доз за карьеру, принятых разными космическими агентствами (Методические указания МУ 2.6.1. 44-03-2004; National Council on Radiation Protection and Measurement. Report 132, 2000)
Отдаленные последствия Страна Начальный возраст, годы Доза за карьеру, Зв Примечание
0,6 0,7 0,9 1,0 1,2 1,5 2,9
Суммарный радиационный риск, % 30 40 50 6,0 7,0 9,0 10 12 15 >30 Те же значения Те же значения Расчет на основе среднетканевой дозы в России
Сокращение продолжительности жизни, годы 30 40 50 2,0 2,4 3,1 3,4 4,1 5,0 10 1,8 2,2 2,8 3,1 3,7 4,5 9,0 1,6 1,9 2,4 2,7 3,2 3,9 7,8 Расчет на основе среднетканевой дозы в России
Риск опухолей США 25 2,6 3,0 3,8 4,3 5,2 6,4 12,5 NASA
Япония 27-29 3,0 3,5 4,5 5,0 6,0 7,5 14,5 NASDA
Россия 30 2,8 3,2 4,2 4,6 5,6 6,9 13,5
Риск опухолей США 35 1,8 2,1 2,7 3,0 3,6 4,5 8,7 NASA
США 45 1,2 1,4 1,8 2,0 2,4 3,0 5,8 NASA
Япония 36-39 1,8 2,1 2,7 3,0 3,6 4,5 8,7 NASDA
Россия 40 1,9 2,2 2,8 3,1 3,7 4,7 9,0
Риск опухолей США 55 0,6 0,7 0,9 1,0 1,2 1,5 3,0 NASA
Япония >40 1,5 1,8 2,3 2,5 3,0 3,7 7,3 NASDA
Россия 50 1,4 1,7 2,2 2,4 2,9 3,6 7,0
Примечание. Выделенные значения соответствуют предельным значениям доз за карьеру для космонавтов, астронавтов разных возрастов, принятых в разных странах.
et al., 2006). В этой работе авторы отмечают также высокий риск развития неопухолевой отдаленной патологии, связанной с развитием поражения сосудистого эндотелия и развитием нарушений в системе кровообращения. Они оценивают этот риск как 14% на 1 Зв.
На III Международном симпозиуме «Проблемы биохимии, радиационной и космической биологии» к 100-летию со дня рождения Н.М. Сисакяна в докладе доктора М. Durante «Cosmic radiation and noncancer risk» автор рассматривал, кроме вероятности возникновения рака в результате облучения, дополнительный риск развития в отдаленном периоде нейродегенеративных и сердечных болезней (частоты ишемической болезни сердца и инфарктов), нарушений в иммунной и эндокринной системах, а также сосудистых нарушений. Он оценивал суммарный канцерогенный и неканцерогенный риск при облучении в дозе 1 Зв жителей Хиросимы и Нагасаки за период 1968-1997 гг. равным от 10 до 14%. После орбитальных полетов на МКС и последующем полете к Марсу при накопленных дозах от 2,5 до 2,9 Зв его оценки суммарного риска достигали 40%. Механизм неопухолевых эффектов автор связывает с радиационно-обусловленным ускоренным старением.
Представленные выше данные показывают обоснованность новых принятых в России нормативных значений доз для космонавтов, реализующих радиационную безопасность при проведении длительных орбитальных полетов, а также обеспечивающих сохранение здоровья и работоспособности космонавтов в отдаленном периоде после завершения полетов.
Основной целью при обосновании пределов доз в новом нормативном документе МУ 2.6.1.44-03-2004 было сохранение нормального уровня здоровья и работоспособности космонавтов не только в полете, но и после завершения трудовой деятельности, а также обеспечение непревышения предельного значения суммарного радиационного риска в течение жизни космонавтов — 10%.
Данные о величинах риска, оцененные на основе расчетов и реальных измерений дозовых нагрузок за 28 основных экспедиций на станции «Мир», представленные в табл. 8.3, показывают, что нормативы, ограничивающие дозы космонавтов в документе (Методические указания МУ 2.6.1.44-03-2004), вполне выполняются.
Так, суммарный риск после полета продолжительностью 1 год не превысит 2,0%, максимальная оценка риска развития опухолей
567
у космонавтов в возрастах 30, 40 и 50 лет без учета коэффициента редукции, связанного с низкой величиной мощности дозы, составит 1,0; 0,7 и 0,5%. Сокращение продолжительности жизни для космонавтов этих возрастов не превысит 0,7; 0,6 и 0,5 года. Отмеченные выше линейные соотношения между величинами рисков и среднетканевой дозой доказывают возможность космонавтам осуществлять свою профессиональную деятельность, связанную с орбитальными полетами, до 5 лет.
При обосновании пределов доз для членов экипажей орбитальных космических станций были использованы представленные в разд. 8 расчеты величин рисков дополнительной смертности в течение жизни космонавтов и оценки сокращения продолжительности их жизни, а также приведенные в разд. 4 и 9 материалы о возможных нарушениях в различных системах организма и об отдаленных неблагоприятных последствиях, которые могли бы привести к снижению работоспособности космонавтов после завершения полетов. Это рассмотренные выше данные 35-45-летних наблюдений за персоналом предприятия «Маяк», который подвергался хроническому облучению в широком диапазоне доз, сведения об отдаленных эффектах у лиц, подвергшихся атомным бомбардировкам в Хиросиме и Нагасаки, некоторые данные по изменению здоровья ликвидаторов последствий аварии на ЧАЭС за 15-летний период наблюдения за ними, а также материалы использования ионизирующих излучений в онкологической практике и данные о случаях аварийного облучения людей.
Прежде чем проводить обоснование нормативных уровней доз для космонавтов при полете к Марсу, следует еще раз остановиться на дозиметрических функционалах, наиболее адекватно характеризующих риски различных неблагоприятных отдаленных последствий.
Сопоставление расчетных значений локальных эквивалентных доз в различных точках на станции «Мир», эквивалентных доз в представительных точках органов в фантомах, представляющих модель тела человека (ГОСТ 25645.203-83 БРЭКАКП. Модель тела человека, 1984), а также расчетных величин эффективной дозы на основе результатов фантомных измерений на станции «Мир» показало, что величина среднетканевой эквивалентной дозы оказалась на 10-15% выше рассчитанного значения эффективной дозы и на 20-25% выше дозы на костный мозг (Yasuda Н.,
568
Komiyama T., Fujitaka, 1999; Шафиркин A.B., 1999-в; Шафиркин и др., 2002; Методические указания МУ 2.6.1.44-03-2004).
Недавно тщательно проведенные расчеты эффективной и среднетканевой эквивалентных доз в фантоме (геометрической модели тела человека с подробным описанием внутренних органов), расположенном в салоне большого диаметра служебного модуля Международной космической станции (Митрикас В.Г., 2008), показали совпадение расчетных значений указанных дозиметрических функционалов с точностью до 1%.
Таким образом, для целей радиационной безопасности космических полетов среднетканевая доза может выступать в качестве верхней, а доза на костный мозг (на глубине 5 см) — в качестве нижней оценки эффективной дозы. Эти величины легко определяются на основе измеряемых дозиметрических величин (данных о распределении поглощенной дозы по станции по показаниям приборов радиационного контроля и результатов индивидуального дозиметрического контроля).
Нам представляется, что использование среднетканевой эквивалентной дозы, а также обобщенной дозы является более перспективным для решения вопросов радиационной безопасности, поскольку использование этих дозиметрических функционалов позволяет оценивать суммарный неканцерогенный и канцерогенный радиационный риск в течение жизни космонавтов, который для старших возрастных групп является в 6-9 раз большим, чем последний. На основе значений среднетканевой дозы можно также проводить отдельно расчеты вероятности развития опухолей, а также оценивать риск нарушений в системе кровообращения и увеличение частоты отмеченной выше неопухолевой отдаленной патологии.
10.3. Обоснование допустимых величин суммарного радиационного риска и пределов доз для космонавтов при осуществлении полета к Марсу
В разд. 8.1 нами рассмотрены вопросы радиационной опасности и оценены значения радиационного риска при полете к Марсу с использованием двигательного комплекса, состоящего из модулей большой и малой тяги, включающего жидкостной реактивный двигатель (ЖРД) и ядерно-энергетическую двигательную уста
569
новку (ЯЭРДУ). В этом случае на начальной стадии полета можно значительно сократить время пребывания корабля с экипажем в радиационных поясах Земли (РПЗ) и продолжительность всей экспедиции, как указывалось выше, могла быть сокращена до 530-615 суток (Демин В.П. и др., 1993). При полете с использованием комбинированной схемы ЖРД и ЯЭРДУ, радиационную опасность для экипажа в основном представляют галактические космические лучи (ГКЛ) и солнечные космические лучи (СКЛ) во время осуществления солнечных протонных событий (СПС). Дозами от протонов и электронов РПЗ и вкладом от них в радиационный риск можно было пренебречь.
В последних проектах марсианских космических аппаратов (КА) склоняются к решению отказаться от ядерно-энергетических установок на борту (Глушко В.П., Семенов Ю.П., Горшков Л.А., 1988, Семенов Ю.П., Горшков Л.А., 1990, Горшков Л.А., 2006). Как отмечал в своих интервью, посвященных полету к Марсу, главный научный сотрудник Ракетно-космической корпорации «Энергия», профессор Леонид Горшков (Горшков Л.А., 2006) при наземных испытаниях ЯЭРДУ дают мощную радиоактивную струю, которую трудно изолировать от атмосферы. Кроме того, реакторы на борту необходимо удалять от жилых отсеков и сооружать большую пассивную физическую защиту, что малоэффективно применительно к задачам экспедиции и в связи с необходимостью размещения полезного научного оборудования, топлива, продуктов питания.
В настоящее время в проекте предусматривается использование сравнительно простых экологически чистых электрореактив-ных двигателей малой тяги с использованием солнечной энергии. Комплекс с использованием почти 400 двигателей имеет высокую надежность и минимальную массу. Его проще, чем какой-либо другой, собрать на околоземной орбите (Глушко В.П., Семенов Ю.П., Горшков Л.А., 1988; Семенов Ю.П., Горшков Л.А., 1990; Горшков Л., 2006). Несмотря на увеличение продолжительности экспедиции, которая может составить от 730 до 900 дней, эта концепция марсианской экспедиции обладает основным главным преимуществом — высокой вероятностью благополучного возвращения экипажа (http://www.energia.ru/energia/mars/concept.html; Горшков Л.А., 2006).
Основные характеристики межпланетного комплекса по концепции РКК следующие. Рассматривается различная тяговоору-
570
женность а от 0,00006 до 0,0001 единиц для медленной и более быстрой раскрутки марсианского корабля (МК) в РПЗ. Для более медленного варианта раскрутки в РПЗ в соответствии с данными (http://www.energia.ru/energia/mars/concept.html; Горшков Л., 2006), принимается, что тяговооруженность марсианского корабля а на момент отлета составляет 0,00006. Использование двигателя малой тяги влечет за собой необходимость рассмотрения большего круга вопросов по оценке радиационной опасности и суммарного радиационного риска для членов экипажа, поскольку увеличивается длительность полета и возникает необходимость учета радиационного воздействия от протонов и электронов РПЗ. И то, и другое требует дополнительной радиационной защиты и оценок суммарного радиационного риска в результате полета (Ковалев Е.Е. и др., 1969; Дудкин В.Е. и др., 1991; Демин В.П. и др., 1993).
Проведенные в работе (Ковалев Е.Е. и др., 1969) оценки массы радиационного убежища (РУ) в вариантах полета с малотяговым двигателем базируются на модели РПЗ, созданной в 70-е годы, когда пространственно-энергетические характеристики протонов и электронов были изучены недостаточно полно. С разработкой более совершенных моделей пространственно-энергетических распределений протонов и электронов РПЗ (см. разд. 1 и 2) появилась возможность более точных оценок радиационных характеристик РПЗ, воздействующих на экипаж КА при полете к Марсу с использованием электрореактивных двигателей. Кроме того, как уже отмечалось, в настоящее время существенно снижены пределы допустимых доз ионизирующих излучений для работников атомной промышленности за весь период их работы (Нормы радиационной безопасности НРБ-99), а также ограничены допустимые дозы за профессиональную деятельность космонавтов при осуществлении орбитальных полетов (разд. 10.2) уровнем не более 100 сЗв (Методические указания МУ 2.6.1.44-03-2004).
Для проведения расчетов дозовых нагрузок на членов экипажа было использовано приближенное выражение для скорости удаления космического корабля в радиальном направлении при тяго-вооруженности а ~ 10”4 + 10“5.
В соответствии с (Ковалев Е.Е. и др., 1969):
уг=±Ц^, (10.8)
571
где g — ускорение силы тяжести; ц — гравитационная постоянная, равная 398606,6 км3/сек2, г — радиальное расстояние корабля от центра Земли.
Формула (10.8) позволяет связать плотность потока заряженных частиц за время раскрутки в РПЗ F(E) с тяговооруженно-стью:
F(E) = f F(E, t)dt = f F(E, r)dr/Vr = f F(E, r)r-3/2 dr,
J J ag J
(10.9)
где F(E,r) — плотность потока заряженных частиц, падающего на поверхность космического аппарата за виток спирали на расстоянии г со скоростью удаления от центра Земли Vr.
Можно видеть из выражений (10.8) и (10.9), что плотность потока заряженных частиц, а следовательно, и доза радиационного воздействия за время раскрутки в РПЗ обратно пропорциональна тяговооруженности а.
Время раскрутки от опорной орбиты радиуса гоп гоп до орбиты с радиусом г может быть вычислено из следующего выражения
tp = / ^ = — (г;„1/2 - г"1/2), сек. (10.10) rJ Vr ag гоп
С помощью выражения (10.10) можно оценить время нахождения КА во внутреннем и внешнем РПЗ. Так, при раскрутке с опорной круговой орбиты высотой 500 км время нахождения во внутреннем РПЗ составит -50 суток при тяговооруженности КА a = 0,00006. Время нахождения во внешнем РПЗ (16378-36 378 км) при том же значении тяговооруженности составит -32 суток. Увеличение тяговооруженности пропорционально уменьшает длительность пребывания в РПЗ и уменьшает дозу облучения протонами РПЗ. Если увеличить тяговооруженность до 0,0001, то длительность раскрутки в протонном поясе снизится в 1,67 раза.
Расчет зависимости эквивалентной дозы за защитой проводился по следующей схеме. Сначала рассчитывались геоцентрические координаты при раскрутке КА в РПЗ. Расчет L, В-координат, на базе которых построены модели РПЗ, проводился с использованием текущих геоцентрических координат. По текущим L, В-ко-ординатам в соответствии с (Sawyer D.W., Vette J.I., 1976; ГОСТ
572
25645.138-86 БРЭКАКП, 1986; ГОСТ 25645.139-86 БРЭКАКП, 1986) определялись интегральные спектры протонов и электронов, которые суммировались по времени.
Далее по стандартизованным методикам (РД 50-25645.206-84. БРЭКАКП, 1985; РД 50-25645.208-84 БРЭКАКП, 1986) производился расчет эквивалентной дозы за защитой из алюминия. Кривые ослабления эквивалентной дозы позволили рассчитать среднетканевую эквивалентную дозу в сферическом фантоме (ГОСТ 25645.203-83. Модель тела человека, 1984; ГОСТ 25645.204-83 БРЭКАКП, 1984). Результаты расчетов для периодов минимума и максимума солнечной активности представлены на рис. 10.1.
Рис. 10.1. Кривые ослабления локальной эквивалентной, среднетканевой и обобщенной доз от протонов при раскрутке в РПЗ с использованием двигателей малой тяги (а = 0,00006) для полетов в периоды максимума и минимума солнечной активности (СА)
В разд. 8.1 и 8.2 мы величины радиационного риска в течение жизни космонавтов оценивали с использованием расчетных значений обобщенных доз Но применительно к оценке отдаленных
573
неблагоприятных эффектов, которые вычислялись на основе значений среднетканевых эквивалентных доз от источников космических излучений и коэффициентов КВ, учитывающих снижение биологической эффективности радиационного воздействия при значительном снижении мощности дозы за счет развития восстановительных процессов на уровне организма.
В разд. 5.2 в отношении ближайших радиационных эффектов после облучения протонами и гамма-излучением показано значительное снижение биологической эффективности радиационного воздействия при снижении мощности дозы ниже 1000 сЗв/сут. При этом продемонстрирован тождественный характер радиационных нарушений на клеточном, тканевом и организменном уровнях при действии протонов с энергией более 30 МэВ и гамма-излучения.
Отдаленные эффекты, связанные с возможным сокращением продолжительности жизни, также значительно модифицируются при снижении мощности дозы, за счет развития компенсаторных и восстановительных процессов на уровне организма. Анализ большого числа экспериментов на разных млекопитающих при протяженном и фракционированном их облучении протонами и гамма-излучением с дозой за сутки менее 2 сЗв (см. разд. 4; 5.2 и 5.3) показал, что эффективность такого радиационного воздействия снижается более, чем в 4 раза. Примерно в 4 и более раз возрастают дозы, приводящие к гибели 50% животных при протяженных воздействиях по сравнению с острым кратковременным воздействием. Сокращение продолжительности жизни на единицу дозы также снижается в этой пропорции. Поэтому в разделе 8 при расчетах радиационного риска и величин обобщенных доз Но от протонов СКЛ и РПЗ значения среднетканевых доз были уменьшены в 4 раза. Обобщенные дозы от РПЗ при раскрутке с малотяговым двигателем энерговооруженностью 0,00006 также представлены на рис. 10.1.
Как видно из данных, представленных на рис. 10.1, за возможной реальной защитой КА в диапазоне 10-30 г/см2 обобщенные дозы от РПЗ будут заключены в диапазоне от 30 до 18 сЗв. При меньшем времени нахождения КА в РПЗ в случае использования двигателя с энерговооруженностью 0,0001 значения обобщенных доз снизятся в 1,67 раза и составят от 18 до И сЗв.
В разд. 1 было показано, что ГКЛ характеризуются сложным составом, состоящим из высокоэнергетичных протонов, легких,
574
средних и тяжелых ядер с относительно жестким спектром, простирающимся до сотен ГэВ. Это излучение слабо ослабляется защитой. В разд. 6 мы отмечали высокую относительную биологическую эффективность ГКЛ и быстрых нейтронов, которая может быть даже существенно выше, чем в нормативном документе, определяющем зависимость ККО от ЛПЭ (ГОСТ 25645.218-90 БРЭКАКП,1991). Эффективность указанных излучений как в отношении ближайших, так и отдаленных неблагоприятных эффектов не модифицируется мощностью дозы, поэтому значение коэффициента временной неравномерности радиационного воздействия КВ равно 1, применительно к радиационному воздействию ГКЛ. Поэтому обобщенная доза от ГКЛ числено совпадает со значениями среднетканевой дозы от ГКЛ. Для оценки величин доз от ГКЛ использовали представленные в работе (Dudkin V.E. и др., 1992) и в разд. 7 и 8 зависимости мощности среднетканевой эквивалентной дозы ГКЛ для шарового фантома, представляющего стандартизованную модель тела человека, от толщины защиты для периодов максимума и минимума СА.
На рис. 10.2 представлены данные по обобщенным дозам от ГКЛ за полет продолжительностью один год в период минимума и максимума СА и для полетов в период максимума СА длительностью 730 и 900 суток. Кроме этого для сопоставления на этом рисунке представлены данные по обобщенным дозам от протонов РПЗ при тяговооружености двигателей 0,00006 и 0,0001. Обобщенные дозы от электронов РПЗ не представлены, поскольку за толщинами защиты более 5 г/см2 они слишком малы (менее 0,1 сЗв).
Как видно из данных рис. 10.2, обобщенная доза от ГКЛ при полетах в период минимума СА более, чем в 2 раза превышает аналогичные значения при полете в период максимума СА. Мы ранее уже отмечали (Шафиркин А.В, 1999в; Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В., 2004) предпочтительность полета к Марсу в период максимума СА. Поэтому остальные расчетные оценки доз на рис. 10.2 приведены для периода именно максимума СА. Анализ этих данных показывает, что имеют место существенно более высокие значения обобщенных доз от ГКЛ и РПЗ при полетах продолжительностью 2,5 года и раскрутке с двигателем малой тяги с а = 0,00006, что представляет повышенную радиационную опасность. Поэтому требуют специального
575
90
Рис. 10.2. Зависимость обобщенных доз от ГКЛ и РПЗ при длительностях полета 1; 2 и 2,5 года в периоды минимума и максимума СА при тяговооруженности двигателей 0,00006 и 0,0001 от толщины защиты КА
рассмотрения вопросы соотношения толщины защиты марсианского корабля и оцениваемых значений суммарного радиационного риска.
В разд. 8.1 представлен алгоритм и проведены расчеты суммарного радиационного риска для космонавтов в течение всей их жизни после завершения межпланетных полетов различной продолжительности для различных толщин защиты бытового отсека ХБО и радиационного убежища Хру. Он основан на модели радиационной скорости смертности млекопитающих, описывающей радиационно-обусловленное в зависимости от обобщенной дозы Но повышение значений возрастных коэффициентов смертности для мужчин (см. разд. 5.3). Суммарный риск определялся в течение всей жизни космонавтов (мы в расчетах использовали период до 70 лет). Он вычислялся по разности функций дожития (обычно используемых в демографии) для когорт с начальным возрас
576
том от 30 до 55 лет без радиационного воздействия и при облучении в обобщенной дозе Но. Мы в разделе 8.1 показали, что значения суммарного радиационного риска линейно зависят от длительности полета и от величин обобщенной дозы. При этом значение суммарного радиационного риска практически не зависит от возраста космонавтов в начале карьеры и оказывается равным 0,13 на 1 Зв. Также линейно с длительностью полета и с величиной обобщенной дозы изменяются оценки возможного сокращения средней предстоящей продолжительности жизни (Шафиркин А.В., 1999в; Шафиркин А.В. и др., 2002). Эти материалы подробно рассмотрены в разд. 8 и 10.2).
На основе расчетных значений обобщенных доз от ГКЛ и РПЗ, представленных на рис. 10.2, и указанной величины суммарного радиационного риска на единицу дозы проведены оценки радиационного риска для космонавтов после завершения полета к Марсу в период максимума С А продолжительностью 730 и 900 дней в случае использования электрических двигателей малой тяги для максимальной и минимальной энерговооруженности (рис. 10.3).
При оценках общего риска необходимо добавить вклад в него от воздействия СКЛ. Ранее в разд. 8 мы проводили расчеты суммарного радиационного риска от ГКЛ и СКЛ в случае использования комплекса двигателей ЖРД и ЯЭРДУ, когда мы не учитывали вклад РПЗ. Расчеты проведены для длительностей полета до 3 лет в период минимума и максимума СА при минимальной толщине защиты бытовых отсеков ХБО, равной 1 г/см2 и защите радиационного убежища ХРУ, равной 1, 5,10, 20 и 50 г/см2.
Расчеты проведены методом Монте-Карло, когда случайным образом в процессе длительного полета разыгрывались моменты СПС, величины флюенсов и энергетические характеристики спектров СКЛ. Средние значения величин доз и рисков рассчитывали на основании 104 историй полета. Было получено значительное снижение величин доз от СКЛ и суммарного радиационного риска от этого источника по мере увеличения толщины защиты радиационного убежища. При толщине защиты Хру 20 г/см2 величины дозы и риск определялись практически только воздействием ГКЛ.
На основе этих данных могут быть оценены значения суммарного радиационного риска от СКЛ в зависимости от толщины защиты бытовых отсеков марсианского корабля. Эти значения представлены в табл. 10.7 для полетов продолжительностью 730 и 900 суток.
577
Рис. 103. Суммарные значения радиационного риска для космонавтов России от ГКЛ и РПЗ после завершения полета к Марсу в период максимума СА продолжительностью 730 и 900 дней в случае использования электрических двигателей малой тяги с максимальной и минимальной энерговооруженностью
Таблица 10.7
Значения суммарного радиационного риска от СКЛ (%) при полете к Марсу в течение 730 и 900 дней при различных толщинах защиты КА
Толщина защиты бытовых отсеков КА, г/см2, алюминия Длительность полета, сутки
730 900
1 7,0 8,5
5 2,5 3,0
10 1,2 1,5
20 0,4 0,5
578
В разд. 8 и 10.2 показано, что как суммарный радиационный риск, так и оцениваемые значения сокращения СППЖ линейно зависят от длительности полета. При этом приращению суммарного риска на 3% соответствует дополнительное сокращение продолжительности жизни на 1 год.
В соответствии с (Дудкин В.Е. и др., 2000; Сакович В.А., Семенов В.Ф., 2005) средняя толщина защиты марсианского корабля составляет ~15г/см2 при условии, что оборудование равномерно располагается по поверхности космического корабля. При реально возможном распределении толщины защиты от 10 до 30 г/см2 суммарные обобщенные дозы от ГКЛ и РПЗ в случае полета 900 суток и медленной раскрутки в РПЗ составят 85 и 58 сЗв соответственно (см. рис. 10.2). Оцениваемые значения суммарного радиационного риска только за полет окажутся равными Ии 7,5%. Для толщины защиты КА 15 г/см2 вклад в величину суммарного риска от СКЛ не превысит 1%, а учитывая то, что во время СПС космонавты могут находиться в более защищенных отсеках, вклад СКЛ будет заметно меньше 1%.
Во время 30-суточного пребывания на поверхности Марса характер радиационного воздействия не очень сильно отличается от воздействия в полете, поскольку защитный слой атмосферы также составляет 15-16 г/см2 (Швидковская Т.Е., 1983). Кроме того, дополнительно Марс экранирует около половины излучения ГКЛ и СКЛ, что уменьшает уровень радиационного воздействия по сравнению с полетом. В случае развития очень мощного СПС именно в момент нахождения космонавтов на Марсе они могут укрыться в десантном модуле так, что радиационный риск от этого события не превысит 1%.
Таким образом, суммарный радиационный риск в максимальном случае 900 суточного полета с минимальной скоростью раскрутки в РПЗ при толщинах бытовых отсеков марсианского корабля 10, 15, 20, 25 и 30 г/см2 составит 12,5; 10,7; 9,4; 8,3 и 7,5%, а сокращение продолжительности жизни 4,2; 3,6; 3,1; 2,8 и 2,5 года соответственно. В случае использования двигателей с более высокой тягой, энерговооруженностью 0,0001 и при длительности полета 730 дней суммарный радиационный риск будет заметно снижен (см. рис. 10.3). С учетом рассмотренного выше незначительного вклада в величину обобщенной дозы от СКЛ суммарный радиационный риск при рассмотренных выше толщинах защиты
579
составит 9,2; 8,0; 7,0; 6,1 и 5,7. В этом случае риск уменьшится приблизительно на 3% при ХБО = 15 г/см2, а сокращение СППЖ может составить 2,5 года.
Следует, однако, учитывать, что в марсианскую экспедицию будут отобраны космонавты, имеющие значительный опыт длительных орбитальных полетов, которые в течение также длительного периода проходят медицинские обследования, в том числе неоднократные рентгенологические обследования. Таким образом к моменту отбора космонавтов к марсианской экспедиции величины суммарных накопленных эквивалентных доз космонавтов составят около 30 сЗв и суммарный риск до полета уже может быть оценен равным 4%, а величина сокращения продолжительности жизни — на 1,3 года.
При полете к Марсу длительностью 900 суток с использованием электрических двигателей малой тяги с энерговооруженностью 0,00006 и представленного среднего варианта распределения защиты КА, равного 15 г/см2, итоговый суммарный риск в течение жизни космонавта составит около 15%, а возможное сокращение продолжительности жизни — около 5 лет. Это в 1,5 раза превышает предельное значение риска для космонавтов за всю профессиональную деятельность, согласно методическим указаниям применительно к орбитальным полетам (Методические указания МУ 2.6.1.44-03-2004).
Чтобы обосновать более корректно необходимую защиту КА, предельные значения доз и радиационного риска для космонавтов применительно к экспедиции к Марсу, следует обратиться, с одной стороны, к вопросам надежности осуществления полета и выполнения его программы при увеличении веса пассивной защиты. С другой стороны, необходимо еще раз рассмотреть различные подходы и критерии для оценки радиационного риска в разных странах, а также сопоставить радиационные риски с рисками воздействия других экологических и социальных факторов, действующих на человека в течение жизни.
Во-первых, увеличение толщины защиты марсианского корабля в среднем на 5-10 г/см2 алюминия приведет к снижению суммарного радиационного риска всего на 1,3 и 2,4% при экспедиции 900 суток с двигателем меньшей тяги и на 1,0 и 1,9% при полете в течение 730 дней с максимальной скоростью раскрутки. Снижение оцениваемой величины суммарного радиационного риска от
580
представленного выше максимального значения 15% составит незначительную величину, хотя в то же время резко увеличится вес марсианского корабля, что существенно снизит надежность экспедиции и выполнение необходимой полетной программы.
С целью количественного в полной мере представления степени радиационной опасности при воздействии ионизирующих излучений необходимо историческое рассмотрение изменения ее критериальных оценок. Как было показано в разд. 10.2, в последних нормативных документах по радиационной безопасности в нашей стране применительно к профессионально работающим в атомной промышленности НРБ-99 основным дозовым функционалом выступает эффективная эквивалентная доза — величина, предназначенная на основании эквивалентных доз в органах рассчитывать только риск развития канцерогенеза как основного и единственного критерия радиационной опасности. Эта же дозиметрическая величина и этот же единственный критерий радиационной опасности в отдаленном периоде рассматривается в нормативных документах США и Японии применительно к космическим полетам (в NASA и NASDA).
Расчеты суммарного радиационного риска в течение жизни и риска развития опухолей, проведенные для космонавтов разных возрастов, показывают, что для возрастов 45-50 лет суммарный радиационный риск оказывается больше оцениваемого риска опухолей в 3,5 и 9 раз. Таким образом, при использовании расчетов только эффективных доз и риска канцерогенеза происходит многократная недооценка реального суммарного радиационного риска (см. разд. 10.2).
Наши расчеты суммарного радиационного риска основаны на представлениях о различном характере отдаленной радиационной патологии, включающей как увеличение частоты канцерогенеза, так и развитие значительных нарушений во многих системах организма, и в первую очередь нарушений в центральной нервной системе, сердечно-сосудистой системе, нарушений нейроэндокринной регуляции, связанных с отмеченными морфологическими изменениями центрального регуляторного звена в гипоталамусе, снижением функции гипофиза и гипофункциональными изменениями в щитовидной железе, надпочечниках и других железах внутренней секреции. Отмечены серьезные изменения сосудов во многих органах и нарушения системы кровообращения. К чему может привести недооценка опасности для космонавтов в случае
581
использования только концепции эффективной дозы, мы показали в последних нормативных документах, принятых в 2004 г. в России по обеспечению безопасности космонавтов при орбитальных космических полетах (Методические указания МУ 2.6.1.44-03-2004). Эти материалы подробно обсуждались нами в разд. 4, 9 и 10.2.
Выше нами было показано, что при полете с малотяговым двигателем с минимальной их энерговооруженностью суммарный радиационный риск с учетом радиационной нагрузки, связанной с предыдущими орбитальными полетами и в результате полета к Марсу, может составить 15%, а возможное сокращение продолжительности жизни — около 5 лет. Это в 1,5 раза превышает существующие предельные уровни, установленные для космонавтов применительно к орбитальным космическим полетам (Методические указания МУ 2.6.1.44-03-2004).
Представленные в настоящей книге оценки суммарного радиационного риска на основе значений обобщенных и среднетканевых эквивалентных доз являются максимальными из тех, что представлены в литературе. Но мы отмечали, что по мере уточнения зависимости коэффициентов качества от ЛПЭ и возможных более высоких их оценок, а также установления реальных оценок коэффициентов модификации радиационного ответа KMq за счет нерадиационных факторов космического полета, которые могут быть существенно больше 1,0, значения суммарного радиационного риска могут возрасти в несколько раз.
При разработке нового нормативного документа по ограничению доз и радиационного риска применительно к полету на Марс следует учитывать численность экипажа и возможное действие также других факторов полета. В марсианскую экспедицию отправится очень ограниченное число участников (от 4 до 6 человек), и пределы доз следует устанавливать только для этого строго ограниченного контингента, тогда как в существующих нормативных международных и национальных документах по радиационной безопасности на Земле и в Космосе они распространяются на большие группы населения от 103 до 107 и более. При этом следует учитывать уникальность полета, историческую его значимость для всего человечества и высокую международную оценку.
При решении вопросов нормирования радиационного воздействия при полете к Марсу следует обратиться также к концепции приемлемого риска, впервые рассмотренной в работе (Кова
582
лев Е.Е., 1976), и развитой в ряде последующих работ (Шафиркин А.В., 2001; Шафиркин А.В., 2003; Шафиркин А.В. и др., 2005), в которых проводится сопоставление радиационного риска с риском воздействия ряда других экологических и социальных факторов, а также риском других опасных профессий.
В табл. 10.8 представлена классификация по степени опасности и приведены значения рисков для ряда профессий и видов деятельности за год на основе данных работы (Ковалев Е.Е., 1976). В этой таблице мы дополнительно представили значения радиационного риска при осуществлении космических полетов. Риски в таблице дополнительно сопоставлены с современным уровнем демографического риска Rdemo, который для 40-летнего мужчины в России составлял в период 1993-1996 гг. приблизительно 1% в год (Шафиркин А.В., 1999в; Шафиркин А.В., 2001; Шафиркин А.В., 2003; Шафиркин А.В. и др., 2005).
В табл. 10.9 представлены соответствующие рассматриваемым классам опасности уровни риска в течение всей продолжительности профессиональной работы, которые близки к уровням риска в течение жизни.
У лиц ряда профессий, относящихся к первому классу с пренебрежимо малым уровнем риска, период 10-20 летней профессиональной работы не приведет к каким-либо заметным статистически значимым отклонениям в их здоровье. Какие-либо малые изменения не могут быть непосредственно связаны с профессиональной работой и быть отдифференцированны существующими медицинскими методиками, применяемыми в эпидемиологических исследованиях, на фоне изменяющихся климатических условий, непрерывно меняющейся интенсивности действующих экологических факторов, а также изменяющихся социальных условий, качества и образа жизни населения.
Проблема обоснования нормативов воздействия различных физических воздействий на человека, в том числе стандартов профессионального радиационного воздействия на Земле обычно состоит в установлении таких уровней воздействия (дозовых пределов), при которых риск был бы достаточно малым. Он, в сущности, должен быть на том же уровне, как для ряда обычных профессий или видов деятельности и относиться ко 2-му классу относительно безопасных уровней.
Профессии в большинстве отраслей промышленности, относящиеся к классу 2 — характеризующиеся относительно невысоким
583
584
Таблица 10.8
Значения риска смертности на человека в год для различных профессий и видов деятельности и их распределение по степени опасности по данным работ
(Ковалев Е.Е., 1976; Шафиркин А.В., 1999-в; Шафиркин А.В., 2001; Шафиркин А.В., 2003)
Номер класса профессии Характеристика степени опасности Величины риска на человека в год абсолютные и относительные Профессии, отрасли промышленности и виды профессиональной деятельности Виды непрофессиональной деятельности (в пересчете на 40 часов в неделю)
1 Пренебрежимо малый уровень риска <10’4 < 0,01 Rdemo Швейная, обувная, текстильная, бумажная, пищевая, обрабатывающая промышленности, типографские рабочие —
2 Относительно невысокий уровень риска (относительно безопасный) 10“4-10“3 (0,01-0,1) Rdemo Экипажи гражданской авиации, пожарники, полицейские, боксеры профессиональные, гончары, работники в атомной промышленности, рабочие в большом числе отраслей промышленности Велосипед, бокс
3 Относительно высокий уровень риска 10’3-5 10'3 (0,1-0,5) Rdemo Углекоксование, вулканизация, рабочие угольных шахт, строители, экипажи гражданской авиации (условия максимального риска), экипажи реактивных бомбардировщиков, экипажи орбитальных космических станций в процессе полета Охота, лыжи
4 Исключительно высокий уровень риска 5 10-3-10-2 (0,5-1,0) Rdemo и более Некоторые производства в химической промышленности, верхолазы, трактористы, летчики-испытатели, пилоты реактивных истребителей, экипажи межпланетных космических аппаратов в процессе полета за защитой от 10 до 20 г/см2 Мотоциклетный спорт, гребля, альпинизм, скачки с препятствиями
уровнем риска за год, в течение жизни также подвержены малому уровню риска, но только в условиях соблюдения безопасных режимов работы в соответствии со своими должностными инструкциями по технике безопасности.
Таблица 10.9
Шкала приемлемости риска смерти за весь период профессиональной деятельности или в течение всей жизни
(Ковалев Е.Е., 1976; Шафиркин А.В., 1999в; Шафиркин А.В., 2001)
Уровень риска Оценка приемлемости риска
< 2 1СГ3 Пренебрежимо малый уровень риска
<1(Г2 Малый уровень риска
io-2-io-‘ Относительно высокий уровень риска. Необходимо применение мер безопасности
>10-1 Исключительно высокий уровень риска. Необходимо применение мер защиты
Работники ряда химических производств, экипажи гражданской авиации и реактивных бомбардировщиков в условиях максимального риска подвергаются ежегодно относительно высокому уровню риска (класс 3). При осуществлении орбитальных космических полетов, в виду жестких ограничений на вес защиты космического аппарата и относительно небольшого круга лиц, отбираемых для полетов, допускаются более высокие дозы радиационного воздействия с несколько большим уровнем радиационного риска за год, чем тот, который допускается на Земле. Этот риск соответствует риску для ряда относительно опасных профессий класса 3, рассмотренных выше. В работе необходимо постоянно применять меры безопасности. Длительность профессиональной работы сокращается так, что суммарный уровень риска в течение жизни не превышает 10%.
Следует отметить, что ряд профессий на Земле характеризуется исключительно высоким уровнем риска в год (класс 4). К этому риску относится работа верхолазов, трактористов, летчиков-испытателей, пилотов реактивных истребителей и работа на отдельных химических производствах. Столь высоким риском ха-
585
растеризуются и некоторые виды деятельности (см. табл. 10.8). Суммарный риск в течение жизни у работников этих профессий может превышать 10% и достигать 15-20%.
Как было представлено выше, при осуществлении полета на Марс, космонавты будут подвергаться сложному радиационному воздействию космических излучений, обладающих высокой биологической эффективностью, в сравнительно больших дозах. Хотя радиационный риск в процессе полета по своим количественным характеристикам может быть отнесен к классу 3 и составляет от 0,1 до 0,5 от демографического риска за толщинами защиты 5-20 г/см2, общий риск от факторов полета конечно следует отнести к классу 4 с исключительно высоким уровнем риска за год. Проведенные нами расчеты показывают, что радиационный риск за всю жизнь в результате осуществления экспедиции на Марс также может составить до 15% при толщине защиты из алюминия 15 г/см2, что вполне соответствует риску ряда других чрезвычайно опасных профессий, относящихся к классу 4. Работы и виды деятельности, связанные с этим классом опасности, требуют применения мер защиты.
Нами в ряде работ показаны еще большие значения риска для населения от загрязнения воздушного бассейна в городах с развитой промышленностью и широкой сетью транспорта в условиях недостаточности природоохранных мероприятий. Так, например, в случае максимальных уровней химического загрязнения, свойственного в 1991 г. таким городам Российской Федерации, как Москва, Санкт-Петербург, Липецк, Челябинск, Омск, имеющим ранг от 1 до 5 (уровень вредных химических выбросов в год, в среднем равный 720 тыс. тонн), и действия этих выбросов в течение года, 5, 10 и 20 лет, коэффициент смертности может увеличится соответственно на 2,9, 15, 33 и 77%. Величина суммарного риска в течение жизни составит для двух последних случаев 9,6 и 19%, а возможное сокращение продолжительности жизни от 3 до 6 лет (Шафиркин А.В., 1999в; Шафиркин А.В., 2001; Шафиркин А.В., 2003; Шафиркин А.В. и др., 2005).
В последние годы нами были продолжены работы по количественному сопоставлению риска воздействия ионизирующих и электромагнитных излучений, химического загрязнения окружающей среды и длительного действия социального стресса после начала кардинальных экономических преобразований в стране. Было показано, что риск от социального стресса и длительной
586
психоэмоциональной напряженности у людей в критические периоды начала перестройки с 1991 по 1994 г., а также после дефолта с 1998 по 2002 г. многократно превосходил риск от экологических факторов за предыдущие 30 лет. Снижение средней продолжительности предстоящей жизни мужчин всего за 3 года с 1991 по 1994 г. составило 7 лет, и разница по сравнению с развитыми странами Западной Европы, США, Японией достигла 17-18 лет (Шафиркин А.В., 1999в; Шафиркин А.В., 2003; Шафиркин А.В. и др., 2005, 2006, 2007).
Учитывая представленные в книге материалы, можно в первом приближении считать вполне допустимой величину суммарной среднетканевой эквивалентной дозы 150 сЗв, а суммарного радиационного риска в 15% для космонавтов в результате осуществления 900-суточного полета к Марсу на корабле со средней толщиной защиты из алюминия 15 г/см2 при использовании электрических двигателей малой тяги с энерговооруженностью 0,00006. Это тем более оправдано, поскольку это — уникальная экспедиция мирового значения для всего человечества. Члены экспедиции будут приветствоваться во всех странах, как герои столетия, получат большое моральное удовлетворение в течение всей последующей жизни, будут иметь высокий социальный статус. Это в свою очередь приведет не к снижению продолжительности жизни, а даже к возможному ее увеличению.
ЗАКЛЮЧЕНИЕ
В книге с целью обоснования нормативных уровней радиационного воздействия на космонавтов при длительных орбитальных космических полетах, а также межпланетного полета к Марсу, проведено целенаправленное изучение экспериментальных и теоретических работ, в которых рассмотрены вопросы формирования поражения организма в отдельных его системах в ближайшем и отдаленном пострадиационных периодах при острых и хронических воздействиях стандартных видов излучений в различных дозах и в широком диапазоне мощностей доз.
Для решения этой задачи прежде всего следует выделить проведенный большим числом исследователей ряда институтов страны с нашим участием уникальный «Хронический эксперимент» по многолетнему облучению большой партии собак, в котором моделировались возможные величины доз от галактических и солнечных космических лучей, которые могут воздействовать на космонавтов при полете на Марс. Моделировался также характер распределения дозы во времени и по телу космонавтов. Суммарная длительность эксперимента составила 14 лет.
Кроме того в книге значительное внимание обращено на новые критерии оценки радиационной опасности для космонавтов при проведении длительных космических полетов и дозовые функционалы, определяющие эту опасность как в процессе космических полетов, так и в отдаленном периоде после их завершения. Представлен новый дозиметрический функционал — обобщенная доза для количественной оценки опасности для экипажа космического аппарата в космическом полете в условиях комплексного воздействия радиационных и нерадиационных факторов, который позволяет привести сложный характер радиационного воздействия в условиях космического полета к стандартному облучению в наземных условиях. Проанализированы также экспериментальные материалы о биологической эффективности ускоренных протонов, быстрых нейтронов и многозарядных ионов при однократных, повторных острых воздействиях.
В книге впервые предлагается новый вид зависимости коэффициентов относительной биологической эффективности излуче
588
ний от величины линейной передачи энергии применительно к оценке риска ближайших радиационных проявлений в процессе полета. Показано, что в отношении степени проявления радиобиологических эффектов в различных системах организма в процессе космических полетов, предложенные значения коэффициентов качества космических излучений в зависимости от ЛПЭ (Радиационная защита. Рекомендация МКРЗ, Публикация № 26, 1978; ГОСТ 25645. 218-90 БРЭКАКП, 1991) почти в 3 раза завышают реально наблюдаемые в экспериментах значения коэффициентов ОБЭ. Это может рассматриваться как коэффициент запаса в отношении обеспечения нормальной работоспособности космонавтов и выполнения программы полета.
В то же время проведенный в 6 разделе анализ последних экспериментальных данных по определению коэффициентов ОБЭ нейтронов спектра деления и ускоренных многозарядных ионов в отношении риска развития опухолей, поражения нейронов коры головного мозга, риска возможного помутнения хрусталика и развития катаракт показал, что наблюдаемые в эксперименте величины коэффициентов ОБЭ значительно превосходят максимальные значения коэффициентов качества в указанных выше нормативных документах.
Необходима дальнейшая работа по уточнению зависимости коэффициентов качества космических излучений от ЛПЭ, поскольку в настоящее время может иметь место значительная недооценка радиационного риска неблагоприятных последствий в отдаленном периоде после завершения космонавтами своей профессиональной деятельности.
Нами предложена оригинальная модель формирования радиационного поражения у млекопитающих с учетом быстрых восстановительных процессов на клеточном, тканевом уровнях и более медленных процессов восстановления на уровне организма в условиях хронических облучений с различной мощностью дозы и сочетанных радиационных воздействий со сложным характером распределения дозы во времени.
Эта модель эффективной остаточной дозы позволила достаточно хорошо описать значительное число представленных в литературе радиобиологических экспериментов с длительными хроническими облучениями и острыми повторными радиационными воздействиями. Она позволила привести эффекты протяженных облучений к условиям стандартного острого радиационного воз
589
действия и была использована для определения коэффициента временной неравномерности радиационного воздействия для различных источников космического излучения КВр
В книге приведен анализ радиобиологической эффективности и степени опасности острых радиационных воздействий, которые могут иметь место в условиях космического полета при развитии мощных солнечных протонных событий и наличии значительного перепада дозы по телу космонавтов или значительной экранировки значительных участков костного мозга. Осуществлено дальнейшее развитие модели равноценной дозы для описания формирования поражения в системе кроветворения после острых неравномерных радиационных воздействий. Эта модель позволяет привести эффекты неравномерного облучения к условиям стандартного равномерного облучения, вычислить значения коэффициентов пространственной неравномерности радиационного воздействия KPj и определить величину обобщенной дозы, которая практически определяет вероятность выживания организма.
Проведенный в книге анализ экспериментальных результатов комбинированного действия облучения и различных нерадиационных факторов показал, что ближайшие радиобиологические эффекты при этом могут быть усилены в отдельных случаях, но коэффициент модифицирующего воздействия по дозе КМБ не превысит значения, равного 1,3. Это следует учитывать при оценке возможного снижения работоспособности космонавтов в процессе полета и их жизнеспособности при развитии солнечных протонных событий.
Для целей нормирования радиационного воздействия на космонавтов при осуществлении орбитальных и межпланетных полетов рассмотрены зависимости частоты и тяжести от дозы возможных ближайших неблагоприятных радиобиологических эффектов, которые могли бы сказаться на снижении работоспособности и выполнении программы полета и снижении жизнеспособности космонавтов в процессе полета. Проанализирован характер формирования поражения в системе кроветворения, коже в ближайшем периоде после радиационных воздействий в различных дозах и с различной мощностью дозы, поскольку именно эти критические системы рассматриваются при обосновании допустимых уровней доз для космонавтов за полет.
Нами разработаны и представлены алгоритмы и результаты расчетов радиационного риска для космонавтов в процессе меж
590
планетных и орбитальных полетов для различной их продолжительности, толщины защиты космического аппарата, цикла солнечной активности, возраста космонавтов.
На основе разработанной модели радиационной скорости смертности млекопитающих, определяющей степень снижения компенсаторных резервов организма и увеличение возрастных коэффициентов смертности животных в зависимости от дозы и мощности дозы радиационного воздействия, впервые представлены алгоритмы и материалы расчетов дополнительного суммарного радиационного риска в течение всей жизни космонавтов, а также возможного сокращения продолжительности их жизни после завершения межпланетного и орбитальных полетов.
Представлены также численные значения канцерогенного радиационного риска, который оказался в несколько раз ниже расчетных значений суммарного радиационного риска. Проанализированы зависимости рисков указанных отдаленных последствий от продолжительности полетов, толщины защиты космического аппарата, цикла солнечной активности, возраста космонавтов.
С целью обоснования норм радиационной безопасности космических полетов в книге подробно рассмотрены данные экспериментальных исследований состояния центральной нервной системы (ЦНС) и сердечно-сосудистой системы (ССС) при облучениях в различных дозах, а также материалы длительных гигиенических обследований работников различных предприятий атомной промышленности и научно-исследовательских институтов, работа которых связана с использованием источников ионизирующих излучений. Рассмотрено состояние различных систем и особенно ЦНС и ССС в зависимости от длительности работы и величин поглощенных доз.
Серьезному анализу в зависимости от дозы и мощности дозы было подвергнуты также некоторые другие неблагоприятные отдаленные последствия, связанные с нарушениями в кроветворной системе, в системе обновления кожи, а также материалы о вероятности развития помутнения хрусталика и образования зрелых катаракт.
В настоящей книге убедительно показано, что радиационный риск в полете существенно (почти на порядок) меньше, чем суммарный радиационный риск в течение всей жизни космонавтов. Вследствие этого он не может выступать как определяющий в нормативах по радиационной безопасности космических полетов,
591
как это имело место в нормах (ГОСТ 25645.215-85 БРЭКАКП, 1985) для установления пределов доз в зависимости от длительности полета.
Подчеркнуто, что суммарный радиационный риск гибели в течение жизни, а также возможное сокращение средней предстоящей продолжительности жизни являются более подходящими критериями для обоснования допустимых уровней радиационного воздействия на космонавтов за их карьеру. При использовании этих критериев рассматривается максимальная опасность для космонавтов. Учитывая то, что суммарный радиационный риск в течение жизни является в несколько раз более высоким по абсолютной величине, чем риск развития опухолей, и практически не зависит от возраста космонавтов, этот критерий является более предпочтительным.
На основе вышеуказанных материалов коллективом сотрудников ГНЦ РФ-ИМБП РАН, ФГУ «Федеральный медицинский биофизический центр им. А.И. Бурназяна», ГНИИИ военной медицины МО России, ГПНИИЦ Радиационной безопасности космических объектов при нашем активном участии были разработаны и утверждены в 2004 г. Методические указания МУ 2.6.1.44-03-2004 «Ограничение облучения космонавтов при околоземных космических полетах». Эти нормативы предназначены для обеспечения радиационной безопасности космонавтов при осуществлении орбитальных полетов на МКС.
В книге представлены материалы о величинах суммарных эквивалентных доз за различными толщинами космического аппарата и предельных значений суммарного радиационного риска для космонавтов при осуществлении различных сценариев полета к Марсу с использованием жидкостных реактивных двигателей и ядерно-энергетических двигательных установок при длительностях полета от 600 до 720 суток. Кроме того, рассмотрен вариант более длительного полета к Марсу в течение 2-3 лет с использованием более безопасных и экономичных электрореактивных двигателей малой тяги. При этом кроме оценок величин доз от ГКЛ и СКЛ рассмотрены также дополнительно дозы от радиационных поясов Земли и вклад этого компонента в величину суммарного радиационного риска.
Нами представлены оптимальные толщины защиты космического корабля и предельно допустимые значения доз для космонавтов при полете к Марсу. Для обоснования норм радиационной
592
безопасности космонавтов проведены количественные расчеты суммарного радиационного риска и оценки возможного сокращения продолжительности жизни в результате осуществления нескольких длительных орбитальных полетов и после успешного завершения полета к Марсу. Для большей убедительности представленных предельных значений суммарного радиационного риска подробно рассмотрена концепция приемлемого риска.
Проведено сопоставление профессионального риска для космонавтов с рисками других профессий на Земле и рисками отказов, связанных с рядом других экологических и социальных факторов, действующих на население страны. Показано, что максимальным приемлемым уровнем для профессий с исключительно высоким уровнем риска может быть дополнительный уровень риска в пределах 10-15% от демографического риска, обусловленного состоянием здоровья населения страны в рассматриваемый период времени.
В заключение мы выражаем большую благодарность Коломенскому Александру Васильевичу за материалы расчетов поглощенных и эквивалентных доз от ГКЛ и СКЛ при межпланетных полетах за различными толщинами защиты в шаровом и антропоморфном фантомах, представляющих стандартизованную модель тела человека, а также расчетов доз от ГКЛ и РПЗ применительно к орбитальным полетам на станциях «Мир» и МКС. Эти расчеты были проведены им в рамках выполненных нами в 1996-2000 гг. тем по заданию Федерального управления «Мед-биоэкстрем» по расчетам радиационного риска и обоснованию норм для космонавтов при осуществлении длительных космических полетов.
Еще раз мы выражаем благодарность и признательность всем коллегам, принимавшим участие в исследованиях по программе «Хронического эксперимента», а также Невской Галине Федоровне и научным сотрудникам ее лаборатории: Абрамовой Галине Михайловне, Гинзбург Елене Викторовне, Скорик Алле Степановне, Каландаровой Марии Петровне и Юргову Всеволоду Васильевичу, с которыми совместно работали и проводили анализ результатов исследований эффективности локальной защиты различных участков тела собак в отношении снижения поражения организма при воздействии протонов высоких энергий.
593
Кроме того, мы выражаем благодарность Фарберу Юрию Владимировичу и Горлову Виктору Григорьевичу, принимавшим вместе с нами участие в экспериментальных работах по изучению комбинированного действия радиации и других физических факторов и исследованию характера развития радиационного поражения и восстановления организма при протяженных и повторных острых радиационных воздействиях на мелких лабораторных животных.
Мы также признательны Петрову Владиславу Михайловичу и коллегам возглавляемого им отдела, с которыми мы сотрудничали последние почти 20 лет в плане обеспечения радиационной безопасности космонавтов при осуществлении орбитальных космических полетов на станциях «Мир» и МКС.
ПЕРЕЧЕНЬ СОКРАЩЕНИЙ, УСЛОВНЫХ ОБОЗНАЧЕНИЙ И СИМВОЛОВ
ПКК — пилотируемый космический комплекс
МКС — международная космическая станция
КА — космический аппарат
КП — космический полет
ГКЛ — галактические космические лучи
РПЗ — радиационные пояса Земли
СКЛ — солнечные космические лучи
СПС — солнечные протонные события
СА — солнечная активность
ЖРД — жидкостной реактивный двигатель
ЯЭРДУ — ядерно-энергетическая двигательная установка
ОБЭ — относительная биологическая эффективность излучения
ЛПЭ — линейная передача энергии
Dtk — среднетканевая поглощенная доза излучения
®эф — эффективная остаточная доза излучения
Е — эффективная доза излучения
G — равноценная доза
КК — коэффициент качества излучения
КВ — коэффициент временной неравномерности радиационного воздействия
КР — коэффициент равноценности радиационного воздействия
КМ — коэффициент модификации радиационного ответа
Нт — эквивалентная доза
595
НБ — обобщенная доза излучения для характеристики ближайших эффектов
Но — обобщенная доза излучения для характеристики отдаленных эффектов
тзч — тяжелые заряженные частицы
МКРЗ — Международная комиссия по радиационной защите
НУР — нормативные уровни радиационного воздействия
БРЭКАКП — безопасность радиационная экипажей космических аппаратов в космическом полете
ЦНС — центральная нервная система
внд — высшая нервная деятельность
ССС — сердечно-сосудистая система
АГ — артериальная гипертензия
вед — вегетативно-сосудистая дистония
ДЭ — дисциркуляторная энцефалопатия дэм — демиелинизирующий энцефаломиелоз МИ — мозговой инсульт
нпнмк — начальные признаки недостаточности мозгового кровообращения
пдд — предельно допустимая доза
ХЛБ — хроническая лучевая болезнь
ЦА — церебральный атеросклероз
ЦВБ — цереброваскулярные болезни
НУР — нормативные уровни радиационного воздействия
ЛИТЕРАТУРА
Абрамова Ж.Н., Кузьминская Г.П., Чередниченко Л.К. Экспериментальные материалы к вопросу о повторном воздействии ионизирующей радиации // Труды научной сессии НИИ Гигиены труда и профзаболеваний 1957 г. Л.: АМН СССР, 1959. С. 28-33.
Абрамова Г.М. Радиобиологические принципы разработки локальной защиты: дисс. канд. мед. наук. М.: ИМБП М3 СССР, 1969.
Абросимова А.Н., Шафиркин А.В., Федоренко Б.С. Вероятность развития помутнений хрусталика и образования зрелых катаракт при действии излучений с различными значениями ЛПЭ // Авиакосмическая и экологическая медицина. 2000. Т. 34. №3. С. 33^11.
Авакян С.В., Вдовин А.И., Пустарнаков В.Ф. Ионизирующие и проникающие излучения в околоземном космическом пространстве: Справочник. СПб.: Гидроме-теоиздат, 1994. 501 с.
Авдюшин С.И., Переяслова Н.К., Свидский П.М., Малышев А.Б. Прогноз и диагностика потоков и спектров солнечных космических излучений // Космическая биология и авиакосмическая медицина. 1983. Т. 17. № 2. С. 86.
Аветисов Г.М. Закономерности поражения млекопитающих в условиях общих неравномерных лучевых воздействий: дисс. докт. биол. наук, М.: ИБФ М3 СССР, 1975.
Азизова Т.В., Сумина М.В., Мусаткова О.Б. О роли ионизирующих излучений в формировании церебрального атеросклероза у профессионалов радиационно-опасного производства. Материалы радиобиологического съезда. Киев, 20-25 сентября 1993 г., Пущино, ОНТИ НЦБИ, 1993. С. 11-12.
Азизова Т.В. Состояние нервной системы у лиц, подвергавшихся хроническому профессиональному воздействию ионизирующего излучения (35-45 лет наблюдения): дисс. канд. мед. наук. М.: ГНЦ РФ-ИБФ, 1999.
Айтмагометов М.Т., Деев А.И., Владимирова Ю.А. Увеличение доступности белковых флюорофоров хрусталика мышей для воды при развитии радиационной катаракты // Бюлл. экспер. биол. и мед. 1991. Т. 111. № 4. С. 367-369.
Акатов Ю.А., Архангельский В.В., Петров В.М. Индивидуальные дозы космонавтов на орбитальной станции «Мир» за период ее функционирования. Материалы XI конференции по космической биологии и авиакосмической медицине, 22-26 июня 1998. М., 1998. Т. 1. С. 15.
Акоев И.Г. Проблемы постлучевого восстановления. М.: Атомиздат, 1970.
Акоев И.Г. Теоретические и количественные аспекты радиационного поражения организма// Современные проблемы радиобиологии Т. 5. М.: Атомиздат, 1976. С. 190-246.
Акоев И.Г., Максимов Г.К., Тяжелова В.Г. Количественные закономерности радиационного синдрома. М.: Энергоатомиздат, 1981.
Александров С.Н. Вопросы отдаленной лучевой паталогии // Современные проблемы радиобиологии. Радиационное поражение организма. М.: Атомиздат, 1976. С. 162-189.
Александров С.Н. Патогенез сокращения продолжительности жизни облученных биологических объектов // Современные проблемы радиобиологии. Т. 7. М.: Атомиздат, 1978. С. 192-207.
597
Амосов И.С. Дегтярев В.А., Морозова Т.Г. и др. Микроангиографические данные о ближайших и отдаленных изменениях мелких кровеносных сосудов кожи в процессе заживления радиационных ран у крыс. В кн: Материалы Всесоюзной конференции «Отдаленные последствия и оценка риска воздействия радиации». М., 197. С. 46-47.
Андреев Е.М., Добровольская В.М. Об одном методе изучения кривых дожития // Продолжительность жизни: анализ и моделирование. М.: Статистика, 1979. С. 80-103.
Антипенко Д.Б. Влияние хронического гамма-облучения на липидный обмен в сыворотке крови собак. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 117-118.
Антипов В.В., Добров Н.Н., Саксонов П..Основные направления в исследовании биологического действия космической радиации и изысканий средств противолучевой защиты // Проблемы космической биологии. М.: Наука, 1964. Т. 3. С. 113-124.
Антипов В.В., Коноплянников А.Г., Кудряшов Ю.Б., Тарусов Б.Н. Относительная биологическая эффективность и картина лучевого поражения при действии ионизирующих излучений с различной величиной линейной потери энергии // Проблемы космической биологии. Т. 6. М.: Наука, 1967. С. 381-391
Антипов В.В. и др. О комбинированном действии различных факторов полета // Основы космической биологии и медицины. М.: Наука, 1975. Т. 2. Кн. 2. С. 244-256.
Антипов В.В., Давыдов Б.И., Ушаков И.Б., Федоров В.П. Действие факторов космического полета на центральную нервную систему: структурно-функциональные аспекты радиомодифицирующего влияния. Л.: Наука, 1989. — 328 с.
Ахунов А.А. Данные биохимических исследований сыворотки крови у собак при хроническом действии ионизирующей радиации. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак» 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 115-116.
Ахунов А.А. Изменение содержания сахара в крови у собак при 6-летнем хроническом гамма-облучении // Космическая биология и авиакосмическая медицина. 1978а. Т. 12. № 5. С. 35-39.
Ахунов А.А. Изменение активности аминотрансфераз и альдолазы в сыворотке крови собак при 6-летнем хроническом и сочетанном гамма-облучении И Радиобиология. 19786. Т. 18. № 3. С. 423-426.
Багдасаров А.А., Альперин П.М., Родина Р.И. Тезисы доклада 7-го Всесоюзного съезда рентгенологов и радиологов. Саратов, 1958. С. 6-7.
Багдасаров А.А., Альперин П.М., Касаткин Е.В., Родина Р.И. Признаки некоторых функциональных отклонений у работников рентгеновских учреждений // Клиническая медицина. 1959. № 4. С. 19-25.
Баевский Р.М. Прогнозирование состояний на грани нормы и патологии. М., 1979. С. 30-45.
Байсоголов Г.Д., Гуськова А.К. // Медицинская радиология. 1966. Т. 11. № 6. С. 37-39.
Балмуханов С.Б. Сосудистые реакции при лучевой терапии. Алма-Ата. Из-во АН Каз. СССР, 1962.
Балуда В.П., Дорофеев В.М., Хныщев С.С. и др. Повышение радиоустойчивости собак при физической защите небольшого участка костного мозга малоактивного в функциональном отношении // Вопросы радиобиологического и биологического действия цитостатических препаратов. Томск, 1973. Т. 5. С. 20-22.
598
Баранов А.Е., Петросян Л.Н., Пяткин Е.К. и др. Случай острой лучевой болезни, развившейся после острого равномерного гамма — облучения (Со-60) // Медицинская радиология. 1977. Т. 22. С. 48-55.
Барбичев М.С., Казанцева Н.А., Гусева Л.И. Поздние лучевые повреждения кожи и подлежащих тканей при лечении онкологических больных // Вопросы онкологии 1980. Т. 26. № 8. С. 59-62.
Бейли Н. Математика в биологии и медицине. М.: Мир, 1970.
Белоусова О.И., Трушина М.Н. Количественные изменения различных клеточных генераций костного мозга собак после однократного общего гамма — облучения // Радиобиология, 1974. Т. 14. № 4. С. 531-535.
Бенгин В.В., Петров В.М., Шуршаков В.А. Учет эффектов западно-восточной асимметрии потоков протонов в области Бразильской магнитной аномалии // Космические исследования. 1993. Т. 38. № 4. С. 82- 86.
Берикашвили В.Ш. Расчет режима облучения при экспериментальном моделировании хронических профессиональных облучений // Радиобиология. 1975. Т. 15. Вып. 4. С. 44-49.
Беспалова Л.А. Ультраструктурные изменения миокарда собак, находящихся в условиях хронического облучения. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак». 16-20 октября 1972 г. Истра. ИМБП М3 СССР, 1972. С. 147-150.
Биологическое действие протонов высоких энергий. М.: Атомиздат, 1967. 506 с.
Блэр X. Формулировка взаимосвязи между дозой облучения и сокращением продолжительности жизни // Материалы международной конференции по мирному использованию атомной энергии. Т. II. М.: Медгиз, 1958. С. 147-149.
Бобков В.Г., Демин В.П., Кеирим-Маркус И.Б. и др., Радиационная безопасность при космических полетах. М.: Атомиздат, 1964.
Богатырев А.В., Свердлов А.Г., Кавукчан Т.В. Благоприятный эффект при экранировании костного сустава собак при рентгеновском облучении // Радиобиология. 1970. Т. 11. № 5. С 766-768.
Богомолов А.В. и др. Измерение потоков и спектров нейтронов с энергиями 20-400 МэВ в эксперименте на орбитальном комплексе «Салют-7» — «Космос-1686» // Космические исследования. 1995 Т. 33. № 3. С. 248-253.
Болеславски Лех Когортные таблицы продолжительности жизни // Изучение продолжительности жизни М.:Статистика, 1977. С. 12-38.
Бонд В., Флиднер Т., Аршамбо Д. Радиационная гибель млекопитающих М.: Атомиздат, 1971.
Бонд В. Радиационная гибель животных различных видов // Сравнительная клеточная и видовая радиочувствительность. М.: Атомиздат, 1974. С. 5-17.
Бондаренко В.А., Митрикас В.Г., Цетлин В.В. Вариации солнечной активности и радиационная обстановка на космической станции «Мир» в период 1986— 1994 г. // Авиакосмическая и экологическая медицина, 1995. Т. 29. № 6. С. 64—68.
Бондаренко В.А. Оценка радиационных нагрузок на космонавтов МКС с использованием геометрической модели тела человека. Автор, дисс. канд. техн. наук. М.: ГНЦ РФ-ИМБП РАН, 2007.
Борисов В.А. и др. Население мира. Демографический справочник. М.: Мысль, 1989.
Брагина В.А., Кирсанова Г.И. Лечение камерными ванными с эмульсией нафталана нарушений периферического кровообращения у лиц, подвергавшихся хроническому воздействию ионизирующей радиации // Гигиена труда и проф. заболевания. 1968. № 1.С. 43—45.
599
Бриллиант М.Д., Воробьев А.И., Баранов А.Е. Патогенез цитопенического синдрома при миелотоксических воздействиях // Новое в гематологии. М.: Медицина, 1974. С. 37-49.
Бузини П.А., Калашников Б.П. Влияние хронического непрерывного действия ионизирующей радиации на возникновение лучевых повреждений глаз у экспериментальных животных // Вопросы радиобиологии и клинической радиологии, 1965. Т. 5. С. 54-79.
Быстрова Ю.А. Лучевые и старческие катаракты при рентгенотерапии опухолей кожи лица и век // Вопросы клинической радиологии. Л., 1960. С. 244-252.
Ванников Л.Л. Отдаленные последствия поражений, вызванных воздействием ионизирующих излучений. М.: Медицина, 1959. С. 138- 145.
Волкова К.В. Состояние хрусталика и других структур глаза животных при условии ежедневного общего рентгеновского облучения в малых дозах в течение ряда лет // «Сб. рефератов по радиационной медицине за 1957г» М.: Медгиз, 1959. Т. 1.С. 149-151.
Воробьев Е.И. Радиационная кардиология. М.: Атомиздат 1971.
Воробьев А.И., Бриллиант М.Д., Баранов А.Е. Два случая острой лучевой болезни тяжелой степени // «Терапевтический Архив». 1973. Т. 45. № 9. С. 85-93.
Воробьев А.И., Бриллиант М.Д., Чертков И.Л. Классификация лейкозов в свете современной схемы кроветворения // Новое в гематологии. М.: Медицина, 1974. С. 3-21.
Воробьев Е.И., Степанов Р.П. Ионизирующие излучения и кровеносные сосуды. М.: Энергоатомиздат, 1985.
Ворожцова С.В. Радиобиологические эффекты в клетках эпителия роговицы при воздействии протонов и тяжелых ионов. Автореф. дисс. канд. биол. наук. М.: ИМБП М3 СССР, 1973
Ворожцова С.В., Шафиркин А.В., Федоренко Б.С Относительная биологическая эффективность ускоренных тяжелых ионов и быстрых нейтронов на основе изучения частоты аберрантных митозов эпителия роговицы // Авиакосмическая и экологическая медицина. 2006. Т. 40. № 3. С. 42-49.
Вороновская В.И., Чайка Г.В., Халявка И.Г., Дубровина Г.В. Состояние психофизиологических функций у участников ликвидации последствий аварии на Чернобыльской АЭС. Материалы Международной конференции «Актуальные и прогнозируемые нарушения психического здоровья после ядерной катастрофы в Чернобыле» 24-28 мая 1995 г. Киев. 1995. С. 44.
Волохова Н.А. Об индивидуальной чувствительности собак к лучевому воздействию // Медицинская радиология. 1964. Т. 9. № 11. С. 40-45.
Временные нормы радиационной безопасности при космических полетах (ВНРБ-75) М.: Минздрав СССР, 1976.
Гаврилов В.А. Патоморфология сосудов внутренних органов собак при хроническом облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 151- 154.
Гиммельфарб А.А., Гинзбург Л.Г. Полуэктов Р.А. и др. Динамическая теория биологических популяций / Под ред. Р.А. Полуэктова. М.: Наука, 1974.
Гладилкин А.Н., Игнатов И.В., Кузин Р.А. и др., Гамма-установки для радиобиологических исследований. М.: Энергоиздат, 1981.
Глазунов И.С., Благовещенская В.В. Отдаленные последствия острой лучевой болезни. // Журнал невропатологии и психиатрии имени С.С. Корсакова. 1968. Т. 68. №8. С. 1129-1134.
600
Глазунов И.С., Благовещенская В.В., Мартынова Г.Н. Клинико-физиологические методы исследования астенического синдрома у лиц, контактирующих с ионизирующим излучением // Журнал невропатологии и психиатрии им. С.С. Корсакова. 1969. Т. 69. № 5. С. 667- 673.
Глазунов И.С. и др. Методические возможности объективизации астенического синдрома при воздействии малых доз ионизирующей радиации // Действие малых доз ионизирующей радиации на центральную нервную систему. Минск, 1971. С. 48-54.
Глушко В.П., Семенов Ю.П., Горшков Л.А. «Дорога к Марсу» // Газета «Правда». 1988. № 145.
Гозенбук В.Л., Кеирим-Маркус И.Б. Дозиметрические критерии тяжести острого облучения человека. М.: Энергоатомиздат, 1988.
Головченко Ю.И. Радиобиологические аспекты ускоренного старения по данным церебральной гемодинамики // Материалы радиобиологического съезда. Киев, 20-25 сентября 1993 г., Пущино, ОНТИ НЦБИ, 1993. С. 235-236.
Голодец Р.Г. Астенические состояния при хроническом воздействии ионизирующего излучения. Клиника, патогенез, терапия: дисс. докт. мед. наук М.: 1963.
Голощапов П.В., Бойцова В.П., Воробьева М.И. Анализ сокращения продолжительности жизни в эксперименте с хроническим внешним гамма-облучением. Структура смертности // Радиобиология. 1987. Т. 27. В. 4. С. 497-500.
Горизонтов П.Д. Патологическая физиология лучевых поражений // Радиационная медицина / под ред. А.И. Бурназяна М.: Атомиздат, 1968. С. 133-220.
Горизонтов П.Д. Механизмы радиационного поражения и восстановления // Патологическая физиология и экспериментальная терапия. 1977. С. 14-23. -
Горизонтов П.Д., Белоусова О.И., Федотова М.И. Стресс и система крови. М.: Медицина, 1983.
Горлов В.Г. Материалы к количественной оценке процессов восстановления после тотального и локального гамма-облучения крыс. Автореф. канд. дисс. М.: ИБФ М3 СССР, 1967.
Горлов В.Г., Шафиркин А.В., Попов В.И. и др. Формирование эффективной дозы при хроническом воздействии радиации с различной мощностью дозы // Теоретические предпосылки и модели процессов радиационного поражения систем организма. Пущино, ОНТИ НЦБИ АН СССР, 1975. С. 86-94.
Горлов В.Г. Радиорезистентность и процессы восстановления после однократных, фракционированных, протяженных и хронических лучевых воздействий: дисс. докт. мед. наук М.: ИМБП М3 СССР, 1981.
Горшков Л.А. Миссия выполнима // «Московия». 2006. № 10.
ГОСТ 25645.122-85 Безопасность радиационная экипажа космического аппарата в космическом полете (БРЭКАКП). Протоны галактических космических лучей, энергетические спектры. М.: Госстандарт СССР, 1986.
ГОСТ 25645.123-85 БРЭКАКП. Энергетические спектры, ядра гелия. М.: Госстандарт СССР, 1986.
ГОСТ 25645.124-85 БРЭКАКП. Группа средних ядер. Энергетические спектры. М.: Госстандарт СССР, 1986.
ГОСТ 25645. 134-86 БРЭКАКП. Лучи космические солнечные. Модель потоков протонов. М.: Госстандарт СССР, 1986.
ГОСТ 25645.138-86. БРЭКАКП. Пояса Земли радиационные естественные. Пространственно-энергетические характеристики плотности потока протонов. М.: Госстандарт СССР, 1986.
601
ГОСТ 25645.139-86. БРЭКАКП. Пояса Земли радиационные естественные. Пространственно-энергетические характеристики плотности потока электронов. М.: Госстандарт СССР, 1986.
ГОСТ 25645.144-88 БРЭКАКП. Группы легких, тяжелых и очень тяжелых ядер ГКЛ. М.: Госстандарт СССР, 1989.
ГОСТ 25645.150-90. БРЭКАКП. Лучи космические галактические. Модель изменения потоков частиц. М.: Госстандарт СССР, 1991.
ГОСТ 25645. 201-83. БРЭКАКП. Термины и определения. М.: Госстандарт СССР, 1984.
ГОСТ 25645.203-83. БРЭКАКП. Модель тела человека для расчета тканевой дозы. М.: Госстандарт СССР, 1984.
ГОСТ 25645.204-83. БРЭКАКП. Методика расчета экранированное™ точек внутри фантома. М.: Госстандарт СССР, 1984.
ГОСТ 25645.212-85 БРЭКАКП. Характеристики ядерных взаимодействий многозарядных ионов. М.: Госстандарт СССР, 1986.
ГОСТ 25645.214-85 БРЭКАКП. Модель обобщенного радиобиологического эффекта. М.: Госстандарт СССР, 1986.
ГОСТ 25645.215-85 БРЭКАКП. Нормы безопасности при продолжительности полетов до трех лет. М.: Госстандарт СССР, 1986.
ГОСТ 25645.218-90. БРЭКАКП. Зависимость коэффициента качества космических излучений от линейной энергии. М.: Госстандарт СССР, 1991.
ГОСТ 25645.219-90 БРЭКАКП. Модель учета влияния пространственной неравномерности радиационного воздействия на обобщенный радиобиоло-гический эффект. М.: Госстандарт СССР, 1991.
Григорьев А.И., Баевский Р.М. Концепция здоровья и проблема нормы в космической медицине М.: ГНЦ РФ-ИМБП, 2001. 93 с.
Григорьев Ю.Г. Материалы к изучению реакций центральной нервной системы человека на проникающее излучение М.: Медицина, 1958.
Григорьев Ю.Г. Лучевые поражения и компенсация нарушенных функций. М.: Атомиздат, 1963.
Григорьев Ю.Г., Гуськова А.К., Домшлак М.П. и др. Проблема обоснования допустимых доз ионизирующей радиации на членов экипажа космических кораблей. Материалы 16 Международного астронавтического конгресса. Афины, 13-18 сентября 1965г. М.: М3 СССР, 1965. С. 1-14.
Григорьев Ю.Г., Раевская С.А., Аврунина Г.А. Некоторые подходы к обоснованию величин допустимых доз для космонавтов при длительных космических полетах // Радиобиология, 1970. Т. 10. № 2. С. 294-299.
Григорьев Ю.Г., Фарбер Ю.В., Волохова Н.А. Вестибулярные реакции. Методы исследования и влияние различных факторов внешней среды. М.: Медицина, 1970.
Григорьев Ю.Г., Рыжов Н.И., Ворожцова С.В. и др. Цитогенетическое действие ускоренных ионов углерода и бора на клетки эпителия роговицы мышей. // Радиобиология. 1971. Т. 11. Вып. 6. С. 835-840.
Григорьев Ю.Г. Радиационная безопасность космических полетов. М.: Атомиздат, 1975.
Григорьев Ю.Г., Тобайес К. Ионизирующие излучения // Основы космической биологии и медицины Т. И. М.: Наука, 1975. С. 79-136.
Григорьев Ю.Г., Каландарова М.П., Попов В.И. и др. Закономерности развития поражения и восстановления в гемопоэтической системе собак при повторных воздействиях радиации // Теоретические предпосылки и модели процессов ра
602
диационного поражения систем организма. Пущино: ОНТИ НЦБИ АН СССР, 1975. С. 75-85.
Григорьев Ю.Г. Космическая радиобиология. М.:Энергоатомиздат, 1982.
Григорьев Ю.Г., Попов В.И., Шафиркин А.В., Антипенко Ж.Б. Соматические эффекты хронического гамма-облучения. М.: Энергоатомиздат, 1986
Груздев Г.П. Проблема поражения кроветворной ткани при острой лучевой болезни М.: Медицина, 1968.
Груздев Г.П. Острый радиационный костномозговой синдром М.: Медицина, 1988.
Губин А.Т., Минаев Ю.Л., Сакович В.А. Биофизические основы действия космической радиации и излучений ускорителей. Проблемы космической биологии. Т. 60. Л.: Наука, 1989. С. 198-228.
Губин А.Т., Сакович В.А., Шафиркин А.В. Математическая модель изменения кле-точности костного мозга при радиационных воздействиях // Радиационная биология и радиоэкология. 1995. Т. 35. № 6. С. 889-897.
Гуськова А.К., Юрков Н.Н., Кирюшкин В.И. К вопросу о компенсаторных реакциях при недостаточности мозгового кровообращения // Журнал невропатологии и психиатрии им. С.С. Корсакова. 1961. № 10. С. 1457-1462.
Гуськова А.К., Ларионова И.К. К вопросу о патогенезе болевого синдрома при хронической недостаточности периферического кровообращения // Журнал невропатологии и психиатрии им. С.С. Корсакова. 1963. № 5. С. 708-713.
Гуськова А.К. и др. Условия труда и состояние здоровья работающих в объединенном институте ядерных исследований. // Гигиена труда и профзаболеваний. 1966. Т. 10. № 1. С. 5-11.
Гуськова А.К., Понизовская А.И., Денисова Е.А. и др. Некоторые данные клинико-физиологического наблюдения за людьми, работающими на ускорителях // Биологическое действие протонов высоких энергий. М.: Атомиздат, 1967. С. 373-401.
Гуськова А.К., Байсоголов Г.Д. Лучевая болезнь человека. М.: Медицина, 1971.
Гуськова А.К., Барабанова А.В., Кирсанова Г.И., Лосев А.А. Изменения в нервной системе при профессиональном воздействии ионизирующей радиации // Действие малых доз ионизирующей радиации на центральную нервную систему. Минск, 1971. С. 27-34.
Гуськова А.К., Денисова Е.А., Чернига Г.В. и др. Основные итоги и задачи организации медицинского наблюдения за работающими с источниками излучений // Медицинская радиология. 1977. № 7. С. 5-15.
Гуськова А.К. Использование данных медицинского наблюдения за работающими с источниками ионизирующего излучения для обоснования «риска» профессионального облучения // Медицинская радиология. 1980. Т. 25. №11. С. 41-45.
Гуськова А.К. Современные проблемы клинической радиационной медицины // Клиническая медицина. 1992. Т. 20. № 2. С. 3-7.
Давыдов Б.И. Переносимость экстремального ускорения после воздействия ионизирующей радиации. Доклад АН СССР, 1966. Т. 168. № 3. С. 691-694.
Давыдов Б.И., Антипов В.В., Саксонов П.П. Обоснование допустимых доз облучения при планировании космических полетов // Космические исследования. 1968. Т. 6. №3. С. 450-470.
Давыдов Б.И., Тихончук В.С., Антипов В.В. Биологическое действие, нормирование и защита от электромагнитных излучений. М.: Энергоатомиздат, 1984.
Давыдов Б.И., Ушаков И.Б. Ионизирующие излучения и мозг: поведенческие и структурно-функциональные паттерны // Итоги науки и техники. Радиационная биология. Т. 8. М., 1987.
603
Даренская Н.Г. и др., ОБЭ протонов больших энергий И Вопросы общей радиобиологии. М.: Атомиздат, 1966. С. 235-241.
Даренская Н.Г., Кознова Л.Б., Акоев И.Г., Невская Г.Ф. Относительная биологическая эффективность излучений. Фактор времени облучения. М.: Атомиздат, 1968.
Даренская Н.Г. Сопоставление зависимости доза-эффект для разных видов животных и значение этих данных для радиобиологии человека// Радиобиологический эксперимент и человек. М.: Атомиздат, 1970. С. 50-62.
Даренская Н.Г., Горлов В.Г. Видовые различия в скорости восстановления // Вопросы общей радиобиологии. М.: Атомиздат, 1971. С. 225-232.
Деев А.И., Асейчев А.В., Ситарчук И.А. и др. Физико-химические изменения в хрусталике мышей на ранних стадиях катарактогенеза, индуцированного общим гамма-облучением. Материалы 3 Съезда по радиационным исследованиям. Москва 14-17 октября 1997. Пущино, 1997. Т. 1. С. 114
Демографические перспективы России М.: Госкомстат России, 1993. С. 60-65.
Демографический ежегодник СССР 1990. М.: Финансы и статистика, 1990.
Денисова Е.А. Скорость распространения пульсовой волны как метод оценки функционального состояния сердечно-сосудистой системы у людей при хроническом лучевом воздействии // Медицинская радиология. 1962. Т. 7. № 10. С. 28
Денисова Е.А. Состояние сердечно-сосудистой системы при хроническом лучевом воздействии в профессиональных условиях. Автореф. дисс. докт. мед. наук. М., 1970.
Демин В.П., Долгопятов А.М., Ковалев Е.Е. и др. Обеспечение радиационной безопасности экипажа марсианского экспедиционного комплекса // Ракетно-космические двигатели и энергетические установки. Вып. 3. М.: НИИТП им. М.В. Келдыша, 1993. С. 172-176.
Демин В.П. и др. Модель защищенности орбитальной станции «МИР» Доклад на VI научной конференции по защите от ионизирующих излучений ФТИ. Обнинск, 1994.
Джикидзе Э.К. Инфекционные осложнения и состояние иммуногенеза у обезьян при длительном облучении. Материалы Всесоюзного симпозиума «Патогенез, клиника, лечение острой лучевой болезни в опытах на обезьянах». Сухуми, Алашара, 1964. С. 62-76.
Джикидзе Э.К., Косиченко Л.П., Куксова М.И. Морфологические и цитогенетические изменения в костном мозге обезьян в отдаленные сроки после хронического облучения в малых дозах // Радиобиология. 1980. Т. 20. № 2. С. 281-284.
Дозовые зависимости нестохастических эффектов, основные концепции и величины, используемые в МКРЗ / пер. с англ. М.: Энергоатомиздат, 1987.
Домшлак М.П., Григорьев Ю.Г., Даренская Н.Г. и др. Отдаленные наблюдения за людьми, подвергавшимися лучевой терапии // Медицинская радиология. 1962. Т. 7. №1. С. 10-15.
Домшлак М.П., Даренская Н.Г., Терещенко Н.Я. Динамика наблюдения радиационной патологии у людей в отдаленные сроки после лучевой терапии // Отдаленные последствия лучевых поражений. М.: Атомиздат, 1971. С. 88-92.
Дорман Л.И. Экспериментальные и теоретические основы астрофизики космических лучей. М.: Наука, 1975.
Дудкин В.Е., Ковалев Е.Е., Коломенский А.В., Сакович В.А. Оценки массы радиационного убежища при пилотируемом полете к Марсу. Материалы V Всесоюзной научной конференции по защите от ионизирующих излучений ядерно-тех-нических установок. Протвино, 1989. С. 190.
604
Дудкин В.Е., Ковалев Е.Е., Коломенский А.В.и др. Оценки радиационной защиты при пилотируемом полете к Марсу // Атомная энергия. 1991. Т. 1. № 4. С. 351-353.
Дудкин В.Е., Мелкумян Л.В., Плющев В.А., Потапов Ю.В. Энергетические спектры быстрых и промежуточных нейтронов на ОПС «Мир». Доклад на международной конференции «Радиационная обстановка в космосе. Эмпирические и физические модели». Дубна, 1993 июнь.
Дудкин В.Е., Потапов Ю.В., Лягушин В.И. и др. Сравнение результатов измерений энергетических спектров нейтронов на орбитальном комплексе «Мир» Материалы XI конференции по космической биологии и авиакосмической медицине, 22-26 июня 1998 г. М.: 1998. Т. 1. С. 246-247.
Дудкин В.Е., Коломенский А.В., Крючков В.П., Сакович В.А. Радиационная защита экипажа пилотируемой экспедиции на Марс. Предварительный проект пилотируемой экспедиции на Марс. Т. 12. Ч. 5. Проект МНТЦ № 1172. М.: Центр М.В. Келдыша, 2000.
Дэвидсон Г.О. Биологические последствия общего гамма-облучения человека. М.: Атомиздат, 1960.
Ежегодник мировой санитарной статистики 1969. ВОЗ, Женева, 1970.
Ежегодник мировой санитарной статистики 1988. ВОЗ, Женева, 1990.
Ежегодник мировой санитарной статистики 1992. ВОЗ, Женева, 1994.
Ефимов В.И., Разговоров Б.Л., Сычков М.А. и др. В материалах VI Всесоюзной конференции «Восстановительные и компенсаторные процессы при лучевых поражениях». Л.: ЦНИРРИ, 1973. С. 48.
Жданова О.М. Изменение состава периферической крови у экспериментальных животных под влиянием магнитного поля в сочетании с радиацией. Труды НИИ рентгенологии, радиобиологии и онкологии. Баку, 1972. Т. 9. С. 299-301.
Жербин Е.А. и др. Действие гамма-лучей и быстрых нейтронов на монослойные культуры костного мозга человека// Медицинская радиология. 1978. Т. 23. № 8. С. 53-57.
Жмуркин В.П., Денисова Е.А., Кирсанова Г.И., Львовская Э.Н. К характеристике сосудистой дистонии у лиц, подвергающихся хроническому лучевому воздействию // Терапевтический архив, 1965. Т. 37. № 2. С. 46-50.
Задорожный Б.А., Звягинцева М.В. Лучевые поражения кожи. Киев: Здоровья, 1966. — 175 с.
Заликина Ж.Г. Поражение гонад при протяженных и хронических лучевых воздействиях. Автор, дисс. канд. мед. наук. М.: ИМБП Минздрава СССР, 1977.
Запольская Н.А. Федорова А.В., Лаврентьев Л.Н. и др. Влияние длительного хронического внешнего гамма-облучения на организм животного. М.: Атомиздат, 1976. С. 3-19.
Защита работников от ионизирующих излучений / пер. с англ. Л.Б. Прохоровой М.: Иностранная лит-ра, 1958.
Зедгенидзе Г.А., Ткачева Г.А. Отдаленные биологические эффекты ионизирующего излучения // Медицинская радиология. 1980. Т. 25. № 1. С. 78-85.
Зиль М.В., Коломенский А.В., Петров В.М. Ослабление дозы солнечных космических лучей геомагнитным полем // Космические исследования. 1986. Т. 24. № 6. С. 944-947.
Зубенкова Э.С. Система обновления гранулоцитов у собак, подвергнутых длительному действию радиации. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 43-46.
605
Зуева В.А. Исследование некоторых показателей иммунологической реактивности собак при воздействии гамма-лучей 60 Со в течение 3 лет. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 83-86.
Зуева В.А. Влияние хронического гамма-облучения на развитие аутоиммунной реакции и антиинфекционную устойчивость организма. Автореф. дисс. канд. мед. наук. М.: ИБФ М3 СССР, 1978.
Зухбая Т.М. Митотическая активность гемопоэтических клеток костного мозга собак при длительном гамма-облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972а. С. 99-102.
Зухбая Т.М. Изменения хромосом, видимых в анафазе клеток костного мозга собак при хроническом гамма-облучении с различной мощностью дозы. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 19726. С. 105-108.
Зухбая Т.М. Количественные изменения отдельных генераций клеток эритроидного и гранулопоэтического ростков в костном мозге крыс при постоянном гамма-облучении с различной мощностью дозы // Радиобиология. 1979. Т. 19. № 2. С. 278-282.
Зяблицкий В.М., Хныщев С.С., Жаворонков Л.П. и др. Радиозащитный эффект экранирования костного мозга различной функциональной активности // Медицинская радиология. 1978. Т. 23. № 3. С. 37-41.
Иванов А.Е., Куршакова Н.Н., Шиходыров В.В. Патологическая анатомия лучевой болезни. М.: Медицина, 1981.
Иванов В.К., Максютов М.А., Чекин С.Ю. и др. Радиационно-эпидемиологический анализ неонкологической заболеваемости ликвидаторов чернобыльской катастрофы // Радиация и риск. 2001. № 12. С. 82-98.
Изергина А.Г. Реакция собак на физическую нагрузку при хроническом гамма-облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 67-69.
Илюхин А.В., Бурковская Т.Е., Путилов Б.С. Цитокинетические механизмы поражения и компенсации кроветворения при длительном гамма-облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 39-42.
Илюхин А.В., Зубенкова Э.С., Кахетелидзе М.Г. Лейкопоэз // Нормальное кроветворение и его регуляция / Под ред. Н.А.Федорова. М.: Медицина, 1976. С. 458-488.
Илюхин А.В., Шашков В.С., Бурковская Т.Е. и др. Цитокинетика и морфология кроветворения при хроническом облучении. М.: Энергоиздат, 1982.
Ионизирующее излучение: источники и биологические эффекты. Т. II. НКДАР ООН. Нью Йорк, 1982.
Источники и эффекты ионизирующих излучений. Отчет НКДАР ООН-2000. Т. 1. М.: РАДЭКОН, 2002.
Кабаченко А.Н. Катарактогенная эффективность протонов различных энергий. Дисс. канд. биол. наук. М.: ИМБП М3 СССР, 1974.
Каландарова М.П. Состояние кроветворения у собак при облучении протонами высоких энергий в условиях экранирования различных частей тела: дисс. канд. мед. наук. М.: ИМБП М3 СССР, 1970.
606
Каландарова М.П. Кроветворение при лучевом воздействии с различным пространственным и временным распределением доз: дисс. докт. мед. наук. М.: ИМБП М3 СССР, 1988.
Кардаш А.Ю. К построению имитационной модели дожития реального поколения // Продолжительность жизни: анализ и моделирование. М.: Статистика, 1979. С.124—147.
Карповский А.Л., Федоренко Б.С., Рыжов Н.И., Смирнова О.А. Повреждение нейронов коры головного мозга крыс после воздействия протонов различных энергий // Радиобиология. 1981. Т. 21. № 3. С. 384-389.
Карповский А.Л., Федоренко Б.С., Рыжов Н.И., Смирнова О.А. Цитоморфологиче-ские повреждения нейронов коры головного мозга крыс в отдаленные сроки после облучения нейтронами и ТЗЧ // Биологические эффекты малых доз радиации. М., 1983. С. 39-40.
Карповский А.Л. Медленная прогрессирующая лучевая болезнь в центральной нервной системе. ОИЯИ. Препринт Р 19-85-342. Дубна, 1985.
Качанова Е.М., Солдатова В.А., Смирнова М.И. Мозговой кровоток и центральная гемодинамика в отдаленном периоде хронической лучевой болезни // Медицинская радиология. 1981. Т. 26. № 7. С. 72-75.
Кирсанова Г.И. Клинико-физиологическая характеристика состояния церебрального кровообращения при профессиональном воздействии ионизирующих излучений: дисс. канд.мед. наук. М., 1968.
Киселев П.Н., Бузини П.А., Никитина К.И. Иммунологический анализ состояния повышенной резистентности организма к ионизирующим излучениям // Медицинская радиология. 1956. Т. 1. № 1. С. 43-48.
Клемпарская Н.Н. Аутофлора как тест клинического изучения иммунобиологической реактивности лучевых повреждений. // Медицинская радиология. 1966. Т. 2. №2. С. 85-91.
Клестова О.В., Сильченко Н.И., Пушницина А.Д., Станжевская Т.П. Расселение клеток костного мозга при субтотальном облучении собак // Актуальные вопросы клинической и экспериментальной рентгенологии и радиологии. Л.: Медицина, 1977. С. 35-36.
Ковалев Е.Е., Коломенский А.В., Сакович В.А., Смиренный Д.Н., Степнов В.Д. Защита экипажей межпланетных кораблей с двигателями малой тяги от протонов радиационного пояса Земли // Вопросы дозиметрии и защиты от излучений. М.: Атомиздат. 1969. Вып. 9. С. 122-128.
Ковалев Е.Е. Радиационный риск на земле и в космосе. М.: Атомиздат, 1976.
Ковалев И.Ф. Патогенез лучевых катаракт: дисс. докт. мед. наук. Одесса, 1967.
Козлова А.В., Воробьев Е.И. Клиника и лечение повреждений, возникающих при взрыве атомной бомбы. М.: Медгиз, 1956.
Козлова А.В. Осложнения при лучевой терапии доброкачественных и злокачественных опухолей и неопухолевых заболеваний // Медицинская радиология. 1962. Т. 7. №2. С. 58-63.
Кознова Л.Б. К вопросу о биологическом действии протяженных облучений с постоянной и переменной мощностями доз // Вопросы общей радиобиологии. М.: Атомиздат, 1971. С. 154—165.
Колмогорова Л.А. К вопросу о механизмах нарушения эритропоэза при длительном фракционированном рентгеновском облучении: Автореф. дисс. канд. мед. наук. Томск, 1980.
Коломенский А.В. Характеристики поля излучений в космосе // Проблемы космической биологии. Т. 60 / Под ред. А.М. Уголева, Ленинград: Наука, 1989. С. 122-125.
607
Коломенский А.В., Петров В.М., Шафиркин А.В. Методика оценки радиационных воздействий на космонавтов по показаниям штатного дозиметра при орбитальном полете // Авиакосмическая и экологическая медицина. 1998. Т. 32. № 4. С. 44-49.
Кондратенко В.Г., Федорова Н.Л. Реакция семенников собак на хроническое гамма-облучение. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 91-94.
Кондратенко В.Г., Ганзенко Л.Ф. Действие малых доз радиации на сперматогенез // Радиобиология. 1975. Т. 15. № 6. С. 861-865.
Кондратенко В.Г. Действие ионизирующей радиации на семенники млекопитающих // Успехи современной биологии. 1977. Т. 83. № 2. С. 305-319.
Коноплянников А.Г. Сопоставление дозовых кривых выживаемости для нормальных и опухолевых клеток при действии нейтронов различных энергий. В сб.: Использование нейтронов в медицине. Материалы Всесоюзной конференции, 18-19 мая 1976 г. Обнинск, НИИМР АМН СССР, 1976. С. 32.
Коноплянникова О.А., Коноплянников А.Г. Смертность животных и повреждения клеток стволового типа при облучении мышей быстрыми нейтронами // Использование нейтронов в медицине. Мат. Всесоюзной конф. 18-19 мая 1976 г., Обнинск, НИИМР АМН СССР, 1976. С. 31.
Коноплянников А.Г. Стволовые клетки самообновляющихся систем как детерминанты выживаемости животных в острый период лучевого поражения // Итоги науки и техники. Сер. Радиационная биология. Т. 3. М.: ВИНИТИ, 1980. С. 5-38.
Коноплянников А.Г., Колесникова А.И., Каплан В.П. и др. Действие нейтронов двух разных энергий (0,25 и 0,85 МэВ) на клетки костного мозга мышей, способные формировать гранулоцитарно-макрофагальные колонии в диффузных камерах // Радиобиология. 1980. Т. 20. № 6. С. 911-913.
Коноплянников А.Г. Радиобиология стволовых клеток. М.: Энергоатомиздат, 1984.
Коржуев П.А., Глазова Т.И., Алякринская И.О., Каландарова М.П. Количественное и качественное распределение костного мозга у взрослых собак // Космическая биология и медицина. 1968. Т. 2. № 2. С. 51-55.
Короткевич А.О. Изменения в эндокринной системе собак при кроветворной форме лучевой болезни // Радиобиология. 1987. Т. 27. № 6. С. 765-769.
Корчемкин В.И. Влияние физической нагрузки на ЭКГ собак, подвергаемых хроническому гамма-облучению. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 55-58.
Кривицкая Г.Н., Деревягин В.И., Кабицина Р.А. и др. Патоморфологические изменения нейронов головного мозга крыс в отдаленном периоде после облучения ионами углерода и гамма-излучением // Радиобиология 1988. Т. 28. № 5. С. 681-685.
Кузин А.М. Стимулирующее действие ионизирующего излучения на биологические процессы. М.: Атомиздат, 1977.
Кумец П.И. Функция полукружных каналов лабиринта собак в течение 5 лет постоянного облучения. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 59-62.
Лазаретник Б.Ш., Бакбардин Ю.В., Гребенник А.В. Орган зрения как возможный показатель преждевременного старения при радиационном поражении // Офтальмологический журнал. 1993. № 3. С. 129-132.
608
Лайта Л.Г. Модели, связанные с влиянием радиации на пул стволовых клеток // Руководство по радиационной гематологии. М.: Медицина, 1974. С. 129-143.
Лампусов Б.А. О значении двигательной функции для сохранения жизнеспособности организма человека // Физические проблемы детренированности. М.: Изд-во АН СССР, 1968. С. 28.
Лаптева-Попова М.С. Изменение крови при систематическом длительном воздействии рентгеновских лучей в малых дозах // Определение последствий поражений ионизирующей радиации. М., 1959. С. 64-73.
Лебедев Б.И. Структуры центральной нервной системы при постоянном гамма -облучении собак в малых дозах // Соматические эффекты хронического облучения / Под ред. А.И. Бурназяна М.: М3 СССР, 1972. С. 143-146.
Лебедева Г.А. Морфологические изменения желудочно-кишечного тракта при длительном воздействии малых уровней радиации. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 55-156.
Летов В.Н., Рябухин Ю.С., Иванов В.Н. Об экспериментальных исследованиях по нейтрон-захватной терапии с 6 Li И От радиобиологического эксперимента к человеку. М.: Атомиздат, 1976. С. 18-26.
Либерман А.Н., Бронштейн И.Э., Сафронов М.В. О путях переноса на человека результатов экспериментальных исследований по обоснованию ПДУ облучения кожи // От радиобиологического эксперимента к человеку. М.: Атомиздат, 1976. С. 31-35.
Литвинов Н.Н. Изменение костной системы при поражении радиоактивными веществами. Дисс. докт. мед. наук. М., 1962.
Лошак А.Я. К вопросу о биологическом действии комбинированного рентгеновского и СВЧ-облучения. Материалы конференции «Проблемы космической медицины». М., 1966. С. 262-263.
Львовская Э.Н. Состояние органа зрения при хроническом внешнем гамма-нейтронном и рентгеновском облучении (Клинико — экспериментальное исследование): дисс. канд. мед. наук. М., 1969.
Львовская Э.Н., Котова Э.С. Состояние органа зрения собак, подвергавшихся хроническому внешнему гамма-облучению. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 27-29.
Макарова Г.В. Радиобиологические предпосылки применения быстрых нейтронов в лучевой терапии злокачественных опухолей // Быстрые нейтроны в лучевой терапии злокачественных опухолей. М.: ВНИИМП М3 СССР, 1976.
Макарченко А.Ф. и др., Влияние хронического воздействия малыми дозами ионизирующих излучений на высшую нервную деятельность и картину периферической крови собак // Головной мозг и регуляция функций. Киев: Изд-во АН УССР, 1963. С. 118.
Макарычева Р.И. Изменение скелета под влиянием радиоактивных веществ и динамика развития костных изменений в рентгенологическом изображении: дисс. канд. мед. наук. М., 1962.
Методические указания РД 50-25645.205-83 БРЭКАКП. Метод расчета радиационного риска. М.: Госстандарт СССР, 1984.
Методические указания МУ 2.6.1.44-03-2004. Ограничение облучения космонавтов при околоземных космических полетах (ООКОКП — 2004). М., 2004.
Мешков Н.А., Рыжов Н.И., Рыжов Б.Н. и др. Изменение умственной работоспособности и личностного профиля у участников ликвидации последствий аварии на
609
Чернобыльской АЭС. Материалы Международной конференции «Актуальные и прогнозируемые нарушения психического здоровья после ядерной катастрофы в Чернобыле», 24-28 мая 1995 г. Киев, 1995. С. 56
Мешков Н.А., Куликова Т.А. Хроническая цереброваскулярная патология у ликвидаторов последствий аварии на Чернобыльской АЭС. М.: Комтехпринт, 2006.
Миловидова И.А., Москалев Ю.И. Изучение и количественная оценка отдаленного эффекта на хрусталике у крыс при действии бета-излучения стронция-90 + иттрия-90. Материалы Всесоюзной конференции «Отдаленные последствия и оценка риска воздействия радиации». Москва, 3-5 октября 1978 г. М.: ИБФ М3 СССР, 1978. С. 50-51.
Миловидова И.А. К вопросу о лучевой катаракте. -В сб.: Биологические эффекты малых доз радиации. М.: ИБФ М3 СССР, 1983. С. 31-35.
Мирошниченко Л.И., Петров В.М. Динамика радиационных условий в космосе. М.: Энергоатомиздат. 1985.
Митрикас В.Г., Мартынова А.Н. Модель защищенности обитаемых отсеков базового блока станции «Мир» И Космические исследования. 1994. Т. 32. Вып. 3. С.115-123.
Митрикас В.Г. Динамическая модель радиационной обстановки для оперативного обеспечения радиационной безопасности космонавтов в космическом полете: дисс. докт. техн, наук М.: ГНЦ РФ-ИБФ М3 РФ, 2000.
Митрикас В.Г., Цетлин В.В. Проблемы обеспечения радиационного контроля на ОС «Мир» в 22-м цикле солнечной активности И Космические исследования. 2000. Т. 38. №2. С. 121-126.
Митрикас В.Г. Оценка эффективных и среднетканевых доз на МКС // Авиакосмическая и экологическая медицина. 2008. Т. 42. № 4. С. 50- 55.
Моничев А.Я., Груздев Г.П. Об особенностях кинетики восстановления кроветворения, связанных с взаимодействием клеток предшественников И Теоретические предпосылки и модели процессов радиационного поражения систем организма. Пущино, ОНТИ НЦБИ АН СССР, 1975. С. 57-63.
Моничев А.Я. Динамика кроветворения. М.: Медицина, 1984.
Морозов А.Л. и др. К вопросу о состоянии здоровья лиц, подвергавшихся воздействию ионизирующей радиации в производственно-лабораторных условиях // Труды Всесоюзной, конф, по медицинской радиологии «Клиника и терапия лучевой болезни». М., 1957. С. 20-25.
Москалев Ю.И., Шелеснова В.И., Стрельцова В.Н. Канцерогенная эффективность общего внешнего воздействия бета — излучения на крыс. Тез. Всесоюзной конференции «Отдаленные последствия и оценка риска воздействия радиации». М, 1978. С 49-51.
Москалев Ю.И. Отдаленные последствия воздействия ионизирующих излучений. М.: Медицина, 1991. С. 74-85.
Мосягина Е.Н., Владимирская Е.Б., Торубарова Н.А., Мызина Н.В. Кинетика форменных элементов крови. М.: Медицина, 1976.
Муксинова К.Н., Суходеев В.В., Мурзина Л.Д. Кинетика клеточных популяций в отделах делящихся, созревающих нейтрофилов костного мозга при длительном внешнем облучении И Проблемы гематологии и переливания крови. 1979. Т. 24. №6. С. 16-21.
Муксинова К.Н. Кинетика клеточных популяций основных отделов кроветворения при длительном внешнем облучении: автореф. дисс. докт. мед. наук Обнинск, КИМР АМН, 1985.
610
Мушина И.Н. Влияние физической нагрузки,окружающей температуры и кровопотери на тяжесть острой лучевой болезни: автореф. дисс. канд. мед. наук. М., 1958.
Надарейшвили К.М. Вопросы влияния ионизирующей радиации на сердечно-сосудистую систему. Тбилиси. 1966.
Народное хозяйство СССР в 1990 г. М.: Финансы и статистика, 1991.
Народное хозяйство Российской Федерации, 1992 / Госкомстат России. М.: Респ. информ.-издат. центр, 1992.
Невская Г.Ф. Роль критических органов при неравномерных острых лучевых воздействиях: дисс. докт. мед. наук. М: ИМБП М3 СССР, 1974.
Нелюбов А.А. Количественные закономерности и особенности поражения собак в условиях общих неравномерных гамма-лучевых воздействий: дисс. канд. мед. наук. М.: ИБФ М3 СССР, 1972.
Никонова К.В., Соколова И.П. К проблеме гигиенического нормирования комбинированного действия СВЧ и мягкого рентгеновского излучений И О биологическом действии электромагнитных полей радиочастот. Труды НИИ Гигиены труда и профзаболеваний АМН. СССР. Вып. 4. М., 1973. С. 91-94.
Нормы радиационной безопасности НРБ-76/87. Основные санитарные правила ОСП-72/87. М.: Энергоатомиздат, 1988.
Нормы радиационной безопасности (НРБ-96). М.: Госкомсанэпиднадзор России, 1996.
Нормы радиационной безопасности (НРБ-99): Гигиенические нормативы. М.: Центр сан.-эпид. нормирования, гигиенич. сертификации и экспертизы Минздрава России, 1999.
Нуждин Н.И. Действие ионизирующих излучений на организм М.: АН СССР, 1962.
Нуждин Н.И., Шапиро Н.И., Померанцева М.Д., Кузнецова Н.Н. Сравнительное изучение эффективности однократного и фракционированного рентгеновского облучения семенников мыши И Радиационная генетика. М.: АН СССР, 1962. С. 115-132.
Окберг Е.Ф., Кларк Э. Действие величины и мощности дозы на радиационные повреждения сперматогоний и ооцитов мышей, определяемое по выживаемости клеток И Восстановление клеток от повреждений: пер. с англ. / Под ред. В.И. Корогодина, М.: Атомиздат, 1963.
Окладникова Н.Д., Пестерникова В.С., Сумина М.В. и др. Хроническая лучевая болезнь человека, вызванная внешним гамма-облучением в отдаленный период // Вестник АМН СССР. 1992. № 2. С. 22-24.
Орлов В.М. Клинико-физиологическая оценка состояния кожи рук лиц, работающих в условиях профессионального лучевого воздействия. Автореф. дисс. канд. мед. наук. М., 1968.
Осанов Д.П. Дозиметрия и радиационная биофизика кожи. М.: Энергоатомиздат, 1990.
Охрана здоровья в СССР. Стат, сборник. М.: Финансы и статистика, 1990.
Панкова А.С., Савина Е.А. Сравнительная характеристика морфологических изменений в почках и надпочечниках собак при хроническом гамма-облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 161-164.
Ларин В.В., Антипов В.В., Давыдов Б.И. и др.Результаты исследований биологической эффективности ряда факторов космического полета И Космические исследования. 1965. Т. 3. № 2. С. 315-324.
611
Петров В.М., Коломенский А.В., Зиль М.В. Радиационная опасность солнечных вспышек в околоземном космическом пространстве. 2. Методика оценки дозы и риска ее превышения // Космические исследования. 1979. Т. 17. № 1. С. 122— 126.
Петров В.М. и др. Обеспечение радиационной безопасности пилотируемых полетов на орбитальной станции «Мир» В кн: Орбитальная станция «Мир». Космическая биология и медицина. Т. 1. Медицинское обеспечение длительных полетов, М.: ГНЦ РФ — ИМБП РАН, 2001. С. 187-229.
Петров Р.В. и др. Защита от радиоактивных осадков. М.: Медгиз, 1963.
Петровнин М.Г., Попова Н.А. Реакция на тепловую нагрузку хронически облучаемых собак. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 63-65.
Плахута-Плакутина Г. И., Савина Е.А., Федорова Н.Л. Морфологические изменения в семенниках собак при хроническом и комбинированном гамма-облучении // Космическая биология и медицина. 1972. Т. 6. № 6. С. 29-34.
Плахута-Плакутина Г. И. Влияние четырехлетнего гамма-облучения на половые железы собак. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972а. С. 95-98.
Плахута-Плакутина Г. И. Морфологические изменения в щитовидной железе собак при хроническом гамма-облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 19726. С. 169-170.
Поздние неопухолевые последствия облучения всего тела. Материалы НКДАР при ООН, 1979. С. 154-181.
Прасличка М.А., Калина И. Влияние низких суточных доз пролонгированного облучения на изменение КОЕ и периферическую кровь у мышей И Радиобиология. 1976. Т. 16. № 3. С. 376-380.
Пресман А.С., Левитина П.А. Влияние нетеплового микроволнового облучения на резистентность животных к гамма-облучению И Радиобиология. 1962. Т. 2. № 1. С. 170-171.
Прокопчук В.А. Действие радиоактивного фосфора на кожу животных: автореф. дисс. канд. мед. наук. Минск, 1961.
Пяткин Е.К., Баранов А.Е. Биологическая индикация дозы с помощью анализа аберраций хромосом и количества клеток в периферической крови И Итоги науки и техники. Сер. Радиационная биология. Т. 3. М.: ВИНИТИ, 1980. С. ЮЗ-179.
Рабен А.С., Антоньев А.А. Профессиональная дерматология. М.: Медицина, 1975. Радиационная защита. Рекомендации МКРЗ, Публикация 26. М.: Атомиздат, 1978. Радиация. Дозы, эффекты, риск. М.: Мир, 1990.
Раевский Б. Дозы радиоактивных излучений и их действие на организм. М.: Медгиз, 1959.
Ранние эффекты облучения человека высокими дозами ионизирующего излучения. Материал 37-й сессии НКДАР ООН. Вена, 6-17 июня 1988 г.
Рахманов В.А., Линденбратен Л.Д., Романенко Г.Ф. и др. Изменения кожи в области полей облучения в отдаленные сроки после рентген-гамма терапии злокачественных опухолей И Медицинская радиология. 1963. № 10. С. 43-47.
РД 50-25645.205-83. БРЭКАКП. Методические указания. Метод расчета радиационного риска М.: Госстандарт СССР, 1984.
612
РД 50-25645.206-84. БРЭКАКП. Методика расчета ионизационных потерь и пробегов тяжелых заряженных частиц. М.: Госстандарт СССР, 1985.
РД 25645.207-85. БРЭКАКП. Методика расчета поглощенных и эквивалентных доз от многозарядных ионов космических лучей. М.: Госстандарт СССР, 1986.
РД 50-25645.208-84. БРЭКАКП. Методика расчета поглощенной и эквивалентной дозы от протонов космических лучей за защитой. М.: Госстандарт СССР, 1986.
РД.50-25645.209-85. БРЭКАКП. Методические указания. Методика учета индивидуальных доз космонавтов в период их профессиональной деятельности. М.: Госстандарт СССР, 1986.
Резонтов В.А. Снижение скорости восстановительных процессов, как характерная черта острой лучевой болезни при повторном облучении И Медицинская радиология. 1963. Т. 8. № 7. С. 52-56.
Рекомендации международной комиссии по радиологической защите. Интерпретация рекомендаций комиссии о необходимости поддерживать дозы облучения на таких низких уровнях, какие только можно реально достигнуть. Публикация МКРЗ № 22. М.: М3 СССР, 1975.
Рекомендации международной комиссии по радиологической защите 1990 года. Пределы годового поступления радионуклидов в организм работающих, основанные на рекомендациях 1990 года. Публикации № 60 и 61. М.: Энергоатомиз-дат, 1994.
Рекомендации национального комитета США по радиационной защите и измерениям. Доклад № 29. М.: Госатомиздат, 1963.
Роббинс Д.Е., Петров В.М., Шиммерлинг В., Ушаков И.Б. Ионизирующая радиация И Человек в космическом полете / под ред. В.В. Антипова, А.И. Григорьева (РФ) и К. Лич Хантун (США). Т. III. Кн. 2. Сер. Космическая биология и медицина. М.: Наука, 1997. Гл. 17. С. 155-205.
Роничевская Г.М. Реакция семенников у белых мышей при их кратковременном и хроническом непрерывном облучении гамма-радиацией 60Со: автореф. дисс. канд. мед. наук. Л., 1958.
Российские статистические ежегодники 1994-1997 гг. М.: Госкомстат России, 1994-1997 гг.
Россия в цифрах 1995-1997. Краткие стат, сборники. Госкомстат России М.: Финансы и статистика, 1995-1997.
Рыжов Н.И. и др. Лучевые поражения у собак при действии протонов высоких энергий И «Биологическое действие протонов высоких энергий». М.: Атомиздат, 1967. С. 172-181.
Рыжов Н.И., Дербенева Н.Н., Серая В.М. и др. ОБЭ протонов с энергией 510,240 и 126 МэВ при облучении мелких лабораторных животных // Биологическое действие протонов высоких энергий. М.: Атомиздат, 1967. С. 262-268.
Рыжов Н.И., Ворожцова С.В., Красавин Е.А. Эффекты поражения и пострадиационного восстановления в клетках эпителия роговицы при действии многозарядных ионов И Радиобиология. 1980. Т. 20. № 3. С. 373-379.
Рыжов Н.И. Биологическое действие ускоренных тяжелых заряженных частиц: дисс. докт. мед. наук. М.: ИМБП М3 СССР, 1982.
Рябов С.И., Шостка Г.Д. Молекулярно-генетические аспекты эритропоэза. Л.: Медицина, 1973.
Савина Е.А., Яковлева В.И., Панкова А.С. Анализ причин смерти животных, павших в ходе «Хронического эксперимента». Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 139-142.
613
Савина Е.А. и др. Особенности морфологических реакций внутренних органов и эндокринных желез при шестилетнем гамма-облучении // Космическая биология и авиакосмическая медицина. 1976. Т. 10. № 1. С. 57-60.
Савич А.В. Действие ионизирующей радиации на внутриклеточные мембраны и тканевое дыхание // Тканевая гипоксия и ее корреляция. Новосибирск, 1981. С. 63-70.
Савченко Н.Я. Влияние пространственного распределения поглощенной дозы ионизирующего излучения на биологический эффект. Автореф. дисс. канд. мед. наук. М.: ИМБП М3 СССР, 1967.
Сайкова В.А. и др. Действие нейтронов на золотистых хомяков при различном вкладе гамма-излучения в суммарную дозу И Радиобиология. 1977. Т. 17. № 6. С. 861-864.
Сакович В. А., Семенов В.Ф. Радиационная безопасность при пилотируемом полете на Марс. Концепция // Атомная энергия. 2005. Т. 99. Вып. 4. С. 301-310.
Саковская М.С., Вайнштейн П.Р. Особенности сочетанного действия рентгеновского и СВЧ излучения // Радиационная безопасность при работе с источниками мягких рентгеновских лучей. Л.: Изд-во ЛИРГ, 1969. С. 9-10.
Саковская М.С. и др. Особенности действия сочетанного рентгеновского и СВЧ излучений на организм // Материалы республиканской конференции по радиационной гигиене. Вып. 4. Л.: Изд-во ЛИРГ, 1971. С. 55-57.
Саксонов П.П., Антипов В.В., Давыдов Б.И. Влияние факторов полета на радиобиологические эффекты // Очерки космической радиобиологии. Проблемы космической биологии. Т. IX. М.: Наука, 1968а. С. 133-196.
Саксонов П.П., Антипов В.В., Давыдов Б.И. Особенности биологического действия космической радиации // Очерки космической радиобиологии. Проблемы космической биологии. Т. IX. М.: Наука, 1968а. С. 196-226.
Саксонов П.П., Антипов В.В., Давыдов Б.И. Очерки космической радиобиологии. (Проблемы космической биологии Т. IX.) М.: Наука, 19686.
Свердлов А.Г. Биологическое действие нейтронов и химическая защита. Л., Наука, 1974.
Севанькаев А.В., Лучник Н.В. Влияние гамма-облучения на хромосомы человека И Генетика. 1977. Т. 13. № 3. С. 524-532.
Севастьянов В.Д. и др. Измерение энергетического спектра нейтронов, генерируемых протонами с энергией 70 МэВ в «толстой» мишени из алюминия И ПТЭ. 1995. №3. С. 28-33.
Севастьянов В.Д., Тарновский Г.Б., Лягушин В.И. Измерение энергетического спектра нейтронов на орбитальной станции «Мир» И Космические исследования. 1997. Т. 35. № 2. С. 216-220.
Селье Г. На уровне целого организма. М.: Наука, 1972.
Сельцер В.К., Лосева Н.В. Компенсаторные возможности сердечно-сосудистой системы кроликов при пятилетием непрерывном облучении И Отдаленные последствия лучевых поражений. М.: Атомиздат, 1971. С. 119-125.
Семашко Л.Л. Кинетика эритропоэза у собак в условиях «Хронического эксперимента» Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16—20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 47-50.
Семенов Ю.П., Горшков Л.А. «Марс. Готовы ли мы к встрече?» И Журнал «Наука в России». 1990. № 3.
614
Серая В.М. Исследование системы кроветворения у экспериментальных животных, облученных протонами с энергией 120 Мэв: дисс. канд. мед. наук. М.: ИМБП М3 СССР, 1970.
Сизан Е.П. Состояние сложных условных рефлексов у собак при хроническом гамма-облучении. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 51-54.
Сисакян Н.М., Антипов В.В., Саксонов П.П., Яздовский В.И.Исследование биологического действия космической радиации в условиях космического полета // Радиобиология. 1964. Т. 4. Вып. 3. С. 337-343.
Слепчонок О.Ф. Обоснование дозиметрического критерия острого радиационного поражения на основе концепции равноценной дозы: дисс. канд. техн. наук. М.: ИБФ М3 СССР, 1989.
Соколова И.П. Влияние комбинированного воздействия электромагнитных полей СВЧ и мягкого рентгеновского излучений на периферическую кровь И О биологическом действии электромагнитных полей радиочастот. Труды НИИ гигиены труда и профзаболеваний АМН СССР. Вып. 4. М., 1973. С. 95-99.
Солдатова В.А. Состояние здоровья и клинические особенности реакций на профессиональное облучение у медицинских рентгенологов: дисс. канд. мед. наук. М., 1968.
Солдатова В.А., Солодова Р.А., Гуськова А.К. Клиническая характеристика хронической лучевой болезни в периоде восстановления И Отдаленные последствия лучевых поражений. М.: Атомиздат, 1971. С. 62-69.
Соловьев Ю.Н. Об афферентной иннервации и изменении сосудисто-нервных элементов кости при поражении стронцием-90: дисс. канд. мед. наук. М., 1959.
Солодова Р.А., Бодрова Д.А., Вершинин Н.В. К профилактике поздних клинических проявлений у лиц, работающих со светосоставом постоянного действия (СПД) // Клиническая медицина. 1966. Т. 64. № 11. С. 35-40.
Солодова Р.А. Значимость отдельных факторов комбинированного лучевого воздействия в клинических проявлениях у лиц, работающих со светосоставами постоянного действия: дисс. канд. мед. наук. М., 1967.
Стрелер Б. Время, клетки и старение. М.: Мир, 1964.
Стрелин Г.С. Регенерационные процессы в развитии и ликвидации лучевого повреждения. М.: Медицина, 1978.
Стрелин Г.С., Шмидт Н.К. Частичная защита костного мозга у крыс с помощью экрана и эффективность аутотрансплантации после повторных воздействий радиации И Эффект экранирования части костного мозга при фракционированном облучении организма. Л.: Медицина, 1978. С. 57-64.
Сумина М.В., Юрков Н.Н., Ларионова И.К. Неврологические синдромы хронической лучевой болезни в динамике за 30-летний период наблюдения // Бюллетень радиационной медицины. 1983. № 3. С. 12-17.
Сухина Л.А., Смирнова А.Ф., Чубарь С.В., Али 3. О значении углубленного обследования органа зрения лиц, подвергшихся влиянию ионизирующей радиации // Офтальмологический журнал. 1993. № 3. С. 133-135.
Табакова Л.А. Материалы к оценке пострадиационного восстановления при повторных облучениях: автореф. дисс. канд. биол. наук. М.: ИМБП М3 СССР, 1972.
Тетерина В.И., Сорокина В.А. и др. К вопросу о механизмах нарушения гемопоэза при хронической лучевой болезни И Биофизика, физиология и патология эритропоэза. Красноярск, 1974. С. 154.
615
Тихонов К.Б. Кровеносные сосуды в норме и при острой лучевой болезни по данным ангиографии: дисс. докт. мед. наук. Л.: ЦНИРРИ, 1963.
Тихончук В.С. Влияние комплексного СВЧ и гамма-облучения на кроветворение И Космические исследования. 1974. Т. 12. № 3. С. 478-480.
Толкачева Е.Н. Количественная характеристика репарационных процессов, идущих в организме после общего облучения И Биофизика. 1957. Т. 2. № 5. С. 581— 588.
Толтская М.С., Никонова К.В., Воронцова Р.С. Патологоанатомическая характеристика изменений, возникающих у экспериментальных животных при комбинированном облучении микроволнами и рентгеновскими лучами // О биологическом действии электромагнитных полей радиочастот. Труды НИИ гигиены труда и профзаболеваний АМН СССР. Вып. 4. М., 1973. С. 103-108.
Торубаров Ф.С., Чинкина О.В. Психическое состояние и трудоспособность пострадавших при аварии на ЧАЭС в период восстановления и ближайших последствий лучевой болезни И Гигиена труда и профзаболевания. 1989. № 7. С. 43-51.
Трифонов Ю.Н. О влиянии мышечной тренировки различного характера на устойчивость организма к ионизирующим излучениям: автореф. дисс. канд. мед. наук. Л., 1963.
Тяжелова В.Г., Акоев И.Г. Закономерности действия радиации различной интенсивности на организм и его системы. Препринт ИБФ АН СССР. Пущино, 1974.
Ужанский Н.Г. Физиологические механизмы регенерации крови. М.: Медицина, 1968.
Ульянова В.А., Шафиркин А.В., Фарбер Ю.В., Маркелов Б.А. Некоторые закономерности формирования радиационного поражения и развития восстановительных процессов в кроветворной ткани мышей после повторных воздействий быстрых нейтронов и гамма-излучения // Радиобиология. 1987. Т. 27. № 4. С. 510-515.
Ушаков И.Б., Федоров В.П. Изменения водно-электролитного обмена головного мозга крыс при гамма-облучении головы в высоких дозах И Радиобиология. 1983. Т. 23. №3. С. 372-375.
Ушаков И.Б., Антипов В.В., Федоров В.П., Горлов В.Г. Комбинированное действие факторов космического полета // Человек в космическом полете / Под ред. В.В. Антипова, А.И. Григорьева (РФ) и К. Лич Хантун (США), ТIII. Кн. 2. Сер. Космическая биология и медицина. М.: Наука, 1997. Гл. 21. С. 291-353.
Ушаков И.Б., Арлащенко Н.И., Должанов А.Я., Попов В.И. Чернобыль: радиационная психофизиология и экология человека. М.: ГНИИИ авиационной и космической медицины, 1997.
Ушаков И.Б., Карпов В.Н. Мозг и радиация М.: ГНИИИ авиационной и космической медицины, 1997.
Фарбер Ю.В., Табакова Л.А., Шафиркин А.В. Исследование влияния длительного вращения на радиационное поражения организма // Космическая биология и авиакосмическая медицина, 1978. Т. 12. № 4. С. 46-49.
Фарбер Ю.В., Григорьев Ю.Г., Шафиркин А.В. Лучевое поражение гемопоэза в условиях высокогорья в зависимости от длительности адаптации // Радиобиология. 1984. Т. 24. № 5. С. 624-629.
Фарбер Ю.В., Шафиркин А.В. Состояние сердечно-сосудистой системы в ближайшем и отдаленном периодах после воздействия на организм ионизирующих излучений в различных дозах И Авиакосмическая и экологическая медицина. 1999. Т. 33. №5. С. 64-71.
616
Федоренко Б.С., Кабицина Р.А., Кривицкая Г.Н. и др. Исследование частоты морфологических изменений в нейронах коры головного мозга крыс при воздействии ускоренных ионов углерода И Космическая биология и авиакосмическая медицина. 1987. Т. 21. № 1. С. 51-54.
Федоренко Б.С., Шафиркин А.В., Буденная Н. Морфологические изменения в центральной нервной системе в зависимости от дозы и времени после воздействий излучений с различными значениями ЛПЭ И Авиакосмическая и экологическая медицина. 1998. Т. 32. № 3. С. 4-11.
Федоренко Б.С. Радиобиологические эффекты корпускулярных излучений. Радиационная безопасность космических полетов. М.: Наука, 2006.
Федорова Н.Л. Воспроизводительная способность собак при хроническом и комбинированном гамма-облучении: автореф. дисс. канд. биол. наук. М.: ИМБП М3 СССР, 1972.
Филюшкин И.В., Петоян И.М. Прогноз канцерогенного риска малых уровней ионизирующего излучения. Материалы I Всесоюзного радиобиологического съезда, 21-27 августа 1989 г. Т. IV. М., 1989. С. 856.
Фомичев В.В., Черток И.М. Сопоставление данных о потоках протонов у Земли с результатами диагностики солнечных протонных вспышек по радиовсплескам // Геомагнетизм и аэрономия. 1988. Т. 28. № 3. С. 353-359.
Хафнер Д. Ядерное излучение и защита в космосе. М.: Атомиздат, 1971.
Хоруженко А.Ф., Лаптев А.И., Орешкин И.Г. и др. Некоторые истолкования биологического эффекта хронических гамма-облучений И Космическая биология и медицина. 1967. Т. 1. № 5. С. 52-56.
Хуг О., Келлерер А. Стохастическая радиобиология. М.: Атомиздат, 1969.
Цессарская Т.П., Бурковская Т.Е., Зубенкова Э.С., Зухбая Т.М., Илюхин А.В., Семашко Л.Л. Гематологический статус собак при хроническом облучении в течение 5-ти лет и выведенных из-под облучения после 3 лет опыта. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 35-37.
Цеглин В.В., Акатов Ю.А., Архангельский В.В. и др. Некоторые результаты мониторинга радиационных условий на борту международной космической станции (2000-2003) И Космические исследования. 2005. Т. 43. № 5. С. 330-334.
Цеглин В.В., Акатов Ю.А., Архангельский В.В. и др. Результаты мониторинга радиационных условий внутри PC МКС (2000-2005) И Авиакосмическая и экологическая медицина. 2006. Т. 40. № 5. С. 21-25.
Черкасова Л.С., Миронова Т.М., Тайц М.Ю и др. Показатели углеводно-энергетического обмена в тканях животных в «Хроническом эксперименте» Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 119-120.
Черных И.В., Бенгин В.В., Иванов Ю.В. и др. Динамика радиационных условий на станции «Мир» по данным прибора «Доза-Al» И Авиакосмическая и экологическая медицина. 1998. Т. 32. № 5. С. 51-57.
Чинкина О.В., Торубаров Ф.С. Психологические особенности больных, перенесших острую лучевую болезнь в связи с аварией на Чернобыльской АЭС И Физиология человека. 1991. Т. 17. № 4. С. 159-166.
Шанин А.П. Опухоли кожи их происхождение, клиника и лечение. Л.: Медицина, 1969.
617
Шафиркин А.В., Горлов В.Г. Модельное описание кинетики эффективного поражения организма при протяженных и хронических лучевых воздействиях // Радиобиология. 1978. Т. 18. № 2. С. 253-258.
Шафиркин А.В. Разработка и экспериментальное обоснование модели формирования поражения организма при протяженных воздействиях радиации: дисс. канд. биол. наук. Пущино: ИБФ АН СССР, 1983а.
Шафиркин А.В. Некоторые закономерности изменения относительного числа стволовых кроветворных клеток при протяженном облучении с различной мощностью дозы И Радиобиология. 19836. Т. 23. № 5. С. 630-636.
Шафиркин А.В. Выживаемость животных и человека в ближайшем периоде после стандартных радиационных воздействий в различных дозах. Материалы международного симпозиума «Проблемы биохимии, радиационной и космической биологии» Москва — Дубна, 22-25 января 1997 г. М.: ГНЦ РФ — ИМБП, 1997. С. 262-274.
Шафиркин А.В., Федоренко Б.С. Обоснование зависимости коэффициентов качества излучений от ЛПЭ применительно к оценке ближайших радиобиологических эффектов И Авиакосмическая и экологическая медицина. 1998. Т. 32. № 2. С. 4-9.
Шафиркин А.В. Исследование эффективности протяженных радиационных воздействий в зависимости от мощности дозы и длительности облучения на основе реакции организма и отдельных его систем в ближайшем пострадиационном периоде // Авиакосмическая и экологическая медицина. 1998. Т. 32. № 3. С. 44-49.
Шафиркин А.В., Венедиктова В.П. Определение радиационного риска в процессе осуществления межпланетного космического полета в различные периоды солнечной активности И Авиакосмическая и экологическая медицина. 1999а. Т. 33. № 3. С. 13-15.
Шафиркин А.В., Венедиктова В.П. Суммарный радиационный риск для космонавтов к концу их профессиональной деятельности и за всю жизнь при осуществлении межпланетных и орбитальных космических полетов // Авиакосмическая и экологическая медицина. 19996. Т. 33. № 5. С. 57-64.
Шафиркин А.В., Григорьев Ю.Г. Методика для оценки опасности радиационного воздействия на космонавтов в условиях длительного космического полета на основе обобщенного дозиметрического функционала// Авиакосмическая и экологическая медицина. 1999. Т. 33. № 2. С. 55-59.
Шафиркин А.В. Методические подходы к установлению значений коэффициентов пространственной неравномерности радиационного воздействия КРБ для расчетов обобщенной дозы применительно к ближайшим радиобиологическим эффектам // Авиакосмическая и экологическая медицина. 1999а. Т. 33. № 1. С. 50-56.
Шафиркин А.В. Модель радиационной скорости смертности млекопитающих, определяющая отдаленные последствия радиационного воздействия в различных дозах И Авиакосмическая и экологическая медицина. 19996. Т. 33. № 4. С. 64—69.
Шафиркин А.В. Радиобиологическое обоснование величин радиационного риска и норм по радиационной безопасности космических полетов: автореф. дисс. докт. биол. наук. М.: ГНЦ РФ-ИМБП, 1999в.
Шафиркин А.В., Григорьев Ю.Г., Петров В.М. Анализ существующих нормативных документов по проблеме «Радиационная безопасность космических полетов» и предложения по их совершенствованию И Авиакосмическая и экологическая медицина. 1999. Т. 33. № 6. С. 21- 32.
618
Шафиркин А.В., Венедиктова В.П. Радиационный риск образования злокачественных опухолей у космонавтов за период их жизни в результате осуществления межпланетного и орбитальных космических полетов // Авиакосмическая и экологическая медицина. 2000. Т. 34. № 1. С. 14-21.
Шафиркин А.В. Развитие концепции приемлемого риска // Инженерная физика. 2001. №4. С. 32-37.
Шафиркин А.В., Акатов Ю.А., Архангельский В.В. и др. Методика оценки радиационной опасности для членов экипажей орбитальных станций «МИР» и МКС на основе данных бортового индивидуального дозиметрического контроля // Авиакосмическая и экологическая медицина. 2002. Т. 36. № 1. С. 49-55.
Шафиркин А.В. Компенсаторные резервы организма и здоровье населения в условиях хронических антропогенных воздействий и длительного психоэмоционального стресса И Физиология человека. 2003. Т. 29. № 6. С. 12-22.
Шафиркин А.В., Григорьев Ю.Г. Формализованные оценки степени модификации эффектов ионизирующей радиации при дополнительном воздействии ряда факторов на Земле и в условиях космического полета И Авиакосмическая и экологическая медицина. 2004. Т. 38. № 4. С. 14-20.
Шафиркин А.В., Григорьев Ю.Г., Коломенский А.В. Радиационный риск для космонавтов при осуществлении полета к Марсу И Авиакосмическая и экологическая медицина. 2004. Т. 38. № 2. С. 3-14.
Шафиркин А.В., Григорьев Ю.Г., Ушаков И.Б., Штемберг А.С., Васин А.Л. Сопоставительный анализ рисков хронического действия ионизирующих излучений, электромагнитных полей радиочастот, химического загрязнения окружающей среды и социального стресса на здоровье населения различных регионов России. Материалы конференции работ по программе Президиума РАН «Фундаментальные науки — медицине». Москва, 14—16 декабря 2005 г. С. 208-211.
Шафиркин А.В., Штемберг А.С., Григорьев Ю.Г., Васин А.Л. Оценка опасности микроволнового излучения, включая воздействие сотовых телефонов различной мощности, на центральную нервную систему и здоровье различных групп населения. Материалы конференции работ по программе Президиума РАН «Фундаментальные науки — медицине». Москва, 27-29 ноября 2006 г. С. 160-162.
Шафиркин А.В., Штемберг А.С. Анализ основных тенденций, касающихся состояния здоровья населения различных регионов России за период 1965-2005 гг. и прогноз их изменения до 2010 г. с учетом экологической обстановки и мер по улучшению качества жизни населения в этих регионах. Материалы конференции работ по программе Президиума РАН «Фундаментальные науки — медицине». Москва, 3-4 декабря 2007 г. С. 33-35.
Шафиркин А.В. Радиобиологические основы нормирования при длительных межпланетных космических полетах И Проблемы биохимии, радиационной и космической биологии. III Международный симпозиум под эгидой Юнеско, посвященный 100-летию со дня рождения академика Н.М. Сисакяна. Дубна, 2007. С. 58-78.
Шафиркин А.В Биологическое действие космических излучений и вопросы радиационной безопасности космических полетов: Учеб, пособие. М.: НИИЯФ МГУ, 2008.
Швец В.Н. Влияние мощности дозы гамма-лучей Со-60 на колониеобразующие клетки костного мозга мышей И Радиобиология. 1975. Т. 15. № 2. С. 212-217.
Швец В.Н., Шафиркин А.В. Радиочувствительность стволовых кроветворных клеток при их клонировании в костном мозге и селезенке И Радиобиология. 1979. Т. 19. № 1.С. 48-53.
619
Швидковская Т.Е. Атмосфера планет. Модель космического пространства (модель космоса-82) / Под ред. академика С.Н. Вернова. М.: Моск, ун-т, 1983. Т. 3. С. 265-280.
Шеин В.И. Комбинированное биологическое действие постоянного магнитного поля и ионизирующей радиации. Материалы III Всесоюзного симпозиума «Влияние магнитных полей на биологические объекты». Калининград, 1975. С. 223-234.
Шеин В.И. Комбинированное действие постоянного магнитного поля и ионизирующей радиации // Радиобиология. 1988. Т. 28. № 5. С. 703- 706.
Шелеснова В.И. Бластомогенное действие длинноволнового рентгеновского излучения на кожу и молочные железы крыс. Тезисы Всесоюзной конференции «Отдаленные последствия и оценка риска воздействия радиации». М., 1978. С. 47-49.
Шиходыров В.В., Шувырина И.Д. Морфологические изменения в коре надпочечных желез собак при хроническом воздействии малых доз ионизирующей радиации. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 165- 168.
Шкромида М.И., Мосяк М.А., Бойчук Р.В., Сенюк И.А. Экологические аспекты катаракты на Прикарпатье // Офтальмологический журнал. 1993. № 3. С. 142— 145.
Шкурдода В.А. Влияние кратковременной физической тренировки на выживаемость белых крыс, находящихся в условиях гиподинамии и изоляции // Авиационная и космическая медицина. М., 1963. С. 491—492.
Шубик В.М. Влияние малых доз ионизирующих излучений на иммунитет. Материалы Всесоюзной конференции по действию малых доз ионизирующей радиации. Киев: Паукова думка, 1984. С. 36-36.
Щербова Е.Н., Груздев Т.П. Анализ динамики восстановления нейтрофилов периферической крови при радиационном поражении // Радиобиология. 1977. Т. 17. №2. С. 231-236.
Эльясберг П.Е. Введение в теорию полета искусственных спутников Земли. М.: Наука, 1965.
Юрков Н.Н., Ларионова И.К. Недостаточность мозгового кровообращения и нарушения нейродинамики мозга у больных ХЛБ с клиническими проявле-ниями атеросклероза мозговых сосудов // Бюллетень радиологической медицины. 1977. №2. С.15-19.
Юрков Н.Н. Преходящие нарушения мозгового кровообращения и инсульты у людей в отдаленном периоде ХЛБ // Бюллетень радиологической медицины. 1983. № 3. С. 8-11.
Яковлева В.И. Динамика морфологических изменений в печени собак в зависимости от длительности и характера облучения. Материалы Всесоюзного симпозиума «Хроническое действие внешнего гамма-облучения на организм собак», 16-20 октября 1972 г. Истра, ИМБП М3 СССР, 1972. С. 157-160.
Ярмоненко С.П., Коноплянников А.Г. Противолучевая защита в связи с проблемой относительной биологической эффективности редкоионизирующих излучений // Проблемы космической биологии. Т. 4. М.: Наука, 1965. С. 139-164.
Ярмоненко С.П., Вайнсон А.А., Календо Г.С., Рампан Ю.И. Биологические основы лучевой терапии опухолей. М.: Медицина, 1976.
Ярмоненко С.П., Вайнсон А.А. Радиобиология человека и животных. М.: Высшая школа, 2004.
620
Adams J.H., Swerberg J.R., Tsao C.H. Cosmic ray effects on micro-electronics. Part IV Naval Research Laboratory Memorandum Report 5501. 31 December, 1986.
Adams J.H., James H. Cosmic ray effects on microelectronics Part IV ONRL Memorandum Report 5901. Dec. 1986.
Ainsworth E.A., Leong G.F., Kendall K., Alpen E.L. Comparative lethality responses of neutron and X-irradiated dogs: influence of dose rate and exposure aspect // Radiat. Res. 1965. Vol. 26. N 1. P. 32-43.
Ainsworth E.J., Leong G.F. Recovery from radiation injury in dogs as evaluated by the split-dose technique // Radiation Research. 1966. Vol. 129. N 1. P. 131-142.
Ainsworth E.J., Page N.P., Taylor J.F., Leong G.F., Still E. Dose rate studies with sheep and swine // The Proceedings of a symposium on dose rate in mammalian radiation biology. April 29 — May 1. Oak Ridge, Tennessee, 1968. Ch. 4. P. 1-19.
Aleksandrow S.N. Late radiation pathology of mammals. Berlin; Acad. Verlag, 1982.
Alpen E.L. et al. The comparative biological response of dog. // Radiology, 1958. Vol. 70. N4. P. 541-550.
Alpen E.L. Comparision of haematological responses and radiation recovery in several mammalian species // Effects of ionizing radiation on the haematopoietic tissue. Proceedings of a panel. Vienna, 17-20 May 1966. IAEA, Vienna, 1967. P. 103-110.
Andersen A.C., Rosenblatt L.S. The effect of whole-body X-irradiation on the median life span of female dogs (beagles) // Radiation Research, 1969. Vol. 39. N 1. P. 177-200.
Archambeau J.O., Jones A., Fajardo L.F. Correlation of the dermal microvasculature morphology with the epidermal population changes produced by single X-ray fractions of 1649,2231 and 2619 rad in swine // Int. J. Rad. Oncol. Biol. Phys. 1985. Vol. 11. P. 1639.
Armstrong T.W. et al. Calculaion of Neutron Flux Spectra Induced in the Earth»s Atmosphere by Galactic Cosmic Rays // Journal of Geophysical Research. 1973. Vol. 78.N 16. P. 2715-2726.
Badhwar G.D., Cucinotta F.A., O’Neill P.M. Depth-Dose Equivalent Relationship for Cosmic Rays at Various Solar Minima // Radiation Research. 1993. Vol. 134. N 1. P.9-15.
Badhwar G.D., O’Neill P.M. An improved model of GCR for space exploration missions. Nucl. Tracks // Radiat. Meas., 1992. Vol. 20. P. 403-410.
Badhwar G.D., Cucinotta F.A., Braby L.A. and A. Konradi Measurements on the Shuttle of the LET Spectra of Galactic Cosmic Radiation and Comparison with the Radiation Transport Model // Radiation Research. 1994. Vol. 139. P. 344-351.
Badhwar G.D. et al. A Study of the Radiation Environment on Board the Space Shuttle Flight STS-57 // Radiation Measurements. 1995. Vol. 24. N 3. P. 283-289.
Badhwar G.D., Konrady A., Atwell W. et. al. Measurements of the linear energy transfer spectra on the MIR orbital station and comparison with radiation transport models // Radiation Measurements. 1996. Vol. 26. N 2. P. Ц7-158.
Badhwar G.D., Atwell W., Cash В et.al. Intercomparison of Radiation Measurements on STS-63 // Radiation Measurements. 1996. Vol. 26. N 6. P. 901-916.
Baker D.G., Hunter C.G., MacDonald J.C.F., Best G.H. A device by which animals may by irradiated at dose rate similar to those, that have been observed from the gamma-component of a radioactive fallout // Radiation Research. 1958. Vol. 9. N 1. P. 89.
Benghin V.V., Petrov V.M., Ivanov Yu.V. et.al. Space radiation quality factor investigations with Nausicaa — device on board the «MIR» space station // Adv. Space. Res. 1996. Vol. 17. N 12. P. 167-170.
621
Bilitza D. Models of Trapped Particle Fluxes AE-8 (electrons) and AP-8 (protons) in Inner and Outer Radiation Belts. NSSDC Code 633. Greenbelt Maryland. October 1987.
Blair H.A. Some aspects properties of reparable and irreparable radiation injury. Some aspects of intemation irradiation. Oxford: Pergamon Press, 1962. P. 147-150.
Blair H.A. The constancy of repair rate and irreparability during protracted exposure to ionizing radiation // Ann. New York Acad. Sci. 1964. Vol. 114. Part. 1. P. 150-157.
Boche R.D. Effects of chronic exposure to X-radiation on growth and survival // Biological effects of external X-and gamma-radiation. New-York, Me. Graw-Hill, 1954. Vol. 2. Chap. 10. P. 222-252.
Boice J.D., Day N.E., Andersen A. et al. Second cancer following radiation treatment for cervical cancer. An International collaboration among cancer registries // Journal of the National Cancer Institute. 1985. Vol. 74. N 5. P. 955-975.
Bond V.P., Cronkite E.P., Sondhaus C.A. et al. The influence of exposure geometry on the pattern of radiation dose delivered to large animal phantoms // Radiation Research. 1957. Vol. 6. P. 554-572.
Bond V.P., Robinson C.V. Bone-marrow stem-cell survival in the nonuniformly exposed mammal // Effect of ionizing radiation on the haematopoietic tissue. Proceedings of a Panel. Vienna, 17-20 May 1966. IAEA, Vienna, 1967. P. 69-74.
Bond V.P., Robinson C.V. A mortality determinant in non-uniform exposures of the mammals Radiation Research Suppl, 1967. Vol. 7. P. 265-275.
Brenner D.J., Medvedovsky C., Huang G. et al. Accelerated heavy particles and the lens. VI. RBE studies at low doses // Radiation Research. 1991. Vol. 128. N 1. P. 73-81.
Brown D.G., Cragle R.G. Some observation of dose rate effect of radiation on burros, swine and cattle // The proceedings of a symposium on dose rate in mammalian radiation biology. April 29-May 1. 1968.
Oak-Ridge, Tennessee: 1968. Chapter 5. P. 1-15.
Carsten A.L. Bond V.P., Thompson K. The RBE of different energy neutrons as measured by the hematopoietic spleen-colony technique // Int. J. Radiat. Biol. 1976. Vol. 29. N. 1. P. 65-70.
Casarett G.F. Long-term effect of irradiation on spermoproduction of dogs // Effect ionizing radiation on reproductive system. Paris, Pergamon Press, New York. 1964. P. 137-146.
Chlebovsky O., Praslicka M Mortality of rats and the peripheral blood picture during continuous high dose irradiation// Studiabiophysica. 1967. Vol. 2. Heff. 6. P. 435-438.
Christenberry K.W., Furth J. Induction of cataracts in mice by slow neutron and X-rays // Proc. Soc. Exp. Biol. Med. 1951. Vol. 77. P. 559.
Chu-tse W.U., Lajtha L.G. Haemopoietic stem cell kinetics during continuous irradiation // Int. J. Radiat. Biology. 1975. V. 27. N 1. P. 41-50.
Cole L.J., Haire H.M., Alpen E.L. Partial shielding of dogs: Effectiveness of small external epicondylar lead cuffs against lethal X-radiation // Radiation Research. 1967. Vol. 32.N l.P. 54-63.
Corp M.J., Mole R.H. The kinetics of recovery during the first few weeks after whole-body X-irradiation of mice, // Int. J. Radiat. Biol. 1966. V. 11. N l.P. 69-86.
Court L., Bassant M., Gourmelon P. et al. Impairment of electrical functions of CNS and alteration in cell populations associated with irradiation // Brit. J. Cancer. 1986. Vol. 53. Suppl. N 7. P. 230-231.
Cronkite E.P., Sipe C., Eltzholtz D. et al. Increased tolerance of vice to lethal X-radiation, as a result of previous sublethal exposure // Soc. Exptl. Biol, and Med. 1950. Vol. 70. P. 184-187.
622
Cucinotta F.A., Manuel F.K., Jones J. et al. Space radiation and cataracts in astronauts // Radiation Research. 2001. Vol. 156. P. 460-466.
Dalrimple G.V., Lane J.W., Capehart M.E., Robinette C.D. Irreparable injury after irradiation// Radiation Research. 1963, Vol. 18. N 3. P. 321-325.
Dalrimple G.V. et al. The kinetics of recuperation following 55-MeV proton irradiation // Radiation Research. 1966. Vol. 28. N 2. P. 465^470.
Dalrimple G.V., Lindsay I.R., Hall I.D. et al. Some effect of 138 MeV Protons on Primates // Radiation Research. 1966. Vol. 28. N 2. P. 406-433.
Darby S.C., Nakashima E., Kato H. A parallel analysis of cancer mortality among atomic bomb survivors and patients with ankylosing spondylitis given X-ray therapy // J. Nat. Cancer Inst. 1985. Vol. 75. N 1. P. 1-21.
Darden E.B., Christenberry K.W., Beanchamp J.J. et al. Comparison of 60 MeV protons and 300 kVp X-rays for induction of lens opacities in RF mice // Radiation Research. 1970. Vol. 43.N3.P. 598-12.
Dealy J.B., Tubiana M. Hematological responses to inhomogeneous and homogeneous whole-body irradiation // Ann. New York Acad, of Sci. 1964. Vol. 114. P. 268-276.
Dose-Response Relationship for Radiation-Induced Cancer. U.N. Scientific Committee on the Effects of Atomic Radiation Thirty-third session of UNCEAR Vienna, 25-29 june 1984.
Dudkin V.E. et al. Differential neutron energy spectra measured on spacecraft in low earth orbit//Nucl. Tracks Radiat. Meas. 1990. Vol. 17. P. 87-91.
Dudkin V.E., Kovalev E.E., Kolomensky A.V. et al. Radiation shielding estimates for manned Mars space flight // Nucl. Tracks. Radiat. Meas. 1992. Vol. 20. N 1. P. 29-32.
Dudkin V.E., Potapov Yu.V. Doses from galactic cosmic ray particles under spacecraft shielding//Nucl. Tracks Radiat. Meas. 1992. Vol. 20. N 1. P. 33-39.
Dudkin V.E. et al. Neutron fluences and energy spectra in the Cosmos-2044 biosatellite orbit//Nucl. Tracks Radiat. Meas. 1992. Vol. 20. P. 139-141.
Dym M., Clermont V. Role of spermatogonia in the seminiferous epithelium following X-irradiation of the rat testis // Amer. J. Anat. 1970. Vol. 128. N 3. P. 268-282.
Eltringham J.R. Recovery of rhesus monkey from an acute radiation injury exposure as evaluated by the split-dose technique preliminary result // Radiation Research. 1967. Vol. 31.N3. P. 533.
Eschenbrenner A.B., Miller E., Lorenz E. Quantitative histologic analysis of the effect on chronic whole-body irradiation with gamma-ray on the spermatogonic elements and the interstitial tissue of testes of mice // J. Natl. Cancer Inst. 1948. Vol. 9. N 3. P. 133-148.
Fliedner T.M. Radiation effect on granulocyte formation and maturation in various species and a different levels of exposure // Effects of Ionizing Radiation on Haematopoietic Tissue. Vienn. IAEA. 1967. P. 126-142.
Fritz T.E. et al. Hematologic response of beagles exposed continuously to low doses of Co-60 gamma-radiation // Exptl. Hemat. Today. 1982. Vol. 14. P. 229-240.
Fry R.J.M., Nachtwey D.S. Radiation Protection Guidelines for Space Mission // Health Physics. 1988. Vol. 55. N 2. P. 159-164.
Fursh J., Upton A.C., Kimball A.W. Late pathologie effects of atomic detonation and their pathogenesis // Radiation Research. 1959. Suplement 1. P. 243-264.
Geard C.R., Jenkins-Baker G., Grabham P. et al. Human endothelial cells in 2 D and 3-D system. Noncancer effects and space-related radiations // 4-th Intemation Workshop on Space Radiation Research and 17-th Annual NASA Space Radiation Health Investigators Workshop. Dubna. 2006. P. 34-35.
623
Geeracts W.J., Ham W.T., Muller H.A. et al. Effects of acute and protracted ionizing radiation on the rabbit lens. Part. 1 Acute X-rays and proton irradiations // Acta ophthalmol. 1971. Vol. 49. N 6. P. 817-855.
Gerstner H.B. Acute radiation syndrome in man.-United States // Armed Forces Medical Journal. 1958. Vol. 9. N 3. P. 313-354.
Gerstner H.B. Reaction to short-term radiation in man // Ann. Rev. Med. 1960. Vol. 11. P. 289-302.
Gilbert C.W. The relationship between the mortality of whole animals and the survival curve for single cells // Int. J. Rad. Biol. 1969 Vol. 16. N 3. P. 287-294.
Grahn D., Sacher G.A. Fractionation and protraction factors and the late effects of radiation in small mammals // The proceedings of a symposium on dose rate in mammalian radiation biology. April 29 — May 1,1968, Tennessee: Oac Ridge, 1968. Chapt 1. P. 1-27.
Guidance on radiation received in space activities. Recommendation of the national council on radiation protection and measurements. NCRP Report. N 98. 7910 Woodmont Avenue / Bethesda. MD. 20814, 1989.
Haigh M.V., Paterson E. Effects of a single session of whole-body irradiation in the rhesus monkey // British J. Radiology. 1956. Vol. 29. N 339. P. 148-157.
Hanks G.E., Page N.P., Ainsworth E.J. et al. Acute mortality and recovery studies in sheep irradiated with cobalt-60 gamma or 1 Mvp X-rays // Radiation Research. 1966. Vol. 27. N 2. P. 397-405.
Haymaker W., Ibrahim M.Z., Miquel J., Call N., Riopelle A.J. Delayed radiation effects in the brains of monkeys exposed to X- and r-rays // J. Neuropathol and Exp. Neurol. 1968. Vol. 27. N 1. Part 1. P. 50-79.
Haymaker W., Ibrahim M.Z., Call N. et.al. Acute changes in the central nervous system of monkeys exposed to proton // J. Nervopathol. and Exp. Neurol. 1972 Vol. 31. N 1. P. 72-101.
Hollowey R.J., Leong G.F., Ainsworth E.J. et al. Recovery from radiation injury in the hamster as evaluated by the split-dose technique // Radiation Research. 1968. Vol. 33. N 1. P. 37^49. http://www.energia.ru/ energia/mars/concept.html
Hume S.P., Field S.B. Hyperthermic sensitization of mouse in testine to damage by X-rays: the effect of sequence and temporal separation of the two treatments // Brit. J. Radiol. 1978. Vol. 51. N 604. P. 302-306.
Hupp E.W., Austin J.W., Krise G.M. et al. Survival of Spanish goats exposed to continuous or acute irradiation // Int. J. Radiat. Biol. 1971. Vol. 20. N 4. P. 475-484.
Ingram M., Mason W.B. Effect of chronic exposure to X-radiation on the peripheral blood of experimental animals. In: Biological effects of external radiation. Vol. 2. Chapt 11. New York: McGraw Hill, 1954. P. 253-267.
Jammet H.P., Gongora R, Le Go R et al. Observation clinique et traitment d’un cas d’irradiation globale accidentalle // Proceedings of the first international congress on the radiation protection. Rome: Pergamon Press. 1968. P. 1249-1257.
Jones D.C., Kimeldorf D.J. Effect of age irradiation on life span in the male rat // Radiation Research. 1964. Vol. 22. N 1. P. 106-115.
Jose J.G., Ainsworth E.J. Cataract production in mice by heavy charged argon, neon and carbon particles // Radiation Research. 1983. Vol. 94. N 3. P. 513-528.
Juraskova V. The effect of the continuous irradiation of bone marrow on the colony forming activity and differentiation of the stem cells // Folia biologica (Praha). 1967. Vol. 13. P. 79-83.
Kadama K., Shimizu Y., Sawada H. et al. Incidence of stroke and coronary heart disease in adult health study sample 1958-1978 // RERFTR 22-84, 1984.
624
Kalina L, Praslicka M., Petrovicova J. Effect of different daily rate of continuous irradiation upon changes in CFU number // Radiobiol. Radiotherapia. 1975. Bd. 16. №. 3. P. 347-354.
Kalina I., Praslicka M., Petrovicova J. Effect of different daily rate of continuous irradiation upon changes in CFU number // Folia biologica (Praha). 1977. Vol. 23. N 2. P. 111-115.
Kirk J.H., Casey H.W., Traynor J.E. Summary of latent effects in long term survivors of whole body irradiation in primates // Life Sci. and Space Res. Berlin, 1972. V. X. P. 165-173.
Kohn H.I., Kaliman R.F. The influence of strain on acute X-rays lethality in the mice. 2. Recovery rate studies // Radiation Research. 1957. Vol. 6. N 3. P. 329-338.
Krebs J.S., Brauer R.W., Kalbach H. The estimation of the nonrecuperable injury caused by ionizing radiation // Radiation Research. 1959. Vol. 10. N l.P. 80-88.
Krebs J.S., Leong G.F. Dependence of lethal response to radiation on dose rate // Radiation Research. 1968. Vol. 35. N 4. P. 532-535.
Lajtha J.G., Pozzi L. V., Schofild K., Fox M. Kinetic properties of haemapoietic stem cells // Cell Tissue Kinetic. 1969. Vol. 2. P. 39—49.
Lajtha J.G., Gilbert C.W., Guzman E. Kinetics of haemapoietic colony growth // Brit. J. Haematology. 1971. Vol. 20. N 2. P. 343-354.
Lamerton L.F. et.al. Effect of protracted irradiation on the blood-forming organs of the rat // Brit. J. Radiology. 1960. Vol. 33. N 389. P. 287-301.
Langham W.H., Brooks F.M., Grahn D. Radiation biology and Space environmental parameters in manned spacecraft design and operations // Aerospace Medicine. 1965. N 2. Section II. P. 14-41.
Leong G.F., Wisecup W.G., Grisham J.W. Effects of divided doses of X-ray on mortality and hematology of small and large domestic animals // Ann. New York Academy of Sci. 1964. Vol. 114. N 1. P. 138-149.
Letaw I.R., Clearwater S. Radiation Shielding Reguirements on Long Duration Space Missions. SCC Report 86-02. Maryland, 1986.
Levon H., et. al. Radiosensitivity of mice exposed to various temperatures and low dose rate radiation // Amer. J. Physiol. 1970. Vol. 219. N 4. P. 1033-1035.
Lorenz E. Some biologic effects of long-continued irradiation // Am.J. Roentgenol. Radium Therapy, 1950. Vol. 63. P. 176-185.
Lorenz E. et.al. Effects of long-continued total-body gamma irradiation on mice, guinea pigs and rabbits. III. Effects on life span, weight, blood picture and carcinogenesis and the role of the intensity of radiation // Biological effect of external X and gamma-radiation. Part 1. New York: McGraw Hill Book Co, 1954. P. 24-148.
Maloney M.A., Patt H.M. Granulocyte transit from bone marrow to blood // Blood. 1968. Vol. 31. N 2. P. 195.
McIlwain C.E. Magnetic coordinates. Space Science Reviews. 1966. Vol. 5. P. 585-598.
Melkonian G., Bourrieau J. Cost considerations of solar events effect on manned space mission. In materials of XXXXI congress IAF Oktober 6-12 1990. Dresden. GDR. P. 1-4.
Merriam G.R., Focht E.F. A clinical study of radiation cataract and the relationship to dose // Am.J. Roentg. Rad. Therap. Nucl. Med. 1957. Vol. 77. P. 759-785.
Merriam G.R., Biavati B.J., Bateman J.L et al. The dependence of RBE on the energy of fast neutrons. IV. Induction of lens opacities in mice // Radiation Research. 1965. Vol. 25. N l.P. 123.
625
Metcalf R.G., Inda F.A. Pathology in animals subjected to repeated daily exposure to X-rays // Biological effects of external X-and gamma- radiation. New York: Me Graw-Yill, 1954. Vol. 2. Chap. 12. P. 268-338.
Mewissen D.L., Comar C.L. , Trum B.F., Rust J.H. A formula for chronic radiation dosage versus shortening of life span: application to a large mammals // Radiation Research. 1957. Vol. 6. N 3. P. 450-459.
Michaelson S.M., Howland J.W Radiation injury and recovery in the dog // Radiation Research. 1958. Vol. 9. N 1. P. 153.
Michaelson S.M., Thomson R.A.E., Odland L.T., Howland J.W. The influence of microwaves on ionizing radiation exposure // Aerospace Med. 1963. Vol. 34. N 2. P. 111-115.
Miller L.S., Fletcher G.H., Gerstner H.B. Radiobiologic observations on cancer patients treated with whole-body irradiation // Radiation Research. 1958. Vol. 8. N 2. P. 150-165.
Mine M., Nakamara T., Mori H. et al. Statistical studies on cause of death among A-bomb survivors from 1970-1976 in Nagasaki city // J. Hiroshima Med. Ass. 1980. Vol. 33. P. 401-403.
Mole R.H. Quantitative observation on recovery from whole-body irradiation in mice. 1. Recovery after single large doses of radiation // Brit. J. Radiol. 1956. Vol. 29. N 346. P. 563-569.
Mole R.H., Thomas A.M. Life-shortening in female CBA mice exposed to daily irradiation for limited periods of time // Int. J. Radiat. Biol. 1961. Vol. 3. N 5. P. 493-508.
Nachtwey D.S., Ainsworth E.J., Leong G.F. Recovery from radiation injury in swine as evaluated by the split-dose technique // Radiation Research. 1967. Vol. 31. N 3. P. 353-367.
Nachtwey D.S. Radiobiological Health Risks // 19 Intersociety Conference on Environmental System. San Diego, California, July 24-26, 1989.
National Council on Radiation Protection and Measurement. Recommendations of Dose Limits for Low Earth Orbit. NCRP Report 132. Bethesda, MD, 2000.
Neary G.J., Hulse E.V., Mole R.H. The relative biological efficiency of fast neutron and gamma-rays for life-shortening in chronically irradiated CBA mice // Int. J. Radiat. Biol. 1962. Vol. 4. N 3. P. 239-248.
Newsome J.R. Overman R.R. The protective effect of aminoethylisothiuronium Br, HBr and p-aminopropiophenone against acute sublethal whole-body X-irradiation in dog // Radiation Research. 1964. Vol. 21. N 4. P. 530-540.
Norris W.P., Fritz T.E., Renfeld C.E., Poole C.M. The response of the beagle dog to Cobalt-60 gamma radiation: Determination of the LD50/30 and description of associated changes // Radiation Research. 1968. Vol. 35. N 3. P. 681-708.
Norris W.P., Fritz T.E., Rehfeld C.E., Brennan P.C. The relationship of dose rate to the production of three forms of marrow damage and death in dogs given protracted whole-body irradiation // Radiation Research. 1971. Vol. 47. N 1. P. 237.
Norris W.P., Fritz T.E. Response of the beagle dog to protracted exposure to Co-60 gamma rays // Radiation Research. 1974. Vol. 59. N 1. P. 145.
Oakberg E.F. Sensitivity and time of degeneration of spermatogenic cells irradiated in various stages of maturation in the mouse // Radiation Research. 1955. Vol. 2. N 4. P. 369-371.
Oakberg E.F., Clark E. Species comparisons of radiation response of the reproductive system. New York: Pergamon Press, 1964. P. 11-25.
Otake M., Schull W.J. // Radiation Research. 1991. Vol. 32. Suppl. P. 283-293.
626
Page N.P., Nachtwey D.S., Leong G.F., Ainsworth E.J., Alpen E.L. Recovery from radiation injury in sheep, swine and dogs, as evaluated by the split-dose technique // Radiation Research. 1965. Vol. 22. N 1. P. 224.
Page N.P., Ainsworth E.J., Taylor J.F. The relationship of exposure rate and exposure time to radiation injury in sheep // Radiation Research. 1968. Vol. 33. N 1. P. 94-106.
Paterson E., Gilbert C.W., Mathews J. The time-intensity factors and whole-body irradiation // Brit. J. Radiol. 1952. Vol. 25. P. 427-433.
Paterson E., Gilbert C.W., Haigh B. Effects of paired doses of whole-body irradiation in the rhesus monkey // Brit. J. Radiol., 1956. Vol. 29. N 340. P. 218-226.
Patt H.M. Rates of blood formation and of blood cell depletion and recovery after irradiation // Effects Ionizing Radiation on Haematopoietic Tissue. Vienna. IAEA. 1967. P. 14.
Payn R. // Aeromed.Rev. 1963. N 3. P. 34.
Petrov V.M., Bengin V.V., Andronow E.A. et al. Solar cosmic rays angular distributions in 9 luly 1985 solar proton event. 20-th Intemanional cosmic Ray Conference. Moscow, 1986. Vol. 3. P. 155-158.
Petrov V.M., Ivanov Yu.V., Shurshakov V.A., Nguyen V.D., Siegrist M. Space radiation quality factor investigations near the solar sycle maximum in the experiment with NAUSICAA-device aboard the MIR space station. 5-th European Symposium on Life Sciences Research in Space. 26 September — 1 October 1993. Arcachon, France. RAD-0-09.
Praslicka M., Chlebovsky O. Hematological changes during continuous gamma irradiation//Radiobiol. Radiotherapia. 1973. Bd 14. T. 2. P. 213-217.
Puro E.A., Clark G.M. The effect of exposure rate on animal lethality and spleen colony cell survival // Radiation Research. 1972. Vol. 52. N 1. P. 115-129.
Radiation Protection Guides and Constraints for Space Mission and Vehicle-Design Studies Involving Nuclear Systems. Radiobiological Advisory Panel Committee on Space Medicine (Langham W.H. and Grahn D. Eds.) NAS/NRC 1970. National Academy Press, Washington, 1970.
Radiobiological factors in manned space flight / ed. W.H. Langham: Washington. National Academy of Sciences, 1967. P. 273.
Rail J.F. et al. Report of the National Institute of Health Ad. Hoc. Working Group to develop Radioepidemiological Tables DHHS Publication (NIH) N 85-2748 (U. S. Goverment Printing Office Washington), 1985.
Recomendations of the International Commission on Radiological Protection ICRP Publication 9. Pergamon Press, Oxford, 1966.
Recommendation of the ICRP Publication 26 Annals of the ICRP. N 3. New York: Pergamon, 1977.
Recommendation of the ICRP Publication 60 Annals of the ICRP. Vol. 21. N 1-3. New York: Pergamon, 1991.
Remler M.P., Marcussen W.H. Time course of early delayed blood brain barrier changes in individual cats after ionizing radiation // Exp. Neurol. 1981. Vol. 73. N 1. P. 310-314.
Report of the RBE Committee to the International Commission on radiological protection and on radiological units and measurements. Health Physics, Pergamon Press. 1963. Vol. 9. N 4. P. 357-386.
Reyners H., Gianfelici R.E., Reyners E., Maisin J.R. // Radiat. Risk: Develop. Nervous Syst. Int. Symp. Neuherberg near Munhen, June 18-20, 1985; New York, 1986. P. 117-129.
627
Riopelle A.J., Ades H.W., Morgan F.E. Peripheral blood of the X-irradiated rhesus monkey // Radiation Research. 1957. Vol. 7. N 6. P. 581-590.
Robertson T.L., Shimizu Y., Kato H. et al. Incidence of stroke and coronary heart disease in atomic bomb survivors, living in Hiroshima and Nagasaki 1954-1974 // RERFTR 12-79, 1979.
Robinson C.V. Relationship between animal and stem cell dose-survival curves // Radiation Research. 1968. Vol. 35. N 2. P. 318-334.
Sacher G.A., Grahn D. Survival of mice under duration of life exposure to gamma rays. 1. The dosage-survival relation and the lethality function // J. Natl. Cancer Inst. 1964. Vol. 32. N 2. P. 277-321.
Sacher G.A. Lethal effects of whole-body irradiation in mice // Radiol. Clin. North. Amer. 1965. Vol. 3.N2. P. 227-241.
Sannikov A.V., Savitskaya E.N. Ambient dose and ambient dose equivalent conversion factors for high energy neutrons. CERN/TIS-RP/TM/93-38, 1993.
Sawyer D.W., Vette J.I., AP-8 Trapped Prapped Proton Environment for Solar Maximum and Minimum, NSSDS/WDS-A-R&S 76-06, 1976.
Spalding J.F. et. al. Dependence of rate of recovery from acute gamma-ray exposure on size of the conditioning dose // Radiation Research. 1961. Vol. 15. N 3. P. 378-389.
Spalding J.F., Holland L.M., Johnson O.S. Kinetics of injury and repair in monkeys and dogs exposed to X-ray fractionation // Heal. Phys. 1969. Vol. 17. N l.P. 11-17.
Spalding J.F., Holland L.M., Prine J.R. The effect of dose protraction on hematopoiesis in the primate and dogs // Life Sciences and Space Research. Berlin: Academic Verlag, 1972. P. 155-164.
Spalding J.F. et al., Comparative effect on dose protraction and residual injury in dogs and monkey // Radiation Research. 1973. Vol. 54. N 3. P. 454-462.
Still E.T., Page N.P., Taylor J.F. et al. Acute mortality and recovery studies in burros irradiated 1 MeV X-rays // Radiation Research. 1969. Vol. 39. N 3. P. 580-593.
Storer J.B. Effect of dose size on rate of recovery from radiation damage in mice. // Radiat. Res., 1961. Vol. 14, N 2, P. 206-212.
Storer J.B. Radiation resistance with age in normal and irradiated population of mice // Radiation Research. 1965. Vol. 25. N 3. P. 435-459.
Taketa S.T. Biological effects of proton and neutrons in large animal. In II Symposium on protection against radiation in space. NASA. Washington., 1965. P. 75-84.
Tawnsend L.W., Wilson J.W., Cucinotta F.A., Shinn J.L. Galactic cosmic ray transport methods and radiation quality issues // Nucl. Tracks Radiat. Meas. 1992. Vol. 20. N 1. P 65-72.
Taylor J.F., Still E.T., Page N.P., Leong G.F., Ainsworth E.J. Acute lethality and recovery of goats after 1 MVP X-irradiation // Radiation Research. 1971. N l.P. 110-126.
The Effects of Atomic Weapons. U.S. Atomic Energy Commission. New York; Toronto — London: McGran-Hill Book Company, 1950.
The Effect on Population of Exposure to Low Level of Ionizing Radiation. Report of the Committee on the Biological Effects of Ionizing Radiation NAS/NRC, 1980.
The Evaluation of Risks from Radiation. ICRP Publication 8. Oxford: Pergamon Press, 1966.
Thomson R.A.E. et al. Modification of X-irradiation lethality in mice by microwaves radar // Radiation Research. 1965. Vol. 24. N 4. P. 631-635.
Thomson R.A.E., Michaelson S.W., Howland I.W. Leukocite response following simultaneous ionizing and microwave (radar) irradiation // Blood. 1966. Vol. 28. N 2. P. 157-162.
628
Till J.E., McCulloch E.A. A direct measurement of the radiation sensitivity of normal mouse bone marrow cells // Radiation Research. 1961. Vol. 14. N 2. P. 213-222.
Till J.E., McCulloch E.A. Early repair processes in marrow cells irradiated and proliferating in vivo // Radiation Research. 1963. Vol. 18. N 1. P. 96-105.
Till J.E., McCulloch E.A. Repair processes in irradiated mouse hematopoietic tissue // Ann. New York Acad. Sci. 1964. Vol. 114. N 1. P. 115-124.
Tsuya A., Wakano Y., Otake M. Capillary Microscopic Observation on the Superficial Minute Vessels of Atomic Bomb Survivors, 1956-1957 // Radiation Research. 1971. Vol. 46.N l.P. 9-216.
Upton A.C. Late effect of fast neutron and gamma-rays in mice as influenced by the dose rate of irradiation: induction of neoplasia // Radiation Research. 1970. Vol. 41. N 3. P. 467-491.
Vana N., Schoner W., Noll M. et al. // Radiation Protection Dosimetry. 1999. Vol. 85. N 1-4. P. 291-294.
Weyland M., et. al. Analysis of Risks Associated with Radiation Exposure from Past Major Solar Particle Evants // Radiation Research — A. Twentieth — Century Perspective. V. 1. Congress Abstract ICRR 9th Toronto, 7-12 July, 1991. Academic Press — San Diego; New York; London; Tokio; Toronto. P. 24.08 WP.
Withers H. R., Mason K.A. The kinetics of recovery in irradiated colonie mucosa of the mouse // Cancer. 1974. Vol. 34. N 3. Suppl. 1. P. 896-903.
Worgul B., Medvedovsky C., Powers-Risius P., Alpen E. The effect of acceleration iron ions on the murine lens // Radiation Research. Proceed. 8 Intern. Congress Radiat. Res. Edinburg, July, 1987. V. 1. P. 249.
Worgul B., Merriam G., Medvedovsky C., Brenner D. Acceleration heavy particles and the lens. Ill Cataract enhancement by dose fractionation // Radiation Research. 1989. Vol. 118.N l.P. 93-110.
Yasuda H., Komiyama T., Fujitaka Organ tissue absorbed doses measured with a human torso in the 9-th Shuttle — Mir mission (STS — 91 // Aerospace Env. Med. 1999. Vol. 36. P. 105-112.
СОДЕРЖАНИЕ
Предисловие.............................................7
Введение...............................................12
1. Источники радиационной опасности и дозовые нагрузки на космонавтов при межпланетных космических полетах ... 21
1.1. Анализ радиационной обстановки при межпланетном космическом полете в различные периоды солнечной активности...........................................21
1.2. Алгоритм расчета и определение дозовых нагрузок от ГКЛ на различные органы космонавтов при межпланетном космическом полете в период минимума солнечной активности.................................23
1.3. Алгоритм расчета и определение дозовых нагрузок от ГКЛ на различные органы космонавтов при межпланетном космическом полете в период максимума СА.........................................32
1.4. Определение дозовых нагрузок на различные органы космонавтов при межпланетном космическом полете в период максимума СА от солнечных космических лучей (СКЛ)..........................................34
2. Основные источники радиационной опасности и дозовые нагрузки на космонавтов при полетах на орбитальных станциях «Мир» и МКС....................................42
2.1 Основные источники радиационной опасности при орбитальных космических полетах.......................42
2.2. Расчетные значения дозовых нагрузок от космических излучений на различные органы и ткани космонавтов .... 51
2.3. Оценка дополнительного вклада излучения вторичных нейтронов в среднесуточную величину эквивалентной дозы при осуществлении орбитальных космических полетов на станции «Мир» на основе экспериментальных измерений............................................61
630
2.4. Сравнительный анализ результатов расчета дозовых нагрузок на космонавтов и данных дозиметрических и спектрометрических измерений на орбитальных станциях «Мир» и МКС...................................66
3. Анализ существующих подходов к оценке радиационной опасности для космонавтов в процессе межпланетных и орбитальных космических полетов. Клинико-экспериментальное обобщение возможных ближайших неблагоприятных эффектов.................................73
3.1. Вероятность и характер развития первичной лучевой реакции в результате острых облучений в различных дозах..................................................75
3.2. Характеристика клинических проявлений и изменение жизнеспособности организма в ближайшем пострадиационном периоде в зависимости от поглощенной дозы .... 81
3.3. Экспериментальные и медико-гигиенические материалы о формировании поражения и восстановлении кроветворения после острого и в процессе хронических воздействий ионизирующих излучений.....................91
3.4. Состояние сперматогенеза и воспроизводительной способности животных после острых и протяженных облучений в различных дозах...........................115
3.5. Изменение состояния кожного покрова в ближайшем пострадиационном периоде в зависимости от дозы........123
4. Хронический эксперимент по 3- и 6-летнему облучению собак с моделированием дозовых нагрузок на космонавтов в условиях длительного полета к Марсу...................134
4.1. Методология постановки эксперимента.............134
4.2. Радиационно-физические условия проведения
«Хронического эксперимента»........................146
4.3. Клинико-физиологическая характеристика состояния собак в процессе 3- и 6-летнего облучения с различной мощностью дозы..............................167
4.4. Результаты биохимических клинических исследований..........................................177
4.5. Иммунологическая реактивность животных..........185
4.6. Состояние нервной системы.......................188
4.7. Состояние кроветворения у собак в процессе и после
3 и 6 лет облучения................................198
631
4.8. Восстановление системы кроветворения после облучения и применения дополнительных воздействий..............228
4.9. Сперматогенез и воспроизводительная способность животных в процессе и после 3 и 6 лет облучения.......237
4.10. Патоморфологические и гистологические исследования собак в «Хроническом эксперименте»...................256
4.11. Характеристика отдаленных последствий при хроническом облучении.....................................272
4.12. Сокращение продолжительности жизни у собак в «Хроническом эксперименте».........................281
5. Математические модели радиационного поражения организма после острых повторных и протяженных облучений с различной мощностью дозы...................291
5.1. Модельное описание закономерности формирования поражения в системе кроветворения при протяженном облучении и после острых радиационных воздействий ... 291
5.2. Модели эффективной остаточной дозы для описания поражения организма и его восстановления после острых повторных и хронических облучений с различной мощностью дозы.............................300
5.3. Модель радиационной скорости смертности млекопитающих для описания изменения возрастной зависимости коэффициентов смертности от дозы и мощности дозы радиационного воздействия.......................332
6. Методика установления опасности сложного радиационного воздействия на космонавтов в условиях длительного космического полета на основе обобщенного дозиметрического функционала..................................342
6.1. Развитие концепции обобщенного дозиметрического функционала для количественного определения опасности сложного по характеру радиационного воздействия на человека.............................................342
6.2. Зависимость коэффициентов относительной биологической эффективности и коэффициентов качества излучений от линейной передачи энергии тканям.........346
6.3. Методические подходы к установлению значений коэффициентов пространственной неравномерности радиационного воздействия для расчетов обобщенной дозы применительно к ближайшим радиобиологическим эффектам 358
632
6.4. Степень модификации радиационного ответа организма за счет действия нерадиационных факторов космического полета.........................................372
7. Радиационный риск для космонавтов в процессе осуществления межпланетных и орбитальных космических полетов....................................377
7.1. Разработка алгоритма для расчета радиационного риска при межпланетных космических полетах...........377
7.2. Радиационный риск для космонавтов при осуществлении межпланетных космических полетов в различные периоды солнечной активности....................390
7.3. Радиационный риск для космонавтов при орбитальных космических полетах на станциях «Мир» и МКС..........396
8. Радиационный риск для космонавтов в течение всей их жизни после завершения межпланетных и орбитальных космических полетов...............................402
8.1. Суммарный радиационный риск для космонавтов к концу их профессиональной деятельности и за всю жизнь после завершения межпланетных полетов.........402
8.2. Радиационно-обусловленный риск образования злокачественных опухолей у космонавтов за период их жизни после завершения межпланетных космических полетов......................................420
8.3. Определение суммарного радиационного риска и риска образования опухолей в течение всей жизни космонавтов после осуществления орбитальных космических полетов в различные периоды СА.............435
9. Отдаленные неблагоприятные последствия радиационных воздействий на животных и человека в различных дозах (к проблеме нормирования радиационных воздействий на космонавтов).......................................452
9.1. Отдаленные нарушения в системе кроветворения у млекопитающих после острых и хронических радиационных воздействий с различной мощностью дозы.........452
9.2. Морфологические и функциональные изменения в центральной нервной системе и нарушения работоспособности в зависимости от дозы радиационного воздействия.........................................462
633
9.3. Оценка состояния сердечно-сосудистой системы в ближайшем и отдаленном периодах после воздействия на организм ионизирующих излучений в различных дозах................................................493
9.4. Отдаленные последствия лучевых поражений кожи в зависимости от дозы радиационного воздействия......513
9.5. Анализ катарактогенной эффективности воздействия излучений с различной плотностью ионизации...........522
10. Проблема нормирования радиационных воздействий на космонавтов при орбитальных и межпланетных космических полетах....................................547
10.1. Анализ существующих подходов к нормированию радиационных воздействий в процессе космических полетов..............................................547
10.2. Совершенствование подходов к нормированию и обоснование новых предельно допустимых уровней радиационных воздействий на космонавтов при орбитальных космических полетах......................560
10.3. Обоснование допустимых величин суммарного радиационного риска и пределов доз для космонавтов при осуществлении полета к Марсу..................569
Заключение.............................................588
Перечень сокращений, условных обозначений и символов.... 595
Литература.............................................597
CONTENTS
Foreword.............................................................7
Introduction........................................................12
1. Sources of radioactive danger and doze impacts
on astronauts during interplanetary space flights.............21
1.1. Analysis of radiation conditions during interplanetary space flights in different periods of solar activities.........21
1.2. Algorithm of calculations and determination of Galaxy space beams dose impact on different organs of astronauts during interplanetary space flights in the periods
of minimal solar activity.....................................23
1.3. Algorithm of calculations and determination of Galaxy space beams dose impact on different organs of astronauts during interplanetary space flights in the periods
of maximal solar activity.....................................32
1.4. Determination of solar space beams dose impact on different organs of astronauts during interplanetary space flights in the periods of maximal solar activity................34
2. Main sources of radiation danger and dose impacts
on astronauts during orbital flights of <Mir> and MKS stations.........................................................42
2.1. Main sources of radiation danger during orbital space flights.........................................................42
2.2. Calculated values of space radiation dose impacts on different organs and tissues of astronauts...................51
2.3. Evaluation of supplementary contribution of secondary neutron radiation to average daily value of equivalent dose during orbital space flights of «Mir» station on the basis of experimental measurements..............................61
2.4. Comparative analysis of the results of calculations of dose impacts astronauts are exposed, dosimetric data and spectrometer measurements on board of «Mir» and MKS orbital stations........................................66
635
3. Analysis of different approaches to the evaluation of radiation danger for astronauts in the process of interplanetary and orbital space flights, Clinical and experimental generalization of possible forthcoming unfavourable effects...............................................73
3.1. Probability and peculiarities of the development
of initial radial reactions as a result of acute irradiation in different doses...........................................75
3.2. Peculiarities of clinical indications of organism viability change in the nearest post-radiation period dependent of the dose absorbed............................................81
3.3. Experimental and medical-hygienic materials on destruction and restoration of hematopoiesis after acute and in the process of chronic influence of ionizing radiation...........................................91
3.4. Condition of spermatogenesis and reproduction ability of animals after acute and long-term radiation in various doses..................................................115
3.5. Change of the conditions of skin in the nearest post-radiation period dependent on the dose....................123
4. «Chronic experiment» on 3- and 6-year irradiation of dogs modelling dose impacts on astronauts during long-term flights to Mars...................................................132
4.1. Methodology of experiment implementation..................134
4.2. Radiation and physical conditions of «chronic experiment» implementation.................................................146
4.3. Clinic and physiological characteristics of dog conditions in the process of 3- and 6-year irradiation by doses of various intensity..............................................167
4.4. Results of biochemical clinic investigation...............177
4.5. Immunological responsiveness of animals..................185
4.6. Condition of nervous system...............................188
4.7. Condition of dogs’ hematopoiesis in the process and after 3- and 6-year irradiation................................198
4.8. Regeneration of hematopoiesis system after radiation and supplementary influence....................................228
4.9. Spermatogenesis and reproduction ability of animals in the process and after 3- and 6-year irradiation.............237
4.10. Patomorphological and histological of dogs during «chronic experiment»...........................................256
636
4.11. Characteristics of remote consequences of chronic irradiation.....................................................272
4.12. Reduction of dogs’ life duration in «chronic experiment» 281
5. Mathematic models of radiation impacts on organism after acute repeated and long-term irradiation with various dose powerfulness..........................................291
5.1. Model description of conformity to formation of impacts on hematopoiesis system during long-term irradiation and after acute radiation influence.................291
5.2. Models of effective residual doses for the description of organism damage and its regeneration after acute repeated and chronic irradiation with various dose powerfulness....................................................300
5.3. Model of rapidness of radiation death of mammals for the description of age dependence of the coefficients of death on dose and powerfulness of dose of radiation influence.......................................................332
6. Methodology of determination of the danger of complex radiation influence on astronauts during long-term space flights on the basis of a generalized dosimetric functional.... 342
6.1. Development of the conception of a generalized functional for the quantitative determination of danger of complex radiation impacts on men........................................342
6.2. The dependence of coefficients of relative biological effectiveness and coefficients of irradiation quality on linear energy transmission......................................346
6.3. Methodical approaches to determination of the meanings of coefficients of spatial irregularity of radiation influence for calculations of a generalized dose with regard to the nearest radiobiological effects.........358
6.4. The degree of modification of organism radiation reaction due to the influence of non-radiation factors of space flight.................................................372
7. Radiation risk for astronauts during interplanetary and orbital space flights..........................................377
7.1. Creation of algorithm for the calculation of radiation risk during interplanetary space flights........................377
637
7.2. Radiation risk astronauts are exposed to during interplanetary space flights in the periods of different solar activity.................................................390
7.3. Radiation risk astronauts are exposed to during orbital space flights of «Mir» and MKS stations................396
8. Radiation risk for astronauts during all their life after orbital and interplanetary flights are over.......................402
8.1. Total radiation risk for astronauts by the end
of their professional activities and during all their life after interplanetary space flights are over.................402
8.2. Radiation induced risk of malignant tumour formation during all astronauts’ life after interplanetary space flights are over...............................................420
8.3. Determination of total radiation risk and the risk of malignant tumour formation during all astronauts’ life after orbital space flights in the conditions
of various solar activity are over..........................435
9. Future unfavourable consequences of radiation influence on animals and people in different doses (to the problem of rate-setting of radiation influence on astronauts)............452
9.1. Future failures in the system of blood formation
of mammals after acute and chronic radiation impacts by doses of different powerfulness..........................452
9.2. Morphological and functional changes in the central nervous system and work efficiency failures dependent on the dose of radiation influence.............................462
9.3. Evaluation of cardiovascular system in the nearest and future periods after organism has been exposed to ionizing irradiation in different doses.....................493
9.4. Future consequences of radiation skin damage dependent on the radiation impact dose...................................513
9.5. Analysis of cataracta-genic efficiency of irradiation with different ionization density...................................522
10. The problem of setting rates of radiation impacts on astronauts during orbital and interplanetary space flights...........................................................547
10.1. Analysis of existing approaches to setting rates of radiation impacts during space flights......................547
638
10.2. Improvement of the approaches to setting rates and substantiation of new utmost permissible levels of radiation influence on astronauts during orbital space flights.......................................................560
10.3. Substantiation of permissible values of the total radiation risk and the limits of doses for astronauts
during the flight to Mars...................................569
Inference.........................................................588
List of abridgements, conventional designations and symbols . . . 595
Literature........................................................597
Научное издание
Шафиркин Александр Венецианович Григорьев Юрий Григорьевич
МЕЖПЛАНЕТНЫЕ И ОРБИТАЛЬНЫЕ КОСМИЧЕСКИЕ ПОЛЕТЫ. РАДИАЦИОННЫЙ РИСК ДЛЯ КОСМОНАВТОВ (РАДИОБИОЛОГИЧЕСКОЕ ОБОСНОВАНИЕ)
Главный редактор Е.В. Полиевктова Художественное оформление А.В. Кинсбурского Графика В.Л. Ардашникова
ИД № 03627 от 25.12.2000.
Подписано в печать с оригинал-макета 02.07.2009. Формат 60 х 90)^6. Бумага офсетная. Гарнитура «Петербург». Печ.л. 40. Тираж 1000 экз. Изд. № 8473.
Заказ № 1210
ЗАО «Издательство «Экономика» 123995, Москва, Бережковская наб., 6.
Типография «Наука» 121099, Москва, Шубинский пер., 6.
Григорьев Юрий Григорьевич,
профессор, доктор медицинских наук, Лауреат Государственной премии СССР, ведущий научный сотрудник Федерального медицинского биофизического центра им. А.И. Бурназяна ФМБА.
С1964 по 1977 гг. - научный руководитель исследований по космической радиобиологии и безопасности пилотируемых космических полетов, возглавляющий соответствующую службу в Институте медико-биологических проблем Минздрава СССР.
Профиль научных исследований: биологическое действие ионизирующей и неионизирующей радиации, радиационная безопасность пилотируемых космических полетов, экстремальная физиология, космическая радиобиология, нормирование физических факторов среды.
Член Российской Научной Комиссии по радиол^' ической защите, председатель Российского национального Комитета по защите от неионизирующих излучений, член Консультативного Комитета ВОЗ по международной программе "Электромагнитные поля и здоровье населения",член правления Научного Совета по проблеме радиобиологии РАН, член редколлегии журнала РАН "Радиационная биология. Радиоэкология".
Автор 15 монографий и более 300 публикаций в научных отечественных и зарубежных журналах. В том числе монографии: Радиационная безопасность космических полетов, 1975; Космическая радиобиология,1982; Действие тяжелых ионов на биологические объекты,1990; Соматические эффекты хронического гамма-облучения,1986, соавтор главы в Советско-Американско издании "Основы космической биологии и медицины", 1975 и др.
Шафиркин Александр Венецианович, выпускник МИФИ, доктор биологических наук, ведущий научный сотрудник Государственного научного центра-Института медико-биологических проблем РАН, специалист в области биофизики, радиобиологии, космической биологии и медицины.
Профиль научных исследований: биологическое действие ионизирующей и неионизирующей радиации, космическая радиобиология, радиационная безопасность пилотируемых космических полетов, обобщенные показатели и модели состояния отдельных систем и устойчивости организма при протяженном воздействии экстремальных факторов, риски в течение жизни воздействия экстремальных экологических и социальных факторов на человека и население, нормирование физических факторов среды на Земле и в условиях космического полета.
С 1994 по 2002 г. - научный руководитель тем по обоснованию предельных уровней воздействия ионизирующих излучений на космонавтов при осуществлении длительных орбитальных и межпланетных полетов
Член Российского национального Комитета по защите от неионизирующих излучений, Автор 174 научных работ и 2-х изобретений. За период с 2001 по 2008 гг. опубликованы материалы в 4-х монографиях и главах монографий, 22 статьи в рецензируемых журналах, 6 статей в научных сборниках, сделано 12 докладов на научных конференциях, съездах, международных симпозиумах
ISBN 978-5-282-02948-2