Author: Соловьев А.А. Пухальский В.А. Бадаева
Tags: ботаника биология биология клетки
ISBN: 978-5-9532-0449-3
Year: 2007
Text
УЧЕБНИКИ И УЧЕБНЫЕ ПОСОБИЯ ДЛЯ СТУДЕНТОВ
ВЫСШИХ УЧЕБНЫХ ЗАВЕДЕНИЙ
В. А. ПУХАЛЬСКИЙ, А. А. СОЛОВЬЕВ,
Е. Я БАДАЕВА, В. Н. ЮРЦЕВ
ПРАКТИКУМ
ПО ЦИТОЛОГИИ
И ЦИТОГЕНЕТИКЕ
РАСТЕНИЙ
Рекомендовано Министерством сельского хозяйства
Российской Федерации в качестве учебного пособия для
студентов высших учебных заведений, обучающихся
по направлению 110200 «Агрономия» и специальнос-
ти 110204 «Селекция и генетика сельскохозяйствен-
ных культур»
МОСКВА «КолосС» 2007
УДК 58(075.8)
ББК 28.54/55я73
П90
Редактор И. А. Фролова
Рецензенты: доктор биологических наук, профессор А. В. Зеленин (Институт
молекулярной биологии им. В. А. Энгельгардта РАН), кандидат биологических
наук Г. И. Карлов (РГАУ — МСХА им. К. А. Тимирязева)
Юриев В. Н.
М.:
Пухальский В. А., Соловьев А. А., Бадаева Е
П90 Практикум по цитологии и цитогенетике растений.
КолосС, 2007. — 198 с.: ил. — (Учебники и учеб, пособия для
студентов высш. учеб, заведений).
ISBN 978-5-9532-0449-3
В учебном пособии приведены общие сведения о строении растительной
клетки, образовании гамет, процессах оплодотворения и развития зароды-
ша. Разобраны нарушения, возникающие при отдаленной гибридизации ра-
стений и мутагенезе. Изложены методы получения полиплоидных растений.
Подробно описаны методы приготовления цитологических и цитогенети-
ческих препаратов и принципы световой микроскопии. Представлены мето-
ды дифференциального окрашивания хромосом, а также методы молекуляр-
ной цитогенетики, основанные на гибридизации нуклеиновых кислот —
флуоресцентная гибридизация in situ FISH и GISH.
Учебное пособие предназначено для лабораторно-практических занятий
и самостоятельной работы студентов высших учебных заведений, обучаю-
щихся по направлению «Агрономия» и специальности «Селекция и генетика
сельскохозяйственных культур», а также и биологическим специальностям.
Представляет также интерес для аспирантов, преподавателей и научных со-
трудников.
УДК 58 (075.8)
ББК 28.54/55я73
ISBN 978—5—9532—0449—3
© Коллектив авторов, 2007
© Издательство «КолосС», 2007
ОТ АВТОРОВ
Полноценная подготовка специалистов в области биологии, ге-
етики и селекции растений невозможна без фундаментальных
наний основ цитологии и цитогенетики. При этом особое внима-
[ие должно быть уделено освоению студентами основных методов
^следований, используемых специалистами этих двух дисцип-
[ин. Естественно, что всегда надо с чего-то начинать и не с са-
мого сложного. В связи с этим авторы включили в настоящее
учебное пособие методы, которые не только широко используют-
ся в научных лабораториях, но и являют собой основу более слож-
зых методов, получающих развитие в последнее время. При этом
1ЛЯ четкого понимания подходов к выбору определенных методов
исследований в учебном пособии приведены сведения о строении
растительной клетки, процессах формирования женских и муж-
ских генеративных клеток, оплодотворения, развития зародыша и
эндосперма, а также об отдаленной гибридизации и нарушениях
клеточных делений, возникающих при этом, полиплоидии и хро-
мосомных перестройках.
В данном учебном пособии мы отдали предпочтение методам с
использованием световой микроскопии. Однако наряду с этим в
нем приведены самые современные методики гибридизации нук-
леиновых кислот in situ, как одного из наиболее разработанных
направлений молекулярной цитогенетики.
В целом учебное пособие несколько отличается по структуре от
подобного вида изданий, что обусловлено желанием избежать воз-
можных повторов и позволить преподавателю проводить занятия
по своему усмотрению и возможностям, не выходя за рамки про-
граммы подготовки в области цитологии и цитогенетики студен-
тов агрономических и биологических специальностей, в полном
соответствии с которой и написано пособие. Необходимость со-
здания подобного учебного пособия продиктована изменением в
последние 10—15 лет требований к курсам цитологии и цитогене-
тики растений и полным отсутствием учебников и учебных посо-
бий подобного типа.
При написании пособия мы основывались на компетенции
каждого из авторов в том или ином вопросе и совместимости их
взглядов на целесообразность выбора того или иного метода.
Введение написано А. А. Соловьевым, глава 1 — В. Н Карце-
вым и А. А. Соловьевым; глава 2 — В. А. Пухальским, Е. Д. Бадае-
вой и А. А. Соловьевым, главы 3, 4, 5 — В. А. Пухальским и
А. А. Соловьевым, главы 6, 7 — Е. Д. Бадаевой, глава 8 — В. А. Пу-
хальским, глава 9 — В. А. Пухальским и А. А. Соловьевым, гла-
ва 10— В. А. Пухальским, В. Н. Юрцевым и А. А. Соловьевым,
глава 11 и предметный указатель — А. А. Соловьевым, приложе-
ния 1, 2, 3 — В. А. Пухальским, список литературы — Е. Д. Бадае-
вой и А. А. Соловьевым.
Авторы надеются, что изложенные в учебном пособии методы
исследований будут полезны также аспирантам, начинающим
преподавателям, а также специалистам, проводящим исследова-
ния в области цитологии и цитогенетики растений.
Авторы будут благодарны за все замечания и пожелания, кото-
рые просим направлять по адресу:
127550 Москва, ул. Тимирязевская, 49, Российский государ-
ственный аграрный университет — МСХА имени К. А. Тимирязе-
ва, кафедра генетики. E-mail: genetics@timacad.ru.
В. Пухальский
А. Соловьев
Е. Бадаева
В. Юрцев
ВВЕДЕНИЕ
Становление цитологии неразрывно связано с изоб-
ретением микроскопа и развитием микроскопии. Созда-
ние этого важного не только для биологии прибора
было подготовлено прежде всего развитием оптики.
Хотя некоторые оптические свойства изогнутых поверх-
ностей были известны еще Евклиду (300 лет до н. э.), их
увеличительная способность не нашла практического
применения. В связи с этим первые очки были изобре-
тены лишь в 1285 г. С. Арлеати в Италии. В XVI в. Лео-
нардо да Винчи и Мауролико показали, что малые
объекты лучше изучать с помощью лупы. В 1590 г. в
Нидерландах потомственные оптики 3. и X. Янсены
смонтировали две выпуклые линзы внутри одной труб-
ки, т. е. фактически создали первый микроскоп с уве-
личением от 3 до 10 раз и заложили основы для созда-
ния сложных микроскопов. Каждый следующий мик-
роскоп был значительно совершеннее предыдущих. В
конце XVI в. микроскопы датских, английских и италь-
янских конструкторов постепенно распространялись,
закладывая фундамент современной микроскопии.
Именно в это время появилось название этого опти-
ческого прибора — микроскоп (от греческих микрос —
небольшой и скопео — рассматриваю), и он вошел в
обиход медиков.
Первым ученым, увидевшим в микроскоп клетки,
стал Р. Гук, который описал клеточное строение проб-
ковой ткани и ввел термин «клетка». С улучшением оп-
тики в 1674 г. А. ван Левенгук изготовил линзы с увели-
чением, достаточным для проведения простых научных
наблюдений. Следует отметить, что в XVII в. наряду с
Левенгуком еще несколько ученых занимались усовер-
шенствованием микроскопа. Так, Г. Галилей (1610)
сконструировал микроскоп, представляющий собой со-
четание линз в свинцовой трубке. Декарт в своей книге
«Диоптрика» (1637) описал сложный микроскоп, со-
5
ставленный из двух линз — плоско-вогнутой (окуляр) и
двояковыпуклой (объектив).
Как самостоятельная наука цитология определилась
к концу XIX — началу XX в. Это было обусловлено тех-
ническим усовершенствованием микроскопа. Следует
отметить, что именно в середине XIX в. была сформули-
рована клеточная теория. Совершенствование экспери-
ментальных методов сопровождалось развитием учения
о клетке. Окончательно теория клеточного строения
организмов была сформулирована к середине XIX в.,
что связано прежде всего с именами Мейена (1830),
М. Шлейдена (1838), Т. Шванна (1839) и Р. Вирхова
(1858).
В конце XIX — начале XX в. благодаря успехам в раз-
витии микроскопической техники, усовершенствова-
нию оптики, разработке новых фиксаторов и красите-
лей стало возможным описание строения клетки, струк-
туры ее ядра и выявление органоидов. В 70—90-е гг.
XIX в. было открыто непрямое деление соматической
клетки, или митоз (В. Шлейхер, 1882), описаны стадии
этого деления (В. Флеминг, 1882; М. Гейденгайн, 1894).
Ядерные элементы получили название хромосом
(В. Вальдейер, 1888). Именно в эти годы было установ-
лено, что каждый организм имеет постоянное число
хромосом и что у разных видов они отличаются друг от
друга (К. Рабль, Е. Ван-Бенеден, Т. Бовери), описано
явление мейоза у животных (Е. Ван-Бенеден, 1884) и
растений (В. Беляев, 1898), слияние сперматозоида с яд-
ром яйцеклетки у иглокожих (О. Гертвиг, 1875), покры-
тосеменных (Е. Страсбургер, 1875) и голосеменных
(Н. Горожанкин, 1880—1883) растений. Было показано,
что в отличие от соматических клеток в процессе разви-
тия половых клеток — мейозе — происходит редукция
числа хромосом, а при оплодотворении оно восстанав-
ливается.
Формирование и развитие цитогенетики как отдель-
ной области науки происходило на фоне открытия веду-
щей роли хромосом в хранении и передаче наследствен-
ной информации. Обнаружение постоянства числа хро-
мосом, поддерживаемого в ряду поколений мейотичес-
ким делением, а также связи между наследованием
менделевских признаков и расхождением хромосом в
мейозе; фенотипических эффектов, наблюдаемых у по-
липлоидных растений; появление хромосомной теории
Т. Моргана — это первые шаги цитогенетики, которые
сопровождались бурным развитием методов фиксации
материала и изготовления цитологических препаратов.
6
Первый период развития цитогенетики связан прежде
всего с определением числа хромосом и их размеров, а в
дальнейшем с изучением дополнительных характерис-
тик хромосом. Разработка метода дифференциального
окрашивания позволила не только решить проблемы
идентификации морфологически близких хромосом, но
и проводить их картирование. Большой вклад в разви-
тие цитологии и цитогенетики внесли отечественные
ученые, среди которых такие корифеи науки, как Г. Ле-
витский, С. Навашин, Л. Делоне, М. Навашин, А. Ни-
колаева, О. Сорокина, Г. Карпеченко и др. Особое зна-
чение имели работы С. Навашина и Г. Левитского по
изучению морфологии хромосом и работы М. Навашина
по цитологии межвидовых гибридов, эксперименталь-
ному получению структурных изменений хромосом с
использованием рентгеновских лучей и амфипластии.
В настоящее время происходит интенсивное разви-
тие молекулярной цитогенетики — направления, объе-
диняющего классический цитогенетический анализ и
современные достижения молекулярной биологии. Ме-
тод гибридизации нуклеиновых кислот in situ позволил
идентифицировать положение гена на конкретном участ-
ке хромосомы, выявлять наличие генетического мате-
риала от других видов при использовании отдаленной
гибридизации. Среди методов микроскопии широкое
распространение получили флуоресцентная микроско-
пия с использованием специфических красителей —
флуорохромов; конфокальная микроскопия, позволяю-
щая значительно повысить эффективную разрешающую
способность; проточная цитофотометрия, применение
которой позволяет проводить работы с отдельными хро-
мосомами и компонентами клетки. Наряду со световой
микроскопией для изучения тончайшей структуры хро-
мосом используется электронная микроскопия. Широ-
кое распространение цитогенетических методов сопро-
вождается автоматизацией проведения анализов с ши-
роким внедрением компьютерных программ фиксации
и анализа изображений.
Основные задачи цитогенетического анализа — до-
стоверная идентификация хромосом, отдельных их уча-
стков и выявление взаимосвязи между структурной орга-
низацией хромосом и морфологическими, физиологи-
ческими, биохимическими и другими признаками орга-
низма. При этом важное значение имеет изучение
строения, функционирования и репродукции хромосом,
генетического контроля их поведения в митотическом и
мейотическом делениях, цитогенетической нестабиль-
7
ности. Достигнутые здесь успехи способствовали разви-
тию частной генетики сельскохозяйственных культур и
эффективному использованию в селекционном процес-
се дикорастущих форм, геномных, хромосомных и ген-
ных мутаций. Примером использования достижений
хромосомной инженерии в селекционной практике мо-
жет служить создание форм с определенным набором
хромосом (сорта с замещениями хромосом у тритикале,
сорта пшеницы, капусты, томата и т. д. с интрогрессия-
ми от других культурных и дикорастущих видов). Кроме
того, цитогенетический метод играет важную роль в мо-
ниторинге и оценке влияния загрязнения окружающей
среды на наследственный аппарат растений, животных
и человека.
Г л а в a 1
ОСОБЕННОСТИ РАБОТЫ С МИКРОСКОПОМ
ПРИ ЦИТОЛОГИЧЕСКИХ И ЦИТОГЕНЕТИЧЕСКИХ
ИССЛЕДОВАНИЯХ
1.1. УСТРОЙСТВО МИКРОСКОПА И РАБОТА С НИМ
В ПРОХОДЯЩЕМ СВЕТЕ
Для проведения тонких цитологических и эмбриологических
исследований можно использовать далеко не все марки микроско-
пов. Из отечественных микроскопов для этих целей наиболее при-
годны МБИ-3, МБР-3, МБИ-6, МБИ-11, «Биолам», а такж*е серия
микроскопов Микмед-1.
Микроскоп для цитологических исследований должен иметь
набор из 4—7 высокоапертурных объективов апохроматов, в том
числе объективов 90х с нумерической (числовой) апертурой (NA)
1,3—набор компенсационных окуляров; апланатический кон-
денсор прямого и косого освещения с NA не менее 1,4; штатив;
механизмы фокусировки объективов и перемещения препаратов;
бинокулярную насадку для наблюдения в микроскоп обоими гла-
зами, набор светофильтров, а также точную центрировку всех оп-
тических и механических деталей микроскопа. Кроме того, мик-
роскоп должен быть оснащен осветителем, который может быть
как вынесенным (ОИ-9м для МБР-3), так и встроенным (у микро-
скопов МБИ-6, МБИ-11, Микмед-1 вариант 2). Освещение уста-
навливают в соответствии с принципом Келера, который заключается
в обеспечении условий для максимального использования апертур
оптических компонентов микроскопа, т. е. в создании условий на-
блюдения, при которых числовые апертуры конденсора и объек-
тива совпадают.
Устройство микроскопа наглядно показано на рисунках 1.1 и
1.2. Кроме того, для работы в проходящем свете могут быть ис-
пользованы:
устройство для наблюдения по методу фазового контраста;
конденсор темного поля ОИ-13 для освещения объектов по
методу темного поля;
комплект поляфильтров для работы в поляризованном свете.
При работе с микроскопом можно:
фотографировать микрообъекты с помощью микрофотонаса-
док с монокулярным (МФН-12) или бинокулярным наблюдением
(МФН-11), либо с использованием цифровых фото- и видеокамер;
зарисовывать и проецировать изображение с помощью ри-
совально-проекционного аппарата РА-7;
9
Рис. 1.2. Устройство микроскопа
Микмед-1 с встроенным осветителем:
в £
1 — окуляры; 2 — бинокулярная насадка;
3 — револьверное устройство; 4 — объектив;
5 — предметный столик; 6 — конденсор;
7— корпус коллекторной линзы; 8 — пат-
рон с лампой; 9 — шарнир; 10 — рукоятка
перемещения кронштейна конденсора; 11 —
рукоятка тонкой фокусировки; 12— руко-
ятка грубой фокусировки; 13 — тубусодер-
жатель; 14 — выключатель; 15 — адаптер;
16 — гнездо для подключения штекера ис-
точника электропитания; 17— штекер
Рис. 1.1. Устройство микроскопа
с зеркалом:
1 — окуляры; 2 — бинокулярная насад-
ка; 3 — револьверное устройство; 4 —
объектив; 5 — предметный столик; 6 —
конденсор; 7 — зеркало; 8 — рукоятка
перемещения кронштейна конденсора;
9— рукоятка тонкой фокусировки; 10—
рукоятка грубой фокусировки; 11 — ту-
бусодержатель; 12 — винт для крепле-
ния насадки
производить измерения с помощью микрометра;
указывать отдельные детали объекта с помощью демонстра-
ционного окуляра АТ-34.
Рассмотрим устройство микроскопа. Визуальная насадка
микроскопа, как правило, бинокулярная (рис. 1.3). Она позволяет
устанавливать расстояние между осями окулярных тубусов в соот-
ветствии с глазной базой наблюдателя в диапазоне от 54 до 72 мм
(на рисунке возможность изменения этого расстояния показана
стрелками). В левом окулярном тубусе имеется диоптрийный меха-
низм, который с помощью вращения кольца 2 позволяет компенси-
ровать ошибку наблюдателя от плюс 5 до минус 5 дптр. Окулярные
10
Рис. 1.3. Устройство бинокулярной насадки:
1 — окулярные тубусы; 2 — кольцо диоптрийного
механизма; 3 — окуляры; 4 — оправа для установ-
ки поляфильтра -анализатора
тубусы имеют наклон 45°. Увеличе-
ние бинокулярной насадки — 1,5х.
В комплект микроскопа может
входить монокулярная насадка (рис.
1.4.), которая позволяет проводить
исследование объектов только од-
ним глазом. В отличие от биноку-
лярной насадки она имеет увеличе-
ние, равное Iх. При использовании такой насадки можно приме-
нять поляфильтры для исследования в поляризованном свете. При
работе с объективами, рассчитанными на длину тубуса, отличаю-
щуюся от стандартной 160 мм, применяется вертикальная насадка
с прямым выдвижным тубусом (рис. 1.5). С помощью шкалы на
выдвижном тубусе 2 устанавливается механическая длина тубуса,
на которую рассчитан объектив.
Окуляры, входящие в комплект микроскопа, могут иметь
различное увеличение и позволяют проводить наблюдения в по-
лях зрения разного диаметра (табл. 1.1). Окуляры увеличивают со-
здаваемое объективами изображение. Маркировка окуляра позво-
ляет определить его увеличение, а в некоторых случаях — диаметр
поля зрения (рис. 1.6). Для измерений в фокальную плоскость
Рис. 1.4. Устройство монокуляр-
ной насадки:
1 — окуляр; 2 — окулярный тубус; 3 —
оправа с резьбой для установки поля-
фильтра-анализатора
Рис. 1.5. Устройство
вертикальной насадки:
1 — вертикальная насадка;
2 — выдвижной тубус со
шкалой
11
Рис. 1.6. Маркировка окуляров:
К — компенсационный; 7е, 10х —
видимое увеличение, 18 — диаметр
видимого поля зрения
окуляра могут быть вставлены шкала или сетка (рис. 1.7). При де-
монстрации интересующего участка объекта может использовать-
ся окуляр с указателем.
1.1. Характеристика некоторых окуляров
Маркировка
окуляра ,
Увеличение
Диаметр поля
зрения, мм
К5Х
К7Х
К10*
К10х/18
К15х
К204
5 22
7 18
10 13
10 18
15 11
20 9
Рис. 1.7. Шкала (7) и сетка (2) измерительного
окуляра КТ*
12
Рис. 1.8. Револьверное устройство:
1 — тубусодержатель; 2 — винт; 3 — конусная
поверхность; 4 — револьверное устройство
Револьверное устрой-
ство обеспечивает установку че-
тырех объективов (рис. 1.8). Сме-
на объективов производится вра-
щением револьверного устрой-
ства за конусную поверхность 3
до фиксированного положения.
Правильное положение револь-
верного устройства относительно оси тубуса обеспечено при юсти-
ровке микроскопа с помощью винта 2. Винт служит упором и дол-
жен упираться в тубусодержатель 1.
Объективы выполняют главную функцию: в их системе
линз формируется первичное изображение, которое передается в
окуляры. Объективы рассчитаны на механическую длину тубуса
160 мм, линейное поле в плоскости изображения 18 мм и толщи-
ну покровного стекла 0,17 мм. Характеристики некоторых объек-
тивов указаны в таблице 1.2. Маркировка объективов представ-
лена на рисунке 1.9. Важное значение имеет полное или частич-
ное отсутствие в объективе оптических аберраций, которые мо-
гут привести к тому, что изображение объекта может быть
искаженным вследствие его размытости, искривления, окрашен-
ности.
1.2. Некоторые характеристики объективов
№
п/п
Объективы (увеличение, числовая апертура,
наличие иммерсии)
1. Планахроматы
9 х 0,20
10 х 0,20
Рабочее расстояние,
мм
13,13
13,13
2. Ахроматы
8 x 0,20 8,53
20x0,40 1,70
40 х 0,65 0,41
85 x 1,00 (ВИ)* 0,18
90 х 1,25 (МИ)** 0,10
3. Апохроматы
10 х 0,30 4,80
20 х 0,65 0,67
90x 1,3 0,12
* Водная иммерсия.
* * Масляная иммерсия.
Рис. 1.9. Маркировка объективов:
I — увеличение; 2 — тип оптической коррекции (ПЛАН — объективы-ахроматы с плоским
полем, АПО — объективы- апохроматы); 3 — числовая апертура; 4 — иммерсионная среда
(МИ — масляная иммерсия, ВИ — водная иммерсия); 5 — цветовая маркировка иммерсион-
ных объективов {черное кольцо — масляная иммерсия)
Глубина резкости изображения (глубина фокуса) — способность
объектива одновременно давать резкие изображения точек, нахо-
дящихся от него на разном расстоянии, или глубина препарата,
видимая одновременно резко. Каждый объектив позволяет видеть
препарат на определенную глубину в одной плоскости. На боль-
шом увеличении необходимо поочередно фокусировать объектив
в разных плоскостях. На малых увеличениях и малой апертуре глу-
бина резкости больше, чем при больших увеличениях. Показатель
глубины резкости следует особенно учитывать при микрофотогра-
фии, когда необходимо четко видеть изображение объекта в одной
плоскости зрения.
При работе с объективами следует соблюдать осторожность,
чтобы не повредить линзы. Особенно это важно при работе с
объективами с большим увеличением, для которых рабочее рас-
стояние (расстояние между поверхностью покровного стекла и
линзой объектива) составляет 0,10—0,12 мм.
Качество микроскопа определяется не увеличением, а разреша-
ющей способностью оптических устройств. Разрешающая способ-
ность объектива микроскопа (d) — наименьший диаметр частицы,
которую можно увидеть при данном объективе, или то наименьшее
расстояние между двумя линиями, при котором они видны как
отдельные.
Разрешающая способность объектива микроскопа зависит от
значений нумерической (числовой) апертуры (NA) объектива и кон-
денсора и длины волны источника света (X). Для пучка лучей, па-
раллельных оптической оси микроскопа, разрешающую способ-
ность объектива микроскопа определяют по формуле
(1.1)
Для наклонных лучей разрешающая способность в 2 раза выше:
2№4‘
(1.2)
Длина волны лучей источника света в видимой части спектра
может меняться от 0,4 мкм (400 нм) для фиолетовых лучей до
0,7 мкм для красных. Следовательно, чем короче длина волны лу-
чей источника света и чем больше нумерическая апертура объек-
тива, тем выше разрешающая способность объектива микроскопа,
т. е. тем более тонкие структуры мы сможем увидеть в микроскоп.
При освещении объекта наклонными лучами разрешающая спо-
собность объектива микроскопа в 2 раза выше, чем при освеще-
нии прямо падающими лучами. Освещая препарат синими лучами
(X = 0,47 мкм), т. е. применяя в осветителе синий светофильтр,
можно изучать более тонкие структуры, чем при освещении обыч-
ным белым светом.
Пример: для объектива с NA = 1,4 при освещении белым светом
(X = 0,55 мкм) диаметр наименьшей видимой частицы при прямо
падающем свете равен 0,39 мкм, при косом освещении —
0,20 мкм, а при освещении синим светом — 0,34 и 0,17 мкм соот-
ветственно. Максимальное разрешение, которое можно получить
при использовании светового микроскопа, 0,20—0,35 мкм. Увели-
чить разрешающую способность можно при использовании ульт-
рафиолетового света (длина волны 0,26—0,28 мкм), что позволяет
получить разрешение 0,13—0,14 мкм.
Нумерическая (числовая) апертура (NA) — величина, характери-
зующая светособирающую способность объектива, которая опре-
деляется произведением показателя преломления среды (и), нахо-
дящейся между передней (фронтальной) линзой объектива и по-
кровным стеклом препарата, на синус половины угла входного от-
верстия объектива — sin а, где а — половина угла входного
отверстия объектива (рис. 1.10).
В случае сухих объективов (без ис-
пользования жидких сред — иммерсии)
коэффициент преломления равен еди-
нице (п = 1) и NA < 0,95.
Иммерсионная система — объектив
микроскопа, у которого пространство
между фронтальной линзой и рассмат-
риваемым предметом заполнено жидко-
стью с более высоким показателем пре-
ломления, чем воздух. Для иммерсион-
Рис. 1.10. Угол отверстия объектива микроскопа:
Об — объектив; Кн — конденсор; Р — плоскость препара-
та; d — диафрагма; F — фокальная плоскость; а — угол
отверстия объектива
15
ных объективов нумерическая апертура зависит от показателя
преломления жидкости, находящейся между препаратом и объек-
тивом. Поэтому для водно-иммерсионных объективов NA < 1,25
(вода имеет п = 1,33), а для масляно — иммерсионных объективов
NA< 1,4 (кедровое масло имеет п = 1,515). На рисунке 1.11 пред-
ставлен ход лучей при использовании масляной иммерсии и сухо-
го объектива. Как видно из этого рисунка, в сухой системе некото-
рая часть лучей не попадает в объектив, так как при выходе из
покровного стекла они отклоняются. Лучи, которые в месте вы-
хода к поверхности стекла образуют угол больше 41 ° (предельный
угол), полностью отражаются. Для стекла и воды предельный угол
равен 4Г, для кедрового масла и стекла он не существует по при-
чине равенства показателей их преломления. Для улучшения каче-
ства изображения часто применяется полная иммерсия, когда им-
мерсионную жидкость наносят и на конденсор.
При работе с иммерсионными объективами следует соблюдать
осторожность, чтобы при опускании тубуса не повредить линзу.
Иммерсионную жидкость наносят между линзой и объективом
в виде капли на поверхность покровного стекла препарата и, опус-
кая затем тубус, погружают линзу в каплю иммерсии. Иммерсион-
ную жидкость можно нанести и на поверхность линзы объектива
либо по капле и на препарат, и на объектив. Главное требова-
ние — создание иммерсии без пузырьков воздуха.
Аберрации оптики микроскопа могут быть
разного типа. Сферическая аберрация — изображение точки переда-
ется в виде кружка рассеяния. Астигматизм — изображение точ-
ки передается в виде кружка рассеяния эллипсоидной формы.
Кома — резкость изображения снижается от центра к границе
поля зрения. Кривизна поля зрения не позволяет одновременно ви-
деть резко центр и края поля зрения. Дисторсия — нарушения по-
добия между объектом и его изображением вследствие разного ли-
нейного увеличения на краях и в центре поля зрения. Хроматичес-
кие аберрации — хроматизм увеличения и хроматизм положения.
Хроматизм положения — изображения, созданные разными цвета-
ми, располагаются на неодинаковом расстоянии от оптической
системы. Хроматизм увеличения —
изображения находятся в одной
плоскости, но имеют неодинако-
вые размеры.
Высококачественные объективы-
апохроматы изготавливают с высо-
Рис. 1.11. Сравнение хода лучей при исполь-
зовании сухого (слева) и иммерсионного
(справа) объективов. В случае иммерсионного
объектива применяется масло (л = 1,5)
16
Рис. 1.12. Установка конденсора:
1 — кронштейн; 2 — винт крепления конденсора;
3 — конденсор; 4 — рукоятка перемещения крон-
штейна с конденсором
кой нумерической апертурой. В
них устранены сферическая и хро-
матическая аберрации. Объекти-
вы-апохроматы применяются в
сочетании с компенсационными
окулярами.
До упора
Окуляр для работы с микроскопом {правило подбора окуляра)
следует выбирать так, чтобы общее увеличение микроскопа не
превышало 1000 NA, т. е. предельную величину полезного увели-
чения микроскопа. Например, при объективе 90х с нумерической
апертурой 1,3 полезное увеличение микроскопа составит 1300 раз,
поэтому не рекомендуется применять окуляры с увеличением
больше 15х. Если нарушить это правило и применять окуляр 20х
или более сильный, то мы не увидим в рассматриваемых структу-
рах дополнительных деталей, более того, из-за дифракции на
контурах элементов объекта появятся световые окаймления, что
не только ухудшит изображение, но и может привести к оптичес-
ким ошибкам.
Для полного использования оптических возможностей объек-
тивов высококачественных микроскопов необходимо устанавли-
вать освещение препарата в соответствии с принципом Келера.
Только в случае соответствия апертур коллектора осветителя, кон-
денсора и объектива разрешающая способность оптики микроско-
па используется полностью.
Конденсор обеспечивает освещение полей на объекте при
работе с объективами с увеличением от 3,5 до 100х. Установка кон-
денсора в кронштейн показана на рисунке 1.12.
Конденсор ОИ-14 (рис. 1.13) кроме прямого освещения объек-
та обеспечивает косое, что позволяет получить более рельефное и
контрастное изображение. Для установки косого освещения нуле-
вое деление шкалы 6 (ирисовая апертурная диафрагма) смещается
Рис. 1.13. Устройство конденсора ОИ-14:
1 — линза в оправе (№1=1,4); 2 — кольцо; 3 —
рукоятка регулировки открытия ирисовой апер-
турной диафрагмы; 4 — откидная рамка для ма-
тового стекла, светофильтра или поляфильтра;
5 — индекс; 6 — шкала; 7 — рукоятка смещения
апертурной ирисовой диафрагмы; 8 — линза в
оправе (М4=0,3)
17
2 В. А. Пухальский и др.
Рис. 1.14. Устройство прямоугольного
столика с координатным перемещением
объекта:
1,3 — держатели объекта; 2 — винты для
крепления держателей; 4 — рукоятка переме-
щения объекта в поперечном направлении;
5— рукоятка перемещения объекта в*про-
дольном направлении
от индекса 5 с помощью руко-
ятки 7. Предел смещения —
10 мм. В комплект конденсора
входят две сменные линзы 1
(NA = 1,4) и 8 (№4 = 0,3). При установленной линзе 1 в оправе
конденсор имеет апертуру 1,4 и используется для работы с объек-
тивами с увеличением в 20 раз и более. Значение нумерической
апертуры указывают на оправе объективов и конденсора. Совре-
менные конденсоры имеют числовую апертуру не менее 1,2—1,4.
Фокусирование на объект осуществляют перемещением тубусо-
держателя. Грубую фокусировку производят вращением рукояток
макровинта, расположенных по обеим сторонам тубусодержателя.
Диапазон грубой фокусировки микроскопа — 40 мм. Тонкую фо-
кусировку производят с помощью микровинта, выполненного в
виде диска с накаткой. Один оборот диска соответствует переме-
щению тубусодержателя на 0,5 мм, а вращение диска от упора до
упора — не менее 2 мм. Перед началом работы необходимо уста-
новить рукоятку тонкой фокусировки приблизительно в среднее
положение.
Препарат крепят на предметном столике с помо-
щью клемм или держателей (рис. 1.14). Предметные столики мо-
гут быть различной формы, вращаемыми, оснащенными препара-
товодителями с координатным перемещением объекта. В после-
дних держатели можно перемещать относительно друг друга (в за-
висимости от размера предметного стекла) при помощи винтов 2.
Координаты объекта и величину перемещения отсчитывают по
шкалам с ценой деления 1 мм и нониусам с ценой деления 0,1 мм.
Диапазон перемещения объекта в поперечном направлении
40 мм, в продольном — 80 мм.
Осветительные устройства могут быть вынесен-
5 4 3 2 1
ными, накладными и встроен-
ными. В случае вынесенного ос-
ветителя используется зеркало.
Рис. 1.15. Установка патрона с лампой
в шарнир в основании микроскопа:
1 — шарнир; 2 — галогенная лампа; 3 — кон-
тактные пластины; 4 — выступ; 5 — рукоятка
18
Оно имеет две отражающие поверхности: плоскую и вогнутую.
Вогнутую поверхность используют при естественном освещении,
в отдельных случаях она может служить для повышения освещен-
ности объекта. Накладные осветители ОИ-32М или ОИ-35 встав-
ляют в посадочное гнездо в основании микроскопа. Встроенный в
основание микроскопа осветитель включает галогенную лампу,
коллекторную линзу, вблизи фокуса которой располагается нить
лампы. Установка лампы показана на рисунке 1.15.
1.2. НАСТРОЙКА ОСВЕЩЕНИЯ В МИКРОСКОПЕ
1.2.1. НАСТРОЙКА ОСВЕЩЕНИЯ В МИКРОСКОПЕ
С ВЫНЕСЕННЫМ ОСВЕТИТЕЛЕМ
В соответствии с принципом Келера при установке освещения
для микроскопа типа МБИ-3, а также микроскопов серии Микмед
с вынесенным осветителем необходимо руководствоваться следу-
ющими правилами.
1. Устанавливают осветитель ОИ-19 (или 0И-9м) перед микро-
скопом с помощью соединительной планки, что обеспечивает
нормальное расстояние микроскопа от осветителя. Включают его
через трансформатор в сеть и, поворачивая корпус, направляют
световой поток на плоское зеркало микроскопа.
2. Поднимают конденсор микроскопа в верхнее положение и
полностью закрывают его диафрагму.
3. Уменьшают диаметр отверстия ирисовой диафрагмы освети-
теля до 1—2 мм.
4. Перемещая патрон лампочки осветителя вдоль оси и одно-
временно поворачивая зеркало микроскопа и корпус осветителя,
добиваются получения изображения нити лампочки на закрытой
диафрагме конденсора. При этом центр изображения нити лам-
почки должен находиться в центральной части ирисовой диа-
фрагмы.
5. Открывают отверстие диафрагмы конденсора и осветителя.
6. Уменьшают яркость свечения нити лампочки при помощи
реостата.
7. Помещают исследуемый препарат на предметный столик
микроскопа, ставят необходимый объектив в рабочее положение
и, глядя в окуляры бинокулярной насадки микроскопа, перемеще-
нием тубуса фокусируют оптику микроскопа на объект.
8. Почти полностью закрывают диафрагму осветителя и пере-
мещением конденсора добиваются резкого изображения диафраг-
мы осветителя в поле зрения микроскопа.
9. Поворотом зеркала центрируют изображение диафрагмы осве-
тителя, а затем открывают ее настолько, чтобы изображение диаф-
рагмы было равно (или немного больше) полю зрения микроскопа.
2*
19
10. Вынимают один окуляр и, глядя в тубус микроскопа, умень-
шают диафрагму конденсора до едва заметного появления ее краев
на фоне светлого кружка задней линзы объектива.
11. Помещают окуляр на место. В прорези осветителя вставля-
ют синее и матовое стекла. Затем, глядя в микроскоп, при помощи
реостата осветителя устанавливают необходимую освещенность
препарата.
12. Исследуют препарат.
W
Примечания. 1. При работе с низкоапертурными объективами малого
увеличения (10х и меньше) перед настройкой освещения устанавливают сменный
низкоапертурный конденсор или, если это позволяет конструкция конденсора,
отделяют (отвинчивают) его верхнюю линзу.
2. Пункт 7 можно выполнить в самом начале при произвольно установленном
освещении, а затем внести коррективы в соответствии с принципом Келера.
1.2.2. НАСТРОЙКА ОСВЕЩЕНИЯ В МИКРОСКОПЕ
СО ВСТРОЕННЫМ В ОСНОВАНИЕ ОСВЕТИТЕЛЕМ
Порядок настройки микроскопа со встроенным осветителем.
1. Устанавливают матовое стекло в откидную рамку конденсора.
2. Вводят в ход лучей объектив меньшего увеличения (10х и
менее).
3. Вводят в ход лучей матовое стекло и откидную линзу кон-
денсора.
4. Поднимают рукояткой кронштейн с конденсором до упора и
полностью раскрывают апертурную диафрагму конденсора.
5. Устанавливают патрон с лампой в шарнир до упора.
6. Устанавливают лампу таким образом, чтобы ее нить распола-
галась горизонтально.
7. Подключают источник питания к сети и включают лампу.
8. Фокусируют микроскоп на резкое изображение препарата,
установленного на предметном столике.
9. Перемещая патрон с лампой за рукоятку вдоль оси и разво-
рачивая его вместе с шарниром в горизонтальной плоскости, до-
биваются наиболее яркого и равномерного освещения поля зре-
ния микроскопа.
10. При работе с другим объективом повторяют настройку ос-
вещения.
11. ВНИМАНИЕ! При работе с объективами с увеличением бо-
лее 10х откидная линза конденсора должна быть выведена из хода
лучей.
1.3. ПРАВИЛА РАБОТЫ С МИКРОСКОПОМ
Микроскоп необходимо содержать в чистоте и предохранять от
повреждений. В нерабочем состоянии микроскоп должен быть на-
крыт чехлом.
20
Особое внимание следует обращать на чистоту объективов и
других оптических деталей.
ВНИМАНИЕ! Нельзя касаться пальцами поверхностей линз.
Для предохранения оптических деталей визуальной насадки от
пыли следует оставлять окуляры в тубусах или надевать на них
колпачки.
Оптические поверхности окуляров, объективов и конденсора
можно осторожно протирать чистой ватой, навернутой на дере-
вянную палочку и смоченной специальной жидкостью для чистки
оптических деталей.
При загрязнении внутренних поверхностей линз объектива не-
обходимо объектив отправить для чистки в оптическую мастер-
скую.
ВНИМАНИЕ! Запрещается самим разбирать объективы, оку-
ляры, конденсор.
1.4. НАИБОЛЕЕ РАСПРОСТРАНЕННЫЕ ОШИБКИ
ПРИ РАБОТЕ С МИКРОСКОПОМ
Рассмотрим важнейшие погрешности при работе с микроско-
пом, чтобы начинающие исследователи не допускали их с самых
первых шагов, добиваясь таким образом максимального использо-
вания возможностей микроскопа. К таким ошибочным действиям
необходимо отнести следующие.
1. Одновременное применение вогнутого зеркала и конденсо-
ра, что нарушает принцип освещения препарата.
2. Использование высокоапертурных конденсоров с NA = 1,2 —
—1,4 с низкоапертурными объективами с NA = 0,2 — 0,4 ухудшает
качество изображения. Для устранения этой ошибки следует пред-
варительно уменьшить нумерическую апертуру конденсора путем
снятия (отвинчивания) его верхней линзы.
3. Произвольное опускание конденсора без учета толщины
предметного стекла может привести к появлению артефактов.
4. Регулировка освещенности поля зрения микроскопа при по-
мощи опускания и поднятия конденсора, поскольку это влияет на
качество изображения.
5. Произвольное изменение величины отверстия апертурной
диафрагмы конденсора с целью регулировки освещенности поля
зрения микроскопа. :
6. Пренебрежение нейтральными светофильтрами и матовыми
стеклами для регулировки освещенности поля зрения микроско-
па, что ухудшает восприятие препарата и может оказывать отрица-
тельное влияние на зрение исследователя.
7. Применение толстых предметных стекол (толще 1,2 мм), что
препятствует правильной установке освещения при высокоапер-
турных объективах, поскольку при этом не удается сфокусировать
конденсор на объекте.
21
8. Применение покровных стекол несоответствующей толщи-
ны (толще или тоньше 0,17 мм).
9. Пренебрежение созданием полной иммерсии при работе с
объективами, имеющими нумерическую апертуру более 1,2, что не
позволяет полностью использовать нумерическую апертуру объек-
тива.
1.5. МЕРЫ БЕЗОПАСНОСТИ ПРИ РАБОТЕ
С МИКРОСКОПОМ
При работе с микроскопом с осветителем следует соблюдать
меры безопасности, соответствующие мерам, принимаемым при
эксплуатации электроустановок напряжением до 1000 В.
ВНИМАНИЕ! Замену лампы в осветителе микроскопа произ-
водить только при отключении от электрической сети. Во избежа-
ние ожога кожи рук о колбу лампы или контактные пластины пат-
рона замену лампы следует производить через 15—20 мин после ее
перегорания.
Замену плавкой вставки (предохранителя) в микроскопе следу-
ет производить при отключенном от сети микроскопе.
После работы на микроскопе с осветителем необходимо отклю-
чить его от сети.
Не рекомендуется оставлять без присмотра включенный в сеть
микроскоп.
1.6. МЕТОД СВЕТЛОГО ПОЛЯ
Метод светлого поля — один из наиболее распространенных и
доступных методов наблюдения. Используется для исследования
прозрачных объектов. Изображение создается за счет неодинако-
вого поглощения пучков света, проходящих через препарат, участ-
ками с разной плотностью. В данном случае речь идет о микроско-
пии в проходящем свете, при которой пучок света от источника
(осветителя) концентрируется в конденсоре и подается на препа-
рат. При прохождении света через препарат формируется изобра-
жение объекта, которое увеличивается в объективе, а затем в оку-
лярах. Лучше всего использовать этот метод для изучения окра-
шенных постоянных препаратов срезов или давленых препаратов
тканей растений. Непрозрачные объекты можно исследовать в па-
дающем (отраженном) свете, в этом случае пучок света падает на
препарат из объектива, который служит конденсором и, отража-
ясь, вновь попадает в объектив.
Для получения информации о рельефном изображении объек-
та, а также для улучшения контрастности препарата используют
метод косого освещения. В данном случае происходит отклонение
пучка света за счет смещения апертурной диафрагмы.
22
1.7. МЕТОД ТЕМНОГО ПОЛЯ
В основе метода лежит дифракция световых волн, возникаю-
щая на каждом препятствии для светового луча. Из-за дифракции
световых волн на границах мельчайших частиц (размеры которых
могут быть даже меньше длины световой волны) они становятся
как бы самостоятельными источниками излучения. При микро-
скопировании в проходящем свете этот дифракционный свет пере-
крывается более ярким недифракционным, и мы его не видим.
Если в обычном микроскопе препарат осветить косыми лучами,
не попадающими в объектив, а на пути прямых лучей, которые
попадают в объектив, поставить препятствие в виде черного круж-
ка, то мы получим эффект темного поля, на котором будет видно
свечение дифрагированным светом мельчайших (ультрамикроско-
пических) частиц цитоплазмы клеток (рис. 1.16). Явление, кото-
рое мы наблюдаем при микроскопировании в темном поле, по-
добно свечению мельчайших пылинок в темной комнате, когда на
них падает солнечный луч.
Освещение косыми лучами на темном поле, как и использова-
ние наклонных лучей (формула 1.2), в 2 раза повышает разрешаю-
щую способность объективов микроскопа.
Метод темного поля позволяет наблюдать тончайшие измене-
ния дисперсности коллоидов цитоплазмы при действии различ-
ных факторов, отличать погибшие клетки от живых, наблюдать
движение цитоплазмы, мелкие объекты, особенно если они под-
вижны, и т. д. Кроме того, этот метод может быть использован
при изучении действия различных факторов на физиологическое
состояние цитоплазмы в растущих пыльцевых трубках или при
изучении клеток рыльца пестиков у злаков и других полупрозрач-
ных живых клеток. Однако в целом следует отметить, что при на-
блюдении в темном поле можно установить лишь форму объектов
и их состояние (покоя или движения).
Для темнопольных наблюдений выпускают специальные кон-
денсоры ОИ-13 и ОИ-Ю. При отсутствии такого конденсора про-
стейшие наблюдения на темном поле можно проводить, если в
центре на круглом стекле в кольцевой откидной оправе, находя-
щейся под конденсором микроскопа, поместить черный кружок
диаметром 14—15 мм (можно вырезать из плотной бумаги или из
станиоля кружок с тремя лапками и поместить в кольцевой опра-
ве). Диаметр черного кружка в
миллиметрах можно вычислить
по формуле Д = 20АС4.
Рис. 1.16. Схема хода лучей в светло-
польном конденсоре (слева) и в темно-
польном конденсоре при центральной
диафрагме (справа)
1.8. ПОВЫШЕНИЕ КОНТРАСТНОСТИ ПРЕПАРАТА
И МЕТОД ФАЗОВОГО КОНТРАСТА
Для повышения контрастности препарата можно использовать:
красители;
светофильтры;
механизмы микроскопа;
специальные устройства (фазово-контрастный микроскоп).
Окрашивание препаратов будет подробно рассмотрено в гла-
ве 5. К. настоящему времени существует множество разнообраз-
ных красителей, которые позволяют проводить окрашивание, в
том числе и специфическое, не только тканей, но и органелл
клетки.
В качестве светофильтра используют стекла, проходя через ко-
торые световой поток качественно или количественно изменяется.
Нейтральные светофильтры, имеющие одинаковый коэффициент
пропускания для всех монохроматических излучений, изменяют
световой поток количественно. В отличие от них селективные све-
тофильтры, пропуская свет только определенной длины волны
(это особенно широко используют в флуоресцентной микроско-
пии), изменяют световой поток качественно.
Для повышения контрастности можно использовать цветные
светофильтры, соблюдая при этом правила дополнительных цве-
тов. Дополнительными называют цвета, которые при наложении
друг на друга дают белый. Например, совместное использование
чистого красного и сине-зеленого светофильтров или чистого
синего и желтого, или чистого зеленого и пурпурного даст белый
цвет. При освещении монохроматическим светом окрашенного
препарата дополнительные цвета на нем будут темными, а те, ко-
торые совпадают с освещающим светом, — светлыми. Поэтому
при работе с объектами, окрашенными в пурпурный цвет, лучше
применять зеленый светофильтр (например, при анализе препа-
ратов, окрашенных ацетокармином), а при изучении окрашен-
ных в синий цвет препаратов (например, при использовании кра-
сителя Гимза) — желтые.
Светофильтры можно использовать для повышения не только
контрастности, но и разрешающей способности (см. раздел 1.1),
качества изображения (зеленый светофильтр используется при
работе с объективами-ахроматами), для регулирования освещен-
ности (нейтральные светофильтры и матовые стекла), а также при
работе методом люминесцентной или флуоресцентной микроско-
пии (раздел 1.9).
Другой способ повышения контрастности — использование
апертурной диафрагмы конденсора. Уменьшение диаметра све-
тового пучка позволяет получать более контрастное изображе-
24
ние, однако нельзя этим увлекаться, поскольку чрезмерное зак-
рытие отверстия диафрагмы может привести к появлению арте-
фактов.
Метод фазового контраста — один из наиболее широко при-
меняемых методов при анализе растительных клеток. Он служит
прежде всего для исследования прозрачных неокрашенных
объектов. Фазовый контраст представляет собой устройство, ко-
торое обеспечивает сдвиг фазы колебаний волн света нулевого
максимума по отношению к колебаниям волн дифракционных
максимумов. Для этого в фокальную плоскость конденсора по-
мещают кольцевую диафрагму, через которую пучок света попада-
ет на фазовое кольцо объектива, толщину и показатель преломле-
ния которого подбирают таким образом, чтобы прошедший свет
испытал сдвиг на 1 /4 X.
Для применения этого метода на практике используют специ-
альные фазово-контрастные конденсоры с набором кольцевых
диафрагм, размеры которых подобраны в соответствии с аперту-
рой специальных фазовых объективов. У фазовых объективов в
отличие от обычных на задней линзе имеется кольцеобразная
фазовая пластинка (рис. 1.17). Для совмещения кольцевой диаф-
рагмы конденсора и фазового кольца используют вспомогатель-
ный микроскоп (см. рис. 1.17). Его вставляют вместо одного из
окуляров, фокусируют, перемещая выдвижную трубку таким об-
разом, чтобы можно было наблюдать одновременно фазовое
кольцо и кольцевую диафрагму. Совмещения их достигают с по-
мощью центрирующих винтов конденсора. После этого вынима-
ют вспомогательный микроскоп, вставляют обратно окуляр и
проводят наблюдения.
1
Рис. 1.17. Фазово-контрастное устройство, включающее конденсор (слева)
и вспомогательный микроскоп (справа):
/ — фокальная линза конденсора; 2 — револьверное устройство, содержащее кольцевые диа-
фрагмы для разных объективов, 3 — центрировочные винты; 4 — регулировочный винт вспомо-
гательного микроскопа
25
1.9. МЕТОД ФЛУОРЕСЦЕНТНОЙ ИЛИ ЛЮМИНЕСЦЕНТНОЙ
МИКРОСКОПИИ
В основе флуоресцентной (люминесцентной) микроскопии ле-
жит способность некоторых веществ к свечению (излучению све-
та). Флуоресценция наряду с фосфоресценцией являются различ-
ными вариантами люминесценции и различаются по продолжи-
тельности свечения: флуоресценция — быстро затухающая люми-
несценция, фосфоресценция — медленно затухающая. Объекты,
не обладающие природной способностью к люминесценции, об-
рабатывают специальными веществами — флуорохромами. К ним
относятся красители (аурамин, корифосфин и др.), пигменты и их
производные (хлорофилл, порфирины), некоторые алкалоиды
(берберин) и др. Возбуждение люминесценции микроскопических
объектов, окрашенных флуорохромами, производят ультрафиоле-
товым, фиолетовым и синим светом. Люминесцентная микроско-
пия с применением флуорохромов по сравнению с обычным окра-
шиванием (в особенности биологических объектов) дает преиму-
щество в различении деталей структуры. Благодаря высокой
чувствительности люминесцентного метода концентрация флуо-
рохрома может быть очень малой, что позволяет производить на-
блюдение на живых биологических объектах (прижизненное
флуорохромирование) и исследовать происходящие в них процес-
сы обмена веществ. При исследовании хромосом используют сле-
дующие красители (табл. 1.3).
1.3. Характеристика некоторых флуорохромов, применяемых во флуоресцентной
гибридизации in situ
Флуорохромы
Максимум
возбуждения, нм
Максимум эмиссии,
нм
DAPI
DEAC
FITC
SpecOrange
TexasRed
Су5
359
426
494
559
595
649
460
480
533
588
615
670
Общая схема флуоресцентного микроскопа представлена на
рисунке 1.18. Микроскоп, применяемый для флуоресцентного
анализа, содержит источник возбуждения люминесценции, флуо-
рохром, регистрирующее устройство, а также светофильтры для
выделения подходящих длин волн возбуждения (возбуждающие
фильтры) и испускания (запирающие фильтры). Флуоресценцию
можно наблюдать визуально, фотографировать или измерять при
помощи специальных приспособлений.
При исследовании препаратов в проходящем свете испускае-
мая флуоресценция собирается объективом, и ее наблюдают с
26
Рис. 1.18. Схема конструкции флуоресцентного микроскопа с наблюдением
в падающем свете (описание в тексте)
помощью окуляров. Конденсор фокусирует возбуждающий свет,
а объектив собирает испускаемый. Недостаток освещения прохо-
дящим светом заключается в том, что практически весь возбуж-
дающий свет попадает в объектив и для разделения возбуждаю-
щего и испускаемого света требуются высококачественные
фильтры.
При использовании падающего света для отделения испускае-
мого света флуоресценции от возбуждающего используют светоде-
лительное зеркало, которое располагается на пути падающего све-
та над объективом (см. рис. 1.18). Такое зеркало имеет интерфе-
ренционное покрытие, отражающее на препарат свет, длина вол-
ны которого меньше определенного значения, и пропускает более
длинноволновой свет флуоресценции в окуляры. Объектив в дан-
ном случае служит как для фокусировки возбуждающего света на
препарат, так и для собирания испускаемого флуоресцирующим
препаратом света.
27
В качестве источника света могут служить ртутные, ксеноновые
и галогеновые лампы. Следует отметить, что использование ртут-
ных и ксеноновых ламп требует особого соблюдения требований
техники безопасности.
Примеры применения флуоресцентной микроскопии рассмот-
рены в главах 8 «Флуоресцентная гибридизация in situ» и 10 «Фер-
тильность и жизнеспособность пыльцы».
1.10. ИСПОЛЬЗОВАНИЕ ДРУГИХ МЕТОДОВ
МИКРОСКОПИИ
Интерференционная микроскопия. Пучок световых лучей от ос-
ветителя разделяется на два потока, один из которых проходит че-
рез объект, а другой минует его. В призмах объектива они соеди-
няются и интерферируют между собой, в результате чего строится
изображение, основанное на разности толщины и плотности.
Данный метод можно использовать для определения концентра-
ции, массы сухого вещества в клетке.
Микроскопия в поляризованном свете. Используется поляризо-
ванный свет, который получается при прохождении пучка света
через фильтр-поляризатор, который выделяет световые волны оп-
ределенной плоскости поляризации. После препарата и объектива
устанавливается анализатор, который позволяет визуализовать
объект. Метод используют для изучения объектов с упорядочен-
ной ориентацией субмикроскопических частиц.
1.11. ИЗМЕРЕНИЕ МИКРОСКОПИЧЕСКИХ ОБЪЕКТОВ
При цитологических исследованиях нередко требуется изме-
рить диаметр ядра и пыльцевых зерен, длину пыльцевых трубок,
определить размеры клеток и т. д. Для этой цели служат специаль-
ные вспомогательные принадлежности и приборы к микроскопам
(окуляр-микрометр, компенсационный окуляр со шкалой, винто-
вой окуляр-микрометр, объект-микрометр).
Окуляр-микрометр. Представляет собой круглую стеклянную
пластинку с линейной шкалой длиной 10 мм, разделенную соот-
ветственно на 100 частей (рис. 1.19, 1, см. также рис. 1.7). Для из-
мерения микроскопического объекта необходимо отвинтить глаз-
ную линзу окуляра и поместить окуляр-микрометр внутрь окуляра
на диафрагму. Глядя в окуляр микроскопа, мы одновременно уви-
дим шкалу окуляр-микрометра и изучаемый объект на препарате.
Передвигая препарат при одновременном поворачивании окуляра
вокруг его оси, можно определить размеры объекта в делениях
окуляр-микрометра. Для установления истинного размера микро-
28
Рис. 1.19. Шкала окуляр-микрометра (7) и объект-микрометра (2)
скопического объекта в микрометрах или долях миллиметра необ-
ходимо умножить его размеры в делениях окуляр-микрометра на
цену одного деления, которую определяют отдельно для каждой
комбинации объектива и окуляра микроскопа. Для каждого мик-
роскопа составляется специальная таблица. При этом используют
специальный вспомогательный препарат — объект-микрометр, на
котором в качестве объекта помещена шкала длиной 1 мм, состоя-
щая из 100 частей. Цена деления шкалы объект-микрометра
10 мкм (рис. 1.19, 2).
Поместив объект-микрометр на столик микроскопа, получают
резкое изображение его шкалы, которое совмещают с изображе-
нием шкалы окуляр-микрометра. Устанавливают, сколько деле-
ний объект-микрометра точно приходится на определенное число
делений окуляр-микрометра и, разделив первую величину на вто-
рую и умножив результат на 10 мкм (цена деления объект-микро-
метра), получают цену деления окуляр-микрометра.
Пример. При объективе 40х и окуляре 7х определили, что 5 деле-
ний объект-микрометра совпадают с 13 делениями окуляр-микро-
метра. Цена одного деления окуляр-микрометра будет равна
5 • 10/13 = 3,85 мкм.
Использование винтового окуляр-микрометра МОВ-1-15х для из-
мерения микрообъектов. Этот окуляр-микрометр позволяет опре-
делить размеры микроскопического объекта более точно, чем это
можно сделать компенсационным окуляром со шкалой. Прибор
состоит из вмонтированных в один корпус: компенсационного
окуляра с увеличением 15х, неподвижной шкалы с восемью деле-
ниями, подвижной сетки с перекрестием и двойным штрихом и
микрометрического винта со 100 делениями на барабане. Цена од-
ного деления на барабане соответствует 0,01 деления неподвиж-
29
ной шкалы окуляр-микрометра. За один полный оборот барабана
сетка с перекрестием передвигается на одно деление неподвижной
шкалы, по которой отсчитываются целые части, тогда как дроб-
ные — по шкале барабана.
Для измерения объекта винтовой окуляр-микрометр надевают
на тубус микроскопа взамен его окуляра. Для каждого объектива
микроскопа определяют цену деления шкалы барабана при помо-
щи объект-микрометра. Кладут на столик микроскопа препарат и,
вращая барабан, подводят перекрестие подвижной сетки к одному
краю измеряемого объекта. Производят отсчет на барабане, затем
подводят перекрестие к другому краю объекта и вновь производят
отсчет. Разность между двумя отсчетами по барабану дает размер
объекта в делениях шкалы барабана. Зная цену деления шкалы ба-
рабана, определяют истинные размеры объекта в микрометрах.
Измерение толщины микроскопических объектов. Для этой цели
можно воспользоваться шкалой, нанесенной на барабане (бараш-
ке) микрометрического винта микроскопа. Сначала фокусируют
микроскоп на верхнюю, а затем на нижнюю поверхность микро-
скопического объекта. Расстояние, на которое опустился тубус,
определяют по делениям шкалы барабана. Цена одного деления
этой шкалы в большинстве случаев указана на барабане. Обычно
вся шкала имеет 50 делений, и один поворот барабана перемещает
тубус микроскопа на 0,1 мм. Отсюда цена одного деления равна
0,002 мм, или 2 мкм. Однако для определения истинной толщины
объекта нельзя просто умножить полученное число делений на
цену одного деления, необходимо еще умножить на поправочный
коэффициент. Для сухих объективов поправочный коэффициент
равен 1,5, т. е. отношению показателей преломления стекла и воз-
духа. Для масляной иммерсии отношение между показателями
преломления стекла и кедрового масла равно 1,0 и необходимость
умножения на поправочный коэффициент отпадает.
1.12. ФИКСИРОВАНИЕ ИЗОБРАЖЕНИЯ
Для регистрации изображения и его фиксирования могут быть
использованы различные приемы, например зарисовка объекта с
помощью рисовальных или рисовально-проекционных аппаратов,
фотографирование с помощью классических пленочных фотоап-
паратов либо с использованием интенсивно развивающихся циф-
ровых фото- и видеокамер, включая прижизненную видеосъемку
происходящих в клетках процессов.
1.12.1. МИКРОФОТОГРАФИЯ
Один из наиболее удобных методов для фиксирования изобра-
жения — микрофотография. Важной особенностью этого метода
является его объективность. Для микрофотографии могут быть ис-
30
пользованы как отечественные фотокамеры, например МФН-11,
так и импортные, которые, как правило, имеют ряд преимуществ.
Рассмотрим некоторые характеристики фотокамер на примере ав-
томатической фотонасадки МС80. Пульт управления позволяет
проводить как автоматический выбор выдержки в зависимости от
освещенности препарата, так и подбор экспозиции вручную. Кро-
ме того, предусмотрены режимы фотографии с использованием
специальных методов — фазового контраста, косого освещения и
темного поля. Перевод кадра в фотокамере осуществляется также
автоматически (рис. 1.20).
Для микрофотографии правильная установка света по Келеру
еще более важна, чем для визуального наблюдения, так как пленка
не может «исправлять» дефекты изображения, как это делает глаз
человека, и они будут заметны. В данном случае получается рав-
номерное освещение поля зрения, полевая диафрагма ограничи-
вает диаметр освещаемого участка, а апертурная диафрагма опре-
деляет угол конуса падающего света. Важно, чтобы в конечное
изображение не попали нить лампы или частицы пыли. При фо-
тографировании иммерсионных препаратов следят, чтобы в жид-
кости не было пузырьков воздуха.
Для улучшения контраста изображения на пленке применяют
светофильтры: при работе с препаратами, окрашенными в крас-
ный цвет, фотографируют с зеленым светофильтром, в фиолето-
вый цвет — с желтым и т. д.
Рис.1.20. Автоматическая фотокамера МС80
31
Выбор экспозиции, (времени выдержки кадра) зависит от многих
причин — источника света, светофильтров, комбинации окуляра
и объектива, среды между препаратом и объективом, объекта, фо-
томатериалов. В случае классических фотонасадок, применяемых
на отечественных микроскопах, экспозицию подбирают экспери-
ментально. Для этого устанавливают освещение в соответствии с
принципом Келера, затем находят на препарате интересующий
объект и делают несколько (3—5) пробных снимков с разной
экспозицией (с шагом 1, 3, 5 или 10 сек в зависимости от осве-
щенности препарата: чем выше освещенность, тем меньше вы-
держка и шаг).
В случае применения фотосистем экспозиция устанавливается
автоматически. Однако для успешного получения фотографий
следует использовать серии из 2—3 снимков с различной экспози-
цией, что позволит отобрать лучшие снимки.
При фотографировании объекта необходимо использовать уст-
ройства коррекции изображения, которые могут различаться у фо-
тосистем разных фирм-производителей. В случае, когда объект
выходит за пределы поля зрения, например, если съемку осуще-
ствляют при большом увеличении, а пластинка хромосом имеет
большой разброс, то делают несколько снимков, а при анализе
изображения эти снимки соединяют. Для контроля проводят
съемку при малом увеличении так, чтобы вся пластинка была в
поле зрения.
Для определения увеличения изображения после съемки
объекта фотографируют объект-микрометр с той же комбинацией
окуляров и объектива. После чего проводят оценку отношения ве-
личины деления объект-микрометра на фотографии (снимке) и
его реальной величины. Например, если величина деления на фо-
тобумаге равна 7 мм, а реальная величина — 0,01 мм, то увеличе-
ние будет равно 7/0,01 = 700.
Качество снимков зависит от фотоматериалов и их обработки
после фотосъемки. Для получения качественных препаратов луч-
ше всего использовать мелкозернистые фотопленки, например
Микрат 200, Микрат 400, Микрат 500. Для обработки фотопленки
могут быть использованы как поступаемые в продажу смеси про-
явителей и фиксажей, так и приготовленные непосредственно в
лаборатории.
Приведем некоторые прописи приготовления этих реагентов.
Следует учитывать, что более контрастное изображение можно
получить при использовании разбавленных проявителей. Время
проявления в этом случае увеличивается.
Проявитель для микрофотографии ФЕН-2: в 600 мл дистиллиро-
ванной воды растворяют при постоянном перемешивании следу-
ющие реагенты:
32
сульфит натрия безводный 100 г
гидрохинон 5 г
бура (кристаллическая) 3 г
борная кислота 3,5 г
фенидон 0,2 г
бензотриазол 20 иг
вода до 1 л
Проявитель хранят в темных бутылях при комнатной темпера-
туре, перед проявлением разводят водой 1:1. Одним рабочим ра-
створом можно проявить до 3 пленок, время проявления 20 мин.
Проявитель УП-2 (для фотопленок)'.
метол 5 г
гидрохинон 6 г
сульфит натрия 40 г
гидрокарбонат натрия 31 г
бромид калия 4 г
вода до 1 л
Время проявления 3—8 мин при 20 "С.
Проявитель N1 для фотопленок и фотобумаги:
метол 1г
. гидрохинон 5 г
сульфит натрия 26 г
карбонат натрия 20 г
бромид калия 1 г
вода до 1 л
Фиксаж для фотопленок и фотобумаги:
1-й раствор:
гипосульфит натрия 250 г
2-й раствор:
сульфит натрия 20 г
ледяная уксусная кислота 15 мл
Перед употреблением оба раствора слить и довести их объем
водой до 1 л.
Фиксаж: в 600 мл дистиллированной воды растворяют следую-
щие компоненты:
тиосульфат натрия (Na2S2O3 • 5Н2О) 250 г
сульфит натрия безводный 25 г
хлорид аммония 40 г
ледяная уксусная кислота 8 мл
вода до 1 л
Жидкость хранят в темноте при комнатной температуре.
Полученные пленки можно отсканировать и выполнять работу
с изображениями при помощи специальных программ анализа
изображений.
В некоторых случаях полученные негативы могут оказаться пе-
реэкспонированными, либо на них может образоваться вуаль, а
провести повторное фотографирование невозможно, например,
3 В. А. Пухальский и др.
33
при работе с временными препаратами. В этих случаях можно ис-
пользовать ослабители, которые позволяют пропорционально ос-
ветлить изображение и снять вуаль.
В качестве ослабителя могут быть использованы следующие ра-
створы.
Ослабитель Фармера.
Раствор А:
калий железосинеродистый 1 —5 г
вода до 1 л
Раствор Б:
тиосульфат натрия 30 г
вода до 1 л
Формула рабочего раствора: 1 часть раствора А + 1 часть ра-
створа Б + 8 частей воды. Рабочий раствор готовят непосредствен-
но перед использованием. Степень ослабления контролируют ви-
зуально. После ослабления негатив промывают в течение 10—
15 мин и сушат.
Марганцевый ослабитель:
перманганат калия 1 г
вода до 1 л
После достижения желаемой степени ослабления (через. 2—
40 мин) негатив ополаскивают водой и осветляют в свежем кислом
фиксаже. Затем промывают в проточной воде 10—15 мин и сушат.
Готовые осветленные негативы имеют зеленовато-коричневый цвет.
Следует помнить, что перманганат калия является агрессивным
реагентом, поэтому повышение концентрации может привести к
растворению фотослоя.
1.12.2. ИСПОЛЬЗОВАНИЕ ЦИФРОВЫХ КАМЕР
Применение цифровых камер позволяет получать качествен-
ные изображения, которые могут быть сразу обработаны с помо-
щью компьютерных программ анализа изображений. Примером
может служить цифровая камера «Olympus С-5060» (рис. 1.21).
Однако при использовании в работе цифровых камер необхо-
димо наличие адаптеров. Они по-
зволяют крепить фотокамеру на
микроскопе и получать каче-
ственные изображения. Оптичес-
кий адаптер — это абсолютно не-
обходимое связующее звено меж-
ду микроскопом и цифровыми
фотоаппаратами. Тринокулярный
Рис. 1.21. Цифровая камера «Olympus
С-5060»
34
Переходный
цилиндр
Корпус
ЯкКяй
> s>
Рис. 1.22. Пример тринокулярного адаптера
адаптер состоит из трех основных частей: втулки фотоаппарата,
корпуса и переходного цилиндра. Благодаря такой конструкции
удалось добиться универсальности адаптера, он подходит ко мно-
гим выпускаемым микроскопам и быстро меняющимся моделям
цифровых фотоаппаратов (рис. 1.22).
Окулярный адаптер вставляется в окулярное гнездо бинокуляр-
ной насадки микроскопа вместо одного из окуляров (рис. 1.23).
Его применяют для комплектования микроскопов, для которых не
выпускают соответствующие тринокулярные насадки. Это в ос-
новном устаревшие модели микроскопов, например МИМ-10 или
ММР-4 (ЛОМО, Россия).
Рис. 1.23. Схема крепления окулярного адаптера
3*
35
1 12 3 ИСПОЛЬЗОВАНИЕ ВИДЕОКАМЕР ДЛЯ РЕГИСТРАЦИИ
ИЗОБРАЖЕНИЙ
Простая и дешевая видеосистема DCM35 в комплекте с персо-
нальным компьютером (рис. 1.24) позволяет проводить анализ
изображений по слайдам. Ее можно установить как на отечествен-
ные, так и на импортные микроскопы. Для установки вынимают
окуляр и на его место вставляют видеокамеру. Для использования
видеокамер на разных моделях микроскопов имеются адаптеры.
Рис. 1.24. Система видеокамеры DCM35 и персонального компьютера
г •., - ' *
Изображения, полученные с использованием цифровых фото-
и видеокамер, могут быть проанализированы с помощью специ-
альных программ анализа изображений, таких, как Adobe
Photoshop.
Глава 2
ОСНОВНЫЕ СВЕДЕНИЯ О РАСТИТЕЛЬНОЙ
КЛЕТКЕ. МИТОЗ
2.1. СТРОЕНИЕ РАСТИТЕЛЬНОЙ КЛЕТКИ
Растительные клетки имеют сложное строение (рис. 2.1) и са-
мую разнообразную морфологию. Основные их части — оболочка,
цитоплазма и ядро.
Оболочка. Сложное структурное образование, определяющее
форму клетки и защищающее от внешних воздействий. Часто вы-
полняет опорные функции. У клеток меристемы оболочка носит
название первичной оболочки и состоит из неупорядоченных
фибрилл целлюлозы. От цитоплазмы ее отделяет клеточная мемб-
рана. Первичные оболочки соседних клеток вместе с межклеточ-
ным веществом образуют трехслойную клеточную стенку толщи-
ной от 0,5 до 1 мкм. В первичной оболочке имеются канальцы,
через которые проходят цитоплазменные тяжи — плазмодесмы. С
окончанием роста клетки формируется вторичная клеточная обо-
лочка за счет образования новых слоев со стороны клеточной
мембраны. Фибриллы целлюлозы, составляющие основу этих от-
ложений, более мощные, чем у первичной оболочки, располага-
ются параллельно. Однако направление их расположения в каж-
дом новом слое иное, что способствует повышению прочности
вторичной клеточной оболочки. Вторичная оболочка имеет поры,
через которые от клетки к клетке проходят плазмодесмы.
Цитоплазма. Состоит из полужидкой массы — основного веще-
ства, или цитоплазматического матрикса, и органоидов. В цито-
плазме находятся пластиды, митохондрии, рибосомы, вакуоли,
аппарат Гольджи, а также эндоплазматический ретикулум, микро-
трубочки и микрофиламенты.
Пластиды. Одно из основных отличий растительной клет-
ки от животной — наличие пластид. К ним относятся лейкоплас-
ты — бесцветные и хромопласты — окрашенные пластиды. К лей-
копластам относят, например, амилопласты, элайопласты, а к
хромопластам — хлоропласты, каротиноидопласты и др. Пласти-
ды осуществляют функции: фотосинтеза (хлоропласты), синтеза
крахмала (лейкопласты) и каротиноидов — каротина и ксанто-
филла (каротиноидопласты, красные хромопласты). Генетическая
система хлоропластов представлена циклическими молекулами
ДНК достаточно большой длины — 120—180 т. п. н. (тысяч пар
37
Рис. 2.1. Схема строения растительной клетки:
1—2 — стенки клетки; 3 — пора в оболочке; 4 — обо-
лочка ядра; 5 — эндоплазматическая сеть; 6 — аппа-
рат Гольджи; 7 — ядро с ядрышком; 8 — митохонд-
рия; 9 — капля жира; 10 — вакуоль; 11 — крахмальное
зерно; 12 — хлоропласт; 13 — пропластида (Атабеко-
ва А. И., Устинова Е. И. Цитология растений. — М,:
Колос, 1967. -С. 15)
нуклеотидов). При этом в отличие от
ядерной ДНК хлоропластов не обра-
зует комплексов с гистонами. В хло-
ропластах выявлены все типы РНК и
рибосомы, участвующие в синтезе
хлоропластных белков.
Митохондрии. Их основная
функция связана с синтезом АТФ.
Чаще всего это гранулы, реже ните-
видные образования. Длина грану-
лярных митохондрий колеблется от
0,5 до 7 мкм, а нитевидных — может
достигать 20 мкм. Митохондрии состоят из наружной и внутрен-
ней мембран и системы внутренних складок — крист (рис. 2.2).
Внутренняя мембрана окружает жидкий матрикс, в котором нахо-
дятся ДНК, РНК, белки, рибосомы. ДНК митохондрий существу-
ет в виде кольцевых молекул.
Рибосомы. Участвуют в синтезе белка. У всех растительных
(да и животных) организмов они идентично устроены и выполня-
ют одинаковую функцию синтеза белка. Их размеры варьируют от
17 до 23 нм в диаметре, вследствие чего они не видны в световой
микроскоп.
В состав эукариотической рибосомы входят четыре молекулы
РНК, различающиеся по длине: от 120 до 4700 нуклеотидов, кото-
рые связаны с белком. Число рибосом в клетке, как правило,
чрезвычайно велико (до 107 шт.). Рибосомы могут образовывать
комплексы, называемые полирибосомами или полисомами.
Клетки, активно синтезирующие белки, имеют, как правило,
много полисом.
Аппарат Гольджи. Состоит из диктиосом — группы
плоских дисковидных пузырьков, разветвленных в сложные сис-
темы трубочек. Выполняет секреторные функции, а в раститель-
ной клетке участвует и в построении клеточной стенки при деле-
нии, вырабатывая полисахариды матрикса.
Цитоплазматические вакуоли. Представляют со-
бой полости, ограниченные мембраной и заполненные клеточным
соком. Они являются вместилищем продуктов обмена веществ ци-
38
Липид
Б Белок Белок
Рис. 2.2. Схема ультраструктуры митохондрии:
А — объемная схема расположения наружной (7) и внутренней мембран (2), крист (3) и мат-
рикса (4); Б — митохондриальная криста при большом увеличении: внутренняя полость (5),
наружная полость (6); В — молекулярная структура кристы (Робертис и др., из: Атабекова А. И.,
Устинова Е. И. Цитология растений. — М.: Колос, 1971. — С. 44)
»
топлазмы, ядра и пластид, растворенных в воде (органические
кислоты, сахара, алкалоиды и др.). Основные функции вакуо-
лей — увеличение размера клеток, поддержание упругости тканей,
разрушение макромолекул.
Микротрубочки. Это тонкие структуры разной длины,
состоящие из белка тубулина и играющие важную роль в митоти-
ческом делении и построении клеточной оболочки.
Микрофиламенты. Представлены нитями белка акти-
на, участвующими в формировании цитоскелета клетки.
Эндоплазматический ретикулум. Представля-
ет собой обширную систему мембран, которая функционально
связана с ядерной оболочкой, рибосомами. Он содержит сеть мел-
ких вакуолей и каналов и играет основную роль в биосинтезе бел-
ков, липидов и углеводов.
39
Ядро. Выполняет две важнейшие функции: контроль жизнедея-
тельности клеток и хранение и передача генетической информа-
ции. Ядро содержит нуклеиновые кислоты — ДНК и РНК, белки,
небольшие молекулы и ионы. Почти у всех растительных клеток
оно имеет сферическую форму и состоит из нуклеоплазмы, хрома-
тина и ядерной оболочки. Хроматином называют комплексы ДНК с
белками. У растений ядро клетки включает также небольшое сфе-
рическое тельце, получившее название ядрышка, которое пред-
ставляет собой область внутри ядра, где локализованы гены, от-
ветственные за синтез рибосомной РНК. У некоторых видов рас-
тений в ядрах клеток имеется несколько ядрышек. Участки хромо-
сом, в которых происходит формирование ядрышка, называются
ядрышковыми организаторами или ядрышкоорганизующими района-
ми (ЯОР). Хроматин состоит из комплекса, образуемого молекула-
ми ДНК и белками основной природы — гистонами. Кроме них в
состав хромосом могут входить высокомолекулярные белки и
PH К. Диаметр ядра у высших организмов обычно колеблется от 10
до 30 мкм.
2.2. ХРОМОСОМЫ, ИХ ТИПЫ И СТРОЕНИЕ
Хромосомы — наиболее важная составная часть ядра. Они иг-
рают ведущую роль в явлениях наследственности. Хромосомы
большинства растений в момент деления клетки хорошо видны в
световой микроскоп. Хромосомы неделящихся ядер не видны, так
как находятся в деконденсированном состоянии. Показано, что
чем выше степень деконденсации хромосом, тем активнее проте-
кают метаболические процессы в самом ядре. Морфологически
хромосомы растений и животных имеют нитевидную или палоч-
кообразную форму. Метафазная хромосома состоит из двух хрома-
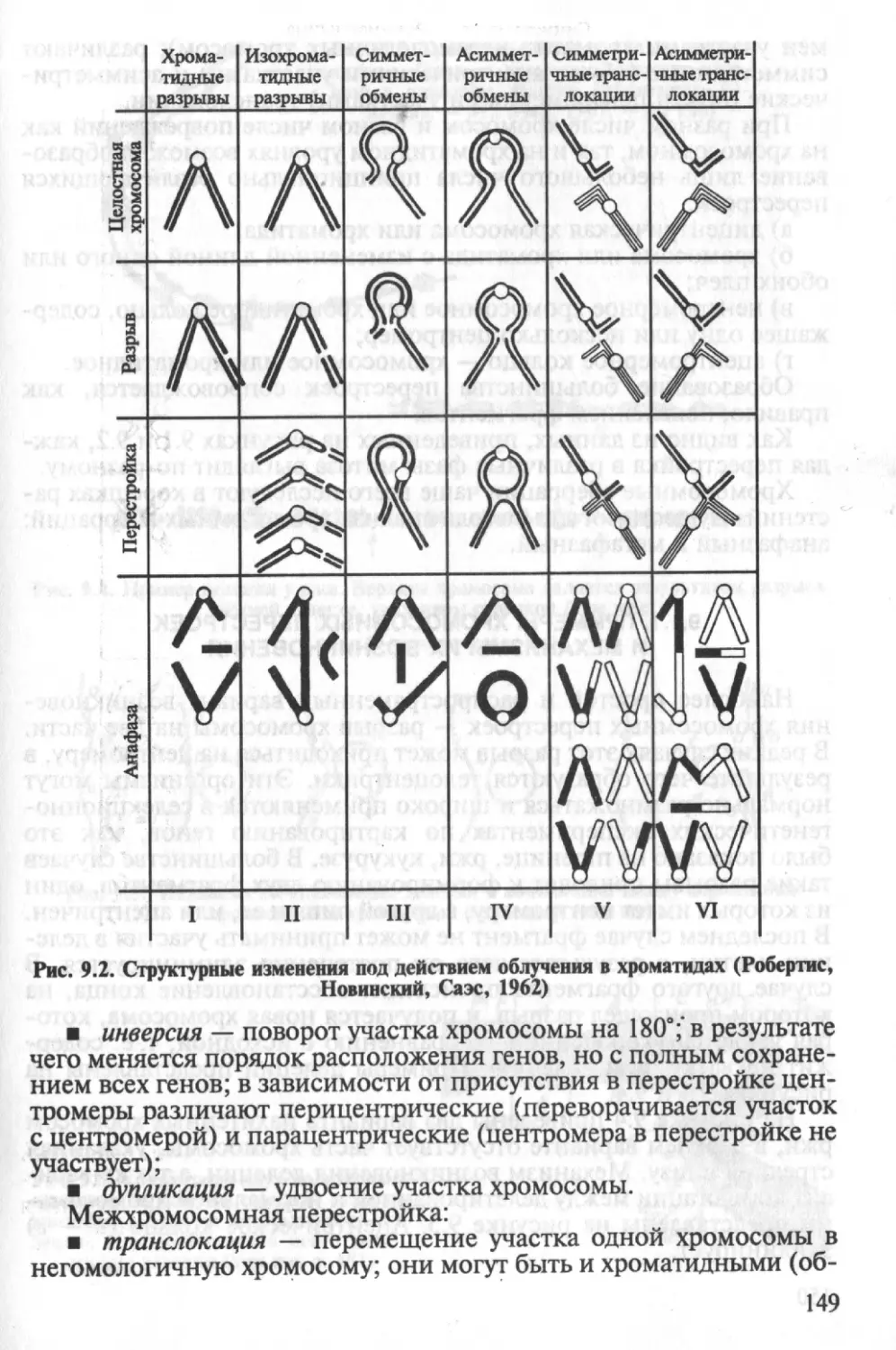
тид, хроматиды одной хромосомы называют сестринскими. Как
правило, хромосомы имеют локализованную центромеру (первич-
ную перетяжку), которая делит их на два плеча (рис. 2.3). Под
микроскопом первичная перетяжка представлена светлой (нео-
крашенной) зоной, которая играет основную роль в перемещении
хромосом при делении ядра. Центромера на каждой из хромосом
занимает строго определенное место. В области центромеры рас-
полагаются кинетохоры — белковые элементы, к которым при-
крепляются нити веретена деления, и происходит разделение хро-
мосомы на хроматиды. Однако у ряда видов, например некоторых
растений семейства Ситниковые, ожики, а также водорослей,
мхов, грибов, отдельных представителей насекомых (полужест-
кокрылые, скорпионы) и клешей, хромосомы не имеют четко вы-
деленной центромеры. Такую центромеру называют диффузной.
Хромосомы, имеющие диффузные центромеры, называют голоки-
нетическими. Расхождение хромосом в анафазе митотического де-
40
Рис.2.3. Схема строения хромосомы:
1 — две сестринские хроматиды; 2 — центромера; 3 — вторичная
перетяжка; 4 — спутник; 5 — теломера
ления обеспечивается прикреплением нитей
веретена деления по всей длине хромосом.
Хромосомы, имеющие одну центромеру, назы-
ваются моноцентрическими, две — дицентричес-
кими, три и более центромер — полицентричес-
кими. При этом ди- и полицентрические хро-
мосомы встречаются крайне редко, в районах
центромер таких хромосом также прикрепля-
ются кинетохоры.
Каждая хромосома может быть охарактери-
зована некоторыми параметрами, из которых
важное значение имеют:
центромерный индекс Iе
———"100% — от-
ношение длины короткого плеча (*$) к сумме
длин короткого и длинного плеча (5 + А);
плечевой индекс 1Ь =—-100% — отношение длины длинного
плеча (L) к длине короткого плеча (S) хромосомы;
абсолютная длина хромосомы La — реальная длина хромосомы,
выраженная в микрометрах;
относительная длина хромосомы
•100%
отношение длины хромосомы к сумме длин всех хромосом ядра.
При проведении каридлогического анализа важное значение
имеет такой показатель, как индекс спирализации хромосом {Is) —
отношение суммарной длины двух самых коротких хромосом к
суммарной длине двух самых длинных, выраженное в процентах.
Этот показатель используют для подбора пластинок при иденти-
фикации хромосом.
По положению центромеры хромосомы делят на метацентри-
ческие (приблизительно равноплечие, Iе находится в пределах
37,5—50j0 %), субметацентрические (плечи разной длины, Iе со-
ставляет 25,0—37,4 %), субакроцентрические (центромера распо-
ложена вблизи одного из плеч, Iе равняется 12,5—24,9 %), акро-
центрические (одно из плеч едва заметно, Iе равняется 0,1 —
12,4%) и телоцентрические (имеется только одно плечо) (рис.
2.4). Встречаются хромосомы, у которых имеется и вторичная
перетяжка. Она, как правило, располагается у дистального (рас-
41
Рис. 2.5. Диплоидный набор метафаз-
ных хромосом в клетке Crepis capilaris
(In — 6). Одинаковыми буквами поме-
чены гомологичные хромосомы. (Лоба-
шов М.Е. Генетика.— Л.: Изд-во ЛГУ,
1967. - С. 9)
Рис. 2.4. Типы метафазных хромосом
в зависимости от положения центро-
меры:
1 — метацентрические; 2 — субметацент-
рические; 3 — субакроцентрические; 4 —
акроцентрические; 5 — телоцентрические
(схема, Levan, 1968)
положенного вдали от центромеры) конца хромосомы и отделяет
небольшой участок хромосомы, получивший название спутника.
Хромосому, имеющую спутник, называют спутничной (рис. 2.5,
хромосомы D и £>]).
Вторичная перетяжка не участвует в движении хромосом при
ядерном делении. Вторичные перетяжки получили название яд-
рышковых организаторов, так как в этом месте обычно находятся
ядрышкообразующие области. Вторичные перетяжки являются
кариотаксономическим признаком: их число и положение специ-
фичны для вида. Концевые участки хромосом называются тело-
мерными, они препятствуют деградации, потере внутренних после-
довательностей и соединению хромосомы друг с другом.
Соматическим клеткам каждого вида растений свойственно
строго определенное число хромосом, обозначаемое 2л — дипло-
идное число (приложение 2). В половых клетках число хромосом
уменьшено в два раза и равно п — гаплоидное число. В соматичес-
ких клетках организма каждая из хромосом имеет пару, идентич-
ную как морфологически (см. рис. 2.5), так и генетически. Такие
хромосомы получили название гомологичных. Исключение из это-
го правила составляют половые хромосомы у гетерогаметных рас-
тений и животных.
Совокупность хромосом организма в соматических клетках, ха-
рактеризуемая числом, формой, размером, величиной и числом
спутников, а также распределением эу- и гетерохроматина, назы-
вается кариотипом (рис. 2.6). Графическое изображение кариоти-
42
Рис. 2.6. Хромосомы сорта твердой пшени-
цы Капелли на стадии метафазы (Giorgi В.,
1964)
па, показывающее его структур-
ные особенности, называется иди-
ограммой (рис. 2.7).
Выявление распределения эу-
и гетерохроматиновых сегментов
возможно при использовании ме-
тодов дифференциального окраши-
вания хромосом. При этом на каж-
дой из хромосом прокрашиваются
специфические, характерные только для нее, полосы (бэнды).
Рисунок основных полос для каждой хромосомы является доста-
точно постоянным, что значительно облегчает идентификацию
хромосом, особенно морфологически одинаковых (рис. 2.8).
Хромосомы, по которым отличаются особи разного пола, полу-
чили название половых хромосом, а все остальные хромосомы —
аутосом.
Хромосомы — чрезвычайно сложно организованные компо-
ненты клетки, состоящие на 90 % из комплекса ДНК и гистонов.
Особенность строения хромосом зависит от уровня компакгиза-
ции хроматина, который меняется при переходе от интерфазного
состояния хромосом к метафазному. Процесс компактизации хро-
матина проходит следующие уровни (стадии): 1) нуклеосома;
1В 2А ЗВ 4А 5В 6А ЗА 4В 5А 6В 7А ЗА 2В 1А
Хромосомы
Рис. 2.7. Идиограмма хромосом сорта твердой пшеницы Капелли (Giorgi В., 1964,
с добавлениями)
43
Рис. 2.8. Дифференциально окрашенные хромосомы Т. durum
А ' hd -%. T.J 71г'?
Рис. 2.9. Схема различных уровней компактизации хроматина:
I — нуклеосомный; 2 — нуклеомерный; 3 — хромомер, петлевой домен; 4 — хромонема; 5—
хроматида (Ченцов Ю. С. Общая цитология. — М.: Изд-во МГУ, 1995. — С. 129)
2) нуклеомер, или соленоид; 3) петельно-доменная структура,
включающая хромомеры; 4) хромонема; 5) хроматида (рис. 2.9).
На стадии нуклеосомы хроматин выглядит как волокно диамет-
ром 10 нм либо как вытянутое волокно с утолщениями — «бу-
синками» диаметром 10 нм. Каждая из бусинок состоит из вось-
ми молекул гистонов Н2А, Н2В, НЗ и Н4, по две молекулы каж-
дого, и называется нуклеосомным кором. На этот октамер на-
кручивается молекула ДНК, обвиваясь 13/4 раза и образуя
сверхспираль.
В присутствии гистона Н1 в хроматине происходит структур-
ный переход к формированию волокна (фибриллы) диаметром
30 нм, при этом нуклеосомы располагаются вплотную, что при-
водит к переходу в состояние нуклеомера, или соленоида. Длина
волокна уменьшается в 6 раз в сравнении с длиной нуклеосомно-
го волокна и в 40—50 раз по сравнению с исходной свободной
ДНК.
В интерфазных ядрах нити хроматина организованы в виде пе-
тель длиной 50—100 т.п.н. Это следующий уровень компактиза-
ции ДНК. Петли называются хромомерами, образование которых
обусловлено наличием специфических последовательностей нук-
леотидов. Сближение хромомер приводит к образованию толстых
нитей, которые видны в световой микроскоп, — следующий хро-
монемный уровень конденсации хромосом.
Постепенная конденсация хроматина наблюдается на протяже-
нии всей профазы митоза, достигая максимума к метафазе.
2.3. СПОСОБЫ КЛАССИФИКАЦИИ ХРОМОСОМ.
ЦИТОЛОГИЧЕСКАЯ И ГЕНЕТИЧЕСКАЯ НОМЕНКЛАТУРЫ
Существовали два основных подхода к идентификации хромо-
сом: цитологический и генетический. Цитологическая классифика-
ция, или составление кариотипа, основана на сравнении морфоло-
гических параметров хромосом, тогда как генетическая классифи-
кация учитывает генетическое родство хромосом разных видов.
Правила цитологической классификации хромосом впервые были
сформулированы еще в начале XX в., и этот подход интенсивно
используется вплоть до настоящего времени для описания карио-
типов разных видов животных и растений. В соответствии с прин-
ципами цитологической номенклатуры в кариотипах сначала
даются хромосомы основного набора (А-хромосомы), после кото-
рых приводят (если есть) добавочные (В-хромосомы). Половые
хромосомы обычно ставят после аутосом. Порядок аутосом опре-
деляется их линейной длиной: они ранжируются от крупных к
мелким. Таким образом, под номером 1 всегда идет самая боль-
45
13-15 16 17-18
X X Л X • л * I
19-20 21-22
Рис. 2.10. Кариотип женщины (2л — 46, XX), стандартная классификация хромосом
* «• ' I К. г V Ъ
шая хромосома набора. Нередко в хромосомном наборе индиви-
да встречаются несколько пар хромосом приблизительно одина-
ковой длины.
В этом случае их распределяют в соответствии с уменьшением
центромерного индекса — от метацентрических к акро- и тело-
центрическим хромосомам. Если несколько пар хромосом неотли-
чимы друг от друга по морфологическим критериям, их объединя-
ют в общую группу. По этому принципу, в частности, была пост-
роена первая стандартная классификация хромосом человека,
принятая на Парижской конференции 1967 г. (рис. 2.10). Позже
появление методов дифференциального окрашивания хромосом
сделало возможным идентификацию всех пар индивидуальных
хромосом человека.
В некоторых случаях при составлении кариотипа руководству-
ются следующими принципами: хромосомы располагают в соот-
ветствии с их типом (центромерным индексом) и относительной
длиной хромосомы в порядке убывания. Таким образом, сначала
идут метацентрические крупные, средние и мелкие, затем субме-
тацентрические и так далее до телоцентрических. Формулу карио-
типа записывают, как число хромосом каждого типа.
Другая классификация хромосом растений основана на сход-
ных принципах, однако в ней принято выделять группу спутнич-
I II III IV V VI VII
7H 2H ЗН 4Н 1Н 6Н 5Н
Рис. 2.11. Сравнение цитологической (римские цифры вверху) и генетической
(арабские цифры внизу) классификаций хромосом ячменя
Рис. 2.12. Генетическая классификация хромосом мягкой пшеницы
хромосома 2А
хромосомы
5-й группы
ных хромосом, которые приводятся после хромосом, без спутни-
ков (рис. 2.11). L
Генетическая классификация в отличие от цитологической ос-
новывается на генетическом родстве (гомеологии), а не морфоло-
гии хромосом. Ее принципы были заложены в работах американ-
ского генетика Е. Сирса (Е. Sears), который создал серию анеуп-
лоидных линий мягкой пшеницы и на основе ее анализа разделил
хромосомы на семь групп генетически родственных (гомеологич-
ных) хромосом. Каждая группа включала три хромосомы, относя-
щиеся к А-, В- и D-геномам (рис. 2.12). Впоследствии было уста-
новлено, что хромосомы других видов злаков также родственны
хромосомам мягкой пшеницы и соответственно могут быть отне-
сены к одной из гомеологичных групп. Генетическая номенклату-
ра более объективна и обладает рядом преимуществ по сравнению
с цитологической классификацией. Однако она разработана лишь
для очень ограниченного числа видов, поскольку требует деталь-
ного знания генетики объекта и существования достаточно насы-
щенных генетических карт хромосом.
2.4. ДЕЛЕНИЕ РАСТИТЕЛЬНОЙ КЛЕТКИ
Деление растительной клетки начинается с деления ядра. В со-
матической клетке оно носит название митоза — непрямого или
кариокинетического деления (рис. 2.13), который протекает в ме-
ристематических тканях. В результате этого деления из одной
клетки образуются две дочерние, имеющие такое же число хромо-
сом, какое было у родительской клетки. Период от окончания од-
ного митоза до окончания следующего получил название клеточ-
ного цикла (рис. 2.14). Между двумя клеточными делениями про-
ходит период, во время которого внешне клетка находится в со-
стоянии покоя — стадия интерфазы.
Однако этот покой только видимый, а
в клетке интенсивно протекают про-
цессы на молекулярном уровне, под-
готавливающие вновь образовавшие-
ся клетки к новому делению. Интер-
фаза включает пресинтетический пе-
Митоз
Рис. 2.13. Клеточный цикл:
Gj — пресинтетический период; S — синтетический
период; G? — постсинтетический период; П — профа-
за; А/ — метафаза; А — анафаза; Т — телофаза
48
4 В. А. Пукал ыжий и др.
и к Л М
Рис. 2.14. Митоз в клетках корешка лука:
а — инте
•и»
аза; б, в, г — профаза; д, е, ж — метафаза; з, и — анафаза; к, л — телофаза; м — цитокинез (Белару, из: Baur Е. Einfuhrung in die
Vererbungs lehre. Berlin, 1930. — P. 151)
риод (<п), синтетический период (S), постсинтетический период
(G2).
В период Gj продолжается рост клеток, синтезируются специ-
фические белки и нуклеотиды, необходимые для синтеза ДНК.
Период S характеризуется синтезом ДНК (ее количество в клет-
ке удваивается) и гистонов. Удвоение содержания ДНК связано с
репликацией хромосом. В конце этого периода каждая из хромо-
сом состоит из двух хроматид.
Период G2 характеризуется накоплением веществ и энергии,
необходимых для протекания митоза. В этот период начинаются
процессы конденсации хромосом. Перед расхождением в дочер-
ние клетки хромосомы постепенно переходят в метаболически не-
активное состояние.
Продолжительность клеточного цикла очень сильно варьирует
в зависимости от ткани, вида растения и внешних условий. На-
пример, по данным К. Свенсона и П. Уэбстера, в кончиках боко-
вых корешков конских бобов (Vicia faba) средняя продолжитель-
ность клеточного цикла в меристематических клетках при 22 °C
составила 14 ч: период 6) занимал 2,5 ч, период S— 6 ч, период
G2 — 3,5 ч и собственно митоз продолжался 2 ч. Внутри клеточно-
го цикла наиболее сильно варьирует продолжительность периода
С), который может практически отсутствовать в активно делящих-
ся клетках или казаться практически постоянным в случае специа-
лизированных тканей. В случае последних часто используют ха-
рактеристику Go, т. е. неактивной фазы G}.
В митозе выделяют два взаимосвязанных процесса — кариоки-
нез (деление ядра) и цитокинез (деление цитоплазмы). Митоз
состоит из следующих стадий: профазы, метафазы, анафазы и те-
лофазы (см. рис. 2.13).
Профаза характеризуется продолжением процесса конденсации
хроматина, в результате чего хромосомы становятся видимыми в
световой микроскоп. На этой стадии исчезает ядрышко (ядрыш-
ки). В конце профазы появляются микротрубочки и начинает фор-
мироваться веретено деления.
Затем клетка плавно переходит в метафазу. К началу метафазы
ядерная оболочка разрушается, а хромосомы достигают макси-
мального уровня конденсации. В то же время окончательно фор-
мируется веретено деления, состоящее из пучков микротрубочек:
опорных — идущих от полюса к полюсу, и тянущих — от полюсов к
центромерам дихроматидных хромосом. Хромосомы выстраива-
ются перпендикулярно к нитям веретена на равном удалении от
полюсов, образуя метафазную пластинку.
В анафазе центромеры делятся в продольном направлении и
хроматиды (теперь это самостоятельные хромосомы) под действи-
ем тянущих нитей веретена начинают движение к полюсам. Деле-
ние центромер происходит синхронно за счет разделения белков
50
когезинов. К концу анафазы в экваториальной плоскости клетки
на опорных нитях веретена образуются небольшие узелки, кото-
рые в дальнейшем (по завершению телофазы) сливаются и дают
начало первичной клеточной перегородке.
Заключительная фаза митоза — телофаза. Во время этой фазы
начинается деконденсация хромосом, восстанавливаются ядрыш-
ки и формируется ядерная оболочка, начинает закладываться кле-
точная перегородка. Митоз завершается формированием клеточ-
ной стенки, а два дочерних ядра в двух новых клетках вступают в
интерфазу.
Митоз свойствен всем эукариотам. Его биологическое значе-
ние заключается в том, что в результате обе дочерние клетки име-
ют одинаковое с родительской число хромосом.
2.5. МИТОТИЧЕСКИЙ ИНДЕКС И ПРОДОЛЖИТЕЛЬНОСТЬ
КЛЕТОЧНОГО ДЕЛЕНИЯ
Один из важных показателей меристематической ткани — ее
митотическая активность — доля клеток, находящихся в митозе.
Для оценки митотической активности используют митотический
индекс — отношение клеток, находящихся на разных стадиях ми-
тоза (профазы, метафазы, анафазы и телофазы) к общему числу
клеток, включая находящиеся в интерфазе и митозе, выраженное
в промилле (%о):
П+М+А+Т
Ml =---------
(П+М+А + Т)+И
1000%о,
где MI — митотический индекс, П, М, А, Т, И — соответственно число клеток в
профазе, метафазе, анафазе, телофазе и интерфазе.
Для определения митотического индекса можно использовать
постоянные препараты срезов корешков либо временные препа-
раты. При изготовлении временных препаратов необходимо доби-
ваться получения монослоя клеток с помощью мацерации. Для
подсчета MI используют только меристематическую зону корня.
Клетки корневого чехлика и зоны растяжения не используют. В
каждом поле зрения подсчитывают число клеток, находящихся в
каждой стадии митоза и интерфазы. Анализируют не менее
500 клеток.
Разные ткани одного организма обладают неодинаковой мито-
тической активностью, которая зависит и от условий внешней
среды. Наивысшего значения митотический индекс достигает в
меристематических тканях, где интенсивно происходят митозы. В
то же время, рассматривая отдельные зоны меристемы, можно от-
метить, что максимальное значение митотического индекса дос-
тигается в периферической зоне, а в центральной и подстилаю-
щей зонах митотический индекс будет ниже.
2.1. Продолжительность митоза и отдельных его фаз
Организм, ткань
Продолжительность, мин
Профаза
Метафаза
Анафаза
Телофаза
Митоз всего
Бобы, меристема
Горох, эндосперм
Ирис, эндосперм
Злаки, клетки
устьиц
Солнечники
(простейшие)
Крысы, клетки
печени
90 31
40 20
40-60 10-30
36-45 7-10
12 3-6
240 10
34
12
12-22
15-20
4
30
34
ПО
40-75
20-35
8-11
30
189
182
102-187
78-110
27-33
310
Продолжительность клеточного цикла, митоза и его отдельных
фаз можно определить различными способами. Среди них — оп-
ределение относительной продолжительности фаз митоза по доле
клеток, находящихся в данной стадии, при расчете митотического
индекса. Среди методов, позволяющих определить время прохож-
дения отдельных фаз клеточного цикла, — методы, основанные на
использовании цитостатиков — веществ, влияющих на прохожде-
ние клеточного деления, среди которых наибольшее распростра-
нение имеет колхицин, а также кофеин, монобромнафталин, ок-
симочевина и др. Продолжительность клеточного цикла можно
определить и с использованием радиоактивных меток. При опре-
делении продолжительности клеточного цикла, как и при подсче-
те митотического индекса, следует учитывать, что на скорость
прохождения фаз влияют тип ткани (ее митотическая активность),
а также условия среды, в которых происходит деление клеток. Не-
которые примеры продолжительности фаз митоза представлены в
таблице 2.1.
Продолжительность клеточного цикла практически не зависит
от содержания ДНК в клетке (табл. 2.2).
2.2. Содержание ДНК и продолжительность клеточного цикла (Kidd et al., 1992)
Культура
Содержа-
ние ДНК,
Продолжительность клеточного цикла и его фаз, ч
Митоз
Весь
клеточ-
ный цикл
Secale се re ale, сорт
UC90 г
Triticum turgidum
сорт Cocorit
6х Triticale
(Cocorit х UC90)
8,3 3,1 5,9 3,0 0,9 12,9
13,3 3,3 5,8 2,3 1,0 12,4
21,5 3,3 5,1 2,7 0,8 11,9
2.6. ОТКЛОНЕНИЯ ОТ ТИПИЧНОГО ХОДА МИТОЗА
Помимо митоза имеют место еще три типа деления ядра сома-
тических клеток: амитоз, эндомитоз и политения.
Амитоз — это прямое деление ядра, при котором оно делит-
ся перетяжкой на две части. Затем происходит разделение цито-
плазмы клетки и возникает клеточная перегородка. Амитотичес-
кое деление приводит к неравномерному распределению ДПК в
дочерних клетках. Амитоз, как правило, свойствен клеткам высо-
кополиплоидных дифференцированных тканей, таких, как клетки
стенок завязи, крахмалообразующие клетки клубней картофеля,
клетки перисперма и др.
Эндомитоз. При этом типе деления (рис. 2.15) ядерная
оболочка не распадается. Удвоение хромосом, как и при митозе,
происходит во время предшествующей интерфазы. Процесс удво-
ения проходит неоднократно, поэтому число хромосом в ядре и
размеры самого ядра увеличиваются. Эндомитоз впервые был об-
наружен в клетках тапетума шпината (Spinacia sativa), а затем в ан-
типодах семейств астровых (Asteraceae) и лютиковых (Ranuncula-
сеае). При эндомитозе хромосомы проходят те же стадии, что и
при нормальном митозе. Встречаются два типа этого деления, от-
личающиеся тем, что в одном случае хроматиды в эндоанафазе
расходятся, а в другом — нет. Последний приводит к политении.
Политения. Ее можно рассматривать как частный случай
эндомитоза. При политении образуются гигантские хромосомы за
счет многократной редупликации хроматид без разделения цент-
ромеры. При этом степень конденсации хроматид меньше, чем у
митотических хромосом. Хроматиды плотно прилегают друг к
другу, и хромомеры многочисленных хроматид образуют попереч-
ные диски и пуффы (рис. 2.16). Впервые политенные хромосомы
были обнаружены в слюнных железах личинки комара, а затем и в
ядрах эндосперма, синергид и антипод представителей различных
семейств растений.
А Б В
Рис.2.15. Схема эндомитоза в клетках тапетума Spinacia oleracea:
А — эндопрофаза; Б — эндометафаза; В — эндоанафаза; Г— эндотелофаза (Уткус, из:
Атабекова А. И., Устинова Е. И. Цитология растений. — М.: Колос, 1971. — С. 90)
53
Рис. 2.16. Политенные хромосомы из клеток слюнных желез Drosophila
melanogaster (Lefevre G., из: Айала Ф., Кайгер Дж. Современная генетика. М.:
Мир, 1987.- Т. 1. - С. 147)
2.7. РЕГУЛЯЦИЯ КЛЕТОЧНОГО ЦИКЛА
Факторы, влияющие на процесс деления клетки, можно разде-
лить на две группы: экзогенные (внеклеточные) и эндогенные
(внутриклеточные). Экзогенные факторы из окружающей клетку
среды взаимодействуют с поверхностью клетки. Эндогенные фак-
торы вырабатываются самой клеткой и действуют внутри нее. Од-
нако некоторые факторы, вырабатывающиеся в одной из клеток,
могут действовать на другие, т.е. являются для них экзогенными.
В нормальных условиях деление клетки зависит от правильной
координации клеточного цикла. Выделяют три периода (конт-
рольные точки), во время которых происходят важные для перехо-
да клетки к следующему этапу события.
ф-л е р е х о д, во время которого клетка либо переходит к
последующему 5-периоду, либо впадает в состояние покоя (бЬ-фаза);
б2-п е р е х о д, во время которого осуществляется контроль
правильности синтеза ДНК и происходит репарация (восстановле-
ние исходной структуры) перед вступлением клетки в митоз.
Л/-п е р е х о д, во время которого осуществляется контроль
за правильностью расхождением хроматид.
Контроль клеточного деления осуществляет ряд ферментов,
среди которых особую роль играют циклинзависимые киназы
54
(CDK). Они необходимы для нормального прохождения клеточно-
го цикла, при этом их концентрация остается практически неиз-
менной. Активация циклинзависимых киназ происходит после их
взаимодействия со специфическим белком — циклином. Образова-
ние такого комплекса становится возможным только после дости-
жения циклином критической концентрации. Некоторые цик-
линзависимые киназы активируются более чем одним циклином.
Каждый тип циклинов, обозначаемых буквами латинского алфа-
вита от А до Н, имеет специфический участок (циклиновый бокс),
который отвечает за связывание с циклинзависимыми киназами.
На протяжении клеточного цикла вслед за активацией отдельных
циклинзависимых киназ по мере необходимости происходит их
инактивация. Однако чтобы приобрести способность к выполне-
нию своих функций в клеточном цикле, CDK должны не только
образовывать комплекс с циклинами, но и претерпеть посттранс-
ляционные модификации под действием белков — регуляторов
клеточного цикла. Кроме того, имеются ингибиторы циклинзави-
симых киназ, среди которых важное значение имеют белки р16,
р21 и р27. Одним из ключевых в обеспечении перехода к митозу
является MPF-фактор, состоящий из циклина В и продукта гена
cdc2. Этот фактор имеет большое значение и в обеспечении пере-
хода к мейотическому делению. Несмотря на то что первые сведе-
ния о MPF-факторе появились в печати более 30 лет назад, его
структура и функции остаются во многом неясными.
Рис. 2.17. Схема генетической регуляции клеточного цикла у дрожжей (гены
отмечены курсивом)
Генетический контроль клеточного цикла НЗТТболее полно изу-
чен у дрожжей, у которых открыто более 30 генов, определяющих
его течение. Разработанная модель состоит из шести ключевых
этапов, схематически представленных на рисунке 2.17, на котором
показан и генетический контроль этих процессов.
2.8. АПОПТОЗ
Апоптоз — запрограммированная гибель клеток (организован-
ная форма гибели клеток), встречается у всех форм живого. При
апоптозе происходит фрагментация клетки с образованием апоп-
тических мембранных телец, ядерная и цитоплазматическая кон-
денсация и эндолитическое расщепление ДНК до небольших оли-
гонуклеотидных фрагментов. Клетки или фрагменты клеток затем
фагоцитируются макрофагами. Программируемая гибель клетки в
некоторых случаях является необходимым условием для сохране-
ния всего организма. Это касается прежде всего клеток, поражен-
ных вирусными или грибными болезнями, клеток с повреждения-
ми ДНК, опухолевых клеток и клеток иммунной системы. Кроме
того, назначение апоптоза состоит и в определении размеров и
морфологии организма, что проявляется в поддержании постоян-
ства численности клеток; определении формы организма и его ор-
ганов; обеспечении нужного соотношения численности клеток
разных типов; удалении генетически дефектных клеток. Сигнала-
ми к апоптозу может быть информация, поступающая от ядра, на-
рушения в результате ионизирующей радиации, вирусная инфек-
ция или сигналы от других клеток. Внешние сигналы могут либо
супрессировать, либо индуцировать апоптоз, и один и тот же сиг-
нал может обеспечивать жизнь одному типу клеток и вызывать ги-
бель других. Большинство данных по молекулярной генетике
апоптоза получены на нематоде Caenorhabditis elegans, на которой
показано, что апоптоз проходит в четыре стадии:
«принятие решения» о том, что клетка должна умереть;
смерть;
поглощение мертвой клетки фагоцитами;
разложение поглощенной клетки.
Существует несколько механизмов регуляции апоптоза:
вызывание его сигналами, формирующимися внутри клетки;
вызывание его внешними сигналами;
запуск его разрушительными окислительными реакциями.
О механизме апоптоза у растений известно мало. Здесь следует
отличать апоптоз от некроза, при котором в первую очередь про-
исходит нарушение целостности мембраны, а затем набухание и
лизис клетки. Большинство данных на растениях получено с ис-
пользованием воздействий химических и физических факторов,
поскольку они вызывают синхронный апоптоз с высоким выхо-
56
дом погибших клеток, что облегчает последующий анализ резуль-
татов. При апоптозе размер клетки уменьшается, цитоплазма кон-
денсируется, происходит деградация ДНК с образованием сначала
крупных, а затеЪ' мелких фрагментов. Подобно митохондриям, иг-
рающим важную роль в апоптозе животных, в апоптозе растений
возможно участие хлоропластов.
Гиперчувствительный ответ на заражение фитопатогенами со-
провождается накоплением активных форм кислорода в клетках
растений. Трансгенные растения табака, у которых синтез этих
ферментов подавлен, гиперчувствительны к патогенам: у них
апоптоз вызывается даже низкими дозами патогенов, которые не
оказывают влияния на контрольные растения.
Глава 3
МЕЙОЗ. РАЗВИТИЕ МУЖСКОГО И ЖЕНСКОГО
ГАМЕТОФИТОВ. ОПЛОДОТВОРЕНИЕ, РАЗВИТИЕ
ЗАРОДЫША И ЭНДОСПЕРМА
: з.1. мейоз
Мейоз — особый тип деления клеток, при котором число хро-
мосом в дочерних клетках уменьшается вдвое, т. е. происходит ре-
дукция числа хромосом (рис. 3.1). Этот тип деления свойствен
только спорогенным тканям.
Мейозу предшествует интерфаза, которая аналогична таковой
при митозе. В 5-п е р и о д е интерфазы происходит редуплика-
ция хромосом, поэтому, вступая в процесс мейотического деле-
ния, как и в случае митоза, они состоят из двух хроматид. Мейоз
состоит из двух ядерных делений, которые следуют одно за другим
(см. рис. 3.1). При первом делении (мейоз I) происходит уменьше-
ние (редукция) числа хромосом в дочерних клетках в 2 раза. Вто-
рое деление (мейоз II) протекает по типу митоза. Как и при мито-
зе, первое и второе деления мейоза подразделяются на следую-
щие фазы: профаза, метафаза, анафаза и телофаза. Соответствен-
но эти фазы обозначают: метафаза I, метафаза II, анафаза I,
анафаза II и т. д.
Мейоз I начинается с профазы!. Это наиболее продолжи-
тельная фаза мейоза. Она, в свою очередь, подразделяется на ста-
дии лептотена, зиготена, пахитена, диплотена и диакинез. На ста-
дии лептотены в ядре появляются слабоконденсированные хро-
мосомы нитевидной формы.
Зиготена начинается с постепенного попарного соединения
(конъюгация, синапсис) по длине гомологичных хромосом. Со-
единенные попарно хромосомы образуют биваленты. В связи с тем
что перед началом мейоза произошла редупликация хромосом, в
состав каждого бивалента входят четыре хроматиды. Функцию си-
напсиса выполняет синаптонемный комплекс. Это белковое образо-
вание, входящее в состав бивалента и имеющее вид трехслойной
ленты, располагающейся между конъюгирующими хромосомами
(рис. 3.2).
Синаптонемный комплекс формируется постепенно по прин-
ципу застежки молнии на протяжении всей стадии зиготены. Об-
разование бивалентов создает предпосылки для возможности об-
мена гомологичными участками между хроматидами — кроссинго-
58
9
10
11
12
Рис. 3.1. Схема мейоза у покрытосеменных растений:
1 — интерфазное ядро; 2—5 — профаза 1(2 — лептотена; 3 — зиготена; 4 — пахитена; 5 — ди-
акинез); 6, 7 — метафаза I; 8 — анафаза I; 9 — интеркинез (диада микроспор); 10 — метафаза
П; 11— анафаза II; 12 — телофаза II (Атабекова А. И., Устинова Е. И. Цитология растений. —
М.: Колос, 1971. - С. 99)
a — вид под электронным микроскопом; б — схема; в — модель; 1 — хроматин; 2 — осевой
элемент, 3 — боковые элементы (Ченцов Ю.С. Общая цитология. — М.: Изд-во МГУ, 1995. —
С. 381)
вера. Одновременно с этим продолжается процесс конденсации
хромосом.
Пахитена — это стадия, на которой синаптонемный комплекс
уже сформирован по всей длине хромосом (стадия стабильного
синапсиса). Она характеризуется продолжающимся утолщением
хромосом в результате непрерывной конденсации хроматина. На
этой стадии происходит кроссинговер. На стадии диплотены про-
60
должается конденсация хромосом, но при этом начинается про-
цесс расхождения гомологичных хромосом, которые удерживают-
ся в точках обмена участками хроматид при кроссинговере. Эти
точки получили название хиазм (рис. 3.3).
Диакинез — последняя стадия профазы I, на которой конденса-
ция хромосом максимальна, ядрышко уменьшается в размерах и
исчезает, а биваленты располагаются по периферии ядра. При
этом гомологичные хромосомы удерживаются в составе бивален-
тов благодаря хиазмам.
Началу метафазы I соответствует распад оболочки ядра и
формирование веретена деления. Биваленты располагаются в эк-
ваториальной плоскости.
Затем начинается анафаза I, во время которой гомологич-
ные хромосомы расходятся к полюсам. В результате число хромо-
сом во вновь образующейся клетке будет в 2 раза меньше (и), чем в
родительской (2п). В этом состоит отличие анафазы I мейоза от
анафазы митоза.
Окончательное расхождение хромосом к полюсам свидетель-
ствует о том, что началась телофаза I. За этой стадией у ряда
видов следует очень короткий интеркинез, во время которо-
го синтез ДНК и репликация хромосом не происходят, и начинает-
ся второе деление мейоза. В этом случае хромосомы не деконденси-
руются. Однако у некоторых видов растений интеркинез между
первым и вторым делением мейоза продолжается довольно долго,
хромосомы деконденсируются, образуются два ядра, разделенные
клеточной перегородкой (диада микроспор или макроспор).
Мейоз II (второе деление мейоза) протекает синхронно в клет-
ках диад и довольно быстро по типу обычного митоза. В тех случа-
ях, когда интерфаза короткая, профаза II выпадает и второе
деление начинается с метафазы II.
Вметафазе II происходит образование веретена деления и
хромосомы располагаются в экваториальной плоскости. Вана-
фазе II центромеры хромосомы делятся и начинается расхожде-
ние хроматид к полюсам, которое заканчивается на следующей
стадии.
На стадии телофазы II происходит полная деконденсация
хроматина, образуются ядра и клеточные перегородки. В конеч-
а . б в
Рис. 3.3. Типы хиазм:
Л ~ одиночная хиазма; Б — две хиазмы, затрагивающие пару хроматид; В — две хиазмы, свя-
зывающие три хроматиды; Г — две хиазмы, связывающие все четыре хроматиды (Айала Ф.,
Кайгер Дж. Современная генетика. — М.: Мир, 1987. — Т. 1. — С. 30)
61
ном итоге в результате мейоза образуется четыре клетки {тетрада
микроспор или макроспор). Каждая из этих клеток содержит в ядре
гаплоидное (и) число хромосом и имеет особое сочетание генов,
обусловленное рекомбинацией в результате кроссинговера и слу-
чайного расхождения гомологичных хромосом.
На продолжительность мейоза оказывают сильное влияние ус-
ловия внешней среды (температура и влажность воздуха).
3.2. МИКРОСПОРОГЕНЕЗ И РАЗВИТИЕ МУЖСКОГО
ГАМЕТОФИТА
На ранних этапах развития конуса нарастания происходит за-
ложение тычиночных бугорков. В дальнейшем из верхней части
этих бугорков развивается пыльник, а из нижней тычиночная нить.
Вначале в пыльнике в четырех его участках образуются крупные
клетки мужского археспория с большими ядрами и густой
цитоплазмой, получившие название материнских клеток микро-
спор {микроспороциты). Внутри пыльника непосредственно к ар-
хеспориальным клеткам примыкает слой выстилающих клеток —
тапетум (рис. 3.4).
Археспориальные клетки делятся путем мейоза, и
образуется тетрада микроспор, в которой четыре клетки окружены
общей оболочкой (рис. 3.5).
При образовании тетрады микроспор наблюдаются определен-
ные отличия между однодольными и двудольными растениями
(рис. 3.6). У однодольных растений после первого деления мейоза
обычно образуется две клетки {диада). При наступлении метафазы
II у однодольных в обеих этих клетках закладываются параллельно
друг другу два веретена. В конце второго деления хорошо видна
Рис. 3.4. Схема развития пыльника:
А — тычинки паслена черного: 1 — пыльник; 2 — тычиночная нить; Б — стадии дифферен-
циации пыльника у нивяника обыкновенного: Т — тапетум; СП — спорогенная ткань; В —
отдельный сектор пыльника: 1 — эпидермис; 2 — фиброзный слой; 3 — промежуточный
слой; 4 — тапетум; 5 — материнские клетки микроспор (Страсбургер, из: Атабекова А. И., Ус-
тинова Е. И. Цитология растений. — M.: Колос, 1980. — С. 198)
62
9 10 11 12
Рис. 3.5. Схема мейоза у покрытосеменных растений:
7 — интерфазное ядро; 2 — лептотена; 3 — зиготена; 4 — пахитена; 5 — диакинез; 6 —
метафаза I; 7 — анафаза I; £ — интеркинез (диада микроспор); 9 — метафаза II; 10 — анафаза
II; 11 — телофаза II; 12 — тетрада микроспор (Атабекова А. И., Устинова Е. И. Цитология ра-
стений, — М.: Колос, 1971. — С, 99)
вся четверка микроспор. Такой тип образования тетрад называет-
ся сукцессивным или последовательным.
У двудольных растений, как правило, не происходит разделе-
ние материнской клетки перед вторым делением мейоза на две, а в
метафазе II веретена закладываются перпендикулярно друг другу.
В результате этого в тетраде хорошо просматриваются только три
микроспоры. Такой тип образования микроспор называется си-
мультанный или одновременный.
Существует и третий тип образования микроспор, называемый
промежуточным, который чаще относят к симультанному типу.
При этом после первого деления мейоза клеточная перегородка
либо не образуется вовсе, либо только частично, но цитоплазма
делится на две части, с после второго — на четыре. Такой тип опи-
сан у представителей магнолиевых, подорожниковых и др. Часто
тип образования тетрад используется в качестве систематического
признака. Однако это не всегда возможно, так как среди некото-
рых семейств двудольных могут встречаться как оба типа заложе-
63
ния тетрад, так и только сукцессивный (например, у лютиковых,
подорожниковых и др.), а среди однодольных — либо только си-
мультанный, либо оба — симультанный и сукцессивный (напри-
мер, у лилейных, ирисовых и др.).
Образовавшиеся в результате мейоза тетрады различаются по
морфологии и взаимному расположению клеток, что обусловлено
типом образования тетрад и формой микроспороцита. Описано
шесть типов образования тетрад: изобилатеральный (все клетки
находятся в одной плоскости), тетраэдральный, Т-образный, ли-
нейный, крестообразный, ромбический.
После распада тетрад микроспор начинается процесс образова-
ния пыльцы, или микрогаметогенез (рис. 3.7). Оболоч-
ка, окружающая тетраду микроспор, распадается. У большинства
покрытосеменных растений соединение микроспор в тетраду про-
должается от нескольких часов до нескольких суток и зависит от
температуры окружающего воздуха. Вокруг каждой микроспоры
постепенно образуется по две оболочки: наружная (экзина) и внут-
ренняя (интина). Одновременно закладываются поры, число ко-
торых колеблется от 1 до 40, но чаще всего образуется одна, две
или три поры. Ядро переходит из центра к периферии клетки. За-
Рис. 3.6. Типы развития тетрад микроспор:
А — последовательный (сукцессивный) тип: 1 — профаза I; 2 — метафаза 1; 5 — метафаза II;
4— анафаза II; 5 — тетрада микроспор; Б — промежуточный тип: 1 — профаза I; 2 — диада мик-
роспор; 3 — метафаза II; 4 — тетрада микроспор; В — одновременный (симультанный) тип :
1 — профаза I; 2 — метафаза I; 3 — метафаза II (веретена митотического аппарата развиваются
в разных плоскостях); 4 — начало образования микроспор; 5 — тетрада микроспор (Атабеко-
ва А. И., Устинова Е. И. Цитология растений. — М.: Колос, 1971. — С. 140)
64
8
Рис. 3.7. Развитие пыльцевого зерна у кукурузы:
1,2—деление первичного ядра микроспоры; 3, 4 — образование вегетативной и генеративной
клеток; 5—7—деление в ядре генеративной клетки (спермиогенез); 8— образование спермиев;
9 — зрелое пыльцевое зерно (Поддубная-Арнолъди и Пащенко, из: Атабекова А. И., Устино-
ва Е. И. Цитология растений. — М.: Колос, 1971. — С. 150)
тем ядро делится по типу митоза и образуются две клетки: веге-
тативная (большая) и генеративная (малая). Далее происходит
деление по типу митоза ядра генеративной клетки — спермиоге-
нез и образуются два спермия. На этом заканчивается образование
мужского гаметофита — пыльцевого зерна, состоящего из веге-
тативной клетки и двух спермиев {мужские гаметы). Следует от-
метить, что у многих растений (лилия, пион, томат и др.) спер-
миогенез происходит в пыльцевой трубке при прорастании
пыльцы.
3.3. МАКРОСПОРОГЕНЕЗ И РАЗВИТИЕ
ЖЕНСКОГО ГАМЕТОФИТА
В завязи пестика образуется семяпочка. Вначале появляется не-
большой бугорок, который быстро увеличивается в размерах. Из
верхней части бугорка образуется тело семяпочки {нуцеллус), а из
нижней — ножка семяпочки (фуникулюс). У злаков семяножка от-
сутствует. Место образования семяпочки называют плацентой. По
бокам нуцеллуса образуются специфические образования — по-
кровы семяпочки, называемые интегументами. Интегументы на
верхушке семяпочки не срастаются и образуют пыльцевход, или
микропиле. Растениям свойственно огромное разнообразие типов
семяпочек.
В. А. Пухальский и др. £.с
В дальнейшем в субэпидермальном слое нуцеллуса закладыва-
ется крупная археспориальная клетка (у некоторых
растений, например, клевера, закладывается несколько таких кле-
ток). Археспориальная клетка претерпевает деление путем мейоза.
В результате образуется тетрада макроспор (мегаспор), характер-
ным признаком которой является линейное расположение макро-
спор, определяющееся расположением веретен деления при пер-
вом и втором делениях (рис. 3.8).
В дальнейшем происходит дегенерация трех мегаспор, и оста-
ется одна, которая примыкает к халазе, т. е. к основанию нуцеллу-
са семяпочки. Ядро этой клетки делится путем митоза, и образует-
ся двухъядерный зародышевый мешок. При этом ядра отходят к по-
люсам клетки, а цитоплазма перегородкой не делится. Далее про-
исходят еще два митотических деления ядер зародышевого мешка,
и последовательно образуются четырехъядерный и восъмиядерный
Рис. 3.8. Развитие зародышевого мешка Polygonum-типа:
1 — материнская клетка макроспоры; 2 — метафаза I; 3 — интеркинез; 4 — метафаза II; 5 —
тетрада макроспор; 6—11 — деление ядер макроспоры; 12 — сформировавшийся зародышевый
мешок (Шарп, из: Петров Д.Ф. Генетика с основами селекции. — М.: Высшая школа, 1954. —
С. 86)
66
Тип
Мате-
ринская
клетка
мегаспор
5
S
I
в
в
Деление
Рис. 3.9. Схема развития основных типов зародышевых мешков у покрытосеменных
растений (Мегешвари П. Эмбриология покрытосеменных. — М.: Иностр, лит.,
1954. - С. 86)
5*
зародышевые мешки. В восьмиядерном зародышевом мешке у каж-
дого полюса, т. е. на микропилярном (у пыльцевхода) и халазаль-
ном (на противоположном пыльцевходу) концах зародышевого
мешка располагается по четыре ядра. Затем от каждого полюса по
одному ядру отходит к центру зародышевого мешка, где они обыч-
но сливаются, образуя центральное ядро зародышевого мешка. В
этом случае в центральном ядре зародышевого мешка число хро-
мосом равняется 2л, тогда как в других образованиях зародышево-
го мешка — п.
Затем происходит образование клеток на противоположных
концах зародышевого мешка. У микропилярного конца формиру-
ется яйцевой аппарат: яйцеклетка и две синергиды, а у халазально-
го — три антиподы. Яйцеклетка по величине значительно крупнее
синергид и имеет грушевидную форму. На этом заканчивается
формирование зародышевого мешка или женского гаметофита.
Женской гаметой является яйцеклетка. Подобный тип формирова-
ния зародышевого мешка называется нормальным типом (Poly-
gonum-mun). Существуют и другие типы развития зародышевых
мешков у покрытосеменных растений (рис. 3.9).
3.4. ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ МЕЙОТИЧЕСКОГО
ДЕЛЕНИЯ
Мейотическое деление у разных организмов протекает сход-
ным образом. Исходя из этого, И.Н. Голубовской была предложе-
на схема генетического контроля мейоза, в которой автор выделя-
ет семь основных этапов: вступление в мейоз, конъюгация гомо-
логичных хромосом, мейотическая рекомбинация, хиазмообразо-
вание, расхождение гомологов, цитокинез, второе деление мейоза.
На различных организмах показано наличие генов, контролирую-
щих каждый этап.
I этап: вступление в мейоз. Запуск мейотического деления, т. е.
переход клетки к генеративному делению, генетически запрог-
раммирован. Ген am (ameiotic) у кукурузы или гены cdc28, tra3 у
дрожжей являются ключевыми в определении перехода клетки к
мейозу. ‘'
II этап: конъюгация гомологичных хромосом. Во время профазы I
происходит синапсис гомологичных хромосом, попарное сближе-
ние параллельно расположенных и слабоконденсированных хро-
мосом, формирование СК, кроссинговер, процессы, генетический
контроль которых определяется большим набором генов. У дрож-
жей Schizosaccharomices cerevisiae идентифицированы 10 ключевых
генов, которые участвуют в обеспечении мейотической рекомби-
нации. Ортологи (гены, имеющие высокую функциональную и
структурную гомологию) этих дрожжевых генов обнаружены и у
других эукариотических организмов, показывая таким образом,
68
что функции некоторых из них являются высококонсервативны-
ми. Так, гомологи одного из белков, играющих важную роль в ре-
комбинации у кишечной палочки {Escherichia coli}, RecA, также
обнаружены у растений, дрожжей и животных.
На этом этапе проявляются следующие группы мутаций.
1. Отсутствие первого деления. У кукурузы обнаружена мута-
ция afd (the absence of the first division}, у которой фактически отсут-
ствует профаза I, в метафазе I 20 унивалентов упорядоченно выст-
раиваются в экваториальной плоскости и в анафазе I к полюсам
расходятся по 20 хроматид. В анафазе — телофазе второго деления
хроматиды распределяются между полюсами случайным образом,
в результате чего растения практически стерильны.
2. Мутации по функционированию СК. Синаптонемный ком-
плекс описан для многих видов, исключения составляют низший
гриб Aspergillus nidulans, дрожжи S. cerevisiae и самцы некоторых
мух, например Drosophila melanogaster. Формирование СК контро-
лируется группой асинаптических генов, мутации которых могут
полностью выключать события, связанные с гомологичной конъ-
югацией и мейотической рекомбинацией. У асинаптических му-
тантов (as) СК практически полностью отсутствует. Такие мутан-
ты обнаружены у многих культур, включая кукурузу, рожь, томат
и др. В то же время часто СК закладывается частично или полнос-
тью, но распадается раньше времени, это явление, десинапсис,
обнаруживается у десинаптических мутантов (ds). Мутация гена
cdc28 дрожжей (5. cerevisiae}, напротив, приводит к нарушению
процессов разборки СК, вследствие чего происходит остановка
мейоза на стадии пахитены.
III этап: мейотическая рекомбинация. Во время этого этапа гене-
тическая изменчивость формируется за счет кроссинговера и слу-
чайного расхождения хромосом и хроматид. Можно выделить не-
сколько важных событий.
1. Изменение частоты кроссинговера. Необходимо отметить,
что она зависит как от внешних факторов, так и от возраста и со-
стояния организма. Кроме того, действие генов может быть сег-
ментоспецифическим. Так, действие гена Rml {recombination
modulator system} у петунии может как повышать частоту кроссин-
говера, так и не оказывать на нее никакого влияния, что зависит
от локализации генов в хромосомах. Наряду с этим действие само-
го гена может быть скорректировано генами-модификаторами.
2. Гомеологичная рекомбинация. У аллополиплоидных видов,
несущих несколько разных геномов, нормальная бивалентная конъ-
югация обусловлена наличием строгой генетической системы. У
пшеницы — это РЛ-система {pairing homeologous}, в которую входят
гены — супрессоры гомеологичной конъюгации (основной супрес-
сор расположен в 5В хромосоме), а также гены-промоторы. В слу-
чае мутации по гену-супрессору наблюдается гомеологичная конъ-
югация, которая может быть использована в практических целях
69
для увеличения генетической рекомбинации между хромосомами
пшеницы и ее сородичей с целью передачи ценных признаков. У
мягкой пшеницы мутации по генам-промоторам приводят к по-
вышенной частоте унивалентов в мейозе. Подобные генетические
системы выявлены у многих полиплоидных видов растений.
IV этап: хиазмообразование. Кроссинговер играет еще одну важ-
ную роль: в результате этого процесса образуются хиазмы — со-
единения несестринских хроматид гомологичных хромосом, кото-
рые удерживают хромосомы в бивалентном состоянии. Число хи-
азм уменьшается на протяжении периода от начала диплотены до
конца диакинеза таким образом, что остаются, как правило, 2—
3 хиазмы на хромосому. Как было отмечено ранее, у группы деси-
наптических мутантов, которые встречаются у многих культур
(мутации dsy, as, dy — у кукурузы, ds — у томата), синаптонемный
комплекс разрушается раньше, вследствие чего в диакинезе — ме-
тафазе I наблюдается повышенное число унивалентов.
V этап: расхождение гомологов. Расхождение гомологов обус-
ловлено работой веретена деления и контролируется сходными ге-
нами в первом и во втором мейотическом делениях. Мутации ге-
нов ms28, ms43 обусловливают нарушения расхождения хромосом
в первом мейотическом делении. Расхождение хромосом зависит
также от их ориентации в экваториальной плоскости (dv) и от
функциональной активности центромер (рс).
VI этап: цитокинез. Деление клетки во время как телофазы I,
так и телофазы II у кукурузы контролируется геном va.
VII этап: второе деление. Переход ко второму делению у кукуру-
зы обеспечивается работой гена el, у других растений гены dyad у
дурмана и рс у картофеля также обеспечивают прохождение второ-
го деления.
3.5. МЕЙОЗ У ОТДАЛЕННЫХ ГИБРИДОВ
Основу цитогенетических исследований отдаленных гибридов
составляет изучение конъюгации хромосом в процессе мейоза. При
нормальном течении мейоза происходит конъюгация гомологич-
ных хромосом. В процессе отдаленной гибридизации у гибридов
можно встретиться с двумя ситуациями. Первая: хромосомы скре-
щиваемых форм идентичны, образуют нормальные биваленты, и в
результате получается вполне фертильное потомство. Такие скре-
щивания получили название конгруентных. Вторая: хромосомы
скрещиваемых форм частично или полностью негомологичны. В
результате происходят нарушения при образовании бивалентов и
формируется частично или полностью стерильное потомство. Та-
кие скрещивания называются инконгруентными.
70
ab x AB}(a x AbbJ ab x Ap3
ab x abba ab x AC ab x CD
III IV v
4
Рис. ЗЛО. Типы конъюгации хромосом по Г. Д. Карпеченко (1935):
I— нормальная; II— неопределенная; III — кольцевая; IV— частичная; V— отсутствие конъ-
югации; VI — сверхконъюгация (то же, что и I, но при скрещивании разных по числу хромо-
сом форм). Гомологичные хромосомы одинаково заштрихованы
Все широкое разнообразие вариантов конъюгации хромосом
при отдаленной гибридизации было систематизировано и сведено
Г. Д. Карпеченко (1935) к шести типам (рис. 3.10).
1. Нормальная конъюгация (eusyndesis). Сюда относятся случаи,
когда число образовавшихся бивалентов не отличается от аналогич-
ного показателя у родительских форм или она, по крайней мере, не
меньше, чем у родительской формы с меньшим числом хромосом.
Например, при скрещивании Pisum humile (л = 7) х Р. sativum
(п =7). При этом в Fj 2п = 14, а в мейозе наблюдается 711*.
2. Неопределенная конъюгация (poikilosyndesis). В этом случае
имеет место большое разнообразие в числе бивалентов и унива-
лентов. Например, при скрещивании Brassica carinata (л = 17) х
х Raphanus sativus (л = 9) в Fj (2л = 26) образуется от О11 до 9й и/или
от 261 до 81.
* Здесь и далее римская цифра обозначает тип конъюгации хромосом: II — би-
валент, III — тривалент (конъюгация трех хромосом), IV — квадривалент (конъ-
югация четырех хромосом), V — пентавалент (конъюгация пяти хромосом) и т. п.,
al — унивалент (хромосома не конъюгирует). Арабские же цифры показывают
число определенных ассоциаций хромосом.
71
3. Частичная конъюгация (hyposyndesis). В этих случаях число
бивалентов в F{ меньше, чем у родительских форм. Так, при скре-
щивании Aegilops ovata (п = 14) х Triticum dicoccum (л = 14) в F\
2л =28 и в мейозе I образуется 7П + 141.
4. Отсутствие конъюгации (asyndesis). При этом биваленты ни-
когда не образуются. Например, в комбинации Ае. ovata (п = 14) х
х T.aestivum (л =21) в наблюдается 351.
5. Сверхконъюгация (hypersyndesis). При этом в F\ число бива-
лентов всегда больше, чем у родительской формы с наименьшим
числом хромосом: Papaver nudicaule (и = 7) х Р. striatocarpum (п = 35),
в F] 2п = 42, а в MI образуется 21п.
6. Кольцевая конъюгация (cyclosyndesis). Особый случай, когда
хромосомы гибрида F\ образуют кольца. Например, при скрещи-
вании Oenotera hookeri (п=7) х O.albians (п =7) в F^ образуется
кольцо из 14 хромосом.
Изучение конъюгации хромосом в мейозе является основой ге-
номного анализа. Так, было показано, что хромосомы Т. aestivum
(2п = 42) относятся к геномам А, В и D, т. е. каждый геном состоит
из семи хромосомных групп: 1А, 2А, ЗА, 4А, 5А, 6А, 7А, IB, 2В, ЗВ,
4В, 5В, 6В, 7В и ID, 2D, 3D, 4D, 5D, 6D и 7D. Хромосомы, обозна-
ченные в каждой из групп одинаковыми цифрами, получили на-
звание гомеологичных. Гомеологичные хромосомы — это хромосо-
мы, у которых последовательность локусов чаще всего нарушена,
вследствие чего их конъюгация затруднена или отсутствует. У
Т. durum (2п = 28) имеется только два генома — А и В. Хромосомы
этих геномов гомологичны хромосомам геномов А и В Т. aestivum.
Поэтому при скрещивании T.durum х Т. aestivum у гибридов F[ в
метафазе I образуется 1411 (хромосомы геномов А и В) + 71 (хромо-
сомы генома D), а при скрещивании T.aestivum (2п —42, геном
ABD) х Ае. squarrosa (2п = 14, геном D) в F\ образуется 711 + 141.
Этим скрещиванием было подтверждено, что хромосомы генома
Ае. squarrosa гомологичны хромосомам генома D мягкой пшеницы
и сделан вывод, что этот вид эгилопса в далеком прошлом явился
одним из родоначальников Т. aestivum.
На основе геномного анализа были проведены эксперименты
по ресинтезу некоторых видов пшеницы (например, Т. spelta) и
предложена схема филогении рода Triticum L. (рис. 3.11).
У отдаленных гибридов обнаружено деление центромеры хро-
мосомы не в продольном, а в поперечном направлении. Такое де-
ление получило название мис-дивижен. В результате каждое из
плеч превращается в маленькую хромосому, получившую назва-
ние телоцентрика. Поскольку удвоение хромосом происходит до
начала мейоза, в ряде случаев одна из хроматид телоцентрика по-
ворачивается вокруг центромеры и образуется так называемая
изохромосома (рис. 3.12).
72
T. urartu
и и
A A
V
Ae. speltoides
SS(rfrf)
Удвоение хромосом
T. beoticum
А А
. <а
• г
1
Т. dicoccoides
ААВВ
T. araraticum
Aa'gG
T. dicoccum x Ae. squarrosa
AABB
DD
T. timopheevii x T. monococcum
a'a'gg
А А
Т, durum
ААВВ
Т. spelta
AABBDD
Т. turgidum
ААВВ
Т. zhukovskyi
t t J) d>
A AB В GG
Г. aestivum
AABBDD
Т. carthlicum
ААВВ
Т, polonicum
ААВВ
T. antiquorum
AABBDD
I
Т. compactum
AABBDD
*
Т. sphaerococcum
AABBDD
Рис. 3.11. Схема филогении рода Triticum L
Разрыв
Рис. 3.12. Вероятное происхождение изохромосом из унивалентов:
А — унивалент с поперечным разломом, проходящим через центромеру; Б — телоцентрические
хромосомы, образовавшиеся в результате разлома через центромеру; В, Г, Д— возникновение
изохромосомы с идентичными плечами (Эллиот Ф. Селекция растений и цитогенетика. — М.:
Иностр, лит., 1961. — С. 101)
МЛ1ИДЖЧН I- I-- -------------- - - ——————Л—
Рис. 3.13. Изменчивость конъюгации хромосом у гибридов Fi Т, aestivum (сорт
Родина) х Ае. speltoides в метафазе I:
а-5п + 1Ш + 15’;^—6й + 16’; в - 1111 +61; г - 4» + 2П| + 141; д - 411 + З’п + Н!;е- 1” +
5П| + 111; ж — 6n + 1IV + 121; з — 3й + 4nI + 1IV + 6[. (Пухальский В. А., Лапочкина И. Ф.,
1983)
Нетрудно представить, что нарушения в MI (рис. 3.13) приво-
дят к определенным нарушениям и в AI. Прежде всего это нерав-
номерное расхождение хромосом к полюсам. В результате очень
часто это приводит к образованию женских и мужских гамет с раз-
ным числом хромосом и, как следствие, к различной жизнеспо-
собности гамет (чаще гибнут мужские гаметы с несбалансирован-
ным числом хромосом), а при нормальном оплодотворении — к
появлению анеуплоидных растений (рис 3.14).
К другим нарушениям в AI следует отнести задержку унива-
лентов (одного или нескольких) на экваторе и, как следствие,
образование микроядер в диаде микроспор и макроспор, хромо-
сомных или хроматидных мостов, а также нарушение функций
веретена. В последнем случае вместо диады микроспор может
образоваться триада и т. п. Естественно, цепочка нарушений
процесса мейоза у отдаленных гибридов продолжается и во вре-
мя второго деления. На каждой из стадий может наблюдаться
много отклонений.
Они проявляются в виде отставаний хромосом, мостов, фраг-
ментов, многополюсности. Часто в пределах одного пыльника
встречаются клетки, находящиеся в стадиях от диакинеза до тет-
рад, наблюдается асинхронность деления. Все это в конце концов
приводит к возникновению дефектных тетрад (с различным чис-
лом микроядер) и полиад — пентад, гексад и т. п. (рис. 3.15).
Для оценки стабильности мейоза используют интегральный
показатель — мейотический индекс, который представляет собой
процент нормальных тетрад от общего числа изученных. При мей-
отическом индексе 90 % и выше растение считается цитологиче-
ски стабильным, т. е. оно будет воспроизводить в потомстве ста-
бильное число хромосом.
Рис. 3.14. Частота встречаемости (%)
растений с разным числом хромосом в
F2 гибридной комбинации к-45365
(2л = 42) х Народная (2л = 28):
а
1 — теоретически ожидаемая; 2 — 1977 г.;
3 — 1979 г (теплица); 4 —1979 г. (вегетаци-
онный домик) (Пухальский В. А. и др.,
1983)
28 30 32 34 36 38 40 42
Число хромосом
75
б
Рис. 3.15. Нарушения в мейозе:
в
а — формирование мультивалентных ассоциаций; б — задержка хромосом на экваторе в AI;
в — полиады (из коллекции кафедры генетики РГАУ—МСХА им. К. А. Тимирязева)
3.6. ПАХИТЕННЫЙ АНАЛИЗ ХРОМОСОМ
Структура пахитенных хромосом позволяет идентифицировать
индивидуальные хромосомы, выявлять изменения их морфоло-
гии, анализировать характер конъюгации при наличии перестро-
ек. Хромосомы в этой стадии имеют специфический рисунок ок-
рашивания, который постоянен внутри вида (рис. 3.16). Интен-
сивно окрашивающиеся гетерохроматиновые участки могут раз-
личаться по величине и месту положения в хромосоме. Так, у
томата они занимают только прицентромерное положение, в то
время как остальная часть хромосомы состоит из широких слабо и
сильно окрашивающихся участков хроматина. В качестве диагнос-
тических признаков для идентификации каждой пары хромосом
используют относительную длину пахитенной хромосомы; мес-
тоположение центромеры; характер-
ные особенности гетерохроматиновых
участков; наличие и распределение
узелков. На основе пахитенного ана-
лиза составляют пахитенную карту
(рис. 3.17), позволяющую проводить
идентификацию хромосом, особенно
в случае отдаленных гибридов.
Рис. 3.16. Пахитенные хромосомы томата
76
Рис. 3.17. Пахитенная карта томата (Жученко А. А.
Генетика томатов. — Кишинев, 1973)
3.7. ОПЛОДОТВОРЕНИЕ, РАЗВИТИЕ ЭНДОСПЕРМА
И ЗАРОДЫША
Процесс оплодотворения происходит у большинства растений
следующим образом. Пыльца, попав на рыльце пестика, начинает
прорастать (прогамная фаза), образуя пыльцевую трубку. Содержи-
мое пыльцевого зерна (два спермия и ядро вегетативной клетки)
постепенно переходит в пыльцевую трубку. Через некоторое вре-
мя, прорастая в тканях столбика, пыльцевая трубка достигает за-
родышевого мешка и врастает в него. У большинства растений
пыльцевая трубка врастает через микропиле (порогамия), но отме-
чены случаи, когда пыльцевая трубка врастает в зародышевый ме-
шок через халазу (халазогамия) или через интегументы (мезога-
мия). При попадании в зародышевый мешок пыльцевая трубка
лопается и изливает в него свое содержимое. Далее происходит
процесс двойного оплодотворения, открытый С. Г. Навашиным
77
в 1898 г. (рис. 3.18). Один из спермиев внедряется в яйцеклетку, и
его ядро сливается с ядром яйцеклетки. В результате образуется
зигота с удвоенным числом хромосом (2я). В дальнейшем из зиго-
ты развивается зародыш семени. Второй спермий сливается с цент-
ральным ядром зародышевого мешка, имеющим 2п хромосом, в
результате чего новое ядро имеет тройной набор хромосом (Зл).
Деление этого ядра дает начало развитию эндосперма. Поэтому
ядра эндосперма всегда триплоидны. Развитие эндосперма начи-
нается раньше развития зародыша и протекает в два этапа: рост
эндосперма и накопление в нем запасных питательных веществ.
Образуется ткань, питающая зародыш при его развитии. Описано
три типа образования эндосперма: нуклеарный, целлюлярный и
базальный, или гелобиальный. При нуклеарном типе деление ядер
вначале не сопровождается образованием клеточных перегородок.
Они появляются позже. При целлюлярном типе деление ядер эн-
досперма сопровождается образованием клеточных перегородок.
Базальный тип образования эндосперма занимает промежуточное
положение между нуклеарным и целлюлярным.
У некоторых видов растений питательные вещества накаплива-
ются в клетках нуцеллуса и образуется так называемый перисперм.
Выделяют два типа перисперма: настоящий (сохраняется в зрелом
семени) и транзиторный (расходуется в процессе развития).
Развитие зародыша (рис. 3.19) начинается после того, как
сформируется эндосперм. В результате первого деления зиготы
образуются две клетки {двухклеточный проэмбрио). Клетка, обра-
щенная к микропилярному концу зародышевого мешка, носит на-
звание базальной, а клетка, обращенная к
халазальному концу, — апикальной. В даль-
нейшем из базальной клетки развивается
подвесок, а из апикальной — зародыш. Деле-
ние апикальной клетки протекает довольно
интенсивно путем митоза. Через некоторое
время образуется шаровидный зародыш (гло-
була), в дальнейшем происходит дифферен-
циация (начало в стадии сердца) многокле-
точного зародыша на отдельные органы —
семядоли, почечку, зародышевый корешок
(рис. 3.20).
Рис. 3.18. Двойное оплодотворение у подсолнечника:
1 — яйцеклетка; 2 — ядро центральной клетки; 3 — спермин;
4 — синергиды; 5 — пыльцевая трубка (Навашин, из: Атабе-
кова А. И., Устинова Е. И. Цитология растений. — М.: Колос,
1980. - С. 246)
78
Рис. 3.19. Стадии развития зародыша у пастушьей сумки (Capsella bursapastoris):
А—Е— последовательные стадии развития (Мегешвари П. Эмбриология покрытосемен-
ных. —М.: Изд-во Иностр, лит., 1954. — С. 264)
Рис.3.20. Продольный
разрез семени:
А — двудольного растения
(свекла): 1 — перисперм; 2 —
эндосперм; 3 — зародыш; 4 —
перисперм; 5 — семяножка;
6 — халаза; 7 — семенная ко-
жура ( перикарп); Б — одно-
дольного растения (сорго):
7 - щиток; 2 — колеоптиле;
3— точка роста стебля; 4 —
зачаток корешка; 5 — корне-
вой чехлик; 6 — колеориза;
7— алейроновый слой; 8 —
эндосперм; 9 — рубчик (Арт-
шватер, Брандес и Старрет,
из: Атабекова А. И., Устинова
Е- И. Цитология растений. —
М.: Колос, 1980. — С. 278)
Б
3.8. ОСОБЕННОСТИ РАЗМНОЖЕНИЯ
ГОЛОСЕМЕННЫХ РАСТЕНИЙ
В отличие от покрытосеменных растений у голосеменных се-
мязачатки и семена расположены открыто на поверхности споро-
филлов или аналогичных структур. Микро- и мегаспорангии
большинства голосеменных формируются в отдельных шишках
на одном и том же дереве. Рассмотрим подробнее размножение
голосеменных на примере сосны. Мужские (микроспорангиевые)
шишки (рис. 3.21) у сосны относительно мелкие, они обычно
формируются на нижних ветвях, а женские (мегаспорангиевые) —
на верхних, что обеспечивает предпочтительное перекрестное
опыление. Микроспорофиллы располагаются в шишках спираль-
но, в каждом из них имеется по два микроспорангия (см.
рис. 3.21). Микроспороциты, во множестве находящиеся в каждом
микроспорангии, ранней весной делятся путем мейоза, образуя
четыре гаплоидные микроспоры каждый. Из каждой микроспоры
развивается пыльцевое зерно, которое состоит из двух проталли-
альных клеток, генеративной клетки и клетки трубки (рис. 3.22). В
этом состоянии происходит рассеивание пыльцы, перенос ее к
женским шишкам.
Рис. 3.21. Микроспорангиатные (мужские) шишки (Л) и продольный разрез мужской
шишки сосны (Б) — видны микроспорофиллы и микроспорангии, содержащие зрелые
Б
ильцевые зерна
80
Рис. 3.22. Пыльцевые зерна с мужскими гаметофитами внутри (Л) и пыльцевое зерно
с двумя воздушными мешками под сканирующим электронным микроскопом (Б).
Когда оно прорастает, пыльцевая трубка выходит снизу между воздушными мешками
В женских шишках каждый семязачаток содержит многокле-
точный нуцеллус (мегаспорангий), окруженный массивным инте-
гументом с отверстием — микропиле (рис. 3.23). В мегаспорангии
содержится одна клетка мегаспороцита, в результате мейотическо-
го деления дающая линейный ряд мегаспор. Три мегаспоры, рас-
полагающиеся ближе к микропиле, отмирают.
Рис. 3.23. Продольный разрез молодой женской шишки (слева) и увеличенный
фрагмент разреза (справа)
6 В. А. Пухальский и др.
81
Рис. 3.24. Оплодотворе-
ние у сосны: слияние ядер
спермия и яйцеклетки
Опыление происходит весной. Пыль-
ца прилипает к капле клейкой жидкости,
которая выделяется вблизи микропиле.
При испарении жидкости пыльцевое
зерно втягивается в микропиле и попада-
ет на нуцеллус. Пыльцевое зерно прорас-
тает, образуя пыльцевую трубку, задолго
до мейоза в мегаспорангии. Мегагамето-
фит формируется лишь спустя несколько
месяцев. Примерно через 15мес после
опыления пыльцевая трубка достигает
сформировавшейся лишь к этому време-
ни яйцеклетки архегония и два спермия
вместе с цитоплазмой попадают внутрь
(рис. 3.24). Ядро одного из спермиев сли-
вается с ядром яйцеклетки, а у другого —
дегенерирует.
Для хвойных характерна полиэмбрио-
ния, которая возникает в результате опло-
дотворения яйцеклеток всех архегониев.
Кроме того, в дальнейшем на ранней ста-
дии эмбриогенеза из образующихся четы-
рех ярусов клеток одновременно могут развиваться несколько за-
родышей.
Семя хвойных представляет собой комбинацию двух спорофит-
ных поколений — семенной кожуры (и остатков нуцеллуса) и за-
родыша и одного гаметофитного, служащего запасом питательных
веществ.
3.9. ЯВЛЕНИЕ КСЕНИЙНОСТИ
Процесс двойного оплодотворения служит у растений причи-
ной явления, получившего название ксенийности. Это сравнитель-
но редкое явление, при котором признаки отцовского растения
проявляются уже на гибридных зернах, развивающихся на мате-
ринском растении. Так, у кукурузы окраска зерен зависит от цвета
алейрона, а не семенной оболочки — перикарпа (материнское об-
разование). Если растение с белыми зернами опылить пыльцой
растения с фиолетовыми зернами, то гибридные зерна початка
материнской формы будут фиолетовыми (алейрон фиолетового
цвета).
3.10. АПОМИКСИС
У некоторых видов растений встречаются случаи развития за-
родыша без оплодотворения — апомиксис. Существует четыре типа
апомиксиса.
82
1. Нерегулярный апомиксис. При этом типе апомиксиса нор-
мально протекает мейоз, образуется зародышевый мешок, а заро-
дыш развивается без оплодотворения из яйцеклетки (партеноге-
нез) или из других клеток гаметофита (апогамия).
Партеногенез. У растений описано два типа партеноге-
неза: редуцированный и нередуцированный. При редуцированном
партеногенезе зародыш развивается из неоплодотворенной яйце-
клетки, имеющей число хромосом, равное п. В дальнейшем из та-
кого зародыша развивается гаплоидное растение. Такие растения
полностью стерильны, поскольку мейоз проходит с большими на-
рушениями. Встречается у растений семейств Liliaceae, Brassica-
сеае и др. Нередуцированный партеногенез свойственен видам из
семейств Poaceae, Ranunculacea и др. При этом типе партеноге-
неза при развитии зародышевого мешка мейоз отсутствует, его
заменяет митоз. В этом случае яйцеклетка в зародышевом мешке
имеет нередуцированный набор хромосом 2п. Из такой яйце-
клетки при нередуцированном партеногенезе развивается фер-
тильное растение.
Апогамия (апогаметия). При этом виде апомиксиса
развитие зародыша происходит из синергид или антипод. Подоб-
ный тип развития зародыша встречается у льна и кукурузы. Расте-
ния при этом, как правило, гаплоидны, т. е. имеют редуцирован-
ный набор хромосом (л), однако встречаются и с нередуцирован-
ным числом хромосом (2л).
2. Регулярный апомиксис. В этом случае диплоидный зародыше-
вый мешок формируется из клетки археспория или из клетки ну-
целлуса (апоспория), зародыш образуется либо из яйцеклетки
(партеногенез), либо из любой другой клетки зародышевого
мешка.
Апоспория. Зародышевый мешок развивается из клеток
нуцеллуса или интегументов. Редукции числа хромосом при этом
не происходит. Как правило, такие зародышевые мешки после об-
разования отмирают. Апоспория описана у разных групп цветко-
вых растений. Чаще встречается у представителей семейств
Asteraceae, Poaceae и Rosaceae.
3. Адвентивная эмбриония (спорофитное почкование). Это разви-
тие зародыша из клеток нуцеллуса (нуцеллярная эмбри-
ония) или из клеток интегумента (интегументальная
эмбриония). В обоих случаях зародыш образуется из клеток
внутреннего интегумента. Первая встречается в семействах
Solanaceae, Orchidaceae, Poaceae и др., а вторая описана для се-
мейств Caryophyllaceae, Alliaceae и др.
4. Вивипария. Это тип апомиксиса, при котором цветки замене-
ны луковичками либо другими образованиями, предназначенны-
ми для вегетативного размножения, которые могут прорастать на
растении.
6*
83
Глава 4
ФИКСАЦИЯ ЦИТОЛОГИЧЕСКОГО МАТЕРИАЛА
4.1. ПОДГОТОВКА МАТЕРИАЛА К ФИКСАЦИИ
Наилучшим материалом для цитологических исследований
(подсчет числа хромосом, изучение их морфологии) служат быст-
ро растущие молодые корешки растений или главные корешки
проросших семян. Это объясняется тем, что в меристематических
тканях молодых корешков интенсивно происходят митотические
деления, что облегчает цитологические исследования. В осталь-
ных органах растений интенсивность делений ниже, кроме того,
фигуры деления расположены хаотически. Однако иногда для
подсчета числа хромосом используют формирующиеся пыльники
с делящимися внутри них материнскими клетками микроспор,
развивающиеся лепестки бутонов, например арабидопсиса, или
зачаточные листья сахарной свеклы.
Цель предфиксационной обработки материала — получение
качественных препаратов за счет увеличения доли клеток в иссле-
дуемой стадии, лучшего разброса хромосом в клетке и их компак-
тизации.
Для изучения мейотических хромосом используют развиваю-
щиеся пыльники или завязи в формирующихся бутонах.
В зависимости от цели для эмбриологических исследований бе-
рут молодые бутоны цветков в разных фазах развития, а также
цветки после опыления и оплодотворения. В некоторых случаях
используют только пыльники или только пестики.
Основное требование при подготовке растений к фиксации —
создание оптимальных условий для их роста и развития.
Рассмотрим основные этапы подготовки к фиксации материа-
ла, предназначенного для изучения соматических тканей, т. е.
митотического деления.
Для подсчета числа хромосом и изучения их морфологии, как
правило, используют проросшие семена либо молодые корешки
растений, что сложнее и требует бережного отношения к растени-
ям и тщательного промывания отделенных от субстрата корешков.
При использовании семян их проращивают на влажной фильт-
ровальной бумаге в чашках Петри при температуре 20...25 °C. К
фиксации приступают по достижении корешками длины 0,8—
1,5 см. Иногда перед фиксацией желательна обработка исследуе-
84
мого матерела различными веществами, улучшающими разброс
и компактизацию хромосом. Некоторые варианты обработок
представлены в таблице 4.1.
4.1. Варианты предфиксационной обработки материала
Вещество
Концентрация
Продолжи-
тельность
обработки,ч
Температура, °C
Культура
Ледяная вода
18
24
18-20
а-В г-нафталин
Колхицин
Насыщенный
раствор (1 капля
раствора на 100 мл
воды)
0,05-0,2%
4-9
24
2-6
2...4
2...4
2...4
20
2...4
Томат
Тритикале,
пшеница,
рожь
Гил ия
Тритикале,
пшеница,
рожь
8-Гидрокси-
хинол ин
2 мМ (0,029 г
на 100 мл воды)
2,5-4
20
17
Пшеница,
рожь,
тритикале
Пшеница,
ячмень
После обработки этими веществами проростки или корешки не-
обходимо тщательно промыть в проточной воде в течение не менее
15 мин, для чего их кладут в мешочки из сложенной вдвое марли с
этикеткой данного образца и опускают в химический стакан,
который помещают под струю воды. При работе с колхицином,
а-В г-нафталином, 8-гидроксихинолином необходимо соблюдать
осторожность, и все работы проводить в резиновых перчатках и в
ватно-марлевом респираторе под вытяжным шкафом.
Для фиксации отрезают от каждого корешка кончик длиной
5—7 мм и быстро помещают в фиксирующую жидкость. Семена
же с проростками и укороченными при фиксации корешками
можно посадить в вазоны и вырастить из них растения.
В тех случаях, когда приходится брать корешки от растений,
произрастающих в поле, за несколько дней до фиксации необхо-
димо взрыхлить почву возле растения, подкормить их удобрения-
ми и регулярно поливать. Накануне фиксации растения следует
обильно полить. При извлечении корешков из почвы растение
подкапывают с одной стороны (или вынимают его из сосуда вмес-
те с комом земли при выращивании в вегетационном домике), от-
мывают водой обнаженные корни, отрезают кончики молодых ко-
решков длиной до 1 см и немедленно опускают их в фиксирую-
щую жидкость. У некоторых растений удобно получать нужное
количество корешков при укоренении побегов. Так, при работе с
томатом укоренение можно проводить в воде, либо индуцировать
корнеобразование созданием влажной камеры из смоченной во-
дой ваты, завернутой полиэтиленовой пленкой, прямо на расте-
85
нии. В этом случае нужно избегать применения удобрений и дру-
гих химических веществ, чтобы не вызвать появления клеток с
аномалиями.
В случае эмбриологических исследований подготовка растений
перед фиксацией их бутонов, пыльников и других органов заклю-
чается в создании оптимальных условий для роста и развития рас-
тений. В ряде случаев при подготовке эмбриологического матери-
ала приходится производить кастрацию и искусственное опыле-
ние цветков. При этом, как правило, применяют темпоральную
фиксацию (материал фиксируют через определенные промежутки
времени, продолжительность которых зависит от скорости изме-
нения изучаемых процессов), так как очень трудно заранее уста-
новить такие параметры, как скорость роста пыльцевых трубок,
момент оплодотворения, фазу развития зародыша.
При фиксации крупных бутонов или завязей их расчленяют на
части для более быстрого проникновения фиксирующей жидко-
сти. При фиксации конусов нарастания у злаков их необходимо
освободить от кроющих листьев.
Для видов растений с длинными хромосомами за 1 ч до фикса-
ции желательна обработка корешков, полученных в чашках Пет-
ри, 0,5—1%-м раствором хлоралгидрата с последующей промыв-
кой в проточной воде в течение 1 ч. В этом случае происходит уко-
рочение и выпрямление хромосом, что облегчает их подсчет. Ана-
логичным действием обладает 8-гидроксихинолин.
С этой же целью отрезанные корешки помещают в сосуды с
водой, а сосуды — на лед или в холодильник и выдерживают в те-
чение 24 ч при температуре 0...2 °C.
4.2. СОСТАВ И ПРИМЕНЕНИЕ
НАИБОЛЕЕ РАСПРОСТРАНЕННЫХ
ФИКСИРУЮЩИХ ЖИДКОСТЕЙ
Фиксация материала — результат быстрой (почти мгновенной)
гибели клеток из-за погружения в ядовитую жидкость, что позво-
ляет сохранить почти без изменения прижизненную структуру ор-
ганоидов клеток. Кроме того, при фиксации коллоиды клеток пе-
реходят в нерастворимое состояние и приобретают способность
окрашиваться красителями. Таким образом, цель фиксации — пе-
ревод компонентов клеток в нерастворимое состояние с наиболее
полным сохранением их прижизненной структуры.
Фиксацию осуществляют путем погружения свежего расти-
тельного материала (корешки, бутоны и др.) в различные ядови-
тые жидкости на срок от нескольких часов до нескольких суток.
Для более полного сохранения прижизненных структур клетки
применяют избирательно действующие фиксаторы. В связи с этим
их подразделяют на три группы.
86
1. Фиксирующие ядро, или ядерные фиксаторы (фиксаторы
Навашина, Карнуа и др.).
2. Фиксирующие цитоплазму (фиксаторы Флемминга, Герма-
на и др.).
3. Фиксирующие органоиды клеток (фиксатор Левитского и др.).
При цитологических и эмбриологических исследованиях обыч-
но имеют дело только с ядерными фиксаторами. В качестве их
компонентов обычно используют следующие вещества: спирт, ук-
сусную, хромовую, осмиевую, пропионовую и пикриновую кисло-
ты, формалин, диоксан и др.
Для устранения недостатков каждой из ядовитых жидкостей
применяют их смеси, составляя комбинированные фиксаторы.
В зависимости от используемого растворителя фиксаторы де-
лят на водные (например, фиксаторы Навашина и Модилевского)
и спиртовые (например, фиксаторы Карнуа и Чемберлена).
Водные фиксаторы медленно проникают в клетки растений,
поэтому материал в них выдерживают от 30 мин до 12 ч в зависи-
мости от его размеров. Водные фиксаторы обладают более мягким
действием, чем спиртовые, поэтому для небольших нежных
объектов используют преимущественно их. Для крупных объек-
тов водные фиксаторы непригодны, так как они плохо в них про-
никают.
Для цитологических и цитогенетических исследований обычно
используют следующие фиксаторы.
Фиксатор Навашина (10-4-1)*. Используют для фиксации хро-
мосом в корешках и мелких эмбриологических объектов. Матери-
ал выдерживают в фиксирующей жидкости 24 ч в темноте. Состав
фиксатора:
хромовая кислота 1%-й раствор — 10 частей
формалин 16%-й раствор (40%-й от продажного) — 4 части
ледяная уксусная кислота — 1 часть.
Смешивать растворы следует непосредственно перед фиксаци-
ей, так как фиксирующая смесь быстро разлагается (формалин
окисляется хромовой кислотой). Фиксатор действует очень мягко,
хорошо сохраняет структуру хромосом.
! (осле фиксации препараты хорошо окрашиваются ядерными
красителями (гематоксилином Гейденгайна, гематоксилином Эр-
лиха).
Фиксатор Модилевского (9-2-2-Z). Используют при эмбриоло-
гических исследованиях. Материал выдерживают в фиксаторе
24 ч. Состав фиксатора:
хромовая кислота 1%-й раствор — 9 частей
формалин 16%-й раствор — 2 части
бихромат калия 5%-й раствор — 2 части
* В скобка- > к ано объемное соотношение компонентов.
87
уксусная кислота 5%-й раствор — 2 части.
По действию на материал сходен с фиксатором Навашина.
Фиксатор Карнуа (6-3-1). Используют для цитологических и
эмбриологических исследований. Материал выдерживают в фик-
саторе от 2 до 12 ч. Состав фиксатора:
спирт 100%-й или 96%-й — 6 частей
хлороформ — 3 части
ледяная уксусная кислота — 1 часть.
Этот фиксатор быстро проникает в крупные эмбриологические
объекты, но действует менее мягко, чем фиксатор Навашина.
После фиксации препараты хорошо окрашиваются ядерными
красителями (кармином, гематоксилином Делафильда).
Уксусный алкоголь, или измененный Карнуа (3-1). Используют
для фиксации цитологического и эмбриологического материала.
Объекты выдерживают в фиксирующей смеси от 2 до 12 ч. Состав
фиксатора:
спирт 100%-й или 96%-й — 3 части
ледяная уксусная кислота — 1 часть.
Фиксатор действует подобно фиксатору Карнуа.
Фиксатор Чемберлена (18-1-1), или формолацеталкоголь. Почти
универсальный фиксатор. Используется для цитологических и эм-
бриологических исследований. Материал выдерживают в фикса-
торе не менее 12 ч. В этом фиксаторе материал можно хранить
продолжительное время без повреждений. Состав фиксатора:
спирт 50—70%-й — 18 частей
формалин 40%-й (продажный) — 1 часть
ледяная уксусная кислота— 1 часть.
Фиксатор Чемберлена быстро проникает в крупные эмбриоло-
гические объекты. После него препараты хорошо окрашиваются
ядерными красителями. Фиксатор Чемберлена действует на мате-
риал более мягко, чем фиксатор Карнуа, но не так мягко, как фик-
саторы Навашина и Модилевского.
Фиксатор Яковлева (8-4-1). Используют как для цитологичес-
ких, так и для эмбриологических исследований. Зафиксирован-
ный материал можно хранить в нем довольно продолжительное
время. Состав фиксатора:
спирт 100%-й — 8 частей
хлороформ — 4 части
ледяная уксусная кислота — 1 часть.
Фиксатор Риего (4-1). Используют для изучения клеточных ор-
ганоидов. Состав фиксатора:
бихромат калия 3%-й — 4 части
формалин 40%-й (продажный) —1 часть.
Материал выдерживают в фиксаторе в темноте в течение 4 сут,
ежедневно заменяя раствор на свежий. После этого материал по-
88
мещают в 3%-й бихромат калия на 3—8 сут, а затем промывают в
проточной воде.
Фиксатор Ньюкомера (6-3-1-1-1). Ядерный фиксатор. Его ши-
роко используют при изучении хромосомных аберраций и мейоза.
Состав фиксатора:
изопропиловый спирт — 6 частей
пропионовая кислота — 3 части
ацетон — 1 часть
диоксан — 1 часть
петролейный эфир — 1 часть.
Материал в фиксаторе выдерживают в течение 24 ч при ком-
натной температуре, затем заливают свежим раствором фиксатора
и хранят в холодильнике.
Следует помнить, что диоксан и пропионовая кислота — силь-
ные яды. Работать с этим фиксатором можно только в резиновых
перчатках и под вытяжным шкафом.
Ледяная уксусная кислота. Может быть использована для фик-
сации корешков некоторых видов растений.
45%-я уксусная кислота. Используют в качестве мягкого фикса-
тора.
4.3. ТЕХНИКА ФИКСАЦИИ И ПРОМЫВКА МАТЕРИАЛА
ОТ ФИКСАТОРОВ
Существуют следующие правила фиксации, строгое соблюде-
ние которых дает возможность получить зафиксированный мате-
риал высокого качества.
1. Выбор фиксатора, отвечающего целям исследования.
2. Использование фиксирующей жидкости в количестве не ме-
нее чем в 50 раз превышающем массу фиксируемого материала.
Для фиксации корешков удобно использовать плоскодонные про-
бирки диаметром 1,5—2 см и полезным объемом не менее 7—
10 мл. В случае применения пробирок Эппендорфа объемом 1,5—
2 мл в каждую из них отбирают не более 15 корешков длиной
0,5 см.
3. Фиксация совершенно свежего материала, лучше всего на
месте его получения.
4. Отбор только прямых корешков длиной 7—8 мм. При фик-
сации эмбриологического материала следует удалять ненужные
для исследования части органов (лепестки, чашелистики, цвето-
ножки и др.).
5. Быстрое проведение всех операций при фиксации.
89
4.3.1. ПОСЛЕДОВАТЕЛЬНОСТЬ ОПЕРАЦИЙ ПРИ ФИКСАЦИИ
КОРЕШКОВ РАСТЕНИЙ И ПРОРАСТАЮЩИХ СЕМЯН
1. Накануне фиксации обильно поливают растения и перено-
сят вазоны в помещение с температурой воздуха 20...25 °C. При
работе с семенами их проращивают в чашках Петри, которые луч-
ше всего поместить в термостат.
2. Готовят пробирки и этикетки. Последние изготавливают из
плотной бумаги, их размер зависит от объема пробирки. В каче-
стве этикеток удобно использовать самоклеящиеся наклейки. На
этикетке простым карандашом делают необходимые надписи (по-
рядковый номер фиксации, дата, краткие сведения о растении,
сокращенное название фиксатора). Пробирки закрывают хорошо
подобранными пробками.
3. Одновременно с подписыванием этикетки производят запи-
си в журнал регистрации фиксаций, где также указывают вышепе-
речисленные данные, а также приводят дополнительные сведения
об исследуемом растении и указывают время фиксации.
4. Раскладывают пробирки с вложенными в них этикетками
около соответствующих растений или чашек Петри с проросшими
семенами.
5. Готовят фиксирующую жидкость. Большинство используе-
мых фиксаторов готовят заранее. Уксусный алкоголь и фиксатор
Навашина лучше готовить непосредственно перед фиксацией. На-
ливают фиксирующую жидкость в пробирку и одновременно све-
ряют этикетку. Пробирку ставят вертикально и не закрывают
пробкой. Фиксатор уксусный алкоголь готовят заранее, поскольку
он хорошо хранится в холодильнике.
6. Отрезанные корешки немедленно помещают в пробирку с
фиксирующей жидкостью. Длина отрезанных участков должна
быть равна 5—7 мм. В случае прилипания корешка к сухой стенке
пробирки его сбрасывают в фиксатор при помощи тонкой стек-
лянной палочки. Рекомендуется фиксировать по 10—20 корешков
для каждого образца исследуемого материала.
Для ускорения проникновения фиксирующей жидкости в
крупные корешки применяют метод вакуум-инфильтрации по
В.Н. Юрцеву. Собирают установку из аппаратуры, имеющейся в
каждой лаборатории. Установка состоит из эксикатора с краном в
крышке, вакуумного насоса системы Комовского (или водоструй-
ного насоса), металлического и стеклянного тройников, отдельно-
го стеклянного крана, соединительных вакуумных толстостенных
резиновых трубок (общей длиной до 1 м), отрезка мягкой резино-
вой трубки и отрезка стеклянной или металлической трубки. В со-
бранном виде установка показана на рисунке 4.1.
Бюксы (пробирки или пенициллиновые пузырьки) с расти-
тельным материалом, находящимся в фиксирующей жидкости,
помещают на картонный поддон в эксикатор. Крышки бюксов
должны быть открытыми. Накрывают эксикатор крышкой, .встав-
90
Рис. 4.1. Схема соединения приборов при методике вакуум-инфильтрации:
1 — растительные объекты в бюксах с фиксирующей жидкостью; 2 — эксикатор; 3 — кран эк-
сикатора; 4 — разъединительная трубка; 5 — тройник; 6 — отрезок мягкой резиновой трубки
(заменяет манометр); 7 — кран для впуска воздуха; 8 — вакуумный насос; 9 — резиновая труб-
ка для отвода воздуха; 10 — соединительные вакуумные резиновые трубки
ляют в нее кран, соединенный резиновой трубкой с насосом, и
создают в эксикаторе разрежение. После полного сжатия мягкой
трубки 6 насос останавливают, закрывают кран 3, чтобы масло из
насоса не попало в резиновые трубки установки, открывают кран
7. Из-за падения давления вокруг объектов, находящихся в жидко-
сти, из них выходит воздух и внутри объектов создается разреже-
ние. Затем постепенно открывают кран 3 и впускают наружный
воздух в эксикатор, он начинает давить на фиксирующую жид-
кость и она устремляется под небольшим давлением внутрь объек-
тов и фиксирует их. Метод вакуум-инфильтрации позволяет в не-
сколько раз ускорить фиксацию объектов.
4.3.2. ПРОМЫВКА ЗАФИКСИРОВАННОГО МАТЕРИАЛА
И ЕГО СОХРАНЕНИЕ
После фиксации материал необходимо промыть для удаления
фиксирующих веществ или продуктов их разложения. При фикса-
ции водными фиксаторами промывку произ-
водят водой, при фиксации спиртовыми фик-
саторами — спиртом. Если своевременно не
удалить фиксирующее вещество из материала,
то могут произойти нежелательные измене-
ния последнего (чрезмерное уплотнение и
приобретение хрупкости, мацерация и др.).
После водных фиксаторов материал промыва-
ют в проточной воде в течение 1—24 ч. Про-
должительность промывки зависит от размера
объектов, температуры воды и т. п. В зимнее
время промывают дольше, чем в летнее. Так,
Рис. 4.2. Стакан с воронкой для промывки зафиксирован
ного материала
91
после фиксатора Навашина корешки промывают в проточной
воде летом 1—2 ч, а зимой — 2—3 ч. Не рекомендуется промывать
водой корешки растений дольше 3—4 ч, так как в этом случае хро-
мосомы окрашиваются хуже, а их края оказываются как бы разъ-
еденными.
При промывке корешки вместе с этикеткой переносят из про-
бирки в марлевые узелки. Затем их помещают в химический ста-
кан с носиком (рис. 4.2), вставляют в него воронку диаметром не-
сколько большим, чем диаметр стакана, и ставят под струю из во-
допроводного крана. Вода попадает в стакан через воронку и,
омывая материал в направлении снизу вверх, вытекает через щель
между воронкой и стаканом.
При работе с небольшим количеством материала удобно исполь-
зовать металлические ситечки с мелкой сеткой, которые устанавли-
вают под струю воды. Этикетки переносят вместе с материалом.
После промывки материал постепенно переносят в 80%-й
спирт. Для этого материал и этикетку переносят из марлевого
узелка в плоскодонную пробирку, в которую последовательно на-
ливают спирты возрастающей концентрации (20, 40, 60 и 80 %),
выдерживая в каждом по 30 мин. В 80%-м спирте материал можно
хранить длительное время, плотно закупорив пробирку.
После спиртовых фиксаторов материал промывают в трех сме-
нах 80%-го спирта, оставляя в каждом из них материал на 1 ч.
После третьей смены 80%-го спирта запах уксусной кислоты, со-
держащейся в фиксаторах Карнуа, Чемберлена и др., исчезает.
Материал хранят в 80%-м спирте.
Если материал после промывки сразу же подвергается дальней-
шей обработке, то для промывки лучше брать 96%-й спирт, что
позволит значительно ускорить процесс обезвоживания.
Промывку материала спиртом осуществляют следующим обра-
зом. Накрывают пробирку с материалом кусочком марли и осто-
рожно сливают фиксатор, а затем в пробирку наливают первую
смену спирта. Через 1 ч заменяют спирт на свежий и т. д.
Если в отдельных пробирках фиксируется 1—2 корешка, то
удобно при промывке от фиксатора пользоваться капилляром,
присоединенным к водоструйному (или подобному ему) насосу.
При этом жидкость из пробирки легко отсасывается без потери
корешка.
Глава 5
МЕТОДЫ ПРИГОТОВЛЕНИЯ ЦИТОЛОГИЧЕСКИХ
ПРЕПАРАТОВ
5.1. ВРЕМЕННЫЕ ПРЕПАРАТЫ
5.1.1. ОКРАШИВАНИЕ ХРОМОСОМ В КОРЕШКАХ РАСТЕНИЙ
АЦЕТОКАРМИНОМ
Кармин представляет собой экстракт пигмента из жировых от-
ложений в теле самок насекомых кошенили (Coccus cacti) из по-
дотряда кокцид. Это ядерный краситель, он дает четкое окраши-
вание ядер и хромосом. Обычно используют раствор кармина в
45%-й уксусной кислоте (ацетокармин), который можно исполь-
зовать и в качестве фиксатора.
Приготовление ацетокармина. К 55 мл дистиллированной воды
приливают 45 мл ледяной уксусной кислоты, прибавляют 2—5 г
кармина и кипятят 3—6 ч в колбе на водяной бане с применением
обратного холодильника (можно вставить в колбу обычную ворон-
ку). Эту операцию лучше проводить в вытяжном шкафу. После ох-
лаждения насыщенный темно-красный раствор фильтруют и по-
мещают в склянку с притертой пробкой. Кармин, осевший на
фильтре, высушивают и используют снова. Раствор кармина со-
храняется неограниченно долгое время. Для работы ацетокармин
держат в небольших капельницах. Иногда в раствор кармина до-
бавляют несколько капель ацетата железа, что ускоряет окрашива-
ние препарата. Однако лишняя капля ацетата железа приводит к
быстрой порче ацетокармина, который буреет и перестает окра-
шивать.
Приготовление временных препаратов для подсчета хромосом в
корешках растений. Временные препараты готовят двумя спосо-
бами.
Способ 1. Корешки фиксируют в фиксаторе Карнуа или
«уксусном алкоголе» 2—3 ч, промывают 80%-м спиртом и в нем
хранят. Зафиксированные корешки помещают в фарфоровый ти-
гель, наливают ацетокармин, накрывают крышечкой и нагревают
до закипания. Охлаждают в течение 15—20 мин и снова нагревают.
Эту операцию можно повторить несколько раз. Затем помещают
один корешок на предметное стекло, добавляют каплю свежего
ацетокармина и каплю глицерина, накрывают покровным стек-
лом. Сверху кладут 2—3 слоя фильтровальной бумаги (формат бу-
мажек должен немного превышать размеры покровного стекла) и
кругообразными движениями осторожно надавливают ручкой
препаровальной иглы. Снимают фильтровальную бумагу и края
покровного стекла закапывают («окантовывают») расплавленным
парафином либо лаком для ногтей.
Способ 2. Корешки фиксируют уксусным алкоголем и про-
мывают 80%-м спиртом. Затем их помещают в небольшую про-
бирку с 45%-м раствором ацетокармина. Пробирку опускают в ки-
пящую водяную баню на 10—20 мин. Затем один корешок поме-
щают на предметное стекло в каплю 45 %-й уксусной кислоты и
бритвой отделяют кончик корешка (он всегда окрашен в более
темный цвет) от остальной части и последнюю отбрасывают.
Фильтровальной бумажкой удаляют уксусную кислоту и наносят
каплю свежей уксусной кислоты, накрывают препарат покровным
стеклом и раздавливают, как это было описано ранее. Последнюю
операцию можно проводить и в капле хлоралгидрата, что значи-
тельно улучшает мацерацию. Мацерация — это распад ткани на
отдельные клетки вследствие растворения пектиновых прослоек,
соединяющих оболочки растительных клеток.
Приготовление раствора хлоралгидрата.
Растворяют 5 г хлоралгидрата в 2 мл дистиллированной воды.
Ускоренный метод подсчета хромосом в зачаточных листочках са-
харной свеклы. При подсчете хромосом этим методом кроме рас-
смотренных ранее препаратов используют просветляющий и кон-
сервирующий раствор Смита.
Приготовление раствора Смита. Смешивают
55 мл дистиллированной воды, 8 мл глицерина, 25 г арабской ка-
меди и 10 г хлоралгидрата. После полного растворения смесь
фильтруют.
Ускоренный метод подсчета хромосом включает следующие
этапы.
1. Молодой листочек сахарной свеклы длиной несколько мил-
лиметров фиксируют в уксусном алкоголе в течение 1 —24 ч.
2. Вынутый из фиксатора листочек при помощи фильтроваль-
ной бумаги очищают от остатков фиксатора и мацерируют в смеси
(1:1) концентрированной соляной кислоты и 96%-го метилового
спирта в течение 5 мин.
3. Промывают дистиллированной водой в течение 5 мин.
4. Дополнительно обрабатывают фиксатором Чемберлена в те-
чение 5—7 мин.
5. Помещают в уксусный алкоголь на 2—3 мин.
6. Объект помещают на предметное стекло и в капле ацетокар-
мина раздавливают при помощи стеклянной палочки с шариком
на конце.
7. Накрывают покровным стеклом и в течение 15—20 с нагре-
вают на пламени спиртовки до 50—60° (рука еще может терпеть!).
Затем при помощи двух препаровальных игл с двух сторон попе-
ременно приподнимают покровное стекло для более равномерно-
го распределения клеток и их лучшего прокрашивания.
94
8. Заменяют ацетокармин на раствор Смита. Для этого с одной
стороны покровного стекла наносят каплю раствора Смита, а с
другой — кладут фильтровальную бумагу. Покровное стекло со
стороны раствора Смита можно немного приподнять.
9. Исследуют препарат под микроскопом. Подсчет хромосом
лучше всего проводить с помощью фазово-контрастного микро-
скопа.
5.1.2. ОКРАШИВАНИЕ ХРОМОСОМ В КОРЕШКАХ РАСТЕНИЙ
АЦЕТООРСЕИНОМ
Приготовление ацетоорсеина. Растворяют в 45 мл ледяной ук-
сусной кислоты, нагретой на водяной бане до температуры кипе-
ния, 1 г орсеина. Остужают и добавляют 55 мл дистиллированной
воды. Раствор перемешивают и фильтруют.
Техника приготовления препаратов. Корешки фиксируют в фик-
саторе Карнуа, промывают 80%-м этиловым спиртом. При иссле-
довании их помещают на 32 ч в раствор ацетоорсеина, налитый в
небольшую пробирку. Затем на предметное стекло в каплю 45 %-й
уксусной кислоты помещают корешок. Отрезают лезвием бритвы
его кончик, а остальную часть корешка удаляют. Фильтровальной
бумагой убирают уксусную кислоту, а затем наносят каплю свежей
45%-й уксусной кислоты. Накрывают кончик корешка покровным
стеклом. Сверху на стекло кладут 3—4 слоя фильтровальной бума-
ги и кругообразными движениями ручкой препаровальной иглы
раздавливают корешок. Во избежание проникновения воздуха
края покровного стекла окантовывают расплавленным парафином
или лаком для ногтей.
Приготовленные препараты можно довольно продолжительное
время хранить в холодильнике, поместив в баночку с притертой
пробкой, на дно которой положена вата, смоченная 45%-й уксус-
ной кислотой.
5.1.3. ОКРАШИВАНИЕ КОРЕШКОВ АЦЕТОЛАКМОИДОМ
Приготовление ацетол акмоида. В 45 мл ледяной уксусной кис-
лоты, нагретой на водяной бане до кипения, растворяют 1 г лак-
моида. Добавляют 55 мл дистиллированной воды. Охлаждают и
затем фильтруют.
Последовательность операций. Окрашивание корешков ацето-
лакмоидом проводят следующим образом.
1. Фиксируют корешки в фиксаторе Карнуа.
2. Помещают корешки на 5 мин в смесь, состоящую из 10 час-
тей ацетолакмоида и 1 части 1 н. НС1.
3. Слегка подогревают эту смесь на спиртовке.
4. Помещают корешки в ацетолакмоид на 20 мин.
5. Раздавливают корешки в капле 45%-й уксусной кислоты.
6. Исследуют препарат под микроскопом.
95
покровного стекла закапывают («окантовывают») расплавленным
парафином либо лаком для ногтей.
Способ 2. Корешки фиксируют уксусным алкоголем и про-
мывают 80%-м спиртом. Затем их помещают в небольшую про-
бирку с 45%-м раствором ацетокармина. Пробирку опускают в ки-
пящую водяную баню на 10—20 мин. Затем один корешок поме-
щают на предметное стекло в каплю 45%-й уксусной кислоты и
бритвой отделяют кончик корешка (он всегда окрашен в более
темный цвет) от остальной части и последнюю отбрасывают.
Фильтровальной бумажкой удаляют уксусную кислоту и наносят
каплю свежей уксусной кислоты, накрывают препарат покровным
стеклом и раздавливают, как это было описано ранее. Последнюю
операцию можно проводить и в капле хлоралгидрата, что значи-
тельно улучшает мацерацию. Мацерация — это распад ткани на
отдельные клетки вследствие растворения пектиновых прослоек,
соединяющих оболочки растительных клеток.
Приготовление раствора хлоралгидрата.
Растворяют 5 г хлоралгидрата в 2 мл дистиллированной воды.
Ускоренный метод подсчета хромосом в зачаточных листочках са-
харной свеклы. При подсчете хромосом этим методом кроме рас-
смотренных ранее препаратов используют просветляющий и кон-
сервирующий раствор Смита.
Приготовление раствора Смита. Смешивают
55 мл дистиллированной воды, 8 мл глицерина, 25 г арабской ка-
меди и 10 г хлоралгидрата. После полного растворения смесь
фильтруют.
Ускоренный метод подсчета хромосом включает следующие
этапы.
1. Молодой листочек сахарной свеклы длиной несколько мил-
лиметров фиксируют в уксусном алкоголе в течение 1 —24 ч.
2. Вынутый из фиксатора листочек при помощи фильтроваль-
ной бумаги очищают от остатков фиксатора и мацерируют в смеси
(1:1) концентрированной соляной кислоты и 96%-го метилового
спирта в течение 5 мин.
3. Промывают дистиллированной водой в течение 5 мин.
4. Дополнительно обрабатывают фиксатором Чемберлена в те-
чение 5—7 мин.
5. Помещают в уксусный алкоголь на 2—3 мин.
6. Объект помещают на предметное стекло и в капле ацетокар-
мина раздавливают при помощи стеклянной палочки с шариком
на конце.
7. Накрывают покровным стеклом и в течение 15—20 с нагре-
вают на пламени спиртовки до 50—60° (рука еще может терпеть!).
Затем при помощи двух препаровальных игл с двух сторон попе-
ременно приподнимают покровное стекло для более равномерно-
го распределения клеток и их лучшего прокрашивания.
94
8. Заменяют ацетокармин на раствор Смита. Для этого с одной
стороны покровного стекла наносят каплю раствора Смита, а с
другой — кладут фильтровальную бумагу. Покровное стекло со
стороны раствора Смита можно немного приподнять.
9. Исследуют препарат под микроскопом. Подсчет хромосом
лучше всего проводить с помощью фазово-контрастного микро-
скопа.
5.1.2. ОКРАШИВАНИЕ ХРОМОСОМ В КОРЕШКАХ РАСТЕНИЙ
АЦЕТООРСЕИНОМ
Приготовление ацетоорсеина. Растворяют в 45 мл ледяной ук-
сусной кислоты, нагретой на водяной бане до температуры кипе-
ния, 1 г орсеина. Остужают и добавляют 55 мл дистиллированной
воды. Раствор перемешивают и фильтруют.
Техника приготовления препаратов. Корешки фиксируют в фик-
саторе Карнуа, промывают 80%-м этиловым спиртом. При иссле-
довании их помещают на 32 ч в раствор ацетоорсеина, налитый в
небольшую пробирку. Затем на предметное стекло в каплю 45%-й
уксусной кислоты помещают корешок. Отрезают лезвием бритвы
его кончик, а остальную часть корешка удаляют. Фильтровальной
бумагой убирают уксусную кислоту, а затем наносят каплю свежей
45%-й уксусной кислоты. Накрывают кончик корешка покровным
стеклом. Сверху на стекло кладут 3—4 слоя фильтровальной бума-
ги и кругообразными движениями ручкой препаровальной иглы
раздавливают корешок. Во избежание проникновения воздуха
края покровного стекла окантовывают расплавленным парафином
или лаком для ногтей.
Приготовленные препараты можно довольно продолжительное
время хранить в холодильнике, поместив в баночку с притертой
пробкой, на дно которой положена вата, смоченная 45%-й уксус-
ной кислотой.
5.1.3. ОКРАШИВАНИЕ КОРЕШКОВ АЦЕТОЛАКМОИДОМ
Приготовление ацетолакмоида. В 45 мл ледяной уксусной кис-
лоты, нагретой на водяной бане до кипения, растворяют 1 г лак-
моида. Добавляют 55 мл дистиллированной воды. Охлаждают и
затем фильтруют.
Последовательность операций. Окрашивание корешков ацето-
лакмоидом проводят следующим образом.
1. Фиксируют корешки в фиксаторе Карнуа.
2. Помещают корешки на 5 мин в смесь, состоящую из 10 час-
тей ацетолакмоида и 1 части 1 н. НС1.
3. Слегка подогревают эту смесь на спиртовке.
4. Помещают корешки в ацетолакмоид на 20 мин.
5. Раздавливают корешки в капле 45%-й уксусной кислоты.
6. Исследуют препарат под микроскопом.
95
5.1.4. ОКРАШИВАНИЕ АЦЕТОЖЕЛЕЗОГЕМАТОКСИЛИНОМ
Приготовление красителя. Смешивают 1 г гематоксилина, 25 мл
45%-й уксусной кислоты, 250 мг железо-аммонийных квасцов —
NH4Fe(SO4)2 • 12Н2О (квасцы растереть в ступке).* Краситель вы-
держивают 4—5 сут, иногда встряхивая. Хранят при температуре
2 ’С. Краситель можно использовать неоднократно.
Помещают корешки в фиксатор Карнуа (6-3-1) на 24 ч. Про-
мывают 2 раза по 2—3 мин 45%-й уксусной кислотой со следами
хлорного или уксусного железа (кристаллы добавляют в 45%-й ра-
створ уксусной кислоты до приобретения раствором соломенно-
желтого цвета). Затем помещают материал в 1—3 мл 4%-го ацето-
железогематоксилина на 2—5 сут.
Окрашенный материал промывают в 45%-й уксусной кислоте и
помещают на предметное стекло в 1—2 капли смеси Гойера. На-
крывают покровным стеклом и раздавливают.
Смесь Гойера. Просветляющая и консервирующая. Для ее при-
готовления смешивают 50 мл дистиллированной воды, 30 г гумми-
арабика,** 16 мл очищенного глицерина, 200 г хлоралгидрата.
После добавления глицерина и хлоралгидрата смесь Гойера про-
фильтровывают и хранят в темной склянке с плотно закрытой
пробкой в холодильнике.
5.1.5. ОКРАШИВАНИЕ РЕАКТИВОМ ШИФФА
9
В основе окрашивания лежит химическое взаимодействие фук-
синсернистой кислоты (реактива Шиффа) с молекулой ДНК, име-
ющей открытые альдегидные группы. В результате этого взаимо-
действия образуется окрашенное в красно-фиолетовый цвет со-
единение. В молекуле ДНК альдегидные группы связаны, поэто-
му, чтобы их освободить, необходим гидролиз соляной кислотой.
Возможно проведение как горячего (при 60 °C), так и холодного
гидролиза (при комнатной температуре). Время обработки и кон-
центрация соляной кислоты зависят от культуры. Ориентировоч-
ные варианты гидролиза приведены в таблице 5.1. Окрашенный
материал хранят в 70%-м спирте. Давленые препараты готовят
либо в 45%-й уксусной кислоте, либо в смеси глицерин : вода
(1:1). При использовании 45%-й уксусной кислоты препарат при
длительном хранении обесцвечивается, поэтому необходимо неза-
* Вместо железных квасцов можно использовать хромовые квасцы KCr(SO4)2 х
х 24Н2О. — Прим. авт.
** Вместо гуммиарабика можно использовать светлую камедь вишни. Камедь
растирают в ступке, добавляют дистиллированную воду и выдерживают при ком-
натной температуре в течение 30 мин и затем кипятят на водяной бане 5 мин. —
Прим. авт.
медлительно анализировать окрашенные препараты. Для получе-
ния качественных препаратов в смеси глицерин : вода необходи-
ма хорошая мацерация материала.
5.1. Использование гидролиза соляной кислотой для приготовления
цитологических препаратов
Культура
Концентрация HCI, н. Пв^!??ь
к ’ оораоотки (t С)
- - — - — - — — — - - —
Пшеница (корешки)
Пшеница (корешки)
Томат (корешки)
Тритикале (корешки)
Г ил ия (корешки)
Вербена (корешки)
Томат(пыльники)
Томат(пыльники)
Тритикале (пыльники)
5
1
5
5
5
5
1
5
1
15-30 мин (20 ’С)
1-3 мин (60 ’С)
20-25 мин (20 ’Q
15-30 мин (20 ’Q
20 мин (20 ’С)
15 мин (20 ’Q
3 мин (60 ’Q
15 мин (20 ’С)
3-5 мин (60 ’0
Окрашивают материал перед приготовлением давленых препа-
ратов.
Схема окра
ивания реактивом Шиффа. Схема дана на примере
тритикале.
1. Зафиксированный материал отмывают от фиксатора тремя
сменами дистиллированной воды по 5 мин в каждой.
2. Проводят гидролиз 5 н. соляной кислотой в течение 15 мин
при комнатной температуре.
3. Отмывают от соляной кислоты тремя сменами дистиллиро-
ванной воды по 5 мин в каждой.
4. Заливают материал реактивом Шиффа на 15—30 мин. Время
окрашивания подбирают индивидуально для каждой культуры.
Оно может меняться от 15 мин для злаков до 3—4 ч для кресто-
цветных.
5. Тщательно отмывают материал от красителя в проточной
воде в течение 10—15 мин.
6. Готовят давленые препараты в 45 %-й уксусной кислоте или
смеси глицерина с водой.
7. Окрашенный материал переносят в 70%-й спирт для хране-
ния.
Приготовление реактива Шиффа. В емкости из темного стекла
растворяют, осторожно помешивая, 1 г фуксина в 190 мл дистил-
лированной воды. К полученному раствору добавляют 1 г метаби-
сульфита калия или натрия (K2S2O5 или Na2S2O5). Приливают в
раствор 10 мл 1 н. НС1. Закрывают притертой пробкой. Слегка
взбалтывают и оставляют на ночь или на 3—4 ч. К полученному
раствору добавляют 1 г измельченного активированного угля и
взбалтывают. Через 5 мин фильтруют. Хранят в посуде из темного
стекла, желательно в холодильнике. Готовый краситель должен
быть прозрачным и пахнуть сернистым газом.
7 В. А. Пухальский и др.
97
5.1.6. ГИДРОЛИЗ МАТЕРИАЛА
Для получения монослоя клеток при приготовлении давленых
препаратов необходимо, чтобы материал хорошо раздавился. По-
этому перед приготовлением препаратов осуществляют размягче-
ние материала, обычно обработкой соляной кислотой. Гидролиз
проводят 0,5—5 н. соляной кислотой в течение 5—20 мин при
комнатной температуре или 1—5 мин при 60 °C. Концентрацию и
время выдержки подбирают для каждой культуры. Некоторые ва-
рианты обработок приведены в таблице 5.1. Они позволяют полу-
чить хороший препарат и стабильное окрашивание реактивом
Шиффа.
5.2. ПРИГОТОВЛЕНИЕ ПОСТОЯННЫХ ПРЕПАРАТОВ
К постоянным относятся препараты, заключенные в отличие
от временных в канадский бальзам или синтетические смолы типа
Depex или Enthellan. Их можно использовать в течение длитель-
ного времени. Постоянные препараты могут быть изготовлены из
временных, а также по специальным методикам. Методики изго-
товления постоянных препаратов путем микротомирования, ши-
роко используемые в эмбриологии, подробно описаны в других
руководствах (Юрцев, Пухальский, 1968). В данном руководстве
приведена методика приготовления препаратов путем распласты-
вания клеток, которая удобна для цитологического анализа числа
хромосом растений и их морфологии. Кроме того, даны варианты
перевода временных препаратов в постоянные.
5.2.1. ПЕРЕВОД ВРЕМЕННЫХ ПРЕПАРАТОВ В ПОСТОЯННЫЕ
Для перевода временных препаратов в постоянные используют
хорошие препараты, на которых имеются нужные стадии деления
либо обнаружены интересные цитогенетические факты. Для этого
могут быть использованы подсушивание предметного и покров-
ного стекол после снятия последнего, а также примораживание
препарата к предметному стеклу с помощью жидкого азота или
сухого льда.
Последовательность операций при подсушивании. При использо-
вании данного метода необходимо обладать определенной сно-
ровкой для успешного снятия покровного стекла с препарата.
После разделения оба стекла подсушивают над пламенем горелки,
а затем проводят через батарею спиртов для обезвоживания. При
подсушивании необходимо следить, чтобы температура была не
выше 50...60 °C и не произошло сильное высушивание. Для обезво-
живания препаратов применяют батарею спиртов, т. е. чередова-
ние этилового спирта повышающейся концентрации от 70- до
98
96%-го, смеси этилового спирта с толуолом и толуола. Часто ис-
пользуют батарею, состоящую из пяти спиртов, в каждом из кото-
рых препараты выдерживают в течение 2—3 мин. Сразу после про-
водки через батарею спиртов на препарат наносят каплю канадс-
кого бальзама и накрывают покровным стеклом.
Использование сухого льда. Отобранные временные препараты
помещают на кусок сухого льда и выдерживают в течение 3—
5 мин, в результате чего препарат (раздавленная меристема) примо-
раживается к предметному стеклу. После примораживания по-
кровное стекло снимают при помощи скальпеля и, как правило, в
дальнейшем не используют. Препарат проводят через батарею
спиртов и заключают в канадский бальзам.
Использования сжиженного азота. Применяют алюминиевую
пластинку, которую опускают в азот, а затем помещают на нее
препараты. В другом случае сами препараты опускают в азот, а за-
тем снимают с них покровные стекла. В последнем случае необхо-
димо использование специальных предметных стекол, устойчивых
к низким температурам, иначе можно сразу потерять препарат из-
за неправильно выбранного стекла. После снятия покровного
стекла препарат проводят через батарею спиртов и заключают в
канадский бальзам.
5.2.2. ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ МЕТОДОМ
РАСПЛАСТЫВАНИЯ КЛЕТОК
В данном случае обязательно применение ферментативной ма-
церации, использование чистых стекол, свежеприготовленных ра-
створов уксусного алкоголя и 60%-й уксусной кислоты. Последо-
вательность операций такова.
1. Зафиксированные корешки тщательно промывают в проточ-
ной воде в течение 15 мин.
2. Отрезают меристемы корешков и помещают их в раствор
смеси ферментов пектиназы и целлюлазы в цитратном буфере при
температуре 37 ’С. Цитратный буфер готовят из лимонной кисло-
ты (21,01 г/л), цитрата натрия (29,41 г/л) и дистиллированной
воды в соотношении 23 : 27 : 50. Количество ферментов определя-
ется их активностью. Время обработки подбирают эксперимен-
тально. В некоторых случаях для лучшего размягчения применяют
гидролиз соляной кислотой, после которого требуется тщательная
промывка проточной водой.
3. Обработанные в ферментах меристемы используют для при-
готовления препаратов. Для быстрой остановки мацерации про-
бирки с меристемами можно перенести в ледяную воду. Как пра-
вило, меристемы не промывают от ферментов, поскольку при хо-
рошей мацерации велика вероятность потери самих меристем.
Пастеровской пипеткой с длинным носиком аккуратно отбирают
99
меристему из пробирки и помещают на чистое предметное стекло,
которое для лучшего прилипания клеток протирают этанолом.
I [ипеткой удаляют лишнюю жидкость от меристемы и, не доводя
до подсушивания, наносят каплю 60%-й уксусной кислоты, в ко-
торой с помощью препаровальных игл тщательно измельчают ме-
ристему. Полученную суспензию окаймляют свежеприготовлен-
ным раствором фиксатора (уксусный алкоголь), после чего каплю
его наносят в центр окаймленной суспензии. Препарат споласки-
вают в 96%-м этиловом спирте и подсушивают. Приготовленный
таким образом препарат может быть использован как для моно-
хромного, так и для дифференциального окрашивания. Подоб-
ным образом готовят препараты пыльников для изучения мейоти-
ческого деления.
5.3. МОНОХРОМНОЕ ОКРАШИВАНИЕ
КРАСИТЕЛЕМ ГИМЗА
Приготовленные постоянные препараты окрашивают 1—3%-м
раствором красителя Гимза в фосфатном буфере Соренсена с pH
6,8—7,0 в течение 10—20 мин. Время подбирают эксперименталь-
но. Анализ препаратов проводят без заключения их в бальзам с
использованием масляной иммерсии, которую можно удалить вы-
держиванием препарата в толуоле. Препарат может храниться в
течение нескольких лет. В случае необходимости его можно за-
ключить в канадский бальзам либо другую жидкость, предвари-
тельно проведя через батарею спиртов для обезвоживания.
5.4. ПРИГОТОВЛЕНИЕ ГЛИЦЕРИН-ЖЕЛАТИНОВЫХ
ПРЕПАРАТОВ
При изучении прорастания пыльцевых зерен на рыльцах пес-
тиков злаков и других растений часто сталкиваются с необходимо-
стью быстрого приготовления постоянных препаратов пыльцевых
трубок и рылец пестиков с большим сроком сохранности (от не-
скольких месяцев до нескольких лет). В этом случае незаменим
метод приготовления постоянных препаратов с применением гли-
церин-желатина в качестве среды. Далее приводится один из ва-
риантов этого метода.
На предметное стекло кладут исследуемое рыльце пестика из
цветка пшеницы, ржи или других растений с проросшими пыль-
цевыми зернами и наносят несколько капель лактофенола с ра-
створенным в нем красителем — 1%-м раствором хлопчатобумаж-
ного синего. При этом материал одновременно фиксируется и ок-
рашивается. Через 5—10 мин пипеткой удаляют раствор и заменя-
ют чистым лактофенолом с целью дифференцировки окраски
препарата. Затем удаляют лактофенол, наносят каплю подогретого
100
глицерин-желатина и накрывают покровным стеклом. Рекомен-
дуется предварительно нанести на нижнюю поверхность покров-
ного стекла теплую каплю глицерин-желатина. После остывания
глицерин-желатина удаляют скальпелем и смоченной в воде тря-
почкой выступившие капли на краях покровного стекла. Для
большей сохранности препарата обводят края покровного стекла
расплавленным парафином, воском или лаком для ногтей.
Приготовление лактофенола. Лактофенол одновременно являет-
ся и фиксирующей, и просветляющей жидкостью. Состав лакто-
фенола Аммана: молочная кислота, фенол, глицерин, вода в соот-
ношении 1 :1 :2 :1.
Приготовление глицерин-желатина. Берут 1 г желатина высшего
сорта и намачивают его в 6 мл дистиллированной воды. Дают же-
латину набухнуть в течение 2—4 ч. После этого приливают 7 мл
очищенного, прозрачного глицерина и добавляют кристаллик фе-
нола или тимола. Смесь нагревают на водяной бане при непре-
рывном помешивании до тех пор, пока не произойдут разжижение
и равномерное перемешивание составных частей смеси. Получен-
ный раствор фильтруют в горячем виде через бумажный фильтр
(лучше это делать в термостате). Очищенный глицерин-желатин
наливают в пробирку и закрывают пробкой, через которую проде-
та стеклянная палочка. Пробирку помешают в стакан с горячей
водой или в небольшую колбу Эрленмейера, подогреваемую на
водяной бане.
Глава 6
МЕТОДЫ ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
ХРОМОСОМ
6.1. МЕТОД С-ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
ХРОМОСОМ
Метод С-дифференциального окрашивания, или С-бэндинга,
был случайно открыт Pardue and Gall (1970) при проведении на
хромосомах мыши экспериментов по гибридизации in situ мечен-
ной тритием сателлитной ДНК. В своих опытах авторы сначала
денатурировали хромосомную ДН К гидроксидом натрия, а затем
ренатурировали в натрийцитратном (SSC) буфере. Гибридизацию
проявляли авторадиографией, подкрашивая хромосомы красите-
лем Гимза. При этом было обнаружено, что проба ДНК гибриди-
зовалась преимущественно с центромерными участками хромосом
(центромера по англ, centromere). Кроме того, эти же участки хро-
мосом более интенсивно, чем другие, окрашивались красителем
Гимза.
Вскоре после этого С-окрашивание было получено сначала на
хромосомах других млекопитающих и человека, а несколько поз-
же на хромосомах растений. Процедуры С-окрашивания хромо-
сом животных и растений в целом сходны, однако при денатура-
ции хромосомной ДНК животных чаще используют гидроксид на-
трия, а растений — гидроксид бария
К настоящему времени для изучения хромосом растений пред-
ложено множество различающихся между собой модификаций
метода С-окрашивания, однако наиболее широкое распростране-
ние получили две. Первая разработана в лаборатории функцио-
нальной морфологии хромосом Института молекулярной биоло-
гии им. В. А.Энгельгардта РАН для исследования хромосом зла-
ков. Она обладает высокой разрешающей способностью, позволя-
ет получать полные метафазные пластинки с хорошим разбросом
хромосом, воспроизводима и с небольшими модификациями при-
годна для изучения растений других таксономических групп. Вто-
рая модификация метода С-окрашивания, которую применяют во
многих зарубежных лабораториях, сравнительно проста и дает вы-
сокий уровень дифференцировки хромосом у широкого круга рас-
тительных объектов. Проблема, с которой сталкиваются при ис-
пользовании данной модификации, состоит в сложности получе-
102
ния полных метафазных пластинок, особенно у видов с крупными
хромосомами или многохромосомных объектов. В то же время она
более предпочтительна для видов растений с очень мелкими хро-
мосомами, таких, например, как лен.
6.2. МОДИФИКАЦИИ МЕТОДА С-ДИФФЕРЕНЦИАЛЬНОГО
ОКРАШИВАНИЯ
6.2.1. ПРИГОТОВЛЕНИЕ ХРОМОСОМНЫХ ПРЕПАРАТОВ
Проращивание семян. Семена замачивают в стакане водопро-
водной воды при комнатной температуре приблизительно на сут-
ки, а затем переносят в чашки Петри на влажную фильтровальную
бумагу и оставляют в холодильнике на ночь или более. Старые или
зараженные возбудителями грибных болезней семена перед зама-
чиванием обрабатывают раствором перманганата калия или 2%-м
раствором пероксида водорода 15—20 мин. Для синхронизации
клеточных делений и улучшения прорастания $емян можно ис-
пользовать режим чередующихся температурных циклов: днем ма-
териал держат в холодильнике, а на ночь переносят в термостат на
24...26 °C или же оставляют на столе при комнатной температуре.
Обычно в работу берут молодые проростки с корешками 1,5—
2,5 см, однако можно использовать молодые корешки, срезанные
с взрослых растений.
Предобработка корешков для накопления метафазных пластинок.
Перед фиксацией семена вынимают из холодильника и оставляют
при комнатной температуре на 14—16 ч. Работу с материалом луч-
ше начинать утром или в первой половине дня. Существуют не-
сколько способов накопления метафазных пластинок:
семена или корешки обрабатывают 0,2%-м водным раство-
ром колхицина («Fluka», кат. № 27650 или «Sigma», кат. № С 9756)
в течение 1,5—2,5 ч или 0,05%-м колхицином 3—3,5 ч, после чего
корешки обрезают и переносят в воду со льдом на 30—60 мин;
отрезанные корешки выдерживают в воде со льдом 16—24 ч:
корешки помещают во флаконы с дистиллированной водой и ос-
тавляют в холодильнике в коробке со смесью воды и колотого
льда.
Сравнение указанных методов показало, что на колхициновых
препаратах рисунок С-окрашивания получается более контраст-
ным, что особенно важно при исследовании видов с низким со-
держанием гетерохроматина. Однако митотический индекс бывает
ниже, чем при использовании воды со льдом. К недостаткам вто-
рой модификации следует отнести менее четкую морфологию
хромосом и утрату некоторых мелких С-блоков преимущественно
в прицентромерных и интерстициальных участках хромосом.
103
Фиксация. Корешки фиксируют 45%-й уксусной кислотой 3—
4ч в холодильнике. Фиксатор сменяют через 15 мин и, если это
возможно, через 1,5 ч с момента начала фиксации. Для удобства
работы на этой стадии и при последующих обработках корешки от
каждого образца помещают в отдельный стеклянный или пласти-
ковый цилиндр с дном, затянутым капроновой сеткой. Цилиндры
ставят в бюкс или стакан, в котором проводят обработки. При
смене реактива или переносят цилиндры с корешками из одного
бюкса в другой, или заменяют раствор в бюксе.
Отмывка. Кислоту отмывают шестью сменами холодной дис-
тиллированной воды, выдерживая по 10 мин в каждой смене. Во
время первой отмывки воду сменяют 2—3 раза до исчезновения
резкого запаха уксуса.
Насыщение и гидролиз. После отмывки корешки помещают в
холодную 0,2 н. НС1 на 15—20 мин для насыщения. Одновременно
в водяной бане нагревают бюкс с соляной кислотой для гидролиза.
Его проводят в 0,2 н. НС1 при 60 °C в течение 5 мин, после чего
корешки быстро переносят в воду со льдом.
Отмывка и обработка ферментом. Кислоту отмывают дистилли-
рованной водой 3 раза по 10 мин, кончики корешков (непрозрач-
ную часть длиной 1,5—2 мм, соответствующую зоне деления) об-
резают и помещают в пробирки с водным раствором целлюлизина
(«Calbiochem», кат. № 219466). Концентрацию фермента подбира-
ют в зависимости от его активности, а также общего числа и раз-
мера обрабатываемых корешков. Для мацерации одного образца
достаточно 150—200 мкл 0,2—0,3%-го раствора целлюлизина (ак-
тивность фермента 10 000—12 400 у.е/г при pH 4). Обработку про-
водят в термостате при 26 °C или при комнатной температуре
(18...24 °C) в течение ночи. Для очень тонких корешков или их не-
большого количества (1 —3) концентрацию целлюлизина снижают
в 2 раза или более.
Приготовление хромосомных препаратов. Корешки осторожно
промывают несколькими сменами холодной дистиллированной
воды. В зависимости от задачи исследования хромосомные препа-
раты можно готовить несколькими способами.
В отдельную пробирку помещают 5—8 корешков. Воду уда-
ляют и в пробирку с корешками наливают 45%-ю уксусную кисло-
ту на 1,5—2 мин (за время обработки в кислоте корешки становят-
ся прозрачными и опускаются на дно пробирки). Кислоту отбира-
ют и в пробирку добавляют 2—3 капли свежего раствора уксусной
кислоты. После этого корешки мацерируют с помощью металли-
ческой петли в течение 1—2 мин до получения гомогенной сус-
пензии. Каплю суспензии наносят на сухое чистое предметное
стекло и накрывают покровным стеклом размером 18x18 мм. Из-
лишек жидкости осторожно промокают фильтровальной бумагой
104
и препарат раздавливают. После замораживания на сухом льду
или в жидком азоте покровное стекло снимают и препараты остав-
ляют в 95%-м этаноле на ночь или более.
Если анализ материала проводят по растениям, препараты
готовят из индивидуальных корешков. Для этого корешок поме-
шают на предметное стекло, осторожно подсушивают с помощью
фильтровальной бумаги и заливают большим объемом 45 %-й ук-
сусной кислоты. Через 1,5—2 мин излишек кислоты удаляют, до-
бавляют каплю свежей кислоты и корешок измельчают лезвием
бритвы в течение 2—3 мин до получения однородной суспензии.
Препарат накрывают покровным стеклом размером 18x18 мм,
подсушивают фильтровальной бумагой и раздавливают. Покров-
ное стекло снимают после замораживания на сухом льду или в
жидком азоте и помещают препараты в 95%-й этиловый спирт на
ночь или более.
6.2.2. ПРОЦЕДУРА С-ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
Г ХРОМОСОМ
Для окрашивания лучше брать свежие препараты. Наблюдения
показали, что при длительном хранении препаратов из обработан-
ных в ледяной воде корешков некоторые С-блоки не выявляются.
Колхициновые препараты можно хранить до 1 мес.
Препараты сушат на воздухе от 0,5 ч до нескольких суток. Су-
хие препараты обрабатывают насыщенным раствором Ва(ОН)2 в
течение 6 мин при комнатной температуре, споласкивают 10—15 с
в 1 н. НС1 и промывают струей проточной воды. Препараты под-
сушивают горячим воздухом или с помощью резиновой груши,
инкубируют в растворе 2 х SSC при 60 °C в течение 1 ч, моют в
проточной воде не менее 15 мин и сушат. Окрашивание проводят
4—8%-м раствором Гимза на 0,125М Tris-HCl буфере (pH 6,8),
контролируя процесс с помощью микроскопа. Время окрашива-
ния считается достаточным, если все гетерохроматические блоки,
включая центромерные и мелкие интеркалярные, хорошо видны,
тела хромосом отличаются от фона и контрастируют с окраской
блоков. Оптимальное время окрашивания составляет 15—30 мин.
При более быстром окрашивании трудно контролировать время
окраски каждого препарата, а длительное окрашивание приводит
к загрязнению препаратов. Проводку препаратов и их обработки
удобно проводить в специальной посуде (рис. 6.1).
Хорошую дифференцировку эу- и гетерохроматических райо-
нов хромосом дают красители компаний «Giemsa-Merck» и
«Giemsa-Fisher». Рисунки С-бэндинга, получаемые с использова-
нием этих красителей, очень сходны, однако красители фирмы
105
Рис. 6.1. Посуда, используемая для дифференциального окрашивания
«Giemsa-Fisher» выявляют больше блоков, чем фирмы «Giemsa-
Merck», кроме того, их можно применять в более низкой концент-
рации. Красители фирмы «Banco» и «Leishman Stain» для данного
варианта С-бэндинга непригодны.
Раствор красителя тщательно смывают струей проточной воды
и сушат препарат горячим воздухом. Сухие стекла споласкивают в
мета- или лара-ксилоле, на препарат наносят каплю энтеллана
(«Merck») и накрывают покровным стеклом размером 22 х 22 или
24 х 24 мм. Из-под покровного стекла осторожно удаляют пузырь-
ки воздуха и сушат препараты на ровной горизонтальной поверх-
ности в течение 1 сут.
6.2.3. РАБОТА С ПРЕПАРАТАМИ ДИФФЕРЕНЦИАЛЬНО
ОКРАШЕННЫХ ХРОМОСОМ
Хорошо подсушенные заключенные препараты анализируют
под микроскопом при малом увеличении (объектив 16х или 25х).
Метафазные пластинки, имеющие полный набор хромосом с хо-
рошими морфологией и рисунком дифференциального окрашива-
ния (допустимо наличие небольшого числа наложений хромосом)
(рис. 6.2—6.5), фотографируют с помощью микрофотонасадки
или цифровой камеры при использовании иммерсионного объек-
тива апохромата 100х или 63х. При фотографировании препаратов
особое внимание следует уделять правильной настройке света.
Если метафазная пластинка превышает размер поля зрения, ее
следует снимать по частям, чтобы включить все хромосомы.
106
ж
;<>W:
Рис. 6.2. Метафазная пластинка дифференциально окрашенных хромосом
Т. dicoccoides
Рис. 6.3. Метафазная пластинка дифференциально окрашенных хромосом
• ' Г. dicoccum
Рис. 6.4. Метафазная пластинка дифференциально окрашенных хромосом ржи
V. cereale
Рис. 6.5. Метафазная пластинка дифференциально окрашенных хромосом мягкой
пшеницы сорта Новосибирская 67
6.2.4. РАБОТА С ФОТОГРАФИЯМИ
Для съемки хромосомных препаратов разработаны специаль-
ные типы микропленки с мелким зерном и высокой контрастнос-
тью. Оптимальные результаты можно получить при использова-
нии пленок Микрат-300, Микрат-Н и Микрат-500. Печатать мик-
рофотографии хромосом лучше на глянцевой бумаге нормальной
контрастности (№ 3) с высоким содержанием серебра. Проявлять
фотографии желательно с помощью специально разработанных
проявителей (например, А-108).
Заключенные препараты хромосом, окрашенных по С-методу,
анализируют под микроскопом сначала при небольшом увеличе-
нии (объективы планохроматы 10х или 16х), а затем отобранные
полные метафазные пластинки фотографируют на фотопленку
Микрат-300 (ISO 5-6) или Technical Pen (ISO 100) с использовани-
ем иммерсионных объективов апохроматов 100х или 63х. Пленки
проявляют стандартными проявителями D-19, D-41 или же спе-
циально разработанным для микрофотографии проявителем
ФЕН-2. Фотографии хромосомных пластинок печатают на фото-
бумаге нормальной контрастности «Унибром» № 3, «Ко dab гот»
F4 или аналогичных (см. гл. 1).
6.2.5. СОСТАВ БУФЕРНЫХ СМЕСЕЙ ДЛЯ С-БЭНДИНГА
2х SSC. Натрийцитратный буфер (SSC): 0,15 М NaCl + 0,015 М
цитрат натрия: 17,53 г NaCl и 8,82 г двухводного цитрата натрия
(или 10,74 г 5,5-водного цитрата натрия) растворяют в 800 мл
дистиллированной воды. С помощью разбавленной соляной кис-
лоты доводят pH раствора до 7,0, затем добавляют дистиллирован-
ную воду до конечного объема 1 л.
0,125 М Tris-HCl: растворяют 14,6 г Trizma-base («Sigma») в
800 мл дистиллированной воды. С помощью концентрированной
НС1 доводят pH раствора до 6,9—7,0 (потребуется не менее 10 мл
кислоты). Через несколько дней pH доводят до 6,8 разбавленной
соляной кислотой.
0,1 М фосфатный буфер Серенсена: часть А — 9,47 г/л безводно-
го Na2HPO4; часть В — 9,07 г/л безводного КН2РО4. Части А и В
смешивают в определенном соотношении в зависимости от pH:
pH Объем р-ра А, мл Объем р-ра В, мл
5,8 7,9 92,1
6,0 12,0 88,0
6,2 17,8 82,2
6,4 25,5 74,5
6,6 35,2 64,8
6,8 46,3 53,7
7,0 57,7 42,3
109
68,4
77,4
84,5
89,6
93,2
31,6
22,6
15,5
10,4
6,8
6.3. МЕТОД N-ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
ХРОМОСОМ
Метод N-бэндинга первоначально был предназначен для ис-
следования ядрышкообразующих районов (nucleolar organizing
region, NOR, отсюда и название метода) хромосом растений и жи-
вотных. Позже было обнаружено, что у злаков данный метод вы-
являет также районы конститутивного гетерохроматина и поэтому
может быть использован для идентификации хромосом. Реактивы
для N-окрашивания сравнительно недороги, а сама методика про-
ста для работы. Однако этот метод непригоден для изучения неко-
торых видов растений, поскольку выявляет не все типы гетерохро-
матина, окрашивающиеся при С-бэндинге. Сравнительно недавно
была разработана модификация N-бэндинга, совместимая с мето-
дом гибридизации in situ.
6.3.1. ПРИГОТОВЛЕНИЕ ХРОМОСОМНЫХ ПРЕПАРАТОВ
Метод приготовления хромосомных препаратов для N-бэндин-
га можно использовать практически без модификаций для гибри-
дизации in situ.
Семена проращивают в чашках Петри на влажной фильтро-
вальной бумаге при комнатной температуре. Корешки обрезают и
выдерживают в воде со льдом 16—20 ч (до 26 ч). Фиксацию провод
дят смесью абсолютного спирта с ледяной уксусной кислотой
(3 :1) от 1 до 3 дней при комнатной температуре, а затем в холо-
дильнике при 2...4 °C до 3—4 недель. Зафиксированный материал
можно хранить в течение нескольких месяцев при —20 °C.
Корешки окрашивают 1%-м раствором ацетокармина от 10 мин
до 1 ч при комнатной температуре или в течение ночи в холодиль-
нике. Для приготовления давленого препарата корешок кладут на
предметное стекло в каплю 45%-й уксусной кислоты, удаляют
корневой чехлик и с помощью тупого скальпеля выдавливают не-
большой кусочек меристематической ткани. Препарат накрывают
покровным стеклом 18x18 мм, предварительно подложив под
одну из его сторон лезвие бритвы. Придерживая покровное стекло
фильтровальной бумагой, осторожно распределяют кусочек кор-
невой меристемы под покровным стеклом остро заточенной дере-
вянной палочкой или препаровальной иглой. После этого бритву
убирают, препарат слегка подогревают над пламенем спиртовки и
ПО
раздавливают. Покровное стекло снимают после замораживания
на сухом льду или в жидком азоте. Готовый препарат помещают
сначала в 45%-ю уксусную кислоту, затем обезвоживают, проводя
через серию спиртов (70, 95 и 100%-й этанол по 5 мин в каждом) и
сушат на воздухе. Красить лучше свежие препараты, однако при
необходимости их можно держать в герметично закрытой коробке
в морозильной камере при —20 °C не более 1 мес.
При приготовлении препаратов для гибридизации in situ необ-
ходимо учитывать, что:
фиксированные корешки можно хранить в холодильнике не
более 1 мес;
общее время обработки корешков в ацетокармине не долж-
но превышать 1 ч;
после удаления покровного стекла препараты помещают в
70%-й этиловый спирт, а не 45%-ю уксусную кислоту.
6.3.2. ОКРАСКА ХРОМОСОМНЫХ ПРЕПАРАТОВ
Препараты ставят по одному в стакан с горячим (92 ± 2 °C)
фосфатным буфером на 2 мин, споласкивают дистиллированной
водой и переносят в раствор красителя «Giemsa-Banco» в 1/15 М
фосфатном буфере Серенсена из расчета 1 капля краски на 1 мл
буфера. Время окрашивания обычно составляет 20—30 мин и кон-
тролируется с помощью микроскопа. Краску смывают проточной
водой и сушат препараты на воздухе или с помощью резиновой
груши. Окрашенные препараты анализируют под микроскопом и
метафазные пластинки с хорошим разбросом хромосом фотогра-
фируют. Для гибридизации in situ препараты обесцвечивают через
серию спиртов и сушат на воздухе. Если препарат не обесцветился
в спиртах, его можно несколько раз сполоснуть 45%-й уксусной
кислотой, после чего повторно провести через серию спиртов.
6.3.3. РЕАКТИВЫ ДЛЯ N-БЭНДИНГА
1%-й ацетокармин. Растворяют 10 г сухого кармина («Fisher») в
1 л 45%-й уксусной кислоты; объем посуды должен превышать
объем раствора примерно в 3 раза. Ацетокармин варят в колбе с
обратным холодильником 24 ч, затем охлаждают до комнатной
температуры, фильтруют и хранят в холодильнике в темных бу-
тылках.
Горячий буфер для N-бэндинга (1 М NaH2PO4). Разводят 120 г
безводного NaH2PO4 («Fisher», кат. № S-381-3) дистиллированной
водой до конечного объема 1 л.
Буфер Серенсена. Смешивают в равных объемах части А и В.
Часть А: 9,47 г/л Ма2НРО4(мол. м. в. 142,0), «Sigma».
Часть В: 9,07 г/л КН2РО4 (мол. м. в. 136,1), «Sigma».
111
Глава 7
МЕТОД ГИБРИДИЗАЦИИ IN SITU
Гибридизация нуклеиновых кислот in situ как метод прямого
картирования последовательностей ДНК на хромосомах была
впервые проведена в конце 60-х годов на животных объектах и не-
сколько позже — на растительных. В первых работах для гибриди-
зации с цитологическими препаратами использовали РНК- или
ДНК-зонды, меченные 3Н или *"1, а денатурацию хромосомной
ДНК проводили с помощью обработки щелочами, сильными кис-
лотами, некоторыми органическими растворителями или нагрева-
нием. В 1970 г. для увеличения степени денатурации ДНК при на-
гревании было предложено использовать формамид. В настоящее
время термическая обработка хромосомной ДНК солевым раство-
ром, содержащим формамид, является наиболее распространен-
ным способом денатурации. Для выявления гибридизационного
сигнала в первых работах использовали авторадиографию.
Радиоактивная гибридизация in situ является высокочувстви-
тельным методом для локализации различных типов повторов на
хромосомах животных и растений, однако она имеет ряд недостат-
ков. Наиболее существенными из них считают:
короткий период полураспада изотопов;
необходимость подсчета зерен серебра на большом числе
метафазных пластинок для получения статистически достоверных
результатов;
длительное время проявления автографов (от нескольких
недель до нескольких месяцев);
опасность для здоровья и окружающей среды;
проблемы с хранением, использованием и утилизацией от-
ходов.
Разработанный в начале 80-х годов метод гибридизации in situ с
ДНК-зондами, меченными биотином, позволил преодолеть эти
сложности. Впервые гибридизация с использованием биотиниро-
ванных зондов была проведена на хромосомах животных, а не-
сколько позднее эта методика была модифицирована для хромо-
сом растений. Согласно этому методу ДНК-зонд метят биотини-
рованным дУТФ (био-дУТФ), а сайты гибридизации выявляют
ферментными репортерными молекулами — пероксидазой хрена
112
или щелочной фосфатазой, ковалентно связанной с авидином
или стрептавидином. Позднее была разработана система, осно-
ванная на использовании меченных дигоксигенином нуклеоти-
дов (диг-дУТФ), выявляемых с помощью антител, связанных с
ферментом (например, Anti-digoxigenin-POD, fab fragment). Ди-
гоксигенин, стероидный гаптен, выделенный из наперстянки
(Digitalis), распространен в природе намного реже, чем биотин. В
связи с этим использование диг-меченных зондов для гибридиза-
ции позволяет существенно снизить уровень неспецифического
связывания при детекции сигнала по сравнению с биотиниро-
ванными пробами.
Дальнейшим усовершенствованием метода гибридизации in situ
стала разработка способов флуоресцентной детекции сигнала —
Fluorescence in situ Hybridization, или FISH. Важным преимуще-
ством FISH по сравнению с другими методами явилась возмож-
ность локализации на одном препарате одновременно несколь-
ких (до семи) ДНК-зондов. Для этого несколько проб метят раз-
личными гаптенами и затем выявляют с помощью разных флуо-
рохромов. Использование зондов, меченных непосредственно
флуорохромами, упрощает исследования, поскольку не требует
детекции сигнала. Однако из-за сравнительно низкой чувстви-
тельности последний подход оказался непригодным для локали-
зации малокопийных и уникальных последовательностей ДНК.
Создание камер, улавливающих сигналы гибридизации, и разра-
ботка систем анализа изображения еще более расширили воз-
можности FISH.
Одним из наиболее интересных вариантов метода является ге-
номная гибридизация in situ — Genomic in situ Hybridization, или
GISH. В этом варианте меченую геномную ДНК одного из роди-
телей полиплоидного вида используют как пробу, а фрагментиро-
ванную геномную ДНК другого родителя или самого полиплоида
добавляют в гибридизационную смесь для блокирования кросс-
гибридизации. В результате в кариотипе полиплоида проявляется
четкая дифференцировка между хромосомами и участками хромо-
сом, унаследованными от разных предков. GISH служит уникаль-
ным подходом к изучению процесса формирования геномов поли-
плоидных видов и выявлению степени их родства, анализу инт-
рогрессии чужеродного генетического материала и локализации
точек разрывов при межгеномных транслокациях у отдаленных
гибридов.
Важным этапом развития методов гибридизации in situ у расте-
ний явилась разработка технологии последовательного бэндинга и
гибридизации in situ. Это связано с тем, что у большинства расте-
ний до сих пор не удалось совместить дифференциальное окраши-
вание с гибридизацией in situ. Метод последовательного N-бэн-
динга и гибридизации in situ дает возможность сначала идентифи-
8 В. А, Пухальский и др.
113
цировать хромосомы, а затем на этих же препаратах определить
локализацию проб ДНК.
Далее приведены методики, используемые при проведении ис-
следований по гибридизации in situ на хромосомах растений: вы-
деления и очистки ДНК, мечения проб, гибридизации проб на
препаратах и детекции сигнала с использованием ферментов и
флуорохромов.
7.1. ПОСЛЕДОВАТЕЛЬНОСТЬ И ТЕХНИКА ОПЕРАЦИЙ
ПРИ ГИБРИДИЗАЦИИ IN SITU
7.1.1. ВЫДЕЛЕНИЕ ГЕНОМНОЙ ДНК (СТАВ-МЕТОД)
1. Растирают 5 г свежесрезанных листьев молодых растений в
жидком азоте в керамической ступке или замораживают в моро-
зильной камере до —70 °C, а затем размалывают с сухим льдом в
электрокофемолке до порошкообразного состояния.
2. Порошок сразу же переносят в стерильные конические кол-
бы на 125 мл, содержащие 20 мл двукратного СТАВ-буфера, и
тщательно, но осторожно размешивают сначала чистым шпате-
лем, а затем путем вращения колбы. Колбу закрывают небольшим
кусочком парафильма, затем алюминиевой фольгой и ставят в во-
дяную баню при 62...65 °C с постоянным перемешиванием на 1 —
2 ч, после чего дают охладиться до комнатной температуры.
3. К каждому образцу добавляют примерно по 16 мл смеси
хлороформа с изоамиловым спиртом (24: 1), осторожно переме-
шивают и выдерживают на качалке при комнатной температуре до
тех пор, пока верхний слой не приобретет молочно-зеленый отте-
нок (примерно через 20 мин).
4. Смесь переливают в центрифужные пробирки на 50 мл с
закручивающимися крышками и центрифугируют при 6000 мин-1
(об/мин) при комнатной температуре в течение 15 мин.
5. С помощью тупого конца стеклянной 10-миллилитровой
пипетки осторожно переносят надосадочную жидкость в чистую
пробирку на 50 мл и добавляют приблизительно 2/3 объема изо-
пропилового спирта, охлажденного до —20 °C. Смесь перемешива-
ют и оставляют при комнатной температуре не менее чем на
30 мин для осаждения ДНК.
6. Раствор изопропанола осторожно сливают, придерживая ко-
мочек ДНК стерильной пастеркой. ДНК промывают раствором
80%-го этанола с добавлением 15 мМ ацетата натрия при комнат-
ной температуре в течение 10 мин, периодически покачивая про-
бирку.
7. Этанол сливают, комочек ДНК подсушивают, добавляют сна-
чала 650 мкл ТЕ-буфера, затем 5 мкл РНКазы А (10 мг/мл) и остав-
ляют в холодильнике при 4 °C на ночь или более, периодически по-
114
мешивая. Обработку РНКазой можно проводить также в термостате
на 37 °C в течение 1 ч. Если за время обработки РНКазой ДНК пол-
ностью не растворилась, в пробирку добавляют ТЕ-буфер до ис-
чезновения осадка.
8. Раствор ДНК переносят в 1,5-миллилитровую пластиковую
пробирку и добавляют равный объем смеси фенола с хлорофор-
мом (1 :1). Поскольку фенол с хлороформом хранят под слоем
Tris-HCl буфера (pH 8,0), смесь берут со дна посуды. Растворы
интенсивно перемешивают в течение 10—15 мин, центрифугиру-
ют 15 мин при 13 000 мин-1 и переносят верхнюю фазу в чистую
пробирку.
9. К раствору добавляют равный объем хлороформа, переме-
шивают и центрифугируют с той же частотой вращения 2—3 мин.
Верхний слой снова переносят в чистую пробирку и повторяют
предыдущий этап. Очистку хлороформом проводят до тех пор,
пока не исчезнет промежуточная (белковая) фаза.
10. После последней очистки верхнюю фазу переносят в чис-
тую пробирку, добавляют 1/10 объема 3 М ацетата натрия (pH 5,5)
и 2 объема абсолютного этилового спирта при —20 °C, смешива-
ют и оставляют в морозилке на 30 мин или более для осаждения
ДНК. _____________________________________________
11. Жидкость сливают, придерживая комочек ДНК наконеч-
ником автоматической пипетки, и осадок трижды промывают
70%-м этанолом при комнатной температуре по 10 мин в каждой
смене.
12. Спирт сливают и ДНК сушат сначала 15—20 мин в вакуум-
ной центрифуге, а затем в открытой пробирке на воздухе до пол-
ного высыхания осадка. ДНК растворяют в 400—1000 мкл ТЕ-бу-
фера в зависимости от количества осадка и определяют концент-
рацию.
13. Концентрацию ДНК проверяют с помощью электрофореза
в 0,8%-м агарозном мини-геле в ТВЕ-буфере. Исследуемую ДНК
разводят в буфере для нанесения образцов (gel-loading buffer) в со-
отношении 1: 100, хорошо перемешивают и наносят 5 мкл смеси
на агарозный гель (соответствует разбавлению ДНК 1 :20). На
этот же гель наносят различные объемы (0,5, 1, 2, 5 и 10 мкл) мар-
керной Х-ДНК с концентрацией 10 нг/мкл. После электрофореза
гель окрашивают бромистым этидием при слабом перемешивании
в течение 15 мин, фотографируют в ультрафиолете и определяют
концентрацию путем сравнения интенсивности бэнда ДНК с мар-
керами концентрации.
7.1.2. ВЫДЕЛЕНИЕ ПЛАЗМИДНОЙ ДНК
Выделение и очистку плазмидной ДНК для гибридизации in
situ в больших объемах можно проводить по методу щелочного ли-
зиса с последующим центрифугированием в градиенте плотности
8*
115
CsCl или использовать готовые наборы реактивов для выделения
плазмидной ДНК в микрообъемах (mini-prep), предлагаемые мно-
гими фирмами. В последнем случае выделение ДНК производят в
соответствии с рекомендациями фирмы-производителя. Для вы-
деления плазмидной ДНК в больших объемах используют следую-
щую методику.
1. К 10 мл жидкой стерильной LB-среды добавляют 4 мкл ма-
точного раствора антибиотика (до конечной концентрации
stringent плазмиды; табл. 7.1), инокулируют единичную колонию и
инкубируют при 37 °C на качалке (частота вращения около
200 мин-1) в течение 4 ч и более.
7.1. Рабочие концентрации некоторых антибиотиков
Антибиотик
Концентрация
маточного раствора,
мкг/мл
Температура
хранения, С
Рабочие концентрации
для плазмиды, мкг/мл
stringent relaxed
Ампициллин
Карбенициллин
Хлорамфеникол
Канамицин
Стрептомицин
Тетрациклин
50 (в воде)
50 (в воде)
34 (в метаноле)
10 (в воде)
10 (в воде)
5 (в этаноле)
-20
—20
-20
-20
-20
-20
20
20
25
10
10
10
60
60
170
50
50
50
2. Переливают 10 мл активно растущей культуры в колбу, со-
держащую 400—1000 мл стерильной LB-среды с соответствующим
антибиотиком (концентрация stringent плазмиды; табл. 7.1), пред-
варительно подогретой до 37 °C, и оставляют на качалке при той
же температуре на ночь. Для клонов, содержащих плазмиду
pBR322 с сайтом рестрикции EcoRV, выход ДНК можно повы-
сить с помощью метода амплификации на богатой среде. Через
2,5 ч после начала инкубации в 1—2 л активно растущей культу-
ры (£>боо = 0,4) с соответствующим антибиотиком добавляют ра-
створ хлорамфеникола до конечной концентрации relaxed плаз-
миды 170 мг/мл и далее инкубируют на качалке при 37 °C в тече-
ние 12—16 ч.
3. Клетки центрифугируют в пробирках на 250 мл 10 мин при
6000 мин-1. Надосадочную жидкость сливают и стерилизуют ра-
створом хлорамина. Центрифужные пробирки с осадком ставят
углом на лед, чтобы отделить остаток жидкости от бактериальных
клеток. Через несколько минут жидкость удаляют стерильной пи-
петкой и осадок ресуспендируют в 5 мл раствора I*, содержащего
5 мг/мл лизоцима (лизоцим добавляется в раствор I непосред-
ственно перед употреблением). После этого культуры переносят в
полиалломерные центрифужные пробирки на 50 мл с закручиваю-
* Состав растворов I, II и III см. на с. 137—138.
116
щимися крышками и оставляют при комнатной температуре на
5 мин.
4. В каждую пробирку добавляют по 10 мл свежеприготовлен-
ного раствора II, смешивают, осторожно переворачивая пробирку
несколько раз, и оставляют при комнатной температуре на 10 мин
и более.
5. К каждому образцу добавляют по 7,5 мл холодного раство-
ра III, быстро перемешивают и оставляют на льду на 10 мин или
более.
6. Осадок отделяют 15-минутным центрифугированием при
12 000 мин-1. Надосадочную жидкость переносят в чистую цент-
рифужную пробирку на 50 мл, добавляют приблизительно 11 мл
холодного изопропанола, перемешивают и оставляют в холодиль-
нике или морозильной камере на 15 мин и более.
7. ДНК осаждают центрифугированием при 12 000 мин-1 в те-
чение 30 мин при комнатной температуре. Надосадочную жид-
кость сливают и обрабатывают хлорамином. Осадок ДНК промы-
вают 70%-м этанолом при комнатной температуре, высушивают и
затем растворяют в 4,3 мл ТЕ-буфера.
8. Раствор CsCl для градиентного центрифугирования гото-
вят так, чтобы масса навески в граммах равнялась объему жидко-
сти в миллилитрах. К раствору ДНК добавляют 4,7 г хлористого
цезия и аккуратно перемешивают, покачивая пробирку, до пол-
ного растворения соли, а затем добавляют 0,4 мл маточного ра-
створа бромистого этидия (10 мг/мл в ТЕ-буфере). Осадившийся
при этом белок можно отделить 10-минутным центрифугирова-
нием при частоте вращения 2000 мин-1 (комплекс белка с бро-
мистым этидием образует пленку на поверхности жидкости).
Плотность полученного раствора должна находиться в пределах
1,55—1,59 г/мл.
9. С помощью пастеровской пипетки жидкость осторожно пе-
реносят в 5-миллилитровые полипропиленовые пробирки для
ультрацентрифугирования, избегая образования пузырьков возду-
ха. Пробирку заполняют до горлышка и закрывают. Центрифуги-
рование проводят при комнатной температуре в течение 6 ч при
частоте вращения 65 000 мин-1 или 14—16 ч при 55 000 мин-1.
10. Образцы осторожно вынимают из ротора. Пробирки за-
крепляют в штативе и под ультрафиолетовой лампой определяют
положение бэнда ДНК по интенсивной флуоресценции. Верхнюю
часть центрифужной пробирки предварительно прокалывают иг-
лой. Блок ДНК снимают шприцем с толстой иглой, прокалывая
пробирку сбоку немного ниже бэнда ДНК, и переносят в пласти-
ковую пробирку на 1,5 мл.
11. Для удаления бромистого этидия из пробы ДНК к раствору
добавляют равный объем изоамилового спирта, интенсивно пере-
мешивают и центрифугируют 1—2 мин, верхнюю фазу отбрасыва-
117
ют. Процедуру повторяют до исчезновения розового оттенка в
верхней (спиртовой) фазе.
12. Образец ДНК разбавляют двойным объемом ТЕ-буфера и к
полученному раствору добавляют два объема 95%-го этанола. Оса-
док ДНК формируется 15—30 мин, затем его центрифугируют
15 мин при 12 000 мин-1. Надосадочную жидкость сливают, оса-
док промывают холодным 70%-м этиловым спиртом и подсушива-
ют на воздухе в течение 30 мин и более.
13. ДНК растворяют в 400 мкл ТЕ-буфера, добавляют 20 мкл
РНКазы А (10 мг/мл) и оставляют при комнатной температуре на
15—60 мин.
14. К образцу ДНК добавляют равный объем смеси фенола с
хлороформом (1 :1), интенсивно перемешивают 10 мин и центри-
фугируют при частоте вращения 13 000 мин-1 в течение 10—
15 мин. Верхнюю фазу переносят в чистую пробирку, добавляют
равный объем хлороформа, смешивают и центрифугируют 1—
2 мин. Очистку хлороформом проводят до исчезновения промежу-
точной (белок + соли) фазы.
15. ДНК осаждают добавлением 1/10 объема ЗМ ацетата на-
трия и двух объемов 95%-го этанола при —20 °C не менее 1 ч. Оса-
док промывают 70%-м этанолом, подсушивают на воздухе и затем
вакуумным центрифугированием в течение 15—20 мин. Для пол-
ного высыхания ДНК осадок досушивают в открытой пробирке в
течение ночи. ДНК растворяют в 50—400 мкл ТЕ буфера и опреде-
ляют концентрацию на мини-геле.
7.1.3. МЕЧЕНИЕ ПРОБ ДНК
Пробы ДНК можно метить различными способами, наиболее
распространенными из которых являются амплификация со слу-
чайными праймерами, полимеразная цепная реакция (PCR) и
ник-трансляция. Поскольку ник-трансляция позволяет легче
контролировать размер фрагментов зонда, этот метод использу-
ется наиболее часто. В том случае, если для гибридизации необ-
ходимо использовать только ДНК-вставки (без плазмиды), для
мечения следует использовать метод PCR со специфическими
праймерами.
7.1.3.1. МЕЧЕНИЕ ПРОБ С ПОМОЩЬЮ НИК-ТРАНСЛЯЦИИ
Мечение ДНК можно проводить с помощью готового набора
реактивов (фирм «Roche Applied Science», «Vector Laboratories»,
«Enzo Diagnostics» и др.) или с отдельно подобранными компо-
нентами реакции. Если для ник-трансляции используют готовый
«кит», реакцию проводят в соответствии с приложенной инструк-
цией. Количество ДНК для одной реакции мечения, соответству-
118
ющее 1 мкг сухого вещества, рассчитывают исходя из концентрации
раствора. Поскольку данный объем не может превышать 16 мкл,
концентрация раствора ДНК должна быть выше 60 нг/мкл.
Расчет компонентов реакционной смеси (в расчете на 50 мкл). Для
проведения ник-трансляции с отдельно подобранными компо-
нентами составляют реакционную смесь, в состав которой входят
«холодные» и меченый нуклеотиды, ДНК-полимераза 1, ДНКаза-1,
очищенная геномная или плазмидная ДНК и вода (табл. 7.2). Для
мечения ДНК используют биотин (biotin- 16-dUTP), дигоксигенин
(digoxigenin-11 -dUTP) или флуорохромы — родамин (rhodamine-
6-dUTP) и флуоресцеин (fluorescein- 15-dATP). Смесь холодных
нуклеотидов (дНТФ) включает дАТФ, дГТФ, дЦТФ и дТТФ. Ма-
точные растворы нуклеотидов разводят дистиллированной водой в
25 раз (до конечной концентрации 4 мкг/мкл) и смешивают в рав-
ных пропорциях.
7.2. Состав реакционной смеси для одной реакции ник-трансляции
№ п/п
Компонент реакции
Необходимое
количество, мкл
- --' ———
1
2
3
4
5
6
7
10 х буфер для ник-трансляции
дНТФ
Меченый дУТФ
Геномная или плазмидная ДНК (1 мкг)
ДНК-полимераза 1 («Promega»)
ДНКаза-1 («Roche Applied Science»)
Деионизированная дистиллированная вода
5
3
2
У
z
До 50
Одним из наиболее важных компонентов реакции, от которого
зависит конечный размер продукта, является ДНКаза-1. Посколь-
ку активность ДНКазы-1, выпускаемой разными компаниями,
неодинакова, для каждой новой партии фермента определяют ра-
бочую концентрацию. Сначала фермент разводят. Разбавление
проводят в два этапа.
1. Готовят маточный раствор, состоящий из 1 части фермента
и 19 частей смеси 25 мМ Tris-HCl (pH 7,6) с глицерином (1: 1).
Маточный раствор хранят при —20 °C. Непосредственно перед
употреблением его разводят дистиллированной водой до конеч-
ного значения. Для ДНКазы-1 фирмы «Enzo-Diagnostic» оно со-
ставляет 1:100—1:200, для «Roche Applied Science» — 1:1000—
1:2000.
2. Количество ДНКазы-1, необходимое для проведения одной
реакции ник-трансляции (z), определяют экспериментально. Для
этого готовят несколько реакционных смесей, содержащих по
1 мкг любой очищенной ДНК и различные количества ДНКазы-1.
Общий объем каждой реакционной смеси доводят водой до
50 мкл. Реакцию проводят при 13... 14 °C в течение 2 ч, после чего
определяют размер фрагментов ДНК при разных концентрациях
119
ДНКазы-1. Поскольку экспериментальные смеси включают не все
необходимые компоненты, размер полученных фрагментов будет
несколько меньше, чем при нормальной реакции ник-трансля-
ции. Учитывая эту поправку, в качестве рекомендуемой концент-
рации берут ту, при которой фрагменты ДНК находятся в интер-
вале 100—200 п.н. (оптимальный размер фрагментов зонда для
гибридизации 300—500 п.н.).
Количество ДНК-полимеразы 1 для одной реакции ник-транс-
ляции (у) зависит от активности фермента и обычно указывается в
прилагаемой инструкции. Например, для ДНК-полимеразы фир-
мы «Promega» (с активностью 9000 у.е/мл) оно составляет 2—
3 мкл. В связи с тем что ДНК-полимераза 1 чувствительна к по-
вторному замораживанию, предпочтительнее пользоваться ра-
створом фермента в глицерине, не замерзающем при —20 °C, и до-
ставать его непосредственно перед использованием.
Составление реакционной смеси. Реакционную смесь готовят в
пластиковых пробирках вместимостью 1,5 мл на льду, осторожно
перемешивая раствор после внесения каждого нового компонента.
Первой добавляют воду, в которую по очереди вносят остальные
составляющие в приведенном в таблице 7.2 порядке. Если в реак-
ции используют меченные флуорохромами нуклеотиды, пробирку
заворачивают в алюминиевую фольгу. ДНКазу-1 добавляют послед-
ней, после чего смесь тщательно перемешивают и собирают на
дне пробирки 1—2-минутным центрифугированием.
Проведение реакции. Пробирку с реакционной смесью инкуби-
руют в водяной бане на 13... 15 °C в течение 2 ч. Реакцию останав-
ливают добавлением 5 мкл стоп-буфера (0,2 М EDTA).
Проверка пробы на размер фрагментов. Кипятят 15 мкл реакци-
онной смеси 5 мин, затем быстро переносят на лед и смешивают с
5 мкл 3-кратного буфера для нанесения образцов. Полученные об-
разцы наносят на мини-гель, используя Х-маркер размера ДНК
как эталон для сравнения.
7.1.3.2. МЕЧЕНИЕ ПРОБ С ПОМОЩЬЮ ПОЛИМЕРАЗНОЙ
ЦЕПНОЙ РЕАКЦИИ
Мечение ДНК с помощью полимеразной цепной реакции
(PCR) лучше всего производить в тех случаях, когда для гибриди-
зации необходимо использовать только ДНК-вставки либо если
производится мечение определенного участка геномной ДНК или
ВАС-клона. Для проведения реакции можно брать готовый набор
реактивов или готовить реакционную смесь из отдельных компо-
нентов. Если метят небольшой фрагмент геномной ДНК образца,
то для реакции синтезируют 15—20-нуклеотидные праймеры к
фланкирующим этот фрагмент участкам, что позволяет метить
120
район ДНК, расположенный между ними. Для амплификации
вставки многих плазмид можно использовать универсальные
праймеры М13 следующего состава:
прямой: 5’—AACAGCTATGACCATG—3’;
обратный: 5’—TGACCGGCAGCAAAATG—3’.
Поскольку при работе этим методом фрагмент оригинальной
ДНК и ее копии амплифицируются многократно, для проведения
реакции можно использовать очень небольшое количество ДН К.
Условия амплификации зависят от многих параметров, включая
концентрацию матричной ДНК, длину и концентрацию прайме-
ров, активность ферментов, содержание ионов магния в реакци-
онной смеси и температурные циклы.
Приготовление реакционной смеси. Реакционную смесь для PCR
готовят в стерильных условиях на льду. Она включает 1/10 объема
10 х буфера. (Его состав: 500 мМ КС1; 100 мМ Tris-HCl, pH 8.3;
15 мМ MgCl2), 0,8 мМ дНТФ, по 0,5 мкМ обоих праймеров, 1U*
Та^-полимеразы, 0,1—2 нг ДНК-матрицы. Объем реакционной сме-
си доводят до 50 мкл стерильной деионизированной водой. В том
случае, когда прибор для амплификации не оснащен нагреваемой
крышкой, реакционную смесь в пробирках покрывают вазелино-
вым маслом.
Условия амплификации. Они зависят от размера и нуклеотидно-
го состава амплифицируемого фрагмента. Цикл амплификации
включает три стадии: денатурации, отжига и элонгации (синтеза).
Во время денатурации двунитевая ДНК переводится в одноцепо-
чечную форму путем нагревания до 92...94 ’С. Снижение темпера-
туры может привести к неполной денатурации ДНК, а ее повыше-
ние — к разрушению фермента. Первая денатурация обычно про-
должается дольше, чем на последующих этапах. Второй^ этап —
отжиг праймера — производится при температуре 37...70 °C в за-
висимости от длины, состава и гомологии праймера. Во время от-
жига праймеры присоединяются к комплементарным участкам
однонитевой ДНК. Во время третьего этапа — элонгации — начи-
нается удлинение праймера по ДНК-матрице с помощью термо-
стабильного фермента. Реакция проходит со средней скоростью
30 нуклеотидов в 1 с при температуре 70...74 °C. Циклы амплифи-
кации повторяют 20—40 раз.
Пробирки помещают в амплификатор, который программиру-
ют следующим образом:
93 °C — 5 мин
94 °C — 0,5—1,0 мин
55 °C — 0,5—1 мин
72 °C — 1,5—2 мин
72 °C — 5 мин.
* U — единица активности. — Прим. ред.
121
После окончания амплификации пробирки переносят на лед.
Продукты амплификации проверяют на агарозном геле (опреде-
ляют размер и концентрацию фрагментов) и чистят.
7.1.4. ОЧИСТКА ПРОБ ДНК
Очистку проб проводят на колонках с сефадексом (Sephadex
G-50). Канюлю туберкулинового шприца на 1 мл затыкают сте-
рильной силиконизированной стекловатой. Шприц помешают в
центрифужную пробирку на 15 мл. С помощью стерильной пас-
терки шприц заполняют доверху 12%-м раствором сефадекса в
ТЕ-буфере и центрифугируют 4—6 мин при 1500—2000 мин-1 для
уплотнения колонки. Выливают из пробирки излишек жидкости,
добавляют в шприц раствор сефадекса и снова центрифугируют.
Процедуру повторяют до тех пор, пока объем столбика не дос-
тигнет 0,9 мл. После этого колонку дважды промывают 55 мкл
ТЕ-буфера, центрифугируя после каждой отмывки по 4 мин при
1500—2000 мин .
На дно центрифужной пробирки ставят стерильную пробирку
на 1,5 мл без крышки, в горлышко которой вставляют канюлю
шприца. На верх колонки наносят 55 мкл продукта ник-трансля-
ции (50 мкл реакционной смеси + 5 мкл стоп-буфера) и центри-
фугируют 6—10 мин при частоте вращения 2000 мин *. Меченая
проба при этом фильтруется и собирается в 1,5-миллилитровой
пробирке. При правильной очистке объем полученного продукта
должен быть близок к 55 мкл, а концентрация меченой ДНК соот-
ветствовать приблизительно 18 нг/мкл. Готовую пробу можно хра-
нить несколько лет в морозильнике, но при частом использовании
ее следует содержать при 2...4 ’С.
Очистку пробы ДНК. можно осуществлять также путем преци-
питации в этаноле.
7.2. ГИБРИДИЗАЦИЯ ПРОБ НА ПРЕПАРАТАХ
Гибридизацию проводят следующим образом.
1. Давленые препараты готовят так же, как для N-бэндинга.
Стекла проверяют под микроскопом с фазово-контрастным
объективом на наличие метафазных пластинок с хорошо выра-
женной морфологией и разбросом хромосом. Покровное стекло
снимают после замораживания в жидком азоте или на сухом льду,
препараты обезвоживают через серию спиртов (70, 95 и 100%-й)
по 5 мин в каждой смене и сушат на воздухе. До гибридизации
препараты выдерживают при комнатной температуре от несколь-
ких часов до недели, затем повторно просматривают под микро-
скопом. В экспериментах используют только те препараты, на ко-
122
торых отсутствует грубая цитоплазматическая подложка, а хромо-
сомы хорошо сохранили морфологию после удаления покровного
стекла. Для удобства работы на стекле с помощью алмазного ка-
рандаша отмечают границы препарата.
Препараты, предназначенные для гибридизации с пробами ри-
босомных генов (18S-5,8S-26S рРНК), предварительно обрабаты-
вают РНКазой, чтобы предотвратить связывание пробы с РНК
цитоплазмы. Для этого маточный раствор РНКазы разводят
2 х SSC-буфером в 10 раз и на каждый препарат наносят по 100 мкл
раствора. Препарат накрывают покровным стеклом 24 х 50 мм и ин-
кубируют в течение 1 ч во влажной камере при 37 °C. Покровное
стекло стряхивают и препараты трижды промывают в 2 х SSC-буфе-
ре при комнатной температуре по 10 мин в каждой смене, затем
проводят через серию спиртов и сушат на воздухе.
2. Препараты денатурируют в 70%-м растворе формамида (фор-
мамид должен быть самого высокого качества) в 2.x SSC-буфере
(70 мл формамида + 10 мл 20 х SSC + 20 мл дистиллированной
воды) 2 мин при 72...74 ’С, затем быстро переносят в 70%-й этанол
при —20 °C. Препараты обезвоживают через серию спиртов (70, 95
и 100%-й) при —20 °C по 5 мин в каждом и сушат на воздухе. Дена-
турацию препаратов можно также проводить на термоплате. Для
этого на каждое стекло наносят по 100 мкл 70%-го раствора форма-
мида в 2 х SSC-буфере, накрывают покровным стеклом 24 х 32 или
24 х 40 мм и кладут по одному на поверхность термоплаты при тем-
пературе 72 °C. Ровно через 3 мин препарат снимают, покровное
стекло стряхивают и быстро переносят препарат в 70%-й этанол
при —20 °C. При работе этим методом значительно сокращается
расход формамида, однако перед началом использования прибора
следует убедиться, что поверхность термоплаты идеально ровная, а
температура регулируется с необходимой точностью.
3. Гибридизационную смесь готовят на льду в 1,5-миллилитро-
вых пробирках. Если проба ДНК мечена флуорохромом, пробирку
заворачивают в фольгу. Гибридизационная смесь (в расчете на два
препарата) состоит из следующих компонентов (табл. 7.3, 7.4).
7.3. Состав гибридизационной смеси для ISH с одной пробой ДНК*
№ п/п
I
Название компонента
Количество
компонента, мкл
1 Деионизированный формамид
2 20xSSC
3 Фрагментированная ДНК спермы лосося
4 Меченая проба ДНК
5 Дистиллированная вода
6 50%-й декстран сульфат
Всего
10
2
2
0,5—2,0
х
4.
20
* Количество меченой пробы для двух препаратов можно снизить с 2 до
0,5 мкл за счет добавления стерильной дистиллированной воды (х).
123
»
7.4. Состав гибридизационной смеси для геномной гибридизации in situ или
multicolor FISH с двумя различно мечеными пробами
№ п/п
Название компонента
Количество
компонента, мкл
1 Деионизированный формамид
2 20 х ssc;
3 Фрагментированная ДНК спермы лосося
4 Первая меченая проба ДНК
5 Вторая меченая проба ДНК или блокирующая ДНК
6 50%-й декстран сульфат
Всего
10
2
2
У
4
20
При составлении гибридизационной смеси для multicolor FISH
определяют оптимальное соотношение между количеством пер-
вой (х) и второй (у) пробы. Обычно оно близко к 1 : 1, но может
варьировать в зависимости от характера последовательностей и
типа гаптенов, использованных при мечении зондов. Если пробы
значительно различаются между собой по интенсивности сигнала
в связи со способом детекции или разной степенью копийности в
геноме, то количество пробы, дающей более слабый сигнал, долж-
но быть увеличено за счет второй пробы (например, 1,5 : 0,5). При
определении оптимального соотношения следует учитывать:
а) ДНК какого родителя была взята в качестве пробы. Показа-
но, что при GISH одного и того же полиплоида четкость разделе-
ния геномов неодинакова, если в качестве зонда использовалась
ДНК разных предков;
б) качество блокирующей ДНК. Известно, что концентрация
раствора блокирующей ДНК должна равняться примерно 0,1—
0,2 мкг/мкл, превышая концентрацию ДНК пробы в 4—10 раз, а
размер фрагментов находиться в интервале 300—500 п.н. Блокиру-
ющую ДНК можно готовить с помощью разных методов: кипяче-
ния в щелочи, многократного пропускания через иглу шприца ма-
лого диаметра, обработки ультразвуком. Последний подход ис-
пользуется наиболее часто и дает хорошие результаты;
в) соотношение между ДНК пробы (л) и блокирующей ДНК
(б). Конкретную пропорцию между ними определяют экспери-
ментально. Сначала проводят гибридизацию со смесями, содержа-
щими:
избыток ДНК пробы — 1,5(л): 0,5(6);
равные доли ДНК пробы и блокирующей — 1:1;
избыток блокирующей Д Н К 0,5 (л): 1,5(6).
В этих экспериментах выясняют, в каком из экспериментов
разделение геномов получается наиболее четким. После этого,
если необходимо, соотношение уточняют в более узком интервале.
В состав гибридизационной смеси входит 50%-й декстран суль-
фат (DS). Раствор DS отличается высокой вязкостью, что затруд-
няет взятие точного количества вещества и может привести к
124
ошибкам. Чтобы избежать этого, DS можно предварительно ра-
зогреть до 65 °C для снижения вязкости раствора. Возможен и
другой подход: сначала визуально или с помощью линейки опре-
деляют, длине какого столбика в наконечнике микропипетки со-
ответствует равный объем дистиллированной воды. Затем нахо-
дят, при каком измерении раствор DS занимает такой же объем,
что и дистиллированная вода, и впоследствии используют эту
поправку.
4. После добавления всех компонентов гибридизационную
смесь тщательно перемешивают и собирают на дне пробирки с
помощью 1—2-минутного центрифугирования. Смесь денатури-
руют в течение 5 мин в водяной бане при 80...85 °C и быстро пере-
носят на лед.
5. На каждый препарат наносят примерно по 10 мкл гибридиза-
ционной смеси и накрывают покровным стеклом 18 х18 мм, избе-
гая образования пузырьков воздуха. Покровное стекло заклеивают
по периметру тонким слоем резинового клея и подсушивают на
воздухе.
6. Препараты помещают во влажную камеру — плотно закрыва-
ющуюся коробку, на дне которой находятся 2—3 слоя влажной
фильтровальной бумаги, с держателями. Препараты кладут на дер-
жатели горизонтально так, чтобы их края не соприкасались.
7. Гибридизацию проводят в термостате при 37’С от 6 ч до
2сут.
7.3. ДЕТЕКЦИЯ СИГНАЛОВ ГИБРИДИЗАЦИИ
После гибридизации препараты отмывают. Существует множе-
ство вариантов постгибридизационной отмывки, различающихся
по последовательности чередования растворов, составу и концен-
трации буферов, продолжительности отмывок и их температур-
ным параметрам (Raybum and Gill, 1985; Ambros et al., 1985;
Schwarzacher et al., 1989; Busch et al. 1994; Leitch et al., 1994;
Schwarzecher and Heslop-Harrison, 2000 и др.). Отмечено, что сни-
жение концентрации солей, повышение температуры и длитель-
ности отмывок (жесткие условия) приводят к снижению фона и
уровня неспецифической гибридизации, однако при этом ослабля-
ется также и интенсивность сигнала.
Постгибридизационная отмывка. Препараты вынимают из влаж-
ной камеры, снимают резиновый клей с помощью пинцета и ста-
вят по одному в стакан с 0,1 х SSC-буфером, чтобы удалить по-
кровное стекло (при соскальзывании оно не повредит поверхнос-
ти препарата).
Препараты отмывают в следующей последовательности:
0,1 х SSC — 2 раза по 10 мин при 37...42 °C;
2 х SSC — 2 раза по 10 мин при 37...42 °C;
2 х SSC — 5 мин при комнатной температуре;
1 х PBS — 5 мин при комнатной температуре.
125
Последующие обработки различаются в зависимости от спо-
соба детекции сигнала (прямое мечение проб флуорохромами,
флуоресцентная и ферментная детекции меченых зондов).
7.3.1. ВЫЯВЛЕНИЕ СИГНАЛОВ ГИБРИДИЗАЦИИ
С ПОМОЩЬЮ ФЛУОРОХРОМОВ
Прямое мечение проб флуорохромами. Чтобы сигнал получался
ярким без амплификации, в геномной гибридизации ш situ или
при гибридизации последовательностей, размер и копийность ко-
торых достаточно велики, можно использовать меченные флуо-
рохромами зонды без последующей детекции сигнала. Это наи-
более простой метод, поскольку он не требует проведения дли-
тельных и сложных обработок: после отмывки препараты прово-
дят через серию спиртов, сушат на воздухе, окрашивают
соответствующим красителем и анализируют под микроскопом.
Отмывки и окрашивание проводят в темноте для предотвращения
выцветания сигнала. Для этого можно использовать непрозрач-
ную посуду (все емкости, в которых производят детекцию, завора-
чивать в алюминиевую фольгу) или же закрывать ее картонной
коробкой.
Если проба небольшого размера или уровень копииности по-
следовательности невелик, так что интенсивность получаемого
сигнала оказалась недостаточной, то можно произвести его амп-
лификацию с помощью специально подобранной системы анти-
тел. В частности, компанией «Dako» (Дания) разработаны систе-
мы первичных и вторичных антител, позволяющие проводить
амплификацию сигналов для проб, меченных флуоресцеином.
Меченый зонд узнается антителами к FITC, полученными из
кролика (Rabbit anti-FITC IgG), которые, в свою очередь, выяв-
ляются антителами кролика, выработанными у свиньи и конъю-
гированными с FITC (swine anti-rabbit/FITC). Это проводят сле-
дующим образом.
1. Отмывают препараты по стандартной методике и слегка под-
сушивают: стекло ставят вертикально на фильтровальную бумагу,
давая стечь излишку жидкости. Препараты должны оставаться
слегка влажными.
2. Во время последней отмывки на льду готовят 0,1—0,5%-й ра-
створ Rabbit anti-FITC IgG в 1 х PBS-буфере (разбавление указано
в описании к реактиву). На каждый препарат наносят по 100 мкл
раствора, накрывают покровным стеклом 24 х 50 мм и инкубиру-
ют во влажной камере при 37...42 °C в течение 40—60 мин.
3. Стряхивают покровное стекло с препарата. Отмывку прово-
дят в 1 х PBS-буфере при комнатной температуре в темноте 3 раза
по 5 мин. После последней отмывки препараты слегка подсуши-
вают.
126
4. Наносят на каждый препарат по 100 мкл 10%-го раствора
swine anti-rabbit/FITC в 1 х PBS-буфере, накрывают покровным
стеклом 24 х 50 мм и инкубируют при 37...42 °C во влажной камере
в течение 40—60 мин.
5. Стряхивают покровное стекло с препарата. Стекла отмывают
в 1 х PBS-буфере 3 раза по 5 мин при комнатной температуре, за-
тем проводят через серию спиртов, сушат на воздухе и окрашива-
ют.
7.3.2. МЕТОДЫ ДЕТЕКЦИИ БИОТИНИЛИРОВАННЫХ ЗОНДОВ
Разработано несколько способов флуоресцентной детекции
биотина. Их можно условно разделить на две группы:
с помощью авидина и стрептавидина;
с помощью системы антител.
Первая из них основана на способности биотина присоединять
к себе молекулу авидина или стрептавидина. Их ковалентно свя-
зывают с молекулой флуорохрома: флуоресцеина (FITC), родами-
на, техасского красного (TR), СуЗ и др. В такой комплексной моле-
куле авидин или стрептавидин узнает меченные биотином участки
ДНК, а сцепленный с ним флуорохром выявляет эти последова-
тельности на цитологических препаратах. Гибридизацию проявля-
ют следующим образом.
1. Препараты отмывают по стандартной методике и слегка под-
сушивают: стекло ставят вертикально на фильтровальную бумагу,
давая стечь излишку жидкости. Препараты должны остаться слег-
ка влажными.
2. Во время последней отмывки на льду готовят раствор авиди-
на-флуорохрома-FITC, родамина, TR™ или стрептавидина-СуЗ в
1 х PBS-буфере. Разбавление варьирует от 1 : 200 до 1: 500 в зави-
симости от флуорохрома и фирмы-производителя; обычно его
указывают в описании к реактиву. Пробирку с проявляющим ра-
створом заворачивают в фольгу.
3. Наносят на каждый препарат по 100 мкл раствора, накрыва-
ют покровным стеклом 24 х 50 мм и инкубируют во влажной каме-
ре при 37...42 °C в течение 40—60 мин.
4. Стряхивают покровное стекло с препарата. Проводят отмыв-
ку в 1 х PBS-буфере 3 раза по 5 мин при комнатной температуре в
темноте.
5. Проводят препараты через серию спиртов, сушат на воздухе
и окрашивают.
Если однократной амплификации недостаточно, то сигнал гиб-
ридизации можно усилить с помощью биотинилированных анти-
тел к авидину или стрептавидину, выпускаемых компанией
«Vector Laboratories», США (антитела подбирают в строгом соот-
ветствии с тем, какой реактив был использован в первой детек-
ции), и повторной обработки авидином-НТС/родамином/ТВ™
127
или стрептавидином-СуЗ. Для этого после завершения 4-го этапа
проводят следующие обработки.
5. Слегка подсушивают препараты и на каждый из них наносят
по 100 мкл раствора биотинилированного авидина (стрептавиди-
на) в 1 х PBS-буфере (разведение 1: 100), накрывают покровным
стеклом 24 х 50 мм и инкубируют при 37...42 °C во влажной камере
в течение 40—60 мин.
6. Стряхивают покровное стекло с препарата. Отмывку произ-
водят при комнатной температуре в трех сменах 1 х PBS-буфера
по 5 мин в каждой, после чего препараты слегка подсушивают на
фильтровальной бумаге.
7. Во время последней отмывки на льду готовят раствор авиди-
на-FITC (вместо последнего можно использовать родамин или
TR™) либо стрептавидина-Су3 в 1 х PBS-буфере.
8. Наносят на каждый препарат по 100 мкл раствора, накрыва-
ют покровным стеклом 24 х 50 мм и инкубируют при 37...42 С во
влажной камере в течение 40—60 мин.
9. Стряхивают покровное стекло с препарата. Стекла отмывают
при комнатной температуре в 1 х PBS-буфере 3 раза по 5 мин,
затем проводят через серию спиртов, сушат на воздухе и окраши-
вают.
Второй способ детекции биотинилированных зондов основан
на использовании первичных и вторичных антител. Молекула
биотина «узнается» первичными антителами к биотину, которые,
в свою очередь, выявляются с помощью вторичных антител, свя-
занных с флуорохромами. Хорошие результаты получают при ис-
пользовании набора реактивов для флуоресцентной детекции сиг-
нала фирмы «Enzo-Diagnostic», США.
1. Отмывают препараты по стандартной методике и слегка под-
сушивают.
2. Во время последней отмывки на льду готовят раствор пер-
вичных антител к биотину (Rabbit anti-Biotin Antibody), разведе-
ние 1: 100. Для разбавления антител используют 1 х PBS-буфер,
содержащий 2 мг/мл альбумина бычьей сыворотки (BSA, Fract. V).
3. Наносят на каждый препарат по 100 мкл раствора антител,
накрывают покровным стеклом 24 х 50 мм и оставляют в термо-
стате (37...42 °C) во влажной камере на 40—60 мин.
4. Стряхивают покровное стекло с препарата. Промывают стек-
ла в 1 х PBS-буфере 3 раза по 5 мин при комнатной температуре и
слегка подсушивают.
5. Во время последней отмывки на льду готовят раствор вто-
ричных антител (FITC-Goat anti-Rabbit Antibody), разведение
1: 200. Для разбавления антител также используют 1 х PBS-буфер,
содержащий 2 мг/мл BSA.
6. Наносят на каждый препарат по 100 Mjyi раствора антител,
накрывают покровным стеклом 24 х 50 мм и инкубируют во влаж-
ной камере в термостате (37...42 °C) в течение 40—60 мин.
128
I
7. Стряхивают покровное стекло с препарата. Стекла трижды
промывают в 1 х PBS-буфере по 5 мин в каждой смене.
8. Препараты проводят через серию спиртов (70, 96 и 100%-й),
сушат на воздухе и окрашивают.
( • v
*
•» , - - • в
7.3.3. ДЕТЕКЦИЯ МЕЧЕННЫХ ДИГОКСИГЕНИНОМ
(ДИГ-МЕЧЕННЫХ) ЗОНДОВ
Для флуоресцентной детекции дигоксигенина фирмой «Roche
Applied Science» была разработана специальная система^ основан-
ная на использовании антител, связанных с молекулой флуоро-
хрома (FITC, родамина, TR и др). Детекцию проводят следующим
образом.
1. Отмывают препараты стандартным способом и слегка подсу-
шивают. , , '
2. Во время последней отмывки на льду готовят раствор Anti-
digoxigenin-fluorescein (или Rhodamine), Fab fragment, made in
sheep («Roche Applied Science») в 1 x PBS-буфере, разведение 1 :10.
Пробирку заворачивают в фольгу.
3. Наносят на каждый препарат по 100 мкл раствора антител,
накрывают покровным стеклом 24 х 50 мм и инкубируют во влаж-
ной камере при 37...42 °C в течение 40—60 мин.
4. Стряхивают покровное стекло с препарата. Стекла отмывают
в 1 х PBS-буфере 3 раза по 5 мин при комнатной температуре в
темноте.
5. Проводят препараты через серию спиртов, сушат на воздухе
и окрашивают.
При необходимости гибридизационный сигнал можно усилить
с помощью соответствующих антител. Если диг-меченные зонды
выявляли с помощью anti-dig-FITC, то для амплификации сигна-
ла можно использовать систему, разработанную для детекции
флуоресцеина (см. раздел 2.1). Если для детекции диг-меченного
зонда был использован родамин, амплификацию сигнала можно
проводить по следующей схеме. В роли вторичных берут антитела
кролика к овце (anti- sheep IgG, made in rabbit, «Vector labora-
tories»), поскольку все типы антител к дигоксигенину вырабатыва-
ются в организме овцы. Вторичные антитела проявляются с помо-
щью антител к кролику, конъюгированных с СуЗ или TRITC
(«Sigma», USA).
7.3.4. ДЕТЕКЦИЯ СИГНАЛОВ ГИБРИДИЗАЦИИ
С ДВУМЯ РАЗЛИЧНО МЕЧЕНЫМИ ПРОБАМИ
(MULTICOLOR FISH)
9 • «- " *
Существуют несколько способов выявления сигналов в
Multicolor FISH, зависящих от типа меченых нуклеотидов, ис-
пользуемого флуорохрома и способа детекции каждой из проб.
-9 В. A. riyxiLibCKitn и др. 129
При подборе систем детекции сигналов необходимо учитывать,
что антитела к различным зондам не должны перекрываться, т. е.
если для выявления биотина, например, предполагается использо-
вать антитела кролика, то их нельзя брать для детекции дигоксиге-
нина или флуоресцеина. Остановимся на трех из этих способов.
1. Это наиболее простой вариант: одну пробу метят флуоресце-
ином, а вторую — родамином или техасским красным. Прямое
мечение не требует долговременной детекции сигналов, однако
его можно использовать только в геномной гибридизации in situ
или для многократно повторенных последовательностей, дающих
крупные гибридизационные сигналы.
2. Наиболее часто используемая в двухцветной FISH схема:
одну пробу метят биотином, а вторую — дигоксигенином. Прояв-
ление обоих зондов проводят одновременно, используя разные
флуорохромы для их дифференцировки. Разработано несколько
способов детекции сигналов, позволяющих выявлять био- или
диг-меченные зонды несколькими комбинациями флуорохромов.
Достаточно хорошие результаты можно получить с помощью сле-
дующих вариантов (табл. 7.5, 7.6).
7.5. Схема детекции сигналов биотина (зеленый) и дигоксигенина (красный)
в multicolor FISH
Био-FITC (зеленый)
Диг-родамин/СуЗ (красный)
1-й Avidin D-FITC «Vector
Laboratories» 1:100—1:500
2-й Biotinilated anti-avidin D, made
in goat «Vector Laboratories»
1:100
3-й Avidin D-FITC «Vector
Laboratories»
1:100—1:500
Anti-dig Rhodamine, FAB fragment,
made in sheep «Roche Applied
Science» 1:10—1:4
Anti-sheep IgG (H+L), made in
rabbit «Vector Laboratories»
1:50-1 :100
Anti-rabbit IgG (whole molecule)
F(ab’)2 fragment-СуЗ, made in sheep
«Sigma-Aldrich» 1:50 или
Anti-rabbit IgG (whole molecule)-
TRITC antibody produced in goat
«Sigma-Aldrich» 1 :400
7.6. Схема детекции сигналов биотина (красный) и дигоксигенина (зеленый)
в multicolor FISH
Био-Rhodamine/Су3 (красный)
Родамин
СуЗ
Диг-FITC (зеленый)
1-й Avidin D-rhodamine
«Vector Laboratories»
1:100 - 1:500
Streptavidin-СуЗ
«Sigma-Aldrich»
1:100-1:500
2-й Biotinilated anti-avidin
D, made in goat
«Vector Laboratories»
1:100
Biotinilated anti-
streptavidin
«Vector laboratories»
1:100
Anti-dig FITC, Fab
fragment, made in
sheep «Roche
Applied Science»
1:10—1:4
Rabbit anti-FITC
(«DAKO»)
1:100-1:500
130
Продолжение
3-й
Avidin D-rhodamine
«Vector Laboratories»
1:100 - 1 : 500
Strep tavidin-Cy3
«Sigma-Aldrich»
1:100-1: 500
Swine anti-Rabbit IgG
FITC-conjugated «DAKO»
1 : 10
В ряде случаев для получения достаточно четкой картины де-
текцию сигналов можно проводить в одну стадию, поскольку при
последовательной амплификации сигналов пропорционально воз-
растает гибридизационный фон.
3. Это комбинация двух проб, меченных биотином (био-) и
флуоресцеином, дающая хорошие результаты. В отличие от ди-
гоксигенина, первичные антитела к которому являются поликло-
нальными и могут неспецифически связываться с белками цито-
плазмы, что приводит к появлению значительного фона даже после
первой детекции, для выявления флуоресцеина используют моно-
клональные антитела. Они не дают перекрестной гибридизации,
что позволяет избежать нежелательного фона. Детекцию сигналов
проводят в два этапа (табл. 7.7).
7.7. Способы детекции биотина (красный) и флуоресцеина (зеленый)
Биотин (СуЗ)
1-й -
2-й Streptavidin—СуЗ
«Sigma-Aldrich»
1:100-1: 500
Флуоресцеин
Rabbit anti-FITC «DAKO»
1:100-1: 500
Swine anti-Rabbit IgG
FITC-conjugated «DAKO»
1:10
После детекции сигналов, независимо от того, какой вариант
метода использовался, препараты отмывают в 1 х PBS-буфере при
комнатной температуре 3 раза по 5 мин, проводят через серию
спиртов (70, 95 и 100%-й) и сушат с помощью фена или ветерка.
Готовые препараты окрашивают DAPI и заключают в специально
разработанную среду для флуоресцентной микроскопии, предот-
вращающую выцветание препаратов (например, Vectashield
mounting media). Окрашенные препараты хранят в холодильнике
или морозильной камере.
7.3.5. ОКРАШИВАНИЕ ПРЕПАРАТОВ ДЛЯ FISH
Для окрашивания препаратов хромосом, выявляемых флуорес-
цеином (возбуждение при Х^ = 494 нм, испускание при
Хтах=523нм), можно использовать йодистый пропидий (PI) или
DAPI (4'6'-diamino-2- phenylindol). Родамин (возбуждение X = 550—
560 нм, испускание X = 568—575 нм) и техасский красный (возбуж-
дение Х= 595—604 нм, испускание Х= 606—615 нм) выявляют с
9*
131
помощью DAPI. Его используют также при анализе препаратов с
двойной меткой. Окрашивание можно проводить двумя способами:
краситель добавляют непосредственно в среду для заключе-
ния препаратов (Vectashield mounting media, «Vector Laboratories»
или аналогичную). Окрашивание на заключенных препаратах
происходит в течение 10—15 мин;
препараты предварительно окрашивают раствором красите-
ля в 1 х PBS-буфере под покровным стеклом 24 х 50 мм в течение
10—15 мин, после чего заключают в Vectashield mounting media.
Желательно, чтобы среда также содержала краситель. В этом слу-
чае препарат окрашивается более равномерно, чем при ранее опи-
санном варианте.
Концентрацию красителя определяют экспериментально. Сна-
чала готовят маточный раствор: PI или DAP1 разводят дистилли-
рованной водой или 1 х PBS-буфером до концентрации 5 мг/мл.
Маточный раствор разбавляют до конечной (рабочей) концентра-
ции средой для заключения препаратов или 1 х PBS-буфером в за-
висимости от способа окрашивания. Конечная концентрация
обычно составляет 1 мкг/мл для PI и 2 мкг/мл для DAPI. Таким
образом, для получения 1 мл рабочего раствора берут соответ-
ственно 2 или 4 мкл маточного раствора PI или DAPI. При пра-
вильном разведении йодистый пропидий должен бледно- или
средне-интенсивно флуоресцировать оранжевым в соответствую-
щем фильтре (для флуоресцеина) и очень ярко светиться красным
в зеленом (для родамина). Окрашивание DAPI не должно быть
слишком интенсивным, поскольку это мешает визуализации сиг-
налов. Препараты анализируют на флуоресцентном микроскопе с
использованием соответствующей системы светофильтров. Ре-
зультаты гибридизации регистрируют с использованием CCD-ка-
меры (рис. 7.1).
Рис. 7.1. Гибридизация in situ GISH на хромосомах тритикале линии 131/7.
Стрелками показаны межгеномные пшенично-ржаные транслокации
132
7.4. ВЫЯВЛЕНИЕ СИГНАЛОВ ГИБРИДИЗАЦИИ
С ПОМОЩЬЮ ФЕРМЕНТОВ
Для детекции биотина обычно используют следующую мето-
дику.
1. Отмывают препараты по стандартному методу и слегка под-
сушивают.
2. Во время последней отмывки на льду готовят проявляющий
раствор, содержащий соответствующий фермент в 1 х PBS-буфе-
ре. Для детекции биотина используют пероксидазу хрена, конъю-
гированную с авидином или стрептавидином (Horseradish peroxi-
dase avidin D, «Vector Laboratories», «Enzo-Diagnostics», «Roche
Applied Science» и др.). Рекомендуемая концентрация фермента
указана в его описании. Для пероксидазы фирмы «Enzo-Diag-
nostics» она составляет 4—10 мкг на 1 мл буфера, фирмы «Vector
Laboratories» — 2—5 мкг/мл. Дигоксигенин выявляют с помощью
Anti-digoxigenin-POD, Fab fragment («Roche Applied Science») в
1 x PBS-буфере (2—10 мкл фермента на 1 мл буфера).
3. Помещают на каждый препарат примерно 100 мкл проявля-
ющего раствора, накрывают покровным стеклом 24 х 50 мм и ин-
кубируют во влажной камере при 37 °C в течение 30—60 мин.
4. Удаляют покровные стекла с препаратов стряхиванием иди
дают им соскользнуть в растворе 1 х PBS-буфера. После этого пре-
параты промывают в растворе i х PBS-буфера при комнатной тем-
пературе 3 раза по 5 мин.
5. Во время отмывок готовят 0,05%-й раствор DAB (diamino-
benzidine tetrahydrochloride, «Sigma»). Поскольку этот реактив
чувствителен к температуре и свету, его держат на льду в плотно
завернутой пробирке с крышкой. DAB — высокотоксичное ве-
щество, поэтому работать с ним следует в резиновых перчатках и
соблюдая меры безопасности. Растворяют 5 мг DAB в 10 мл
1 х PBS-буфера и непосредственно перед использованием добав-
ляют в него 4 мкл 30%-го раствора Н2О2.
6. Слегка подсушивают препараты на фильтровальной бумаге,
кладут по одному в темный ящик на сухую фильтровальную бума-
гу так, чтобы они не соприкасались, и на каждый препарат равно-
мерно наносят по 1 мкл раствора DAB. Проявление сигнала про-
водят в темноте при комнатной температуре в течение 10—60 мин.
За это время цвет препарата или не меняется, или приобретает
желтовато-коричневый оттенок.
7. Дают раствору DAB стечь на фильтровальную бумагу,, накло-
няя каждое стекло, и моют препараты 5 мин в 1 х PBS-буфере. За
это время готовят 2%-й раствор Гимза («Banco» или «Fischer») на
дистиллированной воде. Подкрашивают препараты в красителе
Гимза в течение 2 мин и смывают краску, поставив стакан с кра-
сителем под струю проточной воды. Сушат препараты воздухом
или с помощью резиновой груши и анализируют под микроско-
133
Рис 7 2 Гибридизация in situ FISH на хромосомах Т. aestivum. Зонд — проба
pSc!19
Рис. 7.3. Гибридизация in situ GISH на хромосомах Т. araticum. Стрелками показа
ны межгеномные транслокации
Рис. 7.4. Гибридизация in situ FISH ва хромосомах Т. militinae. Зоцд — проба
на 5S РНК
пом. Сигналы гибридизации проявляются как светло- или темно-
коричневые участки на фоне светлоокрашенных (краситель Гим-
за) районов хромосом (рис. 7.2—7.4).
7.5. ПРИГОТОВЛЕНИЕ РАСТВОРОВ ДЛЯ ГИБРИДИЗАЦИИ
IN SITU
7.5.1. БУФЕРЫ ОБЩЕГО НАЗНАЧЕНИЯ
0,5 М Na2EDTA. К 800 мл дистиллированной воды при посто-
янном перемешивании добавляют 186,1 г EDTA дигидрата. С по-
мощью NaOH доводят pH раствора до 8,0 (потребуется приблизи-
тельно 20 г сухого гидроксида натрия). Добавляют дистиллирован-
ной воды до конечного объема 1 л. Раствор автоклавируют.
IM TRIS. В 800 мл дистиллированной воды растворяют 121,1 г
Trizma base. С помощью концентрированной соляной кислоты до-
водят pH раствора до нужного значения.
pH раствора Приблизительный объем
концентрированной НС1, мл
7,4 70
7,6 60
8,0 42
135
Охлаждают раствор до комнатной температуры и с помощью
1 н. НС1 производят окончательную доводку pH. Добавляют дис-
тиллированной воды до конечного объема 1 л и автоклавируют
раствор.
ТЕ-буфер. Сливают 10 мл IM Tris (pH 8,0), 2 мл 0,5 М EDTA
(pH 0,8). Доводят объем до 1 л дистиллированной водой. Раствор
автоклавируют.
7.5.2. РЕАКТИВЫ И БУФЕРЫ ДЛЯ ВЫДЕЛЕНИЯ И ОЧИСТКИ
ГЕНОМНОЙ ДНК
2 х СТАВ-буфер. Он состоит из следующих ингредиентов:
100 мМ Tris, pH 8,0
2 % СТАВ (hexadecyltrimethylamonium bromide)
20 мМ-EDTA
о-Phenanthroline — 0,3962 г
1,4 М NaCl
0,0001 % 2-меркаптоэтанол — 82 г
Дистиллированная вода — до 1 л
Раствор хранят в темной бутыли при комнатной температуре.
Насыщение фенола. Его проводят следующим образом.
1. Перед насыщением фенол достают из замораживателя, со-
гревают до комнатной температуры и расплавляют при 68 °C. В
жидкий фенол добавляют гидроксихинолин до конечной концен-
трации 0,1 %. Это связано с тем, что гидроксихинолин является
антиоксидантом, частичным ингибитором РНКазы и слабым свя-
зывателем ионов металлов.
2. В расплавленный фенол добавляют равный объем 1 М Tris-HCl
(pH 8,0) и перемешивают на магнитной мешалке при комнатной
температуре в течение 15 мин. Фенол оставляют в темноте на не-
сколько часов, после чего верхнюю (водную) фазу аккуратно
снимают с помощью стеклянной пипетки, соединенной с водо-
струйным насосом. Осуществляют те же операции с 1,0; 0,5; 0,2;
0,1 Tris-HCl (pH 8,0). .... . , < *
3. Фенол смешивают с равным объемом 1 М Tris-HCl (pH 8,0) и
перемешивают на магнитной мешалке при комнатной температу-
ре 15 мин. Последующие манипуляции те же, что на втором этапе.
Повторяют то же с 0,5 М Tris-HCl (р Н8,0), затем 0,2 М Tris-HCl
(pH 8,0), 0,1 М Tris-HCl (pH 8,0) и продолжают насыщение до тех
пор, пока pH фенольной фазы не достигнет 7,8 или выше (прове-
ряется индикаторной бумагой).
4. После того как фенол окончательно насыщен и верхняя
(водная) фаза снята, к нему добавляют 0,1 объема 0,J М Tris-HCl
(pH 8,0). В таком состоянии фенол хранят в темной бутыли при
2 °C до нескольких месяцев.
ДНК спермы лосося. Растворяют 1 г ДНК (Deoxyribonucleic
acid, Sodium salt.) в 100 мл 0,4 н. NaOH при комнатной температу-
136
ре и кипятят 30 мин. На мини-геле проверяют размер фрагментов
(должен составлять приблизительно 200—1000 п.н.). Раствор ох-
лаждают на льду и нейтрализуют до pH 7,0 с помощью уксусной
кислоты, после чего добавляют два объема этанола и ставят в мо-
розильник на —20 °C на 1 ч или более для осаждения ДНК. Ее
осаждают 15-минутным центрифугированием при частоте враще-
ния 6000 мин-1, осадок дважды промывают 70%-м этиловым
спиртом, а затем сушат. ДНК растворяют в 100 мл ТЕ-буфера.
Концентрация ДНК соответствует 10 мг/мл.
РНКаза, свободная от ДНКазы. Растворяют РНКазу-Атип Ш-А
(«Sigma») до концентрации 10 мг/ мл в 10 мМ Tris-HCl (pH 7,5) и
15 мМ NaCl. Кипятят 15 мин и постепенно охлаждают до ком-
натной температуры. Разделяют на небольшие аликвоты и хра-
нят при —20 °C.
7.5.3. БУФЕРЫ ДЛЯ ЭЛЕКТРОФОРЕЗА ДНК
Обычно используют буферы, состав которых приведен ниже.
10 х ТВЕ-буфер.
Trisma base — 108 г
0,5М EDTA (pH 8,0) - 40 мл
Борная кислота — 55 г
НгО — до 1 л
Буфер для нанесения образцов Gel-loading buffer.
Бромфеноловый синий — 0,12г
Ксилен цианон — 0,15 г
Фикол, тип 400—7,5 г
Дистиллированная вода — до 50 мл.
Бромистый этидий. Растворяют 1 г сухого бромистого этидия в
100 мл ТЕ-буфера.
7.5.4. БУФЕРЫ ДЛЯ ВЫДЕЛЕНИЯ ПЛАЗМИДНОЙ ДНК
LB Среда. В 800 мл дистиллированной воды растворяют 10 бак-
то триптон (Bacto Tryptone, Difco), 5 г экстракта дрожжей (Bacto
Yeast Extract, Difco) и 10 г NaCl. Для твердых сред добавляется до-
полнительно 15 г бактоагара (Difco). Доводят pH среды до 7,0 с
помощью гидрооксида натрия, доливают дистиллированной во-
дой до конечного объема 1 л и автоклавируют.
Буферы для щелочного лизиса бактерий.
Раствор I. 25 мМ Tris pH 8,0 (25 мл 1 М Tris)
10 мМ EDTA (20 мл 0,5 М EDTA)
5 г D-(+) глюкозы
Дистиллированная вода до 1 л, автоклавировать.
Раствор II. 0,2 н. NaOH
1%-й (SDS) додецилсульфат натрия
137
Раствор III. 3 М ацетат натрия (pH 4,8). К 60 мл 5 М ацетата
натрия добавляют 11,5 мл ледяной уксусной кислоты и 28,5 мл
дистиллированной воды. Полученный раствор будет 3 М в отно-
шении натрия и 5 М по ацетату.
7.5.5. БУФЕРЫ ДЛЯ МЕЧЕНИЯ И ОЧИСТКИ ПРОБ
Приготовление Сефадекса G-50. В 250 мл ТЕ-буфера при посто-
янном перемешивании медленно добавляют 30 мг сефадекса. Не-
обходимо проследить, чтобы порошок распределился в буфере
равномерно. Дают суспензии отстояться в течение ночи или про-
гревают при 65 °C в течение 2 ч, охлаждают до комнатной темпе-
ратуры и сливают верхнюю фазу, заменив ее равным объемом
ТЕ-буфера. Суспензию хранят в бутылке с завинчивающейся
крышкой в холодильнике.
Буфер для ник-трансляции.
0,5 М Tris-HCl (pH 7,5),
0,1 М MgSO4,
1 нМ дитиотритол (dithiothreitol)
500 мкМ альбумин бычьей сыворотки (BSA, Fraction V).
Раствор делят на небольшие аликвоты и хранят при —20 °C.
7.5.6. БУФЕРЫ ДЛЯ ГИБРИДИЗАЦИИ IN SITU
И ДЕТЕКЦИИ СИГНАЛА
20xSSC (1 xSSC: 0,15 М NaCl + 0,015 М цитрат натрия)
Растворяют в 800 мл дистиллированной воды 175,3 г NaCl и
88,2 г двухводного цитрата натрия (или 107,4 г 5,5-водного цитра-
та натрия). С помощью соляной кислоты доводят pH раствора до
7,0. Добавляют дистиллированной воды до конечного объема 1 л,
раствор автоклавируют.
10 х PBS. В 800 мл дистиллированной воды растворяют 80 г
NaCl, 2 г КС1 (мол.м 74,55), 14,4 г Na2HPO4 (мол.м 142,0), 2,4 г
КН2РО4 (мол.м 136,1). Объем раствора доводят дистиллированной
водой до 1 л (pH раствора должен приблизительно соответствовать
6,8—6,85). Раствор автоклавируют.
50%-й декстран сульфат (DS). Смешивают 1 г DS с 2 мл дистил-
лированной воды и нагревают на водяной бане до полного раство-
рения соли.
Глава 8
МЕТОДЫ ПОЛУЧЕНИЯ И ИДЕНТИФИКАЦИИ
ПОЛИПЛОИДНЫХ ФОРМ
8.1. ПОЛИПЛОИДИЯ
Всем существующим видам растений и животных свойственно
определенное диплоидное число хромосом (2л). Изменчивость
этого числа в пределах вида — явление крайне редкое, хотя встре-
чаются организмы, клетки которых содержат более чем два гапло-
идных набора хромосом. Такие растения называют полиплоидными.
В то же время внутри отдельных родов существуют группы род-
ственных видов, у которых число хромосом кратно основному
гаплоидному числу хромосом, общему для всех видов. Например,
у рода Triticum L. основное число хромосом х = 7, а виды пшени-
цы, относящиеся к этому роду, в соматических клетках имеют:
2л =14 (например, Т. monococcum), 2л = 28 (Т. durum и др.) и
2л = 42 (Г. aestivum и др.) и составляют полиплоидный ряд. Таких
рядов в природе описано довольно много: у табака, люцерны,
овса, хлопчатника, клевера.
С установлением полиплоидной природы многих культурных
растений был отмечен и тот факт, что полиплоиды, как правило,
мощнее своих диплоидных собратьев. В связи с этим и были раз-
работаны методы экспериментального удвоения числа хромосом.
В настоящее время различают следующие виды полиплоидии: ав-
тополиплоидия и аллополиплоидия.
Автополиплоидия — кратное увеличение числа наборов хромо-
сом в клетках растительных форм. Например, из диплоидной фор-
мы гречихи Fagopyrum esculentum (2 л = 16) получена полиплоидная
форма с 2л = 32, имеющая четыре гаплоидных набора хромосом.
Во многих случаях такое увеличение числа хромосом влечет за со-
бой увеличение отдельных органов (рис. 8.1). В то же время отме-
чены факты, когда полиплоидные формы по мощности уступают
исходным. Например, если удвоить число хромосом у Т. aestivum
2п = 42 до 2л = 84, то получится слаборазвитое растение. Это явле-
ние имеет место в тех случаях, когда исходное число хромосом в
соматических клетках относительно велико. При получении авто-
полиплоидов всегда следует иметь в виду и тот факт, что очень ча-
сто они имеют пониженную плодовитость, обусловленную нару-
шениями в мейозе.
139
Рис. 8.1. Растения паслена черного (Solatium nigrum) с различными наборами
хромосом: (Мюнцииг А. Генетика. — М.: Мир, 1967. — С. 398)
1 - 2л (2х) = 36; 2 - 2л (4х) - 72; 3 — 2л (6х) = 108; 4 - 2л (8х) = 144
Чаще всего автополиплоиды получают воздействием на деля-
щиеся соматические клетки различными внешними факторами,
такими, как высокие температуры, и химическими веществами
(колхицин, аценафтен, хлористый сангуинарин, гаммексан, лин-
дан, хлоралгидрат, хлороформ, 8-оксихинолин). Наибольшее рас-
пространение для получения полиплоидов получил колхицин
(C22H25O6N) — алкалоид, выделяемый из луковиц крокуса осенне-
го (Colchicum autumnale). Его применяют в невысоких концентра-
циях (0,1—0,25 %) в виде водных растворов, глицериновой эмуль-
сии, ланолиновой пасты (смесь колхицина с ланолином).
Воздействию колхицином подвергают сухие и проросшие семе-
на, точки роста растений, цветочные и вегетативные почки, стеб-
ли и другие органы растений, в тканях которых интенсивно проте-
кают процессы роста и деления клеток. Колхицин подавляет дей-
ствие механизма веретена деления, что приводит к нерасхожде-
нию хромосом на стадии анафазы митоза, а следовательно, к
удвоению числа хромосом в клетке (рис. 8.2).
Аллополиплоидия — явление, связанное с объединением в ре-
зультате межвидовой гибридизации в одном организме хромосом-
140
Анафаза
Рис. . 8.2. Схема, показывающая различие между нормальным (верхний рисунок) и
колхициновым (нижний рисунок) митозом (Мюнцинг А. Генетика. — М.: Мир,
1967. - С. 409)
• * I , > . ,
ных наборов скрещиваемых видов. Например, Г. Д. Карпеченко
(1935) от скрещивания редьки (Raphanus sativus', 2л = 18) с капус-
той (Brassica oleracea; 2л = 18) получил гибрид Raphanobrassica
(2л =36). При этом вначале полученный гибрид с числом хромо-
сом 2л = 18 был полностью стерилен из-за негомологичности хро-
мосом. Удвоение числа хромосом до 2л = 36 привело к восстанов-
лению фертильности.-
8.2. МЕТОДЫ ПОЛУЧЕНИЯ ПОЛИПЛОИДОВ РАЗЛИЧНЫХ
РАСТЕНИЙ С ПОМОЩЬЮ КОЛХИЦИНА
При работе с колхицином следует соблюдать большую осто-
рожность, так как он очень ядовит. Для приготовления растворов
нуяСной концентрации лучше всего пользоваться маточным 1%-м
раствором колхицина, который следует хранить в темной склянке,
поскольку на свету он разлагается. При работе с колхицином сле-
дует пользоваться ватно-марлевой повязкой и резиновыми пер-
чатками.
В таблице 8.1 приведены методики получения полиплоидов у
различных культур с использованием колхицина.
8.1. Методики создания полиплоидных растений
Вид растения
Метод обработки
Автор
Пшеница
однозернянка
Рожь
Проростки длиной 3—6 мм выдерживают
в течение 20—30 мин в 0,25%-м водном
растворе колхицина
Проросшие семена погружают в 0,1%-й
водный раствор колхицина на 3 ч при
температуре 27 ”С
Dorsey, 1939
Bremer-Reinders .
et al., 1952
141
Продолжение
Вид растения
Метод обработки
Автор
Кукуруза
У проростков, достигших в высоту 2—3 см,
обрезают верхушку и в срез вставляют ват-
ный тампон, который 1—2 раза в сутки
смачивают 0,2%-м водным раствором
Шумный, 1965
Межродовые
гибриды
злаков
Гибриды
пшеницы
с рожью
Межвидовые
гибриды
овса
Ячмень
двурядный
Ячмень
многорядный
Рис
Хлопчатник
колхицина
С помощью иглы продевают через колео-
птиле проростка, достигшего в высоту 2 см,
ватный тампон, который 2—3 раза в сутки
смачивают 0,2%-м водным раствором
колхицина
Молодые корешки и побеги растений в на-
чале кущения погружают в вакууме
в 0,2%-й водный раствор колхицина на 3 ч
при температуре 18...20 °C. При этом дела-
ют продольный надрез побегов на высоте
0,8 см над их основанием
Молодые проростки с хорошо развитой
корневой системой выкапывают и отмы-
вают от земли. Затем корни подрезают и
погружают в 0,2%-й водный раствор колхи-
цина на 8—10 ч
Корни молодых растений погружают на
день в 0,05%-й водный раствор колхицина,
а на ночь переносят в воду. Эту операцию
повторяют в течение 4 дней
Проростки семян погружают в 0,25%-й
водный раствор колхицина на 35 мин
Гибридные зерна замачивают в 0,025—
0,125%-м водном растворе колхицина
на 36 ч
Проростки высотой 3—6 мм погружают
в 0,25%-й водный раствор колхицина
на 20—30 мин
Проростки высотой 3—6 мм погружают
в 0,25%-й водный раствор колхицина
на 20—30 мин
Проростки высотой 3—6 мм погружают
в 0,1%-й водный раствор колхицина на 2 ч
при температуре 21 *С
Проростки высотой 3—5 мм разрезают
бритвой до основания. В разрез встав-
ляют ватные шарики или фильтровальную
бумагу, пропитанные 0,05—0,1 %-м водным
раствором колхицина. Обработанные сеян-
цы содержат при высокой влажности, а за-
тем обрабатывают еще раз. Через день пос-
ле вторичной обработки их промывают и
пересаживают на рассадную грядку
Вымоченные в воде семена, лишенные се-
менной оболочки, проращивают в течение
четырех дней. Полученные проростки пере-
ворачивают корешками вверх и погружают
в 0,5%-й водный раствор колхицина
на 6 ч при температуре 23...26 ’С
Шумный, 1965
Эллиот, 1961
Эллиот, 1961
Wellensiek, 1947
Dorsey, 1939
Dorsey, 1939
Dorsey, 1939
Dorsey, 1939
Luong, 1951
Douwes, 1952
142
Продолжение
Вид растения
Метод обработки
Автор
Сахарная
свекла
На точку роста сеянцев между семядолями
при помощи пипетки наносят каплю 1%-го
водного раствора колхицина. Через 3—4 ч
(в течение 8 дней) наносят по капле 0,1%-й
раствор колхицина, при температуре
16...20 °C и влажности воздуха 70—80 %
Проросшие семена с корешками длиной
до 0,5 см замачивают в 0,1 %-м растворе
колхицина в течение 8 ч при температуре
25 °C
Проростки в фазе семядольных листьев
выдерживают в 0,2%-м растворе колхици-
на в течение 12 ч
Хасанова и др.,
1966
Беляева и др.,
1966
Лен
Нут
Люцерна
Рапс
Арбуз
Яблоня
Редис
Клевер
Сеянцы с корешками длиной 5—8 мм по-
гружают в небольшой слой 0,2—0,3%-го
водного раствора колхицина на 2 ч при тем-
пературе 27 “С или в 0,05%-й раствор
на 24 ч при температуре 16...19°С
Растения выращивают в небольших гор-
шках до высоты 8 см. Затем землю в горшке
хорошо увлажняют, сверху укладывают
смоченную вату и покрывают пергамент-
ной бумагой, которую привязывают к краю
горшка. Затем, перевернув горшок, погру-
жают растение льна в пробирку с 0,1 %-м
водным раствором колхицина на 25 ч
Семена замачивают в 0,25%-м водном
растворе колхицина в течение 30 мин
Растущие побеги погружают в 0,2%-й вод-
ный раствор колхицина на 1,5 ч
При появлении первых листьев на точку
роста при помощи мягкой кисточки нано-
сят каплю 0,5—1,0%-го водного раствора
колхицина. Обработку продолжают в тече-
ние 10 дней
Bremer-Reinders
et al., 1952
Ramanujam
et al., 1932
Evans, 1955
Эллиот, 1961
По одной капле 0,2—0,4%-го водного
раствора колхицина наносят на конус на-
растания молодых проростков в течение
4 дней подряд
На обнаженные верхушечные почки побе-
гов прикладывают капсулы из 0,65%-го
агар-агара, содержащего 1%-й раствор
колхицина, на 24 ч
Раствор 0,2%-го колхицина наносят одно-
кратно на точки роста цветоносных стеб-
лей в районе прикорневой розетки
На цветочные стрелки высотой 4—5 см
4 раза с интервалом 1 сут наносят в вечер-
нее время каплю 0,4%-го раствора колхи-
цина в агар-агаре
Проростки обрабатывают 0,1 %-м раство-
ром колхицина
Kihara, 1951
Hunter et al.,
1950
Тарасевич,
1965
Савоськин и др.,
1965
Навалихина,
1965
143
Продолжение
Автор
Вид растения
Метод обработки
Шелковица Сухие семена помещают в чашки Петри на
фильтровальную бумагу, смоченную
0,02%-м раствором колхицина при темпера-
туре 25...30 °C. Наклюнувшиеся семена
тщательно промывают водой и высаживают
в почву
Горох Сухие семена гороха замачивают в 0,001 —
0,0025%-м растворе колхицина на
2—3 сут
Гаплоиды Корни растений-регенерантов освобож-
ячменя дают от агар-агара и погружают (до уровня
(л = 7) выше точки роста) в раствор, содержащий
0,3 % колхицина и 0,03 % папаина, на 5 ч
при температуре 25 °C. Отмывают колхи-
цин и высаживают растения в грунт
Корни растений-регенерантов освобожда-
ют от агар-агара и промывают водой. Кон-
чики корней обрезают и помещают расте-
ния в раствор колхицина (0,1—0,15%-й
в 4%-м диметилсульфоксиде) на 24 ч. За-
тем корни промывают проточной водой в
течение 4 ч и высаживают растения в грунт
Подрезают корешки растений на 2 см и
помещают в пробирки, содержащие смесь
0,1 %-го колхицина и 2%-го диметилсуль-
фоксида на 5—6 ч при 25 “С на свету. Затем
растения промывают и помещают в воду
на 48—72 ч, после чего их высаживают
в почву
Гаплоиды На поверхность питательной среды при вы-
тритикале ращивании растений в пробирках налива-
(п =21) ют 0,15%-й раствор колхицина в 4%-м ди-
метил сульфоксиде (pH 5,5) так,чтобы все
растение было погружено в раствор. Затем
пробирки помещают в микроаэростат-сосуд,
из которого выкачивают воздух до остаточ-
ного давления 76 мм рт. ст. Через 20 мин
воздух медленно впускают в сосуд. Эту
процедуру повторяют трижды. Затем раст-
вор сливают, растения промывают проточ-
ной водой, освобождают корни от агара и
высаживают растения в почву
Гаплоиды Срезают стерильные колосья на высоте
злаков 3—4 см от основания стебля. На пенек
(ячмень, через пробку плотно насаживают трубку
пшеница, 6 х 0,7 см и наполняют ее раствором колхи-
тритикале), цина (0,1—0,15%-й в 4%-м диметилсуль-
отдаленные фоксиде). Показателями проникновения
гибриды раствора в ткани растения является слабое
злаков увядание и побурение кончиков листьев.
После этого трубку снимают и через не-
сколько дней повторяют эту процедуру.
В период воздействия колхицином жела-
тельно уменьшить полив обрабатываемых
Раушабли,
1966
Дьячук и др.,
1966
Внучкова и др.,
1985
Лукьянюк,
Игнатова,
1980
Liltesoh et al.,
1988
Лукьянюк,
Игнатова,
1980
Bell, 1950
(цит.: по
Лукьянюк и др,
1980)
144
*
Продолжение
Вид растения
Метод обработки
Автор
Гаплоиды
рапса
(и=19)
Отдаленные
гибриды
лука (Allium
сера)
Гибриды Г/
Т, aestivum х
Т. durum
растений, а после окончания обработки
провести их подкормку
Корни растений погружают в 0,05%-й раст-
вор колхицина на 18 ч
Корни растений погружают в 0,1%-й раст-
вор колхицина на 4 ч
В пробирках ткани каллуса, содержащие
меристематические зоны, заливают 0,05%-м
раствором колхицина на 72—96 ч
Абадовская,
1994
Марьяхина и
др., 1986
Гибриды Fi
пшеница х
элимус
Томат
В период кущения растения выкапывают
из почвы, отмывают корни от земли и в
течение четырех дней помещают их
днем в водный 0,05%-й раствор колхици-
на, а на ночь — в воду
В период кущения осторожно делают про-
дольные надрезы стеблей бритвой (для об-
легчения поступления колхицина к точкам
роста) на высоте 0,8 см над их основанием.
В условиях вакуума корни и стебли расте-
ний погружают в 0,2%-й раствор колхи-
цина на 3 ч при температуре 18...20 °C
Сухие семена замачивают в 1%-м растворе
колхицина в течение 24 ч
Шулындин,
1965
Петрова,
1965
Яшин, 2001
8.3. МЕТОДЫ ИДЕНТИФИКАЦИИ ПОЛИПЛОИДНЫХ
РАСТЕНИЙ
Выделение полиплоидных растений возможно как косвенны-
ми, так и прямыми методами. Под косвенными понимают методы
идентификации по изменениям морфологических или цитологи-
ческих признаков, характерных для полиплоидных растений. В
эту группу методов входят анализ морфологических признаков —
увеличенные размеры вегетативных органов, замедленное разви-
тие, а также число хлоропластов в замыкающих клетках устьиц,
увеличенные размеры устьичных клеток, пониженная фертиль-
ность, более крупные размеры, измененная форма и количество
пор у пыльцы. Прямым методом является подсчет числа хромосом
в митозе или в мейозе.
Окрашивание хлоропластов в замыкающих клетках устьиц. Дан-
ный метод позволяет определить число хлоропластов в замыкаю-
щих клетках устьиц, параллельно определяют и размеры устьич-
ных клеток. Для сравнительного анализа диплоидных и тетрапло-
идных (или обработанных колхицином) растений используют вы-
сечки листьев диаметром до 1 см, которые отбирают с нескольких
листьев одного растения. Анализ проводят отдельно по каждому
растению. Обработанные растения часто являются химерами —
10 В. А. Пухальскнн и др.
145
т. е. растениями, у которых встречаются ткани разного уровня
плоидности. Для более точной характеристики требуется отбор
минимум трех высечек с разных листьев. Высечки фиксируют в
ледяной уксусной кислоте, промывают спиртом и окрашивают ра-
створом йода в йодиде калия.
Для повышения контрастности препараты дифференцируют
раствором 45%-й уксусной кислоты, добавляя ее с одной стороны
покровного стекла и удаляя краситель с противоположной при
помощи фильтровальной бумаги.
Анализ числа хромосом и фертильности пыльцы у таких расте-
ний проводят по стандартным методикам.
Приготовление йодного красителя. Краси-
тель готовят растворением измельченных в ступке 5 г металличес-
кого йода и 10 г йодида калия в 100 мл воды.
Г л а в a 9
ХРОМОСОМНЫЕ ПЕРЕСТРОЙКИ И МЕТОДЫ
ИХ УЧЕТА
9.1. ТИПЫ ПЕРЕСТРОЕК
Хромосомной перестройкой или аберрацией называют изменение
структуры хромосомы, происходящее спонтанно или под влияни-
ем излучений, химических веществ и т. д. Как правило, хромосом-
ные перестройки хорошо различимы под световым микроскопом,
но в некоторых случаях они захватывают очень маленький участок
хромосомы и неотличимы в опытах от генных мутаций. Нас в пер-
вую очередь интересуют хромосомные перестройки, видимые под
микроскопом и поддающиеся строгому учету.
Облучая растительные клетки у-лучами и исследуя хромосом-
ные аберрации, следует иметь в виду, что сразу же после облуче-
ния начинается репарация — процесс восстановления поврежден-
ных хромосом. Поэтому непосредственно после обработки, как
правило, можно обнаружить в хромосомах больше нарушений,
чем через некоторое время после него.
Существуют вещества, задерживающие процессы восстановле-
ния поврежденных хромосом (оксид углерода, динитрофенол,
кислород), а также способствующие их восстановлению (азот).
Низкие температуры и анаэробные условия задерживают процесс
восстановления.
Радиация, воздействуя на хромосомы в конце интерфазы, мо-
жет повреждать их на этом этапе, когда они еще не образовали
хроматид и представлены одной нитью, либо уже образовали две
хроматиды, связанные одной центромерой. Отсюда и возникают
разные формы перестроек (рис. 9.1, 9.2). В зависимости от состоя-
ния хромосомы различают следующие типы перестроек: хромосом-
ные, когда обе сестринские хроматиды участвуют в хромосомной
перестройке в идентичных местах, и хроматидные, когда в аберра-
цию вовлечена только одна из сестринских хроматид.
Хроматидные аберрации сходны с хромосомными, но для них
характерно большее разнообразие. Аберрации, происходящие в
пределах одной хромосомы, называются внутрихромосомными,
тогда как межхромосомные аберрации связаны с обменом участка-
ми между разными хромосомами. В ряде случаев радиация по-
вреждает веретено деления в клетке, что приводит к появлению
полиплоидов.
10* 147
Симметричные Асимметричные
обмены обмены
Хромо-
сомный
разрыв
Пери-
центри-
ческая
Пара-
центри-
ческая
Пара-
центри-
ческая
деления
Симмет-
ричная
транс-
локация
Асим-
метрич-
ная транс-
локация
Y-------
Пери-
центри-
ческая
деления
VII
IV
III
Рис. 9.1. Структурные изменения под действием облучения в хромосомах (Робертас,
Новинский, Сазе, 1962)
ААЛА
W
Основные типы внутрихромосомных перестроек:
деления (нехватка) — потеря участка хромосомы; делеции
могут быть хромосомные и хроматидные; концевые (теряется те-
ломера) и интерстициальные (выпадает участок, находящийся
между центромерой и теломерой);
148
Рис. 9.2. Структурные изменения под действием облучения в хроматидах (Робертис,
Новинский, Сазе, 1962)
инверсия — поворот участка хромосомы на 180’;’ в результате
чего меняется порядок расположения генов, но с полным сохране-
нием всех генов; в зависимости от присутствия в перестройке цен-
тромеры различают перицентрические (переворачивается участок
с центромерой) и парацентрические (центромера в перестройке не
участвует);
дупликация — удвоение участка хромосомы.
Межхромосомная перестройка:
транслокация — перемещение участка одной хромосомы в
негомологичную хромосому; они могут быть и хроматидными (об-
149
мен участками хроматид негомологичных хромосом); различают
симметричные (обмен ацентрическими участками) и асимметри-
ческие (обмен центромерными участками) транслокации.
При разном числе хромосом и разном числе повреждений как
на хромосомном, так и на хроматидном уровнях возможно образо-
вание лишь небольшого числа принципиально различающихся
перестроек:
а) дицентрическая хромосома или хроматида;
б) хромосома или хроматида с измененной длиной одного или
обоих плеч;
в) центромерное хромосомное или хроматидное кольцо, содер-
жащее одну или несколько центромер;
г) ацентромерное кольцо — хромосомное или хроматидное.
Образование большинства перестроек сопровождается, как
правило, появлением фрагментов.
Как видно из данных, приведенных на рисунках 9.1 и 9.2, каж-
дая перестройка в различные фазы митоза выглядит по-разному.
Хромосомные аберрации чаще всего исследуют в корешках ра-
стений. Существуют два метода анализа хромосомных аберраций:
анафазный и метафазный.
9.1.1. ПРИМЕРЫ ХРОМОСОМНЫХ ПЕРЕСТРОЕК
И МЕХАНИЗМЫ ИХ ВОЗНИКНОВЕНИЯ
Наиболее простой и распространенный вариант возникнове-
ния хромосомных перестроек — разрыв хромосомы на две части.
В редких случаях этот разрыв может приходиться на центромеру, в
результате чего образуются телоцентрики. Эти организмы могут
нормально размножаться и широко применяются в селекционно-
генетических экспериментах по картированию генов, как это
было показано на пшенице, ржи, кукурузе. В большинстве случаев
такие разрывы приводят к формированию двух фрагментов, один
из которых имеет центромеру, а другой лишен ее, или ацентричен.
В последнем случае фрагмент не может принимать участия в деле-
нии клетки, в результате чего он постепенно элиминируется. В
случае другого фрагмента происходит восстановление конца, на
котором произошел разрыв, и получается новая хромосома, кото-
рая является укороченной по сравнению с исходной, т. е. содер-
жит нехватку, или делецию. Примеры делений представлены на
рисунках 9.3 и 9.4.
На рисунке 9.4 приведены два варианта пахитенных хромосом
ржи, в верхнем варианте отсутствует часть хромосомы, указанная
стрелкой внизу. Механизм возникновения делеции, а также вари-
ант конъюгации между делегированной и нормальной хромосома-
ми представлены на рисунке 9.5. Ацентрическое кольцо (J — с)
элилинирует.
150
Рис. 9.3. Хромосомы кукурузы на стадии па-
хитены. Одна из хромосом содержит деле-
нию в концевом участке (Мюнтцинг. Ге-
нетика. — М.: Мир, 1967. — С. 180)
ц
f Ц
Рис 9 4. Пример делении у ржи. Верхняя хромосома является результатом разрыва
нижней в месте, указанном стрелкой (там же):
Ц — центромера
Рис. 9.5. Механизм возникновения делении и конъюгация между нормальной
хромосомой и хромосомой с делецией (там же)
Рис. 9.6. Конъюгация двух политенных
хромосом из клеток слюнной железы
дрозофилы, одна из которых несет де-
лению. Стрелкой указано место лока-
лизации делении (там же, с. 181)
Рис. 9.7. Конъюгация хромо-
сом в пахитене мейоза у расте-
ния кукурузы, гетерозиготного
по инверсии (там же, с. 182)
Рис. 9.8. Конъюгация хромосом в
пахитене мейоза у растения куку-
рузы, гетерозиготного по одной
транслокации (там же, с. 185)
Рис. 9.9. Конъюгация хромосом
в метафазе I мейоза у растения
ржи, гетерозиготного по одной
транслокации (там же, с. 188)
Пример образования колец между
конъюгирующими гомологами, отли-
чающимися по наличию делеции,
представлен на рисунке 9.6. В клетках
слюнных желез дрозофилы происхо-
дит конъюгация хромосом, и по
структуре дисков политенных хромо-
сом можно четко установить наличие
таковой делеции и осуществить ее ло-
кализацию.
Подобным образом можно иденти-
фицировать другие хромосомные перестройки. Далее приведены
картины поведения мейотических хромосом у растений, гетерози-
готных по инверсии (рис. 9.7) и по транслокации (рис. 9.8 и 9.9).
9.2. АНАФАЗНЫЙ МЕТОД ПОДСЧЕТА
ХРОМОСОМНЫХ АБЕРРАЦИЙ
Наиболее распространен анафазный метод подсчета хромосом-
ных аберраций. В этом случае аберрации изучают в клетках кон-
чиков корешков растений. Для этого проращивают облученные и
необлученные семена (контроль) в чашках Петри на фильтроваль-
ной бумаге и готовят временные цитологические препараты по
одной из описанных ранее методик (см. гл. 5 и разд. 9.3.1). Каж-
дый приготовленный препарат исследуют, отмечая встречающие-
ся нормальные анафазы и телофазы и с перестройками. Нормаль-
ные анафазы и телофазы просто подсчитывают, а анафазы и тело-
фазы с перестройками схематично зарисовывают для того, чтобы
знать характер аберраций. В дальнейшем вычисляют процент кле-
152
ток в анафазе и телофазе с хромосомными аберрациями от общего
числа клеток в этих же фазах и сравнивают с контролем.
Анафазный метод прежде всего применяют для анализа видов
растений с большим числом хромосом и (или) с плохо изученной
морфологией.
Для подсчета хромосомных аберраций в каждом варианте ис-
пользуют не менее 10 корешков, общее же число подсчитанных
анафаз и телофаз должно быть не менее 300.
9.3. МЕТАФАЗНЫЙ МЕТОД ПОДСЧЕТА
ХРОМОСОМНЫХ АБЕРРАЦИЙ
Этот метод заключается в описании и подсчете структурных
изменений в хромосомах на стадии метафазы. Метафазный метод
можно применять при подсчете хромосомных аберраций только у
тех растений, морфология каждой отдельной хромосомы которых
детально описана. Этот метод рассчитан на более квалифициро-
ванного исследователя, чем анафазный.
Для метафазного анализа используют обработанные семена
или проростки. Обработка мутагенами сухих семян более пред-
почтительна, поскольку все ядра находятся в одной стадии деле-
ния, т. е. синхронизированы. Этот вариант более удобен для ана-
лиза хромосомных перестроек. Для изучения хроматидных пере-
строек используют проростки, у которых клетки находятся в раз-
ных стадиях деления, и можно вызвать и хромосомные, и
хроматидные перестройки.
Число корешков, которые берутся для исследований, такое же,
как и при анафазном методе. Ниже приведена методика приготов-
ления препаратов метафазных хромосом у пшеницы.
9.3.1. ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ ДЛЯ ИЗУЧЕНИЯ
МЕТАФАЗНЫХ ПЛАСТИНОК (НА ПРИМЕРЕ
ПРОРОСТКОВ ПШЕНИЦЫ)
Препараты готовят следующим образом.
1. Помещают корешки в насыщенный раствор а-бромнафта-
лина на 4—6 ч при температуре 20 °C. Время экспозиции кореш-
ков в растворе а-бромнафталина и его концентрация могут варьи-
ровать для разных культур. Так, корешки ячменя выдерживают в
насыщенном растворе а-бромнафталина 3 ч. Для корешков гороха
раствор а-бромнафталина разбавляют дистиллированной водой в
соотношении 1 : 1, а корешки выдерживают 2 ч. Для табака, у ко-
торого очень мелкие хромосомы, раствор а-бромнафталина раз-
бавляют водой в соотношении 1: 2, и время экпозиции составляет
3 ч. Затем корешки табака помещают в воду на 1 ч. Для корешков
153
томатов готовят такой же раствор ci-бромнафталина, как для таба-
ка, но корешки в нем выдерживают 2 ч и промывают водой 1 ч.
2. Переносят корешки в дистиллированную воду на 10 мин.
3. Помещают корешки в уксусный алкоголь (3 :1) на 10 мин.
4. Переносят корешки в дистиллированную воду на 10 мин.
5. Проводят гидролиз корешков в 1 н. НС1 при 60 °C в течение
7 мин.
6. Окрашивают корешки фуксином в течение 1 ч.
7. Переносят корешки в 5%-й раствор пектиназы на 20
25 мин при температуре 40 ’С. В случае отсутствия пектиназы уве-
личивают время гидролиза при 60 °C до 12 мин.
8. Помещают корешок на предметное стекло. Отрезают темно-
окрашенный кончик и раздавливают пинцетом, капнув на него
предварительно каплю 50%-й уксусной кислоты. Накрывают по-
кровным стеклом и исследуют препарат под микроскопом.
Приготовление фуксина. В двухлитровую колбу наливают
1800 мл дистиллированной воды и ставят ее на горелку. Когда вода
начнет закипать, понемногу всыпают в нее 18 г фуксина. Поме-
шивают. После полного растворения фуксина колбу снимают с
огня. Когда температура воды в колбе достигнет 70 °C, всыпают,
помешивая, 18 г метабисульфита натрия (Na2S2O5), образуется
осадок. Когда температура в колбе понизится до 45...50 °C, ра-
створ фильтруют в бутыль темного стекла и вливают в него
180 мл 1 н. НС1. После этого бутыль герметично закрывают и по-
мещают в холодильник на 24 ч для обесцвечивания раствора. Че-
рез 24 ч раствор готов к употреблению. Раствор фуксина хранят в
холодильнике.
Глава 10
ФЕРТИЛЬНОСТЬ И ЖИЗНЕСПОСОБНОСТЬ
ПЫЛЬЦЫ
В результате микрогаметогенеза из микроспор формируются
пыльцевые зерна. Нормальное зрелое пыльцевое зерно — это мно-
гоклеточная структура, образующаяся в результате одного или
двух митотических делений в микроспоре. Пыльцевые зерна могут
быть двух- и трехклеточными. Среди представителей класса дву-
дольных у растений 195 семейств пыльцевые зерна двухклеточные,
а 98 — трехклеточные. Среди однодольных в 41 семействе встреча-
ются двухклеточные пыльцевые зерна и в 28 — трехклеточные.
Различают понятия фертильности пыльцы и ее жизнеспособ-
ности.
10.1. ФЕРТИЛЬНОСТЬ ПЫЛЬЦЫ И МЕТОДЫ ЕЕ ОЦЕНКИ
*
Фертильность пыльцы — это способность производить оплодо-
творение. Определяется несколькими методами по степени сфор-
мированное™ (зрелости) пыльцевого зерна. Некоторые из них
приведены далее.
10.1.1. АЦЕТОКАРМИНОВЫЙ МЕТОД
Наиболее распространенный метод. Зафиксированный в уксус-
ном алкоголе материал окрашивают в 1—3%-м растворе ацетокар-
мина. Для этого пыльники выдерживают в ацетокармине при ком-
натной температуре от нескольких минут до нескольких часов в
зависимости от культуры. Пыльца злаков, как правило, окрашива-
ется лучше и быстрее. В случае с томатами пыльники подвергают
нагреванию в тигле в течение 15 мин. Фертильные пыльцевые зер-
на злаков имеют яркоокрашенные спермин, ядро и зернистую ци-
топлазму. В отличие от них стерильные пыльцевые зерна практи-
чески не окрашиваются или их окраска неравномерна, спермиев
нет. У томата фертильная пыльца имеет яркую окраску, при ин-
тенсивном нагревании в фертильной пыльце четко различимы два
ядра. Стерильная пыльца томата по внешнему виду сходна с пыль-
цой злаков.
У отдаленных гибридов растений пыльца может быть несколь-
ких типов: нормальной — с одним вегетативным ядром и двумя эл-
155
липтическими ядрами спермиев; почти нормальной — с одним ве-
гетативным ядром и двумя округлыми ядрами спермиев; двухъ-
ядерной; одноядерной; стерильной (без ядер). Из этих пяти типов
фертильна лишь пыльца первого типа.
Подготовка препаратов пыльников для анализа фертильности
пыльцы аналогична используемой для изучения мейоза.
10.1.2. ЙОДНЫЙ МЕТОД
Для некоторых культур, имеющих толстую экзину, вследствие
чего ацетокармин с трудом проникает в пыльцевое зерно и плохо
его окрашивает, используют йодный метод окрашивания. Он ос-
нован на йодной реакции определения крахмала. Фертильные
пыльцевые зерна в отличие от стерильных содержат значительно
больше крахмала, что четко выявляется на цитологических препа-
ратах. Фертильные пыльцевые зерна окрашиваются в темно-фио-
летовый (почти черный) цвет, в то время как стерильные остаются
практически неокрашенными. Препараты готовят следующим
образом: пыльники вскрывают препаровальными иглами на пред-
метном стекле, капают каплю йодного раствора и, удалив лишние
ткани, накрывают препарат покровным стеклом.
Приготовление йодного раствора. При нагревании растворяют
2 г йодида калия в 5 мл дистиллированной воды. Затем в раствор
добавляют 1 г металлического йода, доводят объем раствора до
300 мл и хранят в склянке из оранжевого стекла.
10.2. ЖИЗНЕСПОСОБНОСТЬ ПЫЛЬЦЫ
И МЕТОДЫ ЕЕ ОЦЕНКИ
Под жизнеспособностью пыльцы понимают ее способность
прорастать на рыльце пестика при наличии всех необходимых
благоприятных условий. Жизнеспособная (т. е. живая) пыльца
физиологически очень активна. Это используется в практике для
определения процента жизнеспособной пыльцы.
Разработано много методов определения жизнеспособности
пыльцы, но ни один из них не является универсальным, т. е. при-
годным для всех видов растений.
10.2.1. МЕТОД ПРОРАЩИВАНИЯ ПЫЛЬЦЫ
ВО ВЛАЖНОЙ КАМЕРЕ ВАН-ТИГЕМА
Камера Ван-Тигема состоит из стеклянного цилиндрического
кольца (диаметр его 12—15 мм, высота 6—8 мм, толщина стенки
1,5—2 мм, оба основания — верхнее и нижнее — шлифованные),
которое прикреплено вазелином или парафином к предметному
стеклу, а сверху накрыто покровным стеклом (рис. 10.1). Внутри
156
Рис. 10.1. Камера Ван-Тигема для проращивания пыльцы
кольца помещают каплю воды. На нижнюю поверхность покров-
ного стекла наносят каплю искусственной среды для проращива-
ния пыльцы. Покровное стекло прикрепляют к кольцу вазелином.
При отсутствии стеклянных колец можно пользоваться кольца-
ми, нарезанными из бумажной многослойной трубки, слои кото-
рой пропитаны парафином или канадским бальзамом.
В качестве среды для проращивания пыльцы обычно служит
1%-й раствор агар-агара на дистиллированной воде с добавлением
химически чистой сахарозы. Количество сахарозы может состав-
лять от 5 до 40 % в зависимости от вида растений (например, для
пыльцы кукурузы необходим 10—15%-й раствор, для пыльцы
ржи — 30—40%-й раствор и т. д.). Раствор помещают в небольшую
коническую колбу, вставляют в нее стеклянную палочку, затыка-
ют отверстие колбы ватой и стерилизуют нагреванием на кипящей
водяной бане.
Для проращивания пыльцы поступают следующим образом. На
чистое покровное стекло наносят каплю теплого стерильного ра-
створа агар-агара с сахарозой. Температура капли искусственной
среды имеет большое значение. Она должна быть примерно равна
температуре внутри цветка, которая бывает на 2...5 °C выше тем-
пературы окружающего воздуха в период массового цветения рас-
тений в естественных условиях. На каплю высевают исследуемую
пыльцу и, перевернув покровное стекло, накрывают им кольцо
камеры Ван-Тигема. Пыльцу высевают не менее чем в пяти каме-
рах. Для ускорения прорастания пыльцы камеры ставят в термо-
стат с температурой 20...30 °C. Через 1—4 ч (время зависит от вида
растений) камеры поочередно помещают на столик микроскопа,
рассматривают пыльцу и подсчитывают число проросших и не-
проросших пыльцевых зерен. Процент проросших пыльцевых зе-
рен определяют не менее чем для 5—10 полей зрения микроскопа.
Метод влажной камеры Ван-Тигема дает заниженные результаты
и непригоден для видов растений, пыльца которых плохо прорас-
тает на искусственных средах.
10.2.2. МЕТОД Д. А. ТРАНКОВСКОГО
На чистые предметные стекла наливают тонкий слой теплого
I—2%-го раствора агар-агара или желатина с добавлением от 5 до
40 % сахарозы или глюкозы. Производят посев исследуемой пыль-
157
цы, затем предметные стекла помещают во влажную камеру. В ка-
честве влажной камеры используют чашки Петри, на дно и крыш-
ки которых положены смоченные водой кружки фильтровальной
бумаги.
Предметные стекла можно положить в чашки на кусочки стек-
лянной палочки. Для ускорения прорастания пыльцы чашки Пет-
ри ставят в термостат. После появления пыльцевых трубок препа-
раты можно накрыть покровными стеклами и рассматривать под
микроскопом. Но, как правило, этого не делают, а изготавливают
постоянные препараты. Предметные стекла с проросшей пыльцой
помещают на 5—30 мин в фиксирующую жидкость Навашина, в
которую добавляют сахарозу, чтобы не лопнули пыльцевые труб-
ки. Затем фиксатор заменяют на свежий, но уже без добавления
сахарозы и выдерживают в нем пыльцу 1—1,5 ч. Промывают водой
в течение 1 ч и окрашивают гематоксилином по Гейденгайну или
генциановым фиолетовым. Окрашенные препараты обезвоживают
и заключают в канадский бальзам общепринятым способом. На
готовых препаратах можно изучать проросшие пыльцевые зерна и
подсчитывать их.
Метод Д. А. Транковского дает заниженный процент жизне-
способности исследуемой пыльцы и пригоден, как и метод Ван-
Тигема, только для пыльцы, легко прорастающей на искусствен-
ных средах. ’
10.2.3. МЕТОД В. С. ШАРДАКОВА
Метод основан на том, что жизнеспособная пыльца содержит в
большом количестве фермент пероксидазу и поэтому легко дает
окрашенное соединение при действии реактивов, содержащих
бензидин. Нежизнеспособная пыльца не содержит, по мнению ав-
тора, пероксидазы и поэтому не окрашивается.
Метод В. С. Шардакова непригоден для долго хранившейся
пыльцы, для которой дает сильно завышенные результаты. Для
свежесобранной пыльцы метод В. С. Шардакова дает более или
менее удовлетворительные результаты.
Приготовление реактива. В отдельных склянках из оранжевого
стекла готовят четыре раствора: \
I — 0,20 г бензидина основного в 100 мл 50%-го этилового
спирта;
II — 0,15 г альфа-нафтола в 100 мл 50%-го этилового спирта;
III — 0,25 г натрия углекислого в 100 мл дистиллированной
воды;
IV — 0,3%-й раствор пероксида водорода.
Перед употреблением растворы I, II и III смешивают в неболь-
ших равных объемах. Смесь растворов 1 + II + III и раствор IV
держат в отдельных капельницах с пипетками.
Исследуемую пыльцу помещают на предметное стекло и пи-
петкой добавляют каплю смеси растворов I + II + III и каплю
158
пероксида водорода. Перемешивают стеклянной палочкой и на-
крывают покровным стеклом. Через 2—3 мин проводят анализ
препарата. Если многочисленные пузырьки выделившегося кис-
лорода будут мешать его изучению, то их удаляют, приподняв по-
кровное стекло. Живая пыльца окрасится в ярко — розовый или
темно-красный цвет благодаря наличию пероксидазы, а мертвая
останется бесцветной или желтоватой. Для получения надежных
результатов рекомендуется сделать подсчеты в 5—10 полях зрения
микроскопа с 50—60 пыльцевыми зернами в каждом поле зрения.
Препарат можно сохранить, заключив его в глицерин-желатин.
10.2.4. МЕТОД ПРИЖИЗНЕННЫХ КРАСИТЕЛЕЙ
(ПО В. Н. ЮРЦЕВУ)
Метод основан на наличии активной избирательной поглоти-
тельной способности у протоплазмы живых клеток пыльцы и от-
сутствии такой способности у протоплазмы нежизнеспособной
пыльцы. Живая протоплазма почти не поглощает «прижизненный
краситель» и не окрашивается, а нежизнеспособная интенсивно
окрашивается. Метод дает вполне надежные результаты при опре-
делении жизнеспособности пыльцы пшеницы, овса и ржи, пыль-
ца которых почти не прорастает на искусственных средах.
Приготавливают два раствора:
раствор химически чистого эритрозина на дистиллирован-
ной воде 1: 5000 (краситель не должен содержать токсичные при-
меси!);
фосфатный буферный раствор Серенсена с pH 7,17 или 7,38.
Приготовление фосфатного буфера Серенсена. Для приготовле-
ния фосфатного буферного раствора с pH 7,17 к 7 мл 1/15 М ра-
створа Na2HPO4- 2Н2О добавляют 3 мл 1/15 М раствора КН2РО4.
В случае приготовления раствора с pH 7,38 берут соответственно 8 и
2 мл исходных растворов.
На предметное стекло наносят каплю свежего буферного ра-
створа и насыпают немного исследуемой пыльцы. Перемешивают
стеклянной палочкой, добавляют каплю свежеприготовленного
раствора эритрозина и снова перемешивают. Через 2—5 мин на-
крывают покровным стеклом и еще через 5 мин (но не позднее
чем через 15—20 мин) подсчитывают число окрашенных и неокра-
шенных пыльцевых зерен не менее чем в 3—5 полях зрения мик-
роскопа. Подсчитывают средний процент неокрашенных пыльце-
вых зерен от общего их числа и принимают его за процент жизне-
способности пыльцы.
Вместо эритрозина может быть использован краситель метиле-
новый синий в той же концентрации (1 : 5000). Жизнеспособная
пыльца содержит фермент дегидрогеназу, который обесцвечивает
проникший метиленовый синий, что усиливает эффективность
метода прижизненных красителей.
159
Метод получил ограниченное применение из-за практической
трудности приобретения красителей, не содержащих токсичных
примесей.
10.2.5. МЕТОД П.И. ДИАКОНУ ДЛЯ ОПРЕДЕЛЕНИЯ
ЖИЗНЕСПОСОБНОСТИ ПЫЛЬЦЫ ПО СТЕПЕНИ АКТИВНОСТИ
СУКЦИНАТДЕГИДРОГЕНАЗЫ
Дыхание клеток тесно связано с жизненными процессами и
осуществляется при участии ферментов дегидрогеназ. Прекраще-
ние процессов дыхания свидетельствует о гибели клетки.
Из числа дыхательных ферментов (дегидрогеназ) можно легко оп-
ределить изменение активности сукцинатдегидрогеназы три помо-
щи бесцветного раствора хлорида трифенилтетразолия (2,3,5-три-
фенилтетразолия хлористого, или сокращенно ТТХ). При наличия
активной сукцинатдегидрогеназы хлорид трифенилтетразолия
восстанавливается в формазан, окрашенный в красный цвет. В
случае прекращения жизненных процессов формазан не образует-
ся и клетки не окрашиваются.
Работу проводят в такой последовательности:
1) готовят 0,5 или 1%-й раствор хлорида трифенилтетразолия в
1/15 М фосфатном буфере Серенсена с pH 7,17 (приготовление
буферного раствора описано в методе прижизненных красителей);
2) наносят пыльцу на предметное стекло и капают на нее 1—
2 капли раствора хлорида трифенилтетразолия;
3) накрывают покровным стеклом и ставят в термостат на 20—
30 мин при температуре 37 °C;
4) просматривают под микроскопом не менее 3—5 препаратов
по 5 полей зрения в каждом и подсчитывают процент окрашенных
пыльцевых зерен от общего числа пыльцевых зерен в поле зрения
микроскопа.
Красное окрашивание пыльцевых зерен указывает на их жиз-
неспособность. Мертвые пыльцевые зерна не окрашиваются и ос-
таются желтыми.
Метод П.И. Диакону считают наилучшим из всех перечислен-
ных.
10.2.6. ФЛУОРЕСЦЕНТНАЯ МИКРОСКОПИЯ ПРОРАСТАЮЩИХ
ПЫЛЬЦЕВЫХ ЗЕРЕН В ПЕСТИКЕ
Наличие каллозы в зрелом пыльцевом зерне позволяет обнару-
живать ее анализом в люминесцентном микроскопе с помощью
окрашивания анилиновым голубым. Данный метод является эф-
фективным при изучении биологии прорастания пыльцевых зе-
рен, а также при анализе несовместимости.
Для исследования берут опыленные цветки, время прорастания
пыльцевых зерен зависит от многих факторов: вида растения,
160
опылителя и качества пыльцы, условии окружающей среды и др.
Материал фиксируют уксусным алкоголем. В случае длительного
хранения зафиксированные цветки промывают в трех сменах
70%-го спирта и хранят в холодильнике. Материал может хра-
ниться и в уксусном алкоголе в течение нескольких недель.
Перед приготовлением препаратов необходимо провести маце-
рацию пестиков. Для этого их помещают в 20%-й спиртовой ра-
створ КОН и выдерживают в течение 20—60 мин. После мацера-
ции пестики промывают дистиллированной водой и заливают ра-
створом анилинового голубого на 30—35 мин. Окрашенные пести-
ки переносят на предметное стекло в каплю смеси глицерина с
водой (1 : 1), накрывают покровным стеклом и слегка раздавлива-
ют. Раствор красителя можно использовать многократно. Препа-
раты сохраняют окраску в течение продолжительного времени.
Приготовление анилинового голубого. Готовят 0,01 %-й раствор
водорастворимого анилинового голубого. К 100 мл этого раствора
добавляют 3,8 г К^НРОд- ЗН2О. Полученный раствор подщелачи-
вают 1 М КОН или NaOH до зеленого цвета.
11 В. А. Пухальский и др.
Глава 11
ТЕМЫ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
11.1. ТЕМЫ ПРАКТИЧЕСКИХ ЗАНЯТИЙ
ПО КУРСУ «ЦИТОЛОГИЯ»
Тема 11.1.1. ПРАВИЛА РАБОТЫ С БИОЛОГИЧЕСКИМИ
МИКРОСКОПАМИ. УСТРОЙСТВО МИКРОСКОПА. ИЗМЕРЕНИЕ
МИКРООБЪЕКТОВ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; наборы объективов различного назначения
(сухие, иммерсионные; планахроматы, ахроматы, апохроматы);
наборы окуляров различного увеличения; различные типы оку-
лярных насадок (монокулярная, бинокулярная, вертикальная);
разные типы предметных столиков; окуляр-микрометр; объект-
микрометр; винтовой окуляр-микрометр.
Материалы: наборы постоянных препаратов для настрой-
ки освещения; наборы постоянных препаратов пыльцы разных ра-
стений для измерения объектов; иммерсионные жидкости (масло,
вода, глицерин).
Разделы практикума, рекомендуемые для
проведения занятия:
1.1-1.5; 1.11.
Тема 11.1.2. МЕТОДЫ ИССЛЕДОВАНИЙ РАСТИТЕЛЬНОЙ КЛЕТКИ:
ТЕМНОГО ПОЛЯ, ФАЗОВОГО КОНТРАСТА, ФЛУОРЕСЦЕНТНОЙ
МИКРОСКОПИИ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров, конденсор для исследований в темном поле
(ОИ-13, ОИ-10, специальный кружок для конденсора из темной
бумаги); фазово-контрастное устройство ФК.У-4; люминесцент-
ный (флуоресцентный) микроскоп.
Материалы: предметные стекла; покровные стекла; препа-
ровальные иглы; пинцеты; скальпели; вода; иммерсионное масло;
растительный материал (кожица лука, листья элодеи); препараты
пестиков петунии или другого растения с прорастающей пыльцой,
окрашенные анилином голубым.
Разделы практикума, рекомендуемые для
проведения занятия:
1.6-1.9.
162
Тема 11.1.3. ФИКСИРОВАНИЕ ИЗОБРАЖЕНИЯ: РИСОВАНИЕ,
МИКРОФОТОГРАФИЯ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; микрофотонасадка, цифровая фотокамера;
рисовальный аппарат; подставка для рисования.
Материалы: постоянные препараты пыльцы, гистологи-
ческих срезов, карандаш. Для микрофотографии: микрофотоплен-
ка (Микрат 200, Микрат 300, Микрат 500); реактивы для приготов-
ления проявителя ФЕН-2: сульфит натрия безводный?4а28Оз, гид-
рохинон, бура (кристаллическая), борная кислота, фенидон, бен-
зотриазол, вода; реактивы для приготовления проявителя УП-2 (для
фотопленок): метол, гидрохинон, сульфит натрия безводный, сода
безводная, бромистым калий, вода; реактивы для приготовления
проявителя для фотобумаги (№ 1 для фотопленок и фотобумаги):
метол, гидрохинон, сульфит натрия безводный, натрий углекис-
лый, калий бромистый, вода; реактивы для приготовления фикса-
жа для фотопленок и фотобумаги: гипосульфит натрия, сульфит
натрия, ледяная уксусная кислота, вода, реактивы для приготовле-
ния фиксажа: тиосульфат натрия (Na2S2O3 • 5Н2О), сульфит на-
трия безводный, хлористый аммоний, ледяная уксусная кислота,
вода.
Разделы практикума, рекомендуемые для
проведения занятия:
1.12.1-1.12.3.
Примечание. Проведение этого занятия можно совместить с
приготовлением временных препаратов.
Тема 11.1.4. МИТОТИЧЕСКИЙ ЦИКЛ И ФАЗЫ МИТОЗА
У РАСТИТЕЛЬНЫХ ОРГАНИЗМОВ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; иммерсионные объективы.
Материалы: постоянные демонстрационные препараты
кончиков корешков лука, ржи, пшеницы, томатов; иммерсионная
жидкость (вода, иммерсионное масло).
Разделы практикума, рекомендуемые для
проведения занятия:
2.1-2.4.
163
Тема 11.1.5. ПРИГОТОВЛЕНИЕ ВРЕМЕННЫХ ДАВЛЕНЫХ
ПРЕПАРАТОВ. ОПРЕДЕЛЕНИЕ МИТОТИЧЕСКОГО ИНДЕКСА
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; спиртовая или газовая горелка; нагреватель-
ный столик.
Материалы: фиксированный материал корешков лука,
ржи, пшеницы, томатов; I—3%-й раствор ацетокармина; 45%-я
уксусная кислота; насыщенный раствор железоаммонийных квас-
цов; предметные стекла; покровные стекла; препаровальные иглы;
пинцеты; скальпели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
2.1-2.4; 5.1.1.
Примечание. При использовании корешков злаков для приго-
товления препаратов необходим их гидролиз (см. раздел 5.6).
Тема 11.1.6. ПРИГОТОВЛЕНИЕ ВРЕМЕННЫХ ПРЕПАРАТОВ
И ПРЕПАРАТОВ ПОЛИТЕННЫХ ХРОМОСОМ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; спиртовая или газовая горелка; нагреватель-
ный столик.
Материалы: личинки комара Chironomus; 1—3%-й раствор
ацетокармина; предметные стекла; покровные стекла; препаро-
вальные иглы; пинцеты; скальпели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
2.1-2.4.
Тема 11.1.7. ПЕРЕВОД ВРЕМЕННЫХ ПРЕПАРАТОВ
В ПОСТОЯННЫЕ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; спиртовая или газовая горелка; нагреватель-
ный столик; термос; сосуд Дюара.
Материалы: фиксированный материал корешков лука,
ржи, пшеницы, томатов; 1—3%-й раствор ацетокармина; 45%-я
уксусная кислота;, насыщенный раствор железоаммонийных квас-
164
цов; батарея спиртов с повышающейся концентрацией; раствор
канадского бальзама; предметные стекла; покровные стекла; пре-
паровальные иглы; пинцеты; скальпели; фильтровальная бумага;
жидкий азот, сухой лед.
Разделы практикума, рекомендуемые для
проведения занятия:
2.4—2.6; 5.1.1; 5.2.1.
Тема 11.1.8. ПРИГОТОВЛЕНИЕ ПОСТОЯННЫХ ПРЕПАРАТОВ
МЕТОДОМ «РАСПЛАСТЫВАНИЯ КЛЕТОК»
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели в случае, когда микроскоп не имеет встроенного осветителя);
наборы светофильтров; водяная баня.
Материалы: фиксированный материал корешков лука,
ржи, пшеницы, томатов; раствор ферментов; 60%-я уксусная кис-
лота; свежий раствор уксусного алкоголя; пипетки Пастера; спирт
этиловый 95%-й; фосфатный буфер Серенсена pH 6,9—7,0; краси-
тель Гимза; предметные стекла; покровные стекла; препароваль-
ные иглы; пинцеты; скальпели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
5.2.2; 5.3.
Тема 11.1.9. ДИФФЕРЕНЦИАЛЬНОЕ ОКРАШИВАНИЕ
ХРОМОСОМ РАСТЕНИЙ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; иммерсионные объективы.
Матери ал ы: постоянные демонстрационные препараты
дифференциально окрашенных хромосом пшеницы, ржи, трити-
кале; иммерсионные жидкости; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
6.1-6.3.
Тема 11.1.10. МЕЙОЗ, МИКРОСПОРОГЕНЕЗ, МИКРОГАМЕТОГЕНЕЗ.
ПРИГОТОВЛЕНИЕ ПРЕПАРАТОВ МЕЙОТИЧЕСКИХ ХРОМОСОМ
Оборудование: то же, что для темы 11.1.5.
Материалы: постоянные демонстрационные препараты
мейотического деления (микроспорогенеза, микрогаметогенеза)
пшеницы, ржи, тритикале, томата; фиксированный материал
пыльников тритикале, ржи, томата, пшеницы; 1—3%-й раствор
165
ацетокармина; 45%-я уксусная кислота; насыщенный раствор же-
лезоаммонийных квасцов; предметные стекла; покровные стекла;
препаровальные иглы; пинцеты; скальпели; фильтровальная бу-
мага.
Разделы практикума, рекомендуемые для
проведения занятия:
3.1 ; 3.2; 5.1.
Тема 11.1.11. МАКРОСПОРОГЕНЕЗ И МАКРОГАМЕТОГЕНЕЗ.
ОПЛОДОТВОРЕНИЕ. РАЗВИТИЕ ЗАРОДЫША И ЭНДОСПЕРМА
Оборудование: то же, что для темы 11.1.9.
Материалы: постоянные демонстрационные препараты и
микрофотографии мейотического деления (макроспорогенеза,
макрогаметогенеза) пшеницы, ржи, тритикале, томата; постоян-
ные демонстрационные препараты и микрофотографии стадий
развития зародыша; иммерсионные жидкости; фильтровальная
бумага.
Раздел практикума, рекомендуемый для
проведения занятия:
3.3 .
Тема 11.1.12. НАРУШЕНИЯ В МЕЙОЗЕ ПРИ ОТДАЛЕННОЙ
ГИБРИДИЗАЦИИ
Оборудование: то же, что для темы 11.1.5.
Материалы: постоянные демонстрационные препараты
нарушений в мейотическом делении отдаленных гибридов томата,
пшеницы, тритикале; фиксированный материал пыльников три-
тикале, ржи, томата, пшеницы; 1—3%-й раствор ацетокармина;
45%-я уксусная кислота; насыщенный раствор железоаммоний-
ных квасцов; предметные стекла; покровные стекла; препароваль-
ные иглы; пинцеты; скальпели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
3.4 ; 3.5; 5.1.
Тема 11.1.13. МЕТОДЫ ОПРЕДЕЛЕНИЯ ФЕРТИЛЬНОСТИ
И ЖИЗНЕСПОСОБНОСТИ ПЫЛЬЦЫ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; термошкаф.
Материалы: постоянные демонстрационные препараты
пыльцы различных растений; фиксированный материал пыльни-
166
ков тритикале, ржи, томата, пшеницы; фиксированный материал
цветков после опыления для изучения прорастания пыльцы; 20%-й
раствор сахарозы; пыльники со зрелой пыльцой, свежесобранная
подсушенная пыльца томата, пшеницы, петунии; 1—3%-й раствор
ацетокармина; 45%-я уксусная кислота; 5%-й раствор йода в йо-
диде калия; 1%-й раствор хлорида трифенилтетразолия; 70%-й ра-
створ этанола; 20%-й раствор гидроксида калия; 0,01 %-й раствор
анилина голубого; гидрофосфат калия; предметные стекла; по-
кровные стекла; предметные стекла для проращивания пыльцы;
препаровальные иглы; пинцеты; скальпели; фильтровальная бу-
мага.
Разделы практикума, рекомендуемые для
проведениязанятия:
3.2; 5.1; 10.1.1; 10.2.
Тема 11.1.14. КОСВЕННЫЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
ПЛОИДНОСТИ РАСТЕНИЙ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров.
Материалы: фиксированный материал пыльников дипло-
идных и тетраплоидных форм томата, свеклы; фиксированный
материал высечек из листа диплоидных и тетраплоидных форм то-
мата, свеклы; 1—3%тй раствор ацетокармина; ледяная уксусная
кислота; 70%-й раствор этанола; йод металлический; йодид калия;
предметные стекла; покровные стекла; препаровальные иглы;
пинцеты; скальпели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
3.2; 5.1; 10.1.1; 10.2.6.
11.2. ТЕМЫ ПРАКТИЧЕСКИХ ЗАНЯТИЙ ПО КУРСУ «МЕТОДЫ
ЦИТОГЕНЕТИКИ»
Тема 11.2.1. МЕТОДЫ ПРЕДФИКСАЦИОННОЙ ОБРАБОТКИ
И ФИКСАЦИИ РАСТИТЕЛЬНОГО МАТЕРИАЛА
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; термос; термостат; холодильник.
Материалы: семена; проростки; корешки с растущих рас-
тений; 0,001—0,1%-й раствор колхицина, насыщенный раствор
167
а-бромнафталина, уксусный алкоголь, 45%-я уксусная кислота;
предметные стекла; пробирки эппендорф; флаконы для фиксации
материала; металлические сеточки; марлевые или нейлоновые ме-
шочки для промывания материала; препаровальные иглы; пинце-
ты; скальпели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия: , ?
4.1-4.3.
Тема 11.2.2. НАРКОЛОГИЧЕСКИЙ АНАЛИЗ С ИСПОЛЬЗОВАНИЕМ
МОНОХРОМНОГО ОКРАШИВАНИЯ
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Primostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; иммерсионные объективы.
Материалы: постоянные препараты митотических хромо-
сом; микрофотографии метафазных пластинок; программы анали-
за изображений — метафазных хромосом; ножницы; клей; штан-
генциркуль; линейка; иммерсионные жидкости; фильтровальная
бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
2.2; 2.3.
Тема 11.2.3. ИДЕНТИФИКАЦИЯ ХРОМОСОМ С ИСПОЛЬЗОВАНИЕМ
ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
Оборудование: то же, что для темы 11.2.
Материалы: постоянные препараты дифференциально ок-
рашенных митотических хромосом; микрофотографии дифферен-
циально окрашенных метафазных пластинок разных видов пше-
ницы, ржи, ячменя; программы анализа изображений—диффе-
ренциально окрашенных метафазных хромосом; ножницы; клей;
штангенциркуль; линейка; иммерсионные жидкости; фильтро-
вальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
2.2; 2.3; 6.1-6.3.
Тема 11.2.4. ИДЕНТИФИКАЦИЯ ХРОМОСОМНЫХ ПЕРЕСТРОЕК
С ИСПОЛЬЗОВАНИЕМ ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
Оборудование: то же, что для темы 11.2.
Материалы: постоянные препараты дифференциально ок-
рашенных митотических хромосом растений с транслокациями,
168
делециями, инверсиями; микрофотографии дифференциально ок-
рашенных метафазных пластинок с наличием хромосомных пере-
строек; программы анализа изображений — дифференциально
окрашенных метафазных хромосом; ножницы; клей; штангенцир-
куль; линейка; иммерсионная жидкость; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
2.2; 2.3; 6.1-6.3; 9.1; 9.3.
Тема 11.2.5. ИССЛЕДОВАНИЯ МЕЙОТИЧЕСКИХ ХРОМОСОМ.
ГЕНОМНЫЙ АНАЛИЗ
Оборудование: то же, что для темы 11.2.2.
Материалы: постоянные демонстрационные препараты
мейотического деления (микроспорогенеза, микрогаметогенеза)
отдаленных гибридов пшеницы с видами эгилопса, ржи, тритика-
ле; фиксированный материал пыльников межвидовых гибридов
тритикале с рожью, тритикале с пшеницей; иммерсионные жид-
кости; 1—3%-й раствор ацетокармина; 45%-я уксусная кислота;
насыщенный раствор железоаммонийных квасцов; предметные
стекла; покровные стекла; препаровальные иглы; пинцеты; скаль-
пели; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
3.1; 3.5.
Тема 11.2.6. ИССЛЕДОВАНИЯ МЕЙОТИЧЕСКИХ ХРОМОСОМ.
ПАХИТЕННЫЙ АНАЛИЗ ХРОМОСОМ
Оборудование: то же, что для темы 11.2.2.
Материалы: постоянные препараты пахитенных хромосом
томата, ржи, кукурузы; пахитенные карты томата, ржи, кукурузы;
ножницы; клей; штангенциркуль; линейка; иммерсионные жид-
кости; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
3.1; 3.6.
Тема 11.2.7. ИССЛЕДОВАНИЯ МЕЙОТИЧЕСКИХ ХРОМОСОМ.
АНАЛИЗ ЧАСТОТЫ ХИАЗМ В ДИАКИНЕЗЕ — МЕТАФАЗЕ I МЕЙОЗА
Оборудование: то же, что для темы 11.2.2.
Материалы: постоянные препараты мейотических хромо-
сом в стадии диакинеза — метафазы I томата, ржи, пшеницы, три-
тикале; микрофотографии мейотических хромосом в стадии диа-
кинеза — метафазы 1 томата, ржи, пшеницы, тритикале; иммерси-
онные жидкости; фильтровальная бумага.
169
Раздел практикума, рекомендуемый для
проведения занятия:
3.1; 3.2.
Тема 11.2.8. ИССЛЕДОВАНИЯ МЕЙОТИЧЕСКИХ ХРОМОСОМ.
НАРУШЕНИЯ МЕЙОТИЧЕСКОГО ДЕЛЕНИЯ У ОТДАЛЕННЫХ
ГИБРИДОВ
Оборудование: то же, что для темы 11.2.2.
Материалы: постоянные препараты мейотических хромо-
сом отдаленных гибридов пшеницы, тритикале, томата; микрофо-
тографии мейотических хромосом отдаленных гибридов пшени-
цы, тритикале, томата; иммерсионные жидкости; фильтровальная
бумага.
Разделы практикума, рекомендуемые для
проведениязанятия:
3.1; 3.5.
Тема 11.2.9. МОЛЕКУЛЯРНАЯ ЦИТОГЕНЕТИКА. ИСПОЛЬЗОВАНИЕ
ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN SITU (FISH)
ДЛЯ ИДЕНТИФИКАЦИИ ХРОМОСОМ
Оборудование: микроскоп флуоресцентный; наборы
светофильтров для флуоресцентной микроскопии.
Материалы: микрофотографии метафазных пластинок с
флуоресцентной гибридизацией in situ (FISH); программы анали-
за изображений метафазных хромосом; ножницы; клей; штанген-
циркуль; линейка.
Разделы практикума, рекомендуемые для
занятия:
Тема 11.2.10. МОЛЕКУЛЯРНАЯ ЦИТОГЕНЕТИКА. ИСПОЛЬЗОВАНИЕ
ГЕНОМНОЙ ФЛУОРЕСЦЕНТНОЙ ГИБРИДИЗАЦИИ IN SITU (GISH)
ДЛЯ ИДЕНТИФИКАЦИИ ХРОМОСОМ
Оборудование: то же, что для темы 11.2.9.
Материалы: препараты хромосом с гибридизацией in situ; мик-
рофотографии метафазных пластинок отдаленных гибридов пше-
ницы, тритикале, томата с геномной гибридизацией in situ
(GISH); программы анализа изображений метафазных хромосом;
ножницы; клей; штангенциркуль; линейка.
Разделы практикума, рекомендуемые для
проведения занятия:
7.1-7.5.
170
Тема 11.2.11. ХРОМОСОМНЫЕ АБЕРРАЦИИ. МЕТАФАЗНЫЙ
И АНАФАЗНЫЙ МЕТОДЫ УЧЕТА ХРОМОСОМНЫХ
ПЕРЕСТРОЕК
Оборудование: микроскоп биологический (Микмед —
различные модификации; МБИ; МБР; Axiostar; Axiolab); освети-
тели (если микроскоп не снабжен встроенным осветителем); на-
боры светофильтров; микрофотонасадка, цифровая фотокамера;
иммерсионные объективы.
Материалы: фиксированный материал корешков лука, то-
мата, пшеницы, обработанных мутагенами; постоянные препараты
дифференциально окрашенных митотических хромосом растений
с транслокациями, делециями, инверсиями; микрофотографии
дифференциально окрашенных метафазных пластинок с наличи-
ем хромосомных перестроек; микрофотографии мейотического
деления у растений с хромосомными перестройками; иммерсион-
ные жидкости; 1—3%-й раствор ацетокармина; 45%-я уксусная
кислота; насыщенный раствор железоаммонийных квасцов; пред-
метные стекла; покровные стекла; препаровальные иглы; пинце-
ты; скальпели; ножницы; клей; штангенциркуль; линейка; иммер-
сионные жидкости; фильтровальная бумага.
Разделы практикума, рекомендуемые для
проведения занятия:
—
ПРИЛОЖЕНИЯ
Приложение 1
КРАТКИЙ СЛОВАРЬ ЦИТОГЕНЕТИЧЕСКИХ
И ЦИТОЭМБРИОЛОГИЧЕСКИХ ТЕРМИНОВ
Аберрация — разрыв хромосомы или хроматиды, возникающий в результате
действия мутагенных факторов.
Автополиплоид — организм, содержащий в клетках несколько хромосомных
наборов одного и того же вида.
Аллополиплоид — организм, содержащий в клетках хромосомные наборы не-
скольких видов.
Амитоз — прямое деление клетки без компактизации хромосом и образования
веретена.
Анафаза —- фаза митоза и мейоза, во время которой хромосомы или хроматиды
расходятся к полюсам.
Ацдроцей — совокупность мужских генеративных органов цветка.
Апикальная клетка — одна из двух клеток, образующаяся при первом делении
зиготы. В дальнейшем из этой клетки развивается зародыш.
Апогамия — развитие зародыша без оплодотворения из синергид или антипод.
Апоспория — развитие зародыша без оплодотворения из клетки нуцеллуса или
интегумента семяпочки.
Апомиксис — развитие зародыша без оплодотворения.
Археспорий — материнские клетки тетрады микроспор или тетрады мегаспор
(макроспор).
Асиндез — отсутствие конъюгации хромосом при редукционном делении у
межвидовых гибридов.
Аутосома — хромосома, не отличающаяся у особей мужского и женского пола.
Базальная клетка — одна из двух клеток, образующихся при первом делении
зиготы, обращенная к микропиле. В дальнейшем из этой клетки развивается под-
весок зародыша.
Базальный тип развития — тип развития эндосперма, промежуточный между
нуклеарным и целлюлярным типом.
Бивалент — пара гомологичных хромосом, сблизившихся во время редукцион-
ного деления.
Вакуоль — внутриклеточная полость, наполненная жидкими продуктами об-
мена веществ различных клеточных органоидов.
Вегетативная клетка — более крупная клетка мужского гаметофита (см. Пыль-
цевое зерно).
Веретено деления — комплекс протеиновых нитей, осуществляющих расхож-
дение хромосом к полюсам.
Гамета — половая клетка.
Гаметогенез — процесс, в результате которого образуются гаметы.
Гаметофит — половое поколение у цветковых растений, которое имеет гапло-
идное (л) число хромосом.
172
Гаплоид — организм с редуцированным (половинным) для данного вида чис-
лом хромосом (л).
Ген — единица наследственности.
Геном — гаплоидный набор хромосом у диплоидных видов.
Гетероплоидия — явление увеличения или уменьшения диплоидного числа
хромосом на одну или несколько хромосом.
Гетерохроматин — участки хромосом с постоянно конденсированным хрома-
тином.
Гинецей — совокупность женских генеративных органов цветка — пестиков.
Гомологичные хромосомы — парные (по морфологии и структуре) хромосомы в
диплоидном наборе.
Двойное оплодотворение — процесс оплодотворения у покрытосеменных рас-
тений, при котором один спермий сливается с яйцеклеткой, а второй — с цент-
ральным ядром зародышевого мешка.
Деления — утрата хромосомой сегмента.
Диакинез — заключительная стадия профазы мейоза, во время которой ком-
пактизация хромосом достигает максимума и биваленты располагаются по пери-
ферии ядра.
Дивергенция — термин, обозначающий расхождение хромосом.
Диплоид — особь, несущая в соматических клетках удвоенное число хромосом
(2л). Образуется при слиянии двух гамет (л) в процессе оплодотворения.
Дистальное прикрепление — прикрепление спутника к длинному плечу у не-
равноплечей хромосомы.
Диплотена — стадия профазы I мейоза, во время которой гомологичные хро-
мосомы бивалента в некоторых местах начинают отходить друг от друга.
Диспермия — слияние яйцеклетки с двумя спермиями.
Дупликация — удвоение участка хромосомы в гаплоидном наборе хромосом.
Зигота — диплоидная клетка, образующаяся в результате слияния мужской и
женской гамет. Из зиготы развивается новый организм.
Зародышевый мешок — женский гаметофит.
Зиготена — стадия профазы I мейоза, во время которой гомологичные хромо-
сомы располагаются попарно.
Идиограмма — схематическое изображение кариотипа с учетом размеров и
морфологических особенностей отдельных хромосом.
Инверсия — поворот какого-либо сегмента хромосомы на 180е, в результате
которого порядок расположения генов в хромосоме изменяется на обратный.
Интегумент — покров семяпочки.
Интеркинез — стадия покоя клетки между I и II мейотическими делениями.
Интерфаза — период между двумя митотическими делениями клетки.
Интина — внутренняя оболочка пыльцевого зерна.
Кариотип — специфический для данного вида набор хромосом.
Кариолимфа — ядерный сок.
Кинетехор — белковая структура, располагающаяся в центромере хромосомы.
Клейстогамия — самоопыление при закрытом цветении.
Комплекс Гольджи — морфологическая структура клетки, принимающая учас-
тие в углеводном и жировом обменах в качестве секреторного аппарата.
Конъюгация хромосом — прилегание гомологичных хромосом друг к другу во
время мейоза.
Крассинуцеллярная семяпочка — семяпочка с сильно разросшимся нуцеллусом.
Ксеногамия — перекрестное опыление.
Лептотена — стадия профазы I мейоза I, во время которой хромосомы ядра
очень слабо компактизованы и располагаются отдельно друг от друга.
173
Мегаспора — гаплоидная клетка, образующаяся в результате мейоза, из кото-
рой развивается в последующем зародышевый мешок.
Мегаспорогенез — процесс образования тетрады мегаспор с гаплоидным набо-
ром хромосом в каждой мегаспоре.
Мезогамия — врастание пыльцевой трубки в зародышевый мешок через инте-
гументы и нуцеллус.
Мейоз — особый тип деления ядра спорогенной клетки, при котором проис-
ходит редукция (уменьшение вдвое) числа хромосом, свойственного данному виду.
Меристема — образовательная ткань.
Метафаза — фаза митоза и мейоза, во время которой хромосомы располагают-
ся в экваториальной плоскости, образуя метафазную пластинку.
Микрогаметогенез — образование спермиев в пыльцевом зерне.
Микропиле — пыльцевход, образованный несросшимися интегументами в вер-
хней части семяпочки.
Митоз — непрямое деление ядра, свойственное меристематическим тканям.
Митохондрии — тельца размером 10—15 нм, находящиеся в цитоплазме и яв-
ляющиеся основными генераторами внутриклеточной энергии.
Моносомик — индивидуум данного вида, имеющий на одну хромосому меньше.
Мутаген — фактор, под действием которого возникают мутации.
Нерасхождение хромосом — явление, при котором гомологичные хромосомы
на стадии анафазы мейоза отходят к одному полюсу.
Нуклеарный тип — развитие эндосперма, при котором деление центрального
ядра зародышевого мешка вначале не сопровождается цитокинезом.
Нуллисомик — организм, у которого оба гомологичных члена одной хромо-
сомной пары отсутствуют (2л — 2).
Нуцеллус — центральная часть семяпочки.
Партеногенез — образование зародыша из неоплодотворенной яйцеклетки.
Партенокарпия — образование бессемянного плода.
Пахитена — стадия профазы I мейоза, во время которой происходит усилен-
ная компактизация хромосом и кроссинговер.
Перисперм —- питательная ткань, образующаяся при накоплении запасных пи-
тательных веществ в клетках нуцеллуса.
Плазмодесмы — цитоплазменные тяжи, проходящие через поры клеточной
оболочки и обеспечивающие связь между цитоплазмами соседних клеток.
Пластиды — мембранные органоиды, находящиеся в цитоплазме раститель-
ной клетки.
Плацента — место заложения семяпочки.
Полиплоидия — увеличение всего хромосомного набора по отношению к
обычному диплоидному числу 2л.
Поли сомик — организм, у которого диплоидный набор хромосом увеличен на
одну или несколько хромосом.
Полиспермия — проникновение в яйцеклетку нескольких спермиев.
Полиэмбриония — развитие нескольких зародышей в одном семени.
Порогамия — врастание пыльцевой трубки в зародышевый мешок через мик-
ропиле.
Профаза — первая фаза митоза и мейоза, во время которой происходит ком-
пактизация хромосом.
Протерандрия — явление, при котором пыльники цветка созревают раньше
пестика.
Протерогиния — явление, при котором пестик цветка созревает раньше пыль-
ников.
Пыльцевое зерно — мужской гаметофит, состоящий из вегетативной и генера-
тивной клеток и двух оболочек (интины и экзины). У многих видов растений в
пыльцевом зерне генеративная клетка делится, образуя два спермия.
174
Редукционное деление — (см. мейоз).
Рибосомы — цитоплазматические гранулы, играющие важную роль в белковом
синтезе. Их размеры от 5 до 15 нм.
Семяпочка — мегаспорангий покрытосеменных растений. Состоит из нуцеллу-
са, зародышевого мешка (женского гаметофита), одного или двух интегументов и
ножки семяпочки (фуникулюса).
Сингамия — объединение гамет при оплодотворении.
Спутник — сегмент хромосомы, отделенный от остальной части хромосомы
вторичной перетяжкой.
Сферосомы — мембранные пузырьки (диаметром 0,1—0,5 мкм) в клетках расте-
ний, в которых происходит накопление липидов (масла).
Тапетум — слой клеток, окружающий материнские клетки пыльцы или мате-
ринскую клетку зародышевого мешка и передающий им питательные вещества.
Телофаза — заключительная фаза митоза или мейоза, во время которой проис-
ходит декомпактизация хромосом и образуется клеточная перегородка.
Тетрады — четыре гаплоидные клетки, которые образуются у цветковых расте-
ний в результате мейоза.
Тонопласт — слой цитоплазмы, окружающий вакуоль.
Унивалент — неконъюгировавшая хромосома в мейозе.
Халаза — нижняя часть семяпочки, примыкающая к плаценте.
Халазогамия — врастание пыльцевой трубки в зародышевый мешок через халазу.
Хиазмы — места соединения хроматид при кроссинговере.
Хроматида — полухромосома.
Хроматин — вещество хромосомы, хорошо окрашивающееся специальными
красителями.
Хромомеры — специфические участки хроматид, различающиеся между собой
по величине, форме и содержанию ДНК.
Хромосома — органоид, входящий в состав клеточного ядра.
Целлюлярный тип развития эндосперма — клеточное развитие эндосперма,
которое характеризуется тем, что деление центрального ядра зародышевого
мешка и каждое последующее деление ядер эндосперма сопровождается цито-
кинезом.
Центромера — динамический центр хромосомы, осуществляющий ее ориента-
цию в митозе и мейозе.
Цитокинез — образование клеточной перегородки.
Цитология — учение о клетке.
Цитоплазма — содержимое клетки за исключением ядра.
Экзина — наружная оболочка пыльцевого зерна.
Эмбриология — отрасль науки, изучающая возникновение и развитие мужско-
го и женского гаметофитов, процессы оплодотворения, развитие зародыша и эн-
досперма.
Эндомитоз — особый цикл развития ядра, при котором происходит редуплика-
ция хромосом внутри неделящегося ядра.
Эндоплазматический ретикулум — часть вакуолярной системы клетки, состоя-
щая из мелких вакуолей и каналов.
Эндосперм — особая питательная ткань, образующаяся при оплодотворении
центрального ядра зародышевого мешка одним из двух спермиев.
Эухроматин — основная масса хроматина хромосомы за исключением участ-
ков гетерохроматина.
Ядрышко — небольшое округлой формы тельце, находящееся в ядре, но отли-
чающееся от него по своим физико-химическим свойствам. Состоит из ДНК (2—
12 %), РНК (5-14 %) и белков.
175
Приложение 2
ДИПЛОИДНОЕ ЧИСЛО ХРОМОСОМ (2п) У РАЗНЫХ видов
РАСТЕНИЙ
1. Пшеница Урарту (Triticum urartu Tham. ex Gandil) 14
2. Однозернянка дикорастущая (T.boeoticum Boiss) 14
3. Однозернянка культурная (Г. топососсит L.) 14
4. Пшеница Синской (Т. sinskaiae A.Filat. et Kurk.) 14
5. Полба дикорастущая (T.dicoccoides Schweinf.) 28
6. Полба обыкновенная, эммер (T.dicoccum Schuebl.) 28
7. Полба колхидская (Г. karamyschevii Nevski.) 28
8. Полба исфаганская (Т, ispahanicum Heslot.) 28
9. Пшеница тургидум (Т. turgidum L.) 28
10. Пшеница твердая (Г. durum Desf.) 28
11. Пшеница туранская (Т. turanicum Jakubz.) 28
12. Пшеница эфиопская (Г. aethiopicum Jakubz.) 28
13. Пшеница полоникум (Т. polonicum L.) 28
14. Пшеница карталинская (Г. carthlicum Nevski) 28
15. Пшеница араратская (Г. araraticum Jakubz.) 28
16. Пшеница Тимофеева (Т. timopheevii Zhuk.) 28
17. Пшеница Милитины (Г. militinae Zhuk, et Migusch.) 28
18. Пшеница Якубцинера (Г. jakubzineri Udacz.et Schachm.) 28
19. Пшеница спельта (Т. spelta L.) 42
20. Пшеница маха (Г. macha Dec. et Men.) 42
21. Пшеница Вавилова (Т. vavilovii Jakubz.) 42
22. Пщеница (Г. compactum Host) 42
23. Пшеница мягкая (Т. aestivum L.) 42
24. Пшеница шарозерная (Т. sphaerococcum Регс.) 42
25. Пшеница Петропавловского (Г. petropavlovskyi Udacz. et Migusch.) 42
26. Пшеница Кихары (Г. kiharae Dovf. et Migusch.) 42
27. Пшеница Мигушовой (T. miguschovae Zhir.) 42
28. Пшеница Жуковского (Т. zhukovskyi Menabde et Eziczjan) 42
29. Рожь культурная (Secale cereale L.) 14
30. Рожь лесная (5. sylvestre Host.) 14
31. Рожь Куприянова (5. kuprianovii Grossh.) 14
32. Рожь горная (5. montanum Guss.) 14
33. Рожь южноафриканская (S. africanum Stapf.) 14
34. Рожь дикая Вавилова (5. vavilovii Grossh.) 14
35. Овес песчаный (Avena strigosa Schreb.) 14
36. Овес бородатый (A. barbata Thell.) 14*
37. Овес абиссинский (A. abyssinica Hochst.) 28
38. Овес Вавилова (A. vaviloviana Mordv.) 28
39. Овес посевной (Л. sativa L.) 42
40. Овес византийский (Л. byzantina C.Koch) 42
41. Овсюг обыкновенный (A.fatua L.) 42
42. Овсюг средиземноморский (Л. sterilis L.) 42
43. Овсюг южный (Л. ludoviciana Gill, et Magne.) 42
44. Ячмень культурный (Hordeum vulgare L.) 14
45. Ячмень дикий (H. spontaneum C.Koch) 14
46. Ячмень луковичный (Я. bulbosum L.) 14*
* У отмеченных видов выявлены расы с иным числом хромосом.
176
47. Кукуруза (Zea mays L.) 20*
48. Просо обыкновенное (Panicum miliaceum L.) 36*
49. Просо просяное (P. miliare Lam.) 36*
50. Рис посевной (Oryza sativa L.) 24*
51. Рис голый (О. glaberrima Stend.) 24
52. Гаолян (Sorghum nervosum Bess, ex Schult.) 20
53. Суданская трава [5. sudanense (Piper) Stapf] 20
54. Джугара (5. cemuum Host) 20
55. Гумай (5. halepense (L.) Pers.) 20
56. Тимофеевка луговая (Phleum pratense L.) 42
57. Житняк гребенчатый (Agropyron cristatum Gaertn.) 28
58. Житняк гребневидный (A. pectiniforme Roem. et Schult.) 28
59. Житняк сибирский (A, sibiricum (Willd.) Beanv.) 28
60. Житняк пустынный (Л. desertorum (Fisch.) Schult.) 28
61. Костер безостый (Bromus inermis Leyss.) 28
62. Полевица обыкновенная (Agrostis vulgaris With.) 28
63. Полевица белая (A. alba L.) 28
64. Луговик дернистый (Deschampsia caespitosa (L.) Beauv.) 26
65. Мятлик луговой (Роа pratensis L.) 56
66. Райграс пастбищный (Lolium perenne L.) 14
67. Райграс многоукосный (L. multiflorum Lam.) 14
68. Райграс высокий (Arrenatherum elatins M. et K.) 28
69. Лисохвост луговой (Alopecurus pratensis L.) 28
70. Ежа сборная (Dactylis glomerata L.) 28
71. Могар (Setaria italica (L.) Beauv.) 18
72. Сахарный тростник (Saccharum afficinarum) 70
73. Горох посевной (Pisum sativum L.) 14
74. Горох полевой, или пелюшка (Р. arvense L.) 14
75. Бобы конские (Viciafaba L.) .12
76. Вигна (Vigna sinensis (L.) Savi) 22
77. Соя культурная (Glycine hispida Maxim.) 40*
78. Нут (Cicer arietinum L.) 14*
79. Люцерна северная (Medicago borealis Grossh.) 16
80. Люцерна голубая (M.coerulea Less.) 16
81. Люцерна Траутфетгера (M. trautvetteri Summ) 16
82. Люцерна синяя (M. sativa L.) 32*
83. Люцерна желтая (М. falcata L.) 32*
84. Люцерна хмелевидная (М. lupulina L.) 16*
85. Люцерна решетчатая (М. caucellata Bieb.) 48
86. Клевер луговой (Trifoliumpratense L.) 14*
87. Клевер малиновый (Т. incamatum L.) 14*
88. Клевер непостоянный (Т. ambiguum Bieb.) 16*
89. Клевер горный (Т, montanum L.) 16
90. Клевер мелкоцветковый (Т. parviflorum Ehre.) 16
91. Клевер репейниковый (Т. lappace urn L.) 16
92. Клевер красный (Т. rubens L.) 16
93. Клевер средний (Т. medium Grufb) 16
94. Клевер розовый (Т. hybridum L.) 16
95. Клевер альпийский (Г. alpinum L.) 16
96. Клевер белый (Г. repens L.) 32
97. Клевер средний (Т. medium L.) 80*
98. Клевер паннонский (Т. pannonicum Jacg.) 130*
99. Арахис культурный (Arachis hypogaea L.) 40
100. Фасоль обыкновенная (Phaseolus vulgaris L.) 22
12 В. А. Пухальский и др. 177
101. Фасоль остролистая (Ph. acutifolins A.Gray)
102. Фасоль лунообразная (Ph. lunatus L.)
103. Фасоль многоцветковая (Ph.coccinens L.)
104. Маш (Ph. aurens Roxb.)
105. Маи, урд (Ph. mungo L.)
106. Фасоль угловатая, адзики (Ph. augularis Willd.)
107. Коровий горох (Vigna unguiculata (L) Walp.)
108. Вика посевная (Vida sativa L.)
109. Вика круглоплодная (И amphicarpa L.)
НО. Французская «чечевица» (V. ervilia (L.) Willd.)
111. Вика паннонская (V. pannonica Grantz)
112. Мышиный горошек (V. cracca L.)
113. Вика узколистная (К angustifolia Roth.)
114. Вика мохнатая (К villosa Roth.)
115. Люпин жесткий (Lupinus subcamosus Hook.)
116. Люпин узколистный (L. angustifolius L.)
117. Люпин изменчивый (L. mutabilis Sweet)
118. Люпин белый (L. albus L.)
119. Люпин желтый (L. luteus L.)
120. Эспарцет песчаный (Onobrychys arenaria (Kit.) Ser.)
121. Эспарцет высокий (O.altissima Grossh.)
122. Эспарцет посевной (О. viciifolia Scop.)
123. Эспарцет закавказский (О. transcaucasica Grossh.)
124. Чечевица пищевая культурная (Lens culinaris Medic.)
125. Чина посевная (Lathyrus sativus L.)
126. Голубиный горох (Cajanus cajan (L.) Millip.)
127. Донник белый (Melilotus alba Medic.)
128. Донник желтый (M.officinalis (L.) Medic.)
129. Лен культурный (Linum usitatissimum L.)
130. Лен узколистный (L. angustifolium Huds.)
131. Лядвинец рогатый (Lotus comiculatus L.)
132. Джут короткоплодный (Corchorus capsularis L.)
133. Джут длинноплодный (C. olitorius L.)
134. Кунжут культурный (Sesamum indicum L.)
135. Клещевина обыкновенная (Ricinus communis L.)
136. Хлопчатник травянистый (Gossypium herbaceum L.)
137. Хлопчатник древовидный (G.arboreum L.)
138. Хлопчатник обыкновенный (G. hirsutum L.)
139. Хлопчатник перувианский (G. peruvianum Cav.)
140. Хлопчатник слабовойлочный (G.tomantosum Nutt, ex Seem.)
141. Гречиха культурная (Fagopyrum esculentum Moeuch.)
142. Гречиха татарская [F. tataricum (L.) Gaertn.]
143. Картофель гибберулозум (Solanum gibberuloseum Jus. et Bik.)
144. Картофель маглия (5. maglia Schlecht.)
145. Картофель культурный (5. tuberosum L.)
146. Картофель пуне (5. punae Juz.)
147. Картофель демиссум (5. demissum Lindl.)
148. Паслен черный (5. nigrum L.)
149. Томат (Lycopersicon esculentum Mill.)
150. Перец овощной (Capsicum annuum L.)
151. Махорка (Nicotiana rustica L.)
152. Табак настоящий (N. tabacum L.)
153. Подсолнечник (Helianthus annuus L.)
154. Земляная груша (H. tuberosus L.)
22
22
22
22
22
22
22
12
10
12
12
12*
12
14
34*
40
48
50*
, 52*
14*
14
28*
28
14
14
22
: 16*
16
30
30
24*
14*
.14
26*
20
26
26*
52
52
52
16
16
24*
36*
48*
48
72
72
24
24
48
48*
34
102
178
155. Цикорий салатный (Cichorium endivia L.)
156. Цикорий обыкновенный (С. intybus L.)
157. Капуста огородная (Brassica oleracea L.)
158. Капуста пекинская (В. pekinensis (Lour.) Rupr.)
159. Капуста китайская (В. chinensis L.)
160. Репа (В. rapa L.)
161. Сурепица (В. campestris L.)
162. Горчица сарепская (BJuncea (L.) Coss.)
163. Рапс (В, rapus L.)
164. Тыква гигантская (Cucurbita maxima Duch.)
165. Тыква мускатная (С moschata Duch.)
166. Тыква пепо, кабачок (С. pepo L.)
167. Дыня (Cucumis melo L.)
168. Огурец (С. sativus L.)
169. Арбуз столовый (Citrullus vulgaris Schrad)
170. Арбуз кормовой (C.colocynthoides Pang.)
171. Рыжик посевной (Camelina sativa (L.) Grantz.)
172. Мак опийный (Papaver somniferum L.)
173. Перилла (судза) (Perilla ocimoides L.)
174. Кориандр (Conundrum sativum L.)
175. Тмин (Carum Carvi L.)
176. Горчица белая (Sinapsis alba L.)
177. Шалфей мускатный (Salvia sclarea L.)
178. Кенаф (Hibiscus cannabinus L.)
179. Кендырь (Apocynum sibiricum Pall.)
180. Яблоня домашняя (Malus domestica Borkh.)
181. Груша домашняя (Pyrus communis L.)
182. Айва (Cydonia oblonga Mill.)
183. Рябина домашняя (Sorbus domestica L.)
184. Рябина обыкновенная (5. aucuparia L.)
185. Мушмула (Mespilus germanica L.)
186. Боярышник восточный (Crataegus orientalis Pall.)
187. Боярышник понтийский (C. pontica C.Koch.)
188. Ирга овальная (Amelanchier rotundifolia Roem.)
189. Ирга канадская (A. canadensis (L.) Medic.)
190. Слива домашняя (Prunus domestica L.)
191. Терн (P, spinosa L.)
192. Абрикос обыкновенный (Armeniaca vulgaris Lam.)
193. Персик обыкновенный (Persica vulgaris Mill.)
194. Миндаль обыкновенный (Amygdalus communis L.)
195. Черешня (Cerasus avium (L.) Moeuch.)
196. Вишня обыкновенная (C. vulgaris Mill.)
197. Малина (Rubus idaeus L.)
198. Ежевика (R. caesius L.)
199. Земляника садовая (Fragaria ananassa Duch.)
200. Смородина красная (Ribes silvestre Mert. et Koch.)
201. Смородина черная (Rmigrum L.)
18*
18
18*
20
20
20
20
36
38
40*
40*
40*
24*
14
22
22
40*
22
38
22
20
24
22
36*
16
34
34
34
34
34
34
68
68
68
68
48
32*
16
16
16
16
32
14*
28
56
16
16
Приложение 3
ПРАВИЛА ПРИГОТОВЛЕНИЯ СПИРТОВ
НЕОБХОДИМОЙ КОНЦЕНТРАЦИИ
Спирт нужной концентрации можно приготовить либо из двух спиртов с раз-
ной концентрацией, либо путем разбавления крепкого спирта дистиллированной
водой. В последнем случае целесообразно пользоваться таблицей, составленной
М. С. Навашиным (1936), которую мы приводим ниже.
12*
179
Таблица для разведения спирта водой*
Нужная концент- рация^ Концентрация имеющегося спирта, %
| 96 90 85 80 75 70 65 60 55 50
90 94 мм» «ММ“ «ММ» —м^м «мм« •реме» —МММ мм»ИМ МММ
85 88 94 мем» ^ммй- ммм «МММ — “м
80 83 89 94 «мни мммм мН «МММ —мм МММ
75 78 83 88 94 •-М-* —— «МММ —— ММ- —ММ
70 73 78 82 87 93 ММММ «ми^м мммм МММ мм—
65 68 72 76 81 86 93 м——1 ——— —м— МММ
60 62 67 71 75 80 86 92 «мм мммм м—
55 57 61 65 69 73 79 85 92 ——м мммм
50 52 55 54 62 67 71 77 83 91 ММММ
45 47 50 53 56 60 64 69 75 82 90
40 42 44 47 50 53 57 61 67 73 80
35 37 39 41 44 47 50 54 58 64 70
30 31 33 35 37 40 43 46 50 55 60
25 26 28 28 31 33 36 38 42 45 50
20 21 22 23 25 27 29 31 33 36 40
15 16 17 18 19 20 21 23 25 27 30
10 10 11 12 12 13 14 15 17 18 20
* Приведенные цифры показывают, сколько миллилитров спирта данной кон-
центрации надо взять, чтобы, долив водой до 100 мл, получить нужную концент-
рацию.
Во всех других случаях применяют правило Леви. Согласно этому правилу для
приготовления из двух растворов какого-либо вещества, имеющих неодинаковую
концентрацию, нового раствора с промежуточной концентрацией следует взять
первый раствор в количестве, численно равном разности между значением кон-
центрации второго раствора и концентрацией приготовляемого раствора, и доба-
вить к нему второй раствор в количестве, численно равном разности между значе-
нием концентрации первого раствора и концентрацией приготовляемого раство-
ра. В результате получится новый раствор нужной концентрации.
Пример. Нужно приготовить спирт с концентрацией 60 % из двух спиртов с
концентрацией 95 и 40 %. Пишем:
95 40
60
20 35
( = 60- 40) (= 95-60),
т. е., взяв 20 мл 95%-го спирта и добавив к нему 35 мл 40%-го спирта, получим
55 мл 60%-го спирта.
Приготовление 100%-го спирта. Обычный продажный крепкий спирт содержит
по объему 95—96 % чистого этилового алкоголя, остальные 4—5 % приходятся на
содержащуюся в нем воду. Приготовление спирта, совершенно не содержащего
180
воды, представляет определенные трудности. Обычно берут самый крепкий 95—
96%-го спирт и удаляют из него остатки воды одним из следующих способов:
при помощи обезвоженного медного купороса;
при помощи обезвоженной желатины в листках;
путем перегонки 96%-го спирта из сосуда, в который насыпан оксид
кальция.
Наиболее распространен первый способ. Согласно этому способу измельчен-
ный медный купорос обезвоживают, осторожно прокаливая его при помешива-
нии в фарфоровой чашке под тягой на газовой горелке или в муфельной печи.
Обезвоженный измельченный медный купорос имеет вид белого аморфного по-
рошка. Нельзя допускать его побурения от перегрева, что свидетельствует о разло-
жении соли. Обезвоженный медный купорос насыпают на дно банки с 96%-м
спиртом, перемешивают стеклянной палочкой, закрывают банку притертой проб-
кой и оставляют на несколько суток, изредка помешивая содержимое банки. При
этом медный купорос интенсивно поглощает воду и приобретает голубой цвет.
Полученный более крепкий спирт переливают в банку с новой порцией обезво-
женного медного купороса, где он теряет последние остатки воды. Количество
медного купороса берется из расчета 200—250 г на 1 л спирта. Такой «абсолютный
спирт» очень ядовит, поскольку содержит ионы меди, и с ним следует работать
очень осторожно. Иногда рекомендуется измельченный обезвоженный медный
купорос предварительно насыпать в бумажные гильзы из фильтровальной бумаги,
которые на концах завязывают ниткой. Гильзы в количестве 3—4 шт. помещают в
сосуд со спиртом и через 3—4 дня заменяют на новые. Применение гильз позво-
ляет получить спирт без мути.
1
предметный указатель
Аберрации оптических приборов 16,17
— астигматизм 16
— дисторсия 16
— кома 16
— кривизна поля зрения 16
— сферическая 16, 17
— хроматизм положения 16
— хроматизм увеличения 16
Аберрации хромосомные (перестрой-
ки) 76, 147
Автополиплоид 139
Агар 115, 122, 157
Аллополиплоид 69, 140
Амитоз 53
Анафаза I мейоза 58, 59, 61
Анафаза II мейоза 58, 59, 61
Анафаза митоза 40, 50, 51
Анилиновый синий 161
Антиподы 68, 83
Антитела 113
Апомиксис 82, 83
Апоптоз 56, 57
Аппарат Гольджи 38
Архегоний 82
Археспорий 62, 66, 83
Аутосома 45
Ацетокармин 24, 93, 95, 111, 115
Ацетоорсеин 35
Белки гистоны 38, 43—45
Белки циклины 54, 55
Бивалент 58, 70
Биотин 112
Бор 33
Буферные растворы 109, 135—138
Вакуоли 38
Вегетативное размножение 83
Веретено 40, 41, 50, 58—61, 140
Вода 16, 33, 34, 85, 92
Гаметофит
182
— женский 65—68, 82, 83
— мужской 62—65, 80
Гаметы 65, 68, 75
Гаплоид 83
Гематоксилин 96, 158
Генетическая рекомбинация 68—70, 82
Геномный анализ 72
Гетерохроматин 42
Гибридизация
— отдаленная 70—76, 185
Гибридизация нуклеиновых кислот
in situ 112
— геномная гибридизация in situ
(GISH) ИЗ
— флуоресцентная гибридизация in
situ (FISH) 113, 126
Гипокотиль 78
Гистоны 38, 43—45
Глицерин 93, 95, 96, 100
Граны 37
•*
Дезоксирибонуклеиновая кислота
(ДНК) 38, 40, 41, 45, 50, 52, 53, 61,
112-125, 136
Деление 48—71, 58—75
Делеция 148—151
Денатурация 102
Диада 61—63, 75
Дигоксигенин 19, 113
Диктиосомы 38
Диплоид 83
Дифференциальное окрашивание хро-
мосом 102
Дупликация 149
Жиры 58
Замораживание — скалывание 99
Замыкающие клетки 145
Запасные вещества 78
Запрограммированная смерть клетки
56, 57
Зародыш растения 77—79
Зародышевый мешок 65—68
Зигота растений 78
Зонд 112, 121, 129
Изменчивость
— генетическая 69
Измерение микрообъектов 28—30
Изохромосома 42
Инверсия 149
Интегументы 65
Интерфаза 48—50, 53, 58
— Go-период 48—50
— Gi-период 48—50
— G2-период 50
— S-период 50—58
Каллоза 160
Кариокинез 50
Кариотип 42, 45
— формула 46
Кармин 93
Каротиноиды 39
Карты хромосом
— генетические 45—48
— пахитенные 76, 77
— цитологические 45—80
Кинетохор 40
Классификация хромосом 45—48
— генетическая 47, 48
— цитологическая 45—47
Клетка(и)
— растительная 35—57
— строение 37—40
Клеточная стенка 37
Клеточная теория 6
Клеточный цикл 43, 52, 54, 55
К-митоз 140
Колхицин 52, 103, 140—145
Компактизация ДНК 43—45
Конденсор 17, 18
Конъюгация хромосом 58, 68, 69, 71
72, 76, 151
Краситель
— ацетокармин 93—95, 145, 153
— ацетоорсеин 95
— Гимза 100 ; .
— фуксин 96, 154
- Шиффа 96, 97
Крахмал 37, 38, 53
Кристы 38, 39
Кроссинговер 58, 69
Ксенийность 82
Лейкопласты 37
Макровинт 10, 18
Макрогаметогенез 68
Макроспорогенез 65, 66
Материнская клетка пыльцы 62, 63
Мацерация 94, 99, 100, 104, 160, 161
Мейоз (мейотическое деление) 100,
139, 152
— генетический контроль 68—70
— фазы
— профаза I 58—61
----лептотена 58
----зиготена 58
----пахите на 60, 151, 152
----ди плоте на 60
----диакинез 61
— метафаза I 61
— анафаза I 61
— телофаза I 61
— интеркинез 61
— профаза II 61
— метафаза II61 \ I
— анафаза II 61
— телофаза II 61
Мейотический индекс 75
Мембрана 37
Меристема 48—52
Метафаза I мейоза 61
Метаоаза 1Ь мейоза 62
Метафаза митоза 45, 49—51
Методы
— витального (прижизненного) изуче-
ния 26
----в падающем свете 22—26
----в проходящем свете 26
— исследования в поляризованном
свете 28
— дифференцировки препаратов 146
— косого освещения 8, 18, 22, 31
— культуры тканей 26
— люминесцентной микроскопии
28
— светлого поля 22
— темного поля 9, 10, 23, 31
— фазового контраста 9, 24, 25, 31
— флуоресцентной микроскопии
26-28
Микровидеосъемка 36
Микровинт 10, 18
Микрогаметогенез 64, 65
Микропиле 65, 81
Микроскоп 9—36
Микроспорогенез 62—64
Микротрубочки 39, 50
Микрофиламенты 39
Микрофотография 30—34
Микрофотонасадка 31
Микрофотосъемка 30—34
Митоз
— генетический контроль 54, 55
— кариокинез 50
— фазы митоза 50
26-
24,
183
— профаза 45, 49—51
— метафаза 45, 49—51, 153, 154
— анафаза 44, 49, 50, 53, 152, 153
— телофаза 49, 54
— цитокинез 50, 55
Митотический индекс 51, 52
Митохондрии 57
Молекулярная цитогенетика 112—138
Монослой 98
Насадка бинокулярная 10
— визуальная 10
— монокулярная 11
Настройка освещения 19, 20
Некроз 56
Нуклеиновые кислоты 40, 41, 50, 52,
53, 112-125
Нуклеомер 45
Нуклеоплазма 40
Нуклеосома 43—45
Нуклеотиды 112—125
Нуцеллус 65, 82
Оболочка 37, 40, 50
Объектив
— апохромат 10, 13, 14, 17
— ахромат 13—24
— иммерсионный 16
— планапохромат 13
— сухой 16
— фазово-контрастный 25
Объект-микрометр 28, 29
Окрашивание
— дифференциальное 43, 46, 100—111
— монохромное 99, 100
— хромосом 93, 111
Окуляр
— демонстрационный 10
— измерительный 12
— компенсационный 12, 28
— окуляр-микрометр 28—30
Оплодотворение у растений 78
Опыление 47
Органоиды 37
Органогенез 78, 79
Осветитель
— встроенный 19
— вынесенный 18, 19
— накладной 19
Ослабитель для негативов 34
Партеногенез 83
Пахитенный анализ 76
Перикарп 82
Перисперм 78
Пестик 65
Плазматическая мембрана 27, 56
Плазмодесмы 37
Пластиды 37
— амилопласты 37
— каратиноидопласты 37
— лейкопласты 37
— хлоропласты 39
Плод растений 82
Половая хромосома 43
Полиады 75
Поливалент 72, 74, 75
Полиплоидия 63, 139—146
— автоплоидия 139
— аллоплоидия 69, 140
— анеуплоидия 75
— гаплоидия 82
— эуплоидия 69
Полирибосомы 38
Политения 53
Полиэмбриония 82
Половое размножение 58—75
Поры
— растительных клеток 37
— пыльцевого зерна 145
— ядерные 40
Правило подбора окуляра 17
Праймер(ы) 118, 120, 121
Принцип Келера 9, 19, 20, 32
Проростки растений 103
Профаза I мейоза 58—61
Профаза II мейоза 61
Профаза митоза 45, 49—51
Проявитель 32, 33
Пыльники 62, 97, 100, 155
Пыльцевая трубка 77, 82, 158
Пыльцевые зерна 65, 80, 155—161
Радиоавтография 102, 112
Радиоактивные изотопы 112
Районы ядрышкового организатора 40
42
Револьверное устройство 10, 13
Редукционное деление 62—65
Рекомбинация 68—70, 72
Репарация 50
Репликация 50, 58
Рибосомная РНК (рРНК) ПО, 135
Рибосомы 38
Световая микроскопия 9—36
Селекция 139, 140
Семя 78
Семядоли 78
Синапсис 69
Синаптонемный комплекс 58—60
— боковой элемент 60
— центральный элемент 60
Синергиды 63, 83
Соляная кислота 94, 97, 104
Спермии 65, 82, 155
Споры 61
Сферосомы 37
184
Теломера 41,42
Телофаза I мейоза 61
Телофаза II мейоза 61
Телофаза митоза 49, 51
Тетрада
— макроспор 66
— микроспор 62
Транслокация 149
Унивалент 69, 70
Упаковка ДНК 43—45
Урацил 112
Фазы мейоза см. — Мейоз
Фазы митоза см. — Мейоз
Фиксаж для пленок 32, 33
Фиксатор 86—92
Фиксирование изображения объектов
— видеосъемка 36
— рисование 30
— фотографирование 30—35, 109
Флуоресцентная гибридизация in situ
FISH 113
Флуоресценция 26—28
Флуорохром 111
Фокусирование 126
Фотобумага 32, 109
Фотопленка 32, 109
Хиазма 61
— частота хиазм 70
Хлоропласт 37
Холодовая обработка 84—86
Хроматиды 58, 72, 75, 147
Хроматин 40, 43—45, 102—111
— гетерохроматин 43
— эухроматин 43
Хромомеры 43, 45, 53
Хромонемы 45
Хромосома 40—48
А-хромосомы 45
— акроцентрические 41
— аутосомы 43, 45
— гомеологичные 48, 72
— гомологичные 42
— добавочные, В-хромосомы 45
— метацентрические 41, 46
— основные 45
— петельная организация 45
— полигонные 53, 54, 151, 152
— половые 43
— спутничные 42, 48
— субакроцентрические 41, 46
— субметацентрические 41, 46
— телоцентрические 41, 46
Хромосомные перестройки 147—150
Хромосомный набор 45, 46
Целлюлоза 27
Центромера 40, 41, 147—150
Центромерный индекс 41
Циклин 54, 55
Циклин-зависимые киназы 54, 55
Цитокинез 50, 55
Цитоплазма 37, 155
Цитоплазматический матрикс 37
Цитоскелет 39
Цитостатики 52
Экспозиция при микрофотографии 32
Эндомитоз 53
Эндоплазматический ретикулум 39
Эндосперм 78
Эукариоты 51
Эухроматин 43
Ядерная оболочка 40, 50
Ядро 40, 155
Ядрышко 40
Ядрышковый организатор 40, 42, НО
Яйцеклетка 68, 78
13 В. А. Пухальский и др.
ЛИТЕРАТУРА
Атабекова А. И., Устинова Е. И. Цитология растений. — М.: Агропромиздат
1987.
Бадаев Н. С., Бадаева Е, Д., Большева Н. Л., Зеленин А. В. Идентификация хро-
мосом А- и D- геномов пшеницы с использованием замещений и перестроек меж-
ду гомеологами у пшениц и тритикале // Докл. АН СССР. — 1983. — Т 273 —
С. 994-996.
Большева Н. Л,, Бадаева Е. Д., Курочкина А. И., Бадаев Н. С. Сравнение диффе-
ренциально окрашенных хромосом у двух родственных форм ржи // Генетика. —
1984. - Т 20. — С. 2025—2030.
Босток К., Самнер Э. Хромосома эукариотической клетки. — М.: Мир, 1981. —
598 с.
Дарлингтон С. Д., Лакур Л. Ф. Хромосомы. Методы работы. — М.: Атомиздат,
1980.
Дубинин Н. П. Избранные труды. Т. 2. Радиоционный и химический мутаге-
нез. — М.: Наука, 2000.
Жученко А. А., Король А. Б. Рекомбинация в эволюции и селекции. — М.: На-
ука, 1985.
Зеленин А. В., Бадаева Е. Д., Бадаев Н. С. Хромосомный анализ злаков. Теоре-
тические и прикладные аспекты // Генетика. — 1987. — Т. 23. — № 10 — С 1749—
1761.
Зурабишвили Т. ГИорданский А. Б., Бадаев Н. С. Поликариограммный анализ
и исследование дифференциальной окраски хромосом Triticum aestivum L. // Докл.
АН СССР. - 1974. -Т. 218. - Вып. 1. - С. 207-210.
Идентификация хромосом ячменя в соответствии с генетической номенклату-
рой хромосом пшеницы / О. В. Муравенко, Н. С. Бадаев, Е. Д. Бадаева и др. //
Доклады АН СССР. — 1986. — Т. 288. — В. 3. — С. 724—727.
Использование тетраплоидных тритикале для идентификации хромосом Л-ге-
нома пшеницы / Н. И. Дубовец, Е. Д. Бадаева, Н. С. Бадаев и др. // Генетика. —
1987. - Т. 23. - Вып. 4. - С. 693-697.
Кариотипический анализ различных генотипов кукурузы / Е. К. Савченко,
Е. Д. Бадаева, Е. В. Бойко и др. // Генетика. — Т. 22. — № 1. — С. 95—101.
Маниатис Т., Фрич Э., Самбрук Дж. Методы генетической инженерии. Моле-
кулярное клонирование. — М.: Мир, 1984. — 479 с.
Мюнтцинг А. Генетика. — М.: Мир, 1967.
186
Нанушъян Е. P.f Болъшева Н. Л», Бадаев Н. С., Тихомиров В. Н. Дифференциаль-
ное окрашивание хромосом Heracleum sibiricum L. с помощью С-метода // Вестник
Московского университета. Биол. Науки. — 1985. - № 5. - С. 72—75.
Рейвн П., Эверт Р, Айкхорн С. Современная ботаника. В двух томах. — М/
Мир, 1990.
Паушева З.П. Практикум по цитологии растений. 4-е изд. — М.: Агропромиз-
дат, 1988.
Поддубная-Арнолъди В. А. Цитоэмбриология покрытосеменных растений. —
М.: Наука, 1976.
Пухалъский В. А., Соловьев А. А., Юрцев В. Н. Цитология и цитогенетика расте-
ний. — М.: Изд-во МСХА, 2004.
Саматадзе Т. Е, Муравенко О. В., Климахин Г. И., Зеленин А. В. Изучение
внутривидового полиморфизма по рисунку С-окрашивания хромосом Matricaria
chamomilla L. (syn. M. recutita L.) // Генетика. — 1997. — T. 33. - № 5. - С. 130—132.
Световая микроскопия в биологии. Методы / Под ред. А. Лейсли — М • Мип
1992. ч ’ ” •
Семенов В. М., Семенова Е. В. Дифференциальная окраска хромосом Zingeria
biebersteiniana (Claus) Р. Smim. в митозе и мейозе // Изв. Сиб. отд. АН СССР 15.
Сер. биол. — 1975. Вып. 3. — С. 80—84.
Смирнов В. Г. Цитогенетика. — М.: Высшая школа, 1991.
Справочник по ботанической микротехнике. Основы и методы / Р. П. Барыки-
на, Т. Д. Веселова, А. Г. Девятов и др. — М.: Изд-во МГУ, 2004.
Тихонович И. Т, Дифференциальная окраска метафазных хромосом ржи. Вест-
ник Ленинградского ун-та. Сер. биол. — 1974. Т. 21. — № 4. — С. 70—73.
Хромосомные числа цветковых растений. — Л.: Наука, 1969.
Ченцов Ю. С. Введение в клеточную биологию. — М.: ИКЦ «Академкнига»
2005.
Ченцов Ю, С. Общая цитология. — М.: Изд-во МГУ, 1984.
Щапова А. И, Дифференциальная окраска хромосом растений. 1. Secale
cerealeL, // Цитология. — 1974. — Т. 16. — С. 370—372.
Щапова А, И., Баутина Т. А. Дифференциальная окраска хромосом ржи и пше-
нично-ржаного амфидиплоида. // Изв. Сиб. отд. АН СССР. 10, Сер биол —
1974. - Т. 10. - Вып. 2. - С. 134—136.
Эмбриология растений. В двух томах. — М.: Агропромиздат, 1990.
Эмбриологические основы андроклинии пшеницы / Н. Н. Круглова, Т. Б. Баты-
гина, В. Ю. Горбунова и др. — М.: Наука, 2005.
Эмбриология цветковых растений / Под ред. Т. Б. Батыгиной. В трех томах. —
СПб: Мир и Семья, 1994—2000.
Юрцев В. Н., Пухалъский В. А, Методическое руководство к лабораторно-прак-
тическим занятиям по цитологической и эмбриологической микротехнике. — М.:
Колос, 1968.
Ячевская Г. Л., Иванова С. В., Наумов А. А. Особенности мейоза при отдален-
ной гибридизации. — М.: Изд-во МСХА, 1990.
Ambros Р. F., Matzke М. A., Matzke A, J. М., 1986. Detection of a 17-kb unique
sequence (T-DNA) in plant chromosomes by in situ hybridization. Chromosoma 94:
11-18.
187
Anamthawat-Jonsson K.t Schwarzacher T, Leitch A. R., Bennett M. D., Heslop-
Harrison J. S., 1990. Discrimination between closely related Triticeae species using
genomic DNA as a probe. Theor. Appl. Genet. 79: 721—728.
Appels R., Driscoll C.r Peacock W. J., 1978. Heterochromatin and highly repeated
DNA sequences in rye (Secale cereale). Chromosoma 70 (1): 67—89.
Appels R., Gerlach W.L., Dennis E.S., Swift H., Peacock J., 1980. Molecular and
chromosomal organization of DNA sequences coding for the ribosomal RNAs in cereals.
Chromosoma, 78: 293—311.
Arrighi F. E.f Hsu T. C., 1971. Localization of heterochromatin in human
chromosomes. Cytogenetics 10: 81— 86.
Badaev N. S.f Badaeva E. D., Bolsheva N. L., Maximov N, G., Zelenin A. V., 1985.
Cytogenetic analysis of forms produced by crossing hexapioid triticale with common
wheat. Theor. Appl. Genet. 70: 536—541.
Badaeva E. D., Badaev N. S., Gill B. S., Filatenko A. A., 1994. Intraspecific karyotype
divergence in Triticum araraticum. Plant Syst. Evol. 192 (1): 117—145.
Badaeva E. D., Friebe B., Gill B. S., 1996. Genome differentiation in Aegilops.
1. Distribution of highly repetitive DNA sequences on chromosome of diploid species.
Genome 39 (2): 293-306.
Badaeva E. D.f Friebe B., Gill B. S., 1996л. Genome differentiation in Aegilops.
2. Physical mapping of 5S and 18S—26S ribosomal RNA gene families in diploid species.
Genome 39 (6): 1150—1158.
Bedbrook R. J., Jones J., O'Dell M., Thompson R. J., Flavell R. B., 1980. A molecular
description of telomeric heterochromatin in Secale species. Cell 19: 545—560.
Bennett M. D., Gustafson J. P., Smith J. B., 1977. Variation in nuclear DNA in the
genus Secale. Chromosoma 61 (1): 149—176.
Brady T, Clutter M.E., 1972. Cytolocalization of ribosomal cistrons in plant polytene
chromosomes. J. Cell Biol. 53 (3): 827—832.
Busch W., Martin R., Herrmann R. G., 1994. Sensitivity enhancement of fluorescence
in situ hybridization on plant chromosomes. Chromosome Res. 2: 15—20.
Cullis C. A., Schweizer D., 1974. Repetitious DNA in some Anemone species.
Chromosoma 44 (4): 417—421.
Darvey N. L.t Gustafson J. P.f 1975. Identification of rye chromosomes in wheat-rye
addition fines and Triticale by heterochromatin bands. Crop. Sci. 15: 239— 243.
Deumling B.f Greilhuber J.t 1982. Characterization of heterochromatin in different
species of the Scilla siberica group (Liliaceae) by in situ hybridization of satellite DNAs
and fluorochrome banding. Chromosoma 84 (4): 535—555.
Doerschug E. B.f 1976. Placement of the genes for ribosomal RNA within the
nucleolar organizing body of Zea mays. Chromosoma 55: 43—56.
Dobel P.f Rieger R.t Michaelis A., 1972. The Giemsa banding patterns of the standard
and four reconstructed karyotypes of Vicia faba. Chromosoma 43 (4): 409—422.
Dvorak JAppels R., 1982. Chromosome and nucleotide sequence differentiation in
genomes of polyploid Triticum species. Theor. Appl. Genet. 63: 349—360.
Dvorak J., Lassner M. W., Kota R. S., Chen К. C., 1984. The distribution of the
ribosomal RNA genes in the Triticum speltoides and Elytrigia elongata genomes. Can.
J. Genet. Cytol. 62: 628-632. : i \ । -
188
Durante M., Cionini P. G., Avanzi S., Cremonini R., D Amato F, 1977. Cytological
localization of the genes for the four classes of ribosomal RNA (25S, 18S, 5.8S and 5S) in
polytene chromosomes of Phaseolus coccineus. Chromosoma 60 (3): 269—282.
Endo T R., 1986. Complete identification of common wheat chromosomes by means
of the C-banding technique. Jpn. J.Genet. 61: 89—93.
Endo T. R.f Gill B. S., 1983. Identification of wheat chromosomes by N-banding. In:
Sakamoto S. (Ed): Proc. 6th Int. Wheat Genet. Symp., Kyoto, Japan, 1983. p. 355—362.
Endo T. R. Gill B. S, 1984. Somatic karyotype, heterochromatin distribution, and
nature of chromosome differentiation in common wheat, Triticum aestivum L. em Thell.
Chromosoma 89: 361—369.
Filion G., 1974. Differential Giemsa staining in plants. I. Banding patterns in
three cultivars of Tulipa. Chromosoma 49: 51— 60.
Friebe B., Tuleen N,f Jiang, J., and Gill B.S. 1993. Standard karyotype of Triticum
longissimum and its cytogenetic relationship with T. aestivum. Genome 36: 731—742.
Friebe B., Gill B. S, 1996. Chromosome banding and genome analysis in diploid and
cultivated polyploid wheats. In: P. P. Jauhar (Ed): Methods in genome analysis in plants:
their merits and piffals. Boca RatiomCRC Press, pp. 39—60.
Fukui K„ Kamisugi Y., Sakai E, 1994. Physical mapping of 5S rDNA loci by direct-
cloned biotinilated probes in barley chromosomes. Genome 37 (1): 105—111.
Funaki K.t Matsui S., Sasaki M.r 1975. Location of nucleolar organizers in animal
and plant chromosomes by means of an improved N-banding technique. Chromosoma
49 (4): 357- 370.
Gall J. G.f Pardue M. L.f 1969. Formation and detection of RNA—DNA hybrid
molecules in cytological preparations. Proc. Natl. Acad. Sci. (U.S.A.) 63: 378—383.
Gerlach Ж 1977. N-banded kaiyotypes of wheat species. Chromosoma 62 (1):
49- 56.
Gill B. S., Kimber G., 1974. The Giemsa C-banded karyotype of rye. Proc. NatLAcad.
Sci. (U.S.A.) 71: 1247-1249.
Gill B. S., Kimer G., \974a. Giemsa C-banding and the evolution of wheat.
Proc.Natl. Acad. Sci. (U.S.A.) 71: 4086—4090.
Gill B. S., Friebe B., Endo T. R., 1991. Standard karyotype and nomenclature system
for description of chromosome bands and structural aberrations in wheat (Triticum
aestivum). Genome 34 (5): 830—839.
Gill K, S., Gill B, S., Snyder E. B.f 1988. Triticum araraticum chromosome sub-
stitutions in common wheat, Triticum aestivum cv. Wichita. In: Miller T.E., Koebner
R.M.D. (Eds): Proc. 7th Int. Genet. Symp., Cambridge, England, 13-19 July 1988.
Bath Press, Bath, pp. 87—92.
Giraldez R., Cermeno M. C., Orellana J.t 1979. Comparison of C-banding patterns in
the chromosomes of inbred lines and open pollinated varieties of rye, Secale cereale L. Z.
Pflanzenzucht. 83: 40—48.
Hennig W., Hennig I., Stein H, 1970. Chromosoma 32: 31—63.
Heslop-Harrison J. S.f Schwarzacher T.f 1996. Genomic southern and in situ
hybridization. In: P.PJauhar (Ed): Methods in genome analysis in plants: their merits
and piffals. Boca RatiomCRC Press, pp. 163—180.
Hsu T, C., Arrighi E. E, 1971. Distribution of constitutive heterochromatin in
mammalian chromosomes. Chromosoma 34: 243—253.
189
Hutchinson J,, Chapman V,, Miller T. E., 1980. Chromosome pairing at meiosis in
hybrids between Aegilops and Secale species: a study by in situ hybridisation using cloned
DNA. Heredity 45: 245-254.
Hutchinson J., Lonsdale D. M., 1982. The chromosomal distribution of cloned highly
repetitive sequences from hexapioid wheat. Heredity 48 (3): 371—376.
Iordansky Л. B., Zurabishvili T. G., Badaev N. S., 1978a. Linear differentiation of
cereal chromosomes. 1. Common wheat and its supposed ancestors. Theor. Appl. Genet.
51 (1): 145-152.
Islam А, К, M. R., 1980. Identification of wheat-barley addition lines with N-banding
of chromosomes. Chromosoma 76: 365—374.
Jewell D. C., 1979. Chromosome banding in Triticum aestivum cv. Chinese Spring
and Aegilops variabilis. Chromosoma 71 (1): 129—134.
Jewell D. C., 1981. Recognition of two types of positive staining chromosomal
material by manipulation of critical steps in the N-banding technique. Stain Technol. 56:
227.
Jiang J.t Gill B. S., 1993. Sequential chromosome banding and in situ hybridization
analysis. Genome 36: 792—795.
Jiang J., Gill B.S., 1994a. New 18S—26S ribosomal RNA gene loci: chromosomal
landmarks for the evolution of polyploid wheats. Chromosoma 103: 179—185.
Jiang J., Gill B.S.,\994b. Different species-specific chromosome translocation in
Triticum timopheevii and T turgidum support diphyletic origin of polyploid wheats.
Chromosome Res. 2: 59—64.
Jiang J., Gill B. 5., 1994c. Nonisotopic in situ hybridization and plant genome
mapping: the first 10 years. Genome 37 (5): 717—725.
John H., Bimsteil M. L., Jones K. W.t 1969. RNA—DNA hybrids at cytological levels.
Nature 223: 582-587.
Jones J. D. G.f Flavell R.B., 1982. The mapping of highly repeated DNA families and
their relationship to C-bands in chromosomes of Secale cereale. Chromosoma 86 (5):
595-612.
Jones J. D. G.f Flavell R. B., 1982a. The structure, amount and chromosomal
localisation of defined repeated DNA sequences in species of the genus Secale.
Chromosoma 86 (5): 613—641.
Kakeda K., Fukui K., Yamagata H, 1991. Heterochromatic differentiation in barley
chromosomes revealed by C- and N-banding techniques. Theor. Appl. Genet. 81 (2):
144-150.
King J. P.f Morgan И< G, Harper J. A., Meredith M. R., Jones R. N., and Tho-
mas H M.f 1997. Introgression mapping: a tool to integrate physical and genetics maps.
In: Physical Mapping of Plant Chromosomes. University of Wales, Aberystwyth, UK,
January 8—10, 1997. p. 7.
Langer-Safer P. R., Levine M., Ward D. C., 1982. Immunological method for
mapping genes on Drosophila polytene chromosomes. Proc. Natl. Acd. Sci (USA) 79*
4381-4385.
Lapitan N, L. V.f Gill B. S.f Sears R. G.f 1987. Genomic and phylogenetic relationships
among rye and perennial species in the Triticeae. Crop. Sci. 27 (4): 682—687.
Le H. T, Armstrong К. C., Miki B., 1989. Detection of rye DNA in wheat-rye hybrids
and wheat translocation stocks using total genomic DNA as a probe. Plant Mol. Biol
Rep. 7: 150-158.
190
Leitch I, J., Heslop-Harrison J. S., 1994. Detection of digoxigenin-labeled DNA
probes hybridized to plant chromosomes in situ. In: Protocols for nucleic acid analysis by
nonradioactive probes (Isaak P.G., Ed.). Methods in molecular biology 28, Humana,
Totowa, New Jersey, pp. 177—186.
Leitch I. J., Leitch A. R., Heslop-Harrison J. S., 1991. Physical mapping of plant DNA
sequences by simultaneous in situ hybridization of two differently fluorescent probes
Genome 34: 329-333.
Leitch A. R., Schwarzacher T., Jackson D., Leitch I.J., 1994. In situ hybridization: a
practical guide. Bios Scientific Publisher:Information Press LTD, Oxford, UK, 118 pp.
Lichter P., Tang C.-J. C., Call K., Hermanson G., Evans G. A, Housman D.,
WardD.C., 1990. High resolution mapping of human chromosome 11 by in situ
hybridization with cosmid clones. Science 247: 64—69.
Linde-Laursen I., 1975. Giemsa C-banding of the chromosomes of «Emir» barley.
Hereditas 81: 285-289.
Linde-Laursen I., 1985. Cytology and cytogenetics of Hordeum vulgare and some
allied species using chromosome banding technique. Riso R-529, 444 PP.
Lukaszewsky A., Gustafson J.P., 1983. Translocations and modifications of
chromosomes in triticale x wheat hybrids. Theor. Appl. Genet. 64: 239—248.
Manuelidis L., Langer, Safer P. R., Ward D. C., 1982. High-resolution mapping of
satellite DNA using biotin-labeled probes. J. Cell Biol. 95: 619—625.
Marks G. E., Schweizer D., 1974. Giemsa banding: karyotype differences in some
species of Anemone and Hepatica nobilis. Chromosoma 44 (4): 405—416.
Matsui S., Sasaki M., 1973. Differential staining of nucleolus organizers in
mammalian chromosomes. Nature 246: 148— 159.
Matsui S., 1974. Nucleolus organizer of Vicia faba chromosomes revealed by the N-
banding technique. Jpn. J. Genet. 49 (2): 93—96.
Merker A., 1973. A Giemsa technique for rapid identification of chromosomes in
Triticale. Hereditas 75 (2): 280—282.
Miller T. E., Gerlach W. L., Flavell R. B., 1980. Nucleolus organizer variation in
wheat and rye revealed by in situ hybridization. Heredity 45 (3): 377—382.
Mukai Y., Endo T. R., Gill B.S., 1990. Physical mapping of the 5S rRNA multigene
family in common wheat. J. Hered. 81: 290—295.
Mukai Y, Endo T. R., Gill B. S., 1991a. Physical mapping of the 18S.26S rRNA
multigene family in common wheat: Identification of a new locus. Chromosoma 100
71-78.
Mukai Y., Gill B. S, 1991. Detection of barley chromatin added to wheat by genomic
in situ hybridization. Genome 34: 448—452.
Mukai Y., Friebe B., Gill B. S., 1992. Comparison of C-banding patterns and in situ
hybridization sites using highly repetitive and total genomic rye DNA probes of
‘Imperial’ rye chromosomes added to ‘Chinese Spring’ wheat. Jpn. J. Genet. 67: 71—83.
Mukai Y, Nakahara Y., Yamamoto M., 1993. Simultaneous discrimination of the
three genomes in hexapioid wheat by multicolor fluorescence in situ hybridization using
total genomic and highly repeated DNA probes. Genome. 36: 489—494.
Mukai Y., 1995. Multicolor fluorescence in situ hybridization: a new strategy for
genome analysis. In: P. P. Jauhar (Ed): Methods in genome analysis in plants: their
merits and piffals. Boca Ration:CRC Press, pp. 39—60.
191
Pardue M. L., Gall J. G.f 1970. Chromosomal localization of mouse satellite DNA.
Science 168: 1356—1358.
Pardue M. L., Gall J. G.f 1975. Nucleic acid hybridization to the DNA of cytological
preparations. Methods Cell Biol. 10: 1—16.
Pinkel D., Straume T.t Gray J. W.t 1986. Cytogenetic analysis using quantitative,
highsensitivity, fluorescence in situ hybridization. Proc. Natl. Acad. Sci. (U.S.A.) 83:
2934-2938.
Ramirez S. A., Sinclair J. H., 1975. Ribosomal gene localization and distribution
(arrangement) within the nucleolar organiser region of Zea mays. Genetics 80: 505—518.
Raybum A. L., Gill B. S.f 1985. Use of biotin-labeled probes to map specific DNA
sequences on wheat chromosomes. J. Hered. 76: 78—81.
Raybum A. L., Gill B. S., 1985a. Molecular evidence for the origin and evolution of
chromosome 4A in polyploid wheats. Can. J. Genet. Cytol. 27 (2): 246—250.
Raybum A. L., Gill B. S., 1986. Isolation of a Z)-genome specific repeated DNA
sequence from Aegilops squarrosa. Plant Mol. Biol. Report. 4: 104—109.
Raybum A. L., Gill B. S., 1987. Molecular analysis of the D-genome of the Triticeae
Theor. Appl. Genet. 73: 85—388.
Ried T., Baldini A., Rand T. C., Ward D. C.f 1992. Simultaneous visualization od
seven different DNA probes using combinatorial fluorescence and digital imaging
microscopy. Proc. Natl. Acad. Sci. (U.S.A.) 89: 1388—1392.
Schwarzacher T., Leitch A. R., Bennett M. D., Heslop-Harrison J. S., 1989. In situ
localization of parental genomes in a wide hybrid. Ann. Bot. (London) 64: 315—324.
Schweizer D., 1973. Differential staining of plant chromosomes with Giemsa.
Chromosoma 40 (3): 307—320.
Schlegel R., Gill B. S., 1984. N-banding analysis of rye chromosomes and the
relationship between N-banded and C-banded heterochromatin. Canad. J.Genet. Cytol.
26 (6): 765-769.
Shang X. M., Jackson R. C., Nguyen H. T., 1988. Heterochromatin diversity and
chromosome morphology in wheats analyzed by HKG banding technique. Genome 30:
956-965.
Sharma N. P., Natarajan A. T.f 1973. Identification of heterochromatic regions in the
chromosomes of rye. Hereditas 74: 233—238.
Singer R. H.f Ward D. C.f 1982. Actine gene expression visualized in chicken muscle
tissue culture by using in situ hybridization with a biotinilated analog. Proc. Natl. Acad.
Sci. (U.S.A.) 79: 7331-7335.
Singh R. J.f Tsuchia T., 1982. Identification and designation of telocentric
chromosomes in barley by means of Giemsa N-banding technique. Theor. Appl. Genet.
64 (1): 13-24.
Sumner A. T.t 1972. A simple technique for demonstrating centromeric
heterochromatin. Exp. Cell Res. 75: 304—306.
Takehisi S., Utsumi S., 1973. Visualization of metaphase heterochromatin in Vicia
faba by the denaturation—renaturation Giemsa staining method. Experientia 29:
120-126.
Teoh S. B., Hutchinson J., 1983. Interspecific variation in C-banded chromosomes
of diploid Aegilops species. Theor. Appl. Genet. 65: 31—40.
192
Teoh S. В., Hutchinson J., Miller T. E., 1983. A comparison of the chromosomal
distribution of cloned repetitive DNA sequences in different Aegilops species. Heredity
51: 635-641.
Timmis J. N., Deumling B., Ingle J., 1975. Localisation of satellite DNA sequences in
nuclei and chromosomes of two plants. Nature (Lond.) 257: 152—155.
Verma S. C.f Rees H., 1974. Giemsa staining and the distribution of heterochromatin
in rye chromosomes. Heredity 32 (1): 118—121.
Vosa C. G., Marchi P., 1972. Quinacrine fluorescence and Giemsa staining in plants.
Nature New Biology 237: 191— 192.
Vosa C. G.f 1973. Heterochromatin recognition and analysis of chromosome
variation in Scilla sibirica. Chromosoma 43 (3): 269—278.
Wiegant J., Ried T.f Nederlof R. M., van der Ploeg M., Tankle H. J., Raap A. K., 1991.
In situ hybridization with fluoresceinated DNA. Nucleic Acids Res. 19: 3237—3241.
Wimber D. E., Steffensen D. M., 1970. Localization of 5S genes on Drosophila
chromosomes by RNA-DNA hybridization in situ. Science (N.Y.) 170: 639—641.
Wimber D. E.f Duffey P. A., Steffensen D. M., Prensky W., 1974. Localization of the
5S RNA genes in Zea mays by RNA—DNA hybridization in situ. Chromosoma 47 (4):
353-360.
Yasmineh W. G, Yunis J. J., 1970. Localization of mouse satellite DNA in
constitutive heterochromatin. Exp. Cell Res. 59: 69—75.
Yunis Z Z, Roldan L., Yasmineh W. G., Lee J. C., 1971. Staining of repetitive DNA in
metaphase chromosomes. Nature 231: 532— 534.
Yunis J. J., Yasmineh W. G, 1970. Satellite DNA in constitutive heterochromatin of
the guinea pig. Science 168: 263—265.
ОГЛАВЛЕНИЕ
От авторов......................................................... 3
Введение............................................................5
Глава 1. ОСОБЕННОСТИ РАБОТЫ С МИКРОСКОПОМ ПРИ ЦИТО-
ЛОГИЧЕСКИХ И ЦИТОГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЯХ................9
1.1. Устройство микроскопа и работа с ним в проходящем свете......9
1.2. Настройка освещения в микроскопе........................... 19
1.2.1. Настройка освещения в микроскопе с вынесенным осветителем .... 19
1.2.2. Настройка освещения в микроскопе со встроенным в основание
осветителем ............................................... 20
1.3. Правила работы с микроскопом................................20
1.4. Наиболее распространенные ошибки при работе с микроскопом....21
1.5. Меры безопасности при работе с микроскопом..................22
1.6. Метод светлого поля..........................................22
1.7. Метод темного поля...........................................23
1.8. Повышение контрастности препарата и метод фазового контраста.24
1.9. Метод флуоресцентной или люминесцентной микроскопии.........26
1.10. Использование других методов микроскопии ..................28
1.11. Измерение микроскопических объектов........................28
1.12. Фиксирование изображения...................................30
1.12.1. Микрофотография......................................30
1.12.2. Использование цифровых камер.........................34
1.12.3. Использование видеокамер для регистрации изображений.36
Глава 2. ОСНОВНЫЕ СВЕДЕНИЯ О РАСТИТЕЛЬНОЙ КЛЕТКЕ.
МИТОЗ..............................................................37
2.1. Строение растительной клетки................................37
2.2. Хромосомы, их типы и строение...............................40
2.3. Способы классификации хромосом. Цитологическая и генетическая
номенклатуры.....................................................45
2.4. Деление растительной клетки.................................48
2.5. Митотический индекс и продолжительность клеточного деления..51
2.6. Отклонения от типичного хода митоза....................... 53
2.7. Регуляция клеточного цикла..................................54
2.8. Апоптоз ....................................................56
194
58
Г л а в a 3. МЕИОЗ. РАЗВИТИЕ МУЖСКОГО И ЖЕНСКОГО
ГАМЕТОФИТОВ. ОПЛОДОТВОРЕНИЕ, РАЗВИТИЕ ЗАРОД]
И ЭНДОСПЕРМА............................
3.1. Мейоз.....................................................53
3.2. Микроспорогенез и развитие мужского гаметофита............62
3.3. Макроспорогенез и развитие женского гаметофита............65
3.4. Генетический контроль мейотического деления...............68
3.5. Мейоз у отдаленных гибридов...............................70
3.6. Пахитенный анализ хромосом................................76
3.7. Оплодотворение, развитие эндосперма и зародыша........... 77
3.8. Особенности размножения голосеменных растений.............80
3.9. Явление ксенийности.......................................82
3.10. Апомиксис.............................................. 82
Глава 4. ФИКСАЦИЯ ЦИТОЛОГИЧЕСКОГО МАТЕРИАЛА......................84
4.1. Подготовка материала к фиксации...........................84
4.2. Состав и применение наиболее распространенных фиксирующих
жидкостей.................................................. „..86
4.3. Техника фиксации и промывка материала от фиксаторов.......89
4.3.1. Последовательность операций при фиксации корешков
растений и прорастающих семян...............................90
4.3.2. Промывка зафиксированного материала и его сохранение.91
Глава 5. МЕТОДЫ ПРИГОТОВЛЕНИЯ ЦИТОЛОГИЧЕСКИХ
5.1. Временные препараты..................,.......................93
5.1.1. Окрашивание хромосом в корешках растений ацетокармином.93
5.1.2. Окрашивание хромосом в корешках растений ацетоорсеином.95
5.1.3. Окрашивание корешков ацетолакмоидом................... 95
5.1.4. Окрашивание ацетожелезогематоксилином..................96
5.1.5. Окрашивание реактивом Шиффа............................96
5.1.6. Гидролиз материала.....................................98
5.2. Приготовление постоянных препаратов..........................98
5.2.1. Перевод временных препаратов в постоянные..............98
5.2.2. Приготовление препаратов методом распластывания клеток.99
5.3. Монохромное окрашивание красителем Гимза....................100
5.4. Приготовление глицерин-желатиновых препаратов...............100
Глава 6. МЕТОДЫ ДИФФЕРЕНЦИАЛЬНОГО ОКРАШИВАНИЯ
ХРОМОСОМ.........................................................102
6.1. Метод С-дифференциального окрашивания хромосом..............102
6.2. Модификации метода С-дифференциального окрашивания..........103
6.2.1. Приготовление хромосомных препаратов..................103
6.2.2. Процедура С-дифференциального окрашивания хромосом....105
6.2.3. Работа с препаратами дифференциально окрашенных
хромосом......................................................106
6.2.4. Работа с фотографиями.................................109
6.2.5. Состав буферных смесей для С-бэндинга.................109
195
6.3. Метод N-дифференциального окрашивания хромосом.............ПО
6.3.1. Приготовление хромосомных препаратов..................ПО
6.3.2. Окраска хромосомных препаратов.......................111
6.3.3. Реактивы для N-бэндинга..............................111
Глава 7. МЕТОД ГИБРИДИЗАЦИИ IN SITU............................112
7.1. Последовательность и техника операций при гибридизации in situ.114
7.1.1. Выделение геномной ДНК (СТАВ-метод)................114
7.1.2. Выделение плазмидной ДНК...........................115
7.1.3. Мечение проб ДНК...................................118
7.1.3.1. Мечение проб с помощью ник-трансляции.......118
7.1.3.2. Мечение проб с помощью полимеразной цепной
реакции..............................................120
7.1.4. Очистка проб ДНК...................................122
7.2. Гибридизация проб на препаратах.........................122
7.3. Детекция сигналов гибридизации..........................125
7.3.1. Выявление сигналов гибридизации с помощью флуорохромов....126
7.3.2. Методы детекции биотинилированных зондов...........127
7.3.3. Детекция меченных дигоксигенином (диг-меченных) зондов....129
7.3.4. Детекция сигналов гибридизации с двумя различно мече-
ными пробами (Multicolor FISH)............................129
7.3.5. Окрашивание препаратов для FISH....................131
7.4. Выявление сигналов гибридизации с помощью ферментов... 133
7.5. Приготовление растворов для гибридизации in situ........135
7.5.1. Буферы общего назначения...........................135
7.5.2. Реактивы и буферы для выделения и очистки геномной ДНК....136
7.5.3. Буферы для электрофореза ДНК.......................137
7.5.4. Буферы для выделения плазмидной ДНК................137
7.5.5. Буферы для мечения и очистки проб..................138
7.5.6. Буферы для гибридизации in situ и детекции сигнала.138
Глава 8. МЕТОДЫ ПОЛУЧЕНИЯ И ИДЕНТИФИКАЦИИ ПОЛИ-
ПЛОИДНЫХ ФОРМ................................................. 139
8.1. Полиплоидия.............................................139
8.2. Методы получения полиплоидов различных растений с помощью
колхицина....................................................141
8.3. Методы идентификации полиплоидных растений..............145
Глава 9. ХРОМОСОМНЫЕ ПЕРЕСТРОЙКИ И МЕТОДЫ ИХ УЧЕТА....................147
9.1. Типы перестроек.............................................
9.1.1. Примеры хромосомных перестроек и механизмы их возник-
новения .....................................................
9.2. Анафазный метод подсчета хромосомных аберраций...........
9.3. Метафазный метод подсчета хромосомных аберраций..........
9.3.1. Приготовление препаратов для изучения метафазных
пластинок (на примере проростков пшеницы)......................
147
150
152
153
153
196
Глава 10. ФЕРТИЛЬНОСТЬ И ЖИЗНЕСПОСОБНОСТЬ ПЫЛЬЦЫ...............155
10.1. Фертильность пыльцы и методы ее оценки................155
10.1.1. Ацетокарминовый метод............................155
10.1.2. Йодный метод.................................... 156
10.2. Жизнеспособность пыльцы и методы ее оценки............156
10.2.1. Метод проращивания пыльцы во влажной камере
Ван-Тигема...............................................156
10.2.2. Метод Д. А. Транковского.........................157
10.2.3. Метод В. С. Шардакова............................158
10.2.4. Метод прижизненных красителей (по В. Н. Юрцеву)..159
пыльцы по степени активности сукцинатдегидрогеназы.......
10.2.6. Флуоресцентная микроскопия прорастающих пыльцевых
зерен в пестике..........................................
10.2.5. Метод П. И. Диакону для определения жизнеспособности
160
160
162
162
162
162
163
163
164
164
164
лава 11. ТЕМЫ ПРАКТИЧЕСКИХ ЗАНЯТИИ..........................
11.1. Темы практических занятий по курсу «Цитология».......
Тема 11.1.1. Правила работы с биологическими микроскопами.
Устройство микроскопа. Измерение микрообъектов.........
Тема 11.1.2. Методы исследований растительной клетки: темного
поля, фазового контраста, флуоресцентной микроскопии...
Тема 11.1.3. Фиксирование изображения: рисование, микрофото-
графия ................................................
Тема 11.1.4. Митотический цикл и фазы митоза у растительных
организмов.............................................
Тема 11.1.5. Приготовление временных давленых препаратов.
Определение митотического индекса......................
Тема 11.1.6. Приготовление временных препаратов и препаратов
политенных хромосом....................................
Тема 11.1.7. Перевод временных препаратов в постоянные.
Тема 11.1.8. Приготовление постоянных препаратов методом
«распластывания клеток»................................
Тема 11.1.9. Дифференциальное окрашивание хромосом растений
165
165
Тема 11.1.10. Мейоз, микроспорогенез, микрогаметогенез. Приго-
товление препаратов мейотических хромосом.......................165
Тема 11.1.11. Макроспорогенез и макрогаметогенез. Оплодотворение.
Развитие зародыша и эндосперма.................................166
Тема 11.1.12. Нарушения в мейозе при отдаленной гибридизации....166
Тема 11.1.13. Методы определения фертильности и жизнеспособности
семян...........................................................166
Тема 11.1.14. Косвенные методы определения плоидности растений..167
11.2. Темы практических занятий по курсу «Методы цитогенетики»......167
Тема 11.2.1. Методы предфиксационной обработки и фиксации
растительного материала.........................................167
Тема 11.2.2. Кариологический анализ с использованием монохром-
ного окрашивания........'.......................................168
Тема 11.2.3. Идентификация хромосом с использованием дифферен-
циального окрашивания...........................................168
197
Тема 11.2.4. Идентификация хромосомных перестроек с использо-
ванием дифференциального окрашивания...........................
Тема 11.2.5. Исследования мейотических хромосом. Геномный
анализ.........................................................
Тема 11.2.6. Исследования мейотических хромосом. Пахитенный
анализ хромосом................................................
Тема 11.2.7. Исследования мейотических хромосом. Анализ частоты
хиазм в диакинезе — метафазе I мейоза..........................
Тема 11.2.8. Исследования мейотических хромосом. Нарушения мейо-
тического деления у отдаленных гибридов........................
Тема 11.2.9. Молекулярная цитогенетика. Использование флуорес-
центной гибридизации in situ (FISH) для идентификации хромосом.
Тема 11.2.10. Молекулярная цитогенетика. Использование геномной
флуоресцентной гибридизации in situ (GISH) для идентификации
хромосом..............................................
Тема 11.2.11. Хромосомные аберрации. Метафазный и анафазный
методы учета хромосомных перестроек...................
168
169
169
169
170
170
170
171
Приложения172
Приложение 1. Краткий словарь цитогенетических и цитоэмбриологических
терминов.............................................................172
Приложение 2, Диплоидное число хромосом (2п) у разных видов растений.176
Приложение 3, Правила приготовления спиртов необходимой концен-
трации ............................................................ 179
Предметный указатель.................................................182
Литература...........................................................186
Учебное издание
Пухалъский Виталий Анатольевич,
Соловьев Александр Александрович,
Бадаева Екатерина Дмитриевна,
Юрцев Виталий Николаевич
ПРАКТИКУМ ПО ЦИТОЛОГИИ И ЦИТОГЕНЕТИКЕ
РАСТЕНИИ
Учебное пособие для вузов
Художественный редактор В. А. Чуракова
Компьютерная верстка Т. Я. Белобородовой
Компьютерная графика М. Л. Бухарева
Корректор 7 Д, Звягинцева
Сдано в набор 10.07.06. Подписано в печать 25.04.07. Формат 60x88 716-
Бумага офсетная. Гарнитура Ньютон. Печать офсетная.
Усл. печ. л. 12,25. Изд. № 05. Тираж 1000 экз. Заказ № 2648
ООО «Издательство «КолосС», 101000, Москва, ул. Мясницкая, д. 17.
Почтовый адрес: 129090, Москва, Астраханский пер., д. 8.
Тел. (495) 680-99-86, тел./факс (495) 680-14-63, e-mail: koloss@koloss.ru,
наш сайт: www.koloss.ru
Отпечатано с готовых диапозитивов
в ОАО «Марийский полиграфическо-издательский комбинат»
424002, г. Йошкар-Ола, ул. Комсомольская, 112
ISBN 978-5-9532*0449-3
9 '7859S3"2Q4491