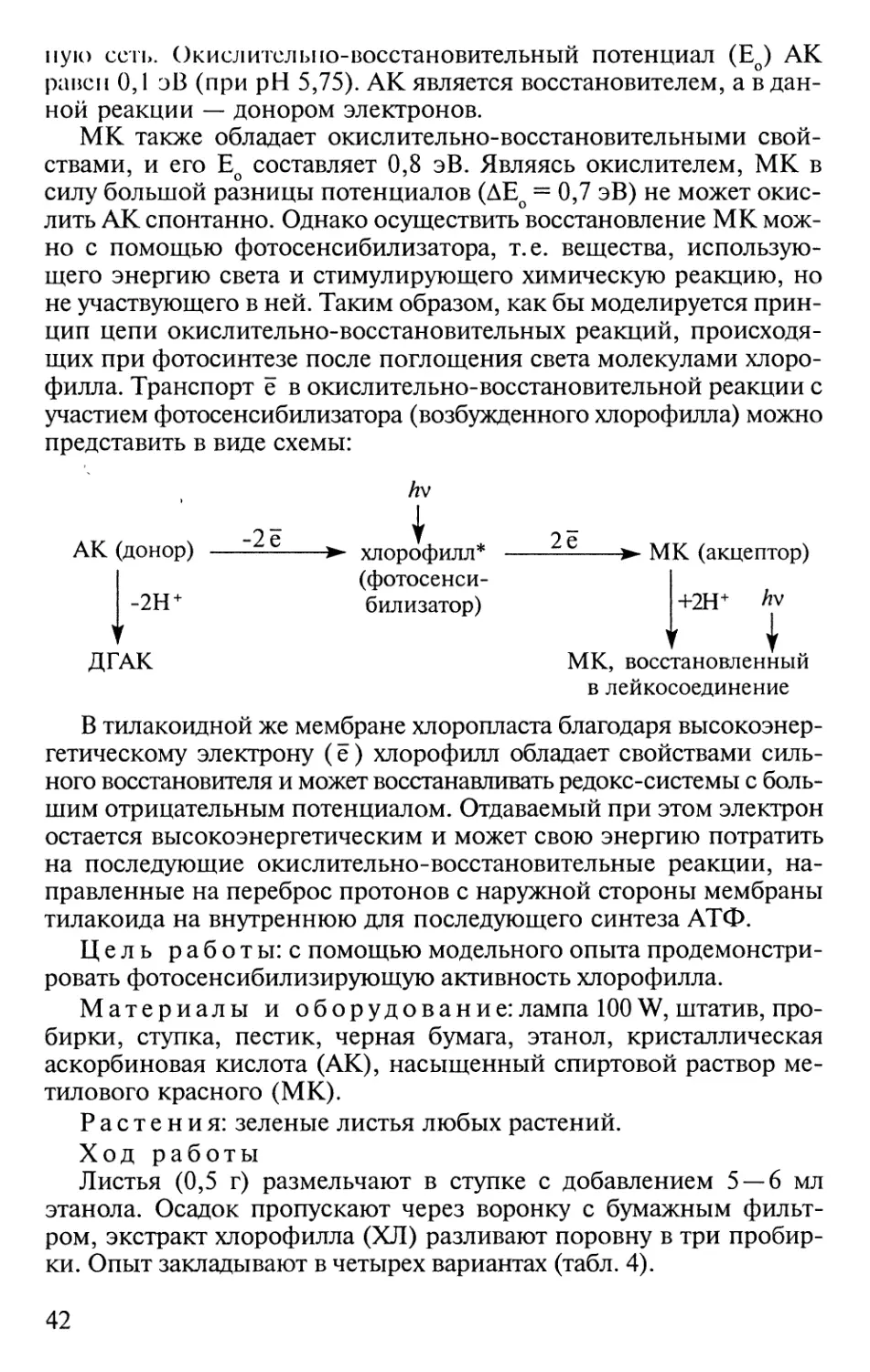
Author: Иванов В.Б.
Tags: зоология ботаника растения биология практикум физиология растений натуралистская биология серия высшее образование издательство academia
ISBN: 5-7695-0668-7
Year: 2001
ВЫСШЕЕ ОБРАЗОВАНИЕ
ПО ФИЗИОЛОГИИ
РАСТЕНИЙ
Под редакцией В. Б. Иванова
Рекомендовано
Учебно-методическим объединением вузов РФ по педагогическому
образованию в качестве учебного пособия для студентов
высших педагогических учебных заведений, обучающихся
по специальности 032400 — Биология
Москва
ACADEMA
2001
УДК 596(075.8)
ББК 28.57я73
П 69
Авторы:
В. Б. Иванов, И. В. Плотникова, Е.А.Живухина, О.Б.Михалевская,
М. А. Туленкова, Г. А. Кириллова, О.Г.Жиленкова
Рецензенты:
доктор биологических наук, профессор Т. И. Пузина,
доктор биологических наук, профессор Г. И. Сорокина
Практикум по физиологии растений: Учеб, пособие для студ.
П 69 высш. пед. учеб, заведений / И. В. Плотникова, Е.А.Живухи-
на, О. Б. Михалевская и др.; Под ред. В. Б. Иванова. — М.: Из-
дательский центр «Академия», 2001. — 144 с.
ISBN 5-7695-0668-7
Учебное пособие, предназначенное для студентов и преподавателей пе-
дагогических институтов и университетов России, содержит более 70 лабо-
раторных работ, которые позволяют составить представление о физиологи-
ческих процессах в растительном организме и методах их исследования.
Пособие может быть полезным и для учителей школ при проведении
лабораторных занятий, демонстрации опытов на уроках и факультативных
занятиях, а также в кружковой работе по биологии.
УДК 596(075.8)
ББК 28.57я73
ISBN 5-7695-0668-7
©Иванов В.Б., Плотникова И.В.,
Живухина Е.А. и др., 2001
© Издательский центр «Академия», 2001
От авторов
В настоящем учебном пособии представлены лабораторные ра-
но ы но физиологии растений для студентов институтов и универ-
ин нов по специальности 032400 — Биология. Разделы руковод-
• ша и подбор лабораторных работ определяются программой по
Физиологии растений той же специальности и новым поколением
I < X ’ ВПО 2000 г.
11редлагаемые работы по основным разделам курса физиологии
1>.к1сний будут содействовать лучшему и более глубокому усвое-
нию студентами учебного материала в целом и развитию у них
। норческих навыков для самостоятельной экспериментальной дея-
н hi,пости.
Авторы сочли необходимым сохранить работы, ставшие клас-
' нчсскими. Наряду с этим пособие включает оригинальные рабо-
II I, апробированные в течение многих лет на кафедре ботаники
МИГУ.
Отличительной чертой практикума является наличие простых и
н.нлядных опытов, которые могут быть поставлены учителями в
школе при изучении ботаники и общей биологии.
В предлагаемом пособии для студентов, в недалеком будущем —
учителей школы, есть работы, которые можно не только проде-
монстрировать учащимся, но и привлечь их к активному участию в
постановке и проведении эксперимента.
Авторы выражают глубокую благодарность заведующей лабора-
юрисй кафедры ботаники Ю. В. Авдеевой, а также Ю.Е.Подоль-
< кой, Я. Г. Авдееву и А. Ю. Хлупову за оказанную помощь при под-
юговке данной рукописи.
1. МЕТОДЫ ИССЛЕДОВАНИЯ
В данном разделе представлены наиболее часто применяемые в
работах практикума отдельные методы измерений, уточняются
понятия проба, вариант, повторность и др.
1.1. Однородность пробы
Проводить опыты, измерения, расчеты и статистическую обра-
ботку целесообразнее, если используемые пробы в основном од-
нородны. Методы достижения такой однородности очень разнооб-
разны, например, выращивание большого количества растений,
необходимых для опыта. Как правило, повторность при этом со-
ставляет 100—200 семян. Повторностей потребуется меньше, если
просеять пробу семян через сито. В любом случае ошибка не долж-
на превышать 1—2%.
Кроме того, для успешного планирования физиологических
опытов необходимо знание анатомии растений. Даже в культурах
тканей имеются нетипичные сосудистые элементы, которые ведут
себя иначе, чем основная масса тканей.
Для приготовления одинаковых срезов следует пользоваться
новыми лезвиями для безопасной бритвы, так как ножницы или
даже скальпель в значительной степени повреждают ткани. По воз-
можности следует использовать прочное режущее приспособление
с двумя или многими лезвиями. Лезвия можно закрепить на оди-
наковом расстоянии друг от друга в полой металлической трубке,
на деревянном или пластиковом бруске или ластике. Прекрасную
панель для нарезания представляет собой кусок парафина, так как
на нем не тупятся лезвия. Царапины от срезов на парафине можно
быстро устранить теплым (но не горячим) столовым ножом или
шпателем.
1.2. Выращивание проростков растений
Для опытов желательно отбирать сходные по виду и массе семе-
на определенного сорта с известными сроками сбора урожая и
всхожестью. Семена перед проращиванием необходимо простери-
лизовать, чтобы предохранить проростки от инфекции. С этой це-
лью используют 1 %-ный раствор перманганата калия или слабый
раствор формалина (1 мл на 300 мл воды) и др. После стерилиза-
4
пин семена отмывают водой и проращивают. Простсрилизовать
«ч-мена можно также облучением их ультрафиолетовым светом в
ic'icHiic 30 мин. Проращивание семян в чашках Петри — самый
прос той, доступный и используемый метод. На ее дно укладывают
«•оо । встствующего диаметра фильтровальную бумагу и равномерно
распределяют семена — от 7 до 100 штук. С наружной стороны
нижней чашки фломастером обозначают вариант опыта. Затем пи-
петкой вносят 10 мл раствора, закрывают крышкой, под которую
1акже укладывают влажную фильтровальную бумагу для создания
(юльшей влажности, и ставят в термостат при 26 °C. Большое ко-
личество проростков выращивают подобным же образом в кюве-
! ах, закрывая их крышками или куском стекла.
Метод «тряпичной куклы» удобен для выращивания пророст-
ков в течение более продолжительного времени и до стадии зеле-
нения листьев. На столе раскладывают пленку шириной 10— 15 см,
па нее укладывают фильтровальную бумагу, чистую ткань или сал-
«|>етки. На подложку с расстоянием 1,0—1,5 см друг от друга в
несколько рядов раскладывают семена. Пленку вместе с подлож-
кой и семенами скатывают в рулон, перевязывают бечевкой или
скрепляют круглой резинкой и помещают в стакан, наполненный
па 1/3 —1/4 водой. Стакан ставят в термостат с температурой 26 ° С.
Через определенное время проростки снимают с подложки и ис-
пользуют в опыте.
1.3. Варианты и повторности
От целей исследования зависит количество вариантов опыта.
Каждый вариант отличается от другого только одним параметром.
11апример, при изучении зависимости интенсивности фотосинте-
за от освещенности меняться должен только один параметр — ос-
вещенность; все остальные — температура окружающей среды,
влажность, минеральное питание и т.д. — должны быть абсолютно
одинаковыми. Каждый вариант опыта имеет несколько повторно-
стей — от 2 до 100 и более. При выполнении лабораторной работы
в связи с ограниченностью во времени число повторностей неве-
лико (2 — 3). При выполнении самостоятельной, курсовой, дип-
ломной работ число повторностей в опыте и число опытов должно
быть значительно больше, чтобы результат был достовернее.
1.4. Измерение длины и площади
При измерении линейной протяженности корней или побегов
или длины и ширины листьев, как правило, надо нанести на ис-
следуемый орган метки на определенном расстоянии. При доста-
5
точно прямых стеблях и отсутствии несущих листья узлов или если
их немного, проще всего воспользоваться дешевым пластмассо-
вым гребешком. Зубцы гребешков, изготовленных машинным спо-
собом, совершенно одинаковы, и, поскольку гребни делают раз-
ных размеров, можно иметь хороший набор шаблонов для марки-
ровки. Кончики зубцов гребешка прижимают к свежесмоченной
штемпельной подушке, затем к стеблю или корню. Чернила окра-
сят орган растения, и, если дать им высохнуть, они сохранятся и
после осторожного полива. Для нанесения более редких меток можно
взять кухонную яйцерезку. Ее проволочки смазывают чернилами,
а затем касаются ими растения. Промеры всегда должны произво-
диться по стандарту на протяжении всего исследования. Посколь-
ку растения часто погружены в субстрат на разную глубину, за
основу измерений можно взять длину стебля от семядольного или
первого узла. Диаметр стебля, который отражает его вторичное утол-
щение, следует замерять в строго определенном месте; обычно это
середина выбранного междоузлия. Точные измерения можно сде-
лать кронциркулем с микрометром.
Существует ряд методов измерения площади поверхности рас-
тения, причем все они имеют одинаковый уровень точности. Для
определения площади листа можно использовать весовой метод.
Он достаточно прост. В этом случае из бумаги вырезают контур
листовой пластинки и взвешивают на торсионных или аналити-
ческих весах. Из такой же бумаги вырезают три квадрата с опреде-
ленной площадью, например 100 см2 (10x10 см). Затем квадраты
взвешивают и вычисляют среднюю массу одного квадрата. Пло-
щадь исследуемого листа находят по формуле
S = (аС)/Ь,
где а — масса контура листа, мг; b — средняя масса квадрата бума-
ги, мг; С — площадь квадрата бумаги, см2.
Метод высечек наиболее доступный и продуктивный, что дела-
ет его особенно ценным в полевых опытах. Отбирают среднюю пробу
растений, быстро срезают листья и определяют их массу. Затем из
каждого листа сверлом определенного диаметра выбивают несколь-
ко высечек, объединяют вместе и устанавливают массу. Диаметр
сверла выбирают в зависимости от размеров листовой пластинки и
ее поверхностной плотности. Площадь листьев определяют по фор-
муле
5= (аС)/Ь,
rjss а — общая масса сырых листьев, г; b — общая масса сырых
высечек, г; С — общая площадь высечек, см2.
Недостатком метода является относительно невысокая точность.
Точные очертания контура быстро получают, обрызгав краской из
6
пульверизатора лист бумаги с прижатым к нему объектом измере-
ния. Нели исследуемый объект симметричен, его очертания можно
определить с помощью планиметра.
1.5. Определение массы
Н эксперименте проводят определение «сырой» и «сухой» массы.
I кипи сначала слегка просушивают фильтровальной бумагой, чтобы
уладить воду с поверхности, и затем сразу же взвешивают. По-
скольку вегетативные части растения по меньшей мере на 90%
состоят из воды, данные о массе сырого вещества отражают в ос-
новном содержание свободной воды в тканях. Масса сырого веще-
ства может сильно изменяться независимо от фактического роста
и увеличения биомассы, например в результате увядания, высо-
кой тургесцентности и т.д. Изменения в содержании воды можно
устранить путем отбора проб в строго определенное время суток
при одних и тех же условиях. Для стандартизации условий полезно
поливать растения за 3 — 5 ч до сбора образцов. Результаты рассчи-
1ывают в граммах (масса сырого вещества одного растения или
органа, например, лист, плод и т.д.).
При определении массы сухого вещества критическим момен-
юм является способ сушки тканей. При слишком низких температу-
рах нельзя полностью удалить всю воду, сушка отнимает слишком
много времени и может способствовать росту микроорганизмов. При
слишком высоких температурах можно обуглить ткани. Лучше всего
использовать сушильный шкаф под вакуумом с температурой 60 —
70 °C или с принудительной тягой с температурой порядка 90 —
105 °C. Следует убедиться, что вода удаляется полностью. Сушку ре-
комендуется проводить в течение 18—24 ч; если есть сомнения по
поводу степени высушивания пробы, ее следует взвесить, а затем
снова на некоторое время поместить в сушильный шкаф. Это на-
зывается доведением до постоянной массы. Результаты подсчиты-
вают так же, как и для массы на сырое вещество.
Можно пользоваться также и биохимическими критериями.
Прежде всего это общее содержание азота или белка в одном рас-
тении, органе или на единицу массы.
1.6. Инфильтрация тканей
Инфильтрация — это заполнение межклетников жидкостью.
Инфильтрацию проводят с помощью медицинского шприца. При
этом высечки из тканей растений (пластинка листа, срезы стебля
и т.д.) помещают в баллон шприца в воду или в вещество, кото-
рое надо закачать в межклетники. Отверстие канюли закрывают
указательным пальцем, наливают воду на 2/3 объема, закладыва-
7
ioi iii.i< I 'u.и и вставляют поршень. Затем перевертывают шприц
। .IHIOIB II вверх и, убрав палец, выгоняют из баллона воздух, вдви-
। ан поршень. После этого, плотно закрыв пальцем отверстие ка-
инит, оттягивают поршень вниз, в результате чего в баллоне по-
нижается давление. Поскольку высечки должны быть погружены в
воду, шприц резко встряхивают, одновременно отнимая палец от
канюли. Давление в баллоне шприца резко повышается, и в меж-
клетники высечек, погруженных в воду, загоняется вода — проис-
ходит инфильтрация. Повторяя операцию несколько раз, можно
добиться полной инфильтрации. Это легко обнаружить по потемне-
нию ткани высечек и по их однородному просвечиванию на свету.
Инфильтрованные высечки опускаются на дно. Иногда этого не
происходит из-за образовавшихся пузырьков газа на поверхности
высечек. Пузырьки легко удалить кисточкой или стеклянной па-
лочкой.
2. ФИЗИОЛОГИЯ КЛЕТКИ
2.1. Движение цитоплазмы
Движение цитоплазмы — характерная особенность живой рас-
тительной клетки, показатель активности процессов ее жизнедея-
тельности. Наиболее удобны для наблюдения за перемещением
клеточных органелл крупные клетки с большими вакуолями. Раз-
личают движение цитоплазмы спонтанное, постоянное и индуци-
рованное внешними факторами — изменением освещенности, тем-
пературы, химическими веществами, механическими воздействи-
ями и т. п. Движение цитоплазмы — один из наиболее чувствитель-
ных показателей жизнеспособности клетки. Многие даже незначи-
тельные воздействия останавливают или, наоборот, ускоряют его.
Движение цитоплазмы обеспечивает внутриклеточный и межкле-
точный транспорт веществ, перемещение органелл внутри клетки.
Оно выполняет, вероятно, и другие, пока еще неизвестные, функ-
ции. В его осуществлении участвуют элементы цитоскелета — мик-
рофиламенты. Источником энергии этого движения служит АТФ.
Цель работы: ознакомиться с методами обнаружения дви-
жения цитоплазмы и измерения его скорости.
Материалы и оборудование: микроскоп, настольная
лампа, термостат на 35 и 40 °C, предметные и покровные стекла,
секундомер, пинцет, препаровальная игла, фильтровальная бу-
мага, этанол.
Растения: элодея, валлиснерия, хара или нителла, цветки
традесканции с опушенными тычиночными нитями.
8
2.1.1. Наблюдение за движением цитоплазмы у разных объектов.
Ход работы
I. Элодея. Отрывают лист вблизи верхушки побега и кладут его в
। .шлю воды, взятой из сосуда с элодеей. Объект накрывают по-
кровным стеклом и рассматривают сначала при малом, затем при
большом увеличении. Лист элодеи состоит только из двух слоев
к исток, и каждый слой легко просматривается под микроскопом.
()брывание листа вызывает в его клетках движение цитоплазмы,
которое легко наблюдать по перемещению всех хлоропластов в
одном направлении вдоль клеточной стенки. Такое движение на-
вивается ротационным. В двух соседних клетках оно может проис-
ходить в разных направлениях — по часовой стрелке и против нее.
I (аиболее интенсивное движение можно увидеть в длинных узких
клетках средней жилки листа. У растений, находившихся перед
исследованием при слабом освещении или в темноте, движения
хпоропластов обычно не наблюдается. Неподвижные хлоропласты
располагаются под клеточными стенками параллельно поверхнос-
|ц листовой пластинки. Но если препарат выдержать несколько
минут, не снимая со столика микроскопа, при освещении, то дви-
жение появляется.
Хлоропласты начинают двигаться сначала медленно, затем бы-
ш рее и занимают положение вдоль боковых клеточных стенок,
расположенных перпендикулярно поверхности пластинки (пара-
с грофное).
Движение цитоплазмы в клетках элодеи можно обнаружить также
по перемещению более мелких, чем хлоропласты, органелл —
мелких бесцветных «зернышек», взвешенных в цитоплазме. Их пе-
ремещение легче всего обнаружить в краевых клетках листовой
пластинки, они легче просматриваются. В этих клетках значитель-
но меньше хлоропластов или они отсутствуют.
2. Валлиснерия. Такое же движение цитоплазмы, как и в клетках
элодеи, можно наблюдать в клетках листа водного растения вал-
лиснерии. Для этого от листовой пластинки острой бритвой отре-
зают небольшой кусочек, стараясь как можно меньше травмиро-
вать лист, помещают его в каплю воды и рассматривают под
микроскопом. Делать срезы с листа не рекомендуется, так как
клетки при этом сильно травмируются и движение в них оста-
навливается.
3. Нителла или хара. У всех харовых водорослей, характеризую-
щихся крупными клетками до 30—40 мм длиной, обычно наблю-
дается очень быстрое движение цитоплазмы, но хлоропласты в
этих клетках неподвижны. Для наблюдения лучше всего брать ку-
сочек водоросли с цельной мутовкой во избежание повреждения
отельных клеток. У нителлы каждая веточка мутовки образована
олной клеткой. У хары каждая веточка образована пучком клеток,
9
и только конец веточки заканчивается единичной клеткой, в ко-
торой наблюдается движение цитоплазмы. К целлюлозной оболоч-
ке непосредственно примыкает плотный и неподвижный слой
цитоплазмы, называемый эктоплазмой. В этом слое фиксированы
хроматофоры, которые по величине и форме очень похожи на хло-
ропласты высших растений. Они образуют один слой плотно при-
мыкающих друг к другу продольных или слегка косо расположен-
ных рядов. Между слоем эктоплазмы и вакуолью находится внут-
ренний жидкий слой цитоплазмы, так называемая эндоплазма. Слой
эндоплазмы постоянно находится в движении, течет. Его интен-
сивное движение можно обнаружить по перемещению отдельных
оторвавшихся хроматофоров, а также ядер и других органелл. Вдоль
всей длины клетки проходит узкая светлая полоса, расположен-
ная с некоторым наклоном к продольной оси клетки. Эта полоса,
так называемая индифферентная зона, представляет собой вырост
оболочки внутрь клетки. Внедрившаяся в цитоплазму оболочка раз-
двигает слой хроматофоров, благодаря чему и возникает светлая
полоска. С одной стороны от индифферентной зоны эндоплазма
течет в одну сторону, а с другой — в противоположную.
Движение цитоплазмы у нителлы и хары можно наблюдать при
малом увеличении микроскопа и даже под лупой. Поэтому эти ра-
стения особенно удобны для показа на уроке в школе при исполь-
зовании микроскопа с малым увеличением.
4. Волоски тычиночных нитей традесканции. Из цветка или из
еще не раскрывшегося бутона осторожно вынимают одну тычин-
ку, отделяют от нее пыльник, а нить с волосками кладут на пред-
метное стекло в каплю воды и осторожно накрывают покровным
стеклом, стараясь не раздавить волоски. Препарат рассматривают
сначала при малом, потом при большом увеличении микроскопа
с объективом х40. Каждый волосок представляет собой цепочку
клеток. Внутри всякой живой неповрежденной клетки происходит
постоянное движение цитоплазмы, которое обнаруживается по
перемещению мелких органелл в одном направлении. Особенно
хорошо это движение видно в тяжах цитоплазмы, пересекающих в
разных направлениях крупную вакуоль. Часто можно наблюдать,
как меняется расположение самого этого тяжа цитоплазмы. В по-
врежденных клетках движения нет и цитоплазма представлена в
виде сгустков.
Задание: сделать схематические рисунки клеток по всем рас-
смотренным объектам и стрелками указать направление движения
цитоплазмы. Отметить, наблюдалось ли движение сразу после приго-
товления препарата или оно менялось под действием освещения.
2.1.2. Определение скорости движения цитоплазмы. На одном из
препаратов, используемых в работе 2.1.1, определяют скорость
10
движения цитоплазмы: у элодеи и валлиснерии — по перемеще-
нию хлоропластов, у нителлы и хары — по движению отдельных
частиц, перемещение которых легко наблюдать вместе с током ци-
топлазмы. Определение ведется до и после воздействия повыше-
нием температуры, светом, раствором этанола. Выявить влияние света
или температуры можно, выдерживая препарат на ярком свету или
в термостате при температуре 35 и 40 °C в течение 5, 10 и 15 мин.
Ход работы
Для определения скорости движения цитоплазмы используют
секундомер и окулярную линейку, помещенную в окуляр микро-
скопа. С помощью секундомера отсчитывают время, в течение ко-
торого хлоропласт или другая движущаяся частица проходит рас-
стояние между двумя выбранными делениями окулярной линейки.
Такие измерения в одной и той же клетке проводят несколько раз.
По ним рассчитывают среднюю величину и среднюю скорость дви-
жения, которая выражается числом делений окулярной линейки,
пройденных движущейся частицей за 1 с. Если известна цена деле-
ния окулярной линейки при данном увеличении микроскопа, то
скорость движения можно найти, поделив величину расстояния в
микрометрах на число секунд, за которые движущаяся частица про-
ходит это расстояние (мкм/с).
Расстояние, которое проходит движущаяся частица, можно
определить и без окулярной линейки, оценивая его приблизитель-
но в долях диаметра поля зрения микроскопа. Диаметр поля зре-
ния при объективе х40 с окуляром х15 составляет 200 мкм, с
окуляром хК15 — 270 мкм, с окуляром хК7 — 900 мкм.
Измерения производят в одних и тех же клетках до и после
воздействия на них внешних факторов, которые могут сначала ус-
корять движение цитоплазмы, затем оно замедляется и даже оста-
навливается. Самым надежным способом стимуляции движения ци-
топлазмы является освещение клеток. При этом необходимо сле-
дить, чтобы освещение не приводило к перегреву клеток. Выдер-
живание препарата в термостате при температуре выше 40 °C, как
правило, ведет к прекращению движения цитоплазмы.
Задание: определить скорость движения цитоплазмы в вы-
бранном объекте до и после воздействия на него повышенной тем-
пературы (или другого фактора).
2.2. Свойства клеточных мембран
Наружная цитоплазматическая мембрана клетки (плазмалемма)
отделяет клетку от окружающей среды, контролирует транспорт
веществ в клетку и из клетки, первая воспринимает информацию
о внешней среде. Внутриклеточные мембраны обеспечивают про-
11
странственную упорядоченность многочисленных процессов, про-
текающих в клетке. Они создают изолированные пространства (ком-
партменты), в которых одновременно могут протекать противопо-
ложно направленные процессы. В мембраны встроено большое ко-
личество мультиферментных комплексов, транспортных систем,
рецепторных молекул, обеспечивающих протекание основных жиз-
ненных процессов.
Важнейшее свойство клеточных мембран — избирательная про-
ницаемость, благодаря которой через них проходят молекулы только
некоторых веществ. Это свойство может изменяться в зависимости
от процессов, протекающих в клетке. Избирательная проницае-
мость мембраны сохраняется до тех пор, пока клетка остается
живой. После ее гибели мембраны становятся полностью прони-
цаемыми.
Цель работы: изучить функциональные особенности мемб-
ран живых клеток.
Материалы и оборудование: микроскоп, предметные
и покровные стекла, стеклянная палочка, препаровальная игла,
скальпель или лезвие безопасной бритвы, пробирки, штатив для
пробирок, фильтровальная бумага, спиртовка или газовая горел-
ка, 30%-ный раствор уксусной кислоты, 1М раствор глюкозы,
1М раствор роданида калия, 1М раствор нитрата калия, 0,7 М
раствор нитрата кальция, 1М раствор карбамида.
Растения: корнеплод столовой свеклы, луковица лука реп-
чатого.
2.2.1. Сравнение проницаемости мембран живых и мертвых кле-
ток. В вакуолях клеток корнеплода столовой свеклы содержится бе-
тацианин — пигмент, придающий ткани корнеплода окраску. То-
нопласты живых клеток непроницаемы для молекул этого пиг-
мента. После гибели клеток тонопласт теряет свойство полупрони-
цаемости, становится проницаемым, молекулы пигмента выходят
из клеток и окрашивают воду.
Ход работы
Корнеплод свеклы после удаления покровных тканей разреза-
ют на кубики (сторона кубика 5 мм) и тщательно промывают во-
дой, чтобы удалить пигмент, вышедший из поврежденных клеток.
Затем по одному кусочку опускают в три пробирки. В первую и
вторую наливают по 5 мл воды, в третью — 5 мл 30 %-ного раство-
ра уксусной кислоты. Первую пробирку оставляют для контроля.
Содержимое второй кипятят 2—3 мин. Во второй и третьей про-
бирках, где клетки были убиты кипячением или кислотой, вода
окрашивается, а в первой пробирке остается неокрашенной.
Задание: выявить различия в проницаемости мембран живых
и мертвых клеток и сделать вывод о причинах этих различий.
12
2.2.2. Сравнение проницаемости клеточных мембран для различ-
ных веществ. Стойкий и временный плазмолиз. Избирательная про-
ницаемость мембран обеспечивает прохождение через них моле-
кул воды, препятствует проникновению растворенных в воде ве-
ществ и обусловливает явление плазмолиза при действии на клет-
ку гипертонического раствора. Если же молекулы растворенного
вещества через мембрану проходят, но медленнее, чем молекулы
воды, то начавшийся плазмолиз потом исчезает. Деплазмолиз про-
исходит в результате постепенного проникновения растворенного
вещества в клетку, выравнивания концентраций снаружи и внут-
ри, а также поступления воды в клетку из наружного раствора по
градиенту концентрации.
Ход работы
На два предметных стекла наносят по капле раствора: на одно —
1М раствор сахарозы, на другое — 1М раствор карбамида. В каж-
дую каплю помещают по листу элодеи, накрывают покровным
стеклом и рассматривают под микроскопом сначала при малом
(объектив х8), потом при большом увеличении (объектив х40).
Находят участки листа, в которых хорошо видны плазмолизиро-
ванные клетки. Отмечают время начала плазмолиза (начало на-
блюдения), зарисовывают плазмолизированные клетки и оставля-
ют препараты на 30 — 60 мин, затем вновь их рассматривают. В ра-
створе сахарозы плазмолиз в клетках сохранился, а в растворе кар-
бамида произошел деплазмолиз. В растворе сахарозы наблюдается
стойкий плазмолиз, а в растворе карбамида — временный. Причи-
ной деплазмолиза в растворе карбамида является проницаемость
клеточных мембран для ее молекул. Так как проницаемость для
карбамида меньше, чем для воды, то вода из клетки выходит бы-
стрее, чем в нее входит мочевина. Это и вызывает плазмолиз, ко-
торый потом исчезает при увеличении в клетке концентрации кар-
бамида и поступлении воды.
Задание: описать работу, зарисовать плазмолизированные и
деплазмолизированные клетки и сформулировать выводы.
2.2.3. Влияние ионов калия и кальция на форму плазмолиза. В ходе
плазмолиза форма плазмолизированного протопласта меняется.
Вначале протопласт отстает от клеточной стенки лишь в отдель-
ных местах, чаще всего в уголках. Плазмолиз такой формы называ-
ют уголковым. Затем протопласт продолжает отставать от клеточ-
ных стенок, сохраняя связь с ними в отдельных местах, поверх-
ность протопласта между этими точками имеет вогнутую форму.
На этом этапе плазмолиз называется вогнутым. Постепенно прото-
пласт отрывается от клеточных стенок по всей поверхности и при-
нимает округлую форму. Такой плазмолиз носит название выпук-
лого. А если у протопласта связь с клеточной стенкой в отдельных
13
местах сохраняется, то при дальнейшем уменьшении объема в ходе
плазмолиза протопласт приобретает неправильную форму. Такой
плазмолиз носит название судорожного (рис. 1). Время, в течение
которого вогнутый плазмолиз переходит в выпуклый, позволяет
оценивать степень вязкости цитоплазмы.
Рис. 1. Формы плазмолиза:
1 — уголковый; 2— вогнутый; 5 — выпуклый; 4 — судорожный; 5— колпачковый
(я — цитоплазма; б — вакуоль)
При сравнении вязкости цитоплазмы в растворах солей калия и
кальция можно отметить, что ионы калия, проникая в цитоплаз-
му, повышают ее гидрофильность, уменьшают вязкость и способ-
ствуют ее быстрому отрыву от клеточной стенки. Поэтому в ра-
створах солей калия плазмолиз быстро принимает форму выпук-
лого. Ионы кальция, наоборот, повышают вязкость цитоплазмы,
увеличивают силы сцепления ее с клеточной стенкой, и плазмо-
лиз принимает форму судорожного плазмолиза.
Ход работы
На одно предметное стекло наносят каплю 1М раствора нитра-
та калия, на другое — 0,7 М раствора нитрата кальция. В обе капли
помещают по кусочку эпидермы лука, снятой с вогнутой поверх-
ности одной и той же чешуи луковицы, накрывают покровными
стеклами. Через 5—10 мин препараты рассматривают под микро-
скопом.
Задание: зарисовать формы плазмолиза, описать работу и сде-
лать выводы.
2.2.4. Наблюдение колпачкового плазмолиза в растворах нитрата
калия и роданида калия. При длительном нахождении клеток в ра-
створе нитрата калия (15 мин и более) цитоплазма набухает в уд-
линенных клетках, там, где протопласт не касается клеточных сте-
нок, образуются так называемые колпачки цитоплазмы. Такой плаз-
молиз носит название колпачкового (см. рис. 1). В еще большей сте-
пени набухание происходит в растворах роданида калия, в кото-
рых колпачки цитоплазмы образуются сразу же после начала плаз-
молиза. Колпачковый плазмолиз может свидетельствовать о раз-
ной проницаемости плазмалеммы и тонопласта для ионов калия.
14
Ионы калия, проникая через плазмалемму в цитоплазму, вызыва-
ют ее набухание. В вакуоль через тонопласт они не проходят. Объем
плазмолированной вакуоли не увеличивается и плазмолиз сохра-
няется.
Ход работы
На предметное стекло наносят каплю 1М раствора роданида
калия, помещают в нее кусочек эпидермы чешуи репчатого лука,
накрывают покровным стеклом и сразу рассматривают под микро-
скопом с объективом х40. Особенно четкая картина колпачкового
плазмолиза наблюдается при использовании эпидермы чешуи ок-
рашенного лука или верхней эпидермы неокрашенного лука, сня-
той с вогнутой поверхности чешуи луковицы и предварительно
окрашенной нейтральным красным.
Задание: сделать рисунок и сформулировать вывод о причине
появления колпачкового плазмолиза.
2.3. Выявление живых и мертвых клеток
В сельскохозяйственной практике и в научных исследованиях
часто возникает вопрос, касающийся состояния клеток растений:
живые они или нет? Состояние клеток можно определить по дви-
жению цитоплазмы и по их способности к плазмолизу в гиперто-
нических растворах. Для этой цели часто используют различные
красители. Красители, окрашенной частью которых служит анион
(кислотные красители), не проникают в живые клетки. Некоторые
основные красители, окрашенной частью которых является кати-
он, проникают в живые клетки, их называют витальными (при-
жизненными) красителями. Из витальных красителей для оценки
жизнеспособности клеток чаще всего используют нейтральный
красный (нейтральрот). Другой эффективный метод определения
жизнеспособности клеток — выявление в них ферментативной ак-
тивности, так как при гибели клеток все их ферменты теряют ак-
тивность.
Цель работы: ознакомиться с методами, позволяющими вы-
явить состояние растительных клеток с помощью их окрашивания.
Материалы и оборудование: микроскоп, предметные
и покровные стекла, часовые стекла, стеклянная палочка, препа-
ровальная игла, лезвие безопасной бритвы, пинцет, кусочки филь-
тровальной бумаги, спиртовка и газовая горелка, 0,1%-ный ра-
створ нейтрального красного в дистиллированной воде, 0,3 %-ный
раствор кислого фуксина, 0,3 %-ный раствор трифенилтетразолия
хлористого (ТТХ) в 0,87 %-ном растворе К^НРО^
Растения: луковица лука репчатого, проростки пшеницы,
кукурузы, почки с побегов деревьев.
15
2.3.1. Окрашивание живых и мертвых клеток нейтральным крас-
ным. Молекулы нейтрального красного не задерживаются в ци-
топлазме живой растительной клетки, а с участием аппарата Голь-
джи и тонопласта активно выделяются в вакуоль. Поэтому у живых
клеток краситель накапливается в вакуоли, а ядро и цитоплазма
остаются неокрашенными. У мертвых клеток, наоборот, цитоплаз-
ма и особенно ядро адсорбируют краситель, а в вакуолярном соке
он не задерживается. Поэтому у мертвых клеток ярко окрашивает-
ся ядро, в меньшей степени цитоплазма, а вакуоли остаются не-
окрашенными.
Для окрашивания используют водный раствор нейтрального
красного в концентрации 0,01 % с реакцией среды, близкой к нейт-
ральной. Этот раствор готовят непосредственно перед употребле-
нием: 0,1%-ный раствор нейтрального красного, приготовленно-
го в дистиллированной воде, разводят водопроводной водой.
Верхняя эпидерма чешуи лука очень удобна для получения пре-
паратов живой эпидермы, так как она легко отделяется от подсти-
лающей ткани без повреждения клеток. На вогнутой поверхности
чешуи луковицы лезвием безопасной бритвы делают надрезы в виде
небольших квадратиков. Уголок квадратика надрезанной эпидер-
мы захватывают пинцетом, легко снимают ее с чешуи и помеща-
ют в раствор красителя на часовое стекло или на предметное стек-
ло. Выдерживают в этом растворе 3 — 5 мин. Затем, накрыв препа-
рат стеклом, рассматривают его при малом, а потом при боль-
шом увеличении. Для обнаружения окраски под конденсор мик-
роскопа нужно ввести матовое стекло и усилить яркость освеще-
ния. Лучше использовать освещение от окна, а не от электричес-
кой лампочки.
При малом увеличении отчетливо видны розовые и розовато-
оранжевые вакуоли, накопившие краситель. Интенсивность их ок-
раски в соседних клетках может быть разной, так как клетки раз-
личаются по скорости накопления красителя. Отсутствие окраски
в цитоплазме и ядре этих клеток легко обнаружить при большом
увеличении.
Окрашенные клетки «убивают», подержав предметное стекло
над пламенем горелки до тех пор, пока под покровным стеклом не
начнут появляться пузырьки. Затем снова рассматривают препарат
под микроскопом.
После гибели клеток окраска их изменилась: ярко окрасилось
ядро, менее ярко — цитоплазма, расположенная тонким слоем
вдоль стенок, а в вакуолях окраска исчезла.
При воздействии на живые клетки эпидермы раствором крас-
ки, приготовленным на дистиллированной воде, pH которой ра-
вен 5,6 и ниже, чем у водопроводной воды, картина получается
иная: вакуоли живых клеток, цитоплазма и ядро также остаются
16
неокрашенными, окрашиваются только клеточные стенки. То же
самое наблюдается при окраске слегка поврежденных или травми-
рованных клеток при неосторожном снятии эпидермы.
2.3.2. Окрашивание живых и мертвых клеток кислым фуксином.
Срезы делают через зародыши наклюнувшихся семян кукурузы или
других злаков. Одну часть срезов убивают, поместив их в каплю
воды на предметное стекло и нагревая над пламенем горелки. За-
тем живые и мертвые срезы кладут в часовые стекла с 0,3 %-ным
раствором кислого фуксина на 15 мин, после чего промывают во-
дой, рассматривают под микроскопом и сравнивают их окраску.
Так как фуксин не является витальным красителем, то мертвые
клетки окрашиваются гораздо сильнее живых.
2.3.3. Использование солей тетразолия для выявления живых и
мертвых клеток. Соли тетразолия в окисленном состоянии бес-
цветны, а при восстановлении окрашиваются. Восстановление их
происходит с участием ферментов дегидрогеназ, которые активны
только в живых клетках. Поэтому восстановления тетразолия в мерт-
вых клетках, а значит, и появления окраски не происходит.
Восстановленные формы солей тетразолия (формазаны) — ин-
тенсивно окрашенные соединения. Разные соли тетразолия (три-
фенилтетразолий хлористый — ТТХ, неотетразолий синий, нит-
росиний тетразолий и др.) при восстановлении приобретают раз-
ную окраску (красную, синюю, фиолетовую) в зависимости от
вида красителя и полноты восстановления. На воздухе формазаны
не окисляются, поэтому их удобно использовать для обнаружения
активности дегидрогеназ на срезах растительных тканей.
С выбранных объектов (зародыши наклюнувшихся семян, вер-
хушки побегов проростков, крупные почки древесных растений)
делают срезы лезвием безопасной бритвы. Срезы не должны быть
тонкими. Можно использовать также целые, не разрезанные кон-
чики корней длиной не более 2 — 3 см. Часть объектов «убивают»,
нагревая в воде над пламенем горелки. Живые и мертвые ткани
помещают в часовое стекло в 0,1%-ный раствор ТТХ, приготов-
ленный на 0,87 %-ном растворе К2НРО4, и выдерживают в течение
30 — 60 мин. Это время можно сократить, поместив часовое стекло
со срезами в термостат с температурой 30 —35 °C. У живых срезов
наблюдается окрашивание, особенно яркое в местах расположе-
ния меристематических тканей. У мертвых срезов такого окраши-
вания не происходит.
Задание: во всех опытах сравнить окраску живых и мертвых
клеток, сделать рисунки, сформулировать выводы о возможности
использования витальных красителей для выявления живых и мерт-
вых клеток.
17
3. ВОДНЫЙ ОБМЕН
3.1. Растительная клетка как осмотическая система
Вода растительными клетками поглощается по законам осмоса.
Перемещение молекул воды из внешней среды в клетку, а также
от клетки к клетке происходит по градиенту уровня свободной
энергии молекул воды, который определяется их химическим по-
тенциалом (pj. Точкой отсчета уровня свободной энергии молекул
воды берется ее уровень у молекул чистой воды в стандартных
условиях (ц“). Химический потенциал воды в водных растворах и
клетках меньше, чем у чистой воды. Эта разница, называемая вод-
ным потенциалом (v), отражает способность воды в данной систе-
ме совершать работу в сравнении с работой, которую при тех же
условиях совершала бы чистая вода. Водный потенциал рассчиты-
вается по уравнению
_ Ц1Г ~ ци.
Ни-
где Vw — парциальный мольный объем воды.
Водный потенциал определяет способность молекул воды диф-
фундировать, испаряться или поглощаться. Он имеет размерность
энергии, деленной на объем, что совпадает с размерностью дав-
ления (атмосферы, бары, паскали).
Молекулы растворенных в воде веществ снижают уровень
свободной энергии молекул воды. Это снижение измеряется
осмотическим потенциалом (уосм). Осмотический потенциал —
компонент водного потенциала раствора, который определя-
ется присутствием растворенных веществ, снижающих хими-
ческий потенциал воды. Поэтому уосм всегда величина отрица-
тельная. Если два раствора с разными концентрациями разде-
лить полупроницаемой мембраной, пропускающей только мо-
лекулы воды, но не пропускающей молекулы растворенных в
ней веществ, то молекулы воды будут перемещаться по гради-
енту у — из раствора с меньшей концентрацией, в котором
уосм выше (т.е. менее отрицательная величина), в раствор с боль-
шей концентрацией, в котором уосч ниже (т.е. более отрица-
тельная величина).
У молекул воды, находящихся под давлением, уровень свобод-
ной энергии повышается. Поэтому величина водного потенциала
раствора или клетки увеличивается при повышении в них гидро-
статического (тургорного) давления. Водный потенциал, зависи-
мый от гидростатического давления (величина всегда положитель-
ная), называется потенциалом давления (удавл).
18
Общий водный потенциал клетки (уо) зависит от осмотиче-
ского потенциала и потенциала давления (ждавл):
ш ш + ш
' кл ' осм ’ да вл
При помещении клетки в чистую воду последняя будет входить
в клетку до тех пор, пока 1итем в клетке не будет уравновешено
увеличивающимся удавл. Увеличение удавл происходит из-за сопро-
тивления клеточной стенки возрастанию объема протопласта при
поступлении в него воды.
Если клетку поместить в водный раствор, \|/осм которого будет
более отрицательным, чем то вода будет выходить из клетки в
этот наружный раствор. При этом будет уменьшаться из-за
уменьшения в клетке как уосм, так и удавл. Выход воды из клетки
будет происходить до тех пор, пока у у клетки и у наружного
раствора не сравняются.
3.1.1. Явление осмоса. Перемещение воды по градиенту водного
потенциала в искусственной «клеточке» Траубе. «Клеточка» Траубе —
модель клетки, предложенная исследователем Траубе. Ее получа-
ют, помещая кристаллик гексоцианоферрата (И) калия K4[Fe(CN6)]
в водный раствор CuSO4.
Вокруг кристаллика в результате взаимодействия солей образу-
ется осадочная мембрана гексоцианоферрата (II) меди:
K4[Fe(CN)6] + 2CuSO4= Cu2[Fe(CN)6] + 2K2SO4.
Эта мембрана проницаема только для молекул воды, но не для
растворенных в ней веществ, т. е. обладает свойством полупрони-
цаемости.
Цель работы: получить «клеточку» Траубе и пронаблюдать
явление осмоса — перемещение воды через полупроницаемую мем-
брану по градиенту осмотического потенциала.
Материалы и оборудование: 0,5%-ный водный раствор
CuSO4, кристаллы гексоцианоферрата (II) калия, пробирки или
цилиндры на 10 мл.
Ход работы
В небольшой цилиндр или пробирку наливают на 3/4 объема
0,5 %-ный раствор медного купороса и затем на дно этого сосуда
опускают кристаллик K4[Fe(CN)6].
Мембрана образует замкнутый мешочек, который автор опыта
Траубе назвал искусственной клеточкой. Полупроницаемая плен-
ка Cu2[Fe(CN6)] разделяет два раствора разной концентрации: внут-
ри мешочка находится концентрированный раствор ферроциани-
да калия (образующийся при растворении кристаллика соли), а
снаружи — раствор сульфата меди. Возникает ток воды внутрь ме-
19
точка, объем раствора ферроцианида калия увеличивается, в ре-
зультате чего мембрана растягивается. Будучи очень тонкой, мемб-
рана в отдельных местах разрывается под действием гидростати-
ческого давления. В этих местах соли снова взаимодействуют, воз-
никают новые участки мембраны, что приводит к неравномерно-
му увеличению размера мешочка. Мешочек будет расти, пока весь
кристаллик не растворится. Дальнейшее поступление воды в ме-
шочек приведет к разрыву пленки и она осядет в виде хлопьев на
дно стаканчика.
Задание: описать опыт, сделать рисунок, сформулировать вы-
вод о механизме перемещения воды через полупроницаемую мем-
брану.
3.1.2. Явление плазмолиза и деплазмолиза. Растительная клетка
похожа на искусственную «клеточку» Траубе, так как внутри нее
в вакуоли находится водный раствор различных веществ, окру-
женный тонопластом, плазмалеммой и слоем цитоплазмы между
ними. Все вместе они образуют полупроницаемую мембрану. Вода
может поступать в клетку или выходить из нее в зависимости от
величин водных потенциалов в клетке и в наружной среде. Сна-
ружи от полупроницаемой мембраны находится клеточная стен-
ка, которая проницаема для воды и растворенных в ней веществ
и не препятствует перемещению воды. Процесс выхода воды из
клетки и поступления ее в клетку через полупроницаемую мемб-
рану можно проследить, наблюдая явления плазмолиза и деплаз-
молиза. При помещении клетки в водный раствор какого-либо
вещества происходит плазмолиз — отхождение протопласта от
стенки клетки из-за уменьшения его объема вследствие выхода
воды из клетки в наружный раствор. После замены наружного
раствора на чистую воду последняя начинает поступать внутрь
клетки. Объем протопласта при этом увеличивается и происходит
деплазмолиз. После его завершения протопласт вновь заполняет
весь объем клетки.
Цель работы: доказать на основании явлений плазмолиза и
деплазмолиза, что клетка — это осмотическая система.
Материалы и оборудование: микроскоп, предметные
и покровные стекла, лезвие безопасной бритвы, препаровальная
игла, пинцет, 1 М раствор NaCl или сахарозы, вода.
Растения: луковица лука репчатого.
Ход работы
На предметное стекло наносят каплю раствора (NaCl или са-
харозы) и помещают в нее срез, сделанный с выпуклой стороны
живой чешуи луковицы. Можно также использовать эпидерму с
вогнутой стороны чешуи. В этом случае скальпелем или бритвой
непосредственно на чешуе предварительно разрезают кожицу на
20
квадратики. Затем пинцетом прихватывают квадратик за уголок и
снимают эпидерму с чешуи. Препарат накрывают покровным стек-
лом и рассматривают под микроскопом сначала при малом, а
потом при большом увеличении. Отхождение протопласта от кле-
точных стенок сначала происходит в клетках по краю среза, а
потом и в его середине. Затем, не снимая предметное стекло со
столика микроскопа, удаляют раствор из-под покровного стек-
ла, приложив к нему с одной стороны кусочек фильтровальной
бумаги. С другой стороны покровного стекла в непосредственной
близости к нему наносят каплю чистой воды, которая проникает
под стекло к рассматриваемой эпидерме. Наблюдают за измене-
ниями, происходящими в клетках. Вода поступает в клетку, в
сторону более концентрированного раствора. Это приводит к уве-
личению объема протопласта. В результате деплазмолиз сменяет
плазмолиз сначала в клетках по краю среза, а затем и в осталь-
ных; постепенно протопласт занимает прежнее постенное поло-
жение.
Задание: описать опыт, сделать рисунки и сформулировать
выводы.
3.1.3. Тургор растительной клетки. Поглощение воды и ее выход
из клеток корнеплода моркови. Поступление воды в растительную
клетку, помещенную в чистую воду, ограничено клеточной стен-
кой, растяжение которой не бесконечно. В клетке повышается гид-
ростатическое (тургорное) давление. Это увеличивает свободную
энергию молекул воды до уровня свободной энергии молекул чи-
стой воды, и водный потенциал клетки становится равным
нулю. Это полностью насыщенные водой клетки. Если клетки по-
местить не в воду, а в раствор какого-либо осмотика (поваренная
соль, сахароза и др.), то вода выходит из клеток и они теряют
тургор.
Сравнение клеток тургоресцентных и потерявших тургор удоб-
но провести в опыте с корнеплодом моркови.
Цель работы: продемонстрировать явление тургора на при-
мере поступления и выхода воды в клетках корнеплода моркови.
Материалы и оборудованием стакана, насыщенный
раствор NaCl, вода, нож.
Растение: корнеплод моркови.
Ход работы
Из середины корнеплода моркови вырезают, начиная с кончи-
ка корня, продольную полосу ткани шириной 8—12 мм и удаляют
ее. Две части корня остаются соединенными на протяжении при-
мерно 1/5 всей его длины (рис. 2). Обе части корнеплода помещают
в два стакана, стоящие рядом, в одном — насыщенный водный
раствор хлорида натрия, в другом — вода.
21
Рис. 2. Поглощение и выход воды из
клеток корнеплода моркови:
1 — корнеплод моркови; 2 — стакан с водой;
3 — стакан с раствором поваренной соли
Через 1,5 —2 ч корень извлекают из
стаканов, сравнивают размер и тургор
тканей в его половинах и делают вы-
вод о том, в каком из стаканов про-
изошел выход воды из тканей корня,
приведший к потере ими тургора.
Задание: сделать рисунок корнеп-
лода моркови и сформулировать вывод
о состоянии обеих его частей.
3.2. Определение водного потенциала растительных тканей
3.2.1. Определение величины осмотического потенциала в клетках
растительной ткани плазмолитическим методом. Этот метод осно-
ван на подборе наружного раствора известной концентрации, ос-
мотический потенциал которого будет равен осмотическому по-
тенциалу клеток. Такой раствор выбирают, наблюдая за степенью
плазмолиза, вызываемого в клетках исследуемой ткани раствора-
ми разных концентраций. Чем больше осмотический потенциал
наружного раствора по сравнению с осмотическим потенциалом
клеток, тем сильнее выражен плазмолиз, и наоборот. Задача сво-
дится к тому, чтобы найти два соседних по концентрации раство-
ра, в одном из которых можно наблюдать едва заметный уголко-
вый плазмолиз 50 % клеток, а в другом — отсутствие плазмолиза.
Первый раствор будет гипертоническим по отношению к раствору
внутри клеток, а второй — гипотоническим. Изотоническим по
отношению к раствору внутри клеток следует признать раствор,
концентрация которого будет средней между концентрациями двух
указанных выше растворов. Осмотический потенциал этого раствора
равен осмотическому потенциалу клеток. Тургорное давление в
клетках, помещенных в этот раствор, равно нулю, поскольку они
находятся в состоянии, предшествующем плазмолизу. Поэтому
способность поглощать воду определяется только их осмотическим
потенциалом.
Цель работы: ознакомиться с плазмолитическим методом
определения величины осмотического потенциала клеток.
Материалы и оборудование: 1М раствор хлорида на-
трия или сахарозы, дистиллированная вода, пробирки или ста-
канчики для приготовления растворов, предметные и покровные
22
стекла, фильтровальная бумага, лезвие безопасной бритвы, пин-
цет, стеклянная палочка, микроскоп, бюретки.
Растения: луковица лука репчатого.
Ход работы
Готовят по 10 мл растворов хлорида натрия (или сахарозы)
следующих концентраций: 0,1, 0,2, 0,4, 0,6, 0,8, 1М. Для этого
исходный 1М раствор разбавляют дистиллированной водой по схеме
(табл. 1).
Таблица 1
Схема приготовления растворов NaCl
Концентрация раствора, М 1М исходный раствор NaCl, мл Дистиллированная вода, мл
1,0 10 0
0,8 8 2
0,6 6 4
0,4 4 6
0,2 2 8
о,1 1 9
0 0 10
В седьмой стаканчик наливают дистиллированную воду. Для от-
меривания воды и раствора пользуются бюретками. Приготовлен-
ные растворы взбалтывают и закрывают крышечками. Стаканчики
этикетируют и ставят в один ряд по убывающей концентрации.
Против каждого из стаканчиков кладут чистые и сухие предмет-
ные стекла и переносят на них с помощью стеклянной палочки
капли растворов из соответствующих стаканчиков. Перед погруже-
нием стеклянной палочки в следующий раствор ее споласкивают
дистиллированной водой, тщательно вытирают фильтровальной
бумагой. В приготовленные капли помещают кусочки верхней эпи-
дермы чешуи луковицы. Для этого в средней части одной и той же
чешуи на ее вогнутой стороне лезвием бритвы надрезают эпидер-
му небольшими квадратиками. Затем пинцетом снимают находя-
щиеся рядом кусочки эпидермы, помещают их на предметные стек-
ла в заранее приготовленные капли разных растворов и накрывают
чистыми и сухими покровными стеклами. Вся процедура приго-
товления препаратов эпидермы должна проходить быстро, без за-
держек, чтобы избежать подсыхания капель растворов и кусочков
23
ткани, так как это может привести к изменению их водных потен-
циалов. Через 10—20 мин препараты просматривают под микроско-
пом, отмечая наличие или отсутствие плазмолиза. Делают рисунки
клеток с типичной для каждого раствора степенью плазмолиза.
Сильный плазмолиз показывает, что осмотический потенциал
внешнего раствора значительно ниже, чем осмотический потен-
циал клетки. Отсутствие плазмолиза может означать, что осмоти-
ческий потенциал раствора выше осмотического потенциала клетки
или равен ему. Выбирают такие два соседних по концентрации ра-
створа, в одном из которых наблюдается уголковый плазмолиз, а
в другом плазмолиза нет. Раствор со средней концентрацией меж-
ду концентрациями этих двух растворов будет изотоничен раство-
ру в клетке, т.е. его водный потенциал будет равен водному потен-
циалу клетки. Рассчитывают величину уосм этого раствора, исполь-
зуя уравнение Вант-Гоффа:
У™ = ~RTCi,
где R — газовая постоянная 0,0821 (л-атм)/(град-моль); Т — абсо-
лютная температура, градусы; С — концентрация в молях; / — изо-
тонический коэффициент, характеризующий степень гидролити-
ческой диссоциации растворенного вещества (см. приложение, табл.
IV) и для неэлектролитов равный 1. Для перевода величины вод-
ного потенциала, рассчитанного в атмосферах, в килопаскали по-
лученный результат нужно умножить на 101,3.
Задание: определить величину осмотического потенциала в
клетках эпидермы чешуи луковицы плазмолитическим методом.
3.2.2. Определение водного потенциала растительных тканей ме-
тодом Уршпрунга (по изменению длины брусочков ткани). Этот ме-
тод основан на подборе внешнего раствора известной концентра-
ции, водный потенциал которого окажется равным величине вод-
ного потенциала клеток тканей (утк). Водный потенциал внешнего
раствора определяется его осмотическим потенциалом (уосм). При
погружении полосок исследуемой ткани в раствор, уосм которого
меньше \|/тк, длина полосок ткани уменьшается. Если утк меньше
уосм раствора, то клетки поглощают воду из раствора, объем их
увеличивается и длина полосок ткани тоже увеличивается. Длина
полосок ткани остается без изменения в том растворе, у которого
уосм равен \|/тк-
Цель работы: познакомиться с методом определения вод-
ного потенциала ткани по Уршпрунгу.
Материалы и оборудование: 1 М раствор хлорида на-
трия, дистиллированная вода, бюретки, штативы для бюреток,
пробирки, нож для вырезания полосок ткани, линейки или мил-
лиметровая бумага.
24
Растения: клубни картофеля, корнеплоды репы, моркови.
Ход работы
В семи пробирках готовят по 20 мл растворов хлорида натрия
убывающей концентрации: 1,0; 0,8; 0,6; 0,5; 0,4; 0,3; 0,2 М, в вось-
мую наливают дистиллированную воду. Для приготовления раство-
ров пользуются бюретками. Исходный 1М раствор NaCl разбавля-
ют дистиллированной водой.
Из органа растения нарезают пластины толщиной 5—10 мм и
делят на одинаковые бруски шириной около 5 мм и длиной 40—70
мм. Длину каждого бруска точно измеряют с помощью линейки
перед его погружением в раствор и после выдерживания в растворе
в течение 40—50 мин. Результаты измерений записывают в таблицу 2.
Таблица 2
Влияние концентрации раствора на длину брусочков клубня картофеля
Концентрация растворов, М Первоначальная длина брусочков, мм Длина брусочков после пребывания в растворе, мм Изменение длины брусочков, мм
1,0
0,8
0,6
Констатируют, как изменилась длина брусочка в каждом ра-
створе. Выявляют тот раствор, в котором длина брусочка не изме-
нилась; уосм этого раствора оказался равным утк. Его величину рас-
считывают, используя уравнение Вант-Гоффа.
Задание: определить величину водного потенциала тканей клуб-
ня картофеля методом Уршпрунга.
3.2.3. Определение водного потенциала растительных тканей по
изменению концентрации внешнего раствора (по Шардакову). Метод
основан на определении изменения концентрации раствора после
выдерживания в нем исследуемых растительных тканей. Измене-
ние концентрации раствора можно определить разными метода-
ми: 1) по изменению показателя преломления раствора, измеряе-
мого с помощью рефрактометра и 2) по изменению плотности
раствора, измеряемого методом Шардакова.
Метод Шардакова основан на сравнении плотностей исходного
(контрольного) раствора с этим же раствором после выдержива-
ния в нем ткани. У раствора, не изменившего плотности, ц/осм ра-
вен уте.
25
Цель работы: ознакомиться с методом Шардакова и опре-
дслить водный потенциал кусочков ткани выбранных объектов.
Материалы и оборудование: 1М раствор хлорида на-
трия, дистиллированная вода, бюретки, штативы, пробирки,
пробочные сверла диаметром 5 мм, тонкая стеклянная палочка, пи-
петка с резинкой и оттянутым кончиком, мерная пипетка на 1 мл,
фильтровальная бумага.
Растения: клубни картофеля, корнеплоды репы, моркови,
листья разных растений.
Ход работы
В пробирках готовят по 10 мл растворов хлорида натрия следу-
ющих концентраций: 0,8; 0,6; 0,5; 0,4; 0,3; 0,2; 0,1 М. Мерной пи-
петкой переносят по 1 мл каждого из приготовленных растворов
в маленькие чистые и сухие пробирки, а оставшиеся растворы
являются контрольными. Объемы растворов, перенесенные в ма-
ленькие пробирки, должны быть строго одинаковы. Поэтому все
растворы нужно брать одной пипеткой, начиная с раствора са-
мой низкой концентрации и последовательно переходя к раство-
рам с большей концентрацией. После каждого раствора промы-
вать пипетку дистиллированной водой нельзя. Необходимо лишь
удалять из нее с помощью фильтровальной бумаги все остатки
предшествующего раствора. Благодаря этому объемы растворов в
маленьких пробирках будут одинаковы, а изменения их концент-
раций из-за использования одной и той же пипетки без ее про-
мывания и высушивания будут наименьшими. Для предотвраще-
ния испарения воды пробирки можно закрыть пробками. Затем
берут пробы тканей. Они должны быть одинаковыми, поэтому их
высекают сверлом диаметром не менее 5 мм из пластинки, выре-
занной из органа растения. Можно также сначала вырезать из него
пробочным сверлом столбик, который затем разрезать на диски
одинаковой толщины. При работе с тканями корня или клубня
диски делают толщиной 6 — 8 мм. Если объектом служит лист, то
для одной пробы берут по 4—6 дисков из листовой пластинки.
Все диски по мере возможности должны состоять из одинаковых
тканей.
Диски слегка обсушивают фильтровальной бумагой и опуска-
ют в маленькие пробирки с растворами, выдерживая их 20—30
мин. Затем ткани вынимают, а растворы подкрашивают метиле-
новым синим, для чего используют его интенсивно окрашенный
раствор, который переносят в пробирку тонкой стеклянной па-
лочкой. Переносить краску пипеткой не рекомендуется, так как
это может изменить плотность исследуемого раствора, в котором
были выдержаны высечки тканей. Плотность каждого из подкра-
шенных растворов сравнивают с плотностью исходных растворов
следующим образом: пипеткой с тонким оттянутым концом от-
26
бирают небольшую порцию подкрашенного опытного раствора.
Кончик пипетки опускают в большую пробирку с соответствую-
щим исходным раствором (примерно до его середины) и, слабо
нажимая на резинку, выпускают из пипетки небольшую капель-
ку раствора. Наблюдают за окрашенной каплей, которая в разных
растворах будет или всплывать, или опускаться, или останется
на месте. Результат наблюдений заносят в таблицу по следующей
форме:
Таблица 3
Изменение плотности растворов NaCl после выдерживания ткани
Концентрация раствора, М 0,2 0,3 0,4 0,5 0,6 0,8 1,0
Движение капли
Величину уосм рассчитывают, пользуясь уравнением Вант-
Гоффа.
Задание: определить и рассчитать величину водного потен-
циала тканей. Объяснить, в каких случаях капля подкрашенного
раствора будет всплывать, опускаться или оставаться на месте.
3.3. Наблюдение за движением устьиц
У замыкающих клеток устьиц стенки, прилегающие к устьич-
ной щели, утолщены, а наружные стенки тоньше. Неодинаковая
толщина стенок замыкающих клеток приводит к тому, что при
изменении тургора замыкающие клетки способны менять форму,
открывая или закрывая при этом устьичную щель. Следовательно,
степень насыщения клеток водой оказывает очень большое влия-
ние на движение устьиц. Различают три типа устьичных движений:
гидропассивные, гидроактивные, фотоактивные.
Гидропассивные движения закрывания связаны с насыщением
водой клеток, которые окружают устьица. Гидроактивное закры-
вание устьиц связано с увеличением в самих клетках устьиц вод-
ного дефицита и с повышением в них содержания абсцизовой
кислоты, которая подавляет работу Н+-насосов на мембранах за-
мыкающих клеток. Это приводит к снижению тургора замыкаю-
щих клеток и, следовательно, к закрыванию устьиц. Фотоакгивное
открывание устьиц состоит в увеличении ширины устьичной щели
при повышении интенсивности освещения (главная роль при этом
отводится синему свету). Механизм фотоактивных движений еще
пока не совсем ясен.
27
Цель работы: наблюдать за устьичными движениями в воде
и в растворе глицерина.
Материалы и оборудование: растворы глицерина(5%-
и 20%-ный), 1М раствор сахарозы, микроскопы, предметные и
покровные стекла, препаровальные иглы, фильтровальная бума-
га, бюксы.
Растения: листья любых растений.
Ход работы
Приготавливают несколько срезов нижней эпидермы листа и
помещают их на 2 ч в 5 %-ный раствор глицерина. Глицерин про-
никает в вакуоли замыкающих клеток, понижает их водный по-
тенциал и, следовательно, повышает их способность насасывать
воду. Срезы помещают на предметное стекло в том же растворе,
отмечают состояние клеток и зарисовывают их.
Затем заменяют глицерин на воду, оттягивая его из-под стекла
фильтровальной бумагой. При этом наблюдается открывание усть-
ичных щелей. Препарат зарисовывают.
После этого воду заменяют сильным осмотиком — 20%-ным
раствором глицерина или 1М раствором сахарозы. Наблюдают за-
крывание устьиц.
Задание: зарисовать устьица в воде и в растворах 5 %- и 20 %-
ного глицерина. Объяснить причину устьичных движений.
4. ФОТОСИНТЕЗ
4.1. Пигменты фотосинтеза и их свойства
Пигменты фотосинтеза находятся в мембранах тилакоидов. У выс-
ших растений это хлорофиллы а и Ь, каротин, ксантофилл, фео-
фитин. Хлорофилл а — главная функциональная часть пигментной
системы растений. Он способен, поглотив квант света, передавать
его энергию через цепь последовательных превращений на компо-
ненты электронно-транспортной цепи. С их участием совершается
преобразование энергии электронного возбуждения хлорофилла в
химическую энергию АТФ и восстановленного НАДФН2.
Хлорофиллы по своей химической природе являются сложными
эфирами дикарбоновой кислоты хлорофиллина и двух спиртов —
высокомолекулярного одноатомного спирта фитола С20Н39ОН и
метилового спирта СН3ОН и представляют собой фетилметилхло-
рофиллиды (см. формулу на с. 29).
Хлорофилл а отличается от хлорофилла b тем, что у третьего
углеродного атома во втором пирольном кольце его молекулы ме-
тильная группа заменена на альдегидную. Каротиноиды подразде-
28
СООСНз
Хлорофилл a MgN4OH30C32
СООС20Н39
соосн3
Хлорофилл b MgN4OH28C32
СООС20Н39
ляются на каротины (ненасыщенные углеводороды с эмпириче-
ской формулой С40Н56) и ксантофиллы, отличающиеся от кароти-
ноидов присутствием кислорода (С40Н56О2). Обычно пигменты из
растительной ткани извлекают полярными растворителями (эта-
нолом, этиловым эфиром, ацетоном), которые нарушают связь
хлорофиллов и каротиноидов с липопротеидами пластид и обеспе-
чивают их полное экстрагирование из живых листьев. Из сухого ра-
стительного материала экстракцию ведут с добавлением воды, что-
бы нарушить связи с молекулами белка. Неполярные растворители
(гексан, петролейный эфир и др.) не нарушают связи этих пигмен-
тов с белками и потому не могут их извлечь из свежих листьев.
Все хлорофиллы — вещества нестойкие. Извлеченные из листа,
они легко окисляются на воздухе.
Цель работы: ознакомиться с методами экстракции пиг-
ментов и с их химическими свойствами.
Материалы и оборудование: ступка с пестиком, во-
ронка, фильтр, штатив с пробирками, стеклянные палочки, 2
колбы на 200 мл, баня, пробка с обратным холодильником, элек-
троплитка, NaOH или КОН в кристаллах, этанол.
Растения: зеленые листья любых растений, сухие листья кра-
пивы.
4.1.1. Получение спиртовой вытяжки из листьев.
Ход работы
Для последующих работ с пигментами растений в основном
используют спиртовой экстракт из листьев. Экстракт пигментов
в количестве от 3 до 10 мл получают из живых листьев. Навеску
листьев в 0,5 —2 г размельчают и тщательно растирают в ступке
с небольшим количеством спирта, добавляя его несколькими
порциями. Осадок пропускают через складчатый бумажный
29
фильтр для ускорения фильтрации. Экстракт пигментов исполь-
зуют в работе.
Для получения большого объема экстракта употребляют высу-
шенные листья крапивы, которые помещают в коническую колбу
вместимостью 200 мл и обваривают кипятком, затем воду сливают.
В колбу приливают 100 мл этилового спирта, закрывают ее проб-
кой с обратным холодильником и ставят на 5 мин в баню с кипя-
щей водой для экстрагирования пигментов. Затем содержимое колбы
охлаждают и раствор осторожно декантацией сливают через во-
ронку со складчатым бумажным фильтром. Отфильтрованный ра-
створ используют в последующих опытах. Хранить растворы пиг-
ментов следует в темноте в холодильнике.
4.1.2. Омыление хлорофилла щелочью. Обработка хлорофилла
щелочью может вызвать омыление эфирных связей, т.е. отщепле-
ние остатков метилового спирта и фитола:
СООСН3 COONa
MgN4OH30C32 +NaOH = MgN4OH30C32 + C20H39OH+CH3OH
COOC20H39 COONa
Образующаяся при этом соль хлорофиллиновой кислоты сохра-
няет зеленую окраску, но отличается от хлорофилла большей гид-
рофильностью.
В данной работе образование щелочной соли обнаруживают по
ее лучшей растворимости в спирте, чем в бензине. После омыле-
ния хлорофилла, находящегося в бензиновом слое, соль хлоро-
филлина перейдет в спиртовой слой и окрасит его в зеленый цвет.
Ход работы
В пробирку с 2 — 3 мл спиртовой вытяжки пигментов добавля-
ют такой же объем бензина и 2—3 капли воды. Закрывают пробкой
и сильно встряхивают содержимое в течение 15 —20 с, после чего
пробирку ставят в штатив до начала разделения слоев бензина и
спирта. Хлорофилл находится в верхнем бензиновом слое, вслед-
ствие чего этот слой окрашен в зеленый цвет, нижний спиртовой
слой — желтый, так как там остался ксантофилл. Затем в пробирку
бросают кусочек кристаллической щелочи (КОН или NaOH) и
снова сильно встряхивают содержимое до ее растворения. Дают
смеси жидкостей расслоиться, и полученная соль хлорофиллино-
вой кислоты переходит в нижний спиртовой слой, так как спир-
товой слой стал зеленым. В верхнем бензиновом слое остается жел-
тый пигмент каротин.
30
4.1.3. Получение феофитина и обратное замещение в нем водоро-
да атомом металла. Феофитин присутствует в растениях в незначи-
тельных количествах, но выполняет важную функцию в цепи пе-
реноса электронов. Его легко получить и изучить его химические
свойства. При взаимодействии хлорофилла с концентрированной
кислотой атом магния в нем замещается атомами водорода, в ре-
зультате образуется нестойкое соединение бурого цвета — феофи-
тин. Если к его раствору добавить несколько кристалликов ацетата
цинка (CH3COO)2Zn или ацетата меди (СН3СОО)2Си и осторожно
подогреть, то можно наблюдать восстановление зеленой окраски
раствора. В этом случае ионы металла (цинка или меди) вытесняют
водород в молекуле феофитина и занимают центральное положе-
ние в его молекуле, образуя очень стойкое соединение — металло-
замещенный хлорофилл.
Свойство металлозамещенного хлорофилла — долго сохранять
зеленую окраску и не окисляться на воздухе — используют, когда
хотят приготовить постоянный препарат из зеленых органов (лис-
тьев, плодов) растений и сохранить его на длительный период.
Для этого заливают препарат формалином, к которому прибавля-
ют 10 %-ный раствор медного купороса (CuSO4- 5Н2О). Выдержива-
ют препарат в растворе 10—15 дней. За этот период хлорофилл в
клетках листа превращается в стойкое соединение — металлоза-
мещенный хлорофилл. Через 10 дней раствор формалина с мед-
ным купоросом заменяют чистым раствором формалина. Такой
препарат можно хранить годами, а листья все равно останутся
зелеными.
Ходработы
В три пробирки отливают по 2 мл спиртовой вытяжки пиг-
ментов. Одну пробирку оставляют для контроля. В двух других
приготовляют феофитин. Для этого в пробирки добавляют по
2 — 3 капли 10%-ной соляной кислоты или в пробирки с раство-
рами пигментов погружают стеклянные палочки, смоченные в
концентрированной соляной кислоте. При этом окраска вытяж-
ки становится бурой, так как хлорофилл превращается в фео-
фитин:
СООСНз СООСНз
MgN4OH30C32 +2НС1 = H2N4OHMC32 +MgCl2
СООС20Н39 СООС20Н39
Одну пробирку с феофитином оставляют для сравнения, а в
другой феофитин переводят в металлозамещенный хлорофилл,
31
добавляя в нее 2 — 3 кристаллика ацетата цинка или ацетата меди,
затем подогревают. Зеленый цвет пигмента восстанавливается:
СООСНз соосн3
H2N4OH32C32 +(CH3COO)2Zn = ZnN4OH30C32 +2СН3СООН
СООС20Н39 СООС20Н39
Задание: записать уравнения реакций получения щелочной
соли хлорофиллина и металлозамещенного хлорофилла. Сравнить
по цвету пробирки с растворами хлорофилла и металлозамещен-
ного хлорофилла, закрыть их пробками, снабдить этикетками и
оставить в штативе на свету. Через неделю сделать выводы о стой-
кости хлорофилла и металлозамещенного хлорофилла, отмечая
изменения цвета раствора.
4.2. Разделение смеси фотосинтетических пигментов
Один из первых методов разделения пигментов был предложен
немецким ученым Краусом в 1860 г. Он основан на разной раство-
римости пигментов в спирте и бензине. Эти растворители не сме-
шиваются при сливании и образуют два слоя: верхний — бензино-
вый, где растворены хлорофиллы и каротин, и нижний — спирто-
вой, где растворен ксантофилл.
Этот метод не позволяет разделить хлорофиллы а и Ь, однако
его целесообразно использовать для получения желтых пигментов
каротина и ксантофилла в больших количествах.
Для разделения и получения хлорофиллов а и b и каротиноидов
применяют другой метод разделения пигментов, разработанный в
1906 г. русским ученым М. С. Цветом. Метод получил название ад-
сорбционного. Именно он лежит в основе современных методов
хроматографии.
Сущность метода заключается в том, что различные вещества
обладают неодинаковой способностью адсорбироваться на твер-
дом порошкообразном адсорбенте. Если смесь пигментов листа,
растворенную в каком-либо органическом растворителе, напри-
мер бензине, пропустить через сухой адсорбент (сахарная пудра,
крахмал, углекислый кальций, окись цинка, фильтровальная бу-
мага), то произойдет разделение пигментов. Каждый пигмент об-
ладает определенной, только ему свойственной способностью ад-
сорбироваться на данном адсорбенте. В результате на адсорбцион-
ной колонке пигменты разделятся и распределятся в определен-
ном порядке.
32
К разновидности адсорбционного метода относится и метод раз-
деления пигментов с помощью бумажной хроматографии, разра-
ботанный в 1951 г. и широко применяемый в настоящее время при
разделении смесей, различных соединений и их идентификации.
4.2.1. Метод Крауса.
Цель работы: ознакомиться с методом, получить растворы
каротина и ксантофилла.
Материалы и оборудование: штатив с пробирками,
этанол, NaOH или КОН кристаллические, бензин, колба Бунзена
со стеклянным фильтром, водоструйный насос, ступка с пестиком.
Растения: листья любых растений или спиртовой экстракт
из листьев, полученный в работе 4.1.1.
Ход работы
В пробирку с 3 — 5 мл спиртового раствора пигментов добавля-
ют такое же количество бензина и одну каплю воды (для лучшего
отделения спирта от бензина). Пробирку хорошо взбалтывают и
дают смеси пигментов отстояться. Происходит расслоение жидко-
сти: в верхний, бензиновый, слой, переходят оба хлорофилла и
каротин, в нижнем, спиртовом, слое остается желтый пигмент —
ксантофилл, так как он лучше, чем бензин, растворим в спирте.
Для отделения каротина от хлорофилла верхний бензиновый
слой пипеткой переносят в чистую пробирку. В этой зеленой вы-
тяжке каротин незаметен, так как его маскирует хлорофилл, пре-
обладающий количественно. В пробирку добавляют 2 мл этилово-
го спирта и 3 — 4 капли воды, вносят несколько кристалликов
щелочи и сильно встряхивают. При взаимодействии щелочи с
хлорофиллом происходит его омыление, образуется щелочная
соль хлорофиллина, которая легко переходит из бензина в спирт.
В результате в пробирке образуются два слоя: верхний, бензино-
вый, слой — желтого цвета с содержанием каротина и нижний,
спиртовой, — зеленого цвета, содержащий щелочную соль хло-
рофиллина.
Задание: зарисовать пробирки с разделенными пигментами;
сделать выводы о растворимости пигментов в различных раствори-
телях и способах выделения индивидуальных пигментов.
4.2.2. Метод Цвета.
Цель работы: ознакомиться с методом разделения пигмен-
тов посредством колоночной хроматографии; выявить пигменты
зеленого листа.
Материалы и оборуд ован и е: весы с разновесами, ступ-
ка с пестиком, фарфоровый фильтр, колба Бунзена, водоструй-
ный насос, делительная воронка, мерный цилиндр на 50 мл, 2 мер-
ные пробирки, коническая колба с пробкой, в которую вставляют
адсорбционную колонку, адсорбционная колонка, бюкса с при-
2—338
33
irpioii крышкой, вата, бензин, ацетон, прокаленный Na2SO4, фар-
форовые чашки для сбора пигментов с колонки.
Растения: листья любых растений.
Ход работы
1. Приготовление вытяжки пигментов из листьев растений.
Навеску из свежих листьев (3 г) тщательно растирают в фарфо-
ровой ступке с небольшим количеством растворителя, состояще-
го из смеси 10 мл бензина и 10 мл ацетона. Продолжают растира-
ние до гомогенного состояния с одновременной экстракцией пиг-
ментов небольшими порциями смеси.
Осадок и надосадочную жидкость переносят на стеклянный
фильтр, укрепленный в колбе Бунзена. Ступку ополаскивают не-
большим количеством чистого ацетона и также сливают на стек-
лянный фильтр. Фильтрование ускоряют, отсасывая воздух из кол-
бы с помощью водоструйного насоса.
2. Концентрирование пигментов в бензине.
Отфильтрованную вытяжку переливают в делительную воронку
и проводят отмывание ацетона для концентрирования пигмента в
бензиновой фракции. Осторожно, не взбалтывая содержимого, через
воронку вливают 30 мл дистиллированной воды. После разделения
жидкости на две фазы водно-ацетоновый нижний слой сливают.
Промывание проводят 2 — 3 раза, при последнем промывании пол-
ностью освобождаются от воды. Очищенную от примесей скон-
центрированную вытяжку пигментов переливают в бюксу с при-
тертой крышкой и высыпают туда 3 — 5 г прокаленного Na2SO4,
оставляют на 15 — 20 мин дня полного обезвоживания экстракта.
Это очень важно для последующего разделения пигментов на ад-
сорбционной колонке.
3. Приготовление адсорбционной колонки.
Адсорбционная колонка представляет собой стеклянную труб-
ку диаметром 1 — 1,5 см и длиной 10— 15 см, суженную на одном
конце. В суженный конец трубки вкладывают кусочек ваты, чтобы
сахарная пудра не высыпалась. Небольшими порциями вводят в
колонку хорошо высушенную сахарную пудру на 2/3 ее высоты.
Для равномерного уплотнения пудры колонку слегка постукивают
о твердый предмет. Для успешного разделения пигментов надо иметь
абсолютно сухие колонки, сахарную пудру и прокаленный серно-
кислый натрий и следить за равномерным уплотнением сахарной
пудры во всем объеме трубки.
4. Разделение пигментов.
Бензиновую вытяжку (1—3 мл) осторожно наливают по краю
трубки в свободное пространство колонки. Через несколько минут
происходит разделение и обособление пигментов. Вверху колонки
остается зеленая зона, состоящая из смеси пигментов, потом жел-
34
Рис. 3. Разделение пигментов на адсорбционной колонке
(по М. С. Цвету):
1 — каротин; 2 — ксантофилл; 3 — хлорофилл а\ 4 — хлорофилл Ъ\
5 — стеклянная колонка с адсорбентом; 6 — бензиновый экстракт;
7 — кусочек ваты; 8 — коническая колба
то-зеленая зона хлорофилла Ь, затем сине-зеленая зона
хлорофилла а, ниже располагается зона темно-желто-
го пигмента ксантофилла, а в самом низу колонки —
светло-желтый каротин, который первым смывается
с колонки (рис. 3). Пигменты поочередно можно смыть
с колонки бензином и собрать в выпаривателъные чаш-
ки или колбочки для дальнейшего исследования.
Задание: сделать рисунок поочередного разделе-
ния пигментов на колонке и подписать зоны с разны-
ми пигментами.
Для школы: получить разделение пигментов зеленого листа
можно на куске мела в форме столбика, предварительно хорошо
высушенного в сушильном шкафу или на батарее. Одним концом
мел погружают на 0,5— 1,0 см в бензиновый экстракт пигментов
(тоже осушенный Na2SO4). Четкое разделение пигментов происхо-
дит на столбике мела в течение 5—10 мин.
4.2.3. Метод хроматографии на бумаге. Этот метод основан на
разделении пигментов между волокнами целлюлозы хроматогра-
фической бумаги и подвижной фазой — растворителем. Когда ра-
створ движется по бумаге под действием капиллярных сил, то мо-
лекулы пигментов распределяются между двумя фазами. Чем выше
растворимость пигмента в подвижной фазе, тем дальше он про-
двигается по бумаге вместе с растворителем, и наоборот.
Расстояние, пройденное нанесенным на бумагу пигментом в
направлении движения растворителя, характеризуется величиной
Rf, которая представляет собой отношение расстояния, пройденного
растворенным пигментом, к расстоянию, пройденному фронтом ра-
створителя. В стандартных условиях эта величина для данного пиг-
мента постоянна и соответствует его коэффициенту распределения.
Хроматографирование на бумаге проводят восходящим и нис-
ходящим способами. При восходящей хроматографии бумажную
полоску подвешивают вертикально; ее нижний конец, на который
нанесена смесь пигментов, погружают в растворитель. При этом
место нанесения смеси должно находиться выше уровня раствори-
теля. По мере движения растворителя под действием капиллярных
сил вертикально вверх происходит разделение растворенных веществ.
При нисходящей хроматографии верхний конец бумажной по-
лосы со смесью пигментов, нанесенных недалеко от кромки бума-
35
Рис. 4. Разделение пигментов методом хроматографии
на бумаге:
1 — хроматографическая камера; 2 — растворитель; 3 — хрома-
тографическая бумага; 4 — линия старта (место нанесения смеси
пигментов); 5 — зона разделения пигментов; 6 — крышка камеры
ги, закрепляют в сосуде и размещают в верхней
части камеры. Нижний конец бумаги спускают вниз,
но так, чтобы он не касался налитого на дне каме-
ры растворителя. В результате действия капилляр-
ных сил и силы тяжести растворитель начинает пе-
редвигаться вниз по бумажной полосе, в результате чего происхо-
дит разделение смеси.
Хроматографирование проводят в герметически закрытых ка-
мерах, где поддерживается атмосфера, насыщенная парами ра-
створителей, что предотвращает их испарение с бумаги (рис. 4).
Для эффективного распределения пигментов бумага должна быть
равномерной по толщине и обладать достаточной плотностью. Та-
ким требованиям отвечают сорта хроматографической бумаги, вы-
пускаемой в России, № 1,2, немецкой — Filtrak и английской —
Whatman №1,2 (см. приложение, табл. VII).
Цель работы: ознакомиться с методом разделения пигмен-
тов посредством бумажной хроматографии.
Материалы и оборудование: бензин или концентри-
рованная бензиновая вытяжка, полученная в работе 4.2.2, хрома-
тографическая бумага, ножницы, сосуд с пробкой, капилляры,
простой карандаш, цветные карандаши, нитки, линейка.
Растения: листья любых растений или вытяжка пигментов,
полученная в работе 4.2.2.
Ход работы
Полоску хроматографической бумаги шириной 2 — 3 см и дли-
ной, соответствующей высоте сосуда, кладут на чистую поверх-
ность и карандашом на бумаге чертят горизонтальную линию старта
на расстоянии 4 см от края.
Из ранее приготовленной спиртовой или бензиновой вытяжки
берут микропипеткой или капилляром небольшую порцию экст-
ракта и переносят ее многократно на стартовую линию хромато-
графической бумаги в виде полоски или пятна диаметром не более
1 см. Бумагу подсушивают на воздухе, и нанесение повторяют 5 —
6 раз, чтобы сконцентрировать пигмент и не допустить образова-
ния большого пятна.
Далее в сосуд или цилиндр с растворителем (бензин) на дне
опускают хроматограмму стартовой линией вниз, так, чтобы бу-
мага слегка касалась растворителя, и плотно закрывают пробкой.
Сосуд должен быть насыщен растворителем, который, поднима-
36
ясь вверх по хроматографической бумаге, увлекает за собой смесь
пигментов. Они разделяются примерно на расстоянии 5 —10 см от
стартовой линии.
Пигменты распределяются в следующем порядке: первым сни-
зу адсорбируется хлорофилл b желто-зеленого цвета, затем сине-
зеленая зона хлорофилла а, выше — ксантофилл, каротин очень
быстро движется и располагается вверху полоски хроматографи-
ческой бумаги у фронта растворителя.
По окончании разделения пигментов хроматограмму вынима-
ют, сразу же отмечают границу подъема растворителя, так назы-
ваемую линию фронта, высушивают и рассчитывают значение Bf
для каждого пигмента.
Задание: наклеить хроматограмму в тетрадь. Пятна пигментов
обвести соответствующим по цвету карандашом (пигменты нестой-
ки, быстро разрушаются и теряют цвет). Отметить в выводе пре-
имущества метода разделения пигментов посредством бумажной
хроматографии.
4.3. Оптические свойства пигментов зеленого листа
Для пигментов листа, как и для всех пигментов вообще, харак-
терно избирательное поглощение лучей света. Хлорофилл погло-
щает красные и сине-фиолетовые лучи, каротиноиды поглощают
только сине-фиолетовые лучи.
Для определения того, какие лучи поглощает пигмент, пользу-
ются спектроскопом. Он имеет три тубуса, расположенные в од-
ной плоскости и сходящиеся в камере со стеклянной призмой. Один
из тубусов с наружного конца имеет узкую щель, через которую
луч света падает на призму, разлагающую его в спектр — набор
лучей с разной длиной волн. Спектр рассматривают с помощью
второго тубуса, в который вставлен окуляр. В третий тубус встав-
ляется шкала с указанием длины волн в нанометрах — от 800 до
400 нм. При освещении щели спектроскопа лампой или другим
источником через второй тубус можно наблюдать спектр излуче-
ния источника света. Чем уже щель спектроскопа, тем полнее про-
исходит разделение света на составляющие его лучи. Однако при
сужении щели интенсивность этих лучей уменьшается. Ее можно
увеличить, расширяя щель, но при этом зоны разных лучей начи-
нают накладываться друг на друга, снижая чистоту спектра.
Для определения, какие именно лучи поглощает пигмент, нужно
кювету с раствором пигмента поставить перед щелью спектроско-
па, через которую проходят лучи от источника света. На месте
лучей, поглощаемых молекулами пигмента, в спектре излучения
источника света появляются темные полосы. Чем полнее поглоща-
ются лучи, тем темнее полоса. Этот спектр с темными полосами
37
на месте поглощенных лучей и называется спектром поглощения
пигмента. Наиболее темные полосы в зонах поглощения соответ-
ствуют максимумам поглощения.
Ширина полос поглощения зависит от количества молекул
пигмента в слое раствора, через который проходит луч света, по-
падающий в щель спектроскопа. Количество молекул увеличивает-
ся при увеличении концентрации раствора пигмента или при уве-
личении толщины слоя его раствора.
Положение максимумов поглощения может смещаться за счет
взаимодействия отдельных молекул пигмента между собой или с
белками.
4.3.1. Спектры поглощения пигментов листа.
Цель работы: исследовать оптические свойства пигментов
листа.
Материалы и оборудование: концентрированная спир-
товая вытяжка пигментов, растворы каротина и ксантофилла (при-
ложение 10.3), этанол, спектроскоп, два осветителя, набор кювет
разной ширины с плоскопараллельными стенками, ступка с пес-
тиком, пробирки, воронка, бумажный фильтр, медицинский
шприц, дистиллированная вода, пинцеты.
Растения: листья комнатных растений.
Ход работы
Налаживают освещение щели и шкалы спектроскопа так, что-
бы спектр излучения совпадал со шкалой длины волн. Этот спектр
зарисовывают цветными карандашами и отмечают длину волны
разных его участков. Затем наливают спиртовой раствор пигментов
в кювету и устанавливают ее перед щелью спектроскопа. Спектр
поглощения хлорофилла рассматривают и зарисовывают, точно
указывая длины волн поглощаемых лучей. Полосы поглощения —
более узкую в красной части спектра и довольно широкую в сине-
фиолетовой части — заштриховывают черным карандашом. Рас-
сматривают и зарисовывают спектры поглощения каротина и ксан-
Рис. 5. Спектры поглощения
пигментов листа:
7 — хлорофиллы а и Ь; 2 — каротин;
3 — ксантофилл
тофилла (рис. 5). Для этого ис-
пользуют растворы пигментов,
полученные в работе 4.2.1.
4.3.2. Влияние концентрации
пигментов на ширину полос по-
глощения.
Ход работы
Для этой работы готовят
концентрированный раствор
пигментов (см. 4.1.1).
В пять одинаковых плоских
кювет наливают по 3 — 5 мл
38
этилового спирта. Затем в каждую переносят по нескольку капель
концентрированного раствора пигментов, последовательно увели-
чивая концентрацию. Например, в первую добавляют 3 капли, во
вторую — 7, в третью — 15, в четвертую — 25, в пятую — 35
капель, в шестую кювету наливают концентрированный раствор.
Вместо растворов с разной концентрацией удобно использовать
кюветы разной ширины: 0,1; 1; 2; 3; 5 мм, которые заполняют
раствором одной и той же концентрации. Тогда концентрация пиг-
ментов в кюветах изменяется соответственно в 10, 20, 30 и 50 раз.
В обоих случаях меняется количество молекул, поглощающих свет.
Наладив спектроскоп, перед его щелью поочередно устанавлива-
ют кюветы с растворами хлорофилла. Спектры поглощения после-
довательно рассматривают и зарисовывают на миллиметровой бу-
маге. Рисунки спектра располагают один над другим. С левой сто-
роны против каждого из спектров указывают степень разведения
или ширину кюветы. На спектрах точно показывают полосы по-
глощения, заштриховывая их черным карандашом в зоне соответ-
ствующих длин волн (рис. 6).
Задание: сделать выводы о характере поглощения лучей хлоро-
филлом в зависимости от концентрации его спиртового раствора.
4.3.3. Влияние связи хлорофилла с белком на смещение полос
поглощения в красной области спектра.
Ход работы
Готовят по 3 мл спиртовой и водной вытяжек из листьев и ку-
сочек инфильтрированного листа (1,5 х 1,5 см). Инфильтрация листа
Рис. 6. Спектрограмма хлорофилла:
а — 1, 2, 3, 10 — порядковые номера возрастающих концентраций хлорофилла;
б — шкала длины волн видимого спектра
39
за пузырьков воздуха в межклетниках лучи проходящего в листе
света не будут рассеиваться.
Кусочек инфильтрированного листа прикладывают к щели спект-
роскопа и рассматривают его спектр поглощения, отмечая по шкале
положение полосы поглощения в красной области спектра. Затем рас-
сматривают спектры поглощения спиртовой и водяной вытяжек ли-
ста. Сравнивают положение полос поглощения в красной области у
всех трех спектров поглощения. Отмечают смещение красного макси-
мума поглощения хлорофилла в длинноволновую область у водной
вытяжки и у живого листа по сравнению со спиртовой вытяжкой.
Задание: зарисовать спектры поглощения хлорофилла, каро-
тина и ксантофилла; сделать вывод о различиях в их спектрах по-
глощения. Зарисовать спектры поглощения хлорофилла при раз-
ных концентрациях его растворов. Описать различия в положении
красного максимума поглощения хлорофилла в водной и спирто-
вой вытяжках и в живом листе.
4.4. Фотохимическая активность хлорофилла
4.4.1. Наблюдение флуоресценции хлорофилла. Флуоресценция
хлорофилла — испускание возбужденной молекулой хлорофилла
света с длиной волны, большей, чем длина волны света, возбу-
дившего флуоресценцию. Флуоресценция обнаруживается по крас-
ному цвету раствора хлорофилла, рассматриваемого в отраженном
свете на темном фоне. Возбуждающий флуоресценцию свет значи-
тельно интенсивнее света флуоресценции. Поэтому раствор хлоро-
филлов выглядит зеленым. В отраженном свете в глаз наблюдателя
попадает значительно меньше возбуждающего флуоресценцию све-
та, поэтому становится видна сама флуоресценция (рис. 7).
Независимо от длины волны возбуждающего света хлорофилл
флуоресцирует только красным светом.
В живом листе основным флуоресцирующим пигментом явля-
ется хлорофилл а. При этом в листьях флуоресценция выражена
гораздо слабее, чем в растворе, так как часть поглощенной энер-
гии используется на сенсибилизирование фотохимических реак-
ций. Поэтому возрастание интенсивности фотосинтеза, как пра-
вило, влечет за собой ослабление флуоресценции.
Цель работы: наблюдать флуоресценцию хлорофилла.
Материалы и оборудование: электрическая лампа, шта-
тив, пробирка, ступка, пестик, 5 мл этанола.
Растения: зеленые листья любых растений.
Ход работы
Листья растений (1г) размельчают в ступке с 5 мл этилового
спирта. Содержимое наливают в пробирку через воронку с бумаж-
ным фильтром.
40
1
1
Рис. 7. Спиртовая вытяжка хлорофилла в отраженных (а)
и проходящих лучах (б):
1 — свет лампы, освещающий пробирку с раствором хлорофилла и возбуждающий
его флуоресценцию; 2 — свет лампы, проходящий через пробирку с раствором хло-
рофилла; 3 — свет лампы, отраженный от пробирки; 4 — флуоресценция хлорофилла
Рассматривают раствор пигментов в пробирке или колбе в от-
раженном свете настольной лампы (см. рис. 7). Отмечают красную
флуоресценцию спиртовой вытяжки листа, которая содержит все
пигменты. Рассматривают спиртовую вытяжку листа в проходящем
свете, отмечают ее зеленую окраску, обусловленную присутстви-
ем хлорофилла. В проходящем свете красная флуоресценция не
видна, так как интенсивный проходящий свет маскирует ее.
Задание: сделать вывод о наличии флуоресценции у хлоро-
филла. Описать способ наблюдения флуоресценции и цвет раство-
ра хлорофилла в проходящем и отраженном свете.
4.4.2. Демонстрация фотосенсибилизирующей активности хлоро-
филла в модельном опыте. В 1948 г. академик А. А. Красновский про-
стым опытом доказал, что хлорофилл в фотосинтезе является участ-
ником и инициатором окислительно-восстановительных реакций.
Показать эту способность хлорофилла можно в модельном опыте с
помощью двух соединений — аскорбиновой кислоты (АК) и ме-
тилового красного (МК), обладающих окислительно-восстановитель-
ными свойствами. АК способна к необратимой окислительно-восста-
новительной реакции с образованием дегидроаскорбиновой кисло-
ты (ДГАК), что сопровождается переносом электрона к акцептору:
СНА - 2ё = СНА+ 2ё + 2Н+.
ООО 000
В этом заключается важнейшая функция АК в клетках живых
организмов, где она выступает в качестве источника энергии, от-
давая электроны и протоны в дыхательную электронно-транспорт-
41
ную сеть. Окислительно-восстановительный потенциал (Ео) АК
равен 0,1 эВ (при pH 5,75). АК является восстановителем, а в дан-
ной реакции — донором электронов.
МК также обладает окислительно-восстановительными свой-
ствами, и его Ео составляет 0,8 эВ. Являясь окислителем, МК в
силу большой разницы потенциалов (ДЕо = 0,7 эВ) не может окис-
лить АК спонтанно. Однако осуществить восстановление МК мож-
но с помощью фотосенсибилизатора, т.е. вещества, использую-
щего энергию света и стимулирующего химическую реакцию, но
не участвующего в ней. Таким образом, как бы моделируется прин-
цип цепи окислительно-восстановительных реакций, происходя-
щих при фотосинтезе после поглощения света молекулами хлоро-
филла. Транспорт ё в окислительно-восстановительной реакции с
участием фотосенсибилизатора (возбужденного хлорофилла) можно
представить в виде схемы:
hv
-2ё I
АК (донор) ----------► хлорофилл*
(фотосенси-
-2Н+ билизатор)
▼
ДГАК
-----► МК (акцептор)
+2Н+ hv
т I
МК, восстановленный
в лейкосоединение
В тилакоидной же мембране хлоропласта благодаря высокоэнер-
гетическому электрону (ё) хлорофилл обладает свойствами силь-
ного восстановителя и может восстанавливать редокс-системы с боль-
шим отрицательным потенциалом. Отдаваемый при этом электрон
остается высокоэнергетическим и может свою энергию потратить
на последующие окислительно-восстановительные реакции, на-
правленные на переброс протонов с наружной стороны мембраны
тилакоида на внутреннюю для последующего синтеза АТФ.
Цель работы: с помощью модельного опыта продемонстри-
ровать фотосенсибилизирующую активность хлорофилла.
Материалы и оборудование: лампа 100W, штатив, про-
бирки, ступка, пестик, черная бумага, этанол, кристаллическая
аскорбиновая кислота (АК), насыщенный спиртовой раствор ме-
тилового красного (МК).
Растения: зеленые листья любых растений.
Ход работы
Листья (0,5 г) размельчают в ступке с добавлением 5 —6 мл
этанола. Осадок пропускают через воронку с бумажным фильт-
ром, экстракт хлорофилла (ХЛ) разливают поровну в три пробир-
ки. Опыт закладывают в четырех вариантах (табл. 4).
42
Таблица 4
Обнаружение фотохимической активности хлорофилла
Вариант опыта Компоненты среды и освещенность Перво- началь- ный цвет Измене- ние цвета Причины изменения цвета или их отсутствия
I ХЛ + МК + АК + свет
II ХЛ + МК + АК + темнота
III ХЛ + МК + свет
IV МК + АК + свет
В четвертую пробирку наливают столько же этанола. Затем во
все четыре пробирки по каплям добавляют спиртовой раствор ме-
тилового красного, пока зеленая окраска не приобретет бурый цвет
в первых трех вариантах опыта и красный в IV варианте. Много
добавлять метилового красного не следует.
В пробирки I, II и IV вариантов добавляют по 30 мг (на кончике
скальпеля) кристаллической аскорбиновой кислоты и встряхива-
ют. Во II варианте пробирку закрывают черной бумагой. Штатив с
пробирками ставят непосредственно перед яркой лампой, помес-
тив между ними сосуд с водой с плоскопараллельными стенками,
чтобы предотвратить нагрев растворов.
Через 10—20 мин от начала экспозиции в одной пробирке про-
исходят изменения и раствор снова приобретает зеленую окраску,
так как метиловый красный восстанавливается в лейкосоедине-
ние, и только хлорофилл обеспечивает зеленый цвет раствора.
В остальных вариантах опыта красная и красно-бурая окраски
не изменяются.
Задание: зарисовать пробирки в конце опыта, после измене-
ния окраски в одном из вариантов. Сделать выводы относительно
фотосенсибилизирующей активности хлорофилла, роли АК, МК
и света.
4.5. Обнаружение процесса фотосинтеза
Исходя из суммарного уравнения фотосинтеза
6СО, + 12Н,0 + энергия света -» С,Н„О, + 60, + 6Н,О,
2 2 о 12 о 2 2 7
можно сделать вывод о том, что обнаружить процесс фотосинтеза
можно или по поглощению СО2, или по выделению кислорода,
или по накоплению углерода в листьях.
43
4.5.1. Выделение кислорода водными растениями.
Цель работы: обнаружить фотосинтез у водных растений по
выделению пузырьков газа и доказать, что этот газ — кислород.
Материалы и оборудование: 2 стеклянных сосуда, 2 во-
ронки, водопроводная вода, прокипяченная и остуженная в за-
крытом сосуде, 0,5 %-ный раствор гидрокарбоната натрия, приго-
товленный на этой воде, термометр, пробирки, спички, лучин-
ки, водопроводная вода, электрическая лампочка 100 W, лезвия.
Растения: элодея, валлиснерия, роголистник.
Ход работы
В один сосуд наливают прокипяченную воду (вода без СО2), в
другой — 0,5 %-ный раствор гидрокарбоната натрия (вода с СО2). От-
бирают здоровые растения. Обновляют под водой срезы. На суженные
концы воронок надевают пробирки, заполненные теми же раствора-
ми, что и в сосудах. Под воронки помещают растения (рис. 8). Сосуды
с растениями устанавливают под яркий свет (лампа 100 W). Темпе-
ратура всех жидкостей в опыте должна достигать 26 °C. В пробирки,
заполненные газом, который выделяют растения, опускают зажжен-
ную лучинку. Горение свидетельствует о присутствии кислорода.
Задание: сделать рисунки. Отметить время заполнения каж-
дой из пробирок кислородом и сделать выводы о том, что для
фотосинтеза необходим СО2.
Рис. 8. Влияние углекислого газа на выделение кислорода водными
растениями:
1 — элодея; 2 — воронки; 3 — сосуд с раствором соды; 4 — пробирка с раствором
соды; 5 —- сосуд с прокипяченной водой; 6 — пробирка с прокипяченной водой
44
4.5.2. Обнаружение выделенного при фотосинтезе О2 с помощью
метиленового синего. Известный краситель — метиленовый синий
(МС) способен к окислительно-восстановительным превращени-
ям, он может быть как акцептором ионов водорода, так и их
донором.
В основе данного опыта лежит свойство метиленового синего
давать бесцветное соединение при воздействии восстановителя
Na2SO3 и переходить снова в окрашенное соединение при воздей-
ствии окислителей Н2О2 или О2.
Цель работы: доказать, что растение на свету выделяет О2.
Материалы и оборудование: высокие пробирки или
цилиндры, концентрированный раствор метиленового синего в
спирте, насыщенный раствор Na2SO3, 3%-ный Н2О2, настольная
лампа 100 W.
Растения: элодея, валлиснерия, роголистник.
Ход работы
В три пробирки наливают водопроводную воду и подкрашивают
метиленовым синим до ярко-голубой окраски, а затем добавляют
по каплям Na2SO3 до обесцвечивания всех трех растворов. Во вто-
рую пробирку наливают пероксид водорода до изменения цвета
снова в ярко-голубой, а в третью помещают растение. Все пробир-
ки выставляют на свет и наблюдают за тем, как изменяется в них
цвет раствора. Температура среды 26 °C.
Задание: описать опыт; зарисовать пробирки; объяснить при-
чину изменения цвета в пробирках.
4.5.3. Всплывание на свету инфильтрированных дисков из листь-
ев. У наземных растений выделяющийся при фотосинтезе кисло-
род накапливается в межклетниках листа. Если межклетники листа
наполнены газом, то плотность тканей листа мала и лист плавает
на поверхности воды. Если межклетники заполнены водой, то лист
оседает на дно. Кислород, выделяющийся при фотосинтезе, вы-
тесняет из межклетников воду, лист становится легче и всплывает
на поверхность. На этом явлении основан метод определения фо-
тосинтеза, предложенный Сапожниковым.
Цель работы: определить интенсивность фотосинтеза по вы-
делению О2 в зависимости от освещенности.
Материалы и оборудование: пробочные сверла, ста-
канчики, раствор питьевой соды 0,5 %-ный, медицинские шпри-
цы с цилиндром 10 мл, стеклянные трубки.
Растения: листья растений.
Ход работы
Пробочным сверлом из листа делают высечки и инфильтриру-
ют их водой, насыщенной СО2.
45
Инфильтрированные высечки помещают по шесть штук в ста-
канчики с водой, обогащенной С02. Один из стаканчиков поме-
щают в темноту (контроль), другие выставляют на свет на разные
расстояния от его источника и засекают время.
Высечки всплывают в разное время в зависимости от интенсив-
ности света (расстояние от лампы 0, 25, 50, 100 см) в результате
вытеснения воды из межклетников кислородом, образующимся
при фотосинтезе. Высечки, находящиеся в темноте, не должны
всплывать. Мерой интенсивности фотосинтеза служит время, про-
шедшее с момента установки стакана с инфильтрированными вы-
сечками на свет до всплывания 50 % высечек.
Задание: определить время всплывания высечек в стакан-
чиках, установленных на разных расстояниях от лампы. Сделать
вывод о влиянии интенсивности света на интенсивность фото-
синтеза.
4.5.4. Изменение окраски крезолового красного при поглощении
листом СО2.
Цель работы: доказать, что живой лист растения поглощает
СО2 из воздуха при фотосинтезе. Сделать это можно с помощью
индикатора — крезолового красного, который меняет свою окрас-
ку при изменении pH среды.
Материалы и оборудование: три узких высоких сосуда
с пробками, лампа 100 W, раствор крезолового красного (1 %-ный
в спирте).
Растения: листья колеуса, герани и др.
Ход работы
В три сосуда наливают водопроводную воду до 1/2 объема. В I —
воду, содержащую СО2 не более 0,3% (как в воздухе), со значени-
ем pH, близким к нейтральной, во II — прокипяченную воду,
остуженную при закрытой пробке (без СО2), со слабощелочной
реакцией, в III — воду, обогащенную СО2 путем 10-минутного
вдувания через трубочку выдыхаемого воздуха, со слабокислым
значением pH, которое обусловлено наличием в воде СО2.
Во все три сосуда добавляют одинаковое количество крезолово-
го красного до окрашивания растворов: в I — до темно-желтого,
во II — до красного, в III — до светло-желтого.
К пробке III сосуда крепят крючок, на крючок надевают лист и
опускают в сосуд. Сосуды выставляют на свет. Спустя 12 ч отмеча-
ют изменения, произошедшие с растворами индикатора. В III со-
суде лист поглощает НСО~ из раствора, и он изменяет желтую
окраску на красную в связи с изменением значения pH до слабо-
щелочного (табл. 5).
Задание: данные опыта внести в таблицу; объяснить причину
изменения окраски индикатора с листом на свету.
46
Таблица 5
Поглощение СО2 зеленым листом
Вариант опыта Окраска крезолового красного pH среды Условия опыта Изменение окраски
I: СО2 мало Темно-желтая Нейтральная
II: СО2 отсутствует Красная Сл абощел оч ная
III: СО2 МНОГО 4- ЛИСТ Светло-желтая Кислая
4.5.5. Получение отпечатков на листьях с помощью крахмальной
пробы. Эта работа лежит в основе одного из обязательных школь-
ных демонстрационных опытов по ботанике, носящего название
«фигуры Сакса». Опыт наглядно показывает, что при фотосинтезе
на свету в листе образуется органическое вещество в виде крахма-
ла, а также доказывает необходимость света в этом процессе. Рабо-
ту можно проводить в условиях открытого грунта и на комнатных
растениях.
Цель работы: показать, что в листьях на свету в процессе
фотосинтеза синтезируется крахмал.
Материалы и оборудование: этанол, раствор йода в
йодиде калия, водяная баня, газовая горелка или электроплитка,
колба коническая, тарелка, лампа на 100—200 W, плотная бума-
га, фольга, канцелярские скрепки, стеклянная банка, стеклянные
пластинки (2 шт.), нитки, фотонегативы, трафареты с вырезан-
ными фигурами, пинцет, клейкая лента.
Растения: гортензия, пеларгония, колеус, герань, примула,
подсолнечник, настурция, табак, сахалинская гречиха, одуван-
чик и т.д.
Ход работы
При подготовке листьев к опыту необходимо поместить их в
темноту, чтобы произошел отток крахмала из клеток листа или
чтобы он был израсходован на процессы метаболизма. Комнатные
растения переносят в темный шкаф на двое суток (не забывая о
поливе), а у грунтовых растений на тот же срок листья закрывают
плотной бумагой с обеих сторон.
В жаркий солнечный день бумагу следует заменить фольгой,
отражающей свет и препятствующей перегреву листа. К тому же не
надо использовать скрепки. Их можно заменить клеящейся лен-
той, так как она меньше травмирует лист.
Через сутки бумагу заменяют трафаретом с вырезанным отвер-
стием. Трафарет делают из сложенного вдвое листа плотной бума-
47
ги или фольги с какой-либо вырезанной фигурой (рис. 9). Накла-
дывая его на лист, надо следить, чтобы очертания фигуры на верх-
ней и нижней сторонах листа совпадали, затем трафарет осторож-
но прикрепляют.
Вместо бумажного трафарета на верхнюю сторону листа можно
наложить четкий фотографический негатив, тогда с нижней стороны
лист тщательно закрывают черной бумагой. Под лист подкладывают
дощечку, негатив кладут эмульсией вверх. Экспозиция на свету мо-
жет длиться от 2 до 8 ч (в зависимости от вида растения и интенсив-
ности освещения). Зимой в помещении в качестве источника света
устанавливают лампу 100—200 W на расстоянии 60—70 см от листа.
По окончании экспозиции на свету листья срезают, снимают с
них трафарет, погружают на 2 — 3 мин в кипяток, чтобы убить
ткани, а затем в горячий спирт для извлечения пигментов. Колбу
со спиртом и листьями помещают в водяную баню с кипящей
водой и выдерживают в горячем спирте до полного извлечения
пигментов из листьев и их обесцвечивания.
В спирте происходит сильное обезвоживание листа, он стано-
вится жестким и легко ломается. Поэтому спирт сливают, а в кол-
бу наливают воду, лист становится мягким, затем его переносят в
кювету или в тарелку с раствором йода в йодиде калия. Постепен-
но на освещавшихся участках листа появляется темная фигура,
соответствующая трафарету.
Рис. 9. Получение отпечатков на листьях с помощью крахмальной пробы:
1 — освещенное растение; 2 — лист, закрытый трафаретом; 3 — отпечаток
(крахмальная проба) на листе
48
Если на листьях получены хорошие отпечатки, их можно со-
хранить на длительный срок. Для этого берут два стекла, которые
по размерам больше листа. Одно стекло подводят под лист, лежа-
щий в растворе йода в йодиде калия, и расправляют его. По краям
стекла с двух сторон укладывают по тонкой лучинке. Сверху на-
крывают вторым стеклом, и оба стекла скрепляют между собой.
Лист оказывается в камере между двумя стеклами. В таком виде его
опускают в банку с раствором йода в йодиде калия, которую плот-
но закрывают крышкой. Препарат хранят в темном месте, так как
на свету йод и отпечаток на листе быстро обесцвечиваются. Время
от времени раствор йода заменяют свежим. Если при длительном
хранении отпечаток обесцветился, выбрасывать его не следует.
Новый раствор йода восстановит изображение.
Следует заметить, что у разных растений процесс расходования
крахмала длится 24—120 ч. Так, например, листья фасоли, на-
стурции, периллы полностью обескрахмаливаются лишь в течение
96 ч, а в листьях примулы крахмал частично остается и после это-
го срока. У подсолнечника обескрахмаливание происходит за 24 ч,
а у герани, сои, табака и сахалинской гречихи через 72 ч.
Критерием выбора объекта для этой работы может быть срав-
нительно короткий срок исчезновения крахмала при затенении,
быстрая и легкая экстракция пигментов и прочность листьев, обес-
печивающая их длительное хранение.
Использование для описанного выше опыта комнатного расте-
ния колеус, у которого на листе имеются помимо зеленых участ-
ков белые и окрашенные антоцианом, будет его выгодно отличать.
Лист колеуса закрывают полоской черной бумаги, и растение
помещают под лампу. Спустя 48 ч лист срезают и выполняют про-
цедуры, описанные выше. Затемненный участок листа, а также
белые участки остаются обесцвеченными, а зеленые, освещенные
светом, дают темную окраску, свидетельствующую о наличии крах-
мала. Опытный лист с отпечатком сравнивают с живым листом на
растении.
Задание: описать опыт и методику проявления «отпечатков»,
зарисовать листья, сделать вывод о том, в какой части листа про-
изошел синтез крахмала.
4.6. Зависимость интенсивности фотосинтеза
от освещенности листьев
Процесс фотосинтеза протекает за счет световой энергии, по-
глощаемой пигментами листа, поэтому его интенсивность зави-
сит от интенсивности падающего на лист света, точнее, от ин-
тенсивности фотосинтетически активной радиации. Это легко
показать на водных растениях, у которых интенсивность фото-
49
синтеза измеряется количеством выделяющихся пузырьков кис-
лорода (см. 4.5.1).
Цель работы: выявить зависимость интенсивности фотосин-
теза от интенсивности света.
Материалы и оборудование: лампа 100 W, пробирка,
сосуд для теплового экрана, термометр, стеклянная палочка, пин-
цет, черная бумага для экрана, линейка, кипяченая вода в закры-
той склянке, 0,5%-ный раствор NaHCO3.
Растения: элодея, валлиснерия, роголистник.
Ход работы
Выбирают здоровое растение элодеи. Под водой обламывают
веточку длиной 3 — 4 см с верхушечной почкой и помещают в про-
бирку с водой, обогащенной СО2 с помощью раствора питьевой
соды в концентрации не более 0,5 %. Более высокие концентрации
соды оказывают вредное действие на живые клетки и могут приве-
сти к подавлению фотосинтеза. Вместо применения раствора соды
можно продуть воду выдыхаемым через трубочку воздухом. Проду-
вание в течение 5—10 мин насытит воду углекислотой.
Элодею помещают в пробирку верхушкой вниз, так, чтобы све-
жеобломанный кончик ветки был на 5 см ниже поверхности воды.
Пробирку с веточкой помещают во внешний цилиндр с темпера-
турой воды 27 °C. Слой воды служит тепловым фильтром.
Из свежесрезанного побега, помещенного на свет, начинают
выделяться пузырьки газа — происходит фотосинтез. Если пузырь-
ки крупные и поступают редко, то нужно слегка придавить кон-
чик среза пинцетом или слегка прижать его стеклянной палочкой
к стенке пробирки. Это изменит величину пузырьков и скорость их
выделения. Иногда полезно обновить срез. Во избежание утомле-
ния глаз прибор надо держать не прямо перед лампой, а справа
или слева от нее. Когда пузырьки начнут выделяться равномерно,
надо убедиться в том, что при затенении пробирки с веточкой ток
пузырьков останавливается, а при ее освещении продолжается. По-
вторяют затенение несколько раз, пока пузырьки газа из растения
совсем прекратят выделяться. Затенение производят черной бума-
гой, помещенной между лампой и прибором, так, чтобы веточка
была закрыта.
Затем надо проследить, как влияет интенсивность света на фо-
тосинтез. Веточку элодеи помещают сначала под лампу, а затем
отодвигают на расстояние 5, 15, 25, 50, 100 см. Величина осве-
щенности при этом меняется пропорционально квадрату расстоя-
ния от лампы. Мерилом интенсивности фотосинтеза служит коли-
чество пузырьков, выделяющихся за 1 мин. При этом удобно пользо-
ваться песочными часами.
Счет пузырьков продолжают в течение 3 мин. Для каждого рас-
стояния берут среднее из трех отсчетов. Сравнение числа пузырь-
50
ков при разных условиях освещения и при разной концентрации
СО2 нужно проводить на одном и том же объекте (веточке), так
как величина пузырьков, от которой зависит скорость их выделе-
ния, определяется величиной перерезанных межклетников. У раз-
ных веточек эти величины будут разными. Они изменяются также,
если сдавить срез или сделать новый на той же веточке.
Задание: описать ход работы, посчитать среднее число пу-
зырьков, которые выделяются за 1 мин из одной и той же веточки
при установке ее на разное расстояние от лампы; внести данные в
таблицу, сделать выводы.
4.7. Накопление первичного (ассимиляционного) крахмала
в клетках листьев С3- и С4-растений
Растения, у которых первый стабильный продукт фотосинтеза
представлен трехуглеродной фосфоглицериновой кислотой (ФГК),
принято называть С3-растениями. Синтез сахаров в фотосинтезе
осуществляется у них в цепи реакций, образующих цикл Кальви-
на. У С3-растений во всех фотосинтезирующих клетках функцио-
нирует цикл Кальвина и поэтому во всех клетках листа образуется
крахмал. У С4-растений первичная ассимиляция СО2 осуществля-
ется и в цикле Хетча-Слека в клетках мезофилла листа. Первыми
продуктами этого цикла являются четырехуглеродные органичес-
кие кислоты, поэтому такие растения принято называть С4- расте-
ниями. Цикл Кальвина функционирует у них только в клетках об-
кладки проводящих пучков листа. Поэтому крахмал образуется толь-
ко в этих клетках, но не в клетках мезофилла.
Цель р а б о т ы: на срезах листовых пластинок выявить клет-
ки, в которых у С3- и С4-растений находятся хлоропласты, накап-
ливающие крахмал.
Материалы и оборудование: микроскопы, осветите-
ли, предметные и покровные стекла, лезвия безопасной бритвы,
стакан с водой, препаровальные иглы, стеклянные палочки, филь-
тровальная бумага, кусочки пенопласта или бузины, раствор Лю-
голя, 30 %-ный раствор NaOH или КОН.
Растения: листья кукурузы и любых С3-растений, зафикси-
рованных в солнечный летний день в 70%-ном этаноле. Можно
воспользоваться листьями С3-растений и молодых растений куку-
рузы, выращенных в теплице. Перед фиксацией материала расте-
ния следует выдержать несколько часов на ярком свету.
Ход работы
Продольные и поперечные срезы листьев кукурузы и С3-расте-
ний (хлорофитума, традесканции и др.) делают острым лезвием
безопасной бритвы. Для получения поперечных срезов используют
51
кусочки бузины или пенопласта. Срезы помещают на предметное
стекло в каплю 30%-ного раствора КОН или NaOH для их про-
светления. Через 10—15 мин, а если позволяет время, то и более
(до 1,5 ч), щелочь «отсасывают» фильтровальной бумагой, промы-
вают водой и добавляют каплю раствора Люголя. Затем срезы на-
крывают покровным стеклом и исследуют под микроскопом сна-
чала при малом увеличении, а затем при большом.
Изучая срезы, обращают внимание на локализацию крахмала
в клетках листа. У кукурузы крахмал локализируется в клетках
обкладки проводящих пучков и в клетках устьиц. В остальных клет-
ках мезофилла, расположенных между жилками, крахмала нет.
Поэтому на продольном срезе проводящие пучки с обкладкой
четко выделяются как темные полосы, а на поперечном срезе
клетки обкладки выглядят в виде темной короны (так называе-
мая «кгапг»-анатомия), окружающей неокрашенные ткани кси-
лемы и флоэмы.
В листьях С3-растений крахмал находится во всех клетках мезо-
филла, а также в замыкающих клетках устьиц. Неокрашенными
остаются только клетки эпидермы и сосудистые пучки.
Задание: сделать рисунки продольных и поперечных срезов
листьев С3- и С4-растений. Отметить локализацию крахмала в тка-
нях листьев. Объяснить причину разной локализации крахмала у
С3- и С4-растений.
5. ДЫХАНИЕ
5.1. Обнаружение дыхания растений
Дыхание — это сложный, многоступенчатый, ферментативный
процесс, протекающий в каждой живой клетке растения и являю-
щийся источником энергии и метаболитов для нее. Дыхание ха-
рактеризуется постепенным окислением органических веществ —
субстратов дыхания. Одновременно происходит поглощение кис-
лорода и выделение углекислого газа. Поэтому большинство мето-
дов обнаружения дыхания основаны на учете изменения состава
воздуха в замкнутом сосуде после выдерживания в нем живых ра-
стений. Содержание углекислого газа, выделяемого при дыхании,
определяют по помутнению баритовой воды:
Ва(ОН)2 + СО2 = BaCO3J- + Н2О.
Отсутствие кислорода в сосуде с растениями проверяют вве-
дением в сосуд горящей лучинки, которая в данных условиях
гаснет.
52
Цель работы: доказать, что при дыхании растений выделя-
ется СО2.
Материалы и оборудование: 2 стеклянные банки вме-
стимостью 300 — 400 мл, 2 резиновые пробирки с отверстиями для
воронки и трубки, 2 воронки, 2 изогнутые в виде буквы «П» стек-
лянные трубки длиной 18 — 20 см и диаметром 4 — 5 мм, 2 пробир-
ки, химический стакан, раствор Ва(ОН)2.
Растения: проросшие семена пшеницы, подсолнечника, ку-
курузы, гороха и др.
Ход работы
В стеклянную банку насыпают 50—60 г проросших семян, плотно
закрывают ее пробкой, в которую вставлены воронка и изогнутая
стеклянная трубка (рис. 10) и оставляют на 1 — 1,5 ч. За это время в
результате дыхания семян в банке накопится диоксид углерода. Он
тяжелее воздуха, поэтому сосредоточен в нижней части банки и
не попадает в атмосферу через воронку или трубку. Одновременно
берут контрольную банку без семян, также закрывают ее резино-
вой пробкой с воронкой и стеклянной трубкой и ставят рядом с
первой банкой.
Рис. 10. Обнаружение углекислого газа, выделившегося
при дыхании растений:
1 — банка с проросшими семенами; 2 — резиновая пробка; 3 — воронка; 4 — изо-
гнутая трубка; 5 — пробирка с баритовой водой; 6 — стакан с водой
53
По окончании опыта свободные концы стеклянных трубок опус-
кают в две пробирки с баритовой водой. В обе банки через воронки
начинают понемногу наливать воду. Вода вытесняет из банок воз-
дух, обогащенный СО2, который поступает в пробирки с раство-
ром Ва(ОН)2. В результате баритовая вода мутнеет. Сравнивают сте-
пень помутнения Ва(ОН)2 в обеих пробирках.
Задание: зарисовать прибор, который помогает обнаруживать
дыхание по выделению СО2, сделать подписи к рисунку и вывод о
выделении СО2 в процессе дыхания.
5.2. Определение интенсивности дыхания в чашках Конвея
Определение интенсивности дыхания данным методом осно-
вано на учете количества СО2, выделяемого при дыхании расте-
нием, находящимся в замкнутом сосуде. За определенный проме-
жуток времени углекислый газ поглощается известным объемом
раствора щелочи. Ее избыток титруют соляной кислотой. Учет на-
чального объема СО2 проводят в таком же замкнутом пространстве.
В качестве замкнутого сосуда используют чашки Конвея (рис. 11).
Чашка Конвея состоит из двух низких цилиндров — внешнего и
внутреннего. Внутренний цилиндр меньшего диаметра закреплен в
центре внешнего цилиндра. Он предназначен для раствора Ва(ОН)2,
который будет поглощать СО2. Свободный объем внешнего цилин-
дра (кольцо вокруг внутреннего цилиндра) заполняют определен-
ной навеской растительного материала. Наружный цилиндр чашки
Конвея и ее крышка снабжены шлифами, которые позволяют гер-
метично закрывать чашку.
Определение дыхания в чашках Конвея дает возможность срав-
нивать интенсивность дыхания разных объектов, например моло-
дых и старых листьев, листьев разного яруса, листьев растений
разных экологических и возрастных групп, а также выявить изме-
нения в интенсивности дыхания в условиях стресса.
Цель работы: ознакомиться с методом определения интен-
сивности дыхания растений в чашках Конвея.
Рис. 11. Чашка Конвея:
1 — внешний цилиндр; 2 — внутренний ци-
линдр; 3 — шлиф чашки; 4 — стеклянная
пластина со шлифом (крышка)
Материалы и обо-
рудование: чашки Кон-
вея, вазелин, бюретки,
штативы, фильтровальная
бумага, ножницы, весы,
разновесы, реактивы: 0,1н
Ва(ОН)2; 0,1н НС1, фенол-
фталеин.
Растения: любые
проростки и взрослые ра-
стения или их органы.
54
Ход работы
Чашки Конвея перед опытом калибруют, они должны быть оди-
накового объема для контрольного и опытного вариантов. Каждый
вариант опыта ставят в трех повторностях.
Во внешний круг чашки Конвея раскладывают навеску расти-
тельного материала массой 0,5—1,0 г. Во внутренний цилиндр на-
ливают 1 или 2 мл 0,1 н Ва(ОН)2. Шлиф чашки смазывают вазели-
ном. Чашку герметично закрывают притертой крышкой (так, что-
бы на крышке проявился прозрачный контур шлифа чашки) и
ставят на 20 — 40 мин в темноту (для исключения фотосинтеза в
зеленых тканях растений). За время экспозиции накопившийся в
объеме чашки Конвея углекислый газ реагирует с гидроксидом
бария:
СО2 + Ва(ОН)2 = ВаСО3 + Н2О.
Избыток Ва(ОН)2 оттитровывают 0,1н НС1 по фенолфталеину
до исчезновения розовой окраски.
Одновременно с опытной ставят контрольную чашку Конвея (без
навески). В нее наливают такой же объем раствора 0,1н Ва(ОН)2,
закрывают притертой крышкой и оставляют рядом с опытной чаш-
кой. Гидроксид бария в этой чашке реагирует с углекислым газом,
изначально находившимся в ее объеме в составе воздуха. Избыток
барита оттитровывают.
По разнице объемов раствора соляной кислоты, пошедшей на
оттитровывание избытка Ва(ОН)2 в контрольной и опытной чаш-
ках, вычисляют интенсивность дыхания (И.д.):
2,2 (ИНС| - Ина ) .
И.д.=----*---, мг СО2/(г-ч),
где ИНС1к — объем 0,1н НО, пошедший на титрование избытка
Ва(ОН)2 в контрольной чашке; ИНС1оп — объем 0,1 н НО, пошед-
ший на титрование избытка Ва(ОН)2 в опытной чашке; Р — масса
навески, г; t — время, ч; 2,2 — коэффициент пересчета НС1 в СО2
(1 мл 0,1 н НС1 или Ва(ОН)2 эквивалентен 2,2 мг СО2).
Задание: проделать опыт и вычислить интенсивность дыха-
ния исследуемых объектов в зависимости от вариантов опыта.
5.3. Определение дыхательного коэффициента
Показателем химической природы субстрата, используемого для
дыхания, может служить дыхательный коэффициент (ДК) — от-
ношение объема СО2, выделяемого при дыхании, к объему погло-
щаемого О2.
55
При окислении углеводов ДК равен 1:
С6Н|2Об + 6О2 = 6СО2 + 6Н2О (ДК = 6СО2/6О2).
При окислении белков или жиров ДК меньше I:
С|7Н35СООН + 26О2 = 18СО2 + 18Н2О (ДК = 18СО2/26О2).
При окислении органических кислот ДК больше 1:
2С2О4Н2 + О2 = 4СО2 + 2Н2О (ДК = 4СО2/О2).
Величина ДК зависит также от количества кислорода, поступа-
ющего к тканям, от состояния организма и фазы его онтогенеза.
Прибор для определения ДК состоит из пробирки, в которую
плотно вставляется пробка с изогнутой под прямым углом тонкой
трубкой. К трубке присоединена измерительная шкала из миллимет-
ровой бумаги либо градуируется трубка (рис. 12).
В начале опыта в трубку вводится капля окрашенной воды. Ее
передвижение будет успешным при чистой трубке, отмытой хром-
пиком. Если объемы поглощенного О2 и выделенного СО2 равны
(ДК — 1), то капля в трубке передвигаться не будет. При величине
ДК не равной 1, т. е. объемы поглощенного О2 и выделенного СО2
не соответствуют друг другу, капля смещается. Она будет переме-
щаться в сторону пробирки, если объем выделенного СО2 будет
меньше объема поглощенного О2, и давление в пробирке упадет
(ДК < 1). Капля передвинется от пробирки к концу трубки при
объеме выделенного СО2 больше объема поглощенного О2, и дав-
ление в пробирке увеличится (ДК > 1). Данный метод определения
ДК позволяет получать хорошие сравнительные результаты.
Цель работы: сравнить величину дыхательного коэффици-
ента прорастающих семян разных растений.
Материалы и оборудование: большая пробирка с хо-
рошо пригнанной резиновой пробкой, в которую вставлена изог-
нутая под углом 90° тон-
кая стеклянная трубка,
миллиметровая бумага,
высокий стакан, вата,
фарфоровая чашечка,
пинцет, песочные часы
на 5 мин, пипетка с от-
тянутым концом, фильт-
ровальная бумага, стакан
химический на 250 мл,
подкрашенная вода,
20 %-ный раствор КОН.
Растения: наклю-
нувшиеся семена пше-
ницы, подсолнечника,
гороха.
Рис. 12. Прибор для определения
дыхательного коэффициента:
1 — пробирка; 2 — резиновая пробка;
3 — трубка с измерительной шкалой;
4 — капля окрашенной воды
56
Ход работы
Пробирку заполняют проросшими семенами пшеницы до по-
ловины объема и плотно закрывают пробкой со стеклянной труб-
кой. Ставят пробирку в высокий стакан с ватой, чтобы избежать
нагревания прибора от рук. В трубку вводят каплю подкрашенной
воды пипеткой с оттянутым концом. За каплей в трубке наблюда-
ют в течение 5 мин, чтобы убедиться в устойчивости ее положения.
Следовательно, объем выделенного семенами пшеницы СО2 ра-
вен объему поглощенного О2, а ДК = 1.
Семена пшеницы высыпают из пробирки и помещают в нее
проросшие семена подсолнечника. Снова собирают прибор. Когда
капля оторвется от края трубки, отмечают положение внутреннего
мениска капли. Через каждые 5 мин 3 раза определяют ее смеще-
ние и вычисляют среднее расстояние, пройденное каплей за 5 мин
(А). Оно соответствует разности между объемами поглощенного
кислорода и выделенного СО2.
Затем пробирку открывают, проветривают и в верхней ее части
над семенами помещают кольцо из фильтровальной бумаги, слег-
ка смоченное раствором щелочи. Вновь собирают прибор, вводят в
трубку каплю окрашенной воды. Отмечают смещение внутреннего
мениска капли за 3 пятиминутных интервала. Вычисляют среднюю
величину смещения (В). Выделенный же при дыхании СО2 будет
поглощаться щелочью, и второе смещение капли отразит только
уменьшение объема О2, поглощенного при дыхании.
Все то же самое повторяют с проросшими семенами гороха.
Расчет величины ДК проводят следующим образом.
Определяют величины А и В:
А = О2- СО2; СО2 = О2- А.
В = О2, следовательно, СО2 = В — А.
Вычисляют ДК (СО2/О2 = (В - А)/В).
Результаты заносят в таблицу (табл. 6).
Задание: результаты опыта занести в таблицу, вычислить ДК;
сделать выводы о химической природе веществ, используемых для
дыхания прорастающими семенами пшеницы, подсолнечника,
гороха.
5.4. Изучение ферментных систем дыхания
Процессы дыхания в клетках обеспечиваются активностью уча-
ствующих в них ферментов — оксидоредуктаз. Эти ферменты ка-
тализируют реакции переноса электронов от окисляемого суб-
страта — донора электронов к акцептору электронов. Во многих
реакциях электрон переносится вместе с протоном, т.е. путем пе-
57
реноса атомов водорода от донора к акцептору. Оксидоредуктазы,
катализирующие перенос водорода, называют дегидрогеназами. Ак-
цептором электронов может служить кислород или различные со-
единения, так называемые промежуточные акцепторы. Оксидоре-
дуктазы, которые катализируют перенос электронов на молеку-
лярный кислород или на кислород пероксида водорода и органи-
ческих перекисей, называют оксидазами. В дыхательной цепи мито-
хондрий конечной (терминальной) оксидазой является цитохро-
моксидаза. Многие другие оксидазы катализируют реакции окис-
ления, не связанные с дыхательной цепью митохондрий. Они за-
вершают многочисленные окислительные процессы, часто про-
исходящие вне митохондрий. Такие оксидазы, как каталаза и пе-
роксидаза, выполняют функцию защиты клетки от сильных окис-
лителей — оксидов водорода, возникающих в процессе метабо-
лизма. Среди митохондриальных оксидаз, не связанных с элект-
ронтранспортной цепью митохондрий, выделяют группу циани-
дустойчивых оксидаз, получивших название альтернативных ок-
сидаз.
Ткани растения, отличающиеся интенсивным метаболизмом,
характеризуются интенсивным дыханием и высокой активностью
оксидоредуктаз. Активность этих ферментов различается в тканях,
выполняющих в растении разные функции.
Таблица 6
Сравнение ДК у наклюнувшихся семян различных растений
Расте- ние Расстояние, пройденное каплей за 5 мин, мм Кол-во со2 Вели- чина ДК Дыха- тель- ный суб- страт
без щелочи (А) со щелочью (В)
1 2 3 X 1 2 3 X
Пше- ница
Под- солнеч- ник
Горох
Примечание. X — средняя величина.
5.4.1. Качественная реакция с тетразолием на общую дегидроге-
назную активность тканей. Метод обнаружения дегидрогеназ осно-
58
ван на том, что соли тетразолия при восстановлении меняют свою
окраску: в окисленном состоянии они бесцветны, а в восстанов-
ленном — окрашены. Дегидрогеназы — ферменты, катализирую-
щие дегидрирование дыхательного субстрата. Дыхательный субстрат
является донором водорода. Активированный дегидрогеназами водо-
род дыхательного субстрата передается ими на другой фермент —
переносчик водорода. Этот фермент передает водород дальше сле-
дующему ферменту — акцептору водорода и так далее по дыха-
тельной цепи. Соли тетразолия в силу того, что они имеют низкий
окислительно-восстановительный потенциал, способны перехва-
тывать водород, становясь его акцепторами. Чем больше имеется в
тканях восстановленных дегидрогеназ, тем больше молекул тетра-
золия может восстановиться.
Восстановленные формы солей тетразолия — формазаны —
представляют собой интенсивно окрашенные соединения. Форма-
заны не окисляются вновь на воздухе, что делает их незаменимы-
ми в гистохимии. В настоящей работе используется трифенилтетра-
золий хлористый (ТТХ).
Цель работы: сравнить по общей дегидрогеназной активно-
сти функционально разные ткани растения.
Материалы и оборудование: микроскоп, предметные
и покровные стекла, часовые стекла, лезвие безопасной бритвы,
термостат на 30 —35 °C, 0,1%-ный раствор ТТХ, приготовленный
на 0,87 %-ном водном растворе К2НРО4.
Растения: наклюнувшиеся и набухшие семена кукурузы, под-
солнечника, фасоли.
Ход работы
В часовое стекло с небольшим количеством раствора ТТХ (2 —
3 мл) помещают срезы, сделанные с семян. Толщина срезов 0,5 —
1 мм. При наличии в тканях активных дегидрогеназ спустя 30 —
60 мин на срезах появляется окрашивание. Для ускорения окраши-
вания срезы можно поместить в термостат с температурой 30 —
35 °C. После появления окраски срезы просматривают под микро-
скопом или лупой. По интенсивности окраски делают сравнитель-
ную оценку дегидрогеназной активности разных тканей.
Для уверенности, что окраска обусловлена активностью фермен-
тов, необходимо ставить контроль со срезами, в которых ферменты
инактивированы. Для этого срезы кипятят в воде 2—3 мин, эти уби-
тые срезы используют в тех же реакциях, что и живые.
После образования окраски в срезах их рассматривают под лу-
пой или микроскопом при малом увеличении и устанавливают
локализацию дегидрогеназной активности в тканях. Делают рисун-
ки живых и убитых срезов.
О величине дегидрогеназной активности отдельных тканей мож-
но судить также по скорости появления в них окраски, обуслов-
59
ленной формазаном. Там, где окраска появляется раньше, там и
самая высокая активность этих ферментов.
5.4.2. Количественное определение активности дегидрогеназ. Ок-
раска тканей разных растений тетразолием позволяет количественно
оценить их дегидрогеназную активность.
Цель работы: сравнить активность дегидрогеназ в разных
тканях растения и в разных растениях.
Материалы и оборудование: ФЭК, стеклянные бюк-
сы, весы торсионные, лезвия безопасной бритвы, 0,1%-ный ра-
створ ТТХ в 0,87 %-ном растворе К2НРО4, 0,87 %-ный раствор
К2НРО4, этанол, медицинский шприц, мерные цилиндры на 10 мл.
Растения: набухшие (но не проросшие) семена и проростки
бобов, фасоли, тыквы, спящие и прорастающие почки деревьев.
Ход работы
Зародыши освобождают от семенной кожуры, с почек снима-
ют чешуи. Берут по две навески (200—300 мг) исследуемых объек-
тов — семядолей или почек без чешуй. Разрезают лезвием безопас-
ной бритвы на тонкие пластинки толщиной 1 — 2 мм. Срезы раз-
ных объектов помещают в отдельные стеклянные бюксы. В один
бюкс наливают 10 мл раствора ТТХ, в другой — 10 мл 0,87 %-ного
раствора К2НРО4. Затем все срезы в обоих вариантах инфильтриру-
ют этими же растворами с помощью медицинского шприца. После
инфильтрации срезы переносят вновь в бюксы, закрывают крыш-
ками и помещают на 30 мин в термостат с температурой 37 °C.
Срезы в бюксах с раствором ТТХ приобретают красный цвет, ин-
тенсивность которого зависит от активности дегидрогеназ.
Затем срезы каждой пробы вынимают из бюкса и растирают в
ступке с небольшим количеством этанола. Содержимое ступки пе-
реносят в мерный цилиндр и доводят этанолом до определенного
объема (5—10 мл), выбранного по интенсивности окраски ра-
створа, — чем интенсивнее окраска, тем больший можно выбрать
объем. Остатки измельченных образцов должны полностью обес-
цветиться. После растирания пробы центрифугируют, и получен-
ный экстракт, окрашенный формазаном, сразу колориметрируют
на ФЭКе при синем светофильтре. Если в исследуемых тканях име-
ется хлорофилл и контрольная вытяжка окрашивается в зеленый
цвет, а опытная — вместо красного в бурый, то колориметрирова-
ние проводят при зеленом светофильтре, что значительно снижа-
ет помехи, обусловленные дополнительным зеленым окрашива-
нием. Об активности дегидрогеназ судят по разнице в оптической
плотности между величиной показаний ФЭКа в опытной и конт-
рольной пробах. Для получения достоверных данных по активнос-
ти дегидрогеназ в данном объекте исследование необходимо по-
вторить не менее 3 раз. Величину дегидрогеназной активности в
60
данных объектах выражают в относительных единицах, исходя из
разницы в величинах оптической плотности опытной (с ТТХ) и
контрольной (без ТТХ) проб.
5.4.3. Определение активности каталазы. Каталаза в клетках вы-
полняет функцию обезвреживания очень активного и потому опас-
ного для живых клеток окислителя — пероксида водорода, ката-
лизируя реакцию 2Н2О2 = 2Н2О + О2. Этот фермент особенно ак-
тивен в молодых растущих тканях. Он активен также в зеленых
листьях, где участвует в процессе фотодыхания у С3-растений. Для
количественного определения активности каталазы можно исполь-
зовать и газометрический метод.
Материалы и оборудование: лупа, предметные и ча-
совые стекла, лезвие безопасной бритвы, спиртовка, 5%-ный ра-
створ пероксида водорода.
Цель работы: обнаружение активности каталазы в тканях
растений.
Растения: проростки кукурузы, бобов, тыквы, листья элодеи.
Ход работы
С проростков делают срезы толщиной 0,5—1 мм, а с побегов
элодеи отрывают отдельные листья. Часть срезов и листьев убива-
ют, нагревая их в капле воды на предметном стекле над пламенем
спиртовки. Живые и убитые срезы и листья помещают в воду на
часовое стекло и добавляют несколько капель раствора пероксида
водорода. Под лупой наблюдают появление пузырьков газа у по-
верхности живых срезов и листьев. Это выделяется кислород в ре-
зультате разложения пероксида под воздействием каталазы. Отме-
чают отсутствие пузырьков у убитых объектов.
Задание: описать опыт и сделать вывод о наличии активности
каталазы в живых тканях и об отсутствии ее в мертвых.
6. РОСТ РАСТЕНИЙ
6.1. Определение скорости роста корня
Рост корня в длину и его ветвление обеспечивают способность
растения поглощать воду и минеральные ионы.
Цель работы: познакомиться с методом быстрого определе-
ния скорости роста кончика корня. Метод основан на том, что за
кончиком корня ведется наблюдение под микроскопом, через оп-
ределенные промежутки времени учитывается смещение его вдоль
делений линейки окулярмикрометра (окулярной линейки).
Материалы и оборудование: стеклянный сосуд с влаж-
ными опилками, «горизонтальный микроскоп» (микроскоп с го-
61
ризонтальным тубусом), обеспечивающий 10—20-кратное увели-
чение, окулярная линейка, полоска миллиметровой бумаги или
линейка с миллиметровыми делениями.
Растения: 2 — 3-дневные проростки огурца, тыквы, подсол-
нечника, кукурузы и др.
Ход работы
В специальные каналы, сделанные у стенки стеклянного сосуда
с влажными опилками, помещают проросток. При этом кончик
корня, направленный вниз, должен быть хорошо виден через стекло.
Сверху сосуд закрывают стеклом, проросток прикрывают влаж-
ными опилками или влажной фильтровальной бумагой во избежа-
ние его подсыхания. Необходимо обеспечить устойчивое положе-
ние микроскопа и сосуда с проростком, чтобы не допустить их ма-
лейшего смещения в пространстве. В противном случае, например,
если стол будет сдвинут, измерения провести не удастся (рис. 13).
Затем фокусируют микроскоп на кончик корня и совмещают его
с делением окулярной линейки. Записывают, против какого де-
ления находится верхушка кончика корня. В результате роста кон-
чик будет перемещаться вдоль линейки. Через 10 или 15 мин про-
веряют, на сколько делений переместился кончик, и повторяют
это наблюдение еще раз.
На основании полученных данных определяют, на какое число
делений окулярной линейки корень удлинился за время наблюде-
ния, и рассчитывают его прирост за 1 ч. Например, если за 10 мин
Рис. 13. Определение скорости роста с помощью горизонтального
микроскопа:
1 — горизонтальный микроскоп; 2 — сосуд с опилками; 3 — проросшие семена в
каналах; 4 — первоначальное положение корня; 5 — конечное положение корня
62
корень переместился на 2 деления, то за 1 ч он переместится на 12
делений.
Цену деления окулярной линейки определяют в долях мил-
лиметра. Поскольку увеличение «горизонтального» микроскопа
небольшое, для этого можно использовать обычную линейку с
делениями в 1 мм. Для этого фокусируют микроскоп на эту ли-
нейку или полоску миллиметровой бумаги и считают, сколько
миллиметров укладывается в определенное число делений оку-
лярной линейки. Например, если в 100 делениях окулярной ли-
нейки укладывается 5 мм, то цена деления окулярной линейки
равна 0,05 мм. Чтобы рассчитать скорость роста корня в милли-
метрах в час, следует умножить величину скорости его роста,
выраженную в делениях окулярной линейки, на цену деления
этой линейки, выраженную в миллиметрах. Например, если за
10 мин кончик корня переместился на два деления окулярной
линейки, то скорость его роста равна: (2-0,05) мм/10 мин =
— 0,01 мм/мин = 0,6 мм/ч.
Сравнивают скорость роста корней разных проростков при оди-
наковых условиях или одного и того же корня при изменении тем-
пературы, влажности и других факторов.
Задание: зарисовать установку (камера с корнем и микро-
скоп), охарактеризовать объект исследования, сделать запись о ре-
гистрации числа делений окулярной линейки и времени наблюде-
ния, об определении цены деления окулярной линейки и расчет
скорости роста корня.
6.2. Влияние фитогормонов на рост растений
Фитогормоны — это вещества, которые синтезируются в расте-
ниях в очень малых количествах, но физиологическая роль их в
регуляции роста велика. Различают группы фитогормонов: аукси-
ны, гиббереллины, цитокинины, абсцизовая кислота и этилен.
Функции отдельных фитогормонов разграничены, но вместе с тем
все они обладают рядом общих свойств: активизируют рост, пере-
двигаются по растению и поэтому могут проявлять свое действие
на расстоянии от места их синтеза. Фитогормоны оказывают сти-
мулирующее действие на рост только в очень малых концентраци-
ях. Повышенное их количество вызывает торможение роста. На этом
свойстве гормонов основан метод их определения с помощью био-
логических объектов, или метод биотестов. В настоящее время ис-
пользуют регуляторы роста, которые получают синтетическим спо-
собом. Их действие на рост зависит также от концентрации. Как
правило, в практике для обработки растений регуляторы роста при-
меняют в молярной (10~4—10~12) или процентной концентрации.
63
6.2.1. Влияние ауксина на рост растяжением отрезков колеопти-
лей злаков. Ауксины способны стимулировать рост растяжением
отрезков стеблей или колеоптилей. Это проявление одной из мно-
гочисленных функций ауксина было использовано для разработки
метода биотеста, позволяющего определить активность фитогор-
мона в растительном материале.
Эффект, вызываемый присутствием ауксина, прямо пропор-
ционален (в определенных пределах) логарифму концентрации
добавленного гормона. В низких концентрациях ауксин ускоряет
ростовые процессы, а при превышении оптимальной концентра-
ции — замедляет их.
Цель работы: изучить зависимость роста отрезков колеоп-
тилей злаков от концентрации ауксина.
Материалы и оборудование: раствор ИУК 10-4 М (р-
индолилуксусной кислоты), станочки (2 лезвия, вставленные па-
раллельно на расстоянии 5 мм друг от друга в пластиковую, метал-
лическую или деревянную основу), чашки Петри, стеклянные ка-
пилляры длиной 10 см, лодочки — узкие стеклянные кюветы дли-
ной 11 — 12 см.
Растения: отрезки колеоптилей пшеницы, овса, кукурузы в
фазе растяжения.
Ход работы
Готовят набор концентраций ИУК: 10~4, 10~6, 10~8, 10~10 М. Раз-
ливают растворы в лодочки (до половины высоты лодочки, объем
раствора везде должен быть одинаков). В контрольную лодочку на-
ливают такой же объем дистиллированной воды.
Семена пшеницы замачивают в воде в течение суток, затем
переносят в термостат и выращивают при температуре 26 °C в тече-
ние 48 ч. У проростков отделяют целые колеоптили одинакового
размера (18 — 20 мм). Укладывают их таким образом, чтобы вер-
хушки колеоптилей находились на одной линии, и высекают ста-
ночком отрезки длиной 5 мм на расстоянии 4 —5 мм от верхушки.
Отрезки колеоптилей нанизывают по 7—10 штук на стеклянные
капилляры, предварительно удалив кусочки зеленых листьев, и
временно помещают в чашку Петри с водой.
На каждом капилляре измеряют общую длину всех отрезков,
сложенных вместе, записывают результаты измерений и перено-
сят по одному капилляру в лодочки с определенными концентра-
циями ауксина. Еще один капилляр опускают в контрольную ло-
дочку с водой. Лодочки оставляют в термостате при температуре
25°C на 2,5 —3 ч (лучше на 18 — 24 ч). Опыт ставят в трехкратной
повторности.
По окончании опыта пинцетом вынимают колеоптили из лодо-
чек и измеряют длину всех отрезков. Результаты записывают в таб-
лицу (табл. 7).
64
Таблица 7
Влияние разных концентраций ИУК на рост
отрезков колеоптилей пшеницы
Вариант опыта Длина отрезков колеоптилей в начале опыта, мм Длина отрезков колеоптилей в конце опыта, мм Прирост, мм Прирост, % к контролю
Контроль (вода)
ИУК, М: 10~4 10~6 10~8 10-10
Задание: сделать график зависимости роста отрезков колеоп-
тилей пшеницы от концентрации ИУК. Сформулировать выводы.
6.2.2. Влияние гиббереллина на рост карликовых сортов растений.
Одним из наиболее типичных проявлений действия гибберелли-
нов является их способность вызывать удлинение стебля. Особенно
сильно эта способность гиббереллина проявляется при обработке
гормоном карликовых растений, которые служат биотестом при
определении гиббереллинов.
Цель работы: изучить стимулирующее действие гибберел-
лина на рост стебля растений карликового гороха или фасоли.
Материалы и оборудование: химические стаканы на
100 мл, пипетки на 5 мл, фильтровальная бумага, лезвия, линей-
ки, пинцеты, полиэтиленовая пленка, круглые резинки, термо-
стат, раствор гиббереллина 5 • 10~4 мг/л.
Растения: семена карликовых сортов гороха или фасоли.
Ход работы
1. Семена карликового сорта гороха предварительно замачива-
ют в течение 15 —20 ч и проращивают 48 ч в термостате при тем-
пературе 26 °C. Через 2 дня отбирают одинаковые проростки с дли-
ной корешка 1,5 —2сми2—Зч выдерживают в холодильнике при
температуре 1 — 0 °C.
Готовят растворы гиббереллина в концентрациях 5 • 10~4, 5 • ИН,
5 • 10~6, 5 • 10~7, 5 • 10~8 мг/л и разливают их в химические стаканы
по 4 мл в каждый. В контрольные стаканы наливают по 4 мл дис-
тиллированной воды. Опыт проводят в двух-трех повторностях, т. е.
для каждого варианта готовят 2—3 стакана. На дно стаканов мож-
но положить кусочек фильтровальной бумаги. Стаканы накрывают
полиэтиленовой пленкой во избежание испарения растворов.
3—338
65
Отобранные проростки гороха разрезают пополам так, чтобы
срез проходил поперек семядолей. Корешок подрезают, оставляя
участок у основания корня длиной 5 мм. Половинки семядолей с
остатком корешка и наклюнувшейся почкой помещают срезом вниз
на дно стакана с испытуемым раствором. В стаканы их укладывают
по пять штук. Каждый стакан закрывают куском полиэтиленовой
пленки, которую закрепляют кольцевой резинкой и ставят в тер-
мостат при температуре 26 °C. На четвертые сутки для учета росто-
вой реакции эпикотиль срезают у основания и измеряют его длину.
Семядоли и корешок отбрасывают. Результаты заносят в таблицу
(табл. 8).
Таблица 8
Действие гиббереллина на рост карликового гороха
Вариант опыта Длина эпикотиля, мм Средняя длина эпикотиля, мм Прирост, % к контролю
Контроль (вода)
Гиббереллин, мг/л: 5 • КН 5- 10~5 5- 10*6 5- 10~7 5- 10~8
Задание: построить кривую зависимости прироста карлико-
вого гороха от концентрации гиббереллина. Сделать выводы о дей-
ствии гиббереллина на рост растений карликового сорта гороха.
2. В качестве другого биотеста для определения активности гиб-
береллинов может быть использован салат сорта Берлинский. На
этом растении так же, как и на горохе, удобно продемонстриро-
вать зависимость ростовых процессов от концентрации гибберел-
лина.
Семена салата проращивают при температуре 25 °C в течение
24 ч. Отбирают наклюнувшиеся семена с корешком 2 — 4 мм и рас-
кладывают в стаканы с водой и растворами гиббереллина (кон-
центрации те же) на кусочек фильтровальной бумаги. Стаканы за-
крывают и ставят на непрерывное освещение в факторостатную
камеру при температуре 25 °C на 72 ч. После экспозиции измеряют
длину гипокотиля салата и определяют процент прироста гипоко-
тилей в опытных вариантах по отношению к контролю. Результаты
заносят в таблицу (аналогично предыдущему опыту).
Задание: то же.
66
6.2.3. Влияние цитокининов на старение изолированных органов
растений. Одной из наиболее важных функций цитокинина в рас-
тении является замедление процессов старения. Этот эффект про-
является как на изолированных листьях, так и на листьях интакт-
ных растений. Обработанные цитокинином листья долгое время
остаются зелеными, в то время как в необработанных листьях ус-
коренно идут процессы разрушения хлорофилла, белков и т.д. Ци-
токинины могут не только задерживать процессы распада, но и
стимулировать синтез этих соединений.
Цель работы: изучить влияние цитокининов на старение изо-
лированных листьев.
Материалы и оборудование: высокие химические ста-
каны на 150—200 мл, лезвия, весы, сушильный шкаф, теплица,
кристаллизатор, раствор 6-бензиламинопурина (6-БАП) в кон-
центрации 50 мг/л.
Растения: листья герани, подсолнечника, топинамбура.
Ход работы
С разных побегов одного и того же яруса срезают 20 взрослых
листьев. В каждом из четырех вариантов опыта используют по че-
тыре листа. Срезы черешков обновляют под водой в кристаллиза-
торе, листья расставляют в химические стаканы, наполненные до
половины водой (контроль) и растворами 6-БАП в концентраци-
ях 25, 35 и 50 мг/л. Стаканы с листьями ставят на яркое освещение
в теплицу. У каждого из четырех оставшихся листьев определяют
массу сухого вещества после выдерживания в сушильном шкафу
при температуре 105 °C в течение 6 ч. Рассчитывают среднее значе-
ние массы одного листа (А).
Через 7 дней отмечают состояние листьев. Если листья, находя-
щиеся в воде, начали желтеть, опыт можно прекратить. Для учета
результатов листья вынимают, фильтровальной бумагой обсуши-
вают черешки. По два-три листа из каждого варианта используют
для определения массы сухого вещества одного листа (Б). Чем боль-
ше убыль сухого вещества (А—Б), тем сильнее идут процессы рас-
пада, тем интенсивнее происходит процесс старения.
Интенсивность этого процесса можно также определить, срав-
нивая визуально количество хлорофилла в оставшихся листьях.
Результаты заносят в таблицу (табл. 9).
Задание: сделать вывод о влиянии 6-БАП на задержку процесса
старения в листьях. Определить оптимальную концентрацию 6-БАП.
6.2.4. Влияние цитокинина, гиббереллина и абсцизовой кислоты
на рост изолированных семядолей огурца. Существуют достаточно
специфичные биотесты на отдельные фитогормоны. Под воздей-
ствием ауксина наблюдается изгиб колеоптиля овса и рост зоны
растяжения колеоптиля злаков, гиббереллины (ГК) ускоряют рост
67
побега, цитокинины (ЦК) стимулируют рост каллуса в культуре
ткани и синтез антоцианов. Абсцизовая кислота (АБК) ингибиру-
ет рост, ускоряет опадение плодов, листьев и т.д.
Таблица 9
Влияние обработки 6-БАП на содержание хлорофилла
и изменение массы листьев (на сухое вещество)
Вариант опыта Исходная масса, мг (А) Конечная масса, мг (Б) Убыль массы, мг (А-Б) Содержание хлорофилла, баллы
Контроль (вода)
6-БАП, мг/л: 25 35 50
Трудно найти биотест, дающий специфические реакции на все
перечисленные фитогормоны. Однако изолированные семядоли
проростков тыквенных растений — огурцов, кабачков, тыквы,
цуккини в этом отношении являются хорошими объектами и до-
статочно специфично отвечают на воздействие ЦК, ГК и АБК.
Цель работы: сравнить характер воздействия различных фи-
тогормонов и их смеси на рост изолированных семядолей на при-
мере огурца.
Материалы и оборудование: простерилизованныечаш-
ки Петри, пипетки или цилиндры на 10 мл, колбы мерные на 250
мл, раствор ЦК (20 мг/л), ГК (25 мг/л), АБК (20 мг/л), растворы
смеси гормонов (ЦК — 20 мг/л, ГК — 25 мг/л) в соотношении 1:1,
бритвы, марля, кристаллизатор, ножницы, дистиллированная вода,
маркер по стеклу, миллиметровая линейка, раствор КМпО4.
Растения: семена огурца, тыквы, кабачков; диски листьев
капусты (при отсутствии проростков огурца работу можно выпол-
нить с дисками, вырезанными из листа кочанной капусты).
Ход работы
1. Выращивание проростков. Семена огурца, выровненные по
размеру и наполненности, промывают 10—15 мин темно-розовым
раствором КМпО4, раскладывают на фильтровальной бумаге в кю-
вете и помещают на 5 дней в термостат при температуре 27 °C.
2. Заложение опыта. Для работы подготавливают чашки Петри:
подписывают нижнюю чашку по боковой стороне, указав вариант
опыта, фамилию, номер подгруппы. Вкладывают в чашку фильтр,
вливают в нее (соответственно варианту опыта) по 10 мл раство-
ров фитогормонов.
68
Срезают у каждого проростка обе семядоли, не затрагивая вер-
хушечную почку зародыша. Отделенные семядоли помещают на
марлю в кристаллизатор с дистиллированной водой, а затем рас-
кладывают в чашки Петри по 10 семядолей нижней поверхностью
на фильтр, а верхней к свету. Чашки Петри помещают в специаль-
ный лабораторный шкаф с ярким освещением при температуре
23 —25 °C на 7 дней.
3. Измерения. Определяют длину, ширину, массу 10 семядолей,
оценивают в баллах содержание хлорофилла. Результаты заносят в
таблицу. Отдельно записывают наблюдения по возможным случа-
ям проявления морфогенеза, закручивания семядолей (какая сто-
рона семядолей закручивается — нижняя или верхняя). Измерения
проводят с помощью полоски миллиметровой бумаги с точностью
до 1 мм. Содержание хлорофилла сравнивают с контролем, при-
нимая его за 5 баллов.
Таблица 10
Действие фитогормонов на рост изолированных семядолей огурца
Вариант опыта Длина семядолей, см Ширина семядолей, см
1 2 3 4 5 6 7 8 9 10 X % 1 2 3 4 5 6 7 8 9 10 S X %
Конт- роль (Н2О)
ГК
ЦК
гк+цк
АБК
Примечание. £ — сумма; X — средняя величина.
Задание: полученные данные внести в таблицу, провести рас-
четы, построить диаграммы, сделать выводы.
6.2.5. Изменение анатомии семядолей огурца под влиянием цито-
кинина. Под действием цитокинина активируется деление клеток,
их рост и дифференцировка. В семядолях цитокинин стимулирует
дифференциацию новых проводящих пучков, деление клеток столб-
чатой ткани, рост клеток губчатой ткани.
Цель работы: изучить влияние цитокинина на анатомию изо-
лированных семядолей огурца.
Материалы и оборудование: микроскопы, предметные
и покровные стекла, пинцеты, препаровальные иглы, новые лез-
69
вия безопасной бритвы, пенопласт, окуляр-микрометр с установ-
ленной ценой деления, салфетки, фильтровальная бумага, вода,
стеклянные палочки, осветители к микроскопам, соляная кисло-
та и флороглюцин.
Растения: семядоли проростков огурца (тыквы, кабачка),
которые остались от работы 6.2.4, по вариантам: контроль и ЦК
20 мг/л.
При ограниченном количестве времени работа выполняется
одновременно несколькими студентами, объединенными в две
бригады. Одна бригада (три студента) анализирует семядоли конт-
рольного варианта, другая — семядоли, подвергшиеся воздействию
ЦК. Полученные данные заносят в таблицу (табл. 11), которая дол-
жна быть представлена в тетради каждого студента.
Таблица 11
Влияние цитокинина на гистологию изолированных семядолей
Вариант опыта Тол- щина плас- ТИНКИ, мм Число слоев клеток ткани Число устьиц на 1 мм2 эпидермы Приме- чания
пали- садной губчатой верхней нижней
Контроль
ЦК
Ход работы
1. Приготовление срезов. На чистые предметные стекла наносят
по капле воды и готовят препараты поперечных срезов семядоли,
а также верхней и нижней эпидермы. Все пробы берут из средней
части семядоли. У более крупного объекта (семядоли тыквы, ка-
бачка) для приготовления поперечного среза предварительно вы-
резают полоску из средней части семядоли шириной 4—5 мм.
В центре полоски оказывается главная жилка. Препараты готовят
по общепринятой методике. Каждый студент бригады ответствен
за один из препаратов. При параллельной работе происходит зна-
чительная экономия времени. Для получения хорошего препарата
делают несколько повторных срезов и выбирают лучшие.
Срезы становятся более прозрачными после обработки их
10%-ным раствором НС1. Для этого фильтровальной бумагой уби-
рают воду, оставив срезы достаточно влажными, и обрабатывают
их раствором НО. Через 3 — 4 мин фильтровальной бумагой «уби-
рают» кислоту, а на препарат наносят глицерин. Количество гли-
церина должно быть достаточным для того, чтобы покрыть срезы
полностью, но его не должно быть так много, чтобы он выступал
70
за пределы покровного стекла. Лишнюю жидкость убирают фильт-
ровальной бумагой и срезы накрывают чистым покровным стек-
лом. Глицерин позволит сохранить срезы в течение длительного
времени. Препараты следует для этого поместить в коробку с
крышкой.
Поперечные срезы семядолей обрабатывают флороглюцином и
соляной кислотой. При такой обработке рассматриваемый объект
не только становится более прозрачным, но и одревесневшие обо-
лочки клеток окрашиваются в красно-малиновый цвет. Это свой-
ственно элементам ксилеммы и склеренхимным волокнам флоэ-
мы. Оттянув жидкость фильтровальной бумагой, на срезы наносят
глицерин и прикрывают их покровным стеклом.
2. Работа с микроскопом. При рассмотрении эпидермы (увели-
чение 7 х 40) необходимо обратить внимание на форму эпидер-
мальных клеток (клетки паренхимные или прозенхимные) и прежде
всего на характер шва (радиальные стенки между соседними клет-
ками). Определяют число устьиц в поле зрения или на условно
выбранной площади, предварительно поместив в окуляр кружок
плотной бумаги с вырезанным квадратиком посередине. Сторону
квадрата при том же увеличении измеряют с помощью объектив-
ной линейки и определяют площадь квадрата.
Считают число устьиц на разных участках эпидермы, сделав не
менее 5—10 измерений, и определяют среднее число. Установив
число устьиц на выбранной площади, делают пересчет на 1 мм2.
При рассмотрении поперечного среза семядоли (сперва при уве-
личении 7 х 8, а потом — 7 х 40) окуляр-микрометром определяют
толщину среза (несколько измерений в разных частях среза), под-
считывают число слоев клеток в области столбчатой и губчатой тка-
ней. Обращают внимание на форму и размер клеток, степень вытя-
нутости клеток столбчатой ткани. Устанавливают, за счет какой тка-
ни прежде всего увеличилась толщина семядоли в варианте с ЦК.
Задание: в оформленной работе помимо таблицы должны быть
представлены рисунки эпидермы и поперечного среза семядоли
по двум вариантам. Сделать вывод о влиянии физиологически ак-
тивного вещества на гистологию семядолей огурца (тыквы, ка-
бачка).
6.2.6. Изменение анатомии семядолей огурца под влиянием абсци-
зовой кислоты.
Цель работы: изучить влияние абсцизовой кислоты на ана-
томию семядолей огурца (тыквы, кабачка), изолированных от за-
родыша.
Материалы и оборудование: см. работу 6.2.5.
Растения: семядоли огурца (тыквы, кабачка), оставленные
от работы 6.2.4.
71
Ход работы
См. работу 6.2.5. Полученные данные заносят в таблицу (табл. 12).
Таблица 12
Влияние абсцизовой кислоты на гистологию семядолей
Вариант опыта Тол- щина плас- тинки, мм Число слоев клеток палисад- ной ткани Число слоев клеток губчатой ткани Число устьиц на 1 мм2 эпидермы Приме- чания
верхней нижней
Контроль
АБК
Задание: оформленная работа включает таблицу с занесен-
ными в нее данными и должна быть проиллюстрирована рисунка-
ми (нижняя и верхняя эпидерма, поперечный срез семядоли из
разных вариантов опыта). Сделать выводы о влиянии АБК на ги-
стологию семядолей огурца (тыквы, кабачка).
6.3. Состояние покоя
Для роста растений на любых этапах онтогенеза характерен пе-
риод покоя. Согласно Н. А. Максимову, период покоя — наследствен-
но закрепленное приспособление к перенесению неблагоприят-
ного времени года, периодически наступающего в большинстве
районов земного шара. Однако временная приостановка ростовых
процессов характерна и для тропических растений, несмотря на
круглогодичные благоприятные условия. Если растение не прошло
периода покоя, в последующем темпы его роста снижаются, ухуд-
шается плодоношение. Таким образом, период покоя можно рас-
сматривать не только как приспособление к неблагоприятным ус-
ловиям внешней среды, но и как необходимое звено онтогенеза
растений. Различают вынужденный покой, вызванный отсутствием
необходимых для роста условий, и глубокий, или органический, по-
кой, когда рост растения не возобновляется даже при наличии всех
благоприятных условий.
6.3.1. Глубина покоя в зимний период у разных видов древесных
и кустарниковых растений. У деревьев и кустарников умеренного
климата к зиме рост прекращается, они теряют листья (кроме
ряда хвойных пород) и переходят в состояние покоя. В это время
все жизненные процессы в организме протекают чрезвычайно мед-
ленно, что делает его более устойчивым к неблагоприятным внеш-
72
ним воздействиям. Глубина покоя у разных видов неодинакова.
Осенью, после опадения листьев, покой наиболее глубокий, орга-
нический. Одни растения раньше выходят из этого состояния, но
остаются в вынужденном покое, обусловленном неблагоприят-
ными для роста условиями внешней среды. У других видов орга-
нический покой сохраняется более длительный период и завер-
шается, как правило, к концу зимы. Эти растения также остают-
ся в состоянии вынужденного покоя. Если органический покой
завершен, то у растений (или их побегов), перенесенных в благо-
приятные условия, почки трогаются в рост и отрастают новые
побеги.
Цель работы: выявить различия в глубине и продолжитель-
ности органического покоя у разных видов деревьев и кустарни-
ков, произрастающих в одном районе.
Материалы и оборудование: банки вместимостью 200—
500 мл.
Растения: ветки древесных и кустарниковых растений (чере-
муха, береза, липа, клен, лещина, крушина и т.д.).
Ход работы
Для реализации поставленной цели необходимо продолжитель-
ное время. На одном из занятий в начале учебного года (октябрь)
обсуждают этот вопрос и закладывают опыт. На втором занятии
(конец февраля — март) подводят итоги. Каждой бригаде из 2 — 3
человек предлагают взять для работы и наблюдения не менее трех
видов растений, например черемуху, березу, дуб (возможны раз-
ные варианты). Общее число видов на группу окажется гораздо
большим. Собранные в природе ветки ставят в банки с водой. Пред-
варительно подрезают под водой проксимальные концы веток. На
банку наклеивают этикетку с указанием исполнителей и даты сбо-
ра растений в природе. В последующем не менее чем раз в месяц
(ноябрь, декабрь, январь, февраль) регулярно срезают в природе
ветки тех же видов растений и следят за сроком выхода их из со-
стояния покоя. Ветки этикетируют с указанием срока сбора. Не
реже одного раза в неделю воду меняют и подрезают концы веток
под водой.
Главная задача — не пропустить время «пробуждения» почек
(их набухание и развертывание) и начало роста новых побегов.
Данные наблюдений заносят в тетрадь. При их анализе надо обра-
тить внимание на скорость развертывания почек у побегов одного
вида, но собранных в разные сроки. Одинаков ли отрезок времени
от сбора их в природе до развертывания почек?
На втором занятии в сводную таблицу каждая бригада заносит
полученные ею данные. Их анализируют и делают вывод о глубине
и продолжительности покоя у разных видов древесных и кустар-
никовых растений, произрастающих в одной местности.
73
Задание: перенести сведения, полученные каждым студен-
том группы, в тетрадь и заполнить сводную таблицу (табл. 13).
Таблица 13
Различия в глубине покоя у разных растений
Растения Срок взятия пробы
Октябрь Ноябрь Декабрь Январь
Время развертывания почек и начала роста побегов
Черемуха Береза Дуб
6.3.2. Глубина покоя у генеративных и вегетативных почек одного
и того же вида растений. У многих древесных и кустарниковых ра-
стений уже к осени сформированы вегетативные и генеративные
почки. После перезимовки они трогаются в рост.
Цель работы: установить, одинаковая или разная глубина
покоя у вегетативных и генеративных почек одного и того же вида.
Материалы и оборудование: банки вместимостью не
менее 1 л, вода.
Растения: ветки ясеня обыкновенного, ивы козьей, клена
американского, лещины обыкновенной и других видов.
Ход работы
Во второй половине зимы (февраль—март) собранные в при-
роде ветки ставят по 10 штук каждого вида в банки с водой. Пред-
варительно срезы веток обновляют под водой. Результаты заносят
в таблицу.
Лещина обыкновенная — однодомное растение. Мужские цветки
собраны в соцветия сережки. Цветение их и созревание пыльцы
пропустить трудно. Следует быть внимательными к пробуждению
вегетативных почек и почек с женскими цветками. К периоду
цветения генеративная почка с пестичными цветками набухает и
вскоре на ее верхушке между несколько разошедшимися чешуями
появляется «пучок» красно-бордовых рыльцев, готовых «поймать»
пыльцу.
Задание: для оформления работы надо сделать рисунки побе-
гов до начала опыта и по его завершении. Обратить внимание на
размеры сережек в начале опыта и в конце, на внешний вид жен-
ского соцветия, отрастающие вегетативные побеги после развер-
тывания почек. Дать биологические объяснения наблюдаемому яв-
лению. Отметить, совпадает ли порядок развертывания вегетатив-
74
ных и генеративных побегов в помещении и в природе. Получен-
ные в опыте данные занести в таблицу (табл. 14).
Таблица 14
Сравнение глубины покоя генеративных и вегетативных почек
Растения Дата Приме- чания
постанов- ки опыта зацвета- ния муж- ских цвет- ков и вы- сыпания пыльцы зацвета- ния женских цветков разверты- вания вегетатив- ных почек и роста побега
Лещина обыкно- венная
6.3.3. Выведение из состояния покоя побегов древесных растений.
Практические рекомендации
Работа рассчитана на два занятия с интервалом не менее од-
ного месяца. На первом — заложение опыта и обсуждение про-
блемы, на втором подведение итогов и обсуждение результа-
тов опыта. В остальное время ведут наблюдения за растениями и
ухаживают за ними.
1. Для умеренной климатической зоны следует учитывать, что в
октябре —ноябре древесные и кустарниковые растения находятся
в покое. Глубина покоя у разных видов неодинакова, это должно
быть учтено при подготовке опыта, подборе материала и метода
воздействия на растение.
В декабре и январе большинство древесных растений после воз-
действия низких зимних температур находятся в вынужденном
покое.
В феврале и марте растения наших широт находятся в вынуж-
денном покое и менее чем через месяц после перенесения в благо-
приятные условия трогаются в рост. На примере опыта с побегами
вишни видна прямая зависимость срока ее цветения от времени
заложения опыта (табл. 15).
Многие виды не только выходят из покоя, но и цветут, пред-
ставляя декоративную ценность, особенно в преддверии 8 марта
(табл. 16).
Помимо видов, перечисленных в таблице, для выгонки можно
использовать айву японскую, яблони декоративные, сливу трех-
75
лопастную, калину бульдонеж, сирень, дерен, дейцию, смороди-
ну, каштан конский, форзицию, тамариск, орешник и многие
другие растения.
Таблица 15
Зависимость времени цветения побегов вишни от времени срезки в природе
Дата срезки побегов Дата цветения Время от срезки до цветения, сут
14.12 10.01 27
10.01 28.01 18
2.02 19.02 17
2.03 14.03 12
Таблица 16
Выведение из состояния покоя веток кустарников и деревьев (по Малюгину)
Растения Срезка веток Набу- хание почек Распус- кание листьев Пол- ная облист- вен- ность Буто- низация Начало цвете- ния
Береза бородавчатая 25.02 28.02 8.03 15.03 2.03 6.03
Ива белая 15.02 23.02 1.03 9.03 27.02 6.03
Лиственница сибирская 20.02 22.02 7.03 13.03 — —
Миндаль низкий 25.02 28.02 12.03 19.03 2.03 5.03
Рябинник рябинолистный 25.02 26.02 7.03 15.03 — —
Таволга Вангута 15.02 20.02 26.02 7.03 26.02 4.03
Черемуха виргинская 15.02 16.02 23.02 7.03 22.02 4.03
Черемуха обыкновенная 15.02 20.02 26.02 6.03 25.02 5.03
2. Условия выгонки. Предпочтительная длина побегов — 40 см.
Их концы погружают в раствор на 15 см, и каждый раз при смене
раствора срез следует обновлять под водой. Выгонку проводят при
76
температуре 20—22 °C. С началом распускания почек температуру
снижают до 16— 18°С. Продолжительность светового периода 10—
12 ч в сутки (возможно и круглосуточное). Чтобы предупредить
засыхание почек, ветки каждые 2—3 дня опрыскивают водой. При
постановке опыта в феврале букет будет готов через 15 — 20 дней.
3. Приготовление питательного раствора. Очень хорошо зареко-
мендовал себя питательный раствор, приготовленный по методу
профессора Рупрехта (Германия): 0,08%-ный раствор алюмокали-
евых квасцов, 0,03 %-ный раствор NaNO3 или 0,03 %-ный раствор
NaCl. Можно использовать и полную питательную смесь Кнопа:
Ca(NO3)2 - 1 г, КН2РО4 - 0,25 г, MgSO4 - 0,25 г, КС1 - 0,125 г,
FeCl3 — следы на 1 л.
Выгонке некоторых растений способствует добавление 0,01%
лимонной кислоты или 1 % сахарозы. Растворы меняют каждую
неделю. Каждый вид растений устанавливают в отдельный сосуд.
4. Приемы ускоренной выгонки и ингибирования распускания
почек:
а) ГК в концентрации 50—100 мг/л, а также кинетин в кон-
центрации 30 мг/л являются веществами, способными вывести
растения из любой стадии покоя. Под действием гибберелловой
кислоты наблюдается не только развертывание листьев, но и рост
удлиненных побегов;
б) тепловая ванна (рис. 14) — очень действенный прием. Чем
выше ее температура, тем меньше продолжительность выдержива-
ния в ней растений: при 33 —36°С — 10—12 ч; при 18 —20°С —
15-18 ч; при 15 —20°С - 24 ч;
в) эфиризация. Применяют обработку 0,5 мл диэтилового эфира
на 1 л воздуха при температуре 18 —20 °C в течение 12 ч. Под стек-
лянный колпак помещают побеги и склянку с эфиром ставят в со-
суд с водой, насыщая таким образом воздух его парами (рис. 15);
г) воздействие аммонийных
солей NH4C1 и NH4NO3 также
способствует выходу побегов из
покоя. Опытным путем можно вы-
явить, какая из работ предпочти-
тельнее для данного растения. Так,
лиственница, рябина, сирень хо-
рошо отзываются на тепловую
ванну; орешник, смородина, дуб,
лох серебристый, ясень — на об-
работку парами эфира;
д) можно ингибировать выход
из покоя почек древесных расте-
ний абсцизовой кислотой в кон-
центрации 30 мг/л.
Рис. 14. Тепловая ванна:
1 — ветки растения; 2 — сосуд с
теплой водой; 3 — термостат (пе-
нопластовый ящик)
77
Рис. 15. Эфиризация:
1 — ветки растений; 2 — кюветы с водой; 3 — склянка с эфиром; 4 — стеклян-
ный колпак
5. Выведение из состояния покоя луковичных, корневищных и
растений, имеющих клубни. К луковичным выгоночным расте-
ниям относятся гиацинты, тюльпаны, нарциссы, сциллы, фри-
тиллярии, крокусы, хохлатки, мускари, галантусы, амарилли-
сы, лилии и др. Посаженные осенью (сентябрь, октябрь) в горш-
ки с песком растения помещают в холодильную камеру с темпе-
ратурой 1—4°С. Спустя 2 — 2,5 месяца их проращивают в поме-
щении с температурой 10 °C в темноте (декабрь) до высоты 10 см
и, наконец, переносят в оранжерею с подсветкой, где выращи-
вают до цветения. Тюльпаны зацветают через 20 дней (18 —20 °C),
гиацинты через 14 дней (23—25 °C), нарциссы через 20 дней (16—
18 °C). В помещение для проращивания их переводят в зависимо-
сти от планируемого срока получения цветков (декабрь, январь,
февраль).
Из многолетников для выгонки ценится ландыш. В горшки с
опилками или песком высаживают корневища ландыша с трех-
годичной цветковой почкой, имеющей тупую округлую форму.
Предварительно их промораживают 5 —6 ч в морозильнике или
сутки в снегу. В горшок сажают 8—15 побегов и выдерживают в
холодильнике до определенной даты, а затем помещают в камеру
со светом и достаточной влажностью при температуре 25 °C. По-
ливают водой, нагретой до 25 °C. После появления цветоноса пе-
реносят в помещение с температурой 10—12°С для удлинения
срока цветения.
Для стимулирования прорастания клубней картофеля осенью
их обрабатывают 1 —2%-ным раствором тиокарбамида или АБК
(30 мг/л) в течение 2 —3 ч, а затем высаживают в песок при тем-
пературе 20 °C.
Цель работы: познакомиться с приемами выведения дре-
весных растений из состояния покоя.
Материалы и оборудование: банки, растворы, нитки,
бумага вощеная для этикеток на побеги, бумага для этикеток на
78
банки, секатор, большой сосуд с водой, растворы алюмокалиевых
квасцов — 0,08 %-ный, NaNO3 — 0,03 %-ный или NaCl — 0,03 %-
ный, карандаш простой, маркер по стеклу.
Растения: ветки кустарников или деревьев.
Ход работы
Первое занятие — заложение опыта.
Ветки для опыта желательно брать с одного и того же дерева
или большого куста.
Для каждого растения следует сделать свою таблицу (табл. 17),
указав время заложения опыта.
Таблица 17
Наблюдения за выведением веток из состояния покоя
Вариант опыта Всего почек на 10 ветках Дата Всего распу- стив- шихся почек % к конт- ролю
набу- хания почек рас- пус- кания лис- тьев пол- ного обли- стве- ния буто- низа- ции цве- тения
Контроль (вода)
Тепловая ванна
Эфириза- ция
ГК
АБК
Отметить условия проведения опыта: освещенность, темпера-
туру, влажность, состав раствора, частоту смены раствора и т.д.
Задание: заполнить таблицу; сделать выводы — в глубоком
или вынужденном покое находились опытные растения.
6.4. Движения растений
На изменение внешних воздействий растения реагируют не толь-
ко изменением метаболизма, но и изменением положения своих
органов в пространстве. Выделяют два вида движения органов рас-
тений путем изменения их роста — тропизмы и настии.
79
Тропизмами называют ориентированные ростовые движения
отдельных органов растения в ответ на одностороннее действие
внешнего раздражения. По отношению к тому или иному опреде-
ленному фактору ориентация отдельных органов растений может
быть положительной или отрицательной. Те органы, которые по-
ворачиваются к источнику раздражения, проявляют положитель-
ный тропизм; при противоположной реакции — отрицательный.
Орган называется плагиотропным, если он располагается под тем
или иным углом к направлению действия раздражителя. Раздражи-
телем может быть свет (фототропизмы), земное притяжение (геотро-
пизмы), вода (гидротропизмы) и другие факторы внешней среды.
Настии — движение органов с дорсовентральным строением в
ответ на изменение диффузно действующих факторов внешней
среды, таких как свет, температура и т.д.
6.4.1. Фототропизм побега или его частей. Положительный фо-
тотропизм органа (листа, побега, цветоножки) — это результат
задержки роста на освещенной его стороне и усиление роста на
противоположной стороне. Орган изгибается в сторону наимень-
шего роста.
Цель работы: проиллюстрировать реакцию листьев на од-
ностороннее световое раздражение.
Материалы и оборудование: два вазона для выращи-
вания растений, почва или влажные опилки, семена пшеницы
(ячменя, овса и др.), фототропическая камера, настольная лампа.
Растение: проростки злака.
Ход работы
Выращивают проростки злака (4—5 см и выше). Один вазон с
проросками ставят в условия одностороннего освещения (в фото-
тропическую камеру), а другой оставляют на диффузном освеще-
нии. Камеру можно изготовить из картона. Внутренние стенки сле-
дует зачернить краской или обклеить черной бумагой. На одной из
сторон камеры, которая будет обращена к источнику света, дела-
ют небольшое отверстие на высоте, соответствующей положению
надземной части проростков. Через 1 — 2 дня подводят итоги по
наблюдаемому явлению.
Задание: зарисовать установку в начале и в конце опыта. За-
писать вывод.
6.4.2. Определение места восприятия светового раздражения у
проростков злака.
Цель работы: показать, что восприятие светового раздра-
жения у проростков овса (ячменя, кукурузы, пшеницы и др.) осу-
ществляется верхушкой колеоптиля.
Материалы и оборудование: два вазона для выращи-
вания проростков, почва или влажные опилки, семена овса (яч-
80
меня, кукурузы и др.), фототропическая камера, настольная лам-
па, фольга, спички.
Растения: проростки злака в двух вазонах в состоянии цело-
стности колеоптиля, который еще не прорван следующими за ним
листьями. Проростки выращивают в темноте.
Ход работы
Заготавливают маленькие колпачки из фольги, оборачивая ее
вокруг спички. Колпачки надевают на верхушки проростков в од-
ном из вазонов. Затем оба вазона помещают в фототропическую
камеру так, чтобы луч света падал только на верхушки проростков
(верхушки их колеоптилей). Через 1 — 2 сут проверяют результаты
опыта, обсуждают их.
Задание: сформулировать выводы, сделать рисунки.
6.4.3. Обнаружение отрицательного геотропизма у побегов и их
частей. Способность растений реагировать на земное притяжение
называют геотропизмом. Положительно геотропные органы растут
к центру Земли, а отрицательно геотропные — в направлении от
центра Земли. Геотропный изгиб — это обычно результат неодина-
кового роста на противоположных сторонах органа. Воздействие на
растение земного притяжения и, как результат этого, возникнове-
ние в организме возбуждения приводят к неравномерному распре-
делению ауксина в зоне растяжения растущего органа. Например,
ауксина больше скапливается на нижней стороне колеоптиля, стеб-
ля, черешка, если их расположить горизонтально. Орган начинает
расти более усиленно на той стороне, где клетки обогащены ИУК.
Эта сторона становится выпуклой и стебель (черешок листа, коле-
оптиль) изгибается вверх.
Для иллюстрации отрицательного геотропизма у листьев уко-
роченных побегов можно использовать корнеплоды моркови, свек-
лы, редьки и других растений. Их почки трогаются в рост особенно
активно с середины зимы.
Цель работы: продемонстрировать отрицательный геотро-
пизм у побегов ряда овощных культур.
Материалы и оборудование: емкости для размещения
корнеплодов (ящики, кристаллизаторы и др.).
Растения: корнеплоды моркови, петрушки, свеклы, зеле-
ной редьки и др. (или их верхушки).
Ход работы
Выбранные для опыта корнеплоды (или их верхушки) поме-
щают в шкаф (ящик, кристаллизатор), где поддерживаются дос-
таточные для роста температура и влажность воздуха. Корнепло-
ды раскладывают по-разному: одним придают нормальное поло-
жение (корень обращен вниз; для этого используют банки в каче-
стве подставки), другим горизонтальное, третьим — корнем вверх
4-338
81
(рис. 16). После развертывания почек и отрастания побегов кор-
неплоды переносят во влажную камеру с освещением постоян-
ным или переменным. Положение корнеплодов в пространстве
сохраняют прежним. Рост побега продолжается, листья зеленеют.
Рис. 16. Отрицательный геотропизм у побегов:
1 — редька; 2 — свекла; 3 — морковь
Задание: результаты наблюдений зарисовать и сделать выво-
ды о влиянии земного притяжения на направление роста укоро-
ченных побегов у выбранных для опыта растений.
6.4.4. Обнаружение положительного геотропизма у корня.
Цель работы: продемонстрировать свойственный корню по-
ложительный геотропизм.
Материалы и оборудование: три банки, три стеклян-
ные пластинки, легко помещаемые в банки, мягкая оберточная
или фильтровальная бумага серого или более темного цвета, мате-
риал (шнурок, резинка и др.) для укрепления на стекле бумаги и
проростков, вода.
Растения: проростки гороха (фасоли, кукурузы, конских бобов
и др.) с пряморастущим вниз главным корнем (до 1,5 см длиной).
Ход работы
На стеклянные пластинки, обернутые бумагой, прикрепляют
проростки, и пластинки вставляют в банки. На дно каждой банки
наливают немного воды, благодаря чему бумага, на которой на-
82
ходится проростки, и окружающий их воздух поддерживаются во
влажном состоянии. В первую банку помещают пластинку с про-
ростками, расположенными вертикально вниз корнями, во вто-
рую переносят пластинку, на которой проростки расположены
под углом к горизонтальной линии, в третью вставляют пластин-
ку с проростками, расположенными корнями вверх. Банки при-
крывают крышками. Через сутки уже можно наблюдать геотропи-
ческие изгибы.
Задание: обсудить наблюдаемые явления, сделать выводы,
подготовить рисунки. Обратить внимание на зону геотропического
изгиба у корня.
6.4.5. Определение места восприятия силы земного притяжения
у корня.
Цель работы: показать, что корень воспринимает геотропи-
ческое раздражение верхушкой.
Материалы и оборудование: кристаллизатор или кю-
вета, стеклянный колпак или банка, пробковая пластинка, булав-
ки, лезвие безопасной бритвы, фильтровальная бумага, пинцеты.
Растения: проростки гороха, фасоли, кукурузы с прямыми
корешками (см. раздел 1.2).
Ход работы
Проростки с прямыми корешками прикрепляют булавками к
пробковой пластинке (рис. 17). У одних проростков отрезают кон-
чик корня (зону деления, прикрытую чехликом), у других пророст-
ков сохраняют цельные кор-
ни. Пластинку с растениями
помещают на дно кюветы с
небольшим слоем воды так,
чтобы проростки находились
над водой. Верхнюю часть
проростка прикрывают по-
лоской фильтровальной бума-
ги, концы которой опускают
в воду. Это позволяет избежать
подсыхания проростков. Кю-
вету накрывают стеклянным
колпаком или банкой. Всю
установку помещают в тем-
ное место. Через сутки про-
веряют результаты опыта, де-
лают рисунки, формулируют
выводы о значении верхуш-
ки корня в геотропической
реакции.
Рис. 17. Определение места восприя-
тия земного притяжения у корня:
1 — проросток с корневым чехликом;
2 — проросток без корневого чехлика;
3 — стеклянный колпак; 4 — кристалли-
затор с водой; 5 — пробковая пластина;
6 — фильтровальная бумага
83
6.4.6. Настические изгибы черешков листьев гортензии под вли-
янием ауксина. Примером настических движений могут служить
гипонастии (изгибание листа кверху) и эпинастии (изгибание
листа книзу), возникающие в результате неодинакового роста вер-
хней и нижней сторон черешка листа. Настические движения ре-
гулируются фитогормонами (ауксином, этиленом). У листьев эти
движения можно вызвать искусственно, нанося пасту, содержа-
щую ауксин, на черешок листа.
Цель работы: проследить за настическими движениями ли-
стьев после обработки ауксином.
Материалы и о бор уд о в ан и е: ланолиновая паста с ИУК
(см. приложение 10.3), стеклянная палочка.
Растения: гортензия, герань и другие комнатные растения.
Ход работы
Выбирают супротивные листья растения. Пасту с ауксином стек-
лянной палочкой наносят на нижнюю сторону черешка одного из
листьев и на верхнюю сторону других. В течение нескольких дней
следят за изгибом листьев и ростом черешка.
Задание: зарисовать растения в конце опыта; сделать выводы
о причине настических движений.
6.4.7. Наблюдение за движением устьиц при воздействии абсцизо-
вой кислоты, света и темноты. Общеизвестен факт фотонастических
движений замыкающих устьичных клеток. Они открывают устьица
на свету и закрывают в темноте. В основе их движения лежит актив-
ный перенос ионов калия в вакуоли замыкающих клеток, сопро-
вождающийся осмотическим током воды в том же направлении.
При увеличении тургора в замыкающих клетках в результате
насасывания ими воды из окружающих соседних клеток устьица
открываются, так как их более тонкие наружные стенки растяги-
ваются сильнее, а внутренние, утолщенные, принимают полуок-
руглую форму. Это приводит к открытию устьичной щели.
Замыкающие клетки тонко реагируют на свет, водный дефи-
цит, содержание СО2 и АБК. Последняя участвует в адаптацион-
ных реакциях, защищающих растения от обезвоживания при вод-
ном стрессе. В этом случае повышается уровень АБК, что приводит
к изменению проницаемости мембран. АБК из клеток мезофилла
поступает в замыкающие клетки и активизирует выход ионов К+ в
обмен на Н+. Околоустьичные клетки выполняют роль резервуаров
для сохранения К+. При выходе ионов К+ осмотический потенциал
клеток возрастает и устьица закрываются, так как замыкающие
клетки отдают воду. При эндогенном введении АБК устьица также
закрываются.
Цель работы: показать влияние света, темноты и АБК на
движение устьиц.
84
Материалы и оборудование: микроскоп, осветитель,
предметные стекла, раствор оргстекла в хлороформе (см. приложе-
ние), узкая прозрачная клейкая лента, стеклянная палочка, ра-
створ АБК (30 мг/л), дистиллированная вода, чашки Петри, филь-
тровальная бумага.
Растения: 10—15-дневные проростки овса, заранее помещен-
ные на 1 ч: а) в темноту и б) на яркое освещение.
Ход работы
1. Влияние света и темноты на движение замыкающих клеток и
получение слепков.
С листьев проростков, выдержанных в течение часа в темноте и
на ярком свету, сделать слепки. Пробы всегда следует брать с 3 лис-
тьев из срединной части пластинки около центральной жилки (I и
IV варианты, табл. 18). Отпечатки эпидермы по Давыдову получают
просто: стеклянной палочкой наносят незначительное количество
раствора оргстекла в хлороформе на эпидерму. После высыхания
раствора (15 — 20 с) поверх оргстекла накладывают кусок клейкой
ленты (1,5 х 1,5 см2), тут же отделяют ее вместе с отпечатком эпи-
дермы и прикладывают к предметному стеклу. Отпечатки легко эти-
кетируются, они не требуют покровных стекол при микроскопиро-
вании. На получение одного препарата затрачивают менее 1 мин.
Таблица 18
Движение замыкающих клеток устьиц при воздействии
света, темноты и АБК
Варианты опыта Уве- ли- чение Число открытых устьиц в поле зрения микроскопа (5—7 повторностей для каждого листа)
Открытых Закрытых
1-й лист 2-й лист З-й лист X 1-й лист 2-й лист З-й лист X
I. Свет
II. Вода + свет
III. АБ + свет
IV. Темнота
Примечание. X — среднее число.
2. Влияние АБК на движение устьиц.
Поскольку АБК способствует закрыванию устьиц, то для на-
блюдения за ее воздействием следует взять лист с изначально от-
крытыми устьицами, т. е. с растений, экспонированных на свету.
85
В две чашки Петри с водой (контроль) и раствором АБК поме-
стить по три листа нижней стороной к раствору (II и III варианты
опыта). В течение 10 мин экспонировать на свету. По истечении
этого времени листья вынуть, осушить осторожно фильтроваль-
ной бумагой и быстро сделать слепки. Раствор хлороформа наносят
на срединную часть пластинки с обеих сторон от средней жилки
каждого из трех листьев. Приготовленный препарат рассматривают
под микроскопом при малом и большом увеличениях. Данные за-
носят в таблицу. В каждом варианте опыта делают по одному слеп-
ку с трех листьев. Подсчитывают в каждом из них число открытых
и закрытых устьиц в поле зрения микроскопа в разных участках
препарата (не менее пяти повторностей).
Задание: проанализировать полученные данные и сделать вы-
воды о влиянии света, темноты и АБК на работу устьичного аппа-
рата. Охарактеризовать механизм воздействия АБК на устьичные
клетки, обеспечивающий движение устьичной щели.
7. МИНЕРАЛЬНОЕ ПИТАНИЕ РАСТЕНИЙ
7.1. Определение содержания золы в разных частях растений
В состав растений входят почти все известные химические эле-
менты. При сжигании растительного материала углерод, азот и
водород улетучиваются в виде воды, СО2 и других оксидов. Остаю-
щийся нелетучий осадок (зола) содержит элементы, называемые
зольными. Их содержание у различных растений и в разных частях
одного и того же растения неодинаково и зависит от состава поч-
вы, физиологических особенностей и возраста растения.
На количество золы, образующейся при сжигании разных ча-
стей растения, влияет также соотношение в них живых и мертвых
клеток. Мертвые клетки состоят из одних клеточных стенок, в ко-
торых находится небольшое количество кальция или кремния, тогда
как в цитоплазме и органеллах живых клеток содержится много
зольных элементов как в составе органических веществ (сера — в
белках, фосфор — в нуклеиновых кислотах и фосфолипидах, маг-
ний — в хлорофилле и т.п.), так и в форме ионов.
Зола в растении составляет приблизительно 5 % от массы сухо-
го вещества. Однако отдельные органы растений сильно различа-
ются по содержанию золы. Ее больше там, где преобладают живые
клетки. Так, в среднем в древесине — около 1 % золы, в семенах —
около 3%, в стеблях и корнях — 5%, а в листьях — 15%.
Цель работы: определить количество золы в различных орга-
нах растения.
86
Материалы и оборудование: тигли, прокаленные и ох-
лажденные в эксикаторе (перед прокаливанием номера на тиглях
обозначать концентрированным раствором FeCl3); тигельные щип-
цы, спиртовка или газовая горелка, штатив с кольцом, фарфоро-
вый треугольник, ступка, весы с разновесами, муфельная печь,
эксикатор, скальпель, препаровальные иглы (2 шт.), этанол, глян-
цевая бумага, спички, рукавицы.
Растения: хорошо высушенные на воздухе ткани и органы
растений (древесина сосны, березы и других растений, наколо-
тая лучинками; листья лучше собирать в конце лета, когда в них
накапливается много зольных элементов), соцветия, плоды, се-
мена.
Ход работы
1. Озоление древесины.
Предварительно прокаленный и охлажденный в эксикаторе
тигель взвешивают с точностью до 0,01 г. Отдельно взвешивают 3 г
тонко наколотых лучинок. В конец лучины втыкают препароваль-
ную иглу, зажигают другой конец и за иглу держат им несколько
вверх над открытым тиглем, поставленным на лист глянцевой бу-
маги (для собирания золы, падающей мимо тигля). Остатки сго-
ревшей лучины собирают в тигель и прокаливают в муфельной
печи до полного выжигания остатков угля.
2. Озоление листьев и семян.
Материал измельчают, растирают в ступке, помещают в пре-
дварительно прокаленный и взвешенный тигель. Навеска долж-
на составлять 0,5—1 г. Открытый тигель помещают на фарфоро-
вый треугольник, закрепленный в штативе, добавляют 1—2 мл
спирта и поджигают. После прекращения горения процедуру
со спиртом повторяют еще раз. Заканчивают озоление в муфель-
ной печи.
Тигли выставляют на металлическую полочку муфельной печи
и проверяют полноту сжигания, о которой судят по отсутствию в
золе несгоревших частей и угля. Перемешивают золу двумя тонки-
ми препаровальными иглами или кусочками проволоки. Если по-
сле продолжительного прокаливания не произошло полного сго-
рания (остаются кусочки спекшегося угля), тигель следует охла-
дить, добавить в него несколько капель спирта, содержимое пере-
мешать препаровальными иглами и повторно прокалить при высо-
кой температуре в муфельной печи.
Все операции по сжиганию растительного материала проводят
под тягой.
После того как озоление закончено, тигли закрывают крышка-
ми и переносят в эксикатор. При полном охлаждении их взвешива-
ют и определяют количество золы, содержащейся в исследуемом
материале. Данные вносят в таблицу (табл. 19).
87
Таблица 19
Содержание золы в исследуемом материале
Расте- ние, орган № ТИГЛЯ Масса, г Содер- жание золы, %
пустого тигля тигля с мате- риалом тигля с золой мате- риала золы
Задание: описать работу. Сделать вывод о содержании золы в
различных органах растений; в одноименных частях разных расте-
ний. Высказать свои суждения о причине этих различий.
7.2. Микрохимический анализ золы растений
В основе микрохимического анализа лежит свойство некоторых
солей образовывать характерной формы кристаллы, по которым
можно судить о наличии в составе золы того или иного элемента.
Цель работы: выявить некоторые ионы (К+, Са2+, Mg2+, Fe3+,
SO2-, СГ, РО3-) в золе разных органов растений.
Материалы и оборудование: микроскопы, стеклянные
тонкие палочки с оттянутыми концами, предметные стекла, про-
бирки, воронки, фильтровальная бумага, бумажные фильтры, мар-
кер для стекла, этанол, дистиллированная вода, 10 %-ный раствор
НС1, 1 %-ные растворы кислот H2SO4, HNO3, Н2С2О4; 1 %-ные ра-
створы солей NaHC4H4O6, PtCl4, K4[Fe(CN)6], Hg2(NO3)2,
(NH4)2MoO4, (CH3COO)2Pb, AgNO3, Na2HPO4, смесь следующего
состава: 1 г Na2HPO4, 4 г NH4C1, 6 г NH4OH, 2 г лимонной кисло-
ты в 250 мл воды (реактив на магний).
Растения: зола из заготовленных летом высушенных листь-
ев, стеблей, соцветий, плодов и кусочков древесины различных
растений.
Ход работы
Из золы, полученной в предыдущей работе, готовят в пробир-
ках два раствора — водный для выявления СГ и К+ и солянокис-
лый для определения всех остальных ионов. Одну вторую часть золы
заливают 3 мл дистиллированной воды, перемешивают и отфильт-
ровывают в чистую пробирку. К оставшейся золе прибавляют 3 мл
10% НС1, перемешивают и отфильтровывают раствор в чистую
пробирку.
С растворами проделывают все качественные реакции. Появле-
ние типичных кристаллов показывает наличие в золе соответству-
ющих элементов.
Техника проведения реакции показана на рисунке 18.
88
Следует заметить, что
дня сохранения чистоты ре-
активов каждый из них бе-
рут отдельной стеклянной
палочкой. Для удобства па-
лочку укрепляют в пробке,
которой закрывают данный
реактив. После использова-
ния палочки следует тща-
тельно мыть.
На разные концы пред-
метного стекла помещают
по капле необходимого ре-
актива на ион, который хо-
тят выявить. Рядом с одной
Рис. 18. Техника проведения реакции:
1 — вытяжка из золы; 2 — раствор, содер-
жащий обнаруживаемый элемент; 3 — ре-
актив на обнаруживаемый элемент; 4 — «мо-
стик» между раствором и реактивом; 5 —
предметное стекло
из них наносят каплю какой-либо соли, содержащей данный ион,
а с другой — каплю солянокислого или водного экстракта золы.
Чистой стеклянной палочкой с заостренным концом две соседние
капли соединяют перемычками. В результате взаимодействия ра-
створов образуются продукты реакции, которые при медленном
подсушивании препарата будут выпадать в осадок с образованием
характерных кристаллов. Следует избегать полного перемешивания
капель растворов: самые крупные и правильно сформированные
кристаллы образуются в тонких перемычках между каплями. Очень
важно правильно подсушить препарат. Для этого его держат высо-
ко над пламенем горелки и подогревают до полного испарения
воды, слегка перемещая из стороны в сторону. Подсушивание пре-
кращают, как только исчезнет последняя капля жидкости. Крис-
таллы рассматривают под микроскопом на сухом препарате без
покровного стекла, зарисовывают и сравнивают с контрольным
вариантом.
Проделывают все качественные реакции с растворами и с экст-
рактами золы. Появление типичных кристаллов показывает нали-
чие соответствующих элементов в золе.
1. Обнаружение ионов калия:
а) реактивом на ионы калия может быть гидротартрат натрия
NaHC4H4O6, который с нейтральным раствором солей калия дает
осадок гидротартрата калия КНС4Н4О6 в виде крупных призм и
пластинок (рис. 19).
Кристаллы гидротартрата хорошо растворяются в кислотах и ще-
лочах, поэтому для определения иона калия берут водный экстракт;
б) ионы калия можно обнаружить также с помощью хлорида
платины PtCl4. В этом случае выпадают кристаллы хлороплатината
калия K2PtCl6 (см. рис. 19) в виде тетраэдров, октаэдров и кубов
желтовато-зеленоватого цвета.
89
Рис. 19. Кристаллы гидротартрата калия (а) и хлороплатината калия (б)
2. Обнаружение ионов кальция:
а) на предметном стекле каплю испытуемого раствора и конт-
рольного раствора соединяют с каплями щавелевой кислоты. При
медленном нагревании выпадают кристаллы оксалата кальция
СаС2О4 • ЗН2О в виде октаэдров, кубов, иногда крестов (рис. 20);
б) более характерным реактивом на кальций является сер-
ная кислота. В результате этой реакции при той же технике вы-
полнения выпадают игольчатые кристаллы гипса CaSO4- 2Н2О,
которые иногда располагаются группами, напоминающими сне-
жинки;
СаС12 + H2SO4= CaSO4 + 2НС1.
3. Обнаружение ионов магния.
Рис. 20. Кристаллы оксалата кальция (а) и гипса (б)
90
Капли испытуемого раствора и контрольной соли соединяют с
реактивом, состоящим из гидрофосфата натрия, хлорида аммо-
ния, лимонной кислоты и гидроксида аммония. При медленной
кристаллизации выпадают кристаллы фосфата магния-аммония в
виде трапеций, призм и октаэдров; при быстрой кристаллизации —
в виде звезд, крестов и ветвящихся образований (рис. 21):
MgCl2 + Na2HPO4 + NH4OH = NH4MgPO4 + 2 NaCl.
6
Рис. 21. Кристаллы фосфата магния-аммония, полученные:
а — при медленной, б — при быстрой кристаллизации
4. Обнаружение ионов железа.
Присутствие в вытяжке ионов железа Fe3+ обнаруживают при
взаимодействии с гексоцианоферратом (II) калия K4[Fe+2(CN)'].
В результате образуется интенсивно-синий осадок гексоцианофер-
рата (II) железа Fe4[Fe(CN)6]3.
Железа в некоторых образцах золы мало, поэтому исходную
вытяжку следует нанести на стекло несколько раз и упарить. Нали-
чие ионов железа выявляют по синей окраске:
4 FeCl3 + 3 KJFe(CN)6] = Fe4[Fe(CN)6]3 + 12КС1.
Реакцию на железо можно проводить в пробирке с частью со-
лянокислого экстракта, к которому по каплям прибавляют раствор
гексоцианоферрата (II) калия.
5. Обнаружение фосфора:
а) растворы солей фосфорной кислоты образуют с цитратом
ртути Hg2(NO3)2 кристаллический осадок фосфата ртути Hg3PO4 в
виде розеток или пучков игл;
б) ионы РО3 можно обнаружить в растворе при взаимодей-
ствии с молибдатом аммония (NH4)2MoO4. Каплю раствора фос-
форной кислоты, слегка подкисленную азотной кислотой, соеди-
91
няют с каплей раствора молибдата аммония. В результате выпадают
зеленовато-желтые мелкие кристаллы сложной комплексной соли
(рис. 22):
Н3РО4 + 12(NH4)2MoO4 + 21HNO3 =
= (NH4)3H4[PO4(Mo2O7)6] NH4NO3 + 12H2O.
Рис. 22. Кристаллы фосфата ртути (а) и фосфат-молибдата аммония (б)
6. Обнаружение ионов SO^~:
а) в качестве реактива используют раствор ацетата свинца
(СН3СОО)2РЬ. Выпадают очень мелкие кристаллы сульфата свинца
в виде длинных игл, звезд и ромбов;
б) в присутствии нитрата серебра AgNO3 осаждаются кристал-
лы сульфата серебра Ag2SO4 в форме вытянутых шестиугольников
и ромбов. Трение стеклянной палочкой на холоде ускоряет выпа-
дение осадка (рис. 23).
Рис. 23. Кристаллы сульфата свинца (а) и сульфата серебра (б)
92
7. Обнаружение ионов хлора.
Анионы хлора обнаруживают в водном растворе золы нитратом
серебра. При взаимодействии хлора с этим реактивом выпадает
белый осадок, который и служит доказательством присутствия
ионов хлора в растворе.
Задание: при оформлении работы записать уравнения реак-
ций и зарисовать характерные формы кристаллов. В выводе отме-
тить, какое количество золы в процентах от сухой массы содер-
жится в данном органе и какие элементы обнаружены в золе ис-
следованных растений.
7.3. Антагонизм ионов
Антагонизмом ионов называют такое явление, когда один ион
уменьшает или устраняет действие другого. Например, отдельные
соли могут проявлять токсичное действие на живые клетки, тогда
как их смесь оказывается нейтральной. Раствор с оптимальным
соотношением ионов называется уравновешенным.
Антагонизм ионов проявляется и в конкуренции за переносчи-
ков на поверхности плазмалеммы, за активные центры фермен-
тов, а также в противоположном воздействии на гидратацию бел-
ков, на вязкость и проницаемость цитоплазмы.
Опыты по антагонизму ионов необходимо проводить с очень
чистыми реактивами и посудой, так как даже небольшое загрязне-
ние посторонними ионами может быть причиной получения не-
правильных результатов.
Цель работы: ознакомиться с явлением антагонизма ионов.
Материалы и оборудование: растворы КС1 — 9 г/л и
СаС12 — 6,7 г/л (оба раствора должны быть приготовлены из хими-
чески чистых солей на бидистиллированной воде), бидистиллиро-
ванная вода, кристаллизатор, чашки Петри (4 шт.), пипетки гра-
дуированные на 10 мл (3 шт.), пинцет, ножницы, фильтроваль-
ная бумага, маркер, миллиметровая бумага или линейка.
Растения: наклюнувшиеся семена пшеницы, ячменя и дру-
гих растений.
Ход работы
Отобрать 30 — 40 семян, находящихся на одинаковой стадии
прорастания, и 3—4 раза промыть их бидистиллированной водой.
В четыре чашки Петри, сполоснутые также бидистиллированной
водой, положить фильтровальную бумагу. На боковой стенке ниж-
ней половины чашки написать вариант опыта, а затем пинцетом в
каждой из них разложить по 12 проростков и добавить по 10 мл:
в первую чашку — бидистиллята (контроль); во вторую — раствор
КО; в третью — раствор СаС12; в четвертую — 8,6 мл раствора КС1
и 1,4 мл раствора СаС12.
93
Чашки Петри поместить в термостат при температуре 26 °C. Че-
рез неделю измерить длину колеоптилей и корней, вычислить сред-
ние величины, данные занести в таблицу (табл. 20).
Таблица 20
Результаты опыта по изучению антагонизма ионов
Вариант опыта Длина колеоптиля Длина главного корня Число боковых корней
см % к контролю см % к контролю шт. % к контролю
Конт- роль (бидис- тиллят) 100 100 100
КС1
СаС12
КС1 + + СаС12
Задание: построить диаграммы по данным таблицы; проана-
лизировать данные таблицы и диаграмм и сформулировать выводы.
7.4. Диагностика заболеваний растений при голодании
по элементам минерального питания
Распознавание признаков голодания растений, вызываемых
недостатком тех или иных элементов минерального питания, крайне
важно для устранения признаков заболевания путем своевремен-
ной подкормки. Внимательное изучение признаков голодания у
растений парка, леса, окрестных полей поможет сделать вывод о
дефиците тех или иных элементов в данном районе и дать реко-
мендации о состоянии почв и внесении недостающих удобрений
под культурные растения.
Цель работы: познакомиться с признаками голодания по
отдельным элементам минерального питания у культивируемых и
дикорастущих растений.
Материалы и оборудование: гербарные листы боль-
ных растений, цветные карандаши, атласы и книги с иллюстра-
циями признаков голодания. Из них можно рекомендовать: Мит-
тлайдер Дж. Здоровые овощи по методу д-ра Миттлайдера. — По-
селок Заокский Тульской обл., 1993; Признаки голодания расте-
94
нии: Сб. статей / Под ред. Б. Бэра и Р. Колмана. — М., 1957; Лархер В.
Экология растений. — М., 1978; Ernahzungsstorungen bei Kulturp-
flanzen in Farbbildern von W. Bergman. — Veb. I Fischer, Verlag Jena,
1976.
Растения: больные листья и побеги комнатных растений в
зимний период; растения сада, огорода, поля, леса, пустырей и
т.д. в период вегетации.
Ход работы
Заранее собирают больные листья и поврежденные побеги раз-
личных растений. С помощью преподавателя и с использованием
имеющихся атласов, книг, пособий и таблицы 21 ставят диагноз
заболевания растений. Данные вносят в таблицу 22.
Таблица 21
Признаки заболеваний растений при голодании по элементам питания
Элемент Симптомы недостаточности
N Слабый рост, карликовость, склероморфизм. Отноше- ние побеги / корни сдвинуто в пользу корней. Прежде- временное пожелтение более старых листьев, их некроти- ческие концы
Р Задержка цветения, отсутствие роста, фиолетовая окраска листьев и стеблей, тенденция к скручиванию и перевертыванию листьев
К Белые и бурые пятна, рваный край листа, дырки, отверстия в листе, краевой ожог листьев (запал). По мере возрастания дефицита элемента повреждения увеличиваются
S Сходны с симптомами азотной недостаточности. Отставание в росте растений. Листья от бледно-зеленой до кремовой и желтой окраски. При голодании по сере отсутствует характерный признак азотистого голодания — общее пожелтение всего растения
Mg Белые или желтые пятна на листьях сливаются, лист буреет и отмирает. При глубоком дефиците листья узкие, по цвету — красные, оранжевые, пурпурные. Наблюдается слабый рост и межжилковый хлороз старых листьев
Са Гофрированные, сморщенные листья с некротическими зонами. Отсутствие верхушечных почек. Нарушение роста связанного с делением и растяжением клеток
95
Окончание табл.
Элемент Симптомы недостаточности
Fe Бледно-желтая окраска ткани листьев между жилками у молодых листьев, жилки остаются зелеными. Хлороз. Малая мощность растения, неурожай. Старые листья поражаются позже сходным образом
Мп Однородная желтизна старых и молодых листьев, а также верхушечной почки. Межжилкового хлороза на поздних стадиях нет. На ранних — имеется угнетение роста и меж- жилковый хлороз
В Отмирание верхушечных почек, закрученные, дефор- мированные листья; черная гниль у корнеплодов свеклы, моркови; полые кочерыжки капусты
Zn Ярко-желтая окраска всей поверхности листьев и зеле- ный цвет жилок. Желтые полосы на листьях злаков. Мелколистность верхушечных побегов. «Розеточность», «желтуха», «мелколистность», «пятнистость листьев» — так называется дефицит Zn
Си Бледно-желтая окраска листьев или полосатые закручен- ные листья. Вдоль краев листьев хлороз с последующим некрозом
Мо Узкие, длинные, скрученные листья, выемки на листо- вой пластинке, хлороз сложных листьев, включая черешок
Na Растения не испытывают недостатка. Избыток прояв- ляется в виде неоднородной пестроты, некроза верхушек листьев, краев и тканей между жилками
Cl Из видимых симптомов — увядание растений, остальные симптомы специфичны для отдельных видов растений. Дефицит встречается редко
Таблица 22
Установление диагноза заболевания по признакам голодания растений
Вид растения и место обитания Орган (побег, лист: верхний, нижний) Описание признаков голодания Рисунок Диагноз Способы устране- ния заболе- вания
Задание: заполнить таблицу 22; сделать рисунки; отметить рас-
положение больных листьев на побеге (верхние, нижние); сделать
выводы о типичных видах голодания у растений огорода, сада,
леса, поля данного района.
96
8. УСТОЙЧИВОСТЬ РАСТЕНИЙ
К ЭКСТРЕМАЛЬНЫМ ВОЗДЕЙСТВИЯМ
8.1. Методы определения устойчивости
к разным факторам среды
8.1.1. Определение устойчивости тканей листьев растений к высо-
ким температурам. Устойчивость растений — это их способность
адаптироваться к неблагоприятным воздействиям внешней среды,
сохраняя стабильность всех физиологических процессов. Чем меньше
отклонение какого-либо процесса или реакции от нормы в ре-
зультате воздействия экстремального фактора и чем быстрее они
возвращаются к норме, тем выше устойчивость растений. Меха-
низмы достижения устойчивости у них различны и могут происхо-
дить как на генетическом, так и на физиолого-биохимическом и
морфологическом уровнях.
При экстремальных воздействиях на ткани, например при по-
вышении температуры, мембраны клетки, в том числе и мембра-
ны хлоропластов, теряют свойство полупроницаемости. Вследствие
этого ионы водорода, присутствующие в клетке, замещают ион
Mg в молекуле хлорофилла, который превращается в феофитин,
имеющий бурый цвет. Чем больше хлорофиллоносных клеток по-
вреждено, тем большая площадь листа буреет.
Цель работы: сравнить устойчивость органов разных расте-
ний к высоким температурам.
Материалы и оборудование: водяная баня, плитка, тер-
мометр, кристаллизаторы, белая пластиковая пластина, 0,2 М ра-
створ НС1.
Растения: разных экологических групп (огурцы, полынь, оду-
ванчик, кислица, лебеда и др.), листья разных ярусов.
Ход работы
В водяной бане поддерживают температуру 40 °C. В воду опуска-
ют листья растений, взятых для опыта. Предварительно к их че-
решкам прикрепляют этикетки с указанием максимальной темпе-
ратуры, при которой эти листья будут выдерживаться. Первую пробу
извлекают из бани через 30 мин и временно переносят в кристал-
лизатор с водой комнатной температуры. Затем температуру в бане
поднимают на 5 °C.
Через 10 мин из нее извлекают вторую пробу листьев, их так-
же переносят в кристаллизатор с водой. Постепенно температуру
воды в бане доводят до 60 °C, забирая пробы каждые 10 мин пос-
ле увеличения температуры в бане на каждые 5 °C. Затем листья
извлекают из воды комнатной температуры и заливают раство-
ром 0,2 М НС1, в котором листья приобретают бурую окраску
97
(если у растений клеточный сок кислый, то листья буреют уже в
воде).
Время пребывания в кислоте должно быть одинаковым для всех
листьев.
Через 10—20 мин листья извлекают из раствора соляной кисло-
ты, переносят в воду, промывают и раскладывают на белой пласти-
ковой пластине в порядке увеличения площади бурой окраски.
Задание: сравнить степень повреждения листьев при разной
температуре у разных растений. Листья зарисовать и раскрасить по-
врежденные участки. Сделать выводы.
8.1.2. Определение солеустойчивости злаков по всхожести их се-
мян. В условиях избыточной засоленности почвы всхожесть семян
и интенсивность роста растений часто снижаются. При определе-
нии солеустойчивости показателем устойчивости служит сравне-
ние числа проросших семян в растворах соли и в дистиллирован-
ной воде.
Цель работы: определить солеустойчивостьзлаков.
Материалы и оборудование: чашки Петри, фильтро-
вальная бумага, раствор формалина (1 мл формалина на 300 мл
воды), химические стаканы, марлевые мешочки, этикетки, тер-
мостат, сушильный шкаф, пипетки на 10 мл, раствор NaCl.
Растения: семена ячменя, кукурузы и др.
Ход работы
Подбирают здоровые семена растений, помещают их в разные
марлевые мешочки с этикеткой внутри и обрабатывают раствором
формалина в течение 3 — 5 мин. Затем слегка просушивают и рас-
кладывают по 10—20 семян в каждую чашку Петри. Предваритель-
но чашки Петри прокаливают в сушильном шкафу при 150 °C в
течение 1 ч, на их дно укладывают фильтровальную бумагу. В каж-
дую чашку наливают по 10 мл 7 %- или 10%-ного раствора NaCl и
10 мл дистиллированной воды (контроль). Опыт проводят в трех-
кратной повторности.
Чашки Петри с семенами помещают в термостат при темпера-
туре 26 °C для проращивания. На дно термостата ставят кювету с
водой. Через семь дней в каждом варианте подсчитывают число
проросших семян. Определяют процент всхожести. Результаты за-
писывают в таблицу (табл. 23).
Задание: сделать вывод о солеустойчивости исследованных
растений.
8.1.3. Влияние засоления на степень «выцветания» хлорофилла.
При ухудшении водоснабжения растений под воздействием солей
происходит деструкция хлоропластов, нарушается синтез хлоро-
филла, снижается интенсивность ростовых процессов.
98
Таблица 23
Всхожесть семян злаков в зависимости от засоления почвы
Растение Вариант опыта Число проросших семян Всхожесть, %
Ячмень Н2О
NaCl, %
Кукуруза Н2О
NaCl, %
Цель работы: показать влияние высоких концентраций со-
лей на рост растений и разрушение хлорофилла в листьях.
Материалы и оборудование: химические стаканы, лез-
вия, 4%-ный раствор NaCl или Na2SO4, линейки.
Растения: побеги березы, клена и т.д.
Ход работы
Берут не закончившие рост побеги березы, клена и других ра-
стений. Их проксимальные концы подрезают под водой. Измеря-
ют длину побегов, подсчитывают число листьев, измеряют дли-
ну верхних, растущих, листьев. Побеги помещают в пять сосудов:
один с чистой водой (контрольный вариант) и четыре с раство-
ром NaCl (или Na2SO4) разной концентрации: 2,5%-, 5%-, 10%-,
15%-ные.
Банки с побегами на семь дней помещают в условия рассеян-
ного освещения. На третьи и седьмые сутки учитывают изменения
в окраске листьев, измеряют длину побега (обращая внимание на
удлинение верхних междоузлий) и длину взятых под наблюдение
верхних листьев, отмечают возможное появление новых листьев
при продолжающемся росте побега за счет развертывания верху-
шечной почки.
Под влиянием солей, поступающих в листья, возможно разру-
шение хлорофилла. При сравнении с контрольным вариантом ли-
стья становятся менее зелеными (происходит их выцветание).
Кроме того, на листьях появляются «солевые пятна», площадь
которых со временем увеличивается.
Задание: описать ход работы, сделать рисунки листьев на тре-
тий и седьмой дни опыта, описать состояние побегов; сформули-
ровать выводы о влиянии засоления на интенсивность ростовых
процессов и степень разрушения хлорофилла в листьях.
Работа может быть рекомендована для демонстрации в школе.
99
8.2. Защитное действие криопротекторов на клетки растений
при их замораживании
Повреждение тканей при замораживании растений связано с
образованием льда как внутри клеток, так и снаружи. Внеклеточ-
ный лед вызывает дегидратацию клеток, оттягивая из них воду.
Кристаллы внутриклеточного льда вызывают механические повреж-
дения мембран цитоплазмы.
У разных растений в неодинаковой мере выражена способность
противостоять образованию льда внутри клеток. Это обеспечивает-
ся, в частности, высоким содержанием углеводов, жирных кислот
и белков, способных связывать воду внутри клетки и снижать тем-
пературу замерзания.
Перенесению морозов способствует увеличение содержания в
клетках веществ, которые на этапе замораживания должны умень-
шить повреждение клеток в результате осмотического и механи-
ческого стресса. Эти вещества называются криопротекторами. Крио-
протекторы подбирают по принципу наименьшей токсичности и
оптимального эффекта для каждого растения, каждой ткани. Из
числа криопротекторов наиболее известны различные сахара, гли-
церин, поливинил пирролидон, диметилсульфоксид. В лаборатор-
ной практике, как правило, используют смеси криопротекторов,
что позволяет снизить токсичность одного компонента смеси за
счет присутствия другого и добиться наилучшего действия, пото-
му что каждый криопротектор отличается своими свойствами. В ра-
стениях в качестве криопротекторов выступают биополимеры, спо-
собные связать большое количество воды, гидрофильные белки,
моно- и олигосахариды.
8.2.1. Превращение запасных веществ в побегах древесных расте-
ний. В течение вегетационного периода продукты фотосинтеза от-
кладываются в запасающих тканях стеблей древесных растений. Зи-
мой некоторые запасные вещества подвергаются гидролизу, в ходе
которого накапливаются соединения, повышающие устойчивость
клеток к низким температурам. Таким образом, они выполняют
роль криопротекторов.
Цель работы: проследить за изменением качественного со-
става и локализации запасных веществ в тканях стеблей древесных
растений в осенне-зимний период.
Материалы и оборудование: раствор I в KI (концент-
рированный раствор, приготовленный по прописи, разбавить в 3
раза); раствор краски Судан III, насыщенный раствор CuSO4, ще-
лочной раствор сегнетовой соли, феллингова жидкость, глице-
рин, микроскоп, предметные и покровные стекла, лезвие, пин-
цет, скальпель, спиртовка, препаровальная игла, штатив с про-
100
бирками (2 шт.), держатель для пробирок, стеклянная палочка,
стакан с водой, кусочки фильтровальной бумаги, спички.
Растения: зафиксированные в парах спирта побеги дуба и
липы, срезанные в сентябре и в январе и поставленные в верти-
кальном положении в плотно закрытые банки, на дно которых
налит 96 %-ный спирт.
Ход работы
На поперечных срезах стебля на срединной и верхней частях
побега проводят реакции для обнаружения крахмала, жиров и ре-
дуцирующих сахаров и сравнивают их содержание в осенних и зим-
них образцах побегов.
1. Обнаружение крахмала.
Делают тонкий поперечный срез стебля (достаточно получить
сектор, включающий все части стебля — сердцевину, древесину и
кору).
Помещают срез на предметное стекло в каплю раствора йода,
закрывают покровным стеклом и рассматривают в микроскоп сна-
чала при малом, а затем при большом увеличении. Крахмальные
зерна выглядят черными гранулами.
2. Обнаружение жиров.
Помещают тонкий срез в каплю раствора красителя Судан III,
накрывают его покровным стеклом и выдерживают в растворе не
менее 10 мин. Затем срез промывают водой и помещают в каплю
глицерина.
Рассматривают в микроскоп при большом увеличении основ-
ную паренхиму коры и сердцевины, древесную и лубяную парен-
химы и паренхиму лубодревесных лучей. Капли жира окрашивают-
ся в оранжевый или красный цвет.
3. Обнаружение редуцирующих сахаров.
Отрезок побега длиной в несколько сантиметров разрезают вдоль
и помещают в концентрированный раствор CuSO4 на 5 мин, после
чего промывают водой и помещают в пробирку с кипящим ще-
лочным раствором сегнетовой соли, кипятят 2 мин. Обработанные
таким способом кусочки побега промывают водой, делают тонкие
поперечные срезы, помещают их на предметное стекло в каплю
воды, которую затем заменяют на глицерин, срезы накрывают
покровным стеклом и рассматривают под микроскопом. Крис-
таллы Си2О при малом увеличении кажутся черными, а при боль-
шом увеличении имеют красный оттенок. Более грубый метод за-
ключается в том, что не очень тонкий срез помещают на пред-
метное стекло в большую каплю феллинговой жидкости и, держа
пинцетом за край стекла, нагревают до кипения. Образующийся
при этом осадок Си2О распределяется по всему препарату, что не
дает возможности судить о количестве сахара в отдельных тканях
(табл. 24).
101
Таблица 24
Состав и локализация запасных веществ в побегах
Растение Дата взятия пробы Локализация запасных веществ в тканях побега Крахмал Жир Сахар
Задание: Результаты опыта записать в таблицу, отметив, в ка-
ких тканях обнаружены те или иные запасные вещества, и дать оцен-
ку их количества (по пятибалльной шкале). Для каждой древесной
породы запись начинают с результатов анализа осенних проб.
Зарисовать препараты, раскрасить их цветными карандашами,
сделать подписи к рисункам.
8.2.2. Действие криопротекторов на жизнеспособность клеток ра-
стительных тканей при замораживании.
Цель работы: показать, что защитное действие смеси гли-
церина и сахарозы, используемых в качестве криопротекторов,
выше, чем действие их чистых растворов.
Материалы и оборудование: кристаллизатор, скальпе-
ли, бритвы, термометр со шкалой от — 50 до +50 °C, водяная баня,
электроплитка, пробирки, штатив для пробирок, химические ста-
каны, линейки, пробочное сверло большого диаметра (8—10 мм),
NaCl, снег или кубики льда (см. приложение, табл. III), 12 %-ный
раствор глицерина, 2М раствор сахарозы, пипетки на 5—10 мл.
Растения: корнеплоды свеклы.
Ход работы
Из корнеплода столовой свеклы пробочным сверлом диамет-
ром 8—10 мм вырезают цилиндр и разрезают его на диски толщи-
ной 2 — 3 мм. Все диски (общее их число 105) должны быть одина-
ковыми. Затем их помещают в химический стакан и тщательно про-
мывают водой, чтобы удалить клеточный сок, вытекающий из по-
врежденных клеток.
Отмытые кружочки по 5 штук помещают в 7 пробирок, в каж-
дой из которых находится по 5 мл следующих жидкостей: дистил-
лированной воды; 2М раствора сахарозы; 1М раствора сахарозы;
12%-ного раствора глицерина; 12%-ного раствора глицерина и 2М
раствора сахарозы в соотношении 1:1 (по 2,5 мл); 12%-ного ра-
створа глицерина и 1М раствора сахарозы в соотношении 1:1 (по
2,5 мл); 12 %-ного раствора глицерина и 0,5 М раствора сахарозы в
соотношении 1:1 (по 2,5 мл).
Опыт проводится в трехкратной повторности. Состав смесей ра-
створов сахарозы и глицерина можно менять (в таком случае за-
102
полняют дополнительные пробирки), что может быть особенно
необходимо при смене объекта, так как каждый новый объект тре-
бует индивидуального подбора криопротекторов и их смесей.
Все пробирки помещают в охлаждающую смесь, состоящую из
трех частей снега и одной части сухой поваренной соли (темпера-
тура —21 °C). Пробирки выдерживают в ней до полного замерзания
содержимого (см. приложение, табл. III).
После этого пробирки переносят в водяную баню с температурой
25—30 °C для размораживания. После оттаивания растворы тщательно
перемешивают и сравнивают интенсивность их окрашивания.
Задание: расположить пробирки в ряд по мере увеличения
интенсивности окрашивания растворов. Установить связь между ин-
тенсивностью окрашивания растворов и составом смесей, находя-
щихся в этих пробирках. Сделать выводы о роли криопротекторов
(сахарозы и глицерина) и их смесей в сохранении жизнеспособ-
ности клеток растительных тканей при их замораживании.
9. ЭКОЛОГИЧЕСКИЙ МОНИТОРИНГ.
РАСТЕНИЯ КАК ИНДИКАТОРЫ СРЕДЫ
9.1. Определение степени экологического загрязнения
различных субстратов с помощью биотеста на проростках
Биотестирование с помощью растений (проростков, эксплан-
тов, различных органов) разнообразных субстратов (воды, почвы
и т.д.) является стандартным приемом и может быть использова-
но при оценке степени их загрязнения.
Преимуществом биотестирования (как первичного этапа, на-
пример, перед химическим анализом) является простота опера-
ций, минимальное оборудование и достаточно быстрое получение
ответа. При химическом анализе не всегда известно, что токсично.
Поскольку корневые системы очень отзывчивы на воздействия
среды, то и учет проводится в основном на них.
Цель работы: познакомиться с методом оценки воды и по-
чвы на загрязнение.
Материалы и оборудование: чашки Петри, фильтро-
вальная бумага, мерные пипетки на 10 мл, маркер по стеклу, тер-
мостат с температурой 26 °C, весы, разновесы, линейки, дистил-
лированная вода, 1 %-ный раствор перманганата калия или сла-
бый раствор формалина, образцы водных сред из городского водо-
провода, ближайших водоемов (пруда, озера, реки), вода из от-
стойников очистительной станции, взятая в день заложения опы-
та, а также твердые субстраты (почва, сточные осадки из экологи-
чески благоприятных и неблагоприятных районов города).
103
Растения: семена огурца, кресс-салата, горчицы и др.
Ход работы
1. Заложение биотеста.
Калибровку сортовых семян проводят визуально с учетом их
размера и выполненности. На 10 — 20 мин их помещают в 1 %-ный
раствор перманганата калия или формалина, а затем отмывают
водой и раскладывают в чашки Петри по 12 штук. В каждую чашку
Петри вводят по 10 мл испытуемой жидкости, а в контрольный
вариант — дистиллированную воду. При оценке загрязнения твер-
дого субстрата (почвы, твердых осадков и т.д.) навеску субстрата
(3 — 5 г) помещают на дно чашки Петри, равномерно распределя-
ют по дну, закрывают субстрат бумажным фильтром и заливают
20 — 30 мл дистиллированной воды на сутки. На следующий день
на поверхность фильтровальной бумаги раскладывают семена так-
же по 12 штук в каждую чашку. Чашки Петри помещают в термо-
стат при температуре 26 °C на четверо суток.
2. Измерения.
Учитывают длину главного корня и длину зоны боковых кор-
ней у 10 однородных проростков. Измерения проводят с помо-
щью линейки или полоски миллиметровой бумаги. Данные вно-
сят в таблицы 25 и 26. При отсутствии статистической обработки
ингибирующий или стимулирующий эффект оценивают ±15%
(тройная ошибка при 5 %-ном уровне статистической достовер-
ности, приложение 10.2). Санитарно-токсикологически значи-
мое воздействие принимают при степени ингибирования более
30%.
Таблица 25
Учет длины главного корня и зоны боковых корней у проростков огурца
Вариант опыта Длина главного корня, см Длина зоны боковых корней, см
Повторности Повторности
1 2 3 4 5 6 7 8 9 10 X 1 2 3 4 5 6 7 8 9 10 X
Контроль (дистил- лирован- ная вода)
Вода из водо- провода
Вода из Москва- реки
Примечание. X — сумма, X — средняя величина.
104
Таблица 26
Влияние водных сред на рост главного корня проростков огурца
Вариант опыта Средняя длина главного корня Средняя длина зоны боковых корней
см % см %
Контроль (дистиллиро- ванная вода) 100 100
Вода из водопровода
Вода из Москва-реки
Задание: провести измерения корней и заполнить таблицы 25
и 26; сделать вывод о чувствительности биотеста и о возможности
его применения к данным исследованиям, охарактеризовать сре-
ды с экологической точки зрения и данных биотестирования.
9.2. Обнаружение тяжелых металлов в растениях
гистохимическим методом
Тяжелые металлы — опасные загрязнители окружающей среды.
Среди них наиболее распространены Cd и РЬ, что обусловлено в
основном хозяйственной деятельностью человека: 1) сжигание
жидкого и твердого топлива, сопровождающееся выбросами в ат-
мосферу, преимущественно РЬ; 2) сбрасывание сточных вод, в
которых Cd и РЬ содержатся в повышенных концентрациях, как
результат выделений металлоплавильных производств, а также от-
ходы человека и животных; 3) внесение в почву химикатов, в том
числе удобрений. В организм человека и животных большая часть
Cd и РЬ поступает из растительной пищи. Многие растения акку-
мулируют металлы, концентрация которых в клетках и тканях пре-
вышает их концентрации в почве. Способность растений аккуму-
лировать тяжелые металлы с успехом используют для очистки поч-
вы, водоемов, воздуха от загрязнения.
Изучение локализации тяжелых металлов в растительных тка-
нях и их способности к передвижению важно для понимания ре-
акции на них растений. Кроме того, определение содержания тя-
желых металлов имеет важное значение для экологического мони-
торинга.
В данной работе используется способность тяжелых металлов
давать красное окрашивание при реакции с дитизоном:
105
N - NH - C6H5
z
HS-C
N = N — C6H5
Дитизон обладает высокой чувствительностью к кадмию и свин-
цу и образует в присутствии исследуемых металлов нерастворимые
соли — дитизонаты, окрашенные в красный цвет. Дитизон и дити-
зонаты практически нерастворимы в нейтральных и кислых водных
растворах. Помимо кадмия и свинца дитизон может образовывать
окрашенные комплексы с цинком, кобальтом, медью, хромом,
железом, никелем и некоторыми другими металлами.
Для обнаружения тяжелых металлов используют проростки ку-
курузы, у которых концентрации 10-3М Pb(NO3)2 и 10-4 М Cd(NO3)2
ингибируют рост корня на 50%. Для других проростков (подсол-
нечник, огурец, горох и т.д.) следует уточнить концентрации как
летальные, так и ингибирующие рост корня на 50%. С помощью
реакции с дитизоном можно исследовать любые растения и их
органы из неблагоприятных и благоприятных районов города, ра-
стения водоемов, а также содержание тяжелых металлов в сточных
водах, осадках и т.д.
Цель работы: познакомиться с гистохимическим методом
выявления Cd и РЬ в растениях и изучить распределение тяжелых
металлов в проростках кукурузы.
Материалы и оборудование: чашки Петри, фильтро-
вальная бумага, маркер по стеклу, термостат с температурой 26 °C,
растворы Pb(NO3)2 (10-3М), Cd(NO3)2 (10-4М), реактив дитизон
(готовится перед употреблением и не подлежит хранению), ра-
створы КМпО4 или формалина для обработки семян.
Растения: проростки кукурузы.
Ход работы
Работа складывается из двух этапов: 1) выращивание пророс-
тков на растворах солей; 2) приготовление срезов и их микро-
скопирование.
1. Зерновки кукурузы, предварительно обработанные в течение
10—20 мин слабым раствором формалина или перманганата ка-
лия, раскладывают по семь штук в чашки Петри на фильтроваль-
ную бумагу и наливают в каждую чашку по 15 мл дистиллирован-
ной воды (контроль), раствора Pb(NO3)2 в концентрации 10-3М и
раствора Cd(NO3)2 в концентрации 10-4М. Чашки выдерживают в
термостате при температуре 26 °C. Спустя семь дней проводят из-
мерение длины главного корня, колеоптиля и зоны боковых кор-
ней. Для каждого варианта рассчитывают средние величины и про-
цент к контролю (табл. 27).
106
Таблица 27
Влияние тяжелых металлов на проростки кукурузы
Вариант опыта Длина главного корня Длина колеоптиля Длина зоны боковых корней
см % см % см %
Контроль 100 100 100
Pb(NO3)2 10~3 М
Cd(NO3)2 10~4 М
2. Для определения локализации Cd и РЬ в растениях готовят
серии поперечных срезов корня на разных расстояниях от апекса,
а также срезы колеоптиля, мезокотиля и первых листьев на разных
расстояниях от их оснований.
Серии срезов помещают на предметное стекло, на него пере-
носят 3 — 4 капли дитизона, накрывают покровным стеклом и че-
рез несколько минут рассматривают под микроскопом при разных
увеличениях.
Задание: заполнить таблицу и сделать вывод о влиянии тя-
желых металлов на рост проростков; сделать рисунки поперечных
срезов корня и отметить локализацию в их тканях Cd и РЬ; сде-
лать вывод о локализации Cd и РЬ в тканях корня и о возможно-
сти продвижения тяжелых металлов по тканям; выяснить, суще-
ствует ли барьер для передвижения тяжелых металлов по тканям
корня.
9.3. Обнаружение нитратов в растениях
Интенсификация земледелия в XX в. породила нитратную про-
блему. Азотные удобрения, вносимые без соблюдения дозы и пра-
вил, привели к увеличению содержания нитратов в растительных
продуктах до размеров, угрожающих здоровью человека.
Попадание большой дозы нитратов в организм грозит острым
отравлением. Нередки отравления дынями, арбузами и другими
продуктами с повышенным содержанием нитратов; возможно от-
равление питьевой водой за счет попадания повышенного количе-
ства удобрений в водные источники.
По данным Министерства здравоохранения РФ, предельно
допустимая доза нитратов для взрослого человека в сутки со-
ставляет 500 мг, токсичная — 600 мг, для грудного ребенка доза
в 10 мг может быть смертельной. Сведения о содержании нитра-
тов в овощах, их распределении по органам и тканям даны в
таблицах 28 и 29.
107
Соли азотной и азотистой кислот, поглощаемые корнями из
почвы, восстанавливаются в растении до аммиака, который ис-
пользуется для синтеза аминокислот и других соединений. Для
восстановления нитратов требуется АТФ, образующаяся в про-
цессе окислительного или фотосинтетического фосфорилиро-
вания.
При достаточном содержании растворимых углеводов и высо-
кой активности соответствующих ферментов перечисленные био-
химические процессы происходят в клетках корня. Однако при
неблагоприятных условиях часть нитратов (нередко весьма зна-
чительная) может пройти через паренхиму коры корня в неиз-
мененном виде. В этом случае нитраты попадают в сосуды ксиле-
мы и поднимаются с восходящим током к листьям, где и проис-
ходит их восстановление.
Определение содержания нитратов в соке, отжатом из стеблей,
черешков и пластинок листа, позволяет судить о восстановлении
нитратов в корнях: чем меньше в них обнаруживается нитрат-ионов,
тем активнее происходит этот процесс в клетках корня. Сопостав-
ление содержания нитратов в различных органах растения, напри-
мер в черешках, пластинках листа, корнях, дает представление о
нитратредуктазной активности этих органов.
Для обнаружения нитратов можно использовать реактив с ди-
фениламином, который в присутствии иона NO^ дает синюю ок-
раску. По интенсивности посинения можно судить о количестве
нитратов в исследуемом объекте.
Данные таблицы 28 позволяют с помощью этого реактива оце-
нить количество нитратов в растении на разных стадиях развития
и сделать вывод о необходимости азотной подкормки. Малое коли-
чество нитратов в начале вегетации растений означает недостаток
азотного питания. Такое же малое количество их в фазе цветения
является нормой и не требует подкормки растений.
Таблица 28
Шкала для определения нитратов в срезах и соке растений
(по Церлинг)
Балл Окраска среза или сока Необходимость в азотных удобрениях
в начале вегетации в фазу цветения
1 2 3 4
0 Нет окраски Очень сильная (60 кг/га) Средняя (30 кг/га)
1 Бледно-голубая, быстро исчезает Сильная (60 кг/га) Слабая (30 кг/га)
108
Окончание таблицы
1 2 3 4
2 Голубая проводя- щих сосудов Средняя (30 кг/га) Не нуждаются
3 Голубая, исчезает через 2—3 мин Слабая (30 кг/га) ••
4 Синяя, сохраняется несколько минут н
5 Темно-синяя, сохраняется некоторое время Не нуждаются •1
6 Темно-синяя, устойчивая Избыток нитратов
В связи с опасностью, которую представляют нитраты для здо-
ровья человека, приводим сведения о границах содержания их в
овощах и бахчевых культурах (табл. 29), а также данные о распреде-
лении нитратов по тканям и органам зеленых растений (табл. 30).
Эти сведения позволят избежать токсичных доз нитратов.
У столовой свеклы и редиса необходимо удалять верхнюю и
нижнюю части корнеплода. Использовать в пищу редис традици-
онных круглых сортов, так как в них нитратов значительно мень-
ше, чем у сортов типа «Красный великан». В капусте наибольшее
количество нитратов сосредоточено в верхних кроющих листьях и
кочерыжке. Кабачки, огурцы и патиссоны накапливают нитраты в
кожице и в части, прилегающей к плодоножке. Их необходимо
чистить и срезать 2 — 3 см вместе с плодоножкой.
В картофеле нитратов накапливается меньше, однако его упот-
ребляют чаще других овощей и в большом количестве. Для снижения
нитратов в картофеле его следует замачивать на ночь в растворе NaCl.
Цель работы: познакомиться с простым и доступным спо-
собом определения нитратов в растительном сырье и грамотно оце-
нить их количество. Это необходимо для определения дозы внесе-
ния азотных удобрений в период вегетации растений, а также для
изучения того, как локализованы нитраты в различных частях и
органах растения, и оценки их количества в пищевых продуктах.
Материалы и оборудование: раствор KNO3 или NaNO3
в концентрациях, мг/л: 1000, 900, 800, 700, 600, 500, 400, 300,
200, 100, 50, 10 в небольших склянках; 1 %-ный раствор дифени-
ламина в концентрированной H2SO4 в капельнице (хранить в тем-
ноте на подставке), пинцет, стеклянные палочки, плоские белые
фарфоровые тарелки, кусок стекла, фломастер, цветные каранда-
ши, фильтровальная бумага, ножницы, нож, скальпель, бритва.
109
Растения: любые дикорастущие растения, произрастающие
в разных экологических условиях; культурные растения, выра-
щенные на разных питательных средах, любые овощи, фрукты,
зелень.
Нормы содержания нитратов в продуктах
Министерством здравоохранения РФ установлены следующие
нормативы по содержанию нитратов в сельскохозяйственной про-
дукции (в мг/кг по нитрат-иону). В числителе приводятся нормы
для ранних и тепличных овощей, в знаменателе — для поздней
продукции открытого грунта:
картофель — 250 капуста — 900/500 морковь — 400/250 томаты — 300/150 лук репчатый — 80 лук-перо — 800/600 огурцы — 400/150 арбузы — 60 дыни — 90 перец сладкий — 200 кабачки — 400
Таблица 29
Минимальные и максимальные количества нитратов в овощах, мг/кг,
по данным Института почвоведения и фотосинтеза АН России
Культура Минимум Максимум Культура Минимум Максимум
1 2 3 4 5 6
Арбузы 44 572 Петрушка (зелень) 1760 1892
Баклажаны 88 264 Ревень 1760 2420
Брюква 398 528 Редька черная 1540 1760
Горошек зеленый 22 88 Редис 440 2640
Горчица салатная 1320 1760 Репа 660 880
Дыни 44 484 Салат 396 2860
Капуста белая 66 2860 Свекла столовая 44 2640
Кабачки 196 704 Кресс- - салат 320 4840
Перец сладкий 44 352 Картофель 44 968
НО
Окончание таблицы
1 2 3 4 5 6
Лук зеленый 44 1320 Тыква 308 1320
Лук репчатый 66 880 Укроп 396 2200
Морковь 176 2200 Фасоль 22 880
Огурцы 88 528 Чеснок 44 308
Патиссоны 176 880 Шпинат 660 3960
Тархун 1320 2200 Щавель 264 396
Ход работы
На белую фарфоровую поверхность тарелки или стеклянной
пластинки наносят капли контрольных растворов KNO3 или NaNO3
и добавляют одну каплю дифениламина. Заполняют концентраци-
онную шкалу окраски, соответствующую определенному содер-
жанию нитратов (табл. 31).
Таблица 30
Содержание нитратов в различных органах зеленых овощей, мг/кг
Орган Культура
Шпинат Кориандр Укроп
Корень 74 90 384
Стебель 833 163 487
Черешок листа 814 165 441
Пластинка листа 213 14 95
Таблица 31
Концентрационная шкала окраски на нитраты
Концентрация NaNO3, мг/л Изображение цвета Описание цвета
1 2 3
10
111
Окончание таблицы
1 2 3
50
100
200
300
400
500
600
700
800
900
1000
С помощью этой шкалы количественно оценивают содержание
нитратов в растительном материале, сравнивая с ней по цвету
опытную пробу.
Взятые для исследования плоды, клубни, корнеплоды, луко-
вицы и т.д. раскладывают на столе, отделяют ткани и части орга-
нов для анализа. Сок отжимают на поверхность стекла, под кото-
рым лежит лист белой бумаги, или на поверхность тарелки с по-
мощью пинцета или стеклянной палочки. Образцы подписывают
фломастером. Одновременно острой бритвой делают срезы изучае-
мой ткани, органа. На срез и выжатую порцию сока переносят
каплю дифениламина. Оценивают количество нитратов согласно
данным концентрационной шкалы окраски (см. табл. 31), заносят
результаты по их содержанию в таблицу 32. Смывая по окончании
работы ткани и сок, необходимо помнить о свойствах концентри-
рованной серной кислоты оставлять ожоги при попадании на кожу.
Задание: в таблицу, оформленную по вышеприведенному об-
разцу, записать результаты анализа тканей и органов исследуемых
растений с учетом условий их произрастания. Сделать вывод о воз-
можности употребления этих растений в пищу и о необходимости
внесения азотных удобрений в фазе вегетации.
Метод прост, дает полезную информацию, не требует сложно-
го оборудования и доступен для использования в школе на кружке
или факультативе в полном объеме. В настоящее время можно при-
обрести прибор, предназначенный для экспресс-контроля каче-
ства свежей овощной продукции на предмет концентрации нитра-
112
тов. Этот прибор позволяет моментально определить, нуждаются
ли молодые растения в подкормке азотом, содержание нитратов в
данном продукте, а также выбрать оптимальный вариант употреб-
ления этого продукта без ущерба для здоровья. Прибор «Морион
ОК-2» выпускает ГСП АО «Морион», г. Пермь. Его размеры неве-
лики, диапазон индикации нитратов 20 — 200%. Относительная ин-
струментальная погрешность в диапазоне 30—100% равна ±20%.
Помимо нитратов с помощью «Морион ОК-2» можно опреде-
лить и кислотность почвы в диапазоне значения pH 4—8.
Прибор удобен для использования в быту и будет полезен в
школьной лаборатории и в институте.
Содержание нитратов в растениях
Таблица 32
Вид расте- ния Усло- вия выра- щива- ния Окраска Количество NO;, мг/кг Допусти- мое коли- чество продукта, г в сутки для человека Необходи- мость внесения азотных удобрений до цветения
среза сока в срезе в соке
5—338
ПРИЛОЖЕНИЕ
Техника лабораторных работ
Требования к помещению лаборатории и технике безопасности.
В каждой лаборатории должны быть средства пожаротушения и
индивидуальной защиты — огнетушители, емкости с песком, ас-
бестовое одеяло, резиновые сапоги и фартук, защитные очки, рес-
пираторы, резиновые перчатки, деревянный шест с крючком.
В лаборатории необходимы емкости (15 —20 л) из полиэтилена
или других антикоррозионных материалов для слива ненужных,
отработанных реактивов. Эти емкости по мере наполнения выво-
зят в специальные хранилища.
На видном месте должна находиться аптечка с набором меди-
каментов и препаратов, таких как мазь от ожогов, 3%-ный ра-
створ гидрокарбоната натрия (против кислотных ожогов), 1 %-ный
раствор уксусной кислоты (от щелочных ожогов), этиловый спирт,
настойка йода, жгут, пластырь, перевязочные средства, вода, мен-
зурка для капель, нашатырь, сердечные средства.
В лаборатории недопустимо скопление большого числа рабо-
тающих.
Перед началом цикла работ в лаборатории студентам необходи-
мо ознакомиться с общими для всех лабораторий правилами тех-
ники безопасности и расписаться в книге инструктажа.
Общие правила работы
1. Работать тщательно, аккуратно, без спешки; соблюдать ти-
шину.
2. Не загромождать рабочее место портфелями, свертками, сум-
ками и т.п. Для них отведены специальные места.
3. Курение, прием пищи (и ее хранение), употребление напит-
ков в лаборатории запрещены.
4. Желательно работать на одном и том же месте, иметь халаты,
резиновые перчатки, очки и другие средства защиты.
5. Прежде чем приступить к работе по данной теме, необходимо
тщательно ознакомиться с ее описанием.
6. Без указания и разрешения преподавателя не производить
никаких дополнительных опытов.
7. Перед работой с прибором и установками студент обязан проч-
но усвоить принципы действия прибора и основные правила обра-
щения с ним.
8. Не брать приборы, аппараты, реактивы общего пользования
на свое рабочее место.
114
9. Расходовать реактивы следует экономно. Если препарата при-
готовлено больше, чем необходимо, то его излишки надо сливать
в определенную емкость, но не возвращать в склянку.
10. Пользоваться можно только маркированными реактивами.
11. Работы с вредными веществами проводить только под тягой.
Концентрированные кислоты и щелочи наливать осторожно под
вытяжным шкафом; не брать их на свои рабочие места.
12. Если случайно пролита кислота или щелочь, то необходимо
быстро смыть раствор интенсивной струей воды из водопроводно-
го крана, а потом обратиться к лаборанту и по его указанию при-
вести в надлежащий порядок свое рабочее место.
13. Не выливать в раковину отработанные концентрированные
кислоты и шелочи, а пользоваться для этого банками, установ-
ленными под тягой.
14. Никакие вещества в лаборатории нельзя пробовать на вкус.
Если необходимо определить запах газа или паров жидкости, хра-
нящейся в банке или сосуде, нельзя подносить их близко к лицу,
следует легкими движениями руки направить воздух от горлышка
или отверстия сосуда к носу.
15. В процессе каких-либо реакций на воздухе или при нагре-
вании нельзя держать сосуд отверстием к себе или другим рабо-
тающим.
16. Горячие приборы и посуду ставить только на специальные
подставки, а не на открытый стол.
17. Нельзя пользоваться при проведении опытов грязной посудой.
18. Нельзя использовать стеклянную посуду, если на ней име-
ются трещины, сколы, щербины. При обработке стекла напильни-
ком следует смочить его водой, чтобы стеклянная пыль не попала
в глаза. Перед тем как вставлять стеклянную трубку в резиновый
шланг или пробку, их нужно смочить водой или глицерином, а
руку обмотать полотенцем. Это предохранит от тяжелых травм.
19. При работе с вакуумными приборами всегда имеется опас-
ность взрыва. Прибор следует поместить в проволочную сетку или
хотя бы обернуть полотенцем.
20. Внимательно следить, чтобы не было утечки газа, в противном
случае немедленно сообщать об этом лаборанту или преподавателю.
21. После окончания работы нужно вымыть использованную по-
суду, выключить воду, газ, электричество и приведенное в поря-
док место сдать лаборанту.
22. Тщательно вымыть руки теплой водой с мылом и щеткой.
Химическая посуда. По назначению посуду можно разделить на
посуду общего назначения, специального и мерную.
Посуда общего назначения необходима для большинства работ и
всегда есть в лаборатории. Это пробирки, воронки простые и дели-
115
тельные, колбы плоскодонные, стаканы, кристаллизаторы, кони-
ческие колбы (Эрленмейера), колбы Бунзена, холодильники, ре-
торты. Специальная посуда применяется только для какой-то опре-
деленной цели, например аппарат Киппа, аппарат Сокслета, при-
боры для определения плотности, молекулярного веса и др. ^мер-
ной посуде относят мерные цилиндры и мензурки, пробирки, пи-
петки, бюретки и мерные колбы.
При проведении качественных опытов применяют пробирки
вместимостью 5 — 6 мл, чаще конические. Их помещают в пласт-
массовые или деревянные штативы. Совершенно недопустимо при-
слонять пробирки с веществами к каким-либо предметам.
Объем реагентов в пробирке не должен превышать 1/4 объема.
Сыпучие вещества вносят в пробирку с помощью шпателя или
совочка из кальки или бумаги шириной, немного меньшей диа-
метра пробирки, а длиной, соответствующей длине пробирки. Ре-
активы, налитые в пробирку, перемешивают в левой руке, ударяя
по низу пробирки указательным пальцем правой руки. Если про-
бирка заполнена жидкостью больше чем наполовину, ее содержи-
мое перемешивают стеклянной палочкой. Нельзя закрывать про-
бирку пальцем и встряхивать ее содержимое.
Нагревать вещества до 100 °C (температура кипения воды) мож-
но и в конических колбах, и в химических стаканах на электро-
плитке или газовой горелке с асбестированной сеткой. Реакции
при более высокой температуре проводят в круглодонных колбах.
Различные сорта стекол обладают разными термическими свой-
ствами. Обычное химическое стекло из-за высокого температурно-
го коэффициента расширения термически малоустойчиво. Тонко-
стенную посуду и изделия из обычного химического стекла можно
нагревать только до температуры кипения воды на асбестовой сет-
ке, избегая резких изменений температуры. Нельзя нагревать кри-
сталлизаторы — плоскодонные стеклянные толстостенные чашки.
Стекло «пирекс» жароустойчиво и химически устойчиво. Высокой
механической прочностью и термоустойчивостью характеризуется
и «молибденовое» стекло, однако оно химически менее устойчиво.
Наиболее термостойко кварцевое стекло.
Для хранения и переливания небольших количеств жидкостей
используют капельницы, пипетки и бюретки. Капельницы бывают
чаще всего двух типов. Сдавливая и отпуская резиновый колпачок
(от глазной пипетки) капельницы, можно набирать в пипетку жид-
кость, отливать нужное число капель. Из капельницы с клювиком
жидкость выливается в сосуд при нагревании воздуха над раство-
ром теплом руки.
В лабораториях пользуются пипетками Мора (простые) и пи-
петками градуированными. Последние применяют для отмерива-
ния различных объемов жидкости. Пипетки Мора предназначены
116
для переноса определенного объема жидкости из одного сосуда в
другой.
Пипетки наполняют жидкостью следующим образом. Пипетку
берут большим и средним пальцами и опускают нижний конец ее
в жидкость; через верхний конец пипетки ртом всасывают жид-
кость так, чтобы уровень ее поднялся выше метки. Быстро закры-
вают указательным пальцем верхнее отверстие пипетки. Держа
пипетку строго вертикально, поднимают ее так, чтобы метка ока-
залась на уровне глаз, затем понемногу ослабляют палец на верх-
нем отверстии пипетки, чтобы жидкость медленно вытекала. В тот
момент, когда нижняя часть мениска опускающейся жидкости кос-
нется метки, верхнее отверстие опять плотно закрывают пальцем.
Ядовитые и сильно пахнущие жидкости, а также крепкие ра-
створы кислот и щелочей рекомендуется отбирать резиновой гру-
шей, присоединяя ее при помощи резиновой трубки к верхнему
концу пипетки. После насасывания грушу снимают и жидкость
доводят до метки, как было указано выше.
Бюретки применяют для титрования раствора, используемого в
лаборатории в объемном анализе. Для отсчета малых объемов жид-
кости используют микробюретки.
Бюретку споласкивают 3—4 раза дистиллированной водой и
3 раза небольшими порциями заполняемого раствора. Каждый раз
после промывания дают возможность жидкости полнее стечь из
бюретки. Затем бюретку наполняют раствором несколько выше верх-
ней черты и открывают кран или зажим так, чтобы кончик бюрет-
ки наполнился раствором и вышли все пузырьки воздуха. Если из
кончика бюретки пузырек не выходит, надо, согнув каучуковую
трубку, поднять кверху кончик бюретки и открыть зажим. Пузырек
быстро поднимается вверх и выходит. Если бюретка с краном,
можно удалить пузырек, резко открыв кран и пустив сильную струю
раствора, или при помощи резиновой груши.
Перед самым началом титрования надо довести уровень жидко-
сти в бюретке до нулевой черты. Точность отсчетов по бюретке
составляет 0,02 мл. Поэтому отсчеты следует записывать с двумя
десятичными знаками (например, 15,00 или 16,34). Микробюрет-
ки в отличие от обычных имеют градуировку 0,01 мл, что дает
возможность делать отсчеты с большей точностью.
Мерная (измерительная) химическая посуда применяется для от-
меривания (и измерения) объемов жидкостей или для приготов-
ления растворов заданного объема и определенной концентра-
ции. На наружной стенке цилиндров и мензурок нанесены деле-
ния, указывающие объем в миллиметрах или в долях миллиметра
(1 мл соответствует 1 см3, 1000 мл = 1л, 1л соответствует 1 дм3,
1 дм3 = 1 х 10~3 м3). Кольцевая метка на горле колбы соответствует
указанному на ней объему при 25 °C. Чтобы отмерить нужный объем
117
жидкости или определить имеющийся, жидкость наливают в из-
мерительный сосуд до тех пор, пока край мениска не достигнет
желаемого деления. Глаз и поверхность жидкости должны нахо-
диться в одной горизонтальной плоскости. Обычно измерение объе-
ма проводят по нижнему краю мениска, если жидкости, смачива-
ющие стекло, прозрачные, и по верхнему — для непрозрачных.
Вся мерная посуда должна быть тщательно вымыта хромовой
смесью и промыта водой.
При пользовании градуированной мерной посудой важно знать
так называемую цену деления, т. е. скольким миллилитрам или до-
лям миллилитра жидкости соответствует каждое деление.
Цена деления определяется следующим образом: на шкале на-
ходят нулевое деление, а затем, внимательно рассматривая шка-
лу, находят следующее деление, обозначенное цифрой. Например,
объем от 0 до 1 составляет 1 мл; считают число мелких делений
между нулем и первой значащей цифрой; непосредственно опре-
деляют цену одного деления. Для этого объем от нуля до значащей
цифры делят на число делений.
Фарфоровая посуда более прочная, чем стеклянная. Обычно ис-
пользуются фарфоровые стаканы различных вместимостей, чашки
для выпаривания разного диаметра, ступки, фарфоровые тигли,
воронки Бюхнера, ложки и шпатели.
Посуда из полиэтилена, фторопласта и других пластиков также
есть в лабораторном обиходе. Она легкая, прочная, химически стой-
кая. Чаще всего используют флаконы и промывалки из полиэтиле-
на, воронки, мензурки и центрифужные пробирки из него. В поли-
этиленовую посуду можно наливать горячие растворы с темпера-
турой до 200 °C. Недостатком полиэтиленовой посуды является спо-
собность прочно адсорбировать азотную и соляную кислоту. После
них отмыть полиэтиленовую посуду довольно трудно.
Эксикаторы применяют для высушивания материала и сохра-
нения веществ, поглощающих влагу из воздуха, а также для ваку-
ум-инфильтрации растворов в растения. Стеклянная крышка эк-
сикатора притерта к верхнему цилиндру. Эксикаторы бывают обык-
новенные и вакуумные, имеющие краник. Можно соединить экси-
катор с вакуумным насосом, создаваемое внутри разрежение спо-
собствует высушиванию хранящегося в нем материала.
Притертые части эксикатора должны быть смазаны вазелином
или вакуумной смазкой. Внутрь на дно цилиндра помещают фар-
форовую вкладку. В качестве поглотителей в эксикаторе использу-
ют безводный хлористый кальций, силикагель и фосфорный ан-
гидрид — самый сильный поглотитель воды. Количественную часть
эксикатора заполняют поглотителем примерно на треть высоты.
Для поглощения воды можно использовать и серную кислоту, но
лишь когда ее пары не взаимодействуют с материалом в эксикаторе.
118
Маркировка посуды. Каждая колба, пробирка или сосуд должны
быть маркированы, т.е. на них должны быть обозначены название
вещества, номер опыта, дата, время и другие нужные сведения.
Чаще всего применяют временную маркировку восковыми ка-
рандашами (некоторые выдерживают высокую температуру, даже
автоклавирование). Применяют также чернила разного цвета, фло-
мастеры и стеклографы.
Сосуды для растений обычно маркируют, втыкая в субстрат
деревянную или пластмассовую планку (можно использовать де-
ревянный медицинский шпатель), а также привязывая бумажные
этикетки. Пластмассовые контейнеры можно пометить липкой лен-
той, фломастером или восковым карандашом для стекла.
Правила приготовления растворов щелочей и кислот.
Техника приготовления растворов щелочей и кислот отличает-
ся от техники приготовления растворов солей.
Правила приготовления растворов щелочей
1. Кусочки щелочи нельзя брать голыми руками, их можно брать
пинцетом, щипцами, а если нужно взять руками, то обязательно в
резиновых перчатках. Гранулированную щелочь (в виде маленьких
лепешек) насыпают фарфоровой ложечкой.
2. Отвешиваемую щелочь нельзя класть на бумагу; ее можно взве-
шивать только в стеклянной или фарфоровой посуде.
3. Щелочь нельзя растворять в толстостенных бутылях, так как
при растворении происходит сильное разогревание и бутыль мо-
жет лопнуть.
Правила приготовления растворов кислот
Расчеты при приготовлении кислот иные, чем при приготовле-
ний солей и щелочей, так как концентрированные растворы кис-
лот содержат воду. Нужное количество кислоты не отвешивают, а
отмеряют мерным цилиндром.
1. Раствор нельзя приготовлять в толстостенной бутыли, так как
при разбавлении кислот, особенно серной, происходит сильное
разогревание. Растворы кислот готовят в колбах.
2. При разбавлении раствора нельзя лить воду в кислоту. В колбу
наливается рассчитанное количество воды, а затем тонкой струей,
постепенно, при перемешивании добавляют нужное количество
кислоты. Кислоту и воду отмеряют мерными цилиндрами. Опера-
цию проводят в очках.
3. После того как раствор остынет, его переливают в бутыль и
наклеивают этикетку.
Весы и взвешивание. В зависимости от точности, с которой про-
водится взвешивание, различают и группы весов. Одни предназна-
119
чены для грубого взвешивания (точность до 1 г), другие — для
более точного (до 1 мг). К первым относятся чашечные и циферб-
латные весы, ко вторым — технохимические и технические весы.
Самые точные — аналитические весы — позволяют определить
массу с точностью до долей миллиграмма.
Для каждых весов имеется свой разновес — набор гирь разной
массы. В разновесе для чашечных весов могут быть гири от 1 кг до
1 г. Весы могут быть одночашечные и двухчашечные.
На весах обычно указана предельная нагрузка, превышать ко-
торую не рекомендуется.
Общие правила работы с весами
1. Одно из главных правил — установка весов в правильном
положении по уровню или отвесу. Для регулировки положения ис-
пользуют передние винтовые подпорки весов. Необходимо исклю-
чить их вибрацию.
2. Весы запрещается передвигать и тем более переносить с места
на место.
3. Нуль на весах обязательно проверяется перед работой.
4. Ни в коем случае нельзя насыпать вещества на чашку весов!
Взвешивать вещества разрешается на листе бумаги (лучше каль-
ки), на часовом стекле, в стакане, бюксе и т. п. Разумеется, масса
вещества определяется как результат разницы двух взвешиваний —
пустой тары и с веществом.
5. Запрещается на чашки ставить грязные предметы.
6. Класть предметы на чашку можно только при арретирован-
ных весах.
7. Вещества и тару всегда взвешивают при той температуре, при
которой находятся сами весы. Поэтому если взвешиваемое тело
было взято из сушильного шкафа, печи или холодильника, его
следует выдержать рядом с весами 5—10 мин, чтобы оно приобре-
ло температуру весов.
8. Если в одной работе требуется провести несколько взвешива-
ний, то следует пользоваться только одними и теми же весами (и
одним разновесом). Перед началом работы следует проверить вер-
тикальное положение стойки весов.
Фильтрование. Фильтрованием называют отделение от жидкости
находящихся в ней частиц твердого вещества при помощи фильт-
рирующей перегородки (фильтра). Жидкость, отделяемая при филь-
тровании, называется фильтратом.
Складчатый бумажный фильтр изготовляют следующим образом:
сначала делают из фильтровальной бумаги простой гладкий фильтр,
затем складывают его пополам и сгибают несколько раз в одну и
другую сторону, далее каждую четверть фильтра снова сгибают попо-
лам и так далее, пока не получится конусообразная гармошка. При
120
фильтровании фильтр не должен выступать за края воронки или
быть ниже их на 0,5 — 1 см. Складчатые фильтры используют, когда
для последующей работы нужен раствор; если нужно получить оса-
док, то используют гладкие фильтры, с которых его легче собрать.
Зачастую фильтрование в колбу приостанавливается из-за того,
что воздух не проходит в месте соприкосновения воронки с краем
горла колбы. В этом случае надо почаще слегка приподнимать во-
ронку или под воронку на колбу положить кусочек бумаги, свер-
нутый в трубочку и загнутый посередине.
Иногда требуется отфильтровать горячий раствор, предупреж-
дая его охлаждение и выпадение в осадок растворенного вещества.
Здесь целесообразны воронки для горячего фильтрования.
Фильтрование при пониженном давлении. Фильтрование можно
существенно ускорить, подавая раствор на фильтр под давлением
или, наоборот, снижая давление под фильтром.
В лабораторном практикуме применяется фильтрование при по-
ниженном давлении (иногда говорят «под вакуумом»). Его проводят
при помощи толстостенной колбы с отростком, подсоединяемым к
вакуумной сети или водоструйному насосу. В колбу через резиновую
пробку или шлиф вставляют обычную воронку или специальную
воронку Бюхнера. Пониженное давление для фильтрования (и вы-
сушивания) веществ создают при помощи стеклянного или ме-
таллического водоструйного насоса. Разрежение в нем создается
водяной струей, захватывающей при своем движении воздух.
Выключать воду в водоструйном насосе надо медленно, чтобы
давление в колбе постепенно приблизилось к атмосферному, в про-
тивном случае водопроводная вода устремляется в колбу с отфильт-
рованной жидкостью. Для предотвращения попадания воды в филь-
трат иногда между насосом и колбой включают промежуточную
толстостенную двугорлую склянку.
Статистическая обработка данных
Измерения являются основной составной частью любого экс-
перимента. От тщательности измерений и последующих вычисле-
ний зависят его результаты.
В любом исследовании после многократных измерений интере-
сующего нас параметра получают п различных результатов — Xt,
Хг, ..., Хп. В качестве оценки действительного значения величины
этого параметра ХЛ пользуются средним арифметическим (X) этих
результатов:
— _ х} +х2 +...+х„
п —
С увеличением числа повторных измерений достоверность X воз-
растает.
121
Оценка действительного значения параметра при ограничен-
ном числе измерений производится в форме двух значений — ми-
нимального и максимального. Эти крайние значения, в пределах
которых может находиться искомая величина изучаемого парамет-
ра, называются доверительными границами.
Действительное значение параметра X может отличаться от
найденного по ограниченному числу измерений среднего арифме-
тического значения X не более чем на величину возможной по-
грешности Д, определяемой по данным проведенных измерений.
Это правило выражается следующими формулами:
Хд = Х± Д;
Хд = не более (X + Д);
Хд = не менее (X — Д),
где Хд — действительное значение измеряемой величины;
Х_ — среднеарифметическое значение измеряемой величины;
X + Д — максимальная доверительная граница, или возмож-
ный_максимум;
X — Д — минимальная доверительная граница, или возможный
минимум;
Д = tc<5% — возможная максимальная абсолютная погрешность
при прогнозе действительного значения измеряемой величины;
tc — критерий надежности (коэффициент Стьюдента), опреде-
ляемый по таблице I;
о — среднее квадратичное отклонение от среднего;
ах = —- — ошибка средней арифметической при числе из-
мерений менее 20.
о = 1--------- — среднее квадратичное отклонение резуль-
II п-1
татов измерений от среднего арифметического.
Точность выполняемых измерений обычно характеризуется
величиной с>х или в относительных единицах ее отношением к
. „ ЮОоу
средней арифметической: —=А-%.
Разброс показателей (однородность) измерения характеризу-
ется величиной дисперсии и показателем вариации (изменчивос-
ти) Кв.
122
Таблица I
Критерии надежности tc (коэффициента Стьюдента) для различных
доверительных вероятностей а и различного числа измерений п
Измерения, п Значение критерия надежности tc при доверительной вероятности а
а = 0,90 а = 0,95 а = 0,99 а = 0,999
2 6,31 12,71 63,70 637, 21
3 2,92 4,30 9,92 31,60
4 2,35 3,18 5,84 12,94
5 2,13 2,77 4,60 8,61
6 2,02 2,57 4,03 6,86
7 1,94 2,45 3,71 5,96
8 1,90 . 2,36 2,50 5,40
9 1,86 2,31 3,36 5,04
10 1,83 2,26 3,25 4,78
12 1,80 2,20 3,11 4,49
14 1,77 2,16 3,01 4,22
16 1,75 2,13 2,95 4,07
18 1,74 2,11 2,90 3,96
20 1,73 2,09 2,86 3,88
П ример. Имеются 10 измерений высоты побега растений.
Необходимо определить доверительный интервал для среднего
арифметического значения высоты побега при доверительной
вероятности, равной 0,95, и коэффициент вариации серии из-
менений.
Для решения поставленной задачи сначала находим среднее
арифметическое значение X для десяти проведенных измерений:
ю
2=1
65 + 67 + 68 + 69 + 70 + 71 + 72 + 73 + 74 + 75
10
123
Затем находим отклонение каждого измерения от полученного
среднего в миллиметрах и квадраты этих отклонений (табл. II):
Таблица II
Отклонения от средней величины при измерении побегов
Измерения, п Отклонения от средней величины, мм Квадраты отклонений, мм2
1 65-70 = —5 (65 —70)2 = 25
2 67-70 = - 3 (65 —70)2 = 9
3 68-70 = —2 (68 —70)2 = 4
4 68-70 = —2 (68—70)2 = 4
5 69-70 = - 1 (70-70)2 = 1
6 70-70 =0 (71 - 70)2 = 0
7 71-70 = 1 (72 —70)2 = 1
8 73-70 - 3 (73-70)2 = 9
9 74-70 =4 (74—70)2 = 16
10 75-70 =5 (75-70)2 = 25
Определяем среднее квадратичное отклонение от среднего при
числе измерений п = 10 по формуле
а- 25 + 9 + 4 + 4 + 1 + 1 + 9 + 16 + 25 ,_94_323
М п-1 V 10-1 ” 9 ” ’
и среднее квадратичное отклонение среднего значения по фор-
муле
о 3,23 3,23
о? = ,— = ...= —— = 1,08.
у/п-л 710-1 з
Для доверительной вероятности 0,95 по таблице I при числе
измерений п — 10 определяем критерий надежности /. = 2,26. Под-
ставив его в вышеприведенную формулу, получим границы дове-
рительного интервала для среднего арифметического:
А = tc оу - 2,26 • 1,08 = ±2,44 мм.
Следовательно, высота h измеренного побега равна:
/г = У± А = 70,00 ±2,44 мм.
124
Относительная погрешность результатов серии из 10 измере-
ний при доверительной вероятности 95% будет равна:
S = 10°2yZc = 2dlioo% = 3,48%.
X 70,00
Коэффициент вариации будет равен:
Къ =
100g _ 3,23
X "70,00
100% = 4,61.
Приготовление некоторых растворов, реактивов,
красителей, индикаторов и т.д.
Растворы
1. Баритовая вода. На 1 л раствора берут 7 — 10 г гидроксида бария.
Растворяют его в 100 мл дистиллированной воды (при слабом на-
гревании). Затем быстро и плотно закупоривают сосуд и в течение
10—15 мин взбалтывают. Процедуру повторяют 10—15 раз в про-
должение суток. Затем, когда раствор отстоится, через сифон осто-
рожно переливают его в бутылку (лучше такого же объема). Сифон-
ные трубки должны быть плотно вставлены в пробки бутылок, иначе
при соприкосновении с углекислотой воздуха раствор будет мутнеть.
2. Вода без СО2. Дистиллированную воду прокипятить не менее
30 мин для удаления растворенного СО2. Перелить в склянку с
плотно закрывающейся крышкой, закрыть и охладить.
3. Дезинфицирующие растворы: 3 —5%-ный раствор фенола,
0,5 —3%-ный раствор хлорамина, 2 —3%-ный раствор NaHCO3;
формалина 1 мл в 300 мл воды, 1%-ный раствор перманганата
калия и др.
4. Калий едкий для просветления срезов. 5 %-ный раствор хра-
нят в пузырьке с корковой пробкой, пропитанной парафином.
Иногда используют 30 %-ный NaOH или КОН для той же цели.
5. Концентрированные растворы пигментов для изучения опти-
ческих свойств:
а) хлорофилл в смеси пигментов. Сухие листья крапивы из-
мельчают и наполняют ими склянку темного стекла на 2/3 объема.
Заливают этанолом на 2 — 3 см выше уровня листьев и оставляют
на 5 —7 дней в холодильнике для экстракции, а затем экстракт
отфильтровывают;
б) каротин. 2 — 3 корнеплода моркови размельчают на терке,
помещают в темную склянку и заливают бензином на 1 — 2 см
выше уровня ткани. Оставляют в холодильнике на 5 —7 дней, а
затем отфильтровывают;
125
в) ксантофилл. К вытяжке пигментов (см. подпункт а) добавля-
ют бензин в соотношении 1:1 и 1 — 2 капли воды. Резко встряхива-
ют. Верхний зеленый слой отбирают пипеткой. Если нижний слой
имеет зеленоватый оттенок, доливают чистый бензин и 1 — 2 кап-
ли воды и опять встряхивают. Процедуру повторяют до полного
удаления зеленого оттенка. Чистоту пигментов контролируют с
помощью спектрофотометра или спектроскопа.
6. Люголя раствор (для окраски крахмала, гликогена, гранулезы
белков).
I способ. Кристаллический йод — 7 г, йодид калия — 20 г, дис-
тиллированная вода — до 300 мл. Йодид растирают в ступке с 10 мл
дистиллированной воды, добавляя навеску йода. И вновь растирают
до полного растворения йода в йодиде калия (йод в воде нераство-
рим). Раствор переносят в склянку, общий объем доводят до 300 мл
дистиллированной водой. Раствор хранят в темной склянке 30 дней.
II способ. Наиболее часто используют рецепт Грама: 2 г йодида
калия растворяют при нагревании в 5 мл дистиллированной воды;
затем в этом растворе растворяют 1 г металлического йода, после
чего добавляют воды до 300 мл. Хранят в оранжевой склянке с
притертой пробкой. Под действием реактива крахмальные зерна
окрашиваются до черного и голубого цвета, а белки (алейроновые
зерна, цитоплазма) — в желтый цвет. Для обнаружения белков
чаще применяют видоизмененный раствор следующего состава: 1 г
йода + 3 г йодида калия + 100 мл воды.
7. Питательный раствор Кнопа для водных культур, а также для
подкормки растений:
(г/л): Ca(NO3)2 — 1,00; KNO3 - 0,25; КН2РО4- 0,25; КС1 -
0,12; MgSO4-7H2O - 0,25; FeCl3 6H2O 5 %-ный - 1 капля.
8. Смесь микроэлементов:
№ 1 (г/л): Н3ВО3- 2,86; МпС12- 1,81; ZnSO4- 0,22; CuSO4-
0,08; молибденовая кислота — 0,02;
№ 2 (%): Н3ВО4 - 0,03-0,05; ZnSO4 - 0,03-0,05; КМпО4-
0,06-0,1; CuSO4— 0,02-0,05; 5(NH4)2MoO4 - 0,06-0,01; NiSO4-
0,001-0,002.
9. Оргстекло в хлороформе для получения отпечатков (слепков)
устьиц. Стекло и хлороформ, взятые в соотношении 1:10, раство-
ряют в течение 12 ч. Добавляют небольшое количество хлорофор-
ма, пока тягучая капля легко стекает со стеклянной палочки. Хра-
нят в сосуде с притертой пробкой.
10. Tween-80 или Tween-60 — смачиватели для лучшего проник-
новения фитогормонов и других веществ в растения. Применяют
водные растворы в концентрации 0,01 %.
11. Фитогормоны для обработки растений:
а) навески веществ ИУК, абсцизовой кислоты, гиббереллина в
необходимой концентрации (мг/л, М, % и т.д.) растворяют в не-
126
большом количестве этанола (0,2—1 мл) и доводят объем водой
до нужного;
б) кинетин (20 мг/л). Навеску 2 мг растворяют в 1 — 3 мл 0,1 н
КОН, доводят значение pH до 6,5 — 7, добавляя 0,1 н НС1, а затем
дистиллированной водой доводят объем до 100 мл;
в) ланолиновая паста с ИУК. В фарфоровую чашку помещают 5 г
ланолина, приливают 5 мл 0,01 %-ного раствора ИУК и тщательно
растирают смесь стеклянной палочкой до гомогената белого цвета.
Хранят в холодильнике.
12. Растворы для охлаждения.
Таблица III
Охлаждающие смеси
Соли, добавляемые на 100 частей снега Достигаемая температура, °C Соли, добавляемые на 100 частей снега Достигаемая температура, °C
30 частей КС1 -10,9 9 частей KNO3 + + 67 частей NH4CNS -28,2
25 частей NH4C1 -15,4 32 части NH4NO, + + 59 частей NH4CNS -30,6
45 частей NH4NO3 -16,7 54,5 части NaNO3 + + 39,5 части NH4CNS -37,4
50 частей NaNO3 -17,7 143 части СаС12 (кристаллический) -50,0
33 части NaCl -21,3 — —
13. Формалин СН2О. Стандартный раствор формалина содержит
37 — 37,3 %-ный формальдегид, 6—15 %-ный метанол, который ис-
пользуют в качестве стабилизатора, и 0,02—0,04 %-ную муравьи-
ную кислоту, благодаря чему раствор имеет кислую реакцию сре-
ды (pH 2,8 —4,0). Формальдегид полимеризуется с образованием
параформальдегида, который при длительном хранении раствора
выпадает в осадок. При наличии мути или осадка формалин перед
употреблением фильтруют, что несколько снижает концентрацию
формальдегида. Целесообразнее подогреть препарат до температу-
ры 50 °C и выдержать в термостате при этой температуре 24 ч. Сле-
дует иметь в виду, что формалин токсичен. Предельно допустимая
концентрация его в воздухе — 0,001 мг/дм3.
Хранят формалин в стеклянной таре, в защищенном от света
месте, при температуре не ниже 21 °C — для высшего сорта, и не
ниже 7 °C — для первого сорта.
127
14. Хромовая смесь для мытья посуды — «хромпик». В концент-
рированную серную кислоту добавляют 5 % (от объема кислоты)
хорошо размельченного дихромата калия. Полученную смесь взбал-
тывают и оставляют на сутки для растворения. Готовый раствор
имеет темно-оранжевый цвет и может быть применен для мытья
посуды. Изменение цвета хромовой смеси на темно-зеленый сви-
детельствует о ее непригодности.
15. Флороглюцин — для выявления лигнина. 1 г флороглюцина
растворяют в 100 мл 96 %-ного этанола.
16. Хлорида натрия насыщенный раствор. В коническую колбу
вместимостью 200 см3 вносят 26,4 г хлорида натрия и 100 см3 дис-
тиллированной воды температурой 25 °C. Содержимое колбы пере-
мешивают. Колбу закрывают пробкой и выдерживают при темпе-
ратуре 25 °C в течение нескольких часов. После этого содержимое
отфильтровывают.
17. Изотонический коэффициент (NaCl) для расчета осмоти-
ческого потенциала по уравнению Вант-Гоффа.
Таблица IV
Значение изотонического коэффициента I для растворов NaCl (20°С)
NaCl, М 1,0 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0,01
Z 1,62 1,64 1,66 1,68 1,70 1,73 1,75 1,78 1,83 1,93
Здесь i = 1 + а (п — 1), где а — степень диссоциации; п — число
ионов, на которое диссоциирует молекула.
18. Молекулярные массы веществ для расчета молярной и нор-
мальной концентраций растворов.
Таблица V
Молекулярные массы некоторых соединений
Вещество Молекулярная масса Вещество Молекулярная масса
Неорганические соли Кислоты
СаС12 • 6Н2О 219,09 НС1 36,47
Ca(NO3)2 164,10 HNO3 63,02
Са3(РО4)2 310,20 H2SO4 98,08
CaSO4 • 2Н2О 172 17 Н3РО4 98,00
128
Окончание табл.
Вещество Молекулярная масса Вещество Молекулярная масса
FeCl3 • 6Н2О 270,32 сн3соон 60,05
Fe3(PO4)2 357,51 Щелочи
KCNS (безводный) 97,17 KOH 56,10
КС1 74,55 NaOH 40,01
КН2РО4 136,09 nh4oh 35,05
к2нро4 174,18 Ba(OH)2 171,38
KNO3 101,10 Ca(OH)2 74,10
ВД 174,25 Органические вещества
MgCl2 • 6Н2О 203,33 Карбамид 60,06
MgSO4 • 7Н2О 246,49 Глюкоза 180,16
NaCl 58,45 Сахароза 342,30
NaH2PO4 119,99 Абсцизовая кислота 264,3
Na,HP04 • 2Н,0 2 4 2 178,01 Гибберелловая кислота 346,4
NaNO3 85,01
Na2SO2 • ЮН2О 322,21 Кинетин 215,2
nh4ci 53,50 ИУК 175,20
NH4MgPO4 137,34 имк 203,20
nh4no3 80,05 2,4-Дихлорфен- оксиуксусная кислота 221,00
(NH4)2SO4 132,14
Реактивы
1. Вазелиновое масло предотвращает испарение с поверхности
срезов.
2. Глицерин [С3Н5(ОН)3] употребляют для просветления времен-
ных препаратов (2 части глицерина, 1 часть воды), для сохранения
срезов, для приготовления глицерин-желатины и для других целей.
129
3. Иммерсионное масло — очищенное и сгущенное кедровое
масло (л = 1,515). Применяют для рассмотрения препаратов при
работе с объективом х90. Каплю иммерсионного масла помещают
между объективом и покровным стеклом препарата. Для удаления
иммерсионного масла с объективов и препаратов применяют бен-
зин или спирт.
4. Канадский бальзам — смола некоторых видов пихты, раство-
ренная в ксилоле до консистенций жидкого меда. Используют как
лучшую среду для приготовления постоянных препаратов.
5. Спирт абсолютный — обычный этиловый спирт-ректификат,
имеет крепость 96%. Некоторые опыты проводят с абсолютным
спиртом. Для его получения небольшое количество CuSO4-5H2O
тщательно растирают в ступке и прокаливают в фарфоровом тигле
до полного перехода синей окраски порошка в белую, что указы-
вает на обезвоживание медного купороса. После остывания тигля
(в эксикаторе) обезвоженный сульфид меди высыпают в склянку
со спиртом и плотно закрывают пробкой.
6. Дитизон — реактив на тяжелые металлы. 3 мг дитизона ра-
створяют в 6 мл ацетона, добавляют 2 мл Н2О и 1—2 капли ледя-
ной уксусной кислоты. Используют свежеприготовленный раствор.
Фиксирующие жидкости
1. Этанол 70—80 %-ный. Время фиксации 12 ч.
2. Уксусный алкоголь. Состав: 3 части абсолютного (или 96 %-
ного) этанола и 1 часть ледяной уксусной кислоты. Продолжи-
тельность фиксации от 2 до 12 ч, после чего материал промывают
тремя сменами 80 %-ного этанола.
3. Фиксатор Чемберлена. Состав: 50—70%-ного этанола — 90
частей, 40 %-ного формалина — 5 частей, ледяной уксусной кис-
лоты — 5 частей. Продолжительность фиксации 12—16 ч. В фикса-
торе можно хранить материал долгое время.
4. Фиксатор Карнуа. 96 %-ный этанол — 60 мл, хлороформ — 30
мл, ледяная уксусная кислота — 10 мл. Время фиксации 12 ч.
Красители
1. Нейтральный красный для прижизненного окрашивания кле-
ток. Сначала готовят концентрированный раствор, который мож-
но хранить. 0,1г нейтрального красного растворяют в 60 мл этано-
ла и добавляют воды до 100 мл. Для прижизненной окраски этот
раствор разбавляют перед употреблением водопроводной водой,
имеющей pH 7, в отношении 1:10000.
2. Сафранин. 2,5% раствор сафранина в 96%-ном этаноле —
10 мл; вода дистиллированная — 100 мл. В виде концентрирован-
ного водного раствора используется как реактив на лигнин. Сре-
130
зы помещают в каплю воды или глицерина и слегка подкрашива-
ют сафранином. Одревесневшие оболочки окрашиваются в крас-
ный цвет.
3. Судан III и Судан IV для окраски жиров кутина, суберина в
концентрации 0,5% в 96 %-ном этиловом спирте или концентрц-
рованной молочной кислоте.
4. Метиленовый синий. 6 г растворяют в 100 мл 96 %-ного эта-
нола. Навеску краски высыпают в склянку из темного стекла, за-
ливают спиртом и ставят в термостат при температуре 37 °C на 18—
24 ч, периодически встряхивая раствор. За это время большая часть
краски растворяется, на дне склянки остается небольшой осадок,
свидетельствующий о насыщении раствора. На основе насыщен-
ных растворов готовят водные растворы красок на дистиллирован-
ной воде, используя красители в соотношении: 1:100; 1:1000 (для
прижизненных препаратов и метода Шардакова, обнаружения
выделения О2 при фотосинтезе) или 1:10; 1:40 (для постоянных
препаратов).
5. Фуксин основной. 10 г краски растворяют в 100 мл 96 %-ного
этанола.
Кислотно-основные индикаторы
1. Метиловый красный для определения фотосенсибилизирую-
щей активности хлорофилла. Область перехода окраски индикато-
ра pH 4,2—6,2, навеску в 0,2 г растворяют в 60 мл 96 %-ного эта-
нола и добавляют воды до 100 мл.
2. Метиловый красный для титрования слабых оснований и амми-
ака. Водный раствор метилового красного окрашен в оранжевый
цвет. Несколько капель такого раствора окрашивают 50 —100 мл
воды в бледно-желтый цвет. Главное преимущество этого индика-
тора состоит в чрезвычайно резком переходе бледно-желтой ок-
раски в фиолетово-красную от одной капли соляной кислоты (без
промежуточных оттенков), которая почти обесцвечивается от од-
ной капли 0,1 гидроксида натрия. Для приготовления раствора ме-
тилового красного берут навеску 0,02 г и растворяют ее в 100 мл
горячей воды. По охлаждении раствора его фильтруют. На каждые
100 мл титруемого раствора берут 2—3 капли индикатора.
Способ приготовления и свойства отдельных индикаторов
(табл. VI).
Бумага
1. Фильтровальная. Употребляют для изготовления фильтров,
остатки нарезают размером примерно 2,5 х 2,5 см и используют для
удаления избытка воды и реактивов с временных препаратов и для
других целей.
2. Хлоркобальтовая. Фильтровальную бумагу или обеззоленные
тонкие фильтры помещают в течение минуты в кювету с раство-
131
Таблица VI
Характеристика некоторых кислотно-основных индикаторов
Индикатор Область перехода (интервал pH) Окраска Способ приготовления
кислотной формы щелочной формы
Крезоловый красный с массовой долей 0,1% 0,2—1,8 7,0-8,8 Красная Желтая Желтая Пурпурная 0,10 ±0,01 г индикатора растворяют в 100 см3 дистиллированной воды
Крезоловый пурпурный с массовой долей 0,1% 1,2-2,8 7,4-9,0 Красная Желтая Желтая Пурпурная 0,10 ±0,01 г индикатора растворяют в 100 см3 этанола
Метиловый красный с массовой долей 0,1 % 4,4-6,2 Красная Желтая 0,10 ±0,01 г индикатора растворяют в 100 см3 95%-ного этанола
Метиловый оранжевый с массовой долей 0,1% 3,1-4,4 Розовая Оранжево- желтая 0,10 ±0,01 г индикатора растворяют в 100 см3 дистиллированной воды
Нейтраль- ный красный с массовой долей 0,1% 6,8-8,0 Красная Желто - коричневая 0,10 ±0,01 г индикатора растворяют в 100 см3 96%-ного этанола
Тимол- фталеин с массовой долей 0,1% 9,3-10,5 Отсут- ствует Синяя 0,50 ± 0,01 г индикатора растворяют в 100 см3 96%-ного этанола
Фенол- фталеин с массовой долей 0,1% 8,0-9,6 Отсут- ствует Красная 0,10 ±0,01 г индикатора растворяют в 100 см3 96%-ного этанола
Азолитлин лакмус 5,0-8,0 Красная Синяя 0,50 ± 0,01 г индикатора растворяют в 100 см3 воды
132
ром хлорида кобальта, приготовленным по Камерлингу (в 100 мл
воды растворяют 67 г Co(NO3)2 + 264 г NaCl), а затем кусочки
бумаги высушивают в подвешенном состоянии на стеклянных па-
лочках до появления голубого цвета. Из бумаги вырезают кружоч-
ки диаметром 1 см и полиэтиленовой лентой с клейким слоем
приклеивают по две к подложке (стеклу, пластмассе, отмытой
фотопленке, полиэтиленовой пленке). Хранят подложки с хлор-
кобальтовой бумагой в эксикаторе над хлоридом.
3. Хроматографическая для разделения пигментов (табл. VII).
Таблица VII
Свойства хроматографической бумаги
Страна- изготовитель Марка и номер бумаги Плотность, мг/см2 Скорость впитывания воды, Мм/10 мин
Россия Германия Англия Б (№ 1, 2) М (№ 3, 4) Filtrak FN1 FN2 Ватман № 1 №2 №ЗММ 8,5 8,5-9,0 12,0-12,5 8,5-9,0 9,5-10,0 18,5 Быстрая Медленная 140-160 140-160 140—220 мин/30 см 200—300 мин/30 см 150—250 мин/30 см
Лабораторные материалы
1. Сердцевина бузины. Используют при изготовлении срезов с
помощью бритвы в качестве держателя нарезаемых объектов. Осе-
нью или зимой берут однолетние сильнорослые побеги и, осто-
рожно срезая ножом древесину, извлекают сердцевину. Кусочки
сердцевины диаметром 7—10 мм и длиной 2—3 см помещают в
колбу с водой, варят несколько часов. Затем переносят в банку с
притертой пробкой и наливают 60—80%-ный спирт, чтобы за-
крыть всю бузину. Хранить такую бузину можно очень длительное
время.
2. Кусочки пенопласта также используют в качестве держателя
нарезаемых объектов при изготовлении срезов.
3. Тушь для нанесения меток на растения. Тушь смешивают с
канцелярским клеем (1:1) или в 1 флаконе туши растворяют 1 ку-
сок сахара и тщательно размешивают.
4. Штемпельная краска используется для той же цели без разве-
дения.
133
Растения для опытов
1. Семена и проростки', пшеницы, ржи, ячменя, овса, кукуру-
зы, огурца, тыквы, кабачка, подсолнечника, гороха, фасоли, бо-
бов, горчицы, салата, тагетеса и др.
Семена хранят в банках с крышками и этикетками. Способы
выращивания проростков см. 1.2.
2. Корнеплоды', свеклы, моркови, редьки, репы, брюквы, клубни
картофеля, луковицы лука репчатого, тюльпанов, нарциссов, гиа-
цинтов и др.
3. Ветки кустарников и деревьев: ивы, березы, орешника, бузи-
ны, сирени, тополя, липы, дуба, яблони, вишни, сливы, дей-
ции, вейгеллы, форзиции, лиственницы, сосны, ели, пихты и др.
Ветки заготавливают в лесу, парке перед постановкой опыта.
4. Водные растения: элодея, валлиснерия, роголистник, ряска,
хара и др. Растения заготавливают осенью и содержат в аквариумах
или банках с водой на южном окне или с подсветом.
5. Комнатные растения: хлорофитум, традесканция, колеус, ге-
рань (зеленые и пестролистые формы), фуксия, бальзамин, сцин-
дапсус, плектрантус, традесканция кукурузолистная, гортензия,
амариллис, кливия, бегония, рео и др. Подавляющее большинство
этих растений нетребовательны к окружающей среде и легко вос-
производятся в условиях лаборатории. Использование этих расте-
ний подробно описано в практических работах.
ЛИТЕРАТУРА
Ашихмина Т.Я. Школьный экологический мониторинг. — М.,
2000.
Баславская С. С., Трубецкова О. М. Практикум по физиологии
растений. — М., 1964.
Buchanan В., Gruissem W., Jones R. Biochemistry and Molecular
biology of Plants. Amer. Soc. of Phisiol. — Rockwill: Maryland, 2000.
Валыпер О. А., Пиневич Л. M., Варасов Н. Н. Практикум по физио-
логии растений с основами биохимии. — М.; Л., 1957.
Васильева 3. К., Кириллова Г. А., Строчкова А. В. Учеб, пособие по
физиологии растений. — М., 1977.
Викторов Д. П. Малый практикум по физиологии растений. —
М., 1983.
Водный обмен растений / В.Н.Жолкевич и др. — М., 1989.
ГэлстонА., Девис П., Сэттер Р. Жизнь зеленого растения. — М.,
1983.
Давыдов В. А. Простой метод получения эпидермальных отпе-
чатков с помощью оргстекла и клейкой ленты // Ботанический
журнал. — 1993. — № 7.
Живухина Г.М. Практические занятия по физиологии расте-
ний. — М., 1971.
Живухина Е.А. Методическое пособие к летнему практикуму по
физиологии растений. Раздел «Водный режим». — М., 1998.
Клейн Р.М., КлейнД.Т. Методы исследования растений. — М., 1974.
Лархер В. Экология растений. — М., 1978.
Лосев А. С., Петров-Спиридонов А.Е. Устойчивость растений к
неблагоприятным факторам среды: Учеб, пособие. — М., 1985.
Малый практикум по физиологии растений: Учеб, пособие /
Под ред. М. В. Гусева. — М., 1982.
Малый практикум по физиологии растений: Учеб, пособие /
Под ред. акад. А. Т. Мокроносова. — М., 1994.
Максимов КА. Краткий курс физиологии растений. — М., 1958.
Малюгин Н. И. Выгонка веток декоративных растений // Цвето-
водство. — 1980. — № 1.
Методы биотестирования качества водной среды / Под ред.
О.Ф.Филенко. — М., 1989.
Миттлайдер Дж. Здоровые овощи по методу д-ра Миттлайде-
ра. — Поселок Заокский Тульской обл., 1993.
Михалевская О. Б. Практикум по физиологии растительных кле-
ток. - М., 1975.
135
Окружающая среда.: Энциклопедический словарь: В 2 т. / Пер. с
нем. — М., 1999.
Полевой В. В. Физиология растений. — М., 1989.
Практикум по биохимии растений / Под ред. В. В. Полевого и
С.М.Щипарева. - СПб., 1996.
Практикум по физиологии растений / Ф.Д.Сказкин и др. —
М., 1958.
Практикум по физиологии растений / Под ред. Н. Н. Третьяко-
ва. — М., 1990.
Практикум по фотосинтезу и дыханию растений / Под ред.
В. В. Полевого и Т. В.Чирковой. — СПб., 1997.
Признаки голодания растений / Под ред. Б. Бэра и Р. Колма-
на. - М., 1957.
Программа по специальности 032400 Биология. — М., 1999.
Сабинин Д. А. Физиологические основы питания растений. — М.,
1955.
Сабинин Д. А. Физиология развития растений. — М., 1963.
Серегин И. В., Иванов В. Б. Гистохимические методы изучения
распределения кадмия и свинца в растениях // Физиология расте-
ний. - 1997. - Т. 44. - № 6.
Справочник биохимика / Р. Досон и др. — М., 1991.
Фотосинтез и биопродуктивность: Методы определения / Под
ред. А. Т. Мокроносова, А. Г. Ковалева. — М., 1989.
Якушкина Н.И. Физиология растений. — М., 1993.
СОДЕРЖАНИЕ
() г авторов.............................................. 3
1. МЕТОДЫ ИССЛЕДОВАНИЯ.....................................4
1.1. Однородность пробы....................................4
1.2. Выращивание проростков растений.......................4
1.3. Варианты и повторности................................5
1.4. Измерение длины и площади.............................5
1.5. Определение массы.....................................7
1.6. Инфильтрация тканей...................................7
2. ФИЗИОЛОГИЯ КЛЕТКИ.......................................8
2.1. Движение цитоплазмы...................................8
2.1.1. Наблюдение за движением цитоплазмы у разных объектов .... 9
2.1.2. Определение скорости движения цитоплазмы........10
2.2. Свойства клеточных мембран.............................11
2.2.1. Сравнение проницаемости мембран живых и мертвых
клеток................................................12
2.2.2. Сравнение проницаемости клеточных мембран
для различных веществ. Стойкий и временный плазмолиз...13
2.2.3. Влияние ионов калия и кальция на форму плазмолиза.13
2.2.4. Наблюдение колпачкового плазмолиза в растворах нитрата
калия и роданида калия................................14
2.3. Выявление живых и мертвых клеток.....................15
2.3.1. Окрашивание живых и мертвых клеток нейтральным
красным...............................................16
2.3.2. Окрашивание живых и мертвых клеток кислым фуксином .... 17
2.3.3. Использование солей тетразолия для выявления живых
и мертвых клеток......................................17
3. ВОДНЫЙ ОБМЕН...........................................18
3.1. Растительная клетка как осмотическая система.........18
3.1.1. Явление осмоса. Перемещение воды по градиенту водного
потенциала в искусственной «клеточке» Траубе..........19
3.1.2. Явление плазмолиза и деплазмолиза...............20
3.1.3. Тургор растительной клетки. Поглощение воды и ее выход
из клеток корнеплода моркови........................ 21
3.2. Определение водного потенциала растительных тканей...22
3.2.1. Определение величины осмотического потенциала в клетках
растительной ткани плазмолитическим методом...........22
137
3.2.2. Определение водного потенциала растительных тканей
методом Уршпрунга (по изменению длины брусочков ткани).... 24
3.2.3. Определение водного потенциала растительных тканей
по изменению концентрации внешнего раствора
(по Шардакову).....................................25
3.3. Наблюдение за движением устьиц........................27
4. ФОТОСИНТЕЗ..............................................28
4.1. Пигменты фотосинтеза и их свойства....................28
4.1.1. Получение спиртовой вытяжки из листьев...........29
4.1.2. Омыление хлорофилла щелочью......................30
4.1.3. Получение феофитина и обратное замещение в нем
водорода атомом металла.................................31
4.2. Разделение смеси фотосинтетических пигментов..........32
4.2.1. Метод Крауса.....................................33
4.2.2. Метод Цвета......................................33
4.2.3. Метод хроматографии на бумаге....................35
4.3. Оптические свойства пигментов зеленого листа..........37
4.3.1. Спектры поглощения пигментов листа...............38
4.3.2. Влияние концентрации пигментов на ширину полос
поглощения..............................................38
4.3.3. Влияние связи хлорофилла с белком на смещение полос
поглощения в красной области спектра....................39
4.4. Фотохимическая активность хлорофилла..................40
4.4.1. Наблюдение флуоресценции хлорофилла..............40
4.4.2. Демонстрация фотосенсибилизирующей активности
хлорофилла в модельном опыте............................41
4.5. Обнаружение процесса фотосинтеза......................43
4.5.1. Выделение кислорода водными растениями...........44
4.5.2. Обнаружение выделенного при фотосинтезе О2
с помощью метиленового синего...........................45
4.5.3. Всплывание на свету инфильтрированных дисков
из листьев..............................................45
4.5.4. Изменение окраски крезолового красного
при поглощении листом СО2...............................46
4.5.5. Получение отпечатков на листьях с помощью
крахмальной пробы.......................................47
4.6. Зависимость интенсивности фотосинтеза от освещенности
листьев.....................................................49
4.7. Накопление первичного (ассимиляционного) крахмала
в клетках листьев С3- и С4-растений.........................51
5. ДЫХАНИЕ.................................................52
5.1. Обнаружение дыхания растений..........................52
5.2. Определение интенсивности дыхания в чашках Конвея.....54
5.3. Определение дыхательного коэффициента.................55
138
5.4. Изучение ферментных систем дыхания......................57
5.4.1. Качественная реакция с тетразолием на общую
дегидрогеназную активность тканей......................58
5.4.2. Количественное определение активности дегидрогеназ.60
5.4.3. Определение активности каталазы....................61
6. РОСТ РАСТЕНИЙ.............................................61
6.1. Определение скорости роста корня........................61
6.2. Влияние фитогормонов на рост растений...................63
6.2.1. Влияние ауксина на рост растяжением отрезков
колеоптилей злаков.....................................64
6.2.2. Влияние гиббереллина на рост карликовых сортов растений ....65
6.2.3. Влияние цитокининов на старение изолированных
органов растений.......................................67
6.2.4. Влияние цитокинина, гиббереллина и абсцизовой
кислоты на рост изолированных семядолей огурца.........67
6.2.5. Изменение анатомии семядолей огурца под влиянием
цитокинина.............................................69
6.2.6. Изменение анатомии семядолей огурца под влиянием
абсцизовой кислоты.....................................71
6.3. Состояние покоя.........................................72
6.3.1. Глубина покоя в зимний период у разных видов древесных
и кустарниковых растений...............................72
6.3.2. Глубина покоя у генеративных и вегетативных почек
одного и того же вида растений.........................74
6.3.3. Выведение из состояния покоя побегов древесных
растений...............................................75
6.4. Движения растений.......................................79
6.4.1. Фототропизм побега или его частей..................80
6.4.2. Определение места восприятия светового раздражения
у проростков злака.....................................80
6.4.3. Обнаружение отрицательного геотропизма у побегов
и их частей............................................81
6.4.4. Обнаружение положительного геотропизма у корня.....82
6.4.5. Определение места восприятия силы земного притяжения
у корня................................................83
6.4.6. Настические изгибы черешков листьев гортензии
под влиянием ауксина...................................84
6.4.7. Наблюдение за движением устьиц при воздействии
абсцизовой кислоты, света и темноты....................84
7. МИНЕРАЛЬНОЕ ПИТАНИЕ РАСТЕНИЙ..............................86
7.1. Определение содержания золы в разных частях растений....86
7.2. Микрохимический анализ золы растений....................88
7.3. Антагонизм ионов........................................93
7.4. Диагностика заболеваний растений при голодании
по элементам минерального питания..........................94
139
8. УСТОЙЧИВОСТЬ РАСТЕНИЙ К ЭКСТРЕМАЛЬНЫМ
ВОЗДЕЙСТВИЯМ..............................................97
8.1. Методы определения устойчивости к разным факторам среды.97
8.1.1. Определение устойчивости тканей листьев растений
к высоким температурам................................97
8.1.2. Определение солеустойчивости злаков по всхожести
их семян..............................................98
8.1.3. Влияние засоления на степень «выцветания» хлорофилла.98
8.2. Защитное действие криопротекторов на клетки растения
при их замораживании.....................................100
8.2.1. Превращение запасных веществ в побегах древесных
растений..............................................100
8.2.2. Действие криопротекторов на жизнеспособность
клеток растительных тканей при замораживании.........102
9. ЭКОЛОГИЧЕСКИЙ МОНИТОРИНГ. РАСТЕНИЯ
КАК ИНДИКАТОРЫ СРЕДЫ.....................................103
9.1. Определение степени экологического загрязнения различных
субстратов с помощью биотеста на проростках..............103
9.2. Обнаружение тяжелых металлов в растениях гистохимическим
методом..................................................105
9.3. Обнаружение нитратов в растениях.........................107
ПРИЛОЖЕНИЯ....................................................114
Техника лабораторных работ....................................114
Требования к помещению лаборатории и технике
безопасности......................................114
Химическая посуда..........................................115
Правила приготовления растворов щелочей и кислот...........119
Весы и взвешивание.........................................119
Фильтрование...............................................120
Статистическая обработка данных...............................121
Приготовление некоторых растворов, реактивов, красителей,
индикаторов и т.д.....................................125
Растения для опытов...........................................134
Литература....................................................135
Учебное издание
Иванов Виктор Борисович,
Плотникова Инна Васильевна,
Живухина Елена Александровна и др.
Практикум по физиологии растений
Учебное пособие
Редактор А. П. Сашина
Технический редактор Е. Ф. Коржуева
Компьютерная верстка: И. В. Земскова
Корректоры В. И. Хомутова, Э. Г. Юрга
Диапозитивы предоставлены издательством.
Подписано в печать 30.03.2001. Формат 60x90/16. Бумага тип. № 2. Печать офсетная.
Усл. печ. л. 9,0. Тираж 30 000 экз. (1-й завод 1 -5 500 экз.). Заказ № 338.
Лицензия ИД № 02025 от 13.06.2000. Издательский центр «Академия».
105043, Москва, ул. 8-я Парковая, 25. Тел./факс (095)165-4666, 367-0798, 305-2387.
Отпечатано на Саратовском полиграфическом комбинате.
410004, г.Саратов, ул.Чернышевского, 59.