Author: Блохина Н.И. Блохин И.В.
Tags: неорганическая химия общая и неорганическая химия химия задачи по химии
ISBN: 978-5-4499
Year: 2020
Text
Н. И. Блохина, И. В. Блохин
Неорганическая химия
в цепочках превращений,
задачах и тестах
Пособие для учащихся 9–11 классов школ,
лицеев и гимназий с углубленным изучением химии
Москва
Берлин
2020
УДК 546(075)
ББК 24.1я721
Б70
Блохина, Н. И.
Б70
Неорганическая химия в цепочках превращений, зада-
чах и тестах / Н. И . Блохина, И. В . Блохин.
—
Москва :
Берлин : Директ-Медиа, 2020. — 1 12 с.
ISBN 978-5-4499 -1745-4
Пособие составлено в соответствии с программой по химии
базового и углубленного уровня. В него включены цепочки превра-
щений, задачи, упражнения и тесты по неорганической химии, поз-
воляющие систематизировать, углубить и оценить знания учащихся.
В настоящий сборник включены задачи разного типа и уровня слож-
ности. Издание может быть полезно как при проведении факульта-
тивных занятий, так и при подготовке к экзаменам в вузы.
УДК 546(075)
ББК 24.1я721
ISBN 978-5-4499-1745-4
© Блохина Н. И., Блохин И. В., текст, 2020
© Издательство «Директ-Медиа», оформление, 2020
Оглавление
1. Водород ................................................................................................................................. 5
1.1. Упражнения и задачи........................................................................................ 5
1.2. Тестовые задания по теме «Водород» .................................................... 9
2. Галогены ............................................................................................................................12
2.1. Упражнения и задачи......................................................................................12
2.2. Тестовые задания по теме «Галогены» ................................................15
3. Халькогены .......................................................................................................................18
3.1. Упражнения и задачи......................................................................................18
3.2. Тестовые задания по теме «Кислород»...............................................23
3.3. Тестовые задания по теме «Сера» ..........................................................24
4. Подгруппа азота.............................................................................................................27
4.1. Упражнения и задачи......................................................................................27
4.2. Тестовые задания по теме «Азот. Аммиак» ......................................32
4.3. Тестовые задания по теме «Оксиды азота.
Азотная кислота».......................................................................................................34
4.4. Тестовые задания по теме «Фосфор» ....................................................36
5. Подгруппа углерода.....................................................................................................39
5.1. Упражнения и задачи......................................................................................39
5.2. Тестовые задания по теме «Углерод» ...................................................42
5.3. Тестовые задания по теме «Кремний» .................................................44
6. Металлы IA и IIА групп ..............................................................................................47
6.1. Упражнения и задачи......................................................................................47
6.2. Тестовые задания по теме «Щелочные металлы».........................51
6.3. Тестовые задания
по теме «Щелочноземельные металлы»......................................................53
7. Алюминий и его соединения..................................................................................55
7.1. Упражнения и задачи......................................................................................55
7.2. Тестовые задания по теме «Алюминий
и его соединения» .....................................................................................................59
8. Железо и его соединения .........................................................................................62
8.1. Упражнения и задачи......................................................................................62
8.2. Тестовые задания по теме «Железо и его соединения».............67
9. Хром и его соединения...............................................................................................69
9.1. Упражнения и задачи......................................................................................69
9.2. Тестовые задания по теме «Хром и его соединения» ..................72
10. Цинк. Медь. Серебро .................................................................................................74
10.1. Упражнения и задачи ...................................................................................74
10.2. Тестовые задания по теме «Цинк. Медь. Серебро» .....................79
11. Марганец и его соединения..................................................................................81
11.1. Упражнения и задачи ...................................................................................81
11.2. Тестовые задания по теме «Марганец и его соединения» .....83
Приложение 1. Периодическая система
химических элементов Д. И . Менделеева.............................................................86
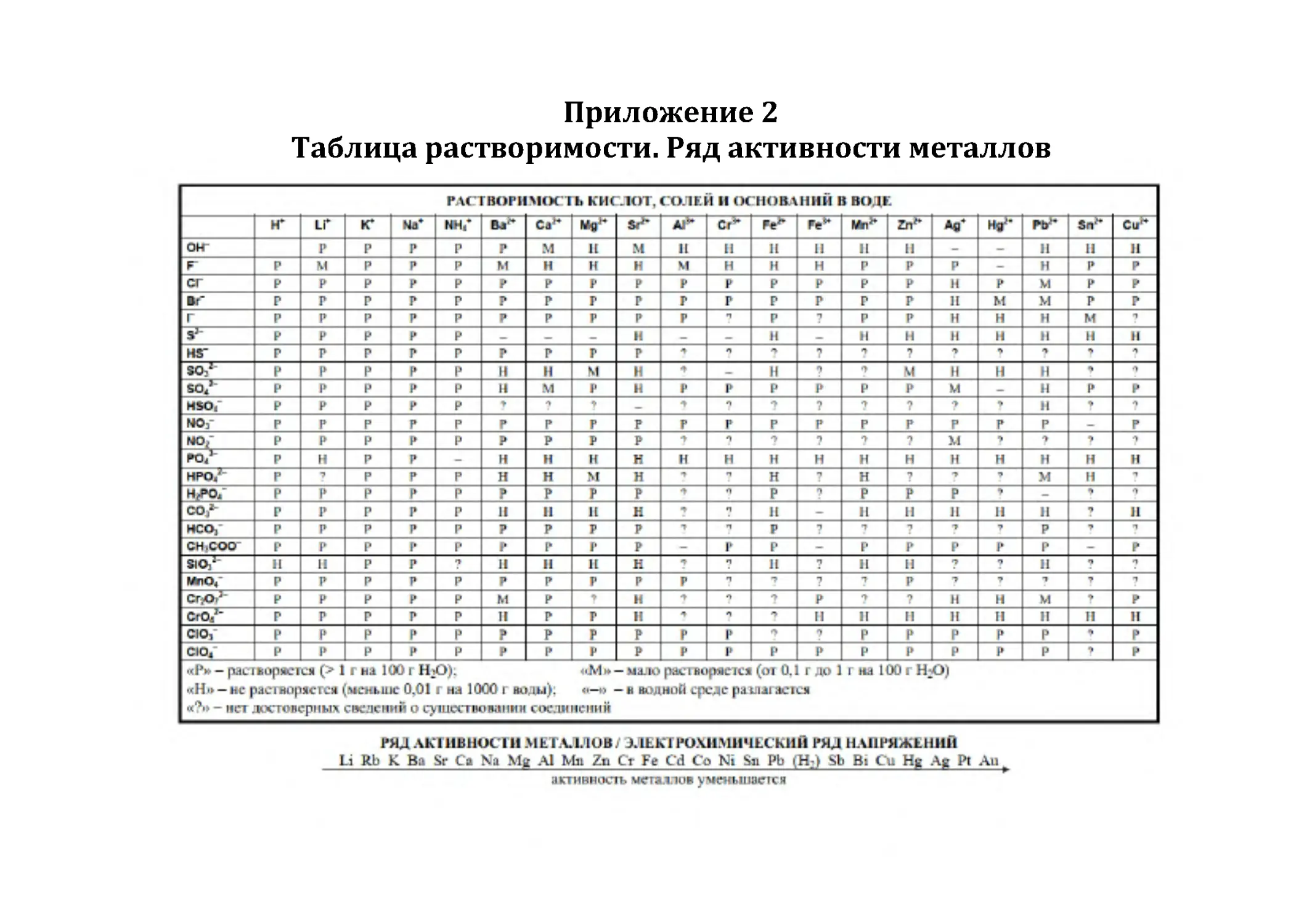
Приложение 2. Таблица растворимости.
Ряд активности металлов .............................................................................................87
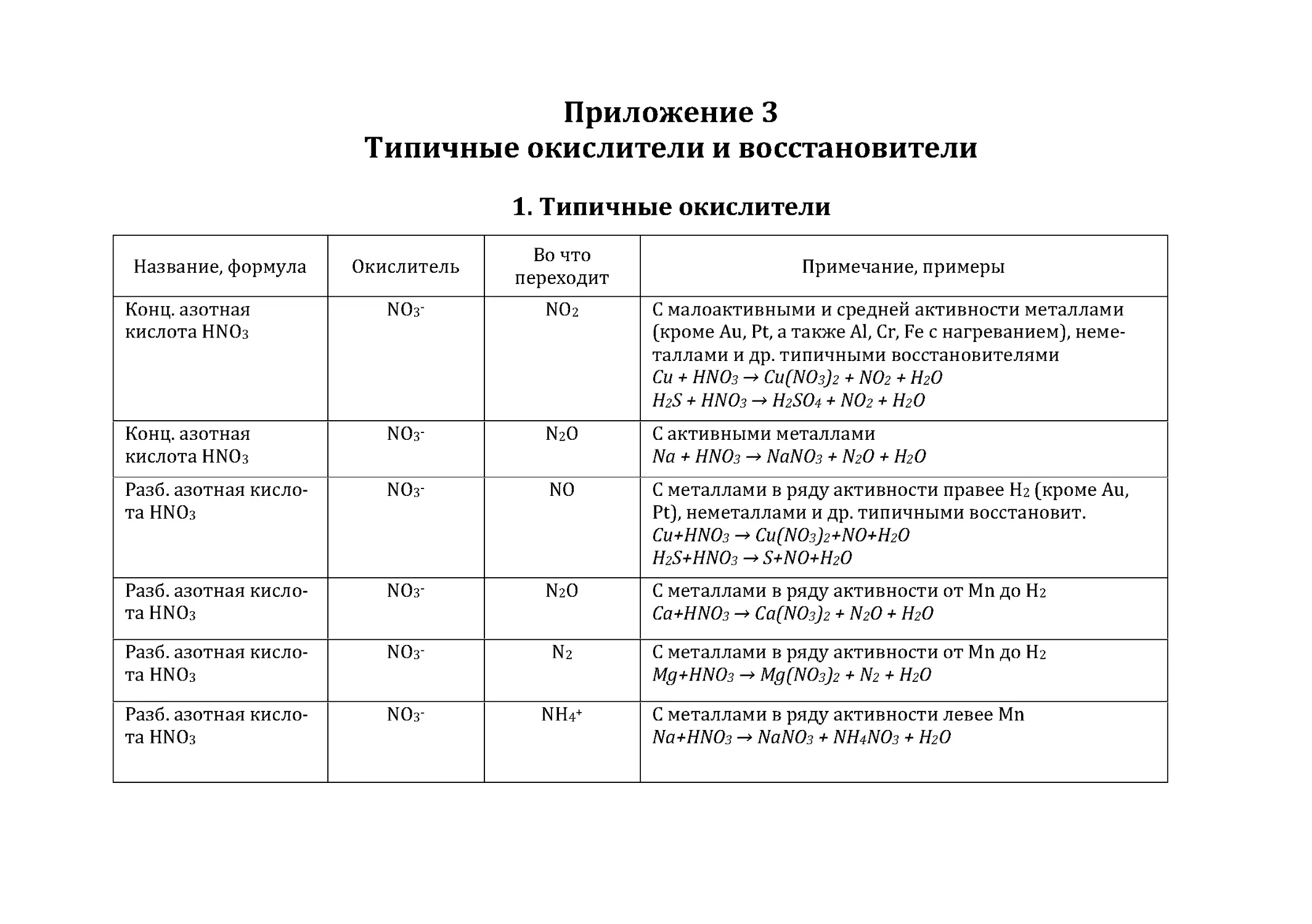
Приложение 3. Типичные окислители и восстановители .........................88
1. Типичные окислители .......................................................................................88
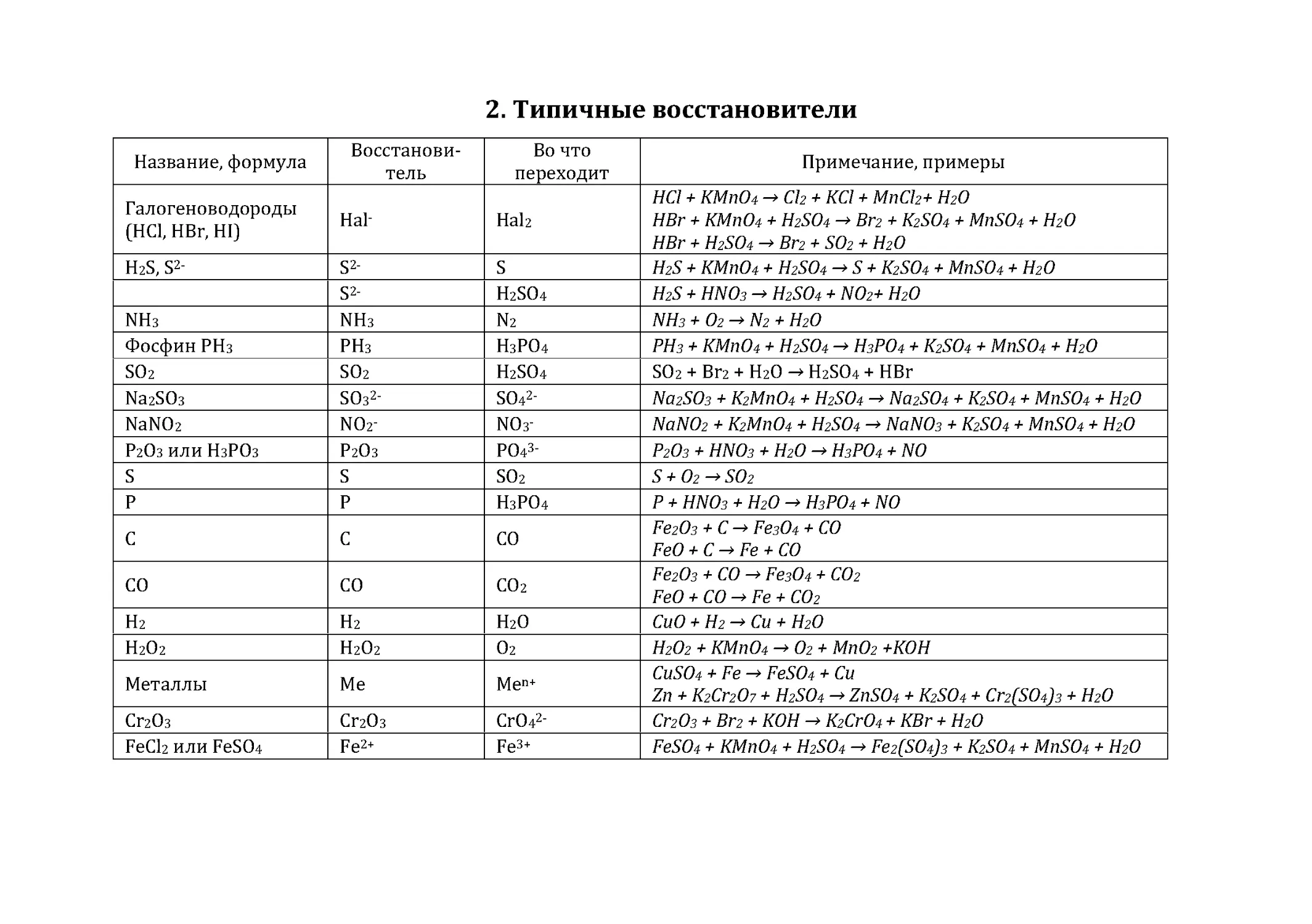
2. Типичные восстановители..............................................................................91
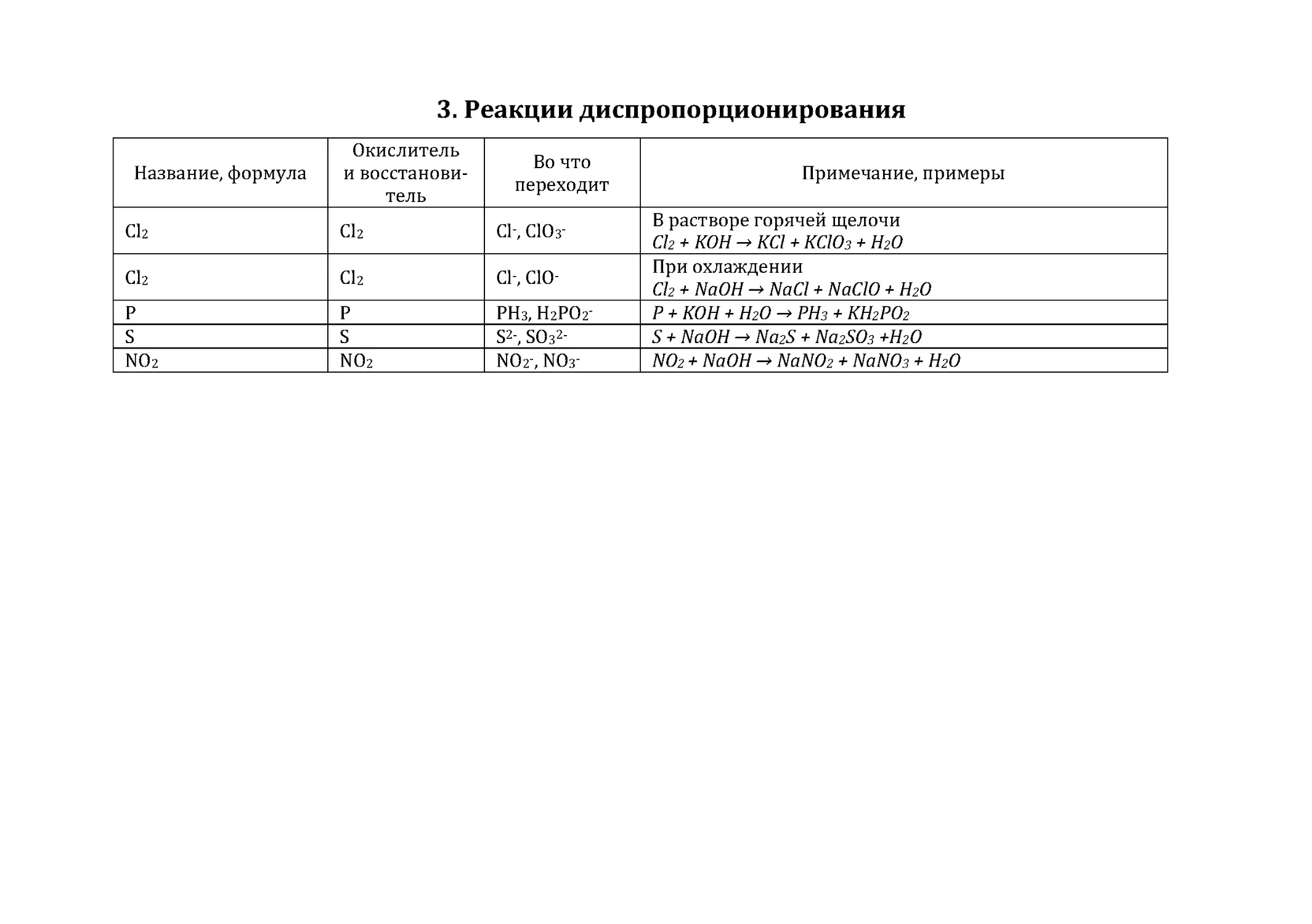
3. Реакции диспропорционирования .............................................................92
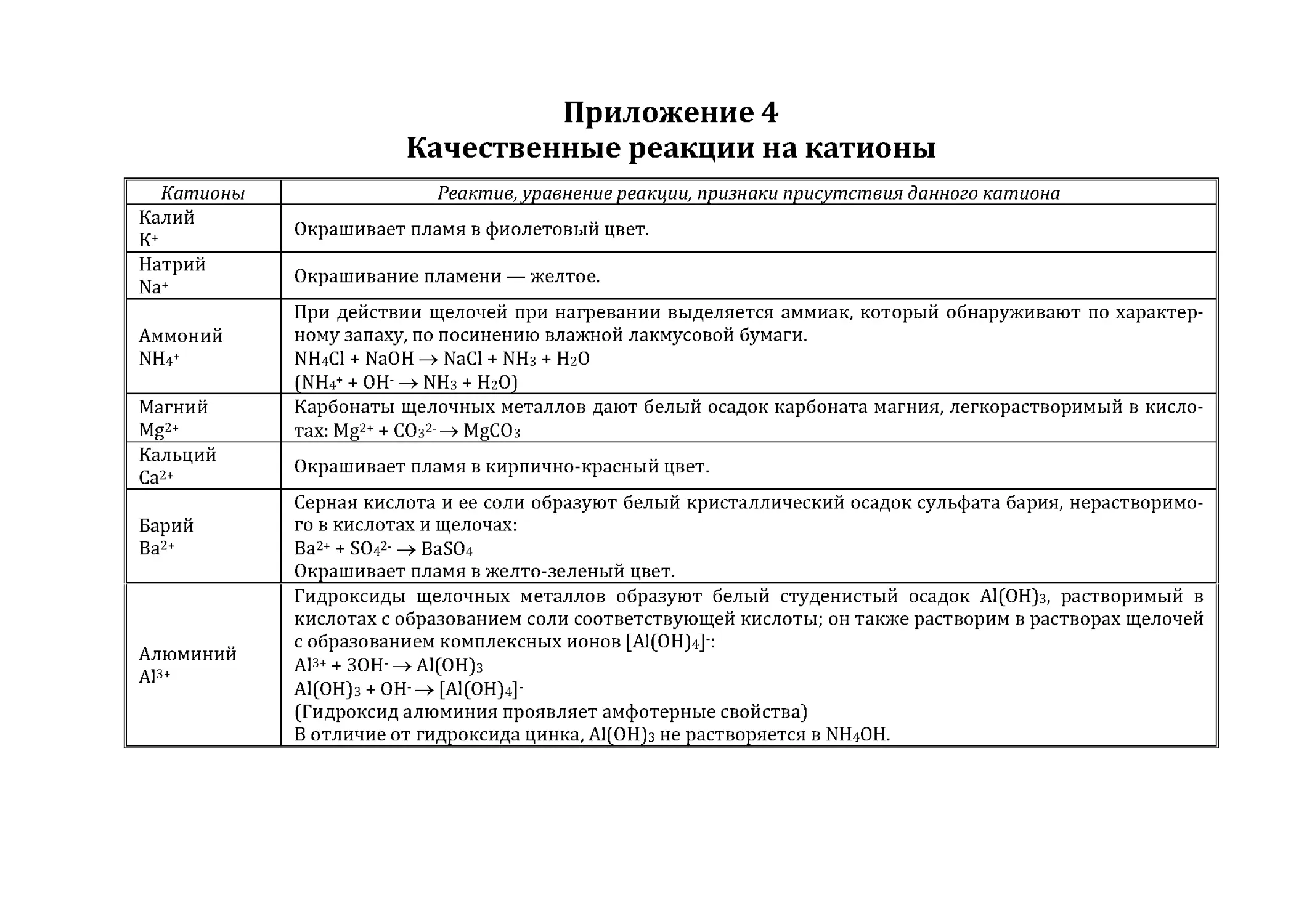
Приложение 4. Качественные реакции на катионы......................................93
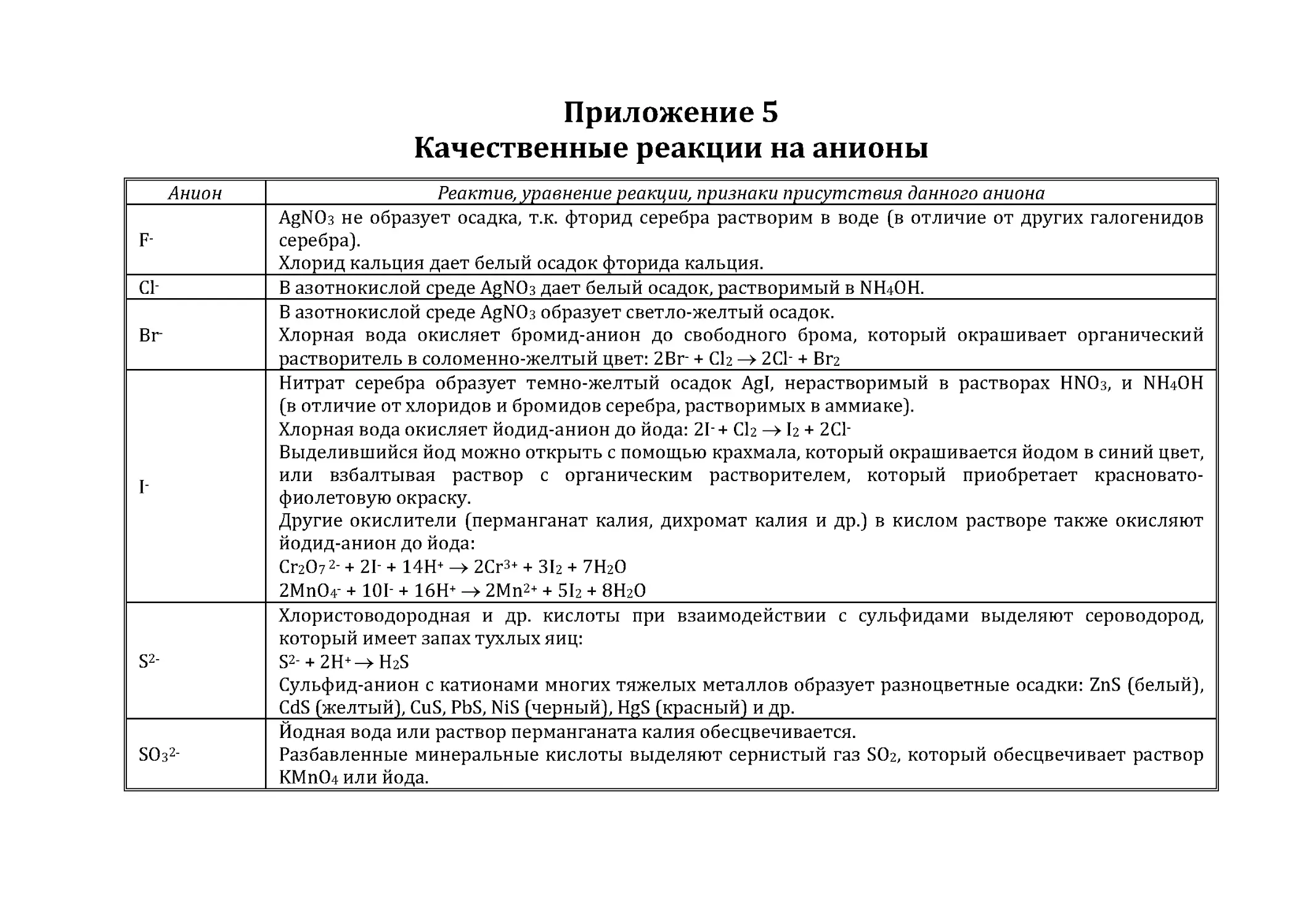
Приложение 5. Качественные реакции на анионы ........................................95
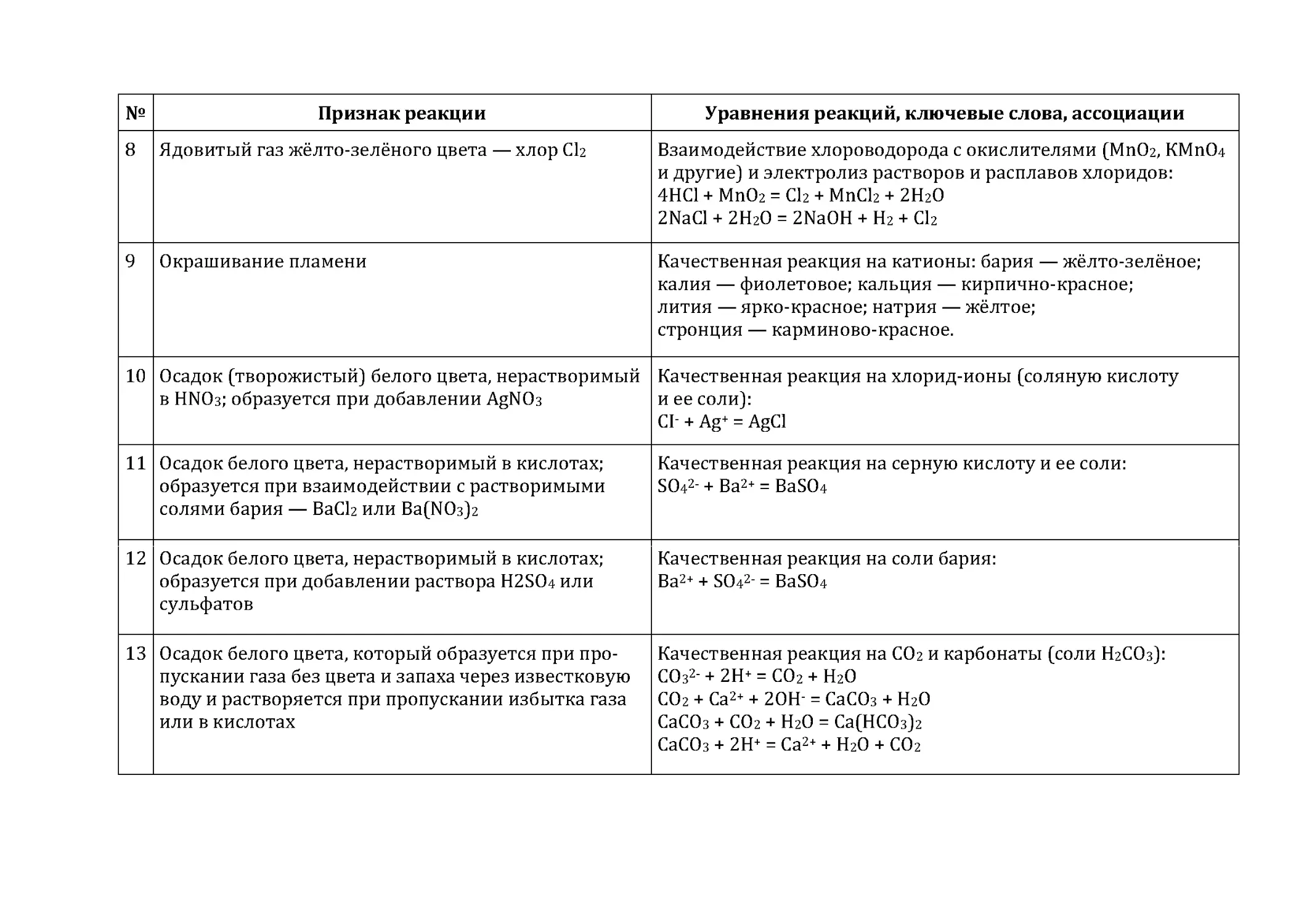
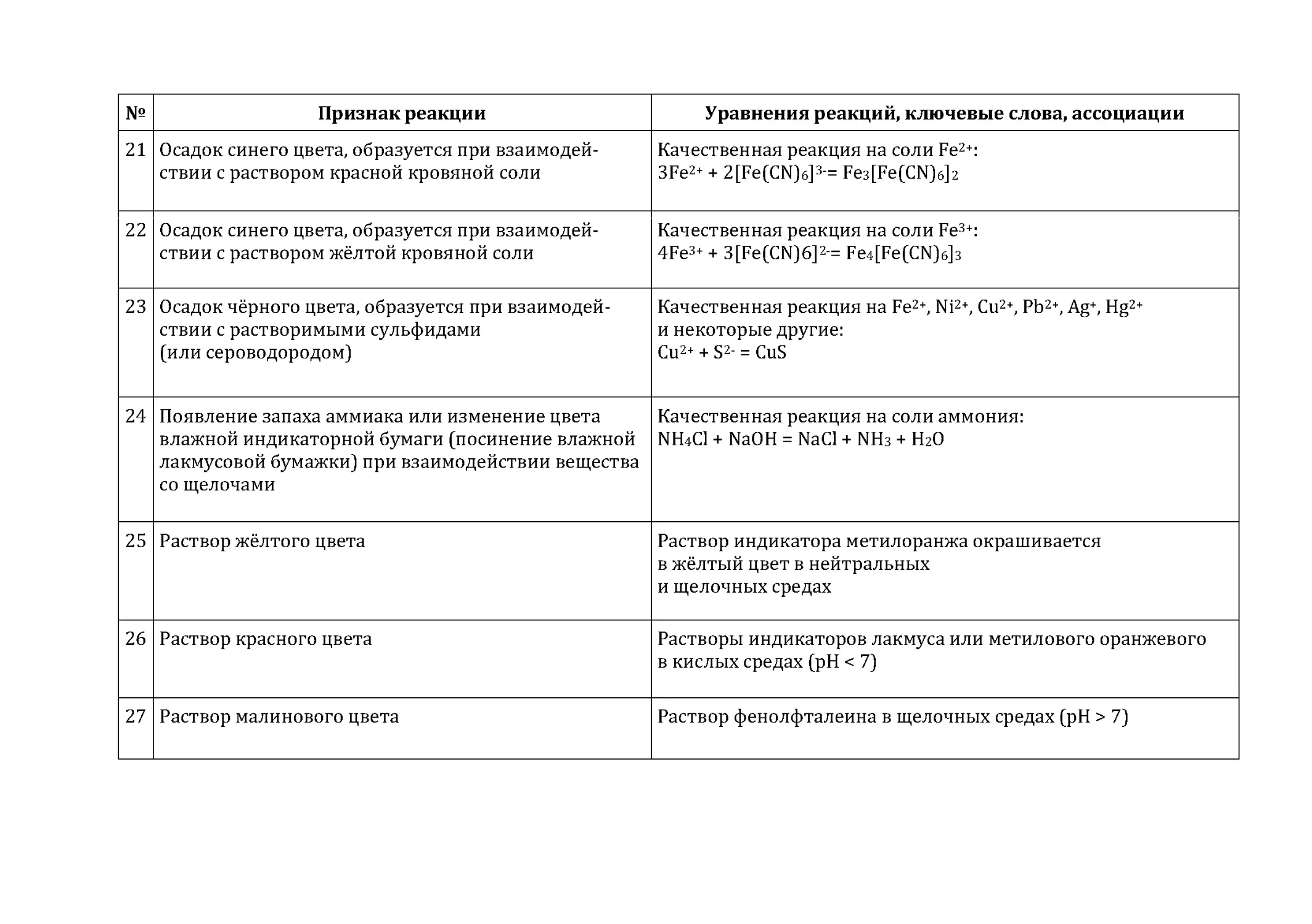
Приложение 6. Некоторые качественные реакции
неорганических соединений и изменения,
сопровождающие химические превращения ....................................................97
Приложение 7. Словарь тривиальных названий.......................................... 103
Ответы к тестам ............................................................................................................... 105
1. Водород
1.1 . Упражнения и задачи
1. Напишите уравнения реакций, протекающих по следу-
ющим схемам:
а)H2O→NaOH→H2→NH3→H2O;
б)H2O→H2S→SO2→NaHSO3→H2O;
в)K→KH→H2→H2O→H2;
г) СаH2 → Сa(OH)2 → СаСО3 → CaO → Сa(OH)2 → Са(НСО3)2;
д)KОН→H2→NH3→NH4Cl→NH3→N2.
2. Напишите по одному уравнению реакции водорода с:
а) металлом,
б) неметаллом,
в) оксидом металла,
г) оксидом неметалла,
д) солью,
е) органическим веществом.
3. Закончите уравнения реакций и расставьте коэффици-
енты:
а)H2O2+H2S→...;
б)H2O2+PbS→...;
в)H2O2+HIO3→...;
г) H2O2 + Ca(OCl)2 → ...;
д) H2O2 + СаОСl2 → ...;
е) H2O2 + Cr(NO3)3 + KOH → ...;
ж)H2O2+Ag2O→...;
з)H2O2+H2SO4+KMnO4→...;
и)H2O2+CrBr3+NaOH→...;
к) H2O2 + Fe(OH)2 → ...;
л)H2O2+KI+H2SO4→...;
м)H2O2+NaCrO2+NaOH→...;
н) H2O2 + Hg(NO3)2 + NaOH → ...;
о)H2O2+AgNO3+NH4OH→...;
п) H2O2 + K2Cr2O7 + H2SO4 → ...
4. Напишите по два уравнения реакций воды с предста-
вителями разных классов неорганических соединений:
а) металлами,
б) неметаллами,
5
в) основными оксидами,
г) кислотными оксидами,
д) солями.
5. Напишите по одному уравнению реакции воды с пред-
ставителями разных классов органических соединений:
а) алкеном,
б) алкином,
в) хлоралканом,
г) сложным эфиром,
д) дисахаридом,
е) дипептидом.
6. Приведите по одному примеру следующих реакций во-
ды с солями:
а) частичного гидролиза с образованием кислой среды,
б) частичного гидролиза с образованием щелочной среды,
в) полного гидролиза,
г) образования кристаллогидрата.
7. Приведите по одному уравнению реакций, в которых
пероксид водорода:
а) является окислителем,
б) является восстановителем,
в) диспропорционирует.
8. Приведите по одному уравнению реакций пероксида
водорода с:
а) оксидом,
б) кислотой,
в) солью,
г) основанием.
9. В солнечной атмосфере содержится 82 % водорода-1 и
18 % гелия-4 (по числу атомов). Рассчитайте массовую долю
атомарного водорода в атмосфере Солнца.
10. Имеется бесцветное кристаллическое вещество. Бу-
дучи нагрето на воздухе, оно воспламеняется и сгорает с обра-
зованием воды и оксида, который, растворяясь в воде, даёт
щелочную реакцию. Это бесцветное вещество бурно реагирует
с водой с выделением легкого газа и полученный при этом
раствор имеет щелочную реакцию. Если через этот раствор
пропустить оксид углерода (IV), то сначала выделяется осадок,
а затем он пропадает. Какое это вещество? Написать уравнения
всех протекающих реакций.
6
11. Бесцветный газ А с резким запахом хорошо растворя-
ется в воде. При действии цинка на водный раствор этого газа
выделяется горючий газ В, который при пропускании над
твердым веществом С черного цвета превращает его в простое
вещество красного цвета. Что представляют собой вещества А,
В и С? Напишите уравнения всех реакций.
12. Установите формулу гидрида, который содержит
25 % водорода по массе. Чему будет равна массовая доля водо-
рода в этом соединении, если все атомы протия заменить на
атомы трития?
13. Массовая доля водорода в химическом соединении,
содержащем водород и неизвестный химический элемент (А),
равна 5,88 %. Определите химический элемент А. Степень
окисления А в данном соединении равна ‒2.
14. Во сколько раз масса кислорода в воде больше массы
водорода? Зависит ли ответ от количества воды?
15. Определите относительную плотность по воздуху га-
зовой смеси, состоящей из водорода, азота и аммиака, массо-
вые доли которых соответственно равны 5, 50 и 45 %.
16. Какую массу гидрида кальция следует обработать во-
дой, чтобы полученным водородом можно было полностью
восстановить до железа оксид железа (II, III) массой 6,96 г.
17. Водород, полученный в результате термического раз-
ложения гидрида кальция массой 2,1 г, пропустили над раска-
ленным оксидом меди (II) массой 8 г. Определите массовые
доли веществ в твердом остатке.
18. При растворении металла массой 15,64 г (в соедине-
ниях металл образует однозарядные катионы) в 100 мл воды
выделилось 4,48 л (н. у.) водорода. Определите природу метал-
ла и массовую долю электролита в полученном растворе.
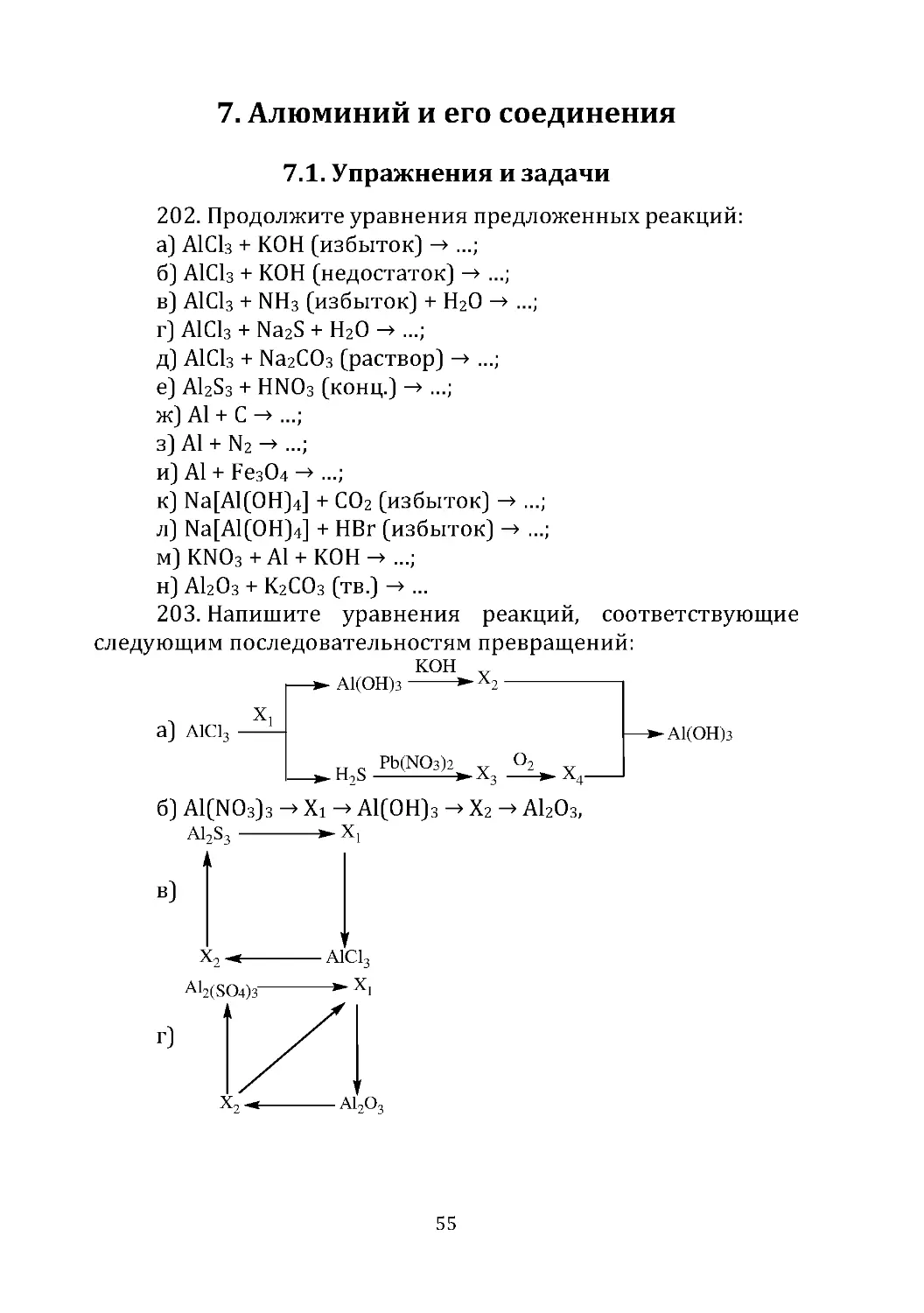
19. Газ, выделившийся при обработке водой гидрида
кальция, пропустили над раскаленным оксидом железа (II).
В результате реакции произошло уменьшение массы на 16 г.
Сколько граммов гидрида кальция обработали водой?
20. Вычислите массовую долю едкого натра в растворе,
полученном при взаимодействии 2,3 г натрия с 28,2 мл воды.
Какой объем (н. у.) займет выделившийся газ? Сколько мл
20 %-ной серной кислоты (ρ = 1,14 г/мл) необходимо взять для
нейтрализации 8 г полученного раствора?
7
21. Водород, образовавшийся при действии избытка же-
леза на 100 мл соляной кислоты, пропустили через трубку с
раскаленным оксидом меди (II). Масса трубки после реакции
уменьшилась на 2 г. Вычислите молярную концентрацию
хлороводорода в исходном растворе.
22. Газ, полученный при взаимодействии железа массой
2,24 г и соляной кислоты объемом 77,68 мл с массовой долей
хлороводорода 7,3 % (ρ = 1,03 г/мл), пропущен через трубку,
содержащую оксид меди (II) массой 6,4 г при нагревании. Ка-
кие вещества находятся в трубке после реакции и какой объем
раствора азотной кислоты с ω(НNO3) = 32 % (ρ = 1,2 г/мл) ну-
жен для их растворения.
23. Над смесью оксидов железа (II) и меди (II) пропустили
избыток водорода при нагревании. В результате реакции масса
твердого остатка оказалась на 1,6 г меньше суммарной массы
оксидов. Найдите массы оксидов в их исходной смеси, если
известно, что в ней на один атом меди приходится 3 атома
кислорода.
24. Какую массу водорода по методу Боша можно полу-
чить из 6 т кокса, содержащего 95 % углерода, и воды, взятой в
избытке? В этом процессе водяной пар пропускают над раска-
ленным коксом. В результате реакции образуются Н2 и СО.
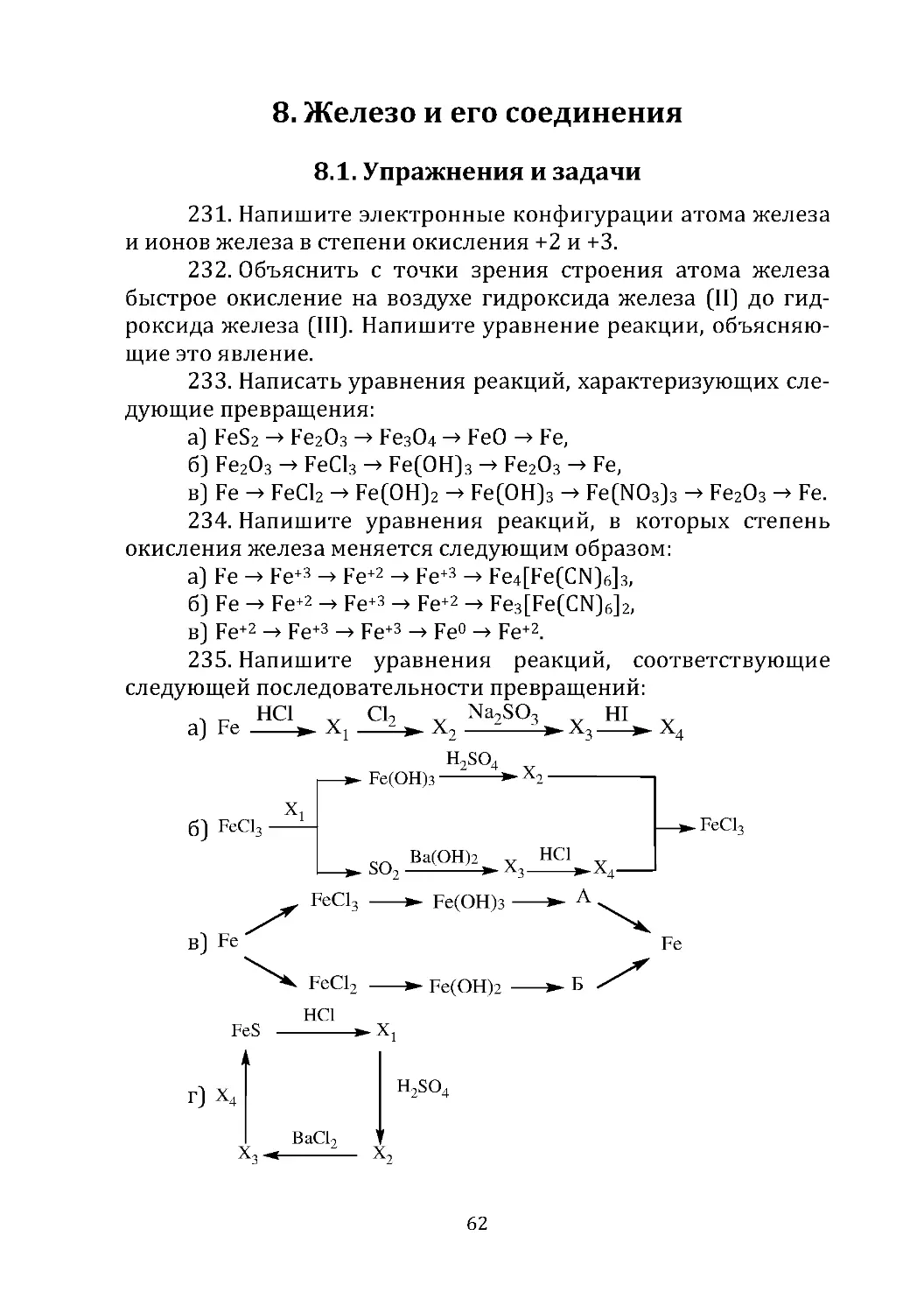
Затем к смеси добавляют новую порцию пара и пропускают ее
над катализатором (Fe2O3) при 450 °С, в результате этого СО
реагирует с Н2О с образованием СО2 и водорода. Выход Н2 и СО
на первой стадии процесса равен 90 %, на второй стадии выход
водорода 95 %.
25. На 66 г смеси оксида и пероксида бария подействова-
ли избытком серной кислоты. После отделения осадка было
получено 300 мл раствора, к пробе которого объемом 3 мл по
каплям добавляли подкисленный раствор перманганата калия
до полного прекращения выделения кислорода. Объем кисло-
рода составил 67,2 мл. Рассчитайте молярную концентрацию
полученного раствора Н2О2, массовую долю ВаО2 в исходной
смеси и массу полученного осадка.
26. Имеется смесь азота и водорода. Азот получен терми-
ческим разложением 12,8 г нитрита аммония, водород — рас-
творением 19,5 г цинка в избытке разбавленной серной
кислоты. В соответствующих условиях газы прореагировали,
8
а затем их пропустили через 100 мл 32 %-го раствора серной
кислоты (ρ = 1,22 г/мл). Определите, какой газ оказался в из-
бытке и какова массовая доля соли в растворе.
27. Анилин, полученный восстановлением 17 г нитробен-
зола, был полностью прогидрирован. Газообразные продукты
горения полученного соединения после приведения к нор-
мальным условиям заняли объем 7 л. Каков выход реакции
восстановления нитробензола, если выходы остальных реак-
ций условно приняты за 100 %?
28. Вычислите массу пероксида водорода, вступившего
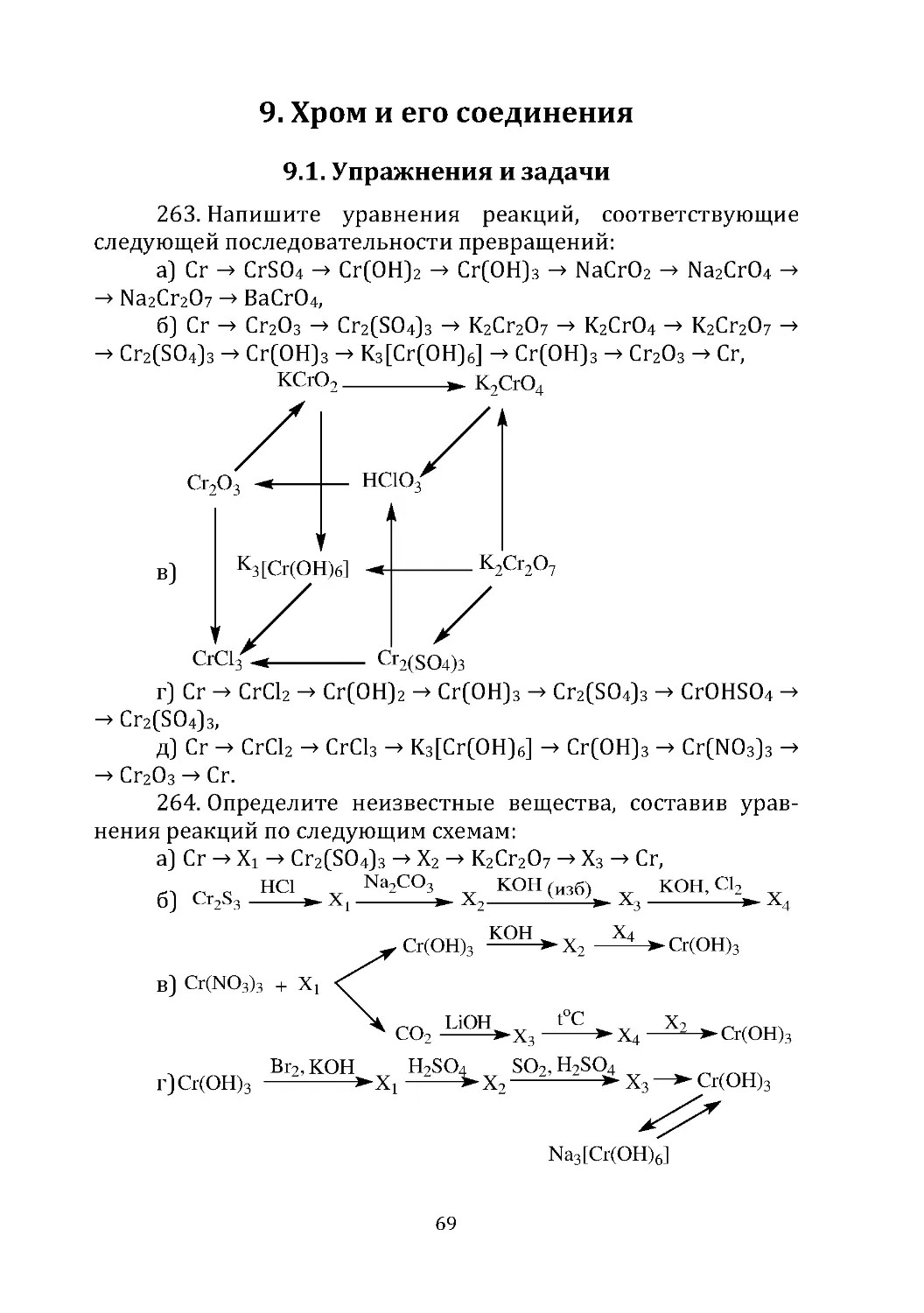
в реакцию с сульфидом никеля (II) в сернокислом растворе,
если при этом выделилось 9,6 г серы.
29. Водород пропустили через расплавленную серу. Отно-
сительная плотность по воздуху смеси газов на выходе равна 1.
Вычислите, с каким выходом прошла реакция синтеза серово-
дорода.
30. Водород, образовавшийся при действии железа на
150 мл смеси соляной и серной кислоты, пропустили через
трубку с натрием при температуре 300 °С. Масса трубки по
окончании реакции увеличилась на 0,5 г. Вычислите молярную
концентрацию ионов водорода в исходном растворе.
1.2 . Тестовые задания по теме «Водород»
1. Какие характеристики объединяют водород со щелоч-
ными металлами:
а) число валентных электронов в атоме;
б) окислительные свойства в химических реакциях;
в) возможность проявлять в соединениях степень окис-
ления +1;
г) число электронов, недостающих до завершения внеш-
него энергетического уровня;
д) общее число электронов в атоме?
2. Водород образуется при электролизе водных растворов:
а) AlCl3,
б) AgF,
в) AgNO3,
г) NaNO3,
д) CuSO4.
9
3. С простым веществом водород будет взаимодейство-
вать каждое из веществ ряда:
а) C2H4, Cu, H2O;
б) СО, О2, NaH;
в) NaCl, Cl2, S;
г) CuO, N2, Li;
д) C2H2, Ca, BaSO4.
4. Укажите схемы реакций, в которых водород — окисли-
тель:
а)С+Н2→...;
б)Na+Н2→...;
в)N2+Н2→...;
г) Fe2O3 +H2 → ...;
д)Ca+Н2→...;
5. Какие из предложенных реакций сопровождаются вы-
делением водорода?
а)Al+NaOH→...;
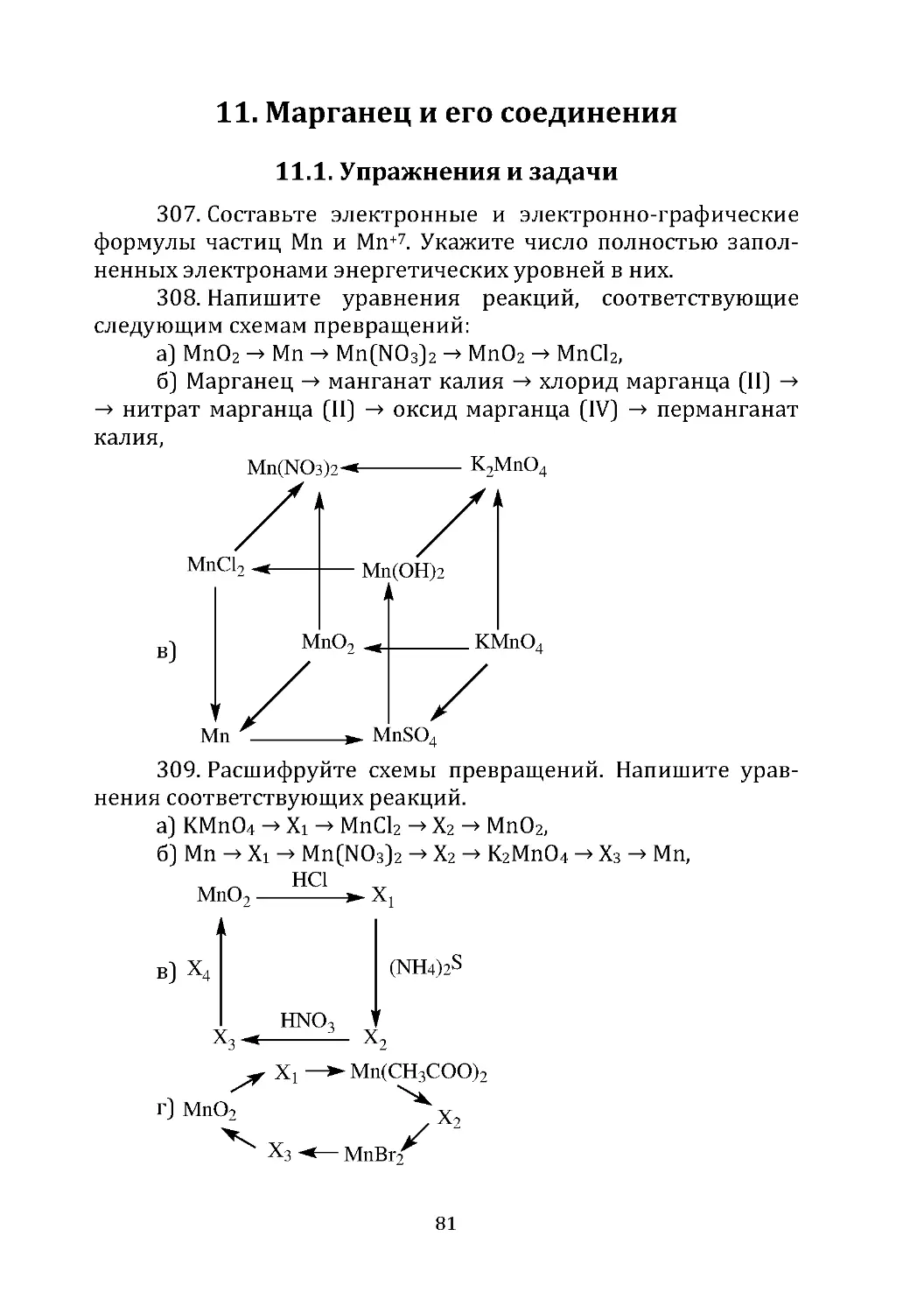
б)Са3Р2+Н2О→...;
в)Zn+HCl→...;
г)Mg3N2+HCl→...;
д)СаС2+Н2О→...
6. Формулы соединений, в которых степень окисления
водорода равна соответственно +1 и ‒1, — это:
а) SiH4, NaH;
б) CaH2, HF;
в) HCl, CaH2;
г) H2O, KH;
д) Ca(OH)2, NH3.
7. В схеме превращений Н2 → Х → Н2 веществом Х может
быть:
а) NaОH,
б) НNO3,
в) H2SO4,
г) СаН2,
д) H2O.
8. Какие два из приведенных веществ можно использо-
вать для получения водорода в лаборатории:
а) серную кислоту,
б) воду,
10
в) медь,
г) цинк,
д) раствор аммиака.
9. Продуктами реакции железа с водой при нагревании
являются:
а) FeO,
б) Fe3O4,
в) Fe(OH)3,
г) Fe(OH)2,
д) H2.
10. Какие из приведенных оксидов будут реагировать с
водородом:
а) СuO,
б) SO3,
в) Fe2O3,
г) Al2O3,
д) P2O5?
2. Галогены
2.1. Упражнения и задачи
31. Закончите уравнения реакций и расставьте коэффи-
циенты:
а)KMnO4+NaBr+H2SO4→...,
б) K2Cr2O7 + KBr + H2SO4 → ...,
в)Cl2+SO2+H2O→...,
г)KCrO2+I2+KOH→...,
д)Cl2+I2+H2O→...,
е)Br2+I2+H2O→...,
ж)K2SO3+I2+KOH→...,
з)KClO+SO2+H2O→...
32. Написать уравнения реакций, соответствующих це-
почке превращений:
а)HCl→Cl2→KClO→KHCO3→KCl→HCl→AgCl,
б) NaBr
NaCl
Cl2
KClO3
KCl
Cl2
Ca(ClO)2
O2
в) MnO2
HCl
t
Ca(OH)2
(газ)
0oC
H2O
KI
KOH
t
AgNO3
А
Б
А
В
Г
Д
CO2
г)Сl2→KCl→KOH→KClO3→KCl→KNO3→O2,
д) KClO3 → Cl2 → Ca(ClO)2 → CaCO3 →CaCl2,
е)MnO2→Cl2→HCl→Cl2→KClO3,
ж)CuCl2→BaCl2→KCl→HCl→Cl2,
з)FeBr3→KBr→Br2→PBr3→HBr,
и)KClO3→KCl→Cl2→KClO→HClO→HCl→AuCl3,
к)
Cl2
Ba(ClO3)2
KClO3
HClO3
BaCl2
Ba(ClO)2
KCl
HCl
12
33. Напишите уравнения реакций, с помощью которых
можно осуществить следующие превращения:
а) бромид калия → бром → бромат калия → бром → бро-
моводород → бром → бромид меди (II) → бромид серебра →
бром;
б) хлор → хлорат калия → хлорид калия → хлороводо-
род → хлор → хлороводородная кислота → хлорид натрия →
хлор → хлороводород.
34. Напишите по одному уравнению реакций, в которых
газообразный хлор:
а) восстанавливается,
б) окисляется,
в) одновременно окисляется и восстанавливается.
35. Как отличить иодид калия от фторида лития? Пред-
ложите два способа, один из которых основан на окислитель-
но-восстановительной реакции.
36. Приведите качественные реакции на:
а) хлор,
б) йод,
в) хлороводород,
г) йодоводород.
37. Определите формулу фторида двухвалентного метал-
ла, который содержит 48,7 % фтора по массе.
38. Растворимость брома в воде составляет 3,55 г на
100 г воды при 20°С. Рассчитайте массовую долю брома в
насыщенном водном растворе.
39. Какой объем (н. у.) хлороводорода нужно растворить
в 200 г воды, чтобы получить раствор соляной кислоты с мас-
совой долей 20 %?
40. Рассчитайте молярную концентрацию ионов водоро-
да в соляной кислоте, полученной растворением 10 л хлорово-
дорода (н. у.) в 500 мл воды. Считайте, что хлороводород
полностью диссоциирует в водном растворе.
41. Образец железа прореагировал с соляной кислотой.
Другой образец железа такой же массы прореагировал с хло-
ром. Оказалось, что масса хлора, вступившего в реакцию,
больше массы хлороводорода на 3,35 г. Определите массу же-
леза в образце.
13
42. В результате электролиза водного раствора хлорида
калия массой 200 г выделилось 2,24 дм3 (н. у.) хлора. Опреде-
лите массовую долю гидроксида калия в растворе по оконча-
нию электролиза.
43. Смесь, содержащую NaF, NaCl и NaBr (масса галогени-
дов равна 49,1 г), растворили в воде. К половине раствора
добавили избыток раствора хлорида кальция. В результате
реакции выпал осадок массой 7,8 г. Ко второй половине доба-
вили избыток раствора нитрата серебра. При этом образовался
осадок массой 33,15 г. Определите массовую долю хлорида
натрия в исходной смеси.
44. Смесь хлора с неизвестным газом объемом 3,53 л име-
ет массу 8,22 г. Определите молярную массу неизвестного газа,
если известно, что при получении хлора, входящего в состав
смеси, взаимодействием MnO2 с соляной кислотой объе-
мом 50 мл с ω(НCl) = 30 % (ρ = 1,15 г/мл) массовая доля хлоро-
водорода снизилась до 18 %.
45. При термическом разложении в присутствии катали-
затора бертолетовой соли массой 36,75 г получили твердый
остаток массой 31,95 г. Этот остаток обработали избытком
соляной кислоты и получили газ объемом 6,72 л (н. у.) . Найди-
те степень разложения соли и массовые доли веществ в твер-
дом остатке.
46. При смешивании 135 г 20 %-го раствора хлорида ме-
ди (II) и 680 г 10 %-го раствора нитрата серебра образовался
осадок. Оставшийся раствор отделили от осадка и подвергли
электролизу. Определить качественный и количественный
состав веществ, выделившихся на электродах.
47. Газовую смесь объемом 3,6 л, предназначенную для
синтеза хлороводорода (плотность смеси по водороду рав-
на 20), пропустили через раствор массой 200 г, содержа-
щий 26,12 г смеси бромида и иодида калия. Хлор и соли
прореагировали полностью. Определите массовые доли солей
в исходном растворе и состав исходной смеси газов (в % по
объему).
48. Молярное соотношение бромида калия и сульфата
калия в смеси равно 2:1, а общее число атомов равно 3,01×1023.
Какая масса брома выделится при обработке этой смеси пер-
манганатом калия в кислой среде?
14
49. Через холодный раствор КОН с концентрацией
2,05 моль/л объемом 150 мл (ρ = 1,095 г/мл) пропустили
3,53 л (100 кПа, 10 °С) смеси хлора с хлороводородом, имею-
щую плотность по воздуху 1,655. Вычислите массовые доли
солей в получившемся растворе.
50. Какой объем смеси хлора с азотом (давление 98 кПа,
температура 5 °С, относительная плотность по водороду 25)
следует пропустить через 1 кг насыщенного раствора гидрок-
сида кальция для получения максимально возможной массы
хлорной извести (растворимость гидроксида кальция при
температуре опыта равна 0,18 г в 100 г воды)?
51. К раствору, в котором молярные концентрации бро-
мида натрия и фторида натрия равны, добавили водный рас-
твор, содержащий 0,03 моль фторида серебра, в результате
чего образовался осадок желтоватого цвета массой 1,88 г.
Какой объем 45 %-го раствора нитрата кальция (ρ = 1,42 г/мл)
необходимо добавить к раствору, полученному после отделе-
ния осадка, до полного прекращения выпадения осадка?
52. 81,95 г смеси хлорида калия, нитрата калия и берто-
летовой соли прокалили до постоянной массы. При этом
происходило выделение газа. После взаимодействия этого
газа с водородом получилось 14,4 г воды. Продукт прокалива-
ния растворили в воде и раствор обработали нитратом
серебра. Выпало 100,45 г осадка. Определите массовый состав
смеси.
53. Для нейтрализации 10 г раствора, содержащего смесь
хлороводородной и бромоводородной кислот, потребовалось
2,5 г 3,2 %-го раствора гидроксида натрия, а при действии на
раствор той же массы избытка раствора нитрата серебра вы-
пало 0,3315 г осадка. Определите массовые доли кислот в ис-
ходном растворе.
2.2 . Тестовые задания по теме «Галогены»
1. Укажите справедливые суждения для галогенов:
а) молекулы при н. у. двухатомны,
б) высшая валентность атомов всех галогенов равна VII,
в) в соединениях с кислородом степень окисления атомов
всех галогенов положительна,
15
г) на внешнем энергетическом уровне в атомах всех гало-
генов в основном состоянии находится 7 электронов,
д) окислительные свойства галогенов увеличиваются
в группе снизу вверх.
2. Расположите предложенные кислоты в порядке усиле-
ния кислотных свойств:
а) HI,
б) HBr,
в) HF,
г) HCl.
3. Формулы соединений, в которых хлор проявляет свою
максимальную степень окисления:
а) HСlО2,
б) Cl2O7,
в) CCl4,
г) HCl,
д) КClO4.
4. Наиболее полярна химическая связь в соединении во-
дорода с:
а) бромом,
б) фтором,
в) хлором,
г) иодом.
5. В схеме превращений Cl2 → X1 → X2 → Cl2 веществами Х1
и Х2 являются соответственно:
а) H2,
б) KClO3,
в) PCl5,
г) KCl,
д) CaCl2.
6. Хлор в соединениях может проявлять степени окисле-
ния, равные:
а) ‒1, +3 +7;
б) ‒2, ‒1, +1, +2;
в) +3 +5, +7, +8;
г) ‒1, +3, +5, +7;
д) ‒2, +3, +5, +6.
7. Отметьте схемы реально протекающих реакций:
а)KBr+Cl2→...;
б)KBr+I2→...;
16
в)KF+Br2→...;
г)KCl+Br2→...;
д)KI+Br2→...
8. Соляная кислота является восстановителем, реагируя с:
а) KMnO4,
б) Zn,
в) NH3,
г) MnO2,
д) СаО.
9. Установите соответствие между реагирующими веще-
ствами и одним из продуктов их взаимодействия:
РЕАГЕНТЫ
ОДИН ИЗ ПРОДУКТОВ
А)KI+Cl2→...;
1) I2,
Б)MnO2+KI+H2SO4→...;
2) H2,
В)HCl+KClO3→...;
3) HI,
Г)Fe2O3+HI→...
4) HCl,
5) Cl2.
10. Бром реагирует с:
а) фосфором,
б) оксидом алюминия,
в) кислородом,
г) хлоридом железа (II),
д) гидроксидом калия.
3. Халькогены
3.1 . Упражнения и задачи
54. Напишите уравнения химических реакций, в которых
степень окисления кислорода и серы меняется следующим
образом:
а)О‒2→О0→О‒1→О‒1→О0→О0,
б)S‒2→S0→S+4→S+6→S+4→S0→S‒2
,
в)S0→S‒2→S+4→S+6→S0.
55. Закончите уравнения химических реакций:
а) S + H2SO4(конц.) → ...;
б)SO2+KMnO4+H2O→...;
в)S+Al→...;
г)H2SO4(р-р)+Fe→...;
д)S+HNO3(конц.)→...;
е) CuS + HNO3 (конц.) → ...;
ж)S+КОН(конц.р-р)→...;
з)Na2SO3+H2O+AlCl3→...;
и) H2S + Pb(NO3)2 → ...;
к) FeS2 + H2SO4 (конц.) → ...;
л)H2S+SO2→...;
м) SOCl2 + NaOH (изб.) → ...;
н)H2S+Br2(р-р)→...;
о)FeCl3+H2S→...;
п) SO2 + KOH (недостаток) → ...
56. Напишите уравнения реакций по следующим схемам
превращений:
а)SO2→S→H2SO4→Na2SO4→BaSO4,
б) H2S → SO2 → Ca(HSO3)2 → CaSO3 → CaCl2,
в) H2SO4 → SO2 → MnSO4 → BaSO4 → BaS,
г) SO2 → Na2SO3 → NaHSO3 → Na2SO3 → Na2SO4,
д)Fe→FeS→H2S→S→SO2→SO3→H2SO4,
е)S
NaOH
HCl
H2S
Cr2S3
FeCl2
KMnO4, H2SO4
А
Б
В
Г
Д
Е
Ж
ж)Al→Al2S3→H2S→S→H2SO4→SO2,
18
з)
1
2
3
4
5
6
7
8
9
10
11
12
S
H2S
FeS
Na2S
Na2S2O3
SO2
Na2SO4
Fe2(SO4)3
57. Напишите уравнения реакций, соответствующих сле-
дующим схемам. Определите неизвестные вещества.
а)KMnO4→X→KClO3→Y→Z→K2O2;
б)S→K2SO3→X→SO2→S.
58. Воздух содержит 21 % кислорода по объему. Прини-
мая молярную массу воздуха 29 г/моль, рассчитайте массовую
долю кислорода в воздухе.
59. Массовая доля серы в земной коре равна 0,03 %,
а кислорода 49,13 %. Во сколько раз атомов кислорода в зем-
ной коре больше, чем атомов серы?
60. Какой объем воздуха необходим для полного сгора-
ния 1000 л природного газа, содержащего 95 % СН4 и 5 % С2Н6
по объему?
61. При сжигании железа на воздухе образуется оксид,
в котором массовая доля кислорода равна 27,6 %. Установи-
те формулу и название оксида и напишите уравнение этой
реакции.
62. Некоторую массу пероксида бария обработали рас-
твором серной кислоты. Полученный осадок отфильтровали и
фильтрат массой 400 г оставили стоять открытым на свету,
в результате этого выделилось 2,24 л газа. Затем раствор
подкислили и обработали избытком перманганата калия.
Выделилось еще 11,2 л газа. Какова массовая доля вещества,
находившегося в фильтрате?
63. Определите объем озонированного кислорода, содер-
жащего 25 % озона, необходимый для сжигания 90 л смеси
оксида углерода (II) и водорода с плотностью по водороду
равной 11,1.
19
64. При полном разложении нитрата щелочного металла
масса выделившегося кислорода составила 8,2 % от исходной
массы нитрата. Установите формулу нитрата.
65. При восстановлении оксида металла (III) массой 80 г с
выходом 90 % получили металл и одновременно образовалось
24,3 г воды. Установите формулу оксида.
66. Какое из перечисленных ниже соединений надо взять,
чтобы при термическом разложении их одинаковых масс полу-
чить максимальное количество кислорода: BaO2, KMnO4, NaNO3,
KClO3?
67. Определите, сколько теплоты выделится при сгора-
нии 104 г ацетилена. Известно, что при сгорании 1 моль ацети-
лена выделяется 1300 кДж теплоты.
68. Массовая доля кислорода в составе смеси NO и N2O
равна 40 %. Определите массовую долю NO в смеси.
69. Над серебром пропустили 1 л смеси озона с кислоро-
дом, которая имела плотность по водороду 18. Что произошло с
серебром и на сколько граммов увеличилась его масса?
70. В результате пропускания электрического разряда
через 5 л кислорода его объем уменьшился на 60 мл. Опреде-
лите объемную долю озона в образовавшейся смеси.
71. Смесь О2 и О3 имеет плотность по водороду 16,4. После
частичного разложения озона плотность по водороду умень-
шилась на 1,5 %. Найдите массовую долю озона в полученной
смеси газов.
72. После нагревания бертолетовой соли масса твердого
веществ уменьшилась на 25 %. Определите степень разложе-
ния соли.
73. При действии соляной кислоты на смесь KMnO4 и
MnO2 при нагревании выделилось 7,84 л газа (н. у.), а при тер-
молизе такой же смеси — 672 мл газа (н. у.). Определите массу
смеси.
74. При полном термолизе смеси KMnO4 и KClO3 получили
17,92 л газа (н. у.), а при обработке такой же смеси избытком
соляной кислоты выделилось 39,2 л газа (н. у.). Чему равна
массовая доля хлората калия в исходной смеси?
75. Равномолекулярную смесь двух оксидов состава МеО
массой 30 г растворили в соляной кислоте, получив смесь
солей массой 57,5 г. Установите формулы оксидов, если отно-
шение их молярных масс 1:2.
20
76. В результате горения газообразного соединения Х объ-
емом 4,48 дм3 (н. у .) образовалось 3,6 г воды и 4,48 дм3 (н. у.) SO2.
Определите химическую формулу вещества, если известно, что
его плотность по оксиду углерода (IV) равна 0,773.
77. Массовая доля серы в соединении H2SX4 равна
32,655 %. Установите Х.
78. Смесь сульфита и сульфата щелочного металла общей
массой 15 г обработали избытком соляной кислоты, при этом
выделилось 896 мл газа (н. у.). Такую же исходную смесь той
же массы обработали избытком раствора нитрата бария. Мас-
са осадка оказалась равной 20,3 г. Установите, какой металл
входил в состав солей.
79. Для окисления 3,255 г сульфита, который образован
металлом, имеющим в соединениях постоянную степень окис-
ления (+2), добавили 150 г 3,2 %-го раствора брома. Для полно-
го обесцвечивания не вступившего в реакцию брома через
полученную смесь пропустили 336 мл SO2 (н. у.) Установите
металл и вычислите массовую долю веществ в получившемся
растворе.
80. Сульфид массой 22 г, в состав которого входит металл
в степени окисления +2, обработали избытком соляной кисло-
ты. Выделившийся газ пропустили через 50 мл раствора гид-
роксида натрия с молярной концентрацией 7,5М. В результате
этого получился раствор с равными молярными концентраци-
ями кислой и средней соли. Установите, какой металл входил в
состав сульфида?
81. 6 г железа сплавили с 3,2 г серы. Затем добавили из-
быток соляной кислоты. Выделившийся газ пропустили через
избыток раствора CuSO4. Определите массу образовавшегося
осадка.
82. Какую массу SO3 нужно растворить в воде, чтобы по-
лучить раствор серной кислоты массой 200 г с массовой до-
лей 9,8 %?
83. В 100 г 70 %-й серной кислоты растворили 20 г оксида
серы (VI). Рассчитайте массовую долю серной кислоты в новом
растворе.
84. Какую массу оксида серы (VI) надо растворить в 200 г
50 %-й серной кислоты для получения 98 %-го раствора?
85. К смеси сульфатов бария, меди (II) и натрия мас-
сой 30 г добавили воду. Часть смеси не растворилось. Масса
21
нерастворенного вещества составила 10 г. Надосадочную жид-
кость отделили и через нее пропустили избыток сероводорода.
В результате этого выпал осадок массой 9,6 г. Определите
массу сульфата натрия в исходной смеси солей.
86. Растворимость оксида серы (IV) в 100 г воды при 0 °С
равна 22,8 г . После нагревания 200 г насыщенного при 0 °С
раствора до 20 °С его масса составила 181,6 г. Определите рас-
творимость SO2 при 20 °С в 100 г воды.
87. В газовой смеси, состоящей из оксида серы (IV) и кис-
лорода, с плотностью по водороду равной 24, часть оксида
серы (IV) прореагировало и образовалась равновесная газовая
смесь с плотностью по водороду на 25 % больше, чем плот-
ность исходной смеси. Рассчитайте состав равновесной смеси в
процентах по объему.
88. При сжигании 50 л смеси сероводорода с кислородом с
плотностью по водороду равной 16,2, полученный оксид серы
пропустили через 45 мл раствора гидроксида натрия с массо-
вой долей 41,66 % и плотностью 1,28 г/мл. Найдите массовые
доли веществ в образовавшемся растворе.
89. Через 200 мл раствора смеси гидроксида калия и гид-
роксида натрия пропустили 17,92 л смеси азота и оксида
серы (IV) с плотностью 2,448 г/л (н. у.), при этом образовались
только две кислые соли. Вычислите концентрацию гидроксид-
ионов в исходном растворе.
90. Смесь общей массой 90,2 г солей магния, образован-
ных серной, азотной и соляной кислотами, обработали раство-
ром хлорида бария объемом 1 л с концентрацией 0,2 моль/л.
Масса осадка равна 23,3 г. В полученный после отделения
осадка раствор добавили раствор нитрата серебра, в результа-
те чего образовалось 115 г осадка. Вычислите массовую долю
солей в исходной смеси.
91. Какой объем подкисленного раствора перманганата
калия с концентрацией 0,05М может обесцветить смесь СО2 и
SO2, в котором на два атома серы приходится 9 атомов кисло-
рода, а число атомов углерода в 2 раза меньше числа Авогадро.
92. Смешали 1,58 %-й раствор перманганата калия и
1,58 %-й раствор сульфита калия, в соотношении по массе 2:3.
Вычислите массовую долю калия в растворе после окончания
реакции и отделения осадка.
22
3.2 . Тестовые задания
по теме «Кислород»
1. Укажите справедливые суждения для элементов под-
группы кислорода:
а) высшая валентность всех атомов равна VI,
б) все элементы являются неметаллами,
в) сверху вниз металлические свойства элементов увели-
чиваются,
г) низшая степень окисления атомов элементов равна ‒2,
д) формула высшего оксида ЭО2.
2. Кислород не выделяется в результате нагревания:
а) малахита,
б) перманганата калия,
в) нитрита калия,
г) оксида ртути,
д) нитрата калия.
3. Кислород можно распознать:
а) индикатором,
б) по запаху,
в) тлеющей лучиной,
г) известковой водой,
д) баритовой водой.
4. Какие оксиды образуются при нагревании меди и же-
леза в токе кислорода:
а) CuO,
б) Fe2O3,
в) Fe3O4,
г) Cu2O,
д) FeO.
5. Укажите, какие из приведенных веществ могут реаги-
ровать с кислородом:
а) Cl2, SO2, FeS;
б) Fe, Fe2O3, FeO;
в) Fe, CO, FeO;
г) MgO, Cu, C;
д) CH4, SO2, CuS.
6. Озон является:
а) соединением кислорода с водородом,
б) изотопом кислорода,
23
в) изомером кислорода,
г) аллотропной модификацией кислорода,
д) неустойчивым соединением.
7. Окислительные свойства простых веществ последова-
тельно нарастают в ряду:
а) теллур, сера, селен;
б) сера, теллур, селен;
в) кислород, сера, теллур;
г) теллур, сера, кислород;
д) селен, сера, кислород.
8. Какие газы не способны гореть в атмосфере кислорода:
а) метан,
б) углекислый газ,
в) сернистый газ,
г) хлор,
д) водород.
9. В реакциях с какими веществами образуются соедине-
ния со степенью окисления кислорода ‒1?
а) Na,
б) Mg,
в) K,
г) F2,
д) H2.
10. Масса хлората калия (в граммах), из которого получе-
но 448 л (н. у.) кислорода при выходе 80 % равна:
а) 1541,7;
б) 2253,1;
в) 1633,3;
г) 2041,7.
3.3 . Тестовые задания
по теме «Сера»
1. В реакциях с какими веществами сера проявляет окис-
лительные свойства:
а) водородом,
б) гидроксидом натрия,
в) железом,
24
г) кислородом,
д) хлором?
2. С помощью каких катионов можно обнаружить присут-
ствие в водном растворе сульфид-ионов:
а) К+,
б) Сu2+,
в) Pb2+,
г) Na+,
д) NH4+?
3. Оксид серы (IV) взаимодействует с каждым из двух ве-
ществ:
а) H2O, KCl;
б) Ba(OH)2, BaO;
в) H2O, H2S;
г) CaO, CO2;
д) Сa(OH)2, N2.
4. В растворах каких солей среда щелочная:
а) K2S,
б) Na2SO4,
в) Na2SO3,
г) KHSO4,
д) NaНSO3?
5. Концентрированная серная кислота в отличие от раз-
бавленной серной кислоты:
а) при обычных условиях реагирует с железом и алюми-
нием;
б) вытесняет из кристаллических хлоридов хлороводород;
в) окислитель за счет ионов Н+;
г) окислитель за счет ионов S+6;
д) реагирует только с металлами, стоящими в ряду
напряжения до водорода.
6. Находящиеся в разных пробирках водные растворы
сульфата и сульфида натрия можно различить с помощью:
а) лакмуса,
б) раствора нитрата серебра,
в) раствора хлорида калия,
г) соляной кислоты,
д) водного раствора аммиака.
25
7. Установите соответствие между реагирующими веще-
ствами и одним из продуктов реакции
РЕАГЕНТЫ
ОДИН ИЗ ПРОДУКТОВ
А)FeS2+O2→...;
1) FeO,
Б)H2SO4(конц)+S→...;
2) NO,
В)H2S +O2(изб.)→ ...;
3) NO2,
Г)H2S +O2(нед.)→ ...
4) S,
5) SO2,
6) SO3.
8. Разбавленная серная кислота реагирует с каждым из
двух веществ:
а) Ag, Cu(OH)2;
б) CaO, Ba(NO3)2;
в) Fe2O3, NaNO3;
г) Fe, Al2O3;
д) NaOH, C.
9. Сера образуется в результате реакций:
а) H2S + O2 (избыток) → ...;
б) H2S + O2 (недостаток) → ...;
в)H2S+SO2→...;
г)К2S+HCl→...;
д)H2S+Н2О→...
10. Какой минимальный объем воздуха (л, н. у.) нужен
для полного окисления 10 л (н. у.) сероводорода:
а) 70;
б) 71,4;
в) 15;
г) 80;
д) 100?
4. Подгруппа азота
4.1. Упражнения и задачи
93. Осуществите превращения:
а)N‒3→N0→N+2→N+4→N+5→N‒3;
б)N+3→N+3→N+5→N+5→N+4;
в)Р0→Р+3→Р+3→Р+5→Р+5;
г)Р0→Р-3→Р-3→Р+5→Р+5;
94. Напишите уравнения следующих реакций:
а) CuO + NH3 →t,C
...;
б) Fe(NO3)2 →t,C
...;
в) NH4NO2 →t,C
...;
г) NaNO2 + H2SO4 + KClO3 → ...;
д)NO2+KOH→...;
е)Au+HNO3+HCl→...;
ж) Fe + HNO3 (конц.) →t,C
...;
з)KNO2+Al+KOH→...;
и) Ва + HNO3 (разб.) → ...;
к) Са3N2 + HCl (избыток) → ...;
л) Р + H2SO4 (конц.) → ...;
м)Са3Р2+HCl→...;
н) Mg3P2 + H2SO4 (конц.) → ...;
о) Ca(OH)2 (избыток) + Н3РО4 → ...;
п)P2O5+HNO3→...;
р) Ca(OH)2 + Н3РО4 (избыток) → ...
95. Составьте уравнения химических реакций, позволяю-
щих осуществить следующие превращения:
а)NH4Cl→NH3→NH4NO2→N2→NO→NO2→HNO3→Ag-
NO3 → NO2
б) P → P2O5 → H3PO4 → Ca3(PO4)2 → H3PO4
в)N2→NH3→NO→NO2→NaNO3→NaNO2→HNO2→
HNO3→NH4NO3→N2O→N2
г)P→Ca3P2→PH3→P2O5→HPO3→H3PO4→H4P2O7
д) P → PCl5 → H3PO4 → Ca3(PO4)2 → Ca(H2PO4)2 → Ca3(PO4)2 →
P→PI5→H3PO4→H4P2O7
е)NH4NO3→NH3→NO→NO2→NH4NO2→NH4NO3→N2O.
27
96. Напишите уравнения окислительно-восстановительных
реакций, протекающих по схеме:
а)H3PO4→Х→P→У→H3PO4
б)KNO2→Х→NO2→У→Ba(NO3)2
Укажите неизвестные вещества Х и У.
97. Напишите уравнения реакций, соответствующих сле-
дующим схемам:
а)
1
2
3
4
5
6
7
8
9
10
11
12
NO2
NH4NO2
HNO3
HNO2
N2
NH3
N2O
NH4NO3
б)
Ca3(PO4)2
K3PO4
P2O5
H3PO4
P
KH2PO2
Mg3P2
PH3
1
2
3
4
5
6
7
8
9
10
11
12
98. Азот образует 5 оксидов. Какие из них реагируют с
раствором щелочи? Напишите уравнения реакций.
99. Напишите уравнения реакций разложения солей ам-
мония: хлорида, карбоната, нитрата, дихромата. Какие из этих
реакций относятся к окислительно-восстановительным?
100. Массовая доля фосфора в составе апатита равна
16 %. Определите массовую долю фосфата кальция в составе
апатита, если весь фосфор входит в состав фосфата кальция.
101. Газовая смесь состоит из 40 л азота и 10 л аммиака.
Сколько атомов азота приходится на один атом водорода в
этой смеси?
28
102. Смесь N2 и Н2 пропустили над катализатором. При
этом ее объем уменьшился с 10 л до 7,2 л. Какова будет массовая
доля полученного аммиака при его растворении в 25 мл воды.
103. К 300 см3 смеси NO и NO2 добавили 200 см3 кислоро-
да, после чего объем смеси увеличился на 100 см3 по сравне-
нию с исходным объемом смеси оксидов азота и кислорода.
Определите объемы оксидов азота в их исходной смеси.
104. В замкнутый сосуд поместили 2 моль азота и 4 моль
водорода. Смесь нагрели в присутствии катализатора. Опреде-
лите массовую долю аммиака к моменту, когда в реакцию
вступило 75 % водорода.
105. Азот смешали с водородом в соотношении 1:3 и под
большим давлением пропустили над нагретым катализатором.
Выход аммиака составил 40 % от теоретического. Рассчитайте
объемные доли всех газов в полученной смеси.
106. При пропускании аммиака над раскаленным окси-
дом меди (II) масса твердого вещества уменьшилась на 6,4 г.
Какой объем азота (н. у.) при этом образовался?
107. Рассчитайте концентрацию гидроксид-ионов в вод-
ном растворе аммиака с концентрацией 3 моль/л, если степень
диссоциации равна 0,24 %.
108. Дано термохимическое уравнение: 2NO + O2 =
= 2NO2 + 114 кДж. Сколько теплоты выделяется при сгорании
75 г оксида азота (II)?
109. При непродолжительном прокаливании 100 г нитра-
та меди (II) масса твердого вещества уменьшилась на 21,6 г.
Какая часть соли разложилась?
110. При частичном термическом разложении нитрата
калия массой 25 г выделилось 3,2 г кислорода. Определите
массовую долю нитрита калия в твердом остатке.
111. После прокаливания 25 г нитрата меди (II) масса
твердого остатка составила 22,84 г. Определите объем кисло-
рода (н. у.), выделившегося при разложении нитрата меди.
112. Какова масса твердого остатка при прокаливании
нитрата серебра массой 27 г к моменту, когда выделилось
3,36 л газов (н. у.).
113. Рассчитайте количество моль ионов водорода в рас-
творе, содержащем 49 г фосфорной кислоты. Степень диссоци-
ации Н3РО4 по первой ступени равна 5 %. Диссоциацией по
второй и третьей ступени пренебречь.
29
114. В растворе Н3РО4 (массовая доля 10 %) массой 80 г
растворили при нагревании Р2О5. В результате этого массовая
доля фосфорной кислоты увеличилась на 5 %. Определите
массу растворенного оксида фосфора (V).
115. Сколько граммов красного фосфора и бертолетовой
соли было израсходовано, если при растворении образовавше-
гося в результате их взаимодействия оксида фосфора (V) в
85,5 г 50 %-го раствора фосфорной кислоты массовая доля
последней в растворе увеличилась на 12,5 %?
116. Из азота объемом 67,2 л и водорода объемом 224 л
образовался аммиак (н. у.) . Используя этот аммиак, получили
раствор объемом 400 мл с массовой долей азотной кислоты
40 % и плотностью 1,25 г/мл. Определите выход продукта
реакции.
117. Оксид фосфора (V), полученный окислением 31 г
фосфора, растворен при нагревании в 495 мл воды. В получен-
ный раствор прибавили 44,8 л аммиака (н. у.). Определите
состав и массовую долю соли в полученном растворе.
118. Газ, полученный при нагревании 26,4 г сульфата ам-
мония с избытком щелочи, поглощен раствором, содержащим
39,2 г ортофосфорной кислоты. Какая соль при этом образова-
лась и какова ее масса?
119. В 200 г раствора с ω(NH4H2PO4) = 23 % пропущен газ,
полученный при взаимодействии 10,7 г NH4Cl с избытком
щелочи. Рассчитайте массы веществ в полученном растворе.
120. Сжигают 7,5 г фосфора в избытке кислорода, продукт
вносят в 214 мл раствора с ω(NаОН) = 23,7 % (ρ = 1260 г/л).
Найдите массовую долю соли в полученном растворе.
121. Имеется смесь азота и водорода. Азот получен тер-
мическим разложением 12,8 г нитрита аммония, водород —
растворением 19,5 г цинка в разбавленной серной кислоте.
В присутствии катализатора эти газы прореагировали, а затем
полученную смесь пропустили через 100 мл раствора серной
кислоты (ω = 32 %, ρ = 1,22 г/мл). Определите: а) количество
избыточного газа; б) массовую долю и состав соли в растворе.
122. Прокалили 27,25 г смеси нитратов натрия и меди.
Полученные газы пропустили через 89,2 мл воды, при этом
1,12 л газа (н. у.) не поглотилось. Найдите массовые доли солей
в исходной смеси и массовую долю вещества в полученном
растворе.
30
123. Газы, выделившиеся при нагревании 6,43 г смеси
нитратов калия и серебра, пропустили через воду. При этом
448 мл газа (н. у.) не поглотилось. Найдите массу нитрата сере-
бра в смеси.
124. Какая масса перманганата калия потребуется для то-
го, чтобы выделившемся при его разложении кислородом
сжечь фосфор. Образовавшийся оксид фосфора (V) растворить
в воде и получить 200 г раствора с ω(Н3РО4) = 19,6 %.
125. К раствору массой 242,9 г с ω(Н3РО4) = 8 % прибави-
ли 7,1 г оксида фосфора (V) и раствор прокипятили. Чему равна
массовая доля вещества в полученном растворе?
126. Какую массу оксида фосфора (V) нужно прилить к
500 г раствора с ω(Н3РО4) = 64 %, чтобы после нагревания
получить безводную кислоту?
127. Какую массу оксида фосфора (V) надо добавить к
85,8 г раствора с ω(Н3РО4) = 6,3 %, чтобы после кипячения
получить раствор с ω(Н3РО4) = 25 % ?
128. Оксид фосфора (V) растворили в 500 мл раствора
Н3РО4 (ω = 85 %, ρ = 1,7 г/мл), при этом массовая доля кислоты
увеличилась на 7,6 %. Найдите массу фосфора, затраченную на
получение оксида фосфора (V).
129. Какую массу Р2О5 надо растворить в 400 г раствора
гидроксида натрия с ω(NаОН) = 37 %, чтобы массовые доли
обеих кислых солей стали равными между собой?
130. На взаимодействие с 29,4 г смеси железа, меди и
алюминия нужно 17,94 л хлора (н. у.). При обработки такой же
навески смеси металлов концентрированной азотной кислотой
при комнатной температуре выделилось 8,96 л (н. у.) бурого
газа. Найдите массы металлов в смеси.
131. В 1 кг раствора находится смесь KNO3, NH4Cl и Na3PO4
общей массой 70 г. При обработке 100 г такого раствора из-
бытком щелочи выделяется 448 мл (н. у.) газа. При обработке
10 г исходного раствора избытком нитрата серебра (I) выпада-
ет 1,544 г осадка. Найдите массовые доли веществ в исходной
смеси.
132. Оксид металла, в котором массовая доля металла
70 %, полностью восстановили водородом. При растворении
11,2 г полученного металла в азотной кислоте образовался
нитрат трехвалентного металла и выделилось 13,44 л (н. у.)
NO2. Определите оксид и его массу.
31
133. При полном сгорании 6,8 г вещества получилось
14,2 г оксида фосфора (V) и 5,4 г воды. К полученным продук-
там реакции добавлено 37 мл раствора гидроксида натрия с
ω(NаОН) = 32 % (ρ = 1,35 г/мл). Установите формулу исходного
вещества и массовую долю полученной соли.
134. Имеется 54,6 г смеси нитрата меди (II) и нитрата не-
которого одновалентного металла. При прокаливании этой
смеси образуется 14,56 л газов (н. у.), при пропускании кото-
рых через холодный раствор щелочи объем уменьшается до
3,36 л (растворимостью кислорода пренебречь). Нитрат какого
металла находился в смеси, если известно, что меди в ней было
1,204×1023 атомов, а оксид неизвестного металла при разложе-
нии его нитрата не образуется.
135. На растворение металла понадобилось 52,17 мл раз-
бавленной азотной кислоты (ω = 13,48 %, ρ = 1,075 г/мл). В полу-
ченном растворе массовая доля нитрата металла (II) 17,63 %.
При растворении выделился газ с плотностью по азоту 1,071.
Какой металл растворили?
136. После нагревания 18 г металла в атмосфере азо-
та 5 % полученного нитрида разложили водой и получили
336 мл газа (н. у.). Установите формулы металла и нитрида,
если степень окисления металла +2.
137. При обработке водой смеси фосфида и гидрида ще-
лочного металла с равными массовыми долями получена газо-
вая смесь с плотностью по азоту 0,2926. Установите металл.
4.2 . Тестовые задания
по теме «Азот. Аммиак»
1. Для элементов подгруппы азота справедливы утвер-
ждения:
а) с ростом атомного номера растет радиус атома,
б) все элементы являются неметаллами,
в) атомы всех элементов имеют вакантные d-орбитали,
г) формула летучих водородных соединений — ЭН3,
д) высшая валентность равна V.
2. Азот проявляет одинаковую степень окисления в каж-
дом из двух соединений:
а) NH3, N2O3;
б) Mg3N2, NH3;
32
в) NaNH2, NH4Cl
г) NH3, HNO2;
д) NaNO2, NaNO3.
3. Азот в составе аммиака является:
а) только окислителем,
б) только восстановителем,
в) и окислителем, и восстановителем,
г) донором электронов,
д) простым веществом.
4. Бинарные (двухэлементные) соединения металлов
с азотом называются:
а) карбиды,
б) амины,
в) нитраты,
г) нитриды,
д) азиды.
5. Отметьте схемы осуществимых в водном растворе ре-
акций:
а) NH4Cl + AgNO3 → ...;
б) NH4OH + H3PO4 → ...;
в) (NH4)2SO4 + H3PO4 → ...;
г) NH4NO3 + NaOH → ...;
д) (NH4)2SO4 + KCl → ...
6. Азот в лаборатории получают:
а) ректификацией жидкого воздуха,
б) разложением нитрита аммония,
в) взаимодействием меди с НNO3 (конц.),
г) взаимодействием меди с НNO3 (разб.),
д) перегонкой жидкого воздуха.
7. Охарактеризуйте реакцию NH3 + HCl → NH4Cl:
а) экзотермическая,
б) степень окисления атома азота изменяется от ‒3 до ‒4,
в) эта реакция соединения,
г) эндотермическая,
д) каталитическая.
8. Какие вещества образуются при термическом разложе-
нии нитрата аммония?
а) N2,
б) N2O,
33
в) H2O,
г) H2,
д) NO2.
9. С хлоридом аммония в водном растворе реагируют:
а) азотная кислота,
б) нитрат серебра (I),
в) гидроксид калия,
г) аммиак,
д) сульфат натрия.
10. Какой оксид азота реагирует с медью, если в резуль-
тате получено 2,24 л N2 (н. у.) и 32 г CuO:
а) NO,
б) N2O,
в) NO2,
г) N2O5,
д) N2O3.
4.3 . Тестовые задания
по теме «Оксиды азота. Азотная кислота»
1. Какие из перечисленных оксидов являются несолеоб-
разующими:
а) NO,
б) NO2,
в) N2O,
г) N2O3,
д) N2O5?
2. Концентрированная азотная кислота при обычных
условиях не реагирует с:
а) медью,
б) углеродом,
в) алюминием,
г) серебром,
д) хромом.
3. Оксид азота (IV) не может быть получен термическим
разложением:
а) AgNO3,
б) NaNO3,
в) Cu(NO3)2,
34
г) NH4Cl,
д) Cа(NO3)2.
4. Водные растворы серной и азотной кислот можно раз-
личить с помощью:
а) Cu,
б) CuO,
в) Fe(OH)3,
г) Ag,
д) SiO2.
5. В каком азотном удобрении массовая доля азота рав-
на35%?
а) мочевина,
б) аммиачная селитра,
в) калийная селитра,
г) натриевая селитра.
6. С образованием металла, оксида азота (IV) и кислорода
разлагаются при нагревании:
а) нитрат меди,
б) нитрат железа (III),
в) нитрат серебра,
г) нитрат алюминия,
д) нитрат ртути (II).
7. Отметьте схемы реакций, в которых преимущественно
образуется оксид азота (II):
а) Cu + HNO3 (разб.) → ...;
б) NH4NO2 → ... (t °C);
в)NH3+O2→...(t°C,Кат.);
г) Cu + HNO3 (конц.) → ...;
д)NH3+CuO→...
8. Установите соответствие между реагирующими веще-
ствами и одним из продуктов их взаимодействия:
РЕАГЕНТЫ
ОДИН ИЗ ПРОДУКТОВ
А)KNO2+KI+H2SO4→...;
1) Cl2,
Б)Cu + HNO3(разб)→ ...;
2) NO,
В)Hg+HNO3(конц) → ...;
3) NH3,
В)Mg+HNO3(разб)→ ...
4) NO2,
5) N2,
6) N2O5.
35
9. Установите соответствие между схемой химической
реакции и изменением степени окисления окислителя в ней:
СХЕМА РЕАКЦИИ
ИЗМЕНЕНИЕ СТЕПЕНИ
ОКИСЛЕНИЯ ОКИСЛИТЕЛЯ
А)Cu + HNO3(конц)→ ...; 1)Cu+2 → Cu0,
Б) NH4NO2 → ... (t °C);
2)N+3→N0,
В)CuO+NH3→...;
3) N+5 → N+4,
Г)NaNO3→...(t°C);
4)N‒3→N0,
5) Cu0 → Cu+2
,
6) N+5 → N+3.
10. Массовые доли азота и кислорода в оксиде азота со-
ответственно равны 30,43 и 69,57 %. Укажите простейшую
формулу оксида:
а) NO,
б) N2O,
в) NO2,
г) N2O5,
д) N2O3.
4.4. Тестовые задания по теме «Фосфор»
1. Максимальную степень окисления фосфор проявляет
в составе:
а) фосфидов металлов,
б) метафосфорной кислоты,
в) фосфористой кислоты,
г) фофина,
д) ортофосфатов.
2. Фосфор является окислителем, реагируя с:
а) кальцием,
б) хлоратом калия,
в) галогенами,
г) гидроксидом калия,
д) кислородом.
3. Отметьте формулы веществ, с которыми реагирует ок-
сид фосфора (V):
а) КОН,
б) СО2,
в) HNO3,
36
г) H2O,
д) CuO.
4. С какими веществами реагируют как ортофосфорная,
так и азотная разбавленная кислота:
а) аммиак,
б) сульфат кальция,
в) серебром,
г) оксид фосфора (III),
д) оксидом магния.
5. Укажите формулы веществ, с которыми фосфат калия
реагирует с образованием осадка:
а) H3PO4,
б) AgNO3,
в) H2SO4 (конц),
г) CaCl2,
д) Cu(OH)2.
6. В каких рядах указаны формулы веществ, все из кото-
рых реагируют с ортофосфорной кислотой:
а) NH3, K2O, Ca(H2PO4)2;
б) Na2CO3, Ba(NO3)2, H2O;
в) K2HPO4, CaO, NH4HCO3;
г) CaHPO4, Ca, KHS;
д) Cu, Mg, KOH.
7. Чтобы дигидрофосфат натрия перевести в гидрофос-
фат натрия нужно воспользоваться реактивом:
а) гидроксид калия,
б) ортофосфорная кислота,
в) вода,
г) гидроксид натрия,
д) гидроксид магния.
8. Какие из приведенных реакций могут быть использо-
ваны для получения ортофосфорной кислоты:
а) Ca3(PO4)2 + H2SO4 → ...;
б)Na3PO4+CO2+H2O→...;
в)KH2PO4+KOH→...;
г) Na3PO4 + H2SiO3 → ...;
д)HPO3+H2O→...
9. Укажите формулы дигидроортофосфатов:
а) MgH2P2O7,
б) K2HPO4,
37
в) NaH2PO4,
г) (NH4)2HPO4,
д) NH4H2PO4.
10. С какими веществами может реагировать дигидро-
ортофосфат аммония:
а) гидроксидом калия,
б) хлоридом калия,
в) аммиаком,
г) гидроксидом магния,
д) водой.
5. Подгруппа углерода
5.1 . Упражнения и задачи
138. Составьте уравнения реакций, соответствующих
схемам:
а)С0→С‒4→С‒4→С+4→С+2;
б)С0→С0→С+2→С+4→С0;
в)Si+4→Si0→Si‒4→Si+4→Si+4.
139. Напишите уравнения реакций, с помощью которых
можно осуществить следующие превращения:
а)СО2→С→СО→СО2→СаСО3→Са(НСО3)2→СаСО3→СО2,
б)Si→Mg2Si→SiH4→SiO2→SiF4→Si→Na2SiO3,
в)С→СО2→Na2СO3→СаСО3→СО2→С,
г) Са(НСО3)2 → СаСО3 →Са(НСО3)2 → NaНСO3 → СО2 → О2,
д) Si
NaOH
CuO
H2SO4
H2S
HCl
А
Б
В
Г
Д
Е
Ж
HF
е)SiO2→Si→Х→ВаSiО3,
ж)
1
2
3
4
5
6
7
8
Si
Mg2Si
SiH4
SiO2
BaSiO3
K2SiO3
Si
SiO2
140. Приведите по два уравнения реакций, в которых уг-
лерод и кремний выступают:
а) в качестве восстановителей,
б) в качестве окислителей.
141. Завершите уравнения реакций:
а)SiO2+C→...;
б)Si+KOH→...;
в)CaCO3+C→...;
г) NO2 + Na2SiO3 → ...;
д)Na2SO4+C→...;
е) SO2 + Na2SiO3 → ...;
ж)SiO2+HF→...;
з) NH4Cl + K2SiO3 → ...;
39
и)Cl2+CO→...;
к)CuO+CO→...
142. Тонкий порошок гидрокарбоната натрия применя-
ется для сухого огнетушения. Какое превращение происходит
с веществом при нагревании и как это связано с противопо-
жарным действием?
143. Один из технических способов получения соды за-
ключается в действии воды и углекислого газа на алюминат
натрия. Составьте уравнение реакции.
144. Приведите пример растворимой в воде соли, при
действии на которую как кислоты, так и щелочи (при нагрева-
нии) выделяется газ. Напишите уравнения реакций.
145. Приведите уравнения реакций, которые лежат в ос-
нове получения различных стекол.
146. Какие соединения называют жидкими стеклами?
На каких свойствах жидких стекол основано их практическое
использование?
147. Составьте структурные формулы соединений угле-
рода с кислородом, алюминием, серой, фтором. Укажите степе-
ни окисления и валентности атомов.
148. Плотность по водороду смеси СО2 и О2 равна 19. Вы-
числите объемные и массовые доли газов в их смеси.
149. Определите объем водорода (н. у.), выделившегося
при обработке раствором гидроксида натрия смеси, получен-
ной при сплавлении 6 г магния с 45 г оксида кремния (IV).
150. При обработке кислотой 9,92 г смеси карбидов каль-
ция и алюминия образуется 4,48 л (н. у.) смеси газов. Опреде-
лите состав смеси карбидов (в % по массе).
151. Смесь водорода и оксида углерода (II) общим объе-
мом 3,36 л (н. у.) пропустили через трубку с раскаленным окси-
дом меди (II). Какая масса меди после этого образовалась?
Насколько уменьшилась масса трубки?
152. Известняк, содержащий 20 % примесей по массе, об-
работали избытком кислоты, а полученный газ пропустили
через избыток раскаленного угля. Какой газ и в каком объеме
образуется?
153. 24 г технического карбида кальция обработали из-
бытком раствора соляной кислоты. Определите объем (н. у.)
40
полученного при этом газа, если массовая доля примесей
в карбиде кальция составляет 10 %, а выход газообразного
продукта реакции равен 80 %.
154. Газовая смесь, состоящая из угарного и углекислого
газов (н. у.), имеет такую же массу, как и 1 моль воздуха,
и занимает объем, равный объему 21 г азота. Найдите массу
и объем каждого газа в смеси.
155. Через раствор Са(ОН)2 пропустили смесь оксида уг-
лерода (II) и оксида углерода (IV). В результате этого выпал
осадок массой 10 г, а объем газа стал равным 4,48 л (н. у.).
Определите объемную долю СО в исходной смеси.
156. 14 л (н. у.) смеси азота, угарного газа и углекислого
газа последовательно пропустили через избыток известковой
воды и над нагретым оксидом меди (II). В результате образо-
валось 15 г осадка и 12,6 г меди. Определите объемные доли
газов в исходной смеси.
157. К 200 г 3 %-го раствора хлорида кальция добавили
24 г кристаллогидрата карбоната натрия (кристаллизуется с
10 молекулами воды). Через образовавшуюся смесь пропусти-
ли 1,5 л углекислого газа (н. у.), после чего раствор профиль-
тровали. Вычислите массу осадка.
158. Оксид углерода (IV), полученный при действии из-
бытка кислоты на 28,5 г магнезита, поглощен раствором едко-
го натра. При этом масса раствора возросла на 13,75 г.
Определите массовую долю карбоната магния в магнезите.
159. Газ, полученный при сжигании 5,6 л смеси этана и
пропана, плотность которой по водороду равна 19,9, пропусти-
ли в 160 г раствора с массовой долей NaOH 20 %. Чему равны
массы всех веществ в конечном растворе?
160. Обычное сырье при варке стекла — сода, известняк и
кремнезем. Рассчитайте массу каждого из этих веществ, необ-
ходимую для производства 20 кг стекла, состав которого опи-
сывается формулой Na2O × CaO × 6SiO2.
161. Тугоплавкое стекло содержит (в процентах по массе)
18,43 % оксида калия, 10,98 % оксида кальция и 70,59 % диок-
сида кремния. Выразите его состав через оксиды и найдите
массу поташа, содержащего 6 % примесей, нужную для получе-
ния 100 кг такого стекла.
41
162. При обработке 50 г плавикового шпата серной кис-
лотой получили фтороводород, при взаимодействии которого
с избытком оксида кремния (IV) получили 5,6 л (н. у.) тет-
рафторида кремния. Найдите массовую долю СaF2 в плавико-
вом шпате.
163. Имеется смесь кремния, алюминия и карбоната
кальция. При обработке ее раствором щелочи выделяется
17,92 л (н. у.) газа, а при обработке такой же навески исход-
ной смеси избытком соляной кислоты так же выделяется
17,92 л (н. у .) газов, пропускание которых через раствор
Са(ОН)2 дает 16,2 г гидрокарбоната кальция. Определите коли-
чественный (моль) состав смеси.
164. При взаимодействии с серной кислотой 4,1 г сплава
алюминия с кремнием выделилось 3,36 л (н. у.) водорода, а при
растворении такого же сплава в щелочи получено 5,6 л (н. у.)
водорода. Определите массовые доли компонентов в исходной
смеси.
165. Имеется смесь кремния, алюминия и карбоната
кальция. Определите массовую долю кремния в смеси, если
известно, что при обработке этой смеси раствором щелочи
выделяется 26,88 л (н. у.) смеси газов с относительной плотно-
стью по водороду, равной 8.
166. При обработке 40 г смеси меди, цинка, оксида крем-
ния и оксида цинка разбавленной серной кислотой выдели-
лось 4,48 л (н. у.) газа. Не растворившийся осадок был сплавлен
со стехиометрическим количеством карбоната натрия, при
этом получили 3,36 л газа (н. у.). После обработки сплава водой
твердый остаток растворили в концентрированной серной
кислоте и получили 2,24 л газа (н. у.) . Определите массовую
долю оксида цинка в смеси.
5.2. Тестовые задания по теме «Углерод»
1. Аллотропными модификациями углерода являются:
а) графит,
б) активированный уголь,
в) карбид,
г) кокс,
д) алмаз.
42
2. Степени окисления углерода в хлорметане и карбиде
кальция соответственно равны:
а) +1,
б) ‒1,
в) ‒4,
г) +2,
д) ‒2.
3. Углерод выступает в качестве восстановителя в реак-
циях с:
а) водородом,
б) оксидом меди (II),
в) алюминием,
г) кислородом,
д) кальцием.
4. Кристаллическую структуру, подобную структуре ал-
маза имеют:
а) кремнезем,
б) оксид натрия,
в) кристаллический йод,
г) карборунд,
д) белый фосфор.
5. Гидрокарбонат натрия можно перевести в карбонат
натрия:
а) прокаливанием,
б) взаимодействием с NaOH(р-р),
в) взаимодействием с соляной кислотой,
г) с помощью водного раствора углекислого газа,
д) карбонатом магния.
6. Карбонат-ион можно обнаружить с помощью:
а) KOH,
б) HCl,
в) NaCl,
г) CaCl2,
д) BaSO4.
7. Какое вещество является реактивом на углекис-
лый газ?
а) магний,
б) гидроксид кальция,
в) гидроксид калия,
43
г) баритовая вода,
д) оксид кальция.
8. В лаборатории углекислый газ в основном получают:
а) сжиганием метана,
б) взаимодействием мрамора с соляной кислотой,
в) обжигом известняка,
г) сжиганием угля в избытке кислорода.
9. Карбонат калия в растворе не взаимодействует с:
а) сульфатом натрия,
б) азотной кислотой,
в) углекислым газом,
г) гидроксидом натрия,
д) гидроксидом бария.
10. Относительная плотность по водороду смеси СО и СО2
равна 18. Объемная доля (%) СО2 в газовой смеси составляет:
а) 45,
б) 50,
в) 55,
г) 60.
5.3 . Тестовые задания по теме «Кремний»
1. Чем различаются между собой атомы кремния и атомы
углерода:
а) зарядом ядра;
б) числом валентных электронов;
в) числом энергетических уровней;
г) числом вакантных орбиталей на внешнем энергетиче-
ском уровне;
д) высшей степенью окисления
2. Оксид кремния реагирует с:
а) фтороводородной кислотой;
б) сульфатом меди;
в) водой;
г) карбонатом калия;
д) фосфорной кислотой
3. Что общего между оксидами кремния (IV) и углеро-
да (IV):
а) тип кристаллических решеток для твердых оксидов;
б) степень окисления атомов кремния и углерода;
44
в) валентность атомов кремния и углерода;
г) реакцией с водой;
д) оба несолеобразующие?
4. Укажите схемы реакций, в которых кремний является
восстановителем:
а) Mg2Si + H2O → SiH4↑ + Mg(OH)2;
б)SiO2+C→Si+CO↑;
в)SiO2+K2O→...;
г) Si + KOH(р-р) → ...;
д)Si+O2→...
5. С какими веществами реагируют водные растворы как
силиката, так и гидрокарбоната калия:
а) Ba(OH)2,
б) HCl,
в) NaCl,
г) NaOH,
д) CuSO4?
6. Укажите схемы реакций, в результате которых может
образоваться кремниевая кислота:
а)SiO2+H2O→...;
б)Si+NaOH(р-р)→...;
в)K2SiO3+H2O→...;
г)Na2SiO3+H2O+SO2→...;
д) K2SiO3 + H3РО4 → ...
7. Соединения кремния с металлами называются:
а) силикатами,
б) кремнеземами,
в) силанами,
г) силицидами,
д) силикагелями.
8. Кремнезем растворяется в:
а) соляной кислоте,
б) царской водке,
в) воде,
г) плавиковой кислоте,
д) концентрированном растворе щелочи.
9. Концентрированные растворы силикатов натрия и ка-
лия называют:
а) жидкими кристаллами,
б) кристаллогидратами,
45
в) жидким стеклом,
г) жидким мылом,
д) растворимыми стеклами.
10. Соединение содержит по массе 70 % кремния и 30 %
углерода. Укажите его простейшую формулу:
а) SiC2,
б) Si2C,
в) SiC,
г) Si3C2.
6. Металлы IA и IIА групп
6.1. Упражнения и задачи
167. Напишите уравнения реакций, позволяющих осуще-
ствить следующие превращения: вода → водород → хлорово-
дород → хлорид натрия → натрий → пероксид натрия →
кислород → вода →водород → гидрид натрия → гидроксид
калия → карбонат калия → гидрокарбонат калия → карбонат
калия → водород → вода → кислород → пероксид натрия →
оксид натрия → гидроксид натрия.
168. Какие из указанных газов: H2S, H2, Cl2, CO2, NO будут
поглощаться при пропускании их через раствор едкого натра?
Напишите соответствующие уравнения реакций.
169. Составьте уравнения реакций в соответствии со схе-
мами превращений:
а)K→KH→KOH→KNO3→KNO2→K2SO4→KCl→HCl,
б) Mg → MgSO4 → Mg(NO3)2 → MgO → (CH3COO)2Mg,
в) CaCO3 → CaO → Ca(OH)2 → CaCO3 → Ca(NO3)2,
д)LiCI→Li→Li3N→LiOH→LiHSO3,
е) CaCl2 → Ca → CaO → Ca(OH)2 → CaCO3 → Ca(HCO3)2 → Ca-
CO3 → CaCl2,
ж) Na
O2
CO2
SO2
CaCl2
А
Б
В
Г
з)Cl2→CaOCl2→CaCO3→CaO→CaC2→Ca(OH)2→
→ Ca(HSO3)2,
и) SrCO3 → Sr(HCO3)2 → SrCO3 → Sr(NO3)2 → SrSO3 →
→ SrSO4 → SrS.
170. Напишите уравнения реакций, соответствующие
следующей схеме:
Mg(NO3)2 → Х1 → X2 → Mg(NO3)2.
Определите неизвестные вещества. Рассмотрите два
случая:
а) все реакции обменные,
б) все реакции — окислительно-восстановительные.
171. Найдите неизвестные вещества в схемах превра-
щений:
а) Na2SO4 → NaBr → X → NaHSO4,
б) MgSO4 → X1 → MgCl2 → X2 → Mg(OH)2,
47
в)
CaC2
Ca(CH3COO)2
X1
X2
г)
1
2
3
4
56
X1
X2
Ca(HCO3)2
CaO
172. Почему нельзя тушить горящий магний углекислот-
ным огнетушителем?
173. Имеется смесь карбонатов калия и кальция. Предло-
жите схему получения чистых металлов из этой смеси.
174. Имеется смесь кальция, оксида кальция и карбида
кальция с молярным соотношением 1:3:4 (в порядке перечис-
ления). Какой объем воды может вступить в химическое взаи-
модействие с 35 г такой смеси?
175. В 150 г воды растворили 11,2 г лития. Рассчитайте
массовую долю вещества в полученном растворе.
176. Рассчитайте количество вещества воды, в котором
необходимо растворить 18,8 г оксида калия для получения
5,6 %-го раствора гидроксида калия.
177. Сколько граммов оксида натрия надо растворить
в 676 г раствора, содержащего 160 г едкого натра, чтобы полу-
чить 40 %-й раствор щелочи?
178. Вычислите количество вещества калия и массу воды,
необходимые для приготовления 150 г 15 %-го раствора щелочи.
179. Какую массу лития нужно растворить в 0,1 л воды
для получения раствора с массовой долей щелочи, равной 0,1.
180. К 250 г 0,1 %-го водного раствора гидроксида каль-
ция добавили 0,1 г оксида кальция. Вычислите массовую долю
вещества в полученном растворе.
181. Растворимость гидроксида лития в 100 г воды при
30 °С равна 12,7 г. К раствору, полученному смешением 12 г
оксида лития с 200 г 1,5 %-го раствора гидроксида лития,
добавили 2,1 г лития. Вычислите массу образовавшегося осадка.
48
182. Смешали 50 г раствора гидроксида натрия с массо-
вой долей 10 % и 100 г гидрокарбоната натрия с массовой
долей 5 %. Рассчитайте массовые доли веществ в новом рас-
творе.
183. 25 г питьевой соды прокалили и остаток растворили
в 200 г воды. Вычислите массовую долю соли в растворе.
184. Амальгамы представляют собой сплавы различ-
ных металлов со ртутью. 50 г амальгамы калия поместили в
100 мл воды. Рассчитайте с точность до тысячных долей мас-
совую долю гидроксида калия в образовавшемся растворе,
если в амальгаме содержалось 1,95 % калия по массе.
185. При кипячении 1 л воды из скважины образовался
осадок карбоната кальция массой 1 г. Рассчитайте молярную
концентрацию гидрокарбоната кальция в воде.
186. После полного обезвоживания 2,11 г смеси глауберо-
вой соли (Na2SO4 × 10 H2O) и соды (Na2СO3 × 10 H2O) ее масса
уменьшилась до 0,85 г. Определите массовый состав (в % по
массе) исходной смеси кристаллогидратов.
187. Некоторую массу соли состава MgCO3 × H2O прокали-
вали до прекращения выделения газов. Последние были про-
пущены через промывные склянки с концентрированной
серной кислотой и известковой водой. Масса первой склянки
увеличилась на 1,8 г, а во второй выпало 2 г осадка. Определи-
те состав исходного кристаллогидрата и его массу.
188. Смесь оксида натрия и оксида калия общей мас-
сой 6 г растворили в 100 г 15 %-го раствора гидроксида калия.
На нейтрализацию полученного раствора потребовалось
72,89 мл 20 %-й соляной кислоты (ρ = 1,1 г/мл). Рассчитайте
массовые доли оксидов в исходной смеси.
189. Металлический кальций массой 4 г сплавили с из-
бытком графита. На полученное твердое вещество подейство-
вали избытком соляной кислоты, при этом выделился газ,
который образует осадок при пропускании через аммиачный
раствор оксида серебра. Напишите уравнения всех описанных
процессов и рассчитайте массу осадка.
190. Образец смеси хлоридов аммония, натрия, калия
массой 10 г прокалили в платиновом тигле. Сплав раствори-
ли в воде, а полученный раствор обработали небольшим
49
избытком нитрата серебра. Масса выпавшего осадка оказалась
равной 1,89 г. Установите массовые доли исходных веществ в
исходной смеси, если после прокаливания масса смеси умень-
шилась на 0,5 г.
191. Определите состав смеси хлоридов натрия и калия
(в граммах), если известно, что при нагревании 4,15 г этой
смеси с избытком концентрированной серной кислоты было
получено газообразное вещество, при растворении которого в
22,8 мл воды получили кислый раствор. Чему равна массовая
доля вещества в этом растворе, если при действии на раствор
избытка цинковой пыли выделилось 0,672 л газа (н. у.) .
192. Кусок металлического лития долгое время находил-
ся на воздухе при комнатной температуре. Затем его раствори-
ли в воде при нагревании и получили раствор и 4,704 л газовой
смеси. Эту газовую смесь вновь пропустили через воду, при
этом объем газовой смеси уменьшился до 4,48 л. Полученный
в первом случае раствор потребовал для нейтрализации
193,45 г 10 %-го раствора соляной кислоты. Установите исход-
ную массу лития и состав окисленного куска лития.
193. Через раствор хлорида натрия пропускали электри-
ческий ток. При этом выделилось 3360 мл хлора (н. у.) . Масса
исходного раствора 200 г, а массовая доля NaCl — 0,2. Вычис-
лите состав раствора в массовых долях после окончания элек-
тролиза.
194. Кислород, выделившийся при прокаливании 8,5 г нит-
рата натрия, смешали с водородом, выделившимся при взаи-
модействии натрия с водой. Образовавшуюся газовую смесь
подожгли. По окончании реакции выяснилось, что объем неиз-
расходованного кислорода составил 110 мл (н. у.). Вычислите
массу натрия, вступившего в реакцию.
195. 13,44 л оксида серы (IV) (н. у.) пропустили через
трубку, заполненную 50 г смеси оксида натрия и хлорида
натрия. Вышедший из трубки газ обесцветил бромную воду,
содержащую 16 г брома. Определите массовые доли веществ в
исходной смеси.
196. Два стакана одинаковой массы, в одном из которых
находится 100 г 18,25 %-й соляной кислоты, а в другом — 100 г
16 %-го раствора сульфата меди (II), поместили на две чаши
50
весов. К соляной кислоте добавили 2 г карбоната кальция.
Вычислите массу железа, которую нужно добавить в другой
стакан, чтобы весы уравновесились.
197. Образец соединения натрия с кислородом мас-
сой 7,8 г содержит 1,2×1023 атомов натрия. Определите форму-
лу этого соединения.
198. Гидрид щелочного металла массой 0,8 г поместили
в 50 мл раствора гидрокарбоната того же металла с молярной
концентрацией 0,4 моль/л. По окончании выяснилось, что в
растворе находится только одна соль. Какая это соль? Опреде-
лите ее массу.
199. При действии избытка оксида углерода (IV) на
13,75 г пероксида щелочного металла выделился газ объемом
1,4 л (н. у.) . Напишите уравнение реакции и определите металл.
200. При реакции одновалентного металла с водой обра-
зуется хорошо растворимое в воде соединение и выделяется
газ, причем масса вещества в растворе после реакции в грам-
мах относится к объему выделившегося газа в литрах как 5:1.
Назовите металл.
201. 1,97 г карбоната двухвалентного металла прокалили
при 800 °С. Полученный белый порошок бурно прореагировал с
водой. К образовавшемуся раствору прибавили избыток рас-
твора сульфата калия. Промытый и высушенный осадок весит
2,33 г. Определите металл. Напишите уравнения реакций.
6.2 . Тестовые задания
по теме «Щелочные металлы»
1. Укажите характеристики, одинаковые для всех щелоч-
ных металлов:
а) число электронов на внешнем энергетическом уровне,
б) основной характер оксидов,
в) число энергетических уровней в атоме,
г) степень окисления в соединениях.
2. Атомы калия и натрия различаются между собой:
а) числом энергетических уровней,
б) числом валентных электронов,
в) размерами,
г) числом протонов в ядре.
51
3. Отметьте схемы реакций, в которых получится гидрок-
сид натрия:
а)Na+H2O→...;
б) Na2CO3 + Ba(OH)2 → ...;
в)NaNO3+KOH→...;
г)Na2O+H2O→...
4. При взаимодействии щелочных металлов с водой обра-
зуются:
а) гидриды и кислород,
б) щелочи и водород,
в) пероксиды и водород,
г) супероксиды и озон.
5. С кислотами все щелочные металлы реагируют:
а) со взрывом,
б) очень медленно,
в) с образованием щелочей и водорода,
г) только при сильном охлаждении.
6. Карбонаты щелочных металлов при прокаливании:
а) разлагаются по уравнению Ме2СО3 = Ме2О + СО2↑,
б) не разлагаются даже при сильном нагревании,
в) разлагаются по уравнению: 2Ме2СО3 = 4Ме + 2СО2↑+ О2↑,
г) возгоняются.
7. Щелочные металлы могут реагировать со спиртами,
образуя при этом:
а) гидроксиды металлов и простые эфиры,
б) гидриды металлов и альдегиды,
в) алкоголяты металлов и водород,
г) азиды и сложные эфиры.
8. Укажите формулы веществ, с которыми реагирует ок-
сид калия:
а) Al2O3,
б) NaOH,
в) H2SO4,
г) CrO3.
9. Укажите формулы веществ, с которыми реагирует гид-
роксид натрия:
а) Cl2,
б) Al2O3,
в) Al,
г) BaSO4.
52
10. При длительном прокаливании нитрата щелочного
металла масса образовавшихся газообразных продуктов соста-
вила 78,26 % от исходной массы нитрата. Установите формулу
нитрата:
а) KNO3,
б) CsNO3,
в) LiNO3,
г) RbNO3.
6.3 . Тестовые задания
по теме «Щелочноземельные металлы»
1. Укажите формулы веществ, с которыми реагирует из-
вестковая вода:
а) СО2,
б) Са(НСО3)2,
в) Cl2,
г) К2СО3.
2. Временную жесткость воды можно устранить:
а) добавлением известкового молока,
б) добавлением кальцинированной соды,
в) кипячением,
г) добавлением питьевой соды.
3. Укажите формулы солей, обуславливающих постоян-
ную жесткость воды:
а) Mg(HCO3)2,
б) Ca(HCO3)2,
в) CaCl2,
г) MgSO4.
4. Укажите схемы реакций, в результате которых можно
получить карбонат кальция:
а) СаCl2 + К2СО3 → ...;
б) 1 моль Са(ОН)2 + СО2 (избыток) → ...;
в)1мольСа(ОН)2+1мольСО2→...;
г) Са(НСО3)2 + КОН → ...
5. Известковая вода используется для обнаружения:
а) оксида азота (IV),
б) оксида углерода (II),
в) оксида углерода (IV),
г) хлорид-ионов.
53
6. Формулы белильной и негашеной извести соответ-
ственно указаны в ряду:
а) Ca(OCl)2 и Са(ОН)2;
б) Ca(ClО2)2 и СаСО3;
в) Ca(OCl)2 и СаО;
г) Ca(ClО2)2 и СаС2.
7. Ряд, в котором основные свойства гидроксидов возрас-
тают:
а) КОН, Mg(OH)2, Ba(OH)2;
б) Bе(OH)2, Mg(OH)2, КОН;
в) Ba(OH)2, Сa(OH)2, КОН;
г) Mg(OH)2, Bе(OH)2, КОН.
8. Карбонаты щелочноземельных металлов при прокали-
вании дают:
а) оксиды металлов и углекислый газ;
б) при прокаливании остаются неизменными;
в) металл, углекислый газ и кислород;
г) металл, угарный газ и кислород.
9. Имеется смесь кальция, гашеной извести и карбида
кальция с молярным соотношением 1:3:4 (в порядке перечис-
ления). Какой объем воды может вступить в химическое взаи-
модействие с 35 г такой смеси?
а) 12,15 мл;
б) 22,4 л;
в) 10 мл;
г) такая смесь не взаимодействует с водой.
10. Карбонат кальция:
а) распространенное в природе вещество,
б) белое, нерастворимое в воде вещество,
в) при прокаливании не разлагается,
г) не реагирует с кислотами,
д) реагирует с солями аммония в горячем растворе,
е) применяется для производства стекла.
7. Алюминий и его соединения
7.1 . Упражнения и задачи
202. Продолжите уравнения предложенных реакций:
а) AlCl3 + KOH (избыток) → ...;
б) AlCl3 + KOH (недостаток) → ...;
в) AlCl3 + NH3 (избыток) + Н2О → ...;
г)AlCl3+Na2S+H2O→...;
д) AlCl3 + Na2CO3 (раствор) → ...;
е) Al2S3 + HNO3 (конц.) → ...;
ж)Аl+C→...;
з)Al+N2→...;
и)Al+Fe3O4→...;
к) Na[Al(OH)4] + CO2 (избыток) → ...;
л) Na[Al(OH)4] + HBr (избыток) → ...;
м)KNO3+Al+KOH→...;
н) Al2O3 + K2CO3 (тв.) → ...
203. Напишите уравнения реакций, соответствующие
следующим последовательностям превращений:
а) AlCl3
X1
X2
X3
X4
Al(OH)3
KOH
H2S
Pb(NO3)2
O2
Al(OH)3
б) Al(NO3)3 → X1 → Al(OH)3 → X2 → Al2O3,
в)
Al2S3
AlCl3
X1
X2
г)
Al2(SO4)3
Al2O3
X1
X2
55
д) Al2(SO4)3 + X1
Al(OH)3
KOH
X2
CO2 X3
Al2(SO4)3
X4
SO2
Br2 + H2O
X4
X3 Al2(SO4)3
е)
KAlO2
Al(OH)3
X1
X2
Определите неизвестные вещества. Укажите условия
протекания реакций.
204. Напишите уравнения реакций превращения алюми-
ния и его соединений, указав условия протекания реакций:
а) Al → AlCl3 → Al(NO3)3 → KAlO2 → K[Al(OH)4] → Al(OH)3 →
→ AlCl3 → Al,
б) Al → Al2(SO4)3 → Al(OH)3 → Na[Al(OH)4] → Al(OH)3 →
→ Al(OH)2NO3 → AlOH(NO3)2 → Al(NO3)3 → Al2O3 → Al → Al2S3
→ Al(OH)3 → K[Al(OH)4] → K2CO3,
в)Al+NaOH
А
HCl Б
Na2SO3 В
Г
H2O2
Д
Е
H2SO4 Ж
Br2
г) Al → AlBr3 → Al(OH)3 → KAlO2 → K[Al(OH)4] → Al(OH)3.
205. В одной пробирке находится хлорид магния, в дру-
гой — хлорид алюминия. С помощью какого одного реактива
можно установить, в какой из пробирок находится каждая
соль?
206. Какой из указанных ниже способов можно использо-
вать для получения сульфида алюминия:
а) нагревание сульфата алюминия с углем,
б) взаимодействие алюминия с серой в отсутствие влаги
при нагревании,
в) смешивание растворов сульфида натрия и хлорида
алюминия?
Напишите уравнения реакций, происходящих в каждом
случае.
207. Имеются два газа — А и Б, молекулы которых трех-
атомны. При добавлении каждого из них к раствору алюмината
56
калия выпадает осадок. Предложите возможные формулы А
и Б, имея в виду, что молекулы каждого газа состоят из атомов
только двух элементов. Как можно химическим путем разли-
читьАиБ?
208. Вычислите объем газа (н. у.), который выделится
при взаимодействии алюминия массой 2,7 г с 40 %-м раство-
ром гидроксида калия массой 50 г.
209. Сколько граммов оксида меди (II) восстановится во-
дородом, выделившимся при взаимодействии алюминия с
139,87 мл 40 %-го раствора гидроксида натрия (ρ = 1,287 г/мл)?
210. Определите объем водорода, образующегося при
взаимодействии 15 г сплава силумина (89 % Al, 11 % Si (по
массе)) с избытком раствора щелочи.
211. Массовая доля алюминия в его сплаве с медью
составляет 70 %. Какую массу сплава обработали концентри-
рованным раствором гидроксида калия, если при этом выде-
лилось 61 мл водорода (н. у.)?
212. При растворении 1,11 г смеси железных и алюмини-
евых опилок в 18,25 %-й соляной кислоте (ρ = 1,09 г/мл) выде-
лилось 0,672 л водорода (при н. у.) . Найдите массовые доли
металлов в смеси и определите объем соляной кислоты, израс-
ходованной на растворение смеси.
213. Для полного разложения некоторого количества
гидроксида алюминия потребовалось 28,5 кДж теплоты. Полу-
ченное твердое вещество растворили в 300 г 21 %-й азотной
кислоты. Рассчитайте массовую долю соли в полученном рас-
творе. Тепловой эффект реакции разложения гидроксида алю-
миния равен 95 кДж/моль.
214. При взаимодействии навески алюминия с раствором
гидроксида натрия выделилось 30 л газа (н. у.) . Какой объем
оксида азота (II) (н. у.) выделится при взаимодействии такой
же навески алюминия с 40 %-й азотной кислотой?
215. Смешали 400 г раствора гидроксида натрия (ω = 2 %)
и 243,3 г раствора хлорида алюминия (ω = 30 %). Найдите
массовые доли солей в полученном растворе.
216. Определите массу гидроксида алюминия, образую-
щегося при сливании раствора, содержащего 14 г NaOH, и рас-
твора, содержащего 13,35 г AlCl3.
57
217. Определите состав и массу твердого остатка, полу-
ченного при прокаливании осадка, образовавшегося при сли-
вании по 25 г 8 %-х растворов хлорида алюминия и гидроксида
натрия.
218. К 50 г 4 %-го раствора бромида алюминия прибави-
ли 50 г 4 %-го раствора гидроксида натрия. Определите массо-
вые доли веществ в образовавшемся растворе.
219. Вычислите максимальную массу гидроксида бария,
которая вступит в реакцию с 150 г 5 %-го раствора сульфата
алюминия.
220. К 50 мл 0,2М раствора нитрата алюминия
(ρ = 1,03 г/мл) добавили 6,84 г гидроксида бария. Вычислите
массу раствора после окончания реакции.
221. Какой объем 3,5М раствора КОН потребуется для
полного растворения 32 г смеси гидроксидов бериллия и алю-
миния, если массовая доля кислорода в смеси гидроксидов
составляет 65 %?
222. Для растворения 1,26 г сплава магния с алюмини-
ем использовано 35 мл 19,6 %-го раствора серной кислоты
(ρ = 1,14 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл
раствора гидрокарбоната калия с концентрацией 1,4 моль/л.
Определите массовые доли металлов в сплаве и объем газа
(при н. у.), выделившегося при растворении сплава.
223. 13,8 г смеси, состоящей из кремния, алюминия
и железа, обработали при нагревании избытком гидроксида
натрия, при этом выделилось 11,2 л газа (н. у .). При дей-
ствии на такую же массу смеси избытка соляной кислоты
выделяется 8,96 л газа (н. у .). Определите массы компонен-
тов смеси.
224. Пластина дюралюминия (сплав алюминия, меди и
магния) массой 8 г опущена в раствор соляной кислоты, при
этом выделилось 9,42 л водорода. Из полученного раствора
добавлением избытка щелочи был получен осадок, масса кото-
рого после прокаливания составила 2,7 г. Определите состав
сплава (в % по массе).
225. Смесь сульфата меди (II) и сульфата алюминия,
в которой число атомов кислорода равно числу Авогадро,
а число атомов меди составляет 25 % от числа атомов серы,
58
растворили в воде. К полученному раствору добавили избыток
раствора КОН. Вычислите массу выпавшего осадка.
226. Сплав алюминия с серебром обработали избытком
концентрированного раствора азотной кислоты, остаток рас-
творили в уксусной кислоте. Объемы газов, выделившиеся в
обеих реакциях и измеренные при одинаковых условиях, ока-
зались равными между собой. Вычислите массовые доли ме-
таллов в сплаве.
227. Какую массу квасцов KAl(SO4)2 × 12H2O необходимо
добавить к 1000 г 5 %-го раствора сульфата калия, чтобы мас-
совая доля последнего увеличилась вдвое? Найдите объем газа
(при н. у.), который выделится при действии на полученный
раствор избытка сульфида калия.
228. Какую массу квасцов KAl(SO4)2 × 12H2O необходимо
добавить к 500 г 6 %-го раствора сульфата калия, чтобы массо-
вая доля последнего увеличилась вдвое? Найдите объем газа
(при н. у.), который выделится при действии на полученный
раствор избытка сульфида калия.
229. При действии избытка соляной кислоты на смесь
алюминия и неизвестного одновалентного металла получено
6,72 л (н. у.) водорода, а масса металлов уменьшилась вдвое.
При действии на не растворившийся остаток азотной кислотой
получено 0,5 г оксида азота (II). Найдите отношение количеств
веществ металлов в смеси, установите второй металл.
230. При сжигании в атмосфере кислорода 23,6 г смеси
фосфида и сульфида одного элемента III группы с равными
массовыми долями образовался осадок массой 36,78 г и выде-
лилось 6,72 л газа (н. у.) с плотностью по кислороду 2. Устано-
вите, какой элемент входит в состав соединений.
7.2 . Тестовые задания
по теме «Алюминий и его соединения»
1. Укажите формулы веществ, с которыми при обычных
условиях реагирует алюминий:
а) HCl (р-р),
б) KOH (р-р),
в) H2SO4 (разб.),
г) HNO3 (конц.) .
59
2. Установите формулы веществ, которые образуются
при взаимодействии алюминия и избытка водного раствора
гидроксида натрия:
а) Al(OH)3 и H2,
б) Na[Al(OH)4] и Al(OH)3,
в) Al3O3 и H2,
г) Na[Al(OH)4] и H2.
3. Отметьте формулу вещества, которое образуется при
сплавлении оксида алюминия и гидроксида калия:
а) K[Al(OH)4],
б) K2AlO2,
в) KAlO2,
г) Al(OH)3.
4. Формула продукта, который образуется при взаимо-
действии AlCl3 с избытком NaOH, — это:
а) Al(OH)3,
б) Al(OH)2Cl,
в) (AlOH)Cl2,
г) Na[Al(OH)4].
5. Укажите схемы реакций, в которых образуется гидрок-
сид алюминия:
а)Al+H2O→...,
б) Al(NO3)3 + KOH(изб.) → ...,
в) 1 моль Al2(SO4)3 + 6 моль KOH → ...,
г)Al3O3+H2O→...
6. Схема алюминотермического процесса — это:
а) Al3O3 + К2O →... (t °C);
б)Al+Fe3O4→...(t°C);
в) Al + KOH(р-р) → ...;
г)Al3O3+H2SO4→...
7. Укажите формулы веществ, с которыми при опреде-
ленных условиях реагирует оксид алюминия:
а) H2О,
б) К2О,
в) H2SO4,
г) NaОН.
8. Между собой взаимодействуют пары веществ:
а) Al(OH)3 и КNO3,
б) Al(OH)3 и Ва(ОН)2,
60
в) KAlO2 и НNO3,
г) Na[Al(OH)4] и H2SO4.
9. Гидроксид алюминия проявляет свойства кислоты, ре-
агируя с:
а) HCl,
б) KOH (р-р),
в) H2SO4 (разб.),
г) К2О.
10. Оксид алюминия проявляет свойства основного окси-
да в реакциях с:
а) HNO3,
б) Са(OH)2,
в) H2SO4,
г) SO3.
8. Железо и его соединения
8.1 . Упражнения и задачи
231. Напишите электронные конфигурации атома железа
и ионов железа в степени окисления +2 и +3.
232. Объяснить с точки зрения строения атома железа
быстрое окисление на воздухе гидроксида железа (II) до гид-
роксида железа (III). Напишите уравнение реакции, объясняю-
щие это явление.
233. Написать уравнения реакций, характеризующих сле-
дующие превращения:
а)FeS2→Fe2O3→Fe3O4→FeO→Fe,
б) Fe2O3 → FeCl3 → Fe(OH)3 → Fe2O3 → Fe,
в) Fe → FeCl2 → Fe(OH)2 → Fe(OH)3 → Fe(NO3)3 → Fe2O3 → Fe.
234. Напишите уравнения реакций, в которых степень
окисления железа меняется следующим образом:
а) Fe → Fe+3 → Fe+2 → Fe+3 → Fe4[Fe(CN)6]3,
б) Fe → Fe+2 → Fe+3 → Fe+2 → Fe3[Fe(CN)6]2,
в)Fe+2→Fe+3→Fe+3→Fe0→Fe+2.
235. Напишите уравнения реакций, соответствующие
следующей последовательности превращений:
а)
X1
X2
X3
X4
Fe
HCl
Cl2
Na2SO3
HI
б) FeCl3
X1
X2
X3
X4
Fe(OH)3
H2SO4
SO2
Ba(OH)2
HCl
FeCl3
в) Fe
FeCl3
FeCl2
Fe(OH)3
Fe(OH)2
А
Б
Fe
г)
FeS
X2
X1
X3
HCl
H2SO4
BaCl2
X4
62
д) FeCl2
Fe2O3
X1
X2
е)
Fe(OH)3
FeS
X1
X2
ж)
FeCl3
Fe(NO3)2
X1
X2
з)Fe→Х1→Fe(OH)3→Х2→Fe(OH)3,
и) Fe2(SO4)3
FeCl3
Fe3O4
X1
X3
X2
к)
Na2CO3
Fe2(SO4)3
FeSO4
X1
X2
X3
H2O
X4
Fe
Fe3O4
Fe(OH)3
Fe(OH)2
, H2O
236. Напишите уравнения реакций, соответствующие
следующей схеме: FeS → Х1 → Х2 → FeS. Определите неизвест-
ные вещества, рассмотрев два случая:
а) все реакции протекают без изменения степени окис-
ления,
б) все реакции — окислительно-восстановительные.
237. Напишите уравнения реакций, соответствующие
следующей схеме: FeCl2 → X → Fe2O3. Рассмотрите три случая:
а) обе реакции — окислительно-восстановительные,
б) окислительно-восстановительной является только
первая реакция,
в) окислительно-восстановительной является только
вторая реакция.
63
238. Напишите уравнения реакций, соответствующие
следующей схеме: FeSO4 → X → Fe(NO3)3. Рассмотрите три
случая:
а) обе реакции — окислительно-восстановительные,
б) окислительно-восстановительной является только
первая реакция,
в) окислительно-восстановительной является только
вторая реакция.
239. Напишите уравнения реакций, соответствующие
следующей схеме: Fe(NO3)2 → X → FeCl3. Рассмотрите три
случая:
а) обе реакции — окислительно-восстановительные,
б) окислительно-восстановительной является только
первая реакция,
в) окислительно-восстановительной является только
вторая реакция.
240. Напишите уравнения реакций, соответствующие
следующей схеме: FeBr3 → X → FeSO4. Рассмотрите три случая:
а) обе реакции — окислительно-восстановительные,
б) окислительно-восстановительной является только
первая реакция,
в) окислительно-восстановительной является только
вторая реакция.
241. Определите, могут ли реагировать следующие веще-
ства:
а) FeCl3 и Cu,
б) FeCl3 и H2S,
в) FeCl3 и Hg,
г) FeCl2 и HNO3.
242. Даны вещества: хлорид железа (III), гидроксид
натрия, бром, иодид калия. Напишите уравнения возможных
реакций между этими веществами, укажите условия их проте-
кания. В уравнениях окислительно-восстановительных реак-
ций расставьте коэффициенты методом электронно-ионного
баланса.
243. Предложите способы получения оксида железа (III),
исходя из:
а) соли бескислородной кислоты,
б) соли кислородсодержащей кислоты.
64
244. Предложите способы получения бромида железа (III)
с помощью:
а) обменной реакции,
б) окислительно-восстановительной реакции.
245. Соединения двухвалентного железа могут проявлять
как окислительные, так и восстановительные свойства. Напи-
шите по одному уравнению реакций, в которых хлорид желе-
за (II) является: а) окислителем, б) восстановителем.
246. Получите четырьмя различными способами оксид
железа (III).
247. В смеси двух сульфатов железа на один атом железа
приходится 5 атомов кислорода. Вычислите массовую долю
железа в этой смеси.
248. При обжиге пирита выделилось 25 м3 оксида
серы (IV) (измерено при 25 °С и 101 кПа). Рассчитайте массу
образовавшегося при этом твердого вещества.
249. Железную пластинку массой 15,2 г продолжительное
время выдерживали в растворе, содержащем 16 г сульфата
меди (II). По окончании реакции пластинку вынули из раство-
ра и высушили. Чему стала равна ее масса?
250. Железную пластинку массой 10 г опустили в
50 мл раствора нитрата серебра. По окончании реакции пла-
стинку из раствора удалили, промыли водой и высушили.
Ее масса оказалась равной 10,8 г. Вычислите молярную кон-
центрацию нитрата серебра в исходном растворе.
251. При действии избытка соляной кислоты на сплав
железа с медью выделилось 224 мл газа (н. у.). Вычислите
массу сплава, если известно, что железа в нем содержалось
20 % по массе.
252. Найти массовые доли оксидов алюминия и железа (III)
в смеси, если при обработке некоторого количества такой
смеси раствором щелочи ее масса уменьшилась на 4 г, а при
восстановлении такого же количества смеси водородом обра-
зовалось 5,4 г воды.
253. Смесь алюминия и железа может прореагировать
максимально с 560 мл хлора (н. у.). Какая масса 98 %-го горяче-
го раствора серной кислоты потребуется для полного раство-
рения такой же смеси металлов с той же массой?
65
254. Достаточно ли 30 мл 25 %-го раствора серной кисло-
ты (ρ = 1,18 г/мл) для окисления 5,6 г железа? Ответ подтвер-
дите расчетом.
255. При обжиге 12,48 г пирита получили 4,48 л оксида
серы (IV). Весь газ поглотили 25 %-м раствором гидроксида
натрия (ρ = 1,28 г/мл) объемом 250 мл. Какая соль образова-
лась? Определите массовую долю примесей в пирите.
256. К 50 мл 10 %-го раствора хлорида железа (III)
(ρ = 1,085 г/мл) добавили гидроксид калия массой 5 г. Выпав-
ший осадок отфильтровали и прокалили. Вычислите массу
твердого остатка.
257. К 10 мл раствора, содержащего смесь двух сульфатов
железа, добавляли 1,25М раствор аммиака до прекращения
выпадения осадка. Всего израсходовано 4 мл раствора. Осадок
отфильтровали и прокалили до постоянной массы, равной
152 мг. Найдите молярные концентрации солей в исходном
растворе (все процессы проводились в атмосфере инертного
газа).
258. Через 100 мл 12,33 %-го раствора хлорида железа (II)
(ρ = 1,03 г/мл) пропускали хлор до тех пор, пока концентрация
хлорида железа (III) в растворе не стала равна концентрации
хлорида железа (II). Определите объем поглощенного хлора
(при н. у.) .
259. К 15 %-му раствору хлорида железа (III) добавили
карбонат калия. Полученный раствор отфильтровали и проки-
пятили. Выяснилось, что массовая доля соли железа уменьши-
лась в три раза. Установите состав полученного раствора в
массовых долях.
260. К 100 г 40 %-го раствора сульфата железа (III) доба-
вили 12 г гидрида калия. Вычислите массовые доли веществ,
находящихся в растворе.
261. Смесь сульфатов железа (II) и (III), в которой число
атомов кислорода равно числу Авогадро, а число атомов желе-
за составляет 75 % от числа атомов серы, растворили в воде.
В полученный раствор погрузили железную пластинку массой
7 г и выдержали до прекращения реакции. Во сколько раз
уменьшится масса пластинки?
262. К раствору, содержащему 40,55 г смеси сульфата
алюминия и одного из хлоридов железа, добавлялся постепенно
66
концентрированный раствор щелочи. Максимальная масса
осадка оказалась равной 20,1 г. При добавлении избытка ще-
лочи масса осадка уменьшилась до 4,5 г и перестала изменять-
ся при добавлении еще большего избытка. Установите, какой
хлорид железа находился в исходной смеси?
8.2 . Тестовые задания
по теме «Железо и его соединения»
1. Число электронов на внешнем энергетическом уровне
атома железа в основном состоянии:
а) 2,
б) 6,
в) 4,
г) 3.
2. Соединения со степенью окисления +3 образуются в
реакциях:
а)Fe+HCl→...;
б)Fe+Cl2→...;
в) Fe + H2SO4(конц.) → ...;
г) Fe + HNO3(конц.) → ...
3. Схемы реакций, в которых может образоваться железо:
а)Fe3O4+O2→...;
б)Fe3O4+Al→...;
в) Fe(NO3)2 + Zn → ...;
г)Fe2O3+C→...
4. Укажите схемы реакций, в результате которых образу-
ются соединения со степенью окисления железа +2:
а) Fe + H2SO4(разб.) → ...;
б)Fe+HCl→...;
в)Fe3O4+O2→...;
г) Fe3O4 + CО(изб.) → ...
5. Соль образуется, когда гидроксид железа (III) вступает
во взаимодействие с водными растворами:
а) KCl,
б) H2SO4,
в) HNO3,
г) NaNO3.
67
6. Охарактеризуйте свойства гидроксида железа (III):
а) слабый электролит,
б) устойчив к нагреванию,
в) реагирует с сильными кислотами,
г) реагирует с растворимыми солями калия.
7. Гидроксид железа (III) может образоваться в результа-
те протекания реакций:
а)Fe(ОН)2+О2+H2O→...;
б) Fe(ОН)2 + H2О2 → ...;
в) FeСl3+ КOН → ...;
г)Fe2O3+H2O→...
8. Охарактеризуйте свойства и получение гидроксида же-
леза (II):
а) более сильное основание, чем Fe(ОН)3,
б) разлагается при нагревании,
в) образуется при взаимодействии FeO и H2O,
г) реагирует с соляной кислотой, но не реагирует с сер-
ной кислотой.
9. Укажите значение коэффициента перед окислителем
в реакции пирита с избытком кислорода:
а) 11,
б) 8,
в) 22,
г) 4.
10. Формулы продуктов, которые образуются при обжиге
сульфида железа (II) в избытке кислорода:
а)FeиSO3,
б)FeиSO2,
в) Fe2О3 и SO3,
г) Fe2О3 и SO2.
9. Хром и его соединения
9.1 . Упражнения и задачи
263. Напишите уравнения реакций, соответствующие
следующей последовательности превращений:
а) Cr → CrSO4 → Cr(OH)2 → Cr(OH)3 → NaCrO2 → Na2CrO4 →
→ Na2Cr2O7 → BaCrO4,
б) Cr → Cr2O3 → Cr2(SO4)3 → K2Cr2O7 → K2CrO4 → K2Cr2O7 →
→ Cr2(SO4)3 → Cr(OH)3 → K3[Cr(OH)6] → Cr(OH)3 → Cr2O3 → Cr,
в)
KCrO2
K2CrO4
Cr2O3
HClO3
K2Cr2O7
K3[Cr(OH)6]
CrCl3
Cr2(SO4)3
г) Cr → CrCl2 → Cr(OH)2 → Cr(OH)3 → Cr2(SO4)3 → CrOHSO4 →
→ Cr2(SO4)3,
д) Cr → CrCl2 → СrCl3 → K3[Cr(OH)6] → Cr(OH)3 → Cr(NO3)3 →
→ Cr2O3 → Cr.
264. Определите неизвестные вещества, составив урав-
нения реакций по следующим схемам:
а)Cr→X1→Cr2(SO4)3→X2→K2Cr2O7→X3→Cr,
б) Cr2S3
HCl
X1
Na2CO3
X2
KOH (изб) X3
KOH, Cl2
X4
в)
X2
X4
+
toC
X1
X2
LiOH
X3
X4
Cr(OH)3
KOH
Cr(NO3)3
CO2
Cr(OH)3
Cr(OH)3
г)
H2SO4
X1
X2
X3
H2SO4
Cr(OH)3
Na3[Cr(OH)6]
KOH
Cr(OH)3
Br2,
SO2,
69
д) CrCl3 → X1 → Cr(OH)3 → X2 → Cr2O3,
е) Cr(NO3)3 → X1 → CrCL3 → X2 → CrSO4,
ж) Cr2S3 → X1 → Cr2O3 → X2 → K3[Cr(OH)6],
з) Cr2S3 → X1 → K3[Cr(OH)6] → X2 → BaCrO4,
и) X4
SO2,
Br2,
X1
X2
X3
KOH
Cr(OH)3
H2SO4
H2SO4
(разб.)
265. Закончите уравнения следующих реакций:
а) K2Cr2O7 + CH3OH + H2SO4 → HCOOH + ...;
б) Cr2O3 + Ca(OCl)Cl + NaOH → CaCl2 + ...;
в) K2Cr2O7 + H2C2O4 + H2SO4 → CO2 + ...;
г) Cr2O3 + Na2CO3 + KClO3 → ...;
д) K2Cr2O7 + K2SO3 + H2O → ...;
е) K2Cr2O7 + НCl → ...;
ж) Cr(NO3)3 + H2O2 + KOH → ...;
з) K2Cr2O7 + H2S + H2SO4 → ...;
и)CrCl3+К2СО3+H2O→...;
к)K2CrO4+KNO2+KOH→...
266. Даны наборы водных растворов веществ:
а) CrCl2, NaOH, Na2CrO4, H2SO4;
б) SO2, CsOH, K2Cr2O7, H2SO4.
Напишите уравнения возможных реакций между ве-
ществами каждого набора. В уравнениях окислительно-
восстановительных реакций расставьте коэффициенты мето-
дом электронного баланса.
267. Напишите уравнения реакций, соответствующие
следующей схеме:
K2Cr2O7 → X → CrCl3.
Рассмотрите три случая:
а) обе реакции — окислительно-восстановительные,
б) окислительно-восстановительной является только
первая реакция,
в) окислительно-восстановительной является только
вторая реакция.
70
268. Напишите уравнения реакций, описывающих пре-
вращение:
Cr+6 → Cr+3
а) в кислой среде,
б) в щелочной среде.
269. Хром образует оксид, в котором его степень окисле-
ния равна +6. При растворении этого оксида в воде образуется
кислота. Напишите структурную формулу бариевой соли этой
кислоты.
270. Вычислите объемные доли газов в смеси, образо-
вавшейся при действии горячей концентрированной серной
кислоты на хлорид хрома (II).
271. К 3,92 г сульфата хрома (III) добавили 2 г гидроксида
калия. Какую массу гидроксида калия необходимо еще доба-
вить, чтобы образовавшийся осадок полностью растворился.
272. К раствору, содержащему 39,2 г сульфата хрома (III),
добавили щелочь и бромную воду (в избытке), а затем раствор
хлорида бария до прекращения образования осадка. Какова
масса выпавшего осадка?
273. Смешали 78,4 г 5 %-го раствора сульфата хрома (III),
26,2 г 10 %-го раствора дихромата натрия и 24 мл 5М раствора
гидроксида натрия. Вычислите количества веществ, находя-
щихся в растворе.
274. Какой объем 5,6М раствора едкого кали потребуется
для полного растворения смеси гидроксида хрома (III) и гид-
роксида алюминия общей массой 5 г? Массовая доля кислорода
в исходной смеси равна 50 %.
275. При электролизе раствора нитрата хрома (III) выде-
лилось 20,8 г хрома. Какое вещество и в каком объеме (н. у.)
выделилось на аноде (электролизом воды пренебречь)? Полу-
ченный хром растворили в соляной кислоте, после чего рас-
твор оставили на воздухе, а затем к нему постепенно прилили
раствор щелочи. Выпавший вначале осадок при этом полно-
стью растворился. Напишите уравнения реакций и вычислите,
какой объем 40 %-го раствора гидроксида натрия (ρ = 1,4 г/мл)
потребуется для полного растворения осадка.
276. Смесь хлоридов алюминия и хрома (III) массой 58,4 г
обработали избытком раствора щелочи и бромной воды.
71
В образовавшийся раствор добавили избыток раствора хлори-
да бария, при этом выпало 50,6 г осадка. Определите массовые
доли (%) солей в исходной смеси.
9.2 . Тестовые задания
по теме «Хром и его соединения»
1. Атому хрома в степени окисления +3 соответствует
электронная конфигурация:
а) 1s22s22p63s23p63d54s1,
б) 1s22s22p63s23p63d14s0,
в) 1s22s22p63s23p63d34s0,
г) 1s22s22p63s23p63d44s0.
2. Равновесие в растворе хлорида хрома (III):
CrCl3 + H2O ↔ CrOHCl2 + HCl
сместится в сторону реакции нейтрализации при:
а) уменьшении концентрации HCl,
б) понижении температуры,
в) добавлении воды,
г) повышении давления.
3. Хром, так же как алюминий и железо:
а) способен образовывать соединения со степенью окис-
ления +6,
б) пассивируется холодными концентрированными сер-
ной и азотной кислотами,
в) образует оксид со степенью окисления +3,
г) образует типичный кислотный оксид.
4. Оксид хрома (IV) — это:
а) ангидрид хромовой и дихромовой кислот, представля-
ющий собой ярко-красные кристаллы, растворимые в воде;
б) типичный амфотерный оксид;
в) легколетучая жидкость при комнатной температуре;
г) идеальный растворитель органических соединений.
5. Хромату бария соответствует формула:
а) BaCr2O7,
б) Ba3[Cr(OH)6]2,
в) BaCrO4;
г) Ba(CrO2)2.
72
6. Дихромат калия в кислой среде:
а) обладает запахом сирени,
б) придает раствору оранжевую окраску,
в) восстанавливает щелочные металлы из щелочей,
г) диспропорционирует даже при легком нагревании.
7. При окислении толуола дихроматом калия в щелочной
среде получают:
а) щавелевую кислоту;
б) бензойную кислоту;
в) ацетат калия;
г) бензоат калия.
8. Установите соответствие между формулой вещества
и степенью окисления хрома в нем:
ФОРМУЛА ВЕЩЕСТВА СТЕПЕНЬ ОКИСЛЕНИЯ ХРОМА
А) (NH4)2Cr2O7
1) +2
Б) K3[Cr(OH)6]
2) +3
В) CrCl2
3) +4
Г) Cr2(SO4)3
4) +5
5) +6
6) +7
9. Вещества Cr(OH)2 и Cr2O3 являются соответственно:
а) амфотерным гидроксидом и амфотерным оксидом,
б) амфотерным гидроксидом и основным оксидом,
в) основанием и амфотерным оксидом,
г) основанием и основным оксидом.
10. Краткое ионное уравнение реакции между Cr(OH)3 и
HCI — это
а) Cr3+ + 3HCl = CrCl3 + 3H+;
б) Cr(OH)3 + 3Cl‒
= CrCl3 + 3OH‒;
в)H++OH‒ = H2O;
г) Cr(OH)3 + 3H+ = Cr3+ + 3H2O.
10. Цинк. Медь. Серебро
10.1. Упражнения и задачи
277. Напишите уравнения реакций, соответствующие
следующим схемам превращений:
а) Zn → ZnCl2 → Zn(OH)2 → Zn(NO3)2,
б) Zn → Na2ZnO2 → Zn(OH)2 → K2[Zn(OH)4] → ZnCl2 → Zn,
в) ZnO → ZnSO4 → Zn(NO3)2 → ZnO → Zn(OH)2,
г) ZnCl2 → Zn → Na2[Zn(OH)4] → Na2ZnO2,
д) ZnS → ZnO → Zn → Zn(NO3)2 → Na2ZnO2,
е) Сu2O → CuO → CuSO4 →Cu(NO3)2 → Cu(OH)2 → CuO,
ж)Ag→Ag2SO4→AgNO3→Ag2O→Ag,
з)Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu;
и)
AgCl
Ag2O
Ag
AgNO3
[Ag(NH3)2]OH
[Ag(NH3)2]2SO4
Ag2SO4
C3H3Ag
к)
CuCl2
CuCl
Cu
Cu(NO3)2
[Cu(NH3)2]Cl
CuO
CuSO4
C3H3Cu
278. Расшифруйте схемы превращений. Напишите соот-
ветствующие уравнения реакций:
а)ZnO→X1→X2→ZnO,
б) Zn(NO3)2 → X1 → Zn(OH)2 → X2 → ZnO,
в) ZnCO3
t
А C,t
БHCl ВNaOH
NaOH
Г
(р-р)
Д
CO2
E
74
г)CuO C,t
2NaOH
CH3CHO
X1
H2SO4
(конц)
X2
X3
X4+X5
д) Cu2S → X1 → CuO → X2 → (CH3COO)2Cu,
е) CuCl2
K2S
X1
NH3
(р-р)
X2
X3
Cu
HNO3
(конц)
X4
ж)Cu2O→X→CuCl2
з)
Ag2O
Ag2S
X1
X2
и)
X1
X2
CuS
Cu(OH)2
к)Ag→X1→AgNO3→X2→[Ag(NH3)2]OH→X3→Ag,
л)
X1
X2
X3
Cu2O
Cu
Cu(NO3)2
м)
CuCl2
CuS
X1
X2
н)
X1
X2
Cu2O
CuSO4
о) Cu(NO3)2 → X1 → CuCl2 → X2 → Cu(OH)2,
п)CuCl2→X1→Cu(OH)2→X2→CuO,
р)CuBr2→X1→X2→CuBr2.
279. Предложите уравнения реакций в соответствии со
схемой: Cu0 → Cu+2 → Cu+2 → Cu+1 → Cu0.
75
280. Как из смеси оксидов меди (II), алюминия и кремния
химическими методами выделить индивидуальные простые
вещества? Напишите уравнения соответствующих химических
реакций и укажите условия их проведения.
281. Вычислите, какая из медных руд наиболее богата
медью: куприт Cu2O, халькозин Cu2S, халькопирит CuFeS2 или
малахит CuCO3 × 3Cu(OH)2?
282. Какую массу медного купороса и воды надо взять
для приготовления 40 кг 20 %-го раствора сульфата меди (II)?
283. В каком соотношении по массе следует взять две
навески меди, чтобы при внесении одной в концентрирован-
ную серную кислоту, а другой — в разбавленную азотную
кислоту выделились равные объемы газов?
284. Для растворения одного и того же образца меди
необходимо 100 г 98 %-го раствора серной кислоты или 200 г
концентрированной азотной кислоты. Рассчитайте концен-
трацию азотной кислоты.
285. 0,5 г серебряного сплава растворили в разбавленной
азотной кислоте. После обработки раствора соляной кислотой
получено 0,287 г осадка. Найдите массовую долю серебра в
сплаве.
286. Вычислите объем 98 %-го раствора серной кислоты
(ρ = 1,84 г/мл), теоретически необходимый для окисления
10 г меди.
287. Сжигают цинк на воздухе, продукт растворяют в
концентрированном растворе едкого натра, полученный рас-
твор насыщают углекислым газом. Выпадает 24,75 г осадка.
Установите затрату воздуха (в литрах, н. у .), считая содержание
кислорода в нем равным 20,94 % (по объему).
288. Чтобы определить содержание меди в техническом
препарате, 4 г его растворили в 20 %-й азотной кислоте. Полу-
ченный раствор обработали раствором щелочи. После прока-
ливания всего выпавшего осадка образовалось 4,8 г оксида
меди (II). Какой объем занял выделившийся оксид азота (II)
(н. у.). Вычислите объем 20 %-го раствора азотной кислоты
(ρ = 1,12 г/мл), вступившего в реакцию. Какова массовая доля
меди в препарате?
289. При взаимодействии смеси цинка и его карбоната
с избытком соляной кислоты выделилось 6,72 л газа (н. у.) .
76
После его сжигания и конденсации водяных паров объем газа
уменьшился до 4,48 л. Найдите массовую долю цинка в исход-
ной смеси.
290. Сульфид цинка подвергли обжигу на воздухе. В ре-
зультате реакции масса твердого вещества уменьшилась на
12,8 г. Вычислите массу цинка, образующуюся при восстанов-
лении углеродом остатка, полученного после обжига.
291. К 15 %-му раствору сульфата цинка массой 75 г до-
бавили осторожно 0,46 г натрия. Вычислите массовые доли
веществ в образовавшемся растворе.
292. Какова массовая доля вещества в растворе, полу-
чившемся после растворения меди в избытке 17,8 %-го раство-
ра азотной кислоты, если после окончания реакции массы
кислоты и соли стали равны.
293. При растворении 3 г сплава меди с серебром в кон-
центрированной азотной кислоте получили 7,34 г смеси нит-
ратов. Определите массовые доли металлов в сплаве.
294. При обработке избытком соляной кислоты 15,5 г
смеси алюминия, магния и меди получено 7,84 л (н. у.) газа.
Остаток растворили в концентрированной азотной кислоте с
выделением 5,6 л газа. Найдите массу каждого металла в смеси.
295. Смесь цинка и его оксида обработали очень разбав-
ленной азотной кислотой, раствор выпарили досуха, сухой
остаток прокалили, продукты охладили до комнатной темпе-
ратуры. Получили 35,84 л (н. у.) газообразных продуктов
и 48,6 г сухого остатка. Определите мольную долю цинка
в исходной смеси.
296. Смесь азотной и соляной кислот в растворе массой
200 г реагирует с 96 г оксида меди (II). После выпаривания
раствора, прокаливания сухого остатка и обработки кипящим
раствором едкого кали выпадает 72 г твердого вещества.
Определите массовые доли компонентов в исходном растворе
и мольное отношение HNO3 : HCl.
297. Электролиз 400 мл 6 %-го раствора сульфата ме-
ди (II) (ρ = 1,02 г/мл) продолжали до тех пор, пока масса рас-
твора не уменьшилась на 10 г. Определите массовые доли
соединений в оставшемся растворе и массы продуктов, выде-
лившихся на инертных электродах.
298. В раствор, содержащий 4,2 г смеси хлоридов калия и
натрия, прилили раствор, содержащий 17 г нитрата серебра.
77
После отделения осадка в фильтрат поместили медную пла-
стинку, при этом 1,27 г меди растворилось. Определите состав
исходной смеси хлоридов.
299. При взаимодействии латуни (сплав меди с цинком)
с соляной кислотой выделилось 0,561 л (н. у .) водорода, а на
полное хлорирование такой же навески сплава потребовалось
1,035 л (н. у.) хлора. Определите массовые доли металлов в
сплаве.
300. В раствор сульфата меди (II) массой 50 г опустили
железную пластинку массой 10 г. Через некоторое время ее
вынули, масса ее оказалась равной 10,75 г. Вычислите массо-
вую долю соли железа в получившемся растворе.
301. Смесь нитратов меди (II) и серебра массой 10 г (мо-
лярное отношение 1:2) растворили в 100 г воды. В полученном
растворе выдержали до окончания реакции цинковую пла-
стинку массой 5 г. Какое количество вещества воды следует
выпарить из образовавшегося раствора, чтобы получить гекса-
гидрат нитрата цинка?
302. Отрезок медной проволоки массой 141 г поместили
в раствор нитрата серебра (I), после чего масса проволоки
составила 171,4 г. Затем проволоку обработали 60 %-й азотной
кислотой (ρ = 1,365 г/мл) до образования прозрачного раствора.
Найдите объем кислоты, затраченной на проведение реакции.
303. При электролизе водного раствора нитрата некоторого
металла на платиновых электродах выделилось 1,08 г металла
и 56 мл кислорода (н. у.) . Определите металл, входящий в со-
став соли.
304. 39 г смеси алюминия и оксида металла (II) (оксид не
амфотерен) обработали избытком раствора КОН. Выделив-
шийся газ сожгли и получили 27 г воды. Не растворившийся
остаток полностью растворили в 25,2 мл раствора соляной
кислоты (ω = 36,5 %, ρ = 1,19 г/мл). Назовите оксид.
305. 12,8 г неизвестного металла прореагировало с кон-
центрированным раствором кислоты с образованием соли
двухвалентного металла и 4,48 л газа, содержащего 50 % кис-
лорода и 50 % серы. Плотность газа по воздуху равна 2,2. Назо-
вите металл.
306. Смесь двухвалентного металла и его карбоната мас-
сой 8 г растворили в избытке соляной кислоты. В результате
78
взаимодействия выделилось1720 мл газа (н. у.), при пропуска-
нии которого через избыток известковой воды выпало 5 г
осадка. Определите металл и состав смеси по массе.
10.2. Тестовые задания
по теме «Цинк. Медь. Серебро»
1. Ион серебра нельзя определить с помощью раствора,
содержащего:
а) хлорид-ионы,
б) бромид-ионы,
в) нитрат-ионы,
г) иодид-ионы.
2. Алюминий при обычных условиях реагирует с :
а) разбавленной серной кислотой,
б) раствором гидроксида калия,
в) раствором хлорида магния,
г) оксидом бария,
д) бромом,
е) водой.
3. Медь реагирует с:
а) раствором хлорида железа (III),
б) раствором гидроксида калия,
в) раствором нитрата серебра,
г) соляной кислотой,
д) хлором,
е) водой.
4. Алюминий окисляется каждым из веществ:
а) HNO3(разб.) и Cl2,
б) Cu и SiO2,
в) H2SO4(конц.) и Ar,
г) CO2 и Na2SO4.
5. В соответствии с термохимическим уравнением реакции:
2Ag2O=4Ag+O2—61кДж
122 кДж тепла поглощается при разложении оксида се-
ребра количеством вещества
а) 1 моль,
б) 2 моль,
в) 3 моль,
г) 4 моль.
79
6. Установите соответствие между названием вещества и
продуктами электролиза его водного раствора:
НАЗВАНИЕ ВЕЩЕСТВА
ПРОДУКТЫ ЭЛЕКТРОЛИЗА
ВОДНОГО РАСТВОРА
А) нитрат цинка
1) цинк, водород, кислород,
азотная кислота;
Б) бромид цинка
2) водород, кислород;
В) хлорид меди (II)
3) цинк, оксид азота (IV);
Г) сульфат меди (II)
4) цинк, водород, бром;
5) медь, кислород, серная
кислота;
6) медь, хлор.
7. Установите соответствие между названием вещества
и классом веществ:
НАЗВАНИЕ ВЕЩЕСТВА КЛАСС ВЕЩЕСТВ
А) оксид цинка
1) кислотный оксид,
Б) гидроксид меди (II) 2) основный оксид,
В) оксид серебра (I)
3) амфотерный оксид,
Г) гидроксид алюминия 4) несолеобразующий оксид,
5) амфотерный гидроксид,
6) основание.
8. Оксид цинка реагирует с каждым из веществ:
а) вода и соляная кислота,
б) соляная кислота и раствор гидроксида калия,
в) раствор гидроксида калия и хлорид натрия,
г) хлорид натрия и медь.
9. Медные опилки можно очистить от примеси железных
с помощью:
а) воды,
б) магнита,
в) HNO3(конц.),
г) H2SO4(конц.) .
10. Алюминий не вытесняет водород из:
а) соляной кислоты,
б) раствора гидроксида натрия,
в) концентрированной серной кислоты,
г) разбавленной серной кислоты.
11. Марганец и его соединения
11.1. Упражнения и задачи
307. Составьте электронные и электронно-графические
формулы частиц Mn и Mn+7. Укажите число полностью запол-
ненных электронами энергетических уровней в них.
308. Напишите уравнения реакций, соответствующие
следующим схемам превращений:
а) MnO2 → Mn → Mn(NO3)2 → MnO2 → MnCl2,
б) Марганец → манганат калия → хлорид марганца (II) →
→ нитрат марганца (II) → оксид марганца (IV) → перманганат
калия,
в)
Mn(NO3)2
K2MnO4
MnCl2
Mn(OH)2
KMnO4
MnO2
Mn
MnSO4
309. Расшифруйте схемы превращений. Напишите урав-
нения соответствующих реакций.
а)KMnO4→X1→MnCl2→X2→MnO2,
б)Mn→X1→Mn(NO3)2→X2→K2MnO4→X3→Mn,
в)
MnO2
X1
X3
X2
X4
HCl
(NH4)2S
HNO3
г)
X1
X2
X3
MnO2
Mn(CH3COO)2
MnBr2
81
д) MnO2 → MnCl2 → X → Mn(NO3)2,
е) Mn(NO3)2 → X1 → MnO → X2 → Mn(SO)4.
310. Напишите уравнения реакций, соответствующие
следующим превращениям:
Mn+7 → Mn+4 → Mn+2 → Mn+2 → Mn+4.
311. Методом электронного баланса расставьте коэф-
фициенты в уравнениях окислительно-восстановительных
реакций:
а) Mn(OH)2 + KMnO4 + KOH → K2MnO4 + H2O,
б) Mn2O3 + HNO3 → MnO2 + Mn(NO3)2 + H2O,
в) K2MnO4 + HNO3 → KMnO4 + MnO2 + KNO3 + H2O,
г) С6Н5С2Н5 + KMnO4 + H2SO4 → С6Н5СOOH + MnSO4 + K2SO4 +
+CO2+H2O.
312. Расположите формулы указанных соединений в по-
рядке уменьшения основных свойств веществ:
а) MnO, MnO3, Mn2O3, MnO2, Mn2O7;
б) H2MnO4, Mn(OH)3, Mn(OH)2, HMnO4, Mn(OH)4.
313. Через 273 г 10 %-го раствора перманганата калия
пропустили 13,44 л (н. у.) смеси оксида серы (IV) и азота, име-
ющей плотность по водороду 18,5. Вычислите массовые доли
веществ в образовавшемся растворе.
314. К раствору, содержащему 3,16 г перманганата калия,
прибавили раствор, содержащий 22,8 г сульфата железа (II)
и 19,6 г серной кислоты. Определите количественный состав
образовавшегося раствора.
315. Соли марганца применяются в сельском хозяйстве
для борьбы с некоторыми болезнями злаковых. Рассчитайте
массу тетрагидрата сульфата марганца (II), который необхо-
димо внести на 40 га почвы для предупреждения поражения
злаковых твердой головней, если норма внесения элемента
марганца составляет 1 кг на 1 га.
316. Для смачивания обожженной кожи используется
4 %-й раствор перманганата калия. Какой объем воды необхо-
димо добавить к 100 г 25 %-го раствора перманганата калия,
чтобы получить раствор необходимой концентрации?
317. При нагревании перманганата калия массой 31,6 г
выделилось 1,68 л (н. у.) газа. Определите количествен-
ный состав твердого остатка (в моль) и объем (н. у.) газа,
82
выделившегося при обработке полученного остатка избыт-
ком соляной кислоты.
318. После нагревания 28,44 г перманганата калия обра-
зовалось 27,16 г твердой смеси. Какой максимальный объем
хлора (н. у.) можно получить при действиеи на образовавшую-
ся смесь 36,5 %-й соляной кислоты (плотность 1,18 г/мл) при
нагревании? Какой объем кислоты для этого понадобится?
319. Навеску железных опилок массой 0,56 г раствори-
ли в 10,75 мл 20 %-го раствора серной кислоты (плот-
ность 1,14 г/мл). Полученный раствор обработали 20 мл 0,1М
раствора перманганата калия. Вычислите молярное соотноше-
ние солей в полученном растворе.
320. Навеску сульфата железа (II) массой 0,38 г, содержа-
щую примесь сульфата железа (III), растворили в воде, получив
100 мл раствора. Из полученного раствора отобрали 25 мл и
постепенно добавляли подкисленный раствор перманганата
калия до тех пор, пока раствор не перестал обесцвечиваться.
Всего было израсходовано 20 мл 0,005М раствора пермангана-
та калия. Вычислите массовую долю сульфата железа (III) в
исходной навеске.
11.2. Тестовые задания
по теме «Марганец и его соединения»
1. Наибольшую степень окисления марганец проявляет
в соединении:
а) K2MnO4,
б) MnO2,
в) MnCl2,
г) KMnO4.
2. Перманганат калия — это
а) нерастворимое в воде соединение зеленого цвета;
б) сильный восстановитель;
в) растворимая в воде соль фиолетового цвета;
г) реактив, используемый для качественного обнаруже-
ния фторид-ионов.
3. При прокаливании перманганата калия происходит
следующее превращение:
а) 2KMnO4 = K2MnO4 + MnO2 + O2;
б) 2KMnO4 = K2O2 + 2MnO2 + O2;
83
в) 4KMnO4 = 2K2MnO4 + 2MnO + 5O2;
г) соль возгоняется.
4. Оксид марганца (IV) — это:
а) ангидрид марганцевой кислоты,
б) самое распространенное соединение марганца в при-
роде,
в) типичный восстановитель,
г) растворимый в воде осадок ярко красного цвета.
5. Установите соответствие между исходными вещества-
ми и продуктами их взаимодействия:
ИСХОДНЫЕ ВЕЩЕСТВА
ПРОДУКТЫ РЕАКЦИИ
А)HCl+MnO2→...;
1) MnCl2 + H2;
Б)HCl+Mn→...;
2) MnCl2 + H2O;
В) HCl + Mn(OH)2 → ...;
3) MnCl4 + H2O;
Г)HCl+MnO→...
4) MnCl2 + CI2 + H2O;
5) MnCl4 + H2.
6. Оксиды MnO и Mn2О7 являются соответственно:
а) основным и амфотерным,
б) основным и кислотным,
в) основным и основным,
г) амфотерным и кислотным.
7. С раствором перманганата калия взаимодействуют:
а) ацетальдегид,
б) бензол,
в) циклогексан,
г) толуол,
д) пропен,
е) уксусная кислота.
8. Определите сумму чисел атомов всех элементов в про-
дукте, получаемом при взаимодействии Mn2О7 и ВаО:
а) 7,
б) 9,
в) 11,
г) 13.
9. Определите сумму коэффициентов в кратком ионном
уравнении реакции в растворе Mn(OH)2 + KHSO4 → ...:
а) 3,
б) 4,
84
в) 5,
г) 6.
10. В окислительно-восстановительной реакции:
MnO2+КОН+КNO3→K2MnO4+KNO2+...
вещество MnO2 выполняет функцию:
а) окислителя,
б) восстановителя,
в) химической среды,
г) реагента без всяких функций.
Приложение 1
Периодическая система
химических элементов Д. И. Менделеева
Приложение 2
Таблица растворимости. Ряд активности металлов
Приложение 3
Типичные окислители и восстановители
1. Типичные окислители
Название, формула
Окислитель
Во что
переходит
Примечание, примеры
Конц. азотная
кислота HNO3
NO3-
NO2
С малоактивными и средней активности металлами
(кроме Au, Pt, а также Al, Cr, Fe с нагреванием), неме-
таллами и др. типичными восстановителями
Cu+HNO3→Cu(NO3)2+NO2+H2O
H2S+HNO3→H2SO4+NO2+H2O
Конц. азотная
кислота HNO3
NO3-
N2O
С активными металлами
Na+HNO3→NaNO3+N2O+H2O
Разб. азотная кисло-
та HNO3
NO3-
NO
C металлами в ряду активности правее H2 (кроме Au,
Pt), неметаллами и др. типичными восстановит .
Cu+HNO3 → Cu(NO3)2+NO+H2O
H2S+HNO3 → S+NO+H2O
Разб. азотная кисло-
та HNO3
NO3-
N2O
С металлами в ряду активности от Mn до H2
Ca+HNO3 → Ca(NO3)2 + N2O + H2O
Разб. азотная кисло-
та HNO3
NO3-
N2
С металлами в ряду активности от Mn до H2
Mg+HNO3 → Mg(NO3)2 + N2 + H2O
Разб. азотная кисло-
та HNO3
NO3-
NH4+
С металлами в ряду активности левее Mn
Na+HNO3 → NaNO3 + NH4NO3 + H2O
Название, формула
Окислитель
Во что
переходит
Примечание, примеры
Соли азотной
кислоты
NO3-
NH3
В щелочной среде с активными металлами
Al + NaNO3 + NaOH + H2O → NH3 + Na[Al(OH)4]
Конц. серная
кислота H2SO4
SO42-
SO2
C металлами в ряду активности правее H2
(кроме Au, Pt), неметаллами
и др. типичными восстановителями
Cu+H2SO4→CuSO4+SO2+H2O
Конц. серная
кислота H2SO4
SO42-
S
С металлами в ряду активности от Mn до H2 (кроме Al,
Cr, Fe без нагревания)
Zn+H2SO4→ZnSO4+S+H2O
Конц. серная
кислота H2SO4
SO42-
H2S
С металлами в ряду активности левее Mn
Na+H2SO4→Na2SO4+H2S+H2O
Перманганат калия
KMnO4
MnO4-
Mn2+
В кислой среде
H2S+KMnO4+H2SO4→S+K2SO4+MnSO4+H2O
Перманганат калия
KMnO4
MnO4-
MnO2
В нейтральной среде
H2S+KMnO4+H2O→S+KOH+MnO2
Перманганат калия
KMnO4
MnO4-
MnO42-
В щелочной среде
H2S+KMnO4+KOH→S+K2MnO4+H2O
Манганат калия
K2MnO4
MnO42-
Mn2+
В кислой среде
H2S+K2MnO4+H2SO4→S+K2SO4+MnSO4+H2O
MnO2
MnO2
Mn2+
В кислой среде
MnO2+HCl→Cl2+MnCl2+H2O
Дихромат калия
K2Cr2O7
Cr2O72-
Cr3+
В кислой среде
H2S + K2Cr2O7 + H2SO4 → S + K2SO4 + Cr2(SO4)3 + H2O
Название, формула
Окислитель
Во что
переходит
Примечание, примеры
Хромат калия K2CrO4
CrO42-
Cr3+
В кислой среде
H2S + K2CrO4 + H2SO4 → S + K2SO4 + Cr2(SO4)3 + H2O
Хромат калия K2CrO4
CrO42-
[Cr(OH)6]3– В щелочной среде
K2S + K2CrO4 + KOH + H2O → S + K3[Cr(OH)6]
Хлорат калия KClO3
ClO3-
Cl2
В кислой среде
KClO3+HCl→Cl2+KCl+H2O
Хлорат калия KClO3
ClO3-
Cl-
В щелочной среде
MnSO4+KClO3+KOH→K2MnO4+KCl+K2SO4+H2O
Гипохлорит натрия
NaClO
ClO-
Cl2
В кислой среде
NaClO+HCl→Cl2+NaCl+H2O
Галогены (Cl2, Br2, I2)
Hal2
Hal-
Fe(OH)3 + Cl2+ KOH → K2FeO4 + KCl + H2O
O2
O2
H2O
H2S+O2→SO2+H2O
S
S
S2-
Fe+S→FeS
H2O2
H2O2
H2O
SO2 + H2O2 → H2SO4
Кислота (кроме
HNO3 и H2SO4(конц))
H+
H2
Fe+HCl→FeCl2+H2O
FeCl3
Fe3+
Fe2+
FeCl3+KI→I2+FeCl2+KCl
FeCl3 + Cu → FeCl2 + CuCl
CuSO4
Cu2+
Cu+
CuSO4+KI→I2+Cu2SO4+K2SO4
CuSO4
Cu2+
Cu
CuSO4+Fe→FeSO4+Cu
AgNO3
Ag+
Ag
AgNO3+PH3+H2O→Ag+H3PO4+HNO3
2. Типичные восстановители
Название, формула
Восстанови-
тель
Во что
переходит
Примечание, примеры
Галогеноводороды
(HCl, HBr, HI)
Hal-
Hal2
HCl+KMnO4→Cl2+KCl+MnCl2+H2O
HBr+KMnO4+H2SO4→Br2+K2SO4+MnSO4+H2O
HBr+H2SO4→Br2+SO2+H2O
H2S, S2-
S2-
S
H2S+KMnO4+H2SO4→S+K2SO4+MnSO4+H2O
S2-
H2SO4
H2S + HNO3 → H2SO4 + NO2+ H2O
NH3
NH3
N2
NH3+O2→N2+H2O
Фосфин PH3
PH3
H3PO4
PH3 + KMnO4 + H2SO4 → H3PO4 + K2SO4 + MnSO4 + H2O
SO2
SO2
H2SO4
SO2+Br2+H2O→H2SO4+HBr
Na2SO3
SO32-
SO42-
Na2SO3 + K2MnO4 + H2SO4 → Na2SO4 + K2SO4 + MnSO4 + H2O
NaNO2
NO2-
NO3-
NaNO2 + K2MnO4 + H2SO4 → NaNO3 + K2SO4 + MnSO4 + H2O
P2O3 или H3PO3
P2O3
PO43-
P2O3+HNO3+H2O→H3PO4+NO
S
S
SO2
S+O2→SO2
P
P
H3PO4
P+HNO3+H2O→H3PO4+NO
C
C
CO
Fe2O3+C→Fe3O4+CO
FeO+C→Fe+CO
CO
CO
CO2
Fe2O3+CO→Fe3O4+CO2
FeO+CO→Fe+CO2
H2
H2
H2O
CuO+H2→Cu+H2O
H2O2
H2O2
O2
H2O2 + KMnO4 → O2 + MnO2 +KOH
Металлы
Me
Men+
CuSO4+Fe→FeSO4+Cu
Zn + K2Cr2O7 + H2SO4 → ZnSO4 + K2SO4 + Cr2(SO4)3 + H2O
Cr2O3
Cr2O3
CrO42-
Cr2O3+Br2+KOH→K2CrO4+KBr+H2O
FeCl2 или FeSO4
Fe2+
Fe3+
FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
3. Реакции диспропорционирования
Название, формула
Окислитель
и восстанови-
тель
Во что
переходит
Примечание, примеры
Cl2
Cl2
Cl-
, ClO3-
В растворе горячей щелочи
Cl2+KOH→KCl+KClO3+H2O
Cl2
Cl2
Cl-
, ClO-
При охлаждении
Cl2+NaOH→NaCl+NaClO+H2O
P
P
PH3, H2PO2-
P+KOH+H2O→PH3+KH2PO2
S
S
S2-
, SO32-
S + NaOH → Na2S + Na2SO3 +H2O
NO2
NO2
NO2-
, NO3-
NO2+NaOH→NaNO2+NaNO3+H2O
Приложение 4
Качественные реакции на катионы
Катионы
Реактив, уравнение реакции, признаки присутствия данного катиона
Калий
К+
Окрашивает пламя в фиолетовый цвет.
Натрий
Na+
Окрашивание пламени — желтое.
Аммоний
NH4+
При действии щелочей при нагревании выделяется аммиак, который обнаруживают по характер-
ному запаху, по посинению влажной лакмусовой бумаги.
NH4Cl+NaOH→NaCl+NH3+H2O
(NH4++OH-→NH3+H2O)
Магний
Mg2+
Карбонаты щелочных металлов дают белый осадок карбоната магния, легкорастворимый в кисло-
тах: Mg2+ + CO32- → MgCO3
Кальций
Са2+
Окрашивает пламя в кирпично-красный цвет.
Барий
Ва2+
Серная кислота и ее соли образуют белый кристаллический осадок сульфата бария, нерастворимо-
го в кислотах и щелочах:
Ba2+ + SO42- → BaSO4
Окрашивает пламя в желто-зеленый цвет.
Алюминий
Al3+
Гидроксиды щелочных металлов образуют белый студенистый осадок Al(OH)3, растворимый в
кислотах с образованием соли соответствующей кислоты; он также растворим в растворах щелочей
с образованием комплексных ионов [Al(OH)4]-:
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- → [Al(OH)4]-
(Гидроксид алюминия проявляет амфотерные свойства)
В отличие от гидроксида цинка, Al(OH)3 не растворяется в NH4OH.
Катионы
Реактив, уравнение реакции, признаки присутствия данного катиона
Хром
Cr 3+
Окислители (например, перманганат калия, пероксид водорода, бромная вода) превращают зеле-
ные или фиолетовые соединения хрома (III) в соединения хрома (VI)– хроматы СrO42- (желтого
цвета) в щелочной среде или дихроматы Cr2O72- (оранжевого цвета) в кислой среде.
Гидроксиды щелочных металлов образуют серо-голубой осадок Сr(OH)3, проявляющий амфотер-
ные свойства — растворяется в растворах кислот и в избытке щелочей и NH4OH.
Железо
Fe 3+
Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) образует темно-синий осадок
берлинской лазури:
4K4[Fe(CN)6] + 4Fe3+ → 12К+ + 4КFeIII[FeII(CN)6]
Гидроксиды щелочных металлов и NH4OH образуют гидроксид железа (III) красно-бурого цвета,
растворимый в кислотах и нерастворимый в избытке щелочей (отличие от гидроксидов алюминия
и хрома).
Fe3+ + 3OH- → Fe(OH)3
Роданид калия или аммония вызывает кроваво-красное окрашивание раствора
FeCl3 + 3NH4SCN → 3NH4Cl + Fe(SCN)3
Железо
Fe2+
Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) образует темно-синий осадок
турнбулевой сини:
3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6] + 6K+
Цинк
Zn2+
Гидроксиды щелочных металлов образуют белый амфотерный осадок Zn(OH)2, ко торый растворим
в NH4OH c образованием комплексных соединений:
Zn2+ + 2OH- → Zn(OH)2 Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
Серебро
Ag+
Соляная кислота дает белый творожистый осадок, растворимый в аммиаке, при подкислении HNO3
аммиачного раствора снова выпадает белый осадок:
Ag++Cl-→AgCl
AgCl + 2NH4OH → [Ag(NH3)2]+ + Cl- + 2H2O
[Ag(NH3)2]+ + Cl- + 2H+ → AgCl + 2NH4+
Медь
Cu2+
Растворы солей Сu2+ окрашены в голубой цвет; Cu2+ окрашивает пламя в зеленый цвет.
Гидроксид меди растворяется в концентрированных растворах аммиака, образуя аммиакат меди
интенсивно синего цвета (реактив Швейцера; растворяет целлюлозу):
Cu(OH)2 + 4NH3 → [Cu(NH3)4]2+ + 2OH-
Приложение 5
Качественные реакции на анионы
Анион
Реактив, уравнение реакции, признаки присутствия данного аниона
F-
AgNO3 не образует осадка, т.к. фторид серебра растворим в воде (в отличие от других галогенидов
серебра).
Хлорид кальция дает белый осадок фторида кальция.
Cl-
В азотнокислой среде AgNO3 дает белый осадок, растворимый в NH4OH.
Br-
В азотнокислой среде AgNO3 образует светло-желтый осадок.
Хлорная вода окисляет бромид-анион до свободного брома, который окрашивает органический
растворитель в соломенно-желтый цвет: 2Br- + Cl2 → 2Cl- + Br2
I-
Нитрат серебра образует темно-желтый осадок AgI, нерастворимый в растворах HNO3, и NH4OH
(в отличие от хлоридов и бромидов серебра, растворимых в аммиаке).
Хлорная вода окисляет йодид-анион до йода: 2I- + Cl2 → I2 + 2Cl-
Выделившийся йод можно открыть с помощью крахмала, который окрашивается йодом в синий цвет,
или взбалтывая раствор с органическим растворителем, который приобретает красновато-
фиолетовую окраску.
Другие окислители (перманганат калия, дихромат калия и др.) в кислом растворе также окисляют
йодид-анион до йода:
Cr2O72-+2I-+14H+→2Cr3++3I2+7H2O
2MnO4- + 10I- + 16H+ → 2Mn2+ + 5I2 + 8H2O
S2-
Хлористоводородная и др. кислоты при взаимодействии с сульфидами выделяют сероводород,
который имеет запах тухлых яиц:
S2- + 2H+→H2S
Сульфид-анион с катионами многих тяжелых металлов образует разноцветные осадки: ZnS (белый),
CdS (желтый), CuS, PbS, NiS (черный), HgS (красный) и др.
SO32-
Йодная вода или раствор перманганата калия обесцвечивается.
Разбавленные минеральные кислоты выделяют сернистый газ SO2, который обесцвечивает раствор
KMnO4 или йода.
Анион
Реактив, уравнение реакции, признаки присутствия данного аниона
SO42-
Хлорид бария дает белый осадок, нерастворимый в HNO3:
Ba2+ + SO42- → BaSO4
CO32-
Минеральные кислоты разлагают карбонаты (и гидрокарбонаты) с образованием углекислого газа
СO2, который с известковой водой образует белый осадок:
CO32-+2H+→H2O+CO2
Ca(OH)2 + CO2 → CaCO3
SiO32-
Минеральные кислоты выделяют гель кремниевой кислоты
СН3СОО-
При растирании в ступке уксуснокислой соли с гидросульфатом калия появляется характерный запах
уксусной кислоты (сильная кислота вытесняет из соли слабую):
CH3COOK + KHSO4 → CH3COOH + K2SO4
Приложение 6
Некоторые качественные реакции
неорганических соединений и изменения,
сопровождающие химические превращения
No
Признак реакции
Уравнения реакций, ключевые слова, ассоциации
1 «Бурый» газ — оксид азота (IV)
Выделяется при окислении NO до NO2, взаимодействии
тяжелых металлов, неметаллов и некоторых сложных
веществ с HNO3 (конц) и разложении нитратов металлов,
находящихся в ряду активности правее магния.
2NO+O2=2NO2
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2Н2O
С+4HNO3=CO2+4NO2+2H2O
Fe(NO3)2 + 2HNO3 = Fe(NO3)3 + NO2 + H2O
2Zn(NO3)2 = 2ZnO + 4NO2 + O2
2AgNO3=2Ag+2NO2+O2
2 Газ с запахом тухлых яиц — сероводород H2S
Выделяется при взаимодействии сульфидов металлов
с кислотами и очень активных металлов,
и сильных восстановителей с H2SO4 (конц.).
FeS+2НСl=FeCl2+H2S
4Mg + 5H2SO4(конц) = 4MgSO4 + H2S + 4H2O
8HI + H2SO4(конц) = 4I2 + H2S + 4H2O
No
Признак реакции
Уравнения реакций, ключевые слова, ассоциации
3 Газ с резким (характерным) запахом, растворимый
в воде — оксид серы (IV) SO2
Образуется при обжиге серосодержащих веществ
и взаимодействии тяжелых металлов и некоторых других
восстановителей с H2SO4 (конц.).
S+O2=SO2
2H2S+3O2=2SO2+2Н2O
2ZnS+3O2=2SO2+2ZnO
Cu + 2H2SO4 =CuSO4 + SO2 + 2H2O
С + 2H2SO4(конц) = CO2 + 2SO2 + 2H2O
4 Газ с характерным запахом, очень хорошо раствори-
мый в воде — аммиак NH3
Образуется при синтезе аммиака и взаимодействии солей
аммония со щелочами.
N2+3H2=2NH3
NH4Cl+NaOH=NaCl+NH3+H2O
5 Газ, не поддерживающий горение, неядовитый,
малорастворимый в воде — азот N2
Горение и окисление (некаталитическое) азотсодержащих
веществ, синтез аммиака и разложение нитрита аммония.
4NH3+3O2=2N2+6Н2O
2NH3+ЗСuО=N2+ЗСu+ЗН2O
NH4NO2 = N2 + 2Н2O
6 Газ, поддерживающий горение (вспыхивает тлеющая
лучинка), — кислород O2
С+O2=CO2
7 Газы, поддерживающие горение (вспыхивает тлею-
щая лучинка)
Озон, оксиды азота
ЗС+2O3=ЗСO2
С+2NO2=СО2+2NO
No
Признак реакции
Уравнения реакций, ключевые слова, ассоциации
8 Ядовитый газ жёлто-зелёного цвета — хлор Сl2
Взаимодействие хлороводорода с окислителями (МnO2, КМnO4
и другие) и электролиз растворов и расплавов хлоридов:
4НСl+МnO2=Cl2+МnСl2+2Н2O
2NaCl+2Н2O=2NaOH+H2+Сl2
9 Окрашивание пламени
Качественная реакция на катионы: бария — жёлто-зелёное;
калия — фиолетовое; кальция — кирпично-красное;
лития — ярко-красное; натрия — жёлтое;
стронция — карминово-красное.
10 Осадок (творожистый) белого цвета, нерастворимый
в HNO3; образуется при добавлении AgNO3
Качественная реакция на хлорид-ионы (соляную кислоту
и ее соли):
CI-+Ag+=AgCl
11 Осадок белого цвета, нерастворимый в кислотах;
образуется при взаимодействии с растворимыми
солями бария — ВаСl2 или Ba(NO3)2
Качественная реакция на серную кислоту и ее соли:
SO42- + Ba2+ = BaSO4
12 Осадок белого цвета, нерастворимый в кислотах;
образуется при добавлении раствора H2SO4 или
сульфатов
Качественная реакция на соли бария:
Ва2+ + SO42- = BaSO4
13 Осадок белого цвета, который образуется при про-
пускании газа без цвета и запаха через известковую
воду и растворяется при пропускании избытка газа
или в кислотах
Качественная реакция на СO2 и карбонаты (соли Н2СO3):
CO32-+2H+=CO2+H2O
СО2 + Са2+ + 2OН-
= СаСO3 + Н2O
СаСO3 + СO2 + Н2O = Са(НСO3)2
СаСO3+2Н+ =Са2++Н2O+CO2
No
Признак реакции
Уравнения реакций, ключевые слова, ассоциации
14 Осадок белого цвета, который образуется при про-
пускании бесцветного газа с резким запахом через
известковую воду и растворяется при пропускании
избытка газа или в кислотах
Качественная реакция на SO2 и сульфиты (соли H2SO3):
SO32-+2Н+ = SO2+Н2O
SO2 + Са2+ + 2OН-
= CaSO3 + Н2O
CaSO3 + SO2 + Н 2O = Ca(HSO3)2
CaSO3+2H+=Ca2++SO2+H2O
15 Осадок белого (светло-зелёного) цвета; образуется
при взаимодействии с растворами щелочей
Качественная реакция на соли Fe2+:
Fe2+ + 2OH-
= Fe(OH)2
16 Осадок кремового цвета, нерастворимый в HNO3;
образуется при взаимодействии с AgNO3
Качественная реакция на бромид-ионы Br-:
Br-+Ag+=AgBr
17 Осадок жёлтого цвета, нерастворимый в HNO3;
образуется при взаимодействии с AgNO3
Качественная реакция на йодид-ионы I-:
I-+Ag+=AgI
18 Осадок жёлтого цвета, растворимый в кислотах;
образуется при взаимодействии с AgNO3
Качественная реакция на ортофосфат-ионы РО43-:
РO43-+ 3Ag+ = Ag3PO4
19 Осадок бурого цвета, образуется при взаимодей-
ствии с растворами щелочей
Качественная реакция на соли Fe3+:
Fe3+ + ЗОН-
= Fe(OH)3
20 Осадок голубого (синего) цвета, образуется при
взаимодействии с растворами щелочей
Качественная реакция на соли Сu2+:
Сu2+ + 2OН- = Cu(OH)2
No
Признак реакции
Уравнения реакций, ключевые слова, ассоциации
21 Осадок синего цвета, образуется при взаимодей-
ствии с раствором красной кровяной соли
Качественная реакция на соли Fe2+:
3Fe2+ + 2[Fe(CN)6]3-= Fe3[Fe(CN)6]2
22 Осадок синего цвета, образуется при взаимодей-
ствии с раствором жёлтой кровяной соли
Качественная реакция на соли Fe3+:
4Fe3+ + 3[Fe(CN)6]2-= Fe4[Fe(CN)6]3
23 Осадок чёрного цвета, образуется при взаимодей-
ствии с растворимыми сульфидами
(или сероводородом)
Качественная реакция на Fe2+, Ni2+, Cu2+, Pb2+, Ag+, Hg2+
и некоторые другие:
Cu2++S2-=CuS
24 Появление запаха аммиака или изменение цвета
влажной индикаторной бумаги (посинение влажной
лакмусовой бумажки) при взаимодействии вещества
со щелочами
Качественная реакция на соли аммония:
NH4Cl+NaOH=NaCl+NH3+H2O
25 Раствор жёлтого цвета
Раствор индикатора метилоранжа окрашивается
в жёлтый цвет в нейтральных
и щелочных средах
26 Раствор красного цвета
Растворы индикаторов лакмуса или метилового оранжевого
в кислых средах (рН < 7)
27 Раствор малинового цвета
Раствор фенолфталеина в щелочных средах (рН > 7)
No
Признак реакции
Уравнения реакций, ключевые слова, ассоциации
28 Раствор синего цвета
Раствор фиолетового лакмуса в щелочных средах
29 Раствор кроваво-красного цвета
Качественная реакция на соли Fe3+ с раствором роданида
калия KCNS (или роданида аммония NH4CNS):
Fe3+ + 3CNS-
= Fe(CNS)3
30 Осадок белого цвета, который образуется
при добавлении щёлочи в раствор и растворяется
в избытке щёлочи
Качественная реакция на соли Аl3+ и Zn2+ (амфотерных гидрок-
сидов):
Аl3+ + ЗОН-
= Аl(ОН)3
Аl(ОН)3 + ОН-
= [Аl(ОН)4] -
Zn2+ + 2OН-
= Zn(OH)2
Zn(OH)2 + 2OН-
= [Zn(OH)4]2-
Приложение 7
Словарь тривиальных названий
Na2CO3 (карбонат натрия) — кальцинированная сода;
Na2CO3 × 10H2O (декагидрат карбоната натрия) — кри-
сталлическая сода;
NaHCO3 (гидрокарбонат натрия) — пищевая сода, питье-
вая сода, двууглекислая сода;
NaOH (гидроксид натрия) — едкий натр, каустическая
сода, каустик;
Na2SO4 × 10Н2O (декагидрат сульфата натрия) — глаубе-
рова соль;
Na2SiO3 (силикат натрия) — растворимое стекло, жидкое
стекло;
NaNO3 (нитрат натрия) — чилийская селитра, натриевая
селитра;
Na3[AlF6] или 3NaF × AIF3 (гексафторалюминат натрия) —
криолит;
NaCl (хлорид натрия) — поваренная соль, каменная соль,
пищевая соль;
К2СO3 (карбонат калия) — поташ;
КОН (гидроксид калия) — едкое кали;
КСlO3 (хлорат калия) — бертолетова соль;
K2SiO3 (силикат калия) — жидкое стекло, растворимое
стекло;
СаСO3 (карбонат кальция) — мел, известняк, мрамор;
СаО (оксид кальция) — негашёная известь;
Са(ОН)2 (гидроксид кальция) — гашёная известь, бе-
лильная известь;
Са(СlO)2 + СаСl2 (смесь гипохлорита и хлорида кальция) —
хлорная известь;
Са(Н2РO4)2 + 2CaSO4 (смесь дигидрофосфата и сульфата
кальция) — простой суперфосфат;
Са(Н2РO4)2 (дигидрофосфат кальция) — двойной супер-
фосфат;
CaSO4 × 2H2O (дигидрат сульфата кальция) — гипс;
FeCl2 (хлорид железа (II)) — хлористое железо;
FeCl3 (хлорид железа (III)) — хлорное железо;
103
FeS2 (дисульфид железа (II)) — пирит, железный колче-
дан, серный колчедан;
FeSO4 × 7H2O (гептагидрат сульфата железа (II)) — же-
лезный купорос;
ZnSO4 × 7H2O (гептагидрат сульфата цинка) — цинковый
купорос;
ZnS (сульфид цинка) — цинковая обманка;
CuSO4 × 5H2O (пентагидрат сульфата меди (II)) — медный
купорос;
(CuOH)2CO3 (карбонат гидроксомеди (II)) — малахит;
N2O (оксид азота (I)) — веселящий газ;
NO2 (оксид азота (IV)) — бурый газ;
NH4Cl (хлорид аммония) — нашатырь;
NH3 × H2O или NH4OH — гидроксид аммония, нашатыр-
ный спирт;
NH4H2PO4 + (NH4)2HPO4 (смесь дигидрофосфата и гидро-
фосфата аммония) — аммофос;
СО (оксид углерода (II)) — угарный газ;
СO2 (оксид углерода (IV)) — углекислый газ, угольный
ангидрид;
SO2 (оксид серы (IV)) — сернистый газ, сернистый
ангидрид;
SO3 (оксид серы (VI)) — серный ангидрид;
H2SO4 × SO3 — олеум (раствор SO3 в концентрированной
серной кислоте);
HF (фтороводород) — плавиковая кислота (раствор HF
в воде);
Аl2O3 (оксид алюминия) — корунд, боксит, глинозём;
SiO2 (оксид кремния (IV)) — горный хрусталь, силика-
гель, кварц, песок;
CrO3 (оксид хрома (VI)) — хромовый ангидрид;
MnO2 (оксид марганца (IV)) — пиролюзит.
Ответы к тестам
1.2. Тестовые задания по теме «Водород»
1.а,в
2.а,г
3.г
4.б,д
5.а,в
6.а,в,г
7.г,д
8.а,г
9.б,д
10.а,в
2.2. Тестовые задания по теме «Галогены»
1.а,г
2.в,г,б,а
3.б,д
4.б
5.б,г
6.г
7.а,д
8.а,г
9. 1151
10.а,д
3.2. Тестовые задания по теме «Кислород»
1.в,г
2.а,в
3.в
4.а,в
5.в,д
6.г,д
7.г,д
8.б,г
9.а,в
10. г
3.3. Тестовые задания по теме «Сера»
1.а,в
2.б,в
105
3.б,в
4.а,в
5.б,г
6.а,г
7. 5554
8.б,г
9.б,в
10. б
4.2. Тестовые задания по теме «Азот. Аммиак»
1.а,г
2.б,в
3.б,г
4.г
5.а,б,г
6.б
7.а,в
8.б,в
9.б,в
10. в
4.3. Тестовые задания по теме «Оксиды азота. Азотная
кислота»
1.а,в
2.в,д
3.б,г,д
4.а,г
5.б
6.в,д
7.а,в
8. 2245
9. 3216
10. в
4.4 . Тестовые задания по теме «Фосфор»
1.б,д
2.а
3.а,г
4.а,д
5.б,г
106
6.в,г
7.а,г
8.а,д
9.в,д
10.а,в
5.2. Тестовые задания по теме «Углерод»
1.а,д
2. ДБ
3.б,г
4.а,г
5.а,б
6.б,г
7.б,г
8.б
9.а,г
10. б
5.3. Тестовые задания по теме «Кремний»
1.а,в
2.а,г
3.б,в
4.г,д
5.а,б
6.г,д
7.г
8.г,д
9.в,д
10. в
6.2. Тестовые задания по теме «Щелочные металлы»
1.а,б,г
2.а,в,г
3.а,б,г
4.б
5.в
6.б
7.в
8.а,в,г
9.а,б,в
10. в
107
6.3. Тестовые задания по теме «Щелочноземельные ме-
таллы»
1.а,б,в,г
2.а,б,в
3.в,г
4.а,в,г
5.в
6.в
7.б
8.а
9.а
10.а,б,е
7.2. Тестовые задания по теме «Алюминий и его соеди-
нения»
1.а,б,в
2.г
3.в
4.г
5.а,в
6.б
7.б,в,г
8.б,в,г
9.б,г
10.а,в,г
8.2 . Тестовые задания по теме «Железо и его соединения»
1.а
2.б,в,г
3.б,в,г
4.а,б
5.б,в
6.а,в
7.а,б,в
8.а,б
9.а
10. г
9.2 . Тестовые задания по теме «Хром и его соединения»
1.в
2.б
108
3.б,в
4.а
5.в
6.б
7.г
8. 5212
9.в
10. г
10.2. Тестовые задания по теме «Цинк. Медь. Серебро»
1.в
2.а,б,д
3.а,в,д
4.а
5.г
6. 1465
7. 3625
8.б
9.б
10. в
11.2. Тестовые задания по теме «Марганец и его соеди-
нения»
1.г
2.в
3.а
4.б
5. 4122
6.б
7.а,г,д
8.в
9.г
10. б
Блохина Наталья Ивановна
Блохин Игорь Васильевич
Неорганическая химия
в цепочках превращений,
задачах и тестах
Пособие для учащихся 9–11 классов школ,
лицеев и гимназий с углубленным изучением химии
Текст приводится в авторской редакции
12+
Ответственный редактор С. Краснова
Верстальщик А. Тельная
Издательство «Директ-Медиа»
117342, Москва, ул. Обручева, 34/63, стр. 1
Тел/факс + 7 (495) 334-72-11
E-mail: manager@directmedia.ru
www.biblioclub.ru
www.directmedia.ru
Издайте свою книгу у нас!
Издательство «Директ-Медиа» публикует учебники, монографии,
литературу NON-FICTION, аудиокниги, новые издания и те, что с годами не
утратили своей актуальности, коллективные научные сборники.
Наше издательство берет свои корни в книгоиздательских традициях и
технологиях Германии. Мы – лидеры современного книгоиздательского
процесса, охватывающего цифровые образовательные платформы для
школ и вузов, издание электронных и печатных книг. Нашу продукцию
отличает высокое полиграфическое качество и высокотехнологичный
процесс продвижения книги.
Наши авторы – ведущие ученые и преподаватели страны. За 20 лет работы в
России нами издано более 10 000 изданий учебной, академической и
научно-популярной литературы.
Приобрести наши книги можно в интернет-магазине DIRECTMEDIA.RU и в
ЭБС «Университетская библиотека онлайн» (BIBLIOCLUB.RU), в книжных и в
интернет-магазинах страны.
Хотите приобрести книгу издательства «Директ-Медиа»
или издать свое произведение?
Мы ждем Вас!
www.directmedia.ru
Email: manager@directmedia.ru
Tel.: 8-800 -333 -6845 (звонок бесплатный)
Для заметок
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________
___________________________________________________