Author: Буланов М.Н.
Tags: гинекология акушерство медицинская радиология и рентгенология медицина
ISBN: 978-5-88429-135-5
Year: 2010
Text
М.Н. Буланов
УЛЬТРАЗВУКОВАЯ
ГИНЕКОЛОГИЯ
Том 2
ВИДАР
УДК 618.1-073.43(042.4)
ББК 53.6+57.1
Б90
М.Н. Буланов - доктор медицинских наук, заместитель главного врача Владимирской областной клинической больницы по медицинской части (диагностическая служба); главный внештатный специалист Департамента здравоохранения Владимирской области по ультразвуковой диагностике; профессор Ивановской государственной медицинской академии и Новгородского государственного университета.
Буланов М.Н.
Б90 Ультразвуковая гинекология: курс лекций в трех томах. Том 2. - М.: Издательский дом Видар-М, 2010. - 306 с.
ISBN 978-5-88429-135-5 (т.2)
ISBN 978-5-88429-133-1
В трехтомном издании подробно излагаются вопросы теории и практики ультразвуковой диагностики в гинекологии. «Ультразвуковая гинекология» отражает наработки ведущих отечественных и зарубежных ученых, а также более чем 20-летнюю деятельность автора в этой области. Книга актуальна и для начинающих, и для опытных специалистов. Второй том посвящен вопросам ультразвуковой диагностики опухолевидных процессов и опухолей женских половых органов (влагалище, шейка матки, эндометрий, яичники). Большое внимание уделено решению проблемы эффективной дифференциальной ультразвуковой диагностики доброкачественных и злокачественных новообразований. При этом детально рассмотрены аспекты практического использования всех основных современных ультразвуковых методик, применяемых в гинекологии и онкогинекологии: В-режим, цветовая/энергетическая допплерография, уголзависимые и уголнезависимые допплерометрические показатели, трехмерная энергетическая допплерография с расчетом объемных индексов васкуляризации.
УДК 618.1 -073.43(042.4)
ББК 53.6+57.1
ISBN 978-5-88429-135-5 (т.2)
ISBN 978-5-88429-133-1
© М.Н. Буланов, 2010
© «Издательский дом Видар-М», 2010
Оглавление
Список сокращений........................................9
Предисловие.............................................10
I. Основы и принципы ультразвуковой диагностики в онкогинекологии..........................................11
Введение................................................11
Опухолевый рост: общие сведения.........................12
Патологическая неоваскуляризация........................13
ИсследованияФолкмана..................................13
Сущность ангиогенеза..................................14
Четыре типа перфузии злокачественной опухоли по Курьяку....................................15
Злокачественный ангиополиморфизм и доброкачественнный ангиомономорфизм ................16
Ультразвуковая визуализация опухолевого роста.......................................17
Первичная диагностика опухоли ........................17
Определение характера выявленного очагового образования: опухоль - не опухоль, «добро - зло»......18
Выявление исходной локализации процесса...............18
Выявление местной распространенности процесса ........19
Выявление метастатического поражения лимфатических узлов, метастазов в отдаленные органы, асцита................................................19
Определение динамики опухолевого процесса (результаты адъювантного лечения, диагностика рецидивов) ...............................20
Качественная оценка неоваскуляризации: цветовая/энергетическая допплерография (2D и 3D)........20
Наличие или отсутствие цветовых пятен.................20
Количество внутриопухолевых локусов неоваскуляризации (2D- и 3D- методики)................21
Количественная оценка неоваскуляризации: SD-энергетическая допплерография......................22
Локализация выявленных внутриопухолевых зон неоваскуляризации.....................................24
Количественная оценка неоваскуляризации: импульсная допплерометрия...............................25
Литература .............................................28
3
II. Патологические состояния влагалища...................31
Введение..............................................31
Ультразвуковое исследование влагалища в норме. Культя влагалища.............................................32
Культя влагалища ...................................32
Кисты влагалища.......................................34
Доброкачественные опухоли влагалища...................36
Злокачественные опухоли влагалища ....................36
Классификация клинических стадий рака влагалища......................................37
Ультразвуковое исследование при злокачественных опухолях влагалища .............39
Литература ...........................................39
III. Доброкачественные патологические процессы шейки матки............................................41
Введение..............................................41
Классификация заболеваний шейки матки.................42
Гиперплазия эндоцервикса .............................42
Полипы эндоцервикса...................................46
Эхокартина полипов эндоцервикса.....................46
Значение цветовой допплерографии при полипах эндоцервикса ...........................51
Количественный анализ кровотока при полипах эндоцервикса ...........................55
Ретенционные кисты шейки матки .......................55
Литература ...........................................58
IV. Рак шейки матки......................................59
Введение..............................................59
Кратко об истории использования метода в диагностике рака шейки матки......................................60
Классификация клинических стадий рака шейки матки ....60
Преинвазивный и микроинвазивный рак...................62
Преинвазивный рак...................................62
Микроинвазивный рак (стадия IA) ....................64
Инвазивный рак в пределах шейки матки ................66
Ультразвуковая диагностика на стадии IB.............66
Качественный анализ внутриопухолевого кровотока при РШМ ..................................71
4
Количественный анализ внутриопухолевой гемодинамики при РШМ ................................73
Значение метода ультразвуковой диагностики при выявлении малоинвазивного РШМ....................76
Распространенный инвазивный рак.........................76
Распространение опухоли за пределы шейки матки, но без перехода на стенки таза или нижнюю треть влагалища (стадия НА)..........................76
Опухолевая инвазия параметрия без перехода на стенку таза (стадия НВ)...........................81
Инвазия нижней трети влагалища, метастазы в придатках матки (стадия IIIA)......................84
Опухолевая инвазия параметрия до стенки таза, регионарные метастазы в лимфатических узлах таза, гидронефроз (стадия IIIB) ...........................84
Допплерография при РШМ III стадии ...................86
Прорастание опухоли в мочевой пузырь или прямую кишку (стадия IVA)........................86
Карцинома шейки матки IVB стадии ....................88
Точность метода в диагностике и определении стадии РШМ...........................................89
Состояние после лучевой терапии и химиотерапии .........89
Редкие стромальные злокачественные опухоли шейки матки ... .93
Литература .............................................93
V. Гиперпластические процессы эндометрия ..................95
Введение................................................95
Классификация патологических состояний эндометрия (по Я.В. Бохману)............................95
Железистая гиперплазия эндометрия в детородном и пременопаузальном возрасте ...........................96
Ультразвуковые диагностические критерии железистой гиперплазии эндометрия....................97
Особенности гиперпластических процессов эндометрия в постменопаузе........................................109
Изменения эндометрия на фоне приема тамоксифена .......111
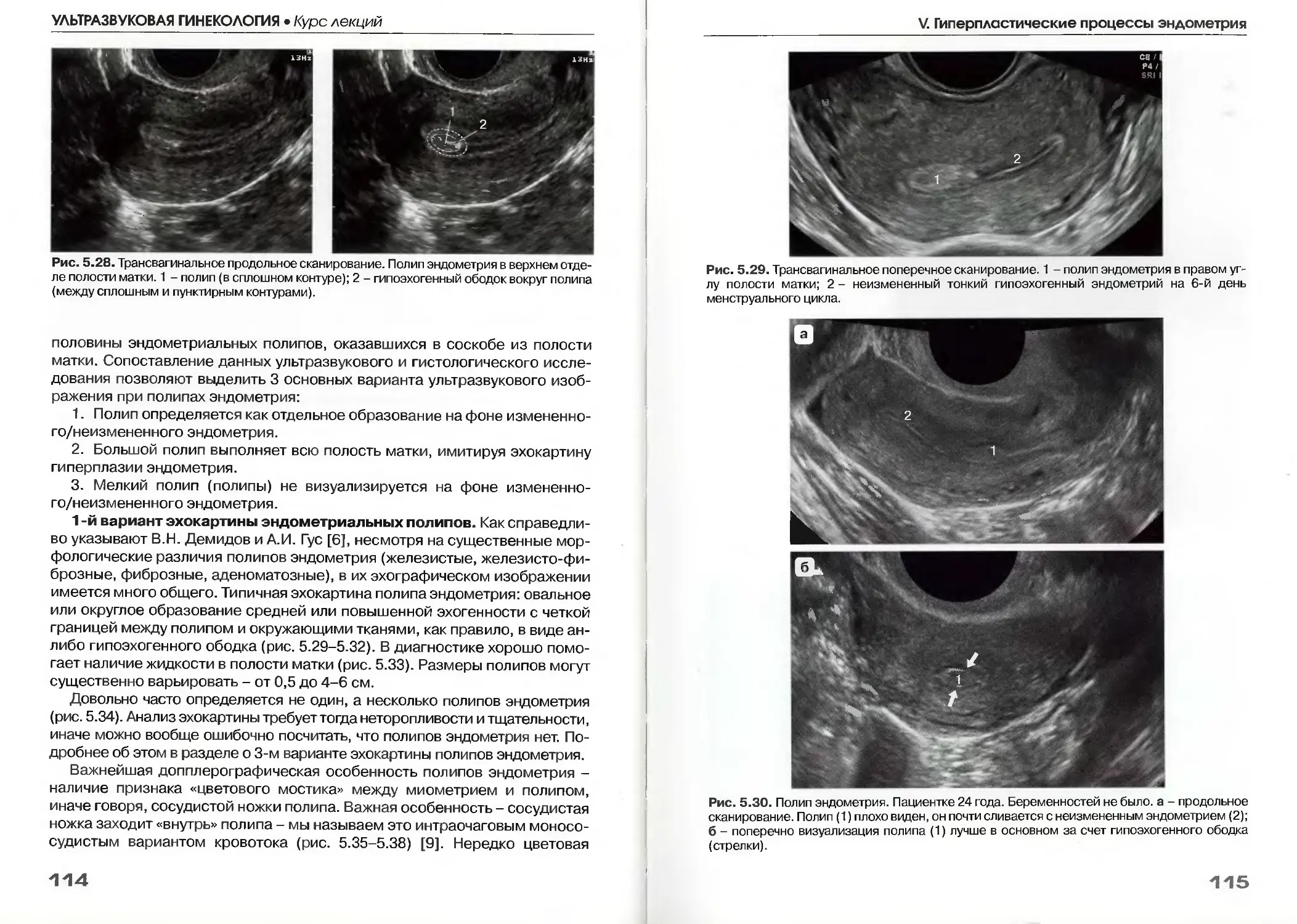
Полипы эндометрия .....................................112
Эхографические признаки полипов эндометрия..........113
Атипические гиперпластические процессы эндометрия .....125
Ультразвуковые критерии диагностики атипической гиперплазии эндометрия..............................126
Ультразвуковая диагностика аденоматозных полипов ...129
5
Концепция доклинической ультразвуковой диагностики патологии эндометрия. Нарушение десквамации эндометрия.
Очаговый фиброз эндометрия. Очаговая гиперплазия эндометрия..................................131
Прогноз рецидивов гиперпластических процессов эндометрия после лечения .....................135
Литература .............................................135
VI. Рак эндометрия.........................................137
Рак эндометрия. Патогенетические варианты. Классификация .137
Своевременная диагностика рака эндометрия. Факторы риска.
Понятие минимального рака эндометрия....................139
Факторы риска........................................139
Понятие минимального рака эндометрия.................139
Ультразвуковой скрининг рака эндометрия ................140
Ультразвуковой скрининг асимптомных женщин в постменопаузе .....................................140
Ультразвуковое исследование женщин с кровянистыми выделениями в постменопаузе...........142
Оптимальный алгоритм скрининговой диагностики рака эндометрия......................................143
Постадийные критерии диагностики
I патогенетического варианта рака эндометрия............143
Рак эндометрия IA стадии ............................143
Рак эндометрия IB стадии.............................146
Рак эндометрия IC стадии.............................146
Рак эндометрия II стадии.............................155
Рак эндометрия 111А стадии ..........................155
Критерии диагностики II патогенетического варианта рака эндометрия ........................................155
Серозометра как прогностический фактор
II патогенетического варианта рака эндометрия: «за и против» .......................................155
Алгоритм ранней диагностики II патогенетического варианта рака эндометрия ............................163
Особенности ультразвуковой картины
II патогенетического варианта рака эндометрия на этапе развернутой инвазии ........................163
Литература .............................................170
6
VII. Опухолевидные образования яичников ................173
Введение.............................................173
Классификация опухолевидных образований яичников.....173
Лютеома беременности ................................175
Гиперплазия стромы яичника (гипертекоз)..............176
Ультразвуковые признаки гипертекоза................177
Функциональные кисты яичников........................177
Фолликулярные кисты ...............................179
Кисты желтого тела.................................183
Параовариальные кисты................................195
Ультразвуковые признаки параовариальной кисты......195
Литература ..........................................197
VIII. Доброкачественные опухоли яичников ...............199
Введение.............................................199
Классификация и распространенность доброкачественных опухолей яичников..................199
Эпителиальные опухоли................................201
Серозные опухоли...................................203
Серозная папиллярная цистаденома ..................208
Допплерография серозных папиллярных цистаденом.....213
Муцинозные опухоли ................................213
Прочие эпителиальные опухоли.......................218
Опухоли стромы полового тяжа ........................218
Гранулезоклеточная опухоль ........................219
Группа теком и фибром .............................224
Фиброма............................................224
Текома.............................................225
Андробластомы......................................227
Дифференциальный ряд при эхокартине преимущественно солидного образования .............231
Герминогенные опухоли ...............................232
Зрелые тератомы (дермоидные кисты).................232
Литература ..........................................242
IX. Злокачественные опухоли яичников ...................245
Введение.............................................245
Классификация, клиническая картина и распространенность злокачественных опухолей яичников. Группы риска......246
7
Дифференциальная ультразвуковая диагностика доброкачественных и злокачественных новообразований яичников..............................248
Форма, контур, размеры..............................248
Внутренняя эхоструктура опухоли.....................249
Система подсчета баллов для дифференциальной диагностики доброкачественных и злокачественных
опухолей яичников по Sassone и Lerner ..............256
Рак яичников - допплерография ......................256
Пороговые значения допплерометрических критериев малигнизации опухолей яичников. Их изолированное и сочетанное использование (принцип «и/или»)........268
Комплексная система подсчета баллов для дифференциальной диагностики доброкачественных
и злокачественных опухолей яичников..................269
Пограничные опухоли яичников.........................271
Ультразвуковое изображение злокачественных опухолей яичников различных гистологических типов (первичные и метастатические опухоли).................273
Серозная аденокарцинома.............................274
Серозная папиллярная цистаденокарцинома.............274
Поверхностная папиллярная цистаденокарцинома .......274
Злокачественная серозная аденофиброма ..............277
Муцинозная цистаденокарцинома.......................279
Эндометриоидная цистаденокарцинома .................279
Смешанные эпителиальные злокачественные опухоли яичников ...................................282
Дисгерминома........................................282
Дисгерминома-семинома...............................282
Метастатические опухоли яичников ...................282
Особенности ультразвукового изображения злокачественных опухолей яичников в зависимости от стадии. Диагностика рецидивов онкологического процесса........287
Первичный рак яичников..............................289
Определение распространенности злокачественного процесса. Метастазы рака яичников .292
Рецидивы злокачественных опухолей яичников ........292
Вопросы скрининга рака яичников.......................292
Биохимический онкомаркер СА-125 ....................300
Ультразвуковой скрининг рака яичников...............301
Заключение............................................303
Литература ...........................................303
8
Список сокращений
АГЭ - атипическая гиперплазия эндометрия
ЖГЭ - железистая гиперплазия эндометрия
РВ - рак влагалища
РШМ - рак шейки матки
РЭ - рак эндометрия
РЯ - рак яичников
3D - трехмерный режим
3D-PD - трехмерная энергетическая допплерография
GIS - карцинома in situ
Fl - индекс потока (индекс кровотока)
PI - пульсационный индекс
PRF - частота повторения импульсов
RI - индекс резистентности
Vmax - максимальная артериальная скорость
Vmeari - средняя артериальная скорость
VEGF - фактор роста эндотелия сосуда
VFI - васкуляризационно-потоковый индекс
VI - индекс васкуляризации
Wmax - максимальная венозная скорость
9
Предисловие
Дорогие коллеги! Как известно, самый надежный метод диагностики злокачественных новообразований - биопсия. Только по ее результатам можно поставить диагноз, неинвазивные методики в этом случае недостоверны (Бохман Я.В.).
Вместе с тем неинвазивные визуализирующие методики сегодня играют основную роль в раннем выявлении подозрительной с точки зрения риска малигнизации зоны интереса, которая и становится в конечном счете объектом уже инвазивной диагностической манипуляции.
Многолетний опыт работы многих исследователей, в том числе и наш собственный, показывает, что ультразвуковое исследование заслуживает рассмотрения в качестве метода выбора при доинвазивной диагностике опухолевых процессов малого таза.
Использование высокоразрешающей трансвагинальной эхографии в сочетании с разнообразными качественными и количественными допплеровскими методиками в настоящее время очень часто позволяет визуализировать опухолевый рост и неоваскуляризацию на весьма ранних этапах их развития, более того, достаточно успешно проводить дифференциальную ультразвуковую диагностику доброкачественных и злокачественных новообразований внутренних гениталий.
В своих выступлениях на конференциях, посвященных обозначенной теме, я постоянно ставлю на обсуждение следующий вопрос: может ли сегодня врач ультразвуковой диагностики давать заключение: «ультразвуковые признаки новообразования с малигнизацией»/«ультразвуковые признаки новообразования без малигнизации»? (Кстати, если я этот вопрос во время выступления не ставлю, мне его почти всегда немедленно задают из зала.)
Поэтому едва ли не главная цель написания этого тома - убедить читателя в том, что правильный ответ: ДА.
Искренне Ваш, М.Н. Буланов
Основы и принципы ультразвуковой диагностики в онкогинекологии
Введение • Опухолевый рост: общие сведения • Патологическая неоваскуляризация • Ультразвуковая визуализация опухолевого роста • Качественная оценка неоваскуляризации: цве-товая/энергетическая допплерография (2D и 3D) • Количественная оценка неоваскуляризации: импульсная допплерометрия • Литература
Введение
Корифей отечественной он ко гинекологи и Ян Владимирович Бохман писал более 20 лет назад: «В течение длительного времени основные исследования в онкогинекологии были направлены на усовершенствование методов лечения. В последние годы наметился решительный поворот в сторону патогенетических подходов к раннему выявлению и профилактике...» [1].
Стремительное развитие в последние годы разнообразных диагностических технологий, в том числе и ультразвукового метода, прекрасно подтверждает эти слова. Роль врача ультразвуковой диагностики при поиске онкогинекологической патологии в настоящее время заслуженно становится все более значимой. Какие же задачи стоят перед нами в этой обширной и очень сложной области медицины?
Профессор М.А. Чекалова обозначила следующие основные направления ультразвуковой диагностики в онкогинекологии:
• Ранняя диагностика и определение топической принадлежности опухоли.
• Уточняющая диагностика распространенности опухолевого процесса.
• Ранняя диагностика рецидивов, метастазов, послеоперационных осложнений [2].
В настоящем томе мы постараемся уделить должное внимание всем этим задачам. Вместе с тем основной акцент будет сделан на возможностях раннего выявления, а также уточнении распространенности новообразования.
Однако прежде чем приступить к описанию разнообразных ультразвуковых диагностических критериев наличия опухолевого процесса, а также дифференциации «добра» и «зла», давайте кратко рассмотрим патофизиологические основы возможности использования диагностического ультразвука для решения вышеназванных задач. Начнем с краткого экскурса в биологию опухолевого роста.
44
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Опухолевый рост: общие сведения
Для воспроизводства нормальных клеток в здоровых тканях образуется столько клеток, сколько требуется организму. Замедление пролиферации и ускорение гибели клеток предотвращают их избыток [3].
Жизнедеятельность клетки происходит в виде осуществления так называемого клеточного цикла, включающего фазы покоя, во время которого клетка не делится и выполняет свои функции, а также многоэтапной фазы деления. Клеточное деление состоит из ряда периодов, контролируемых за счет синхронной активации и инактивации регуляторов клеточного цикла (определенных онкогенов и белков, например гормонов, факторов роста и пр.). Специальные регуляторы клеточного цикла стимулируют мембранные рецепторы клетки, которые в свою очередь направляют внутрь клетки сигнал к пролиферации.
В норме клеточный цикл в определенные моменты на время останавливается для «проверки» в так называемых контрольных точках, представляющих собой не что иное, как границы периодов клеточного цикла. Считается, что эту очень важную «функциональную» остановку вызывают белки-супрессоры опухолевого роста. Во время «остановки» клетка не меняется внешне, хотя в ней продолжается синтез белков, необходимых для вступления в следующий период; одновременно происходит выявление и устранение возникших поломок (прежде всего - мутаций). При наличии неустранимых поломок, а также старения клеток (в итоге ставших ненужными) в действие вступает механизм апоптоза, представляющего собой запрограммированную клеточную гибель.
Способность клетки делиться обратно пропорциональна степени ее дифференцировки. Нормальные клетки всегда имеют естественный предел количества делений (обычно не более нескольких десятков раз). Опухолевые клетки способны делиться бесконечно. Считается, что секрет этого «бессмертия» связан с концевыми участками хромосом - теломерами. В нормальных клетках после каждого деления теломеры укорачиваются, что и является залогом конечности деления. В опухолевых клетках длина теломер постоянно восстанавливается за счет действия фермента теломеразы.
Опухолевый рост - это накопление клеток за счет их избыточного образования и недостаточной гибели. Постепенно эти клетки все больше проникают в органы и ткани, повреждая и разрушая их. Опухолевые клетки дефектны по своей природе и быстро гибнут, но скорость их гибели отстает от скорости образования новых клеток [3].
Каковы основные причины опухолевого роста? Это: 1) дефекты генов-супрессоров; 2) нарушение апоптоза; 3) ускоренная независимая пролиферация. Кстати, помимо нарушения регуляции собственного апоптоза, для опухолевых клеток характерна способность выделять вещества, вызывающие апоптоз здоровых клеток, что является одной из причин раковой кахексии. Ускоренная пролиферация, независимая от факторов роста, обычно связана с мутациями. Дефекты генов-супрессоров опухолевого
42
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Рис. 1.1. Схема инвазии и метастазирования злокачественной опухоли (приводится по [6] с изменениями). А: 1 - нормальный эпителий; 2 - экстрацеллюлярный матрикс; 3 - эндотелий; В - ранняя трансформация и карцинома in sitw, С -инвазия стромы с протеолизом и деградацией экстрацеллюлярного матрикса; D - интрава-зация с дальнейшим протеолизом; Е - миграция; F - экстра-вазация в отдаленном от первичной опухоли месте.
роста ведут к образованию опухоли из-за неспособности организма уничтожить клетки, в которых возникли мутации.
Запуску названных выше процессов способствуют разнообразные канцерогенные факторы, перечислять которые не хватит и нескольких страниц. Среди них особо выделим онкогенные вирусы, например вирус папилломы человека, ДНК которого обнаруживают у 80-90% больных раком шейки матки. Длительное воздействие кацерогенных факторов приводит к формированию многочисленных онкогенов, совокупно вызывающих опухолевую трасформацию клетки.
К главным особенностям опухолевых клеток относятся клональная природа (развитие из единственной дефектной клетки), а также способность делиться без адгезии к твердой подложке (даже в полужидкой среде). Кстати, последнее свойство (иначе называемое утратой зависимости от окружающей среды) обусловливает важнейшую особенность злокачественной опухоли - способность к метастазированию (рис. 1.1).
Патологическая неоваскуляризация
Ультразвуковая диагностика опухоли - это, перефразируя язык рентгенологов, не только визуализация «плюс-ткани», появившейся за счет патологического деления клеток, но также «плюс-сосудов», а именно патологической неоваскуляризации. Допплеровское исследование опухолевой гемодинамики, интенсивно развивающееся последние два десятилетия, внесло неоценимый вклад в современную онкогинекологию, существенно повысив выявляемость ранних стадий гинекологического рака.
Исследования Фолкмана
Фундаментальная патофизиологическая основа метода была заложена еще в начале 60-х годов прошлого столетия исследованиями J. Folkman [4], показавшим, что адекватное кровоснабжение является необходимым условием для злокачественного роста. В эксперименте при имплантации
13
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
раковых клеток в неваскуляризованную камеру глаза кролика опухолевые узлы увеличивались не более чем до 1-2 мм. Однако когда те же раковые клетки имплантировались в васкуляризованную область глаза кролика, происходил быстрый рост опухоли, вскоре занимавшей все глазное яблоко. Таким образом стало очевидным, что рост опухоли ограничивается наличи-ем/отсутствием сосудов. Дальнейшие исследования на животных показали, что имплантируемые опухоли сами индуцируют рост новых капилляров. Этот процесс получил название ангиогенеза (неоваскуляризации) [5].
Сущность ангиогенеза
В условиях васкулярного дефицита в колониях опухолевых клеток длительное время может сохраняться баланс между размножением и гибелью (клетки умирают с такой же скоростью, с какой размножаются). Размер колоний при этом не превышает 1 мм. С появлением сосудов скорость гибели клеток падает, и опухоль начинает быстро расти.
Сущность ангиогенеза заключается в формировании новых кровеносных сосудов из посткапиллярных венул в ответ на ангиогенную стимуляцию, запуск которой обеспечивается разнообразными факторами. Основным регулятором ангиогенеза считается фактор роста эндотелия сосудов - VEGF (vascular endothelial growth factor). Этот фактор вызывает образование своих рецепторов на зрелых покоящихся клетках эндотелия. В отсутствие VEGF нормальный эндотелий не имеет таких рецепторов [6].
Процесс ангиогенеза начинается с выхода эндотелиальных клеток из состояния покоя (при этом скорость удвоения их популяции возрастает почти в 100 раз). Следствием такого интенсивного деления является образование эндотелиального ростка, который прорывает базальную мембрану и распространяется в соединительную ткань. Дальнейшая канализация эндотелиального ростка формирует микрососудистую петлю. В просвете последней начинают циркулировать клетки крови, что и знаменует собой свершившийся ангиогенез (рис. 1.2).
В организме практически постоянно происходит физиологическая неоваскуляризация, являющаяся необходимым залогом таких важнейших процессов, как овуляция, формирование желтого тела, имплантация, плацентация, эмбриогенез, заживление ран, формирование коллатерального кровотока при тромбозах, пролиферативная фаза воспаления и пр. В настоящее время доказано, что свойствами ангиогенной активации обладают не один десяток образующихся в тканях веществ (так называемых ангиогенных факторов) [6].
Оказалось, что злокачественные новообразования также способны вырабатывать в большом количестве ангиогенные факторы, формируя собственную сосудистую сеть, в свою очередь способствующую дальнейшему росту опухоли. В отличие от нормальных сосудов опухолевые сосуды высокопроницаемы. За счет этого белки плазмы, например фибриноген, выходят наружу, образуя вокруг опухоли студенистую массу, содержащую фактор роста эндотелия, который стимулирует дальнейший ангиогенез. Также установлено, что VEGF предотвращает апоптоз активированного эндотелия [3].
44
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Рис. 1.2. Схема ангиогенеза (приводится по [7] с изменениями). 1 - посткапиллярная венула; 2 - рецептор VEGF; 3 - эндотелиальный росток (почка); 4 - начало канализации эндотелиального ростка; 5 - сформирована микрососудистая петля.
Рис. 1.3. Запуск патологической неоваскуляризации опухолью (приводится по [7] с изменениями). 1 - опухоль; 2 - расположенный поблизости нормальный кровеносный сосуд; 3 - эндотелиальный росток, начавший развиваться за счет вырабатываемых опухолью факторов ангиогенеза; 4 -новообразованный сосуд.
Нужно отметить, что патологическая неоваскуляризация возникает «не на пустом месте», для ее запуска необходимо наличие расположенных в непосредственной близости сосудов, «порабощаемых» опухолью для дальнейшего создания своего кровеносного бассейна (рис. 1.3).
Четыре типа перфузии злокачественной опухоли по Курьяку
Работы выдающегося хорватского ученого Азима Курьяка имели решающее значение для разработки концепции использования допплерографии в дифференциальной диагностике доброкачественных и злокачественных новообразований женской половой сферы.
Кратко изложим ее основные положения. Поскольку для новообразованных сосудов злокачественной опухоли, как и для ее клеток, характерен быстрый и беспорядочный рост, для анатомии такой кровеносной сети характерны: беспорядочное, часто дихотомичное переплетение сосудов, значительно варьирующих по диаметру, с наличием многочисленных либо суженных, либо синусоидально расширенных сегментов, многочисленные артериовенозные шунты. Морфология стенок сосудов в значительной степени неполноценна, в них имеются значительные дефекты эндотелия, практически отсутствует мышечный слой, а базальная мембрана прерывиста [7].
Для таких сосудов типичен не только быстрый рост, но и быстрый разрыв или тромбирование, приводящие к ишемии и некрозу опухолевой ткани.
Вместе с тем в злокачественных новообразованиях некоторые фрагменты сосудистого русла могут характеризоваться нормальной анатомией, поскольку представляют собой оказавшиеся в зоне распространения опухоли нормальные артерии и вены.
45
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 1.4. Четыре типа перфузии злокачественной опухоли. I - гиперемия за счет неоваскуляризации; II - ишемия; III - некроз (аваскулярная зона); IV - сосуды с нормальной гемодинамикой.
Таким образом легко объяснимо одновременное наличие в злокачественной опухоли четырех типов перфузии (рис. 1.4):
• гиперемия за счет неоваскуляризации, гемодинамически характеризуемая высокой скоростью и низкой резистентностью кровотока (последняя обусловлена дряблыми, неэластичными стенками сосудов, которые не в состоянии обеспечить достаточный тонус стенки);
• ишемия, гемодинамически характеризуемая низкой скоростью, в сочетании со средней или высокой резистентностью кровотока;
• некроз (аваскулярная зона);
• сосуды с нормальной гемодинамикой.
Злокачественный ангиополиморфизм и доброкачественнный ангиомономорфизм
Перечисленными выше причинами легко объясняются такие особенности «злокачественного» внутриопухолевого кровотока, как сосуществование в пределах одного бассейна сосудов с очень высокой и очень низкой скоростью кровотока, преимущественно очень низкой, но порой и высокой резистентностью, а также аваскулярных участков.
В то же время морфология и архитектура сосудистой сети доброкачественных новообразований в целом в значительной степени приближены к нормальной, что и отражается достаточно стабильными, иначе говоря, монотонными гемодинамическими показателями по всей опухоли, характеризующимися невысокой скоростью и средней или высокой резистентностью.
Мы в своих работах, посвященных ультразвуковой диагностике онкопатологии яичников, назвали такие типы васкуляризации соответственно «злокачественным ангиополиморфизмом» и «доброкачественным ангиомономорфизмом» (рис. 1.5) [8].
Первые сообщения, посвященные использованию допплерографии для диагностики злокачественных новообразований женской половой сферы, были опубликованы в 1989 г. тремя независимыми группами исследователей: A. Kurjak и соавт. [9], Т. Bourne и соавт. [10], Т. Hata и соавт. [11]. В дальнейшем возможность эффективного использования допплерографических методов для диагностики онкологической патологии была наглядно продемонстрирована очень большим количеством (счет идет уже на тысячи) проведенных за 20 лет исследований.
46
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Рис. 1.5. Доброкачественный ангиомономорфизм и злокачественный ангиополиморфизм. Две зеленые пирамидки представляют собой максимальный и минимальный показатели Vmax. которые удалось получить в одной доброкачественной опухоли, разница между ними недостоверна (Р >0,05), две красные пирамидки - максимальный и минимальный показатели Vmax, которые удалось получить в одной злокачественной опухоли, разница между ними выраженная (Р <0,05).
У\ьтразвуковая визуализация опухолевого роста
Читатели 1-го тома уже смогли убедиться в том, что автор является активным и последовательным поборником допплеровского метода во всех его проявлениях. Тем не менее на первом месте в ультразвуковой диагностике всегда была и остается серошкальная визуализация. Прежде чем мы сможем оценить гемодинамические особенности опухоли, нам необходимо визуализировать саму опухоль.
Среди обширного числа печатных работ, посвященных эхографической визуализации в онкологии, подкупает своей академичной обстоятельностью «Ультразвуковая онкоурология» Л.А. Митиной, В.И. Казакевича и С.О. Степанова [12]. Рассказывая об общих принципах ультразвуковой диагностики онкологических заболеваний, позволю себе оттолкнуться от концепции этих уважаемых ученых.
Первичная диагностика опухоли
Самое главное и самое сложное - обнаружить сам факт опухолевого процесса, т.е. впервые визуализировать новообразование. Автору ежедневно приходится выступать в качестве эксперта, уточняющего наличие онкогинекологической патологии либо распространенность процесса. Должен признаться - экспертом второго уровня, уточняющим диагноз, быть существенно проще, нежели диагностом, первым сталкивающимся с онкологической ситуацией. А поскольку онкологический процесс может
47
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
определенное время персистировать без каких-либо клинико-лабораторных проявлений, врач, проводящий ультразвуковое исследование, должен быть внутренне готов к возможности наличия онкологической патологии у каждой женщины, которой проводится эхография.
Таким образом, любое ультразвуковое исследование должно рассматриваться как онкоскрининг. Малейшее сомнение должно быть поводом для коллегиального осмотра, а также непродолжительного динамического наблюдения: пациентке проводится контрольное исследование через несколько дней или недель для того, чтобы изменить обстоятельства, мешающие оптимальной визуализации (вздутый кишечник, неподходящая фаза менструального цикла, функциональные образования яичников, секреторный эндометрий и пр.).
Определение характера выявленного очагового образования:
опухоль - не опухоль, «добро - зло»
Данная задача решается одновременно с предыдущей. Пожалуй, даже именно с нее все и начинается. Мы обнаруживаем подозрительное образование и в первую очередь должны решить, опухоль ли это, а затем (что нередко еще труднее) решиться написать об этом в заключении протокола исследования. Но после того, как мы сделали вывод, что перед нами опухоль, возникает еще более сложный вопрос: а какая это опухоль, доброкачественная или злокачественная? Как уже было сказано выше, поиску возможности уверенного ответа на него посвящен весь этот том.
Мне трудно написать здесь о решающих эхографических критериях новообразований женской половой сферы, поскольку они, с одной стороны, не настолько специфичны, а с другой - не настолько универсальны. В последующих главах будет уделено самое пристальное внимание особенностям ультразвукового изображения онкогинекологических образований практически всех локализаций.
Выявление исходной локализации процесса
При относительной ограниченности топографического спектра онкоги-некологической патологии (влагалище, шейка, миометрий, эндометрий, яичники, трубы, брюшина малого таза - вот практически и все) решение вопроса о локализации первичной опухоли может оказаться не самым простым. Для подчеркивания важности этой проблемы приведу лишь несколько примеров. Солидная опухоль яичника может оказаться крукенбер-говским метастазом рака желудка, опухоль влагалища - вторично исходить из первичной карциномы шейки матки, новообразование миометрия -быть злокачественным следствием пузырного заноса и т.д.
Также важно помнить о первично-множественных опухолях (так называемая теория опухолевого поля), составляющих не менее 2-3% от всех случаев впервые установленного диагноза злокачественного новообразования.
48
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Выявление местной распространенности процесса
Установив наличие опухоли, очень важно определить, насколько вовлечен в онкологический процесс весь орган, а также соседние органы и ткани малого таза. Следующая семиотика вариантов ультразвуковой картины надежно помогает решить проблему вовлеченности в онкологический процесс смежных зон [12]:
I. Смежные структуры и органы в опухолевый процесс не вовлечены:
1) отсутствие связи: соседний орган легко отодвигается и смещается -это нетрудно определить бережным давлением датчика или сочетанным инструментально-манульным исследованием (методика описана в I главе 1-го тома);
2) прилежание органа - орган трудно сместить, но четко видна граница между ним и пораженной зоной;
3) сдавление или оттеснение - ситуация сходна с предыдущей, при этом смежный орган не только смещен с привычного места, но и деформирован.
II. Смежные структуры и органы в опухолевый процесс вовлечены:
1) подрастание (врастание) или периорганный рост опухоли - обычно при этом смежный орган составляет единый конгломерат с органом первичной локализации онкологического процесса;
2) прорастание и/или опухолевый тромб (для сосудов) - данная ситуация в онкогинекологии встречается относительно редко.
Выявление метастатического поражения лимфатических узлов, метастазов в отдаленные органы, асцита
Определив наличие злокачественной (или подозрительной на злокачественную) опухоли органов малого таза, следует взять в руки абдоминальный, а затем поверхностный датчик, чтобы оценить состояние всех потенциальных мишеней выявленного онкологического процесса.
Всегда следует помнить о типичных путях метастазирования для той или иной локализации опухоли. Однако при практически любой топике онкоги-некологического заболевания следует внимательно обследовать: брюшную полость, обратив особое внимание на брыжейку кишечника и сальник, печень, селезенку, почки и забрюшинное пространство, молочную и щитовидную железы.
Следующий скрупулезный этап - лимфатические узлы: паховые, тазовые, запирательные, подвздошные, параортальные, висцеральные (наиболее опытные специалисты рекомендуют не забывать о подмышечных, а также под- и надключичных лимфатических узлах).
Поиск и оценка выраженности асцита - обязательные составляющие при диагностике любой онкогинекологической патологии. Жидкость в брюшной полости следует внимательно искать от дугласова до надпеченочного пространства. Мы хорошо знаем, что диагностика асцитической жидкости в малом тазу часто затруднена из-за разнообразных неонколо
49
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
гических причин (овуляция, воспаление). Следует тщательно рассчитать объем карманов жидкости в малом тазу. При объеме последних свыше 10-15 см3 следует серьезно задуматься об онкологической причине (конечно, исключив кровотечение и пельвиоперитонит).
Определение динамики опухолевого процесса (результаты адъювантного лечения, диагностика рецидивов)
Распространенные формы гинекологического рака часто подвергаются адъювантной (либо изолированной) химио- и лучевой терапии. Динамическое ультразвуковое наблюдение позволяет легко определить изменение распространенности как первичной опухоли, так и метастазов. Часто это помогает онкогинекологам своевременно решить вопрос о наступлении этапа операбельности опухоли.
После комплексного лечения ультразвуковая диагностика может выступать в качестве неоценимого метода мониторинга состояния больной. Так, трансвагинальная эхография позволяет визуализировать рецидивы онкологического процесса в малом тазу на самых начальных этапах (при высокочастной эхографии начиная с размеров 5-7 мм).
Ультразвуковой метод также является прекрасным подспорьем при выполнении миниинвазивных диагностических и лечебных манипуляций, когда они делаются под ультразвуковым контролем. Очень эффективно применение интраоперационной ультразвуковой диагностики. Особая область использования диагностического ультразвука в онкогинекологии -разметка опухоли перед хирургическим вмешательством или лучевой терапией (брахитерапией). Поскольку эти пособия преимущественно используются в специализированных онкологических центрах, мы не будем уделять им здесь подробного внимания.
Качественная оценка неоваскуляризации: цветовая/энергетическая допплерография (2D и 3D)
Наличие или отсутствие цветовых пятен
В настоящее время используемые блоки цветовой/энергетической допплерографии отличаются достаточно высокой чувствительностью, что позволяет визуализировать внутриопухолевый кровоток в большинстве доброкачественных (70-90%) и почти всех злокачественных новообразованиях женской половой сферы независимо от их локализации. Таким образом, обнаружение кровотока в зоне интереса само по себе не может быть критерием малигнизации [8].
Вместе с тем необнаружение кровотока в подозрительном очаге, как правило, свидетельствует об отсутствии неоваскуляризации и, следовательно, может быть рассмотрено в качестве критерия доброкачественности
20
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Рис. 1.6. Энергетическая допплерография доброкачественной опухоли, к тому же с дегенерацией. Кровоток определяется только по контуру (1), а также в периферических отделах опухоли (2).
Рис. 1.7. Энергетическая допплерография злокачественной опухоли. Диффузная беспорядочная васкуляризация многочисленными сосудами.
(рис. 1.6). Правда, еще пионеры использования допплерографии в гинекологии A. Kurjak и I. Zalud [13] предупреждали, что если внутриопухолевый кровоток не визуализируется, то в данной опухоли либо отсутствует неоваскуляризация, либо имеющаяся в распоряжении исследователя аппаратура обладает недостаточной чувствительностью.
Количество внутриопухолевых локусов неовоскуляризоции (2D- и 3D- методики)
A. Kurjak и S. Kupesic [7] отмечали, что для рака яичников характерны множественные внутриопухолевые сосуды (рис. 1.7), в то время как для доброкачественных новообразований типичны единичные сосуды. Попытки количественной оценки выраженности внутриопухолевой васкуляризации предпринимаются давно. Так, по данным Н. Prompeler и соавт. [14], среднее количество визуализируемых зон неоваскуляризации составило в доброкачественных и злокачественных новообразованиях яичников 3 и 9 соответственно (Р < 0,0001). В наших исследованиях при цветовой допплерографии количество цветовых локусов в доброкачественных опухолях яичников составило в среднем 2,4 ± 0,8 (колебания от 1 до 6 цветовых локусов в опухоли), в то же время
21
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
в злокачественных опухолях среднее количество цветовых локусов было 6,4 ± ±1,8 (колебания от 1 до 14 цветовых локусов в опухоли) (Р < 0,05) [8].
К сожалению, на практике эта методика оказалась трудновоспроизводимой. Количество внутроиопухолевых цветовых пятен существенно варьировало в зависимости не только от настройки допплеровского блока, но также от класса используемого прибора (нередко определялась существенная разница в данных между приборами сходного класса, но принадлежащим разным производителям), конституции пациентки и пр.
Таким образом, при несомненной наглядности энергетической допплерографии, демонстрирующей существенно отличающиеся визуально доброкачественные и злокачественные сосудистые русла, нецелесообразно рассматривать этот метод в качестве надежного критерия дифференциальной диагностики доброкачественного и злокачественного процесса.
В качестве своеобразного продолжения вышеописанной методики выступила трехмерная (3D) энергетическая допплерография с расчетами объемных индексов васкуляризации.
Количественная оценка неоваскуляризации: ЗО-энергетическая допплерография
Мы уже отмечали, что энергетическая допплерография позволяет провести только субъективную оценку выраженности неоваскуляризации. В связи с этим очевидно, что был бы очень актуален метод, количественно оценивающий удельный объем новообразованного сосудистого русла, а также интенсивность кровотока в нем. В последние годы с этой целью стала использоваться ЗО-энергетическая допплерография с количественной оценкой объема и интенсивности кровотока. В качестве условной единицы объема при этом рассматривается вексель, а единицы объема сосудистого русла - цветовой воксель. Расчеты соотношений в различных комбинациях цветовых и нецветовых векселей и представляют собой индексы васкуляризации. По сути это не что иное, как объемные гистограммы.
Первые публикации на обозначенную тему появились в конце XX века. Первоначально предлагалось использовать до 5 различных объемных индексов васкуляризации, в настоящее время используются 3 общепринятых индекса: 1) VI (индекс васкуляризации); 2) FI (индекс потока); 3) VFI (васкуляризацион-но-потоковый индекс). На рис. 1.8 представлены схематические обозначения этих индексов, а также объяснение их сущности с формулами расчетов [15].
Следует отметить, что главным условием правильного расчета объемных индексов васкуляризации является точное определение объема зоны интереса, т.е. опухоли или какой-либо ее области. Сделать это возможно с использованием специального программного пакета расчета объема VOCAL (Virtual Organ Computer Aided anaLysis).
Таким образом, для получения объемных индексов васкуляризации необходимо осуществить два этапа: 1) виртуальное создание объемной зоны интереса (рис. 1.9); 2) получение цветовой объемной гистограммы виртуально созданного объема (рис. 1.10).
22
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Рис. 1.8. Схематическое обозначение объемных индексов васкуляризации (приводится по [15] с изменениями).
VI (vascularization index) - индекс васкуляризации; Fl (flow index) - индекс потока; VFI (vascularization-flow index) - васкуляризационно-потоковый индекс. В виде черного куба представлен объем зоны интереса, в которой производятся расчеты индексов.
VI: цветные пятна различных оттенков красного цвета в левом кубе обозначают все цветовые воксели в исследуемом объеме (в данном случае векселем мы будем называть условную единицу объема). При этом яркость красной точки зависит от амплитуды ее сигнала (шкала амплитуды представлена вертикальным красным прямоугольником). Однако независимо от амплитуды при расчете VI учитываются все пятна, окрашенные в оттенки красного. Таким образом, этот индекс отражает весь удельный объем сосудистого русла. Адаптированная формула VI: все цветовые воксели / все воксели.
FI: стрелка указывает среднюю амплитуду сигнала. При расчете FI учитываются цветные пятна высокой амплитуды - взвешенные воксели (на схеме они окрашены ярко-красным цветом). Считается, что взвешенные воксели отражают сам кровоток (а не сосудистое русло). Таким образом, этот индекс демонстрирует уже только интенсивность кровотока, не являясь в полном смысле объемным. Адаптированная формула FI: взвешенные цветовые воксели / все цветовые воксели.
VFI: желтые пятна обозначают «взвешенные» цвета, отражающие интенсивность потока, которая также изображена в виде треугольной шкалы желтого цвета Данный индекс отражает удельный объем интенсивности кровотока, являясь комбинацией VI и FI. Адаптированная формула VFI: взвешенные цветовые воксели / все воксели.
Рис. 1.9. Виртуальное создание объемного региона интереса. Параметры настройки допплеровского блока: Fr normal; PRF 0,6 kHz; Gain 4,0; WMF «low»
Первоначально с помощью режима «3D Static» производится запись в базу данных 3D-ceK-тора в режиме энергетической допплерографии. Для оптимальных условий сбора данных регион интереса должен занимать весь экран, а пациентку нужно попросить оставаться неподвижной в течение 10-20 с, пока будет проводиться сбор данных.
Затем с использованием режима VOCAL с помощью ручной обводки (manual trace) региона интереса формируется виртуальный объем. Срезы, на которых нужно проводить ручную обводку, меняются через определенное количество градусов (шаг может меняться от 6° до 30° по желанию пользователя). Соответственно количество срезов, которые нужно вручную обвести, тоже будет меняться от 30 до 6. Проще и быстрее работать с большим шагом (30°). Опыт показал, что при изменении шага и соответственно количества обводок результаты меняются очень незначительно. Стрелкой показан пунктир ручной обводки региона интереса на одном из срезов.
23
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 1.10. а - объемный регион интереса виртуально создан (стрелка). Он имеет форму, полученную в результате интегрирования компьютером прибора заданного количества контуров, созданных пользователем вручную (см. рис. 1.9). В конкретном случае объем виртуального образования составляет 22,6 см3; б - расчет объемных индексов васкуляризации (в желтом контуре).
Первые результаты проведенных исследований показали как перспективность, так, к сожалению, и лабильность данной методики. О практическом использовании ЗО-энергетической допплерографии с целью диагностики патологической неоваскуляризации внутренних гениталий будет сказано в соответствующих главах этого тома.
Локализация выявленных внутриопухолевых зон неоваскуляризации
В 1991 г. A. Fleisher и соавт. [16] первыми опубликовали результаты исследований локализации выявленных внутриопухолевых сосудов. Результаты позволили авторам разделить внутриопухолевую васкуляризацию на периферическую и центральную. Вскоре A. Fleischer и соавт. [17] пришли к выводу, что центральная локализация сосудов типична прежде всего для злокачественного процесса. Вместе с тем авторы не сочли возможным предлагать этот признак в качестве самостоятельного критерия малигни-зации, а указали на необходимость использовать его в комплексе с количественными показателями внутриопухолевой гемодинамики.
24
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
Рис. 1.11. Спектральная допплерография злокачественной опухоли: доминирование одного патологического признака в одном сосуде. В данном случае допплерографический критерий малигнизации - высокая VmBX (27 см/с). Показатель RI (0,52), демонстрирующий среднюю резистентность кровотока, в данном случае во внимание не принимается.
Дальнейшие исследования G. Bogner и соавт. [18] позволили сделать вывод, что для карциномы характерна не столько центральная, сколько диффузная беспорядочная васкуляризация многочисленными сосудами (см. рис. 1.7). Авторы также отметили, что оценка топографии неоваскуляризации является субъективным зрительным процессом и зависит от опыта. Сходные результаты получены в результате наших собственных исследований неоваскуляризации в шейке матки и яичниках [8, 19].
Таким образом, при цветовой/энергетической допплерографии злокачественное образование от доброкачественного отличает: большее количество часто хаотично расположенных сосудов в опухоли; преимущественно центральное расположение зон васкуляризации в образовании солидного типа эхоструктуры; наличие множественных сосудов в перегородках и солидных папиллярных разрастаниях опухоли (при кистозно-солидной эхост-руктуре опухоли).
Количественная оценка неоваскуляризации: импульсная допплерометрия
Вне зависимости от первичной локализации опухоли при исследовании злокачественной неоваскуляризации внутренних гениталий обнаружены общие гемодинамические особенности: высокая скорость (рис. 1.11) и низкая резистентность артериального кровотока (рис. 1.12), высокая скорость венозного кровотока (рис. 1.13). В свою очередь гемодинамику доброкачественных новообразований отличает низкая скорость и высокая резистентность артериального кровотока (рис. 14), а также низкая скорость венозного кровотока.
Наши исследования количественных показателей внутриопухолевой гемодинамики внутренних гениталий позволили сформулировать ряд принципов оптимального использования импульсной допплерометрии для успешной дифференциальной диагностики доброкачественных и злокачественных опухолей:
25
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 1.12. Спектральная допплерография злокачественной опухоли: доминирование одного патологического признака в одном сосуде. В данном случае допплерографический критерий малигнизации - низкий RI (0,28). Низкая величина Vmax (6 см/с) в данном случае во внимание не принимается.
Рис. 1.13. Спектральная допплерография злокачественной опухоли. Высокий показатель Wmax: 12 см/с (в норме не более 5-6 см/с).
Рис. 1.14. Спектральная допплерография доброкачественной опухоли. Оба допплерометрических показателя: и Vmax(6 см/с), и RI (0,68) соответствуют доброкачественному процессу.
26
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
1. В целом для доброкачественных опухолей характерны низкая Vmax и высокий RI артериального внутриопухолевого кровотока, а также низкая Wmax, для злокачественных - высокая Vmax, низкий RI, высокая Wmax. Здесь не будут приводиться конкретные величины названных гемодинамических показателей, которые можно использовать в качестве дифференциально-диагностических критериев. Эти показатели различаются для опухолей различной локализации, поэтому они будут приведены в соответствующих главах.
2. Для доброкачественных новообразований не характерно достоверное изменение допплерометрических показателей в зависимости от возраста больных, гистологических типов и размеров опухолей, а также локализации внутриопухолевых сосудов.
3. При гнойно-некротическом воспалении доброкачественных новообразований часто определяется повышение скорости и снижение резистентности артериального кровотока, что может быть причиной ложноположительных результатов при диагностике рака.
4. Для злокачественных новообразованиях не характерно достоверное изменение допплерометрических показателей в зависимости от возраста больных и гистологических типов опухолей.
5. Для злокачественных новообразований характерно повышение скорости артериального и венозного кровотока, а также понижение резистентности артериального кровотока с увеличением размеров опухолей, уменьшением степени дифференцированности, а также возрастанием стадии онкологического процесса.
6. Важной особенностью внутриопухолевого кровотока является монотонность значений допплерометрических показателей в доброкачественных опухолях (доброкачественный ангиомономорфизм) и значительная вариабельность этих показателей в злокачественных опухолях (злокачественный ангиополиморфизм).
7. При исследовании количественных показателей внутриопухолевой гемодинамики не следует принимать во внимание сосуды, расположенные по контуру опухоли. Это могут оказаться примыкающие к опухоли и огибающие ее нормальные сосуды малого таза, показатели гемодинамики которых не имеют никакого отношения к гемодинамике опухоли. Пренебрежение этим правилом может привести как к ложноположительной, так ложноотрицательной диагностике злокачественного процесса.
8. Определение показателя Vmax в качестве критерия наличия/отсутствия малигнизации проводится так: необходимо оценить Vmax во всех (!) визуализируемых внутриопухолевых артериальных сосудах. В качестве критерия следует использовать максимальный показатель Vmax из всех полученных. Рассчитывать среднюю величину в опухоли нецелесообразно.
9. Определение показателя RI в качестве критерия наличия/отсутствия малигнизации проводится так: необходимо оценить RI во всех (!) визуализируемых внутриопухолевых артериальных сосудах. В качестве критерия следует использовать минимальный показатель RI из всех полученных. Кстати, для злокачественных новообразований характерно снижение резне-
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
тентности артериального кровотока от периферии к центру опухоли. Рассчитывать среднюю величину RI в опухоли нецелесообразно.
10. Определение показателя Wmax в качестве критерия наличия/отсутст-вия малигнизации проводится так: необходимо оценить Wmax во всех (!) визуализируемых внутриопухолевых венозных сосудах. В качестве критерия следует использовать максимальный показатель Wmax из всех полученных. Рассчитывать среднюю величину Wmax в опухоли нецелесообразно.
11. Очень часто в сосуде с высокой Vmax (критерий злокачественности) одновременно определяется высокий RI (критерий доброкачественности) и, наоборот, в сосуде с низким RI (критерий злокачественности) часто определяется низкая Vmax (критерий доброкачественности). Какой критерий принимать во внимание? Ответ: тот, который более типичен для малигнизации (при этом критерием «доброкачественности» следует пренебречь). Мы называем эту особенность «доминированием одного патологического признака в одном сосуде».
Таким образом, при обнаружении в исследуемом внутриопухолевом сосуде высокой Vmax и высокого RI следует, пренебрегая показателем RI, сделать вывод о гемодинамике, типичной для малигнизации (см. рис. 1.11).
При обнаружении в исследуемом внутриопухолевом сосуде низкой Vmax и низкого RI следует, пренебрегая показателем Vmax, также сделать вывод о гемодинамике, типичной для малигнизации (см. рис. 1.12).
При обнаружении в исследуемом внутриопухолевом сосуде низкой Vmax и высокого RI следует сделать вывод о гемодинамике, типичной для доброкачественного процесса (см. рис. 1.14).
12. Отсутствие признаков внутриопухолевого кровотока с высокой вероятностью позволяет исключить злокачественный процесс (допплеровский блок при этом должен быть настроен в режиме максимальной чувствительности с минимальным значением частоты повторения импульсов, а также отключенным фильтром подавления шумов).
Литература
1. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989.
2. Чекалова М.А., Зуев В.М. Ультразвуковая диагностика в онкогинекологии. М.: Издательский дом «Русский врач», 2004.
3. Ловитц Б., Касчиато Д. Введение в онкологию // Онкология / Под ред. Д. Касчиато. М.: Практика, 2008. С. 29-60.
4. Folkman J. Growth and metastasis of tumor in organ culture // Cancer. 1963. V. 16. P. 453-460.
5. Folkman J. Tumor angiogenesis 11 Adv. Cancer. Res. 1985. V. 43. P. 175-182.
6. Annunziata C.M., Azad N.S., Hoskins E.R. et al. Tumor invasion, angiogenesis, and metastasis: biology and clinical application // Principles and practice of gynecologic oncology. 5th ed. / Barakat R., Markman M., Randall M.E. Philadelphia et al.: Wolters Kluwer Health I Lippincott Williams & Wilkins, 2009. P. 71-85.
7. Kurjak A., Kupesic S. The assessment of pelvic tumor angiogenesis // An atlas of transvagi-nal color Doppler. 2nd ed / Eds A. Kurjak, S. Kupesic. New York; London: The Parthenon publishing group, 2000. P. 149-161.
28
I. Основы и принципы ультразвуковой диагностики в онкогинекологии
8. Буланов М.Н. Значение трансвагинальной цветовой допплерографии в сочетании с импульсной допплерометрией для дифференциальной диагностики доброкачественных и злокачественных новообразований яичников: Дис. ... канд. мед. наук. М., 1999.
9. Kurjak A., Zalud I., Jurkovic D. et al. Transvaginal color Doppler for the assessment of pelvic circulation //Acta Obstet. Gynecol. Scand. 1989. V. 68. P. 131-135.
10. Bourne T., Campbell S., Steer C. et al. Transvaginal color flow imaging: a possible screening tecnicue for ovatian cancer // Br. Med. J. 1989. V. 299. P. 136.
11. Hata T, Hata K., Senoh D. et al. Doppler ultrasound assesment of tumor vascularity in gynecologyc disorders //J.Ultrasound Med. 1989. V. 8. P. 309-314.
12. Митина Л.А., Казакевич В.И., Степанов С.О. Ультразвуковая онкоурология. М.: Сфера, 2005. С. 5-9.
13. Kurjak A., Zalud I. Ultrasound assessment of adnexal masses // Color Doppler imaging in obstetrics and gynecology I Eds R. Jaffe, S.L. Warsof. New York: McGraw-Hill, Inc., 1992. P. 265-282.
14. Prompeler H.J., Madjar H., Sauerbrei W. et al. Transvaginal color-coded Doppler ultrasound in ovarian tumors // Geburtsh. u. Frauenheilkd. 1994. V. 54. N4. P. 216-221.
15. Pairleitner H., Steiner H., Hasenoehrl G., Staudach A. Three-dimensional power Doppler sonography: imaging and quantifying blood flow and vascularization // Ultrasound Obstet. Gynecol. 1999. V. 14. P. 139-143.
16. Fleisher A., Rodgers W., Rao B. et al. Assesment of ovarian tumor vascularity with transvaginal color Doppler sonography //J. Ultrasound Med. 1991. V. 10. P. 563-568.
17. Fleischer A.C., Rodgers W.H., Kepple D.M. et al. Color Doppler sonography of ovarian masses: a multiparameter analysis // J. Ultrasound Med. 1993. V. 12. N1. P. 41-48.
18. Bogner G., Gruber R., Steiner H. Is the assessment of ovarian masses with colour Doppler ultrasound dependent of training? // Ultrasound Obstet. Gynecol. 1996. V.8. Suppl. 1. P. 152.
19. Буланов М.Н. Ультразвуковая диагностика патологии шейки матки: Дис.... д-ра мед. наук. М., 2004.
29
II
Патологические состояния влагалища
Введение • Ультразвуковое исследование влагалища в норме. Культя влагалища • Кисты влагалища • Доброкачественные опухоли влагалища • Злокачественные опухоли влагалища • Литература
Введение
Несмотря на то что в гинекологической практике патология влагалища встречается очень часто [1], во время ультразвукового исследования гениталий этот замечательный орган обычно «остается в стороне». Часто врач, проводящий трансвагинальную эхографию, попросту забывает о нем, в прямом и переносном смысле «проскальзывая» сразу к матке.
Во многом это объяснимо тем, что подавляющая часть заболеваний влагалища - это проблемы на уровне эпителия, связанные с гормональным дисбалансом, инфекциями, травмами и пр. А ввиду того, что размеры этих проблем микроскопические и часто измеряются даже не миллиметрами, а микронами, то очевидно, что современный диагностический ультразвук с его разрешающей способностью (см. I главу в 1-м томе) никак не может в данных ситуациях рассматриваться в качестве реального помощника.
Но сказанное выше не означает, что влагалище и ультразвуковая диагностика «несовместимы». Прочитав III главу в 1-м томе, посвященную врожденным аномалиям гениталий, вы убедились, как велика роль нашего метода при своевременном выявлении поперечных перегородок и заращений плевы, осложненных гематокольпосом, а также кист гартнерова хода. При травмах, осложненных подслизистыми гематомами, эхография помогает точно оценить их объем, а также провести прицельную пункцию и дренаж.
Внимательная ультразвуковая диагностика неоценима при выявлении кист и фибром влагалища, прекрасно помогая во время выработки оптимальной лечебной тактики.
И конечно же, эхография не может не служить серьезнейшим подспорьем при оценке статуса злокачественных процессов влагалища, видимая область которых нередко представляет «вершину айсберга», недоступную объективной оценке ни при кольпоскопии, ни при пальпации.
Надеюсь, что материал этой главы убедит читателей в том, что ультразвуковое исследование влагалища в качестве достаточно полноправного члена заслуживает включения в протокол ультразвукового гинекологического исследования.
31
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Ультразвуковое исследование влагалища в норме. Культя влагалища
Влагалище достаточно неплохо визуализируется при трансабдоминальном исследовании с наполненным мочевым пузырем в виде лентовидного образования средней или пониженной эхогенности, «тянущегося» от проекции лонного сочленения к шейке матки (рис. 2.1). При трансвагинальном исследовании датчик непосредственно примыкает к слизистой оболочке влагалища, поэтому визуализация стенки затруднена (однако не невозможна).
Есть несложные приемы, позволяющие получить более полное представление о состоянии вагинальной стенки:
• Во-первых, необходимо использовать максимальную из возможных частоту датчика. Многие современные полостные датчики позиционируются производителями, как работающие на частоте до 9-12 МГц. Такой уровень рабочей частоты позволяет добиться удовлетворительной визуализации тканей, непосредственно примыкающих к датчику.
• Во-вторых, введение датчика во влагалище должно быть очень медленным. Тогда вы легко увидите, как стенки влагалища раздвигаются под давлением сканирующей поверхности, и сможете достаточно отчетливо визуализировать состояние стенки (рис. 2.2). Полученной эхокартины будет абсолютно недостаточно для исследования воспалительных процессов, но вполне хватит для вывода о наличии/отсутствии органических изменений в стенке.
• В-третьих, создание эхонегативной прослойки между сканирующей поверхностью датчика и слизистой оболочкой позволит получить гораздо более полное представление о состоянии слизистой и подслизистой оболочек. Наиболее простой способ создания такой прослойки - большое количество геля в презервативе.
Культя влагалища
После экстирпации матки всегда следует уделять внимание оценке состояния культи влагалища. Это особенно актуально при оценке статуса онколо-
Рис. 2.1. Продольное трансабдоминальное сканирование. 1 - тело матки; 2 - шейка матки; 3 - влагалище; 4 - мочевой пузырь; 5 - кишка, содержащая газ.
гических больных. Именно в области дистального отдела культи влагалища следует искать рецидивы злокачественных опухолей малого таза. С учетом этого важно иметь верное представление об эхоструктуре дистального отдела культи влагалища (см. рис. 2.2). При поперечном сканировании латеральные отделы дистального отдела культи могут визуализироваться в виде своеобразных гипоэхогенных «карманов», которые неопытный врач может принять за рецидивы опухоли (рис. 2.3).
32
II. Патологические состояния влагалища
Рис. 2.2. Продольное трансвагинальное сканирование культи влагалища. Сканирующая поверхность датчика (*) раздвигает переднюю (1) и заднюю (2) стенки влагалища. Стенки влагалища между стрелками. Кпереди от датчика определяются еще не раздвинутые передняя (3) и задняя (4) стенки влагалища; 5 -полость влагалища с эхонегативным содержимым; 6 -слепой конец культи влагалища; 7 - петля кишечника, примыкающая к культе влагалища. Петля не фиксирована, во время исследования определяется ее перистальтика; 8 - мочевой пузырь.
Рис. 2.3. Поперечное трансвагинальное сканирование. Трансвагинальный датчик (*) в дистальном отделе (слепом конце) культи влагалища, а - правый, б -левый «карман» дистального отдела культи (стрелки).
33
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Кисты влагалища
Большинство доброкачественных объемных образований влагалища представляет собой результат аномального развития эпителия мюллеро-вых протоков и гартнеровых ходов. Гораздо реже причиной является эндометриоз. Изредка встречаются посттравматические эпителиальные кисты влагалища [2].
Среди кистозных образований влагалища чаще всего (75%) встречаются так называемые мюллеровы эпителиальные кисты. Они обычно локализуются в передней или задней стенке влагалища (рис. 2.4).
Кисты гартнеровых ходов (гартнеровы кисты) являются рудиментами, происходя из мезонефральных протоков. Локализуются эти кисты обычно в латеральной стенке влагалища, причем достаточно глубоко.
Рис. 2.4. Киста передней стенки влагалища у 85-летней женщины. Серия снимков (а-г) демонстрирует изменение положения и формы кисты в зависимости от положения трансвагинального датчика и соответственно от давления датчиком на кисту. 1 - киста с ультразвуковым признаком дисперсной взвеси, при допплерографии содержимое выглядит аваскуляр-ным; 2 - мочевой пузырь; 3 - примыкающие друг к другу задняя стенка мочевого пузыря и передняя стенка влагалища; 4 - артефакт усиления эхосигнала; 5 - артефакт боковой тени.
34
II. Патологические состояния влагалища
Гартнеровы кисты бывают как единичными, так и множественными. Большие кисты могут достигать 10-12 см в диаметре, сдавливая смежные органы [2].
При повышении плотности содержимого таких кист эхографически последние могут походить на солидные образования, хотя при этом все равно для них будет типично латеральное псевдоусиление эхосигнала (рис. 2.5).
Посттравматические эпителиальные кисты могут локализоваться в любом отделе влагалища. Изначально данные образования будут иметь все признаки организованных гематом, затем за счет резорбции содержимого внутренняя эхоструктура такой кисты станет характеризоваться эхонегативным содержимым, иногда с тонкими перегородками (нити фибрина).
Кисты парауретральных желез, а также вестибулярных желез возникают исключительно по передней стенке нижней трети влагалища. В данном случае необходимо проводить дифференциальную диагностику с дивертикулами мочевого пузыря и уретры [2].
Рис. 2.5. Трансвагинальное сканирование. Киста передней стенки влагалища небольших размеров с содержимым средней эхогенности и мелкими рассеянными гиперэхогенными включениями. Такая эхоструктура может имитировать солидную опухоль, а - сканирующая поверхность датчика в нижнем (проксимальном) отделе влагалища. Киста (1) плохо визуализируется за счет того, что датчик не примыкает к ней вплотную, а также за счет ревербераций от окружающих тканей и пузырька воздуха (стрелка) в своде влагалища; б - сканирующая поверхность датчика примыкает к кисте. Киста (1) визуализируется лучше. Передняя стенка влагалища - стрелка, задняя стенка влагалища - черная стрелка. Между ними определяется эхонегативный просвет полости влагалища (*).
35
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Доброкачественные опухоли влагалища
Доброкачественные соединительнотканные опухоли влагалища встречаются очень редко, происходя из субэпителиальной мезенхимы. Обычно это фибролейомиома влагалища. Очень редко можно встретить такие опухоли влагалища, как гемангиомы, липомы, а также нейрофибромы [3].
Для доброкачественных опухолей влагалища характерны четко очерченные контуры, сниженная или средняя эхогенность, а также отсутствие латерального псевдоусиления эхосигнала [2].
Злокачественные опухоли влагалища
Первичный рак влагалища (РВ) встречается редко, составляя 1-2% от всех злокачественных опухолей женских половых органов [4], в несколько раз чаще наблюдаются метастатические опухоли. Первичные опухоли влагалища у детей в первые годы жизни представлены эмбриональными рабдомиосаркомами, в юности - светлоклеточными аденокарциномами, у женщин среднего и старшего возраста это практически всегда плоскоклеточный низкодифференцированный рак. Поэтому, если онкологи обнаруживают у взрослых женщин другой гистологический тип опухоли влагалища, возникает необходимость исключения метастатического новообразования. Основной источник метастатических опухолей влагалища - рак шейки (РШМ) и тела матки, существенно реже - рак яичников и гипернефрома. Во влагалище также могут распространяться злокачественные опухоли уретры, мочевого пузыря, прямой кишки, бартолиновых желез [1].
У 74 больных преинвазивным РШМ обнаруживаются мультицентричес-кие очаги карциномы in situ (Са in situ - CIS) во влагалище, у 1/з больных преинвазивным РВ в течение предшествующих двух лет проводилось лечение CIS шейки матки [4].
Возникновение РВ в среднем наступает на 10-15 лет позже, чем РШМ, что объясняется более зрелым эпителием влагалища по сравнению с переходным эпителием шейки матки. Средний возраст больных составляет 60-65 лет.
Считается, что в патогенезе РВ имеет значение сочетание ряда факторов: вирусное инфицирование в репродуктивном возрасте, инволютивные и дистрофические процессы, облучение и иммуносупрессия [4].
Для РВ наиболее характерен лимфогенный тип метастазирования (частота лимфогенных метастазов составляет 10-20%). Метастазирование рака верхней трети влагалища происходит по тем же лимфатическим коллекторам, что и при РШМ: наружные, внутренние подвздошные и запирательные узлы. Опухоли средней трети влагалища метастазируют в лимфатические узлы таза, а также в пахово-бедренные опухоли нижней трети влагалища - в основном в пахово-бедренные лимфатические узлы [4].
36
II. Патологические состояния влагалища
Классификация клинических стадий рака влагалища
Приводим две классификации клинических стадий РВ, используемые на практике в нашей стране. Это классификация Министерства здравоохранения СССР (табл. 2.1), а также классификация Международной федерации акушеров и гинекологов (FIGO) (табл. 2.2). Классификация Министерства здравоохранения СССР несколько подробнее выделяет подстадии инвазивного рака (Illa—III6).
Таблица 2.1. Клинические стадии рака влагалища. Классификация Министерства здравоохранения СССР, 1985 (приводится по [4])
0 । Преинвазивная карцинома (синонимы: CIS, внутриэпителиальный рак) Опухоль диаметром до 2 см, прорастает не глубже подслизистого слоя. Регионарные метастазы не определяются
и Опухоль более 2 см в диаметре с той же глубиной инвазии или опухоль тех же или меньших размеров с паравагинальным инфильтратом, не распространяющаяся до стенок таза. Регионарные метастазы не определяются
Illa Опухоль любого размера с паравагинальным инфильтратом, распространяющаяся до стенок таза. Регионарные метастазы не определяются
Шб Опухоль той же или меньшей степени местного распространения с подвижными регионарными метастазами
iVa Опухоль любого размера, прорастает соседние органы (слизистую оболочку уретры, мочевого пузыря, прямой кишки) и ткани (промежность, кости таза)
IV6 Опухоль любого размера с фиксированными регионарными или отдаленными метастазами
Таблица 2.2. Клинические стадии рака влагалища. Классификация FIGO (приводится по [1])
0 I Рак in situ (отсутствие инвазии) Опухоль ограничена слизистой оболочкой влагалища
II Опухоль вовлекает субвагинальные ткани, но не распространяется на стенки таза
III IV Опухоль распространяется на стенки таза Опухоль распространяется за пределы малого таза или прорастает слизистую оболочку мочевого пузыря или прямой кишки. Буллезный отек
IVA IVB Распространение опухоли на близлежащие органы Отдаленные метастазы
37
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 2.6. Раковая опухоль передней стенки влагалища. а - продольное трансвагинальное сканирование. Ретродевиация матки. 1 -опухоль; 2 - передняя стенка влагалища, еще не вовлеченная в инвазию; 3 -передняя губа шейки матки; 4 - задняя губа шейки матки; 5 - тело матки; б - поперечное трансвагинальное сканирование. 1 - опухоль; 2 - передняя стенка влагалища, еще не вовлеченная в инвазию; 3 - артефакты реверберации от пузырьков газа во влагалище.
Рис. 2.7. Продольное трансвагинальное сканирование. Рак задней стенки влагалища. 1 - опухоль больших размеров; 2 - задняя стенка влагалища, еще не вовлеченная в инвазию.
38
II. Патологические состояния влагалища
Рис. 2.8. Раковая опухоль (1) передней стенки влагалища. В режиме энергетической допплерографии определяется интенсивная неоваскуляризация опухоли (стрелка).
Ультразвуковое исследование при злокачественных опухолях влагалища
Уже на I стадии РВ в проекции стенки последнего визуализируется образование продолговатой, как бы уплощенной формы, имеющее сниженную эхогенность и неровные контуры (рис. 2.6, 2.7). Цветовая допплерография обычно позволяет визуализировать интенсивную неоваскуляризацию опухоли (рис. 2.8).
Онкогинекологам практически не нужна помощь эхографии при первичной диагностике РВ. Однако точно оценить размеры опухоли, ее инвазию на смежные органы и ткани нашему методу вполне по силам. Ультразвуковой метод позволяет достаточно надежно оценить степень подвижности слизистой влагалища в месте опухоли, тем самым помогая определить выраженность инвазии.
Литература
1. Де Черни А.Х., Натан J1. Акушерство и гинекология. Диагностика и лечение. Т. II. Гинекология. Учебное пособие: Пер. с англ. / Под общей ред. А.Н. Стрижакова. М.: МЕДпресс-информ, 2009. С. 417-137.
2. Merz Е. Ultrasound in obstetrics and gynecology. V. 2. Gynecology. Stuttgart; New York: Thieme, 2007. P. 130-132.
3. Moore D.H., Koh W., McGuire W.P. et al. Vagina // Principles and Practice of Gynecologic Oncology. 5th ed. / Barakat R., Markman M., Randall M.E. Philadelphia et al.: Wolters Kluwer Health / Lippincott Williams & Wilkins, 2009. P. 553-591.
4. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. С. 164-172.
39
Ш Доброкачественные патологические процессы шейки матки
Введение • Классификация заболеваний шейки матки • Гиперплазия эндоцервикса • Полипы эндоцервикса • Ретенционные кисты шейки матки • Литература
Введение
Основные заболевания шейки матки целесообразно рассматривать через призму двух проблем: первая - нарушения фертильностии, вторая -онкологическая заболеваемость. Исходя из общей тематической направленности книги, внимательно рассмотрим данный орган в свете именно онкологической настороженности. С этой точки зрения вся патология шейки матки может быть представлена в виде последовательных нозологических этапов: фоновый процесс - предрак - рак. Такой взгляд представляется особенно актуальным в связи с продолжающимся ростом заболеваемости раком шейки матки.
Традиционно (и совершенно правильно) шейка матки считается легкодоступной визуальному гинекологическому осмотру. Однако сделаем необходимую поправку - доступна не вся шейка, а только эктоцервикс. Между тем в 10-15% случаев рак шейки матки развивается в эндоцервик-се [1]. Многие фоновые процессы также протекают в толще шейки матки, не определяясь визуально. Таким образом, несомненна целесообразность включения в программу скрининга рака шейки матки метода, позволяющего эффективно и вместе с тем быстро и нетравматично оценить внутреннюю структуру стромы шейки матки и цервикального канала. Очевидно, что в качестве претендента на эту роль я подразумеваю именно метод ультразвуковой диагностики.
В XX веке использование эхографии с этой целью было связано с ограничениями, обусловленными низкой разрешающей способностью имевшейся аппаратуры. Поэтому до недавнего времени шейка матки оставалась «недооцененной» врачами ультразвуковой диагностики. Недавние исследования в этой области, проведенные с использованием высокочастотной цифровой трансвагинальной эхографии и допплерографии [2], позволили самым существенным образом пересмотреть возможности ультразвуковой диагностики при оценке состояния шейки матки.
41
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ « Курс лекций
Классификация заболеваний шейки матки
Общеизвестна классификация патологических процессов шейки матки Я.В. Бохмана, отражающая все основные звенья патогенетической цепи, ведущей от фонового процесса к инвазивному раку.
Классификация патологических процессов шейки матки
(по Я.В. Бохману, 1976, приводится по [3])
I. Фоновые процессы: псевдоэрозия, лейкоплакия, полип, плоские кондиломы.
II. Предраковый процесс - дисплазия: слабая, умеренная, тяжелая.
III. Преинвазивный рак (Са in situ, внутриэпителиальный рак).
IV. Микроинвазивный рак.
V. Инвазивный рак: плоскоклеточный ороговевающий, плоскоклеточный неороговевающий, аденокарцинома, диморфный железисто-плоскоклеточный (мукоэпидермоидный), низкодифференцированный.
Так называемые фоновые процессы не являются предраком, но именно на их фоне могут развиваться очаговые пролиферативные изменения эпителия шейки матки [4]. Природа фоновых процессов может быть любой: дисгормональной, воспалительной, а также посттравматической. Помимо указанных в классификации, к ним также относят хронический эндоцерви-цит, шеечный эндометриоз, шеечную миому, гиперплазию эндоцервикса.
К предраковым состояниям относят пролифераты эпителия с явлениями анаплазии клеток, не выходящими за пределы базальной мембраны. Это дисплазия и предраковые полипы. Они имеют прямое отношение к возникновению опухолей, хотя последние развиваются из них не всегда [5].
В книге мы стараемся сочетать как органный, так и нозологический подход к изложению материала. В связи с этим вопросы ультразвуковой диагностики эндометриоза и миомы шейки матки рассмотрены в соответствующих главах 1 -го тома. В этой главе мы остановимся на гиперпластических процессах эндоцервикса, а также на ретенционных кистах шейки матки.
Гиперплазия эндоцервикса
По данным некоторых морфологов, гиперплазия эндоцервикса встречается почти у 75% женщин, нередко развиваясь на фоне хронического эндо-цервицита (рис. 3.1), а также приема гормональных контрацептивов. Для железистой гиперплазии характерно неравномерное, обычно очаговое утолщение слизистой оболочки цервикального канала, железы имеют различную форму и выстланы эпителием эндоцервикального типа. В большинстве случаев гиперплазия носит доброкачественный характер и обратима. Для аденоматозной гиперплазии характерны множественные скопления кистозно расширенных желез [6].
Ультразвуковая диагностика гиперплазии эндоцервикса чревата высокой вероятностью ложноположительных заключений. Важнейшим условием
42
III. Доброкачественные патологические процессы шейки матки
Рис. 3.1. Трансвагинальное продольное сканирование. Гиперплазия на фоне хронического эндоцервицита у 25-летней нерожавшей пациентки. Инструментальных вмешательств в анамнезе не было. Выявлен хламидиоз. Эндоцервикс утолщен до 10 мм (стрелки). Его эхогенность незначительно снижена, эхоструктура диффузно неоднородна, с множественными мелкими эхонегативными включениями (черные стрелки).
Рис. 3.2. Трансвагинальное продольное сканирование. Гиперплазия эндоцервикса. Эндоцервикс утолщен до 11 мм (стрелки). Его эхогенность незначительно снижена, эхоструктура диффузно неоднородна, с множественными мелкими эхонегативными включениями (черные стрелки). Следует отметить, что угол сканирования в данном случае не оптимален - 42° (пересекающиеся сплошные линии), поэтому возможно завышение толщины эндоцервикса.
точной диагностики гиперплазии эндоцервикса является угол сканирования. При взаимно перпендикулярном расположении оси шейки матки и оси сканирования возможно с максимальной точностью измерить толщину эндоцервикса, а также оценить его эхоструктуру. При параллельном или близком к нему расположении этих осей сделать это корректно практически невозможно. В таком случае при сомнениях лучше воздержаться от интерпретации (рис. 3.2, 3.3).
При поиске гиперплазии эндоцервикса не требуется исследования в строго определенные дни, поскольку, как известно, последний почти Не претерпевает каких-либо значимых изменений в течение менструального цикла. Вместе с тем исследование в позднюю пролиферативную фазу (12-14-й день) облегчает визуализацию слизистой за счет расширения цервикального канала эхонегативным содержимым (слизистая пробка).
43
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.3. Гиперплазия эндоцервикса. а - трансвагинальное продольное сканирование; б - трансвагинальное поперечное сканирование. Эндоцервикс утолщен до 8 мм (стрелки). Напомним, что толщину эндоцервикса следует измерять только при продольном сканировании шейки матки. Его эхогенность незначительно неравномерно повышена, эхоструктура диффузно неоднородна, с мелкими эхонегативными включениями (черные стрелки).
Средняя толщина эндоцервикса при его гиперплазии, по нашим данным [2], составила 9,2 ± 1,8 мм (колебания от 8 до 12 мм) (см. рис. 3.1-3.3). Эхогенность эндоцервикса при этом была преимущественно средней (60%) и пониженной (25%). Высокая эхогенность эндоцервикса при гиперплазии наблюдается относительно редко (15%). Эхоструктура эндоцервикса при этом выглядит преимущественно диффузно неоднородной, часто с мелкими кистозными включениями (см. рис. 3.1-3.3).
Расширение цервикального канала жидким содержимым всегда улучшает визуализацию как просвета цервикального канала, так и эндоцервикса (рис. 3.4).
Допплерографически в шейке матки при этом определяется преимущественно умеренная васкуляризация при достаточно равномерном распределении сосудов без наличия локальных участков гиперваскуляризации (рис. 3.5). Количественные показатели шеечной гемодинамики при гиперплазии эндоцервикса достоверно не отличаются от нормы [2].
44
III. Доброкачественные патологические процессы шейки матки
Рис. 3.4. Трансвагинальное продольное сканирование. Пациентке 61 год, у нее обнаружена гиперплазия эндометрия. Гиперплазия эндоцервикса (стрелки). Эхогенность эндоцервикса снижена, эхоструктура диффузно неоднородна, с мелкими эхонегативными включениями (черные стрелки). Расширение цервикального канала за счет жидкости (1) облегчает визуализацию эндоцервикса. В данном случае интерпретация существенно затруднена из-за некорректного угла сканирования - оси сканирования и шейки матки расположены под очень острым углом - они почти параллельны (пересекающиеся под углом линии). Окончательный диагноз был поставлен гистологически после раздельного диагностического выскабливания по поводу утолщения эндометрия в постменопаузе до 6 мм на фоне кровотечения.
Рис. 3.5. Трансвагинальное сканирование в режиме ЗО-энергетической допплерографии, а также в 3D- реконструкции «стекловидное тело» («glass body») (внизу справа). Гиперплазия эндоцервикса (стрелки). На фронтальном срезе полости матки (внизу слева) хорошо видна неравномерная эхогенность эндоцервикса с гипо- (1) и гиперэхогенными (2) участками. Скудная васкуляризация преимущественно в периферических отделах эндоцервикса (черные стрелки).
45
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Полипы эндоцервикса
Полипы эндоцервикса составляют почти 1/4 среди доброкачественных патологических состояний шейки матки, при этом они в 70% случаев наблюдаются при других гинекологических заболеваниях (в основном это миома, гиперплазия и полипы эндометрия) [4]. Как и эндометриальные, полипы эндоцервикса имеют в основе своего этиопатогенеза дисгормональные нарушения и являются следующим количественным этапом гиперплазии слизистой оболочки шейки матки.
Величина и форма полипов разнообразны, чаще их диаметр составляет 2-4 мм, длина - 2-10 мм, форма овальная или круглая. Поверхность гладкая, консистенция мягкая, при большем содержании фибрина более плотная. Основание - тонкая либо широкая ножка [5]. Основание полипа обычно находится в средней или верхней трети цервикального канала, а верхушка часто выходит в наружный зев и определяется визуально. Полипы могут быть множественными. Кровеносные сосуды полипов толстостенные, склерозированные и располагаются в центральном отделе или у основания полипа. Морфологически полипы бывают фиброзными, железисто-фиброзными, железистыми. Нередко в них наблюдаются воспаление, некроз, поверхностные изъязвления.
Описываются также аденоматозные (с пролиферативной активностью железистого компонента и его структурной перестройкой) и ангиоматоз-ные (богатые сосудами) полипы.
Рецидивы полипов шейки матки составляют 9-10%. Необходимо дифференцировать полипы эндоцервикса и истмического отдела матки (рис. 3.6).
Эхокартина полипов эндоцервикса
Е.М. Куковенко и С.А. Саркисов [6] описывают полипы эндоцервикса в виде овальных гиперэхогенных участков, дилатирующих цервикальный канал. При крупных полипах (до 1 см) лоцировалась ножка в виде узкой эхопозитивной линии, придававшей трехслойный характер продольному сечению цервикального канала (3 эхогенные линии: слизистая передней стенки, ножка полипа, слизистая задней стенки). Авторы обращают особое внимание на практическую невозможность визуализировать полипы, расположенные в нижней трети цервикального канала, независимо от их размеров. Визуализации доступны полипы в средней и верхней трети цервикального канала при диаметре более 5 мм, причем в основном железистофиброзные и фиброзные. Авторы отмечают повышение эхогенности с увеличением фиброзного компонента в полипе.
Визуализация полипов, расположенных в нижней трети цервикального канала, существенно затруднена, часто невозможна (при этой локализации удается обнаружить примерно 30% полипов).
Важно определить, откуда исходит ножка полипа. В V главе, посвященной гиперпластическим процессам эндометрия, мы описываем полип,
46
III. Доброкачественные патологические процессы шейки матки
Рис. 3.6. Трансвагинальное продольное сканирование. Большой полип, исходящий из истми-ческого отдела матки. 1 - полип, имеет неравномерно повышенную эхогенность; 2 - основание полипа, расположенное в истмическом отделе матки (стрелка); 3 - нижний полюс полипа, находящийся уже за пределами наружного зева (черная стрелка); 4 - эндометрий.
ножка которого располагалась почти в дне полости матки, а нижний конец -в области наружного зева. Здесь мы тоже приводим изображение полипа эндоцервикса, занимающего весь шеечный канал, от внутреннего до наружного зева (см. рис. 3.6).
Обратим внимание на существенное отличие эхокартины полипа эндо-цервикального от полипа эндометрия. Контур полипов, как правило, четкий и ровный, эхогенность средняя или немного повышенная (см. рис. 3.6, 3.7). Однако типичный эхопризнак «эхонегативного ободка», описываемый при эндометриальных полипах, в данном случае очень часто не виден. Полипы эндоцервикса выглядят как бы «сдавленными» тесно прилегающими стенками цервикального канала (см. рис. 3.7, а, б). Тогда для более уверенной визуализации полипа потребуется использование режима Zoom в сочетании с высокой частотой сканирования (см. рис. 3.7, в).
При наличии в просвете цервикального канала свободной жидкости изображение полипов существенно улучшается (рис. 3.8-3.10).
По нашим данным [2], железисто-фиброзные полипы визуализировались в виде образований продолговатой, реже овоидной формы, расположенных в просвете цервикального канала. При этом их длина составила в среднем 24,3 ±11,2 мм (6-38 мм), диаметр- 8,2 ± 5,3 мм (4-15 мм), объем - 0,78 ± 0,23 см3 (0,24-3,6 см3).
Следует отметить, что важнейшим условием точной диагностики полипов эндоцервикса является угол сканирования. При взаимно перпендикулярном расположении оси шейки матки и оси сканирования ситуация оптимальна. При параллельном или близком к нему расположении этих осей вероятность успеха близка к нулю. Лучше не стоит даже пытаться интерпретировать полученную картину. Правда, при достаточно больших образованиях шейки матки угол сканирования не столь фатально влияет на успех интерпретации.
47
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.7. Трансвагинальное продольное сканирование. Во всех трех случаях наблюдаются маленькие полипы средней эхогенности, расположенные в средней трети эндоцервикса (стрелки), в - трудно визуализируемый полип, по своей эхогенности не отличающийся от окружающего эндоцервикса (черные стрелки). При сканировании в режиме реального времени в уточнении диагноза помог эффект скольжения полипа, имевшего тонкую ножку, исходящую из верхней трети эндоцервикса (на эхограмме не видна). При легком надавливании датчиком полип смещался в просвете цервикального канала.
48
III. Доброкачественные патологические процессы шейки матки
Рис. 3.8. a - трансвагинальное продольное сканирование; б - трансвагинальное поперечное сканирование. При наличии в просвете цервикального канала свободной жидкости (1) изображение полипов (стрелка) улучшается; в -трансвагинальное продольное сканирование. В анамнезе диатермоэксцизия шейки матки по поводу дисплазии. Цервикальный канал значительно расширен (1) и деформирован (2). Иллюзия полипа на широком основании (стрелки)за счет рубцовой деформации цервикального канала.
49
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.9. Трансвагинальное продольное сканирование. Множественные мелкие полипы эндоцервикса (1) хорошо видны на фоне эхонегативной жидкости в просвете цервикального канала (2).
Рис. 3.10. а - трансвагинальное поперечное сканирование; б - трансвагинальное продольное сканирование с направленной энергетической допплерографией. 1 - полип; 2 -жидкость в полости цервикального канала; 3 - сосудистая ножка полипа. При продольном сканировании красный цвет цветовой карты демонстрирует направление кровотока от внутреннего к наружному зеву (направление к датчику).
50
III. Доброкачественные патологические процессы шейки матки
Значение цветовой допплерографии при полипах эндоцервикса
Мы считаем, что допплерография имеет очень существенное значение в диагностике полипов эндоцервикса. Хорошо демонстрируемая при цве-товой/энергетической допплерографии сосудистая ножка помогает точно определить локализацию основания полипа (см. рис. 3.10). При очень тонких полипах, практически сливающихся с изображением эндоцервикса, допплерографическое изображение сосудистой ножки, выглядящей своеобразной цветовой осью полипа, не оставляет сомнений в наличии последнего (рис. 3.11). При этом всегда хорошо видно направление кровотока от внутреннего к наружному зеву (см. рис. 3.10, 3.11).
Рис. 3.11. Трансвагинальное продольное сканирование. В В-режиме с трудом визуализируются очень тонкие полипы, расположенные в средней и нижней трети цервикального канала (стрелки). Интерпретацию немного облегчает свободная жидкость в просвете канала (1) В режиме энергетической допплерографии (на верхнем снимке - направленной) отчетливо видны сосудистые ножки полипов, выглядящие как своебразные цветовые оси полипов, красное прокрашивание которых (на верхнем снимке) подчеркивает направление кровотока к внутреннему зеву.
5Н
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.12. Трансвагинальное продольное сканирование. Полип эндоцервикса очень плохо виден, в частности за счет неадекватного угла сканирования, но помогает энергетическая допплерография, демонстрирующая его сосудистую ножку (стрелка).
Рис. 3.13. а - трансвагинальное продольное сканирование; б - трансвагинальное поперечное сканирование. Большой железистофиброзный полип (стрелки) с эпидермизацией и дисплазией III степени в зоне эпидермизации, с выраженными некротическими изменениями в строме. Обращает на себя внимание неоднородная эхоструктура полипа с эхонегативными участками (1).
52
III. Доброкачественные патологические процессы шейки матки
Рис. 3.14. Большой аденоматозный полип эндоцервикса. а - В-режим. Полип указан стрелкой; б - направленная энергетическая допплерография демонстрирует интенсивную васкуляризацию полипа (стрелка) с высокой скоростью кровотока (Vmax 21 см/с).
Полипы, расположенные в нижней трети цервикального канала и плохо визуализируемые в В-режиме, более четко обнаруживают себя демонстрацией сосудистой ножки при цветовой допплерографии (см. рис. 3.11, в).
Цветовая допплерография может помочь в преодолении проблемы угла сканирования шейки матки. Полипы, сливающиеся с изображением эндоцервикса в В-режиме за счет неадекватного угла сканирования, можно более уверенно определить с помощью цветовой допплерографии (рис. 3.12).
Эхоструктура аденоматозных полипов не имеет существенных отличий. Они немного больше простых железистых, но эти отличия недостоверны. Размеры аденоматозных полипов: длина 32,3 ± 12,3 мм (8-42 мм), диаметр 9,2 ± 5,7 мм (7-16 мм), объем 1,12 ± 0,31 см3 (0,75-3,8 см3). На рис. 3.13 и 3.14 показаны большие аденоматозные полипы.
Допплеровское исследование аденоматозных полипов часто демонстрирует интенсивную васкуляризацию последних, когда сосудистая ножка не просто проникает внутрь полипа, но «ветвится», давая своеобразный признак сосудистого дерева полипа (см. рис. 3.14, 3.15) [2].
53
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.15. Богато васкуляризованный небольшой полип эндоцервикса. В режиме энергетической допплерографии видна интенсивная васкуляризация полипа (стрелка).
Рис. 3.16. Триплексный режим. Аденоматозный полип эндоцервикса. Vmax 71 см/с.
Таблица 3.1. Допплерометрические показатели кровотока в полипах эндоцервикса [2]
Показатель Простые полипы Аденоматозные полипы Р
Vmax5 С М/С 8,3 ±2,7 (5,2-12,8) 19,6 ±8,4 (14,0-70,7) <0,01
RI 0,57 + 0,05 (0,50-0,68) 0,54 ±0,05 (0,52-0,64) >0,05
Wmax, см/с 4,3 ±2,0 (4,2-6,8) 6,1 ±2,6 (4,0-9,5) >0,05
54
III. Доброкачественные патологические процессы шейки матки
Количественный анализ кровотока при полипах эндоцервикса
Результаты количественной оценки гемодинамики эндоцервикальных полипов представлены в таблице 3.1.
Таким образом, обращает на себя внимание выраженное повышение скорости кровотока (см. рис. 3.14, 3.16) в аденоматозных полипах (19,6 ± ± 8,4 см/с), в то время как в простых полипах эндоцервикса допплерометрические показатели достоверно не отличаются от нормативов внутриэн-доцервикального кровотока. Очевидно, что это может помочь в формировании группы повышенного риска онкологической патологии.
Ретенционные кисты шейки матки
Небольшие кистозные образования - почти неотъемлемая часть ультразвукового «пейзажа» этого органа. Они обнаруживаются как минимум у 75% женской популяции. Визуализация кист шейки матки может быть объяснена как проявление патологии шейки матки. Они могут наблюдаться, например, при эндометриозе (см. главу V «Эндометриоз» в 1-м томе), хроническом эн-доцервиците (см. главу «Воспалительные заболевания» в 3-м томе).
Однако оказалось, что не всегда эхокартина кист шейки матки объясняется наличием конкретного заболевания. Довольно часто кисты шейки матки разнообразных размеров и локализации обнаруживаются при ультразвуковом исследовании клинически здоровых женщин. Своего рода «образцовым» подтверждением этой точки зрения является нередкая визуализация цервикальных кист у девственниц. Мы определяли такие кисты примерно у половины virgo при трансректальном ультразвуковом исследовании [2].
Таким образом, целесообразно говорить и о ретенционных кистах шейки матки как таковых, по всей видимости, не являющихся эхопризнаком какой-либо определенной патологии. Общеизвестно, что такие кисты возникают вследствие закупорки выводных протоков желез эндоцервикса. Этому могут способствовать инфекция и травма шейки матки в родах или при инструментальном вмешательстве.
Однако не стоит, обнаружив «изолированные» кисты шейки матки на фоне нормального в остальном ультразвукового изображения, сразу давать заключение о наличии нездоровья. Можно ограничиться ультразвуковым заключением: ультразвуковые признаки ретенционных кист шейки матки. При этом в описательной части протокола исследования следует подробно охарактеризовать количество кист, их локализацию и размеры (рис. 3.17-3.19).
Количество ретенционных кист в шейке матки колеблется от единичных до множественных - 5-6 кист и более (см. рис. 3.17-3.19). Оказалось, что почти в половине случаев визуализации цервикальных кист обнаруживаются именно единичные кисты. При множественных кистах шейки матки определяется прямая корреляционная связь между количеством кист и числом
55
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.17. Трансвагинальное продольное сканирование. Изображение нескольких сагиттальных срезов одной шеики матки. Различная локализация кист шейки матки, а - в субэктоцер-викальной (1), субэндоцер-викальной (2) зоне, нижней трети эндоцервикса (3); б - в субэндоцервикальной зоне (2) и эндоцервиксе (3); в-в нижней трети эндоцервикса (3) и субэктоцерви-кальной зоне (1).
56
III. Доброкачественные патологические процессы шейки матки
Рис. 3.17 (окончание), г-в нижней трети эндоцервикса (3) и строме шейки (4).
Рис. 3.18. Трансвагиналь-ное косопоперечное сканирование. Множественные кисты шейки матки. Строма шейки матки практически не визуализируется. При осмотре на гинекологическом кресле шейка матки выглядела значительно гипертрофированной. Ультразвуковое исследование помогло исключить эндофитную форму рака.
Рис. 3.19. Трансвагинальное косопродольное сканирование. 1 - большая киста шейки матки; 2 - строма шейки матки; 3 - тело матки.
57
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 3.20. Трансвагинальное сканирование. Триплексный режим. Огибающие сосуды по периферии кист шейки матки (стрелки). Vmax5 см/с, RI 0,63.
родов и (или) абортов в анамнезе. Однако более всего эта связь оказалась выраженной с возрастом женщины (максимальный коэффициент корреляции). Важная деталь - количество цервикальных кист растет с годами, но только до менопаузы. В постменопаузе их количество снова уменьшается, при ее продолжительности более 15-20 лет мы уже почти всегда имеем дело только с единичными кистами шейки матки.
Диаметр кист шейки матки чаще всего колеблется в пределах 1-8 мм. Имеется определенная связь между локализацией и размерами кист. Суб-эктоцервикальные кисты обычно имеют диаметр 2-8 мм. Эндоцервикаль-ные кисты почти не превышают 4 мм, при этом у перешейка и в средних отделах эндоцервикса их диаметр практически не бывает более 3 мм. Диаметр кист субэндоцервикса у перешейка и в средних отделах чаще всего составляет 2-4 мм, а у переходной зоны - 3-5 мм. В строме размеры кист варьируют больше, в основном составляя от 1 до 8 мм. Вместе с тем изредка можно встретить ретенционные кисты шейки матки весьма большого диаметра, достигающего 3-4 см и даже более.
Допплерографически по периферии кист может определяться скудный кровоток, характеризующийся низкой скоростью и средней или высокой резистентностью (рис. 3.20). Очевидно, что это огибающие кисты стромальные сосуды шейки матки.
Литература
1. Козаченко В.П. Современное состояние проблемы рака шейки матки // Заболевания шейки матки, влагалища и вульвы: (Клинические лекции) / Под ред. В.Н. Прилеп-ской. М.: МЕДпресс-информ, 2000. С. 133.
2. Буланов М.Н. Ультразвуковая диагностика патологии шейки матки: Дис.... д-ра мед. наук. М., 2004
3. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. С. 173-275.
4. Хмельницкий О.К. Патоморфологическая диагностика гинекологических заболеваний. СПб.: Сотис, 1994. С. 334-354.
5. Русакевич П.С. Заболевания шейки матки. Минск: Вышейшая школа, 2000.
6. Куковенко Е.М., Саркисов С.Э. Возможности трансвагинального ультразвукового исследования и цервикогистероскопии в диагностике полипов цервикального канала //Ультразвук, и функцион. диагн. 2003. №1. С. 41-46.
IV
Рак шейки матки
Введение • Кратко об истории использования метода в диагностике рака шейки матки • Классификация клинических стадий рака шейки матки • Преинвазивный и микроинвазивный рак • Инвазивный рак в пределах шейки матки • Распространенный инвазивный рак • Состояние после лучевой терапии и химиотерапии • Редкие стромальные злокачественные опухоли шейки матки • Литература
Введение
В III главе уже говорилось о важности использования ультразвуковой диагностики для своевременного выявления фоновых и предраковых заболеваний шейки матки.
Каково же значение нашего метода при выявлении рака шейки матки (РШМ)? Многие авторитетные онкогинекологи обоснованно высказываются о серьезных трудностях, сопряженных с ультразвуковой диагностикой ранних форм цервикальной карциномы [1].
Вместе с тем наш опыт показывает, что все стадии РШМ имеют достаточно характерные эхографические и допплерографические признаки, позволяющие реально помочь онкогинекологам в своевременной диагностике и определении стадии опухоли [2].
Предлагаемые ниже ультразвуковые критерии, несомненно, должны способствовать своевременному выявлению изменений шейки матки на различных этапах онкологического процесса. Уверен, что применение комплекса предлагаемых эхографических и допплерографических методик реально поможет гинекологам и онкогинекологам сократить время установления диагноза. Особую важность это приобретает в амбулаторных условиях, в итоге приводя к повышению эффективности лечения и увеличению продолжительности жизни больных.
Более того, я надеюсь, что предложенный алгоритм использования метода ультразвуковой диагностики при поиске патологических состояний шейки матки позволит занять данному методу достойное место в программе онкоги-некологического скрининга. В первую очередь это касается тех случаев, когда РШМ изначально развивается в шеечном канале и доступен визуальному он-когинекологическому осмотру, как правило, уже при распространенной инвазии . Напомним, что частота РШМ, изначально развивающегося в эндоцервик-се (а не в переходной зоне), по данным различных авторов, составляет от 10% [3] до 17% [4].
Еще один важнейший аспект использования эхографии при РШМ - своевременное определение точных размеров опухоли. Оказалось, что трехлетний безрицидивный период после радикального лечения I стадии плоскокле
59
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ « Курс лекций
точного РШМ отмечен у 95% больных с микроинвазивной формой рака, у 88% при размере опухоли 3 см и меньше и только у 68% при размерах опухоли больше 3 см [1].
Кратко об истории использования метода в диагностике рака шейки матки
Если публикации, посвященные ультразвуковой диагностике рака эндометрия и яичников, появились уже в середине 70-х годов прошлого столетия, то впервые мнение о возможности диагностики РШМ с помощью эхографии было высказано лишь в 1986 г. G. Bernaschek и соавт. [5]. Авторы использовали трансректальный и трансвагинальной методы сканирования, отметив, что им удалось постадийно дифференцировать онкологический процесс начиная со стадии IB. В 1989 г. R. Osmers и соавт. [6] заявили о возможности визуализировать РШМ на доклиническом этапе с помощью трансвагинальной эхографии.
Однако большинство работ, выполненных в 80-е и 90-е годы XX века, в настоящее время не представляются актуальными, поскольку описывают в основном распространенные инвазивные формы РШМ, когда эхография играла скорее констатирующую, чем реальную диагностическую роль. Несомненно, это связано с недостаточной разрешающей способностью имевшейся аппаратуры. Поданным A. Kikuchi и соавт. [7], при попытке диагностировать преинвазивный РШМ оказался неэффективным даже такой высокоразрешающий метод, как интрацервикальная эхография с высокочастотным микродатчиком. Закономерно мнение М.А. Чекаловой, высказанное в 1997 г., о том, что эхография при поиске РШМ имеет лишь уточняющее значение [8].
Тем не менее уже в 2000 г. S. Ivanov и соавт. [9] с успехом использовали трансвагинальную эхографию для оценки инвазии стромы, считая метод предпочтительнее компьютерной томографии. Тогда же, на рубеже веков, A. Suren и соавт. [10] одними из первых обнаружили признак локального усиления васкуляризации при РШМ, используя трехмерную реконструкцию энергетической допплерографии.
Наши собственные исследования с использованием высокоразрешающей трансвагинальной ультразвуковой диагностики также продемонстрировали достаточно высокую диагностическую точность метода для своевременной диагностики и определения стадии РШМ [2].
Классификация клинических стадий рака шейки матки
Приводим две очень сходные классификации клинических стадий РШМ, используемые на практике в нашей стране. Это классификация Министерства здравоохранения СССР (табл. 4.1), а также классификация Международной федерации акушеров и гинекологов (FIGO) (табл. 4.2). Классифика-
60
IV. Рак шейки матки
Таблица 4.1. Клинические стадии рака шейки матки. Классификация Министерства здравоохранения СССР, 1985 (приводится по [4])
0 la Преинвазивный рак (Са in situ] Опухоль ограничена шейкой матки и инвазией в строму не более 3 мм (диаметр меньше 10 мм) - микроинвазивный рак
I6 На Опухоль ограничена шейкой матки с инвазией в строму более 3 мм Опухоль инфильтрирует влагалище, не переходя на его нижнюю треть и/или распространяется на тело матки
Нб Опухоль инфильтрирует параметрий на одной или обеих сторонах, не переходя на стенку таза
Illa Опухоль инфильтрирует нижнюю треть влагалища и/или имеются метастазы в придатках матки, регионарные метастазы отсутствуют
Шб Опухоль инфильтрирует параметрий на одной или обеих сторонах до стенки таза и/или имеются регионарные метастазы в лимфатических узлах таза, и/или определяется гидронефроз и нефункционирующая почка, обусловленные стенозом мочеточника
IVa IV6 Прорастание опухоли в мочевой пузырь или прямую кишку Отдаленные метастазы за пределами таза
Таблица 4.2. Клинические стадии рака шейки матки. Классификация FIGO (приводится по [1])
0 I Рак in situ (отсутствие инвазии) Опухоль ограничена шейкой матки
IA Опухоль определяется только при гистологическом исследовании (микроинвазивный рак)
IA, 1А2 Глубина инвазии 3 мм и менее Глубина инвазии более 3 мм, но равна или менее 5 мм, диаметр 7 мм и менее
IB Опухоли, глубина инвазии и размеры которых превышают описанные для стадии IA (>5 и >7 мм)
IB, IB2 II Размеры опухоли 40 мм и менее Размеры опухоли более 40 мм Распространение опухоли за пределы шейки матки, но без перехода на стенки таза или нижнюю треть влагалища
ПА Распространение на влагалище, кроме дистальной трети, без вовлечения параметрия
IIB III Вовлечение параметрия Опухоль распространяется на стенку таза или нижнюю треть влагалища, а также все случаи РШМ с гидронефрозом или нефункционирующей почкой
IIIA IIIB Вовлечение нижней трети влагалища Опухоль распространяется на стенку таза, гидронефроз или нефункционирующая почка
IV Опухоль распространяется за пределы малого таза или прорастает слизистую оболочку мочевого пузыря или прямой кишки
IVA Опухоль прорастает слизистую оболочку мочевого пузыря или прямой кишки
IVB Отдаленные метастазы
61
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Таблица 4.3. Выживаемость пациенток с карциномой шейки матки на основании классификации стадий заболевания FIGO (приводится по [11 ] с изменениями)
Стадия Выживаемость, %
1 год 2 года 3 года
IA 98 97 95
IB 96 89 80
ПА 92 81 66
IIB 92 79 64
IIIA 79 57 33
IIIB 77 55 39
IVA 52 31 17
IVB 35 23 9
ция FIGO несколько подробнее выделяет подстадии микро- и малоинвазивного рака (IA-IB). В то же время классификация Министерства здравоохранения СССР в стадии III6 (IIIB по FIGO) больше детализирует распространенность онкологического процесса, выделяя вовлечение регионарных лимфатических узлов. В этой главе мы постараемся учитывать особенности обеих классификаций.
В табл. 4.3 приведены показатели выживаемости пациенток с карциномой шейки матки на основании классификации стадий заболевания FIGO.
Преинвазивный и микроинвазивный рак
Несмотря на то что вопросам ультразвуковой диагностики пре- и микро-инвазивного РШМ мы постараемся уделить достаточное внимание, следует признать, что на практике эти патологические состояния пока еще малодоступны нашему методу, большей частью оставаясь «ультразвуковыми невидимками». Вместе с тем сегодня уже можно говорить о минимальных успехах ультразвуковой диагностики в этой области, о чем и будет рассказано ниже.
Преинвазивный рак
Как хорошо известно, РШМ большей частью развивается в так называемой переходной зоне (зоне трансформации), расположенной примерно в области наружного зева. Именно здесь, на стыке многослойного плоского эпителия эктоцервикса и цилиндрического эпителия эндоцервикса начинается 85-90% шеечной карциномы. Кстати, стык эпителиев может располагаться на разных уровнях шейки матки. Это зависит от возраста и соответствующего гормонального статуса: в репродуктивном возрасте в области наружного зева, в пери- и постменопаузе уже выше.
Злокачественный процесс в шейке матки развивается с преинвазивной стадии, или карциномы in situ (Са in situ - CIS). По определению Я.В. Бохмана, под термином «Са in situ» принято понимать патологию покровного эпителия шейки матки, во всей толще которого имеются гистологические признаки рака, но отсутствует инвазия в подлежащую строму [4]. Как пишет автор, «Са in situ находится в состоянии динамического равновесия...».
Другой важной особенностью описываемого процесса является то, что он почти никогда не возникает «на пустом месте», а в основном на фоне псевдоэрозии, эндоцервицита, эктропиона, разрывов, дисплазии и пр., являясь, на-
62
IV. Рак шейки матки
Рис. 4.1. Продольное трансвагинальное сканирование. CIS. Эхокартина не отличается от нормальной.
1 - переходная зона (стрелка); 2 - субэндоцервикаль-ные кисты.
пример, казуистикой у девственниц [3]. Давно доказано, что РШМ в своем развитии, как правило, проходит несколько фаз - от дисплазии различной степени выраженности к преинвазивному раку (CIS) и, наконец, к инвазии [4].
Ультразвуковое исследование при CIS
CIS - злокачественный процесс микроскопического порядка, который по определению не может визуализироваться при ультразвуковом исследовании. На сегодняшний день ни один вид ультразвуковой диагностики, включая эластографию, не позволяет визуализировать специфические особенности CIS [12].
Вместе с тем наш ретроспективный анализ эхограмм больных с CIS показал ряд особенностей эхоструктуры шейки матки, который позволяет помочь в формировании группы повышенного риска развития злокачественных процессов. Изменения, которые можно наблюдать при ультразвуковом исследовании в шейке матки у таких больных, представляют собой эхокартину фоновых процессов в шейке матки. Представленные эхограммы - вторичный осмотр после уже установленного морфологического диагноза CIS (рис. 4.1).
63
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Специфических допплерографических особенностей при CIS также не обнаруживается. Можно отметить тенденцию к незначительному диффузному усилению васкуляризации шейки матки без локального усиления кровотока.
Таким образом, ультразвуковое изображение шейки матки при CIS - это изображение не собственно злокачественного процесса, а только фонового состояния. Еще раз подчеркнем, что ультразвуковые признаки гиперплазии эндоцервикса, хронического эндоцервицита (описание см. в 3-м томе) помогают в формировании группы повышенного риска онкопатологии шейки матки.
Микроинвазивный рак (стадия IA)
Онкологи выделяют понятие «микроинвазивный рак шейки матки» ввиду его очень большого практического значения. Именно на этой стадии еще отсутствуют лимфогенное метастазирование и мульти центрические очаги роста, что делает возможным проведение органосохраняющего лечения [4].
При микроинвазивном раке (стадия IA) опухоль ограничена шейкой матки и инвазией в строму не более 3-5 мм, а диаметр опухоли не должен превышать 7-10 мм (в зависимости от классификации).
Ультразвуковое исследование при стадии IA
Очень часто на этой стадии ультразвуковое изображение тоже мало отличается от нормы либо фонового процесса (рис. 4.2).
Вместе с тем примерно у половины больных с микроинвазивной карциномой шейки матки можно визуализировать участок пониженной эхогенности без четких контуров (см. рис. 4.2), локализующийся, как правило, в проекции зоны трансформации либо в других участках субэктоцервикальной или субэндоцервикальной области (чувствительность 50%, специфичность 62%). Размеры этого участка составляют 5-7 мм.
Рис. 4.2. Продольное трансвагинальное сканирование. Разные случаи РШМ IA стадии. Эхоструктура шейки матки мало отличается от нормальной. 1 - эндоцер-викс; 2 - строма шейки матки; 3 - тело матки, а - определяется незначительная диффузная неоднородность нижней трети эндоцервикса (стрелки).
64
IV. Рак шейки матки
Рис. 4.2 (окончание).
б - эхокартина шейки матки неотличима от нормы; в, г-в режиме энергетической допплерографии определяется интенсивная васкуляризация в проекции переходной зоны и нижней трети эндоцервикса (черная стрелка).
65
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Использование энергетической допплерографии на стадии IA несколько улучшает ситуацию. Имеются данные о том, что высокоразрешающая допплерография позволила визуализировать внутриопухолевый кровоток у 58% больных с микроинвазивной карциномой. При этом глубина инвазии коррелировала с плотностью микросососудов, определяемой гистохимически [13].
Наши исследования показали, что у 85-90% больных в субэндоцер-викальной либо субэктоцервикальной области удается визуализировать достаточно локализованную зону гиперваскуляризации (см. рис. 4.2). Локальная гиперваскуляризация наблюдалась у всех пациенток с обнаруженным описанным выше участком пониженной эхогенности, причем топографически зона локальной гиперваскуляризации и гипоэхогенный участок совпадали. При гистологическом исследовании это оказывалось зоной злокачественной инвазии.
Ввиду столь низких значений диагностической точности необходимо признать, что ультразвуковая диагностика еще не пригодна для первичного выявления РШМ на стадии IA. Однако метод может быть полезен для дифференциации стадии IA и эндоцервикального варианта стадии IB.
Инвазивный рак в пределах шейки матки
При РШМ стадии IB опухоль ограничена шейкой матки, однако инвазия в строму составляет более 3 мм. По классификации ВОЗ, для этой стадии характерна глубина инвазии 5 мм и более, горизонтально 7 мм и более. Принципиальная важность деления на стадии IA и IB заключается в следующем: считается, что лимфатические щели на расстоянии не более 3 мм от базальной мембраны настолько узкие, что распространение опухолевых клеток по ним маловероятно. По мере же увеличения глубины опухолевой инвазии число опухолевых эмболов в лимфатических щелях растет и как следствие существенно возрастает частота метастазирования, несмотря на то что формально имеет место лишь I стадия злокачественного процесса [1]. Таким образом, стадия IB знаменует переход от микроинвазивного к распространенному инвазивному РШМ. Именно поэтому, если при мик-роинвазивном раке возможна конизация шейки матки либо экстирпация матки с оставлением яичников, то на стадии IB уже показана расширенная экстирпация матки по Вертгейму, а также лучевая терапия [4].
Ультразвуковая диагностика на стадии IB
Именно на этой стадии появляется решающий серошкальный критерий, отличающийся очень высокой информативностью: у всех больных в строме шейки матки определяется участок достаточно однородно пониженной эхогенности, примерно в 2/з случаев имеющий вполне четкие границы, позволяющие уверенно дифференцировать здоровую и пораженную ткань шейки матки (рис. 4.3-4.7).
Наш опыт показывает, что РШМ уверенно визуализируется при размере опухоли 8-10 мм (см. рис. 4.3), а средние размеры участка злокачественной
66
IV. Рак шейки матки
Рис. 4.3. Продольное трансвагинальное сканирование. РШМ IB, стадии. Опухоль (1) определяется в проекции нижней трети цервикального канала, а также передней губы шейки матки. Максимальный размер опухоли составляет 8 мм.
Рис. 4.4. РШМ IB! стадии. Эндоцервикальный вариант опухоли, долгое время может не определяться визуально. а - продольное трансвагинальное сканирование. 1 - опухоль распространяется преимущественно в строму задней стенки шейки матки; 2 - ретенционная киста в передней губе шейки матки; б - поперечное сканирование на уровне максимального поперечного размера опухоли. Хорошо видно, что опухоль почти достигает наружный контур шейки на уровне 7 ч (черная стрелка).
67
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.4 (окончание), в - поперечное сканирование на уровне нижней трети цервикального канала. Определяется инвазия опухоли в сторону наружного контура шейки влево (стрелка); г - продольное трансвагинальное сканирование с энергетической допплерографией. 1 - опухоль; васкуляризация опухоли указана стрелкой
68
IV. Рак шейки матки
Рис. 4.5. РШМ 1В2 стадии. Эндоцервикальный вариант опухоли, а - продольное сканирование. Инвазия (1) распространилась как до внутреннего (2), так и до наружного (3) зева; б - поперечное сканирование; в -поперечное сканирование с энергетической допплерографией на уровне максимального поперечного размера опухоли. Неоваскуляризация опухоли указана стрелками.
69
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.6. РШМ 1В2 стадии. Эндоцервикальный вариант опухоли. Продольное сканирование. Инвазия (1) распространилась как до внутреннего (2), так и до наружного (3) зева. Ввиду неоптимального угла сканирования (между «лучом» и осью шейки менее 90°) и расположения датчика не в переднем своде влагалища, а практически у наружного зева визуализация опухоли затруднена.
Рис. 4.7. РШМ 1В2 стадии. Продольное трансвагинальное сканирование. Опухоль (1) выполнила практически две нижних трети стромы шейки матки. Определяется узкий участок инвазии (2), достигающий проекцию внутреннего зева. Стрелкой указан артефакт акустической тени. 3 - тело матки.
Рис. 4.8. РШМ 1В2 стадии. Продольное трансвагинальное сканирование с энергетической допплерографией. 1 - опухолевая инвазия выполнила всю переднюю стенку шейки матки; 2 - строма задней стенки шейки матки, выглядящая не вовлеченной в опухолевую инвазию; 3 - гипернеоваскуляризация.
70
IV. Рак шейки матки
инвазии, выявленной нами на стадии IB, составили 26 мм. Таким образом, речь идет об уверенной ультразвуковой диагностике РШМ уже на начальном этапе стадии IB,.
Здесь будет очень уместно сослаться на давнюю работу В. Magee и со-авт. [14], представивших данные послеоперационного мониторинга больных РШМ в течение 18 мес: при размере первичной опухоли менее 30 мм рецидивы не наблюдались, при диаметре 31-39 мм рецидивы были выявлены у 11% больных, 41-49 мм - у 25%, а при 50 мм и более - у 38% пациенток. Авторами отмечена достоверная корреляция между размером первичной опухоли и частотой рецидивов.
Таким образом, мы просто не имеем права «не вписаться» в 100% диагностику РШМ менее 30 мм, сводящую к минимуму частоту рецидивов.
Ультразвуковая диагностика эндоцервикальных вариантов
РШМ на стадии 1В,
Особое внимание обратим на возможность эхографии, которую трудно переоценить. Это прекрасная визуализация эндоцервикальных вариантов РШМ, начиная с очень небольших размеров опухоли, практически только миновавших границу между стадиями IA и IB,. Обычно данные формы рака начинают проявляться клинически только уже на II стадии.
По нашему опыту, эндоцервикальный вариант РШМ на стадии 1В4 уверенно визуализируется эхографически (см. рис. 4.4) еще за полгода до клинической манифестации (см. рис. 4.5-4.7), к проявлениям которой относятся боли, кровотечение, бочкообразная шейка, видимая инвазия при осмотре шейки в зеркалах.
На мой взгляд, доклиническую ультразвуковую диагностику эндоцерви-кального варианта РШМ на стадии IB, можно считать высшим достижением нашего метода в области выявления злокачественной патологии шейки матки (по сути дела мы можем вести речь о неинвазивной цервикоскопии). Главное здесь, чтобы врач-онколог адекватно среагировал на ультразвуковое заключение и своевременно провел уточняющую инвазивную диагностику (цервикоскопия, биопсия эндоцервикса). Все зависит от того, насколько клиницист доверяет ультразвуковому заключению. Если он усомнится, то, обнаружив при гинекологическом осмотре неувеличенную шейку, чистый эктоцервикс, оставит пациентку «в покое» до тех пор, пока она не вернется с болевым синдромом, выделениями и II стадией.
Качественный анализ внутриопухолевого кровотока при РШМ
Цветовая/энергетическая допплерография, формально являясь вспомогательным методом диагностики РШМ, в данном случае по своему значению может соперничать с В-режимом. У всех больных еще на стадии IB, при цветовой (энергетической) допплерографии в обнаруженном гипоэхо-генном образовании определяется очень большое количество кровеносных сосудов (см. рис. 4.4, 4.8).
7Л
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.9. Продольное трансвагинальное сканирование. РШМ IB, стадии, а -опухоль(в стрелках) распространяется экзофитно из передней губы шейки матки. Черными стрелками отмечена граница между гипоэхо-генной зоной опухолевой инвазии и изоэхогенной стромой шейки матки, предположительно не вовлеченной в патологический процесс; б - в режиме энергетической допплерографии (ЗО-реконструкция) определяется интенсивная неоваскуляризация в проекции опухолевой инвазии (стрелка).
Каковы же особенности внутриопухолевой васкуляризации при РШМ?
• Для изображения сосудистого дерева опухоли на этой стадии всегда характерно очень большое количество сосудов на единицу площади (объема) ги-поэхогенной зоны. При сравнении допплерограмм карциномы шейки и тела матки, а также яичников мы обратили внимание, что картина настолько интенсивной неоваскуляризии характерна именно для злокачественного поражения шейки матки. Это позволило нам предложить допплерографический термин «гипернеоваскуляризация», характерный именно для карциномы шейки матки, особенно наглядный при ЗО-энергетической допплерографии (рис. 4.9).
• Сосудистому дереву свойственны признаки частого ветвления сосудов, причем для последнего весьма характерен дихотомичный характер, который трудно обнаружить в доброкачественных новообразованиях (дихотомия -
72
IV. Рак шейки матки
деление целого на два, а последующих частей снова на два). Часто удается визуализировать дихотомию внутриопухолевых сосудов второго или даже третьего порядка (см. рис. 4.8, 4.9). Практически это не всегда легко, поскольку сосуды очень часто хаотично переплетаются (см. рис. 4.8, 4.9).
• Внутриопухолевые сосуды часто имеют неправильную, извитую форму, они разнонаправлены. Сосуды, кажущиеся сосудами одного уровня, могут существенно отличаться в диаметре. Важная деталь: речь, конечно, идет о «диаметре» вытянутых цветовых пятен, соответствующих сосудам, в В-режиме сосуды опухоли не визуализируются.
• Гипернеоваскуляризация четко отграничивается контуром гипоэхо-генной зоны инвазии, в то время как допплерографическая картина неизмененной стромы соответствует норме.
Количественный анализ внутриопухолевой гемодинамики при РШМ
Наш многолетний опыт показал, что помимо ультразвуковой визуализации опухолевого процесса, сопровождающегося допплерографическим признаком гипернеоваскуляризации, в диагностике и определении стадии РШМ большое вспомогательное значение имеет количественный анализ внутриопухолевой гемодинамики. Выявление характерных для новообразованных сосудов особенностей скорости и резистентности зачастую помогает не просто поставить уверенную точку в диагнозе, но и развеять возможные сомнения.
Исследованию количественных показателей неоваскуляризации при РШМ посвящено много исследований. Во избежание фактографических нагромождений не будем приводить здесь эти данные, интересующиеся могут узнать о них в соответствующих обзорах литературы [2].
Анализ допплерометрических показателей в сосудах малого таза вне опухоли очень мало информативен. Главное внимание следует уделить количественным показателям гемодинамики именно внутриопухолевых сосудов. Допплерометрические показатели внутриопухолевого кровотока при РШМ представлены в табл. 4.4 и на рис. 4.10-4.12.
Таблица. 4.4. Количественные показатели внутриопухолевого кровотока в зависимости от стадии РШМ
Стадия ^тах» С М/С RI Wmax) CM/C
М ± SD min-max M±SD min-max M±SD min-max
IA 12,1 ±6,0 6-19 0,64 ±0,1 0,54-0,80 9,4 ±5,3 3-18
IB 20,4 ±6,8 13-32 0,60 ± 0,06 0,50-0,70 10,9±2,8 6-15
ПА 24,2 ± 6,6 19-34 0,46 ±0,10 0,35-0,54 11,8 ±2,4 8-17
НВ 35,4 ±5,3 20-49 0,43 ±0,10 0,23-0,75 12,9 ±2,4 8-15
III 39,4 ±7,1 22-127 0,43 ± 0,2 0,28-0,80 12,9 ±3,7 8-19
Р < 0,05 IA/IB-III; IB/IIA-III; IB/IIA-III; IIA/IIB, IB/IIA-III; IIA/IIB, III;
IIA/IIB, III; IIB/III III; IIB/III IIB/III
73
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.10. Динамика внутриопухолевой Vmax в зависимости от стадии РШМ.
0,7г СМ/С
0,4-
0,3 -
0,2 -
0,1 -
01-------1------1------1------1------1
IA IB НА IIB III
Рис. 4.11. Динамика внутриопухолевого RI в зависимости от стадии РШМ.
Рис. 4.12. Динамика внутриопухолевой Wmax в зависимости от стадии РШМ.
Среди допплерометрических показателей внутриопухолевого кровотока самым эффективным является показатель Vmax. Особенно важной оказалась достоверность его изменений, подчеркивающих переход от микроинвазивного (12 см/с) к инвазивному раку (20 см/с).
Резистентность кровотока в опухоли также достоверно снижалась с увеличением стадии, однако обратила на себя внимание относительно «поздняя реакция» RI на прогрессирование опухолевой инвазии по сравнению с показателем Vmax. Достоверные изменения RI обнаружены уже только между стадиями IB и ПА.
Показатели венозного внутриопухолевого кровотока, на первый взгляд, будучи второстепенными, на самом деле могут играть неплохую вспомогательную роль при диагностике в онкогинекологии. Нередко за счет выраженной дряблости новообразованных сосудов поток выглядит настолько «ламинарным», что трудно понять - это низкая резистентность или вена. В этой ситуации будет полезна оценка скорости, помогающая пойти по верному пути дифференциации доброкачественности и злокачественности.
На основе полученных данных нами разработаны пороговые значения допплерометрических показателей внутриопухолевого кровотока для диагностики РШМ (рис. 4.13):
• Vmax > 10 СМ/С,
• RI < 0,454;
• VVmax>7 см/с.
74
IV. Рак шейки матки
Рис. 4.13. Количественные показатели внутриопухолевого кровотока при РШМ. а - РШМ IB стадии: V^ 17 см/с, RI 0,60; б - РШМ НВ стадии: Vmax 14 см/с, RI 23; в - РШМ III стадии. Vmax 130 см/с, RI 1,0.
75
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Значение метода ультразвуковой диагностики при выявлении малоинвазивного РШМ
Обобщенные выводы о диагностической ценности метода при диагностике и определении стадии РШМ будут приведены в конце главы. Однако уже сейчас отмечу, что результаты наших многолетних исследований позволяют убежденно настаивать на том, что врач ультразвуковой диагностики, использующий современное высокоразрешающее оборудование, должен выявлять карциному шейки матки с точностью, приближающейся к 100%, уже на стадии IB,.
Такой уровень выявляемое™ будет практически наверняка гарантировать отсутствие рецидивов заболевания после проведенного комплексного лечения.
Распространенный инвазивный рак
При распространенном инвазивном РШМ происходит опухолевая инфильтрация тела матки, параметрия, влагалища, придатков с последующим отдаленным метастазированием. Прогноз для больных на этих стадиях уже достаточно редко бывает благоприятным. Конечно, нельзя не согласиться с обоснованностью мнения о том, что на манифестирующих этапах злокачественного процесса ультразвуковая диагностика имеет уже скорее констатирующее значение. Но это не означает, что при распространенном инвазивном РШМ диагностический ультразвук уже малопригоден. Точное определении стадии опухоли первостепенно для онколога, и при решении этой задачи эхография проявляет себя очень достойно.
Распространение опухоли за пределы шейки матки, но без перехода на стенки таза или нижнюю треть влагалища (стадия ПА)
На стадии II появляется характерный серошкальный признак: если на стадии IB описанное выше образование сниженной эхогенности с гиперваскуляризацией всегда определялось в пределах шейки матки, то теперь гипоэхогенное образование переходит за пределы шейки матки, распространяясь в миометрий или верхнюю треть влагалища.
Опухоль инфильтрирует влагалище, не переходя на его нижнюю треть
Экзофитный рост опухоли проявляется в виде ее распространения на стенку влагалища. Обычно это легко определяется при гинекологическом осмотре. Однако в ряде случаев может потребоваться дифференциальная диагностика с рождающимся миоматозным узлом или эндоцервикальным полипом. Ультразвуковые признаки экзофитного варианта РШМ НА стадии в большинстве случаев очень наглядны (рис. 4.14-4.17). За счет наружного распространения гипоэхогенной и гиперваскуляризованной зоны инвазии шейка матки приобретает характерную грибовидную форму (рис. 18).
76
IV. Рак шейки матки
Рис. 4.14. РШМ ПА стадии, а - продольное сканирование; б - поперечное сканирование. Распространение на влагалище (экзофитный рост опухоли). Опухоль (1) выполняет заднюю губу шейки матки и распространяется на влагалище; 2 -строма шейки матки, выглядящая не вовлеченной в инвазию; 3 - тело матки; 4 -жидкость в малом тазу; 5 -прямая кишка.
Рис. 4.15. РШМ ПА стадии. Продольное сканирование. Распространение на влагалище (экзофитный рост опухоли). Опухоль (1) выполняет заднюю губу шейки матки и распространяется на влагалище; 2 - строма шейки матки, выглядящая не вовлеченной в инвазию; 3 - тело матки; 4 - жидкость в малом тазу; 5 - прямая кишка.
77
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.16. РШМ ПА стадии, а - продольное сканирование; б - в режиме Zoom более четко видна граница ги-поэхогенной зоны инвазии (контур). Распространение на влагалище (экзофитный рост опухоли). Опухоль (1) выполняет заднюю губу шейки матки и распространяется на влагалище. 2 -строма шейки матки, выглядящая не вовлеченной в инвазию; 3 - тело матки; 4 -слизистая оболочка влагалища.
Рис. 4.17. РШМ ПА стадии. Распространение на влагалище (экзофитный вариант), а - опухоль (1) исходит из передней губы. Также определяется инвазия эндоцервикса (2); б - опухоль (1) исходит из передней губы. За счет присоединившихся воспалительно-некротических изменений по заднему контуру зоны инвазии определяется гипоэхогенный ободок (стрелка), а по переднему - эхогенные включения (черная стрелка).
78
IV. Рак шейки матки
Рис. 4.18. РШМ ИА стадии. Распространение на влагалище. Грибовидная форма шейки матки. 1 - опухоль в форме шляпки гриба; 2 - строма шейки матки, выглядящая не вовлеченной в инвазию. В режиме энергетической допплерографии определяется интенсивная внут-риопухолевая неоваскуляризация (стрелки).
79
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.19. РШМ ПА стадии. Распространение на тело матки (эндофитный рост). 1 -опухоль; 2 - миометрий, не вовлеченный в инвазию; 3 -серозометра.
Рис. 4.20. РШМ ПА стадии. Распространение на тело матки и на влагалище, а: 1 -опухоль; 2 - миометрий, не вовлеченный в инвазию; 3 -серозометра; 4 - жидкость в просвете влагалища.
80
IV. Рок шейки матки
Рис. 4.20 (окончание), б -в режиме энергетической допплерографии с ЗР-рекон-струкцией определяется интенсивная неоваскуляризация.
Дополнительным признаком инвазии карциномы во влагалище может служить отсутствие эффекта скольжения стенки последнего относительно эктоцервикса при надавливании датчиком.
Иногда бывает трудно уверенно визуально разграничить зону инвазии и еще не вовлеченную в патологический процесс строму. Чаще всего это бывает при распространенном раке, когда зоны пониженной и повышенной эхогенности представляют собой уже не «патологическую» и «здоровую» ткани, а разнородные участки самой опухоли, выполняющей уже практически весь орган.
Опухоль распространяется на тело матки
Эндофитный рост опухоли, т.е. инвазия в миометрий, наблюдается несколько чаще. Соотношение частоты инвазии в миометрий по отношению к инвазии во влагалище составляет примерно 2:1. Несмотря на то что миометрий нередко имеет достаточно низкую эхогенность, граница между миометрием и инвазией в большинстве случаев определяется достаточно четко (рис. 4.19, 4.20).
Почти у половины больных с распространением инвазии в тело матки и у 1/4 больных с инвазией во влагалище определяется серозометра (см. рис. 4.19). В целом серозометру можно наблюдать у 30% больных РШМ II стадии. Чувствительность и специфичность серошкальной эхографии при выявлении инвазии в миометрий, по нашим данным [2], составляют 95 и 89% соответственно.
Эхография помогает хорошо визуализировать сочетание инфильтрации верхнего отдела влагалища и тела матки (см. рис. 4.20).
Опухолевая инвазия параметрия без перехода на стенку таза (стадия IIВ)
Своевременная диагностика инвазии параметрия имеет большое значение. Эхография позволяет выявить даже небольшую злокачественную ин-
81
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.21. РШМ НВ стадии. Инвазия параметрия, не доходящая до стенки таза. Поперечное трансвагинальное сканирование. 1 - опухоль, а - инвазия параметрия справа (стрелки); б - инвазия параметрия слева (стрелка); в - двусторонняя инвазия параметрия (стрелки); г - инвазия параметрия справа. В режиме энергетической допплерографии неоваскуляризация основной зоны опухоли (2), инвазии параметрия (3).
82
IV. Рак шейки матки
Рис. 4.22. РШМ НВ стадии. Продольное сканирование. Инвазия параметрия, не доходящая до стенки таза. 1 -опухоль; 2 - матка; 3 - инвазия параметрия спереди; 4 - серозометра; 5 - жидкость в малом тазу.
фильтрацию этой области. При этом показатели диагностической точности существенно зависят как от класса используемого оборудования, так и от опыта врача, проводящего исследование.
Одно из первых исследований в этой области, проведенное почти 20 лет назад S. Aoki и соавт. [15], сразу продемонстрировало преимущество эхографии по сравнению с пальцевым исследованием: если чувствительность и специфичность пальцевого осмотра при оценке инвазии параметрия составили 25 и 90%, то эхографии - 100 и 93% соответственно (Р <0,05). Понятно, что авторы имели дело не с минимальной инвазией, но все равно результаты впечатляют. Последующие, в том числе наши, исследования показали, что на самом деле ультразвуковая диагностика инфильтрации параметрия отличается высокой точностью, составляющей не менее 90-95% [2].
Вместе с тем ультразвуковая визуализация инвазии параметрия - всегда непростая задача. В режиме только серой шкалы определить это бывает очень трудно. Речь идет о начальных этапах этого процесса, в то время как диагностировать инвазию, доходящую до стенок таза, не составляет труда.
Начальная инвазия параметрия может быть выявлена эхографически как весьма маленькое образование неправильной формы и пониженной эхогенности, непосредственно исходящее из опухоли шейки матки (рис. 4.21). Лучше всего удается визуализировать начальную инвазию параметрия при поперечном сканировании. По своей форме участки начальной инвазии параметрия могут напоминать своеобразные завитки, придающие опухоли «фестончатый» контур (см. рис. 4.21).
При дальнейшем распространении очаги инфильтрации увеличиваются, принимая разнообразную форму (см. рис. 4.21,4.22). Тщательное мульти-плоскостное сканирование позволяет визуализировать разнообразные по топике и размерам зоны инвазии (см. рис. 4.22).
Допплерография участков инфильтрации наглядно демонстрирует все те же особенности гипернеоваскуляризации, которые уже можно было определить на стадии IB. Нередко признак усиленной васкуляризации помо-
83
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.23. РШМ III стадии. Трансвагинальное сканирование. Распространение опухоли до стенок таза, а - солидно-кистозный конгломерат; б - солидный конгломерат с неоваскуля ризацией.
гает более четко определить распространенность опухолевой инвазии параметрия (см. рис. 4.22).
Инвазия нижней трети влагалища, метастазы в придатках матки (стадия III А)
На стадии IIIA особенностью эхокартины является наличие серометры (часто это пиометра) у всех больных (рис. 4.23). Часто обнаруживаются вторичные злокачественные опухоли придатков матки. Инвазия распространяется до нижней трети влагалища у 40% больных.
Опухолевая инвазия параметрия до стенки таза, регионарные метастазы в лимфатических узлах таза, гидронефроз (стадия 111В)
Примерно у 40% больных в малом тазу обнаруживается единый конгломерат неоднородной эхоструктуры, достигающий стенок таза, в котором трудно или невозможно дифференцировать пораженные органы и ткани (см. рис. 4.23). В 85-90% случаев определяются увеличенные регионарные лимфатические узлы. У каждой третьей больной обнаруживается односторонний гидронефроз, у каждой десятой - двусторонний.
Поражение лимфатических узлов малого таза
Диагностика ортоградного поражения лимфатических узлов малого таза (т.е. по направлению оттока лимфы), а также запирательных лимфатических узлов может представлять значительные трудности. Главное значение при этом имеет трансвагинальное сканирование. Увеличенные лимфатические узлы визуализируются как образования овальной формы и пониженной эхогенности, обычно локализованные у стенки малого таза (рис. 4.24). Напомним, что в норме лимфатические узлы малого таза не определяются.
84
IV. Рак шейки матки
Рис. 4.24. РШМ IIIB стадии. Метастазы в регионарные лимфатические узлы, а -поперечное трансвагинальное сканирование. Увеличенный лимфатический узел у стенки малого таза 1 - лимфатический узел; 2 - яичник; б - трансабдоминальное сканирование 1 - увеличенный подвздошный лимфатический узел; 2 - подвздошная артерия; 3 - вена.
Поражение подвздошных лимфатических узлов
Ультразвуковая диагностика увеличения подвздошных лимфатических узлов существенно легче. Выполняется она с помощью трансабдоминального сканирования (см. рис. 4.24). При этом может возникать необходимость дифференцирования увеличенных лимфатических узлов и яичников. В репродуктивном возрасте это проще, поскольку помогает визуализация фолликулярного аппарата. В постменопаузе могут возникать проблемы дифференцирования, поскольку яичники имеют однородную низкую эхогенность, что делает их сходными с патологически увеличенными гипоэхо-генными узлами (кстати, в норме подвздошные лимфатические узлы также не должны определяться). Для успешной дифференциальной диагностики следует использовать сочетание трансабдоминального (с наполненным мочевым пузырем) и трансвагинального доступов.
85
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Поражение паховых лимфатических узлов
Опухолевое поражение паховых лимфатических узлов при РШМ является ретроградным, т.е. оно возникает после опухолевого блока на пути орто-градного лимфооттока. Диагностика этого состояния должна проводиться с использованием высокочастотных линейных датчиков. Если ваш прибор не оснащен соответствующим датчиком, не стоит даже пытаться визуализировать паховые лимфатические узлы трансабдоминальным или полостным датчиком - вы обязательно ошибетесь!
Визуализация паховых лимфатических узлов нетрудна. Важно не перепутать, какой лимфатический узел перед вами - нормальный или патологически измененный. Ведь паховые лимфатические узлы прекрасно определяются и в норме. Представим ультразвуковое изображение нормального пахового лимфатического узла (рис. 4.25), имеющего уплощенную форму, а также относительно более толстый эхогенный мозговой слой (корковой слой должен определяться в виде тонкого, иногда слабо различимого гипо-эхогенного ободка).
При опухолевой инфильтрации лимфатический узел приобретает близкую к округлой форму (толщина может приближаться к длине, тогда как в норме их соотношение составляет менее 1 :2); толщина коркового слоя становится больше толщины мозгового слоя либо последний вообще не визуализируется, что делает весь лимфатический узел гипоэхогенным (см. рис. 4.25).
Я сознательно не привожу абсолютные размеры лимфатических узлов, поскольку они здесь играют второстепенную роль: в норме могут определяться лимфатические узлы лентовидной формы, их длина может достигать 4-6 см.
Допплерография при РШМ III стадии
При допплеровском исследовании РШМ III стадии принципиальных отличий в локальной васкуляризации по сравнению с картиной на предыдущих стадиях нет. Энергетическая допплерография практически во всех участках выявленного гипоэхогенного образования показывает признак гипернеоваскуляризации. Это особенно наглядно проявляется в режиме ЗЭ-энергетической допплерографии. Одной из главных допплеровских особенностей этой стадии становится допплерометрическая, а именно «зашкаливающая» скорость внутриопухолевого кровотока. Можно наблюдать случаи РШМ III стадии с показателями Vmax, достигающими почти 1,5 м/с (!) (см. рис. 4.13).
Прорастание опухоли в мочевой пузырь или прямую кишку (стадия IVA)
Для этого этапа характерно распространение опухоли на смежные экс-трагенитальные органы малого таза. Приведем примеры визуализации инфильтрации опухолью стенки мочевого пузыря (рис. 4.26), а также прямой кишки.
86
IV. Рак шейки матки
Рис. 4.25. РШМ IIIB стадии. Увеличение паховых лимфатических узлов. 1 - корковый слой; 2 - мозговой слой, а - нормальная эхоструктура лимфатического узла; б - значительное утолщение коркового слоя; в -мозговой слой не виден.
Рис. 4.26. РШМ IVA стадии. Продольное трансвагинальное сканирование. Прорастание слизистой мочевого пузыря. 1 - опухоль в пределах шейки; 2 - инвазия в стенку пузыря. Хорошо видно, что инвазией поражена вся толща стенки пузыря (стрелка); 3 - полость пузыря; 4 - пиометра.
87
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Карцинома шейки матки IVB стадии
Увеличение парааортальных лимфатических узлов свидетельствует об однозначно плохом прогнозе для больных РШМ. Появление этого признака заставляет еще раз провести углубленный поиск прочих отдаленных метастазов.
Ультразвуковая диагностика увеличения парааортальных лимфатических узлов (в норме не определяются) не должна представлять проблем даже у тучных пациенток. Увеличенные парааортальные лимфатические узлы определяются в виде овоидных и округлых образований пониженной эхогенности, часто сливающихся в конгломераты (рис. 4.27).
Может возникнуть необходимость их дифференцирования с петлями тонкой кишки, а также крупными сосудами брюшной полости.
Дифференцирование с петлями тонкой кишки требует проведения внимательного и неторопливого исследования. Иногда гипоэхогенный участок тонкой кишки может достаточно долгое время оставаться неподвижным, имитируя патологическое образование. Если вы не дождались перистальтики подозрительного участка, а сомнения сохраняются, повторите исследование через несколько дней или даже несколько часов - ситуация обязательно прояснится: кишка «уйдет», а увеличенный лимфатический узел останется.
В преодолении трудностей дифференцирования с крупными сосудами брюшной полости отличную помощь оказывает цветовая допплерография, при этом гипоэхогенные лимфатические узлы (обычно без видимого крово-
Рис. 4.27. РШМ IVB стадии. Продольное трансабдоминальное сканирование. 1 -конгломерат увеличенных парааортальных лимфатических узлов; 2 - брюшная аорта; 3 - кровоток в брюшной аорте, а - аорта не попала в срез; б - лимфатические узлы на фоне аорты.
88
IV. Рак шейки матки
Таблица. 4.5. Показатели диагностической ценности метода (в %)
Стадия РШМ Чувствительность Специ-фичность Прогностическая ценность Точность
положительная отрицательная
IA 60 75,2 85,2 72,5 73,4
IB 100 98 100 97 98,3
НА 100 91 93,2 92,1 93,5
НВ 100 92 94,1 93,2 95,4
III 100 90 92,2 93,5 94,2
тока) отлично выделяются на фоне «прокрашенных» сосудов (см. рис. 4.27). Энергетическая допплерография в данном случае менее предпочтительна, поскольку ее использование на фоне перистальтики кишечника, пульсации аорты, а также дыхательных движений пациентки приводит к появлению множества нежелательных цветовых артефактов.
Точность метода в диагностике и определении стадии РШМ
Приведем собственные показатели диагностической ценности комплексной ультразвуковой диагностики РШМ, включающей в себя сочетание следующих ультразвуковых критериев малигнизации шейки матки: гипо-эхогенное образование неправильной формы в строме шейки матки с допплерографическим эффектом локальной гиперваскуляризации и превышением пороговых значений допплерометрических показателей: Vmax > Ю см/с и (или) RI < 0,45 и (или) Wmax > 7 см/с (табл. 4.5).
Состояние после лучевой терапии и химиотерапии
Как известно, при локально распространенном РШМ НВ-IVA стадии основная лечебная тактика - первичное облучение с последующей химиотерапией.
Ультразвуковая диагностика высокоинформативна для мониторинга больных этой группы. При эффективности проводимого лечения уже в течение 2-3 мес опухоль значительно уменьшается в размерах, а через полгода после начала лечения может даже не визуализироваться (рис. 4.28, 4.29). Шейка матки при этом существенно уменьшена в размерах по сравнению с нормой, часто приобретает неправильную коническую форму.
Очень распространенным побочным эффектом для описываемой категории пациенток является расширение верхней и средней трети цервикального канала за счет серозного содержимого. Одновременно цервикальный канал у этих больных в нижней трети, как правило, не визуализируется за счет адгезии после радиационного ожога (см. рис. 4.28). Серозоцервикс (и даже серозометра) могут в дальнейшем сохраняться очень длительное время, даже годами (см. рис. 4.28).
89
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.28. Продольное трансвагинальное сканирование. Состояние после лучевой терапии. а - через 1 мес после начала курса. 1 - опухоль уже значительно уменьшилась; 2 - се-розометра; 3 - серозоцервикс; б - через 6 мес после окончания курса. Опухоль не визуализируется. Также не виден цервикальный канал в нижней трети (стрелка); б - через 8 лет после лучевой терапии. Сходная эхокартина. Не виден цервикальный канал в нижней трети (стрелка).
90
IV. Рак шейки матки
Рис. 4.29. Продольное трансвагинальное сканирование. Через 1 мес после окончания 2-месячного курса лучевой терапии и химиотерапии, а - опухоль (1) выглядит в пределах эндоцервикса. Ее размеры 1,6 х 1,3 х 1,8 см (до лечения 5,7 х 3,5 х 4,2 см, преимущественно экзофитный рост); б - в режиме цветовой допплерографии единичные сосуды (стрелка); в -триплексный режим. Vmax 6 см/с, RI 0,55.
Допплерография после лучевой терапии демонстрирует быстро оскудевающую васкуляризацию, сопровождающуюся снижением скорости и повышением резистентности внутриопухолевого кровотока. При адекватном лечении уже через 2-3 мес качественные и количественные допплерогра-'фические показатели внутриопухолевого кровотока могут не отличаться от нормы. Через 5-6 мес после лучевой терапии кровоток в шейке матки часто вообще не визуализируется, что является дополнительным признаком эффективности проведенного лечения.
Значение ультразвуковой диагностики рецидивов заболевания сопоставимо с таковым при выявлении первичной опухоли. При обследовании этой категории больных важно вовремя визуализировать инвазию мочевого пузыря (рис. 4.30) или прямой кишки (рис. 4.31).
Большое внимание следует уделять выявлению у таких больных увеличенных подвздошных и паховых лимфатических узлов, а также отдаленных метастазов.
91
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 4.30. Рецидив РШМ через 9 лет после лучевой терапии. Прорастание мочевого пузыря. 1 - опухоль в пределах шейки; 2 - инвазия в стенку мочевого пузыря (в контуре); 3 - внутренние слои стенки мочевого пузыря деформированы, еще не вовлечены в инвазию; 4 - полость мочевого пузыря; 5 - серозометра.
Рис. 4.31. Рецидив РШМ через 6 лет после лучевой терапии. Распространение на прямую кишку. 1 - опухоль в пределах шейки; 2 -рецидив, распространяющийся на прямую кишку; 3 -матка.
Рис. 4.32. Продольное трансвагинальное сканирование. Злокачественная мезодермальная смешанная опухоль шейки матки с инвазией в строму 5 мм (стадия IB) - вариант саркомы. а:1 - опухоль сниженной эхогенности (черные стрелки); 2 - субэктоцервикаль-ные кисты шейки матки.
92
IV. Рак шейки матки
Рис. 4.32 (окончание), б-энергетическая допплерография. Очень скудная периферическая васкуляризация опухоли (стрелка). Показатели гемодинамики не отличаются от нормального кровотока в строме шейки матки. Vmax 6 см/с, RI 0,65.
Редкие стромальные злокачественные опухоли шейки матки
Саркома шейки матки встречается очень редко. При этом ее ультразвуковое изображение имеет как сходство, так и отличия по сравнению с карциномой шейки матки. Сходство заключается в серошкальном изображении, которое мало отличается от эхокартины РШМ (рис. 4.32). Однако при цветовой допплерографии опухоль выглядит очень скудно васкуляризованной, почти аваскулярной (см. рис. 4.32). Это может затруднять дифференциальную диагностику с доброкачественной очаговой патологией шейки матки.
Литература
1. Randall М.Е., Michael Н., Long III Н. et al. Uterine cervix // Principles and Practice of Gynecologic Oncology. 5th ed. I Richard R., Barakat R.R., Markman M., Randall M.E. Philadelphia et al.: Wolters Kluwer Health/Lippincott Williams &Wilkins, 2009. P. 623-683.
2. Буланов M.H. Ультразвуковая диагностика патологии шейки матки: Дис. д-ра мед. наук. М., 2004.
3. Козаченко В.П. Современное состояние проблемы рака шейки матки // Заболевания шейки матки, влагалища и вульвы: (Клинические лекции) / Под ред. В.Н. Прилеп-ской. М.: МЕДпресс-информ, 2000. С. 133.
4. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. С. 173-275.
5. Bernaschek G., Deutinger J., Bartl W., Janisch H. Endosonographic staging of carcinoma of the uterine cervix//Arch. Gynecol. 1986. N1. P. 21-26.
6. Osmers R., Bergholz M., Kuhn W. Vaginal sonographic visualisation of a cervical carcinoma // Int. J. Gynaecol. Obstet. 1989. N3. P. 283-285.
7. Kikuchi A., Okai T., Kobayashi K. et al. Intracervical US with a high-frequency miniature probe: a method for diagnosing early invasive cervical cancer // Radiology. 1996. N198(2). P. 411-413.
8. Чекалова M.A. Ультразвуковая диагностика в онкогинекологии // Клиническое руководство по ультразвуковой диагностике. Т. Ill/Подред. В.В.Митькова, М.В.Медведева. М.: Видар, 1997. С. 201-239.
93
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
9. Ivanov S., Ivanov S. Transvaginal sonography, dilatation and curettage, computed tomography and hysteroscopy as methods for the diagnosis of the involvement of the cervical canal in cases of endometrial carcinoma // Akush. GinekoL (Sofiia). 2000. N39. P. 37-39.
10. Suren A., Osmers R., Kuhn W. 3D Color Power Angio imaging: a new method to assess intracervical vascularization in benign and pathological conditions // Ultrasound Obstet. Gynecol. 1998. N2. P. 133-137.
11. Де Черни A.X., Натан JI. Акушерство и гинекология. Диагностика и лечение. Т. II. Гинекология. Учебное пособие: Пер. с англ. / Под общей ред. А.Н.Стрижакова. М.: МЕДпресс-информ, 2009.
12. Thomas A. Imaging of the cervix using sonoelastography // Ultrasound Obstet. Gynecol. 2006. V. 28(3). P. 356-357.
13. Cheng W.F., Lee C.N., Chu J.S. et al. Vascularity index as a novel parameter for the in vivo assessment of angiogenesis in patients with cervical carcinoma // Cancer. 1999. N1. V. 85(3). P. 651-657.
14. Magee B.J., Logue J.P., Swindell R., McHugh D. Tumour size as a prognostic factor in carcinoma of the cervix: assessment by transrectal ultrasound // Br. J Radiol. 1991. N64(765). P. 812-815.
15. Aoki S., Hata T., Senoh D. et al. Parametrial invasion of uterine cervical cancer assessed by transrectal ultrasonography: preliminary report//Gynecol. Oncol. 1990. N1. P. 82-89.
Гиперпластические процессы эндометрия
• Введение • Классификация патологических состояний эндометрия • Железистая гиперплазия эндометрия в детородном и пременопаузальном возрасте • Особенности гиперпластических процессов эндометрия в постменопаузе • Изменения эндометрия на фоне приема тамоксифена • Полипы эндометрия
• Атипические гиперпластические процессы эндометрия • Концепция доклинической ультразвуковой диагностики патологии эндометрия. Нарушение десквамации эндометрия. Очаговый фиброз эндометрия. Очаговая гиперплазия эндометрия • Прогноз рецидивов гиперпластических процессов эндометрия после лечения • Литература
Введение
Ультразвуковая диагностика железистой гиперплазии эндометрия (ЖГЭ) - ответственное дело. Гинекологи большей частью склонны доверять нашим заключениям. Ложноположительный эхографический диагноз ЖГЭ может стать причиной неоправданного кюретажа полости матки, не несущего пациентке ничего, кроме вреда. При ультразвуковом исследовании эндометрия правильное заключение о его состоянии может быть дано только после детального сопоставления эхографической картины с клинико-анамнестическими данными. Ультразвуковое изображение эндометрия, оторванное от клинической картины, анамнеза, фазы менструального цикла, не может быть основанием для диагноза гиперплазии.
Прежде чем начать разговор о нюансах эхографической диагностики патологических состояний эндометрия, позвольте напомнить простую и ясную классификацию патологических состояний эндометрия, принадлежащую Яну Владимировичу Бохману [1]. Классификация имеет четко выраженный практический характер. При этом заболевания объединены в соответствующие группы исходя из степени онконастороженности и соответственно прогноза для женщины.
Классификация патологических состояний эндометрия (по Я.В. Бохману)
I. Фоновые процессы: железистая гиперплазия, эндометриальные полипы.
II. Предраковое заболевание: атипическая гиперплазия.
III. Рак: аденокарцинома, аденоакантома, светлоклеточная мезонефро-идная аденокарцинома, железисто-плоскоклеточный рак, недифференцированный рак.
95
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ » Курс лекций
Железистая гиперплазия эндометрия в детородном и пременопаузальном возрасте
Состояние гиперплазии - это увеличение числа структурных элементов нормальных тканей. Чаще всего это компенсаторная реакция или на утрату этих тканей, или на повышенные функциональные требования к тканям, либо результат нарушенного гормонального контроля. ЖГЭ относится преимущественно к третьему варианту, представляя собой доброкачественную патологию слизистой оболочки матки на фоне гиперэстрогении. Именно дисбаланс эстрогенов стимулирует чрезмерное разрастание эндометрия. Как типичная, так и атипическая железистая гиперплазия возникает вследствие постоянного воздействия на эндометрий эстрогенов при отсутствии надлежащего количества прогестерона.
Данное патологическое состояние часто обнаруживается у женщин, страдающих ановуляторными маточными кровотечениями [1]. Морфологически часто выделяют железистую и железисто-кистозную гиперплазию эндометрия, хотя с точки зрения онкологической настороженности и соответственно прогноза эта разница не представляется столь существенной. Морфологический диагноз гиперплазии, проявляющейся прежде всего в пролиферации желез и стромы, - это важнейший прогностический признак ановуляции и гиперэстрогении (ядерная атипия при этом отсутствует). Эндометрий при дисгормональной пролиферации обычно утолщен до 1-1,5 см и больше [2]. При этом количество желез не увеличивается, просто они гипертрофированы и/или кистовидно расширены, имеют извитую форму. Отсутствие увеличения количества желез, в частности, также отличает простую ЖГЭ от атипической. Термин «простая» используется не всегда, но даже если он опущен, морфологами подразумевается отсутствие атипии, иначе говоря, предрака. Ряд морфологов также выделяют простую и сложную (комплексную) гиперплазию эндометрия. Последняя отличается извитостью и тесным расположением желез. Вместе с тем для обоих вариантов атипия не характерна. Также выделяют простую железистую и железисто-кистозную формы гиперплазии эндометрия, отмечая при этом, что между ними нет принципиальной разницы [2]. Особо следует отметить, что в дисгормонально измененном эндометрии сохраняются функционирующие спиральные артерии, которые не подвергаются редукции [3].
За рубежом широкое распространение имеет классификация гиперплазии эндометрия R. Kurman и Н. Norris (табл. 5.1).
Очаговая гиперплазия эндометрия. Морфологи отмечают, что ЖГЭ может носить очаговый характер (так называемая очаговая гиперплазия эндометрия). Это, по выражению О.К. Хмельницкого [2], логично увязывается с представлением о структурной единице эндометрия. Кроме того, вследствие различного эффекта действия эстрогенов на отдельные структурные единицы эндометрия может наблюдаться сочетание гнезд активной железистой гиперплазии на фоне покоящейся, замершей железистой гиперплазии.
96
V. Гиперпластические процессы эндометрия
Таблица 5.1. Классификация эндометриальной гиперплазии (приводится по [4])
Тип гиперплазии Частота малигнизации,%
Простая (кистозная без атипии) 1
Комплексная (аденоматозная без атипии) 3
Атипическая простая (кистозная с атипией) 8
Атипическая комплексная (аденоматозная с атипией) 29
Важное отличие ЖГЭ от опухолей заключается в том, что это временный процесс. Ведь железистая пролиферация возникает не сама по себе, а потому существует столько, сколько требует функциональная необходимость или действуют причинные факторы.
С клинической точки зрения особенностью ЖГЭ является симптоматика, часто сходная с таковой на ранних стадиях рака эндометрия [5]. Вместе с тем весьма часто ЖГЭ протекает бессимптомно, являясь случайной гистологической находкой после гистерэктомии. Без лечения в течение 15-летнего периода ЖГЭ в большинстве случаев (до 80-85%) спонтанно регрессирует, однако в 1-3% трансформируется в рак [5]. Именно то, что ЖГЭ может предшествовать раку тела матки, заставляет обращать особое внимание на своевременную диагностику ЖГЭ с последующим выделением пациенток с данной патологией в группу онкологического риска.
Ультразвуковые диагностические критерии железистой гиперплазии эндометрия
Когда следует проводить ультразвуковое исследование для диагностики гиперплазии?
Первым условием точной диагностики ЖГЭ должно быть проведение эхографии в соответствующую фазу менструального цикла. Преобладающее мнение, с которым трудно не согласиться, - исследование следует выполнять в фазу ранней пролиферации, т.е. на 5-7-й день менструального цикла. В это время, как известно, эндометрий в норме выглядит тонким (<6 мм), ровным, гипоэхогенным, однородным и аваскулярным (рис. 5.1). По мнению В.Н. Демидова и А.И. Гуса [6], ультразвуковое исследование эндометрия следует осуществлять в первые 3 дня после окончания менструации. Рекомендация в принципе соответствует сказанному выше, это как раз и будет 5-7-й день цикла. Однако как быть в случае полименореи или затяжной метроррагии? По нашему мнению, проводить исследование нужно всегда на 5-7-й день (в зависимости от обстоятельств на 4-8-й день) менструального цикла вне связи с тем, сохраняются или нет выделения из влагалища. Промедление может привести к затушевыванию эхокартины гиперплазии разросшимся пролиферативным эндометрием. Как быть, если время упущено? Выход один - необходимо выполнить повторное исследование на 5-7-й день следующего менструального цикла. Нередко такое
97
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.1. Трансвагинальное продольное сканирование. Норма. Исследование проводится на 6-й день менструального цикла. Эндометрий (1) выглядит тонким (4 мм), гипоэхогенным, аваскулярным в режиме цветовой/энергетической допплерографии.
затягивание диагностики ЖГЭ невозможно в связи с продолжающимся и угрожающим здоровью и даже жизни женщины кровотечением. Что ж, тогда гинеколог, очевидно, примет решение об обоснованном диагностическом выскабливании по жизненным показаниям без нашей уточняющей диагностики. В подобной ситуации ультразвуковой диагноз ЖГЭ, выставляемый позже 7-8-го дня от начала менструации (кровотечения), также правомочен, но он должен быть исключительно предположительным. Причем эта предположительность, неокончательность ультразвукового диагноза должна быть особо оговорена в заключительной части протокола исследования.
Толщина эндометрия при гиперплазии
В фазу ранней пролиферации толщину эндометрия больше 6 мм следует считать превышающей норму (рис. 5.2). Важно подчеркнуть, что почти во всех случаях доброкачественной гиперплазии (а именно таковой является ЖГЭ) этот показатель находится в пределах 0,8-1,5 см, редко достигая 2 см (рис. 5.3, 5.4). По нашим данным, толщина эндометрия при ЖГЭ репродуктивного возраста (41,4 ± 4,2 года) в среднем составила 10,3 ± 2,6 мм1 * * * * * * В.
1 Ряд авторов признаками гиперплазии эндометрия считают увеличение толщины М-эхо
свыше 15 мм при измерении в конце второй фазы цикла [16]. Понимая логику этих кри-
териев (нормальная толщина эндометрия в фазу поздней секреции в среднем составля-
ет 12 мм), все же порекомендую основное внимание уделять исследованию в первую
фазу цикла. Вместе с тем нужно признать, что в практике встречаются пациентки с гиперполименореей и при этом утолщенным эндометрием во вторую фазу, но нормаль-
ным как по толщине, так по эхоструктуре в первую фазу цикла. Вероятно, это контингент
пациенток с дисгормональным утолщением (т.е. той же диффузной гиперплазией) эндометрия без нарушения десквамации (т.е. без сохранения в новом менструальном цикле в полости матки гиперплазированного функционального слоя с предыдущего цикла).
В подобных случаях эхография позволит гинекологу, не обращаясь к кюретажу, уверенно выбрать в качестве лечебной тактики лишь гормональное лечение.
98
V. Гиперпластические процессы эндометрия
Рис. 5.2. Трансвагиналь-ное продольное сканирование. ЖГЭ. Толщина эндометрия 7 мм (стрелки), эхогенность неравномерно повышена. В передней губе шейки матки ретенционная киста (длинная стрелка).
Рис. 5.3. Трансвагинальное поперечное сканирование. ЖГЭ. Эндометрий утолщен до 8 мм (пунктир), имеет повышенную эхогенность с немногочисленными мелкими эхонегативными включениями (стрелка).
Однако не всегда толщина эндометрия является определяющим фактором диагностики гиперпластического процесса. Можно привести примеры ЖГЭ с лишь незначительным утолщением эндометрия (рис. 5.5). Важно не забывать, что в ряде случаев точная оценка толщины эндометрия может быть затруднена. Это бывает связано с положением оси матки, особенностями эхоструктуры звукопроводимости как миометрия (чаще всего субэндометриальных участков), так и самого эндометрия (рис. 5.6-5.8). Следовательно, необходимо обратить внимание и на другие критерии диагностики этого патологического состояния, а именно эхоструктуру и васкуляризацию эндометрия.
99
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.4. Трансвагинальное продольное сканирование. ЖГЭ. Эндометрий утолщен до 12 мм (1), его эхогенность незначительно и неравномерно повышена. За счет большой толщины и сниженной звукопроводимости эндометрия его дистальный контур нечеткий (длинная стрелка), что несколько затрудняет измерение толщины М-эхо. Эхоструктура М-эхо в целом однородна, с единичными мелкими эхонегативными включениями (стрелки). Линия смыкания листков эндометрия не определяется. В области перешейка несколько ретенционных кист (2).
Рис. 5.5. Трансвагинальное продольное сканирование. ЖГЭ. В В-режиме информации для диагноза недостаточно. Толщина эндометрия 5 мм - в пределах нормы для 6-го дня менструального цикла. Эхогенность эндометрия средняя, эхоструктура выглядит достаточно однородной. Для уточнения диагноза нужна допплерография (об этом ниже).
Рис. 5.6. Трансвагинальное продольное сканирование. Матка отклонена кзади. Пунктиром показана ось матки. Хорошо виден гиперэхогенный и утолщенный эндометрий (стрелки). Однако положение продольной оси матки почти перпендикулярно сканирующей поверхности не позволяет провести объективное измерение толщины эндометрия, которая может оказаться завышенной. Это обязательно следует отразить в протоколе исследования.
нею
V. Гиперпластические процессы эндометрия
Рис. 5.7. Трансвагинальное продольное сканирование (Zoom). ЖГЭ на фоне аденомиоза. Эхогенные вертикальные борозды (1), сливающиеся с М-эхо (2), затрудняют оценку толщины эндометрия. 3 - субэндометриальная мелкая киста.
Рис. 5.8. Трансвагинальное продольное сканирование. Zoom. ЖГЭ в постменопаузе. Эндометрий утолщен до 9 мм, имеет неравномерно высокую эхогенность с эхонегативными включениями (стрелки). На эхограмме не совсем ясно, что представляет собой тонкая эхогенная линия (длинная стрелка) - проекцию полости матки или линейный артефакт. Прояснить это может изменение угла сканирования, а в идеале - введение жидкости в полость матки. Вообще данный случай очень коварен в смысле интерпретации: может показаться, что эхогенная линия не что иное, как задняя стенка полости матки, а зона повышенной эхогенности дистальнее линии (в пределах пунктира) - зеркальный артефакт. Уточнить, так ли это, можно, также меняя угол сканирования.
ЛОЛ
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ » Курс лекций
Эхокартина контуров эндометрия при гиперплазии
Многие авторитетные авторы подчеркивают, что при диагностике ЖГЭ особое внимание следует уделять особенностям эхоструктуры эндометрия. Последовательно рассмотрим ее. Четкость контуров эндометрия при ЖГЭ выглядит по-разному, это нередко зависит от состояния окружающего миометрия. Так, при сочетании ЖГЭ и внутреннего эндометриоза контур эндометрия может казаться нечетким (рис. 5.9). Для диффузной ЖГЭ небольшой толщины часто характерен достаточно четкий контур эндометрия (см. рис. 5.3, 5.5, 5.6), хотя нередки исключения в виде неровного, прерывистого края М-эхо (см. рис. 5.9), в основном, как уже отмечалось,за счет аденомиоза. ЖГЭ большой толщины (1,5-2 см) обычно демонстрирует нечеткие, даже размытые контуры (см. рис. 5.4), иногда принимающие своеобразную волнообразную форму [7]. Эта особенность эхоструктуры многими авторами рассматривается уже как признак повышенного риска малигнизации.
Следует обратить внимание на особенности не только наружного (по отношению к датчику), но и внутреннего контура эндометрия при ЖГЭ, а именно на эхогенную линию смыкания переднего и заднего листков эндометрия. Обычно она визуализируется плохо, а часто совсем не видна (см. рис. 5.2-5.4). Связано это со следующей важной особенностью эхоструктуры эндометрия при ЖГЭ, а именно с повышением его эхогенности.
Внутренняя эхоструктура эндометрия при гиперплазии
Эхогенность эндометрия при ЖГЭ обычно повышена (рис. 5.10), именно за счет этого, как и в фазу поздней секреции, перестает визуализироваться эхогенная линия смыкания листков эндометрия. Эхоструктура гиперплазии диффузно неоднородна (см. рис. 5.10), часто с множественными мелкими анэхогенными включениями. Их размер и количество очень варьируют. Так, размеры могут быть от минимальных и практически не поддающихся измерению, составляя меньше 1 мм, до относительно больших, достигающих 4-5 мм (см. рис. 5.8, 5.11). Количество включений также может быть разным - от единичных до множественных. За счет этих особенностей эхоструктуры дистальнее ЖГЭ может отмечаться акустический эффект усиления (см. рис. 5.11).
При визуализации участков повышения эхогенности на фоне практически неизмененного эндометрия возможен вывод о наличии очаговой гиперплазии (рис. 5.12, 5.13). Минимальные размеры очаговой ЖГЭ, которые можно определить при эхографии, обычно составляют 3-4 мм. Количество таких очагов в эндометрии бывает разным, чаще 1-2, но иногда больше. Следует помнить, что морфологически так называемая очаговая гиперплазия может оказаться мелкими полипами либо очаговым фиброзом.
Допплерография эндометрия при гиперплазии
На наш взгляд, допплерография играет очень важную, хотя и вспомогательную роль в диагностике ЖГЭ. Сам факт визуализации внутриэндомет-риального (эндометриального) кровотока при цветовой/энергетической
102
V. Гиперпластические процессы эндометрия
Рис. 5.9. Трансвагинальное продольное сканирование. ЖГЭ на фоне аденомиоза. Диффузно неоднородная эхоструктура как эндометрия (1), так и субэндометриального миометрия задней стенки матки (2) существенно затушевывает задний контур эндометрия, поэтому точно оценить толщину эндометрия в данном случае трудно.
Рис. 5.10. Трансвагинальное сканирование. Построение фронтального среза полости матки с помощью 30-реконструкции. Гиперплазированный эндометрий, имеющий неравномерно повышенную эхогенность, выполняет всю полость матки, подчеркивая ее треугольную форму. Полость матки обведена квадратным контуром.
Рис. 5.11. Трансвагинальное продольное сканирование. Железисто-кистозная гиперплазия в постменопаузе (стрелки). Контур М-эхо очень неровный, эхогенность М-эхо повышена, с эхонегативными включениями (длинные стрелки). Дистальнее М-эхо определяется зона акустического усиления (черные стрелки).
103
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.12. Трансвагинальное продольное (справа) и поперечное (слева) сканирование. Очаговая ЖГЭ (стрелки) определяется как образование овоидной формы и повышенной эхогенности. Характерная особенность очаговой гиперплазии - отсутствие демаркационного ободка между ЖГЭ и эндометрием.
Рис. 5.13. Трансвагинальное продольное сканирование. Очаговая ЖГЭ (стрелка). Также обращает на себя внимание неоднородная эхоструктура эндометрия в целом, прерывистость тонкой эхогенной линии смыкания переднего и заднего слоев (длинная стрелка).
допплерографии в раннюю пролиферативную фазу обязывает заподозрить патологическое состояние слизистой (рис. 5.14, 5.15). По данным различных авторов [7, 10-12], кровоток в эндометрии при ЖГЭ определяется в 40-100%. Такой разброс данных, несомненно, связан не только с ангио-морфологическими особенностями зоны интереса, но также с чувствительностью допплеровского блока. Наш опыт применения с названной целью аппаратуры как среднего, так и экспертного класса показал, что использование высокочувствительного, а главное, правильно настроенного допплеровского блока обеспечивает визуализацию внутриэндометриального кровотока практически во всех случаях ЖГЭ.
Как уже отмечалось выше, васкуляризация ЖГЭ не является продуктом патологического ангиогенеза. Преимущественно это не подвергнувшиеся обратному развитию спиральные сосуды. Таким образом, допплерографическая картина эндометрия при ЖГЭ обладает некоторым сходством с допплерограммой нормального эндометрия в среднюю секреторную фазу. Эндометриальный кровоток при ЖГЭ определяется в виде немногочисленных сосудов, относительно равномерно располагающихся в периферических отделах эндометрия (рис. 5.16, 5.17). Визуализация сосудов в цент-
ЛО4
V. Гиперпластические процессы эндометрия
Рис. 5.14. То же наблюдение, что на рис. 5.5. Трансвагинальное продольное сканирование. ЖГЭ. Режим энергетической допплерографии. Интраэндометри-альный кровоток (стрелки), определяемый в фазу пролиферации, подтверждает наличие ЖГЭ.
Рис. 5.15. Трансвагинальное продольное сканирование. ЖГЭ. Относительно тонкий эндометрий (пунктир). Однако обращает на себя внимание его повышенная эхогенность и диффузно неоднородная эхоструктура. Энергетическая допплерография подтверждает ЖГЭ визуализацией достаточно выраженного интраэндометриального кровотока (стрелки). Хорошо видна извитость сосудов, не характерная для нормальных спиральных артерий.
Рис. 5.16. Трансвагинальное продольное сканирование. ЖГЭ. Эндометрий утолщен до 12 мм (пунктир). Режим энергетической допплерографии. Интраэндометриальный кровоток (стрелка).
Л 05
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.17. Трансвагинальное продольное сканирование. ЖГЭ. Эндометрий утолщен до 9 мм (пунктир). Нечеткий контур М-эхо (стрелка). Режим энергетической допплерографии. Интраэндометриальный кровоток (длинные стрелки).
Рис. 5.18. Трансвагинальное сканирование. Режим ЗЭ-энергетической допплерографии. В трех проекциях хорошо визуализируется ЖГЭ (1), а также типичная для ЖГЭ васкуляризация в периферических отделах гиперплазии (2). Режим ЗО-реконструкции «стекловидное тело» (в желтом овальном контуре) позволяет получить более наглядное представление о васкуляризации гиперплазии.
ральных отделах изображения эндометрия, их ветвистый характер позволяют заподозрить более серьезные морфологические изменения - атипическую гиперплазию или рак. Объективный количественный анализ выраженности васкуляризации эндометрия (проще говоря, подсчет количества эндометриальных сосудов) - труднодостижимая цель. Однако использование ЗО-энергетической допплерографии позволяет приблизиться к ней (рис. 5.18, 5.19). Поданным G. Opolskiene и соавт. [8], показатели ЗО-энергетической допплерографии при доброкачественных гиперпластических процессах эндометрия составили (п = 49): VI = 1,2 (0-67), FI = 24,3 (0-50), VFI = 0,3 (0-34). Представим наши данные, основанные на анализе 52 случаев ЖГЭ у женщин детородного и пременопаузального возраста (41,4±4,2 года): VI = 3,64 ± 0,8 (0,14-6,8), FI = 28,42 ± 4,3 (22,1-36,7), VFI = 1,33 ± 0,3 (0,03-4,1). Пример расчета объемных индексов васкуляризации представлен на рис. 5.20.
Допплерометрические показатели эндометриального кровотока при ЖГЭ отличаются низкой скоростью и средней резистентностью (рис. 5.21).
Л 06
V. Гиперпластические процессы эндометрия
Рис. 5.19. Трансвагинальное сканирование. 1 -ЖГЭ. Режим ЗЭ-энергетической допплерографии. Режим ЗО-реконструкции «стекловидное тело» позволяет получить более наглядное представление о васкуляризации гиперплазии. В 30-режиме особенно нагляден периферический характер интраэндометриальной васкуляризации, характерный для простой ЖГЭ (стрелки).
Рис. 5.20. Пример расчета индексов васкуляризации в режиме ЗО-энергетичес-кой допплерографии с помощью программы VOCAL. Результаты расчета обведены желтым контуром. VI = 4,1, FI = 27,7, VFI = 1,16. В правом нижнем углу изображения стрелкой указан результат расчета объема эндометрия - 13,8 см3.
-I* WMF 70 Hz SV Angle 0 Size 2.0mm Frq mid PRF 1.3kHz
Pwr100 Q
Gn 0 CS ! M5
P2 / E2 SRI II 6
Рис. 5.21. Трансвагинальное сканирование. Триплексный режим. ЖГЭ в 31 год. Определяется интраэндо-метриальный периферический кровоток (стрелки). Спектр кривой венозного типа, скорость кровотока 2,5 см/с.
-4cm/s
Pwr100 % Gn 0.0 Frq mid Dual norm WMF fowl PRF 0.6kHz
cnvs
ЛО7
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.22. Трансвагинальное поперечное сканирование. Режим цветовой/энер-гетической допплерографии. Очаговая ЖГЭ (стрелка). Вариант субочагового кровотока (длинная стрелка). Сосуд «доходит» до очага гиперплазии, но не проникает в него.
Рис. 5.24. Трансвагинальное продольное сканирование. ЖГЭ в постменопаузе. Эндометрий немного утолщен (5 мм), имеет неравномерно повышенную эхогенность с эхонегативными включениями (стрелки).
Рис. 5.23. Трансвагинальное продольное сканирование. Очаговая ЖГЭ (1) на фоне диффузной ЖГЭ - эндометрий утолщен до 10 мм (пунктир). В режиме энергетической допплерографии хорошо видны интра-эндометриальные сосуды (2), наиболее крупный из которых (3) подходит к очагу ЖГЭ (субочаговый вариант кровотока). В проекции очага ЖГЭ видны мелкие цветовые пятна (4) - это допплеровский артефакт вспышки. Кстати, визуализация интраэндометриаль-ных сосудов подтверждает гиперплазию эндометрия даже на фоне «нормальной» эхокартины последнего.
Л 08
V. Гиперпластические процессы эндометрия
Показатель Vmax обычно не превышает 12-14 см/с, что позволяет предложить его пороговое значение: Vmax <15 см/с. Средние показатели Rlmiri составляют 0,50-0,54, причем практически не отмечается различий между значениями RI в сосудах ЖГЭ и базальных артериях. Предлагаемое нами пороговое значение RI для ЖГЭ: <0,50.
Особенности гемодинамики при очаговой гиперплазии эндометрия заключаются в аваскулярности самого эхогенного участка, однако при этом практически всегда можно визуализировать идущий от проекции базального слоя «питающий» сосуд, который доходит до участка гиперплазии, но не «заходит» внутрь (рис. 5.22, 5.23). ГА. Мустафина2 и соавт. [9] назвали это «субочаговым вариантом кровотока». Этот признак справедливо можно считать весьма важным для дифференциации очаговой гиперплазии от других объемных образований эндометрия.
Особенности гиперпластических процессов эндометрия в постменопаузе
Для диагностики гиперплазии эндометрия в постменопаузе не нужно дожидаться его утолщения до 7-8 мм, как в детородном возрасте. Уже при толщине эндометрия 5 мм правомочно давать заключение о его патологическом утолщении (рис. 5.24). Некоторые авторы рекомендуют делать это уже при толщине эндометрия 4,5 мм и более [8]. С учетом все большего распространения высокоразрешающей аппаратуры такой подход можно только приветствовать.
Многочисленные публикации подтверждают эту точку зрения. Так, очень убедительны данные И.А. Озерской [7], исследовавших репрезентативную группу женщин с ЖГЭ в постменопаузе. У обследуемых толщина М-эхо составила в среднем 6,2 ±1,5 мм (от 3 до 8 мм). Обратите внимание, что этот средний показатель почти в 2 раза меньше по сравнению с нашими данными у пациенток с ЖГЭ старшего детородного возраста (41,4 ± 4,2 года). Другой важной особенностью ЖГЭ в постменопаузе оказалась неоднородность эхоструктуры эндометрия, выявленная в 100% (!) случаев, а также серозометра, обнаруженная у 40% женщин с ЖГЭ. Авторы также отмечают, что при сочетании ЖГЭ и полипов в 20% полипы не были обнаружены эхографически. Наши данные не только подтверждают, но даже превосходят эту грустную статистику - мы не смогли обнаружить мелкие полипы на фоне ЖГЭ в постменопаузе у 43% больных, при том, что использовали оборудование экспертного класса.
2Галина Анатольевна Мустафина (1967-2006), талантливый врач и исследователь. Внесла значительный вклад в исследование маточной гемодинамики при гиперпластических процессах эндометрия. В 2006 г. с успехом защитила кандидатскую диссертацию на тему «Значение допплерографии в оценке поэтапных изменений субэндометриального и интраэндометриального кровотока у больных с доброкачественной очаговой патологией эндометрия».
Л 09
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.25. Трансвагинальное продольное сканирование. ЖГЭ в постменопаузе, а - эндометрий утолщен до 7 мм (пунктир), имеет высокую эхогенность с эхонегативными включениями (длинная стрелка). Режим направленной энергетической допплерографии. Инт-раэндометриальный периферический кровоток (стрелки); б - то же наблюдение в режиме Zoom. Обращает на себя внимание визуализация цветовых пятен только в периферических отделах М-эхо, почти только по контуру. Стрелки указывают то же, что на рис. а.
Рис. 5.26. Трансвагинальное продольное сканирование. ЖГЭ в постменопаузе. Эндометрий утолщен до 6 мм (пунктир). Его контур неровный, эхогенность незначительно повышена, с эхонегативными включениями (стрелка). Режим энергетической допплерографии. Интраэндометри-альный периферический кровоток (длинные стрелки).
ИЛО
V. Гиперпластические процессы эндометрия
Таблица 5.2. Показатели интраэндометриального кровотока при гиперпластических процессах в постменопаузе [12]
Вариант гиперпластического процесса Vmax» СМ/С RI
Гиперплазия эндометрия в постменопаузе Полипы эндометрия в постменопаузе 7,1 ± 1,6 6,0 ±2,8 0,62 + 0,08 0,61 +0,08
Допплеровское исследование в постменопаузе позволяет визуализировать внутриэндометриальный кровоток в 30-80% ЖГЭ в постменопаузе (рис. 5.25, 5.26). Ряд авторов связывают различия в качественных и количественных показателях при ЖГЭ в постменопаузе не только с морфологическим типом патологии, но и с длительностью постменопаузы [11]. Для количественных показателей гемодинамики гиперпластических процессов эндометрия в постменопаузе характерна преимущественно весьма низкая скорость и высокая резистентность кровотока (табл. 5.2).
Изменения эндометрия на фоне приема тамоксифена
Антиэстрогенная терапия тамоксифеном широко применяется в составе комплексного лечения при раке молочной железы. Препарат конкурентно ингибирует рецепторы эстрогенов в органах-мишенях и опухолях, происходящих из этих органов. Тамоксифен обладает антигонадотропными свойствами, тормозит прогрессирование опухолевого процесса, стимулируемого эстрогенами. При адъювантном лечении тамоксифеном у больных раком молочной железы примерно на 50% снижается риск развития онкологического процесса в контралатеральной молочной железе. Однако часто препарат оказывает парадоксальное прогонадотропное и проэстро-генное влияние на органы-мишени. Среди ряда побочных эффектов препарата - опухолевидные образования яичников и гиперплазия эндометрия. Вызывает весьма серьезную озабоченность подтвержденная многочисленными исследованиями информация об увеличении в 2-4 раза частоты рака эндометрия на фоне приема тамоксифена по сравнению с больными, которым тамоксифен не назначался. Считается, что относительный риск развития эндометриальной карциномы достигает 6-7% при приеме тамоксифена в течение 3-4 лет [4]. Вместе с тем имеется обоснованное мнение о том, что польза от 50% снижения частоты рака молочной железы, который требует выполнения высокотравматичного, нередко инвалидизирующего оперативного вмешательства, химио- и лучевой терапии (при этом многие больные все равно погибают), значительно перевешивает вред, который приносит прием тамоксифена.
Таким образом, наша задача в данном случае заключается в своевременной диагностике гиперплазии, а также, по возможности, минимального рака эндометрия.
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.27. Трансвагинальное продольное сканирование. Железисто-кистозная гиперплазия в постменопаузе (стрелки) на фоне приема тамоксифена. Эхогенность М-эхо повышена, с эхонегативными включениями (длинные стрелки).
На фоне приема тамоксифена ультразвуковое изображение эндометрия, напоминающее таковое при ЖГЭ, возникает уже через 4-6 мес от начала лечения. Одна из особенностей эхокартины - множественные мелкие кистозные включения в утолщенном эндометрии (рис. 5.27). Важная особенность -бессимптомное утолщение эндометрия, причем, по данным М.А. Чекаловой и соавт. [13], почти в 80% «при этом никакой патологии со стороны эндометрия при гистологическом исследовании не обнаруживается».
Полагаем, что тамоксифен-индуцированное утолщение эндометрия в пределах 5-9 мм следует расценивать как ожидаемое и не требующее инвазивной тактики. В течение года после отмены тамоксифена мы наблюдаем постепенное уменьшение толщины эндометрия до показателей нормы для соответствующего возрастного периода.
Несмотря на повышенный риск развития рака эндометрия на фоне приема тамоксифена, некоторые авторы [5] не считают целесообразным выполнять скрининговые ультразвуковые исследования у больных этой группы. По нашему мнению, такой скрининг все же оправдан, его целесообразно проводить по схеме через 3 мес, а затем каждые 6 мес. При толщине эндометрия 10 мм или больше показана его биопсия. Сходную точку зрения высказывают М.А. Чекалова и соавт. [13], рекомендуя производить гистероскопию с биопсией при выявлении ультразвуковым методом утолщения эндометрия до 8-10 мм.
Полипы эндометрия
Полипы эндометрия развиваются путем пролиферации эпителия желез базального слоя эндометрия. Вначале разрастающиеся железы и окружающая их строма образуют полиповидный вырост на широком основании,
ПП2
V. Гиперпластические процессы эндометрия
позднее формируется ножка различной толщины, в которую могут быть втянуты мышечные волокна [14]. Именно наличие ножки, состоящей из фиброзной и гладкомышечной ткани, - непременное анатомическое свойство полипов. Благодаря ножке полип приобретает признак «органоидности», отличающий его от полиповидной формы ЖГЭ, иногда еще называемой полипозом эндометрия (последнее определение считается спорным) [1]. В своей экзофитной части полип часто покрыт слоем функционального эндометрия. Эта «шапочка» участвует в циклических изменениях, происходящих в окружающем эндометрии, и может отторгаться в фазу десквамации.
Расположение желез в полипе характеризуется неравномерностью и беспорядочностью. В составе ножки полипа обычно проходит основной питающий сосуд, затем ветвящийся внутри самого полипа. Такая сосудистая ножка возникает за счет вовлечения в растущую экзофитную часть полипа сосудов базального слоя эндометрия. Сосуды полипов обычно имеют утолщенные склерозированные стенки, а в основании полипов могут образовывать клубки.
Как и ЖГЭ, полипы эндометрия проявляют определенную гормональную зависимость, выраженность которой, однако, связана с особенностями гистологического типа последних. Если в составе желез полипа преобладает высокопризматический эпителий пролиферативного типа, то он реагирует на эстрогенную/гестагенную стимуляцию подобно эндометрию. Их еще называют полипами функционального типа. В случае преобладания низкопризматического эпителия, а также выраженного фиброза стромы полипы могут оказаться гормононезависимыми. Их называют полипами базального типа [2]. Морфологически также выделяют пролиферирующие железистые, а также стромальные эндометриальные полипы.
Полипы эндометрия могут быть единичными или множественными и чаще всего располагаются в области дна и трубных углов тела матки. Более типичны одиночные полипы. Размеры полипов разнообразны - от микроскопических, определяемых в соскобе в виде мелких фрагментов железистой ткани, до больших экзофитных образований, выполняющих всю полость матки и проникающих через цервикальный канал во влагалище. В большинстве случаев размеры полипов варьируют в пределах 3-10 мм. Основание полипов (ножка) обычно узкое, изредка встречается широкое основание полипа.
Риск злокачественного перерождения полипов эндометрия в детородном возрасте невысок (2-5%). Однако он существенно возрастает в постменопаузе (до 10%) [1].
Эхографические признаки полипов эндометрия
Особенности ультразвукового изображения полипов эндометрия приводятся во многих работах [6, 7]. Вот описание типичной эхокартины полипов эндометрия: овальное или округлое образование средней или повышенной эхогенности с четкой границей между полипом и окружающими тканями, как правило, в виде гипохогенного ободка (рис. 5.28). К сожалению, наш опыт показал, что подобное «классическое» изображение имеют не более
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.28. Трансвагинальное продольное сканирование. Полип эндометрия в верхнем отделе полости матки. 1 - полип (в сплошном контуре); 2 - гипоэхогенный ободок вокруг полипа (между сплошным и пунктирным контурами).
половины эндометриальных полипов, оказавшихся в соскобе из полости матки. Сопоставление данных ультразвукового и гистологического исследования позволяют выделить 3 основных варианта ультразвукового изображения при полипах эндометрия:
1. Полип определяется как отдельное образование на фоне измененно-го/неизмененного эндометрия.
2. Большой полип выполняет всю полость матки, имитируя эхокартину гиперплазии эндометрия.
3. Мелкий полип (полипы) не визуализируется на фоне измененно-го/неизмененного эндометрия.
1 -й вариант эхокартины эндометриальных полипов. Как справедливо указывают В.Н. Демидов и А.И. Гус [6], несмотря на существенные морфологические различия полипов эндометрия (железистые, железисто-фиброзные, фиброзные, аденоматозные), в их эхографическом изображении имеется много общего. Типичная эхокартина полипа эндометрия: овальное или округлое образование средней или повышенной эхогенности с четкой границей между полипом и окружающими тканями, как правило, в виде ан-либо гипоэхогенного ободка (рис. 5.29-5.32). В диагностике хорошо помогает наличие жидкости в полости матки (рис. 5.33). Размеры полипов могут существенно варьировать - от 0,5 до 4-6 см.
Довольно часто определяется не один, а несколько полипов эндометрия (рис. 5.34). Анализ эхокартины требует тогда неторопливости и тщательности, иначе можно вообще ошибочно посчитать, что полипов эндометрия нет. Подробнее об этом в разделе о 3-м варианте эхокартины полипов эндометрия.
Важнейшая допплерографическая особенность полипов эндометрия -наличие признака «цветового мостика» между миометрием и полипом, иначе говоря, сосудистой ножки полипа. Важная особенность - сосудистая ножка заходит «внутрь» полипа - мы называем это интраочаговым моносо-судистым вариантом кровотока (рис. 5.35-5.38) [9]. Нередко цветовая
V. Гиперпластические процессы эндометрия
Рис. 5.29. Трансвагинальное поперечное сканирование. 1 - полип эндометрия в правом углу полости матки; 2 - неизмененный тонкий гипоэхогенный эндометрий на 6-й день менструального цикла.
Рис. 5.30. Полип эндометрия. Пациентке 24 года. Беременностей не было, а - продольное сканирование. Полип (1) плохо виден, он почти сливается с неизмененным эндометрием (2); б - поперечно визуализация полипа (1) лучше в основном за счет гипоэхогенного ободка (стрелки).
1И5
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.31. Полип эндометрия больших размеров в нижней трети полости матки. Хорошая визуализация полипа (стрелка) и при продольном (а), и при поперечном (б)сканировании.
Рис. 5.32. Полип эндометрия больших размеров. Хорошая визуализация полипа (стрелка) и при продольном (а), и при поперечном (б) сканировании. Небольшое количество жидкости в полости матки (длинные стрелки).
416
V. Гиперпластические процессы эндометрия
Рис. 5.33. Хорошая визуализация полипа (стрелка) на фоне свободной жидкости в полости матки (длинная стрелка)
Рис. 5.34. Трансвагинальное продольное сканирование. 1 - множественные небольшие полипы эндометрия. Видна деформация эхогенной полоски смыкания листков эндометрия (стрелки).
117
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.35. Направленная энергетическая допплерография. 1 - полип эндометрия с основанием по передней стенке матки; 2 - гипо-эхогенный ободок; 3 - эндометрий повышенной эхогенности; 4 - сосудистая ножка, проникающая внутрь полипа, подтверждает локализацию основания полипа.
Рис. 5.36. Трансвагинальное продольное сканирование. Направленная энергетическая допплерография. 1 - полип эндометрия с основанием по задней стенке матки; 2 - гипоэхогенный ободок; 3 - сосудистая ножка, проникающая внутрь полипа, подтверждает локализацию основания полипа.
Рис. 5.37. Трансвагинальное поперечное сканирование. Режим энергетической допплерографии. 1 - полип эндометрия с основанием в правых отделах стенки матки; 2 - гипоэхогенный ободок; 3 - сосудистая ножка полипа.
418
V. Гиперпластические процессы эндометрия
Рис. 5.38. Трансвагиналь-ное поперечное сканирование. Режим энергетической допплерографии. Полип эндометрия с основанием по задней стенке матки (стрелка). Сосудистая ножка полипа (длинная стрелка). При извитой форме сосудистой ножки полипа не всегда удается проследить ее проникновение внутрь полипа. В данном случае кровоток выглядит субочаговым (черная стрелка).
Рис. 5.39. Маленький полип эндометрия без четких контуров (стрелка). В уточнении диагноза помогает энергетическая допплерография, демонстрирующая сосудистую ножку (длинная стрелка), проникающую внутрь образования (интра-очаговый монососудистый вариант кровотока).
допплерография, наглядно демонстрируя сосудистую ножку полипа, помогает более уверенно поставить ультразвуковой диагноз эндометриального полипа при плохой визуализации последнего в режиме серой шкалы (рис. 5.39, 5.40). В этих ситуациях также неплохо помогает использование режима ЗО-энергетической допплерографии (рис. 5.41,5.42).
Показатели Vmax в простых полипах составляют в среднем 9-10 см/с (от 5 до 15 см/с), a RI - 0,56-0,58 (от 0,5 до 0,8). Не обнаружено никаких достоверных отличий гемодинамических показателей между различными морфологическими типами простых полипов эндометрия (железистые, железисто-фиброзные и пр.) [6, 12]. Для стандартизации исследований рекомендуем снимать допплеровский спектр с «сосудистого мостика» в области основания полипа (см. рис. 5.44, б) Можно рекомендовать пороговые допплерометрические показатели для простых полипов эндометрия: Vmax < 15 см/с, RI > 0,5.
Полипы эндометрия могут достигать весьма больших размеров и даже рождаться во влагалище (как субмукозные миомы на ножке). В этих случаях необходима дифференциальная диагностика с уже упомянутой рож-
4Л9
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.40. Маленький полип эндометрия повышенной эхогенности (стрелка). Энергетическая допплерография демонстрирует сосудистую ножку (длинная стрелка), проникающую внутрь образования (интраочаговый монососудистый вариант кровотока).
Рис. 5.41. Режим ЗЭ-энергетической допплерографии. На фоне неизмененного эндометрия (1) определяется образование небольших размеров с неровными и нечеткими контурами, повышенной эхогенности, без гипоэхогенного ободка (стрелки). Таким образом, изображение в В-режиме типично для очаговой ЖГЭ. Однако в режиме энергетической допплерографии в одной из трех проекций удалось визуализировать сосудистую ножку, проникающую внутрь образования (2). Гистологическое заключение: железисто-фиброзный полип эндометрия.
120
V. Гиперпластические процессы эндометрия
Рис. 5.42. Режим ЗР-энергетической допплерографии. На фоне гипоэхогенного эндометрия (1) определяется образование небольших размеров с четкими контурами, повышенной эхогенности, без гипоэхогенного ободка (стрелки). В режиме энергетической допплерографии в одной из трех проекций визуализируется сосудистая ножка, проникающая внутрь образования. Сосуд сканируется поперечно (длинная стрелка). Гистологическое заключение: железисто-фиброзный полип эндометрия.
дающейся миомой, а также карциномой эндометрия. Главная особенность таких полипов - достаточно четко прослеживающаяся анатомическая и сосудистая ножка с характерными показателями гемодинамики (рис. 5.43).
2-й вариант эхокартины эндометриальных полипов. Этот вариант редок (1-5%) и наиболее типичен для постменопаузы. Длительно существующие полипы выполняют всю полость матки. При этом часто исчезает существенная эхографическая особенность полипов эндометрия - гипо-эхогенный ободок. В результате эхокартина представлена достаточно симметричным М-эхо, имеющим ровные контуры, высокую эхогенность, мелкие эхонегативные включения (рис. 5.44, а), - согласитесь, что я только что привел типичное описание эхокартины гиперплазии эндометрия в постменопаузе. Может возникнуть резонный вопрос: велика ли разница между ультразвуковыми заключениями о гиперплазии и полипе в постменопаузе? Морфологически - почти нет. Но есть существенная разница с точки зрения успешности дальнейшей гинекологической тактики. Как оказалось, первостепенное значение имеет достоверная информированность гинеколога, выполняющего гистероскопию, о том, с чем он будет иметь дело - полипом или диффузной гиперплазией. При длительно существующих в постменопаузе больших полипах поверхность последних при гистероскопии может имитировать стенку матки, чему способствует спаечно-склерозирующий процесс, скрывающий «щели» между краями полипа и стенками матки, а также приводящий к сходному изображению поверхности полипа и маточной стенки. Таким образом, гинеколог, проводящий гистероскопию, мо-
121
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.43. Рождающийся полип. Большой полип эндометрия с основанием по задней стенке матки в области ее дна. Нижний полюс полипа в области наружного зева шейки матки, а-в -продольное трансвагинальное сканирование; г - поперечное сканирование шейки матки, полип в стрелках. 1 -основание полипа; 2 - ножка полипа; 3 - нижний полюс полипа, содержит кистозные включения 2-5 мм; 4-эндометрий; 5 - внутренний зев шейки матки; 6 - раск-
рытый до 7 мм наружный зев шейки матки, его края указаны стрелками; 7 - строма шейки матки; д, е - направленная энергетическая допплерография; 8 - сосудистая ножка полипа; 9 - кровоток в нижнем полюсе полипа; ж - триплексный режим. Количественные показатели кровотока в ножке полипа. Vmax5 см/с, RI 0,49.
122
V. Гиперпластические процессы эндометрия
Рис. 5.44. а - 2-й вариант визуализации полипа эндометрия. Постменопауза. Эхо-картина мало отличается от таковой при ЖГЭ прежде всего за счет отсутствия гипоэ-хогенного ободка. Стрелкой отмечен контур полипа, выполняющего полость матки;
б - в режиме цветовой допплерографии прекрасно видна сосудистая ножка полипа (стрелка). Допплерометрические показатели:
11 см/с, RI 0,71.
жет быть почти в полной уверенности, что гистероскоп находится между стенками полости матки, в то время как одна из «стенок» матки - поверхность полипа. Между тем продуманная инвазивная тактика, подкрепленная эхографическим знанием о топографии полипа в полости матки, обязательно будет иметь успех.
Врачи ультразвуковой диагностики со стажем могут припомнить нередкие случаи, когда после ультразвукового заключения «выраженная гиперплазия эндометрия в постменопаузе» и последующего кюретажа при проведенном вскоре контрольном ультразвуковом исследовании эхокартина оставалась прежней. В морфологическом же заключении таких пациенток всегда фигурировала фраза: «скудный соскоб». Очевидно, что во всех этих случаях гинеколог просто «скользил» инструментом по поверхности полипа. Кто виноват в неудачном инвазивном вмешательстве? Думаю - мы, не давшие гинекологу объективную информацию.
Как дать правильное ультразвуковое заключение, чтобы не подвести гинеколога и себя? Ответ: включить режим цветового допплеровского блока.
123
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.45. Трансвагинальное сканирование в 30-режиме. 3-й вариант визуализации полипов эндометрия. Полипы эндометрия не видны на фоне неравномерно повышенной эхогенности эндометрия. На 2О-эхограм-мах в трех проекциях хорошо виден интраэндометриаль-ный сосуд (стрелки), вероятно, являющийся сосудистой ножкой полипа. Режим ЗО-реконструкции «стекловидное тело» (в желтом контуре): прослеживается извитая форма сосуда.
Рис. 5.46. Трансвагинальное сканирование в 30-режиме. 3-й вариант визуализации полипов эндометрия. Множественные мелкие полипы эндометрия не видны на фоне повышенной эхогенности утолщенного эндометрия (1). На 20-эхограммах в трех проекциях хорошо видны интраэндометриаль-ные сосуды (2), преимущественно расположенные в периферических отделах М-эхо. Режим ЗО-реконструк-ции «стекловидное тело» (в желтом контуре). Ультра
звуковой диагноз - гиперплазия эндометрия. Гистологическое заключение после раздельного диагностического выскабливания: множественные железистые полипы эндометрия
Рис. 5.47. Трансвагинальное сканирование в 3D-pe-жиме. Железистый полип эндометрия в постменопаузе. 3-й вариант визуализации. Во всех трех проекциях определяется только тонкое М-эхо (5 мм) повышенной эхогенности (стрелки). Кровоток наблюдается только в миометрии (длинная стрелка). Особенно хорошо это видно в режиме «стекловидное тело» (в желтом контуре).
'124
V. Гиперпластические процессы эндометрия
При цветовой допплерографии больших эндометриальных полипов в большинстве случаев удается определить сосудистую ножку полипа в виде достаточно выраженного цветового «мостика» между миометрием и полипом (рис. 5.44, б). Чаще всего такой «мостик» проникает в М-эхо не менее чем на середину его толщины. При диффузной гиперплазии таких «мостиков» может быть несколько, но они тонкие, извитые и неглубокие (проникают в М-эхо менее чем наполовину).
3-й вариант эхокартины эндометриальных полипов. При данном варианте полипы часто не то чтобы не видны вообще, их просто очень трудно визуально отдифференцировать от эндометриального фона. Эхоструктура эндометрия в этих случаях чаще всего выглядит неоднородной, с зонами различной эхогенности, однако типичных признаков 1-го варианта изображения полипов нет. Впервые на это обратили внимание В.Н. Демидов и А.И. Гус [6], отметив, что при наличии мелких полипов эндометрия (<0,5 см) диагностика затруднена, и единственным эхопризнаком может явиться деформация срединной линейной гиперэхогенной структуры М-эхо (см. рис. 5.34). Следует признать, что иногда даже ретроспективный сравнительный анализ записи ультразвукового исследования, выполненного на экспертной диагностической аппаратуре, не позволяет уверенно выявить участки эхокартины эндометрия, которые можно было бы интерпретировать как полипы (рис. 5.45-5.47). Вместе с тем при 3-м варианте эхокартины полипов эндометрия в большинстве случаев удается избежать тактических ошибок. Ведь чаще всего здесь будет дано заключение о гиперплазии эндометрия, поскольку он будет выглядеть скорее всего утолщенным и диффузно измененным, с характерными особенностями гемодинамики (см. рис. 5.45-5.47). А поскольку «невизуализируемые» полипы обычно мелкие и не имеют прочной органической связи с базальным слоем, они достаточно легко удаляются при раздельном диагностическом выскабливании.
Атипические гиперпластические процессы эндометрия
За последние 30 лет заболеваемость раком тела матки в нашей стране возросла в 3 раза и составляет 21 на 100 тыс. женского населения, уступая лишь раку молочной железы среди онкологических болезней женщин. Что настораживает особенно - среди заболевших неуклонно увеличивается удельный вес женщин молодого возраста. По выражению Е.Г Новиковой и соавт. [10], традиционное представление о данном заболевании как о болезни женщин пожилого возраста постепенно меняется.
Особое значение приобретает четкое выделение группы предраковых состояний. Как показывает статистика, огульно относить к ним все случаи гиперплазии и эндометриальных полипов неверно, эти состояния малигни-зируются не более чем в 1-5%. А именно такой подход чреват слишком высокой частотой неоправданных кюретажей и оперативных вмешательств,
Л 25
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
когда удельный вес осложнений после такой агрессивной тактики способен превысить ущерб от случаев запущенного рака.
Что же следует отнести к состоянию предрака эндометрия и каковы оптимальные критерии его ультразвуковой диагностики? Главным предраковым состоянием эндометрия следует считать атипическую гиперплазию (АГЭ), непосредственно предшествующую высокодифференцированной аденокарциноме эндометрия. Выделяют 3 степени АГЭ: легкая, умеренная, выраженная. Последняя некоторыми онкогинекологами справедливо расценивается уже как CIS [10]. Следует обратить внимание на некоторую терминологическую путаницу: ряд морфологов вкладывают не совсем одинаковый смысл в понятия «аденоматозная» и «атипическая» гиперплазия. Одни считают эти два термина синонимами, другие рассматривают их как разные морфологические состояния. Во избежание недоразумений мы в дальнейшем будем ограничиваться термином «атипическая гиперплазия».
Развитию гиперплазии, предрака (атипической гиперплазии) и рака эндометрия существенно способствует относительная гиперэстрогения, развивающаяся на фоне дефицита прогестерона. Именно поэтому пациентки с хронической ановуляцией в репродуктивном возрасте (т.е. с овариальным фактором бесплодия) в первую очередь должны включаться в группу повышенного риска развития предрака и рака.
Важнейшую морфологическую особенность АГЭ отмечает Я.В. Бохман [1]: атипия может обнаруживаться как в гиперплазированном, так и в атрофическом эндометрии и полипах.
Ультразвуковые критерии диагностики атипической гиперплазии эндометрия
Разработка эффективных ультразвуковых критериев диагностики АГЭ -ключ к раннему выявлению минимального рака эндометрия. К сожалению, сегодня эта проблема еще не нашла адекватного решения. Однако существующие современные методы ультразвуковой диагностики позволяют надеяться, что мы у порога ее решения.
Пионеры ультразвуковой диагностики АГЭ в нашей стране В.Н. Демидов и Б.И. Зыкин еще 25 лет назад указывали, что специфических эхографических критериев диагностики АГЭ нет. Толщина эндометрия при этом состоянии, по их данным, колеблется в пределах 1,5-2 см, в отдельных случаях достигая 3 см. Эхогенность АГЭ средняя, эхоструктура достаточно однородная (рис. 5.48).
В дальнейшем вопросам эхографии АГЭ было посвящено много работ, авторы которых отмечают отсутствие специфических ультразвуковых признаков этой патологии. Е.Г. Новикова и соавт. [10] выделяют следующие эхографические особенности АГЭ: утолщение М-эхо до 10-20 мм, фолликулярные кисты яичников у 60% больных, синдром поликистозных яичников у 20%, миома матки небольших размеров у 37%.
Использование допплерографии также не дало однозначного ответа. Так, Б.И. Зыкин [12] не обнаружил достоверных отличий между простой
126
V. Гиперпластические процессы эндометрия
Рис. 5.48. Трансвагиналь-ное продольное сканирование. АГЭ. Эндометрий утолщен до 14 мм (пунктир), имеет среднюю эхогенность с мелкими эхонегативными включениями (стрелки).
Рис. 5.49. Трансвагинальное продольное сканирование. Режим цветовой допплерографии. Атипическая ЖГЭ на фоне жидкости в полости матки. 1 - ЖГЭ; 2 -жидкость в полости матки. Определяется интраэндо-метриальный кровоток как в периферических (3), так и в центральных (4) отделах эндометрия.
гиперплазией эндометрия и АГЭ при использовании допплеровских методик, за исключением заметного усиления суб- и интраэндометриального кровотока у большей части больных. При этом интраэндометриальный кровоток имел значения Vmax 6-8 см/с, a RI 0,58-0,6 [8]. Е.Г. Новикова и соавт. [10] отмечают, что при АГЭ Vmax базальных артерий по сравнению с нормой не меняется (6 см/с), в то время как снижаются показатели периферического сопротивления: PI 0,88 (в норме 1,14), RI 0,53 (в норме 0,55). Показатели гемодинамики в спиральных сосудах при АГЭ следующие: Vmax 15 см/с, RI 0,55, PI 0,85.
Несмотря на отсутствие четких ультразвуковых критериев, все же сопоставим основные ультразвуковые особенности простой гиперплазии эндометрия и АГЭ, которые, возможно, помогут в формировании группы онкологического риска. Данные получены на основании нашего собственного опыта и представлены в табл. 5.3, а также на рис. 5.49, 5.50.
Таким образом, можно сделать вывод, что для АГЭ характерны более выраженное по сравнению с простой ЖГЭ утолщение эндометрия, а также более интенсивная эндометриальная васкуляризация с тенденцией к повышению скорости и снижению резистентности кровотока.
127
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.50. Трансвагинальное сканирование. АГЭ. Режим SD-энергетической допплерографии с ЗО-реконструкцией «стекловидное тело». В 30-режиме особенно нагляден как периферический (1), так и центральный (2) характер интраэндометриальной васкуляризации, характерный для АГЭ. Обращают на себя внимание высокая плотность сосудов, их ветвление (стрелка).
Таблица 5.3. Ультразвуковые особенности простой гиперплазии эндометрия и АГЭ
Показатель Простая гиперплазия эндометрия АГЭ Р
Толщина эндометрия, мм Эхогенность эндометрия 10,3 ±2,6 (7-20) Повышена 14,5 ±2,9 (11-27) Средняя 0,05
Эхоструктура эндометрия Однородная, часто с эхонегативными включениями Однородная >0,05
VI эндометриального кровотока 3,6+ 0,8 (0,14-6,8) 4,3 ± 0,7 (0,23-10,5) 0,05
FI эндометриального кровотока 28,4 ±4,3 (22,1-36,7) 30,2 ±3,8 (18,2-37,6) >0,05
VFI эндометриального кровотока 1,3 ±0,3 (0,03-4,1) 1,7 ±0,3 (0,05-6,4) >0,05
Vmax эндометриального кровотока, см/с 12,5 ±0,09 (6-17) 15,3 ±0,06 (10-18) >0,05
RI эндометриального кровотока 0,53 ±0,14 (0,50-0,59) 0,50±0,18 (0,47-0,55) >0,05
128
V. Гиперпластические процессы эндометрия
Рис. 5.51. Трансвагиналь-ное продольное сканирование. 1 - аденоматозный полип эндометрия. В режиме энергетической допплерографии определяется сосудистая ножка (2), разветвляющаяся внутри полипа интраочаговый мультисосу-дистый кровоток (3).
Рис. 5.52. Трансвагинальное продольное сканирование. 1 - аденоматозный полип эндометрия. В режиме направленной энергетической допплерографии определяется сосудистая ножка (2), разветвляющаяся внутри полипа: интраочаговый мультисосудистый кровоток (3).
Ультразвуковая диагностика аденоматозных полипов
Для эхокартины аденоматозного полипа не характерны какие-то значимые особенности. Аденоматозные полипы могут быть больше простых полипов, но многие исследователи с этим не согласны. Отличия между простым и аденоматозным полипом начинаются с момента включения цветового допплеровского блока. В первую очередь бросается в глаза более интенсивная васкуляризация аденоматозных полипов эндометрия, причем если в простом полипе цветовой рисунок ограничивается «мостиком», иначе говоря, «интраочаговым монососудистым вариантом кровотока», то в аденоматозных полипах «мостик», как правило, ветвится (рис. 5.51-5.53). Такой тип васкуляризации называется интраочаговым мультисосудистым вариантом кровотока [15].
129
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.53. Трансвагинальное продольное сканирование. Режим цветовой допплерографии.
Большой фиброзный полип (1) с мультисосудистым типом интраочагового кровотока (2).
Рис. 5.54. Аденоматозный полип эндометрия (1). Триплексный режим. Высокая скорость кровотока в сосудистой ножке полипа (стрелка). Vmax43 см/с.
Допплерометрические показатели также существенно разнятся: в аденоматозных полипах по сравнению с простыми полипами в 2 раза выше (!), достигая в среднем 18-20 см/с (от 10 до 25 см/с). На рис. 5.54 продемонстрирован небольшой полип эндометрия с показателем Vmax 43 см/с. Показатель RI в аденоматозных полипах также ниже, чем в простых, составляя в среднем 0,53-0,55 (от 0,45 до 0,65), но эти отличия недостоверны. Столь существенная разница между показателями Vmax позволила Г.А. Мустафиной [15] предложить для дифференциальной диагностики простых и аденоматозных полипов пороговое значение Vmax 17 см/с. Поданным автора, диагностическая ценность этого критерия оказалась достаточно высокой: чувствительность 90%, а специфичность 96%.
130
V. Гиперпластические процессы эндометрия
Концепция доклинической ультразвуковой диагностики патологии эндометрия.
Нарушение десквамации эндометрия. Очаговый фиброз эндометрия.
Очаговая гиперплазия эндометрия
Нарушение десквамации эндометрия иначе называется замедленным неравномерным отторжением эндометрия [2]. Дисфункциональные кровотечения при этом отличаются разнообразием как клинической, так и морфологической картины. Известно, что для фазы менструального кровотечения характерны почти одновременно происходящие процессы десквамации и регенерации. При описываемом патологическом состоянии страдают оба процесса. Нарушение десквамации проявляется в замедленном отторжении функционального эндометрия, преимущественно только его поверхностных слоев (рис. 5.55, 5.56). Нарушение регенерации проявляется в обратном развитии неотторгнувшегося эндометрия. С наступлением нового менструального цикла неотторгнувшаяся ткань функционального слоя подвергается обратному развитию. Строма базального слоя эндометрия при этом может подвергаться очаговому фиброзу, приобретает неравномерную плотность. Несколько неожиданная и тем более важная морфологическая информация с точки зрения практического использования допплерографии при данном состоянии - клубки спиральных артерий не подвергаются достаточной редукции и соответственно не полностью запу-стевают. В целом морфологическая картина нарушения десквамации довольно пестрая: в соскобе обнаруживаются некротизированная ткань, преимущественно секреторный эндометрий в состоянии обратного развития, регенерированный эндометрий, фрагменты гипопластического эндометрия пролиферативного типа, часто встречаются клубки спиральных артерий [2].
Клинический результат этих патологических процессов - гиперполименорея, вплоть до меноррагии. Чаще всего описываемая проблема возникает у женщин пременопаузального возраста. Очевидно, что данные состояния (нарушение десквамациии и очаговый фиброз) с морфофункциональной точки зрения можно рассматривать как предшествующие гиперпластическим процессам эндометрия.
Представляется весьма важным как можно более рано диагностировать разнообразные варианты патологии эндометрия. Это значимо и с точки зрения своевременного формирования группы повышенного риска развития онкологической патологии эндометрия, и с точки зрения своевременного выявления эндометриального фактора бесплодия. С этой целью была проведена работа по изучению возможностей современной эхографии для доклинической диагностики патологии эндометрия [15]. Как оказалось, у ряда пациенток с нормальной эхокартиной эндометрия при цветовой
131
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 5.55. Трансвагинальное продольное сканирование. Ретродевиация матки. Нарушение десквамации эндометрия (стрелки) в виде мелких пристеночных включений на широком основании, имеющих пониженную и среднюю эхогенность. Их визуализацию существенно улучшает небольшое количество жидкости в полости матки (1). 2 - межмышечно-субсе-розный узел; 3 - вены миометрия.
Рис. 5.56. Трансвагинальное продольное сканирование. Ретродевиация матки. Нарушение десквамации эндометрия (стрелка) в виде мелкого пристеночного включения на широком основании. Его визуализацию существенно улучшает небольшое количество жидкости в полости матки (1). 2 - вены миометрия.
допплерографии выявлялось локальное усиление субэндометриального кровотока. Авторы назвали это признаком «локальной субэндометриальной гиперваскуляризации на фоне нормальной эхокартины эндометрия». В течение 1 года динамического наблюдения более чем у половины этих пациенток (57%) были обнаружены эхографические признаки доброкачественной очаговой патологии эндометрия, подтвержденные гистологически (гистероскопия, прицельная биопсия).
Допплерографические критерии локальной субэндометриальной гиперваскуляризации: в субэндометриальной зоне при проведении цветовой допплерографии в раннюю пролиферативную фазу определяется достаточно интенсивный цветовой сигнал (рис. 5.57), при этом допплерометрические показатели этой области характеризуются достоверным повышением Vmax и снижением RI по сравнению с другими сосудами субэндометриальной зоны (табл. 5.4).
132
V. Гиперпластические процессы эндометрия
Рис. 5.57. Трансвагиналь-ная допплерография. Локальная гиперваскуляризация эхографически неизмененного эндометрия. 1 -участок гиперваскуляризации (эхограммы из работы ГА. Мустафиной [15]).
Гистологическое исследование выявило 3 морфологических типа очаговой патологии эндометрия, являющихся своеобразными предшественниками полипов: локальное нарушение десквамации, очаговая железистая гиперплазия, очаговый фиброз.
Промежуток времени от обнаружения локальной субэндометриальной гиперваскуляризации до появления эхопризнаков очаговой патологии эндометрия колебался от 2 мес до 1 года. Причем раньше всего проявлялось локальное нарушение десквамации (через 2-4 мес), несколько позднее (через 6-12 мес) - очаговый фиброз и очаговая гиперплазия.
Достоверных отличий допплерометрических показателей между этими тремя морфологическими типами нет. Следует признаться, что и внятных эхографических отличий между ними мы тоже не находим. Диаметр очагов колеблется от 5 до 10 мм, во всех случаях имеет место повышенная эхогенность очагов. Более детально эхографические собенности этих образова-
133
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Таблица 5.4. Допплерометрические показатели кровотока в субэндометриальной зоне при первичном обследовании (до мониторинга)
Показатель Норма Локальная субэндометриальная гиперваскуляризация Р
Vmax, см/с RI 7,1 ±0,9 (5,0-9,2) 0,58 ±0,06 (0,47- 0,71) 8,7 ± 1,9 (5,9-13,1) 0,55 ± 0,05 (0,47-0,69) <0,05 <0,05
Таблица 5.5. Особенности эхокартины эндометрия при малых формах очаговой патологии [15]
Ультразвуковые особенности Локальное нарушение десквамации Очаговая железистая гиперплазия Очаговый фиброз
Толщина эндометрия, мм 8,33 + 2,25 12,33 ± 1,53 7,75 ± 1,5
Деформация линии смыкания переднего и заднего листков эндометрия Есть Есть Нет
Максимальный диаметр очагов, мм 0,6 ±0,1 1,0 ±0,5 1,0 ±0,4
Объем очагов, см3 0,11 ±0,04 0,30 ± 0,44 0,31 ±0,25
Контуры очагов Нечеткие Четкие Нечеткие
Эхогенность очагов Повышена Повышена Повышена
Таблица 5.6. Тактика ведения пациенток с различными вариантами суб-и интраэндометриального кровотока [15]
Тип цветовой картины Вероятный морфотип Тактика
Локальная субэндометриальная гиперваскуляризация на фоне нормальной эхокартины эндометрия Риск ОГ Динамическое ультразвуковое исследование каждые 6 мес
Субочаговый вариант кровотока ОГ Ультразвуковое исследование через 2 мес. При персистенции ультразвуковой картины -оперативная гистероскопия
Интраочаговый монососудистый вариант кровотока ЭП Оперативная гистероскопия
Интраочаговый мультисосудистый вариант кровотока АП Оперативная гистероскопия с прицельным поиском злокачественной патологии
Примечание. ОГ - очаговая гиперплазия эндометрия; ЭП - эндометриальный полип; АП - аденоматозный полип.
434
V. Гиперпластические процессы эндометрия
ний, которые мы назвали малыми формами очаговой патологии эндометрия, отражены в табл. 5.5.
Все же следует отметить, что очевидный недостаток специфичности визуализации с лихвой исчерпывается замечательной чувствительностью современной высокоразрешающей эхографии и высокочувствительной допплерографии. Мы полагаем, что локальная субэндометриальная гиперваскуляризация на фоне нормальной эхокартины эндометрия указывает на функционирующие спиральные артерии, остающиеся в ткани глубоких отделов функционального слоя эндометрия, которые и являются залогом развития очаговой патологии эндометрия. Таким образом этот признак может использоваться для прогноза формирования очаговой патологии эндометрия, появление которой можно ожидать в течение года у 50-60% пациенток с локальной субэндометриальной гиперваскуляризацией. Рекомендуемая тактика ведения пациенток с различными вариантами суб- и интра-эндометриального кровотока представлена в табл. 5.6.
Прогноз рецидивов гиперпластических процессов эндометрия после лечения
Использование эхографии с целью не просто диагностики, но и профилактики гиперпластических процессов эндометрия является одним из ярких примеров наиболее мудрого использования нашего метода в гинекологии. Ранее мы уже рассказывали о концепции доклинической ультразвуковой диагностики патологии эндометрия [9].
Использование ультразвуковой диагностики с целью прогноза рецидивов гиперплазии эндометрия после лечения является логическим продолжением описанной выше концепции. Кстати, исследования, посвященные данной проблеме, на самом деле были проведены еще раньше (2000). Так, Е.В. Федорова обнаружила, что если через 2 мес после раздельного диагностического выскабливания и гормональной терапии RI в радиальных и базальных артериях эндометрия больше 0,75 и 0,68 соответственно, то терапию можно считать эффективной, а если показатели окажутся меньше 0,60 и 0,48, то со степенью достоверности Р < 0,05 проводимое лечение не окажет ожидаемого воздействия в плане профилактики рецидива гиперпластического процесса эндометрия. В первом случае медикаментозная терапия выбранным препаратом может быть продолжена, а во втором - необходимы замена лекарственного средства, увеличение его дозы или изменение вида лечения [16].
Литература
1. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. С. 275-339.
2. Хмельницкий О.К. Цитологическая и гистологическая диагностика заболеваний шейки и тела матки. СПб.: Сотис, 2000.
3. Kurjak A., Kupesic S. (Eds). Ап atlas of transvaginal color Doppler. Second edition. New York; London: The Parthenon publishing group, 2000. P. 161-171.
'135
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
4. Barakat R., Markman М., Randall М.Е. Principles and Practice of Gynecologic Oncology. 5th ed. Philadelphia: Wolters Kluwer Health / Lippincott Williams & Wilkins, 2009. P. 683-732.
5. Де Черни A.X., Натан Л. Акушерство и гинекология. Диагностика и лечение. Т. II. Гинекология: Учебное пособие: Пер. с англ. / Под общей ред. А.Н. Стрижакова. М.: МЕДпресс-информ, 2009.
6. Демидов В.Н., Гус А.И. Ультразвуковая диагностика гиперпластических и опухолевых процессов эндометрия // Клиническое руководство по ультразвуковой диагностике /Подред. В.В. Митькова, М.В.Медведева Т. 3. М.: Видар, 1997. С. 175-201.
7. Озерская И.А. Эхография в гинекологии. М : Медика, 2005.
8. Opolskiene G., Sladkevicius R, Jokubkiene L., Valentin L. Three-dimensional ultrasound imaging for discrimination between benign and malignant endometrium in women with postmenopausal bleeding and sonographic endometrial thickness of at least 4.5 mm // Ultrasound Obstet. Gynecol. 2010. V. 35(1). P. 94-102.
9. Мустафина Г.А., Буланов M.H., Макарова Е.Ф., Зыкин Б.И. Особенности суб- и интра-эндометриального кровотока при доброкачественной очаговой патологии эндометрия // Эхография. 2004. № 1. С. 8-12.
10. Новикова Е.Г., Чулкова О.В., Пронин С.М. Предрак и начальный рак эндометрия у женщин репродуктивного возраста. М.: МИА, 2005.
11. Проскурякова О.В. Эхографический и допплерографический мониторинг бессимптомного течения постменопаузы: Автореф. дис.... д-ра мед. наук. М., 2002.
12. Зыкин Б.И. Стандартизация допплерографических исследований в онкогинекологии: Дис.... д-ра мед. наук. М., 2001.
13. Чекалова М.А., Махова Е.Е., Шабанов М.А и др. Значение ультразвукового мониторинга состояния эндометрия у больных раком молочной железы // Опухоли женской репродуктивной системы. 2007. №1. С. 17-23.
14 Хэтч К., Хэкер Н. Дисплазии шейки матки, влагалища и вульвы // Гинекология по Эмилю Новаку / Под ред. Берека Дж., Адаши И., Хиллард П.М.: Практика, 2002. С. 280-303.
15. Мустафина Г.А. Значение допплерографии в оценке поэтапных изменений субэндометриального и интраэндометриального кровотока у больных с доброкачественной очаговой патологией эндометрия: Автореф. дис.... канд. мед. наук. М., 2006.
16. Федорова Е.В., Липман А.Д. Применение цветового допплеровского картирования и допплерометрии в гинекологии. М.: Видар-М, 2002.
VI
Рак эндометрия
Рак эндометрия. Патогенетические варианты. Классификация • Своевременная диагностика рака эндометрия. Факторы риска. Понятие минимального рака эндометрия • Ультразвуковой скрининг рака эндометрия • Постадийные критерии диагностики I патогенетического варианта рака эндометрия • Критерии диагностики II патогенетического варианта рака эндометрия • Литература
Рак эндометрия. Патогенетические варианты. Классификация
Рак эндометрия (РЭ) - самая распространенная злокачественная опухоль женских гениталий. Пациентки этой группы редко бывают моложе 45 лет (около 5%), примерно 70-80% из них - в состоянии постменопаузы [1,2]. Средний возраст больных карциномой эндометрия составляет 57-60 лет (в подавляющем большинстве случаев в пределах 50-70 лет). В старческом возрасте заболеваемость существенно снижается. Отмечаются расовые особенности заболеваемости РЭ - чаще это белые женщины [1].
Большой заслугой отечественной онкогинекологической школы в лице Я.В. Бохмана является создание концепции о двух патогенетических вариантах РЭ. Выделяют I, или гормонозависимый, и II, или автономный, варианты РЭ. Они существенно отличаются друг от друга особенностями возраста, гормонального статуса, конечно, патогенеза, и самое главное, прогноза (табл. 6.1). I вариант является, если угодно, привычным, не нарушающим ожидаемого порядка патологических изменений: фоновый процесс, предрак, CIS, инвазивный рак. II вариант очень опасен своей главной особенностью - возникновением de novo, т.е. внезапно, без предшествующих фоновых и предраковых изменений (иногда даже минуя стадию CIS). В этой главе мы постараемся уделить достаточное внимание ультразвуковым критериям диагностики обоих патогенетических вариантов РЭ.
Представляем две почти идентичные классификации РЭ - Министерства здравоохранения СССР и Международной федерации акушеров и гинекологов (FIGO). Их главное отличие - русские и английские буквы, используемые для обозначения подстадий РЭ (табл. 6.2).
Также выделяют 3 степени гистологической дифференцировки РЭ: G1 (высокодифференцированный), G2 (среднедифференцированый), G3 (низкодифференцированный), а также недифференцированный рак.
Главный клинический симптом заболевания - патологические маточные кровотечения, к сожалению, этот признак в большинстве случаев появляет-
137
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Таблица 6.1. Патогенетические варианты рака эндометрия по Я.В. Бохману [2]
I (гормонозависимый) II (автономный)
Частота 65-70% Чаще у молодых На фоне гиперэстрогении, нейроэндокринно-метаболических нарушений (ожирение) Возникает на фоне гиперплазии эндометрия Высокодифференцированный и менее злокачественный рак В яичниках часто гиперплазия тека-ткани, гормональноактивные опухоли Относительно более благоприятный прогноз Частота 30-40% Чаще у пожилых У больных эндокринные нарушения не выражены, чаще они худые Возникает на фоне атрофии эндометрия Преобладают низко- и умеренно дифференцированные формы рака Яичники без особенностей Высокая потенция к лимфогеному метастазированию. Менее благоприятный прогноз
Таблица 6.2. Клинические стадии рака эндометрия. Классификация Министерства здравоохранения СССР (1985) и FIGO (приводится по [2])
0 1 1а (а) 16(b) 1в(с) II На (а) 116(b) III Illa Преинвазивная карцинома (атипическая гиперплазия) Опухоль в пределах тела матки Опухоль в пределах эндометрия Инвазия миометрия менее половины его толщины Инвазия миометрия более половины его толщины Распространение опухоли на шейку матки Распространение на железы шейки матки Распространение на строму шейки матки Распространение за пределы матки, но не за пределы малого таза Опухоль прорастает серозную оболочку матки, распространяется на придатки, опухолевые клетки обнаруживаются в перитонеальной жидкости
lllb lllc IV Инвазия влагалища Метастазы в тазовые, а также параортальные лимфатические узлы Прорастание мочевого пузыря и/или прямой кишки или за пределы малого таза
Н38
VI. Рак эндометрия
ся на стадиях IC или даже II. Кстати, сбор анамнеза показывает, что у каждой третьей больной РЭ в пременопаузе отмечались регулярные и обильные менструации [1-3].
Известно, что когда женщина в постменопаузе отмечает кровянистые выделения, первая мысль, которая приходит в голову сначала ей, а затем нам, - это мысль о раке. На самом деле причин кровянистых выделений в постменопаузе немало, и в большинстве своем они не фатальны. Самая распространенная из них (примерно у 50%) - это атрофия эндометрия. Далее следуют: гиперплазия и полипы (часто на фоне гормонально-активных опухолей яичников), субмукозная миома, сенильный кольпит. Двумя зловещими причинами являются рак шейки матки и РЭ. Причем по статистике только у 4-5% женщин с кровянистыми выделениями в постменопаузе обнаруживается РЭ. Таким образом, однозначно инвазивная тактика у пациенток с названной жалобой уже давно считается не оправданной. Неинвазивная визуализация эндометрия у этой группы женщин, как оказалось, позволяет избежать необоснованного кюретажа более чем в 90% случаев [1]. Сразу становится понятной очень почетная и вместе с тем весьма ответственная роль врача ультразвуковой диагностики в такой ситуации.
Своевременная диагностика рака эндометрия.
Факторы риска. Понятие минимального рака эндометрия
Факторы риска
Один из существенных способов решения проблемы своевременной диагностики РЭ - формирование и диспансеризация группы риска. В свете этого особое значение приобретает знание факторов риска этого заболевания. Самые важные из них [1-3]:
• бесплодие;
• хроническая ановуляция;
• гиперполименорея в пременопаузе;
• поздняя менопауза (после 52 лет);
• ожирение;
• поликистозные яичники, эстрогенпродуцирующие опухоли яичников;
• заместительная гормональная терапия без прогестагенов;
• применение тамоксифена;
• сахарный диабет;
• онкологически отягощенный семейный анамнез;
• рак молочной железы или толстой кишки в анамнезе.
Понятие минимального рака эндометрия
Главная задача нашего метода применительно к РЭ - своевременная диагностика заболевания. В данном случае это в первую очередь означает выявление минимального РЭ, который объединяет в себе стадии CIS, IA,
Н39
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
а также самые начальные проявления IB (когда речь идет еще о микроинва-зивном злокачественном процессе). Аденокарицинома эндометрия в пределах слизистой оболочки характеризуется нарушением эндометриальной структуры. Железы имеют неправильную форму, тесно расположены, нередко с полной утратой предшествующего строения эндометрия. Строма между железами почти полностью отсутствует. При распространении опухолевых клеток за пределами предшествующих железистых структур уже можно говорить о микроинвазивном раке [3].
Минимальный РЭ в настоящее время составляет примерно 30% от всех случаев выявленного заболевания (это не так мало, но как хочется, чтобы этот показатель был как можно ближе к 100%!). В 65% наблюдений это микроинвазивный и в 35% - внутриэндометриальный рак. Диаметр минимального РЭ составляет 2 см и менее, глубина инвазии - 0,5 см и менее, за исключением наблюдений мультицентрического роста [4]. Больные минимальным РЭ относительно моложе. Минимальный РЭ локализуется в верхней трети полости матки, т.е. в наиболее сложных для диагностики участках (преимущественно это дно и трубные углы). Чаще всего это I патогенетический вариант, дифференцировка G1 и G2 и соответственно относительно низкая потенция к метастазированию в регионарные лимфатические узлы таза (приблизительно 1%).
Ультразвуковой скрининг рака эндометрия
Отношение к самой идее онкологического скрининга применительно к РЭ неоднозначно. Есть две точки зрения: «за» и «против». Аргументы противников скрининга: частота РЭ составляет примерно 1 случай на 200 женщин в возрасте старше 45 лет. Таким образом, скрининг представляется недостаточно обоснованным с экономической точки зрения [5]. Аргументы сторонников: многие формы начального рака возникают на фоне дисплазии и CIS. Однако немалая часть опухолей возникает de novo, минуя этапы дисплазии и CIS. Таким образом, проблему ранней диагностики РЭ может решить только массовый скрининг или селективный скрининг в группах риска. Мы также склоняемся ко второй точке зрения.
Ультразвуковой скрининг асимптомных женщин в постменопаузе
В постменопаузе эндометрий обычно не визуализируется. Оптимальная эхокартина М-эхо при этом - тонкая эхогенная полоска, измерить толщину которой не представляется возможным (рис. 6.1). При утолщении эндометрия совершенно обоснованно возникает онконастороженность. Данный признак длительное время может быть единственным критерием постменопаузального неблагополучия. Для того чтобы определить, при превышении какого порогового значения толщины эндометрия в постменопаузе следует предпринимать инвазивные действия, были проведены многочисленные, в том числе мультицентровые, исследования.
Н4О
VI. Рак эндометрия
Рис. 6.1. Продольное трансвагинальное сканирование, а - визуализация эндометрия в постменопаузе в норме в виде тонкой а эхогенной линии (стрелка). Измерить ее толщину не представляется возможным; б - измерение передне-заднего размера (между стрелками) утолщенного М-эхо в постменопаузе (5 мм).
Главный вывод большинства авторов - незначительное асимптомное утолщение эндометрия в постменопаузе, как правило, свидетельствует в пользу отсутствия РЭ. Верхняя граница толщины эндометрия, при которой еще не стоит «бить тревогу», у разных авторов в основном варьирует в пределах 5-8 мм (см. рис. 6.1) [6-8]. С точки зрения некоторых авторов [9], даже при толщине эндометрия 1 см (!) риск РЭ остается низким, а биопсия таким пациенткам не показана.
Отметим, что асимптомное утолщение эндометрия в постменопаузе сверх пороговых значений также не свидетельствует о существенном повышении риска РЭ. По данным большинства авторов [5-8], частота выявления РЭ при асимптомном утолщении эндометрия более 5-6 мм составляет 2-4%. При этом с увеличением порогового значения толщины эндометрия отмечается тенденция к увеличению частоты выявления РЭ (табл. 6.3). Толщина эндометрия более 1 см сопряжена уже с достаточно высоким риском РЭ [10].
На основании приведенных выше данных, а также собственного опыта можно сделать следующие выводы о риске РЭ при асимптомном утолщении эндометрия в постменопаузе:
Таблица 6.3. Частота обнаружения РЭ при асимптомном утолщении эндометрия в постменопаузе
Автор Год Пороговое значение, мм п Частота РЭ, %
М. Gambacciani et al. 2004 >5 112 3,7
A. Lev-Sagie et al. 2005 >5 82 0
A.M. Buccoliero et al. 2007 >5 293 2,0
T. Schmidt et al. 2009 >6 304 3,9
ЛАЛ
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
• асимптомное утолщение эндометрия в постменопаузе <5 мм: минимальный риск РЭ, сопоставим с общепопуляционным;
• асимптомное утолщение эндометрия в постменопаузе >5 мм, но <10 мм: частота РЭ составляет 2-5%;
• асимптомное утолщение эндометрия в постменопаузе >10 мм: частота РЭ составляет 10-20%.
Ультразвуковое исследование женщин с кровянистыми выделениями в постменопаузе
При кровянистых выделениях в постменопаузе онкологическая обеспокоенность совершенно обоснованно повышается, несмотря на то что так проявляет себя далеко не только РЭ. Вместе с тем у каждой женщины с постменопаузальными кровянистыми выделениями должна быть проведена адекватная оценка состояния эндометрия. Опыт многочисленных исследований показывает, что это не обязательно должна быть инвазивная диагностика. Напротив, используя методику неинвазивной визуализации эндометрия, оптимально избежать необоснованного раздельного диагностического выскабливания.
Пожалуй, наиболее авторитетный мультицентровый анализ очень большого количества постменопаузальных кровотечений (>1000) был проведен в первой половине 90-х годов прошлого века группой скандинавских исследователей [11]. Авторы получили поразительные результаты: при толщине эндометрия 4 мм и менее не было обнаружено ни одного (!) случая РЭ. Во всех случаях РЭ толщина М-эхо колебалась в пределах 5-55 мм, составив в среднем 18 мм. Авторы первыми пришли к выводу о нецелесообразности диагностического кюретажа у женщин с постменопаузальными кровянистыми выделениями при толщине М-эхо 4 мм и менее. Результаты большого количества исследований, проведенных в последующие годы, в целом не смогли опровергнуть эту позицию. Конечно, рядом авторов приводились данные о наличии малигнизации и при тонком эндометрии (<4 мм) [12]. Но в конечном счете, как заключил один из корифеев ультразвуковой гинекологии S. Goldstein [13], у женщин с кровотечением в постменопаузе при толщине эндометрия 4 мм и менее риск РЭ составляет примерно 1 :917, поэтому, считает он, биопсию эндометрия в этих случаях можно не назначать.
Частота РЭ при постменопаузальном кровотечении и толщине эндометрия 4 мм и более (ряд авторов [14] предлагают порог 4,5 мм и более) составляет 20-30% [1 ]. Это, по мнению большинства авторов, является основанием для биопсии эндометрия.
Существенный комментарий: по ряду причин (конституция пациентки, маленький угол между осью сканирования и длинной осью матки и пр.) не удается достаточно точно измерить толщину эндометрия. Т.К. Saha и соавт. [15] отмечают, что неправильная оценка толщины эндометрия может иметь место в 8-15% случаев. Понятно, что в подобной ситуации толщина эндометрия не может быть адекватным критерием его состояния.
142
VI. Рак эндометрия
Таким образом, можно сделать следующие выводы о риске РЭ при утолщении эндометрия у женщин с кровянистыми выделениями в постменопаузе:
• утолщение эндометрия <4,5 мм: минимальный риск РЭ;
• утолщение эндометрия >4,5 мм: частота РЭ составляет 20-30%.
Оптимальный алгоритм скрининговой диагностики рака эндометрия
Каков же должен быть оптимальный алгоритм скрининговой диагностики РЭ?
Y . Minagawa и соавт. [16] предлагают следующую тактику:
• Цитологическое исследование у всех женщин с атипичными кровотечениями, а также у асимптомных женщин при толщине эндометрия в постменопаузе >5 мм, а в пременопаузе >20 мм.
• При отрицательном цитологическом результате гинекологическое обследование и эхография проводятся каждые 3, 6, 12 мес.
Авторы отмечают высокую чувствительность (100%) и специфичность (90%) предлагаемой схемы. Нам такой подход к скрининговой диагностике РЭ также представляется оптимальным.
Постадийные критерии диагностики
I патогенетического варианта рака эндометрия
При РЭ ультразвуковое исследование часто проводится на этапе достаточно выраженной распространенности опухоли. В таких случаях в нашу задачу уже не входит первичная диагностика РЭ, поскольку диагноз, как правило, уже известен. Однако здесь мы можем оказать очень существенную помощь онкогинекологам в определении стадии онкологического процесса. Алгоритм ультразвукового исследования при этом должен быть выстроен следующим образом:
• толщина и объем эндометрия (М-эхо);
• состояние контуров эндометрия;
• эхогенность и эхоструктура эндометрия;
• васкуляризация эндометрия: визуализация (20/30-цветовая/энерге-тическая допплерография);
• васкуляризация эндометрия: количественные показатели;
• толщина, эхоструктура и васкуляризация миометрия.
Ниже мы постараемся дать ультразвуковую характеристику различных стадий РЭ, следуя приведенной выше схеме.
Рак эндометрия IA стадии
Ультразвуковая диагностика минимального РЭ довольно сложна. Следует признать, что все основные ультразвуковые критерии на этой подстадии онкологического процесса не обладают достаточной специфичностью (рис. 6.2).
• Толщина М-эхо: в среднем 12 мм (7-18 мм).
Н43
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.2. РЭ IA стадии. Продольное трансваг иналь-ное сканирование, а - толщина М-эхо 9 мм, эхогенность повышена. Обращает на себя внимание нечеткий контур М-эхо (стрелка). В режиме энергетической допплерографии васкуляризация не определяется. В целом этот случай достоверно не отличается от железистой гиперплазии; б -толщина М-эхо 10 см, эхогенность повышена. Обращает на себя внимание достаточно выраженная васкуляризация эндометрия (стрелки).
• Контуры: достаточно четкие.
• Эхогенность высокая, эхоструктура обычно выглядит однородной.
• Цветовая/энергетическая допплерография: васкуляризация несколько усилена.
• Допплерометрия: Vmax 15 см/с, RI 0,48 (при железистой гиперплазии эндометрия: 12 см/с и 0,51. Р >0,05).
• Толщина, эхоструктура и васкуляризация миометрия соответствуют норме.
Таким образом, провести уверенную дифференциальную ультразвуковую диагностику между РЭ IA стадии и доброкачественными гиперпластическими процессами едва ли представляется возможным. Тем не менее нами получены интересные результаты при использовании ЗЭ-энергетиче-ской допплерографии с расчетами объемных индексов васкуляризации (рис. 6.3). При сравнении показателей индексов васкуляризации интраэн-дометриального кровотока между гиперпластическими процессами эндометрия и РЭ IA стадии были обнаружены достоверные отличия (табл. 6.4, см. нас. 154).
Н44
VI. Рак эндометрия
Рис. 6.3. Случай минимального РЭ (IA, G2). а - режим ЗО-энергетической допплерографии. Стрелками отмечена усиленная интраэндометриальная васкуляризация; б - режим ЗО-энергетической допплерографии: усиленная интраэндометриальная васкуляризация в режиме «стекловидное тело»; в -индексы васкуляризации: VI 5,7, FI 30,9, VF11,7.
145
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Очевидно, что на этом этапе злокачественного процесса показатель толщины не является определяющим. Как справедливо отмечал Б.И. Зыкин [17], в данном случае не толщина, а аномальные цветовые локусы являются ранним признаком патологии. Эта точка зрения была высказана еще до реального практического использования объемных индексов васкуляризации. Ее правоту подтверждают новейшие исследования. Однако лабильность методики (см. главу I этого тома), а также малое количество обследованных больных требуют проведения дальнейшей работы в этом направлении.
Рак эндометрия IB стадии
Ультразвуковое изображение эндометрия при РЭ IB стадии «почти похоже» на таковое при выраженной железистой гиперплазии эндометрия, однако сразу обращают на себя внимание нечеткие контуры М-эхо, а также относительное уменьшение толщины миометрия в области наибольшей инвазии. Отметим, что обычно инвазия не распространяется одинаково пропорционально на окружающий миометрий. Как правило, хорошо заметна асимметрия стенок матки в зависимости от того, какая стенка больше, а какая меньше поражена инвазией (рис. 6.4, 6.5).
• Толщина М-эхо: 15 мм (8-30 мм).
• Контуры неровные, нечеткие, как бы размытые, появляется признак ги-поэхогенного ободка, также достаточно размытого (см. рис. 6.4, 6.5).
• Эхогенность эндометрия смешанная и может зависеть от степени дифференцировки РЭ. Исследования М.А. Чекаловой и В.М. Зуева [18] показали, что для высоко- и умеренно-дифференцированного РЭ более характерна высокая эхогенность, в то время как при низкодифференцированном РЭ чаще встречается средняя и пониженная эхогенность.
• Цветовая/энергетическая допплерография: васкуляризация эндометрия существенно усилена, что наглядно подтверждается использованием ЗЭ-энергетической допплерографии (см. рис. 6.5).
• Допплерометрия: Vmax 17 см/с, RI 0,42. Эти показатели достоверно отличаются от таковых при РЭ IA стадии и доброкачественных процессах (Р <0,05).
• Толщина стенок матки уже может выглядеть неравномерно уменьшенной, при этом она редко составляет менее 1 см; васкуляризация миометрия соответствует норме.
Рак эндометрия IC стадии
На данном этапе злокачественного процесса проблемы интерпретации ультразвукового изображение возникают очень редко. В данной ситуации следует обращать особое внимание на выраженность инвазии миометрия, тщательно отражая в протоколе толщину всех его стенок. Известно, что риск рецидивов заболевания и летальных исходов значительно выше, если минимальное расстояние от опухоли до серозной оболочки матки менее 5 мм [19]. О распространении инвазии можно судить не только по серошкальному изображению (рис. 6.6), но также и по особенностям васкуляризации. J1.A. Ашрафян и соавт. [20] отмечают, что при глубокой злокачест-
Н46
VI. Рак эндометрия
Рис. 6.4. РЭ IB стадии, а-в - отмечается утолщенное до 8-9 мм М-эхо повышенной эхогенности (1) с нечеткими, как бы размытыми контурами (стрелки). В режиме энергетической допплерографии усиленный интраэндометриальный кровоток (черные стрелки); г -количественная оценка неоваскуляризации: Vmax 6 см/с, RI 0,39.
Н47
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
tn/s
Рис. 6.5. РЭ IB стадии, а - отмечается утолщенное до 12 мм М-эхо повышенной эхогенности (1) с нечеткими размытыми контурами (стрелка). В режиме направленной энергетической допплерографии усиленный интраэндометриальный кровоток (пунктирная стрелка); б - количественная оценка интраэндометриальной неоваскуляризации: Vmax 16 см/с, RI 0,7.
448
VI. Рак эндометрия
Рис. 6.5 (окончание), в - Vmax 18 см/с, RI 0,44; г - режим ЗО-энергетической допплерографии. В желтом контуре выраженная интраэндометриальная неоваскуляризация (режим «стекловидное тело»). Индексы васкуляризации V119,1, FI 32,7, VFI 6,2.
449
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.6. Особенности эхокартины РЭ на стадии IC. Особое внимание во всех случаях следует обращать не только на эхоструктуру М-эхо (1), но и на миометрий, выглядящий не затронутым инвазией (2). В протоколе следует отметить толщину «здорового» миометрия в области передней и задней стенок, а также дна матки, а - М-эхо почти средней, чуть повышенной эхогенности, относительно однородной эхоструктуры. Передняя стенка матки не видна за счет артефакта тени (стрелка) от петли тонкой кишки в пузырно-маточном пространстве; б - М-эхо повышенной эхогенности, в полости матки немного жидкости (стрелка); в -больной 68 лет, 1 год назад М-эхо было 16 мм, больная не явилась на контрольное исследование и пришла только после начавшихся кровянистых выделений. М-эхо преимущественно средней неоднородной эхогенности, по всем стенкам матки инвазия почти достигает серозной оболочки.
450
VI. Рак эндометрия
Рис. 6.6 (окончание), г -М-эхо повышенной эхогенности с множественными эхонегативными включениями (стрелки); д - М-эхо повышенной эхогенности с немногочисленными эхонегативными включениями (стрелка); е - М-эхо низкой неоднородной эхогенности (низкодифференцированный процесс с некротическими изменениями), миометрий почти не виден за счет инвазии почти до серозной оболочки.
454
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.7. РЭ IC стадии, а -энергетическая допплерография: интенсивная неоваскуляризация М-эхо (1), которая выглядят распространяющейся и на миометрий (2); б - 30-энерге-тическая допплерография. В желтом контуре реконструкция неоваскуляризации в режиме «стекловидное тело». Индексы васкуляризации: VI 26,3, FI 36,4, VFI 9,6.
венной инфильтрации миометрия (что соответствует стадии IC) определяется следующая картина васкуляризации: на фоне более или менее выраженного усиления кровотока эндометрия - значительное увеличение кровотока в субэндометриальной зоне (рис. 6.7, 6.8).
• Толщина М-эхо: обычно составляет уже более половины толщины матки - 20 мм (10-37 мм).
• Контуры: неровные, нечеткие, прерывистые, с уже описанным гипоэхо-генным ободком (см. рис. 6.6).
• Эхогенность средняя и смешанная. Повышенная звукопроводимость. Эхоструктура неоднородная, часто с эхонегативными включениями (см. рис. 6.6); примерно в половине случаев в полости матки определяется жидкость (ее количество небольшое, особенно в сравнении со II патогенетическим вариантом РЭ - см. ниже).
452
VI. Рак эндометрия
Рис. 6.8. РЭ у женщины 58 лет. а: 1 - М-эхо; 2 - миометрий, выглядящий незатронутым инвазией; б - в режиме направленной энергетической допплерографии определяется васкуляризация не только в области видимой инвазии (1), но и за ее пределами (2).
• Цветовая/энергетическая допплерография: множественные, обычно хаотически расположенные сосуды, что особенно наглядно визуализируется при ЗО-энергетической допплерографии (см. рис. 6.7).
• Допплерометрия: Vmax23 см/с, RI 0,37. Эти показатели достоверно отличаются от таковых при РЭ IA-B стадии и доброкачественных процессах (Р<0,05).
• Обращают на себя внимание неравномерное истончение или даже исчезновение нормального изображения миометрия (см. рис. 6.6, 6.7), выраженная васкуляризация субэндометриальных областей (см. рис. 6.8).
Основные биометрические и допплерографические критерии доброкачественной и злокачественной патологии эндометрия также представлены нами в табл. 6.4 и на рис. 6.9. По представленным в табл. 6.4 данным хорошо прослеживается устойчивая тенденция к увеличению толщины и объема
153
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Таблица 6.4. Основные биометрические и допплерографические показатели эндометрия при доброкачественной и злокачественной патологии
Показатель Гиперплазия эндометрия Атипическая гиперплазия эндометрия Стадия РЭ
IA IB IC
Толщина, мм 10,3+2,6 7-20 14,5+2,9* 11-27 12,7+2,5 9-23 16,3+3,0 9-30 20,4±2,5* 12-39
Объем, см3 6,4±1,2 1,5-9,3 8,5+1,3 3,2-14,7 9,3+1,1 3,2-15,2 15,1+1,9* 6,4-19,2 21,3+2,2* 11,2-35,1
^гпах» С М/С 12,5±0,09 6-17 15,3±0,06* 10-18 16,1 ±0,03 12-17 17,5+0,07 12-21 23,3 ±0,12* 12-28
RI 0,53+0,14 0,50-0,59 0,50±0,18* 0,47-0,55 0,48+0,15 0,45-0,52 0,42+0,16* 0,39-0,52 0,37±0,11* 0,35-0,46
VI 3,6±0,8 0,14-6,8 4,3*±0,7 0,23-10,5 5,7*±1,0 0,31-12,2 19,1+0,8* 11,4-25,2 29,7 ±0,8* 12,4-36,5
FI 28,4+4,3 22,1-36,7 30,2±3,8* 18,2-37,6 30,9+4,5 16,0-39,4 33,4±3,8* 19,5-40,2 42,6±5,1* 24,2-56,3
VFI 1,3±0,3 0,03-4,1 1,7+0,3 0,05-6,4 1,8±0,5 0,05-6,9 5,8+0,5* 3,4-7,2 12,1 ±0,8* 8,1-14,2
Примечание. * - различия достоверны: Р < 0,05.
50 г
40 -
30 -
20 -
10 -
° ГП АГП IA
Fl
IB
IC
Рис. 6.9. Объемные индексы васкуляризации интраэндометриального кровотока при доброкачественной и злокачественной патологии эндометрия. ГП - гиперплазия эндометрия; АГП - атипическая гиперплазия эндометрия.
454
VI. Рак эндометрия
эндометрия, повышению Vmax, снижению RI, а также увеличению объемных индексов васкуляризации на различных стадиях злокачественного поражения эндометрия. Вместе с тем мы не смогли выявить достоверные отличия почти всех этих показателей между доброкачественной патологией и минимальным РЭ, за исключением VI (Р <0,05).
Рак эндометрия II стадии
Особенности эхоструктуры и васкуляризации тела матки соответствуют таковым при IC стадии. Необходимо провести тщательное обследование нижнего сегмента тела матки, а также шейки матки, чтобы визуализировать инвазию эндоцервикса, что соответствует стадии НА (рис. 6.10, 6.11), либо инвазию стромы шейки матки, что соответствует стадии НВ (рис. 6.12).
Рак эндометрия IIIA стадии
Дифференциальная диагностика между РЭ IC стадии и начальным этапом IIIA стадии, когда прорастание серозной оболочки еще минимально, может представлять значительные трудности. В подобных ситуациях оказать помощь может метод энергетической допплерографии, демонстрирующий неоваскуляризацию за пределами проекции серозной оболочки (рис. 6.13, 6.14).
Критерии диагностики II патогенетического варианта рака эндометрия
Серозометра как прогностический фактор II патогенетического варианта рака эндометрия: «за и против»
Важнейшая особенность II патогенетического варианта РЭ - возникновение опухоли на фоне атрофии эндометрия в постменопаузе. Результаты ультразвуковых исследований показали, что почти у каждой третьей пациентки с РЭ II типа толщина М-эхо составила менее 4 мм либо эндометрий определялся в виде тонкой эхогенной линии [1].
Таким образом, для этой группы больных толщина эндометрия не может быть надежным прогностическим признаком наличия или отсутствия риска развития онкологического процесса (конечно, мы имеем в виду проблему ранней диагностики РЭ, ведь при визуализации развернутой злокачественной инвазии вопрос оценки толщины М-эхо теряет всякую актуальность).
Что может в данной ситуации помочь в формировании группы риска? Ответ есть - визуализация жидкости в полости матки (серозометры). Однако мы обязаны сразу внести ясность - само по себе наличие жидкости в полости матки в постменопаузе еще не является предиктором малигнизации. Все дело в ее количестве.
А сейчас небольшой экскурс в историю вопроса. На заре онкологической эхографии считалось, что жидкость в полости матки - «зловещий»
455
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.10. РЭ ПА стадии, а - инвазия эндоцервикса (стрелка). В режиме энергетической допплерографии интенсивная неоваскуляризация; б - Vmax 60 см/с, RI 0,42; в - другой случай. Инвазия эндоцервикса (стрелка).
-156
VI. Рак эндометрия
Рис. 6.11. РЭ НА стадии, а - определяется инвазия РЭ в цервикальный канал (стрелка). 1 - опухоль; 2 -жидкость в полости матки; б, в - в режиме направленной энергетической допплерографии определяется интенсивная внутриопухо-левая неоваскуляризация (стрелки).
457
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.12. РЭ НВ стадии. Продольное трансвагинальное сканирование. Инвазия стромы шейки матки (стрелка). 1 - опухоль; проекция внутреннего зева (пунктир).
458
VI. Рак эндометрия
Рис. 6.12 (окончание).
Рис. 6.13. РЭ IIIA стадии с инвазией передней стенки до серозной оболочки, а -визуализация в В-режиме: опухоль (1) распространяется до серозной оболочки передней стенки матки (стрелка); б - метод энергетической допплерографии демонстрирует неоваскуляризацию за пределами проекции серозной оболочки (стрелка).
159
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.14. РЭ IIIA стадии с инвазией до серозной оболочки матки. Возраст больной 59 лет. а - продольное трансабдоминальное сканирование. Опухоль (1) хорошо определяется, однако оценить степень инвазии миометрия затруднительно; б - продольное трансвагинальное сканирование. Опухоль (1) достигает проекции серозной оболочки передней стенки матки (стрелка); в - направленная энергетическая допплерография. Неоваскуляризация (стрелка).
460
VI. Рак эндометрия
Рис. 6.14 (окончание).
г - направленная энергетическая допплерография в режиме Zoom демонстрирует неоваскуляризацию за пределами проекции серозной оболочки; д - триплексный режим. Трудно дифференцируемый тип кривой кровотока (стрелка). V = 22 смз; е _ 3D-
энергетическая допплерография. Неоваскуляризация в режиме стекловидного тела (в желтом контуре). Индексы васкуляризации: VI 29,7, FI 40,7, VFI 12,1.
464
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.15. Критерии доклинической диагностики II патогенетического варианта РЭ. Формирование группы риска при серозометре толщиной более 5 мм. а - измерение толщины эндометрия при жидкости в полости матки (стрелки); б - серозо-метра толщиной 6 мм (пунктир).
и практически облигатный признак РЭ. Как справедливо писала М.А. Чекалова: «Жидкость в полости матки может быть единственным и косвенным признаком рака эндометрия» [21]. Следует признать, что эта точка зрения доминировала в «эпоху» трансабдоминального ультразвука. Однако в 1991 г. S. Goldstein [22], используя метод трансвагинальной эхографии, показал, что умеренная серозометра - признак преимущественно лишь атрофической окклюзии цервикального канала. Автор рекомендовал главным образом обращать внимание на толщину эндометрия по периферии серо-зометры. При этом сначала измеряется толщина каждого листка по отдельности, а затем оба показателя суммируются (рис. 6.15). Несмотря на всю логичность такого подхода, мы должны помнить, что при II патогенетическом варианте РЭ до этапа макроинвазии измерять еще нечего!
J. Wang и соавт. [23], обследовав большую группу больных со II патогенетическим вариантом РЭ, обнаружили, что практически у половины больных с невизуализируемым эндометрием (линейный тип М-эхо) определялась серозометра. Наши исследования дали сходные результаты.
462
VI. Рак эндометрия
При этом, как уже отмечалось выше, само по себе наличие жидкости в полости матки в постменопаузе еще не предиктор малигнизации. Небольшая серозометра (толщиной 1-3 мм или объемом 1-3 см3), как оказалось, еще не является сигналом тревоги. Результаты наблюдения показывают, что эта жидкость у большей части обследуемых самопроизвольно исчезает в течение 6-18 мес наблюдения. Однако при выявлении относительно большого количества жидкости в полости матки (толщиной 6-15 мм или объемом 5-10 см3) у половины женщин в течение года развивалась клиническая симптоматика РЭ. R. Bedner и I.Rzepka Gorska [24] также полагают, что небольшая серозометра в постменопаузе (до 5 см3) вряд ли может ассоциироваться с карциномой эндометрия, описывая случай последней с объемом внутриматочной жидкости 12 см3.
Алгоритм ранней диагностики II патогенетического варианта рака эндометрия
Ретроспективный анализ позволил нам предложить следующий прогностический критерий высокого риска развития II патогенетического варианта РЭ: это серозометра объемом более 4 см3 или толщиной более 5 мм (см. рис. 6.15). При обнаружении данного критерия рекомендуется диагностический алгоритм: цитологическое исследование аспирата из полости матки у асимптомных женщин. При отрицательном цитологическом результате проводится контрольная эхография каждые 3,6,12 мес. При наличии серозометры меньшего объема и (или) толщины можно рекомендовать ограничиться только ультразвуковыми исследованиями каждые 6 мес. Толщина эндометрия в этих случаях является независимым признаком (см. раздел «Ультразвуковой скрининг рака эндометрия»).
Особенности ультразвуковой картины II патогенетического варианта рака эндометрия на этапе развернутой инвазии
На этапе макроинвазии (стадия IB-С и далее) наблюдается несомненное сходство как серошкальной, так допплеровской эхокартины I и II патогенетических вариантов РЭ. При этом для II патогенетического варианта РЭ характерны свои особенности. К ним в первую очередь следует отнести большое количество жидкости в полости матки. Это может быть как серозометра, так и пиометра. При этом стенка матки может существенно истончаться, и последняя превращается в тонкостенный мешок с жидкостью. Я хорошо помню нашу диагностическую ошибку, совершенную больше 20 лет назад, когда при трансабдоминальном исследовании очень полной пациентки мы приняли раковую пиометру за кисту яичника. На рис. 6.17 показан не именно тот, но очень сходный клинический случай.
Другая особенность эхокартины II патогенетического варианта РЭ - прекрасно определяемая на фоне большого количества жидкости атрофия эндометрия (рис. 6.16-6.20). Размеры визуализируемой опухоли могут существенно варьировать.
Л 63
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.16. II патогенетический вариант РЭ. Пациентка 62 лет. 10 мес назад обнаружена серозометра 8 мм / 5,2 см3. Результат цитологического исследования аспирата отрицательный. Рекомендована явка через 3 мес. По личным причинам явилась позже. 1 - опухоль; 2 - серозометра; 3 - серо-зоцервикс. а - продольное трансвагинальное сканирование. Хорошо видно, что слизистая, не вовлеченная в инвазию, атрофирована (стрелка); б - поперечное трансвагинальное сканирование. Черной стрелкой указана граница видимой инвазии опухоли в миометрий; в - ЗО-реконструкция фронтального среза тела матки. Стрелкой указана граница видимой инвазии опухоли в миометрий; г - энергетическая допплерография. Неоваскуляризация (стрелка).
464
VI. Рак эндометрия
Рис. 6.17. II патогенетический вариант РЭ. Различные клинически случаи, а -продольное трансвагинальное сканирование. 1 - опухоль в виде мелких папиллярных разрастаний в нижнем отделе полости матки; 2 - выраженная пиометра; 3 - атрофированный эндометрий; б - продольное трансвагинальное сканирование. 1 - опухоль в виде разрастания в нижнем отделе полости матки и цервикальном канале; 2 - выраженная пиометра; 3 - атрофированный эндометрий; в - поперечное трансвагинальное сканирование. Мелкие папиллярные разрастания (стрелки) на фоне серозометры, ее переднезадний размер 12 мм.
'165
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.18. II патогенетический вариант РЭ. Случайная находка у асимптомной больной 63 лет. а - серозо-метра 80 см3 (1), опухоль в дне (2). Несмотря на эхо-картину, подозрительную на стадию IIIA, при цветовой допплерографии (б) неоваскуляризация (стрелка) не достигала проекции серозной оболочки. При лапаротомии: серозная оболочка оказалась не затронутой (стадия IC).
466
VI. Рак эндометрия
Рис. 6.19. II патогенетический вариант РЭ. а - поперечное трансвагинальное сканирование. 1 - опухоль; 2 - пиометра, б, в - выраженная неоваскуляризация в большом солидном компоненте (стрелки).
467
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 6.20. II патогенетический вариант РЭ. Возраст больной 69 лет. а: 1 - опухоль; 2 - пио-метра. Виден уровень между фракциями разной плотности (стрелка); б: 1 - опухоль; 2 - пи-ометра.
468
VI. Рак эндометрия
Рис. 6.20 (окончание).
в - направленная энергетическая допплерография - неоваскуляризация (стрелка). 1 - опухоль; г -триплексный режим: Vmax 38 см/с, RI 0,32; д - триплексный режим: Wmax 10 см/с (хотя, возможно, это артериальный кровоток очень низкой резистентности).
169
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Литература
1. Merz Е. Ultrasound in obstetrics and gynecology. V. 2. Gynecology. New York; Stuttgart: Thieme, 2007. P. 136-148.
2. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989. С. 275-340.
3. Новикова Е.Г., Чулкова О.В., Пронин С.М. Предрак и начальный рак эндометрия у женщин репродуктивного возраста. М.: МИД, 2005.
4. Максимов С.Я. Минимальный рак эндометрия // Практ. онкол. 2004. Т. 5. № 1. С.60-68.
5. McMeekin D.S., Kavanagh J., Wolfson A., Tornos C. Corpus: Epithelial tumors // Principles and Practice of Gynecologic Oncology. 5th ed. / Richard R., Barakat R., Markman M., Randall M.E. Philadelphia et al.: Wolters Kluwer Health / Lippincott Williams & Wilkins, 2009. P. 688-733.
6. Suchocki S., Luczynski K., Szymczyk A. et al. Evaluation of endometrial thickness by trans-vaginal ultrasonography as a screening method in early diagnosis of endometrial cancer // Ginek. Pol. 1998. V. 69(5). P. 279-282.
7. Gambacciani M., Monteleone R, Ciaponi M. et al. Clinical usefulness of endometrial screening by ultrasound in asymptomatic postmenopausal women 11 Maturitas. 2004. V. 48(4). P. 421-424.
8. Lev-Sagie A., Hamani Y, ImbarT etal. The significance of intrauterine lesions detected by ultrasound in asymptomatic postmenopausal patients // Br. J.Obstet. Gynaecol. 2005. V. 112(3). P. 379-381.
9. Smith-Bindman R., Weiss E., Feldstein V. How thick is too thick? When endometrial thickness should prompt biopsy in postmenopausal women without vaginal bleeding // Ultrasound Obstet. Gynecol. 2004. V. 24(5). P. 558-565.
10. Dubinsky TJ., Stroehlein K., Abu Ghazzeh Y. et al. Prediction of benign and malignant endometrial disease: hysterosonographic-pathologic correlation // Radiology. 1999. V. 210(2) P. 393-397.
11. Karlsson B., Granberg S., Wikland M. et al. Transvaginal ultrasonography of the endometrium in women with postmenopausal bleeding—a Nordic multicenter study //Am. J. Obstet. Gynecol. 1995. V. 172(5). P. 1488-1494.
12. Tsikouras R, Liberis V., Galazios G. et al. TV sonographic assessment in postmenopausal women with bleeding // Eur. J. Gynaecol. Oncol. 2008. V. 29(1). P. 67-71.
13. Goldstein S.R. The role of transvaginal ultrasound or endometrial biopsy in the evaluation of the menopausal endometrium //Am. J. Obstet. Gynecol. 2009. V. 201(1). P. 5-11.
14. Opolskiene G., Sladkevicius P., Valentin L. Ultrasound assessment of endometrial morphology and vascularity to predict endometrial malignancy in women with postmenopausal bleeding and sonographic endometrial thickness >or= 4.5 mm // Ultrasound Obstet. Gynecol. 2007. V. 30(3). P. 332-340.
15. Saha T.K., Amer S.A., Biss J. et al. The validity of transvaginal ultrasound measurement of endometrial thickness: a comparison of ultrasound measurement with direct anatomical measurement// Br. J.Obstet. Gynaecol. 2004. V. 111(12). P. 1419-1424.
16. Minagawa Y, Sato S., Ito M. et al. Transvaginal ultrasonography and endometrial cytology as a diagnostic schema for endometrial cancer // Gynecol. Obstet. Invest. 2005. V. 59(3). P. 149-154.
17. Зыкин Б.И. Стандартизация допплерографических исследований в онкогинекологии: Дис.... д-ра мед. наук. М., 2001.
18. Чекалова М.А., Зуев В.М. Ультразвуковая диагностика в онкогинекологии. М.: Русский врач, 2004.
Л 70
VI. Рак эндометрия
19. Медведев В.М., Чекалова М.А., Терегулова Л.Е. Рак эндометрия //Допплерография в гинекологии / Под ред. Б.И. Зыкина, М.В. Медведева. 1-е изд. М.: Реальное время, 2000. С.145-149.
2О. Ашрафян Л.А., Антонова И.Б., Ивашина С.В. и др. Ранняя диагностика рака эндометрия и яичников // Практ. онкол. 2009. Т. 10. № 2. С. 71-75.
21. Чекалова М.А. Ультразвуковая диагностика в онкогинекологии // Клиническое руководство по ультразвуковой диагностике. Т. Ill / Под ред. В.В. Митькова, М.В. Медведева. М.: Видар, 1997. С. 175-201.
22. Goldstein S.R. Postmenopausl endometrial fluid collections revisited: look at the doughnut rather than the hole // Obstet. Gynecol. 1994. V. 83. P. 738-740.
23. Wang J., Wieslander C., Hansen G. et al. Thin endometrial echo complex on ultrasound does not reliably exclude type 2 endometrial cancers // Gynecol. Oncol. 2006. V. 101(1). P. 120-125.
24. Bedner FL, Rzepka Gorska I. Diagnostic value of uterine cavity fluid collection in the detection of pre-neoplastic lesions and endometrial carcinoma in the asymptomatic postmenopausal women // Ginek. Pol. 1998. V. 69(5). P. 237-240.
Л7Л
™ Опухолевидные образования яичников
Введение • Классификация опухолевидных образований яичников •Лютеома беременности • Гиперплазия стромы яичника (гипертекоз) • Функциональные кисты яичников • Параовари-альные кисты • Литература
Введение
Заболевания яичников, сопровождающиеся их увеличением, делятся на три большие группы: опухолевидные образования, доброкачественные опухоли, злокачественные опухоли. Каждый из этих трех вариантов предполагает совершенно особую тактику ведения, а также кардинально различающийся прогноз для здоровья и жизни женщины.
Опухолевидные образования яичников (также употребляется термин «опухолевидные процессы») представляют собой чрезвычайно пеструю с морфоклинической точки зрения группу. Тем не менее эта группа объединена одним существеннейшим признаком: для гистологии опухолевидных образований не типичны присущие истинным новообразованиям изменения генетического аппарата клеток, приводящие к нарушению регуляции их деления. Иначе говоря, для опухолевидных процессов характерно отсутствие истинного бластоматозного роста [1].
Классификация опухолевидных образований яичников
Общепринятой является классификация опухолевидных процессов яичников С.Ф. Серова и соавт. Она представляет собой раздел IX гистологической классификации опухолей яичников, разработанной в 1973 г. большой международной группой под руководством советских ученых.
Классификация опухолевидных процессов яичников
(по С.Ф. Серову и соавт., 1977 (приводится по [2]):
А. Лютеома беременности.
Б. Гиперплазия стромы яичника и гипертекоз.
В. Массивный отек яичника.
Г. Единичная фолликулярная киста и киста желтого тела.
Д. Множественные фолликулярные кисты (поликистозные яичники).
Е. Множественные лютеинизированные фолликулярные кисты и/или желтые тела.
Ж. Эндометриоз.
Л 73
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
3. Поверхностные эпителиальные кисты.
И. Простые кисты.
К. Воспалительные процессы.
Л. Параовариальные кисты.
Несмотря на то что эта классификация разработана уже без малого 40 лет назад, и сегодня некоторые из включенных в нее морфологических типов могут быть более (параовариальные кисты) или менее (гипертекоз) обоснованно отнесены к истинным опухолям яичников, она по-прежнему считается актуальной, будучи признанной во всем мире.
Вполне допустимо, демонстрируя убедительные возможности диагностического ультразвука, проиллюстрировать эхограммами каждый из пунктов классификации.
Однако из перечисленных в классификации состояний поликистозные яичники и эндометриоз яичников уже были описаны в соответствующих разделах 1-го тома; об отеке и воспалительных процессах будет сказано в главах 3-го тома, посвященных неотложным состояниям и воспалительным процессам малого таза.
Множественные лютеинизированные фолликулярные кисты и/или желтые тела также характеризовались в 1 -м томе (раздел, посвященный синдрому гиперстимуляции яичников). Добавим здесь, что эти образования возникают также при трофобластической болезни и многоплодной беременности. В нашей практике был случай двусторонних множественных текалютеиновых кист яичников, развившихся в III триместре одноплодной беременности. Оба яичника представляли собой многокамерные образования диаметром до 20 см (!). Стенки камер были тонкие, содержимое эхонегативное. Поскольку образования сохранялись и после родов, акушеры-гинекологи стали склоняться к решению об оперативном вмешательстве. Помогла консультация профессора А.М. Стыгара (Научный центр акушерства, гинекологии и перинатологии), рекомендовавшего продолжить динамическое наблюдение в течение нескольких месяцев. Через полгода мы наблюдали эхокартину нормальных яичников.
В этой главе мы не будем подробно описывать перечисленные выше образования. Также здесь не будут рассматриваться поверхностные эпителиальные кисты (как и простые кисты) по причине их очень малых, как правило, микроскопических размеров. Поверхностные эпителиальные кисты располагаются в строме коркового слоя, возникая из поверхностного эпителия яичника. Они могут являться предшественниками цистаденом яичников [3]. Мы обязательно еще раз упомянем эти мелкие, но важные для опухолевого этиопатогенеза образования в главе, посвященной истинным опухолям яичников.
Таким образом, мы подробно остановимся на лютеоме беременности, гипертекозе, фолликулярной кисте и кисте желтого тела, а также параова-риальных кистах.
Л 74
VII. Опухолевидные образования яичников
Лютеома беременности
Лютеома беременности - это опухолевидное образование, представляющее собой опухолеподобные узелки из лютеиновых клеток, часто множественные и двусторонние [4]. Размеры лютеомы могут достигать 20 см, однако чаще всего находятся в пределах 5-10 см. Вне беременности лютеома исчезает. В большинстве случаев лютеома протекает бессимптомно, иногда оказывая вирилизирующий эффект на беременную. Вообще это очень редкое заболевание, в мировой литературе описано не более 2-3 сотен лютеом беременности.
Хорошо известно, что опухолевидные образования яичников во время беременности - не редкость. Эхокартина кисты яичника обнаруживается как минимум у каждой десятой беременной, направленной на ультразвуковое исследование в начале I триместра. Почти все эти кисты перестают определяться в 14-18 нед беременности, что позволяет ретроспективно поставить диагноз гравидарной кисты желтого тела. Однако иногда (к счастью, очень редко) кистозные образования не исчезают. Это заставляет серьезно задуматься о природе образования и дальнейшей тактике. В случаях персистенции небольшого асимптомного образования (не более 4-5 см), имеющего, к примеру, эхоструктуру, характерную для простой овариальной или параовариальной кисты либо зрелой тератомы, акушеры-гинекологи могут справедливо прибегнуть к консервативной тактике. При характерной эхокартине папиллярной цистаденомы или карциномы выбор в пользу хирургической тактики во время беременности тоже очевиден.
Лютеома беременности не требует оперативного лечения. Однако это образование не исчезает к моменту окончательного формирования плаценты и может сохраняться не только в течение всей беременности, но и весь период лактации, только потом пропадая, как и подобает истинному опухолевидному процессу яичников. Описаны случаи персистенции лютеомы беременности в течение 1,5-2 лет (можно только восхититься отваге и выдержке врачей, наблюдавших этих пациенток). Дополнительная сложность при интерпретации лютеомы беременности состоит в том, что она часто выглядит как образование с тревожно неоднородной эхострукту-рой солидно-кистозного типа. Использование даже высокоразрешающей эхографии и магнитно-резонансной томографии далеко не всегда может помочь в уверенной дифференциации с недоброкачественной опухолью. Наш опыт ультразвуковой визуализации лютеомы беременности согласуется с данными других авторов. В одном случае это было одностороннее образование размерами 5,7 х 4,2 х 4,6 см преимущественно средней эхогенности с эхонегативным включением неправильной формы (рис. 7.1). При допплерографии в образовании определялся достаточно интенсивный кровоток: Vmax 14 см/с, RI 0,48 (см. рис. 7.1). В другом случае это были двусторонние образования яичников с максимальным диаметром 7 см,
Л 75
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.1. Лютеома беременности. Трансвагинальное сканирование, а - В-режим. Одностороннее образование размерами 5,7 х 4,2 х 4,6 см (стрелки) преимущественно средней эхогенности (1) с эхонегативным включением неправильной формы (2); б - направленная энергетическая допплерография. Кровоток в солидной части образования (стрелки).
солидного типа эхоструктуры, с чередующимися зонами средней и пониженной эхогенности. С обеих сторон определялся отчетливый внутренний кровоток с довольно высокой скоростью (Vmax 18 см/с) и средней резистентностью (RI 0,45). В данном случае в дифференциальный ряд была включена аденокарцинома и опухоль Крукенберга. Беременная отказалась от операции, а образования после родов исчезли.
В заключение отметим, что диагностика лютеомы беременности - изрядное испытание для нервов врача. Имеющая место в подобных ситуациях гипердиагностика в пользу злокачественного процесса, к сожалению, как ожидаема, так и объяснима.
Гиперплазия стромы яичника (гипертекоз)
Гиперплазия стромы яичников (синонимы: гипертекоз, текоматоз) встречается преимущественно у женщин старше 50 лет.
Данный опухолевидный процесс представляет собой пролиферацию клеток стромы яичника. В гиперплазированной строме могут в некотором избытке образовываться половые гормоны, причем как эстрогены, так и андрогены [4]. Можно условно выделить три клинических варианта гипер-текоза: а) эстрогенный (может сопровождаться гиперплазией эндометрия и кровотечениями в постменопаузе); б) андрогенный (сопровождается умеренной вирилизацией); б) асимтомный. Единого мнения о врачебной тактике при гипертекозе нет. Она часто определяется прогрессирующим увеличением размеров яичников, а также симптоматикой. Есть точка зрения о целесообразности овариэктомии для профилактики рака. При асимптомном гипертекозе гинекологи иногда рекомендуют ограничиваться только тщательным наблюдением с динамическими ультразвуковыми исследованиями не реже 2 раз в год.
Л 76
VII. Опухолевидные образования яичников
Ультразвуковые признаки гипертекоза
Пациентки этой группы обычно ходят от врача к врачу с расхожим диагнозом «увеличение яичников в постменопаузе». И действительно, практически единственное эхографическое проявление гипертекоза - это диффузное двустороннее увеличение яичников. Фолликулярный аппарат при этом обычно выражен очень незначительно или вообще не виден, ведь основная часть этих пациенток привлекает внимание врачей уже в постменопаузе своими слишком большими яичниками. По нашим данным, объем яичников в постменопаузе при гипертекозе варьирует от 2,6 до 6,2 см3 (причем разницы в объеме между правым и левым яичниками почти нет). Эхоструктура яичников выглядит достаточно однородной, хотя иногда может складываться впечатление о зонах различной эхогенности в строме (рис. 7.2). Допплерографически васкуляризация может вообще не определяться. В ряде случаев мы наблюдали симметричный скудный интраова-риальный кровоток, при этом допплерометрические показатели либо не определялись, либо демонстрировалась очень низкая скорость (Vmax < 7-5 см/с) и высокая резистентность (RI > 0,6) кровотока.
При постановке ультразвукового диагноза гипертекоза необходимо очень скрупулезно проводить биометрию яичников с обязательным расчетом объема. Небрежность измерения приведет к ложному заключению о прогрессирующем увеличении яичников при контрольном исследовании, которое сделает ваш более (или, напротив, менее) аккуратный коллега. Еще хуже, когда за счет нечеткой визуализации одного из яичников (обычно левого - рис. 7.3) делается ложный вывод об асимметричном увеличении яичников, что, как известно, может быть косвенным признаком опухоли.
При двустороннем симметричном увеличении яичников целесообразно дообследование надпочечников для исключения их гиперплазии или опухоли [5].
Функциональные кисты яичников
С.Ф. Серов и соавт. объединили фолликулярную кисту и кисту желтого тела в одну позицию своей классификации. При определенной морфологической разнице этих состояний такое объединение абсолютно логично. Дело в том, что оба образования относятся к так называемым функциональным кистам яичников (еще их называют ретенционными). Важнейшее отличие функциональных образований от других опухолевидных процессов - транзиторный (временный) характер существования, всегда заканчивающийся спонтанным регрессом. Стойко закрепившееся обозначение «функциональные кисты» достаточно верно отражает патогенетическую сущность этих образований, по сути представляющих собой результат сбоя в развитии двух важнейших функциональных структур яичников - доминантного фолликула и желтого тела. Образуются они чаще всего в репродуктивном периоде, но это может произойти в любом возрасте [6]. Считается, что
177
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.2. Гипертекоз. Постменопауза. а - правый и б - левый яичник указан стрелкой; в -матка, стрелкой указан эндометрий. Его толщина на верхней границе нормы (4 мм). Обращает на себя внимание неравномерная эхогенность стромы яичников.
478
VII. Опухолевидные образования яичников
Рис. 7.3. Трансвагиналь-ное сканирование. Гипертекоз. Яичники указаны стрелками, а - правый яичник в продольном сканировании; б - левый яичник. Он кажется меньше правого, но это за счет косопоперечного, а не строго продольного сканирования
функциональные опухолевидные образования яичников могут обнаруживаться при эхографии почти у каждой десятой клинически здоровой женщины, а также у каждой второй с жалобами на боли внизу живота [5].
Фолликулярные кисты
Фолликулярные кисты образуются в результате персистенции неразор-вавшегося доминантного фолликула, в полости которого скапливается фолликулярная жидкость. Располагаются чаще с одной стороны, хорошо подвижны. Минимальный диаметр фолликулярной кисты составляет 3 см (при меньшем размере еще стоит говорить о доминантном фолликуле). Максимальный диаметр, как правило, не превышает 10 см. Стенка кисты содержит гранулезные и тека-клетки, которые через 2-3 мес слущиваются и подвергаются процессу гиалинизации. Фолликулярные кисты обычно исчезают в течение 1 -3 мес за счет резорбции их содержимого. В периме-нопаузальном периоде процесс резорбции может удлиняться до 4-5 мес. Спавшиеся стенки кисты облитерируются, превращаясь в гиалиновые атре-тические тела [7]. Поскольку фолликулярная киста подвергается резорб-
Л79
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.4. Трансвагинальное сканирование. 1 - фолликулярная киста; 2 - строма яичника; 3 - фолликулы, дающие эффект кист в кисте (объяснение в тексте); 4 - тонкая стенка кисты практически не визуализируется (стрелка); 5 - дистальное усиление эхосигнала.
ции и атрезии за 1-4 мес, соответственно запаздывает и спад уровня ее гормонов, вызывающий менструацию. Это - причина нередкого «выпадения» менструации при фолликулярных кистах [7].
Ультразвуковые признаки фолликулярной кисты
Эхографически это однокамерное образование правильной округлой или овальной формы, расположенное сбоку, выше или кзади от матки. Ввиду хорошей подвижности киста может сместиться достаточно высоко. В этих случаях ее можно уверенно обнаружить только с помощью трансабдоминального сканирования. Как уже отмечалось, фолликулярные кисты чаще односторонние, но могут быть варианты кист в обоих яичниках, а также двух кист в одном яичнике (иногда при этом может возникнуть иллюзия двухкамерного образования). При трех и более фолликулярных кистах в одном яичниках вероятен синдром гиперстимуляции яичников.
Стенка фолликулярной кисты очень тонкая, поэтому измерить ее толщину при ультразвуковом исследовании обычно невозможно. Строго говоря, мы визуализируем не стенку кисты, а только тонкую и ровную эхогенную границу между эхопозитивной средой стромы яичника (или прочих окружающих тканей) и эхонегативным содержимым кисты (рис. 7.4). Внутренняя поверхность фолликулярных кист всегда ровная, строение эхонегативное. Дистальнее кисты всегда определяется эффект акустического усиления (см. рис. 7.4). Размеры кист колеблются отЗ до 10 см, но редко бывают более 6-7 см в диаметре [6-11]. Вдоль наружной части стенки кисты часто удается визуализировать нормальную ткань яичника, как бы растянутого на кисте (см. рис. 7.4). При этом могут быть видны строма яичника и фолликулярный аппарат. При смежном расположении фолликулярной кисты и другого антрального фолликула последний как бы вдается в полость кисты, образуя эффект кисты в кисте (см. рис. 7.4). Наблюдать такую картину можно часто, важно не перепутать ее с картиной папиллярной кистомы яичника.
Л 80
VII. Опухолевидные образования яичников
Рис. 7.5. Трансвагиналь-ное сканирование. Цветовая допплерография. Кровоизлияние в полость фолликулярной кисты, определяемое в виде внутренней дисперсной взвеси (стрелка). Признак акустической текучести в виде «вспыхивающих» мелких цветовых пятен.
Для допплерографической картины фолликулярной кисты типичен скудный кровоток в проекции ее стенки, а количественные показатели (Vmax5-18 см/с, RI 0,48-0,56) сходны с интраовариальными в среднюю и позднюю фолликулярную фазу менструального цикла [8]. Гемодинамические показатели могут меняться в зависимости от времени существования кисты, а также ее размеров.
Изредка встречается кровоизлияние в полость фолликулярной кисты, определяемое в виде внутренней дисперсной взвеси (рис. 7.5). В подобных случаях может потребоваться дифференциальная диагностика с эндометриоидной кистой. Помимо динамического наблюдения, можно также использовать цветовую допплерографию содержимого кисты. В фолликулярной кисте с геморрагической взвесью будет наблюдаться признак акустической текучести (см. рис. 7.5), которого никогда не будет в эндометриоидной кисте.
Условия постановки ультразвукового диагноза фолликулярной кисты. Тактика
• Ультразвуковое заключение о наличии фолликулярной кисты при первом исследовании может быть только предположительным. Ведь сходную эхокартину могут иметь эпителиальные опухоли яичника.
• Окончательный ультразвуковой диагноз фолликулярной кисты может быть поставлен только после ее исчезновения в процессе динамического наблюдения на протяжении 2 или 3 менструальных циклов (рис. 7.6).
• Время резорбции фолликулярной кисты может удлиняться при спаечном процессе.
• В перименопаузе наблюдение может быть продлено до 4 менструальных циклов ввиду своеобразной «замедленности» эндокринно-обменных процессов, характерных для этого возрастного периода. При наблюдении кист в постменопаузе известны случаи их исчезновения в течение 5-6 мес и даже года (рис. 7.7).
• При персистенции кистозного образования яичника дольше оговоренных сроков следует высказать предположение о наличии истинной опухо-
'181
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.6. Трансвагинальное поперечное сканирование. Резорбция фолликулярной кисты через 2 менструальных цикла. 1 -киста представляет собой эхонегативное образование неправильной продолговатой формы с максимальным диаметром 2,2 см (стрелка); 2 - матка.
Рис. 7.7. Трансвагинальное сканирование. Двухкамерное образование яичника на 2-м году постменопаузы. Исчезло через 10 мес. а - В-ре-жим. Стрелкой указана перегородка между камерами. Эхогенные образования, дающие эффект утолщения перегородки и пристеночных папиллярных разрастаний, очевидно, были элементами стромы яичника (черная стрелка); б - цветовая допплерография. Скудный кровоток в проекции стенки кисты (Vmax4,5 см/с, RI 0,62).
Л 82
VII. Опухолевидные образования яичников
Рис. 7.8. Трансвагиналь-ное сканирование. Разрыв функциональной кисты. В малом тазу определяются фрагменты стенки кисты (1), геморрагическое содержимое (2), свободная жидкость (3).
ли. Даже если последняя не подтвердится, оперативное лечение будет обоснованным ввиду риска разрыва или перекрута.
• При персистенции кисты на фоне выраженного спаечного процесса оперативное удаление кисты может представить значительные технические трудности. В этом случае возможны пункция и опорожнение кисты под ультразвуковым контролем.
• Другими исходами ретенционных кист яичников могут быть разрыв (рис. 7.8) и перекрут. После овариэктомии с техническими трудностями на фоне спаечного процесса может возникнуть синдром овариальных остатков, в ультразвуковой манифестации которого значительная роль принадлежит именно функциональным кистам. Подробнее эти клинические ситуации будут рассмотрены в 3-м томе.
Кисты желтого тела
Киста желтого тела (или лютеиновая киста) морфологически сходна с желтым телом, возникает при двухфазном менструальном цикле после овуляции. Киста образуется вследствие нарушений кровообращения и лимфооттока в желтом теле, часто на фоне хронического воспалительного и соответственно спаечного процесса. У одной из наших пациенток киста желтого тела возникала несколько раз в течение года в одном и том же яичнике, практически «замурованном в спайках» (цитата из протокола лапароскопии), каждый раз являясь причиной тяжелейшего болевого синдрома. Женщина почувствовала себя удовлетворительно, в итоге перестав регулярно оказываться в больнице скорой помощи, только после назначения гормональных контрацептивов, исключивших овуляцию. Минимальный диаметр кисты желтого тела составляет 3 см (при меньшем размере еще стоит говорить о кистозном желтом теле), в среднем 5-6 см. Максималь
П83
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
ный диаметр редко превышает 7-8 см. Для строения этих кист типичны толстые стенки и серозно-геморрагическое содержимое (сгустки крови и нити фибрина, «плавающие» в более жидкой среде). Обратное развитие продолжается не менее 2 мес, заканчиваясь формированием белого гиалинового тела. Поскольку менструальный цикл остается двухфазным, его регулярность обычно не нарушается [7].
Ультразвуковые признаки кисты желтого тела.
Варианты эхокартины
Эхографически это однокамерное образование достаточно правильной округлой или овальной формы, расположенное сбоку, выше или кзади от матки. Отметим, что в отличие от фолликулярных кист, обычно имеющих геометрически правильную форму, лютеиновые кисты могут иметь несколько менее ровный контур. Вероятно, это связано с неоднородностью содержимого и относительно меньшим тургором (рис. 7.9). Кисты желтого тела чаще односторонние, но могут быть варианты кист в обоих яичниках (рис. 7.10). Можно встретить и две кисты в одном яичнике (рис. 7.11) либо кисту желтого тела рядом с фолликулярной или эндометриоидной кистой, при этом может определяться довольно сложная для восприятия и интерпретации картина (рис. 7.12).
Стенка кисты желтого тела довольно толстая, причем это утолщение неравномерно (см. рис. 7.11). Внутреннее строение всегда очень полиморфно.
В.Н. ДемидовиА.И. Гус [9,10] одними из первых описали основные особенности ультразвуковой картины кисты желтого тела, выделив три эхографических варианта ее строения: а) мелко- и среднесетчатое строение средней эхогенности наблюдалось почти в 60% кист желтого тела, причем в 2/з случаев эти структуры занимали всю или большую часть кисты, а в 1/3 случаев - менее трети кисты, всегда располагаясь пристеночно (рис. 7.13); б) у 10% женщин визуализировалось однородное и анэхогенное содержи-
Рис. 7.9. Трансвагинальное сканирование. Двусторонние кисты желтого тела (1 и 2), расположенные позади матки.
484
VII. Опухолевидные образования яичников
мое в сочетании с множественными или единичными нежными, полными или неполными неправильной формы перегородками (см. рис. 7.9); в) у 30% пациенток в полости кисты определялись включения высокой эхогенности (авторы интерпретировали их как сгустки крови), имевшие неправильную форму либо форму булавы или веретена. Чаще эти образования имели диаметр 1-1,5 см и пристеночную локализацию (рис. 7.14).
Т. Okai и соавт. [11] в 21% случаев обнаружили диффузное эхогенное внутреннее строение кисты желтого тела, представляющее собой отражение от сгустков крови, в 38% - смешанное, с четким отграничением солидной части, в 13% - гиперэхогенное, губчатоподобное или сетчатое, в 29% -неопределенное (смешанное) строение (рис. 7.15, 7.16).
Рис. 7.10. Трансвагинальное сканирование. Две кисты желтого тела (1 и 2) в одном яичнике. Хорошо видно неравномерное утолщение стенок кист (3).
Рис. 7.11. Трансвагинальное сканирование. Киста желтого тела (1) рядом с эндометриоидной кистой (2). При цветовой допплерографии определяется достаточно интенсивный кровоток в стенке кисты (3).
Л 85
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.12. Трансвагинальное сканирование. Киста желтого тела, а - мелкосетчатое строение средней эхогенности (1), занимает почти всю полость кисты; 2 - строма яичника с фолликулярным аппаратом (стрелка); 3 - эффект акустического усиления; б -среднесетчатое строение средней эхогенности (1), занимает всю полость кисты. Стенка кисты утолщена, с эффектом двойного контура (стрелка).
Рис. 7.13. Трансвагинальное сканирование. Киста желтого тела (стрелки). Анэхо-генное содержимое в сочетании с множественными нежными, полными или неполными неправильной формы перегородками. Обращает на себя внимание неправильная форма кисты.
Л 86
VII. Опухолевидные образования яичников
Рис. 7.14. Трансвагиналь-ное сканирование. Киста желтого тела. В полости кисты на фоне эхонегативного содержимого (1) включения неправильной формы и высокой эхогенности (2). а - компактная форма кровяного тромба (2); б - форма кровяного тромба в виде песочных часов (2).
Рис. 7.15. Трансвагинальное сканирование. Киста желтого тела повышенной эхогенности (1) с эхонегативными включениями (2). Этот тип строения можно определить как смешанный или неопределенный. 3 -матка.
Л87
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.16. Трансвагинальное сканирование. Киста желтого тела с включениями сетчатого типа (1), а также с включениями высокой эхогенности (2). 3 - эхонегативное содержимое.
Рис. 7.17. Трансвагинальное сканирование. Кисты желтого тела (стрелки) смешанного строения. 1 - фолликулярный аппарат.
188
VII. Опухолевидные образования яичников
Добавим, что нетрудно встретить кисты желтого тела, эхоструктура которых в разнообразных сочетаниях варьирует и объединяет все перечисленные варианты строения (рис. 7.17).
Дистальнее кисты желтого тела также хорошо определяется эффект акустического усиления (см. рис. 7.13, а). Размеры кист колеблются от 3 до 8 см, но редко бывают более 5-6 см в диаметре. Как и в случае с фолликулярными кистами, вдоль наружной части стенки кисты часто удается визуализировать нормальную ткань яичника, как бы растянутого на кисте (см. рис. 7.13, а, 7.17). В отличие от фолликулярных кист при смежном расположении кисты желтого тела и антрального фолликула эффекта кисты в кисте не возникает, очевидно, за счет толстой и плотной стенки кисты.
При проведении допплерографии мы наблюдаем все характерные особенности васкуляризации желтого тела, описанные в 1-м томе. Это визуализация интенсивного цветового кольца по периферии кисты желтого тела за счет выраженной физиологической неоваскуляризации (рис. 7.18). В отличие от фолликулярных кист для количественных показателей кровотока (рис. 7.19) в стенке кист желтого тела типична высокая скорость (Vmax 11-42 см/с) и относительно низкая резистентность (RI 0,32-0,46).
Диагностические трудности.
Дифференциальная диагностика
Таким образом, кисты желтого тела в отличие от фолликулярных могут иметь чрезвычайно полиморфную эхоструктуру, что хорошо видно на представленных выше эхограммах (см. рис. 7.9-7.19). В результате нередко возникает иллюзия наличия многочисленных, различных по толщине перегородок, солидных включений, напоминающих типичные особенности внутренней эхоструктуры папиллярных цистаденом и даже цистаденокар-цином, тубоовариальных абсцессов, внематочной беременности. Визуальный полиморфизм кист желтого тела также может привести к ложноположительному диагнозу эндометриоидной кисты или дегенеративно измененного миоматозного узла [12].
Следует отметить, что четкое представление о патогенезе и морфологии кисты желтого тела позволяет в большинстве случаев достаточно уверенно интерпретировать его, на первый взгляд, тревожно разнообразное содержимое, представляющее собой не более чем серозно-геморрагический субстрат с разной степенью внутреннего соотношения тромбов и нитей фибрина.
Наш опыт позволяет предложить следующий прием, который может помочь дифференцировать кисту желтого тела и папиллярную цистаденому. При легких (осторожных!) толчкообразных движениях трансвагинальным датчиком кровяные тромбы и нити фибрина в кисте желтого тела достаточно легко смещаются, как бы «желеобразно подрагивая» или совершая маятникообразные движения (рис. 7.20), в то время как папиллярные разрастания и перегородки в цистаденомах обычно остаются неподвижными.
Цветовая допплерография играет очень значительную, иногда решающую роль в дифференциальной диагностике кист желтого тела и истинных
Л89
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.18. Трансвагинальное сканирование. Цветовая/энергетическая допплерография. Кисты желтого тела. Интенсивная васкуляризация в проекции стенки кисты (1), при этом содержимое кисты независимо от типа строения остается аваскулярным (2). Эффект периферической гиперваскуляризации дают не только новообразоанные сосуды желтого тела, но и расположенные рядом сосуды малого таза (3).
490
VII. Опухолевидные образования яичников
Рис. 7.19. Трансвагиналь-ное сканирование. Цветовая допплерография. Триплексный режим, а - Vrnax 23 см/с; б - RI 0,42.
Рис. 7.20. Трансвагинальное сканирование. Смещение пристеночного тромба в кисте желтого тела при толчкообразном движении датчика, а - исходное положение. Расстояние между верхушкой тромба и стенкой 6 мм (между стрелками).
19Л
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.20 (окончание), б -после толчка расстояние на долю секунды уменьшилось до 3 мм (стрелка).
Рис. 7.21. Трансабдоминальное сканирование. Киста желтого тела у девочки 14 лет. а - поперечное сканирование в В-режиме; б - продольное сканирование в В-режиме; в - цветовая допплерография: выраженная васкуляризация в проекции стенки (2), отсутствие признаков васкуляризации внутреннего содержимого (1).
'192
VII. Опухолевидные образования яичников
Рис. 7.22. Трансвагинапь-ное сканирование. Грави-дарная киста желтого тела. 1 - эхонегативное содержимое кисты, при этом обращает на себя внимание толстая стенка кисты (2). При допплерографии - эффект цветового кольца (3).
опухолей. При этом допплерограмма кисты желтого тела будет иметь две важнейшие особенности: во-первых, выраженную васкуляризацию в проекции стенки, а во-вторых, никаких признаков васкуляризации внутреннего содержимого - организованные сгустки крови и нити фибрина лишены сосудов (см. рис. 7.18, 7.19, 7.21).
Врачи-диагносты с небольшим опытом или работающие в одиночку, а также имеющие оборудование невысокого класса, не оснащенное допплеровским блоком, нередко затрудняются при визуализации кист желтого тела, предполагая наличие истинной опухоли. Чаще всего они разумно направляют пациенток для уточняющей диагностики в другие медицинские учреждения, где исследование проводится более опытным врачом, использующим соответствующую аппаратуру. Иногда уточняющая диагностика даже не требуется, поскольку между двумя исследованиями успевает пройти менструация и киста исчезает. Такую тактику можно только поприветствовать. Главное при этом для врача «первого уровня диагностики» -аккуратное соблюдение деонтологии при написании ультразвукового заключения во избежание психологической травмы женщины, весь период между двумя исследованиями засыпающей и просыпающейся с мыслью, что у нее рак. Вообще опыт показывает, что кисты желтого тела могут и появляться, и исчезать очень быстро. Мы наблюдали кисты, появляющиеся в течение 2 дней и исчезающие в течение недели (но за эту неделю обязательно проходила менструация).
Важно отметить, что в ряде случаев кисты желтого тела могут представляться в виде тонкостенных однокамерных образований с эхонегативной внутренней структурой [8]. Именно так может выглядеть эхоструктура гра-видарной кисты желтого тела, причем эта эхонегативность может сохраняться даже при трансвагинальной визуализации (рис. 7.22). Такая однородность строения гравидарной лютеиновой кисты, вероятно, связана с усиленным процессом обмена.
493
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.23. Трансабдоминальное поперечное сканирование. Параовариальная киста (1) на фоне поликистозных (2) яичников у девочки 16 лет; 3 - перешеек матки.
Рис. 7.24. Трансвагинальное сканирование. Маленькая параовариальная киста диаметром 2,6 см. 1 - яичник; 2 - строма; 3 - фолликулярный аппарат; 4 - матка.
Рис. 7.25. Трансвагинальное сканирование. Большая параовариальная киста диаметром 10 см. 1 - яичник; 2 - строма; 3 - фолликулярный аппарат. Стрелкой указан реверберационный артефакт.
494
VII. Опухолевидные образования яичников
Параовариальные кисты
Параовариальные кисты представляют собой опухолевидные образование перитубарной области, возникающие из зачатков персистирующих эмбриональных структур надъяичникового придатка (мезонефральный проток, опоофорон, параофорон, целомический эпителий). Вообще это групповое обозначение всех кистозных образований, встречающихся за пределами яичников, в мезосальпинксе [3]. Типичная параовариальная киста располагается между трубой и яичником, она обычно односторонняя, тонкостенная, выстлана однорядным кубическим или цилиндрическим эпителием (изредка определяются очаги пролиферации и даже малигниза-ции), содержимое кисты прозрачное и однородное [3]. В стенке располагаются тонкие множественные сосуды из брыжейки маточной трубы.
Столь разнообразная морфология объясняет наличие и так называемых параовариальных цистаденом. Так, С. Korbin и соавт. [13] описали 14 случаев параовариальных цистаденом, 3 из которых выглядели простыми кистами, а в 11 наблюдались солидные включения.
Все сказанное выше объясняет, почему некоторые относят параовариальные кисты к истинным опухолям, другие - к врожденным аномалиям, одновременно достаточно справедливо считая, что эти образования вообще не имеют отношения к яичникам.
Яичник обычно расположен у задненижнего полюса параовариальной кисты. Размеры образований варьируют от 1-2 см до очень больших, занимающих всю брюшную полость. Параовариальная киста пожизненно персистирует и медленно растет. Риск малигнизации параовариальной кисты крайне незначителен, но полностью не исключен.
Ультразвуковые признаки параовариальной кисты
Эхографически параовариальная киста практически неотличима от ретенционных кист яичников. Однако четким дифференциально-диагностическим признаком является возможность визуализации интактного яичника, расположенного в непосредственной близости от кисты (рис. 7.23-7.25). При больших размерах кисты, технических сложностях, а также небрежно проведенном исследовании яичник может не определяться, вследствие чего дается ошибочное заключение о наличии овариального кистозного образования. Драматических последствий эта ошибка не имеет, но все же лучше постараться поставить правильный диагноз с первого раза.
Так называемые параовариальные папиллярные цистаденомы отличает визуализация внутренних пристеночных включений небольших размеров, имеющих четкие контуры и среднюю или повышенную эхогенность (рис. 7.26).
По нашим данным, при цветовой допплерографии кровоток в стенках параовариальной кисты и параовариальной цистаденомы определялся в виде единичных цветовых пятен (см. рис. 7.26). Допплерометрия демонстрировала низкую скорость (Vmax 8,3 ± 3,2) и высокую резистентность
495
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 7.26. Трансвагинальное сканирование, а - пара-овариальная цистаденома в постменопаузе (стрелки). 1 - кистозный компонент; 2 - пристеночное включение средней эхогенности; 3 - яичник средней однородной эхогенности; б -в режиме цветовой допплерографии пристеночное включение выглядит аваску-лярным, кровоток определяется только за пределами кисты в примыкающих сосудах малого таза (черные стрелки).
(RI 0,63 ± 0,2) кровотока. Во внутренних включениях так называемых пара-овариальных папиллярных цистаденом визуализировать цветовые пятна при допплерографии не удавалось (см. рис. 7.26).
Дифференциальная диагностика при параовариальных кистах требуется с овариальными образованиями (если не виден отдельный яичник), а также с гидросальпинксом, гидатидами, в меньшей степени с кистой гартнерова хода (если яичник виден). Затруднений при этом обычно не возникает, в первую очередь ввиду характерных для гидросальпинкса продолговатой формы, а также признака неполных внутренних перегородок. Гидатиды обычно имеют очень маленькие размеры (в пределах 1-1,5 см), редко примыкают интимно к яичнику. Киста гартнерова хода обычно располагается также на некотором отдалении от яичника, в непосредственной близости от влагалища и шейки матки.
196
VII. Опухолевидные образования яичников
Ультразвуковой диагноз параовариальной кисты можно достаточно уверенно поставить уже при первом исследовании. При малейших сомнениях целесообразно уточняющее исследование через 1-4 мес.
Литература
1. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989
2. Селезнева И.Д., Железнов Б.И. Доброкачественные опухоли яичников . М.: Медицина, 1982. С.65-71.
3. Колосов А.Е. Опухоли яичников и прогноз для больных. Киров, 1996. С. 148-150.
4. Де Черни А.Х., Натан Л. Акушерство и гинекология. Диагностика и лечение. T. II. Гинекология: Учебное пособие: Пер.с англ. / Под общей ред. А.Н. Стрижакова. М.: МЕД-пресс-информ, 2009.
5. Озерская И.А. Эхография в гинекологии. М.: Медика, 2005.
6. Berek J.S., Adashi E.Y., Hillard Р.А. Novak’s gynecology. Philadelphia: Williams&Willkins, 1996. P. 212.
7. Вихляева E.M (ред.). Руководство по эндокринной гинекологии. М., 1998. С. 65-89.
8. Зыкин Б.И., Проскурякова О.В., Буланов М.Н. Ультразвуковое исследование яичников // Клиническое руководство по ультразвуковой диагностике. Т. Ill / Под ред. В.В Митькова, М.В. Медведева. М.: Видар, 1997. С.132-175.
9. Демидов В.Н., Гус А.И., Струков А.В. Применение влагалищной эхографии для диагностики кист придатков матки //Ультразвук, диагн. вакуш., гинекол., педиатр. 1992. №1. С. 74-78.
10. Гус А.И. Современные принципы ранней дифференцированной диагностики и мониторинга больных с опухолевидными образованиями и доброкачественными опухолями яичников, гиперпластическими процессами мио- и эндометрия Автореф. дис. ... д-ра мед. наук. М., 1996.
11 .Okai Т, Kobayashi К., Ryo Е. et al. Transvaginal sonographic appearance of hemorrhagic functional ovarian cysts and their spontaneous regression // Int. J. Gynecol. Obstet. 1994. V. 44. N.1. P. 47-52.
12. Зыкин Б.И., Буланов М.Н. Опухолевидные образования яичников//Допплерография в гинекологии / Под ред. Б.И. Зыкина, М.В. Медведева. 1-е изд. М.: Реальное время, 2000. С.99-106.
13.Korbin C.D., Brown D.L., Welch W.R. Paraovarian cystadenomas and cystadenofibromas: sonographic characteristics in 14 cases// Radiology. 1998. V. 208. N2 P. 459-462.
197
ЛТТТТ Доброкачественные V JLJLJL опухоли яичников
Введение • Классификация и распространенность доброкачественных опухолей яичников • Эпителиальные опухоли • Опухоли стромы полового тяжа • Герминогенные опухоли • Литература
Введение
Большинство опухолей яичников является доброкачественными, составляя, по данным разных авторов [1], 70-90% всех овариальных новообразований . При этом хорошо известно, что большинство злокачественных опухолей возникает из доброкачественных (вспомним известный термин «рак в кистоме»). Вряд ли будет преувеличением утверждать, что каждая доброкачественная опухоль рано или поздно малигнизируется, соответственно этому своевременное выявление и удаление доброкачественного новообразования - один из самых действенных способов профилактики рака.
Классификация и распространенность доброкачественных опухолей яичников
Опухоли яичников отличаются необычайным разнообразием, какого не встретить ни в одном другом органе [2]. Знаменитая классификация С.Ф. Серова и соавт. (1977) отражает его в полной мере [1].
Тем не менее из девяти морфологических групп, представленных в этом по своему уникальном своде, реальное практическое значение имеют только три группы первичных опухолей: эпителиальные, стромальные и герминогенные, а также одна группа вторичных (метастатические).
К ним примыкает пестрая когорта опухолевидных процессов, о которой уже рассказывалось в VII главе. Остальные четыре группы - липидно-клеточные, гонадобластомы, неспецифические мягкотканные и неклассифицированные имеют очень небольшое практическое значение, поскольку встречаются почти казуистически редко.
Мы сочли оправданным привести здесь всю упомянутую классификацию. Однако ввиду ее некоторой громоздкости она будет приводиться по частям соответственно рассматриваемой гистологической группе.
Данные о распространенности различных гистологических типов доброкачественных опухолей противоречивы. Так, частота эпителиальных опухолей среди всех овариальных новообразований, по данным разных авторов,
499
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Метастатические, 2%
Стромы полового тяжа, 5% \ а
Прочие, 1%
Рис. 8.1. Частота выявления различных морфологических типов опухолей яичников.
Фибромы, 8%
Рис. 8.2. Структура доброкачественных опухолей яичников.
Гранулезо-и текаклеточные,
Рис. 8. 3. Наиболее часто встречаемые варианты доброкачественных опухолей яичников.
варьирует от 57% [1] до 90% [3]. Такие различия объяснимы разницей в специализированности медицинских учреждений, на базе которых проводился сбор и анализ статистических данных.
Приведем результаты нашего анализа распространенности различных морфологических типов опухолей яичников, которые в целом не противоречат общей тенденции, согласно которой основная доля овариальных опухолей - эпителиальные (75%), затем с большим отрывом следуют гер-миногенные (17%) и стромы полового тяжа (5%). На долю прочих остается 3%. Эти данные, а также структура и наиболее часто встречаемые варианты доброкачественных опухолей яичников приведены на рис. 8.1-8.3.
200
VIII. Доброкачественные опухоли яичников
Эпителиальные опухоли
Гистологическая классификация эпителиальных опухолей яичников (по С.Ф. Серову и соавт., 1977, приводится по [1]):
А. Серозные опухоли.
1. Доброкачественные:
а) цистаденома и папиллярная цистаденома;
б) поверхностная папиллома;
в) аденофиброма и цистаденофиброма.
2. Пограничные (потенциально низкой степени злокачественности): а) цистаденома и папиллярная цистаденома;
б) поверхностная папиллома;
в) аденофиброма и цистаденофиброма.
3. Злокачественные:
а) аденокарцинома, папиллярная аденокарцинома и папиллярная цистаденокарцинома;
б) поверхностная папиллярная карцинома;
в) злокачественная аденофиброма и цистаденофиброма.
Б. Муцинозные опухоли.
1. Доброкачественные:
а) цистаденома;
б) аденофиброма и цистаденофиброма.
2. Пограничные (потенциально низкой степени злокачественности): а) цистаденома;
б) аденофиброма и цистаденофиброма.
3. Злокачественные:
а) аденокарцинома и цистаденокарцинома;
б) злокачественная аденофиброма и цистаденофиброма.
В. Эндометриоидные опухоли.
1. Доброкачественные:
а) аденома и цистаденома;
б) аденофиброма и цистаденофиброма.
2. Пограничные (потенциально низкой степени злокачественности): а) аденома и цистаденома;
б) аденофиброма и цистаденофиброма.
3. Злокачественные:
а) карцинома (аденокарцинома; аденоакантома; злокачественная аденофиброма и цистаденофиброма);
б) эндометриоидная стромальная саркома;
в) мезодермальные (мюллеровы) смешанные опухоли, гомологичные и гетерологичные.
Г. Светлоклеточные (мезонефроидные) опухоли.
1. Доброкачественные: аденофиброма.
2. Пограничные (потенциально низкой степени злокачественности).
3. Злокачественные: карцинома и аденокарцинома.
2ОЛ
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.4. а - нормальный яичник (микропрепарат). 1 - строма яичника; 2 - однослойный кубический зародышевый эпителий (между стрелками); 3 - инклюзионная киста в круглом контуре. Приводится по [4] с изменениями;
б - трансвагинальное сканирование. Мелкие эхогенные включения по периферии яичника (стрелки). 1 - яичник; 2 - фолликулярный аппарат. Кстати, достигнув диаметра в несколько миллиметров, инклюзионные кисты могут визуализироваться и в виде таких эхонегативных включений по периферии стромы яичника, не отличаясь, таким образом, от изображения фолликулярного аппарата. Правда, в отличие от фолликулов они будут сохраняться на том же месте длительное время. 3 - матка.
Д. Опухоли Бреннера (уроэпителиальные).
1. Доброкачественные.
2. Пограничные (пограничной злокачественности).
3. Злокачественные.
Е. Смешанные эпителиальные опухоли.
1. Доброкачественные.
2. Пограничные (пограничной злокачественности).
3. Злокачественные.
Ж. Недифференцированная карцинома.
3. Неклассифицируемые эпителиальные опухоли.
Самую многочисленную группу новообразований яичников составляют эпителиальные опухоли, развивающиеся из зародышевого эпителия, выстилающего поверхность яичника, редко из мерцательного эпителия маточных труб. В основном это цистаденомы, источником которых считаются так называемые инклюзионные кисты, возникающие за счет инвагинации поверхностного эпителия в строму яичника (рис. 8.4) [1,4].
Количество и размеры инклюзионных кист напрямую связаны с количеством овуляций, исходом которых в конечном счете и являются эти дефек
202
VIII. Доброкачественные опухоли яичников
ты наружного контура яичника. Приведенные данные дополнительно объясняют роль беременности, лактации, а также гормональной контрацепции для профилактики опухолей яичников.
Инклюзионные кисты первоначально имеют микроскопические размеры и не определяются при ультразвуковом исследовании. Правда, есть мнение, что точечные эхогенные включения, нередко визуализируемые по контуру яичника, как раз соответствуют названным морфологическим структурам. Несмотря на спорность такой точки зрения, все же приведем эхограмму яичника с периферическими эхогенными фокусами (см. рис. 8.4).
Как и все прочие, эпителиальные опухоли подразделяются на три варианта: доброкачественные, пограничные, злокачественные. Для пограничной опухоли характерно наличие некоторых, но не всех, признаков злокачественности. Например, в них отсутствует инфильтративный рост.
Рассмотрим два самых распространенных гистологических типа эпителиальных опухолей: серозные и муцинозные.
Серозные опухоли
Серозные опухоли (цистаденомы, или кистомы) названы так потому, что эпителий, выстилающий стенку опухоли, сецернирует (гладкостенная цист-аденома) с образованием серозного содержимого, а также пролиферирует (папиллярная цистаденома), образуя внутренние перегородки и пристеночные папиллярные разрастания. Серозные цистаденомы составляют более половины всех доброкачественных опухолей яичников [2], являясь самыми частыми новообразованиями у женщин 30-50 лет. В 10-12% случаев эти опухоли двусторонние.
Серозная гладкостенная цистаденома
Этот морфологический тип в свою очередь самый распространенный среди серозных кистом (около 2/з). Макроскопически опухоль весьма сходна с фолликулярной кистой, главное морфологическое отличие от последней - цилиндрический характер эпителиальной выстилки.
Важной особенностью эхокартины гладкостенной серозной цистаденомы является ее практическая идентичность с эхокартиной фолликулярной кисты яичника: тонкостенное образование с четкими внутренними контурами, однородным эхонегативным содержимым, высокой звукопроводимостью с дистальным усилением эхосигнала (рис. 8.5).
Правда, в отличие от фолликулярной кисты гладкостенная кистома может достигать большего размера. Он редко превышает 15-17 см, но встречаются серозные кистомы, выполняющие почти всю брюшную полость (рис. 8.6). При небольших кистомах в уточнении диагноза помогает динамическое 2-3-месячное наблюдение, в течение которого функциональное образование должно исчезнуть.
Иногда, особенно при больших размерах серозных кистом, визуализируется признак дисперсной эховзвеси в полости кистомы (рис. 8.7), кото-
203
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.5. Трансвагинальное сканирование. 1 - гладкостенная серозная цист-аденома яичника; 2 - матка; 3 - подвздошные сосуды.
Рис. 8.6. Трансабдоминальное сканирование. 1 - большая гладкостенная цистадено-ма яичника. Опухоль занимает всю брюшную полость, выполняя на эхограмме все пространство между брюшной стенкой (2) и позвоночником (3).
Рис. 8.7. Трансабдоминальное сканирование, а -режим Zoom. Большая гладкостенная цистаденома яичника. Акустический артефакт эхогенной взвеси (стрелки). При исследовании макропрепарата - содержимое соломенно-желтого цвета, прозрачное, без взвеси.
204
VIII. Доброкачественные опухоли яичников
Рис. 8.7 (окончание).
б - режим Zoom. Энергетическая допплерография. Большая гладкостенная цистаденома яичника у девушки 18 лет. Феномен акустического течения (стрелкой показана одна из эхогенных частиц, смещающихся в режиме реального времени).
рая «перемещается» при включении режима цветовой допплерографии -мы говорим об уже неоднократно описанном признаке акустического течения (см. рис. 8.7). Несмотря на эховзвесь, при макроскопическом исследовании содержимое таких кистом прозрачно и однородно, иногда немного опалесцирует.
При допплерографическом исследовании в проекции стенки кистомы определяются единичные сосуды (рис. 8.8) с низкой скоростью (Vmax 7-15 см/с) и средней резистентностью (RI0,5-0,6) кровотока.
Подозревать наличие серозной кистомы следует при неисчезающем в течение 3-4 менструальных циклов тонкостенном эхонегативном образовании яичника диаметром 3 см и более. В постменопаузе этот нижний порог исчезает, кистомой может оказаться эхонегативное включение яичника любого, даже совсем небольшого размера (рис. 8.9).
Эхокартина простой кисты в области придатков -дифференциальный ряд
Ввиду универсальной эхокартины простой кисты, присущей гладкостенной кистоме яичника, надлежит проводить следующую дифференциальную диагностику:
• фолликулярная киста;
• гравидарная киста желтого тела;
• параовариальная киста;
• перитонеальная киста (серозоцеле);
• гидатида брыжейки трубы;
• поперечное сканирование сосуда;
• переполненный мочевой пузырь;
• цистаденокарцинома (по мнению некоторых авторов).
205
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.8. Трансвагинальное сканирование, а - энергетическая допплерография. 1 - гладкостенная серозная цистаденома яичника; 2 - кровоток в проекции стенки цистаденомы;
б - триплексный режим. Гладкостенная серозная цистаденома. В проекции стенки опухоли немногочисленные сосуды (стрелка). Vmax 16 см/с, RI 0,9.
Рис. 8.9. Трансвагинальное сканирование. 1 - маленькая гладкостенная серозная цистаденома в перименопаузе; 2 - виден персистирующий фолликул; 3 - строма яичника.
206
VIII. Доброкачественные опухоли яичников
Об особенностях эхокартины фолликулярной и лютеиновой, а также параовариальной кист, позволяющих дифференцировать их с серозной кистомой, говорилось в VII главе, посвященной опухолевидным образованиям яичников.
Перитонеальные кисты обычно имеют относительно небольшое внутреннее давление и поэтому принимают форму примыкающих к ним органов и тканей малого таза. К тому же в большинстве случаев удается обнаружить интактный яичник. Подробнее об этих структурах будет сказано в 3-м томе в разделе, посвященном спаечному процессу.
Гидатида брыжейки маточной трубы всегда имеет очень небольшие размеры и находится обычно надостаточном отдалении от яичника.
Поперечное сканирование сосуда малого таза дифференцируется от кистомы очень легко изменением положения датчика на 90°, а также включением режима цветовой допплерографии. В нашей практике однажды был случай аневризмы яичниковой артерии, представлявший некоторые интерпретационные сложности, однако прилежное допплерографическое исследование решило все проблемы.
Переполненный мочевой пузырь может стать источником очень серьезных диагностических ошибок. Обычно данная ситуация встречается у женщин преклонного возраста (нейрогенная дисфункция пузыря). Мочевой пузырь занимает весь нижний этаж брюшной полости (если не больше), часто сопутствующее ожирение затрудняет оценку внутренней эхоструктуры наблюдаемого образования. Необнаружение кпереди от «кистомы» мочевого пузыря, визуализация струй мочи из устьев мочеточников в режиме цветовой допплерографии [5], а главное, постоянная готовность к подобной ситуации позволяют избежать оплошности. В своих лекциях я всегда привожу в качестве примера ошибку, допущенную мною на заре профессиональной деятельности. У пожилой, страдавшей значительным ожирением пациентки при трансабдоминальной эхографии было обнаружено кистозное образование, занимавшее почти всю брюшную полость. Заподозрена большая кистома яичника, однако смутила невизуализация мочевого пузыря. При контрольном самостоятельном мочеиспускании получено 300 мл мочи (!). Больная, кстати, отмечала частые мочеиспускания небольшими порциями. Повторное исследование выявило сохраняющееся эхонегативное образование, визуально не изменившееся в размерах. В результате с диагнозом «гигантская кистома яичника» пациентка поступила на оперативное лечение. Спасла положение медицинская сестра, выведшая катетером мочу у больной уже на операционном столе. После получения нескольких литров мочи «опухоль», хорошо определявшаяся до этого визуально, «опала». В последующем мы, при даже небольших сомнениях подобного рода, всегда добивались опорожнения мочевого пузыря катетером перед контрольным ультразвуковым исследованием.
Что касается цистаденокарциномы, то мы с имеющимися на то основаниями полагаем, что эхокартина простой кисты никогда не ассоциирована со злокачественной опухолью. Подробнее об этом будет сказано в следующей, IX, главе.
207
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Серозная папиллярная цистаденома
Для серозных папиллярных цистаденом яичников характерны сосочковые разрастания (известное выражение - по типу «цветной капусты») и перегородки, в результате чего кистомы выглядят многокамерными. Почти в 25% случаев такие опухоли оказываются двусторонними.
Ультразвуковое изображение серозной
папиллярной цистаденомы
Оценивая эхокартину данного типа опухоли, следует внимательно изучить: 1) наружный и внутренний контуры образования; 2) количество и толщину перегородок; 3) количество, форму и размеры папиллярных разрастаний; 4) особенности васкуляризации всех названных выше структур. Все эти признаки могут иметь существенное значение для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников. В этой главе мы подробно расскажем о признаках, наиболее присущих именно доброкачественному процессу. Непосредственно же проблеме дифференциации «добра и зла» уделено много места в I, а также следующей, IX, главе этого тома.
Наружный и внутренний контуры образования
Серозные кистомы обычно имеют ровный внутренний контур. Неровный внутренний контур всегда является настораживающим с точки зрения риска малигнизации признаком. Также очень важно постараться оценить наружный контур образования ввиду нередкого наличия наружных папиллярных разрастаний. Однако выявить их без наличия жидкости в малом тазу очень трудно.
Папиллярные включения
Папиллярные разрастания определяются как пристеночные нелинейные включения средней или повышенной эхогенности, высота которых составляет 3 мм и более (рис. 8.10) [6]. Методика измерения папиллярного включения представлена на рис. 8.11. Следует обратить внимание не только на высоту, но и на характер основания «сосочкового разрастания». Оно может быть узким и широким относительно основной части сосочка. Размеры папиллярных разрастаний в доброкачественных опухолях, как правило, не превышают 10 мм. Количество их может разным, но при доброкачественном росте обычно можно наблюдать единичные или немногочисленные пристеночные включения.
Папиллярные разрастания могут определяться не только на стенках, но и на перегородках (рис. 8.12). Этот признак следует считать настораживающим с точки зрения повышенного риска малигнизации.
Перегородки
Для этого гистологического типа также характерно наличие тонких линейных эхогенных включений (перегородок), т.е. многокамерность. Обратим внимание на то, что ультразвуковым изображением перегородки следует считать линейное эхогенное включение, идущее от одной до другой
208
VIII. Доброкачественные опухоли яичников
Рис. 8.10. а - трансвагинальное сканирование. Серозная папиллярная цистаденома малых размеров (27 мм). 1 - полость кистомы; 2 - папиллярное разрастание; 3 - строма яичника; 4 - матка;
б - трансвагинальное сканирование. Серозная папиллярная цистаденома с единственным маленьким папиллярным разрастанием высотой 3 мм (стрелка);
в - трансабдоминальное сканирование. Папиллярная серозная цистаденома. 1 - папиллярное включение. За счет толстой передней брюшной стенки пациентки (между стрелками на уменьшенном изображении) множественные реверберационные артефакты имитируют взвесь в полости кисты (2). Рядом с включением артефакты исчезли, наблюдается однородное эхонегативное содержимое (3).
209
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.11. Оценка размеров папиллярного включения (приводится по [6] с изменениями), а - высота измеряется от проекции внутреннего контура кистомы (внутренняя дуга). Толщина самой стенки кистомы (между двумя дугами) не учитывается. Ширина измеряется в двух проекциях: сначала так, как на эхограмме (пунктир), а затем после поворота датчика на 90°. После получения трех линейных размеров рассчитывается объем включения;
б - при больших папиллярных разрастаниях бывает трудно определить проекцию внутреннего контура стенки кистомы. Тогда высоту включения (сплошная линия) можно измерить от условной линии между краями основания измеряемого включения (пунктир).
2НО
VIII. Доброкачественные опухоли яичников
Рис. 8.12. Трансвагинальное сканирование с энергетической допплерографией. Серозная папиллярная цистаденома у пациентки 70 лет. Множественные перегородки, неравномерно утолщенные до 2,7 мм (1), с определяемыми в них сосудами (2) -\/тах12см/с, RI 0,48.3-папиллярные разрастания на перегородках.
211
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.13. Трансвагинальное сканирование. Серозная папиллярная цистаденома.
1 - полость одной из камер кистомы; 2 - перегородки. а - при сканировании в данной плоскости создается впечатление, что перегородка не достигает стенки (стрелка); б - изменение плоскости сканирования помогает убедиться в том, что это не так (стрелка).
Рис. 8.14. Трансабдоминальное сканирование. Серозная папиллярная цистаденома больших размеров. 1 - полость одной из камер; 2 - перегородки.
212
VIII. Доброкачественные опухоли яичников
внутренней стенки кистозной опухоли (здесь и далее, помимо терминологической классификации Б.И. Зыкина (1-й том, стр. 65), мы будем пользоваться стандартизованными терминами, предложенными международной группой анализа овариальных опухолей (International Ovarian Tumor Analysis Group - IOTA), предложенными в 2000 г. [6]) (рис. 8.13, 8.14). Толщина перегородок у этих опухолей обычно равномерная и небольшая, как правило, не превышающая 1-2 мм.
Допплерография серозных папиллярных цистаденом
При цветовой допплерографии следует внимательно исследовать качественные и количественные показатели гемодинамики всех отделов опухоли. Кровоток может визуализироваться в стенке, папиллярных разрастаниях, а также перегородках опухоли (рис. 8.15). Данные о частоте выявления внутриопухолевого кровотока в этом морфологическом типе опухолей колеблются, составляя от 40 до 95% (рис. 8.16) [5, 7].
Количественные показатели гемодинамики, как показали наши исследования, в зависимости от локализации внутриопухолевых сосудов существенно не различались (рис. 8.17), хотя и наблюдалась тенденция к увеличению Vmax в нелинейных включениях (папиллярных разрастаниях) по сравнению со стенкой и перегородками. Так, если в среднем VapTmK в нелинейных включениях доброкачественных новообразований составила 18,1 ± 3,6 см/с, то по контуру и в линейных включениях - 12,2 ± 4,9 и 10,9 ± 6,3 см/с соответственно [8]. Показатели резистентности внутриопухолевого кровотока в зависимости от локализации также достоверно не различались, отмечалась тенденция к относительно низкой резистентности в перегородках и папиллярных включениях (RI 0,48-0,53) по сравнению с показателями в стенке опухоли (RI 0,58).
Муцинозные опухоли
Макроскопически доброкачественные и пограничные муцинозные опухоли имеют вид кисты, часто очень больших размеров; обычно они многокамерные. Нередко имеют ножку, которая может перекручиваться, вызывая соответствующую симптоматику. Выстилающий эпителий, как правило, высокопризматический, четко контурированный, обладает способностью к слизеобразованию, причем муцин в виде зерен находится в клетке. Митозы не встречаются [1,3]. Муцинозные опухоли чаще возникают в возрасте 50-60 лет, составляют 10-15% всех доброкачественных опухолей яичников. В 30-50% случаев эти опухоли двусторонние. Для них типичен быстрый рост. По сравнению с серозными муцинозные опухоли гораздо чаще имеют большие размеры - в 85% наблюдений их средний диаметр превышает 15 см. При разрыве стенки опухоли возникает миксома брюшины [1].
213
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.15. Трансвагинальное сканирование. Энергетическая допплерография. Папиллярная цистаденома. При энергетической допплерографии кровоток определяется: а - в стенке опухоли (стрелка); б - в папиллярном включении (стрелка); в-в перегородке (стрелка).
214
VIII. Доброкачественные опухоли яичников
Рис. 8.16. Трансвагинальное сканирование. Энергетическая допплерография. Папиллярная цистаденома. При энергетической допплерографии кровоток в папиллярном включении (стрелка) не определяется. Такая повышенная эхогенность папиллярного разрастания может также наблюдаться при цистаденофибромах.
Рис. 8.17. Трансвагинальное сканирование. Триплексный режим. Папиллярная цистаденома. Допплерометрические показатели кровотока: а - в перегородке (Vmax7 см/с, RI 0,50); б -в папиллярном разрастании (Vmax 8 см/с, RI 0,49).
2Л5
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.18. Трансвагинальное сканирование. Небольшая муцинозная цистаденома. Взвесь в камере опухоли (в прямоугольном контуре).
Рис. 8.19. Трансвагинальное сканирование. Муцинозная цистаденома. 1 -взвесь в одной из камер опухоли; 2 - содержимое другой камеры выглядит эхонегативным.
Рис. 8.20. Трансабдоминальное сканирование. Большая муцинозная цистаденома, выполняющая почти всю брюшную полость. 1 - множественные перегородки; 2 -взвесь в камерах.
2Н6
VIII. Доброкачественные опухоли яичников
Особенности ультразвукового изображения муцинозных кистом
Поскольку в муцинозных цистаденомах эпителий, выстилающий стенку опухоли, сецернирует муцин, появляется характерный эхопризнак дисперсной взвеси (рис. 8.18). Иногда может наблюдаться сочетание эхокартины камер со взвесью и эхонегативных полостей (рис. 8.19). Считается, что это может свидетельствовать о смешанном характере опухоли.
Другой существенной особенностью муцинозных цистаденом является наличие многочисленных перегородок, дающих эхокартину многокамерного образования (рис. 8.20) [7]. Перегородки в муцинозных опухолях могут быть толще, чем в серозных, но и здесь их толщина редко превышает 2-2,5 мм. Толщина таких перегородок тоже достаточно равномерная.
Что касается папиллярных разрастаний, то для муцинозных кистом они как раз нехарактерны.
Допплеровское исследование муцинозных опухолей дает результаты, сходные с таковыми при серозных новообразованиях яичников.
Эхокартина миксомы брюшины
Миксома брюшины по своей эхоструктуре имеет сходство с муцинозной цистаденомой. Обращает на себя внимание отсутствие четких контуров опухоли. Мы наблюдали при миксоме эхокартину содержимого с густой неоднородной эховзвесью, как бы окутывающей петли кишечника в виде муфты. После оперативного вмешательства и удаления миксомы в последующем могут наблюдаться рецидивы опухолевого процесса.
Дифференциальный ряд при эхокартине кистозного образования с дисперсной взвесью (приводится по [5])
Ультразвуковое изображение эхонегативного образования с внутренним дисперсным содержимым может наблюдаться при разнообразных патологических образованиях малого таза. Соответственно приводим необходимый дифференциально-диагностический ряд:
• муцинозная кистома;
• киста желтого тела (глава VII «Опухолевидные образования яичников»);
• эндометриоидная киста (1 -й том, глава V «Эндометриоз»);
• перекрут яичника с кровоизлиянием (3-й том, глава «Неотложные состояния»);
• тубоовариальный абсцесс (3-й том, глава «Воспаление»);
• пиосальпинкс (3-й том, глава «Воспаление»);
• дермоидная киста (ниже в этой главе);
• карцинома яичника (глава IX);
• миома с дегенеративными изменениями по типу гиалиноза (1-й том, глава VI «Миома матки»);
• внематочная беременность (3-й том);
2Л7
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
• расширенная петля кишечника (3-й том, глава «Экстрагенитальная патология малого таза»);
• послеоперационая гематома (3-й том, глава «Послеоперационные осложнения»).
Прочие эпителиальные опухоли
Доброкачественные эндометриоидные опухоли встречаются крайне редко. Их описывают как преимущественно кистозные образования с папиллярными разрастаниями и дисперсной взвесью в кистозном компоненте за счет геморрагических и некротических внутренних изменений [9].
Ультразвуковое изображение светлоклеточных аденофибром, по данным наблюдавших их авторов, мало отличалось от эхокартины прочих папиллярных кистом [10].
Опухоли Бреннера преимущественно доброкачественны (средний возраст больных старше 60 лет), имеют овальную форму, неровную поверхность, каменистую плотность. Микроскопически состоят из стромы. Опухоли Бреннера могут обнаруживаться в каких-либо других эпителиальных опухолях, например в стенке муцинозной кисты [1], обладать эстрогенной активностью (кровянистые выделения в постменопаузе, гиперплазия эндометрия, миома матки). Ультразвуковая картина опухоли Бреннера часто сходна с таковой при фибротекомах (см. следующий раздел).
Опухоли стромы полового тяжа
Опухоли стромы полового тяжа составляют 5-7% опухолей яичников [11]. Они состоят из клеток, которые возникли из полового тяжа или мезенхимы эмбриональных гонад. В соответствии с определением ВОЗ (1977) опухоли стромы полового тяжа содержат гранулезные клетки, тека-клетки, коллаген продуцирующие клетки, клетки Сертоли и Лейдига и клетки, напоминающие их эмбриональных предшественников, отдельно или в разных комбинациях [1]. Таким образом, они могут состоять из клеток, характерных как для яичников (гранулезоклеточная опухоль и текома), так и для яичек (сертолиома и лейдигома), а также из недифференцированных клеток (см. классификацию).
Образно говоря, стромальные опухоли - единственная группа чисто овариальных опухолей. Своеобразный парадокс в том, что эти «истинные опухоли яичников» являются весьма редкими, тогда как самыми распространенными являются опухоли, происходящие не из собственно овариальной ткани (эпителиальные и герминогенные).
В большинстве случаев опухоли стромы полового тяжа - гормонопродуцирующие. Гистогенез их очень разнообразен, опухоли стромы полового тяжа происходят из структур «женской» и «мужской» части гонады, секретирующей соответственно эстрогены или андрогены, обусловливающие развитие феминизирующих или вирилизирующих симптомов. Соотношение доброкачественных и злокачественных опухолей стромы полового тяжа составляет примерно 1 : 2 [12].
2Л8
VIII. Доброкачественные опухоли яичников
В отличие от прочих опухолей яичников гормонопродуцирующие новообразования отличаются выраженной клинической манифестацией заболевания, даже когда размеры самой опухоли еще очень небольшие и яичник представляется неувеличенным как при бимануальном обследовании, так и при эхографии. К тому же доброкачественные опухоли стромы полового тяжа более склонны к малигнизации, поэтому их иногда называют потенциально злокачественными опухолями.
С эхографической точки зрения, по сравнению с эпителиальными и гер-миногенными опухолями принципиальное отличие опухолей стромы полового тяжа заключается в том, что это образования не кистозного, а преимущественно солидного типа эхоструктуры.
В связи со сказанным выше мы уделим относительно большое внимание не только собственно ультразвуковой диагностике опухолей этой группы, но и их клинической составляющей.
Классификация опухолей стромы полового тяжа [1]
А. Гранулезо-стромальноклеточные опухоли.
1. Гранулезоклеточная опухоль (доброкачественная, злокачественная).
2. Группа теком-фибром:
а) текома (доброкачественная, злокачественная);
б) фиброма;
в) неклассифицируемые опухоли.
3. Смешанные.
Б. Андробластомы, опухоли из клеток Сертоли и Лейдига.
1. Высокодифференцированные:
а) тубулярная андробластома, опухоль из клеток Сертоли (серто-лиома);
6) тубулярная андробластома с накоплением липидов, опухоль из клеток Сертоли с накоплением липидов (липидная фолликулома Лессена);
в) опухоль из клеток Сертоли и Лейдига;
г) опухоль из клеток Лейдига (лейдигома), опухоль из хилюсных клеток.
2. Промежуточные (переходной дифференцировки) или умереннодифференцированные.
3. Низкодифференцированные (саркоматоидные).
4. С гетерологичными элементами.
В. Гинандробластома.
Г. Неклассифицируемые опухоли стромы полового тяжа.
Гранулезоклеточная опухоль
Гранулезоклеточная опухоль (синонимы: фолликулома, фолликулярная эпителиома, фолликулярная аденома, феминизирующая мезенхиома и др.) чаще представляет собой высокодифференцированную злокачественную опухоль. Распространенность составляет 1-2% от первичных опухолей яич
219
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
ников [1], соотношение доброкачественных и злокачественных новообразований приблизительно 1 :2. Эстрогенсекретирующие гранулезоклеточные опухоли встречаются в любом возрасте, при этом средний возраст составляет 50 лет для доброкачественных и 39 лет для злокачественных. Подобной зависимости при первичных эпителиальных опухолях не наблюдается [2].
Чаще всего эти опухоли односторонние (двусторонние наблюдаются в 5-8% случаев), размеры колеблются от нескольких миллиметров до 20 см и более. Поверхность гладкая или дольчатая, структура солидная, кистозный тип встречается редко. Гистологически гранулезоклеточные опухоли обычно состоят из клеток, напоминающих гранулезные клетки фолликулов с митозами. У детей и подростков гранулезоклеточные опухоли преимущественно кистозного строения [11].
У девочек в 3/4 случаев наблюдают ложное преждевременное половое развитие. В детородном возрасте данные опухоли проявляются нарушениями менструального цикла, гиперплазией эндометрия, в постменопаузе -кровянистыми выделениями. Примерно у каждой двадцатой больной с гранулезоклеточной опухолью диагностируется и рак эндометрия.
Опухоль может латентно существовать многие годы, однако начавшись, прогрессирование с метастазированием протекает очень быстро [11].
Ультразвуковое изображение гранулезоклеточной опухоли
Большинство авторов подчеркивают очень разнообразный характер изображения описываемого новообразования. При этом многие отмечают, что маленькие (до 3-4 см) гранулезоклеточные опухоли имеют преимущественно солидный тип строения (рис. 8.21), в то время как для больших характерен смешанный солидно-кистозный тип эхоструктуры (рис. 8.22, 8.23) [13-15].
М.А. Чекалова и О.А. Строкова [16] выделяют шесть типов строения гранулезоклеточной опухоли на основании анализа впечатляющего количества случаев (более 50!):
• однокамерное кистозное образование с тонкой капсулой, по внутренней поверхности которой иногда отмечались шероховатости;
• однокамерное кистозное образование с неравномерно утолщенной капсулой, шероховатыми стенками и неоднородным густым содержимым;
• опухоль с небольшим солидным компонентом губчатой и мелкоячеистой структуры, мультилокулярным компонентом, образующим крупные (>3 см) полости, разделенные толстыми рыхлыми перегородками;
• образования с выраженным локально расположенным солидным компонентом мелкозернистой и мелкоячеистой структуры, кистозный компонент был представлен несколькими крупными (>2 см) полостями, разделенными перегородками неравномерной толщины;
• кистозно-солидные образования с мелкими (<2 см) полостями неправильной формы, рассеянными в толще рыхлой неоднородной опухолевой ткани;
• солидные дольчатые образования губчатой либо мелкозернистой структуры.
220
VIII. Доброкачественные опухоли яичников
Рис. 8.21. Транс вагинальное сканирование. Гранулезоклеточная опухоль небольших размеров, сопоставимых с размером нормального яичника.
а - преимущественно солидный тип эхоструктуры с мелкими гипоэхогенными участками. 1 - опухоль; 2 -матка;
б - солидный тип эхоструктуры дольчатого типа (стрелки указывают на ги-поэхогенные границы между «долями»).
Наш опыт изучения эхоструктуры восьми гранулезоклеточных опухолей малых размеров (т.е. когда опухоль по своему объему сопоставима с неуве-личенным яичником) показал, что опухоль имела округлую или овоидную форму. В половине случаев определялась однородная сниженная или средняя эхогенность опухоли (рис. 8.24), еще в половине - на фоне достаточно однородной сниженной эхогенности наблюдались единичные эхонегативные включения диаметром 0,3-0,5 см (см. рис. 8.22).
Допплерография гранулезоклеточных опухолей
Результаты допплерографического анализа опухолей этой группы заслуживают особого внимания. Большинство авторов отмечают интенсивную васкуляризацию всех или почти всех гранулезоклеточных опухолей [16].
221
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.22. Трансвагинальное сканирование. Энергетическая допплерография. Гранулезоклеточная опухоль максимальным диаметром 7 см. На фоне преимущественно пониженной эхогенности определяются небольшие эхонегативные включения неправильной формы (1). Во всех отделах опухоли определяются кровеносные сосуды (2).
Рис. 8.23. Трансабдоминальное сканирование. Большая гранулезоклеточная опухоль солидно-кистозного типа эхоструктуры. Центральные отделы опухоли преимущественно солидного типа эхоструктуры (1), по периферии многочисленные эхонегативные включения (2).
Рис. 8.24. Трансвагинальное сканирование. Энергетическая допплерография. Гранулезоклеточная опухоль диаметром 3 см солидного типа эхоструктуры. Эхогенность опухоли средняя и однородная. Во всех отделах опухоли, в том числе в центральных, определяется интенсивный кровоток (стрелка).
222
VIII. Доброкачественные опухоли яичников
Мы определяли интенсивный артериальный и венозный кровоток в 100% наблюдений (рис. 8.24, 8.25), причем во всех отделах опухолей. Допплерометрия показала достаточно высокую скорость и среднюю, с тенденцией к низкой резистенность внутриопухолевого кровотока (рис. 8.26): Vmax 21,2 ± 6,8 см/с (14-43 см/с), RI 0,44 ± 0,03 (0,40-0,52), Wmax 6,2 ± 2,4 см/с (4-9 см/с).
Оценка злокачественного потенциала гранулезоклеточных опухолей
Нами получены парадоксальные результаты при ультразвуковой оценке риска малигнизации по собственной балльной шкале (пороговое значение высокого риска малигнизации 8 баллов и больше): при анализе только эхоструктуры все опухоли «набрали» 4 балла и меньше, в то время как количество баллов только за счет допплеровских критериев во всех случаях составляло 7 и больше. В сумме почти все (7 из 8) гранулезоклеточные
Рис. 8.25. Трансвагинальное сканирование. Энергетическая допплерография. Гранулезоклеточная опу холь. Во всех отделах опухоли определяется достаточно интенсивный кровоток (стрелки).
223
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.26. Трансвагинальное сканирование. Триплексный режим. Гранулезоклеточная опухоль. Низкая резистентность кровотока: а - RI 0,35; б - RI 0,16 - резистентность настолько низкая, что тип кровотока походит на венозный.
опухоли «набрали» 8 баллов и больше, т.е. превысили пороговое значение высокого риска малигнизации. Это позволило нам в целом образно охарактеризовать особенности ультразвуковой картины гранулезоклеточной опухоли малых размеров как своеобразное сочетание «спокойной» эхограммы и «неспокойной» допплерограммы.
С учетом известного злокачественного потенциала данной гистологической группы приведенные нами результаты не удивляют.
Группа теком и фибром
Фибромы и текомы имеют сходные гистологические типы. При феминизирующем эффекте их классифицируют как текомы, «нефункционирующие» стромальные опухоли называют фибромами. Часто встречаются гистологические заключения о наличии фибротекомы.
Фиброма
Фиброма - почти всегда доброкачественная, малигнизируется очень редко (тогда ее называют саркомой или фибросаркомой яичника). Соотно-
224
VIII. Доброкачественные опухоли яичников
шение односторонних и двусторонних опухолей составляет 9:1. Гистологически фибромы не отличаются разнообразием и состоят из клеточных элементов и волокнистого вещества в разных соотношениях. В подавляющем большинстве случаев опухоль бедна кровеносными сосудами [1]. Иногда при фибромах яичников проявляются асцит, гидроторакс и анемия. Однако все три компонента вместе встречаются редко. Причина анемии чаще не в самой фиброме, а в сопутствующей субмукозной миоме матки или аденомиозе, асцит и гидроторакс появляются при больших размерах опухоли, за счет чего ее могут на этапе дооперационного обследования ошибочно принять за злокачественную опухоль. Осложнениями фибромы могут быть перекрут ножки, некроз и нагноение.
Ультразвуковая диагностика фибромы яичника
Одно из первых в литературе описание эхокартины фибромы представлено В.Н. Демидовым и Б.И. Зыкиным [13]: образование различных размеров округлой или овальной формы с четкими и ровными контурами. Внутренняя структура опухоли обычно однородна, эхогенность понижена, с эффектом ослабления сигнала или даже акустической тенью. Редко в фиброме могут обнаруживаться плотные включения (кальцификаты) или анэ-хогенные образования - участки гиалиноза, кистозные полости.
По нашим данным [7], для фибром обычно характерна визуализация образования округлой формы, преимущественно эхопозитивного, достаточно однородного строения, что требует проведения дифференциальной диагностики с субсерозной миомой матки (рис. 8.27-8.29).
I.E. Timor-Tritsch и S.R. Goldstein [17] описывают два варианта ультразвукового изображения фибромы: «классический» солидный тип эхоструктуры с зонами снижения звукопроводимости (тени) и встречающийся по их данным примерно в 20% кистозный тип с пристеночными эхогенными и при этом аваскулярными мелкими включениями диаметром менее 5 мм. Авторы отмечают, что размеры и эхоструктура этого типа могут не меняться в течение длительного времени
Описаны редкие, но встречающиеся случаи сочетания фибромы с новообразованиями других гистологических типов, например фиброма левого яичника в сочетании с папиллярной серозной цистаденомой правого и т.д.
Текома
Текомы практически всегда односторонние, имеют округлую форму, размеры - любые, с гладкой или бугристой поверхностью. Имеется беловатая капсула, на разрезе характерны кистевидные полости, участки некроза и кровоизлияний, а также солидные структуры интенсивно желтого цвета. В целом гистология теком весьма разнообразна за счет функционального состояния тека-клеток и насыщенности их липидами [1].
Ее гормональная активность чаще проявляется андрогенизацией, таким образом, клинически не отличаясь от андробластомы. Однако описаны и феминизирующие варианты теком. При доброкачественной текоме также
225
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.27. Трансвагинальное сканирование. Энергетическая допплерография. Небольшая фиброма преимущественно сниженой эхогенности. В основном в периферических отделах опухоли немногочисленные сосуды (стрелки).
Рис. 8.28. Большая фиброма правого яичника. Опухоль имеет солидный тип эхоструктуры. Звукопроводимость опухоли (1) снижена, в дистальных отделах опухоли определяется затухание эхосигнала, за счет чего дальний контур опухоли виден плохо (стрелка). Правый яичник не виден, слева определяется матка (2).
Рис. 8.29. Трансвагинальное сканирование. Энергетическая допплерография. Большая фиброма яичника. Опухоль имеет резко сниженную звукопроводимость (1). Кровоток определяется только в периферических отделах опухоли, практически по контуру (2).
226
VIII. Доброкачественные опухоли яичников
может встречаться асцит, как и при фибромах яичника, вплоть до синдрома Мейгса [2].
По данным Я.В. Бохмана [2], частота теком составляет 2,4%, причем соотношение доброкачественных и пограничных/злокачественных - примерно 9:1, а средний возраст больных - 58 лет и 42 года соответственно [4]. Клинические проявления, лечение и прогноз при злокачественной текоме практически не отличаются от таковых при гранулезоклеточной опухоли.
Ультразвуковая диагностика текомы
Эхогенность опухоли либо средняя, либо несколько пониженная, в отличие от фибромы звукопроводимость чаще обычная, в связи с чем непосредственно за ней не отмечается акустический эффект ни ослабления, ни усиления [13]. Внутреннее строение текомы обычно однородное. Жидкостные включения, свидетельствующие о наличии дегенеративных изменений, в основном наблюдаются при опухоли больших размеров или ее злокачественности [5].
М. Bazot и соавт. [18] при анализе компьютерных томограмм и эхограмм 23 фибротеком обнаружили, что 79% опухолей имели солидный тип изображения с замедленным накоплением контрастного вещества. В 21% случаев опухоли имели солидно-кистозный тип строения, что затрудняло их дифференциацию от других овариальных образований
При текомах иногда может иметь место «каменистая» эхоструктура с эффектом латеральной эхографической тени [9].
Допплерография фибром и теком
Результаты допплерографических исследований фибром и теком немногочисленны. В отличие от гранулезоклеточных опухолей кровоток в фибромах и текомах визуализируется не всегда, обычно он менее интенсивен (см. рис. 8.27). В текомах и фибромах высокой плотности (и соответственно низкой звукопроводимости) кровоток может вообще не выявляться (см. рис. 8.29).
Допплерометрические показатели, по нашим данным [8], в доброкачественных текомах и текофибромах составили: Vmax 5-7 см/с, RI 0,58-0,62, Wmax 4-6 см/с (рис. 8.30).
Андробластомы
Андробластомы, или опухоли из клеток Сертоли и Лейдига, - удел молодых женщин (20-35 лет). Встречаются они редко (около 1% от всех овариальных опухолей), соотношение доброкачественных и злокачественных составляет 5 :4 [4], причем последние чаще высокодифференцированные.
Почти всегда это односторонняя опухоль, растущая в пределах капсулы яичника. Сертолиома (синонимы: тубулярная андробластома, тубулярная аденома) наряду с андрогенами секретирует эстрогены, что приводит к появлению на фоне вирилизации умеренной гиперплазии эндометрия. Опухоль обычно не больше 10 см в диаметре, с плотной капсулой, на разрезе дольчатое плотное строение.
227
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.30. Трансвагинальное сканирование. Энергетическая допплерография. Фибротеко-ма. а - обращает на себя внимание то, что эхоструктура и васкуляризация опухоли имеют определенное сходство как с гранулезоклеточной опухолью, так и с фибромой; б - при этом количественные показатели гемодинамики опухоли отличаются от гранулезоклеточной опухоли - здесь мы наблюдаем низкую скорость (Vmax 8 см/с) и высокую резистентность (RI 0,6) кровотока.
Опухоль из клеток Сертоли и Лейдига маленькая (не более 5-6 см), мягкой консистенции, без капсулы, на разрезе напоминает незрелые криптор-хичные яички. У некоторых больных могут быть врожденные аномалии внутренних половых органов, в частности отсутствие матки, а также тестикулярная феминизация [1].
Лейдигома развивается в области ворот яичника в виде отграниченного, не имеющего капсулы узла диаметром не более 5-6 см. Основные клинические симптомы - аменорея и вирилизация, которая, однако, встречается не у всех больных (70-85%).
Так, мы наблюдали двух молодых женщин с лейдигомами. У одной это была случайная находка. Другая обследовалась по поводу первичного бесплодия, жаловалась на нерегулярные месячные, имела спортивный тип те-
228
VIII. Доброкачественные опухоли яичников
Рис. 8.31. Трансвагинальное сканирование. Опухоль Лейдига. В неувеличенном яичнике располагается маленькая опухоль неправильной овоидной формы, эхогенность которой немного ниже эхогенности стромы яичника. Контуром отмечены границы опухоли. 1 - опухоль; 2 - строма яичника; 3 - фолликул.
лосложения. После удаления опухоли цикл нормализовался, а через 6 мес наступила беременность.
Очевидно, что асимптомность андробластом обсловлена их удачным выявлением на доклиническом этапе. Я.В. Бохман отмечает постепенную динамику симптоматики: заболевание обычно начинается с аменореи, далее атрофируются молочные железы, гипертрофируется клитор, отсутствует либидо. Позднее фигура теряет женские очертания, отмечается рост волос по мужскому типу. После удаления опухоли женский облик больных постепенно восстанавливается [2].
Ультразвуковое изображение андробластом
Для небольших андробластом (диаметр 2-3 см, объем 4-8 см3) практически всегда характерны правильная овоидная или округлая форма и солидный тип эхоструктуры (рис. 8.31). Капсула в этих опухолях не определяется, но за счет однородной эхогенности, более низкой по сравнению с эхогенностью овариальной стромы, достаточно хорошо видна граница между тканью опухоли и стромой яичника (см. рис. 8.31).
Андробластомы относительно большого размера тоже имеют преимущественно солидный, дольчатый тип эхоструктуры, однако в них часто определяются различных размеров единичные или множественные жидкостные включения [3]. Важная деталь: интактный яичник может быть уменьшен в размерах, а его фолликулярный аппарат не визуализироваться (очевидно, за счет андрогенного воздействия опухоли) [19].
Результаты допплерографического анализа опухолей этой группы крайне интересны. Несмотря на малые размеры опухолей, во всех них определяется очень интенсивный внутренний кровоток, причем более выраженный, чем во всех остальных опухолях стромы полового тяжа (рис. 8.32). При этом допплерометрические показатели составляют: Vmax 16-26 см/с, RI 0,35-0,42, WTOX 3-6 см/с.
229
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.32. Трансвагинальное сканирование Опухоль Лейдига.
а - энергетическая допплерография; б - триплексный режим. Во всех отделах опухоли чрезвычайно интенсивная васкуляризация. При первом обследовании, которое проводилось во вторую половину цикла, мы даже были вынуждены предположить цветущее желтое тело солидного типа эхоструктуры, хотя и понимали, что это маловероятно из-за не только периферического (1), но и центрального (2) типа васкуляризации. Вопросы снялись при осмотре после менструации. Количественный анализ гемодинамики показал высокую скорость (Vmax 26 см/с) и низкую резистентность (RI 0,38). Плотность разнонаправленных сосудов в опухоли оказалось настолько высокой, что, несмотря на небольшие размеры пробного объема (3), при развертке допплеровской кривой определялся артефакт зеркала (4) в виде кривых скоростей по обе стороны изолинии.
230
VIII. Доброкачественные опухоли яичников
Оценка злокачественного потенциала андробластом и опухолей стромы полового тяжа в целом
Как и в случае с гранулезоклеточными опухолями, достаточно парадоксальные результаты получены при ультразвуковой оценке риска малигни-зации по нашей балльной шкале (пороговое значение высокого риска ма-лигнизации 8 баллов и больше): при анализе только эхоструктуры количество баллов для всех андробластом составляло 2 и больше, тогда как только за счет допплеровских критериев также во всех случаях - 5 и больше. В сумме большинство андробластом «набирают» 8 баллов и больше, что превышает пороговое значение высокого риска малигнизации.
Это позволило нам в целом охарактеризовать особенности ультразвуковой картины практически всех вариантов опухолей стромы полового тяжа, за исключением «чистых» фибром, как своеобразное сочетание «относительно спокойной» эхограммы и «неспокойной» допплерограммы.
Дифференциальный ряд при эхокартине преимущественно солидного образования
Поскольку для опухолей стромы полового тяжа более характерен преимущественно солидный тип эхоструктуры, приведем соответствующий дифференциальный ряд (приводится по [5] с изменениями и добавлениями):
• фиброма яичника;
• тератома;
• текома (фибротекома);
• гранулезоклеточная опухоль;
• опухоль из клеток Сертоли-Лейдига;
• опухоль Бреннера;
• карцинома яичника;
• метастатическая опухоль яичника (опухоль Крукенберга);
• пиовар;
• эндрометриоидная киста;
• субсерозная миома матки на ножке;
• рецидив опухоли малого таза;
• опухоль мочевого пузыря;
• инородное тело мочевого пузыря (например, обызвествленный катетер Фолея);
• опухоль маточной трубы;
• опухоль брыжейки кишечника;
• опухоль тонкой кишки;
• опухоль толстой кишки;
• опухоль забрюшинная;
• увеличенный лимфатический узел;
• воспаление мышц малого таза (особенно пояснично-подвздошной мышцы);
• тазовая дистопия почки;
• тазовая дистопия селезенки;
23Л
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
• петля тонкой кишки;
• нисходящий отдел толстой кишки.
Сейчас мы не будем проводить подробный анализ приведенного выше перечня. Для этого нужна отдельная глава. Именно такую главу, названную «Экстрагенитальная патология малого таза», вы прочитаете в 3-м томе книги.
Герминогенные опухоли
Герминогенные (зародышевые) опухоли представляют собой довольно разнообразную группу опухолей, прежде всего с точки зрения их злокачественного потенциала. Сюда входят как абсолютно доброкачественные, практически никогда не малигнизирующиеся зрелые тератомы, так и безусловно злокачественные дисгерминома, хорионэпителиома и эмбриональная карцинома. Прочие опухоли этой группы очень редки и, как правило, тоже злокачественны.
Общим для всей этой группы опухолей является происхождение из одного либо всех трех зародышевых листков - эктодермы, мезодермы и эндодермы.
Герминогенные опухоли имеют примечательную возрастную особенность: они относительно редко встречаются в репродуктивном возрасте, будучи в основном доброкачественными, однако у детей и подростков они составляют не менее 2/з среди опухолей яичников, при этом часто являются злокачественными (или пограничными).
Классификация герминогенных опухолей
А. Дисгерминома.
Б. Опухоль эндодермального синуса.
В. Эмбриональная карцинома.
Г. Полиэмбриома.
Д. Хорионэпителиома.
Е. Тератомы (незрелые, зрелые).
Ж. Смешанные герминогенные опухоли.
Зрелые тератомы (дермоидные кисты)
Эти «врожденные» опухоли яичников возникают из эмбриональных зачатков (преимущественно эктодермы). Зрелая тератома гистологически состоит из зрелых структур тканей и органов зародыша [3]. В зависимости от типа и дифференцировки эмбриональных листков содержимое опухоли могут составлять жир, волосы, кожа, зубы, кости, нервная ткань, зачатки глаза, тиреоидная ткань (струма яичника). Зрелые тератомы подразделяются на солидные и кистозные. Они составляют 20-25% от всех опухолей яичников. Двусторонние дермоидные кисты встречаются в 15-20% случаев, обнаруживаются с самого молодого возраста [1]. Особенностью зрелых тератом является крайне медленный рост и минимальный риск малигнизации [2].
232
VIII. Доброкачественные опухоли яичников
Зрелые тератомы - типы эхокартины
Опухоли хорошо подвижны, при больших размерах часто располагаются кпереди от матки (рис. 8.33, а). Поскольку для зрелых тератом совершенно не типичен инвазивный рост, даже при относительно больших размерах опухоли часто удается обнаружить примыкающую к опухоли овариальную ткань со всеми ультразвуковыми признаками нормально функционирующего яичника. Эта особенность иногда вызывает диагностические трудности, когда рядом с тератомой визуализируется фолликулярная киста или желтое тело.
Ультразвуковое изображение зрелых тератом очень разнообразно, что легко объяснимо с точки зрения их содержимого. Такой выраженный эхографический полиморфизм может вызывать трудности при дифференциальной диагностике со злокачественными процессами. Следует отметить, что всегда, когда различные авторы пытались разработать балльные системы для оценки риска малигнизации опухоли, дермоидная киста обычно «смешивала карты», набирая количество баллов, достаточное для заключения о высоком риске малигнизации.
С другой стороны, известная неопределенность эхоструктуры тератом могла нередко приводить к противоположному результату - опухоль сливалась с окружающими тканями и просто не замечалась при ультразвуковом исследовании. Это привело к появлению термина «опухоль-невидимка».
Такое разнообразие эхокартины дермоидной кисты вызвало насущную необходимость систематизации ее ультразвуковых проявлений [5, 6, 10]. В конечном счете можно выделить пять основных вариантов изображения дермоидной кисты:
• эхогенное образование с четко визуализируемыми краями, как правило, небольших размеров (минимальный 4-5 мм). Вокруг образования хорошо визуализируется нормальная ткань яичника (рис. 8.34). При небольших тератомах во время лапароскопии яичник может выглядеть нормальным;
• эхогенное образование с плохо визуализируемым дистальным отделом (эффект «верхушки айсберга»). Всегда имеет место дистальное ослабление эхосигнала (рис. 8.35);
• гипо- или изоэхогенное образование, содержащее эхогенное включение («дермоидный бугорок», «протуберанец Рокитанского», состоит из перечисленных выше плотных структур), нередко также с эффектом «верхушки айсберга» за счет дистального ослабление эхосигнала (рис. 8.36). Гипоэхогенный (или изоэхогенный) компонент дермоидной кисты представляет собой жир, обычно проявляющий акустические признаки жидкости при исследовании. Однако при макроскопическом исследовании послеоперационного материала эта структура часто предстает скорее солидной. Связано это с тем, что жир может быть жидким при температуре человеческого тела и загустевать при комнатной [10];
• гетерогенное содержимое сетчато-ячеистого типа (может не содержать или содержать эхогенное включение) (рис. 8.37);
• трудно дифференцируемая по типу эхоструктуры опухоль (см. рис. 8.33). Сюда можно отнести и те зрелые тератомы, эхоструктура которых соответствует сразу нескольким описанным выше вариантам.
233
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.33. Эхокартина тератомы в виде трудно дифференцируемой по типу эхоструктуры опухоли (между стрелками), а - продольное трансабдоминальное сканирование; большая тератома спереди от матки (1); б-г - трансвагинальное сканирование.
234
VIII. Доброкачественные опухоли яичников
Рис. 8.34. Трансвагиналь-ное сканирование. Маленькие тератомы (стрелки) в пределах яичниковой ткани. 1 - строма яичника; 2 -фолликулы. Заметно, что эхоструктура совсем маленьких тератом (a-в) выглядит относительно однородной, их эхогенность подчеркнуто выше эхогенности овариальной стромы.
235
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.34 (окончание). При увеличении тератом, хотя они по прежнему в пределах яичника (г-е), их контуры становятся неровными и нечеткими, эхоструктура неоднородной, с гипоэхо-генными включениями (черные стрелки).
236
VIII. Доброкачественные опухоли яичников
Рис. 8.35. Трансвагиналь-ное сканирование. Зрелая тератома в виде эхогенного образования (1) с плохо визуализируемым дистальным отделом (эффект «верхушки айсберга») за счет дистального ослабления эхосигнала с формированием акустической тени (2). На рис. айв хорошо видна ткань яичника с фолликулами (стрелки). 3 - матка.
237
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.36. а, б - трансабдоминальное сканирование; в,г -трансвагинальное сканирование. Тератома больших размеров в виде гипоэхогенного (1) или изоэхогенного (2) образования, содержащего эхогенное включение с дистальной тенью (3).
238
VIII. Доброкачественные опухоли яичников
Рис. 8.37. а-в - трансвагинальное сканирование; г - трансабдоминальное сканирование. Эхоструктура тератомы в виде гетерогенного содержимое сетчато-ячеистого типа (1), которое может не содержать или содержать эхогенное включение (2).
239
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.38. Трансвагинальное сканирование. Двусторонние тератомы. а: 1 - тератома правого яичника; 2 -матка; б: 1- тератома левого яичника; 2 - матка.
Рис. 8.39. Трансабдоминальное сканирование. Тератома у девочки 9 лет. а: 1 - тератома; 2 - петля кишечника с преимущественно газообразным содержимым; 3 - наполненный мочевой пузырь; б - в режиме энергетической допплерографии определяется скудный кровоток за пределами контура опухоли (стрелка).
240
VIII. Доброкачественные опухоли яичников
Двусторонние тератомы могут иметь разные размеры, но часто сопоставимые (рис. 8.38).
Диагностика высокорасположенных тератом у девочек может вызывать некоторые затруднения, поскольку небольшие тератомы при абдоминальном исследовании могут проявлять свойства «невидимок», а трансректальное исследование оказывается малоэффективным ввиду отдаленного расположения опухоли отдатчика. Повторные динамические наблюдения с использованием цветовой допплерографии помогают добиться положительного результата (рис. 8.39).
Особенности допплерографического изображения зрелых тератом
Допплерография прекрасно помогает уточнить диагноз дермоидной кисты при наличии сомнений. При цветовой/энергетической допплерографии кровоток всегда удается определить только в здоровой ткани яичника, примыкающей к опухоли (рис. 8.40) [20]. Структура зрелой тератомы всегда выглядит аваскулярной.
Из сказанного очевидны результаты количественных показателей гемодинамики, которые будут соответствовать таковым для нормальной овариальной ткани с учетом фазы менструального цикла.
При выявлении цветовых пятен в структуре «тератомы» следует подозревать злокачественный процесс.
Точность ультразвуковой диагностики при зрелых тератомах.
Тактика ведения
Таким образом, несмотря на кажущуюся сложность ультразвукового изображения зрелых тератом, внимательное исследование (с использованием описанных эхографических критериев, а также особенностей васкуляризации) позволяет почти в 100% случаев не только выявить тератомы, но и до операции определить их нозологическую принадлежность.
Дифференциально-диагностический ряд при выявлении тератом примерно тот же, что и при муцинозных опухолях.
Динамическое ультразвуковое наблюдение тератом подтверждает их крайне медленный рост (1-2 мм в год), а также минимальный риск озлока-чествления. В связи с этим некоторые авторы предлагают консервативную тактику при характерной ультразвуковой картине зрелой тератомы небольшого размера (<6 см) [10].
Тератомы большого размера малигнизируются чаще маленьких, но также крайне редко. В нашей практике имел место случай, когда пациентка с диагнозом дермоидной кисты яичника не желала оперироваться в течение 16 лет и согласилась на оперативное лечение только тогда, когда ей стало трудно дышать из-за размеров опухоли, подпирающей диафрагму. При гистологическом исследовании в ткани зрелой тератомы были обнаружены очень мелкие очаги (1-2 мм) эмбриональной карциномы.
24^1
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 8.40. Трансвагинальное сканирование. Энергетическая допплерография. Независимо от типа эхоструктуры зрелой тератомы васкуляризация (стрелка) определяется только в пределах овариальной ткани (1), примыкающей к опухоли (2). Сама опухоль всегда выглядит аваскулярной.
Литература
1. Селезнева Н.Д., Железнов Б.И. Доброкачественные опухоли яичников. М.: Медицина, 1982.
2. Бохман Я.В. Руководство по онкогинекологии. Л.: Медицина, 1989.
3. Колосов А.Е. Опухоли яичников и прогноз для больных: Руководство для врачей. Киров, 1996.
4. Серов В.Н., Звенигородский И.Н. Диагностика гинекологических заболеваний с курсом патологической анатомии (эхограммы представлены М.Н. Булановым). М.: БИНОМ, 2003.
5. Merz Е. Ultrasound in obstetrics and gynecology. V. 2. Gynecology. Stuttgart; New York: Thieme, 2007. P. 149-162.
6. Timmerman D., Valentin L., Bourne Т.Н. et al. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) group // Ultrasound Obstet. Gynecol. 2000. V. 16. P. 500-505.
242
VIII. Доброкачественные опухоли яичников
7. Зыкин Б.И., Проскурякова О.В., Буланов М.Н. Ультразвуковое исследование яичников // Клиническое руководство по ультразвуковой диагностике / Под ред. В.В. Мить-кова, М.В. Медведева. М.: Видар, 1997. С. 132-175.
8. Буланов М.Н. Значение трансвагинальной цветовой допплерографии в сочетании с импульсной допплерометрией для дифференциальной диагностики доброкачественных и злокачественных новообразований яичников: Дис. ... канд. мед. наук. М., 1999.
9. Зыкин Б.И. Диагностика новообразований внутренних половых органов у женщин с помощью эхографии: Дис. ... канд. мед. наук. М., 1982.
10. Valentin L, Callen R W. Ultrasound evaluation of the adnexa (ovary and fallopian tubes) // Ultrasonography in obstetrics and gynecology. 5th ed. I Ed. Peter W. Callen. Philadelphia: Elsevier, Inc., 2008. P. 968-985.
11. Гинекология по Эмилю Новаку / Под ред. Дж. Берека, И. Адаши, П. Хиллард. М.: Практика, 2002.
12. Вишневская Е.Е. Предопухолевые заболевания и злокачественные опухоли женских половых органов. Минск, 2002.
13. Демидов В.Н., Зыкин Б.И. Ультразвуковая диагностика в гинекологии. М.: Медицина, 1990.
14. Hong В.К., Jeng C.J., Huang S.Y. et al. Sonographic and clinical finding of granulosa cell tumor 11 Chung Hua I Hsueh Ts Chin Taipei. 1996. V. 57. N3. P. 214-218.
15. Липатенкова Ю.И. Возможности эхографии и допплерометрии в диагностике гранулезоклеточных опухолей яичников //Ультразвук, диагн. 1999. №1. С. 23-27.
16. Чекалова М.А., Строкова О.А. Возможности современного ультразвукового исследования в диагностике гранулезоклеточных опухолей яичников: Материалы VI съезда РАСУДМ. М., 2007.
17. Timor-Tritsch I.E., Goldstein S.R.. Ultrasound in gynecology. Philadelphia: Churcill Livingstone, 2007. P. 149-162.
18. Bazot M., Ghossain M.A., Buy J.N. et al. Fibrothecomas of the ovary: CT and US findings //J. Comput. Assist. Tomogr. 1993. V. 17(5). P. 754-759.
19. Демидов B.H., Гус А.И., Адамян Л.В., Липатенкова Ю.И. Эхографическая характеристика андробластом яичников //Ультразвук, диагн. в акуш., гинекол., педиатр. 1994. №3. С. 55-61.
2O. Zalel Y, Caspi В., Tepper R. Doppler flow characteristics of ovarian dermoid cysts - the unique appearance of struma ovarii // Ultrasound Obstet. Gynecol. 1996. V. 8. Suppl. 1. P. 186.
243
T'Vr Злокачественные опухоли яичников
Введение • Классификация, клиническая картина и распространенность злокачественных опухолей яичников. Группы риска • Дифференциальная ультразвуковая диагностика доброкачественных и злокачественных новообразований яичников • Ультразвуковое изображение злокачественных опухолей яичников различных гистологических типов (первичные и метастатические опухоли) •Диагностика рецидивов онкологического процесса • Вопросы скрининга рака яичников • Заключение • Литература
Введение
Один из пионеров отечественной ультразвуковой диагностики в гинекологии Б.И. Зыкин еще почти 30 лет назад справедливо отмечал, что «определение характера опухолей яичников является одним из наиболее сложных аспектов применения ультразвука в гинекологии» [1]. До сего дня, несмотря на постоянное внедрение в клиническую практику все более качественной диагностической аппаратуры, это высказывание нисколько не утратило своей актуальности. При этом проблема ранней диагностики рака яичников (РЯ) остается одной из наиболее важных и наименее решенных [2], поскольку, с одной стороны, во всем мире сохраняются высокие показатели смертности от этого заболевания, а с другой - ни один из до сих пор существующих диагностических методов на практике не смог обеспечить чувствительность и специфичность, равные или хотя бы приближающиеся к 100% показателю [3].
Не являясь самым распространенным онкологическим заболеванием, РЯ остается одним из самых смертельных (здесь и далее под определением «рак яичников» мы подразумеваем все злокачественные опухоли яичников). В России средний показатель 5-летней выживаемости больных РЯ не превышает 20-30%, в США - 40-45%, что тоже мало [2]. Причина, по точному определению И.Д. Нечаевой [4], заключается в том, что раннее выявление остается скорее исключением, чем правилом.
Известно, что при диагностике РЯ на I стадии 5-летняя выживаемость достигает 80%, в то время как диагностика на поздних стадиях снижает этот показатель до 12%. Однако сегодня вряд ли более 20% больных начинают лечение на I стадии. Происходит это по двум причинам: во-первых, опухоль практически никогда не проявляется клинически на I стадии, во-вторых, не существует эффективного скрининга этого заболевания (как,
245
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
например, при раке шейки матки). В связи с этим не прекращается активный поиск диагностических методов, которые могли бы способствовать кардинальному решению задачи раннего выявления РЯ.
Ультразвуковая диагностика давно и заслуженно рассматривается в качестве одного из ключей к разрешению проблемы ранней диагностики РЯ [5]. Ниже мы постараемся шаг за шагом рассмотреть основные ультразвуковые критерии дифференциации доброкачественных и злокачественных новообразований яичников.
Классификация, клиническая картина и распространенность злокачественных опухолей яичников. Группы риска
В VIII главе уже приведена распространенная классификация гистологических типов новообразований яичников, охватывающая как доброкачественные, так и злокачественные опухоли. Не была упомянута только группа вторичных (метастатических) опухолей.
В целом с точки зрения развития заболевания злокачественные опухоли яичников можно разделить на три принципиально отличающиеся группы [6]:
1. Первичный РЯ. Злокачественная опухоль возникает непосредственно в овариальной ткани, часто одновременно поражаются оба яичника. Пожалуй, можно провести параллель между этим вариантом РЯ и II патогенетическим вариантом рака эндометрия. Общим для них является в первую очередь возникновение de novo, а также высокий злокачественный потенциал. Первичный РЯ составляет не более 5% от всех злокачественных опухолей яичников.
2. Вторичный РЯ развивается в доброкачественных опухолях яичников (в основном это папиллярные цистаденомы). Известен старый гинекологический термин «рак в кистоме». Вторичный РЯ составляет 80-85% от всех злокачественных овариальных опухолей.
3. Метастатический рак яичников составляет примерно 10% от всех случаев РЯ. Источниками этой группы в половине случаев являются злокачественные процессы желудочно-кишечного тракта, в 1/з - молочных желез, в остальных случаях - из смежных органов малого таза.
Приведем классификацию клинических стадий РЯ, используемую на практике как во всем мире, так и в нашей стране. Это классификация Международной федерации акушеров и гинекологов (FIGO) (табл. 9.1).
Общемировая статистика показывает, что ежегодно на 100 000 женщин приходится 10 новых случаев злокачественной опухоли яичников. Этот показатель существенно варьирует в зависимости от возраста: до 40 лет -менее 5:100 000, после 70 лет - более 50 : 100 000 [8].
Как уже отмечалось, одна из главных причин столь плачевной ситуации с ранним выявлением РЯ - поздняя клиническая манифестация заболевания. Пока не начинается карциноматоз брюшины, редко имеет место четкая симптоматика. С распространением процесса (особенно при асците)
246
IX. Злокачественные опухоли яичников
Таблица 9.1. Клинические стадии злокачественных новообразований яичников. Классификация FIGO, 1985 (приводится по [7])
I стадия. Рост опухоли ограничен яичниками
la Опухоль ограничена одним яичником, асцита нет
la(i) Капсула интактна
la (ii) Имеется прорастание капсулы и/или ее разрыв
lb Опухоль ограничена двумя яичниками
lb(i) Капсула интактна
lb (ii) Имеется прорастание капсулы и/или ее разрыв
Ic la или lb и опухоль яичника с разрывом капсулы, асцитом, положительными результатами патологического исследования смывов с брюшины на наличие злокачественных клеток
II стадия. Распространение новообразования из яичников
в полость малого таза
Ila Распространение процесса на матку и маточные трубы
lib Распространение процесса на другие ткани малого таза, включая брюшину малого таза
Нс На или НЬ и опухоль яичника с разрывом капсулы, асцитом, положительными результатами патологического исследования смывов с брюшины на наличие злокачественных клеток
III стадия. Распространение процесса на брюшную полость
и/или метастазы в забрюшинные лимфатические узлы
Illa Микроскопические метастазы на поверхности брюшины за пределами малого таза
lllb Опухолевые метастазы размером менее 2 см
lllc Опухолевые метастазы размером более 2 см или метастазы в парааортальные и паховые лимфатические узлы
IV стадия. Отдаленные метастазы
Злокачественный плевральный выпот Метастазы в легочную ткань Метастазы в ткань печени и селезенки (а не поверхностные импланты) Метастазы в подключичные лимфатические узлы или кожу
появляются жалобы на желудочно-кишечные нарушения: тошноту, диспепсию, раннее насыщение, вздутие живота и пр. Возникают чувство тяжести внизу живота, боли. К сожалению, при перечисленных выше жалобах в лучшем случае выявляется стадия Illa.
Очевидный вывод из сказанного выше: необходима разработка методов ранней диагностики в группах риска. К ним в первую очередь относят [2,9]:
• Возраст старше 40 лет. По нашим данным [10], средний возраст больных РЯ составил 56 лет. Половина американок заболевают РЯ в возрасте старше 65 лет.
247
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
• Отсутствие беременностей и связанное с этим относительно большое количество овуляций, приводящих к хронической травматизации поверхностного эпителия, активации механизмов клеточного деления, лежащих в основе репарации. Чрезмерно активное клеточное деление рано или поздно может выйти из-под контроля, став, таким образом, злокачественным. Большое количество овуляций также приводит к образованию значительного количества инклюзионных овариальных кист, что тоже чревато возникновением опухолей.
• Раннее менархе и поздняя менопауза также приводят к большому количеству овуляций. Напротив, при хронической ановуляции (эндогенной или экзогенной, например при гормональной контрацепции) риск РЯ снижается. Именно поэтому одним из важных факторов снижения риска РЯ считается длительный прием комбинированных гормональных контрацептивов (при использовании чистых эстрогенов риск РЯ, наоборот, возрастает).
• Генетическая предрасположенность. Примерно в 5-10% случаев РЯ является семейным. Считается, что у женщины существенно повышен риск РЯ (в 2 раза), если этим заболеванием страдала ее мать. Описывается этническая предрасположенность к РЯ (например, среди евреек-ашкенази и исландок).
• Хронические гинекологические заболевания: хронический аднексит, эндометриоз.
• Любая онкологическая патология в анамнезе, особенно рак молочной железы и тела матки.
• Ожирение, сахарный диабет.
• Отсутствие половой жизни.
• Высокий социальный статус: наибольшая распространенность в развитых странах (азиатки, проживающие в США и Западной Европе, заболевают РЯ несколько чаще живущих на родине).
Дифференциальная ультразвуковая диагностика доброкачественных и злокачественных новообразований яичников
При ультразвуковом исследовании новообразования яичника главное не попытка определения гистологического типа опухоли, а исключение или подтверждение злокачественного процесса. Рассмотрим основные ультразвуковые критерии дифференциальной диагностики, которые можно использовать на практике.
Форма, контур, размеры
Ряд авторов [11,12] предлагают использовать в качестве критериев ма-лигнизации новообразований яичников неправильную форму, неровный контур, большие размеры. Однако нами не обнаружены достоверные отличия между доброкачественными и злокачественными опухолями яичников
248
IX. Злокачественные опухоли яичников
по этим признакам. При том, что неправильную форму имели 1/3 доброкачественных и 2/з злокачественных новообразований, отличия оказались недостоверными (Р > 0,05). Сходная ситуация сложилась и с характером контуров опухолей: неровный контур отмечался в 50% доброкачественных и 80% злокачественных опухолей (Р > 0,05). Средний объем доброкачественных новообразований составил 400 см3, в то время как злокачественных - 650 см3 (Р > 0,05).
Конечно, во всех случаях очевидно наличие тенденции к неправильной форме и неровному контуру, а также относительно большему размеру злокачественных опухолей яичников. Но рассматривать эти особенности строения в качестве надежных дифференциально-диагностических критериев «добра и зла» нельзя.
Различия в особенностях формы и контуров между доброкачественными и злокачественными опухолями особенно мало заметны при визуализации новообразований небольших размеров. Повсеместное распространение высокоразрешающей аппаратуры ставит перед нами задачу доинвазивной дифференциации именно таких новообразований, сопоставимых по объему с не увеличенным яичником. Следовательно, мы должны детально изучить особенности внутреннего эхографического строения опухоли.
Внутренняя эхоструктура опухоли
Эхокартина простой кисты
По мнению С. Conway и соавт. [13], эхокартина простой кисты (иначе говоря, полностью эхонегативный тип эхоструктуры) позволяет с уверенностью сделать вывод об отсутствии малигнизации. Мы также не обнаружили ни одной злокачественной опухоли яичника, имевшей эхокартину простой кисты (рис. 9.1). Вместе с тем в 17-20% случаев доброкачественные новообразования яичников имеют данный тип эхоструктуры [10].
Однако некоторые авторы полагают, что эхокартина простой кисты - одна из масок РЯ. Так, по RG. Osmers и соавт. [14], такую структуру имели 35,7% образований, обнаруженных в постменопаузе, при этом каждая десятая «простая киста» оказалась РЯ. Авторы считают, что визуализация эхокартины «простой кисты» в постменопаузе абсолютно не исключает злокачественную патологию. Уважая точку зрения этих авторитетных ученых, мы все же рассматриваем эхонегативную структуру в качестве надежного критерия доброкачественности.
При этом необходимо помнить, что ультразвуковое изображение простой кисты - признак если не рака, но, весьма вероятно, истинной опухоли, которая со временем может малигнизироваться.
Количество линейных включений (перегородок) в преимущественно эхонегативных образованиях
Частой особенностью новообразований яичников преимущественно эхонегативного типа является визуализация внутренних линейных эхогенных
249
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.1. Дифференциальная ультразвуковая диагностика. Эхокартина простой кисты. 1 - артефакт реверберации; 2 - артефакт боковых лучей.
Рис. 9.2. Дифференциальная ультразвуковая диагностика. а - единичные перегородки в преимущественно эхонегативном образовании (стрелка); б -множественные перегородки в преимущественно эхонегативном образовании (стрелки).
250
IX. Злокачественные опухоли яичников
включений, т.е. перегородок. Оказалось, что в доброкачественных новообразованиях по сравнению со злокачественными количество перегородок достоверно меньше. При этом в 85% доброкачественных опухолей нами наблюдалось 1-5 перегородок, в то время как в 76% злокачественных опухолей обнаружено более 5 перегородок [10]. Соответственно нами предложено пороговое значение количества внутренних перегородок 6 и более для вывода о наличии малигнизации (рис. 9.2). При использовании этого порогового значения прогностическая ценность положительного результата составила 83%. Это позволяет сделать вывод о возможности его использования в комплексной дифференциальной диагностике доброкачественных и злокачественных овариальных новообразований.
Толщина линейных включений (перегородок) в преимущественно эхонегативных образованиях
Оценка толщины внутренних перегородок в опухолях яичников преимущественно кистозного типа эхоструктуры показала, что в злокачественных опухолях внутренние перегородки толще. В 75% доброкачественных опухолей толщина перегородок составила 1-2 мм, в то время как в 67% злокачественных новообразований перегородки были толщиной 3 мм и более. Соответственно нами предложено пороговое значение этого признака 3 мм и более для вывода о наличии малигнизации (рис. 9.3). Прогностическая ценность положительного результата этого критерия малигнизации оказалась равной 67%, что мы расцениваем как относительно невысокий показатель, считая, что его можно использовать для дифференциальной диагностики только в комплексе с другими критериями.
Количество нелинейных (папиллярных) включений в преимущественно эхонегативных образованиях
Другая особенность опухолей преимущественно эхонегативного типа -внутренние эхогенные включения, т.е. папиллярные разрастания. Оказалось, что в 80% доброкачественных опухолей этого типа эхоструктуры наблюдалось не более 1-2 пристеночных включений. Более того, мы почти не встречали доброкачественных опухолей с 6 и более пристеночными включениями. Напротив, единичные (1-2) папиллярные включения были обнаружены лишь в 25% злокачественных опухолей этого типа строения, при этом в каждой третьей раковой опухоли наблюдались множественные (>6) пристеночные включения (рис. 9.4). Соответственно мы сочли возможным использовать для комплексной дифференциальной диагностики следующий критерий: >6 пристеночных папиллярных включений.
Размеры нелинейных (папиллярных) включений в преимущественно эхонегативных образованиях
После того, как мы подсчитали количество папиллярных включений, следует оценить их размеры (методика измерения подробно описана в VIII главе). Как оказалось, в злокачественных опухолях папиллярные включения
25Л
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.4. Дифференциальная ультразвуковая диагностика. 1 - эхонегативное содержимое, а - единичные папиллярные включения в преимущественно эхонегативном образовании (стрелка); б - множественные папиллярные включения в преимущественно эхонегативном образовании (стрелки).
Рис. 9.3. Дифференциальная ультразвуковая диагностика, а - тонкие перегородки (2 мм) в преимущественно эхонегативном образовании (стрелка); б, в - толстые перегородки (> 3 мм) в преимущественно эхонегативном образовании (стрелка).
252
IX. Злокачественные опухоли яичников
в среднем относительно больше. Нами предложено пороговое значение максимального диаметра папиллярного включения 4 мм и более для вывода о повышенном риске малигнизации (рис. 9.5).
В ряде случаев следует говорить уже не о папиллярных разрастаниях, а скорее о солидном компоненте опухоли кистозно-солидного типа эхоструктуры (см. рис. 9.5, 9.6). В данном случае возможно использовать пороговое значение 10 мм и более.
Как выяснилось, изолированное использование размеров папиллярных включений/солидного компонента в качестве дифференциально-диагностического критерия не дало высоких показателей диагностической точности. Однако этот критерий оказалось возможным использовать для комплексной дифференциальной ультразвуковой диагностики.
Солидный тип эхоструктуры
Анализ новообразований яичников преимущественно солидного типа эхоструктуры позволил разделить их на две группы: характерные и не характерные для малигнизации.
Рис. 9.5. Дифференциальная ультразвуковая диагностика. 1 - эхонегативное содержимое, а - большое папиллярное включение в преимущественно эхонегативном образовании (стрелка); б - относительно большое папиллярное включение в преимущественно эхонегативном образовании (стрелка), занимающее почти половину полости образования; в - большие папиллярные включения в преимущественно эхонегативном образовании (стрелки).
253
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.6. Дифференциальная ультразвуковая диагностика. Солидные типы эхоструктуры, более характерные для малигнизации. а, б - эхопозитивное с эхонегативными и гипоэхоген-ными включениями; в - эхопозитивное с включениями всех типов; г, д - смешанный тип эхоструктуры.
254
IX. Злокачественные опухоли яичников
Рис. 9.6 (окончание).
Типы эхоструктуры, менее характерные для малигнизации. Ультразвуковая классификация типов эхоструктуры патологических образований малого таза представлена в I главе 1-го тома. Оказалось, что среди солидных злокачественных опухолей яичников редко встречаются опухоли следующих типов эхоструктуры: однородная гиперэхогенная, однородная изо-эхогенная, однородная гипоэхогенная.
Однако отметим, что среди злокачественных новообразований солидного типа строения, имеющих небольшие размеры, почти в половине случаев можно было встретить опухоли достаточно однородного строения.
Типы эхоструктуры, более характерные для малигнизации. Для злокачественных опухолей наиболее характерна солидно-кистозная морфология, причем в солидной части новообразования часто определяются некрозы и кровоизлияния. Как отмечают М.А. Чекалова и В.М. Зуев [15], большая часть злокачественных эпителиальных опухолей может быть обозначена как мультиформная карцинома, так как в процессе мульти-центрического и неодномоментного роста образуются новообразования самой разнообразной структуры, что и определяет вариабельность ультразвукового изображения. Разнообразие также обусловлено степенью дифференцировки опухоли. Так, недифференцированные карциномы (железисто-солидный, медуллярный рак) преимущественно имеют солидное строение.
Анализ ультразвуковой картины большого количества злокачественных опухолей преимущественно солидного строения показал, что среди них чаще всего встречаются следующие типы эхоструктуры образования: эхопозитивное с гиперэхогенными включениями, эхопозитивное с гипоэхоген-ными включениями, эхопозитивное с включениями всех типов, смешанный тип эхоструктуры (см. рис. 9.6). Следует признать, что названные особенности внутреннего эхографического строения более типичны для распространенных стадий онкологического процесса (III-IV), а также рецидивирующих опухолей большого размера.
255
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Система подсчета баллов для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников по Sassone и Lerner1
В 1991 г. А.М. Sassone и соавт. [16] одними из первых предложили балльную систему для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников. В ней учитывались такие критерии, как неровность или наличие папиллярных разрастаний на внутренней стенке опухоли (1 балл), толщина стенки (2 балла), наличие тонких или толстых перегородок (3 балла), а также тип эхогенности образования (4 балла). Степень выраженности каждого признака обозначалась определенным количеством баллов. При начислении 9 баллов и более делался вывод о высоком риске малигнизации. Поданным авторов, чувствительность и специфичность разработанной системы составили 83 и 100% соответственно, хотя и был выявлен недостаток: методика не позволяла надежно дифференцировать РЯ и дермоидные кисты. Вскоре она была доработана J.R Lerner и соавт. [17]. Учитывая историческое значение, а также сохранившуюся до настоящего времени актуальность данной балльной системы, позволим себе привести здесь ее иллюстрацию (рис. 9.7).
Рак яичников - допплерография
Doppler assessment of pelvic tumor vascularity requires patience and patients.. ,2 Asim Kurjak Использование допплерографии позволило добиться существенного увеличения точности дифференциации доброкачественных и злокачественных новообразований яичников.
Краткий экскурс в историю развития трансвагинальной цветовой допплерографии (1989-2010): от гипероценки через отрицание к пониманию реальных возможностей
Первое сообщение об опыте использования трансвагинальной цветовой допплерографии в сочетании с импульсной допплерометрией для диагностики злокачественных новообразований яичников было опубликовано Т. Bourne и соавт. в 1989 г. [ 18]. У 9 больных с доброкачественными новообразованиями яичников показатели PI внутриопухолевого кровотока колебались от 3,2 до 7,0, в то время как в 7 из 8 злокачественных новообразованиях яичников значения этого показателя были в пределах 0,3-1,0. Такая выраженная разница в резистентности кровотока между злокачественны-
1 Нами также разработана система подсчета баллов для дифференциальной диагностики опухолей яичников, учитывающая как эхографические, так и допплеровские критерии. Она будет приведена ниже.
2 Допплеровская оценка васкуляризации опухолей малого таза требует [массу] терпения и пациентов. В оригинале игра слов patience (терпение) и patients (пациенты).
256
IX. Злокачественные опухоли яичников
Структура стенки
Гладкая / мелкие неровности <3 мм
Эффект тени
Перегородки
Эхо енность
Эхонегативность, гипоэхогенность, или
Папиллярные включения > 3 мм
Толстые (>3 мм) Смешанная или высокая
Подсчитывается сумма баллов Пороговое значение » 3
Рис. 9.7. Система подсчета баллов для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников по J.P. Lerner и соавт. [17] (приводится по [50] с изменениями)
ми и доброкачественными опухолями позволила авторам сделать вывод о том, что методика может быть использована для идентификации потенциально злокачественных новообразований яичников. Практически в это же время опубликовали свои данные A. Kurjak и соавт. [19], а также Т. Hata и соавт. [20], обнаружившие низкие показатели RI внутриопухолевого кровотока в злокачественных опухолях яичников. Полученные результаты также позволили авторам сделать вывод о возможности эффективного использования допплерографии для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников.
Таким образом, первые исследования внутриопухолевого кровотока при онкологической патологии яичников, проведенные с помощью цветовой допплерографии в сочетании с допплерометрией тремя независимыми группами ученых из Великобритании, Хорватии и Японии, а также работы, выполненные в 1990 г., дали весьма сходные результаты, что послужило толчком для первых оптимистических выводов о появлении нового эффективного метода ранней диагностики РЯ [21].
257
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
На основании результатов первой серии исследований Т. Bourne и соавт. [18] и A. Kurjak и соавт. [22] предложили ввести пороговые значения показателей резистентности (cut-off), которые могли бы служить своеобразным водоразделом, по одну сторону которого «лежит добро, а по другую - зло». Первые предложили в качестве порогового значения показатель PI <1,5, вторые - RI <0,4.
Однако очень скоро стали появляться сообщения о частичном совпадении (overlap) показателей PI и RI в доброкачественных и злокачественных опухолях яичников [23,24]. В результате стали предлагаться новые пороговые значения показателей резистентности. Так, A. Fleisher и соавт. в 1991 г. предложили порог PI <1,0 [25]. Другие авторы вообще стали высказываться о преждевременности рассуждений об однозначных пороговых значениях показателей резистентности, дающих возможность дифференцировать доброкачественный процесс от злокачественного [26]. В последующие годы были проведены многочисленные новые работы в этом направлении, разделившие исследователей на сторонников метода и его критиков.
Так, в обзоре А. Тесау и Р. Jouppila 32 исследований (1996 г.) приводятся цифры - чувствительность трансвагинальной допплерографии варьировала от 25 до 100%, специфичность - от 46 до 100%, прогностическая ценность положительного и отрицательного результатов - от 29 до 100% и от 63 до 100%, точность - от 57 до 100%. В 18 из 32 публикаций приводятся данные о частичном совпадении RI и PI в доброкачественных и злокачественных опухолях [27]. По данным самих авторов, RI <0,4 был установлен в 43% доброкачественных опухолей и в 25% нормальных яичников в пролиферативную фазу менструального цикла. Авторы делают вывод о том, что существующие пороговые значения показателей импеданса не следует использовать ввиду их низкой специфичности.
Тем не менее в это же время авторитетные группы исследователей из Лондона [28] приводят данные о эффективности допплерографии для скринингового выявления РЯ на ранних стадиях.
По мнению A. Kurjak [29], накопленные противоречивые результаты исследований 90-х годов XX столетия обусловлены разницей в опыте, классе аппаратуры и ее настройке (PRF (частота повторения импульсов), допплеровский фильтр, разрешающая способность прибора), а также тем, что доказанные гистологическими исследованиями различные типы неоваскуляризации в пределах одной опухоли соответственно могут приводить к существенной разнице допплерометрических показателей и к частичному совпадению показателей периферического сосудистого сопротивления в доброкачественных и злокачественных опухолях яичников (подробнее об этом в I главе этого тома).
Время расставило все по своим местам. Проведенные более чем за 20 лет многочисленные исследования (в том числе и наши собственные [10]) позволяют сделать вывод о том, что методологически взвешенное, стандартизованное использование допплеровских методик в сочетании с эхографическими критериями позволяет с достаточно высокой точностью еще на доинвазивном этапе дифференцировать доброкачественные
258
IX. Злокачественные опухоли яичников
и злокачественные новообразования яичников. Новейшие работы с использованием трехмерных допплеровских методик также подтверждают эту точку зрения (далее в этой главе).
Качественная допплерографическая оценка неоваскуляризации
В I главе этого тома уже отмечалось, что используемые сегодня блоки цветовой/энергетической допплерографии отличаются достаточно высокой чувствительностью и это позволяет визуализировать внутриопухолевый кровоток в большинстве доброкачественных и почти всех злокачественных новообразованиях яичников. Поэтому визуализация внутриопухолевого кровотока сама по себе еще не должна рассматриваться в качестве критерия малигнизации.
При этом отсутствие визуализации цветовых пятен в опухоли яичника может рассматриваться в качестве достаточно надежного критерия доброкачественности (если, конечно, используемый допплеровский блок обладает достаточной чувствительностью) (рис. 9.8).
Локализация выявленных внутриопухолевых
зон неоваскуляризации
Нами уже говорилось о двух типах внутриопухолевой васкуляризации -периферическом и центральном. Преимущественно центральная локализация сосудов типична прежде всего для злокачественного процесса. Этот признак можно использовать в комплексе с эхографическими критериями, а также количественными показателями внутриопухолевой гемодинамики.
В целом для карциномы яичника характерна не столько центральная, сколько диффузная беспорядочная васкуляризация многочисленными сосудами при солидном типе эхоструктуры, а также наличие множественных сосудов в перегородках и солидных папиллярных разрастаниях опухоли при кистозно-солидном типе эхоструктуры (см. рис. 9.8).
Количество внутриопухолевых локусов неоваскуляризации
Для злокачественных опухолей яичников (как и для рака другой локализации) типичны множественные внутриопухолевые сосуды (см. рис. 9.8), в то время как для доброкачественных новообразований - единичные. Проблему составляет точная количественная оценка выраженности внутриопухолевой васкуляризации. Очень многое зависит от класса прибора, а также от параметров настройки допплеровского блока прибора (что не менее, а может быть, даже более важно). Так, в наших исследованиях более чем 10-летней давности при цветовой допплерографии количество цветовых локусов в доброкачественных опухолях яичников составило в среднем 2,4 ± 0,8 (1-6), а в злокачественных - 6,4 ± 1,8 (1-14) (Р < 0,05) [10]. Однако можно не сомневаться, что обследование этой же когорты больных с использованием более современного оборудования дало бы совсем другие результаты.
259
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.8. Дифференциальная ультразвуковая диагностика. Цветовая/энергетическая допплерография. а - снимок 1995 г. Отсутствие признаков васкуляризации в солидном компоненте опухоли (1); 2 - эхонегативное содержимое; б - снимок 1995 г. Признаки выраженной неоваскуляризации (стрелка) в солидном компоненте опухоли; в - признаки выраженной неоваскуляризации (стрелка) в солидном компоненте опухоли; 2 - эхонегативное содержимое; г - дихотомичный тип васкуляризации в опухоли. 1 - основной сосуд; 2 - две его ветви.
260
IX. Злокачественные опухоли яичников
Рак яичников - 30-допплерография
О возможностях, а также методике использования трехмерной энергетической допплерографии (3D-PD) с количественной оценкой объема и интенсивности кровотока рассказывалось в I главе этого тома. Уже опубликовано достаточно большое количество работ, демонстрирующих хорошие возможности метода при дифференциальной диагностике доброкачественных и злокачественных опухолей яичников [30-33]. Приведем результаты исследований научно-исследовательской группы из Мальме (Швеция) (табл. 9.2).
Эти данные L. Jokubkiene и соавт. [33] наглядно демонстрируют достоверность отличий между объемными индексами васкуляризации в доброкачественных и злокачественных новообразованиях яичников. Однако авторы, сравнив все основные эхографические и допплеровские критерии малигнизации, приходят к парадоксальным выводам: при эффективности ЗО-индексов для точной дифференциальной диагностики достаточно серой шкалы и двумерной допплерографии - 2D-PD. На наш взгляд, очевидна экономическая подоплека такой точки зрения.
Добавлю от себя: таким образом, если вы являетесь счастливыми пользователями экспертной ультразвуковой системы с ЗО-блоком, используйте все, в том числе и 3D, критерии дифференциальной диагностики. Если нет, будьте уверены, что и в отсутствие ЗО-блока вы сможете успешно решать обозначенные задачи. Впрочем, искренне желаю всем коллегам иметь в своем распоряжении 30-машины (и главное, пользоваться всеми их возможностями).
Наш опыт использования объемных индексов васкуляризации дал сходные результаты. При этом мы еще раз обращаем особое внимание на лабильность методики, хотя и несомненную ее перспективность (рис. 9.9).
Количественные показатели внутриопухолевой гемодинамики
Максимальная (пиковая) скорость внутриопухолевого артериального кровотока (Vmax). Первые сообщения об измерении пиковой систолической скорости артериального кровотока (Vmax) в новообразованиях
Таблица 9.2. Объемные индексы васкуляризации в доброкачественных и злокачественных опухолях яичников [33]
ЗО-индексы Доброкачественные опухоли Злокачественные опухоли Р
Показатели во всей опухоли
VI 1,2 (0,06-29,08) 5,4 (0,34-25,40) <0,001
FI 29,5 + 4,78 35,5 ± 5,89 <0,001
VFI 0,4 (0,01-10,37) 2.1 (0,10-11,43) <0,001
Показатели в наиболее васкуляризованных участках опухоли
VI 5,1 (0,03-60,53) 35,6(4,73-78,61) <0,001
FI 31,8 ±6,90 42,9 + 8,04 <0,001
VFI 1,5(0,01-23,75) 12,9(1,82-41,51) <0,001
26Н
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.9. Дифференциальная ультразвуковая диагностика. 3D- энергетическая допплерография, а -3D-реконструкция методом свободной руки. 1 - опухоль, стрелкой показана выраженная внутриопухоле-вая неоваскуляризация; б -ЗО-реконструкция методом ниши позволяет получить более четкое представление о внутреннем строении опухоли, а также о внутри-опухолевом сосудистом русле; в, г - ЗО-энергети-ческая допплерография с расчетом индексов васкуляризации. Эти две иллюстрации демонстрируют лабильность методики: на рис. в показатель PRF = 0,6 кГц, на рис. г PRF = 0,3 кГц. Соответственно изменилась не только визуализация неоваскуляризации в В-режиме (1) и режиме «стекловидное тело» (2) (на рис. г неоваскуляризация выглядит более выраженной), но и показатели объемных индексов васкуляризации: на рис. t Vl=25,7, на рис. г VI = 33,5.
262
IX. Злокачественные опухоли яичников
Рис. 9.9 (окончание).
яичников появились в 1993 г. и принадлежит A. Kurjak и соавт. [34], а также А.С. Fleischer и соавт. [35], которые, однако, не смогли обнаружить статистически достоверной разницы между показателями Vmax в доброкачественных и злокачественных новообразованиях яичников. Только в 1995 г. появилось первое сообщение об успешном использовании Vmax в качестве нового дифференциально-диагностического критерия, которое принадлежит К. Hata и соавт. [36]. По их данным, Vmax в злокачественных новообразованиях яичников составила 23,9 ±11,5 см/с, в то время как в доброкачественных - 13,1 ±9,1 см/с (Р < 0,05). Авторы предложили пороговое значение Vmax 16 см/с, которое, по их мнению, дает возможность дифференцировать доброкачественную и злокачественную патологию яичников с чувствительностью 83,3% и специфичностью 91,6%, и делают вывод о том, что Х/тахдаже предпочтительнее RI для дифференциальной диагностики доброкачественных и злокачественных опухолей придатков.
По нашим данным, показатель Vmax составил в доброкачественных опухолях 14 см/с, в то время как в злокачественных - 30 см/с (табл. 9.3, рис. 9.10).
Средняя (усредненная по времени) скорость внутриопухолевого артериального кровотока (Vmean). Первыми об успешном использовании Чпеап В качестве дифференциально-диагностического критерия сообщили A. Tailor и соавт. [37]. Авторы пришли к выводу, что Vmean при пороговом значении 12 см/с и более имеет наибольшую дифференциально-диагностическую точность по сравнению с прочими количественными показателями (RI, PI, vmax)- Чувствительность и специфичность порогового значения Vmean > 2 см/с составили 88,9 и 83,3% соответственно. Тем не менее, проведя дополнительные исследования, авторы пришли к выводу о необходимости использовать в комплексе показатели скорости и импеданса для повышения точности диагностики [38]. J. Alkazar и соавт. [39] также обнаружили
263
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Таблица 9.3. Допплерометрические показатели внутриопухолевого кровотока в доброкачественных и злокачественных новообразованиях яичников [10]
Показатель Доброкачественные опухоли Злокачественные опухоли Р
Vmax, см/с 13,9 ±9,2 3,9-43,6 29,9 ± 16,6 3,6-182,0 <0,01
Vmeanj СМ/С 8,6 ±6,1 2,4-27,6 19,4± 15,1 2,6-78,4 <0,01
RI 0,53 ± 0,09 0,42-0,77 0,35 ±0,19 0,09-1,00 <0,01
PI 1,05 ± 0,32 0,55-1,85 0,56 ±0,51 0,10-2,4 <0,01
VVmax, см/с 3,64± 1,17 1,4-12,2 8,53 ± 1,07 2,1-45,8 <0,05
достоверную разницу Vmax между доброкачественными и злокачественными опухолями яичников (27,3 ± 11,8 и 45,3 ± 22,6 см/с соответственно).
Наши исследования подтвердили достоверность различий между показателями Vmean в доброкачественных и злокачественных опухолях яичников (см. табл. 9.3, рис. 9.10).
Минимальный индекс резистентности внутриопухолевого артериального кровотока (Rlmin)- Учитывая, что практически все авторы, исследовавшие минимальные значения RI в опухолях яичников, получили достоверные различия этого показателя между злокачественными и доброкачественными новообразованиями яичников, с 1991 г. стали предлагаться различные пороговые значения этого показателя для дифференциальной диагностики онкологической патологии яичников. Сразу следует обратить внимание, что, учитывая разницу в средних показателях RI в злокачественных опухолях, варьировавшую у различных авторов от 0,33 до 0,5, соответственно и предлагаемые пороговые значения RI колебались от 0,4 до 0,8.
По нашим данным, в доброкачественных и злокачественных опухолях показатели Rlmin составили 0,53 и 0,35 соответственно (см. табл. 9.3, рис. 9.11,9.12).
Минимальный пульсационный индекс внутриопухолевого артериального кровотока (Plmin). Наиболее низкие средние значения PI в злокачественных опухолях (0,45) приводят L.E. Timor-Tritsch и соавт. [40], тогда как в доброкачественных новообразованиях этот показатель составил 1,15. А.С. Fleisher и соавт. [35] предложили пороговое значение PI <1,0.
Мы также получили достоверные отличия этого показателя между доброкачественными и злокачественными новообразованиями (см. табл. 9.3, рис. 9.11).
Отсутствие дикротической выемки. При анализе кривой скорости кровотока в сосудах злокачественных новообразований описывается отсутствие дикротической выемки, тогда как в кривых кровотока сосудов доброкачественных опухолей она есть [35].
264
IX. Злокачественные опухоли яичников
Рис. 9.10. Дифференциальная ультразвуковая диагностика Допплерометрические показатели, а -показатели кровотока в солидном компоненте опухоли (стрелка): Vmax 51 см/с, Vmean 30 см/с; б - показате-ли кровотока в перегородке преимущественного кистозного компонента опухоли (стрелка): Vniax 22 см/с.
Рис. 9.11. Дифференциальная ультразвуковая диагностика. Допплерометрические показатели, а - показатели кровотока в солидном компоненте опухоли (стрелка). В зоне интереса расположено множество новообразованных сосудов мелкого диаметра, поэтому в окне «sample volume» оказались артерия (RI 0,36) и вена (Wmax 8 см/с); б - показатели кровотока в солидном компоненте опухоли (стрелка): RI 0,2, PI 0,21.
265
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.12. Дифференциальная ультразвуковая диагностика. Допплерометрические показатели. В главе I мы обращали внимание на снижение RI от периферии к центру опухоли. В данном случае этого не произошло, а - показатели кровотока в перегородке кистозного компонента на периферии опухоли (стрелка): RI 0,29; б - показатели кровотока в перегородке кистозного компонента ближе к центру опухоли (стрелка): RI 0,29.
Максимальная скорость внутриопухолевого венозного кровотока (Wmax). Нами впервые были описаны достоверные отличия показателя Wmax между доброкачественными и злокачественными опухолями яичников [41-43]. Как оказалось, максимальная скорость внутриопухолевого венозного кровотока в доброкачественных новообразованиях была гораздо ниже по сравнению со злокачественными (см. табл. 9.3, рис. 9.13).
На наш взгляд, этот критерий может иметь очень важное вспомогательное значение. Дело в том, что при очень низкой резистентности внутриопухолевого сосудистого русла иногда бывает очень трудно уверенно определить тип кривой скорости кровотока, который может иметь неопределенный ламинарный характер. В наших исследованиях в 3% злокачественных опухолей определялся именно только такой, неопределенный тип допплеровской кривой, похожей на венозный, но с неровным верхним контуром. Однако во всех случаях такого типа кривой кровотока определялись показатели скорости более 6 см/с.
Допплеровские артефакты. Дополнительные трудности при использовании допплерографии для диагностики овариальной малигнизации могут представить допплеровские артефакты (см. подробно о них в I главе 1 -го тома). Так, при цветовой/энергетической допплерографии существенную помеху может представить артефакт вспышки, дающий иллюзию внутриопухолевого кровотока (рис. 9.14).
Другой своеобразный артефакт был обнаружен нами в нескольких злокачественных опухолях (из более чем тысячи обследованных с помощью допплерографии). Мы полагаем, что он связан с локусом высокоскоростного
266
IX. Злокачественные опухоли яичников
Рис. 9.13. Дифференциальная ультразвуковая диагностика. Допплерометрические показатели. Wmax = 80 см/с в солидном компоненте опухоли (стрелка).
Рис. 9.14. Дифференциальная ультразвуковая диагностика. Допплеровские артефакты. а - артефакт вспышки (стрелка) искажает и скрывает истинную картину неоваскуляризации; б -артефакт мерцания (стрелка). Особенностью данного артефакта является его стойкая локализация в одном месте, а также сохранение независимо от показателя PRF; в данном случае артефакт выглядит «одиноким цветным пятном» ввиду максимального показателя PRF (при низких значениях PRF в рамке опроса цветовой допплерографии визуализировались множественные цветные пятна, что свидетельствовало о выраженной неоваскуляризации). Допплеровская развертка (черная стрелка) демонстрирует беспорядочные вертикальные линии независимо от настройки PRF. Поскольку данный артефакт встречался исключительно в злокачественных опухолях с выраженной неоваскуляризацией, мы предполагаем, что так выглядит кровоток в шунтирующем сосуде с очень высокой скоростью и турбулентностью.
267
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ * Курс лекций
Таблица 9.4. Показатели диагностической значимости самостоятельных пороговых значений RlITljr [10]
Пороговое значение RI Чувствительность, % Специфичность, % Прогностическая ценность, % Точность, %
положительного теста отрицательного теста
0,40 67,2 96,3 93,5 78,8 83,4
0,41 71,9 95,1 92,0 81,1 84,8
0,42 76,5 95,1 92,5 83,7 86,9
0,43 79,7 95,1 92,7 85,6 88,3
0,44 82,8 95,1 93,0 87,6 89,7
0,45 82,8 95,1 93,0 87,6 89,7
0,46 85,9 93,8 91,7 89,4 90,3
0,47 85,9 93,8 91,7 89,4 90,3
0,48 85,9 92,6 90,2 89,3 89,7
0,49 85,9 92,6 90,2 89,3 89,7
0,50 85,9 91,4 88,7 89,2 89,1
турбулентного кровотока в опухоли (см. рис. 9.14). Ввиду того что до настоящего времени нам не встретился этот артефакт ни в одном доброкачественном новообразовании, его, пожалуй, можно также считать критерием малигнизации, имеющим 100% специфичность (правда, его чувствительность близка к нулю).
Пороговые значения допплерометрических критериев малигнизации опухолей яичников.
Их изолированное и сочетанное использование (принцип «и/или»)
Таким образом, к настоящему времени разработаны десятки достаточно эффективных ультразвуковых диагностических критериев злокачественных новообразований яичников, о многих из которых рассказано выше. Однако, как показывает поучительный опыт, ни один из них не оправдал себя в полной мере при объективном клиническом использовании. Вот один из наиболее типичных примеров. В 1992 г. A. Kurjak и соавт. [44] приводят данные о высочайшей диагностической точности порогового значения RI <0,4, составившей 99% (!). На основании этих данных получается, что можно сделать вывод о решении проблемы диагностики РЯ. Однако многочисленные исследования, проведенные в последующем, дали разброс диагностической точности этого критерия от 100 до 30% (наш результат диагностической точности для RI <0,4 - 83%). Весьма показательным представляется наш собственный анализ диагностической точности различных показателей RI, используемых в качестве самостоятельных критериев дифференциальной диагностики (табл. 9.4). В свое время мы сходным образом
268
IX. Злокачественные опухоли яичников
проанализировали практически все допплерометрические критерии [10], но, наверное, нет необходимости приводить здесь эти результаты полностью (вполне достаточно RI).
Итак, при несомненной пользе большинства разработанных ультразвуковых критериев малигнизации изолированное использование любого из них не дает желанного стопроцентного эффекта. Достаточно удачным способом повышения диагностической ценности этих критериев оказалось их сочетанное использование.
Мы обратили внимание, что у авторов, использовавших пороговые допплерометрических показатели в комплексе друг с другом, а также с эхографическими критериями, чувствительность, специфичность, прогностическая ценность положительного и отрицательного результатов не опускались ниже 58, 80, 49 и 91 % соответственно. В то же время у авторов, использовавших пороговые значения RI и PI в качестве самостоятельных диагностических критериев, эти показатели падали до 13, 46, 25 и 70% соответственно [11-13, 17-25].
Нами разработаны собственные пороговые значения допплерометрических показателей внутриопухолевого кровотока (табл. 9.5). Дальнейшие проспективные исследования подтвердили, что при относительно невысокой диагностической точности пороговых значений отдельных допплерометрических показателей наибольшую точность дало их сочетание (см. табл. 9.5).
«Сочетание» (принцип «и/или») означает, что предположение о малигнизации высказывается при наличии хотя бы одного из пороговых значений вне зависимости от того, каковы величины других допплерометрических параметров. При этом точность диагностики достигает 91-94%.
Полученные нами результаты подтверждаются многими авторами. Так, одна из наиболее авторитетных европейских исследовательских групп, используя комплексные ультразвуковые критерии малигнизации, получила сходные показатели диагностической точности (93%) [45].
Комплексная система подсчета баллов для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников
На основании перечисленных выше критериев нами также разработана комплексная система подсчета баллов для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников (табл. 9.6). В ней мы постарались учесть все основные ультразвуковые критерии: эхо-структура, цветовая/энергетическая, допплерография, допплерометрические показатели.
Следует отметить, что использование этой балльной системы не повысило показатели чувствительности и специфичности по сравнению с методикой сочетанного использования ультразвуковых критериев онкологической
269
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Таблица 9.5. Показатели диагностической значимости оптимальных пороговых значений эхографических признаков и допплерометрических показателей внутриопухолевого кровотока
sp £ н о о х т О СО CD CD СО со г- СО СО со’ b-' 1-' со' СП со' г- г- СО СО 00 СТ)
Sp О4 _d н о о I I ф =г о: ф х о ф т S I— о о I о Q С отрицательного Т5 Ф СМ О СО со st CD СМ st См' st со' со' Г-' со' Г~ Г~~ Г- Г- СО СО СТ)
положительного о СМ СО st о см о о со' СП СО СО -г-' СО Т-' Г- СО СО О) СП СП СП
- С х 5 о г э-^ S ZT ф с Э СО Т- СО СО СО -Г- со Т-* СО см со со' со' см' со та та га га О) О)
х 3 о г X X) 3 со г —_ s- st со °° °?, st СО СП см' Т-' см' со' СО СО СО СО СО СО СП
Пороговое значение Эхографические признаки* Утах>19см/с Vmean СМ/С Wmax >6 см/с Plmin <0,67 Plmln <0,44 Сочетанное использование этих критериев по принципу «и/или»
ф
го о
со
ф
СК
со о та га о.
со
ф о
ф о
к
га m о та го CL со
со о
со
со
со
ф ф
°> 2
2
5 со со
со
S d ф г S X S ф ф ф X с 3 с с с X с с X ;1 I 3 ; ш i о : С : О’ L со ’ 3 I 5 : I > ф
со
та х та
2
5 со
ф
ф
2 з ф
с:
та со
го о. со
со
ф
ф
ф
ф со
ф ф та о
ф I
s ф
2
S ЕТ
I 2
ф со
т 2 X .0
5 X
со >s
ф
X X
-D S
I с;
ф
ф X
I S с; ф ф с;
ф о
I ю
S 3 с; S со
о
н S
с;
S X
с;
S н
Ф
со с
VS S
ф н
с S н о о
о X
1— со
о S
со
та L— ф
ф
X ф
2 о;
ф
ф со
-е-2 га та о. х к- со
о X о
2
ф со
ф
2
ф
5
ф
щественно эхонегативного типа.
270
IX. Злокачественные опухоли яичников
Таблица 9.6. Комплексная шкала балльной оценки опухолей яичников (пороговое значение для вывода о повышенном риске малигнизации 8 баллов и более)
Показатель Количество баллов
Смешанная эхогенность 2
Перегородки: <3 мм 1
>3 мм 2
Папиллярные включения: <4 мм 1
>4 мм 2
Солидный компонент: <10 мм 1
>10 мм 2
Кровоток в перегородке 1
Папиллярный/солидный кровоток (не по контуру опухоли) 2
Дихотомичное распределение сосудов: >1 : 2 2
^тах 8 СМ/С 2
Rlmm <0,44 2
Wmax >6 см/с 1
патологии яичников (принцип «и/или»), В конечном счете для практического использования можно выбрать одну из двух методик по своему усмотрению.
Нельзя не упомянуть о противниках количественного подхода к проблеме. Например, такой эксперт в области гинекологического ультразвука, как L. Valentin, вообще полагает, что оптимальным для дифференциации «добра и зла» в овариальных новообразованиях является субъективная оценка серошкального и допплерографического изображений [46, 47]. Отметим, что, конечно, при большом опыте работы бывает достаточно одного взгляда на эхокартину, чтобы сделать достаточно обоснованное предположение о доброкачественности или злокачественности процесса. Но такой подход неприменим для менее опытных специалистов. К тому же, будучи сторонниками доказательной медицины, мы обязаны раз за разом, перефразируя Пушкина, «поверять гармонию» диагноза «алгеброй» четких критериев.
Пограничные опухоли яичников
Пограничные опухоли яичников относятся к новообразованиям, которые нельзя отнести ни к доброкачественным, ни к злокачественным. Однако другое их определение - опухоли «потенциально низкой степени злокачественности» подчеркивает неоднозначность положительного прогноза для больной. К тому же, поскольку эти опухоли также могут распространяться за пределы яичников на брюшину и сальник, их следует считать близкими к истинно злокачественным неоплазиям. При этом почти у 70% больных с пограничными опухолями имела место I стадия заболевания [48].
27Л
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.15. Пограничная папиллярная цистаденома. а, б - В-режим. Стрелками показаны пристеночные папиллярные разрастания. Черная стрелка - артефакт реверберации, который тоже можно принять за солидный пристеночный компонент опухоли; в - энергетическая допплерография демонстрирует неоваскуляризацию в пристеночном папиллярном разрастании (стрелка).
Важной особенностью этой группы опухолей является относительно молодой возраст больных. Так, по данным Е.Г. Новиковой и Г.Ю. Батталовой [48], он составил в среднем 45 лет, при этом 61 % больных были в возрасте до 40 лет.
Особенности ультразвукового изображения
пограничных опухолей
Ультразвуковое изображение и гемодинамика пограничных серозных и муцинозных опухолей не имеют какой-то особой специфики. Большинство визуализируемых нами опухолей этого типа при использовании комплексной системы подсчета баллов для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников соответствовали злокачественным (рис. 9.15, 9.16).
Особенности эхоструктуры и гемодинамики опухолей стромы полового тяжа, которые также очень часто оказываются пограничными, представлены в VIII главе этого тома.
272
IX. Злокачественные опухоли яичников
Рис. 9.16. Трансвагинальное сканирование. Рецидив муцинозной пограничной опухоли, а, б - В-режим. Множественные перегородки в небольшой опухоли (стрелка); в - при энергетической допплерографии в перегородках определяется достаточно интенсивный кровоток (стрелка).
Таким образом, нам представляется наиболее правильным не пытаться давать ультразвуковое заключение о наличии пограничной опухоли яичника. Ультразвуковое заключение о новообразовании с высокой вероятностью малигнизации, которое скорее всего будет выставлено в этом случае, вряд ли следует считать ошибочным.
Ультразвуковое изображение злокачественных опухолей яичников различных гистологических типов (первичные и метастатические опухоли)
Определение гистологической принадлежности злокачественной опухоли вряд ли должно считаться основной задачей ультразвукового исследования. К тому же гистологические типы злокачественных опухолей редко демонстрируют какую-то особую специфику эхокартины. Тем не менее приведем несколько клинических примеров злокачественных новообразований яичников различных морфологических типов.
273
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Серозная аденокарцинома
Серозные аденокарциномы редко бывают очень большими и имеют преимущественно солидный тип строения, часто с эхонегативными включениями. В солидном компоненте почти всегда можно обнаружить допплерографические признаки неоваскуляризации с кровотоком центрального типа (рис. 19.17). М.А. Чекалова и В.М. Зуев [15] отмечают, что характерной особенностью таких опухолей является образование с маткой единого опухолевого конгломерата, когда матка буквально «замурована» в опухолевых массах и визуализируется неотчетливо. Мочевой пузырь при этом наполняется недостаточно, определяется утолщение пузырно-маточной складки. Границы опухоли удается проследить не на всем протяжении, контуры часто нечеткие из-за подпаянных петель кишечника
Серозная папиллярная цистаденокарцинома
Эта опухоль обычно развивается на фоне предшествующей серозной цистаденомы, считается, что ее частота составляет 70% от всех злокачественных овариальных неоплазий. Средний возраст больных около 50 лет.
Считается, что одной из особенностей ультразвукового изображения этой опухоли являются многокамерность, а также пристеночные папиллярные разрастания неправильной формы, часто по типу «цветной капусты». Папиллярные разрастания зачастую располагаются не только по внутренней, но и по наружной поверхности опухоли. Практически всегда удается визуализировать кровоток в перегородках, а также в солидном компоненте опухоли. Вместе с тем нам нередко удавалось визуализировать серозные папиллярные цистаденокарциномы однокамерного типа, при этом в них всегда определялся выраженный солидный компонент (рис. 9.18-9.20).
Поверхностная папиллярная цистаденокарцинома
Поверхностная папиллярная цистаденокарцинома встречается редко, преимущественно у молодых и бесплодных женщин. Поверхность яичника
Рис. 9.17. Серозная аденокарцинома. Опухоль (в стрелках) имеет преимущественно солидный тип эхоструктуры с эхонегативными включениями, с допплерографическими признаками неоваскуляризации. Кровоток центрального типа (черная стрелка).
274
IX. Злокачественные опухоли яичников
Рис. 9.18. Три случая серозной папиллярной цистаденокарциномы больших размеров. Стрелками показаны большие пристеночные папиллярные разрастания неправильной формы Черными стрелками указаны реверберационные артефакты.
Рис. 9.19. а-е - шесть случаев серозной папиллярной цистаденокарциномы. Неоваскуляризация в солидном компоненте опухоли (стрелки). Черной стрелкой на рис. а указано сочетание кровотока по контуру опухоли с артефактом вспышки, на рис. б, в - реверберационные артефакты.
275
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.19 (окончание).
2.76
IX. Злокачественные опухоли яичников
Рис. 9.20. Серозная папиллярная цистаденокарцинома (стрелка), а - кровоток в перегородке. RI 0,41; б - кровоток в солидном компоненте опухоли. RI 0,35.
при этом макроскопически приобретает бархатчатый или бородавчатый характер. Процесс часто имеет гнездный тип [49].
При ультразвуковом исследовании визуализировать поверхностные папиллярные разрастания бывает очень трудно, особенно когда опухоль возникает на фоне не увеличенного яичника. Однако этот морфологический тип быстро дает метастазирование по брюшине и асцит, что способствует установлению диагноза, к сожалению, часто уже запоздалого (рис. 9.21).
Злокачественная серозная аденофиброма
Опухоль часто возникает в предшествующей фиброме яичника. Иначе говоря, гистологически это часто сочетание аденокарциномы с фибромой или текомой [49]. В нашем наблюдении опухоль этого гистологического типа имела эхоструктуру, сходную с прочими злокачественными опухолями солидного строения. При этом злокачественная серозная аденофиброма отличалась несколько более высокой эхогенностью. Васкуляризация опухоли выглядела относительно скудной, хотя наблюдался характерный для злокачественного роста центральный тип (рис. 9.22).
277
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.21. Маленькая поверхностная папиллярная цистаденокарцинома с карциноматозом брюшины. Это клиническое наблюдение обнажает фатальность онкологического процесса. Женщина 36 лет, страдающая сахарным диабетом 1-го типа, не имевшая беременностей, длительное время не жившая половой жизнью, обратилась с жалобами на чувство тяжести в животе через 2 мес после успешной защиты докторской диссертации и избрания на должность заведующей кафедры, а - в брюшной полости определяется около 3 л свободной жидкости. Левый яичник выглядит немного увеличенным, с двумя небольшими кистозными включениями (1). В проекции стромы яичника определяется интенсивный кровоток (стрелка). Vmax 18 см/с, RI 0,39. 2 - асцитическая жидкость. Черной стрелкой указан неровный, чуть бугристый контур яичника; б - в проекции дугласова пространства определяется участок карциноматоза средней эхогенности (1) с интенсивной неоваскуляризацией (RI 0,35). 2 -асцитическая жидкость; 3 - фрагмент яичника.
278
IX. Злокачественные опухоли яичников
Рис. 9.22. Злокачественная серозная аденофиброма. Опухоль (в стрелках) имеет преимущественно солидный тип эхоструктуры (средней и повышенной эхогенности) с единичными мелкими эхонегативными включениями, с допплерографическими признаками неоваскуляризации. Кровоток центрального типа (черная стрелка).
Муцинозная цистаденокарцинома
Муцинозная цистаденокарцинома обычно развивается на фоне предшествующей муцинозной цистаденомы, составляя 10-15% от всех злокачественных опухолей яичников. Средний возраст больных около 50 лет. Эти опухоли часто достигают очень больших размеров, они многокамерные. Камеры опухоли, особенно маленькие, нередко замещены опухолевой тканью, а в больших камерах опухолевая ткань может наблюдаться в виде узлов на ее стенке [4].
Для эхоструктуры опухоли характерны множественные, неравномерно утолщенные перегородки на фоне анэхогенного содержимого с неравномерной эховзвесью (рис. 9.23, 9.24). Эффект эховзвеси иногда бывает настолько выраженным, что его можно принять за солидный компонент опухоли. Для дифференциации в этом случае может помочь энергетическая допплерография, демонстрирующая признак «акустического течения» (см. подробнее о нем в I главе 1 -го тома). Большое количество толстых перегородок может придавать эхокартине опухоли ячеистый рисунок (или «пчелиных сот»). Следует отметить, что размеры камер могут быть не обязательно маленькими, их диаметр часто варьирует от 1 до 10 см [15]. В перегородках всегда удается визуализировать кровоток (см. рис. 9.23).
Эндометриоидная цистаденокарцинома
Эндометриоидные опухоли яичников развиваются из герминальных кист и включений, локализующихся в яичниках, а также из имплантов эндометрия в ткань яичников, т.е. из эндометриоза. В главе, посвященной эндометриозу, мы уже упоминали об определенном злокачественном потенциале этого заболевания. Средний возраст больных с эндометриоидными опухолями относительно молодой и составляет 42 года. Опухоли эти редкие. Морфологически эндометриоидная цистаденокарцинома представлена кистозным компонентом с коричневым содержимым, солидная часть имеет пестрый вид с кровоизлияниями [4].
В приведенном нами случае опухоль имеет большие размеры, солиднокистозный тип эхострукуры с типичной внутренней неоваскуляризацией (рис. 9.25).
279
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.23. Четыре случая муцинозной цистаденокарциномы (а-г). Обращают на себя внимание множественные неравномерно утолщенные перегородки (стрелка) на фоне анэхоген-ного содержимого с неравномерной эховзвесью (1). На рис. в: 2 - асцитическая жидкость. На рис. г большое количество толстых перегородок придает эхокартине опухоли ячеистый рисунок. Кровоток в перегородке (черная стрелка): RI 0,39.
Рис. 9.24. Муцинозная цистаденокарцинома. Стадия НБ. Дифференцировка G1. Возраст больной 41 год. а - трансабдоминальное сканирование. 1 - опухоль; 2 - брюшная стенка; 3 -латеральная боковая тень от стенки опухоли; б - продольное трансвагинальное сканирование. 1 - опухоль, 2 - матка; 3 - асцит; 4 - тонкая кишка; 5 - толстая кишка.
280
IX. Злокачественные опухоли яичников
Рис. 9.25. Эндометриоидная цистаденокарцинома. Стадия ИБ. Дифференцировка G2. Возраст больной 40 лет. а - трансабдоминальное продольное сканирование. 1 - опухоль; 2 -брюшная стенка; 3 - матка; б - трансвагинальное сканирование. 1 - опухоль; 2 - шейка матки; 3 - асцит; 4 - кишечник; в - трансабдоминальное продольное сканирование с энергетической допплерографией в режиме Zoom. Стрелкой указана неоваскуляризация; г - трансвагинальное сканирование с энергетической допплерографией. Стрелкой указана неоваскуляризация. RI 0,37.
28Л
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Смешанные эпителиальные злокачественные опухоли яичников
Смешанные эпителиальные злокачественные опухоли яичников состоят из сочетания из сочетания двух и более из описанных выше эпителиальных опухолей. Считается, что прогноз при злокачественной смешанной эпителиальной опухоли более благоприятен, чем при каком-либо определенном гистологическом типе карциномы яичника [4].
Опухоли этой группы часто достигают больших размеров, их эхоструктура отличается многообразием (рис. 9.26, 9.27).
Дисгерминома
Это самая частая злокачественная герминогенная опухоль. Чаще всего эта опухоль наблюдается у детей и молодых женщин (средний возраст больных 21 год), составляет 2-3% от всех злокачественных опухолей яичников. Опухоль обычно односторонняя. Прогноз при дисгерминомах считается относительно благоприятным, особенно при гистологической однородности опухоли [4]. Величина опухоли может быть любой, консистенция плотноэластическая или мягкая с участками некроза и кровоизлияний [49]. Гормонально эти опухоли обычно неактивны.
Эхографически это, как правило, большое солидное образование с неровными бугристыми контурами, дольчатого типа эхоструктуры. На фоне «долей» средней и/или пониженной эхогенности могут определяться мелкие гипо- или анэхогенные включения - обычно это участки ишемии и некроза (рис. 9.28). В солидном компоненте опухоли всегда удается визуализировать кровоток со всеми особенностями неоангиогенеза (см. рис. 9.28, в).
Дисгерминома-семинома
Данный вариант развивается чаще у молодых женщин и подростков, страдающих инфантилизмом, замедленным половым развитием, нередко с признаками псевдогермафродитизма [49]. Диагноз может быть и не совсем женским, например при дисгенезии гонад. Ультразвуковое изображение дисгерминомы-семиномы представлено на рис. 9.29.
Метастатические опухоли яичников
Считается, что в яичники могут метастазировать злокачественные опухоли любой локализации, хотя преобладающими источниками являются желудочно-кишечный тракт и молочные железы. Довольно часто метастатические опухоли (опухоли Крукенберга) бывают двусторонними. Они составляют примерно 8-10% от всех злокачественных опухолей яичников.
Эхографически это опухоли относительно небольших размеров округлой или овоидной формы. Как отмечают М.А. Чекалова и В.М. Зуев [15], эти опухоли часто повторяют форму яичника. Метастатические опухоли небольших размеров обычно имеют преимущественно солидное строение, с увеличением размера опухолей эхоструктура приобретает кистозно-солидный характер (рис. 9.30-9.32).
282
IX. Злокачественные опухоли яичников
Рис. 9.26. Трансвагиналь-ное сканирование с энергетической допплерографией. Нижний полюс большой смешанной эпителиальной цистаденокарциномы, выполняющей значительную часть брюшной полости. В одной из камер эффект мелкодисперсной взвеси за счет муцинозного содержимого (1). Перегородки неравномерно утолщены до 3-4 мм. В них определяется неоваскуляризация (стрелки).
Рис. 9.27. Большие смешанные эпителиальные злокачественные опухоли яичников. Трансабдоминальное сканирование. Опухоли имеют характерный тип эхоструктуры: преимущественно средняя эхогенность с включениями всех типов эхогенности.
283
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.28. Дисгерминома. Возраст больной 15 лет. а, б - трансабдоминальное сканирование. Большая опухоль солидно-кистозного типа эхоструктуры; в - неоваскуляризация Vmax21 см/с.
284
IX. Злокачественные опухоли яичников
Рис. 9.29. Дисгерминома -семинома. Возраст больной 16 лет. а: 1 - опухоль размером 6 х 4 см (40 см3); 2 -неоваскуляризация; б -Vmax 18 см/с.
Рис. 9.30. Опухоли Крукенберга, а - трансабдоминальное сканирование. 1 - опухоль правого яичника солидно-кистозного типа эхоструктуры; 2 - матка; 3 - асцит; 4 - акустические артефакты от примыкающих петель тонкой кишки; 5 - псевдоусиление эхосигнала дистальнее опухоли; б - трансвагинальное сканирование. 1 - опухоль правого яичника; 2 - матка; 3 -асцит.
285
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.30 (окончание), в -трансвагинальное сканирование. 1 - опухоль левого яичника; 2 - матка; 3 - асцит; 4 - тонкая кишка; г - трансвагинальное сканирование, энергетическая допплерография. 1 - опухоль правого яичника; 2 - матка. Стрелкой указана интенсивная неоваскуляризация опухоли.
Рис. 9.31. Опухоль Крукенберга односторонняя, солидно-кистозного типа эхоструктуры (стрелка), с неоваскуляризацией (черная стрелка).
286
IX. Злокачественные опухоли яичников
Рис. 9.32. Опухоли Крукенберга. а - опухоль правого яичника солидно-кистозного типа эхоструктуры (стрелка) с выраженной неоваскуляризацией: цветовые сигналы выполняют практически весь солидный компонент опухоли; б - опухоль левого яичника несколько меньшего размера, солидно-кистозного типа эхоструктуры (стрелка). В брюшной полости свободная жидкость. В малом тазу определяется небольшой карман свободной жидкости (черная стрелка).
По нашему опыту, по всех случаях метастатических опухолей яичников при допплеровском исследовании всегда определялась очень интенсивная внутри опухолевая неоваскуляризация, субъективно более выраженная по сравнению с первичными злокачественными опухолями (см. рис. 9.30, 9.31).
Особенности ультразвукового изображения злокачественных опухолей яичников в зависимости от стадии. Диагностика рецидивов онкологического процесса
Хорошо известны три типа распространения РЯ [6]:
1. Непосредственный рост опухоли с прорастанием капсулы и переходом на соседние органы. Опухоль может прорастать в просвет прямой кишки, надвлагалищную часть шейки матки, а также в тазовую клетчатку и область больших сосудов при межсвязочной локализации новообразования.
2. Диссеминация процесса по брюшине, в первую очередь тазовой (прямокишечно-маточное углубление и широкие связки), затем сальника, висцеральной и париетальной брюшины.
287
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.33. Маленькая серозная папиллярная цист-аденокарцинома (стрелки). Неоваскуляризация определяется как по периферии (1), так и в солидном компоненте опухоли (2).
Рис. 9.34. Маленькая серозная папиллярная цист-аденокарцинома. а - относительно большой солидный компонент (1), выполняющий почти всю опухоль; 2 -кистозный компонент опухоли. Стрелкой указана неоваскуляризация в солидном компоненте; б - RI 0,32.
288
IX. Злокачественные опухоли яичников
3. Лимфогенное распространение: парааортальные, затем забрюшинные лимфатические узлы, оттуда в главный лимфатический проток. В процесс могут вовлекаться лимфатическая система верхнего отдела брюшной и плевральной полостей, надключичные и шейные лимфатические узлы, преимущественно левосторонние.
Важно подчеркнуть, что размеры и особенности эхоструктуры и васкуляризации опухоли далеко не всегда корреллируют со стадией заболевания. Часто 1-11 стадия заболевания выявляется при больших, иногда гигантских новообразованиях, в то время как опухоли небольших, порой микроскопических размеров имели III—IV стадию [15].
Конечно, современная высокоразрешающая аппаратура в сочетании с правильно организованной диспансеризацией групп риска все чаще и чаще позволяет визуализировать маленькие злокачественные опухоли на I стадии (рис. 9.33-9.35).
Вообще диагностика I стадии РЯ - это часто решение проблемы визуализации целостности капсулы злокачественной опухоли яичника. При этом опухоль может иметь как маленькие, так и достаточно большие размеры, а также разнообразную внутреннюю эхоструктуру. Тщательное изучение контуров опухоли с целой капсулой (без прорастания) выявляет их достаточную четкость, ровность, отсутствие жидкости в малом тазу и брюшной полости, а также признаков карциноматоза (рис. 9.36). В большинстве случаев при таких опухолях могут определяться нормальные показатели опухолевого онкомаркера СА-125.
Первичный рак яичников
Иная ситуация наблюдается при так называемом первичном РЯ, когда опухоль возникает в не увеличенном органе (а не имеющейся уже кистоме). Такой вариант рака отличается очень агрессивным течением. Обычно это двусторонний процесс. При даже еще небольших размерах опухоли быстро развиваются асцит, карциноматоз брюшины, сальника, отдаленные метастазы. На рис. 9.37 представлено клиническое наблюдение первичного РЯ. Кстати, описанный выше вариант поверхностной папиллярной цистадено-карциномы тоже можно уверенно отнести к агрессивному типу первичного рака (см. рис. 9.21). Известен и «невидимый» вариант эхокартины первичного рака, когда яичники выглядят совершенно не увеличенными и даже уменьшенными в размерах, на фоне выраженного асцита и карциноматоза. Эхоструктура яичников при этом не отличается от нормы, а размеры опухоли оказываются микроскопическими. Онкологи иногда называют такой вариант РЯ «асцитным». Один из возможных механизмов патогенеза «невидимого асцитного» РЯ, как уже отмечалось ранее, - супрессорное действие метастазов на первичный очаг [9].
289
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.35. Два случая маленькой муцинозной цист-аденокарциномы. а - опухоль (в стрелках). Несмотря на маленькие размеры опухоли, сопоставимые с размером не увеличенного яичника, в эхоструктуре опухоли преобладают множественные неравномерно утолщенные перегородки, сливающиеся друг с другом; б - множественные неравномерно утолщенные перегородки (стрелка), неоваскуляризация в перегородках (черная стрелка).
Рис. 9.36. Относительно большая серозная цистаденокарцинома с нормальными показателями СА-125 (26 нг/л). I стадия онкологического процесса, а - солидный (1) и кистозный (2) компоненты опухоли; б - интенсивная неоваскуляризация в солидном компоненте (стрелки).
290
IX. Злокачественные опухоли яичников
Рис. 9.37. Двусторонняя серозная аденокарцинома яичников с асцитом по типу первичного рака, а - опухоль правого яичника небольших размеров, неправильной формы, средней эхогенности (1), с интенсивной неоваскуляризацией (стрелка); 2 - асцитическая жидкость; 3 - петля кишечника; б - опухоль левого яичника небольших размеров, неправильной формы, средней эхогенности (1), с эхонегативными включениями (2), с интенсивной неоваскуляризацией (стрелка); 3 - асцитическая жидкость; 4 - петля кишечника; в - RI 0,38.
294
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Определение распространенности злокачественного процесса. Метастазы рака яичников
Ультразвуковое исследование оказывает неоценимую помощь в определении степени распространенности онкологического процесса, исходящего из яичников.
На рис. 9.38 представлено наблюдение РЯ с прорастанием стенки прямой кишки. При наличии жидкости в малом тазу и брюшной полости можно уверенно визуализировать карциноматоз как висцеральной, так и париетальной брюшины. Отметим, что небольшие диссеминаты обычно имеют достаточно однородную среднюю эхогенность, форма их при этом может быть разной: «папиллярное разрастание», «цветная капуста», «валик» и пр. (рис. 9.39-9.41). Допплерографически в большинстве диссеминатов удается визуализировать неоваскуляризацию (см. рис. 9.39, д,е, 9.41).
Ультразвуковой визуализации успешно поддаются метастатические изменения в брюшной полости, сальнике, передней брюшной стенке, печени, лимфатических узлах различной локализации (рис. 9.42).
Рецидивы злокачественных опухолей яичников
Ультразвуковая диагностика весьма эффективна при выявлении рецидивов РЯ. Главное при поиске возврата опухоли - это тщательное, неторопливое обследование как малого таза, так и органов всей брюшной полости, а также забрюшинного пространства.
Обычно рецидивы РЯ определяются как новообразования небольших размеров (минимальные размеры рецидивирующей опухоли, которые удается визуализировать, составляют несколько миллиметров). Правда, все зависит от локализации. При рецидиве в малом тазу, особенно с асцитом, легко визуализируются опухоли диаметром не более 5-6 мм. Кстати, так называемая прикультевая область - наиболее типичное место локализации рецидива (рис. 9.43, 9.44).
Определить рецидивы в брюшной полости, особенно без асцита, нередко удается только начиная с 2-3 см. В рецидивах, расположенных в малом тазу, почти всегда удается визуализировать неоваскуляризацию (см. рис. 9.43, 9.44). Параллельно с данными ультразвуковой диагностики в выявлении рецидивов большое значение имеет определение уровня онкомаркера СА-125. Этот биохимический показатель не обладает достаточной эффективностью при диагностике первичного рака, однако в данном случае его использование оправдано.
Вопросы скрининга рака яичников
Проблема эффективного скрининга РЯ разрабатывается довольно давно [50-56]. Ввиду клинической манифестации заболевания только на поздних стадиях в качестве одного из возможно эффективных способов диагностики РЯ на I стадии рассматривается скрининг всей женской популяции.
292
IX. Злокачественные опухоли яичников
Рис. 9.38. Трансвагиналь-ное продольное сканирование. Рак яичника с вовлечением прямой кишки. 1 -матка; 2 - большая опухоль позади матки.
Рис. 9.39. Трансабдоминальное сканирование Карциноматоз брюшины. Опухолевые диссеминаты указаны стрелками. 1 - асцит; 2 - реверберационный артефакт; 3 - кишечник, а - по париетальной брюшине; б-е - по висцеральной брюшине; в - карциноматоз (стрелка) выглядит в виде изоэхогенного слоя неравномерной толщины, «окутывающего» кишечник.
293
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.39 (окончание).
д - тот же случай, что и на рис. в. Допплерографически в диссеминатах определяется интенсивная неоваскуляризация; е - RI 0,42, PI 0,63.
Рис. 9.40. Трансвагинальное сканирование. Карциноматоз брюшины малого таза, а: 1 - диссеминаты; 2 -асцит; 3 - матка.
294
IX. Злокачественные опухоли яичников
Рис. 9.40 (продолжение). б - диссеминаты указаны стрелками. 1 - асцит; в: 1 -асцит с выраженной дисперсной эховзвесью; 2 - петли тонкой кишки; г - продольное сагиттальное сканирование. 1 - диссеминат в прямокишечно-маточном пространстве; 2 - асцит; 3 -матка с незначительной се-розометрой; 4 - петли тонкой кишки.
295
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.40 (окончание).
д - тот же случай, что и на рис. г. Продольное сканирование несколько лате-ральнее сагиттального. 1 -диссеминат в прямокишечно-маточном пространстве; 2 - асцит; 3 - латеральный отдел шейки матки; 4 - петли тонкой кишки.
Рис. 9.41. Трансвагинальное сканирование с энергетической допплерографией. Карциноматоз брюшины малого таза. а: 1 - диссеминат; 2 - неоваскуляризация; 3 -асцит; б - диссеминат с неоваскуляризацией (стрелка). 1 - асцитическая жидкость с признаком дисперсной эховзвеси.
296
IX. Злокачественные опухоли яичников
Рис. 9.41 (окончание).
в: 1 - диссеминат; 2 - нео-васкуляризация; 3 - асцит; 4 - прямая кишка; г: 1 - диссеминат в прямокишечноматочном пространстве; 2 -неоваскуляризация; 3 - асцит; 4 - матка; д: 1 - диссеминат; 2 - неоваскуляризация; 3 - асцит; 4 - кровоток в расположенном рядом подвздошном сосуде.
297
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.42. Отдаленные метастазы рака яичника (стрелки). Трансабдоминальное сканирование. а, б - брюшная полость; в - сальник и передняя брюшная стенка; г - паренхима печени; д - по краю печени; е - парааортальные лимфатические узлы. В режиме цветовой допплерографии визуализируется кровоток в аорте. В данном случае без использования цветовой допплерографии отличить почти эхонегативные увеличенные лимфатические узлы и просвет сосуда очень трудно.
298
IX. Злокачественные опухоли яичников
Рис. 9.43. Рецидивы рака яичников. Трансвагинальное сканирование а -инвазия стенки толстой кишки. 1 - опухоль; 2 - стенка кишки; б-г - новообразования солидно-кистозного типа эхоструктуры (стрелка) с неоваскуляризацией (черная стрелка), определяемые в непосредственной близости от культи шейки матки или культи влагалища.
299
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
Рис. 9.44. Рецидивы рака яичников, а - опухоль неправильной формы, средней эхогенности (стрелка). Неоваскуляризация (черная стрелка) RI 0,39, PI 0,50; б -опухоль (в стрелках) с интенсивной неовасакуляри-зацией. Vmax 37 см/с.
В настоящее время основными (из имеющихся) методами овариального скрининга считаются трансвагинальное ультразвуковое исследование и определение уровня биохимического онкомаркера СА-125.
Биохимический онкомаркер СА-125
Онкомаркер СА-125 (Carcinoma Antigen-125) является основным опухолевым маркером эпителиального РЯ, представляя собой антиген фетального амниотического и целомического эпителия. Подчеркнем, что он не будет реагировать на злокачественные опухоли других гистологических групп (например, герминогенные и стромы полового тяжа). Уровень СА-125 определяется в сыворотке крови путем иммунологического исследования. Верхняя граница нормы - 35 МЕ/мл. К сожалению, этот антиген является весьма низкоспецифичным, реагируя далеко не только на РЯ.
Причины ложноположительного повышения уровня СА-125 при скрининге РЯ очень разнообразны [53]:
Гинекологические заболевания:
• эндометриоз;
• миома;
• геморрагические кисты яичников;
• менструация;
• острое воспаление органов малого таза;
• I триместр беременности.
Злокачественные опухоли другой локализации:
• эндометрий;
• поджелудочная железа;
300
IX. Злокачественные опухоли яичников
• мочевой пузырь;
• молочная железа;
• печень;
• легкие.
Воспалительные заболевания:
• перикардит;
• системная красная волчанка;
• синдром Шегрена;
• узловой полиартериит;
• дивертикулит;
• колит;
• острый панкреатит;
• активный хронический гепатит.
Прочие:
• болезни почек;
• цирроз.
Таким образом, определение уровня СА-125 вряд ли стоит считать эффективным скрининговым пособием для доклинической диагностики РЯ, хотя, как уже отмечалось выше, метод оправдывает себя при мониторинге больных после лечения.
Ультразвуковой скрининг рака яичников
В настоящее время Американская коллегия превентивной медицины не рекомендует использовать с целью овариального скрининга асимптомных женщин ни определение уровня онкомаркера СА-125, ни трансвагинальную эхографию. Применение названных методик считается допустимым для овариального скрининга в группах риска, хотя их эффективность считается неочевидной [54].
Прошу не удивляться тому, что я начинаю раздел, посвященный ультразвуковому скринингу РЯ, со столь пессимистичного резюме. Необходимо признать, что уточняющая диагностика 2-го уровня, проводимая опытным врачом с использованием высококлассной аппаратуры (чему большей частью и посвящена эта глава), и скрининг женской популяции - разные вещи. Даже в высокоразвитых странах чрезвычайно трудно добиться соблюдения единого стандартного протокола исследования. А если мы вспомним об очень различающихся по классу приборах, которыми оснащены разные клиники как России, так и всего мира, а также об отличающихся по своей квалификации врачах-диагностах, то причины недостаточной эффективности ультразвукового скрининга станут еще более очевидны.
Простой пример: чтобы наладить ежегодный ультразвуковой скрининг женской популяции старше 40 лет только во Владимирской области, нужно проводить примерно 2000 исследований ежедневно, для чего задействовать на полный рабочий день почти сотню врачей и как минимум 50 приборов (при работе в две смены). Для справки: во всей Владимирской области сертификат врача ультразвуковой диагностики имеют примерно 200 докто
зол
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
ров, а также имеется около 40 приборов с возможностью трансвагинальной допплерографии. Полагаю, что в других регионах нашей страны ситуация не сильно отличается от таковой во Владимирской области.
Отметим, что в ряде стран Западной Европы, а также в Японии и Америке проводились попытки ультразвукового гинекологического скрининга, по своему масштабу сопоставимого с общепопуляционным. Расскажем о результатах последних из них, проведенных в Японии и США. Н. Kobayashi и соавт. [55] приводят данные о скрининге 41 688 асимптомных женщин (группа рандомизирована, средний возраст 58 лет) с использованием онкомаркера СА-125 и трансвагинальной эхографии. Скрининг проводился в течение нескольких лет. Выявляемость РЯ составила 3,8-7,4 случая заболевания на 10 000 обследованных. Если сравнить эти данные с показателями общемировой статистики заболеваемости (ежегодно 1 новый случай клинической манифестации на 10 000 женской популяции), то результаты скрининга впечатляют. Однако «другой стороной медали» явилось то, что на 1 случай выявленного РЯ пришлось 33 хирургических вмешательства (!), выполненных на основании ложноположительных результатов скрининга.
Е. Partidge и соавт. [54] приводят сходные итоги скринингового ультразвукового обследования 34 261 асимптомной женщины старше 55 лет (критериями положительного результата были: объем яичника более 10 см3; в случае визуализации кисты - ее объем более 10 см3; солидный компонент или папиллярное включение в кистозном образовании любого размера). Прогностическая ценность положительного результата (для РЯ) составила 1-1,3% (!). Количество операций на 1 случай выявленного рака было меньше, чем у японских авторов, но также впечатляющим - 19,5 вмешательств. Однако, пожалуй, самым негативным результатом исследования Е. Partidge и соавт. стали результаты определения стадии выявленных в результате скрининга случаев РЯ. Только 28% злокачественных опухолей были выявлены на I-II стадии, остальные 78% случаев рака имели уже III—IV стадию.
Таким образом, становится понятным вопрос, которым задавались и задаются многие авторы: во благо или во зло скрининг? [56]. (По крайней мере в том виде, в каком его пытаются проводить в настоящее время.)
Однако в свете изложенного выше ситуация с ультразвуковым скринингом мне лично не представляется столь плачевной. Ведь если посмотреть на результаты скрининга, поданным Е. Partidge и соавт. [54] и Н. Kobayashi и соавт. [55], и не только с позиции выявления рака, а с точки зрения выявленной доброкачественной патологии, то окажется, что в большинстве случаев оперативные вмешательства были выполнены достаточно обоснованно. А если мы вспомним, что до 80% РЯ возникает в уже существующих доброкачественных опухолях, то вообще получается, что авторы цитированных выше работ провели успешную профилактику РЯ весьма большой когорте женщин.
Очевидно, что проблема скрининга РЯ остается открытой, но не менее очевидно, что высокоразрешающая ультразвуковая диагностика (в сочетании с разнообразными допплеровскими методиками) будет играть в ее решении не последнюю роль.
302
IX. Злокачественные опухоли яичников
Заключение
Диагностика опухолей яичников как клинически, так и гистологически архитрудна...
А.Е. Колосов [49]
Я начинаю и заканчиваю эту главу высказываниями врача ультразвуковой диагностики и врача-патолога о серьезных трудностях при верификации овариальных неоплазий. Несмотря на это, я очень высоко оцениваю значение нашего метода в данной области.
Надеюсь, что мне удалось продемонстрировать в этой главе объективные возможности ультразвуковой диагностики для дифференциации доброкачественных и злокачественных новообразований яичников, а также раннего выявления овариальной малигнизации.
Дополнительным залогом этого оптимизма являются результаты многолетнего плодотворного сотрудничества с врачами-гинекологами Владимирской области, областной клинической больницы и областного клинического онкологического диспансера, их позитивная оценка наших скромных усилий.
Литература
1. Зыкин Б.И. Диагностика новообразований внутренних половых органов у женщин с помощью эхографии: Дис.... канд. мед. наук. М., 1982.
2. Fleming G.F., Ronnett В.М., Seidman J., Zaino R.J. Epithelial ovarian cancer // Principles and Practice of Gynecologic Oncology. 5th ed. / Richard R., Barakat R., Markman M., Randall M.E. Philadelphia et al.: Wolters Kluwer Health / Lippincott Williams & Wilkins, 2009. P. 763-837.
3. Valentin L., Callen P.W. Ultrasound evaluation of the adnexa (ovary and fallopian tubes) // Ultrasonography in obstetrics and gynecology. 5th ed. / Ed. P.W. Callen. Philadelphia: Elsevier, Inc., 2008. P. 968-985.
4. Нечаева И.Д. Опухоли яичников и маточных труб // Руководство по онкогинекологии / Бохман Я.В. (ред.). Л.: Медицина, 1989. С. 384-420.
5. Kurjak A., Kupesic S., Ertan A.K. Malignant adnexal tumors // Color Doppler sonography in gynecology and obstetrics / Schmidt W.O., Kurjak A. Stuttgart; New York: Thieme, 2005. P. 310-321.
6. ГилязутдиноваЗ.Ш. Опухоли яичников //Онкогинекология: Руководство для врачей / Под. ред. З.Ш. Гилязутдиновой, М.К. Михайлова. М.: МЕДпресс-информ, 2000. С. 9-89.
7. Де Черни А.Х., Натан Л. Акушерство и гинекология. Диагностика и лечение. T. II. Гинекология. Учебное пособие: Пер. с англ. / Под общей ред. А.Н.Стрижакова. М.: МЕДпресс-информ, 2009. С. 491-512.
8. Merz Е. Ovarian masses // Ultrasound in obstetrics and gynecology. V. 2. Gynecology / Merz E. Stuttgart; New York: Thieme, 2007. P. 148-162.
9. Мемарзаде С., Фариас-Эйснер P., Берек Дж. Злокачественные опухоли женских половых органов // Онкология / Под ред. Д. Касчиато. М.: Практика, 2008. С. 384-396.
10. Буланов М.Н. Значение трансвагинальной цветовой допплерографии в сочетании с импульсной допплерометрией для дифференциальной диагностики доброкачественных и злокачественных новообразований яичников: Дис.... канд. мед. наук. М., 1999.
303
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
11. Stein S.M., Laifer-Narin S., Johnson M.B. et al. Differentiation of benign and malignant adnexal masses: relative value of gray-scale, color Doppler, and spectral Doppler sonography//Am. J. Roentgenol. 1995. V. 164. N 2. P. 381-386.
12. Ferrazzi E., Zanetta S., Dordoni D. et al. Transvaginal ultrasonographic characterization of ovarian masses; comparison of five scoring systems in a multicenter study // Ultrasound. Obstet. Gynecol. 1997. V.10. N 3. P. 192-204.
13. Conway C., Zalud I., Dilena M. et al. Simple cyst in the postmenopausal patient: detection // Book of Abstracts of 7th World Congress on Ultrasound in Obstetrics and Gynecology. Washington, DC, 1997. P. A97.
14. 0smers R.G., Osmers M., von Maydell B. et al. Evaluation of ovarian tumors in postmenopausal women by transvaginal sonography // Eur. J. Obstet. Gynecol. Reprod. Biol. 1998.V.77.N1.P. 81-88.
15. Чекалова M.A., Зуев B.M. Ультразвуковая диагностика в онкогинекологии. М.: Русский врач, 2004.
16. Sassone А.М., Timor-Tritsh I.E. Artner A. et al. Transvaginal sonographic characterization of ovarian desease: evaluation of a new scoring system to predict ovarian malignancy // Obstetric. Gynecol. 1991. V. 78 P. 70-76.
17. Lerner J.P., Timor-Tritsh I.E., Federman A. et al. Transvaginal sonographic characterization of ovarian masses using an improved, weighted scoring system // Am. J. Obstet. Gynecol. 1994. V. 170. P. 81-85.
18. Bourne T., Campbell S., Steer C. et al. Transvaginal colour flow imaging: a possible new screening technique for ovarian cancer// Br. Med. J. 1989. V. 299. P. 1367-1370.
19. Kurjak A., Zalud I., Jurkovic D. et al. Transvaginal color Doppler for the assessment of pelvic circulation //Acta Obstet. Gynecol. Scand. 1989. V. 68. P. 131-135.
2O. Hata T, Hata K., Senoh D. et al. Doppler ultrasound assessment of tumor vascularity in gynecological disorders // J. Ultrasaund Med. 1989. V. 8. P. 309-312.
21. Kurjak A. Transvaginal Color Doppler / Carnforth N.J. Parthenon Publishing, 1990.
22. KurjakA., Zalud I., AlfirevicZ. et al. The assessment of abnormal pelvic blood flow by transvaginal color Doppler // Ultrasound Med. Biol. 1991. V. 16. P. 437-442.
23. Bourne T, Transvaginal color Doppler in gynecology // Ultrasound. Obstet. Gynecol. 1991. V. 1. P.359-373.
24. Hata K. Transvaginal color Doppler examination for evaluation of the benign or malignant nature of ovarian tumors // Announcement in the 2nd Abdominal Doppler Study Meeting of the Japan Society of Ultrasonics in Medicine, 1991 (in Japanese).
25. Fleisher A., Rodgers W., Rao B. at al. Assesment of ovarian tumor vascularity with transvaginal color Doppler sonography // J. Ultrasaund Med. 1991. V. 10. P. 563-568.
26. Tecay A., Jouppila P. Validity of pulsality and resistance indices in classification of adnexal tumors with transvaginal color Doppler ultrasound // Ultrasound. Obstet. Gynecol. 1992. V.2. P. 338-344.
27. Tecay A., Jouppila P. Controversies in assessment of ovarian tumors with transvaginal and color Doppler ultrasound // Ultrasound. Obstet. Gynecol. 1996. V.8. Suppl. 1. P. 172.
28. Bourne T, Tailor A., Hacket E. et al. Familial ovarian cancer screening using vaginal ultrasound, color Doppler, and the limited role of CA-125 // Ultrasound. Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 33.
29. Kurjak A. Screening for pelvic malignancy: how to reduce false positives // Book of Abstracts of Sixth World Congress on Ultrasound in Obstetrics and Gynecology. Washington, DC, 1997.
304
IX. Злокачественные опухоли яичников
30. Marret Н., Sauget S., Giraudeau В. et al. Power Doppler vascularity index for predicting malignancy of adnexal masses // Ultrasound Obstet Gynecol. 2005. V. 25(5). P. 508-513.
31. Wilson W.D., Valet A.S., Andreotti R.F. et al. Sonographic quantification of ovarian tumor vascularity//J. Ultrasound Med. 2006 V. 25(12). P. 1577-1581.
32. Chase D.M., Crade M., Basu T, Saffari B., Berman M.L. Preoperative diagnosis of ovarian malignancy: preliminary results of the use of 3-dimensional vascular ultrasound // lot. J. Gynecol. Cancer. 2009. V. 19(3). P. 354-360.
33. Jokubkiene L., Sladkevicius R, Valentin L. Does three-dimensional power Doppler ultrasound help in discrimination between benign and malignant ovarian masses? // Ultrasound Obstet Gynecol. 2007. V. 29(2). P. 215-225.
34. Kurjak A., Predanic M , Kupesic-Urek S. et al. Transvaginal color and pulsed Doppler assessment of adnexal tumor vascularity//Gynecol. Oncol. 1993. V. 50. N1. P. 3-9.
35. Fleischer A.C., Rodgers W.H., Kepple D.M. et al. Color Doppler sonography of ovarian masses: a multiparameter analysis//J. Ultrasound. Med. 1993. V. 12. N1. P.41-48.
36. Hata K., Hata T., Kitao M. Intratumoral peak systolic velocity as a new possible predictor for detection of adnexal malignancy // Am. J. Obstet. Gynecol. 1995. V. 172. N5. P.1496-1500.
37. Tailor A., Jurkovic D., Bourne T. etal. Comparison of blood flow indices for the diagnosis of ovarian cancer using color Doppler imaging and color Doppler energy // Ultrasound. Obstet. Gynecol. 1995. V. 6. Suppl. 2. P. 16.
38. Tailor A., Jurcovic D., Bourne T. et al. A comparison of intratumoral indices of blood flow velocity and impedance for the diagnosis of ovarian cancer // Ultrasound Med. Biol. 1996. V. 22. P. 837-843.
39. Alkazar J., Jurado M., Ruiz J. Use of a logistic model to predict adnexal malignancy based on patient age, sonography, color doppler and CA-125 levels // Book of Abstracts of Sixth World Congress on Ultrasound in Obstetrics and Gynecology. Washington, DC, 1997.
40. Timor-Tritsch L.E., Lerner J.P., Monteagudo A. et al. Transvaginal ultrasonographic characterization of ovarian masses using color flow-directed Doppler measurements // Ultrasound. Obstet. Gynecol. 1992. V.2. Suppl. 1. P.171.
41. Буланов M.H., Зыкин Б.И., Митьков В.В. Первый опыт изучения скорости внутриопухолевого венозного кровотока в новообразованиях яичников с помощью трансвагинальной цветовой допплерографии в сочетании с импульсной допплерометрией // Ультразвук, диагн. 1997. №4. С. 9.
42. Bulanov М., Zykin В., Mitjkov V. Velocity of intratumoral venous blood flow in benign and malignant ovarian tumors // Book of Abstracts of 7th World Congress on Ultrasound in Obstetrics and Gynecology. Washington, DC, 1997.
43. Bulanov M., Zykin B., Novikova T. Intratumoral blood flow in benign and malignant ovarian tumors - our experience // Ultrasound. Obstet. Gynecol. 1998. V. 12. Suppl. 1. P. 178.
44. Kurjak A., Schulman H., Sosic A. Transvaginal ultrasound, color flow, and Doppler waveform of the postmenopausal adnexal mass// Obstet. Gynecol. 1992. V. 80. N6. P. 917-921.
45. Van Calster B., Timmerman D., Bourne T. et al. Discrimination between benign and malignant adnexal masses by specialist ultrasound examination versus serum CA-125 // J. Nat. Cancer Inst. 2007. V. 99(22). P. 1706-1714.
46. Valentin L. Gray scale sonography, subjective evaluation of the color Doppler image and measurement of blood flow velocity for distinguishing benign and malignant tumors of suspected adnexal origin // Eur. J. Obstet. Gynecol. Reprod. Biol. 1997. V. 72. P. 63-72.
305
УЛЬТРАЗВУКОВАЯ ГИНЕКОЛОГИЯ • Курс лекций
47. Valentin L. Prospective cross-validation of Doppler ultrasound examination and gray-scale ultrasound imaging for discrimination of benign and malignant pelvic masses // Ultrasound Obstet. Gynecol. 1999. V. 14(4). P. 273-283.
48. Новикова Е.Г, Батталова Г. Ю. Пограничные опухоли яичников. М.: Медицинское информационное агентство, 2007.
49. Колосов А.Е. Опухоли яичников и прогноз для больных: Руководство для врачей. Киров, 1996.
50. Timor-Tritsch I.E. Adnexal masses // Ultrasound in gynecology / Timor-Tritsch I.E., Goldstein S.R. Philadelphia: Churcill-Livingstone, 2007. P. 100-114.
51 .van Nagell J.R. Jr., DePriest RD., Ueland F.R. et al. Ovarian cancer screening with annual transvaginal sonography: findings of 25,000 women screened // Cancer. 2007. V. 109(9). P. 1887-1896.
52. Kauff N.D., Hurley K.E., Hensley M.L. et al. Ovarian carcinoma screening in women at intermediate risk: impact on quality of life and need for invasive follow-up // Cancer. 2005. V. 104(2) P. 314-320.
53. Neesham D. Ovarian cancer screening // Aust Fam. Physician. 2007. V. 36(3). P. 126-128.
54. Partridge E., Kreimer A.R., Greenlee R.T. et al. PLCO Project Team. Results from four rounds of ovarian cancer screening in a randomized trial // Obstet. Gynecol. 2009. V. 113(4). P. 775-782.
55. Kobayashi H., Yamada Y, Sado T. et al. A randomized study of screening for ovarian cancer: a multicenter study in Japan // Int. J. Gynecol. Cancer. 2008. V. 18. P. 414-420.
56. Valentin L. Update on gynecological cancer screening and diagnosis // Ultrasound Obstet.Gynecol. 1996. V. 8. Suppl. 1. P. 157.
306