Author: Тыщенко В.П.
Tags: insecta hexapoda насекомые энтомология физиология животных физиология насекомых
Year: 1976
Text
0С1Ш1
nn ши
ЛЕНИНГРАДСКИЙ ОРДЕНА ЛЕНИНА
И ОРДЕНА ТРУДОВОГО КРАСНОГО ЗНАМЕНИ
ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ИМЕНИ А. А. ЖДАНОВА
В, П. ТЫЩЕНКО
основы ФИЗИОЛОГИИ НАСЕКОМЫХ
Часть 1
ФИЗИОЛОГИЯ МЕТАБОЛИЧЕСКИХ СИСТЕМ
ИЗДАТЕЛЬСТВО ЛЕНИНГРАДСКОГО УНИВЕРСИТЕТА ЛЕНИНГРАД 1976
Печатается по постановлению
Редакционно-издательского совета Ленинградского университета
УДК 595.7 :591.1
Тыщенко В. П. Основы физиологии насекомых. Ч. 1. Физиология метаболических систем. Л., Изд-во Ленингр. ун-та, 1976. 364 с.
В книге обсуждаются основные проблемы метаболической физиологии насекомых. Последовательно рассматриваются функции покровных тканей, физиология дыхания, питания и пищеварения, выделительных органов, кровеносной системы и жирового тела. Излагаются взгляды на механизмы физиологических процессов, связанных с деятельностью метаболических систем у насекомых.
Книга рассчитана на научных работников — зоологов и физиологов, а также на аспирантов и студентов старших курсов биологических факультетов. Может быть использована как учебное пособие. Ил.—114, табл.—10, библиогр.—1128 назв.
21008—115
Т 076(02)—76
132-76 ©
Издательство Ленинградского университета, 1976 г.
Посвящается светлой памяти моего незабвенного учителя профессора Александра Сергеевича Данилевского
Введение
Физиология насекомых принадлежит к таким разделам энтомологии, которые получили особенно широкое и всестороннее развитие в последние годы. Возникшая в начале XX века в качестве придатка к морфологии, она превратилась во вполне самостоятельную область знаний, имеющую свои цели, задачи и перспективы как в теоретическом, так и в прикладном аспекте.
Первоначально развитие физиологии насекомых было тесно связано с решением сугубо практических задач. Важное место в работе энтомологов физиологического направления отводилось поискам химических инсектицидов, выяснению путей их проникновения в организм насекомого и механизмов их действия. Эти проблемы оказались, однако, настолько обширными, потребовали столь конкретных теоретических сведений, что их разработка надолго стимулировала физиологические исследования в энтомологии. В настоящее время физиология насекомых, обогащенная новыми идеями и фактами, способна предложить современные эффективные методы борьбы с вредными насекомыми и клещами. Впечатляющие успехи, достигнутые при изучении гормонов насекомых, позволили выдвинуть идею использования гормональных аналогов в качестве нового «поколения инсектицидов», обладающих высокой специфичностью и не затрагивающих других форм жизни. Эксперименты, проводившиеся в Гарвардском университете К. М. Вильямсом и К- Сламой с использованием «бумажного фактора», который избирательно подавляет развитие клопов сем. Pyrrhocorida'e, вселяют надежду на создание подобных инсектицидов в недалеком будущем.
Физиологическое изучение насекомых вносит существенный вклад в общую энтомологию^ позволяя оценить с функциональных позиций принципы организации систем органов и тканей у этих животных. Однако несомненно, что физиология насекомых имеет много точек соприкосновения и с другими биологическими науками.
У насекомых достигается не меньшая клеточная специализация, чем у позвоночных, но некоторые функции, свойственные всем живым организмам, именно у насекомых открываются с новой, неожиданной стороны и оказываются наиболее доступными для экспериментального анализа. Достаточно вспомнить гигантские (политенные) хромосомы в клетках слюнных желез двукрылых, которые помогли цитогенетикам установить лока
3
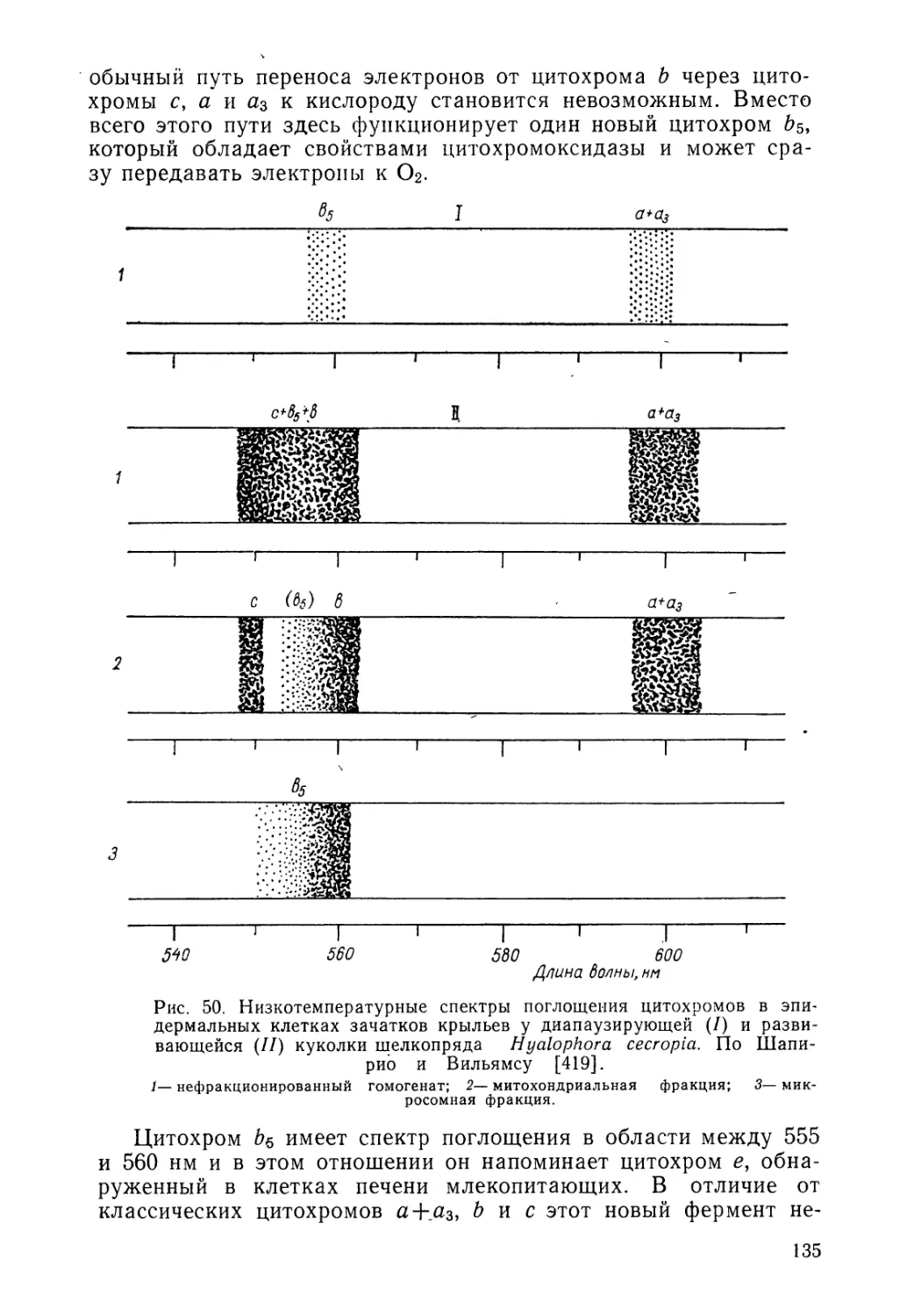
лизацию отдельных генов в хромосоме. Можно сослаться также па значение работ Д. Кейлина по дыханию насекомых для открытия и изучения цитохромов, играющих столь важную роль в дыхательном метаболизме у всех живых организмов.
Уже приведенных примеров достаточно, чтобы убедиться в том, что физиологические исследования на насекомых помогают разработке общих вопросов физиологии животных. Перед всеми животными встают одни и те же функциональные задачи, но на разных уровнях филогенеза они разрешаются по-разному. Сравнительное изучение данной функции открывает широкие возможности для объяснения ее происхождения и последующей эволюции.
Многие физиологические явления у насекомых опосредованы своеобразным эволюционным положением, глубокой древностью и малыми размерами всех представителей данной группы. Необычайно широкое видовое разнообразие насекомых позволяет без труда подобрать наиболее удобные объекты для решения любой конкретной задачи. Нет сомнений в том, что изучение насекомых будет способствовать глубокому проникновению в самые интимные механизмы физиологических процессов.
В предлагаемой первой части монографии рассматриваются метаболические системы насекомых. Такие системы охватывают покровные ткани, органы дыхания, пищеварения и выделения, кровеносную систему и жировое тело. Основные задачи всех этих систем сводятся к поддержанию постоянства внутренней среды, к обмену веществ и извлечению энергии химических связей с целью ее последующего использования для роста, развития, размножения и поведения насекомых.
Вторая чабть посвящена физиологии информационных систем, охватывающих нервные и нервно-мышечные образования, органы чувств, эндокринные ткани и органы размножения. Эти системы обеспечивают информационные связи насекомых с внешней средой и регуляторные взаимоотношения органов и клеток внутри целостного организма. Разумеется, все эти связи и взаимоотношения базируются на метаболических процессах, рассматриваемых в первой части руководства, но основные функции информационных систем не сводятся к обмену веществ, они преследуют иную цель — обмен информацией.
В оформлении рукописи мне существенно помогли сотрудники кафедры энтомологии Ленинградского университета, особенно Н. Н. Кяо, А. X. Саулич, И. А. Кузнецова и Г. Ф. Тыщенко. Всем этим лицам я приношу свою искреннюю признательность. Я благодарен также докторам биологических наук Е. Б. Виноградовой и С. М. Верещагину, любезно согласившимся просмотреть рукопись книги при подготовке ее к печати.
4
Глава I. ФИЗИОЛОГИЯ И БИОХИМИЯ ПОКРОВНЫХ ТКАНЕЙ
§ 1. Строение и функции покровов
Общий план строения, классификация и терминология покровных тканей. Своеобразное строение покровов позволяет понять многие особенности физиологии и поведения насекомых. Под покровами мы будем подразумевать две различные группы образований — живые клетки эпидермиса (гиподерма, эпителий) и мертвую неклеточную кутикулу, которая является продуктом выделения этих клеток. Снизу эпидермис подстилается базальной мембраной (рис. 1).
Под электронным микроскопом базальная мембрана выглядит как аморфное гранулярное образование толщиной около 0,5 мкм [1]. Происхождение и химический состав ее не вполне
ск? к. ж П.К.Ж
Рис. 1. Схема строения покровов насекомых. По Уигглсуорсу [4].
б. м — базальная мембрана; в — волосок; к.ж. — кожная железа; к.э — неспециализированная клетка эпидермиса; п.к.ж — проток кожной железы; с.к.ж —секрет кожной железы; с.к.э — специализированная клетка эпидермиса, образующая волосок; эк — экзокутикула; эн — эндокутикула; эп. эпикутикула; я.к.э — ядро клетки эпидермиса.
5
выяснены; скорее всего она секретируется определенными клетками гемолимфы и состоит из мукополисахаридов [2]. Эпидермис представлен непрерывным одноклеточным рядом столбчатых или многогранных клеток, нередко связанных друг с другом, с мышцами и с кутикулой различными типами межклеточных соединений, которые подробно изучены Хагопяном [3] у таракана Leucophaea maderae. Каждая эпидермальная клетка содержит одно крупное ядро. Непосредственно примыкающая к кутикуле поверхность клетки снабжена многочисленными микроворсинками, которые можно увидеть только при электронном микроскопировании.
Кроме обычных неспециализированных клеток, в эпидермисе насекомых обнаруживаются специализированные клетки, образующие волоски и сенсиллы (рис. 1, с.к.э), определенные клетки гемолимфы — эноциты и разнообразные кожные железы, снабженные выводными протоками (рис. 1, к.ж., п.к.ж). Эти железы принимают участие в процессах растворения и формирования кутикулярных слоев во время линьки. Иногда выделения подобных желез не имеют никакого отношения к покровным тканям и могут использоваться как защитные или привлекающие вещества или же в качестве строительного материала.
В кутикуле можно выделить относительно толстый внутренний слой прокутикулы, содержащий хорошо известный энтомологам хитин, и тонкий наружный слой эпикутикулы, лишенный хитина. Оба основных слоя подразделяются на ряд вторичных слоев. Так, прокутикулу принято подразделять на пигментированную, расположенную ближе к поверхности экзокутикулу и непигментированную, лежащую более глубоко эндокутикулу. В состав эпикутикулы входят различные соединения, которые формируют несколько обособленных вторичных слоев. Следовательно, может быть предложена следующая упрощенная схема классификации и терминологии покровных тканей\
»Эпикутикула
Г окровы-------—^Кутикула ।-------------->Экзокутикула
1—Эпидермис Ьпрокутикула
—^Базальная мембрана ''Эндокутикула
Проницаемая для воды прокутикула выполняет в основном функцию механической защиты тканей насекомых, а водонепроницаемая эпикутикула — функцию защиты от высыхания.
Сравнивая строение кутикулы в разных группах членистоногих можно заметить, что отсутствие эпикутикулы составляет достаточно распространенное явление, свойственное многим представителям этого типа [5]. По мнению М. С. Гилярова
6
[6, 7] обитавшие в воде предки современных наземных членистоногих не имели эпикутикулы, так как перед ними не стояла задача защиты от иссушения. При переходе к жизни вне воды низшие членистоногие были связаны с почвой, где воздух обычно насыщен водяными парами, и примитивное двухслойное строение кутикулы (эндокутикула + экзокутикула) могло сохраниться. Однако при переходе к обитанию в воздушной среде с дефицитом влажности обязательно развивается наружный водонепроницаемый слой эпикутикулы. Поэтому покрывающая все тело эпикутикула выражена у всех членистоногих, способных длительное время существовать вне укрытий. Промежуточное состояние покровов наблюдается у тех членистоногих, у которых эпикутикула покрывает одни участки тела, но отсутствует на других. При вторичном переходе представителей наземных групп к жизни в воде или в почве нередко уже приобретенная однажды эпикутикула снова редуцируется.
Этот путь приспособительной эволюции кутикулы членистоногих хорошо, иллюстрируется на примере насекомых. Среди первичнобескрылых насекомых (Apterygota) почвенные формы характеризуются кутикулой, состоящей только из двух слоев —• экзо- и эндокутикулы. Однако у ногохвостки Sminthurus viri-dis, которая ведет открытый образ жизни и встречается на листьях живых растений, а также у щетинохвосток рода Cteno-lepisma появляется очень тонкая, но явственная эпикутикула [5, 8].
Все крылатые насекомые (Pterygota) во взрослом состоянии способны длительное время находиться, в открытой атмосфере, и именно для них характерно типичное строение кутикулы, состоящей из эндо-, экзо- и эпикутикулы. Личинки насекомых, развивающихся с полным превращением, если они ведут открытый образ жизни, также имеют эпикутикулу. В то же время те личинки, которые живут в почве, в гнилой древесине, в растительных тканях (например, в минах или в галлах) и в других влажных субстратах, где исключена возможность быстрой потери влаги, как правило, лишены эпикутикулы. Так, эпикутикула полностью отсутствует в личиночной стадии у почвенных комаров-долгоножек (Tipulidae) или у жужелиц Наг-palus. У личинок Elateridae, большинства Scarabaeidae и Сага-bidae эпикутикула отсутствует на значительной площади тела, особенно на мягких межсегментных мембранах. При этом даже у постоянно живущих в почве личинок отмечается ясная связь строения покровов с конкретными условиями влажности в среде обитания [9]. В целинных почвах пустынь и полупустынь Средней Азии встречаются личинки жуков, обладающие . явственной эпикутикулой (рис. 2, А). Однако в тех же районах личинки/ которые живут в постоянно влажных почвах орошаемых земель, характеризуются полным или частичным отсутствием эпикутикулы (рис. 2, Б).
7
У личинок, окончательно перешедших к жизни в воде, эпикутикула не развита [10]. Такие насекомые не способны противостоять иссушению: личинки комара Chironotnus plumosus, например, погибают после 3-часового пребывания на воздухе. Однако личинки, развивающиеся в воде, но способные ее покидать, имеют эпикутикулу хотя бы на отдельных участках тела. Способность противостоять иссушению у таких форм развита гораздо сильнее: личинки стрекозы Aeschna grandis, например, в 9 раз более устойчивы к потерям воды через кутикулу, чем
Рис. 2. Строение кутикулы почвенных личинок жуков. По Семеновой [9]. А — кутикула личинки Opatroides punctulatus, обитающей в засушливых почвах целинных земель. Б — кутикула личинки Pentodon dubius, обитающей в почвах орошаемых земель. Обозначения см. на рис. 1.
поденок, ручейников и жесткокрылых, по-видимому, представляет собой адаптацию к обитанию во временных и пересыхающих водоемах.
Прокутикула. Прокутикула — это довольно толстый слой кутикулы с относительно высоким содержанием воды (до 30— 40%). Основу химического материала прокутикулы составляют белки, связанные с хитином.
В области эндокутикулы процессы затвердевания и пигментации не выражены; полимерные молекулы хитиново-протеинового комплекса образуют здесь чередующиеся слои, составленные из тончайших пластинок —ламелл, которые хорошо видны на срезах кутикулы. Ширина ламелл может варьировать от 0,2 мкм в кутикуле таракана до 10 мкм в оптических линзах сложных глаз и глазков [11]. Используя электронный микроскоп, можно доказать, что эти ламеллы отражают ориентацию более тонких микроволокон. В эндокутикуле жуков вместо ламелл обнаруживаются довольно толстые тяжи, называемые балками. Подобные балки образуют прослойки, расположенные друг над другом «по принципу фанеры» [12].
8
Слоистое строение эндокутикулы насекомых, вероятно, обусловливается ритмической активностью эпидермиса при ламел-логенезе, т. е. при образовании хитиново-протеиновых ламелл. В отличие от большинства других слоев кутикулы эндокутикула может продуцироваться не только во время линьки, но и после сбрасывания экзувиальной шкурки: у гусениц Calpodes ethlius, например, толщина ее увеличивается в межлиночный период с 10—15 до 100 мкм [13]. У саранчовых, кузнечиков, тараканов и клопов ламеллогенез эндокутикулы регулируется «биологическими часами»: каждые сутки кутикула прибавляет по одному слою, причем та часть слоя, которая образуется ночью, имеет отчетливо пластинчатое строение [14]. При отсутствии суточного ритма освещения и температуры формируется только бесструктурная, непластинчатая эндокутикула.
В области экзокутикулы хитиново-протеиновые молекулы стабилизируются* хинонами и пропитываются пигментами. Следовательно, экзокутикула может рассматриваться как затвердевшая, окрашенная прокутикула, утратившая свое пластинчатое строение. Общая толщина экзокутикулы может сильно варьировать от едва различимой тонкой прослойки в покровах различных мух до занимающего почти всю толщу кутикулы слоя у имаго жуков. Между экзо- и эндокутикулой иногда выделяют промежуточную зону слабо окрашенной, но стабилизированной и гомогенной мезокутикулы.
Вся прокутикула снизу доверху пронизана многочисленными поровыми канальцами, которые начинаются от эпидермиса и обеспечивают его связь с наружной поверхностью покровов. Необходимость в такой связи возникает при секретировании и восстановлении слоев эпикутикулы, при задубливании экзокутикулы и при заживлении ран на покровах. Каждый поровый каналец представляет собой тонкое спиральное образование, внутри которого проходят один или несколько нитевидных отростков эпидермальной клетки. Наиболее крупные поровые канальцы описаны у личинок мух, где их максимальный диаметр достигает 2,5 мкм. Каждая эпидермальная клетка в этом случае связана с 50—70 канальцами, а. общее число канальцев достигает 15 000 на 1 мм2 поверхности кутикулы [15]. У таракана Periplaneta ainericana максимальный диаметр порового канальца составляет лишь 0,2 мкм, но их общее число превышает, миллион на 1 мм2 кутикулы [16].
Функция поровых канальцев, несомненно, связана с секрецией кутикулы при линьке и восстановлением поврежденных покровов. Видимо, особенно велико значение этих образований в процессах синтеза и транспортирования кутикулярных восков [17].
Эпикутикула. В световом микроскопе эпикутикула выявляется как полупрозрачная поверхностная линия толщиной от
9
• • •
Рис. 3. Схема расположения слоев кутикулы насекомых. По Л оку [1]. 1— цементный слой; 2— восковой слой; 3— кутикулин; 4— гомогенная протеиновая эпикутикула; 5—экзокутикула; 6— эндокутикула; 7— экзувиальная мембрана.
одного до нескольких микрон (рис. 1 эп). В отличие от прокутикулы эпикутикула не содержит хитина; она формируется из нескольких слоев, имеющих различный химический состав. Обычно здесь выделяют 3—4 слоя (рис. 3), но для некоторых насекомых описано двухслойное строение эпикутикулы.
При эмбриональном развитии и при формировании покровов во время линьки первым появляется самый внутренний протеиновый слой эпикутикулы в виде тонкой мембраны над поверхностью эпидермальных клеток. Верхняя часть этого слоя образована задубленным хинонами липопротеиновым комплексом — кутикулином [18]. Более внутренняя часть слоя плотная, гомогенная, значительно более толстая, чем кутикулино-вое покрытие (рис. 3).
Белки и липиды, составляющие протеиновый слой эпикутикулы, видимо, секретируются эпидермальными эноци-тами, которые обнаруживают определенные морфологические изменения, связанные с периодом линьки [19]. Гистохимическими .методами доказано, что секреторные включения эноцитов и вновь образующаяся кутикула имеют сходный химический состав [20]. Протеиновый слой обладает высокой проницаемостью по отношению к воскам и воде и ;вряд ли служит эффективным барьером, ограничивающим проникновение через кутикулу небольших молекул других химических соединений. Однако во время линьки
10
кутикулин задерживает экзувиальную жидкость и не дает возможности ее ферментам нарушить стабильность новой кутикулы.
В протеиновом слое, наряду с белками, содержатся полифенолы и дифенолы, принимающие участие в задубливании и окрашивании покровных тканей насекомых (см. с. 30). В незатвердевшей и светлой кутикуле только что перелинявшего насекомого фенольные соединения могут образовать полифеноловый слой эпикутикулы, расположенный над ее протеиновым слоем. После линьки, однако, дискретный полифеноловый слой бесследно исчезает и не выявляется даже при электронном микроскопировании [1].
Над белками и полифенолами располагаются липидные соединения эпикутикулы в виде четкого воскового слоя толщиной от 0,11 до 0,13 мкм в области крыловой мембраны или от 0,11 до 1,26 мкм на элитрах жуков [21]. Воска, образующие этот слой, включают в себя длинноцепочечные углеводороды, жирные кислоты, их эфиры и диоловые спирты. Химический состав восков специфичен буквально для каждого вида насекомых.
Материал воскового слоя продуцируется эпидермальными клетками в виде полужидких удлиненных кристаллов, которые транспортируются к поверхности покровов либо через поровые канальцы, либо путем непосредственной диффузии через прокутикулу [22]. Так, у тараканов воск может проходить даже через полностью затвердевшую кутикулу, и в этом случае слои прокутикулы бывают импрегнированы диффундирующими восками [23]. Так же легко воск проходит через протеиновую эпикутикулу, причем в местах его проникновения образуются специальные восковые канальцы. У гусениц толстоголовки Calpo-des ethlius такие канальцы расположены в мельчайших «кратерах» кутикулы (рис. 4). Гистохимически в этих канальцах и «кратерах» обнаружена высокая активность эстераз — ферментов, синтезирующих воска. Предполагается поэтому, что восковые компоненты кутикулы не выделяются в готовом виде, а синтезируются на поверхности ее из жирных кислот и спиртов, поступающих из эпидермиса [24]. Процесс секреции исходных веществ при синтезе кутикулярных восков регулируется эндокринными органами, из которых наиболее важное значение имеют мозговые железы corpora allata и corpora cardiaca [25].
В сформированной кутикуле восковой слой играет роль барьера, ограничивающего транспирацию и защищающего насекомых от потерь воды. Установлено, что этот слой отличается высокой водонепроницаемостью, которая возникает в результате определенной ориентации молекул воска. В тех случаях, когда восковой слой не в состоянии обеспечить эффективную защиту от испарения воды, развиваются дополнительные приспособления, усиливающие эту его функцию. Так, у мух Dacus tryoni воска выделяются не только обычными эпидермальными
11
Рис. 4. Продуцирующие воск «кратеры» на поверхности эпикутикулы гусеницы Calpodes ethilus. По Л оку [1].
А — общая картина расположения «кратеров» (рисунок по электронной микрофотографии); полигональные структуры, в которые объединяются «кратеры», отражают расположение эпидермальных клеток. Б — схема строения одиночного «кратера» на поперечном срезе, в.ц — полый восковой цилиндр, который секретируется «кратером»; в.К\, в.к2 — восковые канальцы на поперечном и продольном срезах кутикулы; л.пк— ламеллы прокутикулы; п.эп — протеиновая эпикутикула.
клетками, но и парными железами пятого тергита брюшка. Муха периодически размазывает секрет этих желез по всему телу, создавая как бы дополнительное восковое покрытие кутикулы [26]. Назначением секрета является ограничение потерь воды особенно в первое время после окрыления, когда водонепроницаемость покровов еще недостаточно хорошо выражена.
У многих насекомых воска эпикутикулы прикрываются сверху тонким цементным слоем, который продуцируется кожными железами. В химическом отношении материал цементного слоя изучен плохо. У червеца Laccifer lacca он, вероятно, формируется из смолистых веществ, подобных шеллаку; в состав этих веществ входят лаккоза и липиды [27]. По-видимому, было бы более правильно называть этот слой «лаковым» слоем эпикутикулы.
Не подлежит сомнению, что «цемент» обеспечивает механическую защиту легко повреждаемого воска эпикутикулы. Проницаемость этого слоя, видимо, достаточно высока, но все же у термитов он, дополняя восковой слой, может ограничивать испарение воды через покровы [28].
Лауэр [29] считает необходимым отличать протеиновую эпикутикулу от других эпикутикулярных слоев, которые он обозначает общим термином амфион. Эпикутикула, содержащая белки, включает в себя один слой, который подразделяется на две зоны — наружную кутикулиновую и внутреннюю гомогенную (см. рис. 3). Секретирование этого слоя происходит только во время линьки. Лишенный белков амфион распадается на 2—3 слоя, которые частично могут продуцироваться в меж-линочные периоды. В тех случаях, когда исчезает эпикутикула, редуцируется, по-видимому, только амфион, а белковая ее часть сохраняется.
Характерное для многих членистоногих двухслойное строение эпикутикулы хорошо согласуется с этим подразделением ее на протеиновую эпикутикулу и амфион. Описанное выше многослойное строение эпикутикулы отмечается у клопа Rhod-nius prolixus [30], пухоеда Eomenacantus stramineus [31], жука Tenebrio molitor [32], ногохвостки Podura aquatica [33] и у некоторых других насекомых. Однако уже давно было известно, что у таракана Periplaneta americana [16], личинок мухи Sarcophaga falcullata [15], гусеницы Bombyx mori [34] и пчелы Apis mellifera [35] в эпикутикуле обнаруживается только два слоя: наружный, содержащий липиды и фенолы, и внутренний, содержащий белки. Эти слои, следовательно, можно считать аналогичными (или даже, гомологичными) амфиону и протеиновой эпикутикуле, если придерживаться терминологии покровных тканей, предложенной Лауэром [29].
Эпидермис и формирование кутикулы. Морфология клеток эпидермиса была описана выше (см. с. 6). Теперь необходимо рассмотреть функции этих клеток.
13
Почти у всех насекомых эпидермальные клетки содержат гранулы пигментов и могут принимать участие в создании разнообразных окрасок наружных покровов. Окраска покровов, впрочем, обусловливается также пигментами, содержащимися в экзокутикуле. К кутикулярным пигментам относятся главным образом черные, бурые и желтые красящие вещества. Примером таких веществ могут служить меланины. Эпидермальные пигменты, представленные различными соединениями, обычно оранжево-желтые, красные и пурпурные. Подробнее окраска покровов и химический состав пигментов насекомых обсуждаются на с. 36—55.
Участие эпидермальных клеток в пигментации тела насекомых составляет первую, но далеко не единственную их функцию. Важное значение имеет секреторная функция эпидермиса, которая проявляется в растворении старой кутикулы и в продуцировании новых кутикулярных слоев во время линьки и в межлиночные периоды. При этом эпидермальные клетки синтезируют химические вещества кутикулы, определяют последовательность расположения кутикулярных слоев, регулируют процессы формирования покровов.
Рассмотрим сначала функции эпидермиса во время линьки. Перед началом линьки эпидермальные клетки увеличиваются в размерах и приступают к митотическому делению. Только у личинок мух, у которых существует строго постоянное число клеток в эпидермисе, митозы не наблюдаются [15]. Характерным признаком скорого наступления линьки .может служить появление свободного пространства между кутикулой и эпидермальными клетками. В это пространство изливается экзу-виальная жидкость, которая продуцируется кожными железами. Подобные железы, образованные из эпидермальных клеток, могут быть одноклеточными и многоклеточными. Они накапливают секрет в многочисленных вакуолях и выводят его наружу через специальные протоки (рис. 5, А, к.ж). В экзу-виальной жидкости содержатся ферменты, растворяющие белки и хитин старой кутикулы. Эти ферменты, видимо, первоначально выделяются в виде неактивных гранул, которые становятся активными лишь после образования протеинового слоя новой кутикулы [36]. Экзувиальная жидкость не содержит ферментов, способных растворить липиды эпикутикулы [2],. Поэтому во время линьки разрушается лишь прокутикула, а эпикутикула, иногда вместе с поверхностным слоем экзокутикулы, формирует экзувиальную шкурку, которая сбрасывается насекомыми.
Одновременно с выделением экзувиальной жидкости эпидермальные клетки начинают формирование слоев новой кутикулы, которая, следовательно, располагается под старой кутикулой (рис. 5, Б, н.к). Вначале продуцируется эпикутикула 14
в виде тонкой пленки, гладкой или сильно складчатой. Затем образуется прокутикула, причем секретирование хитина и белка происходит вокруг нитевидных выростов эпидермальных клеток; эти выросты впоследствии атрофируются, а оставшиеся от них полости превращаются в поровые канальцы. Новая кутикула отделена от старой тонкой экзувиальной мембраной, составленной из липопротеинов с высоким содержанием стеру-
Рис. 5. Формирование кутикулы и изменения кожных желез во время линьки кровососущего клопа Rhodnius prolixus. По Уигглсуорсу [37].
Поперечные срезы через покровы нимфы на 8-й (Л), 11-й (Б), 14-й (В), и 13-й (Г) день после насасывания крови, к.ж — кожная железа; к.э — клетки эпидермиса; н.к — новая кутикула; р.к — остатки растворяющейся старой кутикулы; с.к — старая кутикула.
15
нов [38]. Эта мембрана отличается высокой устойчивостью к действию ферментов экзувиальной жидкости. По-видимому, она препятствует растворению вновь образующихся кутикулярных слоев.
Сбрасывание экзувиальной шкурки происходит только тогда, когда процесс отложения новых слоев кутикулы в основном заканчивается. При этом старая кутикула образует трещины в строго определенных местах, вдоль так называемых клиночных линий», которые обычно располагаются на голове и груди. На клопах Rhodnius prolixus показано, что непосредственно перед сбрасыванием экзувиальной шкурки некоторые кожные железы выделяют муцин, который, накапливаясь в свободном пространстве между старой и новой кутикулой, играет роль смазки, сильно облегчающей линьку [39].
После сбрасывания экзувиальной шкурки происходит затвердевание кутикулы и ее окрашивание. Необходимые для этих процессов химические соёдинения секретируются эноцитами, связанными с эпидермисом [40, 41]. Возможно, что эноциты могут также принимать участие в формировании некоторых слоев кутикулы [20].
Большая часть материала кутикулы продуцируется только во время линьки. Однако восковой слой эпикутикулы и внутренние слои прокутикулы могут восстанавливаться и продолжать рост также и в межлиночные периоды [I]. Эти процессы «внелиночного роста кутикулы» регулируются гормональным путем [25, 42], но в отличие от процессов секреции кутикулы при линьке в их регуляции не принимает участие гормон проторакальных желез — экдизон, вызывающий линьку насекомых.
Таким образом, секреторная функция клеток эпидермиса не ограничивается временем линьки, а частично распространяется и на межлиночный период. Эта функция эпидермальных клеток демонстративно проявляется также при заживлении ран на покровах.
Первой реакцией на повреждение покровов является образование ложной соединительной ткани, которая, как подушка, закупоривает рану. Эта ткань формируется клетками гемолимфы и жирового тела. Она носит временный характер и постепенно исчезает по мере восстановления эпидермиса, которое происходит путем миграции и размножения эпидермальных клеток. У саранчи Locitsta migratoria в течение первых суток под вырезанным участком покровов наблюдается перемещение соседних эпидермальных клеток в| область раны [43]. Лишь,на вторые сутки эти клетки приступают к митотическому делению. Первоначально они имеют необычно крупные размеры, но затем уменьшаются. По мере восстановления эпидермиса происходит отложение новой кутикулы, причем сначала обра
16
зуется протеиновый слой, а потом и другие слои. Затвердевание и окрашивание кутикулы при заживлении ран протекают так же, как и при линьке. Повреждение покровов приводит к активированию профенолазы, которая, переходя в активную фенолазуг синтезирует дубильные и красящие вещества кутикулы [44].
Любая достаточно глубокая рана .приводит к разобщению некоторых клеток эпидермиса и побуждает их восстанавливать контакт друг с другом. Результатом этого «побуждения» является отмеченная выше миграция клеток в область раны. В экспериментах на клопах Rhodnius prolixus показано, что эпидермис довольно быстро обрастает любое имплантированное инертное тело, сохраняя, таким образом, свою непрерывность и взаимный контакт всех клеток [45]. Однако обрастание эпидермиса не происходит вокруг миллипорового фильтра, даже если диаметр его пор имеет незначительные размеры (10-2 мкм). По-видимому, в таких случаях отдельные клетки обмениваются через поры фильтра активными молекулами, которые и создают видимость непрерывного клеточного контакта.
Митотическое деление эпидермальных клеток и секреция кутикулы при заживлении раны не связаны с действием гормона линьки. Показано, что после удаления проторакальных желез, продуцирующих этот гормон, сохраняется способность насекомых восстанавливать повреждение покровов [46]. Выжигание нейросекреторных клеток мозга, которые являются источником гормона, активирующего проторакальные железы, тормозит линьку, но не препятствует процессам залечивания раны [47]. Ювенильный гормон, который определяет характер линьки и управляет метаморфозом насекомых, также не принимает участия в восстановлении покровов [48]. Очевидно, линька и заживление ран регулируются независимо, причем последний процесс может стимулироваться главным образом местными факторами, возникающими в зоне повреждения.
При секреции кутикулы эпидермальные клетки выполняют еще одну важную функцию: они определяют пространственную ориентацию кутикулярных образований. Удобной моделью для изучения этих явлений послужило расположение поперечных ребрышек на сегментах имаго клопов Rhodnius и Triatoma [24]. Оказалось, что, если у нимфы последнего возраста пересаживают идентичные по размерам участки покровов, расположенные по поперечной оси одного сегмента, то никаких изменений ориентации ребрышек у взрослого клопа не наблюдается (рис. 6, Д). Такая же пересадка покровов от одного сегмента на аналогичный участок другого сегмента не влияет на расположение ребрышек (ср. рис. 6 Г и Д). Однако, если трансплантированный участок при межсегментной или внутри-
17
81
сегментной пересадке поворачивают на 90° или на 180°, то у взрослых клопов нарушается ориентация кутикулярных ребрышек. Нарушения расположения ребрышек наблюдаются даже тогда, когда участок покровов у нимфы вырезают, поворачивают, а затем помещают на старое место (рис. 6, Б, Bf Е). Следовательно, существует определенный градиент в клетках эпидермиса по продольной оси сегмента. Было сделано предположение, что этот градиент возникает в результате изменений концентрации какого-то гипотетического вещества, названного «градиент-фактором». Ребрышки на кутикуле клопов располагаются параллельно линиям равной концентрации этого фактора, так называемым «изомиксам» [49].
Наличие градиента эпидермальных клеток и его значение для ориентации структур кутикулы было подтверждено в опытах, в которых изучали расположение чешуек и формирование рисунка на крыльях бабочек [50].
Эпидерма'льные клетки могут регулировать пространственную ориентацию не только структур кутикулы, но и тесно связанных с ней внутренних органов. К таким органам относятся, например, скелетные мышцы, которые прикрепляются к кутикуле. При развитии куколки Galleria mellonella клетки эпидермиса, вступающие в связь с крыловой мускулатурой, размещаются перед зачатками продольных крыловых мышц или непосредственно над зачатками поперечной мускулатуры. При удалении этих участков эпидермиса новые эпидермальные клетки, закрывающие рану, оказываются неспособными правильно ориентировать крыловые мышцы [51]. Однако эпидермис, ориентирующий продольную мускулатуру, может создавать также нормальную ориентацию поперечной мускулатуры. Таким образом, в состав эпидермиса входят клетки, способные и неспособные ориентировать скелетные мышцы, причем все клетки первой группы являются взаимозаменяемыми.
§ 2. Химический состав кутикулы
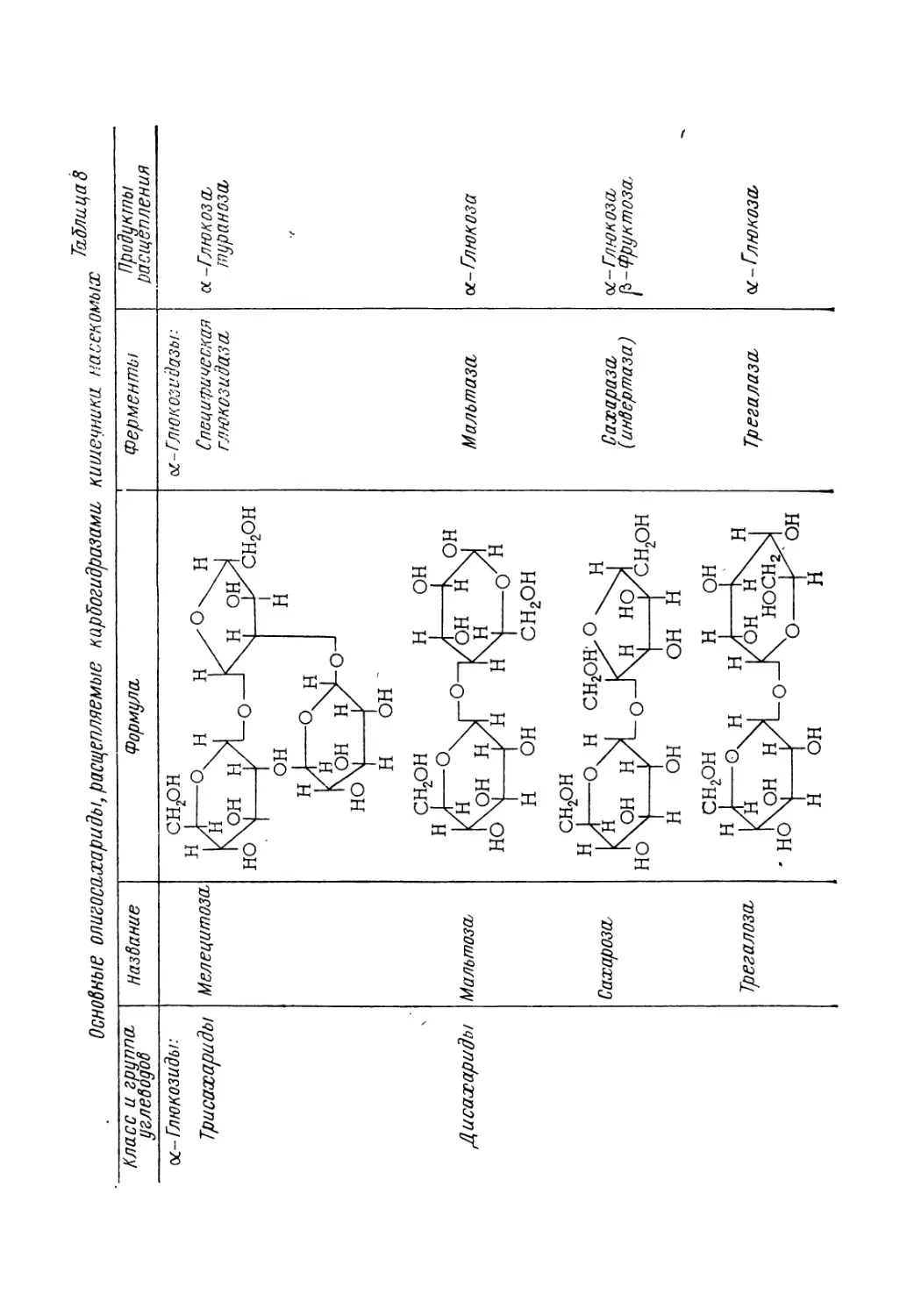
Хитин. Одним из важнейших веществ, входящих в состав кутикулы насекомых, является азотсодержащее полимерное соединение, которое Одье [52] назвал хитином. От одной трети до половины сухого материала кутикулы представлено этим
Рис. 6. Схема опытов по изучению влияния эпидермальных клеток на расположение ребрышек на кутикуле клопа Rhodnius prolixus. По Локу [24]. Н5 — сегменты нимфы V возраста. И — сегменты имаго с кутикулярными ребрышками (прерывистые линии поперек каждого сегмента). Квадратами на прямоугольниках показаны кусочки покровов, которые вырезались у нимфы и пересаживались в направлениях, указанных стрелками. А — двухсторонние пересадки участков покровов, расположенных по поперечной оси сегмента нимфы. Б, В — поворот участка покровов на 90° (стрелками показано направление поворота). Г — двухсторонние пересадки одинаковых участков покровов между двумя соседними сегментами. Д — пересадка участка покровов с передней половины одного сегмента на заднюю половину другого сегмента (и в обратном направлении). Е— поворот участка покровов на 180° в направлении, указанном стрелкой.
19
соединением; совместно с белками оно составляет основу наружного скелета членистоногих. Процентное содержание хитина в кутикуле определенного вида насекомых обычно не зависит от условий воспитания, размера или пола отдельных особей. Однако в различных участках покровов одного и того же насекомого количество хитина может быть различным: у таракана Blatta, например, тергит брюшного сегмента содержит меньше хитина, чем стернит [53].
Целлюлозой
.Рис. 7. Структурные формулы фрагментов молекулы хитина, целлюлозы и гликогена.
20
По своей химической природе хитин представляет собой высокомолекулярный полисахарид, который напоминает гликоген или целлюлозу, но в отличие от этих соединений содержит
аминогруппу NH, связанную с ацетильной группой О = С—СН3.
(рис. 7). Поэтому полное химическое название хитина — поли-Ь1-ацетил-д!-глюкозамин. Гексозные кольца в молекуле хитина связаны друг с другом В-связью (от первого атома углерода, к четвертому атому),, и атомы кислорода занимают противоположное положение в двух соседних гексозных кольцах. Такая же fi-связь имеет место в молекуле целлюлозы, но молекула гликогена построена на основе a-связи, которая создает одностороннее расположение атомов кислорода всех гексозные колец.
Выделенный в чистом виде хитин представляет собой белый порошок, который в ультрафиолетовом свете дает голубую флуоресценцию [54]. Физико-химические свойства этого соединения изучены достаточно подробно. Известно, что хитин нерастворим в воде, в щелочах и органических растворителях, но растворяется в крепких минеральных кислотах. В концентрированных растворах многих солей хитин также растворяется, давая коллоидную массу. При нагревании хитина с едким кали происходит его частичное деацетилирование с образованием хитозана, который легко растворяется даже в сильно разбавленных кислотах. При обработке азотной кислотой хитозан превращается в хитозу:
НСО
I
НС---------
неон
I О неон
НС---------
СН2ОН
Для целей качественного определения хитина в кутикуле может быть рекомендована реакция Висселинга, основанная на способности хитозана давать красно-фиолетовое окрашивание с раствором йода в присутствии 1%-го раствора серной кислоты.
При гидролизе хитина в соляной кислоте образуется солянокислый глюкозамиц, из которого при действии диэтиламина может быть получен свободный d-глюкозамин:
21
он
I
НС------
hcnh2
неон - о
I неон
I
НС------
СН2ОН
В присутствии ацетилацетона глюкозамин с диметиламинобензол альдегидом дает характерное красно-фиолетовое окрашивание.
В природных процессах разрушения хитина основную роль играют бактерии Bacterium chitinolyticum, В. chitinasum и В. chitinoclorum, которые были выделены из лесной почвы [55]. К хитинразрушающим бактериям относится также Bacillus chitinovorus [56]. Эти бактерии выделяют фермент хитиназу, гидролизующую хитин до N-ацетилглюкозамина:
хитин + (Н2О)„ = п
ОН
I
НС----------
HCNH-CO-CHg
I неон о
неон
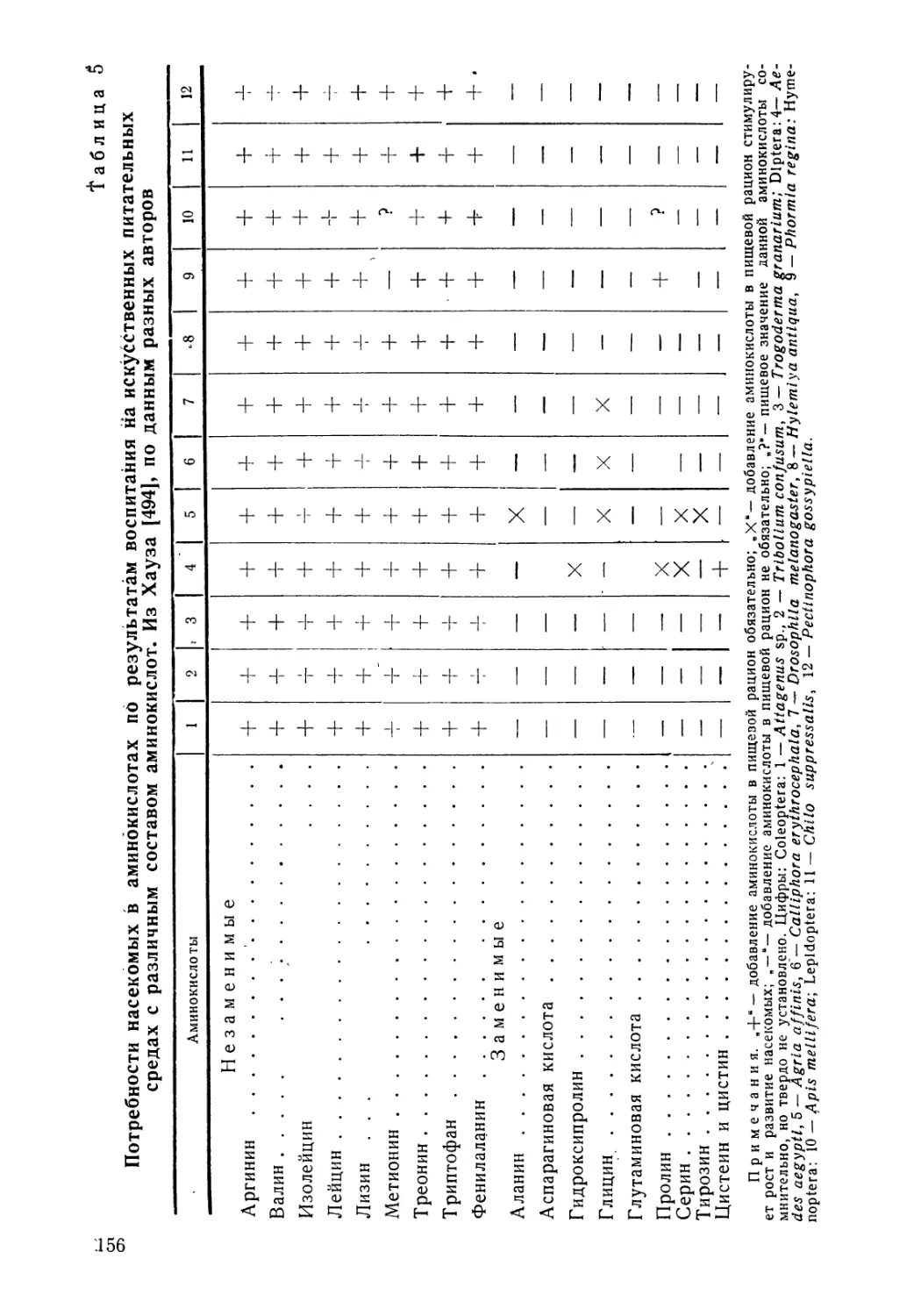
I
НС----------
СН2ОН
Кроме бактерий, хитиназа продуцируется грибами, почвенными простейшими, улитками, слизнями и самими насекомыми. Благодаря совокупной деятельности всех этих организмов хитин в природе разрушается достаточно быстро и никогда не образует больших скоплений.
Образованйе N-ацетилглюкозамина демонстрирует лишь первый этап распада хитина в природе. В дальнейшем разрушение производных хитина приводит, вероятно, к появлению меланоидинов — аморфных азотсодержащих веществ, которые в экспериментальных условиях получаются при взаимодейст-
22
вии аминокислот с восстанавливающими сахарами. Исследования Т. В. Дроздовой [57] показали, что хитин и глюкозамин при определенных условиях действительно образуют мелано-идины. Одновременно накапливаются флуоресцирующие в ульт-трафиолете непредельные соединения, химическая природа которых еще не установлена.
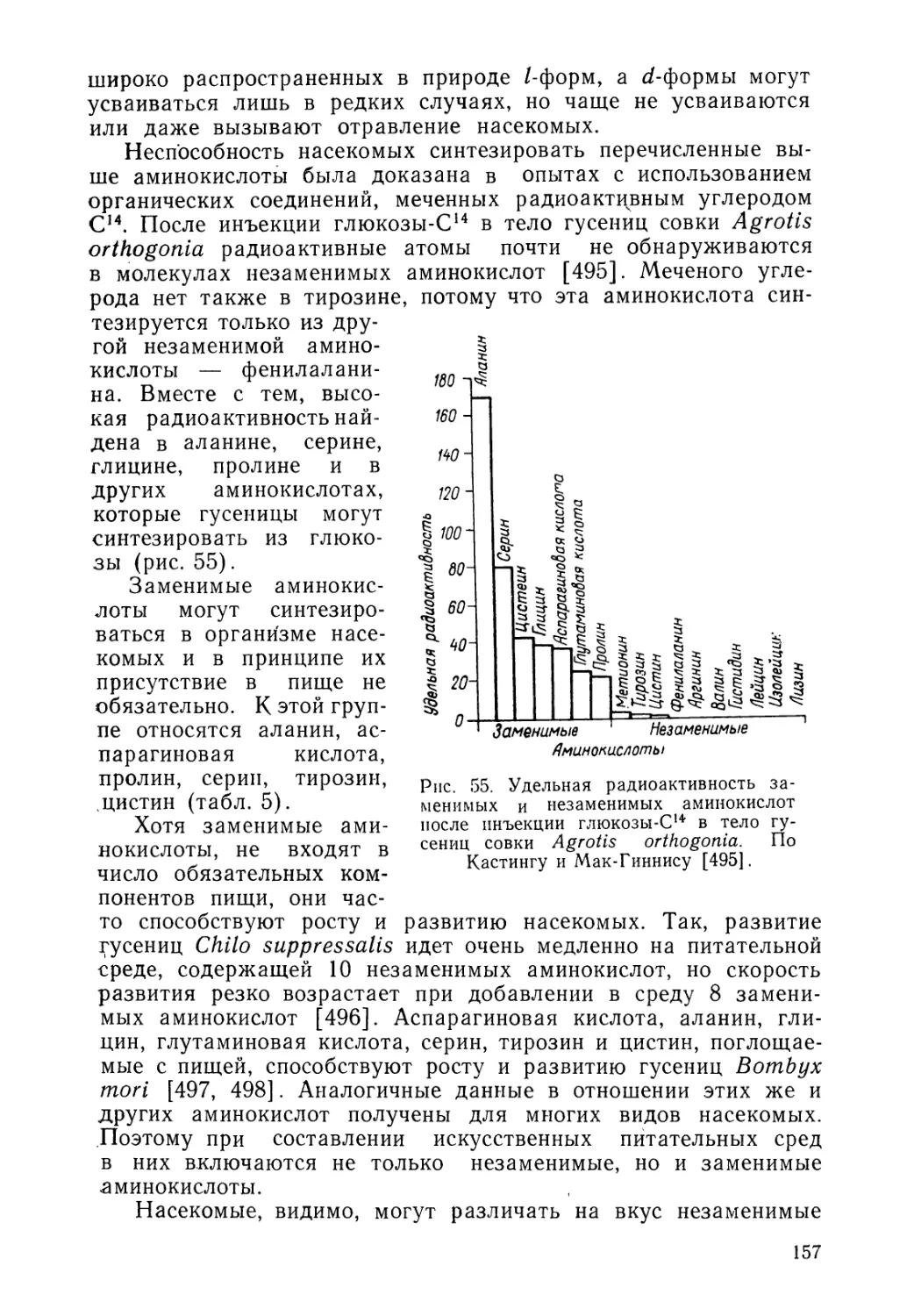
Исходным соединением для синтеза хитина в организме насекомых, вероятно, является глюкоза. После инъекции радиоактивной глюкозы в гусениц IV возраста павлиноглазки Нуа-lophora cecropia большая часть меченого углерода включается в хитин кутикулы в следующем V возрасте [58]. Наиболее вероятный путь биосинтеза хитина был установлен Кэнди и Килби [59] на основании биохимических исследований кутикулы крыльев молодых имаго саранчи Schistocerca gregaria (рис. 8). Этот путь включает в себя фосфорилирование глюкозы, которая превращается во фруктозо-6-фосфат, с последующим ее аминированием и ацетилированием. Образующийся в результате этих реакций фосфорилированный N-ацетилглюкозамин затем соединяется с уридиндифосфатом. При синтезе хитина используется энергия макроэргических связей аденозинтрифос-форной кислоты (АТФ). Синтез хитина может осуществляться и клетками гемолим-клетки выращиваются.
не только эпидермальными клетками, но фы, причем даже в том случае, если эти в искусственной среде [60].
АТФ. /Глюкоза
\ (фосфогексаза
к изомераза )
АДФ рллюкозо-G- _Фруктоз»--фосфат - фосфат
5- /Глутамил
АДФ
[люкозамит-ь-
киСЛОГГт
АТФ
_ Коэнзим Аг Н-ицетилглюкозамин-ё-' ацетат - фосфат
(фосфоацетил-
уридандифосфат-N-ацетилглюкозамин
'мугл а за) 'цётилгляксзамин --1-фотрат
Рис. 8. Схема биосинтеза хитина у насекомых. По данным Кэнди и Килби [59].
В кутикуле членистоногих цепочки хитина связаны в строго организованные нитчатые или пластинчатые мицеллы/ которые можно выявить по эффекту двойного лучепреломления, наблю
2Я
дать под электронным микроскопом и исследовать с помощью рентгеноструктурного анализа. По данным Мейера и Панкова [61], хитин кутикулы ракообразных образует структуры в форме параллелепипедов с длиной сторон а = 9,4-10~4 мкм, б= 10,46-10~4 мкм и в = 19,25-10-4 мкм (рис 9). Сходные результаты были получены и другими исследователями [62, 63].
Под электронным микроскопом структурные единицы хитина выглядят как микрофибриллы, имеющие диаметр до 3-10“2 мкм [64]. Большая длина этих фибрилл доказывает, что они могут распространяться на значительные расстояния по телу насекомых, формируя более крупные нитчатые структуры, которые выявляются при световом микроскопировании. Диаметр таких «нитей» достигает 1 мкм [62].
По-видимому, каждая полимерная молекула хитина включает в себя от одной сотни до нескольких сот остатков N-аце-тилглюкозамина. Природа сил, удерживающих такие длинные молекулы в обособленных кристаллических мицеллах, изучена недостаточно. Вероятно, в формировании крупных фибрилл из отдельных молекул хитина принимают участие водородные связи [65]. Подобная связь является результатом электростатического взаимодействия между ядром атома водорода и элек-
Рис. 9. Схема расположения молекул в одиночной мицелле хитина по данным рентгеноструктурного анализа. По Мейеру и Панкову [61]. Стрелки указывают изменения в ориентации молекулярных цепочек.
тронами атомов кислорода. По данным Дармона и Рудэля [66], приблизительно половина всех аминоацетильных групп двух соседних молекул хитина имеет взаимные связи типа
24
/N—Н’*”О = СС. Другая половина этих же групп связана' по типу —О—H*e,,O=CG
Формирование надмолекулярных структур цепочками хитиновых молекул, видимо, может идти по-разному в зависимости от типа кутикулы и ее свойств. Иногда, например в тонкой мембране крыловой пластинки, фибриллярные структуры хитина вообще не обнаруживаются [64]. В эндокутикуле саранчи при воспитании в условиях 12-часового освещения или та7 кого же 12-часового ритма температуры отмечается чередование «ночных» пластинчатых слоев хитина с «дневными» бесструктурными слоями [67]. При отсутствии ритма внешних факторов (т. е. при непрерывном освещении и при постоянной температуре) хитиновая кутикула остается бесструктурной. Этот пример показывает, что образование мицеллярных единиц хитина и их объединение в фибриллы представляют собой ритмические процессы, регулируемые внешними условиями. Эти процессы еще более усложняются в результате формирования связей хитина с белками, которые будут рассмотрены ниже.
Белки. Белки составляют от одной четверти до половины сухого материала кутикулы членистоногих. Используя различные растворители, например теплую воду, водный раствор соли или мочевины, можно получить несколько фракций кутикулярных белков, которые имеют довольно сходные наборы аминокислот. Любопытно, что у крылатых насекомых (подкласс Pterygota) все эти фракции лишены серосодержащих аминокислот — метионина, цистина и цистеина. Однако у первичнобескрылых насекомых (подкласс Apterygota) кутикулярные белки содержат значительные количества органической серы, которая, по-видимому, принимает деятельное участие в процес-сак затвердевания покровов после линьки [68].
Растворимая в воде фракция белков кутикулы получила название артроподина. Вторичная структура белков этой фракции изучалась Френкелем и Рудэлем [69], которые показали, что белковые молекулы построены по типу растянутых 6-спиралей, связанных друг с другом межмолекулярными водородными связями. Подобная структура молекулярной цепочки обеспечивает надежную связь артроподина с хитином. Как известно, в а-спиралях белков отдельные звенья цепочки расположены компактно, удерживаясь в таком состоянии внутримолекулярными водородными связями. Однако неизвестно, существуют ли подобные спирали в кутикуле насекомых.
Артроподин — это не единичный гомогенный белок, а смесь из нескольких белковых соединений. Так, при электрофорезе на бумаге у жука Diaphonia dorsalis удается выявить 5 белков, входящих в состав этой смеси [70]. Артроподин мухи Sarco-phaga bullata при электрофоретическом анализе также оказался гетерогенным, однако в ультрацентрифуге не удалось разделить составные части белковой фракции: все они осаждались 25>
как гомогенное соединение с молекулярным весом от 7000 до 8000 [71].
Артроподин, соединяясь с хитином, создает основной глю-копротеиновый компонент кутикулы. Прочность наружного скелета насекомых связана главным образом с этим соединением. При воздействии фенольных веществ водорастворимые. белки превращаются в нерастворимые склеротины, вызывающие затвердевание кутикулы после линьки [72]. Подробнее эти процессы рассматриваются на с. 30—36.
Нерастворимая в воде белковая фракция кутикулы недостаточно изучена. Миллс с соавторами [73] выяснили состав растворяющихся в КС1 белков кутикулы сверчка Gryllus do-mesticus. Оказалось, что в исследуемой фракции содержится 5 белковых соединений, которые могут быть разделены при центрифугировании и последующей фильтрации на полиакриламидном геле. Самый «легкий» белок имел молекулярный вес 7000, а все другие белки были в несколько раз «тяжелее». Функциональное значение этих белков остается неизвестным.
В составе нерастворимой в воде фракции кутикулы обнаруживается своеобразный белок резилин, который накапливается только в наиболее эластичных участках покровов, например в скелете крыловых сочленений [74]. Внутренний слой такой эластичной кутикулы формируется из параллельных пластинок хитина толщиной около 0,2 мкм, склеенных полосами резилина, которые достигают толщины до 3 мкм. Белок может быть экстрагирован из кутикулы 0,1 н раствором соляной кислоты при нагревании до 97°С. По своим механическим и оптическим свойствам резилин очень сходен с натуральным и искусственным каучуком, отличаясь от него только отсутствием текучести. Первичные цепи молекул этого белка практически не образуют вторичных соединений, возникающих на основе водородных связей.
Третичная структура молекул резилина представлена трехразмерной сетью из белковых цепочек, расположенных на одинаковых расстояниях друг от друга. Иногда резилин образует в кутикуле крупные скопления величиной до 100 мкм. Природа боковых связей молекул в таком скоплении неизвестна, но эти связи очень стабильны и отличаются от всех других до сих пор известных белковых связей. В отношении аминокислотного состава резилин хорошо отличается от других кутикулярных белков, но подобно артроподину он также лишен серосодержащих аминокислот [75].
Каждая фракция кутикулярных белков, по-видимому, является достаточно специфичной в отношении ее связей с молекулами других химических соединений. Так, Хакман и Голдберг [76] установили, что в кутикуле жука Agrionome spinicollis 14% общего количества белков составляют водорастворимые
26
белки, которые не связаны с какими-либо соединениями. Белки, растворяющиеся в 0,16 моль/л растворе Na2SO4, составляют 2%; они связаны с другими компонентами кутикулы слабыми ван-дер-Ваальсовскими связями. Подобная связь основана на взаимодействии между двумя электрическими диполями, имеющими одинаковые по величине, но противоположные по знаку заряды. Белки, растворяющиеся в 7 моль/л водном растворе мочевины, составляют 25% и связываются с другими соединениями межмолекулярными водородными связями. Только 3% белков кутикулы жука составляют белки, растворяющиеся в 0,01 н растворе NaOH; они связаны с другими молекулами электровалентными или двойными ковалентными связями. Оба типа связей являются достаточно прочными и основываются на межатомных взаимодействиях. Остальные 56% белков связаны с хитином.
Природу связей белкового и хитинового компонентов в глю-копротеиновом комплексе кутикулы начали обсуждать в 1941 г.„ и эта дискуссия продолжается до сих пор [77]. Установлено, что хитин способен абсорбировать водорастворимый кутикулярный белок, причем преимущественно поглощаются богатые тирозином фракции белка [78]. Количество абсорбированного белка зависит от pH и солевой концентрации раствора: при pH, равном 9, весь абсорбированный белок освобождается. Хакман [79] считает, что в образовании комплекса хитина и белка участвуют ковалентные связи, возникающие благодаря обмену электронов между отдельными атомами двух молекул.
Хитин, вступая в связь с белком, сильно изменяет свои свойства и приобретает устойчивость к действию хитиназы, Гидролиз хитина этим ферментом возможен только после разрыва его связей с белками [80].
Липиды. Современными исследованиями с использованием методов хроматографии на бумаге, инфракрасной спектроскопии и газовой хроматографии доказано, что «воска», составляющие основу воскового слоя эпикутикулы, содержат достаточно сложный набор химических соединений. У разных насекомых этот слой формируется различными липидами. Так, у сверчков и тараканов более половины жировых соединений кутикулы представлено углеводородами, а у личинки мучного хрущака Tenebrio moliior — диолами [81, 82, 83]. Довольно значительный процент липидной фракции кутикулы составляют свободные жирные кислоты, но алифатические спирты здесь, как правило, отсутствуют. Небольшое количество холестерина обнаружено в кутикуле сверчка Gryllus domesticus и. таракана Periplaneta americatia. Указания на присутствие каких-то стеринов среди кутикулярных липидов приводятся и для других насекомых.
Физические свойства восков эпикутикулы представляют для'
27
•физиолога не меньший интерес, чем их химический состав. Температура плавления воскового слоя имеет непосредственное отношение к проблеме транспирации через покровы. У разных видов составляющие этот сЛой воска плавятся при разной температуре, которая в пределах всего класса насекомых может варьировать от 36—42 до 108—109°С [84, 85]. Эти колебания точки плавления воска иллюстрируют различную устойчивость насекомых к температурным изменениям во внешней среде. В момент, когда воск плавится, изменяются не только его состояние, но и другие физические свойства (например, оптическая плотность и контактный угол). Особенно важно отметить, что одновременно с этими изменениями резко повышается проницаемость кутикулы. Более подробно это явление рассматривается на с. 59—60.
Фенольные соединения. Дезаминированные и азотсодержащие фенолы, входящие в состав кутикулы, синтезируются из тирозина и его производного — дигидроксифенилаланина (ДОФА). Состав фенолов кутикулы (рис. 10) выяснен для многих насекомых, но наиболее точные данные были получены
R = H катехин
= СН3 4-Метилкатехип
= СООН 3,4-дигидроксибензойная (протокатеховая) кислота
= СН2—СООН 3,4-дигидроксифенилуксусная кислота
= СН2—СН2—СООН 3,4-дигидроксифепилпропионовая кислота
= СН2—СНОН — СООН 3,4-дигидроксифенилмолочная кислота
= СН2—СН2—NH—СОСНз N-ацетилдофамин <
= СН2—СН—СООН 3,4-дигидроксифенилалапин (ДОФА)
I
NH2
Гидрохинон Пирогаллол (п - диоксийвнзол) (/,2,3- триоксидензол)
Рис. 10. Структурные формулы фенолов, изолированных из кутикулы насекомых. По Хакману [86].
Малеком [87] для имаго саранчи Schistocerca gregaria. Биосинтез фенольных соединений, их превращение в хиноны и значение тех и других в процессах затвердевания кутикулы подробно обсуждаются на с. 30—35.
.28
Ферменты. Среди ферментов покровных тканей насекомых наиболее известны фенолазы, синтезирующие фенольные соединения, необходимые для затвердевания и окрашивания кутикулы после линьки. Совершенно ясно, что сложный цикл превращений тирозина в полигидроксифенолы и продукты их окисления — хиноны — обеспечивается целой системой ферментов. Однако нам известны лишь некоторые из «биологических катализаторов» этих процессов, причем их субстратная специфичность изучена недостаточно.
При синтезе фенольных соединений кутикулы первоначально происходит превращение тирозина в ДОФА. Эта реакция осуществляется тирозиназой, которая была обнаружена в кутикуле различных насекомых. Затем ДОФА-декарбоксилаза превращает ДОФА в дофамин. Этот фермент достаточно специфичен: он не действует на тирозин или триптофан и только в незначительной степени проявляет свою активность в отношении некоторых производных триптофана. Трансацетилаза переносит ацетильную группу на дофамин. С тем же успехом этот фермент ацетилирует тирамин, гистамин и серотонин [88]. Различные и высоко специфичные в отношении их субстратов фенолксидазы окисляют фенолы до хинонов; последние соединения, реагируя с кутикулярными белками, вызывают затвердевание покровов насекомых. Одна из фенолоксидаз была выделена в кристаллической форме из личинок мухи Calliphora erythrocephala [89]. Этот фермент оказался орто-дигидрокси-фенолазой. Он не действовал на фенолы, содержащие только одну гидроксильную группу. Аналогичными свойствами обладает фенолоксидаза, продуцируемая левой придаточной железой у самок таракана Periplaneta americana [90].
Почти все фенолазы выделяются в неактивной форме проферментов и лишь в определенные моменты жизненного цикла приходят в активное состояние под влиянием специальных активаторов. Залечивание ран в покровах связано с активированием профенолазы, которая, переходя в активную фенолазу, обусловливает синтез пигментов и фенольных соединений кутикулы [44]. Аналогичные процессы протекают при образовании пупария у мух, когда профенолоксидаза активируется специальным ферментом [91]. Действие фермента-активатора воспроизводится такими протеазами, как хемотрипсин и аминопептидаза.
Широкий набор разнообразных ферментов содержится в эк-зувиальной жидкости, которая появляется в период линьки в пространстве между старой и новой кутикулой. Так, например, в водном экстракте экзувиальной жидкости гусениц тутового шелкопряда были обнаружены амилаза, инвертаза, протеаза и хитиназа [92]. Все эти ферменты принимают участие в разрушении химических соединений внутренних слоев старой кутикулы.
29
Хитиназа экзувиальной жидкости изучена наиболее подробно [93]. Оптимум pH для этого фермента 4,9—5,5, а оптимальная температура 37°С. Синтез хитина новых кутикулярных слоев осуществляется хитинсинтетазой. Активность фермента наиболее высока в митохондриальной фракции эпидермиса [94].
Неорганические соединения. Основная часть кутикулы насекомых построена из органического материала, а неорганические соединения составляют менее 1 % по отношению к сухому весу всей кутикулы. Общее содержание неорганических веществ намного выше в эпикутикуле, чем в прокутикуле.,
В золе, которая получается после полного сгорания кутикулы личинок Sarcophaga bullata, содержится 25 химических элементов, причем наиболее высока концентрация Mg и К [95]. В кутикуле личинок Agrionome spinicollis основным неорганическим элементом является Са [76]. Содержание Са достаточно велико в тех случаях, когда затвердение покровов связано с импрегнацией кутикулы известью. Соли Са у наземных насекомых откладываются непосредственно под эпикутикулой, а у водных личинок Psychodidae и Stratiomyidae накапливаются на ее поверхности в виде наплывов или кристаллических конкреций [85]. Как правило, в кутикуле присутствует СаСО3, но в стенках оотек у тараканов обнаружен оксалат [96], а у богомолов — цитрат кальция [97].
Во всех перечисленных примерах биологическое значение солей кальция достаточно очевидно: наряду с фенолами они обеспечивают прочность наружного скелета насекомых. Однако значение других неорганических элементов кутикулы не установлено.
§ 3. Склеротизация кутикулы
Склеротины и их свойства. Каждый раз во время линьки членистоногих кутикула сбрасывается и образуется заново. Только что сформированная кутикула мягка и бесцветна. Ее затвердевание — склеротизация — обычно тесно связано с окрашиванием— пигментацией. Пигментация, обусловленная синтезом меланина и других красящих веществ экзокутикулы, будет рассмотрена в, следующем разделе данной главы. Здесь мы остановимся на процессах склеротизации, в результате которых гибкая и податливая кутикула затвердевает, образуя прочный каркас, одевающий все тело насекомого.
Выше уже подчеркивалось, что прочность кутикулы насекомых обеспечивается специальными белками, которые тесно связаны с хитином. В полностью затвердевшей кутикуле эти белки утрачивают гибкость и способность к растяжению, превращаясь в особо прочные склеротины. Склеротизация кутикулы, следовательно, может рассматриваться как процесс формирования склеротиков.
30
Переход белка в склеротин напоминает производственный процесс дубления кожи. Как известно, кожа задубливается под влиянием различных дубильных веществ, например таннина. Аналогичные вещества, вызывающие затвердевание кутикулы насекомых, могут быть названы склеротизирующими агентами. Роль этих веществ заключается в том, что они связывают свободные аминогруппы белков и формируют поперечные мостики между белковыми цепями, создавая сплошную плотно сшитую кутикулярную структуру [72]. Кроме того, полимерные молекулы склербтизирующего агента заполняют пустоты между белками или кристаллами хитина и стабилизируют кутикулу в механическом отношении [98]. Природа и образование таких агентов рассматривается ниже.
(жлеротизация кутикулы при образовании оотеки у тараканов. При склеротизации кутикулы, образующей стенку оотеки у тараканов, большую роль играют дезаминированные полифенолы и их производные — хиноны, которые происходят из тирозина, свободно растворенного в гемолимфе [99]. Под действием фермента тирозиназы тирозин присоединяет вторую гидроксильную группу и превращается в дигидроксифенилаланин (ДОФА):
nh2 nh2
сн2— сн—соон сн2—сн—соон он он
Тирозин ДОФк
В результате дезаминирования и последующего декарбоксилирования ДОФА получаются дифенолы соответствующих органических кислот, которые, после окисления их в хиноны, могут быть использованы для целей склеротизации кутикулы (рис. 11).
В оотеках тараканов Periplaneta americana и Blatta orienta-lis затвердевание кутикулы осуществляется в основном хиноном протокатеховой кислоты [100]. Исходные продукты для задубливания белков поступают из придаточных желез, расположенных на конце брюшка у самок этих насекомых. Правая придаточная железа вырабатывает фермент [3-глюкозидазу; секрет левой железы содержит [3-глюкозид дифенилпротокате-ховой кислоты, фермент фенолазу и кутикулярный белок [99, 101]. Накопление глюкозидного соединения в левой придаточной железе происходит только в присутствии гормона приле-
31
жащих тел [102]; синтез глюкозидазы в правой железе идет постоянно и не регулируется прилежащими телами. Когда формируется оотека, секреты обеих желез смешиваются и 0-глюко-зидаза разрушает связь между р-глюкозидом и дифенилпро-токатеховой кислотой, освобождая дифенол, который окисляется фенолазой до соответствующего хинона. В свою очередь хинон реагирует с белком, обеспечивая его задубливание.
ДОФА
Д езаминиробание
ОН ОН
3,4 - дигидроксифенил- 3,4 = дигидьоксиф'енил-
молочная кислота, пропионовая кислота, д
| к
сн2-соон ОН 2-СООН р
и J=o k U—он и
\Z л
II I “р
О ОН Ро
Хинон этой, кислоты 3,4 = ди гидроксифенил Л уксусная кислота, н
I в
СООН СООН
6=^-------------^ОН
о он
Хинон этой кислоты
3,4 = дигидрокси-бензойная (прото-катехоВая) кислотой
Окисление
Рис. И. Трансформации дигидроксифенилаланина (ДОФА), приводящие к образованию дифенолов и хинонов, необходимых для склеротизации кутикулы в оотеке тараканов. По Ричардсу [И].
Процесс затвердевания оотеки начинается с поверхности и распространяется вглубь, захватывая протеиновую эпикутикулу и ту часть прокутикулы, которая потом становится экзокутикулой. Хинон первоначально вступает в связь с концевыми аминогруппами кутикулярного белка, образуя поликатехин-бел-32
ковые соединения [98, 103]. В таких соединениях, атомы азота белковой молекулы химически связаны с ароматическим ядром хинона:
°=1
О =1
NH—CH—С—NH —
Когда концевыче аминогруппы оказываются «заполненными» хинонами, последние начинают реагировать с аминогруппами лизина, входящего в состав молекул белка. В результате белковые молекулы фиксируются ароматическими кольцами хинонов не только на их концах, но и в промежуточных точках. Хитин, который тесно связан с кутикулярным белком, придает дополнительную жесткость склеротину оотеки.
Склеротизация кутикулы при образовании пупария у мух. При образовании пупария у мух кутикула личинки последнего возраста подвергается особенно сильной склеротизации (рис. 12). В этом случае основным склеротизирующим агентом является азотсодержащий полифенол N-ацетилдофамин, впервые изолированный из личинок Calliphora erythrocephala [104]. Это соединение возникает из тирозина, который первоначально гидроксилируется тирозиназой и превращается в ДОФА. У молодых личинок последнего возраста ДОФА дезаминируется, превращаясь главным образом в гидроксифенилпировиноградную и гидроксифенил пропионовую кислоту [105], т. е. метаболизм полифенолов — производных тирозина — осуществляется так же, как и в оотеках тараканов (см. рис. 11). Однако у старших личинок, за день до окукления, дезаминирование ДОФА прекращается и главный продукт, в который превращается тирозин,— это N-ацетилдофамин. Следовательно, в этот период развития личинок происходит накопление склеротизирующего агента. Такое изменение в метаболизме тирозина связано с выделением гормона кольцевой железы — экдизона, вызывающего кукол очную линьку [106].
Путь биосинтеза N-ацетилдофамина у старших личинок последнего возраста мух С. erythrocephala тщательно изучен Карлсоном и Секерисом [104]. ДОФА под действием ДОФА-декарбоксилазы, превращается в дофамйн, освобождая углекислоту:
NH2
сн2-сн-соон
со2
СН2- СН2-NHa
он
Рис. 12. Изменения кутикулы личинки Sarcophaga falculata при окуклении и образовании пупария. По Деннелу [15].
А — покровы личинки через 2 дня после выхода из яйца; Б — то же у взрослой личинки; В — то же при окуклении, перед отделением пупария от эпидермиса; Г — оболочка вполне сформированного старого пупария; прокутикула сильно уменьшена в размерах в связи с ее обезвоживанием, л.эп — липидная "Эпикутикула; пк — прокутикула; п.эп — протеиновая эпикутикула; э — эпидермис.
Дофамин превращается в N-ацетилдофамин путем присоединения ацетильной группы от ацетил-коэнзима А:
Допамин
Ацетил КоА К о А
О
II
NH-C-СН3
I сн2-сн2 -QLoh он
N - ацетилдосрамин
Фермент, осуществляющий эту реакцию, всегда присутствует у личинок и активность его не изменяется под влиянием гормона кольцевой железы [88].
34
Непосредственно для задубливания белка в пупарии используется не сам N-ацетилдофамин, а хинон, получаемый при его окислении:
О
II
NH--C—СН3
сн2—СН2
N- ацетилдофамин---
v-°
II
О
Хинон N- ацетилдофамина.
Окисление N-ацетилдофамина катализируется ферментной системой, включающей в себя профенолоксидазу и специфический фермент-активатор [107, 108]. Активность обоих ферментов достигает максимума у старших личинок перед образованием пупария [109].
Описанный здесь путь склеротизации стенок пупария иногда дополняется или даже заменяется другими путями. По-видимому, У Дрозофил Drosophila melanogaster основным склероти-зирующим агентом является не N-ацетилдофамин, а один из продуктов его последующего превращения [110]. Хрупкие белые пупарии мухи Musca autumnalis образуются в результате пропитывания покровов углекислым кальцием [111]. В данном случае кальцификация заменяет фенольную склеротизацию, поэтому после обработки кислотами, растворяющими соли кальция, пупарии становятся бесцветными, прозрачными и мягкими.
Гормональный контроль склеротизации. Склеротизация кутикулы после линьки насекомых вызывается специальным гормоном, который получил название бурсикона. У тараканов Periplaneta americana этот гормон продуцируется нейросекреторными клетками последнего брюшного ганглия [112]. Поэтому наложение лигатуры между грудью и брюшком у только что отлинявших имаго тараканов предотвращает склеротизацию покровов в переднем участке тела; кзади от лигатуры склеротизация протекает нормально. Методом биопроб установлено, что бурсикон начинает выделяться вскоре после линьки и через 90 мин содержание его в гемолимфе достигает максимума [113]. Винсент, [114] доказал, что у саранчи Locusta migratoria migratorioides бурсикон также выделяется последним брюшным ганглием.
35
У мух, которые в отличие от прямокрылых и тараканов имеют сильно концентрированную нервную систему, основным поставщиком бурсикона являются клетки заднего отдела сложной торакально-абдоминальной нервной массы [115]. Частично гормон выделяется также нейросекреторными клетками межцеребральной части мозга.
По своей химической природе бурсикон принадлежит к белковым соединениям; молекулярный вес его около 40 000 [116, 117]. Гормоны, выделенные из ганглиев тараканов и мух, оказались очень близкими, но не идентичными соединениями.
§ 4. Пигменты и окраска покровов
Общая характеристика окраски насекомых. В окраске тела и крыльев насекомых можно найти почти все известные в природе цвета и различные переходы этих цветов, то резкие и внезапные, то плавные и постепенные. Разнообразные сочетания цветовых оттенков создают сложный рисунок, который или выступает ярко, контрастируя с окружением (предостерегающая, апосематическая окраска), или, наоборот, сливается с фоном, маскируя самих носителей окраски (покровительственная, криптическая окраска).
Далеко не всегда одинаковый цветовой эффект достигается одними и теми же способами у различных насекомых. Так, например, покровительственная зеленая окраска у гусениц, вероятно обусловлена содержащимися в гемолимфе пигментами, близкими к хлорофиллу [118], а у бабочки Ornithoptera posei-don блестящий зеленый цвет крыльев создается сочетанием какого-то желтого пигмента с синей структурной окраской i[l 19]. Этот пример показывает, что окраска насекомых может быть связана по крайней мере с двумя факторами: во-первых, с присутствием специальных красящих веществ — пигментов, и, во-вторых, с особенностями микроскопического строения кутикулы.
Пигментные окраски широко распространены у насекомых. При этом пигмент, формирующий наружный рисунок, откладывается в экзокутикуле {кутикулярные окраски), существует в виде гранул в клетках эпидермиса {эпидермальные окраски) или же находится в растворенном состоянии в плазме гемолимфы, в жировом теле и в кишечнике {субэпидермалъные окраски). В двух последних случаях он просвечивает через покровы, обусловливая общий тон окраски, на который накладываются четкие цветовые пятна, создаваемые кутикулярными пигментами.
По своей природе пигменты насекомых неоднородны. Они принадлежат к разнообразным химическим соединениям, которые по формальному признаку присутствия или отсутствия атомов азота в молекуле можно разделить на две группы. Безазо-тистые пигменты, как правило, заимствуются насекомыми из
36
растительной пищи и могут подвергаться лишь незначительным перестройкам в организме насекомого. Исключение в этом плане составляют лишь афины — субэпидермальные красящие вещества тлей; аналогичные соединения неизвестны среди растительных пигментов. Азотсодержащие пигменты, как правило, синтезируются самими насекомыми. Однако и здесь имеются исключения: синтез тетрапиррольных пигментов насекомых, по-видимому, тесно связан с метаболизмом хлорофилла растительной пищи.
Структурная окраска покровов связана с некоторыми специфическими особенностями микроскопического строения кутикулы, которая создает явления интерференции, дифракции и рассеивания света. Структурная окраска обнаруживается не у всех насекомых; чаще всего она свойственна жукам и бабочкам. Меньшее развитие подобный тип окраски получает у двукрылых, полужесткокрылых и стрекоз. Структурная окраска часто выступает в качестве дополнительной, усиливающей и подчеркивающей эффект основной окраски, обусловленной такими пигментами как каротиноиды, флавоноиды, антоцианы, антрахиноны, афины, птерины, оммохромы, тетрапирролы и меланины. Все эти пигменты рассматриваются ниже.
Каротиноиды. Каротиноиды, которые иногда называют также липохромами, являются широко распространенными нерастворимыми в воде растительными пигментами. В некоторых отношениях каротиноиды сходны с жирами, но в действительности они представляют собой непредельные высокомолекулярные углеводы. В организме насекомых каротиноиды обычно существуют в тесной связи с белками, образуя сложные красящие вещества каротин-альбумины.
Все каротиноиды можно разделить на две большие группы. Среди не содержащих кислорода каротинов наиболее обычными пигментами насекомых являются оранжево-желтый (^-каротин и красный ликопин. Оба пигмента имеют одинаковую су?л-марную формулу . С40Н56, но различаются по структуре моле-
= каротин
Гсксолн
37
Еще одно соединение этой группы — а-каротин— было об-, наружено в элитрах некоторых жуков — «божьих коровок» (семейство Coccinellidae) и в красных пятнах на теле самок палочника Carausius morosus [120, 121]. Молекулы 0-каротина и а-каротина очень сходны и отличаются друг от друга только по положению двойной связи во втором углеводородном кольце:
сх = каротин
При питании колорадского жука (Leptinotarsa decemlinea-ta) листьями картофеля, содержащиеся в них каротины не перевариваются; они в неизменном состоянии проходят через стенки кишечника и накапливаются в гемолимфе или в надкрыльях жука [122]. Все каротиноиды, найденные в листьях, обнаружены и у жуков или у их личинок [123]. Хищный клоп Perillus, который нападает на колорадского жука, поглощает каротины вместе с его гемолимфой. Эти пигменты также не задерживаются в покровах, обусловливая красную и желтую окраску.
Гораздо реже каротинов в покровах членистоногих обнаруживаются содержащие кислород каротиноиды из группы ксантофиллов. Подобно каротинам ксантофиллы попадают в организм насекомых с растительной пищей.
У- насекомых наиболее обычным пигментом этой группы является лютеин — гидроксилированное производное а-каротина:
Это соединение очищено и выделено в кристаллической форме из коконов тутового шелкопряда и из листьев тута, которыми питаются гусеницы [124].
К группе ксантофиллов следует отнести и некоторые^ другие пигменты насекомых, заимствованные ими у растений [125, 126]:
СНз
38
о
о
Астаксантин
Сравнительно недавно у тлей Macrosiphum liriodendri были найдены необычные каротиноиды, которые ранее считались специфичными для микроорганизмов [127]. Возможно, что эти пигменты синтезируются бактериями — микросимбионтами тлей.
Флавоноиды. Подобно каротиноидам флавоноиды не синтезируются самими насекомыми, а заимствуются ими у растений. Однако в отличие от каротиноидов флавоноиды являются водорастворимыми пигментами.
Группа флавоноидов объединяет многочисленные красящие вещества высших растений. В химическом отношении все они представляют собой производное желтого пигмента флавона (2-фенилхромона):
Флавоноиды встречаются у насекомых редко и всегда в небольших количествах. Поэтому состав этих пигментов и их участие в создании окраски покровов выяснены еще недостаточно. В крыльях бархатницы Melanargia galathea идентифицированы желтые флавоноиды — лютеолин, трицин и следы других пигментов этой группы [128]:
39
Трицин, лютеолин и их производные (глюкозиды) обнаружены в крыльях бабочки Coenonympha pamphilus [129]. Пигменты, попадают в кишечник гусениц вместе с растительной пищей, а затем во время окукления откладываются в крыльях имаго.
Антрахиноны и афины. Пигменты этой группы представляют собой производные ароматического соединения — антрахинона:
О
II
Антрахиноны принадлежат к числу широко распространенных в природе растительных пигментов. Однако обнаруженные у насекомых антрахиноны синтезируются ими самостоятельно и в растениях не встречаются. Не подлежит сомнению все же, что исходными продуктами для этого синтеза являются пигменты, содержащиеся в растительной пище.
Антрахиноны и афины функционируют в качестве пигментов только у Homoptera. Неполимерные антрахиноны обнаружены у кокцид, у которых отмечается видовая специфичность каждого пигмента: у Kermesococcus ilicus синтезируется кер-мезиновая кислота, а у Dactylopius coccus — карминовая кислота. Структура обоих пигментов была установлена Димросом с соавторами [130, 131]:
НО
СН3О ОН о
соон о он
соон о он
Кермезиновая кислота,
Карминовая кислота.
Несколько десятков лет назад, до того как дешевые синтетические красители получили широкое распространение, красный пигмент кошенили D, coccus добывался в виде калиевой соли из жирового тела насекомого и использовался в качестве красителя.
Полимерные антрахиноны, получившие название афинов, обнаружены в качестве пигментов в гемолимфе 20 видов тлей. Просвечивая через покровы, они придают темную окраску этим насекомым. Обычно афины мало стабильны и легко разрушаются при экстрагировании. Наиболее устойчивым соединением из группы афинов является эритроафин, который в химическом 40
отношении представляет собой 4,9-дигидроксиперилен-З, 10-хи-нон [132]:
Карминово-красные эритроафины, выделенные из гемолимфы Aphis fabae и Tuberolachnus salignus, являются стереоизомерами одного и того же соединения. Структурные формулы нестабильных промежуточных пигментов — оранжевого хризо-афина и желтого ксантоафина — пока не установлены. Все три пигмента растворимы в воде. Все они интенсивно флуоресцируют, в особенности в ультрафиолетовом свете.
Птериновые пигменты. Птерины — это максимально обогащенные азотом пигментные вещества кутикулы и эпидермальных клеток. Все птериновые пигменты являются производными гетероциклического соединения птеридина:
ППери.н
В первом азотсодержащем кольце группа NH2 и кислород свойственны всем птеринам. Радикалы Ri и R2 могут быть представлены различными группировками атомов; часто присутствует лишь один радикал, а второй замещен водородом. Простейший птериновый пигмент, обнаруженный у насекомых, вообще не имеет радикалов Ri и R2 (точнее, оба радикала представлены водородом, как и в молекуле птеридина):
2- амино - Р -оксиптеридин
41
Этот голубой флуоресцирующий пигмент был выделен из тела дрозофилы [133].
В ряду пигментов, принадлежащих к группе лейкоптерина, радикалы Ri и R2 (или один из этих радикалов) замещены кислородом (рис. 13).
Три флуоресцирующих пигмента этой группы (белые лейко-птерин и изоксантоптерин и желтый ксантоптерин) были выделены из крыльев бабочек-белянок, подробно изучены, а затем синтезированы. Лейкоптерин обнаружен только у чешуекрылых, а два других пигмента присутствуют также в покровах других насекомых.
В пигментах группы эритроптерина один из радикалов (Ri или R2) представлен различными химическими группировками, содержащими 3 атома углерода (рис. 13). Оранжево-красный пигмент эритроптерин первоначально был изолирован из крыль
Группоь леикоптеринсь
Ксантоптерин
Лейкоптерин
Группа эритроптерина.
Группа
птерородина
Птеророоин
Биоптерин
Дрозоптерин
Рис. 13. Основные птериновые пигменты насекомых.
42
ев бабочек, но затем обнаружен у клопов. Биоптерин и сепиап-терин присутствуют в глазах и в покровных тканях многих насекомых, в первую очередь двукрылых.
Желтый флуоресцирующий пигмент сепиаптерин, который появляется в глазах мутанта sepia дрозофилы [133], отсутствует у дикой формы этого вида, но постоянно обнаруживается в глазах Calliphora erythrocephala [134]. Мутация lemon гусениц тутового шелкопряда, по всей вероятности, также связана с накоплением этого пигмента [135]. Сепиаптерин очень близок к рибофлавину по спектру поглощения, флуоресценции, чувствительности к свету и поведению на хроматограммах. Проблема разграничения этих веществ специально обсуждалась Циглер-Гюндером [136], который показал, что сепиаптерин не обладает активностью витамина В2, свойственной рибофлавину. Следовательно, наиболее надежный метод разграничения обоих соединений — это использование биологических тестов, чувствительных к витамину В2.
Из других пигментов группы эритроптерина наиболее известны дрозоптерины, свойственные исключительно дрозофилам и пока не обнаруженные в глазах или в покровных тканях других насекомых [133].
У двукрылых сепиаптерин и дрозоптерины синтезируются из биоптерина. В глазах Calliphora и мутанта sepia дрозофилы синтез идет в направлении биоптерин-> сепиаптерин, а у дикой формы дрозофилы биоптерин при окислении превращается в дрозоптерин. Легко осуществляется и обратный переход дро-зоптеринов в биоптерин [137].
Среди птеринов, обнаруженных у насекомых, наиболее сложное строение имеет птерородин, который следует отнести к особой группе птериновых соединений [138]. В молекуле пте-рородина объединены два остатка птеридина, соединенные метиленовым мостиком (рис. 13).
В покровах насекомых птерины часто присутствуют в смеси с другими пигментами. У бабочки Colias eurytheme они локализуются в чешуйках и вместе с меланинами создают рисунок из оранжевых и черных пятен на крыльях [139]. Ярко-красная окраска некоторых клопов обусловлена совместным действием эритроптерина и каротиноидов [140].
Особенно велика роль птеринов в создании ярких расцветок крыльев дневных бабочек. У желтушек (р. Colias) система крыловой птериновой пигментации включает в себя 7 основных компонентов: лейкоптерин, изоксантоптерин, ксантоптерин, эритроптерин, сепиаптерин, птерин-6-карбоксиловую кислоту и птерородин [141]. Разнообразие окраски у различных видов этого рода связано с различными соотношениями птериновых компонентов. Белая окраска обусловливается только лейкопте-рином и изоксантоптерином. Желтая окраска связана с добавлением к этим двум пигментам ксантоптерина и сепиаптерина,
43
а при оранжевой окраске добавляется еще и эритроптерин. Наконец, оранжево-красные виды бабочек обладают полным набором птериновых пигментов, хотя основное значение для создания красной окраски крыльев имеет птерородин.
Вариации окраски крыльев у внутривидовых форм Pieris napi связаны с изменениями содержания сепиаптерина [142]. У формы bryoniae, которая характеризуется желтой окраской на нижней стороне задних и на верхушке передних крыльев и белой окраской остальных участков каждого крыла, имеются 4 птериновых пигмента: ксантоптерин, изоксантоптерцн, лейко-птерин и сепиаптерин. Последний пигмент обусловливает желтую окраску крыльев. У формы subtalba, у которой сепиаптерин отсутствует, желтые пятна на крыльях исчезают. Окраска крыльев у этой формы одноцветная, белая. У формы sulphurea с ярко-желтыми крыльями увеличивается содержание сепиаптерина, а количество изоксантоптерина и лейкоптерина сильно снижается.
В пигментных клетках фасеточных глаз птерины наряду с оммохромами, являются светозащитными пигментами. У мухи Calliphora erythrocephala птериновые пигменты глаз представлены сепиаптерином и тетрагидробиоптерином [143]. Как све-тозащита от ближних ультрафиолетовых лучей птерины и ом-мохромы взаимно дополняют друг друга. Оба типа пигментов, однако, прозрачны для красных лучей. Благодаря этому они играют роль светофильтров, повышающих чувствительность глаза мухи к излучениям длинноволнового конца спектра [144].
Остается дискуссионным вопрос об экскреторной функции птеринов. Открывший птериновые пигменты Гопкинс [145] писал о них, как об «экскреторных продуктах; формирующих орнамент рисунка». Однако Гопкинс ошибочно полагал, что белое вещество крыльев бабочек-белянок (сем. Pieridae) — это мочевая кислота или какой-то дериват мочевой кислоты. Действительно, по своим химическим свойствам, форме кристаллов и поведению на хроматограммах лейкоптерин сильно напоминает мочевую кислоту. Лишь в 1926 г. Шёпф и Виленд [146] показали, что. крыловые пигменты Pieridae относятся к другой группе химических соединений — к птеринам. Не обнаружив метаболической связи между птеринами и уратами (производными мочевой кислоты), авторы полностью отрицали экскреторную функцию пигментов. Позднее Беккер [147] высказал мысль, что птериновые пигменты ^обеспечивают возможность выведения из организма конечных продуктов обмена веществ путем их отложения в покровах. В ходе эволюции пигментная функция птеринов, по-видимому, вытеснила их первичную экскреторную функцию, и в настоящее время лишь ксантоптерин, который обнаруживается в выделениях некоторых насекомых, может служить примером экскретируемого пигмента из группы
44
птеринов. Такого взгляда на происхождение и функцию птеринов в основном придерживаются современные исследователи [134].
Эволюционная связь птеринов с экскреторными веществами подтверждается при изучении синтеза птериновых пигментов. Показано, что птерины могут быть синтезированы из пуриновых соединений, таких как аденин и гуанин, которые иногда присутствуют в экскретах членистоногих [148, 149]. Доказательством синтеза ксантоптерина из гуанозина-С14 служит интенсивное включение углеродной метки в молекулу птеринового пигмента (рис. 14). Ксантоптерин служит предшественником для синтеза других пигментов, таких как лейкоптерин и эритроптерин.
Рис. 14. Включение меченого гуанозина в птериновые пигменты крыльев у куколок Colias eurytheme. По Уатту [150].
I— ксантоптерин; 2— лейкоптерин; 3— сепиаптерин; 4—эритроптерин.
Интенсивный синтез птеринов наблюдается на куколочной стадии развития насекомых [134, 151]. При этом пигменты покровов первоначально синтезируются и депонируются в жировом теле, но за несколько дней до отрождения имаго они переносятся гемолимфой в крылья и в очень небольшом количестве (около 2%) — в меконий. Синтез птериновых пигментов у насекомых идет, по-видимому, без участия микроорганизмов.
Оммохромы. Оммохромы образуют единую группу коричневых, желтых или красных пигментов, которые встречаются в покровах и в фасеточных глазах членистоногих. При этом они вступают в связь с белками, формируя сложные красящие соединения — хромопротеины.
45
Существуют две группы оммохромов — омматины и омми-ны [152].
Омматины, имеющие сравнительно низкий молекулярный вес, представлены тремя различными соединениями: /
соон ч
I hcnh2
I сн2
I
Родомматин
ОмматинD
Ксантомматин
Любой из этих пигментов может существовать либо в окисленной, либо в восстановленной форме. Для ксантомматина стабильной является окисленная, а для родомматина — восстановленная форма пигмента. Переход оммохрома из одной формы в другую вызывает изменение окраски. Цвет пигмента зависит также от белка — носителя хромопротеинового комплекса.
Ксантомматин — наиболее распространенный пигмент фасеточных глаз, где он 'выполняет функцию светозащиты или фильтра, пропускающего только излучения определенной длины волны. В период метаморфоза синтез глазных пигментов имаго происходит на стадии куколки, как у Drosophila mela-nogaster [153], или же на личиночной стадии, как у Apis melli-ferai [154]. Встречается ксантомматин и в покровах. Изменения содержания этого пигмента могут определять особенности окраски различных вариететов палочника Carausius morosus: при черной или темно-коричневой окраске тела обнаруживается высокое содержание оммохрома, а светлая (зеленая или желтая) окраска связана с низким его содержанием [155].
У гусениц гарпии Cerura vinula оммохромы накапливаются в клетках эпидермиса в конце гусеничной стадии, незадолго перед окуклением. В результате синтеза оммохромных пигментов на зеленом теле гусеницы появляются красные участки. Сначала в эпидермисе образуется восстановленная форма ксантомматина, а затем этот пигмент исчезает, заменяясь родомма-тином и омматином D [156].
Оммины, имеющие сравнительно высокий молекулярный вес, встречаются в покровах и в глазах насекомых наряду с омма-46
тинами. В настоящее время известен лишь один представитель омминов, выделенный из глаз тутового шелкопряда:
Оммин А
При развитии глаз у куколок медоносной пчелы оммины появляются позже, чем омматины. Однако у взрослых особей оба типа оммохромных пигментов присутствуют примерно в одинаковых'4 количествах [154].
Использование меченых атомов позволило расшифровать основной путь биосинтеза оммохромов в организме насекомых [157]. Исходным соединением, из которого синтезируются пигменты, является аминокислота триптофан. При участии фер-* ментов триптофан-пирролазы и кинуренин-формамидазы триптофан превращается в Формилкинуренин, а затем в кинуренин:
соон соон
I I
Триптофан „ ч Ьормилкинуренин Кинуренин
На последующих этапах синтеза оммохромов кинуренин гидроксилируется и затем, после конденсации молекул 3-гид-роксикинуренина, дает омматины и оммины. Превращение кинуренина в оммохромы осуществляется при участии хинона ДОФА, который под действием фермента фенолазы восстанавливается до ДОФА. При этом хинон принимает на себя электроны,
47
освобождающиеся в процессе конденсации молекул 3-гидрокси-кинуренина: <-
?соон
hc-nh2
ХиМон ДОФА
Фенолаза
ДОФА
Омматины а
оммины
он
3-гидроксикинуренин
Мутации по цвету глаз у насекомых часто возникают в результате нарушения основного пути биосинтеза оммохромов [158]. Так, у мутанта v Drosophila и у а-мутанта Ephestia триптофан не превращается в кинуренин из-за отсутствия соответствующих ферментов. Нормальный цвет глаз у этих мутантов можно восстановить при инъекции кинуренина. У других мутантов (например, сп у Drosophila и Wi у Bombyx) для полного восстановления цвета глаз необходима инъекция 3-гидроксикинуренина, потому что у них блокируется реакция гидроксилирования кинуренина. Наконец, у мутанта w2 Bombyx синтез оммохромов прерывается на стадии между 3-гидрокси-кинуренином и самим пигментом.
Дустманом [159] изучены нарушения синтеза пигментов в омматидиях у 14 генетических мутаций трутней Apis mellifera. У белоглазых мутантов оммохромы отсутствуют. При этом у мутации s (снежно-белые глаза) накапливается избыток триптофана, у i (глаза цвета слоновой кости) — избыток кинуренина, а у р и сг (жемчужные и кремовые глаза) — 3-гидрокси-кинуренина. Таким образом, синтез оммохромов может быть прерван на любом этапе, т. е. он контролируется несколькими генами согласно следующей схеме:
Синтезируемые продукты Мутантные гены
Триптофан ...................................................s
Формилкинурении
I...............................................?
Кинуренин ф......................~..............................i
3 -гидроксикинуренин ф . ......................’..............’.................р, сг
Оммохром
48
У мутантов с рыжевато-коричневыми, темно-коричневыми и коричневыми глазами наблюдается замедленное и уменьшенное образование оммохромов. У всех мутантов типа шартрез (зеленоглазые трутни) 3-гидроксикинуренин накапливается не в гемолимфе, как у р и сг, а в пигментных клетках. На проявление окраски глаз в этой последней группе мутантов влияют гены-модификаторы, которые тормозят или полностью подавляют синтез оммохромов.
Тетрапиррольные пигменты. В качестве простетической группы тетрапирролы входят в состав таких биологически важных белковых соединений, как хлорофилл, гемоглобин и цитохромы. К этой же группе химических соединений относятся и некоторые красящие вещества покровных тканей насекомых. Так, водорастворимый зеленый пигмент богомолов и саранчевых, который долгое время считали хлорофиллом или производным хлорофилла, на самом деле оказался биливердином IX [160]. Молекула этого пигмента составлена из четырех пиррольных колец, поочередно связанных друг с другом:
В покровах насекомых биливердин присутствует исключительно в виде связанного с белком комплекса — хромопротеина. Такой комплекс может обусловливать различную окраску тканей — зеленую, если биливердин находится в восстановленной форме, и бурую или кремовую, если он окислен. Следовательно, окисление и восстановление биливердина может вызывать изменение окраски покровов — явление хорошо известное у многих прямокрылых и богомолов. Синтез тетрапирроль-ных пигментов в организме насекомых, по-видимому, осуществляется из глицина [161]. ,
К числу тетрапиррольных пигментов, близких к простетической группе хлорофилла, принадлежат порфирины, обнаруженные в тканях и экскреторных продуктах некоторых гусениц [162]. В молекулах этих пигментов пиррольные кольца образуют замкнутый цикл.
Меланины. Во время склеротизации экзокутикула пропитывается азотсодержащими полимерными пигментами — меланинами, возникающими на основе фенольных соединений. При синтезе меланинов ДОФА окисляется в дофахинон, а затем мо
49
лекула дофахинона замыкается в кольца, образуя 5, 6-дигид-роксиндол:
Это соединение синтезировано искусственно. Доказана его способность к быстрому окислению и превращению в меланин в водных растворах. Процессы окисления и полимеризации 5, 6-дигидроксиндола протекают спонтанно без участия ферментов, но только в присутствии кислорода воздуха [163]. Поэтому покровы перелинявших насекомых не пигментируются в атмосфере чистого азота.
Меланины создают темную (темно-коричневую, коричневато-красную или черную) окраску покровов. Особенно интенсивно они накапливаются в наиболее толстых и склеротизованных участках кутикулы. Полагают, что образование меланинов и последующее их отложение в покровах служит средством избавления организма от ядовитых фенольных соединений,7 вырабатывающихся при кутикулярной склеротизации [164].
Изменения окраски покровов. У насекомых мы встречаемся с двумя основными типами изменений окраски: медленным — морфологическим — и быстрым — физиологическим [165].
Морфологическое изменение окраски обусловлено накоплением, синтезом или разрушением пигментов в определенные моменты жизненного цикла. Эти процессы имеют необратимый характер и контролируются внешними условиями. Освещение, температура, влажность, даже окраска субстрата могут либо затормозить, либо стимулировать пигментацию покровов.
Среди перечисленных экологических факторов наибольшее влияние на пигментацию покровов оказывают условия освещения. При этом окраска насекомых зависит как от спектрального состара или интенсивности света, так и от длины дня (фотопериода).
В природе фотопериод .определяет различную окраску сезонных форм. Подобные фотопериодические эффекты были описаны для ряда чешуекрылых и цикад [166]. У голубянки Lycaena phlaeas daimio весенние и осенние бабочки характери- ' зуются ярким оранжевым фоном крыла, а летняя форма обладает почти совсем темными крыльями. При воспитании гусениц голубянки в длинном дне вылетающие бабочки имели преимущественно темную окраску, а при коротком дне почти все
50
особи были светлыми [167]. В этом случае, как и у большинства других насекомых, влияние фотопериода на пигментацию покровов тесно связано с фотопериодической регуляцией диапаузы.
Детальное изучение влияния спектрального состава света на окраску покровов проводилось на куколках дневных чешуекрылых [168, 169]. Было показано, что окраска куколки зависит от количественных соотношений различных пигментов, синтез которых вызывается освещением гусеницы перед окуклением. Естественно, что эффективность спектрального состава света в отношении пигментации покровов сказывается и тогда, когда гусеницы подвергаются воздействию отраженных лучей света при воспитании на субстрате с различной окраской.
Окраска куколок Papilio polyxenus astericus определяется фотопериодом, воздействующим на протяжении всей гусеничной стадии, и цветом фона, на котором находились гусеницы перед окуклением [170]. В условиях короткого дня на любом фоне получаются коричневые диапаузирующие куколки. В условиях длинного дня куколки не диапаузируют, а их окраска (зеленая или коричневая) изменяется в зависимости от цвета фона.
У многих насекомых и других членистоногих влияние отраженного света на пигментацию покровов лежит в основе хроматической адаптации, которая дает возможность животному выработать маскирующую окраску, в наибольшей степени отвечающую фону. Это явление в особенности свойственно малоподвижным видам или отдельным стадиям развития членистоногих. Некоторые пауки, обитающие на цветах, имеют различную окраску в соответствии с окраской лепестков, среди которых они прячутся в ожидании добычи [171].
Еще более поразительный пример медленной хроматической адаптации дают некоторые африканские прямокрылые, которые живут на участках саванн и степей, почерневших от пожаров [172]. После пожара в течение нескольких дней насекомые изменяют свою окраску в соответствии с новым окружением. У перелетной саранчи, например, в экзокутикуле возникает пятнистый черный рисунок, образованный каким-то неизвестным пигментом.
Хроматическая адаптация на территориях, почерневших от степных пожаров, является следствием индивидуального приспособления насекомых к окраске субстрата. Ее необходимо отличать от индустриального меланизма — почернения насекомых, обитающих в промышленных районах, когда темная окраска возникает в результате естественного отбора и формирования локальных генетических линий. Экспериментально показано, что меланистические формы бабочек Biston betularia в промышленных районах выживают на 30% успешнее, чем типичные более светлые особи [173].
51
Морфологические изменения окраски насекомых регулируются гормональными стимулами, причем источниками этих стимулов могут быть различные эндокринные образования. По-ви-димому, основное значение в регуляции морфологических изменений окраски принадлежит прилежащим телам (corpora al-lata). Хромактивный гормон этих желез после выделения его в гемолимфу может привести к синтезу или разрушению определенных пигментов. У темных куколок Pieris rapae crucivora после имплантации с. allata появляются зеленые пятна в области расположения имплантанта [174]. Особенно интересно, что такой же эффект дает инъекция ювенильного гормона, который выделяется прилежащими телами. Впрочем морфологические изменения окраски у чешуекрылых могут регулироваться не только гормональными стимулами прилежащих тел, но и другими хромактивными гормонами, которые продуцируются ганглиями брюшной нервной цепочки.
Процесс выделения любого гормона, вызывающего морфологические изменения окраски, контролируется воздействием экологических факторов на рецепторы и центральную нервную систему. Освещение и цвет субстрата, например, влияют на выделение гормона и пигментацию покровов исключительно через фоторецепторы-. Значение латеральных глазков для хроматической адаптации четко выявляется при ослеплении гусениц: при этом исчезает зависимость окраски куколок от цвета субстрата. У саранчовых Oedipoda coerulescens закрашивание черным лаком фасеточных глаз лишает насекомых способности адаптироваться к цвету почвы [175].
Роль гормонов с. allata в регуляции температурных изменений окраски была доказана в опытах на клопах Oncopeltus fas-ciatus [176]. На вентральной стороне брюшка у клопов, воспитанных при комнатной температуре, появляются обширные темные пятна. При температурах выше комнатной эти пятна уменьшаются в размерах или совсем исчезают. Аналогичный эффект исчезновения темных пятен на покровах можно получить и без повышения температуры, ио после имплантации прилежащих тел в нимф клопа.
Таким образом, влияние внешних экологических факторов на окраску покровов осуществляется через внутренние физиологические факторы нейрогуморальной природы, которые образуют рефлекторную цепь: рецептор -► нервный центр -> прилежащие тела или другие эндокринные образования. Однако иногда морфологические изменения окраски вызываются исключительно самими внутренними факторами и наблюдаются на строго определенных этапах метаморфоза. Так, некоторые гусеницы (например, Cerura vinuld) перед окуклением приобретают красный цвет вследствие отложения в эпидермисе красного пигмента оммохрома [177, 178]. Опыты с перешнуровкой гусениц показали, что их окраска изменяется под влия-52
нием центра, лежащего в груди. Этим центром оказались проторакальные железы, выделяющие гормон линьки и метаморфоза— экдизон. Введение чистого препарата экдизона в задний конец тела перешнурованных гусениц С. vinula приводит к типичному «покраснению». Следовательно, в данном случае морфологические изменения окраски у гусениц в пред-куколочный период представляют собой просто побочный эффект действия гормона, вызывающего куколочную линьку.
Физиологическое изменение окраски происходит очень быстро в результате перемещения гранул пигментов в эпидермальных клетках или изменения объема специальных клеток (ме-ланофор), заполненных пигментами. Среди насекомых первый
Рис. 15. Физиологические изменения окраски палочника Carausius morosus. По Ги^рсбергу [179].
А. Б — положение пигментных гранул в эпидермальных клетках «светлого» и «темного» палочника. В— доказательство гормональной регуляции физиологического изменения окраски палочника, к — кутикула; л —лигатура; т — крупные гранулы пигмента, перемещающиеся вертикально (изменения окраски покровов обусловлены перемещением этих гранул); п2 — средние по величине гранулы пигмента, перемещающиеся горизонтально; п3 — мелкие Гранулы неподвижного пиг--мента; я — ядро эпидермальной клетки.
случай описан в покровах Carausius morosus, а второй — в стенках воздушных мешков у личинки двукрылого — корет-ры (Corethra sp.).
В эпидермальных клетках палочника можно найти гранулы
53
четырех типов пигментов. Зеленый и желтый пигменты равномерно распределены по всей цитоплазме; оранжевый и коричневый собраны в крупные гранулы, способные передвигаться и занимать различное положение в клетке [179]. Передвижения этих пигментов вызывают обратимые физиологические изменения окраски палочника. Когда гранулы коричневого пигмента находятся у основания клетки, тело приобретает светлую окраску (рис. 15, Д); перемещение гранул в направлении вершины клетки вызывает потемнение покровов (рис. 15, Б).
Палочник изменяет свою окраску в ответ на множество стимулов, в том числе на изменение температуры или осмотического давления гемолимфы, на механическое воздействие, изменение влажности и зрительные восприятия. Окраска палочника подвержена суточному ритму: днем палочник становится более светлым, а ночью темнеет.
Эпидермальные клетки насекомых не иннервируются. Поэтому естественно было предполагать, что перемещения пигментных гранул в этих клетках регулируются гормональным путем. Действительно, гормональный контроль данной реакции доказывается следующими опытами. Если пересадить участок покровов от светлого палочника к темному, то пересаженный участок всецело подчиняется изменениям окраски реципиента [180]. Увеличение влажности ведет к потемнению, а уменьшение влажности — к посветлению животного. Если поместить брюшко палочника во влажную камеру, то возникает «волна/ потемнения», распространяющаяся от головы к брюшку [179]. /Можно остановить движение этой волны, если наложить лигатуру на тело палочника (рис. 15, В). В таком же опыте потемнение палочника не происходит после перерезки окологлоточных коннектив. Если, однако, перевернуть оперированное насекомое и поместить его голову во влажную камеру, то опять-таки вначале потемнеет голова, а затем возникает «волна потемнениям, распространяющаяся спереди назад. Очевидно гормон, вызывающий передвижения пигментных гранул в эпидермисе, выделяется в голове и затем распространяется назад с током гемолимфы. Поэтому после удаления мозга палочник утрачивает способность к изменению окраски и его тело приобретает однотонный бледно-серый цвет. Введение мозгового экстракта вызывает быстрое потемнение покровов палочника. Особенно эффективными в этом отношении оказались экстракты тритоцеребральных долей мозга с их нейросекреторными клетками [181]. В протоцеребруме содержание гормона значительно ниже, а в дейтоцеребруме он вообще отсутствует. В небольших количествах хромактивный гормон выделяется и другими ганглиями нервной цепочки [182].
Описанные выше опыты с использованием^ влажной камеры показали, что повышенная или пониженная влажность влияет на выделение гормона через рецепторы и нервные пути. Осве-54
щение, вызывающее быстрое посветление покровов палочника, также действует только через глаза и зрительный тракт [183]. Отсюда следует, что при физиологическом изменении окраски экологические воздействия оказывают свое влияние через внутренние нейрогормональные факторы, образующие рефлекторный путь: рецептор -> нервный центр -> секреторные клетки мозга.
В стенках воздушных мешков личинки Corethra пигмент сосредоточен в амебоидных меланофорах. Воздушные мешки хорошо видны у живой личинки: они просвечивают сквозь прозрачные покровы (рис. 16, Д). Когда личинка находится на темном субстрате, меланофоры образуют широкие отростки,
Рис. 16. Доказательство гормональной регуляции физиологического изменения окраски воздушных мешков личинки Corethra sp. По Гершу [184].
А — схема строения тела и расположения лигатур на теле личинки. в.м — воздушные мешки; V бр.г — пятый брюшной ганглий. Б, В — окраска грудных и брюшных воздушных мешков до раздражения VII брюшного ганглия. Г, Д — то же после раздражения.
покрывающие почти всю поверхность воздушного мешка; когда личинка попадает на светлоокрашенный субстрат, меланофоры, сжимаясь, уменьшаются в объеме, и воздушные мешки становятся более светлыми.
55-
Процессы вытягивания и сокращения отростков меланофор, вызывающие быстрые изменения окраски воздушных мешков, регулируются гормональными стимулами, причем основным источником хромактивных гормонов является мозг [184]. Однако и другие ганглиц нервной системы также могут продуцировать такие гормоны. Поэтому после наложения двух лигатур на тело личинки (одной позади головы, а 'другой — перед VI брюшным сегментом) и перерезки нервной цепочки в области V брюшного ганглия раздражение последних брюшных ганглиев вызывает изменение окраски только задней пары воздушных мешков (рис. 16, В, Д). Гормон, который при этом выделяется в заднем участке тела личинки, не может пройти через вторую лигатуру в передний участок тела; в результате окраска воздушных мешков, расположенных в груди, не меняется после раздражения брюшных ганглиев (рис. 16, Б, Г).
§ 5. Проницаемость кутикулы
Физико-химическая характеристика проницаемости кутикулы. Проникновение различных веществ через кутикулу осуществляется в результате пассивного или активного переноса молекул. При пассивном переносе силы, обеспечивающие прохождение вещества^ через систему кутикулярных слоев, локализованы во внешней среде и не связаны с биологической активностью клеток эпидермиса. Одна из основных действующих сил в данном случае обусловлена градиентом концентрации проникающего вещества. Пусть мы имеем два раствора разной концентрации, но одного и того же состава, разделенных слоем гемолимфы, который в большей или меньшей степени затрудняет диффузию. Если концентрация данного вещества по одну сторону кутикулы R, а по другую сторону ее — причем то вследствие градиента концентрации, выражаемого как отношение вещество будет диффундировать через кутикулу, пока не установится равновесное состояние^- = 1. Проницаемость кутикулы для данного вещества, следовательно, должна оцениваться как скорость -диффузии его через кутикулу, т. е. в количестве вещества (в количестве молекул, в молях и т. д.), перенесенного за единицу времени через единицу площади кутикулы. Она, очевидно, равна:
„(Ri-R)k SI
где Р—проницаемость, (7?i—7?)— разность концентраций проникающего вещества по обе стороны кутикулы, S — площадь кутикулы на участке, на котором наблюдается диффузия вещества, I — толщина кутикулы и k — коэффициент диффузии, который зависит от природы проникающего вещества (скорос-56
ти движения молекул при данной температуре и величины молекул) и микроструктурных особенностей кутикулярных слоев (наличия и величины межмолекулярных пространств).
Для удобства сравнения проницаемость разных мембран может быть выражена числом кубических микрон воды, проходящих через 1 мкм2 клеточной или кутикулярной мембраны за 1 мин под действием разности осмотического давления в 1 атм. При таком способе выражения константы проницаемости покровов насекомых и клещей будут составлять около 0,1, т. е. проницаемость наружной кутикулы крайне незначительна. Только в области трахеол проницаемость кутикулы достаточно высока и может достигать 6 единиц.
Если кутикула проницаема для растворителя и непроницаема для молекул растворенного вещества возникает явление осмоса: растворитель переходит через кутикулу, стремясь выравнять концентрации обоих веществ. Как правило, более сложные молекулы растворенного вещества проникают через, кутикулу насекомых с меньшей скоростью, чем более простые молекулы растворителя. Поэтому проницаемость кутикулы часто оценивается на основе осмотических явлений, и силы, действующие в направлении градиента концентрации растворителя, называют просто осмотическими силами.
Наряду с осмотическими силами деятельное участие в пассивном переносе молекул через кутикулу могут принимать электрические силы, которые, однако, проявляют свое действие только в том случае, если проникающая молекула диссоциирована на ионы, * несущие определенные электрические заряды. Кутикула насекомых подобно обычной клеточной мембране обладает способностью сохранять известную разность потенциалов между ее наружной и внутренней поверхностью. На изолированном участке кутикулы таракана, помещенном в 1%-й раствор NaCl, эта разность потенциалов достигает 150—200 мВ [185]. Следовательно, между обеими сторонами кутикулы существует градиент электрического потенциала, который, как и градиент концентрации, служит движущей силой при переносе веществ через кутикулу.
Пассивный перенос веществ через кутикулу в связи с незначительной проницаемостью воскового слоя имеет ограниченное значение. С другой стороны, известно немало примеров, когда интенсивное движение молекул через кутикулу происходит в направлении, противоположном действию осмотических или электрических сил. В этих случаях перенос веществ происходит на основе активного транспорта молекул, который осуществляется за счет энергии, освобождающейся в результате обменных процессов в эпидермальных клетках (см. с. 64).
Испарение воды через кутикулу. Испарение жидкости происходит только с поверхностного слоя ее, и поэтому увеличение
57'
шлощади при одинаковом объеме влечет за собой повышение скорости испарения. У членистоногих из-за их малых размеров отношение площади тела к его объему во много раз выше, чем
Наземные водные
Рис. 17. Сравнение скорости испарения воды через кутикулу у наземных и водных членистоногих. По данным Уигглсуорса [186], Бимен-та [187] и Клаудсли-Томпсона [188].
I— таракан Blatellcr, 2—клоп Rhodnius^ 3— куколка жука Tenebrio\ 4—личинка пилильщика Nematus\ 5— скорпион Hadru-rus; 6— паук. Eurypelmcr, 7— фаланга Ga-leodes; 8— клещ Ixodes\ 9— личинка ручейника Litnnophilus; Ю-~ клоп Corixcr, 11— личинка комара Bibio; 12— личинка комара Tipula; 13— личинка Hepiatus.
Температура 20°С.
у позвоночных, и при наземном образе жизни защита от высыхания превращается для них в фатальную необходимость. Под давлением этой необходимости наземные насекомые приобрели водонепроницаемую эпикутикулу, которая позволила им выжить и приспособиться к существованию в условиях дефицита влаги. С другой стороны, постоянно обитающие в воде или во влажной почве личинки многих насекомых, которым, очевидно, не грозит опасность иссушения, имеют полностью или частично редуцированную эпикутикулу [9, 10]. Проницаемость кутикулы, измеряемая при одной и той же температуре, у таких насекомых намного выше, чем у наземных (рис. 17). Связь строения кутикулы с условиями обитания четко прослеживается у личинок галлиц. Показано, что личинки галлиц, ведущие открытый
.58
образ жизни, имеют толстую трехслойную кутикулу с хорошо^ выраженной эпикутикулой, тогда как развивающиеся в галлах личинки лишены эпикутикулы [189].
' Эпикутикула представляет собой целую систему защитных образований, направленных против опасности иссушения, однако решающее значение в борьбе с транспирацией имеет восковой слой. Эта идея, впервые высказанная Рамсеем [190]„ в последнее время получила прочное экспериментальное обоснование. В частности были установлены следующие факты.
Рис. 18. Влияние температуры на скорость испарения воды через кутикулу различных насекомых и клещей. По Бименту [187].
Характерный перелом в ходе кривых соответствует температуре плавления восков эпикутикулы. 1— клещ Ixodes, имаго; 2— личинка мухи Calliphora; 3—куколка жука Tenebrio\ 4— клещ Ornithodorus, имаго.
1. Скорость испарения воды через кутикулу наземных насекомых и клещей резко повышается при температуре, вызывающей плавление восков эпикутикулы [186, 187, 190, 191, 192]. При повышении температуры испарение воды вначале растет очень медленно, но после некоторой «критической точки» проницаемость кутикулы внезапно увеличивается в несколько раз (рис. 18). Подробный анализ феномена «критической температуры» позволил установить его тесную связь с изменениями свойств воскового слоя эпикутикулы. Этот слой у разных видов насекомых образован различными восками, имеющими разную' температуру плавления. Как правило, более устойчивы к нагреванию молекулы воска, имеющие длинные алифатические цепочки; если восковой слой обволакивается более короткими
59
цепочками молекул, его точка плавления лежит в области более низких температур [193]. Оказалось, что «критическая температура», прй которой наблюдается резкое возрастание проницаемости кутикулы, обычно совпадает с температурой плавления ее воскового слоя (табл. 1).
2. У обитающих в воде личинок многих насекомых, у которых отсутствует эпикутикула, скорость испарения воды с повышением температуры либо вообще не увеличивается, либо растет очень медленно, не обнаруживая внезапного повышения проницаемости кутикулы [194]. Однако у тех водных насекомых, которые имеют липоидную эпикутикулу (имаго водных жуков и клопа Notonecta) повышение температуры до опреде-
Таблица 1
Сравнение „критической температуры" (°C) с температурой плавления воска, изолированного из эпикутикулы
Название и стадия насекомого „Критическая температура“ Температура плавления воска
По данным Уигглсуорса [186] По данным Бимента [187]
Гусеница Pieris 35-45 38 42—47
Куколка Pieris 55—60 58 60-65
Личинка Tenebrio 52 51 50-55
Личинка Nematus .......... 30-35 33 30—35
Личинка Calliphora 35 38 . 35—40
Куколка Calliphora 50—55 51 47—52
Нимфа Rhodnius 55—60 58 55—60
ленного предела вызывает скачкообразное повышение проницаемости кутикулы, но этот скачок наблюдается при более низких температурах, чем у наземных насекомых.
3. Сцарапывание наружной поверхности кутикулы или растворение восков жировыми растворителями влечет за собой быструю гибель насекомых от иссушения [186]. Если насекомое после сцарапывания кутикулы содержать во влажной среде, то восковой слой постепенно регенерирует и одновременно все яснее проявляется способность насекомого противостоять иссушению.
Нарушение защитных свойств воскового слоя объясняет так называемый «эффект Цахера» — гибель амбарных вредителей от опудривания зерна мелкими порошками неядовитых веществ. Этот эффект основан на способности некоторых порошков поглощать воск из всех слоев эпикутикулы вплоть до про-теиново-хитиновой прокутикулы, содержащей большое количество воды, пронизанной поровыми канальцами и обладающей относительно высокой водопроницаемостью. В результате воз
60
действия порошка восковой слой эпикутикулы превращается как бы в «молекулярное сито», через которое легко испаряется вода, и насекомое погибаёт от иссушения через 10—15 мин. Эффективность различных порошков зависит от величины частиц и диаметра пор в этих частицах [195]. Порошки с диаметром пор менее 2-10“4 мкм неэффективны для многих насекомых, так как они не могут поглощать сравнительно крупные липоидные молекулы с числом атомов углерода порядка 30 и выше. Однако такие порошки эффективны по отношению к тараканам, у которых восковой слой эпикутикулы составлен из сравнительно коротких молёкул. Так, по данным Жилби и Кокса [82] число атомов углерода в молекулах углеводородной фракции кутикулы таракана Periplaneta americana равно 7 для ненасыщенного компонента и 17—29 для трех насыщенных компонентов.
4. Если приготовить модель кутикулы, используя коллоидную мембрану или мембрану крыла насекомого, то мы можем на такой модели наблюдать все те феномены транспирации, которые' наблюдаются и на целом насекомом. Если покрыть освобожденную от воска мембрану крыла искусственной восковой пленкой, используя воск, экстрагированный хлороформом из сброшенных экзувиев насекомых, из коконов бабочек или пчелиный воск, то оказывается, что скорость испарения воды через такую мембрану в общем тем выше, чем ниже точка плавления использованного воска и чем выше окружающая температура [196].
Изложенные факты позволяют считать вполне доказанным решающее значение воскового слоя для процессов транспирации и вообще для процессов водного обмена через кутикулу. Остальные слои эпикутикулы и вся прокутикула могут принимать лишь незначительное участие в этих процессах. Функциональная неоднородность различных слоев кутикулы дает нам возможность понять, почему толщина кутикулы не имеет существенного значения в определении проницаемости ее для молекул воды [197].
Защитные свойства липоидных слоев кутикулы, направленные против испарения воды, зависят от ориентации молекул поверхностного мономолекулярного слоя, который можно рассматривать как восковой монослой кутикулы. Крайняя степень водонепроницаемости покровов достигается в том случае, если все молекулы монослоя ориентированы наружу гидрофобными парафиновыми связями, а гидрофильные группы обращены внутрь [198]. Искусственным путем, например электрической поляризацией кутикулы, можно вызвать переориентацию («переворачивание») молекул воскового слоя. При этом липоидная кутикула приобретает высокую водопроницаемость по направлению к ее наружной поверхности [193].
Молекулы монослоя являются полярными молекулами, т. е.
61
они несут определенные электрические заряды, которые при правильной ориентации молекул создают суммарное электрическое поле кутикулы. Как уже отмечалось выше (см. с. 5.6), между идентичными 1%-ми растворами NaCl по обеим сторонам мертвой кутикулы.,таракана электрическое поле достигает 150—200 мВ, однако после экстрагирования воскового слоя эта разность потенциалов исчезает [185]. На основании измерения электрического поля кутикулы можно судить о характере ориентации восковых молекул монослоя. Если через кутикулу таракана пропускается постоянный электрический ток, наблю-
Рис. 19. Увеличение веса яиц клопа Notostira erratica в процессе развития при контакте с водой. По Джонсону [202].
Температура 28°С. По оси абсцисс — время с момента яйцекладки.
дается тенденция к переворачиванию монослоя и к изменению знака электрического заряда кутикулы. При этом первоначально мы видим лишь временное, обратимое снижение разности потенциалов, но затем при увеличении силы пропускаемого тока возникает обратная разность потенциалов. Одновременно происходит изменение свойств кутикулы: липоидная кутикула из гидрофобной, отталкивающей молекулы воды, становится гидрофильной, притягивающей эти молекулы.
Абсорбция воды в яйцах. В яйцах насекомых способность абсорбировать воду из влажного воздуха проявляется только в определенные моменты эмбриогенеза [199]. У жука Phyllo-pertha horticola, например, увеличение веса яиц в результате поглощения воды отмечается в период между 3-м и 8-м днями развития при 20°С[200]. У сверчка Gryllus domesticus при 33°С интенсивная гидратация яиц начинается примерно через 60 ч после откладки и заканчивается через 108 ч [201].
62 *
Яйца, откладываемые внутрь растений, абсорбируют воду из растительной ткани также не постоянно, а лишь в определенные периоды эмбрионального развития. Так, яйца растительноядного клопа Notostira erratica начинают поглощать воду через 60 ч после откладки и достигают максимального насыщения спустя еще 100 ч [202]. Изменения веса, или объема, яйца служат четким показателем процесса поглощения воды (рис. 19).
Рис. 20. Схема, поясняющая гипотезу Мак-Фарлана [203].
А — свежеотложенное яйцо сверчка Gryllus dotnesticus. Б — растрескивание внутреннего липоидного слоя. В — затвердевание новой серозной оболочки яйца, вн.с — внутренний слой серозной оболочки; н. с — наружный слой серозной оболочки; с — серозная оболочка; экх — экзохорион; энх — эндохорион; х — хорион.
Накопление воды яйцами часто связано с нарушениями структуры и проницаемости яйцевых оболочек. Основная оболочка свежеотложенных яиц сверчка носит название хориона (рис. 20, Л) и состоит из двух слоев [203]. Наружный более толстый слой, экзохорион, гомологичен прокутикуле взрослого насекомого. Он формируется из белков и .обладает высокой проницаемостью для воды. Внутренний слой, эндохорион, имеющий толщину всего лишь 0,4 мкм, содержит липоиды и тирозиназу. Проницаемость его вряд ли выше проницаемости эпикутикулы. Когда начинается абсорбция воды, эндохорион лопается на мелкие кусочки (рис. 20, Б). Между «осколками» эндохориона остаются широкие просветы, через которые молекулы воды проникают внутрь яйца. Сразу же после начала абсорбции воды формируется новая, серозная оболочка яйца (рис. 20, В). Кутикула этой оболочки имеет тоже два слоя, расположенных так же, как и у взрослого насекомого. Первоначально образуется наружный липоидный слой серозы, а затем внутренний хитиново-протеиновый слой. Этот последний
63
слой, впрочем, существует недолго, и к моменту вылупления нимфы он разрушается. Абсорбция воды яйцами прекращается в тот период, когда завершается формирование серозной оболочки. Задубленная фенолами кутикула этой оболочки представляет, вероятно, непреодолимое препятствие для проникновения молекул Н2О внутрь яйца.
У сверчка вода абсорбируется равномерно по всей поверхности яйца [204]. У других насекомых иногда обнаруживаются специальные структуры, направленные на облегчение транспорта воды через яйцевые оболочки. Так, у саранчового Mela-noplus differ ent ialis на заднем конце яйца имеется небольшой округлый участок «желтой кутикулы», которая секретируется особенно крупными видоизмененными клетками серозы. Хорион, расположенный над этим участком кутикулы, обладает повышенной проницаемостью для воды и функционирует в качестве «гидропиле», через которое осуществляется насасывание воды [205]. У алейродид каждое яйцо укрепляется на листе с помощью небольшого отростка, вводимого внутрь растительной ткани. Этот отросток представляет собой тонкостенную трубочку, через которую вода перекачивается из растения в яйцо [206].
Активный транспорт воды через кутикулу. Способность поглощать воду из влажной атмосферы свойственна не только яйцам членистоногих; нередко это явление обнаруживается у личинок или у взрослых животных. У клещей Ixodidae и Аг-gasidae абсорбция воды наблюдается только при относительной влажности воздуха выше 92% [207, 208], у личинок мучного хрущака Tenebrio molitor — выше 88% [209], а у личинок кобылки Chorthippus sp. — выше 82% [210]. Еще более показательны в этом отношении пустынные щетинохвостки Cteno-lepisma terebrans, которые способны поглощать воду из воздуха даже при 50% относительной влажности [211]. Способность к поглощению влаги из воздуха не исчезает после закупорки дыхалец [208]. Очевидно, вода насасывается не через трахейную систему, а непосредственно через кутикулу.
Выше было показано, что кутикулярные воска резко ограничивают проницаемость покровов наземных членистоногих по отношению к воде. Однако этот механизм ограничения проницаемости действует только в одном направлении — от прокутикулы к эпикутикуле. Обратный транспорт молекул воды осуществляется гораздо легче и быстрее. Именно благодаря этой функциональной асимметрии кутикулы становится возможным активное поглощение воды из влажной, но не насыщенной водой атмосферы.
Механизм поглощения воды из воздуха во многом остается непонятным. Ясно, что этот процесс осуществляется активно, т. е. он идет против градиента концентрации молекул Н2О и требует затрат энергии. Установлено, что недостаток кисло
64
рода^ накопление избыточных количеств СО2 или дыхательные яды — цианиды — затрудняют и замедляют абсорбцию воды через кутикулу.
Функциональная асимметрия кутикулы проявляется и при насасывании жидкой воды. Если капелька воды помещается на поверхность кутикулы таракана, то на наиболее проницаемых участках кутикулы уже через 10 мин эта капелька полностью проникает внутрь организма. Этот простейший опыт может служить удобной моделью для изучения активного транспорта молекул Н2О через покровы [185].
Не связано ли насасывание воды через покровы с действием осмотических сил? На этот вопрос следует ответить отрицательно, так как капелька 1%-го раствора NaCl поглощается с такой же скоростью, как и капелька дистиллированной воды. Даже если используется капелька насыщенного раствора поваренной соли, она всасывается также через 10 мин, оставляя на поверхности кутикулы кристаллы хлористого натрия. В этом случае молекулы воды транспортируются против градиента концентрации, создающего осмотическую силу в 300 атм!
Согласно гипотезе Бимента [185] феномен насасывания воды через покровы связан с некоторыми особенностями поведения вязких молекул воска, формирующих поверхностные слои кутикулы членистоногих. Контактный угол между водой и данной поверхностью служит выражением сродства воды к этой поверхности. В кутикуле водных насекомых восковые молекулы поверхностного мономолекулярного слоя ориентированы так, что все гидрофобные группы — СН3 обращены наружу. В этом случае контактный угол составляет около 130° и кутикула максимально проявляет свою гидрофобность. Если же молекулы воска на поверхности кутикулы будут ориентированы противоположно, то контактный угол составит 30° и кутикула будет максимально гидрофильной.
У таракана липоидный слой кутикулы содержит различно ориентированные группы, поэтому его контактный угол около 80°. Однако когда капелька воды наносится на поверхность кутикулы, этот угол уменьшается, так как гидрофильные концы молекул переворачиваются наружу, формируя организованный липоидный монослой. Уже через 3 мин после нанесения капельки завершается этот процесс переворачивания молекул: контактный угол составляет 30°. Капелька воды растекается по поверхности такой гидрофильной кутикулы, а молекулы воска обволакивают ее со всех сторон. В результате капелька проникает внутрь организма в окружении монослоя организованных липоидных молекул.
Подтверждением гипотезы Бимента могут служить опыты, в которых капелька воды наносилась дважды на один и тот же участок поверхности тела таракана, причем второй раз — сразу после насасывания предыдущей капельки. В этом случае
3 198
65
из-за односторонней ориентации молекул воска в месте поглощения воды контактный угол для второй капельки первоначально составлял около 130° (а не 80° как для первой!), через 3 мин уменьшался до 80°, а затем, опять через 3 мин, — до 30°. Молекулы воска, следовательно, переворачивались для «захвата» новой порции воды, но это переворачивание занимало вдвое больше времени, чем в контроле. При этом в течение 6 мин объем капельки не уменьшается, и лишь когда завершается процесс переворачивания молекул воска, становится возможным проникновение воды через покровы.
Предложенная гипотеза может, однако, объяснить лишь феноменологическую картину поглощения воды в покровах членистоногих. Для объяснения физической природы этого процесса необходимо допустить существование какой-то помпы (насоса), обеспечивающей непрерывный ток воды в одном направлении и притом против градиента концентрации. Работа этой помпы потребует определенных затрат энергии на преодоление осмотических сил.
По мнению Бимента, перенос молекул воды через покровы в гемолимфу осуществляется белками кутикулы. Моделью этбй системы может служить белковая пластинка, разделяющая два водных раствора. Белок первоначально поглощает из растворов определенное количество воды в соответствии со способностью его к гидратации при данной изоэлектрической точке, а затем устанавливается равновесное состояние. Если, однако, к белку будет приложен внешний источник энергии, способный изменить его состояние, то степень гидратации белковых молекул может измениться. Внешний источник энергии может, следовательно, вызвать поглощение новых порций воды белком. Но как только мы прекратим энергетическое снабжение белка, будет восстановлена его начальная степень гидратации, и белковые молекулы отдадут воду, которую они успели поглртить.
Аналогичные явления, вероятно, происходят в кутикуле, где роль белковой пластинки выполняет гидрофильная, обогащенная водой прокутикула. Однако в отличие от описанной выше модели кутикула членистоногих имеет на своей поверхности систему клапанов, затрудняющих движение воды изнутри — наружу. Такими клапанами могут быть организованные восковые молекулы поверхностных слоев эпикутикулы. Поэтому при гидратации белка вода насасывается с обеих сторон кутикулы (в том числе и с наружной поверхности или даже из влажного воздуха), но при дегидратации белок отдает воду главным образом внутрь организма. Цикл гидратации — дегидратации может многократно повторяться, если на белок прокутикулы периодически воздействует какой-либо источник энергии, вызывающий изменение его свойств (изоэлектрической точки, степени гидратации и т. д.). Поставщиками этой энергии могут
служить живые клетки эпидермиса. Действительно, показано, что эпидермальные клетки могут активно изменять степень гидратации белков кутикулы [185]. Возможно, что в процессе поглощения воды принимают участие также поровые канальцы с их длинными цитоплазматическими отростками' эпидермальных клеток.
Проницаемость кутикулы для органических и неорганических соединений. Выше уже отмечалось, что в среднем проницаемость кутикулы для воды очень низка. Однако различные растворы электролитов или неэлектролитов проходят через кутикулу с еще большим трудом, чем чистая вода. Процесс проникновения растворов через кутикулу характеризуется кинетикой первого порядка [212], т. е. скорость проникновения пропорциональна концентрации проникающего вещества. В этом случае должно быть справедливым уравнение
где с—концентрация вещества в проникающем растворе в данный момент времени /, a k — коэффициент диффузии. Отсюда следует, что / = 2,3fe-log f, где /— количество вещества, которое не успело проникнуть через кутикулу за время t и осталось на поверхности покровов. Следовательно, скорость проникновения должна находиться в прямо пропорциональной зависимости от времени, что в действительности и наблюдается при проникновении растворов химических веществ через кутикулу насекомых [213, 214].
Два плохо проникающих через кутикулу соединения при их совместном воздействии могут давать неожиданный эффект значительного повышения . проницаемости. Так, например, личинки мясных мух относительно устойчивы к действию спирта или керосина,*но при одновременном нанесении на покровы спирта, смешанного с керосином, личинки быстро погибают. Это явление в токсикологии рассматривается в качестве примера потенцированного синергизма ядов и используется для повышения эффективности инсектицидов.
Кажется вполне ясным, что кутикула лишь с большим трудом пропускает через себя различные органические и неорганические вещества. Поэтому вызывает удивление способность контактных инсектицидов проникать через покровы насекомых. В большинстве случаев не выяснены те возможности, которые позволяют инсектицидам преодолевать ограниченную проницаемость кутикулы. Счастливое исключение в этом отношении составляет ДДТ: проникновение данного инсектицида внутрь организма насекомого изучалось наиболее подробно [215].
Современные представления о механизме действия ДДТ основаны на признании его способности растворяться в восках эпикутикулы. Яд, растворенный в свободных липоидах, может,
67
по-види^ому, проникать в организм через наиболее проницаемые участки покровов. Такими участками могут служить либо очень тонкая эпикутикула над нервными окончаниями и у основания щетинок, играющая роль «входных ворот» для проникновения ДДТ [216], либо межсегментные мембраны, кутикула которых исключительно богата свободными липоидами. Вероятно, для прохождения яда могут служить также протоки кожных 'И восковых желез [217]. В процессе проникновения инсектицида через покровы большое значение может иметь способность хитина абсорбировать ДДТ [218]. Как показали опыты с очищенным хитином, он хорошо поглощает ДДТ из водной суспензии, так что суспензия полностью теряет токсичность. Таким образом, высокая проницаемость покровов насекомых по отношению к ДДТ может быть связана с двумя обстоятельствами — с одной стороны, со способностью этого яда растворяться в липоидах эпикутикулы и, с другой стороны, с абсорбцией его хитином прокутикулы.
Приведенный пример показывает, что сама кутикула может активно участвовать в проникновении инсектицида в организм насекомого. Однако наряду с этим она является и пассивным барьером для проникающих молекул отравляющих веществ. Экспериментальной разработке этого вопроса была посвящена одна из ранних работ Уигглсуорса [219]. Автор помещал на покровы кровососущего клопа Rhodnius prolixus микрокамеру, в которой находился пиретршн, растворенный в каком-либо маслянистом веществе. Проникая через покровы, пиретрин вызывал паралич насекомого. По времени наступления паралича можно было судить о проницаемости кутикулы для пиретрина. Выше было показано, что для процесса проникновения воды через кутикулу толщина последней не имеет существенного значения, ибо основным барьером для молекул Н2О является восковой слой эпикутикулы. Однако для пиретрина Уигглсуор-сом найдены несколько иные соотношения, а именно — чем тоньше кутикула, тем выше скорость проникновения инсектицида. В одном из опытов при толщине кутикулы 8—9 и 20 мкм паралич наступал соответственно через 1,5 ч и через 8—9 ч. Отношение толщины кутикулы к скорости проникновения инсектицида в этом опыте составляет в первом случае 5,7, а во втором — 2,3, т. е. скорость проникновения вещества при увеличении толщины кутикулы уменьшается не так сильно, как этого следовало бы ожидать, если бы проницаемость всех слоев ее для пиретрина была бы абсолютно одинаковой. Увеличение толщины кутикулы достигается главным образом за счет внутренних слоев ее. Следовательно, мы можем сделать вывод, что и по отношению к пиретрину кутикула представляет собой гетерогенное образование, внутренние слои которого оказываются более проницаемыми, чем наружные. И действительно, в той же работе Уигглсуорса было показано, что эпикутикула
68
играет большую роль в ограничении проницаемости покровов для инсектицидов, ибо если обработать кутикулу эфиром или другим веществом, растворяющим жиры, то проницаемость ее к пиретрину заметно повышается. Установлено также, что повреждение наружных слоев кутикулы алюминиевым порошком резко усиливает проникновение внутрь организма таких инсектицидов, как ротенон и никотин [2].
Если использовать очень грубую аналогию, намеренно отвлекаясь от способности кутикулярных липоидов и хитина переносить молекулы инсектицида, то кутикулу членистоногих можно уподобить ряду расположенных друг над другом сит с разными диаметрами отверстий. Молекула инсектицида, «просеиваемая» через такое «сито», может проходить через него свободно или же при определенной ориентации сил притяжения составляющих ее атомов вызывать деформацию покровов. В соответствии с этим все инсектициды могут быть разбиты на две основные группы: 1) такие соединения, которые проходят через кутикулу, не деформируя ни один из ее слоев, и 2) такие соединения, которые разрушают кутикулу и изменяют ее проницаемость [85] .
К первой группе, вероятно, следует отнести многие фосфорорганические инсектициды, действующие на внутренние ферментативные системы организма насекомого. На процессе проникновения таких инсектицидов через покровы особенно сильно сказывается барьерная роль кутикулы. Паратион, например, не в состоянии пройти через ^оболочку яиц клопа Oncopeltus fasciatus, и поэтому он не обладает овицидным действием. Однако личинки клопа, имеющие более проницаемую кутикулу, при выходе из обработанных паратионом яиц отравляются тем ядом, который сохраняется- на оболочке, и вскоре погибают [220].
Ко второй группе относятся хлорорганические инсектициды и в первую очередь ДДТ и ГХЦГ. Правда, токсичность этих соединений, вероятно, объясняется нарушениями проницаемости клеточной мембраны, но аналогичные процессы могут разыгрываться и на поверхности кутикулы. ДДТ, к примеру, имеет ясно выраженные липофильные свойства и при прохождении через кутикулу вызывает обширные разрушения — от слабого разрыва эпикутикулы до полного ее растворения [217].
Глава II. ФИЗИОЛОГИЯ ДЫХАНИЯ
§ 1. Кожное и жаберное дыхание
Роль кожного дыхания в общем газообмене насекомых. Основными органами дыхания насекомых являются трахеи, открывающиеся наружу с помощью дыхалец (стигм). Однако некоторые мелкие насекомые, например коллемболы, лишены трахей. Кроме того, у насекомых, которых можно назвать ап-нейстическими, трахеи имеются, но открытые дыхальца отсутствуют. Такая трахейная система замкнутого типа характерна для водных и эндопаразитических насекомых, дышащих кислородом, растворенным в воде или в полостной жидкости хозяина. Трахейная система открытого типа типична для наземных свободпоживущих видов или для водных насекомых, дышащих атмосферным кислородом.
У насекомых, лишенных трахей, газообмен осуществляется через всю поверхность тела — это общее кожное дыхание. Возможность такого дыхания обеспечивается сравнительно высокой проницаемостью кутикулы для газов. Специальные расчеты показывают, что любой сферический живой организм^ обладающий хитиновыми покровами, может обеспечить достаточно высокий уровень метаболизма на основе одного общего кожного дыхания, если его радиус не превышает 1 мм [221]. Поэтому лишь очень мелкие насекомые используют кожное дыхание в качестве единственного способа поглощения кислорода. Иногда на отдельных участках тела развивается особенно высокая проницаемость кутикулы для газов и появляются органы местного кожного дыхания. У эндопаразитических личинок мух и наездников функцию таких органов выполняют хвостовые придатки, имеющие вид нитей или пузырей.
Жаберное дыхание водных насекомых составляет частный случай местного кожного дыхания, причем органами, приспособленными для поглощения кислорода, являются специализированные высокопроницаемые выросты тела — трахейные или дыхальцевые жабры. Кисдород, поглощенный через жаберную поверхность, затем распространяется по замкнутой трахейной системе и доставляется непосредственно к отдельным участкам тела, органам или клеткам. Таким образом, при апнейстичес-
70 '
ком дыхании просвет трахей отделен от внешней среды, во-первых, покровами жабр, во-вторых, слоем гемолимфы в жабрах и, в-третьих, оболочкой трахейных трубочек. Дыхательная вентиляция, очевидно, происходит в результате двойной диффузии кислорода, который должен проникнуть сквозь стенки жабры в гемолимфу, а затем пройти из гемолимфы через кутикулярные оболочки трахейных разветвлений. Физико-химический механизм этих сложных процессов газовой диффузии
еще не изучен.
При жаберном дыхании способность к общему кожному , дыханию не исчезает. Наоборот, в ряде случаев дыхание через всю поверхность покровов сохраняет значение основного способа газообмена у апнейстических насекомых, а жабры исполь-
зуются лишь в качестве дополнительных дыхательных органов. Более того, даже при открытой трахейной системе общее кожное дыхание играет подчас значительную роль. В большой се
рии экспериментов с выключением дыхалец на самых различных насекомых было показано, что в среднем 10—50% всего газообмена падает на долю кожного дыхания [222]. 1
Особенно большое значение имеет кожное дыхание для
почвенных насекомых. Воздух в почве уже на небольшой глубине насыщен водяными парами, что делает возможным поглощение кислорода через покровы при минимальной потере вла-ти на испарение. Например, М. С. Гиляровым [223] на личинках комаров долгоножек р. Tipula, являющихся типичными обитателями почвы, было показано, что кожное дыхание
для них имеет превалирующее'значение в сравнении с дыханием через дыхальца.
Иные результаты были получены при изучении соотношения кожного и трахейного дыхания у личинок мухи Phormia ге-gina, которые живут в трупах, в гниющем мясе и рыбе [224]. Эти личинки снабжены двумя парами дыхалец — по одной паре на переднем и заднем концах тела. Задние дыхальца могут полностью удовлетворять потребности личинки в кислороде, но передняя пара удовлетворяет эти потребности лишь на 60%. При выключении всех четырех дыхалец интенсивность дыхания личинки резко снижается и составляет всего лишь 10% от среднего потребления О2 в контроле. Следовательно, у личинок Р. regina основное значение приобретает трахейное дыхание, а непосредственно через кутикулу тела поступает лишь незначительное количество кислорода.
Дыхание яиц. Яйцо насекомого окружено твердой оболочкой— хорионом, восковой слой которого затрудняет ^диффузию дыхательных газов. При образовании хориона на вершине яйца остаются отверстия — микропиле, которые служат для входа сперматозоидов. На клопе Rhodnius prolixus было показано, что дыхание яиц происходит главным образом через эти отверстия [225].
71
Обычно потребление кислорода яйцом клопа растет от 0,08 мм3 за 1 ч на 3-й день эмбрионального развития до 0,181 мм3 на 10-й день. Однако, если покрыть верхушку яйца газонепроницаемым лаком; то потребление кислорода снижается до постоянного уровня 0,02 мм3 и в дальнейшем не увеличивается. Таким образом, 0,02 мм3 О2 за каждый час проходит внутрь яйца непосредственно через его оболочку, а остальная часть газообмена осуществляется через микропильные и псев-домикропильные каналы.
По всей вероятности, микропиле используются для потребления кислорода лишь в оплодотворенных яйцах, когда начинается развитие эмбриона и интенсивность дыхания резко увеличивается (см. с. НО).. В неоплодотворенных яйцах с постоянным низким уровнем газообмена кожное дыхание может служить единственным способом поглощения О2.
Использование микропиле для дыхания оплодотворенных яиц представляет собой далеко не единственную адаптацию, обеспечивающую возможность проникновения кислорода к органам и тканям эмбриона. В некоторых случаях для этой цели на верхушке яйца развиваются специальные дыхательные рожки, которые можно сравнить с жабрами водных насекомых [226, 227].
На яйцах некоторых мух, откладываемых в навоз, в гниющие растительные или животные ткани, дыхательные рожки имеют особенно разнообразное строение и иногда достигают значительной длины (рис. 21, Л). Подобные яйцевые, выросты, выполняющие функцию эмбриональных органов дыхания, характеризуются одной интересной особенностью: они пронизаны тонкими капиллярными каналами, заполненными воздухом и не пропускающими воду. Разветвления этих каналов образуют дыхательную сеть — пластрон (рис. 21, Б). Пластрон яиц двукрылых приспособлен как для атмосферного дыхания, так и для поглощения кислорода, растворенного в воде. Адаптивное значение этого органа очевидно, в особенности для яиц, находящихся в среде с недостатком кислорода. Ниже будет показано, что пластронное дыхание свойственно также водным куколкам или личинкам некоторых насекомых (см. с. 78).
Трахейные жабры. Водные нимфы и личинки насекомых часто имеют замкнутую трахейную систему и трахейные жабры, которые служат для поглощения кислорода, растворенного в воде. На теле насекомого обычно присутствует несколько жабр в виде пучков нитей или лепестков, обильно снабженных ветвящимися трахеями. Конечные разветвления этих трахей замкнуты слепо; они нигде не открываются наружу.
Известно три основных типа трахейных жабр.
Брюшные жабры представляют собой пластинчатые или перистые выросты тела по бокам брюшных сегментов у нимф поденок (рис. 22) или веснянок и у личинок жуков-вертячек
72
(сем. Gyrinidae) или ручейников. Обычно брюшные жабры сидят открыто, но у некоторых поденок они располагаются под крышкой специальной жаберной камеры, которая формируется из зачатков крыльев, из отростков грудных сегментов или из передней пары жабр.
Концевые жабры обнаруживаются у нимф равнокрылых стрекоз (подотр. Zygoptera) в виде трех выступающих лопастей на последнем сегменте' брюшка.
Рис. 21. Дыхательные рожки на яйцах некоторых мух. По Хинтону [227]. /1 — яйца, снабженные дыхательными рожками: /— Sepsis oiolacea, 2 Нebecnema umbratica, 3— Drosophila gibberosa. Б — Продольный срез через дыхательный рожок Dryomyza flaveola на расстоянии 30 мкм от его основания.
Ректальные жабры, характерные для нимф разнокрылых стрекоз (подотр. Anisoptera), являются внутренними органами и находятся в прямой кишке. Поверхность этих жабр образована многочисленными складчатыми лепестками стенок прямой кишки. Внутрь каждого лепестка заходит тонкий трахейный ствол с его разветвлениями.
В некоторых случаях два типа жабр функционируют одновременно у одного и того же насекомого. Так, у нимф стрекозы Epallage имеются и брюшные и концевые жабры. Личинки ручейников обладают^пятью ректальными жабрами и наружными дыхательными нитями, которые парными рядами р-асполагают-
73
ся на брюшке и являются аналогами пластинчатых брюшных жабр поденок.
Дыхание с помощью трахейных жабр принципиально не отличается от рассмотренного нами выше кожного дыхания. У всех насекомых с замкнутой трахейной системой парциальное давление О2 в тканях и трахеях всегда меньше, а давление СО2 всегда больше, чем в воде. Различия в парциальном давлении обоих дыхательных газов обеспечивают их диффузию в противоположных направлениях, т. е. выход углекислоты и поглощение кислорода через легко проницаемые трахейные жабры. Поскольку водные личинки и нимфы насекомых не имеют сплошного слоя эпикутикулы (см. с. 8), такая диффузия может происходить и через остальную поверхность тела. Поэтому при вполне развитых трахейных жабрах кожное дыхание получает широкое распространение, а иногда играет даже ведущую роль в общем газообмене водных насекомых.
У нимф стрекозы Agrion pulchellum от 32 до 45% кислорода проникает в трахейную систему через концевые жабры [228]. Следовательно, более половины всего газообмена нимфы осуществляется непосредственно через поверхность тела. Вероятно, еще меньшее значение в общем дыхательном обмене имеют брюшные жабры. Хотя у нимф Hexagenia recurvata после ампутации всех трахейных жабр наблюдается некоторое понижение двигательной активности и интенсивности дыхания [229], у многих других нимф поденок подобная операция не вызывает даже временного снижения газообмена [230]. В воде с высоким содержанием О2 оперированные «безжаберные» нимфы нормально развиваются и заканчивают метаморфоз.
Отсутствие брюшных жабр может привести к сильному снижению интенсивности дыхания и гибели насекомых лишь в условиях низкого содержания кислорода в воде. У нимф Cloert, dipterum с ампутированными жабрами потребление О2 такое же, как и у контрольных неоперированных нимф, вплоть до концентрации этого газа, равной 0,3%. Однако ниже этой концентрации наблюдается падение газообмена у «безжаберных» поденок и появляются большие различия в интенсивности дыхания между оперированными и контрольными нимфами [230]. Личинки ручейников также дышат через брюшные жабры только в воде, обедненной кислородом [231]. В нормальных условиях основным местом газообмена личинок является поверхность тела, в особенности в области заднего участка груди и первых сегментов брюшка [232].
У нимф веснянок трахейные жабры обеспечивают возможность выживания в случае пониженного содержания кислорода в воде. Поэтому те виды веснянок, которые не имеют этих органов дыхания, живут в толще воды в ручьях и реках с быстрым течением, т. е. в условиях хорошей аэрации. Нимфы, снабженные жабрами, держатся под камнями, где скапливаются раз-
74
латающиеся части растений, течение воды замедлено, а содержание О2 резко снижено [233].
Ампутация брюшных жабр в эксперименте часто приводит к нарушению дыхательной вентиляции, вызываемой движениями жаберных лепестков. У нимф поденок эти движения обеспечивают симметричные потоки воды над всей дорсальной поверх-
Рис. 22. Нимфа поденки Ecdyonurus venosus в состоянии покоя. По Истаму [234].
Стрелками показаны направления токов воды, вызываемых ритмическими движениями жаберных лепестков (ж.л).
ностью груди и брюшка (см. рис. 22). Несомненно, что «трепетания» трахейных жабр имеют большое значение для создания условий, облегчающих поглощение О2 при кожном дыхании. Циркуляция воды, обусловленная этими'движениями, становится невозможной при удалении жабр, и в этом можно видеть одну из причин падения газообмена после такой операции. Действительно, в спокойной воде с низким содержанием- О2 интактные нимфы поденок потребляют больше кислорода, чем нимфы без жабр. Однако при волнении воды в водоеме, когда
75
создаются местные потоки, доставляющие кислород к поверхности тела, различия в интенсивности дыхания между контрольными и оперированными насекомыми не выявляются [230]. Можно думать поэтому, что вентиляционные движения трахейных жабр отражают одну из основных функций этих органов — функцию поддержания постоянной циркуляции воды вокруг дыхательной поверхности всего тела.
Рис. 23. Зависимость частоты движений жаберных лепестков у нимфы поденки Ephemera simulans от содержания кислорода в воде. По Эриксону [235].
Эта функция трахейных жабр приобретает особенно важное значение в воде, обедненной кислородом. Поэтому при понижении содержания О2 нимфы поденок увеличивают частоту колебательных движений жаберных лепестков (рис. 23). Следовательно, трахейные жабры могут использоваться водными насекомыми для целей регуляции дыхания наряду с другими регуляторными механизмами. v
При дыхании с помощью ректальных жабр лепестки дыхательного аппарата омываются водой, которая ритмически насасывается через анальное отверстие, а затем выводится на
76
ружу. При этом вода либо спокойно выходит из кишечника, либо выбрызгивается с силой, сообщая насекомому поступательный толчок. Этот «реактивный принцип» используется нимфами для быстрого передвижения в воде.
У нимф стрекоз подотр. Anisoptera, снабженных ректальными жабрами, в этих органах осуществляется основная часть
По Хинтону [237] и И. А. Рубцову [239].
А — Lipsothrix remota. Б — Anthocha viiripennis. В — Sin\uliutn nolleri. Г — Aphrosylus celtiber.
газообмена. После закупорки анального отверстия у нимф Ы-bellula или Aeschna поглощение О2 падает с 0,128 до 0,008 см3/ /г-ч [236]^ Однако подобные изменения газообмёна имеют место лишь в воде, а в воздушной среде после закупорки кишечника дыхание нимф меняется незначительно. Очевидно, в период кратковременного пребывания на воздухе нимфы не пользуются жабрами и поглощают кислород через поверхность тела.
77
Таким образом, среди всех типов трахейных жабр ректальные жабры являются наиболее эффективными дыхательными органами, хорошо приспособленными к поглощению кислорода, растворенного в воде. У нимф стрекоз из подотр. Anisoptera они почти полностью вытеснили кожное дыхание, которое столь широко распространено у других водных насекомых с замкнутой трахейной системой.
Дыхальцевые жабры. Своеобразные дыхательные органы, названные дыхальцевыми (кутикулярными)' жабрами, описаны у куколок многих Diptera и некоторых Coleoptera, а также у личинок тропических жуков из небольшого подотр. Myxopha-ga [237]. Энтомологи хорошо знакомы с этими образованиями на примере куколок длинноусых двукрылых — долгоножек (рис. 24, А, Б) и мошек (рис. 24, В). Однако менее широко известно, что такие же органы дыхания можно обнаружить у куколок короткоусых двукрылых, например у Aphrosylus из сем. Dolichopodidae (рис. 24, Г) или у Сапасе из сем. Canacei-dae. При наличии пупария у круглошовных мух дыхательные органы, устроенные в виде небольших рожков, выступают наружу через специальные отверстия в его стенке [238]. Эти рожки послужили исходными структурами для возникновения высоко специализированных дыхальцевых жабр.
В типичном случае дыхальцевые жабры имеют вид длинных нитей, расположенных на голове (см. рис. 24), но в общем их форма и местоположение подвержены большой изменчивости. Они всегда тесно связаны с дыхальцами и возникают в результате модификаций самого дыхальца или стенки тела вблизи него. Кислород поглощается дыхальцевыми жабрами через пластрон, а затем, через дыхальца, проникает в трахеи и разносится по их разветвлениям по всему телу насекомого. Только у куколок комаров сем. Ghironomidae пластрон отсутствует и растворенный в воде кислород диффундирует в дыхальце, проходя через слой гемолимфы.
Пластрон служит основным местом газообмена в дыхальцевых жабрах. Строение его приблизительно такое же, как в дыхательных рожках яиц. Обычно пластрон формируется из вертикальных стоек, которые соединяются друг с другом горизонтальными веточками, образующими гидрофобную сетчатую структуру (рис. 25). Капиллярные отверстия «сетки» заполнены воздухом; через эти воздушные прослойки осуществляется диффузия кислорода, проникающего в атрйальную полость ды-хальцевой жабры. У куколок комара Geranomyia unicolor вертикальные стойки имеют вид спрутообразных обособленных структур, поднимающихся над поверхностью кутикулы на 5—6 ножках (рис. 25, В). Горизонтальные мостики между этими структурами образуются редко, и воздух задерживается в пространстве, ограниченном ножками каждого «спрута».
78
Общая поверхность дыхальцевых жабр достаточно велика: у куколок Simulium subornatum, длина тела которых всего лишь 4 мм, она достигает 6,6 мм2 [240]. Соотношение между весом тела и поверхностью пластрона сильно варьирует у разных видов. У Simuliidae относительная поверхность пластрона составляет 105—106 мкм2 на 1 мг веса куколок. В этом случае кислород потребляется куколкой исключительно через дыхаль-цевые жабры [241]. У куколок мухи Ophyra anescens единственными органами дыхания также являются дыхательные рож-
Рис. 25. Строение дыхальцевой жабры куколки комара-долгоножки Geranomyia unicolor. По Хинтону [237].
А — общая форма и положение дыхальцевой жабры. Б — продольный срез через вершину жабры. В — микроструктура пластрона дыхальцевой жабры (реконструкция по фотографиям, полученным в сканирующем электронном микроскопе), а — аэропиль; а.п — атриальная полость; г —гемолимфа; к.и — кутикула имаго; к.к.— куко-лочная кутикула; п — пластрон; т — трахея; э.щ — экзувиальная щель.
ки, .выступающие из пупариев [238]. Кожное дыхание, дополняющее поглощение кислорода через дыхальцевые жабры, видимо, имеет место только в тех случаях, когда относительная поверхность пластрона невелика, например у куколок австралийских комаров Eutanyderus wilsoni [237].
Дыхальцевые жабры, несущие пластрон, используются в качестве органов дыхания либо типично водными, либо амфибио-тическими насекомыми. В воде пластрон поглощает кислород только в условиях хорошей аэрации — в литорали больших озер и морей, в ручьях и речках с быстрым 'течением и т. д. Он может функционировать и в воздушной среде, причем в отличие от обычного кожного дыхания дыхание через пластрон не препятствует развитцю эпикутикулы на поверхности всего тела с целью защиты от иссушения.
Использование пластрона для поглощения кислорода особенно выгодно для тех насекомых, личинки которых живут и окукливаются в приливной зоне вдоль морских побережий [242]. Таковы некоторые виды комаров-долгоножек. Если бы
79
личинки и куколки этих насекомых были способны только к кожному дыханию, при отливе они легко могли бы погибнуть в результате потерь воды через легко проницаемые покровы. С другой стороны, если бы морские насекомые дышали только с помощью открытой трахейной системы, они бы не смогли использовать ее для поглощения кислорода, находясь под водой. Вполне естественно .также, что дыхание через пластрон получает особенно широкое распространение на неподвижных стадиях развития насекомых (яйцо, куколка), которые в период снижения влажности среды не могут перейти в глубь, почвы и занять новый водоем, как это делают подвижные Почвенные или водные насекомые.
§ 2. Дыхание при открытой трахейной системе
Общий план строения трахейной системы. У подавляющего большинства насекомых воздух доставляется ко всем органам по системе разветвленных трахей, которые сообщаются с внешней средой через дыхальца, снабженные замыкательными аппаратами. По числу и месту расположения дыхалец всех насекомых принято дёлить на три группы:
1) голопнейстические формы имеют 10 пар функционирующих дыхалец — 2 пары грудных и 8 пар брюшных. Такое относительно примитивное состояние трахейной системы типично для некоторых Apterygota и многих Pterygota;
2) гемипнейстические формы имеют различное, но всегда уменьшенное число дыхалец по сравнению с голопнейстиче-скими насекомыми. Среди личинок комаров, например, Cecido-myiidae имеют 9 пар (1 грудная и 8 брюшных), Mycetophyli-dae—8 пар (1 грудная и 7 брюшных), Psychodidae—2 пары (1 грудная и 1 брюшная), a Culicidae, Limoniidae и Tipulidae — 1 пару функционирующих дыхалец, расположенных на самом конце брюшка;
3) апнейстические формы лишены функционирующих дыхалец и обладают замкнутой трахейной системой. Такие насекомые дышат всей поверхностью тела или с помощью жабр; они уже рассматривались нами в «предыдущем разделе этой главы.
Каждое функционирующее дыхальце ведет в атриальную полость (атриум, рис. 26). За счет стенок этой полости образуются замыкательный аппарат и специальная система фильтрации воздуха, проникающего в трахею. Для грудных дыхалец некоторых насекомых характерны наружные замыкательные аппараты в виде подвижных вальв, закрывающих вход в трахею. Брюшные дыхальца обычно имеют внутренние замыкательные аппараты, представленные различными структурами в глубине атриума. Система фильтрации воздуха присутствует только в дыхальцах с внутренними замыкательными аппара-
те
ми и состоит из множества разветвленных щетинок, образующих фильтрующее сито.
Замыкательные аппараты дыхалец обслуживаются одной или двумя мышцами. Если имеется только одна мышца, она функционирует как замыкатель дыхальца: при ее сокращении вход в трахею закрывается (рис. 26, Б, Б', Б"). Открывание
Рис. 26. Схема строения запирательных аппаратов дыхалец. Из Обепбергера [243].
А — продольный срез через дыхальце, обслуживаемое двумя мышцами. А' — то же, поперечный срез, дыхальце открыто. Б — продольный срез через дыхальце, обслуживаемое одной мышцей. Б', Б" — то же, поперечный срез, дыхальце в открытом и закрытом состоянии, а.п — атриальная полость; З-д1— мышца закрыватель дыхальца; к — кутикула; о.д — мышца открыватель дыхальца; т — трахеи; ф.а — структуры, образующие фильтрующий аппарат дыхалец; э — эпителий.
дыхальцевого отверстия происходит главным образом за счет эластичности покровов. В замыкательных аппаратах, снабженных двумя мышцами, эта вторая мышца является антагонистом первой и работает как открыватель дыхальца: при ее сокращении открывается вход в трахею (рис. 26, А, А').
Трахеи начинаются от атриальной полости дыхальца и затем, обильно разветвляясь, проникают во все органы тела насекомых. На любом горизонте ветвления стенки трахей построены из тех же основных компонентов, что и покровные ткани, т. е. из однослойного эпидермиса (трахейного эпителия) и кутикулы, выделяемой эпидермальными клетками. Кутикула
81
трахей представляет собой непосредственное продолжение прокутикулы наружных покровов. Эпикутикула в трахейных стенках отсутствует. Прокутикула, выстилающая трахеи, носит название интимы. Она имеет- правильные утолщения — тенидии, которое поддерживают постоянство просвета трахей, не давая им спадаться под давлением внутренних органов и гемолимфы.
Перед окончанием трахеи ее диаметр резко уменьшается от U5—2 до 0,8—1 мкм, и сама трахея переходит в трахеолу. Общая длина трахеол достигает 200—350 мкм, а диаметр их кончика составляет всего лишь 0,1—0,2 мкм. Трахеолы либо лежат на поверхности клеточных оболочек, либо проникают внутрь клеток. Подобно крупным трахеям, они имеют спиральные утолщения, которые, однако, удается обнаружить лишь при больших увеличениях под электронным микроскопом [244, 245]. Концевые разветвления трахеол связаны с так называемыми звездчатыми клетками. По-видимому, эти клетки принимают участие в трахеолярном контроле снабжения тканей кислородом (см. с. 102).
В типичном случае у голопнейстических насекомых каждое дыхальце открывается в три трахеи: 1) дорсальную трахею, снабжающую дорсальную мускулатуру и сердце; 2) вентральную трахею, снабжающую вентральную мускулатуру, мышцы ног, крылья и брюшную нервную цепочку; 3) медиальную (висцеральную) трахею, снабжающую пищеварительный тракт, жировое тело и гонады [246]. В сегменте, снабженном дыхальцами, эти три пары трахей образуют сеть сегментарных поперечных трахейных стволов (рис. 27).
Продольные трахейные стволы формируют вторичную связь сегментарных трахей и дифференцируются на пару л.атеродор-сальных, пару латеровентральных и пару висцеральных стволов. Вертикальные веточки связывают латеродорсальные и ла-теровентральные стволы. Горизонтальные веточки, или трахейные комиссуры, обеспечивают связь двух продольных стволов в пределах каждой пары.
Эта схема расположения органов дыхания насекомых может рассматриваться лишь как приблизительное, упрощенное описание морфологии трахейной системы. В действительности трахеация многих органов и участков тела бывает очень разнообразной и сложной. Особенно большие усложнения, нарушающие исходный план расположения трахей, отмечаются в области груди летающих насекомых в связи с развитием мощной крыловой мускулатуры. Трахейные разветвления в этой области очень обильны, а их топография определяется общей структурой грудных сегментов и положением отдельных органов.
У многих хорошо летающих насекомых на продольных трахейных стволах образуются местные расширения, известные под названием воздушных мешков. Эти образования в отличие от
82
обычных трахей лишены тенидиев, поэтому их полость не постоянна и может спадаться при выходе воздуха. Воздушные мешки имеют главным образом аэростатическое значение, способствуя уменьшению удельного веса насекомых и механического давления во время полета. У водных насекомых они выполняют и п!дростатическую функцию. Достаточно важной является также роль воздушных мешков в регулировании объема и положения других внутренних органов [248].
Рис. 27. Принципиальная схема распределения трахейных стволов в теле насекомого. По Веберу [247].
а—антенна; б.г — брюшной ганглий; в.г.т — вентральная головная трахея; г.г —грудной ганглий; <91 — первое грудное дыхальце; д1— первое брюшное дыхальце; д.г.т — дорсальная головная трахея; к.т — крыловая трахея; м — мозг; н.т — ножная трахея; п.г — подглоточный ганглий; с.к.с— спинной кровеносный сосуд; т.н.ц— трахеи, обслуживающие нервную цепочку. Продольные трахейные стволы: 1— дорсальный; 2— вентральный; 3— медиальный.
Следует специально остановиться на вопросе об эволюции трахейной системы газообмена. Бимент. [249] полагает, что трахеи возникли еще у водных предков наземных членистоногих, причем первоначально они были замкнутыми и выполняли функцию переноса кислорода от жабр к различным .участкам тела. Однако с экологической точки зрения трудно представить происхождение трахейной системы в условиях водной среды. К тому же истинные трахеи никогда не встречаются у таких бесспорно первичноводных животных, как ракообразные (кл. Crustacea). Наоборот, замкнутая трахейная система получает широкое распространение у многих вторичноводных личинок насекомых (личинки * некоторых длинноусых двукрылых, ручейников и др.). Поэтому кажется более обоснованной гипотеза М. С. Гилярова [250], который полагает, что трахеи возникли только как приспособление к дыханию атмосферным воздухом, а все ныне живущие в воде апнейстические нимфы и личинки насекомых являются вторично измененными предками наземных форм.
83
В разных группах членистоногих при переходе из воды на сушу наблюдается независимое возникновение и параллельная эволюция трахейной системы газообмена. Всего в пределах типа Arthropoda трахеи возникали по крайней мере 10 раз [251].
Несомненно, что в классе насекомых (Insecta) трахеи первоначально возникли как метамерные, посегментно расположенные трубочки и лишь позже появились связывающие их продольные и поперечные стволы. Среди современных насекомых пример такого примитивного состояния трахейной системы дают щетинкохвостки р. Machilis, у которых еще не установились связи между отдельными сегментарными трахеями.
После возникновения продольных и поперечных трахей дальнейшая эволюция органов дыхания у насекомых шла в различных направлениях, причем зачастую совершенно разные процессы эволюционных изменений протекали в голове, груди и брюшке одного и того же животного. Отметим следующие основные тенденции в эволюции органов дыхания насекомых:
1) гипертрофия отдельных участков трахейной системы в связи с усилением функции определенных органов. Примеры: усиленное развитие и усложнение трахей, снабжающих крыловую мускулатуру многих Pterygota, мускулатуру прыгатель-ных ног Sallatoria и органы свечения светляков (Lampyridae);
2) появление воздушных мешков, связанное с высокой активностью насекомых и с приспособлением их к полету. Примеры: высокоразвитая система воздушных мешков у таких хорошо летающих насекомых, как пчелы и мухи;
3) обособление отдельных участков трахейной системы для выполнения некоторых специальных функций, не связанных с дыханием. Примеры: у некоторых совок полностью закрытые трахеи подстилают чувствительные элементы омматидиев, образуя слой сложного глаза, отражающий свет; крупные воздушные мешки у самцов певчих цикад образуют полость, которая служит . резонатором звуковых сигналов этих насекомых;
4) дегенерация части трахей и дыхалец, связанная с утерей способности к полету, уменьшением размеров и специфическими условиями обитания насекомых. Крайняя степень дегенерации трахей достигается у очень мелких насекомых (Collembola), у которых трахеи вообще, исчезают, а газообмен осуществляется только на основе общего кожного дыхания.
Вообще трахейная система отличается исключительно высокой пластичностью и способностью чутко реагировать на изменения функций тех органов, которые она обслуживает. Эта пластичность в развитии трахей прослеживается не только на фоне длительных исторических периодов филогенеза, она проявляется даже в ходе онтогенеза, когда степень трахеации органа изменяется в зависимости от состава газовой среды (см. с. 102).
84
Вентиляция трахей. У насекомых с открытой трахейной системой дыхательная вентиляция, как смена поступающего внутрь тела объема вдыхаемых газов на соответствующий объем выдыхаемой смеси «отработанных» газов, часто производится ритмически при помощи дыхательных движений. Эти движения, однако, наблюдаются далеко не во всех случаях. Они отсутствуют, например, у гусениц и у тараканов, но всегда имеют место, когда одних сил газовой диффузии недостаточно для дыхания и когда наружные покровы сильно склеротизова-ны. Впрочем, даже у одного и того же насекомого дыхательные движения могут быть выражены в разной степени в зависимости от содержания О2 или СО2 в атмосфере и от уровня активности тканей. Поэтому изменение амплитуды и ритма дыхательных движений, вызванное импульсами нервной системы, составляет один из наиболее широко распространенных механизмов регуляции дыхательного обмена насекомых.
Дыхательные движения приурочены в основном к брюшку и совершаются у одних насекомых как ритмические расширения брюшка, а у других — как телескопические надвигания сегментов друг на друга. Первый тип дыхательных движений обусловливается периодическими сокращениями мышц, расположенных между тергитом и стернитом соответствующего сегмента, а второй — сокращениями продольных межсегментных мышц. Иногда в осуществлении одиночного вентиляционного цикла принимают участие обе группы мышц.
У большинства насекомых только экспирация (выдох) совершается активно за счет сокращения мышц. Инспирация (вдох) почти всегда осуществляется пассивно и обусловливается упругостью покровов, внутренних органов и трахейных стенок, сжатых в момент выдоха; определенная роль в этих процессах приписывается эластичному белку кутикулы — резилину [252]. В некоторых же случаях (например, у богомолов) как экспираторные, так и инспираторные дыхательные движения могут происходить самостоятельно при сокращениях разных мышц и даже отделяются друг от друга некоторой паузой.
Объем максимального выдоха после максимального вдоха позволяет определить жизненную емкость трахейной системы. Эта величина, разумеется, меньше общей емкости трахей, причем разница между общей и жизненной емкостью дает представление об объеме остаточного воздуха. По расчетам Крога [253] общая емкость органов дыхания личинки плавунца Dytis-cus на 66% составляется из жизненной емкости и на 34% из остаточного воздуха. У личинки мухи Eristalis установлены подобные же соотношения этих величин [254], но у имаго жука Melolontha жизненная емкость трахей составляет менее 35% от их общей емкости [255]. У саранчи Schistocerca даже при максимальных дыхательных движениях количество воздуха, «наса
85>
сываемого» при вдохе, едва достигает 20% от общего объема трахейной системы [256].
Таким образом, коэффициент вентиляции, вычисляемый по соотношению количества вдыхаемого воздуха и общего его объема в трахеях, сравнительно невелик. Эта небольшая величина коэффициента вентиляции указывает на то, что одни дыхательные движения еще не в состоянии обеспечить заполнения всей трахейной ^системы насекомого. Можно думать, что дыхательные движения «проталкивают» воздух только в наиболее крупные трахейные стволы,
р.м
Рис. 28. Схема газовой камеры, предназначенной для изучения направления токов воздуха по трахейной системе пчелы. По Бейли [257].
б.д — брюшное дыхальце; " <91 — первое грудное дыхальце; дШ — дыхальце про-лодеума — переднего брюшного сегмента, которое у жалоносных перепончатокрылых входит в состав груди; з.к.т — капиллярная трубочка с капелькой жидкости, измеряющей объем воздуха- в задней половине камеры; п.к.т — капиллярная трубочка с капелькой жидкости, измеряющей объем воздуха в передней половине камеры; р.м — резиновая мембрана.
а в более мелких трахеях и трахеолах продвижение кислорода поддерживается за счет сил диффузии.
В отношении направления токов газов внутри тела насекомого при вентиляции в принципе могут быть высказаны три априорных предложения:
1) ток вдыхаемого воздуха может прохрдить по тем же путям, что и ток выдыхаемой смеси газов, и совершаться лишь в обратном направле-'нии. В таком случае каждое дыхальце должно иметь значение и входного и выходного отверстия, а движения воздуха должны происходить ритмически и толчкообразно, то
в одном, то в другом направлении по одному ш тому же пути;
2) возможно существование разных путей: одних для входа воздуха, других для выхода «отработанных газов». В этом случае дыхальца по своей функции могут быть разными: одни
инспираторными, другие экспираторными;
3) инспирация может происходить через дыхальца, а удаление углекислоты, азота и паров воды, после полного поглощения кислорода ткаными,— диффузным путем через кожные покровы и кишечник.
Многочисленные экспериментальные исследования показали,
что у насекомых могут использоваться все три возможных пути вентиляции трахей, но чаще всего используется второй путь, сопровождающийся обособлением инспираторных и экспираторных дыхалец и сегментов.
Для изучения функциональной специализации дыхалец насекомое помещается в стеклянный сосуд, имеющий приводящую и отводящую трубки'(рис. 28) и перегороженный посередине резиновой мембраной (р.м). Через центральное отверстие
86 '
в мембране протаскивают тело насекомого так, .что его передняя часть находится в одной половине сосуда, а задняя — в другой. Мембрана герметически закрепляется на стенках сосуда, а изменения объема воздуха в обеих его половинках точно учитываются.
Использование этого метода показало, что у саранчи Schis-tocerca gregaria воздух входит в трахейную систему через оба грудных и два первых брюшных дыхальца, а выходит из нее через остальные шесть брюшных дыхалец [258] L Расположив мембрану между вторым и третьим брюшными дыхальцами^ можно было наблюдать непрерывный ток воздуха из передней половины сосуда в заднюю его половину. У тараканов воздух по трахейной системе также двигается спереди назад, и вдох осуществляется преимущественно грудными, а выдох — брюшными дыхальцами [260, 261].
У пчелы Apis mellifera основное направление токов воздуха — от груди к брюшку, но грудные дыхальца могут служить и для инспирации, и для экспирации [257]. У гусениц каждый сегмент тела служит самостоятельной респираторной единицей, и любое дыхальце работает при вдохе и при выдохе, хотя первый процесс осуществляется более интенсивно на переднем участке тела. Наконец, иногда воздух двигается по трахеям сзади наперед. Так, например, у кобылки Stenobothrus брюшные дыхальца являются инспираторными, а грудные как инспираторными, так и экспираторнымй [262].
Направленный ток воздуха у насекомых возникает благодаря координации работы дыхалец. При вдохе инспираторные дыхальца открываются, а экспираторные закрываются; при выдохе, наоборот, открываются экспираторные дыхальца, но закрываются инспираторные. Во время полета насекомых, когда потребление О2 резко возрастает, состояние дыхалец заметно меняется и некоторые из них открываются постоянно и широко или работают в ритме, синхронном с колебаниями крыльев.
, Диффузия кислорода по трахеям. Одним из наиболее важных факторов, обеспечивающих транспортирование кислорода по трахеям, является процесс диффузии газов. В подтверждение этого положения можно привести расчеты автора диффузионной теории дыхания Крога [253} для гусеницы древоточца Cossus cossus.
Движущей силой диффузии является разность парциальных давлений газа в атмосфере и в трахеях. Парциальное давление кислорода выше в атмосфере и ниже в тканях, испытывающих потребность в этом газе. В результате возникают диффузионные потоки О2, направленные внутрь тела насекомого. Для вы-
1 По данным Гамильтона [259] последнее, десятое дыхальце у саранчовых функционирует как инспираторное при покое, но служит для экспирации при полете.
87
числения сил, создающих эти потоки, можно использовать следующую формулу:
(1)
где S — количество О2, потребляемого одним животным в единицу времени; k — коэффициент диффузии О2 по трахеям; а — сумма поперечных сечений всех трахей; I — средняя длина участка трахеи, в которой происходит диффузия кислорода; р—pi — разность парциальных давлений кислорода в атмосфере (д=159 мм ртутного столба при содержании О2 20,96%) и в кончиках трахей или в тканях (pi).
В экспериментальных условиях для С. cossus были получены следующие значения: S = 3-10-4 см3 на 1 гусеницу за 1 с, /г=0,18. Число дыхалец у гусениц, как и у других голопнейсти-ческих насекомых, равно 20, а площадь поперечного сечения каждого дыхальца 0,34 мм2. Допуская, что сумма сечений всех трахей на любом горизонте ветвления равна сечению ствола, от которого отходят эти трахеи, легко подсчитать, что а = =6,8 мм2. Средняя длина диффузионного участка трахеи /, согласно измерениям Крога, равна 7,4 мм.
Подставляя эти величины в формулу (1), находим, что Р—Pi=0,02, или 2% от атмосферного давления. Иными словами, расчеты Крога показывают, что диффузия газа в трахеях может осуществляться вполне успешно, если парциальное давление его в тканях хотя бы на 2% ниже атмосферного. В действительности парциальное давление растворенного в тканях кислорода намного ниже атмосферного: почти на 40% ниже у гусениц С. cossus и Pieris brassicae, на 33%—у личинок и куколок мучного хрущака Tenebrio molitor, на 10%—у куколок бражника Sphinx ligustri [263].
Поддерживая диффузионную теории, Вейс-Фо [264] считает, что даже в таких высоко активных тканях, как крыловые мышцы, необходима вентиляция лишь первичных наиболее крупных трахей, а в последующих трахейных веточках для транспортирования кислорода достаточно простой диффузии.
При полёте насекомых дыхание мышц исключительно аэробное [265], и поэтому мышечные волокна нуждаются в постоянном притоке кислорода. У летящей стрекозы Aeschna потребление О2 достигает 1,8 мм на 1 г мышечной ткани за 1 мин [264]. Для обеспечения такого высокого уровня дыхания необходимо, чтобы воздух обновлялся в трахеях с каждым циклом движений крыльев. В первичных и в наиболее крупных вторичных трахейных стволах это обновление воздуха обусловливается сокращениями самой крыловой мускулатуры, которая, синхронно с колебаниями крыльев, накачивает воздух в трахеи и выталкивает его из воздушных мешков к мышцам. Подобный
.88
способ снабжения кислородом работающих мыцщ получил название автовентиляции трахей.
Несмотря на то, что диффузионная теория Крога в целом получает поддержку и подтверждение в ряде современных исследований, против некоторых ее положений выдвинуты серьезные возражения [266].
Во-первых, в расчетах Крога принимается, что дыхальца насекомого всегда открыты, тогда как на самом деле они открываются на очень короткий срок, достаточный лишь для вдоха или выдоха (см. с. 87). Этот факт теорией диффузии не учитывается.
Во-вторых, проверяя, расчеты Крога, Нуноме [267] установил, что сумма поперечных сечений всех трахейных веточек не остается постоянной повсюду; она достигает максимума в точке, отстоящей примерно на 7з пути от дыхалец, и затём постепенно снижается, составляя в области трахеолярных кончиков только 7б от, максимальной величины. На основе этих новых данных и с учетом общей суммы сечений 1 400'000 трахеол были сделаны перерасчеты по формуле (1) для гусениц тутового- шелкопряда (Bombyx mori) и было показано, что для успешной диффузии кислорода парциальное давление его в тканях должно быть па 15% ниже атмосферного, т. е. разность р—р\ должна быть значительно выше, чем по расчетам Крога для гусеницы древоточца.
В-третьих, в расчетах Крога и Нуноме не принималось во внимание, что самый кончик трахей часть бывает заполнен жидкостью, мало проницаемой для О2 (см. с. 104). Даже если заполненный жидкостью участок составляет всего Vioooo диффузионного пути, то и тогда сильно затрудняется проникновение кислорода из кончика трахеол в цитоплазму клеток.
В общем, оценивая теорию Крога сейчас, через 50 лет после ее создания, следует сказать, что, хотя обеспечение потребностей насекомых в кислороде, насколько нам известно, осуществляется только за счет диффузии его, количественные стороны этого процесса остаются во многом неясными. Предложенные Крогом расчеты можно рассматривать лишь как очень приближенное описание физического механизма транспортирования кислорода по трахеям и трахеолам.
Выделение углекислоты. Парциальное давление углекислоты высокое в организме насекомого и низкое в окружающей атмосфере, поэтому ее транспортирование по трахеям может осуществляться за счет сил диффузии. Однако углекислота в 36 раз быстрее кислорода проникает через живые клетки, гемолимфу и покровы, но гораздо медленнее кислорода диффундирует в газовой среде [268]. Поэтому у некоторых насекомых трахейная система может не принимать участия в выделении СО2, так как более эффективным оказывается ее выведение из организма через покровы.
89=
У позвоночных выделение углекислоты осуществляется благодаря химическому связыванию ее с водой:
СО2 + Н2О^Н2СО3.
.Эта реакция катализируется особым ферментом крови — угольной ангидразой, или карбангидразой. Образующаяся угольная кислота переносится к легким с помощью гемоглобина. В легких происходит обратный процесс распада угольной кислоты на углекислый газ и воду. f
Е. М. Крепсом и Е. И. Ченыкаевой [269, 270] было показано, что, несмотря на чрезвычайно напряженный дыхательный обмен, в гемолимфе насекомых карбангидраза отсутствует. Позднее эти данные были подтверждены и другими исследователями. Так, у сверчка Gryllus domesiicus электрометрическим методом карбангидраза была обнаружена в кишечнике, жировом теле, покровах и в мускулатуре груди, но одновременно было доказано отсутствие фермента в трахеях, мальпигиевых сосудах и гемолимфе [271]. Единственным насекомым, у которого найдена карбангидраза в гемолимфе, является личинка комара Chironomus [272].
По-видимому, транспорт углекислоты у насекомых происходит не в химически связанном состоянии, как у позвоночных, а в виде газа по трахеям или в растворенном состоянии по гемолимфе. Если гемолимфа насекомых не является переносчиком химически связанных дыхательных газов и если углекислота в ней не вступает в связь с молекулами воды, то, очевидно, не нужна и карбангидраза. Более того, ее присутствие могло бы даже оказаться вредным. И в самом деле, в гемолимфе некоторых насекомых Е. М. Крепе и Е. И. Ченыкаева обнаружили вещество, препятствующее гидратации углекислоты и этим обеспечивающее ее свободное выведение через трахеи. Следовательно, дыхательная функция крови насекомых состоит не в транспорте газов в связанном состоянии, а, скорее в предупреждении этого связывания и в обеспечении выведения углекислоты в виде газа. Вещество, препятствующее реакции гидратации углекислоты, обнаружено в плазме гемолимфы в свободно растворенном состоянии, не связанном с белками крови. Это вещество не действует на карбангидразу других животных, являясь, вероятно, существенным и специфическим дополнением к трахейной системе газообмена.
У некоторых насекомых наблюдается интересное явление циклического освобождения углекислоты. При таком способе дыхания кислород поглощается непрерывно и с постоянной скоростью, а углекислота выделяется периодическими залпами, или «выхлопами» (рис. 29). Частота таких залпов может варьировать o’? 25 раз в течение часа до 1 раза в сутки, а их длительность соответственно колеблется от 1 мин до получаса.
90
Циклическое освобождение углекислоты отмечалось у саранчовых, тараканов, клопов, жуков и бабочек, но оно в особенности характерно для зимующих куколок чешуекрылых [274]. При 25° диапаузирующие куколки американского шелкопряда Hyalophora cecropia выделяют примерно 90% всей углекислоты в виде «выхлопов», повторяющихся в среднем через каждые 7,3 ч [273, 275]. Остальная углекислота выводится
Рис. 29. Непрерывное поглощение кислорода и залповое выделение углекислоты у диапаузирующей куколки американского шелкопряда Hyalophora cecropia при температуре 25°С. По Шнейдерману и Вильямсу [273].
1— поглощение О2; 2 — выделение СО2.
непрерывно с очень низкой постоянной скоростью. При 10° «выхлопы» происходят всего 1 раз в несколько дней, но их объем и длительность остаются такими же, как и при высокой температуре.
Прерывистое, залповое, выделение углекислоты обусловливается цикличностью работы запирательных аппаратов дыхалец, которые открывают вход в трахею только на время «выхлопа» СО2. После замазывания всех дыхалец воском газообмен куколки снижается до едва ощутимой величины. Любопытно, что заклеивание даже одного-единственного дыхальца приводит к изменению цикличности дыхания. Очевидно, пери
91
одичность работы замыкательных аппаратов регулируется колебаниями внутритрахеального давления газов, которое может быть сильно нарушено при выключении одного или нескольких дыхалец. Леви и Шнейдерман [276] подтвердили это предположение, измерив внутритрахеальное давление СО2 и О2 в течение дыхательного цикла у куколок Н. cecropia.
По всей вероятности, циклический характер выделения углекислоты связан с необходимостью крайнего ограничения испарения воды через дыхальца, что особенно важно для диапау-зирующцх насекомых. Когда дыхальца открываются лишь редко и на короткий срок, сильно ограничиваются потери влаги через легко проницаемые и не защищенные кутикулой стенки трахей. Поэтому способность к прерывистому дыханию развивается в первую очередь у насекомых, зимующих над поверхностью почвы. Однако у диапаузирующих куколок и предку-колок пилильщиков, обитающих в почве, где угроза испарения воды минимальна, как потребление О2, так и выделение СО2 происходят непрерывно [277].
§ 3. Регуляция дыхания
Адаптивные изменения дыхания при недостатке кислорода и избытке углекислоты. Интенсивность дыхания насекомых не является ^постоянной величиной. Она определяется, с одной стороны, внешними условиями (содержанием кислорода и углекислоты в атмосфере), а с другой, — потребностями организма в кислороде и необходимостью удаления избыточных количеств СО2. Адаптивные изменения дыхания в зависимости от внешних и внутренних условий обеспечиваются специальными регуляторными механизмами.
Регуляция дыхания насекомых может осуществляться тремя основными путями: а) изменениями дыхательных движений, б) изменениями работы дыхалец, в) включением дополнительных механизмов вентиляции трахей. При усилении мышечной работы, которая требует дополнительных затрат кислорода, при снижении содержания кислорода в среде или при повышении содержания углекислоты могут быть использованы все три пути или какой-нибудь один из них (рис. 30).
Регуляторные механизмы дыхания позволяют адекватно изменять количество кислорода, поступающего в трахеи, в зависимости от внешних и внутренних факторов. Однако эти механизмы еще не дают возможности усилить поступление кислорода из трахей в клетки интенсивно работающих органов. Для этой цели у насекомых используется специальный путь трахеолярного контроля дыхательного обмена (см. с. 102).
Эффект снижения содержания кислорода (гипоксии) у многих насекомых легко компенсируется усилением дыхания. Такая компенсация, однако, возможна лишь до некоторого пре
92
дела, ниже которого интенсивность дыхания быстро падает (рис. 31, 2). Та минимальная концентрация кислорода, при которой регуляторные механизмы еще в состоянии обеспечить обычный уровень дыхательного обмена, носит название критической концентрации. Среди наземных насекомых прц комнатной температуре эта концентрация составляет 3—4% У имаго Aedes [278], 7,5% У личинок Calliphora [222] и выше 10% у личинок Phormia [279]. Наиболее низкие значения критической концентрации отмечаются у диапаузирующих куколок: ниже 1% у Agapema [280] и около 2% у Promethea [281].
Рис. 30. Схема регуляции дыхания насекомых.
Водные личинки насекомых не всегда могут компенсировать недостаток кислорода в воде усилением дыхания. Вместо регуляции дыхательного обмена здесь имеет место конформация, т. е. прямая зависимость интенсивности дыхания от содержания кислорода. При этом в различных экологических условиях, в которых обитают личинки, можно- наблюдать все переходы от регуляции к конформации дыхания. Как правило, насекомые, приспособленные к воде с высоким содержанием кислорода, имеют более высокое значение его критической концентрации и слабо выраженную способность к регуляции дыхательного обмена [282]. Так, у личинок комара Tanytarsus, которые живут в обогащенной кислородом про
93
точной воде, интенсивность дыхания явственно зависит от содержания О2 (рис. 31, 1). У личинок Chironomus, которые живут в условиях гипоксии в заболоченных канавах и в прудах,
интенсивность дыхания постоянна в широких пределах изменений содержания кислорода (рис. 31, 2). Таким образом, способность к регуляции дыхательного обмена представляет собой адаптацию к экологической обстановке, в которой обитает животное. Эту способность можно легко усилить в экспериментальных условиях. Показано, что личинки сем. Chironomidae
Рис. 31. Зависимость интенсивности дыхания от содержания кислорода в воде у личинок двух видов двукрылых. По Вэльше [283].
становятся менее чувствительными к гипоксии после предварительного их выдерживания в течение нескольких часов в пробирке с водой, недостаточно богатой кислородом [283].
В некоторых случаях у водных насекомых конформация дыхания имеет место лишь в неестественной обстановке эксперимента и не наблюдается в природных условиях. Так, зарывающиеся в грунт нимфы поденок долгое время считались неспособными к регуляции газообмена [284]. В действительности же оказалось, что регуляция дыхания у этих насекомых хорошо выражена, но она может быть обнаружена лишь в присутствии «оптимального
1—Т anytarsus (конформация дыхания); Субстрата» В ВИДе пеСЧИНОК 2— Chironomus (регуляция дыхания).
у или мелких кусочков грунта
[285]. Если же дыхание нимф изучается в чистой воде без грунта, то у них отмечается прямая зависимость газообмена от содержания О2.
Таким образом, регуляторные механизмы дыхания могут обеспечить нормальный уровень дыхательного обмена даже
в условиях, когда содержание кислорода в среде понижается. Снижение парциального давления кислорода ведет к учащению дыхательных движений и увеличению их амплитуды. Усиление вентиляции может быть достигнуто также путем изменения работы дыхалец. Последние при гипоксии длительное время остаются открытыми, а закрываются ненадолго и неплотно. Иногда дыхальца в этих условиях вообще не закрываются (см. с. 99).
Повышение содержания углекислоты в среде действует по
94
добно недостатку кислорода, вызывая усиление дыхательных движений, а также длительное и широкое открывание дыхалец. Так, у диапаузирующих куколок Hyalophora cecropia циклическое освобождение СО2 превращается в непрерывное либо при снижении содержания кислорода ниже 15%, либо при увеличении содержания углекислоты выше 10% [275]. У таракана Periplaneta [285], у блохи Xenopsylla [286] и жужелицы Carabus [287] дыхальца полностью открываются когда содержание СО2 достигает 1,5—2%. Повышение интенсивности дыхания, обусловленное увеличением содержания углекислоты, обычно наблюдается до концентраций СО2, не превышающих -20—25%. Более высокие концентрации вызывают обездвиживание животных и снижение интенсивности дыхательного обмена. На этом основано применение углекислоты в качестве наркотизирующего средства при оперировании насекомых.
Регуляция дыхания при полете насекомых. Количество кислорода, циркулирующего по трахейным трубкам в покое, в 12 раз превышает потребности насекомого. Имеется, следовательно, некоторый кислородный запас, который может быть использован при повышении двигательной активности животного. Однако во время полета количество потребляемого кислорода увеличивается в 24 раза у саранчовых [265], в 50 раз у пчел [288], в 96 раз у тараканов [289] и в 100—150 раз у бабочек [290]. Повышенный спрос на кислород, превышающий кислородный запас, удовлетворяется, во-первых, за счет богатого снабжения трахеями крыловой мускулатуры и, во-вторых, за счет регуляторных механизмов дыхания.
Во время полета все грудные дыхальца (или некоторые из них) постоянно и широко открыты [258]. Например, у саранчи Schistocerca gregaria первая пара дыхалец груди при полете ведет себя так же, как и в покое, по две задних пары широко открываются. Крыловая мускулатура снабжается кислородом через эти две пары дыхалец, а проторакальная пара вентилирует в основном грудные ганглии [291]. Выведение воздуха при выдохе происходит через брюшные дыхальца.
- Для снабжения кислородом интенсивно работающей крыловой мускулатуры большое значение имеет явление автовентиляции трахей. Изменения объема груди при полете позволяют «проталкивать» по трахеям значительные количества воздуха. Из 320 л воздуха (в расчете на 1 кг веса в 1 ч), вентилирующих грудь летящей саранчи, 250 л поступают за счет изменений объема груди, синхронных с движениями крыльев [292].
Регуляция дыхательных движений. Дыхательные движения у насекомых осуществляются благодаря координированным сокращениям туловищных мышц, которые вызываются импульсами центральной нервной системы (ЦИС). Дыхательная иннервация каждого сегмента контролируется по крайней мере двумя типами нервных центров: 1) первичным, вызывающим
95
сами дыхательные движения, и 2) вторичным, который стимулирует или тормозит деятельность первичного центра.
Первичные центры метамерны и расположены в брюшных сегментах, а также в задне- и среднегруди. Каждый из них контролирует дыхательные движения своего сегмента, поэтому у форм с .неконцентрированной нервной системой, например, у личинок комара Corethra, у тараканов или у саранчовых, эти
20 \1с мкв -------
Рис. 32. «Дыхательные разряды» в нервной системе жука-плавунца Dytiscus marginalis. По Эдриану [294].
А — регистрация импульсов от каудального пучка нервов. Б — регистрация импульсов от брюшных ганглиев. В — одиночный «дыхательный разряд» при более высокой скорости регистрации. Г — схема нервной цепочки жука: б.г —брюшные ганглии; г.г — грудные ганглии; п.к.н— пучок каудальных нервов. Стрелками обозначено положение электродов при регистрации импульсов на осциллограммах А, Б и В.
движения продолжаются на отдельных изолированных сегментах брюшка [293]. Однако в целой нервной цепочке, когда ганглии не изолированы друг от друга, среди них выявляется ведущий дыхательный центр, который навязывает ритм своей работы всем остальным сегментарным центрам и, тем самым, определяет общий ритм дыхательных движений тела насекомого. Залпы нервных импульсов этого ведущего центра, совпадающие по ритму с дыхательными движениями, распространяются по нервной системе и могут быть зарегистрированы в любом ее участке. Подобные «дыхательные разряды» имеют .вид
96
периодических вспышек потенциалов высокой амплитуды, которые впервые были обнаружены Эдрианом [294] в нервных ганглиях жука Dytiscus marginalis (рис. 32). ,
Обычно ведущий дыхательный центр расположен в метато-ракальном и первом брюшном ганглии у наземных насекомых, имеющих открытую трахейную систему [295], или же в последнем брюшном ганглии у нимф стрекоз, которые дышат с помощью кишечных жабр [296]. Разряды нервных импульсов дыхательного центра возникают в специальных генераторных нейронах, которые могут сохранять свою активность даже после полной их изоляции от рецепторов. Тем не менее рецепторы могут оказывать влияние на частоту разрядов ведущего центра и, следовательно, изменять ритм дыхательных движений. Так, у Periplaneta americana ритмическое раздражение сегментарных нервов изменяет ритм «дыхательных разрядов», если естественная и навязываемая частоты мало отличаются друг от друга [297]. Однако адаптивных изменений вдыхания периферические рецепторные влияния обеспечить не могут; эта функция выполняется вторичными дыхательными центрами, которые модифицируют ритмы разрядов первичного центра в соответствии с условиями среды.
Вторичные дыхательные центры расположены в головных и грудных ганглиях. Эксперименты Хубера [298] показали, что у сверчка Gryllus domesticus определенные участки протоце-ребрума могут изменять ритм активности первичных дыхательных центров. При раздражении мозга электрическим током отмечается либо -снижение, либо повышение частоты дыхательных движений, а после удаления грибовидных тел наступает гипервентиляция трахей. Интенсивные дыхательные движения наблюдались также у тараканов после обезглавливания [299].
Головные и передние грудные ганглии обладают более высокой чувствительностью к углекислоте, чем нижележащие нервные центры [258, 291]. При этом углекислота оказывает влияние на сами нейроны ЦНС, и ее эффект проявляется даже после перерезки связей ганглия с периферическими рецепторами, т. е. после полной деафферентации [300]. Влияние СО2 па нервные клетки неспецифично, оно может быть имитировало слабым подкислением физиологического раствора [301]. Очевидно, ганглии способны реагировать на изменение pH гемолимфы, обусловленное или избыточным содержанием углекислоты, или, при недостатке кислорода, накоплением других недоокисленных продуктов. В итоге в обоих случаях будет наблюдаться увеличение частоты нервных импульсов во вторичном дыхательном центре, что, в свою очередь, вызовет повышение ритма разрядов первичного центра. Таким образом, видимо, и осуществляется адекватное приспособление частоты дыхательных движений к газовому составу внешней среды.
4 198
97
Регуляция работы дыхалец. Замыкательные аппараты дыхалец насекомых приводятся в действие одной или двумя мышцами (см. с. 80). Когда имеются две антагонистические мышцы, одна из них — замыкатель дыхальца, — сокращаясь, сдвигает вальвы и закрывает вход в трахею. Расслабление этой мышцы и сокращение открывателя дыхальца вызывает раздвигание вальв и открывает, вход в трахею. Подобные дыхальца с двумя мышцами функционируют обычно в брюшных сегментах. Грудные . дыхальца чаще обслуживаются лишь одной мышцей — замыкателем. Раздвигание вальв в этом случае обусловливается расслаблением мышцы, вызванным эластичностью 'покровов в области дыхальцевого отверстия.
У прямокрылых и у взрослых стрекоз в обоих типах дыхалец мышца-замыкатель иннервируется двумя двигательными аксонами непарного нерва (рис. 33). Сокращение мышцы вызывается импульсами этих нервных волокон, берущих начало от специальных клеток-пейсмейкеров («водителей ритма»), расположенных в ганглиях. Ритмичность импульсации аксонов определяется эндогенным возбуждением нейрона-пейсмейкера. У саранчи Schistocerca gregaria во время инспираторной фазы импульсы в аксонах замыкателя проторакального дыхальца полностью подавляются и дыхальце открывается [302, 303; рис. 34]. Во время экспираторной фазы частота нервных импульсов достигает максимальной величины. Вальвы в этот период закрываются, и «отработанные газы» выводятся через брюшные дыхальца. Во время паузы в дыхании, которая приходится на середину экспираторной фазы, частота нервных импульсов снижается, но вальвы дыхальца остаются закрытыми. Они открываются лишь с началом нового вдоха, когда импульсы в двигательных аксонах мышцы-замыкателя совсем исчезают.
98 5
Рис. 33. Иннервация мышц проторакального дыхальца саранчи Schistocerca gregaria. По Миллеру [302].
— проторакальный ганглий; all — ме-зоторакальный ганглий; м.з — мышца-замыкатель дыхальца; м.о — мышца-от-крывателъ дыхальца; н.г.И — смешанный нерв мезоторакального ганглия; н.м.о — двигательная нервная веточка, обслуживающая мышцу-открыватель; н.м.д — чувствительная нервная веточка, связанная с механорецепторами дыхальца;
н.н — непарный нерв.
У той же саранчи проторакальное дыхальце снабжено двумя мышцами (рис. 33). Открыватель дыхальца обслуживается тремя аксонами: два из них отходят от непарного нерва в области первого грудного, а третий — в области мезоторакально-го ганглия. Импульсы, всех трех нервных волокон вызывают сокращение мышцы-открывателя и способствуют раздвиганию вальв в момент расслабления мышцы-замыкателя. Активность
аксонов, иннервирующих открыватель дыхальца, достигает максимума (40 имп/с) во время инспирации, когда активность
нервных волокон мышцы-ан; тагониста падает до нуля.
Контроль за количеством воздуха, поступающего в трахеи через дыхальце, может осуществляться двумя основными путями: путем измене-нения длительности открытого состояния дыхалец и путем градуального изменения степени их открывания. У Sch. gregaria используются оба эти пути регуляции работы дыхалец. В обычных условиях ды
Рис. 34. Изменения частоты нерв-
ных импульсов в аксонах мышцы-замыкателя проторакального дыхальца саранчи Schistocerca gregaria во время дыхательного цикла. По Миллеру [302].
/ — графическая запись : дыхательных движений; 2 — частота нервных импульсов.
хальца саранчи остаются открытыми не более 25—30% времени вентиляционного цикла [291]. При усилении вентиляции и при увеличении содержания СО2 в воздухе про
должительность периода от-
крытой фазы дыхальца увеличивается. В атмосфере с 5% СО2 дыхальца могут быть открыты в течение 80—90% всего време
ни вентиляционного цикла.
У блохи Xenopsylla cheopsis длительность открытого состояния дыхалец обратно пропорциональна содержанию кислорода; при уменьшении его концентрации ниже 1% дыхальца совсем не закрываются [286]. Длительность открытой фазы дыхальца сильно увеличивается и при повышении содержания углекислоты до 2%. Интенсивная мышечная работа насекомых также сопровождается продолжительным открыванием дыхалец [285].
Если насекомые постоянно живут в условиях низкого содержания кислорода и повышенного содержания углекислоты, дыхальца у них открыты постоянно. К таким насекомым относятся, например, личинки, куколки и имаго жука-дровосека Orthosoma brunneum, которые заселяют гниющую древесину, где О2 всего 2%, а СО2 15% [304, 305]. В воздухе с обычным соотношением газов эти жуки периодически закрывают дыхальца
99
и дышат «залпами» как диапаузирующие куколки шелкопрядов (с. 90). Однако в естественной среде обитания дыхание жуков носит непрерывный характер, потому что дыхальца никогда не закрываются.
В зависимости от содержания углекислоты в воздухе у саранчи наблюдается градуальное изменение степени открывания и закрывания дыхалец. При низком содержании СО2 дыхальца открываются не полностью, но закрываются очень полно и плотно. При высоком содержании СО2 дыхальца полностью открываются, но закрываются лишь частично*. Такой характер изменения работы дыхалец во время инспирации и экспирации обеспечивает дополнительную регуляцию поступления воздуха в трахеи.
„ Быстрые“ „ Медленные“
Jc к к f
Рис. 35. Запись сокращений мышцы-замыкателя мезоторакального дыхальца саранчи Schistocerca gregaria при раздражении «быстрого» и «медленного» двигательного аксона. По Хойлу [306].
Контролирование степени открывания дыхалец у саранчи столь эффективно потому, что два аксона, обслуживающие мышцу-замыкатель, принадлежат к разным функциональным типам нервных волокон. Одно из них является «быстрым», а другое — «медленным» нервным волокном [306]. Раздражение «быстрого» аксона, имеющего диаметр 7 мкм, вызывает крупные потенциалы нервно-мышечного соединения, которые приводят к сильному сокращению мышцы. Напряжение мышечных волокон при раздражении этого аксона развивает силу в 0,14 г (рис. 35). Раздражение «медленного» аксона, имеющего диаметр 6 мкм, приводит к более слабому напряжению мышцы силой до 0,05 г. Следовательно, при возбуждении разных аксонов можно получить различную силу сокращения мышцы и различную степень открывания дыхальца.
Еще более сложная картина иннервации мышцы-замыкателя наблюдается у куколок Hyalophora cecropia и Telea polyp-hemus [307]. Единственная мышца дыхальца снабжается аксонами, проходящими в двух различных нервных веточках. Одиночное, или ритмическое, раздражение передней нервной веточки вызывает «быстрое» сокращение замыкателя, которое сопровождается крупными потенциалами мышечных волокон. Аксоны задней нервной веточки отвечают только на ритмическое раздражение, вызывая длительное повышение частоты спонтанных разрядов мышцы. В регуляции работы дыхальца, по-видимому, принимает участие не только возбуждающая, но
100
и тормозная иннервация, которая активно противодействует мышечному сокращению и закрыванию входа в трахею.
Регуляция длительности и степени открывания дыхалец осуществляется двумя основными механизмами: периферическим и центральным.
Периферический механизм регуляции основывается на влиянии углекислого газа на передачу возбуждения с нерва на мышцу [306, 308]. Насколько известно, этот механизм действует только в тех дыхальцах, которые имеют одну мышцу (у стрекоз, двукрылых, у куколок чешуекрылых и во втором грудном дыхальце саранчовых). Углекислота в достаточно высоких концентрациях ухудшает переход возбуждения с веточек непарного нерва на мышцу-замыкатель. В результате этого нервно-мышечная передача блокируется: нервные импульсы не достигают мышечных волокон, не вызывают сокращения мышцы, а следовательно, и закрывания дыхальца. Частичный блок нервно-мышечной передачи приведет, очевидно, к неполному и кратковременному закрыванию дыхалец; при полном блоке дыхальца вообще не будут закрываться. Следовательно, один периферический механизм регуляции работы дыхалец, даже без участия ЦИС, в состоянии обеспечить адаптивные изменения замыкательного аппарата в зависимости от содержания СО2 в воздухе. Любопытно, что чувствительность мышцы к углекислоте сохраняется и после полной ее денервации, т. е. после перерезки всех двигательных аксонов. Это обстоятельство дает возможность рассматривать мышцу-замыкатель дыхальца как «независимый эффектор» — прибор, обладающий способностью самостоятельно воспринимать действие СО2 и реагировать на изменение ее концентрации [309].
Центральный механизм регуляции действует во всех типах дыхалец и основывается па рефлекторном торможении или возбуждении мышц замыкательного аппарата импульсами нервных ганглиев. Частота импульсов в аксонах, иннервирующих эти мышцы, явственно зависит от содержания кислорода. Так, у имаго стрекоз Ictinogomphus ferox и Aeschna суапеа при содержании О2, равном 10%, импульсы в аксоне мышцы-замыкателя следуют с частотой более 40 в секунду, и поэтому грудные' дыхальца даже в момент вдоха не открываются полностью |310|. При 2ПХ) ()2 нервные импульсы исчезают, мышца не сокращается даже' в момент выдоха, и дыхальца вообще не закрываются. У стрекоз нервные центры, видимо, чувствительны лпнн. к гипоксии, а повышенное содержание СО2 вызывает открывание дыхалец только через периферический механизм блокирования нервно-мышечной передачи (см. выше). У диа-наузирующих куколок шелкопрядов углекислота также оказывает периферическое, а гипоксия — центральное влияние на деятельность замыкательных аппаратов дыхалец [311]. У мух эти регуляторные механизмы тесно взаимосвязаны, потому что
101
чувствительность мышцы-замыкателя к СО2 повышается при гипоксии [312]. Следовательно, центральная нервная система может направленно изменять деятельность периферического механизма регуляции дыхалец.
Импульсы нервных центров вызывают открывание дыхалец и улучшают условия вентиляции во время полета насекомых (с. 95). Установлено, что у стрекоз широкое открывание дыхалец при полете является результатом рефлекторного торможения сокращений мышцы-замыкателя [308]. Дополнительное значение может иметь повышение температуры тела летящего насекомого, так как повышенная температура способствует открыванию дыхалец. Повышение температуры при полете обусловливается работой мышц,, а у стрекоз также определенной ориентацией тела по отношению к солнцу [310].
Рефлекторное закрывание дыхалец наблюдается при повышении частоты импульсов, приходящих к мышце-замыкателю, или при снижении частоты импульсов, достигающих мышцы-открывателя. Показано, что у тараканов Periplaneta и Blabe-rus раздражение механорецепторных волосков, расположенных в области дыхальцевого отверстия, вызывает плотное смыкание вальв в обоих дыхальцах данного сегмента [313]. Возбуждение, запускающее этот рефлекс, проводится от механорецептора к ганглию через нерв н.м.д (см. рис. 33).
Уже давно известно, что длительность и степень открывания дыхалец резко сокращается при снижении влажности воздуха или содержания воды в теле самого насекомого [314, 315]. По данным Миллера [316], закрывание дыхалец при снижении влажности основано на центральном механизме и обусловлено следующей системой взаимосвязанных процессов:
1) снижение влажности ведет к повышению испарения воды через дыхальца;
2) повышение испарения воды увеличивает относительную концентрацию ионов в гемолимфе;
3) увеличение концентрации ионов стимулирует активность нервного центра, управляющего сокращениями мышцы-замыкателя;
4) высокая частота импульсов активированных нервных клеток вызывает сокращение мышцы-замыкателя и смыкание вальв дыхальца.
Однако, по мнению Хойла [317], повышение содержания К+ в гемолимфе при подсушивании насекомых может оказывать прямое влияние на мышцу-замыкатель дыхальца, вызывая ее сильное и длительное сокращение. В таком случае пониженная влажность действует не через центральный, а через периферический механизм регуляции дыхалец.
Трахеолярный контроль снабжения тканей кислородом. Снабжение органа трахеями определяется его потребностями в кислороде и содержанием этого газа в атмосфере. Так, если
102
у нимф клопа Rhodnius prolixus перерезать крупный трахейный ствол, который обслуживает часть эпидермальных клеток брюшка, то вскоре можно наблюдать миграцию трахеол к тканям, испытывающим потребность в кислороде. Активную роль в этих процессах играют сами эпидермальные клетки, которые образуют длинные цитоплазматические тяжи, направленные
Рве. 36. Движения жидкости в кончиках трахеол у личинок комара Aedes aegypti. По Уигглсуорсу [321].
А— кончик трахеи и звездчатая концевая клетка. Б — трахеолы, обслуживающие мышечное волокно в покое. В — трахеолы, обслуживающие работающее мышечное волокно. гр —тонкая веточка трахеолы; з. к — звездчатая клетка; т — трахея; тр — концевая часть трахеолы, содержащая жидкость.
к ближайшим неповрежденным трахеолам [318]. Захватывая кончики трахеол, такие тяжи подтягивают их к своим клеткам и восстанавливают трахеацию тканей.
Образование клеточных тяжей у Rhodnius наблюдается й без нарушения целостности трахей при снижении содержания кислорода в среде. Если нимфы длительное время воспитываются при недостатке кислорода, то после линьки устанавливается новая картина распределения трахей и появляются новые разветвления трахеол. В таком случае грудные ганглии, например, получают дополнительную трахеацию со стороны брюшка. Следовательно, недостаток кислорода компенсируется усиленным развитием трахейной системы, позволяя поддерживать дыхательный обмен нейронов на таком же высоком уровне, как и при нормальном содержании О2.
103
Другую возможность регуляции поглощения кислорода тканями составляет движение жидкости в кончиках трахеол. У большинства насекомых концевая часть трахеолы заполнена жидкостью (рис. 36, Л). Наблюдения Уигглсуорса над живыми личинками комаров [319] и над некоторыми наземными насе-
Рис. 37. Постепенное вытеснение жидкости газом в концевых разветвлениях трахеол брюшка блохи Xenopsylla при выдерживании насекомых в атмосфере с различным содержанием кислорода. По Уигглсуорсу [286].
Показаны только трахеи и трахеолы, освободившиеся от жидкости.
комыми [320] показали, что высота столбика этой жидкости зависит от функционального состояния ткани. Если мышечная ткань находится в покое, то столбик жидкости в обслуживающих мышцу трахеолах достаточно длинен (рис. 36, Б). Если же мышца переходит в активное состояние, то столбик жидкости укорачивается, воздух проходит на его место, и снабжение мышечных волокон кислородом улучшается в связи с их возрастающими потребностями (рис. 36, В). Этот механизм движения жидкости в трахеолах может быть использован не только для удовлетворения повышенных запросов на кислород со стороны интенсивно работающих тканей, но и для компенсации эффектов сниженного содержания О2 (рис. 37) или -повышенного содержания СО2.
Жидкость трахеол, по-видимому, представляет, собой жидкую часть гемолимфы. Давление столбика этой жидкости уравновешивается капиллярными силами, которые противодействуют осмотическим силам тканей, отсасывающих жидкость из трахеолы [322]. Капиллярные силы, удерживающие жидкость
104
в трахеоле, достаточно велики: они могут достигать 10 атм. При интенсивной мышечной работе и при недостатке кислорода накапливаются недоокисленные продукты обмена веществ; это вызывает повышение осмотического давления и отсасывание жидкости из трахеолы против сил капиллярности. На место жидкости в кончик трахеолы поступает воздух, который затем поглощается тканями. Так, видимо, и осуществляется трахеолярный контроль снабжения тканей кислородом в зависимости от уровня дыхания клеток и от газового состава среды.
§ 4. Общий дыхательный обмен
Общий и основной газообмен. Исследование общего дыхательного обмена (газообмена) основано на измерении количества поглощенного кислорода и выделенной углекислоты согласно химической реакции окисления сложных органических соединений в более простые вещества, т. е. реакции типа: СН2О-НгО-рОг 7-* СО2+2Н2О. Однако на самом деле этот процесс более сложен; он включает в себя ряд промежуточных этапов, рассматриваемых как промежуточный (или межуточный) газообмен. Последний происходит при обязательном участии окислительных ферментов и будет обсуждаться в следующем разделе настоящей главы.
Общий газообмен характеризует интенсивность дыхания насекомых на данной стадии развития и при данных экологических условиях. Изучение интенсивности дыхания при полном мышечном покое, после питания и при насыщении воздуха водяными парами дает представление о том минимальном количестве кислорода, которое необходимо для поддержания жизнедеятельности организма. Эта величина называется основным дыхательным обменом животного. Из данных, приведенных в табл. 2, видно, что в имагинальном состоянии при 25°С высокий уровень основного газообмена отмечается у мух. Более низкие значения интенсивности дыхания при покое и при той же температуре наблюдаются у бабочек и жуков, а самые низкие — у тараканов.
Измерение основного газообмена при строго постоянных условиях дает лишь абстрактную величину, которая позволяет судить о возможном минимуме потребления кислорода у обездвиженного интактного животного. Реальные потребности насекомых в кислороде лишь в незначительной степени определяются уровнем его основного газообмена. Гораздо больше они зависят от внешних и внутренних факторов, оказывающих сильнейшее влияние на интенсивность дыхания.
Влияние некоторых экологических факторов на газообмен. Изучению влияния температуры на интенсивность дыхания насекомых посвящено большое количество работ, причем все ис-
105
Таблица 2
Основной дыхательный обмен некоторых взрослых насекомых при температуре 23—25°С
Отряд Вид Кол-во потребляемого O2 в мм’/мг-ч Источник
Diptera Musca domestica 3,6 323
Phormia regina 2,0—2,6 279
Lepidoptera Galleria mellonella 2,0 324
Bombyx mori сГ1,1 325
» 90,98
Coleoptera Phytodecta rufipes 1,25 326
Melasoma populi 0,9 327
Leptinotarsa decemlineata 0,8 327
Hymenoptera Formica polyctena 0,87 328
Camponotus pennsylvanicus 0,6 329
Orthoptera Schistocerca gregaria б0,7 330
90,4
Phasmodea Carausius morosus 0,4 331
Blattoptera Periplaneta americana 0,34 332
Blatt a orientalis 0,3 333
следователи приходят к единодушному заключению, что повышение температуры в определенных границах вызывает усиление дыхания.
Согласно правилу Вант-Гоффа повышение температуры на 10° увеличивает скорость химической реакции в 2—3 раза, т. е. температурный коэффициент реакции (Qio) примерно равен 2,5±0,5. Зависимость интенсивности дыхания многих насекомых от температуры, на первый взгляд, хорошо соответствует этому правилу: при повышении температуры от 15 до 25°С потребление кислорода возрастает в 2 раза у нимф Schistocerca [330], в 2,25 раза у имаго Periplaneta [332], в 2,6 раза у личинок Calandra [334] и имаго Phormia [279], в 3 раза у гусениц Galleria [324]. Однако отклонения от правила Вант-Гоффа столь же обычны для газообмена насекомых, как и случаи, когда это правило вполне оправдывается. Такие отклонения особенно часто наблюдаются в области температур, неоптимальных для данного вида.
Когда высокая температура приближается к летальной границе существования данного вида, наблюдается резкое падение интенсивности дыхания и Qio становится меньше 1. Эта верхняя критическая температура газообмена составляет 35°С
106
у таракана Periplaneta americana [332], 42° у гусениц Galleria mellonella [324], 45° у рабочих особей муравьев Formica polyc-tena [328] и 34° у куколок этого же вида [335]. У жуков Те-nebrio molitor падение интенсивности дыхания начинается, когда температура переходит 32°С, поэтому в интервале 30—32° Qio равно 1,2, а в интервале 32—35° Qio равно 0,35 [336]. Падение газообмена при верхней критической температуре, вероятно, объясняется частичной инактивацией дыхательных ферментов.
Иногда отклонения температурной характеристики газообмена от правила Вант-Гоффа связаны со способностью насекомых поддерживать дыхание на строго постоянном уровне в определенных границах оптимальных температур. В результате возникает независимость интенсивности дыхания от температуры CQio=l); снижение газообмена при падении температуры компенсируется регуляторными механизмами дыхания. Например, у муравьев Formica polyctena потребление кислорода постоянно и не зависит от температуры в интервале между 20 и 30°С [328].
У насекомых арктических широт, живущих в условиях низких температур, наблюдается обратная картина: у них газообмен очень сильно зависит от температуры. Так, у тех личинок комаров р. Chironomus, которые живут на крайнем севере, перепад температуры от —5 до 0°С увеличивает интенсивность дыхания в 25 раз и более [337]. Вероятно, такое большое значение температурного коэффициента (Qio=5O) связано с необходимостью максимально использовать кратковременные повышения температуры для синтеза запасных питательных веществ в организме насекомого.
Влияние влажности на газообмен в большинстве случаев менее определенно, чем влияние температуры. В условиях пониженной влажности, когда возникает угроза быстрого испарения воды из организма, насекомые часто закрывают дыхальца, что приводит к снижению интенсивности дыхания. Показано, что мухи-дрозофилы потребляют больше кислорода в насыщенной влагой атмосфере, чем в сухом воздухе [338].
При изучении газообмена проявление- подобных эффектов влажности часто зависит от содержания воды в теле насекомого. Так, например, тараканы, как и дрозофилы, имеют наиболее высокий газообмен во влажной среде, однако потребление кислорода в тех же условиях возрастает при предварительном подсушивании насекомых [339]. Вызванное подсушиванием усиление дыхания связано с максимальным открыванием дыхалец, а также с повышением двигательной активности и температуры тела тараканов. .
Для водных животных важным экологическим фактором является кислотность (pH) среды. В работах Хефко и Мирона [340, 341] было доказано влияние этого фактора на интенсив-
107
ность дыхания личинок комаров Chironomus plutnosus, веснянок Perla marginata и поденок Ecdyonurus sp. Оказалось, что у всех изученных насекомых количество потребляемого кислорода максимальное при нейтральном pH и увеличивается в кислой и в щелочной среде.
Освещение, видимо, вызывает только рефлекторные изменения дыхания, действуя через центральный механизм его регуляции. Показано, что покрытие сложных глаз светонепроницаемым лаком приводит к уменьшению выделения СО2 у ряда видов саранчовых [342]. Этот эффект сохраняется все время, пока глаза остаются закрытыми: насекомое, следовательно, не в состоянии адаптироваться к затемнению. Двигательная активность саранчовых сильно подавляется в условиях постоянной темноты [343], что, вероятно, и вызывает снижение интенсивности дыхательного обмена.
Влияние всего комплекса экологических факторов обусловливает суточный ритм дыхания насекомых. Периодические суточные изменения газообмена давно известны у членистоногих и других животных. Максимум поглощения кислорода обычно совпадает с периодом наибольшей двигательной активности животного. Поэтому у «дневных» насекомых (пчелы, шмели, осы) дыхание днем более интенсивное, чем ночью. Наоборот, «ночные» насекомые обнаруживают ночью значительно более интенсивное поглощение кислорода, чем днем. Иногда в течение суток отмечены два или даже три максимума поглощения кислорода. Степень выраженности ритма и положение максимумов на шкале времени меняются в течение сезона и под непосредственным воздействием факторов внешней среды [344].
Дыхательный коэффициент. При общем и промежуточном газообмене субстратами для окисления могут служить белки, жиры и углеводы. Определить, какой из этих трех субстратов используется в качестве источника энергии у данного насекомого, можно па основе измерения дыхательного коэффициента, представляющего собой отношение количества выделенной углекислоты к количеству поглощенного кислорода:
где RQ— дыхательный коэффициент, а V — объем дыхательных газов.
Известно, что RQ при окислении углеводов равен 1, белков — 0,77—0,82 и жиров — 0,7. Обычно каждый вид насекомого на данной стадии развития характеризуется определенными значениями дыхательного коэффициента, отвечающими химическому составу его основной пищи. У насекомых-полифагов, способных питаться на различных пищевых субстратах, 108
дыхательный коэффициент изменяется при изменении пищевого рациона. Так, у тараканов при питании крахмалом RQ равен 1,01 —1,07, а при питании жирами—0,78—0,83.
Основной резервный питательный материал насекомых составляют жиры, поэтому при голодании тараканов дыхательный коэффициент понижается до 0,65—0,85, что соответствует преимущественному расходованию ранее запасенных жиров, как субстрата для окисления при газообмене. Жиры служат основным источником энергии дыхания также у куколок и яиц т. е. на тех стадиях метаморфоза, когда насекомые не питаются и используют исключительно запасные питательные вещества. В яйцах углеводы используются в качестве энергетического материала только на самых начальных этапах эмбриогенеза [345, 346]. Если питание прекращается уже на предкуко-лочных стадиях, как, например, у пилильщиков, то значения RQ и в этот период развития близки к 0,7 [277].
Вообще дыхательный коэффициент испытывает сильные изменения при метаморфозе, в особенности при полном превращении, когда происходит резкая смена пищевого рациона в процессе постэмбрионального развития насекомых. Так, у японского жука Popillia japonica изменения RQ во время метаморфоза носят такой характер: питающаяся личинка последнего возраста —0,97, нёпитающаяся предкуколка (пронимфа) — 0,7, куколка — от 0,4 до 0,7 и имаго — от 0,7 до 0,8 [347]. Следовательно, личинка жука использует при дыхании углеводы, предкуколка и куколка — жиры, а взрослый жук — белки и жиры. Такая картина изменений RQ при постэмбриональном развитии типична и для других насекомых из группы Holome-tabola. Однако у рабочих пчел, для которых характерно преимущественно углеводное питание, установлены иные значения RQ: личинка — от 1 до 1,4, а куколка и имаго — 0,9 [348].
По данным Морю и Гордо [349] у мучного хрущака Teneb-rio molitor значение дыхательного коэффициента на всех стадиях метаморфоза выше 1, что можно объяснить либо расщеплением органических и насыщенных жирных кислот, либо превращением углеводов в жиры. В данном случае имеет место процесс, получивший название эндоксибиоза — использование для дыхания кислорода, освобождаемого из тканей внутри самого организма.
Бабочки в большинстве случаев имеют дыхательный коэффициент около 0,7, даже если они питаются углеводами. Очевидно, у этих насекомых углеводы первоначально превращаются в жиры и лишь после этого используются в качестве источников энергии при полете и развитии гонад. У покоящихся бабочек, накормленных глюкозой, в течение нескольких часов после питания дыхательный коэффициент поддерживается на высоком уровне, равном 1,4—1,5: вероятно, в организме насе-
109
комых происходит усиленный синтез жиров [350]. Однако если в это время бабочку заставить летать, то RQ у нее снижается до 0,73 [351]. Очевидно, бабочка при полете неспособна использовать только что поглощенные ею углеводы; она должна сначала превратить их в жиры, которые служат источником энергии для крыловых мышц. Интересно, что крыловые мышцы у мух и комаров, наоборот, используют только углеводы в качестве субстрата для окисления, и RQ у них во время подлета близок к 1.
Отмеченные у некоторых насекомых значения RQ ниже 0,7 (до 0,4, как у куколок японского жука, или даже до 0,2 в диа-паузирующих яйцах сверчка Gryllulus pennsylvanicus) можно объяснить либо обратным процессом превращения жиров в углеводы, либо окислением спиртов. Очень вероятно, что при резком снижении RQ имеет место фиксация СО2 в виде органических кислот, которые затем используются как дополнительный источник энергии. Эта гипотеза находит косвенное подтверждение в увеличении количества органических кислот в период активного роста личинок Gastrophilus [352].
Изменения газообмена при развитии и диапаузе. При развитии яиц изменения газообмена тесно связаны с процессами эмбриогенеза. В яйцах саранчового Melanoplus differ ent ialis до начала бластокинеза, сопровождающегося погружением зародышевой полоски в глубйну желтка, поглощение кислорода равномерно возрастает. В дальнейшем, однако, плавное нарастание газообмена нарушается несколькими подъемами интенсивности дыхания, совпадающими по времени с некоторыми ответственными моментами эмбриогенеза: а) с началом погружения зародышевой полоски в желток, б) с выходом ее на брюшную поверхность яйца, в) с моментом полного поглощения желтка эмбрионом^ [353].
В яйцах клопа Rhodnius prolixus первый максимум интенсивности дыхания достигается на 9-й день развития, когда зародыш погружается в желток и количество митозов резко возрастает. На 10—11-й день дыхание яиц снижается; в этот период происходит окончательное поглощение желтка эмбрионом и количество делящихся клеток уменьшается. На следующем этапе эмбриогенеза начинается новый подъем интенсивности дыхания, продолжающийся до вылупления молодой нимфы [354].
В зимующих яйцах, когда развитие приостанавливается и наступает эмбриональная диапауза, дыхание стабилизируется на минимальном уровне. В диапаузирующих яйцах саранчовых газообмен снижается в 3—4 раза по сравнению с развивающимися яйцами [355, 356]. У сверчка Gryllulus pennsilvanicus при впадении в диапаузу интенсивность дыхания падает в течение нескольких дней, а затем поддерживается на низком стабильном уровне вплоть до возобновления развития после перези-110
мовки. Диапауза яиц является обязательной (облигатной) в цикле развития этого вида и проявляется при любых экологических условиях. Такие же изменения дыхательного обмена характеризуют и факультативную эмбриональную диапаузу, которая вызывается определенными факторами среды (длина дня, температура и влажность).
Рис. 38. Изменения интенсивности дыхания при постэмбрио-нальном развитии клопа Pyrrhocoris apterus. По Слама [358].
Вертикальные стрелки обозначают время линьки. I—V — нимфальные возраста; // — имаго,
Постэмбриональное развитие и метаморфоз сопровождаются закономерными изменениями газообмена. У гемиметабольных насекомых (Hemimetabola), развивающихся с неполным превращением, например у клопов, в ходе постэмбрионального развития отмечаются, во-первых, общее снижение потребления кислорода на единицу веса тела и, во-вторых, периодические колебания интенсивности дыхания в течение каждого ним-фального возраста [260, 357, 358]. Кривая потребления О2 при развитии клопов носит поэтому сложный характер и рисуется в виде серии затухающих осцилляций, максимумы которых приходятся на время линьки (рис. 38). В межлиночный период в каждом возрасте интенсивность дыхания сначала немного возрастает, а затем снижается. Аналогичная картина изменений газообмена при линьке и между линьками наблюдается у саранчи Locusta migratoria [359]. По такому же типу протекает изменение интенсивности дыхания при развитии щетинкохвостки Thermobia domestica на преимагинальных стадиях: потребление О2 снижается к середине каждого межлиночного периода и повышается незадолго до начала линьки [360].
У голометабольных насекомых (Holometabola), развивающихся с полным превращением, на протяжении всего развития личинок, как и у- нимф Hemimetabola, отмечаются общее постепенное снижение интенсивности дыхания и периодические возрастные изменения газообмена (рис. 39). Обычно количество потребляемого кислорода достигает максимума в момент прекращения питания перед линькой [362, 363, 364]. Непосредственно во время линьки интенсивность дыхания снова возрас-
111
тает, причем наблюдаются периодические спады и подъемы на кривой потребления кислорода в период предлиночного «сна» и при сбрасывании экзувиальной шкурки [365].
Рис. 39. Изменения интенсивности дыхания при постэмбриональном развитии Drosophila melanogaster. График построен по данным Ниста [361].
Периоды линек указаны двойными вертикальными линиями.
Когда развитие голометабольных насекомых прерывается личиночной диапаузой, кривая интенсивности дыхания сохраняет форму, свойственную развивающимся личинкам. Общий дыхательный обмен, однако, заметно снижается при диапаузе. Так, например, развивающиеся гусеницы Plodia interpunctella в конце пятого возраста поглощают 4,2 мл кислорода на 1 г веса за 1 ч, а диапаузирующие гусеницы этого же вида — всего лишь 2 мл [366]. У личинок Lucilia при выходе из диапаузы потребление О2 возрастает с 0,34 до 1,1 см3/г-ч [367].
Куколочная стадия метаморфоза характеризуется [7-образной кривой газообмена: максимальное в момент окукления потребление кислорода вначале падает и вновь повышается перед вылетом имаго (рис. 39). Подобные изменения интенсивности дыхания, видимо, свойственны всем типам куколок. Иногда, как, например, у домашних пчел [348] и пилильщиков [368], спад кривой потребления О2 начинается еще в предку-колочный период, в момент, когда личинка прекращает питание, готовясь к линьке на куколку.
Изменения активности некоторых дыхательных ферментов при развитии куколок также имеют [7-образный характер и па-112
Рис. 40. Соотношение изменений газообмена у куколки мухи Calliphora erythrocephala с периодами гистолиза и и гистогенеза тканей. По Агрелю [369, 370].
По оси абсцисс — длительность развития куколки. По оси ординат: 1— поглощение Оа в относительных единицах; 2— количество пикнотических («набухших») ядер; 3 — объем грудных мышц.
раллельны изменениям дыхания целой куколки или гомогенатов ее тканей. Факторы, обусловливающие такие специфические колебания интенсивности общего и промежуточного газообмена в течение куколочного развития, до сих пор окончательно не выяснены. Предполагается, что падение потребления С>2 у куколки совпадает с гистолизом личиночных тканей, а повышение дыхательного обмена — с гистогенезом и с дифференцировкой имагинальных тканей, требующей больших затрат энергии [369]. Несмотря на то, что это очень простое объяснение неоднократно подвергалось критике, оно, по-видимому, в какой-то степени верно. Во всяком случае у куколок мухи Calliphora erythrocephala связь [7-образной кривой газообмена с процессами гистолиза и гистогенеза кажется несомненной (рис. 40).
По-видимому, зависимость интенсивности дыхания от морфогенетических процессов создается гормонами, управляющи-
113
ми куколочным развитием. Этот гормональный механизм регуляции газообмена действует лишь в интактном организме. При вскрытии куколок Bombyx mori или Drosophila melanogaster
Рис. 41. Изменения газообмена при развитии и диапаузе куколок шелкопряда Hyalophora cecropia. По Шнейдерману и Вильямсу [273].
За 0 горизонтальной шкалы принимаются момент окукления и начало развития куколки после диапаузы, а — коконирование; б — окукление; в — начало воздействия реактивирующей низкой температуры (+5°С); г — день переноса реактивированной куколки в высокую температуру (+25°С); д — начало развития реактивированной куколки; е — вылет имаго.
[7-образная кривая поглощения кислорода почти спрямляется вблизи ее самой нижней точки [371]. По всей вероятности, регулирующий механизм включает в себя две группы факторов: 1) факторы, ускоряющие потребление кислорода, действуют во время спада и подъема кривой газообмена; 2) факторы, подавляющие потребление кислорода, обеспечивают стабильность максимального уровня этой кривой.
Если плавный ход метаморфоза насекомых прерывается факультативной или облигатной куколочной диапаузой, то эта остановка развития совпадает по времени с минимальным потреблением кислорода куколкой. Поэтому удиа-паузирующих куколок основание [7-образной кривой газообмена силь
но растягивается, стабилизируясь на весь период диапаузы на постоянном низком уровне. Такая картина, например, наблюдается у американского шелкопряда Hyalophora cecropia [273],
где момент окукления совпадает с периодом резкого снижения интенсивности дыхания, после чего устанавливается постоянный уровень газообмена, доставляющий всего 1,4% от уровня дыхания взрослой гусеницы (рис. 41). У пилильщиков минимальная интенсивность газообмена достигается перед линькой на куколку; именно в этот период, на стадии эонимфы или пронимфы, у них формируется предкуколочная диапауза [372]. Подъем интенсивности дыхания у зимующих куколок или пронимф происходит только после реактивации под действием низких температур, т. е. когда диапауза прекращается и возобновляется метаморфоз.
Повреждение покровов диапаузирующей куколки Н. сесго-
114
pia при проколе или вырезании небольшого участка кутикулы вызывает быстрое повышение потребления О2 до уровня, свойственного развивающимся куколкам [273, 373, 374]. При обширном повреждении интенсивность дыхания максимально увеличивается к 5—6-му дню и только через несколько недель
Рис. 42. Изменения газообмена в течение жизни имаго клопа Pyrrhocoris apterus. По Слама [377].
1— самки; 2— самцы. Кружками на кривой 1 обозначено время откладки яиц.
возвращается к исходному уровню. Поскольку при повреждении покровов у диапаузирующей куколки митозы в эпидермальных клетках не наблюдаются, очевидно, что этот эффект не связан с временным включением процессов метаморфоза. Стимуляция дыхания при повреждении наблюдается и после удаления всей центральной нервной системы; следовательно, этот эффект не связан также с участием нервных механизмов регуляции дыхания.
Установлено, что повышенное потребление кислорода тканями диапаузирующей куколки при повреждении покровов вызывается какими-то местными химическими факторами, которые выделяются в зоне повреждения и разносятся гемолимфой по всему телу насекомого [375]. Эти «факторы повреждения» вырабатываются до тех пор, пока рана остается открытой. У не-диапаузирующих куколок чешуекрылых повышение газообмена при повреждении покровов не наблюдается [374, 376].
У имаго процессы развития, которые существенно отражаются на общем дыхательном обмене, связаны с созреванием яичников и яйцеклеток. Поэтому у самцов наблюдается лишь постепенное снижение интенсивности дыхания по мере старения насекомых, но у самок отмечаются периодические изменения газообмена, протекающие синхронно с откладкой яиц (рис. 42). Так, у самок клопа-солдатика Pyrrhocoris apterus при созревании яиц в яичниках интенсивность дыхания повы
115
шается, а затем снижается за 1—2 дня до яйцекладки [377].
После откладки первой порции яиц этот цикл повторяется несколько раз. У мухи це-це Glossina palpalis, отрож-
Рис. 43. Сравнение интенсивности дыхания жуков-листоедов при различных типах имагиналыюй диапаузы и при активном состоянии. По данным Марцуша [327], Люмана
и Дреса [326].
1— активный период; 2— зимняя диа-
пауза; 3— летняя диапауза, а — Metasoma populi; б — Chrysomela haemoptera; в—Galeruca tanaceti-, г — Phytodecta ru-fipes. Температура 25°C.
дающей живых личинок, потребление О2 вначале постепенно возрастает, но перед самым отрождением личинок резко уменьшается [378]. Увеличение газообмена перед периодом размножения у самок отражает метаболическую переработку пищевых резервов при развитии яйцеклеток. Несомненно, эти процессы требуют определенных затрат энергии.
Во время имагинальноа диапаузы, когда развитие яичников тормозится из-за отсутствия в крови гормона прилежащих тел (corpora allata), интенсивность дыхания насекомых 7 заметно снижается.
Имагинальная диапауза может возникать как в летнее, так и в зимнее время, и в обоих случаях отмечается приблизительно одинаковое снижение газообмена (рис. 43). В условиях «экспериментальной диапаузы», вызванной удалением прилежащих тел
у нормальных недиапаузирующих самок, удается получить столь же резкое падение потребления кислорода [379]. Обратный эффект повышения интенсивности дыхания у диапаузи-рующих самок получается при имплантации «активных» прилежащих тел, взятых от яйцекладущих самок [380, 381]. Подобное влияние гормона corpora allata на дыхательный обмен проявляется только у самок. Потребление кислорода самцами клопа-солдатика не снижается в отсутствии этого гормона, причем интенсивность дыхания у самцов приблизительно такая же, как и у диапаузирующих или лишенных прилежащих тел самок этого же вида [382].
§ 5. Освобождение энергии при промежуточном дыхательном обмене
Источники энергии, их распад и окисление. У всех животных источниками энергии служат углеводы, жиры и белки, поступающие в организм в составе пищи или ранее запасенные
116
в качестве резервных питательных веществ. Процесс освобождения энергии, заключенной в химических связях этих соединений, составляет сущность энергетического обмена: Органические вещества, поставляющие энергию, называются энергетическими субстратами.
Существует два основных пути освобождения энергии в организме животного: 1) анаэробный распад углеводов —гликолиз и 2) аэробное окисление углеводов, белков и жиров — окислительное фосфорилирование. В обоих' случаях происходит окисление энергетического субстрата АН2 с отщеплением водорода и с переносом его на акцептор В:
AH2 + teA+£H2.
Ферменты, которые осуществляют эту реакцию называются дегидрогеназами.
При окислительном фосфорилировании акцептором водорода является молекулярный кислород, поглощаемый при дыхании и активируемый другими ферментами — оксидазами. Поэтому цикл реакций окислительного фосфорилирования может рассматриваться как промежуточный дыхательный обмен, а дегидрогеназы и оксидазы, осуществляющие эти обменные процессы, служат дыхательными ферментами. При гликолизе акцепторами водорода являются различные вещества, кроме молекулярного кислорода.
И при гликолизе, и при окислительном фосфорилировании энергия, высвобождаемая при распаде и окислении субстрата, запасается главным образом в макроэргических ^связях аденозинтрифосфата. Помимо АТФ для запасания энергии дыхания и гликолиза могут служить другие макроэргические соединения, например аргининфосфат или ацетилкоэнзим А. Однако безусловно важнейшим и наиболее лабильным переносчиком энергии в организме любого животного является АТФ. Энергия, заключенная в этом соединении, используется в дальнейшем в процессах биосинтеза, для выполнения механической работы, в процессах накопления веществ и при их активном переносе против градиента концентрации, в процессах проведения нервного импульса и биолюминесценции.
Углеводы могут подвергаться анаэробному распаду при гликолизе, а в присутствии кислорода они служат энергетическими, субстратами окислительного фосфорилирования.
При анаэробном распаде углеводов у позвоночных конечным продуктом является молочная кислота. Суммарная реакция этого превращения глюкозы в молочную кислоту выражается простым уравнением:
С6Н12О6—2СН3-СНОН-СООН.
Однако на самом деле этот процесс протекает гораздо сложнее и включает в себя 12 промежуточных стадий, известных под
117
названием «путь Эмбдена — Мейергофа». В ходе реакций на этом пути затрачиваются две молекулы АТФ и вновь образуются 4 молекулы.
При анаэробном распаде углеводов у насекомых могут накапливаться различные соединения. В прыгательных мышцах саранчового Melanoplus и кузнечика Tachycines, в мышцах ног водяного клопа Belostoma или в гомогенатах, полученных из целых личинок двукрылых, основным продуктом процессов гликолиза является молочная кислота. В этом случае ткани и клетки содержат высокоактивную дегидрогеназу молочной кислоты (лактикодегидрогеназу).
Однако в крыловых мышцах многих насекомых и в мышцах йог перепончатокрылых и тараканов при гликолизе образуются примерно в одинаковых количествах пировиноградная кислота и. а-глицерофосфат, а сама мышечная ткань характеризуется
Таблица 3
Сравнение активности ферментов (в относительных единицах на 1 г веса ткани) в различных тканях имаго
Periplaneta americana. По данным Чефурка [386]
Органы и ткани Дегидрогеназа а-глицерофосфата Дегидрогеназа молочной кислоты
Грудная мускулатура 4824 21
Ножные мышцы 3206 10
Средняя кишка 144 2500
Передняя кишка ; 462 91
Задняя кишка 214 93
Жировое тело 292 20
Придаточные железы ....... 148 8
Нервная цепочка 68 56
высокой активностью соответствующего фермента — дегидрогеназы а-глицерофосфата и низкой активностью дегидрогеназы молочной кислоты (табл. 3). Кроме того, отмечено, что у мух Musca doinestica в условиях аноксии происходит быстрое накопление глицерофосфатных соединений, а молочная кислота не образуется [383]. У паутинных клещей Tetranychus telarius основными продуктами гликолиза также является «-глицерофосфат и пировиноградная кислота, активность дегидрогеназы а-глицерофосфата очень высокая, а дегидрогеназа молочной кислоты, наоборот, имеет крайне низкую активность [384].
Как правило, у хорошо летающих насекомых активность дегидрогеназы а-глицерофосфата в крыловых мышцах на порядок выше, чем в мышцах ног. Иная картина наблюдается у насекомых, не способных к полету; в этом случае активность фермента ниже в тергостернальной мускулатуре груди и выше в мышцах, обслуживающих ноги [385].
Следовательно, у насекомых существуют три основных пути
118
реакций гликолиза, которые приводят к разным* конечным: продуктам:
С(;Н12О(;
-----^СН2ОРОз-СНОН-СООН а-глицерофосфат
------>СН3-СО-СООН Л Пировиноградная кислота
^СНз—СНОН-СООН Молочная кислота
Образование пировиноградной кислоты из глюкозы идет по> типичному пути Эмбдена — Мейергофа, так как она легко переходит в молочную кислоту под действием специфической дегидрогеназы. Но образование а-глицерофосфата только до определенной стадии идет по схеме Эмбдена — Мейергофа, а в дальнейшем оба главных пути гликолиза (глицерофосфатный и пировиноградно-молочнокислый) расходятся, что и приводит к различиям в конечных продуктах анаэробного распада углеводов в организме насекомых (рис. 44).
Специфическими ингибиторами а-глицерофосфатного пути гликолиза у насекомых являются некоторые производные коричной кислоты СбНб—СН=СН — СООН [387]. Вместе с тем эти вещества не являются токсичными и не влияют на процессы аэробного окисления энергетических субстратов.
В тканях и клетках насекомых имеются два типа дегидрогеназ а-глицерофосфата: 1) цитоплазматическая дегидрогеназа, связанная с НАД-ферментом1, и 2) митохондриальная дегидрогеназа, связанная с цитохромами. Образующийся в цитоплазме а-глицерофосфат легко диффундирует внутрь митохондрий, где он окисляется до дигидроксиацетопфосфата под действием мощной флавопротеидпой дегидрогеназы, связанной с молекулярным кислородом через цитохромы. Дегидроксиацетонфосфат диффундирует обратно в цитоплазму, отнимает водород от НАД-Н2 и переводит этот кофермент в окисленную форму НАД. В результате присоединения водорода, взятого от НАД-Н2 дигидроксиацетонфосфат вновь превращается в а-гли-Церофосфат, способный проникать внутрь митохондрий. Сам фермент НАД не в состоянии пройти из цитоплазмы через оболочку митохондрии [388]. Следовательно, а-глицерофосфат с его двумя дегидрогеназами обеспечивает связь гликолиза с процессами окислительного фосфорилирования.
В отличие от анаэробных процессов гликолиза, которые протекают в цитоплазме, основные аэробные процессы окислитель
1 Цитоплазматическая (внемитохондриальная) дегидрогеназа а-глицерофосфата выделена в очищенной кристаллической форме из грудного отдела пчелы Apis mellifera [390]. Установлен аминокислотный состав этого фермента [391].
119-
ного фосфорилирования сосредоточены в митохондриях. Митохондрии, следовательно являются энергетическими резервуарами живых клеток. В мышцах насекомых эти образования раньше. были известны как саркосомы, пока Ватанабе и Вильямс [389] не доказали их идентичность митохондриям позвоночных.
Гликоген
Глюкоза
Фруктозо-1,6-
-дифосфат
3 -фосфоглицерино- Дигидрокии-Молочная выи альдегид ацетонфосфат
кислота
2~ фосфоглицери - а -глицеро -
нобая кислота фосфат
<------НПД -н2
Пировиноградная кислота
Рис. 44. Схема основных этапов гликолиза у насекомых.
Аэробный распад (окисление) углеводов так же, как и гликолиз, начинается с гексокиназной реакции, продуктом которой является глюкозо-6-фосфат. Это соединение, с одной стороны, открывает путь к дальнейшим превращениям в ходе гликолиза, а с другой стороны, оно служит первым этапом на пути окисления углеводов. Последнее в организме насекомых протекает либо в пентозном цикле, либо в цикле трикарбоновых кислот.
При пентозном (пентозофосфатном) цикле в качестве промежуточных продуктов окислительных процессов образуются фосфорилированные пентозы, например рибозофосфат, ксилозофосфат и др. В результате этих реакций из 1 молекулы гексозы получается 3 молекулы углекислоты и 1 молекула триозы.
Реакции пентозного цикла широко распространены в классе насекомых, но, вероятно, основное значение его заключается не в освобождении энергии, а в синтезе пентоз, которые входят в состав таких важных соединений, как нуклеотиды и нуклеиновые кислоты. Действительно, на примере Periplaneta ameri-сапа показано, что энергетическое значение пентозного цикла невелико и что в нем используется только 4—9% глюкозы, содержащейся в пище [392]. Основная масса углеводов подвергается распаду в процессе гликолиза или окисляется в цикле трикарбоновых кислот.
Установлено также, что активность дегидрогеназы глюкозо-6-фосфата (т. е. фермента, с которого начинается пентозный
120
цикл окисления углеводов) крайне низка в мышцах саранчовых и клопов [393, 394].
У насекомых обнаружены почти все ферменты, осуществляющие реакции пентозного цикла. В ряде случаев установлены их оптимумы pH, субстратная специфичность, изучено активирующее действие ионов двухвалентных металлов. Все эти ферменты не связаны с митохондриями; они находятся в плазме клеток, т. е. там же, где протекают и процессы гликолиза.
Цикл трикарбоновых кислот, широко известный в биохимии под названием цикла Кребса или цикла лимонной кислоты, начинается с продуктов превращения пировиноградной кислоты, а до этой стадии процесс распада углеводов идет так же, как и при гликолизе. Включение пировиноградной кислоты в цикл трикарбоновых кислот происходит двумя путями:
1) через образование щавелевоуксусной кислоты при участии, специфической карбоксилазы:
СНзСОСООН - +с°2 ноос-сн2-со-соон.
Пировиноградная Щавелевоуксусная
кислота кислота
Продукт реакции непосредственно вступает в цикл Кребса (рис. 45). У насекомых этот путь, видимо, имеет ограниченное значение. Он доказан только для грудных мышц мухи це-це Glossina palpalis, где обнаружен активный фермент, осуществляющий декарбоксилирование щавелевоуксусной кислоты [395]. В других тканях той же мухи и у других насекомых активность, этого фермента очень низкая;
2) через образование промежуточного соединения — ацетил-коэнзима А (ацетил-КоА):
СНзСОСООН + КоА—>СН3СОКоА.
Пировиноградная Ацетилкоэн-
кислота зим А
Продукт реакции, представляющий собой соединение активного двууглеродного фрагмента «ацетата» (СН3СО_) и коэнзима А, вступает в цикл Кребса (см. рис. 45).
Эта реакция обусловливается сразу несколькими ферментами. Она протекает при участии декарбоксилазы, катализирующей удаление СО2, и дегидрогеназы, катализирующей отнятие водорода, в присутствии пирофосфатного эфира витамина тиамина и никотинамидного фермента НАД, который, присоединяя водород, переходит в восстановленную форму НАД-Н2. В данном случае никотинамидный фермент выполняет функцию акцептора водорода.
12Г
Большая часть углеводов
Некоторые жирные кислоты
--------Некоторые аминокислоты
CH3CO-SKOA------.
\цетилкоэнзим А
COOH-CHf-CO-COOH-
Щавелевоуксусная кислота
I Г~2Й]
:оон- сн2—снон—соон
^Блочная кислота
соон-сн=сн соон
Фумаровая кислота.
Р2Н~]
соон-сн2-сн2
янтарная кислота
СООН
+Н2О
+Н2О
-со2
Г^П
соон
со он-сн2-сон-снгсоон
Лимонная кислота,
|-н2о|
соон
соон-сн=с—сн2-соон
Цис - аконитовая кислота
ЕЩо] соон
соон -снон-сн-сн2-соон
Изолимонная кислота,
соон
соон -со-сн-сн2-соон
щавелевоянтарная кислота,
—соон-со-сн2- снгсоон
<х Кетоглутаробая кислота
Рис. 45. Цикл трикарбоновых кислот.
Вовлечение продуктов гликолиза в окислительное фосфорилирование происходит в основном по пути образования ацетил-коэнзима А. В связи с этим в различных тканях насекомых отмечается высокая активность соответствующих ферментов. Среди них особенно большое значение имеют КоА и «пиридиновые ферменты», у которых в качестве активной группы или кофермента выступают НАД и НАДФ.
Пировиноградная кислота, вступающая в цикл Кребса через образование ацетилкоэнзима А, в дальнейшем претерпевает целый ряд превращений (см. рис. 45). Эти превращения начинаются с конденсации ацетатной группы с щавелевоуксусной кислотой с образованием лимонной кислоты. Затем лимонная кислота последовательно превращается в цис-аконитовую, изоли-монную, щавелевоянтарную, а-кетоглутаровую, янтарную -фумаровую и яблочную кислоты. Окончательным продуктом этих реакций является щавелевоуксусная кислота, которая
-122
вновь соединяется с ацетатом, взятым от ацетилкоэнзима А, давая лимонную кислоту.
Цикл Кребса имеет универсальное значение для освобождения энергии при окислении углеводов, а также некоторых жиров и аминокислот. В результате реакций этого цикла возникает 15 макроэргических фосфатных связей, включая 3 молекулы АТФ, образованные при окислительном карбоксилировании пировиноградной кислоты до ацетил-КоА. Но так как одна молекула глюкозы в процессе гликолиза дает две молекулы пировиноградной кислоты, то, очевидно, полный цикл Кребса при окислении одной гексозной молекулы приводит к синтезу 30 молекул АТФ. К этим 30 молекулам следует добавить 2 молекулы, образующихся при гликолизе, и 6 молекул, синтезированных при переносе водорода, отщепленного от энергетических субстратов, на молекулярный кислород. Таким образом, в процессе аэробного распада одной молекулы глюкозы образуется 38 макроэргических фосфатных связей,, тогда как при анаэробных реакциях гликолиза их возникает только 2. Сопоставление этих цифр показывает, насколько высока энергетическая эффективность промежуточного дыхательного обмена, сопряженного с окислительным фосфорилированием.
У насекомых реакции цикла Кребса изучаются начиная с конца 40-х годов, когда Баррон и Тамисиэн [396] обнаружили, что при поглощении О2 гомогенатами мышц Р. americana в них образуются лимонная, а-кетоглутаровая, янтарная и яблочная кислоты. В дальнейшем в экспериментах на мухах, тараканах, пчелах и саранчовых было установлено, что в мышечных тканях насекомых осуществляются все превращения цикла Кребса [386, 397, 398, 399, 400, 401], а ферменты, катализирующие эти реакции, локализованы в митохондриях [389, 398]. Иногда эти ферменты характеризуются очень высокой активностью. Так, «конденсирующий фермент», осуществляющий соединение ацетатной группы с щавелевоуксусной кислотой,, в грудной мускулатуре тараканов во много раз более активен, чем в скелетных мышцах голубя или крысы [402]. Продукт данной реакции — лимонная кислота —в тканях насекомых накапливается в значительных количествах, достигающих 5 мк моль на 1 г сырого веса [403, 404]. В то же время содержание других три- и дикарбоновых кислот, образующихся в цикле Кребса, у насекомых незначительно.
Углеводы служат основными источниками энергии во многих клетках и тканях насекомых. Второе по значению место среди энергетических субстратов у этих животных принадлежит жирным кислотам, которые образуются из жиров при действии специальных ферментов — липаз. Процессы окислительного фосфорилирования жирных кислот протекают исключительно в митохондриях.
123
У позвоночных окисление жирных кислот начинается с их активации коэнзимом А при участии АТФ:
R-CH2-CH2-COOH+KoASH+ATO—>
—>R-CH2-CH2-CO — SKoA + АМФ + неорг. фосфат.
Затем в результате ряда сложных реакций происходит постепенное отщепление двууглеродных фрагментов от активированного субстрата вплоть до образования ацетилкоэнзима А, вступающего в цикл Кребса.
У насекомых механизм окисления жирных кислот изучен недостаточно, хотя, по всей вероятности, у них протекают аналогичные процессы постепенного распада углеродной цепочки в присутствии КоА и АТФ [386]. Конечная реакция на этом пути осуществляется ферментом р-кетоацетилтиолазой, который был подробно изучен в митохондриальной фракции крыловых мышц саранчи Locusta migratoria [402]. Высокая активность тиолазы указывает на важное энергетическое окисление жирных кислот в грудной мускулатуре насекомых.
Кроме углеводов и жирных кислот источниками энергии могут служить аминокислоты. Окисление аминокислот осуществляется специфическими дегидрогеназами и оксидазами при участии ферментов — трансаминаз, переносящих аминогруппы.
В качестве примера рассмотрим процесс окисления глутаминовой кислоты, содержащейся в гемолимфе насекомых. Под влиянием дегидрогеназы эта аминокислота теряет водород, превращаясь в а-кетоглутаровую кислоту [398, 405]. Акцептором водорода в данной реакции является пиридиновый фермент с активной группой НАД:
NH2
соон-сн2—ch2-ch-cooh+had + н2о--
Глутаминовая кислота
—>СООН-СН2-СН2-СО-СООН + HAD • Н2 + NH3. (I) а-кетоглутаровая кислота Аммиак
Образующаяся" а-кетоглутаровая кислота подвергается дальнейшему окислению и декарбоксилированию в цикле Кребса (см. рис. 45).
Другой продукт реакции — аммиак — не остается в свободном состоянии, а вступает в связь с пировиноградной кислотой, выделяющейся при гликолизе:
‘ 124
СНз-СО-СООН + NH3 + HAD • H2—> Пировиноградная кислота
NH2
I
— CH3-CH-COOH+HAD+H2O. (II)
Аланин
Объединяя реакции (I) и (II), получаем суммарное уравнение:
Глутаминовая Пировиноградная___^а-кетоглутаро- дланин
кислота кислота вая кислота
Перенос аминогруппы с глутаминовой кислоты на пировиноградную осуществляется специальной трансаминазой, которая была обнаружена у нескольких видов насекомых.
Таким образом, трансаминирование глутаминовой кислоты должно приводить к накоплению аланина. Но так как сама глутаминовая кислота возникает при окислении ароматической аминокислоты пролина специфическими оксидазами [406], то, очевидно, именно пролин может служить первоначальным субстратом описанных выше химических превращений. Действительно, у мухи це-це Glossina palpalis [407] и у саранчи Locus-ta migratoria [408] во время полета наблюдается снижение содержания пролина и количественное замещение его аланином при небольшом увеличении концентрации а-кетоглутаровой кислоты. Предполагаемая схема этих реакций показана на рис. 46.
Рассматривая в целом процессы окисления энергетических субстратов, нетрудно заметить, что во всех описанных выше реакциях распад углеводов, жировых соединений и аминокислот завершается их вступлением в цикл Кребса. Следовательно, в цикле Кребса перекрещиваются основные пути обмена всех питательных веществ. Эти пути могут иметь большое значение как для процессов освобождения энергии, так и для биосинтеза органических соединений.
В энергетическом отношении особенно важно подчеркнуть, что процессы распада питательных веществ сопровождаются отщеплением от субстратов атомов водорода. Перенос этих атомов к кислороду происходит в цепи дыхательных ферментов конечного окисления, которые освобождают дополнительные порции энергии, аккумулируемой в АТФ.
Регуляция энергетического обмена. Интенсивность энергетического обмена в конечном счете определяется скоростью протекания реакций гликолиза и окислительного фосфорилирования. В свою очередь скорость любой ферментативной реакции
125
ция неорганического фосфора кана Periplaneta americana в
пролин
Рис. 46. Предполагаемая ческого обмена пролина, кислоты, а-кетоглутаровой кислоты и аланина во время полета мухи це-це Glossi-na palpalis. По Бурселю [407].
зависит от концентрации реагирующих веществ, присутствия некоторых минеральных ионов, оказывающих специфическое влияние на ферменты, и от содержания самих ферментов.
Одним из .важнейших факторов, регулирующих скорость гликолиза в мышечных волокнах насекомых, является концентра-В грудных мышцах тара-ере из чистого азота происходит интенсивный распад аргининфосфата и АТФ, сопровождающийся синтезом эквивалентных количеств a-глицерофосфата [409]. При этом содержание РР остается постоянным. В атмосфере с кислородом происходит быстрый ресинтез макроэргических фосфорных связей с использованием РР, содержание которого быстро падает. Если в момент наименьшей концентрации этого элемента тараканы вновь переносятся в азот, скорость гликолиза оказывается замедленной до тех пор, пока не восстановится исходное высокое содержание РР, после чего аргининфосфат и АТФ расходуются только на синтез «-глицерофосфата. Таким образом, можно считать, что низкая концентрация неорганических .фосфорных соединений действительно ограничивает скорость гликолиза.
При аэробном окислении углеводов, жирных
кислот и аминокислот в митохондриях скорость энергетического обмена не регулируется фосфорными соединениями. Поэтому добавление неорганического фосфора или АДФ к изолированным митохондриям насекомых не влияет на поглощение ими кислорода и не изменяет скорость окислительно-восстановительных реакций [410, 411, 412].
схема энергети-глутаминовой
126
Ферменты, содержащиеся в митохондриях, могут стимулироваться «извне», со стороны цитоплазматических фракций. В грудной мускулатуре мух эффект этих фракций проявляется в увеличении интенсивности промежуточного газообмена в 10— 20 раз [413]. По-видимому, стимулирующее влияние на митохондрии оказывают а-глицерофосфат и пировиноградная кислота, непрерывно образующиеся в цитоплазме в ходе гликолиза [414]. В то же время три- и дикарбоновые кислоты цикла Кребса или НАДН2 не изменяют скорость окислительного фосфорилирования, что может быть связано с непроницаемостью митохондриальных мембран для этих веществ.
Тип клеток, стадия развития и условия питания насекомых сильно отражаются на процессах освобождения энергии при аэробном дыхательном обмене. В митохондриях, выделенных из крыловых мышц, окисление энергетических субстратов протекает быстрее, чем в митохондриальной фракции мускулатуры, обслуживающей ноги. При этом систематическое положение насекомого не имеет существенного значения, и в изолированных митохондриях, взятых из грудных мышц таракана* Peripla-neta или мухи Musca, окислительное фосфорилирование идет почти с одинаковой скоростью [415].
Заметное усиление окислительных процессов в митохондриальной фракции отмечается в период дифференцировки имаги-нальных тканей у куколок, при выходе из диапаузы и по мере созревания гонад у имаго. Во всех этих случаях может наблюдаться не только количественное, но и качественное изменение в ходе энергетического обмена. Так, у американского шелкопряда Hyalophora cecropia на ранних этапах развития пост-диапаузной куколки окисление а-глицерофосфата и пировиноградной кислоты происходит вдвое быстрее, чем окисление янтарной кислоты [416]. Однако на более поздних этапах, незадолго до вылета бабочек, энергетические механизмы переключаются на преимущественное использование янтарной кислоты.
Дыхательные ферменты конечного окисления. При аэробном распаде энергетического субстрата происходит отщепление от него атомов водорода. Соединяясь с молекулярным кислородом/ эти атомы образуют воду, которая наряду с СО2 является основным продуктом газообмена. С химической точки зрения подобное образование воды представляет собой ферментативный окислительно-восстановительный процесс. Но поскольку всякое окисление субстрата ведет к потере им электрона, а всякое восстановление — к приобретению электрона, то можно говорить, что в этом процессе имеет место не перенос водорода, а транспортирование электронов.
Перенос электронов от субстрата или от восстановленного пиридинового кофермента НАД*Н2 на О2 обычно осуществляется каким-либо флавопротеином, коэнзимом Q и цитохромами.
127
Флавопротеины (флавопротеидные дегидрогеназы; ФП) представляют собой естественную группу дыхательных ферментов, способных переносить электроны на цитохромы.
Любой флавопротеиновый фермент обладает строгой специфичностью и может отщеплять водород только от определенного субстрата. В ряду этих ферментов у насекомых наибольшей известностью пользуется сукциндегидрогеназа, которая берет водород от янтарной кислоты и переносит два электрона через коэнзим Q к первому цитохромному ферменту:
СООН СООН
сн2 сн
| +ФП—> II +ФП-Н2
сн2 сн
I I
соон соон
Янтарная Фумаровая
кислота кислота
ФП-Н2 + KoQ + Окисленный—^ФП + KoQ4~ Восстановленный цитохром цитохром.
Подобное окисление янтарной кислоты в фумаровую происходит на одном из этапов цикла Кребса (см. рис. 45). Но, кроме самой янтарной кислоты, сукциндегидрогеназа может отщеплять водород от любого сложного органического соединения, в которое входит группировка СОО~—СН2—СН2—СОО~.
У насекомых этот фермент распространен довольно широко. Во многих случаях он имеет значение основного флавопротеина, осуществляющего связь окисляемого субстрата с цитохромами, а через них — с кислородом воздуха. У Periplaneta ame: ricana обладающая высокой активностью сукциндегидрогеназа обнаружена во всех исследованных органах: в жировом теле, в мышцах, в кишечнике, в мальпигиевых сосудах, в мозге и в нервной цепочке [417].
Другая группа флавопротеиновых ферментов представлена оксидазой НАД-Н2, переносящей электроны от пиридиновых коферментов к цитохромам. Эта ферментная система изучалась в митохондриях крыловых мышц мухи Musca domestica [418], в митрхондриях и микросомах различных тканей шелкопряда Hyalophora cecropia [419], однако отдельные ее компоненты не были изолированы.
Оксидаза а-глицерофосфата также принадлежит к числу флавопротеинов. Этот фермент, подробно изученный в крыловых мышцах насекомых, играет роль посредника, связывающего анаэробный распад углеводов в цитоплазме с процессом аэробного окислительного фосфорилирования в митохондриях.
128
Благодаря этому ферменту конечный продукт гликолиза а-глицерофосфат вовлекается в цитохромную систему транспортирования электронов.
Одним из важных промежуточных веществ на пути от флавопротеинов к цитохромам является коэнзим Q, или убихинон. Это соединение относится к хинонам и имеет следующую структурную формулу:
сн2)пн
где п изменяется от 6 до 10. У насекомых значение п равно 9 или 10 [420]. Участие коэнзима Q в процессах окислительного фосфорилирования было доказано только недавно. Оно обеспечивает ступенчатое окисление энергетического субстрата и облегчает передачу электронов на цитохромную систему.
Цитохромы служат переносчиками электронов от коэнзима Q до молекулярного кислорода. Эти ферменты впервые были обнаружены Кейлином [421] в грудных мышцах пчел и бабочек, причем вначале предполагалось, что существует только три разных цитохрома. Они были обозначены первыми буквами латинского алфавита — а, b и с. Впоследствии были обнаружены другие цитохромы, и в настоящее время известно более 10 дыхательных ферментов этого ряда.
Все цитохромы являются внутриклеточными пигментами и отличаются друг от друга по спектрам поглощения видимого света. Для основных цитохромов, участвующих в транспортировании электронов у насекомых, установлены следующие максимумы поглощения (нм):
цитохром а3 445—510 цитохром а 605—630 цитохром с 540—551
цитохром 551 540—551 цитохром b 564—575 цитохром Ьъ 550—600
Цитохромы с и 551 имеют одинаковые спектры поглощения, но это разные ферменты. Цитохром Ь5, найденный Шапирио и Вильямсом [419] в некоторых тканях шелкопряда Hyalopho-ra cecropia в отличие от остальных цитохромов, расположен не в митохондриях, а в микросомах. Недавно в митохондриях личинки Drosophila melanogaster обнаружен новый цитохром Ci с максимумом поглощения в области 555 нм; его функции и положение в дыхательной цепи не выяснены [422].
Каждый цитохром представляет собой соединение активной простетической группы (гема) и белкового носителя этой группы. Центральное место в простетической группе занимает атом
5 198
129
железа, способный к обратимому изменению валентности при окислении или восстановлении. Белковый компонент цитохромов формируется из длинного ряда аминокислотных остатков. Первичная структура белкового компонента, которая определяется расположением этих остатков, полностью расшифрована для цитохрома с, выделенного из крыловых мышц айлан-тового шелкопряда Philosamia cynthia [423]. Белок имеет
H2NZ>7^ — Вал — Про - Ала - Гли — Асп~№ —Ала — Глу -
Асп-Ы — Гли — Лиз — Лиз — Иле —Фен — Вал —Глц— 10 3
Арг - Цис — Ала - — Цис —Гис — Тре — Вал —
I----Гем----____________I
Гли — Ала — Гли — Гли — Лиз — Гис — Лиз — Вал — Гли — d 30
Про — Асп-^ — Леи — Гис — Гли — Фен — Тир - Гли -4/7
Арг — Лиз — тре — Гли — Глу- N — Ала — Про — Гли —
Фен — Сер — Тир - Сер — Асп-ТЯ — Али — Асп—Ы -Лиз-
50
Ала — Лиз — Гли — Иле — Тре — Три — Гли — Асп — Асп — 60
Тре — Леи — Фен — Глу — Тир — Леи — Глу — Асп-^Ь — 70
Про — Лиз - Лиз — Тир - Иле - Про —Гли - Тре —Лиз — 80
Мет — Вал — Фен - Ала —Гли — Леи —Лиз - ? — Лиз — 90
Ала — ' — Гли — Арг — Али — Асп — Леи — Иле-Али —
100
Тир —Лей — Лиз - Глу — Сер —Тре —Лиз СООН
Рис. 47. Первичная структура белкового компонента цитохрома с, экстрагированного из крыловых мышц айлантового шелкопряда Philosamia cynthia.
По Чану и Марголишу [423].
Обозначения аминокислотных остатков: Ала — аланил; Арг — аргинил; Асп — аспартил; Acn-N — аспаргинил; Вал — валил; Гис — гистидил; Гли — глицил; Глу — глутамил; Глу-N — глутаминил; Иле — изолейцил; Лей — лейцил; Лиз — лизил; Мет — метионил; Про — пролил; Сер — серил; Тир — тирозил; Тре — треонил; Три — триптофенил; Фен —. фенилаланнл; Цис — цистинил; ? — остаток неидентифицированной аминокислоты. Цифрами обозначены порядковые номера аминокислотных остатков.
молекулярный вес 12500 и составляется из 108 остатков аминокислот (рис. 47). Простетическая группа присоединяется к нему в положении между 18-м и 21-м остатками цистина.
Карлсон и Бросемер [424] определили аминокислотный состав белкового компонента цитохрома с, выделенного из медоносной пчелы Apis mellifera, шмеля Bombus nevadensis, пчелы-листогрыза Megachile rotundata и осы Vespula vulgaris. Оказалось, что степень сходства в аминокислотном составе белка
130
в основном соответствует филогенетическому родству видов, но в родословной медоносной пчелы цитохром с эволюционировал значительно быстрее, чем в родословной других перепончатокрылых.
У всех остальных цитохромных ферментов первичная структура белкового носителя изучена недостаточно, однако установлено, что у цитохрома b его молекулярный вес равен 23 000, т. е. почти вдвое больше, чем у цитохрома с [425].
Перенос электронов по цитохромной цепи обусловливается изменениями валентности атомов железа в простетической группе: окисленное двухвалентное железо (Fe2+), приобретая электрон, превращается в восстановленное трехвалентное (Fe3+), но затем, вновь утрачивая электрон, становится двухвалентным. Соответственно окисленный феррицитохром переходит в восстановленный ферроцитохром, а потом опять окисляется. Спектры поглощения обеих форм цитохромов заметно различаются, что позволяет следить за их состоянием в клетке при помощи оптических методов. Известно, что Кейлин [421] наблюдал окисление и восстановление цитохромных ферментов в крыловой мускулатуре бабочек Galleria без вскрытия, непосредственно через прозрачную кутикулу груди.
Как правило, цитохромы не могут окисляться кислородом воздуха. Исключение из этого правила составляют цитохром b с его ограниченной способностью к автоокислению и цитохром функционирующий в качестве основного переносчика электронов в тканях диапаузирующих яиц и куколок. Обычно цитохромы образуют цепь последовательно расположенных ферментов, в которой каждый компонент восстанавливается, присоединяя электрон, взятый, от предыдущего компонента. Эта цепь начинается с флавопротеинов и заканчивается специальным, содержащим медь ферментом — цитохромоксидазой1.
Первым в ряду цитохромных ферментов является цитохром &; от него электрон принимается цитохромом 551 и передается на цитохром с. Совокупность цитохромов а и а3, называемая цитохром-с-оксидазой, передает электрон на цитохромоксидазу, связанную с молекулярным кислородом (рис. 48). Цитохром Ь6 образует боковое ответвление в этой цепи дыхательных ферментов; его связь с другими цитохромами и с коэнзимом Q еще не выяснена.
Конечное окисление субстрата протекает сопряженно с освобождением энергии и ее запасанием в АТФ. Установлено, что при транспортировании одной пары электронов по цепи дыхательных ферментов процесс фосфорилирования повторяется три раза. Первое фосфорилирование происходит на участке между флавопротеином и коэнзимом Q, второе — между цитохромами b и/, а третье—где-то на участке между цитохромом с и мо-
1 Иногда цитохромоксидазой называют всю цепочку дыхательных ферментов, окисляемую молекулярным кислородом.
131
лекулярным кислородом. Во всех этих пунктах АДФ, получая определенную порцию свободной энергии, принимает неорганический фосфор и превращается в АТФ. Следовательно, в течение одного цикла в цепи переносчиков электронов синтезируется 3 макроэргических связи. В пересчете на 1 молекулу глюкозы это дает 6 синтезированных молекул АТФ.
При использовании специальных разобщающих ядов можно предотвратить этот процесс запасания энергии в АТФ, не затрагивая основной дыхательной цепи. Одним из таких ядов ется 2,4-динитрофенол (ДНФ).
он
явля-
? |p~NO2
no2
который разобщает дыхание от фосфорилирования в хондриях насекомых. Показано, что добавление ДНФ к тельной среде дрозофил сильно задерживает рост личинок и уменьшает количество усваиваемого фосфора, вносимого в среду в составе неорганических и органических соединений :[42б].
мито-пита-
Как наиболее важные ингибиторы самой дыхательной , цепи заслуживают упоминания окись углерода (СО) и цианистые соединения (например, цианистый калий KCN). Эти яды приостанавливают окисление цитохром-с-оксидазы, переводя цитохромы а и а3 в восстановленную форму (см. рис. 48). При куколочной и эмбриональной диапаузе, когда промежуточный дыхательный обмен в основном осуществляется через цитохром &5, чувствительность тканей к СО и KCN резко снижается (см. с. 133).
Один из антибиотиков — анти-мицин А, также является специфическим ингибитором цитохромных ферментов. Он нарушает цепь транспортирования электронов на участке между цитохромами b и 551 (см. рис. 48).
дыхательных ферментов при метаморфозе и диапаузе. При метаморфозе^ голометабольных насеко-
-цитоплазма--------
Оксидаза.
ы-глицеро-фосфата, 9П2>
Оксидаза
НАДН2 —
Сукцин-оегидрог&.
наза
ФП5
WIL-----
/ ! СО— [-KCN
цитохром-оксидаза,
9
5 9
Микросомы
Рис, 48. Схема переноса электронов по цепи дыхательных ферментов.
Пунктир,—участки цепи, блокируемые ингибиторами промежуточного дыхательного обмена (антимицином А, окисью углерода и цианистым калием). Вопросительными знаками обозначены гипотетические пути переноса электронов. ФП — флавопротеины; Ко Q — коэнзим Q;
Ь, 551, с, (а+а3) и Ь5 — цитохромы.
Изменения в системе
132
мых изменяется активность дыхательных ферментов, связанных с конечным окислением субстрата. Эти изменения ферментативной активности тканей лежат в основе колебаний интенсивности общего газообмена в течение развития куколки (см. с. 112).
Характер изменений активности дегидрогеназ у развивающихся куколок зависит как от вида насекомого, так и от типа исследуемой ткани. В жировом теле и в кишечнике куколок мучного хрущака Tenebrio molitor активность дегидрогеназ изолимонной и яблочной кислот изменяется по (7-образной кри-вой, напоминающей кривую изменения дыхания при развитии кукокол. Однако эти же ферменты в гонадах обнаруживают только равномерное и постепенное увеличение активности [427]. На куколках амбарной огневки (Ephestia kiihniella) по казано, что по сравнению с другими ферментами гликолиза и окислительного фосфорилирования, сукциндегидрогеназа обладает наименьшей активностью [428]. Отсюда возникло предположение, что именно этот фермент играет роль лимитирующего фактора при определении кривой газообмена.
Для сукциндегидрогеназы вообще очень типично (7-образное изменение активности в течение развития предкуколок и куколок. При метаморфозе восковой моли (Galleria mellonella) активность этого фермента уменьшается у гусениц во время прядения кокона, продолжает падать в течение трех дней после окукления, затем прогрессивно возрастает и достигает максимума на 8—9-й день незадолго перед вылетом бабочки [429]. (7-образная форма кривой сукциндегидрогеназной активности при развитии куколок отмечается у домашней мухи (Musca domestica) [430] и у ряда других насекомых. У куколок Tenebrio molitor [431] или Bombyx mori [432] (7-образный характер кривой менее очевиден, ио и в этих случаях наблюдается первоначальное снижение и последующее повышение ферментативной активности.
Активность цитохромов при метаморфозе голометабольных насекомых, так же как и в рассмотренных выше примерах, с сукциндегидрогеназой, подвержена (7-образным изменениям. Так, в гомогенатах тканей Musca domestica на протяжении личиночной фазы происходит непрерывное уменьшение активности цитохрома с, которое продолжается и у куколки до двухдневного возраста, а потом ферментативная активность постепенно возрастает вплоть до вылета имаго [433]. Активность фермента на любом этапе постэмбрионального развития пропорциональна его концентрации. Подобные' (7-образные изменения активности в системе цитохромов на куколочной стадии отмечены и у других насекомых; до сих пор не обнаружены какие-либо отклонения от этого правила.
При наступлении диапаузы у имаго или у личинок активность сукциноксидазной системы ферментов (цитохромы+сук-
133
циндегидрогеназа) снижается и остается на низком уровне до завершения процессов реактивации и до начала развития [366, 434, 435]. Дыхание диапаузирующих имаго или личинок столь
же чувствительно к цианистым соединениям и окиси углерода, как и дыхание активных насекомых. Очевидно, во время имаги-налыюй или личиночной диапаузы не происходит качественных изменений в системе переноса электронов по цепи дыхательных ферментов от янтарной кислоты до цитохромоксидазы и мо
лекулярного кислорода.
Иная картина наблюдается при куколочной диапаузе, которая сопровождается качественными изменениями в системе цитохромных ферментов. Эти изменения наиболее подробно изучены на примере куколок американского шелкопряда Hyalophora cecropia [419, 436, 437].
Показателем существенных нарушений обычной системы транспорта электронов по дыхательной цепи является низкая
чувствительность диапаузирующих куколок к окиси углерода и цианидам. Яйца, взрослые гусеницы и бабочки шелкопряда погибают после ' 5-дневного
воздействия смесью СО и О2 в соотношении 20:1, а диапау-зирующие куколки благополучно выдерживают более чем 20-дневное воздействие этих газов в пропорции 33:1. Высокая устойчивость тканей диапаузирующей куколки отмечается и по отношению к цианистому калию: сердце та-
Рис. 49. Потребление кислорода развивающимися и7 диапау-зирующими куколками шелкопряда Hyalophora cecropia в зависимости от содержания окиси углерода в атмосфере. По Шнейдерману и Вильямсу [436].
I — диапаузирующие куколки в воздухе; 2 — развивающиеся куколки в воздухе; 3 — развивающиеся куколки в воздухе (1 атм) с добавлением окиси углерода ' (5 атм).
кой куколки продолжает работать с нормальным ритмом сокращений в 0,001 моль/л растворе цианистого калия (KCN).
После действия СО дыхание развивающихся куколок Н. cecropia снижается до уровня, близкого к интенсивности дыхания диап^узирую-щих насекомых (рис. 49). Следовательно, можно думать,
что скромные метаболические потребности диапаузирующих куколок удовлетворяются той системой реакций дыхательного обмена, которая даже у развивающихся насекомых нечувствительна к окиси углерода и цианидам. Подробный анализ этой
системы показал, что в период диапаузы во многих тканях куколки цитохромы b и с полностью исчезают, а содержание цитохромов резко снижается (рис. 50, I). Следовательно^
134
обычный путь переноса электронов от цитохрома b через цитохромы с, а и аз к кислороду становится невозможным. Вместо всего этого пути здесь функционирует один новый цитохром &5, который обладает свойствами цитохромоксидазы и может сразу передавать электроны к О2.
с<-65\6
с (Ь6) в
т
!-------------------------------------1--------------------------------------1-----------------------------------1----------------------------------------1----------------------------------1----------------------------------------1-----------------------------------Г
540 560 580 600
Длина волны, нм
Рис. 50. Низкотемпературные спектры поглощения цитохромов в эпидермальных клетках зачатков крыльев у диапаузирующей (7) и развивающейся (II) куколки шелкопряда Hyalophora cecropia. По Шапи-риб и Вильямсу [419].
1— нефракционированный гомогенат; 2— митохондриальная фракция; 3— микросомная фракция.
Цитохром &б имеет спектр поглощения в области между 555 и 560 нм и в этом отношении он напоминает цитохром е, обнаруженный в клетках печени млекопитающих. В отличие от классических цитохромов а+_а$, b и с этот новый фермент не
135
чувствителен к действию СО или KCN; он локализуется не в митохондриях, а в других внутриклеточных тельцах — в микросомах (рис. 50, II).
Спектрофотометрическое изучение распределения цитохромных ферментов в различных тканях гусениц, куколок и бабочек
Таблица 4
Изменения содержания цитохромов в различных тканях шелкопряда Hyalophora cecropia при метаморфозе и диапаузе. По Шапирио и Вильямсу [419]
Стадия развития Органы и ткани Относительное содержание цитохромов*
с 1 » а+ая 1
Гусеница х Скелетные мышцы +++: +++ +++ 0
Сердце ++' ++ +++ +++
Другие ткани** ++ ++ +++
Диапаузирующая кукол- Скелетные мышцы +++ Т++ +++ 0
ка Сердце 0 0 + 4-
Другие ткани** 0 0 + 1 +
Постдиапаузная кукол- Скелетные мышцы + + + +++ +++ 0
ка на ранних этапах развития Другие ткани** + + ++ ++
Постдиапаузная куколка Скелетные мышцы +++ +++ +++ 0
на поздних этапах развития и бабочка Сердце ++ ++ +++ Следы
Другие ткани** ++ ++ +++ + + +
* Концентрация цитохромов: (4~-Ь + ) — высокая, ( ++) — средняя, ( + ) — низкая, 0— неопределимые количества.
** Были исследованы эпидермальные клетки, кишечник, жировое тело, гонады и мальпигиевы сосуды.
Н. cecropia показало, что у диапаузирующей куколки цитохром осуществляет конечное окисление субстрата в клетках кишечника, в жировом теле, в гонадах, в эпидермальных клетках и в мышцах сердечной трубки, а в скелетной мускулатуре брюшка продолжает функционировать обычный набор цитохромов, чувствительных к СО и KCN (табл. 4). В то же время цитохромы а + а3, b и с образуют основную дыхательную цепь во всех типах тканей у гусениц, активно развивающихся (постдиа-паузных) куколок и у имаго. При этом наряду с классическим набором цитохромов иногда встречается и но его роль в промежуточном дыхательном обмене у недиапаузирующих насекомых крайне невелика.
После прекращения куколочной диапаузы переход от нечувствительной к СО и KCN системы дыхания на обычный путь окисления субстрата происходит в результате синтеза цитохромов Ь + с и в результате восстановления высокой активности
136
Рис. 51. Изменения содержания цитохрома с при развитии пост-диапаузной куколки айлантового шелкопряда Philosamia cynthia. По Чану и Марголишу [438].
цитохром-с-оксидазы (а+_а3). Этот переход обусловливается изменениями в эндокринной системе, вызывающими начало развития реактивированных куколок. В тканях куколок айлантового шелкопряда Philosamia cynthia при 25°С цитохром с впервые появляется на 15-й день после реактивации в низких температурах [438]. В дальнейшем содержание этого фермента быстро восстанавливается и в момент вылета имаго достигает особенно высокой концентрации (рис. 51). Интересно, что даже у диапаузирующей куколки Hyalophora cecropia местное повреждение покровов, которое стимулирует газообмен, приводит к временному увеличению концентрации цитохром-с-оксидазы в эпидермальных клетках и к повышению чувствительности к СО [439]. Следовательно, при повреждении покровов во время диапаузы могут наблюдаться такие же изменения в активности дыхательных ферментов, как и у неповрежденных куколок после возобновления развития. В обоих случаях повышение ферментативной активности связано с усилением синтеза белков, что находит свое отражение в биосинтезе цитохромов.
Глава III. ФИЗИОЛОГИЧЕСКИЕ ОСНОВЫ ПИТАНИЯ
§ 1. Пищевые режимы и пищевая специализация
Пищевые режимы. Во всем животном царстве нет другой такой группы, которая отличалась бы столь же широким разнообразием пищевцгх режимов, как насекомые. Поэтому в данном параграфе мы кратко рассмотрим только основные пищевые режимы насекомых.
Широко распространенным типом питания членистоногих является хищничество. Многие ракообразные, большинство паукообразных и все многоножки Chilopoda — хищники. В классе насекомых хищничество часто характеризует большие систематические. группы в ранге отряда, подотряда или семейства. Таковы стрекозы (отр. Odonata), жуки (подотр. Adephaga) и мухи-ктыри (сем. Asilidae).
Иногда хищники встречаются спорадически в той или иной группе насекомых, приспособленных в основном к растительной пище. Таковы различные плотоядные гусеницы, у которых хорошо прослеживается переход от питания мертвыми тканями животных к хищницеству и даже к паразитизму. Обычно гусеницы-хищники нападают на червецов или тлей и лишь очень редко на других насекомых.
Одним из проявлений хищничества является каннибализм-питание особями своего вида. Это явление обнаруживается не только среди типичных хищников (например, у пауков или скорпионов), но и у некоторых растительноядных гусениц. Обычно поедаются больные или ослабленные насекомые. У мучных хрущаков Tribolium и Tenebrio каннибализм может быть средством ограничения численности популяции при недостатке корма.
Промежуточное положение между хищниками и паразитами занимают насекомые-парализаторы, которые обездвиживают свою жертву с помощью яда, а затем используют живых, но неподвижных насекомых для выкармливания личинок. Факт парализации различных членистоногих осами семейств Scolii-dae, Pompilidae и Sphecidae был установлен выдающимся французским энтомологом Фабром и вначале казался столь удивительным примером «целесообразности» в живой природе, что многие современники этого великого ученого восприняли
138
его как миф. Но впоследствии было с несомненностью доказано, что некоторые осы действительно парализуют других членистоногих, нанося им уколы жалом в нервные ганглии.
Паразитизм составляет широко распространенное явление в мире насекомых и особенно часто встречается в отрядах двукрылых и перепончатокрылых. У Hemimetabola отмечается только эктопаразитизм, когда паразит питается тканями хозяина, оставаясь на поверхности его тела. У Holometabola наряду с таким способом питания обнаруживается и эндопаразитизм, когда паразит проникает внутрь тела хозяина. Паразитами бывают личинки или нимфы, реже — имаго. Круг хозяев паразитических насекомых включает в себя всех наземных или пресноводных членистоногих, моллюсков и ряд позвоночных животных. В некоторых случаях отмечается сверхпаразитизм, при котором один паразит заражает другое тоже паразитирующее насекомое.
Одно из проявлений паразитизма — питание кровью млекопитающих и птиц. С таким способом питания мы встречаемся у клопов сем. Cimicidae и у многих двукрылых. В первом случае кровососами являются оба пола на всех постэмбриональных стадиях развития, а во втором — только самки в имаги-нальной стадии.
У кровососущих самок двукрылых питание кровью составляет необходимое условие развития яичников. Поэтому у многих из них наблюдается четкая зависимость между питанием и откладкой яиц. Это явление получило название гонотрофиче-ского цикла и особенно подробно изучалось на малярийном комаре Anopheles maculipennis [440]. Пути происхождения па-, разитизма могут быть самыми разнообразными. Не останавливаясь на характеристике всех этих путей, отметим, что нередко паразитизм возникает из комменсализма, при котором один организм живет за . счет избытков пищи или отбросов другого животного, но вреда ему не наносит. Такая форма взаимоотношений между клещами и птицами послужила основой для возникновения паразитизма в группе перьевых клещей. Эти паразиты находятся в близкородственных отношениях с некоторыми свободно живущими клещами, которые питаются мертвыми растительными или животными продуктами. Случайно попадая на птиц, клещи сначала вели себя только как комменсалы, питаясь сальными выделениями копчиковой железы и отпадающими чешуйками эпидермиса, но потом они превратились в настоящих паразитов, строго адаптированных к своим хозяевам [441].
Комменсалы позвоночных, эволюционирующие в направлении к паразитизму, но еще не ставшие настоящими паразитами, встречаются и среди современных насекомых. Таковы бескрылые и слепые уховертки сем. Hemimeridae, которые живут на грызунах, питаясь отслаивающимися кусочками кожи.
139
Насекомых-комменсалов, связанных с другими насекомыми, часто называют инквилинами. Подобная форма взаимоотношений может возникать у мирмикофилов и термитофилов с их хозяевами— муравьями и термитами. Насекомые, образующие галлы на растениях, также бывают хозяевами большой группы инквилинов, поселяющихся в тех же галлах.
Комменсализм и инквилинизм можно рассматривать как своеобразную форму симбиоза, однако при настоящем симбиозе (мутуализме) совместное существование должно приносить пользу обоим сожительствующим организмам. Классическим примером такого симбиоза в мире насекомых являются взаимоотношения муравьев и тлей: муравьи, питаясь падью, выделяемой тлями, защищают их от врагов [442].
Паразитизм, хищничество и питание кровью еще не исчерпывают всех возможных пищевых режимов, основанных на использовании животных организмов и их продуктов, т. е. зоофа-гии в широком смысле этого слова. Сюда же следует отнести и уже более редкие среди насекомых случаи питания на трупах позвоночных (некрофагии), характерные для сем. Silphi-dae среди жуков и для некоторых личинок мух из сем. Callip-horidae и Sarcophagidae. На поедании экскрементов позвоночных специализировались жуки-навозники (подсем. Scarabaeinae в сем. Scarabaeidae), часть жуков-карапузиков (сем. Histeri-dae) и личинки мух из различных семейств. Поскольку экскременты являются материалом, уже однажды подвергавшимся перевариванию, и содержат очень мало питательных веществ, насекомые, питающиеся ими (копрофаги), вынуждены поглощать поистине огромные количества пищи.
Питание воском, шелком и шерстью составляет единичные случаи, которые, тем не менее, очень интересны с точки зрения природы усваиваемых продуктов и механизма их расщепления в организме насекомых (см. с. 208 и 210).
Число насекомых-фитофагов огромно. За исключением, вероятно, хвощей и плаунов, ни одно наземное растение не лишено своего потребителя из мира насекомых. Используются в пищу даже такие растения, которые с точки зрения человека являются крайне ядовитыми.
Некоторые растения содержат высокотоксические соединения, которые употребляются в качестве инсектицидов (например, пиретрин, ротенон, никотин и др.). Однако эти растения также служат пищей для определенных видов насекомых. Очевидно, насекомые имеют эффективные биохимические механизмы обезвреживания (детоксикации) ядовитых веществ, входящих в состав их природного корма [443]. К сожалению, эти механизмы еще плохо изучены.
Специфическая устойчивость табачного бражника (Proto-parce sexto) к отравляющему действию никотина связана с высокой скоростью его выведения из организма [444]. Химический
140
анализ алкалоидного состава экскрементов показал, что 95% поглощенного никотина в течение 30 мин выводится через кишечник в неизмененном виде. После инъекции никотина гусеницам значительные количества этого вещества обнаруживаются в гемолимфе, но через 8 ч весь никотин исчезает из гемолимфы и большая часть его определяется в экскрементах. Дополнительным фактором, определяющим высокую устойчи
Питаются корнями
Ц4’-
Питаются плодами.
Lymexelomdae (а) Buprestidae (а) Bostrychidae (л) Сенат bycidae(A) Anobiidae (л) Lyctidae (л)
Сuncal ь от daе (ж)
Atellabidae (л ,ж) Chrysomelidae(Afdic) Scarabaeidae (ж) Meloidae (ж)
Рис. 52. Пищевая специализация различных семейств жуков, связанных с дубом.
ScolytLdae (л.ж)
Г
£
вость Р. sexto, к никотину, является низкая скорость проникновения яда из гемолимфы в нервную систему [445].
Многие растения содержат цианистые соединения, которые, попадая в кишечник и гемолимфу насекомых, могут вызвать тяжелые отравления в результате инактивации дыхательных ферментов. У насекомых, питающихся такими растениями, обычно высока активность роданазы — фермента, расщепляющего цианиды и превращающего их в безвредные4 тиоцианаты [446].
Способы получения пищи из растения очень различны у разных насекомых; различна и природа самого питательного субстрата. У грибов поедаются мицелий и плодовые тела. При
141
этом муравьи и термиты могут культивировать грибы в специальных грибных садах. У цветковых растений в пищу используется всё, начиная с листьев, лепестков и нектара и кончая корнями. Широко распространено питание древесиной — ксилофагия, причем процесс переваривания клетчатки осуществляется часто при участии симбиотических микроорганизмов. Специализация различных семейств жуков на питании разными частями дуба схематически показана на рис. 52.
В качестве примера тесных связей насекомых-фитофагов с разными частями растений можно привести листоверток (Тог-tricidae), для которых первично питание на древесно-кустарниковых растениях (дендрофилия), а переход на травянистую растительность (хортофилия) составляет вторичное явление, характерное для эволюционно более молодых триб и родов (например, для трибы плодожорок). Потенциально листовертки могут повреждать все органы растений, но большинство гусениц этого семейства относится к филлофагам, т. е. питается листьями и почками. По данным В. И. Кузнецова [447], в фауне листоверток юга Дальнего Востока СССР, насчитывающей более 520 видов, примерно 300 видов принадлежит к филлофагам. В группе дендрофилов, связанных с древесно-кустарниковой растительностью, на указанной территории встречаются 80 видов антофагов (питаются цветами), 45 видов карпофагов и 4 вида галлофагов (живут, соответственно, в плодах и в галлах). Аналогичная картина распределения листоверток по разным органам кормовых растений наблюдается и в группе хортофагов, обитающих на травянистой растительности.
Питание водорослями наблюдается, конечно, у водных насекомых, например у личинок комаров сем. Chironomidae. Впрочем, водоросли, а также лишайники служат специальной пищей и некоторых термитов.
Несомненно также, что непосредственную пищу ряда насекомых составляют различные дрожжи и бактерии. Очень высока вероятность того, что мелкие почвенные насекомые-фитофаги живут за счет богатой бактериальной флоры почв. Изве-^ стно, что дрозофилы развиваются в природе на гниющих плодах, но в действительности они используют для питания не сами плоды, а те дрожжевые клетки и бактерии, которые поселяются на них. Личинки комарика Miastor, живущие под гнилой древесцой корой, также питаются не древесиной, а встречающимися в ней бактериями.
Разлагающиеся растения (детрит) и продукты их разложе-жения служат пищей для насекомых-сапрофагов, среди которых особенно много почвенных форм. Принимая активное уча-стие в распаде лесной подстилки, эти насекомые играют большую роль в обмене веществ между почвой и растительностью.
Уникальным типом питания насекомых можно считать ис
142
пользование ими в пищу углеводородов нефти. Еще в XIX в. в лужах нефти вблизи вышек были обнаружены личинки мухи Psilopa petrolei из сем. Ephydridae. При полном отсутствии животной пищи эти личинки выживают в небольшом количестве и заканчивают развитие, питаясь какими-то углеводородами [448]. Такую пищу, однако, трудно считать полноценной даже для Р. petrolei, необходимые питательные вещества личинки могут получать и за счет тех животных, которые случайно попадают в нефтяные лужи.
Наконец, некоторые насекомые во взрослом состоянии вообще не питаются, т. е. являются афагами; они существут за счет тех резервных питательных веществ, которые накапливаются личинкой. Афагия в особенно полной форме проявляется у бабочек самых различных семейств, например у шелкопрядов, но она свойственна и двукрылым, например оводам (сем. Oestriv dae и Hypodermatidae).
Пищевая специализация. Круг пищевых материалов, используемых данным насекомым, может быть широким или достаточно ограниченным. В зависимости от степени ограниченности пищевого рациона насекомые распадаются на три экологические группы: полифаги, олигофаги и монофаги.
Полифаги могут использовать в качестве источника пищи обширную группу животных или растений. Сюда следует отнести саранчовых и многих гусениц из фитофагов, богомолов, и многих жужелиц из хищников, а также так называемых пантофагов, способных питаться как растительной, так и животной пищей. Примерами пантофагов могут служить тараканы, сверчки, многие муравьи и термиты. Большинство паразитов достаточно специализированы в отношении выбора хозяев, но некоторые из них являются полифагами.
У олигофагов набор пищевых объектов ограничен сравнительно узкими рамками. Подавляющее большинство насекомых принадлежит к этой группе. Паразиты, хищники и фитофаги часто используют в качестве источника пищи представителей определенных родов или семейств из мира животных и растений. Так, известно, что наездники-бракониды р. Dacnu-sa паразитируют только в личинках минирующих мух сем. Ag-romyzidae, хищные клопы Perillus bioculatus нападают на колорадского жука и на других листоедов (Chrysomelidae), а капустная тля Brevicoryne brassicae повреждает растения из сем. крестоцветных (Cruciferae).
Олигофагия представляет собой достаточно широкое понятие, объединяющее насекомых с различной пищевой специализацией. Поэтому среди фитофагов обычно выделяют подгруппу узких олигофагов, способных питаться только видами одного рода или нескольких близких родов, и подгруппу широких олигофагов, питающихся на многих родах какого-либо семейства растений. Например, щавелевый листоед Gastroidea viridula,
143
для которого кормовые растения ограничены лишь пределами сем. гречишных (Polygonaceae), — широкий олигофаг, а ильмовый листоед Galerucella luteola, скелетирующий листья 11 видов ильма (р. Ulmus),—у^кий олигофаг. Некоторые авторы выделяют еще подгруппу аномальных олигофагов, использующих ограниченный набор малородственных растений [449]. Такова цикадка Mongolojassus sibiricus, которая живет на видах родов Stipa и Avenastrum. Оба эти рода растений относятся к разным трибам сем. злаковых (Gramineae). Видимо, к подгруппе аномальных олигофагов относится и тутовый шелкопряд, способный развиваться не только на листьях тута, но и на листьях маклюры [450] или на Scorzonerahispanica и Ро-dospermum laciniatum [451].
Предпочтение определенной пищи часто характеризует систематическую группу насекомых-олигофагов и может служить таким же надежным таксономическим признаком, как и морфология личиночных или имагинальных стадий. В некоторых случаях изучение пищевой специализации насекомых позволяет выделить основные направления их эволюции и естественные таксономические категории. Это положение было доказано А. С. Данилевским и В. И. Кузнецовым [452] на примере палеарктических плодожорок трибы Laspeyresiini.
Интересные данные о распределении олигофагов по кормовым растениям приводит А. Ф. Емельянов [449]. Этим автором при анализе пищевой специализации в 14 различных группах фитофагов (насекомых и клещей) установлено, что количество видов узких олигофагов в наибольшей степени зависит от размеров растения или от степени его доминантности в растительном покрове земли и почти совсем не зависит от его филогенетического возраста. Наиболее богатую й разнообразную фауну олигофагов - имеют древесные или кустарниковые породы, а среди них — виды, наиболее обильные в природе и образующие основной растительный покров нашей планеты.
М. И. Фалькович [453], развивая представления А. Ф. Емельянова о роли распределения пищевого материала в эволюции фитофагов, показал на примере пустынных чешуекрылых, что количество насекомых, связанных с определенным видом растений, зависит и от сезонной продолжительности его вегетации. На эфемерах и эфемероидах, характеризующихся коротким (преимущественно весенним) периодом вегетации, развивается лишь 6% чешуекрылых, несмотря на то, что эти растения сос-ставляют 27% пустынной флоры. С другой стороны, на кейруке (Salsola rigidd), который отличается высокой устойчивостью к недостатку влаги и сохраняет листву в течение всего лета, обнаружено 11 видов узких олигофагов — значительно больше, чем на боялычах (S. arbuscula и S. arbusculiformis), играющих более важную роль в растительных сообществах пус
144
тынь. Таким образом, в своеобразных условиях пустыни продолжительность вегетирующего состояния растения выдвигается в число первостепенных факторов, ограничивающих количество насекомых-олигофагов.
У монофагов набор объектов питания ограничен ,одним видом или несколькими близкими видами одного рода растений и животных.
Среди растительноядных насекомых монофагами являются некоторые виды, используемые для уничтожения сорняков. Так, червец Dactylopius ceylonicus, завезенный из Индии в Австралию для борьбы с сорными кактусами-опунциями, оказался настолько специализированным фитофагом, что сумел справиться лишь с одним видом опунции (Opuntia vulgaris), но не с остальными видами этого рода [454]. Столь же эффективно истребляют опунцию другие червецы р. Dactylopius. Особенность этих насекомых заключается в их высокой пищевой избирательности: каждый вид червеца поражает строго определенную группу видов в пределах р. Opuntia.
Среди хищников, пожалуй, наибольшей пищевой специализацией отличаются жуки сем. Coccinellidae: виды р. Rodolia нападают только на австралийского желобчатого червеца Icerya purchasi, а другой , жук Scymnus coccivora питается различными видами червецов, относящимися к р. Pulvinaria [455].
Границы между моно-, олиго- и полифагами, разумеется, условны; есть немало насекомых, которых трудно было бы отнести в ту или иную группу, однако сам факт существования у всех членистоногих пищевого предпочтения и специализации по отношению к определенному источнику пищи не подлежит сомнению. Эта пищевая специализация обусловливается различными причинами.
У хищников набор пищевых объектов определяется в первую очередь способом ловли добычи и местом охоты. Гусеницы, например, не способны к быстрым двигательным реакциям, и поэтому пищей хищных гусениц могут служить только неподвижные или малоподвижные насекомые. С другой стороны, нападение богомола Mantis religiosa провоцируется движениями объекта в его поле зрения, и поэтому богомолы не могут питаться червецами или щитовками. Обычную пищу крупных нимф и взрослых богомолов составляют мухи, пауки, пчелы, осы, прямокрылые и другие членистоногие.
Отказ хищников от определенной добычи иногда связан с наличием ядовитых и резко пахучих веществ в теле некоторых насекомых. Так, медленно летающие и, казалось бы, легко доступные бабочки — пестрянки (Zygaenidae) на самом деле избавлены от нападения хищников, потому что в гемолимфе у них содержатся ядовитые цианистые соединения.
«Опознавательным знаком», указывающим на несъедобность
145
данного объекта для хищника, может служить яркая, предостерегающая окраска тела. На этой основе возникло явление мимикрии, при которой неядовитый и съедобный вид получает защиту от хищников, приобретая окраску, свойственную его «модели» — какому-либо ядовитому виду. Мимикрия может защищать насекомых не только от позвоночных, но и от некоторых беспозвоночных хищников, например от пауков [456].
Наличие отвергаемых, «защищенных» объектов и способы ловли добычи ограничивают круг возможных источников пищи для хищника, однако эти факторы обычно не приводят к строгой монофагии. Поэтому среди хищных насекомых и паукообразных сравнительно мало узких олигофагов и почти совсем нет монофагов. Упомянутые выше примеры сильной пищевой специализации у жуков-кокцинеллид нужно считать исключениями из этого правила.
Абсолютная, строгая монофагия свойственна некоторым насекомым-парализаторам. В этом случае в связи со сложностью инстинктивных операций, направленных на обездвиживание насекомого, необходима очень тонкая и точная подгонка поведения хищника к строению тела жертвы. Поэтому почти все насекомые-парализаторы являются моно- или олигофагами.
Ярко выраженная пищевая специализация обнаруживается у многих паразитических насекомых. Факторами, обеспечивающими и поддерживающими узкую олигофагию, могут быть особенности поведения паразита и его способность развиваться в строго определенных хозяевах. В результате совместного действия этих двух факторов каждый вид паразита оказывается адаптированным к своим хозяевам. Такая адаптированность проявляется в морфологических изменениях, характерных для паразитического образа жизни, в физиологических реакциях подавления иммунитета и в экологической синхронизации циклов развития паразита и хозяина.
При поиске подходящего хозяина паразит сначала выбирает среду, в которой наиболее высока вероятность встречи спим. Кормовое растение хозяина-фитофага часто играет роль основного стимула, привлекающего паразита. Лишь найдя подходящий субстрат, паразит приступает к тщательным поискам самого объекта заражения, руководствуясь, главным образом, обонятельными раздражениями. Показано, что гусеница совки Heliothis virescens при питании оставляет след слюны на растениях, и по этому следу наездник Cardiochiles nigriceps легко находит ее [457]. Вещество слюны, привлекающее паразита, выделяется мандибулярными железами гусениц [458].
Обнаружив хозяина, паразит" должен оценивать его пригодность как объекта для заражения и для питания личинок. Многие паразитические насекомые обладают замечательной способностью различать хозяев, причем запах, который играет
146
важную роль при обнаружении хозяина, имеет подчиненное значение при оценке его пригодности. Стимулами к откладке яиц могут быть движения хозяина, его форма, величина, расцветка и т. д. Некоторые паразитические насекомые выбирают только незараженных, здоровых, хозяев для своего потомства. У наездников этот выбор основывается на специфической чувствительности контактных хеморецепторов яйцеклада. Детье
Chenopodium album Kochia prostrate, Beta, vulgaris Artemisia vulgaris Tri folium, pr a tense Artemisia salina Artemisia, pauciflora Artemisia austriaca Artemisia incana Obi one verrucifera Nicotiana rustica
Рис. 53. Сопоставление предпочитаемости кормовых растений с их влиянием на развитие лугового мотылька Loxostege stic-ticalis. По данным А. С. Данилевского [460].
Кормовые растения расположены по их предпочитаемости, оцениваемой в баллах от 1 до 10. а — средняя длительность развития гусениц, дни; б — смертность в гусеничных возрастах, %; в — вес куколок, мг.
[459] экспериментально доказал, что наездник Exidechtis са-nescens реагирует на химическое раздражение, воспринимая его яйцекладом, выдвинутым из створок.
Пищевая специализация насекомых-фитофагов обычно основана на их способности реагировать на определенные химические компоненты растений. Раньше считалась весьма вероятной связь растительной монофагии и олигофагии со специфичностью белков пищи. Однако в настоящее время показано, что стимулами, привлекающими или отталкивающими насекомое, могут быть различные органические соединения, которые содержатся в растительном корме, но, как правило, не имеют питательной ценности. Чаще всего функцию этих стимулов выполняют глюкозиды или терпены. Химические вещества пищи, привлекающие данное насекомое, называются пищевыми аттрактантами, а отталкивающие вещества — пищевыми репеллентами.
Растение принимается в пищу, если оно содержит необходимые пищевые аттрактанты и не имеет достаточно сильных репеллентов. Обогащенная аттрактантами пища сильнее прив
147
лекает фитофагов и поглощается ими в большем количестве. Поэтому существует прямая связь между степенью привлекательности пищи и ее «оптимальностью», т. е. способностью поддерживать высокие темпы роста насекомых при минимальной смертности (рис. 53). «Неоптимальная» пища может обладать столь же высокой питательной ценностью, но она лишена аттрактантов или имеет сильные репелленты и поэтому поглощается насекомыми в меньшем количестве. Понятно, что при питании «неоптимальной» пищей рост и развитие насекомых замедляются, а смертность заметно возрастает.
Способность растительноядных олигофагов питаться определенной группой растений закреплена наследственностью и выработана естественным отбором. Несмотря на это, насекомые сравнительно легко и быстро могут изменять свое, отношение к различным источникам пищи. Показано, что при воспитании на искусственной питательной среде гусеницы бражника Protoparce sexta в значительной степени утрачивают пищевую специализацию и могут питаться такими растениями, которые, обычно ими в пищу не принимаются [461]. Хорошо известно также, что насекомые-фитофаги наиболее эффективно привлекаются теми растениями, на которых они привыкли питаться с момента . рождения [462, 463, 464, 465]. Очевидно, пищевая избирательность представляет собой комплекс поведенческих реакций, включающих в себя и безусловно-рефлекторные (унаследованные) и условно-рефлекторные (приобретенные) компоненты. Любопытно, что опыт индивидуальной жизни насекомого может создавать высокую предпочитаемость корма даже при его низкой питательной ценности.
Пищевые аттрактанты и репелленты. Во многих случаях пищевая специализация насекомых-фитофагов основана на их различном отношении к аттрактантам и репеллентам, содержащимся в растительном корме. Ниже мы рассмотрим химическую природу и механизм действия этих веществ.
У саранчи Schistocerca gregaria, которую можно рассматривать как насекомое-полифаг, пищевая реакция вызывается какими-то аттрактантами, которые широко распространены в растительном царстве. В роли стимулов, привлекающих саранчу, могут выступать несколько различных веществ, и, например, ежа (Dactylis)' или клевер (Trifolium) содержат 2 пищевых аттрактанта [466]. Те немногие растения, которые совсем не употребляются в пищу саранчой, также имеют привлекающие вещества, но их действие перекрывается репеллентами.
При олигофагии пищевые аттрактанты могут быть свойственны лишь ограниченному кругу растений. Так, у гусениц и бабочек белянок (сем. Pieridae) специализация на питании крестоцветными несомненно связана с привлекающим действием глюкозидов горчичного масла. Представителем этой группы веществ является глюкозид горчицы — синигрин:
148
S-C6HltO5
CH2=CH—CH2—N=c^
о —SO3K
Подобные, содержащие серу глюкозиды вообще очень характерны для крестоцветных. В других группах растений они встречаются редко, чем и можно объяснить строгую олигофа-гию белянок.
Глюкозиды горчичного масла служат пищевыми аттрактантами и для другого олигофага — гусениц капустной моли (Р1и-tella maculipennis) [467]. В данном случае наибольшее привлекающее действие оказывает глюкозид капусты — прогоитрин. Добавление синигрина или прогоитрина к «несъедобным» растениям вызывает положительную пищевую реакцию у этих гусениц. Следовательно, растения, не принимаемые в пищу капустной молью, не содержат репеллентов; они только лишены аттрактантов. С другой стороны, у колорадского жука (Lepti-notarsa decemlineata) пищевая специализация обусловливается как аттрактантами, так и репеллентами [468].
В течение ряда лет канадскими и финскими энтомологами изучались химические стимулы, обусловливающие выбор кормовых растений у жуков сем. Scolytidae, специализирующихся на питании корой и заболонью деревьев. Пищевыми аттрактантами для жуков этой группы являются различные терпены, т. е. углеводороды состава СюН16, которые встречаются особенно часто в коре хвойных. Так, большой сосновый лубоед (Blasto-phagus piniperda) привлекается а-терпинеолом, выделенным из. флоемы сосны [469, 470]:
СН3
но—с —сн3
сн3
Это соединение, подобно другим терпинеолам, обладает приятным запахом, напоминающим запах сирени и ландыша; оно привлекает жуков на расстоянии. К числу дистантных аттрактантов относятся и остальные терпены.
Питание заболонника Scolytus multistriatus стимулируется экстрактами коры его основного кормового растения — американского вяза (Ulmus americana). Однако, в присутствии экстракта из коры другого дерева — Carya ovata — пищевая реакция жука затормаживается. Отпугивающее вещество было
149*
идентифицировано как юглон— ароматическое соединение из группы нафталина [471]:
ОН о
Когда юглон был удален из коры С. ovata, жуки охотно питались на оставшемся субстрате.
Действие репеллента (юглона) специфично по отношению к Scolytus multistriatus, потому что заболонники S. quadrispi-nosus не отпугиваются этим соединением и могут питаться корой Carya ovata [472].
Химические стимулы, исходящие от коры деревьев, можно рассматривать как первичные аттрактанты и репелленты. Однако было установлено, что привлекательность дерева для за-болонников зависит также от вторичных аттрактантов, которые выделяются другими жуками, питающимися на данном дереве. В начальный период заселения деревьев, пней и бревен лубоедом Dendroctonus frontalis жуки интенсивно выделяют аттрактанты, привлекая большое количество этих насекомых. Но по мере заселения процесс выделения аттрактантов питающимися жуками тормозится, привлекательность дерева снижается и значительно сокращается прилет новых жуков [473].
Тутовый шелкопряд может рассматриваться как аномальный олигофаг (с. 144). Для гусениц этого вида известен целый ряд привлекающих веществ: 1) дистантные пищевые аттрактанты; 2) водорастворимые и жирорастворимые контактные пищевые аттрактанты; 3) сахара и другие питательные вещества.
Дистантные пищевые аттрактанты, экстрагированные из листьев тутовника, привлекают гусениц на расстоянии и вызывают их передвижения по направлению к источнику корма. Эти вещества относятся к группе терпенов [474]; один и? важнейших их представителей — цитраль—имеет следующую структурную формулу:
сн3
Н2(р СИ н2с нс=о хсн
II н3с— с— сн3
350
Контактные пищевые аттрактанты вступают в действие при непосредственном соприкосновении ротовых органов гусениц, с кормом. Они вызывают отгрызание кусочка листа и его заглатывание. Вещества, стимулирующие акт отгрызания,— это р-ситостерин и два соединения из группы флавоноидов:
(2,5,7,3'4 = пентагидроксизофлабон),
(3,5,7,21, 41 = пентоьгадроксадзлабон)
Агар, смоченный этими веществами, отгрызается, но не заглатывается гусеницами [476, 475]. К числу веществ, стимулирующих акт глотания, относятся кремневая кислота и целлюлоза [477].
Гусеницы бражника Ceratomia catalpae — монофаги, питающиеся на 4 видах растений из одного р. Catalpa. Гусеницы поедают искусственную питательную среду или листья других растений только в том случае, если они смазаны водными экстрактами из листьев катальпы. Показано, что пищевыми аттрактантами для этого бражника являются катальпозиды — смесь 15 глюкозидов, характерных для р. Catalpa [478].
Таким образом, для того, чтобы данное растение употреблялось в пищу насекомыми, оно должно иметь привлекающие вещества (аттрактанты) в достаточной концентрации и не иметь отталкивающих веществ (репеллентов). Широкое распространение пищевого аттрактанта в мире растений при отсутствии достаточно сильных репеллентов лежит в основе полифагии.
Относительная пищевая специализация насекомых-олигофагов может быть связана с ограниченным распространением аттрактантов или, наоборот, с широким распространением и аттрактантов, и репеллентов. Более узкая, аномальная, олиго-
15b
3 fee
4
б
Рис. 54. Максиллярные вкусовые рецепторы, воспринимающие действие пищевых аттрактантов и репеллентов у гусеницы табачного бражника Protoparce sexta. По Шунховену и Детье [481].
А — схема расположения рецепторов на максилле: л.с. — латеральная вкусовая сенсилла; м.с — медиальная вкусовая сенсилла. Б— электрический ответ рецепторовна действие соков - листьев томата (/, 2) и хлорофитума (3, 4). Реакции на осциллограммах 1 и 3 получены от медиального, а на осциллограммах 2 и 4 — от латерального рецептора.
фагия возникает в том случае, когда питание стимулируется большой группой различных веществ, которые редко присутствуют вместе в одном и том же растении. Наконец, строгая мо-нофагия обусловливается аттрактантами, свойственными только одной небольшой группе растений.
Дистантные аттрактанты и репелленты воспринимаются обонятельными сенсиллами, расположенными на антеннах.. Возбуждение этих сенсилл, вызванное аттрактантами и подкрепленное визуальными стимулами, обеспечивает направленное передвижение насекомого к источнику корма. Однако окончательная судьба этой поведенческой реакции зависит от тех аттрактантов, которые начинают действовать при непосредственном контакте насекомого и пищи.
У гусениц «вкус» пищи, обусловленный присутствием в ней аттрактантов и репеллентов, оценивается сенсиллами максилл. Гусеницы табачного бражника (Protoparce sexta), которые в норме питаются только пасленовыми, после удаления максилл охотно принимают в пищу сложноцветные, подорожниковые и другие растения [479]. Интересно, что при питании на одуванчике и на репейнике у гусениц, лишенных максилл, темпы роста были такими же, как и при нормальной пище [480].
Электрофизиологические исследования пищевой специализации гусениц Р. sexta показали, что аттрактанты и репелленты возбуждают две целоконические вкусовые сенсиллы, расположенные на максиллах (м.с и л.с на рис. 54, Д). При действии аттрактанта частота импульсов медиальной сенсиллы намного превышает частоту импульсов латеральной сенсиллы. При действии репеллентов, наоборот, особенно сильно возбуждается латеральная сенсилла (рис. 54, Б). Следовательно, положительная пищевая реакция гусениц вызывается преимущественным возбуждением медиальных сенсилл на обоих, максиллах, а отрицательная пищевая реакция — преимущественным возбуждением латеральных сенсилл [481]. У гусениц капустной белянки (Pieris brassicae) электрическая реакция на приложение раствора синигрина отсутствует в латеральных сенсиллах, но хорошо выражена в медиальных рецепторах [482]. В зависимости от вариаций возбуждения двух типов вкусовых сенсилл растение либо отвергается, либо принимается в пищу,
§ 2. Потребности насекомых в химических компонентах пищи
Общая характеристика полноценной пищи. Пища называется полноценной, если она содержит в доступной форме и в достаточном количестве все химические вещества, необходимые для роста, развития и размножения насекомых. Основными компонентами полноценной пищи являются белки, жиры и уг
153:
леводы, а дополнительными компонентами — вода, минеральные соли, витамины и факторы роста.
О полноценности пищи можно судить на основании ее химического анализа, но ее истинная питательная ценность зависит от способности насекомог.о усваивать данную пищу. Показате-,лями питательной ценности могут быть коэффициент усвоения (КУ) и коэффициент полезного использования (КПП) пищи. Оба коэффициента выражены в процентах; они вычисляются по специальным формулам:
К/7^ = ЮО, ОН
где В — прибавка веса за время ВП — вес пищи, потребляемой за время t\ ВЭ — вес экскрементов за время t. Таким образом, КУ показывает, насколько эффективно переваривается и усваивается полноценная пища, а КПИ отражает способность насекомых включать химические компоненты пищи в состав тела.
Эффективность использования пищевых субстратов, вычисляемая по формулам I и II, сильно варьирует в зависимости от вида, возраста и пола насекомых, от характера пищи и даже от таких внешних условий, как температура и влажность. В общем, эффективность включения химических компонентов пищи з ткани тела у растительноядных прямокрылых примерно в 2 раза меньше, чем у гусениц. Так, при питании на разных кормах у саранчовых Melanoplus differential и Schistocerca grega-ria КПП равен 8—11%, а у гусениц совок Barathra brassicae и A grot is orthogonia —соответственно 14 и 26% [483].
Во всех известных случаях КУ и КПП уменьшается по мере роста личиночных и. нимфальных фаз; обычно минимальные значения этих коэффициентов приходятся на последние возрасты. Однако и в пределах каждого возраста наблюдаются вариации КУ и КПИ. Так, у гусениц тутового шелкопряда (Bombyx mori) в V (последнем) личиночном возрасте в первые 5 дней КУ равен 39—42%, а в последние. 2 дня перед кокони-рованием — 27% [484].
Потребности в углеводах. Углеводы служат одним из основных источников энергии дыхания, поэтому они должны либо содержаться в пище, либо синтезироваться самими насекомыми.
У специализированных фитофагов эта способность к синтезу углеводов выражена недостаточно и включение сахаров в пищевой рацион строго обязательно. Отсутствие сахаров в искусственной питательной среде вызывает 100%-ю гибель личи
454
нок жука-долгоносика (Anthonomus grandis) [485] и нимф саранчовых [486]. Для многих имагинальных фаз перепончатокрылых, двукрылых или чешуекрылых углеводное питание составляет необходимое условие развития яичников. Во всех этих случаях углеводы не могут быть заменены белками или жирами.
Обычно потребности насекомых в углеводах мало специфичны, но одни сахара используются ими быстрее и легче, чем другие. Например, все известные виды р. Drosophila требуют включения сахаров в пищевой рацион, но оптимальным сахаром для D, immigrans является мальтоза, для D. melanogas-ter — фруктоза, а для D. funebris — трегалоза [487] По данным японских исследователей Хирано и Ишии [488] максимальная скорость роста' гусениц Chilo suppressalis наблюдается на синтетической питательной среде, содержащей фруктозу или глюкозу из числа моносахаридов или мальтозу и сахарозу из дисахаридов.
Различное влияние сахаров на рост и развитие насекомых может быть связано не только с различиями в питательной ценности, но и с их вкусовыми качествами. Показано, что у гусениц ВопгЬух mori наилучшим раздражителем вкусовых рецепторов, вызывающим положительную пищевую реакцию, является сахароза, а фруктоза, раффиноза, глюкоза и другие сахара менее эффективны [489]. Сахароза стимулирует питание гусениц на искусственной среде даже в отсутствии порошка из листьев тутовника.
В отличие от фитофагов насекомые-зоофаги легко синтезируют необходимые им углеводы из белков и жиров. Поэтому исключение сахаров из пищевого рациона не отражается на выживаемости, скорости роста и развитии личинок-зоофагов [490у, 491, 492, 493].
Потребности в аминокислотах. Насекомые не предъявляют специфических требований к строго определенным белкам пищевого рациона. Поэтому белковые компоненты любой пищи можно заменить другими белками, полипептидами или набором соответствующих аминокислот.
Те аминокислоты, которые не синтезируются самими насекомыми, получили название незаменимых; либо в свободном состоянии, либо в составе белков и полипептидов они обязательно должны присутствовать в пищевом рационе. Результаты, полученные при работе с несколькими десятками видов насекомых, показывают, что все они нуждаются в тех же 10 аминокислотах, которые являются незаменимыми и для крысы: аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин (табл. 5). Исключение ив пищевого рациона любой из этих аминокислот ведет к неполноценности корма и гибели насекомого. Необходимо также, чтобы большинство аминокислот присутствовало в пище в виде
155
99 Е
Таблица S
Потребности насекомых в аминокислотах nd результатам воспитания на искусственных питательных средах с различным составом аминокислот. Из Хауза [494], по данным разных авторов
Аминокислоты
Незаменимые Аргинин ................................
Валин........ ..........................
Изолейцин . . . .
Лейцин .................................
Лизин ... ................
Метионин................................
Треонин ................................
Триптофан ..............................
Фенилаланин ............................
Заменимые Аланин .................................
Аспарагиновая кислота ..................
Гидроксипролин .........................
Глицин .................................
Глутаминовая кислота ...................
Пролин..................................
Серин ..................................
Тирозин ................................
Цистеин и цистин.......................4
Примечания, п-р — добавление аминокислоты в пищевой рацион обязательно; „Х“- добавление аминокислоты в пищевой рацион стимулирует рост и развитие насекомых; п —добавление аминокислоты в пищевой рацион не обязательно; пищевое значение данной аминокислоты сомнительно, но твердо не установлено. Цифры: Coleoptera: 1 — Attagenus sp., 2 — TriboUum confusum, 3— Trogoderma granarium; Diptera: 4— Ae-des aegyptl, 5 — Agrla affinis, 6'— Calliphora erythrocephala, 7 — Drosophila melanogaster, 8 — Hylemiya antiqua, 9 — Phormia regina: Hyme-noptera: 10 — Apis mellifera; Lepldoptera: 11 — Chilo suppressalis, 12 — Pectinophora gossypiella.
широко распространенных в природе /-форм, а d-формы могут усваиваться лишь в редких случаях, но чаще не усваиваются или даже вызывают отравление насекомых.
Неспособность насекомых синтезировать перечисленные выше аминокислоты была доказана в опытах с использованием органических соединений, меченных радиоактивным углеродом С14. После инъекции глюкозы-С14 в тело гусениц совки Agrotis orthogonia радиоактивные атомы почти не обнаруживаются в молекулах незаменимых аминокислот [495]. Меченого углерода нет также в тирозине, тезируется только из другой незаменимой аминокислоты — фенилаланина. Вместе с тем, высокая радиоактивность найдена в аланине, глицине, Других
которые гусеницы могут синтезировать зы (рис. 55).
Заменимые лоты могут
ваться в организме насекомых и в принципе их присутствие в пище не обязательно. К этой группе относятся парагиновая
пролин, серин, щистин (табл. 5).
Хотя заменимые аминокислоты, не входят в число обязательных компонентов пищи, они часто способствуют росту и гусениц Chilo suppressalis
среде, содержащей 10 незаменимых аминокислот, но скорость развития резко возрастает при добавлении в среду 8 заменимых аминокислот [496]. Аспарагиновая кислота, аланин, глицин, глутаминовая кислота, серин, тирозин и цистин, поглощаемые с пищей, способствуют росту и развитию гусениц Bombyx mori [497, 498]. Аналогичные данные в отношении этих же и других аминокислот получены для многих видов насекомых. Поэтому при составлении искусственных питательных сред в них включаются не только незаменимые, но и заменимые аминокислоты.
Насекомые, видимо, могут различать на вкус незаменимые
серине, пролине и в аминокислотах,
из глюко-
аминокис-синтезиро-
аланин, ас-кислота, тирозин,
эта аминокислота син-
потому что
Рис, 55. Удельная радиоактивность заменимых и незаменимых аминокислот после инъекции глюкозы-С14 в тело гусениц совки Agrotis orthogonia. По Кастингу и Мак-Гиннису [495].
развитию насекомых. Так, развитие идет очень медленно на питательной
157
и заменимые аминокислоты. На тлей Myzus persicae сильное привлекающее действие оказывают 5 незаменимых аминокислот (изолейцин, лейцин, метионин, триптофан, фенилаланин) и только 1 заменимая аминокислота (аспарагин). Все 6 аминокислот стимулируют питание тлей, а остальные 14 либо вообще их не привлекают, либо обнаруживают лишь незначительный эффект привлечения [499]. Подобные рефлекторные реакции, возможно, облегчают насекомым поиски оптимального корма, который по его аминокислотному составу в наибольшей степени удовлетворяет пищевые потребности.
Потребности в липидах. Многие липиды (жировые соединения) могут синтезироваться насекомыми из белков или углеводов, и поэтому их присутствие в пищевом рационе не обязательно. Только некоторые ненасыщенные жирные кислоты и стерины могут рассматриваться как обязательные компоненты полноценной пищи.
Отсутствие в пище жирных кислот не всегда сказывается на росте и развитии насекомых. ..Обычно возникает потребность лишь в линолевой и линоленовой кислотах:
' СН3—(СН2)^— СН=СН— СНо—сн= сн—(сн2)7—соон
Линолевая кислота,,
СН3—СН о—СН=СН—СН2--СН=СН—СН2-СН==СН~(сн2)7—СООН
Ли; / оле Новая к а слот сь
Личинки жуков Tenebrio molitor и Anthonomus grandis, а также личинки комаров Aedes aegypti могут самостоятельно синтезировать эти кислоты [485, 493, 500], но многие гусеницы должны получать хотя бы одну из них вместе с пищей. Присутствие определенных количеств линолевой или линоленовой кислоты в пищевом рационе совершенно обязательно для нормального развития листовертки Argyrotaenia velutinana. При снижении содержания линолевой кислоты в пище гусениц от-рождаются бабочки без чешуек на крыльях [501]. В искусственную питательную среду для гусениц совки Trichoplusia ni обязательно вносится метиллиноленат, как заменитель линоленовой кислоты, которую гусеницы сами синтезировать не могут [502]. В отсутствии этого вещества наблюдается значительная смертность гусениц и куколок, а бабочки имеют деформированные крылья [503]. Жук-листоед Oulema melanopus также не синтезирует линоленовую кислоту, так как при скармливании жукам ацетата, меченного углеродом С14, радиоактивные атомы не обнаруживаются в этой кислоте [504]. Полноценная пища саранчовых должна содержать линолевую кислоту; при ее недостатке приостанавливается имагинальная линька и нарушаются процессы формирования крыльев [505].
158
Все' насекомые нуждаются в холестерине, который можно заменить другими стеринами животного или растительного происхождения (рис. 56). Доказано, что насекомые сами не в состоянии синтезировать стерины из ацетата, фруктозы, ди-и трикарбонатных кислот цикла Кребса или из сквалена, который служит промежуточным продуктом синтеза холестерина у позвоночных [504, 506, 507, 508]. Впрочем, иногда необходи-
Рис. 56. Структурные формулы стеринов.
мые насекомым небольшие количества стеринов синтезируются и поставляются им симбиотическими микроорганизмами кишечника и жирового тела [509]. В этих редких случаях включение стеринов в пищевой рацион не обязательно.
159
У жуков-кожеедов Dermestes maculatus пищевые потребности личинок в стеринах могут быть удовлетворены только холестерином или его предшественником — дигидрохолестерином [510, 511]. У многих других насекомых холестерин может быть заменен эргостерином р-сйтостерином или стигмастери-ном (рис. 56). Зимостерин может заменить холестерин только у жука Oryzaephilus surinamensisx [512], а кальциферол не заменяет его ни у одного насекомого.
По-видимому, в случае присутствия в пище различных сте-ринов они не превращаются в холестерин, а включаются вместо него в тканевые субстраты и выполняют его функции. Действительно, в опытах Капланиса с соавторами [513] и Боррин-са [514] на Musca domestica не наблюдалось превращения меченного водородом (Н3) В-ситостерина в холестерин.
Необходимость включения стеринов в пищевой рацион оправдывается той большой ролью, которую они играют в организме насекомых [515]. У всех многоклеточных стерины представляют собой важные структурные компоненты субклеточных мембран. Но помимо этого, у насекомых они являются предшественниками гормона линьки — экдизона. Вероятно, поэтому при недостатке холестерина в пище отмечаются нарушения развития насекомых.
Потребности в витаминах и факторах роста. Многие витамины входят в состав ферментов или гормонов, поэтому они оказывают сильнейшее влияние на процессы обмена веществ, рост и развитие животных. У насекомых существует специфическая потребность в водорастворимых витаминах группы В, которые могут быть исключены из пищевого рациона только в том случае, когда они синтезируются, симбиотическими микроорганизмами, заселяющими кишечник и жировое тело. Насколько известно, сами насекомые не в состоянии синтезировать многие витамины этой группы.
Почти все исследованные насекомые нуждаются в таких водорастворимых витаминах, как тиамин, рибофлавин, пиридоксин, никотиновая кислота, которая может быть заменена никотинамидом, пантотеновая кислота, биотин, фолиевая кислота и холин. Авитаминоз, т. е. полное исключение любого из этих веществ из пищевого рациона, ведет к приостановке развития и гибели насекомых. При гиповитаминозе, т. е. при недостаточном содержании витаминов в питательной среде, отмечаются резкое снижение темпов роста, повышение смертности и чувствительности к инфекционным заболеваниям, торможение развития имагинальных дисков и другие неблагоприятные симптомы, свидетельствующие о серьезных нарушениях процессов обмена веществ. В естественных условиях гиповитами-
1 Существуют указания на уникальную способность этого жука синтези* ровать стерины даже из жирных кислот.
160
поз и авитаминоз наблюдаются редко, потому что потребности в витаминах удовлетворяются даже незначительными их количествами. Так, например, оптимальная питательная среда для дрозофил содержит (мкг/г пищи) тиамина — 0,1, рибофлавина — 0,5, пантотеновой кислоты — 4, пиридоксина — 1, никотиновой кислоты — 1 и биотипа — 0,015 [516]. Гипервитаминоз, Т. е. избыточное содержание какого-либо из этих витаминов в пищевом рационе, может привести к замедлению роста насекомых.
Рассмотрим подробнее основные водорастворимые витамины, необходимые для насекомых.
Тиамин (витамин Bi) имеет следующую структурную формулу:
- СН2—N---п— СН3
Н3С-^ JL -nh2 сн -СН2ОН
N S
Он входит в состав ферментов-декарбоксилаз, отщепляющих углерод от некоторых органических субстратов. Например, включение пировиноградной кислоты в цикл Кребса (см. рис. 46) идет при обязательном участии тиамина. Поэтому у гусениц рисового мотылька (Corcyra cephalonica) при недостаточном содержании этого витамина в пищевом рационе наблюдается накопление пировиноградной кислоты [517]. ч
Все насекомые нуждаются в тиамине, но у амбарных жуков (Lasioderma, Stegobium, Oryzaephilus), у тараканов Blatella и у гусениц Galleria этот витамин синтезируется симбионтами, а у остальных насекомых поступает в организм вместе с пищей. Необходимость включения тиамина в пищевой рацион личинок комаров Aedes aegypti была доказана в опытах с использованием его антагонистов — пиритиамина и окситиамина [518].
Рибофлавин (витамин Вг) имеет структурную формулу
СН2ОН
неон
I
неон
I
неон
I
сн2
6 198
161
и входит в состав флавопротеиновых ферментов (ФП), переносящих водород от специфических дегидрогеназ на коэнзим Q и цитохромы в системе реакций конечного окисления субстрата (см. рис. 48). Этот витамин не синтезируется животными, поэтому он должен входить в пищевой рацион всех насекомых, развивающихся в отсутствии симбионтов, способных его синтезировать.
Пиридоксин (витамин В6), имеющий структурную формулу
сн2он
в качестве коэнзима принимает участие во многих реакциях обмена и окисления аминокислот. Для подавляющего большинства насекомых этот витамин является обязательным компонентом пищи, но иногда полное исключение его из синтетической питательной среды ведет только к замедлению, а не к прекращению развития. У комара Л. aegypti добавление к пищевому рациону 4-дезоксипиридоксина, являющегося эффективным антагонистом этого витамина, тормозит рост взрослых личинок и задерживает окукление [519]. Повышения смертности личинок при этом не отмечается, ио у гусениц Pectinophora gossy-piella на пище без пиридоксина наблюдается 100%-я гибель насекомых перед окуклением [520].
Никотиновая кислота (витамин РР) и ее производное никотинамид имеют следующие структурные формулы:
Никотиновая кислота
Никотинамид
Этот витамин входит в состав никотинамидных ферментов НАД и НАДФ, играющих важную роль в промежуточном дыхательном обмене.
Пантотеновая кислота, имеющая формулу
сн3 о
I II
нон2с—с—СНОН—с—NH—сн2—сн2—СООН
СНз
162
входит в состав молекулы коэнзима А. Она является обязательным компонентом пищи всех насекомых, не обладающих симбиотическими микроорганизмами, которые могли бы синтезировать этот витамин.
Биотин имеет следующую структурную формулу:
1IN NH
\ 3 • (СН2)4—соон .
По данным японских исследователей [521, 522], он образует простетическую группу ацил-КоА-карбоксилазы — фермента, участвующего в синтезе жирных кислот у Bombyx mori и у мухи Aldrichina grahami.
Наряду с другими водорастворимыми витаминами/ биотин составляет один из важных компонентов пищи подавляющего большинства насекомых. Однако у жука Anthonomus grandis [523] и только у одного вида дрозофил — Drosophila simulans [524] — потребность в этом витамине не обнаружена. Иногда отсутствие биотина сказывается лишь на темпах роста личинок, но при этом взрослые насекомые оказываются бесплодными [525]. Значительно чаще «биотиновый авитаминоз» вызывает гибель насекомых в личиночных и нимфальных возрастах.
Фолиевая (птероилглютаминовая) кислота, имеющая формулу
представляет собой важный коэнзим, участвующий, в реакциях синтеза муравьиной кислоты и некоторых заменимых аминокислот. Она не является необходимым компонентом пищи у мух Agria affinis [526] и Lucilia sericata [527] или у таракана Blatella germanica [528]. У всех остальных насекомых фолиевая кислота должна обязательно включаться в пищевой рацион.
Холин имеет структурную формулу, в которой три метиловые группы — СНз связаны с 1 атомом азота:
H3C- -N—СН£—СН2ОН . Н3С'^
163
Такое строение молекулы холина позволяет использовать его в качестве лабильного донора и переносчика метиловых групп в организме всех животных.
Потребность насекомых в холине удовлетворяется при содержании его около 1 мкг на 1 г пищи. Личинки Musca domes-tica не требуют холина, если они воспитываются на казеиновой среде [492], потому что небольшие количества этого витамина всегда присутствуют в виде примесей в казеине. Однако при скармливании этим личинкам аминокислотной среды включение холина в. пищевой рацион строго обязательно [529]. Для других видов насекомых Холин следует вносить в пищу даже при воспитании на казеиновой питательной среде.
У комаров Aedes aegypti и мух Phormia regina при отсутствии холина в пищевом рационе личинки гибнут и ни одна из них не достигает куколочной стадии. Внесение в полноценную питательную среду ингибиторов холин-дегидрогеназы дает такой же эффект [530, 531].
Все виды р. Drosophila нуждаются в холине, который, однако, может быть заменен карнитином'.
Н3С +
н3с—^ n—сн2—снон—сн2—сн2он.
Н3СГ
На диете, содержащей карнитин и лишенной холина, полностью завершается цикл развития дрозофил, но скорость роста дичинок замедляется [532], а самцы оказываются бесплодными [533, 534]. Аналог холина, в котором азот замещен серой, также обладает ограниченной способностью заменять этот витамин у Drosophila melanogaster. В отличие от дрозофил личинки долгоносика Anthonomus grandis не могут использовать карнитин вместо холина [523].
В некоторых случаях нормальный рост и развитие насекомых протекают лишь на питательной среде, содержащей перечисленные выше витамины и ряд дополнительных факторов роста — карнитин (витамин Вт), инозит и витамин Bi2. Так, инозит является важным компонентом пищи сверчков:, в отсутствии этого вещества сильно тормозится рост нимф и получаются карликовые взрослые сверчки [535]. Карнитин должен включаться в пищевой рацион жуков сем. Tenebrionidae [635], но, по-видимому, остальные насекомые не нуждаются в этом соединении [537]. Витамин Bi2 увеличивает скорость роста отдельных видов насекомых, относящихся к различным таксономическим группам.
Иногда необходимым компонентом пищи насекомых является витамин С (аскорбиновая кислота). Гусеницы Heliothis zea и Estigmene асгеа, питающиеся на листьях или на плодах
164
хлопчатника, погибают, если в синтетической пище отсутствует аскорбиновая кислота, однако гусеницы Pectinophora gos-sypiella, которые питаются семенами хлопчатника, могут самостоятельно синтезировать этот витамин и не нуждаются в нем [538]. Способность к синтезу витамина С доказана и для других насекомых, например для гусениц рисового мотылька (Corcyra cephalonica) [539].
Специфичным фактором роста гусениц тутового шелкопря,-да является хлорогеновая кислота — жирорастворимое флуоресцирующее соединение из группы фенолов [540, 541]:
сн=сн—со—о—сн2—сн=сн-(снон)3— СООН
Таблица 6
Рецепты полусинтетической пищи для разведения гусениц совки-металловидки Trichoplasia ni
Компоненты питательной среды Содержание
по Игноффо [543] по Шор и [544], %
Порошок из листьев хлопчатника, высушенных при
4-120° С 54 г —
Намоченные в воде бобы фасоли лимской .... — 31,7
Сухие хлебопекарные дрожжи — 3,2
Проростки пшеницы 108 г —
Агар 90 г 1,3
Вода 3100 мл 62,7
Метил-п-гидроксибензоат 36 мл 0,3
Казеин 126 г —
Сахароза 126 г —
Набор минеральных солей 36 г —
Альфацель 18 г —
Холин-НС1 (0,1 г/мл) 36 мл —
КОН (4 моль/л) 18 мл —
Формалин (0,1 г/мл) 15 мл —
Ауреомицин 0,52 г —
Аскорбиновая кислота Набор витаминов группы В * 15 г 0,3
* Набор витаминов содержит (в мг на 100 мл воды): ниацина — 600, пантотената кальция — 600, рибофлавина — 300, тиамина — 150, пиридоксина — 150, фолиевой кислоты — 15, биотина — 12 и витамина В12— 1.2.
165
При отсутствии в корме этого вещества задерживаются рост и окукление гусениц. У других насекомых потребность в хло-рогеновой кислоте не обнаружена.
Искусственные питательные среды. В современной практике лабораторного разведения насекомых широкое распространение получили искусственные питательные среды, включающие в себя все необходимые компоненты пищи от белков и аминокислот до микроэлементов. Искусственные среды могут быть полусинтетическими и синтетическими.
Более простой в отношении ее приготовления является . по-лусинтетическая среда, в которой, наряду с веществами известного химического состава (белки, жиры, углеводы, витамины и минеральные соли), содержатся и компоненты естественной пищи насекомых. Для фитофагов эти компоненты включаются в питательную среду в виде растертых и высушенных листьев или намоченных в воде плодов и семян кормового растения (табл. 6). Для хищников такими компонентами могут быть специально переработанные ткани их добычи. Так, например, различные виды божьих коровок (сем. Coccinellidae) удавалось выращивать от I личиночного возраста до имаго на корме из высушенных и размельченных тлей с примесью цветочной пыльцы [542].
При использовании полусинтетической питательной среды нетрудно получить высокие показатели в отношении скорости развития, процента выживаемости и плодовитости насекомых. Иногда искусственная среда оказывается даже более благоприятной, чем естественная пища. Применение такой среды создает возможность непрерывного выращивания насекомых и получения их в массовых количествах и облегчает поддержание культуры зимой. Однако полусинтетическая питательная среда не может быть использована для изучения роли различных веществ в питании насекомых. Такие исследования могут проводиться лишь на синтетических пищевых рационах. Таким образом, полусинтетические питательные среды преследуют разные цели; поэтому даже для одного и того же вида насекомых могут быть предложены разные рецепты искусственной пищи.
Идеальная синтетическая среда должна содержать только вещества известного химического состава. Такая среда может быть названа химически определенной. Однако в действительности многие синтетические среды являются химически неопределенными, потому что они содержат казеин или другой белок, который используется как источник аминокислот, и агар, не имеющий питательной ценности, но создающий определенную консистентность пищи. При разработке рецепта искусственной питательной среды следует учитывать, что во всех сложных веществах типа казеина или агара могут присутствовать следовые количества витаминов, минеральных солей или 166
других соединений. Поэтому даже в самой совершенной синтетической пище не все 100% входящих в нее компонентов имеют заранее известный химический состав.
Казеин используется чаще других белков в химически неопределенных средах; он содержит все необходимые аминокислоты и не коагулирует при стерилизации среды путем ее нагревания. В некоторых случаях вместо казеина используется яич-
Таблица 7
Сое ran синтетической среды для выкармливания саранчовых Schistocerca gregaria и Locusta migratoria migratorioides. По Дэдду [486]
Компоненты питательной среды
Сахароза ...................... .................
Декстрин ........................................
Казеин ..........................................
Mii'iiiiiiii альбумин............................
Микробиологический пептон ................. . . .
Холестерин ......................................
а-токоферол-ацетат...............................
Линолевая кислота................................
Смесь минеральных солей .........................
Аскорбиновая кислота ............................
Целлюлоза в порошке..............................
Набор витаминов* ................................
Содержание
5 Г
5 г
6 г
2 г
2 г
200 мг
12,5 мг
0,2 мл
1,5 г
100 мг
15 г
10 мл
Набор пп।аминов содержит в виде раствора в 20%-м этиловом спирте (о мы па I г среды): апеурина — 25, рибофлавина -г- 25, никотиновой кислоты — 100, iiiocpoiокеппа — 25, фолиевой кислоты — 25, инозита — 250, пантотената кальции • •'>(), пара-аминобензойной кислоты — 25, биотина — 1 и холин-хлори-да — 1250.
пый альбумин, коагулирующий при нагревании. Пример синтетической среды, содержащей оба эти белка, приведен в табл. 7.
Белковые компоненты химически неопределенной питательной среды могут быть заменены набором аминокислот в химически определенной среде. Как правило, при такой замене белков аминокислотами снижаются темпы роста и плодовитость насекомых. Однако луковая муха (Hylemiya antiqua) лучше развивается на аминокислотной среде, чем на естественной нище [545]. У тлей Myzus persicae и Aphis fabae удавалось получать 25—30 генераций при питании на химически определенной пище [546, 547].
В качестве источников углеводов в искусственных питательных средах используются сахароза и крахмал. Жирные кисло
167
ты, стерины, витамины и минеральные соединения включаются в пищевой рацион в соответствии с потребностями насекомых в этих веществах. Пара-гидроксибензоат, который иногда вносится в питательную среду (см. табл. 6) играет роль антисептика, подавляющего рост грибов и бактерий. Для предотвращения заражения среды микроорганизмами можно применять также стрептомицин.
Искусственная пища должна содержать не только питательные вещества, витамины и факторы роста, но и аттрактанты, вызывающие положительную пищевую реакцию. Если химическая природа аттрактанта уже известна, он обязательно должен включаться в искусственную питательную среду. Показано, что личинки листоеда-бабанухи (Phaedon cochleariae) интенсивно питаются лишь на искусственном корме, содержащем какой-либо глюкозид горчичного масла [548]. Эти глюкозиды, содержащиеся в листьях крестоцветных, стимулируют поедание искусственного корма гусеницами Pieris brassicae [549]. Вещества, привлекающие гусениц тутового шелкопряда, образуют обширную группу химических соединений, содержащихся в кормовом растении (с. 150). Так как природа всех этих веществ еще не установлена, в искусственную питательную среду для В. nwri приходится вносить спиртовой экстракт листьев шелковицы [550].
§ 3. Нервная регуляция питания
Регуляция голода и насыщения у мух Phormia regina. В имагинальном состоянии мухи Ph. regina питаются растворами различных сахаров, причем рецепторы, чувствительные к сахарам, расположены у них на кончиках лапок и на хоботке [551]. Раздражение этих рецепторов вызывает вытягивание хоботка, раздвигание лабеллярных лопастей его и начало сосания. Данная реакция является рефлекторной и обозначается как пищевая реакция. Порог чувствительности к углеводам, т. е. та минимальная концентрация сахара, которая вызывает пищевую реакцию, в начале питания низок, но быстро возрастает по мере насыщения мухи. Питание прекращается, когда возросший порог пищевой реакции превышает концентрацию сахара в данном растворе. Муха в этот момент является относительно «сытой»; можно заставить ее продолжать питание, если предложить ей более концентрированный раствор сахара. Но и тогда питание будет продолжаться только до тех пор, пока порог пищевой реакции не превысит концентрацию сахара в новом растворе.
Таким образом, чем выше порог пищевой реакции, тем более «сытой» является муха, и тем меньше будет длительность
168
поглощения ею сахарного раствора определенной концентрации. Это положение доказано Эвансом и Брауном [552]. Интересно, что все сахара, независимо от их питательной ценности, оказывают сходное влияние на изменения порога пищевой реакции. Так, глюкоза, которая легко усваивается мухами, и d-арабиноза, которая ими совсем не усваивается, могут стимулировать рецепторы лапок или хоботка [553]. Муха, накормленная d-арабинозой, является «сытой» по поведению, но метаболически «голодной». Такая муха не стремится поглощать новые порции сахара и вскоре погибает.
После питания высокий порог пищевой реакции снижается через 5—10 ч и в дальнейшем продолжает падать (рис. 57), т. е. муха постепенно становится все более «голодной», и все более охотно она принимает раствор с низким содержанием сахара. Параллельно с этим развитием состояния «голода» отмечается повышение спонтанной двигательной активности, направленной на поиски источника пищи [552, 554]. Мухи, не принимавшие пищи в течение 24 ч, по крайней мере в 4 раза подвижнее «сытых» мух. Сразу же после питания двигательная активность насекомых резко снижается.
Некоторые авторы считают, что описанные выше изменения порога пищевой реакции, отражающие «голод» и «насыщение» мухи, возникают вследствие адаптации и дезадаптации рецепторов лапок и хоботка [552]. Предполагается, что по мере питания эти рецепторы становятся менее чувствительными, привыкают к данному раздражению (адаптация). Обратный процесс восстановления исходной чувствительности (дезадаптация) происходит постепенно в отсутствии питания.
Однако Детье и Боденш-тейн [555] выдвинули другое объяснение этого явления и сумели подтвердить его экспериментально. Они показали, что перерезка возвратного нерва, соединяющего кишечник с головным ганглием,
прекращения питания. Поглощение сахарного раствора оперированными мухами продолжается до тех пор, пока они не погибнут от разрыва кишечной трубки. Следовательно, в обычных условиях питание прекращается под влиянием тормозных импульсов возвратного нерва, возникающих при заполнении кишечника мухи сахарным раствором. Состояние «голода» или «насыщения» насекомого основывается на соотноше
ние. 57. реакции питания
Изменения порога пищевой мух Phortnia regina после их на растворе глюкозы. По Эвансу и Брауну [552].
к невозможности
169
ниях частоты стимулирующих импульсов от рецепторов хоботка и тормозных импульсов от рецепторов кишечника.
Регуляция питания у кровососущего клопа Rhodnixus proli-XUS, У R. prolixus количество поглощенной пищи также регулируется импульсами чувствительных нервов кишечника. У нимф клопа перерезка нервной цепочки между первым и вторым грудными ганглиями приводит к ненормально долгому сосанию крови и очень сильному расширению брюшка [556]. Количество поглощенной крови в этом случае почти вдвое больше, чем в контроле.
Глава IV. ФИЗИОЛОГИЯ ПИЩЕВАРЕНИЯ
§ 1. Функциональная организация пищеварительной системы насекомых
Строение и основные отделы кишечника. Пищеварительный тракт насекомых включает в себя три основных отдела — переднюю (stomadaeum), среднюю (mesenteron) и заднюю (ргос-todaeum) кишку. Стенки всех отделов кишечника состоят из эпителия, образованного одним > слоем удлиненных (столбчатых) или сильно уплощенных (пластинчатых) клеток (см. рис. 60). Снаружи вокруг эпителиальных клеток располагаются продольные и кольцевые мышечные волокна, сокращения которых обеспечивают продвижение пищи по кишечнику. В эмбриональном развитии передняя и задняя кишка образуются в виде впячиваний эктодермы, поэтому их эпителиальные клетки несут на своей свободной поверхности тонкую хитиновую кутикулу, называемую интимой. Средняя кишка имеет эктодермальное происхождение и лишена интимы.
В генерализованном типе кишечника, свойственном, например, тараканам, в состав передней кишки входят: глотка, пищевод, зоб и мышечный желудок — провентрикулус. С передней кишкой тесно связаны слюнные железы (рис. 58).
Глотка и пищевод, образующие самую переднюю часть пищеварительного тракта, обеспечивают проглатывание пищевого комка и его прохождение в зоб. У многих насекомых, в особенности у видов, питающихся жидкостями, к стенкам глотки прикрепляются мощные мышцы, образующие глоточный насос.
Зоб может служить местом хранения пищи и начального переваривания, которое осуществляется ферментами, проникающими сюда из средней кишки. Среди двукрылых и чешуекрылых зоб найден только на личиночных фазах развития (рис. 59, 5), а у имаго этих насекомых его функцию выполняет пищевой резервуар, который возникает как слепое выпячивание пищевода {рис. 59). Доказано, что у кровососущих двукрылых пищевой резервуар служит местом временного хранения поглощаемой воды или растительных соков, а кровь не заходит в него и непосредственно проникает в среднюю кишку [558, 559, 560]. У Calliphora erythrocephala всасываемая жидкая пища поступает в резервуар, но если к жидкой пище примешаны значи-
171
a
Рис. 58. Принципиальная схема строения кишечника насекомых. По Веберу [557].
а — анальное отверстие; г — глотка; з — зоб; з.к— задняя кишка; к — крипты; к.к — кардиальный клапан; м.с — мальпигиевы сосуды; м. с.ж — мандибулярная слюнная железа; п — пищевод; п.к — прямая кишка; п.кш — передняя кишка; пл.к — пилорический клапан; п.м— перит-рофическая мембрана; пр — провентрику-лус; п.с.эю — проток слюнной железы; р.к— ректальный клапан; р.о — ротовое отверстие; р. п — ротовая полость; р.с — ректальные сосочки; с — саливариум; с.эю — слюнная железа; с. к — средняя кишка; т.к — тонкая кишка.
172
тельные количества плотных частиц, то она проходит сразу в среднюю кишку [561].
Провентрикулус снабжен сильными мышечными стенками и выстлан изнутри толстой интимой с выступающими кутикулярными структурами в виде роговидных отростков, острых зубцов или плотных щетинок. Этот участок передней кишки служит либо для перетирания твердой пищи (у прямокрылых, тдраканов, жуков и Др.), либо для фильтрации жидкостей (у пчел).
В передней'кишке происходит главным образом механическая обработка пищи, подготавливающая последующие процессы ее переваривания и всасывания в среднем отделе кишечника. Передняя кишка отделена от средней кардиальным клапаном— складкой, свисающей в полость кишечника (рис. 58). Функции этого образования связаны с формированием перит-рофической оболочки.
В простейшем случае средняя кишка имеет вид прямой трубки, не подразделенной на вторичные отделы (рис. 58, 59, А—Г), однако у многих насекомых она удлинена и поэтому образует изгибы (рис. 59, К, Л) или, наоборот, сильно укорочена и превращена в мешкообразный орган (рис. 59, О). Эволюционный переход от типичного трубчатого кишечника к пищеварительному тракту, снабженному длинной, спирально закрученной средней кишкой, происходил параллельно и независимо в разных отрядах насекомых.
Характерно для средней кишки образование длинных пилорических придатков (рис. 59, 3) или коротких пальцевидных выростов — крипт (рис. 58, 59, Л, Г, £), которые служат и для увеличения поверхности и как вместилища симбиотических микроорганизмов. У медоносной пчелы Apis mellifera увеличение поверхности кишечника достигается путем образования кольцевых складок средней кишки [563].
Клетки эпителия средней кишки секретируют пищеварительные ферменты, всасывают продукты переваривания и выделяют перитрофическую оболочку. Свободные поверхности этих клеток, обращенные внутрь кишечника, несут палочковый слой (рабдориум), который состоит из неподвижных протоплазматических палочек (рис. 60). В течение жизни насекомого эпителиальные клетки снашиваются и возобновляются за счет размножения клеток регенерационных зон кишечника (рис. 61, р. к). Часто такие зоны находятся в криптах средней кишки.
В отряде клопов (Hemiptera) средняя кишка нередко дифференцируется на несколько хорошо обособленных вторичных отделов (рис. 59, Д, £). Рассмотрим функциональное значение этих отделов на примере черепашки Eurygaster integriceps. На схеме кишечника, показанной на рис. 60, видно, что у этого насекомого в состав средней кишки входят 4 отдела, которые различаются не только по их морфологии, но и по цитологиче-
173
174
ским картинам эпителиальных клеток. О. М. Бочарова-Месснер [564] показала, что выделение пищеварительных ферментов происходит только в первых трех отделах средней кишки, причем максимальная активность имеет место в клетках самого переднего ее отдела. Наибольшее количество клеток, всасывающих продукты переваривания, находится в III отделе. Последний, IV отдел средней кишки служит, главным образом, вместилищем симбиотических микроорганизмов, принимающих участие в процессах переваривания пищи. Только единичные клетки этого отдела могут секретировать пищеварительные ферменты.
Регенерационные клетки принимают участие в процессах преобразования среднекишечного эпителия во время линек и метаморфоза насекомых.
При неполном превращении, перед последней линькой нимфы на имаго, наблюдается отторжение и последующее переваривание части клеток средней кишки [565]. Мелкие регенерационные клетки, постепенно увеличиваясь, включаются в состав эпителиального слоя и заполняются гранулами пищеварительных ферментов. За счет этих клеток осуществляется не только восстановление эпителия, но и его рост от возраста к возрасту.
При полном превращении, от личинки к имаго, происходит смена всего эпителия средней кишки [566]. У питающейся гусеницы Tineola biselliella эпителий представлен удлиненными клетками, активно выделяющими пищеварительное ферменты (рис. 61, Л). У основания этих клеток расположены нефункционирующие регенерационные клетки.
Перед началом окукления регенерационные клетки приступают к митотическому делению, а гусеничный эпителий сжимается и отслаивается от стенок средней кишк,и (рис. 61, Б). На второй день после окукления клетки нового куколочного эпителия уже полностью сформированы и снабжены рабдориу-мом; они выделяют ферменты, растворяющие гусеничные клетки (рис. 61, В). Остатки погибающего гусеничного эпителия образуют так называемое «желтое тело» в полости средней
Рис. 59. Модификации строения кишечника у разных насекомых. Из Обен-бергера [562], по рисункам разных авторов.
На всех рисунках эктодермальная часть кишечника оставлена светлой, а эктодермальная часть пунктирована. I, II и III — передняя, средняя и задняя кишка; п.рз— пищевой резервуар; ф — фильтрационная камера (стрелками здесь и на схеме О показано движение воды через кишечник). Остальные обозначения, как на рис. 58. А — исходная схема строения кишечника насекомых. Б — гусеница Malacosoma arftericana (фитофаг, грызет листья). В — бабочка этого же вида (афаг). Г — жук Popillia japoni-са (фитофаг, грызет листья). Д — водяной клоп Nera cinerea (хищник). Е — наземный клоп Peliopelta abbreviata (фитофаг, сосет листья растений). Ж — самка комара Anopheles bifur catus (зоофаг, питается кровью). 3 — комар Ptychiptera contaminata (фитофаг, питается нектаром цветов). И — жук-плавунец Dytiscus marginalis (хищник). X —личинка мухи Drosophila obscura (фитофаг, питается на гниющих плодах). Л — муха-пестрокрылка Rhagoletis pomonella (фитофаг, питается нектаром цветов). М — схема одного из типов кишечника равнокрылых, имеющих фильтрационную камеру. Я —цикадка Tricentrus albomaculatus (фитофаг, сосет на стеблях растений). О — червец Lepidosaphes sp. (фитофаг, сосет-на листьях и ветвях деревьев).
175
Передняя
Задняя кишка Средняя кишка кишка
Рис. 60. Схема строения кишечника и эпителиальные клетки средней кишки вредной черепашки Eurygaster integriceps. По О. М. Бочаровой-Месснер [564].
I, II, III, IV — вторичные отделы средней’ кишки; в кружках — эпителиальные клетки, б — симбиотические бактерии; ж —капельки резервных жиров; п.о — перитрофическая оболочка; р — рабдориум; я — ядро.
Рис. 61. Среднекишечный эпителий комнатной моли Tineola biselliella на разных стадиях развития. По Лотмару [566].
А — питающаяся гусеница последнего возраста. Б — прекратившая питание коко-нирующаяся гусеница перед окуклением. В — куколка на 2-й день после линьки. Г — то же на 6-й день. Д — то же на 8-й день. Е — то же на 13-й день, г.э — гусеничный эпителий; ж.т — желтое тело; и.э — имагинальный эпителий; к.э — ку полочный эпителий; р.к — регенерационные клетки.
177
кишки. Процессы растворения желтого тела окончательно завершаются к 6-му дню развития куколки (рис. 61,Г).Кэтому времени ставший ненужным куколочный эпителий тоже начинает отслаиваться; под ним происходит формирование имаги-нального эпителия из интенсивно делящихся регенерационных клеток. На 8-й день после окукления имагинальные клетки освобождаются от покрывающей их «шкурки» из отмирающего куколочного эпителия (рис. 61, Д), а к 11 — 13-му дню они приобретают рабдориум (рис. 61, Е).
Развитие куколок зерновки Callosobruchus maculatus сопровождается подобными же процессами замещения личиночного эпителия временными куколочными, а затем и дефинитивными имагинальными клетками [567]. Вместе с тем у многих других насекомых из группы Holometabola куколочный эпителий очень слабо выражен или совсем отсутствует, и тогда среднекишечные клетки личинки прямо заменяются имагинальными клетками. Во всех этих случаях новый эпителий возникает из митотически делящихся регенерационных клеток.
Задняя кишка отделена от средней пилорическим клапаном, расположенным в том участке кишечника, где в него открываются органы выделения — мальпигиевы сосуды (рис. 58, пл.к). Клетки задней кишки покрыты хитиновой интимой, которая иногда образует шипы, зубцы и другие структуры.
У большинства насекомых задняя кишка включает в себя тонкую и прямую кишку, между которыми находится ректальный клапан (рис. 58, р.к). Степень обособления этих вторичных отделов различна в разных таксономических группах класса насекомых. Тонкая кишка, например, не выражена во многих семействах клопов (см. рис. 60).
Задняя кишка иногда дает массивные слепые отростки, которые могут служить для разных целей. У питающихся древесиной личинок сем. Tipulidae и Limoniidae непарный вырост тонкой кишки является «бродильной камерой»; по всей вероятности, здесь осуществляются процессы переваривания клетчатки. У жука-ксилофага Pentalobus barbatus вдоль задней кишки расположены 6 рядов из 14—18 слепых отростков, в которых переваривается клетчатка [568]. У кокцид р. Pseudococcus слепой отросток прямой кишки (ректальная ампула) вступает в связь с передней кишкой, образуя фильтрационную камеру, предназначенную для отцеживания и транспортировки воды.
Фильтрационная камера обнаружена у многих равнокрылых насекомых (отр. Homoptera) и у представителей одного семейства клопов (Phyllocephalidae) L В типичном случае эта
1 Обычно эти клопы в качестве подсемейства включаются в сем. Penta-tomidae, однако Миямото [569] считает необходимым выделить их в особое семейство из-за уникального для Hemiptera признака — наличия хорошо развитой фильтрационной камеры.
178
камера возникает на основе плотного срастания начала и конца средней кишки (рис. 59, Л4). Вода, содержащаяся в пище, диффундирует сквозь стенки фильтрационной камеры, минуя средний отдел кишечника и попадая сразу к началу задней кишки. В то же время освобожденные от воды питательные продукты, подлежащие всасыванию, в концентрированном виде проходят через среднюю кишку. Более сложная система приспособлений, отфильтровывающих воду из пищи, у Lepido-saphes sp. и у Tricentrus albomaculatus (рис. 59, Н, О).
Основные задачи задней кишки — это отсасывание воды из пищи и формирование экскрементов. Для отсасывания воды могут служить особые органы — ректальные железы (ректальные сосочки), которые в числе 3, 4 или 6 опухолевидных выпуклостей располагаются в заднем отделе прямой кишки. Сухопутные насекомые часто живут в условиях Недостаточной влажности, и тогда активная работа ректальных желез помогает восстанавливать запасы воды в организме. В связи с этим степень развития ректальных желез наибольшая у тех видов насекомых, которые нуждаются в сохранении воды. У перепончатокрылых удельная площадь ректальных желез по отношению к общей поверхности задней кишки изменяется пропорционально количеству воды в теле насекомого [570]. У водных клопов железистая область задней кишки также сильно развивается, приобретая функцию поглощения минеральных солей из пищи [571].
Тип пищи часто накладывает отпечаток на морфологию органов пищеварения. Для насекомых-сапрофагов, питающихся относительно трудно усвояемой пищей, характерно увеличение секретирующей поверхности кишечника за счет его удлинения, появления «бродильной камеры» в задней кишке или мощных пилорических придатков многочисленных складок-крипт в области средней кишки. Приспособление к питанию древесиной сопровождается конвергентными морфофизиологическими адаптациями пищеварительной системы даже в далеких систематических группах насекомых. Например, благодаря использованию почти одинаковых трофических ниш сходные видоизменения в строении кишечника развились в процессе эволюции личинок в сем. Tipulidae, Lucanidae, Scarabaeidae и Mordellidae [572]. '
При внекишечном пищеварении ферменты выделяются наружу и в их секретировании принимают активное участие клетки слюнных желез. Поэтому в группе круглошовных двукрылых (Cyclorrapha) пилорические придатки средней кишки хорошо развиты только у личинок-сапрофагов, у которых преобладающее значение имеет внутрикишечное переваривание пищи. Слюнные железы этих личинок сравнительно невелики. В то же время у истинных фитофагов, у которых внекишечное пищеварение наиболее ярко выражено, слюнные железы за
179
метно крупнёе, а пилорические придатки кишечника или очень короткие, или совсем отсутствуют [573]. Усиленное развитие слюнных желез у личинок-фитофагов по сравнению с сапрофагами наблюдается и в подотряде длинноусых двукрылых [574].
У фитофагов и хищных насекомых кишечник, как правило, простой, относительно короткий, без пилорических придатков, крипт или слепых отростков. В отряде двукрылых (Diptera) особенно хорошо прослеживается упрощение в строении кишечника при переходе от сапрофагии к хищничеству или к питанию живыми растительными тканями. Так, например, у личинок-фитофагов Tipula paludosa отсутствует «бродильная камера», характерная для личинок-сапрофагов из этого же рода [575].
Все приведенные выше примеры показывают, что морфология пищеварительных органов насекомых адаптирована к роду пищи. Однако, несмотря на значительное количество таких примеров, гораздо чаще наблюдается сходство в строении кишечников близких групп независимо от способа их питания. Личинки комара Gnaphomyia sp. не хищничают, а питаются различными гниющими остатками под корой, но имеют такой же тип кишечника, как и хищники из этого же семейства [575].
Поэтому строение кишечника может служить таким же хорошим индикатором систематического положения насекомого, как и другие морфологические признаки. Например, у клопов такие признаки, как наличие крипт в средней кишке или ректальных желез в задней кишке, обособление тонкой кишки и форма дополнительных слюнных желез оказываются в высшей степени характерными для каждого семейства или группы близких семейств, несмотря на разнообразие пищевых режимов в пределах отр. Hemiptera [569]. Сходные закономерности, отражающие единый план строения кишечника в отдельных таксономических группах, можно отметить и у других насекомых. Так, в сем. Scarabaeidae навозники подсем. Coprinae вообще лишены крипт средней кишки, Melolonthinae обладают 2 криптами, a Rutelinae — или одним рядом маленьких крипт, или 4 обособленными криптами [576]. Расположенные продольными рядами крипты обнаружены у Dynastinae (2 ряда) и у Cetoniinae1 (4 ряда). У представителей близкого к Scarabaeidae сем. Lucanidae имеется только 1 ряд крипт средней кишки.
Таким образом, строение пищеварительных органов насекомых формируется на основе исторически сложившегося типа кишечника, свойственного данной таксономической группе. Приспособление к новым условиях питания сопровождается в общем незначительными модификациями кишечной трубки (вариации ее длины, появление или исчезновение слепых выростов и т. д.) и не приводит к существенному изменению ее морфологического состава.
180
Слюнные железы и их функции. Все три пары челюстей ротового аппарата — мандибулы, максиллы и нижняя губа — имеют связанные с ними железы, которые соответственно получают названия мандибулярных, максиллярных и лабиальных. Подобные образования, принимающие участие в питании или пищеварении, мы будем называть слюнными железами и рассматривать их в данном параграфе. Чаще всего в качестве слюнных функционируют лабиальные железы. Но иногда железы челюстей выполняют иные функции, не имеющие отношения к перевариванию пищи; в таких случаях они не рассматриваются как слюнные железы.
Строение и функции слюнных желез исключительно разнообразны, поэтому очень трудно дать общую оценку их роли в пищеварении у всех насекомых. Такую задачу легче решить применительно к отдельным группам или даже видам насекомых, выбранным в качестве типичных примеров.
У гусениц лабиальные железы превращены в шелкоотделительные органы. Роль слюнных желез могут выполнять только мандибулярные железы. У Galleria mellonella клетки этих желез выделяют жиры и стерины, а в цитоплазме клеток найдены ферменты, расщепляющие жировые соединения и эфиры фосфорных кислот [577]. У гусениц Bombyx rnori мандибулярные железы содержат карбогидразы, способные гидролизировать разнообразные углеводы — от простых дисахаридов до сложных полисахаридов типа крахмала и декстринов [578]. На има-гинальной стадии развития чешуекрылых мандибулярные и мак-силлярные железы исчезают, а шелкоотделительные органы перестраиваются и превращаются в слюнные железы бабочки [579].
У тараканов Periplaneta americana и Blatta orientalis имеется только одна пара слюнных желез — это гроздевидные лабиальные железы, расположенные по обеим сторонам тела и открывающиеся общим протоком у основания гипофаринкса (рис. 62). Каждая гроздь снабжена специальным резервуаром.
Клетки слюнной железы у Р. americana дифференцируются в двух основных направлениях: 1) пирамидальные, выделяющие ферменты, и 2) гребешковые, вырабатывающие муциновый секрет [581]. Слюна, попадающая в рот, представляет собой смесь ферментов (карбогидраз, протеаз и липаз), муцина и воды. Выделение слюны в ротовую полость происходит под влиянием импульсов нервных клеток, обслуживающих слюнные железы [582]. Полагают, что в передаче нервных влияний на клетки слюнной железы принимает участие адреналин [583]. Вода, входящая в состав слюны таракана, поступает в нее из резервуара, который адсорбирует воду из гемолимфы.
Лабиальные слюнные железы большинства равнокрылых (Homoptera) и полужесткокрылых (Hemiptera) функционируют в тесной связи с органами питания этих насекомых. Обычно
181
г
каждая железа состоит из главной и придаточной долей; последняя открывается в проток главной железы. В слюнных железах образуются пищеварительные ферменты, расщепляющие углеводы, а у ряда видов и ферменты, расщепляющие белки. У клопа Leptopterna dolobrata протеазы в слюнных железах отсутствуют у личинок младших возрастов; они появляются лишь в старших возрастах и у имаго, причем только у самок [584]. Самки этого клопа в начале созревания яиц разыскивают корм, богатый белком, необходимый для созревания яиц.
Рис. 62. Правая слюнная железа таракана Blaitd orientalis. По Миаллу и Денни [580].
о.в.о — общее выводное отверстие слюнных желез и резервуаров; о.п— общий проток слюнных желез; п.п.ж — проток правой слюнной железы; п. п. р — проток правого резервуара; р — резервуар; с.ж — слюнная же-
леза.
Усвоение белков самками требует наличия в слюне протеаз, а у самцов, которые не испытывают повышенной потребности в белковой пище, соответствующие ферменты не выделяются клетками слюнных желез. Липаза обнаруживается только в железах некоторых хищных клопов [585], а у растительноядных видов, например у Oncopeltus fasciatus [586], подобный фермент продуцируется только клетками средней кишки и отсутствует в слюнных железах.
Выделения слюнных желез тлей могут служить для апробирования субстрата перед началом питания. Бескрылые живородящие самки свекловичной тли (Aphis fabae) наносят несколько уколов в разных участках листа, прежде чем поселиться на нем. При таких пробных уколах тли выделяют слюну в пространство между растительными клетками [587]. По-видимому, при пробном уколе тли вводят в растение пектиназу — фермент, растворяющий клеточные оболочки. Мечение слюны тлей радиоактивным рубидием (Rb86Cl) показало, что 182
слюна вводится в растение не только во время пробных уколов; она непрерывно накачивается в пищевой субстрат в течение всего периода питания [588]. У галлообразующих насекомых выделение слюны во время питания может вызывать эффект ненормального роста растительных клеток, принимающих участие в формировании галла [589].
Соединения, препятствующие коагуляции крови позвоночных, выделены из слюнных желез клопов-кровососов сем. Re-ouviidae [590, 591]. У Rhodnius prolixus обнаружено два вещества с подобным действием: проликсин-0 в кишечнике и про-ликсин-S в слюнных железах. Первый проликсин угнетает действие тромбина на белок крови фибриноген, а второй подавляет процесс образования или активирования тромбина1. Физиологическое значение таких веществ очевидно: они предотвращают свертывание крови и обеспечивают ее свободное поступление в кишечник клопа.
Лабиальные слюнные железы прекрасно выражены у двукрылых (Diptera) как в личиночном, так и во взрослом состоянии. У самок комаров р. Anopheles каждая железа состоит из трех лопастей — одной медиальной и двух латеральных. Медиальная лопасть секретирует вещество, вызывающее агг-, лютинацию эритроцитов и предотвращающее коагуляцию крови [592]. Функция ее, следовательно, аналогична функциям целой слюнной железы кровососущих клопов. Латеральные лопасти выделяют токсический агент, химическая природа и механизм действия которого не выяснены. Антикоагулирующие, агглютинирующие и токсические вещества присутствуют лишь в слюнной железе самок комаров, питающихся кровью позвоночных. Ни одно из этих веществ не обнаружено у самцов р. Anopheles которые питаются лишь нектаром цветов [593]. Присутствие аптикоагулирующего соединения в слюнной железе мух це-це (р. Glossina), так же как и у самок комаров, представляет собой физиологическую адаптацию к питанию кровью позвоночных. После хирургического удаления слюнных желез у мух це-це их укусы становятся безболезненными, а насосанная кровь свертывается и закупоривает кишечник мухи [594]. В ряде случаев слюна кровососущих двукрылых обладает гемолитических действием: она растворяет гемоциты поглощаемой крови [595].
Наиболее сложную систему слюнных желез имеют перепончатокрылые (Hymenoptera): кроме обычного набора желез,
1 Как известно, коагуляция крови позвоночных представляет собой процесс ферментативного превращения растворимого в плазме крови фибриногена в нерастворимый фибрин, который и выпадает из раствора в виде рыхлой войдокообразной массы. Ферментом, вызывающим это превращение, является тромбин, который образуется из протромбина при соприкосновении крови с поврежденными тканями. Переход протромбина в тромбин осуществляется под влиянием специального активатора — тромбокиназы.
183
связанных с челюстями, они снабжены еще и глоточными железами, открывающимися в глотку. У таких общественных перепончатокрылых, как муравьи (Formicidae) или некоторые пчелиные (Apidae), следует различать собственно слюнные железы, секрет которых способствует перевариванию пищи, и аллотропические железы, выделяющие питательные вещества для подкармливания личинок или других членов колонии.
У муравьев для выкармливания цариц и личинок половых особей используется секрет лабиальных желез [596]. Глоточные железы также функционируют как аллотрофические образования, и их выделения или распределяются между бесполыми членами колонии, когда муравьи подкармливают друг друга [597], или употребляются в качестве корма личинок [598]. Муравьи имеют и мандибулярные железы, открывающиеся у основания жвал. Считается, что эти железы выделяют вещества, используемые для склеивания частиц почвы при постройке гнезда, или пахучие вещества.
У одиночных и общественных пчелиных найдено четыре пары интересующих нас желез: мандибулярные, глоточные и две пары лабиальных, из которых одна лежит в груди, а другая — в голове [599]. Грудные и головные лабиальные железы, видимо, выполняют разные функции, так как первые секретируют белок, а вторые — липиды [600]. Впрочем, функциональное значение этих образований остается невыясненным. Глоточные железы пчел не гомологичны глоточным железам муравьев [601], поэтому более правильно их называть гипофарингеальными железами. Клетки гипофарингеальных желез продуцируют ферменты, принимающие участие в превращении нектара в мед [602]. Мандибулярные железы, как и у муравьев, не имеют отношения к перевариванию пищи; они выделяют кристаллическое вещество, угнетающее развитие маток в тех ульях, где уже имеется матка.
Механическая обработка и продвижение пищи по кишечнику. Механическая обработка твердой пищи происходит в той или ..иной степени во всех отделах кишечника. Она начинается с отгрызания кусочка' пищевого субстрата ротовыми органами и заканчивается формированием экскрементов в задней кишке. Первоначальное размельчение пищи, подготавливающее ее химическое расщепление, происходит в передней кишке: иногда в зобе, но в значительно большей степени в провентрикулу-се. Поэтому среди жуков подотр. Polyphaga у хищников и ксилофагов провентрикулус развит сильнее, чем у видов, питающихся листьями растений, т. е. в механическом отношении менее грубой пищей [603].
Последовательные сокращения мышц, покрывающих кишечные стенки, обеспечивают продвижение пищи вдоль кишечника, ее перемешивание и пропитывание ферментами. В области зоба у таракана Periplaneta fuliginosa установлены три типа
184
д б
Рис. 63. Перистальтические (4) и антиперистальтические (Б) движения кишечника у личинок комаров р. Anopheles. По Джонсу [605].
з. к —задняя кишка; "с. к —средняя кишка. Стрелками указаны направления движения пищи.
движений — перистальтические, антиперистальтические и сильные асинхронные сокращения [604]. Эти же основные типы движений характерны для других насекомых и для всех отделов пищеварительного тракта.
Особенно большую роль в процессах пищеварения шграют перистальтика и антиперистальтика кишечника. Перистальтические движения заключаются в том, что сокращения кольцевой мускулатуры и вызванные ими сужения кишки на одном участке сочетаются с расслаблениями мышц и расширением просвета кишечника на соседнем участке, расположенном позади первого (рис. 63, Л). В результате пищевой комок из суженного участка перемещается в задний расширенный. Таким путем происходит передвижение пищевой массы по мере ее переваривания. Этими же движениями кишечника обеспечивается выталкивание экскрементов из прямой кишки наружу.
Антиперистальтические движения кишечника происходят так же, как и перистальтические, но совершаются в обратном направлении, поэтому пищевая масса транспортируется сзади наперед (рис. 63, Б). У термитов переваривание клетчатки осуществляется симбиотическими простейшими, которые заселяют заднюю кишку. Продукты переваривания антиперис-тальтическими движениями кишечника передвигаются в среднюю кишку и всасываются здесь. Возвращение переваренной пищи из заднего отдела кишечника в его передние отделы наблюда
лось также у нимф стрекоз [606], у личинок комаров [605, 607J и у многих других насекомых в имагинальной или в личиночной фазе.
Перистальтика кишечника саранчи Schistocerca gregarict управляется желудочным ганглием стоматогастрической нервной системы [608]. После удаления этого ганглия перистальтические движения вначале прекращаются, а затем возобновляются лишь в виде редких и мелких сокращений. Удаление
185
'Других участков нервной системы не сказывается на движениях кишечника. Следовательно, мускулатура кишечной стенки саранчи способна к автоматическим сокращениям, но их ритм и амплитуда определяются какими-то нейронами, расположенными в желудочном ганглии.
Скорость прохождения пищи через кишечник насекомых является видовым признаком и не может быть предсказана на основании анализа кормового режима или соотношения длины .тела и пищеварительного тракта. Даже у близких видов насекомых общее время пребывания пищи в кишечнике неодинаково. Например, у Periplaneta americana пищевые массы оформляются в экскременты и выходят из кишечника через 20 ч после питания, а у другого, близкого, вида Р. australasiae — через 7 ч [609]. У Blatella germanica пища проходит через кишечник всего за 3 ч.
Обычно пища довольно быстро проходит переднюю кишку, значительно дольше задерживаясь в средней и задней кишке. Однако у общественных насекомых, у которых содержимое зоба используется для подкармливания других членов колонии, пища особенно долго хранится в передней кишке, а иногда даже подвергается здесь химической переработке с целью ее длительной консервации. Как известно, общественные осы выкармливают личинок полупереваренной пищей, которая отрыгивается из зоба. В связи с этим у некоторых из них (Paraves-pula germanica и Р. vulgaris) отмечено интересное явление зависимости скорости переваривания пищи от числа насекомых в подопытной группе [610]. У одиночных рабочих, после их изоляции из гнезда, время пребывания пищи в кишечнике составляет в среднем 6,6 дня, а у рабочих, сохранивших трофическую связь с личинками в нормальном гнезде, — 35,6 дня. Осы-самцы, не выкармливающие личинок, обнаруживают одинаковую длительность задержки пищи при любой численности подопытной группы, в гнезде и вне гнезда.
Замедленное переваривание пищи характерно не только для общественных насекомых, но и для кровососов, у которых наличие гонотрофических циклов создает тесную корреляцию во времени процессов пищеварения и размножения.
Перитрофическая оболочка и ее функции. Перитрофическая оболочка в виде тонкой пленки, обволакивающей пищевую массу в средней кишке, найдена у многих видов насекомых, а также у онихофор, ракообразных и многоножек [611]. Основная часть оболочки состоит из белков и хитина, по всей вероятности тесно связанного с белком.
Среди насекомых известно два основных типа образования перитрофической оболочки. При обычном типе, обнаруженном почти во всех отрядах, в ее формировании участвуют все клетки средней кишки. Перитрофическая оболочка обычного типа, как правило, многослойная, но у двукрылых она может быть 186
и однослойной [612]. Ее образование происходит только в период принятия пищи или даже после этого, когда пища попадает в кишечник.
При зональном типе оболочки, свойственном всем исследованным личинкам двукрылых и взрослым высшим двукрылым из группы Cyclorrapha, она продуцируется эпителиальными клетками, расположенными в ограниченном участке провентри-кулуса — вблизи кардиального клапана. На фазе личинки оболочка всегда имеет вид однослойной трубки, а у имаго эта трубка может состоять как из одного, так и из двух или даже трех концентрических слоев [612, 613].
Так как в кишечнике членистоногих нет желез, выделяющих слизь, перитрофическая оболочка защищает от поранений нежную эпителиальную стенку средней кишки при движении твердой пищи. Ссылаясь на защитную функцию этой оболочки, многие авторы полагали, что она обязательно должна присутствовать у тех из них, которые питаются жидкостями. Однако уже давно было известно, что перитрофическая оболочка образуется в кишечнике кровососущих двукрылых [594, 614], хотя в пищеварительном тракте этих насекомых нет твердых частичек, способных повредить эпителиальные клетки. У цикадки Cicadella viridis имеется обычная многослойная оболочка, обволакивающая жидкую пищу перед ее вступлением в фильтрационную камеру [615]. Уотерхауз [616] нашел перитрофиче-скую оболочку у многих бабочек, для которых ее отсутствие считалось ранее чуть ли не таксономическим признаком отряда.
По всей вероятности, наличие перитрофической оболочки характеризует относительно более примитивное состояние пищеварительной системы. Ее отсутствие обусловливается очень сильным сужением пищевого рациона, приспособлением насекомых к питанию однородной, легко перевариваемой пищей. Поэтому перитрофическая оболочка особенно хорошо развита у полифагов, а в группе олигофагов — у насекомых, грызущих листья, потребителей древесины и сапрофагов. Среди хищников способность к ее образованию утрачивается при внекишеч-ном пищеварении (у жуков сем. Carabidae и Dytiscidae). Полная редукция перитрофической оболочки наблюдается у ряда монофагов, а также у насекомых, питающихся только нектаром цветов (самцы кровососущих комаров), или у афагов (имаго шелкопрядов).
Связь присутствия перитрофической оболочки с характером пищевой специализации и экологией вида объясняется ее избирательной проницаемостью по отношению к различным химическим соединениям. По данным Д. П. Жужикова [617] перитрофическая оболочка высших мух легко проницаема для воды и минеральных солей. Из углеводов свободно проходят через нее только моносахариды (глюкоза) и некоторые диса-
187
хариды (мальтоза). Однако другие дисахариды (лактоза) проникают с трудом, а для полисахаридов она вообще непроницаема. Из продуктов белкового гидролиза только дипептиды и аминокислоты способны проникать через целую оболочку, а пептоны и белки ею задерживаются. Особый интерес представляет возможность проникновения пищеварительных ферментов через перитрофическую оболочку. При этом обнаруживается односторонняя проницаемость оболочки; например фермент, расщепляющий полисахариды (амилаза), сравнительно легко проходит через нее от эпителиальных клеток в полость кишечника, но практически не выходит в обратном направлении.
Таким образом, перитрофическая оболочка может иметь значение весьма эффективного фильтра, пропускающего к кишечнику только продукты полного расщепления пищевых веществ (моносахариды, аминокислоты и др.) и задерживающего непереваренные остатки пищи. Кроме того, при ее ограниченной проницаемости перитрофическая оболочка, несомненно, представляет собой непроходимый барьер для микроорганизмов, попадающих в кишечник вместе с пищей, и тем самым защищает организм насекомого от возможной инфекции.
Пёрёваривание и всасывание пищи в средней кишке. Средняя кишка служит основным местом переваривания и всасывания пищи, подвергавшейся до этого лишь механической обработке в передней кишке и первоначальной химической обработке секреторными продуктами слюнных желез.
Источниками ферментов, осуществляющих расщепление пищевого материала, являются эпителиальные клетки стенок средней кишки (мезентериальный эпителий). Продуцируемые ими ферменты распадаются на три основные группы: 1) карбогидразы, гидролизующие сложные сахара (поли- и дисахариды) до простых моносахаридов; 2) протеазы (протеолетиче-ские ферменты), гидролизующие белки до дипептидов и аминокислот; 3) липазы, отщепляющие жирные кислоты от молекул жиров и жировых соединений. Только продукты окончательного распада углеводов, белков и жиров могут поглощаться клетками средней кишки или прямо диффундировать в гемолимфу через кишечные стенки, включаясь в общий цикл биохимических реакций, протекающих в жировом теле и в других-органах тела насекомого.
Секреция пищеварительных ферментов у личинок комаров не сопровождается какими-либо гистологическими изменениями кишечного эпителия [618], но чаще такие изменения имеют место.
При апокринной секреции продукты выделения образуются в виде капелек внутри цитоплазмы, а затем транспортируются к вершине клетки и выходят в полость кишечника, раздвигая реснички рабдориума (рис. 64, Л). Одна из разновидностей 188
Рис. 64. Схема типов секреции пищеварительных ферментов клетками средней кишки. По Веберу [557].
4 — апокринная, Б — мерокринная, В — голокринная, п.с — палочковый слой рабдориум; р.к — регенерационные клетки; с.к — клетки, секретирующие ферменты.
оо
СО
секреции этого типа описана у тараканов, у которых кислая фосфомоноэстераза (фермент из группы липаз) локализуется в специальных вакуолях, содержащих митохондрии и эндоплазматический ретикулум [619]. Накапливающийся в вакуолях фермент постепенно выводится в кишечник.
При мерокринной секреции продукты выделения выходят из клетки вместе с окружающим их небольшим участком цитоплазмы (рис. 64, Б). Этот тип секреции наиболее распространен у насекомых; у некоторых из них (например, у нимф стрекоз) он является единственным способом выделения пищеварительных ферментов в средней-кишке [606].
При голокринной секреции вся клетка или большая ее часть, содержащая ядро, выбрасывается в полость кишечника вместе с накопленными в ней ферментами (рис. 64, В). В таком случае клетка освобождает секреторные продукты в момент ее гибели. Погибшие клетки затем заменяются новыми эпителиальными клетками, образующимися в регенерационных зонах кишечника. Голокринная секреция часто используется лишь как дополнительный способ освобождения ферментов, наряду с другими двумя способами секреции. Однако в сем. галлиц (Cecidomyiidae) у личинок-фитофагов секреция только голокринная, а у детритофагов или ксилофагов — как голокринная, так и мерокринная [574].
Тип секреции клеток средней кишки не всегда является видовым признаком, а зависит от функционального и возрастного состояния организма. У Periplaneta americana при нормальном питании наблюдается и мерикринная, и голокринная продукция ферментов, причем второй тип секреции осуществляется главным образом старыми клетками, пережившими ряд мерокринных циклов секреторной активности [620]. После нескольких дней голодания способность таракана к голокринной секреции временно утрачивается и вновь восстанавливается лишь при регулярном поступлении пищи.
При голодании насекомых наблюдается ослабленная «спонтанная» секреция пищеварительных соков, а поглощение пищи вызывает заметное повышение ферментативной активности. Гистологическими исследованиями показано, что у голодных насекомых почти 90% клеток средней кишки находятся в покоящемся состоянии, а после приема пищи от 50 до 99% клеток выделяют ферменты цо типу мерокринной и голокринной секреции [621].
Присутствие пищи в кишечнике может оказывать прямое и непосредственное влияние на секретирующие клетки мезентериального эпителия. Такой простой механизм регуляции активности ферментов описан у таракана Leucophaea maderae [622]. У этого объекта активность протеаз увеличивается при питании белками,- возрастая пропорционально количеству пищи, попадающей в среднюю кишку. Удаление головных, ганг
190
лиев или мозговых желез (corpora cardiaca и с. allata), а также разрушение межцеребральных участков мозга в области расположения нейросекреторных клеток, не оказьь вает никакого влияния на продукцию протеолитических ферментов.
Другой способ регуляции ферментативной активности средней кишки используется азиатской саранчой Locusta migrato-ria и мухой це-це Glossina palpalis. У саранчи выделение протеаз и карбогидраз стимулируется пищей, но этот эффект проявляется только при продолжительном питании [623, 624]. Протеолитическая активность кишечника возрастает не сразу, а лишь на 3-й день после начала питания. Такая задержка в стимуляции секреторной деятельности мезентериального эпителия свидетельствует о том, что процессы синтеза и выделения ферментов контролируются гормональной системой.
У мухи це-це активность протеазы зависит от объема поглощенной пищи (крови, разведенной в физиологическом растворе). При заполнении зоба жидкой пищей в средней кишке выделяется неактивный профермент, который под влиянием химических агентов, содержащихся в крови, быстро превращается в активную протеазу [625]. Поскольку между зобом и средней кишкой нет прямой нервной связи, можно думать, что растягивание стенок зоба, действуя через нейроэндокринную систему, вызывает секретирование профермента клетками мезентериального эпителия.
Убедительные доказательства участия гормонов в регуляции протеолитической активности средней кишки были получены при изучении динамики процессов пищеварения в ходе постэмбрионального развития насекомых. Вследствие перестроек, претерпеваемых эпителием средней кишки при метаморфозе (см. рис. 61), активность протеаз кишечника резко подавляется в период окукления и возрастает вновь только после отрождения взрослого насекомого. По всей вероятности, подъем ферментативной активности на имагинальной стадии вызывается одним из гормонов, регулирующих метаморфоз и созревание половых желез.
У мухи це-це продукция этого гормона стимулируется заполнением зоба воздухом, который заглатывается мухой при выходе ее из пупария [626]. В итоге протеолитическая активность средней кишки увеличивается почти в 3 раза, но после отделения лигатурой головы от груди она медленно падает, опускаясь ниже достигнутого уровня. В этом случае можно повысить активность ферментов путем введения в грудь экстрактов мозга от других мух.
У имаго мучного хрущака Tenebrio molitor быстрое увеличение протеолитической активности средней кишки происходит в первые дни после выхода из куколки, достигая максимума на 5—6-е сутки [627]. Однако после декапитации куколок за
191
день до линьки на имаго активность протеаз постоянно находится на крайне низком уровне, характерном для куколочкой стадии, и не повышается у отрождающихся жуков. Очевидно, именно в голове находится гормональный центр, стимулирующий секреторную деятельность мезентериального эпителия.
Точная локализация этого центра была установлена в опытах Томсена и Мёллера [628] на мухах Calliphora erythrocephala, у которых, при условии питания мясной пищей, актив-
ность протеаз достигает максимума на 3-й день после вылупления имаго (рис. 65, а). Авторами показано, что удаление corpora allata приводит лишь к некоторому снижению ферментативной активности (рис. 65, б), а удаление нейросекреторных клеток мозга, при сохранении с. allata, особенно сильно сказывается на количестве протеаз, секретируемых клетками средней кишки (рис. 65, в). Предполагается, что гормон нейросекреторных клеток, играющий важную роль в регуляции метаморфоза насекомых, в то же время принимает участие в контролировании процессов белкового синтеза, что находит свое отражение в подавлении синтеза ферментов после выключения источника гормона.
Рис. 65. Влияние мозга и мозговых желез на активность протеаз кишечника в имагинальный период развития мухи Calliphora erythrocephala. По Томсену и Мёллеру [628].
Объяснения в тексте.
Всасывание продуктов переваривания может осуществляться в разных участках средней кишки, в зависимости от вида насекомого и природы усваиваемых веществ. У таракана В1а-berus fuscus всасывание меченного по углероду фенилаланина происходит по всей поверхности мезентериального эпителия [629]. Однако у саранчи Schistocerca gregaria аминокислоты и углеводы быстро поглощаются в области слепых придатков средней^кишки (рис. 66) и гораздо медленнее усваиваются в других участках кишечника [630, 631]. У колорадского жука (Leptinotarsa decemlineata') углеводы усваиваются в передней и средней части, а жиры — только в средней части мезентери-192
ального эпителия [632]. Наконец, у личинок комаров углеводы поглощаются в задней половине средней кишки (рис. 67, А, /), а жиры — в ее передней половине (рис. 67, 5, /)у
Продукты расщепления химических компонентов пищи усваиваются кишечником либо путем активного поглощения
и накопления резервных питательных веществ в его клетках, либо путем диффузии этих веществ через стенки кишечника в гемолимфу. В обоих случаях всасываемые химические соеди
нения в конечном счете передаются трофическим клеткам гемолимфы и разносятся по всему телу насекомого.
По данным Уигглсу-орса [633] скармливание личинкам комаров р. Ае-des глюкозы, фруктозы, аланина или глутаминовой кислоты ведет к накоплению гликогена в клетках, расположенных в задней половине средней кишки (рис. 67, Л, 2). Очевидно, эти клетки обладают способностью синтезировать полисахариды (гликоген) из всасываемых ими моносахаров или аминокислот. При питании личинок сорбозой, арабинозой или рамнозой гликоген в этих клетках не появляется. Всасывание жирных кислот, изученное Де Бой-сезоном [634] на личинках комаров р. Culex, приводит к накоплению капелек жира в клетках передней половины средней кишки (рис. 67, Б 2).
По-видимому, у всех
Рис. 66. Всасывание глюкозы в разных отделах кишечника саранчи Schistocerca gregaria. По Трехерне [630].
Л — кишечник саранчи: з.к.— задняя кишка; м.с — мальпигиевы сосуды; п.к— передняя кишка; с.к — средняя кишка; с.п — слепые придатки средней кишки. Б—поглощение глюкозы в разных отделах кишечника. Пунктир — граница между передней, средней и задней кишкой. Раствор глюкозы 0,02 ммоль/л вводился в кишечник через анальное отверстие. Время после введения глюкозы: 1—5 мин, 2—15 мин, 3—1 ч.
насекомых значительные количества
глюкозы, не поглощенной мезентериальным эпителием, диффундируют в гемолимфу через стенки средней кишки и ее слепых придатков. Движущей силой такой диффузии является разность концентраций моносахарида в полости кишечника и в гемолимфе. Трехерне [630], изучая поглощение глюкозы в пищеварительной системе Schistocerca gregaria, показал, что
7 198
193
попадающая в гемолимфу глюкоза сразу же превращается в дисахарид трегалозу, и благодаря этому превращению постоянно поддерживается градиент концентрации сахара по обе стороны кишечной стенки. У гусениц Bombyx mori глюкоза также выходит из кишечника путем пассивной диффузии и не может абсорбироваться против концентрационного градиента [635]. Следовательно, перенос углеводов из просвета кишечника в гемолимфу не связан с активным транспортом молекул через биологические мембраны, требующим затрат энергии.
Аналогичный вывод может быть сделан и в отношении механизма всасывания аминокислот. После введения меченных по
Рис. 67. Усвоение углеводов (4) и жиров (Б) клетками средней кишки у личинок комаров. По Уигглсорсу [633] и Де Бойсезону [634]. '
/ — окрашивание йодом кишечника личинки, накормленной крахмалом и гликогеном; 2 — накопление гликогена клетками средней кишки; 3 появление капель жира в переднем отделе средней кишки п?сле кормления личинок оливковым маслом; 4 — капельки жира в клетках средней кишки, г — гликоген; ж— жировые капли; з.к.— задняя кишка; м. с. — мальпигиевы сосуды; п.к — передняя кишка; п.с — палочковый слой; ел — средняя кишка; с.п— глепые придатки средней кишки.
194
углероду глицина или серина в кишечник Schistocerca gregaria наблюдается быстрое уменьшение их содержания в средней кишке и в особенности в ее слепых придатках [631]. Если в этих опытах используются такие же концентрации аминокис
лот, в каких они присутствуют в гемолимфе, то происходит быстрый обмен аминокислотами через стенки средней кишки, по общее их содержание в кишечнике всегда поддерживается на высоком уровне (рис. 68). Следовательно, в отсутствии концентрационного градиента аминокислоты легко и быстро могут
проходить внутрь кишечника или выходить из него. Только в том случае, если существует концентрационный градиент аминокислот по обе стороны кишечной стенки, они выносятся с .током воды в гемолимфу, и концентрация этих соединений в средней кишке неуклонно снижается. Проникновение аминокислот через кишечную стенку происходит не только путем простой их диффузии. У Вот-byx rnori транспортирование валина из кишечника в гемолимфу, видимо, осуществляется х каким-то химическим соединением, которое
Время, мин
Рис. 68. Динамика обмена аминокислотами между слепыми придатками средней кишки и гемолимфой у саранчи Schistocerca gregaria.
По Трехерне [631].
1 — изменения общего содержания данной аминокислоты в полости кишечника;
2 — изменения содержания меченной по углероду аминокислоты, введенной в кишечник в такой же концентрации, в какой она содержится в гемолимфе.
играет роль переносчика
этой аминокислоты [636]. Функции задней кишки. Можно считать общим правилом,
что процессы переваривания пищи полностью завершаются в средней кишке насекомых, а задняя кишка, не принимая уча-
стия в этих процессах, служит для накопления непереваренных пищевых остатков в целях оформления их в виде экскрементов (фекалггев). Действительно7, пищеварительные ферменты в задней кишке обнаруживаются очень редко. Например, Е. Н. Павловский и Э. Я. Зарин [563], работая с пчелами Apis mellifera, нашли здесь единственный фермент — каталазу и то лишь во второй половине зимовки. Зимующие пчелы не выделяют экскрементов, поэтому появление каталазы в их задней кишке можно рассматривать как приспособление, предотвращающее гниение каловых масс, скопившихся в задней кишке.
В состав задней кишки обычно входят два участка пищеварительной системы насекомых: тонкая и прямая кишка. Основные функции задней кишки — формирование экскрементов
195
и отсасывание воды из непереваренных остатков пищи — выполняются, видимо, обоими ее участками.
Впрочем, роль тонкой кишки в этих процессах совсем не изучалась физиологами. У пчелы эпителий в данном участке кишечника имеет железистый характер [563], но секретируемые им вещества остаются неизвестными. У термитов и некоторых других насекомых тонкая кишка может служить вместилищем симбиотических микроорганизмов, играющих важную роль в процессах переваривания клетчатки.
Рис. 69. Электронная микрофотография поверхностного участка одной из абсорбирующих воду клеток ректальной железы мухи Calliphora eryth-rocephala. По Гупта и Бэрриджу [639].
к — кутикулярная выстилка прямой кишки; м — митохондрии; м.п — митохондриальная помпа; с.т—система трубочек, образованных впячивапием клеточной мембраны внутрь цитоплазмы. Увеличение 20 000.
Наиболее важную функцию прямой кишки составляет поглощение (реабсорбция) воды и минеральных соединений из экскреторных продуктов или непереваренных остатков пищи. Эта функция выполняется ректальными железами, которые имеют ряд специальных приспособлений для активного транспорта молекул Н2О и некоторых ионов из кишечника в гемолимфу. Работа ректальных желез препятствует неэкономному расходованию воды или минеральных солей при выбросе экскретов и фекалиев из полости прямой кишки.
Филлипсом [637] разработана специальная методика для
196
изучения процессов поглощения воды и солей в прямой кишке насекомых. Пищеварительный тракт выше прямой кишки перевязывают волоском, после чего иглой шприца, смонтированной па микроманипуляторе, через анальное отверстие вводят точно измеренное количество жидкости; через некоторое время анализируют осмотическое давление или содержание определен’ пых ионов в этой жидкости. Использование данной методики показало, что у Schistocerca gregaria вода активно поглощается стенками прямой кишки, и перепад осмотического давления между полостью кишечника и гемолимфой все время увеличивается. Из прямой кишки саранчи могут реабсорбироваться в гемолимфу не только вода, но и Cl-, Na+ и К+, даже против 10—100-кратного градиента их концентрации. Следовательно, клетки ректальных желез обладают какими-то «насосами», способными использовать энергию окислительного фосфорилирования для целей активного транспорта электролитов и молекул Н2О.
Транспорт минеральных ионов и молекул воды происходит только в столбчатых клетках прямой кишки, образующих своего рода оболочку вокруг каждого ректального сосочка [638, 639]. У мухи Calliphora erythrocephala поверхностная мембрана таких клеток снабжена системой специальных трубочек, погруженных в цитоплазму (рис. 69, с.т). Характерно для этих клеток большое количество митохондрий и присутствие особых структур, получивших название «митохондриальных помп» (рис. 69, м.п). Кутикулярная выстилка прямой кишки (рис. 69, к) действует как молекулярное сито, ограничивая скорость проникновения через нее молекул по мере возрастания их величины; она практически непроницаема для молекул более крупных, чем моносахариды [640). Данные Филлипса и Докрилла [641] позволяют рассматривать кутикулярную выстилку прямой кишки саранчи как однородно пористую мембрану, отверстия которой заполнены водой и имеют радиус порядка 6,5-10-4 мкм.
§ 2. Пищеварительные ферменты
Концентрация водородных ионов в кишечнике насекомых. Активность пищеварительных ферментов находится в сильной зависимости от концентрации водородных ионов. Каждый фермент расщепляет субстрат с максимальной скоростью при оптимальных значениях pH, которые определяютсря как свойствами этого фермента (степенью диссоциации ионогенных групп белка и его устойчивостью к кислотно-щелочной денатурации), так и степенью ионизации молекул субстрата. При любых отклонениях от этого оптимума pH скорость ферментативной реакции снижается. Поэтому кривая зависимости активности фермента от концентрации водородных ионов имеет* характер
197
ную колоколообразную форму (рис. 70). Положение вершины «колокола» обычно совпадает с pH средней кишки для данного вида насекомых.
У некоторых насекомых концентрация водородных ионов одинакова на всем протяжении пищеварительного тракта, но чаще отмечаются незначительные различия в значении pH в разных отделах кишечника. Иногда сильные изменения pH наблюдаются даже в пределах одной средней кишки. По данным Гобсона [644] в передней половине средней кишки мух Lucilia sericata выделя-
Рис. 70. Влияние кислотности среды на активность амилазы, выделенной из кишечника личинок жука Tenebrio molitor (а), и инвертазы из кишечника тли Acyrthosi-phonpisum (б). По Апглебауму и др. [642].
Сриваставе и Ауклейру [643].
ется кислый секрет (pH 4,8—5,3), а в задней по-, ловине — щелочной (pH 7,4—7,6). У личинок этих мух оба участка средней кишки имеют примерно одинаковую щелочную реакцию.
Вопреки существовавшим раньше взглядам следует считать, что концентрация водородных ионов в кишечнике насе
комых мало зависит или совсем не зависит от пищевого режима. Так, в отряде жесткокрылых афаги, сапрофаги, расти
тельноядные, хищные и разноядные виды характеризуются близкими значениями pH, которые не обнаруживают какой-либо связи с характером питания [645]. В экспериментальных условиях также не удается сдвинуть концентрацию водородных ионов в кишечнике при выкармливании насекомых «кислой» или «щелочной» пищей [646]. Очевидно, насекомые имеют специальные буферные системы, обеспечивающие стабильность pH пищеварительного тракта в целях поддержания максимальной активности ферментов.
В большинстве отрядов насекомых в области средней кишки отмечена слабокислая реакция, близкая к нейтральной. Только* двукрылые (Diptera) и чешуекрылые (Lepidoptera) составляют исключение из этого правила.
В пределах отр.’ Diptera наблюдаются сильные изменения pH кишечника на разных стадиях развития или у разных особей одного и того же вида (от 4,4 до 7,7). У личинок мух достигается самая высокая среди насекомых кислотность содержимого кишечника: величина pH в области средней кишки составляет 2,8 у личинок Calliphora vicina, 3,22— У Sarcophaga bullata и 3,65—у Musca domestica [647].
198
Lepidoptera — это единственный отряд, характеризующийся высокощелочной реакцией средней киш^и, причем повышенная щелочность отмечается в пищеварительном тракте и гусениц, 'И бабочек [648, 649]. Среди многих исследованных представителей этого отряда только хищная гусеница Eubletna amabilis, питающаяся червецом Kerria lacca, в гемолимфе которого много лаковой кислоты, имела кислую реакцию гомогенатов средней кишки [650]. У всех остальных хищных и растительноядных гусениц величина pH кишечника больше 7. Следовательно, по
Рис. 71. Значения pH средней кишки для трех отрядов насекомых. По Бодину [651], Уотерхаузу [648], У. Сриваставе и П. Сриваста-ве [652] и др.
1 — имаго, 2 — гусеницы. Положение каждого кружка или треугольника на горизонтальной оси соответствует значениям pH для одного вида Coleop-tera (a), Lepidoptera (б) или Orthoptera, включая тараканов и богомолов (в).
концентрации водородных ионов пищеварительного тракта чешуекрылые занимают обособленное положение среди других отрядов насекомых (рис. 71).
Карбогидразы. Пища большинства насекомых богата углеводами и поэтому неудивительно, что в кишечнике этих животных часто обнаруживаются высокоактивные карбогидразы, способные осуществлять гидролиз олиго- и полисахаридов.
Пищеварительные ферменты многих насекомых могут расщеплять такие высокомолекулярные полисахариды, как крахмал и гликоген. Крахмал служит основным резервным углеводом растений, а гликоген выполняет ту же функцию у живот-вотных. Оба соединения имеют одинаковую общую формулу (СбНюОб); они построены из нескольких сотен остатков моносахарида (глюкозы), связанных между собой а-1,4- или а-1,6-связями:
199
сн2о
и.-1,6 связь
н ОН
6
н он н он
связь
Расщепление a-связей в полисахаридных молекулах происходит под влиянием а-амилазы. При гидролизе крахмала в качестве промежуточных продуктов могут быть получены декстрины, но распад гликогена прямо приводит к освобождению дисахарида мальтозы без образования декстринов.
На концах разветвлений молекул крахмала или гликогена глюкозидные остатки могут присоединяться с помощью 13-связей. Эти полисахаридные связи расщепляются 13-амилазой.
Амилаза насекомых может разрывать оба типа связей, т. е. она обладает свойствами а- и 13-амилазы. Аскорбиновая кислота, которая является эффективным ингибитором растительных 13-амилаз, обычно не действует на а-амилазы животных тканей [653]. Однако показано, что витамин С вызывает полное подавление активности кишечной амилазы личинок жука ТепеЬ-rio molitor [642]. В то же время амилаза, изолированная из личинок Т. molitor, активируется ионами Са2+ или С1~, и в этом отношении она сходна с а-амилазами других животных.
Оптимум pH для активности амилазы варьирует в пределах от 5,5 до 9,5 в зависимости от кислотности содержимого средней кишки [609]. У Т. molitor максимальная активность фермента наблюдается при pH 5,4 (рис. 70).
Некоторые насекомые фитофаги и пантофаги могут усваивать клетчатку растений (целлюлозу), которая представляет собой высокомолекулярный однородный полисахарид, построенный из нескольких тысяч остатков глюкозы. Эти остатки соединяются между собой [3-1,4-связями (см. рис. 7). Фермент, разрывающий такие связи в молекуле целлюлозы, получил название целлюлазы.
У насекомых целлюлаза либо выделяется клетками средней кишки, либо поставляется симбиотическими микроорганизмами. Так, щетинохвостки Ctenolepisma lineata самостоятельно расщепляют целлюлазу и при питании на чистой клетчатке, ме
200
ченной углеродом С14, начинают выдыхать углекислый газ, содержащий радиоактивный изотоп углерода [654]. Сверчки Gryllus bimaculatus, получившие с пищей целлюлозу-С14, усваивают и переваривают ее при участии обильной микрофлоры кишечника [655]. Введение в кишечник сверчков антибиотиков, которые подавляют деятельность микроорганизмов, приводит к заметному снижению количества усваиваемой клетчатки. Гусеницы Agrotis orthogonia при таких же исследованиях с применением меченой целлюлозы оказались неспособными переваривать и усваивать клетчатку: всего лишь 0,36% поглощенного с пищей радиоактивного углерода выделяется ими при ‘дыхании и менее 0,0036% включается в ткани [656]. У тараканов, например у Periplaneta americana, имеется два типа целлюлазы: 1) собственная, выделяемая клетками слюнных желез, и 2) микроорганизменная, которая выделяется простейшими и бактериями, заселяющими кишечник [657, 658].
Ферментативное расщепление целлюлозы в кишечнике насекомых приводит к образованию дисахарида целлобиозы, который состоит из двух молекул глюкозы, связанных В-связью. Дальнейший распад этого сахара происходит при воздействии В-глюкозидаз.
Пектины — химические компоненты оболочек растительных клеток—являются достаточно стойкими полисахаридами и лишь очень редко гидролизуются пищеварительными ферментами животных. Молекулы пектиновых веществ построены из остатков галактуроновой кислоты, связанных в неразветвлен-ную цепь а-1,4-связями:
соон н он соон
Среди насекомых фермент, расщепляющий a-связи пектинов, обнаружен в секретах слюнных желез тлей [659, 660]. При питании тли пектиназа инъекцируется через хоботок в растительную ткань и размягчает оболочки клеток, облегчая проникновение хоботка в питательный субстрат. Продукты распада пектинов, по-видимому, не имеют пищевого значения.
К числу азотсодержащих полисахаридных соединений можно отнести хитин, строение которого подробно рассматривалось в I главе. Для подавляющего большинства насекомых хитин не имеет существенного значения как источник пищи, но тем не менее активная хитиназа обнаружена в кишечнике Periplaneta americana [661].
201
Основные олигосахариды, расщепляемые кардогидразама кишечники насекомых
Таблица 8
Класс и группа углеводов
ос- Глюкозиды:
Трисахариды
Дисахариды
Название
Формула
Мелецитозх
Мальтоза
Сахароза.
Трегалоза
Н ОН СН2ОН
Н ОН ОН Н
Ферменты
& - ГЛЮК ОЗидаЗЫ :
Специфическая глюкозидаза
Мальтаза
Сахараза (инвертаза)
Трегалаза
Продукты расщепления
а.-Глюкоз а. тураноза
ы-Глюкоза
ъс-Глюкоза ^-Фруктоза.
^-Глюкоза
^-Глюкозиды: Дисахариды
ы-Гзлактозидьг.
Трисахариды
Дисахариды
^-Галактозиды:
Дисахариды
Целлодиоза СН2ОН н н I/н” °\г-О-|/он но\? но^ЦП h^Lc/oh н он сн2он ^-Глюкозидазы: ЦеллоГиазх ^-Глюкоза,
Рафиноза, о—сн2 к^°\н V°N‘ „Д\ОН H/i J\H нои НО \1 |/ ° ~ \[ |ZCH2OH iv- Галактозидазы: МелиОиаза, -Галактоза, сахароза,
Мелидиоза, к Н он он н он н Ji hcNj1 hJ—2рЭН сн2он Н он Ион й\|-о—сн2 СН2°Н ! Мелидиаза, ^-Галактоза, <у-Глюкоза,
/ н он СН>ОН Н он $>-Галактози-
Лактоза, Ин~ °\|—О-i/OH н\?н ЬГу ^Н н^__ о Ji н он сн.он 1 дазьы Лактаза, ^-Галактоза, ы-Глнжоза,
О способности пищеварительных ферментов расщеплять олигосахариды можно судить по пищевой ценности разных сахаров. Мухи Calliphora erythrocephala, Phormia regina и Luci-lia cuprina погибают, если их пища совсем не содержит углеводов. Сахара с 5 атомами углерода в молекуле (пентозы) не усваиваются мухами и не могут поддерживать их существование в течение сколько-нибудь длительного времени [662, 663]. Наиболее легко усваиваются насекомыми некоторые моносахариды (монозы), имеющие 6 атомов углерода (гексозы). Обычно приемлемыми гексозами являются лишь глюкоза, фруктоза и галактоза, а иногда и манноза.
Дисахариды (биозы) и трисахариды (триозы) расщепляются карбогидразами кишечника только в том случае, если они построены из остатков перечисленных выше легко усваиваемых гексоз. Поэтому подавляющее большинство насекомых может расщеплять такие дисахариды, как мальтоза (глюкоза 4-глюкоза), сахароза (глюкоза4-фруктоза), трегалоза (глюкоза4-+глюкоза), мелибиоза (галактоза4- глюкоза), тураноза (глюкоза 4-фруктоза), целлобиоза (глюкоза+глюкоза), и такие трисахариды, как рафиноза (мелибиоза+фруктоза) и мелеци-тоза (тураноза 4-фруктоза). Структурные формулы этих сахаров и продукты их распада приведены в табл. 8.
Субстратная специфичность карбогидраз обусловливается как химической структурой, так и типом связей углеводных остатков, образующих молекулу олигосахарида. Например, трегалаза разлагает только один дисахарид — трегалозу, а инвертаза действует не только на основной субстрат — сахарозу,— но и на ряд других сахаров. В первом случае говорят об абсолютной, а во второй — об относительной специфичности фермента. В зависимости от типа расщепляемой связи (а-и fi-связь) все карбогидразы могут быть разбиты на несколько групп. Наиболее обширная группа карбогидраз кишечного тракта насекомых представлена а-глюкозидами, способными расщеплять a-связь гексозных остатков в молекулах трегалозы, сахарозы, мальтозы, туранозы и мелецитозы. Каждый из этих сахаров расщепляется особым ферментом, характеризующимся специфическим для данного вида оптимумом pH.
Основной сахар гемолимфы насекомых — трегалоза — расщепляется трегалазой, которая среди всех а-глюкозидаз имеет наиболее высокую субстратную специфичность. При ферментативном расщеплении одной молекулы трегалозы образуются две молекулы а-глюкозы., Скорость этой реакции прямо пропорциональна концентрации фермента, но при повышении концентрации субстрата она линейно увеличивается лишь до некоторой величины, а затем остается на постоянном максимальном уровне. Константа Михаэлиса (Кт), численно равная концентрации субстрата, при которой скорость реакции достигает половины максимального значения, различна для разных 204
видов насекомых (табл. 9). Наиболее высокая Кт была установлена для трегалазы саранчи Melanoplus differentialis.
Энзиматическая активность трегалазы тормозится трегалоза-мином и гидроксиметиламинометаном, но не изменяется под влиянием MgCl2 в концентрации 0,01 моль/л [664, 666]. В этом отношении трегалаза насекомых отличается от такого же фермента дрожжей Saccharomyces cerevisiae, который обладает высокой чувствительностью к . тормозящему действию ионов магния.
Трегалаза может быть найдена не только в кишечнике, но и в других органах и тканях насекомых. В крыловой мускула-
/ Таблица 9
Значения Кт для трегалаз, выделенных из гомогенатов тканей разных видов насекомых
Виды насекомых Km, моль/л Источник
Melanoplus differentialis 5,1-10“3 [664]
Galleria mellonella 1,3-io“3 [665]
Phormia regina 6,7-IO"4 [666]
Bombyx tnori 4,55-10 4 [667]
туре она приобретает особенно большое значение и принимает деятельное участие в запасании и освобождении энергии при полете комаров, мух и перепончатокрылых. Ферменты, изолированные из мышечной ткани и пищеварительной системы одного и того же насекомого, могут различаться. Так, у шелкопряда Hyalophora cecropia трегалаза грудной мускулатуры локализована в митохондриях и имеет оптимум pH в области 6,8, а внемитохондриальная трегалаза стенок кишечника наиболее активна при pH 5,8 [668].
В отличие от трегалозы, у которой два глюкозидных кольца соединены друг с другом через первые углеродные атомы (1,1-связь), в молекуле мальтозы такие же кольца соединяются 1,4-связью. Этот тип связи разрывается ферментом мальтазой, который также принадлежит к числу/обычных а-глюкози-даз пищеварительного тракта насекомых.
Все насекомые, питающиеся углеводами, имеют в средней кишке, а иногда и в слюнных железах, высокоактивную инвертазу (сахаразу) — фермент, гидролизующий сахарозу. Молекула сахарозы, построенная из остатков глюкозы и фруктозы, может подвергаться гидролизу путем отщепления какого-либо одного из этих двух остатков. Если отщепляется фруктозная часть молекулы, соответствующий фермент носит название В-фруктозидазы, но когда отщепляется остаток глюкозы, инвертаза относится к классу а-глюкозидаз.
205
У большинства насекомых инвертаза кишечника является а-глюкозидазой, и лишь в некоторых случаях обнаруживается незначительная fi-фруктозидазная активность этого фермента. Личинки и имаго мухи Calliphora vicina и личинки жука Тго-goderma sp. имеют две разных инвертазы, одна из которых действует как а-глюкозидаза, а вторая — как В-фруктозидаза [669, 670].
Инвертаза может осуществлять не только гидролиз, но и синтез некоторых олигосахаридов. У тлей, кокцид и клопов при действии кишечной инвертазы на сахарозу образуются глюкоза, фруктоза и особый трисахарид глюкосахароза (фруктомальтоза), который накапливается в медвяной росе, выделяемой тлями, червецами и щитовками [671, 672, 673]:
Следовательно кишечная инвертаза насекомых может действовать как трансглюкозидаза, переносящая глюкозидные остатки на молекулы какого-либо акцептора. При образовании глюкосахарозы функцию такого акцептора выполняет сахароза.
Трисахарид мелецитоза, подобно глюкосахарозе, синтезируется инвертазными ферментами тлей, кокцид и пчел. Тля Eucallipterus tiliae, живущая на липах, экскретирует большие количества этого сахара (до 40% всех углеводов медвяной росы), в то время как сок липы, поглощаемый тлями, содержит очень мало мелецитозы [674]. При образовании мелецитозы в кишечнике насекомых акцептором глюкозидного остатка является фруктозная часть молекулы сахарозы, а при синтезе глюкосахарозы глюкозидный остаток переносится на глюкозную часть этой молёкулы. Обе реакции, по-видимому, осуществляются разными инвертазами; во всяком случае установлено, что в медвяной росе червеца Icerya purchasi содержится фермент, продуцирующий, мелецитозу, а у червеца Coccus hes-peridum — обнаруживается фермент, образующий только глюкосахарозу [675].
Распад мелецитозы на составляющие ее моносахариды—2 молекулы глюкозы и 1 молекулу фруктозы — происходит особенно активно в кишечнике тех насекомых, которые питаются медвяной росой (муравьи)'или медом (пчелы).
В группе 6-глюкозидаз кишечника насекомых специального упоминания заслуживает лишь целлобиаза, расщепляющая 206
В-связь двух глюкозидных колец в молекуле дисахарида целлобиозы (табл. 8). Специфичность целлобиазы, видимо, достаточно строгая, потому что она не расщепляет другие В-глюко-зиды, кроме целлобиозы. Оптимум pH для фермента, содержащегося в зобе Locusta migratoria и в средней кишке Periplane-ta americana, колеблется между 5,1 и 5,4 [676, 677]. Близкие значения оптимума pH были найдены для целлобиазы позвоночных животных, а для таких же ферментов бактерий пик активности отмечался в более кислой среде (pH 4,5—4,7).
Сахара, содержащие остатки а-галактозы, расщепляются а-галактозидазами кишечника. Среди этих сахаров существенное пищевое значение имеют только трисахарид рафиноза и дисахарид мелибиоза (табл. 8). Оба сахара гидролизуются одним и тем же ферментом — мелибиазой, который отщепляет галактозидный остаток от молекулы углевода.
Молочный сахар лактоза расщепляется специальным ферментом лактазой, который принадлежит к группе В-галактози-даз (табл. 10).
Протеазы. Расщепление белков в пищеварительном тракте осуществляется двумя типами протеаз: эндопептидазами и экзопептидазами. Эндопептидазы разрывают белковую цепь в каком-либо из ее центральных участков, образуя ряд более коротких полипептидных цепочек. Эти цепочки подвергаются воздействию экзопептидаз, которые отщепляют от них концевые аминокислоты одну за другой.
К числу эндопептидаз принадлежат такие широко известные ферменты позвоночных, как пепсин, действующий, в кислой среде (при pH от 1 до 5), или трипсин и химотрипсин, обладающие максимальной активностью в щелочной среде (при pH от 7 до 9). У насекомых также найдены ферменты, активируемые' или щелочной, или кислой средой. Например, у черепа шки burygaster ititegriceps в кишечнике имеются три протеазы, для которых оптимальные значения pH составляют соответственно 2, 6—7 и 8 [678].
Неоднократно в организме насекомых находили пищеварительные ферменты, аналогичные трипсину позвоночных. Так, личинки мясной мухи Phormia regina при внекишечном переваривании белков продуцируют протеазу, которая инактивируется специфическими ингибиторами трипсина и имеет оптимум pH в области 7,9—9,3 [679]. У жука Pterostichus melanarius найдено 2 протеазы, активируемые в щелочной среде; одна из них действует аналогично трипсину и расщепляет связи аргинина или лизина, а другая действует аналогично химотрипсину и расщепляет связи ароматических аминокислот (тирозин, фенилаланин или триптофан). «Трипсиноподобный» фермент имеет молекулярный вес Т6600, а «химотрипсиноподобный» — 20800 [680].
Известно, что трипсин первоначально выделяется в виде
207
трипсин не расщепляет белок pH (рис. 72).
неактивного профермента трипсиногена, который активируется специальным ферментом энтерокиназой. У жука Carabus и у таракана Periplaneta отмечалась способность энтерокиназы активировать трипсиноподобную протеазу кишечника [681].
У насекомых, видимо, отсутствуют ферменты, по своим свойствам аналогичные пепсину позвоночных. Однако у личинок мух в кислой среде действуют какие-то другие протеазы с оптимумом pH от 2 до 3 [682].
Гусеницы платяных молей (р. Tineola) и некоторые другие насекомые, питающиеся шерстью, имеют своеобразный протеолитический фермент — кератиназу, способную растворять основной белок шерсти — кератин1. Кератиназа кишечника Tineola bisselliella может расщеплять и другие белки, например казеин или азоказеин. При расщеплении казеина максимальная активность фермента отмечается в щелочной области, но при более высоких значениях pH, чем у кристаллического трипсина [684]. Скорость переваривания шерсти кератиназой также увеличивается с повышением pH среды, в то время как шерсти при любых значениях
Устойчивость кератина к действию протеаз' резко снижается при разрыве его дисульфидных связей (—S—S—). Поэтому раньше считали, что в кишечнике платяных молей обязательно происходит первоначальная подготовка кератина к расщеплению при действии каких-то веществ, разрывающих связи серосодержащих аминокислот. В экспериментальных условиях для этих целей использовали тиогли-колевую кислоту при pH 11 [685]. Однако, когда Паунин-гу и Иржикиевичу [684] удалось выделить очищенную ке-
Рис. 72. Переваривание шерсти трипсином (/) и протеиназой (2) моли Tineola biselliella. По данным Паунинга и Иржикиевича [684].
Эффект переваривания оценивали в процентах по отношению к контролю в течение 48 ч. По горизонтали — кислотность среды.
ратиназу из кишечника гусениц Т. bisselliella, было установлено, что этот фермент, даже в отсутствии активаторов может растворить до 30% шерсти.
1 Считается, что белковая фракция шерсти включает в себя 90% кератина и 10% других веществ, доступных воздействию обычных эндопептидаз [683}.
208
Экзопептидазы объединяют, по крайней мере, три группы ферментов:
1) карбоксипептидазы — отщепляют концевые аминокислоты, имеющие свободные карбоксильные группы (—СООН);
2) аминопептидазы —'отщепляют концевые аминокислоты, имеющие свободные аминогруппы (—NH2);
3) дипептидазы — расщепляют связь между двумя аминокислотами, составляющими какой-либо дипептид.
В кишечнике насекомых обнаружены все три группы экзопептидаз, но их свойства остаются неизученными.
Среди дипептидаз насекомых достаточно подробно исследована глицил-глицинпептидаза из тканей долгоносика Sitophilus oryzae [686]. Этот фермент осуществляет гидролиз дипептида, составленного из двух остатков аминокислоты глицина. Активность фермента прямо пропорциональна времени инкубации и имеет четкий оптимум при pH 7,6. В максимальной степени энзиматическая активность пептидазы проявляется в присутствии ионов кобальта; меньшим стимулирующим эффектом обладают Mg2+ и Мп2+. Ионы тяжелых металлов, например свинца, тормозят активность фермента; подобными же свойствами ингибитора дипептидазы обладает аминокислота лейцин и орто-фенантролин. Активный центр фермента, видимо, содержит остатки серина и треонина.
Липазы. Основными субстратами для действия липаз (эстераз) являются жиры и масла, которые в химическом отношении представляют собой триглицериновые эфиры жирных кислот, имеющие общую формулу:
СН2---СН2---СН2
I I I
ООО I 1 I
R—СО R-CO R-CO,
где R—СО — остаток насыщенной или ненасыщенной кислоты.
Ферментативный распад жиров в кишечнике насекомые, заключается в их гидролизе до жирных кислот и глицерина. Действие липазы можно представить себе следующим образом:
Триглицерид---^Диглицерид--->- Моноглицерид-^Глицерин
Y j
Жирная Жирная Жирная
кислота кислота кислота
Оптимум pH для липаз обычно близок к нейтральному.
По данным Бейкера и Парецкого [687] липаза, полученная из тканевых гомогенатов Musca domestica, в условиях in vitro легко расщепляет многие триглицериды, причем наиболее ак-
209
тивно протекает расщепление трибутирила (радикал R имеет формулу СНз—СН2—СН2—СО) и триацетила (формула радикала СНз—СО). Этот фермент не расщепляет этилбутират СНз—СН2—СН2—СООС2Н5, но у других мух [688] и у жука Tribolium castaneum [646] в средней кишке обнаружена эстераза, гидролизующая как этилбутират, так и этилацетат СНз—СН2—СН2—СООСНз.
Воска, составляющие пищу некоторых насекомых, также принадлежат к группе сложных эфиров жирных кислот, но в отличие от жиров они образуются не трехатомным спиртом глицерином, а одноатомными высшими спиртами. Так, один из основных компонентов пчелиного воска представлен мири-циловым эфиром пальмитиновой кислоты:
о
СН3-(СН2)28-СН2— о—с—(сн2)14 — СНз
Впрочем, кроме этого соединения, пчелиный воск содержит и'многие другие эфиры, высшие жирные кислоты, спирты и углеводороды. По данным Янга [689] в воске пчелиных сот можно обнаружить 31 жирную кислоту с числом атомов углерода от 12 до 22 и целый ряд спиртов с прямой цепью, составленной более чем из 20 углеродных атомов.
Изучение питания гусениц восковой моли (Galleria mello-nella) показало, что эти насекомые переваривают и усваивают мирициловый эфир пальмитиновой кислоты, но ни одна из жирных кислот и ни один спирт с длин&й цепи от 14 до 30 углеродных атомов не могут быть эффективными заменителями воска [690]. Механизм расщепления воска 'в кишечнике гусениц изучается уже давно, начиная с первых исследований Дикмана [691] и Дуспивы [692], посвященных этому вопросу, но до сих пор даже не выделен фермент, осуществляющий гидролиз восковых соединений.
Перед началом переваривания воск эмульгируется какими-то веществами, выделяемыми клетками кишечника восковой моли. При этом было отмечено появление в средней кишке большого количества полифосфатов, которые, возможно, облегчают процесс всасывания липидов, образующихся при расщеплении воска [693].
Связь набора ферментов с пищевым режимом. Среди факторов, определяющих различия в свойствах и активности пищеварительных ферментов у разных видов насекомых, первое место принадлежит пищевой специализации. Питание разнообразными органическими веществами требует широкого набора ферментов, способных расщеплять все основные компоненты пищи. Узкая пищевая специализация часто приводит к тесному соответствию между ферментами кишечника и хими-210
ческим составом пищи. В таких случаях «ферментное зеркало», т.е. соотношение качественного и количественного состава ферментов кишечника, хорошо отражает усваиваемые питательные вещества.
Различия в наборе пищеварительных ферментов у насекомых с разной степенью пищевой специализации можно иллюстрировать результатами исследований Уигглсуорса [594, 694, 695, 696]. Среди изученных им видов набор ферментов оказался наиболее обширным у всеядных тараканов Periplaneta americana и Blatella germanica. Ферменты, экстрагированные из кишечников этих насекомых, быстро расщепляли белки, жиры и углеводы. В группе карбогидраз высокая , активность отмечалась для амилазьц инвертазы, мальтазы и даже для лактазы, которая у многих насекомых-фитофагов либо совсем не обнаруживается, либо характеризуется очень низкой активностью [694]. Группа протеаз представлена у тараканов «трипсиноподобным» ферментом и дипептидазой [695].
У питающихся сахарами мух р. Calliphora клетки средней кишки и слюнных желез секретируют высокоактивные .карбогидразы, но протеазы имеют очень низкую активность [696]. У сосущих кровь мух це-це (р. Glossina) наблюдаются обратные соотношения активности этих двух групп, ферментов: в средней кишке очень активна протеаза, а карбогидразы отсутствуют, если не считать очень слабой амилазы [594]. Промежуточное положение между Calliphora и Glossina занимают дождевки (р. Chrysops), которые могут питаться и кровью животных, и нектаром цветов; у них достаточно активны протеаза и некоторые карбогидразы средней кишки.
У паразитических личинок число ферментов, обнаруживаемых в кишечнике и в слюнных железах, как правило, невелико. В этом отношении паразиты напоминают тех свободножи-вущих насекомых, которые, подобно мухам Calliphora и Glossina, характеризуются узкой пищевой специализацией. Личинки сем. Calliphoridae и Sarcophagidae обычно питаются гниющим мясом, трупами и фекалиями, но некоторые их представители переходят к эктопаразитизму на птицах. У таких паразитических личинок активность карбогидраз резко снижена, способность к выделению протеаз сохраняется лишь в заднем участке средней кишки, а липазы могут выделяться только в слюнных железах и накапливаются в зобе [697]. У эндопаразитических личинок кожного овода (Oedemagena ta-randi) амилаза отличается очень слабой активностью, а липаза продуцируется клетками слюнных желез, но не обнаруживается в средней кишке, очищенной от ее содержимого [698]. Таким образом, основные поставщики пищеварительных ферментов— клетки средней кишки — У О. tarandi интенсивно секретируют лишь протеазу. Это указывает на приуроченность питания личинок к белковой пище.
211
Фитофаги, хищники и сапрофаги имеют приблизительно одинаковый и всегда широкий набор пищеварительных ферментов, но их относительная активность может варьировать. Так, Эйр [699] в экспериментах с разными видами муравьев доказал, что активность ферментов может служить показателем пищи насекомых. Те муравьи, которые питаются падью, имеют слабоактивную инвертазу и почти полностью лишены амилазы. Виды, питающиеся грибами, показывают высокую активность обеих карбогидраз кишечника. У всех изученных муравьев найдена протеазная и липазная активность, причем достоверные различия в активности ферментов между хищниками и сапрофагами не были обнаружены.
Таким образом, в классе насекомых различия в степени пищевой специализации от пантофагов до узких олигофагов значительно сильнее сказываются на активности пищеварительных ферментов, чем различия в самих пищевых режимах.
При метаморфозе голометабольных насекомых (группа Holometabola) часто происходит смена пищевого режима, которая сопровождается соответствующими изменениями набора ферментов кишечника.
В отряде чешуекрылых взрослые насекомые питаются углеводами или совсем не питаются, а личиночные стадии грызут листья или являются хищниками, нападающими на личинок цикад, червенцов и щитовок. Поэтому у бабочек могут быть обнаружены лишь ферменты, действующие на сахара, тогда как у гусениц в число пищеварительных ферментов, кроме разнообразных карбогидраз, входят также протеазы и липазы. Так, в кишечнике взрослых бражников имеется только инвертаза, а все остальные ферменты отсутствуют [700].
Некоторые мухи в личиночном состоянии имеют лишь одну карбогидразу со свойствами инвертазы, но после превращения в имаго они приобретают способность расщеплять не только сахарозу, но и ряд других углеводов [701]. В целом следует отметить, что при метаморфозе многих двукрылых набор пищеварительных ферментов и их активность изменяются особенно сильно. Резкий контраст с этими насекомыми составляют пилильщики, у которых состав карбогидраз в кишечнике имаго такой же, как и у личинок [702].
§ 3. Роль симбиотических микроорганизмов в питании и пищеварении насекомых
Типы симбионтов и их связи с насекомыми. Во внутренних органах насекомых и на поверхности их тела обнаружены многочисленные непатогенные микроорганизмы, в том числе бактерии, грибы и простейшие. Некоторые из этих микроорганизмов находятся в симбиотических отношениях с хозяином; подобных симбионтов принято разбивать на две основные группы — 212
внеклеточные и внутриклеточные микроорганизмы [703, 704].
Внеклеточные симбионты могут находиться на внешней поверхности или внутри тела насекомых. Особый тип симбиоза микроорганизмов с насекомыми составляет разведение последними амброзиальных грибов вне тела, например на стенках ходов в древесине, проделанных жуками-короедами (сем. Ipidae). Эти жуки имеют специальные приспособления для переноса спор или частиц мицелия симбиотического гриба, причем вид гриба специфичен для данного вида насекомых. Сами жуки и их личинки питаются амброзиальными грибами, получая из них необходимые питательные вещества. Как известно, некоторые муравьи и термиты, преимущественно живущие в тропиках, также разводят грибы и питаются ими.
Внутри тела насекомых обнаруживается гораздо больше бактерий и других микроорганизмов, чем на его поверхности. Большая часть этих симбионтов локализована в пищеварительном тракте, причем они могут поселяться либо непосредственно в полости кишечника, либо в специальных пилорических придатках и криптах средней кишки. Видовой состав бактериальной флоры достаточно специфичен для каждого вида, и большинство из этих микроорганизмов не удается культивировать на искусственной среде. Ниже будет показано, что симбионты кишечника могут служить поставщиками тех пищеварительных ферментов, которые не вырабатываются самими насекомыми. Так, например, личинки. пластинчатоусых жуков часто имеют специальные «бродильные камеры» в виде слепых отростков средней кишки, в которых при участии бактерий протекают процессы сбраживания клетчатки.
Иногда внеклеточные микроорганизмы кишечника синтезируют витамины, необходимые для питания насекомых. Однако основную роль в этих процессах синтеза играют внутриклеточные симбионты, которые живут в тканевых клетках насекомых, не причиняя им вреда. Такие симбиотические микроорганизмы могут находиться в различных клетках, например в клетках кишечника, но некоторые насекомые имеют особые органы — мицетомы — и специализированные клетки — мицетоциты, —заполненные внутриклеточными симбионтами.
Один из предполагаемых путей происхождения мицетомов и мицетоцитов показан на рис. 73. Внеклеточные симбионты, обитающие в кишечнике, по-видимому, послужили предшественниками внутриклеточных микроорганизмов (рис. 73, А, Б). Следующей ступенью эволюции симбиоза следует считать проникновение микроорганизмов в эпителиальные клетки кишечника и появление пилорических придатков в этой области (рис. 73, В). В дальнейшем, вероятно, происходило обособление выростов кишечной трубки в виде мицетомов, которые, утрачивая связь с пищеварительным трактом, перемещались в жировое гело (рис. 73, Г, Д).
213
По-видимому, многие внутриклеточные симбионты приносят своим хозяевам определенную пользу, а некоторые из них безусловно необходимы для насекомых. Установлено, что вши Pediculus humanus, искусственно лишенные симбионтов, живут не так долго, как нормальные, а интенсивность питания и плодовитость у них сильно снижены [705]. Очень важным открытием, сделанным при изучении внутриклеточных симбионтов, явилось доказательство их способности фиксировать атмосферный азот и тем самым делать его доступным для насекомых [706]. Предполагается, что ряд незаменимых аминокислот может быть синтезирован в организме насекомых внутриклеточными микроорганизмами жирового тела.
Рис. 73. Схема анатомических типов расположения симбионтов по отношению к пищеварительному тракту насекомого. По Штейнхаузу [704].
Объяснения в тексте.
214
Микроорганизмы кишечника как поставщики пищеварительных ферментов. Населяющие кишечник бактерии, дрожжи и простейшие могут вырабатывать пищеварительные ферменты, которые активно участвуют в процессах растворения питательных веществ. В число ферментов, продуцируемых симбионтами, входят протеазы, липазы и карбогидразы. В некоторых случаях микроорганизмы кишечника поставляют ферменты, оказывающие свое действие на то же вещество, что и ферменты, выделяемые насекомым. В других случаях симбионты служат единственным источником ферментов. Например, у тли Acyrtho-siphon pisum расщепление крахмала осуществляется только бактериями кишечника, а сами клетки средней кишки' не секретируют амилазу [643]. Многие насекомые, питающиеся древесиной, не имеют собственной целлюлазы и сбраживают клетчатку при участии простейших из класса жгутиковых (Mas-tigophora).
Наиболее ясные доказательства участия внутриклеточных симбионтов в расщеплении клетчатки были получены для разных видов термитов и для питающихся древесиной тараканов р. Cryptocercus. В задней кишке этих насекомых можно обнаружить богатую и разнообразную фауну жгутиконосцев, принадлежащих к отр. Polymastigida и Hypermastigida. Обычно эти простейшие характеризуются большим количеством жгутиков (рис. 74).
Как правило, у всех термитов определенного вида имеется идентичный набор видов симбиотических жгутиконосцев. Так, у каждой особи термита Termopsis angusticollis в задней кишке найдено в среднем 25 000 крупных жгутиконосцев Tricho-nympha и Leidyopsis и 500 000 мелких Trichomonas [708].
Приспособленность простейших к биологии их хозяев проявляется как в строении, так и во всем жизненном укладе симбионтов. Большинство из них имеют собственную целлюлазу, могут питаться древесиной и заглатывают даже сравнительна крупные кусочки дерева (рис. 75). Это очень важное свойство внутрикишечных жгутиконосцев оказалось полезным для термитов и тараканов Cryptocercus, которые сами не могут переваривать клетчатку.
Для изучения роли простейших в физиологии пищеварения насекомых могут быть рекомендованы три основных метода дефаунации хозяев: 1) термическая дефаунация путем выдерживания термитов или тараканов при относительно высокой температуре; 2) кислородная дефаунация путем их выдерживания в атмосфере чистого кислорода; 3) химическая дефаунация путем скармливания насекомым антибиотиков, убивающих простейших [710].
Выкармливание дефаунированных насекомых разными продуктами показало, что симбиотические простейшие безусловно необходимы для поддержания жизни термитов или тараканов
215
8
Cryptocercus. Большинство термитов, например, питаются древесиной; в отсутствии симбиотических простейших они не могут получить питательные вещества из клетчатки и погибают от голода. Дефаунированные термиты живут достаточно долго только на среде, содержащей глюкозу, но даже дисахарид сахароза усваивается ими с трудом, а клетчатка совсем не усваивается. Термиты лишены бактерий, способных расщеп-
Рис. 75. Жгутиконосец Tichonympha sp.— внутриклеточный симбионт термитов р. Zootermopsis — на разных стадиях поглощения кусочка древесины (д). По Свежи [709].
лять клетчатку, поэтому внутрикишечные жгутиконосцы служат для них единственным источником целлюлазы [711, 712].
Интересны взаимные приспособления жгутиконосцев и термитов к распространению симбионтов среди всех членов колонии. Пока молодые нимфы выкармливаются только выделениями слюнных желёз рабочих особей, они не имеют жгутиконосцев. В дальнейшем рабочие начинают кормить подрастающую молодь жидким содержимым своей задней кишки, в котором в изобилии присутствуют жгутиконосцы. В этот период симбионты от рабочих кормилиц впервые попадают в кишечник
Рис. 74. Жгутиконосцы из кишечника термитов. По Грассе [707].
А — Spirotrichonympha flagellata из Reticulitermes lucifugus. Б — Pseudodeves covina uniflagellata из Neotermes insularis. В — Joenia annectens из Calotermes flavicollis.
Г — Coronympha octonaria из центральноамериканских видов p. Calotermes.
217
нимф и поселяются в задней кишке. После нимфальной линьки, когда вся кутикулярная выстилка задней кишки удаляется вместе с содержащимися в ней простейшими, термиты оказываются временно дефаунированными. Однако привычка кормиться жидкими экскрементами других членов колонии позволяет отлинявшим нимфам быстро восстановить необходимое количество симбионтов.
При имагинальной линьке термиты обычно не избавляются от симбионтов. Например, у Reticulitermes lucifugus имагиналь-ная линька протекает без сбрасывания выстилки задней кишки, которая лишь отстает от эпителиальных стенок и образует «мешок», содержащий всех простейших кишечника. Затем, уже после сбрасывания экзувиальной шкурки, этот «мешок» вместе со всем своим содержимым начинает медленно продвигаться к анальному отверстию; на этом пути жгутиконосцы покидают его и выходят в полость кишечника, а пустая оболочка «мешка» выводится через анальное отверстие [713].
Симбиотические микроорганизмы как поставщики витаминов. Симбионты насекомых могут снабжать своих хозяев витаминами группы В. У табачного жука (Lasioderma serricorne) и хлебного точильщика (Stegobium paniceum) личинки, искусственно стерилизованные со стадии яйца, требуют для своего роста семь витаминов этой группы, а при воспитании в нестерильных условиях они нуждаются лишь в двух витаминах [714]. В чистой культуре дрожжи, изолированные из мицетомов жуков, выделяют в среду тиамин, рибофлавин, никотиновую кислоту, пиридоксин, пантотеновую кислоту, фолиевую кислоту и биотин [715], т. е. как раз те витамины, без которых невозможно развитие насекомых (см. гл. III, с. 160—166). Для ряда насекомых дрожжи и подобные им симбионты могут служить также источниками стеринов, а для S. paniceum — даже источниками незаменимых аминокислот [716].
Внутриклеточные дрожжи, актиномицеты и бактерии имеют особенно большое значение в питании кровососущих насекомых, так как кровь содержит очень мало витаминов [717]. У клопа Rhodnius prolixus поставщиками необходимых витаминов являются актиномицеты Nocardia rhodnii, локализованные в эпителиальных клетках средней кишки. Эти микроорганизмы снабжают клопов пиридоксином, тиамином, пантотеновой и никотиновой кислотами [718]; биотин и фолиевая кислота также выделяются симбионтами, но они в достаточных количествах присутствуют и в самой крови. Молодые нимфы заражаются актиномицетами при поедании экскрементов или кутикулы взрослых насекомых. Лишенные симбионтов нимфы обычно не линяют и не достигают способной к размножению имагинальной стадии, несмотря на поглощение большого количества крови. После заражения клопов симбионтами эти симптомы пищевой недостаточности вскоре исчезают [719].
218
Глава V. ФИЗИОЛОГИЯ ОРГАНОВ ВЫДЕЛЕНИЯ
§ 1. Строение и работа выделительных органов
Характеристика путей выделения у насекомых. В результате распада химических компонентов пищи в гемолимфе насекомых накапливаются вода, углекислота, различные соли, аммиак, мочевина, мочевая кислота, аллантоин и другие азотные соединения. Функция органов выделения заключается в удалении из организма этих конечных продуктов обмена веществ и в поддержании постоянства внутренней среды.
Рис. • 76. Мальпигиевы сосуды и часть кишечника личинки слепня Tabanus autumnalis (Д) и клопа Dysdercus fasciatus (Б). По Н. Г. Олсуфьеву [720] и Бэрриджу [721].
з.к —задняя кишка; /с — крипты средней кишки; м.с — мальпигиевы сосуды; с.к — средняя кишка; т — трахеи.
Мальпигиевы сосуды служат основными органами выделения у подавляющего большинства насекомых. Они имеют вид трубочек, открывающихся в кишечник на границе средней и задней кишки. Очень часто эти трубочки свободно заканчиваются в гемолимфе (рис. 76, Л), но у некоторых клопов (Не-miptera) они попарно срастаются своими концами, образуя две замкнутые петли (рис. 76, Б). В ряде случаев кончики маль-
219'
пигиевых сосудов прирастают к задней кишке. Подобное явление, получившее название криптонефрии, особенно характерно для большинства гусениц, сетчатокрылых (Neuroptera) и жуков (Coleoptera). Среди гусениц только виды сем. Hepialidae и живущие в воде огневки (сем. Pyralidae) имеют свободные мальпигиевы сосуды, а у остальных они криптонефридиальные.
Криптонефрия является специальным приспособлением для экономии расхода влаги [722]. Вода, отсасываемая из кишечника через криптонефридиальную часть мальпигиева сосуда, обеспечивает бесперебойное выведение экскретов из организма даже при общем снижении содержания влаги в теле насекомого. Поэтому прирастание кончиков мальпигиевых сосудов к задней кишке отмечается главным образом у тех насекомых, которые вынуждены экономить воду.
Число мальпигиевых сосудов подвержено широкой изменчивости (от 2—8 до 80—100), но в небольших таксономических категориях оно достаточно постоянно. В подклассе крылатых насекомых (Pterygota) наблюдается ясно выраженная тенденция к олигомеризации (уменьшению числа) мальпигиевых сосудов в процессе филогенетического развития от относительно примитивных к более высоко организованным отрядам.
Первичное отсутствие мальпигиевых сосудов или их примитивное состояние характеризует многих первичнобескрылых насекомых (Apterygota). В этом подклассе мальпигиевы сосуды совсем отсутствуют у Japyx из отр. Diplura и у всех ногохвосток (отр. Collembola). Для остальных родов Diplura и для отр. Рго-tura описаны примитивные органы выделения в виде небольших сосочков в начале задней кишки. Только щетинохвостки (отр. Thysanura) обладают 4—8 (чаще всего 6) настоящими трубочковидными мальпигиевыми сосудами.
Полость мальпигиевых сосудов заполнена экскретами, которые растворены или взвешены в воде, поглощаемой из гемолимфы. Стенки сосудов построены из однослойного эпителия, прикрытого снаружи базальной мембраной и мышечнымй волокнами. Сокращения мышечных волокон обусловливают перистальтические и антиперистальтические движения сосудов, необходимые для перемешивания экскретов и их проталкивания в кишечник. Эти сокращения вызываются только мышечной активностью, потому что мальпигиевы сосуды насекомых не иннервируются.
Каждая эпителиальная клетка выделительной трубочки имеет ядро, большое количество митохондрий и эндоплазматический ретикулум (рис. 77). Поверхность клетки, обращенная внутрь сосуда, несет рабдориум (палочковый слой). Строение рабдориума различно у разных видов или в разных участках мальпигиева сосуда (ср. А и Б на рис. 77). Иногда отдельные эпителиальные клетки вообще лишены рабдориума.
Митохондрии, находящиеся в клетках мальпигиевых сосу
220
дов, служат поставщиками энергии, которая затрачивается на формирование экскретов и их транспортирование в заднюю кишку. Показано, что экскреция у насекомых — это активный процесс, потребляющий энергию окисления [724]. В связи с этим в клетках выделительных трубочек у целого ряда насекомых обнаружены р-азнообразные дыхательные ферменты [725, 726]. В изолированных мальпигиевых сосудах мухи Calliphora eryth-rocephala источниками энергии могут служить различные органические соединения — обычные и фосфорилированные сахара, жирные кислоты и аминокислоты [727].
Работа мальпигиевых сосудов, направленная на поддержание постоянного химического состава гемолимфы, тесно связа-
Рис. 77. Строение эпителиальной клетки в дистальном (4) и проксимальном (Б) отделах мальпигиевых со-судов клопа Rhodnius prolixus. По Уигглсуорсу и Сал-петеру [723].
б.м — базальная мембрана; м — митохондрии; р — рабдориум; э.р — эндоплазматический ретикулум; я — ядро.
221
на с функциями задней кишки. В простейшем случае мальпигиевы сосуды только насасывают плазму гемолимфы и передают ее в заднюю кишку. Все остальные задачи выполняют ректальные железы задней кишки, которые поглощают из плазмы воду и другие полезные продукты, а затем возвращают их в гемолимфу. Такое разделение функций между мальпигиевыми сосудами и задней кишкой наблюдается у саранчи Schistocerca gregaria [728]. Однако у многих насекомых мальпигиевы сосуды частично принимают на себя функцию обратного отсасывания воды, хотя и в этих случаях ректальные железы играют важную роль в окончательном формировании экскретов. Таким образом, мальпигиевы сосуды и задняя кишка образуют единый комплекс выделительных органов, избавляющих гемолимфу от конечных продуктов метаболизма.
Мальпигиевы сосуды и з'адняя кишка выводят экскреты из организма, включая их в состав экскрементов. Однако у насекомых известно еще несколько более редких типов выделительных органов, снабженных самостоятельными выводными протоками. Например, среди Apterygota в отрядах Collembola и Thysanura экскреторная функция выполняется парными лабиальными органами, которые гомологичны антеннальным и максиллярным железам ракообразных [729, 730].
Аналогичные по своим функциям образования встречаются и у некоторых Pterygota. Так, у шелкопряда Hyalophora cecropia лабиальные железы, секретирующие у гусениц шелк, не разрушаются во время метаморфоза: у бабочки они регулируют водный обмен и участвуют в выведении экскретов [731]. Предполагается, что максиллярные железы клопов являются остатками метанефридиев аннелид и тоже выполняют выделительную функцию [732]. Наконец у тараканов надсем. Blabe-roidea описаны особые урикозные железы, секретирующие мочевую кислоту [733]. Урикозные железы относятся к комплексу добавочных половых желез самцов и представлены группой обособленных трубочек. Продуцируемая ими мочевая кислота изливается на сперматофоры и предохраняет их от поедания самками или другими насекомыми.
Все рассмотренные выше органы освобождают организм насекомого от-конечных продуктов обмена веществ путем выведения экскретов во внешнюю среду. Н. Я- Кузнецов [734] предлагает называть их органами эмункториальной экскреции, или, проще, эмункториями. В другом типе органов накопительной экскреции продукты, подлежащие выделению, поглощаются из гемолимфы и накапливаются в клетках или тканях без непосредственного выноса наружу.
К числу наиболее важных органов накопительной экскреции следует отнести жировое тело. Наличие в жировом теле уратных (мочекислых) клеток, накапливающих мочевую кислоту, было известно уже давно. Обычно такие клетки разбро-222
саны по всему жировому телу среди трофоцитов, обогащенных запасными питательными веществами, но иногда они особенно обильны по периферии жирового тела. В отличие от трофоцитов уратные клетки не имеют РНК, липидов, гликогена и белковых гранул [735]. В них крайне мало митохондрий. Мочевая кислота в уратных клетках откладывается в виде кристаллов, которые свободно взвешены в цитоплазме.
Отложения мочевой кислоты в жировом теле могут существовать наряду с обычной ее экскрецией через мальпигиевы сосуды. Однако выделительная функция уратных клеток приобретает особенно большое значение в те периоды развития насекомых, когда деятельность эмункториев становится невозможной или затрудняется. Например, у личинок и куколок эндопаразитических насекомых продукты распада белков откладываются в жировом теле, потому что их выведение в организм хозяина могло бы привести к его отравлению и гибели самого паразита [736]. Вынос экскретов наружу осуществляется лишь после вылета имаго. На куколочной фазе развития двукрылых, когда задняя кишка и мальпигиевы сосуды разрушаются, мочевая кислота аккумулируется в уратных клетках жирового тела [737].
Личинки многих высших перепончатокрылых (ос, шмелей и пчел) проводят всю свою жизнь в небольшой ячейке и не могут выделять экскременты до момента окукливания. Мальпигиевы сосуды личинок оканчиваются слепо у перегородки, отделяющей среднюю кишку от задней, и не содержат мочевую кислоту; конечные продукты обмена веществ накапливаются внутри организма, в особенности в жировом теле [738, 739]. Только у куколок мальпигиевы сосуды вступают в связь с кишечником и постепенно переносят сюда мочевую кислоту, накопившуюся в уратных "клетках. Освобождение кишечника от экскретов происходит после отрождения взрослого насекомого.
Азотистые экскреты, образующиеся в течение эмбрионального развития насекомых, обычно скапливаются в уратных клетках. Так, Хилл [740] отметил присутствие мочевой кислоты в жировом теле у эмбрионов саранчового Melanoplus diffe-rentialis в конце первой половины развития яиц. Однако, при эмбриональном развитии клопов-щитников (надсем. Pentato-moidea) жировое тело практически не принимает участие в процессах выделения [741]. Ведущую роль в этом случае играют другие органы накопительной экскреции, в первую очередь эпидермальные клетки и их производные. На постэмбриональных стадях развития насекомых эпидермис тоже может служить дополнительным органом выделения. Накопление конечных продуктов белкового обмена в клетках эпидермиса часто происходит в виде пигментов — меланинов, оммохромов, птеринов. Следовательно, отложение в покровах азотсодержа-
223
щих пигментов используется насекомыми как один из путей накопительной экскреции.
Типы мальпигиевых сосудов. Функционально-морфологические исследования разных отрядов насекомых позволили выделить 4 основных типа мальпигиевых сосудов [742].
Первый и наиболее простой тип (рис. 78, Л) характерен для прямокрылых (Orthoptera). В этом случае выделительные
Рис. 78. Основные типы мальпигиевых сосудов насекомых. По Уигглсуорсу [744].
А — Orthoptera; Б — Coleoptera; В — HemJptera; Г —Lepidoptera. Стрелками показано движение экскретов, воды и минеральных ионов.
224
органы слепо заканчиваются в полости тела; они никогда Tie соединяются друг с другом и не прирастают к задней кишке. Гистологическое строение стенок сосуда одинаково по всей его длине [743], а все эпителиальные клетки выполняют только одну функцию отсасывания гемолимфы с содержащимися в ней экскреторными продуктами. Осмотическое давление жидкости в полости сосуда такое же, как и в гемолимфе. Эта жидкость транспортируется в заднюю кишку, где происходит обратное поглощение (реабсорбция) воды, ионов Cl-, Na+, К+ и возвращение их в гемолимфу [728]. Экскреторные продукты включаются в состав фекалий и выводятся наружу через заднепроходное отверстие. Вх общем мальпигиевы сосуды первого типа производят первичную мочу подобно капсулам нефронов в почке млекопитающих, а задняя кишка функционирует аналогично извитым канальцам.
По всей вероятности, мальпигиевы сосуды прямокрылых принадлежат к числу относительно примитивных органов выделения, недостаточная эффективность которых компенсируется их огромным количеством. Так, у саранчи Schistocerca gregaria имеется около 250 мальпигиевых сосудов.
Сосуды второго типа (рис. 78,^), обнаруженные у многих жуков (Coleoptera), являются криптонефридиальными: их концевые отделы прирастают к прямому участку задней кишки или даже довольно глубоко погружаются внутрь него. В остальном мальпигиевые сосуды этого типа подобны органам выделения прямокрылых. Показано, что у личинок и имаго зерновки Callosobruchus maculatus эпителиальные клетки по всей длине сосудов совершенно одинаковы [745]. Как и у прямокрылых, у личинок мучного хрущака Tenebrio molitor мальпигиевы сосуды служат лишь для отфильтровывания первичной мочи, а возвращение в гемолимфу воды и минеральных солей осуществляется задней кишкой [746].
Обычно у жуков 6 мальпигиевых сосудов, но в некоторых семействах они неодинаковы по размерам и выполняют разные функции. Например, у листоеда Galerucella viburni гемолимфа фильтруется клетками четырех более длинных сосудов, а одна пара коротких трубочек обеспечивает реабсорбцию воды [747].
Мальпигиевы сосуды третьего типа (рис. 78, В) найдены в отрядах клопов (Hemiptera) и двукрылых (Diptera). У клопа Rhodnius prolixus четыре сосуда; каждый из них свободно оканчивается в полости тела и подразделяется на два четко отграниченных отдела — проксимальный и дистальный (рис. 78, В). Как показали Уигглсуорс и Салпетер [723], рабдориум проксимального отдела представлен тесно упакованными палочками, а в дистальном отделе они раздвинуты гораздо шире и сильно варьируют по структуре (рис. 77). Клетки дистального отдела, занимающего 2/3 длины всей мальпигиевой трубочки, поглощают из гемолимфы воду, мочевую кислоту и мине
8!/4 198
225
ральные соли. Первичная моча, которая состоит из этих основных компонентов, затем передвигается в проксимальный отдел, откуда вода и соли поступают обратно в гемолимфу [748]. На долю проксимального отдела приходится примерно 1/3 длины сосуда.
Таким образом, у /?. prolixus проксимальный отдел мальпигиева сосуда частично принимает на себя ту функцию, которую у прямокрылых и жуков выполняет исключительно задняя кишка. Подобное обособление двух разных по своему строению и функциям отделов выделительных органов обнаружено у многих растительноядных и кровососущих клопов [749, 750]. При этом у Dysdercus koenigi, D. fasciatus и Neraza viridula мальпигиевы сосуды срастаются попарно своими концами, образуя две замкнутые петли (рис. 76, Б).
Мальпигиевы сосуды многих двукрылых морфологически не связаны с задней кишкой и дифференцированы на отделы. Они также могут быть отнесены к третьему типу органов выделения, хотя их строение гораздо сложнее, чем у клопов. Личинки и имаго маслинной мухи (Dacus oleae) имеют две пары мальпигиевых сосудов, которые перед впадением в кишечник соединяются попарно, образуя мочеточники. Каждый сосуд подразделен на четыре отдела: дистальный, промежуточный, медиальный и проксимальный [724, 725]. В дистальном отделе в просвет сосуда экскретируются мочевая кислота, ее соли и ионы Са2+, а в промежуточной и в еще большей степени в медиальной зонах идет транспорт воды из гемолимфы. В проксимальном отделе и в мочеточниках происходит обратное отсасывание полезных веществ из первичной мочи. Совершенно аналогичная по строению и функциям система отделов мальпигиева сосуда обнаруживается у имаго Drosophila rnela-nogaster [751].
Органы выделения мухи Calliphora erythrocephala стоят особняком в ряду возможных модификаций мальпигиевых сосудов двукрылых. У этого вида нет четкого обособления проксимального и дистального отделов, но стенки каждого сосуда построены из обычных и звездчатых клеток, которые встречаются вперемежку [752]. По-видимому, только обычные клетки участвуют в образовании первичной мочи, а звездчатые клетки возвращают в гемолимфу минеральные соли и воду.
Мальпигиевы сосуды четвертого типа (рис. 78, Г), характерные для чешуекрылых (Lepidoptera), сочетают в себе признаки второго и третьего типов: они образуют криптонефридии и в то же время дифференцированы на отделы. У гусеницы рисовой огневки (Corcyra cephalonica) таких отделов три — дистальный, медиальный и проксимальный [753]'. Вк первых двух отделах палочки рабдориума тесно смыкаются, а в третьем они широко расставлены. Опыты с использованием красителей показали, что гемолимфа фильтруется в медиальный отдел со-
226
с. к
Рис. 79. Схема транспорта экскре- ОМ-торных продуктов, солей и воды в мальпигиевом сосуде гусеницы Сог-cyra cephalonica. По Сриваставе
[753]- ПК
1— реабсорбция воды и минеральных солей в проксимальном отделе сосуда; 2— фильтрация гемолимфы в медиальном отделе; 3— перемещение экскреторных продуктов, воды и солей в полости сосуда; 4— отсасывание воды из задней кишки в дистальном отделе сосуда;
а.м.с — ампула мальпигиева сосуда; д.о~ дистальный отдел; м.о — медиальный от-^ —t дел; п.к—прямая кишкд; п.о — петля проксимального отдела; с.к — средняя
кишка; т.к — тонкая кишка.
► д.о
суда (рис. 79). В его проксимальном отделе реабсорбируются метаболически ценные компоненты и вода, так что в заднюю кишку попадают только высококонцентрированные продукты экскреции, которые содержат всего лишь 9,6% воды. Дистальный отдел мальпигиева сосуда, который прирастает к задней кишке, несет чисто осморегуляторные функции и отсасывает воду из экскретов. В дальнейшем эта вода используется для вымывания продуктов выделения из двух других отделов. Мочевая кислота в дистальном отделе не обнаружена. Она содержится лишь в клетках медиального и в полости проксимального отделов.
8 198
227
Приведенные здесь описания четырех типов мальпигиевых сосудов, конечно, еще не исчерпывают всех возможных вариантов их функциональной организации в классе насекомых. Однако они хорошо показывают, как в разных группах этого класса происходило параллельное преобразование органов выделения, связанное с расширением функций от формирования первичной мочи до полной фильтрации гемолимфы с возвращением в нее воды и солей.
Роль мальпигиевых сосудов в транспорте экскреторных продуктов, ионов и воды. Полость мальпигиевых сосудов заполнена жидкостью, которая имеет такое же осмотическое давление, как плазма гемолимфы, но заметно отличается от нее по содержанию основных неорганических ионов [754, 755]. Особенно показательны различия в концентрации Na+ и К+: внутри мальпигиевых сосудов калия всегда больше, а натрия меньше, чем снаружи.
Неравномерное распределение ионов служит причиной появления разности потенциалов между полостью мальпигиевой трубочки и гемолимфой. Величина этой разности составляет от —16 до +45 мВ. В то же время, как показывают расчеты по соответствующим уравнениям, пассивная диффузия ионов К+ должна существовать при более значительном отрицательном электрохимическом градиенте. Следовательно, калий активно переносится внутрь мальпигиевых сосудов против электрохимического градиента. Предполагается, что натрий также активно транспортируется через стенки мальпигиевых сосудов у большинства насекомых, но у Locusta migratoria и Rhodnius prolixus величина и направление разности потенциалов допускают его пассивный перенос [756].
Жидкость мальпигиевых сосудов, которая может быть названа первичной мочой, образуется за счет фильтрации из гемолимфы воды, солей, сахаров, аминокислот и экскретов. У многих насекомых в образовании этой жидкости ведущую роль играют ионы калия. При почти одинаковом осмотическом давлении плазмы гемолимфы и первичной мочи проникновение воды в мальпигиевы сосуды обусловливается активной транспортировкой калия. Иначе говоря, ионы К+ являются «переносчиками» молекул Н2О1. Поэтому у палочника Carausius того-sus и у мухи Calliphora erythrocephala экскреция в изолированных мальпигиевых сосудах зависит от содержания калия в физиологическом растворе [757, 758]. В этих случаях скорость экскреции сильно подавляется в отсутствии ионов К+ во внешней среде. Если мальпигиевы сосуды С. erythrocephala помещаются в растворы с разными соотношениями Na+ и К+, то скорость экскреции оказывается максимальной, когда весь
1 Реальный механизм переноса воды через стенки мальпигиевых сосудов и значение ионов К в этих процессах еще не выяснены.
228
натрий замещен калием (рис. 80, Б). Наоборот, скорость экскреции падает до нуля, когда весь калий замещен натрием.
Иная картина наблюдается у клопа Rhodnius prolixus, у которого изолированные мальпигиевы сосуды очень чувствительны к снижению содержания натрия в физиологическом растворе, а скорость экскреции одинаково зависит от концентрации и Na+, и К+ (рис. 80, Л). Очевидно, что в стенках мальпигиевых сосудов у этого насекомого имеется какой-то «насос», ко
150 125 100 ~75 to ~25 ~0 ЕМ
Концентрация ионов в
Рис. 80. Изменение скорости проникновения ионов .Na + и К+ через стенки мальпигиевых сосудов в зависимости от их концентрации в физиологическом растворе при постоянном осмотическом давлении. По Бэрриджу [758] и Маддрелу [759].
А — клоп Rhodnius prolixus-, Б — муха Calliphora erythrocephala.
200
100 120 100 80 60 00 20 0 [ЬГа]
физиологическом растворе
торый работает, затрачивая энергию дыхания, и активно поглощает ионы Na+ и К+ [759]. Оба эти иона могут транспортировать воду. Предполагается, что такой своеобразный механизм функционирования мальпигиевых сосудов с участием двух катионов . обеспечивает резкое повышение скорости экскреции у клопа-кровососа, поглощающего с пищей относительно большие количества воды.
Мочевая кислота, составляющая один из основных азотистых экскретов у насекомых, содержится в гемолимфе в концентрации от 1 до 70—100 мг на 1 мл [760]. У R. prolixus она переходит в мальпигиевы сосуды в виде уратов — мочекислого калия и мочекислого натрия [761]. В дистальном отделе мальпигиева сосуда, куда проникают эти соли, первичная моча имеет слабощелочную реакцию (pH 7,2). Затем ураты продвига-
229
ются в проксимальный отдел, где в условиях слабой кислотности (pH 6,6) натрий и калий освобождаются, а мочевая кислота выпадает в осадок в виде кристаллических конкреций. Центрами кристаллизации мочевой кислоты в полости мальпигиева сосуда служат многочисленные пузырьки диаметром до 0,1 мкм, которые выделяются рабдориумом клеток в проксимальном отделе [723]. В подтверждение этого процесса Рам-сэй [762] нашел, что количество свободной мочевой кислоты по ходу сосуда от его дистального к проксимальному участку увеличивается с 3 до 10% по отношению к общему сухому весу экскретируемых продуктов. Дополнительное осаждение мочевой кислоты должно происходить в задней кишке, содержимое которой имеет еще более кислую реакцию (pH ^6). Ректальные железы задней кишки возвращают в гемолимфу воду и неорганические ионы. В итоге содержание мочевой кислоты в экскретах, подлежащих удалению из организма, достигает 97,5% [763, 764].
По мнению Уигглсуорса [761], малорастворимая мочевая кислота в полости мальпигиева сосуда или в задней кишке вытесняется угольной кислотой:
Н2СО3 + KHN---------------> КНСО3
угольная мочекислый карбонат
кислота калий калия
4- H2N
мочевая кислота
Легкорастворимый карбонат калия реабсорбируется и возвращается в гемолимфу вместе с током воды, а угольная кислота может вновь синтезироваться из СО2. Но поскольку этот синтез остается гипотетичным, Майлс [765] полагает, что в клетках выделительных органов происходит непосредственное окисление мочекислого калия в мочевую кислоту без участия Н2СОз. Теоретически доказано, что такое окисление может осуществляться флавопротеинами, которые отличаются высокой активностью в стенках мальпигиевых сосудов.
В принципе аналогичные явления образования уратов и их последующего окисления разыгрываются в выделительных органах у Carausius morosus. Так как первичная моча этого насекомого содержит много калия при pH 6,8—7,5, мочевая кислота по всей длине мальпигиева сосуда существует лишь в виде мочекислого калия [766]. Только в задней кишке калий освобождается, а мочевая кислота выпадает в осадок и в дальнейшем выводится из организма вместе с экскрементами. Различия в способах транспортировки ионов и мочевой кислоты у С. morosus и Rhodnius prolixus иллюстрируются схемами на рис. 81.
Гормональная регуляция экскреции. Экскреция у насекомых осуществляется главным образом мальпигиевыми сосудами и задней кишкой с ее ректальными железами. Выделитель-230
пая функция обоих этих органов регулируется гормональным путем.
Активность мальпигиевых сосудов повышается под влиянием диуретического гормона, выделяемого нейросекреторными клетками центральной нервной системы. Изолированные мальпигиевы сосуды клопа Rhodnius prolixus увеличивают скорость диуреза в присутствии гемолимфы, взятой от свеженакормлен-ных клопов [767]. Гемолимфа голодавших особей не вызывает подобного эффекта. Следовательно, сразу после питания в гемолимфе клопов появляется какой-то гормональный фактор, который стимулирует деятельность мальпигиевых сосудов. Пока этот фактор присутствует в гемолимфе, скорость диуреза поддерживается на постоянном уровне, но через 4 ч при 21°С гор-
Рис. 81. Схема транспорта ионов и молекул в мальпигиевых сосудах и в задней кишке у двух видов насекомых. По Стоббарту и Шоу [756].
А — Rhodnius prolixus; Б — Carausius tnorosus. ам — аминокислоты; а.м.с — ампулы мальпигиева сосуда; д.м.с — дистальный участок мальпигиева сосуда; з.к — задняя кишка; м.к. — мочевая кислота; м.с—мальпигиевы сосуды; мч — мочевина; п.и — прочие ионы; п.м.с — проксимальный участок мальпигиева сосуда; р.ж — ректальные железы; с — сахара; с.к — средняя кишка; с.о — слепой отросток средней кишки; у — ураты, 1 — активный транспорт ионов и молекул; 2— способ транспорта неизвестен; 3— пассивный перенос; 4— предполагаемый транспорт; 5— направление движения экскретов.
231
к.н
мон начинает разрушаться и активность мальпигиевых сосудов снижается [768].
У 7?. prolixus диуретический гормон синтезируется в грудных ганглиях. В сложном мезоторакальном ганглии клопа обнаружены три группы нейросекреторных клеток — передняя, средняя и задняя (рис. 82). Основным источником гормона является группа задних клеток, которая обусловливает 97% всей диуретической активности гемолимфы [767]. Выброс гормона осуществляется из аксональных окончаний этих клеток, расположенных на выходе толстых каудальных нервов, т. е. сразу позади мезоторакаль-ного ганглия [769].
Освобождение диуретического гормона у R. prolixus контролируется чувствительными нервными клетками, расположенными^ брюшке [770]. Заполнение кишечника кровью вызывает растяжение брюшка и возбуждение рецепторов, связанных с этими нейронами. ПГаким образом, выделение в гемолимфу гормона, усиливающего диурез, является рефлекторным ответом организма на поступление пищи в кишечник.
Для ряда насекомых доказана диуретическая активность гормонов, которые секретируются мозгом и накапливаются
в мозговой железе corpora cardiaca. Например, у растительноядного клопа Dysdercus fasciatus усиление экскреции в изолированных мальпигиевых трубочках наблюдается в присутствии материала, экстрагированного из медиальных нейросекреторных клетках мозга и с. cardiaca [771]. Гораздо менее эффективным оказался экстракт мезоторакального ганглия. У жука Anisotarsus cupripennis и сверчка Gryllus bimaculatus диуретический гормон, стимулирующий абсорбцию воды мальпигиевыми сосудами, тоже продуцируется мозгом [772, 773]. По мнению Берриджа [771], ведущая роль мезоторакального ганглия
Рис. 82. Схема расположения нейросекреторных клеток в мезоторакальном ганглии клопа Rhodnius prolixus. По Маддрелу [767, 768].
з.н.к — задняя группа нейросекреторных клеток; к.н— каудальные нервы; мт.г — мезо-торакальный ганглий; п.н.к — передняя группа нейросекреторных клеток; пр.г — проторакальный ганглий; с.н.к — средняя группа нейросекреторных клеток.
232
в регуляции выделительных органов у Rhodnius prolixus представляет собой специальную адаптацию, связанную с поглощением больших порций крови и с необходимостью резкого усиления экскреции после питания. По-видимому, гормон грудных ганглиев позволяет создать более сильный стимулирующий эффект: попадая в гемолимфу, он увеличивает скорость экскреции у R. prolixus в 1000 раз, в то время как у Dysdercus fasciatus гормон мозга повышает ее лишь в 6 раз [759].
У таракана Periplaneta americana обнаружено два типа антагонистических гормональных факторов, влияющих на скорость экскреции. Обычный диуретический гормон, стимулирующий экскрецию, выделяется преимущественно последним брюшным ганглием и в меньшей степени другими ганглиями брюшной нервной цепочки [774]. Второй, антидиуретический гормон, угнетающий диурез в мальпигиевых сосудах, содержится в экстрактах мозга, подглоточного ганглия и мозговых желез [775]. Основным источником этого гормона являются медиальные нейросекреторные клетки мозга.
Выделительная функция ректальных желез контролируется теми же гормонами, которые регулируют активность мальпигиевых сосудов. Как уже отмечалось на с. 222, направление токов воды прямо противоположно в клетках мальпигиевых сосудов, абсорбирующих воду из гемолимфы, и в клетках задней кишки, реабсорбирующих воду и возвращающих ее в гемолимфу. По всей вероятности, эффект действия гормонов, влияющих на диурез, зависит от характера работы клеток. Поэтому у саранчи Schistocerca gregaria диуретический гормон, который стимулирует абсорбцию воды и экскретов в мальпигиевых сосудах, подавляет процессы реабсорбции в ректальных железах [776]. Наоборот, у Periplaneta americana антидиуретический гормон, содержащийся в экстрактах нервных ганглиев и мозговых желез, снижает скорость экскреции в мальпигиевых сосудах, но усиливает реабсорбирующую функцию задней кишки [777, 778]. Следовательно, каждый из этих двух гормонов действует соответственно своей основной физиологической задаче: первый из них благоприятствует, а второй препятствует выведению воды через мальпигиевы сосуды и кишечник.
§ 2. Химический состав экскретов
Азотистые соединения. Конечные продукты обмена, содержащие азот, образуются . при распаде нуклеиновых кислот и белковых соединений.
При гидролизе нуклеиновых кислот получаются углевод, фосфорная кислота и 4 обогащенных азотом гетероциклических основания:
233
Пуриновые основания
Пиримидиновые основания
Аденин Гуанин
Тимин
Азот пиримидиновых оснований — цитозина и тимина — может выделяться в виде мочевины и аммиака. Однако обычно пиримидины не подвергаются дальнейшему расщеплению, а используются в процессах обмена веществ в самом организме насекомого. Иная судьба у пуриновых оснований — аденина
и гуанина, — которые служат предшественниками основных
продуктов экскреции.
Нуклеиновые кислоты
Содержа- Раство~ ние азота, -.
%
римость, мг/100мл
Гипоксантин 'К
I Ксантин
37
10
260
У паукообразных (Arachnoidea) в значительном количестве выделяются сами пуриновые основания, причем главным экскреторным продуктом является гуанин [779]. Например, у пауков (Aranei) гуанин составляет от 36 до 76%
Мочевая кислота
I
Аллантоин
Аллантоиновая кислота
Аргинин Гистидин Цистин
33 6
35 60
32 Слабая
*6 И9 300
32 39000
32 15000
21 Умяоятп-'.а.я
К п
Рис. 83. Азотистые конечные продукты обмена и их взаимные превращения у насекомых. По Бурселу [781].
сухого веса экскретов; это соединение выводит от 73 до 87% всего экскретируемого азота [780]. Такой способ выделения можно считать относительно примитивным. По всей вероятности, он связан с недостаточной активностью ферментов, способных осуществлять гидролиз пуриновых оснований.
У многоножек (Му-riapoda) и насекомых (Insecta) после распада нуклеиновых кис-
Переход от аллантоиновой кислоты к мочевине и ам- ЛОТ ПРОИСХОДИТ ОКИС
миаку показан пунктиром, так как соответствующие ферменты редко встречаются у насекомых.
ление и дезаминирова-
234
ние пуриновых оснований по уриколитическому пути [781, 782]. Основной ход реакций на этом пути показан на рис. 83.
Аденин и гуанин при участии специфических ферментов — аденазы и гуаназы — дезаминируются, превращаясь в гипоксантин и ксантин. Пожалуй, только у долгоносика Anthonomus grandis из-за низкой активности гуаназы гуанин может выделяться и в неизменной форме [783],
Аденин
I
, Аденаза
гуанин
Гу а на за
Рис. 84. Образование мочевой кислоты при дезаминировании и окислении пуриповых оснований.
В последующих превращениях гипоксантина и ксантина принимает участие ксантиндегидрогеназа — фермент, окисляющий эти соединения в мочевую кислоту (рис. 84). У одного из мутантов Drosophila melanogaster, у которого отсутствует этот фермент, мальпигиевы сосуды выделяют гипоксантин и ксантин [784]. Однако у подавляющего большинства других насекомых основным азотистым экскретом служит мочевая кислота. В ходе дальнейшего распада мочевой кислоты могут быть получены аллантоин, аллантоиновая кислота, мочевина и аммиак. Как правило, эти соединения, если и присутствуют в экскретах, то в незначительных количествах; лишь в некоторых специальных случаях (см. ниже) они приобретают ведущее значение.
При гидролизе белковых соединений образуются аминокислоты, которые в небольшом количестве включаются в состав
235
экскретов. В качестве экскреторных продуктов чаще всего используется аргинин и гистидин, так как именно эти аминокислоты характеризуются наиболее высоким содержанием азота. Количество азота, которое выводится из организма с помощью аминокислот, непропорционально их содержанию в пище: у клопа-фитофага Dysdercus fasciatus оно составляет 13,2% [785], а у кровососа Rhodnius prolixus менее 0,2% [763], хотя кровь намного богаче белками, чем растительная пища. В экскретах червеца Rerria lacca обнаружены даже такие аминокислоты, которых нет в соке кормового растения [786].
Синтез пуриновых соединений из аминокислот осуществляется турикотелическому пути (см. рис. 83). Легко подсчитать, что накопление больших количеств мочевой кислоты в экскретах нельзя отнести только за счет распада нуклеиновых кислот: очевидно, должна существовать какая-то возможность метаболического превращения аминокислот в мочевую кислоту или ее предшественника.
Синтез мочевины в урикотелическом пути обмена веществ идет по так называемому орнитиновому циклу, который хорошо изучен у позвоночных животных [787]. В этот цикл включаются две молекулы аммиака и одна молекула СО2, причем его реакции тесно сопряжены с циклом трикарбоновых кислот. Установлено, что гусеницы тутового шелкопряда (Bombyx mo-ri) способны к образованию мочевины из цитруллина, который является одним из промежуточных продуктов орнитинового цикла [788]. Аммиак, когда он выделяется в значительных количествах и в свободном виде, возникает при дезаминировании или переаминировании аминокислот.
Таким образом, мочевая кислота, мочевина и аммиак могут быть продуктами окисления пуринов, но они могут синтезироваться и из аминокислот. Насекомые способны и к уриколити-ческому и & урикотелическому образованию этих веществ. Аллантоин и аллантоиновая кислота получаются в результате гидролиза мочевой кислоты.
Большинство наземных насекомых выделяет азот в форме мочевой кислоты или ее производных — аллантоина и аллантоиновой кислоты. Эти соединения плохо растворяются в воде (см. рис. 83), поэтому они могут выводиться из организма в твердом виде, без потерь воды. Более простые азотистые продукты — мочевина и аммиак — имеют очень высокую растворимость (см. рис. 83) и даже в низких концентрациях могут вызывать тяжелые отравления. Использование этих продуктов в качестве экскретов возможно только при условии сильного их разведения в воде. Такой способ выделения связан с большими затратами воды и доступен лишь водным насекомым, которым не грозит иссушение. Среди наземных видов личинки мясной мухи Lucilia sericata, обитающие в условиях высокой влажности, выделяют аммиак подобно водным насекомым [789]. Одна-236
ко куколки и имаго L. sericata экскретируют преимущественно мочевую кислоту и аллантоин [790].
Слабая растворимость и низкая токсичность мочевой кислоты создают возможность ее накопления в клетках жирового тела и в покровах, что открывает еще один путь избавления организма от азота. Именно в силу этих причин мочевая кислота получила широкое распространение у насекомых, как основной продукт экскреции, содержащий азот.
Рис. 85. Процентные соотношения мочевой и аллантоиновой кислоты в экскретах гусениц (а), куколок (б) и бабочек (в) семи видов чешуекрылых. По Разе [793].
1— Barathra brassicae; 2— Agrotis comes; 3— Aglais urticae; 4 — Trigonophora meticulosa; 5 — Pieris brassicae; 6 — Vanessa atalanta; 7 — Conistra vaccinii.
Увеличение относительного содержания мочевой кислоты в экскретах способствует экономному расходованию воды у куколок чешуекрылых и двукрылых. В этом отношении очень показательны изменения экскреторных продуктов в процессе метаморфоза восковой моли {Galleria mellonella). У гусениц этого вида пуриновый азот выделяется в виде мочевой кислоты, гипоксантина и ксантина (соответственно 75, 7 и 18%). На протяжении всей гусеничной жизни это соотношение остается постоянным, тогда как в меконии куколки и в экскретах имаго более 90% азота приходится на мочевую кислоту [791]. Если бы у куколок и бабочек пурины продолжали выделяться в виде ксантина или гипоксантина, гораздо более раст
237
воримых, чем мочевая кислота (см. рис. 83), то экскременты должны были бы содержать в 6 раз больше воды.
В экскретах чешуекрылых, наряду с мочевой кислотой, часто обнаруживаются аллантоин и аллантоиновая кислота [792, 793]. Аллантоин всегда выделяется в небольших количествах, потому что он гораздо лучше растворяется в воде, чем мочевая кислота. Аллантоиновая кислота имеет низкую растворимость, и у некоторых гусениц или бабочек она приобретает значение основного конечного продукта обмена веществ. Однако аллантоиновая кислота более токсична, чем мочевая кислота, поэтому в меконин куколок она всегда содержится лишь в низких концентрациях (рис. 85). Из этого примера ясно, что выбор доминирующего экскреторного продукта зависит не только от растворимости данного соединения, но и от степени его токсичности.
Безазотистые соединения. Органы выделения удаляют из гемолимфы не только азотистые продукты, но и любые другие ионы или молекулы, которые появляются в ней в значительных количествах. Мальпигиевы сосуды могут выводить наружу витальные красители, инсектициды и другие сложные органические вещества, искусственно введенные в гемолимфу.
- Потребляемые с пищей органические вещества разлагаются в кишечнике и всасываются клетками средней кишки, но небольшая часть этих веществ входит в состав экскретов. Например, в экскретах гусениц рисовой огневки (Corcyra cephalo-nica) обнаруживаются следовые количества крахмала [753]. С другой стороны, в полости самих мальпигиевых сосудов могут синтезироваться некоторые достаточно сложные органические соединения, впоследствии выделяемые наружу и используемые для специальных целей. Так, у цикадок-пенниц (сем. Cercopidae и Machaerotidae)-на нимфальных стадиях развития мальпигиевы сосуды секретируют мукополисахариды, которые служат для образования комков «слюны», защищающих нимф от врагов [794].
У палочника Carausius morosus, как и у многих других насекомых, сахара, которые всасываются мальпигиевыми сосудами из гемолимфы и входят в состав первичной мочи, возвращаются в гемолимфу ректальными железами [755]. Лишь в крайне низких концентрациях они присутствуют во вторичной моче, т. е. в экскретах, выводимых наружу. Однако тли и кок-циды, находящиеся в симбиотических отношениях с муравьями, выделяют огромные количества углеводов, которые происходят из потребляемых ими растительных соков. Эти углеводы служат важнейшими компонентами пади (медвяной росы), играющей важную роль в питании муравьев, наездников и других насекомых [795]. По данным Зебелайна [796] 246 видов насекомых, принадлежащих к 49 семействам, питаются падью.
В экскретах тлей содержание углеводов может достигать
238
80 и более процентов от сухого веса пади [797]. Основными сахарами пади являются фруктоза, глюкоза и другие олигосахариды.
Неорганические ионы, .играющие важную роль в экскреторной деятельности мальпигиевых сосудов, в относительно больших количествах присутствуют в первичной моче, но подвергаются обратному избирательному всасыванию в задней кишке. Однако и выделяемые наружу экскреты содержат многие неорганические соединения, в особенности соли кальция, магния, калия и других металлов. У гусениц Tineola bisselliella значительная часть экскретов представляет собой чистую серу, что, по-видимому, связано с питанием этих насекомых белками шерсти, обогащенными серосодержащими аминокислотами [798].
Б. П. Уваровым [799] отмечалось избирательное накопление оксалатных и фосфатных солей кальция в мальпигиевых сосудах некоторых насекомых. В таких случаях мальпигиевы сосуды служат органами не только эмункториальной, но и накопительной экскреции неорганических соединений. Подобная не совсем обычная функция мальпигиевых сосудов часто, наблюдается у личинок двукрылых. У личинок мухи Lucilia cuprina излишки минеральных веществ откладываются в виде сферических гранул в полости выделительных трубочек. По мере роста личинок гранулы увеличиваются в размерах и перед окуклением достигают диаметра около 16 мкм [800]. Каждая гранула состоит из смеси фосфорнокислых и углекислых солей кальция, магния и небольших количеств бария и стронция. У куколок все эти' минеральные соли переносятся в заднюю кишку и включаются в состав мекония, который выводится наружу после вылета взрослой мухи.
Глава VI. ФИЗИОЛОГИЯ КРОВЕНОСНОЙ СИСТЕМЫ
§ 1. Функциональная организация кровеносной системы насекомых
Гемолимфа и ее функции. Насекомые, как и все остальные членистоногие, обладают незамкнутой кровеносной системой. Поэтому гемолимфа представляет собой единственную тканевую жидкость в теле насекомых. Подобно крови позвоночных она состоит из жидкого межклеточного вещества — плазмы и находящихся в ней клеток—гемоцитов. Но в отличие от крови позвоночных гемолимфа циркулирует не по замкнутым сосудам, а непосредственно в полости тела (в гемоцеле). К тому же в ней нет клеток, снабженных гемоглобином или каким-либо другим дыхательным пигментом.
Плазма гемолимфы содержит широкий набор химических соединений, принимающих участие в метаболических процессах. Она является той внутренней средой, в которой живут и функционируют все клетки организма насекомого.
Гемоциты либо находятся в свободном взвешенном состоянии в плазме, либо неподвижно оседают на поверхности внутренних органов. Соотношение числа свободных и седентарных (сидячих) гемоцитов меняется в зависимости от вида, пола, возраста и стадии развития насекомого.
Скопления гемоцитов часто наблюдаются вокруг гемопоэтических (кроветворных) органов, образующих клетки гемолимфы. Такие органы описывались у насекомых неоднократно [801, 802, 803]. Например, у личинок пилильщика Diprion simi-lis они найдены в голове, груди и брюшке в виде плотных ге-моцитарных комплексов, объединяющих под общей оболочкой в среднем около 7000 клеток [801].
Гемолимфа насекомых осуществляет транспорт питательных веществ от стенок кишечного канала ко всем органам. В выполнении этой трофической функции принимают участие гемоциты и химические соединения плазмы. Продукты пищеварения всасываются клетками средней кишки, а затем поступают в гемолимфу и разносятся ею по телу насекомого. Часть питательных веществ передается жировому телу и откладывается в виде запасов в его клетках (рис. 86). При голодании, диапаузе и в моменты линек эти резервные продукты вновь переходят в гемолимфу и могут быть доставлены к местам их ис-
240
пользования. У насекомых, развивающихся с полным превращением, те продукты, которые освобождаются при гистолизе личиночных тканей, точно так же транспортируются гемолимфой.
Вторая важная функция гемолимфы связана с ее участием в защите насекомых от инфекционных заболеваний и заражения паразитами. Особенно важную роль в защитной функции гемолимфы играют белки плазмы, фагоциты и клетки, образующие гемоцитарные капсулы вокруг многоклеточных паразитов.
Гидростатическое давление, развиваемое циркулирующей гемолимфой, используется при выполнении ею механической функции. Этим давлением обеспечивается раскручивание хоботка у бабочек, расправление крыльев у всех крылатых насеко-
Киш.ечник
Рис. 86. Схема метаболических взаимоотношений гемолимфы с другими органами и тканями.
Стрелками указаны направления транспортировки питательных веществ: 1— в период активного питания нимфы, личинки или имаго; 2— во время гистолиза личиночных тканей у куколки.
241
мых, а по некоторым данным также и сбрасывание крыльев термитами после брачного лёта [804].
Кровеносная система и органы кровообращения. Движение гемолимфы в теле насекомого, обеспечивающее перенос питательных веществ, называется кровообращением. Скорость движения гемолимфы в полости тела зависит от активности пульсирующих органов, поддерживающих кровообращение. У гусениц Bombyx mori гемолимфа движется со скоростью от 1,8 до 6,6 см/мин [805]. У нимф таракана Periplaneta americana полный цикл обращения гемолимфы осуществляется за 3—6 мин [806].
Основным пульсирующим органом у насекомых является сердце, которое имеет вид длинной трубки и проходит над кишечником через все брюшко (рис. 87, с). Сердце поделено на камеры (с.к), соответствующие брюшным сегментам. Между соседними камерами находятся парные боковые отверстия —
Рис. 87. Схема расположения сердца у таракана. По Эйдманну [807].
а—аорта; д — диафрагма; к. м — крыло-
видная мышца; м — мозг; о. к.с — ответвления крыловых кровеносных сосудов; с — сердце; с.к — сердечная камера.
остии, через которые гемолимфа проникает в сердце. Остии снабжены примитивными остиальными клапанами. При обычном движении крови по сердцу, направленном сзади наперед, остии пропускают гемолимфу внутрь сердца, по автоматически закрываются, когда она устремляется в полость тела. При обратном токе крови, который наблюдается у некоторых насекомых, остиальные клапаны широко открываются и не функционируют.
В процессе эволюции насекомых наблюдается тенденция к олигомеризации числа камер и остий. Например, у поденок имеется 10 камер, а у клопов и двукрылых — не более 4г Эволюция пауков также сопровождалась постепенным укорочением сердца и уменьшением числа остий от 12 до 4 [808].
Как правило, сердце на заднем конце замкнуто. Впереди сердце продолже
242
но в аорту, приносящую кровь в голову. Аорта лишена камер и остий, а стенки ее не имеют мышц, способных к самостоятельным сокращениям. У тараканов аорта несет в середине 2 пары дорсальных ампул, назначение которых остается неясным. У большинства насекомых передний конец аорты открывается свободно, но у гусениц от него начинаются 4 коротких сосуда, снабжающих кровью антенны и оптические доли мозга. -
Рис. 88. Основные токи гемолимфы в теле пилильщика. а — аорта; с — сердце.
В отсутствии кровеносных сосудов направление токов гемолимфы в полости тела насекомых определяется расположением двух продольных диафрагм. Спинная диафрагма проходит между сердцем и кишечником. Она отделяет дорсальную часть тела — кардиальный синус — от расположенного ниже перивисцераль-ного синуса. Брюшная диафрагма лежит между кишечником и нервной цепочкой. Она отделяет самый нижний перинейраль-ный синус от перивисцерального. Обе диафрагмы частично не доходят до стенок тела, так что по бокам остаются отверстия, через которые проходит кровь.
Циркуляция крови в теле насекомых происходит по схеме, показанной на рис. 88. Через боковые отверстия спинной диафрагмы кровь переходит из перивисцерального синуса в перикардиальный и проникает через остии в сердце. Периодические сокращения сердечной трубки проталкивают кровь в аорту, откуда она изливается в голову. Возвращаясь из головы в грудь,
243
кровь заходит в ноги и крылья. Движение крови в крыльях осуществляется по жилкам, причем согласно правилу Каруса [809] кровь заходит в крыло вдоль костального края и выходит в полость тела через медиальные и анальные жилки. Из груди кровь .переливается в перивисцеральный и перинейраль-ный синусы брюшка.
Реверсия сокращений сердца, обусловливающая обратный ток крови, обнаружена у многих насекомых. Это явление наблюдал еще Мальпиги в 1669 г. Им впервые было установлено, что кровь может заходить в сердце через аорту и двигаться по нему в направлении спереди назад. Токи гемолимфы, возникающие в теле насекомого в результате такой реверсии, до сих пор не изучены. ' _
Проникновение крови в сердце и ее переход из одного синуса в другой связаны с ритмической активностью диафрагм, в которых находятся мышечные волокна, способные к самостоятельным миогенным сокращениям. Нервная система изменяет ритм этих сокращений, но не вызывает их [810]. На спинной диафрагме поперечные мышечные волокна собраны в крупные веерообразные пучки крыловидных мышц (рис. 87, к.м), расположенных посегментно, соответственно камерам сердца. Крыловидные мышцы прикрепляются к стенкам сердечной трубки и, по всей вероятности, участвуют в ее работе.
Местные пульсирующие органы проталкивают кровь в антенны, ноги и крылья. По данным М. Павловой [811] у таракана Blatta orientalis антеннальный орган состоит из широкой фронтальной мышцы, которая соединяется с двумя ампулами, расположенными по бокам головы у основания антенн. Ампулы растягиваются и заполняются кровью при сокращении этой мышцы. Самостоятельные сокращения стенок ампулы выталкивают кровь и нагнетают ее в антеннальный кровеносный сосуд. По такой же принципиальной схеме устроены и другие типы пульсирующих органов: в любом из них мы находим либо ампулу, либо мембранозную сократительную перепонку, связанную со специальной мышцей. \
Все местные пульсирующие органы функционально не связаны с сердцем и характеризуются собственным ритмом сокращений. В ампутированных ногах эти органы продолжают работать в течение нескольких дней у водных клопов [812], но их сокращения прекращаются сразу после ампутации ноги у тли Myzus persicae [813].
§ 2. Химический состав и некоторые свойства плазмы
Осмотическое давление гемолимфы и его регуляция. Плазма гемолимфы представляет собой водный раствор неорганических веществ, аминокислот и ряда других органических 244
соединений. Как известно, осмотическое давление любого раствора служит самым общим суммарным выражением концентрации всех растворенных веществ. Оно зависит от количества молекул или ионов в определенном объеме растворителя, но не зависит ни от их размеров, ни от природы растворенного вещества. Поэтому все химические соединения гемолимфы являются взаимозаменяемыми и одинаково эффективными в отношении их
Классы Отряды
Crustacea Decapoda 1
IsopodafdodHbie) |
Isopoda (наземные)\
Arachnida Ar a net |
Diplopoda. JuLtformia 1
Chiloро da АтьатогрЬа, 1
In, sect a 4 (Apteriiqota) Thysanura 1
Insecta (Pterygota) Odon at a. |
Orthoptera, I
Near opt er cl |
Lepidoptera 1
15\7///А 100°/q
Рис. 89. Процентные соотношения осмотических концентраций основных веществ плазмы в разных группах членистоногих. По данным Сатклиффа [814].
Кривая показывает изменение соотношений между неорганическими и органическими веществами, /—неорганические катионы; 2—неорганические- анионы; 3— аминокислоты; 4 — прочие органические вещества.
влияния на осмотическое давление плазмы. Следовательно, можно говорить об осмотической концентрации гемолимфы, как об общей концентрации содержащихся в ней химических соединений. Эталоном для сравнения осмотических концентраций разных растворов служит эквивалентная концентрация NaCl.
У всех позвоночных и многих беспозвоночных животных осмотическое давление внутриполостных жидкостей создается в основном неорганическими катионами и анионами, в первую очередь Na+ и С1~. В типе членистоногих (рис. 89) неорганические ионы продолжают доминировать в ге;молимфе ракообразных, паукообразных, многоножек и первичнобескрылых насекомых (Apterygota). Однако у крылатых насекомых (Ptery-
9 198 245
gota) состав гемолимфы изменяется. Уже у стрекоз (Odonata) заметную роль начинают играть свободные аминокислоты, которые существенно увеличивают вклад органических соединений в осмотическую концентрацию плазмы, но неорганические ионы все еще сохраняют свое ведущее значение. У прямокрылых (Orthoptera), сетчатокрылых (Neuroptera) и многих других отрядов органические молекулы составляют уже около половины всех химических соединений гемолимфы. Наконец, у чешуекрылых (Lepidoptera) и перепончатокрылых (Нуше-noptera) создается уникальное для животных соотношение органического и неорганического состава внутриполостной жидкости: резко возрастает концентрация аминокислот и соответственно снижается содержание минеральных веществ. Очевидно, в ходе эволюции крылатых насекомых происходило постепенное замещение неорганических ионов гемолимфы молекулами аминокислот и других органических продуктов, которые на высших этапах филогенеза получают преобладающее значение в качестве осмотически эффективных соединений [814]. ,
Очень многие насекомые имеют специальные механизмы осморегуляции, поддерживающие осмотическую концентрацию гемолимфы на постоянном уровне. Деятельность таких механизмов подробно рассматривалась в обзорных работах Шоу и Стоббарта [815, 816]. Здесь будут приведены только некоторые общие заключения этих авторов.
У насекомых, обитающих в пресной воде,' гемолимфа гипертонична по отношению к окружающей среде. Осмотическое давление плазмы существенно не увеличивается при повышении содержания поваренной соли в воде до 1 —1,5%. Однако в более концентрированных растворах NaCl осморегуляторные механизмы выключаются и содержание соли в гемолимфе и в среде возрастает с одинаковой скоростью (рис. 90, /, 2). Поэтому насекомые, адаптированные к условиям пресных вод, быстро погибают в солоноватой или морской воде. Например, пресноводные личинки комаров р. Corethra или жуков р. Helodes не могут жить достаточно долго в воде, в которой соленость больше 10%1 [817, 818].
Насекомые, заселяющие соленые озера, характеризуются очень высокой устойчивостью к повышению солености среды. У личинок мух Ephydra cinerea, обитающих в Большом Соленом озере в штате Юта (США), гемолимфа остается сильно гипотонической даже в воде с соленостью равной 2ОО°/оо [822]. У другого вида этого рода, Е. riparia, осмотическая концентра
1 Соленость среды служит показателем общего содержания в ней солей; она измеряется количеством частей соли на 1000 частей воды. Любую воду с соленостью меньше О,5°/оо можно считать пресной. MopqKan вода имеет среднюю соленость порядка 35%о. Солоноватой можно назвать воду, соленость которой ниже 30, но выше О,5°/оо.
246
ция гемолимфы также очень мало зависит от содержания солей в воде, в которой находятся личинки (рис. 90, 4).
Промежуточное положение между насекомыми пресных вод и соленых озер занимают виды, способные жить в солоноватой воде (рис. 90, 3). Так, нимфы стрекозы Ischnura elegans часто встречаются и в пресных, и в солоноватых водоемах, так как они одинаково хорошо поддерживают гипер- или гипотоничность плазмы в зависимости от внешней концентрации солей
Рис, 90. Зависимость осмотического давления гемолимфы от осмотического давления среды у трех видов водных насекомых. По Уигглсуорсу [819], Сатклиффу [820] и Неуманну [821].
Осмотическое давление выражено в эквивалентной концентрации NaCl в процентах к объему раствора. 1— изотоническая линия, иллюстрирующая прямую зависимость осмотической концентрации от содержания солей в среде; — личинка комара Aedes aegypti, заселяющая пресные воды; 3— личинка комара Chironornus halophilus, заселяющая солоноватые водоемы; 4—личинка мухи Ephydra riparia — обитатель соленых озер.
[823]. Подобная осмотическая лабильность, благодаря которой пресноводные насекомые могут проникать из рек в морскую воду вдоль побережий, свойственна и некоторым личинкам комаров р. Chironomus [821, 824].
Одним из основных механизмов, поддерживающих высокую осмотическую концентрацию в плазме пресноводных насекомых, является активное поглощение ионов из внешней среды. Если личинки комара Aedes aegypti находятся в воде с очень низкой концентрацией Na+ (1—2 мкмоль/л), через несколько дней количество натрия в гемолимфе снижается в 3 раза [825]. Если затем этих личинок переместить в воду, содержащую 2 ммоль/л Na+, то обычный уровень натрия гемолимфы быстро восстанавливается. Поглощение ионов наблюдается как у голодных, так и у питающихся личинок; следовательно, натрий проникает в тело через покровы, а не только через кишечник вместе с пищей.
247
Личинки комаров поглощают минеральные ионы из воды через анальные папиллы, которые располагаются на самом заднем конце брюшка [819, 825, 826, 827]. В сем. Chironomidae приспособление к жизни в водоемах с низким срдержанием солей (например, в оз. Байкал) ведет к увеличению размеров анальных папилл. Наоборот, у видов, обитающих в морях и соленых озерах, папиллы редуцированы до степени небольших бугорков. При постепенной адаптации личинок Aedes aegypti к повышенной солености среды происходит столь же постепенное уменьшение размеров папилл (рис. 91).
Адаптация к поглощению минеральных соединений из воды с пониженной соленостью выражается не только в увеличении размеров, но и в характерных изменениях микроструктуры анальных папилл. Сохал и Копелэнд [828] показали, что, когда личинки A. aegypti содержатся в растворе с низкой концентрацией NaCl, заметно возрастает число цитоплазматических впя-чиваний на эпителиальных клетках, образующих наружную стенку каждой папиллы. В результате этого сильно увеличивается суммарная поверхность клеточной мембраны, т. е. усиливается деятельность клеток, направленная на поглощение ионов и их перенос в гемолимфу. Индикатором высокой метаболической активности клеток в таких папиллах может служить и относительно большое количество митохондрий (см. рис. 91).
У личинок Ephydra cinerea натрий проникает из воды в гемолимфу по всей поверхности покровов [822]. Кроме того, местом интенсивного поглощения ионов водными насекомыми может служить пищеварительный тракт. В частности, у личинки Sialis lutaria повышенная концентрация Na+ и С1_ в гемолимфе поддерживается благодаря заглатыванию воды через рот с последующим активным извлечением этих ионов клетками кишечника [829]. Другие пресноводные личинки и нимфы, вероятно, в состоянии использовать подобный же механизм осморегуляции.
Если водные насекомые помещаются в гипертоническую среду, выведение излишнего количества ионов, попадающих в гемолимфу через покровы и кишечник, осуществляется мальпигиевыми сосудами и задней кишкой. У личинок Aedes aegypti основную роль в регуляции осмотического давления гемолимфы играют ректальные железы задней кишки [827, 830]. В полости мальпигиевых сосудов содержится тем больше натрия, чем выше его концентрация в гемолимфе и во внешней среде, но клетки ректальных желез меняют характер своей деятельности в зависимости от потребностей организма в ионах Na+. Когда личинки находятся в дистиллированной воде, эти клетки работают против градиента концентрации солей и возвращают в гемолимфу почти 85% экскретируемого натрия. При повышении содержания NaCl в среде до 85 ммоль/л задняя кишка выводит наружу весь натрий, поставляемый мальпигиевыми сосудами.
248
Кроме того, сами ректальные железы начинают активно поглощать ионы Na+ из гемолимфы, также включая их в состав экскретов. Таким образом, ректальные железы могут либо способствовать выведению натрия из организма (в гипертонической среде), либо удерживать его в плазме гемолимфы (в гипотонической среде). Первая функция ректальных желез получает усиленное развитие у тех насекомых, которые обитают в соленой воде, а вторая — у тех, которые заселяют пресные воды.
У пресноводных насекомых осморегуляция заключается в предотвращении разбавления гемолимфы водой, т. е. в борьбе со снижением ее осмотического давления. Перед наземными насекомыми встает противоположная проблема борьбы с испарением воды, т. е. с повышением осмотического давления гемолимфы.
У большинства наземных насекомых, как и у рассмотренных выше личинок Aedes aegypti, постоянство осмотической концентрации гемолимфы поддерживается ректальными железами. У палочника Dixippus morosus эти железы реабсорбируют более 95% натрия, поставляемого мальпигиевыми сосудами. По* этому концентрация Na+ в гемолимфе почти не снижается спустя 96 ч голодания. Инъекция поваренной соли в тело палочника, увеличивающая в 4—5 раз содержание натрия в гемолимфе, одновременно в 3—4 раза повышает скорость его поглощения мальпигиевыми сосудами, но при этом количество ионов, возвращаемых в гемолимфу ректальными железами, снижается до 40%, а остальные 60% выводятся наружу в экскретах [831]. В результате совместной работы мальпигиевых сосудов и задней кишки концентрация соли в гемолимфе снижается на 7з за 3 дня.
Способность задней кишки реабсорбировать ионы и воду из первичной мочи является эффективным средством поддержания постоянного осмотического давления гемолимфы. У саранчи Schistocerca gregaria после инъекции в заднюю кишку водного раствора NaCl и КС1, взятых в таких же концентрациях, в каких они присутствуют в гемолимфе, клетки ректальных желез в течение 3 ч переносят в гемолимфу 75% кальция, 70% воды, 31% натрия и 44% хлора [832]. Очевидно, ионы и вода активно транспортируются клетками против концентрационного градиента, хотя скорость переноса молекул или ибнов зависит от их относительного содержания в гемолимфе и в задней кишке. Следует также отметить, что вода и неорганические ионы могут транспортироваться в противоположных направлениях. Так, если внутрь задней кишки саранчи ввести гипертонический раствор солей, то вода начинает входить в кишечник, а ионы Na+, К+ и С1“ выходят из него.
Минеральные соединения. В плазме гемолимфы свободные минеральные соединения, не связанные с белками, находятся в ионизированном состоянии. Эти ионы используются насеко-
249
250
мыми не только для поддержания осмотического давления гемолимфы, но и как резерв неорганических веществ, необходимых для работы живых клеток. В частности, процессы, связанные с переносом ионов через клеточные мембраны, обусловливают возникновение биоэлектрических потенциалов. Поэтому закономерности, управляющие распределением ионов между клетками и гемолимфой, привлекают пристальное внимание физиологов.
Основная масса катионов гемолимфы представлена натрием, калием, кальцием и магнием. У каждого вида количественные соотношения между этими четырьмя ионами зависят от его систематического положения, среды обитания и пищевой специализации [833, 834].
Для древних и относительно примитивных групп насекомых, таких как стрекозы (Odonata) и прямокрылые (Orthoptera), доминирующим катионом гемолимфы является Na+, а в более специализированных отрядах на первый план выдвигаются либо К+ (у перепончатокрылых), либо Mg2+ (у чешуекрылых). Вместе с тем в разных таксономических групцах обитание в водной среде всегда связано с преобладанием Na+ над другими катионами гемолимфы. Например, у всех наземных гусениц в плазме калия больше, чем натрия, но у водной гусеницы Nymphula nymphaeta наблюдаются обратные соотношения концентраций этих ионов [834]. Растительноядные личинки ручейников и водных двукрылых также характеризуются необычно высокими концентрациями Na+ в гемолимфе [833, 834].
Отношение концентраций Na+ и К+, называемое натриево-калиевым коэффициентом, служит хорошим показателем зависимости ионного состава плазмы от пищевой специализации. Пределы вариаций этого коэффициента для всего класса насекомых составляют от 0,04 до 50. Как впервые показали Бонэ [835, 836] и Тобиас [837], у хищников, кровососов и у полифагов, способных питаться продуктами животного происхождения, значения натриево-калиевого коэффициента выше 1. В этих случаях накопление натрия в гемолимфе облегчается благодаря высокому содержанию натриевых солей в животных кормах. Однако и некоторые фитофаги (например, многие виды отр. Orthoptera), недостаточно адаптированные к питанию
Рис. 91. Изменения размеров и микроструктуры анальных папилл у личинок комара Aedes aegypti в зависимости от осмотической концентрации среды.
По Уигглсуорсу [819] и Колелэнду [828].
Вверху — схемы, показывающие относительные размеры анальных папилл; внизу — электронные микрофотографии одной из эпителиальных клеток папиллы. Личинки содержатся в опресненной (Д) или солоноватой (Б) воде. а.Г — аппарат Гольджи; а.п — анальные папиллы; к — кутикула; м— митохондрии; с.с — гомогенный субкутикулярный слой неизвестной природы; ц.в — цитоплазматические впячивания на поверхности эпителиальных клеток; э.р — эндоплазматический ретикулум.
251
to
253
Рис. 92. Соотношения концентраций натрия (/) и калия (2) в гемолимфе насекомых. По данным разных авторов, сведенным в таблицах Флоркина и Женио [838].
Каждая пара столбиков соответствует одному виду. Темная горизонтальная полоска проведена над видами, обитающими в воде.
на растениях, могут накапливать натрий. Растительная пища содержит относительно мало Na+, но много К+ и двухвалентных катионов (Са2+ и Mg2+). Поэтому в разных отрядах насекомых возникают наиболее специализированные группы фитофагов, которые утрачивают способность к накоплению натрия, и тогда доминирующими ионами гемолимфы становятся калий или магний и натриево-калиевый коэффициент меньше 1 (рис. 92). Примерами таких групп могут служить палочники (отр. Phasmodea), листоеды в отр. Coleoptera, пилильщики в отр. Hymenoptera и почти все чешуекрылые (отр. Lepidoptera).
Интересные эволюционные сопоставления могут быть сделаны при сравнительном анализе содержания основных ионов в гемолимфе у разных групп членистоногих [814].
У ракообразных; паукообразных и многоножек относительные количества неорганических ионов гемолимфы соответствуют формулам:
Na>Ca>Mg>K (1)
или
Na>Mg>Ca>K. (2)
Такой состав внутриполостной жидкости примерно отражает количественные соотношения ионов в морской воде.
Наиболее примитивные современные представители подкласса крылатых насекомых (Pterygota), относящиеся к инфраклассу древнекрылых (Palaeoptera), унаследовали от своих далеких предков состав ионов гемолимфы, отвечающий формуле (1). В инфраклассе новокрылых (Neoptera) в когортах Polyneoptera и Paraneoptera все полифаги, зоофаги, детрито-фаги и подавляющее большинство фитофагов имеют такие же соотношения ионов гемолимфы, как в формуле (2). Лишь в некоторых группах наземных открытоживущих фитофагов (палочники среди Polyneoptera и клопы сем. Pentatomidae среди Paraneoptera) относительное содержание катионов изменяется:
Mg > К > Са > Na (3)
или
Mg>Ca>K>Na. (4)
Эволюция насекомых в когорте Oligoneoptera также начиналась с относительно примитивного состояния, которое представлено формулой (2). Подобные соотношения ионов сохраняются у зоофагов, водных и почвенных фитофагов этой таксономической группы. Однако у многих наземных фитофагов (пилильщики, часть пластинчатоусых жуков, все листоеды, большинство чешуекрылых) наблюдается перераспределение катионов в соответствии с формулами (3) или (4). Наконец, 254
особое положение занимают высшие перепончатокрылые (Аси-leata) и небольшая часть чешуекрылых, у которых доминирующее значение приобретает калий:
K>Mg>Ca>Na.
Таким образом, изучение неорганического состава гемолимфы современных Pterygota свидетельствует о достаточно раннем обособлении Neoptera от Palaeoptera, а также о значительном параллелизме в историческом развитии насекомых с неполным и полным превращением.
Кроме отмеченных выше макроэлементов (Na, К, Са и Mg), в гемолимфе насекомых могут быть обнаружены следовые количества микроэлементов (Zn, Си, РЬ и Fe). Почти всегда микроэлементы связаны с крупными органическими молекулами; часто они входят в состав белков и ферментов.
Среди неорганических анионов гемолимфы на первом месте стоит С1_. Содержание хлора в плазме достигает 100— 150 ммоль/л у насекомых, развивающихся с неполным превращением (Hemimetabola), но у насекомых, претерпевающих полное превращение (Holometabola), оно ниже 50 ммоль/л на всех стадиях развития [814, 834, 838]. Уменьшение количества хлоридов в гемолимфе насекомых в процессе эволюции связано С их замещением аминокислотами как основными осмотически активными веществами гемолимфы.
Другие неорганические анионы гемолимфы — это НСО Г и Н2РО“. Оба типа анионов встречаются в низких и примерно одинаковых концентрациях как у Hemimetabola, так и у Holometabola [834, 839].
Следовательно, в классе насекомых концентрация большинства основных неорганических ионов гемолимфы изменяется в широких пределах. Но на эти филогенетические изменения накладываются и значительные индивидуальные ' вариации в содержании отдельных катионов или анионов. Например, у разных особей таракана Periplaneta americana количественные соотношения Na+ и К+ в плазме могут варьировать от 1 до 14 [840]. В результате голодания концентрация К+ снижается на 50%, Na+ — на 30%, а Са2+ — на 20%. Невольно возникает мысль, что насекомые не могут регулировать ионный состав гемолимфы и поддерживать устойчивые концентрации его компонентов в различных экологических условиях. Однако в действительности, несмотря на большую индивидуальную изменчивость, среднее содержание ионов в плазме не зависит от пищевого режима, пола или возраста таракана.
Как у водных, так и у наземных насекомых ионный состав гемолимфы регулируется теми же основными механизмами, которые поддерживают постоянство ее осмотического давления.
255
Особенно важную роль в этой регуляции играют покровные ткани, мальпигиевы сосуды и кишечник.
Углеводы. Основной сахар гемолимфы насекомых—это дисахарид трегалоза, построенный из двух молекул глюкозы. Содержание трегалозы в плазме составляет 80—90% всей углеводной фракции. Известно только несколько исключений из этого правила. ТрегалЪза полностью отсутствует в гемолимфе личинок мухи Phormia regina [841, 842] и гусениц бражника Gelerio euphorbiae [843]. В обоих случаях основным сахаром гемолимфы является глюкоза, а трегалоза начинает синтезироваться только при подготовке к окуклению; у куколок и имаго она уже доминирует над глюкозой.
Нетипичные для насекомых соотношения разных углеводов обнаруживаются у пчелиных (Apis mellifera и виды р. Bom-bus). Например, по данным Маурицио [844] у медоносной пчелы содержание трегалозы в гемолимфе крайне невелико, а большая часть Углеводной фракции представлена фруктозой, глюкозой, сахарозой, мальтозой и трисахаридом фруктомальтозой. Однако у большинства насекомых содержание трегалозы в гемолимфе намного превышает концентрацию других сахаров [845].
Высокая концентрация трегалозы в гемолимфе насекомых оправдывается очень важной для организма транспортной функцией этого сахара. Клетки жирового тела синтезируют трегалозу из глюкозы в присутствии АТФ, а затем выделяют ее в гемолимфу. Синтезированный дисахарид с током гемолимфы разносится по всему телу и вновь поглощается теми тканями, которые нуждаются в углеводах. В тканях поглощаемая из гемолимфы трегалоза расщепляется специальным ферментом трегалазой: трегалоза + Н2О-> 2 глюкозы.
Высокая активность трегалазы обнаруживается в кишечнике, мальпигиевых сосудах, жировом теле и грудной мускулатуре [845]. Очевидно, клетки всех этих органов могут использовать трегалозу гемолимфы в качестве поставщика глюкозы, включаемой в циклы промежуточного окисления или других биохимических превращений.
Крыловые мышцы многих насекомых используют глюкозу, освобождаемую при расщеплении трегалозы, как источник энергии сокращения. Поэтому при продолжительном полете мухи Phormia regina содержание глюкозы в гемолимфе остается на постоянном уровне, а содержание трегалозы падает, и одновременно уменьшается частота колебаний крыльев [846]. После инъекции глюкозы или трегалозы в полость тела восстанавливается высокая частота сокращений крыловых мышц.
Концентрация трегалозы в грудном отделе Ph. regina особенно сильно падает в течение первых 2 мин непрерывного полета. После того, как будет израсходована часть сахаров гемо
256
лимфы, полет мухи поддерживается за счет дополнительного использования гликогена, находящегося в жировом теле. При этом первоначально резкое падение содержания трегалозы сменяется более пологим спадом (рис. 93, Д). Гликоген превращается в трегалозу и в таком виде транспортируется гемолимфой от жирового тела к мышечным волокнам. Как видно из рис. 93, 5, запасы гликогена почти полностью расходуются за 15 мин непрерывного полета [847]. По всей вероятности, более длительный полет мухи связан с расщеплением каких-то других органических соединений или с использованием других мест депонирования углеводов.
В гемолимфе насекомых ферментативное расщепление тре-
Рис, 93. Изменения содержания трегалозы (Л) и гликогена (Б) в грудном отделе мух Phormia regina во время полета. По Сактору и Вормсер-Шавиту [847].
257
галозы идет с очень низкой скоростью, так как присутствующая здесь трегалаза угнетается специальным ингибитором, свободно растворенным в плазме [848]. В периоды линек ингибирование трегалазы гемолимфы снимается. В это время становится особенно ясным большое значение трегалозы, содержащейся в плазме, для процессов обмена веществ в эпидермальных клетках. У гусениц Philosamia ricini при подготовке к линьке или окуклению активность трегалазы в гемолимфе
Рис. 94. Динамика содержания трегалозы (/) и активности трегалазы (2) в гемолимфе в течение V возраста и при окуклении гусениц Philosamia ricini. По Чангу и др.
[849].
г.л. — гусеничная линька с IV на V возраст; к.л — куколочная линька.
возрастает, что приводит к усилению внеклеточного гидролиза трегалозы (рис. 94). Глюкоза, получаемая в ходе этого гидролиза, поглощается эпидермальными клетками и расходуется ими при синтезе новых кутикулярных слоев [849]. Подобный способ активации трегалазы, обусловливающий доступность сахаров гемолимфы для эпидермиса и шелкоотделительных желез, наблюдается также при развитии шелкопряда Botnbyx tnori [850].
Таким образом, трегалоза, несмотря на широкое ее распространение в гемолимфе насекомых, не имеет самостоятельного метаболического значения. Она служит лишь поставщиком глюкозы, которая лежит в основе многих синтетических и метаболических процессов в живых клетках. Мышечные волокна или клетки жирового тела имеют собственную трегалазу и, полу
чая трегалозу из гемолимфы, могут сами расщеплять ее до глюкозы. Но клетки эпидермиса или шелкоотделительных желез, характеризующиеся очень низкой активностью трегалазы, в состоянии использовать сахара гемолимфы лишь тогда, когда усиливается внеклеточный распад трегалозы. Прекращение питания при голодании или линьке является фактором, активи-
рующим этот распад.
Глицерин и сахарные спирты. В группе трехатомных спиртов наиболее простым соединением является глицерин
258
СН2ОН—СНОН—СН2ОН (1, 2, 3-пропантриол). В гемолимфе активно развивающихся насекомых в теплое время года это соединение отсутствует, но оно накапливается в больших количествах во время зимней диапаузы. У диапаузирующих личинок наездника Bracon cephi его концентрация может достигать 25% живого веса, т. е. насекомое на !/4 состоит из чистого глицерина
Рис. 95. Взаимоотношения между содержанием глицерина и температурой переохлаждения у диапаузирующих насекомых. По Сомме [854].
1— яйца пяденицы Alsophila pometaria; 2— личинки хальциды Eurytema gigantea\ 3 — пронимфы орехотворки Diplolepis radicunu, 4 — имаго муравья Camponotus herculeanus\ 5 — личинки короеда Dendroctonus топ-ticolae.
259
[851]. У муравьев Camponotus pennsylvanicus, собранных зимой, содержится в среднем 10% глицерина, а летом он почти полностью исчезает [852].
Высокое содержание глицерина обнаружено и в гемолимфе диапаузирующих куколок шелкопряда Hyalophora cecropia, в то время как у гусениц он отсутствует [853]. Образование глицерина идет особенно интенсивно при понижении температуры до 6°С, а после окончания диапаузы его содержание в гемолимфе быстро снижается. В качестве исходного продукта для синтеза глицерина используется гликоген жирового тела. Поэтому параллельно повышению концентрации этого спирта у диапаузирующих насекомых наблюдается снижение содержания гликогена.
Следовательно, накопление в гемолимфе больших количеств глицерина связано с какими-то нарушениями нормального хода гликогена. Эти нарушения имеют большое адаптивное значение, так как они обеспечивают высокую способность к переохлаждению, свойственную многим диапаузирующим насекомым. Например, у Bracon cephi при максимальной концентрации глицерина отмечается понижение точки переохлаждения до—47°С [851]. Прямая связь между точками переохлаждения и содержанием глицерина в теле зимующих насекомых наблюдается как при личиночной, так и при эмбриональной или имагинальной диапаузе (рис. 95). Глицерин защищает насекомое от образования льда и гибели путем снижения точки замерзания гемолимфы. Обусловленное глицерином снижение этой точки у В. cephi достигает—17°С.
Многоатомные сахарные спирты имеют общую формулу СН2ОН—(СНОН)4—СН2ОН. Накопление этих спиртов в период зимовки преследует, вероятно, ту же цель, что и накопление глицерина, т. е. повышение сопротивляемости холоду.
Липиды. Освобождение липидов из жирового тела в гемолимфу составляет необходимое условие их мобилизации различными тканями. Липиды существуют в плазме и транспортируются ею в химически связанной форме с белками — в виде липопротеинов. Липидная часть этих белковых комплексов представлена жирами, фосфолипидами или стеринами. Например, в гемолимфе таракана Periplaneta americana обнаружено три липопротеиновых фракции, две из которых содержат фосфолипиды, а одна — жиры с примесью небольшого количества стеринов [855].
У куколок Hyalophora cecropia почти 90% всех липидов плазмы представлено жирами, т. е. сложными эфирами глицерина и высших жирных кислот. В зависимости от количества замещенных гидроксильных остатков эти соединения могут быть названы три-, ди- и моноглицеридамлг.
260
II СН2О- С—R О II HCO-C-R
I
CH2O-C-R
О
II СН2О—С—R
О
II HCO-C-R
, I
СН9ОН
О
II
ch2o-c-r
неон
I
СН2ОН
Триглицерид
Диглицерид
Моноглицерид
о
О
II
Во всех приведенных формулах радикалом —С—R обозначен остаток какой-либо жирной кислоты.
В клетках жирового тела у Н. cecropia триглицериды составляют основную часть депонированных липидов; в то же время более половины липидной фракции гемолимфы — это диглицериды [856]. Пальмитиновая кислота, меченная углеродом С14, попадая в жировое тело куколки или бабочки, включается в состав всех глицеридов, но в гемолимфе она обнаруживается главным образом в диглицеридах. Очевидно, образующиеся в жировом теле триглицериды не выделяются в плазму, а накапливаются в его клетках. Только диглицериды используются для транспорта липидных соединений: они выделяются в гемолимфу, вступают в связь с белками и разносятся по всему телу.
Транспортная функция диглицеридов доказана не только для Н. cecropia, но и для ряда других насекомых [857]. Однако у гусениц Galleria mellonella и у клопа Pyrrhocoris apterus липиды транспортируются преимущественно в виде триглицеридов, объединяющихся с белками в липопротеиновые молекулы [858, 859].
Жирные кислоты, которые входят в состав глицеридов гемолимфы, потребляются крыловыми мышцами и другими тканями. Использование липидов в качестве источника энергии особенно эффективно при длительном полете. Так, у саранчи Locusta migratoria содержание жирных кислот в жировом теле равно 21 мг, а во время полета насекомое тратит примерно 4,1 мг этих веществ за 1 ч [860]. Следовательно, общее количество всех жирных кислот жирового тела в состоянии обеспечить непрерывный полет саранчи в течение 5 ч. Как было показано на с. 257, при работе крылового аппарата весь запас углеводов жирового тела расходуется значительно быстрее.
Аминокислоты и пептиды. Для класса насекомых характерна необычайно высокая концентрация свободных аминокислот гемолимфы [838]. Состав аминокислот, которые могут счи
261
таться основными для гемолимфы любого насекомого, показан на рис. 96. Их относительная концентрация варьирует в зависимости от вида, а у Holometabola также и от стадии развития. У всех насекомых на личиночной, нимфальной или имагиналь-ной стадиях развития в аминокислотной фракции плазмы наиболее высоко содержание глутамина и глутаминовой кислоты. Однако у имаго жука-водолюба Hydrophilus piceus и у личинок медоносной пчелы A pis mellifera доминирует пролин [861], а у клопа-кровососа Rhodnius prolixus — гистидин [862]. У куколок чешуекрылых в гемолимфе преобладают лизин, пролин, аланин и аргинин [861]. Первые три из этих аминокислот часто встречаются в относительно высоких концентрациях у гусениц и у многих других насекомых. Наоборот, содержание аргинина у большинства ^насекомых, не относящихся к отряду чешуекрылых, невелико; в гемолимфе таракана Blaberus giganteus эта аминокислота вообще не обнаруживается [864].
Поступление аминокислот в гемолимфу происходит, с одной стороны, из жирового тела, в котором могут синтезироваться заменимые аминокислоты, а с другой стороны — из пищи, перевариваемой в кишечнике. В связи с этим понятно, что химический состав пищи влияет на аминокислотный состав гемолимфы. Установлено, в частности, что гидроксипролин, а-амино-масляная кислота и фенилаланин появляются в гемолимфе таракана Blatella germanica только в том случае, если они поглощаются с пищей [865].
У Holometabola источником аминокислот гемолимфы могут быть подвергающиеся гидролизу белки тех личиночных органов, которые разрушаются во время метаморфоза. Максимальная концентрация свободных аминокислот достигается примерно в середине куколочного развития, когда в основном завершаются процессы гистолиза [866, 867, 868, 869]. После этого наблюдается неуклонное снижение содержания аминокислот, обусловленное частичным их включением в состав имагиналь-ных органов. В результате первоначального освобождения и последующего поглощения ряда аминокислот на куколочном этапе метаморфоза часто наблюдается изменение химического состава гемолимфы, и поэтому ее аминокислотный состав различается у личинок и имаго одного вида. При неполном превращении сохраняется почти идентичный состав свободных аминокислот от нимфы I возраста до имагинальной стадии [870, 871].
Аминокислоты гемолимфы являются поставщиками азотистых соединений, необходимых для постройки новой кутикулы во время линьки. Особенно сильно связаны с линькой количественные изменения тирозина и триптофана, так как эти аминокислоты служат исходными продуктами для синтеза пигментов и веществ, задубливающих кутикулу.
Свободный тирозин накапливается перед каждой линькой
262
у гусениц Bombyx mori, а сразу после сбрасывания экзувиаль-ной шкурки концентрация его резко падает [872]. Линька нимф Rhodnius prolixus наступает на 14-й день после насасывания крови. В этом случае тирозин и триптофан появляются в гемолимфе только на 6-й день после питания. В дальнейшем их концентрация увеличивается до начала линьки, а затем эти аминокислоты полностью расходуются на задубливание и пигментацию кутикулы [873].
Гусеницы шелкопрядов перед окуклением расходуют часть аминокислот гемолимфы на синтез белков шелка, используемого для конструирования коконов. У тутового шелкопряда в период коконирования шелкоотделительные железы берут из гемолимфы глицин, аспарагин, глутамин, серин, треонин и пролин. Хирургическое удаление шелкоотделительных желез приводит к значительному возрастанию концентрации всех этих аминокислот в конце V гусеничного возраста [874, 875]. Ис-пользбвание меченых атомов показало, что глицин гемолимфы прямо включается в состав белков шелковых нитей, а глутамин и аспарагин служат только предшественниками аланина [876]. Как известно, главные' аминокислоты шелка — это глицин, аланин, серин и тирозин [877].
На имагинальной фазе аминокислоты, находящиеся в гемолимфе, могут быть использованы для синтеза белков в органах размножения. У комаров р. Culex для созреваний половых продуктов в семенниках особенно важно присутствие в плазме 6-аланина [878], а для развития яичников — метионина и его производных [879]. По данным Каплана и др. [880], у самок дрозофил содержание свободного метионина в 2 раза выше, чем у самцов. Вероятно, метионин необходим для созревания яйцеклеток и у других насекомых.
При хроматографическом анализе азотсодержащей фрак-щии гемолимфы обнаруживаются не только свободные аминокислоты, но и пептиды (рис. 96). У личинок D. melanogaster при использовании адсорбционных колонок удалось найти в плазме около 600 небелковых соединений, содержащих аминокислоты [881]. Значительная часть этих соединений оказалась полипептидами и дипептидами. Ясная зависимость пептидов гемолимфы от стадии развития свидетельствуют об их участии в морфогенетических процессах, связанных с ростом и метаморфозом [863].
Полипептиды, по всей вероятности, выполняют функцию «хранилищ» аминокислот, которые в любой момент могут быть использованы для синтеза белка. Основная масса пептидов гемолимфы построена из заменимых аминокислот, синтезируемых про запас в период активного питания личинок и нимф/ Дипептиды могут служить для транспорта особо важных аминокислот, участвующих в процессах постэмбрионального развития. Затвердевание и пигментация пупария у мух Sarco-
263
phaga bullata требуют высокого содержания тирозина в гемолимфе. Эта аминокислота доставляется к покровам специальным дипептидом, который первоначально был назван «сарко-фагином», а затем идентифицирован как 6-аланил-Л-тирозин [882, 883]. Накопление дипептида в гемолимфе происходит в течение всей личиночной жизни: его количество достигает
Зоны адсорбции на 150 -сантиметровой колонке
Рис. 96. Разделение аминокислот, содержащихся в гемолимфе личинок дрозофилы (Drosophila melanogaster), с помощью адсорбционных колонок. По Чену и Ханеманну [863].
Адсорбция при длине волны 570 нм (а) или 440 нм (б). Стрелкой показано направление потока растворителя (2 мл метилового спирта на 4 г живого веса тканей). Возраст личинок — 4 дня с момента отрождения из яиц при 25°С. Фракции, содержащие пептиды и другие неизвестные вещества, обозначены номерами по порядку, отвечающему их элюции.
264
максимума перед окуклением, а затем резко падает у куколки. Использование «саркофагина» при формировании пупария очень выгодно, потому что он гораздо лучше растворяется в плазме гемолимфы, чем свободный тирозин. Любопытно, что только личинки р. Sarcophaga (S. bullata и S. argyrostomd) способны синтезировать 0-аланил-£-тирозин. Этот дипептид не обнаружен в гемолимфе личинок Phormia regina и Musca do-mestica. У личинок р. Musca такую же функцию выполняет L-глутамил-Л-фенилаланин [884]. Поставляемый этим дипептидом фенилаланин легко превращается в тирозин, необходимый для склеротизации и пигментации пупария.
Белки. В разных отрядах насекомых содержание белков в плазме гемолимфы не одинаково. В каждых 100 мл плазмы обнаружено в среднем 5 г белковых соединений у Hymenopte-га, 3—4 г у Coleoptera, 2 г у Lepidoptera и 1 г у Orthoptera ,[885]. Концентрация некоторых из этих соединений зависит также от таксономического положения насекомого внутри отряда, от его функционального состояния и стадии развития.
Для анализа белкового состава плазмы применяются разнообразные методы биохимических исследований, но особенно широкое признание получил метод электрофореза, основанный на способности коллоидно-дисперсных частиц передвигаться под действием внешнего электрического тока. Направление движения белковых молекул (к аноду или катоду) обусловлено знаком их заряда, а скорость движения зависит от природы белка.
Электрофорез на бумаге выявляет только небольшое количество основных белковых фракций. Денюс [886], а затем Ю. Б. Филиппович и М. И. Алиева- [887] смогли выделить на бумаге не более 3—5 фракций в гемолимфе гусениц Bombyx rnori и Galleria mellonella. У этих гусениц, по данным, полученным путем электрофореза на крахмальном геле, гемолим-фа имеет по крайней мере 11 разных белков. Однако наилучшие результаты дает электрофорез на полиакриламидном геле, который позволяет разделять гораздо большее число фракций: 22 у сверчка Gryllus domesticus, 21 у личинок жука Tenebrio molitor и 14 у гусениц Galleria mellonella [888]. Особенно многочисленными оказались белковые фракции в гемолимфе пчелы Apis mellifera, у которой электрофорез на полиакриламиде выявил 30 белков [889].
В результате электрофоретического анализа получается электрофореграмма, составленная из ряда полосок, окрашенных специальными красителями (рис. 97, Л). Эти полоски соответствуют разделенным фракциям белка и по интенсивности их окраски можно судить об относительной концентрации отдельных фракций. Такой прием позволяет выразить в виде
26S
графиков всёвозможные количественные и качественные изменения в белковом составе плазмы. В качестве примера можно указать на половые различия в содержании некоторых Щелков у куколок муравья Formica polyctena (рис. 97, Б).
Электрофореграммы белков плазмы служат хорошими таксономическими признаками. При исследовании 14 видов гусениц из сем. совок (Noctuidae), обитающих в Южной Африке, была установлена стабильность белкового состава гемолимфы и четкая специфичность электрофореграмм даже у близкородственных видов [891]. Многие исследователи полагают, что
Рис. 97. Белковые фракции в гемолимфе куколок муравья Formica Polyctena. По Шмидту [890].
Электрофорез на бумаге. Куколки на стадии пигментации глаз. А — электрофореграммы. Б— относительное содержание белковых фракций, выраженное в единицах адсорбции. По горизонтали — длина электрофореграммы, считая от наиболее концентрированной белковой фракции:
данные о составе белков и их электрокинетических свойствах могут быть использованы как для видовой диагностики, так и для решения спорных вопросов о филогенетических взаимоотношениях надвидовых таксонов [892]. Однако при использовании белковых электрофореграмм для целей систематики необходимо учитывать их географическую изменчивость, доказанную для саранчового Cophopodisma ругепаае [893].
Изменения электрофореграмм и общей концентрации белков гемолимфы в ходе постэмбрионального развития свидетельствуют об их важной метаболической роли в организме насекомых.
Общая концентрация белков плазмы увеличивается по мере роста предимагинальных стадий, но, кроме того, в каждом 266
возрасте наблюдаются циклические ее изменения, связанные с периодами линек. Содержание белков гемолимфы особенно резко падает во время линьки, когда достигается наибольшая концентрация водорастворимой белковой фракции в заново формирующейся кутикуле [894, >895]. Можно думать, что снижение концентрации плазменных белков при линьке обусловлено частичным их включением в кутикулу.
У саранчи Locusta migratoria и у таракана Periplaneta ате-ricana при подготовке нимф к линьке на электрофореграммах гемолимфы появляется дополнительная белковая полоса, которая становится особенно четкой в момент сбрасывания экзувиальной шкурки, а в межлиночный период полностью исчезает [895, 896]. На этом примере видно, что линька насекомых сопровождается не только количественными, но и качественными изменениями плазменных белков.
При полном превращении происходят существенные изменения в составе белков. У мухи Phormia regina, как и у других представителей группы Holometabola, окукление влечет за собой перестройку белкового спектра гемолимфы, что приводит к значительным различиям личиночных и имагинальных электрофореграмм (рис. 98). Эти различия могут быть связаны с изменениями аминокислотного состава белков гемолимфы в процессе метаморфоза. Такие изменения, в частности, установлены М. И. Алиевой и Ю. Б. Филипповичем [898, 899] у Bombyx mori. При неполном превращении (в группе Hemimetabola) количество белков плазмы или их электрофоретическая подвижность одинаковы у нимф и неполовозрелых имаго, хотя содержание отдельных фракций может изменяться весьма значительно.
Жировое тело принимает деятельное участие как в синтезе белков гемолимфы, так и в их мобилизации при метаморфозе. Личинки мухи Calliphora erythrocephala синтезируют в жировом теле специфический белок, названный «каллифорином». Этот белок поступает в гемолимфу, где он может быть обнаружен с помощью электрофореза и реакций преципитации [900]. При окуклении капустной белянки (Pieris brassicae) белки плазмы поглощаются клетками жирового тела и откладываются здесь в качестве резервов, которые расходуются при постройке имагинальных органов [901].
У диапаузирующих насекомых, приостанавливающих свое развитие на период неблагоприятных климатических условий, синтез белков гемолимфы в значительной степени подавляется. Например, у куколок Hyalophora cecropia включение глицина в плазменные белки тормозится в состоянии диапаузы и стимулируется после реактивации [902]. Вместе с тем куколочная и пронимфальная диапауза не связана с какими-либо существенными нарушениями белкового состава гемолимфы [901,
267
.268
903]. По-видимому, во время диапаузы подавляется не только* синтез белковых соединений в жировом теле, но и их распад; поэтому итоговая концентрация белков гемолимфы поддерживается почти на таком же уровне, как и при активном развитии.
Специального рассмотрения заслуживает вопрос о значении плазменных белков в развитии ооцитов. В гемолимфе самок у многих насекомых обнаружены особые белковые фракции, которые поглощаются ооцитами и используются ими для образования желтка в формирующихся яйцах. Эти белки получили название вителлогенинов. Синтез вителлогенинов осуществляется вне яичников, в жировом теле, а гемолимфа транспортирует эти белки к созревающим яйцам. Согласно электронномикроскопическим исследованиям белки гемолимфы поглощаются ооцитами в виде цельных молекул, включаемых в состав желтка [904]. Предполагается, что в стенках яичников имеются мельчайшие поры, пропускающие белковые молекулы. Путем пиноцитоза эти молекулы проникают в цитоплазму ооцитов и образуют миниатюрные желточные шарики, которые затем укрупняются, сливаясь друг с другом при соприкосновении [905].
Процесс образования желтка в ооцитах находится под гормональным контролем. Энгельманом [906] и Шеурером [907] на живородящих тараканах Leucophaea maderae доказано, что вителлогенины вырабатываются под влиянием гормона, выделяемого прилежащими телами (corpora allata). По всей вероятности, этот гормональный фактор идентичен ювенильному гормону, который регулирует метаморфоз. Бруксу [908] уда-— лось индуцировать синтез вителлогенина в жировом теле при инъекции одного из химических аналогов ювенильного гормона в изолированные брюшки самок L. maderae. Коулс [909] пришел к заключению, что ювенильный гормон стимулирует как синтез вителлогенинов в жировом теле, так и поглощение их ооцитами у самок клопа Rhodnius prolixus. Таким образом, в процессе развития насекомых особенно хорошо проявляется морфогенетическая функция белков гемолимфы: запас плазменных белков может служить строительным материалом или источником энергии при линьке и метаморфозе.
На всех этапах метаморфоза в плазме гемолимфы, наряду с «чистыми» белковыми фракциями, состоящими только из аминокислот, присутствуют «сопряженные» белки, химически
Рис. 98. Изменения белкового состава гемолимфы при метаморфозе мухи Phormia regina. По Чену и Левенбуку [897].
Электрофорез па полиакриламидном геле. Номерами обозначены белковые фракции. Л3, Л4, Ль— личинки 3-го, 4-го и 5-го дня; БК—белая, непигментированная куколка; К], Кг, Кз— куколки 7-го, 2-го и 3-го дня; И — имаго сразу после отрождения; мк — метка на электрофореграммах.
269
связанные с углеводами и жирами (гликопротеины и липопротеины). У взрослых самок таракана Periplaneta americana в гемолимфе обнаружено 5 сопряженных белковых фракций [910]. При подготовке'нимф к имагинальной линьке наблюдаются глубокие изменения в состоянии этих белков, что указывает на их участие в транспорте тех соединений, которые расходуются на построение новой кутикулы. Перенос жиров и углеводов следует рассматривать как вторую, транспортную, функцию плазменных белков.
Можно выделить еще две функции белков гемолимфы: ферментативную и защитную.
В плазме насекомых не обнаружены сукциндегидрогеназа и цитохромы, которые локализуются в митохондриях или других внутриклеточных тельцах. Однако здесь очень высока активность ферментов, образующих мочевую кислоту [911]. Наличие в гемолимфе жука Tenebrio molitor дегидрогеназ яблочной и изолимонной кислот указывает на то, что некоторые реакции цикла Кребса могут осуществляться непосредственно в плазме.
Защитная функция белков гемолимфы также недостаточно исследована. Как известно, лизоцим — это особый фермент, который способен растворять оболочки бактериальных клеток. Моригом и Месснером [912] лизоцим обнаружен в гемолимфе нескольких видов насекомых. Его содержание у Galleria mello-nella непостоянно: оно повышается после инъекции в тело гусениц живых или мертвых бактерий. Авторы полагают, что активность лизоцима в гемолимфе может определять устойчивость насекомых по отношению к бактериальным заболеваниям.
Гемоглобин. Гемоглобин состоит из содержащего железо порфирина (гема) и связанного с ним белка (глобина). Следовательно, подобно цитохромам, гемоглобин представляет собой железопорфириновый белок. Этот пигмент широко распространен в мире животных. Он выполняет функцию переносчика кислорода в эритроцитах позвоночных. Однако в классе насекомых гемоглобин встречается очень редко. В растворенном состоянии в плазме он обнаруживается только у личинок комаров семейства Chironomidae. Концентрация гемоглобина у этих личинок может быть очень высокой. Например, у Chi-ronomus plumosus вес гемоглобина одной личинки составляет около 45% от ее сырого веса [913]. Гемоглобин присутствует также в специализированных клетках трахейного эпителия у личинок овода Gastrophilus intestinalis [914] и у некоторых водных клопов [915, 916, 917]. Гемоциты насекомых всегда лишены гемоглобина.
Молекула гемоглобина состоит из нескольких мономеров, каждый из которых содержит 1 гем, соединенный с белком. Молекулярный вес мономера равен 16 000—18 000. Если у поз
270
воночных в каждой пигментной молекуле объединены 4 таких мономера, то у насекомых в составе молекулы гемоглобина только 2 мономера [918, 919]. В соответствии с этим молекулярный вес гемоглобина насекомых приблизительно равен 32 000.
В гемолимфе одного и того же насекомого присутствуют несколько гемоглобинов, различающихся по составу и последовательному расположению аминокислотных звеньев белка [920, 921]. У Chironomus thummi найдено 5, а у Ch. plumosus—до 10 таких типов гемоглобина. Эти типы белковых молекул характеризуются разными электрофоретическими свойствами и хорошо разделяются на электрофореграммах. Функциональное значение этой наследственно закрепленной многозначности гемоглобинов у видов р. Chironomus до сих пор неясно.
Двухвалентное железо, занимающее центральное положение в геме, реагирует с молекулярным кислородом и присоединяет его в отношении 1 молекула О2 на 1 атом Fe2+. Следовательно, у личинок Chironomidae каждая димерная молекула гемоглобина может присоединить 2 молекулы О2. Эта реакция называется оксигенацией, и в результате ее восстановленный гемоглобин превращается в оксигемоглобин.
Оксигемоглобин не подвергается распаду до тех пор, пока не снизится парциальное давление О2. Таким образом, гемоглобин гемолимфы может служить для запасания кислорода в организме тех насекомых, которые часто оказываются в бескислородной среде. Поэтому обладающие гемоглобином виды р. Chironomus характеризуются очень высокой способностью к анаэробиозу [922, 923]. В воде с низким содержанием О2 гемоглобин функционирует и в качестве переносчика кислорода [924, 925].
§ 3. Функции гемоцитов
Количество гемоцитов при разных условиях. У большинства насекомых в 1 мм3 гемолимфы содержится от 10 000 до 100 000 гемоцитов. Наибольшее количество клеток циркулирует в_плазме тараканов. Подсчеты, проведенные Смитом [926], показали, что общее число свободных гемоцитов у таракана Periplaneta americana достигает 16 000 000. С другой стороны, в гемолимфе целого ряда насекомых, к которым относятся двукрылые, стрекозы и клопы, очень мало гемоцитов. Например, по данным Тильярда [927], кровь молодой нимфы Апах papuensis имеет всего 200—300 клеток. У некоторых двукрылых почти все клетки гемолимфы переходят в седентарное состояние и не циркулируют с плазмой [928, 929].
Даже у одного и того же вида количество свободных гемоцитов увеличивается или уменьшается в среднем в 2—5 раз
271
в зависимости от функционального состояния, стадии развития, пола и возраста. Эти вариации обусловливаются, во-первых, размножением гемоцитов; во-вторых, изменениями объема крови, и, в-третьих, переходом в гемолимфу некоторых седентарных клеток. Особенно большие по амплитуде вариации наблюдаются при голодании и питании насекомых. Так, у клопа Rhodnius prolixus число гемоцитов в 1 мм3 плазмы резко увеличивается через 2—3 дня после питания ,[930]. В этот период интенсифицируется трофическая функция гемоцитов, связанная с транспортировкой продуктов, которые освобождаются при переваривании пищи.
Как правило, количество свободных гемоцитов повышается перед линькой, снижается при сбрасывании экзувиальной шкурки и вновь возрастает вскоре после линьки [931, 932], После куколочной линьки у Holometabola гемолимфа утрачивает многие гемоциты, которые, по-видимому, лизируются и затем используются для питания развивающихся имагинальных тканей [933]. Исходная высокая численность свободных гемоцитов достигается у имаго благодаря деятельности гемопоэтических органов и митотическим делениям клеток, переживших куколочный период.
Морфологические типы гемоцитов. Морфология форменных; элементов, циркулирующих в крови насекомых, исключительно разнообразна. Рациональная классификация этих клеток должна основываться на генезисе отдельных групп гемоцитов и на их функциях. Неоднократно предпринимались попытки разработать такую классификацию, но все эти попытки недостаточно подкреплены экспериментальными исследованиями и поэтому не могут считаться вполне удавшимися. Функционально-генетический подход последовательно выдержан в классификации Джонса [934], предложившего разбить гемоциты на 9 морфологических типов, среди которых можно выделить две группы— основные и дополнительные клетки.
Все насекомые обладают 3 основными типами гемоцитов.
1. Пролейкоциты (прогемоциты)—небольшие округлые бледно-серые базофильные1, клетки (рис. 99, a, tzi)-.
2. Плазмоциты — тоже базофильные клетки непостоянной формы, лишенные каких-либо внутриклеточных включений (рис. 99, г, гь г2).
3. Гранулоциты — разнообразные по форме клетки, содержащие бесцветные ацидофильные гранулы.
Основные типы гемоцитов легко образуют псевдоподии и переходят в амебоидное состояние. При повреждении покро-
1 Термины «базофильный» и «ацидофильный» характеризуют сродство клеток, соответственно, к щелочным или кислым красителям.
272
bob у диапаузирующих куколок Hyalophora cecropia подвижные амебоидные плазмоциты скапливаются и распластываются под раневой поверхностью. По мере концентрации прикрепленных плазмоцитов активные передвижения их ослабевают, и они образуют сплошной клеточный слой, закрывающий рану [936]. Амебоидные плазмоциты, наряду с другими клетками крови, могут защищать насекомых от бактерий и многоклеточ-
Рис. 99. Типы гемоцитов и их взаимные превращения в гемолимфе насе-. комых. По Джонсу из Мансона [935].
Стрелками указаны превращения гемоцитов: а и сц — две формы пролейкоцитов; б — адипогемоцит; в и в\ — две формы цистоцитов; г, и г2 — три формы плазмоцитов; д — подоцит; е — червеобразная клетка; ж, Ж\ и ж2 — три формы сферических клеток; э —эноцит.
273
них паразитов. Формы основных гемоцитов, не имеющие псевдоподий, выполняют иную функцию: при некоторых условиях они модифицируются и накапливают запасные питательные вещества, превращаясь в новые типы клеток гемолимфы. ,
Установлено, что для основных гемоцитов очень характерна способность к митотическому или амитотическому делению. Размножаясь, они дают специализированные клетки, которые входят в группу дополнительных гемоцитов. По данным Джонса [934] предшественниками всех форменных элементов • крови насекомых являются пролейкоциты (рис. 99). Однако Гупта и Сазерлэнд [937] считают, что все типы основных и дополнительных гемоцитов возникают из плазмоцитов (рис. 100).
Каждый тип дополнительных гемоцитов обнаруживается не у всех, а только у части исследуемых видов. Всего насчитывается 6 таких типов.
4. Цистоциты— разнообразные по форме базофильные клетки, снаружи покрытые гиалиновым слоем жидкой цитоплазмы (рис. 99, в, в1). Ядра округлые. Внутри клеток часто находятся гранулы или капельно-жидкие запасы ацидофильных питательных веществ. На фиксированных мазках крови цистоциты лишь с большим трудом можно отличить от гранулоцитов [938].
5. Сферические клетки — округлые или овальные с очень крупными бесцветными или светло-желтыми включениями (рис. 99, ж, Ж2). У тараканов эти включения представлены кислыми мукополисахаридами [939]. Сферические клетки могут рассматриваться как высокоспециализированный тип гранулоцитов [934].
6. Эноциты — обычно крупные базофильные клетки с мелкозернистой цитоплазмой (рис. 99, э). Внутриклеточные включения присутствуют всегда, они могут иметь вид пластинчатых или игольчатых кристаллов, которые находятся не только в цитоплазме, но и в ядре [940, 941].' Эноциты обнаруживаются преимущественно у насекомых, развивающихся с полным превращением, но также у тлей, у клопа Rhodnius prolixus и у ряда других. Эноциты тесно связаны с -покровами насекомых. По всей вероятности, они продуцируют вещества, необходимые для формирования кутикулинового и воскового слоя эТшкутикулы [942, 943, 944, 945].
7. Адипогемоциты—разнообразные по размерам и непостоянные по форме клетки с большим количеством каплевидных или грануловидпых включений (рис. 99, б). У куколок шелкопряда Hyalophora cecropia эти включения содержат липиды и какие-то ШИК-положительные вещества [946]. Адипогемоциты встречаются во всех крупных отрядах насекомых, и гемолимфа немногих видов не имеет этих клеток.
8. Подоциты — очень большие, уплощенные клетки с длин-
274
ними цитоплазматическими отростками (рис. 99, д). Эти отростки похожи на псевдоподии, но, по-видимому, не изменяют свою форму и не служат для передвижения. Подоциты обнаружены у двукрылых и чешуекрылых.
9. Червеобразные клетки — это, быть может, наиболее специализированный и необычный тип гемоцитов: они имеют вид
Рис. 100. Схема трансформаций плазмоцитов в другие типы клеточных элементов гемолимфы. По Гупта и Сазерлэнду [937].
Стрелками указаны превращения гемоцитов: Ад— адипогемоциты; Гр — гранулоциты; Пл — плазмоциты; По — подоциты; Пр — пролейкоциты; С. к — сферические клетки; Ци — цисто-циты; Ч.к — червеобразные клетки; Эн — эноциты.
сильно удлиненных, почти нитевидных плазмоцитов (рис. 99, е). Такие клетки найдены у чешуекрылых и жуков. Т. Лазаренко [947] наблюдал постепенное превращение червеобразных гемоцитов в звездчатые клетки, похожие на подоциты в культуре тканей жука-носорога (Oryctes nasicornis).
По-видимому, все разнообразие гемоцитов возникает из одного источника (как это показано на рис. 99). Поэтому гемоциты способны к переходу от одной формы к другой. Такие пе
275
реходы неоднократно наблюдались в экспериментах с разными видами насекомых. Особенно хорошо изучены превращения плазмоцитов в другие типы клеточных элементов гемолимфы. На нескольких видах насекомых показано, что плазмоциты могут трансформироваться в иные формы гемоцитов [937]. Предполагаемая схема этих трансформаций изображена на рис. 100.
Благодаря способности к трансформации одни и те же клетки крови, находясь в разных морфологических состояниях, могут выполнять разные функции. Обычно каждый тип гемоцитов накапливается в максимальном количестве только на строго определенном этапе метаморфоза. Ивестно, что число цистоцитов и адипогемоцитов увеличивается перед линькой [930, 948], а число сферических клеток и эноцитов — перед окуклением [940, 949]. Следовательно, физиологические условия и в первую очередь баланс гормонов в гемолимфе обеспечивают необходимые превращения клеток крови. В итоге любая стадия развития насекомых характеризуется специфичной для нее гемограммой, отражающей процентные соотношения разных типов гемоцитов. Гемограмма крайне чувствительна к разнообразным физиологическим изменениям в организме насекомого. Она может использоваться в качестве теста «упитанности» личинок и нимф или для ранней диагностики заболеваний, зараженности паразитами и отравления инсектицидами.
Роль гемоцитов в коагуляции плазмы. При повреждении покровов у многих насекомых гемолимфа, вытекающая наружу, свертывается и образует кровяной сгусток. В свертывании гемолимфы принимают участие ее гемоциты и плазма [950]. Этот процесс протекает в два этапа: сначала происходит коагуляция плазмы, а затем агглютинация (склеивание) гемоцитов.
Некоторые цистоциты, названные коагулоцитами, способны выделять коагулины — вещества, вызывающие свертывание крови. У прямокрылых, тараканов и у некоторых других насекомых под фазово-контрастным микроскопом можно увидеть, как вокруг коагулоцитов образуется ореол загустевшей плазмы [951, 952]. Под электронным микроскопом коагулировавшая плазма имеет вид сплошной губчатой массы [953]. У саранчи Locusta migratoria свертывание гемолимфы сопровождается и значительными ультраструктурными изменениями самих коагулоцитов: ядро раздувается и становится шаровидным, рибосомы исчезают, эргастоплазма фрагментируется на мелкие пузырьки с плотным содержимым [954]. Через 5 мин исчезают фибриллярные гранулы, которые до начала коагуляции заполняли всю цитоплазму клетки. По-видимому, содержимое этих гранул расходуется на образование коагулинов.
Иная картина наблюдается при свертывании крови у гусениц. Здесь коагулоциты образуют длинные тонкие псевдопо
276
дии, вокруг которых и происходит коагуляция гемолимфы. В сетке из переплетающихся псевдоподиальных нитей застревают другие гемоциты, пассивно вовлекаясь в формирование кровяного сгустка. У большинства перепончатокрылых свертывание крови осуществляется одновременно двумя путями: плазма загустевает как вокруг округлых коагулоцитов, так и в переплетениях псевдоподий. У разных видов жуков свертыва- * ние гемолимфы протекает по какому-нибудь из описанных выше способов. Следует, однако, отметить, что у ряда жуков, как
Рис." 101. Амебоидные гемоциты, участвующие в индукции линьки у нимф клопа Rhodnius prolixus. По Уигглсуорсу [955].
А —‘на 3-й день после питания клопа гемоциты имеют мало вакуолей. Б — на 4-й день гемоциты заполнены вакуолями.
и у некоторых других насекомых, плазма гемблимфы вообще не коагулирует [950].
Роль гемоцитов при линьке и метаморфозе. С линьками и метаморфозом насекомых связаны три функции гемоцитов: эндокринная, гистолитическая и трофическая.
Эндокринная функция имеет отношение к проявлению действия гормонов, вызывающих линьку и метаморфоз. Основной гормон линьки насекомых экдизон поставляется проторакальными железами; которые активируются мозговым гормоном. В отсутствии активационного гормона не выделяется и экдизон; в результате линька становится невозможной. Уигглсуорс [955] показал, что у нимф клопа Rhodnius prolixus в активиро
’/2 10 198
277
вании проторакальных желез принимают участие амебоидные клетки гемолимфы (рис. 101). В точности неизвестно назначение этих клеток: они или переносят активационный гормон от мозга к проторакальным железам или продуцируют какие-то вещества, необходимые для синтеза экдизона. При блокировании амебоидных гемоцитов витальными красителями линька нимф на имаго задерживается на срок до 2—2,5 недели. Такая
Рис. 102. Электронная микрофотография гемоцита с заглоченным фрагментом личиночной мышцы, подвергаемой гистолизу у куколки Sarcophaga bul-lata. По Уиттену [956].
278
задержка линьки наблюдается при введении красителя в гемолимфу на 3-й день после питания клопа, когда гемоциты еще слабо вакуолизированы (рис. 101, Л). При инъекции красителя на 4-й день после питания, когда в цитоплазме гемоцитов появляется большое количество вакуолей (рис. 101, £>), линька протекает в нормальные сроки. Очевидно, наличие вакуолей затрудняет поглощение красителя гемоцитами и позволяет им выполнить свою важную задачу по индуцированию линьки.
У насекомых, развивающихся с полным превращением, метаморфоз сопровождается глубокими перестройками всей организации личинки. На куколочном этапе метаморфоза личиночные, так называемые провизорные, органы подвергаются гистолизу и разрушаются, а вместо них формируются имаги-нальные органы. В процессе растворения провизорных органов принимают участие фагоциты гемолимфы, выполняющие гис-толитическую функцию. Менее четко активность фагоцитов проявляется при неполном превращении насекомых.
У куколок мухи Sarcophaga bullata способные к фагоцитозу амебоидные гемоциты являются одной из модификаций гранулоцитов [956]. Во время формирования пупария у них наблюдаются многократные деления ядер без последующего разделения самих клеток. В результате образуются многоядерные гемоцитарные массы, которые активно захватывают фрагменты разрушаемых личиночных тканей (рис. 102). Фагоцитоз продолжается в течение первых 8 дней 11-дневного кукол очного развития, а затем клетки гемолимфы переключаются на выполнение трофической функции.
Принимая участие в гистолизе личиночных органов, клетки гемолимфы обогащаются питательными веществами. Гликоген, мукополисахариды, фосфолипиды, аскорбиновая кислота, белки, многие ферменты и целый ряд других соединений обнаруживаются гистохимическими методами в гемоцитах куколок. Все эти вещества могут быть использованы при росте и дифференцировке имагинальных дисков.
Особенно большое значение для питания формирующихся тканей имеют адипогемоциты. У куколок круглошовных двукрылых (Cyclorrapha) эти клетки образуют цитоплазматические отростки, которые вступают в связь с развивающимися эпидермальными клетками, трахеальным эпителием или мышечными волокнами [957]. Передача питательных материалов от адипогемоцитов к другим клеткам происходит непосредственно по цитоплазматическим отросткам. Целлером [958] убедительно продемонстрирована трофическая роль адипогемоцитов при развитии крыльев у мельничной огневки (Ephestia kuhniella).
Во время развития личинок и нимф гемоциты накапливают запасные питательные вещества. У гусениц Prodeniar eridania гликоген обнаруживается в гемоцитах, начиная с III возраста
279
[959]. По мере роста гусениц содержание гликогена увеличивается и достигает максимума перед окуклением. Гликоген расходуется куколками на построение имагинальных органов и отсутствует в гемоцитах бабочек. Жировые включения в виде маленьких округлых капелек впервые появляются в гемоцитах только у коконирующихся гусениц Р. eridania и полностью исчезают на поздних этапах развития куколок [960]. По-видимому, гемоциты получают жиры от клеток жирового тела.
Таким образом, гемоциты снабжают питательным материалом те органы, которые возникают заново, растут и перестраиваются при превращении личинки в имаго. Источниками этого материала служат либо подвергаемые гистолизу провизорные органы, либо резервные продукты, накопленные в период активного питания личинок.
Защитная функция гемоцитов. Способность гемоцитов к фагоцитозу используется в защитных реакциях гемолимфы по отношению к живым и неживым микроскопическим объектам. В наибольшей степени эта способность присуща пролейкоцитам, плазмоцитам, гранулоцитам и адипогемоцитам [934].
Фагоцитирующие гемоциты могут защищать насекомое от инфекционных заболеваний. Захват фагоцитами патогенных бактерий наблюдался, например, у гусениц Galleria mellonella. Зерна крахмала, эритроциты овец, тушь, бактерии Staphylococcus epidermis интенсивно фагоцитируются в гемолимфе этих гусениц [961]. Вероятно, активность фагоцитов обусловливает высокую устойчивость G. mellonella к большинству видов болезнетворных бактерий. Патогенными для них являются лишь немногие бактерии, подавляющие фагоцитарные реакции [962].
Однако микроорганизмы, проникающие в гемолимфу, не всегда захватываются ее клетками. В таких случаях основную роль в создании иммунитета насекомых к бактериальным, грибковым или вирусным заболеваниям играют плазменные, а не гемоцитарные реакции [963].
Как известно, в кровяной плазме позвоночных действуют две независимые системы иммунитета — неспецифическая и специфическая. Неспецифический иммунитет основан на выделении антибактериальных факторов, создающих естественную или приобретенную устойчивость организма к различным бактериям. К наиболее существенным соединениям этого рода принадлежит пропердин, открытый в 1954 г. Пиллемером и его сотрудниками. Пропердин является очень крупным белком с молекулярным весом около 1 000 000. Предполагается, что этот белок реагирует с полисахаридным компонентом клеточной мембраны и тем самым разрушает бактериальную клетку. Поэтому пропердин действует в основном на микробы, имеющие в своей клеточной мембране липополисахариды. Бриггс [964] в своей работе по иммунитету гусениц к бактериям Pseudomo-280
nas aeruginosa представил доказательства того, что пропердин или какой-то другой аналогичный белок существует в плазме насекомых.
Специфическая система иммунитета связана с образованием антител, избирательно направленных против антигенов, которые вырабатываются определенными штаммами или видами патогенных микроорганизмов. Антитела принадлежат к глобулиновым белкам. Защитное действие любого антитела основано на его способности соединяться с определенным антигеном. Вакцинация, т. е. применение вакцины, содержащей ослабленных или убитых возбудителей заразного заболевания, стимулирует образование специфических антител и создает устойчивость к данному заболеванию.
В организме насекомых антитела не образуются [962, 965]. Несмотря на это, вакцинация эффективно предохраняет клопов Oncopeltus fasciatus и гусениц Galleria mellonella от болезни, вызываемой бактерией Pseudomonas aeruginosa [966, 967, 968, 969]. Возникающий при этом специфический иммунитет объясняется выделением в гемолимфу какого-то вещества, обладающего бактериолитическим действием. Это вещество не является белком, но, по всей вероятности, оно вступает в химическую связь с плазменными белками и транспортируется ими по всему телу насекомого. Иммунитет вырабатывается после однократного введения вакцины, но сохраняется недолго: он достигает максимальной силы через 24 ч и исчезает через несколько дней после вакцинации.
Гемоциты могут защищать организм насекомого не только от патогенных микроорганизмов, но и от многоклеточных эндопаразитов. Основной феномен при такой защите — это реакция инкапсуляции, т. е. образование вокруг тела паразита капсулы из гемоцитов. Паразит, заключенный внутри капсулы, испытывает недостаток питательных веществ и кислорода; он перестает развиваться и вскоре погибает. Капсула возникает вокруг •паразитических нематод, яиц и личинок наездников или даже искусственно внесенных в гемолимфу органов, взятых от другого насекомого (рис. 103). Инкапсулируются и неживые объекты — волоски шерсти, кусочки пластмассы или дерева. Формирующие капсулу гемоциты слипаются друг с другом, но сохраняют свою обособленность и не образуют синцитий [971]. Клетки, принадлежащие к наиболее внутреннему слою капсулы, постепенно дегенерируют, а после гибели паразита часть клеток из наружных слоев возвращается в гемолимфу [972]. Предполагают, что в реакциях инкапсуляции главную роль играют специальные клетки — производные плазмоцитов [973].
Приспосабливаясь к какому-либо хозяину, паразит приобретает способность подавлять реакцию инкапсуляции, причем эта способность часто не распространяется на другие виды хо
10 198
281
зяев. Например, гусеницы Ephestia kuhniella подобно другим насекомым образуют гемоцитарные капсулы вокруг живых или неживых объектов, проникающих внутрь тела. Однако эти гусеницы не инкапсулируют яйца или личинок их обычного паразита наездника Nemeritis canescens [974]. В то же время при искусственном заражении гусениц Galleria mellonella яйцами
Рис. 103. Капсулы, образуемые гемоцитами вокруг чужеродных предметов и многоклеточных паразитов, которые искусственно вводятся в тело насекомых..По Солту [970].
А — гемоциты гусеницы Ephestia kuhniella образуют капсулу вокруг введенного в их тело ганглия саранчи. Б — гемоциты саранчи Schistocerca gregaria инкапсулируют эндопаразитическую личинку наездника.
Af. canescens наблюдается частичная или полная инкапсуляция вылупляющихся личинок, вызывающая гибель паразита [975]. Точно так же яйца или личинки наездника инкапсулируются и погибают в сверчках, палочниках, уховертках и в других насекомых, которые в природных условиях никогда не заражаются этим паразитом [970] . В нимфах саранчи Schistocerca gregaria яйца N. canescens не инкапсулируются, но вокруг личинок образуется гемоцитарная капсула, препятствующая их нормальному развитию (рис. 103, 5).
В теле гусениц Ephestia kuhniella личинка Nemeritis canescens не инкапсулируется только в том случае, если ее покровы
282
остаются невредимыми [974]. Разрушение поверхности покровов или кратковременное воздействие жировыми растворителями, не убивая личинок, приводит к их инкапсуляции гемоцитами хозяина. Следовательно, возможность развития паразита в гусеницах Е. kuhniella связана с защитными свойствами его кутикулы, которая содержит какие-то вещества, предотвращающие образование гемоцитарной капсулы.
У больных насекомых процесс инкапсуляции чужеродных предметов или объектов сильно тормозится. Некоторые паразиты используют эту особенность защитных реакций: при питании они настолько ослабляют хозяев, что те оказываются неспособными сформировать сколько-нибудь прочную и плотную капсулу [976].
Существует множество других специальных приспособлений, которые позволяют эндопаразитам избежать гибели, обусловленной защитными реакциями их обычных хозяев [977]. Анализ таких приспособлений представляет большой интерес с эволюционной точки зрения: он демонстрирует возможности отбора находить разные пути, направленные к одной цели — к предохранению паразита от - инкапсуляции гемоцитами хозяина.
§ 4. Физиология сердца
Гистологическое строение и иннервация сердца. При эмбриональном развитии сердце насекомого возникает из особых мезодермальных клеток, называемых кардиобластами. Как показал А. А. Заварзин [978], следы слияния этих клеток сохраняются даже на вполне сформированном сердце в виде поперечных и Продольных швов, подразделяющих стенку сердечной трубки на отдельные пластинки (рис. 104, А).
Стенка сердца построена из двух основных слоев — адвен-тиции и мышечного слоя (рис. 104, Б). Адвентиция прикрывает сердце снаружи. Она образуется из волокнистой соединительной ткани, в которой присутствуют эластические волокна и некоторые типы гемоцитов. Мышечный слой состоит из поперечнополосатых волокон, объединяемых под общим названием миокарда. Оболочка этих волокон (сарколемма) формирует, с одной стороны, пограничную мембрану между адвентицией и мышечным слоем, а с другой стороны — внутреннюю выстилку сердца, которую Грабер [980] выделял в особый слой и назвал интимой.
Крыловидные мышцы, поддерживающие сердце насекомого на дорсальной диафрагме, состоят из типичных поперечнополосатых мышечных клеток, диаметр которых колеблется от 1 до 20 мкм у бабочки Hyalophora cecropia [981]. Подходя к стенке сердца, крыловидная мышца распадается на 'сеть филаментов,
283
284
которые внедряются в адвентицию в виде вышеупомянутых волокон.
Деятельность сердца обусловливается ритмическими сокращениями миокарда, который, следовательно, в наибольшей степени заслуживает внимания физиологов. В последние годы выполнено несколько электронно-микроскопических исследований тонкого строения мышечных волокон, формирующих миокард у тараканов и других насекомых. Установлено, что у таракана Blatella germanica и у бабочки Hyalophora cecropia имеется один слой кольцевой мускулатуры, охватывающей полость сердечной трубки [982, 983]. Мышечные волокна этого слоя тонического типа, который характеризует скелетные мышцы, не. способные к частым ритмическим сокращениям. Размеры мышечных клеток невелики: в сердце Н. cecropia их ширина составляет 10— 40 мкм, а длина 60—100 мкм [983]. По данным световой микроскопии в миокарде клопа Oncopeltus fasciatus длина и ширина волокон не превышает 1,5 мкм [984].
Сердце тараканов, палочников и стрекоз имеет двойную иннервацию [979, 980, 986]. От симпатической нервной системы оно получает латеральные нервы, а от центральной—сегментарные нервы. В обоих типах нервов найдены не только обычные, но и нейросекреторные волокна [987]. Единственная пара латеральных нервов начинается от стоматогастрической нервной системы и проходит в виде двух длинных стволов по бокам сердечной трубки (рис..104, В). В каждом стволе содержится около 10 аксонов. У тараканов и палочников среди этих аксонов находятся несколько десятков нервных клеток (рис. 104, Г), а у нимф стрекозы Aeschna таких клеток нет. Десять или одиннадцать пар сегментарных нервов берут начало от ганглиев брюшной нервной цепочки и подходят к сердцу в составе веточек, снабжающих мышцы брюшка. В каждом сегментарном нерве обнаруживается 3—4 аксона.
Двойная иннервация сердца свойственна только относительно примитивным насекомым. Ее можно рассматривать как атавистический остаток более сложной системы нервов и ганглиев, обслуживающих сердца у предковых насекомых. Среди современных членистоногих к этому состоянию наиболее близки сердца мечехвостов и некоторых ракообразных. В связи с общим упрощением кровеносной системы в процессе эволюции насекомых вначале исчезли сердечные ганглии, а затем начали
Рис. 104. Строение и иннервация сердца насекомых. По А. А. Заварзину [978] и Александровичу [979].
Нимфа стрекозы Aeschna sp.: Л — рисунок с тотального препарата сердца; Б — поперечный срез через стенку сердца; В — схема иннервации сердца и крыловидных мышц. Таракан Blatta orientalis: Г — нервные клетки в латеральном нерве сердца. а — адвентиция; и — интима; к.м — крыловидные мышцы; л.н — латеральные нервы; м.с — мышечный слой; о — остии; п.п.ш — пластинка поперечного шва; пр.ш — продольные швы; п.ш — поперечные швы; с — сердце; с.н, — сегментарный нерв; э.в — эластическое волокно.
285
исчезать и сердечные нервы.. В результате у многих двукрылых и чешуекрылых сохранилась какая-либо одна система нервов. Например, у гусениц Prodenia eridania сердце иннервируется только сегментарными [986], а у личинки комара Corethra plu-micornis — только латеральными нервами, лишенными нервных клеток [988]. Максимальной степени дегенерация сердечных нервов достигает у бабочки Hyalophora cecropia и у личинки комара Anopheles quadrimaculatus, у которых сердце вообще не иннервируется [983, 989].
Деятельность сердца. В типичном случае сокращение сердца начинается с возникновения на заднем конце его перистальтической волны, распространяющейся вперед. Скорость распространения этой волны различна у разных видов насекомых или на разных стадиях развития одного и того же насекомого, она может двигаться очень быстро и достигать аорты еще до того, как на заднем конце сердца возникает новая волна сокращения. Такое быстрое движение перистальтической волны отмечается, например, у таракана Periplaneta americana [990]. Гораздо медленнее движется сократительная волна у личинок комаров р. Corethra, у которых на сердечной трубке удалось наблюдать одновременно три волны сокращения [991].
По наблюдениям целого ряда авторов перистальтическая волна может двигаться по сердцу не только сзади наперед, но и в обратном направлении, т. е. спереди назад. При таких обратных пульсациях сократительные волны зарождаются на переднем конце сердечной трубки вблизи выхода аорты.
По данным В. Г. Шахбазова и Н. А. Золотухиной [992] у гусениц китайского дубового шелкопряда (Antheraea pernyi) гемолимфа в сердце и аорте движется только сзади наперед. Но у бабочки этого же вида ритм кровообращения усложняется: после нескольких сокращений сердца, проталкивающих гемолимфу сзади наперед, происходит его остановка, а затем возникают обратные движения перистальтических волн от головы к брюшку. В обоих направлениях циркулирует одинаковое количество гемолимфы, перегоняемое к голове частыми, но мелкими, а от головы более редкими, но глубокими сокраще1 ниями сердца. Тенней [993] у бабочки Telea polyphemus отметил даже различия в скорости движения сократительной волны по сердцу в противоположных направлениях; в направлении спереди назад эта скорость оказалась равной 12,5—30 мм/с, а сзади наперед—18—40 мм/с.
Остается неясным функциональное значение обратного движения гемолимфы в сердечной трубке. Пожалуй, только для чешуекрылых это явление может быть объяснено с позиций гипотезы Хесселя [994], который считает, что у бабочек сердце вы-выполняет чисто фагоцитарные функции и полностью утратило свое значение органа, создающего кровоток в гемоцеле. Передний конец аорты бабочек связан с довольно сложной системой 286
кровеносных сосудов, примыкающих к мозгу и антеннам. По мнению Хесселя, гемолимфа не имеет здесь наружного выхода. При прямых пульсациях сердца, направленных сзади наперед, опа проникает через остии в полость сердечной трубки и продвигается к аорте. В это время клетки внутренних стенок сердца захватывают находящиеся в гемолимфе бактерии и другие болезнетворные микроорганизмы. Обратные пульсации, направленные спереди назад, выталкивают из сердца обезвреженную и очищенную кровь также через остиальные отверстия.
Qi 1 L J_I_I_LL
12 3 Ш 2 3 к 1
к ।______।
Рис. 105. Механокардиограмма таракана Periplaneta americana и ее изменения под влиянием прямого электрического раздражения. По Ягеру [998, 999].
А — механокардиограмма: 1— предсистолический зубец, 2— систола, 3 — диастола, 4 — диастазис. Б — эффект одиночных электрических раздражений сердца во время диастолы: э — экстрасистола. В — эффект одиночных электрических раздражений сердца во время систолы: с — суммационное увеличение систолы. Г — эффект ритмических раздражений сердца. На рис. Б — Г точками отмечены моменты нанесения электрических раздражений.
Возникновение перистальтической волны на заднем или переднем конце сердца начинает сердечный цикл, который состоит из следующих трех фаз: 1) систола — период сокращения, 2) диастола—период расслабления, 3) диастазис — общая пауза сердца. Обычно расслабление сердца происходит медленнее, чем его сокращение. При нормальной работе миокарда у личинки комара Corethra соотношение длительностей диастолы и систолы составляет 1,5 : 1 [995], а у. жука Dytiscus 2 : 1 [996]. Однако у чешуйниц (Lepisma и Ctenolepisma) диастолическая фаза короче систолической [997]. У всех насекомых при повышении частоты сердцебиений продолжительность систолы и диастолы изменяется мало, но период диастазиса укорачивается или даже совсем исчезает.
Запись механических эффектов сокращения сердечной мышцы носит название механокардиограммы (МГК). У таракана
287
Periplaneta americana на МКГ отмечается восходящая волна, отвечающая систоле, и нисходящая, отвечающая диастоле (рис. 105, А). Последняя разбивается на два процесса: первоначальный более быстрый спад затем замедляется и незаметно переходит в диастазис. В конце диастазиса перед новым сокращением возникает небольшое расслабление — предсистоличе-ский зубец, или предсистола. Происхождение этого зубца остается неизвестным. Он может возникать либо при сокращении крыловидных мышц, растягивающих стенки сердца, либо при самостоятельном расслаблении миокарда, предшествующем его сокращению. Кроме того, нужно учитывать, что сердце насекомого сокращается не только в продольном направлении; одни участки его смещаются продольно, другие — радиально, а третьи могут описывать эллипсоидные или даже более сложные нелинейные фигуры. Поэтому возможно, что предсистолический зубец обусловливается разной скоростью сокращения продольных и радиальных элементов, формирующих миокард.
В отличие от сердца позвоночных сердечная мышца насекомых не дает максимального сокращения во время систолы [999]. Поэтому электрическое раздражение, поданное на уже сокращенное сердце таракана, ведет к увеличению систолы (рис. 105, В). Следовательно, наблюдается эффект суммации двух сокращений: одного, возникающего при автоматической работе сердца, и другого, вызываемого раздражением миокарда одиночным ударом электрического тока. Если сердце стимулируется электрическим током во время диастолы или диастазиса, наблюдается дополнительное его сокращение, получившее название экстрасистолы (рис. 105, В). Серия частых электрических раздражений вызывает длительное затяжное сокращение миокарда, которое сменяется длительным успокоением сердца после выключения раздражения (рис. 105, Г).
Сердце позвоночных, как известно, не может развить следующее сокращение, прежде чем не закончится предыдущий сократительный акт. Это положение послужило одним из доказательств физиологического закона «все или ничего». Сердечная мышца может давать только максимальный ответ или не давать никакого ответа. Суммации двух сократительных эффектов в сердце позвоночного не может быть.
Сердце насекомого способно к суммированию двух последовательных сокращений, и закон «все или ничего» здесь оказывается неприменимым. Можно думать, что сердечная мышца у насекомых не сокращается вся как единое целое, подобно сердцу позвоночных. Она ведет себя так же, как скелетная мускулатура, в которой каждое волокно сокращается максимально и подчиняется закону «все или ничего», но вся мышца в целом, в силу разной возбудимости мышечных волокон, обнаруживает ступенчатое нарастание амплитуды сокращения в зависимости от силы раздражения. Таким образом, сердечная мышца насе
288
комых очень сходна со скелетной мускулатурой, но в принципе отличается от миокарда позвоночных.
У многоклеточного животного ритм сердечных сокращений определяется возбуждением _пейсмейкеров (водителей ритма), которые могут иметь нервную или мышечную природу. В первом случае автоматизм сердца является нейрогенным, а во втором— миогенным. У мечехвостов обнаружен нейрогенный сердечный автоматизм: сокращения миокарда вызываются и поддерживаются импульсами нервных клеток [1000]. Однако у всех насекомых ритмические сокращения зарождаются в самих стенках миокарда. Нервная система у тараканов еще оказывает регулирующее влияние на ритм сердцебиений, но у личинок комаров наблюдается полная независимость сердца от нервной системы.
Пейсмейкерная клетка работает как релаксационный осциллятор, генерирующий электрические импульсы, которые, распространяясь на соседние клетки, захватывают весь миокард и вызывают его сокращения [1001]. Данные Мак-Кэна [1002] показывают, что у бабочки Hyalophora cecropia водители ритма разбросаны по всей длине сердечной трубки, а не локализованы в каком-либо одном его участке. Предполагается, что при некоторых условиях любая клетка миокарда может приобрести свойства пейсмейкера, создающего ритмическую деятельность сердца.
Частота сердцебиений варьирует в пределах от 10 до 150— 160 в 1 мин; она зависит от многих экологических и физиологических факторов. По мере роста личинок у насекомых, развивающихся с полным превращением, происходит постепенное снижение частоты сердцебиений [989, 992]. Перед окуклением и у куколок сердце работает с минимальной частотой, а у имаго сердечный ритм вновь учащается.
Питание, копуляция, локомоция и любые другие Движения насекомого стимулируют деятельность сердца. У клопа Rhodni-us prolixus даже перистальтика кишечника, связанная с прохождением пищи, повышает частоту сердцебиений [1003].
Изменения ритма сердечных сокращений под влиянием температуры следуют правилу Вант-Гоффа, согласно которому повышение температуры на 10°С увеличивает скорость химических реакций в 2—3 раза (Qio в среднем равно 2,5). Это правило, однако, хорошо выдерживается только в области оптимальных экологических температур, к которым приспособлен данный вид насекомых. Например, у таракана Periplaneta americana пропорциональная линейная зависимость частоты сердечных сокращений от температуры сохраняется в интервале от 12 до 40°С, а более низкие температуры вызывают значительные отклонения от этой зависимости [1004].
Электрофизиология сердечной мышцы. Электрические явления, сопровождающие процесс сокращения сердечной мыш-
289
цы, носят название электрокардиограммы (ЭКГ). При накладывании внеклеточных электродов на живое, работающее сердце насекомого ЭКГ имеет вид более или менее сложных колебаний потенциала (рис. 106). На регистрируемой картине выделяются медленные монофазные и быстрые двухфазные колебания, которые обычно накладываются друг на друга. Полагают, что двухфазные колебания проводят возбуждение по сердцу, а монофазные отражают эффект сокращения мышечных волокон и не распространяются вдоль сердечной трубки [1005]. Однако Кресчителли и Джан [1006] наблюдали сокращения сердца саранчового Melanoplus differ ent iaiis и при отсутствии медленных колебаний на ЭКГ.
В сердце цикады Cryptotympana japonensis отдельные мышечные волокна генерируют простые монофазные потенциалы [1005]. ЭКГ имаго интактного сердца имеет очень сложную форму, но она заметно упрощается после удаления крыловых мышц. Очевидно, в формирова-
нии ЭКГ принимают участие не только те потенциалы, которые возникают в самой сердечной мышце, но и электрические токи, зарождающиеся в других, соседних, органах. Крыловидные мышцы, поддерживающие сердце на дорсальной диафрагме, также являются источниками некоторых колебаний, регистрируемых на ЭКГ [1007, 1008].
’МаМаЙШ
50 Гц
Рис. 106. Электрокардиограммы, регистрируемые на разных участках сердца цикады Cryptotympana japonensis. По Ирисава и др. [1005].
Использование внутриклеточных электродов позволяет следить за электрическими изменениями в одиночных нервных или мышечных клетках. При введении в клетку стеклянного микроэлектрода, заполненного раствором электролита, регистрируется отрицательная разность потенциалов между внутренним со-
ной поверхностью. ал, или потенциал
держимым Это так называемый покоя (рис. 107). В
клетки и ее наруж-мембранный потенци-момент возбуждения
разность потенциалов уменьшается, полностью исчезает дай даже приобретает обратный положительный знак. Следовательно, возбуждение вызывает реполяризацию мембраны; возникаю-
290
щее при этом изменение разности потенциалов называется потенциалом действия. Если потенциал действия превышает потенциал покоя, регистрируется овершут — временный положительный заряд внутреннего содержимого клетки по отношению к ее поверхности.
Эти внутриклеточные потенциалы, характеризующие электрические свойства одиночных возбудимых клеток, были измерены на сердечных мышцах у нескольких видов насекомых. Наиболее высокий уровень потенциалов отмечен в мышечных
мВ
100 не
Рис. 107. Внутриклеточные потенциалы в переднем (4) и заднем (Б) участках сердца бабочки Telea polyphe-mus. По Мак-Кэнну [1009].
м.п — мембранный потенциал; о — овершут; п.д. — потенциал действия.
волокнах сердца у бабочки павлиноглазки Hyalophora cecropia'. мембранный потенциал равен —65, а потенциал действия 85 мВ; следовательно, овершут составляет +20 мВ [1002]. У мухи Musca domestica максимальное значение мембранного потенциала достигает —50 мВ, а среднее его значение —21 мВ [1010].
В сердце бабочки Telea polyphemus регистрируются два типа потенциалов действия: один — в передней, а другой — в задней части сердечной трубки [1009]. Потенциал первого типа (рис. 107, Л) по форме напоминает потенциал действия, регистрируемый в предсердии позвоночных; он имеет овершут, равный +9,5 мВ. На потенциале второго типа (рис. 107, Б), сходном с желудочковым потенциалом позвоночного, овершут несколько больше (в среднем +12,5 мВ). Мембранный потенциал в обоих участках сердца одинаков и равен —47 мВ.
Фармакология и регуляция работы сердца. Чувствительность сердца к фармакологическим веществам и способы регуляции сердечной мышцы зависят от характера ее иннервации.
Богато иннервированное сердце тараканов регулируется двумя путями: 1) нервными импульсами, достигающими мышечных
291
волокон по аксонам; 2) гормонами, которые транспортируются гемолимфой.
Нервная регуляция осуществляется через латеральные и сегментарные нервы, обслуживающие сердечную мышцу. Эти нервы не являются пусковыми; они не вызывают сокращений сердца, а только управляют его работой. Поэтому помещенное
Б
Рис. 108. Роль латеральных нервов в регуляции деятельности сердца у таракана Periplaneta americana. По Миллеру и Меткалфу [1011].
А — спонтанная электрическая активность латеральных нервов. Б — механокардиограмма иннервируемого сердца. В — то же после удаления латеральных нервов.
в физиологический раствор полностью денервированное сердце насекомого продолжает сокращаться. В латеральных нервах таракана Periplaneta americana регистрируются спонтанные разряды, ритм которых приблизительно совпадает с ритмом сердцебиений (рис. 108, Д). После хирургического удаления нервов наблюдаются существенные изменения в автоматической деятельности сердца (рис. 108, Б, В).. Очевидно, сердечная мышца таракана способна к самостоятельным, миогенным со
292
кращениям, но нервные импульсы определяют частоту и силу этих сокращений.
По-видимому, и латеральные, и сегментарные нервы стимулируют сердце таракана. Показано, что повышение частоты импульсов в латеральных нервах, вызванное применением фар-, макологических веществ, сопровождается учащением сердцебиений [1012]. Электрическое раздражение сегментарного нерва увеличивает ритм сердечных сокращений [1013]. Ни одному исследователю не удалось найти такие нервные волокна, которые оказывали бы тормозящий эффект на сердечную мышцу насекомых подобно блуждающему нерву позвоночных.
Как правило, фармакологические соединения влияют на работу сердца через нервные пути его регуляции. Особенно чувствительны к действию этих соединений латеральные нервы. Поэтому полностью денервированное сердце таракана не реагирует на аппликацию ацетилхолина в отличие от полуинтактного вырезанного из тела сердца при сохранении латеральных нервных веточек [1011].
По данным Меткалфа с сотрудниками [1014] у таракана JP. americana ацетилхолин увеличивает частоту сокращений сердца, причем минимальная действующая концентрация равна 10-9 моль/л. У саранчового Melanoplus differentialis подобное влияние ацетилхолина наблюдается при более низких концентрациях, вплоть до 10-14 моль/л [1015]. В то же время сердце личинок комаров Anopheles quadrimaculatus и многих гусениц совершенно нечувствительно даже к очень концентрированным растворам ацетилхолина [949, 1016, 1017, 1018]. Вообще у тех насекомых, у которых сердца имеют латеральные нервы (тараканы и саранчовые), наблюдается учащение сердцебиений при действии низких концентраций ацетилхолина. Одновременно с этим отмечается высокая реактивность сердца по отношению к никотину и адреналину. Однако, если сердце не обслуживается латеральными нервами (у некоторых личинок комаров и гусениц), все эти вещества могут влиять на его работу только в таких больших концентрациях, которые отравляют сердечную мышцу.
В латеральных нервах тараканов находятся обычные нейроны и нейросекреторные клетки. И те и другие дают отростки — аксоны,— иннервирующие сердечную мышцу [1019]. Потенциалы действия в нервных клетках больше по амплитуде, чем в нейросекреторных. Это обстоятельство позволило отдифференцировать на осциллограммах активность обоих типов клеток и установить влияние на них фармакологических соединений. Оказалось, что ацетилхолин в концентрации 10-8 мг на 1 мл возбуждает нервные аксоны, но не влияет на импульсацию нейросекреторных клеток [1012]. Следовательно, только обычные нейроны являются холинэргическими [1020].
Нейросекреторные клетки латеральных нервов участвуют
293
в передаче гормональных влияний на сердце таракана [1012]. У Periplaneta americana нервная система выделяет в гемолимфу вещества, ускоряющие деятельность сердца [1021, 1022, 1023]. Особенно высока эффективность ускорителей, экстрагируемых из кардинальных тел (corpora cardiaca). По мнению Унгера [1024] активность этих экстрактов связана с присутствием гормонов С и D. Под влиянием гормона D увеличивается частота импульсов в нейросекреторных клетках, обслуживающих сердце таракана [1012]. Возможное влияние гормона С на эти клетки не выяснено.
Глава VII. ФИЗИОЛОГИЯ И БИОХИМИЯ ЖИРОВОГО ТЕЛА
§ 1. Строение и функции жирового тела
Морфология жирового тела. Жировое тело представляет собой мезодермальное образование неопределенной формы, часто снабженное многочисленными лопастями, которые проникают между органами или обволакивают их со всех сторон. Окраска жирового тела в большинстве случаев желтовато-белая, реже ярко-желтая или зеленая. Его структура и расположение характерны для вида и стадии развития насекомых. Некоторые особенности строения жировой ткани могут служить признаками надвидовых таксонов — рода, семейства или отряда. Например, у гусениц отдельные клетки жирового тела связаны друг с другом в виде синцития, а у личинок поденок и ручейников они явственно обособлены [1025].
Степень развития жировой ткани зависит от экологических факторов и может служить хорошим индикатором физиологического, состояния насекомого [1026]. Химический состав и количество корма особенно сильно влияют на гистологические картины жировых клеток. На комарах, зимующих во взрослом состоянии, убедительно продемонстрирована роль фотопериода в регуляции ожирения [1027].
Резервы, накопленные в жировом теле в период питания, служат источниками жировых, белковых и углеводных соединений, которые могут быть использованы при линьке, голодании, метаморфозе или развитии половых продуктов. Обмен веществ во время диапаузы также поддерживается за счет этих резервов. Опыты, поставленные Н. Л. Сахаровым [1028] и многими другими исследователями, показали, что без накопления достаточных жировых запасов невозможна благополучная зимовка насекомых.
Другие функции жирового тела, не связанные с накоплением запасных питательных веществ, будут рассмотрены ниже.
Клетки жирового тела. По своей природе и происхождению клетки жирового тела очень близки к гемоцитам. При эмбриональном развитии клетки крови и жирового тела возникают из одного источника [1029]. На постэмбриональных стадиях неоднократно описывались случаи взаимного превращения этих клеток. У многих насекомых удается обнаружить постепенные морфологические переходы от типичных циркулирующих с плаз-
295
мой гемоцитов к седентарным гемоцитам, а затем и к собраниям клеток, напоминающим островки жировой ткани [1026]. Поэтому жировое тело и гемолимфу часто рассматривают как единую систему тканей внутренней среды.
В функциональном отношении клетки жирового тела и гемоциты тоже тесно взаимосвязаны. В период активного питания насекомого гемоциты переносят усвоенные пищевые продукты от кишечника к жировому телу, в клетках которого накапливаются запасные питательные вещества. В случае необходимости эти вещества вновь могут быть переданы гемоцитам и разнесены ими по всему телу. Следовательно, гемоциты, и жировые клетки выполняют отдельные операции в едином процессе рационального использования питательных веществ.
Клетки жирового тела неоднородны. В зависимости от характера цитоплазматических включений они разделяются на 4 категории.
1. Трофоциты составляют основную массу клеток жирового тела. Они могут синтезировать резервные и транспортные продукты. Первые откладываются про запас в самих клетках, а вторые передаются гемоцитам или прямо выделяются в плазму гемолимфы.
Гистологические картины, сопровождающие процессы накопления и расходования резервных продуктов, подробно исследованы Уигглсуорсом [1030] на личинках комара Aedes aegypti. В отсутствии пищи личинки расходуют резервные продукты, количество которых в трофоцитах быстро уменьшается. После 12-дневного голодания жировые капельки, гранулы гликогена или белка исчезают полностью, и в клетках жирового тела остаются только вакуоли, заполненные водой (рис. 109, Л, Б). Израсходованный запас резервных продуктов восстанавливается во время питания. Если личинки потребляют углеводную пищу, в трофоцитах откладываются, главным образом, гликоген и, в меньшей степени, жир (рис. 109, Г2—Г4). При питании оливковым маслом жировые капли составляют единственный резервный продукт (рис. 109, Д2—Дь). Чистый белковый рацион вызывает отложение в трофоцитах капелек жира и гранул резервного белка (рис. 109, Е2—£5). Таким образом, липидные соединения синтезируются и накапливаются в жировом теле при любом химическом составе пищи. Липиды играют роль важнейших резервных продуктов не только у личинок комаров, но и у всех других насекомых.
Уигглсуорс [1031] полагает, что синтез липидов осуществляется в маленьких дисковидных колпачках, которые вплотную примыкают к жировым каплям. Эти колпачки, названные ка-талисомами, впервые были обнаружены в трофоцитах клопа Rhodnius prolixus. Кроме липазы (фермента, необходимого для биосинтеза липидов), в каталисомах обнаружены цитохромы и все ферменты цикла трикарбоновых кислот.
296
Рис. 109. Накопление и расходование продуктов в клетках жирового тела у личинок комара Aedes aegypti. По Уигглсуорсу [1030].
А — трофоцит только что отлинявшей личинки IV возраста. Б — то же после 12 дней голодания. В — уратные клетки в жировом теле голодавших личинок. Ду и Еу — трофоциты голодных личинок. Г2, Г3, Г< — через 1. 2 и 4 суток после питания крахмалом. Д2, Дз, Д< — через 1, 2 и 3 суток после питания оливковым маслом. Е2, Ез, Ei и Е$ — через /, 2, 3 и 7 суток после питания казеином, б.г — белковые гранулы; в — вакуоли, заполненные водой; г — отложения гликогена; ж.к — жировые капли; к.м — кристаллы мочевой кислоты.
Отложения гликогена первоначально появляются по периферии клетки, а затем заполняют всю цитоплазму (рис. 109, Г3, Г4). Белковые гранулы формируются вокруг ядра (рис. 109, £4). Возможно, что в таких гранулах, помимо белков, имеются рибонуклеиновые кислоты и фосфолипиды [1032].
Как правило, на ранних стадиях развития насекомых трофоциты накапливают жир и гликоген. Синтез резервных белков и образование белковых гранул характерны для личинок или нимф старших возрастов [1033, 1034, 1035].
У насекомых, претерпевающих полный метаморфоз, по мере роста личинок трофоциты увеличиваются в размерах, заполняются резервными продуктами, но микроструктура внутриклеточных органелл почти не изменяется [1036]. Деления клеток или любые другие изменения их количества в этот период не наблюдаются. При подготовке к окуклению и на стадии куколки клетки жирового тела испытывают значительные внутренние перестройки в связи с формированием альбуминоидных гранул. Эти гранулы возникают из растворяющихся митохондрий, эндоплазматического ретикулума, аппарата Гольджи, лизосом и гранул гликогена [1037, 1038, 1039, 1040]. Они имеют сложную природу; в их составе найдены белки, мочевая кислота, гликоген и фосфолипиды. По всей вероятности, альбуминоидные гранулы служат поставщиками энергетических субстратов и продуктов, необходимых для формирования имагиналь-ных органов. Появление таких гранул отражает процесс дегенерации трофоцитов, которые со всем своим содержимым потребляются активно развивающимися тканями.
На рис. ПО показана схема трансформации внутриклеточных органелл в различные типы альбуминоидных гранул при метаморфозе бабочки Philosamia cynthia ricini. Предполагается, что органеллы разрушаются пищеварительными ферментами, которые выделяются в цитоплазму из лизосом. Освобождение лизосомных ферментов обусловливается либо изменениями pH гемолимфы, либо гормональными факторами. В результате воздействия ферментов гна митохондрии получаются гранулы типа /, 3, 4 и 5. Другие органеллы дают начало гранулам типа 2 или прямо превращаются в гомогенные гранулы 5.
2. Уратные клетки служат для накопительной экскреции мочевой кислоты. В жировом теле насекомых таких клеток гораздо меньше, чем трофоцитов. Они становятся особенно многочисленными у куколок, когда мальпигиевы сосуды перестают функционировать и единственным способом выведения экскре-
Рис. НО. Схема формирования белковых гранул в трофоцитах при растворении субклеточных структур во время метаморфоза бабочки
Philosamia cynthia ricini. По Уолкеру [1040].
1—5— типы белковых гранул, возникающих при растворении ядерного материала, эндоплазматического ретикулума и других субклеточных структур ферментами, которые вы-4 деляются лизосомами, ли — лизосома; л и'— гранула, возникающая при растворении са-
мой лизосомы.
298
299
тов из гемолимфы является их накопление в клетках жирового тела или в покровах. Обычно кристаллы азотсодержащих экскретов находятся в вакуолях, заполняющих всю цитоплазму (рис. 109, В).
3. Мицетоциты (бактериоциты) —это такие клетки, в которых живут внутриклеточные симбиотические микроорганизмы. Подобные клетки особенно часто встречаются в жировом теле тараканов. Они заполнены палочковидными бактериями, которые хорошо выявляются при световом и электронном микроскопировании [1041, 1042]. Каждая бактерия находится внутри собственной капсулы, отделяющей ее от цитоплазмы мицетоцита [1043]. При скармливании тараканам антибиотиков внутриклеточные симбионты исчезают, и мицетоциты заполняются кристаллами мочевой кислоты [1044].
4. Хромоциты содержат гранулы пигментов и участвуют в создании окраски у тех видов насекомых, которые имеют прозрачные непигментированные покровы. Клетки с такими функциями найдены в жировом теле двукрылых, относящихся к сем. Simuliidae и Thaumaleidae [1045, 1046].
§ 2. Транспортные и резервные вещества жирового тела
Углеводы. В организме насекомого углеводы транспортируются в виде трегалозы. Хорошо выраженной способностью к биосинтезу этого дисахарида обладают только клетки жирового тела. По данным Кэнди и Килби [1047, 1048] одна из двух молекул глюкозы, необходимых для синтеза, фосфорилируется с образованием глюкозо-6-фосфата, а другая поставляется уридиндифосфоглюкозой (УДФГ). В результате соединения гексозных молекул возникает фосфорилированная 4 трегалоза, которая затем распадается на трегалозу и неорганический фосфат. УДФГ, отдавшая глюкозу на синтез трегалозы, восстанавливается опять-таки за счет глюкозо-6-фосфата (рис. 111).
Весь путь синтеза трегалозы завершается очень быстро. Уже через 5 мин после инъекции меченой глюкозы в тело мух Phormia regina 85% радиоактивности обнаруживается в трегалозе [1050]. Поэтому глюкоза, которая выделяется в гемолимфу при всасывании пищи кишечником, лишь очень редко обнаруживается здесь в качестве самостоятельного соединения; она интенсивно поглощается жировым телом, фосфорилируется и превращается в транспортный дисахарид — трегалозу.
Основной резервный углевод жирового тела — полисахарид гликоген — синтезируется из глюкозы, поставляемой УДФГ. Показано, что в жировом теле саранчи Schistocerca cancellata и таракана Periplaneta americana меченный по углероду глюкозный остаток этого соединения передает часть своей радиоактивности гликогену [1051, 1052]. Добавление к инкубацион
300
ной среде глюкозо-6-фосфата не только не увеличивает, а даже уменьшает радиоактивность полисахарида. Возможно, что в трофоцитах жирового тела существуют конкурентные взаимоотношения между синтезом трегалозы и гликогена. Поэтому усиление первого синтетического пути, вызванное внесением глюкозо-6-фосфата, влечет за собой подавление второго пути. Если же в среду вводить глюкозо-1-фосфат, необходимый для восстановления УДФГ (см. рис. 111), то синтез гликогена усиливается.
Рис. 111. Схема синтеза трегалозы в жировом теле саранчи Schistocerca gregaria. По Килби [1049].
АДФ — аденозиндифосфат; АТФ — аденозинтрифосфат; УДФ — уридиндифосфат; УДФГ—ури-
диндифосфоглюкоза; УТФ — уридинтрифосфат.
Основной путь синтеза дисахарида
Путь восстановления уридиндифосфо' глюкозы
Трегалоза * фосфат
Направление метаболических превращений углеводов в жировом теле регулируется гормональным путем. Гормон линьки— экдизон — вызывает усиленный синтез трегалозы, а в отсутствии этого гормона глюкоза превращается* в гликоген [1053]. Следовательно, в период линьки, когда эпидермальные клетки нуждаются в глюкозе для постройки новой кутикулы, временно прекращается отложение резервного углевода и стимулируется образование транспортного сахара. Трегалоза, синтезируемая под влиянием экдизона, переносится гемолимфой от жирового тела к эпидермису и расщепляется до глюкозы.
При постэмбриональном развитии насекомых усиленное накопление гдикогена (до 20—25% от сухого веса тела) достигается в конце личиночной или нимфальной стадии. Во время
П 198
301
метаморфоза накопленный полисахарид затрачивается на формирование имагинальных тканей [1054]. В конце куколочной жизни запасы гликогена частично или полностью восполняются за счет синтеза из глюкозы, освобождаемой при гистолизе личиночных органов.
Гликоген расходуется не только для целей перестройки или новообразования органов во время метаморфоза, но и при интенсивной мышечной работе. Использование углеводов в качестве источника энергии крыловых мышц особенно характерно для двукрылых. В связи с этим Уигглсуорс [1055] наблюдал исчезновение полисахаридных гранул в жировом теле дрозофил после длительного полета, а Клементс [1056] обнаружил подобное же явление у комаров Culex pipiens. В обоих случаях запасы жцров в трофоцитах оставались нетронутыми.
Липиды. В жировом теле насекомых обнаружены разнообразные группы липидных соединений. В составе капелек жира, которые выявляются в трофоцитах при гистологических исследованиях (см. рис. 109), особенно велико содержание глицеридов— сложных эфиров глицерина и высших жирных кислот. Триглицериды служат основными резервными липидами жирового тела. Транспортные липиды представлены либо также триглицеридами, либо диглицеридами.
Жирные кислоты, входящие в состав глицеридов и содержащиеся в свободном состоянии в трофоцита^, могут быть насыщенными (предельными) или ненасыщенными (непредельными). И те и другие имеют не меньше 12, по не больше 18 атомов углерода, образующих открытую цепь.
Наиболее обычные жирные кислоты жирового тела представлены олеиновой, пальмитиновой и стеариновой кислотой. Все три кислоты могут синтезироваться в жировом теле. У большинства представителей двукрылых преобладает пальмитолеиновая [1057], у червецов р. Ceroplastes — лауриновая [1058], а у всех тлей — миристиновая кислота (рис. 112). У гусениц в значительных количествах присутствует или пальмитолеиновая, или линоленовая кислота [1059].
Стерины жирового тела представлены, главным образом, холестерином и p-ситостерином. Часть этих соединений находится в виде стериновых эфиров жирных кислот [1060].
Углеводороды, содержащиеся в теле насекомых, вообще слабо изучены. Например, у личинок колорадского жука (Leptinotarsa decemlineata) обнаружены 3 высокомолекулярных предельных углеводорода (С54Н110, С55Н112 и С57Н116), но их метаболическая роль остается неизвестной [1061]. Из тканей мух Musca domestica выделены углеводороды с меньшим числом атомов углерода — от 16 до 35 [1062]. В молекулах углеводородной фракции, полученной из тараканов Periplaneta americana, максимальное число углеродных атомов не превышает 43 [1063].
302
Рассмотренные выше глицериды относятся к группе нейтральных липидов. К Другой группе, фосфолипидам, принадлежат сложные жиры, содержащие фосфорные группировки. Из числа наиболее известных соединений этой группы следует назвать фосфатиды, которые построены из а-глицерофосфата, связанного -сложноэфирной связью, во-первых, с двумя остатками
Рис. 112. Относительное содержание жирных кислот с разным числом углеродных атомов в теле тлей и жесткокрылых. По данным Барлоу [1057].
По вертикали — содержание жирных кислот в процентах по отношению к их общему количеству. Приведены данные о насыщенных и ненасыщенных кислотах с 18, 16 и 14 атомами углерода. Тли: 1— Pemphigus populicaulis; 2— Tuberolachnus salignus; 3—Acyrthosiphon pisum; 4—Aphis pomi; 5— Dactynotus ambrosias.
Жесткокрылые: 6—Tetraopes tetraophthalmus; 7— Pyropyga decipiens; 8-Trihab-da virgata; 9— Sitona scissifrons; 10— Harpalus caliginosus; 11— Calosoma ca-lidum.
жирных кислот, а, во-вторых, с этаноламином, холином, серином или^йнозитом. В соответствии со структурой химического компонента на третьей связи а-глицерофосфата фосфатиды и получают свое название (фосфатидилэтаноламин, фосфатидил-холин, фосфатидилсерин и фосфатидилинозит).
У насекомых найдены фосфатиды всех 4 известных типов* причем основными соединениями этой фракции являются фосфатидилэтаноламин и фосфатидилхолин.
Фосфолипиды очень плохо растворяются в воде. Именно это обстоятельство позволяет их использовать в качестве идеальных структурных агрегатов субклеточных мембран, от.деляю-
303
щих содержимое митохондрий и микросом от цитоплазмы. Показано, что в митохондриях мух Musca domestica 64% фосфора входит в состав фосфолипидов, а в цитоплазме только 10% [1064]. Можно полагать, что фосфолипиды служат не только пассивными компонентами митохондриальных стенок, а принимают активное участие в процессах окислительного фосфорилирования и в работе дыхательных ферментов. Во время метаморфоза насекомых максимальное содержание фосфолипидов достигается в конце личиночной или нимфальной стадии [1065], что, по всей вероятности, связано с высокой потребностью в фосфатидах на куколочной фазе, когда формируются мембраны гигантских и многочисленных митохондрий в крыловых мышцах [1060].
Нейтральные липиды и фосфолипиды составляют две основные группы жировых веществ, накапливающихся в организме насекомого в период активного питания. Эти резервные жиры служат поставщиками энергии во время линек, метаморфоза, а также при голодании и созревании половых продуктов. Особенно выгодно накопление нейтральных липидов, которые благодаря их относительной химической индифферентности могут откладываться в значительных количествах без нарушения биохимических процессов, протекающих в протоплазме трофоцитов [1066].
Согласно концепции Нидхэма [1067], липиды являются главными источниками энергии во время развития яиц у всех наземных животных, причем основная масса резервных жиров используется на поздних этапах эмбриогенеза. Эта концепция подтверждается для большинства насекомых, у которых в процессе развития яиц наблюдается окисление жирных кислот и снижение общего содержания резервных липидов в желтке. Так, при эмбриогенезе палочника Carausius morosus 2/з затрачиваемой энергии,поставляются жирами [1068].
При неполном метаморфозе насекомых происходит накопление липидов в нимфальной стадии и частичное их использование у нимф последнего возраста с последующим восстановлением жировых запасов при питании имаго [1069]. Точно также при полном метаморфозе личинки создают запасы жира, которые снабжают энергией формирующиеся имагинальные органы у куколок [1070]. Развитие куколок волнянки Leucoma sali-cis сопровождается прогрессирующим снижением концентрации липидов с 11,4 до 7,5% по отношению к сырому весу тканей [1071]. Потребление липидов на куколочной фазе метаморфоза характерно для многих насекомых, но запасы резервного жира не всегда уменьшаются так сильно, как у L. salicis, потому что часть израсходованных глицеридов и жирных кислот восполняется за счет гистолиза личиночных органов или превращения гликогена в жиры [1072].
Диапауза вносит существенные изменения в процесс отло
304
жения липидов в трофоцитах жирового тела. Как правило, содержание липидов в организме насекомого начинает увеличиваться еще при подготовке к диапаузе. Несмотря на прекращение питания при диапаузе, резервные жиры, накопленные к моменту ее наступления, могут поддерживать жизнедеятельность в течение нескольких месяцев или даже лет.
У диапаузирующих мух Musca autumnalis обнаружено в 7 раз больше жиров, чем у активных [1073]. Накопление липидов, представленных, в основном, триглицеридами, происходит постепенно при выдерживании имаго в условиях короткого
Рис. 113. Различия в содержании липидов у диапаузирующих и активных мух Musca autumnalis. По Вальдеру и др. [1074].
Диапауза индуцировалась коротким днем (8 ч) и пониженной температурой (16°С), воздействующими. на имаго с момента отрождения. Активные мухи содержались в условиях длинного дня (16 ч) и повышенной температуры (27°С). а — активные мухи; б — диапаузирующие мухи. А — общее содержание липидов. Б — содержание разных классов липидных соединений на 15-й день после отрождения мух: /—фосфолипиды; 2— углеводороды; 3 — триглицериды; 4 — стерины; 5 — диглицериды; 6 — моноглицериды; 7 — свободные жирные кислоты.'
дня и низкой температуры (рис. 113). Мухи, содержащиеся при длинном дне и высокой температуре, не диапаузируют; они характеризуются низким содержанием триглицеридов.
Пониженный уровень обмена веществ у диапаузирующих насекомых обусловливает экономное расходование резервных липидов. В течение имагинальной диапаузы комара Culex tar-sails количество липидов даже возрастает [1075]. Очевидно, при зимовке этих комаров потребляются главным образом углеводы, и часть из них превращается в липиды. У гусениц Pectinophora gossypiella прогрессирующее снижение содержания жиров начинается лишь после 3 месяцев зимовки, а до этого расходуется только гликоген [1076]. При куколочной диапаузе также существуют два типа обменных реакций, связанных с преимущественным расходованием 1) углеводов —
305
у Hyalophora cecropia [1077] или 2) жиров — у Pieris brassi-сае [1078].
Таким образом, жиры, наряду с углеводами, служат важнейшими источниками эндогенного питания тканей, приостанавливающих свое развитие на время диапаузы.
Специального упоминания заслуживает вопрос о значении жиров в создании высокой холодостойкости диапаузирующих стадий. В ряде работ показано, что воспитание насекомых в пониженной температуре ведет к увеличению содержания ненасыщенных жирных кислот [1079]. Наоборот, при повышенной температуре увеличивается концентрация' насыщенных кислот [1080]. Иными словами, в жировом теле имеют место термочувствительные химические переходы такого типа:
Температура
Ненасыщенные высокая Насыщенные
жирные жирные
кислоты низкая кислоты
Существование таких переходов позволило И. В. Кожанчи-кову [1081] предположить, что соотношение количества ненасыщенных и насыщенных жирных кислот в организме насекомых должно определять их устойчивость к повреждающему действию высоких или низких температур. Однако это предположение не подтверждается в экспериментах [1082]. Холодостойкость насекомых создается не липидами, а глицерином и другими химическими соединениями, накапливающимися в гемолимфе при зимней диапаузе.
Взрослыми прямокрылыми и бабочками липиды жирового тела используются как поставщики .энергии, необходимой для сокращения крыловых мышц. В связи с этим бабочки, мигрирующие на далекие расстояния, характеризуются повышенным содержанием липидов [1083]. У стадной формы саранчи Lo-custa migraioria жировые запасы составляют в среднем 10,7% от сухого веса, а у одиночной формы — только 7,5% [1084].
Детальные исследования Вейс-Фо [1085] показали, что во время непрерывного 5-часового полета саранчи Schistocerca gregaria 80—85% потребляемой энергии поставляется липидными соединениями, причем около 90% липидов транспортируется гемолимфой от жирового тела к крыловой мускулатуре. По словам этого автора, жиры являются идеальными поставщиками энергии для крупных летающих насекомых, потому что энергетически эквивалентные запасы гликогена утяжелили бы тело в 7 раз и потребовали бы дополнительных мощностей для создания подъемной силы. Однако не только такие крупные насекомые, как саранчовые, но и мелкие крылатые тли расходуют при полете резервные жиры [1086]. В течение первого часа полета тлей Aphis fabae используется главным образом гликоген, а жиры обеспечивают 90% энергии в последующие
306
часы. Мухи и комары даже при длительной работе крыловых мышц потребляют только гликоген, а не жир.
Синтез липидов. Синтез транспортных и резервных липидов жирового тела протекает в два этапа. На первом этапе образуются жирные кислоты, а на втором — диглицериды, триглицериды или другие соединения жирного ряда.
Далеко не все жирные кислоты, обнаруживаемые у насекомых, могут синтезироваться ими из более простых соединений. Гусеницы совки Trichoplusia ni линоленовую и линолевую кислоту получают только из пищи и не могут создавать их само-
Таблица 10
Способность насекомых синтезировать жирные кислоты из ацетата-Сц
Отряды, виды и стадии развития i Насыщенные кислоты Ненасыщенные кислоты Источник
стеариновая пал ьмити-новая миристиновая лауриновая масляная олеиновая пальмитолеиновая линолевая линоленовая
Blattodea — тараканы Eurycotis floridana (И) _^_1_ ++ [10891
Homoptera — равнокрылые Myzus persicae (И) ++ + т 4- ++ + -р [1090]
Coleoptera — жесткокрылые Galerna melanopus (И) 4~4~ ++ [4091]
Lepidoptera — чешуекрылые Bombyx mori (Г) ++ +4- ++ [1092]
Prodenia eridania (Г) + 4-4- 4- _L 4- + [1093]
Trichoplusia ni (Г){ + 4-4- + + ++ + [1087]
Примечание. (+) —радиоактивная метка слабо включается в жирную кислоту; (++) — радиоактивная метка интенсивно включается в жирную кислоту. Г — гусеницы, И — имаго.
стоятельно [1087]. Эти же две кислоты не синтезируются и многими другими насекомыми, например гусеницами американского шелкопряда Hyalophora cecropia [1088].
Обычно насекомые не синтезируют насыщенные и ненасыщенные кислоты с числом атомов углерода меньше 14 или больше 18. Как видно из табл. 10, наиболее активно синтезируются пальмитиновая (Ci6:o), стеариновая (С 18:о) .и олеиновая (Cie-.i) кислоты. Исходным продуктом для синтеза этих кислот служит двууглеродный фрагмент ацетат СН3 — С — ОН. У тли Myzus
II
О
persicae после поглощения с пищей меченного по углероду ацетата почти 75% радиоактивности приходится на долю всех трех жирных , кислот [1090]. При аналогичной постановке опытов
307
у растительноядных жуков 60% радиоактивности обнаруживается в одной олеиновой кислоте [1091, 1094].
Синтез жирных кислот осуществляется целой системой ферментов, коферментов, неорганических и органических активаторов. Титц-Дэви [1095] показала, что бесклеточные гомогенаты жировой ткани саранчи Locusta migratoria наиболее полно и с наибольшей скоростью превращают ацетат в жирные кислоты в присутствии АТФ, MgCl2, глутатиона, КНСО3, MnSO4, яблочной кислоты, а-кетоглутаровой кислоты, коэнзима А (КоА) и НАД-ферментов. Если все эти вещества вносятся в инкубационную среду, около 35% находящегося в ней ацетата включается в состав липидов. При этом более половины синтезируемых жирных кислот составляет пальмитиновая кислота. Сходный набор кофакторов необходим для синтеза пальмитиновой кислоты в бесклеточной фракции жирового тела, полученной из личинок мухи Aldrichia grahami [1096].
Жирные кислоты, синтезированные из ацетата, могут испытывать дальнейшие превращения, связанные с перестройками их молекул. Например, у гусениц Bombyx mori углеродные цепочки насыщенных жирных кислот, содержащие от 12 до 16 атомов, «удлиняются» до 18 атомов [1097]. Противоположный процесс укорочения молекулярных цепочек, составленных из 18 атомов углерода, наблюдается у личинок дрозофил [1098].
Полиненасыщенные кислоты, содержащие больше 1 двойной связи, практически не синтезируются насекомыми и не могут получаться из насыщенных кислот. Однако ненасыщенные кислоты с 1 двойной связью легко образуются в жировом теле в результате дегидрогенизации насыщенных кислот [1096, 1099]. Таким путем стеариновая кислота превращается в олеиновую (Cie-.i), а пальмитиновая — в пальмитолеиновую (С16:1).
Только незначительная часть свободных жирных кислот жирового тела подвергается непосредственному окислению до СО2. Значительно большая их часть используется для синтеза нейтральных липидов и фосфолипидов. У большинства насекомых жирные кислоты расходуются главным образом на образование нейтральных липидов. Так, в опытах Ламба и Монро [1100] жукам-листоедам Oulema melanopus скармливались листья ячменя, обрызганные ацетатом-С14, а затем экстракты измельченных тканей жуков фракционировались на хроматографической колонке. Оказалось, что 75% общей радиоактивности содержится в триглицеридах и лишь 5% — в фосфолипидах.
При синтезе нейтральных липидов и фосфолипидов исходными продуктами служат глицерин и жирные кислоты. Глицериновые молекулы могут строиться из молекул глюкозы [1101], а жирные кислоты синтезируются из ацетата. Глицерин превращается в а-глицерофосфат, который, присоединяя две аце-
308
/О \
и
тильные группы и два остатка жирной кислоты \—С—СН2—R/, образует фосфатидную кислоту:
О
II
CH2-O-C-CH2-R
о
II
CH —О—С—СН2—R
СН2-О-РО3Н2
Когда образуется молекула глицерида, фосфатная группа этой кислоты (—РО3Н2) замещается водородом (в диглицери-
О
II
дах) или радикалом —С—СН2—R (в триглицеридах). Когда образуется молекула фосфолипида, данная группа сохраняется, но приобретает сложноэфирную связь с холином, этанола-мином, серином или инозитом. Синтез' и нейтральных липидов, и фосфолипидов идет в цитоплазме трофоцитов и не требует присутствия митохондрий [1102].
Способность насекомых к синтезу стеринов'крайне ограничена. Например, у хлопкового долгоносика (Anthonomus gran-dis') не наблюдается включения в стерины радиоактивной метки от ацетата-С14 [1103]. Аналогичные результаты получены и на других видах насекомых.
Обмен аминокислот. Жировое тело является центром интенсивного обмена и синтеза аминокислот.
В жировом теле протекают реакции трансаминирования, обеспечивающие перенос аминогрупп и взаимные превращения различных аминокислот. Так, у саранчи Schistocerca gregaria а-кетоглутаровая кислота может превращаться в глутаминовую кислоту в результате присоединения группы —NH2 от аспарагина, аланина, глицина и многих других аминокислот [1104]. Ферменты, осуществляющие эти реакции, называются трансаминазами. В тканях саранчи наиболее активны трансаминазы, участвующие в следующих превращениях:
а-кетоглутаровая кислота
Глутамино- 1 Щавелевоук-вая кислота 'сусная кислота
Глутамино- । Пировиноград-вая кислота~ная кислота
Эти же трансаминазы оказались максимально активными и в жировом теле дрозофил [1105].
309
Реакции трансаминирования локализованы, главным образом, в периферических участках жирового тела [1106], так как именно эти участки со всех сторон омываются гемолимфой, из которой трофоциты извлекают нужные им аминокислоты. Кроме жирового тела, трансаминазной активностью обладают мальпигиевы "сосуды, кишечник, нервная цепочка и грудная мускулатура [1107]. Однако трансаминазы совершенно отсутствуют в гемолимфе.
Окисление аминокислот в жировом теле осуществляется оксидазами и специфическими дёгидрогеназами.
По данным Килби и его сотрудников [1104, 1108] система ферментов, в которую входят дегидрогеназа глутаминовой кислоты, НАД и цитохромы, тесно связана в своей работе с трансаминазами; она обеспечивает обратное превращение глутаминовой кислоты в а-кетоглутаровую:
Трансаминазо
Система дегидрогеназы глутаминодой кислоты
Н3+ 1/2 О2
Следовательно в теле насекомого поддерживается постоянная концентрация а-кетоглутаровой кислоты, необходимой для окончательного распада аминокислот и освобождения заключенной в них энергии. Освобождаемая энергия может использоваться во время роста жирового тела, а также при голодании или при работе мышц. Установлено, например, что окисление пролина доставляет энергию для полета мух и саранчовых [1109, 1110].
Энергия, заключенная в химических соединениях, может быть высвобождена не только при полном окислении,, но и при ферментативном гидролизе. Фермент аргиназа, обнаруженный в жировом теле многих насекомых [1111, 1112], обеспечивает распад аргинина до орнитина и мочевины:
nh2 NH,
C = NH 1 1 (СН2)з N Н2
NH 1 + н2о- (СН2)з 1 1 -* CHNH,+ С = О 1 1 СООН nh2
chnh2
1 СООН Аргинин Орнитин Мочевина
310
Предполагается, что орнитин, получаемый при гидролизе аргинина, используется для синтеза азотистых соединений, накапливающихся в уратных клетках жирового тела.
Синтез белков. В растущем организме насекомого клетки жирового тела активно синтезируют белковые соединения. Сво
Концентра,ция валина ,мМ
Рис. 114. Включение меченного по углероду валина в белки жирового тела- у личинок мухи Calliphora erythrocephala. По Прайсу [1115].
А — включение валина в транспортные (/) и резервные (2) белки. Зависимость синтеза белка от возраста личинок (Б), концентрации валина (В) и общей концентрации аминокислот в среде (Г). По вертикали на всех графиках умноженные на 103 показания счетчика радиоактивности в пересчете на 1 мг белка/мин.
Молярная концентрация аминокислот
бодные аминокислоты и пептиды, необходимые для этого синтеза, берутся из гемолимфы.
В условиях in vivo, когда аминокислота, снабженная радиоактивной меткой (С14 или Н3), инъецируется в тело живого насекомого, она используется в разнообразных биохимических реакциях. Например, Мансинг [1113] выявил следующую картину распределения радиоактивности, внесенной с глицином-С14 в тело таракана Blatella germanica*. 23,2% радиоактивности выделяется через дыхальца в виде С14О2; 40,7 обнаружи-
311
вается во фракции свободных аминокислот; 14,6 — во фракции свободных жирных кислот; 6,1—в белковой фракции; 3,6 — в трегалозе, 2,1—в гликогене, 0,9 — во фракции нейтральных липидов и фосфолипидов, 1,9 выделяется через мальпигиевы сосуды и кишечник в виде экскреторных продуктов. Результаты этого опыта свидетельствуют о том, что лишь небольшая часть аминокислот гемолимфы расходуется на синтез белка в жировом теле.
В условиях in vitro изолированное жировое тело, помещенное в физиологический раствор, продолжает свою синтетическую деятельность: оно поглощает из инкубационной среды меченые аминокислоты и включает их в состав формирующейся белковой молекулы. Таким методом было доказано включение лейцина-С14, валина-С14, лизина-С14, аланина-С14, лейцина-Н3, тирозина-Н3 в белки жирового тела у гусениц и личинок мух [1114, 1115, 1116, 1117, 1118].
У самок шелкопряда Hyalophora cecropia. и таракана Periplaneta americana лейцин, меченный тритием Н3, вовлекается в синтез вителлогенинов — специфических белков, которые продуцируются жировым телом и используются в созревающих яйцах при формировании желтка [1119]. На предимагинальных стадиях метаморфоза аминокислоты также используются для преимущественного синтеза транспортных белков. Так, у личинок мухи Calliphora erythrocephala один из основных плазменных белков — каллифорин, — несомненно, образуется в жировом теле, а затем выделяется в гемолимфу [1120]. При инкубации жирового тела личинок С. erythrocephala с валином-С14 в течение 1,5 ч 84,5% синтезируемого белка освобождается в инкубационную среду, а 15,5% откладывается в качестве резерва в жировом теле (рис. 114, Л). Наиболее активный синтез резервных и транспортных белков происходит у 4-дневных личинок (при 25°), а к 6-дневному возрасту он резко снижается и затем падает постепенно до фазы предкуколки (рис. 114, 5). Радиоактивность всей белковой фракции увеличивается при повышении содержания меченого валина до 0,6— 0,8 ммоль/л и при возрастании концентрации 18 «дополнительных» немеченых аминокислот до 0,2—0,4 моль/л (рис. 114, 5, Г). Скорость включения валина в белки жирового тела зависит от ионного состава инкубационной среды [1121].
Реальные пути белкового синтеза в трофоцитах остаются неизвестными, поскольку даже аминокислотный состав белков жирового тела до сих пор не изучался. По современным представлениям ' последовательность аминокислот в белках определяется нуклеиновыми кислотами. Поэтому изучение качественных и количественных изменений - нуклеиновых кислот в разные моменты жизни насекомых необходимо для расшифровки механизма белкового синтеза в жировом теле. Разумеется, такое изучение является лишь предпосылкой дальнейших углуб-312
ленных исследований, которые станут возможными только тогда, когда будет установлена структура белковых молекул, синтезируемых трофоцитами.
Во всех типах клеток синтез белков и нуклеиновых кислот регулируется гормонами, влияющими на развитие насекомых. Это положение в равной степени справедливо для эпидермиса, имагинальных дисков и трофоцитов.
Активационный гормон, который вырабатывается нейросекреторными клетками мозга и накапливается в первой паре мозговых желез (corpora cardiaca) стимулирует синтез белка в жировом теле [1122]. Показано, что хирургическое удаление нейросекреторных клеток мозга вызывает значительное подавление белкового синтеза у саранчовых [1123].
Экдизон — гормон, выделяемый активированными проторакальными железами и вызывающий линьку насекомых, — способствует быстрому включению уридина в рибонуклеиновую кислоту, а аминокислот — в белки жирового тела [1124, 1125]. Под воздействием синтетического экдизона трофоциты гусениц Calpodes ethlius образуют белковые гранулы, характерные для куколок чешуекрылых [1126].
Ювенильный гормон, задерживающий метаморфоз пред-имагинальных стадий и вызывающий развитие яичников у взрослых самок, влияет главным образом на синтез вителлогенинов. Источником данного гормона является вторая пара мозговых желез (corpora allata). В гемолимфе обезглавленных самок таракана Leucophaea maderae исчезают белковые фракции, которые расходуются на формирование желтка в яйцах интактными самками. Однако эти белки появляются в гемолимфе вскоре после имплантации с. allata [1127]. Введение в полость тела тараканов химического аналога ювенильного гормона оказывает такое же положительное влияние на синтез вителлогенинов, как и имплантация мозговых желез [1128].
Выше мы уже упоминали о влиянии гормонов на образование углеводов — трегалозы и гликогена (см. с. 301). В данном разделе обсуждались некоторые факты, иллюстрирующие значение гормонов для синтеза белков. Таким образом, изменения активности эндокринных органов при прохождении определенных стадий метаморфоза служат одним из важнейших регуляторов биохимических процессов, протекающих в жировом теле.
УКАЗАТЕЛЬ ЛИТЕРАТУРЫ
ГЛАВА I
1. Locke М. The structure and formation of the integument in insects.— In: The Physiology of Insecta. Ed. by M. Rockstein. N. Y.— L., Acad. Press, 1964, vol. 3, p. 379—470.
2. Wigglesworth V. B. Insect physiology in relation to insecticides.— J. Roy. Soc. Arts, 1956, vol. 104, p. 426—438.
3. Hagopian M. Intercellular attachements of cockroach nymph epidermal cells.—J. Ultrastruct. Res., 1970, vol. 33, p. 233—244.
4. Wigglesworth V. B. The principles of insect physiology. L., Methuen and Co., 1953. 546 p.
5. Гиляров M. С., Семенова Л. M. Эволюция кутикулы членистоногих.— Усп. совр. биол., 1963, т. 56, с. 208—227.
6. Г и л я р о в М. С. Закономерности приспособлений членистоногих к жизни на суше. М., «Наука», 1970. 276 с.
7. Гиляров М. С. Особенности почвы как среды обитания и ее значение в эволюции насекомых. М.—Л., Изд-во АН СССР, 1949. 279 с.
8. Lower Н. Е. The integument of two Apterygota: Ctenolepisma lon-gicaudata Esh. (Thysanura, Lepismatidae) and Sminthuridae.—J. Morphol., 1958, vol. 103, p. 331—351.
9. С e м e н о в а Л. M. Различия строения покровов личинок насекомых целинных и орошаемых земель пустыни.— Журн. общ. биол., 1964, т. 25, с. 311—319.
10. Семенова Л. М., Родионова А. Н. Особенности кутикулы водных личинок насекомых в связи с условиями жизни.—Журн. общ. биол., 1961, т. 22, с. 128—135.
11. R i с h а г d s A. G. Structure and development of the integument.— In: Insect physiology. Ed. by K. D. Roeder. N. Y.—L., John Wiley and Sons Inc., Chapman and Hall, 1953, p. 1—22.
12. Шванвич Б. H. Курс общей энтомологии. M.—Л., «Сов. наука», 1949. 900 с.
13. С о n d о u 1 i s W. V., Locke М. The deposition of endocuticle in an insect, Calpodes ethlius Stoll (Lepidoptera, Hesperiidae).—J. Insect Physiol., 1966, vol. 12, p. 311—323.
14. Neville A. C. The daily growth layers of insects.—«Zenith», 1965, vol. 3, p. 19—22.
15. Dennell R. A study of an insect cuticle: the larval cuticle of Sar-cophaga falcullata Pand. (Diptera).—Proc. Roy. Soc., 1946, ser. B, vol. 133, p. 348—373.
16. Richards A. G., Anderson T. F. Electron microscope studies of insect cuticle with a discussion of the application of electron optics to this problem.—J. Morphol., 1942, vol. 71, p. 135—183.
17. Locke M. Pore canals and related structures in insect cuticle.— J. Biophys. Biochem. Cytol., 1961, vol. 10, p. 589—618.
18. Wigglesworth V. B. The insect cuticle.—Biol. Rev., 1948, vol. 23, p. 408—451.
19. W i g g 1 e s w о r t h V. B. Structural lipids in the insect cuticle and the function of the oenocytes.—«Tissue and cells», 1970, vol. 2, p. 155—179.
314
20. Delachambre J. Remarques sur 1’histophysiology des oenocytes epidermiques de la nymphe de Tenebrio molitor L. (Col., Tenebrionidae).— Compt. Rend. Acad. Sci.,’ 1966, ser. D, t. 263, p. 764—767.
21. Locke у К. H. The thickness of some insect epicuticular wax layers.—J. Exptl. Biol., 1960, vol. 37, p. 316—329.
22. L о с к e M. The cuticular pattern in an insect; the intersegmental membranes.—J. Exptl. Biol., 1960, vol. 37, p. 398—406.
23. Kramer S., W i g g 1 e s w о r t h V. B. The outer layers of the cuticle in the cockroach Periplaneta americana and the function of the oenocytes.—Quart. J. Microscop. Sci., 1950, vol. 91, p. 63—72.
24. Locke M. Secretion of wax through the cuticle of insects.—«Nature», 1959, vol. 184, p. 1967.
25. Locke M. The hormonal control of wax secretion in an insect, Cal-podes ethlius Stoll (Lepidoptera, Hesperiidae).—J. Insect Physiol., 1965, vol. 11, p. 641—658.
26. Evans J. J. T., St anbury P. J. The function of the tergal glands in the queensland fruit fly, Dacus tryoni.—J. Insect Physiol., 1967, vol. 13, p. 1875—1883.
27. В e a m e n t J. W. L. Wax secretion in the cockroach.—J. Exptl. Biol., 1955, vol. 32, p. 514—538.
28. С о 11 i n s M. S., Richards A. G. Studies on water relations in north American termites. II.—«Ecology», 1966, vol. 47, p. 328—331.
29. L о w e r H. F. The insect epicuticle and its terminology.—Ann. Ento-mol. Soc. Amer., 1959, vol. 52, p. 381—385.
30. W i g g 1 e s w о r t h V. B. The epicuticle in an insect, Rhodnius prolixus,—Proc. Roy. Soc., 1947, ser. B, vol. 134, p. 163—181.
31. Webb J. E. The structure of the cuticle in Eomenacanthus strami-neus (Nitzsch) (Mallophaga).—«Parasitology», 1947, vol. 38, p. 70—71.
32. Wigglesworth V. B. The structure and deposition of the cuticle in the adult mealworm Tenebrio molitor.—Quart. J. Microscop. Sci., 1948* vol. 89, p. 197—217.
33. Noble-Nesbitt J. Transpiration in Podura aquatica L. (Collembola, Isotomidae) and the wetting properties of its cuticle.—J. Exptl. Biol., 1963, vol. 40, p. 681—700.
34. Wigglesworth V, B. The physiology of insect cuticle.—Ann. Rev. Entomol., 1957, vol. 2, p. 27—54.
35. Richards A. G. Studies on arthropod cuticle. XI.—J. Morphol., 1955, vol. 96, p. 537—563.
36. Noble-Nesbitt J. The cuticle and associated structures of Podura aquatica at the moult — Quart. J. Microscop. Sci., 1963, vol. 104, p. 369— 391.
37. W i g g 1 e s w о r t h V. B. The physiology of the cuticle and ecdysis in Rhodnius prolixus Staal.—Quart. J. Microscop. Sci., 1963, vol. 76, p. 269— 318.
38. Delachambre J. Origine et nature de U membrane exuviale chez la nymphe de Tenebrio molitor L. (Ins., Coleoptera).—Z. Zellforsch., 1967, Bd. 81, S. 114—134.
39. Baldwin W. F., Salthouse T. N. Dermal glands and mucin in the moulting cycle of Rhodnius prolixus StaL—J. Insect Physiol., 1959,. vol. 3, p. 345—348.
40. W о 1 f e L. S. Further studies on the 3rd instar larval cuticle of Calliphora erythrocephala— Quart. J. Microscop. Sci., 1955, vol. 96, p. 181—191.
41. Philo gene B. J. R., MacFarlane J. E. The formation of the cuticle in the house cricket Acheta domesticus (L.) and the role of oenocytes.—Canad. J. Zool., 1967, vol. 45, p. 181 —191.
42. Locke M., С о n d о u 1 i s W. V., Hurshman L. F. Molt and'Intermolt activities in the epidermal cells of an insect.— «Science», 1965, vol. 149, p. 437—438.
43. Rinterknecht E. Etude de la reconstitution des teguments chez Locusta migratoria L. adulte.—Bull. Soc. Zool. France, ,1963, t. 88, p. 251— 262.
315
44. L a i - F о о к J. The repair of wounds in the integument of insects.— J. Insect Physiol., 1966, vol. 12, p. 195—226.
45. Locke M. Cell interactions in the repair of wounds in an insect (Rhodnius prolixus).—J. Insect Physiol., 1966, vol. 12, p. 389—395.
46. Rin,terknecht E. Controle hormonal de la cicatrisation chez Locusta migratoria.—Bull. Soc. Zool. France, 1966(1967), t. 91, p. 645—654.
47. Rinterknecht E. Influence de 1’hormone de la mue sur la reconstitution des teguments chez Locusta migratoria larvaire (stade V).—Bull. Soc. Zool. France, 1966(1967), t. 91, p. 789—802.
48. Rinterknecht E. Influence de 1’hormone juvenile sur la reconstitution des teguments chez Locusta migratoria adulte.—Bull. Soc. Zool. France, 1964(1965), t. 89, p. 723—730.
49. Stumpf H. F. Uber gefalleabhangige Bildungen des Insektenseg-nientes.—J. Insect Physiol., 1966, vol. 12, p. 601—617.
50. В r a n d 1 e K., S c h m i d t K. Determination des Zeichungsmusters von Plodia interpunctella (Lepidopt.) durch Entwicklungsverschiebung.— Z. Naturforsch., 1964, Ser. B, Bd. 19, S. 759—763.
51. Sahota T. S., BeckelW. E. The influence of epidermis on the developing flight muscles in Galleria mellonella.—Canad. J. Zool., 1967, vol. 45, p. 407—434.
52. Odier'A. Memoire sur la composition chitinique des perties cornees des insectes.—Mem. Soc. Hist. Natur. Paris, 1823, t. 1, p. 29—42.
53. T s a о С.-H., Richards A. G. Studies on arthropod cuticle. IX.— Ann. Entomol. Soc. Amer., 1952, vol. 45, p. 585—599.
54. E 1 о f f G., В о s a z z a V. L. Penetration of ultra-violet rays through chitin.—«Nature», 1938, vol. 141, p. 608.
55. G e h r i n g F. The destruction of chitin by microorganismus.— ZbL Bacteriol. Parasitenk. Infektionskankh. Hyg., 1955, Bd. 108, S. 232—242.
56. В e n t о n A. G. Chitinovorous bacteria — a preliminary survey — J. Bacteriol., 1935, vol. 29, p. 449—464.
57. Дроздова T. В. Хитин и его превращение в природных процессах. Усп. совр. биол. 1959, т. 47, с. 277—296.
58. В a d е М. L., Wyatt G. R. Metabolic conversions during pupation of the cecropia silkworm. I.—J. Biochem., 1962, vol. 83, p. 470—478.
59. Candy D. J., Kilby B. A. Studies on chitin synthesis in the desert locust.—J. Exptl. Biol., 1962, vol. 39, p. 129—140.
60. R i 11 e r H. J., Bray M. Chitin synthesis in cultivated cockroach blood.—J. Insect Physiol., 1968, vol. 14, p. 361—366.
61. Meyer К. H., Pankow G. W. Sur la constitution et la structure de la chitine.—Helv. Chim. Acta, 1935, t. 18, p. 589—598.
62. Clark Ci. L., Smith A. F. X-ray diffraction studies of chitin, chitosan and derivatives.—J. Physiol. Chem., 1936, vol. 40, p. 863—879.
63. L о t m a r W., P i с к e n L. E.. R. A new crystallographic modification of chitin (polyacetilglucosamine) and its distribution.—«Experientia», 1950, t. 6, p. 58.
64. Richards A. G., Korda F. H. Studies on arthropod cuticle. II.— Biol. Bull., 1948, vol. 94, p. 212—235.
65. Mooney R. C. L. An X-ray study of the structure of polyvinyl alcohol.—J. Amer. Chem. Soc., 1941, vol. 63, p. 2828—2832.
66. D ar mo p S. E., R u d a 11 К. M. Infra-red and X-ray studies of chitin.—Disc. Faraday Soc., 1950, vol. 9, p. 251—260.
67. N e v i 11 e A. C. Chitin lamellogenesis in locust cuticle.—Quart. J. Microscop. Sci., 1965, vol. 106, p. 269—286.
68. Krishan G., Rajulu G. S. Mode of hardening of the cuticle of Machilis variabilis (Apterygota: Thysanura).—«Current Sci.», 1964, vol. 33, p. 639—640.
69. Fraenkel G., R u d a 11 К. M. The structure of insect cuticle.—Proc. Roy. Soc., 1947, ser. B, vol. 129, p. 1—35.
70. Hackman R. H. Chemistry of insect cuticle. II.—J. Biochem., 1953, vol. 54, p. 362—367.
316
71. Moor fie Id H. H. Studies on some integumental proteins of insects.—Ph. diss, thesis. Urbana (Ill.), Univ, of Illinois, 1953, 168 p.
72. Brunet P. C. J. Sclerotins.—«Endeavour», 1967, vol. 26,
p. 68—74.
73. Mills R. R., Lake C. R., A 1 w о r t h "W. L. Biosynthesis of N-acetyl dopamine by the American cockroach.—J. Insect Physiol., 1967, vol. 13, p. 1539—1546.
74. W e i s - F о g h T. A rubber-like protein in insect cuticle.—J. Exptl. Biol., 1960, vol. 37, p. 889—907.
75. В a i 1 e у K-, W e i s - F о g h T. Amino acid composition of a new rubber-like protein, resilin.—Biochim. Biophys. Acta, 1961, t. 48, p. 452—459.
76. Hackman R. H., Goldberg M. J. Proteins of the larval cuticle of Agrionome spinicollis (Coleoptera).—J. Insect Physiol., 1958, vol. 2, p. 221—231.
77. R u d a 11 К. M. The chitin/protein complexes of insect cuticles.—Adv. Insect Physiol., 1963, vol. 1, p. 257—313.
78. Hackman R. H. Studies on chitin. III.—Austral. J. Biol. Sci., 1955, vol. 8, p. 530—536.
79. Hackman R. H. The integument of Arthropoda.—In: Chemical zoology. Ed. by M. Florkin and В. T. Scheer. N. Y.—L., Acad. Press, 1971, vol. 4B, p. 1—62.
80. J e u n i a u x C. Properietes chitinolytiques des extraits aqueus d’exu-vies larvaires prenymphales et nymphales de Tenebrio molitor L.—Arch. Intern. Physiol., 1955, t. 63, p. 114—120.
81. Baker G., Pepper J. H., Johnson L. H. e. a. Estimation of the composition of the cuticular wax of the mormon cricket, Anabrus simplex, Hold.—J. Insect Physiol., 1960, vol. 5, p. 47—60.
82. G i 1 b у A. R., Cox M. E. The cuticular lipids of the cockroach Periplaneta americana (L.).—J. Insect Physiol., 1963, vol. 9, p. 671—681.
83. Bur sell E., Clements A. N. The cuticular lipids of the larva of Tenebrio molitor L. (Coleoptera).—J. Insect Physiol., 1967, vol. 13, p. 1671— 1678.
84. В e a m e n t J. W. L. The cuticular lipoids of insects.—J. Exptl. Biol., 1945, vol. 21, p. 115—131.
85. R i c h a r d s A. G. The integument of arthropods. Minneapolis, Univ. Minnesota Press, 1951. 411 p.
86. Hackman R. H. Chemistry of the insect cuticle—In: The physiology of insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1964, vol. 3, p. 471—506.
87. M a 1 e к S. R. A. Polyphenols and their derivatives in the cuticle of the desert locust, Schistocerca gregaria (Forskal).—«Compar. Biochem. Physiol.», 1961, vol. 2, p. 35—50.
88. К ar Ison P., Ammon H. Zum Tyrosinstoffwechsel der Insekten. XI.—Hoppe Seyler’s Z. physiol. Chem., 1963, Bd. 330, S. 161—168.
89. К a r 1 s о n P., L i e b a u H. Zum Tyrosinstoffwechsel der Insekten. V.—Hoppe Seyler’s Z. physiol. Chem., 1961, Bd. 326, S. 135—143.
90. Whitehead D. L., Brunet P. C. J., Kent P. W. Specificity in vitro of a phenoloxidase system from Periplaneta, americana (L.).—«Nature», 1960, vol. 185, p. 610.
91. Schweiger A., К ar Ison P. Zum Tyrosinstoffwechsel der Insekten. X—Hoppe Seyler’s Z. physiol. Chem., 1962, Bd. 329, S. 210—221.
92. H a m a m u r a Y., I i d a S., О t u к a M. e. a. The enzymatic study on the exuvial fluid of silkworm, Bombyx mori L.—Bull. Fac. Text. Fibers Kyoto Univ. Industr. Arts and Text. Fibers, 1954, vol. 1, p. 127—130.
93. J e u n i a u x C. La chitinase exuviale des insectes.—Mem. Soc. Ento-mol. Belg., 1955, t. 27, p. 312—319.
94. Krueger H. R., Jaworski E. G. The fractionation and solubilization of Prodenia eridania chitin synthetase.—J. Econ. EntomoL, 1966, vol. 59, p. 229—230.
317
95. Richards A. G. The cuticle of arthropods.—Ergebn. Biol., 1958, Bd. 20, S. 2—19.
96. Stay B., King A., Roth L. M..Calcium oxalate in the oothecae of cockroaches.—Ann. Entomol. Soc. Amer., 1960, vol. 53, p. 79—86.
97. P а г к e r K. D., R u d a 11 К. M. Calcium citrate in an insect.—Bio-chim. Biophys. Acta, 1955, t. 17, p. 287—293.
98. P г у о r M. G. M. Sclerotization.—«Compar. Biochem.», 1962, vol. 4, p. 371—396.
99. Pryor M. G. M. On the hardening of the ootheca of Blatta orienta-Its.—Proc. Roy. Soc. L., 1940, vol. 128, ser. B, p. 378—393.
100. Hackman R. H., Goldberg M. Phenolic compounds in the cockroach ootheca.—Biochem. Biophys. Acta, 1963, t. 71, p. 738—740.
101. Stay B., Roth L. M. The collaterial glands of cockroaches.—Ann. Entomol. Soc. Amer., 1962, vol. 55, p. 124—130.
102. W i 11 i s J. H., Brunet P. С. I. The hormonal control of collate-rial gland secretion.—J. Exptl. Biol., 1966, vol. 44, p. 363—378.
103. Mason H. S. Comparative biochemistry of the phenolase complex.—Adv. Enzymol., 1955, vol. 16, p. 105—185.
104. К ar Ison P., Sekeris С. E. N-acetyl-dophamine as sclerotizing agent of the insect cuticle.—«Nature», 1962, vol. 195, p. 85—86.
105. Sekeris С. E., Karlson P. Zum Tyrosinstoffwechsel der Insek-ten. VII.—Biochem. Biophys. Acta, 1962, t. 62, p. 103—113.
106. S ch a ay a E., Sekeris С. E. Ecdysone during insect development. III.—«Gen. Compar. Endocrinol.», 1965, vol. 5, p. 35—39.
107. Karlson P., Schweiger A. Zum Tyrosinstoffwechsel der Insek-ten. IV.—Hoppe Seyler’s Z. physiol. Chem., 1961, Bd. 323, S. 190—210.
108. Гил му p Д. Метаболизм насекомых. M., «Мир», 1968, 229 с.
109. Hackman R. Н., Goldberg М. The o-aiphenoloxydases of fly larvae.—J. Insect Physiol., 1967, vol. 13, p. 531—544.
110. Hodgetts R. B., Konopka R. J. Tyrosine and catecholamine metabolism in wild-type Drosophila melanogaster and a mutant, ebony.—J. Insect Physiol., 1973, vol. 19, p. 1211—1220.
111. Fraenkel G., Hsiao C. Calcification, tanning, and the role of ecdyson in the formation of the puparium of the facefly, Musca autumnalis.— J. Insect Physiol., 1967, vol. 13, p. 1387—1394.
112. Mills R. R., Mathur R. B., Guerra A. A. Studies on the hormonal control of tanning in the American cockroach. I.—J. Insect Physiol., 1965, vol. 11, p. 1047—1053.
113. Mills R. R. Hormonal control of tanning in the American cockroach. III.—J. Insect Physiol., 1966, vol. 12, p. 275—280.
114. Vincent J. F. V. Effects of bursicon on cuticular properties in Lo-custa migratoria migratorioides.—J. Insect Physiol., 1971, vol. 17, p. 625—636.
115. Fraenkel G., Hsiao C. Bursicon, a hormone which mediates tanning of the cuticle in the adult fly and other insects.—J. Insect Physiol., 1965, vol. 11, p. 513—556.
116. Fraenkel G., Hsiao C., Saligman M. Properties of bursicon: an insect protein hormone that control cuticular tanning.—«Science», 1966, vol. 151, p. 91—93.
117. Mi ll.s R. R., Nielsen D. J. Hormonal control of tanning in the American cockroach. V.—J. Insect Physiol., 1967, vol. 13, p. 273—280.
118. Pou It on E. B. The experimental proof that the colours of certain lepidopterous larvae and largely due to modified plant pigments derived from food.—Proc. Roy. Soc., 1893, ser. B, vol. 65, p. 417—430.
119. Onslow H. On a periodic structure in many insect scales, and the cause of their iridescent colours.—Philos. Trans. Roy. Soc. L., 1923, ser. B, vol 211, p. 1—74.
120. Przibram H., Lederer E. Das Tiergriin der Heuschrecken als Mischung aus Farbstoffen —Anz. Akad. Wiss. Wien, Math.-Natur. Klasse. 1933, Bd. 70, S. 163—165.
318
121. Lederer E. Sur les carotenoides des vertebres infcrieurs.—Bull. Soc. Chem. Biol., 1938, t. 20, p. 567—610.
122. Palmer L. S., К n i g h t H. H. Carotin, the principial cause of the red and yellow colors in Perillus bioculatus (Fab.) and its biological origin from the nymph of Leptinoiarsa decemlineata (Say.).—J. Biol. Chem. 1924, vol. 59, p. 443—449.
123. Czeczuga B. Assimilation of carotinoids with food by beetle, Leptinotarsa decemlineata.—J. Insect Physiol., 1971, vol. 17, p. 2017—2025.
124. Oku M. On the natural pigments of raw silk fiber of the domestic cocoon. II.—Bull. Agricult. Chem. Soc. Japan, 1930, vol. 6, p. 40—49.
' 125. С г о m a r t i e R. J. T. Insect pigments.—Ann. Rev. Entomol., 1959, vol. 4, p. 59—76.
126. Goodwin T. W. Carotenoids.—«Compar. Biochem.», 1962, vol. 4, p. 643—675.
127. Weisgraber К. H., Lousberg R. J. J. Ch., Weiss U. The chemical basis of the color dimorphism of an aphid, Macrosiphum liriodendri (Monell), and a locust, Amblycorypha sp. Novel carotinoids.—«Experientia», 1971, t. 27, p. 1017—1018.
128. Morris S., Thomsen R. H. The flavonoid pigments of the marbled white butterfly (Melanargia galathea Seitz).—J. Insect Physiol., 1963, vol. 9, p. 391—399.
129. Morris S., Thomsen R. H. The flavonoid pigments of the small heath butterfly Caenonympha pamphilus L.—J. Insect Physiol., 1964, vol. 10, p. 377—383.
130. Dimroth O., Fick R. Uber den Farbstoff des Kermes.—Ann. Chem. Liebigs, 1916, Bd. 411, S. 315—338.
131. Dimroth O., Kammerer H. Uber die Carminsaure.—Ber. Deut. Chem. Ges., 1920, Bd. 53, S. 471—480.
132. Goodwin T. W. Pigments Arthropoda.—In: Chemical zoology. Ed. by M. Florkin and В. T. Scheer. N. Y.—L., Acad. Press, 1971, vol. 4B, p. 279—306.
133. F о r r e s t H. S., Mitchell H. K. Pteridines from Drosophila. III.—J. Amer. Chem. Soc.,* 1955, vol. 77, p. 4865.
134. Harmsen R. The excretory role of pteridines in insects.—J. Exptl. Biol., 1966, vol. 45, p. 1—13.
135. Nawa S., Taira T. Pterins found in silkworm and Drosophila.— Proc. Japan. Acad., 1954, vol. 30, p. 632—635.
136. Z i e g 1 e r - G й n d e r I. Untersuchungen iiber die photolabilen Pte-rine in der Haut der Arnphibien und in den Augen von Drosophila tnelano-gaster.— Z. Naturforsch., 1956, ser. B, Bd. 11, S. 493—500.
137. Forrest H. S. Pteridines: structure and metabolism.—«Compar. Biochem.», 1962, vol. 4, p. 615—641.
138. Pfleiderer W. Pterorhodin, ein neues naturlicher Schmcttcrlingr spigment.—Z. Naturforsch., 1963, ser. B, Bd. 18, S. 420.
139. Watt W. B. Pteridine components of wing pigmentation in the butterfly Colias eurytheme.—«Nature», 1964, vol. 201, p. 1326—1327.
140. Merlini L., Nasini G. Insect pigments. IV.—J. Insect Physiol., 1966, vol. 12, p. 123—127. 7
141. Descimon H. Note preliminaire sur les pigments pteriniques des ailes du genre Colias (Lepidoptera, Pieridae).—Ann. Soc. Entomol. France, 1967, t. 3, p. 827—833.
142. Watt W. B., Bowden S. R. Chemical phenotypes of pteridine colour forms in Pieris butterflies.—«Nature», 1966, vol. 210, p. 304—306.
143. Pat at U. Uber das Pterinmuster der Facettenaugen von Calliphora erythrocephala.—Z. vergl. PhysioL, 1965, Bd. 51, S..103—134.
144. Langer H., H о f f m a n C. Elektro- und stoffwechselphysiologische Untersuchungen fiber den Einfliiss von Ommochromen und Pteridinen auf die Funktion des Facettenauges von Calliphora erythrocephala.—J. Insect PhysioL, 1966, vol. 12, p. 357—387.
145. Hopkins F. G. The pigments of Pieridae: a contribution to the study of excretory substances which function in ornamenta.—Philos. Trans. Roy. Soc. L., 1895, ser. B, p. 661—682.
319
146, Schopf C., Wieland H. Uber das Leukopterin, das weisse Flii-gelpigment der Kohlweisslinge (Pieris brassicae und P. napi).—Ber. Deut. Chem. Ges., 1926, Bd. 59, S. 2067—2072.
147. Becker E. Uber das Pterinpigment bei Insekten und die Farbung und Zeichnung von Vespa in Besonderen.—Z. Morphol. Oekol. Tiere, 1937, Bd. 32, S. 672—751.
148. Simon H., Weygand F., Walter J. e. a. Zur Biogenese des Leucopterins.—Z. Natuforsch., 1963, Ser. B, Bd. 18, S. 757—764.
149. L i a c i L. Synthesis of sepiapterine by labeled adenine in the eyes of Drosophila melanogaster Meig.—Rev. Biol., 1965, vol. 58, suppl., p. 53—55.
150. Watt W. B. Pteridine biosynthesis in the butterfly Colias eurythe-mc,—L Biol. Chem., 1967, vol. 242, p. 565—572.
151. Descimon H. Chronologic de la secretion des pterines chez Colias croceus Fourcroy (Lepidoptera, Pieridae).— Compt. Rend. Soc. Biol. France, 1966, t. 160, p. 928—932.
152. Becker E. Uber Eigenschaften, Verbreitung und genetische Ent-wicklungsgeschichte Bedeutung des Pigment der Ommin- und Ommatin-grup-pcn bei den Arthropoden.—Z. Indukt. Abstamm. und Vererb., 1942, Bd. 80, S. 157—204.
153. F u g e H. Uber die Bildung der Ommochromgranula von Drosophila melanogaster.—«Naturwissenschaften», 1966, Bd. 53, S. 136.
154. Dustmann J. H. Uber Pigment Untersuchungen an den Augen der Honigbiene Apis mellifica.—«Naturwissenschaften», 1966, Bd. 8, S. 208.
155. Dustmann J. H. Die Redoxpigmente von Carausius morosus und ihre Bedeutung fur den morphologischen Farbwechsel.—Z. vergl. Physiol., 1964, Bd. 49, S. 28—57.
156. Linzen B., Biickm ann D. Biochemische und histologische Untersuchungen zur Umfarbung der Raupe von Cerura vinula L.—Z. Natur-forsch., 1961, Ser. B, Bd. 16, S. 6—18.
157. Butenandt A. Uber Ommochrome, eine Klasse natiirlichen Phe-noxazon-Farbstoffe.— Angew. Chem., 1957, Bd. 69, S. 16—23.
158. К a r 1 s о n P. Biochemische Wirkungen der Gene.—Erg. Enzym-forsch., 1954, Bd. 13, S. 85—206.
159. Dustmann J. H. Eine chemische Analyse der Augenfarbmutanten von Apis mellifera.—J. Insect Physiol., 1969, vol. 15, p. 2225—2238.
160. Passama-Vuillaume M. Etude du pigment vert chez Locus-ta migratoria L. normal et albinos.—Bull. Soc. ZooL France, 1965, t. 90, p. 485—491.
161. Passama-Vuillaume M., Barbier M. Sur la biosynthese de la biliverdine IVcc par la mante Mantis religiosa et le criquet Locusta migratoria.—Compt. Rend. Acad. Sci., 1966, t. 263, ser. D, p. 924—925.
162. Rimington C., Kennedy G. Y. Porphyrins: structure, distribution and metabolism.—«Compar. Biochem.», 1962, vol. 4, p. 557—614.
163. Cromartie R. I. T., Harley-Mason J. Melanin and its precursors. 8.—Biochem. J., 1957, vol. 66, p. 713—720.
164. Шов e и P. Физиология насекомых. M., ИЛ 1953, 494 с.
165. Joly Р. Chromatic adaptation in insects.—«Gen. Compar. Endocrinol.», 1962, vol. 2, suppl. 1, p. 94—97.
166. Данилевский А. С. Фотопериодизм и сезонное развитие насекомых. Изд-во Ленингр. ун-та, 1961. 243 с.
167. Sakai Т., М a s a'k i S. Photoperiod as a factor causing seasonal forms in Lycaena phlaeas daimio Seitz (Lepidoptera: Lycaenidae).—«Kontyu», 1965, vol. 33, p. 275—283.
168. Duerken B. Die Farbungsvariation der Kohlweisslingsraupen aus normalen Umgebung und nach Einwirkungen des farbliches Lichtes.—Mem. Acad. Sci. Nuov. Lincei, 1924, t. 8, p. 251—274.
169. A n g e r s b a c h G., Kayser H. Wave-length dependence of light-controlled pupal pigmentation.—«Naturwissenschaften», 1971, Bd. 58, S. 571 — 572.
170. West D. A., Snell ings W. M., Herbek T. A. Pupal colour dimorphism and its environmental control in Papilio polyxenes asterias Stoll 320
(Lepidoptera: Papilionidae).—J. New York Entomol. Soc., 1972, vol. 80, p. 205—211.
171. Gabritschevsky E. Experiments on colour changes and regeneration in the crab-spider, Misumena vatia.—J. Exptl. Zool., 1927, vol. 47, p. 251—267.
172. Fuzeau-Br aesch S. Le noircissement des insectes sur les bru-lis africains.—Nat. Sci. Progr., 1966, vol. 3380, p. 465—468.
173. К e 111 e w e 11 H. B. D. Adaptation mechanisms in the genetic armoury of Lepidoptera ancient and modern.—«Zenith», 1964, vol. 3, p. 11—14.
174. Hidaka T., Ohtaki T. Effect de 1’hormone juvenile et du farnesol sur la coloration , tegumentaire de la nymphe de Pieris rapae crucivora Boisd.—Compt. Rend. Soc. Biol. France, 1963, t. 157, s. 928—930.
175. Levita B. Pigmentation et photosensibilite chez Oedipoda coerudes-cens L. (acridien, orthoptere).—Compt. Rend. Acad. Sci., 1966, ser. D, t. 262, p 2496—2497.
176. N о v а к V. I. A. To the knowledge of the mechanisms conditioning the development of the ventral black pattern in the abdomen of the bug Onco-peltus fasciatus Dal.—Vestn. Ceskosl. Zool. Spol., 1955, t. 19, s. 233—246.
177. Karlson P., Biickmann D. Experimentelle Auslosung der Um-farbung bei Cerura Raupen durch Prothorakaldriisenhormon.—«Naturwissen-schaften», 1956, Bd. 43, S. 44—45.
178. Biickmann D. Farbwechsel als Teilvorgang der Metamorphose tind seine Hemmung in junge Schmetterlingraupen.—Zool. Anz., 1959, Bd. 22, suppl., S. 137—144.
179. Giersberg H. Uber den morphologischen und physiologischen Farbwechsel der Stabheuschrecke Dixippus.—Z. vergl. Physiol., 1928, Bd. 7, S. 657—695.
180. J a n d a V. Uber den Farbwechsel transplantierter Hautstiicke und kiinstlich bei Dixippus morosus (Br. et Redt.).—Zool. Anz., 1936, Bd. 65, S. 177—185.
181. Raabe M. Recherches experimentales sur la localisation intra-cere-brale du facteur chromactif des insectes.—Compt. Rend. Acad. Sci., 1963, ser. D, t. 257, s. 1804—1806.
182. Dupont-Raabe M. Mise en evidence chez les phasmides, d’une troisieme paire de nervi corporis cardiaci, voil possible cheminement de la substance tritocerebrale vers les corpora cardiaca.—Compt. Rend. Acad. Sci., 1956, ser. D, t. 243, p. 1240—1243.
183. A t z 1 e r M. Untersuchungen liber den morphologischen und physiologischen Farbwechsel von Dixippus (Carausius) tnorosus.—Z. vergl. Physiol., 1930, Bd. 13, S. 505—533.
I 184. Gers ch M. Untersuchungen zur Frage der hormonalen Beeinfliis-sung der Melanophoren bei der Corethra larve.—Z. vergl. Physiol., 1956, Bd. 39, S. 190—208.
185. В earn ent J. W. L. Active transport of water in insects.—Adv. Insect Physiol., 1964, vol. 2, p. 67—129.
186. Wigglesworth V. B. Transpiration through the epicuticle of insects.—J. Exptl. Biol., 1945, vol. 21, p. 97—114.
187. В e a m e n t J. W. L. The waterproofing mechanism of arthropods. I.—J. Exptl. Biol., 1959, vol. 36, p. 391—422.
188. С 1 о u d s 1 e у - T h о m p s о n J. L. The water-relations of scorpions and tarantulas from the Sonoran Desert.—Entomol. Month. Mag., 1967, vol. 103, p. 217—220.
189. Мамаев Б. M., Семенова Л. M. Морфология кутикулы личинок галлиц (Diptera, Cecidomyiidae).— Докл. АН СССР, 1965, т. 162, с. 1404—1407.
190. Ramsay J. A. The evaporation of water from the cockroach.—J. Exptl. Biol., 1935, vol. 12, p. 373—383.
191. Beament J. W. L. The effect of temperature on the waterproofing mechanism of an insect.—J. Exptl. Biol., 1958, vol. 35, p. 494—519.
321
192. 01 offs P. C., Scudder G. G. The transition phenomenon in relation to the penetration of water through the cuticle of an insect, Cenocorixa expleta (Hungerford).—Canad. J. Zool., 1966, vol. 44, p. 621—630.
193. В e a m e n t J. W. L. Wetting properties of insect cuticle.—«Nature», 1960, vol. 186, p. 408—409.
194. Beament J. W. L. The waterproofing mechanism of arthropods. II.—J. Exptl. Biol., 1961, vol. 38, p. 277—290.
195. Ebeling W. Physicochemical mechanisms for the removal of insect wax by means of finely divided powders.—«Hilgardia», 1961, vol. 30, p. 531—564.
196. К о i d s u m i K. Role of melting temperature of surface wax in the regulation of permeability of insect cuticle.—«Kontyu», 1959, vol. 27, p. 35—40.
197. M e 11 a n b у К. The evaporation of water from insects.—Biol. Rev., 1935, vol. 10, p. 317—333.
198. Beament J. W. L. The surface properties of insects—some evolutionary and ecological implications.—Proc. Linnean Soc. L., 1962, vol. 173, p. 115—119.
199. Edney E. B. The water relatior; of terrestrial arthropods. Cambridge Univ. Press, 1957. 109 p.
200. Lawghelin R. Absorption of water by the egg of the garden chafer, Phyllopertha horticola L.—J. Exptl. Biol., 1957, vol. 34, p. 226—236.
201. McFarlane J. E., Furneaux P. J. S. Revised curves for water absorption by the eggs of the house cricket, Acheta domesticus (L.).—Canad. J. ZoqI., 1964, vol. 42, p. 239—243.
202. Johnson C. G. The absorption of water and the associated volume changes in the eggs of Notostira erratica L. (Hemiptera, Capsidae) during embryonic development under experimental conditions.—J. Exptl. Biol., 1937, vol. 14, p. 413—421.
203. McFarlane J. E. Structure and function of the egg shell as related to water absorption by the eggs of Acheta domesticus (L.).—Canad. J. Zool., 1960, vol. 38, p. 231—241.
204. Browning T. O. The influence of temperature and moisture on the uptake and loss of water in the eggs of Gryllulus commodus Walker (Orthoptera—Gryllidae).—J. Exptl. Biol. 1953, vol. 30, p. 104—115.
205. S 1 i f e r E. H. The formation and structure of a special water-absorbing area in the membranes covering the grasshopper egg.—Quart. J. Microscop. Sci., 1938, vol. 80, p. 437—458.
206. Weber H. Lebensweise und Umweltbeziehungen von Trialeurodes vaporariorum.—Z. Morphol. Oekol. Tiere, 1931, Bd. 23, S. 575—753.
207. Lees A. D. The water balance in Ixodes ricinus L. and certain other species of ticks.—«Parasitology», 1946, vol. 37, p. 1—20.
208. Browning T. O. Water balance in the tick Ornithodorus moubata Murray.—J. Exptl. Biol., 1954, vol. 31, p. 331—340.
209. M e 11 a n b у К. The effect of atmospheric humidity on the metabolism of the fasting mealworm (Tenebrio molitor L., Coleoptera)—Proc. Roy. Soc., 1932, ser. B, vol. Ill, p. 376—390.
210. Ludwig D. The effect of different relative humidities on respiratory metabolism and survival of the grasshopper Chortophaga viridifasciata — «Physiol. Zool.», 1937, vol. 10, p. 342—351.
211. Edney E. B. Some aspects of water balance in tenebrionid beetles and a thysanuran from the Namib Desert of Southern Africa.—«Physiol. Zool.», 1971, vol. 44, p. 61—76.
212. Olson W. P., O’Brien R. D. The relation between physical properties and penetration of solutes into the cockroach cuticle.—J. Insect Physiol., 1963, vol. 9, p. 777—786.
213. Lindquist D. A., Dahm P. A. Metabolism of radioactive DDT by the Madeira roach and the European corn borer.—J. Econ. Entomol. 1956, vol. 49, p. 579—584.
214. Schmidt С. H., Dahm P. A. The synthesis of C14-labeled piper
322
onyl butoxide and its fate in the Madeira roach.—J. Econ. Entomol., 1956, vol. 49, p. 729—735.
215. Ильинская H. Б. Механизм действия ДДТ на насекомых. М.—Л., Изд-во АН СССР, 1961. 112 с
216. La u ger Н. Н., Martina Н., Muller Р. Uber Konstitution und toxische Wirkung von natiirlichen und neuen synthetischen insektentotenden Stoffen.—Acta Helvet. Chem., 1944, t. 27, S. 892—928.
217. Ashraf M., Yunus M. Penetration of certain insecticides through the integument of Drosicha stebbingi (Gr.).—Pakistan J. Sci. Res., 1964, vol. 16, p. 117—128.
218. Richards A. G., Cutcomp L. K. Correlation between the poses-sion of a chitinous cuticle and sensitivity to DDT.—Biol. Bull., 1946, vol. 90, ,p. 97—108.
219. W i g g 1 e s w о r t h V. B. Some notes on the integument of insects in relation to the entry of contact insecticides.—Bull. Entomol. Res., 1942, vol. 33, p. 205—218.
220. Z s ch i n t z s ch J., O’Brien R. D., Smith E. H. The relation between uptake and toxicity of organophosphates for eggs of the large milkweed bug.—J. Econ. Entomol., 1965, vol. 58, p. 614—621.
ГЛАВА II
221. Krogh A. The comparative physiology of respiratory mechanisms. Philadelphia, Univ. Pennsylvania Press, 1941. 172 p.
222. Fraenkel G., Herford G. V. B. The respiration of insects through the skin.—J. Exptl. Biol., 1938, vol. 15, p. 266—280.
223. Гиляров M. С. Кожное дыхание обитающих в почве личинок долгоножек рода Tipula и условия дыхания в почве.— Докл. АН СССР, 1947, т. 56, с. 881—884.
224. Buck J. В., Keister М. L. Cutaneous and tracheal respiration in Phormia larva.—Biol. Bull., 1953, vol. 105, p. 402—411.
225. Tuft P. H. The structure of the insect egg-shell in relation to the respiration of the embryo.— J. Exptl. Biol., 1950, vol. 26, p. 327—334.
226. Hinton H. E. Plastron respiration in the eggs of Drosophila and other flies.—«Nature», 1959, vol. 184, p. 280—281.
227. Hinton H. E. The structure and function of the respiratory horns of the eggs of some flies.—Trans. Roy. Soc. L., 1960, vol. 243, p. 45—73.
228. Koch H. J.-A. Aandeel van bepaalde organen aan de zuurstofopna-me door het gesloten trach^system, bij de larven der Odonata Zygoptera.— Natuurwet. Tijdschr., 1934, Bd. 16, S. 75—80.
229. Morgan A. H., Grierson M. C. The functions of the gills in burrowing mayflies (Hexagenia recurvata).—Physiol. Zool., 1932, vol. 5, p. 230—245.
230. Wingfield C. A. The function of the gills of mayfly nymphs from different habitats.—J. Exptl. Biol., 1939, vol. 16, p. 363—373.’
231. Morgan A. H., O’Neil H. D. The function of the tracheal gills in the larva of the caddis fly, Macronema.—«Physiol. Zool.», 1931, vol. 4, p. 361—379.
232. Thorpe W. H. Tracheal and blood gills in aquatic insect larvae.— «Nature», 1933, vol. 131, p. 549.
233. Knights A. W., Gaufin A. R. Function of stonefly gills under reduced dissolved oxygen concentration.—Proc. Utah Acad. Sci. Arts Lettr., 1965, vol. 42, p. 186—190.
234. E a s t h a m L. E. S. The gill movements of nymphal Ecdyonurus ve-nosus (Ephemeroptera) and the currents produced by them in water.—J. Exptl. Biol., 1937, vol. 14, p. 219—228.
235. E r i k s-e n С. H. Respiratory regulation in Ephemera simulans Walker and Hexagertia limbata (Ephemeroptera).—J. Exptl. Biol., 1963, vol. 40, p. 455—467.
236. R a f f у A. L’intensite respiratoire des larves de libellulides dans Pair et dans 1’eau.— Ann. Physiol. Physicochim. BioL, 1933, t. 9, p. 1122—1134.
323
237. Hinton H. E. Spiracular gills.— Adv. Insect Physiol., 1968, vol. 5, p. 65—162.
238. Roddy L. R. A morphological study of the respiratory horns associated with the puparia of some Diptera especially Ophyra anescens (Wied.).— Ann. Entomol. Soc. Amer., 1955, vol. 48, p. 407—415.
239. Рубцов И. А. Мошки (сем. Simuliidae).— В кн.: Фауна СССР. Насекомые двукрылые. Т. 6, вып. 6. М.—Л., Изд-во АН СССР, 1956. 860 с.
240. Pulikowsky N. Die respiratorische Anpassungserscheinungen bei den Puppen der Simuliiden.—Z. Morphol. Oecol. Tiere, 1927, Bd. 7, S.384—443.
241. Fox H. M. Methods of studying the respiratory exchange in small aquatic organisms, with particular reference to the use of flagellates as an indicator for oxygen consumption.— J. Gen. Physiol., 1921, vol. 3, p. 565—573.
242. Hinton H. E. Plastron respiration in marine insects.— «Nature», 1966, vol. 209, p. 220—221.
243. Obenberger J. Entomologie. I. Anatomie, morfologie a embryolo-gie hmyzu. Praha, Prirod. Vydav., 1952. 869 s.
244. Richards A. G., Anderson T. F. Electron micrographs of insect tracheae.-v J. New York Entomol. Soc., 1942, vol. 50, p. 147—167.
245. D e n u c e J. M., Vandermessche G. Etude au microscope electro-nique des trachees des larves d’insectes.— Exptl. Cell. Res., 1954, vol. 6, p. 76—78.
246. Snodgrass R. E. The principles of insect morphology. N. Y., McGraw-Hill Co., 1935. 667 p.
247. Weber H. Grundriss der Insektenkunde. Jena, Gustav Fischer Verlag, 1966. 428 S.
248. Wigglesworth V. B. A further function of the air sacs in some insects.— «Nature», 1963, vol. 198, p. 106.
249. В e a m e n t J. W. L. The surface properties of insects — some evolutionary and ecological implications.— Proc. Linnean Soc. L., 1962, vol. 173, p. 115—119.
250. Гиляров M. С. Особенности почвы как среды обитания и ее значение в эволюции насекомых.М.—Л., Изд-во АН СССР, 1949. 279 с.
251. Ripper W. Versuch einer Kritik der Homologiefrage der Arthropo-dcntracheen.— Z. wiss. Zool., 1931, Bd. 38, S. 303—396.
252. W e i s - F о g h T. A rubber-like protein in insect cuticle.— J. Exptl. Biol., 1960, vol. 37, p. 889—907.
253. Krogh A. Studien uber Tracheenrespiration. II, III.— Pfliigers Arch. Ges. Physiol., 1920, Bd. 179, S. 95—112, 113—120.
254. Krogh A. Some experiments on the osmoregulation and respiration of Eristalis larvae.— Entomol. Medd., 1943, Bd. 23, S. 49—65.
255. Demoll B. Untersuchungen fiber die Atmung der Insekten.— Z. Biol., 1927, Bd. 86, S. 45—66.
256. W e i s - F о g h T. Biology and physics of locust flight. VIII.— J. Exptl. Biol., 1964, vol. 41, p. 257—272.
257. Bailey L. Respiratory currents in the tracheal system of the adult honeybee.—J. Exptl. Biol., 1954, vol. 31, p. 589—593.
258. Fraenkel G. Untersuchungen fiber die Koordination von Reflexen und automatisch-nervosen Rhythmen bei Insekten. II, III, IV.—Z. vergl. Physiol., 1932, Bd. 16, S. 394—417, 418-^443, 444—461.
259. Hamilton A. G. The mechanism of respiration of locusts.— Bull. Entomol. Res., 1937, vol. 28, p. 53—68.
260. Edwards G. A. Respiratory mechanisms.—In: Insect physiology. Ed. by K. D. Roeder, N. Y. — L., John Wiley and Sons, Chapman and Hill, 1953, p. 55—95.
261. Myers T. B. Some aspects of tracheal ventilation in the cockroach, Byrsotria fumigata (Guerin).— Diss. Abstr., vol. 19, p. 2414.
262. Du BuissonM. Observations sur la ventilation tracheene des insectes. I, II.—Bull. Acad. Roy. Belg., 1924, ser. 5, t. 10, p. 373—391, 635—656.
263. Adler G. De la tension d’oxygene dans les tissues de quelques invertebrates.— Scand. Arch. Physiol., 1917, t. 36, p. 146—152.
324
264. Weis-Fogh T. Diffusion in insect wing muscle, the most active tissue known.—J. Exptl. Biol., 1964, vol. 41, p. 229—256.
265. Krogh A., Weis-Fogh T. The respiratory exchange of the desert locust (Schistocerca gregaria) before, during and after flight.— J. Exptl. Biol., 1951, vol. 28, p. 344—357.
266. Buck J. Some physical aspects of insect respiration.— Ann. Rev. Entomol., 1962, vol. 7, p. 27—57.
267. Nunome Z. Studies on the respiration of the silkworm. I, II.— Bull. Serie. Exptl. Sta. Japan, 1944, vol. 12, p. 17—39, 41—90.
268. Krogh A. Studien fiber Tracheenrespiration. I.— J. PhysioL, 1919, vol. 52, p. 391—408.
269. К p e п с E. M., Ченыкаева E. И. О дыхательной функции крови насекомых.— Докл. АН СССР, 1942, т. 34, с. 154—157.
270. Крепе Е. М., Ченыкаева Е. И. Новые данные по обмену СОг у ракообразных и насекомых.— Изв. АН СССР, 1942, сер. биол., № 5, с. 310—321.
271. Edwards L. J., Patton R. L. Carbonic anhydrase in the house cricket, Acheta domesticus.— J. Insect Physiol., 1967, vol. 13, p. 1333—1341.
272. Brinkman R., Margaria. R., Meldrum N. U. e.a. The CO2 catalyst present in blood.— J. PhysioL, 1935, vol. 75, p. 3—4.
273. Schneiderman H. A., Williams С. M. The physiology of insect diapause. VII.— BioL Bull., 1953, vol. 105, p. 320—334.
274. Punt A. The respiration of insects.— «PhysioL Compar. Oecol.», 1950, t. 2, p. 59—74.
275. Schneiderman H. A., Williams С. M. An experimental analysis of the discontinuous respiration of the Cecropia silkworm.— BioL Bull., 1955, vol. 109, p. 123—143.
276. Levi R. S., Schneiderman H. A. Discontinuous respiration in insects. IV.— J. Insect PhysioL, 1966, vol. 12, p. 465—492.
277. SI am a K. Physiology of sawfly metamorphosis. I.— J. Insect PhysioL, 1960, vol. 5, p. 341—348.
278. G a 1 u n R. Respiration of decapitated mosquitoes.— «Nature», 1960, vol. 185, p. 391—392.
279. Keister M., Buck J. Respiration of Phormia regina in relation to temperature and oxygen.— J. Insect PhysioL, 1961, vol. 7, p. 51—72.
280. Buck J., Keister M. Cyclic CO2 release in diapause Agapema pupae —BioL Bull., 1955, vol. 109, p. 144—163.
281. Kurland C. G., Schneiderman H. A. The respiratory enzymes of diapausing silkworm pupae: a new interpretation of carbon monoxide — insensitive respiration.— BioL Bull., 1959, vol. 116, p’. 136—161.
282. Fox H. M., Wingfield C. A., Simmonds B. G. Oxygen consumption of mayfly nymphs in relation to available oxygen.— «Nature», 1936, vol. 138, p. 1015.
283. W a 1 s c h e В. M. Oxygen requirements and thermal resistance of chironomid larvae from flowing and from still waters.—J. Exptl. BioL, 1948, vol. 25, p. 35—44.
284. F о x H. M., Wingfield C. A. The oxygen consumption of epheme-rid nymphs from flowing and from still water in relation to the coricentration of oxygen in the water.— J. Exptl. BioL, 1937, vol. 14, p. 210—218.
285. Hazelhoff E. H. Regeling der Ademhaling bij Insecten en Spin-nen. Utrecht, Proefschr. Rijks-Univ., 1926. 185 s.
286. Wigglesworth V. B. The regulation of respiration in the flea Xenopsylla ’ cheopsis Roths (Pulicidae).—Proc. Roy. Soc., 1935, ser. B, vol 118, p. 397—419.
287. Punt A., Parser W. J., К u c h 1 e i n J. Oxygen uptake in insects with cyclic CO2 release —BioL Bull., 1957, vol. 112, p. 108—119.
288. Hocking B. The intrinsic range and speed of insect flight.— Trans. Roy. Entomol. Soc. L., 1953, vol. 104, p. 223—345.
289. Hofmanova O., Cerasovova A., Faustka M. e. a. Metabo
325
lism of the thoracic musculature of Periplaneta americana during flight.— Acta Univ. Carolinae Biol., 1966, vol. 3—4, p. 183—189.
290. Zeb e E. Z. Uber den Stoffwechsel der Lepidopteren.—Z. vergl. Physiol., 1954, Bd. 36, S. 290—317.
291. Miller P. L. Respiration in the desert locust. I.— J. Exptl. Biol., 1960, vol. 37, p. 224—236.
292. Weis-Fogh T. Respiration and tracheal ventilation in locusts and other flying insects.— J. Exptl. Biol., 1967, vol. 47, p. 561—587.
293. Alverdes F. Corethra- und Ephemeriden-larven nach Unterbrechung ihrer Bauchganglienkette.— Z. vergl. Physiol., 1926, Bd. 23, S. 558—594.
294. Adrian E. D. Potential changes in the isolated nervous system of Dytisciis marginalis.— J. Physiol., 1931, vol. 72, p. 132—151.
295. Farley R. D., Case J. F., Roeder K. D. Pacemaker for tracheal ventilation in the cockroach, Periplaneta americana (L.).— J. Insect Physiol., 1967, vol. 13, p. 1713—1728.
296. Mill P. 4J., H u g h e s G. M. The? nervous control of ventilation dragonfly larvae.— J. Exptl. BioL, 1966, vol. 44, p. 297—316.
297. Farley R. D., Case J. F. Sensory modulation of ventilative pacemaker output in the cockroach, Periplaneta americana.— J. Insect Physiol., 1968, vol. 14, p. 591—601.
298. Huber F. Untersuchungen zur nervosen Atmungsregulation der Orthopteren (Saltatoria: Gryllidae).— Z. vergl. Physiol., 1960, Bd. 43, S. 359—391.
299. Myers T. B., Retzlaff E. Localization and action of the respiratory centre of the Cuban burowing cockroach.—J. Insect Physiol., 1963, vol. 9, p. 607—614.
300. Schreuder J. E., De Wilde J. Analysis of the dyspnoeic action of carbon dioxide in the cockroach with some remarks on the honey-bee.— «Physiol. Compar. Oecol.», 1952, t. 2, p. 355—361.
301. Case J. F. Organization of the cockroach respiratory centre.— Biol. Bull., 1961, vol. 121, 385—392.
302. Miller P. L. The central nervous control of respiratory movements.— In: The physiology of the insect central nervous system. L.— N. Y., Acad. Press, 1965, p. 141—155.
303. Miller P. L. The derivation of the motor command to the spiracles of the locust.—J. Exptl. Biol., 1967, vol. 46, p. 349—371.
304. P a i m U., В e с к e 1 W. E. Seasonal oxygen and carbon dioxide content of decaying wood as a component of microenvironment of Orthosoma brunneum (Forster) (Coleoptera: Cerambycidae).— Canad. J. ZooL, 1963, vol. 41, p. 1133—1147.
305. Paim U., Beckel W. E. The influence of oxygen and carbon dioxide on the spiracles of a wood-boring insect, Orthosoma brunneum (Forster) (Coleoptera: Cerambycidae).— Canad: J. Zool., 1963, vol. 41, p. 1149—1167.
306. Hoyle G. The neuromuscular mechanism of an insect spiracular muscle.— J. Insect Physiol., 1959, vol. 3, p. 378—394.
/ 307. Van der К loot W. G. The electrophysiology and the nervous control
of the spiracular muscle of pupae of the giant silkmoths.—«Compar. Biochem. Physiol.», 1963, vol. 9, p. 317—333.
308. Miller P. L. Spiracle control in adult dragonflies.— J. Exptl. Biol., 1962, vol. 39, p. 513—535.
309. Beckel W. E., Schneiderman H. A. Insect spiracle as an independent effector.— «Science», 1957, vol. 126, p. 352—353.
310. Miller P. L. Factors altering spiracle control in adult, dragonflies: hypoxia and temperature.— J. Exptl. Biol., 1964, vol. 41, p. 345—357.
311. Burkett B. N., Schneiderman H. A. Control of spiracles in silkmoths by oxygen and carbon dioxide.— «Science», ' 1967, vol. 156, p. 1604—1606.
312. Case J. F. Carbon dioxide and oxygen effects on the spiracles of flies.— «Physiol. Zool.», 1956, vol. 29, p. 163—171.
326
313. Case J. F. The median nerves and cockroach spiracular function.— J. Insect Physiol., 1957, vol. 1, p. 85—94.
314. M e 11 a n b у К. The site of loss of water of some insects.— Proc. Roy. Soc., 1934, ser. B, vol. 116, p. 139—149.
315. Ramsay J. A. The evaporation of water from the cockroach.— J. Exptl. Biol., 1935, vol. 12, p. 373—383.
316. Miller P. L. Factors altering spiracle control in adult dragonflies: water balance.— J. Exptl. BioL, 1964, vol. 41, p. 331—343.
317. Hoyle G. Functional contracture in a spiracular muscle.— J. Insect Physiol., 1961, vol. 7, p. 305—314.
318. Wigglesworth V. B. The role of epidermal cells in the «migration» of tracheoles in Rhodnius prolixus (Hemiptera).— J. Exptl. Biol., 1959, vol. 36, p. 632—640.
319. Wigglesworth V. B. A theory of tracheal respiration in insects.— Proc. Roy. Soc., 1930, ser. B, vol. 106, p. 229—250.
320. Wigglesworth V. B. The extent of air in the tracheoles of some terrestrial insects.—Proc. Roy. Soc., 1931, ser. B, vol. 109, p. 354—359.
321. W i g g 1 e s wo r t h V. B. The principles of insect physiology. L., Methuen and Co., 1953. 546 p.
322. W i g g 1 e s w о r t h V. B. Surface forces in the tracheal system of insects.— Quart. J. Microscop. Sci., 1953, vol. 94, p. 507—522.
323. Fullmer О. H., H о s h i n s W. M. Effects of DDT upon the respiration of susceptible and resistent house flies.— J. Econ. Entomol., 1951, vol. 44, p. 858—870.
324. Burkett N. B. Respiration of Galleria mellonella in relation to temperature and oxygen.— Entomol. Exptl. AppL, 1962, t. 5, p. 305—312.
. 325. 1 1 а у a K. Theoretical and experimental physiology of the silkworm. Tokyo, Meibundo, 1936. 189 p.
326. L й h m a n n M., Drees O. Uber die Temperaturabhangigkeit der sommerschlafender Blattkafer.— Zool. Anz., 1952, Bd. 148, S. 13—22.
327. Marzusch K. Z. Untersuchungen fiber die Temperaturabhangigkeit von Lebensprozessen bei Insekten.— Z. vergl. Physiol., 1952, Bd. 34, S. 75—92.
328. К n e i t z G. Untersuchungen zum Atmungsstoffwechsel der Arbeit-eiinnen von Formica polyctena Foerst. (Hym., Formicidae).—In: Compt. rend. 5е Congr. Union intern, etude insectes sociaux (Toulouse, 1965). Toulouse, 1967, p. 277—290.
329. Kennington C. S. Influence of altitude and temperature upon rate of oxygen consumption of Tribolium confusum Duval and Camponotus pen-nsylvanicus modoe Wheeler.— Physiol. Zool., 1957, vol. 30» p. 305—314.
330. Bodenheimer F. S. Studies zur Epidemiologie, Oekologie und Physiologic der afrikanische Wanderheuschrecke, Schistocerca gregaria.— Z. Angew. Entomol., 1929, Bd. 15, S. 435—537.
331. J an da V. Celcova latcova premena hmyzu. II.—Acta Soc. Zool. Bo-hemosl., 1952, t. 16, s. 237—248.
332. Richards A. G. The effect of temperature on the rate of oxygen consumption and on an oxidative enzyme in a cockroach Periplaneta americana.— Ann. Entomol. Soc. Amer., 1963, vol. 56, p. 355—357.
333. Slater W. K. Aerobic and anaerobic metabolism of the common cockroach.—Biochem. J., 1927, vol. 21, p. 198—203.
334. Birch L. C. The oxygen consumption of the small strain of Calandra oryzae L. and Rhyzopertha dominica Fab. as affected by temperature and humidity.— «Ecology», 1947, vol. 28, p. 17—25.
335. Schmidt G. Einfluss der Temperature auf den Atmungsstoffwechsel der Puppen von Formica polyctena (Hymenoptera, Insecta).— Helgolander Wiss. Meeresuntersuch., 1966, Bd. 14, S. 369—379.
336. Chaudhry H. S., Kopoor R. P. D. Studies on the respiratory metabolism of the red flour beetle.— J. Econ. Entomol., 1967, vol. 60, p. 1334—1336.
337. Scholander P. F., Flagg W., Hock R. J., Irving L. Stu
327
dies of the physiology of frozen plants and animals in the arctic.— J. Cell. Compar. Physiol., 1957, vol. 42, suppl. 1, p. 1—56.
338. Thompson W. R., Tennant R. Studies in respirometry; influence of infra-red radiation upon carbon dioxide respiration of Drosophila.— J. Gen. Physiol., 1932, vol. 16, p. 22—26.
339. Gunn D. L., С о s w а у C. A. The temperature and humidity relations in cockroach. III.— J. Exptl. Biol., 1942, vol. 19, p. 124—132.
340. H e f с о V., Miron J. Consumul de oxigen la citeva larve acvatice de insecte si influenta reatiei acido-bazice a mediului.— Ann. Stiint. Univ. Jasi, 1965, ser. 2a, t. 11, p. 33—38.
341. Hefco V., Miron J. Cital respirator la citeva larve acvatice de insecte si influenta pH-ului.— Ann. Stiint. Univ. Jasi, 1965, ser. 2a, t. 11, p. 211—214.
342. Bodine J. H. The effect of light and decapitation on the rate of CO2 output of certain Orthoptera.— J. Exptl. Zool., 1922, vol. 35, p. 47—55.
343. Odhiambo T. R. The metabolic effects of the corpus allatum hormone on the male desert locust. II.— J. Exptl. Biol., 1966, vol. 45, p. 51—63.
344. Эдельман H. M. Некоторые закономерности суточного ритма дыхания насекомых.— Зоол. журн., 1950, т. 5, с. 427—434.
345. Boell Е. J. Respiratory quotients during embryonic development (Orthoptera).—J. Cell. Compar. PhysioL, 1935, vol. 6, p. 369—385.
346. Rakshpal R. Respiratory metabolism during embryogenesis of a diapause species of field cricket, Gryllulus pennsylvanicus Burmeister (Orthoptera, Gryllidae)?—J. Insect Physiol., 1962, vol. 8, p. 217—221.
347. Ludwig D. Studies on metamorphosis of the Japanese beetle.— J. Exp. Zool., 1931, vol. 60, p. 309—323.
348. Me 1 am p у R. W., Willis E. R. Respiratory quotients in the female honey-bee during larval and pupal development.—«PhysioL Zool.», 6, 1939, vol. 12, p. 302—311.
349. Moreau R., Gourdoux L. Etude comparative du metabolisme respiratoire au cours de la seconde partie de I’ontogenese, et plus particuliere-ment pendant Lemergence et 1’expansion des ailes chez Pieris braussicae et Tenebrio molitor.— Compt. Rend. Acad. Sci., 1971, ser. D, t. 273, p. 2302—2305.
350. К о ж а н ч и к о в И. В. Об особенностях тканевого дыхания насекомых.— Докл. АН СССР, 1938, т. 19, с. 759—761.
351. Zebe Е. Uber den respiratorischen Quotienten der Lepidopteren.— «Naturwissenschaften», 1953, Bd. 40, S. 298.
352. Levenbook L., Wang Y. L. Succenic acid in the blood of the larva of Gastrophilus intestinalis.— «Nature», 1948, vol. 162, p. 731—732.
353. Burkholder J. R. A quantitative study of respiratory metabolism in single developing eggs of insects.— «Physiol. Zool.», 1934, vol. 7, p. 247—270.
354. Tuft P. H. The structure of the insect egg-shell in relation to the respiration of the embryo.—Exptl. Cell. Res., 1949, suppl. 1, p. 545—548.
355. Bodine J. H. Factors influencing the rate of respiratory metabolism in the developing egg (Orthoptera).— «PhysioL Zool.», 1929, vol. 2, p. 459—483.
356. В о d i n e J. H., В о e 11 E. J. The effect of cyanide on the oxygen consumption of normal and blocked embryonic cells (Orthoptera).— J. Cell. Compar. PhysioL, 1934, vol. 4, p. 397—404.
357. Zwicky K-, Wiggleswort V. B. The course of oxygen consumption during the moulting cycle of Rhodnius prolixus Stal. (Hemiptera).— Proc. Roy. Entomol. Soc. London, 1956, ser. A, vol. 31, p. 153—160.
358. S1 a m a K. Oxygen consumption during the postembryonic development of Pyrrhocoris apterus (Heterometabola: Heteroptera), and its comparison with that of Holometabola.— Ann. Entomol. Soc. Amer., 1960, vol. 53, p. 606—610.
359. Roussel J.-P. Etude de la consommation d’oxygene chez Locusta migratoria L.— J. Insect PhysioL, 1963, vol. 9, p. 349—361.
360. Rohdendorf E., SI am a K. Wachstum und Sauerstoffverbrauch
328
ini Laufe der Zwischenhautungsperiode bei Imagines von Thermobia domestica (Packard) (Thysanura, Lepismatidae).— Zool. Jahrb, 1966, Abt. 1, Bd. 72, S. 115—122.
361. Nyst R. H. Contribution a 1’etude de I’hormone nymphogene.— Ann. Soc. Roy. Zool. Belg, 1941, t 72, p. 74—104.
362. В a 1 z a m N. Untersuchungen liber den Stoff- und Energiewechsel in der Entwicklung der Insekten. II.—Acta Biol. Exptl, 1933, t. 8, p. 59—72.
363. H sue th T. Y, Tang P. S. Physiology of the silkworm. 1.—«Physiol. Zool.», 1944, vol. 17, p. 71—78.
364. S1 a m a K. Total metabolism during the larval development in sawflies (Hym, Tenthredinoidea).— Acta Soc. Entomol. Ceskoslov, 1959, t. 56, s. 113—125.
365. Петрова Д. В. Особенности газообмена у гусениц китайского дубового шелкопряда во время линьки.— Докл. АН СССР, 1963, т. 151, с. 737—739.
366. W a k и У. Studies on the hibernation and diapause in insects. V.— Sci. Repts. Tohoku Univ, 1960, ser. 4, vol. 26, p. 341—352.
367. Cousin G. Les arrets' du development chez Lucilia ampullacea et remarques sur la diapause.— Bull. Entomol. Soc. France, 1935, t. 48, p. 218—221.
368. S 1 a m a K. The total metabolism of insects. 8.— Mem. Soc. Zool. Ceskoslov, 1958, 22, s. 264—285.
369. A g r e 11 I. The aerobic and anaerobic utilization of metabolic energy during insect metamorphosis.— Acta Physiol. Scand, 1952, vol. 28, p. 306—335.
370. A g r e 11 I. Physiological and biochemical changes during insect development.—In: Hie Physiology of Insecta. Ed. by M. Rockstein. N. Y.—L, Acad. Press, 1964, vol. 1, p. 97—149.
371. Fourche J. Le metabolisme respiratofre au cours des metamorphoses— Bull. Biol. France et Belg, 1969, t. 103, p. 225—236.
372. S 1 a m a K. Metabolism during diapause and development in sawfly metamorphosis.— In: The ontogeny of insects. Acta Symp. de evolut. insecto-rum. Prague, 1960, p. 195—201.
373. Sussman A. D. Tyrosinase and respiration of pupae Platysa-mia cecropia L. — Biol. Bull, Г952, vol. 102, p. 39—47.
374. Schneiderman H. A. Onset .and termination of insect diapause.— In: Physiological triggers. Washington, Amer. Physiol. Soc, 1957, p. 46—59.
375. Harvey W. R, Williams С. M. The injury metabolism of the Cecropia silkworm. I.—J. Insect Physiol, 1961, vol. 7, p. 81—99.
376. Mecca С. E. Lack of elevated respiration in injured pupae of the southern armyworm Prodenia eridania (Lepidoptera).— Ann. Entomol. Soc. Amer, 1960, vol. 53, p. 849—851.
377. S 1 a m a K. Hormonal control of respiratory metabolism during growth, reproduction and diapause in female adults of Pyrrhocoris apterus L. (Hemiptera).— J. Insect Physiol, 1964, vol. 10, p. 283—303.
378. R a j a g о p a 1 P. К., В u r s e 11 E. The respiratory metabolism of resting tsetse flies.— J. Insect Physiol, 1966, vol. 12, p. 287—297.
379. S 1 a m a K. Effect of hormones on the respiration of body fragments of adult Pyrrhocoris apterus L. (Hemiptera).— «Nature», 1965, vol. 205, p. 416—417.
380. De Wilde J, Stegwee D. Two major effects of the corpus alia-turn in the adult Colorado beetle (Leptinotarsa decemlineata).— Arch. Neerl. Zool, 1958, Bd. 13, suppl. 1, S. 270—289.
381. De Wilde J. Diapause in the Colorado beetle (Leptinotarsa decern-lineata Say) as an endocrine deficiency syndrome of the corpora allata.— In: The ontogeny of insects. Acta Symp. de evolut. insectorum. Prague, 1960, p. 226—230.
382. S 1 a m a K. Hormonal control of respiratory metabolism during growth, reproduction and diapause in male adults of Pyrrhocoris apterus L. (Hemiptera).— Biol. Bull, 1964, vol. 124, p. 499—510.
329
383. H e s 1 о p J. Р., Р г е с е G. М., Ray J. W. Anaerobic metabolism in the housefly Musca domestica L.— Biochem. J., 1963, vol. 87, p. 35—38.
384. Mehrotra K. N. Carbohydrate metabolism in the two-spotted spider mite Tetranychus telarius L. II.— Canad. J. Biochem. Physiol., 1963, vol. 41, p. 1595—1602.
385. Kitto G. В., В r i g g s M. H. Relationship between locomotory habits and enzyme concentration in insects.—«Science», 1962, vol. 135, p. 918.
386. Ch'efurka W. Intermediary metabolism of carbohydrates, nitrogenous and lipid compounds in insects.— In: The’ physiology of insecta. Ed. be M. Rockstein. N. Y.— L., Acad. Press, 1965, vol. 2, p. 581—768.
387. O’B r i e n R. D., C h e u n g L., Kimmel E. C. Inhibition of the glycerophosphate shuttle in housefly flight muscle.— J. Insect Physiol., 1965, vol. 11, p. 1241—1246.
388. Sacktor B. The role of mitochondria in respiratory metabolism of flight muscle.— Ann. Rev. Entomol., 1961, vol. 6, p. 103—130.
389. Watanabe M. I. Williams С. M. Mitochondria in the flight muscles of insects. I.— J. Gen. Physiol., 1951, vol. 34, p. 675—689.
390. M a r g u a r d t R. R., Brosemer R. W. Insect extramitochondrial glycerophosphate dehydrogenase. I.— Biochem. Biophys. Acta, 1966, t. 128, p. .454—463.
391. Brosemer R. W., Marguardt R. R. Insect extramitochondrial glycerophosphate dehydrogenase. II.— Biochem. Biophys. Acta, 1966, t. 128, p. 464—473.
392. Silva G. M., Doyle W. P., Wang С. H. Glucose catabolism in the American cockroach.— «Nature», 1958, vol. 182, p. 102—104.
393. V о g e 11 W., В i s h a i F. R., В ii cher T. e. a. Uber strukturelle und enzymatische Muster in Muskeln von Locusta migratoria.— Biochem. Z., 1959, Bd. 332, S. 81—117.
394. A g о s i n M., Scaramelli N., Neghme A. Intermediary carbohydrate metabolism of Triatoma infestans (Insecta, Hemiptera). I.—«Compar. Biochem. Physiol.», 1961, vol. 2, p. 143.
395. В u r s e 11 E. Oxalacetic carboxylase in flight musculature of the tsetse fly.—«Compar. Biochem. Physiol.», 1965, vol. 16, p. 259—266.
396. В a г г о n E. S. G., T a h m i s s i a n T. N. The metabolism of cockroach muscle (Periplaneta americana).— J. Cell. Compar. Physiol., 1948, vol. 32, p. 57—76.
397. Harvey G. T., Beck S. D. Muscle succinoxidase in the American cockroach.—J. Biol. Chem., 1953, vol. 201, p. 765—773.
398. Sacktor B. Cell structure and the metabolism of insect flight muscle —J. Biophys. Biochem. Cytol., 1955, vol. 1, p. 29—46.
399. Sacktor B. Energetics and respiratory metabolism of muscular contraction.—In: The Physiology of Insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1965, vol. 2, p. 483—580.
400. Ho sci ns D. D., Cheldelin V. H., Newburgh R. W. Oxidative enzyme systems of the honey bee, Apis mellifera L.— J. Gen. Physiol., 1956, vol. 39, p. 705—712.
401. Gilmour D. The biochemistry of insects. N. Y.—L., Acad. Press, 1961. 343 p.
402. Zebe E. Die Verteilung von Enzymen des Fettstoffwechsels in Heuschreckenkorper.— Zool. Anz., 1960, Bd. 23, suppl., S. 309—314.
403. Bellamy D. The endogenous citric acid-cycle intermediated and amino acids of mitochondria.— Biochem. J., 1962, vol. 82, p. 218—224.
404. Van der Bergh S. G. Pyruvate oxidation and the permeability of housefly sarcosomes.— Biochem J., 1964, vol. 93, p. 128—136.
405. Desai R. M., Kilby B. A. Some aspects of nitrogen metabolism in the fat body of the larva of Calliphora erythrocephala.— Arch. Intern. Physiol. Biochem., 1958, vol. 66, p. 282—286.
406. Brosemer R. W., Veerabhadrappa P. S. Pathway of proline oxidation in insect flight muscle.— Biochem. Biophys. Acta, 1965, vol. 110, p. 102—112.
330
407. В и г s е 11 Е. Aspects of the metabolism of amino acids in the tsetse fly Glossina (Diptera).— J. Insect Physiol., 1963, vol. 9, p. 439—452.
408. К i г s t e n E., Kirsten R., Arese P. Das Verhalten von freien Aminosauren, energiereichen Phosphor-Saure-Verbindungen und einigen Gly-kolyse- und Txicarbon-Sauere Cycle-Substraten in Musckeln von Locusta migratoria bei der Arbeit.— Biochem. Z., 1963, Bd. 337, S. 117—168.
409. К u b i s t a V., Foustka M. Inorganic phosphate and the rate of glycolysis in insect muscle.—«Nature», 1962, vol. 195, p. 702—703.
410. Sack tor B. Investigations on the mitochondria of the housefly, Musca domestica L. III.— J. Gen. Physiol., 1954, vol. 37, p. 343—359.
411. Chance B., Sacktor B. Respiratory metabolism of insect flight muscle. II.— Arch. Biochem. Biophys., 1958, vol. 76, p. 509—531.
412. Cochran D. G., King K. W. Oxidative phosphorylation in sarco-somes from thoracic muscles of the American cockroach.— Biochem. Biophys. Acta, 1960, t. 37, p. 562—563.
413. Van der Bergh S. G., S 1 a t e r E. C. The respiratory activity and
respiratory control of sarcosomes isolated from the thoracic muscle of the
housefly.— Biochem. Biophys. Acta, 1960, vol. 37, p. 562—563.
414. Van der Bergh S. G., Slater E. C. The respiratory activity and
permeability of housefly sarcosomes.— Biochem. J., 1962, vol. 82, p. 362—371.
415. Harvey W. R., Haskell J. A. Metabolic control mechanisms in insects.— Adv. Insect Physiol., 1966, vol. 3, p. 133—205.
416. Michejaga J/ Physiology and structures of flight muscle sarcosomes in silkworm, Hyalophora cecropia L.—Bull. Soc. Amis. Sci. Lettr. Poznan, 1963, ser. D, p. 108—112.
417. Sacktor B., Thomas G. M. Succino-cytochrome C-reductase activity of tissues of the American cockroach, Periplaneta americana L.— J. Cell. Compar. Physiol., 1955, vol. 45, p. 241—251.
418. Sacktor B. Investigations on the mitochondria of the housefly, Musca domestica L. II.— Arch. Biochem. Biophys., 1953, vol. 45, p. 349—355.
419. Shappirio D. G., W i 11 i a m s С. M. The cytochrome system of the Cecropia silkworm. I.— Proc. Roy. Soc., 1957, vol. 147, ser. B, p. 218—246.
420. Ramasarma T. Lipid quinones.— Adv. Lipid Res., 1968, vol. 6, p. 108—180.
421. Keilin D. On cytochrome a respiratory pigment, common to animals, yeast, and higher plants.— Proc. Roy. Soc., 1925, ser. B, vol. 98, p. 312—339.
422. Goldin H. H., Farnsworth M. W. Low temperature spectra of the cytochromes of Drosophila melanogaster.— J. Biol. Chem., 1966, vol. 241, p. 3590—3594.
423. Chan S. K-, Margoliash E. Properties and primary structure of the cytochrome c from the flight muscles of the moth, Sarnia cynthia.— J. Biol. Chem., 1966, vol. 241, p. 335—348.
424. Carlson C. W., Brosemer R. W. Amino acid compositions of cytochrome c from four hymenopteran species evolutionary significance.— «Syst. Zool.», 1973, vol. 22, p. 77—83.
425. Ohnishi K. Studies on cytochrome b. II.— J. Biochem., 1966, vol. 59, p. 9—16.
425. W i 1 s о n L. P., King R. C. Studies with radiophosphorus in Drosophila. N.— J. Exptl. Zool., 1955, vol. 130, p. 341—352.
427. Jones C. R. Changes in the activity of respiratory enzymes in various .organs during metamorphosis of the mealworm, Tenebrio molitor Linnaeus.— J. Cell. Compar. Physiol., 1964,'vol. 63, p. 65—69.
428. Diamantis W. Activities of respiratory enzymes during the metamorphosis of the Mediterranean flour moth Ephestia kilhniella Zeller (Lepidoptera: Pyralidae).—J. New York Entomol. Soc., 1962, vol. 70, p. 68—78.
429. S u 1 к о w s к i E., W о j t c z a к L. Studies on the biochemistry of the waxmoth (Galleria mellonella L.). 18.— Acta Biol. Exptl., 1958, vol. 18, p. 239—248.
430. Ludwig D.,. В a r s a M. C. Activities of respiratory enzymes during
331
the metamorphosis of the housefly, Musca domestica Linnaeus.—J. New York Entomol. Soc., 1959, vol. 67, p. 151—156.
431. Ludwig D., В arsa M. C. Variations in the activity of the succinoxidase system during the development of the mealworm, Tenebrio molitor Linnaeus (Coleoptera, Tenebrionidae).— Ann. Entomol. Soc. Amer., 1956, vol. 49, p. 103—104.
432. 1 1 о T. The physiology of the metamorphosis of Bombyx mori. IL— Annot. Zool. Japan, 1955, vol. 28, p. 1—7.
433. Laud an i U., Grigolo A. Determinazione della citocromo—c oxi-dasi in nova, larve e pupe del ceppo SRS di Musca domestica L.— Riv. Pa-rassitol., 1965, t. 26, p. 187—192.
434. Davey K. G. The physiology of dormancy in the sweet-clover weevil.— Canad. J. Zool., 1956, vol. 34, p. 86—96.
435. Ушатинская P. С. Активность цитохромоксидазы и ^укцинат-дегидрогеназы у колорадского жука Leptinotarsa decemlineata в преддиапауз-ный период и при наступлении диапаузы.— Докл. АН СССР, 1959, т. 129, с. 687—690.
436. Schneiderman Н. A., Williams С. М. The physiology of insect diapause. VIII.—Biol. Bull., 1954, vol. 106, p. 210—229'
437. Schneiderman H. A., Williams С. M. The physiology of insect diapause. IX.— Biol. Bull., 1954, vol. 106, p. 238—252.
438. Chan S. K., Margoliash E. Biosynthesis of cytochrome c in developing pupae of Sarnia cynthia.— J. Biol. Chem., 1966, vol. 241, p. 2252—2255.
439. Shappirio D. G., Harvey W. R. The injury metabolism of the Cecropia silkworm. II.—J. Insect Physiol., 1965, vol. 11, p. 305—327.
ГЛАВА III
440. Беклемишев В. H. Экология малярийного комара. М., Мед-гиз, 1944. 293 с.
441. Дубинин В. Б. Перьевые клещи (Analgesoidea). Часть 1. Введение в их изучение.— В кн.: Фауна СССР. Т. 6, вып. 5. М.—Л., Изд-во АН СССР, 1951. 363 с.
442. Гринфельд Э. К. Возникновение симбиоза у муравьев и тлей.— Вести. Ленингр. ун-та, 1961, № 15, сер. биол., вып. 3, с. 73—84.
443. D у t е С. Е. Helping plants protect themselves.— «New Scientist», 1967, vol. 36, p. 410—411.
444. Self L. S., C u t h r i e F. E., Hodgson E. Adaptation of tobacco hornworms to the ingestion of nicotine.— J. Insect Physiol., 1964, vol. 10, p. 907—914.
445. Yang R. S. H., Cuthrie F. E. Physiological'responses of insects to nicotine.— Ann. Entomol. Soc. Amer., 1969, vol. 62, p. 141—146.
446. Parsons J., Rothschild M. Rhodanase in the larva and pupa of the common blue butterfly (Polyommatus icarus Rot.) (Lepidoptera).—Entomol. Gaz., 1964, vol. 15, p. 58—59.
447. Кузнецов В. И. Экологические связи листоверток (Lepidoptera, Tortricidae) с растительностью юга Дальнего Востока.— Ежегодн. чтения памяти Н. А. Холодковского. Л., «Наука», 1968, с. 27—52.
448. Chopard L. La mouche du petrole et les questions qu’elle pose.— Nat. Sci. Progr., 1963, vol. 3338, p. 255—256.
449. Емельянов А. Ф. Некоторые особенности распределения насекомых — олигофагов по кормовым растениям.— Ежегодн. чтения памяти Н. А. Холодковского. Л., «Наука», 1966, с. 28—65.
450. К о л а ч ев М. П. Монофаг ли тутовый шелкопряд?— Тр. Туркм. сельскохоз. ин-та, 1956, т. 8, с. 249—251.
451. Pascal М. Vue d’ensemble des recherches sur 1’alimentation per-manente du ver a soie.—Rev. Ver Soie, 1960, t. 12, p. 307—310.
452. Д а н и л e в с к и й А. С., Кузнецов В. И. Листовертки (Tortricidae). Триба плодожорки Laspeyresiinae.— В кн.: Фауна СССР. Чешуекрылые. Т. 5, вып. 1. М.—Л., Изд-во АН СССР, 1968. 635 с.
332
453. Фалькович хМ. И. О пищевых связях пустынных чешуекрылых (Lepidoptera) в Средней Азии.— Ежегодн. чтения памяти Н. А. Холодков-ского. Л., «Наука», 1968, с. 53—88.
454. Rivet! А. С. D. Prickly pear work.—«Science», 1929, vol. 69, p. 72—73.
455. Schilder F. A., Schilder M. Die Nahrung der Coccinelliden und ihre Beziehung zur Verwandschaft der Arten.—Arbeit. Biol. Reichsanst, 1928». Bd. 16, S. 213—282.
456. Тыщенко В. П. Об отношении некоторых пауков сем. Thomi-sidae к мимикрирующим насекомым и их моделям.— Вестн. Ленингр.. ун-та, 1961, № 3, сер. биол., вып. 1, с. 133—139.
457. V i n s о n S. В., L е w i s W. J. A method of host selection by Cardiochiles nigriceps.— J. Econ. Entomol., 1965, vol. 58, p. 869—871.
458. Vinson S. B. Source of a substance in Heliothis virescens (Lepidoptera: Noctuidae) that elicits a searching response in its habitual parasite Cardiochiles nigriceps (Hyrtienoptera: Braconidae).— Ann. Entomol. Soc. Amer.,, 1968, vol. 61, p. 8—10.
459. D e t h i e г V. G. The response of Hymenopterous parasites to chemical stimulation of the ovipositor.— J. Exptl. Zool., 1947, vol. 105, p. 199—207.
460. Данилевский А. С. Роль питающих растений в биологии лугового мотылька — Энтомол. обозр., 1935, т. 26, с. *91—НО.
461. S с h о о n h о v е n L. М. Loss of host-plant specificity by Manduca sexta after rearing on artificial diet.—Entomol. Exptl. Appl., 1967, t. 10» p. 270—272.
462. Рецова А. Б., Лозина-Лозинская Л. К. Роль поведения насекомых в процессе приспособления их к растительной пище.— Зоол. журн,. 1955, т. 34, с. 1066—1078.
' 463. Кожанчиков И. В. Биологические особенности европейских видов рода Galerucella и условия образования биологических форм у Galerucel-la lineola F.— Tp. Зоол. ин-та АН СССР, 1958, т. 24, с. 271—322.
464. I w а о S., М о с h i d a A. Further experiments on the host-plant preference in a phytophagous insect, Epilachna pustulosa Kono.— «Insect Ecol.» (Tokyo), 1961, vol. 9, p. 9—16.
465. J e r m у T., Hanson F. E., Dethier V. G. Induction of specific food preference in lepidopterous larvae.— Entomol. Exptl. Appl., 1968, t. 11» p. 211—230.
466. Goodhue D. Feeding stimulants required by a polyphagous insect» Schistocerca gregaria.— «Nature», 1963, vol. 197, p. 405—406.
467. Nayar J. K-, Th or st ei son A. J. Further investigations into the chemical basis of insecthost-plant relationships on an oligophagous insect» Plutella maculipennis (Curtis) (Lepidoptera: Plutellidae).— Canad. J. Zool., 1963, vol. 41, p. 923—929.
468. J e r m у T. On the nature of the oligophagy in Leptinotarsa decem-lineata Say (Coleoptera: Chrysomelidae).— Acta Zool. Acad. Scient. Hung.» 1961, vol. 7, p. 119—132.
469. Kangas E., Perttunen V., Oksanen H., Rinne M. Orientation of Blastophagus piniperda L. (Col., Scolytidae) to its breeding material.— Suomen hyonteist. Aikokonsk., 1965, t. 31, s. 61—73.
470. Kangas E. Untersuchungen fiber dir Einwirkung der Orientierung der Borkenkafer leitenden chemischen Verbindungen im Baum.—Z. angew. Entomol., 1968, Bd. 61, S. 353—364.
471. Gilbert B. L., Baker J. E., Norris D. M. Juglone (5-hydroxy-1, 4-naphthoquinOne) from Car ya ovata, a deterrent to feeding by Scolytus multistr iatus.— J. Insect Physiol., 1967, vol. 13, p. 1453—1459.
472. Gilbert B. L., Norris D. M. A chemical basis for bark beetle (Scolytus) distribution between host and non-host trees.— J. Insect Physiol., 1968, vol. 14, p. 1063—1068.
473. Vite J. P., Crozier R. G. Studies on the attack behavior of the southern pine beetle. IV.—Contrib. Biol. Thompson Inst., 1968, vol 24, p. 87—93.
* 12 198 “ 333
474. H ama mu г a Y., Naito K. Food selection by silkworm larvae, Bombyx mori.— «Nature», 1961, vol. 190, p. 879—880.
475. Hamamura Y. Food selection by silkworm larvae.— «Nature», 1959, vol. 183, p. 1746—1747.
476. Hamamura Y., Hayashiya K., Naito K. Food selection by silkworm larvae, Bombyx mori.— «Nature», 1961, vol. 190, p. 880—881.
477. Hamamura Y. On the feeding mechanism and prepared food of silkworm Bombyx mori L.—Rev. Ver. Soie, 1963—1964, t. 15—16, p. 49—56.
478. Nayar J. K., Fraenkel G. The chemical basis of the host selection in the Catalpa sphinx, Ceratomia catalpae (Lepidoptera, Sphingidae).— Ann. Entomol. Soc. Amer., 1963, vol. 56, p. 497—530.
479. Waldbauer G. P., Fraenkel G. Feeding on normally rejected plants by maxillectomized larvae of the tobacco hornworms, Protoparce sexta (Lepidoptera, Sphingidae).— Ann. Entomol. Soc. Amer., 1961, vol. 54, p. 477—485.
480. Waldbauer G. P. The growth and reproduction of maxillectomized tobacco hornworms feeding on normally rejected non-solanaceous plants.— Entomol. Exptl. Appl, 1962, t. 5, p. 147—158.
481. Schoonhoven L. M., Dethier V. G. Sensory aspects of hostplant descrimination by lepidopterous larvae.— Arch. Neerl. Zool., 1966, Bd- 16, S. 497—530.
482. Schoonhoven L. M. Chemoreception of mustard oil glucosides in larvae of Pieris brassicae.— Proc. Konikl. Nederl. Akad. Wet., 1967, ser. C, Bd. 70, S. 556—568.
483. Waldbauer G. P. The consumption and utilization of food by insects.—Adv. Insect Physiol., 1968, vol. 5, p. 229—288.
484. Hiratsuka E. Researches on the nutrition of the silkworm.— Bull. Ser. Exp. Sta. Japan, 1920, vol. 1, p. 257—315.
485. Vanderzant E. S. Axenic rearing of the ball weevil on defined diets: amino acid, carbohydrate and mineral requirements.— J. Insect Physiol., 1965, vol. 11, p. 659—670.
486. Dadd R. H. The nutritional requirements of locusts. I.— J. Insect PhysioL, 1960, vol. 4, p. 319—347.
487. Royes W. V. Robertson F. W. The nutritional requirements and growth relations of different species of Drosophila.—J. Exptl. Zool., 1964, vol. 156, p. 105—135.
488. H ir a no C., Ishii S. Nutritive values of carbohydrates for the growth of larvae of the rice stem borer, Chilo suppressalis Walker.— Bull. Nat. Inst. Agricult. Sci. Japan, 1957, ser. C, vol. 7, p. 89—99.
489. 1 1 о T. Effect of sugars on feeding of larvae of the silkworm, Bombyx mori.— J. Insect Physiol., 1960, vol. 5, p. 95—107.
490. iMicheibacher A. E., Hoskins W. M., H e r m s W. B. The nutrition of flesh fly larvae, Lucilia sericata.— J. Exptl. Zool., 1932, vol. 64, p. 109—132.
491. Bru st M., Fraenkel G. The nutritional requirements of the larva of a blowfly, Phormia regina Meig.— «PhysioL Zool.», 1955, vol. 28, p. 186—204.
492. Brookes V. J., Fraenkel G. The nutrition of the larva of the housefly, Musca domestica L. — «Physiol. Zool.», 1958, vol. 31, p. 208—293.
493. Akov S. Qualitative and quantitative study of the nutritional requirements of Aedes aegypti L.— J. Insect PhysioL 1962, vol. 8, p. 319—335.
494. House H. L. Insect nutrition.—In: The physiology of insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1965, vol. 2, p. 769—813.
495. Kasting R., McGinnis A. J. Nutrition of the pale western cutworm, Agrotis orthogonia Morr. (Lepidoptera, Noctuidae). IV.— J. Insect PhysioL, 1962, vol. 8, p. 97—103.
496. I c h i i S., H i r a n о C. Qualitative studies on the essential amino acids for the growth of the larva of the rice stem borer, Chilo simplex Butler, under aseptic conditions.—Bill. Nat. Inst. Agricult. Sci. Japan, 1955, vol.5, p.35—47.
497. Ito T., Arai N. Nutrition of the silkworm, Bombyx mori. IX.— J. Insect PhysioL, 1966, vol. 12, p. 861—869.
334
498. Ito T., Arai N. Nutritive effect of alanine, cysteine, glycine, serine and tyrosine on the silkworm, Bornbyx mori.—J. Insect Physiol., 1967, vol. 13, p. 1813—1824.
499. Mitt 1 er T. E. Gustation of dietary amino acids by the aphid Myzus persicae.—Entomol. Exptl. Appl., 1967, t. 10, p. 87—96.
500. Fraenkel G., Blewett M. Linoleicacid and arachidonic acid in the metabolism of the insects, Ephestia kuhniella (Lepidoptera) and Tenebrio molitor (Coleoptera).—Biochem. J., 1947, vol. 41, p. 475—478.
501. Rock G. C., Patton R. L., Gloss E. H. Studies of the fatty acid requirements of Ar gyrotaenia velutinana (Walker).—J. Insect Physiol., 1965, vol. 11, p. 91—101.
502. Nelson D. R., Sukkestad D. R. Fatty acid composition of the diet of larvae and biosynthesis of fatty acids from 14C-acetate in the cabbage looper, Trichoplusia ni.—J. Insect Physiol., 1968, vol. 14, p. 293—300.
503. Chippendale G. M., Beck S. D., Strong S. D. Methyl linolenate as an essential nutrient for the cabbage looper, Trichoplusia ni.—«Nature», 1964, vol; 204, p. 710—711.
504. Lamb N. L, Monroe R. E. Lipid sytnhesis from acetate-l-C14 by cereal leaf beetle, Oulema melanopus.—Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 1164—1166.
505. Dadd R. H. The nutritional requirements of locusts. V—J. Insect Physiol., 1961, vol. 6, p. 126—145.
506. С 1 а г к A. J., В 1 о c h К. The absence of sterol synthesis in insects.— J. Biol. Chem., 1959, vol. 234, p. 2578—2582.
507. Ishii S., H i r a n о C. Absence of cholesterol biosynthesis in the rice stem borer, Chilo suppressalis Walker.—«Sci. Insect Control», 1961, vol. 26, p. 71—74.
508. Rajalakshmi S., Sarma D. S., Sarma P. S. Cholesterol metabolism in Corcyra cephalonica St.—Indian J. Exptl. Biol., 1963, vol. 1, p. 186—189.
509. Erhardt P. Nachweis einer durch symbiotische Mikroorganismen bewirkten Sterinsynthese in kiinstlich ernahrten Aphiden (Homoptera. Rhyn-chota, Insecta).—«Experientia», 1968, t. 24, p. 82—83.
510. Fraenkel G., Reid J. А., В 1 e w e 11 M. The^terol requirements of the larva of the beetle, Dermestes vulpinus.—Biochem J., 1941, vol. 35, p. 712— 720.
511. Levinson Z. H. The function of dietary sterols in phytophagous insects.—J. Insect Physiol., 1962, vol. 8, p. 191—198.
512. Fraenkel G., Blewett M. The sterol requirements of several insects.—Biochem. J., 1943, vol. 37, p. 629—695.
513. Kaplanis J. N., Monroe R. E., Robbins W. E., L о u 1 о u-des S. J. The fate of dietary H3-fi-sitosterol in the adult house-fly.—Ann. Entomol. Soc. Amer., 1963, vol. 56, p. 198—201.
514. В orrin s W. E. Studies on the utilization metabolism and functions of sterols in the house-fly, Musca domestica.—In: Radiation and radioisotopes application in insect agricultural importance. Vienna, 1963, p. 269—279.
515. С 1 a у t о n R. B. The utilization of sterols by insects.—J. Lipid Res., 1964, vol. 5, p. 3—19. _ '
516. Levinson Z. H. Nutritional requirements of insects.—Riv.. Paras-sitol., 1955, t. 16, p. 113—138.
517. Sarma P. S. Riboflavin and pyridoxin (vitamin B6) as growthpromoting factors for rice-moth larvae (Corcyra cephalonica Si.).—Indian J. Med. Res., 1943, vol. 31, p. 165—171.
518. Ako v S., Guggenheim K. Antimetabolites in the nutrition of Aedes 'aegypti L. larvae. Thiamine, riboflavine and panthotenic acid.—J. Nutr., 1963, vol. 81, p. 419—426.
519. А к о v S., Guggenheim K. Antimetabolites in the nutrition of Aedes aegypti L. larvae. Pyridoxine antagonists.—«Compar. Biochem. Physiol.», 1963, vol. 9, p. 61—68.
335
520. Ouye M. T., Vanderzant E.'S. B-vitamine requirements of the pink bollworm.—J. Econ. Entomol., 1964, vol. 57, p. 427—430.
521. Miura К., Takaya T., Koshiba K. The effect of biotin deficiency on the biosynthesis of the fatty acid in blowfly Aldrichina grahami during metamorphosis under aseptic conditions.—Arch. Intern. Physiol. Biochem., 1967, t. 75, p. 67—76.
522. Horie Y., Nakasone S. Effect of dietary biotin on fatty acid composition of the silkworm, Bombyx mori L.—J. Insect Physiol., 1968, vol. 14, p. 1381—1387.
523. V a n d e r z a n t E. S. Nutrition of the boll weevil larva.—J. Econ. Entomol., 1963, vol. 56, p. 357—362.
524. E г к F. G., Sang J. H. The comparative nutritional requirements of two sebbling species Drosophila simulans and D. melanogaster—J. Insect Physiol., 1966, vol. 12, p. 43—51.
525. Lichtenstein E. P. Growth of Culex molestus under sterile conditions.—«Nature», 1948, vol. 162, p. 227.
526. Barlow J. S. Fatty acid characteristics of some insect taxa.—«Nature», 1963, vol. 197, p. 311.
527. I^adner C. G., La Fleur F. M. The vitamin requirements of Pha->enicia sericata fMeigen) larvae (Diptera: Calliphoridae).—Wassman J. Biol., 1951, vol. 9, p. 129—132.
528. Gordon H. T. Minimal nutritional requirements of the German roach, Blatella germanica L.—Ann. New York Acad. Sci., 1959, vol. 77, p. 290—351.
. 529. House H. L., Barlow J. S. Vitamin requirements of the house fly Musca domestica L. (Diptera, Muscidae).—Ann. Entomol. Soc. Amer., 1958, vol. 51, p.‘ 299—302.
530. Hodgson E., C h e 1 d e 1 i n V. H., Newburg R. W. Nutrition and metabolism of methyl donors and related compounds in the blowfly, Phormia regina (Meigen).—Arch. Biochem. Biophys., 1960, vol. 87, p. 48—54.
531. Akov S. Antimetabolites in the nutrition of Aedes aegypti L. larvae. The substitution of choline by related subtances and the effect of choline inhibitors.—J. Econ. Entomol., 1964, vol. 57, p. 427—430.
532. Fraenkel G. S., Friedman S., H i n t о n T. e. a. The effect of substituting carnitine for choline in the nutrition of several organisms.—Arch. Biochem. Biophys., 1955, vol. 54, p. 432—439.
533. Geer B. W., V о v i s G. F. The effect of choline and related compounds on the growth and development of Drosophila melanogaster.—J. Exptl. Zool., 1965, vol. 158, p. 223—236.
534. Geer B. W., Vo vis G. F., Yu nd M. A. Choline activity during the development of Drosophila melanogaster.— «Physiol. Zool.», 1968, vol. 41, ,p. 280—292.
535. Ritchot C., McFarlane J. E. The B-vitamin requirements of the house cricket.—Canad. J. Res., 1961, ser. zool., vol. 39, p. 11—15.
536. Fraenkel G., Friedman S. Carnitine.—«Vitamins and hormones», 1957, vol. 15, p. 73—118.
537. Hinton H. E. Dietary requirements of insects. Amino acids and vitamins.—Sci. Progr., 1956, vol. 44, p. 292—309.
538. Vanderzant E. S., Richardson C. D. Ascorbic acid in the nutrition of plant-feeding insects.—«Science», 1963, vol. 140, p. 989—991.
539. Sarma P. S., Bhagvat K. The synthesis of vitamin C by rice moth larvae (Corcyra cephalonica Staint.).—«Current Sci.», 1942, vol. 11, p. 394.
540. Kato M., Yamada H. Chlorogenic acid as a growth factor of silkworm.—Rev. Ver. Soie, 1963—1964, vol. 15—16, p. 82—92.
541. Yamada H., Kato M. Chlorogenic acid as an indispensable component of the synthetic diet for the silkworm.—Proc. Japan. Acad., 1966, vol. 42, p. 399—403.
542. Smith В. C. Growth and development of coccinellid larvae on dry
336
foods (Coleoptera: Coccinellidae).—«Canad. Entomol.». 1965, vol. 97, p. 760—• 768.
543. I g n о f f о С. M. A successful technique for mass-rearing cabbage loopers on a semisynthetic diet.—Ann. Entomol. Soc. Amer., 1963, vol. 56, p. 178—182.
544. Shorey H. H. A simple artificial rearing medium for the cabbage looper.—J. Econ. Entomol., 1963, vol. 56, p. 536—537.
545. Friend W. G., Patton R. L. Studies on vitamin requirements of larvae of the onion maggot, Hylemya antiqua (Mg.) under aseptic conditions.—Canad. J. Zool., 1956, vol. 34, p. 152—162.
546. Dadd R. H., M i 111 e r T. E. Permanent culture of an aphid on totally synthetic diet.—«Experientia», 1966, t. 22, p. 832.
547. Dadd R. H., К r i e g e r D. L. Continuous rearing of aphids of the Aphis fabae complex on sterile synthetic diet.—J. Econ. Entcmol.; 1967, vol. 60, p. 1512—1514.
548. T a n t о n M. T. Agar and chemostimulant concentrations and their effect on intake of synthetic food by larvae of the mustard beetle, Phaeodon cochleariae Fab.—Entomol. Exptl. Appl., 1965, t. 8, p. 74—82.
549. David W. A., Gardiner В. О. C. Mustard oil glucosides as feeding stimulants for Pieris brassicae larvae in a semi-synthetic diet.—Entomol. Exptl. Appl., 1966, vol. 9, p. 247—255.
550. Fukuda T., Suto M., К a m e у a m a T. e. a. Synthetic diet for silkworm rearing.—«Nature», 1962, vol. 196, p. 53—54.
551. Dethier V. G. The physiology and histology of the contact chemoreceptors of the blowfly.—Quart. Rev. Biol., 1955, vol. 30, p. 348—371.
552. Evans D. R., Browne L. B. The physiology of hunger in the blowfly.—«Amer. Midi. Natur.», 1960, vol. 64, p. 282—300.'
553. Dethier V. G., Evans D. R., Rhoades M. V. Some factors controlling the ingestion of carbohydrates by the blowfly.—Biol. Bull., 1956, vol. Ill, p. 204—222.
554. Green G. W. The control of spontaneous locomotor activity in Phormia regina Meigen. I.—J. Insect Physiol., 1964, vol. 10, p. 711—726.
555. Dethier V. G., Bodenstein D. Hunger in the blowfly.—Z. Tierpsychol., 1958, Bd. 15, S. 129—140.
556. M a d d r e 1 S. H. P. Control of ingestion in Rhodnius prolixus Stal.— «Nature», 1963, vol. 198, p. 210.
ГЛАВА IV
557. W e b e r H. Grundris der Insektenkunde. Jena, Gustav Fischer Verlag, 1966. 428 S.
558. Олсуфьев H. T. Слепни' (Tabanidae).— В кн.: Фауна СССР. Насекомые двукрылые. Т. 7, вып. 2. М.—Л., Изд-во АН СССР, 1956. 434 с.
559. Перфильев П. П. Москиты.— В кн.: Фауна СССР. Насекомые двукрылые. Т. 3, вып. 2. М.—Л., Изд-во АН СССР, 1937. 145 с.
560. Рубцов И. А. Мошки (сем. Simuliidae).— В кн.: Фауна СССР. Насекомые двукрылые. Т. 6, вып. 6. М.— Л., Изд-во АН СССР, 1956. 860 с.
561. Graham-Smith G. S. The alimentary canal of Calliphora eryth-rocephala L. with special reference to its musculature and to proventriculus, rectal valve and rectal papillae.—«Parasitology», 1934, vol. 26, p. 176—248.
562. Obenberger J. Entomologie. I. Anatomie, morfologie a embryolo-gie hmyzu. Praha, Prirod. Vydav., 1952. 869 s.
563. Павловский E. H., Зарин Э. Я. О строении пищеварительного канала и об его ферментах у пчелы (Apis mellifera L.).—В кн.: Павловский Е. Н. Работы по экспериментальной зоологии и ядовитым животным. М.—Л., Изд-во СССР, 1963, с. 9—57.
564. Бочарова-Месснер О. М. Функциональное значение отделов пищеварительного аппарата вредной черепашки (Eurygaster integriceps).— Докл. АН СССР, 1959, т. 128, с. 198—201.
565. Singh М. Р. Histological changes in the midgut epithelium during
337
metamorphosis Chrysocoris stollii Wolff (Heteroptera, Pentatomidae).—«Mik-roskopie», 1968, Bd. 23, S. 162—165.
566. L otmar R. Das Mitteldarmepithel von Tineola biselliella (Kleider-motte) wahrend der Metamorphose.—Mitt. Schweiz. Entomol.^ Ges., 1942, Bd. 18, S. 445—455.
567. P a j n i H. R. A note on the metamorphosis of the midgut epithelium in Calosobruchus maculatus (F.) (Bruchidae: Coleoptera).—Res. Bull. Panjab Univ., 1967, vol. 18, p. 75—78.
568. Baker W. V. The gross structure and histology of the adult and larval gut of Pentalobus barbatus (Coleoptera: Passalidae).—«Canad. Entomol.», 1968, vol. 100, p. 1080—1090.
569. Miyamoto S. Comparative morphology of alimentary organs of Heteroptera ‘with the phylogenetic consideration.—«Sieboldia», 1961, t. 2, p. 197—260.
570. Bahadur J., Reddy К. K. Structure and function of the rectal pads in Hymenoptera.—Zool. Anz., 1967, Bd. 1.78, S. 262—268.
571. Goodchild A. J. P. Studies on the functional anatomy of the'intestines of Heteroptera.—Proc. Zool. Soc. L., 1963, vol. 141, p. 851—910.
572. Ivanovic J., Marinkovic D., Jankovic M. Histoloske i ci-tohijske karakteristike jednog od tipova digestivnog traktusa ksilofagnih i saproksilofagnih insekata.—Arch. Biol. Nauka, 1964, t. 16, s. 99—108.
573. Шапиро И. Д., Вилкова Н. А., Сазонов А. П. Об адаптивных чертах строения пищеварительных трактов личинок некоторых круглошовных мух (Diptera, Brachycera, Cyclorrapha).— Зоол. журн., 1967, т. 46, с. 540—550.
574. Мамаев Б. М., Семенова Л. М. Анатомия и гистология пищеварительной системы личинок Cecidomyiidae в сравнении с другими Bibio-nomorphae.— Бюлл. МОИП, 1969, отд. биол., с. 53—63.
575. Кривошеина Н. П. Онтогенез и эволюция двукрылых насекомых. М., «Наука??, 1969, 291 с.
576. R а р р W. F. The number of gastric caeca in some larval Scara-baeoidea.—Canad. Entomol., 1947, vol. 79, p. 145—147.
577. W г о n i s z e w s k a A. Mandibular glahds of the wax moth larva Galleria mellonella (L.).—J. Insect Physiol., 1966, vol. 12, p. 509—522.
578. Mukaiyama F. Occurence of several digestive enzymes in the salivary gland of the larva of the silkworm, Bombyx mori.—J. Serie. Sci. Japan, 1961, vol. 30, p. 1—8.
579. Gray J. The post-embryological development bf the digestive system in Homaledra sabalella Chambers.—Ann. Entomol. Soc. Amer., 1931, vol. 24, p. 45—107.
580. M i a 11 L. C., Denny A. The structure and life history of the cockroach (Periplaneta orientalis). An introduction to the study of insects. L., 1886. 112 p.
581. R а у c h a u d h u ry D. N., Ghosh S. K. Study on the histophysio-logy of the salivary apparatus of Periplaneta americana Linn.—'Zool. Anz., 1964, Bd. 173, S. 227—237.
582. Day M. F. The mechanism of secretion by the salivary glands of cockroach Periplaneta americana.—Austr. J. Res., 1951, ser. B, vol. 4, p. 136— 143.
583. В 1 a n d К. P., House C. R., Ginsborg B. L. e. a. Catecholamine transmitter for salivary secretion in the cockroach.—«Nature», New BioL, 1973, vol. 244, p. 26—27.
584. Nuorteva P. Entwicklungsbedigtes Auftreten von Speichelprotea-sen und Phytotoxinen bei Hemipteren.—In: The ontogeny of insects. Acta Symp. de evolut. insectorum. Prague, 1960, p. 181—,184.
585. R a s t о g i S. C. On the salivary enzymes of some phytophagous and predaceous Heteroptera.—«Science and culture», 1962, vol. 28, p. 479— 480.
586. Salkeld E. H. Histochemical studies on localization and distribution of esterases in the salivary glands of the large milkweed bug, Oncopettus 338
fasciatus (Dall.) (Hemiptera, Lygaeid'ae).—Canad. J. Zool., 1959, vol. 37, p. 113—115.
587. Hennig E. Zum Probieren oder sogenannten Probesaugen der schwarzen Bohnenlaus (Aphis fabae Scop.).—Entomol. Exptl. Appl., 1963, t. 6, p. 326—336.
588. Lamb К. P., Ehrhardt P., Moericke V. Labelling of aphid saliva with rubidium-86.—«Nature», 1967, vol. 214, p. 602—603.
589. Schaller Biochemische Analyse des Aphidenspeichels und seine Bedeutung fiir die Gallenbildung.—Zool. Jahrb., 1968, Abt. 1, Bd. 74, S. 54— 87. x
590. Hellman K., Hawkins R. I. Prolixin-S and prolixin-G; two anticoagulants from Rhodnius prolixus Stal.—«Nature», 1965, vol. 207, p. 265— 267.
591. Hellman K., Hawkins R. I. An antithrombin (maculatin) and plasminogen activator extractable from the blood-sucking Hemipteran, Eutrio-toma maculqtus.—Brit. J. Haemotol., 1966, vol. 12, p. 376—384.
592. De Buck A. Some observations on the salivary and stomach secretion of Anopheles and other mosquitos.—Proc. Netuurk. Akad. Wetensch. Amsterdam, 1937, Sect. Sci., Bd. 40, S. 217—223.
593. Metcalf R. L. The physiology of the salivary glands oi' Anopheles quadrimaculatus.—J. Nat. Malaria Soc., 1945, vol. 4, p. 271—278.
594. Wigglesworth V. B. Digestion in the tsetse fly: a study of structure and function.—«Parasitology», 1929, vol. 21, p. 288—321.
595. Брук P. К вопросу о питании личинок комаров.— Тр. ЛОЕ, 1930, т. 60, с. 15—28.
596. Gosswald К., К1 о f t W. Untersuchungen mit radioaktiven Iso-topen an Waldameisen.—«Entomophaga», 1955, Bd. 5, S. 33—41.
597. Naarman H. Untersuchungen Liber Bildung und Weitergabe von Driisensekreten bei Formica (Hymenoptera, Formicidae).—«Experientia», 1963, t. 19, p. 412—413.
598. Delage B. Sur une fonction particuliere des glandes pharyngiennes des fourmis.—Compt. Rend. Acad. Sci., 1966, ser. D, t. 263, p. 1743—1744.
599. Simpson J. The functions of the salivary glands of Apis melli-fera—J. Insect Physiol., 1960, vol. 4, p. 107—121.
600. D a С r u z L. C. Histoquimica e ultraestrutura das glandulas saliva-res das abelhas (Hymenoptera, Apoidea).—Arq. Zool. Est. San Paulo, 1968, t. 17, p. 113—166.
601. Otto D. Uber die Homologicverhaltnisse der Pharynx- und Maxillard-riisen bei Formicidae und Apidae (Hymenoptera).—Zool. A.nz., 1958, Bd. 161, S. 216—226.
602. Simpson J., Riedel J. В. M., W i 11 i n g N. Invertase in the hypo-pharengeal glands of the honey-bee.—J. Agricult. Res., 1968, vol. 7, p. 29—36.
603. Reichenbach-Klinke H.-H. Die Entwicklung des Proventri-kels der Coleopteren mit besonderer Beriicksichtigung der carnivoren Arlen der Unterordnung Polyphaga (Coleoptera) .—Entomol. Bl., 1953, Bd. 49, S. 2—17.
604. Yeager J. F. Observations on crop and gizaard movements in the cockroach Periplaneta fuliginosa.—Ann. Entomol. Soc. Amer., 1931, vol. 24, p. 738—745.
605. Jones J. C. The anatomy and rhythmical activities of the alimentary canal of Anopheles larvae.—Ann. Entomol. Soc. Amer., 1960, vol. 53, p. 459—474.
606. Balentine R. The protolytic enzymes of the nymph of the dragonfly.—Anat. Rec,, 1940, vol. 78, suppl., p. 44.
607. Мончадский А. С. О механизме пищеварения у личинок Chao-borus .(Diptera, Cilicidae).—Зоол. журн., 1945, т. 24, с. 90—98.
608. Clarke К. U., Grenville Н. Nervous control of movements in the foregut of Schistocerca gregaria Forsk.—«Nature», 1960, vol. 186, p. 98—99.
609. Day M. E., W a t e r h о u s e D. F. The mechanism of digestion.—
339
In: Insect physiology. Ed. by K- D. Roeder. N. Y.—L., John Wiley and Sons Inc., 1953, p. 311—330.
610. Montagner H. Comment caracteriser le transit intestinal chez les guepes sociales.—Compt. Rend. Acad. Sci., 1964, t. 259, p. 2016—2019.
611. Peters W. Vorkommen, Zusammensetzung und Feinstruktur peri-trophischen Membranen in Tierreich.—Z. Morphol. Oecol. Tiere, 1968, Bd. 62, S. 9—57.
612. Жужи ко в Д. П. Строение перитрофической оболочки двукрылых.— Вестник Моск, ун-та, сер. биол. и почв., 1963, вып. 1, с. 37—41.
613. Жужи ко в Д. П. Изучение перитрофической оболочки некоторых двукрылых в поляризованном свете.— Вестн. Моск, ун-та, сер. биол. и почв., 1966, вып. 1, с. 37—41.
614. Adler S., Theodor О. The mouth parts, alimentary tract, and salivary apparatus of the female in Phlebotomus papatasii.—Ann. Trop. Med. Parasitol., 1926, vol. 20, p. 103—108.
615. Gouranton J., Mail let P.-L. Sur 1’existence d’une membrane pertrophique chez les insecte suceur de seve, Cicadella viridis L. (Homoptera, Jassidae).—Compt. Rend. Acad. Sci., 1965, ser. B, t. 261, p. 1102—Ц05.
616. Waterhouse D. F. The occurence and significance of the peri-trophic membrane, with special reference to adult Lepidoptera and Diptera.— Aus r. J. Zool., 1953, vol. 1, p. 299—318.
617. Жужиков Д. П. Образование, строение и функции перитрофической оболочки двукрылых. Автореф. канд. дис. Изд-во Моск, ун-та, 1963, 18 с.
618. Wigglesworth V. В. The formation of peritrophic membrans in insects with special reference to the larva of mosquito.—Quart. J. Microscop. Sci., 1930, vol. 73, p. 593—616.
619. Couch E. F., Mills R. R. The midgut epithelium of the American cockroach: acid phosphomonoesterase activity during the formation of autophagic vacuoles.—J. Insect Physiol., 1968, vol. 14, p. 55—62.
620. Srivastava P. N. Oligosaccharide synthesis by the alimentary canal invertase of the larva of Corcyra cephalonica Stainton (Lepidoptera: Py-ralidae).—«Enzymologia», 1966, vol. 30, p. 127—130.
621. Mathew K. Comparative studies on the digestive system of some insects under fed and starved conditions.—Agr. Univ. J. Res. (Sci.), 1961, vol. 10, p. 251—256.
622. Engelman F. Food-stimulated synthesis of intestinal proteolytic enzymes in the cockroach Leucophaea maderae.—J. Insect Physiol., 1969, voL 15, p. 217—235.
623. Khan M. A. Studies on the secretion of digestive enzymes in Lo~ custa migratoria L. I.—Entomol. Exptl. Appl., 1963, vol. 6, p. 181—193.
624. Khan M. A. Studies on the secretion of digestive enzymes in Locus-ta migratoria L. II.—Entomol. Exptl. Appl., 1964, vol. 7, p. 125—130.
625. Langley P. A.- The control of digestion in the tsetse fly, Glossina morsitans.—J. Insect Physiol., 1966, vol. 12, p. 439—448.
626. Langley P. A. Experimental evidence for a hormonal control of digestion in the tsetse fly Glossina morsitans Westwood: a study of the larva, pupa, and teneral adult fly.—J. Insect Physiol., 1967, vol. 13, p. 1921—1931.
627. Dadd R. H. Evidence for humoral regulation of digestive secretion in the beetle, Tenebrio molitor—J. Exptl. Biol., 1961, vol. 38, p. 259—266.
628. Thomsen E., Moller J. Influence of neurosecretory cells and of corpus allatum on intestinal protease activity in the adult Calliphora erythro-cephala Meig.—J. Exptl. Biol., 1963, vol. 40, p. 301—321.
629. M о r t r e u i 1 - L a n g 1 о i s M. Etude autoradiographique de la secretion proteique chez I’orthoptere Blabera f.usca Br.—Compt. Rend. Soc. Biol'., 1963, t. 157, p. 1408—1411.
630. Treherne J. E. The absorption of glucose from the alimentary canal of the locust Schistocerca gregaria (Forsk.).—J. Exptl. Biol., 1958, vol. 35, p. 297—306.
340
631. Treherne J. E. Amino acid absorption in the locust (Schistocerca gregaria Forsk.).—J. Exptl. BioL, 1959, vol. 36, p. 533—545.
632. К o‘c h H. A. Morphologische und histologische Untersuchungen am Verdauungskanal des Kartofellkafers (Leptinotarsa decemlineata Say).— AbhandL Ber. Staatl. Museum Tierkunde Dresden, , 1960, Bd. 25, S. 25—45.
633. W i g g I e s w о r t h V. B. The storage of protein, fat, glycogen and uric acid in the fat body and other tissues of mosquito larvae.—J. Exptl. BioL, 1942, vol. 19, p. 56—77.
634. De Boissezon P. Contribution a 1’etude de la biologie et 1’his-tophysiologie de Culex pipiens.—Arch. Zool. Exp. Geneva, 1930, t. 70, p. 281 — 431.
635. S h у a m a 1 a M. В., В h a t J. V. Intestinal transport of glucose in the silkworm, Bombyx mori L.—Indian J. Biochem., 1965, vol. 2, p. 101—104.
636. Shy am a 1 a M. В., В h a t J. V. Intestinal transport and metabolism of D-amino acids in the silkworm Bombyx mori L.—J. Sericult. Sci. Japan, 1967, vol. 36, p. 320—326.
637. P h i 11 i p s J E. Rectal absorption in the desert locust, Schistocerca gregaria ForskaL I. Water.—J. Exptl. BioL, 1964, vol. 41, p. 15—38.
638. Baccetti B., Mazzi V., Massimello G. Richerche sull’ultra-struttura dell’intestino degli insetti. V.—«Redia», 1963, vol. 48, p. 265—287.
639. Gupta B. L., Berridge M. J. A coat of repeating subunits on the cytoplasmic surface of the plasma membrane in the rectal papillae of the blowfly, Calliphora erythrocephala (Meig.), studied in situ by electron microscopy.—J. Cell. BioL, 1966, vol. 29, p. 376—382.
640. Phillips J. E. Rectal absorption and renal function in insects.— Trans. Roy. Soc. Canada,, 1965, sec. 1—3, vol. 3, p. 237—254.
641. Phillips J. E., Dockrill A. A. Molecular sieving of hydrophilic molecules by the rectal intima of the desert locust (Schistocerca gregaria).— J. Exptl. BioL, 1968, vol. 48, p. 521—532.
642. A p p I e b a u m S. W., Jankovic M., Birk Y. Studies on the midgut amylase activity of Tenebrio molitor L. larvae.—J. Insect Physiol., 1961, vol. 7, p. 100—108.
643. S r i v a s t a v a P. N., A u с 1 a i г J. L. Amylase activity in the pea aphid Acyrthosiphon pisum (Harr.) (Homoptera, Aphididae).— J. Insect Physiol., 1962, vol. 8, p. 349—355.
644. Hobson R. P. Studies on the nutrition of blowflies larvae. I.—J. ExptL BioL, 1931, vol. 8, p. 109—123.
645. Srivastava U. S., Srivastava P. D. On the hydrogen-ion concentration in the alimentary canal of the Coleoptera.—Beitr. Entomol., 1961, Bd. 11, p. 15—20.
646. Krishna S. S., Saxena K. N. Digestion and absorption of food in Tribolium castaneum (Herbst).—«Physiol. Zool.», 1962, vol. 35, p. 66—78.
647. Greenberg B. Micro-potentionmetric pH determination of mus-coid maggot digestive tracts.—Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 365—368.
648. Waterhouse D. F. The hydrogen ion concentration in the alimentary canal of larval and adult Lepitoptera— Austr. J. Sci. Mes., 1949, ser. B, vol. 2, p. 428—437.
649. Srivastava В. К., M a t h u r L. M. L. On the hydrogen-ion concentration in the alimentary canal and blood of phytophagous larval Lepidoptera.—Indian J. Entomol., 1966(1967), vol. 28, p. 422—426.
650. Varsiney R. K., Sundaran R. M. Acidity in the gut of Eub-lemma amabilis larvae—a predator of the lac insect—J. Econ. Entomol., 1967, vol. 60, p. 272.
651. Bodine J. H. Physiology of Orthoptera— BioL Bull., 1925, vol 48, p. 79—82.
652. Srivastava U. S., Srivastava P. D. On the hydrogen-ion concentration in the alimentary a canal of certain, orthopteroid insects.— Beitr. Entomol., 1956, Bd. 6, S. 493—498.
341
653. Purr A. The influence of vitamin C (ascorbic acid) опт plant and animal amylases.—Biochem. J., 1934, vol. 28, p. 1141 —1148.
654. Lasker R., Giese A. G. Cellulose digestion by the silver fish Ctenolepisma lineata.—J. Exptl. Biol., 1956, vol. 33, p. 542—553.
655. Mar to j a R. Assimilation de la cellulose et microorganismes inten-stinaux chez Gryllus bimaculatus De Geer (insecte, orthoptere, grylloidea).— Compt. Rend. Acad, Sci., 1962, t. 254, p. 3040—3042.
656. McGinnis A. J., Ka sting R. Digestibility studies with cellulo-se-U-C14 on larvae of the pale western cutworm Agrotis orthogonia.—J. Insect Physiol., 1969, vol. 15, p. 5—10.
657. Wharton D. R. A., Wharton M. L. The 'cellulase content of various species of cockroaches.—J. Insect Physiol., 1965, vol. 11, p. 1401—1405.
658. Wharton D. R. A., Wharton M. L., Lola J. E. Cellulase in the cockroach, with special reference io Periplaneta americana (L.)—J. Insect PhysioL, 1965, vol. 11, p. 947—959.
659. Adams J. B., McAllan J. W. Pectinase in certain insects.— Canad. J. Zool., 1958, vol. 36, p. 305—308.
660. McAllan J. W., Cameron M. L. Determination of pectin polygalacturonase in four species of aphids.—Canad. J. Zool., 1956, vol. 34, p. 541—543.
661. Powning R. F., Irzykiewicz H. A chitinase from the gut of the cockroach Periplaneta americana.—«Nature», 1963, vol. 200, p. 1128.
662. Ha sett С. C., Dethier V. G., Gans J. A comparison of nutritive values and taste thresholds of carbohydrates for the blowfly.—Biol. Bull., 1950, vol. 99, p. 44.6—453.
663. Webber L. G. Utilization . and digestion of carbohydrates by the Australian sheep blowfly Lucilia cuprina.—Austr. 1. Zool., 1957, vol. 5, p. 164—172.
664. Derr R. E., Randall D. D. Trehalasae of the differential grasshopper, Melanoplus differentialis.—J. Insect Physiol., 1966, vol. 12, p. 1105— 1114.
665. К a 1 f G. F., Rieder S. V. The purification and properties of tre-halase.—J. Biol. Chem., 1958, vol. 230, p. 691—698.
666. Friedman S. The purification and properties of trehalase isolated from Phormia regina Meig.—Arch. Biochem. Biophys., 1960, vol. 87, p. 252— 258.
667. Saito S. Trehalase of the silkworm Bombyx, mori.—J. Biochem. Tokyo, 1960, vol. 48, p. 101—109.
668. Gussin A. E. S., Wyatt G. R. Soluble and membrane-bound tre-halases in insects.—«Amer. Zool.», 1964, vol. 4, p. 382—383.
669. Evans W. A. L., Marsden J. Carbohydrases in blowfly larvae.— «Nature», 1956, vol. 177, p. 478.
670. Krishna S. S. Further studies on digestion of food in the gut of Trogoderma larva. I.—Physiol. Zool., 1958, vol. 31, p. 316—323.
671. Gray H. E., Fraenkel G. Fructomaltose, a recently discovered tiisaccharide isolated from honeydew.—«Science», 1953, vol. 118, p. 304—305.
672. Wolf J. P., Ewart W. H. Carbohydrate composition of the honeydew of- Coccus hesperidum L.—Arch. Biochem. Biophys., 1955, vol. 58, p. 365—372.
673. Saxena K. N., Bhatnagar P. Nature and characteristics of invertase in relation to utilization of sucrose in the gut of Oxycarenus hyalini-pennis (Costa) (Heteroptera: Lygaeidae).—J. Insect Physiol., 1961, vol. 7, p. 109—126.
674. Bacon J. S. D., Dickinson B. The origin of melezitose: a biochemical relationship between the lime tree (Tilia spp.) and an Aphis (Eucal-lipterus tiLiae L.).—Biochem. J., 1957, vol. 66, p. 289—294.
675. Wolf J. P., Ewart W. H. Two carbohydrates occuring in insect-produced honeydews.—«Science», 1955, vol. 122, p. 973.
676. N e w с о m b e r W. S. The occurence of й-glucosidase in digestive
342
juice of the cockroach, Periplaneta americana L.—J. Cell. Compar. Physiol., 1954, vol. 43, p. 79—86.
677. R о b i n s о n D. The fluorometric determination of fi-glucosidasc: its occurence in the tissues of animals, including insects.—Biochem. J„ 1956, vol. 63, p. 79 p. 39—44.
678. Вилкова H. А. К физиологии питания вредной черепашки Eurygaster integriceps (Heteroptera, Scutelleridae).— Энтомол. обозр., 1968, т. 47, с. 701—710.
679. Brookes V. J. Partial purification of a proteolytic enzyme from an insect Phormia regina.—Biochem. Biophys. Acta, 1961, vol. 46, p. 13—21.
680. Gooding R. H., Huang C.-T. Trypsin and chymotrypsin from the beetle Pterostichus melanarius.—J. Insect Physiol., 1969, vol. 15, p. 325—339.
681. Schlottke E. Untersuchungen fiber die Verdauungsfermente der Insekten.—Z. vergl. Physiol., 1937, Bd. 24, S. 210—247.
682. Greenberg B., Paretsky D. Proteolytic enzymes in the house fly, Musca domestica (L.).—Ann. Entomol. Soc. America, 1955, vol. 48, p. 46—50.
683. A1 e x a n d e г P., Hudson R. F. Wool: its chemistry and physics. L., Chapman and Hall Co., 1954. 240 p.
684. Powning R. F., Irzykiewicz H. Studies on the digestive proteinase of clothes moth larvae (Tineola bisseliella). I, II.—J. Insect Physiol., 1962, vol. 8, p. 267—284.
685. L i n d e r s t r0m - L a n g K., Duspiva F: Studies on enzymatic histochemistry. XVI.—Compt. Rend. La\ Carlsberg, 1936, t. 21, p. 53—83.
686. Mehr о tr a K. N. Properties of glycyl-glycine dipeptidase from S/-tophilus oryzae (L.).—J. Insect Physiol., 1965, vol. 11, p. 1179—1184.
687. Baker F. D., Paretsky D. Studies on the enzyme lipase in the housefly.—Arch. Biochem. Biophys., 1958, vol. 77, p. 328—335.
•688. Rockstein M., Kamal A. S. Distribution of digestive enzymes in the alimentary canal of larvae of flies of medical and veterinary importance.—Physiol. Zool., 1954, vol. 27, p. 65—70.
689. Young R. G. Digestion of wax by the greater wax moth, GalUria mellonella.—Ann. Entomol. Soc. Amer., 1964, vol. 57, p. 325—327.
690. Dadd R. H. Beeswax in the nutrition of the wax moth, Galleria mellonella (L.).—J. Insect Physiol., 1966, vol. 12, p. 1479—1492.
691. Dickmann A. Studies on the wax moth, Galleria mellonella, with particular reference to the digestion of wax by the larvae.—J. Cell. Compar. Physiol., 1933, vol. 3, p. 223—246.
692. Duspiva F. Ein Beitrag zur Kenntniss der Verdauung der Wachs-mottenraupen.—Z. vergl. Physiol., 1934, Bd. 21, p. 632—641.
693. Pierpont W. S. Polyphosphates excreted by wax moth larvae (Galleria mellonella Fabr.).—Biochem. J., 1957, vol. 67, p. 624—627.
694. W i g g 1 e s w о r t h V. B. Digestion in the cockroach. II.—Biochem. J., 1927, vol. 21, p. 797—811.'
695. W i g g 1 e s w о r t h V. B. Digestion in the cockroach. III.—Biochem. J., 1928, vol. 22, p. 150—161.
696. W i g g 1 e s w о r t h V. B. Digestion in the tsetse fly.—«Parasitology», 1931, vol. 21, p. 73—76.
697. Kamal A. S. Comparative studies of thirteen species of sarcosap-rophagous Calliphoridae and Sacrophagidae (Diptera). II.—Ann. Entomol. Soc. Amer., 1959, vol. 52, p. 167—173.
698. Гребельский С. Г. О физиологии питания личинок кожного овода (Oedemagena tarandi L.) северного оленя.—Докл. АН СССР, 1948, т. 60, с. 1461—1464.
699. Ауге G. L. The relationships between food and digestive enzymes in five species of ants (Hymenoptera: Formicidae).—«Canad. Entomol.», 1967, vol. 99, p. 408—411.
700. Stober W. K. Ernahrungsphysiologische Untersuchungen an Lepi-dopteren.—Z. vergl. Physiol., 1927, Bd. 6, 'S. 530—565.
701. Galun R., Fraenkel G. I. Physiological effects of carbohydrates in the nutrition of a mosquito, Aedes aegypti and two flies, Sarcophaga bul-
343
lata and Musca domestica.—J. Cell. Compar. Physiol., 1957, vol. 50, p. 1—23.
702. Schulze E.-F., Ehrhardt P. Nachweis kohlenhydratspaltender Fermente in Darmtrakt verschiedener Entwicklungsstadien von Diprion pint L. (Hym., Tenthredinidae).—Entomol. Exptl. Appl., 1963, t. 6, p. 114—122.
703. Штейнхауз Э. Микробиология насекомых. M., ИЛ, 1950. 768 с.
704. Штейнхауз Э. Патология насекомых. М., ИЛ, 1952, 840 с.
705. Aschner М., Ries Е. Das Verhalten der Kleiderlaus bei Ausschal-tung ihrer Symbionten.—Z. Morphol. Oekol. Tiere, 1933, Bd. 26, S. 529—590.
706. T о t h L., Wo 1 sky A., В a tori M. Stickstoffbindung aus der Luft bei den Aphiden und. bei den Homopteren (Rhynchota, Insecta).—J. Insect Physiol., 1942, Bd. 30, S. 67—73.
707. Grasse P.-P. Traite de zoologie. Paris, Masson et Cie Edit., 1952, t. 1, f. 1. 690 p.
708. Andrew B. Method and rate of protozoan refaunation in the termite Termopsis augusticollis Hagen.—Univ. Calif. Publ. Zool., 1930, vol. 33, p. 449—470.
709. Swezy O. The pseudopodial method of feeding by Trichonymphid Flagellates parasitic in wood-eating termites.—Univ. Calif. Publ. Zool., 1923, vol. 20, p. 391—400.
710. Жужиков Д. П., Коровкина H. M. К вопросу о питании термитов черноморского побережья СССР.— В кн.: Термиты и меры борьбы с ними. Ашхабад, «Ылым», 1968, с. 137—141.
711. Dickman A. Studies on the intestinal flora of termites with reference to their ability to digest cellulose.—Biol. Bull., 1931, vol. 61, p. 85—92.
712. Hungate R. F. Studies on the nutrition of Zootermopsis. I.—Zbl. Bakteriol., Parasitenk., Infektionskr. Hyg., 1936, Bd. 2, S. 240—249.
713. Grasse P.-Р., No i rot C. La transmission des flagelles symbio-tiques et les aliments des termites.—Bull. Biol. France et Belg., 1946, t. 79, p. 273—292.
714. Липке Г., Френкель Г. Питание насекомых.— В кн.: Современные проблемы энтомологии. Т. 1. М., ИЛ, 1956, с. 35—60.
715. Grab пег К. Е. Vergleichend-morphologische und physiologische Studien an Anobiiden und Cerambyciden-Symbionten.—Z. Morphol. OecoL Tie-re, 1954, Bd. 42, S. 471—528.
716. Pant N. C., Gupta P., Nay ar J. K. Physiology of intracellular symbiontes of Stegobium paniceum L. with special reference to amino acid requirements of the host.—«Experientia», 1960, t. 16, p. 311.
717. W i g g 1 e s w о r t h V. B. Symbyioses in blood-sucking insects.— Tidschr. Entomol., 1952, t. 95, s. 63—68.
718. Baines S. J. The role of the symbiotic bacteria in the nutrition of Rhodnius prolixus (Hemiptera).—J. Exptl. Biol., 1956, vol. 33, p. 533—541.
719. Brecher G., Wigglesworth V. B. The transmission of Actinomyces rhodnii Erikson in Rhodnius prolixus Stal (Hemiptera) and its influence on the growth of the host.—«Parasitology», 1944, vol. 35, p. 220—224.
ГЛАВА V
720. Олсуфьев H. Г. К микроскопической анатомии головы и пищеварительного тракта личинок Tabanus.— Паразитол. сб. Зоол. ин-та АН СССР, 1936, т. 6, с. 247—278.
721. Berridge М. J. The physiology of excretion in the cotton stainer, Dysdercus fasciatus Signoret. I.—J. Exptl. Biol., 1965, vol. 43, p. 511—521.
722. Гиляров M. С. Закономерности приспособлений членистоногих к жизни на суше. М., «Наука», 1970. 276 с.
723. W i g g 1 е s w о r t h V. В., Salpeter M. M. Histology of the mal-pighian tubules in Rhodnius prolixus Stal (Hemiptera).—J. Insect Physiol., 1962, vol. 8, p. 299—307.
724. Patton R., Gardner J., Anderson A. D. The excretory efficiency of the American cockroach Periplaneta americana L.—J. Insect Physiol., 1959, vol. 3, p. 256—261.
344
725. M a z z i V., В a с c e 11 i B. Richerche istochimiche e al microscopic elettronico sui tubi malpighiani di Dacus oleae Gmel. I.—Z. Zellforsch/ 1963, Bd. 59, S. 47—70.
726. M a z z i V., Baccetti B., Massimello G. Localizzazioni enzi-matiche nei tube malpighiani della larva di Dacus oleae Glem.—«Redia», 1962, t. 47, p. 99—103.
727. Berridge M. J. Metabolic pathways of isolated madpighian tubules of the blowfly functioning in an artificial medium.—J. Insect Physiol., 1966„ vol. 12, p. 1523—1538.
728. Phillips J. E. Rectal absorption and renal function in insects.— Trans. Roy. Soc. Canada, 1965, sec. 1—3, p. 237—254.
729. Philiptschenko J. A. Uber die Kopfdriisen der Thysanuren.—Z. wiss. Zool., 1907, Bd. 88, S. 99—116.
730. G a b e M. Donnees histologiques sur le rein cephalique des Thysa-noures (Insectes Apterygotes).—Ann. Soc. Entomol. France, 1967, t. 3, p. 681—713.
731. Edwards J. S. Diuretic function of the labial glands in adult giant silk moths, Hyalophora cecropia.—«Nature», vol. 203, p. 668—669.
732. Пучкова Л. В. Максиллярные железы полужесткокрылых, их функция и происхождение.— Зоол. журн., 1965, т. 44, с. 1801—1808.
733. Roth L. М. Uricose glands in the accessory sex gland complex of male Blattaria.—Ann. Entomol. Soc. Amer., 1967, vol. 60, p. 1203—1211.
734. Кузнецов H. Я. Основы физиологии насекомых. M.—Л., Изд-во АН СССР, 1953, т. 2, 402 с.
735. Charagozlow I. Ultrastructure et role des cellules a urates du tissu adipeux de Calotermes flavicollis Farbr.—Compt. Rend. Acad. Sci., 1963,. t. 256, p. 2229—2231.
736. Salkeld E. H. Histochemistry of the excretory system of the en-doparasitoid Aphaereta pallipes (Say) (Hymenoptera: Braconidae).—Canad. J. ZooL, 1967, vol. 45, p. 967—973.
737. Bernard G. R., F i x 1 e г D. E. Uric acid content of Drosophila melanogaster during and after metamorphosis.—«Physiol. Zool.», 1963, vol. 36, p. 244—249.
738. March al P. L’acide urique et la fonction tenale chez les inverteb-res.—Mem. Soc. Zool. France, 1890, t. 3, p. 31—87.
739. Nelson J. A. Morphology of the honey:bee larvae.—J. Agricult. Res., 1924, vol. 28, p. 1167—1214.
740. Hill D. L. Carbohydrate metabolism during embryonic development (Orthoptera).—J. Cell. Compar. Physiol., 1945, vol. 25, p. 205—216.
741. Поливанова E. H. Выделительная система и процессы экскреции в эмбриональном развитии клопов-щитников (Hemiptera, Pentatomoi-dea).— Журн. общ. биол., 1965, т. 26, с. 700—710.
742. Patton R. L. Excretion.— In: Insect physiology. Ed. by K- D. Roeder. N. Y.—L., John Wiley and Sons Inc., Chapman and Hall, 1953, p. 387—403.
743. T s u b о J., Brandt P. W. An electron microscopic study of the malpighian tubules of the grasshopper, Dissosteira Carolina.— J. Ultrastr. Res., 1962, vol. 6, p. 28—38
744. W i g g 1 e s w о r t h V. B. Insect physiology, N., Methuen and Co., 1950. 134 p.
745. Pajni H. R. Structure and metamorphosis of the malpighian tubules of Callosobruchus maculatus (F.) (Bruchidae: Coleoptera).—Res. Bull. Panjab. Univ., 1967, vol. 18, p. 61—67.
746; Patton R. L., Craig R. The rates of excretion of certain substances by the larvae of the mealworm, Tenebrio molitor L.—J. Exptl. Biol., 1939, vol. 81, p. 437—457.
747. Dressier M. Licht- und elektronenmikroskopische Untersuchungen der malpigischen Gefafie von Galerucella viburni (Chrysomelidae).— Z. wiss. Zool., 1968, Bd. 178, S. 40—71.
345
748. W i g g I e s w о г t h V. B. The physiology of excretion in a bloodsucking insect, Rhodnius prolixus (Hemiptera, Reduviidae). II.—J. Exptl. Biol., 1931, vol. 8, p. 428—442.
749. Bahadur J. The malpighian tubules of a blood-sucking insect, Cimex rotundatus (Hemiptera).—«Science and culture», 1964, vol. 30, p. 405—406.
750. Bahadur J. The malpighian tubules of certain terrestrial, plantfeeding bugs.— Zool. Anz., 1965, Bd. 175, S. 387—395.
751. Wessing A., Eichelberg D. Elektronenoptische Untersuchungen an den Nierentubuli (malpighische Gefafie) von Drosophila melanogaster. I.—Z. Zellforsch., 1969, Bd? 101, S. 285—322.
752. Berridge M. J., Oschman J. L. A structural basis for fluid secretion by malpighian tubules.—«Tissue and cell», 1969, vol. l,p. 247—272.
753. Srivastava P. N. Physiology of excretion in the larva of Corcyra cephalonica Stainton (Lepidoptera, Pyralidae).— J. Insect Physiol., 1962, vol. 8, p. 223—232.
754. Ramsay J. A. Excretion by the malpighian tubules of the stick insect, Dixippus morosus (Orthoptera, Phasmidae): calcium, magnesium, chloride, phosphate and hydrogen ions.—J. Exptl. Biol., 1956, vol. 33, p. 697—708.
755. RamsaSy J. A. Excretion by malpighian tubules of the stick insect. Dixippus morosus (Orthoptera, Phasmidae): amino acids, sugars and urea.— J. Exptl. Biol., 1958, vol. 35, p. 871—891.
756. Stobbart R. H., Shaw J. Salt and water balance: excretion.— In: The physiology of insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1964, vol. 3, p. 189—258.
757. Ramsay J. A. Active transport of potassium by the malpighian tubules of insects.— J. Exptl. Biol., 1953, vol. 30, p. 358—369.
758. Berridge M. J. Urine formation by the malpighian tubules of Calliphora. I.— J. Exptl. Biol., 1968, vol. 48, p. 159—174.
759. M a d d г e 11 S. H. Secretion by the malpighian tubules of Rhod-nius.— J. Exptl. Biol., 1969, vol. 51, p. 71—97.
760. Buck J. B. Physical properties and chemical composition of insect blood.— In: Insect physiology. Ed. by K. D. Roeder. N. Y.— L., John Wiley and Sons Inc., Chapman and Hall, 1953, p. 147—190.
761. W i g g 1 e s w о r t h V. B. The physiology of excretion in a blood sucking insect, Rhodnius prolixus (Hemiptera, Reduviidae). III.— J. Exptl. Biol., 1931, vol. 8, p. 443—451.
762. Ramsay J. A. The excretion of sodium and potassium by the malpighian tubules of Rhodnius.— J. Exptl. Biol., 1952, vol. 29, p. 110—126.
763. Wigglesworth V. B. The physiology of excretion in a blood sucking insect, Rhodnius prolixus (Hemiptera, Reduviidae). I. J. Exptl'. Biol., 1931, vol. 8, p. 411—427.
764. Harrington J. S. Studies of the amino acids of Rhodnius prolixus. II.—«Parasitology», 1961, vol. 51, p. 319—326.
765. Miles P. W. A modification of Wigglesworth’s model for the excretion of uric acid in insects, in the light of modern hypotheses of ion transport.—J. Theor. Biol., 1966, vol. 12, p. 130—132.
766. Ramsay J. A. The excretory system of the stick insect, Dixippus morosus (Orthoptera, Phasmidae).—J. Exptl. Biol., 1955, vol. 32, p. 183—199.
767. Maddrell S. H. P. Excretion in the blood-sucking bug, Rhodnius prolixus StaL I.—J. Exptl. Biol., 1963, vol. 40,’ p. 247—256.
768. Maddrell S. H. P. Excretion in the blood-sucking bug, Rhodnius prolixus Stal. II.—J. Exptl. Biol., 1964, vol. 41, p. 163—176.
769. Maddrell S. H. P. The site of release of the diuretic hormone in Rhodnius prolixus.—J. Exptl. Biol., 1966, vol. 45, p. 499—508.
770. Maddrell S. H. P. Excretion in the blood-sucking bug, Rhodnius prolixus Stal. III.—J. Exptl. Biol., 1964, vol. 41, p. 459—472.
771. Berridge M. J. The physiology of excretion in the cotton stainer, Dysdercus fasciatus Signoret. IV.—J. Exptl. Biol., 1966, vol. 44, p. 553—566.
772. Nunez J. A. Untersuchungen fiber die Regelung des Wasserhaus-
346
haltes bei Anisotarsus cupripennis Germ.—Z. vergl. Physiol., 1956, Bd. 38, S. 341—354.
773. G i r a r d i e A. Contribution a 1’etude du controle du metabolisme de 1’eau chez Gryllus bimaculatus (Orthoptere).—Compt. Rend. Acad. Sci., 1966, ser. D, t. 262, p. 1361—1364.
774. Mills R. Hormonal control of excretion in the American cockroach. I.—J. Exptl. Biol. 1967, vol. 46, p. 35—41.
775. Wall B. J., Ralph C. L. Evidence for hormonal regulation of mal-pighian tubule excretion in the insect Periplaneta americana (L.)—«Gen. Compar. Endocrinol.», 1964, vol. 4, p. 452—456.
776. M о r d u e W. Hormonal control of malpighian tube and rectal function in the desert locust, Schistocerca gregaria.—J. Insect Physiol., 1969, vol. 15, p. 273—285.
777. Wall B. J. Regulation of water metabolism by the malpighian tubules and rectum in the cockroach Periplaneta americana L.—Zool. Jahrb., 1965, Abt. 1, Bd. 71, S. 702—709.
778. Wall B. J. Evidence for antidiuretic control of rectal water absorption in the cockroach Periplaneta americana L.—J. Insect Physiol., 1967, vol. 13, p. 565—578.
779. R а о К. P., Gopalakrishnareddy T. Nitrogen excretion in arachnids.—«Compar. Biochem. Physiol.», 1966, vol. 7, p. 175—178.
780. Anderson J. F. The excreta of spiders.—«Compar. Biochem. Physiol.», 1966, vol. 17, p. 973—982.
781. Bur sell E. The excretion of nitrogen in insects.— Adv. Insect Physiol., 1967, voi. 4, p. 33—67.
782. Hubert M. Contribution a 1’etudc de i’cxcretion chez les Myriapo-des (Progoneates et Opisthogoneatcs).—Arch. Sci. Physiol., 1968, t. 22, p. 93—109.
783 M i 11 i n N., Vickers D. H., Gast R. T. Estimation of nitrogenous compounds in the feces of boll weevils, Anthonomus grandis, fed different diets.—Ann. Entomol. Soc. Amer., 1964, vol., 57, p. 757—759.
784. Forrest H. S., Glassman E., Mitchell H. K. Conversion of 2-amino-4-hydroxypteridine to isoxanthopterin in D. melanogaster.—«Science», 1956, vol. 124, p. 725—726.
785. Berridge M. J. The physiology of excretion in the cotton stainer, Dysdercus fasciatus Signoret. III.—J. Exptl. Biol., 1965, vol. 43, p. 535—552.
786. Srivastava P. N., Varshney R. K. Composition of the honeydew excreted by the lac insect, Kerria lacca (Homoptera: Coccoidea). I.—«Entomol. Exptl. Appl.», 1966, t. 9, p. 209—212.
787. Проссер Л., Браун Ф. Сравнительная физиология животных. М., «Мир», 1967, 766 с.
788. Inokuchi Т., Н о г i е Y., I fo Т. Urea cycle in the silkworm, Bombyx, mori.—Biochem. Biophys. Mes. Comm., 1969, vol. 35, p. 783—787.
789. Brown A. W. A. The nitrogen metalolism of an insect (Lucilia se-ricata Meig.). II.—Biochem. J., 1938, vol. 32, p. 903—911.
790. Brown A. W. A. The nitrogen metabolism of an insect (Lucilia se-ricata Meig.). I.—Biochem. J., 1938, vol. 32, p. 895—902.
791. Nation J. L., ThomasK. K. Quantitative studies on purine excretion in the greater wax moth, Galleria mellonella.—Ann. Entomol. Soc. Amer., 1965, vol. 58, p. 883—885.
792. R a z e t P. Sur I’elimination simultanee d’acide urique et d’acide al-lantoique chez les insectes.—Compt. Rend. Acad. Sci., 1956, t. 243, p. 185— 187.
793. R a z e t P. Sur I’elimination d’acide allantoique par quelques insectes lepidopteres.—Compt. Rend. Acad. Sci., 1954, t. 239, p. 905—907.
794. Marshall A. T. Spittle-production and tube-building by cercopoid larvae (Homoptera). IV.—J. Insect Physiol., 1966, vol. 12, p. 635—644.
795. Гринфельд Э. К. Происхождение антофилии у насекомых. Изд-во Ленингр. ун-та, 1961. 186 с.
347
796. Zoebelin G. Ein Honigtau als Nahrung der Insekten.—Z. angew. Entomol., 1956, Bd. 38, S. 369—416.
797. Lamb К. P. Composition of the honeydew of the aphid Brevycorine brassicae (L.) "feeding on swedes {Brassica napobrassica De.).—J. Insect Physiol., 1959, vol. 3, p. 1—13.
798. P о w n i n g R. F. The excretion of elementary sulphur by clothes moth larvae Tineola bisselliella.—J. Insect Physiol./1962, vol. 8, p. 93—95.
799. Uvarov В. P. Insect nutrition and metabolism.—Trans. Roy. Soc. L., 1928, vol. 76, p. 255—343.
800. Waterhouse D. F. Studies of the physiology and toxicology of blowflies. XIV.—Austr. J. Biol. Res., 1950, ser. B, vol. 3, p. 76—112.
ГЛАВА VI
801. Klein M. G., С о p p e 1 H. C. Hemocytopoietic organs in larvae of the introduced pine sawfly, Diprion similis.—Ann. Entomol. Soc. Amer., 1969, vol. 62, p. 1259—1261.
802. Hoffmann J. Les organes hematopoietiques de deux insectes ort-hopteres: Locusta migratoria et Gryllus bimaculatus.—Z. Zellforsch., 1970, Bd. 106, S. 451—472.
803. Hoffmann J. A., Porte A., Joly P. L’hematopoiese chez les insectes orthopteres.—Compt. Rend. Soc. BioL France et Belg., 1969(1970), t. 163, p. 2701—2704.
804. Jones J. C. The circulatory system of insects.—In: The physiology of insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1964, vol. 3, p. 2— 107.
805. Beard R. L. Circulation.—In: Insect physiology. Ed. by K- D. Roeder. N. Y.—L., Johh Wiley and Sons Inc., Chapman and Hall, 1953, p. 232— 272.
806. Coon B. F. Effects of paralytic insecticides on heart pulsations and circulation of the blood in the American cockroach.—J. Econ. Entomol., 1944, vol. 37, p4 785—789.
807. Eidmann H. Lehrbuch der Entomologie. Berlin, P. Parey, 1941. 560 S.
808, Petrunkevitch A. An inquiry into natural classification of spiders based on study of their internal anatomy.—Trans. Connect. Acad. Arts Sci., 1933, vol. 31, p. 299—389/
809. С a г u s C. G. An introduction to the comparative anatomy of animal's.) L., Longman and Co., 1827. 232 p.
810. Cuthrie D. M. Control of the ventral diaphragm in an insect.— «Nature», 1962, vol. 196, p. 1010—1012.
811. Pawlowa M. Ueber ampullenartige Bluteiregulationsorgane im Kopfe verschiedener Orthopteren.—Anat. Anz., 1895, Bd. 18, S. 7—10.
812. Crozier W. J., Stier T. J. B. Temporal characteristic for locomotor activity in tent caterpillars.—J. Gen. Physiol., 1927, vol; 9, p. 121 —135.
813. Richardson С. H. The pulsatile vessels in the legs of Aphidi-dae.—«Psyche», 1918, vol. 25, p. 15—17.
814. Sutcliffe D. M. The chemical composition of haemolymph in insects and some other arthropods, in relation to their phylogeny.—«Compar. Biochem. Physiol.», 1963, vol. 9, p. 121 —135.
815. Shaw J., Stobbart R. H. Osmotic and ionic regulation in insects.— Adv. Insect Physiol., 1963, vol., 1, p. 315—399.
816. Stobbart R. H., Shaw J. Salt and water balance: excretion.— In: The Physiology of Insecta. Ed. by M. Rockstein N. Y.— L., Acad. Press, 1964, vol. 3, p. 189—258.
817. Schaller F. Osmoregulation und Wasserhaushalt der Larve von Corethra plumicornis mit besonderer Beriicksichtigung der Vorgange am Darmkanal.—Z. vergl. Physiol., 1949, Bd. 31, S. 684—695.
818. Treherne J. E. Osmotic regulation in the larvae of Helodes (Co-
348
leoptera, Helodidae).— Trans. Roy. Entomol. Soc., 1954, vol. 105, p. 117— 130.
819. W i g g 1 e s w о r t h V. B. Regulation of osmotic concentration and chloride in blood of mosquito larvae.—J. Exptl. Biol., 1938, vol. 15, p. 236— 247.
820. Sutcliffe D. W. Osmotic regulation- in the larvae of some euryhaline Diptera.—«Nature», 1960, vol. 187, p. 331—332.
821. Neumann D. Osmotische Resistenz und Osmoregulation aquatis-cher Chironomidenlarven.—Biol. Zbl., 1961, Bd..8O, S. 693—715.
822. N e m e n z H. On the osmotic regulation of' the larvae of Ephydra cinerea.—J. Insect Physiol., 1960, vol. 4, p. 38—44. .
823. Moens J. Ionic regulation in the larvae of the dragonfly Inschnura elegans (Vanderlinden) (Odonata; Zygoptera).—Arch. Intern. Physiol. Bio-chim., 1967, t. 75, p. 57—64.
824. Sutcliffe D. W. Studies on the biology of some salt-marsch insects. Ph. diss, thesis. King’s College Univer. Durham, 1959. 112 p.
825. Stobbart R. H. Studies on the exchange and regulation of sodium in the larvae of Aedes aegypti (L.-). II.—J. Exptl. Biol., 1960, vol. 37, p. 594—608.
826. Koch H. J. Absorption of chloride ions by anal papillae of Diptera larvae.—J. Exptl. Biol., 1938, vol. 15, p. 152—160.
827. Ramsay J. A. Exchange of sodium and potassium im mosquito larvae.—J. Exptl. Biol., 1953, vol. 30, p. 79—89.
828. Sohal R. S., Copeland E. Ultrastructural variations in the anal papillae of Aedes aegypti (L.) at different environmental salinities.—J. Insect Physiol., 1966, vol. 12, p. 429—434.
829. Shaw J. Ionic regulation and water balance in the aquatic larva of Sialis lutaria.—J. Exptl. Biol., 1955, vol. 32, p. 353—382.
830. Ramsay J. A. Osmotic regulation in mosquito larvae: the role of the malpighian tubules.—J. Exptl. BioL, 1951, vol. 28, p. 62—73.
831. Ramsay J. A. The excretion of sodium, potassium and water by the malpighian tubules of the stick insect Dixippus morosus (Orthoptera, Piasmidae).—J. Exptl. Biol., 1955, vol. 32, p. 200—216.
832. Phillips J. E. Rectal absorption and renal function in insects.— Trans. Roy. Soc. Canada, 1965, sec. 1—3, p. 237—254.
833. Duchateau G., Florkin M., Leclercq J. Concentrations des bases fixes et types de composition de la base totale de 1’hemolymphe des insectes.—Arch. Intern. Physiol. Biochim., 1953, t. 61, p. 271—279.
834. Sutcliffe D. W. The composition of haemolymph in aquatic insects.—J. Exptl. Biol., 1962, vol. 39, p. 325—344.
835. Bone G. J. Le rapport sodium/potassium dans le liquide coelomi-que des insectes. I.—Ann. Soc. Moy. Zool. Belg., 1944, t. 75, p. 123—132.
836. Bone G. J. Regulation of the sodium/potassium ratio in insects.— «Nature», 1947, p. 160, p. 679.
837. Tobias J. M. Potassium, sodium and water interchange in irritable tissues and haemolymph of an omnivorous insect Periplaneta americana.— J. Cell. Compar. Physiol., 1948, vol. 31, p. 125—148.
838. F 1 о г к i n M., Jeuniaux C. Haemolymph: composition.—In: The physiology of insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1964, vol. 3, p. 110—152.
839. Levenbook L. The composition of horse bot fly (Gastrophilus intest inalis) larva blood.—Biochem. J., 1950, vol. 47, p. 336—346.
840. Pi ch on Y. La teneur en ions Na+, K+ et Ca + + de 1’hemolymphe de Periplaneta americana L.; ses variations.—Bull. Soc. Scient. Bretagne, Sci. math, et natur, 1963 (1965), t. 38, p. 147—158.
841. Evans D. R., Dethier V. G. The regulation of taste thresholds for sugars in the blowfly.—J. Insect Physiol., 1957, vol. 1, p. .3—17.
842. Wimer L. T. A comparison of the carbohydrate composition of the hemolymph and fat body of Phormia regina during larval development.— «Compar. Biochem. Physipl.», 1969, vol. 29, p. 1055—1062.
349
843. М о c h п а с к a I., Petryszyn C. Trehalose in Celerio euphor-biae.—Acta Biochim. Pol., 1959, t. 6, p. 307—311.
844. Maurizio A. Untersuchungen fiber das Zuckerbild der Hamolymp-he der Honigbiene (Apis mellifera). I.—J. Insect Physiol., 1965, vol. 11, p. 745—763.
845. Wyatt G. R. The biochemistry of sugars and polysaccharides in insects.—Adv. Insect Physiol., 1967, vol. 4, p. 287—360.
846. Clegg J. S., Evans D. R. The physiology of blood trehalose and its function during flight in the blowfly.—J. Exptl. Biol., 1961, vol. 38, p. 771—792.
847. Sacktor B., Wormser-Shavit E. Regulation of metabolism in working muscle in vivo. I.—J. Biol. Chem., 1966, vol. 241, p. 624—631.
848. Friedman S. Inhibition of trehalase activity in the hemolymph of Phortnia regina.—Arch. Biochem. Biophys., 1961, vol. 93, p. 550—554.
849. Chang С. K., Liu F., Feng H. Metabolism of eri-silkworm during metamorphosis. II.—Acta Entomol. Sin., 1964, vol. 13, p. 494—502.
850. F1 о г к i n M., Jeuniaux C. Metabolisme du trehalose et du glycogene chez le ver a soie, en relation avec la mue, le filage et les metamorphoses.—Bull. Cl. Sci. Acad. Roy. Belg., 1965, t. 51, p. 541—552.
851. Salt R. W. Role of glycerol in producting abnormally low supercooling and freezing points in an insect, Bracon cephi (Gahan).—«Nature», 1958, vol. 181, p. 1281.
852. Dubach P., Smith F., Pratt D. e. a. Possible role of glycerol in the winter-hardiness of insects.—«Nature», 1959, vol. 184, p. 288—289.
853. Wyatt G. R., Meyer W. L. The chemistry of insect hemolymph. Ill—J. Gen. Physiol., 1959, vol. 42, p. 1005—1011.
854. Somme L. Effect of glycerol on cold-hardiness in insects.—Canad. J. Zool., 1964, vol. 42, p. 87—101.
855. S i а к о t о s A. N. The conjugated plasma proteins of the American cockroach. I.—J. Gen. Physiol., 1960, vol. 43, p. 999—1013.
856. Chino H., Gilbert L. I. Lipid release and transport in insects. —Biochim. Biophys. Acta, 1965, t. 98, p. 94—110.
857. Gilbert L. Lipid metabolism and function in insects.—Adv. Insect Physiol., 1967, vol. 4, p. 69—211.
.858 . W 1 о d a w e r P., Lagwinnska E., В a r a n s к a J. Esterification of fatty acids in the wax moth haemolymph and its possible role in lipid transport—J. Insect Physiol., 1966, vol. 12, p. 547—560.
859. Martin J. S. Studies on assimilation, mobilization, and transport of lipids by the fat body and haemolymph of Pyrrhocoris apterus.—J. Insect Physiol., 1969, vok 15, p. 2319—2344.
860. Beenakkers A. M. T. Transport of fatty acids in Locusta migra-ioria during sustained flight.—J. Insect Physiol., 1965, vol. 11, p. 879—888.
861. Duchateau C., Florkin M. A survey of aminoacidemias with special reference to the high concentration of free aminoacids in insect hemolymph.—Arch. Intern. Physiol., 1958, vol. 66, p. 573—591.
862. Harington J. S. Studies of amino acids of Rhodnius prolixus. I—«Parasitology», 1961, vol. 51, p. 309—318.
863. Chen P. S., Haniman F. lonenaustausch-chromatographische Untersuchungen uber die freien Aminosauren und Derivate wahrend der Entwicklung von Drosophila melanogaster.—Z. Naturforsch., 1965, Bd. 20, Ser. B, S. 307—312.
864. В anks W. M., Randolph E. F. Free amino acids in the cockroach Blaberus giganteus.—Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 1027— 1028.
865. A u с 1 a i r J. L. The influence of dietary amino acids on the blood amino acids of the German cockroach, Blatella germanica.—J. Insect Physiol., 1959, vol. 4, p. 127—131.
866. Agrell I. Occurence and metabolism of free amino acids during insect metamorphosis.—Acta Physiol. Scand., 1949, t. 23, p. 179—186.
067. Chen P. S., Kuhn A. Vergleichende Untersuchungen der freien
350
Aminosauren und Peptide wahrend der Raupen- und Puppenentwicklung ver-schiedener Genotypen von Ephestia kuhniella.—Z. Naturforsch., 1956, Ser. B, Bd. 11, S. 305—314.
868. Chen P. S. Studies on protein metabolism of Culex pipiens. L. I — J. Insectf PhysioL, 1958, vol. 2, p. 38—51.
869. Chen P. S. Amino acid and protein metabolism in insect development.—Adv. Insect PhysioL, 1966, vol. 3, p. 53—132.
870. К n о r r e D. Untersuchungen fiber die freien Aminosauren der Ha-molymphe von Periplaneta americana (L.) in Beziehung zu verschiedenen Entwicklungs- und Funktionsphasen.—Zool. Jahrb., 1967, Abt. 1, Bd. 73, S. 1—48.
871. WangC. M., Patton R. L. Nitrogenous compounds in the hemolymph of the cricket, Acheta domesticus.—J. Insect PhysioL, 1969, vol. 15, p. 543—548.
872. Jeuniaux C. Hemolymph—Arthropoda.—In: Chemical zoology.
N. Y.—L., Acad. Press, 1971, vol. 2, p. 64—118.
873. Pickett C., Friend W. G. Free amino acids in the hemolymph of Rhodnius prolixus Stahl (Hemiptera: Reduviidae).—Canad. J. ZooL, 1966, vol. 44, p. 241—249.
874. Bricteux-Gregoire S., Duchateau G., Florkin M., e. a. Contributions a la biochimie du ver a soie. X.— Arch. Intern. Physiol: Biochim., 1959, t. 67, p.'586—596.
875. В r i c t e u x - G r e g о i r e S., Florkin M., Jeuniaux C. Contri-Contributions a la biochimie du ver a soie. X.— Arch. Intern. Physiol. Biochim., 1959, t.‘ 67, p. 182—184.
876. Bricteux-Gregoire S., Dewan dre A., Flor к in M. Contribution^ a la biochimie du ver a soie. XVI.—Arch. Intern. PhysioL Biochim., 1960, t. 68, p. 281—284.
877. А м б a p ц у м о в а С. И., Мамедпиязов О. Н., Филиппо-в и ч Ю. Б. Изменения содержания свободных аминокислот в некоторых тканях и органах контрастных по продуктивности пород тутового шелкопряда.— Изв. АН Туркм. ССР, 1968, сер. биол. наук, т. 3, с. 3—И.
878. Chen Р. S. Studies on the protein metabolism of Culex pipiens L. IV.—J. Insect PhysioL, 1963, vol. 9, p. 453—462.
879. Geiger H. R. Untersuchungen fiber freie Aminosauren wahrend der Adultentwicklung von Culex pipiens und Culex fatigans und deren Einfluss auf die Eireifung.—Rev. Suisse Zool., 1961, vol. 65, p. 583—626.
880. Kaplan W. C., Holden J. T., H о c h m a n B. Occurence of unequal amounts of free methionine in male and female Drosophila tnelanogas-tei.—«Science», 1958, vol. 127, p. 473—474.
881. Mitchell H. K., Simmons J. R. Amino acids and derivatives in Drosophila.—In: Amino acid pools. Ed. by J. T. Holden. Amsterdam, Elsevier, 1962, p. 136—146.
882. Bodnaryk R. P., Levenbook L. The role of fi-alanyl-/-tyrosine (sarcophagine) in puparium formation in the fleshfly Sarcophaga bullata.— «Compar. Biochem. Physiol.», 1969, vol. 30, p. 909—921.
883. L e v e n b о ok L., Bodnaryk R. P., Spande T. F. fi-Alanyl-L tyrosine. Chemical synthesis, properties and occurence in larvae of the fleshfly Sarcophaga bullata Parker.—Biochem. J., 1969, vol. 113, p. 837—841.
884. Bodnaryk R. P. Biosynthesis of gamma-L-glutamyl-L-phenylala-nine by the larva of the housefly Musca domestica.—J. Insect PhysioL, 1970, vol. 16, p. 919—929.
885. F 1 о r k i n M. Sur la teneur du plasma sanguin des insectes en pro-teines, acide urique et CO2 total.—Arch. Intern. PhysioL Biochim., 1937, t. 45, p. 241—246.
886. Denuce J. M. lonenelektrophoretische Untersuchungen der Hamo-lymphe-Proteine von Insekten in verschiedenen Stadien der Larvenentwick-lung.—Z. Naturforsch., 1958, Ser. B, Bd. 13, S. 215—218.
887. Филиппович Ю. Б., Алиева1 M. И. Белковые фракции в ге-
351
молимфе Bombyx mori L. в зависимости от фазы развития и пола.— Жури, общ. биол., 1966, т. 27, с. 489—495.
888. Wang С. М., Patton R. L. The separation and characterization of the haemolymph proteins of several insects.—J. Insect Physiol., 1968, vol. 14, p. 1069—1075.
889. Lensky Y., Alumot E. Proteins in the spermathecae and haemolymph of the queen bee (Apis mellifica L. var. ligustica Spin.).—«Compar. Biochem. Physiol.», 1969, vol. 30, p. 569—575.
890. Schmidt G. H. Elektrophoretische Fraktionierung der Hamolymp-he-proteine von Formica polyctena Foerster (Hymenoptera).— J. Insect Physiol., 1965, vol. 11, p. 71—77.
891. Bosman T. Insect plasma proteins: a preliminary study of their taxonomic significance.—S.-Afrik. Tydskr. Landbouwetensk., 1965, t. 8, p. 371—379.
892. Salkeld E. H. Electrophoretic patterns of egg proteins from several insect taxa.—«Canad. Entomol.», 1969, vol. 101, p. 1256—1265.
893. Marty R., Zalta J.-P. Variations intraspecifiques qualitatives et quantitatives des proteines de 1’hemolymphe de Cophopodisma pyrenaae (Fisch.), (Orthoptere, Catantopidae) en fonction des aires biogeographiques. —Compt. Rend. Acad. Sci., 1967, ser. D, t. 264, p. 643—646.
894. Tobe S. S., Lough ton B. G. The development of blood proteins in the African migratory locust.—Canad. J. Zool., 1967, vol. 45, p. 975—984.
895. Fox F. R., M i 11 s R. R. Changes in haemolymph and cuticle proteins during the moulting process in the American cockroach.—«Compar. Biochem. Physiol.», 1969, vol. 29, p. 1187—1195.
896. McCormick F. W., Scott A. A protein fraction in locust hemolymph associated with the moulting cycle.—«Experientia», 1966, t. 22, p. 228— 229.
897. Ch.en P. S., Le venbook L. Studies on the haemolymph proteins of the blowfly Phormia regina. I.—J. Insect Physiol., 1966, p. 12, p. 1595— 1609.
898. Алиева M. И., Филиппович Ю. Б. Изменения аминокислотного состава белков гемолимфы тутового шелкопряда во время завивки кокона и метаморфоза.— Науч. докл. высш, школы, 1967, сер. биол. наук, вып. 1. с. 41—47.
899. Алиева М. И., Филиппович Ю. Б. Изменения аминокислотного состава белковых фракций гемолимфы тутового шелкопряда во время завивки кокона и метаморфоза.— Науч. докл. высш, школы, 1968, сер. биол. наук, вып. 3, с. 53—57.
900. М u n n Е. A., Price,G. М., Greville G. D. The synthesis in vitro of the protein calliphorin by fat from the larva of the blowfly, Calliphora erythrocephala.—J. Insect Physiol., 1969, vol. 15, p. 1601—1605.
901. Chippendale G. M., Kilby B. A. Relationship between the proteins of the haemolymph and fat body during development of Pieris brassi-cae.—J. Insect Physiol., 1969, vol. 15, p. 905—926.
902. Tel f er W. H., Williams С. M. The effect of diapause, development and injury in the incorporation of radioactive glycine into the blood proteins of the cecropia silkworm.—J. Insect Physiol., 1960, vol. 5, p. 61—72.
903. Chippendale G. M., Beck S. D. Haemolymph proteins of Ost-rinia nubilallis during diapause and prepupal differentiation.—J. Insect Physiol., 1966, vol. 12, p. 1629—1638.
904. Scheurer R. Haemolymph proteins and yolk formation in the cockroach Leucophaea maderae.—J. Insect Physiol., 1969, vol. 15, p. 1673— 1682.
905. Teller W. -H., Melius M. E. The mechanism of blood protein uptake by insect oocytes.—«Amer. Zool.», 1963, vol. 3, p. 185—191.
906. Engelmann F. Female specific protein: biosynthesis controlled by corpus allatum in Leucophaea maderae.—«Science», 1969, vol. 165, p. 407— 409.
907. Scheurer R. Endocrine control of protein synthesis during oocyte
352
maturation in the cockroach Leucophaea maderae.—J. Insect Physiol., 1969, vol. 15, p. 1411—1419.
908. Brookes V. J. The induction of yolk protein synthesis in the fat body of an insect, Leucophaea maderae, by an analog of the juvenile hormone.—Develop. BioL, 1969, vol. 20, p. 459—471.
909. Coles G. C. Haemolymph proteins and yolk formation in Rhodnius prolixus Stal.—J. Exptl. Biol., 1965, vol. 43, p. 425—431.
910. Adiyodi K. G., Nay ar К. K. The conjugated plasma proteins in adult females of Perpilaneta americana (L.) under starvation and other stress.—«Compar. Biochem. Physiol.», 1968, vol. 27, p. 95—104.
911. Prota C. D. Enzymes in the hemolymph of the mealworm. Tenebrio molitor Linnaeus.—J. New York Entomol. Soc., 1961, vol. 69, p. 59—67.
912. M о p и г В., Месснер Б. Значение лизоцима в антибактериальном иммунитете насекомых.— Журн. общ. биол., 1969, т. 30, с. 62—71.
913. Weber R. Е. Aspects of haemoglobin function in the larvae of the-midge, Chironomus plumosus L.—Proc. KoninkL Nederl. Akad. Wet., 1963, ser. C, t. 66, p. 284—295.
914. Keilin'D. Respiratory systems and respiratory adaptations in larvae and pupae of Diptera.—«Parasitology», 1944, vol. 36, p. 1—66.
915. Hungerford H. B. Oxyhaemoglobin present in the backswimmer, Buenoa margaritacea Bueno.— «Canad. Entomol.», 1922, vol. 54, p. 262—263.
916. Miller P. L. The possible role of haemoglobin in Anisops and Buenoa (Hemiptera: Notonectidae:.—Proc. Roy. Entomol. Soc. L., 1964, ser. A, vol. 39, p. 166—175.
917. Miller P. L. The function of haemoglobin in relation to the maintenance of natur neutral buoyancy in Anisops pellucens (Notonectidae, Hemiptera).—J. Exptl. BioL, 1966, vol. 44, p. 529—543.
918. Keil in D., Wang Y. L. Haemoglobin of Gastrophilus. Purification and properties.—Biochem. J., 1946, vol. 40, p. 855—866.
919. Braunitzer G., Braun V. Zur Phylogenie des Hamoglobinmo-lekiils. Untersuchungen an Insekten—Hamoglobinen (Chironomus thummi).— Hoppe-Seyler’s Z. physiol. Chem., 1965, Bd. 340, S. 88—91.
920. Manwell C. Starch gel electrophoresis of the multiple haemoglobins of small and large larval Chironomus— a developmental haemoglobin’ sequence in an invertebrate.—J. Embryol. Exptl. Morphol., 1966, vol. 16, p. 259—270.
921. Braunitzer G., В use G., Braig S. Polygene Struktur der In-sekten-Hamoglobine.—«Naturwissenschaften», 1969, Bd. 56, S. 215.
922. Синица' T. Я. К биологии некоторых иловых Chironomidae.— Вестн. Моск, ун-та, сер. 6, биол., 1937, т. 9, с. 162—185.
923. Lindermann R. L. Experimental stimulation of winter anaero-biosis in a senescent lake.—«Ecology», 1942, vol. 23, p. 1—13.
924. Harnisch O. Primare und sekundare Oxybiose der Larve von Chironomus.—Z. vergl. Physiol., 1936, Bd. 23, S. 391—419.
925. Лавровский В. А. Об участии гемоглобина в транспорте кислорода у личинок хирономия.— Журн. общ. биол., 1966, т. 27, с. 128—130.
926. Smith Н. W. The blood of the cockroach Periplaneta americana L. —New Hampshire Agric. Exptl. Sta. Techn. Bull. 1938, vol. 71, p. 1—23.
927. T i 11 у a r d R. J. The biology of dragonflies (Odonata or Paraneo-ptera). Cambridge Univ. Press, 1917. 396 p.
928. Arvy L. Donnees sur la leucopoiese chez Musca domestica L.— Proc. Roy. Entomol. Soc. L., 1954, ser. A, vol. 29, p. 39—41.
929. Ferri M. D., Tokumaru M., Worsmann T. U. Morfologia dos hemocitos de «Rhynchosciara angelae» Nonato a Pavan, 1951, (Diptera, Mycetophilidae).—Rev. Brasil. BioL, 1968, t. 28, p. 225—234.
930. J о n e s J. C., Liu D. P. Total and differential hemocyte counts of Rhodnius prolixus Stal.—Bull. Entomol. Soc. Amer., 1961, vol. 7, p. 166.
931. Feir D. Haemocite counts in the large milkweed bug, Oncopeltus fasciatus.—«Nature», 1964, vol. 202, p. 1136—1137.
932. Feir D., McClain E. Mitotic activity of the circulating hemocy
353:
tes of the large milkweed bug, Oncopeltus fasciatus.—Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 413—416.
933. Tauber О. E., Yeager J. E. On the total hemolymph (blood) cell counts of insects. II.—Ann. Entomol. Soc. Amer., 1936, vol. 29, p. 112— 118.
934. Jones J. C. Current concept Concerning "insect hemocytes.—«Amer. Zool.», 1962, vol. 2, p. 209—246.
935. Munson S. C. The hemocytes, pericardial cells, and fa*t body.— In: Insect physiology. Ed. by K. D. Roeder. N. Y.—L., John ’Wiley and Sons Inc., Chapman and Hall, 1953, p. 218—231.
936. Clark R. M., Harvey W. R. Cellular membrane formation by plasmocytes of diapausing Cecropia pupae.—J. Insect Physiol., 1965, vol. 11, p. 161—175.
937. Gupta A. P., Sutherland D. J. In vitro transformations of the insect plasmocyte in some insects'—J. Insect Physiol., 1966, vol. 12, p. 1369— 1375.
938. Jones J. C. A phase contrast study of the blood cells of the adult cockroach Periplaneta americana (L.)—Anat. Rec., 1957, vol. 128, p. 571.
939. Gupta A. P., Sutherland D. J. Phase contrast and histochemical studies of spherule cells in cockroaches (Dictyoptera).—Ann. Entomol. Soc. Amer., 1967, vol. 60, p. 557—565.
940. Yeager J. E. The blood picture of the southern armyworm (Pro-denia eridania).—J. Agricult. Res., 1945, vol. 71, p. 1—40.
941. Mizki M. T. M., Rizki R. M. Functional significance of the crystal cells in the larva of Drosophila melanogaster.—J. Biophys. Biochem., Cytol., 1959, vol. 5, p. 235—240.
942. Kramer S., Wigglesworth V. B. The outer layers of the cuticle in the cockroach Periplaneta americana and the functions of the oenocytes.—Quart. J. Microscop. Sci., 1950, vol. 91, p/63—72.
943. Wiggles worth V. B. Insect blood cells.—Ann. Rev. Entomol., 1959, vol. 4, p. 1—16.
944. Delachambre J. Remarques de la nymphe de Tenebrio molitor L. (Col., Tenebrionidae).—Compt. Rend. Acad. Sci., 1966, ser. D, t. 263, p. 764—767.
945. Philo gene B. J. R., McFarlane J. E. The formation of the cuticle in the house cricket Acheta domestica (L.) and the role of oenocytes.— Canad. J. Zool., 1967, vol. 45, p. 181—191.
946. Lea M. S., Gilbert L. I. The hemocytes of Hyalophora cecropia (Lepidoptera).—J. MorphoL, 1966, vol. 118, p. 197—215.
947. Lazarenko T. Beitrage zur vergleichenderi Histologie des Blutes und des Bindegewebes. II.—Z. Mikrosk. Anat. Forsch., 1925, Bd. 3, S. 409— 499, v '
948. Wheeler R. E. Studies on the total haemocyte count and haemolymph volume in Periplaneta americana (L.) with special reference to the last moulting cycle.—J. Insect Physiol., 1963, vol. 9, p. 223—235.
949. Jones J. C. The hemocytes of Sarcophaga bullata Parker.—J. Morp-hol., 1956, vol. 99, p. 233—257.
950. Gregoire C. Hemolymph coagulation.— In: The Physiology of Insecta. Ed. by M. Rockstein. N. Y.—L., Acad. Press, 1964, vol. 3, p. 153—188.
951. Yeager J. F., Knight H. H. Microscopic observations on blood coagulation in several different species of insects.—Ann. Entomol. Soc. Amer., 1933, vol. 26, p. 591—602.
952. Gregoire C., Florkin M. Blood coagulation in arthropods. I.— «Physiol. Compar. Oecol.», 1950, vol. 2, p. 126—139.
953. Gregoire C., Jolivet P. Coagulation du sang chez les arthro-podes.—Exptl. Parc. Nat. Albert, 1957, ser. 2, t. 4, p. 1—45.
954. Hoffmann J. A., Stoeckel M.-E. Sur les modifications ultra-structurales des coagulocytes au cours de la coagulation de 1’hemolymphe chez un insecte orthopteroide: Locusta migratoria.—Compt. Rend. Soc. Biol. France, 1968(1969), t. 162, p. 2257—2259.
354
955. W i g g 1 e s w о г t h V. B. The role of the haemocytes in lli«* p.iuwlli and moulting of an insect, Rhodnius prolixus (Hemipteraj. J. Г\|»11 Bi<»l 1955, vol. 32, p. 649—663.
956. Whitten J. M. Haemocity activity in relation to epidei ni.il rcll growth, cuticle secretion, and cell death in a metamorphosing cydorliaplian pupa.— J. Insect Physiol., 1969, vol. 15, p. 763—778.
957. Whitten J. M. Haemocytes and the metamorphosing tissues in Sarcophaga bullata, Drosophila melanogaster, and other cycloraphous Diple-ra.—J. Insect Physiol., 1964, vol. 10, p. 447—469.
958. Zeller H. Blut und Fettkorper im Flugel der Mehlmotte Ephestia kuhniella Zeller.—Z. Morphol. Okol. Tiere, 1938, Bd. 34, S. 663—738.
959. Yeager J. F., Munson S. C. Histochemical detection of glycogen in blood cells of the southern armyworm (Prodenia eridania) and in other tissues, especially midgut epithelium.—J. Agricult. Res., 1941, vol. 63, p. 257—294.
960. Munson S. C., Yeager J. F. Fat inclusions in cells of southern armyworm, Prodenia eridania (Gram.).—Ann. Entomol. Soc. Amer., 1944, vol, 37> p. 396—400. _
961. Werner R. A., Jones J. C. Phagocytic haemocytes in unfixed Galleria mellonella larvae.—J. Insect Physiol., 1969, vol. 15, p. 425—437.
962. Chadwick J. S. Serological responses of insects.—Feder. Proc., 1967, t. 26, p. 1675—1679.
963. P a i 11 о t A. L’infection chez les insectes. Immunite et symbiose. Paris, G. Patissier, 1933. 535 p.
964. В r i g g s J. D. Humoral immunity in lepidopterous larvae.—J. Exptl. Zool., 1958, vol. 138, p. 155—188.
965. F e i r D., Schmidt G. T. Detection of antibody and antigen in the milkweed bug, Oncopeltus fasciatus.—«Experientia», 1968, t. 24, p. 1217— 1218.
966. Gingrich R. E. Acquired humoral immune response of the large milkweed bug, Oncopeltus fasciatus (Dallas), to injected materials.—J. Insect PhysioL, 1964, vol. 10, p. 179—194.
967 Hink W. F., В r i g g s J. D. Bactericidal factors in haemolymph from normal and immune wax moth larvae, Galleria mellonella.— J. Insect PhysioL, 1968, vol. 14, p. 1025—1034.
968. Kamp H. Untersuchungen zur Humoralen Immunitat bei' Pyrrhoco-ris apterus L. und Galleria mellonella F.— Z. vergl. PhysioL, 1968, Bd. 58, S. 441—464.
969. Chadwick J. S., Vi Ik E. Endotoxins from several bacterial species as immunizing agents against Pseudomonas aeruginosa in Galleria mellonella.— J. Invertebr. Pat., 1969, vol. 13, p. 410—415.
970. Salt G. Experimental studies in insect parasitism. XII.—J. Insect PhysioL, 1963, vol. 9, p. 647—669.
971. Grim st one A. V., R other am S., Salt G. An electronmicrosco-pe of capsule formation by insect blood cells.—J. Cell. Sci., 1967, vol. 2, p. 281—292.
972. Salt G. Cellular defense mechanisms in insects.— Feder. Proc., 1967, vol. 26, p. 1671 — 1674.
973. Streams F. Factors affecting the susceptability of Pseudeucoila bochei eggs to encapsulation by Drosophila melanogaster.— J. Invertebr. Pat., 1968, vol. 12, p. 379—387.
974. Salt G. Experimental studies in insect parasitism. XIV. Proc. Roy. Soc. L., 1966, ser. B, vol. 165, p. 155—178.
975. Salt G. The ichneumonid parasite Nemeritis canescens (Graven-horst) in relation to the wax moth Galleria mellonella (L.)—Trans. Roy. Entomol. Soc. L., 1964, vol. 116, p. 1—14.
976. Smith H. D. Phaeogenes nigridens Wesmael, an important ichneumonid parasite of the pupa of the European corn borer.— Techn. Bull. U. S. Dept. Agricult., 1932, vol. 331, p. 1—45.
355
977. Salt G. The resistance of insect parasitoids to the defence reactions -of their hosts.—Biol. Rev., 1968, vol. 43, p. 200—232.
978. Заварзин А. А. Гистологические исследования насекомых. 1. Сердце личинки стрекозы.— В кн.: А. А. Заварзин. Избранные труды. М., Изд-во АН СССР, 1952, т. 1, с. 29—52.
979. Aleksandrowicz J. S. The innervation of the heart of the cockroach (Periplaneta orientalis).— J. Compar. Neurol., 1926, vol. 41, p. 291—309.
980. Graber V. Ober den propulsatorischen Apparat der Insekten.— Arch, mikroskop. Anat., 1873, Bd. 9, S. 129—196.
981. Sanger J. W., McCann F. V. Ultrastructure of moth alary muscles and their attachment to the heart wall.— J. Insect Physiol., 1968, vol. 14, p. 1539—1544.
982. Edwards G. A., Ch alii се С. E. The ultrastructure of the heart ol the cockroach, Blatella germanica.— Ann. Entomol. Soc. Amer., 1960, vol. 53, p. 369—383.
983. Sanger J. W., McCann F. V. Ultrastructure of the myocardium of the moth, Hyalophora cecropia — J. Insect Physiol., 1968, vol. 14, p. 1105—1111.
984. H i n k s C. F. The dorsal vessel and associated structures in some Heteroptera.— Trans. Roy. Entomol. Soc. L., 1966, vol. 118, p. 375—392.
985. Op ocynska - Sembr a t о wa Z. Recherches sur 1’anatomie et 1’innervation du coeur de Carausius morosus Brunne.— Bull. Intern. Acad. Sci. (Cracovie), 1936, ser. B, t. 5, p. 411—436.
986. Me I nd oo N. E. Innervation of insect hearts.— J. Compar. Neurol., 1945, vol. 83, p. 141—155.
987. Miller T., Thomson W. W. Ultrastructure of cockroach cardiac innervation.— J. Insect Physiol., 1968, vol. 14, p. 1099—1104.
988. Florey E. Neurohormone und ihre function bei Arthropoden.— Zool.' Anz., 1952, Suppl., Bd. 16, S. 199—206.
989. Jones J. C. The heart and associated tissues of Anopheles quadri-maculatus Lay.— J. Morphol., 1954, vol. 94, p. 71—123.
990. Guthrie D. M., Tindall A. R. The biology of the cockroach. N. Y., St. Martin’s Press, 1968. 408 p.
991. Tzonis V. K. Beitrag zur Kenntnis des Herzens der Corethra plu-micornisAarve Fabr.— Zool. Anz., 1935, Bd. 116, S. 81—90.
992. Ш ax баз OB В. Г., Золотухина H. А. Ритмика кровообращения китайского дубового шелкопряда Antheraea pernyi G.-M. на разных ста--диях метаморфоза.— Тр. Ин-та биол. и биол. ф-та Харьк. гос. ун-та, 1957, т. 30, с. 79—86.
993. Tenney S. М. Observations on the physiology of the lepidopteran heart with special reference to reversal of the beat.—«Physiol. Compar. Oecol.», 1953, vol. 3, p. 286—306.
994. H e s s e 1 J. H. The comparative morphology of the dorsal vessel and •accessory structures of the Lepidoptera and its phylogenetic implications.— Ann. Entomol. Soc. Amer., 1969, vol. 62, p. 353—370.
995. D о g i e 1 I. Anatomie und Physiologic des Herzens der Larve von Corethra plumicornis.— Mem. Acad. Imper. St-Petersbourg, 1877, t. 24, N 10, p. 1—37.
996. Duwez Y. L’automatisme cardiaque chez le dytique.— Compt. Rend. Soc. Biol. France, 1936, t. 122, p. 84—87.
997. Barnhart C. S. The internal anatomy of the silver fish Ctenole-pisma campbelli and Lepisma saccharinum.— Ann. Entomol. Soc. Amer., 1961, vol. 54, p. 177—196.
998. Yeager J. F. Mechanographic method of recording insect activity with reference to the effect of nicotine on the isolated heart preparation of Periplaneta americana.— J.'Agricult. Res., 1938, vol. 46, p. 267—276.
999. Y e a g e r J. F. Electrical stimulation of insolated heart preparations from Periplaneta americana.—J. Agricult. Res., 1939, vol. 59, p. 121—137.
1000. Итина H. А. Сердце членистоногих.— Усп. совр. биол., 1948, т. 24, с. 915—930.
•356
1001. Проссер Л., Браун Ф. Сравнительная физиология животных М., «Мир», 1967. 766 с.
1002. McCann F. V. Unique properties of the moth myocardium —Ann. New York Acad. Sci., 1965, vol. 127, p. 84—99.
1003. Maddrell S. H. P. Excretion in the blood-sucking bug, Rhodnius prolixus Stal. II.—J. Exptl. Biol., 1964, vol. 41, p. 163—176.
1004. Richards A. G. The effect of temperature on heart-beat frequency in the cockroach, Periplaneta americana.— J. Insect Physiol., 1963, vol. 9,^ p. 597—606.
1005. Irisawa H., Irisawa A. F., Kadotani T. Findings on the electrograms of the cicada’s heart (Cryptotympana japonensis Kato).—Japan. J. Physiol., 1956, vol. 6, p. 150—161.
' 1006. C r e s c i t e 11 i F., Jahn T. L. Electrical and mechanical aspects,
of the grasshopper cardiac cycle.— J. Cell. Compar. Physiol., 1938, vol. 11, p. 359—376.
1007. Jahn T. L., C r e s c i t e 11 i F., Taylor A. B. The electrogram of the grasshopper (Melanoplus differentialis).— J. Cell. Compar. Physiol., 1937,. vol. 10, p. 439—460.
1008. Pouzat J., Pouzat М.-H., Brocas J. Etude electrophysioloque: des organes pulsatiles chez un coleoptere carabigue: Anthia sexmaculata.— Ann. Soc. Entomol. France, 1967, t. 9, p. 1129—1132.
1009. McCann F. V. Electrophysiology of insect heart.— J. Gen. Physiol., 1963, vol. 46, p. 803—821.
1010. McCann F. V. Physiology of insect hearts.— Ann. Rev. Entomol.,. 1970, vol. 15, p. 173—200.
1011. Miller T., Metcalf R. L. The cockroach heart as a bioassay organ.—«Entomol Exptl. Appl.», 1968, t. 11, p. 455—463.
1012. Richter K-, Stiirzebecher J. Elektrophysiologische Untersuchungen zum Wirkungsmechanismus von Neurohormon D am lateralen Herznerven von Periplaneta americana (L.).—Z. wiss. Zool., 1969, Bd. 180, S. 148—163.
1013. Miller T. Cockroach heart response to carditf-accelerators.— «Entomol. Exptl. Appl.», 1969, t. 12, p. 53—61.
1014. Metcalf R. L., Winton M. Y., Fukuto T. R. The effects of' cholinergic substances upon the isolated heart of Periplaneta americana.—J. Insect Physiol., 1964, vol. 10, p. 353—361.
1015. Hamilton H. L. The action of acetylcholine, atropine, and nicotine on the heart of the grasshopper, Melanoplus differentialis.— J. Cell. Corn-par. Physiol., 1939, vol. 13, p. 91—104.
1016. Davey K. G. The control of visceral muscles in insects.—Adv. Insect Physiol., 1964, vol. 2, p. 219—245.
1017. Fol Hot R. Action de 1’adrenaline sur le fonctionnement du vais-seau dorsal de la larve Galleria mellonella L.— Bull. Soc. Scient. Bretagne, Sci. Math., Phys, et Natur, 1957(1958), t. 32, p. 125—128.
1018. Верещагин С. M., Тыщенко В. П. О начальных этапах эволюции нервно-мышечного прибора насекомых.— Тез. и реф. докл. IV совещ. по эволюц. физиол., Л., 1965, с. 62—63. ,
1019. Miller Т. Role of cardiac neurons in the cockroach heartbeat — J. Insect Physiol., 1968, vol. 14, p. 1265—1275.
1020. Miller T. Response of cockroach cardiac neurons to cholinergic compounds —J. Insect Physiol., 1968, vol. 14, p. 1713—1717.
1021. Unger H. Neurohormonale Steuerung der Herztatigkeit bei Insekten.— «Naturwissenschaften», 1956, Bd. 43, S. 66—67.
1022. Davey K. G. The mode of action of the heart accelerating factor from the corpus cardiacum of insects.— «Gen. Compar. Endocrinol.», 1961, vol. 1, p. 24—29.
1023. Rounds H. D., Gardner F. E. A quantitative comparison of the activity of cardioacceleratory extracts from various portions of the cockroach nerve cord.—J. Insect Physiol., 1968, vol. 14, p. 495—497.
1024. Unger H. Untersuchungen zur neurohormonalen Steuerung der Herztatigkeit bei Schaben.— Biol. Zbl., 1957, Bd. 76, S. 204—225.
357'
ГЛАВА VII
1025. Buys К. S. Adipose tissue in insects.— J. Morphol., 1924, vol. 38, p. 485—528.
1026. Л a p ч e н к о К. И. Закономерности онтогенеза насекомых.— Тр. Зоол. ин-та АН СССР, 1956, т. 23, с. 5—214.
1027. Виноградова Е. Б. Диапауза у кровососущих комаров и ее регуляция Л., «Наука», 1969. 148 с.
1028. Сахаров Н. Л. К изучению холодостойкости насекомых.— Журн. опытн. агроном. Юго-Вост., 1928, т. 6, с. 85—104.
1029. Поспелов В. П. Постэмбриональное развитие и имагинальная диапауза у чешуекрылых.— Зап. Киевск. о-ва естествоисп., 1910, т. 21, с. 163—418.
1030. Wigglesworth V. В. The storage of protein, fat, glycogen and uric acid in the fat body and other tissues of mosquito larvae.— J. Exptl. Biol., 1942, vol. 19, p. 56—77.
1031. W i g g 1 e s w о r t h V. B. «Catalysomes», or enzyme caps on lipid droplets: an intracellular organelle.— «Nature», 1966, wol. 210, p. 759.
1032. Nair K. S. S., Karnavar G. K., George J. C. Studies on the larval fat body of Oryctes with particular reference to the cytochemistry of the proteinaceous globules.—J. Animal Morphol. Physiol., 1967, vol. 14, p. 28—54.
1033. Dahl helm D. Die Entwicklung des Fettkorper bei der Larve von Calliphora' erythrocephala ,Meig.— Biol. Zbl., 1967, Bd. 86, S. 273—301.
1034. Evans J. J. T. Development and ultrastructure of the fat body cells and oenocytes of the Queensland fruit fly, Dacus tryoni (Froog.).— Z. Zellforsch., 1967, Bd. 81, S. 49—61,
1035. Da Cruz L. C., Silveira M. M. L. Transformacoes pos-embrio-narias em Melipona quadrifasciata antihidioides Lep. (Hym., Ap-oidea). I.— Ann. Acad. Brasil. Cienc., 1966, t. 38, p. 475—483.
1036. Ishizaki H. Electron microscope study of changes in the sub-cellular organization during metamorphosis of fat body cell of Philosamia cynthia ricini (Lepidoptera).—J. Insect PhysioL, 1965, vol. 11, p. 845—856.
1037. P a i 11 о t A. C., Noel R. Sur 1’origine des inclusions albuminoides du corps adipeux des insectes.— Compt. Rend. Acad. Sci., 1926, t. 182, p. 1044—1046.
1038. Bishop G. H. Nuclear and cytoplasmic changes in fat body cells of the queen bee during metamorphosis.—J. Exptl. Biol. Zool., 1958, vol. 137, p. 501—516.
1039. Gaudecker B. Uber den Formwechsel einiger Zellorganelle bei der Bildung der Reservestoffe im Fettkorper von Drosophila Larven.—Z. Zellforsch., 1963, Bd. 61, S. 59—65.
1040. Walker P. A. An electron microscope study of the fat body of the moth Philosamia during growth and metamorphosis.— J. Insect PhysioL, 1966, vol. 12, p. 1009—1018.
1041. Koch A. Die Bakteriensymbiose der Kiichenschaben. —«Mikrokos-mos», 1949, Bd. 38, S. 121—126.
1042. Meyer G. F., Frank W. Elektronenmikroskopische Studien zur intracellularen Symbiose verschiedener Insekten. I.— Z. Zellforsch., 1957, Bd. 47, S. 29—42.
1043. Walker P. A. The structure of the fat body in normal and starved cockroaches as seen with the electron microscope.— J. Insect PhysioL, 1965, vol. 11, p. 1625—1631.
1044. Ramazzotto L. J., Ludwig D. Differences in composition of the fat body of normal and aposymbiotic cockroaches (Periplaneta americana).—Ann. Entomol. Soc. Amer., 1967, vol. 60, p. 227—229.
1045. Hinton H. E. The pigmented tissue of the Simuliidae.— Proc. Roy. Entomol. Soc. L., 1958, ser. C, vol. 23, p. 6—7.
1046. Hinton H. E. On the nature and metamorphosis of the colour pat
358
tern of the Thaumulca (Diplei.'i, Tlianmaleidae).— J. Insect Physiol., Д958, vol. 2, p. 249 260.
1047. Candy I). J., Kilby B. A. Site and mode of trehalose biosynthesis in the locusl. • •• Nalinc-, 1959, vol. 183, p. 1594—1595.
1048. Candy 1). J.. Kilby B. A. The biosynthesis of trehalose in the locust fat body.- Bioclicui. J.. 1961, vol. 78, p. 531—536.
1049. Kilby B. A. The biochemistry of the insect fat body.—Adv. Insect Physiol., 1963, vol. I, p. Ill 174.
1050. С 1 e g g .L S., I ', v a n s D. R. The physiology of blood trehalose and its function dining Hight in the blowfly.— J. Exptl. BioL, 1961, vol. 4, p. 771—792.
1051. T r i v e 1 I о n i J. C. Biosynthesis of glucosides and glycogen in the locust.—Arch. Bioclivni. Biophys., 1960, vol. 89, p. 149—150.
1052. V a r d a n i s A. Glycogen synthesis in the insect fat body.—Biochem. Biophys. Ada, 1963, I. 73, p. 565—573.
1053. Kobayashi M., Kimura S. Action of ecdysone on the conversion of14 C-glucose in daiier pupa of the silkworm, Bombyx mori,— J. Insect Physiol., 1967, vol. 13, p. 545 -552.
1054. Shigeinalsu II. On the glycolytic and oxidative action by the enzymes in the fat body of lhe silkworm, Bombyx mori L.— J. Serie. Sci., 1956. vol. 25, p. 115—121.
1055. Wigglesworth V. B. The utilization of reserve substances in Drosophila during flight.— J. Exptl. BioL, 1949, vol. 26, p. 150—163.
1056. Clements A. N. The source of energy for flight in mosquitoes — J. Exptl. BioL, 1955, vol. 32, p. 547—554.
1057. Barlow J. S. Fatty acids in some insect and spider fats.— Canad. J. Biochem., 1964, vol. 42, p. 1365—1374.
1058. T a m a к i Y., К a w a i S. Fatty acids, alcohols and hydrocarbons in the body lipid, of Ceroplastes pseudoceriferus Green, Ceroplastes japotiicus Green, and Ceroplastes rubens Maskell (Homoptera: Coccidae).— «Botyu Ka-gaku», 1967, vol. 32, p. 63—69.
1059. Bracken G. K-, Harris P. High palmitoleic acid in Lepidoptera.—«Nature», 1969, vol. 224, p. 84—85.
1060. Gilbert L. I. Lipid metabolism and function in insects. -Adv. Insect Physiol., 1967, vol. 4, p. 69—211.
1061. Ar den ne M., Osske G., Schreiber K. e. a. Sterine und Triterpenoide. X.— J. Insect Physiol., 1965, vol. 11, p. 1365—1376,
1062. Lou 1 ou des S. J., Chambers D. L., Moyer D. B. e. a. The hydrocarbons of adult house flies. — Ann. Entomol. Soc. Amer., 1962, vol. 55, p. 442—448.
1063. Baker G. L., Vroman H. E., Padmore J. Hydrocarbons of the American cockroach.— Biochem. Biophys. Res. Commun., 1963, vol. 13, p. 360—365.
1064. Sacktor B. The role of mitochondria in respiratory metabolism of flight muscle.— Ann. Rev. Entomol., 1961, vol. 6, p. 103—130.
1065. N i e m i e г к о S., Wlodawer P., Wojtczak A. F. Lipid and phosphorous metabolism during growth of the silkworm (Bombyx mori).—Acta BioL Exptl. Varshava, 1956, t. 17, p. 255—276.
1066. Ушатинская P. С. Основы холодостойкости насекомых. M., Изд-во АН СССР, 1957, 314 с.
1067. Needham J. Biochemistry and morphogenesis. L., Cambr. Univ. Press, 1950. 148 p.
1068. L a f о n M. Utilization of vitellin reserves during embryogenesis.— Arch. Intern. Physiol., 1950, t. 57, p. 309—342. ' '
1069. Agarwal H. C., Rao K. D. P. Variations in the neutral lipids of Dusdercus koenigii (Hemiptera) during its life cycle.— J. Insect Physiol., 1969, vol. 15, p. 161—166.
1070. Mor.a n M. R. Changes in fat content during metamorphosis of the mealworm, Tenebtio molitor.—J. New York Entomol. Soc., 1959, vol. 67, p. 213—222.
359
1071. J an da V., Marek M. Celkov’a lutkova premena hmyzu. 9.— Ceskosl. Spolec. Zool., 1960, t. 24, s. 271—279.
1072. Ludwig D., Crowe P. A., Hassemer M. M. Free fat and glycogen during metamorphosis of Musca domestica L.—J. New York Entomol. Soc., 1964, vol. 72, p. 23—28.
1073. Pitts C. W., Hopkins T. L. Lipid composition of hibernating face flies.— Proc. New Centr. Br. Entomol. Soc. Amer., 1965, vol. 20, p. 72—73.
1074. Vai der S. M., Hopkins T. L., Vai der S. A. Diapause induction and changes in lipid composition in diapausing and reproducing faceflies, Musca autumnalis.— J. Insect Physiol., 1969, vol 15, p. 1199—1214.
1075. Schaefer С. H., Wash i no R. K. Changes in the composition of lipids and fatty acids in adult Culex tarsalis and Anopheles freeborni during the overwintering period.— J. Insect Physiol., 1969, vol. 15, p. 395—402.
1076. Clark E. W., Chadbourne D. S. A comparative study of the weight, and lipid and water content of pink boll-worm.— Ann. Entomol. Soc. Amer., 1962, vol. 55, p/225—228.
1077. Gilbert L. L, Schneiderman H. A. The content of juvenile hormone and lipid in Lepidoptera: sexual differences and development changes.—«Gen. Compar. Endocrinol.», 1961, vol. 1, p. 453—472.
1078. Строгая Г. M. Особенности баланса жира и воды в индивидуальном развитии бабочек боярышницы и капустной белянки как форма адаптации к окружающей среде.— Докл. АН СССР, 1961, т. 139, с. 474—477.
1079. Harwood R. F., Takata N. Effect of photoperiod and temperature on fatty acid composition of the mosquito, Culex tarsalis.— J. Insect Physiol., 1965, vol. 11, p. 711—716.
1080. Munson S. C. Some effects of storage at different temperatures on the lipids of the American roach on the resistance of this insect to heat.— J. Econ. Entomol., 1953, vol. 46, p. 657—666.
1081. Кожанч-иков И. В. Термостабильное дыхание как условие холодостойкости насекомых.— Зоол. журн., 1939, т. 18, с. 86—97.
1082. Fast Р. G. Insect lipids: a review.— Mem. Entomol. Soc. Canada, 1964, vol. 37, p. 1—50.
1083. Beall G. The fat content of a butterfly, Danaus plexippus Linn., as affected by migration.— «Ecology», 1948, vol. 29, p. 80—94.
1084. В 1 ack i th R. E., Howden G. F. The food reserves of hatchling locusts —«Compar. Biochem. Physiol.», 1961, vol. 3, p. 108—124.
1085. Weis-Fogh T. Fat composition and metabolic rate of flying locusts (Schistocerca gregaria Forskal).— Philos. Trans. Roy. Soc. L., 1952,
vol. 237, p. 1—36.
1086. Cockbain A. J. Fuel utilization and duration of tethered flight in Aphis fabae Scop.— J. Exptl. Biol., 1961, vol. 38, p. 163—174.
1087. Nelson D. R., Sukkestad D. R. Fatty acid composition of diet -and larvae and biosynthesis of fatty acids from 14C-acetate in the cabbage looper, Trichoplusia ni.— J. Insect Physiol., 1968, vol. 14, p. 293—300.
1088. Stephen W. F., Gilbert L. I. Fatty acid biosynthesis in the silkmoth, Hyalophora cecropia — J. Insect Physiol., 1969, vol. 15, p. 1833—1854.
1089. Bade M. Biosynthesis of fatty acids in the roach Eurycotis flori-dana.— J. Insect Physiol., 1964, vol. 10, p. 333—341.
1090. Strong F. E. Fatty acids: in vivo synthesis by the green peach aphid, Myzus persicae ‘(Sulzer).— «Science», 1963, vol. 140, p. 983—984.
1091. Lamb N. J., Monroe R. E. Lipid synthesis synthesis from acetate-1-C 14 by the cereal leaf beetle, Oulema melanopus.—Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 1164—1166.
1092. Sridhara S., Bhat J. V. Incorporation of [l-14C]-acetate into the lipids of the silkworm, Bombyx mori L.— Biochem. J., 1964 vol 91 p. 120—123.
1093. Zebe E. С., M c S h a n W. H. Incorporation of 14C-acetate into longchain fatty acids by the fat body of Prodenia eridania (Lep.).—Biochim. Biophys. Acta, 1959, t. 31, p. 513—518.
360
1094. L a m b r c ni о и I E. N., Stein С. I., Bennett Л. F. Synthesis and metabolic conversion of fatly acids by the larval boll weevil.--«Compar. Biochem. PhysioL», 1905, vol. 10, p. 289—302.
1095. T i e t z - D e v i r A. Fat synthesis in cell-free preparations of locust fat body.—5th Intern. Congr. Biochem., 1963, vol. 7, p. 85—89.
1096. T а к а у a T., Miura K. Biosynthesis of fatty acids in the larvae of the blowfly, Aldrichina grahami reared aseptically.— Arch. Intern. Physiol. Biochem., 1968, vol. 76, p. 603—614.
1097. Sridhara S., Rao U. R., В h a t J. V. Metabolism of saturated I-14 C-labelled fatty acids in the silkworm Bombyx mori L.— Biochem. J., 1966, vol. 98, p. 260—265.
1098. Keith A. D. Fatty acid metabolism in Drosophila melanogaster: interaction between dietary fatty acids and de novo synthesis.— «Compar. Biochem. Physiol.», 1967, vol. 21, p. 8, 587—600.
1099. T i e t z A., S t e г n N. Stearate desaturation by microsomes on the locust fat-body.—FEBS Lettr., 1969, vol. 2, p. 286—288.
1100. Lamb N. J., Monroe R. E. Studies of complex lipids synthesized from acetate-1-14 acetate-1-14C by the cereal leaf beetle, Qulema melanopus.— Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 1167—1169.
1101. Blankenship J. W., Miller G. J. Incorporation of 14C-labelled acetate and glucose into triglycerides of Vitula edmandsae serratilineella larvae.—Ann. Entomol. Soc. Amer., 1968, vol. 61, p. 1036—1037.
1102. Tietz A. Fat synthesis in cell-free preparations of the locust fatbody.—J. Lipid Res., 1961, vol. 2, p. 182—187.
1103. Lamb rem on t E. N., Bumgarner J. E., Bennett A. F. Lipid biosynthesis in the boll weevil (Anthonomus grandis Boheman) (Coleop-tera: Curculionidae).—«Compar. Biochem. Physiol.», 1966, vol. 19, p. 417—429.
1104. Kilby B. A., Neville E. Amino acid metabolism in locust tissues.— J. Exptl. BioL, 1957, vol. 34, p. 276—289.
1105. Chen P. S., Bachmann-Diem C. Studies on the transamination reactions in the larval fat body of Drosophila melanogaster.—^. Insect PhysioL, 1964, vol. 10, p. 819—829.
1106. Nair K. S. S., George J. C. A histological and histochemical study of the larval fat body of Anthrenus vorax Waterhouse (Dermestidae, Co-leoptera).— J. Insect PhysioL, 1964, vol. 10, p. 509—517.
1107. McAllen J. W., Chefurka W. Some physiological aspects of glutamate-aspartate transamination in insects.— «Compar. Biochem. Physiol.», 1961, vol. 2, p. 290—299.
1108. Desai R. M., Kilby B. A. Some aspects of nitrogen metabolism in the fat body of the larva of Calliphora erythrocephala.— Arch. Intern. PhysioL Biochim., 1958, t. 66, p. 248—259.
1109. Bur sell E. Aspects of the metabolism of amino acids in the tsetse fly,- Glossina (Diptera).—J. Insect PhysioL, 1963, vol. 9, p. 439—452.
1110. Brosemer R. W., Veerabhadrappa P. S. Pathway of proline oxidation in insect flight muscle. — Biochim. Biophys. Acta, 1965, t. 110, p. 102—112.
1111. Reddy S. R. R., Campbell J. W. Arginine metabolism in insects: properties of insect fat body arginase.— «Compar. Biochem. Physiol.», 1969, vol. 28, p. 515—534.
1112. Reddy S. R. R., Campbell J. W. Arginine metabolism in insects. Role of arginase in proline formation during silkmoth development.—Biochem. J„ 1969, Vol. 115, p. 495—503.
1113. M a n s i n g h A. Glycine catabolism in Blatella germanica (L.).— J. Insect PhysioL, 1965, vol. 11, p. 1031 — 1037.
1114. Stephenson W. P., Wyatt G. P. The metabolism of silkmoth tissues. I.—Arch. Biochem. Biophys., 1962, vol. 99, p. 65—71.
1115. Price G. M. The in vitro incorporation of U-14-valine into fat body protein of the larva of the blowfly, Calliphora erythrocephala.— J. Insect Phy-jsiol., 1966, vol. 12, p. 731—740.
1116. Dinamarca M. L., Levenbook L. Oxidation, utilization, and
361
incorporation into protein of alanine and lysine during metamorphosis of the blowfly Phormia regina (Meigen).— Arch. Biochem. Biophys., 1966, vol. 117, p. 110—119.
1117. Locke M., Collins J. V. The sequestration of protein by the fat body of an insect.— «Nature», 1966, vol. 210, p. 552—553.
1118. Martin M.-D., Kin near J. F., Thomson J. A. Developmental changes in the late larva of Calliphora stygia. II.— Austr. J. Biol. Sci., 1969, vol. 22, p. 935—945.
1119. Pan M. L., Bell W. J., Tel f er W. H. Vitellogenic blood protein synthesis by insect fat body.—«Science», 1969, vol. 165, p. 393—394.
1120. Munn E. A., Price G. M., Grevill G. D. The synthesis in vitro of the protein calliphorin by fat body from the larva of the blowfly, Calliphora erythrocephala.—J. Insect Physiol., 1969, vol. 15, p. 1601—1605.
1121. Price G. M. The effect of different ions on the incorporation of (U-14C) valine into fat body protein of the larva of the blowfly, Calliphora erythrocephala.—J. Insect Physiol., 1967, vol. 13, p. 69—79.
1122. Osborne D. J., Carlisle D. B., Ellis P. E. Protein synthesis in the fat body of the female desert locust, Schistocerca gregaria Forsk., in relation to maturation.— Gen. Compar. Endocrinol., 1968, vol. 11, p. 347—354.
1123. Hill L. The incorporation of 14C-glycine into the proteins of the desert locust during ovarian development.— J. Insect Physiol., 1965, vol. 11, p. 1605—1615.
1124. Neufeld G. J., Thompson J. A., Horn D. H. S. Short-term effects of crustecdysone (20-hydroxyecdysone) on protein and RNA synthesis in third instar larvae of Calliphora.— J. Insect Physiol., 1968, vol. 14, p. 789—804.
1125. Arking R., Shaaya E. Effect of ecdysone on protein synthesis in the larval fat body of Calliphora.— J. Insect Physiol., 1969, vol. 15, p. 287—296.
1126. Collins J. V. The hormonal controLof fat body development in Calpodes ethlius (Lepidoptera, Hesperiidae).— J. Insect Physiol., 1969, vol. 15, p. 341—352.
1127. Scheurer R., Liischer M. Nachweis der Synthese eines Dotter-proteins unter dem Einfluss der corpora allata bei Leucophaea maderae.— Rev. Suisse Zool., 1968, t. 75, p. 715—722.
1128. Brookes V. J. The induction of yolk protein synthesis in the fat body of an insect, Leucophaea maderae, by an analog of the juvenile hormone.— Develop. Biol., 1969, vol. 20, p. 459—471.
ОГЛАВЛЕНИЕ
Введение.................................................. . . . .
Глава 1. Физиология и биохимия покровных тканей ". . . . .
§ 1. Строение и функции покровов.................... . . . .
§ 2. Химический состав кутикулы.............................
§ 3. Склеротизации кутикулы . . .......................
§ 4. Пигменты и окраска покровов ...........................
§ 5. Проницаемость кутикулы ..................z.............
Глава II. Физиология дыхания .....................................
§ 1. Кожное и жаберное дыхание .............................
§ 2. Дыхание при открытой трахейной системе.................
§ 3. Регуляция дыхания .....................................
§ 4. Общий дыхательный обмен ...............................
§ 5. Освобождение энергии при промежуточном дыхательном обмене .................................................
Глава III. Физиологические основы питания ...
§ 1. Пищевые режимы и пищевая специализация ....
§ 2. Потребности насекомых в химических компонентах пищи
§ 3. Нервная регуляция питания .............................
Глава IV. Физиология пищеварения
§ 1. Функциональная организация пищеварительной системы насекомых ...................................................
3
5
19
30
36
56
70
80
92
105
116
138
153
§ 2. Пищеварительные ферменты . .............................197
§ 3. Роль симбиотических микроорганизмов в питании и пищеварении насекомых ............................... . 212
Глава V. Физиология органов выделения ... 219
§ 1. Строение и работа выделительных органов
§ 2. Химический состав экскретов .... . . 233
Глава VI. Физиология кровеносной системы ..........................210
§ 1. Функциональная организация кровеносной системы насекомых
§ 2. Химический состав и некоторые свойства плазмы 211
§ 3. Функции гемоцитов.............................. л . 271
§ 4. Физиология сердца ..................................... 283
Глава VII. Физиология и биохимия жирового тела 29!)
§ 1. Строение и функции жирового тела...............
§ 2. Транспортные и резервные вещества жирового тела .300
Указатель литературы.............................................. 314
Тыщенко Виктор Петрович
Основы физиологии насекомых Часть 1 Физиология метаболических систем
Редактор И, П. Дубровская. Техн, редакторы Г. С.Орлова, Е. Г. Учаева Корректоры Г. Н. Гуляева, Л. А. Соловьева
М-17130. Сдано в набор 4 XI 1975 г. Подписано к печати 13 VIII 1976 г. Формат бумаги бОхЭО1^-Бум. тип. № 3. Печ. л. 22.75. Уч.-изд. л. 25.77. Тираж 2000 экз. Заказ 198. Цена 2 р. 70 коп. Издательство ЛГУ им. А. А. Жданова. 199164, Ленинград, Университетская наб., 7/в.
Сортавальская книжная типография Управления по делам издательств, полиграфии и книжной торговли Совета Министров Карельской АССР. Сортавала. Карельская, 42.